Cytos Biotech - 500 Beiträge pro Seite
eröffnet am 21.05.10 09:00:27 von
neuester Beitrag 30.06.16 22:28:43 von
neuester Beitrag 30.06.16 22:28:43 von
Beiträge: 167
ID: 1.157.936
ID: 1.157.936
Aufrufe heute: 0
Gesamt: 14.095
Gesamt: 14.095
Aktive User: 0
ISIN: CH0325814116 · WKN: A2ALS5
7,0200
EUR
+0,36 %
+0,0250 EUR
Letzter Kurs 13:24:59 Lang & Schwarz
Neuigkeiten
24.04.24 · Accesswire |
17.04.24 · Accesswire |
17.04.24 · EQS Group AG |
13.03.24 · Accesswire |
Werte aus der Branche Biotechnologie
| Wertpapier | Kurs | Perf. % |
|---|---|---|
| 1,9000 | +59,66 | |
| 0,6000 | +57,48 | |
| 1,9200 | +23,87 | |
| 5,4500 | +19,00 | |
| 6,9300 | +17,46 |
| Wertpapier | Kurs | Perf. % |
|---|---|---|
| 4,3600 | -13,49 | |
| 1,6900 | -14,50 | |
| 2,8150 | -15,21 | |
| 2,2900 | -17,63 | |
| 2,2600 | -30,25 |
21.05.2010 07:00
Cytos Biotechnology AG: Plazebo-kontrollierte Phase II-Studie zeigt, dass CYT003-QbG10 sicher und wirksam ist zur Behandlung von allergischem Asthma
Cytos Biotechnology AG / Research Update
21.05.2010 07:00
Veröffentlichung einer Corporate News, übermittelt durch die DGAP - ein Unternehmen der EquityStory AG. Für den Inhalt der Mitteilung ist der Emittent / Herausgeber verantwortlich.
- Alle vom Patienten berichtete Ergebnisparameter waren von Woche 6 bis zum Ende der Studie kontinuierlich und signifikant gegenüber Plazebo verbessert
- Die durch Spirometrie objektiv ermittelte Lungenfunktion (FEV1) war von Woche 6 bis zum Ende der Studie kontinuierlich und signifikant gegenüber Plazebo verbessert
Schlieren (Zürich), Schweiz, 21. Mai 2010 - Cytos Biotechnology AG (SIX:CYTN) berichtete heute erste Resultate einer doppel-blinden, plazebo-kontrollierten, multizentrischen Phase II-Studie, die die klinische Wirksamkeit von CYT003-QbG10 bei persistierendem allergischem Asthma bronchiale untersuchte. Die Studie schloss 63 Patienten ein, die an allergischem Asthma litten, welches eine Langzeitbehandlung mit inhalierten Kortikosteroiden bedingte. Die Patienten erhielten 7 Injektionen mit 900 µg QbG10 oder Plazebo und wurden über einen Zeitraum von 12 Wochen überwacht.
In einer Vorlaufphase vor dem Behandlungsbeginn mit QbG10 oder Plazebo wurden die Patienten auf eine standardisierte Kortikosteroidtherapie mit Beclamethason umgestellt und stabilisiert. Vier Wochen nach dem Behandlungsbeginn mit QbG10 oder Plazebo wurde die Kortikosteroiddosis um 50% reduziert. Wenn möglich wurde nach weiteren vier Wochen die Kortikosteroiddosis auf null reduziert. Beide Arme der Studie befolgten diese Steroidreduktion und es wurden keine signifikanten Unterschiede in der Steroideinnahme zu irgendeinem Zeitpunkt festgestellt. Während der gesamten 12-wöchigen Studiendauer wurden die Asthmasymptome zur Tag- und Nachtzeit, sowie die Einnahme von symptomlindernder Medikation (Sultanol Spray, ein kurz wirksamer beta 2 Agonist) in elektronischen Tagebüchern festgehalten. Zudem wurde bei jeder Visite die Lungenfunktion mittels Spirometrie untersucht, die die forcierte Einsekundenkapazität (FEV1) misst.
Alle von den Patienten berichtete Ergebnisparameter waren in jeder einzelnen Woche von Woche 6 bis zum Ende der Studie in Woche 12 signifikant gegenüber Plazebo verbessert (ITT Analyse, LOCF). In Woche 12 hatte sich der durchschnittliche Asthmasymptomwert zur Tag- und Nachtzeit in der Plazebogruppe um +29% erhöht (d.h. Krankheit verschlechtert), während er unter Behandlung mit QbG10 um -33% verringert (d.h. Krankheit verbessert) hatte (p=0,01). Die Verwendung von symptomlindernder Medikation stieg unter Plazebo im Schnitt um +106% an, während sie in der QbG10 Gruppe unverändert blieb (-4%) (p=0,01). Der durchschnittliche kombinierte Symptom und Medikationswert verschlechterte sich unter Plazebo um +71%, während er sich unter QbG10 um -17% verbesserte (p=0,006). Zusammenfassend lässt sich festhalten, dass die Kortikosteroidreduktion unter Plazebo zu der erwarteten Verschlechterung der Erkrankung führte, während sich der Zustand der Patienten unter QbG10 verbesserte. Diese Verbesserung wurde erreicht, obwohl die Patienten keine oder sehr stark reduziert Kortikosteroide verwendeten.
Eine Subgruppenanalyse der Patienten, die die Kortikosteroidinhalation nach Woche 8 komplett aufgegeben hatten (22 im QbG10 Arm, 21 im Plazebo Arm), erlaubt einen Vergleich des Effektes der Behandlung mit QbG10 (in Wochen 9-12) gegenüber der Beclamethason Therapie zu Beginn der Studie (die zwei Wochen bevor QbG10 oder Plazebo verabreicht wurden). Die Substitution von Beclamethason mit QbG10 führte in diesen Patienten zu einer Reduktion der Asthmasymptome um -37% (p=0,02), einer Reduktion der Sultanoleinnahme um -30% (n.s.) und zu einer Reduktion des kombinierten Symptom und Medikationswertes um -34% (p=0,07). Die entsprechenden Werte unter Plazebo waren +6%, +58% und +33%. Diese Analyse legt den Schluss nahe, dass die Behandlung mit QbG10 zu einem therapeutischen Effekt führt, der dem von inhalierten Kortikosteroiden entspricht oder möglicherweise sogar besser ist.
Die deutliche Verbesserung des Zustandes der Patienten, der sich in den von ihnen beschriebenen Ergebnisparametern zeigte, konnte auch objektiv durch Messungen der Lungenfunktion mittels Spirometrie belegt werden. Dabei war die forcierte Einsekundenkapazität (FEV1) in allen wöchentlichen Messungen von Woche 6 bis zum Ende der Studie in Woche 12 gegenüber Plazebo signifikant verbessert (ITT Analyse, LOCF). In Woche 12 hatte sich der FEV1 Wert auf Plazebo im Schnitt um 251ml (-8,4%) verschlechtert, während er auf QbG10 stabil blieb (-18,5ml, -0,6%) (p=0,01).
Die Behandlung war sicher und gut verträglich. Lokale Reaktionen an der Injektionsstelle von meist milder bis mittlerer Intensität und zwei Vorfälle von Kopfweh waren die einzigen Nebenwirkungen die in einem vermuteten Zusammenhang mit der Behandlung standen und in mehr als einem Patienten auftraten.
Dr. Wolfgang Renner, CEO von Cytos kommentierte die Studienresultate: «Asthma und Allergien tragen wesentlich zur ansteigenden Belastung unserer Gesellschaft durch chronische Erkrankungen bei, und haben epidemische Ausmasse angenommen; dies im Wesentlichen als Folge zunehmender Industrialisierung sowie eines Lebens in urbaner Umgebung. Allergisches Asthma ist eine wichtige Ursache von Morbidität und Mortalität und betrifft häufig Menschen in einem frühen Stadium ihres Lebens. Mit QbG10 haben wir ein Produkt, das das Potential hat, die erste kausal wirkende und krankheits-modifizierende Therapie für allergische Erkrankungen zu werden. Damit wird ein wichtiges medizinisches Bedürfnis abgedeckt.
QbG10 hat gezeigt, dass es objektive und subjektive Krankheitsparameter schnell und stark zu verbessern vermag. Das Ausmass in dem das erreicht wurde, könnte QbG10 künftig als neue Standardtherapie für Allergien und Asthma positionieren. Dieses aussergewöhnliche Resultat in dieser wichtigen Indikation baut auf früheren Erfolgen mit QbG10 in allergischer Rhinitis auf und zeigt, dass unsere VLP Plattform grossen therapeutischen Nutzen in der Behandlung chronischer Erkrankungen zu erbringen vermag, die weite Teile der Weltbevölkerung betreffen.»
Heutige Telefonkonferenz um 15.00 Uhr (MEZ)
Cytos Biotechnology wird heute Freitag, 21. Mai 2010 um 15.00 Uhr (MEZ) eine Telefonkonferenz durchführen, um die heutigen Studienresultate im Detail zu diskutieren.
Cytos Biotechnology AG: Plazebo-kontrollierte Phase II-Studie zeigt, dass CYT003-QbG10 sicher und wirksam ist zur Behandlung von allergischem Asthma
Cytos Biotechnology AG / Research Update
21.05.2010 07:00
Veröffentlichung einer Corporate News, übermittelt durch die DGAP - ein Unternehmen der EquityStory AG. Für den Inhalt der Mitteilung ist der Emittent / Herausgeber verantwortlich.
- Alle vom Patienten berichtete Ergebnisparameter waren von Woche 6 bis zum Ende der Studie kontinuierlich und signifikant gegenüber Plazebo verbessert
- Die durch Spirometrie objektiv ermittelte Lungenfunktion (FEV1) war von Woche 6 bis zum Ende der Studie kontinuierlich und signifikant gegenüber Plazebo verbessert
Schlieren (Zürich), Schweiz, 21. Mai 2010 - Cytos Biotechnology AG (SIX:CYTN) berichtete heute erste Resultate einer doppel-blinden, plazebo-kontrollierten, multizentrischen Phase II-Studie, die die klinische Wirksamkeit von CYT003-QbG10 bei persistierendem allergischem Asthma bronchiale untersuchte. Die Studie schloss 63 Patienten ein, die an allergischem Asthma litten, welches eine Langzeitbehandlung mit inhalierten Kortikosteroiden bedingte. Die Patienten erhielten 7 Injektionen mit 900 µg QbG10 oder Plazebo und wurden über einen Zeitraum von 12 Wochen überwacht.
In einer Vorlaufphase vor dem Behandlungsbeginn mit QbG10 oder Plazebo wurden die Patienten auf eine standardisierte Kortikosteroidtherapie mit Beclamethason umgestellt und stabilisiert. Vier Wochen nach dem Behandlungsbeginn mit QbG10 oder Plazebo wurde die Kortikosteroiddosis um 50% reduziert. Wenn möglich wurde nach weiteren vier Wochen die Kortikosteroiddosis auf null reduziert. Beide Arme der Studie befolgten diese Steroidreduktion und es wurden keine signifikanten Unterschiede in der Steroideinnahme zu irgendeinem Zeitpunkt festgestellt. Während der gesamten 12-wöchigen Studiendauer wurden die Asthmasymptome zur Tag- und Nachtzeit, sowie die Einnahme von symptomlindernder Medikation (Sultanol Spray, ein kurz wirksamer beta 2 Agonist) in elektronischen Tagebüchern festgehalten. Zudem wurde bei jeder Visite die Lungenfunktion mittels Spirometrie untersucht, die die forcierte Einsekundenkapazität (FEV1) misst.
Alle von den Patienten berichtete Ergebnisparameter waren in jeder einzelnen Woche von Woche 6 bis zum Ende der Studie in Woche 12 signifikant gegenüber Plazebo verbessert (ITT Analyse, LOCF). In Woche 12 hatte sich der durchschnittliche Asthmasymptomwert zur Tag- und Nachtzeit in der Plazebogruppe um +29% erhöht (d.h. Krankheit verschlechtert), während er unter Behandlung mit QbG10 um -33% verringert (d.h. Krankheit verbessert) hatte (p=0,01). Die Verwendung von symptomlindernder Medikation stieg unter Plazebo im Schnitt um +106% an, während sie in der QbG10 Gruppe unverändert blieb (-4%) (p=0,01). Der durchschnittliche kombinierte Symptom und Medikationswert verschlechterte sich unter Plazebo um +71%, während er sich unter QbG10 um -17% verbesserte (p=0,006). Zusammenfassend lässt sich festhalten, dass die Kortikosteroidreduktion unter Plazebo zu der erwarteten Verschlechterung der Erkrankung führte, während sich der Zustand der Patienten unter QbG10 verbesserte. Diese Verbesserung wurde erreicht, obwohl die Patienten keine oder sehr stark reduziert Kortikosteroide verwendeten.
Eine Subgruppenanalyse der Patienten, die die Kortikosteroidinhalation nach Woche 8 komplett aufgegeben hatten (22 im QbG10 Arm, 21 im Plazebo Arm), erlaubt einen Vergleich des Effektes der Behandlung mit QbG10 (in Wochen 9-12) gegenüber der Beclamethason Therapie zu Beginn der Studie (die zwei Wochen bevor QbG10 oder Plazebo verabreicht wurden). Die Substitution von Beclamethason mit QbG10 führte in diesen Patienten zu einer Reduktion der Asthmasymptome um -37% (p=0,02), einer Reduktion der Sultanoleinnahme um -30% (n.s.) und zu einer Reduktion des kombinierten Symptom und Medikationswertes um -34% (p=0,07). Die entsprechenden Werte unter Plazebo waren +6%, +58% und +33%. Diese Analyse legt den Schluss nahe, dass die Behandlung mit QbG10 zu einem therapeutischen Effekt führt, der dem von inhalierten Kortikosteroiden entspricht oder möglicherweise sogar besser ist.
Die deutliche Verbesserung des Zustandes der Patienten, der sich in den von ihnen beschriebenen Ergebnisparametern zeigte, konnte auch objektiv durch Messungen der Lungenfunktion mittels Spirometrie belegt werden. Dabei war die forcierte Einsekundenkapazität (FEV1) in allen wöchentlichen Messungen von Woche 6 bis zum Ende der Studie in Woche 12 gegenüber Plazebo signifikant verbessert (ITT Analyse, LOCF). In Woche 12 hatte sich der FEV1 Wert auf Plazebo im Schnitt um 251ml (-8,4%) verschlechtert, während er auf QbG10 stabil blieb (-18,5ml, -0,6%) (p=0,01).
Die Behandlung war sicher und gut verträglich. Lokale Reaktionen an der Injektionsstelle von meist milder bis mittlerer Intensität und zwei Vorfälle von Kopfweh waren die einzigen Nebenwirkungen die in einem vermuteten Zusammenhang mit der Behandlung standen und in mehr als einem Patienten auftraten.
Dr. Wolfgang Renner, CEO von Cytos kommentierte die Studienresultate: «Asthma und Allergien tragen wesentlich zur ansteigenden Belastung unserer Gesellschaft durch chronische Erkrankungen bei, und haben epidemische Ausmasse angenommen; dies im Wesentlichen als Folge zunehmender Industrialisierung sowie eines Lebens in urbaner Umgebung. Allergisches Asthma ist eine wichtige Ursache von Morbidität und Mortalität und betrifft häufig Menschen in einem frühen Stadium ihres Lebens. Mit QbG10 haben wir ein Produkt, das das Potential hat, die erste kausal wirkende und krankheits-modifizierende Therapie für allergische Erkrankungen zu werden. Damit wird ein wichtiges medizinisches Bedürfnis abgedeckt.
QbG10 hat gezeigt, dass es objektive und subjektive Krankheitsparameter schnell und stark zu verbessern vermag. Das Ausmass in dem das erreicht wurde, könnte QbG10 künftig als neue Standardtherapie für Allergien und Asthma positionieren. Dieses aussergewöhnliche Resultat in dieser wichtigen Indikation baut auf früheren Erfolgen mit QbG10 in allergischer Rhinitis auf und zeigt, dass unsere VLP Plattform grossen therapeutischen Nutzen in der Behandlung chronischer Erkrankungen zu erbringen vermag, die weite Teile der Weltbevölkerung betreffen.»
Heutige Telefonkonferenz um 15.00 Uhr (MEZ)
Cytos Biotechnology wird heute Freitag, 21. Mai 2010 um 15.00 Uhr (MEZ) eine Telefonkonferenz durchführen, um die heutigen Studienresultate im Detail zu diskutieren.
Das ganze sieht recht interessant aus. Einige Fragen müssen jedoch noch geklärt werden. Unklar ist beispielsweise, wieso als Entzündungsparameter nur NO und die eosinophilen Granulozyten bestimmt worden sind (eine ungewöhnliche Kombination mit limitierter Aussagekraft) und welchen Patienten während der letzten Studienphase eine abermalige Erhöhung der Kortisondosis zugestanden worden ist (offensichtlich waren in der Mehrzahl Patienten der Verum-Gruppe betroffen).
Insgesamt macht es aber in jedem Fall Sinn, sich näher mit dem Unternehmen zu beschäftigen.
Insgesamt macht es aber in jedem Fall Sinn, sich näher mit dem Unternehmen zu beschäftigen.
Antwort auf Beitrag Nr.: 39.570.196 von Joschka Schröder am 22.05.10 18:40:36Hast Du Dir mal die Anleihe angesehen?
Antwort auf Beitrag Nr.: 39.575.027 von R-BgO am 24.05.10 18:05:13Habe mir heute mal das Mindestticket gegönnt und harre der Dinge, die da kommen.
Cytos Biotechnology AG und Intercell AG vollziehen den Verkauf der Technologieplattform
Schlieren (Zürich), Schweiz, 8. Juni 2010 – Cytos Biotechnology AG (SIX:CYTN) gab heute bekannt, dass der am 6. Mai 2010 bekannt gegebene Verkauf der Technologieplattform zur Entdeckung monoklonaler Antikörper an Intercell AG gestern vollzogen wurde. Vertragsgemäss erfolgte am gestrigen Closing die Bezahlung der ersten Kaufpreisrate von EUR 10 Millionen. Die zweite Rate über EUR 5 Millionen ist am 31. Januar 2011 zur Zahlung fällig und unterliegt keinerlei weiterer Bedingungen.
Schlieren (Zürich), Schweiz, 8. Juni 2010 – Cytos Biotechnology AG (SIX:CYTN) gab heute bekannt, dass der am 6. Mai 2010 bekannt gegebene Verkauf der Technologieplattform zur Entdeckung monoklonaler Antikörper an Intercell AG gestern vollzogen wurde. Vertragsgemäss erfolgte am gestrigen Closing die Bezahlung der ersten Kaufpreisrate von EUR 10 Millionen. Die zweite Rate über EUR 5 Millionen ist am 31. Januar 2011 zur Zahlung fällig und unterliegt keinerlei weiterer Bedingungen.
Die geschriebenen Wandelrechte stammen von der CHF 70 Millionen 2,875% Wandelanleihe (fällig 2012). ISIN: CH0029060735. Zurzeit müsste die Unternehmung beim aktuellen Wandelpreis von CHF 175 für die Wandlung der Wandelobligation 400’000 Namenaktien aus dem bedingten Kapital ausgeben. Diese 400’000 Namenaktien entsprechen einem Stimmrechtsanteil von 7,59% der im Handelsregister des Kantons Zürich eingetragenen Aktien. Der Wandelpreis kann entsprechend den Bedingungen der Wandelanleihe angepasst werden.
Infolge von Teil-Rückkäufen der eigenen Wandelanleihe (ISIN: CH0029060735) besitzt die Unternehmung Erwerbspositionen gem. Art. 13 Abs. 1 lit b BEHV-EBK von CHF 28’875'000 der Wandelanleihe entsprechend 165’000 Namenaktien mit einem Stimmrechtsanteil von 3,13% der im Handelsregister des Kanton Zürich eingetragenen Aktien.
Infolge von Teil-Rückkäufen der eigenen Wandelanleihe (ISIN: CH0029060735) besitzt die Unternehmung Erwerbspositionen gem. Art. 13 Abs. 1 lit b BEHV-EBK von CHF 28’875'000 der Wandelanleihe entsprechend 165’000 Namenaktien mit einem Stimmrechtsanteil von 3,13% der im Handelsregister des Kanton Zürich eingetragenen Aktien.
Was ist heute los?
gibt es eine verbindung zu cytotools?
Cytos Biotechnology AG, 8952 Schlieren
Offenlegung einer Beteiligung nach Art. 20 BEHG
Cytos Biotechnology AG (SIX:CYTN) erhielt am 1. Juli 2010 von Matter Group AG (wirtschaftlicher Berechtigter: Thomas Matter), Toggwilerstrasse 96, 8706 Meilen, Schweiz, die Mitteilung, dass am 30. Juni 2010 infolge Zukäufe, ihre Beteiligung an Cytos Biotechnology AG 180’000 Namenaktien entsprechend einem Stimmrechtsanteil von 3,4155% der im Handelsregister des Kantons Zürich eingetragenen Aktien beträgt.
Offenlegung einer Beteiligung nach Art. 20 BEHG
Cytos Biotechnology AG (SIX:CYTN) erhielt am 1. Juli 2010 von Matter Group AG (wirtschaftlicher Berechtigter: Thomas Matter), Toggwilerstrasse 96, 8706 Meilen, Schweiz, die Mitteilung, dass am 30. Juni 2010 infolge Zukäufe, ihre Beteiligung an Cytos Biotechnology AG 180’000 Namenaktien entsprechend einem Stimmrechtsanteil von 3,4155% der im Handelsregister des Kantons Zürich eingetragenen Aktien beträgt.
Cytos Biotechnology AG / Kooperation
15.07.2010 03:00
Veröffentlichung einer Corporate News, übermittelt durch die DGAP - ein Unternehmen der EquityStory AG. Für den Inhalt der Mitteilung ist der Emittent / Herausgeber verantwortlich.
-------------------------------------------------------------------- -------
Organisationsübergreifendes Projekt könnte eine unabhängige Belieferung der Mitglieder der Vereinigung südostasiatischer Staaten (ASEAN) mit Grippeimpfstoff eröffnen und erweitert zudem die F&E-Pipeline von Cytos
Schlieren (Zürich) Schweiz und Singapur - 15. Juli 2010
1. Das Schweizerische Unternehmen Cytos Biotechnology und die singapurische Behörde Agency for Science, Technology and Research (A*STAR), gaben heute gemeinsam ihre erste Zusammenarbeit für ein virusartiges Partikel (VLP)-Vakzin bekannt. Diese Partnerschaft, an der akademische und klinische Partner aus ganz Singapur beteiligt sind (1), hat die Erforschung, Entwicklung und Kommerzialisierung eines VLP-Vakzins (2) zur Prophylaxe von Grippeinfektionen zum Ziel. Die Zusammenarbeit könnte möglicherweise eine unabhängige Belieferung von Singapur und anderen Mitgliedern der Vereinigung südostasiatischer Staaten (ASEAN) mit Vakzinen zum Schutz vor saisonaler Influenza und zukünftigen Pandemien sichern und bringt zudem eine Erweiterung der F&E-Pipeline von Cytos mit sich.
2. Unter dieser Vereinbarung wird Cytos Biotechnology mit dem Experimental Therapeutics Centre (ETC) von A*STAR und dem Singapore Immunology Network (SIgN) zusammenarbeiten, um einen gegen das Influenza-Hämagglutininprotein gerichteten Impfstoff auf VLP-Basis zu entwickeln und herzustellen. Der Impfstoff-Kandidat wird dann in präklinischen Studien zur Sicherheit und Wirksamkeit von den DSO weiteren Beurteilungen unterzogen. Die Duke-NUS Graduate Medical School Singapore und das Singapore Clinical Research Institute werden eine Proof-of-Concept-Studie zur Bewertung der Sicherheit des Vakzins und seiner Fähigkeit zur Induktion Virus-neutralisierender Antikörper (HI-Titer) durchführen. Anschliessend hält Cytos die weltweiten, unterlizenzierbaren Rechte für die weitere Entwicklung, Herstellung und Vermarktung des Vakzins, wohingegen die A*STAR-Unterorganisationen zur Herstellung des Vakzins für Singapur und andere Mitglieder der Vereinigung südostasiatischer Staaten berechtigt sind. Unter dieser Vereinbarung können die A*STAR-Ableger Lizenzgebühren an den weltweiten Verkäufen des entwickelten Grippeimpfstoffes erhalten.
3. Prof. Sir George Radda, Vorsitzender des Biomedical Research Council der A*STAR, der Teile der Forschung finanziert, bemerkte dazu: 'Wir sind von dem Fortgang und Umfang dieser Zusammenarbeit absolut begeistert. Dank der vorhandenen Kapazitäten in Singapur von der Grundlagenforschung bis hin zur translationalen Forschung und dem technischen Know-how von Cytos kann ein solches Produkt von der Entdeckung bis zur klinischen Anwendungsreife gebracht werden, um zeitnah einen kosteneffektiven Schutz gegen Pandemien aufbauen zu können. Wir freuen uns darauf, weitere solcher starken Partnerschaften mit der Industrie und Gesundheitsorganisationen einzugehen, um den Bedürfnissen des öffentlichen Gesundheitswesens gerecht werden zu können und der Gesellschaft zu dienen.'
4. Dr. Martin Bachmann, Chief Scientific Officer bei Cytos, meinte dazu: 'Über den Zugang zu den singapuresischen Exzellenzzentren für Wissenschaft und Arzneimittelentwicklung wird uns die Möglichkeit eröffnet, ein klinisches Proof-of-Concept für eines der VLP-Vakzine von Cytos im prophylaktischen Anwendungsbereich zu erhalten. Die Influenza-Vakzin-Kooperation ist die erste ihrer Art für Cytos und eröffnet uns andererseits die Chance, Singapur und anderen Mitgliedern der Vereinigung südostasiatischer Staaten (ASEAN) darin zu unterstützen, in der Bereitstellung von Vakzinen, die für die auftretenden Probleme und Fragestellungen im öffentlichen Gesundheitswesen relevant sind, autarker zu agieren und dabei auch noch zu einem wertvollen Produktkandidaten zur Erweiterung der bestehenden Pipeline von Cytos beizutragen.'
5. 'Die Zusammenarbeit mit der Duke-NUS Graduate Medical School und dem Experimental Therapeutics Center zur Aufklärung von Influenza-Pandemien und deren Ausbreitung in der Gesellschaft wird uns besser ermöglichen solche Pandemien zu verhindern und unsere Abwehr dagegen zu verstärken. Wir freuen uns darüber, ein Partner dieser Zusammenarbeit zu sein' sagte Quek Gim Pew, Chief Executive Officer bei den DSO National Laboratories.
6. 'Wir sind überzeugt, dass sich das, was Singapur in biomedizinische Forschung investiert hat, in ein Influenza-Vakzin 'Made in Singapur' umsetzen lässt, das besondere Bedeutung bei der Abmilderung von Gesundheitsrisiken erhalten könnte, die sich durch Influenza-Pandemien verschärfen,' meinte Associate Professor Ooi Eng Eong, führender Prüfarzt des Projektes und Virologe an der Duke-NUS Graduate Medical School in Singapur.
7. Prof. Sam Lim, Chief Operating Officer bei SCRI, sagte: 'Wir sind sehr begeistert über die Chance zur Zusammenarbeit über so viele verschiedene Organisationen hinweg, um eine der ersten Phase 1-Vakzinstudien in Singapur auf den Weg zu bringen. Die Singapurer und andere Länder der ASEAN-Region werden in hohem Masse von dieser hochinnovativen klinischen Forschung profitieren.'
(1) Die beteiligten akademischen und klinischen Partner sind die DSO National Laboratories, die Duke-NUS Graduate Medical School und das Singapore Clinical Research Institute (SCRI)
(2) Informationen über virusartige Partikel (VLP)-Vakzine siehe Anhang.
Über die Agency for Science, Technology and Research (A*STAR) A*STAR ist die führende Organisation zur Unterstützung wissenschaftlicher Weltklasseforschung und Förderung von Talenten für ein dynamisches wissensbasiertes und innovationsgesteuertes Singapur. A*STAR steht über 14 biomedizinischen Wissenschaften, physikalischen Wissenschaften und technischen Forschungsinstituten, sowie neun Konsortien&Zentren mit Sitz in Biopolis und Fusionopolis und deren unmittelbarer Umgebung.
A*STAR unterstützt die wichtigsten Wirtschaftscluster in Singapur durch die Bereitstellung von intellektuellem, humanem und industriellen Kapital an die Partner in der Industrie. Sie unterstützt auch extramurale Forschungsaktivitäten an Universitäten, Kliniken, Forschungszentren und in Zusammenarbeit mit anderen lokalen und internationalen Partnern. Weitere Informationen zu A*STAR finden Sie unter der Internetadresse www.a-star.edu.sg.
Über das Experimental Therapeutics Centre (ETC) Das ETC wurde 2006 ins Leben gerufen und spielt seither eine zunehmend bedeutende Rolle in der Übertragung früher wissenschaftlicher Entdeckungen in praktische Anwendungen. Angefangen vom Engagement in der frühen Erkundung und Entwicklung von Wirkstoffen über die Entwicklung innovativer Forschungshilfsmittel für die klinische Analyse bis hin zur Begründung öffentlich-privater Partnerschaften zur unkomplizierten Weiterentwicklung von Wirkstoffkandidaten trägt ETC massgeblich zu den Fähigkeiten und Ressourcen von Singapur im Prozess der Wirkstoffentdeckung bei. Diese Möglichkeiten und Ressourcen werden beim ETC derzeit hauptsächlich auf die Bereiche Onkologie und Infektionskrankheiten ausgerichtet. Auch wird an neuen Technologien für die Kommerzialisierung gearbeitet und es werden junge Wissenschaftler für die Laufbahn in der pharmazeutischen und biotechnologischen Industrie vorbereitet. Weitere Informationen zum ETC finden Sie unter der Internetadresse www.etc.a-star.edu.sg.
Über das Singapore Immunology Network (SIgN) Das Singapore Immunology Network (SIgN), offiziell am 15. Januar 2008 ins Leben gerufen, ist ein unter dem Biomedical Research Council der Agency for Science, Technology and Research (A*STAR) arbeitendes Forschungskonsortium. Der Auftrag von SIgN ist die Erforschung der Humanimmunologie sowie die Teilnahme an internationalen Projekten zur Lösung von wichtigen Gesundheitsproblemen. Seit der Einführung ist die SIgN rasant gewachsen und zählt gegenwärtig 150 Wissenschaftler aus 25 verschieden Ländern, die von 20 renommierten Persönlichkeiten aus der Wissenschaft angeleitet werden. Bei SIgN wird die Immunantwort, ausgelöst durch Infektionen und Entzündungen, sowie Krebs untersucht. Dabei werden die Forscher durch innovative Technologieplattformen und zentrale Forschungsdienstleistungen unterstützt. Dadurch will SIgN eine starke Plattform in der Grundlagenforschung für die Humanimmunologie aufbauen, um die Forschungsergebnisse besser in klinische Anwendungen überführen zu können. SIgN hat sich zudem vorgenommen, produktive Vernetzungen mit lokalen und internationalen Institutionen herzustellen und ermutigt den Austausch von Ideen und Expertisen zwischen Akademien, Industrien und klinischen Partnern und steuert demnach einen Beitrag an die dynamische Forschungsumgebung in Singapur bei. Weitere Informationen über das SIgN finden Sie unter der Internetadresse www.sign.a-star.edu.sg.
Über Cytos Biotechnology AG Cytos Biotechnology AG ist ein börsenkotiertes Schweizer Biotechnologie-Unternehmen, das sich auf die Entdeckung, Entwicklung und Vermarktung einer neuen Klasse von biopharmazeutischen Präparaten - die Immunodrugs(TM) - spezialisiert hat. Immunodrugs(TM) sind für die Anwendung in der Behandlung und Prävention von häufigen chronischen Krankheiten vorgesehen, die weltweit Millionen von Menschen betreffen. Immunodrugs(TM) sollen das Immunsystem des Patienten dazu bringen, erwünschte therapeutische Antikörper oder T-Zellreaktionen zu erzeugen, welche chronische Krankheitsprozesse modulieren. Cytos Biotechnology nutzt die grosse Flexibilität der Immunodrug(TM)-Technologie und hat eine umfassende Pipeline von Immunodrug(TM)-Kandidaten für verschiedene Krankheitsindikationen entwickelt, von denen sich derzeit sechs in der klinischen Entwicklung befinden. Die Immunodrug(TM)-Kandidaten werden sowohl in eigenen Programmen als auch in Zusammenarbeit mit Novartis, Pfizer und Pfizer Tiergesundheit entwickelt. Das 1995 als Spin-off der Eidgenössischen Technischen Hochschule (ETH) Zürich gegründete Unternehmen hat seinen Sitz in Schlieren (Zürich). Gegenwärtig zählt das Unternehmen 76 Vollzeit-Angestellte. Cytos Biotechnology AG ist an der Schweizer Börse SIX Swiss Exchange kotiert (SIX:CYTN). Weitere Informationen zu Cytos Biotechnology finden Sie unter der Internetadresse www.cytos.com
Über die DSO National Laboratories Die DSO National Laboratories (kurz DSO) sind die nationale Forschungs- und Entwicklungsorganisation von Singapur zur Abwehr biologischer Bedrohungen.
Sie entwickeln selbst fortschrittliche Abwehr- und Waffensysteme, die die Streitkräfte von Singapur (SAF) mit der neuesten Technologie für den Ernstfall ausrüsten. Obwohl das Hauptaugenmerk auf der Belieferung der Streitkräfte liegt, agieren die DSO auch im Bereich Forschung und Entwicklung zur Abwehr von Gefahren für die eigene Bevölkerung.
Mit mehr als 1'000 in der Forschung beschäftigten Wissenschaftlern und Technikern befassen sich die DSO mit neuen Technologien, bringen vielversprechende Ansätze zur Anwendungsreife und integrieren diese in innovative Systemkonzepte, um die Bedürfnisse Singapurs in Abwehr- und Sicherheitsfragen zu erfüllen. Weitere Informationen über die DSO finden sie unter der Internetadresse www.dso.org.sg
Über die Duke-NUS Graduate Medical School Singapore www.duke-nus.edu.sg Die Duke-NUS Graduate Medical School Singapore (Duke-NUS) wurde 2005 als strategische Kollaboration zwischen der Duke University School of Medicine mit Sitz in North Carolina, USA, und der National University of Singapore (NUS) gegründet. Die Duke-NUS bietet Hochschulabgängern eine 4-jährige medizinische Weiterbildung auf Basis des besonderen Duke-Lehrplans an, nach dem ein Jahr vorgesehen ist, in dem sich der Student einem eigenverantwortlichen Studium und Forschungsprojekten einer Grundlagenwissenschaft oder im klinischen Anwendungsbereich zuwenden kann. Die ersten Studenten haben das Studium am 1. August 2007 aufgenommen. Als Hauptakteur in der biomedizinischen Community von Singapur hat die Duke-NUS fünf Forschungsprogramme benannt, für die sich die Studenten einschreiben können: Krebs und Stammzellbiologie, Neurowissenschaften und Verhaltensstörungen, Neue Infektionskrankheiten, Kardiovaskuläre und Metabolische Störungen sowie Forschung im Bereich Gesundheitsdienste und -systeme.
Über das Singapore Clinical Research Institute Das Singapore Clinical Research Institute (SCRI) ist eine Organisation, die es sich zum strategischen Gebot gemacht hat, die Standards in der klinischen Forschung beim Menschen durch die Förderung der Kernkapazitäten, der Infrastruktur sowie des intellektuellen und wissenschaftlichen Führungsanspruchs in Singapur voranzubringen. Die Organisation verfolgt die Vision, das SCRI und die singapuresische Wissenschaft innerhalb des Verbunds der ASEAN-Staaten zu einem Zentrum für Exzellenz in der klinischen Forschung zu machen.
Ziel des SCRI ist es, die Patientenversorgung durch die Konzeptionierung und Durchführung hochqualitativer klinischer Spitzenforschung zu verbessern. Die Organisation ist selbst beteiligt an und unterstützt akademische, aus staatlichen Mitteln finanzierte und Industrie-gesponsorte Studien, angefangen von Proof-of-concept-Studien über Studien in der späten Phase bis hin zu epidemiologischen Studien.
Das SCRI beschäftigt ein erfahrenes und hochqualifiziertes Team aus Wissenschaftlern und Forschungspersonal, die ein umfassendes Spektrum an Kompetenzen in der klinischen Forschung aufbieten können. Die durch deren Expertise abgedeckten Bereiche beinhalten die klinische Projektentwicklung und -durchführung einschließlich Prüfprotokoll- und Studiendesignerstellung, Projektmanagement und Monitoring der Prüfzentren, Datenmanagement und biostatistische Analyse, epidemiologische und Evidenz-basierte Schlussfolgerungen sowie Weiterbildung in verschiedenen Aspekten der klinischen Forschung.
In der Umsetzung seiner Vision will das SCRI die Kompetenzen Singapurs in der klinischen Forschung noch erweitern und seine Expertise durch die Abwicklung multinationaler Forschung an einem einzelnen oder mehreren Zentren und den Aufbau regionaler Netzwerke für klinische Forschung weiter ausbauen.
15.07.2010 03:00
Veröffentlichung einer Corporate News, übermittelt durch die DGAP - ein Unternehmen der EquityStory AG. Für den Inhalt der Mitteilung ist der Emittent / Herausgeber verantwortlich.
-------------------------------------------------------------------- -------
Organisationsübergreifendes Projekt könnte eine unabhängige Belieferung der Mitglieder der Vereinigung südostasiatischer Staaten (ASEAN) mit Grippeimpfstoff eröffnen und erweitert zudem die F&E-Pipeline von Cytos
Schlieren (Zürich) Schweiz und Singapur - 15. Juli 2010
1. Das Schweizerische Unternehmen Cytos Biotechnology und die singapurische Behörde Agency for Science, Technology and Research (A*STAR), gaben heute gemeinsam ihre erste Zusammenarbeit für ein virusartiges Partikel (VLP)-Vakzin bekannt. Diese Partnerschaft, an der akademische und klinische Partner aus ganz Singapur beteiligt sind (1), hat die Erforschung, Entwicklung und Kommerzialisierung eines VLP-Vakzins (2) zur Prophylaxe von Grippeinfektionen zum Ziel. Die Zusammenarbeit könnte möglicherweise eine unabhängige Belieferung von Singapur und anderen Mitgliedern der Vereinigung südostasiatischer Staaten (ASEAN) mit Vakzinen zum Schutz vor saisonaler Influenza und zukünftigen Pandemien sichern und bringt zudem eine Erweiterung der F&E-Pipeline von Cytos mit sich.
2. Unter dieser Vereinbarung wird Cytos Biotechnology mit dem Experimental Therapeutics Centre (ETC) von A*STAR und dem Singapore Immunology Network (SIgN) zusammenarbeiten, um einen gegen das Influenza-Hämagglutininprotein gerichteten Impfstoff auf VLP-Basis zu entwickeln und herzustellen. Der Impfstoff-Kandidat wird dann in präklinischen Studien zur Sicherheit und Wirksamkeit von den DSO weiteren Beurteilungen unterzogen. Die Duke-NUS Graduate Medical School Singapore und das Singapore Clinical Research Institute werden eine Proof-of-Concept-Studie zur Bewertung der Sicherheit des Vakzins und seiner Fähigkeit zur Induktion Virus-neutralisierender Antikörper (HI-Titer) durchführen. Anschliessend hält Cytos die weltweiten, unterlizenzierbaren Rechte für die weitere Entwicklung, Herstellung und Vermarktung des Vakzins, wohingegen die A*STAR-Unterorganisationen zur Herstellung des Vakzins für Singapur und andere Mitglieder der Vereinigung südostasiatischer Staaten berechtigt sind. Unter dieser Vereinbarung können die A*STAR-Ableger Lizenzgebühren an den weltweiten Verkäufen des entwickelten Grippeimpfstoffes erhalten.
3. Prof. Sir George Radda, Vorsitzender des Biomedical Research Council der A*STAR, der Teile der Forschung finanziert, bemerkte dazu: 'Wir sind von dem Fortgang und Umfang dieser Zusammenarbeit absolut begeistert. Dank der vorhandenen Kapazitäten in Singapur von der Grundlagenforschung bis hin zur translationalen Forschung und dem technischen Know-how von Cytos kann ein solches Produkt von der Entdeckung bis zur klinischen Anwendungsreife gebracht werden, um zeitnah einen kosteneffektiven Schutz gegen Pandemien aufbauen zu können. Wir freuen uns darauf, weitere solcher starken Partnerschaften mit der Industrie und Gesundheitsorganisationen einzugehen, um den Bedürfnissen des öffentlichen Gesundheitswesens gerecht werden zu können und der Gesellschaft zu dienen.'
4. Dr. Martin Bachmann, Chief Scientific Officer bei Cytos, meinte dazu: 'Über den Zugang zu den singapuresischen Exzellenzzentren für Wissenschaft und Arzneimittelentwicklung wird uns die Möglichkeit eröffnet, ein klinisches Proof-of-Concept für eines der VLP-Vakzine von Cytos im prophylaktischen Anwendungsbereich zu erhalten. Die Influenza-Vakzin-Kooperation ist die erste ihrer Art für Cytos und eröffnet uns andererseits die Chance, Singapur und anderen Mitgliedern der Vereinigung südostasiatischer Staaten (ASEAN) darin zu unterstützen, in der Bereitstellung von Vakzinen, die für die auftretenden Probleme und Fragestellungen im öffentlichen Gesundheitswesen relevant sind, autarker zu agieren und dabei auch noch zu einem wertvollen Produktkandidaten zur Erweiterung der bestehenden Pipeline von Cytos beizutragen.'
5. 'Die Zusammenarbeit mit der Duke-NUS Graduate Medical School und dem Experimental Therapeutics Center zur Aufklärung von Influenza-Pandemien und deren Ausbreitung in der Gesellschaft wird uns besser ermöglichen solche Pandemien zu verhindern und unsere Abwehr dagegen zu verstärken. Wir freuen uns darüber, ein Partner dieser Zusammenarbeit zu sein' sagte Quek Gim Pew, Chief Executive Officer bei den DSO National Laboratories.
6. 'Wir sind überzeugt, dass sich das, was Singapur in biomedizinische Forschung investiert hat, in ein Influenza-Vakzin 'Made in Singapur' umsetzen lässt, das besondere Bedeutung bei der Abmilderung von Gesundheitsrisiken erhalten könnte, die sich durch Influenza-Pandemien verschärfen,' meinte Associate Professor Ooi Eng Eong, führender Prüfarzt des Projektes und Virologe an der Duke-NUS Graduate Medical School in Singapur.
7. Prof. Sam Lim, Chief Operating Officer bei SCRI, sagte: 'Wir sind sehr begeistert über die Chance zur Zusammenarbeit über so viele verschiedene Organisationen hinweg, um eine der ersten Phase 1-Vakzinstudien in Singapur auf den Weg zu bringen. Die Singapurer und andere Länder der ASEAN-Region werden in hohem Masse von dieser hochinnovativen klinischen Forschung profitieren.'
(1) Die beteiligten akademischen und klinischen Partner sind die DSO National Laboratories, die Duke-NUS Graduate Medical School und das Singapore Clinical Research Institute (SCRI)
(2) Informationen über virusartige Partikel (VLP)-Vakzine siehe Anhang.
Über die Agency for Science, Technology and Research (A*STAR) A*STAR ist die führende Organisation zur Unterstützung wissenschaftlicher Weltklasseforschung und Förderung von Talenten für ein dynamisches wissensbasiertes und innovationsgesteuertes Singapur. A*STAR steht über 14 biomedizinischen Wissenschaften, physikalischen Wissenschaften und technischen Forschungsinstituten, sowie neun Konsortien&Zentren mit Sitz in Biopolis und Fusionopolis und deren unmittelbarer Umgebung.
A*STAR unterstützt die wichtigsten Wirtschaftscluster in Singapur durch die Bereitstellung von intellektuellem, humanem und industriellen Kapital an die Partner in der Industrie. Sie unterstützt auch extramurale Forschungsaktivitäten an Universitäten, Kliniken, Forschungszentren und in Zusammenarbeit mit anderen lokalen und internationalen Partnern. Weitere Informationen zu A*STAR finden Sie unter der Internetadresse www.a-star.edu.sg.
Über das Experimental Therapeutics Centre (ETC) Das ETC wurde 2006 ins Leben gerufen und spielt seither eine zunehmend bedeutende Rolle in der Übertragung früher wissenschaftlicher Entdeckungen in praktische Anwendungen. Angefangen vom Engagement in der frühen Erkundung und Entwicklung von Wirkstoffen über die Entwicklung innovativer Forschungshilfsmittel für die klinische Analyse bis hin zur Begründung öffentlich-privater Partnerschaften zur unkomplizierten Weiterentwicklung von Wirkstoffkandidaten trägt ETC massgeblich zu den Fähigkeiten und Ressourcen von Singapur im Prozess der Wirkstoffentdeckung bei. Diese Möglichkeiten und Ressourcen werden beim ETC derzeit hauptsächlich auf die Bereiche Onkologie und Infektionskrankheiten ausgerichtet. Auch wird an neuen Technologien für die Kommerzialisierung gearbeitet und es werden junge Wissenschaftler für die Laufbahn in der pharmazeutischen und biotechnologischen Industrie vorbereitet. Weitere Informationen zum ETC finden Sie unter der Internetadresse www.etc.a-star.edu.sg.
Über das Singapore Immunology Network (SIgN) Das Singapore Immunology Network (SIgN), offiziell am 15. Januar 2008 ins Leben gerufen, ist ein unter dem Biomedical Research Council der Agency for Science, Technology and Research (A*STAR) arbeitendes Forschungskonsortium. Der Auftrag von SIgN ist die Erforschung der Humanimmunologie sowie die Teilnahme an internationalen Projekten zur Lösung von wichtigen Gesundheitsproblemen. Seit der Einführung ist die SIgN rasant gewachsen und zählt gegenwärtig 150 Wissenschaftler aus 25 verschieden Ländern, die von 20 renommierten Persönlichkeiten aus der Wissenschaft angeleitet werden. Bei SIgN wird die Immunantwort, ausgelöst durch Infektionen und Entzündungen, sowie Krebs untersucht. Dabei werden die Forscher durch innovative Technologieplattformen und zentrale Forschungsdienstleistungen unterstützt. Dadurch will SIgN eine starke Plattform in der Grundlagenforschung für die Humanimmunologie aufbauen, um die Forschungsergebnisse besser in klinische Anwendungen überführen zu können. SIgN hat sich zudem vorgenommen, produktive Vernetzungen mit lokalen und internationalen Institutionen herzustellen und ermutigt den Austausch von Ideen und Expertisen zwischen Akademien, Industrien und klinischen Partnern und steuert demnach einen Beitrag an die dynamische Forschungsumgebung in Singapur bei. Weitere Informationen über das SIgN finden Sie unter der Internetadresse www.sign.a-star.edu.sg.
Über Cytos Biotechnology AG Cytos Biotechnology AG ist ein börsenkotiertes Schweizer Biotechnologie-Unternehmen, das sich auf die Entdeckung, Entwicklung und Vermarktung einer neuen Klasse von biopharmazeutischen Präparaten - die Immunodrugs(TM) - spezialisiert hat. Immunodrugs(TM) sind für die Anwendung in der Behandlung und Prävention von häufigen chronischen Krankheiten vorgesehen, die weltweit Millionen von Menschen betreffen. Immunodrugs(TM) sollen das Immunsystem des Patienten dazu bringen, erwünschte therapeutische Antikörper oder T-Zellreaktionen zu erzeugen, welche chronische Krankheitsprozesse modulieren. Cytos Biotechnology nutzt die grosse Flexibilität der Immunodrug(TM)-Technologie und hat eine umfassende Pipeline von Immunodrug(TM)-Kandidaten für verschiedene Krankheitsindikationen entwickelt, von denen sich derzeit sechs in der klinischen Entwicklung befinden. Die Immunodrug(TM)-Kandidaten werden sowohl in eigenen Programmen als auch in Zusammenarbeit mit Novartis, Pfizer und Pfizer Tiergesundheit entwickelt. Das 1995 als Spin-off der Eidgenössischen Technischen Hochschule (ETH) Zürich gegründete Unternehmen hat seinen Sitz in Schlieren (Zürich). Gegenwärtig zählt das Unternehmen 76 Vollzeit-Angestellte. Cytos Biotechnology AG ist an der Schweizer Börse SIX Swiss Exchange kotiert (SIX:CYTN). Weitere Informationen zu Cytos Biotechnology finden Sie unter der Internetadresse www.cytos.com
Über die DSO National Laboratories Die DSO National Laboratories (kurz DSO) sind die nationale Forschungs- und Entwicklungsorganisation von Singapur zur Abwehr biologischer Bedrohungen.
Sie entwickeln selbst fortschrittliche Abwehr- und Waffensysteme, die die Streitkräfte von Singapur (SAF) mit der neuesten Technologie für den Ernstfall ausrüsten. Obwohl das Hauptaugenmerk auf der Belieferung der Streitkräfte liegt, agieren die DSO auch im Bereich Forschung und Entwicklung zur Abwehr von Gefahren für die eigene Bevölkerung.
Mit mehr als 1'000 in der Forschung beschäftigten Wissenschaftlern und Technikern befassen sich die DSO mit neuen Technologien, bringen vielversprechende Ansätze zur Anwendungsreife und integrieren diese in innovative Systemkonzepte, um die Bedürfnisse Singapurs in Abwehr- und Sicherheitsfragen zu erfüllen. Weitere Informationen über die DSO finden sie unter der Internetadresse www.dso.org.sg
Über die Duke-NUS Graduate Medical School Singapore www.duke-nus.edu.sg Die Duke-NUS Graduate Medical School Singapore (Duke-NUS) wurde 2005 als strategische Kollaboration zwischen der Duke University School of Medicine mit Sitz in North Carolina, USA, und der National University of Singapore (NUS) gegründet. Die Duke-NUS bietet Hochschulabgängern eine 4-jährige medizinische Weiterbildung auf Basis des besonderen Duke-Lehrplans an, nach dem ein Jahr vorgesehen ist, in dem sich der Student einem eigenverantwortlichen Studium und Forschungsprojekten einer Grundlagenwissenschaft oder im klinischen Anwendungsbereich zuwenden kann. Die ersten Studenten haben das Studium am 1. August 2007 aufgenommen. Als Hauptakteur in der biomedizinischen Community von Singapur hat die Duke-NUS fünf Forschungsprogramme benannt, für die sich die Studenten einschreiben können: Krebs und Stammzellbiologie, Neurowissenschaften und Verhaltensstörungen, Neue Infektionskrankheiten, Kardiovaskuläre und Metabolische Störungen sowie Forschung im Bereich Gesundheitsdienste und -systeme.
Über das Singapore Clinical Research Institute Das Singapore Clinical Research Institute (SCRI) ist eine Organisation, die es sich zum strategischen Gebot gemacht hat, die Standards in der klinischen Forschung beim Menschen durch die Förderung der Kernkapazitäten, der Infrastruktur sowie des intellektuellen und wissenschaftlichen Führungsanspruchs in Singapur voranzubringen. Die Organisation verfolgt die Vision, das SCRI und die singapuresische Wissenschaft innerhalb des Verbunds der ASEAN-Staaten zu einem Zentrum für Exzellenz in der klinischen Forschung zu machen.
Ziel des SCRI ist es, die Patientenversorgung durch die Konzeptionierung und Durchführung hochqualitativer klinischer Spitzenforschung zu verbessern. Die Organisation ist selbst beteiligt an und unterstützt akademische, aus staatlichen Mitteln finanzierte und Industrie-gesponsorte Studien, angefangen von Proof-of-concept-Studien über Studien in der späten Phase bis hin zu epidemiologischen Studien.
Das SCRI beschäftigt ein erfahrenes und hochqualifiziertes Team aus Wissenschaftlern und Forschungspersonal, die ein umfassendes Spektrum an Kompetenzen in der klinischen Forschung aufbieten können. Die durch deren Expertise abgedeckten Bereiche beinhalten die klinische Projektentwicklung und -durchführung einschließlich Prüfprotokoll- und Studiendesignerstellung, Projektmanagement und Monitoring der Prüfzentren, Datenmanagement und biostatistische Analyse, epidemiologische und Evidenz-basierte Schlussfolgerungen sowie Weiterbildung in verschiedenen Aspekten der klinischen Forschung.
In der Umsetzung seiner Vision will das SCRI die Kompetenzen Singapurs in der klinischen Forschung noch erweitern und seine Expertise durch die Abwicklung multinationaler Forschung an einem einzelnen oder mehreren Zentren und den Aufbau regionaler Netzwerke für klinische Forschung weiter ausbauen.
Ziegelbrücke (Godmode-Trader.ch) - Die Cytos Biotechnology AG weist für das erste Halbjahr 2010 einen Umsatz von 21,4 Millionen CHF aus (Vorjahr: 6,6 Millionen CHF). Die Betriebskosten werden mit 14,4 Millionen CHF beziffert, nach 22,4 Millionen CHF im Vorjahr. Unter dem Strich resultierte ein Gewinn von 11,2 Millionen CHF, nach einem Verlust von 18,0 Millionen CHF im Vorjahr.
Mit dem vorgestellten Zahlenset hat Cytos die Erwartungen beim Gewinn übertroffen, beim Umsatz jedoch nicht ganz erreicht. Die Analysten der Bank Vontobel hatten im Vorfeld einen Umsatz von 22,4 Millionen CHF und einen Gewinn von 10,8 Millionen CHF erwartet.
Einen konkreten Ausblick gibt Cytos in seinem Halbjahresbericht nicht Gemäss früherer Angaben sieht sich das Pharmaunternehmen aber bis Beginn 2012 finanziert.
Mit dem vorgestellten Zahlenset hat Cytos die Erwartungen beim Gewinn übertroffen, beim Umsatz jedoch nicht ganz erreicht. Die Analysten der Bank Vontobel hatten im Vorfeld einen Umsatz von 22,4 Millionen CHF und einen Gewinn von 10,8 Millionen CHF erwartet.
Einen konkreten Ausblick gibt Cytos in seinem Halbjahresbericht nicht Gemäss früherer Angaben sieht sich das Pharmaunternehmen aber bis Beginn 2012 finanziert.
Antwort auf Beitrag Nr.: 39.859.508 von R-BgO am 22.07.10 10:31:03Im Laufe des ersten Halbjahr 2010, hat Cytos am Markt Anteile der Wandelanleihe
zurückgekauft. Der Nominalwert dieser Anteile betrug CHF 15,99 Mio. und der
durchschnittliche Kaufpreis betrug 59,81% des Nominalwertes. Diese Rückkäufe
ergaben einen Finanzgewinn von CHF 6,4 Mio.
zurückgekauft. Der Nominalwert dieser Anteile betrug CHF 15,99 Mio. und der
durchschnittliche Kaufpreis betrug 59,81% des Nominalwertes. Diese Rückkäufe
ergaben einen Finanzgewinn von CHF 6,4 Mio.
Cytos Biotechnology sichert sich eine starke Patentposition im Bereich ihrer Kerntechnologie für CYT003-QbG10 zur Behandlung von allergischem Asthma und Rhinitis
Schlieren (Zürich),
Schweiz, 28. September 2010 –
Cytos Biotechnology AG (SIX:CYTN) gab heute neuerliche Fortschritte in seinen Bemühungen zum Ausbau einer starken Position für geistiges Eigentum und Operationsfreiheit um die Kerntechnologie für sein Hauptprodukt CYT003-QbG10 in der Behandlung von allergischem Asthma und Rhinitis bekannt. Zum September 2010 ist die Einspruchsfrist für das erteilte Europäische Patent EP 1 450 856 B1 abgelaufen, ohne dass dritte Parteien Einsprüche eingelegt haben. Dies bedeutet, dass der Patentschutz in Kraft ist und dass vor dem Europäischen Patentamt von einer dritten Partei keine Einwände mehr erhoben werden können. Der breiteste Anspruch dieses Europäischen Patentes umfasst jegliche Produkte, die ein nicht methyliertes CpG-haltiges Oligonukleotid verpackt in einem virus-ähnlichen Partikel enthalten.
Mit dem Europäischen Patent EP 1 450 856 B1 wird Cytos Biotechnology daher eine Position für geistiges Eigentum eingeräumt, die weit über den Produktkandidaten CYT003-QbG10 hinausgeht und die im Wesentlichen die gesamte Bandbreite aller in ein virus-ähnliches Partikel verpackten CpG-Oligonukleotide abdeckt. Das Charakteristikum der Verpackung eines CpG-Oligonukleotids in ein virus-ähnliches Partikel ist wahrscheinlich der Schlüssel zum klinischen Erfolg des Produktkandidaten CYT003-QbG10 in der Behandlung von allergischem Asthma und Rhinitis.
Das Europäische Patent EP 1 450 856 B1 läuft im September 2022 aus. Cytos Biotechnology wurden bereits weitere internationale Patente erteilt bzw. es sind Patente angemeldet, die Exklusivansprüche bis mindestens 2026 gewähren sollten. Dies versetzt unseren zukünftigen Partner in die Lage, das kommerzielle Potential des Produktes zu maximieren.
Cytos Biotechnology berichtet zudem, dass sein eigenes Einspruchsverfahren vor dem Europäischen Patentamt gegen das Europäische Patent EP 0 948 510 B1 einer dritten Partei erfolgreich war und zur vollständigen Aufhebung dieses Patentes geführt hat. Diese vollständige Aufhebung wurde in dem anschliessenden Beschwerdeverfahren bestätigt. Dieser Erfolg bestärkt die Sichtweise von Cytos weiter dahingehend, dass keine gültigen und durchsetzbaren Patentansprüche dritter Parteien existieren, die die Operationsfreiheit im Hinblick auf CYT003-QbG10 einschränken könnten.
Dr. Martin Sperrle, Chief Intellectual Property Officer bei Cytos, kommentierte die jüngsten Entwicklungen wie folgt: «Diese wichtigen Fortschritte in unserem Portfolio für geistiges Eigentum sind eine grosse Stütze in unseren laufenden Gesprächen mit möglichen Partnerunternehmen und stärken unsere führende Position auf diesem Gebiet.»
Schlieren (Zürich),
Schweiz, 28. September 2010 –
Cytos Biotechnology AG (SIX:CYTN) gab heute neuerliche Fortschritte in seinen Bemühungen zum Ausbau einer starken Position für geistiges Eigentum und Operationsfreiheit um die Kerntechnologie für sein Hauptprodukt CYT003-QbG10 in der Behandlung von allergischem Asthma und Rhinitis bekannt. Zum September 2010 ist die Einspruchsfrist für das erteilte Europäische Patent EP 1 450 856 B1 abgelaufen, ohne dass dritte Parteien Einsprüche eingelegt haben. Dies bedeutet, dass der Patentschutz in Kraft ist und dass vor dem Europäischen Patentamt von einer dritten Partei keine Einwände mehr erhoben werden können. Der breiteste Anspruch dieses Europäischen Patentes umfasst jegliche Produkte, die ein nicht methyliertes CpG-haltiges Oligonukleotid verpackt in einem virus-ähnlichen Partikel enthalten.
Mit dem Europäischen Patent EP 1 450 856 B1 wird Cytos Biotechnology daher eine Position für geistiges Eigentum eingeräumt, die weit über den Produktkandidaten CYT003-QbG10 hinausgeht und die im Wesentlichen die gesamte Bandbreite aller in ein virus-ähnliches Partikel verpackten CpG-Oligonukleotide abdeckt. Das Charakteristikum der Verpackung eines CpG-Oligonukleotids in ein virus-ähnliches Partikel ist wahrscheinlich der Schlüssel zum klinischen Erfolg des Produktkandidaten CYT003-QbG10 in der Behandlung von allergischem Asthma und Rhinitis.
Das Europäische Patent EP 1 450 856 B1 läuft im September 2022 aus. Cytos Biotechnology wurden bereits weitere internationale Patente erteilt bzw. es sind Patente angemeldet, die Exklusivansprüche bis mindestens 2026 gewähren sollten. Dies versetzt unseren zukünftigen Partner in die Lage, das kommerzielle Potential des Produktes zu maximieren.
Cytos Biotechnology berichtet zudem, dass sein eigenes Einspruchsverfahren vor dem Europäischen Patentamt gegen das Europäische Patent EP 0 948 510 B1 einer dritten Partei erfolgreich war und zur vollständigen Aufhebung dieses Patentes geführt hat. Diese vollständige Aufhebung wurde in dem anschliessenden Beschwerdeverfahren bestätigt. Dieser Erfolg bestärkt die Sichtweise von Cytos weiter dahingehend, dass keine gültigen und durchsetzbaren Patentansprüche dritter Parteien existieren, die die Operationsfreiheit im Hinblick auf CYT003-QbG10 einschränken könnten.
Dr. Martin Sperrle, Chief Intellectual Property Officer bei Cytos, kommentierte die jüngsten Entwicklungen wie folgt: «Diese wichtigen Fortschritte in unserem Portfolio für geistiges Eigentum sind eine grosse Stütze in unseren laufenden Gesprächen mit möglichen Partnerunternehmen und stärken unsere führende Position auf diesem Gebiet.»
Schlieren (Zürich), Schweiz, 21. Oktober 2010 –
Cytos Biotechnology AG (SIX:CYTN) gab heute bekannt, dass ihm ein Untervertrag von «Science Applications International Corporation» (SAIC) zur Unterstützung der U.S.-amerikanischen «National Institutes of Health» (NIH) in der präklinischen Entwicklung eines Malariaimpfstoffes mit dem «National Institute of Allergy and Infectious Diseases» (NIAID) zugesprochen wurde.
Cytos steuert seine auf virus-ähnlichen Partikeln (VLP) basierende Impftechnologie und -expertise bei, während die NIH ihre Malariaantigenkandidaten in die Zusammenarbeit einbringen. Von Cytos entwickelte Impfstoffe werden in präklinischen Malaria-Modellen von den NIH und SAIC geprüft. Dieses Projekt wird im Ganzen oder teilweise mit staatlichen Geldern des «National Institute of Allergy and Infectious Diseases» unter der Vertragsnummer N01-AI-05421 finanziert.
Dr. Martin Bachmann, CSO bei Cytos Biotechnology bemerkte dazu: «Wir freuen uns sehr mit den NIH, dem weltweit grössten Gesundheitsinstitut als Partner für die Entwicklung neuer Impfstoffe zur Prävention von Malaria zusammenarbeiten zu dürfen und fühlen uns dadurch sehr geehrt, zumal Malaria eine der grössten Bedrohungen für Menschen darstellt, die in Risikoregionen leben oder als Reisende dort hinkommen.
Diese Zusammenarbeit ist die zweite partnerschaftliche Entwicklung von Impfstoffen gegen Infektionskrankheiten mit führenden Forschungsinstituten der Welt nach der neuesten Ankündigung unserer Grippeimpfstoff-Zusammenarbeit mit akademischen Instituten in Singapur. Diese neue Zusammenarbeit zeigt die anhaltende Attraktivität der VLP-Plattform für Partnerschaften in den Augen der führenden biomedizinischen Organisationen in der akademischen Welt und in der Industrie.»
Cytos Biotechnology AG (SIX:CYTN) gab heute bekannt, dass ihm ein Untervertrag von «Science Applications International Corporation» (SAIC) zur Unterstützung der U.S.-amerikanischen «National Institutes of Health» (NIH) in der präklinischen Entwicklung eines Malariaimpfstoffes mit dem «National Institute of Allergy and Infectious Diseases» (NIAID) zugesprochen wurde.
Cytos steuert seine auf virus-ähnlichen Partikeln (VLP) basierende Impftechnologie und -expertise bei, während die NIH ihre Malariaantigenkandidaten in die Zusammenarbeit einbringen. Von Cytos entwickelte Impfstoffe werden in präklinischen Malaria-Modellen von den NIH und SAIC geprüft. Dieses Projekt wird im Ganzen oder teilweise mit staatlichen Geldern des «National Institute of Allergy and Infectious Diseases» unter der Vertragsnummer N01-AI-05421 finanziert.
Dr. Martin Bachmann, CSO bei Cytos Biotechnology bemerkte dazu: «Wir freuen uns sehr mit den NIH, dem weltweit grössten Gesundheitsinstitut als Partner für die Entwicklung neuer Impfstoffe zur Prävention von Malaria zusammenarbeiten zu dürfen und fühlen uns dadurch sehr geehrt, zumal Malaria eine der grössten Bedrohungen für Menschen darstellt, die in Risikoregionen leben oder als Reisende dort hinkommen.
Diese Zusammenarbeit ist die zweite partnerschaftliche Entwicklung von Impfstoffen gegen Infektionskrankheiten mit führenden Forschungsinstituten der Welt nach der neuesten Ankündigung unserer Grippeimpfstoff-Zusammenarbeit mit akademischen Instituten in Singapur. Diese neue Zusammenarbeit zeigt die anhaltende Attraktivität der VLP-Plattform für Partnerschaften in den Augen der führenden biomedizinischen Organisationen in der akademischen Welt und in der Industrie.»
noch 6 Mio. CHF EK übrig; Bond steht mit knapp 40 Mio. in Bilanz
Q1 ist da; jetzt noch 1,9 Mio. EK, wird wohl in Q2 ins Minus drehen
41,1 Mio. Bonds ausstehend
41,1 Mio. Bonds ausstehend
Antwort auf Beitrag Nr.: 41.420.562 von R-BgO am 28.04.11 07:39:37meint ihr der bond wird zurückgezahlt ?
Ich bin ad optimistisch !!
Ich bin ad optimistisch !!
Antwort auf Beitrag Nr.: 41.475.369 von suffkopf am 09.05.11 21:27:57ich muss wohl optimistisch sein, da ich ein paar Stücke halte; aber sicher bin ich mir nicht und der Kurs signalisiert auch eine gehörige Portion Risiko...
Antwort auf Beitrag Nr.: 41.476.682 von R-BgO am 10.05.11 09:10:12ich habe gerade 190 000 gekauft denke das klappt
Antwort auf Beitrag Nr.: 41.481.823 von suffkopf am 10.05.11 22:33:15Wo denn? Finde für den ganzen Tag nur 45.000 Umsatz...
Antwort auf Beitrag Nr.: 41.482.229 von R-BgO am 11.05.11 00:34:11ich kaufe schon seit tagen, aktuell auf 215 000 erhöht...ziel 250 000 sfr
einfacher gehts nicht mit dem geld verdienen !!frage mich welche dollboherer bei 83,52 verkaufen
einfacher gehts nicht mit dem geld verdienen !!frage mich welche dollboherer bei 83,52 verkaufen
Antwort auf Beitrag Nr.: 41.489.428 von suffkopf am 12.05.11 08:41:26etwas Beruhigung sollte einem der Aktienkurs geben. Sind ja immerhin noch knapp 60 Mio Makap fuer ein Unternehmen mit 75 Mitarbeitern.
Und das vor dem Hintergrund das in Kuerze eine saftige Kapitalerhoehung vonnoeten ist die mindestens 50 Mio einspielen sollte.
Alternativ waere es moeglich einen grossen Teil des Unternehmens
via Sonderwandlungsrecht den Gläubigern anzubieten.
Der Cashbestand betraegt aktuell 40 Mio.
Allerdings verbrennt cytos 20 Mio im Jahr.
Und das vor dem Hintergrund das in Kuerze eine saftige Kapitalerhoehung vonnoeten ist die mindestens 50 Mio einspielen sollte.
Alternativ waere es moeglich einen grossen Teil des Unternehmens
via Sonderwandlungsrecht den Gläubigern anzubieten.
Der Cashbestand betraegt aktuell 40 Mio.
Allerdings verbrennt cytos 20 Mio im Jahr.
Antwort auf Beitrag Nr.: 41.497.002 von tofu1 am 13.05.11 10:30:24vontobel hat 9 % der aktien
teil des scheins ist schon getilgt somit nur noch 40 mio übrig...und die will ich kaufen bei den kursen sammel ich bis zur obergrenze logisch oder ?
teil des scheins ist schon getilgt somit nur noch 40 mio übrig...und die will ich kaufen bei den kursen sammel ich bis zur obergrenze logisch oder ?
heute weiter augestockt aber leider kaum etwas bekommen...nicht mehr weit bis zur ziellinie...
kurs bleibt glücklicherweise weiter unten...juhu
kurs bleibt glücklicherweise weiter unten...juhu
Antwort auf Beitrag Nr.: 41.520.636 von suffkopf am 18.05.11 14:52:23der Euroanleger kann jetzt schon bei der cyto schoene Waehrungsgewinne realisieren.
Antwort auf Beitrag Nr.: 41.549.209 von tofu1 am 24.05.11 16:15:09ich leider nicht bin in franken drin ...
Antwort auf Beitrag Nr.: 41.553.103 von suffkopf am 25.05.11 10:32:49aeh, die cytos wa ist eine Frankenanleihe insofern hast Du immer automatisch auch ein Investment im SFR.
Antwort auf Beitrag Nr.: 41.553.477 von tofu1 am 25.05.11 11:23:56ich habe aber auch den kredit in franken aufgenommen und nicht in euro !!
Antwort auf Beitrag Nr.: 41.555.670 von suffkopf am 25.05.11 16:25:05kaufst Du sowas auf Kredit?
wenn ja, dann bist Du VIEL mutiger als ich...
wenn ja, dann bist Du VIEL mutiger als ich...
Antwort auf Beitrag Nr.: 41.555.841 von R-BgO am 25.05.11 16:44:43ja das erhöht die rendite deutlich :-)
Antwort auf Beitrag Nr.: 41.560.516 von suffkopf am 26.05.11 13:39:39in beide Richtungen...
Antwort auf Beitrag Nr.: 41.561.837 von R-BgO am 26.05.11 16:57:29wo ist denn das risiko ?
kreditzisen niedrig
anleihe unterbewertet
rendite 28 % p.a.
Firma hat schon zurückgekauft
reste der anleihe nur noch 40 mio
vontobel großaktionär
klarer kauf...da würde ich mein frau drauf verwetten ....
ich habe das ziel reich zu werden...da will ich hin...und ich werde es schaffen !!
kreditzisen niedrig
anleihe unterbewertet
rendite 28 % p.a.
Firma hat schon zurückgekauft
reste der anleihe nur noch 40 mio
vontobel großaktionär
klarer kauf...da würde ich mein frau drauf verwetten ....
ich habe das ziel reich zu werden...da will ich hin...und ich werde es schaffen !!
Antwort auf Beitrag Nr.: 41.564.863 von suffkopf am 27.05.11 08:49:01meine anleihen konntet ihr heute auch haben, auch wenn eine rendite von 30% drauf stand.
danke an den franken, danke an das baord, danke explizit schnuckelinchen, danke cytos-wandler. bitte an den fiskus.
danke an den franken, danke an das baord, danke explizit schnuckelinchen, danke cytos-wandler. bitte an den fiskus.
Antwort auf Beitrag Nr.: 41.578.128 von harrypr am 30.05.11 21:40:53du schmeisst 30 % weg ?? warum ???
Antwort auf Beitrag Nr.: 41.579.886 von suffkopf am 31.05.11 10:10:18- ich habe meine zielrendite mehr als erreicht
- der EUR/CHF-Kurs hat zusätzlich freude gemacht
- Liquidität sank zum 31.3.11 auf 42 Mio (-6,7 Mio)
- Cash burn rate von 2,1 Mio pro monat
Im Q-Bericht noch der folgende Passus:
Die Gesellschaft unterliegt verschiedenen Risiken und Unsicherheiten. So ist es unter
anderem unsicher, wann der Zeitpunkt nachhaltiger Profitabilität erreicht ist. Ebenso
ist es unsicher, dass Entdeckungen und deren Entwicklung von Immunodrugs™
kommerziell vermarktet werden können, zumal dies von den ungewissen Ergebnissen
klinischer Studien sowie der Ungewissheit, ob wichtige Bewilligungen von Behörden
erteilt werden, abhängt. Die Fähigkeit der Gesellschaft zur Aufrechterhaltung des
Betriebs hängt auch davon ab, seine ausstehende Wandelanleihe zu refinanzieren
und/oder weiteres Kapital zur Finanzierung des operativen Geschäftes zu beschaffen
und somit die Bonität der Gesellschaft zu gewährleisten bis die eingehenden Umsätze
eine Höhe erreicht haben, welche einen positiven Cash Flow gewährleisten. Diese
Unsicherheiten und Risiken zeigen auf, dass eine Weiterführung des Betriebes einer
gewissen Unsicherheit unterliegt.
Unter Berücksichtigung der aktuellen Cashpositionen und der Höhe der Ausgaben
gemäss Managementplan und Budget erwartet das Management der Gesellschaft die
Unternehmensfortführung bis zum 1. Quartal 2012 ohne finanzielle Sanierung als
sichergestellt.
Der Verwaltungsrat und das Management ist nach wie vor zuversichtlich, dass, falls
erforderlich, eine finanzielle Sanierung durchgeführt werden kann, um die
ausstehende Wandelanleihe zu refinanzieren und die für die operative Tätigkeit sowie
die Weiterentwicklung von Aktivitäten der Gesellschaft erforderliche Liquidität in
ausreichendem Umfang bereitzustellen. Aus diesen Gründen haben Verwaltungsrat
und Management entschieden, diesen Abschluss auf Basis der «Unternehmensfortführung
» zu erstellen.
ich persönlich sehe schon ein risiko, dass nicht jeder die firma weiter durchfinanzieren möchte. zumindest erspare ich mir die nerven dies bis q1 2012 mitzumachen und setze mein kapital lieber anders ein; auch wenn die 30% sicher lukrativ sind. die hauptstory ist in diesem investment fuer mich "durch".
- der EUR/CHF-Kurs hat zusätzlich freude gemacht
- Liquidität sank zum 31.3.11 auf 42 Mio (-6,7 Mio)
- Cash burn rate von 2,1 Mio pro monat
Im Q-Bericht noch der folgende Passus:
Die Gesellschaft unterliegt verschiedenen Risiken und Unsicherheiten. So ist es unter
anderem unsicher, wann der Zeitpunkt nachhaltiger Profitabilität erreicht ist. Ebenso
ist es unsicher, dass Entdeckungen und deren Entwicklung von Immunodrugs™
kommerziell vermarktet werden können, zumal dies von den ungewissen Ergebnissen
klinischer Studien sowie der Ungewissheit, ob wichtige Bewilligungen von Behörden
erteilt werden, abhängt. Die Fähigkeit der Gesellschaft zur Aufrechterhaltung des
Betriebs hängt auch davon ab, seine ausstehende Wandelanleihe zu refinanzieren
und/oder weiteres Kapital zur Finanzierung des operativen Geschäftes zu beschaffen
und somit die Bonität der Gesellschaft zu gewährleisten bis die eingehenden Umsätze
eine Höhe erreicht haben, welche einen positiven Cash Flow gewährleisten. Diese
Unsicherheiten und Risiken zeigen auf, dass eine Weiterführung des Betriebes einer
gewissen Unsicherheit unterliegt.
Unter Berücksichtigung der aktuellen Cashpositionen und der Höhe der Ausgaben
gemäss Managementplan und Budget erwartet das Management der Gesellschaft die
Unternehmensfortführung bis zum 1. Quartal 2012 ohne finanzielle Sanierung als
sichergestellt.
Der Verwaltungsrat und das Management ist nach wie vor zuversichtlich, dass, falls
erforderlich, eine finanzielle Sanierung durchgeführt werden kann, um die
ausstehende Wandelanleihe zu refinanzieren und die für die operative Tätigkeit sowie
die Weiterentwicklung von Aktivitäten der Gesellschaft erforderliche Liquidität in
ausreichendem Umfang bereitzustellen. Aus diesen Gründen haben Verwaltungsrat
und Management entschieden, diesen Abschluss auf Basis der «Unternehmensfortführung
» zu erstellen.
ich persönlich sehe schon ein risiko, dass nicht jeder die firma weiter durchfinanzieren möchte. zumindest erspare ich mir die nerven dies bis q1 2012 mitzumachen und setze mein kapital lieber anders ein; auch wenn die 30% sicher lukrativ sind. die hauptstory ist in diesem investment fuer mich "durch".
Antwort auf Beitrag Nr.: 41.580.106 von harrypr am 31.05.11 10:36:07gratuliere gutes ausstiegstiming haste da gehabt, ich bin aber weiterhin optimistisch da der kurs mit extrem geringen umsätzen gesunken ist...bei dem orderbuch kann man selber den kurs wieder hochtreiben....aktull 48 % Rendite p.a.
Antwort auf Beitrag Nr.: 41.605.857 von suffkopf am 06.06.11 09:37:51jetzt wird es aber ein bisschen unruhig; gestern nur noch Kurs 66,01...
aus CASH von gestern:
"Unter die Räder kamen Cytos (-23 Prozent), Kardex (-6 Prozent) und Temenos (-9 Prozent) – aus verschiedenen Gründen. Das Biotech-Unternehmen Cytos steht immer wieder wegen Finanzierungsschwierigkeiten unter Druck. So ist noch offen, wie Cytos im Frühling 2012 eine auslaufende Wandelanleihe zurückzahlen kann."
"Unter die Räder kamen Cytos (-23 Prozent), Kardex (-6 Prozent) und Temenos (-9 Prozent) – aus verschiedenen Gründen. Das Biotech-Unternehmen Cytos steht immer wieder wegen Finanzierungsschwierigkeiten unter Druck. So ist noch offen, wie Cytos im Frühling 2012 eine auslaufende Wandelanleihe zurückzahlen kann."
Antwort auf Beitrag Nr.: 41.698.840 von R-BgO am 25.06.11 08:17:34ja sehr unruhig, der ausstiegszeitpunkt unseres freundes aus obigen posting war gut respekt. Ich pers werde nun weiter kaufen ...da ich von einem Deal mit novartis ausgehe.
20 mio sind ja im feb noch da somit ist der kurs bei ca 50 % abgesichert.denke heute sind kaufkurse !!!
eine neue WA könnte zusätzliches Gled einbrinegn ...ein kapitalerhöhung dagegen bringt wenig da der kurs zu sehr verwässert !!
20 mio sind ja im feb noch da somit ist der kurs bei ca 50 % abgesichert.denke heute sind kaufkurse !!!
eine neue WA könnte zusätzliches Gled einbrinegn ...ein kapitalerhöhung dagegen bringt wenig da der kurs zu sehr verwässert !!
Antwort auf Beitrag Nr.: 41.703.116 von suffkopf am 27.06.11 09:28:55die 20 mio cash braucht cytos um wenigstens noch ein paar Monate zu überleben.
Diese koennen insofern nicht zur Tilgung eingesetzt werden. Insofern gehe ich von einer Verlaengerung der WA aus oder von einem Tausch der Anleihen in Aktien.
Diese koennen insofern nicht zur Tilgung eingesetzt werden. Insofern gehe ich von einer Verlaengerung der WA aus oder von einem Tausch der Anleihen in Aktien.
Antwort auf Beitrag Nr.: 41.707.190 von skbond am 27.06.11 21:15:50novartis wird der nächste partner und zahlt eine abschlagschlagszahlung somit ist alles geregelt meiner meinung nach...wenn nicht tja dann wirds übel...
ordentliche bewegung heute im wandler, ohne erkennbaren newsflow. weiss jemand was?
Antwort auf Beitrag Nr.: 41.721.882 von harrypr am 30.06.11 10:54:08das war gestern heute erst 45 000 ind minus 71 %
warum ? bei 100 % p.a. haben einige ein schnäppchen gemacht aber sicherheit sieht bekanntlioch anders aus !!
warum ? bei 100 % p.a. haben einige ein schnäppchen gemacht aber sicherheit sieht bekanntlioch anders aus !!
Antwort auf Beitrag Nr.: 41.723.420 von suffkopf am 30.06.11 14:40:10jetzt ist was los 135 000 und 74 %
Q2-Bericht ist da:
11. Unsicherheiten und die Fähigkeit, den Betrieb
weiterzuführen
Die Gesellschaft unterliegt verschiedenen Risiken und Unsicherheiten. So ist es unter
anderem unsicher, wann der Zeitpunkt nachhaltiger Profitabilität erreicht ist. Ebenso
ist es unsicher, dass Entdeckungen und deren Entwicklung von Immunodrugs™
kommerziell vermarktet werden können, zumal dies von den ungewissen Ergebnissen
klinischer Studien sowie der Ungewissheit, ob wichtige Bewilligungen von Behörden
erteilt werden, abhängt. Die Fähigkeit der Gesellschaft zur Aufrechterhaltung des
Betriebs hängt auch davon ab, ihre ausstehende Wandelanleihe zu refinanzieren
und/oder weiteres Kapital zur Finanzierung des operativen Geschäftes zu beschaffen
und somit die Bonität der Gesellschaft zu gewährleisten bis die eingehenden Umsätze
eine Höhe erreicht haben, welche einen positiven Cash Flow gewährleisten. Diese
Risiken zeigen auf, dass eine Weiterführung des Betriebes einer gewissen
Unsicherheit unterliegt.
Unter Berücksichtigung der aktuellen Cashpositionen und der Höhe der Ausgaben
gemäss Managementplan und Budget erwartet das Management der Gesellschaft die
Unternehmensfortführung bis zum 1. Quartal 2012 als sichergestellt.
Verwaltungsrat und Management sind nach wie vor zuversichtlich, dass eine
Restrukturierung durchgeführt werden kann, um die ausstehende Wandelanleihe zu
refinanzieren und die für die operative Tätigkeit sowie die Weiterentwicklung von
Aktivitäten der Gesellschaft erforderliche Liquidität in ausreichendem Umfang
bereitzustellen. Aus diesen Gründen haben Verwaltungsrat und Management
entschieden, diesen Abschluss auf Basis der «Unternehmensfortführung» zu
erstellen.
11. Unsicherheiten und die Fähigkeit, den Betrieb
weiterzuführen
Die Gesellschaft unterliegt verschiedenen Risiken und Unsicherheiten. So ist es unter
anderem unsicher, wann der Zeitpunkt nachhaltiger Profitabilität erreicht ist. Ebenso
ist es unsicher, dass Entdeckungen und deren Entwicklung von Immunodrugs™
kommerziell vermarktet werden können, zumal dies von den ungewissen Ergebnissen
klinischer Studien sowie der Ungewissheit, ob wichtige Bewilligungen von Behörden
erteilt werden, abhängt. Die Fähigkeit der Gesellschaft zur Aufrechterhaltung des
Betriebs hängt auch davon ab, ihre ausstehende Wandelanleihe zu refinanzieren
und/oder weiteres Kapital zur Finanzierung des operativen Geschäftes zu beschaffen
und somit die Bonität der Gesellschaft zu gewährleisten bis die eingehenden Umsätze
eine Höhe erreicht haben, welche einen positiven Cash Flow gewährleisten. Diese
Risiken zeigen auf, dass eine Weiterführung des Betriebes einer gewissen
Unsicherheit unterliegt.
Unter Berücksichtigung der aktuellen Cashpositionen und der Höhe der Ausgaben
gemäss Managementplan und Budget erwartet das Management der Gesellschaft die
Unternehmensfortführung bis zum 1. Quartal 2012 als sichergestellt.
Verwaltungsrat und Management sind nach wie vor zuversichtlich, dass eine
Restrukturierung durchgeführt werden kann, um die ausstehende Wandelanleihe zu
refinanzieren und die für die operative Tätigkeit sowie die Weiterentwicklung von
Aktivitäten der Gesellschaft erforderliche Liquidität in ausreichendem Umfang
bereitzustellen. Aus diesen Gründen haben Verwaltungsrat und Management
entschieden, diesen Abschluss auf Basis der «Unternehmensfortführung» zu
erstellen.
Antwort auf Beitrag Nr.: 41.857.298 von R-BgO am 28.07.11 10:39:29habe die WA eben mit kleinem Gewinn geschmissen, nachdem ich versucht habe mir die Ausgangslage eines potentiellen Finanzierers vorzustellen:
Warum sollte ich denen Geld geben?
In 7 Monaten bekomme ich eh' was ich will. Es gibt auch kaum noch Vermögen der Aktionäre, was einen Puffer für die Bondholder darstellen könnte, Buchwert ist bereits negativ.
Kann sein, dass ich mich demnächst noch ärgere, glaube ich aber eher nicht.
Warum sollte ich denen Geld geben?
In 7 Monaten bekomme ich eh' was ich will. Es gibt auch kaum noch Vermögen der Aktionäre, was einen Puffer für die Bondholder darstellen könnte, Buchwert ist bereits negativ.
Kann sein, dass ich mich demnächst noch ärgere, glaube ich aber eher nicht.
hallo,
gratuliere zum gewinn und gutem timing
news heute:
cytos schmeisst 80 % der MA raus. es bleiben noch 10 leute übrig fuer das eine produkt welches auf den markt soll.
die anleihe wird zurückgezahlt aber zu welchem preis ????
es fehlen insgesamt 17 mio zur rückzahlung:
somit liegt der rückkaufkurs jenachdem ob man mit kupon rechnet oder ohne bei ca 55 - 60 %
evtl. finden sich noch investoren die später das produkt erwerben oder eine bank finanziert zwischen ???
aktuell haben die noch ca 36 mio die aber täglich weniger werden....
einen teil haben die schon zurückgekauft.
ich kann mir vorstellen, dass die an der börse nun noch weiter kaufen um die bilanz weiter zu verbessern
in jedem fall wird da jetzt was kommen müssen.
ich hoffe noch auf rettung bin aber eher pessimistisch meine 100 % zu bekommen.
mein Verlust ist somit leider bei 30 % der nominale
Schade aber so ist es
gratuliere zum gewinn und gutem timing
news heute:
cytos schmeisst 80 % der MA raus. es bleiben noch 10 leute übrig fuer das eine produkt welches auf den markt soll.
die anleihe wird zurückgezahlt aber zu welchem preis ????
es fehlen insgesamt 17 mio zur rückzahlung:
somit liegt der rückkaufkurs jenachdem ob man mit kupon rechnet oder ohne bei ca 55 - 60 %
evtl. finden sich noch investoren die später das produkt erwerben oder eine bank finanziert zwischen ???
aktuell haben die noch ca 36 mio die aber täglich weniger werden....
einen teil haben die schon zurückgekauft.
ich kann mir vorstellen, dass die an der börse nun noch weiter kaufen um die bilanz weiter zu verbessern
in jedem fall wird da jetzt was kommen müssen.
ich hoffe noch auf rettung bin aber eher pessimistisch meine 100 % zu bekommen.
mein Verlust ist somit leider bei 30 % der nominale
Schade aber so ist es
Cytos ist so gut wie bankrott
Cytos Biotechnology AG bestätigt strategische und organisatorische Veränderungen mit dem Ziel, den Wert des Lead-Produktes zu erhalten und Lösungen im Hinblick auf die Fälligkeit der Wandelanleihe zu suchen
Nach abgeschlossener Konsultation mit den Mitarbeitenden hat der Verwaltungsrat von Cytos Biotechnology AG einstimmig die Implementierung von Massnahmen zur signifikanten Senkung der Kosten genehmigt, um sich auf ihren hauptsächlichen Vermögenswert, CYT003-QbG10, zu konzentrieren.
Zusätzlich zu den bereits früher mitgeteilten Massnahmen erfolgen folgende Veränderungen:
-Sofortige Reduktion der Anzahl der Mitglieder des Verwaltungsrates und der Geschäftsleitung um je zwei Personen
-Abbau des Personals in zwei Schritten von 80 auf 30 Angestellte und von 30 auf 10 Angestellte. Diese Staffelung hat zum Ziel, CYT003-QbG10 für die weitere Phase II Entwicklung bereit zu stellen.
Schlieren (Zürich), Schweiz, 29. August 2011 – Cytos Biotechnology AG (SIX:CYTN) hat heute strategische und organisatorische Veränderungen bestätigt mit dem Ziel, den Wert ihres wichtigsten, noch nicht auslizensierten Lead-Kandidaten CYT003-QbG10 zu erhalten.
Im Nachgang zur Konsultation mit den Mitarbeiterinnen und Mitarbeitern wird Cytos Biotechnology AG die Belegschaft mit Wirkung per Dezember 2011 auf rund 30 Angestellte und mit Wirkung per Mai 2012 auf rund 10 Angestellte reduzieren. Diese Staffelung ermöglicht es Cytos Biotechnology AG die Voraussetzungen zu schaffen, dass CYT003-QbG10 in die erweiterte Phase II Entwicklung eintreten kann inklusive der Produktion des Wirkstoffes für solche Studien.
Sir Mark Richmond und Dr. Jean-Yves le Cotonnec treten mit sofortiger Wirkung vom Verwaltungsrat zurück, womit der Verwaltungsrat auf drei Mitglieder verkleinert wird, namentlich Dr. Thomas Hecht, Verwaltungsratspräsident und Delegierter des Verwaltungsrates, Dr. Thorlef Spickschen, Vizepräsident des Verwaltungsrates und Jakob Schlapbach.
Sowohl Sir Mark Richmond wie auch Dr. Jean-Yves le Cotonnec stehen dem Verwaltungsrat bei Bedarf beratend zur Verfügung. Die Geschäftsleitung wird von Dr. Thomas Hecht geleitet und besteht ab sofort aus Harry Welten, Chief Financial Officer, Dr. Philipp Müller, Head of Clinical Development, und Dr. Frank Hennecke, Head of Product Development.
Nach abgeschlossener Konsultation mit den Mitarbeitenden hat der Verwaltungsrat von Cytos Biotechnology AG einstimmig die Implementierung von Massnahmen zur signifikanten Senkung der Kosten genehmigt, um sich auf ihren hauptsächlichen Vermögenswert, CYT003-QbG10, zu konzentrieren.
Zusätzlich zu den bereits früher mitgeteilten Massnahmen erfolgen folgende Veränderungen:
-Sofortige Reduktion der Anzahl der Mitglieder des Verwaltungsrates und der Geschäftsleitung um je zwei Personen
-Abbau des Personals in zwei Schritten von 80 auf 30 Angestellte und von 30 auf 10 Angestellte. Diese Staffelung hat zum Ziel, CYT003-QbG10 für die weitere Phase II Entwicklung bereit zu stellen.
Schlieren (Zürich), Schweiz, 29. August 2011 – Cytos Biotechnology AG (SIX:CYTN) hat heute strategische und organisatorische Veränderungen bestätigt mit dem Ziel, den Wert ihres wichtigsten, noch nicht auslizensierten Lead-Kandidaten CYT003-QbG10 zu erhalten.
Im Nachgang zur Konsultation mit den Mitarbeiterinnen und Mitarbeitern wird Cytos Biotechnology AG die Belegschaft mit Wirkung per Dezember 2011 auf rund 30 Angestellte und mit Wirkung per Mai 2012 auf rund 10 Angestellte reduzieren. Diese Staffelung ermöglicht es Cytos Biotechnology AG die Voraussetzungen zu schaffen, dass CYT003-QbG10 in die erweiterte Phase II Entwicklung eintreten kann inklusive der Produktion des Wirkstoffes für solche Studien.
Sir Mark Richmond und Dr. Jean-Yves le Cotonnec treten mit sofortiger Wirkung vom Verwaltungsrat zurück, womit der Verwaltungsrat auf drei Mitglieder verkleinert wird, namentlich Dr. Thomas Hecht, Verwaltungsratspräsident und Delegierter des Verwaltungsrates, Dr. Thorlef Spickschen, Vizepräsident des Verwaltungsrates und Jakob Schlapbach.
Sowohl Sir Mark Richmond wie auch Dr. Jean-Yves le Cotonnec stehen dem Verwaltungsrat bei Bedarf beratend zur Verfügung. Die Geschäftsleitung wird von Dr. Thomas Hecht geleitet und besteht ab sofort aus Harry Welten, Chief Financial Officer, Dr. Philipp Müller, Head of Clinical Development, und Dr. Frank Hennecke, Head of Product Development.
die planen über den 20.2 hinaus ...??? wo wollen die denn das geld hernehmen ?
Cytos wird vom Handel ausgesetzt
von Tomke Hansmann
Donnerstag 10.11.2011, 08:40 Uhr
http://www.godmode-trader.ch/nachricht/Cytos-wird-vom-Handel…
Schlieren (Godmode-Trader.ch) –
Die Aktien und Wandelanleihen des angeschlagenen Biotechunternehmens Cytos werden am Donnerstag zunächst vom Handel ausgesetzt. Hintergrund ist, dass die Gläubiger heute über die Restrukturierung der Wandelanleihe entscheiden. „Weil der Ausgang der Versammlung unbekannt und potenziell kursrelevant ist, hat Cytos bei der SIX Swiss Exchange beantragt, den Handel von Cytos Aktien wie auch Wandelanleihen heute von Handelsbeginn an bis mindestens eine Stunde nach Versand der Pressemitteilung betreffend den Ausgang der Versammlung zu suspendieren“, teilte Cytos mit.
von Tomke Hansmann
Donnerstag 10.11.2011, 08:40 Uhr
http://www.godmode-trader.ch/nachricht/Cytos-wird-vom-Handel…
Schlieren (Godmode-Trader.ch) –
Die Aktien und Wandelanleihen des angeschlagenen Biotechunternehmens Cytos werden am Donnerstag zunächst vom Handel ausgesetzt. Hintergrund ist, dass die Gläubiger heute über die Restrukturierung der Wandelanleihe entscheiden. „Weil der Ausgang der Versammlung unbekannt und potenziell kursrelevant ist, hat Cytos bei der SIX Swiss Exchange beantragt, den Handel von Cytos Aktien wie auch Wandelanleihen heute von Handelsbeginn an bis mindestens eine Stunde nach Versand der Pressemitteilung betreffend den Ausgang der Versammlung zu suspendieren“, teilte Cytos mit.
Die heutige Gläubigerversammlung der Cytos Biotechnology AG hat nicht die benötigte Anzahl Stimmen erreicht, um rechtsgültig die Anträge zur Restrukturierung zu bewilligen. Cytos versucht deshalb, nicht eingereichte Stimmen von den Anleihensgläubigern nachträglich einzuholen.
Schlieren (Zürich), Schweiz, 10. November 2011 – Cytos Biotechnology AG hat, wie bereits am 20. Oktober 2011 bekannt gegeben, für heute eine Gläubigerversammlung einberufen mit dem Ziel, die Zustimmung zur vorgeschlagenen Restrukturierung der ausstehenden Wandelanleihen zu erhalten.
Im Vergleich zu den am 20. Oktober 2011 bekannt gegebenen Bedingungen, hat die Gesellschaft den Anleihensgläubigern folgende, verbesserte Konditionen angeboten:
Erhöhung der Rückzahlung der verbleibenden 50% Nominalwert pro ausstehender Wandelanleihe von 100% auf 150%.
Erhöhung der Rückzahlung im Falle einer vorzeitigen Rückzahlung durch Cytos von 100% auf 150%.
Rücknahme der Möglichkeit zur jederzeitigen Rückzahlung durch Cytos.
Cytos’ Recht zur Rückzahlung aller ausstehenden Wandelanleihen zu 150% des Nominalwerts, falls der Schlusskurs der Cytos Aktie während 20 aufeinanderfolgenden Börsentagen eine gewisse Schwelle überschreitet, wurde von 140% auf 190% erhöht.
Ingesamt waren 51.37% aller ausstehenden Anleihen mit einem Nominalwert von CHF 35’945’000 an der Gläubigerversammlung vertreten und stimmten wie folgt über die fünf vorgeschlagenen Anträge ab:
50.95% des ausstehenden Nominalwerts (dies stellt 99.19% des anwesenden Nominalwerts dar) stimmten zu Gunsten von Antrag 1, wohingegen 0.28% dagegen stimmten. 0.14% des ausstehenden Nominalwerts enthielten sich der Stimme.
51.37% des ausstehenden Nominalwerts (dies stellt 100% des anwesenden Nominalwerts dar) stimmten zu Gunsten von Antrag 2.
51.34% des ausstehenden Nominalwerts (dies stellt 99.95% des anwesenden Nominalwerts dar) stimmten zu Gunsten von Antrag 3, wohingegen 0% dagegen stimmten. 0.03% des ausstehenden Nominalwerts enthielten sich der Stimme.
48.92% des ausstehenden Nominalwerts (dies stellt 95.23% des anwesenden Nominalwerts dar) stimmten zu Gunsten von Antrag 4, wohingegen 2.42% dagegen stimmten. 0.03% des ausstehenden Nominalwerts enthielten sich der Stimme.
49.58% des ausstehenden Nominalwerts (dies stellt 96.51% des anwesenden Nominalwerts dar) stimmten zu Gunsten von Antrag 5, wohingegen 1.65% dagegen stimmten. 0.14% des ausstehenden Nominalwerts enthielten sich der Stimme.
Folglich wurde die erforderliche Mehrheit von 2/3 des ausstehenden Nominalwerts, um die Anträge rechtsgültig zu bewilligen, nicht erreicht.
Die Hauptgründe für dieses Ergebnis sind wie folgt:
Die erforderliche Mehrheit von 2/3 des ausstehenden Nominalwerts stellt eine hohe Hürde dar und ist darum im Allgemeinen schwer zu erreichen, da eine substanzielle Anzahl von Anleihensgläubigern in der Regel nicht die Möglichkeit wahrnimmt, an einer Gläubigerversammlung abzustimmen.
Mit Ausnahme weniger Anleihensgläubiger, die eine bedeutende Anzahl von Wandelanleihen in ihrem Besitz haben, ist die Zahl derjenigen Anleihensgläubiger, die nur eine geringe Anzahl von Wandelanleihen besitzen, sehr gross. Der Gesellschaft ist lediglich eine geringe Anzahl von Anleihensgläubigern bekannt wodurch die Möglichkeit, aktiv nach unterstützenden Stimmen zu suchen, erheblich erschwert wird.
Die Rücklaufquote beträgt ungefähr 50%. Demzufolge haben etwa 50% ihre Stimmen nicht abgegeben was gleichbedeutend ist wie wenn diese Anleihensgläubiger mit „nein“ gestimmt hätten.
Cytos Biotechnology AG darf mit den von der Gesellschaft zurückgekauften Wandelanleihen nicht stimmen.
Laut der schweizerischen Gesetzgebung hat Cytos nun zwei Monate Zeit, um weitere Stimmen von Anleihensgläubigern zu gewinnen, welche weder an der Versammlung präsent noch repräsentiert waren. Die Gesellschaft wird zur gegebenen Zeit über die diesbezüglichen Fortschritte berichten. Des Weiteren wird Cytos alle der Gesellschaft offenstehenden Möglichkeiten eruieren.
Schlieren (Zürich), Schweiz, 10. November 2011 – Cytos Biotechnology AG hat, wie bereits am 20. Oktober 2011 bekannt gegeben, für heute eine Gläubigerversammlung einberufen mit dem Ziel, die Zustimmung zur vorgeschlagenen Restrukturierung der ausstehenden Wandelanleihen zu erhalten.
Im Vergleich zu den am 20. Oktober 2011 bekannt gegebenen Bedingungen, hat die Gesellschaft den Anleihensgläubigern folgende, verbesserte Konditionen angeboten:
Erhöhung der Rückzahlung der verbleibenden 50% Nominalwert pro ausstehender Wandelanleihe von 100% auf 150%.
Erhöhung der Rückzahlung im Falle einer vorzeitigen Rückzahlung durch Cytos von 100% auf 150%.
Rücknahme der Möglichkeit zur jederzeitigen Rückzahlung durch Cytos.
Cytos’ Recht zur Rückzahlung aller ausstehenden Wandelanleihen zu 150% des Nominalwerts, falls der Schlusskurs der Cytos Aktie während 20 aufeinanderfolgenden Börsentagen eine gewisse Schwelle überschreitet, wurde von 140% auf 190% erhöht.
Ingesamt waren 51.37% aller ausstehenden Anleihen mit einem Nominalwert von CHF 35’945’000 an der Gläubigerversammlung vertreten und stimmten wie folgt über die fünf vorgeschlagenen Anträge ab:
50.95% des ausstehenden Nominalwerts (dies stellt 99.19% des anwesenden Nominalwerts dar) stimmten zu Gunsten von Antrag 1, wohingegen 0.28% dagegen stimmten. 0.14% des ausstehenden Nominalwerts enthielten sich der Stimme.
51.37% des ausstehenden Nominalwerts (dies stellt 100% des anwesenden Nominalwerts dar) stimmten zu Gunsten von Antrag 2.
51.34% des ausstehenden Nominalwerts (dies stellt 99.95% des anwesenden Nominalwerts dar) stimmten zu Gunsten von Antrag 3, wohingegen 0% dagegen stimmten. 0.03% des ausstehenden Nominalwerts enthielten sich der Stimme.
48.92% des ausstehenden Nominalwerts (dies stellt 95.23% des anwesenden Nominalwerts dar) stimmten zu Gunsten von Antrag 4, wohingegen 2.42% dagegen stimmten. 0.03% des ausstehenden Nominalwerts enthielten sich der Stimme.
49.58% des ausstehenden Nominalwerts (dies stellt 96.51% des anwesenden Nominalwerts dar) stimmten zu Gunsten von Antrag 5, wohingegen 1.65% dagegen stimmten. 0.14% des ausstehenden Nominalwerts enthielten sich der Stimme.
Folglich wurde die erforderliche Mehrheit von 2/3 des ausstehenden Nominalwerts, um die Anträge rechtsgültig zu bewilligen, nicht erreicht.
Die Hauptgründe für dieses Ergebnis sind wie folgt:
Die erforderliche Mehrheit von 2/3 des ausstehenden Nominalwerts stellt eine hohe Hürde dar und ist darum im Allgemeinen schwer zu erreichen, da eine substanzielle Anzahl von Anleihensgläubigern in der Regel nicht die Möglichkeit wahrnimmt, an einer Gläubigerversammlung abzustimmen.
Mit Ausnahme weniger Anleihensgläubiger, die eine bedeutende Anzahl von Wandelanleihen in ihrem Besitz haben, ist die Zahl derjenigen Anleihensgläubiger, die nur eine geringe Anzahl von Wandelanleihen besitzen, sehr gross. Der Gesellschaft ist lediglich eine geringe Anzahl von Anleihensgläubigern bekannt wodurch die Möglichkeit, aktiv nach unterstützenden Stimmen zu suchen, erheblich erschwert wird.
Die Rücklaufquote beträgt ungefähr 50%. Demzufolge haben etwa 50% ihre Stimmen nicht abgegeben was gleichbedeutend ist wie wenn diese Anleihensgläubiger mit „nein“ gestimmt hätten.
Cytos Biotechnology AG darf mit den von der Gesellschaft zurückgekauften Wandelanleihen nicht stimmen.
Laut der schweizerischen Gesetzgebung hat Cytos nun zwei Monate Zeit, um weitere Stimmen von Anleihensgläubigern zu gewinnen, welche weder an der Versammlung präsent noch repräsentiert waren. Die Gesellschaft wird zur gegebenen Zeit über die diesbezüglichen Fortschritte berichten. Des Weiteren wird Cytos alle der Gesellschaft offenstehenden Möglichkeiten eruieren.
Antwort auf Beitrag Nr.: 42.333.419 von R-BgO am 10.11.11 19:46:33Damit gehen dann doch wohl bei cytos die lichter aus, oder ? Wie sollen die denn in den naechsten 8 wochen noch die haelfte aller noch ausstehenden, also noch nicht teilnehmenden glaeubiger, zur zustimmung bewegen ? Frage mich nur warum die aktien nich bei 0,x steht. Denn fuer die aktionaere bleibt doch bei der insolvenz nichts uebrig. An alle in cytos investierten: warum haltet ihr an der aktie fest ? Was ist euer scenario ?
Antwort auf Beitrag Nr.: 42.343.348 von skbond am 13.11.11 16:00:22noch nicht:
Cytos Biotechnology AG erhält die zusätzlich notwendigen Stimmen um die Restrukturierung ihrer Wandelanleihe rechtsgültig bewilligen zu lassen. Unter Vorbehalt der Zustimmung durch das Gericht ist die Weiterführung von Cytos sichergestellt.
Schlieren (Zürich), Schweiz, 12. Dezember 2011 – Cytos Biotechnology AG (“Cytos”) hat heute bekannt gegeben, dass sie erfolgreich die zusätzlich benötigten Stimmen von Anleihensgläubigern erhalten hat um die Restrukturierung der Wandelanleihe rechtsgültig bewilligen zu lassen.
Cytos wird nun die anlässlich der Gläubigerversammlung vom 10. November 2011 bewilligten fünf Resolutionen, für welche das benötigte Quorum von zwei Drittel der ausstehenden Wandelanleihe nunmehr erreicht wurde, an die Obere Kantonale Nachlassbehörde zur Genehmigung einreichen. Die Anleihensrestrukturierung erlangt Rechtskraft sobald diese Genehmigung vorliegt.
Cytos hat zudem bekannt gegeben, dass sie Wandelanleihen im Betrag von nominal CHF 1.225 Millionen mittels eines Pflichtwandeldarlehens im selben Betrag hat refinanzieren können. Aufgrund der Pflichtwandlung des Darlehens in neu geschaffene Cytos Aktien wird die Verschuldung von Cytos zusätzlich reduziert.
Der anwendbare Wandlungspreis beträgt CHF 2.50 pro Aktie entsprechend einer Prämie von 29% zum volumen-gewichteten Aktienkurs der letzten sechzig Handelstage vor dem Erscheinen dieser Pressemitteilung. Das Zustandekommen dieser Refinanzierung hängt von der Genehmigung der Restrukturierung der Wandelanleihe ab.
Cytos Biotechnology AG erhält die zusätzlich notwendigen Stimmen um die Restrukturierung ihrer Wandelanleihe rechtsgültig bewilligen zu lassen. Unter Vorbehalt der Zustimmung durch das Gericht ist die Weiterführung von Cytos sichergestellt.
Schlieren (Zürich), Schweiz, 12. Dezember 2011 – Cytos Biotechnology AG (“Cytos”) hat heute bekannt gegeben, dass sie erfolgreich die zusätzlich benötigten Stimmen von Anleihensgläubigern erhalten hat um die Restrukturierung der Wandelanleihe rechtsgültig bewilligen zu lassen.
Cytos wird nun die anlässlich der Gläubigerversammlung vom 10. November 2011 bewilligten fünf Resolutionen, für welche das benötigte Quorum von zwei Drittel der ausstehenden Wandelanleihe nunmehr erreicht wurde, an die Obere Kantonale Nachlassbehörde zur Genehmigung einreichen. Die Anleihensrestrukturierung erlangt Rechtskraft sobald diese Genehmigung vorliegt.
Cytos hat zudem bekannt gegeben, dass sie Wandelanleihen im Betrag von nominal CHF 1.225 Millionen mittels eines Pflichtwandeldarlehens im selben Betrag hat refinanzieren können. Aufgrund der Pflichtwandlung des Darlehens in neu geschaffene Cytos Aktien wird die Verschuldung von Cytos zusätzlich reduziert.
Der anwendbare Wandlungspreis beträgt CHF 2.50 pro Aktie entsprechend einer Prämie von 29% zum volumen-gewichteten Aktienkurs der letzten sechzig Handelstage vor dem Erscheinen dieser Pressemitteilung. Das Zustandekommen dieser Refinanzierung hängt von der Genehmigung der Restrukturierung der Wandelanleihe ab.
Das sieht gut aus 

Cytos setzt derzeit alles auf eine Karte. Floppt die Heuschnupfenarznei CYT003-QbG10 dürfte es ganz eng für die Schweizer werden...
weiterlesen:www.transkript.de
weiterlesen:www.transkript.de
Restrukturierung der Wandelanleihe rechtskräftig. Weiterführung von Cytos sichergestellt.
Schlieren (Zürich), Schweiz, 13. März 2012 – Cytos Biotechnology AG («Cytos») hat heute bekannt gegeben, dass die vom Obergericht des Kantons Zürich als Obere Kantonale Nachlassbehörde erteilte Genehmigung der Restrukturierung der Wandelanleihe rechtskräftig wurde und die Nominalwertreduktion in Form einer Zahlung von CHF 2’500 pro Wandelobligation von CHF 5’000 per 20. März 2012 erfolgen wird. Wie bereits bekannt gegeben, wird Cytos in eigenem Besitz gehaltene Wandelobligationen im Totalbetrag von nominal CHF 31’255’000 vernichten.
Harry Welten, Chief Financial Officer von Cytos, meinte hierzu: «Die erfolgreiche Restrukturierung der Wandelanleihe stellt die Weiterführung von Cytos sicher und ermöglicht eine potentielle Maximierung des Wertes von Cytos’ Hauptprodukt, CYT003-QbG10.»
Zusätzliche Informationen können von folgender Webseite heruntergeladen werden: http://www.cytos.com/bondrestructuring.
Schlieren (Zürich), Schweiz, 13. März 2012 – Cytos Biotechnology AG («Cytos») hat heute bekannt gegeben, dass die vom Obergericht des Kantons Zürich als Obere Kantonale Nachlassbehörde erteilte Genehmigung der Restrukturierung der Wandelanleihe rechtskräftig wurde und die Nominalwertreduktion in Form einer Zahlung von CHF 2’500 pro Wandelobligation von CHF 5’000 per 20. März 2012 erfolgen wird. Wie bereits bekannt gegeben, wird Cytos in eigenem Besitz gehaltene Wandelobligationen im Totalbetrag von nominal CHF 31’255’000 vernichten.
Harry Welten, Chief Financial Officer von Cytos, meinte hierzu: «Die erfolgreiche Restrukturierung der Wandelanleihe stellt die Weiterführung von Cytos sicher und ermöglicht eine potentielle Maximierung des Wertes von Cytos’ Hauptprodukt, CYT003-QbG10.»
Zusätzliche Informationen können von folgender Webseite heruntergeladen werden: http://www.cytos.com/bondrestructuring.
das hört sich gut an:
von der Cytos HP
MEDIA RELEASE MEDIENMITTEILUNG COMMUNIQUE AUX MEDIAS
Internationale strategische Investoren investieren bis zu CHF 37
Millionen in Cytos, um das Asthma Programm weiter zu
entwickeln
von der Cytos HP
Das dürfte helfen 
Cytos revives lead program in $40M financing deal with Amgen, venBio
March 21, 2012 — 7:53am ET | By Ryan McBride
Swiss biotech Cytos has scraped together $40 million to advance its pipeline of immunotherapies, giving itself much-needed capital after a cash crunch last summer forced the company to ax most of its staff. And now the biotech has the funds to propel its lead drug CYT003 into a Phase IIb trial for allergic asthma.
VenBio led the new financing, which includes equity, debt and warrants, and was joined by a syndicate of backers that includes biotech giant Amgen ($AMGN) and the investment firms Abingworth and Aisling Capital. The deal includes CHF 23.75 million in equity and CHF 13.25 million in convertible notes, and the transaction wraps up the restructuring of debt that the company announced last year, according to its release. Amgen and the rest of the syndicate will own a 54% stake in Cytos at the close of the deal, with an even greater stake in the offing if notes are converted and warrants exercised.
Cytos and its investors in the new financing deal have agreed to bring new blood to the company's board of directors, including Arthur Krieg, CEO of RaNA Therapeutics, John Berriman, deputy chairman of Algeta, Kurt von Emster and Paul Brooke of venBio, as well as Joe Anderson of Abingworth. Thoref Spickschen, who was elected vice chairman in 2010, won't be running for reelection to the board, according to the company's release.
The financing and terms of the deal are expected to be up for approval at the company's next annual shareholder meeting.
"Amgen recognizes there is significant unmet medical need for the treatment of asthma and we are pleased to support the ongoing development of CYT003, a novel immunotherapy based treatment approach which has already generated promising data in a number of earlier clinical studies," Sean Harper, Amgen's executive vice president of R&D, said in a statement.
Indeed, if CYT003 turns out to be a winner in the blockbuster market for allergy meds, the syndicate will make out like bandits with their bet on Cytos.
http://www.fiercebiotech.com/story/cytos-revives-lead-progra…

Cytos revives lead program in $40M financing deal with Amgen, venBio
March 21, 2012 — 7:53am ET | By Ryan McBride
Swiss biotech Cytos has scraped together $40 million to advance its pipeline of immunotherapies, giving itself much-needed capital after a cash crunch last summer forced the company to ax most of its staff. And now the biotech has the funds to propel its lead drug CYT003 into a Phase IIb trial for allergic asthma.
VenBio led the new financing, which includes equity, debt and warrants, and was joined by a syndicate of backers that includes biotech giant Amgen ($AMGN) and the investment firms Abingworth and Aisling Capital. The deal includes CHF 23.75 million in equity and CHF 13.25 million in convertible notes, and the transaction wraps up the restructuring of debt that the company announced last year, according to its release. Amgen and the rest of the syndicate will own a 54% stake in Cytos at the close of the deal, with an even greater stake in the offing if notes are converted and warrants exercised.
Cytos and its investors in the new financing deal have agreed to bring new blood to the company's board of directors, including Arthur Krieg, CEO of RaNA Therapeutics, John Berriman, deputy chairman of Algeta, Kurt von Emster and Paul Brooke of venBio, as well as Joe Anderson of Abingworth. Thoref Spickschen, who was elected vice chairman in 2010, won't be running for reelection to the board, according to the company's release.
The financing and terms of the deal are expected to be up for approval at the company's next annual shareholder meeting.
"Amgen recognizes there is significant unmet medical need for the treatment of asthma and we are pleased to support the ongoing development of CYT003, a novel immunotherapy based treatment approach which has already generated promising data in a number of earlier clinical studies," Sean Harper, Amgen's executive vice president of R&D, said in a statement.
Indeed, if CYT003 turns out to be a winner in the blockbuster market for allergy meds, the syndicate will make out like bandits with their bet on Cytos.
http://www.fiercebiotech.com/story/cytos-revives-lead-progra…
Cytos mit Befreiungsschlag
Die nach Entwicklungsfehlschlägen ins Straucheln geratene Cytos Biotechnology AG bekommt eine Finanzspritze in Millionenhöhe.
Weiterlesen auf www.transkript.de
Die nach Entwicklungsfehlschlägen ins Straucheln geratene Cytos Biotechnology AG bekommt eine Finanzspritze in Millionenhöhe.
Weiterlesen auf www.transkript.de
Q1 Bericht ist da:
http://www.cytos.com/userfiles/file/Cytos_Q1_2012_D.pdf
http://www.cytos.com/userfiles/file/Cytos_Q1_2012_D.pdf
Wichtige Ereignisse in Q1 2012
– Internationale strategische Investoren investieren bis zu CHF 37 Millionen in Cytos, um das
Asthma Programm weiter zu entwickeln.
– Restrukturierung der Wandelanleihe rechtskräftig. Weiterführung von Cytos sichergestellt.
Nachricht vom 30.07.2012 | 07:00
Cytos Biotechnology AG gibt die Finanzresultate für das zweite Quartal 2012 bekannt und informiert über neuere Entwicklungen und Ausschau
Cytos Biotechnology AG / Schlagwort(e): Halbjahresergebnis
30.07.2012 / 07:00
Cytos Biotechnology AG gibt die Finanzresultate für das zweite Quartal 2012 bekannt und informiert über neuere Entwicklungen und Ausschau
- Cytos Biotechnology AG erhöht ihre flüssigen Mittel beträchtlich indem sie CHF 33.58 Millionen in Form von Eigen- und Fremdkapital aufnimmt
- Zusätzlich Stärkung des Verwaltungsrates durch die Nomination von Dr. Christian Itin, vormals Präsident und CEO von Micromet Inc. als nicht-exekutiver Verwaltungsrat
- Start einer grossen globale Phase IIb Studie in allergischem Asthma mit CYT003 in der zweiten Jahreshälfte geplant
Schlieren (Zürich), Schweiz, 30. Juli 2012 - Cytos Biotechnology AG ('Cytos') hat heute die Finanzzahlen sowie die wichtigsten Ereignisse für das zweite Quartal 2012 bekannt gegeben.
Highlights
Während der ersten Jahreshälfte 2012 hat Cytos ihre Finanzmittel substantiell um CHF 33.58 Mio. verstärkt, wobei CHF 23.75 Mio. in Form von Eigenkapital und CHF 6.625 Mio. in Form von Wandeldarlehen aufgenommen wurden. Beides stammt von einem internationalen Investorensyndikat, das aus venBio, Abingworth, Aisling Capital und Amgen besteht. Zudem konnten weitere CHF 3.20 Mio. in Form von Eigenkapital mittels einer Bezugsrechtsemission für die bestehenden Aktionäre aufgenommen werden. Cytos beabsichtigt, diese Finanzmittel primär für die Durchführung einer grossen, globalen Phase IIb Studie in allergischem Asthma mit CYT003 zu verwenden.
Im Zusammenhang mit der Kapitalerhöhung sind folgende Personen zusätzlich für den Verwaltungsrat vorgeschlagen und von der Generalversammlung am 20. April 2012 gewählt worden: Dr. Joseph Anderson (Abingworth), John Berriman (Vizepräsident des Verwaltungsrates von Algeta), Paul Brooke (venBio), Kurt von Emster (venBio) und Dr. Arthur Krieg (CEO von RaNA Therapeutics). Ihre Amtszeit startete am 14. Mai 2012. Die neuen Verwaltungsratsmitglieder bringen bedeutende zusätzliche Erfahrung im Gesundheitswesen mit.
Im Mai 2012 hat Cytos die Nominierung von Dr. Christian Itin als Verwaltungsratsmitglied bekanntgegeben. Der Verwaltungsrat von Cytos wird Dr. Itin den Aktionären an der nächsten Generalversammlung zur Wahl in den Verwaltungsrat vorschlagen. Dr. Itin ist der frühere President und CEO der Firma Micromet Inc., eines ehemals an der Nasdaq kotierten biopharmazeutischen Unternehmens, das im März 2012, von Amgen Inc. für US$ 1.16 Milliarden in bar übernommen wurde. Dr. Itin war für Micromet während 13 Jahren in verschiedenen Führungsfunktionen tätig und wurde 2004 deren CEO.
Die detaillierten Finanzzahlen zum zweiten Quartal 2012 können auf folgender Webseite heruntergeladen werden: http://www.cytos.com/userfiles/file/Cytos_Q2_2012_D.pdf
Für weitere Informationen wenden Sie sich bitte an:
Cytos Biotechnology AG
Harry Welten
Chief Financial Officer
Tel.: +41 44 733 46 46
e-Mail: harry.welten@cytos.com
Website: www.cytos.com
Über Cytos Biotechnology
Cytos Biotechnology AG ist ein börsenkotiertes Schweizer Biotechnologie-Unternehmen, das sich auf die Entwicklung und Vermarktung einer neuen Klasse von biopharmazeutischen Präparaten - die Immunodrugs(TM) - spezialisiert hat. Immunodrugs(TM) sind für die Anwendung in der Behandlung und Prävention von häufigen chronischen Krankheiten vorgesehen, die weltweit Millionen von Menschen betreffen. Immunodrugs(TM) sollen das Immunsystem des Patienten dazu bringen, erwünschte therapeutische Antikörper oder T-Zellreaktionen zu erzeugen, welche chronische Krankheitsprozesse modulieren. Die Immunodrug(TM)-Kandidaten werden sowohl in eigenen Programmen als auch in Zusammenarbeit mit Novartis, Pfizer und Pfizer Tiergesundheit entwickelt. Das 1995 als Spin-off der Eidgenössischen Technischen Hochschule (ETH) Zürich gegründete Unternehmen hat seinen Sitz in Schlieren (Zürich). Cytos Biotechnology AG ist an der Schweizer Börse SIX Swiss Exchange AG gemäss Main Standard unter dem Symbol CYTN kotiert.
This foregoing press release may contain forward-looking statements that include words or phrases such as 'are intended for', 'are designed to', or other similar expressions. These forward-looking statements are subject to a variety of significant uncertainties, including scientific, business, economic and financial factors, and therefore actual results may differ significantly from those presented. There can be no assurance that any further therapeutic entities will enter clinical trials, that clinical trial results will be predictive for future results, that therapeutic entities will be the subject of filings for regulatory approval, that any drug candidates will receive marketing approval from the U.S. Food and Drug Administration or equivalent regulatory authorities, or that drugs will be marketed successfully. Against the background of these uncertainties readers should not rely on forward-looking statements. The Company assumes no responsibility to update forward-looking statements or adapt them to future events or developments.
THIS PRESS RELEASE DOES NOT CONSTITUTE AN OFFER, OR THE SOLICITATION OF AN OFFER TO SUBSCRIBE FOR OR PURCHASE ANY SECURITIES TO ANY PERSON IN AUSTRALIA, CANADA, JAPAN, OR THE UNITED STATES OR IN ANY OTHER JURISDICTION, NOR DOES IT CONSTITUTE A PROSPECTUS WITHIN THE MEANING OF ARTICLE 652A OR 1156 OF THE SWISS CODE OF OBLIGATIONS OR A LISTING PROSPECTUS PURSUANT TO THE LISTING RULES OF THE SIX SWISS EXCHANGE LTD. ANY DECISION TO PURCHASE ANY SECURITIES REFERRED TO HEREIN SHOULD BE SOLELY BASED ON THE RELEVANT PROSPECTUS. IN ADDITION, THE OFFER AND SALE OF THE SECURITIES REFERRED TO HEREIN HAS NOT BEEN AND WILL NOT BE REGISTERED UNDER THE U.S. SECURITIES ACT OF 1933, AS AMENDED (THE 'SECURITIES ACT') OR UNDER THE APPLICABLE SECURITIES LAWS OF AUSTRALIA, CANADA OR JAPAN. THE SECURITIES REFERRED TO HEREIN MAY NOT BE OFFERED, SOLD OR DELIVERED WITHIN THE UNITED STATES ABSENT REGISTRATION UNDER THE SECURITIES ACT OR AN APPLICABLE EXEMPTION FROM, OR IN A TRANSACTION NOT SUBJECT TO, THE REGISTRATION REQUIREMENTS OF THE SECURITIES ACT. SUBJECT TO CERTAIN EXCEPTIONS, THE SECURITIES REFERRED TO HEREIN MAY NOT BE OFFERED OR SOLD IN AUSTRALIA, CANADA OR JAPAN OR TO, OR FOR THE ACCOUNT OR BENEFIT OF, ANY NATIONAL, RESIDENT OR CITIZEN OF AUSTRALIA, CANADA OR JAPAN. THERE WILL BE NO PUBLIC OFFER OF THE SECURITIES IN THE UNITED STATES.
IN THE UNITED KINGDOM, THIS PRESS RELEASE IS DIRECTED ONLY AT (I) PERSONS WHO HAVE PROFESSIONAL EXPERIENCE IN MATTERS RELATING TO INVESTMENTS FALLING WITHIN ARTICLE 19(1) OF THE FINANCIAL SERVICES AND MARKETS ACT 2000 (FINANCIAL PROMOTION) ORDER 2005 (THE 'ORDER'), AND (II) HIGH NET WORTH ENTITIES FALLING WITHIN ARTICLE 49(2) OF THE ORDER, AND (III) PERSONS TO WHOM IT WOULD OTHERWISE BE LAWFUL TO DISTRIBUTE IT.
IN ADDITION, IF AND TO THE EXTENT THAT THIS PRESS RELEASE IS COMMUNICATED IN, OR THE OFFER OF SECURITIES TO WHICH IT RELATES IS MADE IN, ANY EEA MEMBER STATE THAT HAS IMPLEMENTED DIRECTIVE 2003/71/EC (TOGETHER WITH ANY APPLICABLE IMPLEMENTING MEASURES IN ANY MEMBER STATE, THE 'PROSPECTUS DIRECTIVE'), THIS PRESS RELEASE AND THE OFFERING OF ANY SECURITIES DESCRIBED HEREIN ARE ONLY ADDRESSED TO AND DIRECTED AT PERSONS IN THAT MEMBER STATE WHO ARE QUALIFIED INVESTORS WITHIN THE MEANING OF THE PROSPECTUS DIRECTIVE (OR WHO ARE OTHER PERSONS TO WHOM THE OFFER MAY LAWFULLY BE ADDRESSED) AND MUST NOT BE ACTED ON OR RELIED ON BY OTHER PERSONS IN THAT MEMBER STATE.
Ende der Medienmitteilung
30.07.2012 Veröffentlichung einer Pressemitteilung, übermittelt durch
EQS CORPORATE COMMUNICATIONS.
www.eqs.com - Medienarchiv unter www.eqs.com/ch/pressemappen
Für den Inhalt der Mitteilung ist der Herausgeber verantwortlich.
Sprache: Deutsch
Unternehmen: Cytos Biotechnology AG
Wagistr. 25
8952 Schlieren
Schweiz
Telefon: +41 44 733 4747
Fax: +41 44 733 4740
E-Mail: info@cytos.com
Internet: www.cytos.com
ISIN: CH0011025217, CH0029060735
Valorennummer / WKN: -
Börsen: Freiverkehr in Berlin, München, Stuttgart; Open Market in Frankfurt; SIX
Ende der Mitteilung EquityStory AG News-Service
179410 30.07.2012
http://www.dgap.de/news/corporate/cytos-biotechnology-gibt-d…
Cytos Biotechnology AG gibt die Finanzresultate für das zweite Quartal 2012 bekannt und informiert über neuere Entwicklungen und Ausschau
Cytos Biotechnology AG / Schlagwort(e): Halbjahresergebnis
30.07.2012 / 07:00
Cytos Biotechnology AG gibt die Finanzresultate für das zweite Quartal 2012 bekannt und informiert über neuere Entwicklungen und Ausschau
- Cytos Biotechnology AG erhöht ihre flüssigen Mittel beträchtlich indem sie CHF 33.58 Millionen in Form von Eigen- und Fremdkapital aufnimmt
- Zusätzlich Stärkung des Verwaltungsrates durch die Nomination von Dr. Christian Itin, vormals Präsident und CEO von Micromet Inc. als nicht-exekutiver Verwaltungsrat
- Start einer grossen globale Phase IIb Studie in allergischem Asthma mit CYT003 in der zweiten Jahreshälfte geplant
Schlieren (Zürich), Schweiz, 30. Juli 2012 - Cytos Biotechnology AG ('Cytos') hat heute die Finanzzahlen sowie die wichtigsten Ereignisse für das zweite Quartal 2012 bekannt gegeben.
Highlights
Während der ersten Jahreshälfte 2012 hat Cytos ihre Finanzmittel substantiell um CHF 33.58 Mio. verstärkt, wobei CHF 23.75 Mio. in Form von Eigenkapital und CHF 6.625 Mio. in Form von Wandeldarlehen aufgenommen wurden. Beides stammt von einem internationalen Investorensyndikat, das aus venBio, Abingworth, Aisling Capital und Amgen besteht. Zudem konnten weitere CHF 3.20 Mio. in Form von Eigenkapital mittels einer Bezugsrechtsemission für die bestehenden Aktionäre aufgenommen werden. Cytos beabsichtigt, diese Finanzmittel primär für die Durchführung einer grossen, globalen Phase IIb Studie in allergischem Asthma mit CYT003 zu verwenden.
Im Zusammenhang mit der Kapitalerhöhung sind folgende Personen zusätzlich für den Verwaltungsrat vorgeschlagen und von der Generalversammlung am 20. April 2012 gewählt worden: Dr. Joseph Anderson (Abingworth), John Berriman (Vizepräsident des Verwaltungsrates von Algeta), Paul Brooke (venBio), Kurt von Emster (venBio) und Dr. Arthur Krieg (CEO von RaNA Therapeutics). Ihre Amtszeit startete am 14. Mai 2012. Die neuen Verwaltungsratsmitglieder bringen bedeutende zusätzliche Erfahrung im Gesundheitswesen mit.
Im Mai 2012 hat Cytos die Nominierung von Dr. Christian Itin als Verwaltungsratsmitglied bekanntgegeben. Der Verwaltungsrat von Cytos wird Dr. Itin den Aktionären an der nächsten Generalversammlung zur Wahl in den Verwaltungsrat vorschlagen. Dr. Itin ist der frühere President und CEO der Firma Micromet Inc., eines ehemals an der Nasdaq kotierten biopharmazeutischen Unternehmens, das im März 2012, von Amgen Inc. für US$ 1.16 Milliarden in bar übernommen wurde. Dr. Itin war für Micromet während 13 Jahren in verschiedenen Führungsfunktionen tätig und wurde 2004 deren CEO.
Die detaillierten Finanzzahlen zum zweiten Quartal 2012 können auf folgender Webseite heruntergeladen werden: http://www.cytos.com/userfiles/file/Cytos_Q2_2012_D.pdf
Für weitere Informationen wenden Sie sich bitte an:
Cytos Biotechnology AG
Harry Welten
Chief Financial Officer
Tel.: +41 44 733 46 46
e-Mail: harry.welten@cytos.com
Website: www.cytos.com
Über Cytos Biotechnology
Cytos Biotechnology AG ist ein börsenkotiertes Schweizer Biotechnologie-Unternehmen, das sich auf die Entwicklung und Vermarktung einer neuen Klasse von biopharmazeutischen Präparaten - die Immunodrugs(TM) - spezialisiert hat. Immunodrugs(TM) sind für die Anwendung in der Behandlung und Prävention von häufigen chronischen Krankheiten vorgesehen, die weltweit Millionen von Menschen betreffen. Immunodrugs(TM) sollen das Immunsystem des Patienten dazu bringen, erwünschte therapeutische Antikörper oder T-Zellreaktionen zu erzeugen, welche chronische Krankheitsprozesse modulieren. Die Immunodrug(TM)-Kandidaten werden sowohl in eigenen Programmen als auch in Zusammenarbeit mit Novartis, Pfizer und Pfizer Tiergesundheit entwickelt. Das 1995 als Spin-off der Eidgenössischen Technischen Hochschule (ETH) Zürich gegründete Unternehmen hat seinen Sitz in Schlieren (Zürich). Cytos Biotechnology AG ist an der Schweizer Börse SIX Swiss Exchange AG gemäss Main Standard unter dem Symbol CYTN kotiert.
This foregoing press release may contain forward-looking statements that include words or phrases such as 'are intended for', 'are designed to', or other similar expressions. These forward-looking statements are subject to a variety of significant uncertainties, including scientific, business, economic and financial factors, and therefore actual results may differ significantly from those presented. There can be no assurance that any further therapeutic entities will enter clinical trials, that clinical trial results will be predictive for future results, that therapeutic entities will be the subject of filings for regulatory approval, that any drug candidates will receive marketing approval from the U.S. Food and Drug Administration or equivalent regulatory authorities, or that drugs will be marketed successfully. Against the background of these uncertainties readers should not rely on forward-looking statements. The Company assumes no responsibility to update forward-looking statements or adapt them to future events or developments.
THIS PRESS RELEASE DOES NOT CONSTITUTE AN OFFER, OR THE SOLICITATION OF AN OFFER TO SUBSCRIBE FOR OR PURCHASE ANY SECURITIES TO ANY PERSON IN AUSTRALIA, CANADA, JAPAN, OR THE UNITED STATES OR IN ANY OTHER JURISDICTION, NOR DOES IT CONSTITUTE A PROSPECTUS WITHIN THE MEANING OF ARTICLE 652A OR 1156 OF THE SWISS CODE OF OBLIGATIONS OR A LISTING PROSPECTUS PURSUANT TO THE LISTING RULES OF THE SIX SWISS EXCHANGE LTD. ANY DECISION TO PURCHASE ANY SECURITIES REFERRED TO HEREIN SHOULD BE SOLELY BASED ON THE RELEVANT PROSPECTUS. IN ADDITION, THE OFFER AND SALE OF THE SECURITIES REFERRED TO HEREIN HAS NOT BEEN AND WILL NOT BE REGISTERED UNDER THE U.S. SECURITIES ACT OF 1933, AS AMENDED (THE 'SECURITIES ACT') OR UNDER THE APPLICABLE SECURITIES LAWS OF AUSTRALIA, CANADA OR JAPAN. THE SECURITIES REFERRED TO HEREIN MAY NOT BE OFFERED, SOLD OR DELIVERED WITHIN THE UNITED STATES ABSENT REGISTRATION UNDER THE SECURITIES ACT OR AN APPLICABLE EXEMPTION FROM, OR IN A TRANSACTION NOT SUBJECT TO, THE REGISTRATION REQUIREMENTS OF THE SECURITIES ACT. SUBJECT TO CERTAIN EXCEPTIONS, THE SECURITIES REFERRED TO HEREIN MAY NOT BE OFFERED OR SOLD IN AUSTRALIA, CANADA OR JAPAN OR TO, OR FOR THE ACCOUNT OR BENEFIT OF, ANY NATIONAL, RESIDENT OR CITIZEN OF AUSTRALIA, CANADA OR JAPAN. THERE WILL BE NO PUBLIC OFFER OF THE SECURITIES IN THE UNITED STATES.
IN THE UNITED KINGDOM, THIS PRESS RELEASE IS DIRECTED ONLY AT (I) PERSONS WHO HAVE PROFESSIONAL EXPERIENCE IN MATTERS RELATING TO INVESTMENTS FALLING WITHIN ARTICLE 19(1) OF THE FINANCIAL SERVICES AND MARKETS ACT 2000 (FINANCIAL PROMOTION) ORDER 2005 (THE 'ORDER'), AND (II) HIGH NET WORTH ENTITIES FALLING WITHIN ARTICLE 49(2) OF THE ORDER, AND (III) PERSONS TO WHOM IT WOULD OTHERWISE BE LAWFUL TO DISTRIBUTE IT.
IN ADDITION, IF AND TO THE EXTENT THAT THIS PRESS RELEASE IS COMMUNICATED IN, OR THE OFFER OF SECURITIES TO WHICH IT RELATES IS MADE IN, ANY EEA MEMBER STATE THAT HAS IMPLEMENTED DIRECTIVE 2003/71/EC (TOGETHER WITH ANY APPLICABLE IMPLEMENTING MEASURES IN ANY MEMBER STATE, THE 'PROSPECTUS DIRECTIVE'), THIS PRESS RELEASE AND THE OFFERING OF ANY SECURITIES DESCRIBED HEREIN ARE ONLY ADDRESSED TO AND DIRECTED AT PERSONS IN THAT MEMBER STATE WHO ARE QUALIFIED INVESTORS WITHIN THE MEANING OF THE PROSPECTUS DIRECTIVE (OR WHO ARE OTHER PERSONS TO WHOM THE OFFER MAY LAWFULLY BE ADDRESSED) AND MUST NOT BE ACTED ON OR RELIED ON BY OTHER PERSONS IN THAT MEMBER STATE.
Ende der Medienmitteilung
30.07.2012 Veröffentlichung einer Pressemitteilung, übermittelt durch
EQS CORPORATE COMMUNICATIONS.
www.eqs.com - Medienarchiv unter www.eqs.com/ch/pressemappen
Für den Inhalt der Mitteilung ist der Herausgeber verantwortlich.
Sprache: Deutsch
Unternehmen: Cytos Biotechnology AG
Wagistr. 25
8952 Schlieren
Schweiz
Telefon: +41 44 733 4747
Fax: +41 44 733 4740
E-Mail: info@cytos.com
Internet: www.cytos.com
ISIN: CH0011025217, CH0029060735
Valorennummer / WKN: -
Börsen: Freiverkehr in Berlin, München, Stuttgart; Open Market in Frankfurt; SIX
Ende der Mitteilung EquityStory AG News-Service
179410 30.07.2012
http://www.dgap.de/news/corporate/cytos-biotechnology-gibt-d…
Cytos ernennt Christian Itin zum CEO
Im Mai hieß es, der ehemalige Micromet-CEO Dr. Christian Itin, soll neues Verwaltungsratsmitglied der Cytos Biotechnology AG werden. Nun übernimmt er sogar den Vorsitz des Gremiums und wird neuer CEO des Schweizer Unternehmens.
Weiterlesen auf www.transkript.de
Im Mai hieß es, der ehemalige Micromet-CEO Dr. Christian Itin, soll neues Verwaltungsratsmitglied der Cytos Biotechnology AG werden. Nun übernimmt er sogar den Vorsitz des Gremiums und wird neuer CEO des Schweizer Unternehmens.
Weiterlesen auf www.transkript.de
Antwort auf Beitrag Nr.: 39.561.624 von R-BgO am 21.05.10 09:00:27BRANDHEISSER ÜBERNAHMEKANDIDAT
Cytos hat vor wenigen Tagen den positiven Abschluss eines Impfmedikaments in Zusammenarbeit mit Singapore's Agency in der klinische Testphase mitgeteilt. (siehe untereer Link) Cytos hat sich die weltweiten Vermarktungsrechte gesichert.
Der Milliardenkonzern Amgen hat sich erst im November mit 10% bei Cytos eingekauft und nach Abschluss dieser Testphase steht eine Übernahme von Amgen so gut wie sicher. Der aktuelle CEO war bereis früher Wegbereiter bei einer Milliardenübernahme von Amgen. Die Aktie könnte darum bald zweistellig notieren..
A*STAR entwickelt den Impfstoffkandidaten innerhalb eines Forschungs-
Entwicklungs- und Kommerzialisierungsabkommens, welches 2010 2) mit Cytos
abgeschlossen wurde - dies mit dem Ziel, die Regierung von Singapur mit
wirksamen Mitteln im Kampf gegen Grippeepidemien und Pandemien zu
unterstützen. Innerhalb dieses Abkommens hält Cytos die weltweiten
Entwicklungs- und Kommerzialisierungsrechte, während A*STARs
http://www.wallstreet-online.de/nachricht/6535391-cytos-biot…
Cytos hat vor wenigen Tagen den positiven Abschluss eines Impfmedikaments in Zusammenarbeit mit Singapore's Agency in der klinische Testphase mitgeteilt. (siehe untereer Link) Cytos hat sich die weltweiten Vermarktungsrechte gesichert.
Der Milliardenkonzern Amgen hat sich erst im November mit 10% bei Cytos eingekauft und nach Abschluss dieser Testphase steht eine Übernahme von Amgen so gut wie sicher. Der aktuelle CEO war bereis früher Wegbereiter bei einer Milliardenübernahme von Amgen. Die Aktie könnte darum bald zweistellig notieren..
A*STAR entwickelt den Impfstoffkandidaten innerhalb eines Forschungs-
Entwicklungs- und Kommerzialisierungsabkommens, welches 2010 2) mit Cytos
abgeschlossen wurde - dies mit dem Ziel, die Regierung von Singapur mit
wirksamen Mitteln im Kampf gegen Grippeepidemien und Pandemien zu
unterstützen. Innerhalb dieses Abkommens hält Cytos die weltweiten
Entwicklungs- und Kommerzialisierungsrechte, während A*STARs
http://www.wallstreet-online.de/nachricht/6535391-cytos-biot…
Antwort auf Beitrag Nr.: 46.408.220 von luckman_ch am 08.02.14 19:44:22hammermeldung...
party over?
r.i.p.
party over?
r.i.p.

2007 war die cyto von unter 20 in 2006 kommend mal über 100 € !
http://www.wallstreet-online.de/aktien/cytos-biotechnology-a…
http://www.wallstreet-online.de/aktien/cytos-biotechnology-a…
Werden die jetzt ausgelistet, oder kauft da noch einer die Firma?
Antwort auf Beitrag Nr.: 46.826.059 von Aurakel am 15.04.14 11:28:45http://www.cytos.com/uploads/news/id272/Cytos_Press_D_140414…
guckst du hier
guckst du hier
Heute Cytos...morgen Newron !
Noch so unentdeckt;-)!
Die 41 wurde letzte Woche schon angetestet und nach der Gewinnmitnahme am Fr werde ich Mo wieder rein;-)..
Die 41 wurde letzte Woche schon angetestet und nach der Gewinnmitnahme am Fr werde ich Mo wieder rein;-)..
Antwort auf Beitrag Nr.: 47.078.894 von Leonidas112 am 31.05.14 09:43:47Salute:
Und, bist du wieder eingestiegen?
Ich steh immer noch an der Seitenlinie.
Beobachte noch!
lg tz.
Und, bist du wieder eingestiegen?
Ich steh immer noch an der Seitenlinie.
Beobachte noch!
lg tz.
Klingt interessant. Abzuwarten ist natürlich wie es Ende Januar ausgeht.
lg
lg
Antwort auf Beitrag Nr.: 48.713.669 von schlemmii am 07.01.15 10:44:50Da wäre aber auch noch diese Angelegenheit hier !!!
http://www.wallstreet-online.de/nachricht/7280528-dgap-adhoc…
lg tz.
http://www.wallstreet-online.de/nachricht/7280528-dgap-adhoc…
lg tz.
Antwort auf Beitrag Nr.: 48.713.669 von schlemmii am 07.01.15 10:44:50Ich hab mal eine Frage an dich.
Hast du Zugriff zu Daten über den Handel an der schweizerischen Börse?
Hab keinerlei Anzeige bei mir, schon seit Nov. 2014.
lg tz.
Hast du Zugriff zu Daten über den Handel an der schweizerischen Börse?
Hab keinerlei Anzeige bei mir, schon seit Nov. 2014.
lg tz.
Antwort auf Beitrag Nr.: 48.896.414 von taenzerin am 27.01.15 13:41:28
war wohl schon in der Aktie eingepreist...
eigentlich sollte es steil nach oben gehen, deshalb
wurde auch von Cytos der Antrag auf Aussetzung gestellt,
das war aber wohl ein Schuss in den Ofen
Zitat von taenzerin: http://www.wallstreet-online.de/nachricht/7328291-dgap-adhoc…
lg tz.
war wohl schon in der Aktie eingepreist...
eigentlich sollte es steil nach oben gehen, deshalb
wurde auch von Cytos der Antrag auf Aussetzung gestellt,
das war aber wohl ein Schuss in den Ofen

Antwort auf Beitrag Nr.: 48.901.772 von diamanten53 am 27.01.15 19:25:46
Ja du scheinst Recht zu haben, ein Satz mit "x"
Erstens kommt es anders, als zweitens wie man denkt!
Vielleicht muss erst ein paar Tage Gras drüber wachsen.
Ich beobachte auf alle Fälle weiter!
lg tz.
Zitat von diamanten53:Zitat von taenzerin: http://www.wallstreet-online.de/nachricht/7328291-dgap-adhoc…
lg tz.
war wohl schon in der Aktie eingepreist...
eigentlich sollte es steil nach oben gehen, deshalb
wurde auch von Cytos der Antrag auf Aussetzung gestellt,
das war aber wohl ein Schuss in den Ofen
Ja du scheinst Recht zu haben, ein Satz mit "x"
Erstens kommt es anders, als zweitens wie man denkt!
Vielleicht muss erst ein paar Tage Gras drüber wachsen.
Ich beobachte auf alle Fälle weiter!
lg tz.

Bis jetzt noch keine extreme Rücksetzer durch Gewinnmitnahmem. Vielleicht geht da ja morgen was. Hat jemand eine News für die Kursexplosion? Habe nichts gefunden
Noch völlig unendeckt... leider finde ich keine News...
Antwort auf Beitrag Nr.: 49.252.127 von Pireas am 05.03.15 18:14:48Das ist der Hammer was hier ab geht 
Schau dir das Volumen an der Schweizer Börse mal an.
Bin schon richtig im Plus ich halte auf jeden
Fall Weiter.Heute nur kleine Rücksetzer und auf TH geschlossen.
Sind das Insider die mehr wissen????da ist etwas im Busch.

Schau dir das Volumen an der Schweizer Börse mal an.
Bin schon richtig im Plus ich halte auf jeden
Fall Weiter.Heute nur kleine Rücksetzer und auf TH geschlossen.
Sind das Insider die mehr wissen????da ist etwas im Busch.
Die standen kurz vor Insolvenz...
Ich finde nur das hier:
http://www.finanzen.ch/nachrichten/aktien/Cytos-kommt-mit-fi…
Ich finde nur das hier:
http://www.finanzen.ch/nachrichten/aktien/Cytos-kommt-mit-fi…
Ja das ist der letzte Stand.16.03.15 ist Stichtag vielleicht der letzte zock vor der KE??
Oder Steckt da mehr hinter???mich hat dieser massive Anstieg und kaum Gewinnmitnahmen beeindruckt.
Kann morgen wieder massiv steigen oder auch nicht.
Oder Steckt da mehr hinter???mich hat dieser massive Anstieg und kaum Gewinnmitnahmen beeindruckt.
Kann morgen wieder massiv steigen oder auch nicht.
Antwort auf Beitrag Nr.: 49.252.472 von Edison09 am 05.03.15 18:41:50Aus dem Cash.ch Forum
Zürich (awp) - Unter den kleinsten Werten fallen am Donnerstag die Titel des mit der finanziellen Restrukturierung kämpfenden Biopharma-Unternehmens Cytos auf. Über die Gründe der Kurshausse darf spekuliert werden. Branchenbeobachter gehen meist von spekulationsgetriebenen Käufen aus. "Ich bin sehr erstaunt über die hohen Umsätze", sagte CEO Harry Welten auf Anfrage von AWP, derzeit gebe es aber nichts mittzuteilen. "Wenn dem so wäre, hätten wir dies gemacht."
Die Cytos-Aktie notiert um Mittag um 83%% höher auf 0,86 CHF. Damit wird das Unternehmen auf Basis des Aktienkurses derzeit mit rund 52 Mio bewertet. Die Wandelanleihe geht zu 112% um, nachdem sie am Vortag bei 80% geschlossen hatte.
Cytos ist derzeit bekanntlich mitten in einer finanziellen Restrukturierung. Da Ende Januar eine Gläubigerversammlung der Umwandlung von Wandelanleihen in Aktien zugestimmt hatte, konnte der drohende Konkurs vorerst abgewendet werden. Weitere Schritte sind - neben rechtlichen Belangen - nun die Verhandlungen mit den Grossinvestoren, eine ausserordentliche Generalversammlung zur Schaffung von Aktienkapital und dereinst eine strategische Transaktion. Cytos könnte möglicherweise als "Börsenmantel" für eine neue Gesellschaft dienen, heisst es etwa.
Die ausserodentliche Generalversammlung findet am 16. März statt. Traktanden sind eine ordentliche Kapitalerhöhung, verbunden mit einer Herabsetzung des Nennwerts der Cytos-Aktie.
Im Erfolgsfall winken den Gläubigern zwar ein exklusiver Lizenzvertrag mit OnCore Biopharma und Erträgen von 500 Mio USD und mehr, doch wären leztere auch nach einer finanziellen Restrukturierung noch in (sehr) weiter Ferne. Zudem bestehen Zusammenarbeitsverträge mit Pfizer und Novartis. "Wir sind auch bei den Verträgen mit Pfizer und Novartis weit von so genannten value inflection points weg", sagte der Cytos-CEO gegenüber AWP weiter.
Die Schweizer glauben wohl das Tekmira Und OnCore die ganze Bude auf schnupfen.
http://www.cash.ch/community/forum/aktien-schweiz/cytos?page…
"OnCore" bzw. Tekmira kauft von Cytos eine Lizenz für ein Wirkstoffträgersystem, welches spezifisch gegen Hepatitis einsetzbar ist. Die Zahlung von 67 mio USD sind an Forschungserfolg geknüpft. Weitere 110 mio USD sind an den komerziellen Erfolg eines auf Grundlage der Plattform von Cytos entwickelten Wirkstoffs gebunden.
Neben der Hepatitsplattform bietet Cytos noch weitere 5 Plattformen gegen andere Krankheitserreger / Viren an. Tekmira hat sich die Option gesichert, diese ebenfalls zu den gleichen Bedingungen zu lizenzieren.
http://www.cash.ch/community/forum/aktien-schweiz/cytos?page…
Antwort auf Beitrag Nr.: 49.252.550 von Jagubert am 05.03.15 18:51:25Okay dann ist es nur ein zock mal schauen wie weit es noch geht.
Cytos05.03.2015 - 22:13
Mir scheint relativ klar, was hier passiert bei Cytos:
Tekmira merged nun definitiv mit Oncore! Dadurch entsteht ein Milliardenunternehmen welches eine vernünftige Pipeline hat.
Speziell daran ist, dass die Plattform von Cyt003 (TLR9 Agonist) von Cytos verwendet wird.
Gemäss NZZ vom 06.01.2015 steht da folgendes:
Cytos erhofft sich Ausschüttungen von maximal 402 Mio. $ für die ersten Produkte, die Oncore Biopharma unter der Lizenz entwickeln kann. Die Lizenzvereinbarung tritt erst in Kraft, wenn die Wandelanleihen in Aktien umgewandelt wurden.
Es dürfte also relativ klar sein: Tekmiar/Oncore sehen, dass sie die Plattform von Cytos brauchen können.
Als Folge übernehmen Sie den ganzen Laden. Das ist ein Peanutsbetrag für diese Firma resp: Da sind Profis am Werk welche einen Wert einschätzen können. Speziell bei Oncore sind sehr erfahrene Leute an Board, welche bereits einmal eine Firma für Milliarden verkauft haben. Mit Oncore ist denen nun relativ rasch ein weiterer Erfolg geglückt, die Fusion mit Tekmira ist der nächste Schritt.
Meine Prognose?
Tekmiar/Oncore ist die Firma, welche heute all diese Aktien aufgekauft haben. Im Hintergrund dürften wohl bereits Deals abgeschlossen worden sein mit Abingworth Bioventures, welche einen grossteil der ausstehenden Darlehen hält.
Es würde mich ferner überhaupt nicht überraschen, wenn Welten die Wandelanleihe welche im Besitz von Cytos steht direkt an Tekmira/Oncore zum Preis von 50% verkauft wurde. - Von wegen er weiss von nichts...! Ok, er darf noch nichts sagen, aber wissen tut er es bereits.
Dadurch dürfte die Rechnung für Oncore/Tekmira ungefähr so aussehen:
1. Von der Wandelanleihe halten sie bereits ca. 1/3 zu 50%, wodurch sie nach der Wandlung ca. 25Mio Shares zum Preis von lachhaften CHF 0.12 resp. 3Mio gekauft haben.
2. Gestern/Heute haben sie wohl ca. 20Mio Shares vom Markt aufgekauft zu ca. Durchschnitt CHF 0.80, wodurch sie 16Mio investiert haben.
3. Da sie die Mehrheit aller ausstehenden Aktien haben, ist die Wandlung der Anleihe eine Formsache.
4. Im Hintergrund haben sie wohl die Darlehen von den grossen abgekauft, das dürfte ca. 20Mio gekostet haben.
Dadurch dürften sie bereits ca. 50% aller Aktien halten! Den restlichen 50% machen sie ein Übernahmeangebot zu 1.-, womit die Komplettübernahme ca. 90Mio gekostet hat.
Oder:
Sie blockieren die Wandlung, halten aber die 2/3els Mehrheit der 30 Mio Aktien per heute Abend, wodruch sie faktisch an der GV entscheiden können was sie wollen. Sprich: Sie blockieren die Wandlung und zahlen die Darlehen und die Anleihe zurück, was ca. 60Mio zzgl. die kompletten 30Mio Aktien (ca. 30Mio Gesamtkosten). Wird also ungefähr gleich teuer...
So oder so, hier wird es sehr, sehr spannend. Und ich denke, mittels Anleihe kann fast nichts mehr schief gehen.
Entweder man kassiert über 170% oder dann 400-500% resp. nach der Umwandlung ein Preis von über 1CHF/Aktie.
Ich werde morgen weiter aufstocken!
Hier findet ihr noch die aktuellen News zu Tekmira/Oncore - Pipeline (Seite 9!!)
http://files.shareholder.com/downloads/ABEA-50QJTB/406022749…
Btw: Zufall?
Gestern wurde der Merger zwischen Tekmira und Oncore per Abstimmung definitiv! Und ja, da wird wohl das Board nach dem Merger das definitive GO gegeben haben.
http://files.shareholder.com/downloads/ABEA-50QJTB/406050416…
Es wird interessant. Cytos wäre gut aufgehoben bei Tekmira/Oncore. Und leisten können sie es sich auch, immerhin ist das Laden mit ziemlich genau 1MRD bewertet (Total Shares 49.6Mio x 20$).
Gruss
Mir scheint relativ klar, was hier passiert bei Cytos:
Tekmira merged nun definitiv mit Oncore! Dadurch entsteht ein Milliardenunternehmen welches eine vernünftige Pipeline hat.
Speziell daran ist, dass die Plattform von Cyt003 (TLR9 Agonist) von Cytos verwendet wird.
Gemäss NZZ vom 06.01.2015 steht da folgendes:
Cytos erhofft sich Ausschüttungen von maximal 402 Mio. $ für die ersten Produkte, die Oncore Biopharma unter der Lizenz entwickeln kann. Die Lizenzvereinbarung tritt erst in Kraft, wenn die Wandelanleihen in Aktien umgewandelt wurden.
Es dürfte also relativ klar sein: Tekmiar/Oncore sehen, dass sie die Plattform von Cytos brauchen können.
Als Folge übernehmen Sie den ganzen Laden. Das ist ein Peanutsbetrag für diese Firma resp: Da sind Profis am Werk welche einen Wert einschätzen können. Speziell bei Oncore sind sehr erfahrene Leute an Board, welche bereits einmal eine Firma für Milliarden verkauft haben. Mit Oncore ist denen nun relativ rasch ein weiterer Erfolg geglückt, die Fusion mit Tekmira ist der nächste Schritt.
Meine Prognose?
Tekmiar/Oncore ist die Firma, welche heute all diese Aktien aufgekauft haben. Im Hintergrund dürften wohl bereits Deals abgeschlossen worden sein mit Abingworth Bioventures, welche einen grossteil der ausstehenden Darlehen hält.
Es würde mich ferner überhaupt nicht überraschen, wenn Welten die Wandelanleihe welche im Besitz von Cytos steht direkt an Tekmira/Oncore zum Preis von 50% verkauft wurde. - Von wegen er weiss von nichts...! Ok, er darf noch nichts sagen, aber wissen tut er es bereits.
Dadurch dürfte die Rechnung für Oncore/Tekmira ungefähr so aussehen:
1. Von der Wandelanleihe halten sie bereits ca. 1/3 zu 50%, wodurch sie nach der Wandlung ca. 25Mio Shares zum Preis von lachhaften CHF 0.12 resp. 3Mio gekauft haben.
2. Gestern/Heute haben sie wohl ca. 20Mio Shares vom Markt aufgekauft zu ca. Durchschnitt CHF 0.80, wodurch sie 16Mio investiert haben.
3. Da sie die Mehrheit aller ausstehenden Aktien haben, ist die Wandlung der Anleihe eine Formsache.
4. Im Hintergrund haben sie wohl die Darlehen von den grossen abgekauft, das dürfte ca. 20Mio gekostet haben.
Dadurch dürften sie bereits ca. 50% aller Aktien halten! Den restlichen 50% machen sie ein Übernahmeangebot zu 1.-, womit die Komplettübernahme ca. 90Mio gekostet hat.
Oder:
Sie blockieren die Wandlung, halten aber die 2/3els Mehrheit der 30 Mio Aktien per heute Abend, wodruch sie faktisch an der GV entscheiden können was sie wollen. Sprich: Sie blockieren die Wandlung und zahlen die Darlehen und die Anleihe zurück, was ca. 60Mio zzgl. die kompletten 30Mio Aktien (ca. 30Mio Gesamtkosten). Wird also ungefähr gleich teuer...
So oder so, hier wird es sehr, sehr spannend. Und ich denke, mittels Anleihe kann fast nichts mehr schief gehen.
Entweder man kassiert über 170% oder dann 400-500% resp. nach der Umwandlung ein Preis von über 1CHF/Aktie.
Ich werde morgen weiter aufstocken!
Hier findet ihr noch die aktuellen News zu Tekmira/Oncore - Pipeline (Seite 9!!)
http://files.shareholder.com/downloads/ABEA-50QJTB/406022749…
Btw: Zufall?
Gestern wurde der Merger zwischen Tekmira und Oncore per Abstimmung definitiv! Und ja, da wird wohl das Board nach dem Merger das definitive GO gegeben haben.
http://files.shareholder.com/downloads/ABEA-50QJTB/406050416…
Es wird interessant. Cytos wäre gut aufgehoben bei Tekmira/Oncore. Und leisten können sie es sich auch, immerhin ist das Laden mit ziemlich genau 1MRD bewertet (Total Shares 49.6Mio x 20$).
Gruss
Schon 250k in Bid
Edi Edi Edi .... da hättest du gestern ja mal Bescheid geben können ;-)
Wenn ich das richtig interpretiere, könnte der Kurs binnen kürzester Zeit zweistellig werden.
Es sind nur 33 Millionen Aktien im Umlauf.
Antwort auf Beitrag Nr.: 49.256.015 von sirlacoura am 06.03.15 08:41:25Fakt ist, die schweizer Eröffnung wird ne Bombe. Das Orderbuch schwillt heftig an.
Ich bin mal gespannt. für mich heute eine Tages Trading. Hoffentlich in die richtige Richtung :-)
Sorry nächstes mal denke ich an dich versprochen
Das ist der Wahnsinn
Das ist der Wahnsinn
Läuft wohl von einem Trading Halt in den Nächsten.
Ab 2€ habe ich alles raus gehauen gottseidank
Antwort auf Beitrag Nr.: 49.256.981 von Edison09 am 06.03.15 09:49:10Dito. Schnelles Geld ist auch mal nicht zu verachten.
 Läuft grad mal in die völlig falsche Richtung
Läuft grad mal in die völlig falsche Richtung
Läuft grad mal in die völlig falsche Richtung . Verarsche, oder was läuft hier ab ?
War nur ein zock.
Die sind doch inso demnächst kommt ne heftige KE Nennwert dann nur noch 0,01
Die sind doch inso demnächst kommt ne heftige KE Nennwert dann nur noch 0,01
Antwort auf Beitrag Nr.: 49.257.308 von sirlacoura am 06.03.15 10:18:23Ich denke der große Käufer hat fertig oder die Aktienzahl die ER haben wollte erreicht. Jetzt Verkaufsdruck.
War eben ein schneller Zock.
War eben ein schneller Zock.
Antwort auf Beitrag Nr.: 49.257.392 von Jagubert am 06.03.15 10:24:24Genau die grossen Blöcke sind futsch jetzt geht es wie im penny Bereich.
Verschiede mich an der Stelle.
Verschiede mich an der Stelle.
Die gehen heute noch unter 1€ nächste Woche unter 0.50 Cent . Zock ist Zock!
Ich bin zu alt für so´n Scheiß. Das war ein harter Ritt auf ner Kanonenkugel....Riskant nochmal kräftig bei 0,986 nachgekauft, meinen EK dadurch gesenkt und dadurch doch noch mit einem beachtlichen Plus bei knapp über 1,4 wieder raus...... Puh.....da stand das Herz-Kreislaufsystem kurz vorm Exitus.....So...kein Bier vor 4, daher jetzt einen feierlichen Whisky auf das schnell verdiente Geld :-) Hätte aber auch böse enden können.....nicht zur Nachahmung empfohlen
Antwort auf Beitrag Nr.: 49.257.308 von sirlacoura am 06.03.15 10:18:23
Gut das du den Absprung noch rechtzeitig geschafft hast
Da hat einer zu 2,50€ 10.000 stk gekauft der tut mir leid der wird seine Geld nie wieder sehen.
Zitat von sirlacoura: Läuft grad mal in die völlig falsche Richtung . Verarsche, oder was läuft hier ab ?
Gut das du den Absprung noch rechtzeitig geschafft hast

Da hat einer zu 2,50€ 10.000 stk gekauft der tut mir leid der wird seine Geld nie wieder sehen.
Antwort auf Beitrag Nr.: 49.263.530 von Edison09 am 06.03.15 17:22:33Da haben in der Schweiz welche Mio Stck gekauft im Bereich 2,60 SFR
Zitat von Edison09:Zitat von sirlacoura: Läuft grad mal in die völlig falsche Richtung . Verarsche, oder was läuft hier ab ?
Gut das du den Absprung noch rechtzeitig geschafft hast
Da hat einer zu 2,50€ 10.000 stk gekauft der tut mir leid der wird seine Geld nie wieder sehen.
Antwort auf Beitrag Nr.: 49.263.653 von Frhstck am 06.03.15 17:30:50Da hat sich angeblich tekrim eindeckt um über 51% der Stimmrechte zubekommen.
Die haben den Kurs über 2tage lang hochgezogen jetzt ist wieder alles vorbei.
Die haben den Kurs über 2tage lang hochgezogen jetzt ist wieder alles vorbei.
«‹…808182838485868788
philsh
Kommentare: 102
Themen: 1
Cytos06.03.2015 - 17:28
Den Preis kennen wir natürlich nicht. Interessant ist aber auch: Bei Pflichtangeboten gibts keine reinen Tauschangebote - man muss zwischen Cash und (anderen) Aktien wählen können.
Zum Verfassen von Kommentaren bitte Anmelden oder Registrieren.
Krokodil
Kommentare: 1'249
Themen: 7
Cytos06.03.2015 - 17:34
@otti
Du kannst mal "Kaufangebot Merck Serono" googeln. Zuoberst hast du dann ein schönes Beispiel einer Uebernahme.
Zum Verfassen von Kommentaren bitte Anmelden oder Registrieren.
Junktrader
Kommentare: 64
Cytos06.03.2015 - 18:30
Noch etwas Datenfutter zu Oncore Biopharma:
Die Gründer der im 2012 gegründeten Oncore haben vorher im Jahr 2011 die Pharmasset Inc für 11Mrd$ an Gilead verkauft.
Die Herren haben den nötigen Cash und das Know How, wie man erfolgreich in dieser Branche besteht.
Es spricht für die Herren von Oncore, dass sie bereits jetzt wieder 50% an einem Milliardenunternehmen (Tekmira/Oncore) besitzen. Da muss und kann man nur gratulieren.
http://www.reuters.com/article/2011/11/21/us-gilead-pharmass…
Ferner steht beim merger zwischen Oncore und Tekmira folgendes über Cytos:
"The combined company expects to advance additional programs toward the clinic, including products licensed by Doylestown, Pa.-based Oncore from Cytos Biotechnology AG...."
und
"The potential $522 million deal with Cytos, of Schlieren, Switzerland, which included its Qbeta virus-like particle vaccine platform, was disclosed just last week. (See BioWorld Today, Jan. 7, 2015.)"
http://www.bioworld.com/content/oncore-agrees-merger-tekmira…
Cytos selbst hat bereits im 2014 angekündigt, dass sie einen solchen Deal anstreben, hier im Wortlaut:
Cytos beabsichtigt mit interessierten Parteien Gespräche über die VLP B-Zellvakzineplattform zu führen, sowie über die laufenden präklinischen Entwicklungsprogramme, welche auf dieser Plattform basieren.
http://www.cytos.com/uploads/news/id273/Cytos%20PR%20D%205%2…
Oncore/Tekmira kann die CYTN relativ simpel schlucken, erst Recht wenn sie dies mit 60Mio wohl hinbekommen.
Sollten die dann noch einen Teil in eigenen Aktien zahlen, wär's sowieso kein Problem mehr.
Würd mich definitiv nicht mehr wundern.
Zum Verfassen von Kommentaren bitte Anmelden oder Registrieren.
Junktrader
Kommentare: 64
Cytos06.03.2015 - 19:18
DER PRAKTIKUS LIEST AUCH BEI UNS IM FORUM MIT...
AUSZUG FUW.CH / PRAKTIKUS
Spekulationen um Cytos
Am Donnerstag ist der Kurs von Cytos (CYTN 1.35 3.85%) in die Höhe geschossen. Der Titel kommt seit Anfang Woche auf ein Plus von fast 300%. Ich kann nur spekulieren, weshalb die Aktien des Unternehmen, das noch vor kurzem knapp vor dem Konkurs stand, plötzlich so gefragt sind.
Fakt ist, dass es Cytos gelungen ist, Gläubiger vom Tausch ihrer Wandelanleihen in Aktien zu überzeugen. Nächste Woche entscheiden die Aktionäre an einer a.o. GV über eine Kapitalerhöhung, um die Besitzer der Anleihe bedienen zu können. Am Markt machen Gerüchte die Runde, wonach sich das US-Biotechunternehmen OnCore Biopharma im Vorfeld der GV die Stimmenmehrheit sichern will. Die Gesellschaft hat ein Interesse am Fortbestand von Cytos. Sie will einen Wirkstoff aus der Forschungspipeline der Schweizer weiterentwickeln. Dafür zahlt sie Cytos im Erfolgsfall Meilensteinzahlungen von maximal 522 Mio. Fr. Bedingung ist allerdings, dass die Wandelanleihen auch tatsächlich in Aktien getauscht werden. OnCore will womöglich das Abstimmungsresultat sichern.
Vielleicht werden wir nächste Woche mehr wissen, wenn Informationen zu einer Überschreitung der meldepflichtigen Anteile eines Aktionärs publik werden. Doch auch dann steht die Zukunft von Cytos in den Sternen. Selbst wenn es den Anschein macht, dass mutige Investoren derzeit auf den Zug aufspringen: Ich lasse die Finger von den Titeln. Zu riskant.
Zum Verfassen von Kommentaren bitte Anmelden oder Registrieren.Seiten
«‹…808182838485868788
philsh
Kommentare: 102
Themen: 1
Cytos06.03.2015 - 17:28
Den Preis kennen wir natürlich nicht. Interessant ist aber auch: Bei Pflichtangeboten gibts keine reinen Tauschangebote - man muss zwischen Cash und (anderen) Aktien wählen können.
Zum Verfassen von Kommentaren bitte Anmelden oder Registrieren.
Krokodil
Kommentare: 1'249
Themen: 7
Cytos06.03.2015 - 17:34
@otti
Du kannst mal "Kaufangebot Merck Serono" googeln. Zuoberst hast du dann ein schönes Beispiel einer Uebernahme.
Zum Verfassen von Kommentaren bitte Anmelden oder Registrieren.
Junktrader
Kommentare: 64
Cytos06.03.2015 - 18:30
Noch etwas Datenfutter zu Oncore Biopharma:
Die Gründer der im 2012 gegründeten Oncore haben vorher im Jahr 2011 die Pharmasset Inc für 11Mrd$ an Gilead verkauft.
Die Herren haben den nötigen Cash und das Know How, wie man erfolgreich in dieser Branche besteht.
Es spricht für die Herren von Oncore, dass sie bereits jetzt wieder 50% an einem Milliardenunternehmen (Tekmira/Oncore) besitzen. Da muss und kann man nur gratulieren.
http://www.reuters.com/article/2011/11/21/us-gilead-pharmass…
Ferner steht beim merger zwischen Oncore und Tekmira folgendes über Cytos:
"The combined company expects to advance additional programs toward the clinic, including products licensed by Doylestown, Pa.-based Oncore from Cytos Biotechnology AG...."
und
"The potential $522 million deal with Cytos, of Schlieren, Switzerland, which included its Qbeta virus-like particle vaccine platform, was disclosed just last week. (See BioWorld Today, Jan. 7, 2015.)"
http://www.bioworld.com/content/oncore-agrees-merger-tekmira…
Cytos selbst hat bereits im 2014 angekündigt, dass sie einen solchen Deal anstreben, hier im Wortlaut:
Cytos beabsichtigt mit interessierten Parteien Gespräche über die VLP B-Zellvakzineplattform zu führen, sowie über die laufenden präklinischen Entwicklungsprogramme, welche auf dieser Plattform basieren.
http://www.cytos.com/uploads/news/id273/Cytos%20PR%20D%205%2…
Oncore/Tekmira kann die CYTN relativ simpel schlucken, erst Recht wenn sie dies mit 60Mio wohl hinbekommen.
Sollten die dann noch einen Teil in eigenen Aktien zahlen, wär's sowieso kein Problem mehr.
Würd mich definitiv nicht mehr wundern.
Zum Verfassen von Kommentaren bitte Anmelden oder Registrieren.
Junktrader
Kommentare: 64
Cytos06.03.2015 - 19:18
DER PRAKTIKUS LIEST AUCH BEI UNS IM FORUM MIT...
AUSZUG FUW.CH / PRAKTIKUS
Spekulationen um Cytos
Am Donnerstag ist der Kurs von Cytos (CYTN 1.35 3.85%) in die Höhe geschossen. Der Titel kommt seit Anfang Woche auf ein Plus von fast 300%. Ich kann nur spekulieren, weshalb die Aktien des Unternehmen, das noch vor kurzem knapp vor dem Konkurs stand, plötzlich so gefragt sind.
Fakt ist, dass es Cytos gelungen ist, Gläubiger vom Tausch ihrer Wandelanleihen in Aktien zu überzeugen. Nächste Woche entscheiden die Aktionäre an einer a.o. GV über eine Kapitalerhöhung, um die Besitzer der Anleihe bedienen zu können. Am Markt machen Gerüchte die Runde, wonach sich das US-Biotechunternehmen OnCore Biopharma im Vorfeld der GV die Stimmenmehrheit sichern will. Die Gesellschaft hat ein Interesse am Fortbestand von Cytos. Sie will einen Wirkstoff aus der Forschungspipeline der Schweizer weiterentwickeln. Dafür zahlt sie Cytos im Erfolgsfall Meilensteinzahlungen von maximal 522 Mio. Fr. Bedingung ist allerdings, dass die Wandelanleihen auch tatsächlich in Aktien getauscht werden. OnCore will womöglich das Abstimmungsresultat sichern.
Vielleicht werden wir nächste Woche mehr wissen, wenn Informationen zu einer Überschreitung der meldepflichtigen Anteile eines Aktionärs publik werden. Doch auch dann steht die Zukunft von Cytos in den Sternen. Selbst wenn es den Anschein macht, dass mutige Investoren derzeit auf den Zug aufspringen: Ich lasse die Finger von den Titeln. Zu riskant.
Zum Verfassen von Kommentaren bitte Anmelden oder Registrieren.Seiten
«‹…808182838485868788
Antwort auf Beitrag Nr.: 49.263.653 von Frhstck am 06.03.15 17:30:50Wer hat die wohl gekauft? Ich glaube es zu wissen.die hat was in der Pipline wo Jemand gut brauchen kann



Gude... dachte Tekmira hat die im Visier... oder?
Antwort auf Beitrag Nr.: 49.271.222 von mfierke am 08.03.15 09:57:41Bin Short - Ziel 0,70 SFR next week
Zitat von mfierke: Wer hat die wohl gekauft? Ich glaube es zu wissen.die hat was in der Pipline wo Jemand gut brauchen kann
Moin zusammen... ich bin jetzt mal so frei und kopiere einen Text eines Users aus dem cash.ch Forum welchen ich teile... wenn ich gegen irgendwelche Regeln verstosse dann bitte löschen, war keine Absicht... der Text ist für alle, auch unregistrierte Personen lesbar:
Quelle: http://www.cash.ch/community/forum/aktien-schweiz/cytos?page…
Ich habe das so gemacht, aber ob das die beste Lösung war wird sich zeigen.
Meiner Meinung nach ist die Aktie zur Zeit eine 100% Wette, dass der Takeover kommt. Bei solchen Stories den Kursverlauf vorher zu sehen ist immer schwierig, da die kleinste News 100% oder -50% bedeuten können. Für mich ist aber klar: Ohne News, ohne Takeover und mit Umwandlung der Anleihe stehen dann 108Mio aus. Es würde mich also sehr verwundern, wenn die Aktie dann noch CHF 1.35 kostet (hätte natürlich nichts dagegen).
4 Szenarien:
1 Aktie bei kein Takeover
Kommt kein Takeover müsste sich die Aktie bei Umwandlung der Aktie wenigstens halbieren auf ca. CHF 0.65 bis CHF 0.70 (Kapitalisierung Cytos dann ca. 70Mio), womit die Aktie halten definitiv nicht die beste Lösung wäre.
2 Aktie bei Takeover
Kommt ein Takeover, kann es gut sein das die Käuferschaft alles aufkauft bis zu einem gewissen Preis, das können dann auch nochmals Kurse über 2.- sein, wer weiss.
3 Anleihe bei kein Takeover
Kommt kein Takeover, wird die Anleihe wohl ziemlich sicher umgewandelt, womit man zu 130% gerechnet die Aktie zu CHF 0.325 bekommt. Wenn die Aktie nach der Umwandlung also wie bei Szenario 1 bei CHF 0.65 bis 0.70 stehen würde, wären das nochmals 100% Gewinn.
4 Anleihe bei Takeover
Kommt ein Takeover, wird die Käuferschaft am 16. März wohl gegen die Umwandlung der Anleihe stimmen und muss in der Konsequenz wohl die Anleihe direkt zu 173% zurückzahlen. Von 130% betrachtet liegen da also immer noch 30% Rendite drin.
Wir werden es sehen. Traumszenario wäre für mich die Wandlung der Anleihe mit anschliessend irgendwelchen Goodnews auf Ebene Cyt003/VLP-Plattform. Das würde bestimmt Fantasie freisetzen um den Kurs der Aktie auch dann in den Bereich von 1-2CHF zu katapultieren (ob gerechtfertigt oder nicht ist ein anderes Thema) womit mit den umgewandelten Anleiheaktien ein Riesengewinn möglich wäre.
Wir werden es sehen, die Zeit wird's zeigen.
Grüsse
Quelle: http://www.cash.ch/community/forum/aktien-schweiz/cytos?page…
Ich habe das so gemacht, aber ob das die beste Lösung war wird sich zeigen.
Meiner Meinung nach ist die Aktie zur Zeit eine 100% Wette, dass der Takeover kommt. Bei solchen Stories den Kursverlauf vorher zu sehen ist immer schwierig, da die kleinste News 100% oder -50% bedeuten können. Für mich ist aber klar: Ohne News, ohne Takeover und mit Umwandlung der Anleihe stehen dann 108Mio aus. Es würde mich also sehr verwundern, wenn die Aktie dann noch CHF 1.35 kostet (hätte natürlich nichts dagegen).
4 Szenarien:
1 Aktie bei kein Takeover
Kommt kein Takeover müsste sich die Aktie bei Umwandlung der Aktie wenigstens halbieren auf ca. CHF 0.65 bis CHF 0.70 (Kapitalisierung Cytos dann ca. 70Mio), womit die Aktie halten definitiv nicht die beste Lösung wäre.
2 Aktie bei Takeover
Kommt ein Takeover, kann es gut sein das die Käuferschaft alles aufkauft bis zu einem gewissen Preis, das können dann auch nochmals Kurse über 2.- sein, wer weiss.
3 Anleihe bei kein Takeover
Kommt kein Takeover, wird die Anleihe wohl ziemlich sicher umgewandelt, womit man zu 130% gerechnet die Aktie zu CHF 0.325 bekommt. Wenn die Aktie nach der Umwandlung also wie bei Szenario 1 bei CHF 0.65 bis 0.70 stehen würde, wären das nochmals 100% Gewinn.
4 Anleihe bei Takeover
Kommt ein Takeover, wird die Käuferschaft am 16. März wohl gegen die Umwandlung der Anleihe stimmen und muss in der Konsequenz wohl die Anleihe direkt zu 173% zurückzahlen. Von 130% betrachtet liegen da also immer noch 30% Rendite drin.
Wir werden es sehen. Traumszenario wäre für mich die Wandlung der Anleihe mit anschliessend irgendwelchen Goodnews auf Ebene Cyt003/VLP-Plattform. Das würde bestimmt Fantasie freisetzen um den Kurs der Aktie auch dann in den Bereich von 1-2CHF zu katapultieren (ob gerechtfertigt oder nicht ist ein anderes Thema) womit mit den umgewandelten Anleiheaktien ein Riesengewinn möglich wäre.
Wir werden es sehen, die Zeit wird's zeigen.
Grüsse
Antwort auf Beitrag Nr.: 49.273.409 von Frhstck am 08.03.15 20:06:56gutes Gelingen, du wirst es brauchen
Antwort auf Beitrag Nr.: 49.274.588 von mfierke am 09.03.15 07:47:41
Das glaube ich auch... aber wie war das an der Börse... es kommt immer anders als man denkt...
Zitat von mfierke: gutes Gelingen, du wirst es brauchen
Das glaube ich auch... aber wie war das an der Börse... es kommt immer anders als man denkt...
Antwort auf Beitrag Nr.: 49.274.588 von mfierke am 09.03.15 07:47:41Danke, einfacher gehts nicht.
Zitat von mfierke: gutes Gelingen, du wirst es brauchen
Hat jemand das Orderbuch oder einen live Chart? Der auf Google Finance ist glaube ich 15min. versetzt...
@ Frhstck... bei welchen Broker bist du?
Antwort auf Beitrag Nr.: 49.274.663 von Pireas am 09.03.15 08:03:55@ Frhstck... bei welchen Broker bist du?" target="_blank" rel="nofollow ugc noopener">http://www.lynxbroker.de/broker/?affiliate=3355991320&eatte=broker&eatglc=GeJI9OKZPoO&gclid=CPbv-4femsQCFWfKtAodiCAAAQ
Zitat von Pireas: @ Frhstck... bei welchen Broker bist du?
Absturz beginnt schon - siehe TG
RT 1,10 € auf Tradegate - sehr nice - die 0,70 kommen schon heute sehr nah
Antwort auf Beitrag Nr.: 49.274.588 von mfierke am 09.03.15 07:47:41die 1 nach unten ist keine Hürde oder?
Zitat von mfierke: gutes Gelingen, du wirst es brauchen
Die Käufer von letzter Woche Donnerstag/Freitag mittlerweile sehr stark im Minus
Antwort auf Beitrag Nr.: 49.275.509 von Frhstck am 09.03.15 09:36:24so gut rechnen können wir nicht, schön das du uns das sagst. Armer Käufer



Antwort auf Beitrag Nr.: 49.275.554 von mfierke am 09.03.15 09:40:32Man kann nur hoffen das keiner hier eingestiegen ist. Von 2,60 auf 0,50/0,70 ist schon eine Hausnummer
Zitat von mfierke: so gut rechnen können wir nicht, schön das du uns das sagst. Armer Käufer
Antwort auf Beitrag Nr.: 49.275.626 von Frhstck am 09.03.15 09:46:39glaube mir, die haben gewußt was sie machen. Sind bestimmt noch welcher schlauer wie du. Ein Kleinaktionär war es auf jeden Fall nicht

Antwort auf Beitrag Nr.: 49.275.668 von mfierke am 09.03.15 09:50:56na ja, jetzt sind Sie auf jedenfall wieder raus. Kurs akt, schon unter 1,00
Zitat von mfierke: glaube mir, die haben gewußt was sie machen. Sind bestimmt noch welcher schlauer wie du. Ein Kleinaktionär war es auf jeden Fall nicht
Antwort auf Beitrag Nr.: 49.273.409 von Frhstck am 08.03.15 20:06:56close unter 1,10 / + 0,25 - nun Posi auf long gedreht zu 1,17 SFR - volumen nach unten dünnt stark aus
Zitat von Frhstck: Bin Short - Ziel 0,70 SFR next weekZitat von mfierke: Wer hat die wohl gekauft? Ich glaube es zu wissen.die hat was in der Pipline wo Jemand gut brauchen kann
Antwort auf Beitrag Nr.: 49.276.367 von Frhstck am 09.03.15 11:12:14Melde mich zurück - zu 1,25 SFR alle Stücke verkauft. Der 2 Versuch die 1,30 zu erreichen schlug volumentechnisch fehl. Deshalb erstmal wieder raus.
Zitat von Frhstck: close unter 1,10 / + 0,25 - nun Posi auf long gedreht zu 1,17 SFR - volumen nach unten dünnt stark ausZitat von Frhstck: Bin Short - Ziel 0,70 SFR next week...
Allerdings muss man sich immer vor Augen halten - spätestens bei Wandlung steht die wieder bei 0,50 SFR
Antwort auf Beitrag Nr.: 49.278.491 von Frhstck am 09.03.15 15:01:05Hi,
eine Frage zur Wandlung, es kommen ca 77 Millionen neue Aktien
die die Altanleihebestitzer (1 zu 0,25 Cent beziehen und bezahlen müssen? )
angenommen ich hatte eine Anleihe über nominal 100.000 sfr bekomme ich
400.000 Aktien zu0,25= Kapitaleinsatz 100.000 /sfr wenn der Kurs dann auf
0,50 steigt ist der Anleihebesitzer schon +-o raus.
Ist das so richtig.
lg
eine Frage zur Wandlung, es kommen ca 77 Millionen neue Aktien
die die Altanleihebestitzer (1 zu 0,25 Cent beziehen und bezahlen müssen? )
angenommen ich hatte eine Anleihe über nominal 100.000 sfr bekomme ich
400.000 Aktien zu0,25= Kapitaleinsatz 100.000 /sfr wenn der Kurs dann auf
0,50 steigt ist der Anleihebesitzer schon +-o raus.
Ist das so richtig.
lg
Zock ist längst vorbei
RT 0,93 € auf TG - Tja - alles wie vorgesagt
Cytos: Wandlung Anleihe in Aktien gerichtlich genehmigt; Flüssige Mittel 3,4 Mio
13. März 2015 07:17
Schlieren (awp) - Die Cytos Biotechnology ist mit ihrer Restrukturierung der Wandelanleihe einen weiteren Schritt voran gekommen und hat vom Obergericht des Kantons Zürich die Genehmigung zur Wandlung der ausstehenden Anleihe 5,75%/2015 in Aktien erhalten. Derweil stehen Zahlungsverpflichtungen von 6 Mio CHF noch flüssige Mittel von rund 3,4 Mio gegenüber, wie das Unternehmen am Freitag mitteilt.
Die Obere Kantonale Nachlassbehörde (Obergericht des Kantons Zürich) habe die einzige Resolution (Wandlung der Anleihe in Aktien) genehmigt, die anlässlich der Gläubigerversammlung vom 26. Januar 2015 beschlossen und am 2. Februar 2015 an das Zürcher Obergericht eingereicht worden sei. Die Genehmigung erlange Rechtskraft, sofern innerhalb der nächsten dreissig Tage keine Beschwerde an das Bundesgericht eingereicht werde, heisst es in der Mitteilung weiter.
Die Wandlung der Anleihe in 77,49 Mio Cytos-Aktien soll voraussichtlich in der zweiten Aprilhälfte erfolgen, sofern die auf den 16. März 2015 einberufene ausserordentliche Generalversammlung die Schaffung des benötigten Kapitals mit zwei Drittel der anwesenden oder vertretenen Stimmen genehmigt. Nach erfolgter Wandlung werden laut Mitteilung rund 108 Mio Cytos-Aktien ausstehend sein.
Von der ursprünglich ausstehenden Zahlungsverpflichtung aus den Wandeldarlehen von insgesamt 22,2 Mio CHF seien 2 Mio mittels Tausch gegen Wandelanleihen reduziert worden, so die Mitteilung weiter. Der nicht nachrangige Teil von 14,2 Mio sei fristgerecht zurück bezahlt worden. Somit beträgt die noch ausstehende Zahlungsverpflichtung gegenüber der Wandeldarlehensgebern laut Mitteilung 6 Mio, die weiterhin nachrangig sind. Die flüssigen Mittel vom Unternehmen demgegenüber per Ende Februar 2015 mit rund 3,4 Mio angegeben.
rt/cp
Also... im cash.ch Forum wird seit Tagen diskutiert, dass die Aktie fallen würde wenn das was ich oben kopiert habe passiert, deswegen wollen alle die WA haben... meiner Meinung völliger Quatsch, fällt die Aktie fällt doch auch der Gewinn beim tausch von WA in Aktie... Gewinn ist doch über die Anleihe in disem Tauschgeschäft nur möglich, wenn die Aktie einen gewissen Wert hat ansonsten müsste diese sich einpendeln, oder?
13. März 2015 07:17
Schlieren (awp) - Die Cytos Biotechnology ist mit ihrer Restrukturierung der Wandelanleihe einen weiteren Schritt voran gekommen und hat vom Obergericht des Kantons Zürich die Genehmigung zur Wandlung der ausstehenden Anleihe 5,75%/2015 in Aktien erhalten. Derweil stehen Zahlungsverpflichtungen von 6 Mio CHF noch flüssige Mittel von rund 3,4 Mio gegenüber, wie das Unternehmen am Freitag mitteilt.
Die Obere Kantonale Nachlassbehörde (Obergericht des Kantons Zürich) habe die einzige Resolution (Wandlung der Anleihe in Aktien) genehmigt, die anlässlich der Gläubigerversammlung vom 26. Januar 2015 beschlossen und am 2. Februar 2015 an das Zürcher Obergericht eingereicht worden sei. Die Genehmigung erlange Rechtskraft, sofern innerhalb der nächsten dreissig Tage keine Beschwerde an das Bundesgericht eingereicht werde, heisst es in der Mitteilung weiter.
Die Wandlung der Anleihe in 77,49 Mio Cytos-Aktien soll voraussichtlich in der zweiten Aprilhälfte erfolgen, sofern die auf den 16. März 2015 einberufene ausserordentliche Generalversammlung die Schaffung des benötigten Kapitals mit zwei Drittel der anwesenden oder vertretenen Stimmen genehmigt. Nach erfolgter Wandlung werden laut Mitteilung rund 108 Mio Cytos-Aktien ausstehend sein.
Von der ursprünglich ausstehenden Zahlungsverpflichtung aus den Wandeldarlehen von insgesamt 22,2 Mio CHF seien 2 Mio mittels Tausch gegen Wandelanleihen reduziert worden, so die Mitteilung weiter. Der nicht nachrangige Teil von 14,2 Mio sei fristgerecht zurück bezahlt worden. Somit beträgt die noch ausstehende Zahlungsverpflichtung gegenüber der Wandeldarlehensgebern laut Mitteilung 6 Mio, die weiterhin nachrangig sind. Die flüssigen Mittel vom Unternehmen demgegenüber per Ende Februar 2015 mit rund 3,4 Mio angegeben.
rt/cp
Also... im cash.ch Forum wird seit Tagen diskutiert, dass die Aktie fallen würde wenn das was ich oben kopiert habe passiert, deswegen wollen alle die WA haben... meiner Meinung völliger Quatsch, fällt die Aktie fällt doch auch der Gewinn beim tausch von WA in Aktie... Gewinn ist doch über die Anleihe in disem Tauschgeschäft nur möglich, wenn die Aktie einen gewissen Wert hat ansonsten müsste diese sich einpendeln, oder?
wo ist denn unser Frühstück, der hat seine Prognose auch weit verfehlt

nu ja man weiß ja wie das Frühstück schmeckt



nu ja man weiß ja wie das Frühstück schmeckt


Antwort auf Beitrag Nr.: 49.337.519 von mfierke am 16.03.15 09:37:31Läuft alles nach Plan:
Cytos Biotechnology AG: Ausserordentliche Generalversammlung genehmigt alle Anträge
EQS Group-Ad-hoc: Cytos Biotechnology AG / Schlagwort(e): Generalversammlung Cytos Biotechnology AG: Ausserordentliche Generalversammlung genehmigt alle Anträge
16.03.2015 / 11:12 Veröffentlichung einer Ad-hoc-Mitteilung gemäss Art. 53 KR. Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
Ausserordentliche Generalversammlung der Cytos Biotechnology AG genehmigt alle Anträge
Schlieren (Zürich), Schweiz, 16. März 2015 - Cytos Biotechnology AG ("Cytos") hat heute bekannt gegeben, dass die Aktionärinnen und Aktionäre an der heute abgehaltenen, ausserordentlichen Generalversammlung sämtliche Anträge genehmigt haben. Diese beinhalten unter anderem eine ordentliche Kapitalerhöhung im Umfang von 77.49 Millionen Aktien, welche gebraucht werden, um die ausstehenden Wandelobligationen in Aktien zu wandeln, nachdem der Restrukturierungsantrag der Wandelanleihe final und bindend geworden ist, was für die zweite Aprilhälfte 2015 erwartet wird. Nach erfolgter Wandlung werden rund 108 Millionen Cytos Aktien mit einem Nennwert von CHF 0.03 pro Aktie ausstehend sein.
Die ausserordentliche Generalversammlung von Cytos Biotechnology AG fand am Firmensitz in Schlieren (Zürich), Schweiz, statt. 52 Aktionärinnen und Aktionäre folgten der Einladung. Es waren 4'757'980 Aktien oder 15.6% von insgesamt 30'525'276 Aktien vertreten.
Cytos Biotechnology AG: Ausserordentliche Generalversammlung genehmigt alle Anträge
EQS Group-Ad-hoc: Cytos Biotechnology AG / Schlagwort(e): Generalversammlung Cytos Biotechnology AG: Ausserordentliche Generalversammlung genehmigt alle Anträge
16.03.2015 / 11:12 Veröffentlichung einer Ad-hoc-Mitteilung gemäss Art. 53 KR. Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
Ausserordentliche Generalversammlung der Cytos Biotechnology AG genehmigt alle Anträge
Schlieren (Zürich), Schweiz, 16. März 2015 - Cytos Biotechnology AG ("Cytos") hat heute bekannt gegeben, dass die Aktionärinnen und Aktionäre an der heute abgehaltenen, ausserordentlichen Generalversammlung sämtliche Anträge genehmigt haben. Diese beinhalten unter anderem eine ordentliche Kapitalerhöhung im Umfang von 77.49 Millionen Aktien, welche gebraucht werden, um die ausstehenden Wandelobligationen in Aktien zu wandeln, nachdem der Restrukturierungsantrag der Wandelanleihe final und bindend geworden ist, was für die zweite Aprilhälfte 2015 erwartet wird. Nach erfolgter Wandlung werden rund 108 Millionen Cytos Aktien mit einem Nennwert von CHF 0.03 pro Aktie ausstehend sein.
Die ausserordentliche Generalversammlung von Cytos Biotechnology AG fand am Firmensitz in Schlieren (Zürich), Schweiz, statt. 52 Aktionärinnen und Aktionäre folgten der Einladung. Es waren 4'757'980 Aktien oder 15.6% von insgesamt 30'525'276 Aktien vertreten.
Der Wandler ist bei mir gesperrt. Ansonsten würd ich ihn gerne kaufen. Da gibts Aktien für 0.45CHF, die gerade für 1:50+CHF gehandelt werden 

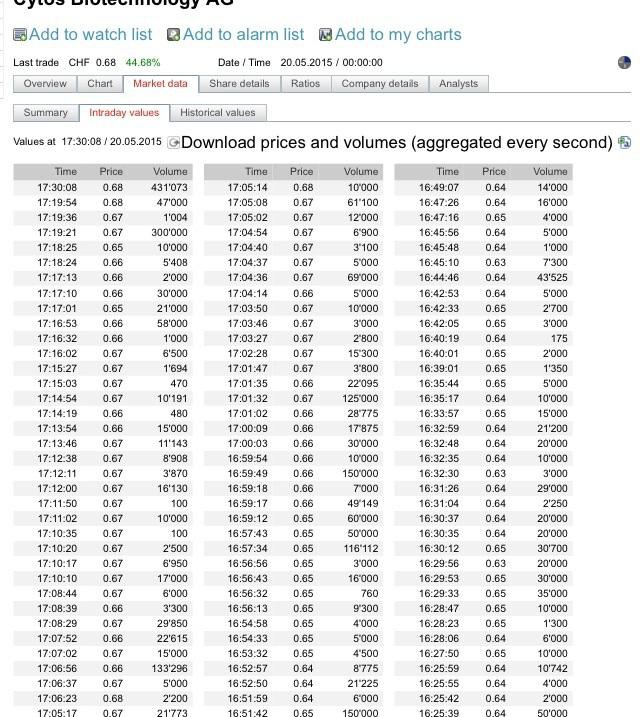
Da sammelt wieder ein großer ein schaut euch mal den letzen Trade an.
Habe mir heute auch 20.000 Stücke gegönnt bin schon kräftig ins Plus gerutscht.
Ich gehe morgen von weiter steigenden Kursen aus.
Auf TH geschlossen und dann noch mit solch ein Volumen über 12mio in der Schweiz.
Sehr interessanter Deal:
http://www.handelszeitung.ch/unternehmen/cytos-erhofft-sich-…
Strong Watch.
http://www.handelszeitung.ch/unternehmen/cytos-erhofft-sich-…
Strong Watch.

etwas Recherche zu Cytos und Management
Anbei eine Recherche zu Cytos Biotech und dessen Management - speziell im Umgang mit der Vermarktung hoch innovativer Produkte der europäischen BioTech Branche.Ich bin gespannt auf euere Einschätzung, wie es bei Cytos wohl weitergehen mag...
Link zur vollständigen Recherche (mit eingebetteten Links im PDF Dokument)
https://www.wetransfer.com/downloads/2d95fb8b44a6c4136358cbe…
Korrektur: etwas Recherche zu Cytos und Management
...leider war eine falsche Vorabversion verlinkt, - anbei die richtige Version:https://www.wetransfer.com/downloads/a89ae087ab7ca4d2ac8129c…
Der Zusammenschluss wurde von der HV genehmigt.
Und was kommt jetzt?
Nehme die Aktie auf meine erweiterte Watchlist.
http://www.boerse-online.de/nachrichten/aktien/DGAP-Adhoc-Cy…
Und was kommt jetzt?
Nehme die Aktie auf meine erweiterte Watchlist.
http://www.boerse-online.de/nachrichten/aktien/DGAP-Adhoc-Cy…
Wäre hier vorsichtig. Die Bruchbude ist in einem Jahr weg.
Neuer Name neues Glück?
EQS Group-Ad-hoc: Cytos Biotechnology AG / Schlagwort(e): Fusionen & Übernahmen Cytos Biotechnology AG wird in Kuros Biosciences AG umbenannt, konstituiert ihren Verwaltungsrat und ernennt die Geschäftsleitung
08.01.2016 / 07:00 Veröffentlichung einer Ad-hoc-Mitteilung gemäss Art. 53 KR. Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
Cytos Biotechnology AG wird in Kuros Biosciences AG umbenannt, konstituiert ihren Verwaltungsrat und ernennt die Geschäftsleitung
Schlieren (Zürich), Schweiz, 8. Januar 2016 - Cytos Biotechnology AG ("Cytos" welche in Kuros Biosciences AG umbenannt wird) hat heute bekannt gegeben, dass sich der Verwaltungsrat konstituiert hat. Dr. Christian Itin tritt als Chief Executive Officer zurück - bleibt aber Präsident des Verwaltungsrates. Herr Dominik Ellenrieder ist zum Vizepräsident des Verwaltungsrates ernannt worden. Der neu konstituierte Verwaltungsrat hat Didier Cowling zum Chief Executive Officer, Dr. Alistair Irvine zum Chief Business Officer und Dr. Jason Schense zum Chief Technology Officer ernannt und Harry Welten als Chief Financial Officer bestätigt. Alle Ernennungen sind wirksam mit dem Vollzug der Akquisition von Kuros Biosurgery Holding AG welche innerhalb der nächsten Wochen erwartet wird.
"Gestern haben die Aktionäre mit überwiegender Mehrheit die Akquisition von Kuros Biosurgery AG unterstützt. Als Konsequenz sind die meisten bestehenden Verwaltungsratsmitglieder zurückgetreten und neue Mitglieder sind gewählt worden. Ich möchten den abtretenden Verwaltungsratsmitgliedern für deren bisherige wertvolle Unterstützung danken und heisse die neuen Mitglieder des Verwaltungsrates und der Geschäftsleitung willkommen.", sagte Dr. Christian Itin, Verwaltungsratspräsident von Cytos. "Ich möchte Herrn Harry Welten, Cytos bisherigem Chief Financial Officer, danken, dass er weiterhin als Chief Financial Officer dient."
Für weitere Informationen wenden Sie sich bitte an:
Cytos Biotechnology AG Harry Welten, MBA Chief Financial Officer Tel: +41 44 733 46 46 harry.welten@cytos.com
EQS Group-Ad-hoc: Cytos Biotechnology AG / Schlagwort(e): Fusionen & Übernahmen Cytos Biotechnology AG wird in Kuros Biosciences AG umbenannt, konstituiert ihren Verwaltungsrat und ernennt die Geschäftsleitung
08.01.2016 / 07:00 Veröffentlichung einer Ad-hoc-Mitteilung gemäss Art. 53 KR. Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
Cytos Biotechnology AG wird in Kuros Biosciences AG umbenannt, konstituiert ihren Verwaltungsrat und ernennt die Geschäftsleitung
Schlieren (Zürich), Schweiz, 8. Januar 2016 - Cytos Biotechnology AG ("Cytos" welche in Kuros Biosciences AG umbenannt wird) hat heute bekannt gegeben, dass sich der Verwaltungsrat konstituiert hat. Dr. Christian Itin tritt als Chief Executive Officer zurück - bleibt aber Präsident des Verwaltungsrates. Herr Dominik Ellenrieder ist zum Vizepräsident des Verwaltungsrates ernannt worden. Der neu konstituierte Verwaltungsrat hat Didier Cowling zum Chief Executive Officer, Dr. Alistair Irvine zum Chief Business Officer und Dr. Jason Schense zum Chief Technology Officer ernannt und Harry Welten als Chief Financial Officer bestätigt. Alle Ernennungen sind wirksam mit dem Vollzug der Akquisition von Kuros Biosurgery Holding AG welche innerhalb der nächsten Wochen erwartet wird.
"Gestern haben die Aktionäre mit überwiegender Mehrheit die Akquisition von Kuros Biosurgery AG unterstützt. Als Konsequenz sind die meisten bestehenden Verwaltungsratsmitglieder zurückgetreten und neue Mitglieder sind gewählt worden. Ich möchten den abtretenden Verwaltungsratsmitgliedern für deren bisherige wertvolle Unterstützung danken und heisse die neuen Mitglieder des Verwaltungsrates und der Geschäftsleitung willkommen.", sagte Dr. Christian Itin, Verwaltungsratspräsident von Cytos. "Ich möchte Herrn Harry Welten, Cytos bisherigem Chief Financial Officer, danken, dass er weiterhin als Chief Financial Officer dient."
Für weitere Informationen wenden Sie sich bitte an:
Cytos Biotechnology AG Harry Welten, MBA Chief Financial Officer Tel: +41 44 733 46 46 harry.welten@cytos.com
Spannend wird sein wie sich die Kuros Altaktionäre verhalten.
Sie haben demnächst die Möglichkeit über die Börse zu verkaufen.
Wenn sie das nicht tun sollte man hellhörig werden.
Cytos war zum Schluss ein schuldenfreier Börsenmantel mit ein paar Lizenzvereinbarungen.
Kuros bringt etwas Spielgeld mit (20 Mio) und einige interessante Produkte vor der Zulassung.
Mal sehen was weiter passiert?
Ich gehe davon aus das bei der nächsten HV und GV eine Kapitalherabsetzung von 1:10 durchgeführt wird.
500 Mio Aktien sind doch etwas zuviel.
Sie haben demnächst die Möglichkeit über die Börse zu verkaufen.
Wenn sie das nicht tun sollte man hellhörig werden.
Cytos war zum Schluss ein schuldenfreier Börsenmantel mit ein paar Lizenzvereinbarungen.
Kuros bringt etwas Spielgeld mit (20 Mio) und einige interessante Produkte vor der Zulassung.
Mal sehen was weiter passiert?
Ich gehe davon aus das bei der nächsten HV und GV eine Kapitalherabsetzung von 1:10 durchgeführt wird.
500 Mio Aktien sind doch etwas zuviel.

Antwort auf Beitrag Nr.: 51.157.668 von Cherrypicker_85 am 23.11.15 20:36:19Hallo Cherrypicker_85,
dein link funktioniert leider nicht mehr.
Hast du die Information noch verfügbar?
dein link funktioniert leider nicht mehr.
Hast du die Information noch verfügbar?
Die neuen Aktien sind nun handelbar.
http://www.dgap.de/dgap/News/adhoc/cytos-biotechnology-melde…
Aus der Adhoc:
Dr. Christian Itin, Verwaltungsratspräsident von Kuros meint: "Wir freuen uns über den erfolgreichen Zusammenschluss und begrüssen unsere neuen Aktionäre. Kuros' Produktkandidaten adressieren wichtige Märkte im Wundheilungs-und Knochen-Regenerations-Bereich. Wir sehen sehr gute Voraussetzungen um langfristiges Potential für eine Wertsteigerung für die Aktionäre zu schaffen."
Wäre ein gutes Zeichen wenn die neuen Aktien nicht sofort auf dem Markt geworfen werden.
http://www.dgap.de/dgap/News/adhoc/cytos-biotechnology-melde…
Aus der Adhoc:
Dr. Christian Itin, Verwaltungsratspräsident von Kuros meint: "Wir freuen uns über den erfolgreichen Zusammenschluss und begrüssen unsere neuen Aktionäre. Kuros' Produktkandidaten adressieren wichtige Märkte im Wundheilungs-und Knochen-Regenerations-Bereich. Wir sehen sehr gute Voraussetzungen um langfristiges Potential für eine Wertsteigerung für die Aktionäre zu schaffen."
Wäre ein gutes Zeichen wenn die neuen Aktien nicht sofort auf dem Markt geworfen werden.

Antwort auf Beitrag Nr.: 51.453.663 von valueanleger am 09.01.16 18:23:07Hallo valueanleger,
hier ist auch der Inhalt im schweizer Chash.ch Forum - viel Spass bei der Lektüre...
hier ist auch der Inhalt im schweizer Chash.ch Forum - viel Spass bei der Lektüre...

Antwort auf Beitrag Nr.: 51.453.663 von valueanleger am 09.01.16 18:23:07Sorry....hier der Link:
http://www.cash.ch/sites/default/files/public/forum/attachme…
http://www.cash.ch/sites/default/files/public/forum/attachme…
Antwort auf Beitrag Nr.: 51.748.684 von Cherrypicker_85 am 15.02.16 12:30:43Könnte das der Grund sein warum sich Kuros die Bude geschnappt hat? 

Bodenbildung in Sicht? 

Neue CMO:
Kuros Biosciences AG ernennt Chief Medical Officer
EQS Group-Ad-hoc: Kuros Biosciences AG / Schlagwort(e): Personalie
2016-03-08 / 07:00
Veröffentlichung einer Ad-hoc-Mitteilung gemäss Art. 53 KR.
Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
Kuros Biosciences AG ernennt Chief Medical Officer
Schlieren (Zürich), Schweiz, 8. März 2016 - Kuros Biosciences AG ("Kuros") hat heute bekannt gegeben, dass Dr. Virginia Jamieson mit sofortiger Wirkung zum Chief Medical Officer und Mitglied der Geschäftsleitung ernannt wurde.
Dr. Jamieson ist seit mehr als 25 Jahren in der pharmazeutischen Industrie tätig und hat substantielle Erfahrung im Bereich frühe und späte klinische Entwicklung, Produkte Registrierung und Medical Affairs. Dr. Jamieson hat ihren medizinischen Titel an der Universität von Edinburgh erlangt und ein Nachdiplomstudium am Royal College of Surgeons in London absolivert. Zudem besitzt sie ein Diplom der Faculty of Pharmaceutical Medicine wo sie als Gutachterin für die Revalidierung von Aerzten in der pharmazeutischen Industrie tätig ist. Dr. Jamieson arbeitete bereits von 2005 bis 2012 als Medical Director und später als Chief Medical Officer für Kuros und kennt deshalb Kuros' Produkte sehr gut.
Didier Cowling, CEO von Kuros, sagte: "Wir sind sehr erfreut, dass Virginia wieder Teil unseres Teams ist. Ihre Erfahrung, sowohl im chirurgischen Umfeld wie auch im pharmazeutischen und medizinischen Gebiet, gepaart mit ihrem profunden Wissen von Kuros' Produkten, macht ihre Ernennung umso bedeutender.»
Für weitere Informationen wenden Sie sich bitte an:
Kuros Biosciences AG
Harry Welten, MBA
Chief Financial Officer
Tel: +41 44 733 46 46
harry.welten@kuros.ch
Kuros Biosciences AG ernennt Chief Medical Officer
EQS Group-Ad-hoc: Kuros Biosciences AG / Schlagwort(e): Personalie
2016-03-08 / 07:00
Veröffentlichung einer Ad-hoc-Mitteilung gemäss Art. 53 KR.
Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
Kuros Biosciences AG ernennt Chief Medical Officer
Schlieren (Zürich), Schweiz, 8. März 2016 - Kuros Biosciences AG ("Kuros") hat heute bekannt gegeben, dass Dr. Virginia Jamieson mit sofortiger Wirkung zum Chief Medical Officer und Mitglied der Geschäftsleitung ernannt wurde.
Dr. Jamieson ist seit mehr als 25 Jahren in der pharmazeutischen Industrie tätig und hat substantielle Erfahrung im Bereich frühe und späte klinische Entwicklung, Produkte Registrierung und Medical Affairs. Dr. Jamieson hat ihren medizinischen Titel an der Universität von Edinburgh erlangt und ein Nachdiplomstudium am Royal College of Surgeons in London absolivert. Zudem besitzt sie ein Diplom der Faculty of Pharmaceutical Medicine wo sie als Gutachterin für die Revalidierung von Aerzten in der pharmazeutischen Industrie tätig ist. Dr. Jamieson arbeitete bereits von 2005 bis 2012 als Medical Director und später als Chief Medical Officer für Kuros und kennt deshalb Kuros' Produkte sehr gut.
Didier Cowling, CEO von Kuros, sagte: "Wir sind sehr erfreut, dass Virginia wieder Teil unseres Teams ist. Ihre Erfahrung, sowohl im chirurgischen Umfeld wie auch im pharmazeutischen und medizinischen Gebiet, gepaart mit ihrem profunden Wissen von Kuros' Produkten, macht ihre Ernennung umso bedeutender.»
Für weitere Informationen wenden Sie sich bitte an:
Kuros Biosciences AG
Harry Welten, MBA
Chief Financial Officer
Tel: +41 44 733 46 46
harry.welten@kuros.ch
Antwort auf Beitrag Nr.: 52.230.043 von valueanleger am 20.04.16 07:09:03
Unglaublich, in Frankfurt wurden bis zu 0,29€ in der Spitze bezahlt.
Man kann sehen welches Potential die Aktie besitzt wenn die Meilensteinzahlung eines Tages etwas größer ausfallen sollten.
Zitat von valueanleger: Eine kleine Meilensteinzahlung:
http://www.dgap.de/dgap/News/adhoc/kuros-biosciences-erhaelt…
Unglaublich, in Frankfurt wurden bis zu 0,29€ in der Spitze bezahlt.

Man kann sehen welches Potential die Aktie besitzt wenn die Meilensteinzahlung eines Tages etwas größer ausfallen sollten.

Kuros ist auf dem richtigen Weg.
Aber wie bei vielen Biotechs muss man auch hier sehr geduldig sein und hoffen das ihre Produkte zugelassen und von Markt angenommen werden.
Kuros Biosciences publiziert Finanzergebnis für das Jahr 2015
EQS Group-Ad-hoc: Kuros Biosciences AG / Schlagwort(e): Jahresergebnis
2016-04-26 / 07:00
Veröffentlichung einer Ad-hoc-Mitteilung gemäss Art. 53 KR.
Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
Kuros Biosciences publiziert Finanzergebnis für das Jahr 2015
- Drei ausserordentliche Faktoren mit Einmalcharakter führen zu einem Reingewinn
- Schuldenfreie Bilanz dank Umwandlung der Anleihen und Einigung mit Darlehensgebern
- Zwei neue Lizenzabkommen für CYT003 und VLP-Plattform mit Checkmate zur Behandlung von Krebs resp. mit Arbutus zur Behandlung von Hepatitis-B-Infektionen
- Zusammenschluss mit Kuros Biosurgery im Januar 2016 schafft führendes Unternehmen im Bereich Gewebereparatur und -regeneration
Schlieren (Zürich), Schweiz, 26. April 2016 - Kuros Biosciences AG ("Kuros") gab heute das Finanzergebnis für das Jahr 2015 bekannt. Der Nettogewinn von CHF 6,23 Mio. kam dank drei ausserordentlichen, nicht-operativen und einmaligen Effekten zustande: (i) markant höheren Umsätze aus Lizenzvereinbarungen insbesondere dem Auskauf von CAD106 durch Novartis, (ii) deutlich tieferen Betriebskosten wegen Einstellung der Forschungs- und Entwicklungsaktivitäten, und (iii) einem signifikant höheren Finanzergebnis dank Tilgung aller ausstehenden Schulden, namentlich der Umwandlung aller Anleihen in Aktien und der Rückzahlung resp. dem teilweisen Forderungsverzicht der Darlehensgeber. Diese Transaktionen schlossen die Bilanzsanierung ab und ebneten den Weg für den Zusammenschluss der Cytos Biotechnology AG mit der Kuros Biosurgery Holding AG mittels Austausches von Aktien der Kuros Biosurgery Holding AG gegen neu geschaffene Aktien der Cytos Biotechnology AG. Mit der am 18. Januar 2016 abgeschlossenen Übernahme entstand ein führendes Unternehmen im Bereich Gewebereparatur und -regeneration.
«Das Geschäftsergebnis 2015 ist geprägt von drei ausserordentlichen, teils nicht-operativen Einmaleffekten. Für uns bedeutend wichtiger war der erfolgreiche Abschluss der Bilanzsanierung durch die Tilgung sämtlicher Schulden, welche die Firma enorm belastet haben. Dadurch gewannen wir die volle Flexibilität für die Suche nach einem strategischen Partner», kommentierte Harry Welten, Chief Financial Officer und Mitglied des Verwaltungsrates der Kuros Biosciences. «Im Januar 2016 übernahmen wir die Kuros Biosurgery Holding AG, eine private Abspaltung der ETH Zürich, um die eigene Produktpalette wieder zu verstärken. Zusammen wollen wir Kuros Biosciences zum führenden Unternehmen für Gewebereparatur und -regeneration machen.»
Fortgeschrittene Programme mit Wundversiegelungsmitteln und orthobiologischen Produktkandidaten
Kuros hat sich auf die Entwicklung innovativer Produkte für die Gewebereparatur und -regeneration spezialisiert. Die am weitesten fortgeschrittenen Kandidaten haben in bisher allen klinischen Studien ihre primären Endpunkte erreicht:
- KUR-023 ist ein neuartiges Biomaterial, welches als Versiegelungsmittel zum schnellen Verschluss der Hirnhaut nach operativen Eingriffen dient.
- KUR-111 und KUR-113 sind zwei neuartige orthobiologische Produkte für die Knochenheilung und Stabilisierung der Wirbelsäule. Beide Kandidaten basieren auf dem gleichen biologisch aktiven Wirkstoff.
Ausserdem führt Kuros die Partnerschaften mit CYT003 und der VLP-Technologie mit Checkmate Pharmaceuticals auf dem Gebiet der Krebsforschung und diejenige mit Arbutus Biopharma (ehemals Oncore Biopharma) bei Hepatitis-B-Infektionen weiter. Beide Vereinbarungen wurden im Jahre 2015 eingegangen. Das CYT003-Programm und die VLP-Technologie werden mit Investitionen der Kooperationspartner weiterentwickelt. Im Erfolgsfall erhält Kuros erhebliche Zahlungen beim Erreichen von Meilensteinen in der Entwicklung und Lizenzgebühren auf künftige Umsätze. Das Unternehmen selber wird jedoch keine weiteren eigenen Mittel investieren.
Ausblick und geplante Nachrichten
Nach erfolgreichem Abschluss der klinischen Entwicklung bereitet Kuros KUR-023 für die CE-Kennzeichnung im Vorfeld der Markteinführung in der Europäischen Union vor. Die Zulassung wird für 2017 erwartet. In den USA plant Kuros eine zweite Zulassungsstudie. Nach dem erfolgreichen Abschluss der grossen Phase-IIb-Studien werden KUR-111 und KUR-113 für die klinische Phase-III-Entwicklung vorbereitet.
Kuros ist dank einer Finanzierungsrunde über CHF 20 Millionen im November 2015 solide finanziert. Das Unternehmen erwartet, mit den aktuellen Mitteln ausreichend finanziert zu sein, um KUR-023 sowohl in Europa wie in auch den USA auf den Markt zu bringen und KUR-111 in die klinische Phase-III-Entwicklung zu bringen.
Konsolidierte Finanzergebnisse
Bilanzsanierung
Kuros Biosciences AG (ehemals Cytos Biotechnology AG) erzielte im Jahr 2015 zwei wichtige Meilensteine bei der Tilgung der Schuldenlast. Erstens stimmten am 26. Januar 2015 die Inhaber der Wandelanleihe einer Umwandlung ihrer Anleihen in Aktien zu. Der Wandel fand am 5. Mai 2015 statt. Zweitens konnten die Ansprüche der Darlehensgeber abgegolten werden durch (i) die Rückzahlung der nicht-nachrangigen Darlehen von CHF 14,2 Mio. bei Fälligkeit am 10. Februar 2015, (ii) einen Tausch von Darlehen gegen Wandelanleihen, womit Ansprüche von einem Darlehensgeber über CHF 2 Mio. durch Umwandlung derselben Summe in 1'600 Wandelanleihen aus dem Eigenbestand getilgt werden konnten, (iii) die Zustimmung der Darlehensgeber zu einer 8%-igen Reduktion ihrer Forderungen, und (iv) die Rückzahlung all ihrer ausstehenden Forderungen über CHF 4,36 Mio. am 28. Juli 2015.
Schuldenfreie Bilanz und markant tiefere Cash-Burn-Rate
Am 31. Dezember 2015 beliefen sich die zur Finanzierung des operativen Geschäfts verfügbaren Mittel (flüssige und Geld nahe Mittel, Debitoren und andere Forderungen) auf CHF 2,83 Mio. Sie lagen damit CHF 14,22 Mio. unter dem Vorjahreswert (2014: CHF 17,06 Mio.), was im Wesentlichen auf die Rückzahlung der nicht-nachrangigen Darlehen von CHF 14,2 Mio. per 10. Februar 2015 sowie die Einigung mit den Wandeldarlehensgebern über ihre sämtlichen Ansprüche in der Höhe von CHF 4,36 Mio. am 28. Juli 2015 zurückzuführen ist. Als Folge dieser Transaktionen wurde die Bilanz von Kuros schuldenfrei. Die Cash-Burn-Rate (brutto) für Betriebsaktivitäten betrug durchschnittlich CHF 0,21 Mio. pro Monat und lag markant unter dem Vorjahreswert von CHF 2,06 Mio.
Höhere Umsätze aus Lizenzeinnahmen und dem Auskauf von CAD 106
Aus der Umsatzabgrenzung von Lizenzgebühren für CAD 106 mit Novartis wurde vom 1. Januar bis 20. August 2015 ein Umsatz von CHF 0,64 Mio. verbucht. Im März 2015 kaufte Novartis die Lizenz mit einer Einmalzahlung von CHF 4 Mio. (plus MwSt.) und wird künftig keine weiteren Gebühren mehr zahlen müssen. Die erhaltene Zahlung trat Kuros im Rahmen der Einigungsvereinbarung an die Darlehensgeber ab. Weitere Umsätze erzielte Kuros mit Checkmate (Lizenzgebühr von CHF 0,98 Mio.) und Arbutus (Material für VLP-Plattform über CHF 0,73 Mio.).
Deutliche Reduktion der Betriebskosten aufgrund der Einstellung der Entwicklungsaktivitäten
Die Betriebskosten betrugen CHF 5,70 Mio. (2014: CHF 19,94 Mio.). Die Kosten für Forschung und Entwicklung gingen um CHF 16,39 Mio. auf CHF 1,09 Mio. zurück, was eine Folge der Beendigung der Phase-IIb-Studie in Asthma im 1. Halbjahr 2014 und der substantiellen Personalreduktion in der Entwicklung und Zulassung war. Die administrativen Kosten sowie Kosten für Verkauf und Marketing zusammen genommen stiegen auf CHF 7,37 Mio. (2014: CHF 5,28 Mio.), was auf die zusätzlichen administrativen Arbeiten zurückzuführen ist, welche früher durch die Forschungs- und Entwicklungsabteilung erledigt wurden. Das übrige Einkommen besteht im Wesentlichen aus den Mietzinseinahmen der Untermieter und belief sich im Jahr 2015 auf CHF 2,75 Mio., was einem Rückgang von CHF 0,26 Mio. gegenüber 2014 (CHF 3,01 Mio.) entspricht. Im Vorjahreswert waren auch Auflösungen von Rückstellungen für Asklia über CHF 0,49 Mio. enthalten.
Positiver Finanzertrag dank Umwandlung der Anleihe
Aufgrund der Umwandlung der Anleihe in Aktien (CHF 9,61 Mio.) und dem teilweisen Forderungsverzicht der Darlehensgeber (CHF 1,62 Mio.) lag der Finanzertrag mit CHF 11,23 Mio. signifikant höher als im Vorjahr (TCHF 88). Beide Effekte sind einmalig und nicht wiederkehrend, da per 31. Dezember 2015 sämtliche Schulden getilgt sind. Die Finanzausgaben betrugen CHF 5,66 Mio. und waren signifikant tiefer als 2014 (CHF 15,19 Mio.) wegen der Umwandlung der Anleihe und der Rückzahlung der nicht-nachrangigen Darlehen im Februar 2015 resp. sämtlicher Ansprüche der Wandeldarlehensgeber im Juli 2015. Das Nettofinanzresultat belief sich auf CHF 5,57 Mio. (2014: CHF -15,10 Mio.)
Reingewinn dank drei ausserordentlichen Einmaleffekten
Drei ausserordentliche Einmaleffekte (deutlich tiefere Betriebskosten, signifikant höheres Finanzergebnis und markant höherer Umsatz) prägten das Geschäftsergebnis 2015 und führten zu einem Reingewinn von CHF 6,23 Mio. gegenüber einem Reinverlust von CHF 34,03 Mio. im Vorjahr.
Zusammenfassung des Finanzergebnisses (IFRS, konsolidiert)
in TCHF 2015 2014
Umsatz 6'355 1'000
Betriebskosten (5'701) (19'937)
Betriebsgewinn (-verlust) 654 (18'937)
Netto Finanzertrag 5'573 (15'097)
Reingewinn (-verlust) 6,227 (34'026)
Reingewinn (-verlust) pro Aktie (in CHF) 0.08 (1.20)
Flüssige und Geld nahe Mittel, Debitoren und andere Forderungen 2'834 17'055
Vollzeitstellen 4 23
Der detaillierte Annual Report 2015 (englisch) ist zugänglich unter:
http://www.kuros.ch/investors/reports-presentations.html
Für weitere Informationen wenden Sie sich bitte an:
Kuros Biosciences Ltd
Harry Welten, MBA
Chief Financial Officer
Tel: +41 44 733 46 46
harry.welten@kuros.ch
Über die Kuros Biosciences AG
Kuros Biosciences AG fokussiert sich auf die Entwicklung von innovativen Produkten im Bereich Wundheilung und Geweberegeneration und ist in Schlieren (Zürich) domiziliert. Die Firma ist an der Schweizer Börse SIX Swiss Exchange AG gemäss Main Standard unter dem Symbol KURN kotiert. www.kuros.ch
Zukunftsorientierte Aussagen
Diese Medienmitteilung enthält bestimmte in die Zukunft gerichtete Aussagen, z.B. Angaben unter Verwendung der Worte wie "wird" oder "erwarten" oder Formulierungen ähnlicher Art. Solche in die Zukunft gerichteten Aussagen unterliegen bekannten und unbekannten Risiken, Ungewissheiten und anderen Faktoren, die dazu führen können, dass die tatsächlichen Ergebnisse, die Finanzlage, die Entwicklung oder die Performance des Unternehmens wesentlich von denjenigen abweichen, die in diesen Aussagen ausdrücklich oder implizit angenommen werden. Das Unternehmen übernimmt keinerlei Verpflichtung, solche zukunftsgerichteten Aussagen zu aktualisieren oder an zukünftige Ereignisse oder Entwicklungen anzupassen. Vor dem Hintergrund dieser Ungewissheiten sollte sich der Leser nicht auf derartige in die Zukunft gerichtete Aussagen verlassen.
Ende der Ad-hoc-Mitteilung
+++++
Zusatzmaterial zur Meldung:
Dokument: http://n.eqs.com/c/fncls.ssp?u=BWSGCOWEAL
Dokumenttitel: Kuros_FY15_160426
2016-04-26 Mitteilung übermittelt durch die Tensid EQS AG. www.eqs.com
Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
Sprache: Deutsch
Unternehmen: Kuros Biosciences AG
Wagistrasse 25
8952 Schlieren
Schweiz
Telefon: +41 44 733 4747
Fax: +41 44 733 4740
E-Mail: info@kuros.ch
Internet: www.kuros.ch
ISIN: CH0011025217
Valorennummer: -
Börsen: Auslandsbörse(n) SIX
Ende der Mitteilung EQS Group News-Service
Aber wie bei vielen Biotechs muss man auch hier sehr geduldig sein und hoffen das ihre Produkte zugelassen und von Markt angenommen werden.
Kuros Biosciences publiziert Finanzergebnis für das Jahr 2015
EQS Group-Ad-hoc: Kuros Biosciences AG / Schlagwort(e): Jahresergebnis
2016-04-26 / 07:00
Veröffentlichung einer Ad-hoc-Mitteilung gemäss Art. 53 KR.
Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
Kuros Biosciences publiziert Finanzergebnis für das Jahr 2015
- Drei ausserordentliche Faktoren mit Einmalcharakter führen zu einem Reingewinn
- Schuldenfreie Bilanz dank Umwandlung der Anleihen und Einigung mit Darlehensgebern
- Zwei neue Lizenzabkommen für CYT003 und VLP-Plattform mit Checkmate zur Behandlung von Krebs resp. mit Arbutus zur Behandlung von Hepatitis-B-Infektionen
- Zusammenschluss mit Kuros Biosurgery im Januar 2016 schafft führendes Unternehmen im Bereich Gewebereparatur und -regeneration
Schlieren (Zürich), Schweiz, 26. April 2016 - Kuros Biosciences AG ("Kuros") gab heute das Finanzergebnis für das Jahr 2015 bekannt. Der Nettogewinn von CHF 6,23 Mio. kam dank drei ausserordentlichen, nicht-operativen und einmaligen Effekten zustande: (i) markant höheren Umsätze aus Lizenzvereinbarungen insbesondere dem Auskauf von CAD106 durch Novartis, (ii) deutlich tieferen Betriebskosten wegen Einstellung der Forschungs- und Entwicklungsaktivitäten, und (iii) einem signifikant höheren Finanzergebnis dank Tilgung aller ausstehenden Schulden, namentlich der Umwandlung aller Anleihen in Aktien und der Rückzahlung resp. dem teilweisen Forderungsverzicht der Darlehensgeber. Diese Transaktionen schlossen die Bilanzsanierung ab und ebneten den Weg für den Zusammenschluss der Cytos Biotechnology AG mit der Kuros Biosurgery Holding AG mittels Austausches von Aktien der Kuros Biosurgery Holding AG gegen neu geschaffene Aktien der Cytos Biotechnology AG. Mit der am 18. Januar 2016 abgeschlossenen Übernahme entstand ein führendes Unternehmen im Bereich Gewebereparatur und -regeneration.
«Das Geschäftsergebnis 2015 ist geprägt von drei ausserordentlichen, teils nicht-operativen Einmaleffekten. Für uns bedeutend wichtiger war der erfolgreiche Abschluss der Bilanzsanierung durch die Tilgung sämtlicher Schulden, welche die Firma enorm belastet haben. Dadurch gewannen wir die volle Flexibilität für die Suche nach einem strategischen Partner», kommentierte Harry Welten, Chief Financial Officer und Mitglied des Verwaltungsrates der Kuros Biosciences. «Im Januar 2016 übernahmen wir die Kuros Biosurgery Holding AG, eine private Abspaltung der ETH Zürich, um die eigene Produktpalette wieder zu verstärken. Zusammen wollen wir Kuros Biosciences zum führenden Unternehmen für Gewebereparatur und -regeneration machen.»
Fortgeschrittene Programme mit Wundversiegelungsmitteln und orthobiologischen Produktkandidaten
Kuros hat sich auf die Entwicklung innovativer Produkte für die Gewebereparatur und -regeneration spezialisiert. Die am weitesten fortgeschrittenen Kandidaten haben in bisher allen klinischen Studien ihre primären Endpunkte erreicht:
- KUR-023 ist ein neuartiges Biomaterial, welches als Versiegelungsmittel zum schnellen Verschluss der Hirnhaut nach operativen Eingriffen dient.
- KUR-111 und KUR-113 sind zwei neuartige orthobiologische Produkte für die Knochenheilung und Stabilisierung der Wirbelsäule. Beide Kandidaten basieren auf dem gleichen biologisch aktiven Wirkstoff.
Ausserdem führt Kuros die Partnerschaften mit CYT003 und der VLP-Technologie mit Checkmate Pharmaceuticals auf dem Gebiet der Krebsforschung und diejenige mit Arbutus Biopharma (ehemals Oncore Biopharma) bei Hepatitis-B-Infektionen weiter. Beide Vereinbarungen wurden im Jahre 2015 eingegangen. Das CYT003-Programm und die VLP-Technologie werden mit Investitionen der Kooperationspartner weiterentwickelt. Im Erfolgsfall erhält Kuros erhebliche Zahlungen beim Erreichen von Meilensteinen in der Entwicklung und Lizenzgebühren auf künftige Umsätze. Das Unternehmen selber wird jedoch keine weiteren eigenen Mittel investieren.
Ausblick und geplante Nachrichten
Nach erfolgreichem Abschluss der klinischen Entwicklung bereitet Kuros KUR-023 für die CE-Kennzeichnung im Vorfeld der Markteinführung in der Europäischen Union vor. Die Zulassung wird für 2017 erwartet. In den USA plant Kuros eine zweite Zulassungsstudie. Nach dem erfolgreichen Abschluss der grossen Phase-IIb-Studien werden KUR-111 und KUR-113 für die klinische Phase-III-Entwicklung vorbereitet.
Kuros ist dank einer Finanzierungsrunde über CHF 20 Millionen im November 2015 solide finanziert. Das Unternehmen erwartet, mit den aktuellen Mitteln ausreichend finanziert zu sein, um KUR-023 sowohl in Europa wie in auch den USA auf den Markt zu bringen und KUR-111 in die klinische Phase-III-Entwicklung zu bringen.
Konsolidierte Finanzergebnisse
Bilanzsanierung
Kuros Biosciences AG (ehemals Cytos Biotechnology AG) erzielte im Jahr 2015 zwei wichtige Meilensteine bei der Tilgung der Schuldenlast. Erstens stimmten am 26. Januar 2015 die Inhaber der Wandelanleihe einer Umwandlung ihrer Anleihen in Aktien zu. Der Wandel fand am 5. Mai 2015 statt. Zweitens konnten die Ansprüche der Darlehensgeber abgegolten werden durch (i) die Rückzahlung der nicht-nachrangigen Darlehen von CHF 14,2 Mio. bei Fälligkeit am 10. Februar 2015, (ii) einen Tausch von Darlehen gegen Wandelanleihen, womit Ansprüche von einem Darlehensgeber über CHF 2 Mio. durch Umwandlung derselben Summe in 1'600 Wandelanleihen aus dem Eigenbestand getilgt werden konnten, (iii) die Zustimmung der Darlehensgeber zu einer 8%-igen Reduktion ihrer Forderungen, und (iv) die Rückzahlung all ihrer ausstehenden Forderungen über CHF 4,36 Mio. am 28. Juli 2015.
Schuldenfreie Bilanz und markant tiefere Cash-Burn-Rate
Am 31. Dezember 2015 beliefen sich die zur Finanzierung des operativen Geschäfts verfügbaren Mittel (flüssige und Geld nahe Mittel, Debitoren und andere Forderungen) auf CHF 2,83 Mio. Sie lagen damit CHF 14,22 Mio. unter dem Vorjahreswert (2014: CHF 17,06 Mio.), was im Wesentlichen auf die Rückzahlung der nicht-nachrangigen Darlehen von CHF 14,2 Mio. per 10. Februar 2015 sowie die Einigung mit den Wandeldarlehensgebern über ihre sämtlichen Ansprüche in der Höhe von CHF 4,36 Mio. am 28. Juli 2015 zurückzuführen ist. Als Folge dieser Transaktionen wurde die Bilanz von Kuros schuldenfrei. Die Cash-Burn-Rate (brutto) für Betriebsaktivitäten betrug durchschnittlich CHF 0,21 Mio. pro Monat und lag markant unter dem Vorjahreswert von CHF 2,06 Mio.
Höhere Umsätze aus Lizenzeinnahmen und dem Auskauf von CAD 106
Aus der Umsatzabgrenzung von Lizenzgebühren für CAD 106 mit Novartis wurde vom 1. Januar bis 20. August 2015 ein Umsatz von CHF 0,64 Mio. verbucht. Im März 2015 kaufte Novartis die Lizenz mit einer Einmalzahlung von CHF 4 Mio. (plus MwSt.) und wird künftig keine weiteren Gebühren mehr zahlen müssen. Die erhaltene Zahlung trat Kuros im Rahmen der Einigungsvereinbarung an die Darlehensgeber ab. Weitere Umsätze erzielte Kuros mit Checkmate (Lizenzgebühr von CHF 0,98 Mio.) und Arbutus (Material für VLP-Plattform über CHF 0,73 Mio.).
Deutliche Reduktion der Betriebskosten aufgrund der Einstellung der Entwicklungsaktivitäten
Die Betriebskosten betrugen CHF 5,70 Mio. (2014: CHF 19,94 Mio.). Die Kosten für Forschung und Entwicklung gingen um CHF 16,39 Mio. auf CHF 1,09 Mio. zurück, was eine Folge der Beendigung der Phase-IIb-Studie in Asthma im 1. Halbjahr 2014 und der substantiellen Personalreduktion in der Entwicklung und Zulassung war. Die administrativen Kosten sowie Kosten für Verkauf und Marketing zusammen genommen stiegen auf CHF 7,37 Mio. (2014: CHF 5,28 Mio.), was auf die zusätzlichen administrativen Arbeiten zurückzuführen ist, welche früher durch die Forschungs- und Entwicklungsabteilung erledigt wurden. Das übrige Einkommen besteht im Wesentlichen aus den Mietzinseinahmen der Untermieter und belief sich im Jahr 2015 auf CHF 2,75 Mio., was einem Rückgang von CHF 0,26 Mio. gegenüber 2014 (CHF 3,01 Mio.) entspricht. Im Vorjahreswert waren auch Auflösungen von Rückstellungen für Asklia über CHF 0,49 Mio. enthalten.
Positiver Finanzertrag dank Umwandlung der Anleihe
Aufgrund der Umwandlung der Anleihe in Aktien (CHF 9,61 Mio.) und dem teilweisen Forderungsverzicht der Darlehensgeber (CHF 1,62 Mio.) lag der Finanzertrag mit CHF 11,23 Mio. signifikant höher als im Vorjahr (TCHF 88). Beide Effekte sind einmalig und nicht wiederkehrend, da per 31. Dezember 2015 sämtliche Schulden getilgt sind. Die Finanzausgaben betrugen CHF 5,66 Mio. und waren signifikant tiefer als 2014 (CHF 15,19 Mio.) wegen der Umwandlung der Anleihe und der Rückzahlung der nicht-nachrangigen Darlehen im Februar 2015 resp. sämtlicher Ansprüche der Wandeldarlehensgeber im Juli 2015. Das Nettofinanzresultat belief sich auf CHF 5,57 Mio. (2014: CHF -15,10 Mio.)
Reingewinn dank drei ausserordentlichen Einmaleffekten
Drei ausserordentliche Einmaleffekte (deutlich tiefere Betriebskosten, signifikant höheres Finanzergebnis und markant höherer Umsatz) prägten das Geschäftsergebnis 2015 und führten zu einem Reingewinn von CHF 6,23 Mio. gegenüber einem Reinverlust von CHF 34,03 Mio. im Vorjahr.
Zusammenfassung des Finanzergebnisses (IFRS, konsolidiert)
in TCHF 2015 2014
Umsatz 6'355 1'000
Betriebskosten (5'701) (19'937)
Betriebsgewinn (-verlust) 654 (18'937)
Netto Finanzertrag 5'573 (15'097)
Reingewinn (-verlust) 6,227 (34'026)
Reingewinn (-verlust) pro Aktie (in CHF) 0.08 (1.20)
Flüssige und Geld nahe Mittel, Debitoren und andere Forderungen 2'834 17'055
Vollzeitstellen 4 23
Der detaillierte Annual Report 2015 (englisch) ist zugänglich unter:
http://www.kuros.ch/investors/reports-presentations.html
Für weitere Informationen wenden Sie sich bitte an:
Kuros Biosciences Ltd
Harry Welten, MBA
Chief Financial Officer
Tel: +41 44 733 46 46
harry.welten@kuros.ch
Über die Kuros Biosciences AG
Kuros Biosciences AG fokussiert sich auf die Entwicklung von innovativen Produkten im Bereich Wundheilung und Geweberegeneration und ist in Schlieren (Zürich) domiziliert. Die Firma ist an der Schweizer Börse SIX Swiss Exchange AG gemäss Main Standard unter dem Symbol KURN kotiert. www.kuros.ch
Zukunftsorientierte Aussagen
Diese Medienmitteilung enthält bestimmte in die Zukunft gerichtete Aussagen, z.B. Angaben unter Verwendung der Worte wie "wird" oder "erwarten" oder Formulierungen ähnlicher Art. Solche in die Zukunft gerichteten Aussagen unterliegen bekannten und unbekannten Risiken, Ungewissheiten und anderen Faktoren, die dazu führen können, dass die tatsächlichen Ergebnisse, die Finanzlage, die Entwicklung oder die Performance des Unternehmens wesentlich von denjenigen abweichen, die in diesen Aussagen ausdrücklich oder implizit angenommen werden. Das Unternehmen übernimmt keinerlei Verpflichtung, solche zukunftsgerichteten Aussagen zu aktualisieren oder an zukünftige Ereignisse oder Entwicklungen anzupassen. Vor dem Hintergrund dieser Ungewissheiten sollte sich der Leser nicht auf derartige in die Zukunft gerichtete Aussagen verlassen.
Ende der Ad-hoc-Mitteilung
+++++
Zusatzmaterial zur Meldung:
Dokument: http://n.eqs.com/c/fncls.ssp?u=BWSGCOWEAL
Dokumenttitel: Kuros_FY15_160426
2016-04-26 Mitteilung übermittelt durch die Tensid EQS AG. www.eqs.com
Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
Sprache: Deutsch
Unternehmen: Kuros Biosciences AG
Wagistrasse 25
8952 Schlieren
Schweiz
Telefon: +41 44 733 4747
Fax: +41 44 733 4740
E-Mail: info@kuros.ch
Internet: www.kuros.ch
ISIN: CH0011025217
Valorennummer: -
Börsen: Auslandsbörse(n) SIX
Ende der Mitteilung EQS Group News-Service
Hier könnte aus charttechnischen Gründen die Trendwende anstehen ... das Volumen steigt und ist unten am Boden schon mal schön nach oben abgeprallt.
ich denke nach unten ist die Aktie ganz gut abgesichert. ( 10 % Risiko )

Langfristig ist nach OBEN eh große LUFT
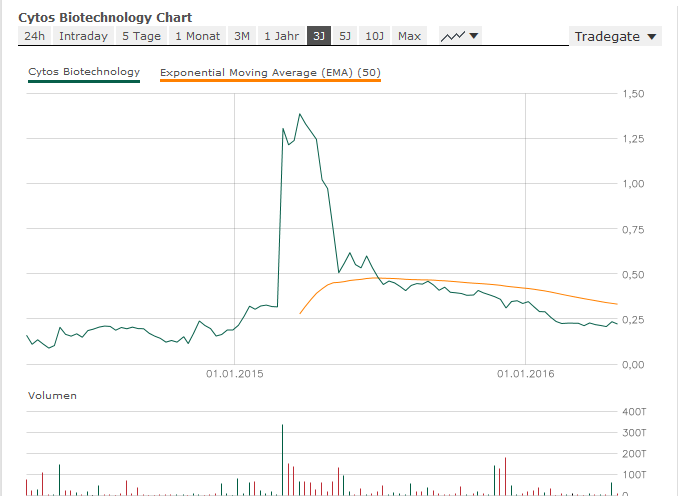
@ value
Bist du schon investiert ?
ich denke nach unten ist die Aktie ganz gut abgesichert. ( 10 % Risiko )

Langfristig ist nach OBEN eh große LUFT


@ value
Bist du schon investiert ?

Antwort auf Beitrag Nr.: 52.279.975 von senna7 am 26.04.16 16:09:04@senna7,
ja - bin schon investiert.
Ich habe mir in den letzten Wochen / Monaten eine günstige Position aufgebaut.
ja - bin schon investiert.
Ich habe mir in den letzten Wochen / Monaten eine günstige Position aufgebaut.

Antwort auf Beitrag Nr.: 51.440.829 von valueanleger am 08.01.16 07:38:23
Die von mir erwartete Kapitalherabsetzung kommt, nur nicht 1:10 sondern 1:100
http://www.dgap.de/dgap/News/adhoc/kuros-biosciences-laedt-z…
Zitat von valueanleger: Spannend wird sein wie sich die Kuros Altaktionäre verhalten.
Sie haben demnächst die Möglichkeit über die Börse zu verkaufen.
Wenn sie das nicht tun sollte man hellhörig werden.
Cytos war zum Schluss ein schuldenfreier Börsenmantel mit ein paar Lizenzvereinbarungen.
Kuros bringt etwas Spielgeld mit (20 Mio) und einige interessante Produkte vor der Zulassung.
Mal sehen was weiter passiert?
Ich gehe davon aus das bei der nächsten HV und GV eine Kapitalherabsetzung von 1:10 durchgeführt wird.
500 Mio Aktien sind doch etwas zuviel.
Die von mir erwartete Kapitalherabsetzung kommt, nur nicht 1:10 sondern 1:100

http://www.dgap.de/dgap/News/adhoc/kuros-biosciences-laedt-z…
Kleine Frage ob ich das richtig verstehe 
kann es sein das man bei ungerader Stückzahl sogar noch einen kleinen Bonus erhält ???
Zitat :
Der Verwaltungsrat will den Handel mit der Aktie erleichtern und den Titel für Anleger attraktiver machen. Zu diesem Zweck beantragt er den Aktionären die Zusammenlegung der Aktien im Verhältnis 100:1, sodass 100 bisherige Namenaktien mit einem Nennwert von je CHF 0.01 neu 1 Namenaktie mit einem Nennwert von CHF 1.00 ergeben. Die bisherigen Aktionäre und Gründer, Dr. Jeffrey Hubbell und Didier Cowling, haben sich bereit erklärt, die aufgrund allfälliger Fraktionen aufgrund des Reverse-Splits zum Ausgleich notwendige Anzahl Aktien unentgeltlich zur Verfügung zu stellen. Damit erhalten alle bisherigen Aktionäre mindestens eine Aktie und in jedem Fall eine ganze Anzahl Aktien.
Beisspiel :
ein Aktionär hat 10000 Aktien = 100 neue Aktien
ein Aktionär hat 10001 Aktie = 101 neue Aktien sprich bekommt dann 99 Alt Aktien geschenkt .....


auch nett Kleinvieh macht aus Mist
Kleinvieh macht aus Mist

kann es sein das man bei ungerader Stückzahl sogar noch einen kleinen Bonus erhält ???
Zitat :
Der Verwaltungsrat will den Handel mit der Aktie erleichtern und den Titel für Anleger attraktiver machen. Zu diesem Zweck beantragt er den Aktionären die Zusammenlegung der Aktien im Verhältnis 100:1, sodass 100 bisherige Namenaktien mit einem Nennwert von je CHF 0.01 neu 1 Namenaktie mit einem Nennwert von CHF 1.00 ergeben. Die bisherigen Aktionäre und Gründer, Dr. Jeffrey Hubbell und Didier Cowling, haben sich bereit erklärt, die aufgrund allfälliger Fraktionen aufgrund des Reverse-Splits zum Ausgleich notwendige Anzahl Aktien unentgeltlich zur Verfügung zu stellen. Damit erhalten alle bisherigen Aktionäre mindestens eine Aktie und in jedem Fall eine ganze Anzahl Aktien.
Beisspiel :
ein Aktionär hat 10000 Aktien = 100 neue Aktien
ein Aktionär hat 10001 Aktie = 101 neue Aktien sprich bekommt dann 99 Alt Aktien geschenkt .....



auch nett
 Kleinvieh macht aus Mist
Kleinvieh macht aus Mist
Heute auf Tradegate über 0,30€.
Ein Buchgewinn von 50% wäre somit erreicht.
Ein Buchgewinn von 50% wäre somit erreicht.

willst du schon aussteigen  ?
?
ich nicht ... ok ich habe noch keine 50% wioll aber mindestens 100 %
auch heute keine Schwäche

 ?
?ich nicht ... ok ich habe noch keine 50% wioll aber mindestens 100 %

auch heute keine Schwäche

Antwort auf Beitrag Nr.: 52.533.629 von senna7 am 03.06.16 11:41:12Nein, ich steige noch nicht aus.
Jetzt da die Sache richtig ins Laufen kommt.
Ob das alles nur Aufrundungskäufe sind?
Sehr spannend - bei den meisten Kapitalherabsetzungen beginnen die Kurse eher zu fallen.
Bei Kuros geht es aber nicht darum ein negatives EK auszugleichen sondern "nur" die Aktie aus dem Pennystockbereich zu hieven.
Mal sehen wie es weiter geht.
Jetzt da die Sache richtig ins Laufen kommt.

Ob das alles nur Aufrundungskäufe sind?
Sehr spannend - bei den meisten Kapitalherabsetzungen beginnen die Kurse eher zu fallen.
Bei Kuros geht es aber nicht darum ein negatives EK auszugleichen sondern "nur" die Aktie aus dem Pennystockbereich zu hieven.
Mal sehen wie es weiter geht.
heute also die HV mit den Beschlüssen :
Generalversammlung von Kuros Biosciences stimmt allen Anträgen zu
Schlieren (Zürich), Schweiz, 16. Juni 2016 - Kuros Biosciences AG ("Kuros") gibt heute bekannt, dass die Aktionäre an der ordentlichen Generalversammlung 2016 sämtliche Anträge genehmigt haben. Sie stimmten insbesondere mit grosser Mehrheit für die vorgeschlagene Aktienzusammenlegung (Reverse Split) im Verhältnis von 100 zu 1 und die dafür notwendigen Statutenänderungen. Mit der Zusammenlegung soll die Handelbarkeit der Namenaktien vereinfacht und die Attraktivität gegenüber Investoren gesteigert werden. Der erste Handelstag der neuen Namenaktien wird voraussichtlich der 23. Juni 2016 sein. Die Generalversammlung beschloss weiter eine genehmigte Kapitalerhöhung, die der Verwaltungsrat teilweise für eine schnelle und flexible Kapitalaufnahme (einschliesslich Privat-platzierungen) zu nutzen beabsichtigt. Die Aktionärinnen und Aktionäre wählten ausserdem Leanna Caron als neues Mitglied in den Verwaltungsrat.
Die Generalversammlung von Kuros fand am Firmensitz in Schlieren/Zurich (Schweiz) statt. 77 Aktionäre folgten der Einladung. Es waren 237'200'269 Aktien oder 46.65% von insgesamt 508'432'244 Aktien vertreten
quelle : http://www.finanznachrichten.de/nachrichten-2016-06/3770765…
Generalversammlung von Kuros Biosciences stimmt allen Anträgen zu
Schlieren (Zürich), Schweiz, 16. Juni 2016 - Kuros Biosciences AG ("Kuros") gibt heute bekannt, dass die Aktionäre an der ordentlichen Generalversammlung 2016 sämtliche Anträge genehmigt haben. Sie stimmten insbesondere mit grosser Mehrheit für die vorgeschlagene Aktienzusammenlegung (Reverse Split) im Verhältnis von 100 zu 1 und die dafür notwendigen Statutenänderungen. Mit der Zusammenlegung soll die Handelbarkeit der Namenaktien vereinfacht und die Attraktivität gegenüber Investoren gesteigert werden. Der erste Handelstag der neuen Namenaktien wird voraussichtlich der 23. Juni 2016 sein. Die Generalversammlung beschloss weiter eine genehmigte Kapitalerhöhung, die der Verwaltungsrat teilweise für eine schnelle und flexible Kapitalaufnahme (einschliesslich Privat-platzierungen) zu nutzen beabsichtigt. Die Aktionärinnen und Aktionäre wählten ausserdem Leanna Caron als neues Mitglied in den Verwaltungsrat.
Die Generalversammlung von Kuros fand am Firmensitz in Schlieren/Zurich (Schweiz) statt. 77 Aktionäre folgten der Einladung. Es waren 237'200'269 Aktien oder 46.65% von insgesamt 508'432'244 Aktien vertreten
quelle : http://www.finanznachrichten.de/nachrichten-2016-06/3770765…
Schlieren (Zürich), Schweiz, 28. Juni 2016 - Kuros Biosciences AG ("Kuros") gibt heute bekannt, dass die unabhängige Life-science-research-Boutique valuationLAB AG ihre erste Studie über das Unternehmen veröffentlicht hat. Darin bewertet valuationLAB die Entwicklungspipeline mit einem risikogewichteten Kapitalwert (net present value, NPV) von CHF 55 pro Aktie. Die Bewertung basiert auf einer Einschätzung der drei am weitest fortgeschrittenen Programme für Operationsverschlusse und orthobiologische Materialien. Grosses Potenzial für Wertsteigerung sieht valuationLAB in der erfolgreichen Entwicklung der Produktkandidaten im Frühstadium.
«Jedes der drei am weitesten fortgeschrittenen Projekte von Kuros zielt auf einen grossen Markt. Wir schätzen die kombinierten Spitzenverkäufe für die Operationsverschlüsse und orthobiologischen Produkte auf über eine Milliarde Franken», kommentierte Bob Pooler, Senior Analyst von valuationLAB. «Die drei Projekte wurden an über 400 Patienten erfolgreich getestet und haben in allen klinischen Studien ihre jeweiligen Endpunkte erreicht.»
Der risikogewichteten NPV von CHF 55 pro Aktie basiert auf einer umfassenden Analyse der drei wichtigsten Programme: 1) KUR-023, ein zusätzlicher Verschluss der Hirnhaut nach Operationen am Hirn und Rückenmark. Die Markteinführung wird für 2017 in der Europäischen Union resp. 2020 in den USA erwartet, Spitzenumsätzen sollen über CHF 100 Million im Jahr liegen; 2) KUR-111, ein Ersatz für Knochentransplantate, der 2022 auf den Markt kommen und jährliche Umsätze von CHF 600 Millionen erzielen soll. KUR-111 könnte die neue Standardtherapie für Knochentransplantate werden; und 3) KUR-113 für die Heilung komplizierter Knochenbrüche. Auch dieses Produkt soll 2022 lanciert werden und Spitzenumsätze von über CHF 300 Millionen pro Jahr erzielen.
Nicht in die Bewertung von valuationLAB eingeschlossen sind die Programme im Frühstadium sowie die an Checkmate Pharmaceuticals, Arbutus Biopharma und Pfizer auslizenzierten Projekte. Hier liegt ein signifikantes Zusatzpotenzial, wobei für die Entwicklung der ehemaligen Cytos-Programme keine weiteren eigenen Mittel mehr notwendig sind.
valuationLAB erachtet die Finanzierung des Unternehmens als ausreichend, um 1) die CE-Kennzeichnung für KUR-023 zu erlangen und das Produkt anschliessend in der EU zu lancieren; 2) eine zweite klinische Studie mit KUR-023 zur Unterstützung des Zulassungsantrags (premarket approval, PMA) in den USA durchzuführen; und 3) KUR-111 und KUR-113 für die Phase-III- Entwicklung vorzubereiten. Gemäss Einschätzung des Analysten benötigt Kuros zusätzliche Mittel für die Markteinführung der beiden orthobiologischen Präparate. Zur Finanzierung der signifikanten Forschungs- und Entwicklungskosten bis 2023 erwartet valuationLAB, dass KUR-023 nach Zulassung resp. KUR-111 und KUR-113 nach positiven Phase-III-Studien an kommerzielle Partner auslizenziert werden. Kuros werde dafür bedeutende Voraus- und Meilensteinzahlungen sowie Umsatzbeteiligungen erhalten.
Als wichtigste anstehende Meilensteine bezeichnet valuationLAB 1) die Eingabe für die CE-Kennzeichnung von KUR-023 zum Jahresende 2016 und die Zulassung resp. Markteinführung in der Europäischen Union (2017); 2) der Start einer Zulassungsstudie zu KUR-023 mit Rückenmarkpatienten in den USA (2017); sowie 3) den Abschluss einer oder mehrere Vertriebsvereinbarung(en) für die EU.
«valuationLAB bietet Anlegern eine gute Entscheidungshilfe für Investitionen. Der Analystenreport zeigt auf, wie wir unsere Strategie umsetzen, unsere drei wichtigsten Programme vorantreiben und das Potenzial in unserer Pipeline für unsere Aktionäre ausschöpfen», kommentierte Harry Welten, Chief Financial Officer. «Wir wollen Kuros Biosciences zum führenden Unternehmen für Gewebereparatur und -regeneration machen.»
Der vollständige Analystenbericht in englischer Sprache ist auf abrufbar unter www.valuationlab.com und auf der Website von Kuros www.kuros.ch unter Investors/Reports & presentations.
«Jedes der drei am weitesten fortgeschrittenen Projekte von Kuros zielt auf einen grossen Markt. Wir schätzen die kombinierten Spitzenverkäufe für die Operationsverschlüsse und orthobiologischen Produkte auf über eine Milliarde Franken», kommentierte Bob Pooler, Senior Analyst von valuationLAB. «Die drei Projekte wurden an über 400 Patienten erfolgreich getestet und haben in allen klinischen Studien ihre jeweiligen Endpunkte erreicht.»
Der risikogewichteten NPV von CHF 55 pro Aktie basiert auf einer umfassenden Analyse der drei wichtigsten Programme: 1) KUR-023, ein zusätzlicher Verschluss der Hirnhaut nach Operationen am Hirn und Rückenmark. Die Markteinführung wird für 2017 in der Europäischen Union resp. 2020 in den USA erwartet, Spitzenumsätzen sollen über CHF 100 Million im Jahr liegen; 2) KUR-111, ein Ersatz für Knochentransplantate, der 2022 auf den Markt kommen und jährliche Umsätze von CHF 600 Millionen erzielen soll. KUR-111 könnte die neue Standardtherapie für Knochentransplantate werden; und 3) KUR-113 für die Heilung komplizierter Knochenbrüche. Auch dieses Produkt soll 2022 lanciert werden und Spitzenumsätze von über CHF 300 Millionen pro Jahr erzielen.
Nicht in die Bewertung von valuationLAB eingeschlossen sind die Programme im Frühstadium sowie die an Checkmate Pharmaceuticals, Arbutus Biopharma und Pfizer auslizenzierten Projekte. Hier liegt ein signifikantes Zusatzpotenzial, wobei für die Entwicklung der ehemaligen Cytos-Programme keine weiteren eigenen Mittel mehr notwendig sind.
valuationLAB erachtet die Finanzierung des Unternehmens als ausreichend, um 1) die CE-Kennzeichnung für KUR-023 zu erlangen und das Produkt anschliessend in der EU zu lancieren; 2) eine zweite klinische Studie mit KUR-023 zur Unterstützung des Zulassungsantrags (premarket approval, PMA) in den USA durchzuführen; und 3) KUR-111 und KUR-113 für die Phase-III- Entwicklung vorzubereiten. Gemäss Einschätzung des Analysten benötigt Kuros zusätzliche Mittel für die Markteinführung der beiden orthobiologischen Präparate. Zur Finanzierung der signifikanten Forschungs- und Entwicklungskosten bis 2023 erwartet valuationLAB, dass KUR-023 nach Zulassung resp. KUR-111 und KUR-113 nach positiven Phase-III-Studien an kommerzielle Partner auslizenziert werden. Kuros werde dafür bedeutende Voraus- und Meilensteinzahlungen sowie Umsatzbeteiligungen erhalten.
Als wichtigste anstehende Meilensteine bezeichnet valuationLAB 1) die Eingabe für die CE-Kennzeichnung von KUR-023 zum Jahresende 2016 und die Zulassung resp. Markteinführung in der Europäischen Union (2017); 2) der Start einer Zulassungsstudie zu KUR-023 mit Rückenmarkpatienten in den USA (2017); sowie 3) den Abschluss einer oder mehrere Vertriebsvereinbarung(en) für die EU.
«valuationLAB bietet Anlegern eine gute Entscheidungshilfe für Investitionen. Der Analystenreport zeigt auf, wie wir unsere Strategie umsetzen, unsere drei wichtigsten Programme vorantreiben und das Potenzial in unserer Pipeline für unsere Aktionäre ausschöpfen», kommentierte Harry Welten, Chief Financial Officer. «Wir wollen Kuros Biosciences zum führenden Unternehmen für Gewebereparatur und -regeneration machen.»
Der vollständige Analystenbericht in englischer Sprache ist auf abrufbar unter www.valuationlab.com und auf der Website von Kuros www.kuros.ch unter Investors/Reports & presentations.
Antwort auf Beitrag Nr.: 52.736.566 von gnaraloo79 am 30.06.16 22:18:34habe der Korrektheit halber mal dieses Kuros Forum eröffnet und bitte zu zügeln (umzuziehen)

Beitrag zu dieser Diskussion schreiben
Zu dieser Diskussion können keine Beiträge mehr verfasst werden, da der letzte Beitrag vor mehr als zwei Jahren verfasst wurde und die Diskussion daraufhin archiviert wurde.
Bitte wenden Sie sich an feedback@wallstreet-online.de und erfragen Sie die Reaktivierung der Diskussion oder starten Sie eine neue Diskussion.
Investoren beobachten auch:
| Wertpapier | Perf. % |
|---|---|
| +3,22 | |
| -1,40 | |
| +0,06 | |
| -1,23 | |
| -0,07 | |
| +0,57 | |
| -0,40 | |
| +0,43 | |
| -1,06 | |
| +2,20 |
Meistdiskutiert
| Wertpapier | Beiträge | |
|---|---|---|
| 220 | ||
| 104 | ||
| 93 | ||
| 77 | ||
| 47 | ||
| 43 | ||
| 41 | ||
| 40 | ||
| 31 | ||
| 31 |
| Zeit | Titel |
|---|---|
| 24.04.24 |





















