Actelion: Biotech Blockbuster aus der Schweiz - 500 Beiträge pro Seite
eröffnet am 22.04.05 08:29:10 von
neuester Beitrag 07.11.17 10:43:34 von
neuester Beitrag 07.11.17 10:43:34 von
Beiträge: 491
ID: 976.370
ID: 976.370
Aufrufe heute: 0
Gesamt: 51.342
Gesamt: 51.342
Aktive User: 0
ISIN: CH0010532478 · WKN: 936767
240,50
EUR
+0,73 %
+1,75 EUR
Letzter Kurs 06.11.17 Tradegate
Werte aus der Branche Pharmaindustrie
| Wertpapier | Kurs | Perf. % |
|---|---|---|
| 1,0400 | +48,57 | |
| 0,5400 | +38,46 | |
| 31,00 | +24,00 | |
| 21,440 | +23,56 | |
| 0,7900 | +21,54 |
| Wertpapier | Kurs | Perf. % |
|---|---|---|
| 0,7500 | -23,47 | |
| 0,7350 | -31,31 | |
| 28,18 | -32,62 | |
| 0,5660 | -40,42 | |
| 2,8100 | -48,72 |
Wovon andere Biotechs nur träumen.
Bei Actelion ist es Realität.
Schwarze Zahlen.
Steigende Gewinne.
Medikamente auf dem Markt mit Potential zum Blockbuster.
Eine prall gefüllte Pipeline mit Produkten in der Klinischen Phase.
Jede Menge Kandidaten in der Vorklinischen Phase so oder so.
Forschung und Entwicklung zahlen nicht die Aktionäre sondern wird aus dem Cash Flow beglichen.
Kapitalerhöhung, Wandelanleihe - Fremdwörter bei Actelion
Natürlich ist die Aktie nicht billig.
Aber dafür ist es auch kein Bioschrott.
Bei Actelion ist es Realität.
Schwarze Zahlen.
Steigende Gewinne.
Medikamente auf dem Markt mit Potential zum Blockbuster.
Eine prall gefüllte Pipeline mit Produkten in der Klinischen Phase.
Jede Menge Kandidaten in der Vorklinischen Phase so oder so.
Forschung und Entwicklung zahlen nicht die Aktionäre sondern wird aus dem Cash Flow beglichen.
Kapitalerhöhung, Wandelanleihe - Fremdwörter bei Actelion
Natürlich ist die Aktie nicht billig.
Aber dafür ist es auch kein Bioschrott.
und wer bb biotech im portfolio hat, der ist ebenfalls gut bedient...denn actelion ist dort eine der beteiligungen!
Richtig Vammi
BB biotech hat gut daran getan, Actelion ins Portfolio zu nehmen.
Leider haben haben sie jedoch zu wenig davon.
Hätten sie mehr, wäre die Performance von bb biotech wesentlich besser gewesen.
Und wichtiger noch: In Zukunft wäre die Perfomance mit einem höheren Anteil an Actelion vermutlich ebenfalls wesentlich besser.
BB biotech hat gut daran getan, Actelion ins Portfolio zu nehmen.
Leider haben haben sie jedoch zu wenig davon.
Hätten sie mehr, wäre die Performance von bb biotech wesentlich besser gewesen.
Und wichtiger noch: In Zukunft wäre die Perfomance mit einem höheren Anteil an Actelion vermutlich ebenfalls wesentlich besser.
22.04.2005 14:45
Actelion: Overweight (Lehman Brothers)
Die Analysten von Lehman Brothers stufen am 22. April die Aktie der Schweizer Pharmaunternehmens Actelion (Nachrichten) unverändert mit "Overweight" ein. Das Kursziel wird von 160 auf 165 CHF erhöht.
Actelion habe die Ergebniszahlen für das erste Quartal des laufenden Geschäftsjahrs veröffentlicht. Der Umsatz liege vor den Planzahlen des Unternehmens. Die Analysten erhöhen deshalb ihre Schätzungen für den Umsatz des Gesamtjahres von 574 Mio. auf 605 Mio. CHF. Der Nettogewinn solle nun 101 Mio. CHF und das EPS 4,50 CHF betragen. Vor allem die gute Entwicklung am Markt von Tracleer würde zu der Erhöhung beitragen.
Actelion: Overweight (Lehman Brothers)
Die Analysten von Lehman Brothers stufen am 22. April die Aktie der Schweizer Pharmaunternehmens Actelion (Nachrichten) unverändert mit "Overweight" ein. Das Kursziel wird von 160 auf 165 CHF erhöht.
Actelion habe die Ergebniszahlen für das erste Quartal des laufenden Geschäftsjahrs veröffentlicht. Der Umsatz liege vor den Planzahlen des Unternehmens. Die Analysten erhöhen deshalb ihre Schätzungen für den Umsatz des Gesamtjahres von 574 Mio. auf 605 Mio. CHF. Der Nettogewinn solle nun 101 Mio. CHF und das EPS 4,50 CHF betragen. Vor allem die gute Entwicklung am Markt von Tracleer würde zu der Erhöhung beitragen.
Actelion: Kursziel angehoben
26.04.2005
Die Analysten der WestLB haben das Kursziel für die Aktie des Schweizer Biotech-Unternehmens Actelion von 142 auf 148 Schweizer Franken erhöht. Die Gewinnschätzung für 2005 ist von 3,28 auf 4,77 Schweizer Franken erhöht worden. Die Gesellschaft sei eine der attraktivsten biopharmazeutischen Gesellschaften Europas.
26.04.2005
Die Analysten der WestLB haben das Kursziel für die Aktie des Schweizer Biotech-Unternehmens Actelion von 142 auf 148 Schweizer Franken erhöht. Die Gewinnschätzung für 2005 ist von 3,28 auf 4,77 Schweizer Franken erhöht worden. Die Gesellschaft sei eine der attraktivsten biopharmazeutischen Gesellschaften Europas.
Actelion provides update on palosuran in diabetic nephropathy
ALLSCHWIL, SWITZERLAND – 23 May 2005 – Actelion Ltd (SWX: ATLN) announced today that preliminary efficacy data generated in the proof-of-concept program testing its urotensin-II receptor antagonist palosuran in the indication diabetic nephropathy do not support the initiation of a full-fledged clinical development program at this point in time. The company will now fully analyze the data generated in three individual studies involving close to 100 patients and discuss the detailed findings with key medical experts in the field.
There were no safety findings that would preclude further development. Together with the scientific community, Actelion will therefore continue to advance the general understanding of the role of urotensin-II in man. In case of newly developing information, Actelion may re-initiate clinical development for palosuran, the first urotensin-II receptor antagonist tested in man.
ALLSCHWIL, SWITZERLAND – 23 May 2005 – Actelion Ltd (SWX: ATLN) announced today that preliminary efficacy data generated in the proof-of-concept program testing its urotensin-II receptor antagonist palosuran in the indication diabetic nephropathy do not support the initiation of a full-fledged clinical development program at this point in time. The company will now fully analyze the data generated in three individual studies involving close to 100 patients and discuss the detailed findings with key medical experts in the field.
There were no safety findings that would preclude further development. Together with the scientific community, Actelion will therefore continue to advance the general understanding of the role of urotensin-II in man. In case of newly developing information, Actelion may re-initiate clinical development for palosuran, the first urotensin-II receptor antagonist tested in man.
Long-term Tracleer (bosentan) safety profile confirmed with completion of non-interventional program in almost 5,000 patients
SAN DIEGO, US – 23 May 2005 – Actelion Ltd (SWX: ATLN) announced that data from almost 5,000 Tracleer®-treated patients amounting to 3,416 patient-years of treatment were presented on Monday at the American Thoracic Society (ATS) meeting in San Diego. The long-term data collected between May 2002 and November 2004 confirm the safety profile of bosentan as seen in phase III clinical trials and provide information on the combination of treatments such as sildenafil or anticoagulants and bosentan.[ii] These data (the TRAcleer® eXcellence Post-Marketing Surveillance - TRAX PMS - Programme) represents the completion of the largest non-interventional study to date of patients treated with bosentan for PAH in daily medical practice.
Other data presented at ATS show that the addition of sildenafil and atorvastatin to bosentan in PAH patients was well tolerated and showed a trend towards a beneficial effect on exercise tolerance.[iii]
PAH is a devastating disease. Untreated, PAH patients die an average of 2.8 years after diagnosis.[iv] Tracleer® (bosentan) is the first and only approved oral treatment for PAH (Class III and IV) to improve exercise capacity and decrease the time to clinical worsening. Bosentan is a dual endothelin receptor antagonist (ERA). It works by comprehensively blocking the binding of endothelin (ET) to both of its receptors ETA and ETB, thereby preventing the deleterious effects of ET.
Long-Term Safety Profile Consistent with Phase III data
The results from TRAX show that the safety profile of bosentan is consistent with that reported in phase III clinical trials.,[v] In particular, liver enzyme measurements showed that elevated ALT and/or AST values were reported in 7.7% of patients compared to 11% as seen in clinical trials and that the likelihood of developing a first aminotransferase elevation decreases over time.i,[vi] Approximately half of those patients with elevated AST and/or ALT values were maintained on bosentan with careful follow-up in line with approved labeling. Of the patients who were rechallenged, the majority were able to continue on bosentan.
Bosentan in Combination with Warfarin is well tolerated
Patients treated for PAH receive various concomitant medications – disease specific as well as others. Two thirds of bosentan treated patients also received anticoagulants (including coumarin derivatives such as Warfarin). This combination was well tolerated in the long-term experience in daily medical practice.ii
Adding Sildenafil and Atorvastatin to Bosentan is Well Tolerated
Also presented at ATS, a 12-week double-blind, randomized, placebo-controlled trial of 23 patients already on treatment with bosentan showed that the addition of sildenafil and atorvastatin to bosentan was well tolerated and that the mean treadmill time (459 seconds and 292 seconds, bosentan-combination and placebo, respectively) in patients receiving the active combination improved by 36% (p <0.01) compared to an improvement of 27% in the placebo group (p <0.05).iii
The safety profile of patients receiving the combination of bosentan and sildenafil was evaluated by a sub-analysis of the long term TRAX data in 119 patients.ii Safety findings in this group of patients were comparable to those in patients treated with bosentan. Elevated liver aminotransferase were noted in 7.6% of patients on bosentan plus sildenafil compared with 7.4% in patients receiving bosentan without sildenafil.ii
Dr Marius Hoeper, University of Hanover Medical School, Germany, comments: “It is important to further confirm if sildenafil can be safely used in patients receiving treatment with bosentan as it would appear to be a useful additional therapy for some patients being treated for PAH .”
Regulatory Status for Tracleer® in PAH
Tracleer was approved in Europe in May 2002 under exceptional circumstances as a result of positive phase III data. Under these circumstances approval was granted with the provision that ongoing safety was monitored for a period of 3 years.[vii] The TRAcleer eXcellence Post-Marketing Surveillance (TRAX PMS) Programme was put in place to record the ongoing safety of bosentan. In the US, Tracleer® was approved in November 2001 under “sub-part H”. Under these circumstances approval was granted with the provision that distribution of Tracleer® was restricted. Tracleer® has also been approved for the treatment of PAH in Japan, Brazil, Israel and other countries worldwide.
Important information related to prescribing Tracleer® in the United States of America:
Indication
Tracleer® is indicated for the treatment of pulmonary arterial hypertension in patients with WHO Class III or IV symptoms, to improve exercise ability and decrease the rate of clinical worsening.
Liver and Pregnancy Warnings
Administration of Tracleer® requires attention to two significant concerns:
* Potential for serious liver injury: Liver monitoring of all patients is essential prior to initiation of treatment and monthly thereafter; and
* high potential for major birth defects: Pregnancy must be excluded and prevented by two forms of birth control; monthly pregnancy tests should be obtained.
Full prescribing information available at www.tracleer.com or at 1-866-462-2856
###
References
Humbert M, Kiely D, Carlsen J et al. Long-term Safety Profile of Bosentan in Patients with Pulmonary Arterial Hypertension from the European Surveillance Program. Mini Symposium Presentation at ATS 2005
[ii] Hoeper M, Kiely D, Carlsen J et al. Safety Profile of Pulmonary Arterial Hypertension Patients Treated with Bosentan and Sildenafil: Results from the European Surveillance Program. Mini-Symposium Presentation at ATS 2005
[iii] Gomberg-Maitland M, McLaughlin V, Gulati M et al. Efficacy and Safety of Sildenafil and Atorvastatin Added to Bosentan as Therapy for Pulmonary Arterial Hypertension (PAH). Poster Presentation K18 at ATS 2005
[iv] D’Azlonzo G et al. Survival in patients with primary pulmonary hypertension. Results from a national prospective registry. Anals Int Med. 1991; 115:343-349
[v] Rubin L, Badesch D, Barst R et al. Bosentan therapy for pulmonary arterial hypertension. NEJM, 2002. 346, 12: 896-903
[vi] Tracleer Prescribing Information
[vii] Tracleer SPC
Actelion Ltd
Actelion Ltd is a biopharmaceutical company with its corporate headquarter in Allschwil/Basel, Switzerland. Actelion`s first drug Tracleer®, an orally available dual endothelin receptor antagonist, has been approved as a therapy for pulmonary arterial hypertension. Actelion markets Tracleer® through its own subsidiaries in key markets worldwide, including the United States (based in South San Francisco), the European Union as well as Canada, Australia and Switzerland. Actelion, founded in late 1997, is a leading player in innovative science related to the endothelium – the single layer of cells separating every blood vessel from the blood stream. Actelion focuses on the discovery, development and marketing of innovative drugs for significant unmet medical needs. Actelion shares are traded on the SWX Swiss Exchange (ticker symbol: ATLN).
For further information please contact:
Actelion Ltd, Gewerbestrasse 16, CH-4123 Allschwil
SAN DIEGO, US – 23 May 2005 – Actelion Ltd (SWX: ATLN) announced that data from almost 5,000 Tracleer®-treated patients amounting to 3,416 patient-years of treatment were presented on Monday at the American Thoracic Society (ATS) meeting in San Diego. The long-term data collected between May 2002 and November 2004 confirm the safety profile of bosentan as seen in phase III clinical trials and provide information on the combination of treatments such as sildenafil or anticoagulants and bosentan.[ii] These data (the TRAcleer® eXcellence Post-Marketing Surveillance - TRAX PMS - Programme) represents the completion of the largest non-interventional study to date of patients treated with bosentan for PAH in daily medical practice.
Other data presented at ATS show that the addition of sildenafil and atorvastatin to bosentan in PAH patients was well tolerated and showed a trend towards a beneficial effect on exercise tolerance.[iii]
PAH is a devastating disease. Untreated, PAH patients die an average of 2.8 years after diagnosis.[iv] Tracleer® (bosentan) is the first and only approved oral treatment for PAH (Class III and IV) to improve exercise capacity and decrease the time to clinical worsening. Bosentan is a dual endothelin receptor antagonist (ERA). It works by comprehensively blocking the binding of endothelin (ET) to both of its receptors ETA and ETB, thereby preventing the deleterious effects of ET.
Long-Term Safety Profile Consistent with Phase III data
The results from TRAX show that the safety profile of bosentan is consistent with that reported in phase III clinical trials.,[v] In particular, liver enzyme measurements showed that elevated ALT and/or AST values were reported in 7.7% of patients compared to 11% as seen in clinical trials and that the likelihood of developing a first aminotransferase elevation decreases over time.i,[vi] Approximately half of those patients with elevated AST and/or ALT values were maintained on bosentan with careful follow-up in line with approved labeling. Of the patients who were rechallenged, the majority were able to continue on bosentan.
Bosentan in Combination with Warfarin is well tolerated
Patients treated for PAH receive various concomitant medications – disease specific as well as others. Two thirds of bosentan treated patients also received anticoagulants (including coumarin derivatives such as Warfarin). This combination was well tolerated in the long-term experience in daily medical practice.ii
Adding Sildenafil and Atorvastatin to Bosentan is Well Tolerated
Also presented at ATS, a 12-week double-blind, randomized, placebo-controlled trial of 23 patients already on treatment with bosentan showed that the addition of sildenafil and atorvastatin to bosentan was well tolerated and that the mean treadmill time (459 seconds and 292 seconds, bosentan-combination and placebo, respectively) in patients receiving the active combination improved by 36% (p <0.01) compared to an improvement of 27% in the placebo group (p <0.05).iii
The safety profile of patients receiving the combination of bosentan and sildenafil was evaluated by a sub-analysis of the long term TRAX data in 119 patients.ii Safety findings in this group of patients were comparable to those in patients treated with bosentan. Elevated liver aminotransferase were noted in 7.6% of patients on bosentan plus sildenafil compared with 7.4% in patients receiving bosentan without sildenafil.ii
Dr Marius Hoeper, University of Hanover Medical School, Germany, comments: “It is important to further confirm if sildenafil can be safely used in patients receiving treatment with bosentan as it would appear to be a useful additional therapy for some patients being treated for PAH .”
Regulatory Status for Tracleer® in PAH
Tracleer was approved in Europe in May 2002 under exceptional circumstances as a result of positive phase III data. Under these circumstances approval was granted with the provision that ongoing safety was monitored for a period of 3 years.[vii] The TRAcleer eXcellence Post-Marketing Surveillance (TRAX PMS) Programme was put in place to record the ongoing safety of bosentan. In the US, Tracleer® was approved in November 2001 under “sub-part H”. Under these circumstances approval was granted with the provision that distribution of Tracleer® was restricted. Tracleer® has also been approved for the treatment of PAH in Japan, Brazil, Israel and other countries worldwide.
Important information related to prescribing Tracleer® in the United States of America:
Indication
Tracleer® is indicated for the treatment of pulmonary arterial hypertension in patients with WHO Class III or IV symptoms, to improve exercise ability and decrease the rate of clinical worsening.
Liver and Pregnancy Warnings
Administration of Tracleer® requires attention to two significant concerns:
* Potential for serious liver injury: Liver monitoring of all patients is essential prior to initiation of treatment and monthly thereafter; and
* high potential for major birth defects: Pregnancy must be excluded and prevented by two forms of birth control; monthly pregnancy tests should be obtained.
Full prescribing information available at www.tracleer.com or at 1-866-462-2856
###
References
Humbert M, Kiely D, Carlsen J et al. Long-term Safety Profile of Bosentan in Patients with Pulmonary Arterial Hypertension from the European Surveillance Program. Mini Symposium Presentation at ATS 2005
[ii] Hoeper M, Kiely D, Carlsen J et al. Safety Profile of Pulmonary Arterial Hypertension Patients Treated with Bosentan and Sildenafil: Results from the European Surveillance Program. Mini-Symposium Presentation at ATS 2005
[iii] Gomberg-Maitland M, McLaughlin V, Gulati M et al. Efficacy and Safety of Sildenafil and Atorvastatin Added to Bosentan as Therapy for Pulmonary Arterial Hypertension (PAH). Poster Presentation K18 at ATS 2005
[iv] D’Azlonzo G et al. Survival in patients with primary pulmonary hypertension. Results from a national prospective registry. Anals Int Med. 1991; 115:343-349
[v] Rubin L, Badesch D, Barst R et al. Bosentan therapy for pulmonary arterial hypertension. NEJM, 2002. 346, 12: 896-903
[vi] Tracleer Prescribing Information
[vii] Tracleer SPC
Actelion Ltd
Actelion Ltd is a biopharmaceutical company with its corporate headquarter in Allschwil/Basel, Switzerland. Actelion`s first drug Tracleer®, an orally available dual endothelin receptor antagonist, has been approved as a therapy for pulmonary arterial hypertension. Actelion markets Tracleer® through its own subsidiaries in key markets worldwide, including the United States (based in South San Francisco), the European Union as well as Canada, Australia and Switzerland. Actelion, founded in late 1997, is a leading player in innovative science related to the endothelium – the single layer of cells separating every blood vessel from the blood stream. Actelion focuses on the discovery, development and marketing of innovative drugs for significant unmet medical needs. Actelion shares are traded on the SWX Swiss Exchange (ticker symbol: ATLN).
For further information please contact:
Actelion Ltd, Gewerbestrasse 16, CH-4123 Allschwil
Actelion Plans Tracleer, Revatio Combination Study
[WERBUNG]
06-06-05 10:19 AM EST
ZURICH -(Dow Jones)- Swiss biotechnology company Actelion AG (ATLN.EB) plans to launch a study that will examine the benefits of adding Pfizer Inc.`s (PFE) Revatio to its own drug Tracleer to treat pulmonary arterial hypertension, spokesman Roland Haefely said Monday.
Actelion of Basel, Switzerland, plans to carefully analyze the package insert that goes with Monday`s approval by the U.S. Food and Drug administration of Revatio before designing a study that looks at a combination treatment, he added.
Given Tracleer`s proven track record, Actelion expects its drug to remain the cornerstone therapy for PAH, a fatal lung disease.
Revatio is only the second oral drug on the market to treat PAH, a difficult- to-diagnose disease where high pressure in the blood vessels moves from the heart to the lungs.
The arrival of new treatments should help raise awareness of PAH -which shows similar symptoms to severe asthma -and therefore help expand the market, Haefely said.
Actelion shares moved lower on the approval of Revatio, but analysts expect losses to remain moderate thanks to Tracleer`s solid track record.
At 1436 GMT, Actelion was down 0.8% at CHF125.30, while the broader market was 0.5% lower.
Tracleer is Actelion`s most important drug, generating around 90% of total revenue.
In 2004, sales of Tracleer amounted to CHF449 million.
Company Web Site: http://www.actelion.com
[WERBUNG]
06-06-05 10:19 AM EST
ZURICH -(Dow Jones)- Swiss biotechnology company Actelion AG (ATLN.EB) plans to launch a study that will examine the benefits of adding Pfizer Inc.`s (PFE) Revatio to its own drug Tracleer to treat pulmonary arterial hypertension, spokesman Roland Haefely said Monday.
Actelion of Basel, Switzerland, plans to carefully analyze the package insert that goes with Monday`s approval by the U.S. Food and Drug administration of Revatio before designing a study that looks at a combination treatment, he added.
Given Tracleer`s proven track record, Actelion expects its drug to remain the cornerstone therapy for PAH, a fatal lung disease.
Revatio is only the second oral drug on the market to treat PAH, a difficult- to-diagnose disease where high pressure in the blood vessels moves from the heart to the lungs.
The arrival of new treatments should help raise awareness of PAH -which shows similar symptoms to severe asthma -and therefore help expand the market, Haefely said.
Actelion shares moved lower on the approval of Revatio, but analysts expect losses to remain moderate thanks to Tracleer`s solid track record.
At 1436 GMT, Actelion was down 0.8% at CHF125.30, while the broader market was 0.5% lower.
Tracleer is Actelion`s most important drug, generating around 90% of total revenue.
In 2004, sales of Tracleer amounted to CHF449 million.
Company Web Site: http://www.actelion.com
Actelion launches Tracleer in PAH in Japan
Approved for all forms of Pulmonary Arterial Hypertension – Full reimbursement status granted
ALLSCHWIL, SWITZERLAND – 8 June 2005 – Actelion Ltd (SWX: ATLN) announced today that Tracleer® (bosentan) is now available upon prescription to all patients in Japan. In early April, the Japanese Ministry of Health, Labor and Welfare had granted formal approval of Tracleer® for the treatment of all forms of Pulmonary Arterial Hypertension PAH (WHO class III and IV). In early June, the same authority has granted full reimbursement status for this orally available dual endothelin receptor antagonist. Tracleer® is being made available in Japan through Actelion`s own affiliate, with initially 35 territory managers focusing on hospital-based physicians.
Jean-Paul Clozel, M.D. and Chief Executive Officer of Actelion, said: “With today`s launch in Japan, Actelion has realized its strategic goal of commercializing Tracleer® with its own infrastructure in all key pharmaceutical markets worldwide. We can now further leverage our worldwide capabilities in clinical development, regulatory affairs and marketing and sales with new innovative compounds from our own drug discovery efforts or, should the opportunity arise, from in-licensed or acquired drugs."
Satoshi Tanaka, Dr med Sci, and President of Actelion Japan, commented: “Since Actelion Japan has been founded in October 2001, we have built a fully government-certified affiliate. By having documented our professionalism, the Japanese authorities have gained the necessary confidence not only in Tracleer® and its clinical benefits, but also in Actelion`s capabilities to responsibly promote Tracleer® in Japan. We are ready to ensure that Japanese physicians and patients are receiving the same level of service and support as Actelion has successfully established already in North America and Europe.
Dr. Tanaka concluded: “By having conducted a local clinical trial - bridging to the results of the international Phase 3 clinical trials -, we have generated initial clinical development and regulatory expertise to support the global clinical development of future Actelion compounds."
http://www.actelion.com
Conference Call
Actelion will host an Investor Conference Call and discussion/Q&A on Wednesday, 8 June 2005, 12.00 CET / 06.00 a.m. EST / 11.00 BST / 19.00 JST
Webcast – Live and replay on demand
Actelion webcasts its Investor Conference Call. On the Web, you may either follow the call live or have the call replayed later on demand. To access the webcast live, simply visit the link on our homepage http://www.actelion.com/ 5-10 minutes before the conference is due to start.
Approximately 60 minutes after the call has ended, the archived investor webcast will be available for replay on the website “Investors/Past Events”.
Approved for all forms of Pulmonary Arterial Hypertension – Full reimbursement status granted
ALLSCHWIL, SWITZERLAND – 8 June 2005 – Actelion Ltd (SWX: ATLN) announced today that Tracleer® (bosentan) is now available upon prescription to all patients in Japan. In early April, the Japanese Ministry of Health, Labor and Welfare had granted formal approval of Tracleer® for the treatment of all forms of Pulmonary Arterial Hypertension PAH (WHO class III and IV). In early June, the same authority has granted full reimbursement status for this orally available dual endothelin receptor antagonist. Tracleer® is being made available in Japan through Actelion`s own affiliate, with initially 35 territory managers focusing on hospital-based physicians.
Jean-Paul Clozel, M.D. and Chief Executive Officer of Actelion, said: “With today`s launch in Japan, Actelion has realized its strategic goal of commercializing Tracleer® with its own infrastructure in all key pharmaceutical markets worldwide. We can now further leverage our worldwide capabilities in clinical development, regulatory affairs and marketing and sales with new innovative compounds from our own drug discovery efforts or, should the opportunity arise, from in-licensed or acquired drugs."
Satoshi Tanaka, Dr med Sci, and President of Actelion Japan, commented: “Since Actelion Japan has been founded in October 2001, we have built a fully government-certified affiliate. By having documented our professionalism, the Japanese authorities have gained the necessary confidence not only in Tracleer® and its clinical benefits, but also in Actelion`s capabilities to responsibly promote Tracleer® in Japan. We are ready to ensure that Japanese physicians and patients are receiving the same level of service and support as Actelion has successfully established already in North America and Europe.
Dr. Tanaka concluded: “By having conducted a local clinical trial - bridging to the results of the international Phase 3 clinical trials -, we have generated initial clinical development and regulatory expertise to support the global clinical development of future Actelion compounds."
http://www.actelion.com
Conference Call
Actelion will host an Investor Conference Call and discussion/Q&A on Wednesday, 8 June 2005, 12.00 CET / 06.00 a.m. EST / 11.00 BST / 19.00 JST
Webcast – Live and replay on demand
Actelion webcasts its Investor Conference Call. On the Web, you may either follow the call live or have the call replayed later on demand. To access the webcast live, simply visit the link on our homepage http://www.actelion.com/ 5-10 minutes before the conference is due to start.
Approximately 60 minutes after the call has ended, the archived investor webcast will be available for replay on the website “Investors/Past Events”.
Die deutschen Börsenblätter entdecken Actelion
Jede Menge Empfehlungen
Actelion Kauf bis 86 EUR
09.06.2005 10:46:12
Die Experten vom Anlegermagazin "FOCUS-MONEY" empfehlen die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) bis 86 EUR zu kaufen.
Dem Unternehmen sei ein furioser Start ins Geschäftsjahr 2005 gelungen. Im Vergleich zum Vorjahr habe der Umsatz um 45 Prozent auf 146,4 Mio. CHF zugelegt. Beim Gewinn habe man sogar ein Plus von 52 Prozent auf 42,1 Mio. CHF geschafft.
Trotz der imposanten Ergebnisse sei die Aktie nur ein Investment für risikobewusste Anleger. Der Erfolg beruhe nämlich vor allem auf dem Medikament Tracleer zur Behandlung von Bluthochdruck im Lungenkreislauf.
Äußerst viel versprechend sei die Produkt-Pipeline der Gesellschaft. So könnten schon bald 13 Neuentwicklungen reif für eine Markteinführung sein. Einige Entscheidungen über die Zulassung würden noch in den kommenden Monaten erwartet. Werde die Zulassung erteilt, sei mit Kursanstiegen zu rechnen.
Die Experten von "FOCUS-MONEY" raten die Actelion-Aktie bis 86 EUR zu kaufen. Stoppkurse sollten bei 72,50 EUR gesetzt werden.
Analyse-Datum: 09.06.2005
Actelion kaufen
09.06.2005 11:28:05
Die Experten vom Anlegermagazin "Der Aktionär" empfehlen die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) zu kaufen.
Das Unternehmen habe mit Tracleer schon ein Präparat auf den Markt gebracht, das im vergangenen Jahr etwa 278 Millionen Euro zum Umsatz beigesteuert habe. Die Fantasie, die von dem Medikament ausgehe, liege aber darin begründet, dass Tracleer momentan in weiteren klinischen Studien auf seine Tauglichkeit bei anderen Indikationen wie etwa offenen Geschwüren oder Lungenfibrose getestet werde. Im dritten und vierten Quartal wolle das Unternehmen entsprechende Ergebnisse aus klinischen Studien der dritten und entscheidenden Phase präsentieren. Dies sollte auch dem Kurs weiteren Auftrieb geben.
Die Experten von "Der Aktionär" stufen die Aktie von Actelion mit "kaufen" ein.
Analyse-Datum: 09.06.2005
09.06.2005 - 14:08 Uhr
Actelion spekulative Empfehlung
Für die Experten der "Wirtschaftswoche" stellt die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) eine spekulative Empfehlung dar.
Actelion sei eine reizvolle Mischung aus profitablem Pharmawert und chancenträchtigem Biotech. Mit Tracleer verfüge die Schweizer Gesellschaft bereits über einen gewinnbringenden Umsatzträger im Portfolio.
Actelion konzentriere sich bei seiner Forschung nicht auf eine Krankheit, sondern auf ein Organ, das Endothel. Aktuell befänden sich 14 Indikatoren in klinischen Studien, zehn davon in Phase III.
Seit dem letzten Jahr arbeite das Unternehmen profitabel. Die Umsätze würden um rund 50% p.a. wachsen und der Gewinn lege überproportional zu. In diesem Jahr sollte ein Umsatz von über 550 Mio. CHF generiert werden (rechne man das erste Quartal hoch). Dazu beitragen könnte die Zulassung von Tracleer für den japanischen Markt und würden einige Phase III-Kandidaten auf den Markt kommen, sei sogar noch mehr drin.
Charttechnisch befinde sich der Titel in einem strammen Aufwärtstrend. Als nächstes dürfte die Marke von 150 CHF in Angriff genommen werden. Unterstützungen befänden sich bei 120 und dann erst wieder bei 100 CHF.
Nach Ansicht der Experten der "Wirtschaftswoche" bietet die Aktie von Actelion ein attraktives Chance/Risiko-Verhältnis. Eingegangene Positionen sollten bei 99,00 CHF abgesichert werden.
Analyse-Datum: 09.06.2005
Jede Menge Empfehlungen
Actelion Kauf bis 86 EUR
09.06.2005 10:46:12
Die Experten vom Anlegermagazin "FOCUS-MONEY" empfehlen die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) bis 86 EUR zu kaufen.
Dem Unternehmen sei ein furioser Start ins Geschäftsjahr 2005 gelungen. Im Vergleich zum Vorjahr habe der Umsatz um 45 Prozent auf 146,4 Mio. CHF zugelegt. Beim Gewinn habe man sogar ein Plus von 52 Prozent auf 42,1 Mio. CHF geschafft.
Trotz der imposanten Ergebnisse sei die Aktie nur ein Investment für risikobewusste Anleger. Der Erfolg beruhe nämlich vor allem auf dem Medikament Tracleer zur Behandlung von Bluthochdruck im Lungenkreislauf.
Äußerst viel versprechend sei die Produkt-Pipeline der Gesellschaft. So könnten schon bald 13 Neuentwicklungen reif für eine Markteinführung sein. Einige Entscheidungen über die Zulassung würden noch in den kommenden Monaten erwartet. Werde die Zulassung erteilt, sei mit Kursanstiegen zu rechnen.
Die Experten von "FOCUS-MONEY" raten die Actelion-Aktie bis 86 EUR zu kaufen. Stoppkurse sollten bei 72,50 EUR gesetzt werden.
Analyse-Datum: 09.06.2005
Actelion kaufen
09.06.2005 11:28:05
Die Experten vom Anlegermagazin "Der Aktionär" empfehlen die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) zu kaufen.
Das Unternehmen habe mit Tracleer schon ein Präparat auf den Markt gebracht, das im vergangenen Jahr etwa 278 Millionen Euro zum Umsatz beigesteuert habe. Die Fantasie, die von dem Medikament ausgehe, liege aber darin begründet, dass Tracleer momentan in weiteren klinischen Studien auf seine Tauglichkeit bei anderen Indikationen wie etwa offenen Geschwüren oder Lungenfibrose getestet werde. Im dritten und vierten Quartal wolle das Unternehmen entsprechende Ergebnisse aus klinischen Studien der dritten und entscheidenden Phase präsentieren. Dies sollte auch dem Kurs weiteren Auftrieb geben.
Die Experten von "Der Aktionär" stufen die Aktie von Actelion mit "kaufen" ein.
Analyse-Datum: 09.06.2005
09.06.2005 - 14:08 Uhr
Actelion spekulative Empfehlung
Für die Experten der "Wirtschaftswoche" stellt die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) eine spekulative Empfehlung dar.
Actelion sei eine reizvolle Mischung aus profitablem Pharmawert und chancenträchtigem Biotech. Mit Tracleer verfüge die Schweizer Gesellschaft bereits über einen gewinnbringenden Umsatzträger im Portfolio.
Actelion konzentriere sich bei seiner Forschung nicht auf eine Krankheit, sondern auf ein Organ, das Endothel. Aktuell befänden sich 14 Indikatoren in klinischen Studien, zehn davon in Phase III.
Seit dem letzten Jahr arbeite das Unternehmen profitabel. Die Umsätze würden um rund 50% p.a. wachsen und der Gewinn lege überproportional zu. In diesem Jahr sollte ein Umsatz von über 550 Mio. CHF generiert werden (rechne man das erste Quartal hoch). Dazu beitragen könnte die Zulassung von Tracleer für den japanischen Markt und würden einige Phase III-Kandidaten auf den Markt kommen, sei sogar noch mehr drin.
Charttechnisch befinde sich der Titel in einem strammen Aufwärtstrend. Als nächstes dürfte die Marke von 150 CHF in Angriff genommen werden. Unterstützungen befänden sich bei 120 und dann erst wieder bei 100 CHF.
Nach Ansicht der Experten der "Wirtschaftswoche" bietet die Aktie von Actelion ein attraktives Chance/Risiko-Verhältnis. Eingegangene Positionen sollten bei 99,00 CHF abgesichert werden.
Analyse-Datum: 09.06.2005
Heute spielt hier die Musik. ( 504350 )















09.08.2005 (09:07)
Zweite Studie mit Bosentan (Tracleer) zeigt eine statistisch signifikante Reduktion neuer digitaler Ulzerationen bei Sklerodermie-Patienten
Actelion Ltd (SWX: ATLN) gab heute das vorläufige Ergebnis der multizentrischen, randomisierten, plazebo-kontrollierten, Doppelblindstudie RAPIDS-2 bekannt. Es handelt sich dabei um eine Phase-III-Studie, die den dualen Endothelin-Rezeptor-Antagonisten Bosentan (Tracleer®) bei 190 Sklerodermie-Patienten mit digitalen Ulzerationen prüft.
Die vorläufige Analyse deutet darauf hin, dass der primäre Endpunkt, eine Reduktion des Auftretens neuer digitaler Ulzerationen während der sechsmonatigen Behandlungsdauer, statistisch signifikant war. Dieses Ergebnis bestätigt frühere positive Befunde der Vorläuferstudie mit dem Namen RAPIDS-1.
RAPIDS-2 untersuchte auch den Effekt der Behandlung auf die Heilungsdauer für bestehende digitale Ulzerationen bei dieser Patientenpopulation. Es ergab sich kein Zeitunterschied bis zur Heilung zwischen Patienten, die Plazebo erhalten hatten und Patienten unter Bosentan. Die Sicherheit und Verträglichkeit von Bosentan entsprach derjenigen, die in früheren klinischen Studien und in der klinischen Praxis mit Tracleer® beobachtet wurde.
Im Hinblick auf Gespräche mit den Zulassungsbehörden und die Einreichung von Zulassungsanträgen weltweit wird Actelion die Daten jetzt einer umfassenden Analyse unterziehen. Die Ergebnisse werden auch bei einem wichtigen internationalen wissenschaftlichen Kongresses präsentiert und in einer Wissenschaftspublikation nach Durchsicht durch Fachkollegen veröffentlicht werden.
Duale Endothelin-Rezeptor-Antagonisten spielen eine wesentliche Rolle bei Sklerodermie
Dr. James R. Seibold, Professor für Innere Medizin und Direktor des Sklerodermie-Programms der University of Michigan in Ann Arbor, Michigan, USA, Leiter der RAPIDS-2 Studiengruppe, kommentierte: "Ich bin sehr erfreut darüber, dass das RAPIDS-Programm die Rolle von dualen Endothelin-Rezeptor-Antagonisten mit Bosentan als potenzieller Behandlungsoption für die Prävention von digitalen Ulzerationen bei Sklerodermie bestätigt."
Dr. Seibold ergänzte: "Dieses Programm ergänzt unser Verständnis von Gefässleiden bei Sklerodermie, einer Krankheit mit verschiedenen verheerenden Erscheinungsformen. Dazu gehört auch die pulmonale arterielle Hypertonie (PAH), für deren Behandlung Bosentan bereits zugelassen ist."
Dr. Isaac Kobrin, Leiter Clinical Development bei Actelion, kommentierte:
"Diese positiven Ergebnisse gemeinsam mit dem früher beschriebenen Nutzen von Bosentan bei PAH-Patienten in Folge von Sklerodermie legen nahe, dass die Stimulation beider Endothelin-Rezeptoren eine wichtige Rolle bei der Entstehung vaskulärer Komplikationen bei Sklerodermie spielt."
Dr. Kobrin fügte hinzu: "Mit dem RAPIDS-Programm hat Actelion einmal mehr das Engagement des Unternehmens bewiesen, zum Fortschritt in der klinischen Praxis für Krankheiten mit hohen unerfüllten medizinischen Bedürfnissen wie den Erscheinungsformen der Sklerodermie beizutragen. Bis zum Ende des Jahres erwarte ich beispielsweise auch die Ergebnisse einer multizentrischen, randomisierten, plazebo-kontrollierten Doppelblindstudie mit dem Namen BUILD-2, die Sicherheit und Verträglichkeit von Bosentan bei pulmonaler Fibrose prüft, einer anderen Manifestation der Sklerodermie."
Zweite Studie mit Bosentan (Tracleer) zeigt eine statistisch signifikante Reduktion neuer digitaler Ulzerationen bei Sklerodermie-Patienten
Actelion Ltd (SWX: ATLN) gab heute das vorläufige Ergebnis der multizentrischen, randomisierten, plazebo-kontrollierten, Doppelblindstudie RAPIDS-2 bekannt. Es handelt sich dabei um eine Phase-III-Studie, die den dualen Endothelin-Rezeptor-Antagonisten Bosentan (Tracleer®) bei 190 Sklerodermie-Patienten mit digitalen Ulzerationen prüft.
Die vorläufige Analyse deutet darauf hin, dass der primäre Endpunkt, eine Reduktion des Auftretens neuer digitaler Ulzerationen während der sechsmonatigen Behandlungsdauer, statistisch signifikant war. Dieses Ergebnis bestätigt frühere positive Befunde der Vorläuferstudie mit dem Namen RAPIDS-1.
RAPIDS-2 untersuchte auch den Effekt der Behandlung auf die Heilungsdauer für bestehende digitale Ulzerationen bei dieser Patientenpopulation. Es ergab sich kein Zeitunterschied bis zur Heilung zwischen Patienten, die Plazebo erhalten hatten und Patienten unter Bosentan. Die Sicherheit und Verträglichkeit von Bosentan entsprach derjenigen, die in früheren klinischen Studien und in der klinischen Praxis mit Tracleer® beobachtet wurde.
Im Hinblick auf Gespräche mit den Zulassungsbehörden und die Einreichung von Zulassungsanträgen weltweit wird Actelion die Daten jetzt einer umfassenden Analyse unterziehen. Die Ergebnisse werden auch bei einem wichtigen internationalen wissenschaftlichen Kongresses präsentiert und in einer Wissenschaftspublikation nach Durchsicht durch Fachkollegen veröffentlicht werden.
Duale Endothelin-Rezeptor-Antagonisten spielen eine wesentliche Rolle bei Sklerodermie
Dr. James R. Seibold, Professor für Innere Medizin und Direktor des Sklerodermie-Programms der University of Michigan in Ann Arbor, Michigan, USA, Leiter der RAPIDS-2 Studiengruppe, kommentierte: "Ich bin sehr erfreut darüber, dass das RAPIDS-Programm die Rolle von dualen Endothelin-Rezeptor-Antagonisten mit Bosentan als potenzieller Behandlungsoption für die Prävention von digitalen Ulzerationen bei Sklerodermie bestätigt."
Dr. Seibold ergänzte: "Dieses Programm ergänzt unser Verständnis von Gefässleiden bei Sklerodermie, einer Krankheit mit verschiedenen verheerenden Erscheinungsformen. Dazu gehört auch die pulmonale arterielle Hypertonie (PAH), für deren Behandlung Bosentan bereits zugelassen ist."
Dr. Isaac Kobrin, Leiter Clinical Development bei Actelion, kommentierte:
"Diese positiven Ergebnisse gemeinsam mit dem früher beschriebenen Nutzen von Bosentan bei PAH-Patienten in Folge von Sklerodermie legen nahe, dass die Stimulation beider Endothelin-Rezeptoren eine wichtige Rolle bei der Entstehung vaskulärer Komplikationen bei Sklerodermie spielt."
Dr. Kobrin fügte hinzu: "Mit dem RAPIDS-Programm hat Actelion einmal mehr das Engagement des Unternehmens bewiesen, zum Fortschritt in der klinischen Praxis für Krankheiten mit hohen unerfüllten medizinischen Bedürfnissen wie den Erscheinungsformen der Sklerodermie beizutragen. Bis zum Ende des Jahres erwarte ich beispielsweise auch die Ergebnisse einer multizentrischen, randomisierten, plazebo-kontrollierten Doppelblindstudie mit dem Namen BUILD-2, die Sicherheit und Verträglichkeit von Bosentan bei pulmonaler Fibrose prüft, einer anderen Manifestation der Sklerodermie."
Actelion RAPIDS-2 Study Modestly Good News
Tuesday, August 09, 2005 4:52:19 AM ET
Dow Jones Newswires
0840 GMT [Dow Jones]--Actelion`s (ATLN.EB) RAPIDS-2 study is "modestly good news," says CSFB. However notes limited potential number of digital ulceration patients that might be prescribed Tracleer. Additionally sees risk of company not receiving label extension for DU, particularly in US, because drug had no impact on time to healing. CSFB says stock reaction likely to be modest, given recent good run, modest commercial size of indication, slightly ambitious headline clinical results. Keeps shares rated outperform. Shares +0.7% at CHF138. (HJS)
Tuesday, August 09, 2005 4:52:19 AM ET
Dow Jones Newswires
0840 GMT [Dow Jones]--Actelion`s (ATLN.EB) RAPIDS-2 study is "modestly good news," says CSFB. However notes limited potential number of digital ulceration patients that might be prescribed Tracleer. Additionally sees risk of company not receiving label extension for DU, particularly in US, because drug had no impact on time to healing. CSFB says stock reaction likely to be modest, given recent good run, modest commercial size of indication, slightly ambitious headline clinical results. Keeps shares rated outperform. Shares +0.7% at CHF138. (HJS)
Encysive Pharma - Vor dem Durchbruch
Encysive wartet auf einen positiven Bescheid der Zulassungsbehörden. Dann will das Unternehmen den Angriff auf den Marktführer starten. Ab 2007 sollen die Gewinne sprudeln.
Von Frank Phillipps
Eines hat die US-Biotech-Firma Encysive Pharmaceuticals vielen von der Größe vergleichbaren Konkurrenten voraus: Das Unternehmen aus Bellaire im Bundesstaat Texas hat mit dem Gerinnungshemmer Argatroban bereits ein Produkt bis zur Marktreife entwickelt. Das Medikament kommt in den seltenen Fällen zum Einsatz, in denen das Standardmittel Heparin paradoxerweise lebensgefährliche Gefäßverschlüsse auslöst. Vermarktet wird Argatroban vom Pharmakonzern GlaxoSmithKline. Encysive ist an den Umsatzerlösen beteiligt. Im zweiten Quartal des laufenden Geschäftsjahres stiegen die Argatroban-Erlöse für Encysive im Vergleich zur entsprechenden Vorjahresperiode um 34 Prozent auf 2,7 Millionen Dollar. Das ganz große Geld erwirtschaftet Encysive damit also noch nicht.
Angriff auf den Marktführer
Den Durchbruch will Encysive mit seinem Medikament Thelin schaffen. Das Präparat, das sich derzeit im Zulassungsverfahren der zuständigen Behörden in den USA und Europa befindet, soll zur Behandlung von Überdruck in der Lungenarterie (pulmonale arterielle Hypertonie) eingesetzt werden. Ein Entscheid wird für das kommende Jahr erwartet. Auch wenn sich die US-Gesundheitsbehörde FDA gerade in der jüngeren Vergangenheit wenig berechenbar gezeigt hat, zweifeln Branchenkenner nicht daran, dass Encysive die Zulassung für Thelin erhalten wird. Dann könnte Encysive mit Thelin den bisherigen Marktführer in diesem Bereich, die Schweizer Firma Actelion, angreifen. Dieser generiert mit dem Konkurrenzprodukt Tracleer rund 95 Prozent seines Gesamtumsatzes, und der betrug im abgelaufenen Geschäftsjahr 2004 immerhin 400 Millionen Dollar. Analysten sprechen Tracleer sogar ein Marktpotenzial von bis zu 750 Millionen Dollar jährlich zu. Von diesem Kuchen dürfte sich Encysive eine dicke Scheibe abschneiden, denn Thelin ist - das sagen nach Expertenansicht die Ergebnisse der klinischen Studie aus - besser verträglich als Tracleer und verursacht weniger Nebenwirkungen.
Ab 2007 sollen Gewinne sprudeln
Derzeit steckt Encysive noch in den roten Zahlen: Im zweiten Quartal des laufenden Geschäftsjahres erwirtschaftete das Unternehmen Umsatzerlöse von drei Millionen Dollar und einen Verlust von 19,2 Millionen Dollar oder 33 Cent je Aktie. Für das Gesamtjahr rechnen die Analysten mit einem satten Fehlbetrag von 1,38 Dollar je Aktie bei einem Umsatz von etwa 12,1 Millionen Dollar. Doch bereits für das kommende Jahr prognostizieren die Experten eine wahre Umsatzexplosion: Dann sollen rund 60,7 Millionen Dollar durch die Encysive-Bücher gehen und der Verlust auf 83 Cent je Anteilschein zurückgeführt werden. Die Gewinnzone wird Encysive voraussichtlich im Jahr 2007 erreichen. Dann soll ein Plus von 20 Cent je Aktie auf der Habenseite stehen. Der Umsatz soll sich 2007 auf 133 Millionen Dollar belaufen, sich im Vergleich zum Vorjahr also noch einmal mehr als verdoppeln.
Rechtzeitig einsteigen
Die Zulassung von Thelin dürfte bei der Encysive-Aktie für einen gewaltigen Kursschub sorgen - und das Unternehmen auf direktem Weg in eine neue Dimension hieven. Ab 2006 ist mit einer Explosion bei den Umsätzen zu rechnen, 2007 sollte Encysive erstmals Gewinne erzielen. Risikofreudige Anleger greifen auf dem aktuellen Niveau zu und legen sich einige Stücke als Beimischung ins Depot.
Artikel aus DER AKTIONÄR 37/05
Behandelte Wertpapiere
Encysive Pharma (US29256X1072; 690003; ENCY)
Encysive wartet auf einen positiven Bescheid der Zulassungsbehörden. Dann will das Unternehmen den Angriff auf den Marktführer starten. Ab 2007 sollen die Gewinne sprudeln.
Von Frank Phillipps
Eines hat die US-Biotech-Firma Encysive Pharmaceuticals vielen von der Größe vergleichbaren Konkurrenten voraus: Das Unternehmen aus Bellaire im Bundesstaat Texas hat mit dem Gerinnungshemmer Argatroban bereits ein Produkt bis zur Marktreife entwickelt. Das Medikament kommt in den seltenen Fällen zum Einsatz, in denen das Standardmittel Heparin paradoxerweise lebensgefährliche Gefäßverschlüsse auslöst. Vermarktet wird Argatroban vom Pharmakonzern GlaxoSmithKline. Encysive ist an den Umsatzerlösen beteiligt. Im zweiten Quartal des laufenden Geschäftsjahres stiegen die Argatroban-Erlöse für Encysive im Vergleich zur entsprechenden Vorjahresperiode um 34 Prozent auf 2,7 Millionen Dollar. Das ganz große Geld erwirtschaftet Encysive damit also noch nicht.
Angriff auf den Marktführer
Den Durchbruch will Encysive mit seinem Medikament Thelin schaffen. Das Präparat, das sich derzeit im Zulassungsverfahren der zuständigen Behörden in den USA und Europa befindet, soll zur Behandlung von Überdruck in der Lungenarterie (pulmonale arterielle Hypertonie) eingesetzt werden. Ein Entscheid wird für das kommende Jahr erwartet. Auch wenn sich die US-Gesundheitsbehörde FDA gerade in der jüngeren Vergangenheit wenig berechenbar gezeigt hat, zweifeln Branchenkenner nicht daran, dass Encysive die Zulassung für Thelin erhalten wird. Dann könnte Encysive mit Thelin den bisherigen Marktführer in diesem Bereich, die Schweizer Firma Actelion, angreifen. Dieser generiert mit dem Konkurrenzprodukt Tracleer rund 95 Prozent seines Gesamtumsatzes, und der betrug im abgelaufenen Geschäftsjahr 2004 immerhin 400 Millionen Dollar. Analysten sprechen Tracleer sogar ein Marktpotenzial von bis zu 750 Millionen Dollar jährlich zu. Von diesem Kuchen dürfte sich Encysive eine dicke Scheibe abschneiden, denn Thelin ist - das sagen nach Expertenansicht die Ergebnisse der klinischen Studie aus - besser verträglich als Tracleer und verursacht weniger Nebenwirkungen.
Ab 2007 sollen Gewinne sprudeln
Derzeit steckt Encysive noch in den roten Zahlen: Im zweiten Quartal des laufenden Geschäftsjahres erwirtschaftete das Unternehmen Umsatzerlöse von drei Millionen Dollar und einen Verlust von 19,2 Millionen Dollar oder 33 Cent je Aktie. Für das Gesamtjahr rechnen die Analysten mit einem satten Fehlbetrag von 1,38 Dollar je Aktie bei einem Umsatz von etwa 12,1 Millionen Dollar. Doch bereits für das kommende Jahr prognostizieren die Experten eine wahre Umsatzexplosion: Dann sollen rund 60,7 Millionen Dollar durch die Encysive-Bücher gehen und der Verlust auf 83 Cent je Anteilschein zurückgeführt werden. Die Gewinnzone wird Encysive voraussichtlich im Jahr 2007 erreichen. Dann soll ein Plus von 20 Cent je Aktie auf der Habenseite stehen. Der Umsatz soll sich 2007 auf 133 Millionen Dollar belaufen, sich im Vergleich zum Vorjahr also noch einmal mehr als verdoppeln.
Rechtzeitig einsteigen
Die Zulassung von Thelin dürfte bei der Encysive-Aktie für einen gewaltigen Kursschub sorgen - und das Unternehmen auf direktem Weg in eine neue Dimension hieven. Ab 2006 ist mit einer Explosion bei den Umsätzen zu rechnen, 2007 sollte Encysive erstmals Gewinne erzielen. Risikofreudige Anleger greifen auf dem aktuellen Niveau zu und legen sich einige Stücke als Beimischung ins Depot.
Artikel aus DER AKTIONÄR 37/05
Behandelte Wertpapiere
Encysive Pharma (US29256X1072; 690003; ENCY)
Bosentan ist Option bei Sklerodermie-Komplikation
6-Minuten-Gehstrecke wird deutlich verlängert
DRESDEN (djb). Bei Patienten mit einer pulmonalen arteriellen Hypertonie (PAH) und einer systemischen Sklerodermie ist der orale Endothelin-Rezeptor-Antagonist Bosentan eine geeignete Therapie. Die Endothelin-1-Plasmakonzentration ist bei Sklerodermie erhöht und korreliert mit dem Schweregrad der Erkrankung, und zwar unabhängig davon, ob sich der Lungenhochdruck bereits manifestiert hat.
Aufgrund neuer Studiendaten soll die Zulassung von Bosentan (Tracleer®) jetzt auch für die Indikation "digitale Ulzerationen" bei systemischer Sklerodermie beantragt werden. Darauf hat jetzt Professor Michael Meurer von der TU Dresden bei einem vom Unternehmen Actelion unterstützten Symposium hingewiesen.
In der Studie RAPIDS-1 mit 122 Sklerodermie-Patienten konnte bereits belegt werden, daß der seit 2002 für die Behandlung bei pulmonaler arterieller Hypertonie zugelassene Endothelin-Rezeptor-Antagonist Bosentan die Rate der digitalen Ulzerationen um 48 Prozent reduziert. Außerdem sei die Handfunktion signifikant verbessert worden, etwa beim Greifen während der Körperpflege, sagte Meurer.
Erste Analysen der erst kürzlich abgeschlossenen RAPIDS-2-Studie mit 190 Patienten hätten die positiven Effekte von Bosentan auf die ischämischen digitalen Ulzerationen bestätigt.
An der Untersuchung nahmen Patienten mit schwereren Formen der Erkrankung teil, und die Behandlungsdauer war mit 24 Wochen länger als in der Studie RAPIDS-1. Fibrosierung und Hypertrophie der Gefäße wurden unabhängig von der Manifestation einer PAH reduziert. Zehn bis 40 Prozent der Sklerodermie-Patienten entwickeln gleichzeitig eine PAH in Assoziation mit der systemischen Sklerodermie.
Bei diesen Patienten kam es unter einer 12- bis 16wöchigen Behandlung mit Bosentan zu einer im Vergleich zu Placebo signifikanten Verlängerung der mittleren 6-Minuten-Gehstrecke und der funktionellen NYHA-Klasse. Die Zeit bis zur klinischen Verschlechterung sei im Vergleich zu Placebo, das Überleben im Vergleich auch zu einer konventionellen Therapie verlängert worden, so Meurer.
Die Prognose von Sklerodermie-Patienten mit PAH sei unter Bosentan nach etwa drei Jahren ähnlich wie die von Patienten mit idiopathischer PAH nach drei bis vier Jahren, sagte Meurer. Die Progredienz der Erkrankung werde verlangsamt. Unter einer nicht-spezifischen, konventionellen Therapie sterben 80 Prozent der Patienten innerhalb von zwei Jahren.
6-Minuten-Gehstrecke wird deutlich verlängert
DRESDEN (djb). Bei Patienten mit einer pulmonalen arteriellen Hypertonie (PAH) und einer systemischen Sklerodermie ist der orale Endothelin-Rezeptor-Antagonist Bosentan eine geeignete Therapie. Die Endothelin-1-Plasmakonzentration ist bei Sklerodermie erhöht und korreliert mit dem Schweregrad der Erkrankung, und zwar unabhängig davon, ob sich der Lungenhochdruck bereits manifestiert hat.
Aufgrund neuer Studiendaten soll die Zulassung von Bosentan (Tracleer®) jetzt auch für die Indikation "digitale Ulzerationen" bei systemischer Sklerodermie beantragt werden. Darauf hat jetzt Professor Michael Meurer von der TU Dresden bei einem vom Unternehmen Actelion unterstützten Symposium hingewiesen.
In der Studie RAPIDS-1 mit 122 Sklerodermie-Patienten konnte bereits belegt werden, daß der seit 2002 für die Behandlung bei pulmonaler arterieller Hypertonie zugelassene Endothelin-Rezeptor-Antagonist Bosentan die Rate der digitalen Ulzerationen um 48 Prozent reduziert. Außerdem sei die Handfunktion signifikant verbessert worden, etwa beim Greifen während der Körperpflege, sagte Meurer.
Erste Analysen der erst kürzlich abgeschlossenen RAPIDS-2-Studie mit 190 Patienten hätten die positiven Effekte von Bosentan auf die ischämischen digitalen Ulzerationen bestätigt.
An der Untersuchung nahmen Patienten mit schwereren Formen der Erkrankung teil, und die Behandlungsdauer war mit 24 Wochen länger als in der Studie RAPIDS-1. Fibrosierung und Hypertrophie der Gefäße wurden unabhängig von der Manifestation einer PAH reduziert. Zehn bis 40 Prozent der Sklerodermie-Patienten entwickeln gleichzeitig eine PAH in Assoziation mit der systemischen Sklerodermie.
Bei diesen Patienten kam es unter einer 12- bis 16wöchigen Behandlung mit Bosentan zu einer im Vergleich zu Placebo signifikanten Verlängerung der mittleren 6-Minuten-Gehstrecke und der funktionellen NYHA-Klasse. Die Zeit bis zur klinischen Verschlechterung sei im Vergleich zu Placebo, das Überleben im Vergleich auch zu einer konventionellen Therapie verlängert worden, so Meurer.
Die Prognose von Sklerodermie-Patienten mit PAH sei unter Bosentan nach etwa drei Jahren ähnlich wie die von Patienten mit idiopathischer PAH nach drei bis vier Jahren, sagte Meurer. Die Progredienz der Erkrankung werde verlangsamt. Unter einer nicht-spezifischen, konventionellen Therapie sterben 80 Prozent der Patienten innerhalb von zwei Jahren.
http://new-www.actelion.com/uninet/www/www_main_p.nsf/Conten…
Media Release
19 Oktober 2005
Actelion announces 9-month results for 2005
Total net revenue of CHF 477.1 million, up 40 percent – Stronger than expected Tracleer® sales of CHF 455.1 m – Operating profit of CHF 126.1 m, up 97 percent – Upgraded revenue and profit guidance for 2005
ALLSCHWIL, SWITZERLAND – 19 October 2005 – Actelion Ltd (SWX: ATLN) today announced its financial results for the first nine months of 2005. With total net revenues for the first nine months of 2005 of CHF 477.1 million (9 m 2004: CHF 341.5 m) and operating expenses of CHF 351.0 million (9 m 2004: 277.6 m), the company reported an operating profit of CHF 126.1 million (9 m 2004: CHF 63.9 m). The net profit for the first nine months of 2005 was CHF 103.8 million (9 m 2004: CHF 64.2 m).
Basic earnings per share (EPS) for the first nine months of 2005 improved to CHF 4.66, compared to CHF 2.92 in the first nine months of 2004. In the first nine months of 2005 Actelion generated net cash flow from operating activities of CHF 92.1 million (9 m 2004: CHF 61.9 m). Cash, cash equivalents and short-term deposits as of 30 September 2005 were CHF 344.0 million (30 June 2005: CHF 302.4 million).
Jean-Paul Clozel, MD and Chief Executive Officer, commented: “I am delighted with our overall performance for the first nine months of 2005. Actelion has been successful in growing the pulmonary arterial hypertension (PAH) market more rapidly than we expected, with physicians becoming even more aware of the benefits of diagnosis and treatment with our dual endothelin receptor antagonist Tracleer®. Actelion has committed additional resources to further increase its educational and clinical efforts in the PAH community.”
Jean-Paul Clozel added: “Actelion has also made substantial advances in implementing its long-term strategy of growing above and beyond Tracleer® in PAH. Our pre-clinical and clinical programs are making rapid progress. Line-extension studies for our two marketed products Tracleer® (bosentan) and Zavesca® (miglustat) will report data before year-end. Over the coming 18 months, Actelion also expects important clinical results from several pipeline projects with the potential to radically improve treatment of various diseases.”
Andrew J. Oakley, Chief Financial Officer commented: "Financial results for the first nine months of 2005 were outstanding as Tracleer® sales continued to grow across all markets. In mid-June 2005, commercial sales of Tracleer® also started in Japan. We expect this market to provide significant growth in 2006. Our cost base continued to increase in-line with both our expectations and the expansion of our business activities.”
Andrew J. Oakley continued: “Considering our continuing success with Tracleer® in PAH, we have revised our full year net revenue guidance upwards, from between 600 to 615 to between 640 and 655 million Swiss Francs – unforeseen events excluded. With no changes to previously forecasted expenditures, Actelion could report an operating profit of between 140 and 155 million Swiss Francs for the full year 2005.”
Financial result overview – Table 9 months 2005 vs. 9 months 2004
In CHF thousands
Result 9 months 2005
Result 9 months 2004
Variance
in %
Net Revenues
477’056
341’517
135’539
+40
Operating Expenses*
350’982*
277’628
73’354
+26
Operating Profit
126’074
63’889
62’185
+97
Net Profit
103’793
64’150
39’643
+62
Basic EPS in CHF
4.66
2.92
1.74
+60
Diluted EPS in CHF
4.49
2.78
1.71
+62
Net cash from operations
92’080
61’922
30’158
+49
*includes non-cash charge for employee stock options of CHF 7.4 million
The full financial statements can be found on http://www.actelion.com.
Outstanding growth of total net revenues
In the first nine months of 2005, Actelion had total net revenues of CHF 477.1 million (9 m 2004: CHF 341.5 m). On a quarter-to-quarter basis, net revenues increased by 21% percent to CHF 180.8 million (Q2 2005: CHF 149.9 m).
Contract revenues for the first nine months of 2005 amounted to CHF 12.1 million (9 m 2004: CHF 12.0 m). On a quarter-to-quarter basis, contract revenues were CHF 3.9 million (Q2 2005: CHF 4.0 m).
For the Full Year 2005, Actelion now expects total net revenue to reach between CHF 640 and CHF 655 million, compared to between CHF 600 and CHF 615 million as previously guided with the H1 2005 results.
Stronger than expected Tracleer® sales
In the first nine months of 2005, Tracleer® sales were CHF 455.1 million (9 months 2004: CHF 325.4 m). On a quarter-to-quarter basis, Tracleer® revenues increased by 21 percent to CHF 172.9 million (Q2 2005: 142.5 m). This increase may partially be attributed to buying pattern variations, similar to those seen in previous quarters.
At the end of September 2005, Tracleer® was approved in 34 countries worldwide, including all major pharmaceutical markets. Since mid-July 2005, Tracleer® has also been commercially available in the Czech Republic. In July 2005, Actelion Pharmaceuticals Korea signed a distribution agreement for Tracleer® in Korea with Handok Pharmaceuticals, a Korean public company.
Regulatory and/or reimbursement reviews are ongoing in many other countries, such as the remaining nine new EU member states as well as in some South East Asian countries.
Further data demonstrates unique clinical features of Tracleer® (bosentan)
In mid-July 2005, Actelion reported top-line results of BREATHE-5, the first ever placebo-controlled study conducted in patients with Eisenmenger’s syndrome, a severe form of Congenital Heart Disease (CHD). The results showed that bosentan treatment decreased pulmonary vascular resistance and improved exercise capacity without a worsening in oxygen saturation. Discussions with regulatory authorities on appropriately labeling these findings are forthcoming. A first scientific presentation will be at CHEST in Montreal at the beginning of November 2005.
In mid-August 2005, the Journal of the American College of Cardiology (JACC) published a new study that investigated the long-term outcome of children with pulmonary arterial hypertension (PAH) treated wi th the bosentan with or without concomitant prostanoid therapy. The authors concluded that bosentan, with or without concomitant prostanoid therapy, in this study was shown to be efficacious for the treatment of PAH in children. In addition, this study also indicated that the safety profile appears similar to that in adult PAH patients.
In early September 2005, Actelion presented two abstracts at the European Society of Cardiology (ESC) conference, which confirmed the long-term safety profile of bosentan in treating PAH. The abstracts included data focusing on PAH associated with chronic thromboembolic pulmonary hypertension (CTEPH) as well as data outlining the safety profile of bosentan in PAH related to congenital heart disease (CHD).
In early August 2005, Actelion announced the preliminary result of a double-blind, placebo-controlled, randomized, multi-center, 190-patient Phase III study, RAPIDS-2, with bosentan in systemic sclerosis patients suffering from digital ulceration. Preliminary analyses indicated that the co-primary endpoint of reduction in the occurrence of new digital ulcers during the 6-month treatment period was statistically significant. This result confirmed the positive findings from an earlier trial, RAPIDS-1. Actelion is currently analyzing data for presentation to regulatory authorities. A first scientific presentation will be at ACR in San Diego in mid-November 2005.
Zavesca® sales continue momentum
Zavesca® sales in the approved indication type 1 Gaucher disease contributed in the first nine months of 2005 CHF 9.8 million (9 months 2004: CHF 4.1 m). On a quarter-to-quarter basis, Zavesca® revenues increased by 19 percent to CHF 4.1 million (Q2 2005: 3.4 m). Zavesca® is commercially available in the United States and in most European markets.
Operating expenses reflect substantial efforts in both marketing and R&D
In the first nine months of 2005 operating expenses were CHF 351.0 million (9 m 2004: CHF 277.6 m). In Q3 2005, operating expenses were CHF 133.6 million. Compared to the previous quarter, this represents an increase of 17% (Q2 2005: CHF 114.7 m). This increase is partially the result of a non-cash charge of CHF 6.8 million for stock-based compensation in Q3 2005.
For the Full Year 2005, Actelion expects total operating expenses to reach between CHF 485 million and CHF 500 million, including a total non-cash charge of approximately CHF 15 million for stock-based compensation.
In the first nine months of 2005, research and development expenses were CHF 121.2 million (9 m 2004: CHF 98.1 m).
In Q3 2005 research and development expenses were CHF 48.0 million. This represents an increase of 17% (Q2 2005: CHF 41.2 m) and includes a CHF 2.3 million charge for stock-based compensation.
Increased development expenses were mainly driven by faster than expected enrollment of patients into the CONSCIOUS-1 phase IIb/III study, evaluating clazosentan in vasospasm as consequence of subarachnoid hemorrhage. Enrollment is expected to be completed before year-end.
Interest in clazosentan was supported by Phase IIa study publication in the July 2005 edition of the Journal of Neurosurgery suggesting that clazosentan could reduce the number and severity of cases of vasospasm following aneurysmal subarachnoid haemorrhage (SAH).
In the first nine months of 2005, marketing and advertising expenses were CHF 88.6 million (9 m 2004: 69.9 m).
In Q3 2005 marketing and advertising expenses were CHF 31.9 million, an increase of 7% compared to the previous quarter (Q2 2005: CHF 29.8 m), which also includes a CHF 1.8 million charge for stock-based compensation.
In the first nine months of 2005 selling, general and administrative expenses amounted to CHF 92.7 million (9 m 2004: CHF 70.1 m).
In Q3 2005 selling, general and administrati ve expenses were CHF 34.8 million, an increase of 20% compared to the previous quarter (Q2 2005: CHF 29.0 m), including a CHF 2.7 million charge for stock-based compensation. The increase is in line with the increase of sales force headcount and related sales-based remuneration.
Strong operating profit
In the first nine months of 2005, a strong increase in sales revenues resulted in an operating profit of CHF 126.1 million (9 m 2004: CHF 63.9 m). Despite a CHF 6.8 million charge for stock-based compensation, Q3 2005 operating profit of CHF 47.2 million was 34 percent higher than the previous quarter (Q2 2005: CHF 35.2 m).
For the Full Year 2005, Actelion now expects that operating profit will reach between CHF 140 and 155 million, compared to previous guidance of CHF 125 and CHF 135 million.
Non-operating items and cash
In the first nine months of 2005, the net profit of CHF 103.8 million (9 m 2004: CHF 64.2 m) includes interest income of CHF 1.9 million, interest expense of CHF 0.04 million, a non-cash charge on the Convertible Bond of CHF 5.8 million, foreign currency losses of CHF 7.6 million and an income tax expense of CHF 10.7 million.
In Q3 2005, the net profit was CHF 37.9 million compared to CHF 23.8 million in the previous quarter.
In the first nine months of 2005 Actelion generated net cash flow from operations of CHF 92.1 million (9 m 2004: CHF 61.9 m). Cash and cash equivalents and short-term deposits as of 30 September 2005 were CHF 344.0 million (30 June 2005: CHF 302.4 million).
Research and Development programs on track
Actelion provided a full update on its current R&D projects at its recent R&D Day on 8th of September 2005. All research and development programs are on track:
* Before the end of the year 2005, the company expects the results from the BUILD program evaluating the safety and efficacy of bosentan in two forms of Pulmonary Fibrosis, idiopathic pulmonary fibrosis (BUILD-1) and pulmonary fibrosis related to systemic sclerosis (BUILD-2).
* Before the end of the year 2005, the company also expects the results from three clinical studies evaluating the safety and efficacy of miglustat in rare lysosomal storage disorders characterized by neurological deficiencies (type 3 Gaucher disease, Nieman-Pick disease and late-onset Tay Sachs).
* The company announced that it is finalizing preparations to commence the evaluation of safety and efficacy of bosentan in PAH patients in combination with sildenafil. The large-scale COMPASS program will evaluate both hemodynamic benefits as well as effects on mortality/ morbidity of the combination.
* The company provided detailed background on the CONSCIOUS program, evaluating the safety and efficacy of clazosentan, an intravenous endothelin receptor antagonist in development for the prevention of vasospasm following sub-arachnoid hemorrhage (SAH).
* The company described the early clinical development of Actelion`s Orexin Receptor antagonist. Preliminary analysis of the ongoing Phase I program indicated that the compound has the pharmacokinetic profile necessary for a drug to be evaluated as a sleep quality improver.
* Actelion announced that it has commenced full pre-clinical development of a novel, orally available immunomodulator. The Actelion S1P1 agonist was well tolerated and efficacious in pre-clinical models of autoimmune diseases, and demonstrated appropriate modulation of the immune system.
* The company provided background on the progress made in the ongoing Global Actelion Merck Renin Inhibitor Alliance that had selected a first highly bioavailable renin inhibitor for full pre-clinical development in the spring of 2005.
* Actelion disclosed that it has a broad research program in the field of antibacterials focusing on fighting resistant bacterial pathogens through novel mechanisms of action.
For documentation purposes – table Q3 2005 vs. Q2 2005
In CHF thousands
Results Q3 2005
Results Q2 2005
Variance
in %
Net Revenues
180’832
149’871
30’961
+21
Operating Expenses
133’595*
114’700
18’895
+17
Operating Profit
47’237
35’171
12’066
+34
Net Profit
37’868
23’815
14’053
+59
Basic EPS in CHF
1.70
1.07
0.63
+59
Net cash from operations
43’036
21’744
21’292
+98
*Includes stock based compensation as follows:
In CHF thousands
Occurred in Q3 2005
Research and development
2’261
Marketing and advertising
1’831
Selling, general and administrative
2’723
Total
6’815
###
Actelion Ltd
Actelion Ltd is a biopharmaceutical company with its corporate headquarter in Allschwil/Basel, Switzerland. Actelion`s first drug Tracleer®, an orally available dual endothelin receptor antagonist, has been approved as a therapy for pulmonary arterial hypertension. Actelion markets Tracleer® through its own subsidiaries in key markets worldwide, including the United States (based in South San Francisco), the European Union, Japan as well as Canada, Australia and Switzerland. Actelion, founded in late 1997, is a leading player in innovative science related to the endothelium – the single layer of cells separating every blood vessel from the blood stream. Actelion focuses on the discovery, development and marketing of innovative drugs for significant unmet medical needs. Actelion shares are traded on the SWX Swiss Exchange (ticker symbol: ATLN).
For further information please contact:
Actelion Ltd, Gewerbestrasse 16, CH-4123 Allschwil
< /p>
Investor Contact
Roland Haefeli
+41 61 565 64 58
+1 650 624 6936
Media Contact
Peter Engel
+41 61 565 66 28
+1 650 624 6996
http://www.actelion.com
Conference Call
Actelion will host an Investor Conference Call and discussion/Q&A on Thursday, 20 October 2005,
16.30 CET / 15.30 BST / 10.30 a.m. EST
Dial:
+41 (0) 91 610 56 00
(Europe)
+1 (1) 866 291 41 66
(U.S.)
+44 207 107 06 11
(U.K.)
Webcast – Live and replay on demand
Actelion webcasts its Investor Conference Call. On the Web, you may either follow the call live or have the call replayed later on demand.
To access the webcast live, simply visit the link on our homepage http://www.actelion.com 5-10 minutes before the conference is due to start. Approximately 60 minutes after the call has ended, the archived investor webcast will be available for replay through our homepage. After 20 November 2005 it will be stored under Investors/Past Events.
Actelion’s financial calendar 2006
Date:
Event:
23 February 2006
Q4 and FY 2005 financial results
10 April 2006
Annual General Meeting
20 April 2006
Q1 2006 financial results
20 July 2006
H1 2006 financial results
19 October 2006
9-month 2006 financial results
Media Release
19 Oktober 2005
Actelion announces 9-month results for 2005
Total net revenue of CHF 477.1 million, up 40 percent – Stronger than expected Tracleer® sales of CHF 455.1 m – Operating profit of CHF 126.1 m, up 97 percent – Upgraded revenue and profit guidance for 2005
ALLSCHWIL, SWITZERLAND – 19 October 2005 – Actelion Ltd (SWX: ATLN) today announced its financial results for the first nine months of 2005. With total net revenues for the first nine months of 2005 of CHF 477.1 million (9 m 2004: CHF 341.5 m) and operating expenses of CHF 351.0 million (9 m 2004: 277.6 m), the company reported an operating profit of CHF 126.1 million (9 m 2004: CHF 63.9 m). The net profit for the first nine months of 2005 was CHF 103.8 million (9 m 2004: CHF 64.2 m).
Basic earnings per share (EPS) for the first nine months of 2005 improved to CHF 4.66, compared to CHF 2.92 in the first nine months of 2004. In the first nine months of 2005 Actelion generated net cash flow from operating activities of CHF 92.1 million (9 m 2004: CHF 61.9 m). Cash, cash equivalents and short-term deposits as of 30 September 2005 were CHF 344.0 million (30 June 2005: CHF 302.4 million).
Jean-Paul Clozel, MD and Chief Executive Officer, commented: “I am delighted with our overall performance for the first nine months of 2005. Actelion has been successful in growing the pulmonary arterial hypertension (PAH) market more rapidly than we expected, with physicians becoming even more aware of the benefits of diagnosis and treatment with our dual endothelin receptor antagonist Tracleer®. Actelion has committed additional resources to further increase its educational and clinical efforts in the PAH community.”
Jean-Paul Clozel added: “Actelion has also made substantial advances in implementing its long-term strategy of growing above and beyond Tracleer® in PAH. Our pre-clinical and clinical programs are making rapid progress. Line-extension studies for our two marketed products Tracleer® (bosentan) and Zavesca® (miglustat) will report data before year-end. Over the coming 18 months, Actelion also expects important clinical results from several pipeline projects with the potential to radically improve treatment of various diseases.”
Andrew J. Oakley, Chief Financial Officer commented: "Financial results for the first nine months of 2005 were outstanding as Tracleer® sales continued to grow across all markets. In mid-June 2005, commercial sales of Tracleer® also started in Japan. We expect this market to provide significant growth in 2006. Our cost base continued to increase in-line with both our expectations and the expansion of our business activities.”
Andrew J. Oakley continued: “Considering our continuing success with Tracleer® in PAH, we have revised our full year net revenue guidance upwards, from between 600 to 615 to between 640 and 655 million Swiss Francs – unforeseen events excluded. With no changes to previously forecasted expenditures, Actelion could report an operating profit of between 140 and 155 million Swiss Francs for the full year 2005.”
Financial result overview – Table 9 months 2005 vs. 9 months 2004
In CHF thousands
Result 9 months 2005
Result 9 months 2004
Variance
in %
Net Revenues
477’056
341’517
135’539
+40
Operating Expenses*
350’982*
277’628
73’354
+26
Operating Profit
126’074
63’889
62’185
+97
Net Profit
103’793
64’150
39’643
+62
Basic EPS in CHF
4.66
2.92
1.74
+60
Diluted EPS in CHF
4.49
2.78
1.71
+62
Net cash from operations
92’080
61’922
30’158
+49
*includes non-cash charge for employee stock options of CHF 7.4 million
The full financial statements can be found on http://www.actelion.com.
Outstanding growth of total net revenues
In the first nine months of 2005, Actelion had total net revenues of CHF 477.1 million (9 m 2004: CHF 341.5 m). On a quarter-to-quarter basis, net revenues increased by 21% percent to CHF 180.8 million (Q2 2005: CHF 149.9 m).
Contract revenues for the first nine months of 2005 amounted to CHF 12.1 million (9 m 2004: CHF 12.0 m). On a quarter-to-quarter basis, contract revenues were CHF 3.9 million (Q2 2005: CHF 4.0 m).
For the Full Year 2005, Actelion now expects total net revenue to reach between CHF 640 and CHF 655 million, compared to between CHF 600 and CHF 615 million as previously guided with the H1 2005 results.
Stronger than expected Tracleer® sales
In the first nine months of 2005, Tracleer® sales were CHF 455.1 million (9 months 2004: CHF 325.4 m). On a quarter-to-quarter basis, Tracleer® revenues increased by 21 percent to CHF 172.9 million (Q2 2005: 142.5 m). This increase may partially be attributed to buying pattern variations, similar to those seen in previous quarters.
At the end of September 2005, Tracleer® was approved in 34 countries worldwide, including all major pharmaceutical markets. Since mid-July 2005, Tracleer® has also been commercially available in the Czech Republic. In July 2005, Actelion Pharmaceuticals Korea signed a distribution agreement for Tracleer® in Korea with Handok Pharmaceuticals, a Korean public company.
Regulatory and/or reimbursement reviews are ongoing in many other countries, such as the remaining nine new EU member states as well as in some South East Asian countries.
Further data demonstrates unique clinical features of Tracleer® (bosentan)
In mid-July 2005, Actelion reported top-line results of BREATHE-5, the first ever placebo-controlled study conducted in patients with Eisenmenger’s syndrome, a severe form of Congenital Heart Disease (CHD). The results showed that bosentan treatment decreased pulmonary vascular resistance and improved exercise capacity without a worsening in oxygen saturation. Discussions with regulatory authorities on appropriately labeling these findings are forthcoming. A first scientific presentation will be at CHEST in Montreal at the beginning of November 2005.
In mid-August 2005, the Journal of the American College of Cardiology (JACC) published a new study that investigated the long-term outcome of children with pulmonary arterial hypertension (PAH) treated wi th the bosentan with or without concomitant prostanoid therapy. The authors concluded that bosentan, with or without concomitant prostanoid therapy, in this study was shown to be efficacious for the treatment of PAH in children. In addition, this study also indicated that the safety profile appears similar to that in adult PAH patients.
In early September 2005, Actelion presented two abstracts at the European Society of Cardiology (ESC) conference, which confirmed the long-term safety profile of bosentan in treating PAH. The abstracts included data focusing on PAH associated with chronic thromboembolic pulmonary hypertension (CTEPH) as well as data outlining the safety profile of bosentan in PAH related to congenital heart disease (CHD).
In early August 2005, Actelion announced the preliminary result of a double-blind, placebo-controlled, randomized, multi-center, 190-patient Phase III study, RAPIDS-2, with bosentan in systemic sclerosis patients suffering from digital ulceration. Preliminary analyses indicated that the co-primary endpoint of reduction in the occurrence of new digital ulcers during the 6-month treatment period was statistically significant. This result confirmed the positive findings from an earlier trial, RAPIDS-1. Actelion is currently analyzing data for presentation to regulatory authorities. A first scientific presentation will be at ACR in San Diego in mid-November 2005.
Zavesca® sales continue momentum
Zavesca® sales in the approved indication type 1 Gaucher disease contributed in the first nine months of 2005 CHF 9.8 million (9 months 2004: CHF 4.1 m). On a quarter-to-quarter basis, Zavesca® revenues increased by 19 percent to CHF 4.1 million (Q2 2005: 3.4 m). Zavesca® is commercially available in the United States and in most European markets.
Operating expenses reflect substantial efforts in both marketing and R&D
In the first nine months of 2005 operating expenses were CHF 351.0 million (9 m 2004: CHF 277.6 m). In Q3 2005, operating expenses were CHF 133.6 million. Compared to the previous quarter, this represents an increase of 17% (Q2 2005: CHF 114.7 m). This increase is partially the result of a non-cash charge of CHF 6.8 million for stock-based compensation in Q3 2005.
For the Full Year 2005, Actelion expects total operating expenses to reach between CHF 485 million and CHF 500 million, including a total non-cash charge of approximately CHF 15 million for stock-based compensation.
In the first nine months of 2005, research and development expenses were CHF 121.2 million (9 m 2004: CHF 98.1 m).
In Q3 2005 research and development expenses were CHF 48.0 million. This represents an increase of 17% (Q2 2005: CHF 41.2 m) and includes a CHF 2.3 million charge for stock-based compensation.
Increased development expenses were mainly driven by faster than expected enrollment of patients into the CONSCIOUS-1 phase IIb/III study, evaluating clazosentan in vasospasm as consequence of subarachnoid hemorrhage. Enrollment is expected to be completed before year-end.
Interest in clazosentan was supported by Phase IIa study publication in the July 2005 edition of the Journal of Neurosurgery suggesting that clazosentan could reduce the number and severity of cases of vasospasm following aneurysmal subarachnoid haemorrhage (SAH).
In the first nine months of 2005, marketing and advertising expenses were CHF 88.6 million (9 m 2004: 69.9 m).
In Q3 2005 marketing and advertising expenses were CHF 31.9 million, an increase of 7% compared to the previous quarter (Q2 2005: CHF 29.8 m), which also includes a CHF 1.8 million charge for stock-based compensation.
In the first nine months of 2005 selling, general and administrative expenses amounted to CHF 92.7 million (9 m 2004: CHF 70.1 m).
In Q3 2005 selling, general and administrati ve expenses were CHF 34.8 million, an increase of 20% compared to the previous quarter (Q2 2005: CHF 29.0 m), including a CHF 2.7 million charge for stock-based compensation. The increase is in line with the increase of sales force headcount and related sales-based remuneration.
Strong operating profit
In the first nine months of 2005, a strong increase in sales revenues resulted in an operating profit of CHF 126.1 million (9 m 2004: CHF 63.9 m). Despite a CHF 6.8 million charge for stock-based compensation, Q3 2005 operating profit of CHF 47.2 million was 34 percent higher than the previous quarter (Q2 2005: CHF 35.2 m).
For the Full Year 2005, Actelion now expects that operating profit will reach between CHF 140 and 155 million, compared to previous guidance of CHF 125 and CHF 135 million.
Non-operating items and cash
In the first nine months of 2005, the net profit of CHF 103.8 million (9 m 2004: CHF 64.2 m) includes interest income of CHF 1.9 million, interest expense of CHF 0.04 million, a non-cash charge on the Convertible Bond of CHF 5.8 million, foreign currency losses of CHF 7.6 million and an income tax expense of CHF 10.7 million.
In Q3 2005, the net profit was CHF 37.9 million compared to CHF 23.8 million in the previous quarter.
In the first nine months of 2005 Actelion generated net cash flow from operations of CHF 92.1 million (9 m 2004: CHF 61.9 m). Cash and cash equivalents and short-term deposits as of 30 September 2005 were CHF 344.0 million (30 June 2005: CHF 302.4 million).
Research and Development programs on track
Actelion provided a full update on its current R&D projects at its recent R&D Day on 8th of September 2005. All research and development programs are on track:
* Before the end of the year 2005, the company expects the results from the BUILD program evaluating the safety and efficacy of bosentan in two forms of Pulmonary Fibrosis, idiopathic pulmonary fibrosis (BUILD-1) and pulmonary fibrosis related to systemic sclerosis (BUILD-2).
* Before the end of the year 2005, the company also expects the results from three clinical studies evaluating the safety and efficacy of miglustat in rare lysosomal storage disorders characterized by neurological deficiencies (type 3 Gaucher disease, Nieman-Pick disease and late-onset Tay Sachs).
* The company announced that it is finalizing preparations to commence the evaluation of safety and efficacy of bosentan in PAH patients in combination with sildenafil. The large-scale COMPASS program will evaluate both hemodynamic benefits as well as effects on mortality/ morbidity of the combination.
* The company provided detailed background on the CONSCIOUS program, evaluating the safety and efficacy of clazosentan, an intravenous endothelin receptor antagonist in development for the prevention of vasospasm following sub-arachnoid hemorrhage (SAH).
* The company described the early clinical development of Actelion`s Orexin Receptor antagonist. Preliminary analysis of the ongoing Phase I program indicated that the compound has the pharmacokinetic profile necessary for a drug to be evaluated as a sleep quality improver.
* Actelion announced that it has commenced full pre-clinical development of a novel, orally available immunomodulator. The Actelion S1P1 agonist was well tolerated and efficacious in pre-clinical models of autoimmune diseases, and demonstrated appropriate modulation of the immune system.
* The company provided background on the progress made in the ongoing Global Actelion Merck Renin Inhibitor Alliance that had selected a first highly bioavailable renin inhibitor for full pre-clinical development in the spring of 2005.
* Actelion disclosed that it has a broad research program in the field of antibacterials focusing on fighting resistant bacterial pathogens through novel mechanisms of action.
For documentation purposes – table Q3 2005 vs. Q2 2005
In CHF thousands
Results Q3 2005
Results Q2 2005
Variance
in %
Net Revenues
180’832
149’871
30’961
+21
Operating Expenses
133’595*
114’700
18’895
+17
Operating Profit
47’237
35’171
12’066
+34
Net Profit
37’868
23’815
14’053
+59
Basic EPS in CHF
1.70
1.07
0.63
+59
Net cash from operations
43’036
21’744
21’292
+98
*Includes stock based compensation as follows:
In CHF thousands
Occurred in Q3 2005
Research and development
2’261
Marketing and advertising
1’831
Selling, general and administrative
2’723
Total
6’815
###
Actelion Ltd
Actelion Ltd is a biopharmaceutical company with its corporate headquarter in Allschwil/Basel, Switzerland. Actelion`s first drug Tracleer®, an orally available dual endothelin receptor antagonist, has been approved as a therapy for pulmonary arterial hypertension. Actelion markets Tracleer® through its own subsidiaries in key markets worldwide, including the United States (based in South San Francisco), the European Union, Japan as well as Canada, Australia and Switzerland. Actelion, founded in late 1997, is a leading player in innovative science related to the endothelium – the single layer of cells separating every blood vessel from the blood stream. Actelion focuses on the discovery, development and marketing of innovative drugs for significant unmet medical needs. Actelion shares are traded on the SWX Swiss Exchange (ticker symbol: ATLN).
For further information please contact:
Actelion Ltd, Gewerbestrasse 16, CH-4123 Allschwil
< /p>
Investor Contact
Roland Haefeli
+41 61 565 64 58
+1 650 624 6936
Media Contact
Peter Engel
+41 61 565 66 28
+1 650 624 6996
http://www.actelion.com
Conference Call
Actelion will host an Investor Conference Call and discussion/Q&A on Thursday, 20 October 2005,
16.30 CET / 15.30 BST / 10.30 a.m. EST
Dial:
+41 (0) 91 610 56 00
(Europe)
+1 (1) 866 291 41 66
(U.S.)
+44 207 107 06 11
(U.K.)
Webcast – Live and replay on demand
Actelion webcasts its Investor Conference Call. On the Web, you may either follow the call live or have the call replayed later on demand.
To access the webcast live, simply visit the link on our homepage http://www.actelion.com 5-10 minutes before the conference is due to start. Approximately 60 minutes after the call has ended, the archived investor webcast will be available for replay through our homepage. After 20 November 2005 it will be stored under Investors/Past Events.
Actelion’s financial calendar 2006
Date:
Event:
23 February 2006
Q4 and FY 2005 financial results
10 April 2006
Annual General Meeting
20 April 2006
Q1 2006 financial results
20 July 2006
H1 2006 financial results
19 October 2006
9-month 2006 financial results
20. Oktober 2005, 11:47, NZZ Online
AKTIENFOKUS
Actelion steigen und steigen und steigen
Zürich (AWP) - Die Aktien der Actelion Ltd sindseit Handelsbeginn in schwindlige Höhen vorgestossen. Die Ursache für den Kurssprung ist im gestern Abend überraschend vorgelegten Quartalsabschluss zu suchen.
Um 10.40 Uhr notieren Actelion Namen noch 8,0% höher auf 141 CHF, wobei der Titel heute schon für bis zu 145,90 CHF die Hand gewechselt hat, was einem Plus von über 11% entspricht. Der Gesamtmarkt gemessen am SPI liegt 0,81% vorn auf 5`229,53 Punkten.
Die publizierten Daten liegen weit über den Markterwartungen. Julius Bär spricht gar von«outstanding results». Sowohl Actelion als auch Analysten führen den jüngsten Erfolg der Gruppe auf die Entwicklung des Hauptumsatzträgers Tracleer (pulmonale arterielle Hypertonie, PAH) zurück.
Besonders positiv aufgenommen wurde, dass das Management von Actelion bereits zum dritten Mal den Ausblick auf das laufende Geschäftsjahr nach oben revidiert hat. Die dritte Erhöhung der Prognose in diesem Jahr spiegle den auch für die Firmenführung überraschenden Erfolg von Tracleer, führt beispielsweise die ZKB hierzu aus.
Sowohl Vontobel als auch ZKB erwarten einen erhöhten Wettbewerbsdruck in der PAH-Behandlung. Allerdings geht die ZKB auch davon aus, dass Actelion in dieser Marktnische ihre weltweit führenden Stellung ausbauen und festigen wird, so die«Daily Market Opinion».
Bezüglich Pipeline von Actelion scheiden sich die Geister. Vontobel nimmt eine vorsichtige Haltung ein was den Newsflow im vierten Quartal 2005 zu den Phase-III-Studien namens BUILD betrifft. Vor diesem Hintergrund hält Vontobel an ihrer«Sector Perform»-Einstufung fest.
Die ZKB weist ihrerseits auf das Risiko hin, dass Actelion derzeit 95% ihres Umsatzes mit Tracleer generiert. Die Zürcher Bank spricht aber auch vom«interessanten Potenzial in den Actelion-Entwicklungsprojekten»und erwartet einen positiven Nachrichtenfluss von der Allschwiler Gruppe. Die ZKB erhöht ihre Einstufung für die Actelion-Namenaktie auf«Übergewichten».
Eine Grossbank weist darauf hin, dass sich das EPS von Actelion in den ersten neun Monaten im Vorjahresvergleich auf 4,66 (2,92) CHF verbessert hat. Dies zeige deutlich den robusten operativen Leverage von Actelions Geschäftsmodel, so der Kommentar.
ek/cf
AKTIENFOKUS
Actelion steigen und steigen und steigen
Zürich (AWP) - Die Aktien der Actelion Ltd sindseit Handelsbeginn in schwindlige Höhen vorgestossen. Die Ursache für den Kurssprung ist im gestern Abend überraschend vorgelegten Quartalsabschluss zu suchen.
Um 10.40 Uhr notieren Actelion Namen noch 8,0% höher auf 141 CHF, wobei der Titel heute schon für bis zu 145,90 CHF die Hand gewechselt hat, was einem Plus von über 11% entspricht. Der Gesamtmarkt gemessen am SPI liegt 0,81% vorn auf 5`229,53 Punkten.
Die publizierten Daten liegen weit über den Markterwartungen. Julius Bär spricht gar von«outstanding results». Sowohl Actelion als auch Analysten führen den jüngsten Erfolg der Gruppe auf die Entwicklung des Hauptumsatzträgers Tracleer (pulmonale arterielle Hypertonie, PAH) zurück.
Besonders positiv aufgenommen wurde, dass das Management von Actelion bereits zum dritten Mal den Ausblick auf das laufende Geschäftsjahr nach oben revidiert hat. Die dritte Erhöhung der Prognose in diesem Jahr spiegle den auch für die Firmenführung überraschenden Erfolg von Tracleer, führt beispielsweise die ZKB hierzu aus.
Sowohl Vontobel als auch ZKB erwarten einen erhöhten Wettbewerbsdruck in der PAH-Behandlung. Allerdings geht die ZKB auch davon aus, dass Actelion in dieser Marktnische ihre weltweit führenden Stellung ausbauen und festigen wird, so die«Daily Market Opinion».
Bezüglich Pipeline von Actelion scheiden sich die Geister. Vontobel nimmt eine vorsichtige Haltung ein was den Newsflow im vierten Quartal 2005 zu den Phase-III-Studien namens BUILD betrifft. Vor diesem Hintergrund hält Vontobel an ihrer«Sector Perform»-Einstufung fest.
Die ZKB weist ihrerseits auf das Risiko hin, dass Actelion derzeit 95% ihres Umsatzes mit Tracleer generiert. Die Zürcher Bank spricht aber auch vom«interessanten Potenzial in den Actelion-Entwicklungsprojekten»und erwartet einen positiven Nachrichtenfluss von der Allschwiler Gruppe. Die ZKB erhöht ihre Einstufung für die Actelion-Namenaktie auf«Übergewichten».
Eine Grossbank weist darauf hin, dass sich das EPS von Actelion in den ersten neun Monaten im Vorjahresvergleich auf 4,66 (2,92) CHF verbessert hat. Dies zeige deutlich den robusten operativen Leverage von Actelions Geschäftsmodel, so der Kommentar.
ek/cf
Actelion outperform
03.11.2005 15:11:10
Die Aktienexperten von Goldman Sachs stufen das Wertpapier des Schweizer Biotechnologieunternehmens Actelion (ISIN CH0010532478/ WKN 936767) weiterhin mit "outperform" ein.
Das Unternehmen habe für seine BREATHE-5-Studie positive Daten vorgelegt. Im Rahmen der Studie werde die Wirkung von Tracleer bei Patienten mit Eisenmenger-Syndrom getestet. Hierbei habe das Präparat Tracleer bei zwei vorläufigen Endpunkten statistisch relevante Ergebnisse geliefert. Die Analysten würden derzeit davon ausgehen, dass Actelion mit Tracleer im kommenden Jahr einen Umsatz von 836 Mio. Schweizer Franken erzielen werde. Kurzfristig dürfte sich das Interesse der Investoren auf die Ergebnisse der BUILD-Studien richten.
Für das laufende Finanzjahr 2005 würden die Aktienexperten von Goldman Sachs mit einem Gewinn von 5,97 Schweizer Franken je Aktie rechnen, die Gewinnschätzung für das Finanzjahr 2006 laute unterdessen auf 8,04 Schweizer Franken je Aktie. Auf Grundlage dieser Prognosen errechne sich ein 2005-KGV von 24,3 sowie ein 2006-KGV von 18,0. Der Ausblick für die Branche sei nach Einschätzung der Analysten durchschnittlich.
Vor diesem Hintergrund bewerten die Analysten von Goldman Sachs die Actelion-Aktie unverändert mit "outperform".
Analyse-Datum: 03.11.2005
03.11.2005 15:11:10
Die Aktienexperten von Goldman Sachs stufen das Wertpapier des Schweizer Biotechnologieunternehmens Actelion (ISIN CH0010532478/ WKN 936767) weiterhin mit "outperform" ein.
Das Unternehmen habe für seine BREATHE-5-Studie positive Daten vorgelegt. Im Rahmen der Studie werde die Wirkung von Tracleer bei Patienten mit Eisenmenger-Syndrom getestet. Hierbei habe das Präparat Tracleer bei zwei vorläufigen Endpunkten statistisch relevante Ergebnisse geliefert. Die Analysten würden derzeit davon ausgehen, dass Actelion mit Tracleer im kommenden Jahr einen Umsatz von 836 Mio. Schweizer Franken erzielen werde. Kurzfristig dürfte sich das Interesse der Investoren auf die Ergebnisse der BUILD-Studien richten.
Für das laufende Finanzjahr 2005 würden die Aktienexperten von Goldman Sachs mit einem Gewinn von 5,97 Schweizer Franken je Aktie rechnen, die Gewinnschätzung für das Finanzjahr 2006 laute unterdessen auf 8,04 Schweizer Franken je Aktie. Auf Grundlage dieser Prognosen errechne sich ein 2005-KGV von 24,3 sowie ein 2006-KGV von 18,0. Der Ausblick für die Branche sei nach Einschätzung der Analysten durchschnittlich.
Vor diesem Hintergrund bewerten die Analysten von Goldman Sachs die Actelion-Aktie unverändert mit "outperform".
Analyse-Datum: 03.11.2005
Kepler Eyes Actelion`s Strong Pipeline
Friday, November 04, 2005 5:22:47 AM ET
Dow Jones Newswires
1001 GMT [Dow Jones] Actelion`s (ATLN.EB) pipeline is stronger than many larger biotech companies, says Kepler Equities, noting that seven sets of Phase II or Phase III clinical data are expected over the next 8 months. Kepler highlights study on Tracleer in two pulomonary fibrosis indications and clazosentan in vasospasm. Best of all is that investors won`t have to wait long, because the outcome of two major trials is slated for December, another for 1H `06, says Kepler. Rates at buy, CHF180 target. Shares trade +0.9% at CHF145.30. (KAB)
Friday, November 04, 2005 5:22:47 AM ET
Dow Jones Newswires
1001 GMT [Dow Jones] Actelion`s (ATLN.EB) pipeline is stronger than many larger biotech companies, says Kepler Equities, noting that seven sets of Phase II or Phase III clinical data are expected over the next 8 months. Kepler highlights study on Tracleer in two pulomonary fibrosis indications and clazosentan in vasospasm. Best of all is that investors won`t have to wait long, because the outcome of two major trials is slated for December, another for 1H `06, says Kepler. Rates at buy, CHF180 target. Shares trade +0.9% at CHF145.30. (KAB)
Hi 11up,
gibt es eine Erklärung für den doch ziemlich heftigen Kursrückgang vor einigen Tagen?
MfG
bandolin
gibt es eine Erklärung für den doch ziemlich heftigen Kursrückgang vor einigen Tagen?
MfG
bandolin
so, bei ca.127 SFr ist die untere begrenzung des 3jährigen aufwärtstrends. sie sollte halten und wieder sich nach oben orientieren 
die firma ist SEHR gut und solide. Die aktie ist etwas volatil, abstürze gabs auch früher. da muss man eben kaufen
ich habe mir auf jedenfall ein paar ins depot gelegt
gruss
emmi

die firma ist SEHR gut und solide. Die aktie ist etwas volatil, abstürze gabs auch früher. da muss man eben kaufen

ich habe mir auf jedenfall ein paar ins depot gelegt

gruss
emmi
[posting]19.110.182 von bandolin am 30.11.05 18:55:10[/posting]die fundamentaldaten stimmen auf jedenfall...
vielleicht hat ein fonds umgeschichtet... kudelski hats deswegen auch zerfetzt...
vielleicht hat ein fonds umgeschichtet... kudelski hats deswegen auch zerfetzt...
achtung, falls aufwärtstrend nicht hält stoploss setzen...
***AUTSCH*** das tut weh 
ausgestoppt und tschüss...

ausgestoppt und tschüss...
Actelion Down On Positive Myogen Trial Result
Monday, December 12, 2005 9:23:25 AM ET
Dow Jones Newswires
1313 GMT [Dow Jones] Actelion (ATLN.EB) -7% at CHF118, hit by news that Myogen`s (MYOG) pulmonary arterial hypertension treatment ambrisentan meets endpoints in the phase III clinical trials. Ambrisentan could take away some market share from Actelion`s Tracleer once it has hit the market, says Denise Anderson from Kepler Equities. Adds the Myogen drug won`t be available before mid 2007. Despite these positive results from Myogen, doesn`t change Tracleer sales forecasts. Keeps at buy with CHF180 target. (SWZ)
Monday, December 12, 2005 9:23:25 AM ET
Dow Jones Newswires
1313 GMT [Dow Jones] Actelion (ATLN.EB) -7% at CHF118, hit by news that Myogen`s (MYOG) pulmonary arterial hypertension treatment ambrisentan meets endpoints in the phase III clinical trials. Ambrisentan could take away some market share from Actelion`s Tracleer once it has hit the market, says Denise Anderson from Kepler Equities. Adds the Myogen drug won`t be available before mid 2007. Despite these positive results from Myogen, doesn`t change Tracleer sales forecasts. Keeps at buy with CHF180 target. (SWZ)
Die Aktie ist meiner Meinung nach ein Investment wert, da sie jetzt Kurspotenzial hat. Die Unternehmensdaten sprechen auch dafür. Schaut euch nur die Empfehlungen an.
Viele Grüße
Viele Grüße
hast mich ueberzeugt
bin schon seit ein paar tagen drin. alles schlecht im kurs eingepreist. jetzt kommt erst mal ein rebound.
so long, Hopi1

bin schon seit ein paar tagen drin. alles schlecht im kurs eingepreist. jetzt kommt erst mal ein rebound.
so long, Hopi1
nur noch mal ein hinweis an evtl interessierte:
der rebound hat gerade begonnen. aus meiner sicht kann man jetzt noch einsteigen. soll kein gepushe sein. dafuer ist der wert zu gross und hat zu wenig interessenten. soll einfach nur mal ein tipp sein.
so long,hopi1
der rebound hat gerade begonnen. aus meiner sicht kann man jetzt noch einsteigen. soll kein gepushe sein. dafuer ist der wert zu gross und hat zu wenig interessenten. soll einfach nur mal ein tipp sein.
so long,hopi1
ok, ein letztes mal noch. ich habe mir mal unten die gewinnschaetzung fuer das volle jahr durchgelesen. die stapeln aber mal wieder sehr tief und nehmen an, dass sie kein wachstum in q4 haben...
meine persoenliche schaetzung:
gesamtumasatz:680 mio sfr
gewinn: 165 mio sfr (ein kgv von 15 hoert sich doch nicht schlecht an - hat noch jemand eine schaetzung?)
weiss einer, wann die zahlen kommen? meine vermutung ist ende dieses monats, solange bleibe ich auf alle faelle erst mal drin.
so long, hopi1
meine persoenliche schaetzung:
gesamtumasatz:680 mio sfr
gewinn: 165 mio sfr (ein kgv von 15 hoert sich doch nicht schlecht an - hat noch jemand eine schaetzung?)
weiss einer, wann die zahlen kommen? meine vermutung ist ende dieses monats, solange bleibe ich auf alle faelle erst mal drin.
so long, hopi1
ich antworte mir lieber selber.
1st Quarter Event Location
9-12 Jan JP Morgan Healthcare Conference San Francisco, US
7-9 Feb Merrill Lynch Conference New York, US
8-10 Mar 9th annual Lehman Brothers Healthcare Conference Miami, Florida, US
11-14 Mar ACC - American College of Cardiology Miami, US
30 Mar-2 Apr SENP -Société Européenne de Neurologie Pédiatrique San Diego, US
die jahreszahlen kommen erst am 23.2.
in der kommenden woche wird es erst mal ein paar impulse von der jp conference geben, ich hoffe positive.
so long, hopi1
1st Quarter Event Location
9-12 Jan JP Morgan Healthcare Conference San Francisco, US
7-9 Feb Merrill Lynch Conference New York, US
8-10 Mar 9th annual Lehman Brothers Healthcare Conference Miami, Florida, US
11-14 Mar ACC - American College of Cardiology Miami, US
30 Mar-2 Apr SENP -Société Européenne de Neurologie Pédiatrique San Diego, US
die jahreszahlen kommen erst am 23.2.
in der kommenden woche wird es erst mal ein paar impulse von der jp conference geben, ich hoffe positive.
so long, hopi1
Moin Hop1,
die Aktie scheint langsam wieder zu sich zu kommen.
Sichere am Besten nach unten hin ab damit keine
bösen Überraschungen passieren. Dürfte im Grunde
nicht sein, da vieles im Kurs bereits enthalten ist.
Ich rechne mit der gleichen Dynamik wie 2005 bzw. 2004.
Auf jedenfall Richtung Norden.

die Aktie scheint langsam wieder zu sich zu kommen.
Sichere am Besten nach unten hin ab damit keine
bösen Überraschungen passieren. Dürfte im Grunde
nicht sein, da vieles im Kurs bereits enthalten ist.
Ich rechne mit der gleichen Dynamik wie 2005 bzw. 2004.
Auf jedenfall Richtung Norden.
moin cashbob,
bin 100% deiner meinung. man muss natuerlich trotzdem immer wachsam sein.
so long, hopi1
bin 100% deiner meinung. man muss natuerlich trotzdem immer wachsam sein.
so long, hopi1
Hat jemand irgendwelche Neuigkeiten über das Unternehmen ?
In München bereits wieder bei 72,95 Euro (20:01:41) 

Actelion gibt Ergebnisse für die ersten neun Monate 2005 bekannt
Gesamtnettoerlös steigt um 40 Prozent auf 477,1 Millionen CHF –Umsatz von Tracleer® mit 455,1 Millionen CHF stärker als erwartet – Betriebsgewinn steigt um 97 Prozent auf 126,1 Millionen CHF – Richtwerte für Ganzjahresumsatz und –gewinn für 2005 erhöht
ALLSCHWIL, SCHWEIZ – 19. Oktober 2005 – Actelion Ltd (SWX: ATLN) gab heute die Finanzergebnisse für die ersten neun Monate des Jahres 2005 bekannt. Mit einem Gesamtnettoerlös in den ersten neun Monaten 2005 von 477,1 Millionen CHF (9 Monate 2004: 341,5 Mio. CHF) und einem Betriebsaufwand von 351,0 Millionen CHF (9 Monate 2004: 277,6 Mio. CHF) weist das Unternehmen einen Betriebsgewinn von 126,1 Millionen CHF (9 Monate 2004: 63,9 Mio. CHF) aus. Der Reingewinn in den ersten neun Monaten 2005 belief sich auf 103,8 Millionen CHF (9 Monate 2004: 64,2 Mio. CHF).
Der Gewinn pro Aktie für die ersten neun Monate 2005 verbesserte sich auf 4,66 CHF verglichen mit 2,92 CHF in der vergleichbaren Vorjahresperiode. In den ersten neun Monaten 2005 erwirtschaftete Actelion einen Nettomittelfluss aus den operativen Aktivitäten von 92,1 Millionen CHF (9 Monate 2004: 61,9 Mio. CHF). Die liquiden Mittel per 30. September 2005 beliefen sich brutto auf 344,0 Millionen CHF (30. Juni 2005: 302,4 Mio. CHF).
Dr. Jean-Paul Clozel, Chief Executive Officer, kommentierte: “Ich bin über unsere Gesamtleistung in den ersten neun Monaten des Jahres 2005 hoch erfreut. Actelion war schneller als erwartet damit erfolgreich, den Markt für pulmonale arterielle Hypertonie (PAH) auszuweiten. Die Ärzte erkennen zunehmend den Nutzen der Diagnose und der Behandlung mit unserem dualen Endothelin-Rezeptor-Hemmer Tracleer®. Actelion hat weitere Mittel für den Ausbau von Fortbildungsprogrammen und klinischen Aktivitäten in PAH-Fachkreisen bereitgestellt.”
Jean-Paul Clozel fügte hinzu: “Actelion hat auch wesentliche Fortschritte bei der Implementierung der langfristigen Strategie gemacht, über Tracleer® bei PAH hinaus zu wachsen. Unsere vorklinischen und klinischen Programme schreiten schnell voran. Ergebnisse von Studien zur Ausweitung der Einsatzmöglichkeiten für unsere bereits im Markt befindlichen Produkte Tracleer® (Bosentan) und Zavesca® (Miglustat) werden vor Jahresende vorliegen. Ausserdem erwartet Actelion während der kommenden 18 Monate wichtige klinische Ergebnisse für verschiedene Pipeline-Projekte, die das Potenzial besitzen, die Behandlung verschiedener Krankheiten grundlegend zu verbessern.“
Andrew J. Oakley, Chief Financial Officer, kommentierte: "Die finanziellen Ergebnisse der ersten neun Monate dieses Jahres waren hervorragend, da die Umsätze von Tracleer® in allen Märkten weiter wuchsen. Mitte Juni lief zudem der kommerzielle Verkauf von Tracleer® in Japan an. Wir erwarten, in diesem Markt in 2006 signifikantes Wachstum zu erreichen. Unsere Kostenbasis erhöhte sich weiter im Einklang mit unseren Erwartungen und mit der Ausweitung unserer Geschäftsaktivitäten.”
Andrew J. Oakley ergänzte: “Angesichts des anhaltenden Erfolgs von Tracleer® bei PAH haben wir unseren Richtwert für den Nettoerlös – vorbehaltlich unvorhergesehener Ereignisse – für das gesamte Jahr nach oben korrigiert und zwar von zwischen 600 und 615 auf 640 bis 655 Millionen Schweizer Franken. Bei gegenüber der bisherigen Schätzung unveränderten Kosten, könnte Actelion für das Gesamtjahr 2005 einen Betriebsgewinn von zwischen 140 und 155 Millionen Schweizer Franken berichten.”
Finanzergebnis im Überblick – Vergleichstabelle 9 Monate 2005 / 9 Monate 2004
Finanzergebnis im Überblick – Vergleichstabelle 9 Monate 2005 / 9 Monate 2004
In 1’000 CHF Ergebnis 9 Ergebnis 9 Veränderung in %
Monate 2005 Monate 2004
Nettoerlös 477’056 341’517 135’539 +40
Betriebsaufwand* 350’982* 277’628 73’354 +26
Betriebsergebnis 126’074 63’889 62’185 +97
Reingewinn 103’793 64’150 39’643 +62
Gewinn pro Aktie 4,66 2,92 1,74 +60
(unverwässert in CHF)
Gewinn pro Aktie 4,49 2,78 1,71 +62
(verwässert in CHF)
Nettoliquidität aus 92’080 61’922 30’158 +49
dem operativen
Geschäft
*inklusive einer nicht cash-wirksamen Belastung für Mitarbeiteraktienoptionen in Höhe von 7,4 Millionen CHF
Die vollständige Konzernrechnung findet sich unter http://www.actelion.com.
Starkes Umsatzwachstum
In den ersten neun Monaten des laufenden Jahres erzielte Actelion einen Gesamtnettoerlös von CHF 477,1 Millionen CHF (9 Monate 2004: 341,5 Mio. CHF). Im Vergleich zum Vorquartal stieg der Gesamtnettoerlös im dritten Quartal 2005 um
21 Prozent auf 180,8 Millionen CHF (2. Quartal 2005: 149,9 Millionen CHF).
Die Erlöse aus vertraglichen Vereinbarungen beliefen sich in den ersten neun Monaten 2005 auf 12,1 Millionen CHF (9 Monate 2004: 12,0 Mio. CHF). Im Vergleich zum Vorquartal blieben die Erlöse aus vertraglichen Vereinbarungen mit 3,9 Millionen CHF nahezu unverändert (2. Quartal 2005: 4,0 Mio. CHF).
Für das gesamte Jahr 2005 erwartet Actelion jetzt einen Gesamtnettoerlös zwischen 640 und 655 Millionen CHF, nachdem die bisherige Schätzung per Ende des ersten Halbjahrs 2005 in einem Bereich von 600 bis 615 Millionen CHF gelegen hatte.
Verkäufe von Tracleer® stärker als erwartet
In den ersten 9 Monaten 2005 betrug der Umsatz von Tracleer® 455,1 Millionen CHF (9 Monate 2004: 325,4 Mio. CHF). Im Vergleich zum vorherigen Quartal stieg der Umsatz von Tracleer® um 21 Prozent auf 172,9 Millionen CHF (2. Quartal 2005: 142,5 Mio. CHF). Diese Steigerung kann zum Teil Schwankungen im Kaufverhalten zugeschrieben werden, ähnlich wie sie in früheren Quartalen beobachtet werden konnten.
Ende September 2005 war Tracleer® in 34 Ländern rund um die Welt zugelassen, darunter in allen bedeutenden Pharmamärkten. Seit Mitte Juli ist Tracleer® kommerziell auch in der Tschechischen Republik verfügbar. Im Juli 2005 unterzeichnete Actelion eine Vertriebsvereinbarung für Tracleer® in Korea mit Handok Pharmaceuticals, einer koreanischen Aktiengesellschaft.
Prüfungen auf Zulassung und/oder Kostenerstattung laufen derzeit in vielen anderen Ländern wie den verbleibenden neun neuen EU-Mitgliedsstaaten sowie in einigen südostasiatischen Ländern.
Weitere Daten belegen die einzigartigen klinischen Eigenschaften von Tracleer®
Mite Juli 2005 berichtete Actelion über wesentliche Ergebnisse von BREATHE-5, der ersten jemals durchgeführten plazebokontrollierten Studie bei Patienten mit Eisenmenger-Syndrom, einer schweren Form von angeborener Herzerkrankung. Die Ergebnisse zeigten, dass ein Behandlung mit Bosentan eine Abnahme des pulmonalen Gefässwiderstands und eine Verbesserung der körperlichen Leistungsfähigkeit bewirkte, ohne dass sich dabei die Sauerstoffsättigung verschlechterte. Derzeit werden Verhandlungen mit Registrierungsbehörden über eine geeignete Dokumentation dieser Ergebnisse geführt. Eine erste Offenlegung der Studienresultate wird anlässlich des CHEST-Kongresses in Montreal Anfang November 2005 erfolgen.
Mitte August veröffentlichte das American College of Cardiology (JACC) eine neue Studie über Langzeitergebnisse bei der Behandlung von Kindern mit pulmonaler arterieller Hypertonie (PAH), die Bosentan mit oder ohne gleichzeitige Verabreichung von Prostanoiden erhielten. Die Autoren folgerten aus den Studienergebnissen, dass Bosentan mit oder ohne gleichzeitige Gabe von Prostanoiden bei der Behandlung von Kindern wirksam ist. Die Studie liefert ausserdem Anhaltspunkte dafür, dass das Sicherheitsprofil dem bei erwachsenen PAH-Patienten beobachteten Profil vergleichbar ist.
Anfang Sept ember stellte Actelion anlässlich der Jahresversammlung der Europäischen Gesellschaft für Kardiologie (European Society of Cardiology – ESC) zwei Abstracts vor, die das langfristige Sicherheitsprofil von Bosentan bei der Behandlung von PAH bestätigten. Die Abstracts enthielten Daten zu PAH in Verbindung mit chronischer thromboembolischer pulmonaler Hypertonie (CTEPH) sowie Daten über das Sicherheitsprofil von Bosentan bei PAH in Verbindung mit angeborenem Herzfehler (Congenital Heart Disease – CHD).
Anfang August 2005 gab Actelion die vorläufigen Ergebnisse einer plazebokontrollierten, randomisierten, multizentrischen Doppelblindstudie der Phase III – RAPIDS-2 – bekannt, an der 190 Patienten mit systemischer Sklerose teilnahmen, die an digitalen Ulzerationen litten. Die vorläufige Analyse deutete darauf hin, dass einer der primären Endpunkte, eine Reduktion des Auftretens neuer digitaler Ulzerationen, während der sechsmonatigen Behandlungsdauer statistisch signifikant war. Dieses Ergebnis bestätigte frühere positive Befunde der Vorläuferstudie mit dem Namen RAPIDS-1. Actelion analysiert die Daten derzeit, um sie dann Registrierungsbehörden zu präsentieren. Eine erste wissenschaftliche Präsentation der Daten soll Mitte November 2005 anlässlich des Kongresses des American College of Rheumatology (ACR) in San Diego erfolgen.
Umsätze von Zavesca® gewinnen an Dynamik
Die Umsätze von Zavesca® in der zugelassenen Indikation Typ-1-Gaucher-Erkrankung betrugen in den ersten neun Monaten des Jahres 9,8 Millionen CHF (9 Monate 2004: 4,1 Mio. CHF). Im Vergleich zum Vorquartal stieg der Umsatz von Zavesca® um 19 Prozent auf 4,1 Millionen CHF (2. Quartal 2005: 3,4 Mio. CHF). Zavesca® ist in den USA sowie auf den meisten europäischen Märkten kommerziell erhältlich.
Betriebsaufwand spiegelt bedeutende Anstrengungen in Marketing sowie F&E wider
Der Betriebsaufwand in den ersten neun Monaten 2005 betrug 351,0 Millionen CHF
(9 Monate 2004: 277,6 Mio. CHF). Im dritten Quartal 2005 belief sich der Betriebsaufwand auf 133.6 Millionen CHF. Verglichen mit dem vorherigen Quartal entspricht dies einem Anstieg um 17 Prozent (2. Quartal 2005: 114,7 Mio. CHF). Dieser Anstieg ist zum Teil auf die nicht cash-wirksame Belastung von 6,8 Millionen CHF für aktienbasierte Entlohnungskomponenten im 3. Quartal 2005 zurückzuführen.
Für das gesamte Jahr 2005 erwartet Actelion einen Gesamtbetriebsaufwand zwischen 485 Millionen CHF und 500 Millionen CHF, einschliesslich insgesamt nicht cash-wirksamer 15 Millionen CHF für die aktienbasierte Entlohnung.
In den ersten neun Monaten 2005 betrugen die Ausgaben für Forschung und Entwicklung 121,2 Millionen CHF (9 Monate 2004: 98,1 Mio. CHF).
Die Aufwendungen für Forschung und Entwicklung im dritten Quartal lagen bei 48,0 Millionen CHF. Dies ist eine Steigerung um 17 Prozent (2. Quartal 2005: 41,2 Mio. CHF) und schliesst eine Belastung von 2,3 Millionen CHF für die aktienbasierte Entlohnung ein.
Die gestiegenen Entwicklungskosten waren hauptsächlich auf die schneller als erwartete Rekrutierung von Patienten für die CONSCIOUS-1 Phase IIb/III Studie zurückzuführen, die Clazosentan bei Gefässspasmen in Folge von Subarachnoidalblutungen untersucht. Es wird erwartet, dass die Rekrutierung vor Jahresende abgeschlossen wird.
Das Interesse an Clazosentan wurde durch die Publikation von Ergebnissen einer Phase IIa Studie im Journal of Neurosurgery in der Ausgabe vom Juli 2005 unterstützt, die darauf hinweisen, dass Clazosentan die Anzahl und den Schweregrad von Gefässspasmen nach einer aneurysmalen Subarachnoidalblutung (SAH) reduzieren könnte.
Die Kosten für Marketing und Werbung betrugen in den ersten neun Monaten 2005 88,6 Millionen CHF (9 Monate 2004: 69,9 Mio. CHF).
Im dritten Quartal 2005 lagen die Kosten für Marketing und Werbung bei 31,9 Millionen CHF. Dies ist eine Steigerung von 7 Prozent im Vergleich zum Vorquartal (2. Quart al 2005: 29,8 Mio. CHF). D er Betrag umfasst auch 1,8 Millionen CHF für die aktienbasierte Entlohnung.
In den ersten neun Monaten 2005 beliefen sich die Kosten für Vertrieb, Allgemeines und Verwaltung auf 92,7 Millionen CHF (9 Monate 2004: 70,1 Millionen CHF).
Im dritten Quartal 2005 betrugen die Kosten für Vertrieb, Allgemeines und Verwaltung 34,8 Millionen CHF, ein Anstieg von 20 Prozent gegenüber dem vorangehenden Quartal (2. Quartal 2005: 29,0 Mio. CHF). Darin enthalten ist eine Belastung von 2,7 Millionen CHF für die aktienbasierte Entlohnung. Die Steigerung entspricht der Aufstockung des Aussendienstes und den damit verbundenen umsatzbezogenen Vergütungen.
Kräftiger Betriebsgewinn
Die deutliche Steigerung des Verkaufserlöses in den ersten neun Monaten des Jahres führte zu einem Betriebsgewinn in Höhe von 126,1 Millionen CHF (9 Monate 2004: 63,9 Millionen CHF). Trotz einer Belastung von 6,8 Millionen CHF für die aktienbasierte Entlohnung lag der Betriebsgewinn im dritten Quartal 2005 in Höhe von 47,2 Millionen CHF um 34 Prozent über dem des Vorquartals (2. Quartal 2005: 35,2 Millionen CHF).
Für das gesamte Jahr 2005 erwartet Actelion jetzt einen Betriebsgewinn zwischen 140 und 155 Millionen CHF gegenüber der früheren Schätzung von 125 bis 135 Millionen CHF.
Neutrale Positionen und liquide Mittel
Der Reingewinn belief sich in den ersten neun Monaten 2005 auf 103,8 Millionen CHF (9 Monate 2004: 64,2 Mio. CHF). Hierin enthalten sind Zinseinnahmen von 1,9 Millionen CHF, Zinsaufwand von 0,04 Millionen CHF, eine nicht liquiditätswirksame Belastung von 5,8 Millionen CHF durch eine Wandelanleihe sowie eine Steuerbelastung von 10,7 Millionen CHF.
Im dritten Quartal 2005 betrug der Reingewinn 37,9 Millionen CHF verglichen mit 23,8 Millionen CHF im vorherigen Quartal.
In den ersten neun Monaten des Jahres erwirtschaftete Actelion einen Nettomittelfluss aus Geschäftstätigkeit in Höhe von 92,1 Millionen CHF (9 Monate 2004: 61,9 Mio. CHF). Die liquiden Mittel per 30. September 2005 betrugen 344,0 Millionen CHF (30. Juni 2005: 302,4 Mio. CHF).
Forschungs- und Entwicklungsprogramme verlaufen nach Plan
Anlässlich ihres jüngsten F&E-Tags am 8. September 2005 gewährte Actelion einen umfassenden Einblick in seine aktuellen F&E-Projekte. Alle Forschungs- und Entwicklungsprogramme liegen im Zeitplan:
* Vor Ablauf des Jahres 2005 erwartet das Unternehmen die Ergebnisse des BUILD-Programms, das die Sicherheit und Wirksamkeit von Bosentan bei zwei Formen von Lungenfibrose, der idiopathischen Lungenfibrose (BUILD-1) und der sklerodermiebedingten Lungenfibrose (BUILD-2) untersucht.
* Ebenfalls vor Jahresende rechnet das Unternehmen mit den Ergebnissen dreier klinischer Studien, die die Sicherheit und Wirksamkeit von Miglustat bei seltenen, durch neurologische Defekte charakterisierte, lysosomalen Speicherkrankeiten untersuchen (Typ-3-Gaucher-Krankheit; Nieman-Pick-Krankheit und spät- einsetzende Tay-Sachs-Krankheit).
* Wie das Unternehmen mitteilte, werden derzeit letzte Vorbereitungen für Studien zur Bewertung von Sicherheit und Wirksamkeit von Bosentan in Kombination mit Sildenafil bei PAH-Patienten getroffen. Das gross angelegte COMPASS-Programm wird sowohl den hämodynamischen Nutzen als auch die Wirkung der Kombinationsbehandlung auf Mortalität und Krankheitsentwicklung untersuchen.
* Das Unternehmen legte detaillierte Hintergrundinformationen über das CONSCIOUS-Programm vor, mit dem die Sicherheit und Wirksamkeit von Clazosentan beurteilt werden sollen. Bei Clazosentan handelt es sich um einen intravenös applizierbaren Endothelin-Rezeptor-Antagonisten, der zur Vorbeugung gegen Gefässspasmen infolge von Subarachnoidalblutungen (SAH) entwickelt wurde.
* Das Unternehmen gab Einblick in die frühe klinische Entwicklung von Actelions Orexin-Rezeptor-Antagonisten. Die Analyse vorläufiger Ergebnisse der laufenden Phase-I-Studie lässt dar auf schliessen, dass der Wirk stoff das für ein Medikament zur Verbesserung der Schlafqualität erforderliche pharmakokinetische Profil aufweist.
* Actelion teilte mit, dass das präklinische Entwicklungsprogramm für einen neuartigen, oral verfügbaren Immunmodulator aufgenommen wurde. Der S1P1-Antagonist von Actelion erwies sich in präklinischen Modellen von Autoimmunerkrankungen als gut verträglich und wirksam und hatte nachweislich einen angemessenen Effekt auf die Modulation des Immunsystems.
* Das Unternehmen gab Hintergrundinformationen zu Fortschritten im Rahmen der Globalen Renin-Inhibitor-Allianz mit Merck, die im Frühjahr 2005 einen ersten Renin-Inhibitor mit ausgeprägter Bioverfügbarkeit für die volle präklinische Entwicklung ausgewählt hatte.
* Actelion gab erstmals Einblick in ein breit angelegtes Forschungsprogramm von antibakteriellen Substanzen, die mit Hilfe neuartiger Wirkmechanismen resistente bakterielle Krankheitserreger unschädlich machen sollen.
Zu Dokumentationszwecken – Tabelle 3. Quartal 2005 vs. 2. Quartal 2005
In 1’000 CHF Ergebnis Ergebnis Veränderung in %
3. Quartal 2005 2. Quartal 2005
Nettoerlös 180’832 149’871 30’961 +21
Betriebsaufwand 133’595* 114’700 18’895 +17
Betriebsgewinn 47’237 35’171 12’066 +34
Unternehmensgewinn 37’868 23’815 14’053 +59
Gewinn pro Aktie (EPS, 1,70 1,07 0,63 +59
unverwässert) in CHF
Nettoliquidität aus 43’036 21’744 21’292 +98
dem operativen
Geschäft
*Inklusive aktienbasierter Entlohnung wie folgt:
In 1’000 CHF Im 3. Quartal 2005 angefallen
Forschung und Entwicklung 2’261
Marketing und Werbung 1’831
Vertrieb, Allgemeines und
Verwaltung 2’723
Total 6’815
###
Actelion Ltd
Actelion Ltd ist ein biopharmazeutisches Unternehmen mit Hauptsitz in Allschwil/Basel, Schweiz. Actelions erstes Medikament, Tracleer®, ist ein zur Therapie der pulmonalen arteriellen Hypertonie zugelassener dualer Endothelin-Rezeptor-Antagonist in Tablettenform. Actelion vertreibt Tracleer® durch eigene Niederlassungen in den wichtigsten internationalen Märkten, so den Vereinigten Staaten (mit Sitz in South San Francisco), der Europäischen Union, Japan, Kanada, Australien und der Schweiz. Actelion, gegründet im Jahre 1997, ist ein weltweit führendes Unternehmen bei der Erforschung des Endothels. Das Endothel trennt die Gefässwand vom Blutstrom. Actelion konzentriert sich darauf, innovative Medikamente in Bereichen mit hohem medizinischem Bedarf zu entdecken, zu entwickeln und zu vermarkten. Actelion Aktien sind am SWX Swiss Exchange notiert (Symbol: ATLN).
Für weitere Informationen wenden Sie sich bitte an:
Actelion Ltd, Gewerbestrasse 16, CH-4123 Allschwil
Investoren-Kontakt
Roland Haefeli
+41 61 565 64 58
+1 650 624 6936
Medien-Kontakt
Peter Engel
+41 61 565 66 28
+1 650 624 6996
http://www.actelion.com
Telefonkonferenz
Actelion wird am Donnerstag, den 20. Oktober um 16.30 Uhr, mitteleuropäischer Zeit (10.30 Uhr amerikanische Ostküste, 15.30 Uhr BST) eine Telefonkonferenz für Investoren mit Diskussion/Fragen und Antworten abhalten.
Einwahll:
+41 (0) 91 610 56 00
(Europa)
+1 (1) 866 291 41 66
(USA)
+44 207 107 06 11
(Grossbritannien)
Webcast im Internet – Live oder auf Abruf nach Bedarf
Actelion überträgt die Telefonkonferenz für Investoren auch live im Internet. Sie können die Konferenz im Internet entweder live verfolgen oder sie zu einem späteren Zeitpunkt nach Bedarf als Aufzeichnung abrufen.
Um die Übertragung im Internet verfolgen zu können, benutzen Sie bitte den Link auf unserer Homepage http://www.actelion.com etwa 5-10 Minuten vor Beginn der Konferenz. Etwa 60 Minuten nach Beendigung der Konferenz wird die Aufzeichnung der Investorenkonferenz auf unserer Homepage abrufbar sein. Nach dem 20. November 2005 wird die Aufzeichnung unter Investors/Past Events abgelegt.
Actelions Finanzkalender 2006
Datum:
Anlass:
23. Februar 2006
4. Quartal und Ganzjahresergebnisse 2005
10. April 2006
Generalversammlung
20. April 2006
Ergebnisse 1. Quartal 2006
20. Juli 2006
Ergebnisse 1. Halbjahr 2006
19. Oktober 2006
9-Monatsergebnisse 2006
Gesamtnettoerlös steigt um 40 Prozent auf 477,1 Millionen CHF –Umsatz von Tracleer® mit 455,1 Millionen CHF stärker als erwartet – Betriebsgewinn steigt um 97 Prozent auf 126,1 Millionen CHF – Richtwerte für Ganzjahresumsatz und –gewinn für 2005 erhöht
ALLSCHWIL, SCHWEIZ – 19. Oktober 2005 – Actelion Ltd (SWX: ATLN) gab heute die Finanzergebnisse für die ersten neun Monate des Jahres 2005 bekannt. Mit einem Gesamtnettoerlös in den ersten neun Monaten 2005 von 477,1 Millionen CHF (9 Monate 2004: 341,5 Mio. CHF) und einem Betriebsaufwand von 351,0 Millionen CHF (9 Monate 2004: 277,6 Mio. CHF) weist das Unternehmen einen Betriebsgewinn von 126,1 Millionen CHF (9 Monate 2004: 63,9 Mio. CHF) aus. Der Reingewinn in den ersten neun Monaten 2005 belief sich auf 103,8 Millionen CHF (9 Monate 2004: 64,2 Mio. CHF).
Der Gewinn pro Aktie für die ersten neun Monate 2005 verbesserte sich auf 4,66 CHF verglichen mit 2,92 CHF in der vergleichbaren Vorjahresperiode. In den ersten neun Monaten 2005 erwirtschaftete Actelion einen Nettomittelfluss aus den operativen Aktivitäten von 92,1 Millionen CHF (9 Monate 2004: 61,9 Mio. CHF). Die liquiden Mittel per 30. September 2005 beliefen sich brutto auf 344,0 Millionen CHF (30. Juni 2005: 302,4 Mio. CHF).
Dr. Jean-Paul Clozel, Chief Executive Officer, kommentierte: “Ich bin über unsere Gesamtleistung in den ersten neun Monaten des Jahres 2005 hoch erfreut. Actelion war schneller als erwartet damit erfolgreich, den Markt für pulmonale arterielle Hypertonie (PAH) auszuweiten. Die Ärzte erkennen zunehmend den Nutzen der Diagnose und der Behandlung mit unserem dualen Endothelin-Rezeptor-Hemmer Tracleer®. Actelion hat weitere Mittel für den Ausbau von Fortbildungsprogrammen und klinischen Aktivitäten in PAH-Fachkreisen bereitgestellt.”
Jean-Paul Clozel fügte hinzu: “Actelion hat auch wesentliche Fortschritte bei der Implementierung der langfristigen Strategie gemacht, über Tracleer® bei PAH hinaus zu wachsen. Unsere vorklinischen und klinischen Programme schreiten schnell voran. Ergebnisse von Studien zur Ausweitung der Einsatzmöglichkeiten für unsere bereits im Markt befindlichen Produkte Tracleer® (Bosentan) und Zavesca® (Miglustat) werden vor Jahresende vorliegen. Ausserdem erwartet Actelion während der kommenden 18 Monate wichtige klinische Ergebnisse für verschiedene Pipeline-Projekte, die das Potenzial besitzen, die Behandlung verschiedener Krankheiten grundlegend zu verbessern.“
Andrew J. Oakley, Chief Financial Officer, kommentierte: "Die finanziellen Ergebnisse der ersten neun Monate dieses Jahres waren hervorragend, da die Umsätze von Tracleer® in allen Märkten weiter wuchsen. Mitte Juni lief zudem der kommerzielle Verkauf von Tracleer® in Japan an. Wir erwarten, in diesem Markt in 2006 signifikantes Wachstum zu erreichen. Unsere Kostenbasis erhöhte sich weiter im Einklang mit unseren Erwartungen und mit der Ausweitung unserer Geschäftsaktivitäten.”
Andrew J. Oakley ergänzte: “Angesichts des anhaltenden Erfolgs von Tracleer® bei PAH haben wir unseren Richtwert für den Nettoerlös – vorbehaltlich unvorhergesehener Ereignisse – für das gesamte Jahr nach oben korrigiert und zwar von zwischen 600 und 615 auf 640 bis 655 Millionen Schweizer Franken. Bei gegenüber der bisherigen Schätzung unveränderten Kosten, könnte Actelion für das Gesamtjahr 2005 einen Betriebsgewinn von zwischen 140 und 155 Millionen Schweizer Franken berichten.”
Finanzergebnis im Überblick – Vergleichstabelle 9 Monate 2005 / 9 Monate 2004
Finanzergebnis im Überblick – Vergleichstabelle 9 Monate 2005 / 9 Monate 2004
In 1’000 CHF Ergebnis 9 Ergebnis 9 Veränderung in %
Monate 2005 Monate 2004
Nettoerlös 477’056 341’517 135’539 +40
Betriebsaufwand* 350’982* 277’628 73’354 +26
Betriebsergebnis 126’074 63’889 62’185 +97
Reingewinn 103’793 64’150 39’643 +62
Gewinn pro Aktie 4,66 2,92 1,74 +60
(unverwässert in CHF)
Gewinn pro Aktie 4,49 2,78 1,71 +62
(verwässert in CHF)
Nettoliquidität aus 92’080 61’922 30’158 +49
dem operativen
Geschäft
*inklusive einer nicht cash-wirksamen Belastung für Mitarbeiteraktienoptionen in Höhe von 7,4 Millionen CHF
Die vollständige Konzernrechnung findet sich unter http://www.actelion.com.
Starkes Umsatzwachstum
In den ersten neun Monaten des laufenden Jahres erzielte Actelion einen Gesamtnettoerlös von CHF 477,1 Millionen CHF (9 Monate 2004: 341,5 Mio. CHF). Im Vergleich zum Vorquartal stieg der Gesamtnettoerlös im dritten Quartal 2005 um
21 Prozent auf 180,8 Millionen CHF (2. Quartal 2005: 149,9 Millionen CHF).
Die Erlöse aus vertraglichen Vereinbarungen beliefen sich in den ersten neun Monaten 2005 auf 12,1 Millionen CHF (9 Monate 2004: 12,0 Mio. CHF). Im Vergleich zum Vorquartal blieben die Erlöse aus vertraglichen Vereinbarungen mit 3,9 Millionen CHF nahezu unverändert (2. Quartal 2005: 4,0 Mio. CHF).
Für das gesamte Jahr 2005 erwartet Actelion jetzt einen Gesamtnettoerlös zwischen 640 und 655 Millionen CHF, nachdem die bisherige Schätzung per Ende des ersten Halbjahrs 2005 in einem Bereich von 600 bis 615 Millionen CHF gelegen hatte.
Verkäufe von Tracleer® stärker als erwartet
In den ersten 9 Monaten 2005 betrug der Umsatz von Tracleer® 455,1 Millionen CHF (9 Monate 2004: 325,4 Mio. CHF). Im Vergleich zum vorherigen Quartal stieg der Umsatz von Tracleer® um 21 Prozent auf 172,9 Millionen CHF (2. Quartal 2005: 142,5 Mio. CHF). Diese Steigerung kann zum Teil Schwankungen im Kaufverhalten zugeschrieben werden, ähnlich wie sie in früheren Quartalen beobachtet werden konnten.
Ende September 2005 war Tracleer® in 34 Ländern rund um die Welt zugelassen, darunter in allen bedeutenden Pharmamärkten. Seit Mitte Juli ist Tracleer® kommerziell auch in der Tschechischen Republik verfügbar. Im Juli 2005 unterzeichnete Actelion eine Vertriebsvereinbarung für Tracleer® in Korea mit Handok Pharmaceuticals, einer koreanischen Aktiengesellschaft.
Prüfungen auf Zulassung und/oder Kostenerstattung laufen derzeit in vielen anderen Ländern wie den verbleibenden neun neuen EU-Mitgliedsstaaten sowie in einigen südostasiatischen Ländern.
Weitere Daten belegen die einzigartigen klinischen Eigenschaften von Tracleer®
Mite Juli 2005 berichtete Actelion über wesentliche Ergebnisse von BREATHE-5, der ersten jemals durchgeführten plazebokontrollierten Studie bei Patienten mit Eisenmenger-Syndrom, einer schweren Form von angeborener Herzerkrankung. Die Ergebnisse zeigten, dass ein Behandlung mit Bosentan eine Abnahme des pulmonalen Gefässwiderstands und eine Verbesserung der körperlichen Leistungsfähigkeit bewirkte, ohne dass sich dabei die Sauerstoffsättigung verschlechterte. Derzeit werden Verhandlungen mit Registrierungsbehörden über eine geeignete Dokumentation dieser Ergebnisse geführt. Eine erste Offenlegung der Studienresultate wird anlässlich des CHEST-Kongresses in Montreal Anfang November 2005 erfolgen.
Mitte August veröffentlichte das American College of Cardiology (JACC) eine neue Studie über Langzeitergebnisse bei der Behandlung von Kindern mit pulmonaler arterieller Hypertonie (PAH), die Bosentan mit oder ohne gleichzeitige Verabreichung von Prostanoiden erhielten. Die Autoren folgerten aus den Studienergebnissen, dass Bosentan mit oder ohne gleichzeitige Gabe von Prostanoiden bei der Behandlung von Kindern wirksam ist. Die Studie liefert ausserdem Anhaltspunkte dafür, dass das Sicherheitsprofil dem bei erwachsenen PAH-Patienten beobachteten Profil vergleichbar ist.
Anfang Sept ember stellte Actelion anlässlich der Jahresversammlung der Europäischen Gesellschaft für Kardiologie (European Society of Cardiology – ESC) zwei Abstracts vor, die das langfristige Sicherheitsprofil von Bosentan bei der Behandlung von PAH bestätigten. Die Abstracts enthielten Daten zu PAH in Verbindung mit chronischer thromboembolischer pulmonaler Hypertonie (CTEPH) sowie Daten über das Sicherheitsprofil von Bosentan bei PAH in Verbindung mit angeborenem Herzfehler (Congenital Heart Disease – CHD).
Anfang August 2005 gab Actelion die vorläufigen Ergebnisse einer plazebokontrollierten, randomisierten, multizentrischen Doppelblindstudie der Phase III – RAPIDS-2 – bekannt, an der 190 Patienten mit systemischer Sklerose teilnahmen, die an digitalen Ulzerationen litten. Die vorläufige Analyse deutete darauf hin, dass einer der primären Endpunkte, eine Reduktion des Auftretens neuer digitaler Ulzerationen, während der sechsmonatigen Behandlungsdauer statistisch signifikant war. Dieses Ergebnis bestätigte frühere positive Befunde der Vorläuferstudie mit dem Namen RAPIDS-1. Actelion analysiert die Daten derzeit, um sie dann Registrierungsbehörden zu präsentieren. Eine erste wissenschaftliche Präsentation der Daten soll Mitte November 2005 anlässlich des Kongresses des American College of Rheumatology (ACR) in San Diego erfolgen.
Umsätze von Zavesca® gewinnen an Dynamik
Die Umsätze von Zavesca® in der zugelassenen Indikation Typ-1-Gaucher-Erkrankung betrugen in den ersten neun Monaten des Jahres 9,8 Millionen CHF (9 Monate 2004: 4,1 Mio. CHF). Im Vergleich zum Vorquartal stieg der Umsatz von Zavesca® um 19 Prozent auf 4,1 Millionen CHF (2. Quartal 2005: 3,4 Mio. CHF). Zavesca® ist in den USA sowie auf den meisten europäischen Märkten kommerziell erhältlich.
Betriebsaufwand spiegelt bedeutende Anstrengungen in Marketing sowie F&E wider
Der Betriebsaufwand in den ersten neun Monaten 2005 betrug 351,0 Millionen CHF
(9 Monate 2004: 277,6 Mio. CHF). Im dritten Quartal 2005 belief sich der Betriebsaufwand auf 133.6 Millionen CHF. Verglichen mit dem vorherigen Quartal entspricht dies einem Anstieg um 17 Prozent (2. Quartal 2005: 114,7 Mio. CHF). Dieser Anstieg ist zum Teil auf die nicht cash-wirksame Belastung von 6,8 Millionen CHF für aktienbasierte Entlohnungskomponenten im 3. Quartal 2005 zurückzuführen.
Für das gesamte Jahr 2005 erwartet Actelion einen Gesamtbetriebsaufwand zwischen 485 Millionen CHF und 500 Millionen CHF, einschliesslich insgesamt nicht cash-wirksamer 15 Millionen CHF für die aktienbasierte Entlohnung.
In den ersten neun Monaten 2005 betrugen die Ausgaben für Forschung und Entwicklung 121,2 Millionen CHF (9 Monate 2004: 98,1 Mio. CHF).
Die Aufwendungen für Forschung und Entwicklung im dritten Quartal lagen bei 48,0 Millionen CHF. Dies ist eine Steigerung um 17 Prozent (2. Quartal 2005: 41,2 Mio. CHF) und schliesst eine Belastung von 2,3 Millionen CHF für die aktienbasierte Entlohnung ein.
Die gestiegenen Entwicklungskosten waren hauptsächlich auf die schneller als erwartete Rekrutierung von Patienten für die CONSCIOUS-1 Phase IIb/III Studie zurückzuführen, die Clazosentan bei Gefässspasmen in Folge von Subarachnoidalblutungen untersucht. Es wird erwartet, dass die Rekrutierung vor Jahresende abgeschlossen wird.
Das Interesse an Clazosentan wurde durch die Publikation von Ergebnissen einer Phase IIa Studie im Journal of Neurosurgery in der Ausgabe vom Juli 2005 unterstützt, die darauf hinweisen, dass Clazosentan die Anzahl und den Schweregrad von Gefässspasmen nach einer aneurysmalen Subarachnoidalblutung (SAH) reduzieren könnte.
Die Kosten für Marketing und Werbung betrugen in den ersten neun Monaten 2005 88,6 Millionen CHF (9 Monate 2004: 69,9 Mio. CHF).
Im dritten Quartal 2005 lagen die Kosten für Marketing und Werbung bei 31,9 Millionen CHF. Dies ist eine Steigerung von 7 Prozent im Vergleich zum Vorquartal (2. Quart al 2005: 29,8 Mio. CHF). D er Betrag umfasst auch 1,8 Millionen CHF für die aktienbasierte Entlohnung.
In den ersten neun Monaten 2005 beliefen sich die Kosten für Vertrieb, Allgemeines und Verwaltung auf 92,7 Millionen CHF (9 Monate 2004: 70,1 Millionen CHF).
Im dritten Quartal 2005 betrugen die Kosten für Vertrieb, Allgemeines und Verwaltung 34,8 Millionen CHF, ein Anstieg von 20 Prozent gegenüber dem vorangehenden Quartal (2. Quartal 2005: 29,0 Mio. CHF). Darin enthalten ist eine Belastung von 2,7 Millionen CHF für die aktienbasierte Entlohnung. Die Steigerung entspricht der Aufstockung des Aussendienstes und den damit verbundenen umsatzbezogenen Vergütungen.
Kräftiger Betriebsgewinn
Die deutliche Steigerung des Verkaufserlöses in den ersten neun Monaten des Jahres führte zu einem Betriebsgewinn in Höhe von 126,1 Millionen CHF (9 Monate 2004: 63,9 Millionen CHF). Trotz einer Belastung von 6,8 Millionen CHF für die aktienbasierte Entlohnung lag der Betriebsgewinn im dritten Quartal 2005 in Höhe von 47,2 Millionen CHF um 34 Prozent über dem des Vorquartals (2. Quartal 2005: 35,2 Millionen CHF).
Für das gesamte Jahr 2005 erwartet Actelion jetzt einen Betriebsgewinn zwischen 140 und 155 Millionen CHF gegenüber der früheren Schätzung von 125 bis 135 Millionen CHF.
Neutrale Positionen und liquide Mittel
Der Reingewinn belief sich in den ersten neun Monaten 2005 auf 103,8 Millionen CHF (9 Monate 2004: 64,2 Mio. CHF). Hierin enthalten sind Zinseinnahmen von 1,9 Millionen CHF, Zinsaufwand von 0,04 Millionen CHF, eine nicht liquiditätswirksame Belastung von 5,8 Millionen CHF durch eine Wandelanleihe sowie eine Steuerbelastung von 10,7 Millionen CHF.
Im dritten Quartal 2005 betrug der Reingewinn 37,9 Millionen CHF verglichen mit 23,8 Millionen CHF im vorherigen Quartal.
In den ersten neun Monaten des Jahres erwirtschaftete Actelion einen Nettomittelfluss aus Geschäftstätigkeit in Höhe von 92,1 Millionen CHF (9 Monate 2004: 61,9 Mio. CHF). Die liquiden Mittel per 30. September 2005 betrugen 344,0 Millionen CHF (30. Juni 2005: 302,4 Mio. CHF).
Forschungs- und Entwicklungsprogramme verlaufen nach Plan
Anlässlich ihres jüngsten F&E-Tags am 8. September 2005 gewährte Actelion einen umfassenden Einblick in seine aktuellen F&E-Projekte. Alle Forschungs- und Entwicklungsprogramme liegen im Zeitplan:
* Vor Ablauf des Jahres 2005 erwartet das Unternehmen die Ergebnisse des BUILD-Programms, das die Sicherheit und Wirksamkeit von Bosentan bei zwei Formen von Lungenfibrose, der idiopathischen Lungenfibrose (BUILD-1) und der sklerodermiebedingten Lungenfibrose (BUILD-2) untersucht.
* Ebenfalls vor Jahresende rechnet das Unternehmen mit den Ergebnissen dreier klinischer Studien, die die Sicherheit und Wirksamkeit von Miglustat bei seltenen, durch neurologische Defekte charakterisierte, lysosomalen Speicherkrankeiten untersuchen (Typ-3-Gaucher-Krankheit; Nieman-Pick-Krankheit und spät- einsetzende Tay-Sachs-Krankheit).
* Wie das Unternehmen mitteilte, werden derzeit letzte Vorbereitungen für Studien zur Bewertung von Sicherheit und Wirksamkeit von Bosentan in Kombination mit Sildenafil bei PAH-Patienten getroffen. Das gross angelegte COMPASS-Programm wird sowohl den hämodynamischen Nutzen als auch die Wirkung der Kombinationsbehandlung auf Mortalität und Krankheitsentwicklung untersuchen.
* Das Unternehmen legte detaillierte Hintergrundinformationen über das CONSCIOUS-Programm vor, mit dem die Sicherheit und Wirksamkeit von Clazosentan beurteilt werden sollen. Bei Clazosentan handelt es sich um einen intravenös applizierbaren Endothelin-Rezeptor-Antagonisten, der zur Vorbeugung gegen Gefässspasmen infolge von Subarachnoidalblutungen (SAH) entwickelt wurde.
* Das Unternehmen gab Einblick in die frühe klinische Entwicklung von Actelions Orexin-Rezeptor-Antagonisten. Die Analyse vorläufiger Ergebnisse der laufenden Phase-I-Studie lässt dar auf schliessen, dass der Wirk stoff das für ein Medikament zur Verbesserung der Schlafqualität erforderliche pharmakokinetische Profil aufweist.
* Actelion teilte mit, dass das präklinische Entwicklungsprogramm für einen neuartigen, oral verfügbaren Immunmodulator aufgenommen wurde. Der S1P1-Antagonist von Actelion erwies sich in präklinischen Modellen von Autoimmunerkrankungen als gut verträglich und wirksam und hatte nachweislich einen angemessenen Effekt auf die Modulation des Immunsystems.
* Das Unternehmen gab Hintergrundinformationen zu Fortschritten im Rahmen der Globalen Renin-Inhibitor-Allianz mit Merck, die im Frühjahr 2005 einen ersten Renin-Inhibitor mit ausgeprägter Bioverfügbarkeit für die volle präklinische Entwicklung ausgewählt hatte.
* Actelion gab erstmals Einblick in ein breit angelegtes Forschungsprogramm von antibakteriellen Substanzen, die mit Hilfe neuartiger Wirkmechanismen resistente bakterielle Krankheitserreger unschädlich machen sollen.
Zu Dokumentationszwecken – Tabelle 3. Quartal 2005 vs. 2. Quartal 2005
In 1’000 CHF Ergebnis Ergebnis Veränderung in %
3. Quartal 2005 2. Quartal 2005
Nettoerlös 180’832 149’871 30’961 +21
Betriebsaufwand 133’595* 114’700 18’895 +17
Betriebsgewinn 47’237 35’171 12’066 +34
Unternehmensgewinn 37’868 23’815 14’053 +59
Gewinn pro Aktie (EPS, 1,70 1,07 0,63 +59
unverwässert) in CHF
Nettoliquidität aus 43’036 21’744 21’292 +98
dem operativen
Geschäft
*Inklusive aktienbasierter Entlohnung wie folgt:
In 1’000 CHF Im 3. Quartal 2005 angefallen
Forschung und Entwicklung 2’261
Marketing und Werbung 1’831
Vertrieb, Allgemeines und
Verwaltung 2’723
Total 6’815
###
Actelion Ltd
Actelion Ltd ist ein biopharmazeutisches Unternehmen mit Hauptsitz in Allschwil/Basel, Schweiz. Actelions erstes Medikament, Tracleer®, ist ein zur Therapie der pulmonalen arteriellen Hypertonie zugelassener dualer Endothelin-Rezeptor-Antagonist in Tablettenform. Actelion vertreibt Tracleer® durch eigene Niederlassungen in den wichtigsten internationalen Märkten, so den Vereinigten Staaten (mit Sitz in South San Francisco), der Europäischen Union, Japan, Kanada, Australien und der Schweiz. Actelion, gegründet im Jahre 1997, ist ein weltweit führendes Unternehmen bei der Erforschung des Endothels. Das Endothel trennt die Gefässwand vom Blutstrom. Actelion konzentriert sich darauf, innovative Medikamente in Bereichen mit hohem medizinischem Bedarf zu entdecken, zu entwickeln und zu vermarkten. Actelion Aktien sind am SWX Swiss Exchange notiert (Symbol: ATLN).
Für weitere Informationen wenden Sie sich bitte an:
Actelion Ltd, Gewerbestrasse 16, CH-4123 Allschwil
Investoren-Kontakt
Roland Haefeli
+41 61 565 64 58
+1 650 624 6936
Medien-Kontakt
Peter Engel
+41 61 565 66 28
+1 650 624 6996
http://www.actelion.com
Telefonkonferenz
Actelion wird am Donnerstag, den 20. Oktober um 16.30 Uhr, mitteleuropäischer Zeit (10.30 Uhr amerikanische Ostküste, 15.30 Uhr BST) eine Telefonkonferenz für Investoren mit Diskussion/Fragen und Antworten abhalten.
Einwahll:
+41 (0) 91 610 56 00
(Europa)
+1 (1) 866 291 41 66
(USA)
+44 207 107 06 11
(Grossbritannien)
Webcast im Internet – Live oder auf Abruf nach Bedarf
Actelion überträgt die Telefonkonferenz für Investoren auch live im Internet. Sie können die Konferenz im Internet entweder live verfolgen oder sie zu einem späteren Zeitpunkt nach Bedarf als Aufzeichnung abrufen.
Um die Übertragung im Internet verfolgen zu können, benutzen Sie bitte den Link auf unserer Homepage http://www.actelion.com etwa 5-10 Minuten vor Beginn der Konferenz. Etwa 60 Minuten nach Beendigung der Konferenz wird die Aufzeichnung der Investorenkonferenz auf unserer Homepage abrufbar sein. Nach dem 20. November 2005 wird die Aufzeichnung unter Investors/Past Events abgelegt.
Actelions Finanzkalender 2006
Datum:
Anlass:
23. Februar 2006
4. Quartal und Ganzjahresergebnisse 2005
10. April 2006
Generalversammlung
20. April 2006
Ergebnisse 1. Quartal 2006
20. Juli 2006
Ergebnisse 1. Halbjahr 2006
19. Oktober 2006
9-Monatsergebnisse 2006
wir werden uns wohl noch einen monat gedulden muessen...
meine u.g. schaetzungen gelten noch.
gruss, hopi1
meine u.g. schaetzungen gelten noch.
gruss, hopi1
Bei 75 Euro scheint ein Wiederstand zu sein,
wenn der erstmal durchbrochen ist, dann gehts
aufwärts
wenn der erstmal durchbrochen ist, dann gehts
aufwärts

1200 GMT [Dow Jones] Bear Stearns reinitiates Actelion (ATLN.EB) at peer perform. Earnings growth until `08 looks secure, says Bear Stearns, with Myogen`s (MYOG) Ambrisentan looking a serious competitor to Actelion`s Tracleer from then on. Threat would be especially serious if Myogen partners with a rheumatology marketing partner, adds Bear Stearns. Actelion`s wildcards Zavesca, Clazosentan and Actelion-1 could lead to earnings upgrades. Sets fair value at CHF110. Shares +0.4% at CHF113.50. (KAB)
113,50 CHF sind etwa 71 Euro, glaube ich nicht !!
Ich wette im September steht die Aktie wieder bei
95 Euro, wenn nicht dann bei 90 Euro
113,50 CHF sind etwa 71 Euro, glaube ich nicht !!
Ich wette im September steht die Aktie wieder bei
95 Euro, wenn nicht dann bei 90 Euro

Hop1:
Biste noch investiert ?
Es geht langsam aber sicher nach oben
Gruß cashbob
Biste noch investiert ?
Es geht langsam aber sicher nach oben
Gruß cashbob
nein, bin mit kleinem gewinn raus. ich brauchte das geld fuer ein anderes invest. habe aber jetzt wieder geld frei.
bin aber am ueberlegen, ob ich vor den zahlen nicht noch mal wieder einsteige...
werde ich in der kommenden woche entscheiden.
viel erfolg, hopi1
bin aber am ueberlegen, ob ich vor den zahlen nicht noch mal wieder einsteige...
werde ich in der kommenden woche entscheiden.
viel erfolg, hopi1
um es kurz zu machen:
scheiss zahlen, scheiss ausblick.
und tschuess, hopi1
scheiss zahlen, scheiss ausblick.
und tschuess, hopi1
Hättest lieber warten sollen
so nu habe ich mich nach satten 35% auch von meinen Anteilen
getrennt
getrennt

Positive Studie bei Actelion!!!
Eyes On Actelion Newsflow From US Conference
Tuesday, May 23, 2006 6:09:21 AM ET
Dow Jones Newswires
0855 GMT [Dow Jones] Kepler eyes Actelion's (ATLN.EB) data release on the use of its flagship drug Tracleer in pulmonary fibrosis, expected to be presented at the American Thoracic Society meeting later Tuesday. An earlier trial of Tracleer in that indication failed to show effectiveness and thus, "there is skepticism in the market about the potential for the indication." Actelion already said it plans a Phase-III trial and if successful, it could add CHF75 a share to Kepler Equities CHF180 target price. Shares trade +1.5% at CHF132.50. (SWZ)
ATS presentation highlights strong rationale for a morbidity/mortality study with bosentan in Idiopathic Pulmonary Fibrosis (IPF)
SAN DIEGO, US – 23 May 2006 – Actelion Ltd (SWX: ATLN) announced today that data presented from the BUILD program (Bosentan Use in Interstitial Lung Disease) at the American Thoracic Society (ATS) conference provide a strong rationale to further evaluate the safety and efficacy of bosentan in a morbidity/mortality-driven Phase III study in patients suffering from idiopathic pulmonary fibrosis (IPF).
The BUILD-1 study was a double-blind, randomized, placebo-controlled, multi-center study, designed to evaluate the efficacy of bosentan in improving the exercise capacity of patients suffering from IPF. Secondary endpoints – for which the study was not powered – included time to death and disease progression. 158 patients took part in the study, of which 154 were fully evaluable.1
As previously communicated in November 2005, bosentan did not have a positive effect on the six-minute walk test (6MWT), but treatment with bosentan showed a positive trend for pre-defined morbidity/mortality endpoints. The combined incidence of disease progression or death up to 12 months was 36.1% in the placebo group versus 22.5% in the bosentan group, representing a relative risk reduction of 38% (p=0.076; 95% CL 37%, 105%). 1
Full analysis of the study now presented at ATS included evaluating the treatment effect of bosentan in patients who had lung biopsy (n=99) as a proof of IPF. The analysis of this patient group, which was considered of special interest by the FDA, showed a significantly more pronounced treatment effect.1 In these patients, the combined incidence of disease progression or death up to 12 months was 38.0% in the placebo group versus 12.2% in the bosentan group, representing a relative risk reduction of 68% (p=0.005; 95% CL 14%, 74%).
The use of bosentan in the study was well tolerated with no unexpected adverse events. The observed safety profile was consistent with earlier findings in the clinical studies that led to the approval of bosentan in pulmonary arterial hypertension (PAH).
Talmadge King Jr. M.D., Professor of Medicine at UCSF, San Francisco General Hospital and Principal investigator of the BUILD-1 study, commented: “The unexpected and very encouraging BUILD-1 findings in lung-biopsy proven IPF definitely warrant further clinical evaluation of bosentan in this indication. I am also encouraged to see that bosentan had a positive effect on the morbidity/mortality endpoint, mostly comprised of pulmonary function tests, which is a clinically important and robust endpoint.”
IPF is a progressive and serious condition with a poor prognosis. Currently, there are no approved therapies in IPF. Median survival of patients with IPF is less than 3 years.2
Actelion is currently in advanced discussion with regulatory authorities to finalize the design and scope of a phase III mortality and morbidity study in patients with biopsy proven IPF. The company expects enrollment in the BUILD-3 program to start by the end of 2006.
Abstracts from ATS are available online at:
http://www.abstracts2view.com/ats06/
Eyes On Actelion Newsflow From US Conference
Tuesday, May 23, 2006 6:09:21 AM ET
Dow Jones Newswires
0855 GMT [Dow Jones] Kepler eyes Actelion's (ATLN.EB) data release on the use of its flagship drug Tracleer in pulmonary fibrosis, expected to be presented at the American Thoracic Society meeting later Tuesday. An earlier trial of Tracleer in that indication failed to show effectiveness and thus, "there is skepticism in the market about the potential for the indication." Actelion already said it plans a Phase-III trial and if successful, it could add CHF75 a share to Kepler Equities CHF180 target price. Shares trade +1.5% at CHF132.50. (SWZ)
ATS presentation highlights strong rationale for a morbidity/mortality study with bosentan in Idiopathic Pulmonary Fibrosis (IPF)
SAN DIEGO, US – 23 May 2006 – Actelion Ltd (SWX: ATLN) announced today that data presented from the BUILD program (Bosentan Use in Interstitial Lung Disease) at the American Thoracic Society (ATS) conference provide a strong rationale to further evaluate the safety and efficacy of bosentan in a morbidity/mortality-driven Phase III study in patients suffering from idiopathic pulmonary fibrosis (IPF).
The BUILD-1 study was a double-blind, randomized, placebo-controlled, multi-center study, designed to evaluate the efficacy of bosentan in improving the exercise capacity of patients suffering from IPF. Secondary endpoints – for which the study was not powered – included time to death and disease progression. 158 patients took part in the study, of which 154 were fully evaluable.1
As previously communicated in November 2005, bosentan did not have a positive effect on the six-minute walk test (6MWT), but treatment with bosentan showed a positive trend for pre-defined morbidity/mortality endpoints. The combined incidence of disease progression or death up to 12 months was 36.1% in the placebo group versus 22.5% in the bosentan group, representing a relative risk reduction of 38% (p=0.076; 95% CL 37%, 105%). 1
Full analysis of the study now presented at ATS included evaluating the treatment effect of bosentan in patients who had lung biopsy (n=99) as a proof of IPF. The analysis of this patient group, which was considered of special interest by the FDA, showed a significantly more pronounced treatment effect.1 In these patients, the combined incidence of disease progression or death up to 12 months was 38.0% in the placebo group versus 12.2% in the bosentan group, representing a relative risk reduction of 68% (p=0.005; 95% CL 14%, 74%).
The use of bosentan in the study was well tolerated with no unexpected adverse events. The observed safety profile was consistent with earlier findings in the clinical studies that led to the approval of bosentan in pulmonary arterial hypertension (PAH).
Talmadge King Jr. M.D., Professor of Medicine at UCSF, San Francisco General Hospital and Principal investigator of the BUILD-1 study, commented: “The unexpected and very encouraging BUILD-1 findings in lung-biopsy proven IPF definitely warrant further clinical evaluation of bosentan in this indication. I am also encouraged to see that bosentan had a positive effect on the morbidity/mortality endpoint, mostly comprised of pulmonary function tests, which is a clinically important and robust endpoint.”
IPF is a progressive and serious condition with a poor prognosis. Currently, there are no approved therapies in IPF. Median survival of patients with IPF is less than 3 years.2
Actelion is currently in advanced discussion with regulatory authorities to finalize the design and scope of a phase III mortality and morbidity study in patients with biopsy proven IPF. The company expects enrollment in the BUILD-3 program to start by the end of 2006.
Abstracts from ATS are available online at:
http://www.abstracts2view.com/ats06/
Antwort auf Beitrag Nr.: 21.771.383 von 11up am 24.05.06 09:24:14Actelion and Roche enter into autoimmune disorder collaboration
Co-development for Actelion’s selective S1P1 receptor agonist in multiple indications with co-promotion and profit share – Actelion to receive upfront payment of USD 75 million – Additional milestones of up to USD 555 million for first compound – Further compounds would trigger further milestones – Undisclosed royalties to Actelion on all product sales
ALLSCHWIL/BASEL, SWITZERLAND – 17 July 2006 – Actelion Ltd (SWX: ATLN) and Roche (SWX: ROG) have announced today that they have entered into an exclusive worldwide collaboration to jointly develop and commercialize Actelion’s selective S1P1 receptor agonist, an immunomodulator with the potential for once-a-day oral dosing. The compound is currently being developed in Phase I. The two companies plan to jointly develop and commercialize this novel compound for multiple autoimmune disorders.
Jean-Paul Clozel, MD and Chief Executive Officer of Actelion commented: “I am very proud about our collaboration with Roche, an excellent partner to develop and promote multiple indications in parallel. Together, we are well prepared to turn Actelion’s scientific breakthrough in selective S1P1 receptor agonists into a treatment that has the potential to dramatically improve medical care for patients with autoimmune disorders.”
“We are very pleased to partner with Actelion in this area where there are still a number of high unmet medical needs and only few treatment options are available,” said Roche Chairman and CEO Franz B. Humer. “This collaboration is a further step to strengthen our emerging autoimmune disease franchise.”
About financial terms of the collaboration
The S1P1 collaboration covers both the current selective S1P1 receptor agonist in Phase I as well as any other selective S1P1 receptor agonists resulting from Actelion’s research efforts in the field. Roche will pay Actelion an upfront payment of USD 75 million in the second half of 2006. In the case of future development and approval milestones being achieved, Actelion will be eligible to receive payments of up to USD 555 million for the first compound for all targeted indications. Further development and approval milestone payments are due for further compounds. On all product sales, Roche will pay Actelion undisclosed royalties.
For the current selective S1P1 receptor agonist, Actelion will fully fund all development activities up to the end of Phase II for the first two indications. All subsequent development and commercialization costs will be shared equally between Roche and Actelion. Both companies will co-promote any product resulting from this collaboration and equally share profit.
The science behind selective S1P1 receptor agonists
Sphingosine-1-phospate (S1P) is a phospholipid released by platelets, mast and other cells. It is currently established that S1P stimulates at least five different G-protein coupled receptors (GPCRs): S1P1,2,3,4, and 5. Activation of these GPCRs mediates a complex variety of biological responses, such as lymphocyte migration, endothelial cell proliferation, blood vessel constriction, heart rate modulation and others.
Actelion’s efforts in the field of selective S1P1 receptor agonists started in 1999 by focusing on receptors found on the endothelium, the inner lining of blood vessels. The result of these research efforts is Actelion’s orally active selective S1P1 receptor agonist currently undergoing Phase I safety and tolerability testing.
Additional discovery and early pre-clinical development efforts in the field of selective S1P1 receptor agonists are underway at Actelion’s research facilities in Allschwil, Switzerland.
About autoimmune disorders
Autoimmune disorders are diseases caused by the body producing an immune response against its own tissues. The cause of autoimmune disorders is unknown. Some of the most common types of autoimmune disorders include psoriasis, rheumatoid arthritis, multiple sclerosis, inflammatory bowel disease and rejection of transplanted organs. These disorders affect millions of people worldwide.
About Roche as a P artner
Roche is a valued partner to more than 50 companies worldwide. Over the past two years, Roche has led the pharmaceutical industry in the number of clinical compound deals signed. In 2005, Roche entered into nine partnerships to jointly develop products for optimal patient benefit and value. Partnerships continue to strengthen Roche’s positions in oncology, virology, transplantation, and primary care. Roche’s partnering culture encourages innovation through a unique pairing of collaboration and autonomy.
About Roche
Headquartered in Basel, Switzerland, Roche is one of the world’s leading research-focused healthcare groups in the fields of pharmaceuticals and diagnostics. As a supplier of innovative products and services for the early detection, prevention, diagnosis and treatment of disease, the Group contributes on a broad range of fronts to improving people’s health and quality of life. Roche is a world leader in diagnostics, the leading supplier of medicines for cancer and transplantation and a market leader in virology. In 2005, sales by the Pharmaceuticals Division totaled 27.3 billion Swiss francs, and the Diagnostics Division posted sales of 8.2 billion Swiss francs. Roche employs roughly 70,000 people in 150 countries and has R&D agreements and strategic alliances with numerous partners, including majority ownership interests in Genentech and Chugai. Additional information about the Roche Group is available on the Internet (www.roche.com).
Actelion Ltd
Actelion Ltd is a biopharmaceutical company with its corporate headquarters in Allschwil/Basel, Switzerland. Actelion's first drug Tracleer®, an orally available dual endothelin receptor antagonist, has been approved as a therapy for pulmonary arterial hypertension. Actelion markets Tracleer® through its own subsidiaries in key markets worldwide, including the United States (based in South San Francisco), the European Union, Japan, Canada, Australia and Switzerland. Actelion, founded in late 1997, is a leading player in innovative science related to the endothelium – the single layer of cells separating every blood vessel from the blood stream. Actelion focuses on the discovery, development and marketing of innovative drugs for significant unmet medical needs. Actelion shares are traded on the SWX Swiss Exchange (ticker symbol: ATLN).
For further information please contact:
Actelion Ltd, Gewerbestrasse 16, CH-4123 Allschwil
Investor Contact
Roland Haefeli
+41 61 565 64 58
+1 650 624 6936
Media Contact
Peter Engel
+41 61 565 66 28
+1 650 624 6996
http://www.actelion.com
F.Hoffmann-La Roche Ltd, Grenzacherstrasse 124, CH-4070 Basel
Media Relations Contacts:
+ 41 61 688 88 88
Head Roche Group Media Office
Daniel Piller
Baschi Dürr
Alexander Klauser
Head R&D Communications
Katja Prowald
Martina Rupp
http://www.roche.com
Co-development for Actelion’s selective S1P1 receptor agonist in multiple indications with co-promotion and profit share – Actelion to receive upfront payment of USD 75 million – Additional milestones of up to USD 555 million for first compound – Further compounds would trigger further milestones – Undisclosed royalties to Actelion on all product sales
ALLSCHWIL/BASEL, SWITZERLAND – 17 July 2006 – Actelion Ltd (SWX: ATLN) and Roche (SWX: ROG) have announced today that they have entered into an exclusive worldwide collaboration to jointly develop and commercialize Actelion’s selective S1P1 receptor agonist, an immunomodulator with the potential for once-a-day oral dosing. The compound is currently being developed in Phase I. The two companies plan to jointly develop and commercialize this novel compound for multiple autoimmune disorders.
Jean-Paul Clozel, MD and Chief Executive Officer of Actelion commented: “I am very proud about our collaboration with Roche, an excellent partner to develop and promote multiple indications in parallel. Together, we are well prepared to turn Actelion’s scientific breakthrough in selective S1P1 receptor agonists into a treatment that has the potential to dramatically improve medical care for patients with autoimmune disorders.”
“We are very pleased to partner with Actelion in this area where there are still a number of high unmet medical needs and only few treatment options are available,” said Roche Chairman and CEO Franz B. Humer. “This collaboration is a further step to strengthen our emerging autoimmune disease franchise.”
About financial terms of the collaboration
The S1P1 collaboration covers both the current selective S1P1 receptor agonist in Phase I as well as any other selective S1P1 receptor agonists resulting from Actelion’s research efforts in the field. Roche will pay Actelion an upfront payment of USD 75 million in the second half of 2006. In the case of future development and approval milestones being achieved, Actelion will be eligible to receive payments of up to USD 555 million for the first compound for all targeted indications. Further development and approval milestone payments are due for further compounds. On all product sales, Roche will pay Actelion undisclosed royalties.
For the current selective S1P1 receptor agonist, Actelion will fully fund all development activities up to the end of Phase II for the first two indications. All subsequent development and commercialization costs will be shared equally between Roche and Actelion. Both companies will co-promote any product resulting from this collaboration and equally share profit.
The science behind selective S1P1 receptor agonists
Sphingosine-1-phospate (S1P) is a phospholipid released by platelets, mast and other cells. It is currently established that S1P stimulates at least five different G-protein coupled receptors (GPCRs): S1P1,2,3,4, and 5. Activation of these GPCRs mediates a complex variety of biological responses, such as lymphocyte migration, endothelial cell proliferation, blood vessel constriction, heart rate modulation and others.
Actelion’s efforts in the field of selective S1P1 receptor agonists started in 1999 by focusing on receptors found on the endothelium, the inner lining of blood vessels. The result of these research efforts is Actelion’s orally active selective S1P1 receptor agonist currently undergoing Phase I safety and tolerability testing.
Additional discovery and early pre-clinical development efforts in the field of selective S1P1 receptor agonists are underway at Actelion’s research facilities in Allschwil, Switzerland.
About autoimmune disorders
Autoimmune disorders are diseases caused by the body producing an immune response against its own tissues. The cause of autoimmune disorders is unknown. Some of the most common types of autoimmune disorders include psoriasis, rheumatoid arthritis, multiple sclerosis, inflammatory bowel disease and rejection of transplanted organs. These disorders affect millions of people worldwide.
About Roche as a P artner
Roche is a valued partner to more than 50 companies worldwide. Over the past two years, Roche has led the pharmaceutical industry in the number of clinical compound deals signed. In 2005, Roche entered into nine partnerships to jointly develop products for optimal patient benefit and value. Partnerships continue to strengthen Roche’s positions in oncology, virology, transplantation, and primary care. Roche’s partnering culture encourages innovation through a unique pairing of collaboration and autonomy.
About Roche
Headquartered in Basel, Switzerland, Roche is one of the world’s leading research-focused healthcare groups in the fields of pharmaceuticals and diagnostics. As a supplier of innovative products and services for the early detection, prevention, diagnosis and treatment of disease, the Group contributes on a broad range of fronts to improving people’s health and quality of life. Roche is a world leader in diagnostics, the leading supplier of medicines for cancer and transplantation and a market leader in virology. In 2005, sales by the Pharmaceuticals Division totaled 27.3 billion Swiss francs, and the Diagnostics Division posted sales of 8.2 billion Swiss francs. Roche employs roughly 70,000 people in 150 countries and has R&D agreements and strategic alliances with numerous partners, including majority ownership interests in Genentech and Chugai. Additional information about the Roche Group is available on the Internet (www.roche.com).
Actelion Ltd
Actelion Ltd is a biopharmaceutical company with its corporate headquarters in Allschwil/Basel, Switzerland. Actelion's first drug Tracleer®, an orally available dual endothelin receptor antagonist, has been approved as a therapy for pulmonary arterial hypertension. Actelion markets Tracleer® through its own subsidiaries in key markets worldwide, including the United States (based in South San Francisco), the European Union, Japan, Canada, Australia and Switzerland. Actelion, founded in late 1997, is a leading player in innovative science related to the endothelium – the single layer of cells separating every blood vessel from the blood stream. Actelion focuses on the discovery, development and marketing of innovative drugs for significant unmet medical needs. Actelion shares are traded on the SWX Swiss Exchange (ticker symbol: ATLN).
For further information please contact:
Actelion Ltd, Gewerbestrasse 16, CH-4123 Allschwil
Investor Contact
Roland Haefeli
+41 61 565 64 58
+1 650 624 6936
Media Contact
Peter Engel
+41 61 565 66 28
+1 650 624 6996
http://www.actelion.com
F.Hoffmann-La Roche Ltd, Grenzacherstrasse 124, CH-4070 Basel
Media Relations Contacts:
+ 41 61 688 88 88
Head Roche Group Media Office
Daniel Piller
Baschi Dürr
Alexander Klauser
Head R&D Communications
Katja Prowald
Martina Rupp
http://www.roche.com
Nach den beiden guten Nachrichten sollte es doch endlich mal klappen den Widerstand bei 150 CHF zu brechen.
Schaut euch wegen der Tabellen auch die Website bei Actelion an.
http://www.actelion.com/uninet/www/www_main_p.nsf/Content/me…
Actelion announces Half Year financial results 2006
Total net revenue of CHF 437.1 million, up 48 percent – Tracleer® sales of CHF 417.9m – Pulmonary Arterial Hypertension market expanding – Strong operating profit of CHF 120.3m, up 53 percent – Upgraded revenue and profit guidance for 2006
ALLSCHWIL/BASEL, SWITZERLAND – 20 July 2006 – Actelion Ltd (SWX: ATLN) today announced its financial results for the first six months of 2006. With total net revenue for H1 2006 of CHF 437.1 million (H1 2005: CHF 296.2 m) and operating expenses of CHF 316.8 million (H1 2005: 217.4 m), the company reported an operating profit of CHF 120.3 million (H1 2005: CHF 78.8 m). The net profit for H1 2006 was CHF 105.0 million (H1 2005: CHF 65.9 m).
Basic earnings per share (EPS) for the first half of 2006 improved to CHF 4.65, compared to CHF 2.96 in H1 2005. The gross cash position as of 30 June 2006 was CHF 418.4 million (31 March 2006: CHF 401.9 m).
Jean-Paul Clozel, MD and Chief Executive Officer commented: “I am very pleased with Actelion’s performance. Our marketable products, especially Tracleer, are performing above our expectations, driving profitability higher. This is especially noteworthy given that we continue to invest substantially in marketed products and expand our clinical and pre-clinical pipeline. With partnerships in place with Merck and Roche, we are very well positioned to successfully execute our innovation-driven strategy of growing the company multiple-fold over the coming years.”
Andrew J. Oakley, Chief Financial Officer commented: “The increasing Tracleer sales momentum impacts our financial performance in 2006 and beyond. Unforeseen events excluded, operating profit for 2006 could now reach between 215 to 230 million Swiss Francs. I also expect Actelion’s 2007 net revenue to be above 1 billion Swiss Francs. ”
Andrew J. Oakley concluded: “For the first time in the company’s nine year history, our balance sheet shows retained earnings. Our ongoing strong cash generation further increases the financial and strategic independence necessary to pursue an aggressive long-term, innovation-driven growth strategy”.
The full financial statements can be found on http://www.actelion.com.
Strong top line growth leads to change in guidance
In the first six months of 2006, Actelion had total net revenue of CHF 437.1 million (H1 2005: CHF 296.2 m). On a quarter-to-quarter basis, net revenue increased by 8 percent to CHF 226.5 million (Q1 2006: CHF 210.6 m).
Contract revenues in H1 2006 amounted to CHF 7.6 million (H1 2005: CHF 8.2 m). On a quarter-to-quarter basis, contract revenues remained unchanged with CHF 3.8 million (Q1 2006: CHF 3.8 m).
For the Full Year 2006, unforeseen events excluded, Actelion now expects total net revenue to reach between CHF 880 and CHF 910 million, compared to between CHF 840 and CHF 860 million as previously guided in April 2006. With somewhat higher costs due to additional sales force expansion, the company now expects an operating profit of between CHF 215 to 230 million (previous guidance in April 2006: CHF 185 to 205 million).
Tracleer in PAH – Expansion continues
In H1 2006, Tracleer® sales were CHF 417.9 million (H1 2005: CHF 282.3 m). On a quarter-to-quarter basis, Tracleer® revenues increased by 7.5 percent to CHF 216.5 million (Q1 2006: CHF 201.4 m). A proportion of this increase could be attributable to buying pattern variations.
At the end of June 2006, Tracleer® was marketed in 22 countries worldwide, including all major pharmaceutical markets. Tracleer continued to grow in all markets. In the second half of 2006, Actelion expects to launch Tracleer in Korea together with Handok, its local partner. In China, reimbursement discussions are ongoing. In the near future, Actelion also plans to make the drug available in other territories, such as Romania.
Christian Chavy, President Business Operations, commented: “The PAH market is continuing to expand worldwide, driven in part by our substantial educational and clinical efforts. The recent introduction of additional approved agents for PAH has led to further market momentum. We also see new prescribers becoming active in the PAH field. Consequently, we are continuing our sales force expansion. In this way, we can reach out to even more physicians, facilitating their entry into the PAH community, a community that now has close to five years of experience with Tracleer.”
Regulatory update for Tracleer
In the first half of 2006, Actelion submitted a new drug application (NDA) to the European regulatory authorities, EMEA concerning Tracleer (bosentan) for the reduction of new digital ulcers in patients with systemic scleroderma. The NDA is based on the two studies RAPIDS-1 and RAPIDS-2. The company expects to make a similar filing to the US regulatory authorities, FDA, later this year.
In many territories, regulatory review is ongoing regarding the inclusion of data from BREATHE-4 and BREATHE-5 studies that included patients with PAH associated with HIV and PAH associated with congenital heart disease (CHD) respectively. In early July, the Canadian regulatory authorities, Health Canada, approved the inclusion of the findings in the prescribing information.
Zavesca® continues to add to top line
Zavesca® sales contributed in the first half of 2006 CHF 11.6 million to Actelion’s revenue (H1 2005: CHF 5.8 m). On a quarter-to-quarter basis, Zavesca® revenues increased by 15 percent to CHF 6.2 million (Q1 2006: CHF 5.4 m). Zavesca® is commercially available in the United States and in most European markets.
Operating expenses in line with expansion of the business
In H1 2006 total operating expenses including cost of goods sold were CHF 316.8 million (H1 2005: CHF 217.4m). In Q2 2006 operating expenses were CHF 167.3 million. Compared to the previous q u ar ter, this represents an increase of 12 percent (Q1 2006: CHF 149.5 m).
In H1 2006 research and development expenses were CHF 101.0 million (H1 2005: CHF 73.2 m). In Q2 2006 research and development expenses were CHF 53.3 m, this represents an increase of 12 percent (Q1 2006: CHF 47.7 m).
In H1 2006 marketing and advertising costs were CHF 85.9 million (H1 2005: CHF 56.7 m). In Q2 2006 marketing and advertising expenses were CHF 44.8 million. Compared to the previous quarter (Q1 2006: CHF 41.1 m), this represents an increase of 9 percent, which is in-line with our participation at multiple major medical congresses, as well as our ongoing educational effort in PAH.
In H1 2006 selling, general and administrative expenses amounted to CHF 84.7 million (H1 2005: CHF 57.9 m). In Q2 2006 selling, general and administrative expenses were CHF 45.3 m, which is an increase of 15 percent (Q1 2006: CHF 39.4 m), mostly driven by additional sales force salaries and sales-related expenses.
Strong operating profit as a result of strong top-line growth
In H1 2006, a strong increase in sales revenues resulted in an operating profit of CHF 120.3 million (H1 2005: CHF 78.8 m). As a result of an increase in R&D spend and additional investments in our marketing and sales forces, Q2 2006 operating profit of CHF 59.3 million was 3 percent lower than the previous quarter (Q1 2006: CHF 61.0 m).
In H1 2006, the net profit of CHF 105.0 million (H1 2005: CHF 65.9 m) includes interest income of CHF 2.5 million, interest expense of CHF 0.03 million, a non-cash charge on the Convertible Bond of CHF 4.1 million, other financial income (mostly foreign currency gains) of CHF 6.2 million and an income tax expense of CHF 19.9 million. In Q2 2006, the net profit was CHF 51.3 million compared to CHF 53.7 million in the previous quarter.
Cash and cash flow
The company generated cash from operations in the first half of 2006 of CHF 78.3 million (H1 2005: CHF 49.0). On 30 June 2006, the company held cash and cash equivalents of CHF 418.4 million (31 March 2006: CHF 401.9 m).
Research and Development update
In the first half of 2006, substantial progress was made in multiple clinical programs. The company expects to provide a comprehensive update – including data disclosure of several projects – at its upcoming Research and Development Day in February 2007.
* The EARLY study, a double-blind, placebo-controlled clinical trial evaluating the safety and efficacy of bosentan in class II PAH patients, finished enrollment with 185 patients. Study results are expected in early 2007.
* The pediatric study FUTURE-1 is evaluating the safety and bioequivalency of a special pediatric formulation of bosentan. With the trial almost fully enrolled, study results are expected early 2007.
* The COMPASS program evaluates the benefits of the combination of bosentan with sildenafil in PAH patients. This program, which will assess short-term hemodynamic benefits (COMPASS-1), as well as impact on mortality / morbidity (COMPASS-2) of the combination, has started enrollment. COMPASS-1 results are expected in 2007.
* The BENEFIT study, a double-blind, placebo-controlled Phase III trial to evaluate the safety and efficacy of bosentan is currently enrolling patients suffering from chronic thrombo-embolic pulmonary hypertension (CTEPH). CTEPH is caused by blockage of the main arteries leading from the heart to the lungs by thrombotic material. Study results are expected in mid-2007.
* The ASSET program with two trials, ASSET-1 and ASSET-2, has started to enroll patients with the goal to evaluate the safety and efficacy of Tracleer® in pulmonary hypertension secondary to sickle cell disease. Study results are expected in late 2007.
* A placebo-controlled randomized trial is currently enrolling patients to eva l u ate the safety and efficacy of bosentan in patients with advanced metastatic melanoma. Results of this event-driven study are expected in the second half of 2007.
* At the American Thoracic Society (ATS) conference in May 2006, Actelion presented findings from the BUILD-1 study in patients with biopsy-proven idiopathic pulmonary fibrosis. Based on this data, the company is preparing BUILD-3, a morbidity/mortality study in patients with idiopathic pulmonary fibrosis. Enrollment for this Phase III trial will start before year-end.
* The MAINTENANCE program, evaluating the long-term safety and efficacy of miglustat (Zavesca®) as a maintenance therapy after a switch from enzyme replacement therapy (ERT) in adult type 1 Gaucher patients with stable disease, is continuing to enroll patients. First interim results could become available by year-end 2007.
* Clinical programs evaluating the safety and efficacy of high-dose miglustat (Zavesca®) in lysosomal storage disorders with predominant neurological manifestations, namely Niemann-Pick type C (NP-C) and Gaucher type 3 (GD3) are ongoing. Both studies are now in their second year. Earlier encouraging findings with Zavesca in NP-C after 12 months of exposure are being discussed with regulatory authorities.
* In June 2006, Actelion announced the preliminary analysis of the dose-finding study CONSCIOUS-1, a multi-center, international, double-blind, randomized, placebo-controlled, parallel group, evaluating the safety and efficacy of three dose levels of clazosentan in preventing the occurrence of cerebral vasospasm following aneurysmal subarachnoid hemorrhage (SAH).
The preliminary analysis of CONSCIOUS-1 demonstrated significance for all three doses versus placebo in terms of clazosentan decreasing cerebral vasospasm in a dose-related fashion (primary endpoint). In the study, the significant reduction in cerebral vasospasm did not translate into an overall clinical benefit as assessed by the chosen key secondary composite endpoint: occurrence of morbidity / mortality.
A full data analysis and consultation with clinical experts is currently ongoing to better understand the apparent disconnect in this study between the significant reduction in cerebral vasospasm and clinical outcome assessed by the endpoint chosen. The company expects that it can make decisions on future development of this compound later in 2006.
* Actelion-1, an undisclosed compound is currently in a Phase IIa program to evaluate its potential in cardiovascular indications. The company expects that it can make decisions on future development of this compound later in 2006.
* In the first half of 2006, the company also commenced enrollment in the Phase II program for Actelion’s Orexin Receptor Antagonist, evaluating the safety and efficacy of this novel compound in patients suffering from insomnia. The company expects that it can make decisions on future development of this compound in the first half of 2007.
* In the first half of 2006, Actelion commenced Phase I with its selective S1P1 receptor agonist, evaluating the safety and tolerability of this compound in healthy volunteers. S1P1 agonism might have therapeutic potential in multiple autoimmune diseases, such as multiple sclerosis or rheumatoid arthritis.
In mid-July 2006, Actelion entered into an exclusive worldwide collaboration with Roche to jointly develop and commercialize Actelion’s selective S1P1 receptor agonist, an immunomodulator with the potential for once-a-day oral dosing. The two companies plan to jointly develop and commercialize this novel compound for multiple autoimmune disorders.
The S1P1 collaboration covers both the current selective S1P1 receptor agonist in Phase I as well as any other selective S1P1 receptor agonists resulting from Actelion’s research efforts in the field. Roche will pay Actelion an upfront payment of USD 75 million in the second half of 2006. In the case of future dev e l opm ent and approval milestones being achieved, Actelion will be eligible to receive additional payments of up to USD 555 million for the first compound for all targeted indications. Further development and approval milestone payments are due for further compounds. On all product sales, Roche will pay Actelion undisclosed royalties.
For the current selective S1P1 receptor agonist, Actelion will fully fund all development activities up to the end of Phase II for the first two indications. All subsequent development and commercialization costs will be shared equally between Roche and Actelion. Both companies will co-promote any product resulting from this collaboration and equally share profit.
* In July 2006, a third milestone in the Global Actelion Merck Renin Inhibitor Alliance project was achieved with entry into man of the first renin inhibitor. For this start of Phase 1, Actelion received a milestone payment of USD 7 million.
* During the first six months of 2006, Actelion initiated full preclinical development for two novel first-in-class compounds in the fields of allergy and antibacterials.
* An additional number of unnamed projects are in various phases of drug discovery. These projects target indications in immunology, cardiovascular disease, infectious disease and central nervous system disorders.
Actelion Ltd
Actelion Ltd is a biopharmaceutical company with its corporate headquarter in Allschwil/Basel, Switzerland. Actelion's first drug Tracleer®, an orally available dual endothelin receptor antagonist, has been approved as a therapy for pulmonary arterial hypertension. Actelion markets Tracleer® through its own subsidiaries in key markets worldwide, including the United States (based in South San Francisco), the European Union, Japan as well as Canada, Australia and Switzerland. Actelion, founded in late 1997, is a leading player in innovative science related to the endothelium – the single layer of cells separating every blood vessel from the blood st rea m. A ctel ion focuses on the discovery, development and marketing of innovative drugs for significant unmet medical needs. Actelion shares are traded on the SWX Swiss Exchange (ticker symbol: ATLN).
Schaut euch wegen der Tabellen auch die Website bei Actelion an.
http://www.actelion.com/uninet/www/www_main_p.nsf/Content/me…
Actelion announces Half Year financial results 2006
Total net revenue of CHF 437.1 million, up 48 percent – Tracleer® sales of CHF 417.9m – Pulmonary Arterial Hypertension market expanding – Strong operating profit of CHF 120.3m, up 53 percent – Upgraded revenue and profit guidance for 2006
ALLSCHWIL/BASEL, SWITZERLAND – 20 July 2006 – Actelion Ltd (SWX: ATLN) today announced its financial results for the first six months of 2006. With total net revenue for H1 2006 of CHF 437.1 million (H1 2005: CHF 296.2 m) and operating expenses of CHF 316.8 million (H1 2005: 217.4 m), the company reported an operating profit of CHF 120.3 million (H1 2005: CHF 78.8 m). The net profit for H1 2006 was CHF 105.0 million (H1 2005: CHF 65.9 m).
Basic earnings per share (EPS) for the first half of 2006 improved to CHF 4.65, compared to CHF 2.96 in H1 2005. The gross cash position as of 30 June 2006 was CHF 418.4 million (31 March 2006: CHF 401.9 m).
Jean-Paul Clozel, MD and Chief Executive Officer commented: “I am very pleased with Actelion’s performance. Our marketable products, especially Tracleer, are performing above our expectations, driving profitability higher. This is especially noteworthy given that we continue to invest substantially in marketed products and expand our clinical and pre-clinical pipeline. With partnerships in place with Merck and Roche, we are very well positioned to successfully execute our innovation-driven strategy of growing the company multiple-fold over the coming years.”
Andrew J. Oakley, Chief Financial Officer commented: “The increasing Tracleer sales momentum impacts our financial performance in 2006 and beyond. Unforeseen events excluded, operating profit for 2006 could now reach between 215 to 230 million Swiss Francs. I also expect Actelion’s 2007 net revenue to be above 1 billion Swiss Francs. ”
Andrew J. Oakley concluded: “For the first time in the company’s nine year history, our balance sheet shows retained earnings. Our ongoing strong cash generation further increases the financial and strategic independence necessary to pursue an aggressive long-term, innovation-driven growth strategy”.
The full financial statements can be found on http://www.actelion.com.
Strong top line growth leads to change in guidance
In the first six months of 2006, Actelion had total net revenue of CHF 437.1 million (H1 2005: CHF 296.2 m). On a quarter-to-quarter basis, net revenue increased by 8 percent to CHF 226.5 million (Q1 2006: CHF 210.6 m).
Contract revenues in H1 2006 amounted to CHF 7.6 million (H1 2005: CHF 8.2 m). On a quarter-to-quarter basis, contract revenues remained unchanged with CHF 3.8 million (Q1 2006: CHF 3.8 m).
For the Full Year 2006, unforeseen events excluded, Actelion now expects total net revenue to reach between CHF 880 and CHF 910 million, compared to between CHF 840 and CHF 860 million as previously guided in April 2006. With somewhat higher costs due to additional sales force expansion, the company now expects an operating profit of between CHF 215 to 230 million (previous guidance in April 2006: CHF 185 to 205 million).
Tracleer in PAH – Expansion continues
In H1 2006, Tracleer® sales were CHF 417.9 million (H1 2005: CHF 282.3 m). On a quarter-to-quarter basis, Tracleer® revenues increased by 7.5 percent to CHF 216.5 million (Q1 2006: CHF 201.4 m). A proportion of this increase could be attributable to buying pattern variations.
At the end of June 2006, Tracleer® was marketed in 22 countries worldwide, including all major pharmaceutical markets. Tracleer continued to grow in all markets. In the second half of 2006, Actelion expects to launch Tracleer in Korea together with Handok, its local partner. In China, reimbursement discussions are ongoing. In the near future, Actelion also plans to make the drug available in other territories, such as Romania.
Christian Chavy, President Business Operations, commented: “The PAH market is continuing to expand worldwide, driven in part by our substantial educational and clinical efforts. The recent introduction of additional approved agents for PAH has led to further market momentum. We also see new prescribers becoming active in the PAH field. Consequently, we are continuing our sales force expansion. In this way, we can reach out to even more physicians, facilitating their entry into the PAH community, a community that now has close to five years of experience with Tracleer.”
Regulatory update for Tracleer
In the first half of 2006, Actelion submitted a new drug application (NDA) to the European regulatory authorities, EMEA concerning Tracleer (bosentan) for the reduction of new digital ulcers in patients with systemic scleroderma. The NDA is based on the two studies RAPIDS-1 and RAPIDS-2. The company expects to make a similar filing to the US regulatory authorities, FDA, later this year.
In many territories, regulatory review is ongoing regarding the inclusion of data from BREATHE-4 and BREATHE-5 studies that included patients with PAH associated with HIV and PAH associated with congenital heart disease (CHD) respectively. In early July, the Canadian regulatory authorities, Health Canada, approved the inclusion of the findings in the prescribing information.
Zavesca® continues to add to top line
Zavesca® sales contributed in the first half of 2006 CHF 11.6 million to Actelion’s revenue (H1 2005: CHF 5.8 m). On a quarter-to-quarter basis, Zavesca® revenues increased by 15 percent to CHF 6.2 million (Q1 2006: CHF 5.4 m). Zavesca® is commercially available in the United States and in most European markets.
Operating expenses in line with expansion of the business
In H1 2006 total operating expenses including cost of goods sold were CHF 316.8 million (H1 2005: CHF 217.4m). In Q2 2006 operating expenses were CHF 167.3 million. Compared to the previous q u ar ter, this represents an increase of 12 percent (Q1 2006: CHF 149.5 m).
In H1 2006 research and development expenses were CHF 101.0 million (H1 2005: CHF 73.2 m). In Q2 2006 research and development expenses were CHF 53.3 m, this represents an increase of 12 percent (Q1 2006: CHF 47.7 m).
In H1 2006 marketing and advertising costs were CHF 85.9 million (H1 2005: CHF 56.7 m). In Q2 2006 marketing and advertising expenses were CHF 44.8 million. Compared to the previous quarter (Q1 2006: CHF 41.1 m), this represents an increase of 9 percent, which is in-line with our participation at multiple major medical congresses, as well as our ongoing educational effort in PAH.
In H1 2006 selling, general and administrative expenses amounted to CHF 84.7 million (H1 2005: CHF 57.9 m). In Q2 2006 selling, general and administrative expenses were CHF 45.3 m, which is an increase of 15 percent (Q1 2006: CHF 39.4 m), mostly driven by additional sales force salaries and sales-related expenses.
Strong operating profit as a result of strong top-line growth
In H1 2006, a strong increase in sales revenues resulted in an operating profit of CHF 120.3 million (H1 2005: CHF 78.8 m). As a result of an increase in R&D spend and additional investments in our marketing and sales forces, Q2 2006 operating profit of CHF 59.3 million was 3 percent lower than the previous quarter (Q1 2006: CHF 61.0 m).
In H1 2006, the net profit of CHF 105.0 million (H1 2005: CHF 65.9 m) includes interest income of CHF 2.5 million, interest expense of CHF 0.03 million, a non-cash charge on the Convertible Bond of CHF 4.1 million, other financial income (mostly foreign currency gains) of CHF 6.2 million and an income tax expense of CHF 19.9 million. In Q2 2006, the net profit was CHF 51.3 million compared to CHF 53.7 million in the previous quarter.
Cash and cash flow
The company generated cash from operations in the first half of 2006 of CHF 78.3 million (H1 2005: CHF 49.0). On 30 June 2006, the company held cash and cash equivalents of CHF 418.4 million (31 March 2006: CHF 401.9 m).
Research and Development update
In the first half of 2006, substantial progress was made in multiple clinical programs. The company expects to provide a comprehensive update – including data disclosure of several projects – at its upcoming Research and Development Day in February 2007.
* The EARLY study, a double-blind, placebo-controlled clinical trial evaluating the safety and efficacy of bosentan in class II PAH patients, finished enrollment with 185 patients. Study results are expected in early 2007.
* The pediatric study FUTURE-1 is evaluating the safety and bioequivalency of a special pediatric formulation of bosentan. With the trial almost fully enrolled, study results are expected early 2007.
* The COMPASS program evaluates the benefits of the combination of bosentan with sildenafil in PAH patients. This program, which will assess short-term hemodynamic benefits (COMPASS-1), as well as impact on mortality / morbidity (COMPASS-2) of the combination, has started enrollment. COMPASS-1 results are expected in 2007.
* The BENEFIT study, a double-blind, placebo-controlled Phase III trial to evaluate the safety and efficacy of bosentan is currently enrolling patients suffering from chronic thrombo-embolic pulmonary hypertension (CTEPH). CTEPH is caused by blockage of the main arteries leading from the heart to the lungs by thrombotic material. Study results are expected in mid-2007.
* The ASSET program with two trials, ASSET-1 and ASSET-2, has started to enroll patients with the goal to evaluate the safety and efficacy of Tracleer® in pulmonary hypertension secondary to sickle cell disease. Study results are expected in late 2007.
* A placebo-controlled randomized trial is currently enrolling patients to eva l u ate the safety and efficacy of bosentan in patients with advanced metastatic melanoma. Results of this event-driven study are expected in the second half of 2007.
* At the American Thoracic Society (ATS) conference in May 2006, Actelion presented findings from the BUILD-1 study in patients with biopsy-proven idiopathic pulmonary fibrosis. Based on this data, the company is preparing BUILD-3, a morbidity/mortality study in patients with idiopathic pulmonary fibrosis. Enrollment for this Phase III trial will start before year-end.
* The MAINTENANCE program, evaluating the long-term safety and efficacy of miglustat (Zavesca®) as a maintenance therapy after a switch from enzyme replacement therapy (ERT) in adult type 1 Gaucher patients with stable disease, is continuing to enroll patients. First interim results could become available by year-end 2007.
* Clinical programs evaluating the safety and efficacy of high-dose miglustat (Zavesca®) in lysosomal storage disorders with predominant neurological manifestations, namely Niemann-Pick type C (NP-C) and Gaucher type 3 (GD3) are ongoing. Both studies are now in their second year. Earlier encouraging findings with Zavesca in NP-C after 12 months of exposure are being discussed with regulatory authorities.
* In June 2006, Actelion announced the preliminary analysis of the dose-finding study CONSCIOUS-1, a multi-center, international, double-blind, randomized, placebo-controlled, parallel group, evaluating the safety and efficacy of three dose levels of clazosentan in preventing the occurrence of cerebral vasospasm following aneurysmal subarachnoid hemorrhage (SAH).
The preliminary analysis of CONSCIOUS-1 demonstrated significance for all three doses versus placebo in terms of clazosentan decreasing cerebral vasospasm in a dose-related fashion (primary endpoint). In the study, the significant reduction in cerebral vasospasm did not translate into an overall clinical benefit as assessed by the chosen key secondary composite endpoint: occurrence of morbidity / mortality.
A full data analysis and consultation with clinical experts is currently ongoing to better understand the apparent disconnect in this study between the significant reduction in cerebral vasospasm and clinical outcome assessed by the endpoint chosen. The company expects that it can make decisions on future development of this compound later in 2006.
* Actelion-1, an undisclosed compound is currently in a Phase IIa program to evaluate its potential in cardiovascular indications. The company expects that it can make decisions on future development of this compound later in 2006.
* In the first half of 2006, the company also commenced enrollment in the Phase II program for Actelion’s Orexin Receptor Antagonist, evaluating the safety and efficacy of this novel compound in patients suffering from insomnia. The company expects that it can make decisions on future development of this compound in the first half of 2007.
* In the first half of 2006, Actelion commenced Phase I with its selective S1P1 receptor agonist, evaluating the safety and tolerability of this compound in healthy volunteers. S1P1 agonism might have therapeutic potential in multiple autoimmune diseases, such as multiple sclerosis or rheumatoid arthritis.
In mid-July 2006, Actelion entered into an exclusive worldwide collaboration with Roche to jointly develop and commercialize Actelion’s selective S1P1 receptor agonist, an immunomodulator with the potential for once-a-day oral dosing. The two companies plan to jointly develop and commercialize this novel compound for multiple autoimmune disorders.
The S1P1 collaboration covers both the current selective S1P1 receptor agonist in Phase I as well as any other selective S1P1 receptor agonists resulting from Actelion’s research efforts in the field. Roche will pay Actelion an upfront payment of USD 75 million in the second half of 2006. In the case of future dev e l opm ent and approval milestones being achieved, Actelion will be eligible to receive additional payments of up to USD 555 million for the first compound for all targeted indications. Further development and approval milestone payments are due for further compounds. On all product sales, Roche will pay Actelion undisclosed royalties.
For the current selective S1P1 receptor agonist, Actelion will fully fund all development activities up to the end of Phase II for the first two indications. All subsequent development and commercialization costs will be shared equally between Roche and Actelion. Both companies will co-promote any product resulting from this collaboration and equally share profit.
* In July 2006, a third milestone in the Global Actelion Merck Renin Inhibitor Alliance project was achieved with entry into man of the first renin inhibitor. For this start of Phase 1, Actelion received a milestone payment of USD 7 million.
* During the first six months of 2006, Actelion initiated full preclinical development for two novel first-in-class compounds in the fields of allergy and antibacterials.
* An additional number of unnamed projects are in various phases of drug discovery. These projects target indications in immunology, cardiovascular disease, infectious disease and central nervous system disorders.
Actelion Ltd
Actelion Ltd is a biopharmaceutical company with its corporate headquarter in Allschwil/Basel, Switzerland. Actelion's first drug Tracleer®, an orally available dual endothelin receptor antagonist, has been approved as a therapy for pulmonary arterial hypertension. Actelion markets Tracleer® through its own subsidiaries in key markets worldwide, including the United States (based in South San Francisco), the European Union, Japan as well as Canada, Australia and Switzerland. Actelion, founded in late 1997, is a leading player in innovative science related to the endothelium – the single layer of cells separating every blood vessel from the blood st rea m. A ctel ion focuses on the discovery, development and marketing of innovative drugs for significant unmet medical needs. Actelion shares are traded on the SWX Swiss Exchange (ticker symbol: ATLN).
Widerstand bei 150 CHF scheint zu fallen.
Schon paar Tage alt aber wurde hier glaub ich noch nicht gepostet:
31.07.2006 16:36:50
Actelion empfohlen
Düsseldorf (aktiencheck.de AG) - Für die Experten der "Wirtschaftswoche" zählt die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) zu den Empfehlungen der Woche. Der Umsatz im ersten Halbjahr habe beim erst neun Jahre alten Biotech-Spezialisten im Vergleich zum ersten Semester 2005 um 48% auf 437 Mio. CHF zugelegt, der operative Gewinn um 53% auf 120,3 Mio. CHF. Zugleich hätten die Schweizer den Ausblick für das Gesamtjahr erhöht. Mit dem Pharmariesen Roche habe Actelion einen Deal vereinbart, der in der Biotech-Branche seinesgleichen suche. Actelion betreibe Forschungen an einem neuen Wirkstoffkomplex gegen Autoimmunerkrankungen wie Schuppenflechte oder multiple Sklerose. Der Markt sei groß und der Wirkstoff wäre ein Goldesel. Die Gesellschaft befinde sich mit ihrem Präparat noch am Beginn der klinischen Tests (Phase I), aber dennoch werde Roche noch 2006 vorab 75 Mio. USD an Actelion für weitere Forschungen zahlen. Überwinde man die Hürden zu den späteren Testphasen würden so genannte Milestone-Zahlungen folgen, unter dem Strich in Höhe von 555 Mio. USD. Die Kosten in der besonders teuren klinischen Phase III und in der Vermarktung würden sich die beiden Unternehmen teilen, ebenso den Gewinn aus den ersten beiden marktreifen Medikamenten. Vor allem die Marketing-Stärke von Roche würde, im Falle einer Zulassung, der kleinen Actelion auf dem Weg zu einem ersten Blockbuster helfen. Nach Ansicht der Experten der "Wirtschaftswoche" gehört die Actelion-Aktie zu den Empfehlungen der Woche. Anleger sollten bei 110,00 CHF einen Stoppkurs platzieren. (31.07.2006/ac/a/a)
Quelle:AKTIENCHECK.DE
31.07.2006 16:36:50
Actelion empfohlen
Düsseldorf (aktiencheck.de AG) - Für die Experten der "Wirtschaftswoche" zählt die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) zu den Empfehlungen der Woche. Der Umsatz im ersten Halbjahr habe beim erst neun Jahre alten Biotech-Spezialisten im Vergleich zum ersten Semester 2005 um 48% auf 437 Mio. CHF zugelegt, der operative Gewinn um 53% auf 120,3 Mio. CHF. Zugleich hätten die Schweizer den Ausblick für das Gesamtjahr erhöht. Mit dem Pharmariesen Roche habe Actelion einen Deal vereinbart, der in der Biotech-Branche seinesgleichen suche. Actelion betreibe Forschungen an einem neuen Wirkstoffkomplex gegen Autoimmunerkrankungen wie Schuppenflechte oder multiple Sklerose. Der Markt sei groß und der Wirkstoff wäre ein Goldesel. Die Gesellschaft befinde sich mit ihrem Präparat noch am Beginn der klinischen Tests (Phase I), aber dennoch werde Roche noch 2006 vorab 75 Mio. USD an Actelion für weitere Forschungen zahlen. Überwinde man die Hürden zu den späteren Testphasen würden so genannte Milestone-Zahlungen folgen, unter dem Strich in Höhe von 555 Mio. USD. Die Kosten in der besonders teuren klinischen Phase III und in der Vermarktung würden sich die beiden Unternehmen teilen, ebenso den Gewinn aus den ersten beiden marktreifen Medikamenten. Vor allem die Marketing-Stärke von Roche würde, im Falle einer Zulassung, der kleinen Actelion auf dem Weg zu einem ersten Blockbuster helfen. Nach Ansicht der Experten der "Wirtschaftswoche" gehört die Actelion-Aktie zu den Empfehlungen der Woche. Anleger sollten bei 110,00 CHF einen Stoppkurs platzieren. (31.07.2006/ac/a/a)
Quelle:AKTIENCHECK.DE
Actelion Among Biotech Top Picks -Vontobel
Friday, September 29, 2006 6:16:36 AM ET
Dow Jones Newswires
0901 GMT [Dow Jones]--Actelion (ATLN.EB), Arpida (ARPN.EB) and Cytos (CYTN.EB) are the Swiss biotech top-picks for Vontobel, as they all have interesting upside potential. Adds that while the US Biotech indices develop negatively, Swiss biotech valuations show a more positive picture. In addition, success stories like Actelion also increase the attractiveness of the sector for more general investors, such as Swiss pension funds. Actelion -0.3% at CHF178.50 , Arpida +2.6% at CHF27.45, Cytos trades flat at CHF126.2.(SWZ)
Friday, September 29, 2006 6:16:36 AM ET
Dow Jones Newswires
0901 GMT [Dow Jones]--Actelion (ATLN.EB), Arpida (ARPN.EB) and Cytos (CYTN.EB) are the Swiss biotech top-picks for Vontobel, as they all have interesting upside potential. Adds that while the US Biotech indices develop negatively, Swiss biotech valuations show a more positive picture. In addition, success stories like Actelion also increase the attractiveness of the sector for more general investors, such as Swiss pension funds. Actelion -0.3% at CHF178.50 , Arpida +2.6% at CHF27.45, Cytos trades flat at CHF126.2.(SWZ)
Wäre Actelion nicht auch ein geeigneter Übernahmekandidat?
Für 250 CHF / Aktie könnte etwas gehen.
CI
Für 250 CHF / Aktie könnte etwas gehen.
CI
Actelion Undervalued,Myogen Deal Shows-Helvea
Tuesday, October 03, 2006 5:01:56 AM ET
Dow Jones Newswires
0742 GMT [Dow Jones]--Actelion (ATLN.EB) is undervalued, says Helvea analyst Olav Zilian. The takover of rival Myogen (MYOG) by Gilead Sciences (GILD) Monday for around $2.5B is an indicator that market underestimates the sales potential of Actelion's main drug Tracleers, as well as its pipeline. "We consider the acquisition price of Myogen as an independent indicator for the current under-valuation of Actelion," he says. Actelion's current market capitalisation is around CHF4.2B. Myogen has a product in the pipeline that some analysts say could challenge Tracleer. Reiterate buy recommendation with a price target of CHF262. Trades -0.2% at CHF183.70. (AAG)
Tuesday, October 03, 2006 5:01:56 AM ET
Dow Jones Newswires
0742 GMT [Dow Jones]--Actelion (ATLN.EB) is undervalued, says Helvea analyst Olav Zilian. The takover of rival Myogen (MYOG) by Gilead Sciences (GILD) Monday for around $2.5B is an indicator that market underestimates the sales potential of Actelion's main drug Tracleers, as well as its pipeline. "We consider the acquisition price of Myogen as an independent indicator for the current under-valuation of Actelion," he says. Actelion's current market capitalisation is around CHF4.2B. Myogen has a product in the pipeline that some analysts say could challenge Tracleer. Reiterate buy recommendation with a price target of CHF262. Trades -0.2% at CHF183.70. (AAG)
Actelion announces 9-month results for 2006
Total net revenue of CHF 684.3 million, up 43 percent – Tracleer® sales of CHF 651.9 m – Pipeline expansion ongoing - Operating profit of CHF 196.8 m, up 56 percent – Net profit of CHF 171.8 m, up 70 percent - Upgraded revenue and profit guidance for 2006
ALLSCHWIL, SWITZERLAND – 19 October 2006 – Actelion Ltd (SWX: ATLN) today announced its financial results for the first nine months of 2006. With total net revenues for the first nine months of 2006 of CHF 684.3 million (9 m 2005: CHF 477.1 m) and operating expenses of CHF 487.5 million (9 m 2005: 351.0 m), the company reported an operating profit of CHF 196.8 million (9 m 2005: CHF 126.1 m). The net profit for the first nine months of 2006 was CHF 171.8 million (9 m 2005 CHF 101.3 m).
Basic earnings per share (EPS) for the first nine months of 2006 improved to CHF 7.60, compared to CHF 4.55 in the first nine months of 2005. In the first nine months of 2006 Actelion generated net cash flow from operating activities of CHF 271.6 million (9 m 2005: CHF 90.2 m). Cash, cash equivalents and short-term deposits and marketable securities as of 30 September 2006 were CHF 636.3 million (30 June 2006: CHF 448.1 m).
Jean-Paul Clozel, MD and Chief Executive Officer, commented: “In the first nine months of 2006, Actelion has been able to focus on operational performance in the market place as well as expanding our efforts in research and development.”
He continued: “In the market place, we have been very successful in increasing awareness about PAH and the unprecedented treatment option provided by Tracleer®, our dual endothelin receptor antagonist first introduced in the United States at the end of 2001. Actelion is committed to further advance and lead the PAH field, with numerous clinical and other programs already ongoing or soon to start.”
Jean-Paul Clozel added: “Our nine years of continuing and expanding investment in other potential medical breakthroughs could result in five different compounds in the final stage of clinical development in 2007, next to an already large lifecycle management program.”
Andrew J. Oakley, Chief Financial Officer commented: "Our financial results continue to be outstanding as Tracleer® sales continued to grow across all markets. I am especially pleased that we have been able to increase net profit by no less than 70 percent compared to the same period last year. With October launches in South Korea and China, we are continuing to expand our revenue base.”
Andrew J. Oakley continued: “The strong performance of Actelion year to date allows us to revise our full year net revenue guidance upwards, from between 880 to 910 to between 930 and 940 million Swiss Francs – unforeseen events excluded. With expenditures as forecasted, Actelion is also revising its operating profit guidance upwards, from between 215 to 230 million to between 240 and 260 million Swiss Francs for the full year 2006.”
The full financial statements can be found on http://www.actelion.com.
Outstanding growth of total net revenues
In the first nine months of 2006, Actelion had total net revenues of CHF 684.3 million (9 m 2005: CHF 477.1 m). On a quarter-to-quarter basis, net revenues increased by 9 percent to CHF 247.2 million (Q2 2006: CHF 226.5 m).
Contract revenues for the first nine months of 2006 amounted to CHF 14.5 million (9 m 2005: CHF 12.1 m). On a quarter-to-quarter basis, contract revenues increased to CHF 6.8 million (Q2 2006: CHF 3.8 m).
For the Full Year 2006, Actelion now expects total net revenue to reach between CHF 930 and CHF 940 million, compared to between CHF 880 and CHF 910 million as previously guided with the H1 2006 results.
Tracleer® sales growth continuing
In the first nine months of 2006, Tracleer® sales were CHF 651.9 million (9 months 2005: CHF 455.1 m). On a quarter-to-quarter basis, Tracleer® revenues increased by 8 percent to CHF 234.0 million (Q2 2006: 216.5 m). This increase may partially be attributed to buying pattern variations, similar to those seen in previous quarters.
At the end of September 2006, Tracleer® was commercially available in 35 countries worldwide, including all major pharmaceutical markets. In October 2006, Tracleer® is being introduced in China and, together with Handok, in South Korea. Regulatory and/or reimbursement reviews are ongoing in many other countries, such as some new EU member states as well as in some South East Asian countries.
In many territories, regulatory review is ongoing regarding the inclusion of data from BREATHE-4 and BREATHE-5 studies that included patients with PAH associated with HIV and PAH associated with congenital heart disease (CHD) respectively. In late September, the European regulatory body (EMEA) issued a positive opinion on the application, expected to result in the inclusion of the findings in the EU prescribing information by year-end.
At the World Congress of Cardiology in Barcelona in early September, Actelion launched the first-ever global PAH awareness campaign to further increase disease awareness amongst healthcare professionals and increase the number of patients appropriately diagnosed and treated. At the same time, the educational website www.pah-info.com was launched to provide the medical community with up-to-date information on the disease and its diagnosis.
Steady growth for Zavesca® sales
Zavesca® sales in the approved indication type 1 Gaucher disease contributed in the first nine months of 2006 CHF 18.0 m i l l ion (9 months 2005: CHF 9.8 m). On a quarter-to-quarter basis, Zavesca® revenues increased by approximately 3 percent to CHF 6.4 million (Q2 2006: 6.2 m). Zavesca® is commercially available in the United States and in most European markets.
Operating expenses reflect substantial efforts in both marketing and R&D
In the first nine months of 2006 operating expenses were CHF 487.5 million (9 m 2005: CHF 351.0 m). In Q3 2006, operating expenses were CHF 170.7 million. Compared to the previous quarter, this represents an increase of 2 percent (Q2 2006: CHF 167.3 m).
For the Full Year 2006, Actelion expects total operating expenses to reach between CHF 675 million and CHF 750 million, including a total non-cash charge of approximately CHF 30 million for stock-based compensation.
In the first nine months of 2006, research and development expenses were CHF 155.1 million (9 m 2005: CHF 121.2 m). In Q3 2006 research and development expenses were CHF 54.1 million, this represents an increase of 1 percent (Q2 2006: CHF 53.3 m).
In the first nine months of 2006, marketing and advertising expenses were CHF 129.4 million (9 m 2005: 88.6 m). In Q3 2006 marketing and advertising expenses were CHF 43.5 million, a decrease of 3 percent compared to the previous quarter (Q2 2006: CHF 44.8 m).
In the first nine months of 2006, selling, general and administrative expenses amounted to CHF 133.2 million (9 m 2005: CHF 92.7 m). In Q3 2006, selling, general and administrative expenses were CHF 48.6 million, an increase of 7 percent compared to the previous quarter (Q2 2006: CHF 45.3 m).
Strong operating profit
In the first nine months of 2006, a strong increase in sales revenues resulted in an operating profit of CHF 196.8 million (9 m 2005: CHF 126.1 m).
Q3 2006 operating profit of CHF 76.5 million was 29 percent higher than the previous quarter (Q2 2006: CHF 59.3 m).
For the Full Year 2006, Actelion now expects that operating profit will reach between CHF 240 and 260 million, compared to previous guidance of CHF 215 and CHF 230 million.
Non-operating items and cash
In the first nine months of 2006, the net profit of CHF 171.8 million (9 m 2005: CHF 101.3 m) includes interest income of CHF 4.6 million, interest expense of CHF 0.05 million, a non-cash charge on the Convertible Bond of CHF 6.1 million, foreign currency gains of CHF 6.6 million and an income tax expense of CHF 30.0 million.
In Q3 2006, the net profit was CHF 66.8 million compared to CHF 51.3 million in the previous quarter.
In the first nine months of 2006, Actelion generated net cash flow from operations of CHF 271.6 million (9 m 2005: CHF 90.2 m). Cash and cash equivalents, short-term deposits and marketable securities as of 30 September 2006 were CHF 636.3 million (30 June 2006: CHF 448.1 m).
Research and Development programs on track
Actelion provided a full update on its current R&D projects in July. All research and development programs are on track.
In early October 2006, Actelion presented the full data analysis of dose-finding study CONSCIOUS-1 (Clazosentan to Overcome Neurological iSChemia and Infarct OccUrring after Subarachnoid hemorrhage). The study reported significant reduction of cerebral vasospasm in patients with aneurysmal subarachnoid hemorrhage in a dose-dependent fashion. Post-hoc blinded central assessment showed a dose-dependent trend towards improved morbidity/mortality. Discussions with regulatory authorities on the appropriate pivotal trial design are forthcoming.
Actelion will provide a full and complete update and all its projects at the upcoming Research and Development day, to be held at the Actelion premises on 22 February 2007. At the same occasion, Actelion will also report its Full Year result 2006.
By the 22nd o f F e bruary 2007, Actelion expects to provide individual updates on
* Actelion-1, an undisclosed cardiovascular agent in Phase IIa
* EARLY, a Phase III study evaluating safety and efficacy of bosentan (Tracleer®) in WHO class 2 PAH patients
Actelion’s financial calendar 2007
Date:
Event:
22 February 2007
Full year 2006 results, R&D day
19 April 2007
3-month 2007 financial results
19 July 2007
6-month 2007 financial results
18 October 2007
9-month 2007 financial results
Total net revenue of CHF 684.3 million, up 43 percent – Tracleer® sales of CHF 651.9 m – Pipeline expansion ongoing - Operating profit of CHF 196.8 m, up 56 percent – Net profit of CHF 171.8 m, up 70 percent - Upgraded revenue and profit guidance for 2006
ALLSCHWIL, SWITZERLAND – 19 October 2006 – Actelion Ltd (SWX: ATLN) today announced its financial results for the first nine months of 2006. With total net revenues for the first nine months of 2006 of CHF 684.3 million (9 m 2005: CHF 477.1 m) and operating expenses of CHF 487.5 million (9 m 2005: 351.0 m), the company reported an operating profit of CHF 196.8 million (9 m 2005: CHF 126.1 m). The net profit for the first nine months of 2006 was CHF 171.8 million (9 m 2005 CHF 101.3 m).
Basic earnings per share (EPS) for the first nine months of 2006 improved to CHF 7.60, compared to CHF 4.55 in the first nine months of 2005. In the first nine months of 2006 Actelion generated net cash flow from operating activities of CHF 271.6 million (9 m 2005: CHF 90.2 m). Cash, cash equivalents and short-term deposits and marketable securities as of 30 September 2006 were CHF 636.3 million (30 June 2006: CHF 448.1 m).
Jean-Paul Clozel, MD and Chief Executive Officer, commented: “In the first nine months of 2006, Actelion has been able to focus on operational performance in the market place as well as expanding our efforts in research and development.”
He continued: “In the market place, we have been very successful in increasing awareness about PAH and the unprecedented treatment option provided by Tracleer®, our dual endothelin receptor antagonist first introduced in the United States at the end of 2001. Actelion is committed to further advance and lead the PAH field, with numerous clinical and other programs already ongoing or soon to start.”
Jean-Paul Clozel added: “Our nine years of continuing and expanding investment in other potential medical breakthroughs could result in five different compounds in the final stage of clinical development in 2007, next to an already large lifecycle management program.”
Andrew J. Oakley, Chief Financial Officer commented: "Our financial results continue to be outstanding as Tracleer® sales continued to grow across all markets. I am especially pleased that we have been able to increase net profit by no less than 70 percent compared to the same period last year. With October launches in South Korea and China, we are continuing to expand our revenue base.”
Andrew J. Oakley continued: “The strong performance of Actelion year to date allows us to revise our full year net revenue guidance upwards, from between 880 to 910 to between 930 and 940 million Swiss Francs – unforeseen events excluded. With expenditures as forecasted, Actelion is also revising its operating profit guidance upwards, from between 215 to 230 million to between 240 and 260 million Swiss Francs for the full year 2006.”
The full financial statements can be found on http://www.actelion.com.
Outstanding growth of total net revenues
In the first nine months of 2006, Actelion had total net revenues of CHF 684.3 million (9 m 2005: CHF 477.1 m). On a quarter-to-quarter basis, net revenues increased by 9 percent to CHF 247.2 million (Q2 2006: CHF 226.5 m).
Contract revenues for the first nine months of 2006 amounted to CHF 14.5 million (9 m 2005: CHF 12.1 m). On a quarter-to-quarter basis, contract revenues increased to CHF 6.8 million (Q2 2006: CHF 3.8 m).
For the Full Year 2006, Actelion now expects total net revenue to reach between CHF 930 and CHF 940 million, compared to between CHF 880 and CHF 910 million as previously guided with the H1 2006 results.
Tracleer® sales growth continuing
In the first nine months of 2006, Tracleer® sales were CHF 651.9 million (9 months 2005: CHF 455.1 m). On a quarter-to-quarter basis, Tracleer® revenues increased by 8 percent to CHF 234.0 million (Q2 2006: 216.5 m). This increase may partially be attributed to buying pattern variations, similar to those seen in previous quarters.
At the end of September 2006, Tracleer® was commercially available in 35 countries worldwide, including all major pharmaceutical markets. In October 2006, Tracleer® is being introduced in China and, together with Handok, in South Korea. Regulatory and/or reimbursement reviews are ongoing in many other countries, such as some new EU member states as well as in some South East Asian countries.
In many territories, regulatory review is ongoing regarding the inclusion of data from BREATHE-4 and BREATHE-5 studies that included patients with PAH associated with HIV and PAH associated with congenital heart disease (CHD) respectively. In late September, the European regulatory body (EMEA) issued a positive opinion on the application, expected to result in the inclusion of the findings in the EU prescribing information by year-end.
At the World Congress of Cardiology in Barcelona in early September, Actelion launched the first-ever global PAH awareness campaign to further increase disease awareness amongst healthcare professionals and increase the number of patients appropriately diagnosed and treated. At the same time, the educational website www.pah-info.com was launched to provide the medical community with up-to-date information on the disease and its diagnosis.
Steady growth for Zavesca® sales
Zavesca® sales in the approved indication type 1 Gaucher disease contributed in the first nine months of 2006 CHF 18.0 m i l l ion (9 months 2005: CHF 9.8 m). On a quarter-to-quarter basis, Zavesca® revenues increased by approximately 3 percent to CHF 6.4 million (Q2 2006: 6.2 m). Zavesca® is commercially available in the United States and in most European markets.
Operating expenses reflect substantial efforts in both marketing and R&D
In the first nine months of 2006 operating expenses were CHF 487.5 million (9 m 2005: CHF 351.0 m). In Q3 2006, operating expenses were CHF 170.7 million. Compared to the previous quarter, this represents an increase of 2 percent (Q2 2006: CHF 167.3 m).
For the Full Year 2006, Actelion expects total operating expenses to reach between CHF 675 million and CHF 750 million, including a total non-cash charge of approximately CHF 30 million for stock-based compensation.
In the first nine months of 2006, research and development expenses were CHF 155.1 million (9 m 2005: CHF 121.2 m). In Q3 2006 research and development expenses were CHF 54.1 million, this represents an increase of 1 percent (Q2 2006: CHF 53.3 m).
In the first nine months of 2006, marketing and advertising expenses were CHF 129.4 million (9 m 2005: 88.6 m). In Q3 2006 marketing and advertising expenses were CHF 43.5 million, a decrease of 3 percent compared to the previous quarter (Q2 2006: CHF 44.8 m).
In the first nine months of 2006, selling, general and administrative expenses amounted to CHF 133.2 million (9 m 2005: CHF 92.7 m). In Q3 2006, selling, general and administrative expenses were CHF 48.6 million, an increase of 7 percent compared to the previous quarter (Q2 2006: CHF 45.3 m).
Strong operating profit
In the first nine months of 2006, a strong increase in sales revenues resulted in an operating profit of CHF 196.8 million (9 m 2005: CHF 126.1 m).
Q3 2006 operating profit of CHF 76.5 million was 29 percent higher than the previous quarter (Q2 2006: CHF 59.3 m).
For the Full Year 2006, Actelion now expects that operating profit will reach between CHF 240 and 260 million, compared to previous guidance of CHF 215 and CHF 230 million.
Non-operating items and cash
In the first nine months of 2006, the net profit of CHF 171.8 million (9 m 2005: CHF 101.3 m) includes interest income of CHF 4.6 million, interest expense of CHF 0.05 million, a non-cash charge on the Convertible Bond of CHF 6.1 million, foreign currency gains of CHF 6.6 million and an income tax expense of CHF 30.0 million.
In Q3 2006, the net profit was CHF 66.8 million compared to CHF 51.3 million in the previous quarter.
In the first nine months of 2006, Actelion generated net cash flow from operations of CHF 271.6 million (9 m 2005: CHF 90.2 m). Cash and cash equivalents, short-term deposits and marketable securities as of 30 September 2006 were CHF 636.3 million (30 June 2006: CHF 448.1 m).
Research and Development programs on track
Actelion provided a full update on its current R&D projects in July. All research and development programs are on track.
In early October 2006, Actelion presented the full data analysis of dose-finding study CONSCIOUS-1 (Clazosentan to Overcome Neurological iSChemia and Infarct OccUrring after Subarachnoid hemorrhage). The study reported significant reduction of cerebral vasospasm in patients with aneurysmal subarachnoid hemorrhage in a dose-dependent fashion. Post-hoc blinded central assessment showed a dose-dependent trend towards improved morbidity/mortality. Discussions with regulatory authorities on the appropriate pivotal trial design are forthcoming.
Actelion will provide a full and complete update and all its projects at the upcoming Research and Development day, to be held at the Actelion premises on 22 February 2007. At the same occasion, Actelion will also report its Full Year result 2006.
By the 22nd o f F e bruary 2007, Actelion expects to provide individual updates on
* Actelion-1, an undisclosed cardiovascular agent in Phase IIa
* EARLY, a Phase III study evaluating safety and efficacy of bosentan (Tracleer®) in WHO class 2 PAH patients
Actelion’s financial calendar 2007
Date:
Event:
22 February 2007
Full year 2006 results, R&D day
19 April 2007
3-month 2007 financial results
19 July 2007
6-month 2007 financial results
18 October 2007
9-month 2007 financial results
ich denke mal hier geht es mindestens bis 250 SFR aufwärts

immer schön bleiben
bleiben


immer schön
 bleiben
bleiben
keiner da???

Actelion announces definitive agreement to acquire US-based CoTherix, Inc.
Strengthening Actelion’s strong role in advancing PAH therapy – Strengthening the reach of Ventavis® in the United States – Immediate positive effect expected on 2007 cash earnings - Bolsters Actelion’s focus on its expanding development pipeline through increased operational cash generation
ALLSCHWIL, SWITZERLAND AND BRISBANE, CALIFORNIA – 20 November 2006 – Actelion Ltd (SWX: ATLN) today announced that it has entered into a definitive agreement to acquire CoTherix, Inc. (Nasdaq: CTRX), a biopharmaceutical company with its headquarters in Brisbane, California. CoTherix currently markets Ventavis® (iloprost), the only approved inhaled therapy for the treatment of Pulmonary Arterial Hypertension in the United States.
The transaction has been approved unanimously by the Boards of Directors of both companies. Actelion will commence a cash tender offer of USD 13.50 per CoTherix Inc. share, for a total acquisition price of approximately USD 420 million (CHF 525 million). This represents an approximate premium of 72 percent over the closing price 1 month prior, and a 21 percent premium over CoTherix’s closing price of USD 11.20 on Friday, November 17, 2006. Subject to regulatory clearance and other customary closing conditions, the transaction is expected to conclude early in Q1 2007.
The directors and executive officers of CoTherix and additional stockholders, together owning approximately 32% of the outstanding shares, have agreed with Actelion to tender their shares pursuant to the offer, subject to customary terms and conditions, including termination rights.
Actelion has had a longstanding relationship with CoTherix, developed through a shared focus on Pulmonary Arterial Hypertension. This relationship was extended with CoTherix’s clinical STEP trial investigating the combined use of Tracleer® and Ventavis®. Based on that relationship, the two companies had previously commenced discussions regarding the strong strategic fit between the two businesses. Those discussions were placed on hold due to certain contractual obligations of CoTherix. Last Friday, after the close of the Swiss market and following the earlier than expected conclusion of these obligations CoTherix inquired of Actelion whether it wished to resume discussions. Following this, Actelion completed its due diligence and the companies finalized negotiations, resulting in the Boards of Directors of both companies approving the transaction and entering into the definitive agreement.
Immediate positive impact on Actelion’s cash earnings
In 2007, Actelion expects Ventavis® sales to contribute more than USD 100 million (CHF 125 million) to product revenues. Actelion expects the transaction to be accretive to cash earnings in 2007 as a result of synergies. In terms of US-GAAP earnings, the transaction is expected to be dilutive in 2007 due to a substantial one-time non-cash charge for in-process research and development (IPRD). The transaction is expected to be accretive to US-GAAP earnings beginning in 2008.
Strengthening PAH therapy – Strengthening the reach of Ventavis®
Jean-Paul Clozel, MD and Chief Executive Officer, commented: “We expect that the transaction will generate immediate substantial value, adding top-line revenue and bottom-line cash earnings by leveraging our existing marketing and sales infrastructure in the United States and expanding the reach of Ventavis®.”
Jean-Paul Clozel continued: “CoTherix and its employees have done an outstanding job with Ventavis®, a product commercially available in the US since March 2005. Through the acquisition of CoTherix, Actelion will further lead the drive towards improved PAH therapy, both today with the existing form of Ventavis® and potentially tomorrow through improved delivery systems and dry-powder inhalation to further enhance convenience for patients.”
Jean-Paul Clozel added: ”By introducing our orally available dual endothelin receptor antagonist Tracleer® (bosentan) in late 2001, Actelion has always led the drive for improved PAH therapy. By applying the proven abilities of our drug development team with those of CoTherix, we are committed to accelerating Ventavis’® develop ment in order to support today's trend of combining agents from multiple drug classes to improve treatment outcomes for patients.”
Donald J. Santel, Chief Executive Officer of CoTherix, Inc, said: “Our vision for CoTherix has been to advance the therapeutic options for patients with cardiovascular disease. Through the efforts of our talented and dedicated employees, we've been successful in introducing Ventavis, the first non-invasive prostacyclin for PAH in the United States. The proposed combination with Actelion, a global leader in cardio-pulmonary medicine, will further accelerate this vision and provide additional benefit to the patient population we've been privileged to serve.”
Jean-Paul Clozel concluded: “This acquisition will leave unchanged the Actelion culture with its desire to discover, develop and market new innovative medicines. Actelion has never been in a better position for substantial future growth from our rapidly expanding product pipeline, with possibly five different compounds in Phase III in 2007.”
Additional information and where to find it:
The tender offer for the outstanding common stock of CoTherix has not yet commenced. It is expected to commence on 8 December 2006. This announcement is for informational purposes only and is neither an offer to purchase nor a solicitation of an offer to sell shares of CoTherix. CoTherix stockholders are urged to read the relevant tender offer materials to be filed with the Securities and Exchange Commission and forwarded to CoTherix stockholders (including an Offer to Purchase, a related Letter of Transmittal and certain other offer documents) and the Solicitation/ Recommendation Statement, which will contain important information which should be read carefully before any decision is made with respect to the tender offer. The Offer to Purchase, the related Letter of Transmittal and certain other offer documents, as well as the Solicitation/Recommendation Statement, will be made available to all stockholders of CoTherix at no expense to them, and will be available for free at the Commission's web site at www.sec.gov. Free copies of the Offer to Purchase, the related Letter of Transmittal and certain other offering documents will be available from Actelion by mailing requests for such materials to Actelion US Holding Company, 333 Lakeside Drive, Foster City, CA 94404, attention: Investor Relations.
In addition to the Offer to Purchase, the related Letter of Transmittal and certain other offer documents, as well as the Solicitation/Recommendation Statement, CoTherix files annual, quarterly and special reports, proxy statements and other information with the Securities and Exchange Commission. You may read and copy any reports, statements or other information filed by CoTherix at the SEC public reference room at 100 F Street, N.E., Washington, D.C. 20549. Please call the Commission at 1-800-SEC-0330 for further information on the public reference room. CoTherix’s filings with the Commission are also available to the public from commercial document-retrieval services and at the website maintained by the Commission at www.sec.gov.
Information on interests of certain persons in the offer and the merger:
Actelion will be, and certain other persons may be, soliciting CoTherix stockholders to tender their shares into the tender offer. The directors and executive officers of Actelion and the directors and executive officers of CoTherix may be deemed to be participants in Actelion’s solicitation of CoTherix’s stockholders to tender their shares into the tender offer.
Additional background information:
About the transaction
Pursuant to the Agreement and Plan of Merger between the parties, Actelion will commence a tender offer to purchase all the outstanding shares of CoTherix, Inc. for USD 13.50 per share on 8 December 2006. This offer is subject to cu stomary conditions, including the tender of at least a majority of the shares of CoTherix common stock outstanding and clearance under the United States Hart-Scott-Rodino Antitrust Improvements Act. Following the successful completion of the tender offer, a subsidiary of Actelion is expected to merge with CoTherix, resulting in CoTherix becoming a wholly-owned subsidiary of Actelion. Lehman Brothers is acting as an adviser to Actelion in relation to this transaction. CIBC World Markets Corp. is acting as financial advisor to CoTherix.
About the financing of the transaction
On 30 September 2006, Actelion has reported cash, cash equivalents and short-term deposits and marketable securities of CHF 636.3 million. The financing of the acquisition can therefore be made entirely from the existing cash balance. In addition, on 9 November 2006, the company priced a CHF 460 million zero-coupon, zero yield to maturity convertible bond with a settlement date of 22 November 2006. The transaction is not subject to a financing condition.
About Pulmonary Arterial Hypertension (PAH)
Pulmonary arterial hypertension (PAH) is a chronic, life-threatening disorder characterized by abnormally high blood pressure in the arteries between the heart and lungs of an affected individual. The function of the heart and lungs is severely compromised, manifested by a limited exercise capacity, and, ultimately, a reduced life expectancy. Approximately 100,000 people in Europe and the United States are afflicted with either primary or secondary forms of the disease related to conditions or tissue disorders that affect the lungs, such as scleroderma, lupus, HIV/AIDS or congenital heart disease.
About Tracleer® in Pulmonary Arterial Hypertension (PAH)
Tracleer® (bosentan), the first oral dual endothelin receptor antagonist, is approved for the treatment of pulmonary arterial hypertension (PAH) and made available by Actelion subsidiaries in the United States, the European Union, Japan, Australia, Canada, Switzerland and other markets worldwide.
In clinical trials leading to the marketing approval of the drug, approximately 11% of PAH patients receiving Tracleer® experienced abnormal but reversible liver enzyme elevations. It is therefore important that patients undergo monthly liver monitoring. Due to the risk of birth defects, women who are pregnant, or of childbearing age that do not use a reliable method of contraception, must not take Tracleer®.
About bosentan in clinical development for PAH
Actelion aims to develop products to their maximum potential by implementing comprehensive strategies of line extensions and new indications. Since gaining approval of Tracleer® in 2001, Actelion has continued to invest in further clinical trials to expand its use. In many territories, regulatory review is ongoing regarding the inclusion of data from BREATHE-4 and BREATHE-5 studies that included patients with PAH associated with HIV and PAH associated with congenital heart disease (CHD) respectively.
Several trials are currently underway to expand the bosentan treatment to class II PAH patients (EARLY), pediatric PAH patients (FUTURE-1), and in combination with sildenafil in PAH patients (COMPASS-1/-2). In addition, bosentan is evaluated in additional forms of PAH, such chronic thrombo-embolic pulmonary hypertension (BENEFIT) and, pulmonary hypertension secondary to sickle cell disease (ASSET-1/-2)
About Ventavis® (iloprost) inhalation solution
Ventavis® (iloprost) Inhalation Solution was approved by the U.S. Food and Drug Administration for the treatment of PAH (WHO Group I) in patients with NYHA class III or IV symptoms. In controlled trials, Ventavis® improved a composite endpoint consisting of exercise tolerance, symptoms (NYHA Class), and lack of deterioration. Ventavis® has not been adequately studied with concomitant use of other approved therapies for pulmonary arterial hypertension.
In March 2 005, top line data of the Phase II clinical trial STEP, evaluating the safety and added benefit of using Ventavis® Inhalation Solution therapy in patients with PAH already undergoing treatment with bosentan, were published. The analysis of this study showed that the combination of Ventavis® added to bosentan therapy was well tolerated and provided clinical benefit in patients with PAH.
In March 2006, CoTherix, Inc., initiated a Phase III clinical trial called VISION to evaluate the safety and efficacy of Ventavis® in combination with sildenafil, an approved oral treatment for PAH. The purpose of this multi-center international trial is to evaluate the safety and effectiveness of adding iloprost or placebo to sildenafil therapy for PAH. The study will also examine whether patients on sildenafil can reduce the number of iloprost inhalations from the approved 6 doses per day to 4 doses per day.
About CoTherix, Inc.
CoTherix, Inc. (Nasdaq: CTRX) is a biopharmaceutical company focused on licensing, developing and commercializing therapeutic products for the potential treatment of cardiovascular disease. CoTherix, Inc. licensed the exclusive U.S. rights to Ventavis® from Schering AG, which currently markets Ventavis® in Europe and Australia. In June 2006, CoTherix, Inc., licensed exclusive rights to develop and commercialize oral and inhaled formulations of Fasudil, a rho-kinase inhibitor, for the treatment of PAH and stable angina in North America and Europe from Asahi Kasei Pharma Corporation.
About Actelion Ltd
Actelion Ltd is a biopharmaceutical company with its corporate headquarters in Allschwil/Basel, Switzerland. Actelion's first drug Tracleer®, an orally available dual endothelin receptor antagonist, has been approved as a therapy for pulmonary arterial hypertension. Actelion markets Tracleer® through its own subsidiaries in key markets worldwide, including the United States (based in South San Francisco), the European Union, Japan, Canada, Australia and Switzerland. At the end of September 2006, Tracleer® was commercially available in 35 countries worldwide. Actelion, founded in late 1997, is a leading player in innovative science related to the endothelium – the single layer of cells separating every blood vessel from the blood stream. Actelion’s over 1’200 employees focus on the discovery, development and marketing of innovative drugs for significant unmet medical needs. Actelion shares are traded on the SWX Swiss Exchange (ticker symbol: ATLN).
Forward-Looking Statements
The statements contained in this press release that are not purely historical are forward-looking statements within the meaning of Section 21E of the Securities Exchange Act of 1934, as amended. Forward-looking statements in this press release include statements regarding CoTherix’s expectations, beliefs, hopes, goals, plans, intentions, initiatives or strategies, including statements regarding risks to both companies that the acquisition of CoTherix will not be consummated as the transaction is subject to certain closing conditions. In addition, when the transaction is consummated, there will be risks and uncertainties related to Actelion’s ability to successfully integrate the products of the two companies. Other factors discussed in the "Risk Factors" section of CoTherix's Quarterly Report on Form 10-Q for the period ended September 30, 2006 filed with the Securities and Exchange Commission.
###
For further information please contact:
Actelion Ltd, Gewerbestrasse 16, CH-4123 Allschwil
Investor Contact
Roland Haefeli
+41 61 565 64 58
+1 650 624 6936
Media Contact
Peter Engel
+41 61 565 66 28
+1 650 624 6996
http://www.actelion.com
For further information please contact:
CoTherix, Inc.
Investor Contact
Anne Bowdidge
+1 650 808 6551
Conference call
Actelion will host an Investor Conference Call and discussion/Q&A on Monday, 20 November 2006,
14.30 CET / 13.30 GMT / 08.30 a.m. ET
Dial:
+41 (0) 91 610 56 00
(Europe)
+1 (1) 866 291 41 66
(U.S.)
+44 (0) 207 107 06 11
(U.K.)
Strengthening Actelion’s strong role in advancing PAH therapy – Strengthening the reach of Ventavis® in the United States – Immediate positive effect expected on 2007 cash earnings - Bolsters Actelion’s focus on its expanding development pipeline through increased operational cash generation
ALLSCHWIL, SWITZERLAND AND BRISBANE, CALIFORNIA – 20 November 2006 – Actelion Ltd (SWX: ATLN) today announced that it has entered into a definitive agreement to acquire CoTherix, Inc. (Nasdaq: CTRX), a biopharmaceutical company with its headquarters in Brisbane, California. CoTherix currently markets Ventavis® (iloprost), the only approved inhaled therapy for the treatment of Pulmonary Arterial Hypertension in the United States.
The transaction has been approved unanimously by the Boards of Directors of both companies. Actelion will commence a cash tender offer of USD 13.50 per CoTherix Inc. share, for a total acquisition price of approximately USD 420 million (CHF 525 million). This represents an approximate premium of 72 percent over the closing price 1 month prior, and a 21 percent premium over CoTherix’s closing price of USD 11.20 on Friday, November 17, 2006. Subject to regulatory clearance and other customary closing conditions, the transaction is expected to conclude early in Q1 2007.
The directors and executive officers of CoTherix and additional stockholders, together owning approximately 32% of the outstanding shares, have agreed with Actelion to tender their shares pursuant to the offer, subject to customary terms and conditions, including termination rights.
Actelion has had a longstanding relationship with CoTherix, developed through a shared focus on Pulmonary Arterial Hypertension. This relationship was extended with CoTherix’s clinical STEP trial investigating the combined use of Tracleer® and Ventavis®. Based on that relationship, the two companies had previously commenced discussions regarding the strong strategic fit between the two businesses. Those discussions were placed on hold due to certain contractual obligations of CoTherix. Last Friday, after the close of the Swiss market and following the earlier than expected conclusion of these obligations CoTherix inquired of Actelion whether it wished to resume discussions. Following this, Actelion completed its due diligence and the companies finalized negotiations, resulting in the Boards of Directors of both companies approving the transaction and entering into the definitive agreement.
Immediate positive impact on Actelion’s cash earnings
In 2007, Actelion expects Ventavis® sales to contribute more than USD 100 million (CHF 125 million) to product revenues. Actelion expects the transaction to be accretive to cash earnings in 2007 as a result of synergies. In terms of US-GAAP earnings, the transaction is expected to be dilutive in 2007 due to a substantial one-time non-cash charge for in-process research and development (IPRD). The transaction is expected to be accretive to US-GAAP earnings beginning in 2008.
Strengthening PAH therapy – Strengthening the reach of Ventavis®
Jean-Paul Clozel, MD and Chief Executive Officer, commented: “We expect that the transaction will generate immediate substantial value, adding top-line revenue and bottom-line cash earnings by leveraging our existing marketing and sales infrastructure in the United States and expanding the reach of Ventavis®.”
Jean-Paul Clozel continued: “CoTherix and its employees have done an outstanding job with Ventavis®, a product commercially available in the US since March 2005. Through the acquisition of CoTherix, Actelion will further lead the drive towards improved PAH therapy, both today with the existing form of Ventavis® and potentially tomorrow through improved delivery systems and dry-powder inhalation to further enhance convenience for patients.”
Jean-Paul Clozel added: ”By introducing our orally available dual endothelin receptor antagonist Tracleer® (bosentan) in late 2001, Actelion has always led the drive for improved PAH therapy. By applying the proven abilities of our drug development team with those of CoTherix, we are committed to accelerating Ventavis’® develop ment in order to support today's trend of combining agents from multiple drug classes to improve treatment outcomes for patients.”
Donald J. Santel, Chief Executive Officer of CoTherix, Inc, said: “Our vision for CoTherix has been to advance the therapeutic options for patients with cardiovascular disease. Through the efforts of our talented and dedicated employees, we've been successful in introducing Ventavis, the first non-invasive prostacyclin for PAH in the United States. The proposed combination with Actelion, a global leader in cardio-pulmonary medicine, will further accelerate this vision and provide additional benefit to the patient population we've been privileged to serve.”
Jean-Paul Clozel concluded: “This acquisition will leave unchanged the Actelion culture with its desire to discover, develop and market new innovative medicines. Actelion has never been in a better position for substantial future growth from our rapidly expanding product pipeline, with possibly five different compounds in Phase III in 2007.”
Additional information and where to find it:
The tender offer for the outstanding common stock of CoTherix has not yet commenced. It is expected to commence on 8 December 2006. This announcement is for informational purposes only and is neither an offer to purchase nor a solicitation of an offer to sell shares of CoTherix. CoTherix stockholders are urged to read the relevant tender offer materials to be filed with the Securities and Exchange Commission and forwarded to CoTherix stockholders (including an Offer to Purchase, a related Letter of Transmittal and certain other offer documents) and the Solicitation/ Recommendation Statement, which will contain important information which should be read carefully before any decision is made with respect to the tender offer. The Offer to Purchase, the related Letter of Transmittal and certain other offer documents, as well as the Solicitation/Recommendation Statement, will be made available to all stockholders of CoTherix at no expense to them, and will be available for free at the Commission's web site at www.sec.gov. Free copies of the Offer to Purchase, the related Letter of Transmittal and certain other offering documents will be available from Actelion by mailing requests for such materials to Actelion US Holding Company, 333 Lakeside Drive, Foster City, CA 94404, attention: Investor Relations.
In addition to the Offer to Purchase, the related Letter of Transmittal and certain other offer documents, as well as the Solicitation/Recommendation Statement, CoTherix files annual, quarterly and special reports, proxy statements and other information with the Securities and Exchange Commission. You may read and copy any reports, statements or other information filed by CoTherix at the SEC public reference room at 100 F Street, N.E., Washington, D.C. 20549. Please call the Commission at 1-800-SEC-0330 for further information on the public reference room. CoTherix’s filings with the Commission are also available to the public from commercial document-retrieval services and at the website maintained by the Commission at www.sec.gov.
Information on interests of certain persons in the offer and the merger:
Actelion will be, and certain other persons may be, soliciting CoTherix stockholders to tender their shares into the tender offer. The directors and executive officers of Actelion and the directors and executive officers of CoTherix may be deemed to be participants in Actelion’s solicitation of CoTherix’s stockholders to tender their shares into the tender offer.
Additional background information:
About the transaction
Pursuant to the Agreement and Plan of Merger between the parties, Actelion will commence a tender offer to purchase all the outstanding shares of CoTherix, Inc. for USD 13.50 per share on 8 December 2006. This offer is subject to cu stomary conditions, including the tender of at least a majority of the shares of CoTherix common stock outstanding and clearance under the United States Hart-Scott-Rodino Antitrust Improvements Act. Following the successful completion of the tender offer, a subsidiary of Actelion is expected to merge with CoTherix, resulting in CoTherix becoming a wholly-owned subsidiary of Actelion. Lehman Brothers is acting as an adviser to Actelion in relation to this transaction. CIBC World Markets Corp. is acting as financial advisor to CoTherix.
About the financing of the transaction
On 30 September 2006, Actelion has reported cash, cash equivalents and short-term deposits and marketable securities of CHF 636.3 million. The financing of the acquisition can therefore be made entirely from the existing cash balance. In addition, on 9 November 2006, the company priced a CHF 460 million zero-coupon, zero yield to maturity convertible bond with a settlement date of 22 November 2006. The transaction is not subject to a financing condition.
About Pulmonary Arterial Hypertension (PAH)
Pulmonary arterial hypertension (PAH) is a chronic, life-threatening disorder characterized by abnormally high blood pressure in the arteries between the heart and lungs of an affected individual. The function of the heart and lungs is severely compromised, manifested by a limited exercise capacity, and, ultimately, a reduced life expectancy. Approximately 100,000 people in Europe and the United States are afflicted with either primary or secondary forms of the disease related to conditions or tissue disorders that affect the lungs, such as scleroderma, lupus, HIV/AIDS or congenital heart disease.
About Tracleer® in Pulmonary Arterial Hypertension (PAH)
Tracleer® (bosentan), the first oral dual endothelin receptor antagonist, is approved for the treatment of pulmonary arterial hypertension (PAH) and made available by Actelion subsidiaries in the United States, the European Union, Japan, Australia, Canada, Switzerland and other markets worldwide.
In clinical trials leading to the marketing approval of the drug, approximately 11% of PAH patients receiving Tracleer® experienced abnormal but reversible liver enzyme elevations. It is therefore important that patients undergo monthly liver monitoring. Due to the risk of birth defects, women who are pregnant, or of childbearing age that do not use a reliable method of contraception, must not take Tracleer®.
About bosentan in clinical development for PAH
Actelion aims to develop products to their maximum potential by implementing comprehensive strategies of line extensions and new indications. Since gaining approval of Tracleer® in 2001, Actelion has continued to invest in further clinical trials to expand its use. In many territories, regulatory review is ongoing regarding the inclusion of data from BREATHE-4 and BREATHE-5 studies that included patients with PAH associated with HIV and PAH associated with congenital heart disease (CHD) respectively.
Several trials are currently underway to expand the bosentan treatment to class II PAH patients (EARLY), pediatric PAH patients (FUTURE-1), and in combination with sildenafil in PAH patients (COMPASS-1/-2). In addition, bosentan is evaluated in additional forms of PAH, such chronic thrombo-embolic pulmonary hypertension (BENEFIT) and, pulmonary hypertension secondary to sickle cell disease (ASSET-1/-2)
About Ventavis® (iloprost) inhalation solution
Ventavis® (iloprost) Inhalation Solution was approved by the U.S. Food and Drug Administration for the treatment of PAH (WHO Group I) in patients with NYHA class III or IV symptoms. In controlled trials, Ventavis® improved a composite endpoint consisting of exercise tolerance, symptoms (NYHA Class), and lack of deterioration. Ventavis® has not been adequately studied with concomitant use of other approved therapies for pulmonary arterial hypertension.
In March 2 005, top line data of the Phase II clinical trial STEP, evaluating the safety and added benefit of using Ventavis® Inhalation Solution therapy in patients with PAH already undergoing treatment with bosentan, were published. The analysis of this study showed that the combination of Ventavis® added to bosentan therapy was well tolerated and provided clinical benefit in patients with PAH.
In March 2006, CoTherix, Inc., initiated a Phase III clinical trial called VISION to evaluate the safety and efficacy of Ventavis® in combination with sildenafil, an approved oral treatment for PAH. The purpose of this multi-center international trial is to evaluate the safety and effectiveness of adding iloprost or placebo to sildenafil therapy for PAH. The study will also examine whether patients on sildenafil can reduce the number of iloprost inhalations from the approved 6 doses per day to 4 doses per day.
About CoTherix, Inc.
CoTherix, Inc. (Nasdaq: CTRX) is a biopharmaceutical company focused on licensing, developing and commercializing therapeutic products for the potential treatment of cardiovascular disease. CoTherix, Inc. licensed the exclusive U.S. rights to Ventavis® from Schering AG, which currently markets Ventavis® in Europe and Australia. In June 2006, CoTherix, Inc., licensed exclusive rights to develop and commercialize oral and inhaled formulations of Fasudil, a rho-kinase inhibitor, for the treatment of PAH and stable angina in North America and Europe from Asahi Kasei Pharma Corporation.
About Actelion Ltd
Actelion Ltd is a biopharmaceutical company with its corporate headquarters in Allschwil/Basel, Switzerland. Actelion's first drug Tracleer®, an orally available dual endothelin receptor antagonist, has been approved as a therapy for pulmonary arterial hypertension. Actelion markets Tracleer® through its own subsidiaries in key markets worldwide, including the United States (based in South San Francisco), the European Union, Japan, Canada, Australia and Switzerland. At the end of September 2006, Tracleer® was commercially available in 35 countries worldwide. Actelion, founded in late 1997, is a leading player in innovative science related to the endothelium – the single layer of cells separating every blood vessel from the blood stream. Actelion’s over 1’200 employees focus on the discovery, development and marketing of innovative drugs for significant unmet medical needs. Actelion shares are traded on the SWX Swiss Exchange (ticker symbol: ATLN).
Forward-Looking Statements
The statements contained in this press release that are not purely historical are forward-looking statements within the meaning of Section 21E of the Securities Exchange Act of 1934, as amended. Forward-looking statements in this press release include statements regarding CoTherix’s expectations, beliefs, hopes, goals, plans, intentions, initiatives or strategies, including statements regarding risks to both companies that the acquisition of CoTherix will not be consummated as the transaction is subject to certain closing conditions. In addition, when the transaction is consummated, there will be risks and uncertainties related to Actelion’s ability to successfully integrate the products of the two companies. Other factors discussed in the "Risk Factors" section of CoTherix's Quarterly Report on Form 10-Q for the period ended September 30, 2006 filed with the Securities and Exchange Commission.
###
For further information please contact:
Actelion Ltd, Gewerbestrasse 16, CH-4123 Allschwil
Investor Contact
Roland Haefeli
+41 61 565 64 58
+1 650 624 6936
Media Contact
Peter Engel
+41 61 565 66 28
+1 650 624 6996
http://www.actelion.com
For further information please contact:
CoTherix, Inc.
Investor Contact
Anne Bowdidge
+1 650 808 6551
Conference call
Actelion will host an Investor Conference Call and discussion/Q&A on Monday, 20 November 2006,
14.30 CET / 13.30 GMT / 08.30 a.m. ET
Dial:
+41 (0) 91 610 56 00
(Europe)
+1 (1) 866 291 41 66
(U.S.)
+44 (0) 207 107 06 11
(U.K.)
Antwort auf Beitrag Nr.: 25.555.247 von cyberinvestor am 20.11.06 21:56:33ich halts nicht aus!
ein actelionfan.
die performance sieht gut aus.
denke wir gehen hier mindestens bis 250 schweizer franken.
die company ist hervorragend positioniert.
zahlen keine dividende und stecken den gewinn in forschung.
das ist besser für das unternehmen - und für den kurs
ein actelionfan.
die performance sieht gut aus.
denke wir gehen hier mindestens bis 250 schweizer franken.
die company ist hervorragend positioniert.
zahlen keine dividende und stecken den gewinn in forschung.
das ist besser für das unternehmen - und für den kurs

tja, leider ist keiner mehr da - oder
- oder
auf jeden fall habe ich nicht übertrieben.
heute schloss das ding auf 265,78 schweizer franken.
einfach nur geil
 - oder
- oderauf jeden fall habe ich nicht übertrieben.
heute schloss das ding auf 265,78 schweizer franken.
einfach nur geil

Frohe Weihnachten und einen guten Rutsch wünsche ich.
Der Weihnachtsmann war dieses Jahr ja wohl sehr spendabel, zumindest für die Actelion Aktionäre.
Die Stille hier im Board stimmt mich optimistisch für die Zukunft.
Will damit sagen, dass Actelion noch immer eine unentdeckte Perle ist, zumindest in Deutschland.
Also dann auf ein gutes 2007
Der Weihnachtsmann war dieses Jahr ja wohl sehr spendabel, zumindest für die Actelion Aktionäre.
Die Stille hier im Board stimmt mich optimistisch für die Zukunft.
Will damit sagen, dass Actelion noch immer eine unentdeckte Perle ist, zumindest in Deutschland.
Also dann auf ein gutes 2007
Antwort auf Beitrag Nr.: 26.405.379 von 11up am 22.12.06 18:18:13tja, das wird wohl auch so bleiben.
unentdeckt heisst ja nicht uninteressant. und das ist sie beileibe nicht. analystenschätzungen gehen hier sogar bis 350 SFR
mal abwarten. dank actelion gibts bald ein neues auto......

nicht auto - limousine
wünsche ebenfalls einen guten rutsch ins neue jahr
unentdeckt heisst ja nicht uninteressant. und das ist sie beileibe nicht. analystenschätzungen gehen hier sogar bis 350 SFR
mal abwarten. dank actelion gibts bald ein neues auto......


nicht auto - limousine

wünsche ebenfalls einen guten rutsch ins neue jahr

15th January 2007
By Victoria Harrison
Actelion has reported that initial results from a study of pulmonary arterial hypertension patients treated with Tracleer showed the drug to be successful.
The study indicated that six months of treatment with Tracleer showed a significant reduction in pulmonary vascular resistance, a primary endpoint of the study. Patients also showed a strong trend towards improvement in 6-minute-walk test compared to placebo, another primary endpoint.
The study met its main secondary endpoint, as treatment with Tracleer was associated with a significant delay in time to clinical worsening compared to placebo, representing a 70% reduction in risk. In this study, Tracleer's safety and tolerability profile was consistent with that observed in previous clinical trials.
The company will now fully analyze the data in anticipation of planned upcoming regulatory filings worldwide to expand the Tracleer indication to include mildly symptomatic pulmonary arterial hypertension (PAH) patients.
"Currently, regulatory approval of PAH drugs focuses on significant symptomatic changes. In this study where patients presented on average with well-preserved exercise capacity at baseline, the six-minute-walk test nevertheless showed a strong trend towards significance. More importantly, Tracleer has consistently demonstrated its unique ability to delay time to clinical worsening, the ultimate treatment goal," concluded Isaac Kobrin, head of Development of Actelion.
By Victoria Harrison
Actelion has reported that initial results from a study of pulmonary arterial hypertension patients treated with Tracleer showed the drug to be successful.
The study indicated that six months of treatment with Tracleer showed a significant reduction in pulmonary vascular resistance, a primary endpoint of the study. Patients also showed a strong trend towards improvement in 6-minute-walk test compared to placebo, another primary endpoint.
The study met its main secondary endpoint, as treatment with Tracleer was associated with a significant delay in time to clinical worsening compared to placebo, representing a 70% reduction in risk. In this study, Tracleer's safety and tolerability profile was consistent with that observed in previous clinical trials.
The company will now fully analyze the data in anticipation of planned upcoming regulatory filings worldwide to expand the Tracleer indication to include mildly symptomatic pulmonary arterial hypertension (PAH) patients.
"Currently, regulatory approval of PAH drugs focuses on significant symptomatic changes. In this study where patients presented on average with well-preserved exercise capacity at baseline, the six-minute-walk test nevertheless showed a strong trend towards significance. More importantly, Tracleer has consistently demonstrated its unique ability to delay time to clinical worsening, the ultimate treatment goal," concluded Isaac Kobrin, head of Development of Actelion.
alles bestens
es waren schon höchststände von 288 schweizer franken.
nun wieder ein wenig konsolidiert.
aktienrückkauf geplant. das ist doch ein gutes zeichen.
denke es geht nicht mehr lange bis wir hier die 300 sfr sehen werden.
für mich ist hier noch nicht das ende der fahnenstange.
zumal die letzten tests optimal verlaufen sind.

es waren schon höchststände von 288 schweizer franken.

nun wieder ein wenig konsolidiert.
aktienrückkauf geplant. das ist doch ein gutes zeichen.
denke es geht nicht mehr lange bis wir hier die 300 sfr sehen werden.
für mich ist hier noch nicht das ende der fahnenstange.
zumal die letzten tests optimal verlaufen sind.

Interessante Firma.
Denke drüber nach ein paar Kröten dort anzulegen.
Allerdings in letzter Zeit sehr heiß gelaufen ...
Hier ein akteuller Bericht zu ACT-078573 in der Nature Med.
und dem aus dem Handelsblatt vom 30.1.07
Nature Med. doi:10.1038/nm1544 (2007)
A novel sleep-inducing agent has been developed that acts by blocking the actions of brain peptides called orexins.
Orexins promote wakefulness, and people with narcolepsy - a condition causing daytime sleepiness and sudden loss of muscle tone - have low orexin levels.
François Jenck of Actelion Pharmaceuticals in Allschwil, Switzerland, and his colleagues report that their new compound, code-named ACT-078573, reduced alertness in rats, dogs and humans. Human subjects receiving the drug fell asleep more quickly than those receiving the placebo, but none of them experienced loss of muscle tone.
Wirkstoff erleichtert das Einschlafen
Schweizer Pharmafirma Actelion entwickelt viel versprechendes Mittel gegen Schlafstörungen SABINE GOLDHAHN | ZÜRICH Schlaf gilt als die natürlichste Sache der Welt. Dennoch leiden viele Menschen unter Schlafstörungen - mehr als ein Fünftel hat Probleme beim Einschlafen oder wacht während der Nacht mehrmals wieder auf und liegt längere Zeit wach. Der damit verbundene Schlafmangel führt zu Unaufmerksamkeit, Leistungsabfall und Gedächtnisstörungen. Im schlimmsten Fall machen Schlafstörungen krank und rufen körperliche Beschwerden hervor. Bislang fehlt ein Medikament, das ohne gefährliche Nebenwirkungen einen annähernd natürlichen Schlaf erzeugt. Dies könnte sich bald ändern: Forscher der Schweizer Pharmafirma Actelion haben eine Substanz entdeckt und mit gesunden Versuchspersonen getestet und bei ihnen klassische Anzeichen für Schlaf hervorgerufen. Im Tierversuch zeigten Ratten und Hunde sogar die natürlichen Traumphasen. "Schlaf ist alles andere als ein passiver Prozess", sagt Esther Werth vom Schlaflabor der Universität Zürich. "Es laufen viele aktive Vorgänge ab, die über komplexe Regelmechanismen zusammenhängen." Daher gibt es über 80 verschiedene Schlafstörungen mit den unterschiedlichsten Ursachen. Den gesunden Schlaf teilen Wissenschaftler in drei Phasen ein, wobei sie die zwei wichtigsten anhand der Augenbewegung unterscheiden. Im Rem- Schlaf - Rem steht für "rapid eye movement"
- träumen die Menschen, und die
Muskulatur entspannt sich. Das Gehirn
wird stärker durchblutet, und Gedächtnisinformationen
werden gespeichert.
Zum Non-Rem-Schlaf dagegen, der etwa
drei Viertel der Schlafzeit ausmacht,
gehören der leichte und der tiefe Schlaf,
bei denen die Körpertemperatur und der
Blutdruck abfallen. Damit man morgens
erholt aufwacht, müssen sich beide
Schlafstadien mehrfach in der Nacht abwechseln.
Das erreicht allerdings keines
der bisher zugelassenen Schlafmittel.
Die neu entwickelte Substanz mit dem
Kürzel "ACT-078573" greift in einen
Stoffwechsel-Kreislauf ein, der erst
1998 entdeckt wurde: in das so genannte
Orexin-System. Orexin ist ein Eiweiß,
das im Hypothalamus - einem
Teil des Zwischenhirns - gebildet wird
und die Nahrungsaufnahme sowie den
Schlaf-Wach-Rhythmus beeinflusst.
Viel Orexin macht munter und führt zu
einer gesteigerten Aufmerksamkeit und
Wachheit. Zu wenig Orexin wurde hingegen
bei Patienten mit Narkolepsie gefunden,
einer Krankheit, bei der die Betroffenen
mehrfach am Tag völlig unerwartet
einschlafen und bei Aufregung
plötzlich zusammensacken.
Da also ein Mangel an Orexin zum Einschlafen
führt, haben Francois Jenck
und sein Team nach einem Stoff gesucht,
der die Orexin-Menge im Gehirn
verringert. Das erreicht "ACT-078573",
indem es die zwei Andockstellen für
Orexin blockiert. Dadurch kann dieses
Eiweiß seine aufputschende Wirkung
nicht mehr entfalten, und man schläft
ein. "Obwohl wir unseren Versuchspersonen
den Orexin-Blocker am Tag in ihrer
aktiven Phase gegeben haben, zeigten
sie bereits nach einer Stunde die typischen
Zeichen für Schlaf, was auch in
der Hirnstromkurve zu sehen war", berichtet
Francois Jenck von Actelion.
Nach sechs bis sieben Stunden seien sie
wieder völlig wach gewesen.
Versuchspersonen, die mit dem weit
verbreiteten Benzodiazepin-Schlafmittel
Zolpidem behandelt wurden, zeigten
zwar auch Anzeichen von Schlaf, jedoch
waren diese Effekte nicht in der
Hirnstromkurve sichtbar. Benzodiazepine,
die seit Jahren Mittel der Wahl gegen
Schlafstörungen sind, wirken auf
einen anderen Regelkreis im Nervensystem.
Sie blockieren keine Andockstellen,
sondern verstärken lediglich eine
natürliche Wirkung der Botenstoffe im
Gehirn. Das führt bei regelmäßigem Gebrauch
zur Sucht. "Wir warten daher auf
ein Medikament, das keine Abhängigkeit
erzeugt und die Patienten auf natürliche
Weise schlafen lässt", sagt Esther
Werth.
Klinische Studien mit "ACT-078573"
laufen bereits. Mit den ersten Ergebnissen
rechnet Actelion noch in diesem
Jahr.Die Bekanntgabe der ersten Forschungsergebnisse
hat gestern die Aktie
der Biotechnologiefirma beflügelt. Sie
stieg an der Börse zunächst um 3,4 Prozent
bis auf 285 Franken (175 Euro)
nach oben und notierten am Nachmittag
bei 283 Franken. Actelion ist bisher vor
allem für sein Lungenmedikament
Tracleer bekannt.
Der Markt für Schlafmittel ist riesig.
Marktführer in dem Bereich sind Sanofi-
Aventis mit seinem Schlafmittel Ambien
gefolgt von Sepracor mit Lunesta.
Sanofi setzte in den ersten neun Monaten
2006 mit Ambien 1,45 Milliarden
Euro um und damit um 30 Prozent mehr
als im entsprechenden Vorjahreszeitraum.
Denke drüber nach ein paar Kröten dort anzulegen.
Allerdings in letzter Zeit sehr heiß gelaufen ...
Hier ein akteuller Bericht zu ACT-078573 in der Nature Med.
und dem aus dem Handelsblatt vom 30.1.07
Nature Med. doi:10.1038/nm1544 (2007)
A novel sleep-inducing agent has been developed that acts by blocking the actions of brain peptides called orexins.
Orexins promote wakefulness, and people with narcolepsy - a condition causing daytime sleepiness and sudden loss of muscle tone - have low orexin levels.
François Jenck of Actelion Pharmaceuticals in Allschwil, Switzerland, and his colleagues report that their new compound, code-named ACT-078573, reduced alertness in rats, dogs and humans. Human subjects receiving the drug fell asleep more quickly than those receiving the placebo, but none of them experienced loss of muscle tone.
Wirkstoff erleichtert das Einschlafen
Schweizer Pharmafirma Actelion entwickelt viel versprechendes Mittel gegen Schlafstörungen SABINE GOLDHAHN | ZÜRICH Schlaf gilt als die natürlichste Sache der Welt. Dennoch leiden viele Menschen unter Schlafstörungen - mehr als ein Fünftel hat Probleme beim Einschlafen oder wacht während der Nacht mehrmals wieder auf und liegt längere Zeit wach. Der damit verbundene Schlafmangel führt zu Unaufmerksamkeit, Leistungsabfall und Gedächtnisstörungen. Im schlimmsten Fall machen Schlafstörungen krank und rufen körperliche Beschwerden hervor. Bislang fehlt ein Medikament, das ohne gefährliche Nebenwirkungen einen annähernd natürlichen Schlaf erzeugt. Dies könnte sich bald ändern: Forscher der Schweizer Pharmafirma Actelion haben eine Substanz entdeckt und mit gesunden Versuchspersonen getestet und bei ihnen klassische Anzeichen für Schlaf hervorgerufen. Im Tierversuch zeigten Ratten und Hunde sogar die natürlichen Traumphasen. "Schlaf ist alles andere als ein passiver Prozess", sagt Esther Werth vom Schlaflabor der Universität Zürich. "Es laufen viele aktive Vorgänge ab, die über komplexe Regelmechanismen zusammenhängen." Daher gibt es über 80 verschiedene Schlafstörungen mit den unterschiedlichsten Ursachen. Den gesunden Schlaf teilen Wissenschaftler in drei Phasen ein, wobei sie die zwei wichtigsten anhand der Augenbewegung unterscheiden. Im Rem- Schlaf - Rem steht für "rapid eye movement"
- träumen die Menschen, und die
Muskulatur entspannt sich. Das Gehirn
wird stärker durchblutet, und Gedächtnisinformationen
werden gespeichert.
Zum Non-Rem-Schlaf dagegen, der etwa
drei Viertel der Schlafzeit ausmacht,
gehören der leichte und der tiefe Schlaf,
bei denen die Körpertemperatur und der
Blutdruck abfallen. Damit man morgens
erholt aufwacht, müssen sich beide
Schlafstadien mehrfach in der Nacht abwechseln.
Das erreicht allerdings keines
der bisher zugelassenen Schlafmittel.
Die neu entwickelte Substanz mit dem
Kürzel "ACT-078573" greift in einen
Stoffwechsel-Kreislauf ein, der erst
1998 entdeckt wurde: in das so genannte
Orexin-System. Orexin ist ein Eiweiß,
das im Hypothalamus - einem
Teil des Zwischenhirns - gebildet wird
und die Nahrungsaufnahme sowie den
Schlaf-Wach-Rhythmus beeinflusst.
Viel Orexin macht munter und führt zu
einer gesteigerten Aufmerksamkeit und
Wachheit. Zu wenig Orexin wurde hingegen
bei Patienten mit Narkolepsie gefunden,
einer Krankheit, bei der die Betroffenen
mehrfach am Tag völlig unerwartet
einschlafen und bei Aufregung
plötzlich zusammensacken.
Da also ein Mangel an Orexin zum Einschlafen
führt, haben Francois Jenck
und sein Team nach einem Stoff gesucht,
der die Orexin-Menge im Gehirn
verringert. Das erreicht "ACT-078573",
indem es die zwei Andockstellen für
Orexin blockiert. Dadurch kann dieses
Eiweiß seine aufputschende Wirkung
nicht mehr entfalten, und man schläft
ein. "Obwohl wir unseren Versuchspersonen
den Orexin-Blocker am Tag in ihrer
aktiven Phase gegeben haben, zeigten
sie bereits nach einer Stunde die typischen
Zeichen für Schlaf, was auch in
der Hirnstromkurve zu sehen war", berichtet
Francois Jenck von Actelion.
Nach sechs bis sieben Stunden seien sie
wieder völlig wach gewesen.
Versuchspersonen, die mit dem weit
verbreiteten Benzodiazepin-Schlafmittel
Zolpidem behandelt wurden, zeigten
zwar auch Anzeichen von Schlaf, jedoch
waren diese Effekte nicht in der
Hirnstromkurve sichtbar. Benzodiazepine,
die seit Jahren Mittel der Wahl gegen
Schlafstörungen sind, wirken auf
einen anderen Regelkreis im Nervensystem.
Sie blockieren keine Andockstellen,
sondern verstärken lediglich eine
natürliche Wirkung der Botenstoffe im
Gehirn. Das führt bei regelmäßigem Gebrauch
zur Sucht. "Wir warten daher auf
ein Medikament, das keine Abhängigkeit
erzeugt und die Patienten auf natürliche
Weise schlafen lässt", sagt Esther
Werth.
Klinische Studien mit "ACT-078573"
laufen bereits. Mit den ersten Ergebnissen
rechnet Actelion noch in diesem
Jahr.Die Bekanntgabe der ersten Forschungsergebnisse
hat gestern die Aktie
der Biotechnologiefirma beflügelt. Sie
stieg an der Börse zunächst um 3,4 Prozent
bis auf 285 Franken (175 Euro)
nach oben und notierten am Nachmittag
bei 283 Franken. Actelion ist bisher vor
allem für sein Lungenmedikament
Tracleer bekannt.
Der Markt für Schlafmittel ist riesig.
Marktführer in dem Bereich sind Sanofi-
Aventis mit seinem Schlafmittel Ambien
gefolgt von Sepracor mit Lunesta.
Sanofi setzte in den ersten neun Monaten
2006 mit Ambien 1,45 Milliarden
Euro um und damit um 30 Prozent mehr
als im entsprechenden Vorjahreszeitraum.
Antwort auf Beitrag Nr.: 27.377.132 von 2CB_06 am 02.02.07 19:26:53habe mich am donnerstag bei 303 sfr von meinen aktien getrennt.
die performance war berauschend. wäre sogar noch ein bisschen höher gegangen. aber wer weiss das schon.
das gibt auf jeden fall eine schöne limousine. danke.
ich steige sicher wieder ein. die company ist noch für einiges gut.
aber ich warte etwas konsolidierung ab. am 22. feb. kommt der letzte quartalsbericht und die zahlen für 2006.
ein einstiegskurs von 260 bis 270 wäre für mich wieder ein thema.
good luck allen investierten.
die performance war berauschend. wäre sogar noch ein bisschen höher gegangen. aber wer weiss das schon.
das gibt auf jeden fall eine schöne limousine. danke.
ich steige sicher wieder ein. die company ist noch für einiges gut.
aber ich warte etwas konsolidierung ab. am 22. feb. kommt der letzte quartalsbericht und die zahlen für 2006.
ein einstiegskurs von 260 bis 270 wäre für mich wieder ein thema.
good luck allen investierten.

tja, das war pech. wie mans nimmt.
heute stehen die dinger auf 316 sfr.
6.5 prozent gestiegen. da steckt man nicht drin.
ein absolut geiles papier
heute stehen die dinger auf 316 sfr.
6.5 prozent gestiegen. da steckt man nicht drin.
ein absolut geiles papier

Antwort auf Beitrag Nr.: 27.439.934 von heilixblechle am 05.02.07 11:35:29Da kann ich nur sagen:
Heilixblechle!
Gruß
CI
Heilixblechle!
Gruß
CI
ist ja auch heiss gelaufen.
eine konsolidierung wie im bilderbuch - und an gewinnmitnahmen ist noch niemand gestorben - wunderbar -
jetzt kommen bald wieder meine einstiegskurse.
eine konsolidierung wie im bilderbuch - und an gewinnmitnahmen ist noch niemand gestorben - wunderbar -
jetzt kommen bald wieder meine einstiegskurse.

Gewinnmitnahmen bei Actelion - weshalb denn nur?

"Andrew J. Oakley concluded: In 2007, I expect that Actelion will continue to report both revenue growth and Cash-EBIT growth. Unforeseen events excluded, total net revenues are expected to reach between CHF 1.175 and 1.225 billion. Operating income under US-GAAP is expected to be in the range of CHF 65 to 75 million, due to a substantial increase in non-cash charges, especially due to an In-Process R&D charge in relation to the CoTherix transaction of approximately CHF 200 million and higher charges for employee stock options due to the 146 percent performance of Actelion shares in 2006. By eliminating such non-cash items, I expect the company to report an increase in Cash-EBIT to between CHF 360 to 395 million."
Schade, dass die CoTherix Übernahme auch Geld gekostet hat
 .
.Dann wären nun wohl alle zufrieden und es gäbe keine Gewinnmitnahmen.
Und natürlich ist es eine Unverschämtheit, dass auch noch die Angestellten an dem fulminaten Kursanstieg der letzten Jahre partizpieren wollen.

Trotzdem ich bleib dabei, denn der Teufel bevozugt für sein "Geschäft" bekanntlich ja immer den größten Haufen
 .
.
Antwort auf Beitrag Nr.: 27.922.859 von 11up am 23.02.07 13:45:58warm regst du dich auf?
bist du zu spät eingestiegen?
ist doch normal, dass angestellte optionen erhalten. aber auch optionen sind an vorgaben gebunden - sprich kursstabilität für einen längeren zeitraum.
auf jeden fall war hier sell on good news angesagt. das war doch vorauszusehen und an gewinnmitnahmen ist noch keiner gestorben.
meine einstiegskurse rücken immer näher.
ein longtime-invest ist hier sicher kein schaden, da actelion alle gewinne in die forschung steckt.
einer neuen kursrallye steht dann nichts mehr im wege.
bei den abgelieferten zahlen ist das risiko gleich null.
ich werde trotzdem noch etwas abwarten.
good luck an alle investierten.
bist du zu spät eingestiegen?
ist doch normal, dass angestellte optionen erhalten. aber auch optionen sind an vorgaben gebunden - sprich kursstabilität für einen längeren zeitraum.
auf jeden fall war hier sell on good news angesagt. das war doch vorauszusehen und an gewinnmitnahmen ist noch keiner gestorben.
meine einstiegskurse rücken immer näher.
ein longtime-invest ist hier sicher kein schaden, da actelion alle gewinne in die forschung steckt.
einer neuen kursrallye steht dann nichts mehr im wege.
bei den abgelieferten zahlen ist das risiko gleich null.
ich werde trotzdem noch etwas abwarten.
good luck an alle investierten.

Antwort auf Beitrag Nr.: 27.959.706 von heilixblechle am 25.02.07 15:54:43Ich dachte die Ironie sei klar erkennbar.
Bin übrigens seit 2001 dabei (mit 33 Euro), ganz ohne Gewinnmitnahmen.
Die sind etwas für Leute die in die Zukunft sehen können - das solls ja geben .
.
Ob wir nun eine längere Konsolidierung (wie 2004 bis Mitte 2006) sehen ist mir egal und ich würde auch nicht dran sterben.
Bin übrigens seit 2001 dabei (mit 33 Euro), ganz ohne Gewinnmitnahmen.
Die sind etwas für Leute die in die Zukunft sehen können - das solls ja geben
 .
. Ob wir nun eine längere Konsolidierung (wie 2004 bis Mitte 2006) sehen ist mir egal und ich würde auch nicht dran sterben.
Antwort auf Beitrag Nr.: 27.966.552 von 11up am 25.02.07 21:51:43Glückwunsch. Da sind wir fast zur gleichen Zeit eingestiegen.
Gruß
CI
Gruß
CI
Antwort auf Beitrag Nr.: 27.966.552 von 11up am 25.02.07 21:51:43genau - immer zum tiefstpunkt eingestiegen und zum höchststand verkauft - wunschträume der aktionäre.
bei actelion musst du schon gewinnmitnahmen realisieren, denn man erhält keine dividende und die börse ist bekanntlich keine einbahnstrasse.
aber nix desto trotz werde ich hier demnächst wieder einsteigen.
hier ist noch gewaltig luft nach oben.
ein papier bei dem man sich schlafen legen kann...

bei actelion musst du schon gewinnmitnahmen realisieren, denn man erhält keine dividende und die börse ist bekanntlich keine einbahnstrasse.
aber nix desto trotz werde ich hier demnächst wieder einsteigen.
hier ist noch gewaltig luft nach oben.
ein papier bei dem man sich schlafen legen kann...


Der angekündigte Aktiensplit sollte sich positiv auf die künftige Kursentwicklung auswirken.
*****************************************************************
Die Aktionäre der Actelion Ltd werden an der kommenden Generalversammlung (GV) vom 4. Mai in Basel über Veränderungen im Kapital befinden.
Actelion-GV: Bedingte Kapitalerhöhung und Aktiensplit 1 zu 5 vorgeschlagen
Der Verwaltungsrat (VR) will einerseits bedingtes Aktienkapital für die Ausgabe von Mitarbeiteroptionen, andererseits Kapital für strategische und/oder finanzielle Geschäftsgelegenheiten, wie es in der Einladung zur ordentlichen GV heisst (u.a. Inserat NZZ 5.4.2007).
Zusätzliches bedingtes Kapital in der Höhe von 5 Mio CHF
Was die Mitarbeiteroptionen betrifft, möchte der VR zusätzliches bedingtes Kapital in der Höhe von 5 Mio CHF (2 Mio Aktien). Dies sei nötig, weil die Rekrutierung und Bindung von hochqualifizierten Mitarbeitenden zur Erreichung der Geschäftsziele von Actelion unerlässlich sei, so die Ausführungen des VR. Was die 'Geschäftsgelegenheiten' betrifft, schlägt der VR den Anteilseignern vor, das für die Ausgabe von Wandelanleihen bestimmte bedingte Aktienkapital um 9,25 Mio CHF (3,7 Mio Aktien) aufzustocken. Zudem soll genehmigtes Aktienkapital von 17,5 Mio CHF (7 Mio Aktien) geschaffen werden.
Aktiensplit im Verhältnis 1:5
Actelion will zudem einen Aktiensplit im Verhältnis 1:5 vornehmen, um die Liquidität der Titel zu vergrössern und um die Aktionärsbasis des Unternehmens auszudehnen. Der Actelion-Valor kostet derzeit rund 280 CHF. Darüber hinaus schlägt der VR den Aktionären die Wiederwahl von Werner Henrich, Jean Malo und Armin Kessler ins Aufsichtsgremium für eine Amtszeit von je drei Jahren vor. (awp/mc/gh)
*****************************************************************
Die Aktionäre der Actelion Ltd werden an der kommenden Generalversammlung (GV) vom 4. Mai in Basel über Veränderungen im Kapital befinden.
Actelion-GV: Bedingte Kapitalerhöhung und Aktiensplit 1 zu 5 vorgeschlagen
Der Verwaltungsrat (VR) will einerseits bedingtes Aktienkapital für die Ausgabe von Mitarbeiteroptionen, andererseits Kapital für strategische und/oder finanzielle Geschäftsgelegenheiten, wie es in der Einladung zur ordentlichen GV heisst (u.a. Inserat NZZ 5.4.2007).
Zusätzliches bedingtes Kapital in der Höhe von 5 Mio CHF
Was die Mitarbeiteroptionen betrifft, möchte der VR zusätzliches bedingtes Kapital in der Höhe von 5 Mio CHF (2 Mio Aktien). Dies sei nötig, weil die Rekrutierung und Bindung von hochqualifizierten Mitarbeitenden zur Erreichung der Geschäftsziele von Actelion unerlässlich sei, so die Ausführungen des VR. Was die 'Geschäftsgelegenheiten' betrifft, schlägt der VR den Anteilseignern vor, das für die Ausgabe von Wandelanleihen bestimmte bedingte Aktienkapital um 9,25 Mio CHF (3,7 Mio Aktien) aufzustocken. Zudem soll genehmigtes Aktienkapital von 17,5 Mio CHF (7 Mio Aktien) geschaffen werden.
Aktiensplit im Verhältnis 1:5
Actelion will zudem einen Aktiensplit im Verhältnis 1:5 vornehmen, um die Liquidität der Titel zu vergrössern und um die Aktionärsbasis des Unternehmens auszudehnen. Der Actelion-Valor kostet derzeit rund 280 CHF. Darüber hinaus schlägt der VR den Aktionären die Wiederwahl von Werner Henrich, Jean Malo und Armin Kessler ins Aufsichtsgremium für eine Amtszeit von je drei Jahren vor. (awp/mc/gh)
Q1 2007 sind veröffentlicht
Die Tabellen sieht man am besten unter:
http://www.actelion.com/UniNet/www/www_main_P.nsf/Content/me…
19 April 2007
Actelion announces first quarter results 2007
Total net revenue increases to CHF 290.4 million, up 38 percent compared to Q1 2006 - Tracleer® sales of CHF 260.4 million - Cash EBIT up 41% to CHF 101.3million - One-time IPRD charge results in US GAAP Operating loss - Increased revenue and Cash EBIT guidance for FY 2007
ALLSCHWIL/BASEL, SWITZERLAND – 19 April 2007 – Actelion Ltd (SWX: ATLN) today announced its financial results for the first quarter of 2007. With total net revenue of CHF 290.4 million (Q1 2006: CHF 210.6 m) and operating expenses of CHF 441.9 million (Q1 2006: 149.5 m) – including a one-time non-cash In-Process Research and Development (IPRD) charge of CHF 224.8 million, the company reported an operating loss under US-GAAP of CHF 151.5 million (Q1 2006: operating profit of CHF 61.0 m). The net loss for the quarter was CHF 150.0 million (Q1 2006: operating profit of CHF 53.7 m).
The loss per share (EPS) for the first quarter of 2007 was CHF 6.43 (basic: number of shares 23.3 million) compared to fully diluted earnings per share of CHF 2.33 in Q1 2006 (fully diluted: number of shares: 23.1 million).
To better measure and compare operating performance over time, Actelion also reports non-GAAP Cash-EBIT (Operating Income excluding non-cash charges such as In-Process R&D, charges related to employee stock options under FAS 123R, as well as non-cash depreciation and amortization charges). In Q1 2007, Actelion’s Cash-EBIT was CHF 101.3 million, an increase of 41% percent compared to Q1 2006.
Jean-Paul Clozel, MD and Chief Executive Officer commented: "Actelion has successfully achieved many different milestones during the first three months of 2007, highlighting the strength of our organization as well as our innovation power. We grew Tracleer® in the marketplace. We demonstrated the benefits of our dual endothelin receptor antagonist in patients suffering from chronic-thromboembolic pulmonary hypertension. We successfully concluded the integration of CoTherix within only a few weeks, adding Ventavis® to our PAH franchise in the US. We obtained a positive opinion in the European Union on the use of Tracleer® in patients with systemic sclerosis and ongoing digital ulcer disease. We further demonstrated the innovation power of Actelion with the outstanding initial efficacy findings obtained with our first-in-class dual orexin receptor antagonist in patients with primary insomnia.”
Jean-Paul Clozel concluded: "I am confident that Actelion has every resource required to continue its long-term growth trajectory. There is upcoming competition in the PAH field, but our two products – both first-in-class – are uniquely supported by outstanding long-term clinical data and a strong and experienced sales force. By year-end, the company could have five different compounds in Phase III and ten compounds in clinical development in total, some of them with blockbuster potential. Therefore, I believe that we have a pipeline at hand with the potential to put the company on an accelerated growth trajectory in the years to come.”
CoTherix integration successfully completed
On 9 January 2007, Actelion consummated the acquisition of CoTherix. Thereby, Actelion strengthened its PAH franchise by adding Ventavis® (iloprost) to its product offerings in the United Sates. Ventavis® is the only approved inhaled therapy for the treatment of Pulmonary Arterial Hypertension (WHO group I) in patients with NYHA class III or IV symptoms.
Actelion is continuing the ongoing programs to further evaluate the safety and efficacy of both, Ventavis® in combination settings and its use in an improved delivery system. Later this year, the company expects to make decisions on how to further improve Ventavis® delivery, via dry-powder reformulation or by other approaches.
After careful review, Actelion has decided not to pursue further development with fasudil. Accordingly, the related agreement with Asahi-Kasei has been terminated.
The CoTherix integration itself was successfully completed in early March 2007. The integration resulted in the rapid realization of the expected synergies, making this acquisition – as expected – immediately cash-accretive.
In terms of accounting under US-GAAP, the transaction resulted in a one-time, non-cash charge for In-Process Research and Development of CHF 224.8 million, as reported in Q1 2007. The transaction also results in an annual recurrent non-cash amortization charge related to acquired capitalized intangible assets of approximately CHF 16 million for each of the next 12 years. In addition, this transaction is expected to result in a slower than expected increase in the corporate tax rate.
Andrew J. Oakley, Chief Financial Officer commented: “Operationally, Actelion has continued to perform strongly in the first three months of 2007, as witnessed by the continued growth of Tracleer® in the market place and the increase in Cash EBIT. As expected, the accounting related to the CoTherix acquisition resulted in an operating loss under US GAAP in Q1 2007. In 2008, the transaction is expected to be US-GAAP earnings accretive.
Andrew J. Oakley continued: “I now believe that, given a three-month performance already ahead of my expectations, Actelion will report – unforeseen events excluded - total net revenues in 2007 of between 1’200 to 1’245 million Swiss Francs (previously estimated at 1’175 to 1’225) and a Cash EBIT of between 380 to 415 million Swiss Francs (previously estimated at 360 to 395).”
Financial result overview – Table Q1 2007 vs. Q1 2006
The full financial statements for the first quarter 2007 can be found on http://www.actelion.com.
Strong top line growth
In the first quarter of 2007, Actelion’s total net revenue was CHF 290.4 million (Q1 2006: 210.6 m). On a quarter-to-quarter basis, total net revenue grew by 11 percent (Q4 2006: 261.4 m).
Contract revenues in Q1 2007 amounted to CHF 6.8 million (Q1 2006: 3.8 m). On a quarter-to-quarter basis, contract revenues were almost unchanged (Q4 2006: CHF 7.1 m).
Continued Tracleer® growth – Ventavis® sales on track
In Q1 2007, Tracleer® sales were CHF 260.4 million (Q1 2006: CHF 201.4 m). On a quarter-to-quarter basis, Tracleer® sales increased by 5 percent (Q4 2006: CHF 246.8 m).
At the end of March 2007, Tracleer® (bosentan) was marketed in over 35 countries worldwide, including all major pharmaceutical markets.
In Q1 2007, Ventavis® (iloprost) sales were CHF 15.8 million. These sales were achieved after CoTherix was formally acquired on 9 January 2007. On a pro-forma basis, first-quarter sales – including those booked by Co-Therix in the period up to 9 January 2007, were CHF 23.2 million. In comparison, Q4 pro-forma sales would have been CHF 15.4 million.
A proportion of the increase in either Tracleer® or Ventavis® sales might be attributable to buying pattern variations.
In the first quarter of 2007, Zavesca® sales reached CHF 7.5 million (Q1 2006: CHF 5.4 m). On a quarter-to-quarter basis, Zavesca® sales were flat (Q4 2006: CHF 7.4 m). Zavesca® (miglustat) is commercially available in the United States and in most European markets.
Tracleer® expands beyond PAH
On 5 March 2007, the double-blind, placebo-controlled, multicenter study BENEFiT (Bosentan Effects in Inoperable Forms of Chronic Thromboembolic Pulmonary Hypertension) demonstrated that treatment with bosentan (Tracleer®) was associated with a significant reduction in pulmonary vascular resistance PVR (positive primary endpoint, p<0.0001).
In this first-ever double-blind study in a patient population suffering from this form of pulmonary hypertension, the six-minute walk test remained stable over the four months of blinded evaluation in both treatment groups. Patients on bosentan showed a significant improvement in breathlessness (Borg dyspnoea score) with exercise and there was a trend in favor of bosentan towards prevention of worsening WHO functional class.
Initial results also indicate that treatment with bosentan was associated with a significant decrease in NT-proBNP, an important biomarker of disease severity. In this study, Tracleer®’s safety and tolerability profile was consistent with that observed in previous placebo-controlled clinical trials in pulmonary arterial hypertension (PAH).
On 26 March 2007, the Committee for Medicinal Products for Human Use (CHMP), the scientific committee of the European Medicines Agency (EMEA), has issued a positive opinion on bosentan (Tracleer®) to extend the use of this dual endothelin receptor antagonist beyond Pulmonary Arterial Hypertension. The CHMP has recommended that the European Commission approve bosentan (Tracleer®) for the reduction of the number of new digital ulcers in patients with systemic sclerosis and ongoing digital ulcer disease. The European Commission is expected to make a final decision before the end of May 2007.
Christian Chavy, President Business Operations, commented: “Actelion continues to strengthen Tracleer® and its PAH franchise ahead of upcoming competition. The positive results, with our orally available dual endothelin receptor antagonist in CTEPH, highlight once again the unique benefits of our lead product. I am also pleased with Ventavis® sales, where we now have the full Actelion US sales force behind this important inhaled treatment option.”
Christian Chavy concluded: “With the positive CHMP decision on the use of Tracleer® for digital ulcerations, we will soon be able to expand the use of Tracleer® beyond PAH. We are preparing a dedicated outreach effort to scleroderma physicians. We will support the appropriate use of the product through a dedicated registry effort.”
Expenditure in line with company expectations
In Q1 2007, operating expenses were CHF 441.9 million (Q1 2006: CHF 149.5 m). Compared to the previous quarter, this represents a 133 percent increase (Q4 2006: CHF 190.0 m). Included in the operating expenses are recurrent non-cash charges of CHF 18.7 million for employee stock options as mandated by FAS 123R, recurrent non-cash charges for depreciation and amortization of CHF 9.2 million as well as a one-time only In-Process Research and Development (IPRD) charge of CHF 224.8 million related to the acquisition of CoTherix.
In Q1 2007, research and development expenses were CHF 65.7 million (Q1 2006: CHF 47.7 m). Compared to the previous quarter, this represents an increase of 16 percent (Q4 2006: CHF 56.7 m), in-line with the start of new pre-clinical and clinical programs, such as the BUILD-3 pivotal study to evaluate the safety and efficacy of bosentan in patients suffering from idiopathic pulmonary fibrosis (IPF) and accelerated recruitment into the Phase II program with the orexin receptor antagonist.
In Q1 2007, marketing and advertising costs were CHF 52.6 million (Q1 2006: CHF 41.1 m). Compared to the previous quarter (Q4 2006: CHF 56.1m), this represents a decrease of 6 percent, in-line with usual seasonal trends.
In Q1 2007, selling, general and administrative expenses amounted to CHF 64.5 million (Q1 2006: CHF 39.4 m). Compared to the previous quarter, these expenses were 24% higher (Q4 2006: CHF 51.9m).
Loss under US GAAP – Increased non-GAAP Cash EBIT
In the first quarter of 2007, Actelion’s operating loss was CHF 151.5 million (Q1 2006: operating profit of CHF 61.0 m). In Q1 2007, Cash EBIT amounted to CHF 101.3 million (Q1 2006: CHF 71.7 m). Compared to Q4 2006, cash EBIT increased by 20%. As a reminder, cash EBIT is operating income excluding non-cash charges such as charges related to employee stock options, depreciation and amortization charges as well as IPRD charges.
Net income
Net loss for the first quarter 2007 was CHF 150.0 million (Q1 2006: net profit of CHF 53.7 m). This includes interest income of CHF 3.8 million, interest expense of CHF 0.1 million, a non-cash convertible bond charge of CHF 2.9 million and other financial income - predominantly related to currency hedging - of CHF 9.3 million. In Q1 2007, the net income tax expense was CHF 8.7 million. Net income for the previous quarter was CHF 69.3 million.
Cash and cash flow
The company generated cash from operations in the first quarter of 2007 of CHF 61.9 million (Q1 2006; CHF 33.2 m). Cash from operations in Q4 2006 was CHF 84.1 million.
Research and Development programs on track
At the ‘Actelion Day’ in mid- February 2007, the company provided a full update on its Research and Development program. The programs discussed are on track. The next update is schedule at the H1 2007 report in July 2007.
For documentation purposes – table Q1 2007 vs. Q4 2006
Actelion Ltd
Actelion Ltd is a biopharmaceutical company with its corporate headquarters in Allschwil/Basel, Switzerland. Actelion's first drug Tracleer®, an orally available dual endothelin receptor antagonist, has been approved as a therapy for pulmonary arterial hypertension. Actelion markets Tracleer® through its own subsidiaries in key markets worldwide, including the United States (based in South San Francisco), the European Union, Japan, Canada, Australia and Switzerland. Actelion, founded in late 1997, is a leading player in innovative science related to the endothelium – the single layer of cells separating every blood vessel from the blood stream. Actelion focuses on the discovery, development and marketing of innovative drugs for significant unmet medical needs. Actelion shares are traded on the SWX Swiss Exchange (ticker symbol: ATLN).
For further information please contact:
Actelion Ltd, Gewerbestrasse 16, CH-4123 Allschwil
Investor Contact
Roland Haefeli
+41 61 565 64 58
+1 650 624 6936
Media Contact
Peter Engel
+41 61 565 66 28
+1 650 624 6996
http://www.actelion.com
Conference Call
Actelion will host an Investor Conference Call and discussion/Q&A on Thursday, 19 April 2007,
15.00 CEST / 09.00 a.m. EDT / 14.00 BST
Dial:
+41 (0) 91 610 56 00
(Europe)
+1 (1) 866 291 41 66
(U.S.)
+44 207 107 06 11
(U.K.)
Webcast – Live and replay on demand
Actelion webcasts its Investor Conference Call. On the Web, you may either follow the call live or have the call replayed later on demand.
To access the webcast live, simply visit the link on our homepage http://www.actelion.com 5-10 minutes before the conference is due to start.
Approximately 60 minutes after the call has ended, the archived investor webcast will be available for replay through our homepage. After 2 weeks, it will be stored under Investors/Past Events.
Die Tabellen sieht man am besten unter:
http://www.actelion.com/UniNet/www/www_main_P.nsf/Content/me…
19 April 2007
Actelion announces first quarter results 2007
Total net revenue increases to CHF 290.4 million, up 38 percent compared to Q1 2006 - Tracleer® sales of CHF 260.4 million - Cash EBIT up 41% to CHF 101.3million - One-time IPRD charge results in US GAAP Operating loss - Increased revenue and Cash EBIT guidance for FY 2007
ALLSCHWIL/BASEL, SWITZERLAND – 19 April 2007 – Actelion Ltd (SWX: ATLN) today announced its financial results for the first quarter of 2007. With total net revenue of CHF 290.4 million (Q1 2006: CHF 210.6 m) and operating expenses of CHF 441.9 million (Q1 2006: 149.5 m) – including a one-time non-cash In-Process Research and Development (IPRD) charge of CHF 224.8 million, the company reported an operating loss under US-GAAP of CHF 151.5 million (Q1 2006: operating profit of CHF 61.0 m). The net loss for the quarter was CHF 150.0 million (Q1 2006: operating profit of CHF 53.7 m).
The loss per share (EPS) for the first quarter of 2007 was CHF 6.43 (basic: number of shares 23.3 million) compared to fully diluted earnings per share of CHF 2.33 in Q1 2006 (fully diluted: number of shares: 23.1 million).
To better measure and compare operating performance over time, Actelion also reports non-GAAP Cash-EBIT (Operating Income excluding non-cash charges such as In-Process R&D, charges related to employee stock options under FAS 123R, as well as non-cash depreciation and amortization charges). In Q1 2007, Actelion’s Cash-EBIT was CHF 101.3 million, an increase of 41% percent compared to Q1 2006.
Jean-Paul Clozel, MD and Chief Executive Officer commented: "Actelion has successfully achieved many different milestones during the first three months of 2007, highlighting the strength of our organization as well as our innovation power. We grew Tracleer® in the marketplace. We demonstrated the benefits of our dual endothelin receptor antagonist in patients suffering from chronic-thromboembolic pulmonary hypertension. We successfully concluded the integration of CoTherix within only a few weeks, adding Ventavis® to our PAH franchise in the US. We obtained a positive opinion in the European Union on the use of Tracleer® in patients with systemic sclerosis and ongoing digital ulcer disease. We further demonstrated the innovation power of Actelion with the outstanding initial efficacy findings obtained with our first-in-class dual orexin receptor antagonist in patients with primary insomnia.”
Jean-Paul Clozel concluded: "I am confident that Actelion has every resource required to continue its long-term growth trajectory. There is upcoming competition in the PAH field, but our two products – both first-in-class – are uniquely supported by outstanding long-term clinical data and a strong and experienced sales force. By year-end, the company could have five different compounds in Phase III and ten compounds in clinical development in total, some of them with blockbuster potential. Therefore, I believe that we have a pipeline at hand with the potential to put the company on an accelerated growth trajectory in the years to come.”
CoTherix integration successfully completed
On 9 January 2007, Actelion consummated the acquisition of CoTherix. Thereby, Actelion strengthened its PAH franchise by adding Ventavis® (iloprost) to its product offerings in the United Sates. Ventavis® is the only approved inhaled therapy for the treatment of Pulmonary Arterial Hypertension (WHO group I) in patients with NYHA class III or IV symptoms.
Actelion is continuing the ongoing programs to further evaluate the safety and efficacy of both, Ventavis® in combination settings and its use in an improved delivery system. Later this year, the company expects to make decisions on how to further improve Ventavis® delivery, via dry-powder reformulation or by other approaches.
After careful review, Actelion has decided not to pursue further development with fasudil. Accordingly, the related agreement with Asahi-Kasei has been terminated.
The CoTherix integration itself was successfully completed in early March 2007. The integration resulted in the rapid realization of the expected synergies, making this acquisition – as expected – immediately cash-accretive.
In terms of accounting under US-GAAP, the transaction resulted in a one-time, non-cash charge for In-Process Research and Development of CHF 224.8 million, as reported in Q1 2007. The transaction also results in an annual recurrent non-cash amortization charge related to acquired capitalized intangible assets of approximately CHF 16 million for each of the next 12 years. In addition, this transaction is expected to result in a slower than expected increase in the corporate tax rate.
Andrew J. Oakley, Chief Financial Officer commented: “Operationally, Actelion has continued to perform strongly in the first three months of 2007, as witnessed by the continued growth of Tracleer® in the market place and the increase in Cash EBIT. As expected, the accounting related to the CoTherix acquisition resulted in an operating loss under US GAAP in Q1 2007. In 2008, the transaction is expected to be US-GAAP earnings accretive.
Andrew J. Oakley continued: “I now believe that, given a three-month performance already ahead of my expectations, Actelion will report – unforeseen events excluded - total net revenues in 2007 of between 1’200 to 1’245 million Swiss Francs (previously estimated at 1’175 to 1’225) and a Cash EBIT of between 380 to 415 million Swiss Francs (previously estimated at 360 to 395).”
Financial result overview – Table Q1 2007 vs. Q1 2006
The full financial statements for the first quarter 2007 can be found on http://www.actelion.com.
Strong top line growth
In the first quarter of 2007, Actelion’s total net revenue was CHF 290.4 million (Q1 2006: 210.6 m). On a quarter-to-quarter basis, total net revenue grew by 11 percent (Q4 2006: 261.4 m).
Contract revenues in Q1 2007 amounted to CHF 6.8 million (Q1 2006: 3.8 m). On a quarter-to-quarter basis, contract revenues were almost unchanged (Q4 2006: CHF 7.1 m).
Continued Tracleer® growth – Ventavis® sales on track
In Q1 2007, Tracleer® sales were CHF 260.4 million (Q1 2006: CHF 201.4 m). On a quarter-to-quarter basis, Tracleer® sales increased by 5 percent (Q4 2006: CHF 246.8 m).
At the end of March 2007, Tracleer® (bosentan) was marketed in over 35 countries worldwide, including all major pharmaceutical markets.
In Q1 2007, Ventavis® (iloprost) sales were CHF 15.8 million. These sales were achieved after CoTherix was formally acquired on 9 January 2007. On a pro-forma basis, first-quarter sales – including those booked by Co-Therix in the period up to 9 January 2007, were CHF 23.2 million. In comparison, Q4 pro-forma sales would have been CHF 15.4 million.
A proportion of the increase in either Tracleer® or Ventavis® sales might be attributable to buying pattern variations.
In the first quarter of 2007, Zavesca® sales reached CHF 7.5 million (Q1 2006: CHF 5.4 m). On a quarter-to-quarter basis, Zavesca® sales were flat (Q4 2006: CHF 7.4 m). Zavesca® (miglustat) is commercially available in the United States and in most European markets.
Tracleer® expands beyond PAH
On 5 March 2007, the double-blind, placebo-controlled, multicenter study BENEFiT (Bosentan Effects in Inoperable Forms of Chronic Thromboembolic Pulmonary Hypertension) demonstrated that treatment with bosentan (Tracleer®) was associated with a significant reduction in pulmonary vascular resistance PVR (positive primary endpoint, p<0.0001).
In this first-ever double-blind study in a patient population suffering from this form of pulmonary hypertension, the six-minute walk test remained stable over the four months of blinded evaluation in both treatment groups. Patients on bosentan showed a significant improvement in breathlessness (Borg dyspnoea score) with exercise and there was a trend in favor of bosentan towards prevention of worsening WHO functional class.
Initial results also indicate that treatment with bosentan was associated with a significant decrease in NT-proBNP, an important biomarker of disease severity. In this study, Tracleer®’s safety and tolerability profile was consistent with that observed in previous placebo-controlled clinical trials in pulmonary arterial hypertension (PAH).
On 26 March 2007, the Committee for Medicinal Products for Human Use (CHMP), the scientific committee of the European Medicines Agency (EMEA), has issued a positive opinion on bosentan (Tracleer®) to extend the use of this dual endothelin receptor antagonist beyond Pulmonary Arterial Hypertension. The CHMP has recommended that the European Commission approve bosentan (Tracleer®) for the reduction of the number of new digital ulcers in patients with systemic sclerosis and ongoing digital ulcer disease. The European Commission is expected to make a final decision before the end of May 2007.
Christian Chavy, President Business Operations, commented: “Actelion continues to strengthen Tracleer® and its PAH franchise ahead of upcoming competition. The positive results, with our orally available dual endothelin receptor antagonist in CTEPH, highlight once again the unique benefits of our lead product. I am also pleased with Ventavis® sales, where we now have the full Actelion US sales force behind this important inhaled treatment option.”
Christian Chavy concluded: “With the positive CHMP decision on the use of Tracleer® for digital ulcerations, we will soon be able to expand the use of Tracleer® beyond PAH. We are preparing a dedicated outreach effort to scleroderma physicians. We will support the appropriate use of the product through a dedicated registry effort.”
Expenditure in line with company expectations
In Q1 2007, operating expenses were CHF 441.9 million (Q1 2006: CHF 149.5 m). Compared to the previous quarter, this represents a 133 percent increase (Q4 2006: CHF 190.0 m). Included in the operating expenses are recurrent non-cash charges of CHF 18.7 million for employee stock options as mandated by FAS 123R, recurrent non-cash charges for depreciation and amortization of CHF 9.2 million as well as a one-time only In-Process Research and Development (IPRD) charge of CHF 224.8 million related to the acquisition of CoTherix.
In Q1 2007, research and development expenses were CHF 65.7 million (Q1 2006: CHF 47.7 m). Compared to the previous quarter, this represents an increase of 16 percent (Q4 2006: CHF 56.7 m), in-line with the start of new pre-clinical and clinical programs, such as the BUILD-3 pivotal study to evaluate the safety and efficacy of bosentan in patients suffering from idiopathic pulmonary fibrosis (IPF) and accelerated recruitment into the Phase II program with the orexin receptor antagonist.
In Q1 2007, marketing and advertising costs were CHF 52.6 million (Q1 2006: CHF 41.1 m). Compared to the previous quarter (Q4 2006: CHF 56.1m), this represents a decrease of 6 percent, in-line with usual seasonal trends.
In Q1 2007, selling, general and administrative expenses amounted to CHF 64.5 million (Q1 2006: CHF 39.4 m). Compared to the previous quarter, these expenses were 24% higher (Q4 2006: CHF 51.9m).
Loss under US GAAP – Increased non-GAAP Cash EBIT
In the first quarter of 2007, Actelion’s operating loss was CHF 151.5 million (Q1 2006: operating profit of CHF 61.0 m). In Q1 2007, Cash EBIT amounted to CHF 101.3 million (Q1 2006: CHF 71.7 m). Compared to Q4 2006, cash EBIT increased by 20%. As a reminder, cash EBIT is operating income excluding non-cash charges such as charges related to employee stock options, depreciation and amortization charges as well as IPRD charges.
Net income
Net loss for the first quarter 2007 was CHF 150.0 million (Q1 2006: net profit of CHF 53.7 m). This includes interest income of CHF 3.8 million, interest expense of CHF 0.1 million, a non-cash convertible bond charge of CHF 2.9 million and other financial income - predominantly related to currency hedging - of CHF 9.3 million. In Q1 2007, the net income tax expense was CHF 8.7 million. Net income for the previous quarter was CHF 69.3 million.
Cash and cash flow
The company generated cash from operations in the first quarter of 2007 of CHF 61.9 million (Q1 2006; CHF 33.2 m). Cash from operations in Q4 2006 was CHF 84.1 million.
Research and Development programs on track
At the ‘Actelion Day’ in mid- February 2007, the company provided a full update on its Research and Development program. The programs discussed are on track. The next update is schedule at the H1 2007 report in July 2007.
For documentation purposes – table Q1 2007 vs. Q4 2006
Actelion Ltd
Actelion Ltd is a biopharmaceutical company with its corporate headquarters in Allschwil/Basel, Switzerland. Actelion's first drug Tracleer®, an orally available dual endothelin receptor antagonist, has been approved as a therapy for pulmonary arterial hypertension. Actelion markets Tracleer® through its own subsidiaries in key markets worldwide, including the United States (based in South San Francisco), the European Union, Japan, Canada, Australia and Switzerland. Actelion, founded in late 1997, is a leading player in innovative science related to the endothelium – the single layer of cells separating every blood vessel from the blood stream. Actelion focuses on the discovery, development and marketing of innovative drugs for significant unmet medical needs. Actelion shares are traded on the SWX Swiss Exchange (ticker symbol: ATLN).
For further information please contact:
Actelion Ltd, Gewerbestrasse 16, CH-4123 Allschwil
Investor Contact
Roland Haefeli
+41 61 565 64 58
+1 650 624 6936
Media Contact
Peter Engel
+41 61 565 66 28
+1 650 624 6996
http://www.actelion.com
Conference Call
Actelion will host an Investor Conference Call and discussion/Q&A on Thursday, 19 April 2007,
15.00 CEST / 09.00 a.m. EDT / 14.00 BST
Dial:
+41 (0) 91 610 56 00
(Europe)
+1 (1) 866 291 41 66
(U.S.)
+44 207 107 06 11
(U.K.)
Webcast – Live and replay on demand
Actelion webcasts its Investor Conference Call. On the Web, you may either follow the call live or have the call replayed later on demand.
To access the webcast live, simply visit the link on our homepage http://www.actelion.com 5-10 minutes before the conference is due to start.
Approximately 60 minutes after the call has ended, the archived investor webcast will be available for replay through our homepage. After 2 weeks, it will be stored under Investors/Past Events.
Antwort auf Beitrag Nr.: 28.891.885 von 11up am 19.04.07 08:12:55Die Belastung - und der damit verbundene Verlust nach US-GAAP - durch die CoTherix Übernahme und das Optionsprogramm wurde in Q1 ja schon ausführlich diskutiert und sollte deshalb eingepreised sein.
"In terms of accounting under US-GAAP, the transaction resulted in a one-time, non-cash charge for In-Process Research and Development of CHF 224.8 million, as reported in Q1 2007. The transaction also results in an annual recurrent non-cash amortization charge related to acquired capitalized intangible assets of approximately CHF 16 million for each of the next 12 years. In addition, this transaction is expected to result in a slower than expected increase in the corporate tax rate."
Siehe hierzu auch Full Year 2006 financial results:
http://www.actelion.com/uninet/www/www_main_p.nsf/Content/me…
"Andrew J. Oakley concluded: “In 2007, I expect that Actelion will continue to report both revenue growth and Cash-EBIT growth. Unforeseen events excluded, total net revenues are expected to reach between CHF 1.175 and 1.225 billion. Operating income under US-GAAP is expected to be in the range of CHF 65 to 75 million, due to a substantial increase in non-cash charges, especially due to an In-Process R&D charge in relation to the CoTherix transaction of approximately CHF 200 million and higher charges for employee stock options due to the 146 percent performance of Actelion shares in 2006. By eliminating such non-cash items, I expect the company to report an increase in Cash-EBIT to between CHF 360 to 395 million”."
"In terms of accounting under US-GAAP, the transaction resulted in a one-time, non-cash charge for In-Process Research and Development of CHF 224.8 million, as reported in Q1 2007. The transaction also results in an annual recurrent non-cash amortization charge related to acquired capitalized intangible assets of approximately CHF 16 million for each of the next 12 years. In addition, this transaction is expected to result in a slower than expected increase in the corporate tax rate."
Siehe hierzu auch Full Year 2006 financial results:
http://www.actelion.com/uninet/www/www_main_p.nsf/Content/me…
"Andrew J. Oakley concluded: “In 2007, I expect that Actelion will continue to report both revenue growth and Cash-EBIT growth. Unforeseen events excluded, total net revenues are expected to reach between CHF 1.175 and 1.225 billion. Operating income under US-GAAP is expected to be in the range of CHF 65 to 75 million, due to a substantial increase in non-cash charges, especially due to an In-Process R&D charge in relation to the CoTherix transaction of approximately CHF 200 million and higher charges for employee stock options due to the 146 percent performance of Actelion shares in 2006. By eliminating such non-cash items, I expect the company to report an increase in Cash-EBIT to between CHF 360 to 395 million”."
Antwort auf Beitrag Nr.: 28.892.906 von 11up am 19.04.07 08:58:35Siehe dazu auch:
http://www.baz.ch/news/index.cfm?ObjectID=08700B59-1422-0CEF…
Übernahmekosten verursachen hohen Verlust bei Actelion
Allschwil. AP/baz. Der Baselbieter Biopharmakonzern Actelion weist im Zuge der Übernahme der kalifornischen Konkurrentin CoTherix für das erste Quartal 2007 einen Verlust von 150 Millionen Franken aus. Im Vorjahresquartal war noch ein Gewinn von 53,7 Millionen Franken erzielt worden.
Im Ergebnis des ersten Quartals ist eine einmalige nicht liquiditätswirksame Belastung für laufende Forschungs- und Entwicklungsprojekte von 225 Millionen Franken enthalten, wie das Unternehmen am Donnerstag weiter mitteilte.
Diese Kosten, die mit der Übernahme von CoTherix verbunden sind, sind damit höher als die angekündigten rund 200 Millionen Franken. Der Umsatz stieg im ersten Quartal um 38 Prozent auf 290,4 Millionen Franken.
http://www.baz.ch/news/index.cfm?ObjectID=08700B59-1422-0CEF…
Übernahmekosten verursachen hohen Verlust bei Actelion
Allschwil. AP/baz. Der Baselbieter Biopharmakonzern Actelion weist im Zuge der Übernahme der kalifornischen Konkurrentin CoTherix für das erste Quartal 2007 einen Verlust von 150 Millionen Franken aus. Im Vorjahresquartal war noch ein Gewinn von 53,7 Millionen Franken erzielt worden.
Im Ergebnis des ersten Quartals ist eine einmalige nicht liquiditätswirksame Belastung für laufende Forschungs- und Entwicklungsprojekte von 225 Millionen Franken enthalten, wie das Unternehmen am Donnerstag weiter mitteilte.
Diese Kosten, die mit der Übernahme von CoTherix verbunden sind, sind damit höher als die angekündigten rund 200 Millionen Franken. Der Umsatz stieg im ersten Quartal um 38 Prozent auf 290,4 Millionen Franken.
http://www.newratings.com/analyst_news/article_1540789.html
Actelion "overweight," target price raised
Wednesday, May 30, 2007 3:49:54 AM ET
J.P. Morgan Securities
LONDON, May 30 (newratings.com) - Analyst Annie J Cheng of JP Morgan maintains her "overweight" rating on Actelion Ltd (ACT.ETR). The target price has been raised from CHF325 to CHF330.
In a research note published this morning, the analyst mentions that the company is well positioned to retain its patient base going forward. The primary driver of Actelion’s stock is expected to be the product pipeline, with success in any one of its four blockbuster programmes having the potential to transform the company, the analyst adds. The global base revenue estimates for Tracleer for 2007 and 2008 are CHF1,066 million and CHF1,130 million, respectively.
Actelion "overweight," target price raised
Wednesday, May 30, 2007 3:49:54 AM ET
J.P. Morgan Securities
LONDON, May 30 (newratings.com) - Analyst Annie J Cheng of JP Morgan maintains her "overweight" rating on Actelion Ltd (ACT.ETR). The target price has been raised from CHF325 to CHF330.
In a research note published this morning, the analyst mentions that the company is well positioned to retain its patient base going forward. The primary driver of Actelion’s stock is expected to be the product pipeline, with success in any one of its four blockbuster programmes having the potential to transform the company, the analyst adds. The global base revenue estimates for Tracleer for 2007 and 2008 are CHF1,066 million and CHF1,130 million, respectively.
Die Baselbieter Biotechnologiefirma Actelion will den geplanten Aktiensplit am kommenden Mittwoch durchführen. Die Teilung erfolgt im Verhältnis 1:5.
Die Aktionäre von Actelion hatten diesem Aktiensplit an der Generalversammlung Anfang Mai 2007 zugestimmt. Das entsprechende Kotierungsinserat werde am 5. Juni 2007 veröffentlicht, teilte Actelion am Donnerstag mit.
Das im November 2006 angekündigte Aktienrückkaufprogramm im Wert von bis zu 48 Mio. Franken sei abgeschlossen, teilte Actelion weiter mit. Mit dieser Massnahme soll der Verwässerungseffekt der 2008 fälligen Wandelanleihe abgeschwächt werden. Insgesamt hat das Unternehmen 129 275 seiner Namenaktien für einen Betrag von 35 Mio. Franken zurückgekauft.
Die Aktionäre von Actelion hatten diesem Aktiensplit an der Generalversammlung Anfang Mai 2007 zugestimmt. Das entsprechende Kotierungsinserat werde am 5. Juni 2007 veröffentlicht, teilte Actelion am Donnerstag mit.
Das im November 2006 angekündigte Aktienrückkaufprogramm im Wert von bis zu 48 Mio. Franken sei abgeschlossen, teilte Actelion weiter mit. Mit dieser Massnahme soll der Verwässerungseffekt der 2008 fälligen Wandelanleihe abgeschwächt werden. Insgesamt hat das Unternehmen 129 275 seiner Namenaktien für einen Betrag von 35 Mio. Franken zurückgekauft.
http://www.actelion.com/uninet/www/www_main_p.nsf/Content/me…
Bosentan (Tracleer®) erhält EU-Zulassung zur Reduzierung der Anzahl neuer digitaler Ulzerationen bei Sklerodermie-Patienten
ALLSCHWIL, SCHWEIZ - 11. Juni 2007 - Actelion Ltd (SWX: ATLN) gab heute bekannt, dass die Europäische Kommission die Marktzulassung für Tracleer® zur Reduzierung der Anzahl neuer digitaler Ulzerationen bei Sklerodermie-Patienten, die an digitalen Ulzerationen leiden, erteilt hat.
Tracleer® ist ein oraler, dualer Endothelin-Rezeptor-Antagonist, der bereits zur Behandlung der pulmonalen arteriellen Hypertonie (PAH Funktionsklasse III und IV in den Vereinigten Staaten seit November 2001, Funktionsklasse III in Europa seit Mai 2002) zugelassen ist.1
Zentrales Merkmal vieler Komplikationen bei Sklerodermie sind Gefässkrankheiten. Daher besteht für an dieser Krankheit leidende Patienten ein hohes Risiko, digitale Ulzerationen sowie pulmonale arterielle Hypertonie zu entwickeln. Digitale Ulzerationen sind eine wichtige und schmerzhafte Komplikation bei Sklerodermie. Rund 50 Prozent der Patienten mit Sklerodermie entwickeln im Laufe ihres Lebens digitale Ulzerationen.2 Nach Schätzungen neuester wissenschaftlicher Veröffentlichungen liegt die Häufigkeit des Auftretens von PAH bei Sklerodermie-Patienten bei ungefähr 12-16%.3,4
Behördliche Verfahren zur Ausweitung des Indikationsbereichs von Tracleer® auf die Behandlung digitaler Ulzerationen laufen weltweit.
###
Über Sklerodermie und digitale Ulzerationen
Sklerodermie (oder systemische Sklerose – SSc) ist eine chronische autoimmune Bindegewebserkrankung, die durch übermässige Kollagenablagerung in der Haut und inneren Organen wie dem Verdauungstrakt, Nieren, Herz und Lungen gekennzeichnet ist. Die Symptome resultieren aus der vaskulären Funktionsstörung, Entzündungen und progressiver Fibrose, die zum Verschluss der Mikrogefässe führen.
Die Gefässschädigungen aufgrund vaskulärer Fehlfunktionen führen zu Komplikationen wie pulmonaler arterieller Hypertonie (ca. 200.000 PAH Patienten weltweit) und digitalen Ulzerationen (ca. 5.000 schwere Fälle jährlich weltweit). Rund 50 Prozent der Sklerodermie-Patienten leiden mindestens einmal in ihrer Krankheitsgeschichte an digitalen Ulzerationen (DUs). DUs sind sehr schmerzhafte und schwer heilende offene Wunden an Fingern und Zehen, die Narben hinterlassen und die Fähigkeit der Patienten zur Ausübung ihrer beruflichen Tätigkeit und zur Bewältigung täglicher Verrichtungen beeinträchtigen, insbesondere solcher, für die die Funktionen der Fingerspitzen erforderlich sind. In schweren Fällen können Infektionen den Verlauf komplizieren und zu Knochenmarkentzündungen oder zur Bildung von Nekrosen führen, die Operationen oder sogar Amputationen erforderliche machen können.
DUs entstehen infolge einer Verengung kleiner Blutgefässe (obliterierende Vaskulopathie wie auch bei PAH in der Lunge zu beobachten), die die Durchblutung von Fingern und Zehen einschränken. Endothelin ist als pathogener Mediator an der Entstehung von Gefässschäden beteiligt. Es verursacht Gefässverengungen und trägt ausserdem zur Entstehung von Fibrosen, vaskulärer Hypertrophie und Entzündungen bei. Tracleer®, ein dualer Endothelin-Rezeptor-Antagonist, wirkt in der Behandlung von PAH bei Sklerodermie-Patienten durch die Blockade des schädlichen Effekts erhöhter Endothelin-Werte.
Über RAPIDS-1
Bei RAPIDS-1 (RAndomized Placebo-controlled Investigation of Digital ulcers in Scleroderma – randomisierte, plazeobo-kontrollierte Untersuchung digitaler Ulzerationen bei Sklerodermie) handelte es sich um eine plazebo-kontrollierte klinische Doppelblind-Studie, in deren Rahmen die Prävention ischämischer digitaler Ulzerationen an 122 Sklerodermie-Patienten in 17 Zentren in Europa und Nordamerika geprüft wurde und deren Design speziell auf die Prävention der Bildung von Geschwüren abgestimmt war. Darüber hinaus gehörte diese Studie zu den wenigen, die eine klinische Wirksamkeit bei systemischer Sklerose belegten.5
Sklerodermie-Patienten, die entweder während der letzten 12 Monate mindestens eine digitale Ulzeration entwickelt hatten oder zur Zeit der Erfassung active digitale Ulzerationen aufwiesen, wurden entweder mit Bosentan (62,5mg zweimal täglich über vier Wochen, dann 125mg zweimal täglich für die nächsten 12 Wochen) oder mit Plazebo behandelt. Die Gesamtzahl neuer Ulzerationen während der Behandlungsperiode lag bei 1,4 bei den mit Bosentan behandelten Patienten versus 2,7 bei den Patienten, die Plazebo erhielten (p=0,0083), was einer 48%igen Reduktion der Anzahl neuer digitaler Ulzerationen gleichkommt.5
Über RAPIDS-2
Ende 2003 lancierte Actelion eine zweite Zulassungsstudie der Phase III (RAPIDS-2: RAndomized Placebo-controlled Investigation of Digital ulcers in Scleroderma) zu Tracleer® bei ischämischen digitalen Ulzerationen in Verbindung mit Sklerodermie. Im Gegensatz zu der vorangegangenen RAPIDS-1-Studie beurteilte diese Studie zusätzlich Heilung und Prävention bei einer Patientenpopulation, die zur Zeit der Erfassung an schweren Formen dieser Erkrankung litt. Auch die Behandlungsdauer wurde verlängert und eine Unterbrechung der Behandlung wurde eingeführt, um die Entwicklung der digitalen Ulzerationen nach einer Behandlungspause bewerten zu können. An der Studie waren 188 Patienten in 41 Zentren weltweit beteiligt.6
Sklerodermie-Patienten mit mindestens einer digitalen Ulzeration wurden entweder mit Bosentan (62,5mg zweimal täglich über vier Wochen, danach 125mg zweimal täglich für mindestens 20 und bis zu 32 Wochen) oder mit Plazebo behandelt. Die Gesamtzahl neuer Ulzerationen über 24 Wochen belief sich auf 1,9 ± 0,2 für Patienten bei Behandlung mit Bosentan versus 2,7 ± 0,3 für Patienten unter Plazeobo (p=0,035), gleichbedeutend mit einer 30%igen Reduktion der Anzahl neuer digitaler Ulzerationen. Die Reduktion der digitalen Ulzerationen fiel bei Patienten mit mehr als drei aktiven digitalen Ulzerationen zu Beginn der Studie ausgeprägter aus.6
Über pulmonale arterielle Hypertonie (PAH)
Pulmonale arterielle Hypertonie (PAH) ist eine chronische, lebensbedrohende Erkrankung, die durch abnorm hohen Blutdruck in den Arterien zwischen Herz und Lunge der betroffenen Patienten gekennzeichnet ist. Die Funktionen von Herz und Lunge sind stark beeinträchtigt, was sich in einer eingeschränkten körperlichen Leistungsfähigkeit und letztendlich einer verkürzten Lebenserwartung niederschlägt. Etwa 100.000 Menschen in Europe und den USA leiden an primärem Lungenhochdruck oder sekundären Formen der Erkrankung. Letztere sind Folge von anderen Krankheiten oder Gewebeveränderungen der Lunge wie Sklerodermie, Lupus, HIV/AIDS oder angeborenen Herzkrankheiten.
Über Tracleer® bei pulmonaler arterieller Hypertonie (PAH)
Tracleer®, der erste orale duale Endothelin-Rezeptor-Antagonist, ist für die Behandlung der pulmonalen arteriellen Hypertonie (PAH) zugelassen und wird durch Niederlassungen von Actelion in den USA, der Europäischen Union, Japan, Australien, Kanada, der Schweiz und anderen Märkten weltweit verfügbar gemacht.
In klinischen Studien, die zur Marktzulassung des Produkts führen, wiesen ca. 11% der mit Tracleer® behandelten PAH-Patienten abnormale jedoch reversible Erhöhungen der Leberenzymwerte auf. Daher ist eine monatliche Kontrolle der Leberenzymwerte erforderlich. Wegen des Risikos einer Schädigung des ungeborenen Kindes dürfen Schwangere und Frauen im gebärfähigen Alter, die keine zuverlässige Verhütungsmethode anwenden, Tracleer® nicht einnehmen .1
Literatur
1. Tracleer® SPC
2. Black C. Pulmonary arterial hypertension: are we doing enough to identify systemic sclerosis patients at high risk of this rare condition? Rheumatology 2005, 44: 141-142
3. McGoon M. et al. Chest 2004, 126: 14-34
4. Distler O. and Pignone A. Rheumatology (Oxford) 2006, 45 Suppl 4:iv22-iv25
5. Korn J. et al. Digital ulcers in systemic sclerosis: Prevention by treatment with bosentan, an oral endothelin receptor antagonist Arthritis & Rheumatism 2004, Issue 12; 50: 3985-3993
6. Seibold J. et al. Bosentan prevents occurrence but does not speed healing of digital ulcers in patients with systemic sclerosis (SSc). ACR 2005. Poster presentation L2: 552
Bosentan (Tracleer®) erhält EU-Zulassung zur Reduzierung der Anzahl neuer digitaler Ulzerationen bei Sklerodermie-Patienten
ALLSCHWIL, SCHWEIZ - 11. Juni 2007 - Actelion Ltd (SWX: ATLN) gab heute bekannt, dass die Europäische Kommission die Marktzulassung für Tracleer® zur Reduzierung der Anzahl neuer digitaler Ulzerationen bei Sklerodermie-Patienten, die an digitalen Ulzerationen leiden, erteilt hat.
Tracleer® ist ein oraler, dualer Endothelin-Rezeptor-Antagonist, der bereits zur Behandlung der pulmonalen arteriellen Hypertonie (PAH Funktionsklasse III und IV in den Vereinigten Staaten seit November 2001, Funktionsklasse III in Europa seit Mai 2002) zugelassen ist.1
Zentrales Merkmal vieler Komplikationen bei Sklerodermie sind Gefässkrankheiten. Daher besteht für an dieser Krankheit leidende Patienten ein hohes Risiko, digitale Ulzerationen sowie pulmonale arterielle Hypertonie zu entwickeln. Digitale Ulzerationen sind eine wichtige und schmerzhafte Komplikation bei Sklerodermie. Rund 50 Prozent der Patienten mit Sklerodermie entwickeln im Laufe ihres Lebens digitale Ulzerationen.2 Nach Schätzungen neuester wissenschaftlicher Veröffentlichungen liegt die Häufigkeit des Auftretens von PAH bei Sklerodermie-Patienten bei ungefähr 12-16%.3,4
Behördliche Verfahren zur Ausweitung des Indikationsbereichs von Tracleer® auf die Behandlung digitaler Ulzerationen laufen weltweit.
###
Über Sklerodermie und digitale Ulzerationen
Sklerodermie (oder systemische Sklerose – SSc) ist eine chronische autoimmune Bindegewebserkrankung, die durch übermässige Kollagenablagerung in der Haut und inneren Organen wie dem Verdauungstrakt, Nieren, Herz und Lungen gekennzeichnet ist. Die Symptome resultieren aus der vaskulären Funktionsstörung, Entzündungen und progressiver Fibrose, die zum Verschluss der Mikrogefässe führen.
Die Gefässschädigungen aufgrund vaskulärer Fehlfunktionen führen zu Komplikationen wie pulmonaler arterieller Hypertonie (ca. 200.000 PAH Patienten weltweit) und digitalen Ulzerationen (ca. 5.000 schwere Fälle jährlich weltweit). Rund 50 Prozent der Sklerodermie-Patienten leiden mindestens einmal in ihrer Krankheitsgeschichte an digitalen Ulzerationen (DUs). DUs sind sehr schmerzhafte und schwer heilende offene Wunden an Fingern und Zehen, die Narben hinterlassen und die Fähigkeit der Patienten zur Ausübung ihrer beruflichen Tätigkeit und zur Bewältigung täglicher Verrichtungen beeinträchtigen, insbesondere solcher, für die die Funktionen der Fingerspitzen erforderlich sind. In schweren Fällen können Infektionen den Verlauf komplizieren und zu Knochenmarkentzündungen oder zur Bildung von Nekrosen führen, die Operationen oder sogar Amputationen erforderliche machen können.
DUs entstehen infolge einer Verengung kleiner Blutgefässe (obliterierende Vaskulopathie wie auch bei PAH in der Lunge zu beobachten), die die Durchblutung von Fingern und Zehen einschränken. Endothelin ist als pathogener Mediator an der Entstehung von Gefässschäden beteiligt. Es verursacht Gefässverengungen und trägt ausserdem zur Entstehung von Fibrosen, vaskulärer Hypertrophie und Entzündungen bei. Tracleer®, ein dualer Endothelin-Rezeptor-Antagonist, wirkt in der Behandlung von PAH bei Sklerodermie-Patienten durch die Blockade des schädlichen Effekts erhöhter Endothelin-Werte.
Über RAPIDS-1
Bei RAPIDS-1 (RAndomized Placebo-controlled Investigation of Digital ulcers in Scleroderma – randomisierte, plazeobo-kontrollierte Untersuchung digitaler Ulzerationen bei Sklerodermie) handelte es sich um eine plazebo-kontrollierte klinische Doppelblind-Studie, in deren Rahmen die Prävention ischämischer digitaler Ulzerationen an 122 Sklerodermie-Patienten in 17 Zentren in Europa und Nordamerika geprüft wurde und deren Design speziell auf die Prävention der Bildung von Geschwüren abgestimmt war. Darüber hinaus gehörte diese Studie zu den wenigen, die eine klinische Wirksamkeit bei systemischer Sklerose belegten.5
Sklerodermie-Patienten, die entweder während der letzten 12 Monate mindestens eine digitale Ulzeration entwickelt hatten oder zur Zeit der Erfassung active digitale Ulzerationen aufwiesen, wurden entweder mit Bosentan (62,5mg zweimal täglich über vier Wochen, dann 125mg zweimal täglich für die nächsten 12 Wochen) oder mit Plazebo behandelt. Die Gesamtzahl neuer Ulzerationen während der Behandlungsperiode lag bei 1,4 bei den mit Bosentan behandelten Patienten versus 2,7 bei den Patienten, die Plazebo erhielten (p=0,0083), was einer 48%igen Reduktion der Anzahl neuer digitaler Ulzerationen gleichkommt.5
Über RAPIDS-2
Ende 2003 lancierte Actelion eine zweite Zulassungsstudie der Phase III (RAPIDS-2: RAndomized Placebo-controlled Investigation of Digital ulcers in Scleroderma) zu Tracleer® bei ischämischen digitalen Ulzerationen in Verbindung mit Sklerodermie. Im Gegensatz zu der vorangegangenen RAPIDS-1-Studie beurteilte diese Studie zusätzlich Heilung und Prävention bei einer Patientenpopulation, die zur Zeit der Erfassung an schweren Formen dieser Erkrankung litt. Auch die Behandlungsdauer wurde verlängert und eine Unterbrechung der Behandlung wurde eingeführt, um die Entwicklung der digitalen Ulzerationen nach einer Behandlungspause bewerten zu können. An der Studie waren 188 Patienten in 41 Zentren weltweit beteiligt.6
Sklerodermie-Patienten mit mindestens einer digitalen Ulzeration wurden entweder mit Bosentan (62,5mg zweimal täglich über vier Wochen, danach 125mg zweimal täglich für mindestens 20 und bis zu 32 Wochen) oder mit Plazebo behandelt. Die Gesamtzahl neuer Ulzerationen über 24 Wochen belief sich auf 1,9 ± 0,2 für Patienten bei Behandlung mit Bosentan versus 2,7 ± 0,3 für Patienten unter Plazeobo (p=0,035), gleichbedeutend mit einer 30%igen Reduktion der Anzahl neuer digitaler Ulzerationen. Die Reduktion der digitalen Ulzerationen fiel bei Patienten mit mehr als drei aktiven digitalen Ulzerationen zu Beginn der Studie ausgeprägter aus.6
Über pulmonale arterielle Hypertonie (PAH)
Pulmonale arterielle Hypertonie (PAH) ist eine chronische, lebensbedrohende Erkrankung, die durch abnorm hohen Blutdruck in den Arterien zwischen Herz und Lunge der betroffenen Patienten gekennzeichnet ist. Die Funktionen von Herz und Lunge sind stark beeinträchtigt, was sich in einer eingeschränkten körperlichen Leistungsfähigkeit und letztendlich einer verkürzten Lebenserwartung niederschlägt. Etwa 100.000 Menschen in Europe und den USA leiden an primärem Lungenhochdruck oder sekundären Formen der Erkrankung. Letztere sind Folge von anderen Krankheiten oder Gewebeveränderungen der Lunge wie Sklerodermie, Lupus, HIV/AIDS oder angeborenen Herzkrankheiten.
Über Tracleer® bei pulmonaler arterieller Hypertonie (PAH)
Tracleer®, der erste orale duale Endothelin-Rezeptor-Antagonist, ist für die Behandlung der pulmonalen arteriellen Hypertonie (PAH) zugelassen und wird durch Niederlassungen von Actelion in den USA, der Europäischen Union, Japan, Australien, Kanada, der Schweiz und anderen Märkten weltweit verfügbar gemacht.
In klinischen Studien, die zur Marktzulassung des Produkts führen, wiesen ca. 11% der mit Tracleer® behandelten PAH-Patienten abnormale jedoch reversible Erhöhungen der Leberenzymwerte auf. Daher ist eine monatliche Kontrolle der Leberenzymwerte erforderlich. Wegen des Risikos einer Schädigung des ungeborenen Kindes dürfen Schwangere und Frauen im gebärfähigen Alter, die keine zuverlässige Verhütungsmethode anwenden, Tracleer® nicht einnehmen .1
Literatur
1. Tracleer® SPC
2. Black C. Pulmonary arterial hypertension: are we doing enough to identify systemic sclerosis patients at high risk of this rare condition? Rheumatology 2005, 44: 141-142
3. McGoon M. et al. Chest 2004, 126: 14-34
4. Distler O. and Pignone A. Rheumatology (Oxford) 2006, 45 Suppl 4:iv22-iv25
5. Korn J. et al. Digital ulcers in systemic sclerosis: Prevention by treatment with bosentan, an oral endothelin receptor antagonist Arthritis & Rheumatism 2004, Issue 12; 50: 3985-3993
6. Seibold J. et al. Bosentan prevents occurrence but does not speed healing of digital ulcers in patients with systemic sclerosis (SSc). ACR 2005. Poster presentation L2: 552
http://de.today.reuters.com/news/newsArticle.aspx?type=marke…
Positive Neuigkeiten veröffentlichten die Pharmafirmen Actelion und Novartis. Der Umsatz des Actelion-Medikaments Tracleer könnte sich nach Angaben eines Unternehmenssprechers bei einer Zulassung für zusätzliche Indikationen verdoppeln.
Positive Neuigkeiten veröffentlichten die Pharmafirmen Actelion und Novartis. Der Umsatz des Actelion-Medikaments Tracleer könnte sich nach Angaben eines Unternehmenssprechers bei einer Zulassung für zusätzliche Indikationen verdoppeln.
http://money.cnn.com/news/newsfeeds/articles/primenewswire/1…
FDA Issues Third Approvable Letter for Thelin (Sitaxsentan Sodium)
Conference Call Scheduled for Monday at 8:00 a.m. ET
June 15, 2007: 07:31 PM EST
HOUSTON, June 15, 2007 (PRIME NEWSWIRE) -- Encysive Pharmaceuticals Inc. (Nasdaq:ENCY) today announced that the Company has received its third approvable letter from the U.S. Food and Drug Administration (FDA) for THELIN(tm) (sitaxsentan sodium), which is under review for the treatment of pulmonary arterial hypertension (PAH).
In this third approvable letter, the FDA stated that Encysive's development program for THELIN did not demonstrate the evidence of effectiveness needed for approval. The FDA did note, however, that the THELIN development program provides some evidence that THELIN improves exercise tolerance in PAH. The FDA encouraged the Company to conduct an additional study to demonstrate the drug's effectiveness in exercise capacity as measured by change in six-minute walk distance.
"We believe we adequately addressed the issue raised by the FDA in the second approvable letter and we are deeply disappointed in their decision. Encysive remains committed to THELIN in Europe, Australia and Canada, where it has been approved for sale," commented Bruce Given, M.D., President and CEO of Encysive Pharmaceuticals Inc. "We greatly appreciate the PAH patients and clinicians in the U.S. and worldwide who have been so supportive of the THELIN development program," he added.
Encysive plans to discuss the most recent approvable letter with the FDA as soon as possible to determine the appropriate path forward.
The Company may be required to make significant reductions in its infrastructure and workforce in the U.S. as a result of the decision by FDA. The Company is reviewing its strategic alternatives and intends to communicate its plans at a later date.
Conference Call Information
Encysive will host a conference call on Monday, June 18, 2007, at 8:00 a.m. ET, to discuss the FDA approval of THELIN. You may access the call either through the call-in number below or through the audio webcast. Please dial in 15 minutes prior to the start time to allow for call processing. The access number for the call is:
Number: (480) 248-5088
Passcode: Encysive Pharmaceuticals
This call is being webcast and can be accessed via Encysive's web site at www.encysive.com.
A replay of the webcast will be available on the Company's web site through July 18, 2007. Additionally, a replay of the call will be available until Friday, June 22, 2007 at 11:59 p.m. ET. The call replay can be accessed by calling:
Number: (320) 365-3844
Access Code: 877197
About Encysive Pharmaceuticals
Encysive Pharmaceuticals Inc. is a global biopharmaceutical company engaged in the discovery, development and commercialization of novel, synthetic, small molecule compounds to address unmet medical needs. Our research and development programs are predominantly focused on the treatment and prevention of interrelated diseases of the vascular endothelium and exploit our expertise in the area of the intravascular inflammatory process, referred to as the inflammatory cascade, and vascular diseases. To learn more about Encysive Pharmaceuticals please visit our web site: www.encysive.com.
The Encysive Pharmaceuticals Inc. logo is available at http://www.primenewswire.com/newsroom/prs/?pkgid=843
This press release contains "forward-looking statements" within the meaning of Section 27A of the Securities Act of 1933, as amended, and Section 21E of the Securities Exchange Act of 1934, as amended. These forward-looking statements are subject to certain risks, trends and uncertainties that could cause actual results to differ materially from those projected. Among those risks, trends and uncertainties are: decisions by the FDA regarding whether and when to approve our NDA for Thelin(tm); unexpected delays in regulatory approval of Thelin(tm) by the FDA in the U.S. and our other products under development; the unpredictability of the duration and results of regulatory review of new drug applications and investigational new drug applications by the FDA; our estimate of the sufficiency of our existing capital resources; our ability to raise additional capital to fund cash requirements for future operations; the availability of sufficient funds to commercialize Thelin(tm) in the U.S. should it be approved by the FDA; the availability of sufficient funds to commercialize Thelin(tm) in the EU, Canada and Australia; market acceptance of Thelin(tm) in the EU, Canada and Australia and the actual rate of acceptance; the impact of reimbursement policies and governmental regulation of prices for Thelin(tm) in the EU, Canada and Australia; our inability to predict revenues from Thelin(tm) and our expense levels in 2007 and beyond; our ability to manufacture and sell any products, potential drug candidates, their potential therapeutic effect, market acceptance or our ability to earn a profit from sales or licenses of any drug candidate; and our ability to discover new drugs in the future, as well as more specific risks, trends and uncertainties facing Encysive such as those set forth in its reports on Forms 8-K, 10-Q and 10-K filed with the U.S. Securities and Exchange Commission. Given these risks, trends and uncertainties, any or all of these forward-looking statements may prove to be incorrect. Therefore you should not rely on any such forward-looking statements. Furthermore, Encysive undertakes no duty to update or revise these forward-looking statements. The Private Securities Litigation Reform Act of 1995 permits this discussion.
CONTACT: Encysive Pharmaceuticals
Investors:
Ann Tanabe, VP, Investor Relations and
Corporate Communications
(713) 796-8822
The Trout Group
Marcy Strickler
(646) 378-2927
Media:
BMC Communications
Dan Budwick
(212) 477-9007 ext. 14
FDA Issues Third Approvable Letter for Thelin (Sitaxsentan Sodium)
Conference Call Scheduled for Monday at 8:00 a.m. ET
June 15, 2007: 07:31 PM EST
HOUSTON, June 15, 2007 (PRIME NEWSWIRE) -- Encysive Pharmaceuticals Inc. (Nasdaq:ENCY) today announced that the Company has received its third approvable letter from the U.S. Food and Drug Administration (FDA) for THELIN(tm) (sitaxsentan sodium), which is under review for the treatment of pulmonary arterial hypertension (PAH).
In this third approvable letter, the FDA stated that Encysive's development program for THELIN did not demonstrate the evidence of effectiveness needed for approval. The FDA did note, however, that the THELIN development program provides some evidence that THELIN improves exercise tolerance in PAH. The FDA encouraged the Company to conduct an additional study to demonstrate the drug's effectiveness in exercise capacity as measured by change in six-minute walk distance.
"We believe we adequately addressed the issue raised by the FDA in the second approvable letter and we are deeply disappointed in their decision. Encysive remains committed to THELIN in Europe, Australia and Canada, where it has been approved for sale," commented Bruce Given, M.D., President and CEO of Encysive Pharmaceuticals Inc. "We greatly appreciate the PAH patients and clinicians in the U.S. and worldwide who have been so supportive of the THELIN development program," he added.
Encysive plans to discuss the most recent approvable letter with the FDA as soon as possible to determine the appropriate path forward.
The Company may be required to make significant reductions in its infrastructure and workforce in the U.S. as a result of the decision by FDA. The Company is reviewing its strategic alternatives and intends to communicate its plans at a later date.
Conference Call Information
Encysive will host a conference call on Monday, June 18, 2007, at 8:00 a.m. ET, to discuss the FDA approval of THELIN. You may access the call either through the call-in number below or through the audio webcast. Please dial in 15 minutes prior to the start time to allow for call processing. The access number for the call is:
Number: (480) 248-5088
Passcode: Encysive Pharmaceuticals
This call is being webcast and can be accessed via Encysive's web site at www.encysive.com.
A replay of the webcast will be available on the Company's web site through July 18, 2007. Additionally, a replay of the call will be available until Friday, June 22, 2007 at 11:59 p.m. ET. The call replay can be accessed by calling:
Number: (320) 365-3844
Access Code: 877197
About Encysive Pharmaceuticals
Encysive Pharmaceuticals Inc. is a global biopharmaceutical company engaged in the discovery, development and commercialization of novel, synthetic, small molecule compounds to address unmet medical needs. Our research and development programs are predominantly focused on the treatment and prevention of interrelated diseases of the vascular endothelium and exploit our expertise in the area of the intravascular inflammatory process, referred to as the inflammatory cascade, and vascular diseases. To learn more about Encysive Pharmaceuticals please visit our web site: www.encysive.com.
The Encysive Pharmaceuticals Inc. logo is available at http://www.primenewswire.com/newsroom/prs/?pkgid=843
This press release contains "forward-looking statements" within the meaning of Section 27A of the Securities Act of 1933, as amended, and Section 21E of the Securities Exchange Act of 1934, as amended. These forward-looking statements are subject to certain risks, trends and uncertainties that could cause actual results to differ materially from those projected. Among those risks, trends and uncertainties are: decisions by the FDA regarding whether and when to approve our NDA for Thelin(tm); unexpected delays in regulatory approval of Thelin(tm) by the FDA in the U.S. and our other products under development; the unpredictability of the duration and results of regulatory review of new drug applications and investigational new drug applications by the FDA; our estimate of the sufficiency of our existing capital resources; our ability to raise additional capital to fund cash requirements for future operations; the availability of sufficient funds to commercialize Thelin(tm) in the U.S. should it be approved by the FDA; the availability of sufficient funds to commercialize Thelin(tm) in the EU, Canada and Australia; market acceptance of Thelin(tm) in the EU, Canada and Australia and the actual rate of acceptance; the impact of reimbursement policies and governmental regulation of prices for Thelin(tm) in the EU, Canada and Australia; our inability to predict revenues from Thelin(tm) and our expense levels in 2007 and beyond; our ability to manufacture and sell any products, potential drug candidates, their potential therapeutic effect, market acceptance or our ability to earn a profit from sales or licenses of any drug candidate; and our ability to discover new drugs in the future, as well as more specific risks, trends and uncertainties facing Encysive such as those set forth in its reports on Forms 8-K, 10-Q and 10-K filed with the U.S. Securities and Exchange Commission. Given these risks, trends and uncertainties, any or all of these forward-looking statements may prove to be incorrect. Therefore you should not rely on any such forward-looking statements. Furthermore, Encysive undertakes no duty to update or revise these forward-looking statements. The Private Securities Litigation Reform Act of 1995 permits this discussion.
CONTACT: Encysive Pharmaceuticals
Investors:
Ann Tanabe, VP, Investor Relations and
Corporate Communications
(713) 796-8822
The Trout Group
Marcy Strickler
(646) 378-2927
Media:
BMC Communications
Dan Budwick
(212) 477-9007 ext. 14
http://www.reuters.com/article/governmentFilingsNews/idUSN15…
UPDATE 3-US approves new drug for severe lung disease
Fri Jun 15, 2007 8:57PM EDT
(Updates with FDA decision on Encysive Pharmaceuticals drug)
By Lisa Richwine
WASHINGTON, June 15 (Reuters) - A new pill for a debilitating and often life-threatening lung disease won approval from U.S. health officials on Friday.
Letairis from Gilead Sciences Inc. (GILD.O: Quote, Profile, Research) received Food and Drug Administration clearance for treating pulmonary arterial hypertension, or PAH.
Industry analysts estimate sales of the drug could top $1 billion a year. The generic name is ambrisentan.
PAH results from high blood pressure in the arteries around the lungs. Early symptoms of fatigue can progress to the point that minor exertion is extremely difficult.
About 100,000 people in the United States have PAH, the FDA said. The disease can occur as a complication of illnesses such as scleroderma and lupus, or for other unknown reasons.
In company studies of 393 patients, people who took Gilead's once-a-day pill were able to walk further on a standard six-minute walk test that measures endurance. Letairis also delayed the worsening of PAH, the FDA said.
The new drug is part of a family called endothelin receptor antagonists (ERAs), which block the action of a substance that narrows blood vessels and elevates blood pressure.
Swiss biotechnology company Actelion (ATLN.S: Quote, Profile, Research) sells a drug in the same class called Tracleer, a twice-a-day pill. Actelion receives nearly 95 percent of its revenue from Tracleer sales.
"Letairis is similar to an existing drug, but offers the potential for fewer drug interactions," Dr. John Jenkins, director of the FDA's Office of New Drugs, said in a statement.
Pfizer also sells a version of Viagra for PAH under the name Revatio.
On Friday, Encysive Pharmaceuticals Inc. (ENCY.O: Quote, Profile, Research) said the FDA again declined to approve its proposed PAH drug called Thelin.
The most common side effects from Letairis included leg and ankle swelling, nasal congestion, facial flushing and sinusitis, the FDA said.
Patients should have monthly blood tests to check for potential liver injury, the FDA said. The drug should not be used by pregnant women or women who may become pregnant because it may cause birth defects. Tracleer carries similar warnings.
A one-month supply will cost $3,940, said Kevin Young, Gilead's executive vice president of commercial operations. The drug will be available in the United States early next week.
Because of the risks of birth defects and liver injury, Letairis will be available only through prescribers, pharmacies and patients who sign up for a restricted distribution program, Gilead said.
Gilead acquired Letairis by buying its developer, Myogen Inc.
Gilead shares rose 1.7 percent to $82.23 in extended trading after closing on Nasdaq at $80.83.
UPDATE 3-US approves new drug for severe lung disease
Fri Jun 15, 2007 8:57PM EDT
(Updates with FDA decision on Encysive Pharmaceuticals drug)
By Lisa Richwine
WASHINGTON, June 15 (Reuters) - A new pill for a debilitating and often life-threatening lung disease won approval from U.S. health officials on Friday.
Letairis from Gilead Sciences Inc. (GILD.O: Quote, Profile, Research) received Food and Drug Administration clearance for treating pulmonary arterial hypertension, or PAH.
Industry analysts estimate sales of the drug could top $1 billion a year. The generic name is ambrisentan.
PAH results from high blood pressure in the arteries around the lungs. Early symptoms of fatigue can progress to the point that minor exertion is extremely difficult.
About 100,000 people in the United States have PAH, the FDA said. The disease can occur as a complication of illnesses such as scleroderma and lupus, or for other unknown reasons.
In company studies of 393 patients, people who took Gilead's once-a-day pill were able to walk further on a standard six-minute walk test that measures endurance. Letairis also delayed the worsening of PAH, the FDA said.
The new drug is part of a family called endothelin receptor antagonists (ERAs), which block the action of a substance that narrows blood vessels and elevates blood pressure.
Swiss biotechnology company Actelion (ATLN.S: Quote, Profile, Research) sells a drug in the same class called Tracleer, a twice-a-day pill. Actelion receives nearly 95 percent of its revenue from Tracleer sales.
"Letairis is similar to an existing drug, but offers the potential for fewer drug interactions," Dr. John Jenkins, director of the FDA's Office of New Drugs, said in a statement.
Pfizer also sells a version of Viagra for PAH under the name Revatio.
On Friday, Encysive Pharmaceuticals Inc. (ENCY.O: Quote, Profile, Research) said the FDA again declined to approve its proposed PAH drug called Thelin.
The most common side effects from Letairis included leg and ankle swelling, nasal congestion, facial flushing and sinusitis, the FDA said.
Patients should have monthly blood tests to check for potential liver injury, the FDA said. The drug should not be used by pregnant women or women who may become pregnant because it may cause birth defects. Tracleer carries similar warnings.
A one-month supply will cost $3,940, said Kevin Young, Gilead's executive vice president of commercial operations. The drug will be available in the United States early next week.
Because of the risks of birth defects and liver injury, Letairis will be available only through prescribers, pharmacies and patients who sign up for a restricted distribution program, Gilead said.
Gilead acquired Letairis by buying its developer, Myogen Inc.
Gilead shares rose 1.7 percent to $82.23 in extended trading after closing on Nasdaq at $80.83.
http://www.gilead.com/wt/sec/pr_1016053
U.S. Food and Drug Administration Approves Gilead's Letairis(TM) (ambrisentan) 5 mg and 10 mg Tablets for the Once-Daily Treatment of Pulmonary Arterial Hypertension (WHO Group 1) in Patients with WHO Functional Class II or III Symptoms
Gilead Also Announces Launch of Gilead(TM)Solutions, a
Comprehensive Access Program
FOSTER CITY, Calif.--(BUSINESS WIRE)--June 15, 2007--Gilead Sciences, Inc. (Nasdaq:GILD) today announced that the U.S. Food and Drug Administration (FDA) has granted approval of Letairis(TM) (ambrisentan) 5 mg and 10 mg tablets. Letairis is an endothelin receptor antagonist (ERA) indicated for the once-daily treatment of pulmonary arterial hypertension (WHO Group 1) in patients with WHO Functional Class II or III symptoms to improve exercise capacity and delay clinical worsening. Letairis will be available in the United States early next week. Because of the risks of liver injury and birth defects, the product will be available through the Letairis Education and Access Program (LEAP), a restricted distribution program designed to help patients learn about the risks of Letairis.
"PAH is a debilitating and life-threatening disease for which there remains a significant need for new treatments," said Lewis J. Rubin, MD, Professor of Medicine, University of California, San Diego. "The availability of new treatments such as ambrisentan is critical to our ability to help patients living with this serious disease."
"All of us at Gilead extend our thanks to the investigators and patients who took part in the Letairis clinical trials, and we appreciate the hard work of the U.S. FDA to ensure this product reaches those in need as quickly as possible," said John C. Martin, PhD, President and CEO of Gilead Sciences. "As a company dedicated to advancing therapeutics for diseases that represent significant unmet medical needs, we look forward to partnering with the PAH community to help patients living with this disease."
In two randomized, double-blind, 12-week, placebo-controlled Phase III clinical trials (ARIES-1 and ARIES-2) involving a total of 393 patients, treatment with Letairis resulted in a significant improvement in six-minute walk distance. An increase in walk distance was observed after four weeks of treatment with each dose regimen of Letairis, with a dose-response observed after 12 weeks of treatment. In ARIES-1, placebo-adjusted mean and median changes from baseline of 31 meters and 27 meters (p=0.008), respectively, were observed for the 5 mg dose. Placebo-adjusted mean and median changes from baseline of 51 meters and 39 meters (p less than 0.001), respectively, were observed for the 10 mg dose. In ARIES-2, placebo-adjusted mean and median changes from baseline of 59 meters and 45 meters (p less than 0.001), respectively, were observed for the 5 mg dose.
Treatment with Letairis also significantly delayed time to clinical worsening of PAH. Clinical worsening was defined as the first occurrence of death, lung transplantation, hospitalization for PAH, atrial septostomy, study withdrawal due to the addition of other PAH therapeutic agents, or study withdrawal due to early escape (progressive disease).
The long-term follow-up of the patients who were treated with Letairis in the two pivotal studies and the open-label extension (n=383) shows that 95 percent were still alive at one year and 94 percent were still receiving Letairis monotherapy. These uncontrolled observations do not allow comparison with a group not given Letairis and cannot be used to determine the long-term effect of Letairis.
In ARIES-1 and ARIES-2, a total of 261 patients received Letairis at doses of 2.5, 5 or 10 mg once daily and 132 patients received placebo. The most common adverse events that occurred at a higher frequency among Letairis-treated patients compared to placebo in the ARIES-1 and ARIES-2 studies included (placebo-adjusted frequency): peripheral edema (6 percent), nasal congestion (4 percent), sinusitis (3 percent), flushing (3 percent) and palpitations (3 percent). Most adverse drug reactions were mild to moderate and only nasal congestion was dose-dependent.
In addition to data from Phase III clinical trials, the Letairis approval is also supported by data from an uncontrolled, open-label study of 36 patients who had previously discontinued endothelin receptor antagonists (bosentan, an investigational drug, or both) due to aminotransferase elevations greater than three times the upper limit of normal(ULN). With a median follow-up period of 13 months and with 50 percent of patients increasing the dose of Letairis to 10 mg, no patients were discontinued for aminotransferase elevations. The most common adverse events observed were peripheral edema, headache, dyspnea and flushing. The study suggests that Letairis may be an option for patients who have experienced asymptomatic aminotransferase elevations on other ERAs after aminotransferase levels have returned to normal.
"Just ten years ago, patients had few options available to combat their disease, but there is now an emerging sense of hope as awareness of this important disease grows and new treatments become available," said Rino Aldrighetti, President and CEO of the Pulmonary Hypertension Association (PHA).
About the Letairis Education and Access Program (LEAP)
Because of the risks of liver injury and birth defects, Letairis is available only through a special restricted distribution program called the Letairis Education and Access Program (LEAP) by calling 1-866-664-LEAP (1-866-664-5327). Only prescribers and pharmacies registered with LEAP are able to prescribe and distribute Letairis. In addition, Letairis may be dispensed only to patients who are enrolled in and meet all conditions of LEAP.
About Gilead(TM)Solutions
Gilead also today announced the launch of Gilead(TM)Solutions, a comprehensive set of programs designed to help patients navigate the reimbursement process for Letairis and help minimize barriers to treatment.
"Gilead is committed first and foremost to patients," said Dr. Martin. "Our hope is that this program will ensure greater access to care for PAH patients with a variety of circumstances, including the often overlooked group of patients who have some form of prescription insurance but have prohibitively high out-of-pocket expenses."
Gilead will assist most eligible privately-insured patients who have high monthly co-payments with a portion of their out-of-pocket expenses. Similarly, patients with Medicare prescription drug coverage or other government-funded insurance may receive assistance with co-payments and deductibles through two existing independent patient foundations. Some restrictions will apply. Gilead's reimbursement support team will guide patients to these resources and explain program eligibility guidelines and the amount of financial assistance available.
Similar to programs Gilead has established for patients in other disease areas, including HIV/AIDS and chronic hepatitis B, uninsured or underinsured patients will have access to reimbursement counseling and support in applying for public insurance programs for which they may qualify.
Gilead has also established a program that addresses the unique access issues that exist at the launch of a new product before formulary status and payer coverage levels are finalized. This will ensure that physicians and patients have immediate access to Letairis while Gilead's reimbursement support team works to identify appropriate financial assistance.
Gilead Solutions programs and services will only be available following enrollment in LEAP.
"Many PAH patients face significant financial barriers, such as prohibitively high co-payment expenses, while also struggling to navigate what can be a difficult treatment authorization process as well as a complicated reimbursement process, all while dealing with their PAH symptoms," said Joy Beckmann, RN, MSN, Chair, PH Resource Network, Pulmonary Hypertension Association and Senior Research Coordinator, Liu Center for Pulmonary Hypertension, Los Angeles Biomedical Research Institute at Harbor-UCLA Medical Center. "It's important that adequate programs are in place to ensure that patients are not denied access to treatment for financial reasons."
WARNING: POTENTIAL LIVER INJURY
Letairis can cause elevation of liver aminotransferases (ALT and AST) to at least three times the upper limit of normal (ULN). Letairis treatment was associated with aminotransferase elevations greater than three times ULN in 0.8 percent of patients in 12-week trials and 2.8 percent of patients including long-term open-label trials out to one year. One case of aminotransferase elevations greater than three times ULN has been accompanied by bilirubin elevations greater than two times ULN. Because these changes are a marker for potentially serious liver injury, serum aminotransferase levels (and bilirubin if aminotransferase levels are elevated) must be measured prior to initiation of treatment and then monthly.
Elevations in aminotransferases require close attention. Letairis should generally be avoided in patients with elevated aminotransferases greater than three times ULN at baseline because monitoring liver injury may be more difficult. If liver aminotransferase elevations are accompanied by clinical symptoms of liver injury (such as nausea, vomiting, fever, abdominal pain, jaundice, or unusual lethargy or fatigue) or increases in bilirubin greater than two times ULN, treatment should be stopped. There is no experience with the re-introduction of Letairis in these circumstances.
CONTRAINDICATION: PREGNANCY
Letairis is very likely to produce serious birth defects if used by pregnant women, as this effect has been seen consistently when it is administered to animals. Pregnancy must therefore be excluded before the initiation of treatment with Letairis and prevented thereafter by the use of at least two reliable methods of contraception unless the patient is unable to become pregnant. In women who can become pregnant, pregnancy tests should be obtained monthly.
Important Safety Information
The most common adverse events that occurred at a higher frequency among Letairis-treated patients compared to placebo included (placebo-adjusted frequency): peripheral edema (6 percent), nasal congestion (4 percent), sinusitis (3 percent), flushing (3 percent), palpitations (3 percent), nasal pharyngitis (2 percent), abdominal pain (2 percent), constipation (2 percent), dyspnea (1 percent) and headache (1 percent).
Elevations of liver aminotransferases have been reported with Letairis and serious liver injury has been reported with related drugs. Patients should be monitored monthly for liver aminotransferases and treatment with Letairis should be discontinued if greater than five times the upper limit of normal or if signs or symptoms of liver dysfunction are observed.
Letairis is not recommended in patients with moderate to severe hepatic impairment. For women of childbearing potential, Letairis treatment should only be initiated after a negative pregnancy test and only in those using at least two reliable methods of contraception.
Decreases in hemoglobin concentration and hematocrit have followed administration of other endothelin receptor antagonists and were observed in clinical studies with Letairis. These decreases were observed within the first few weeks of treatment with Letairis, and stabilized thereafter.
Peripheral edema is a known class effect of endothelin receptor antagonists and is also a clinical consequence of PAH and worsening PAH. In the placebo-controlled studies, there was an increased incidence of peripheral edema in patients treated with doses of 5 or 10 mg of Letairis compared to placebo. Most edema was mild to moderate in severity. Peripheral edema was similar in younger patients (age less than 65 years) receiving Letairis (14 percent; 29/205) or placebo (13 percent; 13/104), and was greater in elderly patients (age greater than or equal to 65 years) receiving Letairis (29 percent; 16/56) compared to placebo (4 percent, 1/28). The results of such subgroup analyses must be interpreted cautiously.
Caution should be used when Letairis is co-administered with cyclosporine A, as it may cause increased exposure to Letairis.
Caution should be used when Letairis is co-administered with strong CYP3A-inhibitors (e.g., ketoconazole) or CYP2C19-inhibitors (e.g., omeprazole).
No clinically relevant interactions of Letairis with warfarin or sildenafil have been observed.
About Letairis(TM)
Letairis(TM) (ambrisentan) is an endothelin receptor antagonist that is selective for the endothelin type-A (ET(A)) receptor. Activation of the ET(A) receptor by endothelin, a small peptide hormone, leads to vasoconstriction (narrowing of blood vessels) and cell proliferation. The clinical impact of high selectivity for ET(A) is not known. PAH is associated with elevated endothelin blood levels.
GlaxoSmithKline holds rights to commercialize ambrisentan for PAH in territories outside of the United States. A Marketing Authorisation Application (MAA) for ambrisentan was filed with the European Medicines Agency (EMEA) earlier this year.
About Pulmonary Arterial Hypertension
PAH is a debilitating disease characterized by constriction of the blood vessels in the lungs leading to high pulmonary arterial pressures. These high pressures make it difficult for the heart to pump blood through the lungs to be oxygenated. Patients with PAH suffer from shortness of breath as the heart struggles to pump against these high pressures, causing such patients to ultimately die of heart failure. PAH can occur with no known underlying cause, or it can occur secondary to diseases such as connective tissue disease, congenital heart defects, cirrhosis of the liver and HIV infection. PAH afflicts approximately 200,000 patients worldwide.
About Gilead Sciences
Gilead Sciences is a biopharmaceutical company that discovers, develops and commercializes innovative therapeutics in areas of unmet medical need. The company's mission is to advance the care of patients suffering from life-threatening diseases worldwide. Headquartered in Foster City, California, Gilead has operations in North America, Europe and Australia. For more information on Gilead Sciences, please visit the company's website at www.gilead.com or call Gilead Public Affairs at 1-800-GILEAD-5 or 1-650-574-3000.
This press release includes forward-looking statements, within the meaning of the Private Securities Litigation Reform Act of 1995, that are subject to risks, uncertainties and other factors, including the risk that Gilead(TM)Solutions will not provide greater access to care for PAH patients with a variety of circumstances. These risks, uncertainties and other factors could cause actual results to differ materially from those referred to in the forward-looking statements. The reader is cautioned not to rely on these forward-looking statements. These and other risks are described in detail in Gilead's Annual Report on Form 10-K for the year ended December 31, 2006 and its Report on Form 10-Q for the first quarter of 2007, filed with the U.S. Securities and Exchange Commission. All forward-looking statements are based on information currently available to Gilead, and Gilead assumes no obligation to update any such forward-looking statements.
Full prescribing information for Letairis is available at www.gilead.com and at www.Letairis.com.
Letairis is a trademark of Gilead Sciences, Inc.
For more information on Gilead Sciences, please visit the company's web site at www.gilead.com or call Gilead Public Affairs at 1-800-GILEAD-5 or 1-650-574-3000.
CONTACT: Gilead Sciences, Inc.
Susan Hubbard, 650-522-5715 (Investors)
Nathan Kaiser, 650-522-1853 (Media)
SOURCE: Gilead Sciences, Inc.
U.S. Food and Drug Administration Approves Gilead's Letairis(TM) (ambrisentan) 5 mg and 10 mg Tablets for the Once-Daily Treatment of Pulmonary Arterial Hypertension (WHO Group 1) in Patients with WHO Functional Class II or III Symptoms
Gilead Also Announces Launch of Gilead(TM)Solutions, a
Comprehensive Access Program
FOSTER CITY, Calif.--(BUSINESS WIRE)--June 15, 2007--Gilead Sciences, Inc. (Nasdaq:GILD) today announced that the U.S. Food and Drug Administration (FDA) has granted approval of Letairis(TM) (ambrisentan) 5 mg and 10 mg tablets. Letairis is an endothelin receptor antagonist (ERA) indicated for the once-daily treatment of pulmonary arterial hypertension (WHO Group 1) in patients with WHO Functional Class II or III symptoms to improve exercise capacity and delay clinical worsening. Letairis will be available in the United States early next week. Because of the risks of liver injury and birth defects, the product will be available through the Letairis Education and Access Program (LEAP), a restricted distribution program designed to help patients learn about the risks of Letairis.
"PAH is a debilitating and life-threatening disease for which there remains a significant need for new treatments," said Lewis J. Rubin, MD, Professor of Medicine, University of California, San Diego. "The availability of new treatments such as ambrisentan is critical to our ability to help patients living with this serious disease."
"All of us at Gilead extend our thanks to the investigators and patients who took part in the Letairis clinical trials, and we appreciate the hard work of the U.S. FDA to ensure this product reaches those in need as quickly as possible," said John C. Martin, PhD, President and CEO of Gilead Sciences. "As a company dedicated to advancing therapeutics for diseases that represent significant unmet medical needs, we look forward to partnering with the PAH community to help patients living with this disease."
In two randomized, double-blind, 12-week, placebo-controlled Phase III clinical trials (ARIES-1 and ARIES-2) involving a total of 393 patients, treatment with Letairis resulted in a significant improvement in six-minute walk distance. An increase in walk distance was observed after four weeks of treatment with each dose regimen of Letairis, with a dose-response observed after 12 weeks of treatment. In ARIES-1, placebo-adjusted mean and median changes from baseline of 31 meters and 27 meters (p=0.008), respectively, were observed for the 5 mg dose. Placebo-adjusted mean and median changes from baseline of 51 meters and 39 meters (p less than 0.001), respectively, were observed for the 10 mg dose. In ARIES-2, placebo-adjusted mean and median changes from baseline of 59 meters and 45 meters (p less than 0.001), respectively, were observed for the 5 mg dose.
Treatment with Letairis also significantly delayed time to clinical worsening of PAH. Clinical worsening was defined as the first occurrence of death, lung transplantation, hospitalization for PAH, atrial septostomy, study withdrawal due to the addition of other PAH therapeutic agents, or study withdrawal due to early escape (progressive disease).
The long-term follow-up of the patients who were treated with Letairis in the two pivotal studies and the open-label extension (n=383) shows that 95 percent were still alive at one year and 94 percent were still receiving Letairis monotherapy. These uncontrolled observations do not allow comparison with a group not given Letairis and cannot be used to determine the long-term effect of Letairis.
In ARIES-1 and ARIES-2, a total of 261 patients received Letairis at doses of 2.5, 5 or 10 mg once daily and 132 patients received placebo. The most common adverse events that occurred at a higher frequency among Letairis-treated patients compared to placebo in the ARIES-1 and ARIES-2 studies included (placebo-adjusted frequency): peripheral edema (6 percent), nasal congestion (4 percent), sinusitis (3 percent), flushing (3 percent) and palpitations (3 percent). Most adverse drug reactions were mild to moderate and only nasal congestion was dose-dependent.
In addition to data from Phase III clinical trials, the Letairis approval is also supported by data from an uncontrolled, open-label study of 36 patients who had previously discontinued endothelin receptor antagonists (bosentan, an investigational drug, or both) due to aminotransferase elevations greater than three times the upper limit of normal(ULN). With a median follow-up period of 13 months and with 50 percent of patients increasing the dose of Letairis to 10 mg, no patients were discontinued for aminotransferase elevations. The most common adverse events observed were peripheral edema, headache, dyspnea and flushing. The study suggests that Letairis may be an option for patients who have experienced asymptomatic aminotransferase elevations on other ERAs after aminotransferase levels have returned to normal.
"Just ten years ago, patients had few options available to combat their disease, but there is now an emerging sense of hope as awareness of this important disease grows and new treatments become available," said Rino Aldrighetti, President and CEO of the Pulmonary Hypertension Association (PHA).
About the Letairis Education and Access Program (LEAP)
Because of the risks of liver injury and birth defects, Letairis is available only through a special restricted distribution program called the Letairis Education and Access Program (LEAP) by calling 1-866-664-LEAP (1-866-664-5327). Only prescribers and pharmacies registered with LEAP are able to prescribe and distribute Letairis. In addition, Letairis may be dispensed only to patients who are enrolled in and meet all conditions of LEAP.
About Gilead(TM)Solutions
Gilead also today announced the launch of Gilead(TM)Solutions, a comprehensive set of programs designed to help patients navigate the reimbursement process for Letairis and help minimize barriers to treatment.
"Gilead is committed first and foremost to patients," said Dr. Martin. "Our hope is that this program will ensure greater access to care for PAH patients with a variety of circumstances, including the often overlooked group of patients who have some form of prescription insurance but have prohibitively high out-of-pocket expenses."
Gilead will assist most eligible privately-insured patients who have high monthly co-payments with a portion of their out-of-pocket expenses. Similarly, patients with Medicare prescription drug coverage or other government-funded insurance may receive assistance with co-payments and deductibles through two existing independent patient foundations. Some restrictions will apply. Gilead's reimbursement support team will guide patients to these resources and explain program eligibility guidelines and the amount of financial assistance available.
Similar to programs Gilead has established for patients in other disease areas, including HIV/AIDS and chronic hepatitis B, uninsured or underinsured patients will have access to reimbursement counseling and support in applying for public insurance programs for which they may qualify.
Gilead has also established a program that addresses the unique access issues that exist at the launch of a new product before formulary status and payer coverage levels are finalized. This will ensure that physicians and patients have immediate access to Letairis while Gilead's reimbursement support team works to identify appropriate financial assistance.
Gilead Solutions programs and services will only be available following enrollment in LEAP.
"Many PAH patients face significant financial barriers, such as prohibitively high co-payment expenses, while also struggling to navigate what can be a difficult treatment authorization process as well as a complicated reimbursement process, all while dealing with their PAH symptoms," said Joy Beckmann, RN, MSN, Chair, PH Resource Network, Pulmonary Hypertension Association and Senior Research Coordinator, Liu Center for Pulmonary Hypertension, Los Angeles Biomedical Research Institute at Harbor-UCLA Medical Center. "It's important that adequate programs are in place to ensure that patients are not denied access to treatment for financial reasons."
WARNING: POTENTIAL LIVER INJURY
Letairis can cause elevation of liver aminotransferases (ALT and AST) to at least three times the upper limit of normal (ULN). Letairis treatment was associated with aminotransferase elevations greater than three times ULN in 0.8 percent of patients in 12-week trials and 2.8 percent of patients including long-term open-label trials out to one year. One case of aminotransferase elevations greater than three times ULN has been accompanied by bilirubin elevations greater than two times ULN. Because these changes are a marker for potentially serious liver injury, serum aminotransferase levels (and bilirubin if aminotransferase levels are elevated) must be measured prior to initiation of treatment and then monthly.
Elevations in aminotransferases require close attention. Letairis should generally be avoided in patients with elevated aminotransferases greater than three times ULN at baseline because monitoring liver injury may be more difficult. If liver aminotransferase elevations are accompanied by clinical symptoms of liver injury (such as nausea, vomiting, fever, abdominal pain, jaundice, or unusual lethargy or fatigue) or increases in bilirubin greater than two times ULN, treatment should be stopped. There is no experience with the re-introduction of Letairis in these circumstances.
CONTRAINDICATION: PREGNANCY
Letairis is very likely to produce serious birth defects if used by pregnant women, as this effect has been seen consistently when it is administered to animals. Pregnancy must therefore be excluded before the initiation of treatment with Letairis and prevented thereafter by the use of at least two reliable methods of contraception unless the patient is unable to become pregnant. In women who can become pregnant, pregnancy tests should be obtained monthly.
Important Safety Information
The most common adverse events that occurred at a higher frequency among Letairis-treated patients compared to placebo included (placebo-adjusted frequency): peripheral edema (6 percent), nasal congestion (4 percent), sinusitis (3 percent), flushing (3 percent), palpitations (3 percent), nasal pharyngitis (2 percent), abdominal pain (2 percent), constipation (2 percent), dyspnea (1 percent) and headache (1 percent).
Elevations of liver aminotransferases have been reported with Letairis and serious liver injury has been reported with related drugs. Patients should be monitored monthly for liver aminotransferases and treatment with Letairis should be discontinued if greater than five times the upper limit of normal or if signs or symptoms of liver dysfunction are observed.
Letairis is not recommended in patients with moderate to severe hepatic impairment. For women of childbearing potential, Letairis treatment should only be initiated after a negative pregnancy test and only in those using at least two reliable methods of contraception.
Decreases in hemoglobin concentration and hematocrit have followed administration of other endothelin receptor antagonists and were observed in clinical studies with Letairis. These decreases were observed within the first few weeks of treatment with Letairis, and stabilized thereafter.
Peripheral edema is a known class effect of endothelin receptor antagonists and is also a clinical consequence of PAH and worsening PAH. In the placebo-controlled studies, there was an increased incidence of peripheral edema in patients treated with doses of 5 or 10 mg of Letairis compared to placebo. Most edema was mild to moderate in severity. Peripheral edema was similar in younger patients (age less than 65 years) receiving Letairis (14 percent; 29/205) or placebo (13 percent; 13/104), and was greater in elderly patients (age greater than or equal to 65 years) receiving Letairis (29 percent; 16/56) compared to placebo (4 percent, 1/28). The results of such subgroup analyses must be interpreted cautiously.
Caution should be used when Letairis is co-administered with cyclosporine A, as it may cause increased exposure to Letairis.
Caution should be used when Letairis is co-administered with strong CYP3A-inhibitors (e.g., ketoconazole) or CYP2C19-inhibitors (e.g., omeprazole).
No clinically relevant interactions of Letairis with warfarin or sildenafil have been observed.
About Letairis(TM)
Letairis(TM) (ambrisentan) is an endothelin receptor antagonist that is selective for the endothelin type-A (ET(A)) receptor. Activation of the ET(A) receptor by endothelin, a small peptide hormone, leads to vasoconstriction (narrowing of blood vessels) and cell proliferation. The clinical impact of high selectivity for ET(A) is not known. PAH is associated with elevated endothelin blood levels.
GlaxoSmithKline holds rights to commercialize ambrisentan for PAH in territories outside of the United States. A Marketing Authorisation Application (MAA) for ambrisentan was filed with the European Medicines Agency (EMEA) earlier this year.
About Pulmonary Arterial Hypertension
PAH is a debilitating disease characterized by constriction of the blood vessels in the lungs leading to high pulmonary arterial pressures. These high pressures make it difficult for the heart to pump blood through the lungs to be oxygenated. Patients with PAH suffer from shortness of breath as the heart struggles to pump against these high pressures, causing such patients to ultimately die of heart failure. PAH can occur with no known underlying cause, or it can occur secondary to diseases such as connective tissue disease, congenital heart defects, cirrhosis of the liver and HIV infection. PAH afflicts approximately 200,000 patients worldwide.
About Gilead Sciences
Gilead Sciences is a biopharmaceutical company that discovers, develops and commercializes innovative therapeutics in areas of unmet medical need. The company's mission is to advance the care of patients suffering from life-threatening diseases worldwide. Headquartered in Foster City, California, Gilead has operations in North America, Europe and Australia. For more information on Gilead Sciences, please visit the company's website at www.gilead.com or call Gilead Public Affairs at 1-800-GILEAD-5 or 1-650-574-3000.
This press release includes forward-looking statements, within the meaning of the Private Securities Litigation Reform Act of 1995, that are subject to risks, uncertainties and other factors, including the risk that Gilead(TM)Solutions will not provide greater access to care for PAH patients with a variety of circumstances. These risks, uncertainties and other factors could cause actual results to differ materially from those referred to in the forward-looking statements. The reader is cautioned not to rely on these forward-looking statements. These and other risks are described in detail in Gilead's Annual Report on Form 10-K for the year ended December 31, 2006 and its Report on Form 10-Q for the first quarter of 2007, filed with the U.S. Securities and Exchange Commission. All forward-looking statements are based on information currently available to Gilead, and Gilead assumes no obligation to update any such forward-looking statements.
Full prescribing information for Letairis is available at www.gilead.com and at www.Letairis.com.
Letairis is a trademark of Gilead Sciences, Inc.
For more information on Gilead Sciences, please visit the company's web site at www.gilead.com or call Gilead Public Affairs at 1-800-GILEAD-5 or 1-650-574-3000.
CONTACT: Gilead Sciences, Inc.
Susan Hubbard, 650-522-5715 (Investors)
Nathan Kaiser, 650-522-1853 (Media)
SOURCE: Gilead Sciences, Inc.
Encysive's THELIN hat noch immer kein approval.
Gilead´s Letairis(TM) (ambrisentan) wird das einzige direkte Konkurenzmedikament mit gleichem Wirkmechanismus.
Pfizer´s Revatio eine Version von Viagra hat ja einen anderen Wirkmechanismus und es steht zu erwarten, dass eine Kombinationstherapie Tracleer/Revatio die optimale Behandlungsmethode wird.
Actelion hat dazu fortgeschrittene Klinische Studien.
Für Gilead´s Letairis(TM) (ambrisentan) sind mir solche Studien nicht bekannt.
http://www.gilead.com/wt/sec/pipeline
Darüber hinaus hat Tracleer gerade die Zulassung für Sklerodermie mit dem Potenzial zur Verdopplung des Umsatzes erhalten und fortgeschrittene Studien laufen für andere Anwendungen.
Das bedeutet Wachstum par excellence
Gilead´s Letairis(TM) (ambrisentan) wird das einzige direkte Konkurenzmedikament mit gleichem Wirkmechanismus.
Pfizer´s Revatio eine Version von Viagra hat ja einen anderen Wirkmechanismus und es steht zu erwarten, dass eine Kombinationstherapie Tracleer/Revatio die optimale Behandlungsmethode wird.
Actelion hat dazu fortgeschrittene Klinische Studien.
Für Gilead´s Letairis(TM) (ambrisentan) sind mir solche Studien nicht bekannt.
http://www.gilead.com/wt/sec/pipeline
Darüber hinaus hat Tracleer gerade die Zulassung für Sklerodermie mit dem Potenzial zur Verdopplung des Umsatzes erhalten und fortgeschrittene Studien laufen für andere Anwendungen.
Das bedeutet Wachstum par excellence
Heute klasse Tahlen vorgelegt, habe zwar keine, bin aber bei BB Biotech dicke drin und das idst dort der dickste Brocken im Portfolio
Antwort auf Beitrag Nr.: 30.756.539 von ntv25 am 19.07.07 10:41:19hat sich aber im Kurs von BB BIO nicht bemerkbar gemacht.

Blockbuster potential for Actelion insomnia drug
By Mike Nagle
16/08/2007- Analysts are waiting with baited breath for the latest clinical data on Actelion's first-in-class insomnia drug, pointing to its blockbuster potential and deriding current insomnia drugs as 'shockingly limited'.
Actelion is due to announce Phase II results for Act-078573 at the World Sleep Congress in the first week of September. Analysts at Swiss firm Landsbanki Kepler have now issued a 'buy' rating on the stock, saying positive data could boost the biotech's valuation.
Successful results are likely though, with early Phase II results having already established proof-of-concept, according to the management at Actelion. In fact, the company is already planning to start Phase III trials by the end of this year.
Although there are quite a few new insomnia drugs in development, the majority work in the same way as established treatments. By contrast, Actelion's Act-078573 works by a new mechanism; it is a small molecule inhibitor of two orexin receptors, OX1 and OX2. Orexins are neuropeptides thought to regulate the sleep-wake cycle and help maintain daytime alertness.
In a research note, Dr Denise Anderson at Landsbanki Kepler explained: "We find the benefit of current sleep pills shockingly limited. Thus, even if ACT-078573's efficacy is not miraculous, it might easily surpass the efficacy of current products. If this is the case, and if the safety holds up, ACT-078573 could easily have blockbuster potential."
By its own admission, the analyst firm's estimate is currently quite conservative; the share price currently stands at CHF66 and Kepler thinks that could move to at CHF75. However, Anderson said: "Outstanding results could add up to CHF10 to our target price."
There are not many branded sleeping drugs available, although total sales of those on the market did add up to $3bn in 2006. However, given that many patients are treated off-label with other classes of drug - for example, antidepressants - and the major don't take any drug at all, the market for new treatments remains largely untapped.
"Management comments have demonstrated huge excitement for the product. Despite the hype surrounding the drug, we conclude that the upside remains greater than the downside going into the event," said Anderson.
As Landsbanki Kepler points out, Actelion might well not have the orexin inhibitor market all to itself; GlaxoSmithKline (GSK) also has a similar drug in development called SB-649868. However, it is not quite as advanced since Phase II clinical trials only began last December.
http://www.drugresearcher.com/news/ng.asp?n=79064-actelion-g…

By Mike Nagle
16/08/2007- Analysts are waiting with baited breath for the latest clinical data on Actelion's first-in-class insomnia drug, pointing to its blockbuster potential and deriding current insomnia drugs as 'shockingly limited'.
Actelion is due to announce Phase II results for Act-078573 at the World Sleep Congress in the first week of September. Analysts at Swiss firm Landsbanki Kepler have now issued a 'buy' rating on the stock, saying positive data could boost the biotech's valuation.
Successful results are likely though, with early Phase II results having already established proof-of-concept, according to the management at Actelion. In fact, the company is already planning to start Phase III trials by the end of this year.
Although there are quite a few new insomnia drugs in development, the majority work in the same way as established treatments. By contrast, Actelion's Act-078573 works by a new mechanism; it is a small molecule inhibitor of two orexin receptors, OX1 and OX2. Orexins are neuropeptides thought to regulate the sleep-wake cycle and help maintain daytime alertness.
In a research note, Dr Denise Anderson at Landsbanki Kepler explained: "We find the benefit of current sleep pills shockingly limited. Thus, even if ACT-078573's efficacy is not miraculous, it might easily surpass the efficacy of current products. If this is the case, and if the safety holds up, ACT-078573 could easily have blockbuster potential."
By its own admission, the analyst firm's estimate is currently quite conservative; the share price currently stands at CHF66 and Kepler thinks that could move to at CHF75. However, Anderson said: "Outstanding results could add up to CHF10 to our target price."
There are not many branded sleeping drugs available, although total sales of those on the market did add up to $3bn in 2006. However, given that many patients are treated off-label with other classes of drug - for example, antidepressants - and the major don't take any drug at all, the market for new treatments remains largely untapped.
"Management comments have demonstrated huge excitement for the product. Despite the hype surrounding the drug, we conclude that the upside remains greater than the downside going into the event," said Anderson.
As Landsbanki Kepler points out, Actelion might well not have the orexin inhibitor market all to itself; GlaxoSmithKline (GSK) also has a similar drug in development called SB-649868. However, it is not quite as advanced since Phase II clinical trials only began last December.
http://www.drugresearcher.com/news/ng.asp?n=79064-actelion-g…

Schlägt sich ja auch außerordentlich gut während der US Immobilienkrise.
Hoffen wir mal dass die Wirkung von Act-078573 auf orexin receptoren beschränkt ist, und nicht etwa eine falsche Wirkung auf den Kusverlauf entfaltet.

Biotech -> Big Biotech -> The Biggest Biotech?!?
Bin seit vielen Jahren schon dabei und habe es nie bereut. Die Reise ist hier noch lange nicht zu Ende!
Gruß
CI
Bin seit vielen Jahren schon dabei und habe es nie bereut. Die Reise ist hier noch lange nicht zu Ende!
Gruß
CI
23.08.2007 14:31:02
Actelion "overweight"
New York (aktiencheck.de AG) - Die Wertpapierspezialisten von J.P. Morgan Securities bewerten den Anteilschein des schweizerischen Unternehmens Actelion (ISIN CH0010532478/ WKN 936767) mit "overweight". Am 5. September werde Actelion die Phase II-Daten zum Schlafmittel "ACT-078573" präsentieren.
Die Nachrichtenlage biete nach Ansicht der Analysten die Gelegenheit zu einer Neubewertung der Aktie. Mit dem richtigen Profil könne "ACT-078573" ein Blockbuster und im Jahr 2012 auf den Markt gebracht werden. Bei einer angenommenen Erfolgswahrscheinlichkeit von 45% bewerte man "ACT-078573" mit 4 Schweizer Franken (CHF) je Aktie. Die Analysten hätten dem Präparat bisher eine unterdurchschnittliche Erfolgswahrscheinlichkeit eingeräumt, da man noch keine Phase II-Daten gesehen habe und es im Zusammenhang mit Schlafmitteln nur niedrige Toleranz bei den Sicherheits- und Wirksamkeitsanforderungen gebe. Vor dem Hintergrund der Einführung von "Letairis" im Juni beobachte man die sequenziellen Änderungen der US-amerikanischen Verschreibungszahlen von "Tracleer" genau. Von Juni bis Juli sei die Zahl der Verschreibungen um 12,6% zurückgegangen. Man sei bei den Rückschlüssen dieser Entwicklung jedoch vorsichtig, da die IMS-Daten nur ca. 20% der Verschreibungen umfassen würden. Die EPS-Schätzungen der Analysten für die Fiskaljahre 2007 und 2008 würden bei 2,61 CHF und 2,76 CHF liegen, woraus sich ein KGV von 24,5 und 23,2 errechnen lasse. Das Kursziel der Aktie sehe man bei 70 CHF. Auf dieser Grundlage lautet das Rating der Börsenanalysten von J.P. Morgan Securities für das Wertpapier von Actelion "overweight". (Analyse vom 23.08.07) (23.08.2007/ac/a/a)
Quelle: AKTIENCHECK.DE
Ein Straddle könnte sich hier lohnen. Hat jemand konkrete Vorschläge für einen Straddle auf Actelion?
Actelion "overweight"
New York (aktiencheck.de AG) - Die Wertpapierspezialisten von J.P. Morgan Securities bewerten den Anteilschein des schweizerischen Unternehmens Actelion (ISIN CH0010532478/ WKN 936767) mit "overweight". Am 5. September werde Actelion die Phase II-Daten zum Schlafmittel "ACT-078573" präsentieren.
Die Nachrichtenlage biete nach Ansicht der Analysten die Gelegenheit zu einer Neubewertung der Aktie. Mit dem richtigen Profil könne "ACT-078573" ein Blockbuster und im Jahr 2012 auf den Markt gebracht werden. Bei einer angenommenen Erfolgswahrscheinlichkeit von 45% bewerte man "ACT-078573" mit 4 Schweizer Franken (CHF) je Aktie. Die Analysten hätten dem Präparat bisher eine unterdurchschnittliche Erfolgswahrscheinlichkeit eingeräumt, da man noch keine Phase II-Daten gesehen habe und es im Zusammenhang mit Schlafmitteln nur niedrige Toleranz bei den Sicherheits- und Wirksamkeitsanforderungen gebe. Vor dem Hintergrund der Einführung von "Letairis" im Juni beobachte man die sequenziellen Änderungen der US-amerikanischen Verschreibungszahlen von "Tracleer" genau. Von Juni bis Juli sei die Zahl der Verschreibungen um 12,6% zurückgegangen. Man sei bei den Rückschlüssen dieser Entwicklung jedoch vorsichtig, da die IMS-Daten nur ca. 20% der Verschreibungen umfassen würden. Die EPS-Schätzungen der Analysten für die Fiskaljahre 2007 und 2008 würden bei 2,61 CHF und 2,76 CHF liegen, woraus sich ein KGV von 24,5 und 23,2 errechnen lasse. Das Kursziel der Aktie sehe man bei 70 CHF. Auf dieser Grundlage lautet das Rating der Börsenanalysten von J.P. Morgan Securities für das Wertpapier von Actelion "overweight". (Analyse vom 23.08.07) (23.08.2007/ac/a/a)
Quelle: AKTIENCHECK.DE
Ein Straddle könnte sich hier lohnen. Hat jemand konkrete Vorschläge für einen Straddle auf Actelion?
Hier nochmal ein Bericht zu ACT-078573 (Schlafmittelkandidat) aus der Nature Med. und dem aus dem Handelsblatt vom Januar 2007:
Nature Med. doi:10.1038/nm1544 (2007)
A novel sleep-inducing agent has been developed that acts by blocking the actions of brain peptides called orexins.
Orexins promote wakefulness, and people with narcolepsy - a condition causing daytime sleepiness and sudden loss of muscle tone - have low orexin levels.
François Jenck of Actelion Pharmaceuticals in Allschwil, Switzerland, and his colleagues report that their new compound, code-named ACT-078573, reduced alertness in rats, dogs and humans. Human subjects receiving the drug fell asleep more quickly than those receiving the placebo, but none of them experienced loss of muscle tone.
Handelsblatt:
Wirkstoff erleichtert das Einschlafen
Schweizer Pharmafirma Actelion entwickelt viel versprechendes Mittel gegen Schlafstörungen SABINE GOLDHAHN | ZÜRICH
Schlaf gilt als die natürlichste Sache der Welt. Dennoch leiden viele Menschen unter Schlafstörungen - mehr als ein Fünftel hat Probleme beim Einschlafen oder wacht während der Nacht mehrmals wieder auf und liegt längere Zeit wach. Der damit verbundene Schlafmangel führt zu Unaufmerksamkeit, Leistungsabfall und Gedächtnisstörungen. Im schlimmsten Fall machen Schlafstörungen krank und rufen körperliche Beschwerden hervor. Bislang fehlt ein Medikament, das ohne gefährliche Nebenwirkungen einen annähernd natürlichen Schlaf erzeugt. Dies könnte sich bald ändern: Forscher der Schweizer Pharmafirma Actelion haben eine Substanz entdeckt und mit gesunden Versuchspersonen getestet und bei ihnen klassische Anzeichen für Schlaf hervorgerufen. Im Tierversuch zeigten Ratten und Hunde sogar die natürlichen Traumphasen. "Schlaf ist alles andere als ein passiver Prozess", sagt Esther Werth vom Schlaflabor der Universität Zürich. "Es laufen viele aktive Vorgänge ab, die über komplexe Regelmechanismen zusammenhängen." Daher gibt es über 80 verschiedene Schlafstörungen mit den unterschiedlichsten Ursachen. Den gesunden Schlaf teilen Wissenschaftler in drei Phasen ein, wobei sie die zwei wichtigsten anhand der Augenbewegung unterscheiden. Im Rem- Schlaf - Rem steht für "rapid eye movement"
- träumen die Menschen, und die Muskulatur entspannt sich. Das Gehirn wird stärker durchblutet, und Gedächtnisinformationen
werden gespeichert. Zum Non-Rem-Schlaf dagegen, der etwa
drei Viertel der Schlafzeit ausmacht, gehören der leichte und der tiefe Schlaf, bei denen die Körpertemperatur und der Blutdruck abfallen. Damit man morgens erholt aufwacht, müssen sich beide
Schlafstadien mehrfach in der Nacht abwechseln. Das erreicht allerdings keines der bisher zugelassenen Schlafmittel.
Die neu entwickelte Substanz mit dem Kürzel "ACT-078573" greift in einen Stoffwechsel-Kreislauf ein, der erst 1998 entdeckt wurde: in das so genannte Orexin-System. Orexin ist ein Eiweiß,
das im Hypothalamus - einem Teil des Zwischenhirns - gebildet wird
und die Nahrungsaufnahme sowie den Schlaf-Wach-Rhythmus beeinflusst.
Viel Orexin macht munter und führt zu einer gesteigerten Aufmerksamkeit und Wachheit. Zu wenig Orexin wurde hingegen
bei Patienten mit Narkolepsie gefunden, einer Krankheit, bei der die Betroffenen mehrfach am Tag völlig unerwartet einschlafen und bei Aufregung plötzlich zusammensacken. Da also ein Mangel an Orexin zum Einschlafen führt, haben Francois Jenck und sein Team nach einem Stoff gesucht, der die Orexin-Menge im Gehirn verringert. Das erreicht "ACT-078573", indem es die zwei Andockstellen für Orexin blockiert. Dadurch kann dieses
Eiweiß seine aufputschende Wirkung nicht mehr entfalten, und man schläft ein. "Obwohl wir unseren Versuchspersonen den Orexin-Blocker am Tag in ihrer aktiven Phase gegeben haben, zeigten
sie bereits nach einer Stunde die typischen Zeichen für Schlaf, was auch in der Hirnstromkurve zu sehen war", berichtet
Francois Jenck von Actelion. Nach sechs bis sieben Stunden seien sie wieder völlig wach gewesen. Versuchspersonen, die mit dem weit
verbreiteten Benzodiazepin-Schlafmittel Zolpidem behandelt wurden, zeigten zwar auch Anzeichen von Schlaf, jedoch waren diese Effekte nicht in der Hirnstromkurve sichtbar. Benzodiazepine, die seit Jahren Mittel der Wahl gegen Schlafstörungen sind, wirken auf
einen anderen Regelkreis im Nervensystem. Sie blockieren keine Andockstellen, sondern verstärken lediglich eine natürliche Wirkung der Botenstoffe im Gehirn. Das führt bei regelmäßigem Gebrauch zur Sucht. "Wir warten daher auf ein Medikament, das keine Abhängigkeit erzeugt und die Patienten auf natürliche
Weise schlafen lässt", sagt Esther Werth.
Klinische Studien mit "ACT-078573" laufen bereits. Mit den ersten Ergebnissen rechnet Actelion noch in diesem Jahr.Die Bekanntgabe der ersten Forschungsergebnisse hat gestern die Aktie der Biotechnologiefirma beflügelt. Sie stieg an der Börse zunächst um 3,4 Prozent bis auf 285 Franken (175 Euro) nach oben und notierten am Nachmittag bei 283 Franken. Actelion ist bisher vor
allem für sein Lungenmedikament Tracleer bekannt. Der Markt für Schlafmittel ist riesig. Marktführer in dem Bereich sind Sanofi-Aventis mit seinem Schlafmittel Ambien gefolgt von Sepracor mit Lunesta. Sanofi setzte in den ersten neun Monaten
2006 mit Ambien 1,45 Milliarden Euro um und damit um 30 Prozent mehr als im entsprechenden Vorjahreszeitraum.
Nature Med. doi:10.1038/nm1544 (2007)
A novel sleep-inducing agent has been developed that acts by blocking the actions of brain peptides called orexins.
Orexins promote wakefulness, and people with narcolepsy - a condition causing daytime sleepiness and sudden loss of muscle tone - have low orexin levels.
François Jenck of Actelion Pharmaceuticals in Allschwil, Switzerland, and his colleagues report that their new compound, code-named ACT-078573, reduced alertness in rats, dogs and humans. Human subjects receiving the drug fell asleep more quickly than those receiving the placebo, but none of them experienced loss of muscle tone.
Handelsblatt:
Wirkstoff erleichtert das Einschlafen
Schweizer Pharmafirma Actelion entwickelt viel versprechendes Mittel gegen Schlafstörungen SABINE GOLDHAHN | ZÜRICH
Schlaf gilt als die natürlichste Sache der Welt. Dennoch leiden viele Menschen unter Schlafstörungen - mehr als ein Fünftel hat Probleme beim Einschlafen oder wacht während der Nacht mehrmals wieder auf und liegt längere Zeit wach. Der damit verbundene Schlafmangel führt zu Unaufmerksamkeit, Leistungsabfall und Gedächtnisstörungen. Im schlimmsten Fall machen Schlafstörungen krank und rufen körperliche Beschwerden hervor. Bislang fehlt ein Medikament, das ohne gefährliche Nebenwirkungen einen annähernd natürlichen Schlaf erzeugt. Dies könnte sich bald ändern: Forscher der Schweizer Pharmafirma Actelion haben eine Substanz entdeckt und mit gesunden Versuchspersonen getestet und bei ihnen klassische Anzeichen für Schlaf hervorgerufen. Im Tierversuch zeigten Ratten und Hunde sogar die natürlichen Traumphasen. "Schlaf ist alles andere als ein passiver Prozess", sagt Esther Werth vom Schlaflabor der Universität Zürich. "Es laufen viele aktive Vorgänge ab, die über komplexe Regelmechanismen zusammenhängen." Daher gibt es über 80 verschiedene Schlafstörungen mit den unterschiedlichsten Ursachen. Den gesunden Schlaf teilen Wissenschaftler in drei Phasen ein, wobei sie die zwei wichtigsten anhand der Augenbewegung unterscheiden. Im Rem- Schlaf - Rem steht für "rapid eye movement"
- träumen die Menschen, und die Muskulatur entspannt sich. Das Gehirn wird stärker durchblutet, und Gedächtnisinformationen
werden gespeichert. Zum Non-Rem-Schlaf dagegen, der etwa
drei Viertel der Schlafzeit ausmacht, gehören der leichte und der tiefe Schlaf, bei denen die Körpertemperatur und der Blutdruck abfallen. Damit man morgens erholt aufwacht, müssen sich beide
Schlafstadien mehrfach in der Nacht abwechseln. Das erreicht allerdings keines der bisher zugelassenen Schlafmittel.
Die neu entwickelte Substanz mit dem Kürzel "ACT-078573" greift in einen Stoffwechsel-Kreislauf ein, der erst 1998 entdeckt wurde: in das so genannte Orexin-System. Orexin ist ein Eiweiß,
das im Hypothalamus - einem Teil des Zwischenhirns - gebildet wird
und die Nahrungsaufnahme sowie den Schlaf-Wach-Rhythmus beeinflusst.
Viel Orexin macht munter und führt zu einer gesteigerten Aufmerksamkeit und Wachheit. Zu wenig Orexin wurde hingegen
bei Patienten mit Narkolepsie gefunden, einer Krankheit, bei der die Betroffenen mehrfach am Tag völlig unerwartet einschlafen und bei Aufregung plötzlich zusammensacken. Da also ein Mangel an Orexin zum Einschlafen führt, haben Francois Jenck und sein Team nach einem Stoff gesucht, der die Orexin-Menge im Gehirn verringert. Das erreicht "ACT-078573", indem es die zwei Andockstellen für Orexin blockiert. Dadurch kann dieses
Eiweiß seine aufputschende Wirkung nicht mehr entfalten, und man schläft ein. "Obwohl wir unseren Versuchspersonen den Orexin-Blocker am Tag in ihrer aktiven Phase gegeben haben, zeigten
sie bereits nach einer Stunde die typischen Zeichen für Schlaf, was auch in der Hirnstromkurve zu sehen war", berichtet
Francois Jenck von Actelion. Nach sechs bis sieben Stunden seien sie wieder völlig wach gewesen. Versuchspersonen, die mit dem weit
verbreiteten Benzodiazepin-Schlafmittel Zolpidem behandelt wurden, zeigten zwar auch Anzeichen von Schlaf, jedoch waren diese Effekte nicht in der Hirnstromkurve sichtbar. Benzodiazepine, die seit Jahren Mittel der Wahl gegen Schlafstörungen sind, wirken auf
einen anderen Regelkreis im Nervensystem. Sie blockieren keine Andockstellen, sondern verstärken lediglich eine natürliche Wirkung der Botenstoffe im Gehirn. Das führt bei regelmäßigem Gebrauch zur Sucht. "Wir warten daher auf ein Medikament, das keine Abhängigkeit erzeugt und die Patienten auf natürliche
Weise schlafen lässt", sagt Esther Werth.
Klinische Studien mit "ACT-078573" laufen bereits. Mit den ersten Ergebnissen rechnet Actelion noch in diesem Jahr.Die Bekanntgabe der ersten Forschungsergebnisse hat gestern die Aktie der Biotechnologiefirma beflügelt. Sie stieg an der Börse zunächst um 3,4 Prozent bis auf 285 Franken (175 Euro) nach oben und notierten am Nachmittag bei 283 Franken. Actelion ist bisher vor
allem für sein Lungenmedikament Tracleer bekannt. Der Markt für Schlafmittel ist riesig. Marktführer in dem Bereich sind Sanofi-Aventis mit seinem Schlafmittel Ambien gefolgt von Sepracor mit Lunesta. Sanofi setzte in den ersten neun Monaten
2006 mit Ambien 1,45 Milliarden Euro um und damit um 30 Prozent mehr als im entsprechenden Vorjahreszeitraum.
Übrigens ist der Actelion-Chart hier auf WO immer noch nicht auf aktuellem Stand: Der vor einigen Monaten durchgeführte Aktiensplit wird vom WO-Chart immer noch fälschlicherweise als Kurssturz abgebildet! 
Wirklich schwach von WO!!
Die Baselbieter Biotechnologiefirma Actelion will den geplanten Aktiensplit am kommenden Mittwoch durchführen. Die Teilung erfolgt im Verhältnis 1:5.
Die Aktionäre von Actelion hatten diesem Aktiensplit an der Generalversammlung Anfang Mai 2007 zugestimmt. Das entsprechende Kotierungsinserat werde am 5. Juni 2007 veröffentlicht, teilte Actelion am Donnerstag mit.

Wirklich schwach von WO!!

Die Baselbieter Biotechnologiefirma Actelion will den geplanten Aktiensplit am kommenden Mittwoch durchführen. Die Teilung erfolgt im Verhältnis 1:5.
Die Aktionäre von Actelion hatten diesem Aktiensplit an der Generalversammlung Anfang Mai 2007 zugestimmt. Das entsprechende Kotierungsinserat werde am 5. Juni 2007 veröffentlicht, teilte Actelion am Donnerstag mit.
Antwort auf Beitrag Nr.: 31.295.113 von Fruehrentner am 25.08.07 23:31:30korrigiere:
WO muss den Chart kürzlich aktualisiert haben, wurde auch Zeit!
Jetzt ist der Aktiensplit im WO-Chart berücksichtigt.
WO muss den Chart kürzlich aktualisiert haben, wurde auch Zeit!
Jetzt ist der Aktiensplit im WO-Chart berücksichtigt.
Antwort auf Beitrag Nr.: 31.295.022 von Fruehrentner am 25.08.07 23:19:12Actelion kündigt Ergebnisse zur "proof-of-concept/dose ranging study" seines orexin receptor antagonisten an.
http://www.actelion.com/uninet/www/www_main_p.nsf/Content/me…
Die Art und Weise wie die Ankündigung erfolgt, läßt kaum einen Zweifel, dass die Ergebnisse positiv sind. Negatives würde sicherlich nicht mit einer "late breaking oral presentation" bedacht. Der im Vergleich zu den Weltbörsen feste Kursverlauf spricht ebenfalls eine deutliche Sprache.
http://www.actelion.com/uninet/www/www_main_p.nsf/Content/me…
Die Art und Weise wie die Ankündigung erfolgt, läßt kaum einen Zweifel, dass die Ergebnisse positiv sind. Negatives würde sicherlich nicht mit einer "late breaking oral presentation" bedacht. Der im Vergleich zu den Weltbörsen feste Kursverlauf spricht ebenfalls eine deutliche Sprache.
Übrigens:
Zu den Kernbeteiligungen von BB Biotech (einer börsennotierten Biotech-Beteiligungsgesellschaft) gehören Actelion mit 21,7 Prozent, Celgene mit 17,2 und Gilead mit 11,6 Prozent. Die Roche-Tochter Genentech macht 10,4 Prozent des Portfolios der Schweizer aus.
die werden schon wissen warum ...
Zu den Kernbeteiligungen von BB Biotech (einer börsennotierten Biotech-Beteiligungsgesellschaft) gehören Actelion mit 21,7 Prozent, Celgene mit 17,2 und Gilead mit 11,6 Prozent. Die Roche-Tochter Genentech macht 10,4 Prozent des Portfolios der Schweizer aus.
die werden schon wissen warum ...

Folgenden Artikel zu Orexin sollte man lesen
http://www.reuters.com/article/health-SP/idUSL29915452200708…
http://www.reuters.com/article/health-SP/idUSL29915452200708…
Antwort auf Beitrag Nr.: 31.337.288 von 11up am 30.08.07 08:16:33Folgenden auch:
http://www.ibtimes.com/articles/20070830/biotech-actelion.ht…
Gruß
CI
http://www.ibtimes.com/articles/20070830/biotech-actelion.ht…
Gruß
CI
Bei (sehr) positiven Daten am Sonntag: Welchen Kursaufschlag haltet ihr ab Montag für möglich? Oder glaubt ihr, dass positive Daten schon weitgehend eingepreist sind?
Antwort auf Beitrag Nr.: 31.352.016 von Fruehrentner am 31.08.07 09:44:44Keinesfalls sind die alle eingepreist.
10-15% könnten locker möglich sein.
Mehr erwarte ich nicht, befinden wir uns doch erst in Phase II.
Lasse mich aber gerne positiv überraschen.
Gruß
CI
10-15% könnten locker möglich sein.
Mehr erwarte ich nicht, befinden wir uns doch erst in Phase II.
Lasse mich aber gerne positiv überraschen.
Gruß
CI
Antwort auf Beitrag Nr.: 31.353.764 von cyberinvestor am 31.08.07 11:48:53Lass uns mal träumen und annehmen, dass:
a) der Schlafmittelkandidat erfolgreich die komplette Phase III besteht
und
b) Die Zulassung zunächst in Europa erteilt wird.
und
c) später auch die Zulassung in USA erteilt wird.
Welche Kurse wären dann zum jeweiligen Zeitpunkt a), b) und c) konservativ geschätzt jeweils denkbar?
a) der Schlafmittelkandidat erfolgreich die komplette Phase III besteht
und
b) Die Zulassung zunächst in Europa erteilt wird.
und
c) später auch die Zulassung in USA erteilt wird.
Welche Kurse wären dann zum jeweiligen Zeitpunkt a), b) und c) konservativ geschätzt jeweils denkbar?
Antwort auf Beitrag Nr.: 31.355.320 von Fruehrentner am 31.08.07 13:40:59zu a), b) und c) überlicherweise höhere 



Antwort auf Beitrag Nr.: 31.356.028 von cyberinvestor am 31.08.07 14:34:56

Ich arbeite auch daran - bei mir ist's leider noch Wunschdenken


Ich arbeite auch daran - bei mir ist's leider noch Wunschdenken

Antwort auf Beitrag Nr.: 31.355.320 von Fruehrentner am 31.08.07 13:40:59Das dauert noch fünf jahre.
Bis dahin wünsche ich euch bei eurer Arbeit viel Freude.
Und denkt doch nicht ständig an die Frührente.
Bis dahin wünsche ich euch bei eurer Arbeit viel Freude.
Und denkt doch nicht ständig an die Frührente.
"Actelion will issue a media release on Sunday, 02 September 2007 (08:00 Basel CEST/ 16:00 Cairns, Australian EST), announcing the results from the proof-of-concept/dose ranging study into the effect of the novel orexin receptor antagonist in patients with primary insomnia."
http://www.actelion.com/uninet/www/www_main_p.nsf/Content/me…
Warum gibts noch keine News?
Sollten doch laut der Ankündigung heute morgen rauskommen.
Oder hab ich was übersehen?
http://www.actelion.com/uninet/www/www_main_p.nsf/Content/me…
Warum gibts noch keine News?

Sollten doch laut der Ankündigung heute morgen rauskommen.
Oder hab ich was übersehen?
Antwort auf Beitrag Nr.: 31.367.488 von Fruehrentner am 02.09.07 14:04:39Hier habt ihr es:
02.09.2007 14:19
Actelion says insomnia drug study positive, plans phase III by yr-end
ZURICH (Thomson Financial) - Swiss pharmaceuticals group Actelion (Nachrichten/Aktienkurs) said new study data showed its insomnia drug almorexant significantly improves sleep for patients with primary insomnia.
Based on the initial positive results, Actelion said it plans to launch phase III tests on the drug by the end of the year.
Actelion said that almorexant significantly improved the time patients with primary insomnia spent sleeping in an eight-hour period at night. Primary insomnia is when a person has trouble going to sleep, staying asleep or feels unrested for at least one month.
The drug was tested on 147 patients in a proof-of-concept study, and was shown to increase time spent in REM (Rapid Eye Movement) sleep as well as having no negative side-effects the following day.
The study demonstrated almorexant's efficiency in 400 mg, 200 mg, and 100 mg dosages, but Actelion noted that there was no noticeable difference in sleep efficiency with the 50 mg dose.
Almorexant is the first-in-class orexin receptor antagonist line of drugs for the treatment of insomnia.
sarah.fenwick@thomson.com

02.09.2007 14:19
Actelion says insomnia drug study positive, plans phase III by yr-end
ZURICH (Thomson Financial) - Swiss pharmaceuticals group Actelion (Nachrichten/Aktienkurs) said new study data showed its insomnia drug almorexant significantly improves sleep for patients with primary insomnia.
Based on the initial positive results, Actelion said it plans to launch phase III tests on the drug by the end of the year.
Actelion said that almorexant significantly improved the time patients with primary insomnia spent sleeping in an eight-hour period at night. Primary insomnia is when a person has trouble going to sleep, staying asleep or feels unrested for at least one month.
The drug was tested on 147 patients in a proof-of-concept study, and was shown to increase time spent in REM (Rapid Eye Movement) sleep as well as having no negative side-effects the following day.
The study demonstrated almorexant's efficiency in 400 mg, 200 mg, and 100 mg dosages, but Actelion noted that there was no noticeable difference in sleep efficiency with the 50 mg dose.
Almorexant is the first-in-class orexin receptor antagonist line of drugs for the treatment of insomnia.
sarah.fenwick@thomson.com
Antwort auf Beitrag Nr.: 31.367.580 von Cashverbrenner am 02.09.07 14:34:10Danke!
Die news könnten kaum besser klingen!
Ich könnte mir vorstellen, dass Actelion bald auf den Radarschirm einiger Big Pharmans auftaucht und Übernahmegerüchte aufkeimen könnten.
Die news könnten kaum besser klingen!

Ich könnte mir vorstellen, dass Actelion bald auf den Radarschirm einiger Big Pharmans auftaucht und Übernahmegerüchte aufkeimen könnten.
Antwort auf Beitrag Nr.: 31.367.642 von Fruehrentner am 02.09.07 14:52:36Ich könnte mir vorstellen, dass Actelion bald auf den Radarschirm einiger Big Pharmans auftaucht und Übernahmegerüchte aufkeimen könnten.
Ja, aber Actelion ist nicht gerade billig. Fürchte die gute Nachricht wird erst mal für Gewinnmitnahmen genutzt.
Ja, aber Actelion ist nicht gerade billig. Fürchte die gute Nachricht wird erst mal für Gewinnmitnahmen genutzt.
New data on orexin receptor antagonist almorexant shows therapeutic potential to restore normal physiological sleep in patients suffering from insomnia
Pre-clinical and clinical data presented at the World Sleep Congress 2007 provides evidence for key role of orexin receptor antagonist almorexant to significantly restore relevant clinical parameters of sleep in a dose-dependent manner – Phase III program RESTORA planned to start by year-end
ALLSCHWIL, SWITZERLAND – 02 September 2007 – Actelion Ltd (SWX: ATLN) announced today the results of its proof-of-concept/dose-ranging study1 into the effect of its first-in-class orexin receptor antagonist almorexant in 147 patients with primary insomnia. Due to be presented during the 2007 World Sleep Congress (WSC), Cairns, Australia, the results of this study prove that almorexant significantly improves the primary parameter of sleep efficiency (time spent sleeping while confined to bed during an eight hour period at night, measured by polysomnography (PSG) - at 400 mg, 200 mg and 100 mg in a dose-dependent manner.
Analysis of secondary and exploratory endpoints, for which the study was not powered, also indicates that the use of almorexant results in clinically relevant improvements in important PSG-assessed sleep parameters. Almorexant was found – again in a dose-dependent fashion – to decrease Latency to Persistent Sleep (LPS, significant finding at 400 mg) and to decrease Wake After Sleep Onset (WASO, significant finding at 400 mg, 200 mg and 100 mg).
Almorexant – again in a dose-dependent manner – increased or maintained percentage of time spent REM (Rapid-Eye-Movement) sleep. Almorexant also significantly improved subjective sleep variables. Treatment with almorexant was not associated with any relevant negative effects on next-day performance (assessed by fine motor testing and mean reaction time).
Principal author Jasper Dingemanse, Ph.D. and Head of Clinical Pharmacology at Actelion commented: “These findings confirm the pivotal role of the highly specific orexin system in controlling the sleep-wake cycle. These data indicate that almorexant assists patients in falling and staying asleep in a non-sedative fashion, while at the same time not exhibiting any negative effects on next-day performance, as is commonly observed with traditional sleep medications targeting benzodiazepine receptors.”
Jasper Dingemanse concluded: “Moreover, almorexant has demonstrated in this study its potential to restore to normal levels time spent in REM sleep. REM sleep is the phase in which we humans dream and this REM phase is thought to be of key importance for our ability to store and process information. Therefore, the orexin receptor antagonist almorexant has the unique potential to restore normal physiological sleep.”
Isaac Kobrin, M.D. and Head of Clinical Development at Actelion said: “Based on these positive results, Actelion is planning to initiate by year-end the pivotal RESTORA program (REstore normal physiological Sleep with The Orexin Receptor antagonist Almorexant). The main doses to be evaluated in the adult population of patients suffering from insomnia will be 100 mg and 200 mg of almorexant taken before bedtime. The main parameters to be evaluated in this program include objective and subjective LPS and WASO as well as tolerability and safety.”
Isaac Kobrin concluded: “Special emphasis will be put on profiling effects related to the unique mode of action of almorexant, such as positively affecting REM and non-REM sleep and improvement of next-day performance compared to medications targeting benzodiazepine receptors. In addition, the RESTORA program will include specific studies in elderly patients.”
Jean-Paul Clozel, M.D. and Chief Executive Officer of Actelion, commented: “Our research efforts at Actelion have led to this highly innovative compound with the potential to transform how sleep disorders might be treated in the future. Actelion will support and drive the RESTORA program by putting behind it all required intellectual and material resources to fully characterize efficacy and safety of almorexant.”
Safety and Tolerability data
Treatment with almorexant was well tolerated and there were no reports of serious adverse events and no emerging safety findings. These results are consistent with earlier observations made in pre-clinical and early clinical studies published recently in Nature Medicine2. In all test settings, there have been no reports of cataplexy (sudden loss of muscle tone); a frequent symptom of narcolepsy syndrome associated with deficient orexinergic function.
Also presented during the World Sleep Congress 2007 is further data from the almorexant entry-into-human study in 70 healthy male subjects assessing tolerability, safety, pharmacokinetics and pharmacodynamics.3,4 Results revealed that the tested doses (1 up to 1000 mg) were well tolerated and there were no safety concerns.
The pharmacokinetic and pharmacodynamic profile of almorexant is compatible with those required for an agent used in sleep disorders.
Actelion also disclosed at the WSC that an additional study performed in healthy volunteers receiving multiple-ascending doses (MAD) up to 1000 mg for up to six days showed comparable results to the single dose study. Detailed data from this MAD study is currently being prepared for later scientific presentation and publication.
- ends-
Notes to editors
About almorexant
Almorexant is the first-in-class orexin receptor antagonist in clinical development as a potential new treatment for insomnia. It is an oral therapy that penetrates the blood-brain barrier and is capable of inducing a transient and reversible blockade of the orexin receptors. It was discovered by researchers at Actelion Pharmaceuticals in 2003. Almorexant is covered under a recently published patent application. Actelion is now accelerating its efforts to advance this promising compound into the final stages of development, with the pivotal program RESTORA (REstore normal physiological Sleep with The Orexin Receptor antagonist Almorexant) expected to be initiated by year-end 2007.
The proof-of-concept/dose-ranging study design
This multicenter, multiple-stage, randomized, double-blind, placebo-controlled, single-dose, two-way crossover study recruited 161 men and women aged 18–65 years with primary insomnia (DSM-IV criteria) at 24 centers in Europe and Israel. The per-protocol population used in the efficacy analysis comprised 147 patients (39 at 400 mg, 38 at 200 mg, 38 at 100 mg and 32 at 50 mg of almorexant). Patients underwent a screening/adaptation night and two treatment nights (one night on placebo, one night on almorexant) separated by one-week intervals. Almorexant or placebo was administered 30 minutes before the start of polysomnography (PSG) recording and the time in bed was fixed to eight hours.
The primary objective of the proof-of-concept/dose ranging study was to demonstrate the efficacy of a dose of 400 mg of almorexant, thereafter assessing the efficacy of lower doses at 200 mg, 100 mg, and 50 mg. Secondary objectives, for which the study was not powered, included the effect of almorexant on LPS, WASO and tolerability.
The proof-of-concept/dose-ranging study results
The study achieved its primary endpoint demonstrating that almorexant significantly increased sleep efficiency in adult primary insomnia patients in a dose-dependent manner at 400 mg (p<0.001,) 200 mg (p<0.001) and 100 mg (p=0.019). Results for sleep efficiency at 50 mg did not reach statistical significance (p=0.119 ns), but were consistent with a dose-dependent response.
In terms of exploratory endpoints, almorexant decreased latency to persistent sleep (LPS) by up to 18.0 minutes and decreased wake after sleep onset (WASO) by up to 54.0 minutes. Latency to REM sleep was reduced by up to 45.2 minutes and subjective measures of total sleep time were increased by up to 55.1 minutes. The magnitude of treatment effect for each endpoint at each of the four doses suggests a dose-dependent response.
Almorexant had no effect on next-day performance in terms of a motor test and reaction time, suggesting an absence of ‘hangover’ often associated with sleep medications targeting the benzodiazepine receptors.
No safety concerns emerged during the conduct of the study.
About RESTORA
The registration program RESTORA (REstore normal physiological Sleep with The Orexin Receptor antagonist Almorexant) will evaluate safety and efficacy of almorexant 100 mg and 200 mg in both adult and elderly patients diagnosed with insomnia. The RESTORA program will also include profiling studies, for example comparing almorexant with currently-used hypnotics targeting benzodiazepine receptors.
The RESTORA program, planned to be initiated by year-end 2007, is expected to last between two and three years. First study results could become available later in 2009.
About orexins
Orexins are proteins produced by the hypothalamus. They play an important role in controlling the sleep-wake cycle.
About sleep disorders
In the United States alone, a 2005 National Institutes of Health (NIH) State of Science conference about chronic insomnia estimated that there were up to 80 million Americans suffering from sleeplessness, of which 25 million suffered from chronic insomnia. Insomnia has a significant health and quality of life impact. People with insomnia tend to have higher rates of mental health problems, drug and alcohol abuse, and cardiac morbidity. The direct and indirect economic costs of sleep disorders are estimated to be up to USD 35 billion annually in the United States.
About REM sleep
REM is the stage of sleep during which most (though not all) dreams occur. During this stage, the eyes move rapidly behind the eyelids, and the activity of the brain's neurons is quite similar to that during waking hours. It is thought that memory is consolidated during REM sleep and is an important part of normal sleep architecture.
About Actelion Ltd
Actelion Ltd is a biopharmaceutical company with its corporate headquarters in Allschwil/Basel, Switzerland. Actelion's first drug Tracleer®, an orally available dual endothelin receptor antagonist, has been approved as a therapy for pulmonary arterial hypertension. Actelion markets Tracleer® through its own subsidiaries in key markets worldwide, including the United States (based in South San Francisco), the European Union, Japan as well as Canada, Australia and Switzerland. Actelion, founded in late 1997, is a leading player in innovative science related to the endothelium – the single layer of cells separating every blood vessel from the blood stream. Actelion focuses on the discovery, development and marketing of innovative drugs for significant unmet medical needs. Actelion shares are traded on the SWX Swiss Exchange (ticker symbol: ATLN).
Conference Call
Actelion will host an Investor Conference Call and discussion/Q&A on Wednesday, 05 September 2007, 21:00 Cairns (Australian EST) / 13:00 Basel (CEST) / 12:00 U.K. (BST) / 07:00 U.S. (EDT)
Dial:
Europe: + 41 44 580 6403
US: + 1 866 895 8561
UK: + 44 207 153 9962
Webcast – live and replay on demand
Actelion webcasts its Investor Conference Call. On the Web, you may either follow the call live or have the call replayed later on demand.
To access the webcast live, simply visit the link on our homepage http://www.actelion.com/" target="_blank" rel="nofollow ugc noopener">http://www.actelion.com/
5-10 minutes before the conference is due to start.
Alternatively, copy the following link into your browser:
http://gaia.world-television.com/actelion/20070905/trunc
Approximately 60 minutes after the call has ended, the archived investor webcast will be available for replay through our homepage. After 05 September 2007, it will be stored under Investors/Past Events.
For further information please contact:
Actelion contact:
Roland Haefeli,
Vice President,
Head of Investor Relations and
Public Affairs
Actelion Ltd, Gewerbestrasse 16, CH-4123 Allschwil
Switzerland
+41 61 565 64 58
+41 79 704 42 15 (mobile)
+1 650 624 6936 (US)
http://www.actelion.com
PR agency:
Jennie Conway (Packer Forbes)
+ 44 7905 787470
jennie@packerforbes.com
Lucy Whitehead (Packer Forbes)
+ 44 20 8772 1551
lucy@packerforbes.com
References:
1. Dingemanse J et al. Proof-of-concept study in primary insomnia patients with almorexant (ACT-078573), a dual orexin receptor antagonist. Poster and oral presentation at the 5th World Congress of the World Federation of Sleep Research and Sleep Medicine Societies, Cairns, Australia, 2–6 September 2007; P0653-J.
2. Brisbare-Roch C. et al. Promotion of sleep by targeting the orexin system in rats, dogs and humans. Nat Med. 2007 Feb;13(2):150-5.
3. Hoever P, et al. Entry-into-humans study with almorexant (ACT-078573), a dual orexin receptor antagonist: tolerability, safety and pharmacokinetics. Poster presentation at the 5th World Congress of the World Federation of Sleep Research and Sleep Medicine Societies, Cairns, Australia, 2–6 September 2007; PO444.
4. Hoever P, et al. Entry-into-humans study with almorexant (ACT-078573), a dual orexin receptor antagonist: pharmacodynamics. Poster presentation at the 5th World Congress of the World Federation of Sleep Research and Sleep Medicine Societies, Cairns, Australia, 2–6 September 2007; P0443.
Pre-clinical and clinical data presented at the World Sleep Congress 2007 provides evidence for key role of orexin receptor antagonist almorexant to significantly restore relevant clinical parameters of sleep in a dose-dependent manner – Phase III program RESTORA planned to start by year-end
ALLSCHWIL, SWITZERLAND – 02 September 2007 – Actelion Ltd (SWX: ATLN) announced today the results of its proof-of-concept/dose-ranging study1 into the effect of its first-in-class orexin receptor antagonist almorexant in 147 patients with primary insomnia. Due to be presented during the 2007 World Sleep Congress (WSC), Cairns, Australia, the results of this study prove that almorexant significantly improves the primary parameter of sleep efficiency (time spent sleeping while confined to bed during an eight hour period at night, measured by polysomnography (PSG) - at 400 mg, 200 mg and 100 mg in a dose-dependent manner.
Analysis of secondary and exploratory endpoints, for which the study was not powered, also indicates that the use of almorexant results in clinically relevant improvements in important PSG-assessed sleep parameters. Almorexant was found – again in a dose-dependent fashion – to decrease Latency to Persistent Sleep (LPS, significant finding at 400 mg) and to decrease Wake After Sleep Onset (WASO, significant finding at 400 mg, 200 mg and 100 mg).
Almorexant – again in a dose-dependent manner – increased or maintained percentage of time spent REM (Rapid-Eye-Movement) sleep. Almorexant also significantly improved subjective sleep variables. Treatment with almorexant was not associated with any relevant negative effects on next-day performance (assessed by fine motor testing and mean reaction time).
Principal author Jasper Dingemanse, Ph.D. and Head of Clinical Pharmacology at Actelion commented: “These findings confirm the pivotal role of the highly specific orexin system in controlling the sleep-wake cycle. These data indicate that almorexant assists patients in falling and staying asleep in a non-sedative fashion, while at the same time not exhibiting any negative effects on next-day performance, as is commonly observed with traditional sleep medications targeting benzodiazepine receptors.”
Jasper Dingemanse concluded: “Moreover, almorexant has demonstrated in this study its potential to restore to normal levels time spent in REM sleep. REM sleep is the phase in which we humans dream and this REM phase is thought to be of key importance for our ability to store and process information. Therefore, the orexin receptor antagonist almorexant has the unique potential to restore normal physiological sleep.”
Isaac Kobrin, M.D. and Head of Clinical Development at Actelion said: “Based on these positive results, Actelion is planning to initiate by year-end the pivotal RESTORA program (REstore normal physiological Sleep with The Orexin Receptor antagonist Almorexant). The main doses to be evaluated in the adult population of patients suffering from insomnia will be 100 mg and 200 mg of almorexant taken before bedtime. The main parameters to be evaluated in this program include objective and subjective LPS and WASO as well as tolerability and safety.”
Isaac Kobrin concluded: “Special emphasis will be put on profiling effects related to the unique mode of action of almorexant, such as positively affecting REM and non-REM sleep and improvement of next-day performance compared to medications targeting benzodiazepine receptors. In addition, the RESTORA program will include specific studies in elderly patients.”
Jean-Paul Clozel, M.D. and Chief Executive Officer of Actelion, commented: “Our research efforts at Actelion have led to this highly innovative compound with the potential to transform how sleep disorders might be treated in the future. Actelion will support and drive the RESTORA program by putting behind it all required intellectual and material resources to fully characterize efficacy and safety of almorexant.”
Safety and Tolerability data
Treatment with almorexant was well tolerated and there were no reports of serious adverse events and no emerging safety findings. These results are consistent with earlier observations made in pre-clinical and early clinical studies published recently in Nature Medicine2. In all test settings, there have been no reports of cataplexy (sudden loss of muscle tone); a frequent symptom of narcolepsy syndrome associated with deficient orexinergic function.
Also presented during the World Sleep Congress 2007 is further data from the almorexant entry-into-human study in 70 healthy male subjects assessing tolerability, safety, pharmacokinetics and pharmacodynamics.3,4 Results revealed that the tested doses (1 up to 1000 mg) were well tolerated and there were no safety concerns.
The pharmacokinetic and pharmacodynamic profile of almorexant is compatible with those required for an agent used in sleep disorders.
Actelion also disclosed at the WSC that an additional study performed in healthy volunteers receiving multiple-ascending doses (MAD) up to 1000 mg for up to six days showed comparable results to the single dose study. Detailed data from this MAD study is currently being prepared for later scientific presentation and publication.
- ends-
Notes to editors
About almorexant
Almorexant is the first-in-class orexin receptor antagonist in clinical development as a potential new treatment for insomnia. It is an oral therapy that penetrates the blood-brain barrier and is capable of inducing a transient and reversible blockade of the orexin receptors. It was discovered by researchers at Actelion Pharmaceuticals in 2003. Almorexant is covered under a recently published patent application. Actelion is now accelerating its efforts to advance this promising compound into the final stages of development, with the pivotal program RESTORA (REstore normal physiological Sleep with The Orexin Receptor antagonist Almorexant) expected to be initiated by year-end 2007.
The proof-of-concept/dose-ranging study design
This multicenter, multiple-stage, randomized, double-blind, placebo-controlled, single-dose, two-way crossover study recruited 161 men and women aged 18–65 years with primary insomnia (DSM-IV criteria) at 24 centers in Europe and Israel. The per-protocol population used in the efficacy analysis comprised 147 patients (39 at 400 mg, 38 at 200 mg, 38 at 100 mg and 32 at 50 mg of almorexant). Patients underwent a screening/adaptation night and two treatment nights (one night on placebo, one night on almorexant) separated by one-week intervals. Almorexant or placebo was administered 30 minutes before the start of polysomnography (PSG) recording and the time in bed was fixed to eight hours.
The primary objective of the proof-of-concept/dose ranging study was to demonstrate the efficacy of a dose of 400 mg of almorexant, thereafter assessing the efficacy of lower doses at 200 mg, 100 mg, and 50 mg. Secondary objectives, for which the study was not powered, included the effect of almorexant on LPS, WASO and tolerability.
The proof-of-concept/dose-ranging study results
The study achieved its primary endpoint demonstrating that almorexant significantly increased sleep efficiency in adult primary insomnia patients in a dose-dependent manner at 400 mg (p<0.001,) 200 mg (p<0.001) and 100 mg (p=0.019). Results for sleep efficiency at 50 mg did not reach statistical significance (p=0.119 ns), but were consistent with a dose-dependent response.
In terms of exploratory endpoints, almorexant decreased latency to persistent sleep (LPS) by up to 18.0 minutes and decreased wake after sleep onset (WASO) by up to 54.0 minutes. Latency to REM sleep was reduced by up to 45.2 minutes and subjective measures of total sleep time were increased by up to 55.1 minutes. The magnitude of treatment effect for each endpoint at each of the four doses suggests a dose-dependent response.
Almorexant had no effect on next-day performance in terms of a motor test and reaction time, suggesting an absence of ‘hangover’ often associated with sleep medications targeting the benzodiazepine receptors.
No safety concerns emerged during the conduct of the study.
About RESTORA
The registration program RESTORA (REstore normal physiological Sleep with The Orexin Receptor antagonist Almorexant) will evaluate safety and efficacy of almorexant 100 mg and 200 mg in both adult and elderly patients diagnosed with insomnia. The RESTORA program will also include profiling studies, for example comparing almorexant with currently-used hypnotics targeting benzodiazepine receptors.
The RESTORA program, planned to be initiated by year-end 2007, is expected to last between two and three years. First study results could become available later in 2009.
About orexins
Orexins are proteins produced by the hypothalamus. They play an important role in controlling the sleep-wake cycle.
About sleep disorders
In the United States alone, a 2005 National Institutes of Health (NIH) State of Science conference about chronic insomnia estimated that there were up to 80 million Americans suffering from sleeplessness, of which 25 million suffered from chronic insomnia. Insomnia has a significant health and quality of life impact. People with insomnia tend to have higher rates of mental health problems, drug and alcohol abuse, and cardiac morbidity. The direct and indirect economic costs of sleep disorders are estimated to be up to USD 35 billion annually in the United States.
About REM sleep
REM is the stage of sleep during which most (though not all) dreams occur. During this stage, the eyes move rapidly behind the eyelids, and the activity of the brain's neurons is quite similar to that during waking hours. It is thought that memory is consolidated during REM sleep and is an important part of normal sleep architecture.
About Actelion Ltd
Actelion Ltd is a biopharmaceutical company with its corporate headquarters in Allschwil/Basel, Switzerland. Actelion's first drug Tracleer®, an orally available dual endothelin receptor antagonist, has been approved as a therapy for pulmonary arterial hypertension. Actelion markets Tracleer® through its own subsidiaries in key markets worldwide, including the United States (based in South San Francisco), the European Union, Japan as well as Canada, Australia and Switzerland. Actelion, founded in late 1997, is a leading player in innovative science related to the endothelium – the single layer of cells separating every blood vessel from the blood stream. Actelion focuses on the discovery, development and marketing of innovative drugs for significant unmet medical needs. Actelion shares are traded on the SWX Swiss Exchange (ticker symbol: ATLN).
Conference Call
Actelion will host an Investor Conference Call and discussion/Q&A on Wednesday, 05 September 2007, 21:00 Cairns (Australian EST) / 13:00 Basel (CEST) / 12:00 U.K. (BST) / 07:00 U.S. (EDT)
Dial:
Europe: + 41 44 580 6403
US: + 1 866 895 8561
UK: + 44 207 153 9962
Webcast – live and replay on demand
Actelion webcasts its Investor Conference Call. On the Web, you may either follow the call live or have the call replayed later on demand.
To access the webcast live, simply visit the link on our homepage http://www.actelion.com/" target="_blank" rel="nofollow ugc noopener">http://www.actelion.com/
5-10 minutes before the conference is due to start.
Alternatively, copy the following link into your browser:
http://gaia.world-television.com/actelion/20070905/trunc
Approximately 60 minutes after the call has ended, the archived investor webcast will be available for replay through our homepage. After 05 September 2007, it will be stored under Investors/Past Events.
For further information please contact:
Actelion contact:
Roland Haefeli,
Vice President,
Head of Investor Relations and
Public Affairs
Actelion Ltd, Gewerbestrasse 16, CH-4123 Allschwil
Switzerland
+41 61 565 64 58
+41 79 704 42 15 (mobile)
+1 650 624 6936 (US)
http://www.actelion.com
PR agency:
Jennie Conway (Packer Forbes)
+ 44 7905 787470
jennie@packerforbes.com
Lucy Whitehead (Packer Forbes)
+ 44 20 8772 1551
lucy@packerforbes.com
References:
1. Dingemanse J et al. Proof-of-concept study in primary insomnia patients with almorexant (ACT-078573), a dual orexin receptor antagonist. Poster and oral presentation at the 5th World Congress of the World Federation of Sleep Research and Sleep Medicine Societies, Cairns, Australia, 2–6 September 2007; P0653-J.
2. Brisbare-Roch C. et al. Promotion of sleep by targeting the orexin system in rats, dogs and humans. Nat Med. 2007 Feb;13(2):150-5.
3. Hoever P, et al. Entry-into-humans study with almorexant (ACT-078573), a dual orexin receptor antagonist: tolerability, safety and pharmacokinetics. Poster presentation at the 5th World Congress of the World Federation of Sleep Research and Sleep Medicine Societies, Cairns, Australia, 2–6 September 2007; PO444.
4. Hoever P, et al. Entry-into-humans study with almorexant (ACT-078573), a dual orexin receptor antagonist: pharmacodynamics. Poster presentation at the 5th World Congress of the World Federation of Sleep Research and Sleep Medicine Societies, Cairns, Australia, 2–6 September 2007; P0443.
Antwort auf Beitrag Nr.: 31.367.940 von Cashverbrenner am 02.09.07 16:30:37Actelion ist nicht gerade billig. Fürchte die gute Nachricht wird erst mal für Gewinnmitnahmen genutzt.
Andersrum kann man sagen, dass viele Beobachter erstmal sicherheitshalber diese Meldung abwarten und jetzt bei positiven Daten einsteigen.
Andersrum kann man sagen, dass viele Beobachter erstmal sicherheitshalber diese Meldung abwarten und jetzt bei positiven Daten einsteigen.
Antwort auf Beitrag Nr.: 31.368.006 von Fruehrentner am 02.09.07 16:48:55Sie haben Gold in den Händen. Jetzt kommt es darauf an etwas draus zu machen.
Wie Jean-Paul Clozel, M.D. and Chief Executive Officer of Actelion, schon commentierte:
“Our research efforts at Actelion have led to this highly innovative compound with the potential to transform how sleep disorders might be treated in the future. Actelion will support and drive the RESTORA program by putting behind it all required intellectual and material resources to fully characterize efficacy and safety of almorexant.
Wie Jean-Paul Clozel, M.D. and Chief Executive Officer of Actelion, schon commentierte:
“Our research efforts at Actelion have led to this highly innovative compound with the potential to transform how sleep disorders might be treated in the future. Actelion will support and drive the RESTORA program by putting behind it all required intellectual and material resources to fully characterize efficacy and safety of almorexant.
Antwort auf Beitrag Nr.: 31.369.901 von 11up am 02.09.07 23:48:01Die Studie zu Tracleer® (EARLY) ist auch positiv verlaufen.
http://www.actelion.com/uninet/www/www_Test_P.nsf/Content/me…
EARLY: First PAH functional class II population study emphasizes need to diagnose and treat PAH early
VIENNA, AUSTRIA – 03 September 2007 – At the 2007 European Society of Cardiology (ESC) congress in Vienna, Actelion Ltd (SWX: ATLN) has presented full results from a Phase IIIb trial1 which demonstrated that six months of treatment with bosentan (Tracleer®) in patients with mildly symptomatic WHO functional class II (FCII) Pulmonary Arterial Hypertension (PAH) significantly delayed time to clinical worsening and reduced the number of patients worsening to WHO functional class III/IV.
The 185-patient EARLY (Endothelin Antagonist tRial in miLdlY symptomatic PAH patients) study1 was a randomized, double blind, placebo-controlled trial and it is the only randomized controlled trial (RCT) to study a dedicated FCII population.
Results from EARLY1 suggest that PAH is a serious and progressive disease, even in FCII patients who typically present with mild symptoms. The effect of bosentan on time to clinical worsening, an important measure of disease progression, was significant, representing a risk reduction of 77% (p=0.0114). Time to clinical worsening was defined by death; hospitalization for PAH and symptomatic progression of PAH. The relevance of this finding was supported by a significantly lower incidence of worsening of functional class (3.4% vs. 13.2%, P = 0.0285) with bosentan compared to placebo, as well as by improvement in quality-of-life indices.
Furthermore, when compared to placebo, bosentan was shown to significantly reduce pulmonary vascular resistance (PVR), representing a treatment effect of -22.6%
(-33.5, -10.0; p< 0.0001), significantly improve several other important hemodynamic measurements, and showed a strong trend for an effect on exercise capacity (measured by the 6-minute walk distance).
The safety and tolerability profile was consistent with previous placebo-controlled clinical trials in pulmonary arterial hypertension.2
Professor Nazzareno Galiè from the University of Bologna, Italy, commented: “PAH is a rare but serious disease that progresses rapidly if left untreated. The results of the EARLY study confirm for the first time that early diagnosis and treatment of PAH have an impact on a relevant end-point such as clinical worsening, even for those patients who present with mild symptoms.”
Jean-Paul Clozel, M.D. and Chief Executive Officer of Actelion, added: “The results of the EARLY study reinforce our understanding of PAH as a progressive and serious disease that needs to be diagnosed and treated in the early stages. This is the third successive RCT with Tracleer® to provide data that shows a significant effect on delaying time to clinical worsening, a reflection of disease progression. This data is being used as a basis for regulatory submissions worldwide. Actelion will continue its clinical research program to further improve our understanding of PAH disease progression and management.”
Findings from other bosentan studies were also presented at the 2007 ESC congress.
COMPASS-13
Hemodynamic effects of a single dose of sildenafil in symptomatic patients on bosentan treatment for PAH
COMPASS-13 was the first clinical trial to provide detailed hemodynamic information on the combination of sildenafil and bosentan. Findings showed that the combination of sildenafil together with long-term bosentan therapy produces significant hemodynamic improvements including a highly significant reduction in mean PVR observed 60 minutes after administration of a single dose of sildenafil 25 mg (-15.2% [95% CI: –20.8 to –9.6]; p < 0.0001) and a decrease in the mean total pulmonary resistance (-13.3% [95% CI: –17.0 to –9.6]; p < 0.0001).
FUTURE4
FormUlation of bosenTan in pUlmonary arterial hypeRtEnsion
This was a phase III open label, single-arm study4 of a novel pediatric formulation to characterize the pharmacokinetic profile in children with PAH. The pediatric formulation of bosentan was well tolerated with a safety profile similar to that seen previously in the adult population. The longer-term safety and efficacy continues to be studied in the FUTURE-2 extension study.
BENEFiT
Bosentan Effects in iNopErable Forms of chronIc Thromboembolic pulmonary hypertension (CTEPH)
Results from the BENEFiT trial, a Phase III double blind, randomized, placebo-controlled study in patients with inoperable CTEPH, will be presented on Wednesday, 05 September 2007.
Bosentan is currently licensed for the treatment of pulmonary arterial hypertension (PAH Functional Class III in Europe, Class III and IV in the United States) to improve exercise ability.5 In the summer of 2007, Actelion has submitted the EARLY data to Health Authorities worldwide for inclusion in the product labeling.
-ends-
Notes to editors
About Tracleer® in Pulmonary Arterial Hypertension (PAH)
Tracleer® (bosentan), the first oral dual endothelin receptor antagonist, is approved for the treatment of pulmonary arterial hypertension (PAH) and made available by Actelion subsidiaries in the United States, the European Union, Japan, Australia, Canada, Switzerland and other markets worldwide5.
Requires attention to two significant safety concerns: Potential for serious liver injury (including rare cases of liver failure and unexplained hepatic cirrhosis in a setting of close monitoring) - Liver monitoring of all patients is essential prior to initiation of treatment and monthly thereafter. High potential for major birth defects -Pregnancy must be excluded and prevented by two forms of birth control; monthly pregnancy tests should be obtained. Because of these risks, Tracleer is only supplied through a controlled distribution.
Online information on pulmonary arterial hypertension (PAH): www.pah-info.com Online information on pulmonary arterial hypertension (PAH): www.pah-info.com
PAH-info.com is part of an international PAH awareness campaign supported by Actelion Pharmaceuticals and has been created to provide healthcare professionals and patients with accurate and continuously updated information on PAH. The website contains information on symptoms, causes, diagnosis and current treatment options in separate sections for healthcare professionals and patients. It also includes a section on Systemic Sclerosis (also known as scleroderma or SSc); a chronic connective tissue disease where PAH is reported in approximately 16% of patients. The website is supported by high-quality resources such as links to an extensive list of worldwide patient associations and professional health organizations and additional sources of information.
Conference Call
Actelion will host an Investor Conference Call and Q&A on Monday, 03 September 2007,
20:00 Cairns (Australian EST) / 12:00 Basel (CEST) / 11:00 U.K. (BST) / 06:00 U.S. (EDT)
Dial: +41 44 580 6403 (Europe)
+1 866 895 8561 (U.S.)
+44 207 153 9962 (U.K.)
Webcast – Live and replay on demand
Actelion webcasts its Investor Conference Call. On the web, you may either follow the call live or have the call replayed later on demand.
To access the webcast live, simply visit the link on our homepage http://www.actelion.com/
5-10 minutes before the conference is due to start.
Alternatively, copy the following link into your browser:
http://gaia.world-television.com/actelion/20070903/trunc
Approximately 60 minutes after the call has ended, the archived investor webcast will be available for replay through our homepage. After 03 September 2007, it will be stored under Investors/Past Events.
http://www.actelion.com/uninet/www/www_Test_P.nsf/Content/me…
EARLY: First PAH functional class II population study emphasizes need to diagnose and treat PAH early
VIENNA, AUSTRIA – 03 September 2007 – At the 2007 European Society of Cardiology (ESC) congress in Vienna, Actelion Ltd (SWX: ATLN) has presented full results from a Phase IIIb trial1 which demonstrated that six months of treatment with bosentan (Tracleer®) in patients with mildly symptomatic WHO functional class II (FCII) Pulmonary Arterial Hypertension (PAH) significantly delayed time to clinical worsening and reduced the number of patients worsening to WHO functional class III/IV.
The 185-patient EARLY (Endothelin Antagonist tRial in miLdlY symptomatic PAH patients) study1 was a randomized, double blind, placebo-controlled trial and it is the only randomized controlled trial (RCT) to study a dedicated FCII population.
Results from EARLY1 suggest that PAH is a serious and progressive disease, even in FCII patients who typically present with mild symptoms. The effect of bosentan on time to clinical worsening, an important measure of disease progression, was significant, representing a risk reduction of 77% (p=0.0114). Time to clinical worsening was defined by death; hospitalization for PAH and symptomatic progression of PAH. The relevance of this finding was supported by a significantly lower incidence of worsening of functional class (3.4% vs. 13.2%, P = 0.0285) with bosentan compared to placebo, as well as by improvement in quality-of-life indices.
Furthermore, when compared to placebo, bosentan was shown to significantly reduce pulmonary vascular resistance (PVR), representing a treatment effect of -22.6%
(-33.5, -10.0; p< 0.0001), significantly improve several other important hemodynamic measurements, and showed a strong trend for an effect on exercise capacity (measured by the 6-minute walk distance).
The safety and tolerability profile was consistent with previous placebo-controlled clinical trials in pulmonary arterial hypertension.2
Professor Nazzareno Galiè from the University of Bologna, Italy, commented: “PAH is a rare but serious disease that progresses rapidly if left untreated. The results of the EARLY study confirm for the first time that early diagnosis and treatment of PAH have an impact on a relevant end-point such as clinical worsening, even for those patients who present with mild symptoms.”
Jean-Paul Clozel, M.D. and Chief Executive Officer of Actelion, added: “The results of the EARLY study reinforce our understanding of PAH as a progressive and serious disease that needs to be diagnosed and treated in the early stages. This is the third successive RCT with Tracleer® to provide data that shows a significant effect on delaying time to clinical worsening, a reflection of disease progression. This data is being used as a basis for regulatory submissions worldwide. Actelion will continue its clinical research program to further improve our understanding of PAH disease progression and management.”
Findings from other bosentan studies were also presented at the 2007 ESC congress.
COMPASS-13
Hemodynamic effects of a single dose of sildenafil in symptomatic patients on bosentan treatment for PAH
COMPASS-13 was the first clinical trial to provide detailed hemodynamic information on the combination of sildenafil and bosentan. Findings showed that the combination of sildenafil together with long-term bosentan therapy produces significant hemodynamic improvements including a highly significant reduction in mean PVR observed 60 minutes after administration of a single dose of sildenafil 25 mg (-15.2% [95% CI: –20.8 to –9.6]; p < 0.0001) and a decrease in the mean total pulmonary resistance (-13.3% [95% CI: –17.0 to –9.6]; p < 0.0001).
FUTURE4
FormUlation of bosenTan in pUlmonary arterial hypeRtEnsion
This was a phase III open label, single-arm study4 of a novel pediatric formulation to characterize the pharmacokinetic profile in children with PAH. The pediatric formulation of bosentan was well tolerated with a safety profile similar to that seen previously in the adult population. The longer-term safety and efficacy continues to be studied in the FUTURE-2 extension study.
BENEFiT
Bosentan Effects in iNopErable Forms of chronIc Thromboembolic pulmonary hypertension (CTEPH)
Results from the BENEFiT trial, a Phase III double blind, randomized, placebo-controlled study in patients with inoperable CTEPH, will be presented on Wednesday, 05 September 2007.
Bosentan is currently licensed for the treatment of pulmonary arterial hypertension (PAH Functional Class III in Europe, Class III and IV in the United States) to improve exercise ability.5 In the summer of 2007, Actelion has submitted the EARLY data to Health Authorities worldwide for inclusion in the product labeling.
-ends-
Notes to editors
About Tracleer® in Pulmonary Arterial Hypertension (PAH)
Tracleer® (bosentan), the first oral dual endothelin receptor antagonist, is approved for the treatment of pulmonary arterial hypertension (PAH) and made available by Actelion subsidiaries in the United States, the European Union, Japan, Australia, Canada, Switzerland and other markets worldwide5.
Requires attention to two significant safety concerns: Potential for serious liver injury (including rare cases of liver failure and unexplained hepatic cirrhosis in a setting of close monitoring) - Liver monitoring of all patients is essential prior to initiation of treatment and monthly thereafter. High potential for major birth defects -Pregnancy must be excluded and prevented by two forms of birth control; monthly pregnancy tests should be obtained. Because of these risks, Tracleer is only supplied through a controlled distribution.
Online information on pulmonary arterial hypertension (PAH): www.pah-info.com Online information on pulmonary arterial hypertension (PAH): www.pah-info.com
PAH-info.com is part of an international PAH awareness campaign supported by Actelion Pharmaceuticals and has been created to provide healthcare professionals and patients with accurate and continuously updated information on PAH. The website contains information on symptoms, causes, diagnosis and current treatment options in separate sections for healthcare professionals and patients. It also includes a section on Systemic Sclerosis (also known as scleroderma or SSc); a chronic connective tissue disease where PAH is reported in approximately 16% of patients. The website is supported by high-quality resources such as links to an extensive list of worldwide patient associations and professional health organizations and additional sources of information.
Conference Call
Actelion will host an Investor Conference Call and Q&A on Monday, 03 September 2007,
20:00 Cairns (Australian EST) / 12:00 Basel (CEST) / 11:00 U.K. (BST) / 06:00 U.S. (EDT)
Dial: +41 44 580 6403 (Europe)
+1 866 895 8561 (U.S.)
+44 207 153 9962 (U.K.)
Webcast – Live and replay on demand
Actelion webcasts its Investor Conference Call. On the web, you may either follow the call live or have the call replayed later on demand.
To access the webcast live, simply visit the link on our homepage http://www.actelion.com/
5-10 minutes before the conference is due to start.
Alternatively, copy the following link into your browser:
http://gaia.world-television.com/actelion/20070903/trunc
Approximately 60 minutes after the call has ended, the archived investor webcast will be available for replay through our homepage. After 03 September 2007, it will be stored under Investors/Past Events.
Einen Kurssprung hat es trotz der guten Meldungen nicht gegeben.
Die Erwartungen der Aktionäre wurden getroffen. Das ist gut so.
Moderate kontinuierliche Kurssteigerungen sind das beste was uns passieren kann.
Die Erwartungen der Aktionäre wurden getroffen. Das ist gut so.
Moderate kontinuierliche Kurssteigerungen sind das beste was uns passieren kann.
Antwort auf Beitrag Nr.: 31.371.096 von 11up am 03.09.07 10:00:21Das sehe ich auch so.
Actelion sehe ich als eine Langfristanlage.
Actelion sehe ich als eine Langfristanlage.
Actelion starts miglustat Phase II study for cystic fibrosis
2nd October 2007
By Staff Writer
Biopharmaceutical company Actelion has initiated a placebo-controlled crossover Phase IIa proof-of-concept study of miglustat for the treatment of cystic fibrosis.
This study will treat 25 patients affected by a specific cystic fibrosis (CF) mutation (delF508). As a primary endpoint the study will investigate the effect of miglustat on the nasal potential difference, a sensitive and non-invasive functional test for the cystic fibrosis transmembrane conductance regulator (CFTR). Defects of CFTR are responsible for the characteristic morbidities of the disease.
Actelion expects full results of this proof-of-concept clinical study to become available at the end of 2008. These results, if positive, will determine the need, size and duration of future studies.
Jean-Paul Clozel, CEO, said: "Actelion's decision to engage in cystic fibrosis with miglustat reinforces the company's commitment to rare genetic diseases with significant unmet medical needs. It also reflects our interest to fully explore the potential of the unique pharmacological properties of miglustat for new indications."
http://www.pharmaceutical-business-review.com/article_news.a…
2nd October 2007
By Staff Writer
Biopharmaceutical company Actelion has initiated a placebo-controlled crossover Phase IIa proof-of-concept study of miglustat for the treatment of cystic fibrosis.
This study will treat 25 patients affected by a specific cystic fibrosis (CF) mutation (delF508). As a primary endpoint the study will investigate the effect of miglustat on the nasal potential difference, a sensitive and non-invasive functional test for the cystic fibrosis transmembrane conductance regulator (CFTR). Defects of CFTR are responsible for the characteristic morbidities of the disease.
Actelion expects full results of this proof-of-concept clinical study to become available at the end of 2008. These results, if positive, will determine the need, size and duration of future studies.
Jean-Paul Clozel, CEO, said: "Actelion's decision to engage in cystic fibrosis with miglustat reinforces the company's commitment to rare genetic diseases with significant unmet medical needs. It also reflects our interest to fully explore the potential of the unique pharmacological properties of miglustat for new indications."
http://www.pharmaceutical-business-review.com/article_news.a…
http://www.ad-hoc-news.de/StocksToWatchAusland/de/13559682/A…
04. Oktober 2007 | 10:34 Uhr Kommentieren | Artikel drucken | Artikel versenden
Actelion Position aufbauen
Börsenticker aus Kulmbach (aktiencheck.de AG) - Die Experten vom Anlegermagazin "Der Aktionär" empfehlen auf dem aktuellen Kursniveau der Actelion-Aktie (ISIN CH0010532478/ WKN 936767) eine erste Position aufzubauen.
Mehr als 10 Mio. Deutsche seien so stark von Schlafstörungen betroffen, dass sie sich in ärztliche Behandlung begeben müssten. Gemäß einer Studie der Bank Vontobel habe der weltweite Markt für Schlafmittel im letzten Jahr ein Umsatzvolumen von rund 4,6 Mrd.
USD umfasst. Jedoch hafte Schlafmitteln immer noch ein negatives Image an. Sollten aber bessere Produkte die Zulassung erhalten, dürfte das Marktvolumen spürbar nach oben schnellen.
Eines dieser Präparate könnte Almorexant von Actelion sein. Dieses Präparat gehöre einer vollkommen neuartigen Generation von Schlafmitteln an. Die jüngsten Ergebnisse der abschließenden Phase-II-Tests seien sehr vielversprechend ausgefallen. Noch in diesem Jahr sollten erste Phase-III-Tests begonnen werden. Wenn alles nach Plan laufe, dürfte dem Medikament, dem Blockbuster-Qualitäten zugebilligt würden, im Jahr 2012 auf den Markt kommen.
Das Unternehmen habe aber noch zahlreiche weitere Produktkandidaten in Phase III und II. Einige davon würden ebenfalls als Blockbuster-Kandidat gehandelt. Demnach dürfte die Gesellschaft gut gerüstet sein, die Mitbewerber in Schach zu halten.
Actelion habe zuletzt seine Gesamtjahresprognosen angehoben. Demnach erwarte die Gesellschaft Umsätze zwischen umgerechnet 768 und 792 Mio. Euro sowie ein Cash-EBIT im Bereich von 259 bis 277 Mio. Euro.
Anleger sollten auf dem derzeitigen Niveau eine erste Position aufbauen sowie eventuelle Kursrücksetzer zum Nachkauf der Actelion-Aktie nutzen, so die Experten von "Der Aktionär". Das Kursziel werde bei 55 Euro gesehen. (Ausgabe 41) (04.10.2007/ac/a/a).
Sie lesen Finanznachrichten und Wirtschaftsmeldungen auf ad-hoc-news.de, ein Presseportal der trading-house.net AG. Weitere Börsennachrichten finden Sie unter www.ad-hoc-news.de & http://www.trading-house.net.
04. Oktober 2007 | 10:34 Uhr Kommentieren | Artikel drucken | Artikel versenden
Actelion Position aufbauen
Börsenticker aus Kulmbach (aktiencheck.de AG) - Die Experten vom Anlegermagazin "Der Aktionär" empfehlen auf dem aktuellen Kursniveau der Actelion-Aktie (ISIN CH0010532478/ WKN 936767) eine erste Position aufzubauen.
Mehr als 10 Mio. Deutsche seien so stark von Schlafstörungen betroffen, dass sie sich in ärztliche Behandlung begeben müssten. Gemäß einer Studie der Bank Vontobel habe der weltweite Markt für Schlafmittel im letzten Jahr ein Umsatzvolumen von rund 4,6 Mrd.
USD umfasst. Jedoch hafte Schlafmitteln immer noch ein negatives Image an. Sollten aber bessere Produkte die Zulassung erhalten, dürfte das Marktvolumen spürbar nach oben schnellen.
Eines dieser Präparate könnte Almorexant von Actelion sein. Dieses Präparat gehöre einer vollkommen neuartigen Generation von Schlafmitteln an. Die jüngsten Ergebnisse der abschließenden Phase-II-Tests seien sehr vielversprechend ausgefallen. Noch in diesem Jahr sollten erste Phase-III-Tests begonnen werden. Wenn alles nach Plan laufe, dürfte dem Medikament, dem Blockbuster-Qualitäten zugebilligt würden, im Jahr 2012 auf den Markt kommen.
Das Unternehmen habe aber noch zahlreiche weitere Produktkandidaten in Phase III und II. Einige davon würden ebenfalls als Blockbuster-Kandidat gehandelt. Demnach dürfte die Gesellschaft gut gerüstet sein, die Mitbewerber in Schach zu halten.
Actelion habe zuletzt seine Gesamtjahresprognosen angehoben. Demnach erwarte die Gesellschaft Umsätze zwischen umgerechnet 768 und 792 Mio. Euro sowie ein Cash-EBIT im Bereich von 259 bis 277 Mio. Euro.
Anleger sollten auf dem derzeitigen Niveau eine erste Position aufbauen sowie eventuelle Kursrücksetzer zum Nachkauf der Actelion-Aktie nutzen, so die Experten von "Der Aktionär". Das Kursziel werde bei 55 Euro gesehen. (Ausgabe 41) (04.10.2007/ac/a/a).
Sie lesen Finanznachrichten und Wirtschaftsmeldungen auf ad-hoc-news.de, ein Presseportal der trading-house.net AG. Weitere Börsennachrichten finden Sie unter www.ad-hoc-news.de & http://www.trading-house.net.
Bei den Kursen heute dürften die Zahlen am Donnerstag früh gut sein.

Antwort auf Beitrag Nr.: 31.994.926 von 11up am 15.10.07 11:02:26na hoffen wir es mal! 


Ich wünsche uns alles Gute mit Actelion.
Bin zwar Späteinsteiger, aber bin von der Aktie überzeugt. Zudem könnte auch eine Übernahmefantasie aufkommen bei der Pipeline und angesichts eher schwacher Pipelines bei den Pharmariesen.



Ich wünsche uns alles Gute mit Actelion.
Bin zwar Späteinsteiger, aber bin von der Aktie überzeugt. Zudem könnte auch eine Übernahmefantasie aufkommen bei der Pipeline und angesichts eher schwacher Pipelines bei den Pharmariesen.
Leider doch nicht so berauschend, aber zumindest war der Kursanstieg vor den Zahlen sicher nicht durch Insiderinformation ausgelöst.
Antwort auf Beitrag Nr.: 32.062.202 von 11up am 18.10.07 11:05:50Hälst Du die Kursreaktion heute als Reaktion auf die Zahlen für übertrieben?
Antwort auf Beitrag Nr.: 32.062.529 von Fruehrentner am 18.10.07 11:30:02Ich denke die Zeit heilt alle Wunden - hoffentlich!
Antwort auf Beitrag Nr.: 32.063.052 von 11up am 18.10.07 12:05:56Slide 9 der Analystenpräsentation (folgender Link)
http://www.actelion.com/uninet/www/www_main_p.nsf/Content/me…
verdeutlicht die Argumentaion des Actelion Managements, der geringere Umsatz in Q3 sei durch Orderverschiebungen zwischen Q2 und Q3 zustande gekommen. Das ist tatsächlich nicht ganz von der Hand zu weisen.
Da am Ausblick für das Gesamtjahr festgehalten wurde muß in Q4 ein Umatz von 329000 - 369000 erreicht werden. Das scheint mir durchaus im Rahmen des Möglichen und würde die aktuelle Umsatzdelle wieder ausbügeln
http://www.actelion.com/uninet/www/www_main_p.nsf/Content/me…
verdeutlicht die Argumentaion des Actelion Managements, der geringere Umsatz in Q3 sei durch Orderverschiebungen zwischen Q2 und Q3 zustande gekommen. Das ist tatsächlich nicht ganz von der Hand zu weisen.
Da am Ausblick für das Gesamtjahr festgehalten wurde muß in Q4 ein Umatz von 329000 - 369000 erreicht werden. Das scheint mir durchaus im Rahmen des Möglichen und würde die aktuelle Umsatzdelle wieder ausbügeln
Antwort auf Beitrag Nr.: 32.084.953 von 11up am 19.10.07 15:37:50Klingt beruhigend!
Zudem habe ich gehört, dass der schwache US-$ das US-Geschäft beeinträchtigt hat. Hoffen wir also, das der Dollar nicht noch weiter abkippt, sondern zwischendurch mal ne Rally macht.
Ausserdem brauchen wir möglichst bald weitere positive Infos vom Schlafmittelkandsidaten, der sich in der klin. Prüfung befindet.
Zudem habe ich gehört, dass der schwache US-$ das US-Geschäft beeinträchtigt hat. Hoffen wir also, das der Dollar nicht noch weiter abkippt, sondern zwischendurch mal ne Rally macht.
Ausserdem brauchen wir möglichst bald weitere positive Infos vom Schlafmittelkandsidaten, der sich in der klin. Prüfung befindet.
Antwort auf Beitrag Nr.: 32.086.536 von Fruehrentner am 19.10.07 17:09:41Für almorexant suchen sie einen Partner hat CEO Jean-Paul Clozel auf der Analystenkonferenz gesagt. Zwar wollen sie die klinischen Tests selber beenden, aber mit einem starken Partner sind sie schneller am Markt. Falls hier eine Meldung kommt wird das dem Kurs wieder auf die Sprünge helfen.
19.10.2007 09:02:07
Actelion "overweight"
New York (aktiencheck.de AG) - Die Wertpapierspezialisten von J.P. Morgan Securities bewerten den Anteilschein des schweizerischen Unternehmens Actelion (ISIN CH0010532478/ WKN 936767) mit "overweight". Der Aktienkurs von Actelion sei nach der Bekanntgabe des Quartalsumsatzes, der die Konsensschätzung um 7,4% und die Analystenprognose um 2,5% verfehlt habe, um 13,5% gefallen. Der Blick der Analysten auf die Fundamentaldaten des Unternehmens sei unverändert. Man denke weiterhin, dass Actelion dank des Potenzials der Produktpipeline eine der überzeugenderen Stories im Midcap-Bereich sei. Actelion habe im dritten Quartal 2007 den Umsatz mit "Tracleer" im Jahresvergleich um 22,5% auf 287 Mio. Schweizer Franken (CHF) gesteigert und damit die Analystenschätzung von 290 Mio. CHF knapp verfehlt. Die Analysten würden für das vierte Quartal weiterhin einen Umsatz von 327 Mio. CHF erwarten, die Umsatzprognose für das Gesamtjahr bewege sich mit 1,273 Mrd. CHF am unteren Ende der Unternehmensvorgabe. Die EPS-Schätzungen der Analysten seien für die Fiskaljahre 2007 und 2008 von 2,52 CHF auf 2,65 CHF angehoben bzw. von 2,67 CHF auf 2,57 CHF gesenkt worden, so dass sich nun ein 2007-KGV von 22,8 und ein 2008-KGV von 23,6 errechnen lasse. Das Kursziel der Aktie sehe man bei 70 CHF. Auf dieser Grundlage lautet das Rating der Börsenanalysten von J.P. Morgan Securities für das Wertpapier von Actelion "overweight". (Analyse vom 19.10.07) (19.10.2007/ac/a/a)
Quelle: AKTIENCHECK.DE
Eigentlich sollte man jetzt langsam nachkaufen
Actelion "overweight"
New York (aktiencheck.de AG) - Die Wertpapierspezialisten von J.P. Morgan Securities bewerten den Anteilschein des schweizerischen Unternehmens Actelion (ISIN CH0010532478/ WKN 936767) mit "overweight". Der Aktienkurs von Actelion sei nach der Bekanntgabe des Quartalsumsatzes, der die Konsensschätzung um 7,4% und die Analystenprognose um 2,5% verfehlt habe, um 13,5% gefallen. Der Blick der Analysten auf die Fundamentaldaten des Unternehmens sei unverändert. Man denke weiterhin, dass Actelion dank des Potenzials der Produktpipeline eine der überzeugenderen Stories im Midcap-Bereich sei. Actelion habe im dritten Quartal 2007 den Umsatz mit "Tracleer" im Jahresvergleich um 22,5% auf 287 Mio. Schweizer Franken (CHF) gesteigert und damit die Analystenschätzung von 290 Mio. CHF knapp verfehlt. Die Analysten würden für das vierte Quartal weiterhin einen Umsatz von 327 Mio. CHF erwarten, die Umsatzprognose für das Gesamtjahr bewege sich mit 1,273 Mrd. CHF am unteren Ende der Unternehmensvorgabe. Die EPS-Schätzungen der Analysten seien für die Fiskaljahre 2007 und 2008 von 2,52 CHF auf 2,65 CHF angehoben bzw. von 2,67 CHF auf 2,57 CHF gesenkt worden, so dass sich nun ein 2007-KGV von 22,8 und ein 2008-KGV von 23,6 errechnen lasse. Das Kursziel der Aktie sehe man bei 70 CHF. Auf dieser Grundlage lautet das Rating der Börsenanalysten von J.P. Morgan Securities für das Wertpapier von Actelion "overweight". (Analyse vom 19.10.07) (19.10.2007/ac/a/a)
Quelle: AKTIENCHECK.DE
Eigentlich sollte man jetzt langsam nachkaufen
22.10.2007 14:25:54
Actelion zugreifen
Endingen (aktiencheck.de AG) - Anleger sollen die derzeit günstigen Kurse bei der Actelion-Aktie (ISIN CH0010532478/ WKN 936767) nutzen, raten die Experten von "Global Biotech Investing". Nach Meinung der Experten könnte der Biotech-Gesellschaft aus der Schweiz mit dem Schlafmittel Almorexxant der endgültige Durchbruch gelingen. So seien die jüngsten Ergebnisse von abschließenden Phase II-Tests sehr gut ausgefallen. Die ersten Phase III-Tests wolle man noch in diesem Jahr beginnen. Beobachter würden dem Präparat Blockbusterpotenzial zutrauen. Nach Einschätzung der Experten könnte Almorexxant 2012 auf den Markt kommen. Die Geschäftsführung von Actelion habe erst kürzlich die Guidance für das laufende Geschäftsjahr 2007 erhöht. So würden nun ein Umsatz von 768 bis 792 Mio. Euro und ein Cash-EBIT von 259 bis 277 Mio. Euro in Aussicht gestellt. Des Weiteren habe das Unternehmen noch weitere Produkte in Phase II und III der klinischen Tests, die teilweise ebenfalls über Blockbusterpotenzial verfügen würden. Mit Tracleer habe Actelion sogar bereits ein Produkt am Markt lanciert. Zwar sei der Umsatz von Tracleer um 33% auf 243 Mio. USD gestiegen, jedoch hätten Analysten mit einem höheren Wachstum gerechnet. Daher sei der Titel zuletzt um rund 15% auf 35 Euro gefallen. Anleger sollen die derzeit günstigen Kurse bei der Actelion-Aktie nutzen, raten die Experten von "Global Biotech Investing". (Ausgabe 20 vom 22.10.2007) (22.10.2007/ac/a/a)
Quelle: AKTIENCHECK.DE
Meine Rede
Actelion zugreifen
Endingen (aktiencheck.de AG) - Anleger sollen die derzeit günstigen Kurse bei der Actelion-Aktie (ISIN CH0010532478/ WKN 936767) nutzen, raten die Experten von "Global Biotech Investing". Nach Meinung der Experten könnte der Biotech-Gesellschaft aus der Schweiz mit dem Schlafmittel Almorexxant der endgültige Durchbruch gelingen. So seien die jüngsten Ergebnisse von abschließenden Phase II-Tests sehr gut ausgefallen. Die ersten Phase III-Tests wolle man noch in diesem Jahr beginnen. Beobachter würden dem Präparat Blockbusterpotenzial zutrauen. Nach Einschätzung der Experten könnte Almorexxant 2012 auf den Markt kommen. Die Geschäftsführung von Actelion habe erst kürzlich die Guidance für das laufende Geschäftsjahr 2007 erhöht. So würden nun ein Umsatz von 768 bis 792 Mio. Euro und ein Cash-EBIT von 259 bis 277 Mio. Euro in Aussicht gestellt. Des Weiteren habe das Unternehmen noch weitere Produkte in Phase II und III der klinischen Tests, die teilweise ebenfalls über Blockbusterpotenzial verfügen würden. Mit Tracleer habe Actelion sogar bereits ein Produkt am Markt lanciert. Zwar sei der Umsatz von Tracleer um 33% auf 243 Mio. USD gestiegen, jedoch hätten Analysten mit einem höheren Wachstum gerechnet. Daher sei der Titel zuletzt um rund 15% auf 35 Euro gefallen. Anleger sollen die derzeit günstigen Kurse bei der Actelion-Aktie nutzen, raten die Experten von "Global Biotech Investing". (Ausgabe 20 vom 22.10.2007) (22.10.2007/ac/a/a)
Quelle: AKTIENCHECK.DE
Meine Rede

Tracleer(R) Shows Clinical Benefit as Combination Therapy with Sildenafil for Pulmonary Arterial Hypertension
- Studies Show Improvement in Hemodynamics and Delay Disease Progression -
CHICAGO, Oct. 23 /PRNewswire/ -- Actelion Pharmaceuticals US, Inc. today announced positive results from two trials demonstrating that Tracleer(R) (bosentan) may be safe and effective as a combination therapy for the treatment of pulmonary arterial hypertension (PAH). Data from both studies suggest that Tracleer, when given in combination with sildenafil, is well-tolerated and improves hemodynamics in PAH patients. The data were presented at CHEST 2007, the annual meeting of the American College of Chest Physicians, taking place in Chicago.
COMPASS-1 (Effects of Combination Of bosentan and sildenafil versus sildenafil Monotherapy on morbidity and mortality in symptomatic PAtientS with pulmonary arterial hypertenSion) was the first clinical trial to provide detailed hemodynamic information on the combination of Tracleer and sildenafil, and showed that the combination of acute oral sildenafil together with long-term Tracleer therapy significantly reduced pulmonary vascular resistance (PVR).
Data from the sildenafil cohort of the Phase 3 EARLY (Endothelin Antagonist tRial in miLdlY symptomatic PAH patients) study showed that Tracleer improved hemodynamics and suggested a delay in disease progression in sildenafil-treated mildly symptomatic PAH patients. The EARLY trial was the first study of its kind to evaluate the benefit of Tracleer and sildenafil combination therapy.
"Despite the availability of effective PAH therapies, we are not meeting key treatment goals for long-term stabilization in the majority of patients," said Nazzareno Galie from the University of Bologna, Italy, also the lead author of the COMPASS-1 study. "Given the progressive and destructive nature of this disease, combining therapies with different modes of action has become an important focus for research, and these results support our belief that adding bosentan to sildenafil could potentially slow disease progression."
"The results of the COMPASS-1 and EARLY studies demonstrate that Tracleer, when used alone or in combination with other therapies, appears to be well-tolerated and an effective treatment option for patients with PAH," said Craig Hopkinson, vice president of U.S. medical at Actelion. "Actelion is committed to conducting studies with Tracleer in combination with other approved therapies in order to evaluate the drug's effect in a combination therapy setting on delaying disease progression and improving patient care."
COMPASS-1 Study Details and Results
The COMPASS-1 trial assessed the acute hemodynamic effects of sildenafil in combination therapy with Tracleer. The open-label, uncontrolled, prospective, multicenter study evaluated 45 patients receiving Tracleer and measured PVR with the addition of inhaled nitric oxide (iNO) and a single 25mg dose of sildenafil.
The % change in PVR induced by iNO and sildenafil was similar. Sildenafil lowered mean PVR by 15.1% from 828+/-724 to 721+/-651 dyne.s.cm-5 60 minutes after intake (p<0.0001). iNO was shown to reduce mean PVR by 14.9% from 807+/-635 to 745+/-740 dyne.s.cm-5 after inhalation (p<0.0001).
EARLY Study Details and Results
The EARLY trial evaluated the safety and efficacy of Tracleer in mildly symptomatic (WHO Functional Class II) PAH patients. This randomized, double-blind, placebo-controlled trial (n=185) assessed the efficacy of Tracleer as a monotherapy and as a combination therapy in patients receiving background sildenafil treatment (n=29).
Mean baseline PVR was higher in patients receiving sildenafil than in patients not taking sildenafil; and six-minute walk distances were similar at baseline. At six months, patients treated with Tracleer (in sildenafil and non-sildenafil subgroups) both saw a reduction in PVR (-20%, P=0.0478 sildenafil; -23%, P<0.0001 no sildenafil).
Data from the trial also suggest that Tracleer is effective in early stage PAH patients as a monotherapy.
About Tracleer(R) in Pulmonary Arterial Hypertension (PAH)
Tracleer(R) (bosentan), the first oral dual endothelin receptor antagonist, is approved for the treatment of pulmonary arterial hypertension (PAH) and made available by Actelion Ltd. subsidiaries in the United States, the European Union, Japan, Australia, Canada, Switzerland and other markets worldwide.
Tracleer requires attention to two significant safety concerns: potential for serious liver injury (including rare cases of liver failure and unexplained hepatic cirrhosis in a setting of close monitoring) and high potential for major birth defects. Liver monitoring of all patients is essential prior to initiation of treatment and monthly thereafter. Pregnancy must be excluded and prevented by two forms of birth control; monthly pregnancy tests should be obtained. Because of these risks, Tracleer is only supplied through a controlled distribution system.
About Actelion Pharmaceuticals
Actelion Pharmaceuticals has pioneered research and development in the pulmonary arterial hypertension (PAH) disease area. More than 40,000 PAH patients have been prescribed Actelion's product Tracleer(R) (bosentan), an orally available dual endothelin receptor antagonist for patients with World Health Organization (WHO) Class III or IV PAH in the U.S., and Class III PAH in Europe. Tracleer was approved in 2001 as the first oral treatment for PAH, and is currently approved in the U.S., the European Union, and other markets worldwide. In January 2007, Actelion acquired CoTherix, Inc., whose product Ventavis(R) (iloprost) Inhalation Solution is approved and marketed in the United States for the treatment of patients with WHO Class III or IV PAH.
- Studies Show Improvement in Hemodynamics and Delay Disease Progression -
CHICAGO, Oct. 23 /PRNewswire/ -- Actelion Pharmaceuticals US, Inc. today announced positive results from two trials demonstrating that Tracleer(R) (bosentan) may be safe and effective as a combination therapy for the treatment of pulmonary arterial hypertension (PAH). Data from both studies suggest that Tracleer, when given in combination with sildenafil, is well-tolerated and improves hemodynamics in PAH patients. The data were presented at CHEST 2007, the annual meeting of the American College of Chest Physicians, taking place in Chicago.
COMPASS-1 (Effects of Combination Of bosentan and sildenafil versus sildenafil Monotherapy on morbidity and mortality in symptomatic PAtientS with pulmonary arterial hypertenSion) was the first clinical trial to provide detailed hemodynamic information on the combination of Tracleer and sildenafil, and showed that the combination of acute oral sildenafil together with long-term Tracleer therapy significantly reduced pulmonary vascular resistance (PVR).
Data from the sildenafil cohort of the Phase 3 EARLY (Endothelin Antagonist tRial in miLdlY symptomatic PAH patients) study showed that Tracleer improved hemodynamics and suggested a delay in disease progression in sildenafil-treated mildly symptomatic PAH patients. The EARLY trial was the first study of its kind to evaluate the benefit of Tracleer and sildenafil combination therapy.
"Despite the availability of effective PAH therapies, we are not meeting key treatment goals for long-term stabilization in the majority of patients," said Nazzareno Galie from the University of Bologna, Italy, also the lead author of the COMPASS-1 study. "Given the progressive and destructive nature of this disease, combining therapies with different modes of action has become an important focus for research, and these results support our belief that adding bosentan to sildenafil could potentially slow disease progression."
"The results of the COMPASS-1 and EARLY studies demonstrate that Tracleer, when used alone or in combination with other therapies, appears to be well-tolerated and an effective treatment option for patients with PAH," said Craig Hopkinson, vice president of U.S. medical at Actelion. "Actelion is committed to conducting studies with Tracleer in combination with other approved therapies in order to evaluate the drug's effect in a combination therapy setting on delaying disease progression and improving patient care."
COMPASS-1 Study Details and Results
The COMPASS-1 trial assessed the acute hemodynamic effects of sildenafil in combination therapy with Tracleer. The open-label, uncontrolled, prospective, multicenter study evaluated 45 patients receiving Tracleer and measured PVR with the addition of inhaled nitric oxide (iNO) and a single 25mg dose of sildenafil.
The % change in PVR induced by iNO and sildenafil was similar. Sildenafil lowered mean PVR by 15.1% from 828+/-724 to 721+/-651 dyne.s.cm-5 60 minutes after intake (p<0.0001). iNO was shown to reduce mean PVR by 14.9% from 807+/-635 to 745+/-740 dyne.s.cm-5 after inhalation (p<0.0001).
EARLY Study Details and Results
The EARLY trial evaluated the safety and efficacy of Tracleer in mildly symptomatic (WHO Functional Class II) PAH patients. This randomized, double-blind, placebo-controlled trial (n=185) assessed the efficacy of Tracleer as a monotherapy and as a combination therapy in patients receiving background sildenafil treatment (n=29).
Mean baseline PVR was higher in patients receiving sildenafil than in patients not taking sildenafil; and six-minute walk distances were similar at baseline. At six months, patients treated with Tracleer (in sildenafil and non-sildenafil subgroups) both saw a reduction in PVR (-20%, P=0.0478 sildenafil; -23%, P<0.0001 no sildenafil).
Data from the trial also suggest that Tracleer is effective in early stage PAH patients as a monotherapy.
About Tracleer(R) in Pulmonary Arterial Hypertension (PAH)
Tracleer(R) (bosentan), the first oral dual endothelin receptor antagonist, is approved for the treatment of pulmonary arterial hypertension (PAH) and made available by Actelion Ltd. subsidiaries in the United States, the European Union, Japan, Australia, Canada, Switzerland and other markets worldwide.
Tracleer requires attention to two significant safety concerns: potential for serious liver injury (including rare cases of liver failure and unexplained hepatic cirrhosis in a setting of close monitoring) and high potential for major birth defects. Liver monitoring of all patients is essential prior to initiation of treatment and monthly thereafter. Pregnancy must be excluded and prevented by two forms of birth control; monthly pregnancy tests should be obtained. Because of these risks, Tracleer is only supplied through a controlled distribution system.
About Actelion Pharmaceuticals
Actelion Pharmaceuticals has pioneered research and development in the pulmonary arterial hypertension (PAH) disease area. More than 40,000 PAH patients have been prescribed Actelion's product Tracleer(R) (bosentan), an orally available dual endothelin receptor antagonist for patients with World Health Organization (WHO) Class III or IV PAH in the U.S., and Class III PAH in Europe. Tracleer was approved in 2001 as the first oral treatment for PAH, and is currently approved in the U.S., the European Union, and other markets worldwide. In January 2007, Actelion acquired CoTherix, Inc., whose product Ventavis(R) (iloprost) Inhalation Solution is approved and marketed in the United States for the treatment of patients with WHO Class III or IV PAH.
Antwort auf Beitrag Nr.: 32.128.607 von 11up am 24.10.07 08:20:22Das ist eine wirklich wichtige Studie.
Mit diesem Ergebnis ist nun Sildenafil kein Konkurenzproduckt mehr.
Ärzte die Sildenafil verschreiben weden gleichzeitig auch Tracleer verschreiben und umgekehrt.
Mit diesem Ergebnis ist nun Sildenafil kein Konkurenzproduckt mehr.
Ärzte die Sildenafil verschreiben weden gleichzeitig auch Tracleer verschreiben und umgekehrt.
Antwort auf Beitrag Nr.: 32.128.697 von 11up am 24.10.07 08:34:56und vor allem sind das absolute nachlegekurse.

nachlegekurs 31,95 - günstiger wirds wohl nicht mehr gehen.
das sind schnäppchenpreise.
das sind schnäppchenpreise.

Antwort auf Beitrag Nr.: 32.145.287 von heilixblechle am 25.10.07 11:47:48total überverkauft der Wert!
Und vor allem aktuell von den Analos runtergepusht, um selber wieder billiger einsteigen zu können, um die Attie dann etwas später wieder hochzujubeln!!
Und vor allem aktuell von den Analos runtergepusht, um selber wieder billiger einsteigen zu können, um die Attie dann etwas später wieder hochzujubeln!!

Antwort auf Beitrag Nr.: 32.149.998 von Fruehrentner am 25.10.07 16:35:15so sieht das aus.....
zeitpunkt zum ausstieg verpasst, oder warum bist du angesäuert?
egal - so oder so - das ding kommt wieder in andere regionen.
bis mai schätze ich über 50 oiro. zurücklehnen und abwarten.
zeitpunkt zum ausstieg verpasst, oder warum bist du angesäuert?
egal - so oder so - das ding kommt wieder in andere regionen.
bis mai schätze ich über 50 oiro. zurücklehnen und abwarten.

Antwort auf Beitrag Nr.: 32.150.090 von heilixblechle am 25.10.07 16:40:42Die meisten Leute steigen zu früh aus wenn eine Aktie steigt und bleiben zu lange investiert wenn eine Aktie fällt.
Diese Erkenntnis wurde mal mit einem Nobelpreis bedacht.
Hoffe mal dass ich nicht zu denjenigen gehöre die zu lange investiert bleiben wenn eine Aktie fällt.
Diese Erkenntnis wurde mal mit einem Nobelpreis bedacht.
Hoffe mal dass ich nicht zu denjenigen gehöre die zu lange investiert bleiben wenn eine Aktie fällt.
heute geht's mal up! Wurde auch Zeit.
Traue den Analos nicht, die reihenweise den Wert abgestuft haben - reines Eigeninteresse unterstelle ich denen hier! Nur meine Meinung.
Traue den Analos nicht, die reihenweise den Wert abgestuft haben - reines Eigeninteresse unterstelle ich denen hier! Nur meine Meinung.
Ich habe mir am Freitag meine kleine Position verdoppelt. Dabei bleibt es aber dann auch. Ich gehe davon aus, daß wir für das Q4 wieder bessere Zahlen sehen. Die Pipeline finde ich auch attraktiv. Letztlich dürfte der niedrigere Kurs das Unternehmen auch wieder interessanter für Übernahmen werden lassen - big Pharma benötigt ja offenbar dringend frisches Blut. Übrigens war Actelion zum 30.09. mit knapp 25% wieder der größte Posten im BB Biotech Portfolio.
Gruß, Dackelbert.
Gruß, Dackelbert.
Und nun?
Immer noch starker Verkaufsdruck..heute Sk 50,8 CHF -1,6%
Das Konkurrenzprodukt von Tracleer scheint Käufer abzuschrecken..
Hoffentlich gibts morgen mal Grün oder wenigstens die 50 CHF halten..
sonst
Immer noch starker Verkaufsdruck..heute Sk 50,8 CHF -1,6%
Das Konkurrenzprodukt von Tracleer scheint Käufer abzuschrecken..
Hoffentlich gibts morgen mal Grün oder wenigstens die 50 CHF halten..
sonst

Allschwil. sda/reuters/baz. Die Allschwiler Biotech-Firma Actelion hat im Rahmen einer Forschungszusammenarbeit mit dem US-Pharmakonzern Merck & Co. einen Erfolg verbucht. Sie erhält dafür 10 Mio. Dollar als so genannte Meilensteinzahlung.
Konkret wurde bei der Erforschung von Renin-Inhibitoren das vierte Etappenziel erreicht, wie Actelion am Mittwoch mitteilte.
Die gemeinsame Forschung habe im Rahmen des Phase-II-Programms mit den Dosierungsstudien für ihre erste gemeinsame Substanz, einen neuartigen Renin-Inhibitor, begonnen, hiess es. Die Actelion-Aktien schlossen am Mittwoch knapp 4 Prozent im Plus.
Konkret wurde bei der Erforschung von Renin-Inhibitoren das vierte Etappenziel erreicht, wie Actelion am Mittwoch mitteilte.
Die gemeinsame Forschung habe im Rahmen des Phase-II-Programms mit den Dosierungsstudien für ihre erste gemeinsame Substanz, einen neuartigen Renin-Inhibitor, begonnen, hiess es. Die Actelion-Aktien schlossen am Mittwoch knapp 4 Prozent im Plus.
Antwort auf Beitrag Nr.: 32.397.271 von Matze900 am 12.11.07 19:03:47mein kursziel ist 50 oironen - bis mitte nächstes jahr.
die company ist bestens aufgestellt und ich denke, da ist noch mehr in der pipeline......
die company ist bestens aufgestellt und ich denke, da ist noch mehr in der pipeline......

Aber der richtige Knaller schlummert ja noch: der Schlafmittelkandidat, der sich zZt in der klin. Phase II befindet.
Leider konnte ich nicht finden, wann die nächsten News zum Stand der klin. Entwicklung hierzu anstehen.
Ich denke im kommenden Frühjahr, oder?
Leider konnte ich nicht finden, wann die nächsten News zum Stand der klin. Entwicklung hierzu anstehen.
Ich denke im kommenden Frühjahr, oder?
Antwort auf Beitrag Nr.: 32.679.499 von Fruehrentner am 06.12.07 08:45:08aus einem anderen board:
Wenn Almorexant es zur Pille gegen Schlaflosigkeit schafft, dann ginge die Aktie nach dem Verkaufsstart des Medikaments gegen 500 CHF! Der Schlafpillenmarkt ist global riesig. Wenn statt Benzos (Beruhigungsmitteln) ein Wachheitshemmer verabreicht werden könnte, würde er den gesamten bisherigen Schlafpillen-Markt verdrängen, und auch einen grossen Teil der Antidepressiva. Mit Almorexant hätte man einen Schlaf mit normalen Tiefschlafphasen, REM, Träumen. Damit seelische Ausgeglichenheit, im Gegensatz zu Benzos, mit denen die Schlafgeplagten zwar nachts Ruhe haben, aber zu Tagwandlern werden ...
Wenn Almorexant es zur Pille gegen Schlaflosigkeit schafft, dann ginge die Aktie nach dem Verkaufsstart des Medikaments gegen 500 CHF! Der Schlafpillenmarkt ist global riesig. Wenn statt Benzos (Beruhigungsmitteln) ein Wachheitshemmer verabreicht werden könnte, würde er den gesamten bisherigen Schlafpillen-Markt verdrängen, und auch einen grossen Teil der Antidepressiva. Mit Almorexant hätte man einen Schlaf mit normalen Tiefschlafphasen, REM, Träumen. Damit seelische Ausgeglichenheit, im Gegensatz zu Benzos, mit denen die Schlafgeplagten zwar nachts Ruhe haben, aber zu Tagwandlern werden ...
05-12-2007 17:43
Actelion erhält von Merck Meilensteinzahlung von 10 Mio USD
Allschwil (AWP) - Der Pharmakonzern Actelion Ltd hat vom amerikanischen Branchenriesen Merck & Co eine Meilensteinzahlung von 10 Mio USD erhalten. Die Zahlung wurde ausgelöst, weil die Forschungsallianz mit Renin-Inhibitoren ihr viertes Etappenziel erreicht hat. Die Allianz hat laut Medienmitteilung von Actelion im Rahmen des Phase-II-Programms mit den Dosierungsstudien für ihre erste gemeinsame Substanz begonnen.
Actelion und Merck waren im Dezember 2003 eine weltweite Allianz eingegangen, um zur Behandlung kardio-renaler Erkrankungen neue Klassen von oral verfügbaren Renin-Inhibitoren zu entdecken, zu entwickeln und zu vermarkten.
ra/ch
Actelion erhält von Merck Meilensteinzahlung von 10 Mio USD
Allschwil (AWP) - Der Pharmakonzern Actelion Ltd hat vom amerikanischen Branchenriesen Merck & Co eine Meilensteinzahlung von 10 Mio USD erhalten. Die Zahlung wurde ausgelöst, weil die Forschungsallianz mit Renin-Inhibitoren ihr viertes Etappenziel erreicht hat. Die Allianz hat laut Medienmitteilung von Actelion im Rahmen des Phase-II-Programms mit den Dosierungsstudien für ihre erste gemeinsame Substanz begonnen.
Actelion und Merck waren im Dezember 2003 eine weltweite Allianz eingegangen, um zur Behandlung kardio-renaler Erkrankungen neue Klassen von oral verfügbaren Renin-Inhibitoren zu entdecken, zu entwickeln und zu vermarkten.
ra/ch
Antwort auf Beitrag Nr.: 32.679.576 von Fruehrentner am 06.12.07 08:53:05zur Erinnerung die letzten News zum Schlafmittelkandidaten:
Neue Daten zu Orexin-Rezeptor-Antagonist Almorexant zeigen therapeutisches Potenzial für Behandlung von Schlafstörungen
04.09.2007 - Actelion Ltd (SWX: ATLN) gab die Ergebnisse seiner Proof-of-Concept-/Dosisfindungsstudie1 zur Wirksamkeit des ersten Orexin-Rezeptor-Antagonisten Almorexant bekannt, an der 147 Patienten mit primärer Insomnie beteiligt waren. Die Studienresultate belegen, dass Almorexant den primären Studienendpunkt Schlafeffizienz (die Zeit, die gemäss polysomnographischer (PSG) Aufzeichnungen während 8 Stunden nachts schlafend im Bett verbracht wird) in Abhängigkeit von der Dosierung ( 400 mg, 200 mg und 100 mg) signifikant verbessert.
Die Analyse der sekundären und exploratorischen Endpunkte, auf deren statistische Relevanz die Studie von der Stichprobengrösse nicht ausgelegt war, weist ausserdem darauf hin, dass Almorexant wichtige, mittels PSG erhobene Schlafparameter in klinisch relevanter Weise verbessert. Je nach Dosierung verringerte Almorexant die Latenzzeit bis zum durchgehenden Schlaf (Latency to Persistent Sleep - LPS; signifikantes Ergebnis bei 400 mg) und die Zeit bis zum Aufwachen nach Einsetzen des Schlafs (Wake after Sleep Onset - WASO; signifikante Resultate bei 400 mg, 200 mg und 100 mg).
Ebenfalls in Abhängigkeit der Dosisstärke erhöhte sich unter Almorexant der prozentuale Anteil der Zeit, der im REM-Schlaf (Rapid-Eye-Movement - rasche Augenbewegung) verbracht wurde oder blieb stabil. Gleichzeitig verbesserte Almorexant signifikant die entsprechenden subjektiven Schlafparameter.
Nach Gabe von Almorexant waren im Rahmen von Tests zur Bestimmung der Feinmotorik und der durchschnittlichen Reaktionszeit keine nennenswerten negativen Wirkungen in Bezug auf die Leistungsfähigkeit am folgenden Tag festzustellen.
Studienleiter Dr. Jasper Dingemanse, Leiter der Klinischen Pharmakologie bei Actelion, kommentierte: "Diese Ergebnisse bestätigen, dass das hochspezifische Orexin-System eine Schlüsselrolle bei der Kontrolle des Schlaf-Wach-Zyklus spielt. Die vorliegenden Daten weisen darauf hin, das Almorexant das Ein- und Durchschlafen von Insomnie-Patienten begünstigt, ohne dabei sedierend zu wirken oder die Leistungsfähigkeit am darauffolgenden Tag zu beeinträchtigen, wie dies häufig im Zusammenhang mit traditionellen, auf Benzodiazepin-Rezeptoren zugeschnittenen Schlafmitteln beobachtet wird."
http://www.bionity.com/news/d/68926/
Neue Daten zu Orexin-Rezeptor-Antagonist Almorexant zeigen therapeutisches Potenzial für Behandlung von Schlafstörungen
04.09.2007 - Actelion Ltd (SWX: ATLN) gab die Ergebnisse seiner Proof-of-Concept-/Dosisfindungsstudie1 zur Wirksamkeit des ersten Orexin-Rezeptor-Antagonisten Almorexant bekannt, an der 147 Patienten mit primärer Insomnie beteiligt waren. Die Studienresultate belegen, dass Almorexant den primären Studienendpunkt Schlafeffizienz (die Zeit, die gemäss polysomnographischer (PSG) Aufzeichnungen während 8 Stunden nachts schlafend im Bett verbracht wird) in Abhängigkeit von der Dosierung ( 400 mg, 200 mg und 100 mg) signifikant verbessert.
Die Analyse der sekundären und exploratorischen Endpunkte, auf deren statistische Relevanz die Studie von der Stichprobengrösse nicht ausgelegt war, weist ausserdem darauf hin, dass Almorexant wichtige, mittels PSG erhobene Schlafparameter in klinisch relevanter Weise verbessert. Je nach Dosierung verringerte Almorexant die Latenzzeit bis zum durchgehenden Schlaf (Latency to Persistent Sleep - LPS; signifikantes Ergebnis bei 400 mg) und die Zeit bis zum Aufwachen nach Einsetzen des Schlafs (Wake after Sleep Onset - WASO; signifikante Resultate bei 400 mg, 200 mg und 100 mg).
Ebenfalls in Abhängigkeit der Dosisstärke erhöhte sich unter Almorexant der prozentuale Anteil der Zeit, der im REM-Schlaf (Rapid-Eye-Movement - rasche Augenbewegung) verbracht wurde oder blieb stabil. Gleichzeitig verbesserte Almorexant signifikant die entsprechenden subjektiven Schlafparameter.
Nach Gabe von Almorexant waren im Rahmen von Tests zur Bestimmung der Feinmotorik und der durchschnittlichen Reaktionszeit keine nennenswerten negativen Wirkungen in Bezug auf die Leistungsfähigkeit am folgenden Tag festzustellen.
Studienleiter Dr. Jasper Dingemanse, Leiter der Klinischen Pharmakologie bei Actelion, kommentierte: "Diese Ergebnisse bestätigen, dass das hochspezifische Orexin-System eine Schlüsselrolle bei der Kontrolle des Schlaf-Wach-Zyklus spielt. Die vorliegenden Daten weisen darauf hin, das Almorexant das Ein- und Durchschlafen von Insomnie-Patienten begünstigt, ohne dabei sedierend zu wirken oder die Leistungsfähigkeit am darauffolgenden Tag zu beeinträchtigen, wie dies häufig im Zusammenhang mit traditionellen, auf Benzodiazepin-Rezeptoren zugeschnittenen Schlafmitteln beobachtet wird."
http://www.bionity.com/news/d/68926/
Antwort auf Beitrag Nr.: 32.679.499 von Fruehrentner am 06.12.07 08:45:08hier ist die Antwort:
Neuartiges Medikament
Almorexant gehört einer völlig neuartigen Generation von Schlafmitteln an. Es beeinflusst die Orexin-Proteine, die eine wichtige Rolle bei der Kontrolle des Schlaf-Wach-Zyklus spielen. Die jüngsten Ergebnisse der abschließenden Phase- II-Tests fielen äußerst vielversprechend aus. So zeigte sich, dass das Medikament den primären Studienendpunkt Schlafeffizienz signifikant verbessert. Außerdem erhöhte sich der prozentuale Anteil, der im REM-Schlaf (Rapid- Eye-Movement – rasche Augenbewegung) verbracht wird. Experten gehen davon aus, dass diese Phase von enormer Bedeutung für die Gedächtnisfunktion ist. Noch in diesem Jahr sollen erste Phase-III-Tests begonnen werden. Läuft alles nach Plan, dürfte das Medikament, dem Blockbuster-Qualitäten zugebilligt werden, im Jahr 2012 auf den Markt kommen. Actelion hat aber noch zahlreiche weitere Produktkandidaten in Phase III und II, einige davon werden ebenfalls als Blockbuster-Kandidaten gehandelt. Somit dürfte das Unternehmen gut gerüstet sein, die Konkurrenz in Schach zu halten. Positiv zu werten ist außerdem die Genehmigung des Hauptumsatzträgers Tracleer für weitere Indikationen in der EU und der Schweiz, was den Druck durch das in diesem Jahr zugelassene Konkurrenzmittel Letairis von Gilead kompensieren dürfte. Aufgrund des außerordentlich guten Geschäftsverlaufs in den ersten sechs Monaten erhöhte Actelion zuletzt seine Prognosen für das Gesamtjahr. Demnach erwartet das Unternehmen Umsätze zwischen umgerechnet 768 und 792 Millionen Euro sowie ein Cash-EBIT im Bereich von 259 bis 277 Millionen Euro.
http://www.deraktionaer.de/xist4c/web/Mehrere-Eisen-im-Feuer…
Neuartiges Medikament
Almorexant gehört einer völlig neuartigen Generation von Schlafmitteln an. Es beeinflusst die Orexin-Proteine, die eine wichtige Rolle bei der Kontrolle des Schlaf-Wach-Zyklus spielen. Die jüngsten Ergebnisse der abschließenden Phase- II-Tests fielen äußerst vielversprechend aus. So zeigte sich, dass das Medikament den primären Studienendpunkt Schlafeffizienz signifikant verbessert. Außerdem erhöhte sich der prozentuale Anteil, der im REM-Schlaf (Rapid- Eye-Movement – rasche Augenbewegung) verbracht wird. Experten gehen davon aus, dass diese Phase von enormer Bedeutung für die Gedächtnisfunktion ist. Noch in diesem Jahr sollen erste Phase-III-Tests begonnen werden. Läuft alles nach Plan, dürfte das Medikament, dem Blockbuster-Qualitäten zugebilligt werden, im Jahr 2012 auf den Markt kommen. Actelion hat aber noch zahlreiche weitere Produktkandidaten in Phase III und II, einige davon werden ebenfalls als Blockbuster-Kandidaten gehandelt. Somit dürfte das Unternehmen gut gerüstet sein, die Konkurrenz in Schach zu halten. Positiv zu werten ist außerdem die Genehmigung des Hauptumsatzträgers Tracleer für weitere Indikationen in der EU und der Schweiz, was den Druck durch das in diesem Jahr zugelassene Konkurrenzmittel Letairis von Gilead kompensieren dürfte. Aufgrund des außerordentlich guten Geschäftsverlaufs in den ersten sechs Monaten erhöhte Actelion zuletzt seine Prognosen für das Gesamtjahr. Demnach erwartet das Unternehmen Umsätze zwischen umgerechnet 768 und 792 Millionen Euro sowie ein Cash-EBIT im Bereich von 259 bis 277 Millionen Euro.
http://www.deraktionaer.de/xist4c/web/Mehrere-Eisen-im-Feuer…
Actelion Provides Update On Bosentan in Metastatic Melanoma
ALLSCHWIL, Switzerland, Dec. 17, 2007 (PRIME NEWSWIRE) -- Actelion Ltd (SWX:ATLN) announced today that preliminary efficacy data generated in the proof-of-concept study evaluating bosentan (500mg bid) in the indication metastatic melanoma (stage 4) do not support the initiation of a full clinical development program in this indication. The observed safety profile was consistent with earlier findings in clinical studies that led to the approval of bosentan (Tracleer(r) 125mg bid) in pulmonary arterial hypertension (PAH).
The company will fully analyze the data generated in this study with close to 90 patients and discuss the detailed findings with key medical experts in the field. The company will also continue to evaluate the potential use of endothelin receptor antagonism in pre-clinical cancer models.
Actelion Ltd
Actelion Ltd is a biopharmaceutical company with its corporate headquarters in Allschwil/Basel, Switzerland. Actelion's first drug Tracleer(r), an orally available dual endothelin receptor antagonist, has been approved as a therapy for pulmonary arterial hypertension. Actelion markets Tracleer(r) through its own subsidiaries in key markets worldwide, including the United States (based in South San Francisco), the European Union, Japan, Canada, Australia and Switzerland. At the end of September 2006, Tracleer(r) was commercially available in 35 countries worldwide. Actelion, founded in late 1997, is a leading player in innovative science related to the endothelium -- the single layer of cells separating every blood vessel from the blood stream. Actelion's over 1,500 employees focus on the discovery, development and marketing of innovative drugs for significant unmet medical needs. Actelion shares are traded on the SWX Swiss Exchange (ticker symbol: ATLN).
ALLSCHWIL, Switzerland, Dec. 17, 2007 (PRIME NEWSWIRE) -- Actelion Ltd (SWX:ATLN) announced today that preliminary efficacy data generated in the proof-of-concept study evaluating bosentan (500mg bid) in the indication metastatic melanoma (stage 4) do not support the initiation of a full clinical development program in this indication. The observed safety profile was consistent with earlier findings in clinical studies that led to the approval of bosentan (Tracleer(r) 125mg bid) in pulmonary arterial hypertension (PAH).
The company will fully analyze the data generated in this study with close to 90 patients and discuss the detailed findings with key medical experts in the field. The company will also continue to evaluate the potential use of endothelin receptor antagonism in pre-clinical cancer models.
Actelion Ltd
Actelion Ltd is a biopharmaceutical company with its corporate headquarters in Allschwil/Basel, Switzerland. Actelion's first drug Tracleer(r), an orally available dual endothelin receptor antagonist, has been approved as a therapy for pulmonary arterial hypertension. Actelion markets Tracleer(r) through its own subsidiaries in key markets worldwide, including the United States (based in South San Francisco), the European Union, Japan, Canada, Australia and Switzerland. At the end of September 2006, Tracleer(r) was commercially available in 35 countries worldwide. Actelion, founded in late 1997, is a leading player in innovative science related to the endothelium -- the single layer of cells separating every blood vessel from the blood stream. Actelion's over 1,500 employees focus on the discovery, development and marketing of innovative drugs for significant unmet medical needs. Actelion shares are traded on the SWX Swiss Exchange (ticker symbol: ATLN).
Allschwil. ap/baz. Der Baselbieter Biopharmakonzern Actelion verzichtet auf ein umfassendes klinisches Entwicklungsprogramm für eine erweiterte Anwendung seines Medikaments Bosentan. Die vorläufigen Daten einer Studie zur Wirksamkeit von Bosentan bei metastatischem Melanom rechtfertigen laut dem Konzern ein solches Programm nicht. Die Daten der Studie mit gegen 90 Patienten sollen aber detailliert analysiert werden.
Actelion nimmt Phase-III-Studie mit Actelion-1 auf
19.12 18:31
Allschwil (AWP) - Das Pharmaunternehmen Actelion Ltd. beginnt mit ihrer Phase-III-Studie Seraphin für ihren gewebespezifischen Endothelin-Rezeptor-Antagonisten (ERA) Actelion-1 (ACT-064992). Mit der Studie solle die Sicherheit und Wirksamkeit von Actelion-1 im Zusammenhang mit einer Verzögerung der Krankheitsprogression und der Mortalität bei Patienten mit pulmonaler arterieller Hypertonie (PAH) untersucht werden, teilt Actelion am Mittwoch mit.
Seraphin ist eine globale Studie, in die mindestens 180 Prüfzentren und mehr als 500 Patienten einbezogen werden, die in einem Verhältnis 1:1:1 zwei verschiedene Dosierungen von Actelion-1 oder Plazebo erhalten werden.
19.12 18:31
Allschwil (AWP) - Das Pharmaunternehmen Actelion Ltd. beginnt mit ihrer Phase-III-Studie Seraphin für ihren gewebespezifischen Endothelin-Rezeptor-Antagonisten (ERA) Actelion-1 (ACT-064992). Mit der Studie solle die Sicherheit und Wirksamkeit von Actelion-1 im Zusammenhang mit einer Verzögerung der Krankheitsprogression und der Mortalität bei Patienten mit pulmonaler arterieller Hypertonie (PAH) untersucht werden, teilt Actelion am Mittwoch mit.
Seraphin ist eine globale Studie, in die mindestens 180 Prüfzentren und mehr als 500 Patienten einbezogen werden, die in einem Verhältnis 1:1:1 zwei verschiedene Dosierungen von Actelion-1 oder Plazebo erhalten werden.
wann werden die Jahreszahlen veröffentlicht?
Antwort auf Beitrag Nr.: 32.789.526 von Matze900 am 17.12.07 11:55:41Würde mich nicht wundern wenn irgend wann einmal diese Studien mit Actelion-1 weitergeführt werden. Actelion-1 ist langfristig gesehen wohl die bessere Alternative zu Bosentan. Es ist sicher sinnvoll sich jetzt auf Actelion-1 zu konzentrieren - so wie es ja auch geschieht (siehe Meldung vom 19.12 18:31 - Actelion nimmt Phase-III-Studie mit Actelion-1 auf)
Zum 10 jährigem Geburtstag von Actelion
http://www.actelion.com/UniNet/www/www_main_P.nsf/Content/me…
Glückwünsche, Lob und Anerkennung.
Es ist wirklich toll was in den letzten 10 Jahren erreicht wurde.
Die Erfolge in der Vergangenheit sind ein Zeichen von hervoragenden Leistungen des Managements und der Beschäftigten und das ist natürlich auch der der beste Garant für eine erfolgreiche Zukunkt.
http://www.actelion.com/UniNet/www/www_main_P.nsf/Content/me…
Glückwünsche, Lob und Anerkennung.
Es ist wirklich toll was in den letzten 10 Jahren erreicht wurde.
Die Erfolge in der Vergangenheit sind ein Zeichen von hervoragenden Leistungen des Managements und der Beschäftigten und das ist natürlich auch der der beste Garant für eine erfolgreiche Zukunkt.
hier nochmal die ganze Meldung:
Phase III study initiated with Actelion-1 – Highly potent tissue-targeting endothelin receptor antagonist – Largest study ever in PAH to demonstrate morbidity/mortality benefits
19 Dec 2007
The study is designed to evaluate the safety and efficacy of Actelion-1 in delaying disease progression and mortality in patients with pulmonary arterial hypertension
ALLSCHWIL, Switzerland | December 19, 2007 | Actelion Ltd (SWX: ATLN) announced today the initiation of the phase III study SERAPHIN (Study with an Endothelin Receptor Antagonist in Pulmonary arterial Hypertension to Improve cliNical outcome) for its highly potent, tissue-targeting endothelin receptor antagonist (ERA) Actelion-1 (ACT-064992). The study is designed to evaluate the safety and efficacy of Actelion-1 in delaying disease progression and mortality in patients with pulmonary arterial hypertension (PAH).
Dr. Lewis Rubin, advisor to the SERAPHIN steering committee, commented: ”There has been tremendous progress in the field of pulmonary hypertension over the past ten years. It is exciting to evaluate the potential of a tissue-targeting ERA to further change the course of this devastating disease”.
Isaac Kobrin, MD and Head of Clinical Development, added: “I believe that with Actelion‑1, our highly experienced discovery team has used its twenty years of experience in the field of endothelin science to take ERA therapy to the next level. We appreciate the dedication of the Steering Committee in designing the largest-ever study in PAH with a clearly defined morbidity/mortality endpoint”.
Jean-Paul Clozel, MD and Chief Executive Officer of Actelion, commented: ”Actelion and Tracleer have revolutionized PAH therapy. A large number of supportive studies in many PAH sub-populations, together with a first-in-class educational marketing approach have made Tracleer the cornerstone of therapy in PAH. With Actelion-1, we are renewing our commitment to the PAH community and our dedication to true innovation with the potential to once more transform medicine”.
About SERAPHIN
The SERAPHIN study is a global study and will enroll more than 500 patients from at least 180 centers, randomized 1:1:1 to receive two different doses of Actelion-1 (3 mg and 10 mg once daily) or placebo. The centers represent over 40 countries in North and South America, Europe, Asia Pacific and Africa.
The SERAPHIN study will evaluate the clinical benefit of Actelion-1 through the primary endpoint of morbidity and all-cause mortality in patients with symptomatic PAH.
Dr. Gerald Simonneau, advisor to the SERAPHIN steering committee, commented: “We raise the bar again with SERAPHIN by embarking on a morbidity-mortality trial from the beginning in order to demonstrate the potential of Actelion-1”.
Full evaluation of benefit and risks
In a phase II study in 379 hypertensive patients, ACT-064992 was significantly better than placebo and better than enalapril 24 hrs after drug intake in reducing blood pressure. In this patient population, ACT-064992 was generally well tolerated. The overall frequency of adverse events was similar to those observed in the placebo group. Similar to other endothelin receptor antagonists, ACT-064992 may potentially exhibit known class effects such as a propensity for elevated liver enzymes, which will be monitored in the SERAPHIN study. Additional interaction studies concluded prior to the start of the SERAPHIN study have shown no clinically relevant interaction with warfarin, sildenafil, or ketoconazole.
About Pulmonary Arterial Hypertension (PAH)
Pulmonary arterial hypertension (PAH) is a chronic, life-threatening disorder characterized by abnormally high blood pressure in the arteries between the heart and lungs of an affected individual. The function of the heart and lungs is severely compromised, manifested by a limited exercise capacity, and, ultimately, a reduced life expectancy. Approximately 100,000 people in Europe and the United States are afflicted with either primary or secondary forms of the disease related to conditions or tissue disorders that affect the lungs, such as scleroderma, lupus, HIV/AIDS or congenital heart disease.
PAH is associated with structural changes in both the pulmonary vasculature and the right ventricle. Recent advances [1] in the understanding of the pathogenic factors leading to the pulmonary vascular disease have led to the development of new therapies targeting specific pathways (the prostacyclin pathway; the endothelin pathway; and the nitric oxide pathway) [2]. The available therapies have positive effects in PAH, but they do not provide a cure, and in many patients the disease will progress. PAH remains a serious life-threatening condition [2,3]. Early recognition and an understanding of the selection and timing of therapeutic options remain critical elements in the optimal management of patients with this disorder.
About endothelin and PAH
Endothelin-1 (ET-1), a 21 amino acid-peptide, is one of the most potent vasoconstrictors and mitogens for smooth muscle, and contributes to increased vascular tone and proliferation in pulmonary vasculopathy. There are two distinct receptors for ET-1, endothelin receptor A (ETA) and endothelin receptor B (ETB). The two receptors have unique binding locations and affinities for the endothelin peptide. The ETA receptors are expressed on pulmonary vascular smooth muscle cells, whereas ETB receptors are present both on pulmonary vascular cells and on smooth muscle cells. When activated, the ETA receptor located in pulmonary vascular smooth muscle cells mediates a potent vasoconstrictive response and ETB receptors on endothelial cells mediate vasodilatation via increased production of nitric oxide and prostacyclin. ET-1 is also known to be a potent mitogen, with the ability to induce cell proliferation in vascular smooth muscle cells. It has been shown that both the ETA and ETB mediate the mitogenic action of ET-1. Laboratory and clinical investigations have clearly shown that ET-1 is over-expressed in several forms of pulmonary vascular disease. ET-1 is likely a major player in the vasodilator and vasoconstrictor imbalance, as well as in the abnormal pulmonary vascular remodeling present in the development and progression of PAH.
About Actelion-1
Actelion-1 (ACT-064992) is a tissue-targeting Endothelin Receptor Antagonist that has been discovered in an in-house research program. Through complete blockade of tissular endothelin, Actelion-1 is expected to protect tissue from the damaging effect of elevated endothelin, specifically in the cardiovascular system. In pre-clinical studies, Actelion-1 also exhibited effects suggesting that it maintains the integrity of the vascular wall and improves long-term outcome. Accordingly, Actelion-1 may provide therapeutic benefit in a wide range of cardiovascular indications.
About Tracleer® in Pulmonary Arterial Hypertension (PAH)
Tracleer® (bosentan), the first oral dual endothelin receptor antagonist, is approved for the treatment of pulmonary arterial hypertension (PAH) and made available by Actelion subsidiaries in the United States, the European Union, Japan, Australia, Canada, Switzerland and other markets worldwide.
Requires attention to two significant safety concerns: Potential for serious liver injury (including rare cases of liver failure and unexplained hepatic cirrhosis in a setting of close monitoring) - Liver monitoring of all patients is essential prior to initiation of treatment and monthly thereafter. Tracleer treatment must not be initiated in women of childbearing potential unless they practice reliable contraception and participate in monthly pregnancy testing. Due to these risks, Tracleer is only supplied through a controlled distribution.
References
1. Farber HW; Loscalzo J. Mechanisms of disease: pulmonary arterial hypertension. N. Eng. J. Med. 2004; 351: 1655–65.
2. Humbert M; Sitbon O; Simonneau G. Treatment of pulmonary arterial hypertension. N. Eng. J. Med. 2004; 351: 1425–36.
3. Humbert M; Morrell NW; Archer SL; et al. Cellular and molecular pathobiology of pulmonary arterial hypertension. J. Am. Coll. Cardiol. 2004; 43: Suppl. 12: 13S–24S.
4. Tracleer® SPC.
Actelion Ltd
Actelion Ltd is a biopharmaceutical company with its corporate headquarters in Allschwil/Basel, Switzerland. Actelion's first drug Tracleer®, an orally available dual endothelin receptor antagonist, has been approved as a therapy for pulmonary arterial hypertension. Actelion markets Tracleer® through its own subsidiaries in key markets worldwide, including the United States (based in South San Francisco), the European Union, Japan, Canada, Australia and Switzerland. At the end of September 2006, Tracleer® was commercially available in 35 countries worldwide. Actelion, founded in late 1997, is a leading player in innovative science related to the endothelium – the single layer of cells separating every blood vessel from the blood stream. Actelion’s over 1,500 employees focus on the discovery, development and marketing of innovative drugs for significant unmet medical needs. Actelion shares are traded on the SWX Swiss Exchange (ticker symbol: ATLN).
SOURCE: ACTELION
http://www.pipelinereview.com/content/view/16748/109/
Phase III study initiated with Actelion-1 – Highly potent tissue-targeting endothelin receptor antagonist – Largest study ever in PAH to demonstrate morbidity/mortality benefits
19 Dec 2007
The study is designed to evaluate the safety and efficacy of Actelion-1 in delaying disease progression and mortality in patients with pulmonary arterial hypertension
ALLSCHWIL, Switzerland | December 19, 2007 | Actelion Ltd (SWX: ATLN) announced today the initiation of the phase III study SERAPHIN (Study with an Endothelin Receptor Antagonist in Pulmonary arterial Hypertension to Improve cliNical outcome) for its highly potent, tissue-targeting endothelin receptor antagonist (ERA) Actelion-1 (ACT-064992). The study is designed to evaluate the safety and efficacy of Actelion-1 in delaying disease progression and mortality in patients with pulmonary arterial hypertension (PAH).
Dr. Lewis Rubin, advisor to the SERAPHIN steering committee, commented: ”There has been tremendous progress in the field of pulmonary hypertension over the past ten years. It is exciting to evaluate the potential of a tissue-targeting ERA to further change the course of this devastating disease”.
Isaac Kobrin, MD and Head of Clinical Development, added: “I believe that with Actelion‑1, our highly experienced discovery team has used its twenty years of experience in the field of endothelin science to take ERA therapy to the next level. We appreciate the dedication of the Steering Committee in designing the largest-ever study in PAH with a clearly defined morbidity/mortality endpoint”.
Jean-Paul Clozel, MD and Chief Executive Officer of Actelion, commented: ”Actelion and Tracleer have revolutionized PAH therapy. A large number of supportive studies in many PAH sub-populations, together with a first-in-class educational marketing approach have made Tracleer the cornerstone of therapy in PAH. With Actelion-1, we are renewing our commitment to the PAH community and our dedication to true innovation with the potential to once more transform medicine”.
About SERAPHIN
The SERAPHIN study is a global study and will enroll more than 500 patients from at least 180 centers, randomized 1:1:1 to receive two different doses of Actelion-1 (3 mg and 10 mg once daily) or placebo. The centers represent over 40 countries in North and South America, Europe, Asia Pacific and Africa.
The SERAPHIN study will evaluate the clinical benefit of Actelion-1 through the primary endpoint of morbidity and all-cause mortality in patients with symptomatic PAH.
Dr. Gerald Simonneau, advisor to the SERAPHIN steering committee, commented: “We raise the bar again with SERAPHIN by embarking on a morbidity-mortality trial from the beginning in order to demonstrate the potential of Actelion-1”.
Full evaluation of benefit and risks
In a phase II study in 379 hypertensive patients, ACT-064992 was significantly better than placebo and better than enalapril 24 hrs after drug intake in reducing blood pressure. In this patient population, ACT-064992 was generally well tolerated. The overall frequency of adverse events was similar to those observed in the placebo group. Similar to other endothelin receptor antagonists, ACT-064992 may potentially exhibit known class effects such as a propensity for elevated liver enzymes, which will be monitored in the SERAPHIN study. Additional interaction studies concluded prior to the start of the SERAPHIN study have shown no clinically relevant interaction with warfarin, sildenafil, or ketoconazole.
About Pulmonary Arterial Hypertension (PAH)
Pulmonary arterial hypertension (PAH) is a chronic, life-threatening disorder characterized by abnormally high blood pressure in the arteries between the heart and lungs of an affected individual. The function of the heart and lungs is severely compromised, manifested by a limited exercise capacity, and, ultimately, a reduced life expectancy. Approximately 100,000 people in Europe and the United States are afflicted with either primary or secondary forms of the disease related to conditions or tissue disorders that affect the lungs, such as scleroderma, lupus, HIV/AIDS or congenital heart disease.
PAH is associated with structural changes in both the pulmonary vasculature and the right ventricle. Recent advances [1] in the understanding of the pathogenic factors leading to the pulmonary vascular disease have led to the development of new therapies targeting specific pathways (the prostacyclin pathway; the endothelin pathway; and the nitric oxide pathway) [2]. The available therapies have positive effects in PAH, but they do not provide a cure, and in many patients the disease will progress. PAH remains a serious life-threatening condition [2,3]. Early recognition and an understanding of the selection and timing of therapeutic options remain critical elements in the optimal management of patients with this disorder.
About endothelin and PAH
Endothelin-1 (ET-1), a 21 amino acid-peptide, is one of the most potent vasoconstrictors and mitogens for smooth muscle, and contributes to increased vascular tone and proliferation in pulmonary vasculopathy. There are two distinct receptors for ET-1, endothelin receptor A (ETA) and endothelin receptor B (ETB). The two receptors have unique binding locations and affinities for the endothelin peptide. The ETA receptors are expressed on pulmonary vascular smooth muscle cells, whereas ETB receptors are present both on pulmonary vascular cells and on smooth muscle cells. When activated, the ETA receptor located in pulmonary vascular smooth muscle cells mediates a potent vasoconstrictive response and ETB receptors on endothelial cells mediate vasodilatation via increased production of nitric oxide and prostacyclin. ET-1 is also known to be a potent mitogen, with the ability to induce cell proliferation in vascular smooth muscle cells. It has been shown that both the ETA and ETB mediate the mitogenic action of ET-1. Laboratory and clinical investigations have clearly shown that ET-1 is over-expressed in several forms of pulmonary vascular disease. ET-1 is likely a major player in the vasodilator and vasoconstrictor imbalance, as well as in the abnormal pulmonary vascular remodeling present in the development and progression of PAH.
About Actelion-1
Actelion-1 (ACT-064992) is a tissue-targeting Endothelin Receptor Antagonist that has been discovered in an in-house research program. Through complete blockade of tissular endothelin, Actelion-1 is expected to protect tissue from the damaging effect of elevated endothelin, specifically in the cardiovascular system. In pre-clinical studies, Actelion-1 also exhibited effects suggesting that it maintains the integrity of the vascular wall and improves long-term outcome. Accordingly, Actelion-1 may provide therapeutic benefit in a wide range of cardiovascular indications.
About Tracleer® in Pulmonary Arterial Hypertension (PAH)
Tracleer® (bosentan), the first oral dual endothelin receptor antagonist, is approved for the treatment of pulmonary arterial hypertension (PAH) and made available by Actelion subsidiaries in the United States, the European Union, Japan, Australia, Canada, Switzerland and other markets worldwide.
Requires attention to two significant safety concerns: Potential for serious liver injury (including rare cases of liver failure and unexplained hepatic cirrhosis in a setting of close monitoring) - Liver monitoring of all patients is essential prior to initiation of treatment and monthly thereafter. Tracleer treatment must not be initiated in women of childbearing potential unless they practice reliable contraception and participate in monthly pregnancy testing. Due to these risks, Tracleer is only supplied through a controlled distribution.
References
1. Farber HW; Loscalzo J. Mechanisms of disease: pulmonary arterial hypertension. N. Eng. J. Med. 2004; 351: 1655–65.
2. Humbert M; Sitbon O; Simonneau G. Treatment of pulmonary arterial hypertension. N. Eng. J. Med. 2004; 351: 1425–36.
3. Humbert M; Morrell NW; Archer SL; et al. Cellular and molecular pathobiology of pulmonary arterial hypertension. J. Am. Coll. Cardiol. 2004; 43: Suppl. 12: 13S–24S.
4. Tracleer® SPC.
Actelion Ltd
Actelion Ltd is a biopharmaceutical company with its corporate headquarters in Allschwil/Basel, Switzerland. Actelion's first drug Tracleer®, an orally available dual endothelin receptor antagonist, has been approved as a therapy for pulmonary arterial hypertension. Actelion markets Tracleer® through its own subsidiaries in key markets worldwide, including the United States (based in South San Francisco), the European Union, Japan, Canada, Australia and Switzerland. At the end of September 2006, Tracleer® was commercially available in 35 countries worldwide. Actelion, founded in late 1997, is a leading player in innovative science related to the endothelium – the single layer of cells separating every blood vessel from the blood stream. Actelion’s over 1,500 employees focus on the discovery, development and marketing of innovative drugs for significant unmet medical needs. Actelion shares are traded on the SWX Swiss Exchange (ticker symbol: ATLN).
SOURCE: ACTELION
http://www.pipelinereview.com/content/view/16748/109/
Actelion startet Phase III-Tests mit Almorexant zur Behandlung der Insomnie
20.12 18:36
Allschwil (AWP) - Der Pharmakonzern Actelion Ltd. hat Studien der Phase III mit seinem Wirkstoffkandidaten Almorexant zur Behandlung von Schlaflosigkeit (Insomnie) lanciert. Das RESTORA-Programm soll die Wirksamkeit und die Sicherheit von Almorexant bei Patienten mit primärer Insomnie bestätigen, teilte Actelion am Donnerstag mit.
Die Studienergebnisse werden im Verlauf des Jahres 2009 zur Verfügung stehen, teilte Actelion weiter mit. 2008 werde Actelion zudem weitere Phase-III-Studien aufnehmen, dabei auch Nordamerika einbeziehen und sich auf eine längere Behandlungszeit, zusätzliche exploratorische Endpunkte und unterschiedliche Patientenkollektive wie ältere Patienten (65 Jahre oder älter) konzentrieren.
Die Ergebnisse der Studien sollen gemeinsam mit anderen noch laufenden oder bereits abgeschlossenen Studien die Grundlage für die weltweite Zulassung von Almorexant bilden.
20.12 18:36
Allschwil (AWP) - Der Pharmakonzern Actelion Ltd. hat Studien der Phase III mit seinem Wirkstoffkandidaten Almorexant zur Behandlung von Schlaflosigkeit (Insomnie) lanciert. Das RESTORA-Programm soll die Wirksamkeit und die Sicherheit von Almorexant bei Patienten mit primärer Insomnie bestätigen, teilte Actelion am Donnerstag mit.
Die Studienergebnisse werden im Verlauf des Jahres 2009 zur Verfügung stehen, teilte Actelion weiter mit. 2008 werde Actelion zudem weitere Phase-III-Studien aufnehmen, dabei auch Nordamerika einbeziehen und sich auf eine längere Behandlungszeit, zusätzliche exploratorische Endpunkte und unterschiedliche Patientenkollektive wie ältere Patienten (65 Jahre oder älter) konzentrieren.
Die Ergebnisse der Studien sollen gemeinsam mit anderen noch laufenden oder bereits abgeschlossenen Studien die Grundlage für die weltweite Zulassung von Almorexant bilden.
Die Kurserholung scheint sich fortzusetzen, trotz schwachem Umfeld. 
News gabs nach meinen Infos seitd em letzten posting nicht; allerdings gab es eine Präsentation bei der JP Morgan Healthcare Conference am 08 Jan 2008. Hier die Präsentation als pdf:
http://www.actelion.com/uninet/www/www_main_p.nsf/Content/08…
Scheint wohl bei den Amis gut angekommen zu sein.
Gibts evtl. neue Gerüchte?

News gabs nach meinen Infos seitd em letzten posting nicht; allerdings gab es eine Präsentation bei der JP Morgan Healthcare Conference am 08 Jan 2008. Hier die Präsentation als pdf:
http://www.actelion.com/uninet/www/www_main_p.nsf/Content/08…
Scheint wohl bei den Amis gut angekommen zu sein.
Gibts evtl. neue Gerüchte?
Jahreszahlen ?
wann kommen die ?
wann kommen die ?
23.01.2008 13:49:51
Actelion "overweight"
New York (aktiencheck.de AG) - Annie J. Cheng, Analystin von J.P. Morgan Securities, bewertet den Anteilschein des Schweizer Unternehmens Actelion (ISIN CH0010532478/ WKN 936767) mit "overweight". Der Listenpreis des Medikaments "Tracleer" werde in den USA mit Wirkung zum 1. Februar 2008 um 3,05% erhöht. So weit man bei J.P. Morgan Securities informiert sei, handele es sich hierbei nicht um die Reaktion auf die Preiserhöhung eines Wettbewerbers. Die aktuelle Nachricht sei als neutral bis leicht positiv für Actelion einzustufen. In der Umsatzschätzung von J.P. Morgan Securities sei für "Tracleer" bisher noch keine Preiserhöhung für das Jahr 2008 berücksichtigt gewesen. Obwohl die angekündigte Erhöhung wahrscheinlich keine wesentlichen Effekte haben werde, so stärke sie doch die Zuversicht der Analysten von J.P. Morgan Securities in ihre eigenen Prognosen. Die Ergebnisse des Geschäftsjahres 2007 werde Actelion voraussichtlich am 21. Februar veröffentlichen. Die Umsatzvorgabe des Unternehmens für 2008 dürfte weitestgehend den Markterwartungen entsprechen, so dass man mit einer Wachstumsvorgabe von rund 10% auf 1,45 Mrd. CHF kalkuliere. Die Umsatzprognose von J.P. Morgan Securities liege für 2008 unterdessen bei 1,433 Mrd. CHF. Die Analysten von J.P. Morgan Securities stufen die Aktie von Actelion mit "overweight" ein. (Analyse vom 23.01.08) (23.01.2008/ac/a/a)
Quelle: AKTIENCHECK.DE
Actelion "overweight"
New York (aktiencheck.de AG) - Annie J. Cheng, Analystin von J.P. Morgan Securities, bewertet den Anteilschein des Schweizer Unternehmens Actelion (ISIN CH0010532478/ WKN 936767) mit "overweight". Der Listenpreis des Medikaments "Tracleer" werde in den USA mit Wirkung zum 1. Februar 2008 um 3,05% erhöht. So weit man bei J.P. Morgan Securities informiert sei, handele es sich hierbei nicht um die Reaktion auf die Preiserhöhung eines Wettbewerbers. Die aktuelle Nachricht sei als neutral bis leicht positiv für Actelion einzustufen. In der Umsatzschätzung von J.P. Morgan Securities sei für "Tracleer" bisher noch keine Preiserhöhung für das Jahr 2008 berücksichtigt gewesen. Obwohl die angekündigte Erhöhung wahrscheinlich keine wesentlichen Effekte haben werde, so stärke sie doch die Zuversicht der Analysten von J.P. Morgan Securities in ihre eigenen Prognosen. Die Ergebnisse des Geschäftsjahres 2007 werde Actelion voraussichtlich am 21. Februar veröffentlichen. Die Umsatzvorgabe des Unternehmens für 2008 dürfte weitestgehend den Markterwartungen entsprechen, so dass man mit einer Wachstumsvorgabe von rund 10% auf 1,45 Mrd. CHF kalkuliere. Die Umsatzprognose von J.P. Morgan Securities liege für 2008 unterdessen bei 1,433 Mrd. CHF. Die Analysten von J.P. Morgan Securities stufen die Aktie von Actelion mit "overweight" ein. (Analyse vom 23.01.08) (23.01.2008/ac/a/a)
Quelle: AKTIENCHECK.DE
28.01.2008 19:21:00
Schwieriges 4. Quartal für BB BIOTECH
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin. Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
Die Aktienkurse der meisten Biotech-Unternehmen entwickelten sich im Jahr 2007 uneinheitlich und schwankten erheblich. Bis Oktober entwickelten sich die Kurse der Biotech-Aktien erfreulich. Dann erlitten einige grosse Unternehmen - darunter auch einige unserer Kernbeteiligungen - erhebliche Rückschläge, was die Bewertungen in den letzten beiden Monaten des Jahres drückte. Der Aktienkurs von BB BIOTECH ist im letzten Quartal um 6.8% (in CHF, inkl. Dividendenzahlung) gefallen und hat per Jahresende mit CHF 89 geschlossen. Wir sind jedoch der Meinung, dass die Kapitalmarktbewegungen auf ausserordentliche Umstände zurückzuführen sind und der Biotechnologie-Sektor grundsätzlich sehr attraktiv bleibt.
Unsere Portfoliounternehmen präsentierten erneut starke operative Ergebnisse - sowohl in Bezug auf den wirtschaftlichen Erfolg als auch hinsichtlich des Fortschritts wichtiger Entwicklungsprojekte. Unsere Kernbeteiligung Actelion erzielte mit Tracleer ein beeindruckendes Wachstum von 30%. Trotz dieses positiven Ergebnisses sahen die Finanzmärkte potenzielle Risiken durch einen neuen Mitbewerber. Dies führte zu einem deutlichen Rückgang des Aktienkurses von Actelion. Wir können diese negative Stimmung nicht nachvollziehen. Angesichts der belegten Langzeitwirksamkeit und -sicherheit von Tracleer gehen wir nach wie vor davon aus, dass einerseits der Umsatz von Tracleer zunehmen wird und dass Medikament einen Eckpfeiler in der Behandlung des Lungenhochdrucks (pulmonal-arterielle Hypertonie, PAH) bildet. Ausserdem hat Actelion bei zwei wichtigen Entwicklungsprojekten (Almorexant zur Behandlung der Schlaflosigkeit und Actelion-1 zur Behandlung von PAH) inzwischen Phase-III-Studien begonnen und damit die letzte Phase der klinischen Entwicklung eingeleitet.
Der Marktführer in der Behandlung der HIV-Infektion, Gilead, hat in diesem Jahr eine gute Leistung gezeigt. Im Juni hat das Unternehmen in den USA die Marktzulassung für das neue Medikament Letairis zur Behandlung von Patienten mit PAH erhalten. Darüberhinaus wurden grosse Fortschritte bei zahlreichen Produkten gemacht, die sich noch in der Entwicklung befinden. Unsere Beteiligung Celgene konnte ihr Kernprodukt Revlimid erfolgreich auf den Markt bringen. Auf der Jahreskonferenz der American Society of Hematology im Dezember wurden aussagekräftige klinische Daten zur Anwendung von Revlimid bei verschiedenen Formen von Blutkrebs vorgestellt. Diese Daten deuten auf eine einzigartige Wirksamkeit hin, die anhand der 2-Jahres-Überlebensrate von Patienten mit Multiplen Myelom bestimmt wurde. In der Zeit nach der Jahreskonferenz fiel der Aktienkurs von Celgene jedoch, da ein Wettbewerber ebenfalls Daten präsentierte. Wir sind trotzdem davon überzeugt, dass Revlimid wegen seiner Wirksamkeit, des günstigen Sicherheitsprofils und des hohen Anwendungskomforts aufgrund der peroralen Applikation zum Goldstandard in der Behandlung verschiedener Krebserkrankungen werden wird. Auch bei Vertex führte der intensivierte Wettbewerb zu einem Wertverlust - trotz der Tatsache, dass Telaprevir, einem neuen Medikament zur Behandlung der Hepatitis C, aus unserer Sicht in der klinischen Entwicklung deutlich weiter ist als alle potenziellen Mitbewerber. Biogen Idec gewann im Laufe des Jahres aufgrund der starken Nachfrage nach dem Medikament Tysabri an Wert. Tysabri wird zur Behandlung von Multipler Sklerose eingesetzt. Im Oktober teilte der Aufsichtsrat von Biogen Idec Pläne für den Verkauf des Unternehmens mit. Diese Pläne wurden im Dezember aufgegeben, als Biogen Idec bekannt gab, weiterhin als eigenständiges Unternehmen operieren zu wollen. Bei Genentech, einem führenden Unternehmen der Branche und eine unserer wichtigsten Beteiligungen, wurde der Antrag auf eine Erweiterung der Indikation für den Blockbuster Avastin durch ein Beratergremium der US-amerikanischen Arzneimittelbehörde FDA zurückgewiesen. Der Antikörper Avastin ist bereits zur Behandlung von Darm- und Lungenkrebs zugelassen. Da jedoch das eingereichte Datenmaterial zu einer klinischen Studie, die von unabhängigen Onkologen durchgeführt worden war, Lücken aufwies, konnte sich das Beratergremium nicht auf eine Entscheidung bezüglich der Zulassung für den metastasierten Brustkrebs einigen. Derzeit führen Genentech und Roche zusätzliche Studien durch. Die klinischen Ergebnisse werden für 2008 erwartet und können nachträglich bei der FDA eingereicht werden. Von den vielen interessanten Biotech-Produkten, die sich zurzeit in der Entwicklung befinden, versprechen die neuen Medikamente zur Behandlung von Alzheimer ein aussergewöhnliches Potenzial - und das sowohl in medizinischer als auch in sozialer und wirtschaftlicher Hinsicht. Unsere Beteiligung an Elan Pharmaceuticals hat sich seit der Bekanntgabe von klinischen Phase III-Studien zur Behandlung von Alzheimer sehr gut entwickelt. 2007 investierten wir neu in NicOx, Optimer Pharmaceuticals und Jerini. Wir reduzierten unsere Beteiligungen an Amgen, Genzyme, Basilea Pharmaceutica, Anadys und Affymax vollständig. Ende des Jahres verkleinerte sich der Abschlag, d.h. der Unterschied zwischen Aktienkurs und Innerem Wert von BB BIOTECH, weiter auf 3.8% (in CHF). Unser Aktienrückkaufprogramm und die Vernichtung von 1.4 Mio. Aktien trugen zu der positiven Entwicklung bei. In Anlehnung an das seit 2004 verfolgte Dividendenmodell wird der Verwaltungsrat der Generalversammlung eine Dividende von CHF 0.90 vorschlagen. Aufgrund des starken Umsatz- und Gewinnwachstums der Biotechnologie-Unternehmen sind die Bewertungskriterien, etwa das Kurs-Gewinn-Verhältnis, auf ein äusserst interessantes Niveau gesunken. Dies stimmt uns sehr optimistisch, dass BB BIOTECH zukünftig langfristige, zweistellige Kursgewinne erzielen wird.
Das Portfolio der BB BIOTECH setzt sich per 31. Dezember 2007 prozentual wie folgt zusammen: KERNBETEILIGUNGEN Actelion 26.6% Gilead 14.5% Celgene 13.0% Genentech 11.8% Biogen Idec 6.6% KLEINERE BETEILIGUNGEN Vertex Pharmaceuticals 6.4% Elan 6.1% Roche Holding GS 3.3% Affymetrix 2.6% Zymogenetics 2.4% The Medicines Company 1.6% NicOx 0.9% BioXell 0.8% Jerini 0.6% Incyte 0.5% Rigel Pharmaceuticals 0.5% Keryx Biopharmaceuticals 0.4% Arena Pharmaceuticals 0.4% Optimer Pharmaceuticals 0.3% Epigenomics 0.1% Genentech Call-Optionen (long) <0.1% SWAP Agreement auf eigene Aktien 0.4% Total Wertschriften CHF 2 037 Mio.
Eigene Aktien (in % der Gesellschaft) 11.7% Flüssige Mittel (netto) CHF (173.4) Mio. Übrige Aktiven 23.6 Mio. Andere Verbindlichkeiten CHF (119.6) Mio. Der ausführliche Jahresbericht ist am 13. März 2008 unter www.bbbiotech.com verfügbar. Für weitere Informationen: Bellevue Asset Management AG, Seestrasse 16, 8700 Küsnacht, Schweiz Anja Stubenrauch, Tel. +41 44 267 67 00 --- Ende der Mitteilung --- BB BIOTECH AG Vordergasse 3 Schaffhausen Schweiz WKN: 888509; ISIN: CH0001441580; Index: SBIOM, IGSP, SLIFE; Notiert: Investment Companies in SWX Swiss Exchange; Copyright © Hugin AS 2008. All rights reserved.
Quelle: HUGIN
Schwieriges 4. Quartal für BB BIOTECH
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin. Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
Die Aktienkurse der meisten Biotech-Unternehmen entwickelten sich im Jahr 2007 uneinheitlich und schwankten erheblich. Bis Oktober entwickelten sich die Kurse der Biotech-Aktien erfreulich. Dann erlitten einige grosse Unternehmen - darunter auch einige unserer Kernbeteiligungen - erhebliche Rückschläge, was die Bewertungen in den letzten beiden Monaten des Jahres drückte. Der Aktienkurs von BB BIOTECH ist im letzten Quartal um 6.8% (in CHF, inkl. Dividendenzahlung) gefallen und hat per Jahresende mit CHF 89 geschlossen. Wir sind jedoch der Meinung, dass die Kapitalmarktbewegungen auf ausserordentliche Umstände zurückzuführen sind und der Biotechnologie-Sektor grundsätzlich sehr attraktiv bleibt.
Unsere Portfoliounternehmen präsentierten erneut starke operative Ergebnisse - sowohl in Bezug auf den wirtschaftlichen Erfolg als auch hinsichtlich des Fortschritts wichtiger Entwicklungsprojekte. Unsere Kernbeteiligung Actelion erzielte mit Tracleer ein beeindruckendes Wachstum von 30%. Trotz dieses positiven Ergebnisses sahen die Finanzmärkte potenzielle Risiken durch einen neuen Mitbewerber. Dies führte zu einem deutlichen Rückgang des Aktienkurses von Actelion. Wir können diese negative Stimmung nicht nachvollziehen. Angesichts der belegten Langzeitwirksamkeit und -sicherheit von Tracleer gehen wir nach wie vor davon aus, dass einerseits der Umsatz von Tracleer zunehmen wird und dass Medikament einen Eckpfeiler in der Behandlung des Lungenhochdrucks (pulmonal-arterielle Hypertonie, PAH) bildet. Ausserdem hat Actelion bei zwei wichtigen Entwicklungsprojekten (Almorexant zur Behandlung der Schlaflosigkeit und Actelion-1 zur Behandlung von PAH) inzwischen Phase-III-Studien begonnen und damit die letzte Phase der klinischen Entwicklung eingeleitet.
Der Marktführer in der Behandlung der HIV-Infektion, Gilead, hat in diesem Jahr eine gute Leistung gezeigt. Im Juni hat das Unternehmen in den USA die Marktzulassung für das neue Medikament Letairis zur Behandlung von Patienten mit PAH erhalten. Darüberhinaus wurden grosse Fortschritte bei zahlreichen Produkten gemacht, die sich noch in der Entwicklung befinden. Unsere Beteiligung Celgene konnte ihr Kernprodukt Revlimid erfolgreich auf den Markt bringen. Auf der Jahreskonferenz der American Society of Hematology im Dezember wurden aussagekräftige klinische Daten zur Anwendung von Revlimid bei verschiedenen Formen von Blutkrebs vorgestellt. Diese Daten deuten auf eine einzigartige Wirksamkeit hin, die anhand der 2-Jahres-Überlebensrate von Patienten mit Multiplen Myelom bestimmt wurde. In der Zeit nach der Jahreskonferenz fiel der Aktienkurs von Celgene jedoch, da ein Wettbewerber ebenfalls Daten präsentierte. Wir sind trotzdem davon überzeugt, dass Revlimid wegen seiner Wirksamkeit, des günstigen Sicherheitsprofils und des hohen Anwendungskomforts aufgrund der peroralen Applikation zum Goldstandard in der Behandlung verschiedener Krebserkrankungen werden wird. Auch bei Vertex führte der intensivierte Wettbewerb zu einem Wertverlust - trotz der Tatsache, dass Telaprevir, einem neuen Medikament zur Behandlung der Hepatitis C, aus unserer Sicht in der klinischen Entwicklung deutlich weiter ist als alle potenziellen Mitbewerber. Biogen Idec gewann im Laufe des Jahres aufgrund der starken Nachfrage nach dem Medikament Tysabri an Wert. Tysabri wird zur Behandlung von Multipler Sklerose eingesetzt. Im Oktober teilte der Aufsichtsrat von Biogen Idec Pläne für den Verkauf des Unternehmens mit. Diese Pläne wurden im Dezember aufgegeben, als Biogen Idec bekannt gab, weiterhin als eigenständiges Unternehmen operieren zu wollen. Bei Genentech, einem führenden Unternehmen der Branche und eine unserer wichtigsten Beteiligungen, wurde der Antrag auf eine Erweiterung der Indikation für den Blockbuster Avastin durch ein Beratergremium der US-amerikanischen Arzneimittelbehörde FDA zurückgewiesen. Der Antikörper Avastin ist bereits zur Behandlung von Darm- und Lungenkrebs zugelassen. Da jedoch das eingereichte Datenmaterial zu einer klinischen Studie, die von unabhängigen Onkologen durchgeführt worden war, Lücken aufwies, konnte sich das Beratergremium nicht auf eine Entscheidung bezüglich der Zulassung für den metastasierten Brustkrebs einigen. Derzeit führen Genentech und Roche zusätzliche Studien durch. Die klinischen Ergebnisse werden für 2008 erwartet und können nachträglich bei der FDA eingereicht werden. Von den vielen interessanten Biotech-Produkten, die sich zurzeit in der Entwicklung befinden, versprechen die neuen Medikamente zur Behandlung von Alzheimer ein aussergewöhnliches Potenzial - und das sowohl in medizinischer als auch in sozialer und wirtschaftlicher Hinsicht. Unsere Beteiligung an Elan Pharmaceuticals hat sich seit der Bekanntgabe von klinischen Phase III-Studien zur Behandlung von Alzheimer sehr gut entwickelt. 2007 investierten wir neu in NicOx, Optimer Pharmaceuticals und Jerini. Wir reduzierten unsere Beteiligungen an Amgen, Genzyme, Basilea Pharmaceutica, Anadys und Affymax vollständig. Ende des Jahres verkleinerte sich der Abschlag, d.h. der Unterschied zwischen Aktienkurs und Innerem Wert von BB BIOTECH, weiter auf 3.8% (in CHF). Unser Aktienrückkaufprogramm und die Vernichtung von 1.4 Mio. Aktien trugen zu der positiven Entwicklung bei. In Anlehnung an das seit 2004 verfolgte Dividendenmodell wird der Verwaltungsrat der Generalversammlung eine Dividende von CHF 0.90 vorschlagen. Aufgrund des starken Umsatz- und Gewinnwachstums der Biotechnologie-Unternehmen sind die Bewertungskriterien, etwa das Kurs-Gewinn-Verhältnis, auf ein äusserst interessantes Niveau gesunken. Dies stimmt uns sehr optimistisch, dass BB BIOTECH zukünftig langfristige, zweistellige Kursgewinne erzielen wird.
Das Portfolio der BB BIOTECH setzt sich per 31. Dezember 2007 prozentual wie folgt zusammen: KERNBETEILIGUNGEN Actelion 26.6% Gilead 14.5% Celgene 13.0% Genentech 11.8% Biogen Idec 6.6% KLEINERE BETEILIGUNGEN Vertex Pharmaceuticals 6.4% Elan 6.1% Roche Holding GS 3.3% Affymetrix 2.6% Zymogenetics 2.4% The Medicines Company 1.6% NicOx 0.9% BioXell 0.8% Jerini 0.6% Incyte 0.5% Rigel Pharmaceuticals 0.5% Keryx Biopharmaceuticals 0.4% Arena Pharmaceuticals 0.4% Optimer Pharmaceuticals 0.3% Epigenomics 0.1% Genentech Call-Optionen (long) <0.1% SWAP Agreement auf eigene Aktien 0.4% Total Wertschriften CHF 2 037 Mio.
Eigene Aktien (in % der Gesellschaft) 11.7% Flüssige Mittel (netto) CHF (173.4) Mio. Übrige Aktiven 23.6 Mio. Andere Verbindlichkeiten CHF (119.6) Mio. Der ausführliche Jahresbericht ist am 13. März 2008 unter www.bbbiotech.com verfügbar. Für weitere Informationen: Bellevue Asset Management AG, Seestrasse 16, 8700 Küsnacht, Schweiz Anja Stubenrauch, Tel. +41 44 267 67 00 --- Ende der Mitteilung --- BB BIOTECH AG Vordergasse 3 Schaffhausen Schweiz WKN: 888509; ISIN: CH0001441580; Index: SBIOM, IGSP, SLIFE; Notiert: Investment Companies in SWX Swiss Exchange; Copyright © Hugin AS 2008. All rights reserved.
Quelle: HUGIN
31.01.2008 10:18:06
Actelion bis 38,00 Euro kaufen
München (aktiencheck.de AG) - Die Experten von "FOCUS-MONEY" empfehlen die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) bis 38,00 zu kaufen. Actelion sei ein solides Pharmaunternehmen mit Sitz in der Schweiz, das bereits mehrere Medikamente gegen seltene Herz- und Lungenerkrankungen am Markt habe und damit Geld verdiene. Seit Jahresanfang habe der Aktienkurs schon über zehn Prozent zulegen können. Im Herbst sei das Unternehmen an der Börse abgestraft worden, nachdem sich die Hoffnungen auf eine weitere Anwendungsmöglichkeit für das Medikament Zavesca zerschlagen hätten und der Umsatz des Hauptumsatzbringers Tracleer rückläufig gewesen sei. Jetzt habe Actelion vorläufige Geschäftszahlen für 2007 vorgelegt. Demnach sei der Umsatz um 39 Prozent auf 827 Mio. Euro gestiegen. Der Gewinn werde über den geschätzten 270 bis 289 Mio. Euro liegen. Die Experten von "FOCUS-MONEY" empfehlen die Aktie von Actelion bis 38,00 Euro zu kaufen und raten einen Stoppkurs bei 29,50 Euro zu setzen. (Ausgabe 06) (31.01.2008/ac/a/a)
Quelle: AKTIENCHECK.DE
Actelion bis 38,00 Euro kaufen
München (aktiencheck.de AG) - Die Experten von "FOCUS-MONEY" empfehlen die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) bis 38,00 zu kaufen. Actelion sei ein solides Pharmaunternehmen mit Sitz in der Schweiz, das bereits mehrere Medikamente gegen seltene Herz- und Lungenerkrankungen am Markt habe und damit Geld verdiene. Seit Jahresanfang habe der Aktienkurs schon über zehn Prozent zulegen können. Im Herbst sei das Unternehmen an der Börse abgestraft worden, nachdem sich die Hoffnungen auf eine weitere Anwendungsmöglichkeit für das Medikament Zavesca zerschlagen hätten und der Umsatz des Hauptumsatzbringers Tracleer rückläufig gewesen sei. Jetzt habe Actelion vorläufige Geschäftszahlen für 2007 vorgelegt. Demnach sei der Umsatz um 39 Prozent auf 827 Mio. Euro gestiegen. Der Gewinn werde über den geschätzten 270 bis 289 Mio. Euro liegen. Die Experten von "FOCUS-MONEY" empfehlen die Aktie von Actelion bis 38,00 Euro zu kaufen und raten einen Stoppkurs bei 29,50 Euro zu setzen. (Ausgabe 06) (31.01.2008/ac/a/a)
Quelle: AKTIENCHECK.DE
Actelion announces Full Year 2007 financial results
ALLSCHWIL/BASEL, SWITZERLAND – 21 February 2008 – Actelion Ltd (SWX: ATLN)
Total net revenues of CHF 1.32 billion, up 39 percent – Tracleer® sales up 31 percent to CHF 1.18 billion – Cash EBIT of CHF 471.4 million, up 47 percent – US-GAAP operating profit of CHF 142.6 million - Rapid pipeline expansion and maturation – Almorexant partnering process ongoing – 2008 expected top-line growth in local currency in the low double digit percentage range – 2008 accelerated R&D investment with multiple Phase III programs results in possible slight margin compression – 2008 US GAAP operating and net profit to increase significantly in absence of large 2007 IPRD charge - Unique potential for long-term growth and transformation
ALLSCHWIL/BASEL, SWITZERLAND – 21 February 2008 – Actelion Ltd (SWX: ATLN) today announced its audited financial results for the full year 2007. With total net revenues for 2007 of CHF 1.32 billion (FY 2006: CHF 945.7 m) and operating expenses of CHF 1.18 billion (FY 2006: CHF 677.5 m) – including a one-time non-cash In-Process Research and Development (IPRD) charge of CHF 224.8 million incurred in the first quarter related to the acquisition of CoTherix Inc. – the company reported an operating profit of CHF 142.6 million (FY 2006: CHF 268.2 m).
To better measure and compare operating performance over time, Actelion continues to report non-US GAAP Cash-EBIT (Operating Income excluding non-cash charges such as In-Process R&D, charges related to employee stock options under FAS 123R as well as non-cash depreciation and amortization charges). In 2007, Actelion achieved a Cash- EBIT of CHF 471.4 million, an increase of 47 percent compared to the same period in 2006. Accordingly, adjusted (non-US GAAP) diluted earnings per share in 2007 were CHF 3.67, compared to CHF 2.48 in 2006, an increase of 48%.
On a US-GAAP basis, the 2007 net profit was CHF 124.6 million (FY 2006: CHF 241.1 m). As a result, 2007 fully diluted earnings per share (EPS) were CHF 1.00, compared to CHF 2.05 in 2006.
Jean-Paul Clozel, M.D. and Chief Executive Officer commented: “In 2007, Actelion executed flawlessly. Only ten years after incorporation, we have already achieved revenues far in excess of 1 billion Swiss Francs. Tracleer® sales alone amounted to 1.18 billion Swiss Francs, documenting our successful efforts in the field of pulmonary arterial hypertension. We successfully integrated CoTherix, adding Ventavis® in the US as a third marketed product to our line-up. Our clinical and pre-clinical pipeline has expanded and matured rapidly, with five different projects alone in the last clinical evaluation phase.“
Jean-Paul Clozel continued:” In 2007, Actelion’s focus on innovation was evident once again with the breakthrough data generated with our first-in-class orexin receptor antagonist, almorexant. Actelion successfully demonstrated that this compound has the potential to transform the way sleep disorders are treated. As a testimony to Actelion’s outstanding skill base and financial strength, Actelion has moved this project rapidly from an in-house research program a few years ago to initiating the comprehensive Phase III program RESTORA in December 2007.“
Jean-Paul Clozel added: “Together with its numerous other innovative projects focusing on small molecules, Actelion has the potential to transform medicine in several areas while transforming itself once again by reaching out to the general practitioner market. This could be achieved either through our partnership with Merck in the field of renin inhibition or through a potential almorexant partnership for which we have recently initiated the related partner selection process. We are focused on maximizing the value of almorexant by allocating all appropriate resources thereby fully leveraging the breakthrough potential of this compound in sleep disorders and beyond.”
Jean-Paul Clozel concluded: “Actelion has both marketed products with significant growth potential as well as an outstanding pipeline with the potential to transform medicine. Our key focus in 2008, therefore, is to make the most appropriate investments in terms of support required for marketed products, additional clinical trials to accelerate pipeline maturation, hiring additional talent and adapting our infrastructure.”
Andrew J. Oakley, Chief Financial Officer commented: “In 2007, we have again grown product sales, pipeline and infrastructure, coupled with continuous strong cash generation. We were able to do so because we made the appropriate investments in the past. Accordingly, our continued focus will be on driving operational excellence through successful management of both top-line expansion and an acceleration of R&D spending, given the multitude of promising growth opportunities.”
Andrew J. Oakley added: “For 2008, unforeseen events excluded, Actelion expects total net revenues to grow – in local currency terms – in the low double digit percentage range. As a result of accelerated investment in R&D, the company expects a slight compression of operating margins, with Cash-EBIT either flat or slightly decreasing in the mid-single digit percentage range. Actelion’s 2008 performance could be positively impacted on both top line and bottom line by an almorexant partnership agreement.”
In terms of US GAAP results, Actelion expects to report significantly improved operating and net profit for 2008, given that 2007 was impacted by the CHF 224.8 million IPRD charge related to the CoTherix acquisition.
Andrew Oakley concluded:” With ongoing strong cash generation, Actelion maintains full strategic flexibility to act on any arising in-licensing or M&A opportunity. At the same time, Actelion remains committed to improve shareholder value through the pro-active management of any dilution that may arise in the future.”
During 2007, Actelion committed to mitigating dilution from both the 2008 convertible bond – conversion of which was forced in February 2007 – and the employee stock option plans. At the end of 2007, Actelion owned a total of 3.3% of its capital as treasury shares and – in early 2008 – concluded a program to reduce dilution by a further 4 percent through derivative instruments. These measures are expected to substantially limit the issuance of new shares in the future.
Financial result overview – Table FY 2007 vs. FY 2006
In CHF thousands
Result FY 2007
Result FY 2006
Variance
%
Net Revenues
1,317,392
945,673
371,719
39
Operating Expenses(1)
1,174,790
677,484
497,306
73
Operating Income
142,602
268,189
(125,587)
(47)
Cash EBIT
471,443
320,375
151,068
47
Net Income
124,586
241,090
(116,504)
(48)
Diluted EPS in CHF
1.00
2.05
(1.05)
(51)
No of shares in calculation
(in million)
124,809
121,627
-
-
(1) includes IPRD charge of CHF 224.8 million incurred in the first quarter related to the acquisition of CoTherix
The full financial statements can be found on http://www.actelion.com
Continued growth of total net revenues
During 2007, total net revenues increased by 39 percent to CHF 1.32 billion (FY 2006: CHF 945.7 m). Contract revenues for the 2007 amounted to CHF 25.3 million (FY 2006: CHF 21.5 m).
Tracleer® sales
During the full year 2007, Tracleer® (bosentan) sales were CHF 1.18 billion (FY 2006: CHF 898.7 m), an increase of 31 percent compared to the same period last year.
At the end of December 2007, Tracleer® was commercially available in over 30 countries worldwide, including all major pharmaceutical markets.
Otto Schwarz, President Business Operations, commented: “This strong growth for Tracleer® is remarkable, especially considering that new competition entered the market in 2007 within the class of endothelin receptor antagonists, in particular in the United States. Actelion’s in-depth knowledge of the PAH market, our highly professional and determined worldwide marketing and sales force, continued medical education activities, and further geographical expansion were the basis for maintaining leadership and further growth.”
In 2007, Actelion submitted an application to Health Authorities worldwide to expand the indication of Tracleer® for patients with PAH in WHO Functional Class II, based on the results of the EARLY study, the only study ever conducted to investigate the effects of a PAH therapy specifically in this patient population. In the EARLY study, Tracleer® showed a significant effect on delaying time to clinical worsening, a measure of disease progression.
In June 2007, the EMEA granted approval in the European Union for an expansion of the indication of Tracleer® for reducing the number of new digital ulcers in patients suffering from systemic sclerosis and ongoing digital ulcer disease. Digital ulcers are a serious and very debilitating consequence of this disease.
From the CoTherix acquisition date in early January 2007, Ventavis® (iloprost) sales reached CHF 78.2 million. On a like-for-like basis, taking into account the pre-acquisition period Ventavis® sales grew by 24 percent in local currency terms year on year.
I n early Q4 2007, Actelion launched – next to its existing strong educational outreach to physicians - additional patient support programs and convenience improvements for the current Ventavis® device. In 2008, Actelion also will conduct a placebo-controlled study to further improve the current device.
Otto Schwarz added: “Furthermore in 2008, our key focus will be on expanding both product sales as well as the PAH market place in general. With increased educational activity by several companies now active in this area, we are already seeing the first signs of increased interest that should lead to further increases in diagnosis rates and prescriptions. With the acquisition of US rights of Ventavis® and the advanced clinical development, we are also demonstrating our continuous commitment to the PAH space.”
Total sales of Zavesca® (miglustat) during 2007 were CHF 35.3 million (FY 2006: CHF 25.5 m). Zavesca® is commercially available in the United States and in most European markets.
Otto Schwarz concluded: ”Actelion has been very successful in so-called orphan drug applications, generating Tracleer® sales in excess of 1 billion Swiss Francs. This is usually the hallmark of medicines prescribed by general practitioners (GP). With a rapidly maturing pipeline comprising medicines such as almorexant that might one day reach the General Practitioner’s office, Actelion is now preparing to successfully manage this next challenge in the not-so distant future.”
Operating expenses – Focus on accelerated R&D investment
During 2007, operating expenses were CHF 1.18 billion, including an In-Process Research and Development (IPRD) charge related to the acquisition of CoTherix of CHF 224.8 million incurred in the first quarter (FY 2006: CHF 677.5 m).
During the same period, research and development expenses increased by 38 percent to CHF 292.1 million (FY 2006: CHF 211.8 m). Actelion’s pipeline now has 10 compounds in clinical development as well as multiple projects in pre-clinical development. In 2007, the level of operational activity in clinical development has significantly increased. Compared to 2006, the number of patients or healthy volunteers enrolled in clinical trials increased by 39 percent. This number is expected to grow significantly in the future, mostly driven by the large number of Phase III programs.
The five ongoing Phase III programs are (in alphabetical order):
Actelion-1 in Pulmonary Arterial Hypertension: The pivotal program evaluating this tissue-targeting endothelin receptor antagonist in pulmonary arterial hypertension was initiated in December 2007. The program will enroll around 500 patients worldwide, aiming at a morbidity/mortality claim. Study results are expected in several years.
Almorexant: The comprehensive Phase III program RESTORA (REstore physiological Sleep with The Orexin Receptor antagonist Almorexant) was initiated in December 2007. The first Phase III study, RESTORA 1, is designed to evaluate efficacy and safety of almorexant in patients diagnosed with primary insomnia. RESTORA 1 is evaluating the effects of almorexant on sleep induction and sleep maintenance, effects previously observed in earlier studies. This study is also expected to provide additional information on sleep architecture and sleep quality, thereby providing further insight into the role of almorexant in restoring normal physiological sleep. RESTORA 1 includes an active reference arm with zolpidem to generate reference information with this agent approved for the treatment of insomnia. Additional RESTORA studies will be initiated throughout 2008, with first results expected in 2009.
Bosentan (Tracleer®) in IPF: The pivotal Phase III study BUILD-3 evaluates the safety and efficacy of this dual endothelin receptor antagonist in 390 patients suffering from idiopathic pulmonary fibrosis (IPF). Enrollment in th i s event-driven study, which was reviewed under a special protocol assessment (SPA) by the US Food and Drug Administration, is expected to close before mid-2008. Study results are expected in late 2009.
Clazosentan in aSAH: The pivotal Phase III study CONSCIOUS-2 (Clazosentan to Overcome Neurological iSChemia and Infarct OccUrring after Subarachnoid hemorrhage) was initiated in November of 2007. It will measure the clinical benefits of clazosentan through the primary endpoint of vasospasm-related morbidity and all-cause mortality, which includes neurological deterioration, new brain infarcts, introduction of vasospasm rescue therapy or death from any cause. CONSCIOUS-2 is a global study which will include a minimum of 765 patients with aSAH and aneurismal surgical clipping from more than 100 centers outside the United States. As of February 2008, discussions with the US Food and Drug Administration (FDA) are ongoing; it is planned to include an additional 24 centers in the United States. Study results may become available in the second half of 2009.
Tezosentan in acute cardiovascular care: The first Phase III study evaluating safety and efficacy of this i.v. endothelin receptor antagonist for reduction of clinically relevant right ventricular failure (RVF) associated with difficult separation from bypass (DSB) in 270 patients undergoing cardiac surgery with cardiopulmonary bypass (CPB) is close to full enrollment, with results expected by mid-2008. If positive, Actelion will then immediately perform a similar second pivotal study to compile a full registration dossier.
Isaac Kobrin, M.D. and Head of Clinical Development commented: ”Throughout 2007, our key focus has been on strengthening our clinical development capabilities. Actelion is now running several large clinical trial programs in parallel. Our focus in 2008 will therefore be on both execution of our large programs and on ensuring that our novel compounds reaching the clinical stage are also appropriately evaluated.”
Additional clinical programs ongoing in 2008 are focusing on areas such as cardiovascular disorders (Renin inhibitor partnered in 2003 with Merck & Co., Inc., entered Phase II in December 2007), genetic disorders (Miglustat (Zavesca®) in cystic fibrosis Phase IIa initiated in H2 2007), allergy (CRTH2 antagonist, Phase IIa initiated in early 2008), autoimmune disorders (selective S1P1 receptor agonist, partnered in 2006 with Roche, Phase I ongoing). In Drug Discovery, there are multiple programs ongoing that should result in new compounds entering into man.
In February 2008, Actelion has taken the decision to withdraw the application for the extension of indication on the use of miglustat (Zavesca®) for the treatment of progressive neurological manifestations in patients with Niemann-Pick type C disease (NP-C). This decision was taken following an oral explanation with the European Committee for Medicinal Products for Human Use (CHMP) and Actelion is currently evaluating its options to resubmit an application at a later stage. At that point in time, new, relevant data from an ongoing survey of NP-C patients treated with miglustat could be provided in order to support an extension of indication.
In 2007, marketing and advertising expenses were CHF 234.1 million (FY 2006: 185.5 m). The increase is the result of ongoing investments to strengthening product sales in all territories worldwide, focusing especially in the PAH area on both education and the generation of additional clinical data sets, such as combination data.
Selling, general and administrative expenses for the full year 2007 amounted to CHF 266.1 million (FY 2006: CHF 185.1 m). Actelion continues to increase its investment into a global infrastructure to support long-term growth for its existing products as well as ensuring that future products can be launched efficiently either by Actelion alone or with its pa rtners.
Operating profit
Actelion’s operating profit for the 2007 was CHF 142.6 million (FY 2006: CHF 268.2 m). Cash EBIT for the same period amounted to CHF 471.4 million (FY 2006: CHF 320.4 m), an increase of 47 percent.
Net Profit
For the full year 2007, the net profit of CHF 124.6 million (FY 2006: CHF 241.1 m) includes interest income of CHF 20.4 million, interest expense of CHF 0.2 million, a non-cash charge on the Convertible Bonds of CHF 4.1 million, foreign currency gains of CHF 9.6 million and an income tax expense of CHF 43.7 million. The effective tax rate for the year (not including the IPRD charge related to the acquisition of CoTherix) was 11 per cent.
Cash and cash flow
During 2007, Actelion generated net cash flow from operations of CHF 394.2 million (FY 2006: CHF 352.8 m).
Strong talent growth
At the end of 2007, Actelion employed 1,592 employees worldwide, an increase of more than 300 compared to the end of 2006. Of those 1,592 employees, 677 were located in Switzerland (2006: 551 employees).
In 2008, Actelion expects to increase its global work force to around 1950 employees. In Switzerland, Actelion expects to employ by year-end 2008 more than 800 employees
For documentation purposes – table Q4 2007 vs. Q3 2007
In CHF thousands
Results
Q4 2007
Results
Q3 2007
Variance
%
Net Revenues(2)
370,943
320,098
50,845
16
Operating Expenses
268,770
228,873
39,897
17
- Research and Development
82,125
74,817
7,308
10
- Marketing and Advertising
69,467
52,320
17,147
33
- Selling, General and Admin.
73,662
61,716
11,946
19
Operating Income
102,173
91,225
10,948
12
Cash EBIT
122,460
117,998
4,462
4
Net Income
88,453
89,086
(633)
(1)
Diluted EPS in CHF
0.71
0.70
0.01
1
No of shares in calculation (in million)
123,786
126,428
-
-
(2)A proportion of the quarterly increases or decreases in Tracleer® and Ventavis® sales might be attributable to buying pattern variations
###
NOTE TO THE SHAREHOLDERS:
The Annual General Meeting of Shareholders approving the Business Report of the year ending 31 December 2007 will be held on 11 April 2008.
Shareholders holding more than CHF 1 million nominal value of shares (i.e. 2’000'000 shares at nominal value of CHF 0.50), being entitled to add items to the agenda of the general meeting of shareholders, are invited to send in proposals, if any, for the Annual General Meeting of Shareholders on 11 April 2008 to Actelion Ltd, attention Corporate Secretary, Gewerbestrasse 16, CH-4123 Allschwil, to arrive no later than 3 March 2008. Any proposal received after the given deadline will be disregarded.
In order to attend and vote at the Annual General Meeting of Shar eholders, shareholders must be registered in the Company's shareholders register by 31 March 2008 at the latest.
Please note that the Annual Report 2007 will be available in early March 2008, both in hard copy as well as on the Company website www.actelion.com
Media and Analyst Conference 2008
Actelion will host a Media and Analyst conference and Webcast on
Thursday, 21 February 2008, 10.30 Basel (CET) / 04.30 a.m. US (EST) / 09.30 UK (GMT).
Conference Call
Dial:
Europe:
0041 44 580 64 03
US:
001 866 895 8561
UK:
0044 207 153 99 62
Participants mode: Listen only
Webcast – Live and replay on demand
Actelion will webcast it Media and Analyst Conference. On the web, you may either follow the conference live or have it replayed later on demand. To access the webcast live, simply visit the link on our homepage http://www.actelion.com 10 – 15 minutes before the conference is due to start. If you experience any access problems go directly to the URL: http://gaia.world-television.com/actelion/20080221/trunc/.
Participants mode: Listen and watch only
Webcast replay:
The archived Investor webcast will be available for replay through http://www.actelion.com/ approximately 60 minutes after the call has ended.
Actelion Ltd
Actelion Ltd is a biopharmaceutical company with its corporate headquarters in Allschwil/Basel, Switzerland. Actelion's first drug Tracleer®, an orally available dual endothelin receptor antagonist, has been approved as a therapy for pulmonary arterial hypertension. Actelion markets Tracleer® through its own subsidiaries in key markets worldwide, including the United States (based in South San Francisco), the European Union, Japan, Canada, Australia and Switzerland. Actelion, founded in late 1997, is a leading player in innovative science related to the endothelium – the single layer of cells separating every blood vessel from the blood stream. Actelion focuses on the discovery, development and marketing of innovative drugs for significant unmet medical needs. Actelion shares are traded on the SWX Swiss Exchange (ticker symbol: ATLN).
For further information please contact:
Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil
Roland Haefeli
Vice President, Head of Investor Relations & Public Affairs
+41 61 565 62 62
+1 650 624 69 36
http://www.actelion.com
ALLSCHWIL/BASEL, SWITZERLAND – 21 February 2008 – Actelion Ltd (SWX: ATLN)
Total net revenues of CHF 1.32 billion, up 39 percent – Tracleer® sales up 31 percent to CHF 1.18 billion – Cash EBIT of CHF 471.4 million, up 47 percent – US-GAAP operating profit of CHF 142.6 million - Rapid pipeline expansion and maturation – Almorexant partnering process ongoing – 2008 expected top-line growth in local currency in the low double digit percentage range – 2008 accelerated R&D investment with multiple Phase III programs results in possible slight margin compression – 2008 US GAAP operating and net profit to increase significantly in absence of large 2007 IPRD charge - Unique potential for long-term growth and transformation
ALLSCHWIL/BASEL, SWITZERLAND – 21 February 2008 – Actelion Ltd (SWX: ATLN) today announced its audited financial results for the full year 2007. With total net revenues for 2007 of CHF 1.32 billion (FY 2006: CHF 945.7 m) and operating expenses of CHF 1.18 billion (FY 2006: CHF 677.5 m) – including a one-time non-cash In-Process Research and Development (IPRD) charge of CHF 224.8 million incurred in the first quarter related to the acquisition of CoTherix Inc. – the company reported an operating profit of CHF 142.6 million (FY 2006: CHF 268.2 m).
To better measure and compare operating performance over time, Actelion continues to report non-US GAAP Cash-EBIT (Operating Income excluding non-cash charges such as In-Process R&D, charges related to employee stock options under FAS 123R as well as non-cash depreciation and amortization charges). In 2007, Actelion achieved a Cash- EBIT of CHF 471.4 million, an increase of 47 percent compared to the same period in 2006. Accordingly, adjusted (non-US GAAP) diluted earnings per share in 2007 were CHF 3.67, compared to CHF 2.48 in 2006, an increase of 48%.
On a US-GAAP basis, the 2007 net profit was CHF 124.6 million (FY 2006: CHF 241.1 m). As a result, 2007 fully diluted earnings per share (EPS) were CHF 1.00, compared to CHF 2.05 in 2006.
Jean-Paul Clozel, M.D. and Chief Executive Officer commented: “In 2007, Actelion executed flawlessly. Only ten years after incorporation, we have already achieved revenues far in excess of 1 billion Swiss Francs. Tracleer® sales alone amounted to 1.18 billion Swiss Francs, documenting our successful efforts in the field of pulmonary arterial hypertension. We successfully integrated CoTherix, adding Ventavis® in the US as a third marketed product to our line-up. Our clinical and pre-clinical pipeline has expanded and matured rapidly, with five different projects alone in the last clinical evaluation phase.“
Jean-Paul Clozel continued:” In 2007, Actelion’s focus on innovation was evident once again with the breakthrough data generated with our first-in-class orexin receptor antagonist, almorexant. Actelion successfully demonstrated that this compound has the potential to transform the way sleep disorders are treated. As a testimony to Actelion’s outstanding skill base and financial strength, Actelion has moved this project rapidly from an in-house research program a few years ago to initiating the comprehensive Phase III program RESTORA in December 2007.“
Jean-Paul Clozel added: “Together with its numerous other innovative projects focusing on small molecules, Actelion has the potential to transform medicine in several areas while transforming itself once again by reaching out to the general practitioner market. This could be achieved either through our partnership with Merck in the field of renin inhibition or through a potential almorexant partnership for which we have recently initiated the related partner selection process. We are focused on maximizing the value of almorexant by allocating all appropriate resources thereby fully leveraging the breakthrough potential of this compound in sleep disorders and beyond.”
Jean-Paul Clozel concluded: “Actelion has both marketed products with significant growth potential as well as an outstanding pipeline with the potential to transform medicine. Our key focus in 2008, therefore, is to make the most appropriate investments in terms of support required for marketed products, additional clinical trials to accelerate pipeline maturation, hiring additional talent and adapting our infrastructure.”
Andrew J. Oakley, Chief Financial Officer commented: “In 2007, we have again grown product sales, pipeline and infrastructure, coupled with continuous strong cash generation. We were able to do so because we made the appropriate investments in the past. Accordingly, our continued focus will be on driving operational excellence through successful management of both top-line expansion and an acceleration of R&D spending, given the multitude of promising growth opportunities.”
Andrew J. Oakley added: “For 2008, unforeseen events excluded, Actelion expects total net revenues to grow – in local currency terms – in the low double digit percentage range. As a result of accelerated investment in R&D, the company expects a slight compression of operating margins, with Cash-EBIT either flat or slightly decreasing in the mid-single digit percentage range. Actelion’s 2008 performance could be positively impacted on both top line and bottom line by an almorexant partnership agreement.”
In terms of US GAAP results, Actelion expects to report significantly improved operating and net profit for 2008, given that 2007 was impacted by the CHF 224.8 million IPRD charge related to the CoTherix acquisition.
Andrew Oakley concluded:” With ongoing strong cash generation, Actelion maintains full strategic flexibility to act on any arising in-licensing or M&A opportunity. At the same time, Actelion remains committed to improve shareholder value through the pro-active management of any dilution that may arise in the future.”
During 2007, Actelion committed to mitigating dilution from both the 2008 convertible bond – conversion of which was forced in February 2007 – and the employee stock option plans. At the end of 2007, Actelion owned a total of 3.3% of its capital as treasury shares and – in early 2008 – concluded a program to reduce dilution by a further 4 percent through derivative instruments. These measures are expected to substantially limit the issuance of new shares in the future.
Financial result overview – Table FY 2007 vs. FY 2006
In CHF thousands
Result FY 2007
Result FY 2006
Variance
%
Net Revenues
1,317,392
945,673
371,719
39
Operating Expenses(1)
1,174,790
677,484
497,306
73
Operating Income
142,602
268,189
(125,587)
(47)
Cash EBIT
471,443
320,375
151,068
47
Net Income
124,586
241,090
(116,504)
(48)
Diluted EPS in CHF
1.00
2.05
(1.05)
(51)
No of shares in calculation
(in million)
124,809
121,627
-
-
(1) includes IPRD charge of CHF 224.8 million incurred in the first quarter related to the acquisition of CoTherix
The full financial statements can be found on http://www.actelion.com
Continued growth of total net revenues
During 2007, total net revenues increased by 39 percent to CHF 1.32 billion (FY 2006: CHF 945.7 m). Contract revenues for the 2007 amounted to CHF 25.3 million (FY 2006: CHF 21.5 m).
Tracleer® sales
During the full year 2007, Tracleer® (bosentan) sales were CHF 1.18 billion (FY 2006: CHF 898.7 m), an increase of 31 percent compared to the same period last year.
At the end of December 2007, Tracleer® was commercially available in over 30 countries worldwide, including all major pharmaceutical markets.
Otto Schwarz, President Business Operations, commented: “This strong growth for Tracleer® is remarkable, especially considering that new competition entered the market in 2007 within the class of endothelin receptor antagonists, in particular in the United States. Actelion’s in-depth knowledge of the PAH market, our highly professional and determined worldwide marketing and sales force, continued medical education activities, and further geographical expansion were the basis for maintaining leadership and further growth.”
In 2007, Actelion submitted an application to Health Authorities worldwide to expand the indication of Tracleer® for patients with PAH in WHO Functional Class II, based on the results of the EARLY study, the only study ever conducted to investigate the effects of a PAH therapy specifically in this patient population. In the EARLY study, Tracleer® showed a significant effect on delaying time to clinical worsening, a measure of disease progression.
In June 2007, the EMEA granted approval in the European Union for an expansion of the indication of Tracleer® for reducing the number of new digital ulcers in patients suffering from systemic sclerosis and ongoing digital ulcer disease. Digital ulcers are a serious and very debilitating consequence of this disease.
From the CoTherix acquisition date in early January 2007, Ventavis® (iloprost) sales reached CHF 78.2 million. On a like-for-like basis, taking into account the pre-acquisition period Ventavis® sales grew by 24 percent in local currency terms year on year.
I n early Q4 2007, Actelion launched – next to its existing strong educational outreach to physicians - additional patient support programs and convenience improvements for the current Ventavis® device. In 2008, Actelion also will conduct a placebo-controlled study to further improve the current device.
Otto Schwarz added: “Furthermore in 2008, our key focus will be on expanding both product sales as well as the PAH market place in general. With increased educational activity by several companies now active in this area, we are already seeing the first signs of increased interest that should lead to further increases in diagnosis rates and prescriptions. With the acquisition of US rights of Ventavis® and the advanced clinical development, we are also demonstrating our continuous commitment to the PAH space.”
Total sales of Zavesca® (miglustat) during 2007 were CHF 35.3 million (FY 2006: CHF 25.5 m). Zavesca® is commercially available in the United States and in most European markets.
Otto Schwarz concluded: ”Actelion has been very successful in so-called orphan drug applications, generating Tracleer® sales in excess of 1 billion Swiss Francs. This is usually the hallmark of medicines prescribed by general practitioners (GP). With a rapidly maturing pipeline comprising medicines such as almorexant that might one day reach the General Practitioner’s office, Actelion is now preparing to successfully manage this next challenge in the not-so distant future.”
Operating expenses – Focus on accelerated R&D investment
During 2007, operating expenses were CHF 1.18 billion, including an In-Process Research and Development (IPRD) charge related to the acquisition of CoTherix of CHF 224.8 million incurred in the first quarter (FY 2006: CHF 677.5 m).
During the same period, research and development expenses increased by 38 percent to CHF 292.1 million (FY 2006: CHF 211.8 m). Actelion’s pipeline now has 10 compounds in clinical development as well as multiple projects in pre-clinical development. In 2007, the level of operational activity in clinical development has significantly increased. Compared to 2006, the number of patients or healthy volunteers enrolled in clinical trials increased by 39 percent. This number is expected to grow significantly in the future, mostly driven by the large number of Phase III programs.
The five ongoing Phase III programs are (in alphabetical order):
Actelion-1 in Pulmonary Arterial Hypertension: The pivotal program evaluating this tissue-targeting endothelin receptor antagonist in pulmonary arterial hypertension was initiated in December 2007. The program will enroll around 500 patients worldwide, aiming at a morbidity/mortality claim. Study results are expected in several years.
Almorexant: The comprehensive Phase III program RESTORA (REstore physiological Sleep with The Orexin Receptor antagonist Almorexant) was initiated in December 2007. The first Phase III study, RESTORA 1, is designed to evaluate efficacy and safety of almorexant in patients diagnosed with primary insomnia. RESTORA 1 is evaluating the effects of almorexant on sleep induction and sleep maintenance, effects previously observed in earlier studies. This study is also expected to provide additional information on sleep architecture and sleep quality, thereby providing further insight into the role of almorexant in restoring normal physiological sleep. RESTORA 1 includes an active reference arm with zolpidem to generate reference information with this agent approved for the treatment of insomnia. Additional RESTORA studies will be initiated throughout 2008, with first results expected in 2009.
Bosentan (Tracleer®) in IPF: The pivotal Phase III study BUILD-3 evaluates the safety and efficacy of this dual endothelin receptor antagonist in 390 patients suffering from idiopathic pulmonary fibrosis (IPF). Enrollment in th i s event-driven study, which was reviewed under a special protocol assessment (SPA) by the US Food and Drug Administration, is expected to close before mid-2008. Study results are expected in late 2009.
Clazosentan in aSAH: The pivotal Phase III study CONSCIOUS-2 (Clazosentan to Overcome Neurological iSChemia and Infarct OccUrring after Subarachnoid hemorrhage) was initiated in November of 2007. It will measure the clinical benefits of clazosentan through the primary endpoint of vasospasm-related morbidity and all-cause mortality, which includes neurological deterioration, new brain infarcts, introduction of vasospasm rescue therapy or death from any cause. CONSCIOUS-2 is a global study which will include a minimum of 765 patients with aSAH and aneurismal surgical clipping from more than 100 centers outside the United States. As of February 2008, discussions with the US Food and Drug Administration (FDA) are ongoing; it is planned to include an additional 24 centers in the United States. Study results may become available in the second half of 2009.
Tezosentan in acute cardiovascular care: The first Phase III study evaluating safety and efficacy of this i.v. endothelin receptor antagonist for reduction of clinically relevant right ventricular failure (RVF) associated with difficult separation from bypass (DSB) in 270 patients undergoing cardiac surgery with cardiopulmonary bypass (CPB) is close to full enrollment, with results expected by mid-2008. If positive, Actelion will then immediately perform a similar second pivotal study to compile a full registration dossier.
Isaac Kobrin, M.D. and Head of Clinical Development commented: ”Throughout 2007, our key focus has been on strengthening our clinical development capabilities. Actelion is now running several large clinical trial programs in parallel. Our focus in 2008 will therefore be on both execution of our large programs and on ensuring that our novel compounds reaching the clinical stage are also appropriately evaluated.”
Additional clinical programs ongoing in 2008 are focusing on areas such as cardiovascular disorders (Renin inhibitor partnered in 2003 with Merck & Co., Inc., entered Phase II in December 2007), genetic disorders (Miglustat (Zavesca®) in cystic fibrosis Phase IIa initiated in H2 2007), allergy (CRTH2 antagonist, Phase IIa initiated in early 2008), autoimmune disorders (selective S1P1 receptor agonist, partnered in 2006 with Roche, Phase I ongoing). In Drug Discovery, there are multiple programs ongoing that should result in new compounds entering into man.
In February 2008, Actelion has taken the decision to withdraw the application for the extension of indication on the use of miglustat (Zavesca®) for the treatment of progressive neurological manifestations in patients with Niemann-Pick type C disease (NP-C). This decision was taken following an oral explanation with the European Committee for Medicinal Products for Human Use (CHMP) and Actelion is currently evaluating its options to resubmit an application at a later stage. At that point in time, new, relevant data from an ongoing survey of NP-C patients treated with miglustat could be provided in order to support an extension of indication.
In 2007, marketing and advertising expenses were CHF 234.1 million (FY 2006: 185.5 m). The increase is the result of ongoing investments to strengthening product sales in all territories worldwide, focusing especially in the PAH area on both education and the generation of additional clinical data sets, such as combination data.
Selling, general and administrative expenses for the full year 2007 amounted to CHF 266.1 million (FY 2006: CHF 185.1 m). Actelion continues to increase its investment into a global infrastructure to support long-term growth for its existing products as well as ensuring that future products can be launched efficiently either by Actelion alone or with its pa rtners.
Operating profit
Actelion’s operating profit for the 2007 was CHF 142.6 million (FY 2006: CHF 268.2 m). Cash EBIT for the same period amounted to CHF 471.4 million (FY 2006: CHF 320.4 m), an increase of 47 percent.
Net Profit
For the full year 2007, the net profit of CHF 124.6 million (FY 2006: CHF 241.1 m) includes interest income of CHF 20.4 million, interest expense of CHF 0.2 million, a non-cash charge on the Convertible Bonds of CHF 4.1 million, foreign currency gains of CHF 9.6 million and an income tax expense of CHF 43.7 million. The effective tax rate for the year (not including the IPRD charge related to the acquisition of CoTherix) was 11 per cent.
Cash and cash flow
During 2007, Actelion generated net cash flow from operations of CHF 394.2 million (FY 2006: CHF 352.8 m).
Strong talent growth
At the end of 2007, Actelion employed 1,592 employees worldwide, an increase of more than 300 compared to the end of 2006. Of those 1,592 employees, 677 were located in Switzerland (2006: 551 employees).
In 2008, Actelion expects to increase its global work force to around 1950 employees. In Switzerland, Actelion expects to employ by year-end 2008 more than 800 employees
For documentation purposes – table Q4 2007 vs. Q3 2007
In CHF thousands
Results
Q4 2007
Results
Q3 2007
Variance
%
Net Revenues(2)
370,943
320,098
50,845
16
Operating Expenses
268,770
228,873
39,897
17
- Research and Development
82,125
74,817
7,308
10
- Marketing and Advertising
69,467
52,320
17,147
33
- Selling, General and Admin.
73,662
61,716
11,946
19
Operating Income
102,173
91,225
10,948
12
Cash EBIT
122,460
117,998
4,462
4
Net Income
88,453
89,086
(633)
(1)
Diluted EPS in CHF
0.71
0.70
0.01
1
No of shares in calculation (in million)
123,786
126,428
-
-
(2)A proportion of the quarterly increases or decreases in Tracleer® and Ventavis® sales might be attributable to buying pattern variations
###
NOTE TO THE SHAREHOLDERS:
The Annual General Meeting of Shareholders approving the Business Report of the year ending 31 December 2007 will be held on 11 April 2008.
Shareholders holding more than CHF 1 million nominal value of shares (i.e. 2’000'000 shares at nominal value of CHF 0.50), being entitled to add items to the agenda of the general meeting of shareholders, are invited to send in proposals, if any, for the Annual General Meeting of Shareholders on 11 April 2008 to Actelion Ltd, attention Corporate Secretary, Gewerbestrasse 16, CH-4123 Allschwil, to arrive no later than 3 March 2008. Any proposal received after the given deadline will be disregarded.
In order to attend and vote at the Annual General Meeting of Shar eholders, shareholders must be registered in the Company's shareholders register by 31 March 2008 at the latest.
Please note that the Annual Report 2007 will be available in early March 2008, both in hard copy as well as on the Company website www.actelion.com
Media and Analyst Conference 2008
Actelion will host a Media and Analyst conference and Webcast on
Thursday, 21 February 2008, 10.30 Basel (CET) / 04.30 a.m. US (EST) / 09.30 UK (GMT).
Conference Call
Dial:
Europe:
0041 44 580 64 03
US:
001 866 895 8561
UK:
0044 207 153 99 62
Participants mode: Listen only
Webcast – Live and replay on demand
Actelion will webcast it Media and Analyst Conference. On the web, you may either follow the conference live or have it replayed later on demand. To access the webcast live, simply visit the link on our homepage http://www.actelion.com 10 – 15 minutes before the conference is due to start. If you experience any access problems go directly to the URL: http://gaia.world-television.com/actelion/20080221/trunc/.
Participants mode: Listen and watch only
Webcast replay:
The archived Investor webcast will be available for replay through http://www.actelion.com/ approximately 60 minutes after the call has ended.
Actelion Ltd
Actelion Ltd is a biopharmaceutical company with its corporate headquarters in Allschwil/Basel, Switzerland. Actelion's first drug Tracleer®, an orally available dual endothelin receptor antagonist, has been approved as a therapy for pulmonary arterial hypertension. Actelion markets Tracleer® through its own subsidiaries in key markets worldwide, including the United States (based in South San Francisco), the European Union, Japan, Canada, Australia and Switzerland. Actelion, founded in late 1997, is a leading player in innovative science related to the endothelium – the single layer of cells separating every blood vessel from the blood stream. Actelion focuses on the discovery, development and marketing of innovative drugs for significant unmet medical needs. Actelion shares are traded on the SWX Swiss Exchange (ticker symbol: ATLN).
For further information please contact:
Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil
Roland Haefeli
Vice President, Head of Investor Relations & Public Affairs
+41 61 565 62 62
+1 650 624 69 36
http://www.actelion.com
Actelion hat die Erwartungen übertroffen
Allschwil (AWP) - Actelion steigerte im Geschäftsjahr 2007 den Nettoumsatzerlös um 39% auf 1'317,4 Mio CHF. Davon entfielen 1'178,6 Mio CHF (+31%) auf das Hauptprodukt Tracleer, das bei Lungenhochdruck (pulmonale arterielle Hypertonie, PAH) eingesetzt wird. Der betriebliche Aufwand stieg auf 1'174,8 (677,5) Mio CHF. Darin enthalten sei ein im ersten Quartal angefallener In-Process-R&D-Aufwand (IBRD) im Zusammenhang mit der Akquisition von CoTherix in der Höhe von 224,8 Mio CHF, wie das biopharmazeutische Unternehmen am Donnerstag mitteilte.
Das Betriebsergebnis sank auf 142,6 (268,2) Mio CHF. Für das laufende Geschäftsjahr rechnet das Management mit einem Wachstum der Nettoumsatzerlöse in lokalen Währungen "im niedrigen zweistelligen Prozentbereich".
Actelion weist zudem einen Cash-EBIT aus, der dem Betriebsergebnis ohne nicht-cashwirksame Belastungen wie laufende F&E-Projekte, Belastungen in Verbindung mit Aktienoptionen für Mitarbeitende sowie Amortisationen und Abschreibungen entspricht. Dieser erhöhte sich im Berichtsjahr um 47% auf 471,4 Mio CHF.
Unter dem Strich sinkt der Reingewinn auf 124,6 (241,1) Mio CHF. In der Folge hat sich der vollständig verwässerte Gewinn pro Aktie (EPS) nach US-GAAP für 2007 auf 1,00 (2,05) CHF verringert.
Das biopharmazeutische Unternehmen hat beim Cash-EBIT, Betriebs- und Reingewinn die Analystenschätzungen übertroffen. Analysten haben im Durchschnitt (AWP-Konsens) mit Cash-EBIT von 464,9 Mio CHF, einem EBIT von 133,4 Mio CHF und einem Reingewinn von 123,3 Mio CHF gerechnet.
Im Berichtsjahr stieg der Netto-Cashflow aus betrieblicher Tätigkeit auf 394,2 (352,8) Mio CHF erhöht.
Die Anzahl Mitarbeiter nahm markant um 313 auf 1'592 zu. Davon waren 677 (551) in der Schweiz beschäftigt.
CEO Jean-Paul Clozel attestiert dem Unternehmen für das Berichtsjahr "eine tadellose Leistung". CoTherix habe erfolgreich integriert werden können. Dadurch habe Actelion in den USA mit Ventavis/Iloprost ein drittes Produkt am Markt platziert. Mit Ventavis erzielte Actelion einen Umsatz von 78,2 Mio CHF. Zudem sei die klinische und präklinische Pipeline "deutlich angewachsen und schnell gereift".
Derzeit hat das Unternehmen 10 Substanzen in der klinischen Entwicklung, davon fünf Projekte in der letzten Phase der klinischen Prüfung. Entsprechend sind die Kosten für die Forschung und Entwicklung um 38% auf 292,1 (211,8) Mio CHF angewachsen.
In Phase-III-Programmen sind Actelion-1 zur Therapierung von pulmonaler arterieller Hypertonie. An diesem Programm seien rund 500 Patienten beteiligt; Ergebnisse würden "in einigen Jahren" erwartet, so die Mitteilung.
Für das Schlafmittel Almorexant wurde das Phase-III-Programm RESTORA im Dezember 2007 begonnen. Im laufenden Geschäftsjahr sollen weitere Studien anlaufen. Erste Ergebnisse werden für 2009 in Aussicht gestellt. Almorexant wird vom Management grosses Potenzial attestiert. Die Suche nach einem Partner zur Weiterentwicklung und Lancierung des Medikaments haben, wie bereits früher gemeldet, begonnen.
Eine zulassungsrelevante und mit der US-Gesundheitsbehörde FDA koordinierte Phase-III-Studie BUILD-3 ist für Bosentan (Tracleer) unterwegs. Diese Prüfung soll Mitte 2008 angeschlossen werden. Ergebnisse werden für Ende 2009 erwartet.
Für Clazosentan gegen aneurysmatische Subarachnoidalblutungen ist im November 2007 mit der Patientenrekrutierung für die zulassungsrelevante Phase-III-Studie CONSCIOUS-2 angefangen worden. Seit diesem Monat würden Gespräche mit der FDA laufen. Die Ergebnisse aus der Studie sollen in der zweiten Jahreshälfte 2009 vorliegen.
Schliesslich ist für Tezosentan zur Sicherstellung der akuten kardiovaskulären Versorgung die erste Phase-III-Studie angelaufen. Ergebnisse würden für Mitte 2008 erwartet. Bei einem positiven Ausgang der Tests soll eine zulassungsrelevante Studie in Angriff genommen werden.
Weitere klinische Programme sind in der Bereichen kardiovaskuläre Erkrankungen (Renin-Hemer), genetisch bedingte Erkrankungen (Miglustat), Allergien (CRTH2-Antagonist), Autoimmunerkrankungen (S1P1-Rezeptor-Antagonist) am Laufen.
Bei Miglustat habe das Unternehmen einen Antrag auf eine Indikationserweiterung zur Behandlung der Erkrankung Niemann-Pick Typ C bei der EU-Behörde zurückgezogen. Ein neuer Antrag soll später gestellt werden.
Für das laufende Geschäftsjahr 2008 erwartet CFO Andrew J. Oakley ein Wachstum der Nettoumsatzerlöse in lokalen Währungen "im niedrigen zweistelligen Prozentbereich". In Folge der beschleunigten Investitionen in F&E sollen die betrieblichen Margen leicht zurück gehen, wobei der Cash-EBIT unverändert bleiben oder in den mittleren einstelligen Prozentbereich zurückgehen dürfte.
Die Performance könnte sowohl beim Umsatz als auch beim Gewinn von einem Abkommen zur Partnerschaft für Almorexant positiv beeinflusst werden. Der operative Betriebsgewinn und der Reingewinn würden 2008 gemäss GAAP angesichts des Wegfalls des 2007 verbuchten hohen IPRD-Aufwands "signifikant" steigen, so Oakley weiter.
rt/ra
http://www.cash.ch/news/story/449/162249/40/40
Allschwil (AWP) - Actelion steigerte im Geschäftsjahr 2007 den Nettoumsatzerlös um 39% auf 1'317,4 Mio CHF. Davon entfielen 1'178,6 Mio CHF (+31%) auf das Hauptprodukt Tracleer, das bei Lungenhochdruck (pulmonale arterielle Hypertonie, PAH) eingesetzt wird. Der betriebliche Aufwand stieg auf 1'174,8 (677,5) Mio CHF. Darin enthalten sei ein im ersten Quartal angefallener In-Process-R&D-Aufwand (IBRD) im Zusammenhang mit der Akquisition von CoTherix in der Höhe von 224,8 Mio CHF, wie das biopharmazeutische Unternehmen am Donnerstag mitteilte.
Das Betriebsergebnis sank auf 142,6 (268,2) Mio CHF. Für das laufende Geschäftsjahr rechnet das Management mit einem Wachstum der Nettoumsatzerlöse in lokalen Währungen "im niedrigen zweistelligen Prozentbereich".
Actelion weist zudem einen Cash-EBIT aus, der dem Betriebsergebnis ohne nicht-cashwirksame Belastungen wie laufende F&E-Projekte, Belastungen in Verbindung mit Aktienoptionen für Mitarbeitende sowie Amortisationen und Abschreibungen entspricht. Dieser erhöhte sich im Berichtsjahr um 47% auf 471,4 Mio CHF.
Unter dem Strich sinkt der Reingewinn auf 124,6 (241,1) Mio CHF. In der Folge hat sich der vollständig verwässerte Gewinn pro Aktie (EPS) nach US-GAAP für 2007 auf 1,00 (2,05) CHF verringert.
Das biopharmazeutische Unternehmen hat beim Cash-EBIT, Betriebs- und Reingewinn die Analystenschätzungen übertroffen. Analysten haben im Durchschnitt (AWP-Konsens) mit Cash-EBIT von 464,9 Mio CHF, einem EBIT von 133,4 Mio CHF und einem Reingewinn von 123,3 Mio CHF gerechnet.
Im Berichtsjahr stieg der Netto-Cashflow aus betrieblicher Tätigkeit auf 394,2 (352,8) Mio CHF erhöht.
Die Anzahl Mitarbeiter nahm markant um 313 auf 1'592 zu. Davon waren 677 (551) in der Schweiz beschäftigt.
CEO Jean-Paul Clozel attestiert dem Unternehmen für das Berichtsjahr "eine tadellose Leistung". CoTherix habe erfolgreich integriert werden können. Dadurch habe Actelion in den USA mit Ventavis/Iloprost ein drittes Produkt am Markt platziert. Mit Ventavis erzielte Actelion einen Umsatz von 78,2 Mio CHF. Zudem sei die klinische und präklinische Pipeline "deutlich angewachsen und schnell gereift".
Derzeit hat das Unternehmen 10 Substanzen in der klinischen Entwicklung, davon fünf Projekte in der letzten Phase der klinischen Prüfung. Entsprechend sind die Kosten für die Forschung und Entwicklung um 38% auf 292,1 (211,8) Mio CHF angewachsen.
In Phase-III-Programmen sind Actelion-1 zur Therapierung von pulmonaler arterieller Hypertonie. An diesem Programm seien rund 500 Patienten beteiligt; Ergebnisse würden "in einigen Jahren" erwartet, so die Mitteilung.
Für das Schlafmittel Almorexant wurde das Phase-III-Programm RESTORA im Dezember 2007 begonnen. Im laufenden Geschäftsjahr sollen weitere Studien anlaufen. Erste Ergebnisse werden für 2009 in Aussicht gestellt. Almorexant wird vom Management grosses Potenzial attestiert. Die Suche nach einem Partner zur Weiterentwicklung und Lancierung des Medikaments haben, wie bereits früher gemeldet, begonnen.
Eine zulassungsrelevante und mit der US-Gesundheitsbehörde FDA koordinierte Phase-III-Studie BUILD-3 ist für Bosentan (Tracleer) unterwegs. Diese Prüfung soll Mitte 2008 angeschlossen werden. Ergebnisse werden für Ende 2009 erwartet.
Für Clazosentan gegen aneurysmatische Subarachnoidalblutungen ist im November 2007 mit der Patientenrekrutierung für die zulassungsrelevante Phase-III-Studie CONSCIOUS-2 angefangen worden. Seit diesem Monat würden Gespräche mit der FDA laufen. Die Ergebnisse aus der Studie sollen in der zweiten Jahreshälfte 2009 vorliegen.
Schliesslich ist für Tezosentan zur Sicherstellung der akuten kardiovaskulären Versorgung die erste Phase-III-Studie angelaufen. Ergebnisse würden für Mitte 2008 erwartet. Bei einem positiven Ausgang der Tests soll eine zulassungsrelevante Studie in Angriff genommen werden.
Weitere klinische Programme sind in der Bereichen kardiovaskuläre Erkrankungen (Renin-Hemer), genetisch bedingte Erkrankungen (Miglustat), Allergien (CRTH2-Antagonist), Autoimmunerkrankungen (S1P1-Rezeptor-Antagonist) am Laufen.
Bei Miglustat habe das Unternehmen einen Antrag auf eine Indikationserweiterung zur Behandlung der Erkrankung Niemann-Pick Typ C bei der EU-Behörde zurückgezogen. Ein neuer Antrag soll später gestellt werden.
Für das laufende Geschäftsjahr 2008 erwartet CFO Andrew J. Oakley ein Wachstum der Nettoumsatzerlöse in lokalen Währungen "im niedrigen zweistelligen Prozentbereich". In Folge der beschleunigten Investitionen in F&E sollen die betrieblichen Margen leicht zurück gehen, wobei der Cash-EBIT unverändert bleiben oder in den mittleren einstelligen Prozentbereich zurückgehen dürfte.
Die Performance könnte sowohl beim Umsatz als auch beim Gewinn von einem Abkommen zur Partnerschaft für Almorexant positiv beeinflusst werden. Der operative Betriebsgewinn und der Reingewinn würden 2008 gemäss GAAP angesichts des Wegfalls des 2007 verbuchten hohen IPRD-Aufwands "signifikant" steigen, so Oakley weiter.
rt/ra
http://www.cash.ch/news/story/449/162249/40/40
off-topic:
25.02.2008 12:28:02
S&P: Patentabläufe werden Konsolidierung in Pharmabranche wieder verstärken
FRANKFURT (dpa-AFX) - Die Konsolidierung in der Pharmabranche wird sich nach
Ansicht der Ratingagentur Standard & Poor's (S&P) aufgrund von Patentabläufen in
den kommenden zwei bis vier Jahren wieder verstärken. 'Es wird für einige
Unternehmen eine Sackgasse geben', sagte Olaf Tölke, Ratinganalyst für
europäische Pharmaunternehmen am Montag in Frankfurt.
Bis 2012 würden einige Konzerne erhebliche Umsatzanteile verlieren. Pfizer büße
durch das Auslaufen von Patenten, etwa für den Blutfettsenker Lipitor und die
Potenzpille Viagra, nach S&P-Schätzungen 41 Prozent an Umsatz und die Hälfte
seines Gewinns ein. Solche Rückgänge seien ohne Akquisitionen nicht aufzufangen,
sagte Tölke./sc/she/wiz
Quelle: dpa-AFX
25.02.2008 12:28:02
S&P: Patentabläufe werden Konsolidierung in Pharmabranche wieder verstärken
FRANKFURT (dpa-AFX) - Die Konsolidierung in der Pharmabranche wird sich nach
Ansicht der Ratingagentur Standard & Poor's (S&P) aufgrund von Patentabläufen in
den kommenden zwei bis vier Jahren wieder verstärken. 'Es wird für einige
Unternehmen eine Sackgasse geben', sagte Olaf Tölke, Ratinganalyst für
europäische Pharmaunternehmen am Montag in Frankfurt.
Bis 2012 würden einige Konzerne erhebliche Umsatzanteile verlieren. Pfizer büße
durch das Auslaufen von Patenten, etwa für den Blutfettsenker Lipitor und die
Potenzpille Viagra, nach S&P-Schätzungen 41 Prozent an Umsatz und die Hälfte
seines Gewinns ein. Solche Rückgänge seien ohne Akquisitionen nicht aufzufangen,
sagte Tölke./sc/she/wiz
Quelle: dpa-AFX
Actelion and Nippon Shinyaku to collaborate on novel PAH compound
29 Mar 2008
Actelion Ltd and Nippon Shinyaku announced today the two companies have signed a binding letter of intent regarding Nippon Shinyaku's novel PGI-2 receptor agonist NS-304
ALLSCHWIL/BASEL, Switzerland and KYOTO, Japan | February 29, 2008 | Actelion Ltd (SWX: ATLN) and Nippon Shinyaku (TYO: 4516) announced today the two companies have signed a binding letter of intent regarding Nippon Shinyaku's novel PGI-2 receptor agonist NS-304.
NS-304, originally discovered and synthesized by Nippon Shinyaku, is an orally available long acting prostaglandin I2 (PGI-2) receptor agonist, which stimulates PGI-2 receptors in blood vessels and exerts vasodilating effects. NS-304 has major potential as a novel treatment of PAH. Nippon Shinyaku has recently completed phase I evaluation in the United Kingdom. A phase II program in PAH patients was initiated in Europe at the end of 2007.
This binding letter of intent foresees that Actelion will be responsible for global development and commercialization of NS-304 outside Japan, whereas the two companies will co-develop and co-commercialize in Japan. Nippon Shinyaku and Actelion expect to conclude and sign the related licensing agreement within the next few months.
Financial details are not disclosed.
Shigenobu Maekawa, President of Nippon Shinyaku, commented: “It is our great pleasure that Actelion’s proper evaluation of NS-304 has resulted in this collaboration. We believe that this collaboration will bring NS-304 to PAH patients as soon as possible and to provide them with a truly novel and important treatment option.”
Jean-Paul Clozel, M.D. and Chief Executive Officer of Actelion, commented: "We are very pleased to work with Nippon Shinyaku to fully realize the potential of their innovative breakthrough. Together with Actelion's exceptional expertise in the area of pulmonary arterial hypertension, be it development or marketing, I am confident that the two parties have the best chance to again improve PAH care in the coming years."
Satoshi Tanaka, Dr. med. Sci., President and Representative Director of Actelion Pharmaceuticals Japan Ltd. commented: ”Actelion is the recognized leader in pulmonary arterial hypertension, also providing PAH patients in Japan with Tracleer®, an orally available dual endothelin receptor antagonist. The combination of the two clinical teams from Nippon Shinyaku and Actelion will result in first-in-class clinical development for this promising compound, inside and outside Japan.”
About Pulmonary Arterial Hypertension (PAH)
Pulmonary arterial hypertension (PAH) is a chronic, life-threatening disorder characterized by abnormally high blood pressure in the arteries between the heart and lungs of an affected individual. The function of the heart and lungs is severely compromised, manifested by a limited exercise capacity, and, ultimately, a reduced life expectancy. Approximately 100,000 people in Europe and the United States are afflicted with either primary or secondary forms of the disease related to conditions or tissue disorders that affect the lungs, such as scleroderma, lupus, HIV/AIDS or congenital heart disease.
PAH is associated with structural changes in both the pulmonary vasculature and the right ventricle. Recent advances [1] in the understanding of the pathogenic factors leading to the pulmonary vascular disease have led to the development of new therapies targeting specific pathways (the prostacyclin pathway; the endothelin pathway; and the nitric oxide pathway) [2]. The available therapies have positive effects in PAH, but they do not provide a cure, and in many patients the disease will progress. PAH remains a serious life-threatening condition [2,3]. Early recognition and an understanding of the selection and timing of therapeutic options remain critical elements in the optimal management of patients with this disorder.
About Tracleer® in Pulmonary Arterial Hypertension (PAH)
Tracleer® (bosentan), the first oral dual endothelin receptor antagonist, is approved for the treatment of pulmonary arterial hypertension (PAH) and made available by Actelion subsidiaries in the United States, the European Union, Japan, Australia, Canada, Switzerland and other markets worldwide.
Requires attention to two significant safety concerns: Potential for serious liver injury (including rare cases of liver failure and unexplained hepatic cirrhosis in a setting of close monitoring) - Liver monitoring of all patients is essential prior to initiation of treatment and monthly thereafter. Tracleer® treatment must not be initiated in women of childbearing potential unless they practice reliable contraception and participate in monthly pregnancy testing. Due to these risks, Tracleer® is only supplied through a controlled distribution.
References
1. Farber HW; Loscalzo J. Mechanisms of disease: pulmonary arterial hypertension. N. Eng. J. Med. 2004; 351: 1655–65.
2. Humbert M; Sitbon O; Simonneau G. Treatment of pulmonary arterial hypertension. N. Eng. J. Med. 2004; 351: 1425–36.
3. Humbert M; Morrell NW; Archer SL; et al. Cellular and molecular pathobiology of pulmonary arterial hypertension. J. Am. Coll. Cardiol. 2004; 43: Suppl. 12: 13S–24S.
4. Tracleer® SPC.
SOURCE: ACTELION
http://www.pipelinereview.com/content/view/18052/109/
29 Mar 2008
Actelion Ltd and Nippon Shinyaku announced today the two companies have signed a binding letter of intent regarding Nippon Shinyaku's novel PGI-2 receptor agonist NS-304
ALLSCHWIL/BASEL, Switzerland and KYOTO, Japan | February 29, 2008 | Actelion Ltd (SWX: ATLN) and Nippon Shinyaku (TYO: 4516) announced today the two companies have signed a binding letter of intent regarding Nippon Shinyaku's novel PGI-2 receptor agonist NS-304.
NS-304, originally discovered and synthesized by Nippon Shinyaku, is an orally available long acting prostaglandin I2 (PGI-2) receptor agonist, which stimulates PGI-2 receptors in blood vessels and exerts vasodilating effects. NS-304 has major potential as a novel treatment of PAH. Nippon Shinyaku has recently completed phase I evaluation in the United Kingdom. A phase II program in PAH patients was initiated in Europe at the end of 2007.
This binding letter of intent foresees that Actelion will be responsible for global development and commercialization of NS-304 outside Japan, whereas the two companies will co-develop and co-commercialize in Japan. Nippon Shinyaku and Actelion expect to conclude and sign the related licensing agreement within the next few months.
Financial details are not disclosed.
Shigenobu Maekawa, President of Nippon Shinyaku, commented: “It is our great pleasure that Actelion’s proper evaluation of NS-304 has resulted in this collaboration. We believe that this collaboration will bring NS-304 to PAH patients as soon as possible and to provide them with a truly novel and important treatment option.”
Jean-Paul Clozel, M.D. and Chief Executive Officer of Actelion, commented: "We are very pleased to work with Nippon Shinyaku to fully realize the potential of their innovative breakthrough. Together with Actelion's exceptional expertise in the area of pulmonary arterial hypertension, be it development or marketing, I am confident that the two parties have the best chance to again improve PAH care in the coming years."
Satoshi Tanaka, Dr. med. Sci., President and Representative Director of Actelion Pharmaceuticals Japan Ltd. commented: ”Actelion is the recognized leader in pulmonary arterial hypertension, also providing PAH patients in Japan with Tracleer®, an orally available dual endothelin receptor antagonist. The combination of the two clinical teams from Nippon Shinyaku and Actelion will result in first-in-class clinical development for this promising compound, inside and outside Japan.”
About Pulmonary Arterial Hypertension (PAH)
Pulmonary arterial hypertension (PAH) is a chronic, life-threatening disorder characterized by abnormally high blood pressure in the arteries between the heart and lungs of an affected individual. The function of the heart and lungs is severely compromised, manifested by a limited exercise capacity, and, ultimately, a reduced life expectancy. Approximately 100,000 people in Europe and the United States are afflicted with either primary or secondary forms of the disease related to conditions or tissue disorders that affect the lungs, such as scleroderma, lupus, HIV/AIDS or congenital heart disease.
PAH is associated with structural changes in both the pulmonary vasculature and the right ventricle. Recent advances [1] in the understanding of the pathogenic factors leading to the pulmonary vascular disease have led to the development of new therapies targeting specific pathways (the prostacyclin pathway; the endothelin pathway; and the nitric oxide pathway) [2]. The available therapies have positive effects in PAH, but they do not provide a cure, and in many patients the disease will progress. PAH remains a serious life-threatening condition [2,3]. Early recognition and an understanding of the selection and timing of therapeutic options remain critical elements in the optimal management of patients with this disorder.
About Tracleer® in Pulmonary Arterial Hypertension (PAH)
Tracleer® (bosentan), the first oral dual endothelin receptor antagonist, is approved for the treatment of pulmonary arterial hypertension (PAH) and made available by Actelion subsidiaries in the United States, the European Union, Japan, Australia, Canada, Switzerland and other markets worldwide.
Requires attention to two significant safety concerns: Potential for serious liver injury (including rare cases of liver failure and unexplained hepatic cirrhosis in a setting of close monitoring) - Liver monitoring of all patients is essential prior to initiation of treatment and monthly thereafter. Tracleer® treatment must not be initiated in women of childbearing potential unless they practice reliable contraception and participate in monthly pregnancy testing. Due to these risks, Tracleer® is only supplied through a controlled distribution.
References
1. Farber HW; Loscalzo J. Mechanisms of disease: pulmonary arterial hypertension. N. Eng. J. Med. 2004; 351: 1655–65.
2. Humbert M; Sitbon O; Simonneau G. Treatment of pulmonary arterial hypertension. N. Eng. J. Med. 2004; 351: 1425–36.
3. Humbert M; Morrell NW; Archer SL; et al. Cellular and molecular pathobiology of pulmonary arterial hypertension. J. Am. Coll. Cardiol. 2004; 43: Suppl. 12: 13S–24S.
4. Tracleer® SPC.
SOURCE: ACTELION
http://www.pipelinereview.com/content/view/18052/109/
03.04.2008 13:42:58
Actelion verfügt über Potenzial
München (aktiencheck.de AG) - Nach Ansicht der Experten von "FOCUS-MONEY" verfügt die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) über Potenzial. Erstmals habe der Umsatz der Actelion AG, die 1997 gegründet worden sei, im letzten Jahr die Hürde von einer Mrd. CHF genommen. Die Einnahmen hätten sich um 39% auf 1,32 Mrd. CHF (840 Mio. Euro) erhöht. Genauso beeindruckend wie die finanzielle Situation sei die Pipeline. Gleich sechs Produkte befänden sich in der Phase III, dem letzten Stadium der klinischen Prüfung von neuen Medikamenten. Nahezu kein Biotech-Unternehmen dieses Alters verfüge über eine so fortgeschrittene Pipeline. Wegen seines neuartigen Wirkmechanismus genieße das Schlafmittel Almorexant besondere Aufmerksamkeit in dem Sextett. Eine Verpartnerung sei in den nächsten sechs Monaten wahrscheinlich. Verpartnerung bedeute, dass ein Unternehmen - oft für Millionensummen und eine Umsatzbeteiligung - die Vermarktungsrechte an einem Medikament erwerbe. Kaum ein Biotech-Unternehmen in Europa sei so gut positioniert wie Actelion. Die Veräußerung der Almorexant-Vermarktungsrechte und Übernahmefantasien könnten der Aktie Antrieb verleihen. Nach Ansicht der Experten von "FOCUS-MONEY" verfügt die Aktie von Actelion über Potenzial. Zur Absicherung sollte ein Stoppkurs bei 31,50 Euro platziert werden. (Ausgabe 15) (03.04.2008/ac/a/a)
Quelle: AKTIENCHECK.DE
Actelion verfügt über Potenzial
München (aktiencheck.de AG) - Nach Ansicht der Experten von "FOCUS-MONEY" verfügt die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) über Potenzial. Erstmals habe der Umsatz der Actelion AG, die 1997 gegründet worden sei, im letzten Jahr die Hürde von einer Mrd. CHF genommen. Die Einnahmen hätten sich um 39% auf 1,32 Mrd. CHF (840 Mio. Euro) erhöht. Genauso beeindruckend wie die finanzielle Situation sei die Pipeline. Gleich sechs Produkte befänden sich in der Phase III, dem letzten Stadium der klinischen Prüfung von neuen Medikamenten. Nahezu kein Biotech-Unternehmen dieses Alters verfüge über eine so fortgeschrittene Pipeline. Wegen seines neuartigen Wirkmechanismus genieße das Schlafmittel Almorexant besondere Aufmerksamkeit in dem Sextett. Eine Verpartnerung sei in den nächsten sechs Monaten wahrscheinlich. Verpartnerung bedeute, dass ein Unternehmen - oft für Millionensummen und eine Umsatzbeteiligung - die Vermarktungsrechte an einem Medikament erwerbe. Kaum ein Biotech-Unternehmen in Europa sei so gut positioniert wie Actelion. Die Veräußerung der Almorexant-Vermarktungsrechte und Übernahmefantasien könnten der Aktie Antrieb verleihen. Nach Ansicht der Experten von "FOCUS-MONEY" verfügt die Aktie von Actelion über Potenzial. Zur Absicherung sollte ein Stoppkurs bei 31,50 Euro platziert werden. (Ausgabe 15) (03.04.2008/ac/a/a)
Quelle: AKTIENCHECK.DE
11.04.2008 12:31:27
Hugin-News: Actelion Pharmaceuticals Ltd
Ordentliche Generalversammlung der Actelion Ltd in Basel, Schweiz
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin.
Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
-------------------------------------------------------------------
ALLSCHWIL/BASEL, SCHWEIZ - 11. April 2008 - An der ordentlichen
Generalversammlung der Actelion Ltd (SWX: ATLN) haben die Aktionäre
heute allen Anträgen des Verwaltungsrats zugestimmt.
Die Aktionäre genehmigten den Geschäftsbericht, inklusive der Angaben
zur Finanz, für das Jahr 2007 und bestätigten Ernst & Young als
Revisionsstelle und Konzernprüfer des Unternehmens für das Jahr 2008.
Die Aktionäre wählten überdies Jean-Paul Clozel, Juhani Anttila und
Carl Feldbaum für weitere drei Jahre in den Verwaltungsrat. Die
personelle Zusammensetzung des Verwaltungsrats bleibt damit
unverändert. Die acht Mitglieder sind: Robert E. Cawthorn
(Präsident), André J. Mueller (Vizepräsident), Jean-Paul Clozel,
Werner Henrich, Armin Kessler, Jean Malo, Juhani Anttila und Carl
Feldbaum.
Die ordentliche Generalversammlung der Actelion Ltd in Basel wurde
von 225 Aktionären besucht, welche 48'620'320 Aktien oder 39,56
Prozent der ausstehenden Aktien vertreten.
###
Actelion Ltd
Actelion Ltd ist ein biopharmazeutisches Unternehmen mit Hauptsitz in
Allschwil/Basel, Schweiz. Actelions erstes Medikament. Tracleer®, ist
ein zur Therapie der pulmonalen arteriellen Hypertonie zugelassener
dualer Endothelin-Rezeptor-Antagonist in Tablettenform. Actelion
vertreibt Tracleer® durch eigene Niederlassungen in den wichtigsen
internationalen Märkten, so den Vereinigten Staaten (mit Sitz in
South San Francisco), der Europäischen Union, Japan, Kanada,
Australien und der Schweiz. Actelion, 1997 gegründet, ist ein
weltweit führendes Unternehmen bei der Erforschung des Endothels. Das
Endothel trennt die Gefässwand vom Blutstrom. Actelion konzentriert
sich darauf, innovative Medikamente in Bereichen mit hohem
medizinischem Bedarf zu entdecken, zu entwickeln und zu vermarkten.
Actelion Aktien sind am SWX Swiss Exchange notiert (Symbol: ATLN).
Für weitere Informationen wenden Sie sich bitte an:
Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil
Roland Haefeli
Vice President, Head of Investor Relations & Public
Affairs
+41 61 565 62 62
+1 650 624 69 36
www.actelion.com
--- Ende der Mitteilung ---
Actelion Pharmaceuticals Ltd
Gewerbestrasse 16 Allschwil
Schweiz
WKN: 936767 ; ISIN: CH0010532478; Index: SBIOM, SLIFE, SMCI, SMIEXP,
SMIM, SPI, SPIEX;
Notiert: Main Market in SWX Swiss Exchange;
http://hugin.info/131801/R/1208267/249455.pdf
http://www.actelion.com
Copyright © Hugin AS 2008. All rights reserved.
Quelle: dpa-AFX
Hugin-News: Actelion Pharmaceuticals Ltd
Ordentliche Generalversammlung der Actelion Ltd in Basel, Schweiz
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin.
Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
-------------------------------------------------------------------
ALLSCHWIL/BASEL, SCHWEIZ - 11. April 2008 - An der ordentlichen
Generalversammlung der Actelion Ltd (SWX: ATLN) haben die Aktionäre
heute allen Anträgen des Verwaltungsrats zugestimmt.
Die Aktionäre genehmigten den Geschäftsbericht, inklusive der Angaben
zur Finanz, für das Jahr 2007 und bestätigten Ernst & Young als
Revisionsstelle und Konzernprüfer des Unternehmens für das Jahr 2008.
Die Aktionäre wählten überdies Jean-Paul Clozel, Juhani Anttila und
Carl Feldbaum für weitere drei Jahre in den Verwaltungsrat. Die
personelle Zusammensetzung des Verwaltungsrats bleibt damit
unverändert. Die acht Mitglieder sind: Robert E. Cawthorn
(Präsident), André J. Mueller (Vizepräsident), Jean-Paul Clozel,
Werner Henrich, Armin Kessler, Jean Malo, Juhani Anttila und Carl
Feldbaum.
Die ordentliche Generalversammlung der Actelion Ltd in Basel wurde
von 225 Aktionären besucht, welche 48'620'320 Aktien oder 39,56
Prozent der ausstehenden Aktien vertreten.
###
Actelion Ltd
Actelion Ltd ist ein biopharmazeutisches Unternehmen mit Hauptsitz in
Allschwil/Basel, Schweiz. Actelions erstes Medikament. Tracleer®, ist
ein zur Therapie der pulmonalen arteriellen Hypertonie zugelassener
dualer Endothelin-Rezeptor-Antagonist in Tablettenform. Actelion
vertreibt Tracleer® durch eigene Niederlassungen in den wichtigsen
internationalen Märkten, so den Vereinigten Staaten (mit Sitz in
South San Francisco), der Europäischen Union, Japan, Kanada,
Australien und der Schweiz. Actelion, 1997 gegründet, ist ein
weltweit führendes Unternehmen bei der Erforschung des Endothels. Das
Endothel trennt die Gefässwand vom Blutstrom. Actelion konzentriert
sich darauf, innovative Medikamente in Bereichen mit hohem
medizinischem Bedarf zu entdecken, zu entwickeln und zu vermarkten.
Actelion Aktien sind am SWX Swiss Exchange notiert (Symbol: ATLN).
Für weitere Informationen wenden Sie sich bitte an:
Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil
Roland Haefeli
Vice President, Head of Investor Relations & Public
Affairs
+41 61 565 62 62
+1 650 624 69 36
www.actelion.com
--- Ende der Mitteilung ---
Actelion Pharmaceuticals Ltd
Gewerbestrasse 16 Allschwil
Schweiz
WKN: 936767 ; ISIN: CH0010532478; Index: SBIOM, SLIFE, SMCI, SMIEXP,
SMIM, SPI, SPIEX;
Notiert: Main Market in SWX Swiss Exchange;
http://hugin.info/131801/R/1208267/249455.pdf
http://www.actelion.com
Copyright © Hugin AS 2008. All rights reserved.
Quelle: dpa-AFX
schon einige Wochen alt, aber diese Meldung hatten wir hier noch nicht:
UPDATE 1-Actelion has 7 partnering proposals on almorexant
Thu Feb 21, 2008 4:42am EST
ZURICH, Feb 21 (Reuters) - Actelion (ATLN.VX: Quote, Profile, Research) had proposals to partner its almorexant sleep medicine from seven of the world's largest 10 drugs companies and is under no pressure to decide, its chief executive told Reuters.
"Among the ten biggest companies in the world, we had proposals from seven. I've never seen that," Actelion CEO Jean-Paul Clozel said in an interview on Thursday. "People are extremely interested."
When asked about a timeframe for a deal, Clozel said three to six months was "not unrealistic" but there was no rush to sign.
Clozel also said Pfizer Inc's (PFE.N: Quote, Profile, Research) acquisition of Encysive Pharmaceuticals (ENCY.O: Quote, Profile, Research), announced on Wednesday, meant Actelion would have to fight harder in the pulmonary arterial hypertension (PAH) market.
Actelion's key drug Tracleer treats PAH and Encysive's Thelin could be a competitor.
"The good news is that Pfizer has decided that this is a growing and important market, and maybe they will grow the market. The negative side of course is that we have a competitor who is really backed now by a bigger company," Clozel said.
"This is not going to change our prospects that we have announced to date, but we need to fight even more, that's true." (Reporting by Sam Cage and Paul Arnold; Editing by Erica Billingham)
http://www.reuters.com/article/rbssHealthcareNews/idUSL21419…
UPDATE 1-Actelion has 7 partnering proposals on almorexant
Thu Feb 21, 2008 4:42am EST
ZURICH, Feb 21 (Reuters) - Actelion (ATLN.VX: Quote, Profile, Research) had proposals to partner its almorexant sleep medicine from seven of the world's largest 10 drugs companies and is under no pressure to decide, its chief executive told Reuters.
"Among the ten biggest companies in the world, we had proposals from seven. I've never seen that," Actelion CEO Jean-Paul Clozel said in an interview on Thursday. "People are extremely interested."
When asked about a timeframe for a deal, Clozel said three to six months was "not unrealistic" but there was no rush to sign.
Clozel also said Pfizer Inc's (PFE.N: Quote, Profile, Research) acquisition of Encysive Pharmaceuticals (ENCY.O: Quote, Profile, Research), announced on Wednesday, meant Actelion would have to fight harder in the pulmonary arterial hypertension (PAH) market.
Actelion's key drug Tracleer treats PAH and Encysive's Thelin could be a competitor.
"The good news is that Pfizer has decided that this is a growing and important market, and maybe they will grow the market. The negative side of course is that we have a competitor who is really backed now by a bigger company," Clozel said.
"This is not going to change our prospects that we have announced to date, but we need to fight even more, that's true." (Reporting by Sam Cage and Paul Arnold; Editing by Erica Billingham)
http://www.reuters.com/article/rbssHealthcareNews/idUSL21419…
21.04.2008 08:02:50
Hugin-News: Actelion Pharmaceuticals Ltd
Actelion und Nippon Shinyaku unterzeichnen Lizenzvereinbarung über neuartigen
PAH-Wirkstoff
------------------------------------------------------------------
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin.
Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
------------------------------------------------------------------
ALLSCHWIL/BASEL, SCHWEIZ und KYOTO - 21. April 2008 - Actelion Ltd
(SWX: ATLN) und Nippon Shinyaku (TYO: 4516) teilten heute mit, dass
die beiden Unternehmen basierend auf der vorausgegangenen
verbindlichen Absichtserklärung eine Lizenzvereinbarung bezüglich
eines neuartigen, oral verfügbaren PGI2-Rezeptor-Agonisten mit der
Bezeichnung NS-304 unterzeichnet haben. NS-304 war ursprünglich von
Nippon Shinyaku für die Behandlung pulmonaler arterieller Hypertonie
(PAH) entdeckt und synthetisiert worden.
Die Vereinbarung wurde im Rahmen einer formellen Zeremonie von Dr.
Jean-Paul Clozel, CEO von Actelion, und Shigenobu Maekawa, Präsident
von Nippon Shinyaku, im Stammhaus von Nippon Shinyaku in Kyoto
unterzeichnet. Bei der Unterzeichnungszeremonie war auch Dr. Satoshi
Tanaka, Präsident und Direktor von Actelion Pharmaceuticals Japan
Ltd. anwesend.
Im Rahmen der Lizenzvereinbarung wird Nippon Shinyaku von Actelion
eine Vorauszahlung und weitere Zahlungen erhalten, die an das
Erreichen bestimmter Entwicklungsziele und Verkaufsergebnisse
gebunden sind. Nippon Shinyaku wird darüber hinaus am Verkaufserlös
des Produkts beteiligt sein. Die Vereinbarung räumt Nippon Shinyaku
zudem das Recht ein, sich möglicherweise an der Entwicklung eines von
Actelion weltweit entwickelten Wirkstoffs in Japan zu beteiligen.
Um NS-304 gegen PAH und potenzielle andere Indikationen möglichst
rasch zur Marktreife zu bringen, wird Actelion die von Nippon
Shinyaku derzeit in Europa durchgeführte klinische Studie der Phase
IIa übernehmen und für die globale Entwicklung und Vermarktung von
NS-304 ausserhalb Japans verantwortlich zeichnen. Die beiden
Unternehmen werden NS-304 in Japan gemeinsam entwickeln und auf den
Markt bringen.
NS-304, das ursprünglich von Nippon Shinyaku entdeckt und
synthetisiert wurde, ist ein oral verfügbarer
Prostaglandin-I2-Rezeptor-Agonist mit langer Wirkungsdauer, der die
PGI2-Rezeptoren in den Blutgefässen stimuliert und gefässerweiternd
wirkt. NS-304 hat grosses Potenzial als neuartiges Therapeutikum zur
Behandlung von PAH. Nippon Shinyaku hat kürzlich Studien der Phase I
in Grossbritannien abgeschlossen. Ein Phase-II-Programm mit
PAH-Patienten wurde Ende 2007 in Europa aufgenommen.
###
Anmerkung für Herausgeber:
Über pulmonale arterielle Hypertonie (PAH)
Pulmonale arterielle Hypertonie (PAH) ist eine chronische,
lebensbedrohende Erkrankung, die durch abnorm hohen Blutdruck in den
Arterien zwischen Herz und Lunge der betroffenen Patienten
gekennzeichnet ist. Die Funktionen von Herz und Lunge sind stark
beeinträchtigt, was sich in einer eingeschränkten körperlichen
Leistungsfähigkeit und letztendlich einer verkürzten Lebenserwartung
niederschlägt. Etwa 100.000 Menschen in Europe und den USA leiden an
primärem Lungenhochdruck oder sekundären Formen der Erkrankung.
Letztere sind Folge von anderen Krankheiten oder Gewebeveränderungen
der Lunge wie Sklerodermie, Lupus, HIV/AIDS oder angeborenen
Herzkrankheiten.
PAH ist mit strukturellen Veränderungen im Gefässsystem der Lunge und
der rechten Herzkammer verbunden. Jüngste Fortschritte [1] im
Verständnis der für Gefässerkrankungen der Lunge verantwortlichen
pathogenen Faktoren führten zur Entwicklung neuer Therapien, die auf
spezifische Signalwege (Pathways) ausgerichtet sind (den
Prostazyklin-Pathway; den Endothelin-Pathway und den
Stickoxid-Pathway) [2]. Die verfügbaren Therapien haben einen
positiven Einfluss auf PAH, stellen aber keine Heilung dar, und bei
vielen Patienten schreitet die Erkrankung weiter voran. PAH bleibt
daher eine schwere, lebensbedrohliche Krankheit [2,3]. Eine
frühzeitige Diagnose und ein Verständnis für Therapiewahl und
Behandlungsbeginn bleiben kritische Elemente bei der optimalen
Versorgung von PAH-Patienten.
Über Tracleer® bei pulmonaler arterieller Hypertonie (PAH)
Tracleer® (Bosentan), der erste orale duale
Endothelin-Rezeptor-Antagonist, ist für die Behandlung der pulmonalen
arteriellen Hypertonie (PAH) zugelassen und wird durch
Niederlassungen von Actelion in den USA, der Europäischen Union,
Japan, Australien, Kanada und der Schweiz sowie in anderen Märkten
weltweit verfügbar gemacht.
Folgende Sicherheitseinschränkungen sind zu beachten:
Mögliche schwere Leberschäden (einschliesslich seltener Fälle von
Leberversagen und ungeklärter Leberzirrhose unter der gegebenen
strikten medizinischen Überwachung). Vor Behandlungsbeginn und
während der Behandlung in monatlichem Rhythmus sind daher bei allen
Patienten Untersuchungen der Leberenzymwerte erforderlich.
Wegen des Risikos einer Schädigung des ungeborenen Kindes dürfen
Schwangere und Frauen im gebärfähigen Alter, die keine zuverlässige
Verhütungsmethode anwenden, Tracleer® nicht einnehmen. Infolge dieser
Risiken ist Tracleer® nur über kontrollierte Distribution erhältlich.
Quellennachweis
1. Farber HW; Loscalzo J. Mechanisms of disease: pulmonary arterial
hypertension. N. Eng. J. Med. 2004; 351: 1655-65.
2. Humbert M; Sitbon O; Simonneau G. Treatment of pulmonary arterial
hypertension. N. Eng. J. Med. 2004; 351: 1425-36.
3. Humbert M; Morrell NW; Archer SL; et al. Cellular and molecular
pathobiology of pulmonary arterial hypertension. J. Am. Coll.
Cardiol. 2004; 43: Suppl. 12: 13S-24S.
4. Tracleer® SPC.
Actelion Ltd
Actelion Ltd ist ein biopharmazeutisches Unternehmen mit Hauptsitz in
Allschwil/Basel, Schweiz. Actelions erstes Medikament, Tracleer®, ist
ein zur Therapie der pulmonalen arteriellen Hypertonie zugelassener
dualer Endothelin-Rezeptor-Antagonist. Actelion vermarktet Tracleer®
durch eigene Niederlassungen in den wichtigsten internationalen
Märkten, so den Vereinigten Staaten (mit Sitz in South San
Francisco), der Europäischen Union, Japan, Kanada, Australien und der
Schweiz. Actelion, Ende 1997 gegründet, ist ein weltweit führendes
Unternehmen bei der Erforschung des Endothels. Das Endothel trennt
die Gefässwand vom Blutstrom. Actelion konzentriert sich darauf,
innovative Medikamente in Bereichen mit hohem medizinischem Bedarf zu
entdecken, zu entwickeln und zu vermarkten. Actelion Aktien sind am
SWX Swiss Exchange notiert (Symbol: ATLN).
Nippon Shinyaku
Weitere Informationen über Nippon Shinyaku können Sie folgender
Website entnehmen:
http://www.nippon-shinyaku.co.jp/english/index.html
Für weitere Informationen wenden Sie sich bitte an:
Nippon Shinyaku Co., Ltd.
Toshihiro Yoshioka
General Manager of Corporate Communications Dept.
+81 75 321 9103
+81 357 745 114
http://www.nippon-shinyaku.co.jp/english/index.html
Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil
Roland Haefeli
Vice President, Head of Investor Relations & Public
Affairs
+41 61 565 62 62
+1 650 624 69 36
http://www.actelion.com
--- Ende der Mitteilung ---
Actelion Pharmaceuticals Ltd
Gewerbestrasse 16 Allschwil
Schweiz
WKN: 936767 ; ISIN: CH0010532478; Index: SBIOM, SLIFE, SMCI, SMIEXP,
SMIM, SPI, SPIEX;
Notiert: Main Market in SWX Swiss Exchange;
http://hugin.info/131801/R/1210844/250724.pdf
http://www.actelion.com
Copyright © Hugin AS 2008. All rights reserved.
Quelle: dpa-AFX
Hugin-News: Actelion Pharmaceuticals Ltd
Actelion und Nippon Shinyaku unterzeichnen Lizenzvereinbarung über neuartigen
PAH-Wirkstoff
------------------------------------------------------------------
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin.
Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
------------------------------------------------------------------
ALLSCHWIL/BASEL, SCHWEIZ und KYOTO - 21. April 2008 - Actelion Ltd
(SWX: ATLN) und Nippon Shinyaku (TYO: 4516) teilten heute mit, dass
die beiden Unternehmen basierend auf der vorausgegangenen
verbindlichen Absichtserklärung eine Lizenzvereinbarung bezüglich
eines neuartigen, oral verfügbaren PGI2-Rezeptor-Agonisten mit der
Bezeichnung NS-304 unterzeichnet haben. NS-304 war ursprünglich von
Nippon Shinyaku für die Behandlung pulmonaler arterieller Hypertonie
(PAH) entdeckt und synthetisiert worden.
Die Vereinbarung wurde im Rahmen einer formellen Zeremonie von Dr.
Jean-Paul Clozel, CEO von Actelion, und Shigenobu Maekawa, Präsident
von Nippon Shinyaku, im Stammhaus von Nippon Shinyaku in Kyoto
unterzeichnet. Bei der Unterzeichnungszeremonie war auch Dr. Satoshi
Tanaka, Präsident und Direktor von Actelion Pharmaceuticals Japan
Ltd. anwesend.
Im Rahmen der Lizenzvereinbarung wird Nippon Shinyaku von Actelion
eine Vorauszahlung und weitere Zahlungen erhalten, die an das
Erreichen bestimmter Entwicklungsziele und Verkaufsergebnisse
gebunden sind. Nippon Shinyaku wird darüber hinaus am Verkaufserlös
des Produkts beteiligt sein. Die Vereinbarung räumt Nippon Shinyaku
zudem das Recht ein, sich möglicherweise an der Entwicklung eines von
Actelion weltweit entwickelten Wirkstoffs in Japan zu beteiligen.
Um NS-304 gegen PAH und potenzielle andere Indikationen möglichst
rasch zur Marktreife zu bringen, wird Actelion die von Nippon
Shinyaku derzeit in Europa durchgeführte klinische Studie der Phase
IIa übernehmen und für die globale Entwicklung und Vermarktung von
NS-304 ausserhalb Japans verantwortlich zeichnen. Die beiden
Unternehmen werden NS-304 in Japan gemeinsam entwickeln und auf den
Markt bringen.
NS-304, das ursprünglich von Nippon Shinyaku entdeckt und
synthetisiert wurde, ist ein oral verfügbarer
Prostaglandin-I2-Rezeptor-Agonist mit langer Wirkungsdauer, der die
PGI2-Rezeptoren in den Blutgefässen stimuliert und gefässerweiternd
wirkt. NS-304 hat grosses Potenzial als neuartiges Therapeutikum zur
Behandlung von PAH. Nippon Shinyaku hat kürzlich Studien der Phase I
in Grossbritannien abgeschlossen. Ein Phase-II-Programm mit
PAH-Patienten wurde Ende 2007 in Europa aufgenommen.
###
Anmerkung für Herausgeber:
Über pulmonale arterielle Hypertonie (PAH)
Pulmonale arterielle Hypertonie (PAH) ist eine chronische,
lebensbedrohende Erkrankung, die durch abnorm hohen Blutdruck in den
Arterien zwischen Herz und Lunge der betroffenen Patienten
gekennzeichnet ist. Die Funktionen von Herz und Lunge sind stark
beeinträchtigt, was sich in einer eingeschränkten körperlichen
Leistungsfähigkeit und letztendlich einer verkürzten Lebenserwartung
niederschlägt. Etwa 100.000 Menschen in Europe und den USA leiden an
primärem Lungenhochdruck oder sekundären Formen der Erkrankung.
Letztere sind Folge von anderen Krankheiten oder Gewebeveränderungen
der Lunge wie Sklerodermie, Lupus, HIV/AIDS oder angeborenen
Herzkrankheiten.
PAH ist mit strukturellen Veränderungen im Gefässsystem der Lunge und
der rechten Herzkammer verbunden. Jüngste Fortschritte [1] im
Verständnis der für Gefässerkrankungen der Lunge verantwortlichen
pathogenen Faktoren führten zur Entwicklung neuer Therapien, die auf
spezifische Signalwege (Pathways) ausgerichtet sind (den
Prostazyklin-Pathway; den Endothelin-Pathway und den
Stickoxid-Pathway) [2]. Die verfügbaren Therapien haben einen
positiven Einfluss auf PAH, stellen aber keine Heilung dar, und bei
vielen Patienten schreitet die Erkrankung weiter voran. PAH bleibt
daher eine schwere, lebensbedrohliche Krankheit [2,3]. Eine
frühzeitige Diagnose und ein Verständnis für Therapiewahl und
Behandlungsbeginn bleiben kritische Elemente bei der optimalen
Versorgung von PAH-Patienten.
Über Tracleer® bei pulmonaler arterieller Hypertonie (PAH)
Tracleer® (Bosentan), der erste orale duale
Endothelin-Rezeptor-Antagonist, ist für die Behandlung der pulmonalen
arteriellen Hypertonie (PAH) zugelassen und wird durch
Niederlassungen von Actelion in den USA, der Europäischen Union,
Japan, Australien, Kanada und der Schweiz sowie in anderen Märkten
weltweit verfügbar gemacht.
Folgende Sicherheitseinschränkungen sind zu beachten:
Mögliche schwere Leberschäden (einschliesslich seltener Fälle von
Leberversagen und ungeklärter Leberzirrhose unter der gegebenen
strikten medizinischen Überwachung). Vor Behandlungsbeginn und
während der Behandlung in monatlichem Rhythmus sind daher bei allen
Patienten Untersuchungen der Leberenzymwerte erforderlich.
Wegen des Risikos einer Schädigung des ungeborenen Kindes dürfen
Schwangere und Frauen im gebärfähigen Alter, die keine zuverlässige
Verhütungsmethode anwenden, Tracleer® nicht einnehmen. Infolge dieser
Risiken ist Tracleer® nur über kontrollierte Distribution erhältlich.
Quellennachweis
1. Farber HW; Loscalzo J. Mechanisms of disease: pulmonary arterial
hypertension. N. Eng. J. Med. 2004; 351: 1655-65.
2. Humbert M; Sitbon O; Simonneau G. Treatment of pulmonary arterial
hypertension. N. Eng. J. Med. 2004; 351: 1425-36.
3. Humbert M; Morrell NW; Archer SL; et al. Cellular and molecular
pathobiology of pulmonary arterial hypertension. J. Am. Coll.
Cardiol. 2004; 43: Suppl. 12: 13S-24S.
4. Tracleer® SPC.
Actelion Ltd
Actelion Ltd ist ein biopharmazeutisches Unternehmen mit Hauptsitz in
Allschwil/Basel, Schweiz. Actelions erstes Medikament, Tracleer®, ist
ein zur Therapie der pulmonalen arteriellen Hypertonie zugelassener
dualer Endothelin-Rezeptor-Antagonist. Actelion vermarktet Tracleer®
durch eigene Niederlassungen in den wichtigsten internationalen
Märkten, so den Vereinigten Staaten (mit Sitz in South San
Francisco), der Europäischen Union, Japan, Kanada, Australien und der
Schweiz. Actelion, Ende 1997 gegründet, ist ein weltweit führendes
Unternehmen bei der Erforschung des Endothels. Das Endothel trennt
die Gefässwand vom Blutstrom. Actelion konzentriert sich darauf,
innovative Medikamente in Bereichen mit hohem medizinischem Bedarf zu
entdecken, zu entwickeln und zu vermarkten. Actelion Aktien sind am
SWX Swiss Exchange notiert (Symbol: ATLN).
Nippon Shinyaku
Weitere Informationen über Nippon Shinyaku können Sie folgender
Website entnehmen:
http://www.nippon-shinyaku.co.jp/english/index.html
Für weitere Informationen wenden Sie sich bitte an:
Nippon Shinyaku Co., Ltd.
Toshihiro Yoshioka
General Manager of Corporate Communications Dept.
+81 75 321 9103
+81 357 745 114
http://www.nippon-shinyaku.co.jp/english/index.html
Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil
Roland Haefeli
Vice President, Head of Investor Relations & Public
Affairs
+41 61 565 62 62
+1 650 624 69 36
http://www.actelion.com
--- Ende der Mitteilung ---
Actelion Pharmaceuticals Ltd
Gewerbestrasse 16 Allschwil
Schweiz
WKN: 936767 ; ISIN: CH0010532478; Index: SBIOM, SLIFE, SMCI, SMIEXP,
SMIM, SPI, SPIEX;
Notiert: Main Market in SWX Swiss Exchange;
http://hugin.info/131801/R/1210844/250724.pdf
http://www.actelion.com
Copyright © Hugin AS 2008. All rights reserved.
Quelle: dpa-AFX
22.04.2008 07:01:00
Actelion gibt Finanzergebnisse für das erste Quartal 2008 bekannt
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin. Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
Nettoumsatz bei CHF 321,6 Millionen - Produkteumsatz steigt im Vergleich zum 1. Quartal 2007 um 19 Prozent in lokalen Währungen - Umsatz von Tracleer® bei CHF 287,6 Millionen aufgrund weiterhin vorhandener Schwankungen beim Kaufverhalten - Cash-EBIT erreicht CHF 99,8 Millionen - Entwicklung von Tezosentan abgebrochen - Vier unterschiedliche Phase-III-Programme auf Kurs - Planmässiger Verlauf der Gespräche über Partnerschaft bezüglich Almorexant
Nettoumsatz bei CHF 321,6 Millionen - Produkteumsatz steigt im Vergleich zum 1. Quartal 2007 um 19 Prozent in lokalen Währungen - Umsatz von Tracleer® bei CHF 287,6 Millionen aufgrund weiterhin vorhandener Schwankungen beim Kaufverhalten - Cash-EBIT erreicht CHF 99,8 Millionen - Entwicklung von Tezosentan abgebrochen - Vier unterschiedliche Phase-III-Programme auf Kurs - Planmässiger Verlauf der Gespräche über Partnerschaft bezüglich Almorexant ALLSCHWIL/BASEL, SCHWEIZ - 22. April 2008 - Actelion Ltd (SWX: ATLN) gab heute die Finanzergebnisse für das erste Quartal 2008 bekannt. Mit einem Nettoumsatz für die ersten drei Monate 2008 in Höhe von CHF 321,6 Millionen (1. Quartal 2007: CHF 290,4 Mio.) und einem betrieblichen aufwand von CHF 253,8 Millionen (1. Quartal 2007: CHF 441,9 Mio. einschliesslich eines einmaligen, infolge der Akquisition von CoTherix angefallenen Aufwands für In-Process Research and Development [IPRD] in Höhe von CHF 224,8 Millionen), realisierte das Unternehmen einen Betriebsgewinn von CHF 67,8 Millionen (1. Quartal 2007: Betriebsverlust von CHF 151,5 Mio.) Um die betriebliche Leistung des Unternehmens besser messen und vergleichen zu können, weist Actelion weiterhin den non-US GAAP Cash-EBIT aus (Betriebsergebnis ausschliesslich IPRD, Belastungen in Verbindung mit Aktienoptionen für Mitarbeitende nach FAS 123R sowie Aufwendungen für nicht-liquiditätswirksame Abschreibungen und Amortisationen). In den ersten drei Monaten 2008 erzielte Actelion einen Cash-EBIT von CHF 99,8 Millionen, ein Rückgang um ein Prozent gegenüber demselben Zeitraum im Vorjahr. In lokalen Währungen wuchs der Cash-EBIT um 12 Prozent. Der angepasste verwässerte Gewinn pro Aktie (EPS) für das erste Quartal 2008 (non-US GAAP) lag bei CHF 0,63 gegenüber CHF 0,88 im ersten Quartal 2007. Gemäss US GAAP lag der Reingewinn für das erste Quartal 2008 bei CHF 48,3 Millionen (1. Quartal 2007: Nettoverlust von CHF 150,0 Mio.). Der vollständig verwässerte Gewinn pro Aktie (EPS) belief sich auf CHF 0,39 gegenüber einem Verlust pro Aktie in Höhe von CHF 1,29 im selben Zeitraum 2007.
Dr. Jean-Paul Clozel, Chief Executive Officer, kommentierte: Actelion ist gut ins Jahr 2008 gestartet. Die Anzahl der Patienten mit pulmonaler arterieller Hypertonie (PAH), die mit Tracleer behandelt werden, steigt weiter und ist Beleg für die tragende Rolle von Tracleer als Eckpfeiler der PAH-Therapie. Mit der Einlizenzierung eines neuartigen PGI-2-Rezeptor-Agonisten von Nippon Shinyaku ist es uns gelungen, unsere Rolle als führendes innovatives Unternehmen im Bereich PAH noch zu verstärken." Jean-Paul Clozel fügte hinzu: Alle unsere klinischen Programme laufen weiterhin nach Plan, mit Ausnahme von Tezosentan. Wir haben entschieden, die Entwicklung dieser Substanz einzustellen, da die beobachtete Ereignisrate und Wirkung in einer kürzlich abgeschlossenen Studie nach Trennung vom kardialen Bypass geringer als erwartet ausfiel und eine erheblich grössere Studie als angenommen erforderlich gewesen wäre. Angesichts der Bedeutung anderer Projekte haben wir alle Ressourcen, die zuvor Tezosentan zugeordnet waren, neu zugeteilt, um diese chancenreichen Projekte zu unterstützen."
Jean-Paul Clozel schloss: Bezüglich Almorexant freue ich mich ganz besonders über die raschen Fortschritte, die wir bei der Patientenrekrutierung für die Dosisfindungs-studie mit älteren Patienten machen. Im Übrigen verlaufen die Gespräche über mögliche Partnerschaften für dieses neuartige Molekül mit dem Potenzial zur Wiederherstellung des normalen physiologischen Schlafs gemäss Plan."
Andrew J. Oakley, Chief Financial Officer, kommentierte: In den ersten drei Monaten des Jahres 2008 ist das Basisgeschäft von Actelion weiterhin entsprechend unseren Erwartungen gewachsen. Dieses Wachstum wird allerdings von Schwankungen im Kaufverhalten sowie der Stärke des Schweizer Franken überdeckt." Andrew Oakley fügte hinzu: Actelion verfügt gemäss Bilanz mit über 850 Millionen Schweizer Franken über eine starke Cash-Position. Wir haben die Absicht, unsere Liquidität bestmöglich zu nutzen. So können wir auch künftig Chancen für Einlizenzierungen wahrnehmen. Darüber hinaus verfügen wir über die Mittel, Massnahmen gegen mögliche künftige Verwässerungseffekte zu treffen, wie wir dies bereits in der Vergangenheit getan haben, wenn sich die Gelegenheit dafür bot." Andrew Oakley schloss: Actelion ist auf gutem Weg, unsere Umsatzschätzungen für 2008 zu erreichen. Ich gehe davon aus, dass das Wachstum des Nettoumsatzes in lokalen Währungen im niedrigen zweistelligen Prozentbereich liegen wird. Der Cash-EBIT - ebenfalls in lokalen Währungen - wird infolge wachsender Investitionen in Forschung und Entwicklung voraussichtlich unverändert bleiben oder im einstelligen Prozentbereich leicht zurückgehen. Sollte die Stärke des Schweizer Franken weiter anhalten, erwarten wir allerdings, dass der Cash-EBIT in unserer Berichtswährung (CHF) im Bereich von 10 bis 20 Prozent zurückgehen wird. Die Performance von Actelion für 2008 könnte durch ein Partnerschaftsabkommen für Almorexant sowohl beim Umsatz als auch beim Gesamtergebnis positiv beeinflusst werden."
Die vollständige Konzernrechnung finden Sie unter http://www.actelion.com
Anhaltendes Umsatzwachstum Im ersten Quartal 2008 stieg der Nettoumsatz von Actelion um 11 Prozent auf CHF 321,6 Millionen (1. Quartal 2007: CHF 290,4 Mio.). Die Umsatzentwicklung wird dabei durch die Stärke des Schweizer Frankens ungünstig beeinflusst. In lokalen Währungen stieg der Nettoumsatz um 19 Prozent. Die Einkünfte aus vertraglichen Vereinbarungen beliefen sich im ersten Quartal 2008 auf CHF 6,9 Millionen (1. Quartal 2007: CHF 6,8 Mio.). Produkteumsatz Der Umsatz von Tracleer® (Bosentan) belief sich im ersten Quartal 2008 auf CHF 287,6 Millionen (1. Quartal 2007: CHF 260,4 Mio.). In lokalen Währungen bedeutet dies einen Anstieg um 18 Prozent gegenüber demselben Zeitraum des Vorjahrs. Im Vergleich zum Vorquartal gingen die Verkaufserlöse für Tracleer® in lokalen Währungen um 9% zurück (4. Quartal 2007: 332,0 Mio.). Dieser Rückgang kann auf Schwankungen im Kaufverhalten zurückgeführt werden, wie dies schon in vorangegangenen Quartalen zu beobachten war. In CHF gerechnet, wurde der Umsatz von Tracleer vom zunehmend starken Schweizer Franken, insbesondere gegenüber dem US-Dollar, dem Euro und dem Britischen Pfund, negativ beeinflusst. Ende März 2008 wurde Tracleer® weltweit in über 50 Ländern vermarktet, darunter allen wichtigen pharmazeutischen Märkten. Anfang April wurde Tracleer auch in Mexiko zugelassen. Otto Schwarz, Präsident Business Operations, kommentierte: Ich bin sehr zufrieden mit der starken Leistung von Tracleer im Markt. Währungsbereinigt ist dies das zweitbeste Quartalsergebnis, das Tracleer® jemals erzielt hat. Trotz wachsenden Drucks durch die Konkurrenz in einem reifenden Markt ist die Anzahl der mit Tracleer behandelten PAH-Patienten in allen Ländern weiter gewachsen. Das Interesse an der Diagnosestellung und Behandlung von PAH ist weiterhin sehr hoch. So nahmen im März und Anfang April über 1300 Ärzte aus ganz Europa an zwei von Actelion organisierten Veranstaltungen zu PAH teil." Der Umsatz von Ventavis® (Iloprost) erreichte im ersten Quartal 2008 CHF 17,4 Millionen. Im Vergleich zum vorangegangenen Quartal ging der Umsatz von Ventavis® in lokalen Währungen um 19 Prozent zurück. Dies ist auf Schwankungen beim Kaufverhalten zurückzuführen, während die Zahl der Patienten, denen Ventavis zugute kommt, im Quartalsvergleich anstieg. Im ersten Quartal 2008 lag der Umsatz von Zavesca® (Miglustat) bei CHF 9,7 Millionen (1. Quartal 2007: CHF 7,5 Mio.). Zavesca® ist in den USA und den meisten europäischen Märkten kommerziell erhältlich. Betrieblicher Aufwand - anhaltende Ausrichtung auf beschleunigte Investitionen in F&E Im ersten Quartal 2008 belief sich der betriebliche Aufwand auf CHF 253,8 Millionen (1. Quartal 2007: CHF 441,9 Mio. - darin eingeschlossen In-Process Research and Development [IPRD]-Belastung im Zusammenhang mit der Akquisition von CoTherix in Höhe von CHF 224,8 Millionen). Im selben Zeitraum stiegen die Kosten für Forschung und Entwicklung um 30 Prozent auf CHF 85,6 Millionen (1. Quartal 2007: CHF 65,7 Mio.). Alle klinischen Programme (mit Ausnahme von Tezosentan) entwickeln sich gemäss Plan (wie anlässlich des Medien- und Analystentages 2008 am 22. Februar 2008 dargestellt).
Ende Februar 2008 kamen Actelion und Nippon Shinyaku überein, in Bezug auf einen von Nippon Shinyaku entdeckten neuartigen Wirkstoff zur Therapie der PAH zusammenzuarbeiten. Der neuartige PGI-2-Rezeptor-Agonist NS-304 ist ein oral verfügbarer Prostaglandin-I2-Rezeptor-Agonist mit langer Wirkungsdauer, der die PGI-2-Rezeptoren in den Blutgefässen stimuliert und gefässerweiternd wirkt. Die beiden Unternehmen sind überzeugt, dass NS-304 über grosses Potenzial als neuartiges Therapeutikum zur Behandlung von PAH verfügt. Nippon Shinyaku hat kürzlich die Auswertung der Phase I in Grossbritannien abgeschlossen. Ein Phase-II-Programm mit PAH-Patienten wurde Ende 2007 in Europa aufgenommen. Gemäss der Mitte April unterzeichneten Lizenzvereinbarung wird Actelion für die globale Entwicklung und Kommerzialisierung von NS-304 ausserhalb Japans verantwortlich sein, während die Substanz in Japan von beiden Unternehmen gemeinsam entwickelt und vermarktet werden soll. Infolge dieser Übereinkunft ist für Actelion im ersten Quartal 2008 ein IPRD-Aufwand von CHF 8,3 Millionen angefallen.
Die Aufwendungen für Verkauf sowie allgemeine und administrative Ausgaben beliefen sich für die ersten drei Monate 2008 auf CHF 121,0 Millionen (1. Quartal 2007: CHF 117,1 Mio.). Betriebsgewinn Der Betriebsgewinn von Actelion für das erste Quartal 2008 lag bei CHF 67,8 Millionen (1. Quartal 2007: Betriebsverlust von CHF 151,5 Mio.). Der Cash-EBIT für denselben Zeitraum betrug CHF 99,8 Millionen (1. Quartal 2007: CHF 101,3 Mio.). Reingewinn Im ersten Quartal 2008 ergab sich ein Reingewinn in Höhe von CHF 48,3 Millionen (1. Quartal 2007: Nettoverlust von CHF 150,0 Mio.). Darin enthalten sind Zinserträge von CHF 5,0 Millionen, ein Zinsaufwand von CHF 1,4 Millionen, eine nicht-liquiditätswirksame Belastung von CHF 0,4 Millionen durch die Wandelanleihe, überwiegend nicht realisierte Wechselkursverluste in Höhe von CHF 17,6 Millionen (Ergebnis aus Hedging-Gewinnen und Währungsverlusten auf Zahlungsverpflichtungen zwischen Gesellschaften des Unternehmens) sowie Einkommensteuern in Höhe von CHF 4,9 Millionen. Liquide Mittel und Cashflow Im ersten Quartal 2008 erwirtschaftete Actelion einen Cashflow aus dem operativen Geschäft in Höhe von CHF 22,1 Millionen (1. Quartal 2007: CHF 61,9 Mio.).
###
Telefonkonferenz Actelion wird am Dienstag, 22. April 2008 um 15.30 Uhr Basel (mitteleuropäischer Zeit) / 14.30 Uhr UK / 9.30 Uhr amerikanische Ostküste / eine Telefonkonferenz für Investoren durchführen. Einwahl: Europa : +41 (0)44 580 64 03 UK.: +44 (0)207 1539 154 US.: +1 866 928 6044 Webcast im Internet - Live oder auf Abruf nach Bedarf Actelion überträgt die Telefonkonferenz zeitgleich im Internet. Die Konferenz ist auch zu einem späteren Zeitpunkt nach Bedarf als Aufzeichnung abrufbar. Um die Übertragung im Internet live verfolgen zu können, benutzen Sie bitte den Link auf unserer Homepage www.actelion.com etwa 10 - 15 Minuten vor Beginn der Konferenz. Sollten Sie Schwierigkeiten beim Zugriff auf den Webcast haben, gehen Sie bitte direkt auf: URL: http://gaia.world-television.com/actelion/20080422/trunc Etwa 60 Minuten nach Beendigung der Konferenz wird die Aufzeichnung der Investorenkonferenz auf unserer Homepage abrufbar sein. Actelion Ltd Actelion Ltd ist ein biopharmazeutisches Unternehmen mit Hauptsitz in Allschwil/Basel, Schweiz. Actelions erstes Medikament, Tracleer®, ist ein zur Therapie der pulmonalen arteriellen Hypertonie zugelassener dualer Endothelin-Rezeptor-Antagonist in Tablettenform. Actelion vertreibt Tracleer® durch eigene Niederlassungen in den wichtigsten internationalen Märkten, so den Vereinigten Staaten (mit Sitz in South San Francisco), der Europäischen Union, Japan, Kanada, Australien und der Schweiz. Actelion, 1997 gegründet, ist ein weltweit führendes Unternehmen bei der Erforschung des Endothels. Das Endothel trennt die Gefässwand vom Blutstrom. Actelion konzentriert sich darauf, innovative Medikamente in Bereichen mit hohem medizinischem Bedarf zu entdecken, zu entwickeln und zu vermarkten. Actelion Aktien sind am SWX Swiss Exchange notiert (Symbol: ATLN). Für weitere Informationen wenden Sie sich bitte an: Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil Roland Haefeli Vice President, Head of Investor Relations & Public Affairs +41 61 565 62 62 +1 650 624 69 36 http://www.actelion.com --- Ende der Mitteilung --- Actelion Pharmaceuticals Ltd Gewerbestrasse 16 Allschwil Schweiz WKN: 936767; ISIN: CH0010532478; Index: SBIOM, SLIFE, SMCI, SMIEXP, SMIM, SPI, SPIEX; Notiert: Main Market in SWX Swiss Exchange; http://www.actelion.com http://hugin.info/131801/R/1211497/251055.pdf Copyright © Hugin AS 2008. All rights reserved.
Quelle: HUGIN
Actelion gibt Finanzergebnisse für das erste Quartal 2008 bekannt
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin. Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
Nettoumsatz bei CHF 321,6 Millionen - Produkteumsatz steigt im Vergleich zum 1. Quartal 2007 um 19 Prozent in lokalen Währungen - Umsatz von Tracleer® bei CHF 287,6 Millionen aufgrund weiterhin vorhandener Schwankungen beim Kaufverhalten - Cash-EBIT erreicht CHF 99,8 Millionen - Entwicklung von Tezosentan abgebrochen - Vier unterschiedliche Phase-III-Programme auf Kurs - Planmässiger Verlauf der Gespräche über Partnerschaft bezüglich Almorexant
Nettoumsatz bei CHF 321,6 Millionen - Produkteumsatz steigt im Vergleich zum 1. Quartal 2007 um 19 Prozent in lokalen Währungen - Umsatz von Tracleer® bei CHF 287,6 Millionen aufgrund weiterhin vorhandener Schwankungen beim Kaufverhalten - Cash-EBIT erreicht CHF 99,8 Millionen - Entwicklung von Tezosentan abgebrochen - Vier unterschiedliche Phase-III-Programme auf Kurs - Planmässiger Verlauf der Gespräche über Partnerschaft bezüglich Almorexant ALLSCHWIL/BASEL, SCHWEIZ - 22. April 2008 - Actelion Ltd (SWX: ATLN) gab heute die Finanzergebnisse für das erste Quartal 2008 bekannt. Mit einem Nettoumsatz für die ersten drei Monate 2008 in Höhe von CHF 321,6 Millionen (1. Quartal 2007: CHF 290,4 Mio.) und einem betrieblichen aufwand von CHF 253,8 Millionen (1. Quartal 2007: CHF 441,9 Mio. einschliesslich eines einmaligen, infolge der Akquisition von CoTherix angefallenen Aufwands für In-Process Research and Development [IPRD] in Höhe von CHF 224,8 Millionen), realisierte das Unternehmen einen Betriebsgewinn von CHF 67,8 Millionen (1. Quartal 2007: Betriebsverlust von CHF 151,5 Mio.) Um die betriebliche Leistung des Unternehmens besser messen und vergleichen zu können, weist Actelion weiterhin den non-US GAAP Cash-EBIT aus (Betriebsergebnis ausschliesslich IPRD, Belastungen in Verbindung mit Aktienoptionen für Mitarbeitende nach FAS 123R sowie Aufwendungen für nicht-liquiditätswirksame Abschreibungen und Amortisationen). In den ersten drei Monaten 2008 erzielte Actelion einen Cash-EBIT von CHF 99,8 Millionen, ein Rückgang um ein Prozent gegenüber demselben Zeitraum im Vorjahr. In lokalen Währungen wuchs der Cash-EBIT um 12 Prozent. Der angepasste verwässerte Gewinn pro Aktie (EPS) für das erste Quartal 2008 (non-US GAAP) lag bei CHF 0,63 gegenüber CHF 0,88 im ersten Quartal 2007. Gemäss US GAAP lag der Reingewinn für das erste Quartal 2008 bei CHF 48,3 Millionen (1. Quartal 2007: Nettoverlust von CHF 150,0 Mio.). Der vollständig verwässerte Gewinn pro Aktie (EPS) belief sich auf CHF 0,39 gegenüber einem Verlust pro Aktie in Höhe von CHF 1,29 im selben Zeitraum 2007.
Dr. Jean-Paul Clozel, Chief Executive Officer, kommentierte: Actelion ist gut ins Jahr 2008 gestartet. Die Anzahl der Patienten mit pulmonaler arterieller Hypertonie (PAH), die mit Tracleer behandelt werden, steigt weiter und ist Beleg für die tragende Rolle von Tracleer als Eckpfeiler der PAH-Therapie. Mit der Einlizenzierung eines neuartigen PGI-2-Rezeptor-Agonisten von Nippon Shinyaku ist es uns gelungen, unsere Rolle als führendes innovatives Unternehmen im Bereich PAH noch zu verstärken." Jean-Paul Clozel fügte hinzu: Alle unsere klinischen Programme laufen weiterhin nach Plan, mit Ausnahme von Tezosentan. Wir haben entschieden, die Entwicklung dieser Substanz einzustellen, da die beobachtete Ereignisrate und Wirkung in einer kürzlich abgeschlossenen Studie nach Trennung vom kardialen Bypass geringer als erwartet ausfiel und eine erheblich grössere Studie als angenommen erforderlich gewesen wäre. Angesichts der Bedeutung anderer Projekte haben wir alle Ressourcen, die zuvor Tezosentan zugeordnet waren, neu zugeteilt, um diese chancenreichen Projekte zu unterstützen."
Jean-Paul Clozel schloss: Bezüglich Almorexant freue ich mich ganz besonders über die raschen Fortschritte, die wir bei der Patientenrekrutierung für die Dosisfindungs-studie mit älteren Patienten machen. Im Übrigen verlaufen die Gespräche über mögliche Partnerschaften für dieses neuartige Molekül mit dem Potenzial zur Wiederherstellung des normalen physiologischen Schlafs gemäss Plan."
Andrew J. Oakley, Chief Financial Officer, kommentierte: In den ersten drei Monaten des Jahres 2008 ist das Basisgeschäft von Actelion weiterhin entsprechend unseren Erwartungen gewachsen. Dieses Wachstum wird allerdings von Schwankungen im Kaufverhalten sowie der Stärke des Schweizer Franken überdeckt." Andrew Oakley fügte hinzu: Actelion verfügt gemäss Bilanz mit über 850 Millionen Schweizer Franken über eine starke Cash-Position. Wir haben die Absicht, unsere Liquidität bestmöglich zu nutzen. So können wir auch künftig Chancen für Einlizenzierungen wahrnehmen. Darüber hinaus verfügen wir über die Mittel, Massnahmen gegen mögliche künftige Verwässerungseffekte zu treffen, wie wir dies bereits in der Vergangenheit getan haben, wenn sich die Gelegenheit dafür bot." Andrew Oakley schloss: Actelion ist auf gutem Weg, unsere Umsatzschätzungen für 2008 zu erreichen. Ich gehe davon aus, dass das Wachstum des Nettoumsatzes in lokalen Währungen im niedrigen zweistelligen Prozentbereich liegen wird. Der Cash-EBIT - ebenfalls in lokalen Währungen - wird infolge wachsender Investitionen in Forschung und Entwicklung voraussichtlich unverändert bleiben oder im einstelligen Prozentbereich leicht zurückgehen. Sollte die Stärke des Schweizer Franken weiter anhalten, erwarten wir allerdings, dass der Cash-EBIT in unserer Berichtswährung (CHF) im Bereich von 10 bis 20 Prozent zurückgehen wird. Die Performance von Actelion für 2008 könnte durch ein Partnerschaftsabkommen für Almorexant sowohl beim Umsatz als auch beim Gesamtergebnis positiv beeinflusst werden."
Die vollständige Konzernrechnung finden Sie unter http://www.actelion.com
Anhaltendes Umsatzwachstum Im ersten Quartal 2008 stieg der Nettoumsatz von Actelion um 11 Prozent auf CHF 321,6 Millionen (1. Quartal 2007: CHF 290,4 Mio.). Die Umsatzentwicklung wird dabei durch die Stärke des Schweizer Frankens ungünstig beeinflusst. In lokalen Währungen stieg der Nettoumsatz um 19 Prozent. Die Einkünfte aus vertraglichen Vereinbarungen beliefen sich im ersten Quartal 2008 auf CHF 6,9 Millionen (1. Quartal 2007: CHF 6,8 Mio.). Produkteumsatz Der Umsatz von Tracleer® (Bosentan) belief sich im ersten Quartal 2008 auf CHF 287,6 Millionen (1. Quartal 2007: CHF 260,4 Mio.). In lokalen Währungen bedeutet dies einen Anstieg um 18 Prozent gegenüber demselben Zeitraum des Vorjahrs. Im Vergleich zum Vorquartal gingen die Verkaufserlöse für Tracleer® in lokalen Währungen um 9% zurück (4. Quartal 2007: 332,0 Mio.). Dieser Rückgang kann auf Schwankungen im Kaufverhalten zurückgeführt werden, wie dies schon in vorangegangenen Quartalen zu beobachten war. In CHF gerechnet, wurde der Umsatz von Tracleer vom zunehmend starken Schweizer Franken, insbesondere gegenüber dem US-Dollar, dem Euro und dem Britischen Pfund, negativ beeinflusst. Ende März 2008 wurde Tracleer® weltweit in über 50 Ländern vermarktet, darunter allen wichtigen pharmazeutischen Märkten. Anfang April wurde Tracleer auch in Mexiko zugelassen. Otto Schwarz, Präsident Business Operations, kommentierte: Ich bin sehr zufrieden mit der starken Leistung von Tracleer im Markt. Währungsbereinigt ist dies das zweitbeste Quartalsergebnis, das Tracleer® jemals erzielt hat. Trotz wachsenden Drucks durch die Konkurrenz in einem reifenden Markt ist die Anzahl der mit Tracleer behandelten PAH-Patienten in allen Ländern weiter gewachsen. Das Interesse an der Diagnosestellung und Behandlung von PAH ist weiterhin sehr hoch. So nahmen im März und Anfang April über 1300 Ärzte aus ganz Europa an zwei von Actelion organisierten Veranstaltungen zu PAH teil." Der Umsatz von Ventavis® (Iloprost) erreichte im ersten Quartal 2008 CHF 17,4 Millionen. Im Vergleich zum vorangegangenen Quartal ging der Umsatz von Ventavis® in lokalen Währungen um 19 Prozent zurück. Dies ist auf Schwankungen beim Kaufverhalten zurückzuführen, während die Zahl der Patienten, denen Ventavis zugute kommt, im Quartalsvergleich anstieg. Im ersten Quartal 2008 lag der Umsatz von Zavesca® (Miglustat) bei CHF 9,7 Millionen (1. Quartal 2007: CHF 7,5 Mio.). Zavesca® ist in den USA und den meisten europäischen Märkten kommerziell erhältlich. Betrieblicher Aufwand - anhaltende Ausrichtung auf beschleunigte Investitionen in F&E Im ersten Quartal 2008 belief sich der betriebliche Aufwand auf CHF 253,8 Millionen (1. Quartal 2007: CHF 441,9 Mio. - darin eingeschlossen In-Process Research and Development [IPRD]-Belastung im Zusammenhang mit der Akquisition von CoTherix in Höhe von CHF 224,8 Millionen). Im selben Zeitraum stiegen die Kosten für Forschung und Entwicklung um 30 Prozent auf CHF 85,6 Millionen (1. Quartal 2007: CHF 65,7 Mio.). Alle klinischen Programme (mit Ausnahme von Tezosentan) entwickeln sich gemäss Plan (wie anlässlich des Medien- und Analystentages 2008 am 22. Februar 2008 dargestellt).
Ende Februar 2008 kamen Actelion und Nippon Shinyaku überein, in Bezug auf einen von Nippon Shinyaku entdeckten neuartigen Wirkstoff zur Therapie der PAH zusammenzuarbeiten. Der neuartige PGI-2-Rezeptor-Agonist NS-304 ist ein oral verfügbarer Prostaglandin-I2-Rezeptor-Agonist mit langer Wirkungsdauer, der die PGI-2-Rezeptoren in den Blutgefässen stimuliert und gefässerweiternd wirkt. Die beiden Unternehmen sind überzeugt, dass NS-304 über grosses Potenzial als neuartiges Therapeutikum zur Behandlung von PAH verfügt. Nippon Shinyaku hat kürzlich die Auswertung der Phase I in Grossbritannien abgeschlossen. Ein Phase-II-Programm mit PAH-Patienten wurde Ende 2007 in Europa aufgenommen. Gemäss der Mitte April unterzeichneten Lizenzvereinbarung wird Actelion für die globale Entwicklung und Kommerzialisierung von NS-304 ausserhalb Japans verantwortlich sein, während die Substanz in Japan von beiden Unternehmen gemeinsam entwickelt und vermarktet werden soll. Infolge dieser Übereinkunft ist für Actelion im ersten Quartal 2008 ein IPRD-Aufwand von CHF 8,3 Millionen angefallen.
Die Aufwendungen für Verkauf sowie allgemeine und administrative Ausgaben beliefen sich für die ersten drei Monate 2008 auf CHF 121,0 Millionen (1. Quartal 2007: CHF 117,1 Mio.). Betriebsgewinn Der Betriebsgewinn von Actelion für das erste Quartal 2008 lag bei CHF 67,8 Millionen (1. Quartal 2007: Betriebsverlust von CHF 151,5 Mio.). Der Cash-EBIT für denselben Zeitraum betrug CHF 99,8 Millionen (1. Quartal 2007: CHF 101,3 Mio.). Reingewinn Im ersten Quartal 2008 ergab sich ein Reingewinn in Höhe von CHF 48,3 Millionen (1. Quartal 2007: Nettoverlust von CHF 150,0 Mio.). Darin enthalten sind Zinserträge von CHF 5,0 Millionen, ein Zinsaufwand von CHF 1,4 Millionen, eine nicht-liquiditätswirksame Belastung von CHF 0,4 Millionen durch die Wandelanleihe, überwiegend nicht realisierte Wechselkursverluste in Höhe von CHF 17,6 Millionen (Ergebnis aus Hedging-Gewinnen und Währungsverlusten auf Zahlungsverpflichtungen zwischen Gesellschaften des Unternehmens) sowie Einkommensteuern in Höhe von CHF 4,9 Millionen. Liquide Mittel und Cashflow Im ersten Quartal 2008 erwirtschaftete Actelion einen Cashflow aus dem operativen Geschäft in Höhe von CHF 22,1 Millionen (1. Quartal 2007: CHF 61,9 Mio.).
###
Telefonkonferenz Actelion wird am Dienstag, 22. April 2008 um 15.30 Uhr Basel (mitteleuropäischer Zeit) / 14.30 Uhr UK / 9.30 Uhr amerikanische Ostküste / eine Telefonkonferenz für Investoren durchführen. Einwahl: Europa : +41 (0)44 580 64 03 UK.: +44 (0)207 1539 154 US.: +1 866 928 6044 Webcast im Internet - Live oder auf Abruf nach Bedarf Actelion überträgt die Telefonkonferenz zeitgleich im Internet. Die Konferenz ist auch zu einem späteren Zeitpunkt nach Bedarf als Aufzeichnung abrufbar. Um die Übertragung im Internet live verfolgen zu können, benutzen Sie bitte den Link auf unserer Homepage www.actelion.com etwa 10 - 15 Minuten vor Beginn der Konferenz. Sollten Sie Schwierigkeiten beim Zugriff auf den Webcast haben, gehen Sie bitte direkt auf: URL: http://gaia.world-television.com/actelion/20080422/trunc Etwa 60 Minuten nach Beendigung der Konferenz wird die Aufzeichnung der Investorenkonferenz auf unserer Homepage abrufbar sein. Actelion Ltd Actelion Ltd ist ein biopharmazeutisches Unternehmen mit Hauptsitz in Allschwil/Basel, Schweiz. Actelions erstes Medikament, Tracleer®, ist ein zur Therapie der pulmonalen arteriellen Hypertonie zugelassener dualer Endothelin-Rezeptor-Antagonist in Tablettenform. Actelion vertreibt Tracleer® durch eigene Niederlassungen in den wichtigsten internationalen Märkten, so den Vereinigten Staaten (mit Sitz in South San Francisco), der Europäischen Union, Japan, Kanada, Australien und der Schweiz. Actelion, 1997 gegründet, ist ein weltweit führendes Unternehmen bei der Erforschung des Endothels. Das Endothel trennt die Gefässwand vom Blutstrom. Actelion konzentriert sich darauf, innovative Medikamente in Bereichen mit hohem medizinischem Bedarf zu entdecken, zu entwickeln und zu vermarkten. Actelion Aktien sind am SWX Swiss Exchange notiert (Symbol: ATLN). Für weitere Informationen wenden Sie sich bitte an: Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil Roland Haefeli Vice President, Head of Investor Relations & Public Affairs +41 61 565 62 62 +1 650 624 69 36 http://www.actelion.com --- Ende der Mitteilung --- Actelion Pharmaceuticals Ltd Gewerbestrasse 16 Allschwil Schweiz WKN: 936767; ISIN: CH0010532478; Index: SBIOM, SLIFE, SMCI, SMIEXP, SMIM, SPI, SPIEX; Notiert: Main Market in SWX Swiss Exchange; http://www.actelion.com http://hugin.info/131801/R/1211497/251055.pdf Copyright © Hugin AS 2008. All rights reserved.
Quelle: HUGIN
Antwort auf Beitrag Nr.: 33.939.758 von Fruehrentner am 22.04.08 10:45:06aktuell steigt die Aktie an der Heimatbörse um 7,5 %
Kurse in der Schweiz unter: www.swx.com, Kürzel ATLN
Kurse in der Schweiz unter: www.swx.com, Kürzel ATLN
Heute aus dem Handelsblatt Investment Idee des Tages 07.05.2008
Biotech-Aktien nehmen neuen Anlauf
Von Sven Prange
Die Kursentwicklungen in der Branche waren zuletzt miserabel, jetzt sehen Analysten erste Erholungssignale. Denn den Unternehmen ist es gelungen, das Risiko von Fehlschlägen in der Entwicklung zu senken. Und auch die Politik gibt Auftrieb. Die Investmentidee des Tages auf Handelsblatt.com.
FRANKFURT. Das Beispiel war symptomatisch für die gesamte Branche: Als die amerikanische Gesundheitsbehörde FDA sich negativ zur Zulassung eines Medikamentes der Jerini AG äußerte, rauschte die Aktie um 70 Prozent in den Keller. Am nächsten Tag hieß es, die europäischen Behörden sähen gute Chancen für die Zulassung - die Aktie kletterte um bis zu 90 Prozent.
Wer in der Biotechbranche investiert, braucht gute Nerven. Bereits im vergangenen Jahr waren die Aktien deutscher Biotech-Firmen eingebrochen, nachdem zwei mit großen Hoffnungen verbundene Mittel in den USA nicht genehmigt wurden. Die ganze Branche wurde in Sippenhaft genommen.
Einige Analysten sehen nun die Trendwende. Morphosys etwa erhält für seine Kooperation mit Novartis in den nächsten zehn Jahren mindestens 600 Mill. Dollar. Der Entwickler menschlicher Antikörper gilt als Hoffnungswert. Die Morphosys-Aktie hat seit vergangenem November, als sie bei 52 Euro notierte, kräftig verloren, sich in den letzten Wochen aber über 40 Euro stabilisiert. WestLB-Analystin Cornelia Thomas sieht das Kursziel bei 59 Euro. Nach einem Forschungsauftrag von Proteomika bewege sich Morphosys auf seine für 2008 gesteckten Ziele zu. Auch die Commerzbank rät bei Morphosys zum Kauf. Analyst Daniel Wendorff erwartet in diesem Jahr ein Umsatzwachstum von zehn Prozent, im ersten Quartal kletterte er bereits um 16 Prozent.
Für gute Nachrichten hat zuletzt auch Medigene gesorgt. Das Münchener Unternehmen hat gerade von der europäischen Zulassungsbehörde Emea die Vermarktungsempfehlung für ein lange erwartetes Produkt bekommen. Die Aktie hat in den letzten Wochen zugelegt und notiert bei rund sechs Euro, nachdem sie im Februar und März noch an der Vier-Euro-Grenze gekratzt hatte. WestLB-Analyst Oliver Kämmerer rät zum Kauf und sieht das Kursziel bei 6,80 Euro, auch wenn Umsatz und Nettoergebnis im vergangenen Jahr unter den Erwartungen geblieben seien. Morgan-Stanley-Experte Karl Bradshaw dagegen ist skeptisch. Er sieht langfristiges Steigerungspotential nur, wenn das Unternehmen in der klinischen Forschung vorankomme.
Für Anleger, die zwar in der Biotech-Branche investieren wollen, ihr Geld aber nicht auf eine einzelne Firma setzen möchten, ist die BB Biotech eine Alternative. Die Schweizer Beteiligungsgesellschaft, deren Aktien in Frankfurt gehandelt werden, hält Anteile an etwa 20 Unternehmen, die insgesamt 42 Produkte in Phase III der klinischen Tests haben.
Von fast 65 Euro im vergangenen November fiel die Aktie auf derzeit rund 50 Euro. Dresdner-Kleinwort-Analystin Stefania Forti rät trotzdem zum Kauf: "Nach einem schwachen vierten Quartal 2007 hat sich BB Biotech im ersten Quartal 2008 wieder erholt." Forti lobt vor allem die breite Streuung des BB-Portfolios: "BB Biotech fährt eine effektive Diversifikations-Strategie, die die negativen Auswirkungen von Medikamenten, die am Markt scheitern, auffangen." Für das Entwicklungspotenzial der BB-Aktie spricht auch der innere Wert, der derzeit etwa elf Prozent über dem tatsächlichen Börsenwert liegt.
"Die Branche hat Fortschritte gemacht", sagt Julia Schüler, Industrieanalystin bei Ernst & Young. "Die Entwicklungsportfolios der Firmen sind reifer geworden, das Risiko von Fehlschlägen ist gesunken", sagt Frank Mathis, Chef der Biotechnologen im Verband Forschender Arzneimittelhersteller. Zum einen gibt es derzeit wieder mehr Medikamente deutscher Biotech-Firmen, deren klinischen Testphasen fortgeschritten sind. Zum anderen sorgt der Beschluss des Bundestages, die Stichtagregelung für die Forschung an Stammzellen neu zu setzen, für Sicherheit.
###
Anmerkung: ACTELION ist im BB Biotech Portfolio mit Abstand am höchsten gewichtet!
Biotech-Aktien nehmen neuen Anlauf
Von Sven Prange
Die Kursentwicklungen in der Branche waren zuletzt miserabel, jetzt sehen Analysten erste Erholungssignale. Denn den Unternehmen ist es gelungen, das Risiko von Fehlschlägen in der Entwicklung zu senken. Und auch die Politik gibt Auftrieb. Die Investmentidee des Tages auf Handelsblatt.com.
FRANKFURT. Das Beispiel war symptomatisch für die gesamte Branche: Als die amerikanische Gesundheitsbehörde FDA sich negativ zur Zulassung eines Medikamentes der Jerini AG äußerte, rauschte die Aktie um 70 Prozent in den Keller. Am nächsten Tag hieß es, die europäischen Behörden sähen gute Chancen für die Zulassung - die Aktie kletterte um bis zu 90 Prozent.
Wer in der Biotechbranche investiert, braucht gute Nerven. Bereits im vergangenen Jahr waren die Aktien deutscher Biotech-Firmen eingebrochen, nachdem zwei mit großen Hoffnungen verbundene Mittel in den USA nicht genehmigt wurden. Die ganze Branche wurde in Sippenhaft genommen.
Einige Analysten sehen nun die Trendwende. Morphosys etwa erhält für seine Kooperation mit Novartis in den nächsten zehn Jahren mindestens 600 Mill. Dollar. Der Entwickler menschlicher Antikörper gilt als Hoffnungswert. Die Morphosys-Aktie hat seit vergangenem November, als sie bei 52 Euro notierte, kräftig verloren, sich in den letzten Wochen aber über 40 Euro stabilisiert. WestLB-Analystin Cornelia Thomas sieht das Kursziel bei 59 Euro. Nach einem Forschungsauftrag von Proteomika bewege sich Morphosys auf seine für 2008 gesteckten Ziele zu. Auch die Commerzbank rät bei Morphosys zum Kauf. Analyst Daniel Wendorff erwartet in diesem Jahr ein Umsatzwachstum von zehn Prozent, im ersten Quartal kletterte er bereits um 16 Prozent.
Für gute Nachrichten hat zuletzt auch Medigene gesorgt. Das Münchener Unternehmen hat gerade von der europäischen Zulassungsbehörde Emea die Vermarktungsempfehlung für ein lange erwartetes Produkt bekommen. Die Aktie hat in den letzten Wochen zugelegt und notiert bei rund sechs Euro, nachdem sie im Februar und März noch an der Vier-Euro-Grenze gekratzt hatte. WestLB-Analyst Oliver Kämmerer rät zum Kauf und sieht das Kursziel bei 6,80 Euro, auch wenn Umsatz und Nettoergebnis im vergangenen Jahr unter den Erwartungen geblieben seien. Morgan-Stanley-Experte Karl Bradshaw dagegen ist skeptisch. Er sieht langfristiges Steigerungspotential nur, wenn das Unternehmen in der klinischen Forschung vorankomme.
Für Anleger, die zwar in der Biotech-Branche investieren wollen, ihr Geld aber nicht auf eine einzelne Firma setzen möchten, ist die BB Biotech eine Alternative. Die Schweizer Beteiligungsgesellschaft, deren Aktien in Frankfurt gehandelt werden, hält Anteile an etwa 20 Unternehmen, die insgesamt 42 Produkte in Phase III der klinischen Tests haben.
Von fast 65 Euro im vergangenen November fiel die Aktie auf derzeit rund 50 Euro. Dresdner-Kleinwort-Analystin Stefania Forti rät trotzdem zum Kauf: "Nach einem schwachen vierten Quartal 2007 hat sich BB Biotech im ersten Quartal 2008 wieder erholt." Forti lobt vor allem die breite Streuung des BB-Portfolios: "BB Biotech fährt eine effektive Diversifikations-Strategie, die die negativen Auswirkungen von Medikamenten, die am Markt scheitern, auffangen." Für das Entwicklungspotenzial der BB-Aktie spricht auch der innere Wert, der derzeit etwa elf Prozent über dem tatsächlichen Börsenwert liegt.
"Die Branche hat Fortschritte gemacht", sagt Julia Schüler, Industrieanalystin bei Ernst & Young. "Die Entwicklungsportfolios der Firmen sind reifer geworden, das Risiko von Fehlschlägen ist gesunken", sagt Frank Mathis, Chef der Biotechnologen im Verband Forschender Arzneimittelhersteller. Zum einen gibt es derzeit wieder mehr Medikamente deutscher Biotech-Firmen, deren klinischen Testphasen fortgeschritten sind. Zum anderen sorgt der Beschluss des Bundestages, die Stichtagregelung für die Forschung an Stammzellen neu zu setzen, für Sicherheit.
###
Anmerkung: ACTELION ist im BB Biotech Portfolio mit Abstand am höchsten gewichtet!
Bei Intercell und Medigene gibts heut wieder Gerüchte bezüglich einer Übernahme bzw. Auftstockung der Anteile.
Auch Actelion ist ein latenter Übernahmekandidat und steigt im Zuge der Gerüchte in der Branche heute ebenfalls leicht an.
Mal sehen, ob das die nächsten Tage anhält. Biotech is back!
Auch Actelion ist ein latenter Übernahmekandidat und steigt im Zuge der Gerüchte in der Branche heute ebenfalls leicht an.
Mal sehen, ob das die nächsten Tage anhält. Biotech is back!
Seit Wochen kennt der Kurs nur eine Richtung: nach oben
Auch heute wieder schönes plus.
Momentan versucht der Kurs die 60 Frankengrenze zu durchbrechen.
Da ist was im Busch, wenn ihr mich fragt!
Ich hoffe, wir sehen das alte high aus dem letzten Jahr bald wieder.
Kurse an der schweizer Heimatbörse unter dem Kürzel ATLN unter www.swx.com
Auch heute wieder schönes plus.
Momentan versucht der Kurs die 60 Frankengrenze zu durchbrechen.
Da ist was im Busch, wenn ihr mich fragt!
Ich hoffe, wir sehen das alte high aus dem letzten Jahr bald wieder.
Kurse an der schweizer Heimatbörse unter dem Kürzel ATLN unter www.swx.com
Actelion-Gründer Clozel als Unternehmer des Jahres geehrt
Zürich. sda. Der Gründer des Biotechnologie-Unternehmens Actelion Jean-Paul Clozel ist von Ernst & Young am Samstagabend zum globalen Unternehmer des Jahres gewählt worden. Damit ging erstmals der Titel in die Schweiz.
Der Schweizer wurde unter 48 Konkurrenten aus mehr als 40 Ländern zum "World Entrepreneur Of The Year" gewählt, wie das Wirtschaftsprüfungs- und -beratungsunternehmen Ernst & Young mitteilte.
Clozel sei in einem unglaublich schwierigen Markt grosse Risiken eingegangen, schreibt die Jury. Diese Risiken hätten sich ausbezahlt: Actelion sei heute ein grosses und erfolgreiches Unternehmen.
Zürich. sda. Der Gründer des Biotechnologie-Unternehmens Actelion Jean-Paul Clozel ist von Ernst & Young am Samstagabend zum globalen Unternehmer des Jahres gewählt worden. Damit ging erstmals der Titel in die Schweiz.
Der Schweizer wurde unter 48 Konkurrenten aus mehr als 40 Ländern zum "World Entrepreneur Of The Year" gewählt, wie das Wirtschaftsprüfungs- und -beratungsunternehmen Ernst & Young mitteilte.
Clozel sei in einem unglaublich schwierigen Markt grosse Risiken eingegangen, schreibt die Jury. Diese Risiken hätten sich ausbezahlt: Actelion sei heute ein grosses und erfolgreiches Unternehmen.
Actelion trotz schwacher Börsen aktuell an der SWX mit 3,7 % satt im plus!!
News habe ich nicht gefunden. Gibt's neue Gerüchte? Oder ist es die aktuell aufkeimende Übernahmefantasie im Biotechbereich?
News habe ich nicht gefunden. Gibt's neue Gerüchte? Oder ist es die aktuell aufkeimende Übernahmefantasie im Biotechbereich?
Antwort auf Beitrag Nr.: 34.236.151 von Fruehrentner am 04.06.08 14:47:55Laut Cash Gurus Gerüchteecke unter www.cash.ch/guru/ heisst es heute:
"Actelion - die einzige Aktie im Plus. Erfreut sich weiterhin guter Analystenempfehlungen."

"Actelion - die einzige Aktie im Plus. Erfreut sich weiterhin guter Analystenempfehlungen."

ich zitiere nachfolgend user "bambus" aus dem Forum von www.cash.ch :
"Besondere Aufmerksamkeit in dem Sextett genießt wegen seines neuartigen Wirkmechanismus das Schlafmittel Almorexant. Eine Verpartnerung in den nächsten sechs Monaten ist wahrscheinlich. „Von den zehn größten Pharma-Firmen der Welt haben sich sieben bei uns gemeldet“, sagt Clozel. Verpartnerung heißt, dass ein Konzern – oft für eine Millionensumme und eine Umsatzbeteiligung – die Vermarktungsrechte an einem Medikament erwirbt.
Die Investmentbank Goldman Sachs spekuliert bereits, dass angesichts der vollen Pipeline manche Pharmafirmen sogar noch mehr wollen als nur Almorexant. „Eine Verpartnerung könnte in einem Übernahmeangebot enden“, heißt es in einer Studie.CSF "
Gruss
Bambus
http://board.cash.ch/bb/viewtopic.php?t=364&postdays=0&posto…
"Besondere Aufmerksamkeit in dem Sextett genießt wegen seines neuartigen Wirkmechanismus das Schlafmittel Almorexant. Eine Verpartnerung in den nächsten sechs Monaten ist wahrscheinlich. „Von den zehn größten Pharma-Firmen der Welt haben sich sieben bei uns gemeldet“, sagt Clozel. Verpartnerung heißt, dass ein Konzern – oft für eine Millionensumme und eine Umsatzbeteiligung – die Vermarktungsrechte an einem Medikament erwirbt.
Die Investmentbank Goldman Sachs spekuliert bereits, dass angesichts der vollen Pipeline manche Pharmafirmen sogar noch mehr wollen als nur Almorexant. „Eine Verpartnerung könnte in einem Übernahmeangebot enden“, heißt es in einer Studie.CSF "
Gruss
Bambus
http://board.cash.ch/bb/viewtopic.php?t=364&postdays=0&posto…
16.06.2008 14:28:42
Actelion chancenreich
Düsseldorf (aktiencheck.de AG) - Den Experten der "Wirtschaftswoche" zufolge ist die Actelion-Aktie (ISIN CH0010532478/ WKN 936767) ein chancenreiches Investment. Als Mitte letzten Jahres Gilead Sciences für sein Medikament Letaris die Zulassung erhalten habe, sei schon ein Ende des Erfolgskurses von Actelion vermutet worden. Denn Actelion generiere 90% seiner Umsätze mit seinem Blockbuster Tracleer, welcher führend bei der Bekämpfung des gefährlichen Bluthochdrucks im Lungenkreislauf sei. Dafür werde auch das Gilead-Produkt eingesetzt. Doch Tracleer verkaufe sich weiterhin gut. Im 1. Quartal sei der Absatz um 10% auf 288 Mio. Franken geklettert. Das Wachstum dürfte auch weiterhin anhalten, so die Experten. Das Unternehmen plane das Produkt auch gegen eine chronische Erkrankung des Lungenbindegewebes einzusetzen. Zudem arbeite der Konzern an Neuentwicklungen. Hier sei das Schlafmittel Almorexant vielversprechend. Trotzdem sei der Titel spekulativ, dessen Entwicklung vom Erfolg weniger Produkte abhänge, jedoch nicht von Konjunkturschwäche betroffen sei. In den letzten Monaten habe die Aktie leicht zulegen können. Den Experten der "Wirtschaftswoche" zufolge ist die Actelion-Aktie ein chancenreiches Investment. (Ausgabe 25) (16.06.2008/ac/a/a)
Quelle: AKTIENCHECK.DE
Actelion chancenreich
Düsseldorf (aktiencheck.de AG) - Den Experten der "Wirtschaftswoche" zufolge ist die Actelion-Aktie (ISIN CH0010532478/ WKN 936767) ein chancenreiches Investment. Als Mitte letzten Jahres Gilead Sciences für sein Medikament Letaris die Zulassung erhalten habe, sei schon ein Ende des Erfolgskurses von Actelion vermutet worden. Denn Actelion generiere 90% seiner Umsätze mit seinem Blockbuster Tracleer, welcher führend bei der Bekämpfung des gefährlichen Bluthochdrucks im Lungenkreislauf sei. Dafür werde auch das Gilead-Produkt eingesetzt. Doch Tracleer verkaufe sich weiterhin gut. Im 1. Quartal sei der Absatz um 10% auf 288 Mio. Franken geklettert. Das Wachstum dürfte auch weiterhin anhalten, so die Experten. Das Unternehmen plane das Produkt auch gegen eine chronische Erkrankung des Lungenbindegewebes einzusetzen. Zudem arbeite der Konzern an Neuentwicklungen. Hier sei das Schlafmittel Almorexant vielversprechend. Trotzdem sei der Titel spekulativ, dessen Entwicklung vom Erfolg weniger Produkte abhänge, jedoch nicht von Konjunkturschwäche betroffen sei. In den letzten Monaten habe die Aktie leicht zulegen können. Den Experten der "Wirtschaftswoche" zufolge ist die Actelion-Aktie ein chancenreiches Investment. (Ausgabe 25) (16.06.2008/ac/a/a)
Quelle: AKTIENCHECK.DE
Übrigens, Takeda hatte einen Rückschlag bei seinem Schlafmittelkandidaten. Gut für Actelions Almorexant!
Takeda to appeal EMEA negative opinion on insomnia drug
17th June 2008
Takeda Pharmaceutical Company has announced that its wholly owned subsidiary, Takeda Global R&D Centre, has requested a re-examination of the opinion given by the Committee for Medicinal Products for Human Use of the European Medicines Agency.
This request is in response to the negative opinion of May 30, 2008, in which the Committee for Medicinal Products for Human Use (CHMP) recommended the refusal of the marketing authorization in the EU for ramelteon in the treatment of patients with primary insomnia, since the CHMP was concerned that the effectiveness of ramelteon had not been demonstrated, which was measured considering only one aspect of insomnia, the time to fall asleep.
The original marketing authorization application (MAA) was submitted by Takeda Global R&D Centre in March 2007 and this request for re-examination was made in accordance with European Medicines Agency's (EMEA) formal process whereby the sponsor of an MAA may request re-examination of the initial CHMP opinion.
Takeda remains convinced of the positive aspect of ramelteon, which induces the natural sleep for the treatment of patients with primary insomnia and looks forward to continuing working with the EMEA and the CHMP to bring this MAA to a positive outcome for patients in the EU.
http://www.pharmaceutical-business-review.com/article_news.a…
Takeda to appeal EMEA negative opinion on insomnia drug
17th June 2008
Takeda Pharmaceutical Company has announced that its wholly owned subsidiary, Takeda Global R&D Centre, has requested a re-examination of the opinion given by the Committee for Medicinal Products for Human Use of the European Medicines Agency.
This request is in response to the negative opinion of May 30, 2008, in which the Committee for Medicinal Products for Human Use (CHMP) recommended the refusal of the marketing authorization in the EU for ramelteon in the treatment of patients with primary insomnia, since the CHMP was concerned that the effectiveness of ramelteon had not been demonstrated, which was measured considering only one aspect of insomnia, the time to fall asleep.
The original marketing authorization application (MAA) was submitted by Takeda Global R&D Centre in March 2007 and this request for re-examination was made in accordance with European Medicines Agency's (EMEA) formal process whereby the sponsor of an MAA may request re-examination of the initial CHMP opinion.
Takeda remains convinced of the positive aspect of ramelteon, which induces the natural sleep for the treatment of patients with primary insomnia and looks forward to continuing working with the EMEA and the CHMP to bring this MAA to a positive outcome for patients in the EU.
http://www.pharmaceutical-business-review.com/article_news.a…
20.06.2008 10:35:26
Actelion "hold"
Zürich (aktiencheck.de AG) - Der Analyst von Vontobel Research, Andrew Weiss, stuft die Actelion-Aktie (ISIN CH0010532478/ WKN 936767) weiterhin mit "hold" ein. Actelions Studienleiter Professor Galié von der Universität Bologna habe die gesamten Daten zur EARLY-Studie in der Fachzeitschrift The Lancet veröffentlicht. Ziel der EARLY-Studie seien die Untersuchung der Wirkung einer Behandlung mit Bosentan für PAH-Patienten der WHO-Funktionsklasse II sowie weitere Erkenntnisse über das Frühstadium der Krankheit gewesen. Die beiden primären Endpunkte hätten in einer Veränderung des Lungen-Gefässwiderstands (PVR) und der Leistungsfähigkeit (6MWD) bestanden. Das Fortschreiten der Erkrankung sei anhand sekundärer Endpunkte untersucht worden. Dazu hätten die Erfassung der Zeit bis zur Verschlechterung des klinischen Zustands und die WHO-Funktionsklasse gehört. Die Studie EARLY sei die erste zur Untersuchung der Wirkung einer ERA-Behandlung von Patienten der Funktionsklasse II (PAH im frühen Stadium). Die (statistisch signifikanten) Daten, die nach einer Behandlungsdauer von 6 Monaten auf eine markante Reduktion von pulmonalem Gefäßwiderstand sowie ein vermindertes Progressionsrisiko hingewiesen hätten, seien bereits am 18. Dezember 2006 veröffentlicht worden. Die Daten seien im Sommer 2007 im Rahmen eines Antrags auf Ergänzung der Produkteinformation eingereicht worden. Die heute veröffentlichten Daten würden auf eindrucksvolle Weise zeigen, dass Patienten mit PAH im frühen Stadium (Funktionsklasse II) sehr gut auf eine Behandlung mit Tracleer ansprechen würden. Zum Zeitpunkt der Veröffentlichung hätten die Analysten in diesen Daten das Potenzial für eine Verdoppelung des Marktes für Tracleer gesehen. Da die PAH-Patienten der Funktionsklasse II nur sehr schwache Symptome zeigen würden, dürfte es jedoch viel Aufwand kosten, die Ärzte für diese spezielle Patientengruppe zu sensibilisieren. Die Analysten würden erwarten, dass sowohl EMEA und auch FDA noch im Sommer 2008 über die eingereichten Zusatzdaten entscheiden würden. Aufgrund der Daten der EARLY-Studie würden die Analysten ihre Finanzprognosen nicht anpassen. Sie würden bei ihren Berechnungen von einer sehr geringen Zunahme der Patientenbasis ausgehen. Sollte sich Actelion bei der Patientenakquirierung allerdings als erfolgreicher als erwartet erweisen, würden die Analysten durchaus ein Aufwärtspotenzial für den Titel sehen. Die Veröffentlichung der EARLY-Daten in der Fachzeitschrift The Lancet sei erwartet worden. Eckdaten seien bereits im Dezember 2006 veröffentlicht worden. Im Sommer 2008 erwarte man die Reaktion der Gesundheitsbehörden EMEA und FDA im Anschluss auf die Einreichung dieser Daten im vergangenen Jahr. Die EARLY-Daten seien das erste Studienergebnis, das den Vorteil einer Behandlung mit EAR in der Funktionsklasse II beweise. Diese Daten sollten Actelion einen weiteren Vorteil gegenüber Letairis von Gilead geben. Die Analysten von Vontobel Research halten an ihrem "hold"-Rating für die Actelion-Aktie und am Kursziel von CHF 62 fest. (Analyse vom 20.06.2008) (20.06.2008/ac/a/a)
Quelle: AKTIENCHECK.DE
Gegenwärtig stehen wir bei ca. 58 CHF!!
Merkwürdig, warum Vontobel kein Wort über den Schlafmittelkandidaten Almorexant und die mögliche Verpartnerung verliert.
Actelion "hold"
Zürich (aktiencheck.de AG) - Der Analyst von Vontobel Research, Andrew Weiss, stuft die Actelion-Aktie (ISIN CH0010532478/ WKN 936767) weiterhin mit "hold" ein. Actelions Studienleiter Professor Galié von der Universität Bologna habe die gesamten Daten zur EARLY-Studie in der Fachzeitschrift The Lancet veröffentlicht. Ziel der EARLY-Studie seien die Untersuchung der Wirkung einer Behandlung mit Bosentan für PAH-Patienten der WHO-Funktionsklasse II sowie weitere Erkenntnisse über das Frühstadium der Krankheit gewesen. Die beiden primären Endpunkte hätten in einer Veränderung des Lungen-Gefässwiderstands (PVR) und der Leistungsfähigkeit (6MWD) bestanden. Das Fortschreiten der Erkrankung sei anhand sekundärer Endpunkte untersucht worden. Dazu hätten die Erfassung der Zeit bis zur Verschlechterung des klinischen Zustands und die WHO-Funktionsklasse gehört. Die Studie EARLY sei die erste zur Untersuchung der Wirkung einer ERA-Behandlung von Patienten der Funktionsklasse II (PAH im frühen Stadium). Die (statistisch signifikanten) Daten, die nach einer Behandlungsdauer von 6 Monaten auf eine markante Reduktion von pulmonalem Gefäßwiderstand sowie ein vermindertes Progressionsrisiko hingewiesen hätten, seien bereits am 18. Dezember 2006 veröffentlicht worden. Die Daten seien im Sommer 2007 im Rahmen eines Antrags auf Ergänzung der Produkteinformation eingereicht worden. Die heute veröffentlichten Daten würden auf eindrucksvolle Weise zeigen, dass Patienten mit PAH im frühen Stadium (Funktionsklasse II) sehr gut auf eine Behandlung mit Tracleer ansprechen würden. Zum Zeitpunkt der Veröffentlichung hätten die Analysten in diesen Daten das Potenzial für eine Verdoppelung des Marktes für Tracleer gesehen. Da die PAH-Patienten der Funktionsklasse II nur sehr schwache Symptome zeigen würden, dürfte es jedoch viel Aufwand kosten, die Ärzte für diese spezielle Patientengruppe zu sensibilisieren. Die Analysten würden erwarten, dass sowohl EMEA und auch FDA noch im Sommer 2008 über die eingereichten Zusatzdaten entscheiden würden. Aufgrund der Daten der EARLY-Studie würden die Analysten ihre Finanzprognosen nicht anpassen. Sie würden bei ihren Berechnungen von einer sehr geringen Zunahme der Patientenbasis ausgehen. Sollte sich Actelion bei der Patientenakquirierung allerdings als erfolgreicher als erwartet erweisen, würden die Analysten durchaus ein Aufwärtspotenzial für den Titel sehen. Die Veröffentlichung der EARLY-Daten in der Fachzeitschrift The Lancet sei erwartet worden. Eckdaten seien bereits im Dezember 2006 veröffentlicht worden. Im Sommer 2008 erwarte man die Reaktion der Gesundheitsbehörden EMEA und FDA im Anschluss auf die Einreichung dieser Daten im vergangenen Jahr. Die EARLY-Daten seien das erste Studienergebnis, das den Vorteil einer Behandlung mit EAR in der Funktionsklasse II beweise. Diese Daten sollten Actelion einen weiteren Vorteil gegenüber Letairis von Gilead geben. Die Analysten von Vontobel Research halten an ihrem "hold"-Rating für die Actelion-Aktie und am Kursziel von CHF 62 fest. (Analyse vom 20.06.2008) (20.06.2008/ac/a/a)
Quelle: AKTIENCHECK.DE
Gegenwärtig stehen wir bei ca. 58 CHF!!
Merkwürdig, warum Vontobel kein Wort über den Schlafmittelkandidaten Almorexant und die mögliche Verpartnerung verliert.
NEWS!!
Published: 01:02 20.06.2008 GMT+2 /HUGIN /Source: Actelion Pharmaceuticals Ltd /SWX: ATLN /ISIN: CH0010532478
Pivotal pulmonary arterial hypertension study published in The Lancet concludes that bosentan (Tracleer®) demonstrates benefits in patients with mildly symptomatic WHO Functional Class II disease
ALLSCHWIL, SWITZERLAND - 20 June 2008 - Actelion Ltd (SWX: ATLN) announced today that data published in The Lancet[1] show that, in mildly symptomatic pulmonary arterial hypertension (PAH) patients (WHO functional class II - WHO FC II), bosentan (Tracleer®) prevented clinical deterioration by significantly delaying time to clinical worsening and reduced the number of patients worsening to WHO FC III/IV. A significant reduction in pulmonary vascular resistance and a positive trend in increasing the 6MWD were also observed. The randomized, placebo-controlled EARLY (Endothelin Antagonist tRial in miLdlY symptomatic PAH patients) trial is the first and only trial conducted exclusively in a dedicated FC II PAH patient population.
Professor Nazzareno Galié of the University of Bologna, Italy and lead investigator commented: "The EARLY trial demonstrates that without treatment, even mildly symptomatic patients experience PAH progression within a short period of time. In contrast, treatment with bosentan significantly delayed PAH progression while improving hemodynamic parameters."
The findings of EARLY indicate that treatment with bosentan may be beneficial for WHO FC II PAH patients. Actelion is working with authorities in the US and Europe and in other countries worldwide to expand the label for Tracleer® to include WHO FC II.
EARLY is the third randomized controlled trial with bosentan, to provide data that show a consistent significant effect on delaying PAH progression and reducing disease severity. The data from the other two pivotal trials, Study 351[2] and BREATHE-1[3 trial, which both investigated bosentan in FC III and IV patients, were published in The Lancet and the New England Journal of Medicine respectively.
The objectives of the EARLY trial were to investigate the effects of bosentan specifically in PAH patients in WHO FC II and to gain more insight into early stage disease. The co-primary endpoints were changes in pulmonary vascular resistance (PVR) and exercise capacity (6MWD). Disease progression was assessed by the secondary endpoints time to clinical worsening and WHO functional class.
A highly significant reduction in PVR of 22.6% (p <0.0001) and a significant 77% risk reduction in delaying the time to clinical worsening (p = 0.011) were seen after six months of bosentan treatment compared with placebo. Time to clinical worsening, defined by death, hospitalization for PAH and symptomatic progression of PAH, showed that more patients remained stable without signs of deterioration in the bosentan-treated group compared with placebo (3.4% vs. 13.2%, p = 0.029). In addition, a significant delay in WHO functional class deterioration was observed in the bosentan group compared with placebo, providing further evidence of delayed disease progression. The improvement in 6MWD did not reach statistical significance (p = 0.076). This may reflect the fact that, on average, patients in EARLY had a relatively well-preserved exercise capacity, which therefore can be more difficult to improve.
The safety and tolerability profile of bosentan was consistent with that observed in previous placebo-controlled clinical trials.[2], [3]
Professor Gérald Simonneau, Hôpital Antoine Béclère, Université Paris-Sud, France commented: "The results from EARLY show the relentlessly progressive nature of PAH, even in its early stages. It is of paramount importance to screen high risk patients to attain a timely diagnosis and then to treat these patients with an evidence-based approach. It is also crucial that all PAH patients, regardless of functional class, are routinely monitored for the earliest signs and symptoms of PAH progression."
A subgroup of patients who received concomitant sildenafil showed improvements in PVR and 6MWD consistent with the overall results.
Further evidence of the effect of bosentan on hemodynamics is provided by the reduction of NT-proBNP plasma concentration in the bosentan-treated group compared to the increase in the placebo-treated patients. It is generally considered that a decrease in plasma concentration of NT-proBNP following targeted PAH therapy is a predictive factor for patient outcome.
An open-label extension of EARLY is ongoing to establish the impact of early intervention on long-term patient outcome.
###
Notes to editor
About Pulmonary Arterial Hypertension (PAH)
PAH is a syndrome characterized by a progressive increase in pulmonary vascular resistance (PVR) leading to right ventricular failure and premature death.[4] If untreated, PAH carries a very poor prognosis with a median survival of 2.8 years after diagnosis.[5]
There are four WHO functional classes for PAH with class I being the least severe and class IV being the most advanced. These reflect the impact on a patient's life in terms of symptoms and physical activity. Class II patients are defined as patients with pulmonary hypertension resulting in mild limitation of physical activity, they are comfortable at rest and ordinary physical activity causes undue dyspnea or fatigue, chest pain or near syncope.[6]
The pathogenesis of PAH involves the increased production of vasoactive compounds, such as endothelin. Endothelin is produced by the endothelial cells and is essential for maintenance of normal vascular tone and function. Tracleer® was the first in a new class of treatments for PAH known as endothelin receptor antagonists. Tracleer® is a dual antagonist as it blocks both ETA and ETB receptors preventing the deleterious effects of endothelin.
Online information on PAH is available at www.pah-info.com. PAH-info.com is part of an international PAH awareness campaign supported by Actelion Pharmaceuticals and has been created to provide information to healthcare professionals and patients.
About Tracleer® in Pulmonary Arterial Hypertension (PAH)
Tracleer® is an oral dual endothelin receptor antagonist, which is currently licensed for the treatment of PAH; in the United States in PAH Functional Class III and IV to improve exercise capacity and decrease the rate of clinical worsening and in Europe in PAH Functional Class III to improve exercise capacity and symptoms. In the EU Tracleer® is also indicated to reduce the number of new digital ulcers in patients with systemic sclerosis and ongoing digital ulcer disease. Regulatory review for the inclusion of functional class II in the Tracleer® label is ongoing on a worldwide basis.
Actelion also conducted clinical trials to further describe the role of bosentan in treating PAH in specific patient populations, such as patients with Eisenmenger syndrome, a congenital heart disorder (BREATHE-5), patients infected with HIV (BREATHE-4). Study results are reflected in the Tracleer® product label. A clinical study with bosentan in children suffering from PAH (BREATHE-3) has resulted in the ongoing clinical evaluation of a specific childrens formulation of bosentan.
Tracleer® has been made commercially available by Actelion subsidiaries in the United States, the European Union, Japan, Australia, Canada, Switzerland and other markets worldwide since 2001. In these six years of clinical experience, more than 50,000 patients have been treated with Tracleer®.
About Tracleer® in Digital Ulcers (DU)
DUs are a manifestation of the underlying vasculopathy which is central to the pathophysiology of systemic sclerosis (SSc) and pivotal in the development of PAH in SSc, one of the leading causes of death in SSc. Endothelin, a pathogenic mediator, is implicated in the underlying vasculopathy in SSc.
DUs can be a frequent, persistent and debilitating complication of SSc. They are caused by a reduction in the lumen of small bloody vessels that decreases blood flow to the fingers and toes causing open sores. DUs are painful, with a debilitating impact on patients' daily life, often making it impossible to work and undertake even simple day-to-day activities, particularly those associated with fingertip function. Reducing the occurrence of new DUs is an important and achievable treatment goal in SSc.
In the EU Tracleer® is indicated to reduce the number of new digital ulcers in patients with systemic sclerosis and ongoing digital ulcer disease. Tracleer® has been shown to improve hand function (i.e. dressing and hygiene) in patients with scleroderma-induced digital ulcers.
Requires attention to two significant safety concerns: Potential for serious liver injury (including rare cases of liver failure and unexplained hepatic cirrhosis in a setting of close monitoring) - Liver monitoring of all patients is essential prior to initiation of treatment and monthly thereafter. High potential for major birth defects -Pregnancy must be excluded and prevented by two forms of birth control; monthly pregnancy tests should be obtained. Because of these risks, Tracleer® is only supplied through a controlled distribution.
References
[1] Galiè N, Rubin LJ, Hoeper MM et al. Treatment of patients with mildly symptomatic pulmonary arterial hypertension with bosentan (EARLY study): a double-blind, randomised controlled trial. The Lancet 2008; 371: 2093-2100.
[2] Channick RN, Simonneau G, Sitbon O et al. Effects of the dual endothelin-receptor antagonist bosentan in patients with pulmonary hypertension: a randomised placebo-controlled study. The Lancet 2001; 358: 1119-23 (Study 351).
[3] Rubin LJ, Badesch DB, Barst RJ et al. Bosentan therapy for pulmonary arterial hypertension. NEJM 2002; 346: 896-903 (BREATHE-1).
[4] Sitbon O, Humbert M, Jais X et al. Long-term response to calcium channel blockers in idiopathic pulmonary arterial hypertension. Circulation 2005; 111: 3105-3111
[5] D'Alonzo GE, Barst RJ, Ayres SM et al. Survival in patients with primary pulmonary hypertension: Results from a national prospective registry. Ann Intern Med 1991; 115: 343-349.
[6] Barst RJ, McGoon M, Torbicki A et al. Diagnosis and differential assessment of pulmonary arterial hypertension. J Am Coll Cardiol 2004; 43(Suppl S): 40S-47S
Published: 01:02 20.06.2008 GMT+2 /HUGIN /Source: Actelion Pharmaceuticals Ltd /SWX: ATLN /ISIN: CH0010532478
Pivotal pulmonary arterial hypertension study published in The Lancet concludes that bosentan (Tracleer®) demonstrates benefits in patients with mildly symptomatic WHO Functional Class II disease
ALLSCHWIL, SWITZERLAND - 20 June 2008 - Actelion Ltd (SWX: ATLN) announced today that data published in The Lancet[1] show that, in mildly symptomatic pulmonary arterial hypertension (PAH) patients (WHO functional class II - WHO FC II), bosentan (Tracleer®) prevented clinical deterioration by significantly delaying time to clinical worsening and reduced the number of patients worsening to WHO FC III/IV. A significant reduction in pulmonary vascular resistance and a positive trend in increasing the 6MWD were also observed. The randomized, placebo-controlled EARLY (Endothelin Antagonist tRial in miLdlY symptomatic PAH patients) trial is the first and only trial conducted exclusively in a dedicated FC II PAH patient population.
Professor Nazzareno Galié of the University of Bologna, Italy and lead investigator commented: "The EARLY trial demonstrates that without treatment, even mildly symptomatic patients experience PAH progression within a short period of time. In contrast, treatment with bosentan significantly delayed PAH progression while improving hemodynamic parameters."
The findings of EARLY indicate that treatment with bosentan may be beneficial for WHO FC II PAH patients. Actelion is working with authorities in the US and Europe and in other countries worldwide to expand the label for Tracleer® to include WHO FC II.
EARLY is the third randomized controlled trial with bosentan, to provide data that show a consistent significant effect on delaying PAH progression and reducing disease severity. The data from the other two pivotal trials, Study 351[2] and BREATHE-1[3 trial, which both investigated bosentan in FC III and IV patients, were published in The Lancet and the New England Journal of Medicine respectively.
The objectives of the EARLY trial were to investigate the effects of bosentan specifically in PAH patients in WHO FC II and to gain more insight into early stage disease. The co-primary endpoints were changes in pulmonary vascular resistance (PVR) and exercise capacity (6MWD). Disease progression was assessed by the secondary endpoints time to clinical worsening and WHO functional class.
A highly significant reduction in PVR of 22.6% (p <0.0001) and a significant 77% risk reduction in delaying the time to clinical worsening (p = 0.011) were seen after six months of bosentan treatment compared with placebo. Time to clinical worsening, defined by death, hospitalization for PAH and symptomatic progression of PAH, showed that more patients remained stable without signs of deterioration in the bosentan-treated group compared with placebo (3.4% vs. 13.2%, p = 0.029). In addition, a significant delay in WHO functional class deterioration was observed in the bosentan group compared with placebo, providing further evidence of delayed disease progression. The improvement in 6MWD did not reach statistical significance (p = 0.076). This may reflect the fact that, on average, patients in EARLY had a relatively well-preserved exercise capacity, which therefore can be more difficult to improve.
The safety and tolerability profile of bosentan was consistent with that observed in previous placebo-controlled clinical trials.[2], [3]
Professor Gérald Simonneau, Hôpital Antoine Béclère, Université Paris-Sud, France commented: "The results from EARLY show the relentlessly progressive nature of PAH, even in its early stages. It is of paramount importance to screen high risk patients to attain a timely diagnosis and then to treat these patients with an evidence-based approach. It is also crucial that all PAH patients, regardless of functional class, are routinely monitored for the earliest signs and symptoms of PAH progression."
A subgroup of patients who received concomitant sildenafil showed improvements in PVR and 6MWD consistent with the overall results.
Further evidence of the effect of bosentan on hemodynamics is provided by the reduction of NT-proBNP plasma concentration in the bosentan-treated group compared to the increase in the placebo-treated patients. It is generally considered that a decrease in plasma concentration of NT-proBNP following targeted PAH therapy is a predictive factor for patient outcome.
An open-label extension of EARLY is ongoing to establish the impact of early intervention on long-term patient outcome.
###
Notes to editor
About Pulmonary Arterial Hypertension (PAH)
PAH is a syndrome characterized by a progressive increase in pulmonary vascular resistance (PVR) leading to right ventricular failure and premature death.[4] If untreated, PAH carries a very poor prognosis with a median survival of 2.8 years after diagnosis.[5]
There are four WHO functional classes for PAH with class I being the least severe and class IV being the most advanced. These reflect the impact on a patient's life in terms of symptoms and physical activity. Class II patients are defined as patients with pulmonary hypertension resulting in mild limitation of physical activity, they are comfortable at rest and ordinary physical activity causes undue dyspnea or fatigue, chest pain or near syncope.[6]
The pathogenesis of PAH involves the increased production of vasoactive compounds, such as endothelin. Endothelin is produced by the endothelial cells and is essential for maintenance of normal vascular tone and function. Tracleer® was the first in a new class of treatments for PAH known as endothelin receptor antagonists. Tracleer® is a dual antagonist as it blocks both ETA and ETB receptors preventing the deleterious effects of endothelin.
Online information on PAH is available at www.pah-info.com. PAH-info.com is part of an international PAH awareness campaign supported by Actelion Pharmaceuticals and has been created to provide information to healthcare professionals and patients.
About Tracleer® in Pulmonary Arterial Hypertension (PAH)
Tracleer® is an oral dual endothelin receptor antagonist, which is currently licensed for the treatment of PAH; in the United States in PAH Functional Class III and IV to improve exercise capacity and decrease the rate of clinical worsening and in Europe in PAH Functional Class III to improve exercise capacity and symptoms. In the EU Tracleer® is also indicated to reduce the number of new digital ulcers in patients with systemic sclerosis and ongoing digital ulcer disease. Regulatory review for the inclusion of functional class II in the Tracleer® label is ongoing on a worldwide basis.
Actelion also conducted clinical trials to further describe the role of bosentan in treating PAH in specific patient populations, such as patients with Eisenmenger syndrome, a congenital heart disorder (BREATHE-5), patients infected with HIV (BREATHE-4). Study results are reflected in the Tracleer® product label. A clinical study with bosentan in children suffering from PAH (BREATHE-3) has resulted in the ongoing clinical evaluation of a specific childrens formulation of bosentan.
Tracleer® has been made commercially available by Actelion subsidiaries in the United States, the European Union, Japan, Australia, Canada, Switzerland and other markets worldwide since 2001. In these six years of clinical experience, more than 50,000 patients have been treated with Tracleer®.
About Tracleer® in Digital Ulcers (DU)
DUs are a manifestation of the underlying vasculopathy which is central to the pathophysiology of systemic sclerosis (SSc) and pivotal in the development of PAH in SSc, one of the leading causes of death in SSc. Endothelin, a pathogenic mediator, is implicated in the underlying vasculopathy in SSc.
DUs can be a frequent, persistent and debilitating complication of SSc. They are caused by a reduction in the lumen of small bloody vessels that decreases blood flow to the fingers and toes causing open sores. DUs are painful, with a debilitating impact on patients' daily life, often making it impossible to work and undertake even simple day-to-day activities, particularly those associated with fingertip function. Reducing the occurrence of new DUs is an important and achievable treatment goal in SSc.
In the EU Tracleer® is indicated to reduce the number of new digital ulcers in patients with systemic sclerosis and ongoing digital ulcer disease. Tracleer® has been shown to improve hand function (i.e. dressing and hygiene) in patients with scleroderma-induced digital ulcers.
Requires attention to two significant safety concerns: Potential for serious liver injury (including rare cases of liver failure and unexplained hepatic cirrhosis in a setting of close monitoring) - Liver monitoring of all patients is essential prior to initiation of treatment and monthly thereafter. High potential for major birth defects -Pregnancy must be excluded and prevented by two forms of birth control; monthly pregnancy tests should be obtained. Because of these risks, Tracleer® is only supplied through a controlled distribution.
References
[1] Galiè N, Rubin LJ, Hoeper MM et al. Treatment of patients with mildly symptomatic pulmonary arterial hypertension with bosentan (EARLY study): a double-blind, randomised controlled trial. The Lancet 2008; 371: 2093-2100.
[2] Channick RN, Simonneau G, Sitbon O et al. Effects of the dual endothelin-receptor antagonist bosentan in patients with pulmonary hypertension: a randomised placebo-controlled study. The Lancet 2001; 358: 1119-23 (Study 351).
[3] Rubin LJ, Badesch DB, Barst RJ et al. Bosentan therapy for pulmonary arterial hypertension. NEJM 2002; 346: 896-903 (BREATHE-1).
[4] Sitbon O, Humbert M, Jais X et al. Long-term response to calcium channel blockers in idiopathic pulmonary arterial hypertension. Circulation 2005; 111: 3105-3111
[5] D'Alonzo GE, Barst RJ, Ayres SM et al. Survival in patients with primary pulmonary hypertension: Results from a national prospective registry. Ann Intern Med 1991; 115: 343-349.
[6] Barst RJ, McGoon M, Torbicki A et al. Diagnosis and differential assessment of pulmonary arterial hypertension. J Am Coll Cardiol 2004; 43(Suppl S): 40S-47S
Antwort auf Beitrag Nr.: 34.340.772 von Fruehrentner am 20.06.08 13:18:37und auf deutsch:
20.06.2008 01:02:00
In britischer Fachzeitschrift The Lancet publizierte zulassungsrelevante Studie zu pulmonaler arterieller Hypertonie (PAH) zeigt Nutzen von Bosentan (Tracleer®) bei Patienten mit milder symptomatischer PAH der WHO-Funktionsklasse II
------------------------------------------------------------------
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin. Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
------------------------------------------------------------------
ALLSCHWIL, SCHWEIZ - 20. Juni 2008 - Actelion Ltd (SWX: ATLN) teilte heute mit, dass die britische Fachzeitschrift The Lancet[1] Daten zu Bosentan (Tracleer®) veröffentlicht hat. Daraus geht hervor, dass Tracleer® bei Patienten mit milder symptomatischer pulmonaler arterieller Hypertonie (PAH) der WHO-Funktionsklasse II (WHO FC II) eine klinische Verschlechterung verhindert, indem es die Zeit bis zur Verschlechterung des klinischen Zustands signifikant hinauszögert und die Zahl der Patienten vermindert, deren Erkrankung in die WHO-Funktionsklassen III/IV voranschreitet. Ausserdem wurde ein Rückgang des Lungen-Gefässwiderstands und ein positiver Trend hinsichtlich der Leistungsfähigkeit im sechsminütigen Lauftest (6MWD) beobachtet. Die randomisierte, Plazebo-kontrollierte EARLY-Studie (Endothelin Antagonist tRial in miLdlY symptomatic PAH patients) ist die erste und bisher einzige Studie, in der ausschliesslich eine PAH-Patientenpopulation der Funktionsklasse II (FC II) untersucht wurde. Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin. Für den Inhalt der Mitteilung ist der Emittent verantwortlich. ---------------------------------------------------------------------- -------------- ALLSCHWIL, SCHWEIZ - 20. Juni 2008 - Actelion Ltd (SWX: ATLN) teilte heute mit, dass die britische Fachzeitschrift The Lancet[1] Daten zu Bosentan (Tracleer®) veröffentlicht hat. Daraus geht hervor, dass Tracleer® bei Patienten mit milder symptomatischer pulmonaler arterieller Hypertonie (PAH) der WHO-Funktionsklasse II (WHO FC II) eine klinische Verschlechterung verhindert, indem es die Zeit bis zur Verschlechterung des klinischen Zustands signifikant hinauszögert und die Zahl der Patienten vermindert, deren Erkrankung in die WHO-Funktionsklassen III/IV voranschreitet. Ausserdem wurde ein Rückgang des Lungen-Gefässwiderstands und ein positiver Trend hinsichtlich der Leistungsfähigkeit im sechsminütigen Lauftest (6MWD) beobachtet. Die randomisierte, Plazebo-kontrollierte EARLY-Studie (Endothelin Antagonist tRial in miLdlY symptomatic PAH patients) ist die erste und bisher einzige Studie, in der ausschliesslich eine PAH-Patientenpopulation der Funktionsklasse II (FC II) untersucht wurde. Professor Nazzareno Galié von der Universität Bologna in Italien und Studienleiter von EARLY, kommentierte: "Die EARLY-Studie belegt, dass PAH selbst bei Patienten mit leichter symptomatischer Erkrankung innerhalb kurzer Zeit voranschreitet, wenn sie nicht behandelt wird. Dagegen konnte die Progression der PAH bei einer Behandlung mit Bosentan signifikant verzögert werden; gleichzeitig wurde eine Verbesserung der hämodynamischen Parameter beobachtet." Die Ergebnisse der EARLY-Studie weisen darauf hin, dass die Behandlung mit Bosentan für Patienten der WHO-Funktionsklasse II nützlich sein dürfte. Actelion arbeitet mit den Behörden der USA, Europas und anderer Länder zusammen, um eine Indikationserweiterung für Tracleer® unter Einschluss der WHO FC II zu erreichen. EARLY ist die dritte randomisierte Kontrollstudie, in der die signifikante Wirkung von Bosentan bei der Krankheitsverzögerung von PAH und der Verminderung der Schwere der Erkrankung anhand konsistenter Daten aufgezeigt werden konnte. Auch die Daten der beiden anderen zulassungsrelevanten Studien 351[2] und BREATHE-1[3], in denen Bosentan bei FC III- und FC IV-Patienten untersucht wurde, waren in The Lancet und dem New England Journal of Medicine veröffentlicht worden. Ziel der EARLY-Studie war es, die Wirkung von Bosentan insbesondere bei PAH-Patienten der WHO-Funktionsklasse II zu untersuchen und einen vertieften Einblick in das Frühstadium der Erkrankung zu gewinnen. Die beiden primären Endpunkte bestanden in einer Veränderung des Lungen-Gefässwiderstands (PVR) und der Leistungsfähigkeit (6MWD). Das Fortschreiten der Erkrankung wurde anhand sekundärer Endpunkte untersucht. Dazu gehörten die Erfassung der Zeit bis zur Verschlechterung des klinischen Zustands und die WHO-Funktionsklasse. Nach sechsmonatiger Behandlungszeit hatte sich der Lungengefäss-Widerstand in der Gruppe, die Bosentan erhielt, gegenüber Plazebo um 22,6% (p <0,0001) hochsignifikant vermindert; gleichzeitig betrug die Zeit bis zur Verschlechterung des klinischen Zustands im Vergleich zu Plazebo signifikante 77% (p = 0,011). Bei der Analyse der Zeit bis zur Verschlechterung des klinischen Zustands, die als Eintreten des Todes, Hospitalisierung infolge PAH und Fortschreiten der Symptome von PAH definiert wurde, zeigte sich, dass der Krankheitszustand der Patienten in der Bosentan-Gruppe stabil blieb und im Gegensatz zur Plazebo-Gruppe keine Zeichen einer Verschlechterung beobachtet wurden (3,4% gegenüber 13,2%, p = 0,029). Ausserdem wurde in der Bosentan-Gruppe im Vergleich zu Plazebo eine signifikante Verzögerung beim Voranschreiten in die nächsten WHO-Funktionsklassen III und IV beobachtet, was einmal mehr darauf schliessen lässt, dass Bosentan die Progression der Erkrankung bremst. Die Verbesserung der Leistungsfähigkeit im sechsminütigen Lauftest war statistisch nicht signifikant (p = 0,076). Dies kann darauf zurückzuführen sein, dass die Leistungsfähigkeit der in die EARLY-Studie einbezogenen Patienten im Schnitt weitgehend erhalten und damit schwer zu verbessern war. Das Sicherheits- und Verträglichkeitsprofil von Bosentan stimmte mit den Ergebnissen aus früheren Plazebo-kontrollierten klinischen Studien überein.[2], [3] Professor Gérald Simonneau vom Hôpital Antoine Béclère der Universität Paris-Sud in Frankreich erklärte: "Die Ergebnisse der EARLY-Studie zeigen, dass die Krankheit selbst im frühen Stadium unaufhaltsam voranschreitet. Die frühzeitige Diagnose und wissenschaftlich abgestützte Behandlung von Risikopatienten ist deshalb ausgesprochen wichtig. Entscheidend ist auch, dass alle PAH-Patienten unabhängig von der für sie geltenden Funktionsklasse regelmässig auf Frühsymptome einer möglichen Krankheitsprogression untersucht werden." Auch bei einer Patienten-Untergruppe mit Kombinationstherapie, die gleichzeitig mit Sildenafil behandelt wurde, zeigten sich übereinstimmend mit den Gesamtergebnissen, Verbesserungen des Lungen-Gefässwiderstands und der Leistungsfähigkeit beim sechsminütigen Lauftest. Ein weiterer Beleg für die Wirkung von Bosentan auf die Hämodynamik zeigt sich in der Abnahme der NT-proBNP-Plasma-Konzentration in der mit Bosentan behandelten Gruppe gegenüber einer Zunahme in der Plazebo-Gruppe. Generell gilt eine verminderte Plasma-Konzentration von NT-proBNP nach einer gezielten PAH-Therapie als Hinweis für einen Behandlungserfolg. EARLY wird als offene Studie weitergeführt, um den Behandlungserfolg bei frühzeitiger Intervention und das langfristige Behandlungsergebnis noch genauer zu ermitteln. ### Anmerkungen für Herausgeber: Über pulmonale arterielle Hypertonie (PAH) PAH ist ein Syndrom, das durch eine progressive Zunahme des Lungengefäss-Widerstands (PVR - pulmonary vascular resistance) gekennzeichnet ist und in der Folge zum Versagen der rechten Herzkammer und zu einem frühzeitigen Tod führt.[4] Wenn PAH nicht behandelt wird, ist die Prognose mit einer durchschnittlichen Überlebensrate von 2,8 Jahren nach der Diagnosestellung sehr schlecht.[5] Es gibt vier WHO-Funktionsklassen für PAH, von denen mit Klasse I die leichteste Form und mit Klasse IV die am weitesten fortgeschrittene Krankheitsausprägung bezeichnet wird. Diese Einstufung entspricht dem Grad der Beeinträchtigung, den Patienten infolge von Symptomen und der Abnahme der körperlichen Leistungsfähigkeit erfahren. PAH-Patienten der Klasse II sind in ihrer körperlichen Leistungsfähigkeit nur leicht eingeschränkt. Im Ruhezustand fühlen sie sich wohl, leiden aber bei körperlicher Betätigung unter Atemnot oder Müdigkeit, Schmerzen in der Brust oder der Tendenz zu kollabieren.[6] PAH wird durch eine übermässige Ausschüttung gefässaktiver Substanzen wie beispielsweise Endothelin hervorgerufen. Endothelin wird von den Endothelzellen produziert und spielt eine entscheidende Rolle bei der Aufrechterhaltung von Gefässtonus und -funktion. Tracleer® ist das erste Therapeutikum einer neuen Klasse von Präparten zur Behandlung von PAH, die als Endothelin-Rezeptor-Antagonisten bezeichnet werden. Tracleer® ist ein dualer Antagonist, der die ETA- und ETB-Rezeptoren blockiert und dadurch die schädliche Wirkung von Endothelin verhindert. Online-Informationen über PAH können über www.pah-info.com abgerufen werden. PAH-info.com ist Teil einer von Actelion unterstützten internationalen Kampagne zur Aufklärung über PAH, die medizinischen Fachkräften und Patienten einschlägige Informationen zur Verfügung stellt. Über Tracleer® bei pulmonaler arterieller Hypertonie (PAH) Tracleer® ist ein oraler dualer Endothelin-Rezeptor-Antagonist, der derzeit für die Behandlung von PAH zugelassen ist. In den Vereinigten Staaten erstreckt sich die Zulassung auf die PAH-Funktionsklassen III und IV zur Verbesserung der körperlichen Leistungsfähigkeit und zur Verzögerung hinsichtlich der Verschlechterung des klinischen Zustands, in Europa auf die PAH-Funktionsklasse III zur Verbesserung der körperlichen Leistungsfähigkeit und zur Verminderung von Symptomen. In der EU ist Tracleer® ausserdem für die Reduktion der Anzahl neuer digitaler Ulzerationen bei Patienten mit systemischer Sklerose und Sklerodermie-Patienten, die an digitalen Ulzerationen leiden, indiziert. Eine Indikationserweiterung von Tracleer® unter Einbeziehung der PAH Funktionsklasse II wird derzeit von den Registrierungsbehörden weltweit geprüft. Actelion führte auch klinische Untersuchungen bei spezifischen Patienten-Populationen durch, um die Rolle von Bosentan bei der Behandlung von PAH umfassender definieren zu können. Hierzu zählten Patienten mit Eisenmenger-Syndrom, einer angeborenen Herzkrankheit (BREATHE-5) und mit HIV-infizierten Patienten (BREATHE-4). Die Ergebnisse dieser Studien sind in die Produktinformation eingeflossen. Im Rahmen einer klinischen Studie mit Bosentan bei Kindern, die unter PAH leiden (BREATHE-3), wird derzeit an einer kindgerechten Darreichungsform gearbeitet. Tracleer® wird seit 2001 durch Niederlassungen von Actelion in den USA, der Europäischen Union, Japan, Australien, Kanada, der Schweiz und anderen Märkten weltweit vertrieben. In diesen sechs Jahren klinischer Erfahrung wurden mehr als 50.000 Patienten mit Tracleer® behandelt. Über Tracleer® bei digitalen Ulzerationen (DU) DUs sind eine klinische Manifestation der zugrunde liegenden Vaskulopathie, die das Entstehen der systemischen Sklerose (SSc) begünstigt und die Entwicklung von sklerodermiebedingter PAH, einer der häufigsten Todesursachen im Zusammenhang mit SSc, entscheidend beeinflusst. Endothelin spielt eine pathogene Mittlerrolle bei der Entstehung der Vaskulopathie. Digitale Ulzerationen sind eine häufig auftretende, hartnäckige Komplikation der systemischen Sklerose. Sie werden durch eine Verengung des Lumens in den kleinen Blutgefässen hervorgerufen. In deren Folge vermindert sich die Blutzirkulation in Fingern und Zehen, was zur Entstehung offener Wunden beiträgt. Digitale Ulzerationen sind schmerzhaft und beeinträchtigen die Patienten bei der Bewältigung ihres Alltags. Die Betroffenen werden oft arbeitsunfähig und können selbst einfache tägliche Verrichtungen nicht mehr ausführen, vor allem wenn die Fingerspitzen eingesetzt werden müssen. Bei der Behandlung der systemischen Sklerose ist die Verminderung der Anzahl neu auftretender DUs ein wichtiges und erreichbares Therapieziel. In der EU ist Tracleer® zur Verminderung der Anzahl neuer digitaler Ulzerationen bei Sklerodermie-Patienten, die an digitalen Ulzerationen leiden, zugelassen. Tracleer® konnte die Funktion der Hände bei Patienten mit Sklerodermie-bedingten digitalen Ulzerationen (wie beispielsweise Anziehen und Hygiene) nachweislich verbessern. Folgende Sicherheitseinschränkungen sind zu beachten: Mögliche schwere Leberschäden (einschliesslich seltener Fälle von Leberversagen und ungeklärter Leberzirrhose unter der gegebenen strikten medizinischen Überwachung). - Vor Behandlungsbeginn und während der Behandlung sind daher bei allen Patienten in monatlichem Rhythmus Untersuchungen der Leberenzymwerte erforderlich. Erhebliche Gefahr von schweren Missbildungen im Mutterleib - Es darf keine Schwangerschaft vorliegen; zudem müssen zwei verschiedene Verhütungsmethoden eingesetzt und monatliche Schwangerschaftstests vorgenommen werden. Infolge dieser Risiken ist Tracleer® nur über kontrollierte Distribution erhältlich. Literaturhinweise [1] Galiè N, Rubin LJ, Hoeper MM et al. Treatment of patients with mildly symptomatic pulmonary arterial hypertension with bosentan (EARLY study): a double-blind, randomised controlled trial. The Lancet 2008; 371: 2093-2100. [2] Channick RN, Simonneau G, Sitbon O et al. Effects of the dual endothelin-receptor antagonist bosentan in patients with pulmonary hypertension: a randomised placebo-controlled study. The Lancet 2001; 358: 1119-23 (Study 351). [3] Rubin LJ, Badesch DB, Barst RJ et al. Bosentan therapy for pulmonary arterial hypertension. NEJM 2002; 346: 896-903 (BREATHE-1). [4] Sitbon O, Humbert M, Jais X et al. Long-term response to calcium channel blockers in idiopathic pulmonary arterial hypertension. Circulation 2005; 111: 3105-3111 [5] D'Alonzo GE, Barst RJ, Ayres SM et al. Survival in patients with primary pulmonary hypertension: Results from a national prospective registry. Ann Intern Med 1991; 115: 343-349. [6] Barst RJ, McGoon M, Torbicki A et al. Diagnosis and differential assessment of pulmonary arterial hypertension. J Am Coll Cardiol 2004; 43(Suppl S): 40S-47S Actelion Ltd Actelion Ltd ist ein biopharmazeutisches Unternehmen mit Hauptsitz in Allschwil/Basel, Schweiz. Actelions erstes Medikament, Tracleer®, ist ein zur Therapie der pulmonalen arteriellen Hypertonie zugelassener dualer Endothelin-Rezeptor-Antagonist in Tablettenform. Actelion vertreibt Tracleer® durch eigene Niederlassungen in den wichtigsten internationalen Märkten, so den Vereinigten Staaten (mit Sitz in South San Francisco), der Europäischen Union, Japan, Kanada, Australien und der Schweiz. Actelion, 1997 gegründet, ist ein weltweit führendes Unternehmen bei der Erforschung des Endothels. Das Endothel trennt die Gefässwand vom Blutstrom. Actelions über 1700 Mitarbeiterinnen und Mitarbeiter konzentrieren sich darauf, innovative Medikamente in Bereichen mit hohem medizinischem Bedarf zu entdecken, zu entwickeln und zu vermarkten. Actelion Aktien sind am SWX Swiss Exchange notiert (Symbol: ATLN). Für weitere Informationen wenden Sie sich bitte an: Kontakt für Fachmedien Kris Matta-Noaman Packer Forbes +44 208 772 1551 kris@packerforbes.com Investoren Konakt Roland Haefeli Vice President, Head of Investor Relations & Public Affairs Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil +41 61 565 62 62 +1 650 624 69 36 http://www.actelion.com --- Ende der Mitteilung --- Actelion Pharmaceuticals Ltd Gewerbestrasse 16 Allschwil Schweiz WKN: 936767; ISIN: CH0010532478; Index: SBIOM, SLIFE, SMCI, SMIEXP, SMIM, SPI, SPIEX; Notiert: Main Market in SWX Swiss Exchange; http://www.actelion.com http://hugin.info/131801/R/1229560/261048.pdf Copyright © Hugin AS 2008. All rights reserved.
Quelle: HUGIN
20.06.2008 01:02:00
In britischer Fachzeitschrift The Lancet publizierte zulassungsrelevante Studie zu pulmonaler arterieller Hypertonie (PAH) zeigt Nutzen von Bosentan (Tracleer®) bei Patienten mit milder symptomatischer PAH der WHO-Funktionsklasse II
------------------------------------------------------------------
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin. Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
------------------------------------------------------------------
ALLSCHWIL, SCHWEIZ - 20. Juni 2008 - Actelion Ltd (SWX: ATLN) teilte heute mit, dass die britische Fachzeitschrift The Lancet[1] Daten zu Bosentan (Tracleer®) veröffentlicht hat. Daraus geht hervor, dass Tracleer® bei Patienten mit milder symptomatischer pulmonaler arterieller Hypertonie (PAH) der WHO-Funktionsklasse II (WHO FC II) eine klinische Verschlechterung verhindert, indem es die Zeit bis zur Verschlechterung des klinischen Zustands signifikant hinauszögert und die Zahl der Patienten vermindert, deren Erkrankung in die WHO-Funktionsklassen III/IV voranschreitet. Ausserdem wurde ein Rückgang des Lungen-Gefässwiderstands und ein positiver Trend hinsichtlich der Leistungsfähigkeit im sechsminütigen Lauftest (6MWD) beobachtet. Die randomisierte, Plazebo-kontrollierte EARLY-Studie (Endothelin Antagonist tRial in miLdlY symptomatic PAH patients) ist die erste und bisher einzige Studie, in der ausschliesslich eine PAH-Patientenpopulation der Funktionsklasse II (FC II) untersucht wurde. Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin. Für den Inhalt der Mitteilung ist der Emittent verantwortlich. ---------------------------------------------------------------------- -------------- ALLSCHWIL, SCHWEIZ - 20. Juni 2008 - Actelion Ltd (SWX: ATLN) teilte heute mit, dass die britische Fachzeitschrift The Lancet[1] Daten zu Bosentan (Tracleer®) veröffentlicht hat. Daraus geht hervor, dass Tracleer® bei Patienten mit milder symptomatischer pulmonaler arterieller Hypertonie (PAH) der WHO-Funktionsklasse II (WHO FC II) eine klinische Verschlechterung verhindert, indem es die Zeit bis zur Verschlechterung des klinischen Zustands signifikant hinauszögert und die Zahl der Patienten vermindert, deren Erkrankung in die WHO-Funktionsklassen III/IV voranschreitet. Ausserdem wurde ein Rückgang des Lungen-Gefässwiderstands und ein positiver Trend hinsichtlich der Leistungsfähigkeit im sechsminütigen Lauftest (6MWD) beobachtet. Die randomisierte, Plazebo-kontrollierte EARLY-Studie (Endothelin Antagonist tRial in miLdlY symptomatic PAH patients) ist die erste und bisher einzige Studie, in der ausschliesslich eine PAH-Patientenpopulation der Funktionsklasse II (FC II) untersucht wurde. Professor Nazzareno Galié von der Universität Bologna in Italien und Studienleiter von EARLY, kommentierte: "Die EARLY-Studie belegt, dass PAH selbst bei Patienten mit leichter symptomatischer Erkrankung innerhalb kurzer Zeit voranschreitet, wenn sie nicht behandelt wird. Dagegen konnte die Progression der PAH bei einer Behandlung mit Bosentan signifikant verzögert werden; gleichzeitig wurde eine Verbesserung der hämodynamischen Parameter beobachtet." Die Ergebnisse der EARLY-Studie weisen darauf hin, dass die Behandlung mit Bosentan für Patienten der WHO-Funktionsklasse II nützlich sein dürfte. Actelion arbeitet mit den Behörden der USA, Europas und anderer Länder zusammen, um eine Indikationserweiterung für Tracleer® unter Einschluss der WHO FC II zu erreichen. EARLY ist die dritte randomisierte Kontrollstudie, in der die signifikante Wirkung von Bosentan bei der Krankheitsverzögerung von PAH und der Verminderung der Schwere der Erkrankung anhand konsistenter Daten aufgezeigt werden konnte. Auch die Daten der beiden anderen zulassungsrelevanten Studien 351[2] und BREATHE-1[3], in denen Bosentan bei FC III- und FC IV-Patienten untersucht wurde, waren in The Lancet und dem New England Journal of Medicine veröffentlicht worden. Ziel der EARLY-Studie war es, die Wirkung von Bosentan insbesondere bei PAH-Patienten der WHO-Funktionsklasse II zu untersuchen und einen vertieften Einblick in das Frühstadium der Erkrankung zu gewinnen. Die beiden primären Endpunkte bestanden in einer Veränderung des Lungen-Gefässwiderstands (PVR) und der Leistungsfähigkeit (6MWD). Das Fortschreiten der Erkrankung wurde anhand sekundärer Endpunkte untersucht. Dazu gehörten die Erfassung der Zeit bis zur Verschlechterung des klinischen Zustands und die WHO-Funktionsklasse. Nach sechsmonatiger Behandlungszeit hatte sich der Lungengefäss-Widerstand in der Gruppe, die Bosentan erhielt, gegenüber Plazebo um 22,6% (p <0,0001) hochsignifikant vermindert; gleichzeitig betrug die Zeit bis zur Verschlechterung des klinischen Zustands im Vergleich zu Plazebo signifikante 77% (p = 0,011). Bei der Analyse der Zeit bis zur Verschlechterung des klinischen Zustands, die als Eintreten des Todes, Hospitalisierung infolge PAH und Fortschreiten der Symptome von PAH definiert wurde, zeigte sich, dass der Krankheitszustand der Patienten in der Bosentan-Gruppe stabil blieb und im Gegensatz zur Plazebo-Gruppe keine Zeichen einer Verschlechterung beobachtet wurden (3,4% gegenüber 13,2%, p = 0,029). Ausserdem wurde in der Bosentan-Gruppe im Vergleich zu Plazebo eine signifikante Verzögerung beim Voranschreiten in die nächsten WHO-Funktionsklassen III und IV beobachtet, was einmal mehr darauf schliessen lässt, dass Bosentan die Progression der Erkrankung bremst. Die Verbesserung der Leistungsfähigkeit im sechsminütigen Lauftest war statistisch nicht signifikant (p = 0,076). Dies kann darauf zurückzuführen sein, dass die Leistungsfähigkeit der in die EARLY-Studie einbezogenen Patienten im Schnitt weitgehend erhalten und damit schwer zu verbessern war. Das Sicherheits- und Verträglichkeitsprofil von Bosentan stimmte mit den Ergebnissen aus früheren Plazebo-kontrollierten klinischen Studien überein.[2], [3] Professor Gérald Simonneau vom Hôpital Antoine Béclère der Universität Paris-Sud in Frankreich erklärte: "Die Ergebnisse der EARLY-Studie zeigen, dass die Krankheit selbst im frühen Stadium unaufhaltsam voranschreitet. Die frühzeitige Diagnose und wissenschaftlich abgestützte Behandlung von Risikopatienten ist deshalb ausgesprochen wichtig. Entscheidend ist auch, dass alle PAH-Patienten unabhängig von der für sie geltenden Funktionsklasse regelmässig auf Frühsymptome einer möglichen Krankheitsprogression untersucht werden." Auch bei einer Patienten-Untergruppe mit Kombinationstherapie, die gleichzeitig mit Sildenafil behandelt wurde, zeigten sich übereinstimmend mit den Gesamtergebnissen, Verbesserungen des Lungen-Gefässwiderstands und der Leistungsfähigkeit beim sechsminütigen Lauftest. Ein weiterer Beleg für die Wirkung von Bosentan auf die Hämodynamik zeigt sich in der Abnahme der NT-proBNP-Plasma-Konzentration in der mit Bosentan behandelten Gruppe gegenüber einer Zunahme in der Plazebo-Gruppe. Generell gilt eine verminderte Plasma-Konzentration von NT-proBNP nach einer gezielten PAH-Therapie als Hinweis für einen Behandlungserfolg. EARLY wird als offene Studie weitergeführt, um den Behandlungserfolg bei frühzeitiger Intervention und das langfristige Behandlungsergebnis noch genauer zu ermitteln. ### Anmerkungen für Herausgeber: Über pulmonale arterielle Hypertonie (PAH) PAH ist ein Syndrom, das durch eine progressive Zunahme des Lungengefäss-Widerstands (PVR - pulmonary vascular resistance) gekennzeichnet ist und in der Folge zum Versagen der rechten Herzkammer und zu einem frühzeitigen Tod führt.[4] Wenn PAH nicht behandelt wird, ist die Prognose mit einer durchschnittlichen Überlebensrate von 2,8 Jahren nach der Diagnosestellung sehr schlecht.[5] Es gibt vier WHO-Funktionsklassen für PAH, von denen mit Klasse I die leichteste Form und mit Klasse IV die am weitesten fortgeschrittene Krankheitsausprägung bezeichnet wird. Diese Einstufung entspricht dem Grad der Beeinträchtigung, den Patienten infolge von Symptomen und der Abnahme der körperlichen Leistungsfähigkeit erfahren. PAH-Patienten der Klasse II sind in ihrer körperlichen Leistungsfähigkeit nur leicht eingeschränkt. Im Ruhezustand fühlen sie sich wohl, leiden aber bei körperlicher Betätigung unter Atemnot oder Müdigkeit, Schmerzen in der Brust oder der Tendenz zu kollabieren.[6] PAH wird durch eine übermässige Ausschüttung gefässaktiver Substanzen wie beispielsweise Endothelin hervorgerufen. Endothelin wird von den Endothelzellen produziert und spielt eine entscheidende Rolle bei der Aufrechterhaltung von Gefässtonus und -funktion. Tracleer® ist das erste Therapeutikum einer neuen Klasse von Präparten zur Behandlung von PAH, die als Endothelin-Rezeptor-Antagonisten bezeichnet werden. Tracleer® ist ein dualer Antagonist, der die ETA- und ETB-Rezeptoren blockiert und dadurch die schädliche Wirkung von Endothelin verhindert. Online-Informationen über PAH können über www.pah-info.com abgerufen werden. PAH-info.com ist Teil einer von Actelion unterstützten internationalen Kampagne zur Aufklärung über PAH, die medizinischen Fachkräften und Patienten einschlägige Informationen zur Verfügung stellt. Über Tracleer® bei pulmonaler arterieller Hypertonie (PAH) Tracleer® ist ein oraler dualer Endothelin-Rezeptor-Antagonist, der derzeit für die Behandlung von PAH zugelassen ist. In den Vereinigten Staaten erstreckt sich die Zulassung auf die PAH-Funktionsklassen III und IV zur Verbesserung der körperlichen Leistungsfähigkeit und zur Verzögerung hinsichtlich der Verschlechterung des klinischen Zustands, in Europa auf die PAH-Funktionsklasse III zur Verbesserung der körperlichen Leistungsfähigkeit und zur Verminderung von Symptomen. In der EU ist Tracleer® ausserdem für die Reduktion der Anzahl neuer digitaler Ulzerationen bei Patienten mit systemischer Sklerose und Sklerodermie-Patienten, die an digitalen Ulzerationen leiden, indiziert. Eine Indikationserweiterung von Tracleer® unter Einbeziehung der PAH Funktionsklasse II wird derzeit von den Registrierungsbehörden weltweit geprüft. Actelion führte auch klinische Untersuchungen bei spezifischen Patienten-Populationen durch, um die Rolle von Bosentan bei der Behandlung von PAH umfassender definieren zu können. Hierzu zählten Patienten mit Eisenmenger-Syndrom, einer angeborenen Herzkrankheit (BREATHE-5) und mit HIV-infizierten Patienten (BREATHE-4). Die Ergebnisse dieser Studien sind in die Produktinformation eingeflossen. Im Rahmen einer klinischen Studie mit Bosentan bei Kindern, die unter PAH leiden (BREATHE-3), wird derzeit an einer kindgerechten Darreichungsform gearbeitet. Tracleer® wird seit 2001 durch Niederlassungen von Actelion in den USA, der Europäischen Union, Japan, Australien, Kanada, der Schweiz und anderen Märkten weltweit vertrieben. In diesen sechs Jahren klinischer Erfahrung wurden mehr als 50.000 Patienten mit Tracleer® behandelt. Über Tracleer® bei digitalen Ulzerationen (DU) DUs sind eine klinische Manifestation der zugrunde liegenden Vaskulopathie, die das Entstehen der systemischen Sklerose (SSc) begünstigt und die Entwicklung von sklerodermiebedingter PAH, einer der häufigsten Todesursachen im Zusammenhang mit SSc, entscheidend beeinflusst. Endothelin spielt eine pathogene Mittlerrolle bei der Entstehung der Vaskulopathie. Digitale Ulzerationen sind eine häufig auftretende, hartnäckige Komplikation der systemischen Sklerose. Sie werden durch eine Verengung des Lumens in den kleinen Blutgefässen hervorgerufen. In deren Folge vermindert sich die Blutzirkulation in Fingern und Zehen, was zur Entstehung offener Wunden beiträgt. Digitale Ulzerationen sind schmerzhaft und beeinträchtigen die Patienten bei der Bewältigung ihres Alltags. Die Betroffenen werden oft arbeitsunfähig und können selbst einfache tägliche Verrichtungen nicht mehr ausführen, vor allem wenn die Fingerspitzen eingesetzt werden müssen. Bei der Behandlung der systemischen Sklerose ist die Verminderung der Anzahl neu auftretender DUs ein wichtiges und erreichbares Therapieziel. In der EU ist Tracleer® zur Verminderung der Anzahl neuer digitaler Ulzerationen bei Sklerodermie-Patienten, die an digitalen Ulzerationen leiden, zugelassen. Tracleer® konnte die Funktion der Hände bei Patienten mit Sklerodermie-bedingten digitalen Ulzerationen (wie beispielsweise Anziehen und Hygiene) nachweislich verbessern. Folgende Sicherheitseinschränkungen sind zu beachten: Mögliche schwere Leberschäden (einschliesslich seltener Fälle von Leberversagen und ungeklärter Leberzirrhose unter der gegebenen strikten medizinischen Überwachung). - Vor Behandlungsbeginn und während der Behandlung sind daher bei allen Patienten in monatlichem Rhythmus Untersuchungen der Leberenzymwerte erforderlich. Erhebliche Gefahr von schweren Missbildungen im Mutterleib - Es darf keine Schwangerschaft vorliegen; zudem müssen zwei verschiedene Verhütungsmethoden eingesetzt und monatliche Schwangerschaftstests vorgenommen werden. Infolge dieser Risiken ist Tracleer® nur über kontrollierte Distribution erhältlich. Literaturhinweise [1] Galiè N, Rubin LJ, Hoeper MM et al. Treatment of patients with mildly symptomatic pulmonary arterial hypertension with bosentan (EARLY study): a double-blind, randomised controlled trial. The Lancet 2008; 371: 2093-2100. [2] Channick RN, Simonneau G, Sitbon O et al. Effects of the dual endothelin-receptor antagonist bosentan in patients with pulmonary hypertension: a randomised placebo-controlled study. The Lancet 2001; 358: 1119-23 (Study 351). [3] Rubin LJ, Badesch DB, Barst RJ et al. Bosentan therapy for pulmonary arterial hypertension. NEJM 2002; 346: 896-903 (BREATHE-1). [4] Sitbon O, Humbert M, Jais X et al. Long-term response to calcium channel blockers in idiopathic pulmonary arterial hypertension. Circulation 2005; 111: 3105-3111 [5] D'Alonzo GE, Barst RJ, Ayres SM et al. Survival in patients with primary pulmonary hypertension: Results from a national prospective registry. Ann Intern Med 1991; 115: 343-349. [6] Barst RJ, McGoon M, Torbicki A et al. Diagnosis and differential assessment of pulmonary arterial hypertension. J Am Coll Cardiol 2004; 43(Suppl S): 40S-47S Actelion Ltd Actelion Ltd ist ein biopharmazeutisches Unternehmen mit Hauptsitz in Allschwil/Basel, Schweiz. Actelions erstes Medikament, Tracleer®, ist ein zur Therapie der pulmonalen arteriellen Hypertonie zugelassener dualer Endothelin-Rezeptor-Antagonist in Tablettenform. Actelion vertreibt Tracleer® durch eigene Niederlassungen in den wichtigsten internationalen Märkten, so den Vereinigten Staaten (mit Sitz in South San Francisco), der Europäischen Union, Japan, Kanada, Australien und der Schweiz. Actelion, 1997 gegründet, ist ein weltweit führendes Unternehmen bei der Erforschung des Endothels. Das Endothel trennt die Gefässwand vom Blutstrom. Actelions über 1700 Mitarbeiterinnen und Mitarbeiter konzentrieren sich darauf, innovative Medikamente in Bereichen mit hohem medizinischem Bedarf zu entdecken, zu entwickeln und zu vermarkten. Actelion Aktien sind am SWX Swiss Exchange notiert (Symbol: ATLN). Für weitere Informationen wenden Sie sich bitte an: Kontakt für Fachmedien Kris Matta-Noaman Packer Forbes +44 208 772 1551 kris@packerforbes.com Investoren Konakt Roland Haefeli Vice President, Head of Investor Relations & Public Affairs Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil +41 61 565 62 62 +1 650 624 69 36 http://www.actelion.com --- Ende der Mitteilung --- Actelion Pharmaceuticals Ltd Gewerbestrasse 16 Allschwil Schweiz WKN: 936767; ISIN: CH0010532478; Index: SBIOM, SLIFE, SMCI, SMIEXP, SMIM, SPI, SPIEX; Notiert: Main Market in SWX Swiss Exchange; http://www.actelion.com http://hugin.info/131801/R/1229560/261048.pdf Copyright © Hugin AS 2008. All rights reserved.
Quelle: HUGIN
DJ HUGIN NEWS/ Bosentan (Tracleer®) erhält positive Beurteilung der EU für die Behandlung von Patienten mit milder symptomatischer pulmonaler arterieller Hypertonie der WHO-Funktionsklasse II
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin.
Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
=-----------------------------------------------------------------
ALLSCHWIL, SCHWEIZ - 27 Juni 2008- Actelion Ltd (SWX: ATLN) teilte
heute mit, dass der Ausschuss für Humanarzneimittel (Committee for
Medicinal Products for Human Use - CHMP), der wissenschaftliche
Ausschuss der Europäischen Arzneimittelagentur EMEA, eine Ausweitung
des Einsatzes von Bosentan (Tracleer®) bei pulmonaler arterieller
Hypertonie (PAH) positiv bewertet hat.
Bezugnehmend auf Daten der EARLY-Studie empfahl der CHMP Bosentan
(Tracleer®) der Europäischen Kommission zur Zulassung für die
Behandlung von PAH-Patienten der WHO-Funktionsklasse II (FC II). Die
vom CHMP empfohlene Ausweitung der Indikation lautet: "Auch bei
PAH-Patienten der WHO-Funktionsklasse II (siehe Absatz 5.1) zeigten
sich einige Verbesserungen." Die Europäische Kommission wird ihre
endgültige Entscheidung voraussichtlich in zwei bis drei Monaten
fällen.
Tracleer® ist ein oraler dualer Endothelin-Rezeptor-Antagonist, der
derzeit für die Behandlung von PAH zugelassen ist. In Europa
erstreckt sich die Zulassung auf die PAH-Funktionsklasse III zur
Verbesserung der körperlichen Leistungsfähigkeit und zur Verminderung
der Symptome und in den Vereinigten Staaten auf die
PAH-Funktionsklassen III und IV zur Verbesserung der körperlichen
Leistungsfähigkeit und zum Hinauszögern einer Verschlechterung des
klinischen Zustands.1 Actelion arbeitet mit den
Registrierungsbehörden in den USA und anderen Ländern weltweit
zusammen, um eine Indikationserweiterung für Tracleer® unter
Einbeziehung der WHO-Funktionsklasse II zu erwirken. In der EU ist
Tracleer® ausserdem für die Reduktion der Anzahl neuer digitaler
Ulzerationen bei Patienten mit systemischer Sklerose und
Sklerodermie-Patienten, die an digitalen Ulzerationen leiden,
indiziert.
Es gibt vier WHO-Funktionsklassen für PAH, von denen mit Klasse I die
leichteste Form und mit Klasse IV die am weitesten fortgeschrittene
Krankheitsausprägung bezeichnet wird. Diese Einstufung entspricht dem
Grad der Beeinträchtigung, den Patienten infolge von Symptomen und
der Abnahme der körperlichen Leistungsfähigkeit erfahren.
PAH-Patienten der Klasse II sind in ihrer körperlichen
Leistungsfähigkeit leicht eingeschränkt. Im Ruhezustand fühlen sie
sich wohl, leiden aber bei körperlicher Betätigung unter Atemnot oder
Müdigkeit, Schmerzen in der Brust oder der Tendenz, zu kollabieren.2
Obwohl diese Patienten nur leichte Symptome verspüren, leiden sie
unter einer schweren Erkrankung. EARLY (Endothelin Antagonist tRial
in miLdlY symptomatic PAH patients), die bisher einzige randomisierte
Plazebo-kontrollierte Studie, in der ausschliesslich PAH-Patienten
der Funktionsklasse II untersucht wurden, zeigt auf, dass PAH
unabhängig von den vorhandenen Symptomen rasch voranschreitet und
belegt den Nutzen einer frühzeitigen Behandlung mit Tracleer®. Diese
Studie wurde unlängst in "The Lancet" veröffentlicht.3
###
Anmerkungen für Herausgeber:
Über pulmonale arterielle Hypertonie (PAH)
PAH ist ein Syndrom, das durch eine progressive Zunahme des
Lungengefäss-Widerstands (PVR - pulmonary vascular resistance)
gekennzeichnet ist und in der Folge zum Versagen der rechten
Herzkammer und zu einem frühzeitigen Tod führt.4 Wenn PAH nicht
behandelt wird, ist die Prognose mit einer durchschnittlichen
Überlebensrate von 2,8 Jahren nach der Diagnosestellung sehr
schlecht.5
Es gibt vier WHO-Funktionsklassen für PAH, von denen mit Klasse I die
leichteste Form und mit Klasse IV die am weitesten fortgeschrittene
Krankheitsausprägung bezeichnet wird. Diese Einstufung entspricht dem
Grad der Beeinträchtigung, den Patienten infolge von Symptomen und
der Abnahme der körperlichen Leistungsfähigkeit erfahren.
PAH-Patienten der Klasse II sind in ihrer körperlichen
Leistungsfähigkeit leicht eingeschränkt. Im Ruhezustand fühlen sie
sich wohl, leiden aber bei körperlicher Betätigung unter Atemnot oder
Müdigkeit, Schmerzen in der Brust oder der Tendenz, zu kollabieren.2
PAH wird durch eine übermässige Ausschüttung gefässaktiver Substanzen
wie beispielsweise Endothelin hervorgerufen. Endothelin wird von den
Endothelzellen produziert und spielt eine entscheidende Rolle bei der
Aufrechterhaltung von Gefässtonus und -funktion. Tracleer® ist das
erste Therapeutikum einer neuen Klasse von Präparaten zur Behandlung
von PAH, die als Endothelin-Rezeptor-Antagonisten bezeichnet werden.
Tracleer® ist ein dualer Antagonist, der die ETA- und ETB-Rezeptoren
blockiert und dadurch die schädliche Wirkung von Endothelin
verhindert.
Online-Informationen über PAH können über www.pah-info.com abgerufen
werden. PAH-info.com ist Teil einer von Actelion unterstützten
internationalen Kampagne zur Aufklärung über PAH, die medizinischen
Fachkräften und Patienten einschlägige Informationen zur Verfügung
stellt.
Über Tracleer® bei pulmonaler arterieller Hypertonie (PAH)
Tracleer® ist ein oraler dualer Endothelin-Rezeptor-Antagonist, der
derzeit für die Behandlung von PAH zugelassen ist. In den Vereinigten
Staaten erstreckt sich die Zulassung auf die PAH-Funktionsklassen III
und IV zur Verbesserung der körperlichen Leistungsfähigkeit und zur
Verzögerung hinsichtlich der Verschlechterung des klinischen
Zustands, in Europa auf die PAH-Funktionsklasse III zur Verbesserung
der körperlichen Leistungsfähigkeit und zur Verminderung von
Symptomen. In der EU ist Tracleer® ausserdem für die Reduktion der
Anzahl neuer digitaler Ulzerationen bei Patienten mit systemischer
Sklerose und Sklerodermie-Patienten, die an digitalen Ulzerationen
leiden, indiziert. Eine Indikationserweiterung von Tracleer® unter
Einbeziehung der PAH Funktionsklasse II wird derzeit von den
Registrierungsbehörden weltweit geprüft.
Tracleer® wird seit 2001 durch Niederlassungen von Actelion in den
USA, der Europäischen Union, Japan, Australien, Kanada, der Schweiz
und anderen Märkten weltweit vertrieben. In diesen sechs Jahren
klinischer Erfahrung wurden mehr als 50.000 Patienten mit Tracleer®
behandelt.
Über die EARLY-Studie
Das Ziel der prospektiven, doppelblinden, randomisierten,
Plazebo-kontrollierten, multizentrischen EARLY-Studie3 bestand darin,
zu untersuchen, ob ein früheres Einsetzen der Behandlung mit Tracleer
im Frühstadium der Erkrankung nicht nur Auswirkungen auf Hämodynamik
und körperliche Leistungsfähigkeit, sondern auch auf eine Verzögerung
der Verschlechterung des klinischen Zustands von Patienten der
WHO-Funktionsklasse II haben würde.
Die Ergebnisse der EARLY-Studie3 mit 185 Patienten der
WHO-Funktionsklassen bestätigen, dass die Krankheit selbst im frühen
Stadium unaufhaltsam voranschreitet. Ein Beleg für diese Erkenntnis
war die Verschlechterung sämtlicher untersuchter Parameter in der
Plazebo-Gruppe, einschliesslich der Zunahme der Fälle mit
verschlechtertem klinischen Zustand. Die primären Endpunkte der
EARLY-Studie3 waren als Änderungen des Lungengefäss-Widerstands (PVR
- pulmonary vascular resistance) und der in einem sechsminütigen
Lauftest (6-MWD) gemessenen körperlichen Leistungsfähigkeit
definiert. Das Fortschreiten der Erkrankung wurde anhand von zwei
sekundären Endpunkten untersucht. Dazu gehörten die Erfassung der
Zeit bis zur Verschlechterung des klinischen Zustands und die
Untersuchung der WHO-Funktionsklassen.
Die Werte für den Lungengefäss-Widerstand verbesserten sich
signifikant und zeigten eine Verminderung des
Lungengefäss-Widerstands um 22,6% (p <0,0001). Die Verbesserung der
Laufstrecke (6-MWD) lag im Mittel bei 19 Metern (p =0,0758). Nach
24-wöchiger Behandlungszeit mit Bosentan ergab sich gegenüber Plazebo
eine Verminderung des Risikos um 77% für die Zeit bis zur
Verschlechterung des klinischen Zustands (p = 0,011). Die Zeit bis
zur Verschlechterung des klinischen Zustands war als Tod,
Hospitalisierung infolge PAH und Fortschreiten der Symptome von PAH
definiert. Der Behandlungseffekt wurde von der Komponente
symptomatisches Fortschreiten beeinflusst. Zudem wurde Bosentan mit
einer geringeren Verschlechterung der Funktionsklasse (3,4% gegenüber
13,2%, p = 0,029) in Verbindung gebracht, was erneut auf eine
verzögerte Krankheitsprogression durch Bosentan hindeutet.
Obwohl die Verbesserung der sechsminütigen Laufstrecke keine
statistische Signifikanz erreichte (p = 0,076), könnte dies darauf
zurückzuführen sein, dass die Leistungsfähigkeit der
Studienteilnehmer - die mit der in der Literatur für Patienten in
PAH-Funktionsklasse II genannten Werten übereinstimmt - zu Beginn der
Studie im Schnitt weitgehend erhalten (Wert beim Ausgangspunkt: 435 ±
88 Meter) und damit schwer zu verbessern war.
Bei einer Patienten-Untergruppe mit Kombinationstherapie, die
gleichzeitig mit Sildenafil behandelt wurde, zeigten sich bei den
(MORE TO FOLLOW) Dow Jones Newswires
June 27, 2008 01:01 ET (05:01 GMT)
DJ HUGIN NEWS/Bosentan (Tracleer®) erhält positive -2-
Patienten, welchen Bosentan verabreicht wurde, übereinstimmend mit
den Gesamtergebnissen, Verbesserungen der hämodynamischen Parameter.
Das Sicherheits- und Verträglichkeitsprofil von Bosentan stimmte mit
den Ergebnissen aus früheren Plazebo-kontrollierten klinischen
Studien überein.
Andere klinische Studien mit Tracleer® in speziellen
Patientenpopulationen
Actelion führte auch klinische Untersuchungen bei spezifischen
Patienten-Populationen durch, um die Rolle von Bosentan bei der
Behandlung von PAH umfassender definieren zu können. Hierzu zählten
Patienten mit Eisenmenger-Syndrom, einer angeborenen Herzkrankheit
(BREATHE-5) und mit HIV-infizierten Patienten (BREATHE-4). Die
Ergebnisse dieser Studien sind in die Produktinformation
eingeflossen. Klinische Studien mit Bosentan wurden auch bei Kindern
durchgeführt, die unter PAH leiden (BREATHE-3, FUTURE-1 und -2). Eine
speziell kindgerechte pädiatrische Formulierung von Bosentan wurde
bei den Europäischen Gesundheitsbehörden vorgelegt und befindet sich
derzeit in der Überprüfung.
Über Tracleer® bei digitalen Ulzerationen (DU)
DUs sind eine klinische Manifestation der zugrunde liegenden
Vaskulopathie, die das Entstehen der systemischen Sklerose (SSc)
begünstigt und die Entwicklung von sklerodermiebedingter PAH, einer
der häufigsten Todesursachen im Zusammenhang mit SSc, entscheidend
beeinflusst. Endothelin spielt eine pathogene Mittlerrolle bei der
Entstehung der zugrunde liegenden Vaskulopathie bei SSc.
Digitale Ulzerationen sind eine häufig auftretende, hartnäckige
Komplikation der systemischen Sklerose. Sie werden durch eine
Verengung des Lumens in den kleinen Blutgefässen hervorgerufen. In
deren Folge vermindert sich die Blutzirkulation in Fingern und Zehen,
was zur Entstehung offener Wunden beiträgt. Digitale Ulzerationen
sind schmerzhaft und beeinträchtigen die Patienten bei der
Bewältigung ihres Alltags. Die Betroffenen werden oft arbeitsunfähig
und können selbst einfache tägliche Verrichtungen nicht mehr
ausführen, vor allem wenn die Fingerspitzen eingesetzt werden müssen.
Bei der Behandlung der systemischen Sklerose ist die Verminderung der
Anzahl neu auftretender DUs ein wichtiges und erreichbares
Therapieziel.
In der EU ist Tracleer® zur Verminderung der Anzahl neuer digitaler
Ulzerationen bei Sklerodermie-Patienten, die an digitalen
Ulzerationen leiden, zugelassen. Tracleer® konnte die Funktion der
Hände bei Patienten mit Sklerodermie-bedingten digitalen Ulzerationen
(wie beispielsweise Anziehen und Hygiene) nachweislich verbessern.
Folgende Sicherheitseinschränkungen sind zu beachten:
Mögliche schwere Leberschäden (einschliesslich seltener Fälle von
Leberversagen und ungeklärter Leberzirrhose unter der gegebenen
strikten medizinischen Überwachung). - Vor Behandlungsbeginn und
während der Behandlung sind daher bei allen Patienten in monatlichem
Rhythmus Untersuchungen der Leberenzymwerte erforderlich. Erhebliche
Gefahr von schweren Missbildungen im Mutterleib - Es darf keine
Schwangerschaft vorliegen; zudem müssen zwei verschiedene
Verhütungsmethoden eingesetzt und monatliche Schwangerschaftstests
vorgenommen werden. Infolge dieser Risiken ist Tracleer® nur über
kontrollierte Distribution erhältlich.
Literaturhinweise
1. Tracleer® SPC
2. Barst RJ, McGoon M, Torbicki A et al. Diagnosis and
differential assessment of pulmonary arterial hypertension. J Am
Coll Cardiol 2004;43 (Suppl S) :40S-47S.
3. Galiè N, Rubin LJ, Hoeper MM et al. Treatment of patients
with mildly symptomatic pulmonary arterial hypertension with bosentan
(EARLY study): a double-blind, randomised controlled trial. The
Lancet 2008; 371: 2093-2100.
4. Sitbon O et al. Long-term response to calcium channel
blockers in idiopathic pulmonary arterial hypertension. Circulation
2005; 111: 3105-3111.
5. D'Alonzo G et al. Survival in patients with primary
pulmonary hypertension. Annals of Internal Medicine 1991;
115:343-349
Actelion Ltd
Actelion Ltd ist ein biopharmazeutisches Unternehmen mit Hauptsitz in
Allschwil/Basel, Schweiz. Actelions erstes Medikament, Tracleer®, ist
ein zur Therapie der pulmonalen arteriellen Hypertonie zugelassener
dualer Endothelin-Rezeptor-Antagonist in Tablettenform. Actelion
vertreibt Tracleer® durch eigene Niederlassungen in den wichtigsten
internationalen Märkten, so den Vereinigten Staaten (mit Sitz in
South San Francisco), der Europäischen Union, Japan, Kanada,
Australien und der Schweiz. Actelion, 1997 gegründet, ist ein
weltweit führendes Unternehmen bei der Erforschung des Endothels. Das
Endothel trennt die Gefässwand vom Blutstrom. Actelions über 1700
Mitarbeiterinnen und Mitarbeiter konzentrieren sich darauf,
innovative Medikamente in Bereichen mit hohem medizinischem Bedarf zu
entdecken, zu entwickeln und zu vermarkten. Actelion Aktien sind am
SWX Swiss Exchange notiert (Symbol: ATLN).
Für weitere Informationen wenden Sie sich bitte an:
Kontakt für Fachmedien
Kris Matta-Noaman
Packer Forbes
+44 208 772 1551
kris@packerforbes.com
Investoren Konakt
Roland Haefeli
Vice President, Head of Investor Relations & Public Affairs
Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil
+41 61 565 62 62
+1 650 624 69 36
http://www.actelion.com
=-- Ende der Mitteilung ---
Actelion Pharmaceuticals Ltd
Gewerbestrasse 16 Allschwil
Schweiz
WKN: 936767; ISIN: CH0010532478; Index: SBIOM, SLIFE, SMCI, SMIEXP,
SMIM, SPI, SPIEX;
Notiert: Main Market in SWX Swiss Exchange;
http://hugin.info/131801/R/1231532/261836.pdf
http://www.actelion.com
Copyright © Hugin AS 2008. All rights reserved.
(END) Dow Jones Newswires
June 27, 2008 01:01 ET (05:01 GMT)
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin.
Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
=-----------------------------------------------------------------
ALLSCHWIL, SCHWEIZ - 27 Juni 2008- Actelion Ltd (SWX: ATLN) teilte
heute mit, dass der Ausschuss für Humanarzneimittel (Committee for
Medicinal Products for Human Use - CHMP), der wissenschaftliche
Ausschuss der Europäischen Arzneimittelagentur EMEA, eine Ausweitung
des Einsatzes von Bosentan (Tracleer®) bei pulmonaler arterieller
Hypertonie (PAH) positiv bewertet hat.
Bezugnehmend auf Daten der EARLY-Studie empfahl der CHMP Bosentan
(Tracleer®) der Europäischen Kommission zur Zulassung für die
Behandlung von PAH-Patienten der WHO-Funktionsklasse II (FC II). Die
vom CHMP empfohlene Ausweitung der Indikation lautet: "Auch bei
PAH-Patienten der WHO-Funktionsklasse II (siehe Absatz 5.1) zeigten
sich einige Verbesserungen." Die Europäische Kommission wird ihre
endgültige Entscheidung voraussichtlich in zwei bis drei Monaten
fällen.
Tracleer® ist ein oraler dualer Endothelin-Rezeptor-Antagonist, der
derzeit für die Behandlung von PAH zugelassen ist. In Europa
erstreckt sich die Zulassung auf die PAH-Funktionsklasse III zur
Verbesserung der körperlichen Leistungsfähigkeit und zur Verminderung
der Symptome und in den Vereinigten Staaten auf die
PAH-Funktionsklassen III und IV zur Verbesserung der körperlichen
Leistungsfähigkeit und zum Hinauszögern einer Verschlechterung des
klinischen Zustands.1 Actelion arbeitet mit den
Registrierungsbehörden in den USA und anderen Ländern weltweit
zusammen, um eine Indikationserweiterung für Tracleer® unter
Einbeziehung der WHO-Funktionsklasse II zu erwirken. In der EU ist
Tracleer® ausserdem für die Reduktion der Anzahl neuer digitaler
Ulzerationen bei Patienten mit systemischer Sklerose und
Sklerodermie-Patienten, die an digitalen Ulzerationen leiden,
indiziert.
Es gibt vier WHO-Funktionsklassen für PAH, von denen mit Klasse I die
leichteste Form und mit Klasse IV die am weitesten fortgeschrittene
Krankheitsausprägung bezeichnet wird. Diese Einstufung entspricht dem
Grad der Beeinträchtigung, den Patienten infolge von Symptomen und
der Abnahme der körperlichen Leistungsfähigkeit erfahren.
PAH-Patienten der Klasse II sind in ihrer körperlichen
Leistungsfähigkeit leicht eingeschränkt. Im Ruhezustand fühlen sie
sich wohl, leiden aber bei körperlicher Betätigung unter Atemnot oder
Müdigkeit, Schmerzen in der Brust oder der Tendenz, zu kollabieren.2
Obwohl diese Patienten nur leichte Symptome verspüren, leiden sie
unter einer schweren Erkrankung. EARLY (Endothelin Antagonist tRial
in miLdlY symptomatic PAH patients), die bisher einzige randomisierte
Plazebo-kontrollierte Studie, in der ausschliesslich PAH-Patienten
der Funktionsklasse II untersucht wurden, zeigt auf, dass PAH
unabhängig von den vorhandenen Symptomen rasch voranschreitet und
belegt den Nutzen einer frühzeitigen Behandlung mit Tracleer®. Diese
Studie wurde unlängst in "The Lancet" veröffentlicht.3
###
Anmerkungen für Herausgeber:
Über pulmonale arterielle Hypertonie (PAH)
PAH ist ein Syndrom, das durch eine progressive Zunahme des
Lungengefäss-Widerstands (PVR - pulmonary vascular resistance)
gekennzeichnet ist und in der Folge zum Versagen der rechten
Herzkammer und zu einem frühzeitigen Tod führt.4 Wenn PAH nicht
behandelt wird, ist die Prognose mit einer durchschnittlichen
Überlebensrate von 2,8 Jahren nach der Diagnosestellung sehr
schlecht.5
Es gibt vier WHO-Funktionsklassen für PAH, von denen mit Klasse I die
leichteste Form und mit Klasse IV die am weitesten fortgeschrittene
Krankheitsausprägung bezeichnet wird. Diese Einstufung entspricht dem
Grad der Beeinträchtigung, den Patienten infolge von Symptomen und
der Abnahme der körperlichen Leistungsfähigkeit erfahren.
PAH-Patienten der Klasse II sind in ihrer körperlichen
Leistungsfähigkeit leicht eingeschränkt. Im Ruhezustand fühlen sie
sich wohl, leiden aber bei körperlicher Betätigung unter Atemnot oder
Müdigkeit, Schmerzen in der Brust oder der Tendenz, zu kollabieren.2
PAH wird durch eine übermässige Ausschüttung gefässaktiver Substanzen
wie beispielsweise Endothelin hervorgerufen. Endothelin wird von den
Endothelzellen produziert und spielt eine entscheidende Rolle bei der
Aufrechterhaltung von Gefässtonus und -funktion. Tracleer® ist das
erste Therapeutikum einer neuen Klasse von Präparaten zur Behandlung
von PAH, die als Endothelin-Rezeptor-Antagonisten bezeichnet werden.
Tracleer® ist ein dualer Antagonist, der die ETA- und ETB-Rezeptoren
blockiert und dadurch die schädliche Wirkung von Endothelin
verhindert.
Online-Informationen über PAH können über www.pah-info.com abgerufen
werden. PAH-info.com ist Teil einer von Actelion unterstützten
internationalen Kampagne zur Aufklärung über PAH, die medizinischen
Fachkräften und Patienten einschlägige Informationen zur Verfügung
stellt.
Über Tracleer® bei pulmonaler arterieller Hypertonie (PAH)
Tracleer® ist ein oraler dualer Endothelin-Rezeptor-Antagonist, der
derzeit für die Behandlung von PAH zugelassen ist. In den Vereinigten
Staaten erstreckt sich die Zulassung auf die PAH-Funktionsklassen III
und IV zur Verbesserung der körperlichen Leistungsfähigkeit und zur
Verzögerung hinsichtlich der Verschlechterung des klinischen
Zustands, in Europa auf die PAH-Funktionsklasse III zur Verbesserung
der körperlichen Leistungsfähigkeit und zur Verminderung von
Symptomen. In der EU ist Tracleer® ausserdem für die Reduktion der
Anzahl neuer digitaler Ulzerationen bei Patienten mit systemischer
Sklerose und Sklerodermie-Patienten, die an digitalen Ulzerationen
leiden, indiziert. Eine Indikationserweiterung von Tracleer® unter
Einbeziehung der PAH Funktionsklasse II wird derzeit von den
Registrierungsbehörden weltweit geprüft.
Tracleer® wird seit 2001 durch Niederlassungen von Actelion in den
USA, der Europäischen Union, Japan, Australien, Kanada, der Schweiz
und anderen Märkten weltweit vertrieben. In diesen sechs Jahren
klinischer Erfahrung wurden mehr als 50.000 Patienten mit Tracleer®
behandelt.
Über die EARLY-Studie
Das Ziel der prospektiven, doppelblinden, randomisierten,
Plazebo-kontrollierten, multizentrischen EARLY-Studie3 bestand darin,
zu untersuchen, ob ein früheres Einsetzen der Behandlung mit Tracleer
im Frühstadium der Erkrankung nicht nur Auswirkungen auf Hämodynamik
und körperliche Leistungsfähigkeit, sondern auch auf eine Verzögerung
der Verschlechterung des klinischen Zustands von Patienten der
WHO-Funktionsklasse II haben würde.
Die Ergebnisse der EARLY-Studie3 mit 185 Patienten der
WHO-Funktionsklassen bestätigen, dass die Krankheit selbst im frühen
Stadium unaufhaltsam voranschreitet. Ein Beleg für diese Erkenntnis
war die Verschlechterung sämtlicher untersuchter Parameter in der
Plazebo-Gruppe, einschliesslich der Zunahme der Fälle mit
verschlechtertem klinischen Zustand. Die primären Endpunkte der
EARLY-Studie3 waren als Änderungen des Lungengefäss-Widerstands (PVR
- pulmonary vascular resistance) und der in einem sechsminütigen
Lauftest (6-MWD) gemessenen körperlichen Leistungsfähigkeit
definiert. Das Fortschreiten der Erkrankung wurde anhand von zwei
sekundären Endpunkten untersucht. Dazu gehörten die Erfassung der
Zeit bis zur Verschlechterung des klinischen Zustands und die
Untersuchung der WHO-Funktionsklassen.
Die Werte für den Lungengefäss-Widerstand verbesserten sich
signifikant und zeigten eine Verminderung des
Lungengefäss-Widerstands um 22,6% (p <0,0001). Die Verbesserung der
Laufstrecke (6-MWD) lag im Mittel bei 19 Metern (p =0,0758). Nach
24-wöchiger Behandlungszeit mit Bosentan ergab sich gegenüber Plazebo
eine Verminderung des Risikos um 77% für die Zeit bis zur
Verschlechterung des klinischen Zustands (p = 0,011). Die Zeit bis
zur Verschlechterung des klinischen Zustands war als Tod,
Hospitalisierung infolge PAH und Fortschreiten der Symptome von PAH
definiert. Der Behandlungseffekt wurde von der Komponente
symptomatisches Fortschreiten beeinflusst. Zudem wurde Bosentan mit
einer geringeren Verschlechterung der Funktionsklasse (3,4% gegenüber
13,2%, p = 0,029) in Verbindung gebracht, was erneut auf eine
verzögerte Krankheitsprogression durch Bosentan hindeutet.
Obwohl die Verbesserung der sechsminütigen Laufstrecke keine
statistische Signifikanz erreichte (p = 0,076), könnte dies darauf
zurückzuführen sein, dass die Leistungsfähigkeit der
Studienteilnehmer - die mit der in der Literatur für Patienten in
PAH-Funktionsklasse II genannten Werten übereinstimmt - zu Beginn der
Studie im Schnitt weitgehend erhalten (Wert beim Ausgangspunkt: 435 ±
88 Meter) und damit schwer zu verbessern war.
Bei einer Patienten-Untergruppe mit Kombinationstherapie, die
gleichzeitig mit Sildenafil behandelt wurde, zeigten sich bei den
(MORE TO FOLLOW) Dow Jones Newswires
June 27, 2008 01:01 ET (05:01 GMT)
DJ HUGIN NEWS/Bosentan (Tracleer®) erhält positive -2-
Patienten, welchen Bosentan verabreicht wurde, übereinstimmend mit
den Gesamtergebnissen, Verbesserungen der hämodynamischen Parameter.
Das Sicherheits- und Verträglichkeitsprofil von Bosentan stimmte mit
den Ergebnissen aus früheren Plazebo-kontrollierten klinischen
Studien überein.
Andere klinische Studien mit Tracleer® in speziellen
Patientenpopulationen
Actelion führte auch klinische Untersuchungen bei spezifischen
Patienten-Populationen durch, um die Rolle von Bosentan bei der
Behandlung von PAH umfassender definieren zu können. Hierzu zählten
Patienten mit Eisenmenger-Syndrom, einer angeborenen Herzkrankheit
(BREATHE-5) und mit HIV-infizierten Patienten (BREATHE-4). Die
Ergebnisse dieser Studien sind in die Produktinformation
eingeflossen. Klinische Studien mit Bosentan wurden auch bei Kindern
durchgeführt, die unter PAH leiden (BREATHE-3, FUTURE-1 und -2). Eine
speziell kindgerechte pädiatrische Formulierung von Bosentan wurde
bei den Europäischen Gesundheitsbehörden vorgelegt und befindet sich
derzeit in der Überprüfung.
Über Tracleer® bei digitalen Ulzerationen (DU)
DUs sind eine klinische Manifestation der zugrunde liegenden
Vaskulopathie, die das Entstehen der systemischen Sklerose (SSc)
begünstigt und die Entwicklung von sklerodermiebedingter PAH, einer
der häufigsten Todesursachen im Zusammenhang mit SSc, entscheidend
beeinflusst. Endothelin spielt eine pathogene Mittlerrolle bei der
Entstehung der zugrunde liegenden Vaskulopathie bei SSc.
Digitale Ulzerationen sind eine häufig auftretende, hartnäckige
Komplikation der systemischen Sklerose. Sie werden durch eine
Verengung des Lumens in den kleinen Blutgefässen hervorgerufen. In
deren Folge vermindert sich die Blutzirkulation in Fingern und Zehen,
was zur Entstehung offener Wunden beiträgt. Digitale Ulzerationen
sind schmerzhaft und beeinträchtigen die Patienten bei der
Bewältigung ihres Alltags. Die Betroffenen werden oft arbeitsunfähig
und können selbst einfache tägliche Verrichtungen nicht mehr
ausführen, vor allem wenn die Fingerspitzen eingesetzt werden müssen.
Bei der Behandlung der systemischen Sklerose ist die Verminderung der
Anzahl neu auftretender DUs ein wichtiges und erreichbares
Therapieziel.
In der EU ist Tracleer® zur Verminderung der Anzahl neuer digitaler
Ulzerationen bei Sklerodermie-Patienten, die an digitalen
Ulzerationen leiden, zugelassen. Tracleer® konnte die Funktion der
Hände bei Patienten mit Sklerodermie-bedingten digitalen Ulzerationen
(wie beispielsweise Anziehen und Hygiene) nachweislich verbessern.
Folgende Sicherheitseinschränkungen sind zu beachten:
Mögliche schwere Leberschäden (einschliesslich seltener Fälle von
Leberversagen und ungeklärter Leberzirrhose unter der gegebenen
strikten medizinischen Überwachung). - Vor Behandlungsbeginn und
während der Behandlung sind daher bei allen Patienten in monatlichem
Rhythmus Untersuchungen der Leberenzymwerte erforderlich. Erhebliche
Gefahr von schweren Missbildungen im Mutterleib - Es darf keine
Schwangerschaft vorliegen; zudem müssen zwei verschiedene
Verhütungsmethoden eingesetzt und monatliche Schwangerschaftstests
vorgenommen werden. Infolge dieser Risiken ist Tracleer® nur über
kontrollierte Distribution erhältlich.
Literaturhinweise
1. Tracleer® SPC
2. Barst RJ, McGoon M, Torbicki A et al. Diagnosis and
differential assessment of pulmonary arterial hypertension. J Am
Coll Cardiol 2004;43 (Suppl S) :40S-47S.
3. Galiè N, Rubin LJ, Hoeper MM et al. Treatment of patients
with mildly symptomatic pulmonary arterial hypertension with bosentan
(EARLY study): a double-blind, randomised controlled trial. The
Lancet 2008; 371: 2093-2100.
4. Sitbon O et al. Long-term response to calcium channel
blockers in idiopathic pulmonary arterial hypertension. Circulation
2005; 111: 3105-3111.
5. D'Alonzo G et al. Survival in patients with primary
pulmonary hypertension. Annals of Internal Medicine 1991;
115:343-349
Actelion Ltd
Actelion Ltd ist ein biopharmazeutisches Unternehmen mit Hauptsitz in
Allschwil/Basel, Schweiz. Actelions erstes Medikament, Tracleer®, ist
ein zur Therapie der pulmonalen arteriellen Hypertonie zugelassener
dualer Endothelin-Rezeptor-Antagonist in Tablettenform. Actelion
vertreibt Tracleer® durch eigene Niederlassungen in den wichtigsten
internationalen Märkten, so den Vereinigten Staaten (mit Sitz in
South San Francisco), der Europäischen Union, Japan, Kanada,
Australien und der Schweiz. Actelion, 1997 gegründet, ist ein
weltweit führendes Unternehmen bei der Erforschung des Endothels. Das
Endothel trennt die Gefässwand vom Blutstrom. Actelions über 1700
Mitarbeiterinnen und Mitarbeiter konzentrieren sich darauf,
innovative Medikamente in Bereichen mit hohem medizinischem Bedarf zu
entdecken, zu entwickeln und zu vermarkten. Actelion Aktien sind am
SWX Swiss Exchange notiert (Symbol: ATLN).
Für weitere Informationen wenden Sie sich bitte an:
Kontakt für Fachmedien
Kris Matta-Noaman
Packer Forbes
+44 208 772 1551
kris@packerforbes.com
Investoren Konakt
Roland Haefeli
Vice President, Head of Investor Relations & Public Affairs
Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil
+41 61 565 62 62
+1 650 624 69 36
http://www.actelion.com
=-- Ende der Mitteilung ---
Actelion Pharmaceuticals Ltd
Gewerbestrasse 16 Allschwil
Schweiz
WKN: 936767; ISIN: CH0010532478; Index: SBIOM, SLIFE, SMCI, SMIEXP,
SMIM, SPI, SPIEX;
Notiert: Main Market in SWX Swiss Exchange;
http://hugin.info/131801/R/1231532/261836.pdf
http://www.actelion.com
Copyright © Hugin AS 2008. All rights reserved.
(END) Dow Jones Newswires
June 27, 2008 01:01 ET (05:01 GMT)
27.06.2008 11:17:59
Actelion "hold"
Zürich (aktiencheck.de AG) - Der Analyst von Vontobel Research, Andrew Weiss, stuft die Actelion-Aktie (ISIN CH0010532478/ WKN 936767) weiterhin mit "hold" ein. Das an der US-Börse notierte Unternehmen Vanda Pharmaceuticals habe nach Handelsschluss an der Schweizer Börse die Daten einer Phase-III-Studie mit Tasimelteon (VEC-162) veröffentlicht. Die Aktien des Unternehmens hätten einen Rückgang von ca. 16% verzeichnet.
Tasimelteon sei ein Melaninrezeptor-Agonist (wie Rozerem), der zur Behandlung von primärer Insomnie eingesetzt werde. Die Dauer bis zum Einsetzen eines anhaltenden Schlafes (LPS) habe sich um rund 60% reduziert (d.h. um ca. 45 Min., verglichen mit einem Wert von 28 Min. bei Placebo-Verabreichung); diese Ergebnisse seien statistisch signifikant. Zu sekundären Endpunkten wie der gesamten Schlafdauer (TST) sowie dem Wiedererwachen nach Einsetzen des Schlafes (WASO), die etwas über die Wirkung des Medikaments auf den Schlafverlauf aussagen würden, seien keine Angaben gemacht worden.
Durch die gestern veröffentlichten klinischen Daten dürfte sich Vanda Pharmaceuticals mit Tasimelteon allerdings kaum gegenüber dem bereits im Markt etablierten Konkurrenzprodukt Rozerem (Takeda, Sepracor) profilieren können. Auch bei Rozerem seien die LPS-Werte übrigens überzeugend, während der Schlafverlauf durch das Medikament nur geringfügig verbessert werde.
Bereits in ihrem Insomnia-Bericht (31. Aug. 07) hätten die Analysten ausgeführt, dass sie den Wirkstoff VEC-162 von Vanda Pharmaceuticals als starken Konkurrenten für Almorexant von Actelion betrachten würden. Dies allerdings nur, wenn es gelinge, die Überlegenheit von VEC-162 gegenüber Rozerem zu beweisen. Es sei bekannt, dass sich Vanda Pharmaceuticals seit Mitte des letzten Jahres nach einem Partner umsehe, bisher allerdings ohne Erfolg.
Angesichts der insgesamt wenig überzeugenden klinischen Daten aus der Phase-III-Studie, die für VEC-162 keinen Vorteil gegenüber Rozerem hätten nachweisen können, würden die Analysten weder glauben, dass das Präparat eine ernst zu nehmende Konkurrenz für Almorexant darstelle, noch dass dadurch Actelions Partnersuche gefährdet werden könnte.
Die Analysten von Vontobel Research bekräftigen daher ihr "hold"-Rating die Actelion-Aktie. Das Kursziel sehe man bei CHF 62. (Analyse vom 27.06.2008) (27.06.2008/ac/a/a)
Quelle: AKTIENCHECK.DE
Actelion "hold"
Zürich (aktiencheck.de AG) - Der Analyst von Vontobel Research, Andrew Weiss, stuft die Actelion-Aktie (ISIN CH0010532478/ WKN 936767) weiterhin mit "hold" ein. Das an der US-Börse notierte Unternehmen Vanda Pharmaceuticals habe nach Handelsschluss an der Schweizer Börse die Daten einer Phase-III-Studie mit Tasimelteon (VEC-162) veröffentlicht. Die Aktien des Unternehmens hätten einen Rückgang von ca. 16% verzeichnet.
Tasimelteon sei ein Melaninrezeptor-Agonist (wie Rozerem), der zur Behandlung von primärer Insomnie eingesetzt werde. Die Dauer bis zum Einsetzen eines anhaltenden Schlafes (LPS) habe sich um rund 60% reduziert (d.h. um ca. 45 Min., verglichen mit einem Wert von 28 Min. bei Placebo-Verabreichung); diese Ergebnisse seien statistisch signifikant. Zu sekundären Endpunkten wie der gesamten Schlafdauer (TST) sowie dem Wiedererwachen nach Einsetzen des Schlafes (WASO), die etwas über die Wirkung des Medikaments auf den Schlafverlauf aussagen würden, seien keine Angaben gemacht worden.
Durch die gestern veröffentlichten klinischen Daten dürfte sich Vanda Pharmaceuticals mit Tasimelteon allerdings kaum gegenüber dem bereits im Markt etablierten Konkurrenzprodukt Rozerem (Takeda, Sepracor) profilieren können. Auch bei Rozerem seien die LPS-Werte übrigens überzeugend, während der Schlafverlauf durch das Medikament nur geringfügig verbessert werde.
Bereits in ihrem Insomnia-Bericht (31. Aug. 07) hätten die Analysten ausgeführt, dass sie den Wirkstoff VEC-162 von Vanda Pharmaceuticals als starken Konkurrenten für Almorexant von Actelion betrachten würden. Dies allerdings nur, wenn es gelinge, die Überlegenheit von VEC-162 gegenüber Rozerem zu beweisen. Es sei bekannt, dass sich Vanda Pharmaceuticals seit Mitte des letzten Jahres nach einem Partner umsehe, bisher allerdings ohne Erfolg.
Angesichts der insgesamt wenig überzeugenden klinischen Daten aus der Phase-III-Studie, die für VEC-162 keinen Vorteil gegenüber Rozerem hätten nachweisen können, würden die Analysten weder glauben, dass das Präparat eine ernst zu nehmende Konkurrenz für Almorexant darstelle, noch dass dadurch Actelions Partnersuche gefährdet werden könnte.
Die Analysten von Vontobel Research bekräftigen daher ihr "hold"-Rating die Actelion-Aktie. Das Kursziel sehe man bei CHF 62. (Analyse vom 27.06.2008) (27.06.2008/ac/a/a)
Quelle: AKTIENCHECK.DE
Allschwill (aktiencheck.de AG) - Die Geschäftsleitung der Schweizer Börse SWX Swiss Exchange hat am Dienstag, unter Anwendung der Indexreglemente und gestützt auf die Empfehlung der Indexkommission, über die Indexkorbveränderungen entschieden.
Dabei werden die Aktien des biopharmazeutischen Unternehmens Actelion Ltd. (ISIN CH0010532478/ WKN 936767) in den Schweizer Leitindex SMI aufgenommen. Dafür scheiden die Aktien des Spezialchemiekonzerns Clariant AG (ISIN CH0012142631/ WKN 895929) aus dem Index aus. Die Indizes werden am 19. September nach Handelsschluss angepasst, mit Wirkung ab dem 22. September 2008.





Während die Actelion-Aktie heute 0,29 Prozent auf 51,70 Schweizer Franken (CHF) nachgab, schloss die Clariant-Aktie 2,96 Prozent leichter bei 9,51 CHF.
(08.07.2008/ac/n/a)
Dabei werden die Aktien des biopharmazeutischen Unternehmens Actelion Ltd. (ISIN CH0010532478/ WKN 936767) in den Schweizer Leitindex SMI aufgenommen. Dafür scheiden die Aktien des Spezialchemiekonzerns Clariant AG (ISIN CH0012142631/ WKN 895929) aus dem Index aus. Die Indizes werden am 19. September nach Handelsschluss angepasst, mit Wirkung ab dem 22. September 2008.





Während die Actelion-Aktie heute 0,29 Prozent auf 51,70 Schweizer Franken (CHF) nachgab, schloss die Clariant-Aktie 2,96 Prozent leichter bei 9,51 CHF.
(08.07.2008/ac/n/a)
News!!!
Actelion and GlaxoSmithKline enter into exclusive collaboration to realise the full potential of almorexant in sleep disorders and beyond
Actelion and GlaxoSmithKline (GSK) to potentially co-develop and co-commercialise other orexin receptor antagonists
ALLSCHWIL, SWITZERLAND and LONDON, UK - 14 July 2008
Actelion Ltd (SWX: ATLN) and GlaxoSmithKline (LSE and NYSE: GSK) announced today that they have entered into an exclusive worldwide collaboration (excluding Japan) for Actelion's almorexant, an orexin receptor antagonist in phase III development with first-in-class potential as a treatment for primary insomnia.
Under the terms of the agreement, GSK will receive exclusive worldwide rights to co-develop and co-commercialise almorexant. Actelion will continue to lead the ongoing development programme and potential registration for almorexant in the first indication, primary insomnia, with GSK contributing 40 per cent of the costs. Almorexant will also be studied in other orexin-related disorders and all costs related to these programmes will be shared equally.
Actelion will receive an upfront payment of CHF 150 million (approximately £66 million) and will be eligible for additional potential milestone payments of up to CHF 415 million in regards to the successful development and approval of almorexant in primary insomnia.In addition, Actelion will be eligible to receive additional milestone payments, pending successful development of two other major indications for almorexant yet to be evaluated through clinical investigation. If all three indications were successfully registered, approved and commercialised, and exceptional sales targets met for all these indications, Actelion would be eligible to receive additional potential milestone payments of up to
CHF 2.735 billion. Also, costs and profits resulting from this collaboration will be shared equally between the two companies.
Dr Moncef Slaoui, Chairman of Research and Development, GSK, commented, "GSK and Actelion both share the vision - based on our individual research efforts - that orexin receptor antagonists have tremendous potential. By targeting orexin, which is known to help regulate the sleep-wake cycle, these novel molecules could help to reduce or even eliminate some of the side-effects associated with current sleep treatments."
Jean-Paul Clozel, MD and Chief Executive Officer of Actelion commented: "Almorexant has the potential to fundamentally change the treatment of sleep disorders. GSK, with its strong track record of successful worldwide commercialisation, is the ideal partner to work with Actelion to rapidly bring this novel medicine - with the potential to restore normal physiological sleep - to insomnia patients all around the globe. In addition, this alliance allows Actelion and GSK to create significant additional value by rapidly expanding clinical development of almorexant beyond primary insomnia."
Collaboration to realise full potential of orexin antagonism
At the end of 2007, Actelion initiated Phase III development for almorexant, with the pivotal studies required for registration in the U.S. scheduled to commence later in 2008. The RESTORA (REstore normal physiological Sleep with The Orexin Receptor antagonist Almorexant) programme is evaluating the safety and efficacy of almorexant in adult and elderly patients diagnosed with primary insomnia.
Actelion and GSK will equally share costs and profit in key pharmaceutical markets worldwide where they will co-commercialise almorexant. In these markets Actelion will book all sales and GSK will book its share of profit. GSK will grant Actelion the right to assist in the commercialisation - as a paid-for sales force - of a GSK product in certain countries and for a limited period of time. In emerging markets, GSK will commercialise the product exclusively, with Actelion receiving a share of profit.
The two companies will continue their important independent efforts in the field of orexin research and under the agreement can exercise the option to jointly select, develop and promote additional new antagonists targeting the orexin system.
Every night, insomnia - or sleeplessness - affects or impairs an estimated 150 million patients worldwide, resulting in significant negative health consequences. Patients with insomnia tend to have higher rates of mental health problems, drug and alcohol abuse, and cardiac morbidity. In the United States alone, the direct and indirect economic costs of sleep disorders are estimated to be in the range of USD 35 billion annually. [1,2]
http://www.actelion.com/uninet/www/www_main_p.nsf/content/_m…
Actelion and GlaxoSmithKline enter into exclusive collaboration to realise the full potential of almorexant in sleep disorders and beyond
Actelion and GlaxoSmithKline (GSK) to potentially co-develop and co-commercialise other orexin receptor antagonists
ALLSCHWIL, SWITZERLAND and LONDON, UK - 14 July 2008
Actelion Ltd (SWX: ATLN) and GlaxoSmithKline (LSE and NYSE: GSK) announced today that they have entered into an exclusive worldwide collaboration (excluding Japan) for Actelion's almorexant, an orexin receptor antagonist in phase III development with first-in-class potential as a treatment for primary insomnia.
Under the terms of the agreement, GSK will receive exclusive worldwide rights to co-develop and co-commercialise almorexant. Actelion will continue to lead the ongoing development programme and potential registration for almorexant in the first indication, primary insomnia, with GSK contributing 40 per cent of the costs. Almorexant will also be studied in other orexin-related disorders and all costs related to these programmes will be shared equally.
Actelion will receive an upfront payment of CHF 150 million (approximately £66 million) and will be eligible for additional potential milestone payments of up to CHF 415 million in regards to the successful development and approval of almorexant in primary insomnia.In addition, Actelion will be eligible to receive additional milestone payments, pending successful development of two other major indications for almorexant yet to be evaluated through clinical investigation. If all three indications were successfully registered, approved and commercialised, and exceptional sales targets met for all these indications, Actelion would be eligible to receive additional potential milestone payments of up to
CHF 2.735 billion. Also, costs and profits resulting from this collaboration will be shared equally between the two companies.
Dr Moncef Slaoui, Chairman of Research and Development, GSK, commented, "GSK and Actelion both share the vision - based on our individual research efforts - that orexin receptor antagonists have tremendous potential. By targeting orexin, which is known to help regulate the sleep-wake cycle, these novel molecules could help to reduce or even eliminate some of the side-effects associated with current sleep treatments."
Jean-Paul Clozel, MD and Chief Executive Officer of Actelion commented: "Almorexant has the potential to fundamentally change the treatment of sleep disorders. GSK, with its strong track record of successful worldwide commercialisation, is the ideal partner to work with Actelion to rapidly bring this novel medicine - with the potential to restore normal physiological sleep - to insomnia patients all around the globe. In addition, this alliance allows Actelion and GSK to create significant additional value by rapidly expanding clinical development of almorexant beyond primary insomnia."
Collaboration to realise full potential of orexin antagonism
At the end of 2007, Actelion initiated Phase III development for almorexant, with the pivotal studies required for registration in the U.S. scheduled to commence later in 2008. The RESTORA (REstore normal physiological Sleep with The Orexin Receptor antagonist Almorexant) programme is evaluating the safety and efficacy of almorexant in adult and elderly patients diagnosed with primary insomnia.
Actelion and GSK will equally share costs and profit in key pharmaceutical markets worldwide where they will co-commercialise almorexant. In these markets Actelion will book all sales and GSK will book its share of profit. GSK will grant Actelion the right to assist in the commercialisation - as a paid-for sales force - of a GSK product in certain countries and for a limited period of time. In emerging markets, GSK will commercialise the product exclusively, with Actelion receiving a share of profit.
The two companies will continue their important independent efforts in the field of orexin research and under the agreement can exercise the option to jointly select, develop and promote additional new antagonists targeting the orexin system.
Every night, insomnia - or sleeplessness - affects or impairs an estimated 150 million patients worldwide, resulting in significant negative health consequences. Patients with insomnia tend to have higher rates of mental health problems, drug and alcohol abuse, and cardiac morbidity. In the United States alone, the direct and indirect economic costs of sleep disorders are estimated to be in the range of USD 35 billion annually. [1,2]
http://www.actelion.com/uninet/www/www_main_p.nsf/content/_m…
Antwort auf Beitrag Nr.: 34.499.927 von Fruehrentner am 14.07.08 10:24:1414.07.2008 08:08:46
GlaxoSmithkline entwickelt und vermarktet Actelion-Schlafmittel exklusiv
ZÜRICH (dpa-AFX) - Der britische Pharmakonzern GlaxoSmithKline (GSK) wird das
Schlafmittel Almorexant der Schweizer Firma Actelion exklusiv vermarkten. GSK
habe die Rechte zur gemeinsamen Entwicklung und Vermarktung weltweit mit
Ausnahme von Japan erhalten, wie das Biotechunternehmen am Montag in Zürich
mitteilte.
Actelion werde weiter federführend für das laufende Entwicklungsprogramm und die
potenzielle Registrierung von Almorexant in der ersten Indikation, der
nichtorganischen Schlafstörungen (primäre Insomnie) sein. GSK übernehme indes 40
Prozent der Kosten. Actelion erhalte eine Vorauszahlung von 150 Millionen
Schweizer Franken sowie zusätzliche Meilensteinzahlungen in Höhe von bis zu 415
Millionen Franken, sofern das Mittel in der Indikation primäre Insomnie
erfolgreich entwickelt und zugelassen wird.
Actelion hat Ende 2007 das Phase-III-Programm für Almorexant gestartet. Die für
die Registrierung in den USA entscheidenden zulassungsrelevanten Studien sollen
in der zweiten Hälfte 2008 aufgenommen werden./ch/AWP/sc
Quelle: dpa-AFX
GlaxoSmithkline entwickelt und vermarktet Actelion-Schlafmittel exklusiv
ZÜRICH (dpa-AFX) - Der britische Pharmakonzern GlaxoSmithKline (GSK) wird das
Schlafmittel Almorexant der Schweizer Firma Actelion exklusiv vermarkten. GSK
habe die Rechte zur gemeinsamen Entwicklung und Vermarktung weltweit mit
Ausnahme von Japan erhalten, wie das Biotechunternehmen am Montag in Zürich
mitteilte.
Actelion werde weiter federführend für das laufende Entwicklungsprogramm und die
potenzielle Registrierung von Almorexant in der ersten Indikation, der
nichtorganischen Schlafstörungen (primäre Insomnie) sein. GSK übernehme indes 40
Prozent der Kosten. Actelion erhalte eine Vorauszahlung von 150 Millionen
Schweizer Franken sowie zusätzliche Meilensteinzahlungen in Höhe von bis zu 415
Millionen Franken, sofern das Mittel in der Indikation primäre Insomnie
erfolgreich entwickelt und zugelassen wird.
Actelion hat Ende 2007 das Phase-III-Programm für Almorexant gestartet. Die für
die Registrierung in den USA entscheidenden zulassungsrelevanten Studien sollen
in der zweiten Hälfte 2008 aufgenommen werden./ch/AWP/sc
Quelle: dpa-AFX
Antwort auf Beitrag Nr.: 34.499.927 von Fruehrentner am 14.07.08 10:24:14und nochmal auf deutsch die komplette Meldung:
14.07.2008 07:00:00
Actelion und GlaxoSmithKline vereinbaren exklusive Zusammenarbeit zur Ausschöpfung des gesamten Potenzials von Almorexant bei Schlafstörungen und anderen Anwendungsgebieten
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin. Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
Actelion und GlaxoSmithKline (GSK) planen gemeinsame Entwicklung und Vermarktung von weiteren Orexin-Rezeptor-Antagonisten
ALLSCHWIL, SCHWEIZ und LONDON, UK - 14. Juli 2008
Actelion Ltd (SWX: ATLN) und GlaxoSmithKline (LSE und NYSE: GSK) teilten heute mit, dass sie eine exklusive, weltweite Kooperation (mit Ausnahme Japans) bezüglich Actelions Almorexant eingegangen sind. Almorexant ist ein Orexin-Rezeptor-Antagonist, der zur Zeit in der klinischen Phase III untersucht wird und als erstes Präparat seiner Klasse zur Behandlung der primären Insomnie eingesetzt werden könnte.
Im Rahmen der Vereinbarung erhält GSK die weltweiten Exklusivrechte zur gemeinsamen Entwicklung und Kommerzialisierung von Almorexant. Actelion wird weiterhin federführend für das laufende Entwicklungsprogramm und die potenzielle Registrierung von Almorexant in der ersten Indikation, primäre Insomnie, sein, während GSK 40 Prozent der Kosten übernehmen wird. Almorexant soll zudem in anderen Orexin-bedingten Indikationen untersucht werden.
Die im Rahmen dieser Programme entstehenden Kosten werden von beiden Partnern zu gleichen Teilen getragen. Actelion erhält eine Vorauszahlung von CHF 150 Millionen (etwa £ 66 Millionen) sowie zusätzliche Meilensteinzahlungen in Höhe von bis zu CHF 415 Millionen, sofern Almorexant in der Indikation primäre Insomnie erfolgreich entwickelt und zugelassen wird. Darüberhinaus stehen Actelion weitere Meilensteinzahlungen für die erfolgreiche Entwicklung von zwei weiteren bedeutenden Indikationen für Almorexant zu, die noch in klinischen Studien geprüft werden müssen.
Wird das Produkt in allen drei Indikationen erfolgreich registriert, zugelassen und vermarktet und werden anspruchsvolle Umsatzziele in diesen Indikationen erreicht, hat Actelion Anspruch auf weitere mögliche Meilensteinzahlungen von bis zu CHF 2,735 Milliarden. Ausserdem sollen im Rahmen dieser Zusammenarbeit anfallende Kosten und Gewinne zwischen beiden Unternehmen gleichmässig aufgeteilt werden.
Dr. Moncef Slaoui, Vorsitzender Forschung und Entwicklung von GSK, kommentierte: "Basierend auf unseren individuellen Forschungsanstrengungen, teilen GSK und Actelion die Vision, dass Orexin-Rezeptor-Antagonisten ein enormes Potenzial aufweisen. Diese neuartigen Moleküle könnten dazu beitragen, einige der mit herkömmlichen Schlafmitteln verbundenen Nebenwirkungen zu vermindern oder sogar zu eliminieren, indem sie Orexin, das bekanntermassen zur Regulierung des Schlaf-Wach-Zyklus beiträgt, gezielt blockieren." Dr. Jean-Paul Clozel, CEO von Actelion, erklärte: "Almorexant hat das Potenzial, die Behandlung von Schlafstörungen grundlegend zu verändern.
GSK verfügt über einen ausgezeichneten Erfolgsausweis in der weltweiten Vermarktung von Medikamenten und ist deshalb der ideale Partner für Actelion, um dieses neuartige Präparat zur Wiederherstellung des normalen physiologischen Schlafs Patienten, die unter Schlaflosigkeit leiden, weltweit rasch zur Verfügung zu stellen. Die eingegangene Allianz erlaubt Actelion und GSK zudem, durch die zügige Ausweitung der klinischen Entwicklung von Almorexant über die primäre Schlaflosigkeit hinaus beträchtlichen Mehrwert zu schaffen."
Zusammenarbeit im Hinblick auf umfassende Nutzung des Potenzials von Orexin-Antagonisten
Ende 2007 lancierte Actelion das Phase-III-Programm für Almorexant. Die für die Registrierung in den USA entscheidenden zulassungsrelevanten Studien sollen in der zweiten Hälfte 2008 aufgenommen werden. RESTORA (REstore normal physiological Sleep with The Orexin Receptor antagonist Almorexant) untersucht die Sicherheit und Wirksamkeit von Almorexant bei erwachsenen und älteren Patienten mit primärer Insomnie.
Actelion und GSK werden sich die Kosten und Gewinne in pharmazeutischen Schlüsselmärkten, in denen sie das Produkt gemeinsam vertreiben, in jeweils gleichem Umfang teilen. In diesen Märkten wird Actelion alle Umsätze und GSK seinen Gewinnanteil verbuchen. GSK räumt Actelion das Recht ein, GSK für einen begrenzten Zeitraum bei der Vermarktung eines GSK-Produkts in bestimmten Ländern in Form eines bezahlten Aussendienstes zu unterstützen. In aufstrebenden Märkten wird GSK das Produkt uneingeschränkt selbst vertreiben, wobei Actelion am Gewinn beteiligt sein wird.
Beide Unternehmen werden ihre bedeutenden Forschungsanstrengungen auf dem Gebiet der Orexine unabhängig voneinander fortsetzen. Im Rahmen der Vereinbarung können sie aber von der Option Gebrauch machen, weitere neue Antagonisten, die auf das Orexin-System abzielen, gemeinsam auszuwählen, zu entwickeln und zu vermarkten.
Jede Nacht sind schätzungsweise 150 Millionen Patienten weltweit von Insomnie - oder Schlaflosigkeit - betroffen, was gravierende Gesundheitsprobleme zur Folge hat. Insomnie-Patienten leiden häufiger unter psychischen Störungen, Medikamenten- und Alkoholmissbrauch sowie Herzerkrankungen. Allein in den Vereinigten Staaten werden die direkten und indirekten Kosten im Zusammenhang mit Schlafstörungen auf jährlich etwa USD 35 Milliarden geschätzt. [1,2]
Hinweise für Herausgeber:
Über Schlafstörungen
Allein in den Vereinigten Staaten, so die Schätzung einer Konferenz der US-amerikanischen Gesundheitsbehörde NIH (National Institutes of Health) zum Thema chronische Schlaflosigkeit, leiden bis zu 80 Millionen Amerikaner unter Schlaflosigkeit, 25 Millionen davon unter chronischer Schlaflosigkeit. Schlafstörungen haben einen erheblichen Einfluss auf die Gesundheit und Lebensqualität. Menschen mit Schlafstörungen leiden vermehrt unter psychischen Problemen, Medikamenten- und Alkoholmissbrauch und Herzerkrankungen. Über Orexine und Almorexant Orexine - früher als Hypocretin bezeichnet - sind Proteine, die im Hypothalamus produziert werden. Sie spielen eine wichtige Rolle bei der Regulierung des Schlaf-Wach-Zyklus.
Almorexant ist der erste Orexin-Rezeptor-Antagonist seiner Klasse, der als neues Therapeutikum zur Behandlung der Schlaflosigkeit und anderer Krankheiten des zentralen Nervensystems in klinischen Studien geprüft wird. Es ist ein orales Therapeutikum, das die Blut-Hirn-Schranke überwindet und in der Lage ist, eine vorübergehende und reversible Blockade der beiden Orexinrezeptoren herbeizuführen. Almorexant wurde 2003 von Actelion-Forschern entdeckt und steht unter Patentschutz. Über das Phase-III-Programm RESTORA mit Almorexant Im Dezember 2007 lancierte Actelion das Zulassungsprogramm RESTORA (REstore normal physiological Sleep with The Orexin Receptor antagonist Almorexant) zur Untersuchung von Wirksamkeit und Sicherheit von Almorexant bei erwachsenen und älteren Patienten mit Insomnie. Im Rahmen des RESTORA-Programms soll ausserdem das Profil von Almorexant, beispielsweise im Vergleich zu gängigen, auf Benzodiazepin-Rezeptoren ausgerichtete Hypnotika klarer herausgearbeitet werden. Erste Ergebnisse des RESTORA-Programms werden voraussichtlich in der zweiten Hälfte 2009 bekannt gegeben werden. Vorläuferstudien zu RESTORA Vor Aufnahme der RESTORA-Studie konnte im Rahmen einer Proof-of-Concept-/Dosisfindungsstudie bei Patienten mit primärer Insomnie gezeigt werden, dass Almorexant den primären Parameter Schlafeffizienz (mittels Polysomnographie - PSG - gemessene Zeit, die nachts während acht Stunden schlafend im Bett verbracht wird) abhängig von der Dosierung bei 400 mg, 200 mg und 100 mg signifikant verbessert. Die Analyse sekundärer und exploratorischer Endpunkte, auf die die Studie nicht ausgelegt war, ergab ausserdem, dass Almorexant andere klinisch relevante Verbesserungen bei wichtigen Schlafparametern bewirkte, die mittels Polysomnographie gemessen wurden. In Abhängigkeit von der Dosierung verringerte Almorexant sowohl LPS (bei 400 mg signifikant) und WASO (bei 400 mg, 200 mg und 100 mg signifikant). Unter Almorexant verbesserte sich der Prozentsatz der Zeit, die im REM (Rapid-Eye-Movement)-Schlaf und im Nicht-REM-Schlaf verbracht wurde oder blieb anteilsmässig gleich.
Almorexant bewirkte ausserdem eine signifikante Verbesserung subjektiver Schlafparameter. Die Behandlung mit Almorexant hatte keinerlei negative Auswirkungen auf die Leistungsfähigkeit am nächsten Tag (getestet mittels Feinmotorik und der durchschnittlichen Reaktionszeit). Die Behandlung mit Almorexant wurde gut vertragen; es wurden keine schweren Nebenwirkungen oder mögliche Sicherheitsrisiken berichtet. Diese Ergebnisse, die anhand von Postern, Abstracts und Präsentationen anlässlich des Weltschlafkongresses 2007 in Cairns, Australien, präsentiert wurden, decken sich mit Beobachtungen aus früheren präklinischen und klinischen Studien, die kürzlich in Nature Medicine veröffentlicht wurden [3]. Die erste klinische Studie zur Ermittlung der Verträglichkeit, Sicherheit, Pharmakokinetik und Pharmakodynamik mit 70 gesunden männlichen Probanden zeigte auf, dass die geprüften Dosisstärken (bis zu 1000 mg) gut vertragen und keinerlei Sicherheitsrisiken beobachtet wurden. Eine weitere Studie, bei der gesunde weibliche und männliche Probanden sechs Tage lang mehrere ansteigende Dosierungen bis 1000 mg erhalten hatten, zeigte vergleichbare Ergebnisse. Literaturnachweis 1. National Institutes of Health (NIH) State of Science conference on chronic insomnia, 2005. 2. EU National Health and Wellness Survey, Insomnia analysis 2006-2007. 3. Brisbare-Roch C. et al. Promotion of sleep by targeting the orexin system in rats, dogs and humans. Nat Med. 2007 Feb;13(2):150-5
Über GlaxoSmithKline
GlaxoSmithKline - ein weltweit führendes, forschungsorientiertes Pharma- und Gesundheitsunternehmen - hat sich zum Ziel gesetzt, die Lebensqualität von Menschen durch ein aktives, längeres und gesünderes Leben zu verbessern.
Actelion Ltd Actelion Ltd ist ein biopharmazeutisches Unternehmen mit Hauptsitz in Allschwil/Basel, Schweiz. Actelions erstes Medikament, Tracleer®, ist ein zur Therapie der pulmonalen arteriellen Hypertonie zugelassener dualer Endothelin-Rezeptor-Antagonist in Tablettenform. Actelion vertreibt Tracleer® durch eigene Niederlassungen in den wichtigsten internationalen Märkten, so den Vereinigten Staaten (mit Sitz in South San Francisco), der Europäischen Union, Japan, Kanada, Australien und der Schweiz. Actelion, 1997 gegründet, ist ein weltweit führendes Unternehmen bei der Erforschung des Endothels. Das Endothel trennt die Gefässwand vom Blutstrom. Actelions über 1700 Mitarbeitende konzentrieren sich darauf, innovative Medikamente in Bereichen mit hohem medizinischem Bedarf zu entdecken, zu entwickeln und zu vermarkten.
Actelion Aktien sind am SWX Swiss Exchange notiert (Symbol: ATLN). Um Fragen zur Zusammenarbeit von Actelion und GlaxoSmithKline zu erläutern, wird Actelion eine Telefonkonferenz/Webcast für Investoren wie folgt durchführen: Datum/Zeit: 14 Juli 2008 07:45 - 08:15 Basel (CET) 06:45 - 07:15 UK (GMT) 01:45 - 02:15 US (EST) Conference Call Connect #: Dial-in participants should start calling the number below 10-15 minutes before the conference is due to start. Dial: Europa: +41 44 580 65 22 UK: +44 203 147 4752 US (gebührenfrei): +1 866 928 6044 Participant's mode: Listen-Only with possibility to open individual lines during Q&A session. Participants will be asked for their Name and Company. Webcast Access: Webcast participants should visit the Actelion website http://www.actelion.com for further details 10-15 minutes before the conference is due to start. If you experience any access problems go directly to the URL: http://gaia.world-television.com/actelion/20080701/trunc Participant's mode: Listen-Only with possibility to ask individual questions by clicking on the Q&A button. Participants will be asked to provide their Name and Company. Webcast Replay: The archived Investor Webcast will be available for replay through http://www.actelion.com/ approximately 60 minutes after the call has ended. Für weitere Informationen wenden Sie sich bitte an: Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil Roland Haefeli Vice President, Head of Investor Relations & Public Affairs +41 61 565 62 62 +1 650 624 69 36 http://www.actelion.com Für Anfragen an GlaxoSmithKline: Anfragen UK Media: Philip Thomson +44 20 8047 5502 Claire Brough +44 20 8047 5502 Alice Hunt +44 20 8047 5502 Gwenan White +44 20 8047 5502 Anfragen US Media: Nancy Pekarek + 1 215 751 77 09 Mary Anne Rhyne + 1 919 483 28 39 Sarah Alspach + 1 215 751 77 09 Anfragen European Analyst/Investor: David Mawdsley +44 20 8047 5564 Sally Ferguson +44 20 8047 5543 Gary Davies +44 20 8047 5503 Anfragen US Analyst/ Investor: Frank Murdolo + 1 215 751 7002 Tom Curry + 1 215 751 5419 http://www.gsk.com --- Ende der Mitteilung --- Actelion Pharmaceuticals Ltd Gewerbestrasse 16 Allschwil Schweiz WKN: 936767; ISIN: CH0010532478; Index: SBIOM, SLIFE, SMCI, SMIEXP, SMIM, SPI, SPIEX; Notiert: Main Market in SWX Swiss Exchange; http://www.actelion.com http://hugin.info/131801/R/1235544/263393.pdf http://gaia.world-television.com/actelion/20080701/trunc Copyright © Hugin AS 2008. All rights reserved.
Quelle: HUGIN
14.07.2008 07:00:00
Actelion und GlaxoSmithKline vereinbaren exklusive Zusammenarbeit zur Ausschöpfung des gesamten Potenzials von Almorexant bei Schlafstörungen und anderen Anwendungsgebieten
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin. Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
Actelion und GlaxoSmithKline (GSK) planen gemeinsame Entwicklung und Vermarktung von weiteren Orexin-Rezeptor-Antagonisten
ALLSCHWIL, SCHWEIZ und LONDON, UK - 14. Juli 2008
Actelion Ltd (SWX: ATLN) und GlaxoSmithKline (LSE und NYSE: GSK) teilten heute mit, dass sie eine exklusive, weltweite Kooperation (mit Ausnahme Japans) bezüglich Actelions Almorexant eingegangen sind. Almorexant ist ein Orexin-Rezeptor-Antagonist, der zur Zeit in der klinischen Phase III untersucht wird und als erstes Präparat seiner Klasse zur Behandlung der primären Insomnie eingesetzt werden könnte.
Im Rahmen der Vereinbarung erhält GSK die weltweiten Exklusivrechte zur gemeinsamen Entwicklung und Kommerzialisierung von Almorexant. Actelion wird weiterhin federführend für das laufende Entwicklungsprogramm und die potenzielle Registrierung von Almorexant in der ersten Indikation, primäre Insomnie, sein, während GSK 40 Prozent der Kosten übernehmen wird. Almorexant soll zudem in anderen Orexin-bedingten Indikationen untersucht werden.
Die im Rahmen dieser Programme entstehenden Kosten werden von beiden Partnern zu gleichen Teilen getragen. Actelion erhält eine Vorauszahlung von CHF 150 Millionen (etwa £ 66 Millionen) sowie zusätzliche Meilensteinzahlungen in Höhe von bis zu CHF 415 Millionen, sofern Almorexant in der Indikation primäre Insomnie erfolgreich entwickelt und zugelassen wird. Darüberhinaus stehen Actelion weitere Meilensteinzahlungen für die erfolgreiche Entwicklung von zwei weiteren bedeutenden Indikationen für Almorexant zu, die noch in klinischen Studien geprüft werden müssen.
Wird das Produkt in allen drei Indikationen erfolgreich registriert, zugelassen und vermarktet und werden anspruchsvolle Umsatzziele in diesen Indikationen erreicht, hat Actelion Anspruch auf weitere mögliche Meilensteinzahlungen von bis zu CHF 2,735 Milliarden. Ausserdem sollen im Rahmen dieser Zusammenarbeit anfallende Kosten und Gewinne zwischen beiden Unternehmen gleichmässig aufgeteilt werden.
Dr. Moncef Slaoui, Vorsitzender Forschung und Entwicklung von GSK, kommentierte: "Basierend auf unseren individuellen Forschungsanstrengungen, teilen GSK und Actelion die Vision, dass Orexin-Rezeptor-Antagonisten ein enormes Potenzial aufweisen. Diese neuartigen Moleküle könnten dazu beitragen, einige der mit herkömmlichen Schlafmitteln verbundenen Nebenwirkungen zu vermindern oder sogar zu eliminieren, indem sie Orexin, das bekanntermassen zur Regulierung des Schlaf-Wach-Zyklus beiträgt, gezielt blockieren." Dr. Jean-Paul Clozel, CEO von Actelion, erklärte: "Almorexant hat das Potenzial, die Behandlung von Schlafstörungen grundlegend zu verändern.
GSK verfügt über einen ausgezeichneten Erfolgsausweis in der weltweiten Vermarktung von Medikamenten und ist deshalb der ideale Partner für Actelion, um dieses neuartige Präparat zur Wiederherstellung des normalen physiologischen Schlafs Patienten, die unter Schlaflosigkeit leiden, weltweit rasch zur Verfügung zu stellen. Die eingegangene Allianz erlaubt Actelion und GSK zudem, durch die zügige Ausweitung der klinischen Entwicklung von Almorexant über die primäre Schlaflosigkeit hinaus beträchtlichen Mehrwert zu schaffen."
Zusammenarbeit im Hinblick auf umfassende Nutzung des Potenzials von Orexin-Antagonisten
Ende 2007 lancierte Actelion das Phase-III-Programm für Almorexant. Die für die Registrierung in den USA entscheidenden zulassungsrelevanten Studien sollen in der zweiten Hälfte 2008 aufgenommen werden. RESTORA (REstore normal physiological Sleep with The Orexin Receptor antagonist Almorexant) untersucht die Sicherheit und Wirksamkeit von Almorexant bei erwachsenen und älteren Patienten mit primärer Insomnie.
Actelion und GSK werden sich die Kosten und Gewinne in pharmazeutischen Schlüsselmärkten, in denen sie das Produkt gemeinsam vertreiben, in jeweils gleichem Umfang teilen. In diesen Märkten wird Actelion alle Umsätze und GSK seinen Gewinnanteil verbuchen. GSK räumt Actelion das Recht ein, GSK für einen begrenzten Zeitraum bei der Vermarktung eines GSK-Produkts in bestimmten Ländern in Form eines bezahlten Aussendienstes zu unterstützen. In aufstrebenden Märkten wird GSK das Produkt uneingeschränkt selbst vertreiben, wobei Actelion am Gewinn beteiligt sein wird.
Beide Unternehmen werden ihre bedeutenden Forschungsanstrengungen auf dem Gebiet der Orexine unabhängig voneinander fortsetzen. Im Rahmen der Vereinbarung können sie aber von der Option Gebrauch machen, weitere neue Antagonisten, die auf das Orexin-System abzielen, gemeinsam auszuwählen, zu entwickeln und zu vermarkten.
Jede Nacht sind schätzungsweise 150 Millionen Patienten weltweit von Insomnie - oder Schlaflosigkeit - betroffen, was gravierende Gesundheitsprobleme zur Folge hat. Insomnie-Patienten leiden häufiger unter psychischen Störungen, Medikamenten- und Alkoholmissbrauch sowie Herzerkrankungen. Allein in den Vereinigten Staaten werden die direkten und indirekten Kosten im Zusammenhang mit Schlafstörungen auf jährlich etwa USD 35 Milliarden geschätzt. [1,2]
Hinweise für Herausgeber:
Über Schlafstörungen
Allein in den Vereinigten Staaten, so die Schätzung einer Konferenz der US-amerikanischen Gesundheitsbehörde NIH (National Institutes of Health) zum Thema chronische Schlaflosigkeit, leiden bis zu 80 Millionen Amerikaner unter Schlaflosigkeit, 25 Millionen davon unter chronischer Schlaflosigkeit. Schlafstörungen haben einen erheblichen Einfluss auf die Gesundheit und Lebensqualität. Menschen mit Schlafstörungen leiden vermehrt unter psychischen Problemen, Medikamenten- und Alkoholmissbrauch und Herzerkrankungen. Über Orexine und Almorexant Orexine - früher als Hypocretin bezeichnet - sind Proteine, die im Hypothalamus produziert werden. Sie spielen eine wichtige Rolle bei der Regulierung des Schlaf-Wach-Zyklus.
Almorexant ist der erste Orexin-Rezeptor-Antagonist seiner Klasse, der als neues Therapeutikum zur Behandlung der Schlaflosigkeit und anderer Krankheiten des zentralen Nervensystems in klinischen Studien geprüft wird. Es ist ein orales Therapeutikum, das die Blut-Hirn-Schranke überwindet und in der Lage ist, eine vorübergehende und reversible Blockade der beiden Orexinrezeptoren herbeizuführen. Almorexant wurde 2003 von Actelion-Forschern entdeckt und steht unter Patentschutz. Über das Phase-III-Programm RESTORA mit Almorexant Im Dezember 2007 lancierte Actelion das Zulassungsprogramm RESTORA (REstore normal physiological Sleep with The Orexin Receptor antagonist Almorexant) zur Untersuchung von Wirksamkeit und Sicherheit von Almorexant bei erwachsenen und älteren Patienten mit Insomnie. Im Rahmen des RESTORA-Programms soll ausserdem das Profil von Almorexant, beispielsweise im Vergleich zu gängigen, auf Benzodiazepin-Rezeptoren ausgerichtete Hypnotika klarer herausgearbeitet werden. Erste Ergebnisse des RESTORA-Programms werden voraussichtlich in der zweiten Hälfte 2009 bekannt gegeben werden. Vorläuferstudien zu RESTORA Vor Aufnahme der RESTORA-Studie konnte im Rahmen einer Proof-of-Concept-/Dosisfindungsstudie bei Patienten mit primärer Insomnie gezeigt werden, dass Almorexant den primären Parameter Schlafeffizienz (mittels Polysomnographie - PSG - gemessene Zeit, die nachts während acht Stunden schlafend im Bett verbracht wird) abhängig von der Dosierung bei 400 mg, 200 mg und 100 mg signifikant verbessert. Die Analyse sekundärer und exploratorischer Endpunkte, auf die die Studie nicht ausgelegt war, ergab ausserdem, dass Almorexant andere klinisch relevante Verbesserungen bei wichtigen Schlafparametern bewirkte, die mittels Polysomnographie gemessen wurden. In Abhängigkeit von der Dosierung verringerte Almorexant sowohl LPS (bei 400 mg signifikant) und WASO (bei 400 mg, 200 mg und 100 mg signifikant). Unter Almorexant verbesserte sich der Prozentsatz der Zeit, die im REM (Rapid-Eye-Movement)-Schlaf und im Nicht-REM-Schlaf verbracht wurde oder blieb anteilsmässig gleich.
Almorexant bewirkte ausserdem eine signifikante Verbesserung subjektiver Schlafparameter. Die Behandlung mit Almorexant hatte keinerlei negative Auswirkungen auf die Leistungsfähigkeit am nächsten Tag (getestet mittels Feinmotorik und der durchschnittlichen Reaktionszeit). Die Behandlung mit Almorexant wurde gut vertragen; es wurden keine schweren Nebenwirkungen oder mögliche Sicherheitsrisiken berichtet. Diese Ergebnisse, die anhand von Postern, Abstracts und Präsentationen anlässlich des Weltschlafkongresses 2007 in Cairns, Australien, präsentiert wurden, decken sich mit Beobachtungen aus früheren präklinischen und klinischen Studien, die kürzlich in Nature Medicine veröffentlicht wurden [3]. Die erste klinische Studie zur Ermittlung der Verträglichkeit, Sicherheit, Pharmakokinetik und Pharmakodynamik mit 70 gesunden männlichen Probanden zeigte auf, dass die geprüften Dosisstärken (bis zu 1000 mg) gut vertragen und keinerlei Sicherheitsrisiken beobachtet wurden. Eine weitere Studie, bei der gesunde weibliche und männliche Probanden sechs Tage lang mehrere ansteigende Dosierungen bis 1000 mg erhalten hatten, zeigte vergleichbare Ergebnisse. Literaturnachweis 1. National Institutes of Health (NIH) State of Science conference on chronic insomnia, 2005. 2. EU National Health and Wellness Survey, Insomnia analysis 2006-2007. 3. Brisbare-Roch C. et al. Promotion of sleep by targeting the orexin system in rats, dogs and humans. Nat Med. 2007 Feb;13(2):150-5
Über GlaxoSmithKline
GlaxoSmithKline - ein weltweit führendes, forschungsorientiertes Pharma- und Gesundheitsunternehmen - hat sich zum Ziel gesetzt, die Lebensqualität von Menschen durch ein aktives, längeres und gesünderes Leben zu verbessern.
Actelion Ltd Actelion Ltd ist ein biopharmazeutisches Unternehmen mit Hauptsitz in Allschwil/Basel, Schweiz. Actelions erstes Medikament, Tracleer®, ist ein zur Therapie der pulmonalen arteriellen Hypertonie zugelassener dualer Endothelin-Rezeptor-Antagonist in Tablettenform. Actelion vertreibt Tracleer® durch eigene Niederlassungen in den wichtigsten internationalen Märkten, so den Vereinigten Staaten (mit Sitz in South San Francisco), der Europäischen Union, Japan, Kanada, Australien und der Schweiz. Actelion, 1997 gegründet, ist ein weltweit führendes Unternehmen bei der Erforschung des Endothels. Das Endothel trennt die Gefässwand vom Blutstrom. Actelions über 1700 Mitarbeitende konzentrieren sich darauf, innovative Medikamente in Bereichen mit hohem medizinischem Bedarf zu entdecken, zu entwickeln und zu vermarkten.
Actelion Aktien sind am SWX Swiss Exchange notiert (Symbol: ATLN). Um Fragen zur Zusammenarbeit von Actelion und GlaxoSmithKline zu erläutern, wird Actelion eine Telefonkonferenz/Webcast für Investoren wie folgt durchführen: Datum/Zeit: 14 Juli 2008 07:45 - 08:15 Basel (CET) 06:45 - 07:15 UK (GMT) 01:45 - 02:15 US (EST) Conference Call Connect #: Dial-in participants should start calling the number below 10-15 minutes before the conference is due to start. Dial: Europa: +41 44 580 65 22 UK: +44 203 147 4752 US (gebührenfrei): +1 866 928 6044 Participant's mode: Listen-Only with possibility to open individual lines during Q&A session. Participants will be asked for their Name and Company. Webcast Access: Webcast participants should visit the Actelion website http://www.actelion.com for further details 10-15 minutes before the conference is due to start. If you experience any access problems go directly to the URL: http://gaia.world-television.com/actelion/20080701/trunc Participant's mode: Listen-Only with possibility to ask individual questions by clicking on the Q&A button. Participants will be asked to provide their Name and Company. Webcast Replay: The archived Investor Webcast will be available for replay through http://www.actelion.com/ approximately 60 minutes after the call has ended. Für weitere Informationen wenden Sie sich bitte an: Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil Roland Haefeli Vice President, Head of Investor Relations & Public Affairs +41 61 565 62 62 +1 650 624 69 36 http://www.actelion.com Für Anfragen an GlaxoSmithKline: Anfragen UK Media: Philip Thomson +44 20 8047 5502 Claire Brough +44 20 8047 5502 Alice Hunt +44 20 8047 5502 Gwenan White +44 20 8047 5502 Anfragen US Media: Nancy Pekarek + 1 215 751 77 09 Mary Anne Rhyne + 1 919 483 28 39 Sarah Alspach + 1 215 751 77 09 Anfragen European Analyst/Investor: David Mawdsley +44 20 8047 5564 Sally Ferguson +44 20 8047 5543 Gary Davies +44 20 8047 5503 Anfragen US Analyst/ Investor: Frank Murdolo + 1 215 751 7002 Tom Curry + 1 215 751 5419 http://www.gsk.com --- Ende der Mitteilung --- Actelion Pharmaceuticals Ltd Gewerbestrasse 16 Allschwil Schweiz WKN: 936767; ISIN: CH0010532478; Index: SBIOM, SLIFE, SMCI, SMIEXP, SMIM, SPI, SPIEX; Notiert: Main Market in SWX Swiss Exchange; http://www.actelion.com http://hugin.info/131801/R/1235544/263393.pdf http://gaia.world-television.com/actelion/20080701/trunc Copyright © Hugin AS 2008. All rights reserved.
Quelle: HUGIN
AKTIENFOKUS
Actelion: Anleger honorieren Almorexant-Partnerschaft mit GSK
14.07 10:20
Zürich (AWP) - Die Titel des biopharmazeutischen Unternehmens Actelion ziehen nach dem Abschluss eines exklusiven Zusammenarbeitsabkommens für das Schlafmedikament Almorexant mit GlaxoSmithKline (GSK) deutlich an. Actelion konnte das seit Monaten angestrebte und noch für dieses Jahr in Aussicht gestellte Abkommen früher und zu besseren Bedingungen abschliessen, als erwartet worden war. Das Partnerschaftsabkommen berechtigt Actelion zu einer Vorabzahlung und Meilensteinzahlungen von zusammen potenziell 3,3 Mrd CHF. Darüberhinaus verbucht das Allschwiler Unternehmen 50% der Almorexant-Umsätze, zudem beteiligt sich GSK an den Kosten der Produktentwicklung und leistet Unterstützung bei der Kommerzialisierung.
Bis um 10.00 Uhr legen Actelion um 4,3% auf 54,85 CHF (bisheriges Tageshoch 57,40 CHF) zu. Der SPI gewinnt bis dahin um rund 0,9%.
Analysten begrüssen in ersten Kommentaren das Partnerschaftsabkommen und insbesondere die Konditionen. "Die Ankündigung des Abschlusses eines Zusammenarbeitsabkommens ist erwartet worden, nicht aber das Ausmass und die Konditionen", schreibt Stephen McGarry von Goldman Sachs. Dies sei ein Deal, der Actelion grundsätzlich verändere, und auch ein grosser Deal für GSK, angesichts eines rund siebenjährigen Vorsprungs gegenüber der Konkurrenz bei der Indikation Schlaflosigkeit und verwandten Indikationen, heisst es weiter. Zudem verringere das Abkommen das finanzielle und generelle Risikoprofil des Unternehmens "deutlich".
Als Risiken des Almorexant-Programmes macht McGarry die langfristige Sicherheit des Medikamentes aus, zumal das Schlafmedikament über längere Zeiträume eingenommen werde.
Andrew C. Weiss von der Bank Vontobel sieht das Umsatzpotenzial für die erste Indikation primäre Insomnie bei 1 Mrd CHF. Die beiden weiteren zu entwickelnden Indikationen müssten aufgrund der hohen potenziellen Meilensteinzahlungen für Umsatzziele ein Potenzial von "leicht 2 Mrd CHF je Indikation" erreichen, heisst es weiter. Dabei geht Weiss davon aus, dass es sich um Insommnie in Verbindung mit Depressionen und Alzheimer handeln dürfte.
Die Partnerschaft habe schneller als erwartet eingegangen werden können und sei mit dem Partner (GSK) und den finanziellen Zuschüssen "sehr erfreulich" ausgefallen, schreibt Sibylle Bischofberger von der ZKB. Mit GSK sei ein "guter Partner an Bord geholt worden", der auch über eine gute Verkaufsorganisation zum Vertrieb von Almorexant bei den Allgemeinpraktikern verfüge. Bischofberger erwartet die Marktzulassung des Schlafmedikamentes für 2011.
Von einem "gewissen Überraschungseffekt" schreiben auch die Analysten der Privatbank Wegelin. Almorexant sei auch aufgrund einer Produktdiversifikation weg von Tracleer für Actelion "sehr wichtig".
Unter den Analysten hat Goldman Sachs Actelion auf der "Pan-Europe Conviction Buy List" mit einem Zwölfmonatskursziel von 100 CHF. "Hold" bzw. "Marktgewichten" sind die Einstufungen von Vontobel ("fair value" neu 73, bisher 70 CHF; Kursziel unverändert 62 CHF) bzw. ZKB, die die Schätzungen "ab 2008 leicht nach oben" anpassen wird.
Actelion: Anleger honorieren Almorexant-Partnerschaft mit GSK
14.07 10:20
Zürich (AWP) - Die Titel des biopharmazeutischen Unternehmens Actelion ziehen nach dem Abschluss eines exklusiven Zusammenarbeitsabkommens für das Schlafmedikament Almorexant mit GlaxoSmithKline (GSK) deutlich an. Actelion konnte das seit Monaten angestrebte und noch für dieses Jahr in Aussicht gestellte Abkommen früher und zu besseren Bedingungen abschliessen, als erwartet worden war. Das Partnerschaftsabkommen berechtigt Actelion zu einer Vorabzahlung und Meilensteinzahlungen von zusammen potenziell 3,3 Mrd CHF. Darüberhinaus verbucht das Allschwiler Unternehmen 50% der Almorexant-Umsätze, zudem beteiligt sich GSK an den Kosten der Produktentwicklung und leistet Unterstützung bei der Kommerzialisierung.
Bis um 10.00 Uhr legen Actelion um 4,3% auf 54,85 CHF (bisheriges Tageshoch 57,40 CHF) zu. Der SPI gewinnt bis dahin um rund 0,9%.
Analysten begrüssen in ersten Kommentaren das Partnerschaftsabkommen und insbesondere die Konditionen. "Die Ankündigung des Abschlusses eines Zusammenarbeitsabkommens ist erwartet worden, nicht aber das Ausmass und die Konditionen", schreibt Stephen McGarry von Goldman Sachs. Dies sei ein Deal, der Actelion grundsätzlich verändere, und auch ein grosser Deal für GSK, angesichts eines rund siebenjährigen Vorsprungs gegenüber der Konkurrenz bei der Indikation Schlaflosigkeit und verwandten Indikationen, heisst es weiter. Zudem verringere das Abkommen das finanzielle und generelle Risikoprofil des Unternehmens "deutlich".
Als Risiken des Almorexant-Programmes macht McGarry die langfristige Sicherheit des Medikamentes aus, zumal das Schlafmedikament über längere Zeiträume eingenommen werde.
Andrew C. Weiss von der Bank Vontobel sieht das Umsatzpotenzial für die erste Indikation primäre Insomnie bei 1 Mrd CHF. Die beiden weiteren zu entwickelnden Indikationen müssten aufgrund der hohen potenziellen Meilensteinzahlungen für Umsatzziele ein Potenzial von "leicht 2 Mrd CHF je Indikation" erreichen, heisst es weiter. Dabei geht Weiss davon aus, dass es sich um Insommnie in Verbindung mit Depressionen und Alzheimer handeln dürfte.
Die Partnerschaft habe schneller als erwartet eingegangen werden können und sei mit dem Partner (GSK) und den finanziellen Zuschüssen "sehr erfreulich" ausgefallen, schreibt Sibylle Bischofberger von der ZKB. Mit GSK sei ein "guter Partner an Bord geholt worden", der auch über eine gute Verkaufsorganisation zum Vertrieb von Almorexant bei den Allgemeinpraktikern verfüge. Bischofberger erwartet die Marktzulassung des Schlafmedikamentes für 2011.
Von einem "gewissen Überraschungseffekt" schreiben auch die Analysten der Privatbank Wegelin. Almorexant sei auch aufgrund einer Produktdiversifikation weg von Tracleer für Actelion "sehr wichtig".
Unter den Analysten hat Goldman Sachs Actelion auf der "Pan-Europe Conviction Buy List" mit einem Zwölfmonatskursziel von 100 CHF. "Hold" bzw. "Marktgewichten" sind die Einstufungen von Vontobel ("fair value" neu 73, bisher 70 CHF; Kursziel unverändert 62 CHF) bzw. ZKB, die die Schätzungen "ab 2008 leicht nach oben" anpassen wird.
Super Deal von Actelion
Beteiligung von 50 % am Almorexant Umsatz ist Spitze..
Was für eine Woche!
zuerst die Aufnahme von Actelion im SMI und nun Bekanntgabe der Partnerschaft mit GSK für Almorexant..
Ich denke alle Anleger können mehr als zufrieden sein.

Beteiligung von 50 % am Almorexant Umsatz ist Spitze..
Was für eine Woche!
zuerst die Aufnahme von Actelion im SMI und nun Bekanntgabe der Partnerschaft mit GSK für Almorexant..
Ich denke alle Anleger können mehr als zufrieden sein.

Die Nachricht wäre eigentlich ein größeres Plus wert. Zeigt sie doch, dass ein Big Player der Pharma Branche nicht unerhebliches Vertrauen in das Potential von Almorexant hat. Gut auch, daß man mit Glaxo wirklich einen sehr starken Partner an Bord hat, der über entsprechende Vertriebskanäle verfügt.
Gruß, Dackelbert.
Gruß, Dackelbert.

Published: 07:00 04.08.2008 GMT+2 /HUGIN /Source: Actelion Pharmaceuticals Ltd /SWX: ATLN /ISIN: CH0010532478
Tracleer® (bosentan) receives EU approval for treatment of patients with mildly symptomatic Pulmonary Arterial Hypertension
ALLSCHWIL/BASEL, SWITZERLAND - 04 August 2008 - Actelion Ltd (SWX: ATLN) announced today that Tracleer® (bosentan), a dual endothelin receptor antagonist, has been approved in the European Union for the treatment of patients with mildly symptomatic pulmonary arterial hypertension (PAH WHO functional class FC II). Since 2002, Tracleer® has been approved and available in the European Union for PAH patients with WHO FC III.
Tracleer® is the first PAH treatment ever to be investigated in a clinical study that exclusively enrolled patients with mildly symptomatic WHO FC II. This 185-patient randomized, double-blind, placebo-controlled study provided the basis for this EU approval. The indication extension reads: "Some improvements have also been shown in patients with PAH WHO functional class II (see section 5.1)" 1
Jean-Paul Clozel, M.D. and Chief Executive Officer of Actelion, commented: "The EARLY study has demonstrated that even patients with mild symptoms are at risk of rapid deterioration. I am very proud that Actelion - together with the scientific community - has been able to demonstrate the important role of Tracleer® in delaying disease progression in these patients. Our dual endothelin receptor antagonist Tracleer® is the only PAH medicine to have demonstrated a delay in disease progression in three independent placebo-controlled, randomized clinical studies. Actelion will now communicate these important clinical findings to encourage early diagnosis and intervention."
The results from EARLY (Endothelin Antagonist tRial in miLdlY symptomatic PAH patients) published in "The Lancet" in June2, document the relentlessly progressive nature of PAH, even in its early stages, and highlight the need for earlier treatment and intervention in PAH management. The PAH progression was evident from the deterioration in all evaluated parameters in the placebo group, including the rate of clinical worsening events. The primary endpoints for the EARLY trial were changes in pulmonary vascular resistance (PVR) and exercise capacity as measured by a 6-minute walk test (6MWD). PAH progression was assessed by evaluating two secondary endpoints which were time to clinical worsening and change in WHO functional class.
The key results of the EARLY study were:
PVR improved significantly, with a reduction of 22.6 percent (p <0.0001) after six months of bosentan compared with placebo.
6MWD increased by a mean of 19 meters (p = 0.0758). Statistical significance was not seen in the 6MWD. However, this may reflect the fact that, on average, enrolled patients had a relatively well-preserved mean exercise capacity at baseline, which can be difficult to further improve.
A significant 77 percent risk reduction in time to clinical worsening (p = 0.011) was seen after six months of bosentan treatment compared with placebo. Time to clinical worsening was defined by symptomatic progression of PAH, hospitalization for PAH or death. Patients receiving bosentan had a lower incidence of worsening functional class (3.4 percent compared to 13.2 percent when receiving placebo,
p = 0.0285), providing further evidence of delayed PAH progression.
A subgroup of patients who received concomitant sildenafil showed improvements in PVR and 6MWD consistent with the overall results.
The safety and tolerability profile of bosentan in the EARLY study was consistent with that observed in previous placebo-controlled clinical trials.3,4
There are four WHO functional classes (FC) for PAH with class I being the least severe and class IV being the most advanced. These reflect the impact on a patient's life in terms of symptoms and physical activity. WHO FC II patients are defined as patients with PAH resulting in slight limitation of physical activity, they are comfortable at rest and ordinary physical activity causes undue dyspnea or fatigue, chest pain or near syncope.5 Despite being mildly symptomatic, these patients still suffer from a severe and rapidly progressive disease.
Regulatory proceedings to extend the label for bosentan to include PAH patients in WHO FC II are ongoing in the US and other territories worldwide.
###
About Pulmonary Arterial Hypertension (PAH)
PAH is a syndrome characterized by a progressive increase in pulmonary vascular resistance (PVR) leading to right ventricular failure and premature death.6 If untreated, PAH carries a very poor prognosis with a median survival of 2.8 years after diagnosis.7
There are four WHO functional classes for PAH with class I being the least severe and class IV being the most advanced. These reflect the impact on a patient's life in terms of symptoms and physical activity. Class II patients are defined as patients with pulmonary hypertension resulting in mild limitation of physical activity, they are comfortable at rest and ordinary physical activity causes undue dyspnea or fatigue, chest pain or near syncope.5
The pathogenesis of PAH involves the increased production of vasoactive compounds, such as endothelin. Endothelin is produced by the endothelial cells and is essential for maintenance of normal vascular tone and function. Tracleer® was the first in a new class of treatments for PAH known as endothelin receptor antagonists. Tracleer® is a dual antagonist as it blocks both ETA and ETB receptors preventing the deleterious effects of endothelin.
Online information on PAH is available at www.pah-info.com. PAH-info.com is part of an international PAH awareness campaign supported by Actelion Pharmaceuticals and has been created to provide information to healthcare professionals and patients.
About Tracleer® in Pulmonary Arterial Hypertension (PAH)
Tracleer® is an oral dual endothelin receptor antagonist, which is currently licensed for the treatment of PAH; in the United States in PAH Functional Class III and IV to improve exercise capacity and decrease the rate of clinical worsening and in Europe in PAH Functional Class III to improve exercise capacity and symptoms as well as PAH Functional Class II where some improvements have also been shown. In the EU, Tracleer® is also indicated to reduce the number of new digital ulcers in patients with systemic sclerosis and ongoing digital ulcer disease. Regulatory review for the inclusion of functional class II in the Tracleer® label is ongoing on a worldwide basis.
Tracleer® has been made commercially available by Actelion subsidiaries in the United States, the European Union, Japan, Australia, Canada, Switzerland and other markets worldwide since 2001. In these seven years of clinical experience, more than 50,000 patients have been treated with Tracleer®.
Other clinical studies with Tracleer® in specific patient populations
Actelion also conducted clinical trials to further describe the role of bosentan in treating PAH in specific patient populations, such as patients with congenital heart disease (with Eisenmenger syndrome; BREATHE-5) and patients infected with HIV (BREATHE-4). Study results are reflected in the Tracleer® product label. Clinical studies with bosentan in children suffering from PAH (BREATHE-3, FUTURE-1 and -2) have been conducted. A dedicated paediatric formulation with bosentan has been submitted to European Health Authority and is currently under assessment.
About Tracleer® in Digital Ulcers (DU)
DUs are a manifestation of the underlying vasculopathy which is central to the pathophysiology of systemic sclerosis (SSc) and pivotal in the development of PAH in SSc, one of the leading causes of death in SSc. Endothelin, a pathogenic mediator, is implicated in the underlying vasculopathy in SSc.
DUs can be a frequent, persistent and debilitating complication of SSc. They are caused by a reduction in the lumen of small bloody vessels that decreases blood flow to the fingers and toes causing open sores. DUs are painful, with a debilitating impact on patients' daily life, often making it impossible to work and undertake even simple day-to-day activities, particularly those associated with fingertip function. Reducing the occurrence of new DUs is an important and achievable treatment goal in SSc.
In the EU, Tracleer® is indicated to reduce the number of new digital ulcers in patients with systemic sclerosis and ongoing digital ulcer disease. Tracleer® has been shown to improve hand function (i.e. dressing and hygiene) in patients with scleroderma-induced digital ulcers.
Requires attention to two significant safety concerns: Potential for serious liver injury (including rare cases of liver failure and unexplained hepatic cirrhosis in a setting of close monitoring) - Liver monitoring of all patients is essential prior to initiation of treatment and monthly thereafter. High potential for major birth defects - pregnancy must be excluded and prevented by two forms of birth control; monthly pregnancy tests should be obtained. Because of these risks, Tracleer® is only supplied through a controlled distribution.
References
1. Tracleer® SPC
2. Galiè N, Rubin LJ, Hoeper MM et al. Treatment of patients with mildly symptomatic pulmonary arterial hypertension with bosentan (EARLY study): a double-blind, randomised controlled trial. Lancet 2008;371: 2093-2100.
3. Channick RN, Simonneau G, Sitbon O et al. Effects of the dual endothelin-receptor antagonist bosentan in patients with pulmonary hypertension: a randomised placebo-controlled study. Lancet 2001;358:1119-23 (Study 351).
4. Rubin LJ, Badesch DB, Barst RJ et al. Bosentan therapy for pulmonary arterial hypertension. NEJM 2002;346:896-903 (BREATHE-1).
5. Barst RJ, McGoon M, Torbicki A et al. Diagnosis and differential assessment of pulmonary arterial hypertension. J Am Coll Cardiol 2004;43 (Suppl S):40S-47S.
6. Sitbon O, Humbert M, Jais X et al. Long-term response to calcium channel blockers in idiopathic pulmonary arterial hypertension. Circulation 2005;111:3105-3111.
7. D'Alonzo GE, Barst RJ, Ayres SM et al. Survival in patients with primary pulmonary hypertension: Results from a national prospective registry. Ann Intern Med 1991;115:343-349.
Actelion Ltd
Actelion Ltd is a biopharmaceutical company with its corporate headquarters in Allschwil/Basel, Switzerland. Actelion's first drug Tracleer®, an orally available dual endothelin receptor antagonist, has been approved as a therapy for pulmonary arterial hypertension. Actelion markets Tracleer® through its own subsidiaries in key markets worldwide, including the United States (based in South San Francisco), the European Union, Japan, Canada, Australia and Switzerland. Actelion, founded in late 1997, is a leading player in innovative science related to the endothelium - the single layer of cells separating every blood vessel from the blood stream. Actelion's over 1700 employees focus on the discovery, development and marketing of innovative drugs for significant unmet medical needs. Actelion shares are traded on the SWX Swiss Exchange (ticker symbol: ATLN).
For further information please contact:
Medical Media Contact
Kris Matta-Noaman
Packer Forbes
+44 208 772 1551
kris@packerforbes.com
Investor Contact
Roland Haefeli
Vice President, Head of Investor Relations & Public Affairs
Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil
+41 61 565 62 62
+1 650 624 69 36
http://www.actelion.com

Antwort auf Beitrag Nr.: 34.643.041 von Fruehrentner am 04.08.08 15:05:57Actelion erhält EU-Zulassung für Tracleer für Funktionsklasse II bei PAH (AF)
04.08 12:20
(Meldung umgeschrieben und ergänzt um Details zu PAH und Analystenkommentaren)
Allschwil (AWP) - Die Actelion Ltd hat für das Medikament Tracleer (Bosentan) die Zulassung in der Europäischen Union für die Behandlung von Patienten mit milder symptomatischer pulmonaler arterieller Hypertonie (PAH) der WHO-Funktionsklasse II erhalten. Die Indikationserweiterung basiere auf einer randomisierten, plazebokontrollierten Doppelblindstudie mit 185 Patienten, teilte das Allschwiler Pharma-Unternehmen am Montag mit. Seit 2002 ist Tracleer in der EU für PAH-Patienten der entsprechenden Klasse III zugelassen.
Tracleer sei das erste Therapeutikum für PAH, das jemals in einer klinischen Studie untersucht worden sei, an der ausschliesslich Patienten mit milder symptomatischer PAH der WHO-Funktionsklasse II teilgenommen hätten, heisst es weiter. Die Studie habe den Beweis erbracht, dass Tracleer eine bedeutende Rolle bei der Verzögerung der Krankheitsprogression bei PAH-Patienten zukomme.
Das Verfahren zur Indikationserweiterung von Bosentan für die Einbeziehung von PAH-Patienten der WHO-Funktionsklasse II laufe derzeit bei den Registrierungsbehörden in den USA und in anderen Ländern weltweit, so Actelion weiter.
PAH ist ein Syndrom, das durch eine progressive Zunahme des Lungengefäss-Widerstands (PVR - pulmonary vascular resistance) gekennzeichnet ist und in der Folge zum Versagen der rechten Herzkammer und zu einem frühzeitigen Tod führt, wie es weiter heisst. Wenn PAH nicht behandelt wird, ist die Prognose mit einer durchschnittlichen Überlebensrate von 2,8 Jahren nach der Diagnosestellung sehr schlecht. PAH wird in vier WHO-Funktionsklassen eingeteilt, von denen mit Klasse I die leichteste Form und mit Klasse IV die am weitesten fortgeschrittene Krankheitsausprägung bezeichnet wird.
Analysten werten die Neuigkeit in ersten Kommentaren als positiv, aber nicht als überraschend. "Die EU-Zulassung war erwartet worden, da das CHMP Ende Juni eine positive Stellungnahme abgegeben hatte, aber die Zulassung erfolgt etwas schneller als wir gedacht hatten", schreiben etwa die Analysten der Bank Vontobel. Die Analysten gingen von einer EU-Zulassung im September 2008 aus. Auch für Helvea kam die Zulassung "ein bis zwei Monate" früher als erwartet.
"Dies ist äusserst erfreulich, da damit nun auch mildere Formen von Lungenhochdruck frühzeitig mit Tracleer behandelt werden können", heisst es in einem Kommentar der ZKB. Positiv wertet die Kantonalbank, dass damit die von Actelion geplante Indikationsausweitung von Tracleer vorankommt.
Für Helvea steht ausser Frage, dass die erweiterte Zulassung die Absatzmöglichkeiten von Tracleer in der EU erhöhe. Etwas konkreter wird Vontobel: "Mit dieser Zulassung erhält Actelion Zugang zu einem neuen Pool möglicher Patienten, die eine PAH-Behandlung benötigen, der Abnehmermarkt könnte sich möglicherweise verdoppeln."
Bezüglich der Marktakzeptanz von Tracleer gibt sich die Privatbank aber vorsichtig. Da das Finden von Patienten mit dieser Indikation eine hohe ärztliche Ausbildung erfordere, sei eine langsamen Marktdurchdringung zu erwarten.
Bei den Anlegern stösst die Neuigkeit am Montag auf offene Ohren. So avanciert der Titel bis gegen 11.15 um 1,7% auf 58,55 CHF; der Gesamtmarkt, gemessen am SPI, verliert derweil 0,49%. (Anmerkung Frührentner: Aktuell + 2,5 % an der schweizer Heimatbörse)
uh/ch/cf
(Quelle: AWP)
http://www.cash.ch/news/story/448/578091/40/40
04.08 12:20
(Meldung umgeschrieben und ergänzt um Details zu PAH und Analystenkommentaren)
Allschwil (AWP) - Die Actelion Ltd hat für das Medikament Tracleer (Bosentan) die Zulassung in der Europäischen Union für die Behandlung von Patienten mit milder symptomatischer pulmonaler arterieller Hypertonie (PAH) der WHO-Funktionsklasse II erhalten. Die Indikationserweiterung basiere auf einer randomisierten, plazebokontrollierten Doppelblindstudie mit 185 Patienten, teilte das Allschwiler Pharma-Unternehmen am Montag mit. Seit 2002 ist Tracleer in der EU für PAH-Patienten der entsprechenden Klasse III zugelassen.
Tracleer sei das erste Therapeutikum für PAH, das jemals in einer klinischen Studie untersucht worden sei, an der ausschliesslich Patienten mit milder symptomatischer PAH der WHO-Funktionsklasse II teilgenommen hätten, heisst es weiter. Die Studie habe den Beweis erbracht, dass Tracleer eine bedeutende Rolle bei der Verzögerung der Krankheitsprogression bei PAH-Patienten zukomme.
Das Verfahren zur Indikationserweiterung von Bosentan für die Einbeziehung von PAH-Patienten der WHO-Funktionsklasse II laufe derzeit bei den Registrierungsbehörden in den USA und in anderen Ländern weltweit, so Actelion weiter.
PAH ist ein Syndrom, das durch eine progressive Zunahme des Lungengefäss-Widerstands (PVR - pulmonary vascular resistance) gekennzeichnet ist und in der Folge zum Versagen der rechten Herzkammer und zu einem frühzeitigen Tod führt, wie es weiter heisst. Wenn PAH nicht behandelt wird, ist die Prognose mit einer durchschnittlichen Überlebensrate von 2,8 Jahren nach der Diagnosestellung sehr schlecht. PAH wird in vier WHO-Funktionsklassen eingeteilt, von denen mit Klasse I die leichteste Form und mit Klasse IV die am weitesten fortgeschrittene Krankheitsausprägung bezeichnet wird.
Analysten werten die Neuigkeit in ersten Kommentaren als positiv, aber nicht als überraschend. "Die EU-Zulassung war erwartet worden, da das CHMP Ende Juni eine positive Stellungnahme abgegeben hatte, aber die Zulassung erfolgt etwas schneller als wir gedacht hatten", schreiben etwa die Analysten der Bank Vontobel. Die Analysten gingen von einer EU-Zulassung im September 2008 aus. Auch für Helvea kam die Zulassung "ein bis zwei Monate" früher als erwartet.
"Dies ist äusserst erfreulich, da damit nun auch mildere Formen von Lungenhochdruck frühzeitig mit Tracleer behandelt werden können", heisst es in einem Kommentar der ZKB. Positiv wertet die Kantonalbank, dass damit die von Actelion geplante Indikationsausweitung von Tracleer vorankommt.
Für Helvea steht ausser Frage, dass die erweiterte Zulassung die Absatzmöglichkeiten von Tracleer in der EU erhöhe. Etwas konkreter wird Vontobel: "Mit dieser Zulassung erhält Actelion Zugang zu einem neuen Pool möglicher Patienten, die eine PAH-Behandlung benötigen, der Abnehmermarkt könnte sich möglicherweise verdoppeln."
Bezüglich der Marktakzeptanz von Tracleer gibt sich die Privatbank aber vorsichtig. Da das Finden von Patienten mit dieser Indikation eine hohe ärztliche Ausbildung erfordere, sei eine langsamen Marktdurchdringung zu erwarten.
Bei den Anlegern stösst die Neuigkeit am Montag auf offene Ohren. So avanciert der Titel bis gegen 11.15 um 1,7% auf 58,55 CHF; der Gesamtmarkt, gemessen am SPI, verliert derweil 0,49%. (Anmerkung Frührentner: Aktuell + 2,5 % an der schweizer Heimatbörse)
uh/ch/cf
(Quelle: AWP)
http://www.cash.ch/news/story/448/578091/40/40
die aktie steigt wieder ..in der schweiz(heimatmarkt)kann man sie am besten beobachten..
http://www.swissquote.ch/fcgi-bin/stockfquote?symbols=acteli…
http://www.swissquote.ch/fcgi-bin/stockfquote?symbols=acteli…
Still und heimlich - ohne news oder Gerüchte - schleicht sich Actelion an das alte Hoch heran.
Hoffentlich erklimmen wir bald wieder die 40 EUR Marke und arbeiten uns von da aus weiter hoch, um den langfristigen Aufwärtstrend wieder aufzunehmen.
Hoffentlich erklimmen wir bald wieder die 40 EUR Marke und arbeiten uns von da aus weiter hoch, um den langfristigen Aufwärtstrend wieder aufzunehmen.
Antwort auf Beitrag Nr.: 34.866.545 von Fruehrentner am 26.08.08 16:55:21Ich denke so langsam spiegeln sich die guten News (ALmorexant/GSK) der letzten wochen im Kurs wieder.
Ausserdem wirde Actelion am 19 Sept. in den Swiss Market Index aufgenommen und somit dann auch für Grossinvestoren Fonds und Pensionskassen interessant.
Zusätzlich werden ETFs dann auch noch dazukommen,
da sie ja den Index 1 zu 1 nachbilden und somit einsteigen "müssen".


Ausserdem wirde Actelion am 19 Sept. in den Swiss Market Index aufgenommen und somit dann auch für Grossinvestoren Fonds und Pensionskassen interessant.
Zusätzlich werden ETFs dann auch noch dazukommen,
da sie ja den Index 1 zu 1 nachbilden und somit einsteigen "müssen".



03.09.2008 14:04
Actelion Ltd.: outperform (Credit Suisse Group )
Zürich (aktiencheck.de AG) - R. Mehrotra, Analyst der Credit Suisse, stuft die Aktie des schweizerischen Unternehmens Actelion (ISIN CH0010532478 (News)/ WKN 936767) mit "outperform" ein.
Der Kapitalmarkt sei derzeit verständlicherweise auf den Einfluss des Gilead Sciences-Medikament "Letairis" auf die Umsätze von "Tracleer" fokussiert. Die Analysten der Credit Suisse hätten die verfügbaren IMS-Daten für "Tracleer" mit den Umsatzprognosen für "Tracleer" auf vierteljährlicher Basis verglichen. Die Untersuchung der Daten habe ergeben, dass eine Korrelation zwischen den Verschreibungstrends und den Umsätzen von Actelion bestehe.
Nach Ansicht der Credit Suisse-Analysten sei der Markt bereit, mehr für Biotech-Aktien zu zahlen, wenn das entsprechende Unternehmen eine vielversprechende Produkt-Pipeline besitze. Anders betrachtet werde mehr für die Produkt-Pipelines der Unternehmen bezahlt, wenn sich das Top-Produkt des Unternehmens gut entwickle. Im Fall von Actelion habe eine gute Entwicklung von "Tracleer" eine tendenziell gute Nachrichtenlage für die Produkt-Pipeline bewirkt. Insgesamt könne ein negatives Sentiment gegenüber "Tracleer" oder der Pipeline einen übersensiblen negativen Effekt auf den Aktienkurs ausüben. Das Kursziel der Actelion-Aktie sehe man bei 67,00 CHF.
Actelion Ltd.: outperform (Credit Suisse Group )
Zürich (aktiencheck.de AG) - R. Mehrotra, Analyst der Credit Suisse, stuft die Aktie des schweizerischen Unternehmens Actelion (ISIN CH0010532478 (News)/ WKN 936767) mit "outperform" ein.
Der Kapitalmarkt sei derzeit verständlicherweise auf den Einfluss des Gilead Sciences-Medikament "Letairis" auf die Umsätze von "Tracleer" fokussiert. Die Analysten der Credit Suisse hätten die verfügbaren IMS-Daten für "Tracleer" mit den Umsatzprognosen für "Tracleer" auf vierteljährlicher Basis verglichen. Die Untersuchung der Daten habe ergeben, dass eine Korrelation zwischen den Verschreibungstrends und den Umsätzen von Actelion bestehe.
Nach Ansicht der Credit Suisse-Analysten sei der Markt bereit, mehr für Biotech-Aktien zu zahlen, wenn das entsprechende Unternehmen eine vielversprechende Produkt-Pipeline besitze. Anders betrachtet werde mehr für die Produkt-Pipelines der Unternehmen bezahlt, wenn sich das Top-Produkt des Unternehmens gut entwickle. Im Fall von Actelion habe eine gute Entwicklung von "Tracleer" eine tendenziell gute Nachrichtenlage für die Produkt-Pipeline bewirkt. Insgesamt könne ein negatives Sentiment gegenüber "Tracleer" oder der Pipeline einen übersensiblen negativen Effekt auf den Aktienkurs ausüben. Das Kursziel der Actelion-Aktie sehe man bei 67,00 CHF.
04.09.2008 09:59:31
Actelion dabeibleiben
München (aktiencheck.de AG) - Die Experten von "FOCUS-MONEY" empfehlen, bei der Actelion-Aktie (ISIN CH0010532478/ WKN 936767) dabeizubleiben. Die Empfehlung der Experten, bei dem unter die Räder gekommenen Pharmahersteller zuzugreifen, habe sich ausgezahlt. Auf CHF-Basis habe der Wert zuletzt den charttechnischen Widerstand überwunden und bewege sich nun geradlinig aufwärts. Anleger, die engagiert sind, sollen bei der Actelion-Aktie dabeibleiben und den Stopp auf 34,70 Euro nachziehen, empfehlen die Experten von "FOCUS-MONEY". (Ausgabe 37) (04.09.2008/ac/a/a)
Quelle: AKTIENCHECK.DE
Actelion dabeibleiben
München (aktiencheck.de AG) - Die Experten von "FOCUS-MONEY" empfehlen, bei der Actelion-Aktie (ISIN CH0010532478/ WKN 936767) dabeizubleiben. Die Empfehlung der Experten, bei dem unter die Räder gekommenen Pharmahersteller zuzugreifen, habe sich ausgezahlt. Auf CHF-Basis habe der Wert zuletzt den charttechnischen Widerstand überwunden und bewege sich nun geradlinig aufwärts. Anleger, die engagiert sind, sollen bei der Actelion-Aktie dabeibleiben und den Stopp auf 34,70 Euro nachziehen, empfehlen die Experten von "FOCUS-MONEY". (Ausgabe 37) (04.09.2008/ac/a/a)
Quelle: AKTIENCHECK.DE
Auf CHF-Basis habe der Wert zuletzt den charttechnischen Widerstand überwunden
hoffentlich dient der Wiederstand nun als Unterstützung!
hoffentlich dient der Wiederstand nun als Unterstützung!
Published: 07:00 22.09.2008 GMT+2 /HUGIN /Source: Actelion Pharmaceuticals Ltd /SWX: ATLN /ISIN: CH0010532478
Actelion included in the Swiss Market Index SMI
ALLSCHWIL/Basel, SWITZERLAND - 22 September 2008 - Actelion Ltd (SWX: ATLN) announced that, as of today, Monday 22 September 2008, its shares (ATLN, CH001053247) will start trading as part of the Swiss Market Index SMI®, the Swiss blue-chip index.
Jean-Paul Clozel, M.D. and Chief Executive Officer commented: "In just eight years following Actelion's initial listing on the Swiss Stock Exchange, our ability to create growth and subsequent long-term shareholder value has been recognized by today's inclusion of our shares in the SMI®. We are proud to be part of a stock market index, which includes some of the best companies in the world. For Actelion, this inclusion is a milestone in our short history and an inspiration to continue the discovery, development and marketing of innovative medicines that have the potential to change patients' lives."
As a blue-chip index, the SMI® is Switzerland's key equity index. It represents about 85% of the free-float capitalization of the Swiss equity market. The index comprises the 20 largest and most liquid equities of the SPI® (Swiss Performance Index®). Since the SMI® is considered to be a mirror of the overall Swiss stock market, it is used as the underlying index for numerous derivative financial instruments such as options, futures and index funds (e.g. ETFs). The composition of the index is examined - and - if appropriate - updated once a year. More details about the SMI® index are available on the SWX Swiss Exchange website at www.swx.com
Upcoming Corporate Events:
Tuesday 21 October, 2008 9-months 2008 results:
-Update on development pipeline (webcast only)
Thursday February 19, 2009 Actelion Day, Allschwil / Switzerland:
-Full Year 2008 results
-Research & Development presentations
-Tour of Actelion's Research facilities
The Sleep 101 educational event has been moved to 2009.
Actelion included in the Swiss Market Index SMI
ALLSCHWIL/Basel, SWITZERLAND - 22 September 2008 - Actelion Ltd (SWX: ATLN) announced that, as of today, Monday 22 September 2008, its shares (ATLN, CH001053247) will start trading as part of the Swiss Market Index SMI®, the Swiss blue-chip index.
Jean-Paul Clozel, M.D. and Chief Executive Officer commented: "In just eight years following Actelion's initial listing on the Swiss Stock Exchange, our ability to create growth and subsequent long-term shareholder value has been recognized by today's inclusion of our shares in the SMI®. We are proud to be part of a stock market index, which includes some of the best companies in the world. For Actelion, this inclusion is a milestone in our short history and an inspiration to continue the discovery, development and marketing of innovative medicines that have the potential to change patients' lives."
As a blue-chip index, the SMI® is Switzerland's key equity index. It represents about 85% of the free-float capitalization of the Swiss equity market. The index comprises the 20 largest and most liquid equities of the SPI® (Swiss Performance Index®). Since the SMI® is considered to be a mirror of the overall Swiss stock market, it is used as the underlying index for numerous derivative financial instruments such as options, futures and index funds (e.g. ETFs). The composition of the index is examined - and - if appropriate - updated once a year. More details about the SMI® index are available on the SWX Swiss Exchange website at www.swx.com
Upcoming Corporate Events:
Tuesday 21 October, 2008 9-months 2008 results:
-Update on development pipeline (webcast only)
Thursday February 19, 2009 Actelion Day, Allschwil / Switzerland:
-Full Year 2008 results
-Research & Development presentations
-Tour of Actelion's Research facilities
The Sleep 101 educational event has been moved to 2009.
Published: 17:35 17.10.2008 GMT+2 /HUGIN /Source: Actelion Pharmaceuticals Ltd /SWX: ATLN /ISIN: CH0010532478
Actelion to discuss financial 9 month Results 2008 with Development pipeline update
Actelion senior management to host Q & A session.
Dear Member of the Investment Community
Actelion Ltd will announce the financial 9 month Results 2008 on Tuesday, 21 October 2008, at 07.00 hrs CEST / 06.00 hrs BST / 01.00 a.m. EDT. An investor conference call & webcast will be held at 15.30 hrs, CEST to discuss the results. In addition, the company will provide an update of Actelion's development pipeline.
To discuss the results, Actelion will host an Investor Conference Call / Webcast as follows:
Date/Time:
21 October 2008
15.30 hrs - 16.45 hrs
Basel (CEST)
14.30 hrs - 15.45 hrs
U.K. (BST)
09.30 a.m. - 10.45 a.m.
U.S. (EDT)
Conference Call Connect #:
Dial-in participants should start calling the number below 10-15 minutes
before the Conference is due to start.
Dial:
Europe:
+41 44 580 64 03
U.K.:
+44 203 14 74 753
U.S.:
+1 866 92 86 044
Participant's mode:
Listen-Only with possibility to open individual lines during Q&A session.
Participants will be asked for their Name and Company.
Webcast Access:
Webcast participants should visit the Actelion website for further details http://www.actelion.com/
10-15 minutes before the conference is due to start. If you experience any access problems go directly to the URL: http://gaia.world-television.com/actelion/20081021/trunc
Participant's mode:
Listen-Only with possibility to ask individual questions by clicking on the Q&A button.
Participants will be asked to provide their Name and Company.
Webcast Replay:
The archived Investor Webcast will be available for replay through http://www.actelion.com/
approximately 60 minutes after the call has ended.
Actelion to discuss financial 9 month Results 2008 with Development pipeline update
Actelion senior management to host Q & A session.
Dear Member of the Investment Community
Actelion Ltd will announce the financial 9 month Results 2008 on Tuesday, 21 October 2008, at 07.00 hrs CEST / 06.00 hrs BST / 01.00 a.m. EDT. An investor conference call & webcast will be held at 15.30 hrs, CEST to discuss the results. In addition, the company will provide an update of Actelion's development pipeline.
To discuss the results, Actelion will host an Investor Conference Call / Webcast as follows:
Date/Time:
21 October 2008
15.30 hrs - 16.45 hrs
Basel (CEST)
14.30 hrs - 15.45 hrs
U.K. (BST)
09.30 a.m. - 10.45 a.m.
U.S. (EDT)
Conference Call Connect #:
Dial-in participants should start calling the number below 10-15 minutes
before the Conference is due to start.
Dial:
Europe:
+41 44 580 64 03
U.K.:
+44 203 14 74 753
U.S.:
+1 866 92 86 044
Participant's mode:
Listen-Only with possibility to open individual lines during Q&A session.
Participants will be asked for their Name and Company.
Webcast Access:
Webcast participants should visit the Actelion website for further details http://www.actelion.com/
10-15 minutes before the conference is due to start. If you experience any access problems go directly to the URL: http://gaia.world-television.com/actelion/20081021/trunc
Participant's mode:
Listen-Only with possibility to ask individual questions by clicking on the Q&A button.
Participants will be asked to provide their Name and Company.
Webcast Replay:
The archived Investor Webcast will be available for replay through http://www.actelion.com/
approximately 60 minutes after the call has ended.
Antwort auf Beitrag Nr.: 35.638.971 von borsalin am 21.10.08 08:48:51auf news klicken
umsatz und gewinnsprung!
umsatz und gewinnsprung!
Actelion mit markantem Umsatz- und Gewinnsprung
21.10 11:38
Das Biotechunternehmen Actelion ist weiter auf Wachstumskurs: Der europäische Marktführer steigerte den Umsatz in den ersten neun Monaten 2008 um 13 Prozent auf 1,07 Mrd. Franken. Der Gewinn verfielfachte sich auf 238,9 Mio. Franken.
In der Vorjahresperiode waren es nur 36,1 Mio. Fr. gewesen, dies nach einer Übernahme in den USA für 225 Mio. Franken. Der Umsatz wuchs in Lokalwährungen um 21 Prozent, wie das Baselbieter Unternehmen weiter mitteilte.
Mit dem zentralen Produkt Tracleer, einem Medikament gegen Pulmonale Hypertonie (Bluthochdruck im Lungenkreislauf), verzeichnete die Firma in Lokalwährungen ebenfalls 21 Prozent mehr Umsatz, nämlich 945,8 Mio. Franken. Auch andere Produkte legten zu. Mehrere Stoffe sind zudem in Phase-III-Studien und könnten bei guten Ergebnissen bald das Portfolio ergänzen.
Konzernchef Jean-Paul Clozel lässt sich optimistisch zitieren: Er gehe von "weiterhin profitablem Wachstum" aus. Er begründet die Zuversicht mit der vollen Pipeline und starken Partnern wie Merck, Roche und GSK.
Finanzchef Andrew Oakley rechnet für das Gesamtjahr 2008 mit 16 bis 19 Prozent mehr Nettoumsatz im Lokalwährungen. Actelion hatte die eigenen Erwartungen heuer schon einmal angehoben, auf 15 Prozent.
In den ersten neun Monaten des Jahres 2008 habe Actelion mit seinen Leistungen wiederum seine eigenen Erwartungen übertroffen, wird Clozel zitiert. Dies gilt auch für die Erwartungen der Analysten auf allen Ebenen. Nach der Zahlen-Publikation stieg der seit Ende September im SMI gehandelte Actelion-Titel am Morgen um 5,8 Prozent.
21.10 11:38
Das Biotechunternehmen Actelion ist weiter auf Wachstumskurs: Der europäische Marktführer steigerte den Umsatz in den ersten neun Monaten 2008 um 13 Prozent auf 1,07 Mrd. Franken. Der Gewinn verfielfachte sich auf 238,9 Mio. Franken.
In der Vorjahresperiode waren es nur 36,1 Mio. Fr. gewesen, dies nach einer Übernahme in den USA für 225 Mio. Franken. Der Umsatz wuchs in Lokalwährungen um 21 Prozent, wie das Baselbieter Unternehmen weiter mitteilte.
Mit dem zentralen Produkt Tracleer, einem Medikament gegen Pulmonale Hypertonie (Bluthochdruck im Lungenkreislauf), verzeichnete die Firma in Lokalwährungen ebenfalls 21 Prozent mehr Umsatz, nämlich 945,8 Mio. Franken. Auch andere Produkte legten zu. Mehrere Stoffe sind zudem in Phase-III-Studien und könnten bei guten Ergebnissen bald das Portfolio ergänzen.
Konzernchef Jean-Paul Clozel lässt sich optimistisch zitieren: Er gehe von "weiterhin profitablem Wachstum" aus. Er begründet die Zuversicht mit der vollen Pipeline und starken Partnern wie Merck, Roche und GSK.
Finanzchef Andrew Oakley rechnet für das Gesamtjahr 2008 mit 16 bis 19 Prozent mehr Nettoumsatz im Lokalwährungen. Actelion hatte die eigenen Erwartungen heuer schon einmal angehoben, auf 15 Prozent.
In den ersten neun Monaten des Jahres 2008 habe Actelion mit seinen Leistungen wiederum seine eigenen Erwartungen übertroffen, wird Clozel zitiert. Dies gilt auch für die Erwartungen der Analysten auf allen Ebenen. Nach der Zahlen-Publikation stieg der seit Ende September im SMI gehandelte Actelion-Titel am Morgen um 5,8 Prozent.
Antwort auf Beitrag Nr.: 35.641.637 von Matze900 am 21.10.08 14:01:23Offenbar der Fels in der Brandung 

21.10.2008 10:18:12
Actelion "under review"
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, setzt die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" "under review". Actelion habe Ergebnisse für das 3. Quartal 2008 bekannt gegeben, die weit über der Prognose der Analysten gelegen hätten. Die Umsätze hätten CHF 393 Mio. eingebracht (VontE: CHF 387,7 Mio., Konsenserwartungen: CHF 371 Mio.), angetrieben von starken Umsätzen bei Tracleer CHF 340 Mio. (VontE: CHF 333 Mio., Konsenserwartungen: CHF 325 Mio.). Barmittel-EBIT hätten, über die Prognose der Analysten hinaus, CHF 164,9 Mio. (VontE: CHF 128,9 Mio.) eingebracht. Die Prognose sei angehoben worden. Actelion habe heute Morgen starke Ergebnisse mit einem unerwartet hohen Umsatz bei Tracleer bekannt gegeben. Tracleer habe CHF 340 Mio. eingebracht (VontE: CHF 333 Mio., Konsenserwartungen: CHF 325 Mio.). Es scheine, als sollten sich die Befürchtungen im Hinblick auf die Konkurrenz durch Gilead und GSK vorläufig nicht bewahrheiten.
Die am vergangenen Donnerstag veröffentlichten Umsatzzahlen von Gilead hätten den Erwartungen der Analysten entsprochen. Die Rentabilität von Actelion sei deutlich höher als erwartet gewesen, was auf niedrigere F&E-Aufwendungen zurückzuführen sei. Die Zugewinne aus dem höheren Umsatz und dem gesunkenen Betriebsaufwand hätten sich in entsprechendem Umfang auch im Reingewinn niedergeschlagen. Die Pipeline scheine immer noch gut gefüllt: Alle großen Phase-III Projekte - ATLN-1, Almorexant, Bosentan (IPF), Clazosentan (aSAH) - würden sich nach Plan entwickeln. Für die drei Letztgenannten dürften im 2. Halbjahr 2009 die Ergebnisse vorliegen. Actelion erhöhe seine Finanzprognose. Für das Geschäftsjahr 2008 werde nun mit einem Wachstum in Lokalwährung von 16 bis 19% gerechnet. Dies würde bedeuten, dass Wettbewerber in Europa und den USA weiterhin nur begrenzt Marktzugang finden würden. Die Wachstumsprognose für den Cash-EBIT in Lokalwährung werde auf 12 bis 14% heraufgesetzt (bisher 10%). Aufgrund dieser herausragenden Ergebnisse für das 3. Quartal 2008 würden die Analysten ihre Umsatzprognose und vermutlich auch ihre Renditeerwartungen für Actelion anheben müssen. Die Analysten von Vontobel Research unterziehen ihr "hold"-Rating und ihr Kursziel für die Actelion-Aktie einer neuen Bewertung. (Analyse vom 21.10.2008) (21.10.2008/ac/a/a)
Quelle: AKTIENCHECK.DE
Actelion "under review"
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, setzt die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" "under review". Actelion habe Ergebnisse für das 3. Quartal 2008 bekannt gegeben, die weit über der Prognose der Analysten gelegen hätten. Die Umsätze hätten CHF 393 Mio. eingebracht (VontE: CHF 387,7 Mio., Konsenserwartungen: CHF 371 Mio.), angetrieben von starken Umsätzen bei Tracleer CHF 340 Mio. (VontE: CHF 333 Mio., Konsenserwartungen: CHF 325 Mio.). Barmittel-EBIT hätten, über die Prognose der Analysten hinaus, CHF 164,9 Mio. (VontE: CHF 128,9 Mio.) eingebracht. Die Prognose sei angehoben worden. Actelion habe heute Morgen starke Ergebnisse mit einem unerwartet hohen Umsatz bei Tracleer bekannt gegeben. Tracleer habe CHF 340 Mio. eingebracht (VontE: CHF 333 Mio., Konsenserwartungen: CHF 325 Mio.). Es scheine, als sollten sich die Befürchtungen im Hinblick auf die Konkurrenz durch Gilead und GSK vorläufig nicht bewahrheiten.
Die am vergangenen Donnerstag veröffentlichten Umsatzzahlen von Gilead hätten den Erwartungen der Analysten entsprochen. Die Rentabilität von Actelion sei deutlich höher als erwartet gewesen, was auf niedrigere F&E-Aufwendungen zurückzuführen sei. Die Zugewinne aus dem höheren Umsatz und dem gesunkenen Betriebsaufwand hätten sich in entsprechendem Umfang auch im Reingewinn niedergeschlagen. Die Pipeline scheine immer noch gut gefüllt: Alle großen Phase-III Projekte - ATLN-1, Almorexant, Bosentan (IPF), Clazosentan (aSAH) - würden sich nach Plan entwickeln. Für die drei Letztgenannten dürften im 2. Halbjahr 2009 die Ergebnisse vorliegen. Actelion erhöhe seine Finanzprognose. Für das Geschäftsjahr 2008 werde nun mit einem Wachstum in Lokalwährung von 16 bis 19% gerechnet. Dies würde bedeuten, dass Wettbewerber in Europa und den USA weiterhin nur begrenzt Marktzugang finden würden. Die Wachstumsprognose für den Cash-EBIT in Lokalwährung werde auf 12 bis 14% heraufgesetzt (bisher 10%). Aufgrund dieser herausragenden Ergebnisse für das 3. Quartal 2008 würden die Analysten ihre Umsatzprognose und vermutlich auch ihre Renditeerwartungen für Actelion anheben müssen. Die Analysten von Vontobel Research unterziehen ihr "hold"-Rating und ihr Kursziel für die Actelion-Aktie einer neuen Bewertung. (Analyse vom 21.10.2008) (21.10.2008/ac/a/a)
Quelle: AKTIENCHECK.DE
07.11.2008 10:19:04
Actelion kaufen
Berlin (aktiencheck.de AG) - Die Experten von "Fuchsbiefe" empfehlen, die Aktien von Actelion (ISIN CH0010532478/ WKN 936767) zu kaufen. Das biopharmazeutische Unternehmen gehöre zu den Shootingstars der Branche. Die Gesellschaft habe sich auf die Behandlung von Gefäßerkrankungen spezialisiert. Hauptumsatzträger sei das Medikament Tacleer, das für knapp 90% des Geschäftsvolumens stehe. Das Unternehmen arbeite profitabel und verfüge über einen positiven Cashflow. Die Gesellschaft entwickle insgesamt neun weitere Medikamente. Der größte Hoffnungsträger in der Pipeline sei derzeit das Mittel gegen Schlaflosigkeit Almorexant, dass sich in Phase drei der klinischen Tests befinde.
In den ersten neun Monaten 2008 habe der Konzern den Umsatz um 13% gesteigert. Der Gewinn je Aktie habe sich gleichzeitig mehr als verfünffacht. Das KGV 2009e liege bei 16. Am 22. September habe die Aktie den Aufstieg in den Schweizer Standardwerteindex geschafft. Die Experten von "Fuchsbriefe" empfehlen, die Aktien von Actelion zu kaufen. Das Kursziel sehe man bei 74 CHF und ein Stoppkurs sollte bei 47,75 CHF gesetzt werden. (Ausgabe 45 vom 06.11.2008) (07.11.2008/ac/a/a)
Quelle: AKTIENCHECK.DE
Actelion kaufen
Berlin (aktiencheck.de AG) - Die Experten von "Fuchsbiefe" empfehlen, die Aktien von Actelion (ISIN CH0010532478/ WKN 936767) zu kaufen. Das biopharmazeutische Unternehmen gehöre zu den Shootingstars der Branche. Die Gesellschaft habe sich auf die Behandlung von Gefäßerkrankungen spezialisiert. Hauptumsatzträger sei das Medikament Tacleer, das für knapp 90% des Geschäftsvolumens stehe. Das Unternehmen arbeite profitabel und verfüge über einen positiven Cashflow. Die Gesellschaft entwickle insgesamt neun weitere Medikamente. Der größte Hoffnungsträger in der Pipeline sei derzeit das Mittel gegen Schlaflosigkeit Almorexant, dass sich in Phase drei der klinischen Tests befinde.
In den ersten neun Monaten 2008 habe der Konzern den Umsatz um 13% gesteigert. Der Gewinn je Aktie habe sich gleichzeitig mehr als verfünffacht. Das KGV 2009e liege bei 16. Am 22. September habe die Aktie den Aufstieg in den Schweizer Standardwerteindex geschafft. Die Experten von "Fuchsbriefe" empfehlen, die Aktien von Actelion zu kaufen. Das Kursziel sehe man bei 74 CHF und ein Stoppkurs sollte bei 47,75 CHF gesetzt werden. (Ausgabe 45 vom 06.11.2008) (07.11.2008/ac/a/a)
Quelle: AKTIENCHECK.DE
Published: 07:00 13.11.2008 GMT+1 /HUGIN /Source: Actelion
Pharmaceuticals Ltd /SWX: ATLN /ISIN: CH0010532478
Actelion's first-in-class selective S1P1 receptor agonist to enter Phase II clinical development
ALLSCHWIL, SWITZERLAND - 13 November 2008 - Actelion Ltd (SWX: ATLN) announced that Actelion and Roche have jointly agreed that preclinical and clinical data support progressing Actelion's S1P1 receptor agonist into Phase II clinical development. An update will be presented at Actelion Day 2009, an event held at Actelion's headquarters in Allschwil on 19 February 2009. This event will be a combination of Actelion's annual Media and Analyst Conference and its Research and Development Day.
The science behind selective S1P1 receptor agonists
Sphingosine-1-phosphate (S1P) is a phospholipid released by platelets, mast and other cells. It is currently established [1,2] that S1P stimulates at least five different G-protein coupled receptors (GPCRs): S1P1,2,3,4, and 5. Activation of these GPCRs mediates a complex variety of biological responses, such as lymphocyte migration, endothelial cell proliferation, blood vessel constriction, heart rate modulation and others.
Actelion's efforts in the field of selective S1P1 receptor agonists started in 1999 by focusing on receptors found on the endothelium, the inner lining of blood vessels. The result of these research efforts is Actelion's orally active selective S1P1 receptor agonist.
About autoimmune disorders
Autoimmune disorders are diseases caused by the body producing an immune response against its own tissues. The cause of autoimmune disorders is unknown. Some of the most common types of autoimmune disorders include psoriasis, rheumatoid arthritis, multiple sclerosis, inflammatory bowel disease and rejection of transplanted organs. These disorders affect millions of people worldwide.
Actelion/Roche Alliance
Actelion and Roche entered into an exclusive worldwide collaboration in July 2006 to jointly develop and commercialize Actelion's selective S1P1 receptor agonist, an immunomodulator with the potential for once-a-day oral dosing. The two companies plan to jointly develop and commercialize this novel compound for multiple autoimmune disorders. For the current selective S1P1 receptor agonist, Actelion will fully fund all development activities up to the end of phase II for the first two indications. All subsequent development and commercialization costs will be shared equally between Roche and Actelion. Both companies will co-promote any product resulting from this collaboration and will equally share profit.
Actelion Ltd
Actelion Ltd is a biopharmaceutical company with its corporate headquarters in Allschwil/Basel, Switzerland. Actelion's first drug Tracleer®, an orally available dual endothelin receptor antagonist, has been approved as a therapy for pulmonary arterial hypertension. Actelion markets Tracleer® through its own subsidiaries in key markets worldwide, including the United States (based in South San Francisco), the European Union, Japan, Canada, Australia and Switzerland. Actelion, founded in late 1997, is a leading player in innovative science related to the endothelium - the single layer of cells separating every blood vessel from the blood stream. Actelion's over 1800 employees focus on the discovery, development and marketing of innovative drugs for significant unmet medical needs. Actelion shares are traded on the SIX Swiss Exchange (ticker symbol: ATLN).
References
1. Huwiler A, Pfeilschifter J. Biochem Pharmacol. 2008 May 15;75(10):1893-900. Review.
2. Rivera J, Proia RL, Olivera A.Nat Rev Immunol. 2008 Oct;8(10):753-63. Review.
For further information please contact:
Roland Haefeli
Vice President, Head of Investor Relations & Public Affairs
Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil
+41 61 565 62 62
+1 650 624 69 36
http://www.actelion.com
Pharmaceuticals Ltd /SWX: ATLN /ISIN: CH0010532478
Actelion's first-in-class selective S1P1 receptor agonist to enter Phase II clinical development
ALLSCHWIL, SWITZERLAND - 13 November 2008 - Actelion Ltd (SWX: ATLN) announced that Actelion and Roche have jointly agreed that preclinical and clinical data support progressing Actelion's S1P1 receptor agonist into Phase II clinical development. An update will be presented at Actelion Day 2009, an event held at Actelion's headquarters in Allschwil on 19 February 2009. This event will be a combination of Actelion's annual Media and Analyst Conference and its Research and Development Day.
The science behind selective S1P1 receptor agonists
Sphingosine-1-phosphate (S1P) is a phospholipid released by platelets, mast and other cells. It is currently established [1,2] that S1P stimulates at least five different G-protein coupled receptors (GPCRs): S1P1,2,3,4, and 5. Activation of these GPCRs mediates a complex variety of biological responses, such as lymphocyte migration, endothelial cell proliferation, blood vessel constriction, heart rate modulation and others.
Actelion's efforts in the field of selective S1P1 receptor agonists started in 1999 by focusing on receptors found on the endothelium, the inner lining of blood vessels. The result of these research efforts is Actelion's orally active selective S1P1 receptor agonist.
About autoimmune disorders
Autoimmune disorders are diseases caused by the body producing an immune response against its own tissues. The cause of autoimmune disorders is unknown. Some of the most common types of autoimmune disorders include psoriasis, rheumatoid arthritis, multiple sclerosis, inflammatory bowel disease and rejection of transplanted organs. These disorders affect millions of people worldwide.
Actelion/Roche Alliance
Actelion and Roche entered into an exclusive worldwide collaboration in July 2006 to jointly develop and commercialize Actelion's selective S1P1 receptor agonist, an immunomodulator with the potential for once-a-day oral dosing. The two companies plan to jointly develop and commercialize this novel compound for multiple autoimmune disorders. For the current selective S1P1 receptor agonist, Actelion will fully fund all development activities up to the end of phase II for the first two indications. All subsequent development and commercialization costs will be shared equally between Roche and Actelion. Both companies will co-promote any product resulting from this collaboration and will equally share profit.
Actelion Ltd
Actelion Ltd is a biopharmaceutical company with its corporate headquarters in Allschwil/Basel, Switzerland. Actelion's first drug Tracleer®, an orally available dual endothelin receptor antagonist, has been approved as a therapy for pulmonary arterial hypertension. Actelion markets Tracleer® through its own subsidiaries in key markets worldwide, including the United States (based in South San Francisco), the European Union, Japan, Canada, Australia and Switzerland. Actelion, founded in late 1997, is a leading player in innovative science related to the endothelium - the single layer of cells separating every blood vessel from the blood stream. Actelion's over 1800 employees focus on the discovery, development and marketing of innovative drugs for significant unmet medical needs. Actelion shares are traded on the SIX Swiss Exchange (ticker symbol: ATLN).
References
1. Huwiler A, Pfeilschifter J. Biochem Pharmacol. 2008 May 15;75(10):1893-900. Review.
2. Rivera J, Proia RL, Olivera A.Nat Rev Immunol. 2008 Oct;8(10):753-63. Review.
For further information please contact:
Roland Haefeli
Vice President, Head of Investor Relations & Public Affairs
Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil
+41 61 565 62 62
+1 650 624 69 36
http://www.actelion.com
Geschäftlich ist das Pharmaunternehmen Actelion auf Kurs, sagt CEO Jean-Paul Clozel im Interview mit cash. Der Ausbau in Allschwil kommt gut voran.
Damit das Wachstum gewährleistet werden kann, baut Actelion in Allschwil fortlaufend aus: "Wir rekrutieren gegenwärtig mehr als 20 neue Mitarbeiter pro Monat", sagt Clozel im Interview. "Das Tempo wollen wir noch etwas beibehalten".
Das Wachstum ist auch den Anlegern nicht entgangen. Actelion ist in diesem Jahr (hochgerechnet) mit einem Zuwachs von 15 Prozent die mit Abstand beste Aktie des Swiss Markt Index (SMI). Actelion ist seit Anfang Oktober im SMI vertreten.
Für Clozel ist klar, dass das Wachstum vorderhand organisch erfolgen und auf Akquisitionen verzichtet werden soll: "Wir haben derzeit keine Kaufobjekte im Auge und halten lieber Cash, um im schwierigen Marktumfeld finanziell flexibel zu bleiben", sagt Clozel.
Actelion will sich selber nicht in die Arme einer Firma werfen: "Derzeit ist es für Actelion das beste, weiter unabhängig zu bleiben. Das gilt auch auf lange Sicht", so Clozel zu cash.
Damit das Wachstum gewährleistet werden kann, baut Actelion in Allschwil fortlaufend aus: "Wir rekrutieren gegenwärtig mehr als 20 neue Mitarbeiter pro Monat", sagt Clozel im Interview. "Das Tempo wollen wir noch etwas beibehalten".
Das Wachstum ist auch den Anlegern nicht entgangen. Actelion ist in diesem Jahr (hochgerechnet) mit einem Zuwachs von 15 Prozent die mit Abstand beste Aktie des Swiss Markt Index (SMI). Actelion ist seit Anfang Oktober im SMI vertreten.
Für Clozel ist klar, dass das Wachstum vorderhand organisch erfolgen und auf Akquisitionen verzichtet werden soll: "Wir haben derzeit keine Kaufobjekte im Auge und halten lieber Cash, um im schwierigen Marktumfeld finanziell flexibel zu bleiben", sagt Clozel.
Actelion will sich selber nicht in die Arme einer Firma werfen: "Derzeit ist es für Actelion das beste, weiter unabhängig zu bleiben. Das gilt auch auf lange Sicht", so Clozel zu cash.
05.12.2008 09:18:06
Actelion Stopp bei 48,50 EUR setzen
München (aktiencheck.de AG) - Die Experten von "FOCUS-MONEY" raten, bei der Actelion-Aktie (ISIN CH0010532478/ WKN 936767) einen Stoppkurs bei 48,50 EUR zu setzen.
Das Schlafmittel Almorexant des Schweizer Biotech-Unternehmens könnte den Schlafmittelmarkt revolutionieren. Anstatt wie bisherige Schlafmittel eine Art Anästhesie auszulösen, beeinflusse Almorexant den Schlaf nur selektiv. Auch seien sonst übliche Nebenwirkungen wie Abhängigkeit und Toleranzentwicklung derzeit nicht bekannt. Die Wahrscheinlichkeit einer Markteinführung des potenziellen Blockbusters würden Analysten auf 40 bis 80% schätzen.
Der Aktienkurs notiere an der Spitze eines symmetrischen Dreiecks. Ein Kaufsignal ergebe sich erst, wenn er nach oben oder nach unten ausbreche. Sollte ein Ausbruch nach oben durch einen Umsatzschub begleitet werden, steige die Wahrscheinlichkeit eines längeren positiven Trends.
Nach Meinung der Experten von "FOCUS-MONEY" sollten Anleger bei der Aktie von Actelion einen Stoppkurs bei 48,50 EUR setzen. (Ausgabe 50) (05.12.2008/ac/a/a)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
Quelle: AKTIENCHECK.DE
Actelion Stopp bei 48,50 EUR setzen
München (aktiencheck.de AG) - Die Experten von "FOCUS-MONEY" raten, bei der Actelion-Aktie (ISIN CH0010532478/ WKN 936767) einen Stoppkurs bei 48,50 EUR zu setzen.
Das Schlafmittel Almorexant des Schweizer Biotech-Unternehmens könnte den Schlafmittelmarkt revolutionieren. Anstatt wie bisherige Schlafmittel eine Art Anästhesie auszulösen, beeinflusse Almorexant den Schlaf nur selektiv. Auch seien sonst übliche Nebenwirkungen wie Abhängigkeit und Toleranzentwicklung derzeit nicht bekannt. Die Wahrscheinlichkeit einer Markteinführung des potenziellen Blockbusters würden Analysten auf 40 bis 80% schätzen.
Der Aktienkurs notiere an der Spitze eines symmetrischen Dreiecks. Ein Kaufsignal ergebe sich erst, wenn er nach oben oder nach unten ausbreche. Sollte ein Ausbruch nach oben durch einen Umsatzschub begleitet werden, steige die Wahrscheinlichkeit eines längeren positiven Trends.
Nach Meinung der Experten von "FOCUS-MONEY" sollten Anleger bei der Aktie von Actelion einen Stoppkurs bei 48,50 EUR setzen. (Ausgabe 50) (05.12.2008/ac/a/a)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
Quelle: AKTIENCHECK.DE
Antwort auf Beitrag Nr.: 36.153.048 von Fruehrentner am 05.12.08 11:28:36Nach Meinung der Experten von "FOCUS-MONEY" sollten Anleger bei der Aktie von Actelion einen Stoppkurs bei 48,50 EUR setzen.
Die meinen wohl 48,50 CHF
Die meinen wohl 48,50 CHF

Miglustat (Zavesca®) erhält positive Empfehlung des europäischen Ausschusses für Humanarzneimittel für die Indikation Niemann-Pick Typ C
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin.
Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
----------------------------------------------------------------------
--------------
ALLSCHWIL/BASEL, SCHWEIZ - 19. Dezember 2008 - Actelion Ltd (SIX:
ATLN) teilte heute mit, dass der europäische Ausschuss für
Humanarzneimittel (European Committee for Medicinal Products for
Human Use - CHMP) einen positiven Bescheid für eine
Indikationserweiterung von Miglustat (ZavescaÒ) erteilt hat, die sich
auf den Einsatz bei Patienten mit der Niemann-Pick-Krankheit Typ C
(NPC), einer sehr seltenen neurodegenerativen genetischen Erkrankung,
bezieht.
Es ist zu erwarten, dass die Europäische Kommission basierend auf der positiven Einschätzung des CHMP innerhalb von zwei Monaten eine
endgültige Entscheidung treffen wird.
Actelion prüft derzeit die Vorlage von Zulassungsanträgen von
Miglustat (Zavesca®) bei NPC in anderen Ländern ausserhalb der
Europäischen Union.
Zavesca® (100 mg Miglustat) ist bereits für die orale Behandlung der
leichten bis mittelschweren Typ-1-Gaucher-Krankheit zugelassen.
Zavesca® darf nur für die Behandlung von Patienten mit
Typ-1-Gaucher-Krankheit eingesetzt werden, bei denen eine
Enzymersatztherapie nicht in Betracht kommt.
###
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin.
Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
----------------------------------------------------------------------
--------------
ALLSCHWIL/BASEL, SCHWEIZ - 19. Dezember 2008 - Actelion Ltd (SIX:
ATLN) teilte heute mit, dass der europäische Ausschuss für
Humanarzneimittel (European Committee for Medicinal Products for
Human Use - CHMP) einen positiven Bescheid für eine
Indikationserweiterung von Miglustat (ZavescaÒ) erteilt hat, die sich
auf den Einsatz bei Patienten mit der Niemann-Pick-Krankheit Typ C
(NPC), einer sehr seltenen neurodegenerativen genetischen Erkrankung,
bezieht.
Es ist zu erwarten, dass die Europäische Kommission basierend auf der positiven Einschätzung des CHMP innerhalb von zwei Monaten eine
endgültige Entscheidung treffen wird.
Actelion prüft derzeit die Vorlage von Zulassungsanträgen von
Miglustat (Zavesca®) bei NPC in anderen Ländern ausserhalb der
Europäischen Union.
Zavesca® (100 mg Miglustat) ist bereits für die orale Behandlung der
leichten bis mittelschweren Typ-1-Gaucher-Krankheit zugelassen.
Zavesca® darf nur für die Behandlung von Patienten mit
Typ-1-Gaucher-Krankheit eingesetzt werden, bei denen eine
Enzymersatztherapie nicht in Betracht kommt.
###
Antwort auf Beitrag Nr.: 36.235.695 von SLGramann am 19.12.08 07:33:55
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, stuft die Aktie von Actelion (ISIN CH0010532478 / WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" weiterhin mit "hold" ein.
Actelion habe bekannt gegeben, dass die CHMP für Zavesca (Miglustat) ein positives Gutachten für die Behandlung des der Niemann-Pick-Krankheit Typ C herausgegeben habe. Im Oktober 2007 habe Actelion für dieselbe Indikation ein negatives Gutachten für Zavesca erhalten.
Anzeige
Niemann Pick Typ C sei eine seltene neurodegenerative Erkrankung mit tödlichem Verlauf, die in erster Linie bei Jugendlichen auftrete. Die genetische Störung führe zum Fehlen eines spezifisches Enzyms, das zur Reduzierung von Glycosphingolipiden benötigt werde. Dementsprechend könne der Mangel dieses Enzyms zum Aufbau von Glycosphingolipiden führen, die neurotoxische Wirkung im Gehirn hätten. Dieser genetische Defekt sei sehr selten und trete bei etwa einer von 150.000 Geburten auf. Die Analysten würden in den westlichen Ländern von einer Population von 1.000 bis 1.500 Patienten mit Niemann Pick Typ C ausgehen.
Die finanziellen Prognosen der Analysten könnten sehr vorsichtig erhöht werden. Die Analysten würden das Umsatzpotenzial für Europa auf CHF 25 bis 50 Mio. schätzen.
Die Analysten von Vontobel Research halten an ihrer "hold"-Empfehlung für die Actelion-Aktie fest. Ihre DCF-Analyse ergebe eine Erhöhung des Fair Value um CHF 1. Ihr Kursziel von CHF 65 würden die Analysten beibehalten. (Analyse vom 19.12.2008) (19.12.2008/ac/a/a)
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, stuft die Aktie von Actelion (ISIN CH0010532478 / WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" weiterhin mit "hold" ein.
Actelion habe bekannt gegeben, dass die CHMP für Zavesca (Miglustat) ein positives Gutachten für die Behandlung des der Niemann-Pick-Krankheit Typ C herausgegeben habe. Im Oktober 2007 habe Actelion für dieselbe Indikation ein negatives Gutachten für Zavesca erhalten.
Anzeige
Niemann Pick Typ C sei eine seltene neurodegenerative Erkrankung mit tödlichem Verlauf, die in erster Linie bei Jugendlichen auftrete. Die genetische Störung führe zum Fehlen eines spezifisches Enzyms, das zur Reduzierung von Glycosphingolipiden benötigt werde. Dementsprechend könne der Mangel dieses Enzyms zum Aufbau von Glycosphingolipiden führen, die neurotoxische Wirkung im Gehirn hätten. Dieser genetische Defekt sei sehr selten und trete bei etwa einer von 150.000 Geburten auf. Die Analysten würden in den westlichen Ländern von einer Population von 1.000 bis 1.500 Patienten mit Niemann Pick Typ C ausgehen.
Die finanziellen Prognosen der Analysten könnten sehr vorsichtig erhöht werden. Die Analysten würden das Umsatzpotenzial für Europa auf CHF 25 bis 50 Mio. schätzen.
Die Analysten von Vontobel Research halten an ihrer "hold"-Empfehlung für die Actelion-Aktie fest. Ihre DCF-Analyse ergebe eine Erhöhung des Fair Value um CHF 1. Ihr Kursziel von CHF 65 würden die Analysten beibehalten. (Analyse vom 19.12.2008) (19.12.2008/ac/a/a)
Actelion verfügt über einige hochspannende Projekte. Almorexant ist eines der spannendsten.
Mein Einstieg in Actelion erfolgte aber erst nach der Meldung aus dem November über den Wechsel von S1P1 in die Phase 2. Aufgrund der Indikation und wegen des sehr frühen Einstiegs von Roche (für mich ein Hinweis auf die hohe Qualität der präklinischen Daten), halte ich den S1P1 für sehr, sehr spannend.
Wenn man die beiden bisher wesentlichen Meldungen dazu nimmt:
ALLSCHWIL/BASEL, SWITZERLAND - 17 July 2006 - Actelion Ltd (SWX: ATLN) and Roche (SWX: ROG) have announced today that they have entered into an exclusive worldwide collaboration to jointly develop and commercialize Actelion's selective S1P1 receptor agonist, an immunomodulator with the potential for once-a-day oral dosing. The compound is currently being developed in Phase I. The two companies plan to jointly develop and commercialize this novel compound for multiple autoimmune disorders.
ALLSCHWIL, SWITZERLAND - 13 November 2008 - Actelion Ltd (SWX: ATLN) announced that Actelion and Roche have jointly agreed that preclinical and clinical data support progressing Actelion's S1P1 receptor agonist into Phase II clinical development. An update will be presented at Actelion Day 2009, an event held at Actelion's headquarters in Allschwil on 19 February 2009. This event will be a combination of Actelion's annual Media and Analyst Conference and its Research and Development Day.
dann fällt auf, dass zwischen dem Beginn der Phase 1 und dem Beginn der Phase 2 gut 2,5 Jahre liegen. Denn zum Zeitpunkt der Roche-Meldung im Juli 2006 war S1P1 ja bereits in der Phase 1.
Für einen reinen Test der Verträglichkeit an gesunden Probanden finde ich diesen Zeitraum relativ lang. Deshalb spekuliere ich schon ein wenig darauf, dass wir hier mehr als eine klassische Phase 1 gesehen haben könnten und vielleicht erste Wirksamkeitsdaten von Patienten vorliegen könnten, es sich also eher um eine P 1 / P 2 a - Studie gehandelt hat.
Vielleicht bekommen wir im Februar mehr Informationen. Wie gesagt, den S1P1 halte ich für sehr, sehr aufregend und verbinde damit große Hoffnungen.
Mein Einstieg in Actelion erfolgte aber erst nach der Meldung aus dem November über den Wechsel von S1P1 in die Phase 2. Aufgrund der Indikation und wegen des sehr frühen Einstiegs von Roche (für mich ein Hinweis auf die hohe Qualität der präklinischen Daten), halte ich den S1P1 für sehr, sehr spannend.
Wenn man die beiden bisher wesentlichen Meldungen dazu nimmt:
ALLSCHWIL/BASEL, SWITZERLAND - 17 July 2006 - Actelion Ltd (SWX: ATLN) and Roche (SWX: ROG) have announced today that they have entered into an exclusive worldwide collaboration to jointly develop and commercialize Actelion's selective S1P1 receptor agonist, an immunomodulator with the potential for once-a-day oral dosing. The compound is currently being developed in Phase I. The two companies plan to jointly develop and commercialize this novel compound for multiple autoimmune disorders.
ALLSCHWIL, SWITZERLAND - 13 November 2008 - Actelion Ltd (SWX: ATLN) announced that Actelion and Roche have jointly agreed that preclinical and clinical data support progressing Actelion's S1P1 receptor agonist into Phase II clinical development. An update will be presented at Actelion Day 2009, an event held at Actelion's headquarters in Allschwil on 19 February 2009. This event will be a combination of Actelion's annual Media and Analyst Conference and its Research and Development Day.
dann fällt auf, dass zwischen dem Beginn der Phase 1 und dem Beginn der Phase 2 gut 2,5 Jahre liegen. Denn zum Zeitpunkt der Roche-Meldung im Juli 2006 war S1P1 ja bereits in der Phase 1.
Für einen reinen Test der Verträglichkeit an gesunden Probanden finde ich diesen Zeitraum relativ lang. Deshalb spekuliere ich schon ein wenig darauf, dass wir hier mehr als eine klassische Phase 1 gesehen haben könnten und vielleicht erste Wirksamkeitsdaten von Patienten vorliegen könnten, es sich also eher um eine P 1 / P 2 a - Studie gehandelt hat.
Vielleicht bekommen wir im Februar mehr Informationen. Wie gesagt, den S1P1 halte ich für sehr, sehr aufregend und verbinde damit große Hoffnungen.
Still und heimlich testet Actelion das Kurshoch aus 2007 und probt den Ausbruch, trotz allgemeiner Marktschwäche
Ob's gelingt? Im Februar stehen die nächsten News an.
Antwort auf Beitrag Nr.: 36.408.801 von Fruehrentner am 20.01.09 10:36:48Ist mir auch schon aufgefallen. Actelion ist auch die größte Beteiligung von BB Biotech.
Sieht echt gut aus!
Sieht echt gut aus!

Published: 17:35 23.01.2009 GMT+1 /HUGIN /Source: Actelion
Pharmaceuticals Ltd /SWX: ATLN /ISIN: CH0010532478
Actelion to host Actelion Day on 19 February 2009
Dear member of the investment community
Actelion Ltd will announce the financial full year 2008 results on
Thursday, 19 February 2009,
at 07.00 CET / 01.00 EST / 06.00 GMT.
The same day, the company hosts Actelion Day 2009. This event will be
a combination of Actelion's annual Media and Analyst Conference (M&A
Day) and its Research and Development Day (R&D Day).
The event will be available via webcast, however, questions will be
restricted to audience members only.
For those of you who have not received a personalized invitation as a
buy- or sell-side analyst and wishing to attend the event in person,
we kindly ask to send an e-mail to investor.relations@actelion.com.
Please note that space is limited.
Actelion will host an Investor Conference Call / Webcast as follows:
Date/Time:
19 February 2009 12.30 hrs - 16.30 hrs Basel (CEST)
11.30 hrs - 15.30 hrs U.K. (BST)
06.30 a.m. - 10.30 a.m. U.S. (EDT)
Conference Call Connect #:
Dial-in participants should start calling the number below 10-15
minutes
before the Conference is due to start.
Dial: Europe: +41 44 580 64 03
U.K.: +44 207 153 91 54
U.S.: +1 866 928 60 44
Participant's mode:
Listen-Only. Questions will be restricted to audience members only.
Webcast Access:
Webcast participants should visit the Actelion website for further
details http://www.actelion.com/" target="_blank" rel="nofollow ugc noopener">http://www.actelion.com/
10-15 minutes before the conference is due to start.
Participant's mode:
Listen-Only. Questions will be restricted to audience members only.
Webcast Replay:
The archived Investor Webcast will be available for replay through
http://www.actelion.com/" target="_blank" rel="nofollow ugc noopener">http://www.actelion.com/
approximately 60 minutes after the call has ended.
For further information please contact:
Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil
Roland Haefeli
Vice President, Head of Investor Relations & Public
Affairs
+41 61 565 62 62
+1 650 624 69 36
http://www.actelion.com
http://hugin.info/131801/R/1284612/287837.pdf
Pharmaceuticals Ltd /SWX: ATLN /ISIN: CH0010532478
Actelion to host Actelion Day on 19 February 2009
Dear member of the investment community
Actelion Ltd will announce the financial full year 2008 results on
Thursday, 19 February 2009,
at 07.00 CET / 01.00 EST / 06.00 GMT.
The same day, the company hosts Actelion Day 2009. This event will be
a combination of Actelion's annual Media and Analyst Conference (M&A
Day) and its Research and Development Day (R&D Day).
The event will be available via webcast, however, questions will be
restricted to audience members only.
For those of you who have not received a personalized invitation as a
buy- or sell-side analyst and wishing to attend the event in person,
we kindly ask to send an e-mail to investor.relations@actelion.com.
Please note that space is limited.
Actelion will host an Investor Conference Call / Webcast as follows:
Date/Time:
19 February 2009 12.30 hrs - 16.30 hrs Basel (CEST)
11.30 hrs - 15.30 hrs U.K. (BST)
06.30 a.m. - 10.30 a.m. U.S. (EDT)
Conference Call Connect #:
Dial-in participants should start calling the number below 10-15
minutes
before the Conference is due to start.
Dial: Europe: +41 44 580 64 03
U.K.: +44 207 153 91 54
U.S.: +1 866 928 60 44
Participant's mode:
Listen-Only. Questions will be restricted to audience members only.
Webcast Access:
Webcast participants should visit the Actelion website for further
details http://www.actelion.com/" target="_blank" rel="nofollow ugc noopener">http://www.actelion.com/
10-15 minutes before the conference is due to start.
Participant's mode:
Listen-Only. Questions will be restricted to audience members only.
Webcast Replay:
The archived Investor Webcast will be available for replay through
http://www.actelion.com/" target="_blank" rel="nofollow ugc noopener">http://www.actelion.com/
approximately 60 minutes after the call has ended.
For further information please contact:
Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil
Roland Haefeli
Vice President, Head of Investor Relations & Public
Affairs
+41 61 565 62 62
+1 650 624 69 36
http://www.actelion.com
http://hugin.info/131801/R/1284612/287837.pdf
Zürich (AWP) - Die Aktien der Actelion Ltd haben bisher die Krise an den Aktienmärkten besser als andere gemeistert. Dennoch äussert sich Actelion-CEO Jean-Paul Clozel kritisch. "Der Kurs spiegelt unsere Erfolge ungenügend", sagte er gegenüber den "Handelszeitung" in einem Interview (Vorabdruck Ausgabe 28.01.).
In den letzten zwei bis drei Jahren habe Actelion den Profit stark erhöht, der Kurs habe sich aber kaum bewegt, so Clozel. Bisher ist das Geschäft allerdings risikoreich, da der Erfolg des Pharmaunternehmens vor allem am Produkt Tracleer hängt. Das Patent für das Medikament läuft 2015 aus.
Trotzdem würden die Aktien von Tracleer im Vergleich zu grossen Konkurrenten wie Genentech ein deutlich niedrigeres Kurs-Gewinn-Verhältnis aufweisen, meinte der CEO.
Spätestens Ende Jahr will Clozel deshalb die abschliessende Studie zur Wirksamkeit von Tracleer gegen idiophatische Lungenfibrose abschliessen. Besten Falls geht er von einer Zulassung durch die Behörden gegen Ende nächsten Jahres aus. Im Erfolgsfall rechnen der Chef von Actelion mit einer Verdoppelung der Tracleer-Umsätze bei einer gleichzeitig vergrösserten Profitabilität.
Nebst dem Schlafmittel Almorexant hat Actelion in ihre Pipeline in der Phase III auch noch das Produkt Actelion 1. Dabei handle es sich um eine Art "Super-Tracleer", so der CEO. Er hofft deshalb mit dem Produkt noch vor Ablauf des Patents von Tracleer auf den Markt zukommen.
Auf Fremdkapital ist das Unternehmen indes nicht angewiesen. Actelion sei komplett unabhängig und brauche keine Kredite, so der CEO. Das Unternehmen verfüge über genügend Liquiditätsreserven und generiere genügend Cashflow um die Expansion zu finanzieren und strategische Optionen wahrzunehmen. Pro Quartal würden rund 100 Mio CHF freier Cashflow generiert.
Für 2008 rechnet Actelion weiterhin mit einem Umsatzwachstum von zwischen 16 und 19% in lokalen Währungen.
--------------------
Dass Actelion 1 vor 2015 zur Zulassung anstehen sollte, habe ich eigentlich immer vorausgesetzt, bei einem Wirkstoff, der schon in Phase 3 ist...
Ansonsten sollte ein CEO den Kurs seines Unternehmens nicht weiter kommentieren imho.
In den letzten zwei bis drei Jahren habe Actelion den Profit stark erhöht, der Kurs habe sich aber kaum bewegt, so Clozel. Bisher ist das Geschäft allerdings risikoreich, da der Erfolg des Pharmaunternehmens vor allem am Produkt Tracleer hängt. Das Patent für das Medikament läuft 2015 aus.
Trotzdem würden die Aktien von Tracleer im Vergleich zu grossen Konkurrenten wie Genentech ein deutlich niedrigeres Kurs-Gewinn-Verhältnis aufweisen, meinte der CEO.
Spätestens Ende Jahr will Clozel deshalb die abschliessende Studie zur Wirksamkeit von Tracleer gegen idiophatische Lungenfibrose abschliessen. Besten Falls geht er von einer Zulassung durch die Behörden gegen Ende nächsten Jahres aus. Im Erfolgsfall rechnen der Chef von Actelion mit einer Verdoppelung der Tracleer-Umsätze bei einer gleichzeitig vergrösserten Profitabilität.
Nebst dem Schlafmittel Almorexant hat Actelion in ihre Pipeline in der Phase III auch noch das Produkt Actelion 1. Dabei handle es sich um eine Art "Super-Tracleer", so der CEO. Er hofft deshalb mit dem Produkt noch vor Ablauf des Patents von Tracleer auf den Markt zukommen.
Auf Fremdkapital ist das Unternehmen indes nicht angewiesen. Actelion sei komplett unabhängig und brauche keine Kredite, so der CEO. Das Unternehmen verfüge über genügend Liquiditätsreserven und generiere genügend Cashflow um die Expansion zu finanzieren und strategische Optionen wahrzunehmen. Pro Quartal würden rund 100 Mio CHF freier Cashflow generiert.
Für 2008 rechnet Actelion weiterhin mit einem Umsatzwachstum von zwischen 16 und 19% in lokalen Währungen.
--------------------
Dass Actelion 1 vor 2015 zur Zulassung anstehen sollte, habe ich eigentlich immer vorausgesetzt, bei einem Wirkstoff, der schon in Phase 3 ist...
Ansonsten sollte ein CEO den Kurs seines Unternehmens nicht weiter kommentieren imho.
Actelion "hold"
28.01.2009
Vontobel Research
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, stuft die Aktie von Actelion (ISIN CH0010532478 / WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" mit "hold" ein.
Gilead habe gestern Abend seine Ergebnisse des 4. Quartals 2008 bekannt gegeben. Die Umsätze von Letairis hätten sich auf USD 36,2 Mio. belaufen.
Die Letairis-Umsätze von USD 36,2 Mio. seien ein Zeichen, dass Gilead noch immer in der Lage sei, seine Patientenbasis leicht auszuweiten. Gilead sei jedoch deutlich hinter den Einschätzungen der Analysten zurückgeblieben. Sie hätten USD 40 Mio. ins Auge gefasst, was etwa 700 Patienten entsprochen hätte, die in diesem Quartal eine Therapie begonnen hätten.
Letairis sei nun seit sechs Monaten auf dem Markt und dieses Geschäft komme gerade einmal auf einen hochgerechneten Jahresumsatz von knapp USD 140 Mio. Die Analysten seien der Ansicht, dass Gilead im weiteren Verlauf des Jahres 2009 seine Vermarktungsstrategie aller Wahrscheinlichkeit nach überdenken müsse. Bis dahin sei kaum anzunehmen, dass sich Gilead zu einer Bedrohung für Actelion entwickeln könnte. Im Hinblick auf GSK sei noch nichts vom Marktauftritt von Volibris zu sehen oder zu hören gewesen.
Das vorherige Szenario der Analysten, demzufolge Actelion nur die Hälfte der Patienten gewinnen würde, die sich einer neuen PAH-Behandlung unterziehen würden, erscheine nun zu konservativ.
Die Analysten von Vontobel Research stufen die Actelion-Aktie derzeit mit einem "hold"-Rating und einem Kursziel von CHF 65 ein. (Analyse vom 28.01.2009) (28.01.2009/ac/a/a)
28.01.2009
Vontobel Research
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, stuft die Aktie von Actelion (ISIN CH0010532478 / WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" mit "hold" ein.
Gilead habe gestern Abend seine Ergebnisse des 4. Quartals 2008 bekannt gegeben. Die Umsätze von Letairis hätten sich auf USD 36,2 Mio. belaufen.
Die Letairis-Umsätze von USD 36,2 Mio. seien ein Zeichen, dass Gilead noch immer in der Lage sei, seine Patientenbasis leicht auszuweiten. Gilead sei jedoch deutlich hinter den Einschätzungen der Analysten zurückgeblieben. Sie hätten USD 40 Mio. ins Auge gefasst, was etwa 700 Patienten entsprochen hätte, die in diesem Quartal eine Therapie begonnen hätten.
Letairis sei nun seit sechs Monaten auf dem Markt und dieses Geschäft komme gerade einmal auf einen hochgerechneten Jahresumsatz von knapp USD 140 Mio. Die Analysten seien der Ansicht, dass Gilead im weiteren Verlauf des Jahres 2009 seine Vermarktungsstrategie aller Wahrscheinlichkeit nach überdenken müsse. Bis dahin sei kaum anzunehmen, dass sich Gilead zu einer Bedrohung für Actelion entwickeln könnte. Im Hinblick auf GSK sei noch nichts vom Marktauftritt von Volibris zu sehen oder zu hören gewesen.
Das vorherige Szenario der Analysten, demzufolge Actelion nur die Hälfte der Patienten gewinnen würde, die sich einer neuen PAH-Behandlung unterziehen würden, erscheine nun zu konservativ.
Die Analysten von Vontobel Research stufen die Actelion-Aktie derzeit mit einem "hold"-Rating und einem Kursziel von CHF 65 ein. (Analyse vom 28.01.2009) (28.01.2009/ac/a/a)
29.01.2009 17:35:29
Hugin-News: Actelion Pharmaceuticals Ltd
Zavesca® (Miglustat) erhält EU-Zulassung für die Behandlung progressiver neurologischer Symptome bei Patienten mit Niemann-Pick Typ C
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin.
Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
-------------------------------------------------------------------
ALLSCHWIL/BASEL, SCHWEIZ - 29. Januar 2009 - Actelion Ltd (SIX: ATLN)
teilte heute mit, dass Zavesca® (Miglustat) in der Europäischen Union
für die Behandlung progressiver neurologischer Symptome bei
Erwachsenen und Kindern mit der Niemann-Pick Typ C-Krankheit (NPC)
zugelassen wurde. Zavesca® ist das erste Präparat, das in dieser
Indikation eine Zulassung erhält. Niemann-Pick Typ C ist eine sehr
seltene, kontinuierlich fortschreitende, genetisch bedingte
neurodegenerative Erkrankung mit tödlichem Ausgang, an der sowohl
Kinder als auch Erwachsene leiden.
Zavesca® (100 mg Miglustat) ist bereits für die orale Behandlung von
erwachsenen Patienten mit leichter bis mittelschwerer
Typ-1-Gaucher-Krankheit zugelassen. Zavesca® darf nur für die
Behandlung von Patienten mit Typ-1-Gaucher-Krankheit eingesetzt
werden, bei denen eine Enzymersatztherapie nicht in Betracht kommt.
Dr. Jean-Paul Clozel, Chief Executive Officer von Actelion
kommentierte: 'Ich bin sehr stolz, dass Actelion in enger
Zusammenarbeit mit der wissenschaftlichen Gemeinschaft aufzeigen
konnte, dass Zavesca® ein Fortschreiten der klinisch relevanten
neurologischen Symptome bei NPC-Patienten bremst. Ich möchte den
Patienten und deren Familien sowie den klinischen Experten für ihr
jahrelanges Engagement bei der Durchführung des klinischen
Studienprogramms danken. Im Streben nach wissenschaftlichem
Fortschritt und einer patientenorientierten Medizin wird sich
Actelion auch in Zukunft für Patienten einsetzen, die an seltenen
Krankheiten leiden.'
Dr. Ed Wraith vom Royal Manchester Children's Hospital erklärte: 'Mit
Zavesca® steht erstmals eine behördlich zugelassene Behandlung für
NPC zur Verfügung. Die in einer klinischen Studie und einer
retrospektiven Kohortenstudie erhobenen Daten zeigten eine
konsistente günstige klinische Reaktion auf. Als behandelnder Arzt
weiss ich, wie wichtig es ist, ein Fortschreiten der neurologischen
Symptome zu bremsen.'
Auch in anderen Ländern wird derzeit die erweiterte Zulassung von
Miglustat für Patienten mit NPC geprüft.
Über die Niemann-Pick-Krankheit Typ C
NPC ist ein sehr seltenes neurodegeneratives, genetisch bedingtes
Leiden mit tödlichem Ausgang, das überwiegend Kinder und Jugendliche
betrifft, jedoch in jedem Alter einsetzen kann. Die Symptome werden
durch die Speicherung gewisser Glykosphingolipide in bestimmten
Körperzellen einschliesslich des Gehirns hervorgerufen. Die
Erkrankung ist unerbittlich progressiv, und die meisten Patienten
sterben innerhalb von fünf bis zehn Jahren nach der Diagnose. Kinder,
die unter dieser Krankheit leiden, erreichen das Erwachsenenalter in
der Regel nicht. Die Verschlechterung neurologischer Funktionen ist
ein Hauptkennzeichen der Krankheit. Sie kann sich in schwerfälligen
Körperbewegungen, Gleichgewichtsproblemen, langsamer und undeutlicher
Sprache, Schluckbeschwerden, Problemen mit den Augenbewegungen und
Krampfanfällen äussern. Ein Nachlassen der intellektuellen
Fähigkeiten ist üblich. In den Endstadien der Erkrankung ist das Kind
oder der junge Erwachsene bettlägerig, hat wenig Muskelkontrolle und
ist intellektuell geschädigt. Die Diagnose der Krankheit kann sich
infolge ihres seltenen Auftretens und der unterschiedlichen
Ausprägung als schwierig und langwierig erweisen. Bisher gab es keine
Behandlungsmöglichkeit für dieses Leiden.
###
Informationen für Herausgeber
Über Zavesca® und Niemann-Pick Typ C
Zavesca® ist für die Behandlung progressiver neurologischer Symptome
bei Erwachsenen und Kindern mit Niemann-Pick Typ C indiziert.
Grundlage für die Zulassung von Zavesca® für die Behandlung von
Niemann-Pick Typ C sind klinische Daten, die im Rahmen der klinischen
Studie OGT918-007 und zwei multizentrischen retrospektiven
Kohortenstudien mit NPC-Patienten gewonnen wurden.
Erwachsene NPC-Patienten erhielten normalerweise dreimal täglich 200
mg Zavesca®. Die Dosierung für Kinder wurde auf Basis der
Körperoberfläche angepasst.
Im Rahmen der klinischen Studie OGT918-007 erhielten erwachsene und
jugendliche NPC-Patienten (n=29, Alter >=12 Jahre) zwölf Monate lang
entweder 200 mg t.i.d. Miglustat (n=20) oder wurden standardmässig
versorgt (n=9) [1]. Ausserdem wurde zwölf Kindern im Alter von vier
bis zwölf Jahren Miglustat in einer an ihre Körperoberfläche
angepassten Dosierung verabreicht. Im Anschluss daran erhielten alle
Patienten für weitere zwölf Monate Miglustat. Endpunkt der Studie war
die Veränderung der Geschwindigkeit der sakkadischen horizontalen
Augenbewegungen (Horizontal saccadic eye movement - HSEM). Andere
Endpunkte beinhalteten Schlucken, Gangbild, neurologische
Untersuchung, neuropsychologische Beurteilung, Tremor und
Lebensqualität. Nach zwölf Monaten hatte sich die
HSEM-Geschwindigkeit bei Patienten unter Miglustat gegenüber der
Gruppe, die standardmässig versorgt wurde, verbessert; signifikante
Ergebnisse wurden bei Ausschluss von Patienten unter Benzodiazepinen
erzielt (p=0.028) [1]. Nach zwölf Monaten zeigte sich auch bei
Kindern eine vergleichbare Verbesserung der HSEM-Geschwindigkeit. Bei
über zwölfjährigen Patienten konnte ausserdem eine Verbesserung des
Schluckvermögens, eine stabile Hörschärfe und eine verlangsamte
Verschlechterung des Mobilitätsindexes festgestellt werden [1].
In einer unkontrollierten Verlängerungsphase der OGT918-007-Studie
zeigten die dabei gewonnenen Daten, dass Miglustat bei wichtigen
Markern für neurologische Fehlfunktionen im Zusammenhang mit NPC eine
Krankheitsstabilisierung sowohl bei jugendlichen/erwachsenen als auch
bei pädiatrischen Kohorten herbeiführen kann. Diese Ergebnisse
stützen die Interpretation, dass in der kontrollierten Studienphase
nach Ablauf von zwölf Monaten mit Miglustat ein Behandlungseffekt
erzielt wurde [2,3].
Die Sicherheit und Verträglichkeit von dreimal täglich 200 mg
Miglustat entsprach den Ergebnissen aus früheren Studien im
Zusammenhang mit Typ-1-Gaucher-Krankheit, in denen nur die Hälfte
dieser Dosierung verabreicht worden war [1, 2, 3].
Eine erste retrospektive Kohortenstudie wurde an 25 Studienzentren in
zwölf Ländern durchgeführt. Dabei wurde die Veränderung des
neurologischen Status und der Behandlungsnutzen von Miglustat bei 66
NPC-Patienten untersucht, die ausserhalb der OGT918-007-Studie
durchschnittlich eineinhalb Jahre lang mit Miglustat behandelt
wurden. Die Bewertung des Schweregrades von Dysphagie (Schlucken),
Dystonie (Feinmotorik), Ataxie (Gangbild) und Dysarthrie
(Artikulationsfähigkeit) bei Diagnosestellung, Behandlungsbeginn und
letzter Konsultation wurde anhand einer krankheitsspezifischen
Behinderungsskala vorgenommen [4]. In Bezug auf diese vier Parameter
blieb die Mehrheit der Patienten nach Abschluss der Behandlung
zumindest stabil, was darauf hindeutet, dass Miglustat das
Fortschreiten neurologischer Manifestationen bei NPC-Patienten
klinisch positiv beeinflusst [4].
Eine zweite retrospektive Kohortenstudie wurde an sieben Zentren in
sechs Ländern durchgeführt. Ziel war die Erhebung von Daten bezüglich
der Veränderung des neurologischen Status bei 57 Patienten, deren
normaler Krankheitsverlauf ohne eine Verabreichung von Miglustat
durchschnittlich fünfeinhalb Jahre lang beobachtet wurde. Die Schwere
von Dysphagie, Dystonie, Ataxie und Dysarthrie zum Zeitpunkt der
Diagnose und der zuletzt erfolgten Konsultation wurde unter
Verwendung derselben Behinderungsskala gemessen. Die Ergebnisse
sollen im ersten Halbjahr 2009 vorgestellt werden.
Der Behandlungsnutzen von Zavesca® im Hinblick auf neurologische
Symptome bei Patienten mit Niemann-Pick Typ C sollte regelmässig,
beispielsweise halbjährlich, evaluiert werden. Nach wenigstens
einjähriger Behandlungsdauer sollte über eine Fortsetzung der
Therapie mit Zavesca® entschieden werden.
Über Zavesca® und Typ-1-Gaucher-Krankheit
Zavesca® (100 mg Miglustat in Kapselform) ist für die orale Therapie
von erwachsenen Patieten mit leichter bis mittelschwerer
Typ-1-Gaucher-Krankheit zugelassen. Zavesca® darf nur für die
Behandlung von Patienten mit Typ-1-Gaucher-Krankheit eingesetzt
werden, bei denen eine Enzymersatztherapie nicht in Betracht kommt.
Das Medikament ist in der Europäischen Union, den USA, Kanada, der
Schweiz, Brasilien, Australien, der Türkei und Israel zugelassen.
Sicherheitsinformationen zu Zavesca®
Bei mehr als 80% der mit Zavesca® behandelten Patienten wurden
Magen-Darm-Reaktionen, vor allem Diarrhoe, entweder zu Beginn der
Behandlung oder auch intermittierend, festgestellt. Diese verlaufen
mehrheitlich mild und verschwinden in der Regel nach den ersten
Behandlungswochen von selbst. In der klinischen Praxis zeigte sich,
dass die Diarrhoe durch eine Veränderung der Nahrungszusammensetzung
(Reduzierung der Einnahme von Lactose und anderer Kohlenhydrate), die
Einnahme von Zavesca® ausserhalb der Mahlzeiten und/oder die Einnahme
von Anti-Diarrhoe-Präparaten wie beispielsweise Loperamid unter
Kontrolle gebracht werden konnte. Bei einzelnen Patienten könnte eine
vorübergehende Herabsetzung der Dosis notwendig werden. Patienten mit
chronischer Diarrhoe oder anderen anhaltenden
Gastrointestinalbeschwerden, die auf diese Massnahmen nicht
reagieren, sollten gemäss klinischer Praxis untersucht werden.
Zavesca® ist bisher nicht bei Patienten mit einer
Krankheitsgeschichte schwerwiegender Gastrointestinalerkrankungen wie
chronisch-entzündlichen Darmerkrankungen untersucht worden.
Bei mit Zavesca® behandelten Patienten mit Typ-1-Gaucher-Krankheit
wurden Fälle von peripherer Neuropathie berichtet. Bei Patienten mit
Typ-1-Gaucher-Krankheit treten im Vergleich zur allgemeinen
Bevölkerung häufiger Fälle von peripherer Neuropathie auf. Alle
Patienten sollten sich zu Beginn einer Behandlung und danach in
regelmässigen Abständen einer neurologischen Untersuchung
unterziehen. Bei Patienten, die Symptome wie Taubheit oder Kribbeln
entwickeln, sollten Nutzen und Risiken der Behandlung sorgsam
abgeklärt werden.
Zavesca® kann bei schwangeren Frauen zu Missbildungen des ungeborenen
Lebens führen. Es darf deshalb nicht an Frauen, die schwanger sind
oder es werden können, abgegeben werden; Patienten sollten auf das
Risiko fötaler Missbildungen hingewiesen werden. Die Einnahme kann
bei Männern zur Unfruchtbarkeit führen. Während einer Therapie mit
Zavesca® und bis drei Monate nach Absetzen der Therapie sollten
deshalb Kontrazeptiva verwendet und keine Schwangerschaft geplant
werden.
Bei einigen prädiatrischen Patienten mit Niemann-Pick Typ C wurde in
der ersten Behandlungsphase mit Zavesca® ein verzögertes Wachstum
beobachtet, wobei die anfängliche verminderte Gewichtszunahme
möglicherweise mit einer verringerten Grössenzunahme korrelierte. Bei
pädiatrischen und heranwachsenden Patienten sollte während der
Behandlung mit Zavesca® das Wachstum überwacht und eine individuelle
Nutzen-Risikoabwägung hinsichtlich der Fortsetzung der Therapie
vorgenommen werden.
Bei einigen NPC-Patienten wurde im Verlauf der Behandlung mit
Zavesca® eine leichte Abnahme der Blutplättchen beobachtet, die nicht
mit Blutungen assoziiert war. Bei 40 bis 50 Prozent der Patienten,
die an der klinischen Studie teilnahmen, lagen die Thrombozytenwerte
bereits vor Behandlungsbeginn unter dem Normwert. Für diese Patienten
wird die Kontrolle der Thrombozytenwerte empfohlen.
Literaturhinweis
1. Patterson MC, Vecchio D, Prady H, Abel L and Wraith JE.
Miglustat for treatment of Niemann-Pick C disease: a randomised
controlled study. Lancet Neurol 2007; 6:765-772.
2. Patterson MC, Vecchio D, Prady H, Abel L and Wraith JE.
Miglustat for treatment of Niemann-Pick C disease: results of 24
month's treatment. Proceedings of 57th Annual meeting of the American
Society of Human Genetics, 2007; abstract # 2253.
3. Patterson MC, Vecchio D, Jacklin E and Wraith JE. Miglustat
in Niemann-Pick disease Type C (NPC): long-term data from a clinical
trial. Proceedings of 58th Annual meeting of the American Society of
Human Genetics, 2008; abstract # 766.
4. Pineda M, Wraith JE, Sedel F, et al. Miglustat in patients
with Niemann-Pick type C disease (NPC): a multicentre retrospective
survey. Journal of Inherited Metabolic Disease 2008; 31(Suppl 1) 98.
Note: this abstract describes the results of the survey with the
first 44 cases collected.
Actelion Ltd
Actelion Ltd ist ein biopharmazeutisches Unternehmen mit Hauptsitz in
Allschwil/Basel, Schweiz. Actelions erstes Medikament, Tracleer®, ist
ein zur Therapie der pulmonalen arteriellen Hypertonie zugelassener
dualer Endothelin-Rezeptor-Antagonist in Tablettenform. Actelion
vertreibt Tracleer® durch eigene Niederlassungen in den wichtigsten
internationalen Märkten, so den Vereinigten Staaten (mit Sitz in
South San Francisco), der Europäischen Union, Japan, Kanada,
Australien und der Schweiz. Actelion, 1997 gegründet, ist ein
weltweit führendes Unternehmen bei der Erforschung des Endothels. Das
Endothel trennt die Gefässwand vom Blutstrom. Mit über 1900
Mitarbeitenden konzentriert sich Actelion darauf, innovative
Medikamente in Bereichen mit hohem medizinischem Bedarf zu entdecken,
zu entwickeln und zu vermarkten. Actelion Aktien werden an der SIX
Swiss Exchange im Rahmen des Blue-chip-Index SMI (Swiss Market Index
SMI®) gehandelt (Symbol: ATLN).
Für weitere Informationen wenden Sie sich bitte an:
Roland Haefeli
Vice President, Head of Investor Relations & Public Affairs
Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil
+41 61 565 62 62
+1 650 624 69 36
http://www.actelion.com
--- Ende der Mitteilung ---
Actelion Pharmaceuticals Ltd
Gewerbestrasse 16 Allschwil
Schweiz
WKN: 936767 ; ISIN: CH0010532478; Index: SBIOM, SLIFE, SMCI, SMIEXP,
SMIM, SPI, SPIEX;
Notiert: Main Market in SIX Swiss Exchange;
http://hugin.info/131801/R/1285897/288482.pdf
http://www.actelion.com
Copyright © Hugin AS 2009. All rights reserved.
Quelle: dpa-AFX
Hugin-News: Actelion Pharmaceuticals Ltd
Zavesca® (Miglustat) erhält EU-Zulassung für die Behandlung progressiver neurologischer Symptome bei Patienten mit Niemann-Pick Typ C
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin.
Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
-------------------------------------------------------------------
ALLSCHWIL/BASEL, SCHWEIZ - 29. Januar 2009 - Actelion Ltd (SIX: ATLN)
teilte heute mit, dass Zavesca® (Miglustat) in der Europäischen Union
für die Behandlung progressiver neurologischer Symptome bei
Erwachsenen und Kindern mit der Niemann-Pick Typ C-Krankheit (NPC)
zugelassen wurde. Zavesca® ist das erste Präparat, das in dieser
Indikation eine Zulassung erhält. Niemann-Pick Typ C ist eine sehr
seltene, kontinuierlich fortschreitende, genetisch bedingte
neurodegenerative Erkrankung mit tödlichem Ausgang, an der sowohl
Kinder als auch Erwachsene leiden.
Zavesca® (100 mg Miglustat) ist bereits für die orale Behandlung von
erwachsenen Patienten mit leichter bis mittelschwerer
Typ-1-Gaucher-Krankheit zugelassen. Zavesca® darf nur für die
Behandlung von Patienten mit Typ-1-Gaucher-Krankheit eingesetzt
werden, bei denen eine Enzymersatztherapie nicht in Betracht kommt.
Dr. Jean-Paul Clozel, Chief Executive Officer von Actelion
kommentierte: 'Ich bin sehr stolz, dass Actelion in enger
Zusammenarbeit mit der wissenschaftlichen Gemeinschaft aufzeigen
konnte, dass Zavesca® ein Fortschreiten der klinisch relevanten
neurologischen Symptome bei NPC-Patienten bremst. Ich möchte den
Patienten und deren Familien sowie den klinischen Experten für ihr
jahrelanges Engagement bei der Durchführung des klinischen
Studienprogramms danken. Im Streben nach wissenschaftlichem
Fortschritt und einer patientenorientierten Medizin wird sich
Actelion auch in Zukunft für Patienten einsetzen, die an seltenen
Krankheiten leiden.'
Dr. Ed Wraith vom Royal Manchester Children's Hospital erklärte: 'Mit
Zavesca® steht erstmals eine behördlich zugelassene Behandlung für
NPC zur Verfügung. Die in einer klinischen Studie und einer
retrospektiven Kohortenstudie erhobenen Daten zeigten eine
konsistente günstige klinische Reaktion auf. Als behandelnder Arzt
weiss ich, wie wichtig es ist, ein Fortschreiten der neurologischen
Symptome zu bremsen.'
Auch in anderen Ländern wird derzeit die erweiterte Zulassung von
Miglustat für Patienten mit NPC geprüft.
Über die Niemann-Pick-Krankheit Typ C
NPC ist ein sehr seltenes neurodegeneratives, genetisch bedingtes
Leiden mit tödlichem Ausgang, das überwiegend Kinder und Jugendliche
betrifft, jedoch in jedem Alter einsetzen kann. Die Symptome werden
durch die Speicherung gewisser Glykosphingolipide in bestimmten
Körperzellen einschliesslich des Gehirns hervorgerufen. Die
Erkrankung ist unerbittlich progressiv, und die meisten Patienten
sterben innerhalb von fünf bis zehn Jahren nach der Diagnose. Kinder,
die unter dieser Krankheit leiden, erreichen das Erwachsenenalter in
der Regel nicht. Die Verschlechterung neurologischer Funktionen ist
ein Hauptkennzeichen der Krankheit. Sie kann sich in schwerfälligen
Körperbewegungen, Gleichgewichtsproblemen, langsamer und undeutlicher
Sprache, Schluckbeschwerden, Problemen mit den Augenbewegungen und
Krampfanfällen äussern. Ein Nachlassen der intellektuellen
Fähigkeiten ist üblich. In den Endstadien der Erkrankung ist das Kind
oder der junge Erwachsene bettlägerig, hat wenig Muskelkontrolle und
ist intellektuell geschädigt. Die Diagnose der Krankheit kann sich
infolge ihres seltenen Auftretens und der unterschiedlichen
Ausprägung als schwierig und langwierig erweisen. Bisher gab es keine
Behandlungsmöglichkeit für dieses Leiden.
###
Informationen für Herausgeber
Über Zavesca® und Niemann-Pick Typ C
Zavesca® ist für die Behandlung progressiver neurologischer Symptome
bei Erwachsenen und Kindern mit Niemann-Pick Typ C indiziert.
Grundlage für die Zulassung von Zavesca® für die Behandlung von
Niemann-Pick Typ C sind klinische Daten, die im Rahmen der klinischen
Studie OGT918-007 und zwei multizentrischen retrospektiven
Kohortenstudien mit NPC-Patienten gewonnen wurden.
Erwachsene NPC-Patienten erhielten normalerweise dreimal täglich 200
mg Zavesca®. Die Dosierung für Kinder wurde auf Basis der
Körperoberfläche angepasst.
Im Rahmen der klinischen Studie OGT918-007 erhielten erwachsene und
jugendliche NPC-Patienten (n=29, Alter >=12 Jahre) zwölf Monate lang
entweder 200 mg t.i.d. Miglustat (n=20) oder wurden standardmässig
versorgt (n=9) [1]. Ausserdem wurde zwölf Kindern im Alter von vier
bis zwölf Jahren Miglustat in einer an ihre Körperoberfläche
angepassten Dosierung verabreicht. Im Anschluss daran erhielten alle
Patienten für weitere zwölf Monate Miglustat. Endpunkt der Studie war
die Veränderung der Geschwindigkeit der sakkadischen horizontalen
Augenbewegungen (Horizontal saccadic eye movement - HSEM). Andere
Endpunkte beinhalteten Schlucken, Gangbild, neurologische
Untersuchung, neuropsychologische Beurteilung, Tremor und
Lebensqualität. Nach zwölf Monaten hatte sich die
HSEM-Geschwindigkeit bei Patienten unter Miglustat gegenüber der
Gruppe, die standardmässig versorgt wurde, verbessert; signifikante
Ergebnisse wurden bei Ausschluss von Patienten unter Benzodiazepinen
erzielt (p=0.028) [1]. Nach zwölf Monaten zeigte sich auch bei
Kindern eine vergleichbare Verbesserung der HSEM-Geschwindigkeit. Bei
über zwölfjährigen Patienten konnte ausserdem eine Verbesserung des
Schluckvermögens, eine stabile Hörschärfe und eine verlangsamte
Verschlechterung des Mobilitätsindexes festgestellt werden [1].
In einer unkontrollierten Verlängerungsphase der OGT918-007-Studie
zeigten die dabei gewonnenen Daten, dass Miglustat bei wichtigen
Markern für neurologische Fehlfunktionen im Zusammenhang mit NPC eine
Krankheitsstabilisierung sowohl bei jugendlichen/erwachsenen als auch
bei pädiatrischen Kohorten herbeiführen kann. Diese Ergebnisse
stützen die Interpretation, dass in der kontrollierten Studienphase
nach Ablauf von zwölf Monaten mit Miglustat ein Behandlungseffekt
erzielt wurde [2,3].
Die Sicherheit und Verträglichkeit von dreimal täglich 200 mg
Miglustat entsprach den Ergebnissen aus früheren Studien im
Zusammenhang mit Typ-1-Gaucher-Krankheit, in denen nur die Hälfte
dieser Dosierung verabreicht worden war [1, 2, 3].
Eine erste retrospektive Kohortenstudie wurde an 25 Studienzentren in
zwölf Ländern durchgeführt. Dabei wurde die Veränderung des
neurologischen Status und der Behandlungsnutzen von Miglustat bei 66
NPC-Patienten untersucht, die ausserhalb der OGT918-007-Studie
durchschnittlich eineinhalb Jahre lang mit Miglustat behandelt
wurden. Die Bewertung des Schweregrades von Dysphagie (Schlucken),
Dystonie (Feinmotorik), Ataxie (Gangbild) und Dysarthrie
(Artikulationsfähigkeit) bei Diagnosestellung, Behandlungsbeginn und
letzter Konsultation wurde anhand einer krankheitsspezifischen
Behinderungsskala vorgenommen [4]. In Bezug auf diese vier Parameter
blieb die Mehrheit der Patienten nach Abschluss der Behandlung
zumindest stabil, was darauf hindeutet, dass Miglustat das
Fortschreiten neurologischer Manifestationen bei NPC-Patienten
klinisch positiv beeinflusst [4].
Eine zweite retrospektive Kohortenstudie wurde an sieben Zentren in
sechs Ländern durchgeführt. Ziel war die Erhebung von Daten bezüglich
der Veränderung des neurologischen Status bei 57 Patienten, deren
normaler Krankheitsverlauf ohne eine Verabreichung von Miglustat
durchschnittlich fünfeinhalb Jahre lang beobachtet wurde. Die Schwere
von Dysphagie, Dystonie, Ataxie und Dysarthrie zum Zeitpunkt der
Diagnose und der zuletzt erfolgten Konsultation wurde unter
Verwendung derselben Behinderungsskala gemessen. Die Ergebnisse
sollen im ersten Halbjahr 2009 vorgestellt werden.
Der Behandlungsnutzen von Zavesca® im Hinblick auf neurologische
Symptome bei Patienten mit Niemann-Pick Typ C sollte regelmässig,
beispielsweise halbjährlich, evaluiert werden. Nach wenigstens
einjähriger Behandlungsdauer sollte über eine Fortsetzung der
Therapie mit Zavesca® entschieden werden.
Über Zavesca® und Typ-1-Gaucher-Krankheit
Zavesca® (100 mg Miglustat in Kapselform) ist für die orale Therapie
von erwachsenen Patieten mit leichter bis mittelschwerer
Typ-1-Gaucher-Krankheit zugelassen. Zavesca® darf nur für die
Behandlung von Patienten mit Typ-1-Gaucher-Krankheit eingesetzt
werden, bei denen eine Enzymersatztherapie nicht in Betracht kommt.
Das Medikament ist in der Europäischen Union, den USA, Kanada, der
Schweiz, Brasilien, Australien, der Türkei und Israel zugelassen.
Sicherheitsinformationen zu Zavesca®
Bei mehr als 80% der mit Zavesca® behandelten Patienten wurden
Magen-Darm-Reaktionen, vor allem Diarrhoe, entweder zu Beginn der
Behandlung oder auch intermittierend, festgestellt. Diese verlaufen
mehrheitlich mild und verschwinden in der Regel nach den ersten
Behandlungswochen von selbst. In der klinischen Praxis zeigte sich,
dass die Diarrhoe durch eine Veränderung der Nahrungszusammensetzung
(Reduzierung der Einnahme von Lactose und anderer Kohlenhydrate), die
Einnahme von Zavesca® ausserhalb der Mahlzeiten und/oder die Einnahme
von Anti-Diarrhoe-Präparaten wie beispielsweise Loperamid unter
Kontrolle gebracht werden konnte. Bei einzelnen Patienten könnte eine
vorübergehende Herabsetzung der Dosis notwendig werden. Patienten mit
chronischer Diarrhoe oder anderen anhaltenden
Gastrointestinalbeschwerden, die auf diese Massnahmen nicht
reagieren, sollten gemäss klinischer Praxis untersucht werden.
Zavesca® ist bisher nicht bei Patienten mit einer
Krankheitsgeschichte schwerwiegender Gastrointestinalerkrankungen wie
chronisch-entzündlichen Darmerkrankungen untersucht worden.
Bei mit Zavesca® behandelten Patienten mit Typ-1-Gaucher-Krankheit
wurden Fälle von peripherer Neuropathie berichtet. Bei Patienten mit
Typ-1-Gaucher-Krankheit treten im Vergleich zur allgemeinen
Bevölkerung häufiger Fälle von peripherer Neuropathie auf. Alle
Patienten sollten sich zu Beginn einer Behandlung und danach in
regelmässigen Abständen einer neurologischen Untersuchung
unterziehen. Bei Patienten, die Symptome wie Taubheit oder Kribbeln
entwickeln, sollten Nutzen und Risiken der Behandlung sorgsam
abgeklärt werden.
Zavesca® kann bei schwangeren Frauen zu Missbildungen des ungeborenen
Lebens führen. Es darf deshalb nicht an Frauen, die schwanger sind
oder es werden können, abgegeben werden; Patienten sollten auf das
Risiko fötaler Missbildungen hingewiesen werden. Die Einnahme kann
bei Männern zur Unfruchtbarkeit führen. Während einer Therapie mit
Zavesca® und bis drei Monate nach Absetzen der Therapie sollten
deshalb Kontrazeptiva verwendet und keine Schwangerschaft geplant
werden.
Bei einigen prädiatrischen Patienten mit Niemann-Pick Typ C wurde in
der ersten Behandlungsphase mit Zavesca® ein verzögertes Wachstum
beobachtet, wobei die anfängliche verminderte Gewichtszunahme
möglicherweise mit einer verringerten Grössenzunahme korrelierte. Bei
pädiatrischen und heranwachsenden Patienten sollte während der
Behandlung mit Zavesca® das Wachstum überwacht und eine individuelle
Nutzen-Risikoabwägung hinsichtlich der Fortsetzung der Therapie
vorgenommen werden.
Bei einigen NPC-Patienten wurde im Verlauf der Behandlung mit
Zavesca® eine leichte Abnahme der Blutplättchen beobachtet, die nicht
mit Blutungen assoziiert war. Bei 40 bis 50 Prozent der Patienten,
die an der klinischen Studie teilnahmen, lagen die Thrombozytenwerte
bereits vor Behandlungsbeginn unter dem Normwert. Für diese Patienten
wird die Kontrolle der Thrombozytenwerte empfohlen.
Literaturhinweis
1. Patterson MC, Vecchio D, Prady H, Abel L and Wraith JE.
Miglustat for treatment of Niemann-Pick C disease: a randomised
controlled study. Lancet Neurol 2007; 6:765-772.
2. Patterson MC, Vecchio D, Prady H, Abel L and Wraith JE.
Miglustat for treatment of Niemann-Pick C disease: results of 24
month's treatment. Proceedings of 57th Annual meeting of the American
Society of Human Genetics, 2007; abstract # 2253.
3. Patterson MC, Vecchio D, Jacklin E and Wraith JE. Miglustat
in Niemann-Pick disease Type C (NPC): long-term data from a clinical
trial. Proceedings of 58th Annual meeting of the American Society of
Human Genetics, 2008; abstract # 766.
4. Pineda M, Wraith JE, Sedel F, et al. Miglustat in patients
with Niemann-Pick type C disease (NPC): a multicentre retrospective
survey. Journal of Inherited Metabolic Disease 2008; 31(Suppl 1) 98.
Note: this abstract describes the results of the survey with the
first 44 cases collected.
Actelion Ltd
Actelion Ltd ist ein biopharmazeutisches Unternehmen mit Hauptsitz in
Allschwil/Basel, Schweiz. Actelions erstes Medikament, Tracleer®, ist
ein zur Therapie der pulmonalen arteriellen Hypertonie zugelassener
dualer Endothelin-Rezeptor-Antagonist in Tablettenform. Actelion
vertreibt Tracleer® durch eigene Niederlassungen in den wichtigsten
internationalen Märkten, so den Vereinigten Staaten (mit Sitz in
South San Francisco), der Europäischen Union, Japan, Kanada,
Australien und der Schweiz. Actelion, 1997 gegründet, ist ein
weltweit führendes Unternehmen bei der Erforschung des Endothels. Das
Endothel trennt die Gefässwand vom Blutstrom. Mit über 1900
Mitarbeitenden konzentriert sich Actelion darauf, innovative
Medikamente in Bereichen mit hohem medizinischem Bedarf zu entdecken,
zu entwickeln und zu vermarkten. Actelion Aktien werden an der SIX
Swiss Exchange im Rahmen des Blue-chip-Index SMI (Swiss Market Index
SMI®) gehandelt (Symbol: ATLN).
Für weitere Informationen wenden Sie sich bitte an:
Roland Haefeli
Vice President, Head of Investor Relations & Public Affairs
Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil
+41 61 565 62 62
+1 650 624 69 36
http://www.actelion.com
--- Ende der Mitteilung ---
Actelion Pharmaceuticals Ltd
Gewerbestrasse 16 Allschwil
Schweiz
WKN: 936767 ; ISIN: CH0010532478; Index: SBIOM, SLIFE, SMCI, SMIEXP,
SMIM, SPI, SPIEX;
Notiert: Main Market in SIX Swiss Exchange;
http://hugin.info/131801/R/1285897/288482.pdf
http://www.actelion.com
Copyright © Hugin AS 2009. All rights reserved.
Quelle: dpa-AFX
02.02.2009 18:17
Die Geschäfte Actelions wachsen in diesem Jahr kräftig weiter, sagt CEO Jean-Paul Clozel. Um das Wachstum zu gewährleisten, wird in Allschwil fleissig ausgebaut und Personal eingestellt.
cash: Stimmt es, dass Sie noch immer einstellen, während anderorts kräftig entlassen wird?
Jean-Paul Clozel: Actelion braucht noch mehr Mitarbeiter, denn unser Geschäft wächst 2009 kräftig weiter. Zusätzliche Leute sind auch notwendig, um Entwicklungsprodukte zur Marktreife zu bringen.
Wie viele neue Arbeitsplätze entstehen bis Ende 2009?
Vergangenen November habe ich Ihnen gesagt, dass wir monatlich etwa 20 Leute einstellen. Dieses Tempo haben wir bis heute in etwa gehalten. Aktuell beschäftigt Actelion allein in der Schweiz rund 850 Mitarbeitende. Ende 2009 werden es voraussichtlich 150 Personen mehr, sprich gut 1000 Beschäftigte sein. Weltweit werden es wohl zwischen 2300 und 2400 Personen sein.
Welche Rolle spielt bei der Rekrutierung die Personenfreizügigkeit, über die nächstes Wochenende entschieden wird?
In der Schweiz finden wir nicht alle benötigten Spezialisten. Deshalb sind wir darauf angewiesen, die passenden Mitarbeiter auch im Ausland rekrutieren zu können. Wenn wir nicht die besten Leute bekommen würden, dann wäre für uns der Standort weniger attraktiv. Die Schweiz darf sich nicht von Europa und dem Rest der Welt isolieren.
Inwiefern spürt Actelion die Wirtschaftskrise?
Unser operatives Geschäft ist von der Krise nicht direkt betroffen. Wir haben ausreichend Cash, keine versteckten Risiken in der Bilanz und starke operative Cashflows. Wir brauchen kein Geld von Banken, um laufende Projekte zu finanzieren. Wir sehen aber, dass viele Biotechs nicht mal mehr für die nächsten drei Monate Geld haben, um zu überleben. Zahlreiche Jungunternehmen werden von der Bildfläche verschwinden. So kommen wiederum Fachkräfte auf den Markt, denen wir Stellen anbieten können.
In Krisenzeiten sind Firmen billig. Actelion hat eine prall gefüllte Kasse. Können Sie sich vorstellen, jetzt Firmen zu kaufen?
Wir schauen uns immer um, gehen dabei aber sehr selektiv vor. Leider sind die wirklich interessanten Unternehmen auch in der Krise nicht billig. Daher halten wir derzeit lieber Cash, um im schwierigen konjunkturellen Umfeld finanziell flexibel zu bleiben. Im Übrigen interessieren uns Produkte mehr als ganze Unternehmen.
Umgekehrt könnte Actelion auf der Einkaufsliste grosser Pharma-Konzerne stehen. Wie stehts um die Unabhängigkeit?
Actelion steht nicht zum Verkauf. Wir sind überzeugt, dass Unabhängigkeit der beste Weg ist, um innovativ zu bleiben und so für Patienten und Aktionäre Mehrwert zu schaffen.
Haben Sie die Ziele für das zurückliegende Geschäftsjahr erfüllen können?
Wir berichten am 19. Februar zum Geschäft und Fortschritt unserer Produktpipeline. Heute kann ich nur sagen, dass wir an unserer Prognose von 16 bis 19 Prozent Wachstum in Lokalwährungen für 2008 festhalten. Wir sind auf Kurs!
Konnten die Konkurrenzprodukte Letairis und Thelin das Wachstum von Actelions Hauptumsatzträger Tracleer im vergangenen Jahr beeinträchtigen?
Die Konkurrenz ist da, aber wir spüren sie nicht besonders. Wir haben kaum Marktanteile verloren und sind weiterhin Marktführer. Das Umsatzwachstum von Tracleer hat sich fortgesetzt.
Mit Partner Glaxo Smith Kline entwickeln Sie den Blockbuster-Kandidaten Almorexant. Wie gehts beim potenziellen Schlafmittel voran?
Mit Almorexant sind wir auf Kurs. Ende 2009 erwarten wir die Resultate aus dem ersten Teil der letzten Studien-Phase III. Unter der Voraussetzung, dass Sicherheit und Wirksamkeit bestätigt werden, könnten wir damit frühestens Ende 2011 auf den Markt kommen.
Actelion stemmte sich gegen den Börsentrend. Was bedeutet Ihnen die starke Aktien-Performance der letzten Monate?
Natürlich bin ich froh darüber. Doch unsere Erfolge sind noch nicht ausreichend im Kurs enthalten. Wir haben unsere Einnahmen in den letzten paar Jahren massiv gesteigert, mehrere Entwicklungsprojekte sind nahe der Marktreife, und der Kurs ist quasi gleich geblieben. Ohne die Krise wäre die Aktie wohl mehr wert.
Wie oft schauen Sie auf den Börsenticker?
Da schaue ich viel zu oft drauf (lacht). Man kommt ja auch nicht drum herum. Viel wichtiger ist mir aber, dass unsere Studien vorankommen und dass es unseren Leuten gut geht. So könnte Actelion in den nächsten zehn Jahren zu den drei weltweit grössten Biotech-Unternehmen aufschliessen. Mit einer innovativen Produktpipeline und einer sehr guten Firmenkultur.Wie zuversichtlich sind Sie, dass Actelion trotz konjunktureller Sorgen zunächst gut durchs 2009 kommen wird?Das laufende Jahr sollte ein gutes werden, was unsere Produktverkäufe betrifft. Sollten dann noch eine oder mehrere klinische Studien erfolgreich sein, so könnte es ein tolles Jahr werden, in dem Actelion sich auf einen noch steileren Erweiterungspfad begibt.
-------------------
Auf den Kurs sollte er bitte gar nicht schauen. Sonst einige gute Aussagen im Interview.
Die Geschäfte Actelions wachsen in diesem Jahr kräftig weiter, sagt CEO Jean-Paul Clozel. Um das Wachstum zu gewährleisten, wird in Allschwil fleissig ausgebaut und Personal eingestellt.
cash: Stimmt es, dass Sie noch immer einstellen, während anderorts kräftig entlassen wird?
Jean-Paul Clozel: Actelion braucht noch mehr Mitarbeiter, denn unser Geschäft wächst 2009 kräftig weiter. Zusätzliche Leute sind auch notwendig, um Entwicklungsprodukte zur Marktreife zu bringen.
Wie viele neue Arbeitsplätze entstehen bis Ende 2009?
Vergangenen November habe ich Ihnen gesagt, dass wir monatlich etwa 20 Leute einstellen. Dieses Tempo haben wir bis heute in etwa gehalten. Aktuell beschäftigt Actelion allein in der Schweiz rund 850 Mitarbeitende. Ende 2009 werden es voraussichtlich 150 Personen mehr, sprich gut 1000 Beschäftigte sein. Weltweit werden es wohl zwischen 2300 und 2400 Personen sein.
Welche Rolle spielt bei der Rekrutierung die Personenfreizügigkeit, über die nächstes Wochenende entschieden wird?
In der Schweiz finden wir nicht alle benötigten Spezialisten. Deshalb sind wir darauf angewiesen, die passenden Mitarbeiter auch im Ausland rekrutieren zu können. Wenn wir nicht die besten Leute bekommen würden, dann wäre für uns der Standort weniger attraktiv. Die Schweiz darf sich nicht von Europa und dem Rest der Welt isolieren.
Inwiefern spürt Actelion die Wirtschaftskrise?
Unser operatives Geschäft ist von der Krise nicht direkt betroffen. Wir haben ausreichend Cash, keine versteckten Risiken in der Bilanz und starke operative Cashflows. Wir brauchen kein Geld von Banken, um laufende Projekte zu finanzieren. Wir sehen aber, dass viele Biotechs nicht mal mehr für die nächsten drei Monate Geld haben, um zu überleben. Zahlreiche Jungunternehmen werden von der Bildfläche verschwinden. So kommen wiederum Fachkräfte auf den Markt, denen wir Stellen anbieten können.
In Krisenzeiten sind Firmen billig. Actelion hat eine prall gefüllte Kasse. Können Sie sich vorstellen, jetzt Firmen zu kaufen?
Wir schauen uns immer um, gehen dabei aber sehr selektiv vor. Leider sind die wirklich interessanten Unternehmen auch in der Krise nicht billig. Daher halten wir derzeit lieber Cash, um im schwierigen konjunkturellen Umfeld finanziell flexibel zu bleiben. Im Übrigen interessieren uns Produkte mehr als ganze Unternehmen.
Umgekehrt könnte Actelion auf der Einkaufsliste grosser Pharma-Konzerne stehen. Wie stehts um die Unabhängigkeit?
Actelion steht nicht zum Verkauf. Wir sind überzeugt, dass Unabhängigkeit der beste Weg ist, um innovativ zu bleiben und so für Patienten und Aktionäre Mehrwert zu schaffen.
Haben Sie die Ziele für das zurückliegende Geschäftsjahr erfüllen können?
Wir berichten am 19. Februar zum Geschäft und Fortschritt unserer Produktpipeline. Heute kann ich nur sagen, dass wir an unserer Prognose von 16 bis 19 Prozent Wachstum in Lokalwährungen für 2008 festhalten. Wir sind auf Kurs!
Konnten die Konkurrenzprodukte Letairis und Thelin das Wachstum von Actelions Hauptumsatzträger Tracleer im vergangenen Jahr beeinträchtigen?
Die Konkurrenz ist da, aber wir spüren sie nicht besonders. Wir haben kaum Marktanteile verloren und sind weiterhin Marktführer. Das Umsatzwachstum von Tracleer hat sich fortgesetzt.
Mit Partner Glaxo Smith Kline entwickeln Sie den Blockbuster-Kandidaten Almorexant. Wie gehts beim potenziellen Schlafmittel voran?
Mit Almorexant sind wir auf Kurs. Ende 2009 erwarten wir die Resultate aus dem ersten Teil der letzten Studien-Phase III. Unter der Voraussetzung, dass Sicherheit und Wirksamkeit bestätigt werden, könnten wir damit frühestens Ende 2011 auf den Markt kommen.
Actelion stemmte sich gegen den Börsentrend. Was bedeutet Ihnen die starke Aktien-Performance der letzten Monate?
Natürlich bin ich froh darüber. Doch unsere Erfolge sind noch nicht ausreichend im Kurs enthalten. Wir haben unsere Einnahmen in den letzten paar Jahren massiv gesteigert, mehrere Entwicklungsprojekte sind nahe der Marktreife, und der Kurs ist quasi gleich geblieben. Ohne die Krise wäre die Aktie wohl mehr wert.
Wie oft schauen Sie auf den Börsenticker?
Da schaue ich viel zu oft drauf (lacht). Man kommt ja auch nicht drum herum. Viel wichtiger ist mir aber, dass unsere Studien vorankommen und dass es unseren Leuten gut geht. So könnte Actelion in den nächsten zehn Jahren zu den drei weltweit grössten Biotech-Unternehmen aufschliessen. Mit einer innovativen Produktpipeline und einer sehr guten Firmenkultur.Wie zuversichtlich sind Sie, dass Actelion trotz konjunktureller Sorgen zunächst gut durchs 2009 kommen wird?Das laufende Jahr sollte ein gutes werden, was unsere Produktverkäufe betrifft. Sollten dann noch eine oder mehrere klinische Studien erfolgreich sein, so könnte es ein tolles Jahr werden, in dem Actelion sich auf einen noch steileren Erweiterungspfad begibt.
-------------------
Auf den Kurs sollte er bitte gar nicht schauen. Sonst einige gute Aussagen im Interview.
19.02.2009 07:00:00
Actelion gibt Ergebnisse für das Jahr 2008 bekannt
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin. Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
-------------------------------------------------------------------
Nettoumsatz bei CHF 1.473,5 Millionen, ein Anstieg um 20 Prozent in lokalen Währungen und 12 Prozent in Schweizer Franken - Umsatz von Tracleer® bei CHF 1.294,1 Millionen, ein Plus von 17 Prozent in lokalen Währungen und von 10 Prozent in Schweizer Franken - Cash EBIT erreicht CHF 476,8 Millionen, ein Anstieg um 16 Prozent in lokalen Währungen und um 1 Prozent in Schweizer Franken - Vier laufende Phase-III-Programme in 2009 - Projekte in der frühen Entwicklungsphase machen Fortschritte, inklusive einer positiven Studie mit dem oral wirksamen CRTH2-Rezeptor-Antagonisten bei Asthma-Patienten - Weitere innovative Substanzen sollten 2009 in die Entwicklung übergehen
ALLSCHWIL/BASEL, SCHWEIZ - 19. Februar 2009 - Actelion Ltd (SIX: ATLN) gab heute die Finanzergebnisse für das Jahr 2008 bekannt. Mit einem Nettoumsatz in Höhe von insgesamt CHF 1.473,5 Millionen für das Jahr 2008 (2007: CHF 1.317,4 Mio.) und einem betrieblichen Aufwand von CHF 1.102,2 Millionen (2007: 1.174,8 Mio.) - erwirtschaftete das Unternehmen einen Betriebsgewinn von CHF 371,4 Millionen (2007: CHF 142,6 Mio.). Um die betriebliche Leistung des Unternehmens besser messen und vergleichen zu können, weist Actelion weiterhin den non-US GAAP Cash EBIT aus (Betriebsergebnis ausschliesslich IPR&D, Aufwendungen in Verbindung mit Aktienoptionen für Mitarbeitende nach FAS 123R sowie Aufwendungen für nicht-liquiditätswirksame Abschreibungen und Amortisationen). Im Jahr 2008 erzielte Actelion einen Cash-EBIT in Höhe von CHF 476,8 Millionen, was einen Anstieg um 1 Prozent gegenüber dem Vorjahr bedeutet. In lokalen Währungen stieg der Cash-EBIT um 16 Prozent. Der angepasste verwässerte Gewinn pro Aktie (EPS) lag im Jahr 2008 bei CHF 3,40 gegenüber CHF 3,57 im Jahr 2007. Gemäss US GAAP lag der Reingewinn für 2008 bei CHF 321,5 Millionen (2007: CHF 124,6 Mio.). Der vollständig verwässerte Gewinn pro Aktie (EPS) belief sich für 2008 auf CHF 2,60 gegenüber CHF 1,00 im Jahr 2007. Dr. Jean-Paul Clozel, Chief Executive Officer, kommentierte: "Im Jahr 2008 hat Actelion in allen wichtigen Bereichen erfolgreiche Arbeit geleistet. Trotz zunehmender Konkurrenz wachsen unsere Produkte weiter. Das Ergebnis unserer Anstrengungen in Vorklinik und Klinik ist eine breit gefächerte Pipeline. Zehn Substanzen befinden sich derzeit in Untersuchungen am Menschen." Jean-Paul Clozel fügte hinzu: "Durch die Verstärkung unserer weltweiten Infrastruktur und die Rekrutierung einiger der besten Kräfte in der Industrie ist Actelion gerüstet, auch 2009 weiter seinen Wachstumskurs fortzusetzen. Ich gehe von weiter steigenden Produkteumsätzen aus und erwarte, dass zusätzliche Substanzen erstmals am Menschen klinisch erprobt werden. Für zwei der vier Phase-III-Programme werden Ende dieses Jahres die abschliessenden Ergebnisse vorliegen. Damit könnte 2009 nicht nur ein Wachstumsjahr, sondern auch ein Jahr des Wandels für Actelion werden." Jean-Paul Clozel schloss: "Ich bin sehr zufrieden mit dem Fortschritt unserer Pipeline insgesamt. Besonders beeindruckt bin ich dabei von den herausragenden Ergebnissen unseres CRTH2-Rezeptor-Antagonisten, der das Potenzial für einen therapeutischen Durchbruch sowohl bei Asthma als auch bei anderen allergischen Erkrankungen besitzt. Wir prüfen die beste geschäftliche Option, um den potenziellen Wert dieser Substanz voll auszuschöpfen." Andrew J. Oakley, Chief Financial Officer, erklärte: "Die finanzielle Leistung von Actelion im Jahr 2008 hat dank der Produkteumsätze, die besser ausfielen als prognostiziert, und dank verbesserter Nutzung unserer operativen Mittel unsere Erwartungen übertroffen. Der Betriebsaufwand stieg in Einklang mit unserer weiterhin verfolgten Strategie, wesentlich in Innovationen zu investieren. Das Ausmass unseres Erfolgs wird allerdings von der Stärke des Schweizer Frankens überschattet, wie am Cash EBIT abzulesen ist, der um 16 Prozent in lokalen Währungen im Vergleich zu 1 Prozent in Schweizer Franken stieg." Andrew J. Oakley fügte hinzu: "Sofern keine unvorhersehbaren Ereignisse auftreten, geht Actelion davon aus, dass auch 2009 ein weiteres Wachstumsjahr werden wird und der Gesamtnettoumsatz - in lokalen Währungen - zwischen 12 bis 15 Prozent wachsen wird. Auch für den Cash EBIT wird ein Anstieg - in lokalen Währungen - von 9 bis 11 Prozent prognostiziert." Andrew J. Oakley schloss: "In Anbetracht unseres anhaltenden Wachstums und unserer starken Bilanz verfügt Actelion über sämtliche Mittel zur vollumfänglichen Finanzierung seiner laufenden Expansion. Gleichzeitig sind wir darauf vorbereitet, Gelegenheiten wahrnehmen zu können, falls innovative Produkte auf dem Markt erhältlich sein sollten." Finanzergebnisse im Überblick - Tabelle 2008 vs. 2007 In CHF Tausend Ergebnisse Ergebnisse Veränderung % 2008 2007 Nettoumsatz 1 473 508 1 317 392 156 116 12 Betriebsaufwand 1 102 1 174 (72 639) (6) 151(1) 790(2) Betriebsgewinn 371 357 142 602 228 755 160 Cash EBIT 476 833 471 443 5 390 1 Reingewinn 321 490 124 586 196 904 158 Verwässerter Gewinn pro Aktie (EPS) in CHF 2,60 1,00 1,60 160 Anzahl Aktien zur 123,418 124,809 - - Berechnung Mio. Mio. (1) Ein Teil der Aufwendungen für F&E hängt mit den im 1. Halbjahr 2008 an Nippon Shinyaku geleisteten Meilensteinzahlungen zusammen (zu den Einzelheiten siehe Anmerkungen zum Jahresabschluss 2008). (2) Darin eingeschlossen ist ein einmaliger, im ersten Quartal 2007 infolge der Akquisition von CoTherix angefallener IPR&D-Aufwand in Höhe von CHF 224,8 Millionen.
Die vollständige Konzernrechnung finden Sie unter http://www.actelion.com.
Anhaltendes Wachstum des Nettoumsatzes Für das Gesamtjahr 2008 verzeichnete Actelion einen Nettoumsatz von CHF 1.473,5 Millionen (2007: CHF 1.317,4 Mio.), ein Anstieg um 12 Prozent gegenüber dem Vorjahr. In lokalen Währungen stieg der Gesamtnettoumsatz um 20 Prozent. Die Einkünfte aus vertraglichen Vereinbarungen stiegen im selben Zeitraum um 76 Prozent, im Wesentlichen infolge der Zurechnung der Einkünfte aus der von GSK erhaltenen Vorauszahlung, die mit Beginn der Kooperation von Actelion und GSK fällig wurde. Actelion ging diese exklusive, weltweite Kooperation (mit Ausnahme Japans) für seinen Orexin-Rezeptor-Antagonisten Almorexant ein, dem ersten Präparat seiner Klasse. Almorexant wird zurzeit in der klinischen Phase III zur Behandlung der primären Insomnie untersucht. Einzelheiten zu dieser Kooperation können der von Actelion und GSK am Montag, 14. Juli 2008 gemeinsam herausgegebenen Pressemitteilung entnommen werden. Produkteumsätze Im Jahr 2008 belief sich der Umsatz von Tracleer® (Bosentan) auf CHF 1.294,1 Millionen (2007: CHF 1.178,6 Mio.), ein Anstieg um 10 Prozent im Vergleich zum Vorjahr. In lokalen Währungen stieg der Umsatz von Tracleer® um 17 Prozent gegenüber dem Vorjahr. Ende Dezember 2008 war Tracleer® in über 50 Ländern weltweit auf dem Markt erhältlich, darunter in allen wichtigen pharmazeutischen Märkten. Mit den für die kommenden Quartale vorgesehenen Einführungen wird Actelion die Verfügbarkeit von Tracleer® im Markt weiter ausbauen. Neben dem Aus- und Aufbau einer eigenen Vertriebsinfrastruktur in China und Russland baut Actelion seinen bestehenden Aussendienst in allen Regionen der Welt weiter aus, um die aktuelle Wachstumsdynamik von Tracleer® zu nutzen und die Expansion des PAH-Marktes weiter voranzutreiben. In der Europäischen Union wurden zusätzliche Ressourcen bereitgestellt, um die neue Indikation von Tracleer® zur Behandlung digitaler Ulzerationen bei Sklerodermie-Patienten zu unterstützen, mit deren Kommerzialisierung 2008 in einzelnen Ländern begonnen wurde. Im August 2008 erhielt Tracleer® (Bosentan) in der Europäischen Union eine Indikationserweiterung für die Behandlung von Patienten mit milder symptomatischer pulmonaler Hypertonie (PAH) der WHO-Funktionsklasse II (FC II). Tracleer® ist das einzige PAH-Therapeutikum, das in einer klinischen Studie untersucht wurde, an der ausschliesslich Patienten mit milder symptomatischer PAH der WHO-Funktionsklasse II teilnahmen. Diese randomisierte, plazebokontrollierte Doppelblindstudie mit 185 Patienten bildete die Basis für die EU-Zulassung. Die Ergebnisse aus der EARLY-Studie (Endothelin Antagonist tRial in miLdlY symptomatic PAH patients) wurden im Juni 2008 in "The Lancet" veröffentlicht. (Galiè N, Rubin LJ, Hoeper MM et al. Treatment of patients with mildly symptomatic pulmonary arterial hypertension with bosentan (EARLY study): a double-blind, randomised controlled trial. The Lancet 2008; 371: 2093-2100). Die behördlichen Prüfungen dieser Indikation laufen derzeit auch in anderen Regionen einschliesslich der USA. Der Umsatz von Ventavis® (Iloprost) belief sich im Jahr 2008 auf CHF 94,6 Millionen. In lokalen Währungen stieg der Umsatz von Ventavis® um 34 Prozent. Das Unternehmen geht davon aus, dass zusätzliche Programme zur Unterstützung von Patienten und die verbesserte Applikationshilfe für Ventavis® zum anhaltenden Umsatzwachstum geführt haben. Derzeit wird eine klinische Studie, PROWESS 15, durchgeführt, die belegen soll, dass eine Einzeldosis Iloprost (mit der Applikationshilfe Power 15 verabreicht) im Vergleich zu Plazebo die Leistungsfähigkeit von PAH-Patienten steigert. Dies ist ein weiteres Beispiel für Actelions anhaltendes Engagement. Otto Schwarz, President Business Operations, kommentierte: "Unsere Produkte haben am Markt trotz wachsender Konkurrenz im Bereich PAH gute Ergebnisse und Zuwächse in allen Märkten weltweit erzielt. Diese hervorragende Leistung ist das Ergebnis sehr starker Produktdaten und deren Kommunikation über eine weltweit etablierte, hochprofessionelle und engagierte Marketing- und Vertriebsorganisation." Der Umsatz von Zavesca® (Miglustat) belief sich im Jahr 2008 auf CHF 40,1 Millionen (2007: CHF 35,3 Mio.). In lokalen Währungen stieg der Umsatz von Zavesca® um 20 Prozent. Zavesca® ist in über 35 Ländern, einschliesslich der Vereinigten Staaten und den meisten europäischen Märkten, kommerziell erhältlich. Die unlängst veröffentlichten Daten zu den positiven Wirkungen von Zavesca® auf Knochenmanifestationen bei Typ-1-Gaucher-Krankheit haben 2008 ihren Niederschlag als Ergänzungen der SmPC (Summary of Product Characteristics, Zusammenfassung der Merkmale eines Arzneimittels) in der EU gefunden. Im Januar 2009 erhielt Zavesca® (Miglustat) die Zulassung in der europäischen Union für die Behandlung progressiver neurologischer Symptome bei Erwachsenen und Kindern mit der Niemann-Pick Typ C-Krankheit (NPC). Zavesca® ist das erste Präparat, das in dieser Indikation eine Zulassung erhält. Niemann-Pick Typ C ist eine sehr seltene und verheerende genetisch bedingte neurodegenerative Erkrankung, an der sowohl Kinder als auch Erwachsene leiden. Otto Schwarz schloss: "Im Jahr 2008 konnten wir unsere weltweite Präsenz weiter verstärken, indem wir unseren Aussendienst ausgebaut haben und eine bessere Abstimmung der Ressourcen im Hauptsitz erreichen konnten, um vorhandene Produkte zu unterstützen und die Einführung neuer Produkte vorzubereiten. Actelion ist daher bestens vorbereitet, in seinem bestehenden Kernmarkt PAH erfolgreich zu bleiben und zudem in neue Märkte vorzustossen oder neue Märkte zu schaffen, zunächst mit Zavesca® in der Indikation NPC in Europa." Betrieblicher Aufwand Für 2008 belief sich der betriebliche Aufwand auf CHF 1.102,2 Millionen (2007: CHF 1.174,8 Mio.). Im selben Zeitraum stiegen die Kosten für Forschung und Entwicklung um 28 Prozent auf CHF 374,5 Millionen (2007: CHF 292,1 Mio.). Dieser Anstieg steht in Einklang mit den fortgesetzten Investitionen in eine rasch wachsende Pipeline und schliesst in der ersten Jahreshälfte 2008 geleistete Meilensteinzahlungen an Nippon Shinyaku für den PGI2-Rezeptor-Agonisten mit ein. Forschung und Entwicklung Die Pipeline von Actelion enthält derzeit 10 Substanzen in der klinischen Entwicklung sowie mehr als 25 aktive Projekte in der Forschung. Dr. Isaac Kobrin, Leiter der Entwicklung bei Actelion, kommentierte: "Ende 2008 sind die klinischen Entwicklungsprogramme bei Actelion rasch vorangekommen und weiter ausgebaut worden. Annähernd 8.300 Patienten und gesunde Freiwillige sind für die Teilnahme an über 75 klinischen Studien vorgesehen. Zudem haben wir sichergestellt, dass wir darauf vorbereitet sind, bei erfolgreichen klinischen Daten aus unseren am weitesten fortgeschrittenen Phase-III-Programmen rasch an die Gesundheitsbehörden herantreten zu können. Dabei handelt es sich um Bosentan (Tracleer®) bei idiopathischer pulmonaler Fibrose und Clazosentan (Pivlaz®) bei Gefässspasmen nach aneurysmatischen Subarachnoidalblutungen." Insgesamt verfolgt Actelion zurzeit vier laufende Phase-III-Programme: Almorexant bei primärer Insomnie: Im Rahmen der ersten Phase-III-Studie als Bestandteil des RESTORA-Programms wurde mit der Patientenrekrutierung begonnen. Das Design der Studie ist darauf ausgelegt die Sicherheit und Wirksamkeit von Almorexant bei Patienten mit primärer Insomnie zu evaluieren. Die 700 Patienten umfassende Studie RESTORA 1 umfasst einen Studienarm mit der Referenzsubstanz Zolpidem, welches für die Insomniebehandlung zugelassen ist. Erste Studienergebnisse werden für die zweite Jahreshälfte 2009 erwartet. Mit der US-amerikanischen Arzneimittelbehörde FDA wurden nach Abschluss der Phase II Gespräche geführt, in deren Verlauf Actelion der FDA zusätzliche Daten zur Sicherheit vorlegte, die über einen Zeitraum von vier Wochen mit gesunden Freiwilligen gewonnen wurden, sowie die Ergebnisse einer erfolgreichen Dosisfindungsstudie mit Almorexant bei älteren Patienten. Im Rahmen der Kooperation von Actelion und GSK dürften weitere klinische Studien mit Almorexant nach Abschluss der Gespräche mit der FDA basierend auf dem ,Special Protocol Assessment' und der Ergebnisse zusätzlicher Studien aufgenommen werden. Bosentan (Tracleer®) bei IPF: Diese multizentrische, randomisierte, plazebokontrollierte, parallelisierte, auf klinische Ereignisse ausgerichtete Doppelblindstudie zu Morbidität und Mortalität (BUILD-3) evaluiert die Sicherheit und Wirksamkeit von Bosentan 125 mg b.i.d. bei Patienten mit idiopathischer pulmonaler Fibrose. Die Patientenrekrutierung für BUILD-3 wurde im November 2008 mit 616 Patienten abgeschlossen. Die erste Zwischenanalyse für BUILD-3 (bei Vorliegen von 50% der als primäre Endpunkte definierten Ereignisse) fand am 17. Februar 2009 statt. Das unabhängige Data and Safety Monitoring Board (DSMB) empfahl die Fortführung der Studie. Abschliessende Ergebnisse der Studie könnten Ende 2009 vorliegen. Clazosentan bei SAB (aneurysmatische Subarachnoidalblutungen): Die Phase-III-Studie CONSCIOUS-2 (Clazosentan to Overcome Neurological iSCHemia and Infarct OccUrring after Subarachnoid hemorrhage - Clazosentan zur Verhinderung von neurologischer Ischämie oder Infarkt nach Subarachnoidalblutung) untersucht die Sicherheit und Wirksamkeit dieses intravenös zu verabreichenden Endothelin-Rezeptor-Antagonisten über den primären Endpunkt der Gesamtmortalität und der Vasospasmus-bedingten Morbidität. Hierzu zählen Vasospasmus-bedingte Verschlechterung der neurologischen Parameter, Vasospasmus-bedingte neue Hirninfarkte, die Einleitung von Notfallmassnahmen im Zusammenhang mit auftretenden Gefässspasmen oder das Eintreten des Todes, unabhängig von dessen Ursache. Derzeit läuft die Patientenrekrutierung für CONSCIOUS-2 in Zentren in über 25 Ländern in der europäischen Union, Kanada, Asien, Australien und Neuseeland. Ende Januar 2009 hat Actelion zudem weitere klinische Zentren in den Vereinigten Staaten in die Studie aufgenommen. Rekrutierungsziel der Studie sind 765 Patienten mit SAB, deren Aneurysma durch operatives Clipping behandelt wurde. Studienergebnisse könnten möglicherweise in der zweiten Jahreshälfte 2009 vorliegen. Bei positivem Ausgang wird Actelion an die Regulierungsbehörden herantreten, um die Zulassung zu beantragen. Eine zweite Phase-III-Studie, CONSCIOUS-3, wurde initiiert, um die Sicherheit und Wirksamkeit von zwei Dosierungen (5 oder 15 mg/h) Clazosentan im Vergleich zu Plazebo bei Patienten zu untersuchen, die nach Auftreten von SAB mit endovaskulärem Coiling behandelt wurden. Der primäre Endpunkt ist ähnlich dem bei CONSCIUS-2, d.h. Verringerung der durch zerebrale Gefässspasmen bedingten Morbidität und Gesamtmortalität über einen Zeitraum von sechs Wochen. Der Start der Patientenrekrutierung für CONSCIOUS-3 in rund 150 Zentren ist für das zweite Quartal 2009 vorgesehen; Ziel ist die Rekrutierung von 1.500 Patienten. Macitentan bei PAH: Das multizentrische, doppelblinde, randomisierte, plazebokontrollierte, parallelisierte und auf klinische Ereignisse ausgerichtete zulassungsrelevante SERAPHIN-Programm untersucht die Sicherheit und Wirksamkeit dieses hochpotenten, auf das Gewebe zielenden Endothelin-Rezeptor-Antagonisten im Hinblick auf Morbidität und Gesamtmortalität bei Patienten mit symptomatischer PAH als primärem Endpunkt. Derzeit läuft die weltweite Patientenrekrutierung, über 200 der geplanten 525 Patienten sind in die Studie aufgenommen worden. Dies ist die grösste Studie mit PAH-Patienten und die erste, die von Anfang an einen klar definierten primären Endpunkt zu Morbidität/Mortalität einschliesst. Isaac Kobrin fügte hinzu: "Ich bin sehr zufrieden damit, dass Actelion nach dem erfolgreichen Abschluss der 'Proof-of-concept'-Studie bei Asthma-Patienten nun auch die fortgeschrittene klinische Entwicklung unseres CRTH2-Rezeptor-Antagonisten, dem ersten Präparat einer neuen Arzneimittelklasse, in Angriff nehmen kann." In einem früheren Stadium der klinischen Entwicklung befinden sich die folgenden Programme: CRTH2-Rezeptor-Antagonist: In einer "Proof-of-mechanism"-Studie mit dem oral wirksamen CRTH2-Rezeptor-Antagonisten bei mildem Asthma ergaben sich positive Daten. In präklinischen Studien verhinderte diese Wirksubstanz die Migration und Aktivierung von Zelltypen, die massgeblich an Entzündungsprozessen beteiligt sind. In der 18 Patienten umfassenden plazebokontrollierten doppelblinden Crossover-Studie wurde der primäre Endpunkt (Einsekundenkapazität FEV1) erreicht und der Wirkstoff zeigte eine gute Verträglichkeit. Die Ergebnisse legen nahe, mit dieser neuartigen Wirksubstanz das komplette Entwicklungsprogramm der Phase-II bei Asthma durchzuführen. Miglustat bei zystischer Fibrose: Diese Substanz durchläuft derzeit eine "Proof-of-concept"-Studie der Phase IIa im Anschluss an vorklinische Befunde, die mögliche krankheitsmodifizierende Eigenschaften erkennen lassen. (Antigny F., Norez C., Becq F. and Vandebrouck C. Calcium homeostasis is abnormal in cystic fibrosis airway epithelial cells but is normalized after rescue of F508del-CFTR. Cell Calcium. 43, 175-83; 2008). Ergebnisse werden später im ersten Quartal 2009 erwartet. Von diesen Ergebnissen, sofern positiv, werden Notwendigkeit, Umfang und Dauer zukünftiger Studien abhängen. Macitentan bei IPF: Actelion beabsichtigt die Aufnahme eines klinischen Entwicklungsprogramms mit diesem hochpotenten, auf das Gewebe zielenden Endothelin-Rezeptor-Antagonisten bei idiopathischer pulmonaler Fibrose. Der Start einer randomisierten, multizentrischen Doppelblindstudie zur Untersuchung der Wirksamkeit und Sicherheit von Macitentan bei IPF-Patienten ist für das zweite Quartal 2009 vorgesehen und soll das Konzept des dualen Endothelin-Rezeptor-Antagonismus bei IPF untermauern. PGI2-Rezeptor-Agonist: Dieser oral aktive Non-Prostanoid-PGI2-Rezeptor-Agonist ist das erste Präparat einer neuen Arzneimittelklasse und wies in Phase I eine gute Verträglichkeit auf. Die Patientenrekrutierung für eine Phase-IIa-Studie mit PAH-Patienten wurde abgeschlossen, Ergebnisse werden im 3. Quartal 2009 erwartet. Der Beginn einer Phase-IIb-Studie ist für die kommenden Monate vorgesehen. Selektiver S1P1-Rezeptor-Agonist: Actelion und Roche sind übereingekommen, dass die Daten aus Vorklinik und Klinik einen Übergang des selektiven S1P1-Rezeptor-Agonisten von Actelion, dem ersten Präparat einer neuen Klasse von Arzneimitteln, in die klinische Entwicklung der Phase II nahe legen. Actelion hat eine "Proof-of-concept"-Studie bei Psoriasis gestartet und die Aufnahme einer Phase-IIb-Studie bei Multipler Sklerose für die kommenden Monate vorgesehen. Renin-Inhibitor: Auf Grundlage der Ergebnisse aus verschiedenen klinischen Studien hat die Renin-Allianz mit Merck & Co., Inc. (über eine Tochterfirma) entschieden, eine bislang nicht bekannt gegebene, bereits in der klinischen Entwicklung befindliche Substanz weiter voranzubringen und damit den ersten Wirkstoff, der im Dezember 2007 in Phase IIa eingetreten war, zu ersetzen. Eine Reihe von Phase-I-Studien wurde durchgeführt, unter anderem Untersuchungen zu Pharmakokinetik und Pharmakodynamik und Studien zu Wechselwirkungen mit anderen Arzneimitteln. Im Rahmen der Kooperation sind die Anstrengungen darauf gerichtet die für diese Arzneimittelklasse beste Renin-Inhibition zu erreichen. Dabei sollen neben der neuen Substanz auch weitere Wirkstoffe geprüft werden. Der Einsatz von Actelion im Bereich der Forschung mit mehr als 25 aktiven Projekten hat zu drei Wirksubstanzen geführt, die sich zum Jahresende 2008 in der präklinischen Untersuchung befanden. Daneben besteht die Möglichkeit, im Lauf des Jahres 2009 mehrere andere präklinische Entwicklungskandidaten auszuwählen. Im Jahr 2008 reichte das Unternehmen 52 Prioritätsanmeldungen für Patente ein. Walter Fischli, Co-Head Drug Discovery bei Actelion, kommentierte: "Wir profitieren auch weiterhin von unserer Erfahrung mit unseren Plattformen für bestimmte Targets. Mit der Ausweitung unseres Plattform-Ansatzes auf Ionenkanäle und Antibiotika und unseren anhaltenden Investitionen in die Screening-Technologie gehen wir davon aus, unsere hohe Produktivität auch in Zukunft halten zu können. 2008 konnten wir unsere hohe Produktivität in der Forschung mit dem Einreichen von mehr als 50 Prioritätsanmeldungen für Patente demonstrieren." Martine Clozel, Co-Head Drug Discovery bei Actelion, fügte hinzu: "Mehrere innovative Substanzen befinden sich in den letzten Stadien der präklinischen Entwicklung und wir gehen davon aus, dass einige dieser Substanzen 2009 weiter vorankommen werden. Wie immer konzentrieren wir uns auf Substanzen mit einzigartigem Wirkmechanismus für Bereiche mit hohem ungedecktem medizinischen Bedarf." Die Aufwendungen für Verkauf sowie allgemeine und administrative Ausgaben beliefen sich im Jahr 2008 auf CHF 550,0 Millionen (2007: CHF 500,1 Mio.), ein Anstieg um 10 Prozent, der darauf zurückzuführen ist, dass das Unternehmen auch weiterhin bei allen drei vermarkteten Produkten das Bewusstsein für diese Erkrankungen fördern will. Die Infrastruktur zur Unterstützung unseres operativen Geschäfts wuchs entsprechend der Expansion des Unternehmens. Betriebsgewinn Der Betriebsgewinn von Actelion im Jahr 2008 belief sich auf CHF 371,4 Millionen (2007: CHF 142,6 Mio.). Der Cash EBIT für denselben Zeitraum betrug CHF 476,8 Millionen (2007: CHF 471,4 Mio.), ein Anstieg um 1 Prozent in Schweizer Franken und um 16 Prozent in lokalen Währungen. Reingewinn Im Jahr 2008 ergab sich ein Reingewinn in Höhe von CHF 321,5 Millionen (2007: CHF 124,6 Mio.). Darin enthalten sind Zinserträge von CHF 21,8 Millionen, Zinsaufwendungen von CHF 6,6 Millionen, eine nicht-liquiditätswirksame Belastung von CHF 1,7 Millionen durch die Wandelanleihe, Währungsverluste in Höhe von CHF 31,9 Millionen (hauptsächlich aufgrund von Bewertungsverlusten auf Forderungen gegenüber Gruppengesellschaften) sowie Einkommensteuern in Höhe von CHF 31,4 Millionen. Liquide Mittel und Cashflow Im Jahr 2008 erwirtschaftete Actelion einen Cashflow aus dem operativen Geschäft in Höhe von CHF 513,7 Millionen (2007: CHF 394,2 Mio.). Per 31. Dezember 2008 beliefen sich die liquiden Mittel (mit Ausnahme eigener Aktien) auf CHF 1.131,7 Millionen. Deutliche personelle Verstärkung Zum Jahresende 2008 beschäftigte Actelion weltweit 1.907 Mitarbeitende, ein Anstieg um mehr als 300 gegenüber dem Jahresende 2007. Von diesen 1.907 Mitarbeitenden waren 862 in der Schweiz beschäftigt. Actelion geht davon aus, die Anzahl der weltweit im Unternehmen Beschäftigten im Jahr 2009 auf rund 2.350 Mitarbeitende zu steigern. In der Schweiz wird Actelion per Ende 2009 voraussichtlich mehr als 1.000 Mitarbeitende beschäftigen. Geschäftsbericht Eine umfassende Darstellung zu den im Jahr 2008 gemachten Fortschritten kann dem Geschäftsbericht 2008 von Actelion entnommen werden. Dieser Bericht besteht aus zwei separaten Teilen: "In Brief" gibt einen Überblick über die Höhepunkte des Jahres 2008. "In Detail" ist ein Nachschlagewerk zu allen Aktivitäten von Actelion einschliesslich der vollständig geprüften Jahresrechnung. Der Geschäftsbericht 2008 kann über www.actelion.com heruntergeladen werden. Zu Dokumentationszwecken - Tabelle 4. Quartal 2008 vs. 3.Quartal 2008 In CHF Tausend Ergebnisse Ergebnisse Veränderung % 4.Quartal 3.Quartal 2008 2008 Nettoumsatz 403 888 393 638 10 250 3 Betriebsaufwand 307 727 255 658 52 069 20 - Forschung und 96 939 76 351 20 588 27 Entwicklung - Verkauf, 162 368 132 483 29 885 23 allgemeine und administrative Kosten Betriebsgewinn 96 161 137 980 (41 819) (30) Cash EBIT 121 190 164 852 (43 662) (26) Reingewinn 82 621 111 764 (29 143) (26) Verwässerter EPS in 0,67 0,91 (0,24) (26) CHF Anzahl Aktien zur 123,377 Mio. 123,269 - - Berechnung Mio. ANMERKUNG FÜR AKTIONÄRE: Die Generalversammlung, an der die Aktionäre den Geschäftsbericht per 31. Dezember 2008 bewilligen, findet am 24. April 2009 statt. Aktionäre mit einem Aktienbestand im Nominalwert von mehr als CHF 1.000.000 (d.h. 2.000.000 Aktien zum Nominalwert von je CHF 0.50), die berechtigt sind, Anträge für die Traktandenliste der Generalversammlung einzubringen, werden gebeten, etwaige Vorschläge für die Generalversammlung vom 24. April 2009 bis spätestens am 13. März 2009 an den Sekretär des Verwaltungsrats, Actelion Ltd, Gewerbestrasse 16, CH-4123 Allschwil, einzureichen. Vorschläge, die nach diesem Datum eintreffen, können nicht mehr berücksichtigt werden. Um an der Generalversammlung teilnehmen und abstimmen zu können, müssen sich die Aktionäre bis spätestens am 9. April 2009 in das Aktienregister des Unternehmens eingetragen haben. Der Geschäftsbericht 2008 steht auf unserer Homepage www.actelion.com zur Verfügung.
### Actelion Ltd Actelion Ltd ist ein biopharmazeutisches Unternehmen mit Hauptsitz in Allschwil/Basel, Schweiz. Actelions erstes Medikament, Tracleer®, ist ein zur Therapie der pulmonalen arteriellen Hypertonie zugelassener dualer Endothelin-Rezeptor-Antagonist in Tablettenform. Actelion vertreibt Tracleer® durch eigene Niederlassungen in den wichtigsten internationalen Märkten, so den Vereinigten Staaten (mit Sitz in South San Francisco), der Europäischen Union, Japan, Kanada, Australien und der Schweiz. Actelion, 1997 gegründet, ist ein weltweit führendes Unternehmen bei der Erforschung des Endothels. Das Endothel trennt die Gefässwand vom Blutstrom. Mit über 1.900 Mitarbeitenden konzentriert sich Actelion darauf, innovative Medikamente in Bereichen mit hohem medizinischem Bedarf zu entdecken, zu entwickeln und zu vermarkten. Actelion Aktien sind am SIX Swiss Exchange notiert (Symbol: ATLN) und werden als Teil des Schweizer Blue-Chip-Index SMI® (Swiss Market Index) gehandelt. Für weitere Informationen wenden Sie sich bitte an: Roland Haefeli Vice President, Head of Investor Relations & Public Affairs Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil +41 61 565 62 62 +1 650 624 69 36 http://www.actelion.com Telefonkonferenz Actelion wird eine Telefonkonferenz plus Webcast wie folgt durchführen: Datum/Zeit: 19. Februar 2009 12.30 Uhr - 16.30 Uhr Basel (MEZ) 11.30 Uhr - 15.30 Uhr U.K. (BST) 06.30 Uhr - 10.30 Uhr U.S. (EDT) Einwahl #: Teilnehmer können untenstehende Nummern 10 bis 15 Minuten vor Konferenzbeginn anwählen. Einwahl: Europa: +41 44 580 64 03 Grossbritannien.: +44 207 153 91 54 USA.: +1 866 928 60 44 Teilnahmemodus: Nur hören. Fragen können ausschliesslich von Plenumsteilnehmern gestellt werden. Zugriff auf den Webcast: Teilnehmer des Webcast sollten etwa 10 bis 15 Minuten vor Beginn der Konferenz die Website von Actelion über http://www.actelion.com aufschalten. Webcast Aufzeichnung: Der archivierte Webcast kann etwa 60 Minuten nach Beendigung der Konferenz über http://www.actelion.com/ als Aufzeichnung abgerufen werden. Vorschau auf wichtige Veranstaltungen und Publikationen Dienstag, 21. April 2009 -Ergebnisse 1. Quartal 2009 Freitag, 24. April 2009 -Generalversammlung 2009 Dienstag, 21. Juli 2009 -Ergebnisse 1. Halbjahr 2009 Dienstag, 20. Oktober 2009 -Ergebnisse neun Monate 2009 --- Ende der Mitteilung --- Actelion Pharmaceuticals Ltd Gewerbestrasse 16 Allschwil Schweiz WKN: 936767; ISIN: CH0010532478; Index: SBIOM, SLIFE, SMCI, SMIEXP, SMIM, SPI, SPIEX; Notiert: Main Market in SIX Swiss Exchange;
http://www.actelion.com
http://hugin.info/131801/R/1291718/291906.pdf http://gaia.world-television.com/actelion/20090219/FYR/trunc… http://gaia.world-television.com/actelion/20090219/FYR/HQ_tr… http://hugin.info/131801/R/1291718/291911.pdf http://hugin.info/131801/R/1291718/291912.pdf
Copyright © Hugin AS 2009. All rights reserved.
Quelle: HUGIN
Actelion gibt Ergebnisse für das Jahr 2008 bekannt
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin. Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
-------------------------------------------------------------------
Nettoumsatz bei CHF 1.473,5 Millionen, ein Anstieg um 20 Prozent in lokalen Währungen und 12 Prozent in Schweizer Franken - Umsatz von Tracleer® bei CHF 1.294,1 Millionen, ein Plus von 17 Prozent in lokalen Währungen und von 10 Prozent in Schweizer Franken - Cash EBIT erreicht CHF 476,8 Millionen, ein Anstieg um 16 Prozent in lokalen Währungen und um 1 Prozent in Schweizer Franken - Vier laufende Phase-III-Programme in 2009 - Projekte in der frühen Entwicklungsphase machen Fortschritte, inklusive einer positiven Studie mit dem oral wirksamen CRTH2-Rezeptor-Antagonisten bei Asthma-Patienten - Weitere innovative Substanzen sollten 2009 in die Entwicklung übergehen
ALLSCHWIL/BASEL, SCHWEIZ - 19. Februar 2009 - Actelion Ltd (SIX: ATLN) gab heute die Finanzergebnisse für das Jahr 2008 bekannt. Mit einem Nettoumsatz in Höhe von insgesamt CHF 1.473,5 Millionen für das Jahr 2008 (2007: CHF 1.317,4 Mio.) und einem betrieblichen Aufwand von CHF 1.102,2 Millionen (2007: 1.174,8 Mio.) - erwirtschaftete das Unternehmen einen Betriebsgewinn von CHF 371,4 Millionen (2007: CHF 142,6 Mio.). Um die betriebliche Leistung des Unternehmens besser messen und vergleichen zu können, weist Actelion weiterhin den non-US GAAP Cash EBIT aus (Betriebsergebnis ausschliesslich IPR&D, Aufwendungen in Verbindung mit Aktienoptionen für Mitarbeitende nach FAS 123R sowie Aufwendungen für nicht-liquiditätswirksame Abschreibungen und Amortisationen). Im Jahr 2008 erzielte Actelion einen Cash-EBIT in Höhe von CHF 476,8 Millionen, was einen Anstieg um 1 Prozent gegenüber dem Vorjahr bedeutet. In lokalen Währungen stieg der Cash-EBIT um 16 Prozent. Der angepasste verwässerte Gewinn pro Aktie (EPS) lag im Jahr 2008 bei CHF 3,40 gegenüber CHF 3,57 im Jahr 2007. Gemäss US GAAP lag der Reingewinn für 2008 bei CHF 321,5 Millionen (2007: CHF 124,6 Mio.). Der vollständig verwässerte Gewinn pro Aktie (EPS) belief sich für 2008 auf CHF 2,60 gegenüber CHF 1,00 im Jahr 2007. Dr. Jean-Paul Clozel, Chief Executive Officer, kommentierte: "Im Jahr 2008 hat Actelion in allen wichtigen Bereichen erfolgreiche Arbeit geleistet. Trotz zunehmender Konkurrenz wachsen unsere Produkte weiter. Das Ergebnis unserer Anstrengungen in Vorklinik und Klinik ist eine breit gefächerte Pipeline. Zehn Substanzen befinden sich derzeit in Untersuchungen am Menschen." Jean-Paul Clozel fügte hinzu: "Durch die Verstärkung unserer weltweiten Infrastruktur und die Rekrutierung einiger der besten Kräfte in der Industrie ist Actelion gerüstet, auch 2009 weiter seinen Wachstumskurs fortzusetzen. Ich gehe von weiter steigenden Produkteumsätzen aus und erwarte, dass zusätzliche Substanzen erstmals am Menschen klinisch erprobt werden. Für zwei der vier Phase-III-Programme werden Ende dieses Jahres die abschliessenden Ergebnisse vorliegen. Damit könnte 2009 nicht nur ein Wachstumsjahr, sondern auch ein Jahr des Wandels für Actelion werden." Jean-Paul Clozel schloss: "Ich bin sehr zufrieden mit dem Fortschritt unserer Pipeline insgesamt. Besonders beeindruckt bin ich dabei von den herausragenden Ergebnissen unseres CRTH2-Rezeptor-Antagonisten, der das Potenzial für einen therapeutischen Durchbruch sowohl bei Asthma als auch bei anderen allergischen Erkrankungen besitzt. Wir prüfen die beste geschäftliche Option, um den potenziellen Wert dieser Substanz voll auszuschöpfen." Andrew J. Oakley, Chief Financial Officer, erklärte: "Die finanzielle Leistung von Actelion im Jahr 2008 hat dank der Produkteumsätze, die besser ausfielen als prognostiziert, und dank verbesserter Nutzung unserer operativen Mittel unsere Erwartungen übertroffen. Der Betriebsaufwand stieg in Einklang mit unserer weiterhin verfolgten Strategie, wesentlich in Innovationen zu investieren. Das Ausmass unseres Erfolgs wird allerdings von der Stärke des Schweizer Frankens überschattet, wie am Cash EBIT abzulesen ist, der um 16 Prozent in lokalen Währungen im Vergleich zu 1 Prozent in Schweizer Franken stieg." Andrew J. Oakley fügte hinzu: "Sofern keine unvorhersehbaren Ereignisse auftreten, geht Actelion davon aus, dass auch 2009 ein weiteres Wachstumsjahr werden wird und der Gesamtnettoumsatz - in lokalen Währungen - zwischen 12 bis 15 Prozent wachsen wird. Auch für den Cash EBIT wird ein Anstieg - in lokalen Währungen - von 9 bis 11 Prozent prognostiziert." Andrew J. Oakley schloss: "In Anbetracht unseres anhaltenden Wachstums und unserer starken Bilanz verfügt Actelion über sämtliche Mittel zur vollumfänglichen Finanzierung seiner laufenden Expansion. Gleichzeitig sind wir darauf vorbereitet, Gelegenheiten wahrnehmen zu können, falls innovative Produkte auf dem Markt erhältlich sein sollten." Finanzergebnisse im Überblick - Tabelle 2008 vs. 2007 In CHF Tausend Ergebnisse Ergebnisse Veränderung % 2008 2007 Nettoumsatz 1 473 508 1 317 392 156 116 12 Betriebsaufwand 1 102 1 174 (72 639) (6) 151(1) 790(2) Betriebsgewinn 371 357 142 602 228 755 160 Cash EBIT 476 833 471 443 5 390 1 Reingewinn 321 490 124 586 196 904 158 Verwässerter Gewinn pro Aktie (EPS) in CHF 2,60 1,00 1,60 160 Anzahl Aktien zur 123,418 124,809 - - Berechnung Mio. Mio. (1) Ein Teil der Aufwendungen für F&E hängt mit den im 1. Halbjahr 2008 an Nippon Shinyaku geleisteten Meilensteinzahlungen zusammen (zu den Einzelheiten siehe Anmerkungen zum Jahresabschluss 2008). (2) Darin eingeschlossen ist ein einmaliger, im ersten Quartal 2007 infolge der Akquisition von CoTherix angefallener IPR&D-Aufwand in Höhe von CHF 224,8 Millionen.
Die vollständige Konzernrechnung finden Sie unter http://www.actelion.com.
Anhaltendes Wachstum des Nettoumsatzes Für das Gesamtjahr 2008 verzeichnete Actelion einen Nettoumsatz von CHF 1.473,5 Millionen (2007: CHF 1.317,4 Mio.), ein Anstieg um 12 Prozent gegenüber dem Vorjahr. In lokalen Währungen stieg der Gesamtnettoumsatz um 20 Prozent. Die Einkünfte aus vertraglichen Vereinbarungen stiegen im selben Zeitraum um 76 Prozent, im Wesentlichen infolge der Zurechnung der Einkünfte aus der von GSK erhaltenen Vorauszahlung, die mit Beginn der Kooperation von Actelion und GSK fällig wurde. Actelion ging diese exklusive, weltweite Kooperation (mit Ausnahme Japans) für seinen Orexin-Rezeptor-Antagonisten Almorexant ein, dem ersten Präparat seiner Klasse. Almorexant wird zurzeit in der klinischen Phase III zur Behandlung der primären Insomnie untersucht. Einzelheiten zu dieser Kooperation können der von Actelion und GSK am Montag, 14. Juli 2008 gemeinsam herausgegebenen Pressemitteilung entnommen werden. Produkteumsätze Im Jahr 2008 belief sich der Umsatz von Tracleer® (Bosentan) auf CHF 1.294,1 Millionen (2007: CHF 1.178,6 Mio.), ein Anstieg um 10 Prozent im Vergleich zum Vorjahr. In lokalen Währungen stieg der Umsatz von Tracleer® um 17 Prozent gegenüber dem Vorjahr. Ende Dezember 2008 war Tracleer® in über 50 Ländern weltweit auf dem Markt erhältlich, darunter in allen wichtigen pharmazeutischen Märkten. Mit den für die kommenden Quartale vorgesehenen Einführungen wird Actelion die Verfügbarkeit von Tracleer® im Markt weiter ausbauen. Neben dem Aus- und Aufbau einer eigenen Vertriebsinfrastruktur in China und Russland baut Actelion seinen bestehenden Aussendienst in allen Regionen der Welt weiter aus, um die aktuelle Wachstumsdynamik von Tracleer® zu nutzen und die Expansion des PAH-Marktes weiter voranzutreiben. In der Europäischen Union wurden zusätzliche Ressourcen bereitgestellt, um die neue Indikation von Tracleer® zur Behandlung digitaler Ulzerationen bei Sklerodermie-Patienten zu unterstützen, mit deren Kommerzialisierung 2008 in einzelnen Ländern begonnen wurde. Im August 2008 erhielt Tracleer® (Bosentan) in der Europäischen Union eine Indikationserweiterung für die Behandlung von Patienten mit milder symptomatischer pulmonaler Hypertonie (PAH) der WHO-Funktionsklasse II (FC II). Tracleer® ist das einzige PAH-Therapeutikum, das in einer klinischen Studie untersucht wurde, an der ausschliesslich Patienten mit milder symptomatischer PAH der WHO-Funktionsklasse II teilnahmen. Diese randomisierte, plazebokontrollierte Doppelblindstudie mit 185 Patienten bildete die Basis für die EU-Zulassung. Die Ergebnisse aus der EARLY-Studie (Endothelin Antagonist tRial in miLdlY symptomatic PAH patients) wurden im Juni 2008 in "The Lancet" veröffentlicht. (Galiè N, Rubin LJ, Hoeper MM et al. Treatment of patients with mildly symptomatic pulmonary arterial hypertension with bosentan (EARLY study): a double-blind, randomised controlled trial. The Lancet 2008; 371: 2093-2100). Die behördlichen Prüfungen dieser Indikation laufen derzeit auch in anderen Regionen einschliesslich der USA. Der Umsatz von Ventavis® (Iloprost) belief sich im Jahr 2008 auf CHF 94,6 Millionen. In lokalen Währungen stieg der Umsatz von Ventavis® um 34 Prozent. Das Unternehmen geht davon aus, dass zusätzliche Programme zur Unterstützung von Patienten und die verbesserte Applikationshilfe für Ventavis® zum anhaltenden Umsatzwachstum geführt haben. Derzeit wird eine klinische Studie, PROWESS 15, durchgeführt, die belegen soll, dass eine Einzeldosis Iloprost (mit der Applikationshilfe Power 15 verabreicht) im Vergleich zu Plazebo die Leistungsfähigkeit von PAH-Patienten steigert. Dies ist ein weiteres Beispiel für Actelions anhaltendes Engagement. Otto Schwarz, President Business Operations, kommentierte: "Unsere Produkte haben am Markt trotz wachsender Konkurrenz im Bereich PAH gute Ergebnisse und Zuwächse in allen Märkten weltweit erzielt. Diese hervorragende Leistung ist das Ergebnis sehr starker Produktdaten und deren Kommunikation über eine weltweit etablierte, hochprofessionelle und engagierte Marketing- und Vertriebsorganisation." Der Umsatz von Zavesca® (Miglustat) belief sich im Jahr 2008 auf CHF 40,1 Millionen (2007: CHF 35,3 Mio.). In lokalen Währungen stieg der Umsatz von Zavesca® um 20 Prozent. Zavesca® ist in über 35 Ländern, einschliesslich der Vereinigten Staaten und den meisten europäischen Märkten, kommerziell erhältlich. Die unlängst veröffentlichten Daten zu den positiven Wirkungen von Zavesca® auf Knochenmanifestationen bei Typ-1-Gaucher-Krankheit haben 2008 ihren Niederschlag als Ergänzungen der SmPC (Summary of Product Characteristics, Zusammenfassung der Merkmale eines Arzneimittels) in der EU gefunden. Im Januar 2009 erhielt Zavesca® (Miglustat) die Zulassung in der europäischen Union für die Behandlung progressiver neurologischer Symptome bei Erwachsenen und Kindern mit der Niemann-Pick Typ C-Krankheit (NPC). Zavesca® ist das erste Präparat, das in dieser Indikation eine Zulassung erhält. Niemann-Pick Typ C ist eine sehr seltene und verheerende genetisch bedingte neurodegenerative Erkrankung, an der sowohl Kinder als auch Erwachsene leiden. Otto Schwarz schloss: "Im Jahr 2008 konnten wir unsere weltweite Präsenz weiter verstärken, indem wir unseren Aussendienst ausgebaut haben und eine bessere Abstimmung der Ressourcen im Hauptsitz erreichen konnten, um vorhandene Produkte zu unterstützen und die Einführung neuer Produkte vorzubereiten. Actelion ist daher bestens vorbereitet, in seinem bestehenden Kernmarkt PAH erfolgreich zu bleiben und zudem in neue Märkte vorzustossen oder neue Märkte zu schaffen, zunächst mit Zavesca® in der Indikation NPC in Europa." Betrieblicher Aufwand Für 2008 belief sich der betriebliche Aufwand auf CHF 1.102,2 Millionen (2007: CHF 1.174,8 Mio.). Im selben Zeitraum stiegen die Kosten für Forschung und Entwicklung um 28 Prozent auf CHF 374,5 Millionen (2007: CHF 292,1 Mio.). Dieser Anstieg steht in Einklang mit den fortgesetzten Investitionen in eine rasch wachsende Pipeline und schliesst in der ersten Jahreshälfte 2008 geleistete Meilensteinzahlungen an Nippon Shinyaku für den PGI2-Rezeptor-Agonisten mit ein. Forschung und Entwicklung Die Pipeline von Actelion enthält derzeit 10 Substanzen in der klinischen Entwicklung sowie mehr als 25 aktive Projekte in der Forschung. Dr. Isaac Kobrin, Leiter der Entwicklung bei Actelion, kommentierte: "Ende 2008 sind die klinischen Entwicklungsprogramme bei Actelion rasch vorangekommen und weiter ausgebaut worden. Annähernd 8.300 Patienten und gesunde Freiwillige sind für die Teilnahme an über 75 klinischen Studien vorgesehen. Zudem haben wir sichergestellt, dass wir darauf vorbereitet sind, bei erfolgreichen klinischen Daten aus unseren am weitesten fortgeschrittenen Phase-III-Programmen rasch an die Gesundheitsbehörden herantreten zu können. Dabei handelt es sich um Bosentan (Tracleer®) bei idiopathischer pulmonaler Fibrose und Clazosentan (Pivlaz®) bei Gefässspasmen nach aneurysmatischen Subarachnoidalblutungen." Insgesamt verfolgt Actelion zurzeit vier laufende Phase-III-Programme: Almorexant bei primärer Insomnie: Im Rahmen der ersten Phase-III-Studie als Bestandteil des RESTORA-Programms wurde mit der Patientenrekrutierung begonnen. Das Design der Studie ist darauf ausgelegt die Sicherheit und Wirksamkeit von Almorexant bei Patienten mit primärer Insomnie zu evaluieren. Die 700 Patienten umfassende Studie RESTORA 1 umfasst einen Studienarm mit der Referenzsubstanz Zolpidem, welches für die Insomniebehandlung zugelassen ist. Erste Studienergebnisse werden für die zweite Jahreshälfte 2009 erwartet. Mit der US-amerikanischen Arzneimittelbehörde FDA wurden nach Abschluss der Phase II Gespräche geführt, in deren Verlauf Actelion der FDA zusätzliche Daten zur Sicherheit vorlegte, die über einen Zeitraum von vier Wochen mit gesunden Freiwilligen gewonnen wurden, sowie die Ergebnisse einer erfolgreichen Dosisfindungsstudie mit Almorexant bei älteren Patienten. Im Rahmen der Kooperation von Actelion und GSK dürften weitere klinische Studien mit Almorexant nach Abschluss der Gespräche mit der FDA basierend auf dem ,Special Protocol Assessment' und der Ergebnisse zusätzlicher Studien aufgenommen werden. Bosentan (Tracleer®) bei IPF: Diese multizentrische, randomisierte, plazebokontrollierte, parallelisierte, auf klinische Ereignisse ausgerichtete Doppelblindstudie zu Morbidität und Mortalität (BUILD-3) evaluiert die Sicherheit und Wirksamkeit von Bosentan 125 mg b.i.d. bei Patienten mit idiopathischer pulmonaler Fibrose. Die Patientenrekrutierung für BUILD-3 wurde im November 2008 mit 616 Patienten abgeschlossen. Die erste Zwischenanalyse für BUILD-3 (bei Vorliegen von 50% der als primäre Endpunkte definierten Ereignisse) fand am 17. Februar 2009 statt. Das unabhängige Data and Safety Monitoring Board (DSMB) empfahl die Fortführung der Studie. Abschliessende Ergebnisse der Studie könnten Ende 2009 vorliegen. Clazosentan bei SAB (aneurysmatische Subarachnoidalblutungen): Die Phase-III-Studie CONSCIOUS-2 (Clazosentan to Overcome Neurological iSCHemia and Infarct OccUrring after Subarachnoid hemorrhage - Clazosentan zur Verhinderung von neurologischer Ischämie oder Infarkt nach Subarachnoidalblutung) untersucht die Sicherheit und Wirksamkeit dieses intravenös zu verabreichenden Endothelin-Rezeptor-Antagonisten über den primären Endpunkt der Gesamtmortalität und der Vasospasmus-bedingten Morbidität. Hierzu zählen Vasospasmus-bedingte Verschlechterung der neurologischen Parameter, Vasospasmus-bedingte neue Hirninfarkte, die Einleitung von Notfallmassnahmen im Zusammenhang mit auftretenden Gefässspasmen oder das Eintreten des Todes, unabhängig von dessen Ursache. Derzeit läuft die Patientenrekrutierung für CONSCIOUS-2 in Zentren in über 25 Ländern in der europäischen Union, Kanada, Asien, Australien und Neuseeland. Ende Januar 2009 hat Actelion zudem weitere klinische Zentren in den Vereinigten Staaten in die Studie aufgenommen. Rekrutierungsziel der Studie sind 765 Patienten mit SAB, deren Aneurysma durch operatives Clipping behandelt wurde. Studienergebnisse könnten möglicherweise in der zweiten Jahreshälfte 2009 vorliegen. Bei positivem Ausgang wird Actelion an die Regulierungsbehörden herantreten, um die Zulassung zu beantragen. Eine zweite Phase-III-Studie, CONSCIOUS-3, wurde initiiert, um die Sicherheit und Wirksamkeit von zwei Dosierungen (5 oder 15 mg/h) Clazosentan im Vergleich zu Plazebo bei Patienten zu untersuchen, die nach Auftreten von SAB mit endovaskulärem Coiling behandelt wurden. Der primäre Endpunkt ist ähnlich dem bei CONSCIUS-2, d.h. Verringerung der durch zerebrale Gefässspasmen bedingten Morbidität und Gesamtmortalität über einen Zeitraum von sechs Wochen. Der Start der Patientenrekrutierung für CONSCIOUS-3 in rund 150 Zentren ist für das zweite Quartal 2009 vorgesehen; Ziel ist die Rekrutierung von 1.500 Patienten. Macitentan bei PAH: Das multizentrische, doppelblinde, randomisierte, plazebokontrollierte, parallelisierte und auf klinische Ereignisse ausgerichtete zulassungsrelevante SERAPHIN-Programm untersucht die Sicherheit und Wirksamkeit dieses hochpotenten, auf das Gewebe zielenden Endothelin-Rezeptor-Antagonisten im Hinblick auf Morbidität und Gesamtmortalität bei Patienten mit symptomatischer PAH als primärem Endpunkt. Derzeit läuft die weltweite Patientenrekrutierung, über 200 der geplanten 525 Patienten sind in die Studie aufgenommen worden. Dies ist die grösste Studie mit PAH-Patienten und die erste, die von Anfang an einen klar definierten primären Endpunkt zu Morbidität/Mortalität einschliesst. Isaac Kobrin fügte hinzu: "Ich bin sehr zufrieden damit, dass Actelion nach dem erfolgreichen Abschluss der 'Proof-of-concept'-Studie bei Asthma-Patienten nun auch die fortgeschrittene klinische Entwicklung unseres CRTH2-Rezeptor-Antagonisten, dem ersten Präparat einer neuen Arzneimittelklasse, in Angriff nehmen kann." In einem früheren Stadium der klinischen Entwicklung befinden sich die folgenden Programme: CRTH2-Rezeptor-Antagonist: In einer "Proof-of-mechanism"-Studie mit dem oral wirksamen CRTH2-Rezeptor-Antagonisten bei mildem Asthma ergaben sich positive Daten. In präklinischen Studien verhinderte diese Wirksubstanz die Migration und Aktivierung von Zelltypen, die massgeblich an Entzündungsprozessen beteiligt sind. In der 18 Patienten umfassenden plazebokontrollierten doppelblinden Crossover-Studie wurde der primäre Endpunkt (Einsekundenkapazität FEV1) erreicht und der Wirkstoff zeigte eine gute Verträglichkeit. Die Ergebnisse legen nahe, mit dieser neuartigen Wirksubstanz das komplette Entwicklungsprogramm der Phase-II bei Asthma durchzuführen. Miglustat bei zystischer Fibrose: Diese Substanz durchläuft derzeit eine "Proof-of-concept"-Studie der Phase IIa im Anschluss an vorklinische Befunde, die mögliche krankheitsmodifizierende Eigenschaften erkennen lassen. (Antigny F., Norez C., Becq F. and Vandebrouck C. Calcium homeostasis is abnormal in cystic fibrosis airway epithelial cells but is normalized after rescue of F508del-CFTR. Cell Calcium. 43, 175-83; 2008). Ergebnisse werden später im ersten Quartal 2009 erwartet. Von diesen Ergebnissen, sofern positiv, werden Notwendigkeit, Umfang und Dauer zukünftiger Studien abhängen. Macitentan bei IPF: Actelion beabsichtigt die Aufnahme eines klinischen Entwicklungsprogramms mit diesem hochpotenten, auf das Gewebe zielenden Endothelin-Rezeptor-Antagonisten bei idiopathischer pulmonaler Fibrose. Der Start einer randomisierten, multizentrischen Doppelblindstudie zur Untersuchung der Wirksamkeit und Sicherheit von Macitentan bei IPF-Patienten ist für das zweite Quartal 2009 vorgesehen und soll das Konzept des dualen Endothelin-Rezeptor-Antagonismus bei IPF untermauern. PGI2-Rezeptor-Agonist: Dieser oral aktive Non-Prostanoid-PGI2-Rezeptor-Agonist ist das erste Präparat einer neuen Arzneimittelklasse und wies in Phase I eine gute Verträglichkeit auf. Die Patientenrekrutierung für eine Phase-IIa-Studie mit PAH-Patienten wurde abgeschlossen, Ergebnisse werden im 3. Quartal 2009 erwartet. Der Beginn einer Phase-IIb-Studie ist für die kommenden Monate vorgesehen. Selektiver S1P1-Rezeptor-Agonist: Actelion und Roche sind übereingekommen, dass die Daten aus Vorklinik und Klinik einen Übergang des selektiven S1P1-Rezeptor-Agonisten von Actelion, dem ersten Präparat einer neuen Klasse von Arzneimitteln, in die klinische Entwicklung der Phase II nahe legen. Actelion hat eine "Proof-of-concept"-Studie bei Psoriasis gestartet und die Aufnahme einer Phase-IIb-Studie bei Multipler Sklerose für die kommenden Monate vorgesehen. Renin-Inhibitor: Auf Grundlage der Ergebnisse aus verschiedenen klinischen Studien hat die Renin-Allianz mit Merck & Co., Inc. (über eine Tochterfirma) entschieden, eine bislang nicht bekannt gegebene, bereits in der klinischen Entwicklung befindliche Substanz weiter voranzubringen und damit den ersten Wirkstoff, der im Dezember 2007 in Phase IIa eingetreten war, zu ersetzen. Eine Reihe von Phase-I-Studien wurde durchgeführt, unter anderem Untersuchungen zu Pharmakokinetik und Pharmakodynamik und Studien zu Wechselwirkungen mit anderen Arzneimitteln. Im Rahmen der Kooperation sind die Anstrengungen darauf gerichtet die für diese Arzneimittelklasse beste Renin-Inhibition zu erreichen. Dabei sollen neben der neuen Substanz auch weitere Wirkstoffe geprüft werden. Der Einsatz von Actelion im Bereich der Forschung mit mehr als 25 aktiven Projekten hat zu drei Wirksubstanzen geführt, die sich zum Jahresende 2008 in der präklinischen Untersuchung befanden. Daneben besteht die Möglichkeit, im Lauf des Jahres 2009 mehrere andere präklinische Entwicklungskandidaten auszuwählen. Im Jahr 2008 reichte das Unternehmen 52 Prioritätsanmeldungen für Patente ein. Walter Fischli, Co-Head Drug Discovery bei Actelion, kommentierte: "Wir profitieren auch weiterhin von unserer Erfahrung mit unseren Plattformen für bestimmte Targets. Mit der Ausweitung unseres Plattform-Ansatzes auf Ionenkanäle und Antibiotika und unseren anhaltenden Investitionen in die Screening-Technologie gehen wir davon aus, unsere hohe Produktivität auch in Zukunft halten zu können. 2008 konnten wir unsere hohe Produktivität in der Forschung mit dem Einreichen von mehr als 50 Prioritätsanmeldungen für Patente demonstrieren." Martine Clozel, Co-Head Drug Discovery bei Actelion, fügte hinzu: "Mehrere innovative Substanzen befinden sich in den letzten Stadien der präklinischen Entwicklung und wir gehen davon aus, dass einige dieser Substanzen 2009 weiter vorankommen werden. Wie immer konzentrieren wir uns auf Substanzen mit einzigartigem Wirkmechanismus für Bereiche mit hohem ungedecktem medizinischen Bedarf." Die Aufwendungen für Verkauf sowie allgemeine und administrative Ausgaben beliefen sich im Jahr 2008 auf CHF 550,0 Millionen (2007: CHF 500,1 Mio.), ein Anstieg um 10 Prozent, der darauf zurückzuführen ist, dass das Unternehmen auch weiterhin bei allen drei vermarkteten Produkten das Bewusstsein für diese Erkrankungen fördern will. Die Infrastruktur zur Unterstützung unseres operativen Geschäfts wuchs entsprechend der Expansion des Unternehmens. Betriebsgewinn Der Betriebsgewinn von Actelion im Jahr 2008 belief sich auf CHF 371,4 Millionen (2007: CHF 142,6 Mio.). Der Cash EBIT für denselben Zeitraum betrug CHF 476,8 Millionen (2007: CHF 471,4 Mio.), ein Anstieg um 1 Prozent in Schweizer Franken und um 16 Prozent in lokalen Währungen. Reingewinn Im Jahr 2008 ergab sich ein Reingewinn in Höhe von CHF 321,5 Millionen (2007: CHF 124,6 Mio.). Darin enthalten sind Zinserträge von CHF 21,8 Millionen, Zinsaufwendungen von CHF 6,6 Millionen, eine nicht-liquiditätswirksame Belastung von CHF 1,7 Millionen durch die Wandelanleihe, Währungsverluste in Höhe von CHF 31,9 Millionen (hauptsächlich aufgrund von Bewertungsverlusten auf Forderungen gegenüber Gruppengesellschaften) sowie Einkommensteuern in Höhe von CHF 31,4 Millionen. Liquide Mittel und Cashflow Im Jahr 2008 erwirtschaftete Actelion einen Cashflow aus dem operativen Geschäft in Höhe von CHF 513,7 Millionen (2007: CHF 394,2 Mio.). Per 31. Dezember 2008 beliefen sich die liquiden Mittel (mit Ausnahme eigener Aktien) auf CHF 1.131,7 Millionen. Deutliche personelle Verstärkung Zum Jahresende 2008 beschäftigte Actelion weltweit 1.907 Mitarbeitende, ein Anstieg um mehr als 300 gegenüber dem Jahresende 2007. Von diesen 1.907 Mitarbeitenden waren 862 in der Schweiz beschäftigt. Actelion geht davon aus, die Anzahl der weltweit im Unternehmen Beschäftigten im Jahr 2009 auf rund 2.350 Mitarbeitende zu steigern. In der Schweiz wird Actelion per Ende 2009 voraussichtlich mehr als 1.000 Mitarbeitende beschäftigen. Geschäftsbericht Eine umfassende Darstellung zu den im Jahr 2008 gemachten Fortschritten kann dem Geschäftsbericht 2008 von Actelion entnommen werden. Dieser Bericht besteht aus zwei separaten Teilen: "In Brief" gibt einen Überblick über die Höhepunkte des Jahres 2008. "In Detail" ist ein Nachschlagewerk zu allen Aktivitäten von Actelion einschliesslich der vollständig geprüften Jahresrechnung. Der Geschäftsbericht 2008 kann über www.actelion.com heruntergeladen werden. Zu Dokumentationszwecken - Tabelle 4. Quartal 2008 vs. 3.Quartal 2008 In CHF Tausend Ergebnisse Ergebnisse Veränderung % 4.Quartal 3.Quartal 2008 2008 Nettoumsatz 403 888 393 638 10 250 3 Betriebsaufwand 307 727 255 658 52 069 20 - Forschung und 96 939 76 351 20 588 27 Entwicklung - Verkauf, 162 368 132 483 29 885 23 allgemeine und administrative Kosten Betriebsgewinn 96 161 137 980 (41 819) (30) Cash EBIT 121 190 164 852 (43 662) (26) Reingewinn 82 621 111 764 (29 143) (26) Verwässerter EPS in 0,67 0,91 (0,24) (26) CHF Anzahl Aktien zur 123,377 Mio. 123,269 - - Berechnung Mio. ANMERKUNG FÜR AKTIONÄRE: Die Generalversammlung, an der die Aktionäre den Geschäftsbericht per 31. Dezember 2008 bewilligen, findet am 24. April 2009 statt. Aktionäre mit einem Aktienbestand im Nominalwert von mehr als CHF 1.000.000 (d.h. 2.000.000 Aktien zum Nominalwert von je CHF 0.50), die berechtigt sind, Anträge für die Traktandenliste der Generalversammlung einzubringen, werden gebeten, etwaige Vorschläge für die Generalversammlung vom 24. April 2009 bis spätestens am 13. März 2009 an den Sekretär des Verwaltungsrats, Actelion Ltd, Gewerbestrasse 16, CH-4123 Allschwil, einzureichen. Vorschläge, die nach diesem Datum eintreffen, können nicht mehr berücksichtigt werden. Um an der Generalversammlung teilnehmen und abstimmen zu können, müssen sich die Aktionäre bis spätestens am 9. April 2009 in das Aktienregister des Unternehmens eingetragen haben. Der Geschäftsbericht 2008 steht auf unserer Homepage www.actelion.com zur Verfügung.
### Actelion Ltd Actelion Ltd ist ein biopharmazeutisches Unternehmen mit Hauptsitz in Allschwil/Basel, Schweiz. Actelions erstes Medikament, Tracleer®, ist ein zur Therapie der pulmonalen arteriellen Hypertonie zugelassener dualer Endothelin-Rezeptor-Antagonist in Tablettenform. Actelion vertreibt Tracleer® durch eigene Niederlassungen in den wichtigsten internationalen Märkten, so den Vereinigten Staaten (mit Sitz in South San Francisco), der Europäischen Union, Japan, Kanada, Australien und der Schweiz. Actelion, 1997 gegründet, ist ein weltweit führendes Unternehmen bei der Erforschung des Endothels. Das Endothel trennt die Gefässwand vom Blutstrom. Mit über 1.900 Mitarbeitenden konzentriert sich Actelion darauf, innovative Medikamente in Bereichen mit hohem medizinischem Bedarf zu entdecken, zu entwickeln und zu vermarkten. Actelion Aktien sind am SIX Swiss Exchange notiert (Symbol: ATLN) und werden als Teil des Schweizer Blue-Chip-Index SMI® (Swiss Market Index) gehandelt. Für weitere Informationen wenden Sie sich bitte an: Roland Haefeli Vice President, Head of Investor Relations & Public Affairs Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil +41 61 565 62 62 +1 650 624 69 36 http://www.actelion.com Telefonkonferenz Actelion wird eine Telefonkonferenz plus Webcast wie folgt durchführen: Datum/Zeit: 19. Februar 2009 12.30 Uhr - 16.30 Uhr Basel (MEZ) 11.30 Uhr - 15.30 Uhr U.K. (BST) 06.30 Uhr - 10.30 Uhr U.S. (EDT) Einwahl #: Teilnehmer können untenstehende Nummern 10 bis 15 Minuten vor Konferenzbeginn anwählen. Einwahl: Europa: +41 44 580 64 03 Grossbritannien.: +44 207 153 91 54 USA.: +1 866 928 60 44 Teilnahmemodus: Nur hören. Fragen können ausschliesslich von Plenumsteilnehmern gestellt werden. Zugriff auf den Webcast: Teilnehmer des Webcast sollten etwa 10 bis 15 Minuten vor Beginn der Konferenz die Website von Actelion über http://www.actelion.com aufschalten. Webcast Aufzeichnung: Der archivierte Webcast kann etwa 60 Minuten nach Beendigung der Konferenz über http://www.actelion.com/ als Aufzeichnung abgerufen werden. Vorschau auf wichtige Veranstaltungen und Publikationen Dienstag, 21. April 2009 -Ergebnisse 1. Quartal 2009 Freitag, 24. April 2009 -Generalversammlung 2009 Dienstag, 21. Juli 2009 -Ergebnisse 1. Halbjahr 2009 Dienstag, 20. Oktober 2009 -Ergebnisse neun Monate 2009 --- Ende der Mitteilung --- Actelion Pharmaceuticals Ltd Gewerbestrasse 16 Allschwil Schweiz WKN: 936767; ISIN: CH0010532478; Index: SBIOM, SLIFE, SMCI, SMIEXP, SMIM, SPI, SPIEX; Notiert: Main Market in SIX Swiss Exchange;
http://www.actelion.com
http://hugin.info/131801/R/1291718/291906.pdf http://gaia.world-television.com/actelion/20090219/FYR/trunc… http://gaia.world-television.com/actelion/20090219/FYR/HQ_tr… http://hugin.info/131801/R/1291718/291911.pdf http://hugin.info/131801/R/1291718/291912.pdf
Copyright © Hugin AS 2009. All rights reserved.
Quelle: HUGIN
Antwort auf Beitrag Nr.: 36.608.645 von Fruehrentner am 19.02.09 09:31:43... Insgesamt verfolgt Actelion zurzeit vier laufende Phase-III-Programme:
Almorexant bei primärer Insomnie: Im Rahmen der ersten Phase-III-Studie als Bestandteil des RESTORA-Programms wurde mit der Patientenrekrutierung begonnen. Das Design der Studie ist darauf ausgelegt die Sicherheit und Wirksamkeit von Almorexant bei Patienten mit primärer Insomnie zu evaluieren.
Die 700 Patienten umfassende Studie RESTORA 1 umfasst einen Studienarm mit der Referenzsubstanz Zolpidem, welches für die Insomniebehandlung zugelassen ist.
Erste Studienergebnisse werden für die zweite Jahreshälfte 2009 erwartet.
...
Almorexant bei primärer Insomnie: Im Rahmen der ersten Phase-III-Studie als Bestandteil des RESTORA-Programms wurde mit der Patientenrekrutierung begonnen. Das Design der Studie ist darauf ausgelegt die Sicherheit und Wirksamkeit von Almorexant bei Patienten mit primärer Insomnie zu evaluieren.
Die 700 Patienten umfassende Studie RESTORA 1 umfasst einen Studienarm mit der Referenzsubstanz Zolpidem, welches für die Insomniebehandlung zugelassen ist.
Erste Studienergebnisse werden für die zweite Jahreshälfte 2009 erwartet.
...
19.02.2009 10:27:56
Actelion "hold"
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, stuft die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" weiterhin mit "hold" ein.
Actelion lege heute Morgen die Zahlen für das Geschäftsjahr 2008 vor. In Allschwil finde eine Analystenkonferenz statt, bei der das Finanzergebnis und der Pipeline-Stand besprochen würden. Der Umsatz habe mit CHF 1,48 Mrd. den Schätzungen der Analysten entsprochen (VontE: CHF 1,47, Konsens: 1,48 Mrd.): Tracleer habe die Erwartungen mit CHF 1,29 Mrd. (VontE: 1,29 Mrd.) erfüllt, Ventavis habe die Prognosen um 18% übertroffen, Zavesca sei -16% zurückgeblieben. Das Cash-EBIT (CHF 121 Mio.) und das EBIT (CHF 96,1 Mio.) hätten die Erwartungen der Analysten um -9 bzw. -7% verfehlt. Der Reingewinn habe mit CHF 82,5 Mio. enttäuscht (VontE: CHF 92,9, Konsens: CHF 107 Mio.).
Der Umsatz habe im Rahmen der Erwartungen der Analysten gelegen. Trotz des Markteintritts von Konkurrenzprodukten verzeichne der Hauptumsatztreiber Tracleer im Geschäftsjahr 2008 mit 20% (in LW) weiterhin ein starkes Umsatzwachstum. Tracleer könne seine Position als Marktführer dank umfassender klinischer Daten und einer starken Vermarktung in den USA und der EU aufrechterhalten. Der Betriebsgewinn habe die Erwartungen verfehlt, was auf hohe Marketingausgaben zurückzuführen gewesen sei (derzeitiger Konkurrenzkampf mit GILD und GSK, deren Markteinführungen jedoch im Moment langsam verlaufen würden, dürfte auf die starken Marketingbemühungen von Actelion zurückzuführen sein). Entsprechend habe der Reingewinn 11% unter den Erwartungen der Analysten gelegen.
Die Vorgaben für das Geschäftsjahr 2009 seien Folgende: Umsatzvorgabe 12 bis 15% in LW ggü. VontE: 11% (positiv); Wachstum des Cash-EBIT 10 bis 12% in LW ggü. VontE: ca. 12 bis 15%, wahrscheinlich wegen höherer Marketing- und F&E-Kosten. Dies veranlasse die Analysten unter Umständen, ihre Schätzung für die operative Rentabilität nach unten zu korrigieren. Heute Nachmittag gebe Actelion in Allschwil ein umfassendes Update zur Pipeline.
Actelion habe das Geschäftsjahr 2008 erneut mit einem Quartal mit starkem Umsatzwachstum, angetrieben durch das Hauptprodukt Tracleer, beendet. Die Umsatzvorgabe für das Geschäftsjahr 2009 laute +12 bis 15% und weise damit auf eine kontinuierliche dominante Marktstellung bei PAH hin. Hinsichtlich des operativen Gewinns tätige Actelion Ausgaben für Marketing, um seine führende Position zu behaupten. Dies werde sich im Geschäftsjahr 2009 fortsetzen, zusammen mit hohen F&E-Aufwendungen zur Unterstützung der Produktpipeline im späten Entwicklungsstadium.
Das Geschäftsjahr 2009 hänge stark von erfolgreichen klinischen Daten ab, vor allem bei dem Schlafmedikament Almorexant, bei Bosentan zur Behandlung von IPF und Clazosentan bei aSAH.
Die Analysten von Vontobel Research halten an ihrer "hold"-Empfehlung und ihrem Kursziel von CHF 65 für die Actelion-Aktie fest. (Analyse vom 19.02.2009) (19.02.2009/ac/a/a)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
Quelle:AKTIENCHECK.DE

Actelion "hold"
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, stuft die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" weiterhin mit "hold" ein.
Actelion lege heute Morgen die Zahlen für das Geschäftsjahr 2008 vor. In Allschwil finde eine Analystenkonferenz statt, bei der das Finanzergebnis und der Pipeline-Stand besprochen würden. Der Umsatz habe mit CHF 1,48 Mrd. den Schätzungen der Analysten entsprochen (VontE: CHF 1,47, Konsens: 1,48 Mrd.): Tracleer habe die Erwartungen mit CHF 1,29 Mrd. (VontE: 1,29 Mrd.) erfüllt, Ventavis habe die Prognosen um 18% übertroffen, Zavesca sei -16% zurückgeblieben. Das Cash-EBIT (CHF 121 Mio.) und das EBIT (CHF 96,1 Mio.) hätten die Erwartungen der Analysten um -9 bzw. -7% verfehlt. Der Reingewinn habe mit CHF 82,5 Mio. enttäuscht (VontE: CHF 92,9, Konsens: CHF 107 Mio.).
Der Umsatz habe im Rahmen der Erwartungen der Analysten gelegen. Trotz des Markteintritts von Konkurrenzprodukten verzeichne der Hauptumsatztreiber Tracleer im Geschäftsjahr 2008 mit 20% (in LW) weiterhin ein starkes Umsatzwachstum. Tracleer könne seine Position als Marktführer dank umfassender klinischer Daten und einer starken Vermarktung in den USA und der EU aufrechterhalten. Der Betriebsgewinn habe die Erwartungen verfehlt, was auf hohe Marketingausgaben zurückzuführen gewesen sei (derzeitiger Konkurrenzkampf mit GILD und GSK, deren Markteinführungen jedoch im Moment langsam verlaufen würden, dürfte auf die starken Marketingbemühungen von Actelion zurückzuführen sein). Entsprechend habe der Reingewinn 11% unter den Erwartungen der Analysten gelegen.
Die Vorgaben für das Geschäftsjahr 2009 seien Folgende: Umsatzvorgabe 12 bis 15% in LW ggü. VontE: 11% (positiv); Wachstum des Cash-EBIT 10 bis 12% in LW ggü. VontE: ca. 12 bis 15%, wahrscheinlich wegen höherer Marketing- und F&E-Kosten. Dies veranlasse die Analysten unter Umständen, ihre Schätzung für die operative Rentabilität nach unten zu korrigieren. Heute Nachmittag gebe Actelion in Allschwil ein umfassendes Update zur Pipeline.
Actelion habe das Geschäftsjahr 2008 erneut mit einem Quartal mit starkem Umsatzwachstum, angetrieben durch das Hauptprodukt Tracleer, beendet. Die Umsatzvorgabe für das Geschäftsjahr 2009 laute +12 bis 15% und weise damit auf eine kontinuierliche dominante Marktstellung bei PAH hin. Hinsichtlich des operativen Gewinns tätige Actelion Ausgaben für Marketing, um seine führende Position zu behaupten. Dies werde sich im Geschäftsjahr 2009 fortsetzen, zusammen mit hohen F&E-Aufwendungen zur Unterstützung der Produktpipeline im späten Entwicklungsstadium.
Das Geschäftsjahr 2009 hänge stark von erfolgreichen klinischen Daten ab, vor allem bei dem Schlafmedikament Almorexant, bei Bosentan zur Behandlung von IPF und Clazosentan bei aSAH.
Die Analysten von Vontobel Research halten an ihrer "hold"-Empfehlung und ihrem Kursziel von CHF 65 für die Actelion-Aktie fest. (Analyse vom 19.02.2009) (19.02.2009/ac/a/a)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
Quelle:AKTIENCHECK.DE

Na ja, die Börse spinnt sich gerade mal weider einen ab... was solls.
S1P1 hat doch noch keine klinischen Wirksamkeitsdaten aufzuweisen, es war also eine reine P1. Da der Wirkstoff in verschiedenen Indikationen getestet werden wird, ist das aber auch logisch.
Die erste Indikation wird wohl Schuppenflechte:
Proof-of-concept study in plaque psoriasis is recruiting (results
expected H2 2009)
Dass schon dieses Jahr P2-Ergebnisse vorliegen sollen, finde ich sehr, sehr positiv und aufregend.
Mit MS gehts dann weiter:
Phase II dose-finding study in multiple sclerosis is foreseen to initiate in the coming months
Und Arthritis ist die dritte Indikation, die kommen wird.
S1P1 hat doch noch keine klinischen Wirksamkeitsdaten aufzuweisen, es war also eine reine P1. Da der Wirkstoff in verschiedenen Indikationen getestet werden wird, ist das aber auch logisch.
Die erste Indikation wird wohl Schuppenflechte:
Proof-of-concept study in plaque psoriasis is recruiting (results
expected H2 2009)
Dass schon dieses Jahr P2-Ergebnisse vorliegen sollen, finde ich sehr, sehr positiv und aufregend.
Mit MS gehts dann weiter:
Phase II dose-finding study in multiple sclerosis is foreseen to initiate in the coming months
Und Arthritis ist die dritte Indikation, die kommen wird.
Antwort auf Beitrag Nr.: 36.612.871 von SLGramann am 19.02.09 17:04:50
Der Newsflow für 2009 (gefettet die mir wichtigsten Sachen):
Actelion in 2009 – News flow
• Positive CRTH2 receptor antagonist results in patients with asthma
• S1P1 receptor agonist
– Top-line results in PoC in psoriasis
– Initiation of Phase IIb in MS
• PGI2 receptor agonist Phase IIa results and Phase IIb initiation
• CONCIOUS-2 results with clazosentan expected by year end
• BUILD-3 results with bosentan expected by year end
• RESTORA 1 results with almorexant expected by year end
• PROWESS 15 results with iloprost expected Q2/Q3 2009
Der Newsflow für 2009 (gefettet die mir wichtigsten Sachen):
Actelion in 2009 – News flow
• Positive CRTH2 receptor antagonist results in patients with asthma
• S1P1 receptor agonist
– Top-line results in PoC in psoriasis
– Initiation of Phase IIb in MS
• PGI2 receptor agonist Phase IIa results and Phase IIb initiation
• CONCIOUS-2 results with clazosentan expected by year end
• BUILD-3 results with bosentan expected by year end
• RESTORA 1 results with almorexant expected by year end
• PROWESS 15 results with iloprost expected Q2/Q3 2009
20.02.2009 11:54:51
Actelion "hold"
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, stuft die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" weiterhin mit "hold" ein.
Actelion habe sein Ergebnis für das GJ08 vorgelegt. Der Umsatz habe im Rahmen der Analystenerwartungen gelegen. Der Betriebs- und Reingewinn habe ihre Erwartungen um 7% bzw. 11% verfehlt. Die Umsatzvorgabe liege leicht über ihren bisherigen Schätzungen. Daher würden sie ihre Umsatzprognose für das GJ09 erhöhen. Der Geschäftsaufwand sei hingegen höher als bisher erwartet, weshalb die Analysten ihre Schätzungen für den Betriebsgewinn um rund 4% für das GJ09 und um 2% für das GJ10 senken würden. Actelion habe eine umfassende Übersicht über die Fortschritte in der Forschung und Entwicklung gegeben. Entscheidend sei, dass alle wichtigen für das 2H09 erwarteten klinischen Meilensteine bestätigt worden seien.
Der Umsatz von Tracleer, Actelions Flaggschiff-Präparat, wachse trotz des Markteintritts von Konkurrenzprodukten durch Gilead, GSK und Encysive (Pfizer) ungehindert weiter. Die Unternehmensleitung von Actelion stelle zudem für das laufende Geschäftsjahr ein Umsatzwachstum in Lokalwährung (LW) von 12 bis 15% in Aussicht. Folglich würden die Analysten ihre Umsatzprognose für Tracleer um rund 4 bis 5% erhöhen. Die Vorgabe für das Cash-EBIT im GJ09 lasse auf Druck bei der Betriebsmarge schließen. Die Analysten würden nun mit einem Umsatzwachstum in LW von 16% rechnen und einem Geschäftsaufwand, der im Rahmen der Vorgaben der Unternehmensleitung liege. Daher dürfte das Cash-EBIT in LW um 15% wachsen (Vorgabe von Actelion: 10 bis 12%).
Von Schlüsselbedeutung für 2009 sei, dass die wichtigen Zeitpläne für die klinischen Daten der Phase-III-Studien mit bedeutenden Produkten wie Almorexant (Schlaflosigkeit), Bosentan (idiopathische Lungenfibrose) und Clazosentan (Vasospasmen nach Subarachnoidalblutungen) bestätigt worden seien.
Das Unternehmen sei weiterhin günstig bewertet.
Im Moment behalten die Analysten von Vontobel Research ihre "hold"-Empfehlung und ihr Kursziel von CHF 65 für die Actelion-Aktie bei. Ihr DCF-basierter Fair Value für Actelion betrage CHF 77. Sie würden ihre Anlagebeurteilung vor dem Eintreten der wichtigen Impulsgeber Ende 2009 überprüfen. (Analyse vom 20.02.2009) (20.02.2009/ac/a/a)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
Quelle:AKTIENCHECK.DE
Actelion "hold"
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, stuft die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" weiterhin mit "hold" ein.
Actelion habe sein Ergebnis für das GJ08 vorgelegt. Der Umsatz habe im Rahmen der Analystenerwartungen gelegen. Der Betriebs- und Reingewinn habe ihre Erwartungen um 7% bzw. 11% verfehlt. Die Umsatzvorgabe liege leicht über ihren bisherigen Schätzungen. Daher würden sie ihre Umsatzprognose für das GJ09 erhöhen. Der Geschäftsaufwand sei hingegen höher als bisher erwartet, weshalb die Analysten ihre Schätzungen für den Betriebsgewinn um rund 4% für das GJ09 und um 2% für das GJ10 senken würden. Actelion habe eine umfassende Übersicht über die Fortschritte in der Forschung und Entwicklung gegeben. Entscheidend sei, dass alle wichtigen für das 2H09 erwarteten klinischen Meilensteine bestätigt worden seien.
Der Umsatz von Tracleer, Actelions Flaggschiff-Präparat, wachse trotz des Markteintritts von Konkurrenzprodukten durch Gilead, GSK und Encysive (Pfizer) ungehindert weiter. Die Unternehmensleitung von Actelion stelle zudem für das laufende Geschäftsjahr ein Umsatzwachstum in Lokalwährung (LW) von 12 bis 15% in Aussicht. Folglich würden die Analysten ihre Umsatzprognose für Tracleer um rund 4 bis 5% erhöhen. Die Vorgabe für das Cash-EBIT im GJ09 lasse auf Druck bei der Betriebsmarge schließen. Die Analysten würden nun mit einem Umsatzwachstum in LW von 16% rechnen und einem Geschäftsaufwand, der im Rahmen der Vorgaben der Unternehmensleitung liege. Daher dürfte das Cash-EBIT in LW um 15% wachsen (Vorgabe von Actelion: 10 bis 12%).
Von Schlüsselbedeutung für 2009 sei, dass die wichtigen Zeitpläne für die klinischen Daten der Phase-III-Studien mit bedeutenden Produkten wie Almorexant (Schlaflosigkeit), Bosentan (idiopathische Lungenfibrose) und Clazosentan (Vasospasmen nach Subarachnoidalblutungen) bestätigt worden seien.
Das Unternehmen sei weiterhin günstig bewertet.
Im Moment behalten die Analysten von Vontobel Research ihre "hold"-Empfehlung und ihr Kursziel von CHF 65 für die Actelion-Aktie bei. Ihr DCF-basierter Fair Value für Actelion betrage CHF 77. Sie würden ihre Anlagebeurteilung vor dem Eintreten der wichtigen Impulsgeber Ende 2009 überprüfen. (Analyse vom 20.02.2009) (20.02.2009/ac/a/a)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
Quelle:AKTIENCHECK.DE
23.02.2009 07:01:00
Actelion kündigt Erwerb einer neuen Formulierung von intravenös zu verabreichendem Epoprostenol mit verbesserter thermischer Stabilität zur Behandlung der pulmonalen arteriellen Hypertonie an
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin. Für den Inhalt der Mitteilung ist der Emittent verantwortlich. -------------------------------------------------------------------
ALLSCHWIL/BASEL, SCHWEIZ - 23. Februar 2009 - Actelion Ltd (SIX: ATLN) gab heute bekannt, dass das Unternehmen eine verbindliche Vereinbarung über den Erwerb einer verbesserten thermostabilen Formulierung von Epoprostenol-Natrium zur intravenösen Behandlung der pulmonalen arteriellen Hypertonie (PAH) mit GeneraMedix Inc. (GXI), einem Unternehmen in Privatbesitz, eingegangen ist. GeneraMedix konzentriert sich auf injizierbare Produkte für Spitäler und andere Spezialiäten-Märkte in den USA und hat seinen Hauptsitz in Liberty Corner, New Jersey/USA. Am 27. Juni 2008 genehmigte die US-amerikanische Arzneimittelbehörde FDA die Zulassung dieser verbesserten Formulierung von Epoprostenol zur Injektion (Ampulle mit 1,5 mg/ml) für die Langzeit-IV-Behandlung der primären pulmonalen Hypertonie und für die in Verbindung mit dem Krankheitsbild der Sklerodermie auftretenden Formen der pulmonalen Hypertonie bei Patienten der NYHA-Klasse III und IV, die auf konventionelle Behandlungsformen nicht ausreichend ansprechen. Diese Formulierung ist geschützt durch Patentanmeldungen. Actelion wird für die weltweite Entwicklung, Registrierung und Kommerzialisierung des Produkts verantwortlich sein. Einzelheiten zu den finanziellen Rahmenbedingungen dieser Vereinbarung wurden nicht bekannt gegeben. Die verbesserte Formulierung von Epoprostenol zur Injektion enthält nicht-proprietäre Verdünnungsmittel und kann nach Herstellung der benutzungsfertigen Lösung für bis zu 48 Stunden bei 25º C oder bis zu 5 Tage im Kühlschrank zwischen 2º und 8º C gelagert werden. Dr. Jean-Paul Clozel, CEO von Actelion, kommentierte: "Wir sind höchst zufrieden mit dem Erwerb dieses innovativen Produkts, da es unser Engagement in der PAH-Therapie stützt. Actelion hat stets eine führende Position bei der Verbesserung der Lebensqualität von PAH-Patienten eingenommen, und wir glauben, dass diese neue, verbesserte Formulierung möglicherweise eine bedeutende Rolle in der Behandlung der PAH spielen kann." Im Unterschied zu anderen, für die PAH-Therapie zugelassenen Formulierungen von Epoprostenol bleibt diese einzigartige Formulierung nach Abfüllung der flüssigen Lösung in die Pumpe über 24 Stunden bei Raumtemperatur stabil und kann daher ohne gefrorene Gelpackungen benutzt werden. Jean-Paul Clozel fuhr fort: "Diese Eigenschaft könnte klare Vorteile im Hinblick auf die Verabreichung des Medikaments bieten. Sie ermöglicht PAH-Patienten voraussichtlich eine grössere Freiheit und Anwenderfreundlichkeit. Gleichzeitig dürften auch geringere Mengen an Arzneimittelresten anfallen, die entsorgt werden müssen. Wir werden zusammen mit Patienten und PAH-Spezialisten an der weiteren Optimierung dieser neuen Formulierung arbeiten." Otto Schwarz, President Business Operations, erklärte: "Actelion hat Tracleer® zum Eckpfeiler der PAH-Therapie gemacht. Wir sind entschlossen, auch weiterhin in die Entwicklung innovativer Therapien für Patienten und ihre behandelnden Ärzte zu investieren. Diese thermostabile Formulierung von Epoprostenol geht mehrere Einschränkungen von konventionellem Epoprostenol an. Wir werden eng mit PAH-Spezialisten zusammenarbeiten, um ausreichend klinische Erfahrungen mit diesem Produkt zu gewinnen und damit zunächst in den Vereinigten Staaten und später auch in anderen Ländern weltweit eines der besten Produkte seiner Klasse für alle PAH-Patienten anbieten zu können."
### Anmerkungen für Herausgeber: Über pulmonale arterielle Hypertonie (PAH) Pulmonale arterielle Hypertonie (PAH) ist eine chronische, lebensbedrohende Erkrankung, die durch abnorm hohen Blutdruck in den Arterien zwischen Herz und Lunge der betroffenen Patienten gekennzeichnet ist. Die Funktionen von Herz und Lunge sind stark beeinträchtigt, was sich in einer eingeschränkten körperlichen Leistungsfähigkeit und letztendlich einer verkürzten Lebenserwartung niederschlägt. Etwa 100.000 Menschen in Europe und den USA leiden an primärem Lungenhochdruck oder sekundären Formen der Erkrankung. Letztere sind Folge von anderen Krankheiten oder Gewebeveränderungen der Lunge wie Sklerodermie, Lupus, HIV/AIDS oder angeborenen Herzkrankheiten. PAH geht mit strukturellen Veränderungen im Gefässsystem der Lunge und der rechten Herzkammer einher. Jüngste Fortschritte [1] im Verständnis der für Gefässerkrankungen der Lunge verantwortlichen pathogenen Faktoren führten zur Entwicklung neuer Therapien, die auf spezifische Signalwege (Pathways) ausgerichtet sind (den Prostazyklin-Pathway; den Endothelin-Pathway und den Stickoxid-Pathway) [2]. Die verfügbaren Therapien haben einen positiven Einfluss auf PAH, stellen aber keine Heilung dar, und bei vielen Patienten schreitet die Erkrankung weiter voran. PAH bleibt daher eine schwere, lebensbedrohliche Krankheit [2,3]. Eine frühzeitige Diagnose und ein Verständnis für Therapiewahl und Behandlungsbeginn bleiben kritische Elemente bei der optimalen Versorgung von PAH-Patienten. Über Tracleer® bei pulmonaler arterieller Hypertonie (PAH) Tracleer® (Bosentan), der erste orale duale Endothelin-Rezeptor-Antagonist, ist für die Behandlung der pulmonalen arteriellen Hypertonie (PAH) zugelassen und wird durch Niederlassungen von Actelion in den USA, der Europäischen Union, Japan, Australien, Kanada und der Schweiz sowie in anderen Märkten weltweit verfügbar gemacht. Folgende Sicherheitseinschränkungen sind zu beachten: Mögliche schwere Leberschäden (einschliesslich seltener Fälle von Leberversagen und ungeklärter Leberzirrhose unter der gegebenen strikten medizinischen Überwachung). Vor Behandlungsbeginn und während der Behandlung in monatlichem Rhythmus sind daher bei allen Patienten Untersuchungen der Leberenzymwerte erforderlich. Wegen des Risikos einer Schädigung des ungeborenen Kindes dürfen Schwangere und Frauen im gebärfähigen Alter, die keine zuverlässige Verhütungsmethode anwenden, Tracleer® nicht einnehmen. Infolge dieser Risiken ist Tracleer® nur über kontrollierte Distribution erhältlich.
[4] Literaturhinweise 1. Farber HW; Loscalzo J. Mechanisms of disease: pulmonary arterial hypertension. N. Eng. J. Med. 2004; 351: 1655-65. 2. Humbert M; Sitbon O; Simonneau G. Treatment of pulmonary arterial hypertension. N. Eng. J. Med. 2004; 351: 1425-36. 3. Humbert M; Morrell NW; Archer SL; et al. Cellular and molecular pathobiology of pulmonary arterial hypertension. J. Am. Coll. Cardiol. 2004; 43: Suppl. 12: 13S-24S. 4. Tracleer® SPC.
Actelion Ltd Actelion Ltd ist ein biopharmazeutisches Unternehmen mit Hauptsitz in Allschwil/Basel, Schweiz. Actelions erstes Medikament, Tracleer®, ist ein zur Therapie der pulmonalen arteriellen Hypertonie zugelassener dualer Endothelin-Rezeptor-Antagonist in Tablettenform. Actelion vertreibt Tracleer® durch eigene Niederlassungen in den wichtigsten internationalen Märkten, so den Vereinigten Staaten (mit Sitz in South San Francisco), der Europäischen Union, Japan, Kanada, Australien und der Schweiz. Actelion, 1997 gegründet, ist ein weltweit führendes Unternehmen bei der Erforschung des Endothels. Das Endothel trennt die Gefässwand vom Blutstrom. Mit über 1.900 Mitarbeitenden konzentriert sich Actelion darauf, innovative Medikamente in Bereichen mit hohem medizinischem Bedarf zu entdecken, zu entwickeln und zu vermarkten. Actelion Aktien sind am SIX Swiss Exchange notiert (Symbol: ATLN) und werden als Teil des Schweizer Blue-Chip-Index SMI® (Swiss Market Index) gehandelt. GeneraMedix, Inc. GeneraMedix Inc. ist ein pharmazeutisches Unternehmen in Privatbesitz, das sich auf schwierig zu entwickelnde und zu produzierende Produkte zur Injektion für den Spitalmarkt in den USA und andere Spezialiäten-Märkte konzentriert. Neben den vom Unternehmen bereits vermarkteten Produkten verfügt GeneraMedix über eine beträchtliche Reihe injizierbarer Produkte, die sich in der Entwicklung befinden sowie eine Reihe von Produkten, die derzeit von der FDA überprüft werden. Das Unternehmen mit Hauptsitz in Liberty Corner, New Jersey, wurde im Juli 2004 mit Kapitalbeteiligung von GTCR Golder Rauner, LLC, und Ferrer Freeman & Company; LLC gegründet. Weitere Informationen finden Sie auf der Website des Unternehmens unter www.generamedix.com Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil Für weitere Informationen wenden Sie sich bitte an: Roland Haefeli Vice President, Head of Investor Relations & Public Affairs Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil +41 61 565 62 62 +1 650 624 69 36 http://www.actelion.com
--- Ende der Mitteilung ---
Actelion Pharmaceuticals Ltd Gewerbestrasse 16 Allschwil Schweiz WKN: 936767; ISIN: CH0010532478; Index: SBIOM, SLIFE, SMCI, SMIEXP, SMIM, SPI, SPIEX; Notiert: Main Market in SIX Swiss Exchange; http://www.actelion.com http://hugin.info/131801/R/1292315/292373.pdf Copyright © Hugin AS 2009. All rights reserved.
Quelle: HUGIN
Actelion kündigt Erwerb einer neuen Formulierung von intravenös zu verabreichendem Epoprostenol mit verbesserter thermischer Stabilität zur Behandlung der pulmonalen arteriellen Hypertonie an
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin. Für den Inhalt der Mitteilung ist der Emittent verantwortlich. -------------------------------------------------------------------
ALLSCHWIL/BASEL, SCHWEIZ - 23. Februar 2009 - Actelion Ltd (SIX: ATLN) gab heute bekannt, dass das Unternehmen eine verbindliche Vereinbarung über den Erwerb einer verbesserten thermostabilen Formulierung von Epoprostenol-Natrium zur intravenösen Behandlung der pulmonalen arteriellen Hypertonie (PAH) mit GeneraMedix Inc. (GXI), einem Unternehmen in Privatbesitz, eingegangen ist. GeneraMedix konzentriert sich auf injizierbare Produkte für Spitäler und andere Spezialiäten-Märkte in den USA und hat seinen Hauptsitz in Liberty Corner, New Jersey/USA. Am 27. Juni 2008 genehmigte die US-amerikanische Arzneimittelbehörde FDA die Zulassung dieser verbesserten Formulierung von Epoprostenol zur Injektion (Ampulle mit 1,5 mg/ml) für die Langzeit-IV-Behandlung der primären pulmonalen Hypertonie und für die in Verbindung mit dem Krankheitsbild der Sklerodermie auftretenden Formen der pulmonalen Hypertonie bei Patienten der NYHA-Klasse III und IV, die auf konventionelle Behandlungsformen nicht ausreichend ansprechen. Diese Formulierung ist geschützt durch Patentanmeldungen. Actelion wird für die weltweite Entwicklung, Registrierung und Kommerzialisierung des Produkts verantwortlich sein. Einzelheiten zu den finanziellen Rahmenbedingungen dieser Vereinbarung wurden nicht bekannt gegeben. Die verbesserte Formulierung von Epoprostenol zur Injektion enthält nicht-proprietäre Verdünnungsmittel und kann nach Herstellung der benutzungsfertigen Lösung für bis zu 48 Stunden bei 25º C oder bis zu 5 Tage im Kühlschrank zwischen 2º und 8º C gelagert werden. Dr. Jean-Paul Clozel, CEO von Actelion, kommentierte: "Wir sind höchst zufrieden mit dem Erwerb dieses innovativen Produkts, da es unser Engagement in der PAH-Therapie stützt. Actelion hat stets eine führende Position bei der Verbesserung der Lebensqualität von PAH-Patienten eingenommen, und wir glauben, dass diese neue, verbesserte Formulierung möglicherweise eine bedeutende Rolle in der Behandlung der PAH spielen kann." Im Unterschied zu anderen, für die PAH-Therapie zugelassenen Formulierungen von Epoprostenol bleibt diese einzigartige Formulierung nach Abfüllung der flüssigen Lösung in die Pumpe über 24 Stunden bei Raumtemperatur stabil und kann daher ohne gefrorene Gelpackungen benutzt werden. Jean-Paul Clozel fuhr fort: "Diese Eigenschaft könnte klare Vorteile im Hinblick auf die Verabreichung des Medikaments bieten. Sie ermöglicht PAH-Patienten voraussichtlich eine grössere Freiheit und Anwenderfreundlichkeit. Gleichzeitig dürften auch geringere Mengen an Arzneimittelresten anfallen, die entsorgt werden müssen. Wir werden zusammen mit Patienten und PAH-Spezialisten an der weiteren Optimierung dieser neuen Formulierung arbeiten." Otto Schwarz, President Business Operations, erklärte: "Actelion hat Tracleer® zum Eckpfeiler der PAH-Therapie gemacht. Wir sind entschlossen, auch weiterhin in die Entwicklung innovativer Therapien für Patienten und ihre behandelnden Ärzte zu investieren. Diese thermostabile Formulierung von Epoprostenol geht mehrere Einschränkungen von konventionellem Epoprostenol an. Wir werden eng mit PAH-Spezialisten zusammenarbeiten, um ausreichend klinische Erfahrungen mit diesem Produkt zu gewinnen und damit zunächst in den Vereinigten Staaten und später auch in anderen Ländern weltweit eines der besten Produkte seiner Klasse für alle PAH-Patienten anbieten zu können."
### Anmerkungen für Herausgeber: Über pulmonale arterielle Hypertonie (PAH) Pulmonale arterielle Hypertonie (PAH) ist eine chronische, lebensbedrohende Erkrankung, die durch abnorm hohen Blutdruck in den Arterien zwischen Herz und Lunge der betroffenen Patienten gekennzeichnet ist. Die Funktionen von Herz und Lunge sind stark beeinträchtigt, was sich in einer eingeschränkten körperlichen Leistungsfähigkeit und letztendlich einer verkürzten Lebenserwartung niederschlägt. Etwa 100.000 Menschen in Europe und den USA leiden an primärem Lungenhochdruck oder sekundären Formen der Erkrankung. Letztere sind Folge von anderen Krankheiten oder Gewebeveränderungen der Lunge wie Sklerodermie, Lupus, HIV/AIDS oder angeborenen Herzkrankheiten. PAH geht mit strukturellen Veränderungen im Gefässsystem der Lunge und der rechten Herzkammer einher. Jüngste Fortschritte [1] im Verständnis der für Gefässerkrankungen der Lunge verantwortlichen pathogenen Faktoren führten zur Entwicklung neuer Therapien, die auf spezifische Signalwege (Pathways) ausgerichtet sind (den Prostazyklin-Pathway; den Endothelin-Pathway und den Stickoxid-Pathway) [2]. Die verfügbaren Therapien haben einen positiven Einfluss auf PAH, stellen aber keine Heilung dar, und bei vielen Patienten schreitet die Erkrankung weiter voran. PAH bleibt daher eine schwere, lebensbedrohliche Krankheit [2,3]. Eine frühzeitige Diagnose und ein Verständnis für Therapiewahl und Behandlungsbeginn bleiben kritische Elemente bei der optimalen Versorgung von PAH-Patienten. Über Tracleer® bei pulmonaler arterieller Hypertonie (PAH) Tracleer® (Bosentan), der erste orale duale Endothelin-Rezeptor-Antagonist, ist für die Behandlung der pulmonalen arteriellen Hypertonie (PAH) zugelassen und wird durch Niederlassungen von Actelion in den USA, der Europäischen Union, Japan, Australien, Kanada und der Schweiz sowie in anderen Märkten weltweit verfügbar gemacht. Folgende Sicherheitseinschränkungen sind zu beachten: Mögliche schwere Leberschäden (einschliesslich seltener Fälle von Leberversagen und ungeklärter Leberzirrhose unter der gegebenen strikten medizinischen Überwachung). Vor Behandlungsbeginn und während der Behandlung in monatlichem Rhythmus sind daher bei allen Patienten Untersuchungen der Leberenzymwerte erforderlich. Wegen des Risikos einer Schädigung des ungeborenen Kindes dürfen Schwangere und Frauen im gebärfähigen Alter, die keine zuverlässige Verhütungsmethode anwenden, Tracleer® nicht einnehmen. Infolge dieser Risiken ist Tracleer® nur über kontrollierte Distribution erhältlich.
[4] Literaturhinweise 1. Farber HW; Loscalzo J. Mechanisms of disease: pulmonary arterial hypertension. N. Eng. J. Med. 2004; 351: 1655-65. 2. Humbert M; Sitbon O; Simonneau G. Treatment of pulmonary arterial hypertension. N. Eng. J. Med. 2004; 351: 1425-36. 3. Humbert M; Morrell NW; Archer SL; et al. Cellular and molecular pathobiology of pulmonary arterial hypertension. J. Am. Coll. Cardiol. 2004; 43: Suppl. 12: 13S-24S. 4. Tracleer® SPC.
Actelion Ltd Actelion Ltd ist ein biopharmazeutisches Unternehmen mit Hauptsitz in Allschwil/Basel, Schweiz. Actelions erstes Medikament, Tracleer®, ist ein zur Therapie der pulmonalen arteriellen Hypertonie zugelassener dualer Endothelin-Rezeptor-Antagonist in Tablettenform. Actelion vertreibt Tracleer® durch eigene Niederlassungen in den wichtigsten internationalen Märkten, so den Vereinigten Staaten (mit Sitz in South San Francisco), der Europäischen Union, Japan, Kanada, Australien und der Schweiz. Actelion, 1997 gegründet, ist ein weltweit führendes Unternehmen bei der Erforschung des Endothels. Das Endothel trennt die Gefässwand vom Blutstrom. Mit über 1.900 Mitarbeitenden konzentriert sich Actelion darauf, innovative Medikamente in Bereichen mit hohem medizinischem Bedarf zu entdecken, zu entwickeln und zu vermarkten. Actelion Aktien sind am SIX Swiss Exchange notiert (Symbol: ATLN) und werden als Teil des Schweizer Blue-Chip-Index SMI® (Swiss Market Index) gehandelt. GeneraMedix, Inc. GeneraMedix Inc. ist ein pharmazeutisches Unternehmen in Privatbesitz, das sich auf schwierig zu entwickelnde und zu produzierende Produkte zur Injektion für den Spitalmarkt in den USA und andere Spezialiäten-Märkte konzentriert. Neben den vom Unternehmen bereits vermarkteten Produkten verfügt GeneraMedix über eine beträchtliche Reihe injizierbarer Produkte, die sich in der Entwicklung befinden sowie eine Reihe von Produkten, die derzeit von der FDA überprüft werden. Das Unternehmen mit Hauptsitz in Liberty Corner, New Jersey, wurde im Juli 2004 mit Kapitalbeteiligung von GTCR Golder Rauner, LLC, und Ferrer Freeman & Company; LLC gegründet. Weitere Informationen finden Sie auf der Website des Unternehmens unter www.generamedix.com Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil Für weitere Informationen wenden Sie sich bitte an: Roland Haefeli Vice President, Head of Investor Relations & Public Affairs Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil +41 61 565 62 62 +1 650 624 69 36 http://www.actelion.com
--- Ende der Mitteilung ---
Actelion Pharmaceuticals Ltd Gewerbestrasse 16 Allschwil Schweiz WKN: 936767; ISIN: CH0010532478; Index: SBIOM, SLIFE, SMCI, SMIEXP, SMIM, SPI, SPIEX; Notiert: Main Market in SIX Swiss Exchange; http://www.actelion.com http://hugin.info/131801/R/1292315/292373.pdf Copyright © Hugin AS 2009. All rights reserved.
Quelle: HUGIN
02.03.2009 11:40:00
Actelion chancenreich
Düsseldorf (aktiencheck.de AG) - Die Experten der "Wirtschaftswoche" halten die Actelion-Aktie (ISIN CH0010532478/ WKN 936767) für ein chancenreiches Investment.
Die Biotech-Gesellschaft aus der Schweiz habe vor Kurzem ihre Zahlen für das abgelaufene Geschäftsjahr publiziert. So sei der Umsatz um 12% auf 1,5 Mrd. CHF ausgeweitet worden das EPS habe sich auf 2,60 CHF belaufen, womit der Rekordwert von 2,05 CHF aus dem Jahre 2006 übertroffen worden sei.
Damit habe das Unternehmen keine schlechten Zahlen publiziert, aber dennoch sei es nach der Bekanntgabe zu leichten Kursverlusten gekommen, was nach Meinung der Experten nun eine Chance für Neueinsteiger sei.
Tracleer, ein Mittel gegen Lungenhochdruck, sei das wichtigste Medikament für Actelion. Es habe inzwischen für 50 Länder die Zulassung erhalten und für die kommenden Monate sei die Einführung zusätzlicher Indikationen vorgesehen. Außerdem befänden sich vier Wirkstoffe in Phase III der klinischen Forschung. Dabei liege der Fokus vor allem auf Almorexant, welches ein Medikament gegen Schlaflosigkeit sei.
Die Firma verfüge über Eigenkapital von 793 Mio. CHF und der Titel sei mit einem KGV 2009e von 16 nicht zu hoch bewertet.
Nach Meinung der Experten der "Wirtschaftswoche" weist die Actelion-Aktie ein attraktives Chance/Risiko-Profil auf. Ein Stoppkurs sollte bei 45 CHF platziert werden. (Ausgabe 10) (02.03.2009/ac/a/a)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
Quelle: AKTIENCHECK.DE
Actelion chancenreich
Düsseldorf (aktiencheck.de AG) - Die Experten der "Wirtschaftswoche" halten die Actelion-Aktie (ISIN CH0010532478/ WKN 936767) für ein chancenreiches Investment.
Die Biotech-Gesellschaft aus der Schweiz habe vor Kurzem ihre Zahlen für das abgelaufene Geschäftsjahr publiziert. So sei der Umsatz um 12% auf 1,5 Mrd. CHF ausgeweitet worden das EPS habe sich auf 2,60 CHF belaufen, womit der Rekordwert von 2,05 CHF aus dem Jahre 2006 übertroffen worden sei.
Damit habe das Unternehmen keine schlechten Zahlen publiziert, aber dennoch sei es nach der Bekanntgabe zu leichten Kursverlusten gekommen, was nach Meinung der Experten nun eine Chance für Neueinsteiger sei.
Tracleer, ein Mittel gegen Lungenhochdruck, sei das wichtigste Medikament für Actelion. Es habe inzwischen für 50 Länder die Zulassung erhalten und für die kommenden Monate sei die Einführung zusätzlicher Indikationen vorgesehen. Außerdem befänden sich vier Wirkstoffe in Phase III der klinischen Forschung. Dabei liege der Fokus vor allem auf Almorexant, welches ein Medikament gegen Schlaflosigkeit sei.
Die Firma verfüge über Eigenkapital von 793 Mio. CHF und der Titel sei mit einem KGV 2009e von 16 nicht zu hoch bewertet.
Nach Meinung der Experten der "Wirtschaftswoche" weist die Actelion-Aktie ein attraktives Chance/Risiko-Profil auf. Ein Stoppkurs sollte bei 45 CHF platziert werden. (Ausgabe 10) (02.03.2009/ac/a/a)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
Quelle: AKTIENCHECK.DE
News!
US Food and Drug Administration issues complete response letter regarding the Tracleer® supplemental New Drug Application - Completion and Approval of Risk Evaluation and Mitigation System (REMS) submission required for final FDA review for inclusion of less severe PAH patients in the product label
ALLSCHWIL/BASEL, SWITZERLAND - 02 March 2009 -
Actelion Ltd (SIX: ATLN) announced today it has received a complete response letter from the US Food and Drug Administration (FDA) regarding the supplemental New Drug Application (NDA) the company filed in August 2007.
In this supplemental NDA, Actelion asked that the US product indication be expanded to include patients suffering from Pulmonary Arterial Hypertension (WHO Group I) with less severe disease (WHO Class II - IV symptoms). Since November 2001, Tracleer® has been commercially available in the United States for PAH patients with WHO III-IV symptoms.
In its Complete Response letter, the FDA has informed Actelion that the REMS submission (Risk Evaluation and Mitigation Strategy) Actelion submitted in September 2008 needs to be finalized and approved before the FDA will then, in turn, be able to conclude the review of the supplemental Tracleer® NDA expanding the indication to the less severe PAH patient population.
Jean-Paul Clozel, M.D. and Chief Executive Officer of Actelion, commented: "We will continue to diligently work with the US Food and Drug Administration on the ongoing REMS submission in order to expand the US product label to include less severe PAH patients."
###
Notes to the editor:
About Pulmonary Arterial Hypertension (PAH)
Pulmonary arterial hypertension (PAH) is a chronic, life-threatening disorder characterized by abnormally high blood pressure in the arteries between the heart and lungs of an affected individual. The function of the heart and lungs is severely compromised, manifested by a limited exercise capacity, and, ultimately, a reduced life expectancy. Approximately 100,000 people in Europe and the United States are afflicted with either primary or secondary forms of the disease related to conditions or tissue disorders that affect the lungs, such as scleroderma, lupus, HIV/AIDS or congenital heart disease.
PAH is associated with structural changes in both the pulmonary vasculature and the right ventricle. Recent advances [1] in the understanding of the pathogenic factors leading to the pulmonary vascular disease have led to the development of new therapies targeting specific pathways (the prostacyclin pathway; the endothelin pathway; and the nitric oxide pathway) [2]. The available therapies have positive effects in PAH, but they do not provide a cure, and in many patients the disease will progress. PAH remains a serious life-threatening condition [2,3]. Early recognition and an understanding of the selection and timing of therapeutic options remain critical elements in the optimal management of patients with this disorder.
About Tracleer® in Pulmonary Arterial Hypertension (PAH)
Tracleer® (bosentan), the first oral dual endothelin receptor antagonist, is approved for the treatment of pulmonary arterial hypertension (PAH) and made available by Actelion subsidiaries in the United States, the European Union, Japan, Australia, Canada, Switzerland and other markets worldwide.
Requires attention to two significant safety concerns: Potential for serious liver injury (including rare cases of liver failure and unexplained hepatic cirrhosis in a setting of close monitoring) - Liver monitoring of all patients is essential prior to initiation of treatment and monthly thereafter. Tracleer® treatment must not be initiated in women of childbearing potential unless they practice reliable contraception and participate in monthly pregnancy testing. Due to these risks, Tracleer® is only supplied through a controlled distribution.
References:
1. Farber HW; Loscalzo J. Mechanisms of disease: pulmonary arterial hypertension. N. Eng. J. Med. 2004; 351:1655-65.
2. Humbert M; Sitbon O; Simonneau G. Treatment of pulmonary arterial hypertension. N. Eng. J. Med. 2004;351:1425-36.
3. Humbert M; Morrell NW; Archer SL; et al. Cellular and molecular pathobiology of pulmonary arterial hypertension. J. Am. Coll. Cardiol. 2004; 43: Suppl. 12: 13S-24S.
4. Tracleer® SPC.
Actelion Ltd
Actelion Ltd is a biopharmaceutical company with its corporate headquarters in Allschwil/Basel, Switzerland. Actelion's first drug Tracleer®, an orally available dual endothelin receptor antagonist, has been approved as a therapy for pulmonary arterial hypertension. Actelion markets Tracleer® through its own subsidiaries in key markets worldwide, including the United States (based in South San Francisco), the European Union, Japan, Canada, Australia and Switzerland. Actelion, founded in late 1997, is a leading player in innovative science related to the endothelium - the single layer of cells separating every blood vessel from the blood stream. Actelion's over 1900 employees focus on the discovery, development and marketing of innovative drugs for significant unmet medical needs. Actelion shares are traded on the SIX Swiss Exchange (ticker symbol: ATLN) as part of the Swiss blue-chip index SMI (Swiss Market Index SMI® )
For further information please contact:
Roland Haefeli
Vice President, Head of Investor Relations & Public Affairs
Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil
+41 61 565 62 62
+1 650 624 69 36
http://www.actelion.com
US Food and Drug Administration issues complete response letter regarding the Tracleer® supplemental New Drug Application - Completion and Approval of Risk Evaluation and Mitigation System (REMS) submission required for final FDA review for inclusion of less severe PAH patients in the product label
ALLSCHWIL/BASEL, SWITZERLAND - 02 March 2009 -
Actelion Ltd (SIX: ATLN) announced today it has received a complete response letter from the US Food and Drug Administration (FDA) regarding the supplemental New Drug Application (NDA) the company filed in August 2007.
In this supplemental NDA, Actelion asked that the US product indication be expanded to include patients suffering from Pulmonary Arterial Hypertension (WHO Group I) with less severe disease (WHO Class II - IV symptoms). Since November 2001, Tracleer® has been commercially available in the United States for PAH patients with WHO III-IV symptoms.
In its Complete Response letter, the FDA has informed Actelion that the REMS submission (Risk Evaluation and Mitigation Strategy) Actelion submitted in September 2008 needs to be finalized and approved before the FDA will then, in turn, be able to conclude the review of the supplemental Tracleer® NDA expanding the indication to the less severe PAH patient population.
Jean-Paul Clozel, M.D. and Chief Executive Officer of Actelion, commented: "We will continue to diligently work with the US Food and Drug Administration on the ongoing REMS submission in order to expand the US product label to include less severe PAH patients."
###
Notes to the editor:
About Pulmonary Arterial Hypertension (PAH)
Pulmonary arterial hypertension (PAH) is a chronic, life-threatening disorder characterized by abnormally high blood pressure in the arteries between the heart and lungs of an affected individual. The function of the heart and lungs is severely compromised, manifested by a limited exercise capacity, and, ultimately, a reduced life expectancy. Approximately 100,000 people in Europe and the United States are afflicted with either primary or secondary forms of the disease related to conditions or tissue disorders that affect the lungs, such as scleroderma, lupus, HIV/AIDS or congenital heart disease.
PAH is associated with structural changes in both the pulmonary vasculature and the right ventricle. Recent advances [1] in the understanding of the pathogenic factors leading to the pulmonary vascular disease have led to the development of new therapies targeting specific pathways (the prostacyclin pathway; the endothelin pathway; and the nitric oxide pathway) [2]. The available therapies have positive effects in PAH, but they do not provide a cure, and in many patients the disease will progress. PAH remains a serious life-threatening condition [2,3]. Early recognition and an understanding of the selection and timing of therapeutic options remain critical elements in the optimal management of patients with this disorder.
About Tracleer® in Pulmonary Arterial Hypertension (PAH)
Tracleer® (bosentan), the first oral dual endothelin receptor antagonist, is approved for the treatment of pulmonary arterial hypertension (PAH) and made available by Actelion subsidiaries in the United States, the European Union, Japan, Australia, Canada, Switzerland and other markets worldwide.
Requires attention to two significant safety concerns: Potential for serious liver injury (including rare cases of liver failure and unexplained hepatic cirrhosis in a setting of close monitoring) - Liver monitoring of all patients is essential prior to initiation of treatment and monthly thereafter. Tracleer® treatment must not be initiated in women of childbearing potential unless they practice reliable contraception and participate in monthly pregnancy testing. Due to these risks, Tracleer® is only supplied through a controlled distribution.
References:
1. Farber HW; Loscalzo J. Mechanisms of disease: pulmonary arterial hypertension. N. Eng. J. Med. 2004; 351:1655-65.
2. Humbert M; Sitbon O; Simonneau G. Treatment of pulmonary arterial hypertension. N. Eng. J. Med. 2004;351:1425-36.
3. Humbert M; Morrell NW; Archer SL; et al. Cellular and molecular pathobiology of pulmonary arterial hypertension. J. Am. Coll. Cardiol. 2004; 43: Suppl. 12: 13S-24S.
4. Tracleer® SPC.
Actelion Ltd
Actelion Ltd is a biopharmaceutical company with its corporate headquarters in Allschwil/Basel, Switzerland. Actelion's first drug Tracleer®, an orally available dual endothelin receptor antagonist, has been approved as a therapy for pulmonary arterial hypertension. Actelion markets Tracleer® through its own subsidiaries in key markets worldwide, including the United States (based in South San Francisco), the European Union, Japan, Canada, Australia and Switzerland. Actelion, founded in late 1997, is a leading player in innovative science related to the endothelium - the single layer of cells separating every blood vessel from the blood stream. Actelion's over 1900 employees focus on the discovery, development and marketing of innovative drugs for significant unmet medical needs. Actelion shares are traded on the SIX Swiss Exchange (ticker symbol: ATLN) as part of the Swiss blue-chip index SMI (Swiss Market Index SMI® )
For further information please contact:
Roland Haefeli
Vice President, Head of Investor Relations & Public Affairs
Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil
+41 61 565 62 62
+1 650 624 69 36
http://www.actelion.com
Antwort auf Beitrag Nr.: 36.680.601 von Fruehrentner am 02.03.09 13:30:1603.03.2009
Vontobel Research
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, stuft die Aktie von Actelion (ISIN CH0010532478 / WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" weiterhin mit "hold" ein.
Actelion habe ein vollständiges Antwortschreiben der US-Arzneimittelbehörde FDA bezüglich der zusätzlichen Einreichung der EARLY-Daten zur Zulassungsprüfung für Tracleer bei Klasse-II-Patienten mit pulmonaler arterieller Hypertonie (PAH) erhalten.
Anzeige
Die EARLY-Daten seien die größte Studie zur Untersuchung von Tracleer in PAH-Patienten der Funktionsklasse II. Durch sie könnte sich der Zielmarkt für Tracleer möglicherweise verdoppeln. Die FDA bitte um die Durchführung des REMS-Programms (Risk Evaluation and Mitigation System, System zur Beurteilung und Verringerung von Risiken), bevor sie Tracleer für die zusätzliche Indikation zulassen könne. REMS und Wortlaut des Beipackzettels würden bezüglich der Beurteilung als unbedeutendere Details angesehen. Actelion werde der Anfrage der FDA nach Erachten der Analysten daher bald nachkommen. Die FDA werde dieser Antwort einen Prüfungsstatus der Klasse I zuteilen, sodass die Zulassung im 2. Quartal 2009 möglich sei.
Die FDA bitte um die Durchführung des REMS-Programms (Risk Evaluation and Mitigation System, System zur Beurteilung und Verringerung von Risiken), bevor sie Tracleer für die zusätzliche Indikation zulassen könne. REMS und Wortlaut des Beipackzettels würden bezüglich der Beurteilung als unbedeutendere Details angesehen. Actelion werde der Anfrage der FDA nach Erachten der Analysten daher bald nachkommen. Die FDA werde dieser Antwort einen Prüfungsstatus der Klasse I zuteilen, sodass die Zulassung im 2. Quartal 2009 möglich sei.
Die Akzeptanz von Funktionsklasse II dürfte bereits ohne Indikation begonnen haben und werde sich langsam fortsetzen. Die Analysten hätten diese Umsatzentwicklung bereits berücksichtigt. Ihre Beurteilung bleibe daher unverändert.
Die Analysten von Vontobel Research bestätigen das "hold"-Rating für die Actelion-Aktie und setzen das Kursziel bei CHF 65 an. (Analyse vom 03.03.2009) (03.03.2009/ac/a/a)
Vontobel Research
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, stuft die Aktie von Actelion (ISIN CH0010532478 / WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" weiterhin mit "hold" ein.
Actelion habe ein vollständiges Antwortschreiben der US-Arzneimittelbehörde FDA bezüglich der zusätzlichen Einreichung der EARLY-Daten zur Zulassungsprüfung für Tracleer bei Klasse-II-Patienten mit pulmonaler arterieller Hypertonie (PAH) erhalten.
Anzeige
Die EARLY-Daten seien die größte Studie zur Untersuchung von Tracleer in PAH-Patienten der Funktionsklasse II. Durch sie könnte sich der Zielmarkt für Tracleer möglicherweise verdoppeln.
 Die FDA bitte um die Durchführung des REMS-Programms (Risk Evaluation and Mitigation System, System zur Beurteilung und Verringerung von Risiken), bevor sie Tracleer für die zusätzliche Indikation zulassen könne. REMS und Wortlaut des Beipackzettels würden bezüglich der Beurteilung als unbedeutendere Details angesehen. Actelion werde der Anfrage der FDA nach Erachten der Analysten daher bald nachkommen. Die FDA werde dieser Antwort einen Prüfungsstatus der Klasse I zuteilen, sodass die Zulassung im 2. Quartal 2009 möglich sei.
Die FDA bitte um die Durchführung des REMS-Programms (Risk Evaluation and Mitigation System, System zur Beurteilung und Verringerung von Risiken), bevor sie Tracleer für die zusätzliche Indikation zulassen könne. REMS und Wortlaut des Beipackzettels würden bezüglich der Beurteilung als unbedeutendere Details angesehen. Actelion werde der Anfrage der FDA nach Erachten der Analysten daher bald nachkommen. Die FDA werde dieser Antwort einen Prüfungsstatus der Klasse I zuteilen, sodass die Zulassung im 2. Quartal 2009 möglich sei.Die Akzeptanz von Funktionsklasse II dürfte bereits ohne Indikation begonnen haben und werde sich langsam fortsetzen. Die Analysten hätten diese Umsatzentwicklung bereits berücksichtigt. Ihre Beurteilung bleibe daher unverändert.
Die Analysten von Vontobel Research bestätigen das "hold"-Rating für die Actelion-Aktie und setzen das Kursziel bei CHF 65 an. (Analyse vom 03.03.2009) (03.03.2009/ac/a/a)
05.03.2009 11:23
Morgan Stanley senkt Ziel für Actelion auf 49,50 Franken
Morgan Stanley hat das Kursziel für Actelion (News) nach Quartalszahlen von 50,40 auf 49,50 Schweizer Franken gesenkt und die Einstufung auf "Underweight" belassen. Auf dem momentanen Kursniveau sei ein Erfolg der Phase III-Tests für drei Wirkstoffe in der zweiten Jahreshälfte bereits eingepreist, schrieb Analyst Karl Bradshaw in einer Studie vom Donnerstag. Der Markt unterschätze damit vermutlich die klinischen Risiken. Für das Mittel Tracleer gebe es weitere Umsatzrisiken in den USA, da das Konkurrenz-Medikament Letairis Marktanteile gewinne.
-----
Aus meiner Sicht ist das abwegig.
Morgan Stanley senkt Ziel für Actelion auf 49,50 Franken
Morgan Stanley hat das Kursziel für Actelion (News) nach Quartalszahlen von 50,40 auf 49,50 Schweizer Franken gesenkt und die Einstufung auf "Underweight" belassen. Auf dem momentanen Kursniveau sei ein Erfolg der Phase III-Tests für drei Wirkstoffe in der zweiten Jahreshälfte bereits eingepreist, schrieb Analyst Karl Bradshaw in einer Studie vom Donnerstag. Der Markt unterschätze damit vermutlich die klinischen Risiken. Für das Mittel Tracleer gebe es weitere Umsatzrisiken in den USA, da das Konkurrenz-Medikament Letairis Marktanteile gewinne.
-----
Aus meiner Sicht ist das abwegig.
Antwort auf Beitrag Nr.: 36.711.814 von SLGramann am 06.03.09 07:46:23Die Wix... von Morgan Stanley sollen ihre dämliche Klappe halten! 
Völlig verwegene Einschätzung Actelions in meinen Augen!

Völlig verwegene Einschätzung Actelions in meinen Augen!
05.03.2009 08:39:06
Actelion bis 40 EUR kaufen
München (aktiencheck.de AG) - Die Experten von "FOCUS-MONEY" raten die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) bis 40 EUR zu kaufen.
Das Unternehmen habe seinen Wettbewerbern einiges voraus, zum Beispiel den Blockbuster Tracleer. Im vergangenen Jahr habe es das Produkt auf einen Umsatz von 1,294 Mrd. CHF, also rund 870 Mio. EUR, gebracht. Die Produktpipeline sei mit zehn Substanzen, von denen sich vier in der letzten Entwicklungsstufe befänden, gut gefüllt.
Um das Medikament Tracleer würden sich neue Fantasien was Gewinne und Umsätze angehe ranken. Bisher sei das Präparat gegen Bluthochdruck in der Lungenarterie eingesetzt worden. Nun seien die Forscher des Unternehmens der Ansicht, dass man mit diesem Medikament auch die Fibrosekrankheit behandeln könne. Da an dieser Krankheit ca. fünfmal mehr Menschen leiden würden als an Lungenarterienhochdruck, könnte sich der Umsatz von Tracleer nochmals steigern, zumal es kein Konkurrenzprodukt gebe. Der Einstieg dürfte sich lohnen, selbst wenn die Aktie vorübergehend Schwäche zeigen sollte.
Der Kurs der Aktie konsolidiere nach dem Anstieg im Jahr 2006 auf hohem Niveau. Wenn der zuletzt misslungene Ausbruchsversuch über den Widerstand um 41 EUR gelinge, seien neue Rekorde drin.
Die Experten von "FOCUS-MONEY" empfehlen die Actelion-Aktie bis 40,00 EUR zu kaufen. Ein Stoppkurs sollte bei 33,40 EUR platziert werden. (Ausgabe 11) (05.03.2009/ac/a/a)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
Quelle: AKTIENCHECK.DE
Actelion bis 40 EUR kaufen
München (aktiencheck.de AG) - Die Experten von "FOCUS-MONEY" raten die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) bis 40 EUR zu kaufen.
Das Unternehmen habe seinen Wettbewerbern einiges voraus, zum Beispiel den Blockbuster Tracleer. Im vergangenen Jahr habe es das Produkt auf einen Umsatz von 1,294 Mrd. CHF, also rund 870 Mio. EUR, gebracht. Die Produktpipeline sei mit zehn Substanzen, von denen sich vier in der letzten Entwicklungsstufe befänden, gut gefüllt.
Um das Medikament Tracleer würden sich neue Fantasien was Gewinne und Umsätze angehe ranken. Bisher sei das Präparat gegen Bluthochdruck in der Lungenarterie eingesetzt worden. Nun seien die Forscher des Unternehmens der Ansicht, dass man mit diesem Medikament auch die Fibrosekrankheit behandeln könne. Da an dieser Krankheit ca. fünfmal mehr Menschen leiden würden als an Lungenarterienhochdruck, könnte sich der Umsatz von Tracleer nochmals steigern, zumal es kein Konkurrenzprodukt gebe. Der Einstieg dürfte sich lohnen, selbst wenn die Aktie vorübergehend Schwäche zeigen sollte.
Der Kurs der Aktie konsolidiere nach dem Anstieg im Jahr 2006 auf hohem Niveau. Wenn der zuletzt misslungene Ausbruchsversuch über den Widerstand um 41 EUR gelinge, seien neue Rekorde drin.
Die Experten von "FOCUS-MONEY" empfehlen die Actelion-Aktie bis 40,00 EUR zu kaufen. Ein Stoppkurs sollte bei 33,40 EUR platziert werden. (Ausgabe 11) (05.03.2009/ac/a/a)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
Quelle: AKTIENCHECK.DE
10.03.2009 11:12:50
Actelion "buy"
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, stuft die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" von "hold" auf "buy" herauf.
Seit der Veröffentlichung der Zahlen des Geschäftsjahres 2008 am 19. Februar 2009 sei die Aktie, wie auch der Rest der Pharmaindustrie, trotz der für das Jahr 2009 erwarteten, starken klinischeren Katalysatoren (Bosentan bei IPF, Clazosentan bei aSAH und Almorexant bei Schlaflosigkeit), solider Bilanzzahlen, einer guten Cash-Position, interessanter Daten bei frühen klinischen Studien (CRTH2 bei Asthma, S1P1 bei Psoriasis) im Jahr 2009 sowie nur schwacher Konkurrenzierung durch Gileads Letairis unter starken Verkaufsdruck gekommen.
Größte klinische Impulse für 2009: 2009 würden die Analysten mit Studienergebnissen der Phase III für drei bedeutsame Wirkstoffe von Actelion rechnen. Zunächst stünden die Studiendaten (BUILD 3) zu Bosentan bei idiopathischer Lungenfibrose (IPF) an. Zwischenergebnisse könnten schon Mitte 2009 vorliegen. Überdies dürfte Actelion die Phase-III-Ergebnisse für Clazosentan (Vasospasmen durch Blutungen im Subarachnoidalraum) und Almorexant (Schlafstörungen) bekannt geben.
Actelion werde nach Erachten der Analysten zudem Gespräche über eine Partnerschaft für die Entwicklung von CRTH2 aufnehmen. Hierbei handle es sich um einen neuen Therapieansatz für Rhinitis und/oder Asthma.
Das Modell der Analysten ergebe zurzeit ein Umsatzplus von 16% in Lokalwährung (übertreffe Unternehmensprognosen von 12-15% und liege 5% über den Konsensschätzungen). Die Analysten würden derzeit davon ausgehen, dass die Patientenzahlen in den USA und in Europa weniger stark wachsen würden. Da die Konkurrenz jedoch erst langsam auf den Zug aufspringe, seien die Analysten vielleicht allzu konservativ mit ihren Prognosen.
Das Unternehmen sei weiterhin günstig bewertet: Nachdem sich die Aktie seit mehr als einem Jahr in einer bestimmten Bandbreite (CHF 50 bis 60) bewegt habe, seien die Analysten der Meinung, dass es jetzt an der Zeit sei, ihre Bewertung zu überdenken.
Da verschiedene klinische Katalysatoren erkennbar würden, stufen die Analysten von Vontobel Research die Actelion-Aktie von "hold" auf "buy" höher und passen ihr Kursziel an ihren DCF Fair Value an. Ihr neues Kursziel von CHF 77 spiegle daher ein Aufwärtspotenzial von 54% wider. (Analyse vom 10.03.2009) (10.03.2009/ac/a/a)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
Quelle: AKTIENCHECK.DE
Actelion "buy"
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, stuft die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" von "hold" auf "buy" herauf.
Seit der Veröffentlichung der Zahlen des Geschäftsjahres 2008 am 19. Februar 2009 sei die Aktie, wie auch der Rest der Pharmaindustrie, trotz der für das Jahr 2009 erwarteten, starken klinischeren Katalysatoren (Bosentan bei IPF, Clazosentan bei aSAH und Almorexant bei Schlaflosigkeit), solider Bilanzzahlen, einer guten Cash-Position, interessanter Daten bei frühen klinischen Studien (CRTH2 bei Asthma, S1P1 bei Psoriasis) im Jahr 2009 sowie nur schwacher Konkurrenzierung durch Gileads Letairis unter starken Verkaufsdruck gekommen.
Größte klinische Impulse für 2009: 2009 würden die Analysten mit Studienergebnissen der Phase III für drei bedeutsame Wirkstoffe von Actelion rechnen. Zunächst stünden die Studiendaten (BUILD 3) zu Bosentan bei idiopathischer Lungenfibrose (IPF) an. Zwischenergebnisse könnten schon Mitte 2009 vorliegen. Überdies dürfte Actelion die Phase-III-Ergebnisse für Clazosentan (Vasospasmen durch Blutungen im Subarachnoidalraum) und Almorexant (Schlafstörungen) bekannt geben.
Actelion werde nach Erachten der Analysten zudem Gespräche über eine Partnerschaft für die Entwicklung von CRTH2 aufnehmen. Hierbei handle es sich um einen neuen Therapieansatz für Rhinitis und/oder Asthma.
Das Modell der Analysten ergebe zurzeit ein Umsatzplus von 16% in Lokalwährung (übertreffe Unternehmensprognosen von 12-15% und liege 5% über den Konsensschätzungen). Die Analysten würden derzeit davon ausgehen, dass die Patientenzahlen in den USA und in Europa weniger stark wachsen würden. Da die Konkurrenz jedoch erst langsam auf den Zug aufspringe, seien die Analysten vielleicht allzu konservativ mit ihren Prognosen.
Das Unternehmen sei weiterhin günstig bewertet: Nachdem sich die Aktie seit mehr als einem Jahr in einer bestimmten Bandbreite (CHF 50 bis 60) bewegt habe, seien die Analysten der Meinung, dass es jetzt an der Zeit sei, ihre Bewertung zu überdenken.
Da verschiedene klinische Katalysatoren erkennbar würden, stufen die Analysten von Vontobel Research die Actelion-Aktie von "hold" auf "buy" höher und passen ihr Kursziel an ihren DCF Fair Value an. Ihr neues Kursziel von CHF 77 spiegle daher ein Aufwärtspotenzial von 54% wider. (Analyse vom 10.03.2009) (10.03.2009/ac/a/a)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
Quelle: AKTIENCHECK.DE
Published: 17:35 12.03.2009 GMT+1 /HUGIN
Source: Actelion
Pharmaceuticals Ltd /SIX: ATLN /ISIN: CH0010532478
Actelion Co-Founder Walter Fischli to focus on advancing scientific
relationships between Actelion and leading academic institutes - Beat Steiner new Co-Head of Drug Discovery
ALLSCHWIL/BASEL, SWITZERLAND - 12 March 2009 - Actelion Ltd (SIX:
ATLN)
today announced that Co-Founder and Senior Vice President, Walter
Fischli will focus on advancing scientific relationships with
academia, providing Actelion with increased access to new
technologies and novel scientific breakthroughs.
As a consequence, in mid-2009, he will hand over his position as
Co-Head of Drug Discovery, Head of Biology to Beat Steiner, who
joined Actelion in 2003 as Deputy Head of Pharmacology and
Preclinical Development.
Walter Fischli, Senior Vice President and Co-Head of Drug Discovery
commented: "After more than 10 years of exciting day-to-day
managerial responsibilities as a company Co-Founder and Co-Head of
Drug Discovery, I want to dedicate myself to advancing scientific
relationships giving Actelion access to fundamental scientific
approaches and innovative technologies."
Describing his efforts at Actelion so far, Walter Fischli added: "I
have tremendously enjoyed my time as head of Actelion's biology
department, working with a great team of dedicated professionals. I
am incredibly proud of the highly productive drug discovery machine
which we in research have realized together and am grateful to all
our collaborators for their part in helping our common dream become a
success story. Our efforts have paved the way forward for numerous
exciting projects, providing a continuous stream of innovative drug
targets and drug candidates."
Jean-Paul Clozel, M.D. and Chief Executive Officer commented:
"Walter's contribution to Actelion's success goes far beyond his drug
discovery leadership role in which he has excelled. As a founding
team member, his enthusiasm, commitment and conviction as a drug
hunter helped us all, in 1997, to take the entrepreneurial risk in
setting up Actelion and creating what is today a global biotech
powerhouse."
Jean-Paul Clozel added: "In his new role, hunting for the ideas and
innovators of tomorrow, he will continue to be a crucial element to
the advancement of innovation at Actelion."
Martine Clozel, Senior Vice President and Co-Head of Drug Discovery
commented: "Since joining Actelion, Beat has played a crucial role in
the selection of several preclinical and clinical candidates such as
the selective S1P1 receptor agonist and CRTH2 receptor antagonist,
both of which are currently undergoing Phase II clinical development
and show great potential in multiple immunological disorders. I am
very happy that Beat has accepted this new challenge."
Thomas Weller, Vice President and Co-Head of Drug Discovery added: "I
am very much looking forward to working with Beat in his new role and
continuing the excellent collaboration between the three Co-Heads of
Drug Discovery."
Beat Steiner studied biochemistry/chemistry and obtained his PhD
degree at the University of Berne. During his postdoctoral education
he received further training in molecular biology and pharmacology
from the University of California in San Francisco. During his almost
20 years at Roche, he led a drug discovery group in the field of
thrombosis and atherosclerosis resulting in the selection of several
first-in-class compounds for clinical development.
Jean-Paul Clozel concluded: "With this new organization Actelion is
in an ideal position to be at the forefront of science in order to
continue discovering novel first-in-class compounds to improve
patients' lives."
###
Source: Actelion
Pharmaceuticals Ltd /SIX: ATLN /ISIN: CH0010532478
Actelion Co-Founder Walter Fischli to focus on advancing scientific
relationships between Actelion and leading academic institutes - Beat Steiner new Co-Head of Drug Discovery
ALLSCHWIL/BASEL, SWITZERLAND - 12 March 2009 - Actelion Ltd (SIX:
ATLN)
today announced that Co-Founder and Senior Vice President, Walter
Fischli will focus on advancing scientific relationships with
academia, providing Actelion with increased access to new
technologies and novel scientific breakthroughs.
As a consequence, in mid-2009, he will hand over his position as
Co-Head of Drug Discovery, Head of Biology to Beat Steiner, who
joined Actelion in 2003 as Deputy Head of Pharmacology and
Preclinical Development.
Walter Fischli, Senior Vice President and Co-Head of Drug Discovery
commented: "After more than 10 years of exciting day-to-day
managerial responsibilities as a company Co-Founder and Co-Head of
Drug Discovery, I want to dedicate myself to advancing scientific
relationships giving Actelion access to fundamental scientific
approaches and innovative technologies."
Describing his efforts at Actelion so far, Walter Fischli added: "I
have tremendously enjoyed my time as head of Actelion's biology
department, working with a great team of dedicated professionals. I
am incredibly proud of the highly productive drug discovery machine
which we in research have realized together and am grateful to all
our collaborators for their part in helping our common dream become a
success story. Our efforts have paved the way forward for numerous
exciting projects, providing a continuous stream of innovative drug
targets and drug candidates."
Jean-Paul Clozel, M.D. and Chief Executive Officer commented:
"Walter's contribution to Actelion's success goes far beyond his drug
discovery leadership role in which he has excelled. As a founding
team member, his enthusiasm, commitment and conviction as a drug
hunter helped us all, in 1997, to take the entrepreneurial risk in
setting up Actelion and creating what is today a global biotech
powerhouse."
Jean-Paul Clozel added: "In his new role, hunting for the ideas and
innovators of tomorrow, he will continue to be a crucial element to
the advancement of innovation at Actelion."
Martine Clozel, Senior Vice President and Co-Head of Drug Discovery
commented: "Since joining Actelion, Beat has played a crucial role in
the selection of several preclinical and clinical candidates such as
the selective S1P1 receptor agonist and CRTH2 receptor antagonist,
both of which are currently undergoing Phase II clinical development
and show great potential in multiple immunological disorders. I am
very happy that Beat has accepted this new challenge."
Thomas Weller, Vice President and Co-Head of Drug Discovery added: "I
am very much looking forward to working with Beat in his new role and
continuing the excellent collaboration between the three Co-Heads of
Drug Discovery."
Beat Steiner studied biochemistry/chemistry and obtained his PhD
degree at the University of Berne. During his postdoctoral education
he received further training in molecular biology and pharmacology
from the University of California in San Francisco. During his almost
20 years at Roche, he led a drug discovery group in the field of
thrombosis and atherosclerosis resulting in the selection of several
first-in-class compounds for clinical development.
Jean-Paul Clozel concluded: "With this new organization Actelion is
in an ideal position to be at the forefront of science in order to
continue discovering novel first-in-class compounds to improve
patients' lives."
###
Antwort auf Beitrag Nr.: 36.711.814 von SLGramann am 06.03.09 07:46:23hallo slgramann - scheinst dich ganz gut auszukennen bei actelion. bin vor kurzem eingestiegen und wundere mich über den kursverlauf. gibt es infos über verkäufe von fonds o.ä.? bei synthes war das am freitag so...ich werde wohl noch mal nachkaufen...
danke für deine antwort
danke für deine antwort
Antwort auf Beitrag Nr.: 36.819.203 von kurzundgut am 22.03.09 07:38:15
Sorry, aber da überschätzt Du mich vielleicht. Ich bin leider definitiv nicht "vom Fach" und meine Investmentidee ist relativ simpel:
Actelion hat mit Traceleer einen Blockbuster, der das Unternehmen nachhaltig gut profitabel sein lässt. Gleichzeitig ist Actelion noch kein Riese und hat, wenn man dem glauben darf, was man liest, eine sehr interessante Pipeline. Ergebnis: Viel Potential bei begrenztem Risiko. Das ist im Wesentlichen schon alles, was ich zu wissen glaube.
Was die Pipeline angeht: Da bin ich zunächst über Almorexant gestolpert. Wie schon mal geschrieben, ist dann bei Wechsel von S1P1 in die P 2 mein endgültiger Investment-Entschluss gefallen. S1P1 ist sicher nicht notwendig, um mit dem Investment erfolgreich zu sein, könnte aber auf Sicht von 5 bis 8 Jahren ein sehr erhebliches Upside-Potential eröffnen.
Zu aktuellen Börsenkursen habe ich fast nie eine wirkliche Meinung. Hier jetzt gerade auch nicht. Die Börse ist kurzfristig meist irrational. Mein Engagement bei Actelion ist dagegen langfristig ausgerichtet.
BB Biotech fasst den derzeitigen Stand bei Actelion übrigens wie folgt zusammen:
Actelion hat für 2008 einen Konzernumsatz von CHF 1 474 Mio. und einen Reingewinn von CHF 321 Mio. ausgewiesen. Tracleer, das Schlüsselmedikament des Unternehmens, ein Endothelin-Rezeptor-Antagonist zur Behandlung von pulmonaler arterieller Hypertonie (PAH), erzielte einen Umsatz von CHF 1 294 Mio. und hat damit erstmalig den Blockbuster-Status (Produkte mit einem Jahresumsatz von mehr als USD 1 Mrd.) erlangt. Tracleers Wachstum belief sich auf 17% in Lokalwährung und wurde von einer vergrösserten Patientenbasis in allen Regionen und in neuen Indikationen erzielt, u. a. für den Einsatz bei digitaler Ulzera und bei PAH-Patienten der NYHA-Funktionsklasse II. Für 2009 prognostiziert das Unternehmen eine Umsatzsteigerung in Lokalwährung von 12% bis 15% durch steigende Patientenzahlen. Actelion hat die Entwicklung seiner Entwicklungspipeline vorangetrieben: Mit ersten Ergebnissen der Phase-III-Studien für das neue Schlafmittel Almorexant wird Ende 2009 gerechnet. Auch die Resultate der Phase-III-Studien für Bosentan (zur Behandlung idiopathischer Lungenfibrose) und Clazosentan (gegen Vasospasmen nach Subarachnoidalblutungen) sollen 2009 verfügbar werden. Actelion hat ausserdem für Macitentan, einen Endothelin-Rezeptor-Antagonisten der nächsten Generation zur PAH-Behandlung, die bisher umfangreichste Phase-III-Studie initiiert.
Sorry, aber da überschätzt Du mich vielleicht. Ich bin leider definitiv nicht "vom Fach" und meine Investmentidee ist relativ simpel:
Actelion hat mit Traceleer einen Blockbuster, der das Unternehmen nachhaltig gut profitabel sein lässt. Gleichzeitig ist Actelion noch kein Riese und hat, wenn man dem glauben darf, was man liest, eine sehr interessante Pipeline. Ergebnis: Viel Potential bei begrenztem Risiko. Das ist im Wesentlichen schon alles, was ich zu wissen glaube.
Was die Pipeline angeht: Da bin ich zunächst über Almorexant gestolpert. Wie schon mal geschrieben, ist dann bei Wechsel von S1P1 in die P 2 mein endgültiger Investment-Entschluss gefallen. S1P1 ist sicher nicht notwendig, um mit dem Investment erfolgreich zu sein, könnte aber auf Sicht von 5 bis 8 Jahren ein sehr erhebliches Upside-Potential eröffnen.
Zu aktuellen Börsenkursen habe ich fast nie eine wirkliche Meinung. Hier jetzt gerade auch nicht. Die Börse ist kurzfristig meist irrational. Mein Engagement bei Actelion ist dagegen langfristig ausgerichtet.
BB Biotech fasst den derzeitigen Stand bei Actelion übrigens wie folgt zusammen:
Actelion hat für 2008 einen Konzernumsatz von CHF 1 474 Mio. und einen Reingewinn von CHF 321 Mio. ausgewiesen. Tracleer, das Schlüsselmedikament des Unternehmens, ein Endothelin-Rezeptor-Antagonist zur Behandlung von pulmonaler arterieller Hypertonie (PAH), erzielte einen Umsatz von CHF 1 294 Mio. und hat damit erstmalig den Blockbuster-Status (Produkte mit einem Jahresumsatz von mehr als USD 1 Mrd.) erlangt. Tracleers Wachstum belief sich auf 17% in Lokalwährung und wurde von einer vergrösserten Patientenbasis in allen Regionen und in neuen Indikationen erzielt, u. a. für den Einsatz bei digitaler Ulzera und bei PAH-Patienten der NYHA-Funktionsklasse II. Für 2009 prognostiziert das Unternehmen eine Umsatzsteigerung in Lokalwährung von 12% bis 15% durch steigende Patientenzahlen. Actelion hat die Entwicklung seiner Entwicklungspipeline vorangetrieben: Mit ersten Ergebnissen der Phase-III-Studien für das neue Schlafmittel Almorexant wird Ende 2009 gerechnet. Auch die Resultate der Phase-III-Studien für Bosentan (zur Behandlung idiopathischer Lungenfibrose) und Clazosentan (gegen Vasospasmen nach Subarachnoidalblutungen) sollen 2009 verfügbar werden. Actelion hat ausserdem für Macitentan, einen Endothelin-Rezeptor-Antagonisten der nächsten Generation zur PAH-Behandlung, die bisher umfangreichste Phase-III-Studie initiiert.
Antwort auf Beitrag Nr.: 36.819.632 von SLGramann am 22.03.09 11:53:26danke für deine stellungnahme. kleine grösse und "nur" ein blockbuster könnten ja auch ein risiko darstellen. ich persönlich sehe actelion auch eher als interessantes investment. könnte sein, dass hier auch durch entsprechende kursmanipulation eine übernahme "vorbereitet" werden soll.
meine frage lautet denn auch eher an "insider": hat jemand hinweise auf systematische verkäufe durch hedgefonds o.ä.?
danke schon mal
meine frage lautet denn auch eher an "insider": hat jemand hinweise auf systematische verkäufe durch hedgefonds o.ä.?
danke schon mal
und was sach ich... gefunden auf cash.ch
cash-«Insider»: Was will Glaxo mit Actelion?
25.03.2009 14:36
Von cash-«Insider»
Die Namenaktien der Actelion Ltd profitieren am frühen Mittwochnachmittag von Übernahmefantasien. In Branchenkreisen wird mit einer Fortsetzung der jüngsten Konzentrationsbewegung gerechnet.
Neusten Spekulationen zufolge will der britische Pharmakonzern GlaxoSmithKline für 15 Milliarden Dollar den Partner Allergan übernehmen. Angeblich habe Allergan bereits im vergangenen Jahr eine Barofferte in der Grössenordnung von 72 Dollar je Aktie zurückgewiesen.
Die Rückschlüsse auf Actelion fallen durchzogen aus. Einerseits gilt das Allschwiler Biotechnologieunternehmen seit längerem als potenzielles Ziel einer Übernahme. Andererseits würde mit GlaxoSmithKline einer der prominentesten potenziellen Käufer wegfallen.
Die Briten arbeiten gemeinsam mit Actelion an der Entwicklung des Schlafmittels Almorexant. Weiterhin Übernahmegelüste im Biotechnologiebereich werden dem französischen Pharmaunternehmen Sanofi-Aventis nachgesagt.
cash-«Insider»: Was will Glaxo mit Actelion?
25.03.2009 14:36
Von cash-«Insider»
Die Namenaktien der Actelion Ltd profitieren am frühen Mittwochnachmittag von Übernahmefantasien. In Branchenkreisen wird mit einer Fortsetzung der jüngsten Konzentrationsbewegung gerechnet.
Neusten Spekulationen zufolge will der britische Pharmakonzern GlaxoSmithKline für 15 Milliarden Dollar den Partner Allergan übernehmen. Angeblich habe Allergan bereits im vergangenen Jahr eine Barofferte in der Grössenordnung von 72 Dollar je Aktie zurückgewiesen.
Die Rückschlüsse auf Actelion fallen durchzogen aus. Einerseits gilt das Allschwiler Biotechnologieunternehmen seit längerem als potenzielles Ziel einer Übernahme. Andererseits würde mit GlaxoSmithKline einer der prominentesten potenziellen Käufer wegfallen.
Die Briten arbeiten gemeinsam mit Actelion an der Entwicklung des Schlafmittels Almorexant. Weiterhin Übernahmegelüste im Biotechnologiebereich werden dem französischen Pharmaunternehmen Sanofi-Aventis nachgesagt.
Published: 17:35 27.03.2009 GMT+1 /HUGIN /Source: Actelion Pharmaceuticals Ltd /SIX: ATLN /ISIN: CH0010532478
Actelion proposes expansion of its Board of Directors
Annual General Meeting of Actelion Shareholders to be held in Basel on 24 April 2009
ALLSCHWIL/BASEL, SWITZERLAND - 27 March 2009 -
Actelion Ltd (SIX: ATLN) today announced that its Board of Directors proposes three new Board members at the upcoming Annual General Meeting.
Andre J. Mueller, one of Actelion's five founding members and currently Vice-Chairman of Actelion and Head of the Finance and Audit Committee, has decided not to seek a new mandate for reason of his gradual transition into full retirement.
Jean-Paul Clozel, M.D., Chief Executive Officer of Actelion, company founder and a member of the Board of Actelion, commented: "Andre has contributed tremendously to the success of Actelion. He was instrumental in gaining outside financing for Actelion in its founding days. As the company's first Chief Financial Officer, he focused on developing both strong financial reporting systems and a company culture driven by value creation for all stakeholders, patients and shareholders alike. We at Actelion are all in his debt and wish him all the best for his future."
To fill the open position on the Board, the Actelion Board of Directors proposes the candidacy of Dr. Michael Jacobi who served until 2007 as Chief Financial Officer of Ciba Specialty Chemicals Inc. He is a member of several Boards of Directors, including Sonova where he also serves as the Head of the Finance and Audit Committee.
The Actelion Board of Directors also proposes expanding the Board with the addition of two further positions. To these positions the Board proposes the candidacy of:
Joseph C. Scodari, who served until March 2008 as Worldwide Chairman Pharmaceuticals, member of the Executive Committee and Corporate Officer of Johnson & Johnson, brings with him a distinguished global business career in the pharmaceutical industry that spanned more than 30 years. As president and CEO of Centocor, he gained significant experience in managing the growth of an innovative biotechnology company. He has also served as vice-chairman on the Board of BIO, the US biotechnology association, with more than 1'000 members.
Elias A. Zerhouni, M.D. who served until October 2008 as the Director of the US National Institutes of Health (NIH), the world's leading public health agency with more than 18'000 employees. The NIH mission is to lead the way toward important medical discoveries that improve people's health and save lives. In addition to his career as a world expert in public health matters, Dr. Zerhouni, a distinguished scientist with more than 200 publications, is a Professor of Medicine at the John Hopkins University (Baltimore) and a senior fellow at the Bill and Melinda Gates Foundation.
Rob Cawthorn, Chairman of Actelion's Board of Directors commented: "It speaks to Actelions' reputation for innovation that we can attract highly qualified experts to serve as new board members. In the coming years, Actelion is poised to turn innovation into medicines that can positively affect patient outcomes and quality of life. The addition of three board members, with significant experience in supervising and guiding the related value creation process, will allow the Board of Directors to provide the required strategic guidance to enable Actelion to fulfill its potential."
The invitation to the Annual General Meeting of the Actelion Shareholders with all proposal put forward to Actelion shareholders is available on www.actelion.com.
###
Notes to the editor
About the proposed three new members of the Actelion Board of Directors
Dr. Michael Jacobi
Dr. Michael Jacobi, a German citizen, was Chief Financial Officer at Ciba Specialty Chemicals Inc. from 1996 until 2007. Dr. Jacobi joined the Ciba Group in 1978 and subsequently held various executive positions in the financial area in Switzerland, Brazil and the U.S.
Since 2003, Dr. Jacobi serves on the Board of Directors of Sonova Holding AG, formerly Phonak AG, since 2004 as the Head of the Audit Committee. Sonova, located in Staefa/Zurich, is a leading provider of innovative hearing healthcare solutions and the market leader in wireless communication systems for audiology applications. Furthermore, Dr. Jacobi serves on the Board of Directors of Hilti AG since 2007. Hilti, located in Schaan (Liechtenstein), provides leading-edge technology to the global construction industry. Since 2008, Dr. Jacobi is also a member of the Board of Trustees of the Martin Hilti Family Trust.
Dr. Jacobi received a PhD in Business Administration from the University of St. Gallen (HSG), St. Gallen, Switzerland, continued his studies at the University of Washington, Seattle, USA, and completed a Program for Management Development at Harvard Business School, Boston, USA.
Joseph C. Scodari
Joseph C. Scodari, a citizen of the U.S., was Worldwide Chairman Pharmaceuticals, member of the Executive Committee and Corporate Officer of Johnson & Johnson from February 2005 until March 2008. Mr. Scodari joined Johnson & Johnson in 1999 as President of Centocor, Inc. when Johnson & Johnson acquired Centocor. At the time of that acquisition, he had been the President and Chief Operating Officer of Centocor and a member of Centocor's Board of Directors since December 1997. In 2001, he was named Company Group Chairman for the Johnson & Johnson North American pharmaceutical business, and became a member of the Pharmaceuticals Group Operating Committee and, in 2003, was named Company Group Chairman, Global Biopharmaceutical Businesses.
Prior to his appointment at Centocor and Johnson & Johnson, Mr. Scodari was Senior Vice President, General Manager - Americas at Rhone-Poulenc Rorer Pharmaceuticals Inc. and previously served in various executive positions at Rhone-Poulenc Rorer and Sterling Drug Inc.
From 2003 to 2007, Mr. Scodari served on the Board of Directors of the Biotechnology Industry Organization (BIO) in Washington, D.C., and served as Vice-Chairman of the Board and Member of the Executive Committee from 2007 until February 2008. BIO represents more than 1,000 biotechnology companies, academic institutions, state biotechnology centers and related organizations in all 50 U.S. states and 33 other nations. BIO members are involved in the research and development of health care, agricultural, industrial and environmental biotechnology products.
Mr. Scodari received a Bachelor's of Arts degree from Youngstown State University, Youngstown, Ohio.
Elias A. Zerhouni, MD
Dr. Elias A. Zerhouni, a citizen of the U.S., served as Director of the US National Institutes of Health (NIH) from May 2002 until October 2008. He was nominated by the President of the United States in March 2002 and confirmed by the US Senate in April 2002.
The National Institutes of Health (NIH), a part of the U.S. Department of Health and Human Services, is the primary Federal agency for conducting and supporting medical research. Helping to lead the way toward important medical discoveries that improve people's health and save lives, NIH scientists investigate ways to prevent disease as well as the causes, treatments, and even cures for common and rare diseases.
From 1978 until 2002, Dr. Elias A. Zerhouni held various academic appointments at The John Hopkins University School of Medicine, Baltimore, Maryland, USA. In 1992, he was named Professor of Radiology at The John Hopkins University School of Medicine. In 1995, Professor Zerhouni was additionally appointed as Professor of Biomedical Engineering at The John Hopkins University. He became Director of the Russell H. Morgan Department of Radiology and Radiological Science at The John Hopkins University School of Medicine in 1996. Concurrently, he served as Executive Vice Dean, Vice Dean for Clinical Affairs and President of the Faculty Association at the John Hopkins University School of Medicine. From 1999 until 2002, he served as Executive Vice Dean and Vice Dean for Research at the John Hopkins University School of Medicine before being named to the directorship of the NIH.
Professor Zerhouni received a M.D. degree at the University of Algiers School of Medicine in Algeria in 1975 and continued his studies at the Department of Radiology at The John Hopkins University School of Medicine in Baltimore, Maryland, USA.
Professor Zerhouni is the author of over 212 publications and holds 8 patents. He has received multiple awards and honors. He was elected to the Institute of Medicine of the US National Academy of Sciences in 2000.
Professor Zerhouni is currently a senior fellow at the Bill and Melinda Gates Foundation and has returned to his professorship at The John Hopkins University. He is a consultant and serves on multiple boards, such as the Lasker Foundation, the Mayo Clinic, Research America Board and the Board of the King Abdallah University of Sciences and Technology.
Actelion Ltd
Actelion Ltd is a biopharmaceutical company with its corporate headquarters in Allschwil/Basel, Switzerland. Actelion's first drug Tracleer®, an orally available dual endothelin receptor antagonist, has been approved as a therapy for pulmonary arterial hypertension. Actelion markets Tracleer® through its own subsidiaries in key markets worldwide, including the United States (based in South San Francisco), the European Union, Japan, Canada, Australia and Switzerland. Actelion, founded in late 1997, is a leading player in innovative science related to the endothelium - the single layer of cells separating every blood vessel from the blood stream. Actelion's over 2'000 employees focus on the discovery, development and marketing of innovative drugs for significant unmet medical needs. Actelion shares are traded on the SIX Swiss Exchange (ticker symbol: ATLN) as part of the Swiss blue-chip index SMI (Swiss Market Index SMI® )
For further information please contact:
Roland Haefeli
Vice President, Head of Investor Relations & Public Affairs
Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil
+41 61 565 62 62
+1 650 624 69 36
http://www.actelion.com
Press Release PDF
Unsubscribe from ‘Stay informed’ service
Of course you can use your right of objection at any time and object to the use of your data by deleting your account via this link:
Unsubscribe from ‘Stay informed’ service
Confidentiality note
The information of this e-mail and in any file transmitted with it is strictly confidential and may be legally privileged. It is intended solely for the addressee. If you are not the intended recipient, any copying, distribution or any other use of this e-mail is prohibited and may be unlawful. In such case, you should please notify the sender immediately and destroy this e-mail.
Actelion Pharmaceutical Ltd
Copyright © 2008 Actelion Pharmaceutical Ltd
Actelion proposes expansion of its Board of Directors
Annual General Meeting of Actelion Shareholders to be held in Basel on 24 April 2009
ALLSCHWIL/BASEL, SWITZERLAND - 27 March 2009 -
Actelion Ltd (SIX: ATLN) today announced that its Board of Directors proposes three new Board members at the upcoming Annual General Meeting.
Andre J. Mueller, one of Actelion's five founding members and currently Vice-Chairman of Actelion and Head of the Finance and Audit Committee, has decided not to seek a new mandate for reason of his gradual transition into full retirement.
Jean-Paul Clozel, M.D., Chief Executive Officer of Actelion, company founder and a member of the Board of Actelion, commented: "Andre has contributed tremendously to the success of Actelion. He was instrumental in gaining outside financing for Actelion in its founding days. As the company's first Chief Financial Officer, he focused on developing both strong financial reporting systems and a company culture driven by value creation for all stakeholders, patients and shareholders alike. We at Actelion are all in his debt and wish him all the best for his future."
To fill the open position on the Board, the Actelion Board of Directors proposes the candidacy of Dr. Michael Jacobi who served until 2007 as Chief Financial Officer of Ciba Specialty Chemicals Inc. He is a member of several Boards of Directors, including Sonova where he also serves as the Head of the Finance and Audit Committee.
The Actelion Board of Directors also proposes expanding the Board with the addition of two further positions. To these positions the Board proposes the candidacy of:
Joseph C. Scodari, who served until March 2008 as Worldwide Chairman Pharmaceuticals, member of the Executive Committee and Corporate Officer of Johnson & Johnson, brings with him a distinguished global business career in the pharmaceutical industry that spanned more than 30 years. As president and CEO of Centocor, he gained significant experience in managing the growth of an innovative biotechnology company. He has also served as vice-chairman on the Board of BIO, the US biotechnology association, with more than 1'000 members.
Elias A. Zerhouni, M.D. who served until October 2008 as the Director of the US National Institutes of Health (NIH), the world's leading public health agency with more than 18'000 employees. The NIH mission is to lead the way toward important medical discoveries that improve people's health and save lives. In addition to his career as a world expert in public health matters, Dr. Zerhouni, a distinguished scientist with more than 200 publications, is a Professor of Medicine at the John Hopkins University (Baltimore) and a senior fellow at the Bill and Melinda Gates Foundation.
Rob Cawthorn, Chairman of Actelion's Board of Directors commented: "It speaks to Actelions' reputation for innovation that we can attract highly qualified experts to serve as new board members. In the coming years, Actelion is poised to turn innovation into medicines that can positively affect patient outcomes and quality of life. The addition of three board members, with significant experience in supervising and guiding the related value creation process, will allow the Board of Directors to provide the required strategic guidance to enable Actelion to fulfill its potential."
The invitation to the Annual General Meeting of the Actelion Shareholders with all proposal put forward to Actelion shareholders is available on www.actelion.com.
###
Notes to the editor
About the proposed three new members of the Actelion Board of Directors
Dr. Michael Jacobi
Dr. Michael Jacobi, a German citizen, was Chief Financial Officer at Ciba Specialty Chemicals Inc. from 1996 until 2007. Dr. Jacobi joined the Ciba Group in 1978 and subsequently held various executive positions in the financial area in Switzerland, Brazil and the U.S.
Since 2003, Dr. Jacobi serves on the Board of Directors of Sonova Holding AG, formerly Phonak AG, since 2004 as the Head of the Audit Committee. Sonova, located in Staefa/Zurich, is a leading provider of innovative hearing healthcare solutions and the market leader in wireless communication systems for audiology applications. Furthermore, Dr. Jacobi serves on the Board of Directors of Hilti AG since 2007. Hilti, located in Schaan (Liechtenstein), provides leading-edge technology to the global construction industry. Since 2008, Dr. Jacobi is also a member of the Board of Trustees of the Martin Hilti Family Trust.
Dr. Jacobi received a PhD in Business Administration from the University of St. Gallen (HSG), St. Gallen, Switzerland, continued his studies at the University of Washington, Seattle, USA, and completed a Program for Management Development at Harvard Business School, Boston, USA.
Joseph C. Scodari
Joseph C. Scodari, a citizen of the U.S., was Worldwide Chairman Pharmaceuticals, member of the Executive Committee and Corporate Officer of Johnson & Johnson from February 2005 until March 2008. Mr. Scodari joined Johnson & Johnson in 1999 as President of Centocor, Inc. when Johnson & Johnson acquired Centocor. At the time of that acquisition, he had been the President and Chief Operating Officer of Centocor and a member of Centocor's Board of Directors since December 1997. In 2001, he was named Company Group Chairman for the Johnson & Johnson North American pharmaceutical business, and became a member of the Pharmaceuticals Group Operating Committee and, in 2003, was named Company Group Chairman, Global Biopharmaceutical Businesses.
Prior to his appointment at Centocor and Johnson & Johnson, Mr. Scodari was Senior Vice President, General Manager - Americas at Rhone-Poulenc Rorer Pharmaceuticals Inc. and previously served in various executive positions at Rhone-Poulenc Rorer and Sterling Drug Inc.
From 2003 to 2007, Mr. Scodari served on the Board of Directors of the Biotechnology Industry Organization (BIO) in Washington, D.C., and served as Vice-Chairman of the Board and Member of the Executive Committee from 2007 until February 2008. BIO represents more than 1,000 biotechnology companies, academic institutions, state biotechnology centers and related organizations in all 50 U.S. states and 33 other nations. BIO members are involved in the research and development of health care, agricultural, industrial and environmental biotechnology products.
Mr. Scodari received a Bachelor's of Arts degree from Youngstown State University, Youngstown, Ohio.
Elias A. Zerhouni, MD
Dr. Elias A. Zerhouni, a citizen of the U.S., served as Director of the US National Institutes of Health (NIH) from May 2002 until October 2008. He was nominated by the President of the United States in March 2002 and confirmed by the US Senate in April 2002.
The National Institutes of Health (NIH), a part of the U.S. Department of Health and Human Services, is the primary Federal agency for conducting and supporting medical research. Helping to lead the way toward important medical discoveries that improve people's health and save lives, NIH scientists investigate ways to prevent disease as well as the causes, treatments, and even cures for common and rare diseases.
From 1978 until 2002, Dr. Elias A. Zerhouni held various academic appointments at The John Hopkins University School of Medicine, Baltimore, Maryland, USA. In 1992, he was named Professor of Radiology at The John Hopkins University School of Medicine. In 1995, Professor Zerhouni was additionally appointed as Professor of Biomedical Engineering at The John Hopkins University. He became Director of the Russell H. Morgan Department of Radiology and Radiological Science at The John Hopkins University School of Medicine in 1996. Concurrently, he served as Executive Vice Dean, Vice Dean for Clinical Affairs and President of the Faculty Association at the John Hopkins University School of Medicine. From 1999 until 2002, he served as Executive Vice Dean and Vice Dean for Research at the John Hopkins University School of Medicine before being named to the directorship of the NIH.
Professor Zerhouni received a M.D. degree at the University of Algiers School of Medicine in Algeria in 1975 and continued his studies at the Department of Radiology at The John Hopkins University School of Medicine in Baltimore, Maryland, USA.
Professor Zerhouni is the author of over 212 publications and holds 8 patents. He has received multiple awards and honors. He was elected to the Institute of Medicine of the US National Academy of Sciences in 2000.
Professor Zerhouni is currently a senior fellow at the Bill and Melinda Gates Foundation and has returned to his professorship at The John Hopkins University. He is a consultant and serves on multiple boards, such as the Lasker Foundation, the Mayo Clinic, Research America Board and the Board of the King Abdallah University of Sciences and Technology.
Actelion Ltd
Actelion Ltd is a biopharmaceutical company with its corporate headquarters in Allschwil/Basel, Switzerland. Actelion's first drug Tracleer®, an orally available dual endothelin receptor antagonist, has been approved as a therapy for pulmonary arterial hypertension. Actelion markets Tracleer® through its own subsidiaries in key markets worldwide, including the United States (based in South San Francisco), the European Union, Japan, Canada, Australia and Switzerland. Actelion, founded in late 1997, is a leading player in innovative science related to the endothelium - the single layer of cells separating every blood vessel from the blood stream. Actelion's over 2'000 employees focus on the discovery, development and marketing of innovative drugs for significant unmet medical needs. Actelion shares are traded on the SIX Swiss Exchange (ticker symbol: ATLN) as part of the Swiss blue-chip index SMI (Swiss Market Index SMI® )
For further information please contact:
Roland Haefeli
Vice President, Head of Investor Relations & Public Affairs
Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil
+41 61 565 62 62
+1 650 624 69 36
http://www.actelion.com
Press Release PDF
Unsubscribe from ‘Stay informed’ service
Of course you can use your right of objection at any time and object to the use of your data by deleting your account via this link:
Unsubscribe from ‘Stay informed’ service
Confidentiality note
The information of this e-mail and in any file transmitted with it is strictly confidential and may be legally privileged. It is intended solely for the addressee. If you are not the intended recipient, any copying, distribution or any other use of this e-mail is prohibited and may be unlawful. In such case, you should please notify the sender immediately and destroy this e-mail.
Actelion Pharmaceutical Ltd
Copyright © 2008 Actelion Pharmaceutical Ltd
Antwort auf Beitrag Nr.: 36.874.294 von Fruehrentner am 29.03.09 15:28:31Die Kurzzusammenfassung der ad-hoc auf deutsch:
27.03.2009 19:13:34
Actelion schlägt Erweiterung seines Verwaltungsrats vor
Allschwill (aktiencheck.de AG) - Das schweizerische Biotechnologieunternehmen Actelion Ltd. (ISIN CH0010532478/ WKN 936767) hat am Freitag eine Erweiterung seines Verwaltungsrats vorgeschlagen.
Demnach will der Verwaltungsrat anlässlich der bevorstehenden Generalversammlung die Aufnahme von drei neuen Verwaltungsratsmitgliedern vorschlagen. André J. Mueller, einer der fünf Gründungsmitglieder von Actelion und derzeit Vize-Präsident des Verwaltungsrats sowie Vorsitzender des Finance und Audit Committee, wird auf eine Wiederwahl verzichten, da er sich schrittweise in den Ruhestand zurückziehen möchte.
Der frei werdende Sitz im Verwaltungsrat soll auf Vorschlag des Verwaltungsrats durch Dr. Michael Jacobi besetzt werden, der bis 2007 Finanzchef bei Ciba Specialty Chemicals Inc. war.
Darüber hinaus schlägt der Verwaltungsrat die Zuwahl von zwei weiteren Personen vor. Zum einen Joseph C. Scodari, der bis März 2008 Worldwide Chairman, Pharmaceuticals, Mitglied der Geschäftsleitung und Vorstandsmitglied von Johnson & Johnson war. Zum anderen Dr. Elias A. Zerhouni, der bis Oktober 2008 Leiter der amerikanischen National Institutes of Health (NIH) war.
Quelle: AKTIENCHECK.DE
27.03.2009 19:13:34
Actelion schlägt Erweiterung seines Verwaltungsrats vor
Allschwill (aktiencheck.de AG) - Das schweizerische Biotechnologieunternehmen Actelion Ltd. (ISIN CH0010532478/ WKN 936767) hat am Freitag eine Erweiterung seines Verwaltungsrats vorgeschlagen.
Demnach will der Verwaltungsrat anlässlich der bevorstehenden Generalversammlung die Aufnahme von drei neuen Verwaltungsratsmitgliedern vorschlagen. André J. Mueller, einer der fünf Gründungsmitglieder von Actelion und derzeit Vize-Präsident des Verwaltungsrats sowie Vorsitzender des Finance und Audit Committee, wird auf eine Wiederwahl verzichten, da er sich schrittweise in den Ruhestand zurückziehen möchte.
Der frei werdende Sitz im Verwaltungsrat soll auf Vorschlag des Verwaltungsrats durch Dr. Michael Jacobi besetzt werden, der bis 2007 Finanzchef bei Ciba Specialty Chemicals Inc. war.
Darüber hinaus schlägt der Verwaltungsrat die Zuwahl von zwei weiteren Personen vor. Zum einen Joseph C. Scodari, der bis März 2008 Worldwide Chairman, Pharmaceuticals, Mitglied der Geschäftsleitung und Vorstandsmitglied von Johnson & Johnson war. Zum anderen Dr. Elias A. Zerhouni, der bis Oktober 2008 Leiter der amerikanischen National Institutes of Health (NIH) war.
Quelle: AKTIENCHECK.DE
Published: 17:35 15.04.2009 GMT+2 /HUGIN /Source: Actelion Pharmaceuticals Ltd /SIX: ATLN /ISIN: CH0010532478
Actelion to discuss first quarter 2009 financial results
Actelion senior management to host Q & A session
Dear Member of the Investment Community,
Actelion Ltd will announce the first quarter 2009 financial results on Tuesday, 21 April 2009, at 07.00 hrs CEST / 06.00 hrs BST / 01.00 a.m. EDT. An investor conference call & webcast will be held at 15.30 hrs, CEST to discuss the results.
New York (aktiencheck.de AG) - Robert Dickinson, Kevin Wilson, Mark Dainty, Peter Verduilt und Sam Twidale, Analysten der Citigroup, stufen die Aktie des schweizerischen Unternehmens Actelion (ISIN CH0010532478/ WKN 936767) weiterhin mit "sell" ein.
Actelion werde die Resultate des ersten Quartals 2009 am 21. April vorlegen. Dabei dürfte die Umsatzentwicklung von der schwachen Vergleichsbasis des Vorjahreszeitraums profitieren. Man rechne mit einem Umsatzwachstum von "Tracleer" von 19% auf 343 Mio. CHF sowie einer Steigerung des Gesamtumsatzes um 24% auf 397 Mio. CHF. Ferner sei ein verwässertes EPS von 0,80 CHF auf GAAP-Basis zu erwarten, während die Konsensschätzung bei 0,76 CHF liege.
97% des derzeitigen Umsatzes werde ab 2010 unter erhöhtem Konkurrenzdruck stehen. Die hohe Bewertung der Aktie spiegele die Annahme eines großen Erfolgs der in der Entwicklung befindlichen Produkte wider. Man halte den Aktienkurs vor dem Hintergrund der hochriskanten Produktpipeline für zu hoch und sehe das Risiko auf der Abwärtsseite. Die EPS-Prognose für die Jahre 2009 und 2010 liege bei 3,07 CHF und 3,15 CHF, woraus sich ein KGV von 16,0 und 15,6 ermitteln lasse. Das Kursziel der Actelion-Aktie sehe man weiterhin bei 47,00 CHF.
In Erwägung dieser Fakten lautet das Rating der Analysten der Citigroup für das Wertpapier von Actelion unverändert "sell". (Analyse vom 17.04.09)
-----------------
Die Analysten sind oft sehr überzeugt, dass Tracleer der Saft abgedreht wird. Zumindest bisher hat sich das so nicht bestätigt. Richtig ist aber sicher, dass die Pipeline nicht floppen darf. Insbesondere ein Erfolg bei Almorexant wäre für die mittlere Zukunft wirklich wichtig imho.
Actelion werde die Resultate des ersten Quartals 2009 am 21. April vorlegen. Dabei dürfte die Umsatzentwicklung von der schwachen Vergleichsbasis des Vorjahreszeitraums profitieren. Man rechne mit einem Umsatzwachstum von "Tracleer" von 19% auf 343 Mio. CHF sowie einer Steigerung des Gesamtumsatzes um 24% auf 397 Mio. CHF. Ferner sei ein verwässertes EPS von 0,80 CHF auf GAAP-Basis zu erwarten, während die Konsensschätzung bei 0,76 CHF liege.
97% des derzeitigen Umsatzes werde ab 2010 unter erhöhtem Konkurrenzdruck stehen. Die hohe Bewertung der Aktie spiegele die Annahme eines großen Erfolgs der in der Entwicklung befindlichen Produkte wider. Man halte den Aktienkurs vor dem Hintergrund der hochriskanten Produktpipeline für zu hoch und sehe das Risiko auf der Abwärtsseite. Die EPS-Prognose für die Jahre 2009 und 2010 liege bei 3,07 CHF und 3,15 CHF, woraus sich ein KGV von 16,0 und 15,6 ermitteln lasse. Das Kursziel der Actelion-Aktie sehe man weiterhin bei 47,00 CHF.
In Erwägung dieser Fakten lautet das Rating der Analysten der Citigroup für das Wertpapier von Actelion unverändert "sell". (Analyse vom 17.04.09)
-----------------
Die Analysten sind oft sehr überzeugt, dass Tracleer der Saft abgedreht wird. Zumindest bisher hat sich das so nicht bestätigt. Richtig ist aber sicher, dass die Pipeline nicht floppen darf. Insbesondere ein Erfolg bei Almorexant wäre für die mittlere Zukunft wirklich wichtig imho.
Total net revenues of CHF 405.6 million, up 26 percent compared to Q1 2008 - Tracleer® sales of CHF 352.2 million, up 24 percent in local currencies - Cash EBIT of CHF 146.5 million - PAH franchise strengthened with novel thermostable i.v. epoprostenol - US launch in preparation
ALLSCHWIL/BASEL, SWITZERLAND - 21 April 2009 - Actelion Ltd (SIX: ATLN) today announced its financial results for the first quarter of 2009. With total net revenues for the first three months of 2009 of CHF 405.6 million (Q1 2008: CHF 321.6 m) and operating expenses of CHF 284.0 million (Q1 2008: CHF 253.8 m), the company reported an operating profit of CHF 121.6 million (Q1 2008: CHF 67.8 m).
To better measure and compare operating performance over time, Actelion continues to report non-US GAAP Cash EBIT (Operating Income excluding charges such as In-Process R&D, charges related to employee stock options under FAS 123R as well as non-cash depreciation and amortization charges). For the first three months of 2009, Actelion achieved a Cash EBIT of CHF 146.5 million, an increase of 60 percent compared to the same period in 2008. In local currencies, Cash EBIT increased by 63 percent. Adjusted (non-US GAAP) diluted earnings per share for the first quarter of 2009 were CHF 1.05, compared to CHF 0.57 in the first quarter of 2008.
http://www.actelion.com/en/our-company/news-and-events/index…
Tracleer noch stärker, als von der Citigroup erwartet... aber klar, strong sell...
Was ich mich auch frage, ist, warum es Actelion gelingt, ihre Projekte so edel zu verpartnern (Almorexant mit Glaxo, S1P1 mit Roche), wenn die ganze Pipe nur aus high-risk-Schrott besteht.
(Dass Pharmaentwicklung risikoreich ist, ist klar. Dass nicht alle Actelion-Projekte durchkommen, ist wahrscheinlich. Aber warum ausgerechnet Actelion so abgewatscht wird, erschließt sich mir nicht so ganz.)
ALLSCHWIL/BASEL, SWITZERLAND - 21 April 2009 - Actelion Ltd (SIX: ATLN) today announced its financial results for the first quarter of 2009. With total net revenues for the first three months of 2009 of CHF 405.6 million (Q1 2008: CHF 321.6 m) and operating expenses of CHF 284.0 million (Q1 2008: CHF 253.8 m), the company reported an operating profit of CHF 121.6 million (Q1 2008: CHF 67.8 m).
To better measure and compare operating performance over time, Actelion continues to report non-US GAAP Cash EBIT (Operating Income excluding charges such as In-Process R&D, charges related to employee stock options under FAS 123R as well as non-cash depreciation and amortization charges). For the first three months of 2009, Actelion achieved a Cash EBIT of CHF 146.5 million, an increase of 60 percent compared to the same period in 2008. In local currencies, Cash EBIT increased by 63 percent. Adjusted (non-US GAAP) diluted earnings per share for the first quarter of 2009 were CHF 1.05, compared to CHF 0.57 in the first quarter of 2008.
http://www.actelion.com/en/our-company/news-and-events/index…
Tracleer noch stärker, als von der Citigroup erwartet... aber klar, strong sell...
Was ich mich auch frage, ist, warum es Actelion gelingt, ihre Projekte so edel zu verpartnern (Almorexant mit Glaxo, S1P1 mit Roche), wenn die ganze Pipe nur aus high-risk-Schrott besteht.
(Dass Pharmaentwicklung risikoreich ist, ist klar. Dass nicht alle Actelion-Projekte durchkommen, ist wahrscheinlich. Aber warum ausgerechnet Actelion so abgewatscht wird, erschließt sich mir nicht so ganz.)
Published: 07:00 21.04.2009 GMT+2 /HUGIN /Source: Actelion Pharmaceuticals Ltd /SIX: ATLN /ISIN: CH0010532478
Actelion announces first quarter 2009 financial results
Total net revenues of CHF 405.6 million, up 26 percent compared to Q1 2008 - Tracleer® sales of CHF 352.2 million, up 24 percent in local currencies - Cash EBIT of CHF 146.5 million - PAH franchise strengthened with novel thermostable i.v. epoprostenol - US launch in preparation
ALLSCHWIL/BASEL, SWITZERLAND - 21 April 2009
Actelion Ltd (SIX: ATLN) today announced its financial results for the first quarter of 2009. With total net revenues for the first three months of 2009 of CHF 405.6 million (Q1 2008: CHF 321.6 m) and operating expenses of CHF 284.0 million (Q1 2008: CHF 253.8 m), the company reported an operating profit of CHF 121.6 million (Q1 2008: CHF 67.8 m).
To better measure and compare operating performance over time, Actelion continues to report non-US GAAP Cash EBIT (Operating Income excluding charges such as In-Process R&D, charges related to employee stock options under FAS 123R as well as non-cash depreciation and amortization charges). For the first three months of 2009, Actelion achieved a Cash EBIT of CHF 146.5 million, an increase of 60 percent compared to the same period in 2008. In local currencies, Cash EBIT increased by 63 percent. Adjusted (non-US GAAP) diluted earnings per share for the first quarter of 2009 were CHF 1.05, compared to CHF 0.57 in the first quarter of 2008.
On a US GAAP basis, net profit for the first quarter 2009 was CHF 102.1 million (Q1 2008: CHF 44.5 m). Starting on 1 January 2009, due to the adoption of FSP APB 14-1, the company incurred total non-cash charges of CHF 4.5 million related to its 2006 convertible bond. The comparative periods have been adjusted.
Fully diluted earnings per share (EPS), on a US GAAP basis, for the first three months of 2009 were CHF 0.83, compared to CHF 0.36 for the same period in 2008.
Jean-Paul Clozel, M.D. and Chief Executive Officer commented: "I am pleased to report a strong performance of Actelion in the first quarter of this year. We demonstrate again our ability to successfully grow our products in the market place, grow profitability today and advance our pre-clinical and clinical pipeline for further profitable growth tomorrow."
Jean-Paul Clozel concluded: "Actelion's success is the result of our focus on innovation in all we do, from the lab bench to the sales call. I am looking forward to share with you study results of our Phase III programs with bosentan in IPF and clazosentan in aSAH once they become available in the second half of 2009. Given our ability to execute on a global scale, positive results could lead to continued and rapidly accelerating growth"
Andrew J. Oakley, Chief Financial Officer commented: "Actelion continues to deliver significant top-line growth, accompanied by measured increases in our cost base. We continue to generate free cash flow and enjoy a strong cash position. From this situation of strength, we continue to invest into potential future revenue drivers from our own pipeline, whilst being able to appropriately strengthen our product range through in-licensing or acquisitions, as demonstrated in late February through the acquisition of another PAH agent."
Andrew J. Oakley added: "With a good start into the year, I am able to confirm previous guidance. Unforeseen events excluded, Actelion expects 2009 to be another year of growth, with total net revenues - in local currencies - to increase between 12 and 15 percent. Cash EBIT is forecasted to increase - in local currencies - to increase between 12 and 15 percent. Cash EBIT is forecasted to increase - in local currencies - by 10 to 12 percent."
[...]
* 2006 convertible bond reclassification according to adoption of FSP APB 14-1 - comparative period adjusted
The full financial statements can be found on http://www.actelion.com.
Continued growth of total net revenues
In the first quarter of 2009, Actelion's total net revenues increased by 26 percent to CHF 405.6 million (Q1 2008: CHF 321.6 m). In local currencies, total net revenues increased by 27 percent compared to the first quarter of 2008.
Contract revenues for the first three months of 2009 amounted to CHF 16.2 million (Q1 2008: CHF 6.9 m).
Product sales
During the first quarter of 2009, Tracleer® (bosentan) sales were CHF 352.2 million (Q1 2008: CHF 287.6 m). In local currencies, this represents an increase of 24 percent compared to the same period last year.
Following the US Food and Drug Administration complete response letter regarding the Tracleer® supplemental New Drug Application in early March 2009, Actelion has responded to all questions raised in the initial review of the Risk Evaluation and Mitigation System (REMS). Once REMS has been resolved successfully, the FDA will then be in a position to finalize their review for inclusion of less severe, so-called Functional Class II, PAH patients to the US product label.
At the end of March 2009, Tracleer® was commercially available in over 50 countries worldwide, including all major pharmaceutical markets.
At the end of March 2009, the Korean Health Authorities expanded the product label for Tracleer® to include Functional Class II patients. In addition, the Korean Health Authorities also approved as a new indication for Tracleer®, the prevention of Digital Ulcers in patients suffering from systemic sclerosis. In mid-April 2009, a similar label expansion and new indication approval was issued by the Brazilian Health Authorities as well.
Actelion continues to strengthen Tracleer®'s availability with further market introductions expected in the coming quarters. In the first three months of 2009, Actelion successfully registered first sales in several new territories such as Mexico.
Ventavis® (iloprost) sales amounted to CHF 27.0 million in the first quarter of 2009
(Q1 2008: CHF 17.4 m). This represents an increase of 45 percent in US Dollar terms.
Otto Schwarz, President Business Operations, commented: "The outstanding performance of Tracleer® is the result of our continued commitment to the PAH community in general and, specifically, the generation and consequent medical communication of important clinical datasets in multiple patient populations."
In late February 2009, Actelion acquired from privately-held GeneraMedix Inc. an improved, thermostable formulation of epoprostenol sodium for the intravenous treatment of pulmonary arterial hypertension (PAH) which was approved in mid-2008 in the United States for the long-term intravenous treatment of primary pulmonary hypertension and pulmonary hypertension associated with the scleroderma spectrum of disease in NYHA Class III and Class IV patients who do not respond adequately to conventional therapy.
Otto Schwarz continued: "We are rapidly moving forward with our efforts to enable US market introduction of this thermostable formulation of Epoprostenol. Also we plan to initiate regulatory review for this product outside of the United States in the near future."
In the first quarter of 2009, Zavesca® (miglustat) sales were CHF 10.3 million (Q1 2008: CHF 9.7 m). In local currencies, Zavesca® sales increased by 11 percent. Zavesca® is commercially available in over 35 countries including the United States and most European markets. At the end of March 2009, the Korean Health Authorities approved Zavesca® for the treatment of adult patients with mild to moderate type I Gaucher disease for whom enzyme replacement therapy is not a therapeutic option.
In January 2009, Zavesca® (miglustat) received approval in the European Union for the treatment of progressive neurological manifestations in adult patients and pediatric patients with Niemann-Pick type C disease (NP-C). Zavesca® is the first treatment to be approved for patients with Niemann-Pick type C disease, a very rare and devastating neurodegenerative genetic disorder affecting both children and adults.
Otto Schwarz concluded: "We are committed to fully explore the benefits of Zavesca® in patients suffering from Gaucher type-1 disease, first and foremost with the ongoing MAINTENANCE study. In addition, we will make not only significant efforts to communicate the use of Zavesca® in NP-C, but we will also work with the medical community to increase disease awareness of this very rare, and under-diagnosed genetic disorder."
In the United States, Actelion had a constructive pre-NDA (New Drug Application) meeting with the FDA and now expects to file a supplemental NDA for miglustat (Zavesca®) in
NP-C in the coming months.
Operating expenses
During the first quarter of 2009, operating expenses were CHF 284.0 million (Q1 2008: CHF 253.8 m).
During the same period, research and development expenses increased by 2 percent to CHF 95.8 million (Q1 2008: CHF 93.9 m). Q1 2008 operating expenses include a milestone payment related to the PGI2 receptor agonist in-licensed from Nippon Shinyaku. Excluding this payment, R&D expenses increased by 12 percent year on year.
Actelion gave a comprehensive description of its research and development pipeline in February at the Actelion Day 2009 event. A replay of this event is available from the investor events section of the corporate website - www.actelion.com.
Actelion's pipeline now has 9 compounds in clinical development as well as more than 25 active projects in drug discovery. The four ongoing Phase III programs include almorexant in primary insomnia (first Phase III results by year-end 2009, additional clinical studies under SPA discussion with US Food and Drug Administration), bosentan in idiopathic pulmonary fibrosis IPF (final study results before year-end 2009) clazosentan for non-traumatic subarachnoid hemorrhage (Phase III results by year-end 2009) and macitentan in PAH (Phase III results in late 2012).
The clinical programs are progressing as outlined at this event with the following update:
Miglustat in Cystic Fibrosis: The proof-of-concept study with miglustat in cystic fibrosis has concluded and Actelion is currently analyzing study results.
Renin Inhibitor: Based on the results of several clinical studies, the renin alliance with Merck & Co., Inc. (through an affiliate), has decided to discontinue the clinical development of the Phase I clinical candidate. The alliance will continue to assess other renin inhibitors currently in the drug discovery phase.
Selling, general and administrative expenses for the first three months of 2009 amounted to CHF 138.8 million (Q1 2008: CHF 121.0 m), an increase of 15 percent.
Creation of Chief Scientific Officer (CSO) position
To further strengthen the medical perspective throughout Actelion's discovery process and to provide additional scientific input in the development process, Martine Clozel, MD and Co-Head of Drug Discovery, has been nominated by the Board of Directors to additionally take on the newly created role of Chief Scientific Officer (CSO).
Operating profit
Actelion's operating profit for the first quarter of 2009 was CHF 121.6 million (Q1 2008: CHF 67.8 m). Cash EBIT for the same period amounted to CHF 146.5 million (Q1 2008: CHF 91.5 m).
Net Profit
In the first quarter of 2009, the net profit of CHF 102.1 million (Q1 2008: CHF 44.5 m) includes interest income of CHF 1.5 million, interest expense of CHF 0.3 million, non-cash interest and amortization charges on the Convertible Bond of CHF 4.5 million, foreign currency losses of CHF 5.4 million and an income tax expense of CHF 10.8 million.
Cash and cash flow
During the first quarter of 2009, Actelion generated net cash flow from operations of CHF 27.8 million (Q1 2008: CHF 22.1 m). As at 31 March 2009 total liquid funds (excluding 7.8 million treasury shares) amounted to CHF 1.1 billion.
For documentation purposes - table Q1 2009 vs. Q4 2008
In CHF thousands [...]
###
Actelion Ltd
Actelion Ltd is a biopharmaceutical company with its corporate headquarters in Allschwil/Basel, Switzerland. Actelion's first drug Tracleer®, an orally available dual endothelin receptor antagonist, has been approved as a therapy for pulmonary arterial hypertension. Actelion markets Tracleer® through its own subsidiaries in key markets worldwide, including the United States (based in South San Francisco), the European Union, Japan, Canada, Australia and Switzerland. Actelion, founded in late 1997, is a leading player in innovative science related to the endothelium - the single layer of cells separating every blood vessel from the blood stream. Actelion's over 2000 employees focus on the discovery, development and marketing of innovative drugs for significant unmet medical needs. Actelion shares are traded on the SIX Swiss Exchange (ticker symbol: ATLN) as part of the Swiss blue-chip index SMI (Swiss Market Index SMI® )
For further information please contact:
Roland Haefeli
Vice President, Head of Investor Relations & Public Affairs
Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil
+41 61 565 62 62
+1 650 624 69 36
http://www.actelion.com
Actelion announces first quarter 2009 financial results
Total net revenues of CHF 405.6 million, up 26 percent compared to Q1 2008 - Tracleer® sales of CHF 352.2 million, up 24 percent in local currencies - Cash EBIT of CHF 146.5 million - PAH franchise strengthened with novel thermostable i.v. epoprostenol - US launch in preparation
ALLSCHWIL/BASEL, SWITZERLAND - 21 April 2009
Actelion Ltd (SIX: ATLN) today announced its financial results for the first quarter of 2009. With total net revenues for the first three months of 2009 of CHF 405.6 million (Q1 2008: CHF 321.6 m) and operating expenses of CHF 284.0 million (Q1 2008: CHF 253.8 m), the company reported an operating profit of CHF 121.6 million (Q1 2008: CHF 67.8 m).
To better measure and compare operating performance over time, Actelion continues to report non-US GAAP Cash EBIT (Operating Income excluding charges such as In-Process R&D, charges related to employee stock options under FAS 123R as well as non-cash depreciation and amortization charges). For the first three months of 2009, Actelion achieved a Cash EBIT of CHF 146.5 million, an increase of 60 percent compared to the same period in 2008. In local currencies, Cash EBIT increased by 63 percent. Adjusted (non-US GAAP) diluted earnings per share for the first quarter of 2009 were CHF 1.05, compared to CHF 0.57 in the first quarter of 2008.
On a US GAAP basis, net profit for the first quarter 2009 was CHF 102.1 million (Q1 2008: CHF 44.5 m). Starting on 1 January 2009, due to the adoption of FSP APB 14-1, the company incurred total non-cash charges of CHF 4.5 million related to its 2006 convertible bond. The comparative periods have been adjusted.
Fully diluted earnings per share (EPS), on a US GAAP basis, for the first three months of 2009 were CHF 0.83, compared to CHF 0.36 for the same period in 2008.
Jean-Paul Clozel, M.D. and Chief Executive Officer commented: "I am pleased to report a strong performance of Actelion in the first quarter of this year. We demonstrate again our ability to successfully grow our products in the market place, grow profitability today and advance our pre-clinical and clinical pipeline for further profitable growth tomorrow."
Jean-Paul Clozel concluded: "Actelion's success is the result of our focus on innovation in all we do, from the lab bench to the sales call. I am looking forward to share with you study results of our Phase III programs with bosentan in IPF and clazosentan in aSAH once they become available in the second half of 2009. Given our ability to execute on a global scale, positive results could lead to continued and rapidly accelerating growth"
Andrew J. Oakley, Chief Financial Officer commented: "Actelion continues to deliver significant top-line growth, accompanied by measured increases in our cost base. We continue to generate free cash flow and enjoy a strong cash position. From this situation of strength, we continue to invest into potential future revenue drivers from our own pipeline, whilst being able to appropriately strengthen our product range through in-licensing or acquisitions, as demonstrated in late February through the acquisition of another PAH agent."
Andrew J. Oakley added: "With a good start into the year, I am able to confirm previous guidance. Unforeseen events excluded, Actelion expects 2009 to be another year of growth, with total net revenues - in local currencies - to increase between 12 and 15 percent. Cash EBIT is forecasted to increase - in local currencies - to increase between 12 and 15 percent. Cash EBIT is forecasted to increase - in local currencies - by 10 to 12 percent."
[...]
* 2006 convertible bond reclassification according to adoption of FSP APB 14-1 - comparative period adjusted
The full financial statements can be found on http://www.actelion.com.
Continued growth of total net revenues
In the first quarter of 2009, Actelion's total net revenues increased by 26 percent to CHF 405.6 million (Q1 2008: CHF 321.6 m). In local currencies, total net revenues increased by 27 percent compared to the first quarter of 2008.
Contract revenues for the first three months of 2009 amounted to CHF 16.2 million (Q1 2008: CHF 6.9 m).
Product sales
During the first quarter of 2009, Tracleer® (bosentan) sales were CHF 352.2 million (Q1 2008: CHF 287.6 m). In local currencies, this represents an increase of 24 percent compared to the same period last year.
Following the US Food and Drug Administration complete response letter regarding the Tracleer® supplemental New Drug Application in early March 2009, Actelion has responded to all questions raised in the initial review of the Risk Evaluation and Mitigation System (REMS). Once REMS has been resolved successfully, the FDA will then be in a position to finalize their review for inclusion of less severe, so-called Functional Class II, PAH patients to the US product label.
At the end of March 2009, Tracleer® was commercially available in over 50 countries worldwide, including all major pharmaceutical markets.
At the end of March 2009, the Korean Health Authorities expanded the product label for Tracleer® to include Functional Class II patients. In addition, the Korean Health Authorities also approved as a new indication for Tracleer®, the prevention of Digital Ulcers in patients suffering from systemic sclerosis. In mid-April 2009, a similar label expansion and new indication approval was issued by the Brazilian Health Authorities as well.
Actelion continues to strengthen Tracleer®'s availability with further market introductions expected in the coming quarters. In the first three months of 2009, Actelion successfully registered first sales in several new territories such as Mexico.
Ventavis® (iloprost) sales amounted to CHF 27.0 million in the first quarter of 2009
(Q1 2008: CHF 17.4 m). This represents an increase of 45 percent in US Dollar terms.
Otto Schwarz, President Business Operations, commented: "The outstanding performance of Tracleer® is the result of our continued commitment to the PAH community in general and, specifically, the generation and consequent medical communication of important clinical datasets in multiple patient populations."
In late February 2009, Actelion acquired from privately-held GeneraMedix Inc. an improved, thermostable formulation of epoprostenol sodium for the intravenous treatment of pulmonary arterial hypertension (PAH) which was approved in mid-2008 in the United States for the long-term intravenous treatment of primary pulmonary hypertension and pulmonary hypertension associated with the scleroderma spectrum of disease in NYHA Class III and Class IV patients who do not respond adequately to conventional therapy.
Otto Schwarz continued: "We are rapidly moving forward with our efforts to enable US market introduction of this thermostable formulation of Epoprostenol. Also we plan to initiate regulatory review for this product outside of the United States in the near future."
In the first quarter of 2009, Zavesca® (miglustat) sales were CHF 10.3 million (Q1 2008: CHF 9.7 m). In local currencies, Zavesca® sales increased by 11 percent. Zavesca® is commercially available in over 35 countries including the United States and most European markets. At the end of March 2009, the Korean Health Authorities approved Zavesca® for the treatment of adult patients with mild to moderate type I Gaucher disease for whom enzyme replacement therapy is not a therapeutic option.
In January 2009, Zavesca® (miglustat) received approval in the European Union for the treatment of progressive neurological manifestations in adult patients and pediatric patients with Niemann-Pick type C disease (NP-C). Zavesca® is the first treatment to be approved for patients with Niemann-Pick type C disease, a very rare and devastating neurodegenerative genetic disorder affecting both children and adults.
Otto Schwarz concluded: "We are committed to fully explore the benefits of Zavesca® in patients suffering from Gaucher type-1 disease, first and foremost with the ongoing MAINTENANCE study. In addition, we will make not only significant efforts to communicate the use of Zavesca® in NP-C, but we will also work with the medical community to increase disease awareness of this very rare, and under-diagnosed genetic disorder."
In the United States, Actelion had a constructive pre-NDA (New Drug Application) meeting with the FDA and now expects to file a supplemental NDA for miglustat (Zavesca®) in
NP-C in the coming months.
Operating expenses
During the first quarter of 2009, operating expenses were CHF 284.0 million (Q1 2008: CHF 253.8 m).
During the same period, research and development expenses increased by 2 percent to CHF 95.8 million (Q1 2008: CHF 93.9 m). Q1 2008 operating expenses include a milestone payment related to the PGI2 receptor agonist in-licensed from Nippon Shinyaku. Excluding this payment, R&D expenses increased by 12 percent year on year.
Actelion gave a comprehensive description of its research and development pipeline in February at the Actelion Day 2009 event. A replay of this event is available from the investor events section of the corporate website - www.actelion.com.
Actelion's pipeline now has 9 compounds in clinical development as well as more than 25 active projects in drug discovery. The four ongoing Phase III programs include almorexant in primary insomnia (first Phase III results by year-end 2009, additional clinical studies under SPA discussion with US Food and Drug Administration), bosentan in idiopathic pulmonary fibrosis IPF (final study results before year-end 2009) clazosentan for non-traumatic subarachnoid hemorrhage (Phase III results by year-end 2009) and macitentan in PAH (Phase III results in late 2012).
The clinical programs are progressing as outlined at this event with the following update:
Miglustat in Cystic Fibrosis: The proof-of-concept study with miglustat in cystic fibrosis has concluded and Actelion is currently analyzing study results.
Renin Inhibitor: Based on the results of several clinical studies, the renin alliance with Merck & Co., Inc. (through an affiliate), has decided to discontinue the clinical development of the Phase I clinical candidate. The alliance will continue to assess other renin inhibitors currently in the drug discovery phase.
Selling, general and administrative expenses for the first three months of 2009 amounted to CHF 138.8 million (Q1 2008: CHF 121.0 m), an increase of 15 percent.
Creation of Chief Scientific Officer (CSO) position
To further strengthen the medical perspective throughout Actelion's discovery process and to provide additional scientific input in the development process, Martine Clozel, MD and Co-Head of Drug Discovery, has been nominated by the Board of Directors to additionally take on the newly created role of Chief Scientific Officer (CSO).
Operating profit
Actelion's operating profit for the first quarter of 2009 was CHF 121.6 million (Q1 2008: CHF 67.8 m). Cash EBIT for the same period amounted to CHF 146.5 million (Q1 2008: CHF 91.5 m).
Net Profit
In the first quarter of 2009, the net profit of CHF 102.1 million (Q1 2008: CHF 44.5 m) includes interest income of CHF 1.5 million, interest expense of CHF 0.3 million, non-cash interest and amortization charges on the Convertible Bond of CHF 4.5 million, foreign currency losses of CHF 5.4 million and an income tax expense of CHF 10.8 million.
Cash and cash flow
During the first quarter of 2009, Actelion generated net cash flow from operations of CHF 27.8 million (Q1 2008: CHF 22.1 m). As at 31 March 2009 total liquid funds (excluding 7.8 million treasury shares) amounted to CHF 1.1 billion.
For documentation purposes - table Q1 2009 vs. Q4 2008
In CHF thousands [...]
###
Actelion Ltd
Actelion Ltd is a biopharmaceutical company with its corporate headquarters in Allschwil/Basel, Switzerland. Actelion's first drug Tracleer®, an orally available dual endothelin receptor antagonist, has been approved as a therapy for pulmonary arterial hypertension. Actelion markets Tracleer® through its own subsidiaries in key markets worldwide, including the United States (based in South San Francisco), the European Union, Japan, Canada, Australia and Switzerland. Actelion, founded in late 1997, is a leading player in innovative science related to the endothelium - the single layer of cells separating every blood vessel from the blood stream. Actelion's over 2000 employees focus on the discovery, development and marketing of innovative drugs for significant unmet medical needs. Actelion shares are traded on the SIX Swiss Exchange (ticker symbol: ATLN) as part of the Swiss blue-chip index SMI (Swiss Market Index SMI® )
For further information please contact:
Roland Haefeli
Vice President, Head of Investor Relations & Public Affairs
Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil
+41 61 565 62 62
+1 650 624 69 36
http://www.actelion.com
Actelion an der Heimatbörse aktuell mit über 10 % im plus! 

21.04.2009 10:17:01
Actelion kann Gewinn im ersten Quartal deutlich steigern, Aktie legt zu
Allschwil (aktiencheck.de AG) - Das schweizerische Biotechnologieunternehmen Actelion Ltd. (ISIN CH0010532478/ WKN 936767) verbuchte im ersten Quartal einen deutlichen Umsatz- und Ergebnisanstieg.
Wie aus einer am Dienstag veröffentlichten Pressemitteilung hervorgeht, lag der Umsatz im Berichtszeitraum bei 405,6 Mio. Schweizer Franken (CHF), nach einem Umsatz von 321,6 Mio. CHF im Vorjahreszeitraum. Besonders deutliche Zuwächse waren beim Bluthochdruckmedikament Tracleer zu verzeichnen, welches ein Umsatzplus von 24 Prozent auf 352,2 Mio. CHF erzielen konnte. Das Cash-EBIT kletterte im Vorjahresvergleich um 60 Prozent auf 146,5 Mio. CHF. Der Reingewinn verbesserte sich auf 102,1 Mio. CHF, nachdem man im Vorjahreszeitraum auf vergleichbarer Basis einen Reingewinn von 44,5 Mio. CHF ausgewiesen hatte.
Für das laufende Fiskaljahr erwartet der Konzern eine Fortsetzung des Wachstumskurses und geht von einem Umsatzplus in Lokalwährungen in Höhe von 12 bis 15 Prozent aus. Beim Cash-EBIT in Lokalwährungen wird ein Anstieg von 10 bis 12 Prozent prognostiziert. Im ersten Quartal hatte der Anstieg beim Cash-EBIT in Lokalwährungen gegenüber dem Vorjahreszeitraum bei 63 Prozent gelegen.
Die Aktie von Actelion notierte zuletzt in der Schweiz mit einem Plus von 9,02 Prozent bei 52,35 CHF. (21.04.2009/ac/n/a)
Quelle: AKTIENCHECK.DE

Actelion kann Gewinn im ersten Quartal deutlich steigern, Aktie legt zu
Allschwil (aktiencheck.de AG) - Das schweizerische Biotechnologieunternehmen Actelion Ltd. (ISIN CH0010532478/ WKN 936767) verbuchte im ersten Quartal einen deutlichen Umsatz- und Ergebnisanstieg.
Wie aus einer am Dienstag veröffentlichten Pressemitteilung hervorgeht, lag der Umsatz im Berichtszeitraum bei 405,6 Mio. Schweizer Franken (CHF), nach einem Umsatz von 321,6 Mio. CHF im Vorjahreszeitraum. Besonders deutliche Zuwächse waren beim Bluthochdruckmedikament Tracleer zu verzeichnen, welches ein Umsatzplus von 24 Prozent auf 352,2 Mio. CHF erzielen konnte. Das Cash-EBIT kletterte im Vorjahresvergleich um 60 Prozent auf 146,5 Mio. CHF. Der Reingewinn verbesserte sich auf 102,1 Mio. CHF, nachdem man im Vorjahreszeitraum auf vergleichbarer Basis einen Reingewinn von 44,5 Mio. CHF ausgewiesen hatte.
Für das laufende Fiskaljahr erwartet der Konzern eine Fortsetzung des Wachstumskurses und geht von einem Umsatzplus in Lokalwährungen in Höhe von 12 bis 15 Prozent aus. Beim Cash-EBIT in Lokalwährungen wird ein Anstieg von 10 bis 12 Prozent prognostiziert. Im ersten Quartal hatte der Anstieg beim Cash-EBIT in Lokalwährungen gegenüber dem Vorjahreszeitraum bei 63 Prozent gelegen.
Die Aktie von Actelion notierte zuletzt in der Schweiz mit einem Plus von 9,02 Prozent bei 52,35 CHF. (21.04.2009/ac/n/a)
Quelle: AKTIENCHECK.DE

21.04.2009 10:54:16
Actelion "buy"
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, stuft die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" weiterhin mit "buy" ein.
Actelion habe heute Morgen das Ergebnis für das 1Q09 vorgelegt. Der Umsatz habe CHF 405,6 Mio. betragen (VontE: CHF 420 Mio., Konsenserwartung: CHF 390 Mio.). Der Umsatz mit Tracleer habe sich auf CHF 352,2 Mio. belaufen (VontE: CHF 354 Mio., Konsenserwartung: CHF 337 Mio.). Der Betriebsgewinn habe bei CHF 121,6 Mio. (VontE: CHF 107,5 Mio., Konsenserwartung: CHF 101,9 Mio.) und der Reingewinn bei CHF 102,1 Mio. gelegen (VontE: CHF 93 Mio., Konsenserwartung: CHF 90,3 Mio.).
Der Umsatz von Tracleer wachse mit 24% in den Lokalwährungen weiterhin stark, wobei das starke Wachstum des Patientenstamms und gewisse Preissteigerungen in den USA impulsgebend seien. Der Umsatz von Ventavis und Zavesca sowie die Vertragseinnahmen seien etwas hinter der Analystenprognose zurückgeblieben. Dank niedrigerer F&E- und Marketingausgaben sei die operative Rentabilität unerwartet gut ausgefallen. Der Nettogewinn habe dank des starken operativen Gewinns oberhalb der Erwartungen der Analysten gelegen.
Aktuelle Informationen zur Pipeline:
Die Entwicklung eines Phase-I-Renin-Inhibitors durch Merck werde gegenwärtig terminiert, die Proof-of-Concept-Studie zu Miglustat bei zystischer Fibrose sei abgeschlossen und werde jetzt analysiert. Die Aktualisierung der Informationen von der US-Gesundheitsbehörde FDA bezüglich des Tracleer-Labels solle EARLY-Daten zur Funktionsklasse II PAH umfassen, sei aber noch nicht abgeschlossen. Die Analysten würden Mitte 2009 eine Genehmigung durch die FDA erwarten.
Der finanzielle Ausblick bleibe unverändert. Für GJ 2009 werde erwartet, dass der Umsatz von LC um 12 bis 15% wachse. Es werde erwartet, dass der Cash-EBIT bei LC um 10 bis 12% wachse.
Actelion habe ausgezeichnete Zahlen vorgelegt, die die Konsenserwartungen deutlich übertroffen hätten und den Analystenprognosen für Tracleer entsprochen hätten. Die gute Kostenkontrolle habe zu einem sehr hohen Gewinn geführt. Die Prognosen würden unverändert bleiben, seien nach Erachten der Analysten jedoch nach wie vor konservativ.
Die Analysten von Vontobel Research halten daher an ihrem "buy"-Rating und dem Kursziel von CHF 77 für die Actelion-Aktie fest. 2009 bleibe ein Jahr mit wichtigen klinischen Meilensteinen. Die nächsten Impulse könnten die Zwischenergebnisse vom BUILD-3-Test zu Bosentan bei idiopathischer Lungenfibrose liefern, die für Mitte 2009 erwartet würden. (Analyse vom 21.04.2009) (21.04.2009/ac/a/a)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
Quelle: AKTIENCHECK.DE
Actelion "buy"
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, stuft die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" weiterhin mit "buy" ein.
Actelion habe heute Morgen das Ergebnis für das 1Q09 vorgelegt. Der Umsatz habe CHF 405,6 Mio. betragen (VontE: CHF 420 Mio., Konsenserwartung: CHF 390 Mio.). Der Umsatz mit Tracleer habe sich auf CHF 352,2 Mio. belaufen (VontE: CHF 354 Mio., Konsenserwartung: CHF 337 Mio.). Der Betriebsgewinn habe bei CHF 121,6 Mio. (VontE: CHF 107,5 Mio., Konsenserwartung: CHF 101,9 Mio.) und der Reingewinn bei CHF 102,1 Mio. gelegen (VontE: CHF 93 Mio., Konsenserwartung: CHF 90,3 Mio.).
Der Umsatz von Tracleer wachse mit 24% in den Lokalwährungen weiterhin stark, wobei das starke Wachstum des Patientenstamms und gewisse Preissteigerungen in den USA impulsgebend seien. Der Umsatz von Ventavis und Zavesca sowie die Vertragseinnahmen seien etwas hinter der Analystenprognose zurückgeblieben. Dank niedrigerer F&E- und Marketingausgaben sei die operative Rentabilität unerwartet gut ausgefallen. Der Nettogewinn habe dank des starken operativen Gewinns oberhalb der Erwartungen der Analysten gelegen.
Aktuelle Informationen zur Pipeline:
Die Entwicklung eines Phase-I-Renin-Inhibitors durch Merck werde gegenwärtig terminiert, die Proof-of-Concept-Studie zu Miglustat bei zystischer Fibrose sei abgeschlossen und werde jetzt analysiert. Die Aktualisierung der Informationen von der US-Gesundheitsbehörde FDA bezüglich des Tracleer-Labels solle EARLY-Daten zur Funktionsklasse II PAH umfassen, sei aber noch nicht abgeschlossen. Die Analysten würden Mitte 2009 eine Genehmigung durch die FDA erwarten.
Der finanzielle Ausblick bleibe unverändert. Für GJ 2009 werde erwartet, dass der Umsatz von LC um 12 bis 15% wachse. Es werde erwartet, dass der Cash-EBIT bei LC um 10 bis 12% wachse.
Actelion habe ausgezeichnete Zahlen vorgelegt, die die Konsenserwartungen deutlich übertroffen hätten und den Analystenprognosen für Tracleer entsprochen hätten. Die gute Kostenkontrolle habe zu einem sehr hohen Gewinn geführt. Die Prognosen würden unverändert bleiben, seien nach Erachten der Analysten jedoch nach wie vor konservativ.
Die Analysten von Vontobel Research halten daher an ihrem "buy"-Rating und dem Kursziel von CHF 77 für die Actelion-Aktie fest. 2009 bleibe ein Jahr mit wichtigen klinischen Meilensteinen. Die nächsten Impulse könnten die Zwischenergebnisse vom BUILD-3-Test zu Bosentan bei idiopathischer Lungenfibrose liefern, die für Mitte 2009 erwartet würden. (Analyse vom 21.04.2009) (21.04.2009/ac/a/a)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
Quelle: AKTIENCHECK.DE
Actelion weiterhin auf rasantem Wachstumskurs
21.04.2009 11:29
Das Baselbieter Biopharmaunternehmen Actelion hat Umsatz und Gewinn im ersten Quartal 2009 unberührt von der Wirtschaftskrise stark steigern können. Der Reingewinn hat sich von 44,5 auf 102,1 Mio. Fr. mehr als verdoppelt.
Der Umsatz weitete sich um 26 Prozent auf 405,6 Mio. Fr. aus, wie Actelion am Dienstag mitteilte. Analysten hatten nur mit einem Gewinn von rund 90 Mio. Fr. und einem Umsatz von 391 Mio. Fr. gerechnet.
Der Hauptumsatzträger Tracleer, ein Medikament gegen Bluthochdruck, steuerte 352,2 Mio. Fr. zum Umsatz bei. Das sind 22,5 Prozent mehr als im Vorjahr. Daneben profitierte das Unternehmen von einem 55-prozentigen Umsatzwachstum des Medikaments Ventavis.
Der Betriebsgewinn erreichte 121,6 (Vorjahresquartal: 67,8) Mio. Franken. Der Cash-EBIT betrug 146,5 (91,5) Mio. Franken. Finanzchef Andrew Oakley erklärte, mit dem guten Start in das Jahr 2009 könne er die Umsatzprognose bestätigen. Actelion erwarte einen Anstieg in Lokalwährungen um 12 bis 15 Prozent.
2009 wird ein weiteres Wachstumsjahr
Für den Cash-EBIT erhöhte Oakley die Prognose leicht. Erwartet werde eine Zunahme in lokalen Währungen um 10 bis 12 Prozent, bisher waren 9 bis 11 Prozent in Aussicht gestellt.
Kaum Wechselkurs-Probleme
Das «sehr starke Ergebnis» im ersten Quartal sei nur in «sehr geringen Ausmass durch negative Wechselkurseffekte geprägt gewesen», sagte Finanzchef Andrew Oakley zur Nachrichtenagentur AWP.
Einerseits hätten sich im Vergleich zum Vorjahresquartal der US- Dollar und der japanische Yen gegenüber dem Schweizer Franken erholt. Andererseits sei der Franken gegenüber dem Euro stärker geworden. «2009 wird ein weiteres Wachstumsjahr», sagte Oakley weiter.
Die Forschungs- und Entwicklungsprojekte sind laut Oakley «auf Kurs». Für drei der vier Phase-III-Projekte - Almorexant bei Schlafstörungen, Tracleer gegen pulmonale Fibrose und Clazosentan bei Schlaganfällen (Subarachnoidal-Blutungen) - werden unverändert auf Ende 2009 hin Ergebnisse erwartet.
Aktien gesucht
Die Actelion-Aktien waren am Dienstagvormittag gesucht. Die Privatbank Wegelin sprach von einem «überzeugenden Zahlensatz», welcher «einen erfrischenden Kontrast zur allgemeinen Katerstimmung bei vielen Unternehmen» darstelle. Bis gegen 11 Uhr stiegen Actelion um 10 Prozent auf 52.80 Franken.
(Quelle: SDA)
http://www.cash.ch/news/topnews/actelion_weiterhin_auf_rasan…
21.04.2009 11:29
Das Baselbieter Biopharmaunternehmen Actelion hat Umsatz und Gewinn im ersten Quartal 2009 unberührt von der Wirtschaftskrise stark steigern können. Der Reingewinn hat sich von 44,5 auf 102,1 Mio. Fr. mehr als verdoppelt.
Der Umsatz weitete sich um 26 Prozent auf 405,6 Mio. Fr. aus, wie Actelion am Dienstag mitteilte. Analysten hatten nur mit einem Gewinn von rund 90 Mio. Fr. und einem Umsatz von 391 Mio. Fr. gerechnet.
Der Hauptumsatzträger Tracleer, ein Medikament gegen Bluthochdruck, steuerte 352,2 Mio. Fr. zum Umsatz bei. Das sind 22,5 Prozent mehr als im Vorjahr. Daneben profitierte das Unternehmen von einem 55-prozentigen Umsatzwachstum des Medikaments Ventavis.
Der Betriebsgewinn erreichte 121,6 (Vorjahresquartal: 67,8) Mio. Franken. Der Cash-EBIT betrug 146,5 (91,5) Mio. Franken. Finanzchef Andrew Oakley erklärte, mit dem guten Start in das Jahr 2009 könne er die Umsatzprognose bestätigen. Actelion erwarte einen Anstieg in Lokalwährungen um 12 bis 15 Prozent.
2009 wird ein weiteres Wachstumsjahr
Für den Cash-EBIT erhöhte Oakley die Prognose leicht. Erwartet werde eine Zunahme in lokalen Währungen um 10 bis 12 Prozent, bisher waren 9 bis 11 Prozent in Aussicht gestellt.
Kaum Wechselkurs-Probleme
Das «sehr starke Ergebnis» im ersten Quartal sei nur in «sehr geringen Ausmass durch negative Wechselkurseffekte geprägt gewesen», sagte Finanzchef Andrew Oakley zur Nachrichtenagentur AWP.
Einerseits hätten sich im Vergleich zum Vorjahresquartal der US- Dollar und der japanische Yen gegenüber dem Schweizer Franken erholt. Andererseits sei der Franken gegenüber dem Euro stärker geworden. «2009 wird ein weiteres Wachstumsjahr», sagte Oakley weiter.
Die Forschungs- und Entwicklungsprojekte sind laut Oakley «auf Kurs». Für drei der vier Phase-III-Projekte - Almorexant bei Schlafstörungen, Tracleer gegen pulmonale Fibrose und Clazosentan bei Schlaganfällen (Subarachnoidal-Blutungen) - werden unverändert auf Ende 2009 hin Ergebnisse erwartet.
Aktien gesucht
Die Actelion-Aktien waren am Dienstagvormittag gesucht. Die Privatbank Wegelin sprach von einem «überzeugenden Zahlensatz», welcher «einen erfrischenden Kontrast zur allgemeinen Katerstimmung bei vielen Unternehmen» darstelle. Bis gegen 11 Uhr stiegen Actelion um 10 Prozent auf 52.80 Franken.
(Quelle: SDA)
http://www.cash.ch/news/topnews/actelion_weiterhin_auf_rasan…
ALLSCHWIL, SCHWEIZ - 24. April 2009 - Actelion Ltd (SIX: ATLN) teilte
heute mit, dass der Ausschuss für Humanarzneimittel (Committee for
Medicinal Products for Human Use - CHMP), der wissenschaftliche
Ausschuss der europäischen Arzneimittelagentur EMEA, eine positive
Stellungnahme zur pädiatrischen Formulierung von Bosentan (Tracleer®)
für die Behandlung der pulmonalen arteriellen Hypertonie (PAH)
abgegeben hat.
Das CHMP sprach sich gegenüber der Europäischen Kommission für eine
Zulassung der neuen dispergierbaren Formulierung von 32mg
Bosentan-Tabletten aus, die speziell für Kinder entwickelt und im
Rahmen der FUTURE-1-Studie bei Kindern ab zwei Jahren untersucht
wurde, die an PAH erkrankt sind. Die Europäische Kommission wird
innerhalb der kommenden zwei Monate eine endgültige Entscheidung
fällen. Actelion arbeitet weiterhin mit den Behörden weltweit
einschliesslich der USA zusammen, um eine Zulassung für diese neue
dispergierbare Formulierung zu erhalten und die Produktinformation
für PAH zu ergänzen, in der das Mindestalter für einen
Behandlungsbeginn auf zwei Jahre herabgesetzt wird.
Bosentan ist ein oraler, dualer Endothelin-Rezeptor-Antagonist, der
bereits in Europa für die Behandlung von PAH zur Verbesserung der
körperlichen Leistungsfähigkeit und zur Verminderung der Symptome in
der WHO-Funktionsklasse III sowie in WHO-Funktionsklasse II, für die
ebenfalls einige Verbesserungen nachgewiesen wurden [1], zugelassen
ist. In der EU ist Tracleer® ausserdem für die Reduktion der Anzahl
neuer digitaler Ulzerationen bei Patienten mit systemischer Sklerose
und Sklerodermie-Patienten, die an digitalen Ulzerationen leiden,
indiziert.
PAH bei Kindern ist eine schwerwiegende Erkrankung. Bleibt sie nach
der Diagnosestellung unbehandelt, ist von einer geschätzten mittleren
Überlebensdauer von 10 Monaten auszugehen [2]. Zurzeit gibt es kein
Medikament, das für die Behandlung von PAH bei Kindern unter 12
Jahren zugelassen ist. Wenn es zur Zulassung kommt, wird Bosentan das
einzige PAH-Therapeutikum mit einer pädiatrischen Formulierung sein.
Die FUTURE-1-Studie (pediatric FormUlation of bosenTan in pUlmonary
arterial hypeRtEnsion) untersuchte die Pharmakokinetik,
Verträglichkeit und Sicherheit der neuen dispergierbaren Formulierung
von Bosentan. Das Sicherheitsprofil entsprach dem für die erwachsene
Patientenpopulation beobachteten Profil.
Die neue, vierfach teilbare dispergierbare Tablette zu 32mg wurde
speziell für Kinder ab zwei Jahren entwickelt und ermöglicht eine
einfache Berechnung der Dosis und Verabreichung.
###
Informationen für Herausgeber:
Über pulmonale arterielle Hypertonie (PAH)
Pulmonale arterielle Hypertonie (PAH) ist eine chronische,
lebensbedrohende Erkrankung, die durch abnorm hohen Blutdruck in den
Arterien zwischen Herz und Lunge der betroffenen Patienten
gekennzeichnet ist. Die Funktionen von Herz und Lunge sind stark
beeinträchtigt, was sich in einer eingeschränkten körperlichen
Leistungsfähigkeit und letztendlich einer verkürzten Lebensdauer
niederschlägt. Etwa 100.000 Menschen in Europa und den USA leiden an
primärem Lungenhochdruck oder sekundären Formen der Erkrankung.
Letztere sind Folge von anderen Krankheiten oder Gewebeveränderungen
der Lunge wie Sklerodermie, Lupus, HIV/AIDS oder angeborenen
Herzkrankheiten.
PAH geht mit strukturellen Veränderungen im Gefässsystem der Lunge
und der rechten Herzkammer einher. Jüngste Fortschritte [4] im
Verständnis der für Gefässerkrankungen der Lunge verantwortlichen
pathogenen Faktoren führten zur Entwicklung neuer Therapien, die auf
spezifische Signalwege (Pathways) ausgerichtet sind (den
Prostazyklin-Pathway, den Endothelin-Pathway und den
Stickoxid-Pathway) [5]. Die verfügbaren Therapien haben einen
positiven Einfluss auf PAH, stellen aber keine Heilung dar, und bei
vielen Patienten schreitet die Erkrankung weiter voran. PAH bleibt
daher eine schwere, lebensbedrohliche Krankheit [5,6]. Eine
frühzeitige Diagnose und ein Verständnis für Therapiewahl und
Behandlungsbeginn bleiben kritische Elemente bei der optimalen
Versorgung von PAH-Patienten.
Über PAH bei Kindern
PAH bei Kindern ist eine schwerwiegende Erkrankung. Bleibt sie nach
der Diagnosestellung unbehandelt, ist von einer geschätzten mittleren
Überlebensdauer von 10 Monaten auszugehen.[2]
Informationen über PAH finden Sie im Internet unter www.pah-info.com.
PAH-info.com wird von Actelion unterstützt und ist Teil einer
internationalen Kampagne zur Stärkung des Bewusstseins für PAH. Die
Website wurde geschaffen, um Informationen für medizinisches
Fachpersonal und Patienten anzubieten.
Über Tracleer® bei pulmonaler arterieller Hypertonie (PAH)
Tracleer® (Bosentan), der erste orale duale
Endothelin-Rezeptor-Antagonist, ist für die Behandlung der pulmonalen
arteriellen Hypertonie (PAH) zugelassen und wird durch
Niederlassungen von Actelion in den USA, der Europäischen Union,
Japan, Australien, Kanada und der Schweiz sowie anderen Märkten
weltweit verfügbar gemacht.
heute mit, dass der Ausschuss für Humanarzneimittel (Committee for
Medicinal Products for Human Use - CHMP), der wissenschaftliche
Ausschuss der europäischen Arzneimittelagentur EMEA, eine positive
Stellungnahme zur pädiatrischen Formulierung von Bosentan (Tracleer®)
für die Behandlung der pulmonalen arteriellen Hypertonie (PAH)
abgegeben hat.
Das CHMP sprach sich gegenüber der Europäischen Kommission für eine
Zulassung der neuen dispergierbaren Formulierung von 32mg
Bosentan-Tabletten aus, die speziell für Kinder entwickelt und im
Rahmen der FUTURE-1-Studie bei Kindern ab zwei Jahren untersucht
wurde, die an PAH erkrankt sind. Die Europäische Kommission wird
innerhalb der kommenden zwei Monate eine endgültige Entscheidung
fällen. Actelion arbeitet weiterhin mit den Behörden weltweit
einschliesslich der USA zusammen, um eine Zulassung für diese neue
dispergierbare Formulierung zu erhalten und die Produktinformation
für PAH zu ergänzen, in der das Mindestalter für einen
Behandlungsbeginn auf zwei Jahre herabgesetzt wird.
Bosentan ist ein oraler, dualer Endothelin-Rezeptor-Antagonist, der
bereits in Europa für die Behandlung von PAH zur Verbesserung der
körperlichen Leistungsfähigkeit und zur Verminderung der Symptome in
der WHO-Funktionsklasse III sowie in WHO-Funktionsklasse II, für die
ebenfalls einige Verbesserungen nachgewiesen wurden [1], zugelassen
ist. In der EU ist Tracleer® ausserdem für die Reduktion der Anzahl
neuer digitaler Ulzerationen bei Patienten mit systemischer Sklerose
und Sklerodermie-Patienten, die an digitalen Ulzerationen leiden,
indiziert.
PAH bei Kindern ist eine schwerwiegende Erkrankung. Bleibt sie nach
der Diagnosestellung unbehandelt, ist von einer geschätzten mittleren
Überlebensdauer von 10 Monaten auszugehen [2]. Zurzeit gibt es kein
Medikament, das für die Behandlung von PAH bei Kindern unter 12
Jahren zugelassen ist. Wenn es zur Zulassung kommt, wird Bosentan das
einzige PAH-Therapeutikum mit einer pädiatrischen Formulierung sein.
Die FUTURE-1-Studie (pediatric FormUlation of bosenTan in pUlmonary
arterial hypeRtEnsion) untersuchte die Pharmakokinetik,
Verträglichkeit und Sicherheit der neuen dispergierbaren Formulierung
von Bosentan. Das Sicherheitsprofil entsprach dem für die erwachsene
Patientenpopulation beobachteten Profil.
Die neue, vierfach teilbare dispergierbare Tablette zu 32mg wurde
speziell für Kinder ab zwei Jahren entwickelt und ermöglicht eine
einfache Berechnung der Dosis und Verabreichung.
###
Informationen für Herausgeber:
Über pulmonale arterielle Hypertonie (PAH)
Pulmonale arterielle Hypertonie (PAH) ist eine chronische,
lebensbedrohende Erkrankung, die durch abnorm hohen Blutdruck in den
Arterien zwischen Herz und Lunge der betroffenen Patienten
gekennzeichnet ist. Die Funktionen von Herz und Lunge sind stark
beeinträchtigt, was sich in einer eingeschränkten körperlichen
Leistungsfähigkeit und letztendlich einer verkürzten Lebensdauer
niederschlägt. Etwa 100.000 Menschen in Europa und den USA leiden an
primärem Lungenhochdruck oder sekundären Formen der Erkrankung.
Letztere sind Folge von anderen Krankheiten oder Gewebeveränderungen
der Lunge wie Sklerodermie, Lupus, HIV/AIDS oder angeborenen
Herzkrankheiten.
PAH geht mit strukturellen Veränderungen im Gefässsystem der Lunge
und der rechten Herzkammer einher. Jüngste Fortschritte [4] im
Verständnis der für Gefässerkrankungen der Lunge verantwortlichen
pathogenen Faktoren führten zur Entwicklung neuer Therapien, die auf
spezifische Signalwege (Pathways) ausgerichtet sind (den
Prostazyklin-Pathway, den Endothelin-Pathway und den
Stickoxid-Pathway) [5]. Die verfügbaren Therapien haben einen
positiven Einfluss auf PAH, stellen aber keine Heilung dar, und bei
vielen Patienten schreitet die Erkrankung weiter voran. PAH bleibt
daher eine schwere, lebensbedrohliche Krankheit [5,6]. Eine
frühzeitige Diagnose und ein Verständnis für Therapiewahl und
Behandlungsbeginn bleiben kritische Elemente bei der optimalen
Versorgung von PAH-Patienten.
Über PAH bei Kindern
PAH bei Kindern ist eine schwerwiegende Erkrankung. Bleibt sie nach
der Diagnosestellung unbehandelt, ist von einer geschätzten mittleren
Überlebensdauer von 10 Monaten auszugehen.[2]
Informationen über PAH finden Sie im Internet unter www.pah-info.com.
PAH-info.com wird von Actelion unterstützt und ist Teil einer
internationalen Kampagne zur Stärkung des Bewusstseins für PAH. Die
Website wurde geschaffen, um Informationen für medizinisches
Fachpersonal und Patienten anzubieten.
Über Tracleer® bei pulmonaler arterieller Hypertonie (PAH)
Tracleer® (Bosentan), der erste orale duale
Endothelin-Rezeptor-Antagonist, ist für die Behandlung der pulmonalen
arteriellen Hypertonie (PAH) zugelassen und wird durch
Niederlassungen von Actelion in den USA, der Europäischen Union,
Japan, Australien, Kanada und der Schweiz sowie anderen Märkten
weltweit verfügbar gemacht.
Antwort auf Beitrag Nr.: 37.037.457 von SLGramann am 24.04.09 18:51:47
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, stuft die Aktie von Actelion (ISIN CH0010532478 / WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" mit "buy" ein.
Am Freitag habe Actelion nach Börsenschluss bekannt gegeben, dass es vom CHMP eine positive Beurteilung für die pädiatrische Anwendung von Tracleer erhalten habe. Die positive Beurteilung von Tracleer basiere auf den Daten der klinischen FUTURE-1-Studie.
Die positive Beurteilung des CHMP zum Gebrauch von Tracleer bei zweijährigen und älteren Kindern sei eine gute Neuigkeit für Kinder, die an PAH leiden würden. Die Analysten würden jedoch denken, dass die an Anzahl der an PAH leidenden Kinder gering sei. Die Schätzungen der Analysten für Tracleer würden anhaltendes Wachstum bei dem Produkt und beinhalten bereits einen leichten Aufwärtsimpuls aufgrund der pädiatrischen Anwendung von Tracleer erfordern. Sie würden deshalb an ihren Finanzprognosen festhalten. Die nächsten Impulse seien von der möglichen Präsentation der Bosentan-Studie bei idiopathischer Lungenfibrose zu erwarten. Die nächsten Zwischenergebnisse würden innerhalb der kommenden Wochen erwartet.
Die Analysten von Vontobel Research bewerten die Actelion-Aktie mit "buy" bei einem Kursziel von CHF 75. (Analyse vom 27.04.2009) (27.04.2009/ac/a/a)
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, stuft die Aktie von Actelion (ISIN CH0010532478 / WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" mit "buy" ein.
Am Freitag habe Actelion nach Börsenschluss bekannt gegeben, dass es vom CHMP eine positive Beurteilung für die pädiatrische Anwendung von Tracleer erhalten habe. Die positive Beurteilung von Tracleer basiere auf den Daten der klinischen FUTURE-1-Studie.
Die positive Beurteilung des CHMP zum Gebrauch von Tracleer bei zweijährigen und älteren Kindern sei eine gute Neuigkeit für Kinder, die an PAH leiden würden. Die Analysten würden jedoch denken, dass die an Anzahl der an PAH leidenden Kinder gering sei. Die Schätzungen der Analysten für Tracleer würden anhaltendes Wachstum bei dem Produkt und beinhalten bereits einen leichten Aufwärtsimpuls aufgrund der pädiatrischen Anwendung von Tracleer erfordern. Sie würden deshalb an ihren Finanzprognosen festhalten. Die nächsten Impulse seien von der möglichen Präsentation der Bosentan-Studie bei idiopathischer Lungenfibrose zu erwarten. Die nächsten Zwischenergebnisse würden innerhalb der kommenden Wochen erwartet.
Die Analysten von Vontobel Research bewerten die Actelion-Aktie mit "buy" bei einem Kursziel von CHF 75. (Analyse vom 27.04.2009) (27.04.2009/ac/a/a)
Antwort auf Beitrag Nr.: 37.050.899 von SLGramann am 28.04.09 07:52:16
aus Cash:
Im Jahre 2008 gehörte Actelion unter den SMI-Gesellschaften noch zu den herausragenden Gewinnern. Weniger ruhmreich ist hingegen die Kursentwicklung seit Jahresbeginn. Die Papiere notieren trotz deutlich besser als erwarteten Quartalszahlen rund 15 Prozent unter dem Stand von Ende letzten Jahres. Händlern zufolge setzen den Aktien auch am Dienstagnachmittag wieder Branchenrotationen aus dem Ausland zu.
Mit verteidigenden Kommentaren kommt den Papieren der für die Credit Suisse tätige Analyst zu Hilfe. Letzterer rechnet schon in den kommenden Wochen, und damit früher als erwartet, mit Studienergebnissen zum Hauptumsatzträger Tracleer. Im Falle eines positiven Studienausgangs für die Indikation IPF sei beim Medikament bis Ende 2012 mit einer Ertragsverdoppelung zu rechnen. Gemäss der Credit Suisse stehen den Risiken im Hinblick auf die anstehenden Studienergebnisse asymmetrische Chancen gegenüber. Im Falle eines negativen Ausgangs betrage das Abwärtsrisiko in den Aktien des Allschwiler Biotechnologiekonzerns rund 10 Prozent. Ein positiver Ausgang könnte die Kursnotierungen hingegen um bis zu 50 Prozent nach oben schnellen lassen. Die Papiere werden vom Analysten deshalb weiterhin mit «Outperform» und einem Kursziel von 74 Franken zum Kauf empfohlen.
-------------------
Ob es bei nur -10% bleiben würde, wenn die i-Lungenfibrose-Studie gescheitert ist, bleibt abzuwarten. Ich könnte mir auch ein stärkeres Minus vorstellen. Im Erfolgsfall sind +50% aber wohl auch eher konservativ, wenn man es auf Sicht von ein bis zwei Jahren sieht.
Das wird auf jeden Fall spannend werden.
aus Cash:
Im Jahre 2008 gehörte Actelion unter den SMI-Gesellschaften noch zu den herausragenden Gewinnern. Weniger ruhmreich ist hingegen die Kursentwicklung seit Jahresbeginn. Die Papiere notieren trotz deutlich besser als erwarteten Quartalszahlen rund 15 Prozent unter dem Stand von Ende letzten Jahres. Händlern zufolge setzen den Aktien auch am Dienstagnachmittag wieder Branchenrotationen aus dem Ausland zu.
Mit verteidigenden Kommentaren kommt den Papieren der für die Credit Suisse tätige Analyst zu Hilfe. Letzterer rechnet schon in den kommenden Wochen, und damit früher als erwartet, mit Studienergebnissen zum Hauptumsatzträger Tracleer. Im Falle eines positiven Studienausgangs für die Indikation IPF sei beim Medikament bis Ende 2012 mit einer Ertragsverdoppelung zu rechnen. Gemäss der Credit Suisse stehen den Risiken im Hinblick auf die anstehenden Studienergebnisse asymmetrische Chancen gegenüber. Im Falle eines negativen Ausgangs betrage das Abwärtsrisiko in den Aktien des Allschwiler Biotechnologiekonzerns rund 10 Prozent. Ein positiver Ausgang könnte die Kursnotierungen hingegen um bis zu 50 Prozent nach oben schnellen lassen. Die Papiere werden vom Analysten deshalb weiterhin mit «Outperform» und einem Kursziel von 74 Franken zum Kauf empfohlen.
-------------------
Ob es bei nur -10% bleiben würde, wenn die i-Lungenfibrose-Studie gescheitert ist, bleibt abzuwarten. Ich könnte mir auch ein stärkeres Minus vorstellen. Im Erfolgsfall sind +50% aber wohl auch eher konservativ, wenn man es auf Sicht von ein bis zwei Jahren sieht.
Das wird auf jeden Fall spannend werden.
Antwort auf Beitrag Nr.: 37.104.420 von SLGramann am 06.05.09 07:35:03Wann kommt eigentlich mal ein Studien-update zum Schlafmittelkandidaten? Spätestensim 2. HJ. 2009 müsste da was entscheidendes kommen. Evtl. aber auch noch im ersten HJ?
Antwort auf Beitrag Nr.: 37.105.077 von Fruehrentner am 06.05.09 09:30:31
Also Actelion selbst kommuniziert folgenden Stand:
Almorexant is currently investigated in the compre-hensive Phase III program RESTORA (REstore physi-ological Sleep with The Orexin Receptor antagonist Almorexant). The first Phase III study, RESTORA 1 has commenced enrollment and is designed to evalu-ate efficacy and safety of almorexant in patients diag-nosed with primary insomnia. First study results are expected in the second half of 2009.
Wenn die Ergebnisse kommen, muss man aber wissen, dass diese Studie noch nicht zulassungsrelevant ist. In 2009 sollen weitere P 3 mit Almorexant anlaufen, die mit der FDA abgestimmt sind. Das geht wahrscheinlich erst 2011 oder 2012 in die heiße Phase. Mal sehen.
Was Tracleer für IPF angeht: Abschließende Daten kommen auch da gewiss auch erst im 2. Halbjahr - das hat Actelion erst vor einem Monat so kommuniziert. Aber vielleicht gibt es schon eher Teilergebnisse? Oder der Analyst spinnt sich was zurecht...
Also Actelion selbst kommuniziert folgenden Stand:
Almorexant is currently investigated in the compre-hensive Phase III program RESTORA (REstore physi-ological Sleep with The Orexin Receptor antagonist Almorexant). The first Phase III study, RESTORA 1 has commenced enrollment and is designed to evalu-ate efficacy and safety of almorexant in patients diag-nosed with primary insomnia. First study results are expected in the second half of 2009.
Wenn die Ergebnisse kommen, muss man aber wissen, dass diese Studie noch nicht zulassungsrelevant ist. In 2009 sollen weitere P 3 mit Almorexant anlaufen, die mit der FDA abgestimmt sind. Das geht wahrscheinlich erst 2011 oder 2012 in die heiße Phase. Mal sehen.
Was Tracleer für IPF angeht: Abschließende Daten kommen auch da gewiss auch erst im 2. Halbjahr - das hat Actelion erst vor einem Monat so kommuniziert. Aber vielleicht gibt es schon eher Teilergebnisse? Oder der Analyst spinnt sich was zurecht...

Antwort auf Beitrag Nr.: 37.106.915 von SLGramann am 06.05.09 12:19:31danke für die Infos 

Antwort auf Beitrag Nr.: 37.107.314 von Fruehrentner am 06.05.09 12:53:32
Tatsächlich Teilergebnisse zu Tracleer bei IPF:
(der Markt wird hoffentlich irgendwann gezwungen sein, diese Indikation einzupreisen - das wird dann wohl teuer werden für die Zuspätgekommenen... )
)
Actelion legt Zwischenbericht zur BUILD-3-Studie bei idiopathischer pulmonaler Fibrose vor - Studie wird gemäss Empfehlung des unabhängigen Data and Safety Monitoring Board fortgeführt
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin.
Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
----------------------------------------------------------------------
--------------
ALLSCHWIL/BASEL, SCHWEIZ - 08. Mai 2009 - Actelion Ltd (SIX: ATLN)
gab heute bekannt, dass das unabhängige Data and Safety Monitoring
Board (DSMB) die Weiterführung der zulassungsrelevanten
Phase-III-Studie BUILD-3 empfohlen hat, mit der die Wirksamkeit und
Sicherheit von Bosentan (Tracleer®) bei Patienten mit idiopathischer
pulmonaler Fibrose untersucht wird.
Das DSMB war beauftragt worden, eine Zwischenanalyse zu Wirksamkeit
und klinischer Rechtfertigung (Futility) von 75% der Ereignisse in
der BUILD-3-Studie durchzuführen. Dabei sollte herausgefunden werden,
ob eine Fortführung der Studie im Hinblick auf das primäre
Studienziel einer Verzögerung der Krankheitsprogression und des Todes
gerechtfertigt ist.
Endgültige Studienergebnisse dürften noch vor Ende 2009 vorliegen.
Tatsächlich Teilergebnisse zu Tracleer bei IPF:
(der Markt wird hoffentlich irgendwann gezwungen sein, diese Indikation einzupreisen - das wird dann wohl teuer werden für die Zuspätgekommenen...
 )
)Actelion legt Zwischenbericht zur BUILD-3-Studie bei idiopathischer pulmonaler Fibrose vor - Studie wird gemäss Empfehlung des unabhängigen Data and Safety Monitoring Board fortgeführt
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin.
Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
----------------------------------------------------------------------
--------------
ALLSCHWIL/BASEL, SCHWEIZ - 08. Mai 2009 - Actelion Ltd (SIX: ATLN)
gab heute bekannt, dass das unabhängige Data and Safety Monitoring
Board (DSMB) die Weiterführung der zulassungsrelevanten
Phase-III-Studie BUILD-3 empfohlen hat, mit der die Wirksamkeit und
Sicherheit von Bosentan (Tracleer®) bei Patienten mit idiopathischer
pulmonaler Fibrose untersucht wird.
Das DSMB war beauftragt worden, eine Zwischenanalyse zu Wirksamkeit
und klinischer Rechtfertigung (Futility) von 75% der Ereignisse in
der BUILD-3-Studie durchzuführen. Dabei sollte herausgefunden werden,
ob eine Fortführung der Studie im Hinblick auf das primäre
Studienziel einer Verzögerung der Krankheitsprogression und des Todes
gerechtfertigt ist.
Endgültige Studienergebnisse dürften noch vor Ende 2009 vorliegen.
Antwort auf Beitrag Nr.: 37.125.791 von SLGramann am 08.05.09 07:40:45Zur Zeit sind die gebeutelten Zykliker und Finanzwerte wieder gefragt.
Sobald diese Welle wieder etwas abebbt kommt wieder die Zeit der defensiven..
solange Actelion sich über 50 CHF hält ist alles ok
Sobald diese Welle wieder etwas abebbt kommt wieder die Zeit der defensiven..
solange Actelion sich über 50 CHF hält ist alles ok
Antwort auf Beitrag Nr.: 37.127.580 von Matze900 am 08.05.09 11:25:49so ist es, sehe ich auch so. 

08.05.2009 07:00:00
Actelion legt Zwischenbericht zur BUILD-3-Studie bei idiopathischer pulmonaler Fibrose vor - Studie wird gemäss Empfehlung des unabhängigen Data and Safety Monitoring Board fortgeführt
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin. Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
----------------------------------------------------
ALLSCHWIL/BASEL, SCHWEIZ - 08. Mai 2009 -
Actelion Ltd (SIX: ATLN) gab heute bekannt, dass das unabhängige Data and Safety Monitoring Board (DSMB) die Weiterführung der zulassungsrelevanten Phase-III-Studie BUILD-3 empfohlen hat, mit der die Wirksamkeit und Sicherheit von Bosentan (Tracleer®) bei Patienten mit idiopathischer pulmonaler Fibrose untersucht wird. Das DSMB war beauftragt worden, eine Zwischenanalyse zu Wirksamkeit und klinischer Rechtfertigung (Futility) von 75% der Ereignisse in der BUILD-3-Studie durchzuführen. Dabei sollte herausgefunden werden, ob eine Fortführung der Studie im Hinblick auf das primäre Studienziel einer Verzögerung der Krankheitsprogression und des Todes gerechtfertigt ist. Endgültige Studienergebnisse dürften noch vor Ende 2009 vorliegen.
###
Hinweise für Herausgeber Über idiopathische pulmonale Fibrose Idiopathische pulmonale Fibrose ist eine fortschreitende Erkrankung des Interstitiums (Zwischengewebes) der Lunge, die in der Regel zum Tode führt. Schätzungen zufolge leben weltweit rund 60.000 Patienten mit der bestätigten Diagnose einer idiopathischen pulmonalen Fibrose (IPF). An IPF erkrankte Patienten leiden aufgrund eines Verlusts der Lungenfunktion und einer Vernarbung der Lunge unter fortschreitender Atemnot. Die Verdickung des Gewebes bewirkt den irreversiblen Verlust der Gewebeeigenschaft, Sauerstoff in den Blutstrom weiterleiten zu können. Endothelin-1 verfügt neben seiner stark verengenden Wirkung auf die Blutgefässe über direkte profibrotische und proinflammatorische Wirkungen. Da die Endothelin-Konzentrationen bei interstitiellen Lungenerkrankungen erhöht sind, gibt es Hinweise darauf, dass Endothelin auch bei dieser Erkrankung eine Rolle spielt. Für IPF-Patienten ausserhalb Japans gibt es derzeit keine zugelassenen Therapien. Über BUILD-3 BUILD-3 (Bosentan Use in Interstitial Lung Disease) ist eine multizentrische, randomisierte, plazebokontrollierte, parallelisierte, auf klinische Ereignisse ausgerichtete Doppelblindstudie zu Morbidität und Mortalität. Sie untersucht die Sicherheit und Wirksamkeit von 125 mg b.i.d. Bosentan bei Patienten mit idiopathischer pulmonaler Fibrose. Die Patientenrekrutierung für BUILD-3 wurde im November 2008 mit 616 Patienten abgeschlossen. Die Studie ist randomisiert, wobei auf zwei mit Bosentan behandelte Patienten ein mit Plazebo behandelter Patient kommt, und ist auf das Erreichen von 202 klinischen Ereignissen ausgerichtet. Nach der im Studienprotokoll vorgesehenen zweiten Zwischenanalyse (75% Ereignisrate) durch ein unabhängiges Data and Safety Monitoring Board wird diese Studie wie geplant fortgeführt. BUILD-3 wird im Rahmen eines "Standard Protocol Assessment" (SPA) der US-amerikanischen Zulassungsbehörde FDA durchgeführt. Über BUILD-1 Im November 2005 berichtete Actelion über die Ergebnisse von BUILD-1, einer klinischen Studie zu idiopathischer pulmonaler Fibrose. Die Studie war zwar hinsichtlich des primären Endpunkts statistisch nicht signifikant, es liessen sich aber positive Trends hinsichtlich der vordefinierten sekundären Endpunkte beobachten, so z.B. die kombinierte Inzidenz von Therapieversagen und Todesfällen nach 12 Monaten (36,1% in der Plazebo-Gruppe gegenüber 22,5% in der mit Bosentan behandelten Gruppe, die eine relative Verringerung des Risikos um 38% darstellt (95% CI, -5, bis 63%; p=0,078) [5].
Über Tracleer® bei pulmonaler arterieller Hypertonie (PAH) Tracleer® (Bosentan) ist der erste orale duale Endothelin-Rezeptor-Antagonist, der derzeit für die Behandlung von PAH zugelassen ist und durch Niederlassungen von Actelion in den USA, der Europäischen Union, Japan, Australien, Kanada, der Schweiz und anderen Märkten weltweit vertrieben wird. Über pulmonale arterielle Hypertonie (PAH) Pulmonale arterielle Hypertonie (PAH) ist eine chronische, lebensbedrohende Erkrankung, die durch abnorm hohen Blutdruck in den Arterien zwischen Herz und Lunge der betroffenen Patienten gekennzeichnet ist. Die Funktionen von Herz und Lunge sind stark beeinträchtigt, was sich in einer eingeschränkten körperlichen Leistungsfähigkeit und letztendlich einer verkürzten Lebensdauer niederschlägt. Etwa 100.000 Menschen in Europa und den USA leiden an primärem Lungenhochdruck oder sekundären Formen der Erkrankung. Letztere sind Folge von anderen Krankheiten oder Gewebeveränderungen der Lunge wie Sklerodermie, Lupus, HIV/AIDS oder angeborenen Herzkrankheiten. PAH geht mit strukturellen Veränderungen im Gefässsystem der Lunge und der rechten Herzkammer einher. Jüngste Fortschritte [2] im Verständnis der für Gefässerkrankungen der Lunge verantwortlichen pathogenen Faktoren führten zur Entwicklung neuer Therapien, die auf spezifische Signalwege (Pathways) ausgerichtet sind (den Prostazyklin-Pathway, den Endothelin-Pathway und den Stickoxid-Pathway) [3]. Die verfügbaren Therapien haben einen positiven Einfluss auf PAH, stellen aber keine Heilung dar, und bei vielen Patienten schreitet die Erkrankung weiter voran. PAH bleibt daher eine schwere, lebensbedrohliche Krankheit [3,4]. Eine frühzeitige Diagnose und ein Verständnis für Therapiewahl und Behandlungsbeginn bleiben kritische Elemente bei der optimalen Versorgung von PAH-Patienten. Über Tracleer® bei digitalen Ulzerationen (DU) DUs sind eine klinische Manifestation der zugrunde liegenden Vaskulopathie, die das Entstehen der systemischen Sklerose (SSc) begünstigt und die Entwicklung von sklerodermiebedingter PAH, einer der häufigsten Todesursachen im Zusammenhang mit SSc, entscheidend beeinflusst. Endothelin spielt eine pathogene Mittlerrolle bei der Entstehung der zugrunde liegenden Vaskulopathie bei SSc. Digitale Ulzerationen sind eine häufig auftretende, hartnäckige Komplikation der systemischen Sklerose. Sie werden durch eine Verengung des Lumens in den kleinen Blutgefässen hervorgerufen. In deren Folge vermindert sich die Blutzirkulation in Fingern und Zehen, was zur Entstehung offener Wunden beiträgt. Digitale Ulzerationen sind schmerzhaft und beeinträchtigen die Patienten bei der Bewältigung ihres Alltags. Die Betroffenen werden oft arbeitsunfähig und können selbst einfache tägliche Verrichtungen nicht mehr ausführen, vor allem, wenn die Fingerspitzen eingesetzt werden müssen. Bei der Behandlung der systemischen Sklerose ist die Verminderung der Anzahl neu auftretender DUs ein wichtiges und erreichbares Therapieziel. In der EU ist Tracleer® zur Verminderung der Anzahl neuer digitaler Ulzerationen bei Sklerodermie-Patienten, die an digitalen Ulzerationen leiden, zugelassen. Tracleer® konnte die Funktion der Hände bei Patienten mit Sklerodermie-bedingten digitalen Ulzerationen (wie beispielsweise Anziehen und Hygiene) nachweislich verbessern. Folgende Sicherheitseinschränkungen sind zu beachten [1]: Mögliche schwere Leberschäden (einschliesslich seltener Fälle von Leberversagen und ungeklärter Leberzirrhose unter der gegebenen strikten medizinischen Überwachung) - Vor Behandlungsbeginn und während der Behandlung sind daher bei allen Patienten in monatlichem Rhythmus Untersuchungen der Leberenzymwerte erforderlich. Erhebliche Gefahr von schweren Missbildungen im Mutterleib - es darf keine Schwangerschaft vorliegen; zudem müssen zwei verschiedene Verhütungsmethoden eingesetzt und monatliche Schwangerschaftstests vorgenommen werden. Infolge dieser Risiken ist Tracleer® nur über kontrollierte Distribution erhältlich.
Literaturhinweise 1. Tracleer® SPC 2. Farber HW; Loscalzo J. Mechanisms of disease: pulmonary arterial hypertension. N. Eng. J. Med. 2004; 351:1655-65. 3. Humbert M; Sitbon O; Simonneau G. Treatment of pulmonary arterial hypertension. N. Eng. J. Med. 2004;351:1425-36. 4. Humbert M; Morrell NW; Archer SL; et al. Cellular and molecular pathobiology of pulmonary arterial hypertension. J. Am. Coll. Cardiol. 2004; 43: Suppl. 12: 13S-24S. 5. King T.E. et al. High-resolution computed tomography (HRCT) features correlate with response to bosentan in idiopathic pulmonary fibrosis (IPF): the BUILD 1 study [abstract]. Am J Respir Crit Care Med. 175:A567;2007
Actelion Ltd Actelion Ltd ist ein biopharmazeutisches Unternehmen mit Hauptsitz in Allschwil/Basel, Schweiz. Actelions erstes Medikament, Tracleer®, ist ein zur Therapie der pulmonalen arteriellen Hypertonie zugelassener dualer Endothelin-Rezeptor-Antagonist in Tablettenform. Actelion vertreibt Tracleer® durch eigene Niederlassungen in den wichtigsten internationalen Märkten, so den Vereinigten Staaten (mit Sitz in South San Francisco), der Europäischen Union, Japan, Kanada, Australien und der Schweiz. Actelion, 1997 gegründet, ist ein weltweit führendes Unternehmen bei der Erforschung des Endothels. Das Endothel trennt die Gefässwand vom Blutstrom. Mit über 2.000 Mitarbeitenden konzentriert sich Actelion darauf, innovative Medikamente in Bereichen mit hohem medizinischem Bedarf zu entdecken, zu entwickeln und zu vermarkten.
Actelion Aktien sind am SIX Swiss Exchange notiert (Symbol: ATLN) und werden als Teil des Schweizer Blue-Chip-Index SMI® (Swiss Market Index) gehandelt.
Für weitere Informationen wenden Sie sich bitte an: Roland Haefeli Vice President, Head of Investor Relations & Public Affairs Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil +41 61 565 62 62 +1 650 624 69 36
http://www.actelion.com --- Ende der Mitteilung --- Actelion Pharmaceuticals Ltd Gewerbestrasse 16 Allschwil Schweiz WKN: 936767; ISIN: CH0010532478; Index: SBIOM, SLIFE, SMCI, SMIEXP, SMIM, SPI, SPIEX; Notiert: Main Market in SIX Swiss Exchange; http://www.actelion.com http://hugin.info/131801/R/1312495/304328.pdf Copyright © Hugin AS 2009. All rights reserved.
Quelle: HUGIN
Actelion legt Zwischenbericht zur BUILD-3-Studie bei idiopathischer pulmonaler Fibrose vor - Studie wird gemäss Empfehlung des unabhängigen Data and Safety Monitoring Board fortgeführt
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin. Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
----------------------------------------------------
ALLSCHWIL/BASEL, SCHWEIZ - 08. Mai 2009 -
Actelion Ltd (SIX: ATLN) gab heute bekannt, dass das unabhängige Data and Safety Monitoring Board (DSMB) die Weiterführung der zulassungsrelevanten Phase-III-Studie BUILD-3 empfohlen hat, mit der die Wirksamkeit und Sicherheit von Bosentan (Tracleer®) bei Patienten mit idiopathischer pulmonaler Fibrose untersucht wird. Das DSMB war beauftragt worden, eine Zwischenanalyse zu Wirksamkeit und klinischer Rechtfertigung (Futility) von 75% der Ereignisse in der BUILD-3-Studie durchzuführen. Dabei sollte herausgefunden werden, ob eine Fortführung der Studie im Hinblick auf das primäre Studienziel einer Verzögerung der Krankheitsprogression und des Todes gerechtfertigt ist. Endgültige Studienergebnisse dürften noch vor Ende 2009 vorliegen.
###
Hinweise für Herausgeber Über idiopathische pulmonale Fibrose Idiopathische pulmonale Fibrose ist eine fortschreitende Erkrankung des Interstitiums (Zwischengewebes) der Lunge, die in der Regel zum Tode führt. Schätzungen zufolge leben weltweit rund 60.000 Patienten mit der bestätigten Diagnose einer idiopathischen pulmonalen Fibrose (IPF). An IPF erkrankte Patienten leiden aufgrund eines Verlusts der Lungenfunktion und einer Vernarbung der Lunge unter fortschreitender Atemnot. Die Verdickung des Gewebes bewirkt den irreversiblen Verlust der Gewebeeigenschaft, Sauerstoff in den Blutstrom weiterleiten zu können. Endothelin-1 verfügt neben seiner stark verengenden Wirkung auf die Blutgefässe über direkte profibrotische und proinflammatorische Wirkungen. Da die Endothelin-Konzentrationen bei interstitiellen Lungenerkrankungen erhöht sind, gibt es Hinweise darauf, dass Endothelin auch bei dieser Erkrankung eine Rolle spielt. Für IPF-Patienten ausserhalb Japans gibt es derzeit keine zugelassenen Therapien. Über BUILD-3 BUILD-3 (Bosentan Use in Interstitial Lung Disease) ist eine multizentrische, randomisierte, plazebokontrollierte, parallelisierte, auf klinische Ereignisse ausgerichtete Doppelblindstudie zu Morbidität und Mortalität. Sie untersucht die Sicherheit und Wirksamkeit von 125 mg b.i.d. Bosentan bei Patienten mit idiopathischer pulmonaler Fibrose. Die Patientenrekrutierung für BUILD-3 wurde im November 2008 mit 616 Patienten abgeschlossen. Die Studie ist randomisiert, wobei auf zwei mit Bosentan behandelte Patienten ein mit Plazebo behandelter Patient kommt, und ist auf das Erreichen von 202 klinischen Ereignissen ausgerichtet. Nach der im Studienprotokoll vorgesehenen zweiten Zwischenanalyse (75% Ereignisrate) durch ein unabhängiges Data and Safety Monitoring Board wird diese Studie wie geplant fortgeführt. BUILD-3 wird im Rahmen eines "Standard Protocol Assessment" (SPA) der US-amerikanischen Zulassungsbehörde FDA durchgeführt. Über BUILD-1 Im November 2005 berichtete Actelion über die Ergebnisse von BUILD-1, einer klinischen Studie zu idiopathischer pulmonaler Fibrose. Die Studie war zwar hinsichtlich des primären Endpunkts statistisch nicht signifikant, es liessen sich aber positive Trends hinsichtlich der vordefinierten sekundären Endpunkte beobachten, so z.B. die kombinierte Inzidenz von Therapieversagen und Todesfällen nach 12 Monaten (36,1% in der Plazebo-Gruppe gegenüber 22,5% in der mit Bosentan behandelten Gruppe, die eine relative Verringerung des Risikos um 38% darstellt (95% CI, -5, bis 63%; p=0,078) [5].
Über Tracleer® bei pulmonaler arterieller Hypertonie (PAH) Tracleer® (Bosentan) ist der erste orale duale Endothelin-Rezeptor-Antagonist, der derzeit für die Behandlung von PAH zugelassen ist und durch Niederlassungen von Actelion in den USA, der Europäischen Union, Japan, Australien, Kanada, der Schweiz und anderen Märkten weltweit vertrieben wird. Über pulmonale arterielle Hypertonie (PAH) Pulmonale arterielle Hypertonie (PAH) ist eine chronische, lebensbedrohende Erkrankung, die durch abnorm hohen Blutdruck in den Arterien zwischen Herz und Lunge der betroffenen Patienten gekennzeichnet ist. Die Funktionen von Herz und Lunge sind stark beeinträchtigt, was sich in einer eingeschränkten körperlichen Leistungsfähigkeit und letztendlich einer verkürzten Lebensdauer niederschlägt. Etwa 100.000 Menschen in Europa und den USA leiden an primärem Lungenhochdruck oder sekundären Formen der Erkrankung. Letztere sind Folge von anderen Krankheiten oder Gewebeveränderungen der Lunge wie Sklerodermie, Lupus, HIV/AIDS oder angeborenen Herzkrankheiten. PAH geht mit strukturellen Veränderungen im Gefässsystem der Lunge und der rechten Herzkammer einher. Jüngste Fortschritte [2] im Verständnis der für Gefässerkrankungen der Lunge verantwortlichen pathogenen Faktoren führten zur Entwicklung neuer Therapien, die auf spezifische Signalwege (Pathways) ausgerichtet sind (den Prostazyklin-Pathway, den Endothelin-Pathway und den Stickoxid-Pathway) [3]. Die verfügbaren Therapien haben einen positiven Einfluss auf PAH, stellen aber keine Heilung dar, und bei vielen Patienten schreitet die Erkrankung weiter voran. PAH bleibt daher eine schwere, lebensbedrohliche Krankheit [3,4]. Eine frühzeitige Diagnose und ein Verständnis für Therapiewahl und Behandlungsbeginn bleiben kritische Elemente bei der optimalen Versorgung von PAH-Patienten. Über Tracleer® bei digitalen Ulzerationen (DU) DUs sind eine klinische Manifestation der zugrunde liegenden Vaskulopathie, die das Entstehen der systemischen Sklerose (SSc) begünstigt und die Entwicklung von sklerodermiebedingter PAH, einer der häufigsten Todesursachen im Zusammenhang mit SSc, entscheidend beeinflusst. Endothelin spielt eine pathogene Mittlerrolle bei der Entstehung der zugrunde liegenden Vaskulopathie bei SSc. Digitale Ulzerationen sind eine häufig auftretende, hartnäckige Komplikation der systemischen Sklerose. Sie werden durch eine Verengung des Lumens in den kleinen Blutgefässen hervorgerufen. In deren Folge vermindert sich die Blutzirkulation in Fingern und Zehen, was zur Entstehung offener Wunden beiträgt. Digitale Ulzerationen sind schmerzhaft und beeinträchtigen die Patienten bei der Bewältigung ihres Alltags. Die Betroffenen werden oft arbeitsunfähig und können selbst einfache tägliche Verrichtungen nicht mehr ausführen, vor allem, wenn die Fingerspitzen eingesetzt werden müssen. Bei der Behandlung der systemischen Sklerose ist die Verminderung der Anzahl neu auftretender DUs ein wichtiges und erreichbares Therapieziel. In der EU ist Tracleer® zur Verminderung der Anzahl neuer digitaler Ulzerationen bei Sklerodermie-Patienten, die an digitalen Ulzerationen leiden, zugelassen. Tracleer® konnte die Funktion der Hände bei Patienten mit Sklerodermie-bedingten digitalen Ulzerationen (wie beispielsweise Anziehen und Hygiene) nachweislich verbessern. Folgende Sicherheitseinschränkungen sind zu beachten [1]: Mögliche schwere Leberschäden (einschliesslich seltener Fälle von Leberversagen und ungeklärter Leberzirrhose unter der gegebenen strikten medizinischen Überwachung) - Vor Behandlungsbeginn und während der Behandlung sind daher bei allen Patienten in monatlichem Rhythmus Untersuchungen der Leberenzymwerte erforderlich. Erhebliche Gefahr von schweren Missbildungen im Mutterleib - es darf keine Schwangerschaft vorliegen; zudem müssen zwei verschiedene Verhütungsmethoden eingesetzt und monatliche Schwangerschaftstests vorgenommen werden. Infolge dieser Risiken ist Tracleer® nur über kontrollierte Distribution erhältlich.
Literaturhinweise 1. Tracleer® SPC 2. Farber HW; Loscalzo J. Mechanisms of disease: pulmonary arterial hypertension. N. Eng. J. Med. 2004; 351:1655-65. 3. Humbert M; Sitbon O; Simonneau G. Treatment of pulmonary arterial hypertension. N. Eng. J. Med. 2004;351:1425-36. 4. Humbert M; Morrell NW; Archer SL; et al. Cellular and molecular pathobiology of pulmonary arterial hypertension. J. Am. Coll. Cardiol. 2004; 43: Suppl. 12: 13S-24S. 5. King T.E. et al. High-resolution computed tomography (HRCT) features correlate with response to bosentan in idiopathic pulmonary fibrosis (IPF): the BUILD 1 study [abstract]. Am J Respir Crit Care Med. 175:A567;2007
Actelion Ltd Actelion Ltd ist ein biopharmazeutisches Unternehmen mit Hauptsitz in Allschwil/Basel, Schweiz. Actelions erstes Medikament, Tracleer®, ist ein zur Therapie der pulmonalen arteriellen Hypertonie zugelassener dualer Endothelin-Rezeptor-Antagonist in Tablettenform. Actelion vertreibt Tracleer® durch eigene Niederlassungen in den wichtigsten internationalen Märkten, so den Vereinigten Staaten (mit Sitz in South San Francisco), der Europäischen Union, Japan, Kanada, Australien und der Schweiz. Actelion, 1997 gegründet, ist ein weltweit führendes Unternehmen bei der Erforschung des Endothels. Das Endothel trennt die Gefässwand vom Blutstrom. Mit über 2.000 Mitarbeitenden konzentriert sich Actelion darauf, innovative Medikamente in Bereichen mit hohem medizinischem Bedarf zu entdecken, zu entwickeln und zu vermarkten.
Actelion Aktien sind am SIX Swiss Exchange notiert (Symbol: ATLN) und werden als Teil des Schweizer Blue-Chip-Index SMI® (Swiss Market Index) gehandelt.
Für weitere Informationen wenden Sie sich bitte an: Roland Haefeli Vice President, Head of Investor Relations & Public Affairs Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil +41 61 565 62 62 +1 650 624 69 36
http://www.actelion.com --- Ende der Mitteilung --- Actelion Pharmaceuticals Ltd Gewerbestrasse 16 Allschwil Schweiz WKN: 936767; ISIN: CH0010532478; Index: SBIOM, SLIFE, SMCI, SMIEXP, SMIM, SPI, SPIEX; Notiert: Main Market in SIX Swiss Exchange; http://www.actelion.com http://hugin.info/131801/R/1312495/304328.pdf Copyright © Hugin AS 2009. All rights reserved.
Quelle: HUGIN
08.05.2009 10:48:33
Actelion "buy"
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, stuft die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" weiterhin mit "buy" ein.
Actelion habe heute Morgen angekündigt, das Drug Safety Monitoring Board (DSMB) habe die Fortsetzung der zulassungsrelevanten Phase-III-Studie BUILD-3 empfohlen, mit der die Wirksamkeit und Sicherheit von Bosentan bei Patienten mit idiopathischer pulmonaler Fibrose untersucht werde. Das DSMB sei beauftragt worden, eine Zwischenanalyse zu Wirksamkeit und klinischer Rechtfertigung (Futility) von 75% der Ereignisse bei BUILD-3 durchzuführen, um zu beurteilen, ob eine Fortsetzung der Studie im Hinblick auf das Hauptziel einer nachweislichen Verzögerung der Krankheitsprogression und des Todes gerechtfertigt sei.
BUILD-3-Studie werde fortgesetzt. Der primäre Endpunkt sei die Verzögerung der Krankheitsprogression und des Todes. Die Auswertung von BUILD-3 durch das DSMB lege nahe, dass es bei 75% der 616 untersuchten Patienten zu einer Progression gekommen sei. Die Studiendaten seien jedoch noch nicht so ausgereift, dass die Wirksamkeit von Bosentan bei IPF statistisch signifikant sei.
Die endgültigen Ergebnisse würden für das zweite Halbjahr 2009 erwartet. Die nächsten Impulsgeber im Jahr 2009: Wichtige Phase-3-Ergebnisse würden im zweiten Halbjahr 2009 auch für Clazosentan bei aSAH und für Almorexant bei Schlaflosigkeit erwartet.
Die Analysten würden den Aktienwert von Actelion nach wie vor als günstig betrachten. Für 2009 würden sie von entscheidenden Phase-III-Ergebnissen als potenzielle klinische Impulsgeber ausgehen. Darüber hinaus sei der Wettbewerbsdruck bei PAH nicht zu spüren, da Gilead und GlaxoSmithKline nur sehr langsam auf den PAH-Markt vordringen würden.
Die Analysten von Vontobel Research bekräftigen ihre "buy"-Empfehlung für die Actelion-Aktie und das Kursziel von CHF 75. (Analyse vom 08.05.2009) (08.05.2009/ac/a/a)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
Quelle: AKTIENCHECK.DE
Actelion "buy"
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, stuft die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" weiterhin mit "buy" ein.
Actelion habe heute Morgen angekündigt, das Drug Safety Monitoring Board (DSMB) habe die Fortsetzung der zulassungsrelevanten Phase-III-Studie BUILD-3 empfohlen, mit der die Wirksamkeit und Sicherheit von Bosentan bei Patienten mit idiopathischer pulmonaler Fibrose untersucht werde. Das DSMB sei beauftragt worden, eine Zwischenanalyse zu Wirksamkeit und klinischer Rechtfertigung (Futility) von 75% der Ereignisse bei BUILD-3 durchzuführen, um zu beurteilen, ob eine Fortsetzung der Studie im Hinblick auf das Hauptziel einer nachweislichen Verzögerung der Krankheitsprogression und des Todes gerechtfertigt sei.
BUILD-3-Studie werde fortgesetzt. Der primäre Endpunkt sei die Verzögerung der Krankheitsprogression und des Todes. Die Auswertung von BUILD-3 durch das DSMB lege nahe, dass es bei 75% der 616 untersuchten Patienten zu einer Progression gekommen sei. Die Studiendaten seien jedoch noch nicht so ausgereift, dass die Wirksamkeit von Bosentan bei IPF statistisch signifikant sei.
Die endgültigen Ergebnisse würden für das zweite Halbjahr 2009 erwartet. Die nächsten Impulsgeber im Jahr 2009: Wichtige Phase-3-Ergebnisse würden im zweiten Halbjahr 2009 auch für Clazosentan bei aSAH und für Almorexant bei Schlaflosigkeit erwartet.
Die Analysten würden den Aktienwert von Actelion nach wie vor als günstig betrachten. Für 2009 würden sie von entscheidenden Phase-III-Ergebnissen als potenzielle klinische Impulsgeber ausgehen. Darüber hinaus sei der Wettbewerbsdruck bei PAH nicht zu spüren, da Gilead und GlaxoSmithKline nur sehr langsam auf den PAH-Markt vordringen würden.
Die Analysten von Vontobel Research bekräftigen ihre "buy"-Empfehlung für die Actelion-Aktie und das Kursziel von CHF 75. (Analyse vom 08.05.2009) (08.05.2009/ac/a/a)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
Quelle: AKTIENCHECK.DE
Vontobel schaut mal auf die Konkurrenz bei PAH:
18.05.2009
Vontobel Research
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, stuft die Aktie von Actelion (ISIN CH0010532478 / WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" mit "buy" ein.
Auf dem Jahreskongress der American Thoracic Society seien die Details der Phase-II-Studie von Imatinib (Gleevec) und der Phase-III-Studie (FREEDOM C) zu oralem Treprostinil veröffentlicht worden. Es werde erwartet, dass eine Phase-III-Studie zu imatinib von Novartis im Sommer 2009 beginne.
Die Daten zu Imatinib bei PAH würden ermutigend aussehen. Vor allem hätten in den vergangenen zwei Jahren wichtige Meinungsführer kontinuierlich betont, dass PAH ein Problem der Zellproliferation sei. Der kleinere Durchmesser der Blutgefässe vom Herz zur Lunge (pulmonale Arterie) führe aufgrund des höheren Widerstands zu einer stärkeren Belastung der rechten Herzkammer. Da Imatinib bei Patienten im späten Stadium ausgewertet werde, sehe man derzeit begrenzten Wettbewerbsdruck zu Tracleer.
Anzeige
Im November 2008 hätten die Gesamtergebnisse der FREEDOM-C-Studie schon erkennen lassen, dass der primäre Endpunkt eines Sechs-Minuten-Lauftests bereits verfehlt worden sei. Die gestern veröffentlichten Details würden zeigen, dass wahrscheinlich die Patienten, die die Studie aufgrund von Nebenwirkungen und anderen unerwünschten Ereignissen ("Adverse Events") abgebrochen hätten, der Grund für das Fehlschlagen der Studie gewesen seien. Interessanterweise sei es bei den Patienten, die langsam auf die stärkste Dosis hätten auftitriert werden können, nicht zu diesen unerwünschten Nebenwirkungen gekommen. Da der primäre Endpunkt verfehlt worden sei, gehe man nicht von einer baldigen Markteinführung von oralem Treprostinil aus.
Auf der ATS-09 sehe man von Gilead begrenzten Wettbewerbsdruck ausgehen. Die Marketingbemühungen von Letairis würden sich nach Erachten der Analysten etwa im gleichen Rahmen wie in der Vergangenheit fortsetzen. Hinsichtlich der neuen Therapien stelle man fest, dass sich die Phase III von Imatinib jetzt Patienten mit pulmonaler arterieller Hypertonie (PAH) zuzuwenden beginne. Bayers Riociguat könnte zu einer Alternative zu PDE-5 werden.
Die Analysten von Vontobel Research stufen die Aktie von Actelion mit einem Kursziel von CHF 75 als "buy" ein. (Analyse vom 18.05.2009) (18.05.2009/ac/a/a)
18.05.2009
Vontobel Research
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, stuft die Aktie von Actelion (ISIN CH0010532478 / WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" mit "buy" ein.
Auf dem Jahreskongress der American Thoracic Society seien die Details der Phase-II-Studie von Imatinib (Gleevec) und der Phase-III-Studie (FREEDOM C) zu oralem Treprostinil veröffentlicht worden. Es werde erwartet, dass eine Phase-III-Studie zu imatinib von Novartis im Sommer 2009 beginne.
Die Daten zu Imatinib bei PAH würden ermutigend aussehen. Vor allem hätten in den vergangenen zwei Jahren wichtige Meinungsführer kontinuierlich betont, dass PAH ein Problem der Zellproliferation sei. Der kleinere Durchmesser der Blutgefässe vom Herz zur Lunge (pulmonale Arterie) führe aufgrund des höheren Widerstands zu einer stärkeren Belastung der rechten Herzkammer. Da Imatinib bei Patienten im späten Stadium ausgewertet werde, sehe man derzeit begrenzten Wettbewerbsdruck zu Tracleer.
Anzeige
Im November 2008 hätten die Gesamtergebnisse der FREEDOM-C-Studie schon erkennen lassen, dass der primäre Endpunkt eines Sechs-Minuten-Lauftests bereits verfehlt worden sei. Die gestern veröffentlichten Details würden zeigen, dass wahrscheinlich die Patienten, die die Studie aufgrund von Nebenwirkungen und anderen unerwünschten Ereignissen ("Adverse Events") abgebrochen hätten, der Grund für das Fehlschlagen der Studie gewesen seien. Interessanterweise sei es bei den Patienten, die langsam auf die stärkste Dosis hätten auftitriert werden können, nicht zu diesen unerwünschten Nebenwirkungen gekommen. Da der primäre Endpunkt verfehlt worden sei, gehe man nicht von einer baldigen Markteinführung von oralem Treprostinil aus.
Auf der ATS-09 sehe man von Gilead begrenzten Wettbewerbsdruck ausgehen. Die Marketingbemühungen von Letairis würden sich nach Erachten der Analysten etwa im gleichen Rahmen wie in der Vergangenheit fortsetzen. Hinsichtlich der neuen Therapien stelle man fest, dass sich die Phase III von Imatinib jetzt Patienten mit pulmonaler arterieller Hypertonie (PAH) zuzuwenden beginne. Bayers Riociguat könnte zu einer Alternative zu PDE-5 werden.
Die Analysten von Vontobel Research stufen die Aktie von Actelion mit einem Kursziel von CHF 75 als "buy" ein. (Analyse vom 18.05.2009) (18.05.2009/ac/a/a)
Und Merrill sieht die Pipeline als extrem risikoreich an:
Actelion (ATLN.VX) shares fall 2 percent, versus a slightly stronger European health care sector .SXDP, after analysts at Bank of America/Merill Lynch downgrade their rating on the stock to "neutral" from "buy", citing risks in development of the biotech company's new drugs.
"Although we believe the shares are pricing in limited value for Actelion's pipeline, we consider (upcoming clinical trial data) high risk and believe negative outcomes could prevent the shares from performing," the analysts say in a note. Reuters Messaging rm://sam.cage.reuters.com@reuters.net
Actelion (ATLN.VX) shares fall 2 percent, versus a slightly stronger European health care sector .SXDP, after analysts at Bank of America/Merill Lynch downgrade their rating on the stock to "neutral" from "buy", citing risks in development of the biotech company's new drugs.
"Although we believe the shares are pricing in limited value for Actelion's pipeline, we consider (upcoming clinical trial data) high risk and believe negative outcomes could prevent the shares from performing," the analysts say in a note. Reuters Messaging rm://sam.cage.reuters.com@reuters.net
Quelle: Cash.CH
Von cash-«Insider»
In der ersten Wochenhälfte standen die Namenaktien von Actelion noch unter Abgabedruck. Am Mittwoch nun bescheren grössere Kaufaufträge aus London den Papieren des Allschwiler Biotechnologiekonzerns eine kleinere Renaissance.
Im Anschluss an die von BNP Paribas veranstaltete «European Healthcare Conference» stufen die Franzosen die Aktien von Actelion mit einem Kursziel von 58 (55) Franken von «Underperform» auf «Neutral» hoch. Dank der guten Voraussehbarkeit der zukünftigen Ertragsentwicklung und in Erwartung positiver Studienergebnisse für die Anwendung von Tracleer bei idiopathischer pulmonaler Fibrose im zweiten Halbjahr erwartet BNP Paribas ein Ende der unterdurchschnittlichen Kursentwicklung. Neu gehen die Franzosen im laufenden Geschäftsjahr von einem Umsatz am oberen Ende der firmeneigenen Prognosenspanne aus.
Auch die Credit Suisse bestätigt ihre positive Einschätzung des Biotechnologiekonzerns. Der Markt unterschätze das Potenzial des Wirkstoffs Clazosentan. Die Schätzung der Grossbank in Bezug auf das Umsatzpotenzial des Medikaments liegen mit 760 Millionen Dollar deutlich über den Konsensschätzungen von 200 Millionen Dollar. Die Credit Suiss empfiehlt die Papiere weiterhin mit «Outperform» und einem Kursziel von 74 Franken zum Kauf.
Von cash-«Insider»
In der ersten Wochenhälfte standen die Namenaktien von Actelion noch unter Abgabedruck. Am Mittwoch nun bescheren grössere Kaufaufträge aus London den Papieren des Allschwiler Biotechnologiekonzerns eine kleinere Renaissance.
Im Anschluss an die von BNP Paribas veranstaltete «European Healthcare Conference» stufen die Franzosen die Aktien von Actelion mit einem Kursziel von 58 (55) Franken von «Underperform» auf «Neutral» hoch. Dank der guten Voraussehbarkeit der zukünftigen Ertragsentwicklung und in Erwartung positiver Studienergebnisse für die Anwendung von Tracleer bei idiopathischer pulmonaler Fibrose im zweiten Halbjahr erwartet BNP Paribas ein Ende der unterdurchschnittlichen Kursentwicklung. Neu gehen die Franzosen im laufenden Geschäftsjahr von einem Umsatz am oberen Ende der firmeneigenen Prognosenspanne aus.
Auch die Credit Suisse bestätigt ihre positive Einschätzung des Biotechnologiekonzerns. Der Markt unterschätze das Potenzial des Wirkstoffs Clazosentan. Die Schätzung der Grossbank in Bezug auf das Umsatzpotenzial des Medikaments liegen mit 760 Millionen Dollar deutlich über den Konsensschätzungen von 200 Millionen Dollar. Die Credit Suiss empfiehlt die Papiere weiterhin mit «Outperform» und einem Kursziel von 74 Franken zum Kauf.
25.05.09 Mit Blick auf eine mögliche Zulassung des Bestsellers Tracleer in der neuen Indikation Idiopathische Pulmonare Fibrose haben die Analysten von Sal. Oppenheim die Aktie von Actelion zum Kauf empfohlen. Sie sehen eine 75%ige Chance darin, dass Tracleer erfolgreich sein werde. Dann könnte der Wirkstoff im Jahr 2015 Blockbuster-Status erreichen. Da die zusätzlichen Umsätze noch nicht eingepreist seien, sollten Anleger Actelion-Aktien kaufen. Die entscheidenden klinischen Ergebnisse werden im Herbst des laufenden Jahres erwartet. Das Kursziel geben die Analysten in ihrem ersten Bericht – die Actelion-Coverage startet gerade – mit 65 CHF an. Derzeit kostet eine Aktie von Actelion rund 53 CHF. Sollte das Präparat im Herbst erfolgreich sein, wird Sal. Oppenheim den fairen Wert um 7 CHF anheben. Derzeit ist Tracleer zur Behandlung der pulmonalen arteriellen Hypertonie zugelassen.
------------------
Na ja, wie auch immer die auf 75% kommen... Das gaukelt eine Prognosegenauigkeit vor, die es so nicht gibt imho.
(Tracleer ist bereits Blockbuster)
------------------
Na ja, wie auch immer die auf 75% kommen... Das gaukelt eine Prognosegenauigkeit vor, die es so nicht gibt imho.

(Tracleer ist bereits Blockbuster)
Einer regen Nachfrage erfreuen sich am frühen Montagnachmittag die Namenaktien von Actelion. Wie schon letzte Woche sorgt der für die Credit Suisse tätige Biotechnologieanalyst am Markt für Aufsehen. Im schlechtesten Fall errechnet der Analyst einen Nettobarwert von 47 Franken je Aktie für die drei sich auf dem Markt befindlichen Medikamente Tracleer, Ventavis und Zavesca.
Sollte der Allschwiler Biotechnologiekonzern die Marktzulassung für Tracleer bei idiopathischer pulmonaler Fibrose und die beiden Präparate Almorexant und Clazosentan erhalten, stiege der Nettobarwert sogar auf 99 Franken pro Titel. Der Analyst stützt sich aber weiterhin auf einen risikogewichteten Nettobarwert der zukünftigen Umsatzträger ab und beziffert das darauf basierende Kursziel unverändert mit 74 Franken je Aktie. Die Papiere von Actelion werden deshalb mit «Outperform» zum Kauf empfohlen.
----------------------
Kursverdopplung wenn das Szenario zutrifft ist ganz sicher drin. Nur, dass wirklich alles klappt, wäre wohl zu schön, um wahr zu werden...
Ich sehe es aber auch so, dass das Aufwärtspotential höher ist, als die Abwärtsrisiken. Denn die werden von Tracleer begrenzt - auch wenn viele Analysten da ständig den Markt an die Konkurrenz gehen sehen.
Sollte der Allschwiler Biotechnologiekonzern die Marktzulassung für Tracleer bei idiopathischer pulmonaler Fibrose und die beiden Präparate Almorexant und Clazosentan erhalten, stiege der Nettobarwert sogar auf 99 Franken pro Titel. Der Analyst stützt sich aber weiterhin auf einen risikogewichteten Nettobarwert der zukünftigen Umsatzträger ab und beziffert das darauf basierende Kursziel unverändert mit 74 Franken je Aktie. Die Papiere von Actelion werden deshalb mit «Outperform» zum Kauf empfohlen.
----------------------
Kursverdopplung wenn das Szenario zutrifft ist ganz sicher drin. Nur, dass wirklich alles klappt, wäre wohl zu schön, um wahr zu werden...
Ich sehe es aber auch so, dass das Aufwärtspotential höher ist, als die Abwärtsrisiken. Denn die werden von Tracleer begrenzt - auch wenn viele Analysten da ständig den Markt an die Konkurrenz gehen sehen.
Abgaben von Actelion (-1,3%) würden unter der möglichen Konkurrenz für das Schlafmedikament Almorexant durch das US-Pharmaunternehmen Somaxon leiden, hiess es unter Marktbeobachtern. Das bereits gegen Depressionen zugelassene und kostengünstige Präparat könnte Experten zufolge den Markt für Schlafmittel von hinten aufrollen.
Published: 07:00 12.06.2009 GMT+2 /HUGIN /Source: Actelion Pharmaceuticals Ltd /SIX: ATLN /ISIN: CH0010532478
Management change at Actelion - Isaac Kobrin to take newly created position of Chief Medical Officer - Guy Braunstein to join as new Head of Clinical Development
ALLSCHWIL/BASEL, SWITZERLAND - 12 June 2009 - Actelion Ltd (SIX: ATLN) today announced the creation of the position of Chief Medical Officer (CMO). This change was initiated to fulfill the needs of a fast growing organization, which is developing products rapidly and managing a growing portfolio. Effective 1 July 2009, the current Head of Clinical Development, Isaac Kobrin will move into this position. He will continue to be a member of Actelion's Executive Committee (AEC).
As a consequence, Isaac will hand over his position as Head of Clinical Development to Guy Braunstein. Guy joins Actelion having served as Chief Medical Officer at Merck Serono and, before this, as Chief Medical Officer at Serono International. Guy will join Actelion's Executive Committee adding his more than 20 years of experience to Actelion's senior management decision-making committee.
Jean-Paul Clozel, M.D. and Chief Executive Officer commented: "With Isaac in this new position and the introduction of Guy to the Clinical Development team, we are increasing our focus on scientific and drug development expertise at Actelion. The sharing of this know-how across the functions of drug discovery, clinical development, registration and commercialization will ensure continued rapid advancement of our innovative compounds that will make a real difference to patients."
Isaac Kobrin, Senior Vice President, Head of Clinical Development and Member of the Actelion Executive Committee commented: "I look forward to taking up this next challenge in my career with Actelion, knowing that the clinical development team will be in good hands with Guy. He brings an excellent understanding of what it takes to fully develop innovative compounds, providing physicians with evidence-based medicine. His arrival at Actelion will bring a fresh approach to our existing and future pipeline and I am sure that this collaborative approach will build on and advance our clinical capabilities."
Guy Braunstein commented: "I am very excited to be joining Actelion where I have found energetic people who are committed to driving their compounds forward with a focus on the patient. The team I have met truly understands the importance of integrating science and medicine to offer potential therapies for these patients who are in desperate need of treatment. In this environment I feel we have an opportunity to really make a difference."
About Guy Braunstein
Guy Braunstein is a French citizen with an MD and is specialized in respiratory medicine. He has a PhD in life science.
Guy joins Actelion from Merck Serono, where he was the Chief Medical Office, having served for 4 years before that as Chief Medical Officer at Serono International. His more than 20 years in the pharmaceutical industry spans a wide range of experience from affiliate Medical Director and Global Medical Affairs through to Research and Development roles. Guy has worked in both large pharmaceutical and biotech environments in companies such as Astra, Glaxo-Wellcome, GSK, Fisons, Rhône-Poulenc Rorer and Chiron. During this time he built experience in multiple therapeutic areas, in particular respiratory, inflammation and autoimmune disorders, multiple sclerosis and oncology.
###
Notes to the editor
About Isaac Kobrin
Isaac Kobrin is an internist educated in Israel with further training (Fullbright Fellowship) at the Ochsner Medical Foundation in New Orleans, LA, USA, mainly in the cardiovascular and nephrology fields.
He joined the clinical cardiovascular development department at F. Hoffmann-La Roche Ltd in 1989. During his 10 years at Roche he was responsible for the worldwide clinical development of key compounds within the company's cardiovascular portfolio (from Phase 1 to marketing approval). In 1997 he became Group Leader of the cardiovascular development group.
Isaac joined Actelion in September 1999 as Senior Vice President, Head of Clinical Development
For further information please contact:
Roland Haefeli
Vice President, Head of Investor Relations & Corporate Communication
Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil
+41 61 565 62 62
+1 650 624 69 36
http://www.actelion.com
Management change at Actelion - Isaac Kobrin to take newly created position of Chief Medical Officer - Guy Braunstein to join as new Head of Clinical Development
ALLSCHWIL/BASEL, SWITZERLAND - 12 June 2009 - Actelion Ltd (SIX: ATLN) today announced the creation of the position of Chief Medical Officer (CMO). This change was initiated to fulfill the needs of a fast growing organization, which is developing products rapidly and managing a growing portfolio. Effective 1 July 2009, the current Head of Clinical Development, Isaac Kobrin will move into this position. He will continue to be a member of Actelion's Executive Committee (AEC).
As a consequence, Isaac will hand over his position as Head of Clinical Development to Guy Braunstein. Guy joins Actelion having served as Chief Medical Officer at Merck Serono and, before this, as Chief Medical Officer at Serono International. Guy will join Actelion's Executive Committee adding his more than 20 years of experience to Actelion's senior management decision-making committee.
Jean-Paul Clozel, M.D. and Chief Executive Officer commented: "With Isaac in this new position and the introduction of Guy to the Clinical Development team, we are increasing our focus on scientific and drug development expertise at Actelion. The sharing of this know-how across the functions of drug discovery, clinical development, registration and commercialization will ensure continued rapid advancement of our innovative compounds that will make a real difference to patients."
Isaac Kobrin, Senior Vice President, Head of Clinical Development and Member of the Actelion Executive Committee commented: "I look forward to taking up this next challenge in my career with Actelion, knowing that the clinical development team will be in good hands with Guy. He brings an excellent understanding of what it takes to fully develop innovative compounds, providing physicians with evidence-based medicine. His arrival at Actelion will bring a fresh approach to our existing and future pipeline and I am sure that this collaborative approach will build on and advance our clinical capabilities."
Guy Braunstein commented: "I am very excited to be joining Actelion where I have found energetic people who are committed to driving their compounds forward with a focus on the patient. The team I have met truly understands the importance of integrating science and medicine to offer potential therapies for these patients who are in desperate need of treatment. In this environment I feel we have an opportunity to really make a difference."
About Guy Braunstein
Guy Braunstein is a French citizen with an MD and is specialized in respiratory medicine. He has a PhD in life science.
Guy joins Actelion from Merck Serono, where he was the Chief Medical Office, having served for 4 years before that as Chief Medical Officer at Serono International. His more than 20 years in the pharmaceutical industry spans a wide range of experience from affiliate Medical Director and Global Medical Affairs through to Research and Development roles. Guy has worked in both large pharmaceutical and biotech environments in companies such as Astra, Glaxo-Wellcome, GSK, Fisons, Rhône-Poulenc Rorer and Chiron. During this time he built experience in multiple therapeutic areas, in particular respiratory, inflammation and autoimmune disorders, multiple sclerosis and oncology.
###
Notes to the editor
About Isaac Kobrin
Isaac Kobrin is an internist educated in Israel with further training (Fullbright Fellowship) at the Ochsner Medical Foundation in New Orleans, LA, USA, mainly in the cardiovascular and nephrology fields.
He joined the clinical cardiovascular development department at F. Hoffmann-La Roche Ltd in 1989. During his 10 years at Roche he was responsible for the worldwide clinical development of key compounds within the company's cardiovascular portfolio (from Phase 1 to marketing approval). In 1997 he became Group Leader of the cardiovascular development group.
Isaac joined Actelion in September 1999 as Senior Vice President, Head of Clinical Development
For further information please contact:
Roland Haefeli
Vice President, Head of Investor Relations & Corporate Communication
Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil
+41 61 565 62 62
+1 650 624 69 36
http://www.actelion.com
auf deutsch:
12.06.2009 07:00:00
Managementwechsel bei Actelion - Isaac Kobrin übernimmt neu geschaffene Position des Chief Medical Officer - Guy Braunstein wird neuer Leiter der Klinischen Entwicklung
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin. Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
ALLSCHWIL/BASEL, SCHWEIZ - 12. Juni 2009
Actelion Ltd (SIX: ATLN) informierte heute über die neu geschaffene Position des Chief Medical Officer (CMO). Diese organisatorische Veränderung erfolgt im Hinblick auf die Anforderungen einer schnell wachsenden Organisation und die damit verbundene Notwendigkeit, Produkte rasch zu entwickeln und eine wachsende Produktepalette effizient zu steuern. Isaac Kobrin, bisher Leiter der Klinischen Entwicklung, wird diese neue Position am 1. Juli 2009 übernehmen und weiterhin dem Executive Committee von Actelion (AEC) angehören. Die Leitung der Klinischen Entwicklung wird Isaac Kobrin an Guy Braunstein abtreten, der bisher als Chief Medical Officer bei Merck Serono und davor bei Serono International tätig war. Guy Braunstein wird ebenfalls Mitglied des Executive Committee von Actelion sein und damit seine mehr als zwanzigjährige Erfahrung in die Entscheidungsfindung der Geschäftsleitung einbringen. Dr. Jean-Paul Clozel, Chief Executive Officer, kommentierte: "Mit Isaac Kobrin in der neu geschaffenen Position und Guy Braunstein als Leiter des klinischen Entwicklungsteams werden wir unser Engagement in der wissenschaftlichen Arzneimittelforschung weiter verstärken. Der vorhandene Wissensschatz wird allen Funktionen von der Arzneimittelforschung über die klinische Entwicklung und Registrierung bis zur Vermarktung unserer Produkte zugute kommen und damit unsere innovativen Substanzen rasch voranbringen, um Patienten neue Perspektiven zu eröffnen." Isaac Kobrin, Senior Vice President, Leiter Klinische Entwicklung und Mitglied der Geschäftsleitung, erklärte: "Ich freue mich auf die neue Herausforderung in meiner beruflichen Laufbahn bei Actelion und weiss, dass das klinische Entwicklungsteam bei Guy Braunstein gut aufgehoben sein wird. Er besitzt ein hervorragendes Wissen über die Entwicklung innovativer Wirkstoffe, die wir den Ärzten als wissenschaftlich breit abgestützte Arzneimittel zur Verfügung stellen. Wir sind davon überzeugt, dass er neue Akzente bei der Weiterentwicklung unserer bestehenden und künftigen Produkte-Pipeline setzen wird, und ich bin sicher, dass wir gemeinsam auf unserem vorhandenen klinischen Knowhow aufbauen und unsere klinische Expertise weiter voranbringen werden." Guy Braunstein kommentierte: "Ich freue mich sehr auf meine neue Position bei Actelion und auf die Zusammenarbeit mit dynamischen Mitarbeitenden, die sich für die zügige Entwicklung neuer Substanzen zum Nutzen von Patienten einsetzen. Ich habe hier ein Team angetroffen, das versteht, wie wichtig die Integration von Wissenschaft und Medizin für die Bereitstellung neuartiger Therapien für Patienten ist, die dringend auf neue Behandlungsmethoden angewiesen sind. In einem solchen Umfeld haben wir die Möglichkeit, herkömmliche Therapiekonzepte grundlegend zu verändern." Über Guy Braunstein Guy Braunstein ist französischer Staatsangehöriger. Als ausgebildeter Mediziner mit einem Doktortitel in Life Science hat er sich auf die Behandlung von Atemwegserkrankungen spezialisiert. Bisher war Guy Braunstein als Chief Medical Officer bei Merck Serono und zuvor vier Jahre lang in der gleichen Position bei Serono International tätig. Er verfügt über eine mehr als zwanzigjährige Erfahrung in der pharmazeutischen Industrie und hatte zahlreiche Positionen vom lokalen und globalen Medical Director bis hin zu verschiedenen Aufgaben in Forschung und Entwicklung inne. Er arbeitete in grossen Pharma- und Biotech-Unternehmen wie Astra, Glaxo-Wellcome, GSK, Fisons, Rhône-Poulenc Rorer und Chiron. Dabei erwarb er Erfahrungen in unterschiedlichen Therapiegebieten, insbesondere in den Bereichen Atemwegserkrankungen, Entzündung, Autoimmunkrankheiten, Multiple Sklerose und Onkologie. ### Anmerkung für Herausgeber Über Isaac Kobrin Isaac Kobrin ist ausgebildeter Internist. Er studierte in Israel und erhielt eine weiterführende Ausbildung (Fullbright Fellowship) an der Ochsner Medical Foundation in New Orleans, LA, USA, wo er sich auf den Gebieten Herz-Kreislauf und Nephrologie spezialisierte. 1989 nahm er seine Tätigkeit in der klinischen Entwicklung für kardio-vaskuläre Wirkstoffe bei F. Hoffmann-La Roche Ltd auf. Während seiner zehnjährigen Tätigkeit bei Roche war er für die weltweite klinische Entwicklung (Phase 1 bis zur Zulassung) bedeutender Wirksubstanzen des Herz-Kreislaufportfolios zuständig. 1997 wurde er Leiter der Entwicklungsgruppe Herz-Kreislauf. Im September 1999 übernahm Isaac Kobrin als Senior Vice President die Leitung der Klinischen Entwicklung bei Actelion.
12.06.2009 07:00:00
Managementwechsel bei Actelion - Isaac Kobrin übernimmt neu geschaffene Position des Chief Medical Officer - Guy Braunstein wird neuer Leiter der Klinischen Entwicklung
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin. Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
ALLSCHWIL/BASEL, SCHWEIZ - 12. Juni 2009
Actelion Ltd (SIX: ATLN) informierte heute über die neu geschaffene Position des Chief Medical Officer (CMO). Diese organisatorische Veränderung erfolgt im Hinblick auf die Anforderungen einer schnell wachsenden Organisation und die damit verbundene Notwendigkeit, Produkte rasch zu entwickeln und eine wachsende Produktepalette effizient zu steuern. Isaac Kobrin, bisher Leiter der Klinischen Entwicklung, wird diese neue Position am 1. Juli 2009 übernehmen und weiterhin dem Executive Committee von Actelion (AEC) angehören. Die Leitung der Klinischen Entwicklung wird Isaac Kobrin an Guy Braunstein abtreten, der bisher als Chief Medical Officer bei Merck Serono und davor bei Serono International tätig war. Guy Braunstein wird ebenfalls Mitglied des Executive Committee von Actelion sein und damit seine mehr als zwanzigjährige Erfahrung in die Entscheidungsfindung der Geschäftsleitung einbringen. Dr. Jean-Paul Clozel, Chief Executive Officer, kommentierte: "Mit Isaac Kobrin in der neu geschaffenen Position und Guy Braunstein als Leiter des klinischen Entwicklungsteams werden wir unser Engagement in der wissenschaftlichen Arzneimittelforschung weiter verstärken. Der vorhandene Wissensschatz wird allen Funktionen von der Arzneimittelforschung über die klinische Entwicklung und Registrierung bis zur Vermarktung unserer Produkte zugute kommen und damit unsere innovativen Substanzen rasch voranbringen, um Patienten neue Perspektiven zu eröffnen." Isaac Kobrin, Senior Vice President, Leiter Klinische Entwicklung und Mitglied der Geschäftsleitung, erklärte: "Ich freue mich auf die neue Herausforderung in meiner beruflichen Laufbahn bei Actelion und weiss, dass das klinische Entwicklungsteam bei Guy Braunstein gut aufgehoben sein wird. Er besitzt ein hervorragendes Wissen über die Entwicklung innovativer Wirkstoffe, die wir den Ärzten als wissenschaftlich breit abgestützte Arzneimittel zur Verfügung stellen. Wir sind davon überzeugt, dass er neue Akzente bei der Weiterentwicklung unserer bestehenden und künftigen Produkte-Pipeline setzen wird, und ich bin sicher, dass wir gemeinsam auf unserem vorhandenen klinischen Knowhow aufbauen und unsere klinische Expertise weiter voranbringen werden." Guy Braunstein kommentierte: "Ich freue mich sehr auf meine neue Position bei Actelion und auf die Zusammenarbeit mit dynamischen Mitarbeitenden, die sich für die zügige Entwicklung neuer Substanzen zum Nutzen von Patienten einsetzen. Ich habe hier ein Team angetroffen, das versteht, wie wichtig die Integration von Wissenschaft und Medizin für die Bereitstellung neuartiger Therapien für Patienten ist, die dringend auf neue Behandlungsmethoden angewiesen sind. In einem solchen Umfeld haben wir die Möglichkeit, herkömmliche Therapiekonzepte grundlegend zu verändern." Über Guy Braunstein Guy Braunstein ist französischer Staatsangehöriger. Als ausgebildeter Mediziner mit einem Doktortitel in Life Science hat er sich auf die Behandlung von Atemwegserkrankungen spezialisiert. Bisher war Guy Braunstein als Chief Medical Officer bei Merck Serono und zuvor vier Jahre lang in der gleichen Position bei Serono International tätig. Er verfügt über eine mehr als zwanzigjährige Erfahrung in der pharmazeutischen Industrie und hatte zahlreiche Positionen vom lokalen und globalen Medical Director bis hin zu verschiedenen Aufgaben in Forschung und Entwicklung inne. Er arbeitete in grossen Pharma- und Biotech-Unternehmen wie Astra, Glaxo-Wellcome, GSK, Fisons, Rhône-Poulenc Rorer und Chiron. Dabei erwarb er Erfahrungen in unterschiedlichen Therapiegebieten, insbesondere in den Bereichen Atemwegserkrankungen, Entzündung, Autoimmunkrankheiten, Multiple Sklerose und Onkologie. ### Anmerkung für Herausgeber Über Isaac Kobrin Isaac Kobrin ist ausgebildeter Internist. Er studierte in Israel und erhielt eine weiterführende Ausbildung (Fullbright Fellowship) an der Ochsner Medical Foundation in New Orleans, LA, USA, wo er sich auf den Gebieten Herz-Kreislauf und Nephrologie spezialisierte. 1989 nahm er seine Tätigkeit in der klinischen Entwicklung für kardio-vaskuläre Wirkstoffe bei F. Hoffmann-La Roche Ltd auf. Während seiner zehnjährigen Tätigkeit bei Roche war er für die weltweite klinische Entwicklung (Phase 1 bis zur Zulassung) bedeutender Wirksubstanzen des Herz-Kreislaufportfolios zuständig. 1997 wurde er Leiter der Entwicklungsgruppe Herz-Kreislauf. Im September 1999 übernahm Isaac Kobrin als Senior Vice President die Leitung der Klinischen Entwicklung bei Actelion.
Ein tiefschürfender FAZ-Artikel zur Entwicklung der Schlafmittel und zu deren Problemen:
http://www.faz.net/s/Rub268AB64801534CF288DF93BB89F2D797/Doc…
Auszug:
Viele der gängigen Mittel stören gerade die erholsamen Tiefschlafphasen. Wesentlich weniger in den natürlichen Schlafrhythmus eingreifen sollte der Wirkstoff Gaboxadol, an dem Forscher von Lundbeck, Merck und dem Münchner Max-Planck-Institut für Psychiatrie jahrelang forschten. Vor zwei Jahren mussten sie kurz vor der Zulassung aufgeben: Probeschläfer der abschließenden Studie hatten nicht nur von mangelnder Wirkung, sondern auch von Halluzinationen und Desorientierung berichtet.
Nach diesem Totalausfall knüpfen sich jetzt die meisten Erwartungen an den Wirkstoff Almorexant des Schweizer Herstellers Actelion. Dieses Mittel fördert nicht die dämpfende Wirkung von GABA, sondern dämpft den Wachheit und Appetit fördernden Effekt des Neurohormons Orexin. Ergebnisse einer Phase-III-Studie werden Ende des Jahres erwartet.
http://www.faz.net/s/Rub268AB64801534CF288DF93BB89F2D797/Doc…
Auszug:
Viele der gängigen Mittel stören gerade die erholsamen Tiefschlafphasen. Wesentlich weniger in den natürlichen Schlafrhythmus eingreifen sollte der Wirkstoff Gaboxadol, an dem Forscher von Lundbeck, Merck und dem Münchner Max-Planck-Institut für Psychiatrie jahrelang forschten. Vor zwei Jahren mussten sie kurz vor der Zulassung aufgeben: Probeschläfer der abschließenden Studie hatten nicht nur von mangelnder Wirkung, sondern auch von Halluzinationen und Desorientierung berichtet.
Nach diesem Totalausfall knüpfen sich jetzt die meisten Erwartungen an den Wirkstoff Almorexant des Schweizer Herstellers Actelion. Dieses Mittel fördert nicht die dämpfende Wirkung von GABA, sondern dämpft den Wachheit und Appetit fördernden Effekt des Neurohormons Orexin. Ergebnisse einer Phase-III-Studie werden Ende des Jahres erwartet.
Ein mal mehr wird die gesamte Pipeline von Actelion für einen Haufen Mist erklärt:
02.07.2009 15:33
UBS senkt Actelion von 'Neutral' auf 'Sell' - Ziel 53 Franken
Die UBS hat Actelion von "Neutral" auf "Sell" heruntergestuft, aber das Kursziel auf 53,00 Schweizer Franken belassen. Der Absatz des Mittels gegen Lungenbluthochdruck Tracleer werde zwar bis zum Ablauf des Patentschutzes stetig zunehmen, schrieb Analyst Martin Wales in einer Studie am Donnerstag. Allerdings impliziere der aktuelle Aktienkurs positive Nachrichten aus der Entwicklungspipeline. Sollte diese misslingen, könnte die Biotechfirma zur Verbesserung der Produkt-Pipeline Konkurrenten übernehmen oder selbst zu einem Übernahmekandidaten werden.
AFA0079 2009-07-02/15:31
02.07.2009 15:33
UBS senkt Actelion von 'Neutral' auf 'Sell' - Ziel 53 Franken
Die UBS hat Actelion von "Neutral" auf "Sell" heruntergestuft, aber das Kursziel auf 53,00 Schweizer Franken belassen. Der Absatz des Mittels gegen Lungenbluthochdruck Tracleer werde zwar bis zum Ablauf des Patentschutzes stetig zunehmen, schrieb Analyst Martin Wales in einer Studie am Donnerstag. Allerdings impliziere der aktuelle Aktienkurs positive Nachrichten aus der Entwicklungspipeline. Sollte diese misslingen, könnte die Biotechfirma zur Verbesserung der Produkt-Pipeline Konkurrenten übernehmen oder selbst zu einem Übernahmekandidaten werden.
AFA0079 2009-07-02/15:31
Antwort auf Beitrag Nr.: 37.512.109 von SLGramann am 03.07.09 08:34:50Diese Säcke!! 


UBS = You Be ASS!



UBS = You Be ASS!

Antwort auf Beitrag Nr.: 37.512.120 von Fruehrentner am 03.07.09 08:36:57Ich würd das nicht so ernst nehmen was die UBS meint...
Die Pfeifen sollen erst mal vor Ihrer eigenen Haustür kehren.
Ich denke im Gegensatz zur UBS macht Actelion seine Arbeit gut
Die Pfeifen sollen erst mal vor Ihrer eigenen Haustür kehren.
Ich denke im Gegensatz zur UBS macht Actelion seine Arbeit gut
Tracleer (Bosentan) erhält Zulassung der EU für pädiatrische
Formulierung. - Erste und bisher einzige zugelassene Therapie zur
Behandlung von pulmonaler arterieller Hypertonie bei Kindern
ALLSCHWIL, SCHWEIZ - 6. Juli 2009 - Actelion Ltd (SIX: ATLN) teilte
heute mit, dass die dispergierbare pädiatrische Formulierung von
Tracleer® (Bosentan) zur Behandlung von pulmonaler arterieller
Hypertonie (PAH) bei Kindern in der Europäischen Union zugelassen
wurde.
Mit dieser Zulassung ist Tracleer® die erste PAH-Therapie, für die
eine pädiatrische Formulierung für die Behandlung von Kindern ab dem
zweiten Lebensjahr zur Verfügung steht. PAH bei Kindern ist eine
schwerwiegende Erkrankung. Bleibt sie nach der Diagnosestellung
unbehandelt, ist von einer geschätzten mittleren Überlebensdauer von
10 Monaten auszugehen [1].
Dr. Martine Clozel, Kinderärztin und Chief Scientific Officer von
Actelion, kommentierte: ´Unser Team ist sehr stolz auf diesen Erfolg.
Schon in der frühen Entwicklungsphase von Tracleer® haben wir
beschlossen, uns mit der Entwicklung einer Formulierung für die
tägliche Behandlung von Kindern, die unter PAH leiden, zu befassen,
selbst wenn diese Patientenpopulation sehr klein ist. Es war ein
langer, aber schlussendlich ausgesprochen lohnender Weg, auf den wir
uns noch vor der ersten Marktzulassung von Tracleer® begeben
hatten.´
Dr. Isaac Kobrin, Leiter klinische Entwicklung bei Actelion,
ergänzte: ´Die Zulassung von Tracleer® in einer exakt dosierten,
kinderfreundlichen Applikationsform ist ein bedeutender Fortschritt
für die PAH-Therapie von Kindern. Nachdem nun die Zulassung für diese
Formulierung in der EU vorliegt, werden wir entsprechende
Registrierungsanträge in anderen Ländern einreichen, damit Kinder
weltweit von dieser pädiatrischen Formulierung für Tracleer®
profitieren können.´
Professor Maurice Beghetti, Leiter Pädiatrische Kardiologie am
Hôpital des Enfants in Genf, erklärte: ´Aufgrund der exakten
Dosierung und des kindgerechten Geschmacks ist die neue
Applikationsform vollkommen auf die Bedürfnisse von Kindern
zugeschnitten. Damit hat Actelion eine grossartige Pionierleistung
vollbracht. Die korrekte Arzneimitteldosierung für pädiatrische
Patienten ist eine grundsätzliche Herausforderung, vor allem aber für
Kinder, die an seltenen Krankheiten leiden. Die neue pädiatrische
Formulierung von Tracleer® ist ein grosser Schritt in die richtige
Richtung bei der Entwicklung von Therapien, die den spezifischen
Bedürfnissen von Kindern gerecht werden.´
Tracleer® ist ein oraler, dualer Endothelin-Rezeptor-Antagonist, der
bereits in Europa für die Behandlung von PAH zur Verbesserung der
körperlichen Leistungsfähigkeit und zur Verminderung der Symptome in
der WHO-Funktionsklasse III sowie in WHO-Funktionsklasse II, für die
ebenfalls einige Verbesserungen nachgewiesen wurden [2], zugelassen
ist. In der EU ist Tracleer® ausserdem für die Reduktion der Anzahl
neuer digitaler Ulzerationen bei Patienten mit systemischer Sklerose
und Sklerodermie-Patienten, die an digitalen Ulzerationen leiden,
indiziert.
Die neue, vierfach teilbare, dispergierbare Tablette von Bosentan zu
32mg wurde speziell für Kinder entwickelt und ermöglicht eine
bequeme, genaue und flexiblere Dosierung in Relation zu einem
niedrigen Körpergewicht.
Die Sicherheit und Verträglichkeit von Tracleer® bei Kindern
entspricht dem Profil, das in vorangegangenen Plazebo-kontrollierten
Studien mit erwachsenen Patienten beobachtet wurde.
Das pädiatrische Forschungsprogramm umfasst folgende massgebliche
Studien:
* BREATHE-3 (Bosentan Randomized trial of Endothelin
Antagonist THErapy for pulmonary hypertension): eine offen
etikettierte Studie, in der die Sicherheit und Wirksamkeit von
Tracleer® bei Kindern mit PAH mit oder ohne
Prostanoid-Begleittherapie nachgewiesen werden konnte. Die Studie
lieferte darüber hinaus wichtige Informationen über die für die
pädiatrische Formulierung erforderliche Dosierung.
* FUTURE-1 (Pediatric FormUlation of bosenTan in pUlmonary
arterial hypeRtEnsion): offen etikettierte Studie zur Ermittlung
der Sicherheit und Pharmakokinetik einer neuen, dispergierbaren
Tabletten-Formulierung von Tracleer®. Diese Studie lieferte
wichtige Informationen zu Pharmakokinetik und Dosierung der neuen
pädiatrischen Formulierung von Tracleer®. Das in FUTURE-1
beobachtete Risikoprofil von Bosentan war mit dem in BREATHE-3 bei
Kindern beobachteten Profil vergleichbar.
* FUTURE-2: offen etikettierte Anschlussstudie zur
Untersuchung der langfristigen Sicherheits- und Wirksamkeitsdaten,
die noch nicht abgeschlossen ist.
###
Formulierung. - Erste und bisher einzige zugelassene Therapie zur
Behandlung von pulmonaler arterieller Hypertonie bei Kindern
ALLSCHWIL, SCHWEIZ - 6. Juli 2009 - Actelion Ltd (SIX: ATLN) teilte
heute mit, dass die dispergierbare pädiatrische Formulierung von
Tracleer® (Bosentan) zur Behandlung von pulmonaler arterieller
Hypertonie (PAH) bei Kindern in der Europäischen Union zugelassen
wurde.
Mit dieser Zulassung ist Tracleer® die erste PAH-Therapie, für die
eine pädiatrische Formulierung für die Behandlung von Kindern ab dem
zweiten Lebensjahr zur Verfügung steht. PAH bei Kindern ist eine
schwerwiegende Erkrankung. Bleibt sie nach der Diagnosestellung
unbehandelt, ist von einer geschätzten mittleren Überlebensdauer von
10 Monaten auszugehen [1].
Dr. Martine Clozel, Kinderärztin und Chief Scientific Officer von
Actelion, kommentierte: ´Unser Team ist sehr stolz auf diesen Erfolg.
Schon in der frühen Entwicklungsphase von Tracleer® haben wir
beschlossen, uns mit der Entwicklung einer Formulierung für die
tägliche Behandlung von Kindern, die unter PAH leiden, zu befassen,
selbst wenn diese Patientenpopulation sehr klein ist. Es war ein
langer, aber schlussendlich ausgesprochen lohnender Weg, auf den wir
uns noch vor der ersten Marktzulassung von Tracleer® begeben
hatten.´
Dr. Isaac Kobrin, Leiter klinische Entwicklung bei Actelion,
ergänzte: ´Die Zulassung von Tracleer® in einer exakt dosierten,
kinderfreundlichen Applikationsform ist ein bedeutender Fortschritt
für die PAH-Therapie von Kindern. Nachdem nun die Zulassung für diese
Formulierung in der EU vorliegt, werden wir entsprechende
Registrierungsanträge in anderen Ländern einreichen, damit Kinder
weltweit von dieser pädiatrischen Formulierung für Tracleer®
profitieren können.´
Professor Maurice Beghetti, Leiter Pädiatrische Kardiologie am
Hôpital des Enfants in Genf, erklärte: ´Aufgrund der exakten
Dosierung und des kindgerechten Geschmacks ist die neue
Applikationsform vollkommen auf die Bedürfnisse von Kindern
zugeschnitten. Damit hat Actelion eine grossartige Pionierleistung
vollbracht. Die korrekte Arzneimitteldosierung für pädiatrische
Patienten ist eine grundsätzliche Herausforderung, vor allem aber für
Kinder, die an seltenen Krankheiten leiden. Die neue pädiatrische
Formulierung von Tracleer® ist ein grosser Schritt in die richtige
Richtung bei der Entwicklung von Therapien, die den spezifischen
Bedürfnissen von Kindern gerecht werden.´
Tracleer® ist ein oraler, dualer Endothelin-Rezeptor-Antagonist, der
bereits in Europa für die Behandlung von PAH zur Verbesserung der
körperlichen Leistungsfähigkeit und zur Verminderung der Symptome in
der WHO-Funktionsklasse III sowie in WHO-Funktionsklasse II, für die
ebenfalls einige Verbesserungen nachgewiesen wurden [2], zugelassen
ist. In der EU ist Tracleer® ausserdem für die Reduktion der Anzahl
neuer digitaler Ulzerationen bei Patienten mit systemischer Sklerose
und Sklerodermie-Patienten, die an digitalen Ulzerationen leiden,
indiziert.
Die neue, vierfach teilbare, dispergierbare Tablette von Bosentan zu
32mg wurde speziell für Kinder entwickelt und ermöglicht eine
bequeme, genaue und flexiblere Dosierung in Relation zu einem
niedrigen Körpergewicht.
Die Sicherheit und Verträglichkeit von Tracleer® bei Kindern
entspricht dem Profil, das in vorangegangenen Plazebo-kontrollierten
Studien mit erwachsenen Patienten beobachtet wurde.
Das pädiatrische Forschungsprogramm umfasst folgende massgebliche
Studien:
* BREATHE-3 (Bosentan Randomized trial of Endothelin
Antagonist THErapy for pulmonary hypertension): eine offen
etikettierte Studie, in der die Sicherheit und Wirksamkeit von
Tracleer® bei Kindern mit PAH mit oder ohne
Prostanoid-Begleittherapie nachgewiesen werden konnte. Die Studie
lieferte darüber hinaus wichtige Informationen über die für die
pädiatrische Formulierung erforderliche Dosierung.
* FUTURE-1 (Pediatric FormUlation of bosenTan in pUlmonary
arterial hypeRtEnsion): offen etikettierte Studie zur Ermittlung
der Sicherheit und Pharmakokinetik einer neuen, dispergierbaren
Tabletten-Formulierung von Tracleer®. Diese Studie lieferte
wichtige Informationen zu Pharmakokinetik und Dosierung der neuen
pädiatrischen Formulierung von Tracleer®. Das in FUTURE-1
beobachtete Risikoprofil von Bosentan war mit dem in BREATHE-3 bei
Kindern beobachteten Profil vergleichbar.
* FUTURE-2: offen etikettierte Anschlussstudie zur
Untersuchung der langfristigen Sicherheits- und Wirksamkeitsdaten,
die noch nicht abgeschlossen ist.
###
13.07.2009 11:52
UBS belässt Actelion auf 'Sell' - Ziel 53 Franken
Die UBS hat Actelion vor Quartalszahlen auf "Sell" mit einem Kursziel von 53,00 Franken belassen. Bei einem erwarteten Umsatz von 423,50 Millionen Franken dürfte der Pharmakonzern im zweiten Quartal einen Gewinn je Aktie in Höhe von 0,81 Franken erzielt haben, schrieb Analyst Martin Wales in einer Studie vom Montag. Falls sich die bisher gute Entwicklung fortsetze, seien steigende Unternehmensprognosen vorstellbar. Allerdings überwögen derzeit die Risken durch drei klinische Phase-III-Studie, die für die zweite Jahreshälfte erwartet würden.
-------------
Es ist ganze 11 (!) Tage her, dass Herr Wales uns erklärt hat, dass Actelion verkauft werden muss, weil die P III-Untersuchungen scheitern könnten.
Er kann ja dieser Meinung sein, aber wird das jetzt bis in alle Zukunft im 11 Tage-Rhyhtmus in Form einer UBS-Studie unters Volk gebracht werden?
Im übrigen stellt sich die Frage, ob man es bei der UBS lieber sähe, wenn Actelion keine Wirkstoffe in der P III hätte. Dann bestünde schließlich auch nicht das Risiko, dass da was scheitern kann.
PS: Ich gehe auch nicht davon aus, dass alle Entwicklungen ein Erfolg werden. Mein Bauchgefühl sagt mir:
- Clazosentan wird ein Erfolg
- Traceleer bei IPF wird ein Misserfolg
- Almorexant geht in die nächste Runde der P III
- Ich rechne fürs 2. HJ auch noch für die Zulassung von Traceleer bei PAH Klasse II-Patienten durch die FDA. Das würde die Wachstumsaussichten für Traceleer weiter verbessern.
Unterm Strich wäre dieses beschriebene Szenario durchaus ein guter Erfolg, obwohl IPF schon weh tun würde. Indes ist das alles natürlich weniger als Kaffeesatzleserei. Wir müssen schon die Daten abwarten. Spannend wirds schon werden.
Wir müssen schon die Daten abwarten. Spannend wirds schon werden.
UBS belässt Actelion auf 'Sell' - Ziel 53 Franken
Die UBS hat Actelion vor Quartalszahlen auf "Sell" mit einem Kursziel von 53,00 Franken belassen. Bei einem erwarteten Umsatz von 423,50 Millionen Franken dürfte der Pharmakonzern im zweiten Quartal einen Gewinn je Aktie in Höhe von 0,81 Franken erzielt haben, schrieb Analyst Martin Wales in einer Studie vom Montag. Falls sich die bisher gute Entwicklung fortsetze, seien steigende Unternehmensprognosen vorstellbar. Allerdings überwögen derzeit die Risken durch drei klinische Phase-III-Studie, die für die zweite Jahreshälfte erwartet würden.
-------------
Es ist ganze 11 (!) Tage her, dass Herr Wales uns erklärt hat, dass Actelion verkauft werden muss, weil die P III-Untersuchungen scheitern könnten.
Er kann ja dieser Meinung sein, aber wird das jetzt bis in alle Zukunft im 11 Tage-Rhyhtmus in Form einer UBS-Studie unters Volk gebracht werden?
Im übrigen stellt sich die Frage, ob man es bei der UBS lieber sähe, wenn Actelion keine Wirkstoffe in der P III hätte. Dann bestünde schließlich auch nicht das Risiko, dass da was scheitern kann.

PS: Ich gehe auch nicht davon aus, dass alle Entwicklungen ein Erfolg werden. Mein Bauchgefühl sagt mir:
- Clazosentan wird ein Erfolg
- Traceleer bei IPF wird ein Misserfolg
- Almorexant geht in die nächste Runde der P III
- Ich rechne fürs 2. HJ auch noch für die Zulassung von Traceleer bei PAH Klasse II-Patienten durch die FDA. Das würde die Wachstumsaussichten für Traceleer weiter verbessern.
Unterm Strich wäre dieses beschriebene Szenario durchaus ein guter Erfolg, obwohl IPF schon weh tun würde. Indes ist das alles natürlich weniger als Kaffeesatzleserei.
 Wir müssen schon die Daten abwarten. Spannend wirds schon werden.
Wir müssen schon die Daten abwarten. Spannend wirds schon werden.
Antwort auf Beitrag Nr.: 37.565.589 von SLGramann am 14.07.09 07:28:28
UBS = You be Ass!
Diese Vollpfosten!!



UBS = You be Ass!
Diese Vollpfosten!!



Antwort auf Beitrag Nr.: 37.565.589 von SLGramann am 14.07.09 07:28:28hier die email von diesem Vollpfosten:
Martin.wales@ubs.com
Martin.wales@ubs.com
Actelion's PGI2 receptor agonist demonstrates efficacy in pulmonary arterial hypertension patients - Morbidity-Mortality Phase III study to be initiated before year-end
ALLSCHWIL, SWITZERLAND - 17 July 2009 - Actelion Ltd (SIX: ATLN) announced today that positive data have been obtained in a Phase IIa study with its first-in-class orally active non-prostanoid PGI2 receptor agonist in pulmonary arterial hypertension (PAH) patients.
In the 43 patient placebo-controlled double-blind study to assess efficacy, safety and tolerability the primary endpoint of change from baseline in pulmonary vascular resistance (PVR) was met with high statistical significance (P<0.01). The compound was well tolerated in the study.
Jean-Paul Clozel, M.D. and Chief Executive Officer of Actelion commented: "Together with our partner Nippon Shinyaku, we are very excited by the remarkable results we have seen in this study. I am especially pleased as efficacy was achieved on top of background therapy with either an endothelin receptor antagonist and/or a PDE-5 inhibitor. This efficacy with good tolerability makes us determined to accelerate our development program."
The positive study results support advancing this first orally active non-prostanoid PGI2 receptor agonist into Phase III. This approach was previously discussed and agreed with the FDA while the study was ongoing. Actelion will now rapidly approach the FDA to finalize the design for a Phase III program with a morbidity/mortality endpoint. Consequently, Actelion expects to initiate this program before year-end.
Jean-Paul Clozel concluded: "For the last 30 years, the medical community has been working towards a well-tolerated and effective oral therapy stimulating the prostacyclin pathway. I am very hopeful that in the not so distant future, our PGI2 receptor agonist will make a significant contribution to therapy for this devastating disease."
###
-------------
Oh Gott, eine neue P III ist angekündigt. Bei UBS werden heute die Alarmsirenen schrillen. Höchste Zeit für eine Rücknahme des Kursziels! Denn: Die Studie könnte scheitern.
ALLSCHWIL, SWITZERLAND - 17 July 2009 - Actelion Ltd (SIX: ATLN) announced today that positive data have been obtained in a Phase IIa study with its first-in-class orally active non-prostanoid PGI2 receptor agonist in pulmonary arterial hypertension (PAH) patients.
In the 43 patient placebo-controlled double-blind study to assess efficacy, safety and tolerability the primary endpoint of change from baseline in pulmonary vascular resistance (PVR) was met with high statistical significance (P<0.01). The compound was well tolerated in the study.
Jean-Paul Clozel, M.D. and Chief Executive Officer of Actelion commented: "Together with our partner Nippon Shinyaku, we are very excited by the remarkable results we have seen in this study. I am especially pleased as efficacy was achieved on top of background therapy with either an endothelin receptor antagonist and/or a PDE-5 inhibitor. This efficacy with good tolerability makes us determined to accelerate our development program."
The positive study results support advancing this first orally active non-prostanoid PGI2 receptor agonist into Phase III. This approach was previously discussed and agreed with the FDA while the study was ongoing. Actelion will now rapidly approach the FDA to finalize the design for a Phase III program with a morbidity/mortality endpoint. Consequently, Actelion expects to initiate this program before year-end.
Jean-Paul Clozel concluded: "For the last 30 years, the medical community has been working towards a well-tolerated and effective oral therapy stimulating the prostacyclin pathway. I am very hopeful that in the not so distant future, our PGI2 receptor agonist will make a significant contribution to therapy for this devastating disease."
###
-------------
Oh Gott, eine neue P III ist angekündigt. Bei UBS werden heute die Alarmsirenen schrillen. Höchste Zeit für eine Rücknahme des Kursziels! Denn: Die Studie könnte scheitern.
Antwort auf Beitrag Nr.: 37.590.138 von SLGramann am 17.07.09 08:05:25Das war jetzt ironisch gemeint, oder? 


You be Ass soll bloß die Klappe halten!



You be Ass soll bloß die Klappe halten!

Antwort auf Beitrag Nr.: 37.590.138 von SLGramann am 17.07.09 08:05:25hier nochmal in deutsch:
17.07.2009 07:00:00
Actelion's PGI2-Rezeptor-Agonist zeigt Wirkung in Patienten mit pulmonaler arterieller Hypertonie - Phase-III-Studie zu Morbidität/Mortalität wird vor Jahresende aufgenommen
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin. Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
-------------------------------------------------------------------
ALLSCHWIL, SCHWEIZ - 17. Juli 2009
Actelion Ltd (SIX: ATLN) informierte heute über positive Ergebnisse im Rahmen einer Phase IIa-Studie, die mit seinem oral aktiven nicht-prostanoiden PGI2-Rezeptor-Agonisten einer neuen Klasse durchgeführt wurde. In der plazebokontrollierten Doppelblindstudie zur Bestimmung von Wirksamkeit, Sicherheit und Verträglichkeit, an der 43 Patienten teilnahmen, wurde der erste Endpunkt - eine Veränderung des pulmonalen Gefässwiderstands (PVR) im Verhältnis zum Ausgangswert - mit hoher statistischer Signifikanz erreicht (p<0,01). Die Substanz wurde gut vertragen.
Dr. Jean-Paul Clozel, Chief Executive Officer von Actelion, kommentierte: "Gemeinsam mit unserem Partner Nippon Shinyaku sind wir hocherfreut über die bemerkenswerten Ergebnissen dieser Studie. Ganz besonders erfreut bin ich, dass die Wirksamkeit zusätzlich zum Nutzen der Hintergrundtherapie nachgewiesen werden konnte, die entweder mit einem Endothelin-Rezeptor-Antagonisten und/oder einem PDE-5-Inhibitor durchgeführt worden war. Angesichts dieser Wirksamkeit und der damit verbundenen guten Verträglichkeit sind wir entschlossen, unser Entwicklungsprogramm zu beschleunigen."
Diese positiven Studienergebnisse unterstützen die Aufnahme eines Phase-III-Programms für diesen ersten oral aktiven nicht-prostanoiden PGI2-Rezeptor-Agonisten. Dieser Schritt war bereits vor Abschluss der Studie in Gesprächen mit der FDA vereinbart worden. Actelion wird sich nun rasch mit der FDA in Verbindung setzen und das Design für ein Phase-III-Programm mit einem Endpunkt hinsichtlich Morbidität und Mortalität fertigstellen. Actelion wird dieses Programm voraussichtlich vor Jahresende aufnehmen können.
Jean-Paul Clozel schloss: "Seit über 30 Jahren arbeitet die ärztliche Gemeinschaft an einer gut verträglichen und wirksamen oralen Therapie, die den Prostazyklin-Signalweg stimuliert. Ich bin zuversichtlich, dass unser PGI2-Rezeptor-Agonist in nicht allzu ferner Zukunft ein erheblicher Therapiebestandteil in der Behandlung der pulmonalen arteriellen Hypertonie sein wird." ###
Anmerkungen für Herausgeber:
Über die Phase-IIa-Studie Im Rahmen dieser multizentrischen, randomisierten, plazebokontrollierten Doppelblindstudie wurden Wirksamkeit und Sicherheit von ACT-293987 bei PAH-Patienten untersucht. Der erste Endpunkt bezog sich auf den pulmonalen Gefässwiderstand. Die Studie, in der 43 Patienten im Verhältnis 3:1 nach dem Zufallsprinzip behandelt worden waren, wurde im Juli 2009 abgeschlossen.
Über pulmonale arterielle Hypertonie (PAH):
Pulmonale arterielle Hypertonie (PAH) ist eine chronische, lebensbedrohliche Erkrankung, die durch abnorm hohen Blutdruck in den Arterien zwischen Herz und Lunge der betroffenen Patienten gekennzeichnet ist. Die Funktionen von Herz und Lunge sind stark beeinträchtigt, was sich in einer eingeschränkten körperlichen Leistungsfähigkeit und letztendlich einer verkürzten Lebensdauer niederschlägt. Etwa 100.000 Menschen in Europa und den USA leiden an primärem Lungenhochdruck oder sekundären Formen der Erkrankung. Letztere sind Folge von anderen Krankheiten oder Gewebeveränderungen der Lunge wie Sklerodermie, Lupus, HIV/AIDS oder angeborenen Herzkrankheiten. PAH geht mit strukturellen Veränderungen im Gefässsystem der Lunge und der rechten Herzkammer einher.
Jüngste Fortschritte im Verständnis der für Gefässerkrankungen der Lunge verantwortlichen pathogenen Faktoren führten zur Entwicklung neuer Therapien, die auf spezifische Signalwege (Pathways) ausgerichtet sind (den Prostazyklin-Pathway, den Endothelin-Pathway und den Stickoxid-Pathway). Die verfügbaren Therapien haben einen positiven Einfluss auf PAH, stellen aber keine Heilung dar, und bei vielen Patienten schreitet die Erkrankung weiter voran.
PAH bleibt daher eine schwere, lebensbedrohliche Krankheit [2,3]. Eine frühzeitige Diagnose und ein Verständnis für Therapiewahl und Behandlungsbeginn bleiben kritische Elemente bei der optimalen Versorgung von PAH-Patienten. Prostazyklin Endothelzellen produzieren verschiedene gefässaktive chemische Substanzen, darunter Prostazyklin (PGI2). Diese Substanzen erweitern die Blutgefässe und verhindern eine Proliferation glatter Muskelzellen sowie die Plättchenaggregation. Das Peptid Endothelin wird ebenfalls vom Endothelium produziert; es wirkt stark gefässverengend und fördert die Zellproliferation. Im gesunden Organismus hilft Prostazyklin die Aktivität von Endothelin auszugleichen. Bei manchen Erkrankungen ist die Prostazyklinproduktion im Endothel allerdings beeinträchtigt. Dadurch werden schädliche Mengen an Endothelin ausgeschüttet. Prostazyklin-Rezeptor Prostazyklin bindet an den Prostazyklin-Rezeptor, der sich auf der Oberfläche der Blutplättchen und der glatten Muskelzellen befindet. Der Rezeptor ist ein G-Protein-gekoppelter Rezeptor, der unter Einwirkung von Prostazyklin die Bildung von zyklischem Adenosin-Monophosphat (cAMP) stimuliert. Bei verschiedenen kardiovaskulären Erkrankungen wie Thrombose, Herzinfarkt, Schlaganfall, Herzmuskelischämie, Atherosklerose und pulmonaler arterieller Hypertonie (PAH) kann es zu Fehlfunktionen im Prostazyklin-System kommen.
Die Wiederherstellung der Prostazyklin-Funktion durch die Aktivierung der IP-Rezeptoren mit Hilfe von Prostazyklin-Analogen verbessert die Prognose für PAH-Patienten. Prostazyklin wirkt der gefässverengenden und prothrombotischen Aktivität von Endothelin entgegen. Actelion entwickelt einen oral verfügbaren nicht-prostanoiden PGI2-Rezeptor-Agonisten mit langanhhaltender Wirksamkeit, der die Wirkung von endogenem Prostazyklin bei der Behandlung von PAH imitiert.
Literaturhinweise 1. Farber HW; Loscalzo J. Mechanisms of disease: pulmonary arterial hypertension. N. Eng. J. Med. 2004; 351:1655-65. 2. Humbert M; Sitbon O; Simonneau G. Treatment of pulmonary arterial hypertension. N. Eng. J. Med. 2004; 351:1425-36. 3. Humbert M; Morrell NW; Archer SL; et al. Cellular and molecular pathobiology of pulmonary arterial hypertension. J. Am. Coll. Cardiol. 2004; 43: Suppl. 12: 13S-24S.
Über die Allianz von Actelion mit Nippon Shinyaku:
Im April 2008 unterzeichneten Actelion und Nippon Shinyaku eine weltweite Lizenzvereinbarung zur exklusiven Zusammenarbeit in Bezug auf einen oral verfügbaren Prostaglandin-Rezeptor-Agonisten I2 (PGI2) mit langer Wirkungsdauer für Patienten, die unter pulmonaler arterieller Hypertonie (PAH) leiden. Dieser Wirkstoff war ursprünglich von Nippon Shinyaku entdeckt und synthetisiert worden. Die Auswertung der Phase I ist abgeschlossen; ein Phase-II-Programm wurde von Nippon Shinyaku Ende 2007 mit PAH-Patienten in Europa eingeleitet. Actelion wird für die globale Entwicklung und Kommerzialisierung des PGI2-Rezeptor-Agonisten ausserhalb Japans verantwortlich sein, während beide Unternehmen die Substanz in Japan gemeinsam weiterentwickeln und vermarkten werden.
Weitere Informationen über Nippon Shinyaku finden Sie unter: http://www.nippon-shinyaku.co.jp/english/index.html
Quelle: HUGIN
17.07.2009 07:00:00
Actelion's PGI2-Rezeptor-Agonist zeigt Wirkung in Patienten mit pulmonaler arterieller Hypertonie - Phase-III-Studie zu Morbidität/Mortalität wird vor Jahresende aufgenommen
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin. Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
-------------------------------------------------------------------
ALLSCHWIL, SCHWEIZ - 17. Juli 2009
Actelion Ltd (SIX: ATLN) informierte heute über positive Ergebnisse im Rahmen einer Phase IIa-Studie, die mit seinem oral aktiven nicht-prostanoiden PGI2-Rezeptor-Agonisten einer neuen Klasse durchgeführt wurde. In der plazebokontrollierten Doppelblindstudie zur Bestimmung von Wirksamkeit, Sicherheit und Verträglichkeit, an der 43 Patienten teilnahmen, wurde der erste Endpunkt - eine Veränderung des pulmonalen Gefässwiderstands (PVR) im Verhältnis zum Ausgangswert - mit hoher statistischer Signifikanz erreicht (p<0,01). Die Substanz wurde gut vertragen.
Dr. Jean-Paul Clozel, Chief Executive Officer von Actelion, kommentierte: "Gemeinsam mit unserem Partner Nippon Shinyaku sind wir hocherfreut über die bemerkenswerten Ergebnissen dieser Studie. Ganz besonders erfreut bin ich, dass die Wirksamkeit zusätzlich zum Nutzen der Hintergrundtherapie nachgewiesen werden konnte, die entweder mit einem Endothelin-Rezeptor-Antagonisten und/oder einem PDE-5-Inhibitor durchgeführt worden war. Angesichts dieser Wirksamkeit und der damit verbundenen guten Verträglichkeit sind wir entschlossen, unser Entwicklungsprogramm zu beschleunigen."
Diese positiven Studienergebnisse unterstützen die Aufnahme eines Phase-III-Programms für diesen ersten oral aktiven nicht-prostanoiden PGI2-Rezeptor-Agonisten. Dieser Schritt war bereits vor Abschluss der Studie in Gesprächen mit der FDA vereinbart worden. Actelion wird sich nun rasch mit der FDA in Verbindung setzen und das Design für ein Phase-III-Programm mit einem Endpunkt hinsichtlich Morbidität und Mortalität fertigstellen. Actelion wird dieses Programm voraussichtlich vor Jahresende aufnehmen können.
Jean-Paul Clozel schloss: "Seit über 30 Jahren arbeitet die ärztliche Gemeinschaft an einer gut verträglichen und wirksamen oralen Therapie, die den Prostazyklin-Signalweg stimuliert. Ich bin zuversichtlich, dass unser PGI2-Rezeptor-Agonist in nicht allzu ferner Zukunft ein erheblicher Therapiebestandteil in der Behandlung der pulmonalen arteriellen Hypertonie sein wird." ###
Anmerkungen für Herausgeber:
Über die Phase-IIa-Studie Im Rahmen dieser multizentrischen, randomisierten, plazebokontrollierten Doppelblindstudie wurden Wirksamkeit und Sicherheit von ACT-293987 bei PAH-Patienten untersucht. Der erste Endpunkt bezog sich auf den pulmonalen Gefässwiderstand. Die Studie, in der 43 Patienten im Verhältnis 3:1 nach dem Zufallsprinzip behandelt worden waren, wurde im Juli 2009 abgeschlossen.
Über pulmonale arterielle Hypertonie (PAH):
Pulmonale arterielle Hypertonie (PAH) ist eine chronische, lebensbedrohliche Erkrankung, die durch abnorm hohen Blutdruck in den Arterien zwischen Herz und Lunge der betroffenen Patienten gekennzeichnet ist. Die Funktionen von Herz und Lunge sind stark beeinträchtigt, was sich in einer eingeschränkten körperlichen Leistungsfähigkeit und letztendlich einer verkürzten Lebensdauer niederschlägt. Etwa 100.000 Menschen in Europa und den USA leiden an primärem Lungenhochdruck oder sekundären Formen der Erkrankung. Letztere sind Folge von anderen Krankheiten oder Gewebeveränderungen der Lunge wie Sklerodermie, Lupus, HIV/AIDS oder angeborenen Herzkrankheiten. PAH geht mit strukturellen Veränderungen im Gefässsystem der Lunge und der rechten Herzkammer einher.
Jüngste Fortschritte im Verständnis der für Gefässerkrankungen der Lunge verantwortlichen pathogenen Faktoren führten zur Entwicklung neuer Therapien, die auf spezifische Signalwege (Pathways) ausgerichtet sind (den Prostazyklin-Pathway, den Endothelin-Pathway und den Stickoxid-Pathway). Die verfügbaren Therapien haben einen positiven Einfluss auf PAH, stellen aber keine Heilung dar, und bei vielen Patienten schreitet die Erkrankung weiter voran.
PAH bleibt daher eine schwere, lebensbedrohliche Krankheit [2,3]. Eine frühzeitige Diagnose und ein Verständnis für Therapiewahl und Behandlungsbeginn bleiben kritische Elemente bei der optimalen Versorgung von PAH-Patienten. Prostazyklin Endothelzellen produzieren verschiedene gefässaktive chemische Substanzen, darunter Prostazyklin (PGI2). Diese Substanzen erweitern die Blutgefässe und verhindern eine Proliferation glatter Muskelzellen sowie die Plättchenaggregation. Das Peptid Endothelin wird ebenfalls vom Endothelium produziert; es wirkt stark gefässverengend und fördert die Zellproliferation. Im gesunden Organismus hilft Prostazyklin die Aktivität von Endothelin auszugleichen. Bei manchen Erkrankungen ist die Prostazyklinproduktion im Endothel allerdings beeinträchtigt. Dadurch werden schädliche Mengen an Endothelin ausgeschüttet. Prostazyklin-Rezeptor Prostazyklin bindet an den Prostazyklin-Rezeptor, der sich auf der Oberfläche der Blutplättchen und der glatten Muskelzellen befindet. Der Rezeptor ist ein G-Protein-gekoppelter Rezeptor, der unter Einwirkung von Prostazyklin die Bildung von zyklischem Adenosin-Monophosphat (cAMP) stimuliert. Bei verschiedenen kardiovaskulären Erkrankungen wie Thrombose, Herzinfarkt, Schlaganfall, Herzmuskelischämie, Atherosklerose und pulmonaler arterieller Hypertonie (PAH) kann es zu Fehlfunktionen im Prostazyklin-System kommen.
Die Wiederherstellung der Prostazyklin-Funktion durch die Aktivierung der IP-Rezeptoren mit Hilfe von Prostazyklin-Analogen verbessert die Prognose für PAH-Patienten. Prostazyklin wirkt der gefässverengenden und prothrombotischen Aktivität von Endothelin entgegen. Actelion entwickelt einen oral verfügbaren nicht-prostanoiden PGI2-Rezeptor-Agonisten mit langanhhaltender Wirksamkeit, der die Wirkung von endogenem Prostazyklin bei der Behandlung von PAH imitiert.
Literaturhinweise 1. Farber HW; Loscalzo J. Mechanisms of disease: pulmonary arterial hypertension. N. Eng. J. Med. 2004; 351:1655-65. 2. Humbert M; Sitbon O; Simonneau G. Treatment of pulmonary arterial hypertension. N. Eng. J. Med. 2004; 351:1425-36. 3. Humbert M; Morrell NW; Archer SL; et al. Cellular and molecular pathobiology of pulmonary arterial hypertension. J. Am. Coll. Cardiol. 2004; 43: Suppl. 12: 13S-24S.
Über die Allianz von Actelion mit Nippon Shinyaku:
Im April 2008 unterzeichneten Actelion und Nippon Shinyaku eine weltweite Lizenzvereinbarung zur exklusiven Zusammenarbeit in Bezug auf einen oral verfügbaren Prostaglandin-Rezeptor-Agonisten I2 (PGI2) mit langer Wirkungsdauer für Patienten, die unter pulmonaler arterieller Hypertonie (PAH) leiden. Dieser Wirkstoff war ursprünglich von Nippon Shinyaku entdeckt und synthetisiert worden. Die Auswertung der Phase I ist abgeschlossen; ein Phase-II-Programm wurde von Nippon Shinyaku Ende 2007 mit PAH-Patienten in Europa eingeleitet. Actelion wird für die globale Entwicklung und Kommerzialisierung des PGI2-Rezeptor-Agonisten ausserhalb Japans verantwortlich sein, während beide Unternehmen die Substanz in Japan gemeinsam weiterentwickeln und vermarkten werden.
Weitere Informationen über Nippon Shinyaku finden Sie unter: http://www.nippon-shinyaku.co.jp/english/index.html
Quelle: HUGIN
Antwort auf Beitrag Nr.: 37.593.597 von Fruehrentner am 17.07.09 14:37:46
Bei verschiedenen kardiovaskulären Erkrankungen wie Thrombose, Herzinfarkt, Schlaganfall, Herzmuskelischämie, Atherosklerose und pulmonaler arterieller Hypertonie (PAH) kann es zu Fehlfunktionen im Prostazyklin-System kommen. Die Wiederherstellung der Prostazyklin-Funktion durch die Aktivierung der IP-Rezeptoren mit Hilfe von Prostazyklin-Analogen verbessert die Prognose für PAH-Patienten.
Langfristig wird es interessant sein zu beobachten, ob die Beeinflussung von Endothelin und/oder Prostazyklin jenseits von PAH zu neuen Medikamenten führen wird. In Bezug auf Macitentan lässt Actelion ja verlauten, dass theoretisch "macitentan may provide therapeutic benefit in a wide range of cardiovascular indications".
Hier und generell wäre in den nächsten Jahren zu wünschen, dass eine Reihe neuer Projekte in die klinische Testung kommen. Denn man muss schon zugeben, dass die Pipeline-Pyramide von Actelion gegenwärtig in merkwürdiger Weise quasi auf dem Kopf steht. Sobald der PGI2 agonist in die P III wechselt, verstärkt sich dieser eindruck natürlich noch.
Bei verschiedenen kardiovaskulären Erkrankungen wie Thrombose, Herzinfarkt, Schlaganfall, Herzmuskelischämie, Atherosklerose und pulmonaler arterieller Hypertonie (PAH) kann es zu Fehlfunktionen im Prostazyklin-System kommen. Die Wiederherstellung der Prostazyklin-Funktion durch die Aktivierung der IP-Rezeptoren mit Hilfe von Prostazyklin-Analogen verbessert die Prognose für PAH-Patienten.
Langfristig wird es interessant sein zu beobachten, ob die Beeinflussung von Endothelin und/oder Prostazyklin jenseits von PAH zu neuen Medikamenten führen wird. In Bezug auf Macitentan lässt Actelion ja verlauten, dass theoretisch "macitentan may provide therapeutic benefit in a wide range of cardiovascular indications".
Hier und generell wäre in den nächsten Jahren zu wünschen, dass eine Reihe neuer Projekte in die klinische Testung kommen. Denn man muss schon zugeben, dass die Pipeline-Pyramide von Actelion gegenwärtig in merkwürdiger Weise quasi auf dem Kopf steht. Sobald der PGI2 agonist in die P III wechselt, verstärkt sich dieser eindruck natürlich noch.
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, stuft die Aktie von Actelion (ISIN CH0010532478 / WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" mit dem Rating "buy" ein.
Actelion habe heute Morgen angekündigt, dass alle Phase IIa-Studien für seinen ausgezeichneten oralen, nicht-prostanoiden PGI2-Rezeptoragonist für die Behandlung von pulmonaler arterieller Hypertonie sein Primärziel erreicht hätten. Actelion werde das Projekt vor Ende des Jahres in die Phase III vorantreiben.
In einer Studie mit 43 Patienten habe Actelions PGI2-Rezeptorantagonist zu einer beträchtlichen Verringerung des pulmonalen Gefässwiderstands (PVR) (p<0.01) geführt. PVR sei ein wichtiger Marker, um bei Patienten mit pulmonaler arterieller Hypertonie (PAH) das Fortschreiten der Erkrankung zu beobachten. Ein erhöhter Gefäßwiderstand führe zu einer Überlastung des Herzens, was wiederum Herzversagen zur Folge haben könne. Der PGI2-Antagonist zur Behandlung der PAH würde mit dem Prostacyclin-Weg konkurrieren, jedoch nicht direkt mit dem Endothelin-Weg (z. B. Tracleer).
Anzeige
Actelion habe angekündigt, noch vor Jahresende mit einer Phase-III-Studie zu Mortalität und Morbidität (M/M-Studie) für den PGI2-Wirkstoff zu beginnen. Es seien keine weiteren Informationen hinsichtlich der Anordnung der Phase-III-Studie oder weitere Daten zur Phase-IIa-Studie veröffentlicht worden. Nach Einschätzungen der Analysten könnte die Rekrutierung für die Phase-III-M/M-Studie bis zu eineinhalb Jahre dauern, die Ergebnisse könnten nach zwei Jahren vorliegen. Der Zulassungsantrag für PGI2 könnte dann Ende 2013 eingereicht werden.
Der orale PGI2-Rezeptoragonist sei eine sehr interessante Mischung und könnte die Behandlungsmöglichkeiten von Actelion für Patienten mit pulmonaler arterieller Hypertonie erweitern. Es sei ermutigend, dass die Phase IIa-Studie erfolgreich abgeschlossen worden sei. Zurzeit würden die Analysten über keine Einzelbewertung für dieses Projekt in ihrem Discounted-Cashflow-Modell nach Produktmodellen verfügen. Sie würden das vollständige klinische Ergebnis der Phase IIa abwarten, bevor sie ihre Prognosen überprüfen würden.
Die Analysten von Vontobel Research bewerten die Actelion-Aktie mit "buy" und veranschlagen ein Kursziel von CHF 75. Die nächsten wichtigen Impulse würden die Ergebnisse des 2. Quartals 2009 am Dienstag sein und die Phase III-Daten von BUILD 3 (Bosentan bei idiopathischer Lungenfibrose). (Analyse vom 17.07.2009)
Actelion habe heute Morgen angekündigt, dass alle Phase IIa-Studien für seinen ausgezeichneten oralen, nicht-prostanoiden PGI2-Rezeptoragonist für die Behandlung von pulmonaler arterieller Hypertonie sein Primärziel erreicht hätten. Actelion werde das Projekt vor Ende des Jahres in die Phase III vorantreiben.
In einer Studie mit 43 Patienten habe Actelions PGI2-Rezeptorantagonist zu einer beträchtlichen Verringerung des pulmonalen Gefässwiderstands (PVR) (p<0.01) geführt. PVR sei ein wichtiger Marker, um bei Patienten mit pulmonaler arterieller Hypertonie (PAH) das Fortschreiten der Erkrankung zu beobachten. Ein erhöhter Gefäßwiderstand führe zu einer Überlastung des Herzens, was wiederum Herzversagen zur Folge haben könne. Der PGI2-Antagonist zur Behandlung der PAH würde mit dem Prostacyclin-Weg konkurrieren, jedoch nicht direkt mit dem Endothelin-Weg (z. B. Tracleer).
Anzeige
Actelion habe angekündigt, noch vor Jahresende mit einer Phase-III-Studie zu Mortalität und Morbidität (M/M-Studie) für den PGI2-Wirkstoff zu beginnen. Es seien keine weiteren Informationen hinsichtlich der Anordnung der Phase-III-Studie oder weitere Daten zur Phase-IIa-Studie veröffentlicht worden. Nach Einschätzungen der Analysten könnte die Rekrutierung für die Phase-III-M/M-Studie bis zu eineinhalb Jahre dauern, die Ergebnisse könnten nach zwei Jahren vorliegen. Der Zulassungsantrag für PGI2 könnte dann Ende 2013 eingereicht werden.
Der orale PGI2-Rezeptoragonist sei eine sehr interessante Mischung und könnte die Behandlungsmöglichkeiten von Actelion für Patienten mit pulmonaler arterieller Hypertonie erweitern. Es sei ermutigend, dass die Phase IIa-Studie erfolgreich abgeschlossen worden sei. Zurzeit würden die Analysten über keine Einzelbewertung für dieses Projekt in ihrem Discounted-Cashflow-Modell nach Produktmodellen verfügen. Sie würden das vollständige klinische Ergebnis der Phase IIa abwarten, bevor sie ihre Prognosen überprüfen würden.
Die Analysten von Vontobel Research bewerten die Actelion-Aktie mit "buy" und veranschlagen ein Kursziel von CHF 75. Die nächsten wichtigen Impulse würden die Ergebnisse des 2. Quartals 2009 am Dienstag sein und die Phase III-Daten von BUILD 3 (Bosentan bei idiopathischer Lungenfibrose). (Analyse vom 17.07.2009)
aus "Cash":
Die Namenaktien von Actelion profitieren am Freitag von Anschlusskäufen aus dem Ausland. Dass der Rezeptoragonist PGI2 dank guten Studienergebnissen früher als erwartet in die Zulassungsphase-III eintreten wird, stösst in Analystenkreisen auf allgemeinen Beifall. Der Markteintritt des Wirkstoffs zur Behandlung von pulmonalem arteriellen Lungenbluthochdruck liegt noch einige Jahre in der Zukunft. Deshalb berücksichtigen erst wenige Analysten den Wirkstoff in ihren Bewertungsmodellen für die Papiere von Actelion.
Branchenkenner rechnen beim Rezeptoragonist PGI2 mit einem jährlichen Umsatzpotenzial von 650 bis 750 Millionen Franken. Die Wahrscheinlichkeit einer Zulassung des Wirkstoffs sei mit den positiven Studienergebnissen der Zulassungsphase-II auf 40 bis 50 Prozent gestiegen. Daraus liesse sich ein Nettobarwert von 4 bis 5 Franken je Aktie ableiten.
Die Namenaktien von Actelion profitieren am Freitag von Anschlusskäufen aus dem Ausland. Dass der Rezeptoragonist PGI2 dank guten Studienergebnissen früher als erwartet in die Zulassungsphase-III eintreten wird, stösst in Analystenkreisen auf allgemeinen Beifall. Der Markteintritt des Wirkstoffs zur Behandlung von pulmonalem arteriellen Lungenbluthochdruck liegt noch einige Jahre in der Zukunft. Deshalb berücksichtigen erst wenige Analysten den Wirkstoff in ihren Bewertungsmodellen für die Papiere von Actelion.
Branchenkenner rechnen beim Rezeptoragonist PGI2 mit einem jährlichen Umsatzpotenzial von 650 bis 750 Millionen Franken. Die Wahrscheinlichkeit einer Zulassung des Wirkstoffs sei mit den positiven Studienergebnissen der Zulassungsphase-II auf 40 bis 50 Prozent gestiegen. Daraus liesse sich ein Nettobarwert von 4 bis 5 Franken je Aktie ableiten.
sehr starke Zahlen!
Total net revenues of CHF 855.2 million, up 27 percent compared to H1 2008 - Tracleer® sales of CHF 739.3 million, up 23 percent in local currencies - Cash EBIT of CHF 304.8 million - Upgraded top and bottom line guidance - Key Phase III results reporting starting in Q4 2009 with almorexant in RESTORA-1 - BUILD-3 with bosentan in IPF in early 2010 - clazosentan in aSAH by-mid 2010
ALLSCHWIL/BASEL, SWITZERLAND - 21 July 2009 - Actelion Ltd (SIX: ATLN) today announced its financial results for the first half of 2009. With total net revenues for the first six months of 2009 of CHF 855.2 million (H1 2008: CHF 676.0 m) and operating expenses of CHF 612.4 million (H1 2008: CHF 538.8 m), the company reported an operating profit of CHF 242.9 million (H1 2008: CHF 137.2 m).
To better measure and compare operating performance over time, Actelion continues to report non-US GAAP Cash EBIT (Operating Income excluding charges such as In-Process R&D, charges related to employee stock options under FAS 123R as well as non-cash depreciation and amortization charges). For the first six months of 2009, Actelion achieved a Cash EBIT of CHF 304.8 million, an increase of 60 percent compared to the same period in 2008. In local currencies, Cash EBIT increased by 61 percent. Adjusted (non-US GAAP) diluted earnings per share for the first six months of 2009 were CHF 2.31, compared to CHF 1.42 during the same period last year.
On a US GAAP basis, net profit for the first half of 2009 was CHF 218.4 million (H1 2008: CHF 119.5 m). Starting on 1 January 2009, due to the adoption of FSP APB 14-1, the company incurred total non-cash charges of CHF 8.8 million related to its 2006 convertible bond. The comparative periods have been adjusted.
Fully diluted earnings per share (EPS) on a US GAAP basis for the first six months of 2009 were CHF 1.79, compared to CHF 0.97 for the same period in 2008.
Jean-Paul Clozel, M.D. and Chief Executive Officer commented: "I am very pleased with our performance in the first six months of 2009. Today, we offer innovative products for patients. We are making significant headway towards obtaining clinical data in the months ahead that might turn development compounds into tomorrow's pharmaceutical options."
Jean-Paul Clozel concluded: "I am especially pleased with the promising results of our PGI2 receptor agonist that allows for accelerated development as an oral agent stimulating the prostacyclin pathway. We have also entered a novel anti-infective into clinical development, thereby demonstrating our commitment to bringing our platform approach in research to fruition in multiple areas of high unmet medical demand."
Andrew J. Oakley, Chief Financial Officer commented: "Again, Actelion is reporting strong top and bottom line growth. We grow top line revenues as a result of the innovation inherent in our products and the way we appropriately communicate those benefits to treating physicians. We grow our bottom line because we make the appropriate investments at the right time to further advance our rapidly expanding and maturing research and development pipeline."
Andrew J. Oakley added: "Considering the operating performance in the first half of 2009, I am confident that Actelion will exceed initial guidance. Hence, Actelion now expects, unforeseen events excluded, that both total net revenues and Cash EBIT - in local currencies - will increase between 16 and 19 percent for the full year of 2009 (initial 2009 revenue guidance: 12 to 15 percent; initial Cash EBIT: 10 to 12 percent).
Total net revenues of CHF 855.2 million, up 27 percent compared to H1 2008 - Tracleer® sales of CHF 739.3 million, up 23 percent in local currencies - Cash EBIT of CHF 304.8 million - Upgraded top and bottom line guidance - Key Phase III results reporting starting in Q4 2009 with almorexant in RESTORA-1 - BUILD-3 with bosentan in IPF in early 2010 - clazosentan in aSAH by-mid 2010
ALLSCHWIL/BASEL, SWITZERLAND - 21 July 2009 - Actelion Ltd (SIX: ATLN) today announced its financial results for the first half of 2009. With total net revenues for the first six months of 2009 of CHF 855.2 million (H1 2008: CHF 676.0 m) and operating expenses of CHF 612.4 million (H1 2008: CHF 538.8 m), the company reported an operating profit of CHF 242.9 million (H1 2008: CHF 137.2 m).
To better measure and compare operating performance over time, Actelion continues to report non-US GAAP Cash EBIT (Operating Income excluding charges such as In-Process R&D, charges related to employee stock options under FAS 123R as well as non-cash depreciation and amortization charges). For the first six months of 2009, Actelion achieved a Cash EBIT of CHF 304.8 million, an increase of 60 percent compared to the same period in 2008. In local currencies, Cash EBIT increased by 61 percent. Adjusted (non-US GAAP) diluted earnings per share for the first six months of 2009 were CHF 2.31, compared to CHF 1.42 during the same period last year.
On a US GAAP basis, net profit for the first half of 2009 was CHF 218.4 million (H1 2008: CHF 119.5 m). Starting on 1 January 2009, due to the adoption of FSP APB 14-1, the company incurred total non-cash charges of CHF 8.8 million related to its 2006 convertible bond. The comparative periods have been adjusted.
Fully diluted earnings per share (EPS) on a US GAAP basis for the first six months of 2009 were CHF 1.79, compared to CHF 0.97 for the same period in 2008.
Jean-Paul Clozel, M.D. and Chief Executive Officer commented: "I am very pleased with our performance in the first six months of 2009. Today, we offer innovative products for patients. We are making significant headway towards obtaining clinical data in the months ahead that might turn development compounds into tomorrow's pharmaceutical options."
Jean-Paul Clozel concluded: "I am especially pleased with the promising results of our PGI2 receptor agonist that allows for accelerated development as an oral agent stimulating the prostacyclin pathway. We have also entered a novel anti-infective into clinical development, thereby demonstrating our commitment to bringing our platform approach in research to fruition in multiple areas of high unmet medical demand."
Andrew J. Oakley, Chief Financial Officer commented: "Again, Actelion is reporting strong top and bottom line growth. We grow top line revenues as a result of the innovation inherent in our products and the way we appropriately communicate those benefits to treating physicians. We grow our bottom line because we make the appropriate investments at the right time to further advance our rapidly expanding and maturing research and development pipeline."
Andrew J. Oakley added: "Considering the operating performance in the first half of 2009, I am confident that Actelion will exceed initial guidance. Hence, Actelion now expects, unforeseen events excluded, that both total net revenues and Cash EBIT - in local currencies - will increase between 16 and 19 percent for the full year of 2009 (initial 2009 revenue guidance: 12 to 15 percent; initial Cash EBIT: 10 to 12 percent).
Antwort auf Beitrag Nr.: 37.611.118 von SLGramann am 21.07.09 07:31:31
das war erwartet:
Die Konsensschätzung der Analysten lässt ein Umsatzwachstum um fast 18 Prozent auf 417 Millionen Franken erwarten (gegenüber dem Vorjahreszeitraum). Der Reingewinn dürfte um rund 24 Prozent auf 97 Millionen Franken zulegen.
Geliefert wurde ein Umsatz von 449 Mio. Franken und ein Nettogewinn von 116 Mio. Franken.
Damit wurden die Analystenerwartungen klar geschlagen.
das war erwartet:
Die Konsensschätzung der Analysten lässt ein Umsatzwachstum um fast 18 Prozent auf 417 Millionen Franken erwarten (gegenüber dem Vorjahreszeitraum). Der Reingewinn dürfte um rund 24 Prozent auf 97 Millionen Franken zulegen.
Geliefert wurde ein Umsatz von 449 Mio. Franken und ein Nettogewinn von 116 Mio. Franken.
Damit wurden die Analystenerwartungen klar geschlagen.
Antwort auf Beitrag Nr.: 37.611.118 von SLGramann am 21.07.09 07:31:31
Indes sind die Verzögerungen bei den P III-Studien, insbesondere bei clazosentan, unerfreulich.
Positiv ist, dass es einen Klinikgang gegeben hat. Die Indikation "Antibiotika" ist zwar sehr "klassisch", aber alles andere als unattraktiv.
Mehr als 25 Projekte sind derzeit in der vorklinischen Entwicklung. Da dürften in den nächsten Jahren einige Klinikgänge folgen. 2 pro Jahr sind ab 2010 sicher nicht unrealistisch.
Indes sind die Verzögerungen bei den P III-Studien, insbesondere bei clazosentan, unerfreulich.
Positiv ist, dass es einen Klinikgang gegeben hat. Die Indikation "Antibiotika" ist zwar sehr "klassisch", aber alles andere als unattraktiv.
Mehr als 25 Projekte sind derzeit in der vorklinischen Entwicklung. Da dürften in den nächsten Jahren einige Klinikgänge folgen. 2 pro Jahr sind ab 2010 sicher nicht unrealistisch.

Wir wollen so werden wie Genentech!
Interview mit J.P. Clozel
Jean-Paul Clozel, Chef von Actelion, ist seinem grossen Ziel ein weiteres Stück näher gekommen, sagt er im Interview mit cash. Und zwar, mit dem Allschwiler Biopharma-Unternehmen eine ähnliche Entwicklung zu vollziehen wie einst der US-Biotech-Riese Genentech.
Von Ulrich Rotzinger
cash: Ein glänzendes Ergebnis im zweiten Quartal, sogar noch besser als das erste. Actelion hat die Erwartungen der Marktbeobachter weit übertroffen. Jetzt war es wohl definitiv an der Zeit, die Guidance für das Gesamtjahr 2009 anzuheben.
Jean-Paul Clozel: Das sehen Sie absolut richtig. Natürlich erhöhen wir die Guidance nur dann, wenn wir einen guten Grund dafür haben. Unsere Erwartungen wurden übertroffen, wir selbst sind ausserordentlich überrascht. Ich kann Ihnen ehrlich sagen, die Zahlen sind fantastisch. Wir haben einen tollen Marketing- und Verkaufserfolg erzielt und wachsen in allen Regionen.
Actelion erwartet neu einen Umsatzanstieg von 16 bis 19 Prozent in Lokalwährungen im laufenden Jahr. Der Cash-Ebit soll ebenfalls in dieser Spanne zulegen. Was macht Sie so optimistisch für 2009?
Die Wahrnehmung im Mark für unser Lungenmedikament Tracleer hat sich deutlich verbessert. Die Nachfrage ist ungebrochen stark. Unser Medikament gilt unter Ärzten als eines der besten gegen pulmonale arterielle Hypertonie. Die Marktdurchdringung geht mit grosser Geschwindigkeit voran.
Dann wird Actelion auch in der zweiten Jahreshälfte die Erwartungen übertreffen?
Eigentlich sollte ich das so kommentieren: Sag niemals nie. Wir haben uns jetzt allerdings eine sehr herausfordernde Guidance gegeben. Es wird ein hartes Jahr für uns. Die Guidance ist aber fair und optimistisch. Und wenn wir es noch besser machen können, werden wir es tun.
Im Februar 2009 sagten Sie mir, dass Actelion sich im 2009 markant wandeln werde. Wie kommentieren Sie das heute?
Ich kann Ihnen am Telefon gar nicht beschreiben, wie aufgeregt und enthusiastisch ich gerade bin, wenn ich den Fortschritt unserer Forschung und Entwicklung sehe. Wir sehen heute ein Unternehmen, dass noch so viele Medikamente entwickeln kann. Schauen Sie nur doch auf unsere starke Produkt-Pipeline. Wir kommen der Verwirklichung unseres Traums immer näher, ein grosses und erfolgreiches Biotech-Unternehmen zu werden wie es Genentech in den USA geschafft hat. In Europa ist es wohl das erste Mal, dass man bei einem Biotech-Unternehmen wie unserem solche Erfolge sieht.
Sie erwarten für drei von vier klinischen Phase-III-Projekten Resultate noch in diesem Jahr. Welches Potenzial haben diese für Actelion?
Drei Projekte laufen in späten klinischen Studien. Wir müssen aber auch fair sein und eingestehen, dass nicht alle Projekte ein Erfolg werden. Das gehört zum Business der forschenden Biotech-Gesellschaften. Aber ich bin mir recht sicher, dass ein paar dieser Projekte ein durchschlagender Erfolg werden. Ein oder zwei dieser Projekte reichen, um Actelion komplett zu verändern.
In den USA wird es aber zu kleineren Verzögerungen beim neuartigen Schlafmittel Almorexant kommen.
Das ist richtig. Der Terminplan für die US-Zulassung verzögert sich etwas. Doch wir sind in engem Kontakt mit der Gesundheitsbehörde FDA, um zu vermeiden, dass wir nachbessern müssen, wenn das Produkt dann auf dem Markt ist.
Sie sagten im Februar auch zu cash, dass Actelions Pipeline nicht ausreichend im Aktienkurs enthalten sei. Liege ich falsch, wenn ich sage, dass ist heute mehr denn je der Fall?
Fragen Sie doch mal die Stakeholder. Glauben Sie, der Aktienkurs bleibt auf gleichem Niveau, wenn sich die Umsätze verdoppeln? Was würden die wohl antworten.
Rechnen Sie nach den starken ersten sechs Monaten dieses Jahres damit, dass Grossinvestoren ihre Beteiligung an Actelion aufstocken?
Ich möchte nicht für unsere Hauptaktionäre sprechen. Was wir aber sehen, ist ein kontinuierlich ansteigendes Interesse neuer institutioneller Investoren. Sie merken, dass Actelion nun in eine andere Liga aufsteigt. Und das schafft grosse Aufmerksamkeit. Ich hege grosse Hoffnungen, dass künftig neue sehr potente Investoren bei Actelion einsteigen.
Und was ist mit Ihnen selbst, Sie halten 3,32 Prozent?
Ein Grossteil meines Vermögens steckt in Actelion. Wissen Sie, das Beste, was ich je tun konnte ist, meine Actelion-Aktien zu halten, besonders in diesen äusserst schwierigen Zeiten. Natürlich werde ich auch künftig daran festhalten.
Eine letzte Frage zum Fortschritt der Neubauten am Hauptsitz in Allschwil. Wie läufts und wann öffnen diese?
Wir sind terminlich mit den Neubauten voll auf Kurs. Der erste wird nächstes Jahr bezogen. Das zweite im 2011.
Quelle : Cash.ch
Interview mit J.P. Clozel
Jean-Paul Clozel, Chef von Actelion, ist seinem grossen Ziel ein weiteres Stück näher gekommen, sagt er im Interview mit cash. Und zwar, mit dem Allschwiler Biopharma-Unternehmen eine ähnliche Entwicklung zu vollziehen wie einst der US-Biotech-Riese Genentech.
Von Ulrich Rotzinger
cash: Ein glänzendes Ergebnis im zweiten Quartal, sogar noch besser als das erste. Actelion hat die Erwartungen der Marktbeobachter weit übertroffen. Jetzt war es wohl definitiv an der Zeit, die Guidance für das Gesamtjahr 2009 anzuheben.
Jean-Paul Clozel: Das sehen Sie absolut richtig. Natürlich erhöhen wir die Guidance nur dann, wenn wir einen guten Grund dafür haben. Unsere Erwartungen wurden übertroffen, wir selbst sind ausserordentlich überrascht. Ich kann Ihnen ehrlich sagen, die Zahlen sind fantastisch. Wir haben einen tollen Marketing- und Verkaufserfolg erzielt und wachsen in allen Regionen.
Actelion erwartet neu einen Umsatzanstieg von 16 bis 19 Prozent in Lokalwährungen im laufenden Jahr. Der Cash-Ebit soll ebenfalls in dieser Spanne zulegen. Was macht Sie so optimistisch für 2009?
Die Wahrnehmung im Mark für unser Lungenmedikament Tracleer hat sich deutlich verbessert. Die Nachfrage ist ungebrochen stark. Unser Medikament gilt unter Ärzten als eines der besten gegen pulmonale arterielle Hypertonie. Die Marktdurchdringung geht mit grosser Geschwindigkeit voran.
Dann wird Actelion auch in der zweiten Jahreshälfte die Erwartungen übertreffen?
Eigentlich sollte ich das so kommentieren: Sag niemals nie. Wir haben uns jetzt allerdings eine sehr herausfordernde Guidance gegeben. Es wird ein hartes Jahr für uns. Die Guidance ist aber fair und optimistisch. Und wenn wir es noch besser machen können, werden wir es tun.
Im Februar 2009 sagten Sie mir, dass Actelion sich im 2009 markant wandeln werde. Wie kommentieren Sie das heute?
Ich kann Ihnen am Telefon gar nicht beschreiben, wie aufgeregt und enthusiastisch ich gerade bin, wenn ich den Fortschritt unserer Forschung und Entwicklung sehe. Wir sehen heute ein Unternehmen, dass noch so viele Medikamente entwickeln kann. Schauen Sie nur doch auf unsere starke Produkt-Pipeline. Wir kommen der Verwirklichung unseres Traums immer näher, ein grosses und erfolgreiches Biotech-Unternehmen zu werden wie es Genentech in den USA geschafft hat. In Europa ist es wohl das erste Mal, dass man bei einem Biotech-Unternehmen wie unserem solche Erfolge sieht.
Sie erwarten für drei von vier klinischen Phase-III-Projekten Resultate noch in diesem Jahr. Welches Potenzial haben diese für Actelion?
Drei Projekte laufen in späten klinischen Studien. Wir müssen aber auch fair sein und eingestehen, dass nicht alle Projekte ein Erfolg werden. Das gehört zum Business der forschenden Biotech-Gesellschaften. Aber ich bin mir recht sicher, dass ein paar dieser Projekte ein durchschlagender Erfolg werden. Ein oder zwei dieser Projekte reichen, um Actelion komplett zu verändern.
In den USA wird es aber zu kleineren Verzögerungen beim neuartigen Schlafmittel Almorexant kommen.
Das ist richtig. Der Terminplan für die US-Zulassung verzögert sich etwas. Doch wir sind in engem Kontakt mit der Gesundheitsbehörde FDA, um zu vermeiden, dass wir nachbessern müssen, wenn das Produkt dann auf dem Markt ist.
Sie sagten im Februar auch zu cash, dass Actelions Pipeline nicht ausreichend im Aktienkurs enthalten sei. Liege ich falsch, wenn ich sage, dass ist heute mehr denn je der Fall?
Fragen Sie doch mal die Stakeholder. Glauben Sie, der Aktienkurs bleibt auf gleichem Niveau, wenn sich die Umsätze verdoppeln? Was würden die wohl antworten.
Rechnen Sie nach den starken ersten sechs Monaten dieses Jahres damit, dass Grossinvestoren ihre Beteiligung an Actelion aufstocken?
Ich möchte nicht für unsere Hauptaktionäre sprechen. Was wir aber sehen, ist ein kontinuierlich ansteigendes Interesse neuer institutioneller Investoren. Sie merken, dass Actelion nun in eine andere Liga aufsteigt. Und das schafft grosse Aufmerksamkeit. Ich hege grosse Hoffnungen, dass künftig neue sehr potente Investoren bei Actelion einsteigen.
Und was ist mit Ihnen selbst, Sie halten 3,32 Prozent?
Ein Grossteil meines Vermögens steckt in Actelion. Wissen Sie, das Beste, was ich je tun konnte ist, meine Actelion-Aktien zu halten, besonders in diesen äusserst schwierigen Zeiten. Natürlich werde ich auch künftig daran festhalten.
Eine letzte Frage zum Fortschritt der Neubauten am Hauptsitz in Allschwil. Wie läufts und wann öffnen diese?
Wir sind terminlich mit den Neubauten voll auf Kurs. Der erste wird nächstes Jahr bezogen. Das zweite im 2011.
Quelle : Cash.ch
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, stuft die Aktie von Actelion (ISIN CH0010532478 / WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" mit dem Rating "buy" ein.
Die heute Morgen von Actelion veröffentlichten Zahlen zum 2. Quartal 2009 hätten deutlich über den Erwartungen der Analysten und dem Marktkonsens gelegen. Der Umsatz habe CHF 449,5 Mio. betragen (VontE: CHF 420,5 Mio., Konsensprognose: CHF 417 Mio.). Der Cash-EBIT habe sich auf CHF 158,3 Mio. (VontE: CHF 134,6 Mio., Konsensprognose: CHF 139,9 Mio.) und der Reingewinn auf CHF 116,3 Mio. (VontE: CHF 91 Mio., Konsensprognose: CHF 97,3 Mio.) belaufen.
Anzeige
Actelion habe ein glänzendes Ergebnis vorgelegt, der Umsatz habe bei CHF 449,5 Mio. gelegen, hauptsächlich bedingt durch Tracleer, das CHF 387,1 Mio. erreicht habe (VontE: CHF 360,7 Mio., Konsenserwartungen: CHF 360,9 Mio.). Der Tracleer-Umsatz beruhe auf einem zweistelligen Wachstum auf allen großen Märkten, dies zeige, dass die Marktdurchdringung mit großer Geschwindigkeit vorangehe. Nach Ansicht der Analysten könne die Konkurrenz die Marktposition von Actelion nicht schmälern.
Das Cash-EBIT habe bei CHF 158,3 Mio. und damit 13% über den Erwartungen der Analysten gelegen, der wichtigste Faktor sei dabei der Operating Leverage. Der Reingewinn habe die Schätzungen der Analysten um 20% übertroffen, da sich das Betriebsergebnis in der Bilanz niederschlage. Die Vorgabe für das Geschäftsjahr 2009 werde für Umsatz und Cash-EBIT heraufgesetzt. Das Unternehmen gehe nun von einem Wachstum von 16 bis 19% in Lokalwährung aus. Die Analysten würden erwarten, dass sich ihre Zahlen um etwa 5% erhöhen würden. Einige kleinere Verzögerungen in der Pipeline seien kein Grund zur Sorge.
Die Analysten von Vontobel Research bewerten die Actelion-Aktie mit "buy" bei einem Kursziel von CHF 75. (Analyse vom 21.07.2009) (21.07.2009/ac/a/a)
Die heute Morgen von Actelion veröffentlichten Zahlen zum 2. Quartal 2009 hätten deutlich über den Erwartungen der Analysten und dem Marktkonsens gelegen. Der Umsatz habe CHF 449,5 Mio. betragen (VontE: CHF 420,5 Mio., Konsensprognose: CHF 417 Mio.). Der Cash-EBIT habe sich auf CHF 158,3 Mio. (VontE: CHF 134,6 Mio., Konsensprognose: CHF 139,9 Mio.) und der Reingewinn auf CHF 116,3 Mio. (VontE: CHF 91 Mio., Konsensprognose: CHF 97,3 Mio.) belaufen.
Anzeige
Actelion habe ein glänzendes Ergebnis vorgelegt, der Umsatz habe bei CHF 449,5 Mio. gelegen, hauptsächlich bedingt durch Tracleer, das CHF 387,1 Mio. erreicht habe (VontE: CHF 360,7 Mio., Konsenserwartungen: CHF 360,9 Mio.). Der Tracleer-Umsatz beruhe auf einem zweistelligen Wachstum auf allen großen Märkten, dies zeige, dass die Marktdurchdringung mit großer Geschwindigkeit vorangehe. Nach Ansicht der Analysten könne die Konkurrenz die Marktposition von Actelion nicht schmälern.
Das Cash-EBIT habe bei CHF 158,3 Mio. und damit 13% über den Erwartungen der Analysten gelegen, der wichtigste Faktor sei dabei der Operating Leverage. Der Reingewinn habe die Schätzungen der Analysten um 20% übertroffen, da sich das Betriebsergebnis in der Bilanz niederschlage. Die Vorgabe für das Geschäftsjahr 2009 werde für Umsatz und Cash-EBIT heraufgesetzt. Das Unternehmen gehe nun von einem Wachstum von 16 bis 19% in Lokalwährung aus. Die Analysten würden erwarten, dass sich ihre Zahlen um etwa 5% erhöhen würden. Einige kleinere Verzögerungen in der Pipeline seien kein Grund zur Sorge.
Die Analysten von Vontobel Research bewerten die Actelion-Aktie mit "buy" bei einem Kursziel von CHF 75. (Analyse vom 21.07.2009) (21.07.2009/ac/a/a)
22.07.2009 11:22:33
Actelion "buy"
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, stuft die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" weiterhin mit "buy" ein.
Actelion habe gestern ein glänzendes Ergebnis für das zweite Quartal 2009 vorgelegt. Während der Telefonkonferenz habe das Management bestätigt, dass das Umsatzwachstum auf eine echte Produktnachfrage zurückzuführen sei und keine Inventarschwankungen die Umsatztrends verzerrt hätten.
Die Analystenprognosen für Umsatz, Cash-EBIT und EPS würden um circa 3 bis 4% angehoben. Die geringfügigen Verzögerungen bei Almorexant gegen Schlafstörungen und Tracleer zur Behandlung von idiopathischer Lungenfibrose (IPF) würden sich praktisch nicht auf die Bewertung auswirken und die neue Umsatzprognose des Unternehmens sei noch immer etwas zu konservativ. Die Cash-EBIT-Prognose von 16 bis 19% umfasse eine nicht offen gelegte Zahlung in Höhe von schätzungsweise CHF 30 Mio. an Nippon Shinyaku, mit der im 4Q/2009 gerechnet werde.
Letairis habe gestern bei USD 44,1 Mio. gelegen (VTe: USD 45 Mio.), was ungefähr der Analystenerwartung entspreche. Nach einem sehr schwachen 1Q/2009 habe sich der Umsatz mit Letairis im 2Q/2009 nicht erholt. Eigenen Schätzungen zufolge beherrsche GILD rund ein Drittel des US-Markts, nach den Analystenberechnungen aber eher ein Viertel. Man gehe davon aus, dass der Umsatz mit Tracleer in den USA im 2Q/2009 im Quartalsvergleich um ungefähr USD 11 Mio. gestiegen sei, bei Letairis jedoch nur USD 4 Mio. Der Umsatz mit Letairis bestätige die Sichtweise der Analysten, wonach das Medikament sich nicht als neue ERA-Erstlinientherapie etabliere und daher keine echte Konkurrenz für Tracleer darstelle.
Die gestern veröffentlichten Ergebnisse des zweiten Quartals 2009 seien grundsolide gewesen. Das Management habe bestätigt, dass das Umsatzwachstum mit der echten Produktnachfrage zusammengehängt habe und nicht mit Inventarschwankungen. Die Cash-EBIT-Prognose beinhalte eine Zahlung in ungenannter Höhe an Nippon Shinyaku, die den Erwartungen zufolge im vierten Quartal 2009 anstehe. Man schätze diese auf CHF 30 Mio. Ohne diesen Sonderposten würde sich das Wachstum auf +22 bis 25% belaufen. Die um einen oder zwei Monate verzögerte Veröffentlichung der Daten der BUILD3-Studie hätten zufolge, dass dieser bedeutende Kursimpuls in das Geschäftsjahr 2010 rutsche.
Die Analysten von Vontobel Research bekräftigen ihr "buy"-Rating für die Aktie von Actelion und erhöhen ihr Kursziel auf CHF 79. (Analyse vom 22.07.2009) (22.07.2009/ac/a/a)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
Quelle: AKTIENCHECK.DE
Actelion "buy"
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, stuft die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" weiterhin mit "buy" ein.
Actelion habe gestern ein glänzendes Ergebnis für das zweite Quartal 2009 vorgelegt. Während der Telefonkonferenz habe das Management bestätigt, dass das Umsatzwachstum auf eine echte Produktnachfrage zurückzuführen sei und keine Inventarschwankungen die Umsatztrends verzerrt hätten.
Die Analystenprognosen für Umsatz, Cash-EBIT und EPS würden um circa 3 bis 4% angehoben. Die geringfügigen Verzögerungen bei Almorexant gegen Schlafstörungen und Tracleer zur Behandlung von idiopathischer Lungenfibrose (IPF) würden sich praktisch nicht auf die Bewertung auswirken und die neue Umsatzprognose des Unternehmens sei noch immer etwas zu konservativ. Die Cash-EBIT-Prognose von 16 bis 19% umfasse eine nicht offen gelegte Zahlung in Höhe von schätzungsweise CHF 30 Mio. an Nippon Shinyaku, mit der im 4Q/2009 gerechnet werde.
Letairis habe gestern bei USD 44,1 Mio. gelegen (VTe: USD 45 Mio.), was ungefähr der Analystenerwartung entspreche. Nach einem sehr schwachen 1Q/2009 habe sich der Umsatz mit Letairis im 2Q/2009 nicht erholt. Eigenen Schätzungen zufolge beherrsche GILD rund ein Drittel des US-Markts, nach den Analystenberechnungen aber eher ein Viertel. Man gehe davon aus, dass der Umsatz mit Tracleer in den USA im 2Q/2009 im Quartalsvergleich um ungefähr USD 11 Mio. gestiegen sei, bei Letairis jedoch nur USD 4 Mio. Der Umsatz mit Letairis bestätige die Sichtweise der Analysten, wonach das Medikament sich nicht als neue ERA-Erstlinientherapie etabliere und daher keine echte Konkurrenz für Tracleer darstelle.
Die gestern veröffentlichten Ergebnisse des zweiten Quartals 2009 seien grundsolide gewesen. Das Management habe bestätigt, dass das Umsatzwachstum mit der echten Produktnachfrage zusammengehängt habe und nicht mit Inventarschwankungen. Die Cash-EBIT-Prognose beinhalte eine Zahlung in ungenannter Höhe an Nippon Shinyaku, die den Erwartungen zufolge im vierten Quartal 2009 anstehe. Man schätze diese auf CHF 30 Mio. Ohne diesen Sonderposten würde sich das Wachstum auf +22 bis 25% belaufen. Die um einen oder zwei Monate verzögerte Veröffentlichung der Daten der BUILD3-Studie hätten zufolge, dass dieser bedeutende Kursimpuls in das Geschäftsjahr 2010 rutsche.
Die Analysten von Vontobel Research bekräftigen ihr "buy"-Rating für die Aktie von Actelion und erhöhen ihr Kursziel auf CHF 79. (Analyse vom 22.07.2009) (22.07.2009/ac/a/a)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
Quelle: AKTIENCHECK.DE
New York (aktiencheck.de AG) - Brigitte de Lima, Analystin von Banc of America Securities-Merrill Lynch Research, stuft die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) unverändert mit "neutral" ein.
Nach stärker als erwartet ausgefallenen Zweitquartalszahlen sei das Kursziel von 58 auf 60 Schweizer Franken nach oben gesetzt worden.
Die weitentwickelten Pipelinekandidaten würden aber weiterhin vorsichtig beurteilt. Beim Schlafmittel Almorexant sehe man bei einer ersten Phase III-Studie nur wenig Aufwärtspotenzial. Für eine erweiterte Verwendung von Tracleer sehe man nur eine Chance von 25%.
Vor diesem Hintergrund bleiben die Analysten von Banc of America Securities-Merrill Lynch Research bei ihrem Votum "neutral" für die Aktie von Actelion. (Analyse vom 22.07.09) (22.07.2009/ac/a/a)
-----------------
Aus meiner Sicht ist das Scheitern von Tracleer bei IPF weitgehend im Kurs drin. Was Almorexant angeht: Dort sieht man also "bei einer ersten Phase III-Studie nur wenig Aufwärtspotenzial". Das ist eine Zocker-Argumentation, die nur die kurze Frist in den Blick nimmt. Es kommt auf die Qualität der Daten an und wenn Almorexant ein Erfolg wird, dann führt das Actelion in eine neue Dimension - und da ist es ziemlich egal, ob das Mittel 2011 oder erst 2013 (womit ich im Erfolgsfall rechne) zugelassen wird.
Außerdem sollte man folgendes mal nicht ignorieren:
Selective S1P1 receptor agonist in psoriasis: The proof-of-concept study with 66 patients in psoriasis has completed enrollment in June 2009. Results are expected to become available in the coming months.
Das ging wirklich zügig mit der IIa! Nach weniger als einem Jahr werden wir die Ergebnisse haben. Im Falle positiver Daten könnte sich hier ein Wirkstoff mit Blockbusterpotential abzeichnen.
Nach stärker als erwartet ausgefallenen Zweitquartalszahlen sei das Kursziel von 58 auf 60 Schweizer Franken nach oben gesetzt worden.
Die weitentwickelten Pipelinekandidaten würden aber weiterhin vorsichtig beurteilt. Beim Schlafmittel Almorexant sehe man bei einer ersten Phase III-Studie nur wenig Aufwärtspotenzial. Für eine erweiterte Verwendung von Tracleer sehe man nur eine Chance von 25%.
Vor diesem Hintergrund bleiben die Analysten von Banc of America Securities-Merrill Lynch Research bei ihrem Votum "neutral" für die Aktie von Actelion. (Analyse vom 22.07.09) (22.07.2009/ac/a/a)
-----------------
Aus meiner Sicht ist das Scheitern von Tracleer bei IPF weitgehend im Kurs drin. Was Almorexant angeht: Dort sieht man also "bei einer ersten Phase III-Studie nur wenig Aufwärtspotenzial". Das ist eine Zocker-Argumentation, die nur die kurze Frist in den Blick nimmt. Es kommt auf die Qualität der Daten an und wenn Almorexant ein Erfolg wird, dann führt das Actelion in eine neue Dimension - und da ist es ziemlich egal, ob das Mittel 2011 oder erst 2013 (womit ich im Erfolgsfall rechne) zugelassen wird.
Außerdem sollte man folgendes mal nicht ignorieren:
Selective S1P1 receptor agonist in psoriasis: The proof-of-concept study with 66 patients in psoriasis has completed enrollment in June 2009. Results are expected to become available in the coming months.
Das ging wirklich zügig mit der IIa! Nach weniger als einem Jahr werden wir die Ergebnisse haben. Im Falle positiver Daten könnte sich hier ein Wirkstoff mit Blockbusterpotential abzeichnen.
Und noch ein weiblicher Analo meldet sich zu Wort:
23.07.2009 09:32:30
Actelion neues Kursziel
New York (aktiencheck.de AG) - Alexandra Hauber, Analystin von J.P. Morgan Securities, stuft die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) unverändert mit "neutral" ein.
Actelion habe im abgelaufenen Jahr bei den Einnahmen über den Erwartungen abgeschnitten, was vor allem auf das gute Geschäft mit Tracleer zurückzuführen sei. Die Umsatzprognosen für 2009 bis 2011 seien um bis zu 5,80% nach oben korrigiert worden.
Ein Bewertungsaufschlag gegenüber der Peer Group sei auf Grund der durchschnittlichen jährlichen Gewinnwachstumsrate gerechtfertigt. Das Kursziel werde von 57 auf 61 Schweizer Franken heraufgesetzt.
Vor diesem Hintergrund bleiben die Analysten von J.P. Morgan Securities bei ihrem Votum "neutral" für die Aktie von Actelion. (Analyse vom 23.07.09)
(23.07.2009/ac/a/a)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
Quelle:AKTIENCHECK.DE

23.07.2009 09:32:30
Actelion neues Kursziel
New York (aktiencheck.de AG) - Alexandra Hauber, Analystin von J.P. Morgan Securities, stuft die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) unverändert mit "neutral" ein.
Actelion habe im abgelaufenen Jahr bei den Einnahmen über den Erwartungen abgeschnitten, was vor allem auf das gute Geschäft mit Tracleer zurückzuführen sei. Die Umsatzprognosen für 2009 bis 2011 seien um bis zu 5,80% nach oben korrigiert worden.
Ein Bewertungsaufschlag gegenüber der Peer Group sei auf Grund der durchschnittlichen jährlichen Gewinnwachstumsrate gerechtfertigt. Das Kursziel werde von 57 auf 61 Schweizer Franken heraufgesetzt.
Vor diesem Hintergrund bleiben die Analysten von J.P. Morgan Securities bei ihrem Votum "neutral" für die Aktie von Actelion. (Analyse vom 23.07.09)
(23.07.2009/ac/a/a)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
Quelle:AKTIENCHECK.DE

03.08.2009 06:34
PRESSE/Actelion-CEO: "Wir wollen zur Genentech von Europa werden"
Bern (awp/sda) - Das Biotechunternehmen Actelion hat seinen Gewinn im ersten Halbjahr zwar deutlich gesteigert. Unternehmenschef Jean-Paul Clozel gibt sich damit aber nicht zufrieden. "Wir wollen zur Genentech von Europa werden", sagt er in einem Interview mit dem "Sonntag".
Für viele Unternehmen sei ein Wachstum von 5% ein realistisches Ziel. Damit gebe sich Actelion jedoch nicht zufrieden, sagt Clozel weiter. "Unser Ziel ist es, in grossen Schritten zu wachsen."
Aus dem heutigen Unternehmen mit 2'200 Mitarbeitern soll laut Clozel ein Biotechriese mit über 10'000 Mitarbeitern werden. Bereits im nächsten Jahr wolle Actelion wie bereits im laufenden Jahr weltweit rund 400 Stellen schaffen, etwa die Hälfte davon sollen in der Schweiz entstehen.
Clozel gibt sich zuversichtlich, dass das Unternehmen trotz Wachstumsplänen unabhängig bleiben könne. Es lägen keine konkreten Angebote auf dem Tisch. Auch Gespräche würden keine geführt.
Obschon Actelion über 1,2 Mrd CHF an flüssigen Mitteln verfüge, wolle sie auch keine kleineren Biotechfirmen übernehmen. "Wir sind nur an einzelnen Produkten interessiert, nicht an ganzen Unternehmen. Ich will meine Zeit nicht mit Reorganisationen verbringen, sondern mit dem Entdecken und Entwickeln neuer Produkte," sagt Clozel.
---------------
Ehrlich gesagt, ist mir der Mann etwas zu laut.
PRESSE/Actelion-CEO: "Wir wollen zur Genentech von Europa werden"
Bern (awp/sda) - Das Biotechunternehmen Actelion hat seinen Gewinn im ersten Halbjahr zwar deutlich gesteigert. Unternehmenschef Jean-Paul Clozel gibt sich damit aber nicht zufrieden. "Wir wollen zur Genentech von Europa werden", sagt er in einem Interview mit dem "Sonntag".
Für viele Unternehmen sei ein Wachstum von 5% ein realistisches Ziel. Damit gebe sich Actelion jedoch nicht zufrieden, sagt Clozel weiter. "Unser Ziel ist es, in grossen Schritten zu wachsen."
Aus dem heutigen Unternehmen mit 2'200 Mitarbeitern soll laut Clozel ein Biotechriese mit über 10'000 Mitarbeitern werden. Bereits im nächsten Jahr wolle Actelion wie bereits im laufenden Jahr weltweit rund 400 Stellen schaffen, etwa die Hälfte davon sollen in der Schweiz entstehen.
Clozel gibt sich zuversichtlich, dass das Unternehmen trotz Wachstumsplänen unabhängig bleiben könne. Es lägen keine konkreten Angebote auf dem Tisch. Auch Gespräche würden keine geführt.
Obschon Actelion über 1,2 Mrd CHF an flüssigen Mitteln verfüge, wolle sie auch keine kleineren Biotechfirmen übernehmen. "Wir sind nur an einzelnen Produkten interessiert, nicht an ganzen Unternehmen. Ich will meine Zeit nicht mit Reorganisationen verbringen, sondern mit dem Entdecken und Entwickeln neuer Produkte," sagt Clozel.
---------------
Ehrlich gesagt, ist mir der Mann etwas zu laut.

Die Citigroup lässt allem Anschein nach keine Gelegenheit für negative Kommentare zu Actelion aus. Nach Kontakten mit zwei behandelnden Ärzten befürchtet die zuständige Analystin Marktanteilsverluste mit dem Medikament Ventavis an Tyvaso. Das Konkurrenzpräparat von United Therpeutics erhielt in den USA erst kürzlich die Marktzulassung und weist gegenüber Ventavis Vorteile bei der Verabreichung auf.
Die Citigroup schätzt, dass sich der nächstjährige Vorsteuergewinn bei Actelion je 100 an Tyvaso verlorenen Patienten um 1,4 Prozent zurückbilden wird. Die Analystin geht derzeit für Ventavis von einem Umsatz für 2010 von 120 Millionen Franken aus. Dies entspricht rund 7 Prozent des erwarteten Gesamtumsatzes.
Die Analystin stuft die Namenaktien von Actelion seit November 2007 mit Verkauf. Seit den besser als erwarteten Quartalszahlen von Ende Juli lautet das Kursziel 50 Franken.
----------------------
Analysten waren sich auch schon mal ganz sicher, dass Tracleer sehr viel Umsatz an Letairis verlieren würde. Das hat sich absolut nicht bestätigt und fällt rückblickend in die Kategorie "inkompetentes Analysten-Geschwurbel zum Schaden der Kleinaktionäre". Vorsatz ist dabei nicht auszuschließen. Was Ventavis angeht, werden wir abwarten, wie die reale Entwicklung verläuft. Außerdem ist das ein Nebenkriegsschauplatz. Wirklich wichtig ist Almorexant.
Die Citigroup schätzt, dass sich der nächstjährige Vorsteuergewinn bei Actelion je 100 an Tyvaso verlorenen Patienten um 1,4 Prozent zurückbilden wird. Die Analystin geht derzeit für Ventavis von einem Umsatz für 2010 von 120 Millionen Franken aus. Dies entspricht rund 7 Prozent des erwarteten Gesamtumsatzes.
Die Analystin stuft die Namenaktien von Actelion seit November 2007 mit Verkauf. Seit den besser als erwarteten Quartalszahlen von Ende Juli lautet das Kursziel 50 Franken.
----------------------
Analysten waren sich auch schon mal ganz sicher, dass Tracleer sehr viel Umsatz an Letairis verlieren würde. Das hat sich absolut nicht bestätigt und fällt rückblickend in die Kategorie "inkompetentes Analysten-Geschwurbel zum Schaden der Kleinaktionäre". Vorsatz ist dabei nicht auszuschließen. Was Ventavis angeht, werden wir abwarten, wie die reale Entwicklung verläuft. Außerdem ist das ein Nebenkriegsschauplatz. Wirklich wichtig ist Almorexant.
Antwort auf Beitrag Nr.: 37.720.747 von SLGramann am 06.08.09 07:40:17
Äh, das überm Strich ist ein Zitat aus Cash.
Äh, das überm Strich ist ein Zitat aus Cash.
Antwort auf Beitrag Nr.: 37.720.944 von SLGramann am 06.08.09 08:33:42Man sollte Actelion über das negative Analogelaber der Citigroup informieren!
Du hast Recht, Vorsatz ist nicht auszuschließen! Und warum wird dieser weibliche Analo nicht konkret mit Namen benannt?!
Du hast Recht, Vorsatz ist nicht auszuschließen! Und warum wird dieser weibliche Analo nicht konkret mit Namen benannt?!

Ach, Herr Clozel, wie Sie wahrscheinlich wissen, braucht Incyte dringend Geld und einen Partner. Wie wärs mit Actelion?
--------------
Im ernst, ein Deal zwischen Actelion und Incyte könnte für beide Unternehmen viel Sinn machen. Actelion könnte wahrscheinlich die Europarechte für den JAK-Inhibitor INCB18424 gegen Royalties bekommen und hätte damit ein sehr aussichtsreiches Produkt mit einer wahrscheinlichen Zulassung in 2011 einlizensiert. Auch andere Incyte-Projekte sind absolut spannend! Auf der anderen Seite wäre es vielleicht auch für Incyte gar nicht schlecht, dass Actelion kein Pharma-Riese ist. Auf wissenschaftlicher Ebene sollte man sich ja gut verstehen...
--------------
Im ernst, ein Deal zwischen Actelion und Incyte könnte für beide Unternehmen viel Sinn machen. Actelion könnte wahrscheinlich die Europarechte für den JAK-Inhibitor INCB18424 gegen Royalties bekommen und hätte damit ein sehr aussichtsreiches Produkt mit einer wahrscheinlichen Zulassung in 2011 einlizensiert. Auch andere Incyte-Projekte sind absolut spannend! Auf der anderen Seite wäre es vielleicht auch für Incyte gar nicht schlecht, dass Actelion kein Pharma-Riese ist. Auf wissenschaftlicher Ebene sollte man sich ja gut verstehen...
ALLSCHWIL, SWITZERLAND - 10. August 2009 - Actelion Ltd (SIX: ATLN)
gab heute bekannt, dass die US-amerikanische Zulassungsbehörde FDA
(Food and Drug Administration) den Antrag auf Indikationserweiterung
(supplemental New Drug Application) für Tracleer® (Bosentan) zur
Behandlung auch von Patienten mit leichteren Symptomen der pulmonalen
arteriellen Hypertonie (PAH), die der sogenannten WHO-Funktionsklasse
II zugeordnet werden, genehmigt hat. Die FDA hat auch Actelions
Risikomanagementstrategie (Risk Evaluation and Mitigation Strategy,
REMS) für Tracleer® zugestimmt.
Dr. Jean-Paul Clozel, Chief Executive Officer von Actelion
kommentierte: ´Ärzte in den USA, die PAH-Patienten behandeln, können
jetzt nicht nur bei Patienten in fortgeschrittenem Stadium sondern
auch in den frühen Phasen dieser rasch voranschreitenden und
lebensbedrohenden Krankheit auf Tracleer® zugreifen. Diese
Indikationserweiterung beruht auf EARLY, der einzigen
plazebokontrollierten Doppelblindstudie in dieser Population von
Patienten mit leichteren Symptomen. Die Ergebnisse von EARLY belegen,
dass Tracleer® das Risiko einer klinischen Verschlechterung bei
Patienten im Frühstadium signifikant reduziert und damit den
Krankheitsfortschritt verzögert.
Dr. Vallerie McLaughlin, Associate Professor für Medizin und Director
des Pulmonary Hypertension Program, University of Michigan Health
System, fügte hinzu: ´PAH ist eine fortschreitende und verheerende
Erkrankung und Patienten werden nicht immer so frühzeitig wie es
erforderlich wäre einer Behandlung unterzogen, die sich positiv auf
die Krankheitsprogression auswirken kann. Die Zulassung von Tracleer®
für die Behandlung von Patienten im frühen Krankheitsstadium
ermöglicht Ärzten jetzt den Einsatz eines bewährten Präparats, das zu
vorteilhaften klinischen Ergebnissen führen könnte.´
Dr. Kirk Taylor, Senior Vice President des Bereichs Medizin bei
Actelion Pharmaceuticals US, Inc. kommentierte: ´Die Zulassung der
FDA von Tracleer® für den Einsatz bei Patienten mit PAH im
Frühstadium eröffnet die Möglichkeit klinische Ergebnisse zu
verbessern. Tracleer® ist das einzige Medikament, für das in drei
unabhängigen Phase-III-Studien gezeigt wurde, dass es das Risiko
einer Verschlechterung des klinischen Zustands von PAH-Patienten
signifikant reduziert.´
Tracleer® ist ein oraler dualer Endothelin-Rezeptor-Antagonist der in
den USA [1] für die Behandlung von PAH der Funktionsklassen II, III
und IV und in der EU [2] für die Funktionsklassen II und III
zugelassen ist. Das Unternehmen arbeitet weltweit mit Behörden
zusammen um im Rahmen einer Indikationserweiterung die Behandlung von
PAH-Patienten der Funktionsklasse II einzuschliessen.
Umfrage hebt Vorteile der frühzeitigen Behandlung von Patienten
hervor
Ergebnisse einer 2008 von Harris Interactive durchgeführten Umfrage
[3] zeigten, dass mehr als 90 Prozent der amerikanischen Ärzte, die
PAH-Patienten behandeln, davon überzeugt sind, dass die Erkrankung
oft später diagnostiziert und behandelt wird als es erforderlich
wäre.
Mehr als drei Viertel der Ärzte sehen den klinischen Nutzen einer
frühzeitigen Behandlung und stimmen zu, dass Behandlungsziele die
Zeitverzögerung bis zur klinischen Verschlechterung und die
Verbesserung relevanter hämodynamischer Parameter umfassen
(pulmonalarterieller Druck, pulmonaler Gefässwiderstand, kardialer
Widerstand, mittlerer rechter Vorhofdruck). Allerdings verschrieben
etwas mehr als die Hälfte dieser Ärzte zum Zeitpunkt der Studie
Endothelin-Rezeptor-Antagonisten.
Nach Durchsicht der Daten der Phase-III-EARLY-Studie äusserten mehr
als 90% der im Survey befragten Ärzte, wahrscheinlich Tracleer®
alleine oder in einer Kombinationstherapie für PAH-Patienten der
Funktionsklasse II verwenden zu wollen.
Die Umfrage wurde bei mehr als 300 Pneumologen, Kardiologen und
Rheumatologen in den USA durchgeführt, die innerhalb den
vorangegangenen 12 Monaten mehr als fünf PAH-Patienten behandelt
hatten. Zusätzlich wurden folgende Daten in der Befragung erhoben:
* 94 Prozent der Ärzte stimmen zu, dass PAH später diagnostiziert
wird als erforderlich wäre
* 92 Prozent der Ärzte glauben, dass PAH später behandelt wird als
erforderlich wäre
* 81 Prozent der Ärzte stimmen zu, dass eine frühzeitige Diagnose
und Behandlung der PAH zahlreiche positive klinische Ergebnisse
in dieser Patientenpopulation bewirken würde
* 51 Prozent der Ärzte verordnen gegenwärtig eine Pharmakotherapie
für Patienten im Frühstadium der Funktionsklasse II
* 66 Prozent der Ärzte würden die Verordnung eines
Endothelin-Rezeptor-Antagonisten bei Patienten der
Funktionsklassen I/II erwägen
Über die zulassungsrelevante Phase-III-EARLY-Studie
Ziel der prospektiven, randomisierten, plazebokontrollierten und
multizentrisch durchgeführten EARLY-Studie (Endothelin Antagonist
tRial in miLdlY symptomatic PAH patients) war es, ein besseres
Verständnis der frühen Krankheitsphase zu erhalten sowie die Wirkung
von Bosentan speziell bei PAH-Patienten der WHO-Funktionsklasse II zu
erforschen.
Die im Juni 2008 in ´The Lancet´ [4] veröffentlichten Ergebnisse der
EARLY-Studie (Endothelin Antagonist tRial in miLdlY symptomatic PAH
patients) bestätigen, dass die Krankheit selbst im frühen Stadium
unaufhaltsam fortschreitet. Beleg dafür war die Verschlechterung
sämtlicher untersuchter Parameter in der Plazebo-Gruppe,
einschliesslich der Zunahme der Fälle mit verschlechtertem klinischem
Zustand. Die primären Endpunkte der EARLY-Studie waren als Änderungen
des Lungengefäss-Widerstands (PVR - pulmonary vascular resistance)
und der in einem sechsminütigen Lauftest (6-MWD) gemessenen
körperlichen Leistungsfähigkeit definiert. Das Fortschreiten der
Erkrankung wurde anhand von zwei sekundären Endpunkten untersucht.
Dazu gehörten die Erfassung der Zeit bis zur Verschlechterung des
klinischen Zustands und die Veränderung der WHO-Funktionsklasse.
Nach 24 Wochen Behandlung mit Bosentan verbesserten sich gegenüber
Plazebo die Werte für den Lungengefäss-Widerstand (PVR) hoch
signifikant um 22,6 Prozent.
gab heute bekannt, dass die US-amerikanische Zulassungsbehörde FDA
(Food and Drug Administration) den Antrag auf Indikationserweiterung
(supplemental New Drug Application) für Tracleer® (Bosentan) zur
Behandlung auch von Patienten mit leichteren Symptomen der pulmonalen
arteriellen Hypertonie (PAH), die der sogenannten WHO-Funktionsklasse
II zugeordnet werden, genehmigt hat. Die FDA hat auch Actelions
Risikomanagementstrategie (Risk Evaluation and Mitigation Strategy,
REMS) für Tracleer® zugestimmt.
Dr. Jean-Paul Clozel, Chief Executive Officer von Actelion
kommentierte: ´Ärzte in den USA, die PAH-Patienten behandeln, können
jetzt nicht nur bei Patienten in fortgeschrittenem Stadium sondern
auch in den frühen Phasen dieser rasch voranschreitenden und
lebensbedrohenden Krankheit auf Tracleer® zugreifen. Diese
Indikationserweiterung beruht auf EARLY, der einzigen
plazebokontrollierten Doppelblindstudie in dieser Population von
Patienten mit leichteren Symptomen. Die Ergebnisse von EARLY belegen,
dass Tracleer® das Risiko einer klinischen Verschlechterung bei
Patienten im Frühstadium signifikant reduziert und damit den
Krankheitsfortschritt verzögert.
Dr. Vallerie McLaughlin, Associate Professor für Medizin und Director
des Pulmonary Hypertension Program, University of Michigan Health
System, fügte hinzu: ´PAH ist eine fortschreitende und verheerende
Erkrankung und Patienten werden nicht immer so frühzeitig wie es
erforderlich wäre einer Behandlung unterzogen, die sich positiv auf
die Krankheitsprogression auswirken kann. Die Zulassung von Tracleer®
für die Behandlung von Patienten im frühen Krankheitsstadium
ermöglicht Ärzten jetzt den Einsatz eines bewährten Präparats, das zu
vorteilhaften klinischen Ergebnissen führen könnte.´
Dr. Kirk Taylor, Senior Vice President des Bereichs Medizin bei
Actelion Pharmaceuticals US, Inc. kommentierte: ´Die Zulassung der
FDA von Tracleer® für den Einsatz bei Patienten mit PAH im
Frühstadium eröffnet die Möglichkeit klinische Ergebnisse zu
verbessern. Tracleer® ist das einzige Medikament, für das in drei
unabhängigen Phase-III-Studien gezeigt wurde, dass es das Risiko
einer Verschlechterung des klinischen Zustands von PAH-Patienten
signifikant reduziert.´
Tracleer® ist ein oraler dualer Endothelin-Rezeptor-Antagonist der in
den USA [1] für die Behandlung von PAH der Funktionsklassen II, III
und IV und in der EU [2] für die Funktionsklassen II und III
zugelassen ist. Das Unternehmen arbeitet weltweit mit Behörden
zusammen um im Rahmen einer Indikationserweiterung die Behandlung von
PAH-Patienten der Funktionsklasse II einzuschliessen.
Umfrage hebt Vorteile der frühzeitigen Behandlung von Patienten
hervor
Ergebnisse einer 2008 von Harris Interactive durchgeführten Umfrage
[3] zeigten, dass mehr als 90 Prozent der amerikanischen Ärzte, die
PAH-Patienten behandeln, davon überzeugt sind, dass die Erkrankung
oft später diagnostiziert und behandelt wird als es erforderlich
wäre.
Mehr als drei Viertel der Ärzte sehen den klinischen Nutzen einer
frühzeitigen Behandlung und stimmen zu, dass Behandlungsziele die
Zeitverzögerung bis zur klinischen Verschlechterung und die
Verbesserung relevanter hämodynamischer Parameter umfassen
(pulmonalarterieller Druck, pulmonaler Gefässwiderstand, kardialer
Widerstand, mittlerer rechter Vorhofdruck). Allerdings verschrieben
etwas mehr als die Hälfte dieser Ärzte zum Zeitpunkt der Studie
Endothelin-Rezeptor-Antagonisten.
Nach Durchsicht der Daten der Phase-III-EARLY-Studie äusserten mehr
als 90% der im Survey befragten Ärzte, wahrscheinlich Tracleer®
alleine oder in einer Kombinationstherapie für PAH-Patienten der
Funktionsklasse II verwenden zu wollen.
Die Umfrage wurde bei mehr als 300 Pneumologen, Kardiologen und
Rheumatologen in den USA durchgeführt, die innerhalb den
vorangegangenen 12 Monaten mehr als fünf PAH-Patienten behandelt
hatten. Zusätzlich wurden folgende Daten in der Befragung erhoben:
* 94 Prozent der Ärzte stimmen zu, dass PAH später diagnostiziert
wird als erforderlich wäre
* 92 Prozent der Ärzte glauben, dass PAH später behandelt wird als
erforderlich wäre
* 81 Prozent der Ärzte stimmen zu, dass eine frühzeitige Diagnose
und Behandlung der PAH zahlreiche positive klinische Ergebnisse
in dieser Patientenpopulation bewirken würde
* 51 Prozent der Ärzte verordnen gegenwärtig eine Pharmakotherapie
für Patienten im Frühstadium der Funktionsklasse II
* 66 Prozent der Ärzte würden die Verordnung eines
Endothelin-Rezeptor-Antagonisten bei Patienten der
Funktionsklassen I/II erwägen
Über die zulassungsrelevante Phase-III-EARLY-Studie
Ziel der prospektiven, randomisierten, plazebokontrollierten und
multizentrisch durchgeführten EARLY-Studie (Endothelin Antagonist
tRial in miLdlY symptomatic PAH patients) war es, ein besseres
Verständnis der frühen Krankheitsphase zu erhalten sowie die Wirkung
von Bosentan speziell bei PAH-Patienten der WHO-Funktionsklasse II zu
erforschen.
Die im Juni 2008 in ´The Lancet´ [4] veröffentlichten Ergebnisse der
EARLY-Studie (Endothelin Antagonist tRial in miLdlY symptomatic PAH
patients) bestätigen, dass die Krankheit selbst im frühen Stadium
unaufhaltsam fortschreitet. Beleg dafür war die Verschlechterung
sämtlicher untersuchter Parameter in der Plazebo-Gruppe,
einschliesslich der Zunahme der Fälle mit verschlechtertem klinischem
Zustand. Die primären Endpunkte der EARLY-Studie waren als Änderungen
des Lungengefäss-Widerstands (PVR - pulmonary vascular resistance)
und der in einem sechsminütigen Lauftest (6-MWD) gemessenen
körperlichen Leistungsfähigkeit definiert. Das Fortschreiten der
Erkrankung wurde anhand von zwei sekundären Endpunkten untersucht.
Dazu gehörten die Erfassung der Zeit bis zur Verschlechterung des
klinischen Zustands und die Veränderung der WHO-Funktionsklasse.
Nach 24 Wochen Behandlung mit Bosentan verbesserten sich gegenüber
Plazebo die Werte für den Lungengefäss-Widerstand (PVR) hoch
signifikant um 22,6 Prozent.
Ventavis (Iloprost) gegen pulmonale arterielle Hypertonie erhält US-Zulassung für stärker konzentrierte 20 mcg/ml-Formulierung
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin.
Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
----------------------------------------------------------------------
--------------
ALLSCHWIL, SCHWEIZ -10. August 2009 - Actelion Ltd (SIX: ATLN) teilte
heute mit, dass die amerikanische Food and Drug Administration (FDA)
eine neue Formulierung von Ventavis® in einer Dosisstärke von 20
Mikrogramm pro Milliliter (mcg/ml) zur Behandlung pulmonaler
arterieller Hypertonie (PAH) der Klasse III und IV gemäss New York
Heart Association zugelassen hat. Bei dieser neuen, stärker
konzentrierten Formulierung von 20 mcg/ml kann die gleiche Dosis mit
einem um die Hälfte reduzierten Lösungsvolumen verabreicht werden.
Dies dürfte sich in einer verkürzten Inhalationszeit und einer
verbesserten Therapietreue der Patienten niederschlagen.
Die Zulassung basiert auf technischen Daten, die belegen, dass die
neue Formulierung weder die Funktionsweise des Applikationssystems
noch die Abgabe der erforderlichen Dosis beeinträchtigt.
Dr. Jean-Paul Clozel, Chief Executive Officer von Actelion,
kommentierte: ´Dies ist eine weitere bedeutende Verbesserung von
Ventavis® in den USA und damit für die Patienten, die diese wichtige
Inhalationstherapie bei PAH verwenden. Die einzige inhalierbare
Prostazyklin-Therapie, für welche signifikante Verbesserungen im
Zustand von Patienten, sowohl bei der Leistungsfähigkeit als auch bei
der NYHA Funktionsklasse, nachgewiesen worden sind. [1] 2008 hat
Actelion bereits ein verbessertes Reinigungsverfahren für das
Applikationssystem erfolgreich implementiert, mit der die
erforderliche Zeit zur Pflege des Systems erheblich verkürzt werden
konnte.
Jean-Paul Clozel ergänzte: ´Mit der neuen konzentrierteren
Formulierung, die Patienten in den USA eine noch bequemere Anwendung
von Ventavis® ermöglicht, können wir nun einen weiteren Erfolg
verbuchen. Wir werden uns auch künftig für Ventavis® und unser
PAH-Produktportfolio einsetzen, um die Situation von PAH-Patienten
weiter zu verbessern.´
Dr. Harold Palevsky, Professor für Medizin an der University of
Pennsylvania School of Medicine, Vorsteher der ´Pulmonary Allergy and
Critical Care Division´ und Leiter des ´Pulmonary Vascular Disease
Program´ am Penn Presbyterian Medical Center in Philadelphia
erklärte: ´ Ventavis® ist eine bedeutende Therapieoption für viele
PAH-Patienten. Wenn die Zeit, die für jede einzelne Inhalation
erforderlich ist, verkürzt wird, bleibt diesen Patienten mehr Zeit
für Tätigkeiten, die in ihrem Leben wichtig sind. Ausserdem dürfte
die neue Formulierung dazu beitragen, die Therapietreue der Patienten
zu verbessern, ein wesentlicher Faktor bei jeder PAH-Therapie.´
Über Ventavis®
Ventavis® ist für die Behandlung der pulmonalen arteriellen
Hypertonie (WHO-Gruppe 1) bei Patienten mit NYHA-Symptomen der Klasse
III und IV indiziert.
Im Januar 2007 gab Actelion den erfolgreichen Abschluss des
Zeichnungsangebots von Aktien der CoTherix, Inc. bekannt und stärkte
durch den damit verbundenen Erwerb von Ventavis® seine
Produktepipeline in den USA sowie seine PAH-Franchise. Bayer Schering
Pharma, der Erfinder von Ventavis®, vermarktet das Medikament derzeit
als erstes inhalierbares Prostazyklin in Europa und anderen Ländern
ausserhalb der USA.
###
Anmerkungen für Herausgeber:
Über pulmonale arterielle Hypertonie (PAH)
Pulmonale arterielle Hypertonie (PAH) ist eine chronische,
lebensbedrohliche Erkrankung, die durch abnorm hohen Blutdruck in den
Arterien zwischen Herz und Lunge der betroffenen Patienten
gekennzeichnet ist. Die Funktionen von Herz und Lunge sind stark
beeinträchtigt, was sich in einer eingeschränkten körperlichen
Leistungsfähigkeit und letztendlich einer verkürzten Lebensdauer
niederschlägt. Etwa 100.000 Menschen in Europa und den USA leiden an
primärem Lungenhochdruck oder sekundären Formen der Erkrankung.
Letztere sind Folge von anderen Krankheiten oder Gewebeveränderungen
der Lunge wie Sklerodermie, Lupus, HIV/AIDS oder angeborenen
Herzkrankheiten.
PAH geht mit strukturellen Veränderungen im Gefässsystem der Lunge
und der rechten Herzkammer einher. Jüngste Fortschritte [2] im
Verständnis der für Gefässerkrankungen der Lunge verantwortlichen
pathogenen Faktoren führten zur Entwicklung neuer Therapien, die auf
spezifische Signalwege (Pathways) ausgerichtet sind (den
Prostazyklin-Pathway, den Endothelin-Pathway und den
Stickoxid-Pathway) [3]. Die verfügbaren Therapien haben einen
positiven Einfluss auf PAH, stellen aber keine Heilung dar, und bei
vielen Patienten schreitet die Erkrankung weiter voran. PAH bleibt
daher eine schwere, lebensbedrohliche Krankheit [3,4]. Eine
frühzeitige Diagnose und ein Verständnis für Therapiewahl und
Behandlungsbeginn bleiben kritische Elemente bei der optimalen
Versorgung von PAH-Patienten.
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin.
Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
----------------------------------------------------------------------
--------------
ALLSCHWIL, SCHWEIZ -10. August 2009 - Actelion Ltd (SIX: ATLN) teilte
heute mit, dass die amerikanische Food and Drug Administration (FDA)
eine neue Formulierung von Ventavis® in einer Dosisstärke von 20
Mikrogramm pro Milliliter (mcg/ml) zur Behandlung pulmonaler
arterieller Hypertonie (PAH) der Klasse III und IV gemäss New York
Heart Association zugelassen hat. Bei dieser neuen, stärker
konzentrierten Formulierung von 20 mcg/ml kann die gleiche Dosis mit
einem um die Hälfte reduzierten Lösungsvolumen verabreicht werden.
Dies dürfte sich in einer verkürzten Inhalationszeit und einer
verbesserten Therapietreue der Patienten niederschlagen.
Die Zulassung basiert auf technischen Daten, die belegen, dass die
neue Formulierung weder die Funktionsweise des Applikationssystems
noch die Abgabe der erforderlichen Dosis beeinträchtigt.
Dr. Jean-Paul Clozel, Chief Executive Officer von Actelion,
kommentierte: ´Dies ist eine weitere bedeutende Verbesserung von
Ventavis® in den USA und damit für die Patienten, die diese wichtige
Inhalationstherapie bei PAH verwenden. Die einzige inhalierbare
Prostazyklin-Therapie, für welche signifikante Verbesserungen im
Zustand von Patienten, sowohl bei der Leistungsfähigkeit als auch bei
der NYHA Funktionsklasse, nachgewiesen worden sind. [1] 2008 hat
Actelion bereits ein verbessertes Reinigungsverfahren für das
Applikationssystem erfolgreich implementiert, mit der die
erforderliche Zeit zur Pflege des Systems erheblich verkürzt werden
konnte.
Jean-Paul Clozel ergänzte: ´Mit der neuen konzentrierteren
Formulierung, die Patienten in den USA eine noch bequemere Anwendung
von Ventavis® ermöglicht, können wir nun einen weiteren Erfolg
verbuchen. Wir werden uns auch künftig für Ventavis® und unser
PAH-Produktportfolio einsetzen, um die Situation von PAH-Patienten
weiter zu verbessern.´
Dr. Harold Palevsky, Professor für Medizin an der University of
Pennsylvania School of Medicine, Vorsteher der ´Pulmonary Allergy and
Critical Care Division´ und Leiter des ´Pulmonary Vascular Disease
Program´ am Penn Presbyterian Medical Center in Philadelphia
erklärte: ´ Ventavis® ist eine bedeutende Therapieoption für viele
PAH-Patienten. Wenn die Zeit, die für jede einzelne Inhalation
erforderlich ist, verkürzt wird, bleibt diesen Patienten mehr Zeit
für Tätigkeiten, die in ihrem Leben wichtig sind. Ausserdem dürfte
die neue Formulierung dazu beitragen, die Therapietreue der Patienten
zu verbessern, ein wesentlicher Faktor bei jeder PAH-Therapie.´
Über Ventavis®
Ventavis® ist für die Behandlung der pulmonalen arteriellen
Hypertonie (WHO-Gruppe 1) bei Patienten mit NYHA-Symptomen der Klasse
III und IV indiziert.
Im Januar 2007 gab Actelion den erfolgreichen Abschluss des
Zeichnungsangebots von Aktien der CoTherix, Inc. bekannt und stärkte
durch den damit verbundenen Erwerb von Ventavis® seine
Produktepipeline in den USA sowie seine PAH-Franchise. Bayer Schering
Pharma, der Erfinder von Ventavis®, vermarktet das Medikament derzeit
als erstes inhalierbares Prostazyklin in Europa und anderen Ländern
ausserhalb der USA.
###
Anmerkungen für Herausgeber:
Über pulmonale arterielle Hypertonie (PAH)
Pulmonale arterielle Hypertonie (PAH) ist eine chronische,
lebensbedrohliche Erkrankung, die durch abnorm hohen Blutdruck in den
Arterien zwischen Herz und Lunge der betroffenen Patienten
gekennzeichnet ist. Die Funktionen von Herz und Lunge sind stark
beeinträchtigt, was sich in einer eingeschränkten körperlichen
Leistungsfähigkeit und letztendlich einer verkürzten Lebensdauer
niederschlägt. Etwa 100.000 Menschen in Europa und den USA leiden an
primärem Lungenhochdruck oder sekundären Formen der Erkrankung.
Letztere sind Folge von anderen Krankheiten oder Gewebeveränderungen
der Lunge wie Sklerodermie, Lupus, HIV/AIDS oder angeborenen
Herzkrankheiten.
PAH geht mit strukturellen Veränderungen im Gefässsystem der Lunge
und der rechten Herzkammer einher. Jüngste Fortschritte [2] im
Verständnis der für Gefässerkrankungen der Lunge verantwortlichen
pathogenen Faktoren führten zur Entwicklung neuer Therapien, die auf
spezifische Signalwege (Pathways) ausgerichtet sind (den
Prostazyklin-Pathway, den Endothelin-Pathway und den
Stickoxid-Pathway) [3]. Die verfügbaren Therapien haben einen
positiven Einfluss auf PAH, stellen aber keine Heilung dar, und bei
vielen Patienten schreitet die Erkrankung weiter voran. PAH bleibt
daher eine schwere, lebensbedrohliche Krankheit [3,4]. Eine
frühzeitige Diagnose und ein Verständnis für Therapiewahl und
Behandlungsbeginn bleiben kritische Elemente bei der optimalen
Versorgung von PAH-Patienten.
Die Zulassung von Tracleer bei Klasse II-Patienten in den USA ist zwar eine "Pflichtübung" gewesen und ist kurzfristig "im Kurs schon drin". Objektiv eröffnet diese Zulassung aber beachtliche Wachstumspotentiale in den nächsten Jahren. Vor allem dürfte die nun mögliche frühzeitige Behandlung von PAH-Patienten mit Tracleer Ärzteschaft und Patienten weiter auf Tracleer einstellen und es der Konkurrenz schwerer machen.
Apropos Konkurrenz. Die Meldung zu Ventavis: Jean-Paul Clozel ergänzte: ´Mit der neuen konzentrierteren Formulierung, die Patienten in den USA eine noch bequemere Anwendung
von Ventavis® ermöglicht, können wir nun einen weiteren Erfolg
verbuchen.
Gerade erst hat uns die Citigroup ja erklärt, dass Ventavis Marktanteile verlieren werde, weil es Nachteile bei der Verabreichung habe. Ich sag nochmal: Warten wirs doch erst mal ab! An die Konkurrenz werden die Vorschusslorbeeren hier offenbar sehr schnell verteilt. Ob das gerechtfertigt ist, ist durchaus fraglich.
Apropos Konkurrenz. Die Meldung zu Ventavis: Jean-Paul Clozel ergänzte: ´Mit der neuen konzentrierteren Formulierung, die Patienten in den USA eine noch bequemere Anwendung
von Ventavis® ermöglicht, können wir nun einen weiteren Erfolg
verbuchen.
Gerade erst hat uns die Citigroup ja erklärt, dass Ventavis Marktanteile verlieren werde, weil es Nachteile bei der Verabreichung habe. Ich sag nochmal: Warten wirs doch erst mal ab! An die Konkurrenz werden die Vorschusslorbeeren hier offenbar sehr schnell verteilt. Ob das gerechtfertigt ist, ist durchaus fraglich.
laut Handelszeitung gabs folgende Reaktionen auf die gestrigen Meldungen:
Analysten kommentieren die Neuigkeiten positiv. Die Beobachter von Wegelin sprechen etwa von einem "positiven Newsflow". Zusammen mit der gut gefüllten Produktepipeline mit Blockbusterqualitäten (wie dem Schlafmittel Almorexant), einer soliden Finanzierung und möglichen Zukäufen von Produkten/Medikamenten in der Entwicklungsphase gehöre die Aktie im Bereich Biotech weit oben auf die Einkaufsliste der Investoren.
Für die Analysten der ZKB ist die Zulassung von Tracleer für die Behandlung von Patienten mit mildem Lungenhochdruck (PAH II) "erfreulich", da damit nun auch mildere Formen von Lungenhochdruck frühzeitig mit Tracleer behandelt werden können. Damit komme die von Actelion geplante Indikationsausweitung von Tracleer voran, nachdem die EU-Zulassung in dieser Indikation bereits vor einem Jahr erteilt worden sei. Die Zulassung sei aber erwartet worden und daher bereits in ihren Schätzungen berücksichtigt, so die ZKB-Analysten weiter.
"Leicht positiv" werten die ZKB-Analysten dagegen die Zulassung für Ventavis in einer stärker konzentrierten Form. Die Experten von Vontobel haben die Zulassung der höheren Dosierung von Ventavis dagegen erwartet, wie es in ihrem Kommentar heisst. Folglich bestätigen sie den Actelion-Titel mit "Buy" und bleiben bei ihrem Kursziel von 79 CHF.
Am Markt lösen die Nachrichten am Montagmorgen keine grossen Kursbewegungen aus. Die Neuigkeiten seien zwar positiv, doch grösstenteils erwartet worden und daher bereits im Kurs eingepreist, heisst es am Markt.
Analysten kommentieren die Neuigkeiten positiv. Die Beobachter von Wegelin sprechen etwa von einem "positiven Newsflow". Zusammen mit der gut gefüllten Produktepipeline mit Blockbusterqualitäten (wie dem Schlafmittel Almorexant), einer soliden Finanzierung und möglichen Zukäufen von Produkten/Medikamenten in der Entwicklungsphase gehöre die Aktie im Bereich Biotech weit oben auf die Einkaufsliste der Investoren.
Für die Analysten der ZKB ist die Zulassung von Tracleer für die Behandlung von Patienten mit mildem Lungenhochdruck (PAH II) "erfreulich", da damit nun auch mildere Formen von Lungenhochdruck frühzeitig mit Tracleer behandelt werden können. Damit komme die von Actelion geplante Indikationsausweitung von Tracleer voran, nachdem die EU-Zulassung in dieser Indikation bereits vor einem Jahr erteilt worden sei. Die Zulassung sei aber erwartet worden und daher bereits in ihren Schätzungen berücksichtigt, so die ZKB-Analysten weiter.
"Leicht positiv" werten die ZKB-Analysten dagegen die Zulassung für Ventavis in einer stärker konzentrierten Form. Die Experten von Vontobel haben die Zulassung der höheren Dosierung von Ventavis dagegen erwartet, wie es in ihrem Kommentar heisst. Folglich bestätigen sie den Actelion-Titel mit "Buy" und bleiben bei ihrem Kursziel von 79 CHF.
Am Markt lösen die Nachrichten am Montagmorgen keine grossen Kursbewegungen aus. Die Neuigkeiten seien zwar positiv, doch grösstenteils erwartet worden und daher bereits im Kurs eingepreist, heisst es am Markt.
jaja, alles Plichtübung und selbstverständlich. Und alles eingepreist gewesen ...


JPMorgan hat Actelion von "Neutral" auf "Overweight" hochgestuft und das Kursziel von 61,00 auf 66,00 Schweizer Franken angehoben. Sie sei vorsichtig optimistisch, dass die Studien zum Lungenmittel Tracleer positive Ergebnisse brächten, schrieb Analystin Alexandra Hauber in einer Studie am Mittwoch. Die Absatzaussichten für das Nachfolgemittel Macitentan ließen sich zwar bislang nur schwer abschätzen. Sie taxierte den möglichen Wert dieses Produktes aber auf 15 Franken je Aktie.
AFA0036 2009-08-19/10:51
------
vorsichtig optimistisch, dass die Studien zum Lungenmittel Tracleer positive Ergebnisse brächten
Das kann sich wohl nur auf die Indikation IPF beziehen. Diese zusammengestümperten Agenturtexte sind ein ziemliches Ärgernis.
AFA0036 2009-08-19/10:51
------
vorsichtig optimistisch, dass die Studien zum Lungenmittel Tracleer positive Ergebnisse brächten

Das kann sich wohl nur auf die Indikation IPF beziehen. Diese zusammengestümperten Agenturtexte sind ein ziemliches Ärgernis.

Antwort auf Beitrag Nr.: 37.814.817 von SLGramann am 20.08.09 07:01:52Egal, wir rennen mal wieder auf die 40 EUR Marke zu.
Mal sehen ob wir es diesmal drüber schaffen (der Wechselkurs EUR/CHF) muss natürlich auch mitspielen).
Langsam sollten wir mal die 60 CHF Marke nachhaltig nach oben durchbrechen und dann die 65 CHF zurückerobern.
Mal sehen ob wir es diesmal drüber schaffen (der Wechselkurs EUR/CHF) muss natürlich auch mitspielen).
Langsam sollten wir mal die 60 CHF Marke nachhaltig nach oben durchbrechen und dann die 65 CHF zurückerobern.
Die 100 Tages-Linie dreht nach langer Zeit wieder nach oben - ein gutes Zeichen.
Bin gespannt, ob die 100-Tageslinie bald die 200-Tageslinie von unten schneidet und ob auch die 200-Tageslinie bald nach oben dreht.

aus Cash:
Branchenkennern zufolge profitiert Actelion derzeit von Problemen beim amerikanischen Mitbewerber Genzyme. Genzyme räumte jüngst Lieferschwierigkeiten für das Medikament Cerezyme ein. Cerezyme steht in Konkurrenz mit dem vom Allschwiler Biotechnologiekonzern vermarkteten Zavesca. Zwar rechnet Genzyme noch im Laufe des Septembers mit einer Wiederaufnahme der Cerezyme-Produktion.
Zavesca könnte sich im dritten Quartal dennoch deutlich besser als erwartet entwickelt haben. Bei Actelion war das Präparat im vergangenen Jahr für einen Umsatz von 40 Millionen Franken verantwortlich. In Analystenkreisen gilt Zavesca allerdings als höchst profitabel. Kann Actelion anlässlich der Drittquartalszahlen dank den Problemen bei Genzyme ein weiteres Mal positiv überraschen?
------------------
Cash sieht bei Actelion gern die positiven Aspekte, während sich viele Analysten offenkundig auf die Risiken konzentrieren. Trotzdem: Selbst wenn die Zavesca/Cerezym-Geschichte stimmt, kann ich mir kaum vorstellen, dass sie die Zahlen signifikant beeinflusst. Die Dimension ist eigentlich zu klein.
Branchenkennern zufolge profitiert Actelion derzeit von Problemen beim amerikanischen Mitbewerber Genzyme. Genzyme räumte jüngst Lieferschwierigkeiten für das Medikament Cerezyme ein. Cerezyme steht in Konkurrenz mit dem vom Allschwiler Biotechnologiekonzern vermarkteten Zavesca. Zwar rechnet Genzyme noch im Laufe des Septembers mit einer Wiederaufnahme der Cerezyme-Produktion.
Zavesca könnte sich im dritten Quartal dennoch deutlich besser als erwartet entwickelt haben. Bei Actelion war das Präparat im vergangenen Jahr für einen Umsatz von 40 Millionen Franken verantwortlich. In Analystenkreisen gilt Zavesca allerdings als höchst profitabel. Kann Actelion anlässlich der Drittquartalszahlen dank den Problemen bei Genzyme ein weiteres Mal positiv überraschen?
------------------
Cash sieht bei Actelion gern die positiven Aspekte, während sich viele Analysten offenkundig auf die Risiken konzentrieren. Trotzdem: Selbst wenn die Zavesca/Cerezym-Geschichte stimmt, kann ich mir kaum vorstellen, dass sie die Zahlen signifikant beeinflusst. Die Dimension ist eigentlich zu klein.
Wann werden eigentlich die nächsten Studiendaten zum Schlafmittel erwartet? Noch im Laufe des 4. Quartals?
Antwort auf Beitrag Nr.: 37.891.627 von Fruehrentner am 01.09.09 10:42:17
Ja, ich gehe vom Q4 aus. So sagt es Actelion auch.
Man muss aber sehen, dass, so wichtig diese Daten auch sein werden, sie nicht zulassungsrelevant sein werden. Das heißt, dass Actelion mit diesen P III- Daten keine Zulassungsantrag einreichen wird.
Derzeit verhandelt man mit der FDA über ein SPA (Special Protocol Assessment) auf dessen Grundlage dann die eigentlich relevanten P III-Studien designt werden müssen, die - wenn alles gut geht - irgendwann 2010 beginnen könnten.
Fazit: Es ist noch ein weiter Weg.
Ja, ich gehe vom Q4 aus. So sagt es Actelion auch.
Man muss aber sehen, dass, so wichtig diese Daten auch sein werden, sie nicht zulassungsrelevant sein werden. Das heißt, dass Actelion mit diesen P III- Daten keine Zulassungsantrag einreichen wird.
Derzeit verhandelt man mit der FDA über ein SPA (Special Protocol Assessment) auf dessen Grundlage dann die eigentlich relevanten P III-Studien designt werden müssen, die - wenn alles gut geht - irgendwann 2010 beginnen könnten.
Fazit: Es ist noch ein weiter Weg.

Antwort auf Beitrag Nr.: 37.892.093 von SLGramann am 01.09.09 11:31:08Danke für die Info. Ist bekannt, ob es Anfang oder eher Ende des 4. Quartals bekannt gegeben werden wird?
Auch wenn die anstehenden P-III Daten nicht zulassungsrelevant sind, kursrelevant sind sie allemal, denke ich
Auch wenn die anstehenden P-III Daten nicht zulassungsrelevant sind, kursrelevant sind sie allemal, denke ich

KURSZIEL/Actelion: Kepler erhöht auf 73 ( 68 ) CHF - BUY
Zürich (awp) - Die Analysten von Kepler gehen bei der Actelion Ltd von höheren Umsätzen mit dem Medikament Zavesca aus. Das Nischenprodukt weise substanzielles Aufwärtspotenzial auf, schreibt Analyst Tero Weckroth. Dieser erhöht seine längerfristigen Umsatzschätzungen auf Konzernebene. Aufgrund von Lieferproblemen bei der Konkurrenz rechnet Weckroth mit einem starken Quartalsergebnis. Er hebt sein Kursziel
für die Aktien auf 73 ( 68 ) CHF an und bekräftigt die Anlageeinstufung Buy.
###
Heute auf Höchstkurs geschlossen, satte 2,0 % zugelegt. Der Angriff auf die 65 CHF Marke beginnt offenbar
Zürich (awp) - Die Analysten von Kepler gehen bei der Actelion Ltd von höheren Umsätzen mit dem Medikament Zavesca aus. Das Nischenprodukt weise substanzielles Aufwärtspotenzial auf, schreibt Analyst Tero Weckroth. Dieser erhöht seine längerfristigen Umsatzschätzungen auf Konzernebene. Aufgrund von Lieferproblemen bei der Konkurrenz rechnet Weckroth mit einem starken Quartalsergebnis. Er hebt sein Kursziel
für die Aktien auf 73 ( 68 ) CHF an und bekräftigt die Anlageeinstufung Buy.
###
Heute auf Höchstkurs geschlossen, satte 2,0 % zugelegt. Der Angriff auf die 65 CHF Marke beginnt offenbar

Published: 17:35 08.09.2009 GMT+2 /HUGIN /Source: Actelion Pharmaceuticals Ltd /SIX: ATLN /ISIN: CH0010532478
Actelion updates US Healthcare Professionals for patients with type 1 Gaucher disease - Information on the potential use of Zavesca® (miglustat) oral capsule to address the supply shortage of intravenous enzyme replacement therapy (imiglucerase)
ALLSCHWIL/BASEL, SWITZERLAND - 8 September 2009 - Actelion Ltd (SIX: ATLN) has distributed updated information to Healthcare Professionals who treat type 1 Gaucher patients in the United States regarding the potential use of Zavesca® (miglustat) to minimize the impact of the supply shortage of imiglucerase (produced and marketed by Genzyme Corporation under the brand name Cerezyme®).
Despite strict supply conservation measures currently being implemented, some patients are facing the prospect of an interruption of their imiglucerase treatment. This shortage is now expected to last longer and to affect more patients than initially predicted in June 2009 by the product manufacturer.
Accordingly, Actelion has taken all the necessary steps to ensure access to Zavesca® where this important oral therapy has been approved for use by patients with Type 1 Gaucher disease, as determined by their physicians. In the United States, Zavesca® has been available since 2003.
Following communication with the US Food and Drug Administration (FDA), Actelion has issued the following letter to remind Health Care Professionals in the United States about the availability of Zavesca® as an immediate treatment option for appropriate type 1 Gaucher patients in relation to the current imiglucerase shortage. Health Care Professionals may also receive additional information by email (usmedinfo@actelion.com) or by calling toll-free (866) 228-3546.
###
Notes to the editor:
About Zavesca® Zavesca® (100 mg miglustat capsule) is indicated for the oral treatment of adult patients with mild to moderate type 1 Gaucher disease. Zavesca® may only be used in the treatment of type 1 Gaucher patients for whom enzyme replacement therapy is unsuitable (European Union) or is not a therapeutic option (United States). It is approved in the European Union, the United States, Canada, Switzerland, Brazil, Australia, Turkey, Israel, South Korea and New Zealand.
In the European Union, South Korea and Brazil, Zavesca® is also indicated for the treatment of progressive neurological manifestations in adult patients and paediatric patients with Niemann-Pick type C disease.
About type 1 Gaucher disease
Type 1 Gaucher disease, an inherited autosomal recessive disorder, is the most common disease among all inherited glycosphingolipid storage disorders, affecting approximately 7,000 patients world-wide. It is a multi-system disease characterized by hepatomegaly, splenomegaly, anemia and thrombocytopenia. In addition, bone manifestations are often underdiagnosed and include osteopenia, lytic lesions, chronic pain, acute episodes of 'bone crisis', bone infarcts, and osteonecrosis, resulting in long-term disability. Approved treatments for patients with type 1 Gaucher disease include intravenous enzyme replacement therapy with Cerezyme® (imiglucerase) and oral substrate reduction therapy with Zavesca® (miglustat).
Zavesca® safety information
Gastrointestinal events, mainly diarrhea, have been observed in more than 80% of patients treated with Zavesca®, either at the onset of treatment or intermittently during treatment. The majority of cases are mild and are expected to resolve after the first weeks on therapy. In clinical practice, diarrhea has been observed to respond to diet modification (reduction of lactose and other carbohydrate intake), to taking Zavesca® away from meals, and/or to antidiarrheal medicinal products such as loperamide. In some patients, temporary dose reduction may be necessary. Patients with chronic diarrhea or other persistent gastrointestinal events that do not respond to these interventions should be investigated according to clinical practice. Zavesca® has not been evaluated in patients with a history of significant gastrointestinal disease, including inflammatory bowel disease.
Cases of peripheral neuropathy have been reported in patients with type 1 Gaucher disease treated with Zavesca®. Peripheral neuropathy seems to be more common in patients with type 1 Gaucher disease compared to the general population. All patients should undergo baseline and repeat neurological evaluation. Patients who develop symptoms such as numbness and tingling should have a careful re-assessment of risk benefit.
Zavesca® may cause fetal harm if administered to a pregnant woman and is contraindicated in women who are or who may become pregnant; patients should be informed of the potential hazard to the fetus. There is a risk of impaired fertility in men. Men should maintain reliable contraceptive methods and not plan to conceive while taking Zavesca® and for three months thereafter.
Actelion Ltd
Actelion Ltd is a biopharmaceutical company with its corporate headquarters in Allschwil/Basel, Switzerland. Actelion's first drug Tracleer®, an orally available dual endothelin receptor antagonist, has been approved as a therapy for pulmonary arterial hypertension. Actelion markets Tracleer® through its own subsidiaries in key markets worldwide, including the United States (based in South San Francisco), the European Union, Japan, Canada, Australia and Switzerland. Actelion, founded in late 1997, is a leading player in innovative science related to the endothelium - the single layer of cells separating every blood vessel from the blood stream. Actelion's over 2000 employees focus on the discovery, development and marketing of innovative drugs for significant unmet medical needs. Actelion shares are traded on the SIX Swiss Exchange (ticker symbol: ATLN) as part of the Swiss blue-chip index SMI (Swiss Market Index SMI®).
For further information please contact:
Roland Haefeli
Vice President, Head of Investor Relations & Public Affairs
Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil
+41 61 565 62 62
+1 650 624 69 36
http://www.actelion.com
Actelion updates US Healthcare Professionals for patients with type 1 Gaucher disease - Information on the potential use of Zavesca® (miglustat) oral capsule to address the supply shortage of intravenous enzyme replacement therapy (imiglucerase)
ALLSCHWIL/BASEL, SWITZERLAND - 8 September 2009 - Actelion Ltd (SIX: ATLN) has distributed updated information to Healthcare Professionals who treat type 1 Gaucher patients in the United States regarding the potential use of Zavesca® (miglustat) to minimize the impact of the supply shortage of imiglucerase (produced and marketed by Genzyme Corporation under the brand name Cerezyme®).
Despite strict supply conservation measures currently being implemented, some patients are facing the prospect of an interruption of their imiglucerase treatment. This shortage is now expected to last longer and to affect more patients than initially predicted in June 2009 by the product manufacturer.
Accordingly, Actelion has taken all the necessary steps to ensure access to Zavesca® where this important oral therapy has been approved for use by patients with Type 1 Gaucher disease, as determined by their physicians. In the United States, Zavesca® has been available since 2003.
Following communication with the US Food and Drug Administration (FDA), Actelion has issued the following letter to remind Health Care Professionals in the United States about the availability of Zavesca® as an immediate treatment option for appropriate type 1 Gaucher patients in relation to the current imiglucerase shortage. Health Care Professionals may also receive additional information by email (usmedinfo@actelion.com) or by calling toll-free (866) 228-3546.
###
Notes to the editor:
About Zavesca® Zavesca® (100 mg miglustat capsule) is indicated for the oral treatment of adult patients with mild to moderate type 1 Gaucher disease. Zavesca® may only be used in the treatment of type 1 Gaucher patients for whom enzyme replacement therapy is unsuitable (European Union) or is not a therapeutic option (United States). It is approved in the European Union, the United States, Canada, Switzerland, Brazil, Australia, Turkey, Israel, South Korea and New Zealand.
In the European Union, South Korea and Brazil, Zavesca® is also indicated for the treatment of progressive neurological manifestations in adult patients and paediatric patients with Niemann-Pick type C disease.
About type 1 Gaucher disease
Type 1 Gaucher disease, an inherited autosomal recessive disorder, is the most common disease among all inherited glycosphingolipid storage disorders, affecting approximately 7,000 patients world-wide. It is a multi-system disease characterized by hepatomegaly, splenomegaly, anemia and thrombocytopenia. In addition, bone manifestations are often underdiagnosed and include osteopenia, lytic lesions, chronic pain, acute episodes of 'bone crisis', bone infarcts, and osteonecrosis, resulting in long-term disability. Approved treatments for patients with type 1 Gaucher disease include intravenous enzyme replacement therapy with Cerezyme® (imiglucerase) and oral substrate reduction therapy with Zavesca® (miglustat).
Zavesca® safety information
Gastrointestinal events, mainly diarrhea, have been observed in more than 80% of patients treated with Zavesca®, either at the onset of treatment or intermittently during treatment. The majority of cases are mild and are expected to resolve after the first weeks on therapy. In clinical practice, diarrhea has been observed to respond to diet modification (reduction of lactose and other carbohydrate intake), to taking Zavesca® away from meals, and/or to antidiarrheal medicinal products such as loperamide. In some patients, temporary dose reduction may be necessary. Patients with chronic diarrhea or other persistent gastrointestinal events that do not respond to these interventions should be investigated according to clinical practice. Zavesca® has not been evaluated in patients with a history of significant gastrointestinal disease, including inflammatory bowel disease.
Cases of peripheral neuropathy have been reported in patients with type 1 Gaucher disease treated with Zavesca®. Peripheral neuropathy seems to be more common in patients with type 1 Gaucher disease compared to the general population. All patients should undergo baseline and repeat neurological evaluation. Patients who develop symptoms such as numbness and tingling should have a careful re-assessment of risk benefit.
Zavesca® may cause fetal harm if administered to a pregnant woman and is contraindicated in women who are or who may become pregnant; patients should be informed of the potential hazard to the fetus. There is a risk of impaired fertility in men. Men should maintain reliable contraceptive methods and not plan to conceive while taking Zavesca® and for three months thereafter.
Actelion Ltd
Actelion Ltd is a biopharmaceutical company with its corporate headquarters in Allschwil/Basel, Switzerland. Actelion's first drug Tracleer®, an orally available dual endothelin receptor antagonist, has been approved as a therapy for pulmonary arterial hypertension. Actelion markets Tracleer® through its own subsidiaries in key markets worldwide, including the United States (based in South San Francisco), the European Union, Japan, Canada, Australia and Switzerland. Actelion, founded in late 1997, is a leading player in innovative science related to the endothelium - the single layer of cells separating every blood vessel from the blood stream. Actelion's over 2000 employees focus on the discovery, development and marketing of innovative drugs for significant unmet medical needs. Actelion shares are traded on the SIX Swiss Exchange (ticker symbol: ATLN) as part of the Swiss blue-chip index SMI (Swiss Market Index SMI®).
For further information please contact:
Roland Haefeli
Vice President, Head of Investor Relations & Public Affairs
Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil
+41 61 565 62 62
+1 650 624 69 36
http://www.actelion.com
Aus dem Actelion-thread auf www.cash.ch schreibt heute ein user folgendes:
Da die Probleme bei Genzyme nun doch länger dauern als gedacht (voraussichtlich bis Mitte November oder Dezember 09) und der Umsatz mit dem Produkt gut 100 Mio. USD pro Monat beträgt, kann man vorsichtig geschätzt für Actelion mit einem zusätzlichen Umsatz bei Zavesca über die ganze Dauer von 100Mio. SFR rechnen.
Nach Abzug der Herstellkosten und Vertrieb dürften es wohl gut 70 Mio sein.Z ieht man nun noch die geschätzen 40 Mio. SFR für die Lizenzzahluhng an Nippon-Shinku für den PGI2 agonist ab,so bleiben gut 30 Mio übrig. Zusammen mit den Neueinführungen sollte dies für gut 476 Mio. Frs. Reingewinn reichen oder 3.90 SFr je Aktie.
Für die einzige Aktie im SMI, die robustes zweistelliges Wachstum bei Umsatz und Gewinn hat und auch in den nächsten Jahren haben wird, ist ein KGV von 16 nicht eben viel.
Da die Probleme bei Genzyme nun doch länger dauern als gedacht (voraussichtlich bis Mitte November oder Dezember 09) und der Umsatz mit dem Produkt gut 100 Mio. USD pro Monat beträgt, kann man vorsichtig geschätzt für Actelion mit einem zusätzlichen Umsatz bei Zavesca über die ganze Dauer von 100Mio. SFR rechnen.
Nach Abzug der Herstellkosten und Vertrieb dürften es wohl gut 70 Mio sein.Z ieht man nun noch die geschätzen 40 Mio. SFR für die Lizenzzahluhng an Nippon-Shinku für den PGI2 agonist ab,so bleiben gut 30 Mio übrig. Zusammen mit den Neueinführungen sollte dies für gut 476 Mio. Frs. Reingewinn reichen oder 3.90 SFr je Aktie.
Für die einzige Aktie im SMI, die robustes zweistelliges Wachstum bei Umsatz und Gewinn hat und auch in den nächsten Jahren haben wird, ist ein KGV von 16 nicht eben viel.
Antwort auf Beitrag Nr.: 37.941.747 von Fruehrentner am 08.09.09 20:56:57auf deutsch nochmal:
08.09.2009 17:35:29
Hugin-News: Actelion Pharmaceuticals Ltd
Actelion informiert US-Ärzte über möglichen Einsatz von Zavesca®
(Miglustat,orale Kapsel) zur Kompensation des Lieferengpasses bei intravenöser Enzym-Ersatztherapie (Imiglucerase) für Patienten mit Typ-1- Gaucher-Krankheit
-------------------------------------------------------------------
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin.
Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
----------------------------------------------------------------------
ALLSCHWIL/BASEL, SCHWEIZ - 8. September 2009 - Actelion Ltd (SIX:
ATLN) hat Ärzte in den USA, die Patienten mit Typ-1-Gaucher-
Krankheit behandeln, in einem Informationsschreiben über den
potenziellen Einsatz von Zavesca® (Miglustat) zum Ausgleich des
Lieferengpasses bei dem von Genzyme Corporation unter dem Markennamen Cerezyme® produzierten und vertriebenen Imiglucerase hingewiesen.
Trotz strikter Massnahmen zur Aufrechterhaltung der Versorgung mit
Imiglucerase müssen einige Patienten mit einer Unterbrechung ihrer
Imiglucerase-Therapie rechnen. Der Lieferengpass wird nun länger
dauern als ursprünglich im Juni 2009 vom Hersteller vorausgesagt, und mehr Patienten werden davon betroffen sein.
Angesichts dieser Situation hat Actelion die erforderlichen
Massnahmen ergriffen, um Patienten mit Typ-1-Gaucher-Krankheit in
Ländern, in denen diese wichtige orale Therapie zugelassen ist,
Zugang zu Zavesca® zu ermöglichen, sofern es vom behandelnden Arzt
verschrieben wurde. In den Vereinigten Staaten ist Zavesca® seit 2003 erhältlich.
Nach einem Informationsaustausch mit der amerikanischen Food and Drug Administration (FDA) hat Actelion den beigefügten Brief verfasst, um Ärzte in den USA angesichts der bestehenden Lieferengpässe bei Imiglucerase auf die sofortige Verfügbarkeit von Zavesca® als Therapieoption für in Frage kommende Patienten mit
Typ-1-Gaucher-Krankheit hinzuweisen. Ärzte können weiterführende
Informationen per E-Mail (usmedinfo@actelion.com) oder über die
Telefonnummer (866) 228-3546 erhalten.
Anmerkungen für Herausgeber
Über Zavesca®
Zavesca® (100 mg Miglustat Kapseln) ist für die orale Therapie
erwachsener Patienten mit leichter bis mittelschwerer
Typ-1-Gaucher-Krankheit zugelassen. Zavesca® darf nur für die
Behandlung von Patienten mit Typ-1-Gaucher-Krankheit eingesetzt
werden, bei denen eine Enzymersatztherapie nicht in Betracht kommt
(Europäische Union) oder keine therapeutische Option darstellt
(Vereinigte Staaten). Das Medikament ist in der Europäischen Union,
den USA, Kanada, der Schweiz, Brasilien, Australien, der Türkei,
Israel, Südkorea und Neuseeland zugelassen.
Über Typ-1-Gaucher- Krankheit
Typ-1-Gaucher-Krankheit, eine autosomal rezessiv vererbte Krankheit,
ist die häufigste angeborene Glykosphingolipid-Speicherkrankheit, an
der weltweit etwa 7000 Patienten leiden. Es ist eine multisystemische
Erkrankung, die durch eine Vergrösserung von Leber und Milz, Anämie
sowie Thrombozytopenie gekennzeichnet ist. Weitere Symptome betreffen
das Knochensystem und werden bei der Diagnose häufig übersehen.
Hierzu zählen Osteopenie, lytische Läsionen, chronische Schmerzen,
akute Knochenkrisen, Knocheninfarkte und Knochennekrose, die
langfristig zu Behinderung führen. Zur Behandlung von
Typ-1-Gaucher-Krankheit stehen bislang die intravenöse
Enzymersatztherapie Cerezyme® (Imiglucerase) und die orale
Substratreduktionstherapie mit Zavesca® (Miglustat) zur Verfügung.
Sicherheitsinformationen zu Zavesca®
Bei mehr als 80% der mit Zavesca® behandelten Patienten wurden
Magen-Darm-Reaktionen, vor allem Diarrhoe, entweder zu Beginn der
Behandlung oder auch intermittierend, festgestellt. Diese verlaufen
mehrheitlich mild und verschwinden in der Regel nach den ersten
Behandlungswochen von selbst. In der klinischen Praxis zeigte sich,
dass die Diarrhoe durch eine Veränderung der Nahrungszusammensetzung
(Reduzierung der Einnahme von Lactose und anderer Kohlenhydrate), die
Einnahme von Zavesca® ausserhalb der Mahlzeiten und/oder die Einnahme
von Anti-Diarrhoe-Präparaten wie beispielsweise Loperamid unter
Kontrolle gebracht werden konnte. Bei einzelnen Patienten könnte eine
vorübergehende Herabsetzung der Dosis notwendig werden. Patienten mit
chronischer Diarrhoe oder anderen anhaltenden
Gastrointestinalbeschwerden, die auf diese Massnahmen nicht
reagieren, sollten gemäss klinischer Praxis untersucht werden.
Zavesca® ist bisher nicht bei Patienten mit einer
Krankheitsgeschichte schwerwiegender Gastrointestinalerkrankungen wie
chronisch-entzündlichen Darmerkrankungen untersucht worden.
Bei mit Zavesca® behandelten Patienten mit Typ-1-Gaucher-Krankheit
wurden Fälle von peripherer Neuropathie berichtet. Bei Patienten mit
Typ-1-Gaucher-Krankheit treten im Vergleich zur allgemeinen
Bevölkerung häufiger Fälle von peripherer Neuropathie auf. Alle
Patienten sollten sich zu Beginn einer Behandlung und danach in
regelmässigen Abständen einer neurologischen Untersuchung
unterziehen. Bei Patienten, die Symptome wie Taubheit oder Kribbeln
entwickeln, sollten Nutzen und Risiken der Behandlung sorgsam
abgeklärt werden.
Zavesca® kann bei schwangeren Frauen zu Missbildungen des ungeborenen
Lebens führen. Es darf deshalb nicht an Frauen, die schwanger sind
oder es werden können, abgegeben werden; Patienten sollten auf das
Risiko fötaler Missbildungen hingewiesen werden. Die Einnahme kann
bei Männern zur Unfruchtbarkeit führen. Während einer Therapie mit
Zavesca® und bis drei Monate nach Absetzen der Therapie sollten
deshalb Kontrazeptiva verwendet und keine Schwangerschaft geplant
werden.
Actelion Ltd
Actelion Ltd ist ein biopharmazeutisches Unternehmen mit Hauptsitz in
Allschwil/Basel, Schweiz. Actelions erstes Medikament, Tracleer®, ist
ein zur Therapie der pulmonalen arteriellen Hypertonie zugelassener
dualer Endothelin-Rezeptor-Antagonist in Tablettenform. Actelion
vertreibt Tracleer® durch eigene Niederlassungen in den wichtigsten
internationalen Märkten, so den Vereinigten Staaten (mit Sitz in
South San Francisco), der Europäischen Union, Japan, Kanada,
Australien und der Schweiz. Actelion, 1997 gegründet, ist ein
weltweit führendes Unternehmen bei der Erforschung des Endothels. Das
Endothel trennt die Gefässwand vom Blutstrom. Mit über 2.000
Mitarbeitenden konzentriert sich Actelion darauf, innovative
Medikamente in Bereichen mit hohem medizinischem Bedarf zu entdecken,
zu entwickeln und zu vermarkten. Actelion Aktien sind am SIX Swiss
Exchange notiert (Symbol: ATLN) und werden als Teil des Schweizer
Blue-Chip-Index SMI® (Swiss Market Index) gehandelt.
Für weitere Informationen wenden Sie sich bitte an:
Roland Haefeli
Vice President, Head of Investor Relations & Corporate Communication
Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil
+41 61 565 62 62
+1 650 624 69 36
http://www.actelion.com
--- Ende der Mitteilung ---
Actelion Pharmaceuticals Ltd
Gewerbestrasse 16 Allschwil
Schweiz
WKN: 936767 ; ISIN: CH0010532478; Index: SBIOM, SLIFE, SMCI, SMIEXP,
SMIM, SPI, SPIEX;
Notiert: Main Market in SIX Swiss Exchange;
http://hugin.info/131801/R/1339276/320220.pdf
http://www.actelion.com
Copyright © Hugin AS 2009. All rights reserved.
Quelle: dpa-AFX
08.09.2009 17:35:29
Hugin-News: Actelion Pharmaceuticals Ltd
Actelion informiert US-Ärzte über möglichen Einsatz von Zavesca®
(Miglustat,orale Kapsel) zur Kompensation des Lieferengpasses bei intravenöser Enzym-Ersatztherapie (Imiglucerase) für Patienten mit Typ-1- Gaucher-Krankheit
-------------------------------------------------------------------
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin.
Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
----------------------------------------------------------------------
ALLSCHWIL/BASEL, SCHWEIZ - 8. September 2009 - Actelion Ltd (SIX:
ATLN) hat Ärzte in den USA, die Patienten mit Typ-1-Gaucher-
Krankheit behandeln, in einem Informationsschreiben über den
potenziellen Einsatz von Zavesca® (Miglustat) zum Ausgleich des
Lieferengpasses bei dem von Genzyme Corporation unter dem Markennamen Cerezyme® produzierten und vertriebenen Imiglucerase hingewiesen.
Trotz strikter Massnahmen zur Aufrechterhaltung der Versorgung mit
Imiglucerase müssen einige Patienten mit einer Unterbrechung ihrer
Imiglucerase-Therapie rechnen. Der Lieferengpass wird nun länger
dauern als ursprünglich im Juni 2009 vom Hersteller vorausgesagt, und mehr Patienten werden davon betroffen sein.
Angesichts dieser Situation hat Actelion die erforderlichen
Massnahmen ergriffen, um Patienten mit Typ-1-Gaucher-Krankheit in
Ländern, in denen diese wichtige orale Therapie zugelassen ist,
Zugang zu Zavesca® zu ermöglichen, sofern es vom behandelnden Arzt
verschrieben wurde. In den Vereinigten Staaten ist Zavesca® seit 2003 erhältlich.
Nach einem Informationsaustausch mit der amerikanischen Food and Drug Administration (FDA) hat Actelion den beigefügten Brief verfasst, um Ärzte in den USA angesichts der bestehenden Lieferengpässe bei Imiglucerase auf die sofortige Verfügbarkeit von Zavesca® als Therapieoption für in Frage kommende Patienten mit
Typ-1-Gaucher-Krankheit hinzuweisen. Ärzte können weiterführende
Informationen per E-Mail (usmedinfo@actelion.com) oder über die
Telefonnummer (866) 228-3546 erhalten.
Anmerkungen für Herausgeber
Über Zavesca®
Zavesca® (100 mg Miglustat Kapseln) ist für die orale Therapie
erwachsener Patienten mit leichter bis mittelschwerer
Typ-1-Gaucher-Krankheit zugelassen. Zavesca® darf nur für die
Behandlung von Patienten mit Typ-1-Gaucher-Krankheit eingesetzt
werden, bei denen eine Enzymersatztherapie nicht in Betracht kommt
(Europäische Union) oder keine therapeutische Option darstellt
(Vereinigte Staaten). Das Medikament ist in der Europäischen Union,
den USA, Kanada, der Schweiz, Brasilien, Australien, der Türkei,
Israel, Südkorea und Neuseeland zugelassen.
Über Typ-1-Gaucher- Krankheit
Typ-1-Gaucher-Krankheit, eine autosomal rezessiv vererbte Krankheit,
ist die häufigste angeborene Glykosphingolipid-Speicherkrankheit, an
der weltweit etwa 7000 Patienten leiden. Es ist eine multisystemische
Erkrankung, die durch eine Vergrösserung von Leber und Milz, Anämie
sowie Thrombozytopenie gekennzeichnet ist. Weitere Symptome betreffen
das Knochensystem und werden bei der Diagnose häufig übersehen.
Hierzu zählen Osteopenie, lytische Läsionen, chronische Schmerzen,
akute Knochenkrisen, Knocheninfarkte und Knochennekrose, die
langfristig zu Behinderung führen. Zur Behandlung von
Typ-1-Gaucher-Krankheit stehen bislang die intravenöse
Enzymersatztherapie Cerezyme® (Imiglucerase) und die orale
Substratreduktionstherapie mit Zavesca® (Miglustat) zur Verfügung.
Sicherheitsinformationen zu Zavesca®
Bei mehr als 80% der mit Zavesca® behandelten Patienten wurden
Magen-Darm-Reaktionen, vor allem Diarrhoe, entweder zu Beginn der
Behandlung oder auch intermittierend, festgestellt. Diese verlaufen
mehrheitlich mild und verschwinden in der Regel nach den ersten
Behandlungswochen von selbst. In der klinischen Praxis zeigte sich,
dass die Diarrhoe durch eine Veränderung der Nahrungszusammensetzung
(Reduzierung der Einnahme von Lactose und anderer Kohlenhydrate), die
Einnahme von Zavesca® ausserhalb der Mahlzeiten und/oder die Einnahme
von Anti-Diarrhoe-Präparaten wie beispielsweise Loperamid unter
Kontrolle gebracht werden konnte. Bei einzelnen Patienten könnte eine
vorübergehende Herabsetzung der Dosis notwendig werden. Patienten mit
chronischer Diarrhoe oder anderen anhaltenden
Gastrointestinalbeschwerden, die auf diese Massnahmen nicht
reagieren, sollten gemäss klinischer Praxis untersucht werden.
Zavesca® ist bisher nicht bei Patienten mit einer
Krankheitsgeschichte schwerwiegender Gastrointestinalerkrankungen wie
chronisch-entzündlichen Darmerkrankungen untersucht worden.
Bei mit Zavesca® behandelten Patienten mit Typ-1-Gaucher-Krankheit
wurden Fälle von peripherer Neuropathie berichtet. Bei Patienten mit
Typ-1-Gaucher-Krankheit treten im Vergleich zur allgemeinen
Bevölkerung häufiger Fälle von peripherer Neuropathie auf. Alle
Patienten sollten sich zu Beginn einer Behandlung und danach in
regelmässigen Abständen einer neurologischen Untersuchung
unterziehen. Bei Patienten, die Symptome wie Taubheit oder Kribbeln
entwickeln, sollten Nutzen und Risiken der Behandlung sorgsam
abgeklärt werden.
Zavesca® kann bei schwangeren Frauen zu Missbildungen des ungeborenen
Lebens führen. Es darf deshalb nicht an Frauen, die schwanger sind
oder es werden können, abgegeben werden; Patienten sollten auf das
Risiko fötaler Missbildungen hingewiesen werden. Die Einnahme kann
bei Männern zur Unfruchtbarkeit führen. Während einer Therapie mit
Zavesca® und bis drei Monate nach Absetzen der Therapie sollten
deshalb Kontrazeptiva verwendet und keine Schwangerschaft geplant
werden.
Actelion Ltd
Actelion Ltd ist ein biopharmazeutisches Unternehmen mit Hauptsitz in
Allschwil/Basel, Schweiz. Actelions erstes Medikament, Tracleer®, ist
ein zur Therapie der pulmonalen arteriellen Hypertonie zugelassener
dualer Endothelin-Rezeptor-Antagonist in Tablettenform. Actelion
vertreibt Tracleer® durch eigene Niederlassungen in den wichtigsten
internationalen Märkten, so den Vereinigten Staaten (mit Sitz in
South San Francisco), der Europäischen Union, Japan, Kanada,
Australien und der Schweiz. Actelion, 1997 gegründet, ist ein
weltweit führendes Unternehmen bei der Erforschung des Endothels. Das
Endothel trennt die Gefässwand vom Blutstrom. Mit über 2.000
Mitarbeitenden konzentriert sich Actelion darauf, innovative
Medikamente in Bereichen mit hohem medizinischem Bedarf zu entdecken,
zu entwickeln und zu vermarkten. Actelion Aktien sind am SIX Swiss
Exchange notiert (Symbol: ATLN) und werden als Teil des Schweizer
Blue-Chip-Index SMI® (Swiss Market Index) gehandelt.
Für weitere Informationen wenden Sie sich bitte an:
Roland Haefeli
Vice President, Head of Investor Relations & Corporate Communication
Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil
+41 61 565 62 62
+1 650 624 69 36
http://www.actelion.com
--- Ende der Mitteilung ---
Actelion Pharmaceuticals Ltd
Gewerbestrasse 16 Allschwil
Schweiz
WKN: 936767 ; ISIN: CH0010532478; Index: SBIOM, SLIFE, SMCI, SMIEXP,
SMIM, SPI, SPIEX;
Notiert: Main Market in SIX Swiss Exchange;
http://hugin.info/131801/R/1339276/320220.pdf
http://www.actelion.com
Copyright © Hugin AS 2009. All rights reserved.
Quelle: dpa-AFX
hier ein Analo-update:
09.09.2009 11:26:09
Actelion "buy"
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, stuft die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" weiterhin mit dem Rating "buy" ein.
Actelion informiere die US-Ärzte über das Medikament Zavesca (Miglustat). Zavesca sei ein zugelassenes Medikament zur Behandlung der Gaucher-Krankheit Typ 1. Typ-1-Gaucher sei eine genetische Störung, bei der die Patienten bestimmte Lipide nicht mehr abbauen könnten, die sich im Körper ansammeln würden und diesen vergiften könnten. Die Störung sei eine seltene Krankheit, die weltweit rund 20.000 Patienten betreffen dürfte, von denen nur gerade 5.000 diagnostiziert seien.
Derzeit herrsche aufgrund von Fertigungsproblemen ein Mangel bei dem Standardmittel Cerezyme (Genzyme). Der britische Pharmakonzern Shire habe gestern bekannt gegeben, er starte eine großflächige klinische Phase-III-Studie mit dem Medikament Velaglucerase Alfa zur Behandlung von Morbus Gaucher Typ 1. Velaglucerase versuche, ähnlich wie Cerezyme (Imiglucerase), das Enzym, das Patienten mit Morbus Gaucher fehle, zu ersetzen.
Zavesca werde für Patienten mit Morbus Gaucher Typ 1 eingesetzt, die Cerezyme nicht vertragen würden. Die Analysten würden schätzen, dass bisher etwa 500 bis 700 Patienten Zavesca als Behandlungsoption einsetzen würden. Aufgrund der derzeitigen Knappheit bei Cerezyme würden sie ein Aufwärtspotenzial für Actelion sehen, es könnten 200 bis 300 Patienten gewonnen werden, die einem Umsatz von etwa CHF 30 bis 35 Mio. entsprechen würden.
Die Analysten würden bei der Bekanntgabe der Zahlen für das Q3/2009 am 20. Oktober 2009 ein Update zu dieser Frage erwarten. Weiteres Aufwärtspotenzial für ihre Umsatzschätzungen für Zavesca würde sich durch positive Phase-III-Ergebnisse der Maintenance-Studie ergeben, die Zavesca als Alternative zur Enzymersatztherapie untersuche.
Der Umsatz von Zavesca (Miglustat) könnte von einem Anstieg der Nachfrage profitieren, da ein Mangel beim Standardmittel Cerezyme für die Behandlung von Typ-1-Gaucher bestehe. Die Analysten würden trotz ihrer Umsatzprognose von CHF 30 bis 35 Mio. noch Steigerungspotenzial für Zavesca sehen. Dies hätte eine Steigerung ihres DCF-basierten Wertes von CHF 1 zur Folge.
Die Analysten von Vontobel Research bestätigen ihr "buy"-Rating für die Actelion-Aktie und ihr Kursziel von CHF 79. (Analyse vom 09.09.2009) (09.09.2009/ac/a/a)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
Quelle: AKTIENCHECK.DE

09.09.2009 11:26:09
Actelion "buy"
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, stuft die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" weiterhin mit dem Rating "buy" ein.
Actelion informiere die US-Ärzte über das Medikament Zavesca (Miglustat). Zavesca sei ein zugelassenes Medikament zur Behandlung der Gaucher-Krankheit Typ 1. Typ-1-Gaucher sei eine genetische Störung, bei der die Patienten bestimmte Lipide nicht mehr abbauen könnten, die sich im Körper ansammeln würden und diesen vergiften könnten. Die Störung sei eine seltene Krankheit, die weltweit rund 20.000 Patienten betreffen dürfte, von denen nur gerade 5.000 diagnostiziert seien.
Derzeit herrsche aufgrund von Fertigungsproblemen ein Mangel bei dem Standardmittel Cerezyme (Genzyme). Der britische Pharmakonzern Shire habe gestern bekannt gegeben, er starte eine großflächige klinische Phase-III-Studie mit dem Medikament Velaglucerase Alfa zur Behandlung von Morbus Gaucher Typ 1. Velaglucerase versuche, ähnlich wie Cerezyme (Imiglucerase), das Enzym, das Patienten mit Morbus Gaucher fehle, zu ersetzen.
Zavesca werde für Patienten mit Morbus Gaucher Typ 1 eingesetzt, die Cerezyme nicht vertragen würden. Die Analysten würden schätzen, dass bisher etwa 500 bis 700 Patienten Zavesca als Behandlungsoption einsetzen würden. Aufgrund der derzeitigen Knappheit bei Cerezyme würden sie ein Aufwärtspotenzial für Actelion sehen, es könnten 200 bis 300 Patienten gewonnen werden, die einem Umsatz von etwa CHF 30 bis 35 Mio. entsprechen würden.
Die Analysten würden bei der Bekanntgabe der Zahlen für das Q3/2009 am 20. Oktober 2009 ein Update zu dieser Frage erwarten. Weiteres Aufwärtspotenzial für ihre Umsatzschätzungen für Zavesca würde sich durch positive Phase-III-Ergebnisse der Maintenance-Studie ergeben, die Zavesca als Alternative zur Enzymersatztherapie untersuche.
Der Umsatz von Zavesca (Miglustat) könnte von einem Anstieg der Nachfrage profitieren, da ein Mangel beim Standardmittel Cerezyme für die Behandlung von Typ-1-Gaucher bestehe. Die Analysten würden trotz ihrer Umsatzprognose von CHF 30 bis 35 Mio. noch Steigerungspotenzial für Zavesca sehen. Dies hätte eine Steigerung ihres DCF-basierten Wertes von CHF 1 zur Folge.
Die Analysten von Vontobel Research bestätigen ihr "buy"-Rating für die Actelion-Aktie und ihr Kursziel von CHF 79. (Analyse vom 09.09.2009) (09.09.2009/ac/a/a)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
Quelle: AKTIENCHECK.DE

und wieder ein Analo mit upgrade mehr... Jetzt können's auch die Analos nicht mehr ignorieren, dass es mit Actelion weiter aufwärts geht!
KURSZIEL/Actelion: Credit Suisse erhöht auf 77 (74) CHF - OUTPERFORM
Zürich (awp) - Nachdem das Aktienresearch der Credit Suisse die Actelion Ltd in die
Credit Suisse European Focus List aufgenommen hat, heben sie auch das Kursziel auf 77
CHF von anhin 74 CHF an. Der zuständige Analyst Ravi Mehrotra geht davon aus, dass auch
das dritte Quartal für das Unternehmen von guten Nachrichten geprägt sein wird.
Entsprechend korrigiert er seine EPS-Schätzung 2009 um 3% auf 3,55 CHF nach oben. Noch besser soll dann die Situation ab 2010 werden, glaubt der Experte weiter. Er bestätigt sein Anlagerating Outperform.

KURSZIEL/Actelion: Credit Suisse erhöht auf 77 (74) CHF - OUTPERFORM
Zürich (awp) - Nachdem das Aktienresearch der Credit Suisse die Actelion Ltd in die
Credit Suisse European Focus List aufgenommen hat, heben sie auch das Kursziel auf 77
CHF von anhin 74 CHF an. Der zuständige Analyst Ravi Mehrotra geht davon aus, dass auch
das dritte Quartal für das Unternehmen von guten Nachrichten geprägt sein wird.
Entsprechend korrigiert er seine EPS-Schätzung 2009 um 3% auf 3,55 CHF nach oben. Noch besser soll dann die Situation ab 2010 werden, glaubt der Experte weiter. Er bestätigt sein Anlagerating Outperform.

Hier mal der Chart an der Schweizer Heimatbörse. Ob wir die 65 CHF knacken?

user profit aus dem Actelion-thread auf cash.ch schreibt:
Bin mir ziemlich sicher, dass wir in den nächsten 2 Wochen News zu Almorexant bekommen. Diese Woche läuft die 52 Testwoche ab also genau 12 Monate seit Testbeginn. Länger dauerts eigentlich sehr selten, für eine erste Testbewertung.
Es wird also ein spannender Herbst bei Actelion!
Bin mir ziemlich sicher, dass wir in den nächsten 2 Wochen News zu Almorexant bekommen. Diese Woche läuft die 52 Testwoche ab also genau 12 Monate seit Testbeginn. Länger dauerts eigentlich sehr selten, für eine erste Testbewertung.
Es wird also ein spannender Herbst bei Actelion!
Die 200-Tageslinie schwenkt nach oben und wurde zudem von der 100-Tageslinie von unten nach oben durchstoßen- charttechnisch kein schlechtes Zeichen. Allerdings hat sich der Kurs von der 200-Tageslinie recht weit entfernt. Mal sehen, was so kommt, besonders zu Almorexant.

Also irgendwas ist da im Busch

So, die 65 CHF sind nahezu erreicht. Und was jetzt? Rückfall oder endlich mal Durchmarsch bis 70 CHF und darüber?

Sanofi-Aventis muss weitere Daten nachliefern, ist wohl eine kleine Enttäuschung für deren Schlafmittelkandidat:
Sanofi-aventis Receives Complete Response Letter from the FDA for Eplivanserin (Ciltyri®) - 17 Sep 2009
Sanofi-aventis announced that the U.S. Food and Drug Administration (FDA) has issued a complete response letter regarding the company’s New Drug Application (NDA) for eplivanserin (Ciltyri®)
Paris, France | September 16, 2009 | Sanofi-aventis (EURONEXT: SAN and NYSE: SNY) announced today that the U.S. Food and Drug Administration (FDA) has issued a complete response letter regarding the company’s New Drug Application (NDA) for eplivanserin (Ciltyri®). Eplivanserin was reviewed as a potential treatment for patients with chronic insomnia characterized by difficulties with sleep maintenance.
Sanofi-aventis is currently reviewing the content of the complete response letter, in which the FDA has requested additional information regarding benefit-risk. The company will contact the FDA in the coming days to request a meeting to discuss what steps and data would be needed for approval.
About eplivanserin (Ciltyri®)
Eplivanserin, discovered and developed by sanofi-aventis, is a serotonin type 2 A receptor antagonist, and unlike benzodiazepine-receptor agonists (BzRAs), has no affinity for GABA receptors. It has been studied in a clinical development program including nearly 3,000 patients.
SOURCE: Sanofi-aventis
http://www.pipelinereview.com/index.php/2009091729523/Small-…

Sanofi-aventis Receives Complete Response Letter from the FDA for Eplivanserin (Ciltyri®) - 17 Sep 2009
Sanofi-aventis announced that the U.S. Food and Drug Administration (FDA) has issued a complete response letter regarding the company’s New Drug Application (NDA) for eplivanserin (Ciltyri®)
Paris, France | September 16, 2009 | Sanofi-aventis (EURONEXT: SAN and NYSE: SNY) announced today that the U.S. Food and Drug Administration (FDA) has issued a complete response letter regarding the company’s New Drug Application (NDA) for eplivanserin (Ciltyri®). Eplivanserin was reviewed as a potential treatment for patients with chronic insomnia characterized by difficulties with sleep maintenance.
Sanofi-aventis is currently reviewing the content of the complete response letter, in which the FDA has requested additional information regarding benefit-risk. The company will contact the FDA in the coming days to request a meeting to discuss what steps and data would be needed for approval.
About eplivanserin (Ciltyri®)
Eplivanserin, discovered and developed by sanofi-aventis, is a serotonin type 2 A receptor antagonist, and unlike benzodiazepine-receptor agonists (BzRAs), has no affinity for GABA receptors. It has been studied in a clinical development program including nearly 3,000 patients.
SOURCE: Sanofi-aventis
http://www.pipelinereview.com/index.php/2009091729523/Small-…

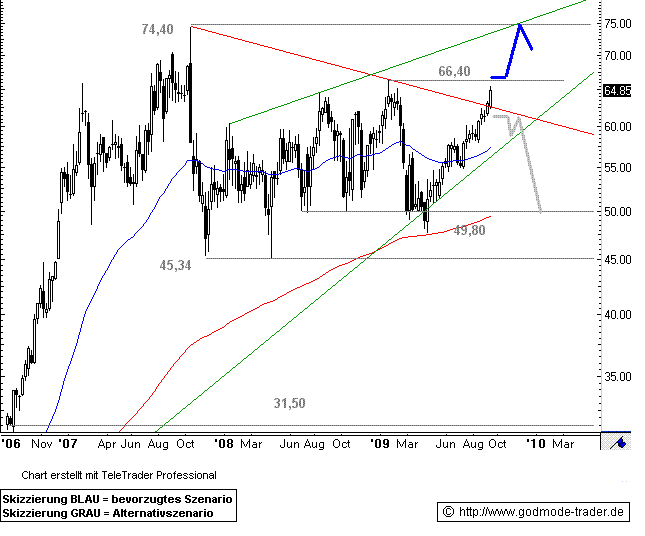
ACTELION Kursverlauf vom 18.08.20006 bis 18.09.2009 (log. Kerzendarstellung / 1 Kerze = 1 Woche)
ACTELION - Allzeithoch könnte bald unter Beschuß geraten
18.09.2009 - 16:48
ACTELION - WKN: 936767 - ISIN: CH0010532478
Börse: SWX in CHF / Kursstand 64,85 CHF
Rückblick: Seit Oktober 2007 war es wenig profitabel in der Actelion- Aktie investiert zu sein- Allerdings konnte sich die Aktie immerhin auf einem relativ hohen Niveau behaupten. Sie lief also deutlich weniger volatil als so viele andere Werte.
Konkret markierte der Wert im Oktober 2007 ein Allzeithoch bei 74,40 CHF. Danach fiel der Wert zunächst schnell auf 45,34 CHF zurück. Seitdem läuft die Aktie seitwärts.
Dabei fiel die Aktie im April kurzzeitig unter die Unterstützung bei 49,80 CHF und damit unter den Aufwärtstrend seit Oktober 2002 zurück. Diesen Rückfall machte der Wert aber eine Woche später wieder wett. Es kam also zu einer Bärenfalle. Wie so oft kommt es nach Bärenfalle auch hier zu starken Aufwärtsbewegung. Denn aktuell nähert sich der Wert dem Widerstand bei 66,40 CHF deutlich an und durchbricht dabei diese Woche den allerdings schwach definierten Abwärtstrend seit 2007. Dieser Trend liegt aktuell bei 62,41 CHF.
Charttechnischer Ausblick: Die Aktie von Actelion steht kurz vor einem Angriff auf das Allzeithoch bei 74,40 CHF. Bestätigt wird dieses Szenario mit einem Wochenschlusskurs über 66,40 CHF.
Ein Rückfall auf Wochenschlusskursbasis unter 62,41 CHF würde die Bullen allerdings einbremsen. Denn viele von ihren würden ihre Positionen glattstellen, was zu einem Abverkauf in Richtung 49,80 CHF führen würde.
Das Schweizer Portal finden Sie unter http://www.godmode-trader.ch
Beachten Sie dort die SMI Matrix mit Ratings und die
jeweils direkt in der Matrix anwählbaren Analysen zu jedem einzelnen Titel http://www.godmode-trader.ch/maerkte/capitas/

Actelion bekräftigt Guidance zu Umsatz und Cash-EBIT für 2009
Allschwil. awp. Die Actelion Ltd hat die Guidance für das laufende Geschäftsjahr bestätigt. Das Management rechnet weiterhin mit einer Zunahme von Umsatz und Cash-EBIT in Lokalwährungen von je 16-19%, wie am Montag aus einer Unternehmenspräsentation anlässlich der UBS Global Life Sciences Conference in New York hervorgeht.
Auf Basis des Geschäftsverlaufs in den ersten zwei Quartalen hatte der biopharmazeutische Konzern die Guidance für das Gesamtjahr im Juli erhöht. Zuvor lautete die Prognose auf ein Umsatzwachstum in Lokalwährungen um 12-15% sowie einem Zuwachs beim Cash-EBIT um 10-12% in Originalwährungen.
Allschwil. awp. Die Actelion Ltd hat die Guidance für das laufende Geschäftsjahr bestätigt. Das Management rechnet weiterhin mit einer Zunahme von Umsatz und Cash-EBIT in Lokalwährungen von je 16-19%, wie am Montag aus einer Unternehmenspräsentation anlässlich der UBS Global Life Sciences Conference in New York hervorgeht.
Auf Basis des Geschäftsverlaufs in den ersten zwei Quartalen hatte der biopharmazeutische Konzern die Guidance für das Gesamtjahr im Juli erhöht. Zuvor lautete die Prognose auf ein Umsatzwachstum in Lokalwährungen um 12-15% sowie einem Zuwachs beim Cash-EBIT um 10-12% in Originalwährungen.
Und wieder gute News 
Sep 22, 2009 07:00 ET
Tracleer Receives Label Extension in Canada for the Treatment of Patients With Mildly Symptomatic WHO Functional Class II Pulmonary Arterial Hypertension
LAVAL, QUEBEC--(Marketwire - Sept. 22, 2009) - Actelion Pharmaceuticals Canada Inc. announced today that Tracleer® (bosentan), a dual endothelin receptor antagonist, has been approved in Canada for the treatment of patients with mildly symptomatic WHO Functional Class II (FC II) pulmonary arterial hypertension (PAH).
Tracleer® has been available to Canadians since 2001, and was previously approved for the treatment of pulmonary arterial hypertension in patients with WHO Functional Class III and IV primary pulmonary hypertension, or pulmonary hypertension secondary to scleroderma or congenital heart disease or human immunodeficiency virus in patients who did not respond adequately to conventional therapy.
Tracleer® is the first PAH treatment ever to be investigated in a clinical study that exclusively enrolled patients with mildly symptomatic WHO FC II. This 185-patient randomized, double-blind, placebo-controlled study provided the basis for this Canadian approval. The indication is now extended to include a prolongation of time to clinical worsening in patients with WHO Functional Class II. (1)
Jacques Archambault, President, Actelion Canada, commented: "The EARLY study has demonstrated that even patients with mild symptoms are at risk of rapid deterioration. I am very proud that Actelion - together with the scientific community - has been able to demonstrate the important role of Tracleer® in delaying disease progression in these patients."
Jacques Archambault continued: "Our dual endothelin receptor antagonist Tracleer® is the only PAH medicine to have demonstrated a delay in disease progression in three independent placebo-controlled, randomized clinical studies. Actelion will now communicate these important clinical findings to the Canadian PAH community to encourage early diagnosis and intervention."
The results from EARLY (Endothelin Antagonist tRial in miLdlY symptomatic PAH patients) - published in "The Lancet" in June, 2008 (2) - document the relentlessly progressive nature of PAH, even in its early stages, and highlight the need for earlier treatment and intervention in PAH management. The PAH progression was evident from the deterioration in all evaluated parameters in the placebo group, including the rate of clinical worsening events. The primary endpoints for the EARLY trial were changes in pulmonary vascular resistance (PVR) and exercise capacity as measured by a 6-minute walk distance (6MWD). PAH progression was assessed by evaluating two secondary endpoints which were time to clinical worsening and change in WHO Functional Class.
The key results of the EARLY study were:
- Significant improvement in PVR, with a reduction of 22.6 percent (p less than 0.0001) after six months of Tracleer compared with placebo.
- 6MWD increased by a mean of 19 meters (p equals 0.0758). Although a positive trend was observed, statistical significance was not seen in the change in 6MWD.
- A significant 77 percent risk reduction in time to clinical worsening (p equals 0.011) was seen after six months of bosentan treatment compared with placebo. Time to clinical worsening was defined by symptomatic progression of PAH, hospitalization for PAH or death. Patients receiving bosentan had a lower incidence of worsening WHO functional class (3.4 percent compared to 13.2 percent when receiving placebo,# equals 0.0285), providing further evidence of delayed PAH progression.
- A subgroup of patients who received concomitant sildenafil also showed improvements in PVR and 6MWD, consistent with the overall results.
- The safety and tolerability profile of bosentan in the EARLY study was consistent with that observed in previous placebo-controlled clinical trials.(3,4)
Dr Sanjay Mehta, London Health Sciences Centre, Ontario, Canada, commented "The results from EARLY show the relentlessly progressive nature of PAH if left untreated, even in its early stages. It is of the utmost importance to screen high risk patients to establish a timely diagnosis of PAH, and then to treat these patients with an evidence-based approach. It is also crucial that all PAH patients, regardless of WHO functional class, are routinely monitored for the earliest signs and symptoms of PAH progression."
There are four WHO Functional Classes (FC) for PAH with Class I being the least severe and Class IV being the most advanced. These reflect the impact of PAH on a patient's life in terms of symptoms and physical limitation. WHO FC II patients are defined as patients with PAH resulting in a slight limitation of physical activity, they are comfortable at rest but ordinary physical activity causes undue dyspnea or fatigue, chest pain or near syncope. (5) Despite being mildly symptomatic, these patients still suffer from a severe and rapidly progressive disease.
Notes to the editor:
About Pulmonary Arterial Hypertension (PAH)
Pulmonary arterial hypertension (PAH) is a chronic, life-threatening disorder characterized by abnormally high blood pressure in the arteries between the heart and lungs of an affected individual. The function of the heart and lungs is severely compromised, manifested by a limited exercise capacity, and, ultimately, a reduced life expectancy. Approximately 100,000 people in Europe and the United States are afflicted with either primary or secondary forms of the disease related to conditions or tissue disorders that affect the lungs, such as scleroderma, lupus, HIV/AIDS or congenital heart disease.
PAH is associated with structural changes in both the pulmonary vasculature and the right ventricle. Recent advances (6) in the understanding of the pathogenic factors leading to the pulmonary vascular disease have led to the development of new therapies targeting specific pathways (the prostacyclin pathway; the endothelin pathway; and the nitric oxide pathway) (7). The available therapies have shown positive treatment effects in patients with PAH, but they do not provide a cure, and in many patients the disease will progress. PAH remains a serious life-threatening condition (7,8). Early recognition and an understanding of the selection and timing of therapeutic options remain critical elements in the optimal management of patients with this disorder.
About Tracleer® in Pulmonary Arterial Hypertension (PAH)
Tracleer® (bosentan), the first oral dual endothelin receptor antagonist, is approved for the treatment of pulmonary arterial hypertension (PAH); in the United States in PAH Functional Class III and IV to improve exercise capacity and decrease the rate of clinical worsening and in Europe in PAH Functional Class III to improve exercise capacity and symptoms as well as PAH Functional Class II where some improvements have also been shown. In the EU, Tracleer® is also indicated to reduce the number of new digital ulcers in patients with systemic sclerosis and ongoing digital ulcer disease.
Tracleer® has been made commercially available by Actelion subsidiaries in the United States, the European Union, Japan, Australia, Canada, Switzerland and other markets worldwide since 2001. In these seven years of clinical experience, more than 68,500 patients have been treated with Tracleer® (9).
Requires attention to two significant safety concerns: Potential for serious liver injury (including rare cases of liver failure and unexplained hepatic cirrhosis in a setting of close monitoring) - Liver monitoring of all patients is essential prior to initiation of treatment and monthly thereafter. High potential for major birth defects -Pregnancy must be excluded and prevented by two forms of birth control; monthly pregnancy tests should be obtained.
References:
1. Tracleer® Product Monograph
2. Galie N, Rubin LJ, Hoeper MM et al. Treatment of patients with mildly
symptomatic pulmonary arterial hypertension with bosentan (EARLY study):
a double-blind, randomised controlled trial. Lancet 2008;371: 2093-2100.
3. Channick RN, Simonneau G, Sitbon O et al. Effects of the dual endothelin-
receptor antagonist bosentan in patients with pulmonary hypertension: a
randomised placebo-controlled study. Lancet 2001;358:1119-23 (Study 351).
4. Rubin LJ, Badesch DB, Barst RJ et al. Bosentan therapy for pulmonary
arterial hypertension. NEJM 2002;346:896-903 (BREATHE-1).
5. Barst RJ, McGoon M, Torbicki A et al. Diagnosis and differential
assessment of pulmonary arterial hypertension. J Am Coll Cardiol 2004;43
(Suppl S):40S-47S
6. Farber HW; Loscalzo J. Mechanisms of disease: pulmonary arterial
hypertension. N. Eng. J. Med. 2004; 351:1655-65.
7. Humbert M; Sitbon O; Simonneau G. Treatment of pulmonary arterial
hypertension. N. Eng. J. Med. 2004;351:1425-36.
8. Humbert M; Morrell NW; Archer SL; et al. Cellular and molecular
pathobiology of pulmonary arterial hypertension. J. Am. Coll. Cardiol.
2004; 43: Suppl. 12: 13S-24S.
9. PSUR - 11th edition
http://www.marketwire.com/press-release/Actelion-Pharmaceuti…

Sep 22, 2009 07:00 ET
Tracleer Receives Label Extension in Canada for the Treatment of Patients With Mildly Symptomatic WHO Functional Class II Pulmonary Arterial Hypertension
LAVAL, QUEBEC--(Marketwire - Sept. 22, 2009) - Actelion Pharmaceuticals Canada Inc. announced today that Tracleer® (bosentan), a dual endothelin receptor antagonist, has been approved in Canada for the treatment of patients with mildly symptomatic WHO Functional Class II (FC II) pulmonary arterial hypertension (PAH).
Tracleer® has been available to Canadians since 2001, and was previously approved for the treatment of pulmonary arterial hypertension in patients with WHO Functional Class III and IV primary pulmonary hypertension, or pulmonary hypertension secondary to scleroderma or congenital heart disease or human immunodeficiency virus in patients who did not respond adequately to conventional therapy.
Tracleer® is the first PAH treatment ever to be investigated in a clinical study that exclusively enrolled patients with mildly symptomatic WHO FC II. This 185-patient randomized, double-blind, placebo-controlled study provided the basis for this Canadian approval. The indication is now extended to include a prolongation of time to clinical worsening in patients with WHO Functional Class II. (1)
Jacques Archambault, President, Actelion Canada, commented: "The EARLY study has demonstrated that even patients with mild symptoms are at risk of rapid deterioration. I am very proud that Actelion - together with the scientific community - has been able to demonstrate the important role of Tracleer® in delaying disease progression in these patients."
Jacques Archambault continued: "Our dual endothelin receptor antagonist Tracleer® is the only PAH medicine to have demonstrated a delay in disease progression in three independent placebo-controlled, randomized clinical studies. Actelion will now communicate these important clinical findings to the Canadian PAH community to encourage early diagnosis and intervention."
The results from EARLY (Endothelin Antagonist tRial in miLdlY symptomatic PAH patients) - published in "The Lancet" in June, 2008 (2) - document the relentlessly progressive nature of PAH, even in its early stages, and highlight the need for earlier treatment and intervention in PAH management. The PAH progression was evident from the deterioration in all evaluated parameters in the placebo group, including the rate of clinical worsening events. The primary endpoints for the EARLY trial were changes in pulmonary vascular resistance (PVR) and exercise capacity as measured by a 6-minute walk distance (6MWD). PAH progression was assessed by evaluating two secondary endpoints which were time to clinical worsening and change in WHO Functional Class.
The key results of the EARLY study were:
- Significant improvement in PVR, with a reduction of 22.6 percent (p less than 0.0001) after six months of Tracleer compared with placebo.
- 6MWD increased by a mean of 19 meters (p equals 0.0758). Although a positive trend was observed, statistical significance was not seen in the change in 6MWD.
- A significant 77 percent risk reduction in time to clinical worsening (p equals 0.011) was seen after six months of bosentan treatment compared with placebo. Time to clinical worsening was defined by symptomatic progression of PAH, hospitalization for PAH or death. Patients receiving bosentan had a lower incidence of worsening WHO functional class (3.4 percent compared to 13.2 percent when receiving placebo,# equals 0.0285), providing further evidence of delayed PAH progression.
- A subgroup of patients who received concomitant sildenafil also showed improvements in PVR and 6MWD, consistent with the overall results.
- The safety and tolerability profile of bosentan in the EARLY study was consistent with that observed in previous placebo-controlled clinical trials.(3,4)
Dr Sanjay Mehta, London Health Sciences Centre, Ontario, Canada, commented "The results from EARLY show the relentlessly progressive nature of PAH if left untreated, even in its early stages. It is of the utmost importance to screen high risk patients to establish a timely diagnosis of PAH, and then to treat these patients with an evidence-based approach. It is also crucial that all PAH patients, regardless of WHO functional class, are routinely monitored for the earliest signs and symptoms of PAH progression."
There are four WHO Functional Classes (FC) for PAH with Class I being the least severe and Class IV being the most advanced. These reflect the impact of PAH on a patient's life in terms of symptoms and physical limitation. WHO FC II patients are defined as patients with PAH resulting in a slight limitation of physical activity, they are comfortable at rest but ordinary physical activity causes undue dyspnea or fatigue, chest pain or near syncope. (5) Despite being mildly symptomatic, these patients still suffer from a severe and rapidly progressive disease.
Notes to the editor:
About Pulmonary Arterial Hypertension (PAH)
Pulmonary arterial hypertension (PAH) is a chronic, life-threatening disorder characterized by abnormally high blood pressure in the arteries between the heart and lungs of an affected individual. The function of the heart and lungs is severely compromised, manifested by a limited exercise capacity, and, ultimately, a reduced life expectancy. Approximately 100,000 people in Europe and the United States are afflicted with either primary or secondary forms of the disease related to conditions or tissue disorders that affect the lungs, such as scleroderma, lupus, HIV/AIDS or congenital heart disease.
PAH is associated with structural changes in both the pulmonary vasculature and the right ventricle. Recent advances (6) in the understanding of the pathogenic factors leading to the pulmonary vascular disease have led to the development of new therapies targeting specific pathways (the prostacyclin pathway; the endothelin pathway; and the nitric oxide pathway) (7). The available therapies have shown positive treatment effects in patients with PAH, but they do not provide a cure, and in many patients the disease will progress. PAH remains a serious life-threatening condition (7,8). Early recognition and an understanding of the selection and timing of therapeutic options remain critical elements in the optimal management of patients with this disorder.
About Tracleer® in Pulmonary Arterial Hypertension (PAH)
Tracleer® (bosentan), the first oral dual endothelin receptor antagonist, is approved for the treatment of pulmonary arterial hypertension (PAH); in the United States in PAH Functional Class III and IV to improve exercise capacity and decrease the rate of clinical worsening and in Europe in PAH Functional Class III to improve exercise capacity and symptoms as well as PAH Functional Class II where some improvements have also been shown. In the EU, Tracleer® is also indicated to reduce the number of new digital ulcers in patients with systemic sclerosis and ongoing digital ulcer disease.
Tracleer® has been made commercially available by Actelion subsidiaries in the United States, the European Union, Japan, Australia, Canada, Switzerland and other markets worldwide since 2001. In these seven years of clinical experience, more than 68,500 patients have been treated with Tracleer® (9).
Requires attention to two significant safety concerns: Potential for serious liver injury (including rare cases of liver failure and unexplained hepatic cirrhosis in a setting of close monitoring) - Liver monitoring of all patients is essential prior to initiation of treatment and monthly thereafter. High potential for major birth defects -Pregnancy must be excluded and prevented by two forms of birth control; monthly pregnancy tests should be obtained.
References:
1. Tracleer® Product Monograph
2. Galie N, Rubin LJ, Hoeper MM et al. Treatment of patients with mildly
symptomatic pulmonary arterial hypertension with bosentan (EARLY study):
a double-blind, randomised controlled trial. Lancet 2008;371: 2093-2100.
3. Channick RN, Simonneau G, Sitbon O et al. Effects of the dual endothelin-
receptor antagonist bosentan in patients with pulmonary hypertension: a
randomised placebo-controlled study. Lancet 2001;358:1119-23 (Study 351).
4. Rubin LJ, Badesch DB, Barst RJ et al. Bosentan therapy for pulmonary
arterial hypertension. NEJM 2002;346:896-903 (BREATHE-1).
5. Barst RJ, McGoon M, Torbicki A et al. Diagnosis and differential
assessment of pulmonary arterial hypertension. J Am Coll Cardiol 2004;43
(Suppl S):40S-47S
6. Farber HW; Loscalzo J. Mechanisms of disease: pulmonary arterial
hypertension. N. Eng. J. Med. 2004; 351:1655-65.
7. Humbert M; Sitbon O; Simonneau G. Treatment of pulmonary arterial
hypertension. N. Eng. J. Med. 2004;351:1425-36.
8. Humbert M; Morrell NW; Archer SL; et al. Cellular and molecular
pathobiology of pulmonary arterial hypertension. J. Am. Coll. Cardiol.
2004; 43: Suppl. 12: 13S-24S.
9. PSUR - 11th edition
http://www.marketwire.com/press-release/Actelion-Pharmaceuti…
Wenn jetzt bald noch gute news zu Almorexant kommen, können wir evt. wirklich bald das Allzeithoch angreifen 

Antwort auf Beitrag Nr.: 38.037.470 von ffdmh am 23.09.09 10:56:51... genau! Und anschließend überschreiten 
Kann nicht mehr lange dauern, bis zu den news zu Almorexant. Die Spannung steigt!

Kann nicht mehr lange dauern, bis zu den news zu Almorexant. Die Spannung steigt!
Ich fress 'nen Besen, wenn die Almorexant-Daten nicht gut ausfallen. Und ich glaube nicht, dass positive Daten schon eingepreist sind.
Alles wartet nun mit Spannung auf die P-III Ergebnisse ...
Alles wartet nun mit Spannung auf die P-III Ergebnisse ...
Antwort auf Beitrag Nr.: 38.039.573 von Fruehrentner am 23.09.09 14:47:01
Tja, über negative Daten wäre ich auch extrem enttäuscht. Mein Investment hängt im Grunde an zwei Projekten: 1.) Almorexant, 2.) S1P1 Agonist. Für beide Projekte kommen in diesem Jahr wichtige Daten. Für Almorexant die ersten P III-Daten und für S1P1 der POC. Hab mich für beides für November eingerichtet - aber keine Ahnung.
Wenn beides schief geht - was ich nicht glaube - ziehe ich mich zurück.
Tja, über negative Daten wäre ich auch extrem enttäuscht. Mein Investment hängt im Grunde an zwei Projekten: 1.) Almorexant, 2.) S1P1 Agonist. Für beide Projekte kommen in diesem Jahr wichtige Daten. Für Almorexant die ersten P III-Daten und für S1P1 der POC. Hab mich für beides für November eingerichtet - aber keine Ahnung.
Wenn beides schief geht - was ich nicht glaube - ziehe ich mich zurück.
Antwort auf Beitrag Nr.: 38.039.689 von SLGramann am 23.09.09 14:58:26Die neuen Daten zu Almorexant sind ja für das 3. Quartal von Actelion offiziell angekündigt.
Trifft dies auch für den S1P1 Agonisten zu? Gibt es seitens Actelion eine definitive Aussage, wann weitere Daten veröffentlicht hierfür werden?
Trifft dies auch für den S1P1 Agonisten zu? Gibt es seitens Actelion eine definitive Aussage, wann weitere Daten veröffentlicht hierfür werden?
Antwort auf Beitrag Nr.: 38.040.029 von Fruehrentner am 23.09.09 15:31:40Zum S1P1 Agonisten hab ich folgendes gefunden:
"The proof-of-concept study with 66 patients in psoriasis completed enrollment in June 2009. Re-sults are expected to become available in the coming months."
Hier ist alles im Überblick als pdf (Stand: Juli 2009):
http://www.actelion.com/documents/corporate/fact_sheets/FS_C…
"The proof-of-concept study with 66 patients in psoriasis completed enrollment in June 2009. Re-sults are expected to become available in the coming months."
Hier ist alles im Überblick als pdf (Stand: Juli 2009):
http://www.actelion.com/documents/corporate/fact_sheets/FS_C…
Antwort auf Beitrag Nr.: 38.040.029 von Fruehrentner am 23.09.09 15:31:40Korrektur: sind für das 4. Quartal 2009 angekündigt.
Antwort auf Beitrag Nr.: 38.040.085 von Fruehrentner am 23.09.09 15:36:49
Genau auf dieser Aussage basiert meine Erwartung. Wenn im Juni die letzten Patienten rekrutiert worden sind, könnte ich mir vorstellen, dass im Oktober die Daten ausgewertet werden können. Noch ein bissel Verzögerung reingerechnet - muss ja auch alles mit Roche abgestimmt werden - sind wir vielleicht im November. Aber wie gesagt, das ist alles nur "aus dem Bauch" und nicht mehr.
Mal sehen, welche Aussagen am 20.10. mit den Q3-Zahlen zur Pipeline kommen. Ist ja auch nicht mehr so lange hin...
Genau auf dieser Aussage basiert meine Erwartung. Wenn im Juni die letzten Patienten rekrutiert worden sind, könnte ich mir vorstellen, dass im Oktober die Daten ausgewertet werden können. Noch ein bissel Verzögerung reingerechnet - muss ja auch alles mit Roche abgestimmt werden - sind wir vielleicht im November. Aber wie gesagt, das ist alles nur "aus dem Bauch" und nicht mehr.
Mal sehen, welche Aussagen am 20.10. mit den Q3-Zahlen zur Pipeline kommen. Ist ja auch nicht mehr so lange hin...
http://www.marketwatch.com/story/actelion-upgraded-to-buy-fr…
Actelion upgraded to buy from neutral at Merrill
By Barbara Kollmeyer
MADRID (MarketWatch) -- Swiss pharmaceutical group Actelion was upgraded to buy from neutral on Wednesday by Merrill Lynch, based on positive expectations from the group's drug used to treat hypertension, Tracleer. "We now see more than a 50% chance of positive headline data in early 2010, based on our analysis of clinical data and feedback from clinicians, and believe that the shares are pricing in limited value for IPF (idiopathic pulmonary fibrosis). Merrill said Tracleer appears to be resistant to the competitive threat from Letairis, and exclusivity should last until November 2015 in the U.S. and 2017 in Europe.
erklärt wohl den schönen Anstieg entgegen dem SMI heute . Und so wies ausschaut rechnen die noch überhaupt nicht mit was anderem als Tracleer... von daher kanns bei guten Almorexant-Daten noch weiter raufgehen
. Und so wies ausschaut rechnen die noch überhaupt nicht mit was anderem als Tracleer... von daher kanns bei guten Almorexant-Daten noch weiter raufgehen 
Actelion upgraded to buy from neutral at Merrill
By Barbara Kollmeyer
MADRID (MarketWatch) -- Swiss pharmaceutical group Actelion was upgraded to buy from neutral on Wednesday by Merrill Lynch, based on positive expectations from the group's drug used to treat hypertension, Tracleer. "We now see more than a 50% chance of positive headline data in early 2010, based on our analysis of clinical data and feedback from clinicians, and believe that the shares are pricing in limited value for IPF (idiopathic pulmonary fibrosis). Merrill said Tracleer appears to be resistant to the competitive threat from Letairis, and exclusivity should last until November 2015 in the U.S. and 2017 in Europe.
erklärt wohl den schönen Anstieg entgegen dem SMI heute
 . Und so wies ausschaut rechnen die noch überhaupt nicht mit was anderem als Tracleer... von daher kanns bei guten Almorexant-Daten noch weiter raufgehen
. Und so wies ausschaut rechnen die noch überhaupt nicht mit was anderem als Tracleer... von daher kanns bei guten Almorexant-Daten noch weiter raufgehen 
Antwort auf Beitrag Nr.: 38.046.186 von ffdmh am 24.09.09 10:17:03http://www.marketwatch.com/story/actelion-upgraded-to-buy-fr…
Danke für die Info zum Analo-upgrade
So langsam scheinen auch diese Typen aufzuwachen.


Schön zu sehen: auch heute wieder die relative Stärke von Actelion.
Ich wette, da wissen schon einige Insider mehr zu Almorexant.
Danke für die Info zum Analo-upgrade

So langsam scheinen auch diese Typen aufzuwachen.



Schön zu sehen: auch heute wieder die relative Stärke von Actelion.
Ich wette, da wissen schon einige Insider mehr zu Almorexant.
Antwort auf Beitrag Nr.: 38.046.186 von ffdmh am 24.09.09 10:17:03
Und so wies ausschaut rechnen die noch überhaupt nicht mit was anderem als Tracleer.
Das sehe ich weitgehend auch so. Tracleer wächst weiter mit befriedigenden Raten und hat durch die Klasse 2-Zulassungen aus diesem Jahr sein Potential weiter erhöht. Die Bewertung von Actelion ist allein durch Tracleer einigermaßen abgesichert.
Mit Almorexant könnte eventuell ein echter Blockbuster kommen. Im Erfolgsfall müsste der Kurs deutlich(!) steigen, denn Almoraxant ist bisher nur wenig eingepreist. Gar nicht, würde ich auch nicht sagen, aber bestenfalls zu 10 bis 15% imho.
Dann haben wir die beiden Projekte Tracleer bei IPF und Clazosentan. Ich mach mir da nicht so große Hoffnungen, vor allem nicht bei IPF, aber das läuft eben aus meiner Sicht alles unter der Rubrik "Bonus". Wenns da 2010 zumindest von einem der Projekte gute Daten geben sollte, dürfte das direkt in einen Bewertungsaufschlag übersetzt werden.
Mit dem S1P1-Projekt ist ein Ansatz in der frühen Entwicklung, der absolut Blockbusterpotential hat. Klar, hier muss man noch lange abwarten und bisher haben wir nicht mal einen proof of concept, aber wenn das richtig gut läuft, dann hat das ein noch größeres Potential als Almorexant imho. Die sehr frühe Verpartnerung mit Roche spricht eindeutig für das Projekt.
Außerdem hat sich Actelion in der Vergangenheit nicht vor Einlizensierungen von Wirkstoffen gescheut und ich denke, dass sie das auch in der Zukunft so tun sollten. (Ich wünsche mir diesbezüglich immer noch einen Deal mit Incyte. )
)
Fazit: Es gibt ne ganze Menge begründete Hoffnung. Indes hängt auf kürzere Sicht doch ne Menge an Almorexant. Diese Daten werden wirklich wichtig sein!
Und so wies ausschaut rechnen die noch überhaupt nicht mit was anderem als Tracleer.
Das sehe ich weitgehend auch so. Tracleer wächst weiter mit befriedigenden Raten und hat durch die Klasse 2-Zulassungen aus diesem Jahr sein Potential weiter erhöht. Die Bewertung von Actelion ist allein durch Tracleer einigermaßen abgesichert.
Mit Almorexant könnte eventuell ein echter Blockbuster kommen. Im Erfolgsfall müsste der Kurs deutlich(!) steigen, denn Almoraxant ist bisher nur wenig eingepreist. Gar nicht, würde ich auch nicht sagen, aber bestenfalls zu 10 bis 15% imho.
Dann haben wir die beiden Projekte Tracleer bei IPF und Clazosentan. Ich mach mir da nicht so große Hoffnungen, vor allem nicht bei IPF, aber das läuft eben aus meiner Sicht alles unter der Rubrik "Bonus". Wenns da 2010 zumindest von einem der Projekte gute Daten geben sollte, dürfte das direkt in einen Bewertungsaufschlag übersetzt werden.
Mit dem S1P1-Projekt ist ein Ansatz in der frühen Entwicklung, der absolut Blockbusterpotential hat. Klar, hier muss man noch lange abwarten und bisher haben wir nicht mal einen proof of concept, aber wenn das richtig gut läuft, dann hat das ein noch größeres Potential als Almorexant imho. Die sehr frühe Verpartnerung mit Roche spricht eindeutig für das Projekt.
Außerdem hat sich Actelion in der Vergangenheit nicht vor Einlizensierungen von Wirkstoffen gescheut und ich denke, dass sie das auch in der Zukunft so tun sollten. (Ich wünsche mir diesbezüglich immer noch einen Deal mit Incyte.
 )
)Fazit: Es gibt ne ganze Menge begründete Hoffnung. Indes hängt auf kürzere Sicht doch ne Menge an Almorexant. Diese Daten werden wirklich wichtig sein!
Antwort auf Beitrag Nr.: 38.046.569 von SLGramann am 24.09.09 10:58:56Sehe ich auch so. Die P-III Daten zu Almorexant werden die News des (Halb)Jahres 2009 für Actelion - ob nun positiv oder negativ wird man sehen.
Aus dem Spiegel:
http://www.spiegel.de/wissenschaft/medizin/0,1518,651170,00.…
Schlafentzug hat möglicherweise mehr Langzeitfolgen als bisher vermutet: Er kann die Bildung von Proteinen im Gehirn fördern, die als Auslöser von Alzheimer gelten. Das haben Versuche mit Mäusen gezeigt. Schlafstörungen sollten deshalb unbedingt behandelt werden, verlangen Forscher.
Washington - Der Mensch braucht regelmäßigen Schlaf. Die Folgen von Schlafentzug sind so gravierend, dass er sogar als Folterinstrument eingesetzt wird, um Gefangene willenlos zu machen. Doch Schlafentzug kann offenbar auch weitreichende Langzeitfolgen haben, wie Forscher der University of Washington in St. Louis bei Experimenten mit Mäusen beobachtet haben. Wenn die Tiere tagelang wachgehalten werden, erhöht sich ihr Alzheimer Risiko. Schlafmangel und ein gestörter Schlaf-Wach-Rhythmus führten im Gehirn der Nager zur Anreicherung sogenannter Beta-Amyloid-Eiweiße, berichtet die Forschergruppe um Jae-Eun Kang im Fachjournal "Science". Diese auch Abeta genannten Proteine spielten eine Schlüsselrolle bei der Entstehung von Alzheimer.
Die Wissenschaftler untersuchten an gentechnisch veränderten Mäusen die Schwankungen, denen der Abeta-Gehalt tagsüber und nachts unterliegt. Gehirnzellen schütten das Protein in die Gewebeflüssigkeit aus, wo es manchmal seine Form ändert. Wenn zu viele veränderte Proteine zugegen sind, verklumpen sie - die sogenannten Alzheimer-Plaques entstehen.
Um den Beginn des Prozesses mitverfolgen zu können, brachten die Forscher die Mäuse drei Wochen lang um den Schlaf: Durch ständige Störungen hielten sie die Tiere wach und ließen sie nur vier Stunden pro Tag in Ruhe. Dabei stellte sich heraus, dass der Abeta-Gehalt negativ mit der Erholungszeit der Mäuse korreliert ist. Das heißt, je weniger Schlaf die Tiere bekommen, desto höher ist die Abeta-Konzentration in ihrer Gewebeflüssigkeit. Wenn die Wissenschaftler zusätzlich verhinderten, dass die Mäuse in den sogenannten REM-Schlaf verfallen, war der Abeta-Gehalt noch höher.
Neben dem Abeta untersuchten die Forscher noch ein zweites Protein namens Orexin, das eine wichtige Rolle im Schlafzyklus spielt: Es reguliert die Wachphasen. Dockt es an bestimmte Rezeptoren an, ist dies ein Signal für den Körper, dass Wachsein angesagt ist. Indem sie die Orexin-Rezeptoren mit einem anderen Molekül blockierten, konnten die Wissenschaftler beweisen, dass auch das Orexin zur Entstehung von Alzheimer beitragen kann: Die Mäuse mit blockierten Rezeptoren schliefen mehr und wiesen eine geringere Abeta-Konzentration in der Gewebeflüssigkeit auf.
"Schlafstörungen müssen nicht nur wegen ihrer akuten Folgen behandelt werden, sondern auch wegen möglicher Langzeitschäden im Gehirn", fasst Co-Autor David Holtzman die Erkenntnisse zusammen. Das Risiko für Alzheimer steige im Alter an, und zusätzlich verändere sich auch der Schlafzyklus immer mehr. Weitere Studien müssten nun zeigen, ob der Grundstein für das höhere Krankheitsrisiko im fortgeschrittenen Lebensalter möglicherweise schon in jungen Jahren gelegt werde.
hda/ddp
----------------
Solche Studien machen natürlich "gutes Wetter" für Almorexant. Denn Almorexant ist ein Orexin-Rezeptor-Antagonist. D.h., dass die Wirkung des Orexins geblockt wird.
Übrigens könnte das Blocken des Orexins theoretisch auch appetitzügelnd wirken. Ob Almorexant so einen Effekt haben würde, kann ich nicht einschätzen, aber ich habe schon länger überlegt, dass das Mittel eine Art "Modedroge" für Mager-Freaks werden könnte. Diese Missbrauchsgefahr sehe ich kritisch und ich habe die Befürchtung, dass das das Engagement der FDA, eine Zulassung zu erteilen, nicht eben befördern würde.
Eine "vorbeugende" Wirkung gegen Alzheimer wäre indes extrem positiv und sollte eine Zulassung "psychologisch" erleichtern.
Bei all dem muss man aber sehr vorsichtig sein, was die Interpretation der Daten angeht. Eine Aussage wie: "Almorexant schützt vor Alzheimer" wäre jedenfalls vollkommen unzulässig.
Alles was ich sagen will, ist, dass sich die Stimmungslage für Almorexant durch diese Forschungen verbessern könnte.
http://www.spiegel.de/wissenschaft/medizin/0,1518,651170,00.…
Schlafentzug hat möglicherweise mehr Langzeitfolgen als bisher vermutet: Er kann die Bildung von Proteinen im Gehirn fördern, die als Auslöser von Alzheimer gelten. Das haben Versuche mit Mäusen gezeigt. Schlafstörungen sollten deshalb unbedingt behandelt werden, verlangen Forscher.
Washington - Der Mensch braucht regelmäßigen Schlaf. Die Folgen von Schlafentzug sind so gravierend, dass er sogar als Folterinstrument eingesetzt wird, um Gefangene willenlos zu machen. Doch Schlafentzug kann offenbar auch weitreichende Langzeitfolgen haben, wie Forscher der University of Washington in St. Louis bei Experimenten mit Mäusen beobachtet haben. Wenn die Tiere tagelang wachgehalten werden, erhöht sich ihr Alzheimer Risiko. Schlafmangel und ein gestörter Schlaf-Wach-Rhythmus führten im Gehirn der Nager zur Anreicherung sogenannter Beta-Amyloid-Eiweiße, berichtet die Forschergruppe um Jae-Eun Kang im Fachjournal "Science". Diese auch Abeta genannten Proteine spielten eine Schlüsselrolle bei der Entstehung von Alzheimer.
Die Wissenschaftler untersuchten an gentechnisch veränderten Mäusen die Schwankungen, denen der Abeta-Gehalt tagsüber und nachts unterliegt. Gehirnzellen schütten das Protein in die Gewebeflüssigkeit aus, wo es manchmal seine Form ändert. Wenn zu viele veränderte Proteine zugegen sind, verklumpen sie - die sogenannten Alzheimer-Plaques entstehen.
Um den Beginn des Prozesses mitverfolgen zu können, brachten die Forscher die Mäuse drei Wochen lang um den Schlaf: Durch ständige Störungen hielten sie die Tiere wach und ließen sie nur vier Stunden pro Tag in Ruhe. Dabei stellte sich heraus, dass der Abeta-Gehalt negativ mit der Erholungszeit der Mäuse korreliert ist. Das heißt, je weniger Schlaf die Tiere bekommen, desto höher ist die Abeta-Konzentration in ihrer Gewebeflüssigkeit. Wenn die Wissenschaftler zusätzlich verhinderten, dass die Mäuse in den sogenannten REM-Schlaf verfallen, war der Abeta-Gehalt noch höher.
Neben dem Abeta untersuchten die Forscher noch ein zweites Protein namens Orexin, das eine wichtige Rolle im Schlafzyklus spielt: Es reguliert die Wachphasen. Dockt es an bestimmte Rezeptoren an, ist dies ein Signal für den Körper, dass Wachsein angesagt ist. Indem sie die Orexin-Rezeptoren mit einem anderen Molekül blockierten, konnten die Wissenschaftler beweisen, dass auch das Orexin zur Entstehung von Alzheimer beitragen kann: Die Mäuse mit blockierten Rezeptoren schliefen mehr und wiesen eine geringere Abeta-Konzentration in der Gewebeflüssigkeit auf.
"Schlafstörungen müssen nicht nur wegen ihrer akuten Folgen behandelt werden, sondern auch wegen möglicher Langzeitschäden im Gehirn", fasst Co-Autor David Holtzman die Erkenntnisse zusammen. Das Risiko für Alzheimer steige im Alter an, und zusätzlich verändere sich auch der Schlafzyklus immer mehr. Weitere Studien müssten nun zeigen, ob der Grundstein für das höhere Krankheitsrisiko im fortgeschrittenen Lebensalter möglicherweise schon in jungen Jahren gelegt werde.
hda/ddp
----------------
Solche Studien machen natürlich "gutes Wetter" für Almorexant. Denn Almorexant ist ein Orexin-Rezeptor-Antagonist. D.h., dass die Wirkung des Orexins geblockt wird.
Übrigens könnte das Blocken des Orexins theoretisch auch appetitzügelnd wirken. Ob Almorexant so einen Effekt haben würde, kann ich nicht einschätzen, aber ich habe schon länger überlegt, dass das Mittel eine Art "Modedroge" für Mager-Freaks werden könnte. Diese Missbrauchsgefahr sehe ich kritisch und ich habe die Befürchtung, dass das das Engagement der FDA, eine Zulassung zu erteilen, nicht eben befördern würde.
Eine "vorbeugende" Wirkung gegen Alzheimer wäre indes extrem positiv und sollte eine Zulassung "psychologisch" erleichtern.
Bei all dem muss man aber sehr vorsichtig sein, was die Interpretation der Daten angeht. Eine Aussage wie: "Almorexant schützt vor Alzheimer" wäre jedenfalls vollkommen unzulässig.
Alles was ich sagen will, ist, dass sich die Stimmungslage für Almorexant durch diese Forschungen verbessern könnte.
Antwort auf Beitrag Nr.: 38.055.111 von SLGramann am 25.09.09 10:37:17
Noch ein kurzer Nachtrag: Ein Vorteil von Almorexant gegenüber herkömmlichen Schlafmitteln soll es ja gerade sein, dass man nicht einfach sediert wird, sondern dass gerade der REM-Schlaf ermöglicht wird. Auch dies ist in diesem Alzheimer-Kontext ja offenbar von Vorteil.
Noch ein kurzer Nachtrag: Ein Vorteil von Almorexant gegenüber herkömmlichen Schlafmitteln soll es ja gerade sein, dass man nicht einfach sediert wird, sondern dass gerade der REM-Schlaf ermöglicht wird. Auch dies ist in diesem Alzheimer-Kontext ja offenbar von Vorteil.
Antwort auf Beitrag Nr.: 38.055.168 von SLGramann am 25.09.09 10:43:59Gernau, das ist ein ganz wichtiger Punkt bei dieser neuen Klasse von Schlafmittel.
Zudem machen die herkömmlichen Schlafmittel abhängig, soviel ich weiss.
Zudem machen die herkömmlichen Schlafmittel abhängig, soviel ich weiss.
28.09.2009 08:26:31
Actelion kaufen
Düsseldorf (aktiencheck.de AG) - Die Experten von "Die Actien-Börse" empfehlen die Actelion-Aktie (ISIN CH0010532478/ WKN 936767) zum Kauf.
Die Gesellschaft wachse derzeit beim Umsatz mit durchschnittlich 20% und beim Gewinn mit fast 24%, was nach Einschätzung der Experten selbst für einen Biotechnologietitel mehr als anspruchsvoll sei. Die Umsatztaxe für das laufende Jahr liege bei 1,7 Mrd. CHF, die Hochrechnungen für drei Jahre würden bis 2,6 Mrd. CHF gehen. Diese Prognosen würden als verhältnismäßig sicher beurteilt, weil das Produktportfolio dafür spreche.
Die derzeitige Börsenbewertung betrage allerdings 7,5 Mrd. CHF bei einem 2009er KGV um 21. Nächstes Jahr liege das KGV bei lediglich 19.
Der Titel stehe unmittelbar vor einem neuen Kaufsignal, das ab 66,00 CHF generiert werde.
Die Experten von "Die Actien-Börse" machen Anlegern den Vorschlag, bei der Aktie von Actelion einen Anfangsbestand aufzubauen, um im Rennen zu bleiben. Das Kursziel werde bei 95,00 CHF gesehen

(Ausgabe 39 vom 26.09.2009) (28.09.2009/ac/a/a)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
Quelle: AKTIENCHECK.DE
Na dann mal los
Actelion kaufen
Düsseldorf (aktiencheck.de AG) - Die Experten von "Die Actien-Börse" empfehlen die Actelion-Aktie (ISIN CH0010532478/ WKN 936767) zum Kauf.
Die Gesellschaft wachse derzeit beim Umsatz mit durchschnittlich 20% und beim Gewinn mit fast 24%, was nach Einschätzung der Experten selbst für einen Biotechnologietitel mehr als anspruchsvoll sei. Die Umsatztaxe für das laufende Jahr liege bei 1,7 Mrd. CHF, die Hochrechnungen für drei Jahre würden bis 2,6 Mrd. CHF gehen. Diese Prognosen würden als verhältnismäßig sicher beurteilt, weil das Produktportfolio dafür spreche.
Die derzeitige Börsenbewertung betrage allerdings 7,5 Mrd. CHF bei einem 2009er KGV um 21. Nächstes Jahr liege das KGV bei lediglich 19.
Der Titel stehe unmittelbar vor einem neuen Kaufsignal, das ab 66,00 CHF generiert werde.
Die Experten von "Die Actien-Börse" machen Anlegern den Vorschlag, bei der Aktie von Actelion einen Anfangsbestand aufzubauen, um im Rennen zu bleiben. Das Kursziel werde bei 95,00 CHF gesehen


(Ausgabe 39 vom 26.09.2009) (28.09.2009/ac/a/a)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
Quelle: AKTIENCHECK.DE
Na dann mal los

Zürich (aktiencheck.de AG) - Martin Wales und Guillaume van Renterghem, Analysten der UBS, stufen die Aktie des schweizerischen Unternehmens Actelion (ISIN CH0010532478/ WKN 936767) weiterhin mit "sell" ein.
Das Actelion-Medikament "Tracleer" könne bei der Behandlung von arteriellem Lungenhochdruck weiter steigende Wachstumsraten verbuchen. Actelion erhöhe die Preise für das Präparat in den USA. Aus diesem Grund hätten die UBS-Analysten ihre EPS-Prognose für die Jahre 2009 und 2010 um 9,8% auf 3,71 CHF und um 9,1% auf 4,22 CHF angehoben. Auf dieser Basis lasse sich für 2009 und 2010 ein KGV von 17,5 und 15,4 ermitteln.
Für "Tracleer" prognostiziere man bis 2015 einen Spitzenumsatz von 2,3 Mrd. CHF. Für das Jahr 2016 sei dann das Auslaufen des "Tracleer"-Patents zu erwarten. Bei "Almorexant" könne nach Ansicht der UBS-Analysten mit positiven Phase III-Daten bei der Behandlung von Schlafstörungen gerechnet werden. Falls ein Special Protocol Assessment (SPA) mit der US-amerikanischen FDA vereinbart werden sollte, sei jedoch ein Anstieg der Entwicklungskosten und eine längere Entwicklungszeit zu erwarten. Das Kursziel der Actelion-Aktie habe man von 54,00 CHF auf 57,00 CHF angehoben.
Das Rating der Analysten der UBS für das Wertpapier von Actelion lautet unverändert "sell". (Analyse vom 29.09.09) (29.09.2009/ac/a/a)
Das Actelion-Medikament "Tracleer" könne bei der Behandlung von arteriellem Lungenhochdruck weiter steigende Wachstumsraten verbuchen. Actelion erhöhe die Preise für das Präparat in den USA. Aus diesem Grund hätten die UBS-Analysten ihre EPS-Prognose für die Jahre 2009 und 2010 um 9,8% auf 3,71 CHF und um 9,1% auf 4,22 CHF angehoben. Auf dieser Basis lasse sich für 2009 und 2010 ein KGV von 17,5 und 15,4 ermitteln.
Für "Tracleer" prognostiziere man bis 2015 einen Spitzenumsatz von 2,3 Mrd. CHF. Für das Jahr 2016 sei dann das Auslaufen des "Tracleer"-Patents zu erwarten. Bei "Almorexant" könne nach Ansicht der UBS-Analysten mit positiven Phase III-Daten bei der Behandlung von Schlafstörungen gerechnet werden. Falls ein Special Protocol Assessment (SPA) mit der US-amerikanischen FDA vereinbart werden sollte, sei jedoch ein Anstieg der Entwicklungskosten und eine längere Entwicklungszeit zu erwarten. Das Kursziel der Actelion-Aktie habe man von 54,00 CHF auf 57,00 CHF angehoben.
Das Rating der Analysten der UBS für das Wertpapier von Actelion lautet unverändert "sell". (Analyse vom 29.09.09) (29.09.2009/ac/a/a)
Antwort auf Beitrag Nr.: 38.079.610 von SLGramann am 29.09.09 18:59:01
Ein SPA ist also negativ, denn es erhöht ja den Aufwand.
So etwas dämlich kurzsichtiges kann nur ein Analyst absondern. Ich wünsche mir jedenfalls, dass man zu einem "safen" SPA mit der FDA kommt. Auf das Jahr hin oder her ist doch echt gesch...
Ein SPA ist also negativ, denn es erhöht ja den Aufwand.
So etwas dämlich kurzsichtiges kann nur ein Analyst absondern. Ich wünsche mir jedenfalls, dass man zu einem "safen" SPA mit der FDA kommt. Auf das Jahr hin oder her ist doch echt gesch...
Antwort auf Beitrag Nr.: 38.079.644 von SLGramann am 29.09.09 19:02:08Hier mal alle Analo-Einschätzungen im Durchschnitt:

http://www.six-swiss-exchange.com/marketpulse/shares/securit…
Derzeit 16 Analysen, durchschnittliches Kursziel: 70,5 CHF (Zeitraum: 21.10.2008 - 29.09.2009)
Kaufen: 10
Halten: 3
Verkaufen: 4

http://www.six-swiss-exchange.com/marketpulse/shares/securit…
Derzeit 16 Analysen, durchschnittliches Kursziel: 70,5 CHF (Zeitraum: 21.10.2008 - 29.09.2009)
Kaufen: 10
Halten: 3
Verkaufen: 4

Antwort auf Beitrag Nr.: 38.079.610 von SLGramann am 29.09.09 18:59:01Die Jungs von der You Be Ass liegen mal wieder voll daneben!! 





Das hier ist nicht so wichtig:
08.10.2009 10:51
Credit Suisse belässt Actelion auf 'Outperform' - Ziel 77 Franken
Credit Suisse hat Actelion vor Quartalszahlen auf "Outperform" mit einem Kursziel von 77,00 Franken belassen. Analyst Ravi Mehrotra passte in einer Studie vom Donnerstag seine Prognosen für das Pharmaunternehmen an die jüngsten Wechselkursveränderungen und in Erwartung einer Abschlagszahlung in Höhe von 30 Millionen Franken an Nippon Shinyaku an. Insgesamt dürften die erwarteten robusten Ergebnisse keine größeren Überraschungen bergen und könnte zu steigenden Markterwartungen für 2010 führen. Auch erschienen ihm die Markterwartungen für das Mittel Tracleer noch immer zu konservativ.
---------------------------------
Aber das hier ist ganz wichtig:
Phase II-Dosisfindungsstudie mit Multiple-Sklerose-Patienten aufgenommen. - Actelion/Roche-S1P1-Partnerschaft erreicht klinisches Etappenziel
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin.
Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
----------------------------------------------------------------------
--------------
ALLSCHWIL, SCHWEIZ - 09 Oktober 2009 - Actelion Ltd (SIX: ATLN)
teilte heute mit, dass der selektive S1P1-Rezeptor-Agonist
ACT-128800/ RG3477 ein wichtiges klinisches Etappenziel erreicht hat.
Für Actelions neuartigen selektiven
S1P1(Sphingosin-1-Phosphat)-Rezeptor-Agonisten wurde eine Phase
IIb-Dosisfindungsstudie bei Patienten mit Multipler Sklerose (MS)
aufgenommen. Dadurch wird eine Meilensteinzahlung in Höhe von USD 20
Millionen seitens Roche an Actelion fällig.
Dr. Guy Braunstein, Leiter klinische Entwicklung bei Actelion,
kommentierte: ´Gemeinsam mit unserem Partner Roche setzen wir uns für
die rasche Entwicklung unseres selektiven S1P1-Rezeptor-Agonisten für
Patienten, die an Autoimmunkrankheiten leiden, ein. Mit der Aufnahme
dieser Dosisfindungsstudie bei MS-Patienten sind wir einen grossen
Schritt vorangekommen.´
Über die Actelion/ Roche- Partnerschaft
Actelion und Roche gingen im Juli 2006 eine exklusive weltweite
Partnerschaft zur gemeinsamen Entwicklung und Vermarktung des
selektiven S1P1-Rezeptor-Agonisten von Actelion ein. Dabei handelt
es sich um einen Immunmodulator, der das Potenzial hat, einmal
täglich oral verabreicht zu werden. Die beiden Unternehmen
beabsichtigen, diese neue Wirksubstanz gemeinsam für verschiedene
Autoimmunerkrankungen zu entwickeln und zu vermarkten. Actelion
übernimmt für den jetzigen selektiven S1P1-Rezeptor-Agonisten
sämtliche Entwicklungskosten für die ersten beiden Indikationen bis
zum Abschluss der Phase-II-Studien. Alle folgenden Entwicklungs- und
Vermarktungskosten werden von Roche und Actelion zu gleichen Teilen
übernommen. Sämtliche Medikamente, die aus dieser Kooperation
entstehen, werden von den beiden Firmen gemeinsam vermarktet und die
Gewinne geteilt.
Diese Zusammenarbeit bezieht sich sowohl auf den derzeit in der
klinischen Entwicklung untersuchten selektiven
S1P1-Rezeptor-Agonisten als auch auf alle weiteren aus Actelions
Froschung hervorgehende S1P1-Rezeptor-Agonisten. Im Juli 2006
erhielt Actelion eine Vorauszahlung in Höhe von USD 75 Millionen.
Sofern andere Etappenziele in der Entwicklung und Zulassung erreicht
werden, hat Actelion Anspruch auf weitere Zahlungen von bis zu USD
535 Millionen für den ersten Wirkstoff in allen dafür infrage
kommenden Indikationen. Zusätzliche Zahlungen werden fällig, wenn
Etappenziele in Entwicklung und Zulassung von weiteren Wirkstoffen
erreicht werden. Auf den Umsatz aller aus der Partnerschaft
hervorgehenden Produkte wird Roche Actelion Lizenzgebühren in
ungenannter Höhe bezahlen.
Selektive S1P1-Rezeptor-Agonisten
Sphingosin-1-Phosphat (S1P) ist ein Phospholipid, das von
Thrombozyten, Mastzellen und anderen Zellen freigesetzt wird. Man
geht heute davon aus, dass S1P mindestens fünf verschiedene
G-Protein-gekoppelte Rezeptoren (GPCR) stimuliert [1,2]: S1P1,2,3,4,
und 5. Die Aktivierung dieser GPCR führt zu vielfältigen biologischen
Reaktionen, darunter Lymphozytenmigration, Vermehrung von
Endothelzellen, Verengung der Blutgefässe, Veränderung des Blutdrucks
u.a.
Das Engagement von Actelion auf dem Gebiet der selektiven
S1P1-Rezeptor-Agonisten begann im Jahr 1999, als man sich mit
GPCR-Rezeptoren auf dem Endothel - einer Zellschicht, die Blutgefässe
auskleidet - beschäftigte. Ergebnis dieser Forschung ist Actelions
oral wirksamer selektiver S1P1-Rezeptor-Agonist.
08.10.2009 10:51
Credit Suisse belässt Actelion auf 'Outperform' - Ziel 77 Franken
Credit Suisse hat Actelion vor Quartalszahlen auf "Outperform" mit einem Kursziel von 77,00 Franken belassen. Analyst Ravi Mehrotra passte in einer Studie vom Donnerstag seine Prognosen für das Pharmaunternehmen an die jüngsten Wechselkursveränderungen und in Erwartung einer Abschlagszahlung in Höhe von 30 Millionen Franken an Nippon Shinyaku an. Insgesamt dürften die erwarteten robusten Ergebnisse keine größeren Überraschungen bergen und könnte zu steigenden Markterwartungen für 2010 führen. Auch erschienen ihm die Markterwartungen für das Mittel Tracleer noch immer zu konservativ.
---------------------------------
Aber das hier ist ganz wichtig:
Phase II-Dosisfindungsstudie mit Multiple-Sklerose-Patienten aufgenommen. - Actelion/Roche-S1P1-Partnerschaft erreicht klinisches Etappenziel
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin.
Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
----------------------------------------------------------------------
--------------
ALLSCHWIL, SCHWEIZ - 09 Oktober 2009 - Actelion Ltd (SIX: ATLN)
teilte heute mit, dass der selektive S1P1-Rezeptor-Agonist
ACT-128800/ RG3477 ein wichtiges klinisches Etappenziel erreicht hat.
Für Actelions neuartigen selektiven
S1P1(Sphingosin-1-Phosphat)-Rezeptor-Agonisten wurde eine Phase
IIb-Dosisfindungsstudie bei Patienten mit Multipler Sklerose (MS)
aufgenommen. Dadurch wird eine Meilensteinzahlung in Höhe von USD 20
Millionen seitens Roche an Actelion fällig.
Dr. Guy Braunstein, Leiter klinische Entwicklung bei Actelion,
kommentierte: ´Gemeinsam mit unserem Partner Roche setzen wir uns für
die rasche Entwicklung unseres selektiven S1P1-Rezeptor-Agonisten für
Patienten, die an Autoimmunkrankheiten leiden, ein. Mit der Aufnahme
dieser Dosisfindungsstudie bei MS-Patienten sind wir einen grossen
Schritt vorangekommen.´
Über die Actelion/ Roche- Partnerschaft
Actelion und Roche gingen im Juli 2006 eine exklusive weltweite
Partnerschaft zur gemeinsamen Entwicklung und Vermarktung des
selektiven S1P1-Rezeptor-Agonisten von Actelion ein. Dabei handelt
es sich um einen Immunmodulator, der das Potenzial hat, einmal
täglich oral verabreicht zu werden. Die beiden Unternehmen
beabsichtigen, diese neue Wirksubstanz gemeinsam für verschiedene
Autoimmunerkrankungen zu entwickeln und zu vermarkten. Actelion
übernimmt für den jetzigen selektiven S1P1-Rezeptor-Agonisten
sämtliche Entwicklungskosten für die ersten beiden Indikationen bis
zum Abschluss der Phase-II-Studien. Alle folgenden Entwicklungs- und
Vermarktungskosten werden von Roche und Actelion zu gleichen Teilen
übernommen. Sämtliche Medikamente, die aus dieser Kooperation
entstehen, werden von den beiden Firmen gemeinsam vermarktet und die
Gewinne geteilt.
Diese Zusammenarbeit bezieht sich sowohl auf den derzeit in der
klinischen Entwicklung untersuchten selektiven
S1P1-Rezeptor-Agonisten als auch auf alle weiteren aus Actelions
Froschung hervorgehende S1P1-Rezeptor-Agonisten. Im Juli 2006
erhielt Actelion eine Vorauszahlung in Höhe von USD 75 Millionen.
Sofern andere Etappenziele in der Entwicklung und Zulassung erreicht
werden, hat Actelion Anspruch auf weitere Zahlungen von bis zu USD
535 Millionen für den ersten Wirkstoff in allen dafür infrage
kommenden Indikationen. Zusätzliche Zahlungen werden fällig, wenn
Etappenziele in Entwicklung und Zulassung von weiteren Wirkstoffen
erreicht werden. Auf den Umsatz aller aus der Partnerschaft
hervorgehenden Produkte wird Roche Actelion Lizenzgebühren in
ungenannter Höhe bezahlen.
Selektive S1P1-Rezeptor-Agonisten
Sphingosin-1-Phosphat (S1P) ist ein Phospholipid, das von
Thrombozyten, Mastzellen und anderen Zellen freigesetzt wird. Man
geht heute davon aus, dass S1P mindestens fünf verschiedene
G-Protein-gekoppelte Rezeptoren (GPCR) stimuliert [1,2]: S1P1,2,3,4,
und 5. Die Aktivierung dieser GPCR führt zu vielfältigen biologischen
Reaktionen, darunter Lymphozytenmigration, Vermehrung von
Endothelzellen, Verengung der Blutgefässe, Veränderung des Blutdrucks
u.a.
Das Engagement von Actelion auf dem Gebiet der selektiven
S1P1-Rezeptor-Agonisten begann im Jahr 1999, als man sich mit
GPCR-Rezeptoren auf dem Endothel - einer Zellschicht, die Blutgefässe
auskleidet - beschäftigte. Ergebnis dieser Forschung ist Actelions
oral wirksamer selektiver S1P1-Rezeptor-Agonist.
Antwort auf Beitrag Nr.: 38.144.839 von SLGramann am 09.10.09 07:33:38
Zur S1P1-Meldung will ich nochmals betonen, dass meiner Meinung nach in diesen Projekten theoretisch(!) noch mehr Potential stecken könnte, als in Almorexant.
Jetzt warten wir mal auf die ersten P II-Daten in der Indikation Psoriasis. Die könnten durchaus in den nächsten Wochen (Oktober, eher November) veröffentlicht werden.
Zur S1P1-Meldung will ich nochmals betonen, dass meiner Meinung nach in diesen Projekten theoretisch(!) noch mehr Potential stecken könnte, als in Almorexant.
Jetzt warten wir mal auf die ersten P II-Daten in der Indikation Psoriasis. Die könnten durchaus in den nächsten Wochen (Oktober, eher November) veröffentlicht werden.
09.10.2009 07:00:00
Phase II-Dosisfindungsstudie mit Multiple-Sklerose-Patienten aufgenommen. - Actelion/Roche-S1P1-Partnerschaft erreicht klinisches Etappenziel
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin. Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
----------------------------------------------------------------------
ALLSCHWIL, SCHWEIZ - 09 Oktober 2009 - Actelion Ltd (SIX: ATLN) teilte heute mit, dass der selektive S1P1-Rezeptor-Agonist ACT-128800/ RG3477 ein wichtiges klinisches Etappenziel erreicht hat. Für Actelions neuartigen selektiven S1P1(Sphingosin-1-Phosphat)-Rezeptor-Agonisten wurde eine Phase IIb-Dosisfindungsstudie bei Patienten mit Multipler Sklerose (MS) aufgenommen. Dadurch wird eine Meilensteinzahlung in Höhe von USD 20 Millionen seitens Roche an Actelion fällig.
Dr. Guy Braunstein, Leiter klinische Entwicklung bei Actelion, kommentierte: "Gemeinsam mit unserem Partner Roche setzen wir uns für die rasche Entwicklung unseres selektiven S1P1-Rezeptor-Agonisten für Patienten, die an Autoimmunkrankheiten leiden, ein. Mit der Aufnahme dieser Dosisfindungsstudie bei MS-Patienten sind wir einen grossen Schritt vorangekommen."
Über die Actelion/ Roche- Partnerschaft Actelion und Roche gingen im Juli 2006 eine exklusive weltweite Partnerschaft zur gemeinsamen Entwicklung und Vermarktung des selektiven S1P1-Rezeptor-Agonisten von Actelion ein. Dabei handelt es sich um einen Immunmodulator, der das Potenzial hat, einmal täglich oral verabreicht zu werden. Die beiden Unternehmen beabsichtigen, diese neue Wirksubstanz gemeinsam für verschiedene Autoimmunerkrankungen zu entwickeln und zu vermarkten. Actelion übernimmt für den jetzigen selektiven S1P1-Rezeptor-Agonisten sämtliche Entwicklungskosten für die ersten beiden Indikationen bis zum Abschluss der Phase-II-Studien. Alle folgenden Entwicklungs- und Vermarktungskosten werden von Roche und Actelion zu gleichen Teilen übernommen. Sämtliche Medikamente, die aus dieser Kooperation entstehen, werden von den beiden Firmen gemeinsam vermarktet und die Gewinne geteilt. Diese Zusammenarbeit bezieht sich sowohl auf den derzeit in der klinischen Entwicklung untersuchten selektiven S1P1-Rezeptor-Agonisten als auch auf alle weiteren aus Actelions Froschung hervorgehende S1P1-Rezeptor-Agonisten.
Im Juli 2006 erhielt Actelion eine Vorauszahlung in Höhe von USD 75 Millionen. Sofern andere Etappenziele in der Entwicklung und Zulassung erreicht werden, hat Actelion Anspruch auf weitere Zahlungen von bis zu USD 535 Millionen für den ersten Wirkstoff in allen dafür infrage kommenden Indikationen. Zusätzliche Zahlungen werden fällig, wenn Etappenziele in Entwicklung und Zulassung von weiteren Wirkstoffen erreicht werden. Auf den Umsatz aller aus der Partnerschaft hervorgehenden Produkte wird Roche Actelion Lizenzgebühren in ungenannter Höhe bezahlen.
Selektive S1P1-Rezeptor-Agonisten Sphingosin-1-Phosphat (S1P) ist ein Phospholipid, das von Thrombozyten, Mastzellen und anderen Zellen freigesetzt wird. Man geht heute davon aus, dass S1P mindestens fünf verschiedene G-Protein-gekoppelte Rezeptoren (GPCR) stimuliert [1,2]: S1P1,2,3,4, und 5. Die Aktivierung dieser GPCR führt zu vielfältigen biologischen Reaktionen, darunter Lymphozytenmigration, Vermehrung von Endothelzellen, Verengung der Blutgefässe, Veränderung des Blutdrucks u.a. Das Engagement von Actelion auf dem Gebiet der selektiven S1P1-Rezeptor-Agonisten begann im Jahr 1999, als man sich mit GPCR-Rezeptoren auf dem Endothel - einer Zellschicht, die Blutgefässe auskleidet - beschäftigte. Ergebnis dieser Forschung ist Actelions oral wirksamer selektiver S1P1-Rezeptor-Agonist.
###
Hinweise für Herausgeber
Über Autoimmunkrankheiten
Autoimmunkrankheiten sind Erkrankungen, welche durch eine Reaktion des Immunsystems gegen körpereigenes Gewebe verursacht werden. Die Gründe dafür sind nicht bekannt. Zu den häufigsten Krankheitstypen gehören Psoriasis, rheumatoide Arthritis, Multiple Sklerose, entzündliche Darmerkrankung und die Abstossung von transplantierten Organen. Millionen Menschen auf der ganzen Welt sind von Autoimmunkrankheiten betroffen.
Über Multiple Sklerose
Multiple Sklerose (MS) ist eine entzündliche Autoimmunkrankheit des zentralen Nervensystems (ZNS). MS ist die häufigste Ursache für progressive neurologische Behinderungen bei jungen Erwachsenen [3,4]. Diese demyelinisierende (entmarkende) Krankheit ist durch heterogene klinische Manifestationen, einen unberechenbaren Verlauf und unterschiedliche Prognosen gekennzeichnet. MS ist das Ergebnis einer Abfolge von Ereignissen: ausgehend von einer Aktivierung des Immunsystems kommt es zu akuten herdförmigen entzündlich-demyelisierenden Läsionen und einem Verlust von Nervenfasern, die nur teilweise wiederhergestellt werden. Die Folge sind chronische, herdförmige Nervenfaserschäden (Plaques) im Gehirn und Rückenmark. Die Vielzahl der Symptome von MS ist die Folge einer Entmarkung der Nervenfasern, durch die die Übertragung der Nervenimpulse an den verschiedenen Läsionsherden im Gehirn und des Rückenmarks gebremst oder blockiert wird. Aufgrund wiederholt auftretender Krankheitsschübe kann es allmählich zu einem Verlust neurologischer Funktionen kommen. Von 100.00 Personen erkranken jährlich sieben an MS. Die Krankheitsursache ist bisher noch ungeklärt. Die Prävalenzrate liegt je nach ethnischer Zugehörigkeit und geographischer Breite zwischen 50 bis 120 pro 100.000 Einwohnern [3]. Gemäss der vorherrschenden wissenschaftlichen Meinung handelt es sich bei MS um eine immunbedingte, demyelinisierende Krankheit, die bei entsprechender genetischer Prädisposition durch unbekannte Umweltfaktoren ausgelöst wird.
Literaturnachweis
1. Huwiler A, Pfeilschifter J. Biochem Pharmacol. 2008 May 15;75(10):1893-900. Review. 2. Rivera J, Proia RL, Olivera A.Nat Rev Immunol. 2008 Oct;8(10):753-63. Review. 3. Compston A, Coles A. Multiple sclerosis. Lancet 2002;359:1221-31. 4. Compston A, Coles A. Multiple sclerosis. Lancet 2008;372:1502-18.
Über Actelion Ltd
Actelion Ltd ist ein biopharmazeutisches Unternehmen mit Hauptsitz in Allschwil/Basel, Schweiz. Actelions erstes Medikament, Tracleer®, ist ein zur Therapie der pulmonalen arteriellen Hypertonie zugelassener dualer Endothelin-Rezeptor-Antagonist in Tablettenform. Actelion vertreibt Tracleer® durch eigene Niederlassungen in den wichtigsten internationalen Märkten, so den Vereinigten Staaten (mit Sitz in South San Francisco), der Europäischen Union, Japan, Kanada, Australien und der Schweiz. Actelion, 1997 gegründet, ist ein weltweit führendes Unternehmen bei der Erforschung des Endothels. Das Endothel trennt die Gefässwand vom Blutstrom. Mit über 2.000 Mitarbeitenden konzentriert sich Actelion darauf, innovative Medikamente in Bereichen mit hohem medizinischem Bedarf zu entdecken, zu entwickeln und zu vermarkten. Actelion Aktien sind am SIX Swiss Exchange notiert (Symbol: ATLN).
Für weitere Informationen wenden Sie sich bitte an: Roland Haefeli Vice President, Head of Investor Relations & Corporate Communications Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil +41 61 565 62 62 +1 650 624 69 36 http://www.actelion.com
--- Ende der Mitteilung ---
Actelion Pharmaceuticals Ltd Gewerbestrasse 16 Allschwil Schweiz WKN: 936767; ISIN: CH0010532478; Index: SBIOM, SLIFE, SMCI, SMIEXP, SMIM, SPI, SPIEX; Notiert: Main Market in SIX Swiss Exchange; http://www.actelion.com http://hugin.info/131801/R/1346477/323455.pdf Copyright © Hugin AS 2009. All rights reserved.
Quelle: HUGIN
Phase II-Dosisfindungsstudie mit Multiple-Sklerose-Patienten aufgenommen. - Actelion/Roche-S1P1-Partnerschaft erreicht klinisches Etappenziel
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin. Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
----------------------------------------------------------------------
ALLSCHWIL, SCHWEIZ - 09 Oktober 2009 - Actelion Ltd (SIX: ATLN) teilte heute mit, dass der selektive S1P1-Rezeptor-Agonist ACT-128800/ RG3477 ein wichtiges klinisches Etappenziel erreicht hat. Für Actelions neuartigen selektiven S1P1(Sphingosin-1-Phosphat)-Rezeptor-Agonisten wurde eine Phase IIb-Dosisfindungsstudie bei Patienten mit Multipler Sklerose (MS) aufgenommen. Dadurch wird eine Meilensteinzahlung in Höhe von USD 20 Millionen seitens Roche an Actelion fällig.
Dr. Guy Braunstein, Leiter klinische Entwicklung bei Actelion, kommentierte: "Gemeinsam mit unserem Partner Roche setzen wir uns für die rasche Entwicklung unseres selektiven S1P1-Rezeptor-Agonisten für Patienten, die an Autoimmunkrankheiten leiden, ein. Mit der Aufnahme dieser Dosisfindungsstudie bei MS-Patienten sind wir einen grossen Schritt vorangekommen."
Über die Actelion/ Roche- Partnerschaft Actelion und Roche gingen im Juli 2006 eine exklusive weltweite Partnerschaft zur gemeinsamen Entwicklung und Vermarktung des selektiven S1P1-Rezeptor-Agonisten von Actelion ein. Dabei handelt es sich um einen Immunmodulator, der das Potenzial hat, einmal täglich oral verabreicht zu werden. Die beiden Unternehmen beabsichtigen, diese neue Wirksubstanz gemeinsam für verschiedene Autoimmunerkrankungen zu entwickeln und zu vermarkten. Actelion übernimmt für den jetzigen selektiven S1P1-Rezeptor-Agonisten sämtliche Entwicklungskosten für die ersten beiden Indikationen bis zum Abschluss der Phase-II-Studien. Alle folgenden Entwicklungs- und Vermarktungskosten werden von Roche und Actelion zu gleichen Teilen übernommen. Sämtliche Medikamente, die aus dieser Kooperation entstehen, werden von den beiden Firmen gemeinsam vermarktet und die Gewinne geteilt. Diese Zusammenarbeit bezieht sich sowohl auf den derzeit in der klinischen Entwicklung untersuchten selektiven S1P1-Rezeptor-Agonisten als auch auf alle weiteren aus Actelions Froschung hervorgehende S1P1-Rezeptor-Agonisten.
Im Juli 2006 erhielt Actelion eine Vorauszahlung in Höhe von USD 75 Millionen. Sofern andere Etappenziele in der Entwicklung und Zulassung erreicht werden, hat Actelion Anspruch auf weitere Zahlungen von bis zu USD 535 Millionen für den ersten Wirkstoff in allen dafür infrage kommenden Indikationen. Zusätzliche Zahlungen werden fällig, wenn Etappenziele in Entwicklung und Zulassung von weiteren Wirkstoffen erreicht werden. Auf den Umsatz aller aus der Partnerschaft hervorgehenden Produkte wird Roche Actelion Lizenzgebühren in ungenannter Höhe bezahlen.
Selektive S1P1-Rezeptor-Agonisten Sphingosin-1-Phosphat (S1P) ist ein Phospholipid, das von Thrombozyten, Mastzellen und anderen Zellen freigesetzt wird. Man geht heute davon aus, dass S1P mindestens fünf verschiedene G-Protein-gekoppelte Rezeptoren (GPCR) stimuliert [1,2]: S1P1,2,3,4, und 5. Die Aktivierung dieser GPCR führt zu vielfältigen biologischen Reaktionen, darunter Lymphozytenmigration, Vermehrung von Endothelzellen, Verengung der Blutgefässe, Veränderung des Blutdrucks u.a. Das Engagement von Actelion auf dem Gebiet der selektiven S1P1-Rezeptor-Agonisten begann im Jahr 1999, als man sich mit GPCR-Rezeptoren auf dem Endothel - einer Zellschicht, die Blutgefässe auskleidet - beschäftigte. Ergebnis dieser Forschung ist Actelions oral wirksamer selektiver S1P1-Rezeptor-Agonist.
###
Hinweise für Herausgeber
Über Autoimmunkrankheiten
Autoimmunkrankheiten sind Erkrankungen, welche durch eine Reaktion des Immunsystems gegen körpereigenes Gewebe verursacht werden. Die Gründe dafür sind nicht bekannt. Zu den häufigsten Krankheitstypen gehören Psoriasis, rheumatoide Arthritis, Multiple Sklerose, entzündliche Darmerkrankung und die Abstossung von transplantierten Organen. Millionen Menschen auf der ganzen Welt sind von Autoimmunkrankheiten betroffen.
Über Multiple Sklerose
Multiple Sklerose (MS) ist eine entzündliche Autoimmunkrankheit des zentralen Nervensystems (ZNS). MS ist die häufigste Ursache für progressive neurologische Behinderungen bei jungen Erwachsenen [3,4]. Diese demyelinisierende (entmarkende) Krankheit ist durch heterogene klinische Manifestationen, einen unberechenbaren Verlauf und unterschiedliche Prognosen gekennzeichnet. MS ist das Ergebnis einer Abfolge von Ereignissen: ausgehend von einer Aktivierung des Immunsystems kommt es zu akuten herdförmigen entzündlich-demyelisierenden Läsionen und einem Verlust von Nervenfasern, die nur teilweise wiederhergestellt werden. Die Folge sind chronische, herdförmige Nervenfaserschäden (Plaques) im Gehirn und Rückenmark. Die Vielzahl der Symptome von MS ist die Folge einer Entmarkung der Nervenfasern, durch die die Übertragung der Nervenimpulse an den verschiedenen Läsionsherden im Gehirn und des Rückenmarks gebremst oder blockiert wird. Aufgrund wiederholt auftretender Krankheitsschübe kann es allmählich zu einem Verlust neurologischer Funktionen kommen. Von 100.00 Personen erkranken jährlich sieben an MS. Die Krankheitsursache ist bisher noch ungeklärt. Die Prävalenzrate liegt je nach ethnischer Zugehörigkeit und geographischer Breite zwischen 50 bis 120 pro 100.000 Einwohnern [3]. Gemäss der vorherrschenden wissenschaftlichen Meinung handelt es sich bei MS um eine immunbedingte, demyelinisierende Krankheit, die bei entsprechender genetischer Prädisposition durch unbekannte Umweltfaktoren ausgelöst wird.
Literaturnachweis
1. Huwiler A, Pfeilschifter J. Biochem Pharmacol. 2008 May 15;75(10):1893-900. Review. 2. Rivera J, Proia RL, Olivera A.Nat Rev Immunol. 2008 Oct;8(10):753-63. Review. 3. Compston A, Coles A. Multiple sclerosis. Lancet 2002;359:1221-31. 4. Compston A, Coles A. Multiple sclerosis. Lancet 2008;372:1502-18.
Über Actelion Ltd
Actelion Ltd ist ein biopharmazeutisches Unternehmen mit Hauptsitz in Allschwil/Basel, Schweiz. Actelions erstes Medikament, Tracleer®, ist ein zur Therapie der pulmonalen arteriellen Hypertonie zugelassener dualer Endothelin-Rezeptor-Antagonist in Tablettenform. Actelion vertreibt Tracleer® durch eigene Niederlassungen in den wichtigsten internationalen Märkten, so den Vereinigten Staaten (mit Sitz in South San Francisco), der Europäischen Union, Japan, Kanada, Australien und der Schweiz. Actelion, 1997 gegründet, ist ein weltweit führendes Unternehmen bei der Erforschung des Endothels. Das Endothel trennt die Gefässwand vom Blutstrom. Mit über 2.000 Mitarbeitenden konzentriert sich Actelion darauf, innovative Medikamente in Bereichen mit hohem medizinischem Bedarf zu entdecken, zu entwickeln und zu vermarkten. Actelion Aktien sind am SIX Swiss Exchange notiert (Symbol: ATLN).
Für weitere Informationen wenden Sie sich bitte an: Roland Haefeli Vice President, Head of Investor Relations & Corporate Communications Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil +41 61 565 62 62 +1 650 624 69 36 http://www.actelion.com
--- Ende der Mitteilung ---
Actelion Pharmaceuticals Ltd Gewerbestrasse 16 Allschwil Schweiz WKN: 936767; ISIN: CH0010532478; Index: SBIOM, SLIFE, SMCI, SMIEXP, SMIM, SPI, SPIEX; Notiert: Main Market in SIX Swiss Exchange; http://www.actelion.com http://hugin.info/131801/R/1346477/323455.pdf Copyright © Hugin AS 2009. All rights reserved.
Quelle: HUGIN
Actelion erreicht Etappenziel mit S1P1 - Zahlung über knapp 20 Mio USD (AF)
(Ergänzt um Analystenkommentare und Entwicklung des Aktienkurses)
Allschwil (awp) - Die Actelion Ltd hat mit dem S1P1-Rezeptor-Agonisten eine Phase IIb-Dosisfindungsstudie bei Patienten mit multipler Sklerose aufgenommen. Damit sei ein wichtiges klinisches Etappenziel erreicht und es werde eine Meilensteinzahlung über knapp 20 Mio USD seitens Roche fällig, teilt das Pharmaunternehmen am Freitag mit.
Actelion und Roche sind im Juli 2006 eine exklusive weltweite Partnerschaft zur gemeinsamen Entwicklung und Vermarktung des selektiven S1P1-Rezeptor-Agonisten von Actelion eingegangen. Dabei handle es sich um einen Immunmodulator, welcher das Potential habe, einmal täglich verabreicht zu werden. Die neue Wirksubstanz soll für verschiedene Autoimmunerkrankungen entwickelt werden.
An der Börse wurde die Nachricht wohlwollend kommentiert, die Aktie steht allerdings mit einem Plus von 0,2% nur knapp besser da als der Gesamtmarkt.
Bei der Bank Vontobel hiess es, dies seien gute Nachrichten aus dem Hause Actelion und die ZKB wertet die Nachricht als "leicht positive News". Die ZKB hatte für den nun erreichten Meilenstein lediglich mit einer Zahlung von Roche über 6 Mio USD gerechnet.
Für die Bank Wegelin bietet die Wirksubstand für verschiedene Autoimmunkrankheiten das Potential für eine Diversifizierung von Actelion.
http://www.handelszeitung.ch/artikel/Unternehmen-AWP_Actelio…
(Ergänzt um Analystenkommentare und Entwicklung des Aktienkurses)
Allschwil (awp) - Die Actelion Ltd hat mit dem S1P1-Rezeptor-Agonisten eine Phase IIb-Dosisfindungsstudie bei Patienten mit multipler Sklerose aufgenommen. Damit sei ein wichtiges klinisches Etappenziel erreicht und es werde eine Meilensteinzahlung über knapp 20 Mio USD seitens Roche fällig, teilt das Pharmaunternehmen am Freitag mit.
Actelion und Roche sind im Juli 2006 eine exklusive weltweite Partnerschaft zur gemeinsamen Entwicklung und Vermarktung des selektiven S1P1-Rezeptor-Agonisten von Actelion eingegangen. Dabei handle es sich um einen Immunmodulator, welcher das Potential habe, einmal täglich verabreicht zu werden. Die neue Wirksubstanz soll für verschiedene Autoimmunerkrankungen entwickelt werden.
An der Börse wurde die Nachricht wohlwollend kommentiert, die Aktie steht allerdings mit einem Plus von 0,2% nur knapp besser da als der Gesamtmarkt.
Bei der Bank Vontobel hiess es, dies seien gute Nachrichten aus dem Hause Actelion und die ZKB wertet die Nachricht als "leicht positive News". Die ZKB hatte für den nun erreichten Meilenstein lediglich mit einer Zahlung von Roche über 6 Mio USD gerechnet.
Für die Bank Wegelin bietet die Wirksubstand für verschiedene Autoimmunkrankheiten das Potential für eine Diversifizierung von Actelion.
http://www.handelszeitung.ch/artikel/Unternehmen-AWP_Actelio…
FAZ.net
Pharmabranche
Actelion - robuste Entwicklung, vernünftige Bewertung
09. Oktober 2009
Die Kursrally der vergangenen Monate zeichnet sich dadurch aus, dass viele jener Werte die größten Kursgewinne verzeichnen, die es aus fundamentaler Sicht ganz und gar nicht verdient haben. Sie ist alleine schon aus diesem Grund hoch spekulativ, auch wenn sich die Nachrichten von unkritischen Meldungen über die angebliche Erholung der Weltwirtschaft nur so überschlagen.
Mittel- und längerfristig orientierte Anleger werden sich davon nur bedingt beeinflussen lassen, indem sie allenfalls spekulative Elemente zu ihren Portfolios beimischen. Das können beispielsweise Kaufoptionen sein, mit welchen sich bei starken Kursbewegungen mit geringem Kapitaleinsatz beachtliche Renditen bei allerdings hohem Risiko erzielen lassen.
Mittel- und langfristig sind Unternehmen mit robustem Wachstum interessant
Ansonsten werden sie eher auf die Aktien jener Unternehmen setzen, die sich längerfristig robust und unabhängig von konjunkturellen Wirren entwickeln können. Zum Beispiel auf die Papiere der Schweizer Pharmafirma Actelion. Das mittelständische Unternehmen kann schon seit Jahren sowohl Umsatz als auch den Gewinn zumindest im Trend steigern.
In den ersten beiden Quartalen des laufenden Jahres nahmen die Erlöse im Vergleich mit den Vorjahresperioden um 26 und 27 Prozent auf insgesamt 855,2 Millionen Franken zu. Im dritten und vierten Quartal geht man von Wachstumsraten von jeweils 14 Prozent aus. In den ersten sechs Monaten konnte das operative Ergebnis vor Ausgaben im Bereich Prozessresearch, Optionsplänen und Abschreibungen und Rückstellungen - die bevorzugte Kennzahl, mit der das Unternehmen aufgrund der Volatilität der Faktoren bewertet werden möchte - von 191 Millionen Franken im Vorjahr auf knapp 305 Millionen Franken steigern. Die Nettogewinne lagen im ersten Quartal bei 102 und im zweiten bei 116 Millionen Franken. Der Gewinn je Aktie lag bei 1,79 Franken, nach 0,97 Franken in den ersten sechs Monaten des vergangenen Jahres.
Das Unternehmen ging bei der Vorlage der Halbjahreszahlen davon aus, die ursprünglich für das Gesamtjahr anvisierten Umsatz- und Ertragslevels bei anhaltendem Wachstum übertreffen zu können. Actelion verfügt sowohl über etablierte Produkte wie Tracleer, Venvatis und Zavesca, deren Erlöse in den erschlossenen Märkten und durch neue Markteintritte weiter deutlich gesteigert werden können. Daneben hat Actelion eine breite „Produktpipeline“. Zehn Komponenten befänden sich in der Entwicklungsphase mit 25 Projekten der Wirkstoffendeckung. Vier Komponenten befänden sich in der fortgeschrittenen Phase III und damit vergleichsweise nahe an einer Vermarktungsmöglichkeit, teilte das Unternehmen mit.
Actelion verfügt über etablierte Produkte und eine interessante „Pipeline“
Am Freitag wurde bekannt, dass Actelion eine so genannte Meilensteinzahlung in Höhe von 20 Millionen Dollar in Aussicht hat, die im Zusammenhang mit dem Erreichen mittelfristiger Ziele bei der Entwicklung eines Multiple-Sklerose-Medikamentes steht. Das bestätigt, dass das Unternehmen durchaus erfolgreich arbeitet und Anlegern eine robuste Perspektive bietet.
Die Aktie blieb in den vergangenen Monaten der Hausse mit einem Plus von knapp 24 Prozent hinter dem breiten Markt zurück, der seit März - gemessen am SMI-Index - knapp 43 Prozent zulegte. Allerdings hat sie in der Schwächeperiode weit weniger verloren als der breite Markt. Auch Sicht von fünf Jahren kommt der SMI-Index auf eine durchschnittlichen Kursgewinn von 15,7 Prozent pro Jahr. Die Aktie von Actelion dagegen legte pro Jahr mehr als 150 Prozent zu, wenn auch vor allem in den ersten Jahren der Betrachtungsperiode.
Mit Kurs-Gewinnverhältnissen von 19 und 17 auf Basis der Gewinnschätzungen für das laufende und das kommende Geschäftsjahr sind die Papiere zwar optisch nicht sonderlich günstig. Kursrückschläge böten jedoch angesichts der robusten Entwicklung ideale Einstiegsmöglichkeiten.
Die in dem Beitrag geäußerte Einschätzung gibt die Meinung des Autors und nicht die der F.A.Z.-Redaktion wieder.
Text: @cri
Bildmaterial: Actelion, FAZ.NET

http://www.faz.net/s/RubF3F7C1F630AE4F8D8326AC2A80BDBBDE/Doc…
Pharmabranche
Actelion - robuste Entwicklung, vernünftige Bewertung
09. Oktober 2009
Die Kursrally der vergangenen Monate zeichnet sich dadurch aus, dass viele jener Werte die größten Kursgewinne verzeichnen, die es aus fundamentaler Sicht ganz und gar nicht verdient haben. Sie ist alleine schon aus diesem Grund hoch spekulativ, auch wenn sich die Nachrichten von unkritischen Meldungen über die angebliche Erholung der Weltwirtschaft nur so überschlagen.
Mittel- und längerfristig orientierte Anleger werden sich davon nur bedingt beeinflussen lassen, indem sie allenfalls spekulative Elemente zu ihren Portfolios beimischen. Das können beispielsweise Kaufoptionen sein, mit welchen sich bei starken Kursbewegungen mit geringem Kapitaleinsatz beachtliche Renditen bei allerdings hohem Risiko erzielen lassen.
Mittel- und langfristig sind Unternehmen mit robustem Wachstum interessant
Ansonsten werden sie eher auf die Aktien jener Unternehmen setzen, die sich längerfristig robust und unabhängig von konjunkturellen Wirren entwickeln können. Zum Beispiel auf die Papiere der Schweizer Pharmafirma Actelion. Das mittelständische Unternehmen kann schon seit Jahren sowohl Umsatz als auch den Gewinn zumindest im Trend steigern.
In den ersten beiden Quartalen des laufenden Jahres nahmen die Erlöse im Vergleich mit den Vorjahresperioden um 26 und 27 Prozent auf insgesamt 855,2 Millionen Franken zu. Im dritten und vierten Quartal geht man von Wachstumsraten von jeweils 14 Prozent aus. In den ersten sechs Monaten konnte das operative Ergebnis vor Ausgaben im Bereich Prozessresearch, Optionsplänen und Abschreibungen und Rückstellungen - die bevorzugte Kennzahl, mit der das Unternehmen aufgrund der Volatilität der Faktoren bewertet werden möchte - von 191 Millionen Franken im Vorjahr auf knapp 305 Millionen Franken steigern. Die Nettogewinne lagen im ersten Quartal bei 102 und im zweiten bei 116 Millionen Franken. Der Gewinn je Aktie lag bei 1,79 Franken, nach 0,97 Franken in den ersten sechs Monaten des vergangenen Jahres.
Das Unternehmen ging bei der Vorlage der Halbjahreszahlen davon aus, die ursprünglich für das Gesamtjahr anvisierten Umsatz- und Ertragslevels bei anhaltendem Wachstum übertreffen zu können. Actelion verfügt sowohl über etablierte Produkte wie Tracleer, Venvatis und Zavesca, deren Erlöse in den erschlossenen Märkten und durch neue Markteintritte weiter deutlich gesteigert werden können. Daneben hat Actelion eine breite „Produktpipeline“. Zehn Komponenten befänden sich in der Entwicklungsphase mit 25 Projekten der Wirkstoffendeckung. Vier Komponenten befänden sich in der fortgeschrittenen Phase III und damit vergleichsweise nahe an einer Vermarktungsmöglichkeit, teilte das Unternehmen mit.
Actelion verfügt über etablierte Produkte und eine interessante „Pipeline“
Am Freitag wurde bekannt, dass Actelion eine so genannte Meilensteinzahlung in Höhe von 20 Millionen Dollar in Aussicht hat, die im Zusammenhang mit dem Erreichen mittelfristiger Ziele bei der Entwicklung eines Multiple-Sklerose-Medikamentes steht. Das bestätigt, dass das Unternehmen durchaus erfolgreich arbeitet und Anlegern eine robuste Perspektive bietet.
Die Aktie blieb in den vergangenen Monaten der Hausse mit einem Plus von knapp 24 Prozent hinter dem breiten Markt zurück, der seit März - gemessen am SMI-Index - knapp 43 Prozent zulegte. Allerdings hat sie in der Schwächeperiode weit weniger verloren als der breite Markt. Auch Sicht von fünf Jahren kommt der SMI-Index auf eine durchschnittlichen Kursgewinn von 15,7 Prozent pro Jahr. Die Aktie von Actelion dagegen legte pro Jahr mehr als 150 Prozent zu, wenn auch vor allem in den ersten Jahren der Betrachtungsperiode.
Mit Kurs-Gewinnverhältnissen von 19 und 17 auf Basis der Gewinnschätzungen für das laufende und das kommende Geschäftsjahr sind die Papiere zwar optisch nicht sonderlich günstig. Kursrückschläge böten jedoch angesichts der robusten Entwicklung ideale Einstiegsmöglichkeiten.
Die in dem Beitrag geäußerte Einschätzung gibt die Meinung des Autors und nicht die der F.A.Z.-Redaktion wieder.
Text: @cri
Bildmaterial: Actelion, FAZ.NET

http://www.faz.net/s/RubF3F7C1F630AE4F8D8326AC2A80BDBBDE/Doc…
hier noch ein interessanter Artikel aus faz.net zu Schlafmitteln, Almorexant wird auch erwähnt:
Schlafmittel - Die Pille davor
Von Georg Rüschemeyer
Die Pillen zur Wahl: Diese „Twenty-Nine Pills” sind allerdings Kunst und stammen von Damien Hirst.
25. Juni 2009
Vielleicht haben die Griechen wirklich noch besser geschlafen. In antiken Darstellungen jedenfalls leert Gott Hypnos sein Schlummerhorn, und schon herrscht schönste Ruhe. Heute kämpfen in den Industriestaaten bis zu dreißig Prozent der Bevölkerung mindestens gelegentlich mit Schlaflosigkeit. Wenn es gar nicht mehr geht und die Nacht zum Tag wird, während man sich tagsüber kaum wach halten kann, wird der Hausarzt konsultiert, der in den allermeisten Fällen ein Schlafmittel verschreibt.
Der Inhalt von Hypnos' Horn ist nicht überliefert. Wohl aber ein anderes seiner Attribute, die Kapsel des Schlafmohns. Den nutzt der Mensch seit der Jungsteinzeit, um in den Schlaf zu finden. Die Karriere dieser Rauschdroge hat allerdings in die Illegalität geführt, heute fällt sie unter das Betäubungsmittelgesetz. Ungleich harmloser wirken andere pflanzliche Beruhigungsmittel wie Baldrian oder Hopfen, die sich bestens verkaufen, auch wenn sie seit 2004 wegen mangelhaftem Wirkungsnachweis nicht mehr von den Krankenkassen bezahlt werden. Die meisten Schlaflosen greifen deshalb früher oder später zu einem Präparat aus der breiten Palette synthetischer Hypnotika, wie Schlafmittel medizinisch korrekt heißen.
Das erste davon, Chloralhydrat, stellte Justus von Liebig schon 1832 her. In besonderen Fällen kommt es immer noch zum Einsatz, anders als die lange Zeit vorherrschenden, heute aber nur noch als Narkosemittel zugelassenen Barbiturate. Angehörige dieser großen Substanzklasse machen nicht nur hochgradig abhängig, bei Überdosierung sorgen sie auch leicht für ewigen Schlaf, was sie früher zum Mittel der Wahl für den klassischen "Selbstmord durch Überdosis" machte.
Hypnotika und Tranquilizer
Moderne Hypnotika gehören fast alle zu einer von zwei Stoffklassen. Entweder zu den seit den sechziger Jahren populären Benzodiazepinen, darunter das Valium (Diazepam) und andere Tranquilizer. Oder zu den chemisch verschiedenen, in ihrem Wirkmechanismus aber ähnlichen Benzodiazepin-Rezeptor-Agonisten (der Kürze halber auch "Z-Drugs" genannt). Diese letzte größeren Innovation auf dem Schlafmittelmarkt hat sich seit den frühen neunziger Jahren durchgesetzt. Wie die Barbiturate wirken auch Benzos und Z-Drugs an den sogenannten GABA-Rezeptoren des zentralen Nervensystems. Dabei handelt es sich um molekulare Schalter an den Verbindungen zwischen zwei Nervenzellen, die den Neurotransmitter Gamma-Amino-Buttersäure (GABA) binden und damit die Erregbarkeit der nachgeschalteten Nervenzelle herabsetzen. Die Medikamente verstärken die Wirkung des Transmitters und sorgen so für Entspannung, insbesondere im Thalamus, einem für die Kontrolle von Schlaf und Wachheit wichtigen Teil des Gehirns.
Welches Schlafmittel der Arzt verschreibt, hängt vor allem von der gewünschten Wirkdauer ab: Für Einschlafstörungen eignen sich eher Mittel wie Zaleplon mit einer physiologischen Halbwertzeit von einer Stunde. Um einem nächtlichen Aufwachen vorzubeugen, sollte der entsprechende Stoff etwas länger wirken. Der Übergang zu den Tranquilizern ist fließend, bis hin zum Valium, mit dessen Abbau die Leber jedoch noch wochenlang beschäftigt ist.
Allen Benzodiazepinen gemeinsam sind ihr hohes Suchtpotential und Nebenwirkungen, die von Tagesmüdigkeit und einer durch geringeren Muskeltonus erhöhten Sturzgefahr beim nächtlichen Toilettengang bis hin zu paradoxen Fällen von Übererregung und Verwirrung reichen. Vor Überraschungen ist man aber auch bei den neuen, teureren Z-Mitteln nicht sicher. So listete ein Report der australischen Gesundheitsbehörden vor zwei Jahren Fälle auf, in denen Patienten unter dem Wirkstoff Zolpidem von Halluzinationen, Gedächtnisverlust oder Schlafwandelattacken heimgesucht wurden - ein Opfer nahm 23 Kilo zu, weil es des Nachts den Kühlschrank leer futterte.
Die ideale Pille wird es nicht geben
In placebokontrollierten Studien bewirken Schlafmittel nur eine um 10 bis 15 Minuten verkürzte Einschlafzeit, die gesamte Nachtruhe verlängert sich durchschnittlich um eine Dreiviertelstunde. "Entscheidend ist allerdings die Lebensqualität am Tage - das wird bei Forschung und Zulassung aber weitgehend vernachlässigt", meint der Neuropharmakologe Bjarke Ebert vom Psychopharmakahersteller Lundbeck.
Viele der gängigen Mittel stören gerade die erholsamen Tiefschlafphasen. Wesentlich weniger in den natürlichen Schlafrhythmus eingreifen sollte der Wirkstoff Gaboxadol, an dem Forscher von Lundbeck, Merck und dem Münchner Max-Planck-Institut für Psychiatrie jahrelang forschten. Vor zwei Jahren mussten sie kurz vor der Zulassung aufgeben: Probeschläfer der abschließenden Studie hatten nicht nur von mangelnder Wirkung, sondern auch von Halluzinationen und Desorientierung berichtet.
Nach diesem Totalausfall knüpfen sich jetzt die meisten Erwartungen an den Wirkstoff Almorexant des Schweizer Herstellers Actelion. Dieses Mittel fördert nicht die dämpfende Wirkung von GABA, sondern dämpft den Wachheit und Appetit fördernden Effekt des Neurohormons Orexin. Ergebnisse einer Phase-III-Studie werden Ende des Jahres erwartet.
"Die ideale Schlafpille für alle Bedürfnisse wird auch das nicht sein", meint Martin Lohse, Leiter des Rudolf-Virchow-Zentrums für experimentelle Biomedizin der Universität Würzburg und Koautor des Kapitels über Hypnotika des "Arzneimittelverordnungsreports". Dieser jährlich erscheinenden Übersicht zufolge wurden im vergangenen Jahr 125 Millionen Tagesrationen synthetischer Schlafmittel verschrieben, nur noch gut halb so viel wie zehn Jahre zuvor. Doch der Report berücksichtigt nur Rezepte, die über eine gesetzliche Krankenkasse abgerechnet wurden. In Wirklichkeit blieben die Verkaufszahlen in den Apotheken weitgehend konstant. Offenbar schreiben immer mehr Ärzte die vergleichsweise billigen Hypnotika auf Privatrezept aus, um der Kontrolle durch die Krankenkassen zu entgehen, vermutet die Arzneimittelkommission der Deutschen Ärzteschaft.
Kognitive Therapien
Das deutet darauf hin, dass ein großer Teil der eigentlich nur für den Kurzzeitgebrauch indizierten Schlafmittel über lange Zeiträume eingenommen wird. "Dabei gewöhnt sich der Körper innerhalb weniger Wochen, und die Mittel zeigen kaum noch Wirkung", sagt Martin Lohse. Beim Absetzen des Medikaments werden die Schlafstörungen schlimmer als je zuvor, es entsteht eine sogenannte Low-Dose-Abhängigkeit, die für Arzt und Patient nur noch schwer zu durchbrechen ist.
Dabei gäbe es Alternativen. Neben einer besseren Schlafhygiene zum Beispiel Methoden wie die Schlafrestriktion, bei der die nächtliche Bettruhe zeitlich begrenzt wird, Entspannungsübungen wie etwa autogenes Training oder das Durchbrechen des nächtlichen Teufelskreises im Kopf mit Hilfe einer kognitiven Therapie. Auf die ersten Wochen beschränkt, können Hypnotika aber durchaus helfen. Das ergab zumindest eine jüngst im Journal JAMA veröffentlichte Studie kanadischer Forscher, in der diese Kombination die besten Resultate brachte: Fast 70 Prozent der Patienten war der Gott des Schlafes auch ein halbes Jahr nach Abschluss der Therapie noch gewogen.
Text: F.A.S.
Bildmaterial: Marcus Kaufhold
http://www.faz.net/s/Rub268AB64801534CF288DF93BB89F2D797/Doc…
Schlafmittel - Die Pille davor
Von Georg Rüschemeyer
Die Pillen zur Wahl: Diese „Twenty-Nine Pills” sind allerdings Kunst und stammen von Damien Hirst.
25. Juni 2009
Vielleicht haben die Griechen wirklich noch besser geschlafen. In antiken Darstellungen jedenfalls leert Gott Hypnos sein Schlummerhorn, und schon herrscht schönste Ruhe. Heute kämpfen in den Industriestaaten bis zu dreißig Prozent der Bevölkerung mindestens gelegentlich mit Schlaflosigkeit. Wenn es gar nicht mehr geht und die Nacht zum Tag wird, während man sich tagsüber kaum wach halten kann, wird der Hausarzt konsultiert, der in den allermeisten Fällen ein Schlafmittel verschreibt.
Der Inhalt von Hypnos' Horn ist nicht überliefert. Wohl aber ein anderes seiner Attribute, die Kapsel des Schlafmohns. Den nutzt der Mensch seit der Jungsteinzeit, um in den Schlaf zu finden. Die Karriere dieser Rauschdroge hat allerdings in die Illegalität geführt, heute fällt sie unter das Betäubungsmittelgesetz. Ungleich harmloser wirken andere pflanzliche Beruhigungsmittel wie Baldrian oder Hopfen, die sich bestens verkaufen, auch wenn sie seit 2004 wegen mangelhaftem Wirkungsnachweis nicht mehr von den Krankenkassen bezahlt werden. Die meisten Schlaflosen greifen deshalb früher oder später zu einem Präparat aus der breiten Palette synthetischer Hypnotika, wie Schlafmittel medizinisch korrekt heißen.
Das erste davon, Chloralhydrat, stellte Justus von Liebig schon 1832 her. In besonderen Fällen kommt es immer noch zum Einsatz, anders als die lange Zeit vorherrschenden, heute aber nur noch als Narkosemittel zugelassenen Barbiturate. Angehörige dieser großen Substanzklasse machen nicht nur hochgradig abhängig, bei Überdosierung sorgen sie auch leicht für ewigen Schlaf, was sie früher zum Mittel der Wahl für den klassischen "Selbstmord durch Überdosis" machte.
Hypnotika und Tranquilizer
Moderne Hypnotika gehören fast alle zu einer von zwei Stoffklassen. Entweder zu den seit den sechziger Jahren populären Benzodiazepinen, darunter das Valium (Diazepam) und andere Tranquilizer. Oder zu den chemisch verschiedenen, in ihrem Wirkmechanismus aber ähnlichen Benzodiazepin-Rezeptor-Agonisten (der Kürze halber auch "Z-Drugs" genannt). Diese letzte größeren Innovation auf dem Schlafmittelmarkt hat sich seit den frühen neunziger Jahren durchgesetzt. Wie die Barbiturate wirken auch Benzos und Z-Drugs an den sogenannten GABA-Rezeptoren des zentralen Nervensystems. Dabei handelt es sich um molekulare Schalter an den Verbindungen zwischen zwei Nervenzellen, die den Neurotransmitter Gamma-Amino-Buttersäure (GABA) binden und damit die Erregbarkeit der nachgeschalteten Nervenzelle herabsetzen. Die Medikamente verstärken die Wirkung des Transmitters und sorgen so für Entspannung, insbesondere im Thalamus, einem für die Kontrolle von Schlaf und Wachheit wichtigen Teil des Gehirns.
Welches Schlafmittel der Arzt verschreibt, hängt vor allem von der gewünschten Wirkdauer ab: Für Einschlafstörungen eignen sich eher Mittel wie Zaleplon mit einer physiologischen Halbwertzeit von einer Stunde. Um einem nächtlichen Aufwachen vorzubeugen, sollte der entsprechende Stoff etwas länger wirken. Der Übergang zu den Tranquilizern ist fließend, bis hin zum Valium, mit dessen Abbau die Leber jedoch noch wochenlang beschäftigt ist.
Allen Benzodiazepinen gemeinsam sind ihr hohes Suchtpotential und Nebenwirkungen, die von Tagesmüdigkeit und einer durch geringeren Muskeltonus erhöhten Sturzgefahr beim nächtlichen Toilettengang bis hin zu paradoxen Fällen von Übererregung und Verwirrung reichen. Vor Überraschungen ist man aber auch bei den neuen, teureren Z-Mitteln nicht sicher. So listete ein Report der australischen Gesundheitsbehörden vor zwei Jahren Fälle auf, in denen Patienten unter dem Wirkstoff Zolpidem von Halluzinationen, Gedächtnisverlust oder Schlafwandelattacken heimgesucht wurden - ein Opfer nahm 23 Kilo zu, weil es des Nachts den Kühlschrank leer futterte.
Die ideale Pille wird es nicht geben
In placebokontrollierten Studien bewirken Schlafmittel nur eine um 10 bis 15 Minuten verkürzte Einschlafzeit, die gesamte Nachtruhe verlängert sich durchschnittlich um eine Dreiviertelstunde. "Entscheidend ist allerdings die Lebensqualität am Tage - das wird bei Forschung und Zulassung aber weitgehend vernachlässigt", meint der Neuropharmakologe Bjarke Ebert vom Psychopharmakahersteller Lundbeck.
Viele der gängigen Mittel stören gerade die erholsamen Tiefschlafphasen. Wesentlich weniger in den natürlichen Schlafrhythmus eingreifen sollte der Wirkstoff Gaboxadol, an dem Forscher von Lundbeck, Merck und dem Münchner Max-Planck-Institut für Psychiatrie jahrelang forschten. Vor zwei Jahren mussten sie kurz vor der Zulassung aufgeben: Probeschläfer der abschließenden Studie hatten nicht nur von mangelnder Wirkung, sondern auch von Halluzinationen und Desorientierung berichtet.
Nach diesem Totalausfall knüpfen sich jetzt die meisten Erwartungen an den Wirkstoff Almorexant des Schweizer Herstellers Actelion. Dieses Mittel fördert nicht die dämpfende Wirkung von GABA, sondern dämpft den Wachheit und Appetit fördernden Effekt des Neurohormons Orexin. Ergebnisse einer Phase-III-Studie werden Ende des Jahres erwartet.
"Die ideale Schlafpille für alle Bedürfnisse wird auch das nicht sein", meint Martin Lohse, Leiter des Rudolf-Virchow-Zentrums für experimentelle Biomedizin der Universität Würzburg und Koautor des Kapitels über Hypnotika des "Arzneimittelverordnungsreports". Dieser jährlich erscheinenden Übersicht zufolge wurden im vergangenen Jahr 125 Millionen Tagesrationen synthetischer Schlafmittel verschrieben, nur noch gut halb so viel wie zehn Jahre zuvor. Doch der Report berücksichtigt nur Rezepte, die über eine gesetzliche Krankenkasse abgerechnet wurden. In Wirklichkeit blieben die Verkaufszahlen in den Apotheken weitgehend konstant. Offenbar schreiben immer mehr Ärzte die vergleichsweise billigen Hypnotika auf Privatrezept aus, um der Kontrolle durch die Krankenkassen zu entgehen, vermutet die Arzneimittelkommission der Deutschen Ärzteschaft.
Kognitive Therapien
Das deutet darauf hin, dass ein großer Teil der eigentlich nur für den Kurzzeitgebrauch indizierten Schlafmittel über lange Zeiträume eingenommen wird. "Dabei gewöhnt sich der Körper innerhalb weniger Wochen, und die Mittel zeigen kaum noch Wirkung", sagt Martin Lohse. Beim Absetzen des Medikaments werden die Schlafstörungen schlimmer als je zuvor, es entsteht eine sogenannte Low-Dose-Abhängigkeit, die für Arzt und Patient nur noch schwer zu durchbrechen ist.
Dabei gäbe es Alternativen. Neben einer besseren Schlafhygiene zum Beispiel Methoden wie die Schlafrestriktion, bei der die nächtliche Bettruhe zeitlich begrenzt wird, Entspannungsübungen wie etwa autogenes Training oder das Durchbrechen des nächtlichen Teufelskreises im Kopf mit Hilfe einer kognitiven Therapie. Auf die ersten Wochen beschränkt, können Hypnotika aber durchaus helfen. Das ergab zumindest eine jüngst im Journal JAMA veröffentlichte Studie kanadischer Forscher, in der diese Kombination die besten Resultate brachte: Fast 70 Prozent der Patienten war der Gott des Schlafes auch ein halbes Jahr nach Abschluss der Therapie noch gewogen.
Text: F.A.S.
Bildmaterial: Marcus Kaufhold
http://www.faz.net/s/Rub268AB64801534CF288DF93BB89F2D797/Doc…
09.10.2009 10:28:15
Actelion "buy"
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, stuft die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" weiterhin mit dem Rating "buy" ein.
Actelion habe heute Morgen verkündet, dass der selektive S1P1-Rezeptor-Agonist (ACT-128800/RG3477), der in Zusammenarbeit mit Roche entwickelt worden sei, einen wichtigen klinischen Meilenstein erreicht habe. Eine Phase II-Dosisfindungsstudie sei bei Patienten mit Multipler Sklerose aufgenommen worden.
Dadurch werde eine Meilensteinzahlung in der Höhe von USD 20 Mio. seitens Roche an Actelion fällig. Die vollständige Meilensteinzahlung erfolge zwar noch in GJ/2009, die Einnahmen von USD 20 Mio. dürften jedoch über die nächsten 18 bis 24 Monate verteilt ausgewiesen werden. Die Auswirkungen auf die EPS-Entwicklung würden sich somit wie folgt gestalten: in GJ/2009 +0,5%, in GJ/2010 +2% und in GJ/2011 +1,5%.
Es seien keine zusätzlichen klinischen Daten veröffentlicht worden. Die Analysten würden somit die Erfolgswahrscheinlichkeit in ihrer DCF-Bewertung unverändert belassen.
Die Analysten von Vontobel Research verändern ihr Bewertungsmodell nicht und bekräftigen ihre "buy"-Empfehlung für die Actelion-Aktie und das Kursziel von CHF 79. (Analyse vom 09.10.2009) (09.10.2009/ac/a/a)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
Quelle: AKTIENCHECK.DE
Actelion "buy"
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, stuft die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" weiterhin mit dem Rating "buy" ein.
Actelion habe heute Morgen verkündet, dass der selektive S1P1-Rezeptor-Agonist (ACT-128800/RG3477), der in Zusammenarbeit mit Roche entwickelt worden sei, einen wichtigen klinischen Meilenstein erreicht habe. Eine Phase II-Dosisfindungsstudie sei bei Patienten mit Multipler Sklerose aufgenommen worden.
Dadurch werde eine Meilensteinzahlung in der Höhe von USD 20 Mio. seitens Roche an Actelion fällig. Die vollständige Meilensteinzahlung erfolge zwar noch in GJ/2009, die Einnahmen von USD 20 Mio. dürften jedoch über die nächsten 18 bis 24 Monate verteilt ausgewiesen werden. Die Auswirkungen auf die EPS-Entwicklung würden sich somit wie folgt gestalten: in GJ/2009 +0,5%, in GJ/2010 +2% und in GJ/2011 +1,5%.
Es seien keine zusätzlichen klinischen Daten veröffentlicht worden. Die Analysten würden somit die Erfolgswahrscheinlichkeit in ihrer DCF-Bewertung unverändert belassen.
Die Analysten von Vontobel Research verändern ihr Bewertungsmodell nicht und bekräftigen ihre "buy"-Empfehlung für die Actelion-Aktie und das Kursziel von CHF 79. (Analyse vom 09.10.2009) (09.10.2009/ac/a/a)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
Quelle: AKTIENCHECK.DE
Warten wir also weiter auf die Almorexant-Daten, die im Laufe dieses Quartals erwartet werden.


http://www.finanznachrichten.de/nachrichten-2009-10/15172857…
JPMorgan hebt Ziel für Actelion auf 70 Franken - 'Overweight'
JPMorgan hat das Kursziel für Actelion von 66,00 auf 70,00 Franken angehoben und die Einstufung auf "Overweight" belassen. Die Markterwartungen reflektierten kaum das Marktpotenzial des Medikaments Clazosentan, schrieb Analystin Alexandra Hauber in einer Studie vom Montag. Das Mittel habe bei der Anwendung zur Verhinderung von Blutgefäßspasmen nach Hirnblutungen ein Umsatzpotenzial von einer Milliarde Euro. Daten zu diesem und weiteren in der Testphase befindlichen Mitteln könnten das Kursziel des Pharmaunternehmens in den kommenden zwölf Monaten auf 85 Franken steigen lassen.
wann hats eigentlich das letzte Mal schlechte News zu Actelion gegeben?
mal abgesehen von den ubs-anal-ysten^^
JPMorgan hebt Ziel für Actelion auf 70 Franken - 'Overweight'
JPMorgan hat das Kursziel für Actelion von 66,00 auf 70,00 Franken angehoben und die Einstufung auf "Overweight" belassen. Die Markterwartungen reflektierten kaum das Marktpotenzial des Medikaments Clazosentan, schrieb Analystin Alexandra Hauber in einer Studie vom Montag. Das Mittel habe bei der Anwendung zur Verhinderung von Blutgefäßspasmen nach Hirnblutungen ein Umsatzpotenzial von einer Milliarde Euro. Daten zu diesem und weiteren in der Testphase befindlichen Mitteln könnten das Kursziel des Pharmaunternehmens in den kommenden zwölf Monaten auf 85 Franken steigen lassen.
wann hats eigentlich das letzte Mal schlechte News zu Actelion gegeben?

mal abgesehen von den ubs-anal-ysten^^
Antwort auf Beitrag Nr.: 38.157.819 von ffdmh am 12.10.09 11:10:15Wann hats eigentlich das letzte Mal schlechte News zu Actelion gegeben?
Ich kann mich jedenfalls nicht erinnern - und ich bin schon alt

Ich kann mich jedenfalls nicht erinnern - und ich bin schon alt


http://www.cash.ch/news/insider/
"Mit ungewohnt positiven Worten zu Actelion gelangt am Mittwoch die UBS an die Öffentlichkeit. Der seit Monaten negativ gestimmte Analyst rechnet am 21. Oktober mit besser als erwarteten Quartalszahlen. Unter Berücksichtigung der überraschenden Preiserhöhung beim Hauptumsatzträger Tracleer im August diesen Jahres liegen die Umsatz- und Gewinnschätzungen der UBS deutlich über den Konsensschätzungen des Marktes. Zudem schliesst der Analyst eine weitere Anhebung der firmeneigenen Gesamtjahresprognosen im Falle starker Quartalszahlen nicht aus.
Aufgrund der weiterhin vorsichtigen Haltung in Bezug auf die ab Ende 2009 zu erwartenden Studienergebnisse zu den drei wichtigsten Entwicklungsprojekten hält die UBS jedoch mit einem Kursziel von 57 Franken an der Verkaufsempfehlung fest."
Das wär ja nen Ding, wenn die Prognose gleich nochmal erhöht werden würde . Naja wir werdens sehen am nächsten Dienstag
. Naja wir werdens sehen am nächsten Dienstag  . Ich hoffe, dass ja auch gleichzeitig News von den diversen Phase III Studien kommen, zumindest halt mal wenigstens ein Update, natürlich noch keine Endergebnisse.
. Ich hoffe, dass ja auch gleichzeitig News von den diversen Phase III Studien kommen, zumindest halt mal wenigstens ein Update, natürlich noch keine Endergebnisse.
Könne je nach dem ein richtiger Kurstreiber wieder werden die Q3 Zahlen
"Mit ungewohnt positiven Worten zu Actelion gelangt am Mittwoch die UBS an die Öffentlichkeit. Der seit Monaten negativ gestimmte Analyst rechnet am 21. Oktober mit besser als erwarteten Quartalszahlen. Unter Berücksichtigung der überraschenden Preiserhöhung beim Hauptumsatzträger Tracleer im August diesen Jahres liegen die Umsatz- und Gewinnschätzungen der UBS deutlich über den Konsensschätzungen des Marktes. Zudem schliesst der Analyst eine weitere Anhebung der firmeneigenen Gesamtjahresprognosen im Falle starker Quartalszahlen nicht aus.
Aufgrund der weiterhin vorsichtigen Haltung in Bezug auf die ab Ende 2009 zu erwartenden Studienergebnisse zu den drei wichtigsten Entwicklungsprojekten hält die UBS jedoch mit einem Kursziel von 57 Franken an der Verkaufsempfehlung fest."
Das wär ja nen Ding, wenn die Prognose gleich nochmal erhöht werden würde
 . Naja wir werdens sehen am nächsten Dienstag
. Naja wir werdens sehen am nächsten Dienstag  . Ich hoffe, dass ja auch gleichzeitig News von den diversen Phase III Studien kommen, zumindest halt mal wenigstens ein Update, natürlich noch keine Endergebnisse.
. Ich hoffe, dass ja auch gleichzeitig News von den diversen Phase III Studien kommen, zumindest halt mal wenigstens ein Update, natürlich noch keine Endergebnisse.Könne je nach dem ein richtiger Kurstreiber wieder werden die Q3 Zahlen
Morgen, Di., 20.10.2009, planmäßige Pressekonferenz zu den 9-Monatszahlen Actelions. Schsun wir mal ...


Heute bröckelts ja - Im Gegensatz zum Gesamttrend - schon mal ein wenig ab. Wieso auch immer die Leute vor den Zahlen noch abstossen, wo doch eher mit einer positiven Überraschung geliebäugelt wird.
Bin nach wie vor sehr positiv gestimmt und freue mich auf Morgen, vor allem dann auf die Analystentelefonkonferenz
Bin nach wie vor sehr positiv gestimmt und freue mich auf Morgen, vor allem dann auf die Analystentelefonkonferenz

Naja noch viel spannender als die Zahlen morgen finde ich die Phase III Studiendaten zu Almorexant, die für's laufende Quartal angekündigt sind.
Vielleicht gibts ja morgen auch News zu Almorexant. Sie geben ja meistens mit den Zahlen auch ein kleineres Pipeline-Update. Zumindest das ungefähre Datum für die REsultate könnten sie ja mal angeben 

Antwort auf Beitrag Nr.: 38.205.739 von ffdmh am 19.10.09 15:01:23Ja zumindest das ungefähre Datum wäre das mindeste.
Ich hatte kürzlich bei der IR nachgefragt, wann genau in diesem Quartal denn die Daten zur Veröffentlichung anstehen.
Darauf hin hiess es lediglich, dass diese "bis spätestens gegen Ende des Jahres erwartet werden".
Das ist ein dehnbarer Begriff, enthielt also keine neue Information.
Warten wir also bis morgen ab.
Ich hatte kürzlich bei der IR nachgefragt, wann genau in diesem Quartal denn die Daten zur Veröffentlichung anstehen.
Darauf hin hiess es lediglich, dass diese "bis spätestens gegen Ende des Jahres erwartet werden".
Das ist ein dehnbarer Begriff, enthielt also keine neue Information.
Warten wir also bis morgen ab.
gut, aber unaufregend:
Actelion announces 9-month financial results 2009
Total net revenues of CHF 1,302.5 million, up 22 percent compared to
the first nine months 2008 – Tracleer® sales of CHF 1,114.7 million, up
19 percent in local currencies – Cash EBIT of CHF 462.0 million, up 33
percent in local currencies – FY 2009 results expected at upper end of
guidance range – Positive 2010 growth outlook – Final Phase III study
results with bosentan and clazosentan in the months ahead
ALLSCHWIL/BASEL, SWITZERLAND – 20 October 2009 – Actelion Ltd (SIX: ATLN)
today announced its financial results for the first nine months of 2009. With total net
revenues for the first nine months of 2009 of CHF 1,302.5 million (9M 2008: CHF 1,069.6
m) and operating expenses of CHF 939.3 million (9M 2008: CHF 794.4 m), the company
reported an operating profit of CHF 363.2 million (9M 2008: CHF 275.2 m).
To better measure and compare operating performance over time, Actelion continues to
report non-US GAAP Cash EBIT (Operating Income excluding charges such as In-
Process R&D, charges related to employee stock options under FAS 123R as well as
non-cash depreciation and amortization charges). For the first nine months of 2009,
Actelion reported a Cash EBIT of CHF 462.0 million, an increase of 30 percent compared
to the same period in 2008. In local currencies, Cash EBIT increased by 33 percent.
Adjusted (non-US GAAP) diluted earnings per share for the first nine months of 2009 were
CHF 3.48, compared to CHF 2.53 during the same period last year.
On a US GAAP basis, net profit for the first nine months of 2009 was CHF 326.9 million
(9M 2008: CHF 227.4 m). Fully diluted earnings per share (EPS) on a US GAAP basis for
the same period were CHF 2.66, compared to CHF 1.84 for the first nine months of 2008.
Jean-Paul Clozel, M.D. and Chief Executive Officer commented: “Actelion continues to
execute in-line with its strategy to create long-term value for patients. Our franchise in
pulmonary arterial hypertension will ensure profitable growth going forward. With two
additional promising PAH compounds in advanced clinical development which include
macitentan and our partnership with Nippon Shinyaku to develop the PGI2 receptor
agonist, we intend to remain on the forefront of PAH research and therapy.”
page 2 of 9
- Actelion announces 9-month results 2009 -
Andrew J. Oakley, Chief Financial Officer commented: “In the first nine months of 2009,
Actelion’s base business is continuing to perform strongly, despite an adverse currency
environment that especially impacted Q3 performance as expressed in our reporting
currency, the Swiss Franc. In July of this year, Actelion upgraded guidance for FY 2009 of
both top-line and Cash EBIT growth between 16 and 19 percent in local currencies.
Today, I can confirm guidance and I forecast that we will very likely be towards the upper
end of the ranges given.”
Andrew J. Oakley concluded: “Unforeseen events excluded, Actelion’s outlook for 2010
continues to be positive. I am confident that top-line growth next year will be in the lowdouble
digit range in local currencies, with commercial leverage allowing for both,
continued strong cash operating margins and above average investment in innovative
growth opportunities.”
Financial result overview – Table 9M 2009 vs. 9M 2008
In CHF thousands Result 9M 2009 Result 9M 2008 Variance %
Net Revenues 1,302,541 1,069,620 232,921 22
Operating Expenses 939,297 794,424 144,873 18
Operating Income 363,244 275,196 88,048 32
Cash EBIT 462,008 355,643 106,365 30
Net Income* 326,902 227,369 99,533 44
Diluted EPS in CHF* 2.66 1.84 0.82 45
No of shares in calculation 122,743 123,431
* 2006 convertible bond reclassification according to adoption of FSP APB 14-1 – comparative period adjusted.
The full financial statements can be found on http://www.actelion.com.
Continued growth of total net revenues
During the first nine months of 2009, Actelion’s total net revenues increased by 22 percent
to CHF 1,302.5 million (9M 2008: CHF 1,069.6 m). In local currencies, total net revenues
increased by 23 percent compared to the first nine months of 2008.
Contract revenues for the first nine months of 2009 amounted to CHF 47.9 million (9M
2008: CHF 29.2 m).
Product sales
During the first nine months of 2009, Tracleer® (bosentan) sales were CHF1,114.7 million
(9M 2008: CHF 945.8 m). In local currencies, this represents an increase of 19 percent
compared to the same period last year.
In early July, the European Commission approved the pediatric dispersible formulation of
Tracleer® for the treatment of pulmonary arterial hypertension (PAH) in children from two
page 3 of 9
- Actelion announces 9-month results 2009 -
years of age. This approval makes Tracleer® the only PAH therapy with an approved
pediatric formulation.
In early August, the U.S. Food and Drug Administration (FDA) approved the company's
supplemental New Drug Application (sNDA) for Tracleer® to treat patients with mildly
symptomatic WHO Functional Class II (FC II) pulmonary arterial hypertension (PAH). The
U.S. FDA has also approved Actelion's Risk Evaluation and Mitigation Strategy (REMS)
for Tracleer®.
At the end of September 2009, Tracleer® was commercially available in over 50 countries
worldwide, including all major pharmaceutical markets.
Ventavis® (iloprost) sales amounted to CHF 101.6 million for the first nine months of 2009
(9M 2008: CHF 64.5 m). This represents an increase of 50 percent in US Dollars. The
ongoing strong performance of Ventavis® is most likely to trigger a one-off performance
milestone payment to Bayer Schering Pharma in the near future. Accordingly, Actelion
has in the third quarter accrued this forthcoming USD 10 million payment under cost of
goods sold (COGS).
In early August 2009, the FDA approved a new 20 microgram per milliliter (mcg/ml)
formulation of Ventavis® as a therapy for New York Heart Association Class III and IV
PAH. This new increased 20 mcg/ml strength formulation will deliver the same dose in half
the volume which is expected to reduce inhalation time and further support patient
compliance.
The approval was based on the submission of technical data showing that the new
formulation did not alter the functional characteristics of the delivery system or the emitted
dose to the patient. A clinical program to evaluate the use of a higher-powered disk for the
delivery device is ongoing.
Otto Schwarz, President Business Operations, commented: “Sales growth remains strong
this year driven by Tracleer®, and our outreach efforts to further expand usage in earlystage
patients based on the broadened US product label will sustain Tracleer® growth
going forward. With the US approval of the 20 mcg/ml Ventavis® solution and the related
reduction in inhalation time, we have also strengthened the competitive profile of
Ventavis®.”
Efforts are ongoing to further strengthen our PAH franchise with the forthcoming market
introduction of an improved, thermostable formulation of epoprostenol sodium for the
intravenous treatment of PAH. This medication was acquired from privately-held
GeneraMedix Inc. in the first half of 2009.
page 4 of 9
- Actelion announces 9-month results 2009 -
The drug was approved in June 2008 in the United States for the long-term intravenous
treatment of primary pulmonary hypertension and pulmonary hypertension associated with
the scleroderma spectrum of disease in NYHA Class III and Class IV patients who do not
respond adequately to conventional therapy. Outside the United States, Actelion expects
to initiate regulatory activities for this product, designed to improve ease of use and
patient convenience.
In the first nine months of 2009, Zavesca® (miglustat) sales were CHF 38.3 million (9M
2008: CHF 30.1 m). In local currencies, Zavesca® sales increased by 33 percent.
Zavesca® is commercially available in over 35 countries including the United States and
most European markets for the treatment of adult patients with mild to moderate type I
Gaucher disease for whom enzyme replacement therapy (ERT) is not a therapeutic
option.
Actelion continues its commitment to patients suffering from type 1 Gaucher disease, not
only by continuing its educational efforts in the field but also by conducting additional
clinical studies. Actelion is following up on the potential use of Zavesca® after a switch
from enzyme replacement therapy by conducting a long-term MAINTENANCE study. This
two-year study was fully enrolled with 42 patients in June 2008. Study results are
expected in H2 2010.
In early September 2009, Actelion provided updated information to US-based Healthcare
Professionals who treat type 1 Gaucher patients regarding the potential use of Zavesca®
(miglustat) to minimize the impact of the supply shortage of imiglucerase (produced and
marketed by Genzyme Corporation under the brand name Cerezyme®).
In January 2009, Zavesca® received approval in the European Union for the treatment of
progressive neurological manifestations in adult patients and pediatric patients with
Niemann-Pick type C disease (NP-C). Zavesca® is the first treatment to be approved for
patients with Niemann-Pick type C disease, a very rare and devastating
neurodegenerative genetic disorder affecting both children and adults. The market
introduction commenced in late Q2 2009 in selected European markets.
In the United States, following a constructive pre-NDA (New Drug Application) meeting
with the FDA in H1 2009, Actelion is currently in the process of filing a supplemental NDA
for miglustat (Zavesca®) in NP-C.
Otto Schwarz concluded: “I am pleased to observe a favorable market reception for
Zavesca® in NPC, resulting in a strong quarter-on-quarter 32 percent growth in local
currencies.”
page 5 of 9
- Actelion announces 9-month results 2009 -
Operating expenses
During the first nine months of 2009, operating expenses were CHF 939.3 million (9M
2008: CHF 794.4 m).
During the same period, research and development expenses increased by 15 percent to
CHF 318.9 million (9M 2008: CHF 277.6 m). Nine-month 2008 operating expenses
included a milestone payment related to the PGI2 receptor agonist in-licensed from Nippon
Shinyaku. Excluding this payment, R&D expenses increased by 29 percent year on year.
Selling, general and administrative expenses for the first nine months of 2009 amounted
to CHF 449.5 million (9M 2008: CHF 387.6 m), an increase of 16 percent.
Research and Development
Actelion’s pipeline now has 10 compounds in clinical development as well as more than
25 active projects in drug discovery.
Jean-Paul Clozel added: “Since Actelion was founded in late 1997, we have created a
highly productive in-house research and development organization, which results in a
broad and promising preclinical and clinical pipeline. To further advance organic value
creation, we continue to partner with industry leaders such as Glaxo-Smith Kline, Merck
and Roche. I am pleased that we are making progress in all three collaborations, working
with fully dedicated partners that share our commitment to innovation and changing patient
lives.”
Jean-Paul Clozel continued: “It is exactly the same commitment that drives our in-licensing
efforts, where we continue to evaluate multiple promising product opportunities on an
ongoing basis to further leverage our existing global infrastructure and expertise. We have
done so successfully in the past with Zavesca® and Ventavis®.”
There are four compounds in Phase III development, with a fifth expected to be initiated
before year-end 2009. In brief, they are:
- Almorexant in primary insomnia: The first Phase III study, part of the RESTORA
program, is on schedule to report top-line results before the end of 2009.
RESTORA 1 is a pivotal study designed to evaluate safety and efficacy of
almorexant in patients diagnosed with primary insomnia. The 700-patient doubleblind,
placebo-controlled, two-dose, four-arm study includes a reference arm with
zolpidem, an approved treatment for insomnia.
- Bosentan (Tracleer®) in IPF: This 616 patient, multicenter, double-blind,
randomized, placebo-controlled, parallel group, event-driven morbidity/mortality
study (BUILD-3) is evaluating the safety and efficacy of bosentan 125mg b.i.d. in
page 6 of 9
- Actelion announces 9-month results 2009 -
patients diagnosed with idiopathic pulmonary fibrosis. Top-line results are
expected in early 2010.
- Clazosentan in aSAH: The Phase III study CONSCIOUS-2 (Clazosentan to
Overcome Neurological iSCHemia and Infarct OccUrring after Subarachnoid
hemorrhage) evaluates efficacy and safety of Clazosentan (5mg/h intravenously
for 14 days) versus placebo in 1,146 patients post aSAH treated by surgical
clipping of the aneurysm. The primary endpoint of the study is all-cause mortality
and vasospasm-related morbidity, which includes vasospasm-related neurological
deterioration, vasospasm-related new brain infarcts and initiation of vasospasmrelated
rescue therapy. CONSCIOUS-2 results are expected to become available
by mid-year 2010. If successful, Actelion will approach health authorities for filing.
Enrollment is ongoing in another Phase III study with clazosentan, CONSCIOUS-
3. This 1,500 patient study evaluates the efficacy and safety of two doses (5 or 15
mg/h) of clazosentan versus placebo in patients post-aSAH treated by
endovascular coiling. The primary endpoint is identical to that of CONSCIOUS 2.
- Macitentan in PAH: The 700 patient multicenter, double-blind, randomized,
placebo-controlled, parallel group, event-driven pivotal SERAPHIN program is
evaluating safety and efficacy of this highly potent tissue-targeting endothelin
receptor antagonist through the primary endpoint of morbidity and all-cause
mortality in patients with symptomatic PAH. Study results expected before yearend
2012.
- Actelion's PGI2 receptor agonist in PAH: Following a successful Phase IIa study
with this first-in-class orally active non-prostanoid PGI2 receptor agonist, Actelion
is currently finalizing the design for a Phase III program with a morbidity/mortality
endpoint. Program initiation is expected before year-end.
A comprehensive update on these and all other clinical programs can be found in the H1
2009 media release, issued on 21 July 2009.
In early October 2009, progress was made with Actelion’s selective S1P1 (Sphingosine-1-
phosphate) receptor agonist as the compound entered into a Phase IIb dose-finding study
in patients suffering from multiple sclerosis. This triggered a milestone payment of USD 20
million from the S1P1-alliance partner Roche to Actelion.
Currently, Actelion and Roche have started to review the data of the recently concluded
Phase IIa proof-of-concept study with this selective S1P1 agonist in psoriasis. Once data
analysis has concluded, the two companies will make further development decisions for
this agent targeting multiple autoimmune disorders.
page 7 of 9
- Actelion announces 9-month results 2009 -
Jean-Paul Clozel concluded: “In the months to come, I am looking forward to reporting
clinical data from three Phase III programs: almorexant in primary insomnia, bosentan in
idiopathic pulmonary fibrosis and clazosentan in non-traumatic subarachnoid
hemorrhage.”
Operating profit
Actelion’s operating profit for the first nine months of 2009 was CHF 363.2 million (9M
2008: CHF 275.2 m). Cash EBIT for the same period amounted to CHF 462.0 million (9M
2008: CHF 355.6 m).
Net Profit
In the first nine months of 2009, the net profit of CHF 326.9 million (9M 2008: CHF 227.4
m) includes interest income of CHF 3.6 million, interest expense of CHF 4.8 million, noncash
interest and amortization charges on the Convertible Bond of CHF 13.3 million,
foreign currency gains of CHF 15.3 million and an income tax expense of CHF 37.1
million.
Cash and cash flow
During the first nine months of 2009, Actelion generated net cash flow from operations of
CHF 300.9 million (9M 2008: CHF 410.7 m). As of 30 September 2009, total liquid funds
(excluding 8.6 million treasury shares) amounted to CHF 1.3 billion.
For documentation purposes – table Q3 2009 vs. Q2 2009
In CHF thousands Result
Q3 2009
Result
Q2 2009
Variance %
Net revenues 447,302 449,626 (2,324) (1)
Operating Expenses 326,934 328,381 (1,447) 0
- Research and Development 109,318 113,737 (4,419) (4)
- Selling, General and Admin. 149,914 160,758 (10,844) (7)
Operating Income 120,368 121,245 (877) (1)
Cash EBIT 157,161 158,308 (1,147) (1)
Net Income 108,462 116,221 (7,759) (7)
Diluted EPS in CHF 0.88 0.95 (0.07) (7)
No of shares in calculation 123,547 122,033
page 8 of 9
- Actelion announces 9-month results 2009 -
Upcoming Corporate Events
Before Year-End 2009
Q1 2010
Thursday, 18 February, 2010
Thursday, 22 April, 2010
Tuesday, 4 May, 2010
Mid-2010
Thursday, 22 July, 2010
Thursday, 21 October, 2010
- RESTORA-1 in primary insomnia
- BUILD-3 in IPF
- Full Year Results 2009
- Q1 Results 2010
- AGM 2010
- CONSCIOUS-2 in clipped aSAH
- Half Year Results 2010
- Q3 Results 2010
###
Actelion announces 9-month financial results 2009
Total net revenues of CHF 1,302.5 million, up 22 percent compared to
the first nine months 2008 – Tracleer® sales of CHF 1,114.7 million, up
19 percent in local currencies – Cash EBIT of CHF 462.0 million, up 33
percent in local currencies – FY 2009 results expected at upper end of
guidance range – Positive 2010 growth outlook – Final Phase III study
results with bosentan and clazosentan in the months ahead
ALLSCHWIL/BASEL, SWITZERLAND – 20 October 2009 – Actelion Ltd (SIX: ATLN)
today announced its financial results for the first nine months of 2009. With total net
revenues for the first nine months of 2009 of CHF 1,302.5 million (9M 2008: CHF 1,069.6
m) and operating expenses of CHF 939.3 million (9M 2008: CHF 794.4 m), the company
reported an operating profit of CHF 363.2 million (9M 2008: CHF 275.2 m).
To better measure and compare operating performance over time, Actelion continues to
report non-US GAAP Cash EBIT (Operating Income excluding charges such as In-
Process R&D, charges related to employee stock options under FAS 123R as well as
non-cash depreciation and amortization charges). For the first nine months of 2009,
Actelion reported a Cash EBIT of CHF 462.0 million, an increase of 30 percent compared
to the same period in 2008. In local currencies, Cash EBIT increased by 33 percent.
Adjusted (non-US GAAP) diluted earnings per share for the first nine months of 2009 were
CHF 3.48, compared to CHF 2.53 during the same period last year.
On a US GAAP basis, net profit for the first nine months of 2009 was CHF 326.9 million
(9M 2008: CHF 227.4 m). Fully diluted earnings per share (EPS) on a US GAAP basis for
the same period were CHF 2.66, compared to CHF 1.84 for the first nine months of 2008.
Jean-Paul Clozel, M.D. and Chief Executive Officer commented: “Actelion continues to
execute in-line with its strategy to create long-term value for patients. Our franchise in
pulmonary arterial hypertension will ensure profitable growth going forward. With two
additional promising PAH compounds in advanced clinical development which include
macitentan and our partnership with Nippon Shinyaku to develop the PGI2 receptor
agonist, we intend to remain on the forefront of PAH research and therapy.”
page 2 of 9
- Actelion announces 9-month results 2009 -
Andrew J. Oakley, Chief Financial Officer commented: “In the first nine months of 2009,
Actelion’s base business is continuing to perform strongly, despite an adverse currency
environment that especially impacted Q3 performance as expressed in our reporting
currency, the Swiss Franc. In July of this year, Actelion upgraded guidance for FY 2009 of
both top-line and Cash EBIT growth between 16 and 19 percent in local currencies.
Today, I can confirm guidance and I forecast that we will very likely be towards the upper
end of the ranges given.”
Andrew J. Oakley concluded: “Unforeseen events excluded, Actelion’s outlook for 2010
continues to be positive. I am confident that top-line growth next year will be in the lowdouble
digit range in local currencies, with commercial leverage allowing for both,
continued strong cash operating margins and above average investment in innovative
growth opportunities.”
Financial result overview – Table 9M 2009 vs. 9M 2008
In CHF thousands Result 9M 2009 Result 9M 2008 Variance %
Net Revenues 1,302,541 1,069,620 232,921 22
Operating Expenses 939,297 794,424 144,873 18
Operating Income 363,244 275,196 88,048 32
Cash EBIT 462,008 355,643 106,365 30
Net Income* 326,902 227,369 99,533 44
Diluted EPS in CHF* 2.66 1.84 0.82 45
No of shares in calculation 122,743 123,431
* 2006 convertible bond reclassification according to adoption of FSP APB 14-1 – comparative period adjusted.
The full financial statements can be found on http://www.actelion.com.
Continued growth of total net revenues
During the first nine months of 2009, Actelion’s total net revenues increased by 22 percent
to CHF 1,302.5 million (9M 2008: CHF 1,069.6 m). In local currencies, total net revenues
increased by 23 percent compared to the first nine months of 2008.
Contract revenues for the first nine months of 2009 amounted to CHF 47.9 million (9M
2008: CHF 29.2 m).
Product sales
During the first nine months of 2009, Tracleer® (bosentan) sales were CHF1,114.7 million
(9M 2008: CHF 945.8 m). In local currencies, this represents an increase of 19 percent
compared to the same period last year.
In early July, the European Commission approved the pediatric dispersible formulation of
Tracleer® for the treatment of pulmonary arterial hypertension (PAH) in children from two
page 3 of 9
- Actelion announces 9-month results 2009 -
years of age. This approval makes Tracleer® the only PAH therapy with an approved
pediatric formulation.
In early August, the U.S. Food and Drug Administration (FDA) approved the company's
supplemental New Drug Application (sNDA) for Tracleer® to treat patients with mildly
symptomatic WHO Functional Class II (FC II) pulmonary arterial hypertension (PAH). The
U.S. FDA has also approved Actelion's Risk Evaluation and Mitigation Strategy (REMS)
for Tracleer®.
At the end of September 2009, Tracleer® was commercially available in over 50 countries
worldwide, including all major pharmaceutical markets.
Ventavis® (iloprost) sales amounted to CHF 101.6 million for the first nine months of 2009
(9M 2008: CHF 64.5 m). This represents an increase of 50 percent in US Dollars. The
ongoing strong performance of Ventavis® is most likely to trigger a one-off performance
milestone payment to Bayer Schering Pharma in the near future. Accordingly, Actelion
has in the third quarter accrued this forthcoming USD 10 million payment under cost of
goods sold (COGS).
In early August 2009, the FDA approved a new 20 microgram per milliliter (mcg/ml)
formulation of Ventavis® as a therapy for New York Heart Association Class III and IV
PAH. This new increased 20 mcg/ml strength formulation will deliver the same dose in half
the volume which is expected to reduce inhalation time and further support patient
compliance.
The approval was based on the submission of technical data showing that the new
formulation did not alter the functional characteristics of the delivery system or the emitted
dose to the patient. A clinical program to evaluate the use of a higher-powered disk for the
delivery device is ongoing.
Otto Schwarz, President Business Operations, commented: “Sales growth remains strong
this year driven by Tracleer®, and our outreach efforts to further expand usage in earlystage
patients based on the broadened US product label will sustain Tracleer® growth
going forward. With the US approval of the 20 mcg/ml Ventavis® solution and the related
reduction in inhalation time, we have also strengthened the competitive profile of
Ventavis®.”
Efforts are ongoing to further strengthen our PAH franchise with the forthcoming market
introduction of an improved, thermostable formulation of epoprostenol sodium for the
intravenous treatment of PAH. This medication was acquired from privately-held
GeneraMedix Inc. in the first half of 2009.
page 4 of 9
- Actelion announces 9-month results 2009 -
The drug was approved in June 2008 in the United States for the long-term intravenous
treatment of primary pulmonary hypertension and pulmonary hypertension associated with
the scleroderma spectrum of disease in NYHA Class III and Class IV patients who do not
respond adequately to conventional therapy. Outside the United States, Actelion expects
to initiate regulatory activities for this product, designed to improve ease of use and
patient convenience.
In the first nine months of 2009, Zavesca® (miglustat) sales were CHF 38.3 million (9M
2008: CHF 30.1 m). In local currencies, Zavesca® sales increased by 33 percent.
Zavesca® is commercially available in over 35 countries including the United States and
most European markets for the treatment of adult patients with mild to moderate type I
Gaucher disease for whom enzyme replacement therapy (ERT) is not a therapeutic
option.
Actelion continues its commitment to patients suffering from type 1 Gaucher disease, not
only by continuing its educational efforts in the field but also by conducting additional
clinical studies. Actelion is following up on the potential use of Zavesca® after a switch
from enzyme replacement therapy by conducting a long-term MAINTENANCE study. This
two-year study was fully enrolled with 42 patients in June 2008. Study results are
expected in H2 2010.
In early September 2009, Actelion provided updated information to US-based Healthcare
Professionals who treat type 1 Gaucher patients regarding the potential use of Zavesca®
(miglustat) to minimize the impact of the supply shortage of imiglucerase (produced and
marketed by Genzyme Corporation under the brand name Cerezyme®).
In January 2009, Zavesca® received approval in the European Union for the treatment of
progressive neurological manifestations in adult patients and pediatric patients with
Niemann-Pick type C disease (NP-C). Zavesca® is the first treatment to be approved for
patients with Niemann-Pick type C disease, a very rare and devastating
neurodegenerative genetic disorder affecting both children and adults. The market
introduction commenced in late Q2 2009 in selected European markets.
In the United States, following a constructive pre-NDA (New Drug Application) meeting
with the FDA in H1 2009, Actelion is currently in the process of filing a supplemental NDA
for miglustat (Zavesca®) in NP-C.
Otto Schwarz concluded: “I am pleased to observe a favorable market reception for
Zavesca® in NPC, resulting in a strong quarter-on-quarter 32 percent growth in local
currencies.”
page 5 of 9
- Actelion announces 9-month results 2009 -
Operating expenses
During the first nine months of 2009, operating expenses were CHF 939.3 million (9M
2008: CHF 794.4 m).
During the same period, research and development expenses increased by 15 percent to
CHF 318.9 million (9M 2008: CHF 277.6 m). Nine-month 2008 operating expenses
included a milestone payment related to the PGI2 receptor agonist in-licensed from Nippon
Shinyaku. Excluding this payment, R&D expenses increased by 29 percent year on year.
Selling, general and administrative expenses for the first nine months of 2009 amounted
to CHF 449.5 million (9M 2008: CHF 387.6 m), an increase of 16 percent.
Research and Development
Actelion’s pipeline now has 10 compounds in clinical development as well as more than
25 active projects in drug discovery.
Jean-Paul Clozel added: “Since Actelion was founded in late 1997, we have created a
highly productive in-house research and development organization, which results in a
broad and promising preclinical and clinical pipeline. To further advance organic value
creation, we continue to partner with industry leaders such as Glaxo-Smith Kline, Merck
and Roche. I am pleased that we are making progress in all three collaborations, working
with fully dedicated partners that share our commitment to innovation and changing patient
lives.”
Jean-Paul Clozel continued: “It is exactly the same commitment that drives our in-licensing
efforts, where we continue to evaluate multiple promising product opportunities on an
ongoing basis to further leverage our existing global infrastructure and expertise. We have
done so successfully in the past with Zavesca® and Ventavis®.”
There are four compounds in Phase III development, with a fifth expected to be initiated
before year-end 2009. In brief, they are:
- Almorexant in primary insomnia: The first Phase III study, part of the RESTORA
program, is on schedule to report top-line results before the end of 2009.
RESTORA 1 is a pivotal study designed to evaluate safety and efficacy of
almorexant in patients diagnosed with primary insomnia. The 700-patient doubleblind,
placebo-controlled, two-dose, four-arm study includes a reference arm with
zolpidem, an approved treatment for insomnia.
- Bosentan (Tracleer®) in IPF: This 616 patient, multicenter, double-blind,
randomized, placebo-controlled, parallel group, event-driven morbidity/mortality
study (BUILD-3) is evaluating the safety and efficacy of bosentan 125mg b.i.d. in
page 6 of 9
- Actelion announces 9-month results 2009 -
patients diagnosed with idiopathic pulmonary fibrosis. Top-line results are
expected in early 2010.
- Clazosentan in aSAH: The Phase III study CONSCIOUS-2 (Clazosentan to
Overcome Neurological iSCHemia and Infarct OccUrring after Subarachnoid
hemorrhage) evaluates efficacy and safety of Clazosentan (5mg/h intravenously
for 14 days) versus placebo in 1,146 patients post aSAH treated by surgical
clipping of the aneurysm. The primary endpoint of the study is all-cause mortality
and vasospasm-related morbidity, which includes vasospasm-related neurological
deterioration, vasospasm-related new brain infarcts and initiation of vasospasmrelated
rescue therapy. CONSCIOUS-2 results are expected to become available
by mid-year 2010. If successful, Actelion will approach health authorities for filing.
Enrollment is ongoing in another Phase III study with clazosentan, CONSCIOUS-
3. This 1,500 patient study evaluates the efficacy and safety of two doses (5 or 15
mg/h) of clazosentan versus placebo in patients post-aSAH treated by
endovascular coiling. The primary endpoint is identical to that of CONSCIOUS 2.
- Macitentan in PAH: The 700 patient multicenter, double-blind, randomized,
placebo-controlled, parallel group, event-driven pivotal SERAPHIN program is
evaluating safety and efficacy of this highly potent tissue-targeting endothelin
receptor antagonist through the primary endpoint of morbidity and all-cause
mortality in patients with symptomatic PAH. Study results expected before yearend
2012.
- Actelion's PGI2 receptor agonist in PAH: Following a successful Phase IIa study
with this first-in-class orally active non-prostanoid PGI2 receptor agonist, Actelion
is currently finalizing the design for a Phase III program with a morbidity/mortality
endpoint. Program initiation is expected before year-end.
A comprehensive update on these and all other clinical programs can be found in the H1
2009 media release, issued on 21 July 2009.
In early October 2009, progress was made with Actelion’s selective S1P1 (Sphingosine-1-
phosphate) receptor agonist as the compound entered into a Phase IIb dose-finding study
in patients suffering from multiple sclerosis. This triggered a milestone payment of USD 20
million from the S1P1-alliance partner Roche to Actelion.
Currently, Actelion and Roche have started to review the data of the recently concluded
Phase IIa proof-of-concept study with this selective S1P1 agonist in psoriasis. Once data
analysis has concluded, the two companies will make further development decisions for
this agent targeting multiple autoimmune disorders.
page 7 of 9
- Actelion announces 9-month results 2009 -
Jean-Paul Clozel concluded: “In the months to come, I am looking forward to reporting
clinical data from three Phase III programs: almorexant in primary insomnia, bosentan in
idiopathic pulmonary fibrosis and clazosentan in non-traumatic subarachnoid
hemorrhage.”
Operating profit
Actelion’s operating profit for the first nine months of 2009 was CHF 363.2 million (9M
2008: CHF 275.2 m). Cash EBIT for the same period amounted to CHF 462.0 million (9M
2008: CHF 355.6 m).
Net Profit
In the first nine months of 2009, the net profit of CHF 326.9 million (9M 2008: CHF 227.4
m) includes interest income of CHF 3.6 million, interest expense of CHF 4.8 million, noncash
interest and amortization charges on the Convertible Bond of CHF 13.3 million,
foreign currency gains of CHF 15.3 million and an income tax expense of CHF 37.1
million.
Cash and cash flow
During the first nine months of 2009, Actelion generated net cash flow from operations of
CHF 300.9 million (9M 2008: CHF 410.7 m). As of 30 September 2009, total liquid funds
(excluding 8.6 million treasury shares) amounted to CHF 1.3 billion.
For documentation purposes – table Q3 2009 vs. Q2 2009
In CHF thousands Result
Q3 2009
Result
Q2 2009
Variance %
Net revenues 447,302 449,626 (2,324) (1)
Operating Expenses 326,934 328,381 (1,447) 0
- Research and Development 109,318 113,737 (4,419) (4)
- Selling, General and Admin. 149,914 160,758 (10,844) (7)
Operating Income 120,368 121,245 (877) (1)
Cash EBIT 157,161 158,308 (1,147) (1)
Net Income 108,462 116,221 (7,759) (7)
Diluted EPS in CHF 0.88 0.95 (0.07) (7)
No of shares in calculation 123,547 122,033
page 8 of 9
- Actelion announces 9-month results 2009 -
Upcoming Corporate Events
Before Year-End 2009
Q1 2010
Thursday, 18 February, 2010
Thursday, 22 April, 2010
Tuesday, 4 May, 2010
Mid-2010
Thursday, 22 July, 2010
Thursday, 21 October, 2010
- RESTORA-1 in primary insomnia
- BUILD-3 in IPF
- Full Year Results 2009
- Q1 Results 2010
- AGM 2010
- CONSCIOUS-2 in clipped aSAH
- Half Year Results 2010
- Q3 Results 2010
###
und hier nochmal auf deutsch:
20.10.2009 07:00:00
Actelion gibt Finanzergebnisse für die ersten neun Monate 2009 bekannt
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin. Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
----------------------------------------------------------------------
Nettoumsatz bei CHF 1.302,5 Millionen, ein Anstieg um 22 Prozent gegenüber den ersten neun Monaten 2008
- Umsatz von Tracleer® bei CHF 1.114,7 Millionen, plus 19 Prozent in lokalen Währungen
- Cash-EBIT erreicht CHF 462,0 Millionen, ein Anstieg um 33 Prozent in lokalen Währungen
- Ergebnisse für das Gesamtjahr 2009 voraussichtlich am oberen Ende der geschätzten Spanne
- Günstige Wachstumsaussichten für 2010
- Abschliessende Ergebnisse aus Phase-III-Studien mit Bosentan und Clazosentan in den kommenden Monaten
ALLSCHWIL/BASEL,
SCHWEIZ - 20. Oktober 2009 - Actelion Ltd (SIX: ATLN) gab heute die Finanzergebnisse des Unternehmens für die ersten neun Monate des Jahres 2009 bekannt. Mit einem Nettoumsatz in Höhe von CHF 1.302,5 Millionen in den ersten neun Monaten 2009 (9 Monate 2008: CHF 1.069,6 Mio.) und einem Betriebsaufwand von CHF 939,3 Millionen (9 Monate 2008: CHF 794,4 Mio.) meldete das Unternehmen einen Betriebsgewinn von CHF 363,2 Millionen (9 Monate 2008: CHF 275,2 Mio.). Um die betriebliche Leistung des Unternehmens besser messen und vergleichen zu können, weist Actelion weiterhin den non-US GAAP Cash-EBIT aus (Betriebsergebnis ausschliesslich IPR&D, Aufwendungen in Verbindung mit Aktienoptionen für Mitarbeitende nach FAS 123R sowie Aufwendungen für nicht-liquiditätswirksame Abschreibungen und Amortisationen). In den ersten neun Monaten 2009 erzielte Actelion einen Cash-EBIT von CHF 462,0 Millionen, ein Anstieg um 30 Prozent gegenüber demselben Zeitraum im Vorjahr. In lokalen Währungen stieg der Cash-EBIT um 33 Prozent. Der angepasste verwässerte Gewinn pro Aktie (EPS) für die ersten neun Monate 2009 (non-US GAAP) belief sich auf CHF 3,48 gegenüber CHF 2,53 im selben Zeitraum des Vorjahrs. Unter Anwendung von US GAAP lag der Reingewinn für die ersten neun Monate 2009 bei CHF 326,9 Millionen (9 Monate 2008: CHF 227,4 Mio.). Der vollständig verwässerte Gewinn pro Aktie (EPS) nach US GAAP belief sich für die ersten neun Monate 2009 auf CHF 2,66 gegenüber CHF 1,84 in den ersten neun Monaten 2008.
Dr. Jean-Paul Clozel, Chief Executive Officer, kommentierte: "Actelion handelt auch weiterhin entsprechend der Strategie unseres Unternehmens, im Interesse der Patienten langfristige Werte zu schaffen. Unser Geschäft im Segment der pulmonalen arteriellen Hypertonie (PAH) wird auch künftig für profitables Wachstum sorgen. Mit zwei weiteren viel versprechenden Substanzen im Bereich PAH, die sich in einem fortgeschrittenen Stadium der klinischen Entwicklung befinden, wollen wir in Forschung und Therapie bei PAH führend bleiben: mit Macitentan sowie dem in Partnerschaft mit Nippon Shinyaku in Entwicklung befindlichen PGI2-Rezeptor-Agonisten."
Andrew J. Oakley, Chief Financial Officer, kommentierte: "In den ersten neun Monaten 2009 hat das Basisgeschäft von Actelion kontinuierlich starke Leistungen erbracht und dies trotz eines sehr ungünstigen Wechselkursumfelds, das insbesondere den Leistungsausweis im 3. Quartal beeinträchtigte, was sich in unserer Berichtswährung, dem Schweizer Franken, widerspiegelt. Im Juli dieses Jahres erhöhte Actelion die Schätzung für das Jahr 2009 sowohl für das Umsatzwachstum als auch das Wachstum des Cash-EBIT auf 16 und 19 Prozent in lokalen Währungen. Heute kann ich diese Schätzungen bestätigen und gehe davon aus, dass wir höchstwahrscheinlich am oberen Ende der vorgegebenen Bandbreiten liegen werden."
Andrew J. Oakley schloss: "Sofern keine unvorhersehbaren Ereignisse eintreten, sind die Aussichten für Actelion auch für 2010 weiterhin günstig. Ich bin zuversichtlich, dass sich das Umsatzwachstum in lokalen Währungen im nächsten Jahr im niedrigen zweistelligen Bereich bewegen wird, was anhaltend starke liquiditätswirksame operative Margen als auch überdurchschnittliche Investitionen in innovative Wachstumsoptionen zur Folge haben dürfte."
Finanzergebnisse im Überblick - Tabelle 9 Monate 2009 vs. 9 Monate 2008 In CHF Tausend Ergebnisse Ergebnisse Veränderung % 9 Monate 9 Monate 2008 2009 Nettoumsatz 1 302 541 1 069 620 232 921 22 Betriebsaufwand 939 297 794 424 144 873 18 Betriebsgewinn 363 244 275 196 88 048 32 Cash-EBIT 462 008 355 643 106 365 30 Reingewinn* 326 902 227 369 99 533 44 Verwässerter Gewinn 2,66 1,84 0,82 45 pro Aktie (EPS) in CHF* Anzahl Aktien zur 122 743 123 431 Berechnung (Angabe in Tausend) * Reklassifizierung der Wandelanleihe von 2006 gemäss FSP APB 14-1 - Vergleichsperiode angepasst.
Die vollständige Konzernrechnung finden Sie unter http://www.actelion.com.
Anhaltendes Wachstum des Nettoumsatzes
In den ersten neun Monaten 2009 stieg der Nettoumsatz von Actelion um 22 Prozent auf CHF 1.302,5 Millionen (9 Monate 2008: CHF 1.069,6 Mio.). In lokalen Währungen stieg der Nettoumsatz gegenüber den ersten neun Monaten 2008 um 23 Prozent. Die Einkünfte aus vertraglichen Vereinbarungen beliefen sich in den ersten neun Monaten 2009 auf 47,9 Millionen (9 Monate 2008: CHF 29,2 Mio.). Produkteumsatz In den ersten neun Monaten 2009 belief sich der Umsatz von Tracleer® (Bosentan) auf CHF 1.114,7 Millionen (9 Monate 2008: CHF 945,8 Mio.). In lokalen Währungen bedeutet dies einen Anstieg um 19 Prozent gegenüber demselben Zeitraum des Vorjahrs. Anfang Juli erteilte die Europäische Kommission die Zulassung für die dispergierbare pädiatrische Formulierung von Tracleer® zur Therapie der PAH bei Kindern ab zwei Jahren. Mit dieser Zulassung wird Tracleer® zur einzigen PAH-Therapie mit einer zugelassenen pädiatrischen Formulierung. Anfang August genehmigte die US-amerikanische Zulassungsbehörde FDA (Food and Drug Administration) den Antrag auf Indikationserweiterung (supplemental New Drug Application) für Tracleer® zur Behandlung auch von Patienten mit leichteren Symptomen der pulmonalen arteriellen Hypertonie (PAH), die der sogenannten WHO-Funktionsklasse II zugeordnet werden. Zudem hat die FDA auch Actelions Risikomanagementstrategie (Risk Evaluation and Mitigation Strategy, REMS) für Tracleer® zugestimmt. Ende September 2009 wurde Tracleer® in über 50 Ländern vermarktet, darunter alle wichtigen pharmazeutischen Märkte. Der Umsatz von Ventavis® (Iloprost) belief sich in den ersten neun Monaten 2009 auf CHF 101,6 Millionen (9 Monate 2008: CHF 64,5 Mio.). In US-Dollar bedeutet dies einen Anstieg um 50 Prozent. Aufgrund der anhaltend starken Leistung von Ventavis® steht demnächst voraussichtlich eine einmalige Meilensteinzahlung an Bayer Schering Pharma an. Actelion hat diese anfallende Zahlung in Höhe von USD 10 Millionen im dritten Quartal als Umsatzaufwendung verbucht. Anfang August 2009 erteilte die amerikanische Food and Drug Administration (FDA) die Zulassung für eine neue Formulierung von Ventavis® in einer Dosisstärke von 20 Mikrogramm pro Milliliter (mcg/ml) zur Behandlung der PAH der Klassen III und IV gemäss New York Heart Association. Bei dieser neuen, stärker konzentrierten Formulierung von 20 mcg/ml kann die gleiche Dosis mit einem um die Hälfte reduzierten Lösungsvolumen verabreicht werden. Dies dürfte sich in einer verkürzten Inhalationszeit und einer verbesserten Therapietreue der Patienten niederschlagen. Die Zulassung basiert auf technischen Daten, die belegen, dass die neue Formulierung weder die Funktionsweise des Applikationssystems noch die Abgabe der erforderlichen Dosis verändert. Zurzeit läuft ein klinisches Programm zur Evaluierung des sogenannten Power 15 disc für die Applikationshilfe. Otto Schwarz, Präsident Business Operations, kommentierte: "Dank Tracleer® verzeichnen wir auch in diesem Jahr ein starkes Umsatzwachstum und unsere Anstrengungen, auf Grundlage der Indikationserweiterung in den USA weitere Patienten in frühen Stadien der Erkrankung zu erreichen, werden zu einem anhaltenden Wachstum von Tracleer® beitragen. Mit der US-Zulassung der 20 mcg/ml-Lösung von Ventavis® und der damit verbundenen kürzeren Inhalationszeit konnten wir überdies das Profil von Ventavis® im Wettbewerb schärfen." Mit der anstehenden Markteinführung einer verbesserten thermostabilen Formulierung von Epoprostenol-Natrium zur intravenösen Behandlung von PAH laufen derzeit weitere Massnahmen zur Stärkung unseres PAH-Geschäfts. Dieses Medikament wurde in der ersten Jahreshälfte 2009 von dem im Privatbesitz befindlichen Unternehmen GeneraMedix Inc. erworben. Dieses Arzneimittel erhielt im Juni 2008 in den Vereinigten Staaten die Zulassung für die intravenöse Langzeitbehandlung der primären pulmonalen Hypertonie und für die in Verbindung mit dem Krankheitsbild der Sklerodermie auftretenden Formen der pulmonalen Hypertonie bei Patienten der NYHA-Klassen III und IV, die auf konventionelle Behandlungsformen nicht ausreichend ansprechen. Für andere Länder ausserhalb der USA bereitet Actelion derzeit Zulassungsanträge für dieses Produkt vor, das für eine einfachere Handhabung und bequemere Anwendung entwickelt wurde. Der Umsatz von Zavesca® (Miglustat) belief sich in den ersten neun Monaten 2009 auf CHF 38,3 Millionen (9 Monate 2008: CHF 30,1 Mio.). In lokalen Währungen stieg der Umsatz von Zavesca® um 33 Prozent. Zavesca® ist in über 35 Ländern einschliesslich der USA und den meisten europäischen Ländern für die Behandlung von Erwachsenen mit leichter bis mittelschwerer Typ-1-Gaucher-Krankheit, für die eine Enzymersatztherapie (EET) nicht angezeigt ist, kommerziell erhältlich. Actelion engagiert sich auch weiterhin für Patienten, die an Typ-1-Gaucher-Krankheit leiden, nicht nur mit der Weiterführung der Fortbildungsangebote auf diesem Gebiet, sondern auch über die Durchführung zusätzlicher klinischer Studien. Actelion verfolgt den potenziellen Einsatz von Zavesca® nach dem Wechsel von einer Enzymersatztherapie und führt hierzu die Langzeitstudie MAINTENANCE durch. Die Patientenerfassung für diese zweijährige Studie wurde im Juni 2008 mit 42 Patienten abgeschlossen. Mit Ergebnissen aus dieser Studie wird im 2. Halbjahr 2010 gerechnet. Anfang September 2009 hat Actelion Ärzte in den USA, die Patienten mit Typ-1-Gaucher- Krankheit behandeln, in einem Informationsschreiben über den potenziellen Einsatz von Zavesca® (Miglustat) zur Minimierung der Auswirkungen des Lieferengpasses für Imiglucerase (von Genzyme Corporation unter dem Markennamen Cerezyme® produziert und vertrieben) hingewiesen. Im Januar 2009 erhielt Zavesca® in der Europäischen Union die Zulassung für die Behandlung progressiver neurologischer Symptome bei Erwachsenen und Kindern mit Niemann-Pick Typ-C-Krankheit (NP-C). Zavesca® ist die erste zugelassene Therapie für Patienten mit Niemann-Pick Typ C, einer sehr seltenen, genetisch bedingten, mit starken Beeinträchtigungen verbundenen neurodegenerativen Erkrankung, die sowohl Kinder als auch Erwachsene treffen kann. Mit der Markteinführung wurde Ende des zweiten Quartals 2009 in ausgewählten europäischen Märkten begonnen. Nachdem es im ersten Halbjahr 2009 in den USA zu einem erfolgreichen Treffen mit der FDA (pre-NDA-Meeting) kam, beantragt Actelion dort derzeit eine Indikationserweiterung für Miglustat (Zavesca®) bei NP-C. Otto Schwarz bemerkte dazu: "Ich bin erfreut über die gute Marktakzeptanz von Zavesca® bei NP-C, die sich in einem starken Wachstum um 32 Prozent in lokalen Währungen gegenüber dem letzten Quartal niederschlägt." Betrieblicher Aufwand In den ersten neun Monaten 2009 belief sich der betriebliche Aufwand auf CHF 939,3 Millionen (9 Monate 2008: CHF 794,4 Mio.). Im selben Zeitraum stiegen die Kosten für Forschung und Entwicklung um 15 Prozent auf CHF 318,9 Millionen (9 Monate 2008: CHF 277,6 Mio.). Der betriebliche Aufwand in den ersten neun Monaten 2008 enthielt eine Meilensteinzahlung im Zusammenhang mit dem von Nippon Shinyaku einlizenzierten PGI2-Rezeptor-Agonisten. Diese Zahlung ausgenommen, stiegen die Kosten für F&E gegenüber dem Vorjahr um 29 Prozent. Die Aufwendungen für den Verkauf sowie allgemeine und administrative Ausgaben beliefen sich in den ersten neun Monaten 2009 auf CHF 449,5 Millionen (9 Monate 2008: CHF 387,6 Mio.), ein Anstieg um 16 Prozent. Forschung und Entwicklung Die Pipeline von Actelion umfasst aktuell 10 Substanzen in der klinischen Entwicklung sowie mehr als 25 aktive Projekte in der Forschung. Jean-Paul Clozel bemerkte: "Seit der Gründung von Actelion Ende 1997 haben wir eine hochproduktive Organisation für Forschung und Entwicklung im eigenen Haus geschaffen. Das Ergebnis ist eine breit gefächerte und viel versprechende präklinische und klinische Pipeline. Um die organische Wertschöpfung weiter voranzutreiben, werden wir auch weiterhin Partnerschaften mit führenden Unternehmen in der Industrie wie GlaxoSmithKline, Merck und Roche eingehen. Ich freue mich, dass wir in allen drei Kooperationen Fortschritte machen und mit hoch motivierten Partnern zusammenarbeiten, die unser Innovationsstreben teilen und wie wir daran arbeiten, das Leben der Patienten zu verändern." Jean-Paul Clozel fuhr fort: "Mit dem gleichen Engagement verfolgen wir mögliche Lizenzprojekte für neue Produkte. Dabei evaluieren wir auch weiterhin verschiedene viel versprechende Produktkandidaten, um unsere bestehende globale Infrastruktur und unsere Fachkenntnisse weiter zu nutzen. In der Vergangenheit waren wir dabei mit Zavesca® und Ventavis® erfolgreich." Vier Substanzen befinden sich in Phase III der Entwicklung, eine fünfte wird voraussichtlich vor Jahresende 2009 folgen. Nachfolgend eine kurze Zusammenfassung: - Almorexant bei primärer Insomnie: Für die erste Phase-III-Studie als Bestandteil des RESTORA-Programms werden planmässig noch vor Jahresende 2009 erste Ergebnisse vorliegen. RESTORA-1 ist eine zulassungsrelevante Studie, deren Design darauf ausgelegt ist, die Sicherheit und Wirksamkeit von Almorexant bei Patienten mit primärer Insomnie zu evaluieren. Die vierarmige, plazebo-kontrollierte Doppelblindstudie mit zwei Dosierungen und 700 Patienten umfasst einen Studienarm mit der Referenzsubstanz Zolpidem, welche für die Insomniebehandlung zugelassen ist. - Bosentan (Tracleer®) bei IPF: Diese multizentrische, randomisierte, plazebokontrollierte, parallelisierte, auf klinische Ereignisse ausgerichtete Doppelblindstudie zu Morbidität und Mortalität (BUILD-3) umfasst 616 Patienten und evaluiert die Sicherheit und Wirksamkeit von 125 mg b.i.d. Bosentan bei Patienten mit diagnostizierter idiopathischer pulmonaler Fibrose. Erste Ergebnisse werden Anfang 2010 erwartet. - Clazosentan bei aSAB (aneurysmatische Subarachoidalblutungen): Die Phase-III-Studie CONSCIOUS-2 (Clazosentan to Overcome Neurological iSCHemia and Infarct OccUrring after Subarachnoid hemorrhage - Clazosentan zur Verhinderung von neurologischer Ischämie oder Infarkt nach Subarachnoidalblutung) untersucht die Wirksamkeit und Sicherheit von Clazosentan (5 mg/h intravenös über 14 Tage) gegenüber Plazebo bei 1.146 Patienten, die nach Auftreten einer aSAB mit operativem Clipping des Aneurysma behandelt wurden. Primärer Endpunkt der Studie ist die Gesamtmortalität und die Vasospasmus-bedingte Morbidität. Hierzu zählen Vasospasmus-bedingte Verschlechterung der neurologischen Parameter, Vasospasmus-bedingte neue Hirninfarkte und die Einleitung von Notfallmassnahmen im Zusammenhang mit auftretenden Gefässspasmen. Ergebnisse von CONSCIOUS-2 werden zur Jahresmitte 2010 erwartet. Bei erfolgreichem Ausgang wird Actelion im Hinblick auf eine mögliche Zulassung an die Registrierungsbehörden herantreten. Derzeit läuft die Patientenrekrutierung für eine weitere Phase-III-Studie mit Clazosentan, CONSCIOUS-3. Diese Studie mit 1.500 Patienten untersucht die Wirksamkeit und Sicherheit von zwei Dosierungen (5 oder 15 mg/h) Clazosentan im Vergleich zu Plazebo bei Patienten, die nach Auftreten einer aSAB mit endovaskulärem Coiling behandelt wurden. Der primäre Endpunkt ist identisch mit dem von CONSCIOUS-2. - Macitentan bei PAH: Das multizentrische, doppelblinde, randomisierte, plazebokontrollierte, parallelisierte und auf klinische Ereignisse ausgerichtete zulassungsrelevante SERAPHIN-Programm mit 700 Patienten untersucht die Sicherheit und Wirksamkeit dieses hochpotenten, gewebespezifischen Endothelin-Rezeptor-Antagonisten im Hinblick auf Morbidität und Gesamtmortalität bei Patienten mit symptomatischer PAH als primärem Endpunkt. Wesentliche Ergebnisse dieser Studie werden vor Jahresende 2012 erwartet. - Actelions PGI2-Rezeptor-Agonist bei PAH: Im Anschluss an eine erfolgreiche Phase-IIa-Studie mit diesem oral aktiven Non-Prostanoid-PGI2-Rezeptor-Agonisten erarbeitet Actelion derzeit das Design für ein Phase-III-Programm mit einem Endpunkt zu Morbidität und Mortalität. Der Start dieses Programms soll noch vor dem Jahresende 2009 erfolgen. Einen umfassenden Überblick zu diesen und allen weiteren klinischen Programmen finden Sie in der Medienmitteilung zum 1. Halbjahr 2009 vom 21. Juli 2009. Mit der Aufnahme einer Dosisfindungsstudie der Phase IIb bei Patienten mit Multipler Sklerose erzielte Actelion Anfang Oktober 2009 einen Fortschritt bei dem selektiven S1P1-(Sphingosin-1-Phosphat) Rezeptor-Agonisten. Dies war mit einer Meilensteinzahlung seitens Roche, dem Partner in der S1P1-Allianz, an Actelion in Höhe von USD 20 Millionen verbunden. Actelion und Roche haben damit begonnen, die Daten der kürzlich abgeschlossenen Proof-of-Concept-Studie der Phase IIa mit diesem selektiven S1P1-Agonisten bei Psoriasis zu überprüfen. Sobald die Datenanalyse abgeschlossen sein wird, werden die beiden Unternehmen Entscheidungen über die weitere Entwicklung dieses auf verschiedene Autoimmunerkrankungen abzielenden Wirkstoffs fällen. Jean-Paul Clozel bemerkte abschliessend: "Ich freue mich, in den kommenden Monaten über klinische Daten aus drei Phase-III-Programmen berichten zu können: Almorexant bei primärer Insomnie, Bosentan bei idiopathischer pulmonaler Fibrose und Clazosentan bei nicht-traumatischer Subarachnoidalblutung." Betriebsgewinn Der Betriebsgewinn für die ersten neun Monate 2009 belief sich auf CHF 363,2 Millionen (9 Monate 2008: CHF 275,2 Mio.). Der Cash-EBIT für denselben Zeitraum betrug CHF 462,0 Millionen (9 Monate 2008: CHF 355,6 Mio.). Reingewinn In den ersten neun Monaten des Jahres 2009 ergab sich ein Reingewinn in Höhe von CHF 326,9 Millionen (9 Monate 2008: CHF 227,4 Mio.). Darin enthalten sind Zinserträge von CHF 3,6 Millionen, ein Zinsaufwand von CHF 4,8 Millionen, nicht-liquiditätswirksame Belastungen aufgrund von Zinsen und Abschreibungen von CHF 13,3 Millionen im Zusammenhang mit der Wandelanleihe, Wechselkursgewinne in Höhe von CHF 15,3 Millionen und eine Einkommensteuerbelastung von CHF 37,1 Millionen. Liquide Mittel und Cash Flow In den ersten neun Monaten 2009 erwirtschaftete Actelion einen Cash Flow aus dem operativen Geschäft in Höhe von CHF 300,9 Millionen (9 Monate 2008: CHF 410,7 Mio.). Zum Stichtag 30. September 2009 beliefen sich die gesamten liquiden Mittel (ohne Berücksichtigung von 8,6 Millionen eigener Aktien im Unternehmensbesitz) auf CHF 1,3 Milliarden. Zu Dokumentationszwecken - Tabelle 3. Quartal 2009 vs. 2. Quartal 2009 In CHF Tausend Ergebnisse Ergebnisse Veränderung % 3. Quartal 2. Quartal 2009 2009 Nettoumsatz 447 302 449 626 (2 324) (1) Betriebsaufwand 326 934 328 381 (1 447) 0 - Forschung und 109 318 113 737 (4 419) (4) Entwicklung - Verkauf, allgemeine 149 914 160 758 (10 844) 7 und administrative Kosten Betriebsgewinn 120 368 121 245 (877) (1) Cash-EBIT 157 161 158 308 (1 147) (1) Reingewinn 108 462 116 221 (7 759) (7) Verwässerter Gewinn pro 0,88 0,95 (0,07) (7) Aktie in CHF Anzahl Aktien zur 123 547 122 033 Berechnung (Angabe in Tausend) Vorschau auf wichtige Veranstaltungen und Publikationen Vor Jahresende 2009 - RESTORA-1 bei primärer Insomnie 1. Quartal 2010 - BUILD-3 bei IPF Donnerstag, 18. Februar 2010 - Ergebnisse Gesamtjahr 2009 Donnerstag, 22. April 2010 - Ergebnisse 1. Quartal 2010 Dienstag, 4. Mai 2010 - Generalversammlung 2010 Mitte 2010 - CONSCIOUS-2 bei "geclippten" aSAB Donnerstag, 22. Juli 2010 - Ergebnisse 1. Halbjahr 2010 Donnerstag, 21. Oktober 2010 - 3. Quartal 2010
###
Actelion Ltd Actelion Ltd ist ein biopharmazeutisches Unternehmen mit Hauptsitz in Allschwil/Basel, Schweiz. Actelions erstes Medikament, Tracleer®, ist ein zur Therapie der pulmonalen arteriellen Hypertonie zugelassener dualer Endothelin-Rezeptor-Antagonist in Tablettenform. Actelion vertreibt Tracleer® durch eigene Niederlassungen in den wichtigsten internationalen Märkten, so den Vereinigten Staaten (mit Sitz in South San Francisco), der Europäischen Union, Japan, Kanada, Australien und der Schweiz. Actelion, 1997 gegründet, ist ein weltweit führendes Unternehmen bei der Erforschung des Endothels. Das Endothel trennt die Gefässwand vom Blutstrom. Mit über 2200 Mitarbeitenden konzentriert sich Actelion darauf, innovative Medikamente in Bereiche mit hohem medizinischem Bedarf zu entdecken, zu entwickeln und zu vermarkten. Actelion Aktien sind am SIX Swiss Exchange notiert (Symbol: ATLN) und werden als Teil des Schweizer Blue-Chip-Index SMI® (Swiss Market Index) gehandelt. Für weitere Informationen wenden Sie sich bitte an: Roland Haefeli Vice President, Head of Investor Relations & Public Affairs Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil +41 61 565 62 62 +1 650 624 69 36 http://www.actelion.com Telefonkonferenz Actelion wird eine Telefonkonferenz plus Webcast wie folgt durchführen: Datum/Zeit: 20. Oktober 2009 15.30 Uhr - 16.30 Basel (MESZ) Uhr 14.30 Uhr - 15.30 UK (Britische Normalzeit) Uhr 09.30 Uhr - 10.30 Uhr USA (EDT, Sommerzeit Ostküste) Einwahl #: Teilnehmer an der Telefonkonferenz sollten sich 10 bis 15 Minuten vor Konferenzbeginn unter unten genannten Nummern einwählen. Einwahl: Europa: +41 44 580 64 03 UK: +44 203 147 47 53 USA: +1 866 931 15 72 Teilnahmemodus: Ausschliesslich Mithören mit der Möglichkeit, während der Frage-&Antwort-Runde individuelle Leitungen zu öffnen. Teilnehmer werden gebeten, ihren Namen und ihr Unternehmen zu nennen. Zugriff auf den Webcast: Teilnehmer des Webcast sollten etwa 10 bis 15 Minuten vor Beginn der Konferenz die Website von Actelion über http://www.actelion.com/ aufschalten. Sollten Sie Schwierigkeiten beim Zugriff auf den Webcast haben, gehen Sie bitte direkt auf URL: http://gaia.world-television.com/actelion/20091020/trunc Webcast-Aufzeichnung: Etwa 60 Minuten nach Beendigung der Konferenz wird die Aufzeichnung des Investoren-Webcast auf unserer Homepage unter http://www.actelion.com/ abrufbar sein.
--- Ende der Mitteilung ---
Actelion Pharmaceuticals Ltd Gewerbestrasse 16 Allschwil Schweiz WKN: 936767; ISIN: CH0010532478; Index: SBIOM, SLIFE, SMCI, SMIEXP, SMIM, SPI, SPIEX; Notiert: Main Market in SIX Swiss Exchange; http://www.actelion.com http://hugin.info/131801/R/1348416/324513.pdf http://www.actelion.com/sites/en/external.page?target=http://gaia.world-television.com/actelion/20091020/trunc http://hugin.info/131801/R/1348416/324494.pdf http://hugin.info/131801/R/1348272/324505.pdf Copyright © Hugin AS 2009. All rights reserved.
Quelle: HUGIN
20.10.2009 07:00:00
Actelion gibt Finanzergebnisse für die ersten neun Monate 2009 bekannt
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin. Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
----------------------------------------------------------------------
Nettoumsatz bei CHF 1.302,5 Millionen, ein Anstieg um 22 Prozent gegenüber den ersten neun Monaten 2008
- Umsatz von Tracleer® bei CHF 1.114,7 Millionen, plus 19 Prozent in lokalen Währungen
- Cash-EBIT erreicht CHF 462,0 Millionen, ein Anstieg um 33 Prozent in lokalen Währungen
- Ergebnisse für das Gesamtjahr 2009 voraussichtlich am oberen Ende der geschätzten Spanne
- Günstige Wachstumsaussichten für 2010
- Abschliessende Ergebnisse aus Phase-III-Studien mit Bosentan und Clazosentan in den kommenden Monaten
ALLSCHWIL/BASEL,
SCHWEIZ - 20. Oktober 2009 - Actelion Ltd (SIX: ATLN) gab heute die Finanzergebnisse des Unternehmens für die ersten neun Monate des Jahres 2009 bekannt. Mit einem Nettoumsatz in Höhe von CHF 1.302,5 Millionen in den ersten neun Monaten 2009 (9 Monate 2008: CHF 1.069,6 Mio.) und einem Betriebsaufwand von CHF 939,3 Millionen (9 Monate 2008: CHF 794,4 Mio.) meldete das Unternehmen einen Betriebsgewinn von CHF 363,2 Millionen (9 Monate 2008: CHF 275,2 Mio.). Um die betriebliche Leistung des Unternehmens besser messen und vergleichen zu können, weist Actelion weiterhin den non-US GAAP Cash-EBIT aus (Betriebsergebnis ausschliesslich IPR&D, Aufwendungen in Verbindung mit Aktienoptionen für Mitarbeitende nach FAS 123R sowie Aufwendungen für nicht-liquiditätswirksame Abschreibungen und Amortisationen). In den ersten neun Monaten 2009 erzielte Actelion einen Cash-EBIT von CHF 462,0 Millionen, ein Anstieg um 30 Prozent gegenüber demselben Zeitraum im Vorjahr. In lokalen Währungen stieg der Cash-EBIT um 33 Prozent. Der angepasste verwässerte Gewinn pro Aktie (EPS) für die ersten neun Monate 2009 (non-US GAAP) belief sich auf CHF 3,48 gegenüber CHF 2,53 im selben Zeitraum des Vorjahrs. Unter Anwendung von US GAAP lag der Reingewinn für die ersten neun Monate 2009 bei CHF 326,9 Millionen (9 Monate 2008: CHF 227,4 Mio.). Der vollständig verwässerte Gewinn pro Aktie (EPS) nach US GAAP belief sich für die ersten neun Monate 2009 auf CHF 2,66 gegenüber CHF 1,84 in den ersten neun Monaten 2008.
Dr. Jean-Paul Clozel, Chief Executive Officer, kommentierte: "Actelion handelt auch weiterhin entsprechend der Strategie unseres Unternehmens, im Interesse der Patienten langfristige Werte zu schaffen. Unser Geschäft im Segment der pulmonalen arteriellen Hypertonie (PAH) wird auch künftig für profitables Wachstum sorgen. Mit zwei weiteren viel versprechenden Substanzen im Bereich PAH, die sich in einem fortgeschrittenen Stadium der klinischen Entwicklung befinden, wollen wir in Forschung und Therapie bei PAH führend bleiben: mit Macitentan sowie dem in Partnerschaft mit Nippon Shinyaku in Entwicklung befindlichen PGI2-Rezeptor-Agonisten."
Andrew J. Oakley, Chief Financial Officer, kommentierte: "In den ersten neun Monaten 2009 hat das Basisgeschäft von Actelion kontinuierlich starke Leistungen erbracht und dies trotz eines sehr ungünstigen Wechselkursumfelds, das insbesondere den Leistungsausweis im 3. Quartal beeinträchtigte, was sich in unserer Berichtswährung, dem Schweizer Franken, widerspiegelt. Im Juli dieses Jahres erhöhte Actelion die Schätzung für das Jahr 2009 sowohl für das Umsatzwachstum als auch das Wachstum des Cash-EBIT auf 16 und 19 Prozent in lokalen Währungen. Heute kann ich diese Schätzungen bestätigen und gehe davon aus, dass wir höchstwahrscheinlich am oberen Ende der vorgegebenen Bandbreiten liegen werden."
Andrew J. Oakley schloss: "Sofern keine unvorhersehbaren Ereignisse eintreten, sind die Aussichten für Actelion auch für 2010 weiterhin günstig. Ich bin zuversichtlich, dass sich das Umsatzwachstum in lokalen Währungen im nächsten Jahr im niedrigen zweistelligen Bereich bewegen wird, was anhaltend starke liquiditätswirksame operative Margen als auch überdurchschnittliche Investitionen in innovative Wachstumsoptionen zur Folge haben dürfte."
Finanzergebnisse im Überblick - Tabelle 9 Monate 2009 vs. 9 Monate 2008 In CHF Tausend Ergebnisse Ergebnisse Veränderung % 9 Monate 9 Monate 2008 2009 Nettoumsatz 1 302 541 1 069 620 232 921 22 Betriebsaufwand 939 297 794 424 144 873 18 Betriebsgewinn 363 244 275 196 88 048 32 Cash-EBIT 462 008 355 643 106 365 30 Reingewinn* 326 902 227 369 99 533 44 Verwässerter Gewinn 2,66 1,84 0,82 45 pro Aktie (EPS) in CHF* Anzahl Aktien zur 122 743 123 431 Berechnung (Angabe in Tausend) * Reklassifizierung der Wandelanleihe von 2006 gemäss FSP APB 14-1 - Vergleichsperiode angepasst.
Die vollständige Konzernrechnung finden Sie unter http://www.actelion.com.
Anhaltendes Wachstum des Nettoumsatzes
In den ersten neun Monaten 2009 stieg der Nettoumsatz von Actelion um 22 Prozent auf CHF 1.302,5 Millionen (9 Monate 2008: CHF 1.069,6 Mio.). In lokalen Währungen stieg der Nettoumsatz gegenüber den ersten neun Monaten 2008 um 23 Prozent. Die Einkünfte aus vertraglichen Vereinbarungen beliefen sich in den ersten neun Monaten 2009 auf 47,9 Millionen (9 Monate 2008: CHF 29,2 Mio.). Produkteumsatz In den ersten neun Monaten 2009 belief sich der Umsatz von Tracleer® (Bosentan) auf CHF 1.114,7 Millionen (9 Monate 2008: CHF 945,8 Mio.). In lokalen Währungen bedeutet dies einen Anstieg um 19 Prozent gegenüber demselben Zeitraum des Vorjahrs. Anfang Juli erteilte die Europäische Kommission die Zulassung für die dispergierbare pädiatrische Formulierung von Tracleer® zur Therapie der PAH bei Kindern ab zwei Jahren. Mit dieser Zulassung wird Tracleer® zur einzigen PAH-Therapie mit einer zugelassenen pädiatrischen Formulierung. Anfang August genehmigte die US-amerikanische Zulassungsbehörde FDA (Food and Drug Administration) den Antrag auf Indikationserweiterung (supplemental New Drug Application) für Tracleer® zur Behandlung auch von Patienten mit leichteren Symptomen der pulmonalen arteriellen Hypertonie (PAH), die der sogenannten WHO-Funktionsklasse II zugeordnet werden. Zudem hat die FDA auch Actelions Risikomanagementstrategie (Risk Evaluation and Mitigation Strategy, REMS) für Tracleer® zugestimmt. Ende September 2009 wurde Tracleer® in über 50 Ländern vermarktet, darunter alle wichtigen pharmazeutischen Märkte. Der Umsatz von Ventavis® (Iloprost) belief sich in den ersten neun Monaten 2009 auf CHF 101,6 Millionen (9 Monate 2008: CHF 64,5 Mio.). In US-Dollar bedeutet dies einen Anstieg um 50 Prozent. Aufgrund der anhaltend starken Leistung von Ventavis® steht demnächst voraussichtlich eine einmalige Meilensteinzahlung an Bayer Schering Pharma an. Actelion hat diese anfallende Zahlung in Höhe von USD 10 Millionen im dritten Quartal als Umsatzaufwendung verbucht. Anfang August 2009 erteilte die amerikanische Food and Drug Administration (FDA) die Zulassung für eine neue Formulierung von Ventavis® in einer Dosisstärke von 20 Mikrogramm pro Milliliter (mcg/ml) zur Behandlung der PAH der Klassen III und IV gemäss New York Heart Association. Bei dieser neuen, stärker konzentrierten Formulierung von 20 mcg/ml kann die gleiche Dosis mit einem um die Hälfte reduzierten Lösungsvolumen verabreicht werden. Dies dürfte sich in einer verkürzten Inhalationszeit und einer verbesserten Therapietreue der Patienten niederschlagen. Die Zulassung basiert auf technischen Daten, die belegen, dass die neue Formulierung weder die Funktionsweise des Applikationssystems noch die Abgabe der erforderlichen Dosis verändert. Zurzeit läuft ein klinisches Programm zur Evaluierung des sogenannten Power 15 disc für die Applikationshilfe. Otto Schwarz, Präsident Business Operations, kommentierte: "Dank Tracleer® verzeichnen wir auch in diesem Jahr ein starkes Umsatzwachstum und unsere Anstrengungen, auf Grundlage der Indikationserweiterung in den USA weitere Patienten in frühen Stadien der Erkrankung zu erreichen, werden zu einem anhaltenden Wachstum von Tracleer® beitragen. Mit der US-Zulassung der 20 mcg/ml-Lösung von Ventavis® und der damit verbundenen kürzeren Inhalationszeit konnten wir überdies das Profil von Ventavis® im Wettbewerb schärfen." Mit der anstehenden Markteinführung einer verbesserten thermostabilen Formulierung von Epoprostenol-Natrium zur intravenösen Behandlung von PAH laufen derzeit weitere Massnahmen zur Stärkung unseres PAH-Geschäfts. Dieses Medikament wurde in der ersten Jahreshälfte 2009 von dem im Privatbesitz befindlichen Unternehmen GeneraMedix Inc. erworben. Dieses Arzneimittel erhielt im Juni 2008 in den Vereinigten Staaten die Zulassung für die intravenöse Langzeitbehandlung der primären pulmonalen Hypertonie und für die in Verbindung mit dem Krankheitsbild der Sklerodermie auftretenden Formen der pulmonalen Hypertonie bei Patienten der NYHA-Klassen III und IV, die auf konventionelle Behandlungsformen nicht ausreichend ansprechen. Für andere Länder ausserhalb der USA bereitet Actelion derzeit Zulassungsanträge für dieses Produkt vor, das für eine einfachere Handhabung und bequemere Anwendung entwickelt wurde. Der Umsatz von Zavesca® (Miglustat) belief sich in den ersten neun Monaten 2009 auf CHF 38,3 Millionen (9 Monate 2008: CHF 30,1 Mio.). In lokalen Währungen stieg der Umsatz von Zavesca® um 33 Prozent. Zavesca® ist in über 35 Ländern einschliesslich der USA und den meisten europäischen Ländern für die Behandlung von Erwachsenen mit leichter bis mittelschwerer Typ-1-Gaucher-Krankheit, für die eine Enzymersatztherapie (EET) nicht angezeigt ist, kommerziell erhältlich. Actelion engagiert sich auch weiterhin für Patienten, die an Typ-1-Gaucher-Krankheit leiden, nicht nur mit der Weiterführung der Fortbildungsangebote auf diesem Gebiet, sondern auch über die Durchführung zusätzlicher klinischer Studien. Actelion verfolgt den potenziellen Einsatz von Zavesca® nach dem Wechsel von einer Enzymersatztherapie und führt hierzu die Langzeitstudie MAINTENANCE durch. Die Patientenerfassung für diese zweijährige Studie wurde im Juni 2008 mit 42 Patienten abgeschlossen. Mit Ergebnissen aus dieser Studie wird im 2. Halbjahr 2010 gerechnet. Anfang September 2009 hat Actelion Ärzte in den USA, die Patienten mit Typ-1-Gaucher- Krankheit behandeln, in einem Informationsschreiben über den potenziellen Einsatz von Zavesca® (Miglustat) zur Minimierung der Auswirkungen des Lieferengpasses für Imiglucerase (von Genzyme Corporation unter dem Markennamen Cerezyme® produziert und vertrieben) hingewiesen. Im Januar 2009 erhielt Zavesca® in der Europäischen Union die Zulassung für die Behandlung progressiver neurologischer Symptome bei Erwachsenen und Kindern mit Niemann-Pick Typ-C-Krankheit (NP-C). Zavesca® ist die erste zugelassene Therapie für Patienten mit Niemann-Pick Typ C, einer sehr seltenen, genetisch bedingten, mit starken Beeinträchtigungen verbundenen neurodegenerativen Erkrankung, die sowohl Kinder als auch Erwachsene treffen kann. Mit der Markteinführung wurde Ende des zweiten Quartals 2009 in ausgewählten europäischen Märkten begonnen. Nachdem es im ersten Halbjahr 2009 in den USA zu einem erfolgreichen Treffen mit der FDA (pre-NDA-Meeting) kam, beantragt Actelion dort derzeit eine Indikationserweiterung für Miglustat (Zavesca®) bei NP-C. Otto Schwarz bemerkte dazu: "Ich bin erfreut über die gute Marktakzeptanz von Zavesca® bei NP-C, die sich in einem starken Wachstum um 32 Prozent in lokalen Währungen gegenüber dem letzten Quartal niederschlägt." Betrieblicher Aufwand In den ersten neun Monaten 2009 belief sich der betriebliche Aufwand auf CHF 939,3 Millionen (9 Monate 2008: CHF 794,4 Mio.). Im selben Zeitraum stiegen die Kosten für Forschung und Entwicklung um 15 Prozent auf CHF 318,9 Millionen (9 Monate 2008: CHF 277,6 Mio.). Der betriebliche Aufwand in den ersten neun Monaten 2008 enthielt eine Meilensteinzahlung im Zusammenhang mit dem von Nippon Shinyaku einlizenzierten PGI2-Rezeptor-Agonisten. Diese Zahlung ausgenommen, stiegen die Kosten für F&E gegenüber dem Vorjahr um 29 Prozent. Die Aufwendungen für den Verkauf sowie allgemeine und administrative Ausgaben beliefen sich in den ersten neun Monaten 2009 auf CHF 449,5 Millionen (9 Monate 2008: CHF 387,6 Mio.), ein Anstieg um 16 Prozent. Forschung und Entwicklung Die Pipeline von Actelion umfasst aktuell 10 Substanzen in der klinischen Entwicklung sowie mehr als 25 aktive Projekte in der Forschung. Jean-Paul Clozel bemerkte: "Seit der Gründung von Actelion Ende 1997 haben wir eine hochproduktive Organisation für Forschung und Entwicklung im eigenen Haus geschaffen. Das Ergebnis ist eine breit gefächerte und viel versprechende präklinische und klinische Pipeline. Um die organische Wertschöpfung weiter voranzutreiben, werden wir auch weiterhin Partnerschaften mit führenden Unternehmen in der Industrie wie GlaxoSmithKline, Merck und Roche eingehen. Ich freue mich, dass wir in allen drei Kooperationen Fortschritte machen und mit hoch motivierten Partnern zusammenarbeiten, die unser Innovationsstreben teilen und wie wir daran arbeiten, das Leben der Patienten zu verändern." Jean-Paul Clozel fuhr fort: "Mit dem gleichen Engagement verfolgen wir mögliche Lizenzprojekte für neue Produkte. Dabei evaluieren wir auch weiterhin verschiedene viel versprechende Produktkandidaten, um unsere bestehende globale Infrastruktur und unsere Fachkenntnisse weiter zu nutzen. In der Vergangenheit waren wir dabei mit Zavesca® und Ventavis® erfolgreich." Vier Substanzen befinden sich in Phase III der Entwicklung, eine fünfte wird voraussichtlich vor Jahresende 2009 folgen. Nachfolgend eine kurze Zusammenfassung: - Almorexant bei primärer Insomnie: Für die erste Phase-III-Studie als Bestandteil des RESTORA-Programms werden planmässig noch vor Jahresende 2009 erste Ergebnisse vorliegen. RESTORA-1 ist eine zulassungsrelevante Studie, deren Design darauf ausgelegt ist, die Sicherheit und Wirksamkeit von Almorexant bei Patienten mit primärer Insomnie zu evaluieren. Die vierarmige, plazebo-kontrollierte Doppelblindstudie mit zwei Dosierungen und 700 Patienten umfasst einen Studienarm mit der Referenzsubstanz Zolpidem, welche für die Insomniebehandlung zugelassen ist. - Bosentan (Tracleer®) bei IPF: Diese multizentrische, randomisierte, plazebokontrollierte, parallelisierte, auf klinische Ereignisse ausgerichtete Doppelblindstudie zu Morbidität und Mortalität (BUILD-3) umfasst 616 Patienten und evaluiert die Sicherheit und Wirksamkeit von 125 mg b.i.d. Bosentan bei Patienten mit diagnostizierter idiopathischer pulmonaler Fibrose. Erste Ergebnisse werden Anfang 2010 erwartet. - Clazosentan bei aSAB (aneurysmatische Subarachoidalblutungen): Die Phase-III-Studie CONSCIOUS-2 (Clazosentan to Overcome Neurological iSCHemia and Infarct OccUrring after Subarachnoid hemorrhage - Clazosentan zur Verhinderung von neurologischer Ischämie oder Infarkt nach Subarachnoidalblutung) untersucht die Wirksamkeit und Sicherheit von Clazosentan (5 mg/h intravenös über 14 Tage) gegenüber Plazebo bei 1.146 Patienten, die nach Auftreten einer aSAB mit operativem Clipping des Aneurysma behandelt wurden. Primärer Endpunkt der Studie ist die Gesamtmortalität und die Vasospasmus-bedingte Morbidität. Hierzu zählen Vasospasmus-bedingte Verschlechterung der neurologischen Parameter, Vasospasmus-bedingte neue Hirninfarkte und die Einleitung von Notfallmassnahmen im Zusammenhang mit auftretenden Gefässspasmen. Ergebnisse von CONSCIOUS-2 werden zur Jahresmitte 2010 erwartet. Bei erfolgreichem Ausgang wird Actelion im Hinblick auf eine mögliche Zulassung an die Registrierungsbehörden herantreten. Derzeit läuft die Patientenrekrutierung für eine weitere Phase-III-Studie mit Clazosentan, CONSCIOUS-3. Diese Studie mit 1.500 Patienten untersucht die Wirksamkeit und Sicherheit von zwei Dosierungen (5 oder 15 mg/h) Clazosentan im Vergleich zu Plazebo bei Patienten, die nach Auftreten einer aSAB mit endovaskulärem Coiling behandelt wurden. Der primäre Endpunkt ist identisch mit dem von CONSCIOUS-2. - Macitentan bei PAH: Das multizentrische, doppelblinde, randomisierte, plazebokontrollierte, parallelisierte und auf klinische Ereignisse ausgerichtete zulassungsrelevante SERAPHIN-Programm mit 700 Patienten untersucht die Sicherheit und Wirksamkeit dieses hochpotenten, gewebespezifischen Endothelin-Rezeptor-Antagonisten im Hinblick auf Morbidität und Gesamtmortalität bei Patienten mit symptomatischer PAH als primärem Endpunkt. Wesentliche Ergebnisse dieser Studie werden vor Jahresende 2012 erwartet. - Actelions PGI2-Rezeptor-Agonist bei PAH: Im Anschluss an eine erfolgreiche Phase-IIa-Studie mit diesem oral aktiven Non-Prostanoid-PGI2-Rezeptor-Agonisten erarbeitet Actelion derzeit das Design für ein Phase-III-Programm mit einem Endpunkt zu Morbidität und Mortalität. Der Start dieses Programms soll noch vor dem Jahresende 2009 erfolgen. Einen umfassenden Überblick zu diesen und allen weiteren klinischen Programmen finden Sie in der Medienmitteilung zum 1. Halbjahr 2009 vom 21. Juli 2009. Mit der Aufnahme einer Dosisfindungsstudie der Phase IIb bei Patienten mit Multipler Sklerose erzielte Actelion Anfang Oktober 2009 einen Fortschritt bei dem selektiven S1P1-(Sphingosin-1-Phosphat) Rezeptor-Agonisten. Dies war mit einer Meilensteinzahlung seitens Roche, dem Partner in der S1P1-Allianz, an Actelion in Höhe von USD 20 Millionen verbunden. Actelion und Roche haben damit begonnen, die Daten der kürzlich abgeschlossenen Proof-of-Concept-Studie der Phase IIa mit diesem selektiven S1P1-Agonisten bei Psoriasis zu überprüfen. Sobald die Datenanalyse abgeschlossen sein wird, werden die beiden Unternehmen Entscheidungen über die weitere Entwicklung dieses auf verschiedene Autoimmunerkrankungen abzielenden Wirkstoffs fällen. Jean-Paul Clozel bemerkte abschliessend: "Ich freue mich, in den kommenden Monaten über klinische Daten aus drei Phase-III-Programmen berichten zu können: Almorexant bei primärer Insomnie, Bosentan bei idiopathischer pulmonaler Fibrose und Clazosentan bei nicht-traumatischer Subarachnoidalblutung." Betriebsgewinn Der Betriebsgewinn für die ersten neun Monate 2009 belief sich auf CHF 363,2 Millionen (9 Monate 2008: CHF 275,2 Mio.). Der Cash-EBIT für denselben Zeitraum betrug CHF 462,0 Millionen (9 Monate 2008: CHF 355,6 Mio.). Reingewinn In den ersten neun Monaten des Jahres 2009 ergab sich ein Reingewinn in Höhe von CHF 326,9 Millionen (9 Monate 2008: CHF 227,4 Mio.). Darin enthalten sind Zinserträge von CHF 3,6 Millionen, ein Zinsaufwand von CHF 4,8 Millionen, nicht-liquiditätswirksame Belastungen aufgrund von Zinsen und Abschreibungen von CHF 13,3 Millionen im Zusammenhang mit der Wandelanleihe, Wechselkursgewinne in Höhe von CHF 15,3 Millionen und eine Einkommensteuerbelastung von CHF 37,1 Millionen. Liquide Mittel und Cash Flow In den ersten neun Monaten 2009 erwirtschaftete Actelion einen Cash Flow aus dem operativen Geschäft in Höhe von CHF 300,9 Millionen (9 Monate 2008: CHF 410,7 Mio.). Zum Stichtag 30. September 2009 beliefen sich die gesamten liquiden Mittel (ohne Berücksichtigung von 8,6 Millionen eigener Aktien im Unternehmensbesitz) auf CHF 1,3 Milliarden. Zu Dokumentationszwecken - Tabelle 3. Quartal 2009 vs. 2. Quartal 2009 In CHF Tausend Ergebnisse Ergebnisse Veränderung % 3. Quartal 2. Quartal 2009 2009 Nettoumsatz 447 302 449 626 (2 324) (1) Betriebsaufwand 326 934 328 381 (1 447) 0 - Forschung und 109 318 113 737 (4 419) (4) Entwicklung - Verkauf, allgemeine 149 914 160 758 (10 844) 7 und administrative Kosten Betriebsgewinn 120 368 121 245 (877) (1) Cash-EBIT 157 161 158 308 (1 147) (1) Reingewinn 108 462 116 221 (7 759) (7) Verwässerter Gewinn pro 0,88 0,95 (0,07) (7) Aktie in CHF Anzahl Aktien zur 123 547 122 033 Berechnung (Angabe in Tausend) Vorschau auf wichtige Veranstaltungen und Publikationen Vor Jahresende 2009 - RESTORA-1 bei primärer Insomnie 1. Quartal 2010 - BUILD-3 bei IPF Donnerstag, 18. Februar 2010 - Ergebnisse Gesamtjahr 2009 Donnerstag, 22. April 2010 - Ergebnisse 1. Quartal 2010 Dienstag, 4. Mai 2010 - Generalversammlung 2010 Mitte 2010 - CONSCIOUS-2 bei "geclippten" aSAB Donnerstag, 22. Juli 2010 - Ergebnisse 1. Halbjahr 2010 Donnerstag, 21. Oktober 2010 - 3. Quartal 2010
###
Actelion Ltd Actelion Ltd ist ein biopharmazeutisches Unternehmen mit Hauptsitz in Allschwil/Basel, Schweiz. Actelions erstes Medikament, Tracleer®, ist ein zur Therapie der pulmonalen arteriellen Hypertonie zugelassener dualer Endothelin-Rezeptor-Antagonist in Tablettenform. Actelion vertreibt Tracleer® durch eigene Niederlassungen in den wichtigsten internationalen Märkten, so den Vereinigten Staaten (mit Sitz in South San Francisco), der Europäischen Union, Japan, Kanada, Australien und der Schweiz. Actelion, 1997 gegründet, ist ein weltweit führendes Unternehmen bei der Erforschung des Endothels. Das Endothel trennt die Gefässwand vom Blutstrom. Mit über 2200 Mitarbeitenden konzentriert sich Actelion darauf, innovative Medikamente in Bereiche mit hohem medizinischem Bedarf zu entdecken, zu entwickeln und zu vermarkten. Actelion Aktien sind am SIX Swiss Exchange notiert (Symbol: ATLN) und werden als Teil des Schweizer Blue-Chip-Index SMI® (Swiss Market Index) gehandelt. Für weitere Informationen wenden Sie sich bitte an: Roland Haefeli Vice President, Head of Investor Relations & Public Affairs Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil +41 61 565 62 62 +1 650 624 69 36 http://www.actelion.com Telefonkonferenz Actelion wird eine Telefonkonferenz plus Webcast wie folgt durchführen: Datum/Zeit: 20. Oktober 2009 15.30 Uhr - 16.30 Basel (MESZ) Uhr 14.30 Uhr - 15.30 UK (Britische Normalzeit) Uhr 09.30 Uhr - 10.30 Uhr USA (EDT, Sommerzeit Ostküste) Einwahl #: Teilnehmer an der Telefonkonferenz sollten sich 10 bis 15 Minuten vor Konferenzbeginn unter unten genannten Nummern einwählen. Einwahl: Europa: +41 44 580 64 03 UK: +44 203 147 47 53 USA: +1 866 931 15 72 Teilnahmemodus: Ausschliesslich Mithören mit der Möglichkeit, während der Frage-&Antwort-Runde individuelle Leitungen zu öffnen. Teilnehmer werden gebeten, ihren Namen und ihr Unternehmen zu nennen. Zugriff auf den Webcast: Teilnehmer des Webcast sollten etwa 10 bis 15 Minuten vor Beginn der Konferenz die Website von Actelion über http://www.actelion.com/ aufschalten. Sollten Sie Schwierigkeiten beim Zugriff auf den Webcast haben, gehen Sie bitte direkt auf URL: http://gaia.world-television.com/actelion/20091020/trunc Webcast-Aufzeichnung: Etwa 60 Minuten nach Beendigung der Konferenz wird die Aufzeichnung des Investoren-Webcast auf unserer Homepage unter http://www.actelion.com/ abrufbar sein.
--- Ende der Mitteilung ---
Actelion Pharmaceuticals Ltd Gewerbestrasse 16 Allschwil Schweiz WKN: 936767; ISIN: CH0010532478; Index: SBIOM, SLIFE, SMCI, SMIEXP, SMIM, SPI, SPIEX; Notiert: Main Market in SIX Swiss Exchange; http://www.actelion.com http://hugin.info/131801/R/1348416/324513.pdf http://www.actelion.com/sites/en/external.page?target=http://gaia.world-television.com/actelion/20091020/trunc http://hugin.info/131801/R/1348416/324494.pdf http://hugin.info/131801/R/1348272/324505.pdf Copyright © Hugin AS 2009. All rights reserved.
Quelle: HUGIN
Antwort auf Beitrag Nr.: 38.210.514 von SLGramann am 20.10.09 08:20:17
Das hier nehme ich mal als Versprechen:
Jean-Paul Clozel continued: “It is exactly the same commitment that drives our in-licensing
efforts, where we continue to evaluate multiple promising product opportunities on an
ongoing basis to further leverage our existing global infrastructure and expertise. We have
done so successfully in the past with Zavesca® and Ventavis®.”
Ich bin absolut der Ansicht, dass Actelion seine Pipeline durch eine oder mehrere Einlizensierungen verstärken sollte. Vielleicht wäre sogar die Übernahme eines Forschungsunternehmens eine gute Option. Man hätte dann auch gleich einen Forschungsstandort in den USA, was sinnvoll wäre.
Für eine Einlizensierung würde ich mir wie schon gesagt Incyte wünschen. Für komplette Übernahmen gäbe es eine Reihe an interessanten Kandidaten. Genannt werden könnten ArQule, Rigel oder Array.
Actelion hat viel Cash und könnte sich so eine Aktion gut leisten. Und es wäre gut, wenn das weltweite Vertriebsteam auch jenseits von Tracleer zu tun bekäme.
Das hier nehme ich mal als Versprechen:
Jean-Paul Clozel continued: “It is exactly the same commitment that drives our in-licensing
efforts, where we continue to evaluate multiple promising product opportunities on an
ongoing basis to further leverage our existing global infrastructure and expertise. We have
done so successfully in the past with Zavesca® and Ventavis®.”
Ich bin absolut der Ansicht, dass Actelion seine Pipeline durch eine oder mehrere Einlizensierungen verstärken sollte. Vielleicht wäre sogar die Übernahme eines Forschungsunternehmens eine gute Option. Man hätte dann auch gleich einen Forschungsstandort in den USA, was sinnvoll wäre.
Für eine Einlizensierung würde ich mir wie schon gesagt Incyte wünschen. Für komplette Übernahmen gäbe es eine Reihe an interessanten Kandidaten. Genannt werden könnten ArQule, Rigel oder Array.
Actelion hat viel Cash und könnte sich so eine Aktion gut leisten. Und es wäre gut, wenn das weltweite Vertriebsteam auch jenseits von Tracleer zu tun bekäme.
20.10.2009 10:53:39
Actelion kann Ergebnis steigern
Allschwill (aktiencheck.de AG) - Die schweizerische Actelion Ltd. (ISIN CH0010532478/ WKN 936767) präsentierte am Dienstag die Geschäftszahlen für die ersten neun Monate des laufenden Fiskaljahres.
Demnach verbesserten sich die Umsatzerlöse im Vergleich zur Vorjahresperiode um 22 Prozent auf 1,30 Mrd. Schweizer Franken (CHF). Dass operative Ergebnis konnte auf 363,2 Mio. CHF gesteigert werden, was gegenüber dem Vorjahreswert von 275,2 Mio. CHF einem Plus von 32 Prozent entspricht. Beim Nettogewinn wurde ein Anstieg auf 326,9 Mio. CHF verbucht, nach 227,4 Mio. CHF im Vorjahreszeitraum. Wesentlichen Anteil an der deutlichen Ergebnisverbesserung hatte die starke Absatzentwicklung bei Medikamenten gegen Bluthochdruck.
Für das Gesamtjahr geht Actelion von einer weiterhin starken operativen Entwicklung aus und erwartet ein Ergebnis am oberen Rand der zuletzt nach oben revidierten Gewinnprognose. Bei der Vorlage der Halbjahreszahlen hatte der Biotechnologiekonzern seine Prognose erhöht und geht von einem Anstieg des Cash-EBIT (in lokalen Währungen) um 16 bis 19 Prozent aus. In den ersten neun Monaten verbesserte sich das Cash-EBIT im Vorjahresvergleich um 30 Prozent auf 462,0 Mio. CHF.
Die Aktie von Actelion notiert aktuell in der Schweiz mit einem Minus von 2,29 Prozent bei 61,75 CHF. (20.10.2009/ac/n/a)
Quelle: AKTIENCHECK.DE

Actelion kann Ergebnis steigern
Allschwill (aktiencheck.de AG) - Die schweizerische Actelion Ltd. (ISIN CH0010532478/ WKN 936767) präsentierte am Dienstag die Geschäftszahlen für die ersten neun Monate des laufenden Fiskaljahres.
Demnach verbesserten sich die Umsatzerlöse im Vergleich zur Vorjahresperiode um 22 Prozent auf 1,30 Mrd. Schweizer Franken (CHF). Dass operative Ergebnis konnte auf 363,2 Mio. CHF gesteigert werden, was gegenüber dem Vorjahreswert von 275,2 Mio. CHF einem Plus von 32 Prozent entspricht. Beim Nettogewinn wurde ein Anstieg auf 326,9 Mio. CHF verbucht, nach 227,4 Mio. CHF im Vorjahreszeitraum. Wesentlichen Anteil an der deutlichen Ergebnisverbesserung hatte die starke Absatzentwicklung bei Medikamenten gegen Bluthochdruck.
Für das Gesamtjahr geht Actelion von einer weiterhin starken operativen Entwicklung aus und erwartet ein Ergebnis am oberen Rand der zuletzt nach oben revidierten Gewinnprognose. Bei der Vorlage der Halbjahreszahlen hatte der Biotechnologiekonzern seine Prognose erhöht und geht von einem Anstieg des Cash-EBIT (in lokalen Währungen) um 16 bis 19 Prozent aus. In den ersten neun Monaten verbesserte sich das Cash-EBIT im Vorjahresvergleich um 30 Prozent auf 462,0 Mio. CHF.
Die Aktie von Actelion notiert aktuell in der Schweiz mit einem Minus von 2,29 Prozent bei 61,75 CHF. (20.10.2009/ac/n/a)
Quelle: AKTIENCHECK.DE

Interview auf www.cash.ch:
Actelion-Chef: «Werden 2010 weniger stark wachsen»
Actelion-CEO Jean-Paul Clozel will den Konzern zur Genentech Europas formen.
20.10.2009 10:00
Der Biotechkonzern hat erneut ein starkes Quartalsergebnis präsentiert und die Umsatz- und Gewinnerwartungen bestätigt. «Wir wachsen mit grossen Schritten, nächstes Jahr werden wir dieses Tempo aber nicht halten können», sagt CEO Jean-Paul Clozel im Audio-Interview mit cash.
Interview von Ulrich Rotzinger
cash: Jean-Paul Clozel, Actelion hat die Umsatz- und Gewinnerwartungen erfüllt in den ersten neun Monaten 2009. Treffen oder übertreffen Sie gar diese Erwartungen auch im letzten Quartal des laufenden Jahres?
Jean-Paul Clozel: Die Umsätze steigen und steigen. So werden wir die Erwartungen auch in den letzten drei Monaten dieses Jahres erfüllen. Wir hoffen, unsere Guidance sogar übertreffen zu können. Darum steht in der heutigen Medienmitteilung auch, dass wir höchstwahrscheinlich am oberen Ende der vorgegebenen Bandbreiten liegen werden.
Wird Actelion die fordernde Guidance von 16 bis 19 Prozent Umsatzwachstum in Lokalwährungen im kommenden Jahr schlagen können?
Wir wuchsen bisher in grossen Schritten. Dass wir dieses hohe Tempo auch im kommenden Jahr halten können oder sogar übertreffen, halte ich nicht für möglich. Da bin ich ehrlich. Natürlich wachsen wir weiter. Ich bin zuversichtlich, dass sich das Umsatzwachstum 2010 im niedrigen zweistelligen Bereich bewegen wird.
Bei unserem letzten Telefongespräch kündigten Sie an, dass Actelion in eine höhere Liga aufsteigen werde. Wie stehen Sie dazu nach den Daten zum dritten Quartal, die Sie am Dienstag präsentiert haben?
Heute kann ich noch nicht sagen, dass wir in eine höhere Liga aufgestiegen sind. Dazu brauchen wir erst die Resultate wichtiger Studien, die sich gerade in der Endphase befinden. Dazu gehören beispielsweise Ergebnisse für Almorexant oder Clazosentan. Und es braucht neue Wirkstoffe für Indikationen wie pulmonalen arteriellen Hypertonie (PAH). Wir brauchen diese Produkte, um wirklich die Liga wechseln zu können.
Wann erwarten Sie diese Resultate?
Im nächsten Jahr ist sehr viel los, was den Newsflow von Resultaten für wichtige Produktkandidaten anbelangt. Wir haben sehr hoffnungsvolle Produkte in der Pipeline, die jedes für sich unseren Umsatz in die Höhe treiben können.
Inwieweit sind Sie Ihrem Ziel näher gekommen, den Allschwiler Biotechkonzern zur «Genentech Europas» zu formen?
Wir sind diesem Ziel teilweise schon näher gekommen. Als ich diese Aussage machte, zur «Genentech Europas» werden zu wollen, dachten alle sofort an Marktanteile. Ich dagegen meinte damit eine durch Wissenschaft und Innovation getriebene Firma, wo Wissenschaftler ihre Träume ausleben können. Genau das ist bei Genentech möglich. Ich hätte diese Aussage nicht gemacht, wenn wir nicht eine so ausserordentlich gut gefüllte Produkt-Pipeline mit vier bis fünf Wirkstoffen in der Studienendphase hätten. Nur brauchen wir eben noch positive Ergebnisse aus diesen Programmen. Warten wir doch einfach das kommende Jahr ab.
Ich frage mich, ob das Unternehmen zu einem Biotech-Riesen mit über 10000 Mitarbeitern werden kann, ohne seine Unabhängigkeit aufgeben zu müssen?
Natürlich ist das möglich. Je grösser wir werden, desto unabhängiger werden wir sein. Anders als wir hatte Genentech kein Geld in der frühen Entwicklungsphase des Unternehmens. Wir dagegen haben die Möglichkeiten, sehr profitabel zu sein. Wir verfolgen eine strikte Finanzpolitik und verfügen über 1,3 Milliarden Franken flüssige Mittel. Wer allerdings seine Finanzen nicht im Griff hat, wird seine Unabhängigkeit verlieren.
Die Aktie von Actelion verbilligte sich im Vorfeld der Publikation der Quartalszahlen. Welches sind die wichtigsten Impulsgeber für den Blue Chip in den nächsten Wochen?
Das sind ganz klar die Resultate unserer klinischen Studien. Eine nicht zulassungsrelevante Phase-III-Studie für das Schlafmittel Almorexant erwarten wir in den nächsten Wochen. Dann haben wir den ersten Einblick über den Nutzen für den Patienten.
http://www.cash.ch/news/front/actelionchef_werden_2010_wenig…
Actelion-Chef: «Werden 2010 weniger stark wachsen»
Actelion-CEO Jean-Paul Clozel will den Konzern zur Genentech Europas formen.
20.10.2009 10:00
Der Biotechkonzern hat erneut ein starkes Quartalsergebnis präsentiert und die Umsatz- und Gewinnerwartungen bestätigt. «Wir wachsen mit grossen Schritten, nächstes Jahr werden wir dieses Tempo aber nicht halten können», sagt CEO Jean-Paul Clozel im Audio-Interview mit cash.
Interview von Ulrich Rotzinger
cash: Jean-Paul Clozel, Actelion hat die Umsatz- und Gewinnerwartungen erfüllt in den ersten neun Monaten 2009. Treffen oder übertreffen Sie gar diese Erwartungen auch im letzten Quartal des laufenden Jahres?
Jean-Paul Clozel: Die Umsätze steigen und steigen. So werden wir die Erwartungen auch in den letzten drei Monaten dieses Jahres erfüllen. Wir hoffen, unsere Guidance sogar übertreffen zu können. Darum steht in der heutigen Medienmitteilung auch, dass wir höchstwahrscheinlich am oberen Ende der vorgegebenen Bandbreiten liegen werden.
Wird Actelion die fordernde Guidance von 16 bis 19 Prozent Umsatzwachstum in Lokalwährungen im kommenden Jahr schlagen können?
Wir wuchsen bisher in grossen Schritten. Dass wir dieses hohe Tempo auch im kommenden Jahr halten können oder sogar übertreffen, halte ich nicht für möglich. Da bin ich ehrlich. Natürlich wachsen wir weiter. Ich bin zuversichtlich, dass sich das Umsatzwachstum 2010 im niedrigen zweistelligen Bereich bewegen wird.
Bei unserem letzten Telefongespräch kündigten Sie an, dass Actelion in eine höhere Liga aufsteigen werde. Wie stehen Sie dazu nach den Daten zum dritten Quartal, die Sie am Dienstag präsentiert haben?
Heute kann ich noch nicht sagen, dass wir in eine höhere Liga aufgestiegen sind. Dazu brauchen wir erst die Resultate wichtiger Studien, die sich gerade in der Endphase befinden. Dazu gehören beispielsweise Ergebnisse für Almorexant oder Clazosentan. Und es braucht neue Wirkstoffe für Indikationen wie pulmonalen arteriellen Hypertonie (PAH). Wir brauchen diese Produkte, um wirklich die Liga wechseln zu können.
Wann erwarten Sie diese Resultate?
Im nächsten Jahr ist sehr viel los, was den Newsflow von Resultaten für wichtige Produktkandidaten anbelangt. Wir haben sehr hoffnungsvolle Produkte in der Pipeline, die jedes für sich unseren Umsatz in die Höhe treiben können.
Inwieweit sind Sie Ihrem Ziel näher gekommen, den Allschwiler Biotechkonzern zur «Genentech Europas» zu formen?
Wir sind diesem Ziel teilweise schon näher gekommen. Als ich diese Aussage machte, zur «Genentech Europas» werden zu wollen, dachten alle sofort an Marktanteile. Ich dagegen meinte damit eine durch Wissenschaft und Innovation getriebene Firma, wo Wissenschaftler ihre Träume ausleben können. Genau das ist bei Genentech möglich. Ich hätte diese Aussage nicht gemacht, wenn wir nicht eine so ausserordentlich gut gefüllte Produkt-Pipeline mit vier bis fünf Wirkstoffen in der Studienendphase hätten. Nur brauchen wir eben noch positive Ergebnisse aus diesen Programmen. Warten wir doch einfach das kommende Jahr ab.
Ich frage mich, ob das Unternehmen zu einem Biotech-Riesen mit über 10000 Mitarbeitern werden kann, ohne seine Unabhängigkeit aufgeben zu müssen?
Natürlich ist das möglich. Je grösser wir werden, desto unabhängiger werden wir sein. Anders als wir hatte Genentech kein Geld in der frühen Entwicklungsphase des Unternehmens. Wir dagegen haben die Möglichkeiten, sehr profitabel zu sein. Wir verfolgen eine strikte Finanzpolitik und verfügen über 1,3 Milliarden Franken flüssige Mittel. Wer allerdings seine Finanzen nicht im Griff hat, wird seine Unabhängigkeit verlieren.
Die Aktie von Actelion verbilligte sich im Vorfeld der Publikation der Quartalszahlen. Welches sind die wichtigsten Impulsgeber für den Blue Chip in den nächsten Wochen?
Das sind ganz klar die Resultate unserer klinischen Studien. Eine nicht zulassungsrelevante Phase-III-Studie für das Schlafmittel Almorexant erwarten wir in den nächsten Wochen. Dann haben wir den ersten Einblick über den Nutzen für den Patienten.
http://www.cash.ch/news/front/actelionchef_werden_2010_wenig…
Actelion im Angebot nach Q3-Zahlen
Beitrag verfasst am: 20.10.2009 - 10:24
AKTIENFOKUS/ Actelion im Angebot nach Q3-Zahlen - kurzfristig orientierte Abgaben
Zürich (awp) - Die Aktien der Actelion Ltd. verlieren am Dienstag nach der vorbörslichen Publikation der Q3-Zahlen an Terrain. Marktbeobachter führen die Abgaben vor allem auf kurzfristig orientierte Verkäufe zurück.
Die Titel seien etwas unter Druck geraten, nachdem sich das Hauptprodukt Tracleer im Berichtsquartal schwächer entwickelt hat als allgemein erwartet. So gaben die Tracleer-Umsätze im Berichtsquartal gegenüber dem Vorquartal auf 375,5 Mio CHF nach - trotz einer Preiserhöhung im August. Im Q2 lagen sie noch bei 387,1 Mio CHF und im Q3 2008 bei 340,6 Mio CHF.
Zudem wurde teils über eine Erhöhung der Guidance für 2009 spekuliert, wogegen das Unternehmen diese "nur" bestätigt hat, jedoch darauf hinwies, dass die Ergebnisse am oberen Ende liegen dürften. Dass die Ausblickerhöhung nun nicht vorgenommen wurde, könnte vom Markt als "leicht enttäuschend" aufgenommen werden, schreibt Sibylle Bischofberger von der ZKB. Längerfristig seien die Aussichten damit intakt, so Marktbeobachter.
Bis um 09.55 Uhr sinken die Actelion-Aktien um 1,8% auf 62,05 CHF. Der SMI verliert um 0,1%.
In den bisherigen Analystenkommentaren wird hervorgehoben, dass das Unternehmen in der Gesamtentwicklung im Rahmen der Erwartungen gelegen hat. Auch werden die Produktpipeline und der bestätigte Ausblick sowie eine erste Guidance für 2010 positiv beurteilt. "Erste Prognosen für das Geschäftsjahr 2010 wurden oberhalb der Erwartungen gegeben", schreibt Andrew C. Weiss von Bank Vontobel denn auch. "Es ist erfreulich, dass die Gesellschaft bereits jetzt einen Ausblick für 2010 geben kann", so Bischofberger (ZKB). "Dies zeigt auch die gute Verfassung, das Selbstvertrauen und die Zuversicht des Unternehmens."
Mehrheitlich positiv beurteilt wird das Gesamtergebnis des Unternehmens im dritten Quartal. So spricht die ZKB von "soliden" Quartalsergebnissen. Für die Bank Vontobel liegt Actelion mit den Zahlen "ungefähr" im Rahmen der Erwartungen. Hingegen wurden die UBS-Schätzungen nicht erreicht.
Einig ist man sich darin, dass die Umsatzentwicklung des Hauptprodukts Tracleer im dritten Quartal unter den Erwartungen gelegen hat. "Ergebnisse bei Tracleer nach zwei starken Quartalen etwas schwach", schreibt denn auch Vontobel. Von einer "leichten Enttäuschung" spricht die ZKB.
Auf längere Sicht wird Actelion jedoch positiv beurteilt, hat das Unternehmen doch vier Produktkandidaten in Phase-III-Tests und soll ein fünfter noch vor Ende 2009 folgen. So wird denn auch die starke Pipeline hervor gehoben, sowie die Tatsache, dass in der Forschung und Entwicklung keine Verzögerungen zu vermelden sind. "Die Pipeline ist erfreulicherweise unverändert und ohne Eliminierungen oder Verzögerungen", fass Bischofberger (ZKB) zusammen.
Die Bank Vontobel empfiehlt die Actelion-Aktie zum Kauf und nennt ein Kursziel von 79 CHF. Auch Helvea hat bisher zu "Buy" geraten (Kursziel: 86 CHF). Für die ZKB sind die Titel ein "Marktgewichten". Die UBS rät hingegen unverändert zu "Sell" (Kursziel: 57 CHF).
rt/ps
Beitrag verfasst am: 20.10.2009 - 10:24
AKTIENFOKUS/ Actelion im Angebot nach Q3-Zahlen - kurzfristig orientierte Abgaben
Zürich (awp) - Die Aktien der Actelion Ltd. verlieren am Dienstag nach der vorbörslichen Publikation der Q3-Zahlen an Terrain. Marktbeobachter führen die Abgaben vor allem auf kurzfristig orientierte Verkäufe zurück.
Die Titel seien etwas unter Druck geraten, nachdem sich das Hauptprodukt Tracleer im Berichtsquartal schwächer entwickelt hat als allgemein erwartet. So gaben die Tracleer-Umsätze im Berichtsquartal gegenüber dem Vorquartal auf 375,5 Mio CHF nach - trotz einer Preiserhöhung im August. Im Q2 lagen sie noch bei 387,1 Mio CHF und im Q3 2008 bei 340,6 Mio CHF.
Zudem wurde teils über eine Erhöhung der Guidance für 2009 spekuliert, wogegen das Unternehmen diese "nur" bestätigt hat, jedoch darauf hinwies, dass die Ergebnisse am oberen Ende liegen dürften. Dass die Ausblickerhöhung nun nicht vorgenommen wurde, könnte vom Markt als "leicht enttäuschend" aufgenommen werden, schreibt Sibylle Bischofberger von der ZKB. Längerfristig seien die Aussichten damit intakt, so Marktbeobachter.
Bis um 09.55 Uhr sinken die Actelion-Aktien um 1,8% auf 62,05 CHF. Der SMI verliert um 0,1%.
In den bisherigen Analystenkommentaren wird hervorgehoben, dass das Unternehmen in der Gesamtentwicklung im Rahmen der Erwartungen gelegen hat. Auch werden die Produktpipeline und der bestätigte Ausblick sowie eine erste Guidance für 2010 positiv beurteilt. "Erste Prognosen für das Geschäftsjahr 2010 wurden oberhalb der Erwartungen gegeben", schreibt Andrew C. Weiss von Bank Vontobel denn auch. "Es ist erfreulich, dass die Gesellschaft bereits jetzt einen Ausblick für 2010 geben kann", so Bischofberger (ZKB). "Dies zeigt auch die gute Verfassung, das Selbstvertrauen und die Zuversicht des Unternehmens."
Mehrheitlich positiv beurteilt wird das Gesamtergebnis des Unternehmens im dritten Quartal. So spricht die ZKB von "soliden" Quartalsergebnissen. Für die Bank Vontobel liegt Actelion mit den Zahlen "ungefähr" im Rahmen der Erwartungen. Hingegen wurden die UBS-Schätzungen nicht erreicht.
Einig ist man sich darin, dass die Umsatzentwicklung des Hauptprodukts Tracleer im dritten Quartal unter den Erwartungen gelegen hat. "Ergebnisse bei Tracleer nach zwei starken Quartalen etwas schwach", schreibt denn auch Vontobel. Von einer "leichten Enttäuschung" spricht die ZKB.
Auf längere Sicht wird Actelion jedoch positiv beurteilt, hat das Unternehmen doch vier Produktkandidaten in Phase-III-Tests und soll ein fünfter noch vor Ende 2009 folgen. So wird denn auch die starke Pipeline hervor gehoben, sowie die Tatsache, dass in der Forschung und Entwicklung keine Verzögerungen zu vermelden sind. "Die Pipeline ist erfreulicherweise unverändert und ohne Eliminierungen oder Verzögerungen", fass Bischofberger (ZKB) zusammen.
Die Bank Vontobel empfiehlt die Actelion-Aktie zum Kauf und nennt ein Kursziel von 79 CHF. Auch Helvea hat bisher zu "Buy" geraten (Kursziel: 86 CHF). Für die ZKB sind die Titel ein "Marktgewichten". Die UBS rät hingegen unverändert zu "Sell" (Kursziel: 57 CHF).
rt/ps
Wie erwartet gute Zahlen, jedoch keine Überraschung nach oben, deswegen sind wohl einiges kurzfristig etwas enttäuscht. Tracleer Verkäufe hätten wohl noch etwas höher sein dürfen nach der Preiserhöhung in den USA, da haben wohl auch die Wechselkurse einen Streich gespielt.
Zudem hat wohl der etwas verhaltenere Zukunftsausblick den ein oder anderen etwas geschreckt. Bislang war aber ACtelion immer vorsichtig im Ausblick und hat dann halt lieber noch die Guidance erhöht
Auf jeden Fall wird es weiterhin sehr spannend bleiben, in den nächsten Monaten werden die diversen Studienresultate starke Kurstreiber sein. Ich schätze die Chancen wohl so 80:20, dass sie mehrheitlich positive sein werden, vor allem Almorexant wird sehr wichtig sein.
Zum Cash-Bestand: Da bin ich sicher, dass wir auch in den nächsten Monaten News von Clozel kriegen werden. Ein Unternehmen werden sie wohl nicht kaufen, die Aussagen sind ja wiederholt klar: Wir wollen nur Produktkandidaten einlizenzieren. Ob ein Einkauf eines Forschungsunternemens in der USA sinnvoll wäre, weiss ich nicht. Aber ich denke es ist noch nicht sooo dringend einen grösseren USA-Standort aufzubauen. Könnte mir aber vorstellen, dass mit einem 2. Blockbuster und den dementsprechenden Mittelflüssen so ein Projekt definitiv mal realisiert wird (zeitraum wohl 5-7 Jahre).
Auf alle Fälle wird uns sicher nicht langweilig und ich bin überzeugt, dass wir bis Ende Jahr ein neues Allzeithoch sehen könnten, wenn denn die Almorexantdaten sehr gut sind.
Zudem hat wohl der etwas verhaltenere Zukunftsausblick den ein oder anderen etwas geschreckt. Bislang war aber ACtelion immer vorsichtig im Ausblick und hat dann halt lieber noch die Guidance erhöht

Auf jeden Fall wird es weiterhin sehr spannend bleiben, in den nächsten Monaten werden die diversen Studienresultate starke Kurstreiber sein. Ich schätze die Chancen wohl so 80:20, dass sie mehrheitlich positive sein werden, vor allem Almorexant wird sehr wichtig sein.
Zum Cash-Bestand: Da bin ich sicher, dass wir auch in den nächsten Monaten News von Clozel kriegen werden. Ein Unternehmen werden sie wohl nicht kaufen, die Aussagen sind ja wiederholt klar: Wir wollen nur Produktkandidaten einlizenzieren. Ob ein Einkauf eines Forschungsunternemens in der USA sinnvoll wäre, weiss ich nicht. Aber ich denke es ist noch nicht sooo dringend einen grösseren USA-Standort aufzubauen. Könnte mir aber vorstellen, dass mit einem 2. Blockbuster und den dementsprechenden Mittelflüssen so ein Projekt definitiv mal realisiert wird (zeitraum wohl 5-7 Jahre).
Auf alle Fälle wird uns sicher nicht langweilig und ich bin überzeugt, dass wir bis Ende Jahr ein neues Allzeithoch sehen könnten, wenn denn die Almorexantdaten sehr gut sind.
Antwort auf Beitrag Nr.: 38.212.140 von ffdmh am 20.10.09 11:38:51ca. 4 % im minmus momentan nach den heutigen Zahlen - naja ein erster Reflex nach dem monatelangen Kursanstieg. Finde ich etwas übertriben, aber einige nehmen jetzt auch mal Gewinne mit.
In den nächsten Wochen kommt es jetzt auf Almoreaxant an: bei positiven Ergebnissen sehe ich auch neue Höchstsände, die uns auf 75 - 80 CHF katapultieren sollten, sofern der Gesamtmarkt freundlich bleibt.
Hoffen wir also auf eine schöne Jahresendralley und in 2010 legen wir uns dann dank Almorexant erst mal zum Schlafen hin, bis die endgültigen P-III Daten kommen
In den nächsten Wochen kommt es jetzt auf Almoreaxant an: bei positiven Ergebnissen sehe ich auch neue Höchstsände, die uns auf 75 - 80 CHF katapultieren sollten, sofern der Gesamtmarkt freundlich bleibt.
Hoffen wir also auf eine schöne Jahresendralley und in 2010 legen wir uns dann dank Almorexant erst mal zum Schlafen hin, bis die endgültigen P-III Daten kommen

20.10.2009 10:41:16
Actelion "buy"
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, stuft die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" weiterhin mit dem Rating "buy" ein.
Actelion habe heute Morgen das Ergebnis für das Q3 09 vorgelegt. Insgesamt habe sich der Umsatz etwas verbessert, aber Tracleer sei schwächer als in den Analystenprognosen gewesen.
Der Umsatz von Tracleer sei hinter den Erwartungen der Analysten (-2%) und hinter der Konsenserwartung (-4%) zurückgeblieben. Der Umsatz von Ventavis sei viel stärker gewesen, möglicherweise wegen der Indikationserweiterung im August 2009. Das Cash-EBIT liege leicht unter den Erwartungen der Analysten, entspreche aber dem Marktkonsens. Reingewinn/EPS seien ungefähr erwartungsgemäß.
Die Pipeline scheine immer noch gut gefüllt. Die wichtigsten Impulsgeber auf klinischer Seite seien erste Daten der Phase-III-Studie für Almorexant. Eckdaten würden bis Ende 2009 erwartet.
Klinische Daten der Phase III für Bosentan (Tracleer) bei idiopathischer pulmonaler Fibrose würden weiterhin für Anfang 2010 erwartet. Bosentandaten seien der wichtigere Impulsgeber.
Prognosespektrum bestätige, das Unternehmen sollte einen Umsatz am oberen Ende des Konsensspektrums erzielen, d.h. 19% in LW. Erste Prognosen für GJ 10 seien oberhalb der Erwartungen gegeben worden. Das Unternehmen erwarte zweistelliges Wachstum in der Lokalwährung.
Insgesamt habe das Unternehmen Ergebnisse für das Q3 09 geliefert, die ungefähr mit den Erwartungen der Analysten (+/-4%) übereingestimmt hätten. Der Umsatz bei Tracleer sei schwächer als die Konsenserwartungen und nur 2% unterhalb der Analystenprognose gewesen. Das Q3 09 scheine ein langsames Quartal für die Rekrutierung neuer Patienten zu sein. Der nächste wichtigere Impulsgeber seien die Phase-III-Daten für Bosentan bei idiopathischer pulmonaler Fibrose.
Die Analysten von Vontobel Research bestätigen ihr "buy"-Rating für die Actelion-Aktie und ihr Kursziel von CHF 79. (Analyse vom 20.10.2009) (20.10.2009/ac/a/a)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
Quelle: AKTIENCHECK.DE
Actelion "buy"
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, stuft die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" weiterhin mit dem Rating "buy" ein.
Actelion habe heute Morgen das Ergebnis für das Q3 09 vorgelegt. Insgesamt habe sich der Umsatz etwas verbessert, aber Tracleer sei schwächer als in den Analystenprognosen gewesen.
Der Umsatz von Tracleer sei hinter den Erwartungen der Analysten (-2%) und hinter der Konsenserwartung (-4%) zurückgeblieben. Der Umsatz von Ventavis sei viel stärker gewesen, möglicherweise wegen der Indikationserweiterung im August 2009. Das Cash-EBIT liege leicht unter den Erwartungen der Analysten, entspreche aber dem Marktkonsens. Reingewinn/EPS seien ungefähr erwartungsgemäß.
Die Pipeline scheine immer noch gut gefüllt. Die wichtigsten Impulsgeber auf klinischer Seite seien erste Daten der Phase-III-Studie für Almorexant. Eckdaten würden bis Ende 2009 erwartet.
Klinische Daten der Phase III für Bosentan (Tracleer) bei idiopathischer pulmonaler Fibrose würden weiterhin für Anfang 2010 erwartet. Bosentandaten seien der wichtigere Impulsgeber.
Prognosespektrum bestätige, das Unternehmen sollte einen Umsatz am oberen Ende des Konsensspektrums erzielen, d.h. 19% in LW. Erste Prognosen für GJ 10 seien oberhalb der Erwartungen gegeben worden. Das Unternehmen erwarte zweistelliges Wachstum in der Lokalwährung.
Insgesamt habe das Unternehmen Ergebnisse für das Q3 09 geliefert, die ungefähr mit den Erwartungen der Analysten (+/-4%) übereingestimmt hätten. Der Umsatz bei Tracleer sei schwächer als die Konsenserwartungen und nur 2% unterhalb der Analystenprognose gewesen. Das Q3 09 scheine ein langsames Quartal für die Rekrutierung neuer Patienten zu sein. Der nächste wichtigere Impulsgeber seien die Phase-III-Daten für Bosentan bei idiopathischer pulmonaler Fibrose.
Die Analysten von Vontobel Research bestätigen ihr "buy"-Rating für die Actelion-Aktie und ihr Kursziel von CHF 79. (Analyse vom 20.10.2009) (20.10.2009/ac/a/a)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
Quelle: AKTIENCHECK.DE
Hier noch ein kleiner Artikel aus nem Pharmafachmedium (Scrip-Magazine http://www.scripnews.com/business/Actelion-revenues-up-but-p…
Actelion revenues up but pipeline still causes unease
20 October 2009
Simon Varcoe
Actelion's net revenue increased by 14% in the third quarter to CHF447 million, but missed analysts' forecasts by 1% due to a negative foreign exchange impact and lower than expected sales of Tracleer (bosentan).
Sales of the treatment for pulmonary arterial hypertension were up by 10% to CHF375 million in the quarter but were 4% below Piper Jaffray analysts' expectations and 3% lower than its performance in the second quarter. Tracleer sales in the year to date increased by 18% to CHF1.1 billion on a reported basis.
Tracleer is currently in a Build-3 study to evaluate its safety and efficacy in idiopathic fibrosis. However analysts have forecast that this study has only a 50% chance of success at best. Top-line results are expected early next year.
Year-to-date sales of Actelion's other marketed products Ventavis (iloprost) and Zavesca (miglustat) grew by 58% to CHF102 million and by 27% to CHF38 million respectively.
The company's net profit in the third quarter increased by just 1% to CHF108 million, though a strong performance in the previous two quarters meant that its year-to-date income rose by 44% to CHF327 million.
Third-quarter R&D expenses leapt by 43% to CHF109 million, while SG&A costs grew by 13% to CHF150 million. Total operating costs were up by 28% to CHF327 million.
Actelion's chief financial officer Andrew Oakley maintained the company's full-year guidance of top-line and cash EBIT growth of 16-19%. This suggests full-year revenues of CHF1.86-1.89 billion if currency remains unchanged, according to Piper Jaffray.
pipeline concerns continue
Although Actelion has maintained strong growth in sales of its marketed products, there remain concerns over its late-stage pipeline.
In addition to doubts over the Build-3 study, the analysts still believe there is a significant probability that the Conscious-2 study (clazosentan to overcome neurological ischaemia and infarct occurring after subarachnoid haemorrhage) will fail ( scripnews.com, July 21st, 2009).
Furthermore, they doubt that the Restora-1 study of almorexant in primary insomnia will shed light on issues that are critical to the drug's success, such as chronic safety.
Piper Jaffray advised investors to hold off from buying up Actelion shares and said that near-term clinical news was most critical to share price performance. Actelion's shares dropped by 1% to open at CHF62.40 on October 20th.
Vor allem die letzten 4 Abschnitte sind wohl interessant. Da scheinen doch gewisse Befürchtungen bzgl. der Pipeline zu sein. Umso schöner, wenn die Studien dann dennoch erfolgreich werden und so den Aktienkurs pushen . Ein Studyfail sollte ja wohl dementsprechend schon teilweise eingepreist sein.
. Ein Studyfail sollte ja wohl dementsprechend schon teilweise eingepreist sein.
Actelion revenues up but pipeline still causes unease
20 October 2009
Simon Varcoe
Actelion's net revenue increased by 14% in the third quarter to CHF447 million, but missed analysts' forecasts by 1% due to a negative foreign exchange impact and lower than expected sales of Tracleer (bosentan).
Sales of the treatment for pulmonary arterial hypertension were up by 10% to CHF375 million in the quarter but were 4% below Piper Jaffray analysts' expectations and 3% lower than its performance in the second quarter. Tracleer sales in the year to date increased by 18% to CHF1.1 billion on a reported basis.
Tracleer is currently in a Build-3 study to evaluate its safety and efficacy in idiopathic fibrosis. However analysts have forecast that this study has only a 50% chance of success at best. Top-line results are expected early next year.
Year-to-date sales of Actelion's other marketed products Ventavis (iloprost) and Zavesca (miglustat) grew by 58% to CHF102 million and by 27% to CHF38 million respectively.
The company's net profit in the third quarter increased by just 1% to CHF108 million, though a strong performance in the previous two quarters meant that its year-to-date income rose by 44% to CHF327 million.
Third-quarter R&D expenses leapt by 43% to CHF109 million, while SG&A costs grew by 13% to CHF150 million. Total operating costs were up by 28% to CHF327 million.
Actelion's chief financial officer Andrew Oakley maintained the company's full-year guidance of top-line and cash EBIT growth of 16-19%. This suggests full-year revenues of CHF1.86-1.89 billion if currency remains unchanged, according to Piper Jaffray.
pipeline concerns continue
Although Actelion has maintained strong growth in sales of its marketed products, there remain concerns over its late-stage pipeline.
In addition to doubts over the Build-3 study, the analysts still believe there is a significant probability that the Conscious-2 study (clazosentan to overcome neurological ischaemia and infarct occurring after subarachnoid haemorrhage) will fail ( scripnews.com, July 21st, 2009).
Furthermore, they doubt that the Restora-1 study of almorexant in primary insomnia will shed light on issues that are critical to the drug's success, such as chronic safety.
Piper Jaffray advised investors to hold off from buying up Actelion shares and said that near-term clinical news was most critical to share price performance. Actelion's shares dropped by 1% to open at CHF62.40 on October 20th.
Vor allem die letzten 4 Abschnitte sind wohl interessant. Da scheinen doch gewisse Befürchtungen bzgl. der Pipeline zu sein. Umso schöner, wenn die Studien dann dennoch erfolgreich werden und so den Aktienkurs pushen
 . Ein Studyfail sollte ja wohl dementsprechend schon teilweise eingepreist sein.
. Ein Studyfail sollte ja wohl dementsprechend schon teilweise eingepreist sein.
21.10.2009 10:33:43
Actelion "buy"
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, stuft die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" weiterhin mit dem Rating "buy" ein.
Die gestern von Actelion veröffentlichten Ergebnisse für das 3. Quartal 2009 hätten ungefähr den Schätzungen der Analysten entsprochen, seien jedoch hinter den Konsenserwartungen zurückgeblieben. Vor diesem Hintergrund hätten sie ihre Prognosen korrigiert. Auch Gilead habe ihre Ergebnisse für das 3. Quartal 2009 bekannt gegeben, einschließlich der Umsatzzahlen für Letairis.
Die Analysten würden ihre Umsatz- und Gewinnzahlen für die Geschäftsjahre 2009 und 2010 um 1 bis 3% erhöhen. Damit würden sie der 6%igen Preiserhöhung bei Tracleer Rechnung tragen, die im September 2009 in den USA durchgeführt worden sei, sowie dem Ausblick für das Geschäftsjahr 2010, der etwas besser ausgefallen sei als erwartet. Actelion erwarte in Lokalwährung gerechnet ein Umsatz- und Gewinnwachstum im niedrigen zweistelligen Prozentbereich. Die Analysten würden mit einem Umsatzwachstum in LW von 12,5% rechnen. Gilead habe für Letairis einen Umsatz von USD 48,1 Mio. bekannt gegeben. Damit habe er fast haargenau der Prognose der Analysten von USD 48 Mio. entsprochen. Die Marktlancierung dieses Medikaments beeindrucke sie nach wie vor nicht. Sie würden weiterhin meinen, dass das Präparat für Tracleer keine ernste Konkurrenz darstellen werde.
Da die Analysten ihre Umsatz- und Gewinnprognosen leicht angehoben hätten, würden sie auch ihr auf Basis des DCF-Modells ermitteltes Kursziel anpassen.
Die Analysten von Vontobel Research bekräftigen ihre "buy"-Empfehlung für die Actelion-Aktie und erhöhen ihr Kursziel von CHF 79 auf CHF 80. (Analyse vom 21.10.2009) (21.10.2009/ac/a/a)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
Quelle: AKTIENCHECK.DE
Actelion "buy"
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, stuft die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" weiterhin mit dem Rating "buy" ein.
Die gestern von Actelion veröffentlichten Ergebnisse für das 3. Quartal 2009 hätten ungefähr den Schätzungen der Analysten entsprochen, seien jedoch hinter den Konsenserwartungen zurückgeblieben. Vor diesem Hintergrund hätten sie ihre Prognosen korrigiert. Auch Gilead habe ihre Ergebnisse für das 3. Quartal 2009 bekannt gegeben, einschließlich der Umsatzzahlen für Letairis.
Die Analysten würden ihre Umsatz- und Gewinnzahlen für die Geschäftsjahre 2009 und 2010 um 1 bis 3% erhöhen. Damit würden sie der 6%igen Preiserhöhung bei Tracleer Rechnung tragen, die im September 2009 in den USA durchgeführt worden sei, sowie dem Ausblick für das Geschäftsjahr 2010, der etwas besser ausgefallen sei als erwartet. Actelion erwarte in Lokalwährung gerechnet ein Umsatz- und Gewinnwachstum im niedrigen zweistelligen Prozentbereich. Die Analysten würden mit einem Umsatzwachstum in LW von 12,5% rechnen. Gilead habe für Letairis einen Umsatz von USD 48,1 Mio. bekannt gegeben. Damit habe er fast haargenau der Prognose der Analysten von USD 48 Mio. entsprochen. Die Marktlancierung dieses Medikaments beeindrucke sie nach wie vor nicht. Sie würden weiterhin meinen, dass das Präparat für Tracleer keine ernste Konkurrenz darstellen werde.
Da die Analysten ihre Umsatz- und Gewinnprognosen leicht angehoben hätten, würden sie auch ihr auf Basis des DCF-Modells ermitteltes Kursziel anpassen.
Die Analysten von Vontobel Research bekräftigen ihre "buy"-Empfehlung für die Actelion-Aktie und erhöhen ihr Kursziel von CHF 79 auf CHF 80. (Analyse vom 21.10.2009) (21.10.2009/ac/a/a)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
Quelle: AKTIENCHECK.DE
Antwort auf Beitrag Nr.: 38.220.709 von ffdmh am 21.10.09 11:27:30
Da scheinen doch gewisse Befürchtungen bzgl. der Pipeline zu sein. Umso schöner, wenn die Studien dann dennoch erfolgreich werden und so den Aktienkurs pushen . Ein Studyfail sollte ja wohl dementsprechend schon teilweise eingepreist sein.
Ja, das ist schon problematisch. Persönlich habe ich Tracleer bei IPF komplett ausgeblendet, weil ich fest von einem Scheitern ausgehe. Wenn ich es recht verstehe, haben sie in der P II ja nicht mal den primären Endpunkt erreicht.
Clazo... na ja, dass die Rekrutierung erweitert werden musste, stärkt auch nicht gerade mein Vertrauen. Ich setze auf Almorexant und S1P1. Nur wird es bei Almorexant eben nicht nur um die Daten gehen, die jetzt kommen, sondern auch darum, ob man auf der Basis ein "passendes" SPA vereinbaren kann.
S1P1 ist noch in einem relativ frühen Stadium.
Es gibt wirklich Gründe, die Pipeline weiter anzureichern. Eine Einlizensierung eines attraktiven und relativ sicheren Kandidaten wie Incytes INCB18424 wäre daher sehr zu begrüßen.
Da scheinen doch gewisse Befürchtungen bzgl. der Pipeline zu sein. Umso schöner, wenn die Studien dann dennoch erfolgreich werden und so den Aktienkurs pushen . Ein Studyfail sollte ja wohl dementsprechend schon teilweise eingepreist sein.
Ja, das ist schon problematisch. Persönlich habe ich Tracleer bei IPF komplett ausgeblendet, weil ich fest von einem Scheitern ausgehe. Wenn ich es recht verstehe, haben sie in der P II ja nicht mal den primären Endpunkt erreicht.

Clazo... na ja, dass die Rekrutierung erweitert werden musste, stärkt auch nicht gerade mein Vertrauen. Ich setze auf Almorexant und S1P1. Nur wird es bei Almorexant eben nicht nur um die Daten gehen, die jetzt kommen, sondern auch darum, ob man auf der Basis ein "passendes" SPA vereinbaren kann.
S1P1 ist noch in einem relativ frühen Stadium.
Es gibt wirklich Gründe, die Pipeline weiter anzureichern. Eine Einlizensierung eines attraktiven und relativ sicheren Kandidaten wie Incytes INCB18424 wäre daher sehr zu begrüßen.
Zu Bosentan bei IPF hier noch ein Update von Pharmawire vom 1.10. kA, ob das sonst in den Medien war, ich habs soweit nirgends entdeckt:
Actelion's bosentan shows more promise in early stage patients in BUILD-3 study, but may falter due to disease variability, physicians say
2009-10-01 Pharmawire
Intelligence Details
Actelion’s (VTX:ATLN) bosentan, for the treatment of idiopathic pulmonary fibrosis (IPF), could benefit an early subgroup in the company's BUILD-3 trial, physicians said. However, they cautioned that this disease is extremely variable and the trial could wind up producing similar results to the failed gamma interferon-1 class of agents.
In 2002, a Phase III study of Intermune's (NASDAQ:ITMN) Actimmune, an interferon gamma-1b subcutaneous injection, failed to confer a survival benefit in patients with IPF. Since the failure, Intermune is trying another drug, pirfenidone, in IPF.
Actelion's BUILD-3 trial is an event-driven Phase III study with time to occurrence of disease worsening or death serving as the primary endpoint.
IPF is characterized by patchy, irreversible fibrosis as result of chronic lung injury with scarring and honeycombing of the lungs, and presence of prominent fibroblast foci as a result of acute lung injury. To date, there are no proven therapies for IPF.
Patients in the BUILD-1 trial who did not have full-fledged honeycombing of the lungs experienced the best response to bosentan, according a spokesperson for Actelion. The honeycombing looks like large holes in patients’ lungs and are indicative of dead tissue and advanced disease, he explained. He added that patients with honeycombing of less than 5% of their lungs who underwent a surgical lung biopsy experienced the most benefit in the BUILD-1 trial.
The BUILD-1 trial of bosentan did not demonstrate superiority compared to placebo on the primary endpoint of the six-minute walk distance test. There was a trend, however, in improving quality of life as well as time to death and disease progression in patients who received a surgical lung biopsy in the BUILD-1 clinical trial, leading to the strategy for the BUILD-3 trail.
Patients enrolled in the BUILD-3 trial were given a surgical lung biopsy, a surrogate marker for patients with earlier disease, according to Dr Steven Nathan, the director of the advanced lung disease and transplant program at the Inova Heart and Vascular Institute.
Nathan said he expects the BUILD-3 trial to reach its target number of events later this year, with top-line results early next year.
Patients who have biopsy-proven disease are a different population from those who have not received biopsy proven disease, according to Dr Harold Collard, a PAH expert in the in the department of medicine of the University of San Francisco. Patients who could be diagnosed with IPF are initially given a CT scan, and those who have a typical CT will not be biopsied while those who have an atypical pattern will receive a surgical biopsy, he explained.
There are differences between the typical and atypical patients biologically and mechanistically, said Collard. The survival rates of patients who have received a CT scan are approximately twice as long compared to patients who have not had a scan, he added.
The CEO of a company developing agents for IPF said although a surgical lung biopsy is the gold standard for IPF trials, his company has not planned to perform the procedure in its studies. He speculated that the primary reason behind Actelion’s use of the procedure was because the drug showed a benefit in that particular patient subgroup. He said that there is also rationale that the drug may work better in patients with earlier stage disease.
The subgroup of patients that was found to do better in the BUILD-1 trial received a surgical lung biopsy, according Nathan. Nathan also explained that patients with a typical CAT scan have reticulation as well as some type of honeycombing in the lungs. Patients with atypical CAT scans do not have honeycombing, and have a much more “central” distribution of their disease, Nathan said. He explained that a surgical lung biopsy is a surrogate for patients with earlier stage disease.
Nathan said that despite this patient group enrollment in the BUILD-3 trial, the course of IPF is so variable that it is extremely difficult to predict the course of decline in patients. He cautioned that the results of the BUILD-1 trial could resemble the gamma interferon 1 class of agents, which demonstrated positive results in a subgroup - but ultimately failed to translate into a positive trial. “It is very difficult to predict how one patient group will fare compared to the next,” Nathan stated.
Dr Christopher Lettieri, an IPF expert and army medical director at the pulmonary, critical care and sleep medicine section at Walter Reed Army Medical Center, also noted that the data from the BUILD-1 trial is difficult to interpret - because the improvement may not be related to the biopsy. Conducting a trial could be really difficult because it is hard to differentiate patients who survive from those who do not, Lettieri said.
There is a correlation, however, between IPF and PAH and mortality, Lettieri said. The link between the two diseases has opened up the opportunity for new agents in IPF, he added.
Mechanism of Action
The spokesperson said Actelion began to conduct trials of bosentan because there was early evidence that endothelin receptor antagonism plays a role in the development of fibrosis in IPF patients. He stressed that there is evidence from large pre-clinical and clinical trials that endothelin dysfunction is in fact involved in IPF disease pathology.
Dr Adrian Gillissen, an IPF expert at St. George Medical Center of Robert-Koch-Hospital in Leipzig, Germany, said that current therapeutic approaches target epithelial cell replacement, manipulation of fibroblasts/myofibroblasts, modulation of procoagulant/fibrinolytic activities, cytokine and growth factor production, angiogenesis, and reduction of oxidative stress.
“Therapeutic interventions interfering with the pathways that lead to myofibroblast expansion and alveolar epithelial cells apoptosis should therefore have a considerable benefit in IPF,” Gillissen said. “The hypothesis (and hope) that bosentan, pirfendione or treprostinil may be useful in the treatment of IPF patients is based on these cellular mechanisms.”
A third clinician added that bosentan’s mechanism could be promising in IPF for two reasons. Bosentan has a vascular vasodilatory effect, and it also probably has an anti-proliferative effect. In pulmonary fibrosis, an agent like this could inhibit the proliferation of fibroblasts and may inhibit scar formation, he explained.
Bosentan is a dual endothelin receptor antagonist that is licensed in the European Union and the United States for the treatment of pulmonary arterial hypertension. The drug is a competitive antagonist of endothelin-1 at the endothelin-A (ET-A) and the endothelin-B (endothelin-B) receptors.
by Klara Czobor and Marc Longpre
Actelion's bosentan shows more promise in early stage patients in BUILD-3 study, but may falter due to disease variability, physicians say
2009-10-01 Pharmawire
Intelligence Details
Actelion’s (VTX:ATLN) bosentan, for the treatment of idiopathic pulmonary fibrosis (IPF), could benefit an early subgroup in the company's BUILD-3 trial, physicians said. However, they cautioned that this disease is extremely variable and the trial could wind up producing similar results to the failed gamma interferon-1 class of agents.
In 2002, a Phase III study of Intermune's (NASDAQ:ITMN) Actimmune, an interferon gamma-1b subcutaneous injection, failed to confer a survival benefit in patients with IPF. Since the failure, Intermune is trying another drug, pirfenidone, in IPF.
Actelion's BUILD-3 trial is an event-driven Phase III study with time to occurrence of disease worsening or death serving as the primary endpoint.
IPF is characterized by patchy, irreversible fibrosis as result of chronic lung injury with scarring and honeycombing of the lungs, and presence of prominent fibroblast foci as a result of acute lung injury. To date, there are no proven therapies for IPF.
Patients in the BUILD-1 trial who did not have full-fledged honeycombing of the lungs experienced the best response to bosentan, according a spokesperson for Actelion. The honeycombing looks like large holes in patients’ lungs and are indicative of dead tissue and advanced disease, he explained. He added that patients with honeycombing of less than 5% of their lungs who underwent a surgical lung biopsy experienced the most benefit in the BUILD-1 trial.
The BUILD-1 trial of bosentan did not demonstrate superiority compared to placebo on the primary endpoint of the six-minute walk distance test. There was a trend, however, in improving quality of life as well as time to death and disease progression in patients who received a surgical lung biopsy in the BUILD-1 clinical trial, leading to the strategy for the BUILD-3 trail.
Patients enrolled in the BUILD-3 trial were given a surgical lung biopsy, a surrogate marker for patients with earlier disease, according to Dr Steven Nathan, the director of the advanced lung disease and transplant program at the Inova Heart and Vascular Institute.
Nathan said he expects the BUILD-3 trial to reach its target number of events later this year, with top-line results early next year.
Patients who have biopsy-proven disease are a different population from those who have not received biopsy proven disease, according to Dr Harold Collard, a PAH expert in the in the department of medicine of the University of San Francisco. Patients who could be diagnosed with IPF are initially given a CT scan, and those who have a typical CT will not be biopsied while those who have an atypical pattern will receive a surgical biopsy, he explained.
There are differences between the typical and atypical patients biologically and mechanistically, said Collard. The survival rates of patients who have received a CT scan are approximately twice as long compared to patients who have not had a scan, he added.
The CEO of a company developing agents for IPF said although a surgical lung biopsy is the gold standard for IPF trials, his company has not planned to perform the procedure in its studies. He speculated that the primary reason behind Actelion’s use of the procedure was because the drug showed a benefit in that particular patient subgroup. He said that there is also rationale that the drug may work better in patients with earlier stage disease.
The subgroup of patients that was found to do better in the BUILD-1 trial received a surgical lung biopsy, according Nathan. Nathan also explained that patients with a typical CAT scan have reticulation as well as some type of honeycombing in the lungs. Patients with atypical CAT scans do not have honeycombing, and have a much more “central” distribution of their disease, Nathan said. He explained that a surgical lung biopsy is a surrogate for patients with earlier stage disease.
Nathan said that despite this patient group enrollment in the BUILD-3 trial, the course of IPF is so variable that it is extremely difficult to predict the course of decline in patients. He cautioned that the results of the BUILD-1 trial could resemble the gamma interferon 1 class of agents, which demonstrated positive results in a subgroup - but ultimately failed to translate into a positive trial. “It is very difficult to predict how one patient group will fare compared to the next,” Nathan stated.
Dr Christopher Lettieri, an IPF expert and army medical director at the pulmonary, critical care and sleep medicine section at Walter Reed Army Medical Center, also noted that the data from the BUILD-1 trial is difficult to interpret - because the improvement may not be related to the biopsy. Conducting a trial could be really difficult because it is hard to differentiate patients who survive from those who do not, Lettieri said.
There is a correlation, however, between IPF and PAH and mortality, Lettieri said. The link between the two diseases has opened up the opportunity for new agents in IPF, he added.
Mechanism of Action
The spokesperson said Actelion began to conduct trials of bosentan because there was early evidence that endothelin receptor antagonism plays a role in the development of fibrosis in IPF patients. He stressed that there is evidence from large pre-clinical and clinical trials that endothelin dysfunction is in fact involved in IPF disease pathology.
Dr Adrian Gillissen, an IPF expert at St. George Medical Center of Robert-Koch-Hospital in Leipzig, Germany, said that current therapeutic approaches target epithelial cell replacement, manipulation of fibroblasts/myofibroblasts, modulation of procoagulant/fibrinolytic activities, cytokine and growth factor production, angiogenesis, and reduction of oxidative stress.
“Therapeutic interventions interfering with the pathways that lead to myofibroblast expansion and alveolar epithelial cells apoptosis should therefore have a considerable benefit in IPF,” Gillissen said. “The hypothesis (and hope) that bosentan, pirfendione or treprostinil may be useful in the treatment of IPF patients is based on these cellular mechanisms.”
A third clinician added that bosentan’s mechanism could be promising in IPF for two reasons. Bosentan has a vascular vasodilatory effect, and it also probably has an anti-proliferative effect. In pulmonary fibrosis, an agent like this could inhibit the proliferation of fibroblasts and may inhibit scar formation, he explained.
Bosentan is a dual endothelin receptor antagonist that is licensed in the European Union and the United States for the treatment of pulmonary arterial hypertension. The drug is a competitive antagonist of endothelin-1 at the endothelin-A (ET-A) and the endothelin-B (endothelin-B) receptors.
by Klara Czobor and Marc Longpre
Antwort auf Beitrag Nr.: 38.221.967 von ffdmh am 21.10.09 13:38:20
Danke für die wertvollen Beiträge. Du bist hier sicher der User mit dem besten fachlichen Einblick imho.
Danke für die wertvollen Beiträge. Du bist hier sicher der User mit dem besten fachlichen Einblick imho.
Naja, ich habe das Glück (oder die Last?) in der Kommunikationsberatung und Medienanalyse für die Pharmabranche zu arbeiten und krieg einigermassen was mit und versteh auch so langsam die ganzen Prozesse, Zulassungsmühsal etc. 
Und ich hab halt geschäftlich Zugang zu diversen teuren Pharma-Fachmedien, wos etwas wissenschaftlichere Infos gibt als in den Google-News .
.
Aber wie und ob Zulassungen etc. kommen, kann ich genauso wenig sagen wie alle hier, dafür sind vor allem auch die Anwendungsgebiete der aktuellen Pipeline-Produkte zu komplex. Siehe Bosentan-PhaseIII Studien. Da wirkts, da nicht, evt. hier etc

Und ich hab halt geschäftlich Zugang zu diversen teuren Pharma-Fachmedien, wos etwas wissenschaftlichere Infos gibt als in den Google-News
 .
.Aber wie und ob Zulassungen etc. kommen, kann ich genauso wenig sagen wie alle hier, dafür sind vor allem auch die Anwendungsgebiete der aktuellen Pipeline-Produkte zu komplex. Siehe Bosentan-PhaseIII Studien. Da wirkts, da nicht, evt. hier etc

Antwort auf Beitrag Nr.: 38.226.441 von ffdmh am 21.10.09 21:00:17
Damit bist Du uns anderen hier weit voraus.
Und bei der Gelegenheit werde ich gleich unverschämt:
In addition to doubts over the Build-3 study, the analysts still believe there is a significant probability that the Conscious-2 study (clazosentan to overcome neurological ischaemia and infarct occurring after subarachnoid haemorrhage) will fail ( scripnews.com, July 21st, 2009).
Ist der angesprochene Artikel für Dich verfügbar? Wär toll...
PS: Bei Clazo hatte ich bisher immer eine etwas höhere Erwartung, als bei der IPF-Sache. Obwohl es letztlich dabei bleibt, dass diese beiden Projekte unter der Rubrik "Bonus" laufen. Wenn da was positives bei rumkommt, ist das unerwartet und definitv nicht eingepreist.
Damit bist Du uns anderen hier weit voraus.
Und bei der Gelegenheit werde ich gleich unverschämt:
In addition to doubts over the Build-3 study, the analysts still believe there is a significant probability that the Conscious-2 study (clazosentan to overcome neurological ischaemia and infarct occurring after subarachnoid haemorrhage) will fail ( scripnews.com, July 21st, 2009).
Ist der angesprochene Artikel für Dich verfügbar? Wär toll...

PS: Bei Clazo hatte ich bisher immer eine etwas höhere Erwartung, als bei der IPF-Sache. Obwohl es letztlich dabei bleibt, dass diese beiden Projekte unter der Rubrik "Bonus" laufen. Wenn da was positives bei rumkommt, ist das unerwartet und definitv nicht eingepreist.
Hmm irgendwie hab ich am 21. Juli nur den Artikel:
Actelion continues 2009 growth, but trial delays hurt product pipeline
21 July 2009
Simon Varcoe
Actelion's product pipeline has again suffered setbacks as a number of its programmes have been delayed by FDA requirements and structural issues, the firm announced in its first-half results.
However, the company's financial performance was positive, posting a 27% increase in its first-half revenues to CHF855.2 million ($798.4 million) on the back of a strong Tracleer (bosentan) performance.
Sales of the treatment for pulmonary arterial hypertension increased by 22% in the second quarter to CHF387.1 million, 7% higher than the consensus estimate. This helped to push its first-half sales to CHF739.3 million (+22%).
Earlier this month, the European Commission approved a paediatric dispersible formulation of Tracleer for the treatment of pulmonary arterial hypertension in children from two years of age. The approval made Tracleer the only PAH therapy with an approved paediatric formulation.
In the first half, Actelion's other PAH treatment Ventavis (iloprost) posted sales of CHF61.5 million (+62%), while Zavesca (miglustat), for the treatment of type 1 Gaucher's disease, had sales of CHF22.4 million (+14%). Ventavis's second-quarter sales were 19% higher than analysts' expectation at CHF34.5 million, while Zavesca's performance in the quarter was inline.
R&D expenses grew by 4% in the first half to CHF209.6 million, and SG&A costs were up by 17% at CHF299.6 million. Both operating expenses were slightly higher than Piper Jaffray's forecast.
Actelion's first-half net profits leapt by 83% to CHF218.4 million in the first half, while its diluted EPS increased by 85% to CHF1.79 on a US GAAP basis.
It has raised its full-year net revenue growth guidance to 16-19%, up from the 12-15% growth that it initially forecast at the start of the year. The analysts' own expectations matched the lower end of this revised guidance.
pipeline falters and stalls
Actelion's product pipeline continues to cause concerns, after it gave an update about its pipeline at the first-quarter results.
It has pushed back the development timeline of the primary insomnia treatment almorexant after the FDA required the company to spend more time in finalising the design of the Restora programme.
This extended the timeline by nine months and Actelion and its partner GlaxoSmithKline now expect to resubmit the clinical protocols to the FDA to gain a special protocol assessment (SPA) by the end of the year. While the Phase III Restora 1 trial is expected to conclude in the second half of this year, Actelion does not expect the remaining Phase III trials to begin before early 2010.
The progress of Actelion's Conscious-2 (clazosentan to overcome neurological ischaemia and infarct occurring after subarachnoid haemorrhage) raised further doubts about the strength of the company's pipeline.
Piper Jaffray analysts stated their belief that the Phase III study of clazosentan had a significant chance of failure in April, and cracks in the programme seem to be appearing already.
Actelion's blinded review of the overall event rate indicated a lower than expected event rate. The company subsequently decided to add 381 patients to the initial 765 patients in the trial "in order to maintain the statistical power of the study", it said. It now expects Conscious-2 results by the middle of next year.
Actelion has also delayed its Build-3 trial of Tracleer in idiopathic pulmonary fibrosis. It now expects results in early 2010, as opposed to the end of 2009.
Könnte das der richtige sein? Da steht ja doch was zu Conscious-2 und Build-3?
Actelion continues 2009 growth, but trial delays hurt product pipeline
21 July 2009
Simon Varcoe
Actelion's product pipeline has again suffered setbacks as a number of its programmes have been delayed by FDA requirements and structural issues, the firm announced in its first-half results.
However, the company's financial performance was positive, posting a 27% increase in its first-half revenues to CHF855.2 million ($798.4 million) on the back of a strong Tracleer (bosentan) performance.
Sales of the treatment for pulmonary arterial hypertension increased by 22% in the second quarter to CHF387.1 million, 7% higher than the consensus estimate. This helped to push its first-half sales to CHF739.3 million (+22%).
Earlier this month, the European Commission approved a paediatric dispersible formulation of Tracleer for the treatment of pulmonary arterial hypertension in children from two years of age. The approval made Tracleer the only PAH therapy with an approved paediatric formulation.
In the first half, Actelion's other PAH treatment Ventavis (iloprost) posted sales of CHF61.5 million (+62%), while Zavesca (miglustat), for the treatment of type 1 Gaucher's disease, had sales of CHF22.4 million (+14%). Ventavis's second-quarter sales were 19% higher than analysts' expectation at CHF34.5 million, while Zavesca's performance in the quarter was inline.
R&D expenses grew by 4% in the first half to CHF209.6 million, and SG&A costs were up by 17% at CHF299.6 million. Both operating expenses were slightly higher than Piper Jaffray's forecast.
Actelion's first-half net profits leapt by 83% to CHF218.4 million in the first half, while its diluted EPS increased by 85% to CHF1.79 on a US GAAP basis.
It has raised its full-year net revenue growth guidance to 16-19%, up from the 12-15% growth that it initially forecast at the start of the year. The analysts' own expectations matched the lower end of this revised guidance.
pipeline falters and stalls
Actelion's product pipeline continues to cause concerns, after it gave an update about its pipeline at the first-quarter results.
It has pushed back the development timeline of the primary insomnia treatment almorexant after the FDA required the company to spend more time in finalising the design of the Restora programme.
This extended the timeline by nine months and Actelion and its partner GlaxoSmithKline now expect to resubmit the clinical protocols to the FDA to gain a special protocol assessment (SPA) by the end of the year. While the Phase III Restora 1 trial is expected to conclude in the second half of this year, Actelion does not expect the remaining Phase III trials to begin before early 2010.
The progress of Actelion's Conscious-2 (clazosentan to overcome neurological ischaemia and infarct occurring after subarachnoid haemorrhage) raised further doubts about the strength of the company's pipeline.
Piper Jaffray analysts stated their belief that the Phase III study of clazosentan had a significant chance of failure in April, and cracks in the programme seem to be appearing already.
Actelion's blinded review of the overall event rate indicated a lower than expected event rate. The company subsequently decided to add 381 patients to the initial 765 patients in the trial "in order to maintain the statistical power of the study", it said. It now expects Conscious-2 results by the middle of next year.
Actelion has also delayed its Build-3 trial of Tracleer in idiopathic pulmonary fibrosis. It now expects results in early 2010, as opposed to the end of 2009.
Könnte das der richtige sein? Da steht ja doch was zu Conscious-2 und Build-3?
Antwort auf Beitrag Nr.: 38.227.490 von ffdmh am 21.10.09 22:48:56
Ja, das wird es wohl sein. Vielen Dank. Die genauen Hintergründe der Clazo-Probleme bleiben leider zumindest für mich aber weiterhin unklar.
Ja, das wird es wohl sein. Vielen Dank. Die genauen Hintergründe der Clazo-Probleme bleiben leider zumindest für mich aber weiterhin unklar.
Hier mal noch ein etwas älterer Artikel (13.5.) aus Pharmawire zu Clazo (Pivlaz), mit einigen Hintergründen, die evt. die Probleme erklären. Generell ist imo das Problem, dass die Resultate nicht statistisch signifikant sind (waren) und deswegen die Patientenpopulation ausgeweitet wurde, um die Effekte auch statistisch signifikant ausweisen zu können (je grösser eine Population, desto eher wird ein Effekt signifikant nachgewiesen werden können).
Aber hier der Artikel:
Actelion: Pivlaz's effect on Glasgow outcome scale may only give limited information on quality of life improvements, physicians say
2009-05-13 Pharmawire
Intelligence Details
* The Glasgow outcome scale is not the ideal measure to evaluate quality of life improvements, which are most important to the patient
* A composite endpoint of several scales would be a more appropriate secondary outcome measure, one physician said
* A problem with the Glasgow outcome scale is that it does not assess the cognitive status of a patient - approximately 70% of patients will have neuropsychological adverse events following the onset of a stroke
Actelion's (VTX:ATLN) Pivlaz's (clazosentan) effect on the Glasgow Outcome Scale (GOS) may only give limited information on quality of life improvements, several physicians said. According to trial data, Pivlaz's Phase III (CONSCIOUS-2) study investigates the effect of Pivlaz on the Extended GOS at week 12 post-aneurismal subarachnoid hemorrhage (aSAH) as a secondary endpoint.
Pivlaz is an intravenous endothelin receptor antagonist that is being studied in the CONSCIOUS-2 study to determine whether it can decrease vasospasm-related morbidity and all-cause mortality in adult patients with aSAH treated by surgical clipping or coiling.
The use of the GOS as the secondary endpoint may not be able to detect minor changes in patient improvement, noted Dr Jacob Schwartz, an expert in the department of neurosurgery at Rigshospitalet, Copenhagen University Hospital in Denmark. The biggest problem with the Glasgow scale is that it is a very crude measure - level 5 on the scale is death and 0 is no disability, Schwartz said. Following a vasospasm, many patients will have some degree of cognitive deficit and memory problems, and these fine levels of diagnosis are not covered by using the Glasgow outcome scale, Schwartz said. Many patients with subarachnoid hemorrhage experience a deficit, Schwartz noted.
The GOS is a 5-point score assigned to patients who experienced traumatic brain injury. The five categories on the scale are good recovery, moderately disabled, severely disabled, vegetative and dead.
Volker Breu, life cycle leader and senior director at Actelion, acknowledged that the Glasgow outcome scale is very basic. It does not provide a physician with an in-depth understanding of why a drug works, but says whether it works or does not work. However, the company is including more sophisticated scales to this outcome measure to get a more accurate picture, he added. Additional secondary endpoints measure quality of life through the Modified Rankin Scale (MRS) and the Telephone Interview for Cognitive Status (TICS) scale.
Furthermore, Actelion uses a very structured interview by trained interviewers as part of the GOS to make it very precise, and has also used other more sophisticated scales to measure endpoints in the study, Breu noted.
Still, Dr Joshua Levine, a neurologist at the University of Pennsylvania Medical Center, suggested that the GOS is just one scale out of many that could be used to evaluate patient improvement. Levine noted that although it is important to evaluate a clinical response to vasospasm, the long-term functional outcome of patients is the most important endpoint to study. He also stressed that multiple measures should be used to study a response to vasospasm.
"The Glasgow Outcome Scale is not adequate," said Dr Quasir Shah, a neurosurgeon at the University of Minnesota. The Glasgow outcome scale is disliked by the neurology community, and does not give an adequate view of patient improvement in the stroke population, Shah noted. It would be more appropriate to use the NIHSS scale, and rely on the GOS scale as a follow up, Shah said.
On this point, Breu added that information for this scale can be devised from company data, and in a way investigators are using the NIHSS scale to qualify patients for the study at day 14. Based on advice from the Screening Committee Members panel, the NIHSS scale was not deemed to be the best scale to use; furthermore, regulators requested the use of the GOS scale, he added.
The Glasgow Outcome Scale is very simple and crude, said Dr Salah Keyrouz, the director of the Arkansas SAVES Telestroke Program. A problem with the Glasgow outcome scale is that it does not assess the cognitive status of a patient - approximately 70% of patients will have neuropsychological adverse events following the onset of a stroke, Keyrouz explained. Moreover, the scale does not evaluate a patients' ability to perform simple tasks, such as going to the bathroom independently, he added.
The patients who survive vasospasms have very poor outcomes, said Dr Walter van den Bergh, a neurologist in the department of intensive care at the University Medical Center in Utrecht. Patients who develop this complication are young, with a mean age of about 55 years, and it would be meaningful for these patients if a drug could improve their quality of life, since the quality of life lost to these patients is significant, van den Bergh said.
In one of his papers, Dr Harvey Levine, a professor in the department of psychiatry and behavioral sciences at Baylor College of Medicine in Houston, Texas, noted that although the original GOS has been shown to be related to neuropsychological impairment after severe traumatic brain injury, the scale was designed to assess global outcome in groups of cases rather than to evaluate impairment in individual patients.
He further stated that in order to improve sensitivity of the Extended GOS scale, a brief structured interview that encompasses independence within the home, independence outside the home, employability, social and leisure activities, and interpersonal relationships has been developed by a number of experts.
Actelion has a market cap of CHF 6.4bn (USD 5.79bn).
by Mintoi Chessa-Florea and Klara Czobor
Aber hier der Artikel:
Actelion: Pivlaz's effect on Glasgow outcome scale may only give limited information on quality of life improvements, physicians say
2009-05-13 Pharmawire
Intelligence Details
* The Glasgow outcome scale is not the ideal measure to evaluate quality of life improvements, which are most important to the patient
* A composite endpoint of several scales would be a more appropriate secondary outcome measure, one physician said
* A problem with the Glasgow outcome scale is that it does not assess the cognitive status of a patient - approximately 70% of patients will have neuropsychological adverse events following the onset of a stroke
Actelion's (VTX:ATLN) Pivlaz's (clazosentan) effect on the Glasgow Outcome Scale (GOS) may only give limited information on quality of life improvements, several physicians said. According to trial data, Pivlaz's Phase III (CONSCIOUS-2) study investigates the effect of Pivlaz on the Extended GOS at week 12 post-aneurismal subarachnoid hemorrhage (aSAH) as a secondary endpoint.
Pivlaz is an intravenous endothelin receptor antagonist that is being studied in the CONSCIOUS-2 study to determine whether it can decrease vasospasm-related morbidity and all-cause mortality in adult patients with aSAH treated by surgical clipping or coiling.
The use of the GOS as the secondary endpoint may not be able to detect minor changes in patient improvement, noted Dr Jacob Schwartz, an expert in the department of neurosurgery at Rigshospitalet, Copenhagen University Hospital in Denmark. The biggest problem with the Glasgow scale is that it is a very crude measure - level 5 on the scale is death and 0 is no disability, Schwartz said. Following a vasospasm, many patients will have some degree of cognitive deficit and memory problems, and these fine levels of diagnosis are not covered by using the Glasgow outcome scale, Schwartz said. Many patients with subarachnoid hemorrhage experience a deficit, Schwartz noted.
The GOS is a 5-point score assigned to patients who experienced traumatic brain injury. The five categories on the scale are good recovery, moderately disabled, severely disabled, vegetative and dead.
Volker Breu, life cycle leader and senior director at Actelion, acknowledged that the Glasgow outcome scale is very basic. It does not provide a physician with an in-depth understanding of why a drug works, but says whether it works or does not work. However, the company is including more sophisticated scales to this outcome measure to get a more accurate picture, he added. Additional secondary endpoints measure quality of life through the Modified Rankin Scale (MRS) and the Telephone Interview for Cognitive Status (TICS) scale.
Furthermore, Actelion uses a very structured interview by trained interviewers as part of the GOS to make it very precise, and has also used other more sophisticated scales to measure endpoints in the study, Breu noted.
Still, Dr Joshua Levine, a neurologist at the University of Pennsylvania Medical Center, suggested that the GOS is just one scale out of many that could be used to evaluate patient improvement. Levine noted that although it is important to evaluate a clinical response to vasospasm, the long-term functional outcome of patients is the most important endpoint to study. He also stressed that multiple measures should be used to study a response to vasospasm.
"The Glasgow Outcome Scale is not adequate," said Dr Quasir Shah, a neurosurgeon at the University of Minnesota. The Glasgow outcome scale is disliked by the neurology community, and does not give an adequate view of patient improvement in the stroke population, Shah noted. It would be more appropriate to use the NIHSS scale, and rely on the GOS scale as a follow up, Shah said.
On this point, Breu added that information for this scale can be devised from company data, and in a way investigators are using the NIHSS scale to qualify patients for the study at day 14. Based on advice from the Screening Committee Members panel, the NIHSS scale was not deemed to be the best scale to use; furthermore, regulators requested the use of the GOS scale, he added.
The Glasgow Outcome Scale is very simple and crude, said Dr Salah Keyrouz, the director of the Arkansas SAVES Telestroke Program. A problem with the Glasgow outcome scale is that it does not assess the cognitive status of a patient - approximately 70% of patients will have neuropsychological adverse events following the onset of a stroke, Keyrouz explained. Moreover, the scale does not evaluate a patients' ability to perform simple tasks, such as going to the bathroom independently, he added.
The patients who survive vasospasms have very poor outcomes, said Dr Walter van den Bergh, a neurologist in the department of intensive care at the University Medical Center in Utrecht. Patients who develop this complication are young, with a mean age of about 55 years, and it would be meaningful for these patients if a drug could improve their quality of life, since the quality of life lost to these patients is significant, van den Bergh said.
In one of his papers, Dr Harvey Levine, a professor in the department of psychiatry and behavioral sciences at Baylor College of Medicine in Houston, Texas, noted that although the original GOS has been shown to be related to neuropsychological impairment after severe traumatic brain injury, the scale was designed to assess global outcome in groups of cases rather than to evaluate impairment in individual patients.
He further stated that in order to improve sensitivity of the Extended GOS scale, a brief structured interview that encompasses independence within the home, independence outside the home, employability, social and leisure activities, and interpersonal relationships has been developed by a number of experts.
Actelion has a market cap of CHF 6.4bn (USD 5.79bn).
by Mintoi Chessa-Florea and Klara Czobor
Posting aus dem Actelion-thread vom 24.10.09 auf http://www.cash.ch/community/forum/aktien/schweiz/
Citigroup hat im Kaffeesatz gelesen - aus der FuW von heute:
Actelion (–7,9%) haben nach der Publikation des Neunmonatsberichts am Dienstag übermässig korrigiert, obwohl Resultate und Ausblick durchaus günstig waren. Die Analysten der Citigroup haben dafür eine einleuchtende Erklärung gefunden: Weil Actelion um die Jahreswende gleich zwei wichtige Testresultate von Medikamentenkandidaten (gegen Schlaflosigkeit und gegen Lungenfibrose) bekanntgeben wird, würden viele konservative Anleger, die Titel mit stetiger Kursentwicklung bevorzugen, Actelion jetzt verkaufen, weil die Testresultate, wie immer sie auch ausfallen werden, hohe Kursschwankungen auslösen könnten. Und offenbar fehlt es noch an spekulativeren Investoren, die den Kursrückgang als Kaufgelegenheit ansehen und auf günstige Testresultate setzen. Gut möglich aber, dass diese risikobereiten Anleger bald schon auf die attraktiven Actelion aufmerksam werden.
Citigroup hat im Kaffeesatz gelesen - aus der FuW von heute:
Actelion (–7,9%) haben nach der Publikation des Neunmonatsberichts am Dienstag übermässig korrigiert, obwohl Resultate und Ausblick durchaus günstig waren. Die Analysten der Citigroup haben dafür eine einleuchtende Erklärung gefunden: Weil Actelion um die Jahreswende gleich zwei wichtige Testresultate von Medikamentenkandidaten (gegen Schlaflosigkeit und gegen Lungenfibrose) bekanntgeben wird, würden viele konservative Anleger, die Titel mit stetiger Kursentwicklung bevorzugen, Actelion jetzt verkaufen, weil die Testresultate, wie immer sie auch ausfallen werden, hohe Kursschwankungen auslösen könnten. Und offenbar fehlt es noch an spekulativeren Investoren, die den Kursrückgang als Kaufgelegenheit ansehen und auf günstige Testresultate setzen. Gut möglich aber, dass diese risikobereiten Anleger bald schon auf die attraktiven Actelion aufmerksam werden.
Kleiner Vorgeschmack auf die Almorexant-Daten... Actelion scheint extrem ambitioniert zu sein mit Almorexant und will wohl zeigen, dass es besser wirkt als alle anderen Schlafmittel, mal sehen ob es klappt 
Actelion: almorexant's ongoing clinical trial design against Ambien sets high bar as targeted mechanism of action may hinder efficacy - experts
2009-10-22 Pharmawire
Intelligence Details
Actelion's (PINK:ALIOF) head-to-head study comparing insomnia drug almorexant against Ambien is considered "bold," several experts noted. Almorexant’s more targeted mechanism is promising, but it may be difficult to demonstrate efficacy compared to a well-established agent like Ambien, they said.
Almorexant is an oral orexin receptor antagonist that acts by producing a transient, reversible blockade of the orexin receptors, OX1 and OX2. According to the website clinicaltrials.gov, the agent is currently being studied in a multi-center, randomized, placebo-controlled, active reference, parallel-group, polysomnography trial to evaluate the safety and efficacy of a 16-day oral administration of ACT-078573 in adults with chronic primary insomnia.
Almorexant, Ambien (zolpidem) and placebo are being studied in the three arms of the trial.
It is too early to determine if a targeted agent like almorexant will have an advantage over a more broadly acting agent like Ambien, according to Dr David Neubauer, the associate director of the Johns Hopkins Sleep Disorder Center. Almorexant’s mechanism on the orexin system is greatly different compared to any other agent in primary chronic insomnia, and it is targeted and rather appealing, Neubauer said. At the same time, chronic insomnia is a complex problem involving multiple metabolic and endocrine changes that cannot be traced back to a single pathology, he added.
Almorexant is a very interesting medication, but it is too early to determine whether or not the agent will be successful, Neubauer said. Many of the agents used to treat primary chronic insomnia are me-too drugs, so it is encouraging that there is an agent with a novel mechanism in development, he noted. "The physician community is very excited about the data that has been available so far, but it is too early to determine if the drug works," he added.
While it is known that the orexins are involved in the pathology of primary chronic insomnia, their exact role is unclear, an investigator noted. It is clear that acting on orexins is manipulating a system that is involved in sleep and wakefulness, but the relationship between sleep and orexins is limited, he said. In addition, data on the long-term effect of stimulating the orexin receptors is lacking, he added.
“There is an upside and a downside to specificity,” said Dr Gary Richardson, an expert in sleep disorders at the Henry Ford Hospital in Detroit. Takeda's (TYO:4502) Rozerem (ramelton) is the only agent for insomnia that has a different mechanism of action and is more specific and has less side effects, but there is a trade-off in response, Richardson noted. It is unclear if there is an orexin hyperactive type of insomnia, Richardson noted. Still, he said he believes that Rozerem was a very good agent.
"We are very happy with the results," said a second clinical investigator on the ongoing clinical trial. The investigator noted that not many patients who are treated with almorexant wake up in the middle of the night, and patients do not seem to have headaches in the morning. The investigator agreed, however, that Ambien is a very strong comparator and noted that somewhere around 60-70% of the overall patient population responds to treatment with Ambien. "I think that this is a good drug, and will be a better drug than the benzodiazepines," the investigator said.
"Neurologists who treat insomnia frequently say that the only agent that is more effective than 10mg of Ambien is 20mg of Ambien," Richardson said. It is likely that Ambien is more effective than most agents for sleep disorders because the drug acts on multiple pathways, and the clinical trial design set a really high bar for demonstrating efficacy, Richardson said. "I would suggest that Ambien should not be the efficacy comparator. A drug like Takeda’s Rozerem would be a better comparator for efficacy," he said.
Ambien is a prescription agent that is used for the short-term treatment of insomnia. The drug is a short-acting nonbenzodiazepine hypnotic that works by potentiating gamma-aminobutyric acid (GABA), an inhibitory neurotransmitter. The agent has a short-half life (two to three hours) and it generally works within 15 minutes.
The study design could also set a high bar because the European approval mechanism is more advanced compared to the United States, Richardson suggested. It is unethical to conduct a placebo controlled trial when there are effective drugs on the market for primary chronic insomnia.
Ambien is one of the better agents that could be used to treat sleeping disorders, and patients generally respond to it after a week of treatment, noted Dr Christina Calamaro, an assistant professor at the University of Maryland School of Nursing in the department of family and community health. A targeted mechanism is very promising because the agent will likely lack side effects, Calamaro said. "Primary chronic insomnia" is a blanket term and there is a lack of biomarkers to help find those who will respond to an agent targeting orexins, she added.
Ambien is a very popular agent, and it is effective in helping patients fall asleep more rapidly, Neubauer agreed. He noted that Ambien helps patients fall asleep more rapidly than other agents, so there is value in using it in the experimental arm of the trial.
The trial design is very “bold” in testing almorexant head-to-head with Ambien as well as placebo, the first investigator said, adding that this specific clinical trial design would encourage companies to move away from “me-too drugs.” If Actelion could demonstrate that almorexant has greater efficacy in prolonging sleep duration, then it has the potential to be a “grand slam,” he noted. He added that “sleep maintenance” is a problem with Ambien, and it is the main area where a novel agent could succeed in showing benefit because there is an unmet need for this problem. There is a big concern that many patients feel “hung-over” after being treated with the benzodiazepine class, he noted.
The primary outcome of the trial is studying the change in latency to persistent sleep (LPS) and the change in wake after sleep onset (WASO).
by Klara Czobor

Actelion: almorexant's ongoing clinical trial design against Ambien sets high bar as targeted mechanism of action may hinder efficacy - experts
2009-10-22 Pharmawire
Intelligence Details
Actelion's (PINK:ALIOF) head-to-head study comparing insomnia drug almorexant against Ambien is considered "bold," several experts noted. Almorexant’s more targeted mechanism is promising, but it may be difficult to demonstrate efficacy compared to a well-established agent like Ambien, they said.
Almorexant is an oral orexin receptor antagonist that acts by producing a transient, reversible blockade of the orexin receptors, OX1 and OX2. According to the website clinicaltrials.gov, the agent is currently being studied in a multi-center, randomized, placebo-controlled, active reference, parallel-group, polysomnography trial to evaluate the safety and efficacy of a 16-day oral administration of ACT-078573 in adults with chronic primary insomnia.
Almorexant, Ambien (zolpidem) and placebo are being studied in the three arms of the trial.
It is too early to determine if a targeted agent like almorexant will have an advantage over a more broadly acting agent like Ambien, according to Dr David Neubauer, the associate director of the Johns Hopkins Sleep Disorder Center. Almorexant’s mechanism on the orexin system is greatly different compared to any other agent in primary chronic insomnia, and it is targeted and rather appealing, Neubauer said. At the same time, chronic insomnia is a complex problem involving multiple metabolic and endocrine changes that cannot be traced back to a single pathology, he added.
Almorexant is a very interesting medication, but it is too early to determine whether or not the agent will be successful, Neubauer said. Many of the agents used to treat primary chronic insomnia are me-too drugs, so it is encouraging that there is an agent with a novel mechanism in development, he noted. "The physician community is very excited about the data that has been available so far, but it is too early to determine if the drug works," he added.
While it is known that the orexins are involved in the pathology of primary chronic insomnia, their exact role is unclear, an investigator noted. It is clear that acting on orexins is manipulating a system that is involved in sleep and wakefulness, but the relationship between sleep and orexins is limited, he said. In addition, data on the long-term effect of stimulating the orexin receptors is lacking, he added.
“There is an upside and a downside to specificity,” said Dr Gary Richardson, an expert in sleep disorders at the Henry Ford Hospital in Detroit. Takeda's (TYO:4502) Rozerem (ramelton) is the only agent for insomnia that has a different mechanism of action and is more specific and has less side effects, but there is a trade-off in response, Richardson noted. It is unclear if there is an orexin hyperactive type of insomnia, Richardson noted. Still, he said he believes that Rozerem was a very good agent.
"We are very happy with the results," said a second clinical investigator on the ongoing clinical trial. The investigator noted that not many patients who are treated with almorexant wake up in the middle of the night, and patients do not seem to have headaches in the morning. The investigator agreed, however, that Ambien is a very strong comparator and noted that somewhere around 60-70% of the overall patient population responds to treatment with Ambien. "I think that this is a good drug, and will be a better drug than the benzodiazepines," the investigator said.
"Neurologists who treat insomnia frequently say that the only agent that is more effective than 10mg of Ambien is 20mg of Ambien," Richardson said. It is likely that Ambien is more effective than most agents for sleep disorders because the drug acts on multiple pathways, and the clinical trial design set a really high bar for demonstrating efficacy, Richardson said. "I would suggest that Ambien should not be the efficacy comparator. A drug like Takeda’s Rozerem would be a better comparator for efficacy," he said.
Ambien is a prescription agent that is used for the short-term treatment of insomnia. The drug is a short-acting nonbenzodiazepine hypnotic that works by potentiating gamma-aminobutyric acid (GABA), an inhibitory neurotransmitter. The agent has a short-half life (two to three hours) and it generally works within 15 minutes.
The study design could also set a high bar because the European approval mechanism is more advanced compared to the United States, Richardson suggested. It is unethical to conduct a placebo controlled trial when there are effective drugs on the market for primary chronic insomnia.
Ambien is one of the better agents that could be used to treat sleeping disorders, and patients generally respond to it after a week of treatment, noted Dr Christina Calamaro, an assistant professor at the University of Maryland School of Nursing in the department of family and community health. A targeted mechanism is very promising because the agent will likely lack side effects, Calamaro said. "Primary chronic insomnia" is a blanket term and there is a lack of biomarkers to help find those who will respond to an agent targeting orexins, she added.
Ambien is a very popular agent, and it is effective in helping patients fall asleep more rapidly, Neubauer agreed. He noted that Ambien helps patients fall asleep more rapidly than other agents, so there is value in using it in the experimental arm of the trial.
The trial design is very “bold” in testing almorexant head-to-head with Ambien as well as placebo, the first investigator said, adding that this specific clinical trial design would encourage companies to move away from “me-too drugs.” If Actelion could demonstrate that almorexant has greater efficacy in prolonging sleep duration, then it has the potential to be a “grand slam,” he noted. He added that “sleep maintenance” is a problem with Ambien, and it is the main area where a novel agent could succeed in showing benefit because there is an unmet need for this problem. There is a big concern that many patients feel “hung-over” after being treated with the benzodiazepine class, he noted.
The primary outcome of the trial is studying the change in latency to persistent sleep (LPS) and the change in wake after sleep onset (WASO).
by Klara Czobor
Antwort auf Beitrag Nr.: 38.251.370 von ffdmh am 26.10.09 11:50:25
Super!
Ansonsten denke ich, Actelion und GSK sehen für Almorexant nur dann ein echtes Potential, wenn sie die wirklich relevanten Hürden überspringen können.
Wobei ich hoffe, dass Almorexant eben auch durch ein besseres Nebenwirkungsprofil überzeugen wird (Effektivität muss natürlich trotzdem voll überzeugen). Denn nur weil "jeder zweite" US-Bürger Ambien schmeißt, heißt das ja nicht, dass das Zeug auch nur einigermaßen harmlos wäre...
Dazu mal das Nebenwirkungsprofil von Stilnox, wie Ambien in Deutschland heißt:
Häufige Nebenwirkungen:
Schläfrigkeit, Benommenheit am folgenden Tag, Kopfschmerzen, gedämpfte Emotionen, eingeschränkte Aufmerksamkeit, Verwirrtheit, Schwindel, Magen-Darm-Beschwerden, Durchfall, Übelkeit, Erbrechen, Sehstörungen, Doppelbilder, Hautreaktionen, Gedächtnisverlust.
Gelegentliche Nebenwirkungen:
Müdigkeit, Muskelschwäche, Gangunsicherheit, Bewegungsunsicherheit.
Seltene Nebenwirkungen:
Vermindertes Sexualverlangen.
Besonderheiten:
Zusätzlich können psychische und "paradoxe" Reaktionen auftreten, wie zum Beispiel Unruhe, Aufgeregtheit, Reizbarkeit, Enthemmung, Aggressivität, abnormes Denken, Wahnvorstellungen, Wutausbrüche, Alpträume, Halluzinationen, Psychosen, unangemessenes Verhalten, wesensfremde Extrovertiertheit und andere Verhaltensauffälligkeiten. Als "paradox" werden diese Reaktionen deshalb bezeichnet, weil sie das Gegenteil der erwünschten beruhigenden und schlaffördernden Wirkung sind.
Mit dem Nachlassen der Wirkung kann es zur Schlaflosigkeit mit Begleitreaktionen wie Unruhe, Stimmungswechsel oder Angstzuständen kommen.
Eine bereits vorhandene Depression kann erstmals sichtbar werden oder sich verstärken.
Die Anwendung kann zur Entwicklung einer körperlichen und geistigen Abhängigkeit führen.
Wird spannend werden. Fast schon zu spannend....
Super!
Ansonsten denke ich, Actelion und GSK sehen für Almorexant nur dann ein echtes Potential, wenn sie die wirklich relevanten Hürden überspringen können.
Wobei ich hoffe, dass Almorexant eben auch durch ein besseres Nebenwirkungsprofil überzeugen wird (Effektivität muss natürlich trotzdem voll überzeugen). Denn nur weil "jeder zweite" US-Bürger Ambien schmeißt, heißt das ja nicht, dass das Zeug auch nur einigermaßen harmlos wäre...
Dazu mal das Nebenwirkungsprofil von Stilnox, wie Ambien in Deutschland heißt:
Häufige Nebenwirkungen:
Schläfrigkeit, Benommenheit am folgenden Tag, Kopfschmerzen, gedämpfte Emotionen, eingeschränkte Aufmerksamkeit, Verwirrtheit, Schwindel, Magen-Darm-Beschwerden, Durchfall, Übelkeit, Erbrechen, Sehstörungen, Doppelbilder, Hautreaktionen, Gedächtnisverlust.
Gelegentliche Nebenwirkungen:
Müdigkeit, Muskelschwäche, Gangunsicherheit, Bewegungsunsicherheit.
Seltene Nebenwirkungen:
Vermindertes Sexualverlangen.
Besonderheiten:
Zusätzlich können psychische und "paradoxe" Reaktionen auftreten, wie zum Beispiel Unruhe, Aufgeregtheit, Reizbarkeit, Enthemmung, Aggressivität, abnormes Denken, Wahnvorstellungen, Wutausbrüche, Alpträume, Halluzinationen, Psychosen, unangemessenes Verhalten, wesensfremde Extrovertiertheit und andere Verhaltensauffälligkeiten. Als "paradox" werden diese Reaktionen deshalb bezeichnet, weil sie das Gegenteil der erwünschten beruhigenden und schlaffördernden Wirkung sind.
Mit dem Nachlassen der Wirkung kann es zur Schlaflosigkeit mit Begleitreaktionen wie Unruhe, Stimmungswechsel oder Angstzuständen kommen.
Eine bereits vorhandene Depression kann erstmals sichtbar werden oder sich verstärken.
Die Anwendung kann zur Entwicklung einer körperlichen und geistigen Abhängigkeit führen.
Wird spannend werden. Fast schon zu spannend....
So langsam sickert immer mehr durch von Almorexant. Mittlerweile denke ich, dass die Ergebnisse noch nicht allzu relevant für den Kurs sein werden, sondern vor allem für das weitere Design der zulassungsrelevanten Studien von Bedeutung sind. Was soll genau getestet werden, welche Verbesserungen finden wo statt etc... Sicher wird es auch erstmals in einer grösseren Studie zeigen, wie und ob Almorexant auch genug Wirkung zeigt oder nicht aber davon geht wohl die Mehrheit bislang aus? Stellt sich nur die Frage, obs halt auch besser und verträglicher ist, als die anderen Produkte, die auf dem markt sind:
Actelion: almorexant's mechanism on orexin receptors could improve sleep maintenance, reduce hangover effect seen with other agents - experts
2009-10-26 Pharmawire
Intelligence Details
Actelion's sleep aid almorexant's mechanism targeting orexin receptors is likely to improve sleep maintenance and reduce the hangover effect seen with other agents, several experts interviewed for this article agreed.
However, they noted that the drug will need to improve co-morbid symptoms to capture a greater portion of the market, since there are so many agents available to treat insomnia.
Almorexant is an oral orexin receptor antagonist that acts by producing a transient, reversible blockade of the orexin receptors, OX1 and OX2.
This news service previously reported that the ongoing clinical trial of almorexant sets a high bar by using Ambien as the comparator agent. Dr Gary Richardson, a sleep expert at the Sleep Disorders and Research Center at the Henry Ford Hospital in Detroit, said that for approval, a novel agent will have to shorten the time to fall asleep and also decrease the time that someone spends awake. However, even though it will be challenging for almorexant to improve upon Ambien, all experts interviewed mentioned that in terms of sleep maintenance and next-day effect almorexant has an advantage.
There is evidence from knockout models in mice that targeting the orexin system is involved in sleep maintenance, according to an almorexant clinical investigator based in the United States. He noted that Ambien (zolpidem) – an agent that is associated with sleep maintenance concerns in some patients – has actions on the GABA receptor complex that avoid the orexin system altogether. “When you get off the Gabba receptor complex, you are not faced with the same type of adverse events,” the investigator said.
The investigator said that acting on the orexin receptor complex promotes sleep maintenance. The greatest value in almorexant’s mechanism of action is that it has the ability to produce therapeutic effects without touching the GABA receptors, the investigator said. Acting on the GABA receptors could give rise to impairment in psychomotor functioning, lead to postural instability, as well as affect anterograde memory, he said. However, the investigator declined to comment on whether almorexant significantly improved symptoms of middle of the night awakening compared to Ambien, in light of the upcoming study results.
A second clinical investigator, who is involved in the European arm of the ongoing trial, noted that almorexant decreases middle of the night awakening and improves next-day impairment.
The data shows that orexins play a role in sleep maintenance and even increase Stage III-IV sleep, according to Dr Paul Doghramji, a family physician at Collegeville Family Practice in Pennsylvania. At least 60% of patients have trouble falling asleep, and for insurance company reimbursement purposes sleep maintenance is an important endpoint to improve, Doghramji said.
Still, he added that even though the improvement in sleep maintenance and Stage III-IV sleep is impressive, but the agent will have to improve quality of life parameters to really capture a large portion of the insomnia market. Many patients with primary chronic insomnia are plagued by depression, psychiatric ailments, and a variety of medical problems; it would be useful if almorexant actually improves upon these endpoints, he added.
Doghramji noted that it is now clear that almorexant significantly improves sleep maintenance over placebo, but he questioned whether the drug improves sleep maintenance compared to drugs such as Sepracor's (NASDAQ:SEPR) Lunesta. He noted that Ambien is a good drug, but Lunesta would set the highest bar in terms of showing a benefit in sleep maintenance.
However, Dr Alexandros Vgontzas, the director of the sleep research and treatment center in the department of psychiatry at Penn State College of Medicine in Hershey, disagreed and said that Ambien is a good comparator. He noted that Ambien’s lack of effect on daytime functioning will be able to show if almorexant has an impact on daytime functioning.
Dr Martin Scharf, the director of the Tristate Sleep Disorders Center in Cincinnati, Ohio, who is also an investigator on the ongoing clinical trial, noted that there is an unmet need to treat patients who have middle of the night awakening. Available data suggests that patients with narcolepsy are deficient in orexins, so adding an orexin receptor antagonist may help improve sleep maintenance, Scharf said. He cautioned, however, that there is data lacking to suggest that a patient with insomnia has excess orexins; all that is known so far is that a system that is involved in sleep and wakefulness is being manipulated, he said. He declined to provide further comment on almorexant because the trial is still ongoing.
The goal of therapy with almorexant is to determine if the drug can improve sleep quality, leave a patient feeling rested the next day without a hangover, and be safe without impairing cognition, noted Dr Christina Calamaro, an assistant professor at the University of Maryland School of Nursing's department of family and community health. If almorexant can be even more specific in mechanism of action to the parts of the brain that control sleep, then it could avoid the side effects of Ambien, Calamaro noted.
Improving Co-Morbid Behaviors
Doghramji said that for approval, Actelion will have to demonstrate that almorexant improves some parameters of sleep such as next-day function, and the time that it takes patients to get to sleep. He noted however that the insomnia market is crowded with agents, and that Actelion will have to show an improvement in the co-morbid disorders associated with insomnia – such as depression and anxiety – to capture a greater market share.
Dr David Neubauer, associate director of the Johns Hopkins Sleep Disorders Center, said the available research data regarding almorexant is preliminary, but he does not believe the medication would lead to daytime cognitive impairment. Still, he said it will be more challenging to show that the drug significantly improves daytime functioning. While there are concrete numbers available to demonstrate improvement on sleep, he said it is difficult to select the correct parameter of daytime functioning to measure.
Richardson also agreed that in addition to decreasing the time it takes to fall asleep and the number of times patients wake up in the middle of the night, the drug will have to improve other co-morbidities of sleeping disorders. Shortening the time it takes for a patient to fall asleep is not the only measure that needs to be improved, he added.
The primary outcome measure of the ongoing clinical trial measured the change in latency to persistent sleep (LPS) and the change in wake after sleep onset (WASO).
by Klara Czobor
Actelion: almorexant's mechanism on orexin receptors could improve sleep maintenance, reduce hangover effect seen with other agents - experts
2009-10-26 Pharmawire
Intelligence Details
Actelion's sleep aid almorexant's mechanism targeting orexin receptors is likely to improve sleep maintenance and reduce the hangover effect seen with other agents, several experts interviewed for this article agreed.
However, they noted that the drug will need to improve co-morbid symptoms to capture a greater portion of the market, since there are so many agents available to treat insomnia.
Almorexant is an oral orexin receptor antagonist that acts by producing a transient, reversible blockade of the orexin receptors, OX1 and OX2.
This news service previously reported that the ongoing clinical trial of almorexant sets a high bar by using Ambien as the comparator agent. Dr Gary Richardson, a sleep expert at the Sleep Disorders and Research Center at the Henry Ford Hospital in Detroit, said that for approval, a novel agent will have to shorten the time to fall asleep and also decrease the time that someone spends awake. However, even though it will be challenging for almorexant to improve upon Ambien, all experts interviewed mentioned that in terms of sleep maintenance and next-day effect almorexant has an advantage.
There is evidence from knockout models in mice that targeting the orexin system is involved in sleep maintenance, according to an almorexant clinical investigator based in the United States. He noted that Ambien (zolpidem) – an agent that is associated with sleep maintenance concerns in some patients – has actions on the GABA receptor complex that avoid the orexin system altogether. “When you get off the Gabba receptor complex, you are not faced with the same type of adverse events,” the investigator said.
The investigator said that acting on the orexin receptor complex promotes sleep maintenance. The greatest value in almorexant’s mechanism of action is that it has the ability to produce therapeutic effects without touching the GABA receptors, the investigator said. Acting on the GABA receptors could give rise to impairment in psychomotor functioning, lead to postural instability, as well as affect anterograde memory, he said. However, the investigator declined to comment on whether almorexant significantly improved symptoms of middle of the night awakening compared to Ambien, in light of the upcoming study results.
A second clinical investigator, who is involved in the European arm of the ongoing trial, noted that almorexant decreases middle of the night awakening and improves next-day impairment.
The data shows that orexins play a role in sleep maintenance and even increase Stage III-IV sleep, according to Dr Paul Doghramji, a family physician at Collegeville Family Practice in Pennsylvania. At least 60% of patients have trouble falling asleep, and for insurance company reimbursement purposes sleep maintenance is an important endpoint to improve, Doghramji said.
Still, he added that even though the improvement in sleep maintenance and Stage III-IV sleep is impressive, but the agent will have to improve quality of life parameters to really capture a large portion of the insomnia market. Many patients with primary chronic insomnia are plagued by depression, psychiatric ailments, and a variety of medical problems; it would be useful if almorexant actually improves upon these endpoints, he added.
Doghramji noted that it is now clear that almorexant significantly improves sleep maintenance over placebo, but he questioned whether the drug improves sleep maintenance compared to drugs such as Sepracor's (NASDAQ:SEPR) Lunesta. He noted that Ambien is a good drug, but Lunesta would set the highest bar in terms of showing a benefit in sleep maintenance.
However, Dr Alexandros Vgontzas, the director of the sleep research and treatment center in the department of psychiatry at Penn State College of Medicine in Hershey, disagreed and said that Ambien is a good comparator. He noted that Ambien’s lack of effect on daytime functioning will be able to show if almorexant has an impact on daytime functioning.
Dr Martin Scharf, the director of the Tristate Sleep Disorders Center in Cincinnati, Ohio, who is also an investigator on the ongoing clinical trial, noted that there is an unmet need to treat patients who have middle of the night awakening. Available data suggests that patients with narcolepsy are deficient in orexins, so adding an orexin receptor antagonist may help improve sleep maintenance, Scharf said. He cautioned, however, that there is data lacking to suggest that a patient with insomnia has excess orexins; all that is known so far is that a system that is involved in sleep and wakefulness is being manipulated, he said. He declined to provide further comment on almorexant because the trial is still ongoing.
The goal of therapy with almorexant is to determine if the drug can improve sleep quality, leave a patient feeling rested the next day without a hangover, and be safe without impairing cognition, noted Dr Christina Calamaro, an assistant professor at the University of Maryland School of Nursing's department of family and community health. If almorexant can be even more specific in mechanism of action to the parts of the brain that control sleep, then it could avoid the side effects of Ambien, Calamaro noted.
Improving Co-Morbid Behaviors
Doghramji said that for approval, Actelion will have to demonstrate that almorexant improves some parameters of sleep such as next-day function, and the time that it takes patients to get to sleep. He noted however that the insomnia market is crowded with agents, and that Actelion will have to show an improvement in the co-morbid disorders associated with insomnia – such as depression and anxiety – to capture a greater market share.
Dr David Neubauer, associate director of the Johns Hopkins Sleep Disorders Center, said the available research data regarding almorexant is preliminary, but he does not believe the medication would lead to daytime cognitive impairment. Still, he said it will be more challenging to show that the drug significantly improves daytime functioning. While there are concrete numbers available to demonstrate improvement on sleep, he said it is difficult to select the correct parameter of daytime functioning to measure.
Richardson also agreed that in addition to decreasing the time it takes to fall asleep and the number of times patients wake up in the middle of the night, the drug will have to improve other co-morbidities of sleeping disorders. Shortening the time it takes for a patient to fall asleep is not the only measure that needs to be improved, he added.
The primary outcome measure of the ongoing clinical trial measured the change in latency to persistent sleep (LPS) and the change in wake after sleep onset (WASO).
by Klara Czobor
Antwort auf Beitrag Nr.: 38.269.656 von ffdmh am 28.10.09 13:04:35
Hi ffdmh,
mit der Zulassungsrelevanz der lfd. Almo-Studie komme ich gerade nicht mehr richtig klar. Ich bin bisher davon ausgegangen, dass die Studie nicht zulassungsrelevant ist. Vielmehr soll (auch) auf dieser Datenbasis ein SPA mit der FDA verhandelt werden. Auf das SPA werden dann die "richtigen" Studien aufgesetzt.
Nun hatten wir im Q3-Bericht folgenden Satz:
RESTORA 1 is a pivotal study designed to evaluate safety and efficacy of almorexant in patients diagnosed with primary insomnia.
In der deutschen PM wurde "pivotal" dann als zulassungsrelevant übersetzt.
RESTORA-1 ist eine zulassungsrelevante Studie, deren Design darauf ausgelegt ist, die Sicherheit und Wirksamkeit von Almorexant bei Patienten mit primärer Insomnie zu evaluieren.
Ja, was denn nun?
Ansonsten ist auch das aus Deinem letzten Artikel interessant:
that the insomnia market is crowded with agents, and that Actelion will have to show an improvement in the co-morbid disorders associated with insomnia – such as depression and anxiety – to capture a greater market share.
Da hoffe ich ja (oder spinne mir das zurecht), dass im Zulassungsfall der Umstand für Almorexant gute Stimmung machen könnte, dass ein Orexin-Rezeptor-Antagonist ja grundsätzlich auch appetitzügelnd wirken könnte und dass kürzlich auch eine Alzheimer-vorbeugende Wirkung behauptet worden ist. Medizinisch ist beides wahrscheinlich mehr als fragwürdig, aber wenn ich als Patient schon entscheiden muss, dann nehme ich den Wirkstoff, der möglichst wenig Nebenwirkungen hat und wenn die dann teilweise auch noch positiv sein könnten, um so besser.
(Die letzten Sätze sollten nicht allzu ernst genommen werden, sind aber vielleicht auch nicht ganz absurd.)
Hi ffdmh,
mit der Zulassungsrelevanz der lfd. Almo-Studie komme ich gerade nicht mehr richtig klar. Ich bin bisher davon ausgegangen, dass die Studie nicht zulassungsrelevant ist. Vielmehr soll (auch) auf dieser Datenbasis ein SPA mit der FDA verhandelt werden. Auf das SPA werden dann die "richtigen" Studien aufgesetzt.
Nun hatten wir im Q3-Bericht folgenden Satz:
RESTORA 1 is a pivotal study designed to evaluate safety and efficacy of almorexant in patients diagnosed with primary insomnia.
In der deutschen PM wurde "pivotal" dann als zulassungsrelevant übersetzt.
RESTORA-1 ist eine zulassungsrelevante Studie, deren Design darauf ausgelegt ist, die Sicherheit und Wirksamkeit von Almorexant bei Patienten mit primärer Insomnie zu evaluieren.
Ja, was denn nun?
Ansonsten ist auch das aus Deinem letzten Artikel interessant:
that the insomnia market is crowded with agents, and that Actelion will have to show an improvement in the co-morbid disorders associated with insomnia – such as depression and anxiety – to capture a greater market share.
Da hoffe ich ja (oder spinne mir das zurecht), dass im Zulassungsfall der Umstand für Almorexant gute Stimmung machen könnte, dass ein Orexin-Rezeptor-Antagonist ja grundsätzlich auch appetitzügelnd wirken könnte und dass kürzlich auch eine Alzheimer-vorbeugende Wirkung behauptet worden ist. Medizinisch ist beides wahrscheinlich mehr als fragwürdig, aber wenn ich als Patient schon entscheiden muss, dann nehme ich den Wirkstoff, der möglichst wenig Nebenwirkungen hat und wenn die dann teilweise auch noch positiv sein könnten, um so besser.

(Die letzten Sätze sollten nicht allzu ernst genommen werden, sind aber vielleicht auch nicht ganz absurd.)
Ich verstehs auch nicht ganz... Prinzipiell bin ich mir eigentlich sicher, dass die aktuelle Studie NICHT zulassungsrelevant ist, da Actelion ja gerade mit der FDA noch in Verhandlungen steht bzgl. des Designs für weitere Phase-III Studien um ein SPA zu erhalten.
Zulassungsrelevant halt in dem Sinn, dass wohl auf Basis dieser Daten die weiteren Schritte gemacht werden.
Bzgl Alzheimer: Da könnte schon was dran, bzw. ist wohl auch was dran. Nur müsste man dafür wohl extra weitere Studien vorantreiben. Einfach einen Alzheimer-Arm in die Studien einbauen wird wohl nicht reichen.
Soweit ich das gelesen habe ist bei Alzheimer die Frage in etwa wie die mit dem Huhn und dem Ei. Wer war zuerst da?
--> Schlafprobleme führen zu Alzheimer oder Alzheimer führt zu Schlafproblemen.
Für die aktuelle Zulassung, bzw. das Design der Studie wird eine Alzheimeranwendung wohl (noch) keine Rolle spielen, es ist aber wohl gut möglich, dass in Zukunft in diese Richtung weitergeforscht wird.
Am wichtigsten für die Zulassung sind wohl die Nebenwirkungen, bzw. halt auch die tatsächliche Wirkung. Stellt sich halt die Frage, obs für die Zulassung stärker wirken muss als die Konkurrenzprodukte oder ob ein besseres Nebenwirkungsprofil ausreicht. (Wirken tuts ja, wie die Vergleiche mit Placebo ja zeigen).
Wenn Almorexant aber wirklich auf einen Umsatz von >5Mrd kommen will, muss es aber wohl definitiv auch eine klar bessere Wirkung als die Konkurrenz aufweisen.
Von daher sind die in Kürze zu erwartenden Daten so oder so sehr spannend. Ob positive Daten auch wirklich kurstreibend wirken werden, muss sich aber auch erst zeigen. Für viele ist das wohl nach wie vor zu unsicher und zu langfristig.
Zulassungsrelevant halt in dem Sinn, dass wohl auf Basis dieser Daten die weiteren Schritte gemacht werden.
Bzgl Alzheimer: Da könnte schon was dran, bzw. ist wohl auch was dran. Nur müsste man dafür wohl extra weitere Studien vorantreiben. Einfach einen Alzheimer-Arm in die Studien einbauen wird wohl nicht reichen.
Soweit ich das gelesen habe ist bei Alzheimer die Frage in etwa wie die mit dem Huhn und dem Ei. Wer war zuerst da?
--> Schlafprobleme führen zu Alzheimer oder Alzheimer führt zu Schlafproblemen.
Für die aktuelle Zulassung, bzw. das Design der Studie wird eine Alzheimeranwendung wohl (noch) keine Rolle spielen, es ist aber wohl gut möglich, dass in Zukunft in diese Richtung weitergeforscht wird.
Am wichtigsten für die Zulassung sind wohl die Nebenwirkungen, bzw. halt auch die tatsächliche Wirkung. Stellt sich halt die Frage, obs für die Zulassung stärker wirken muss als die Konkurrenzprodukte oder ob ein besseres Nebenwirkungsprofil ausreicht. (Wirken tuts ja, wie die Vergleiche mit Placebo ja zeigen).
Wenn Almorexant aber wirklich auf einen Umsatz von >5Mrd kommen will, muss es aber wohl definitiv auch eine klar bessere Wirkung als die Konkurrenz aufweisen.
Von daher sind die in Kürze zu erwartenden Daten so oder so sehr spannend. Ob positive Daten auch wirklich kurstreibend wirken werden, muss sich aber auch erst zeigen. Für viele ist das wohl nach wie vor zu unsicher und zu langfristig.
neues aus dem Schlafmittelbereich:
Transcept Pharmaceuticals Receives Complete Response Letter from FDA on Intermezzo(R) New Drug Application
29 Oct 2009
Transcept Pharmaceuticals announced that the U.S. Food and Drug Administration (FDA) issued a Complete Response Letter regarding the New Drug Application (NDA) for Intermezzo(R) (zolpidem tartrate sublingual tablet)
RICHMOND, CA, USA | October 29, 2009 | Transcept Pharmaceuticals (Nasdaq: TSPT) announced today that the U.S. Food and Drug Administration (FDA) issued a Complete Response Letter regarding the New Drug Application (NDA) for Intermezzo(R) (zolpidem tartrate sublingual tablet). The NDA, submitted by Transcept in September 2008, seeks approval to market Intermezzo(R) for use as-needed for the treatment of insomnia when a middle of the night awakening is followed by difficulty returning to sleep.
In the Complete Response Letter the FDA stated that it believes Transcept has submitted substantial evidence of effectiveness for the use of Intermezzo(R) in the as-needed treatment of insomnia characterized by difficulty returning to sleep after awakening in the middle of the night. The FDA further recognized that the Intermezzo(R) data submitted by Transcept did not indicate significant next day residual effects. However, the FDA indicated that the intended use of Intermezzo(R) in the middle of the night represents a unique insomnia indication and dosing strategy for which safety has not been previously established.
The FDA requested additional data demonstrating that Intermezzo(R), when taken as directed in the middle of the night, would not present an unacceptable risk of residual effects, with particular reference to next day driving ability.
The FDA also expressed two concerns regarding the possibility of patient dosing errors in the middle of the night that could lead to next day residual effects. Specifically, the FDA has asked Transcept to address methods to avoid inadvertent dosing with less than four hours of bedtime remaining, and inadvertent re-dosing in a single night.
Based upon the content of the letter, it is possible that Transcept will need to conduct one or more additional safety studies. Transcept will request a meeting with the FDA to discuss specific requirements for approval.
Glenn A. Oclassen, President and Chief Executive Officer of Transcept, commented, "Transcept is committed to making this important new potential therapy available to insomnia patients. We will continue to work closely with the FDA to address their questions and define the path forward for Intermezzo(R)."
About Intermezzo(R)
Intermezzo(R) (zolpidem tartrate sublingual tablet), the lead product candidate at Transcept, has the potential to be the first prescription sleep aid specifically approved for use in the middle of the night at the time a patient awakens and has difficulty returning to sleep. Intermezzo(R) is a sublingual low dose formulation of zolpidem, the active agent most commonly prescribed in the United States for the treatment of insomnia. Intermezzo(R) uses approximately one-quarter to one-third of the dose of active drug contained in currently marketed zolpidem-based sleep aids, in a formulation designed to promote rapid sublingual absorption.
Two Phase 3 clinical studies evaluated 376 patients receiving either Intermezzo(R) or placebo. In the first study, a sleep laboratory trial using an objective polysomnographic endpoint, Intermezzo(R) demonstrated a statistically significant decrease versus placebo in the time it took patients to return to sleep as measured by Latency to Persistent Sleep. In the second study, an outpatient trial, Intermezzo(R) demonstrated a statistically significant decrease in Latency to Sleep Onset, a subjective patient reported endpoint. The most common adverse event seen in these trials was headache (2.7 percent active versus 1.4 percent placebo in the outpatient study).
Transcept is actively pursuing patents to protect Intermezzo(R) in the United States and key non-U.S. markets, and, as part of the NDA submission, has requested that the FDA grant three years of Hatch-Waxman marketing exclusivity to Intermezzo(R).
About Transcept
Transcept Pharmaceuticals, Inc. is a specialty pharmaceutical company focused on the development and commercialization of proprietary products that address important therapeutic needs in neuroscience. The most advanced Transcept product candidate is Intermezzo(R) (zolpidem tartrate sublingual tablet), which is currently being reviewed by the U.S. Food and Drug Administration (FDA) as a prescription sleep aid for use in the middle of the night at the time a patient awakens and has difficulty returning to sleep. Transcept and Purdue Pharmaceutical Products, L.P. have entered into a collaboration agreement for the development and commercialization of Intermezzo(R) in the United States. For further information, please visit the company's website at: www.transcept.com.
SOURCE: Transcept Pharmaceuticals, Inc.

Das war wohl nix, wie man am Kurs von TRANSCEPT PHARMACEUTICALS sehen kann.
Umso besser, wenn Almorexant positive Ergebnisse bringt.

Transcept Pharmaceuticals Receives Complete Response Letter from FDA on Intermezzo(R) New Drug Application
29 Oct 2009
Transcept Pharmaceuticals announced that the U.S. Food and Drug Administration (FDA) issued a Complete Response Letter regarding the New Drug Application (NDA) for Intermezzo(R) (zolpidem tartrate sublingual tablet)
RICHMOND, CA, USA | October 29, 2009 | Transcept Pharmaceuticals (Nasdaq: TSPT) announced today that the U.S. Food and Drug Administration (FDA) issued a Complete Response Letter regarding the New Drug Application (NDA) for Intermezzo(R) (zolpidem tartrate sublingual tablet). The NDA, submitted by Transcept in September 2008, seeks approval to market Intermezzo(R) for use as-needed for the treatment of insomnia when a middle of the night awakening is followed by difficulty returning to sleep.
In the Complete Response Letter the FDA stated that it believes Transcept has submitted substantial evidence of effectiveness for the use of Intermezzo(R) in the as-needed treatment of insomnia characterized by difficulty returning to sleep after awakening in the middle of the night. The FDA further recognized that the Intermezzo(R) data submitted by Transcept did not indicate significant next day residual effects. However, the FDA indicated that the intended use of Intermezzo(R) in the middle of the night represents a unique insomnia indication and dosing strategy for which safety has not been previously established.
The FDA requested additional data demonstrating that Intermezzo(R), when taken as directed in the middle of the night, would not present an unacceptable risk of residual effects, with particular reference to next day driving ability.
The FDA also expressed two concerns regarding the possibility of patient dosing errors in the middle of the night that could lead to next day residual effects. Specifically, the FDA has asked Transcept to address methods to avoid inadvertent dosing with less than four hours of bedtime remaining, and inadvertent re-dosing in a single night.
Based upon the content of the letter, it is possible that Transcept will need to conduct one or more additional safety studies. Transcept will request a meeting with the FDA to discuss specific requirements for approval.
Glenn A. Oclassen, President and Chief Executive Officer of Transcept, commented, "Transcept is committed to making this important new potential therapy available to insomnia patients. We will continue to work closely with the FDA to address their questions and define the path forward for Intermezzo(R)."
About Intermezzo(R)
Intermezzo(R) (zolpidem tartrate sublingual tablet), the lead product candidate at Transcept, has the potential to be the first prescription sleep aid specifically approved for use in the middle of the night at the time a patient awakens and has difficulty returning to sleep. Intermezzo(R) is a sublingual low dose formulation of zolpidem, the active agent most commonly prescribed in the United States for the treatment of insomnia. Intermezzo(R) uses approximately one-quarter to one-third of the dose of active drug contained in currently marketed zolpidem-based sleep aids, in a formulation designed to promote rapid sublingual absorption.
Two Phase 3 clinical studies evaluated 376 patients receiving either Intermezzo(R) or placebo. In the first study, a sleep laboratory trial using an objective polysomnographic endpoint, Intermezzo(R) demonstrated a statistically significant decrease versus placebo in the time it took patients to return to sleep as measured by Latency to Persistent Sleep. In the second study, an outpatient trial, Intermezzo(R) demonstrated a statistically significant decrease in Latency to Sleep Onset, a subjective patient reported endpoint. The most common adverse event seen in these trials was headache (2.7 percent active versus 1.4 percent placebo in the outpatient study).
Transcept is actively pursuing patents to protect Intermezzo(R) in the United States and key non-U.S. markets, and, as part of the NDA submission, has requested that the FDA grant three years of Hatch-Waxman marketing exclusivity to Intermezzo(R).
About Transcept
Transcept Pharmaceuticals, Inc. is a specialty pharmaceutical company focused on the development and commercialization of proprietary products that address important therapeutic needs in neuroscience. The most advanced Transcept product candidate is Intermezzo(R) (zolpidem tartrate sublingual tablet), which is currently being reviewed by the U.S. Food and Drug Administration (FDA) as a prescription sleep aid for use in the middle of the night at the time a patient awakens and has difficulty returning to sleep. Transcept and Purdue Pharmaceutical Products, L.P. have entered into a collaboration agreement for the development and commercialization of Intermezzo(R) in the United States. For further information, please visit the company's website at: www.transcept.com.
SOURCE: Transcept Pharmaceuticals, Inc.
Das war wohl nix, wie man am Kurs von TRANSCEPT PHARMACEUTICALS sehen kann.
Umso besser, wenn Almorexant positive Ergebnisse bringt.

Wunder über Wunder...
London - Die UBS hat Actelion nach Quartalszahlen von "Sell" auf "Neutral" hochgestuft und das Kursziel auf 57,00 Franken belassen. Wenngleich die Umsätze mit dem Medikament Tracleer im dritten Quartal enttäuscht hätten, seien die Perspektiven für die Preisentwicklung gut, schrieb Analyst Martin Wales in einer Studie vom Montag. Steigende Preise für das Mittel gegen Lungenbluthochdruck dürften die schwache Absatzentwicklung kompensieren. Wichtig seien nun die Phase-III-Testergebnisse für Almorexant - einem Mittel gegen Schlafstörungen - die trotz der Sicherheitsbedenken keine allzu negative Kursreaktion hervorrufen dürften.
----------------
Für November hoffe ich zunächst mal auf eine positive Entscheidung von Roche und Actelion bzgl. S1P1 bei Psoriasis.
London - Die UBS hat Actelion nach Quartalszahlen von "Sell" auf "Neutral" hochgestuft und das Kursziel auf 57,00 Franken belassen. Wenngleich die Umsätze mit dem Medikament Tracleer im dritten Quartal enttäuscht hätten, seien die Perspektiven für die Preisentwicklung gut, schrieb Analyst Martin Wales in einer Studie vom Montag. Steigende Preise für das Mittel gegen Lungenbluthochdruck dürften die schwache Absatzentwicklung kompensieren. Wichtig seien nun die Phase-III-Testergebnisse für Almorexant - einem Mittel gegen Schlafstörungen - die trotz der Sicherheitsbedenken keine allzu negative Kursreaktion hervorrufen dürften.
----------------
Für November hoffe ich zunächst mal auf eine positive Entscheidung von Roche und Actelion bzgl. S1P1 bei Psoriasis.
06.11.2009 16:01
Morgan Stanley hebt Actelion auf 'Equal-weight' - Ziel 54 Franken
Morgan Stanley hat Actelion von "Underweight? auf "Equal-weight" heraufgestuft und das Kursziel von 47,00 auf 54,00 Franken angehoben. Nachdem der Aktienkurs des Pharmaunternehmens nach den Quartalszahlen um mehr als 10 Prozent gefallen sei, habe sich das Chance-/Risiko-Verhältnis deutlich verbessert, schrieb Analyst Karl Bradshaw in einer Studie vom Freitag. Allerdings bestünden weiterhin Sorgen um die Ergebnisse der klinischen Studie Build-3 für das Medikament Tracleer.
AFA0082 2009-11-06/16:00
© 2009 APA-dpa-AFX-Analyser
---------------
Vergesst Tracleer bei IPF doch einfach! Ist eh nicht im Kurs drin. Falls da doch was positives rauskommen sollte - was eh fast keiner glaubt - dann rauscht der Kurs nach oben. Fein. Wenn das Ding scheitert, wovon ja eh "alle" ausgehen, sollte dagegen fast gar nichts passieren imho.
Morgan Stanley hebt Actelion auf 'Equal-weight' - Ziel 54 Franken
Morgan Stanley hat Actelion von "Underweight? auf "Equal-weight" heraufgestuft und das Kursziel von 47,00 auf 54,00 Franken angehoben. Nachdem der Aktienkurs des Pharmaunternehmens nach den Quartalszahlen um mehr als 10 Prozent gefallen sei, habe sich das Chance-/Risiko-Verhältnis deutlich verbessert, schrieb Analyst Karl Bradshaw in einer Studie vom Freitag. Allerdings bestünden weiterhin Sorgen um die Ergebnisse der klinischen Studie Build-3 für das Medikament Tracleer.
AFA0082 2009-11-06/16:00
© 2009 APA-dpa-AFX-Analyser
---------------
Vergesst Tracleer bei IPF doch einfach! Ist eh nicht im Kurs drin. Falls da doch was positives rauskommen sollte - was eh fast keiner glaubt - dann rauscht der Kurs nach oben. Fein. Wenn das Ding scheitert, wovon ja eh "alle" ausgehen, sollte dagegen fast gar nichts passieren imho.
16.11.2009 11:02
JPMorgan hebt Actelion-Ziel von 69 auf 73 Franken - 'Overweight'
JPMorgan hat das Kursziel für Actelion von 69,00 auf 73,00 Schweizer Franken angehoben und die Einstufung auf "Overweight" belassen. Der weiterhin erhebliche Bewertungsaufschlag der mittelgroßen Pharmatitel im Vergleich zu den Large Caps gehe auf deutlich höhere mittelfristige Wachstumsaussichten zurück, schrieb Analystin Alexandra Hauber in einer Branchenstudie vom Montag. Kurstreiber dürften aber weiterhin die individuellen Unternehmensnachrichten sein. Sie passte ihre Kursziele auf die Prognosen mit Basis Dezember 2010 an. Aufgrund des hohen Aufwärtspotenzials und der signifikanten kurzfristigen Katalysatoren bleibe die Aktie von Actelion neben Ipsen ihre bevorzugte Wahl.
AFA0016 2009-11-16/11:02
-----------------
Statt weiterer eher nichts sagender Analystenkommentare würde ich hier gern mal die Meldung einstellen, dass S1P1 in der Indikation Psoriasis in die P II b geht. Hey, Actelion/Roche, könnt ihr da vielleicht noch im November mal den Finger ziehen?!
JPMorgan hebt Actelion-Ziel von 69 auf 73 Franken - 'Overweight'
JPMorgan hat das Kursziel für Actelion von 69,00 auf 73,00 Schweizer Franken angehoben und die Einstufung auf "Overweight" belassen. Der weiterhin erhebliche Bewertungsaufschlag der mittelgroßen Pharmatitel im Vergleich zu den Large Caps gehe auf deutlich höhere mittelfristige Wachstumsaussichten zurück, schrieb Analystin Alexandra Hauber in einer Branchenstudie vom Montag. Kurstreiber dürften aber weiterhin die individuellen Unternehmensnachrichten sein. Sie passte ihre Kursziele auf die Prognosen mit Basis Dezember 2010 an. Aufgrund des hohen Aufwärtspotenzials und der signifikanten kurzfristigen Katalysatoren bleibe die Aktie von Actelion neben Ipsen ihre bevorzugte Wahl.
AFA0016 2009-11-16/11:02
-----------------
Statt weiterer eher nichts sagender Analystenkommentare würde ich hier gern mal die Meldung einstellen, dass S1P1 in der Indikation Psoriasis in die P II b geht. Hey, Actelion/Roche, könnt ihr da vielleicht noch im November mal den Finger ziehen?!

Und ich warte jeden Tag sehnlichst auf die Almorexant-Ergebnisse.
Der November bzw. Dezember wird sehr spannend!
Der November bzw. Dezember wird sehr spannend!
Mal sehen, ob da in 10 Jahren ein IND draus wird... 

Neues Konsortium ebnet den Weg für verbesserte Behandlung von Hypertonie und damit in Zusammenhang stehende Gefässkomplikationen
17.11.2009 09:22:02 - Das Top Institute Pharma (TI Pharma) hat zusammen mit Actelion Pharmaceuticals Ltd, dem Erasmus Medical Centre und der Universität von Maastricht ein Konsortium zur genaueren Bestimmung von neuen Heilmitteln zur Behandlung von Hypertonie (Bluthochdruck) und damit in Zusammenhang stehenden Gefässkomplikationen wie Herz- und Nierenversagen, Herzinfarkt und Schlaganfall gebildet. Basierend auf einem neuen Wirkungsmechanismus könnten neue Medikamente entwickelt werden, die das Potenzial zur Verhinderung von Gefässkomplikationen bei Patienten mit Hypertonie haben. Dies ist eine Möglichkeit, um die Lebensqualität von über eine Milliarde Menschen auf der ganzen Welt zu verbessern. Diese Zusammenarbeit, bei der 3,4 Millionen Euro, 9 neue Forschungsstellen und einzigartige Stoffe eingesetzt werden und bei welcher der Wissenstransfer eine wichtige Rolle spielt, ist auf 3 Jahre angelegt.
Jan Danser, Professor der Pharmakologie am Erasmus MC erklärte: "Idealerweise wirken neue Arzneimittel für diesen Bereich nicht nur blutdrucksenkend, sondern schützen auch die Organe. Unser Projekt wird die Folgen des Blockierens der biologischen Wege in Zellen und Organen, die zur Hypertonie führen, studieren. Damit wird das Projekt den Weg dafür ebnen, neue Möglichkeiten zur besseren Behandlung von Hypertonie und damit in Zusammenhang stehende Gefässkomplikationen zu entwickeln." Zusätzlich wird sich das Projekt auf neue Methoden für die Behandlung von Fibrose und pulmonaler Hypertonie konzentrieren, mit besonderem Fokus auf die Erkrankung von Kindern.
Hypertonie bzw. Bluthochdruck ist ein Hauptrisikofaktor für koronare Herzkrankheit, Niereninsuffizienz, pulmonale Fibrose und Schlaganfall. Hypertonie führt oftmals zu Gefässkomplikationen und Endorganschäden. Wichtige Organe wie das Herz, die Nieren, die Lungen, das Gehirn und die Augen, welche durch das Kreislaufsystem versorgt werden, werden besonders durch Blutdruckfluktuationen beeinflusst. Die Zahl der Personen, die weltweit an Bluthochdruck leiden steigt: Zurzeit sind 1 Milliarde Menschen davon betroffen, doch man rechnet damit, dass im Jahr 2025 die Zahl bei mehr als 1,5 Milliarden liegen wird. Trotz der Häufigkeit der Krankheit, die oftmals eine grosse Bürde darstellt, sind verfügbare Behandlungen oftmals bei weitem nicht ausreichend. So gibt es für Kinder, die unter Hypertonie leiden, bisher keine adäquate Behandlung.
Die Forschungen werden von der Niederländischen Herzstiftung unterstützt. Hans Stem, der Leiter der Niederländischen Herzstiftung erklärte: "Hyptertonie ist ein Hauptrisikofaktor for kardiovaskuläre Erkrankungen wie Herzinfarkt, Herzversagen und Schlaganfall. Leider wirken blutdrucksenkende Mittel in vielen Fällen nicht richtig. So wurde beispielsweise in einer im Auftrag der Niederländischen Herzstiftung durchgeführten Studie herausgefunden, dass 25 % der Patienten keine positive Wirkung durch die Behandlung mit ACE-Hemmern verzeichnen konnten. Eine effektive Behandlung gegen Hypertonie ist von höchster Wichtigkeit in unserem Kampf gegen kardiovaskuläre Erkrankungen. Die Niederländische Herzstiftung freut sich sehr über dieses neue Konsortium und ihre Bestrebungen, neue und effektivere Therapien gegen Hypertonie zu entwickeln.
Rückfragehinweis:
Für weiterführende Informationen kontaktieren Sie bitte Ingeborg van
der Heijden: +31-71-3322036


Neues Konsortium ebnet den Weg für verbesserte Behandlung von Hypertonie und damit in Zusammenhang stehende Gefässkomplikationen
17.11.2009 09:22:02 - Das Top Institute Pharma (TI Pharma) hat zusammen mit Actelion Pharmaceuticals Ltd, dem Erasmus Medical Centre und der Universität von Maastricht ein Konsortium zur genaueren Bestimmung von neuen Heilmitteln zur Behandlung von Hypertonie (Bluthochdruck) und damit in Zusammenhang stehenden Gefässkomplikationen wie Herz- und Nierenversagen, Herzinfarkt und Schlaganfall gebildet. Basierend auf einem neuen Wirkungsmechanismus könnten neue Medikamente entwickelt werden, die das Potenzial zur Verhinderung von Gefässkomplikationen bei Patienten mit Hypertonie haben. Dies ist eine Möglichkeit, um die Lebensqualität von über eine Milliarde Menschen auf der ganzen Welt zu verbessern. Diese Zusammenarbeit, bei der 3,4 Millionen Euro, 9 neue Forschungsstellen und einzigartige Stoffe eingesetzt werden und bei welcher der Wissenstransfer eine wichtige Rolle spielt, ist auf 3 Jahre angelegt.
Jan Danser, Professor der Pharmakologie am Erasmus MC erklärte: "Idealerweise wirken neue Arzneimittel für diesen Bereich nicht nur blutdrucksenkend, sondern schützen auch die Organe. Unser Projekt wird die Folgen des Blockierens der biologischen Wege in Zellen und Organen, die zur Hypertonie führen, studieren. Damit wird das Projekt den Weg dafür ebnen, neue Möglichkeiten zur besseren Behandlung von Hypertonie und damit in Zusammenhang stehende Gefässkomplikationen zu entwickeln." Zusätzlich wird sich das Projekt auf neue Methoden für die Behandlung von Fibrose und pulmonaler Hypertonie konzentrieren, mit besonderem Fokus auf die Erkrankung von Kindern.
Hypertonie bzw. Bluthochdruck ist ein Hauptrisikofaktor für koronare Herzkrankheit, Niereninsuffizienz, pulmonale Fibrose und Schlaganfall. Hypertonie führt oftmals zu Gefässkomplikationen und Endorganschäden. Wichtige Organe wie das Herz, die Nieren, die Lungen, das Gehirn und die Augen, welche durch das Kreislaufsystem versorgt werden, werden besonders durch Blutdruckfluktuationen beeinflusst. Die Zahl der Personen, die weltweit an Bluthochdruck leiden steigt: Zurzeit sind 1 Milliarde Menschen davon betroffen, doch man rechnet damit, dass im Jahr 2025 die Zahl bei mehr als 1,5 Milliarden liegen wird. Trotz der Häufigkeit der Krankheit, die oftmals eine grosse Bürde darstellt, sind verfügbare Behandlungen oftmals bei weitem nicht ausreichend. So gibt es für Kinder, die unter Hypertonie leiden, bisher keine adäquate Behandlung.
Die Forschungen werden von der Niederländischen Herzstiftung unterstützt. Hans Stem, der Leiter der Niederländischen Herzstiftung erklärte: "Hyptertonie ist ein Hauptrisikofaktor for kardiovaskuläre Erkrankungen wie Herzinfarkt, Herzversagen und Schlaganfall. Leider wirken blutdrucksenkende Mittel in vielen Fällen nicht richtig. So wurde beispielsweise in einer im Auftrag der Niederländischen Herzstiftung durchgeführten Studie herausgefunden, dass 25 % der Patienten keine positive Wirkung durch die Behandlung mit ACE-Hemmern verzeichnen konnten. Eine effektive Behandlung gegen Hypertonie ist von höchster Wichtigkeit in unserem Kampf gegen kardiovaskuläre Erkrankungen. Die Niederländische Herzstiftung freut sich sehr über dieses neue Konsortium und ihre Bestrebungen, neue und effektivere Therapien gegen Hypertonie zu entwickeln.
Rückfragehinweis:
Für weiterführende Informationen kontaktieren Sie bitte Ingeborg van
der Heijden: +31-71-3322036
ganz nett, aber absolut nicht das, was derzeit wirklich interessiert. 
Amerikanische Food and Drug Administration eröffnet beschleunigtes Zulassungsverfahren für Miglustat zur Behandlung von Niemann-Pick Typ C
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin.
Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
----------------------------------------------------------------------
--------------
ALLSCHWIL/BASEL, SCHWEIZ - 19. November 2009 - Actelion Ltd (SIX:
ATLN) teilte heute mit, dass die amerikanische Gesundheitsbehörde FDA
einen Antrag auf Indikationserweiterung (supplemental new drug
application - sNDA) für Zavesca® (Miglustat) zur Behandlung von
progressiven neurologischen Symptomen bei Erwachsenen und Kindern mit
Niemann-Pick Typ C-Krankheit (NP-C) akzeptiert hat.
In den USA ist Zavesca® derzeit als orales Therapeutikum für die
Behandlung erwachsener Patienten mit leichter bis mittelschwerer
Typ-1-Gaucher-Krankheit zugelassen, bei denen eine
Enzymersatztherapie nicht in Betracht kommt.
Für die beantragte Indikationserweiterung, die sich auf Ergebnisse
der klinischen Studie OGT 918-007 sowie zwei multizentrische
retrospektive Kohortenstudien bei Patienten mit NP-C stützt, wurde
ein beschleunigtes Zulassungsverfahren eröffnet. Beschleunigte
Zulassungsverfahren sind Arzneimitteln vorbehalten, die einen
bedeutenden therapeutischen Fortschritt darstellen oder
Behandlungsmöglichkeiten für bisher unzureichend therapierbare
Krankheiten eröffnen. Dieser Vorzugsstatus bedeutet auch, dass die
FDA das Prüfverfahren nach Möglichkeit innerhalb von sechs Monaten
abschliessen wird.
Actelion wurde von der FDA darüber informiert, dass der
Erweiterungsantrag bis zum 12. Januar 2010 vom Endocrine and
Metabolic Drug Advisory Committee (EMDAC) geprüft werden wird. Die
FDA stützt sich bei der Beurteilung neuer Therapieansätze häufig auf
die Empfehlungen von wissenschaftlichen Beiräten, beispielsweise wenn
es sich um Krankheiten handelt, für die bisher noch keine Therapie
zuglassen wurde.
Dr. Jean-Paul Clozel, CEO von Actelion, kommentierte: ´Actelion
arbeitet eng mit der FDA zusammen und stellt die für den
Zulassungsprozess erforderlichen Informationen zur Verfügung, damit
Miglustat auch in den USA für Patienten bereitgestellt werden kann,
die unter dieser tödlichen neurodegenerativen genetischen Erkrankung
leiden, die sowohl Kinder wie Erwachsene treffen kann. Miglustat
könnte als erste Therapie gegen NP-C in den USA auf den Markt kommen
und damit für Patienten und deren behandelnde Ärzte einen
medizinischen Durchbruch darstellen.´
Im Jahr 2008 hatte die FDA Miglustat zur Behandlung von NP-C den
Status eines Orphan-Arzneimittels für die USA eingeräumt.
###

Amerikanische Food and Drug Administration eröffnet beschleunigtes Zulassungsverfahren für Miglustat zur Behandlung von Niemann-Pick Typ C
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin.
Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
----------------------------------------------------------------------
--------------
ALLSCHWIL/BASEL, SCHWEIZ - 19. November 2009 - Actelion Ltd (SIX:
ATLN) teilte heute mit, dass die amerikanische Gesundheitsbehörde FDA
einen Antrag auf Indikationserweiterung (supplemental new drug
application - sNDA) für Zavesca® (Miglustat) zur Behandlung von
progressiven neurologischen Symptomen bei Erwachsenen und Kindern mit
Niemann-Pick Typ C-Krankheit (NP-C) akzeptiert hat.
In den USA ist Zavesca® derzeit als orales Therapeutikum für die
Behandlung erwachsener Patienten mit leichter bis mittelschwerer
Typ-1-Gaucher-Krankheit zugelassen, bei denen eine
Enzymersatztherapie nicht in Betracht kommt.
Für die beantragte Indikationserweiterung, die sich auf Ergebnisse
der klinischen Studie OGT 918-007 sowie zwei multizentrische
retrospektive Kohortenstudien bei Patienten mit NP-C stützt, wurde
ein beschleunigtes Zulassungsverfahren eröffnet. Beschleunigte
Zulassungsverfahren sind Arzneimitteln vorbehalten, die einen
bedeutenden therapeutischen Fortschritt darstellen oder
Behandlungsmöglichkeiten für bisher unzureichend therapierbare
Krankheiten eröffnen. Dieser Vorzugsstatus bedeutet auch, dass die
FDA das Prüfverfahren nach Möglichkeit innerhalb von sechs Monaten
abschliessen wird.
Actelion wurde von der FDA darüber informiert, dass der
Erweiterungsantrag bis zum 12. Januar 2010 vom Endocrine and
Metabolic Drug Advisory Committee (EMDAC) geprüft werden wird. Die
FDA stützt sich bei der Beurteilung neuer Therapieansätze häufig auf
die Empfehlungen von wissenschaftlichen Beiräten, beispielsweise wenn
es sich um Krankheiten handelt, für die bisher noch keine Therapie
zuglassen wurde.
Dr. Jean-Paul Clozel, CEO von Actelion, kommentierte: ´Actelion
arbeitet eng mit der FDA zusammen und stellt die für den
Zulassungsprozess erforderlichen Informationen zur Verfügung, damit
Miglustat auch in den USA für Patienten bereitgestellt werden kann,
die unter dieser tödlichen neurodegenerativen genetischen Erkrankung
leiden, die sowohl Kinder wie Erwachsene treffen kann. Miglustat
könnte als erste Therapie gegen NP-C in den USA auf den Markt kommen
und damit für Patienten und deren behandelnde Ärzte einen
medizinischen Durchbruch darstellen.´
Im Jahr 2008 hatte die FDA Miglustat zur Behandlung von NP-C den
Status eines Orphan-Arzneimittels für die USA eingeräumt.
###
Antwort auf Beitrag Nr.: 38.415.765 von SLGramann am 19.11.09 07:27:51Nur Geduld, es wird schon noch ein spannender Herbst bei Actelion.
19.11.2009 12:59:44
Moody's: Negativer Ausblick für die globale Pharmaindustrie - Patentabläufe
PARIS (dpa-AFX) - Die Ratingagentur Moody's hat den Ausblick der globalen
Pharmaindustrie in ihrem jüngsten Branchenausblick negativ eingestuft. Der am
Donnerstag veröffentlichte Bericht mit dem Titel 'Global Pharmaceutical Firms:
Growing Pressure as Patent Expiries Approach' fasst die Prognosen der
Ratingagentur für die fundamentalen Kreditbedingungen im Pharmasektor in den
kommenden 12 bis 18 Monaten zusammen. Einer der Hauptgründe für die Einschätzung
ist der in den nächsten Jahren anstehende Patentablauf für eine Reihe von
Umsatz-Spitzenreitern. Moody’s bewertet derzeit 35 Pharmaunternehmen, davon 4
Generika-Hersteller.
'Im Unterschied zu den meisten anderen Branchen mit negativem Ausblick stützt
sich unsere Sicht auf die Pharmaunternehmen nicht vornehmlich auf das allgemeine
Konjunkturklima, sondern auf branchenspezifische Faktoren', sagte
Moody's-Analystin Marie Fischer-Sabatie. Zwar dürften sich die operativen
Ergebnisse und Mittelzuflüsse in den nächsten ein bis anderthalb Jahren weiter
verbessern. Zwei Indikatoren, die Moody's zur Beurteilung des Pharmasektors
heranzieht, hätten sich jedoch abgeschwächt und dürften sich kurz- bis
mittelfristig weiter verschlechtern: das prozentuale Verhältnis von
Pipeline-Peak-Sales zum Gesamtumsatz und das prozentuale Verhältnis von
Patentabläufen zum Gesamtumsatz.
GENERIKAHERSTELLER SOLLTEN PROFITIEREN
Um den Druck zu mindern, haben die Pharmaunternehmen Fusionen und Übernahmen
getätigt. Diese haben 2009 ein bislang nie dagewesenes Niveau erreicht. Moody’s
rechnet mit einer Fortsetzung der Konsolidierung, wenn auch in geringerem Maße
als in den vergangenen zwölf Monaten. Der negative Ausblick trage zudem der
Unsicherheit wegen der der Gesundheitsreform in den USA Rechnung. Diese könnte
bis Ende des Jahres in Kraft treten und negative Auswirkungen auf die Branche
weltweit haben. 'Derzeit gehen wir jedoch nicht davon aus, dass eine solche
Reform eine schwere Belastung für die Pharmabranche darstellen würde', so
Mitautor Michael Levesque.
Die Generika-Hersteller dürften nach Ansicht der Ratingagentur von einer
Vielzahl von 'Blockbuster'-Präparaten profitieren, bei denen der Patentschutz in
den nächsten Jahren ausläuft. Die Generika-Branche berge zwar nach wie vor
gewisse Kreditrisiken infolge des intensiven Wettbewerbs und des Preisverfalls.
Moody’s geht allerdings davon aus, dass diese Belastungen durch die
Markteinführung neuer Produkte in den nächsten Jahren mehr als ausgeglichen
werden können./ep/nl/tw
Quelle: dpa-AFX
Moody's: Negativer Ausblick für die globale Pharmaindustrie - Patentabläufe
PARIS (dpa-AFX) - Die Ratingagentur Moody's hat den Ausblick der globalen
Pharmaindustrie in ihrem jüngsten Branchenausblick negativ eingestuft. Der am
Donnerstag veröffentlichte Bericht mit dem Titel 'Global Pharmaceutical Firms:
Growing Pressure as Patent Expiries Approach' fasst die Prognosen der
Ratingagentur für die fundamentalen Kreditbedingungen im Pharmasektor in den
kommenden 12 bis 18 Monaten zusammen. Einer der Hauptgründe für die Einschätzung
ist der in den nächsten Jahren anstehende Patentablauf für eine Reihe von
Umsatz-Spitzenreitern. Moody’s bewertet derzeit 35 Pharmaunternehmen, davon 4
Generika-Hersteller.
'Im Unterschied zu den meisten anderen Branchen mit negativem Ausblick stützt
sich unsere Sicht auf die Pharmaunternehmen nicht vornehmlich auf das allgemeine
Konjunkturklima, sondern auf branchenspezifische Faktoren', sagte
Moody's-Analystin Marie Fischer-Sabatie. Zwar dürften sich die operativen
Ergebnisse und Mittelzuflüsse in den nächsten ein bis anderthalb Jahren weiter
verbessern. Zwei Indikatoren, die Moody's zur Beurteilung des Pharmasektors
heranzieht, hätten sich jedoch abgeschwächt und dürften sich kurz- bis
mittelfristig weiter verschlechtern: das prozentuale Verhältnis von
Pipeline-Peak-Sales zum Gesamtumsatz und das prozentuale Verhältnis von
Patentabläufen zum Gesamtumsatz.
GENERIKAHERSTELLER SOLLTEN PROFITIEREN
Um den Druck zu mindern, haben die Pharmaunternehmen Fusionen und Übernahmen
getätigt. Diese haben 2009 ein bislang nie dagewesenes Niveau erreicht. Moody’s
rechnet mit einer Fortsetzung der Konsolidierung, wenn auch in geringerem Maße
als in den vergangenen zwölf Monaten. Der negative Ausblick trage zudem der
Unsicherheit wegen der der Gesundheitsreform in den USA Rechnung. Diese könnte
bis Ende des Jahres in Kraft treten und negative Auswirkungen auf die Branche
weltweit haben. 'Derzeit gehen wir jedoch nicht davon aus, dass eine solche
Reform eine schwere Belastung für die Pharmabranche darstellen würde', so
Mitautor Michael Levesque.
Die Generika-Hersteller dürften nach Ansicht der Ratingagentur von einer
Vielzahl von 'Blockbuster'-Präparaten profitieren, bei denen der Patentschutz in
den nächsten Jahren ausläuft. Die Generika-Branche berge zwar nach wie vor
gewisse Kreditrisiken infolge des intensiven Wettbewerbs und des Preisverfalls.
Moody’s geht allerdings davon aus, dass diese Belastungen durch die
Markteinführung neuer Produkte in den nächsten Jahren mehr als ausgeglichen
werden können./ep/nl/tw
Quelle: dpa-AFX
Tja, den Deal mit Incyte, den ich mir sehr für Actelion gewünscht hätte, den hat jetzt Nachbar Novartis unter Dach und Fach gebracht:
Incyte Announces Major Collaboration and License Agreement for Two Hematology-Oncology Programs
Novartis to Develop and Commercialize Incyte’s Lead JAK1/JAK2 Inhibitor, INCB18424, for Territories Outside the US and Incyte’s cMET Inhibitor, INCB28060, Worldwide
Incyte May Receive Over $1 Billion in Payments, Including $150 Million Upfront Plus an Immediate $60 Million Development Milestone in Addition to Future Potential Milestones and Royalties
WILMINGTON, Del.--(BUSINESS WIRE)--Incyte Corporation (NASDAQ: INCY) announced today that it has entered into a collaboration and license agreement with Novartis for two of its investigational hematology-oncology therapies: INCB18424, an oral JAK1/JAK2 inhibitor that is in Phase III development for myelofibrosis, a serious life-threatening neoplastic condition characterized by varying degrees of bone marrow failure, splenic enlargement and debilitating constitutional symptoms, and INCB28060, an oral cMET inhibitor that is about to enter Phase I development as a potential treatment for multiple cancers.
http://www.businesswire.com/portal/site/home/permalink/?ndmV…
Hätte mir wirklich gut gefallen. Die Zulassung von INCB18424 gilt als quasi sicher. Der cMET-Inhibitor wäre für die langfristige Perspektive auch lecker gewesen.
Wann will Actelion eigentlich mal was im Onkologie-Bereich anschieben? Wenn man sich selbst schon als Europas Genentech abfeiert...
Incyte Announces Major Collaboration and License Agreement for Two Hematology-Oncology Programs
Novartis to Develop and Commercialize Incyte’s Lead JAK1/JAK2 Inhibitor, INCB18424, for Territories Outside the US and Incyte’s cMET Inhibitor, INCB28060, Worldwide
Incyte May Receive Over $1 Billion in Payments, Including $150 Million Upfront Plus an Immediate $60 Million Development Milestone in Addition to Future Potential Milestones and Royalties
WILMINGTON, Del.--(BUSINESS WIRE)--Incyte Corporation (NASDAQ: INCY) announced today that it has entered into a collaboration and license agreement with Novartis for two of its investigational hematology-oncology therapies: INCB18424, an oral JAK1/JAK2 inhibitor that is in Phase III development for myelofibrosis, a serious life-threatening neoplastic condition characterized by varying degrees of bone marrow failure, splenic enlargement and debilitating constitutional symptoms, and INCB28060, an oral cMET inhibitor that is about to enter Phase I development as a potential treatment for multiple cancers.
http://www.businesswire.com/portal/site/home/permalink/?ndmV…
Hätte mir wirklich gut gefallen. Die Zulassung von INCB18424 gilt als quasi sicher. Der cMET-Inhibitor wäre für die langfristige Perspektive auch lecker gewesen.
Wann will Actelion eigentlich mal was im Onkologie-Bereich anschieben? Wenn man sich selbst schon als Europas Genentech abfeiert...

Antwort auf Beitrag Nr.: 38.454.150 von SLGramann am 25.11.09 16:48:01Man kann nicht alles haben, nu wart doch mal ab 



Im Vorfeld der anstehenden Studiendaten erholt sich der Kurs, der Dezember wird spannend!
Katastrophe?
Actelions selektiver S1P1-Rezeptor-Agonist wird in weiterführender klinischer Studie zur Behandlung von Psoriasis geprüft- Dosisfindungsstudie der Phase IIb bei Multipler Sklerose wurde bereits aufgenommen - Roche verlässt S1P1-Partnerschaft nach umfassender Überprüfung und Neugewichtung ihres Portfolios
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin.
Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
----------------------------------------------------------------------
--------------
ALLSCHWIL, SCHWEIZ - 8. Dezember 2009 - Actelion Ltd (SIX: ATLN)
informierte heute über die Weiterführung seines klinischen
Entwicklungsprogramms mit dem selektiven, oral verfügbaren
S1P1-Rezeptor-Agonisten (ACT-128800) zur Behandlung von Psoriasis.
ACT-128800 wird bereits in einer fortgeschrittenen klinischen Studie
gegen Multiple Sklerose geprüft. Für diese Indikation war Anfang
Oktober 2009 im Rahmen einer Dosisfindungsstudie die
Patientenrekrutierung aufgenommen worden.
Actelion wird die Weiterentwicklung von ACT-128800 im Rahmen dieser
beiden Programme und anderer Autoimmunindikationen fortsetzen. Die in
Basel ansässige Roche informierte Actelion am 7. Dezember 2009 über
ihre Absicht, die S1P1-Partnerschaft nach einer umfassenden
Überprüfung ihres Entwicklungsportfolios nicht weiterzuverfolgen.
Nach der Integration des Portfolios von Genentech hatte Roche das
gemeinsame Forschungs- und Entwicklungsportfolio einer eingehenden
Analyse unterzogen.
Als Folge der Aufkündigung der Partnerschaft mit Actelion werden die
erhaltenen Meilensteinzahlungen schneller realisiert als
ursprünglich vorgesehen. Am Tag der Beendigung der Partnerschaft
beliefen sich die zurückgestellten Einnahmen auf 88,7 Mio. USD.
Dieser Betrag wird ab Dezember dieses Jahres im Verlauf der
kommenden sechs Monate verbucht.
Dr. Jean-Paul Clozel, Chief Executive Officer von Actelion,
kommentierte: ´Ich möchte Roche für seinen bis zu diesem Zeitpunkt
geleisteten Beitrag und seine Fachkompetenz bei der Weiterentwicklung
dieses Programms danken. Heute verfügt Actelion über alle
Voraussetzungen - das medizinische Knowhow und die Fachkompetenz bei
der Durchführung globaler klinischer Studien, der globalen
Vermarktung und dem globalen Marketing sowie die erforderlichen
liquiden Mittel - um unseren viel versprechenden selektiven
S1P1-Rezeptor-Agonisten in verschiedenen Indikationen eigenständig
erfolgreich weiterzuentwickeln und zu vermarkten.´
Jean-Paul Clozel schloss: ´Ich bin überzeugt, dass Actelions
selektiver S1P1-Rezeptor-Agonist das Potenzial hat, Patienten eine
verbesserte Therapie zu bieten. Dieses orale Immuntherapeutikum kann
bei Bedarf problemlos abgesetzt werden. Insbesondere könnte unser
selektiver S1P1-Rezeptor-Agonist im Vergleich zu anderen derzeit
erhältlichen oder in Entwicklung befindlichen Therapien, wie
biologischen Immunsuppressiva mit langer Wirksamkeit oder anderen
oralen Behandlungsoptionen, ein vorteilhafteres Sicherheitsprofil
aufweisen.´
Actelions Entscheidung zur Weiterentwicklung des selektiven
S1P1-Rezeptor-Agonisten in der Indikation Psoriasis beruht auf den
Ergebnissen einer kürzlich abgeschlossenen ,Proof-of-Concept´-Studie
der Phase IIa. Die Resultate der Kurzzeitstudie waren zwar
statistisch nicht signifikant, die vorliegenden Informationen
reichten aber aus, um die Aufnahme einer ersten, zulassungsrelevanten
Studie auf dem Gebiet der Psoriasis zu rechtfertigen.
Ergänzend zu den zuvor bei gesunden Freiwilligen erhobenen
Sicherheitsdaten konnten im Rahmen der Phase-IIa-Studie mit einer
grösseren Gruppe von Psoriasis-Patienten über einen
Behandlungszeitraum von sechs Wochen erweiterte
Sicherheitsinformationen gewonnen werden. Die detaillierten
Studienergebnisse sollen anlässlich bedeutender wissenschaftlicher
Kongresse vorgestellt und in wissenschaftlichen Fachblättern
publiziert werden.
Für die Indikation Multiple Sklerose führt Actelion derzeit eine
multizentrische, randomisierte, plazebokontrollierte, parallelisierte
Doppelblindstudie zur Dosisfindung und Bewertung der Wirksamkeit,
Sicherheit und Verträglichkeit des S1P1-Rezeptor-Agonisten mit drei
Dosisstärken durch, bei der 400 Patienten mit schubförmiger Multipler
Sklerose (RRMS) 24 Wochen lang behandelt werden. Das Design der
Studie, deren Endpunkte an Ergebnisse von Kernspintomografien
geknüpft sind, stellt auf eine Bewertung der Wirksamkeit von
ACT-128800 im Vergleich zu Plazebo ab.
Actelions selektiver S1P1-Rezeptor-Agonist wird in weiterführender klinischer Studie zur Behandlung von Psoriasis geprüft- Dosisfindungsstudie der Phase IIb bei Multipler Sklerose wurde bereits aufgenommen - Roche verlässt S1P1-Partnerschaft nach umfassender Überprüfung und Neugewichtung ihres Portfolios
Corporate news- Mitteilung verarbeitet und übermittelt durch Hugin.
Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
----------------------------------------------------------------------
--------------
ALLSCHWIL, SCHWEIZ - 8. Dezember 2009 - Actelion Ltd (SIX: ATLN)
informierte heute über die Weiterführung seines klinischen
Entwicklungsprogramms mit dem selektiven, oral verfügbaren
S1P1-Rezeptor-Agonisten (ACT-128800) zur Behandlung von Psoriasis.
ACT-128800 wird bereits in einer fortgeschrittenen klinischen Studie
gegen Multiple Sklerose geprüft. Für diese Indikation war Anfang
Oktober 2009 im Rahmen einer Dosisfindungsstudie die
Patientenrekrutierung aufgenommen worden.
Actelion wird die Weiterentwicklung von ACT-128800 im Rahmen dieser
beiden Programme und anderer Autoimmunindikationen fortsetzen. Die in
Basel ansässige Roche informierte Actelion am 7. Dezember 2009 über
ihre Absicht, die S1P1-Partnerschaft nach einer umfassenden
Überprüfung ihres Entwicklungsportfolios nicht weiterzuverfolgen.
Nach der Integration des Portfolios von Genentech hatte Roche das
gemeinsame Forschungs- und Entwicklungsportfolio einer eingehenden
Analyse unterzogen.
Als Folge der Aufkündigung der Partnerschaft mit Actelion werden die
erhaltenen Meilensteinzahlungen schneller realisiert als
ursprünglich vorgesehen. Am Tag der Beendigung der Partnerschaft
beliefen sich die zurückgestellten Einnahmen auf 88,7 Mio. USD.
Dieser Betrag wird ab Dezember dieses Jahres im Verlauf der
kommenden sechs Monate verbucht.
Dr. Jean-Paul Clozel, Chief Executive Officer von Actelion,
kommentierte: ´Ich möchte Roche für seinen bis zu diesem Zeitpunkt
geleisteten Beitrag und seine Fachkompetenz bei der Weiterentwicklung
dieses Programms danken. Heute verfügt Actelion über alle
Voraussetzungen - das medizinische Knowhow und die Fachkompetenz bei
der Durchführung globaler klinischer Studien, der globalen
Vermarktung und dem globalen Marketing sowie die erforderlichen
liquiden Mittel - um unseren viel versprechenden selektiven
S1P1-Rezeptor-Agonisten in verschiedenen Indikationen eigenständig
erfolgreich weiterzuentwickeln und zu vermarkten.´
Jean-Paul Clozel schloss: ´Ich bin überzeugt, dass Actelions
selektiver S1P1-Rezeptor-Agonist das Potenzial hat, Patienten eine
verbesserte Therapie zu bieten. Dieses orale Immuntherapeutikum kann
bei Bedarf problemlos abgesetzt werden. Insbesondere könnte unser
selektiver S1P1-Rezeptor-Agonist im Vergleich zu anderen derzeit
erhältlichen oder in Entwicklung befindlichen Therapien, wie
biologischen Immunsuppressiva mit langer Wirksamkeit oder anderen
oralen Behandlungsoptionen, ein vorteilhafteres Sicherheitsprofil
aufweisen.´
Actelions Entscheidung zur Weiterentwicklung des selektiven
S1P1-Rezeptor-Agonisten in der Indikation Psoriasis beruht auf den
Ergebnissen einer kürzlich abgeschlossenen ,Proof-of-Concept´-Studie
der Phase IIa. Die Resultate der Kurzzeitstudie waren zwar
statistisch nicht signifikant, die vorliegenden Informationen
reichten aber aus, um die Aufnahme einer ersten, zulassungsrelevanten
Studie auf dem Gebiet der Psoriasis zu rechtfertigen.
Ergänzend zu den zuvor bei gesunden Freiwilligen erhobenen
Sicherheitsdaten konnten im Rahmen der Phase-IIa-Studie mit einer
grösseren Gruppe von Psoriasis-Patienten über einen
Behandlungszeitraum von sechs Wochen erweiterte
Sicherheitsinformationen gewonnen werden. Die detaillierten
Studienergebnisse sollen anlässlich bedeutender wissenschaftlicher
Kongresse vorgestellt und in wissenschaftlichen Fachblättern
publiziert werden.
Für die Indikation Multiple Sklerose führt Actelion derzeit eine
multizentrische, randomisierte, plazebokontrollierte, parallelisierte
Doppelblindstudie zur Dosisfindung und Bewertung der Wirksamkeit,
Sicherheit und Verträglichkeit des S1P1-Rezeptor-Agonisten mit drei
Dosisstärken durch, bei der 400 Patienten mit schubförmiger Multipler
Sklerose (RRMS) 24 Wochen lang behandelt werden. Das Design der
Studie, deren Endpunkte an Ergebnisse von Kernspintomografien
geknüpft sind, stellt auf eine Bewertung der Wirksamkeit von
ACT-128800 im Vergleich zu Plazebo ab.
Dass Roche den S1P1-Rez.-Agonisten aufgegeben hat, spricht sehr gegen dieses Programm, von dem ich mir nunmehr nicht mehr viel erwarte.
Dass ich von Tracleer bei IPF und von Clazosentan nichts halte, hab ich hier schob oft geschrieben.
Almorexant allein ist mir aber als wirklich aussichtsreiches Pipeline-Projekt mit Blockbuster-Potential zu wenig.
Aus diesem Grunde habe ich heute meine Aktien in Zürich verkauft.
Im Erfolgsfall von Almorexant oder IPF oder Clazo ist ein erheblicher Kursanstieg fast sicher, den ich dann verpassen werde. Aber insgesamt ist mir die Story nun doch zu dünn geworden.
Viele Grüße an den Thread.
Dass ich von Tracleer bei IPF und von Clazosentan nichts halte, hab ich hier schob oft geschrieben.
Almorexant allein ist mir aber als wirklich aussichtsreiches Pipeline-Projekt mit Blockbuster-Potential zu wenig.
Aus diesem Grunde habe ich heute meine Aktien in Zürich verkauft.
Im Erfolgsfall von Almorexant oder IPF oder Clazo ist ein erheblicher Kursanstieg fast sicher, den ich dann verpassen werde. Aber insgesamt ist mir die Story nun doch zu dünn geworden.
Viele Grüße an den Thread.
Ich würde hier jetzt noch längst nicht so schwarz malen... Dafür ein paar Gründe:
1. Man kennt ja die Geschichte von Tracleer... Der Wirkstoff wurde von Roche entdeckt aber irgendwann nicht mehr weiterentwickelt. Aus dem Forscherteam um diesen Wirkstoff entstand dann überhaupt erst Actelion.
2. Roche bereinigt nach der Genentech-Integration ihr Portfolio und konzentriert sich auf seine Stärken, die da vor allem Krebsmedikamente sind. Wo man nicht ganz so viel Know-How hat, wird halt eben abgebrochen bzw. ausgelagert.
3. Actelion verfügt mittlerweile über sehr viel Know-How, die nötigen Strukturen und genügend Cash um das Projekt alleine voranzutreiben.
4. Eine nicht-signifikanz in Phase II bedeutet noch sehr wenig. Erstens hat man meistens eine sehr kleine Patientenpopulation (je grösser die Population, desto eher erreicht man Signifikanzen) und zweitens misst man vielleicht noch nicht korrekt, die Dosis ist zu klein, etc. etc.
Das Proof-of-Concept wurde ja eigentlich mehrheitlich erreicht, von daher würde ich das Projekt noch lange nicht abschreiben.
Aber logischerweise hätte man von einer Zusammenarbeit mit Roche weiter profitieren können, das ist klar.
So langsam könnten sie aber auch endlich mit den Almorexant Ergebnissen rausrücken, da wird man echt auf die Folter gespannt
1. Man kennt ja die Geschichte von Tracleer... Der Wirkstoff wurde von Roche entdeckt aber irgendwann nicht mehr weiterentwickelt. Aus dem Forscherteam um diesen Wirkstoff entstand dann überhaupt erst Actelion.
2. Roche bereinigt nach der Genentech-Integration ihr Portfolio und konzentriert sich auf seine Stärken, die da vor allem Krebsmedikamente sind. Wo man nicht ganz so viel Know-How hat, wird halt eben abgebrochen bzw. ausgelagert.
3. Actelion verfügt mittlerweile über sehr viel Know-How, die nötigen Strukturen und genügend Cash um das Projekt alleine voranzutreiben.
4. Eine nicht-signifikanz in Phase II bedeutet noch sehr wenig. Erstens hat man meistens eine sehr kleine Patientenpopulation (je grösser die Population, desto eher erreicht man Signifikanzen) und zweitens misst man vielleicht noch nicht korrekt, die Dosis ist zu klein, etc. etc.
Das Proof-of-Concept wurde ja eigentlich mehrheitlich erreicht, von daher würde ich das Projekt noch lange nicht abschreiben.
Aber logischerweise hätte man von einer Zusammenarbeit mit Roche weiter profitieren können, das ist klar.
So langsam könnten sie aber auch endlich mit den Almorexant Ergebnissen rausrücken, da wird man echt auf die Folter gespannt

08.12.2009, 11:19 VONTOBEL RESEARCH
Actelion "buy"
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, stuft die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" mit dem Rating "buy" ein.
Roche kündige die Partnerschaft mit Actelion für die Entwicklung von S1P1 für Autoimmunindikationen auf. Actelion werde den Wirkstoff für die Indikationen MS (Multiple Sklerose) und Psoriasis eigenständig weiterentwickeln. Anscheinend habe Roche nach einer internen Überprüfung der eigenen F&E-Pipeline zusammen mit derjenigen von Genentech entschieden, dem S1P1-Projekt keine Priorität mehr einzuräumen. Roche/Genentech würden zurzeit verschiedene monoklonale Antikörper entwickeln, die Ähnlichkeiten mit S1P1 aufweisen würden, für den Einsatz bei Autoimmunerkrankungen.
Actelion erhalte damit wieder die vollen Rechte zurück. Bislang gebe es jedoch noch kaum klinische Daten. Kurzfristig könne Actelion zurückgestellte Einnahmen in Höhe von USD 88,7 Mio. über die nächsten 6 Monate verbuchen. Dies entspreche etwa +3-4% des Gesamtumsatzes für 2009/2010. Die Partnerschaft ROG/ATLN habe auf einer Teilnahme am Gewinn beruht. Das Unternehmen halte nicht aktiv Ausschau nach einem Partner und könne daher in Zukunft wohl 100% der Umsatzerträge verbuchen.
Allerdings müssten die Analysten ihre mittelfristige Schätzung für die F&E-Kosten für S1P1 anheben. Ihre EPS-Prognosen für die Geschäftsjahre 2012 und 2013 dürften um etwa 5% sinken. Da Actelion nun wieder im vollen Besitz des Wirkstoffes sei, ergäben sich in der DCF-Berechnung höhere Kosten, die jedoch durch die höheren operativen Cashflows wettgemacht würden, sobald S1P1 Umsätze generiere. Daher würden sie mit einer unveränderten DCF-Bewertung rechnen.
Die Analysten von Vontobel Research bewerten die Aktie von Actelion mit "buy" bei einem Kursziel von CHF 80.
Als nächste Impulsgeber stünden die ersten Phase-III-Daten für Almorexant (noch vor Jahresende) und Phase-III-Daten für Bosentan bei idiopathischer pulmonaler Fibrose an.
###
Analyse vom 08.12.2009
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
Actelion "buy"
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, stuft die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" mit dem Rating "buy" ein.
Roche kündige die Partnerschaft mit Actelion für die Entwicklung von S1P1 für Autoimmunindikationen auf. Actelion werde den Wirkstoff für die Indikationen MS (Multiple Sklerose) und Psoriasis eigenständig weiterentwickeln. Anscheinend habe Roche nach einer internen Überprüfung der eigenen F&E-Pipeline zusammen mit derjenigen von Genentech entschieden, dem S1P1-Projekt keine Priorität mehr einzuräumen. Roche/Genentech würden zurzeit verschiedene monoklonale Antikörper entwickeln, die Ähnlichkeiten mit S1P1 aufweisen würden, für den Einsatz bei Autoimmunerkrankungen.
Actelion erhalte damit wieder die vollen Rechte zurück. Bislang gebe es jedoch noch kaum klinische Daten. Kurzfristig könne Actelion zurückgestellte Einnahmen in Höhe von USD 88,7 Mio. über die nächsten 6 Monate verbuchen. Dies entspreche etwa +3-4% des Gesamtumsatzes für 2009/2010. Die Partnerschaft ROG/ATLN habe auf einer Teilnahme am Gewinn beruht. Das Unternehmen halte nicht aktiv Ausschau nach einem Partner und könne daher in Zukunft wohl 100% der Umsatzerträge verbuchen.
Allerdings müssten die Analysten ihre mittelfristige Schätzung für die F&E-Kosten für S1P1 anheben. Ihre EPS-Prognosen für die Geschäftsjahre 2012 und 2013 dürften um etwa 5% sinken. Da Actelion nun wieder im vollen Besitz des Wirkstoffes sei, ergäben sich in der DCF-Berechnung höhere Kosten, die jedoch durch die höheren operativen Cashflows wettgemacht würden, sobald S1P1 Umsätze generiere. Daher würden sie mit einer unveränderten DCF-Bewertung rechnen.
Die Analysten von Vontobel Research bewerten die Aktie von Actelion mit "buy" bei einem Kursziel von CHF 80.
Als nächste Impulsgeber stünden die ersten Phase-III-Daten für Almorexant (noch vor Jahresende) und Phase-III-Daten für Bosentan bei idiopathischer pulmonaler Fibrose an.
###
Analyse vom 08.12.2009
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
Rückschlag bei der FDA für einen Wettbewerber bei einem in Entwicklung befindlichen Schlafmittel:
Somaxon Receives Complete Response Letter from the FDA for Silenor NDA
SAN DIEGO--(BUSINESS WIRE)--Dec 7, 2009
Somaxon Pharmaceuticals, Inc. (Nasdaq: SOMX), a specialty pharmaceutical company focused on the in-licensing, development and commercialization of proprietary branded pharmaceutical products and late-stage product candidates for the treatment of diseases and disorders in the central nervous system therapeutic area, today announced that the company has received a Complete Response Letter from the U.S. Food and Drug Administration (FDA) for its New Drug Application (NDA) for Silenor® (doxepin) for the treatment of insomnia.
Based on its review, the FDA has determined that the NDA cannot be approved in its present form. Somaxon previously received a Complete Response Letter for the NDA in February 2009, and it resubmitted the NDA in June 2009.
In the most recent Complete Response Letter, the FDA stated that the Silenor NDA did not meet the approval standard for efficacy due to a lack of robustness of sustained subjective sleep maintenance efficacy in adults with primary insomnia.
With respect to safety, the most recent Complete Response Letter did not raise any clinical safety issues. This is consistent with the February 2009 Complete Response Letter, in which the FDA noted that there were no adverse events observed in the clinical studies included in the NDA that would preclude approval. The most recent Complete Response Letter did request that the company submit an amended Risk Evaluation and Mitigation Strategy (REMS), including a Medication Guide to be distributed with the product, in any resubmission of the NDA.
Because the most recent Complete Response Letter did not contain any specific requirement to conduct any additional clinical work or other specific guidance to address the issue raised by the FDA, Somaxon believes that a meeting with the FDA will be necessary to discuss the basis for the FDA's decision and to seek such specific guidance. The company intends to schedule this meeting as soon as possible.
“We are disappointed in the decision because we believed that our June NDA resubmission adequately addressed the concerns raised by the FDA in its February Complete Response Letter,” said Richard W. Pascoe, Somaxon's president and chief executive officer. “We have carefully reviewed the current Complete Response Letter and have requested a formal meeting with senior FDA leadership to discuss its conclusions.”
“In the February Complete Response Letter, the FDA acknowledged objective and subjective efficacy at the beginning and end of treatment in elderly patients, and at the beginning of treatment for non-elderly adult patients, and the most recent Complete Response Letter did not alter those conclusions,” continued Pascoe. “In addition, statistical significance on the primary endpoint and multiple secondary endpoints was achieved for all of our four Phase 3 clinical trials and both of our Phase 2 clinical trials for Silenor. We are consulting with our clinical and regulatory advisors and intend to take all steps we deem appropriate to seek approval and commercialization of this product candidate.”
About Silenor®
Silenor is a low-dose (3 mg, 6 mg) oral tablet formulation of doxepin hydrochloride that is patent protected for use in insomnia. Physicians have prescribed doxepin for more than 35 years for the treatment of depression and anxiety at dosages typically ranging from 75 mg to 300 mg per day. Based upon the controlled clinical trials of Silenor completed by Somaxon, the company believes that Silenor may be well tolerated by patients. In addition, the FDA has indicated that it will recommend that Silenor not be scheduled as a controlled substance.
About Somaxon Pharmaceuticals, Inc.
Headquartered in San Diego, CA, Somaxon Pharmaceuticals, Inc. is a specialty pharmaceutical company focused on the in-licensing, development and commercialization of proprietary branded pharmaceutical products and late-stage product candidates for the treatment of diseases and disorders in the central nervous system therapeutic area.
For more information, please visit the company's web site at www.somaxon.com.
http://www.pharmalive.com/News/index.cfm?articleid=671510&ca…
Somaxon Receives Complete Response Letter from the FDA for Silenor NDA
SAN DIEGO--(BUSINESS WIRE)--Dec 7, 2009
Somaxon Pharmaceuticals, Inc. (Nasdaq: SOMX), a specialty pharmaceutical company focused on the in-licensing, development and commercialization of proprietary branded pharmaceutical products and late-stage product candidates for the treatment of diseases and disorders in the central nervous system therapeutic area, today announced that the company has received a Complete Response Letter from the U.S. Food and Drug Administration (FDA) for its New Drug Application (NDA) for Silenor® (doxepin) for the treatment of insomnia.
Based on its review, the FDA has determined that the NDA cannot be approved in its present form. Somaxon previously received a Complete Response Letter for the NDA in February 2009, and it resubmitted the NDA in June 2009.
In the most recent Complete Response Letter, the FDA stated that the Silenor NDA did not meet the approval standard for efficacy due to a lack of robustness of sustained subjective sleep maintenance efficacy in adults with primary insomnia.
With respect to safety, the most recent Complete Response Letter did not raise any clinical safety issues. This is consistent with the February 2009 Complete Response Letter, in which the FDA noted that there were no adverse events observed in the clinical studies included in the NDA that would preclude approval. The most recent Complete Response Letter did request that the company submit an amended Risk Evaluation and Mitigation Strategy (REMS), including a Medication Guide to be distributed with the product, in any resubmission of the NDA.
Because the most recent Complete Response Letter did not contain any specific requirement to conduct any additional clinical work or other specific guidance to address the issue raised by the FDA, Somaxon believes that a meeting with the FDA will be necessary to discuss the basis for the FDA's decision and to seek such specific guidance. The company intends to schedule this meeting as soon as possible.
“We are disappointed in the decision because we believed that our June NDA resubmission adequately addressed the concerns raised by the FDA in its February Complete Response Letter,” said Richard W. Pascoe, Somaxon's president and chief executive officer. “We have carefully reviewed the current Complete Response Letter and have requested a formal meeting with senior FDA leadership to discuss its conclusions.”
“In the February Complete Response Letter, the FDA acknowledged objective and subjective efficacy at the beginning and end of treatment in elderly patients, and at the beginning of treatment for non-elderly adult patients, and the most recent Complete Response Letter did not alter those conclusions,” continued Pascoe. “In addition, statistical significance on the primary endpoint and multiple secondary endpoints was achieved for all of our four Phase 3 clinical trials and both of our Phase 2 clinical trials for Silenor. We are consulting with our clinical and regulatory advisors and intend to take all steps we deem appropriate to seek approval and commercialization of this product candidate.”
About Silenor®
Silenor is a low-dose (3 mg, 6 mg) oral tablet formulation of doxepin hydrochloride that is patent protected for use in insomnia. Physicians have prescribed doxepin for more than 35 years for the treatment of depression and anxiety at dosages typically ranging from 75 mg to 300 mg per day. Based upon the controlled clinical trials of Silenor completed by Somaxon, the company believes that Silenor may be well tolerated by patients. In addition, the FDA has indicated that it will recommend that Silenor not be scheduled as a controlled substance.
About Somaxon Pharmaceuticals, Inc.
Headquartered in San Diego, CA, Somaxon Pharmaceuticals, Inc. is a specialty pharmaceutical company focused on the in-licensing, development and commercialization of proprietary branded pharmaceutical products and late-stage product candidates for the treatment of diseases and disorders in the central nervous system therapeutic area.
For more information, please visit the company's web site at www.somaxon.com.
http://www.pharmalive.com/News/index.cfm?articleid=671510&ca…
durchwachsen imho:
Investigational dual orexin receptor antagonist almorexant meets primary endpoint in two-week phase III study in patients suffering from primary insomnia
Evidence for differentiation from traditional GABA-agonist zolpidem observed
ALLSCHWIL, SWITZERLAND 21 December 2009 Actelion Ltd (SIX: ATLN) announced today that the first phase III study with almorexant (RESTORA 1) has met its primary endpoint, superiority of the dual orexin receptor antagonist almorexant compared to placebo on objective and subjective wake after sleep onset (WASO). The finding was highly significant (p<0.001). In addition, several secondary endpoints of the study were met with statistical significance.
In RESTORA 1, the use of almorexant was well-tolerated. However, in this study as well as in the ongoing non-pivotal program, certain safety observations were made that will require further evaluation and assessment in longer-term Phase III studies. The Phase III studies are currently in preparation - in both adults and elderly patients suffering from primary insomnia - and will evaluate long-term efficacy and safety.
Professor Jed Black, M.D. and VP Sleep Development at Actelion, commented: In this two-week study, almorexant has demonstrated clinically meaningful effects on both sleep induction and sleep maintenance for patients suffering from primary insomnia. I am especially encouraged that these effects were maintained both throughout the night and throughout the 16-day treatment period.
Jean-Paul Clozel, M.D and Chief Executive Officer of Actelion, commented: As a result of the use of an active reference arm of zolpidem 10mg in RESTORA 1, we have now obtained a first promising insight of the impact of our dual orexin receptor antagonist almorexant compared to the impact of a traditional GABA-agonist.
Jean-Paul Clozel concluded: Additional studies are being planned to further establish the clinical profile of almorexant. We will explore aspects of sleep quality, absence of addiction and improved next-day performance. Chronic use studies in both adults and elderly will further evaluate the safety profile of this innovative agent.
Die Aussagen zu Zolpidem sind eher nebulös...
Investigational dual orexin receptor antagonist almorexant meets primary endpoint in two-week phase III study in patients suffering from primary insomnia
Evidence for differentiation from traditional GABA-agonist zolpidem observed
ALLSCHWIL, SWITZERLAND 21 December 2009 Actelion Ltd (SIX: ATLN) announced today that the first phase III study with almorexant (RESTORA 1) has met its primary endpoint, superiority of the dual orexin receptor antagonist almorexant compared to placebo on objective and subjective wake after sleep onset (WASO). The finding was highly significant (p<0.001). In addition, several secondary endpoints of the study were met with statistical significance.
In RESTORA 1, the use of almorexant was well-tolerated. However, in this study as well as in the ongoing non-pivotal program, certain safety observations were made that will require further evaluation and assessment in longer-term Phase III studies. The Phase III studies are currently in preparation - in both adults and elderly patients suffering from primary insomnia - and will evaluate long-term efficacy and safety.
Professor Jed Black, M.D. and VP Sleep Development at Actelion, commented: In this two-week study, almorexant has demonstrated clinically meaningful effects on both sleep induction and sleep maintenance for patients suffering from primary insomnia. I am especially encouraged that these effects were maintained both throughout the night and throughout the 16-day treatment period.
Jean-Paul Clozel, M.D and Chief Executive Officer of Actelion, commented: As a result of the use of an active reference arm of zolpidem 10mg in RESTORA 1, we have now obtained a first promising insight of the impact of our dual orexin receptor antagonist almorexant compared to the impact of a traditional GABA-agonist.
Jean-Paul Clozel concluded: Additional studies are being planned to further establish the clinical profile of almorexant. We will explore aspects of sleep quality, absence of addiction and improved next-day performance. Chronic use studies in both adults and elderly will further evaluate the safety profile of this innovative agent.
Die Aussagen zu Zolpidem sind eher nebulös...
07:01 dpa-AFX
Hugin-News: Actelion Pharmaceuticals Ltd
Dualer Orexin-Rezeptor-Antagonist Almorexant erreicht primären Endpunkt in zweiwöchiger Phase-III-Studie bei primärer Insomnie
Actelion Pharmaceuticals Ltd / Dualer Orexin-Rezeptor-Antagonist Almorexant erreicht primären Endpunkt in zweiwöchiger Phase-III-Studie bei primärer Insomnie verarbeitet und übermittelt durch Hugin. Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
Unterscheidung von herkömmlichem GABA-Agonisten Zolpidem belegt
ALLSCHWIL, SCHWEIZ, 21. Dezember 2009
Actelion Ltd (SIX: ATLN) teilte heute mit, dass die erste Studie des Phase-III-Programms mit Almorexant (RESTORA 1) den primären Endpunkt erreicht hat. Dieser war als Überlegenheit des Orexin-Rezeptor-Antagonisten Almorexant gegenüber Plazebo hinsichtlich dem objektiven und subjectiven Schlaferhalt (wake after sleep onset - WASO - Aufwachen nach dem Einschlafen) definiert worden und erzielte hochsignifikante Resultate.
--- Ende der Mitteilung ---
Actelion Pharmaceuticals Ltd Gewerbestrasse 16 Allschwil Schweiz
WKN: 936767 ACTELION N ;ISIN: CH0010532478;
Medienmitteilung PDF: http://hugin.info/131801/R/1365364/333449.pdf
http://www.actelion.com
Hugin-News: Actelion Pharmaceuticals Ltd
Dualer Orexin-Rezeptor-Antagonist Almorexant erreicht primären Endpunkt in zweiwöchiger Phase-III-Studie bei primärer Insomnie
Actelion Pharmaceuticals Ltd / Dualer Orexin-Rezeptor-Antagonist Almorexant erreicht primären Endpunkt in zweiwöchiger Phase-III-Studie bei primärer Insomnie verarbeitet und übermittelt durch Hugin. Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
Unterscheidung von herkömmlichem GABA-Agonisten Zolpidem belegt
ALLSCHWIL, SCHWEIZ, 21. Dezember 2009
Actelion Ltd (SIX: ATLN) teilte heute mit, dass die erste Studie des Phase-III-Programms mit Almorexant (RESTORA 1) den primären Endpunkt erreicht hat. Dieser war als Überlegenheit des Orexin-Rezeptor-Antagonisten Almorexant gegenüber Plazebo hinsichtlich dem objektiven und subjectiven Schlaferhalt (wake after sleep onset - WASO - Aufwachen nach dem Einschlafen) definiert worden und erzielte hochsignifikante Resultate.
--- Ende der Mitteilung ---
Actelion Pharmaceuticals Ltd Gewerbestrasse 16 Allschwil Schweiz
WKN: 936767 ACTELION N ;ISIN: CH0010532478;
Medienmitteilung PDF: http://hugin.info/131801/R/1365364/333449.pdf
http://www.actelion.com
hier nochmal etwas ausführlicher:
Actelion erreicht mit Almorexant primären Endpunkt in Phase-III-Studie (AF)
Allschwil (awp) - Die Actelion Ltd. hat mit ihrem Schlafmittel-Produktkandidaten Almorexant in einer ersten Phase-III-Studie einen Erfolg erzielt. Im zweiwöchigen RESTORA-1-Test habe der Orexin-Rezeptor-Antagonist Almorexant gegenüber einem Plazebo den primären Endpunkt erreicht. Dabei seien hinsichtlich dem objektiven und subjektiven Schlaferhalt (Aufwachen nach dem Einschlafen) hochsignifikante Resultate erzielt worden, teilt das Pharma-Unternehmen am Montag mit. Auch bei einigen sekundären Endpunkten der Studie seien statistisch hochsignifikante Resultate erreicht worden.
Der Wirkstoff habe sich zudem im Rahmen der nicht zulassungsrelevanten Studie als gut verträglich erwiesen. Allerdings seien "gewisse Nebenwirkungen" beobachtet worden, die genauer analysiert und in längerfristigen Studien untersucht werden sollen. Diese Studien seien in Vorbereitung, so die Mitteilung weiter. Studienziel sei die Erhebung der langfristigen Wirksamkeit und Sicherheit bei Erwachsenen und älteren Patienten mit primärer Insomnie.
"Als besonders ermutigend betrachte ich die Tatsache, dass diese Wirkung (Ein- und Durchschlafen) während der ganzen Nacht und über die gesamte 16-tägige Behandlungsdauer hinweg anhielt", wird Jed Black, Vice-President Sleep Development bei Actelion in der Mitteilung zitiert.
"Da RESTORA 1 einen Studienarm mit 10 mg der Referenzsubstanz Zolpidem umfasste, erhielten wir erste viel versprechende Hinweise auf die Wirkkraft unseres Orexin-Rezeptor-Antagonisten Almorexant im Vergleich zu einem herkömmlichen GABA-Agonisten", so CEO Jean-Paul Clozel in der Mitteilung. Die geplanten, weiteren Studien haben gemäss Clozel das Ziel, die Schlafqualität, das Fehlen von Abhängigkeit und eine verbesserte Leistungsfähigkeit am nächsten Tag zu prüfen.
RESTORA 1 ist eine multizentrische, doppelblinde, randomisierte, plazebokontrollierte, Polysomnographie-Studie in parallelen Gruppen mit einem Referenzwirkstoff (Zolpidem). Die Studie prüft die Wirksamkeit und Sicherheit einer 16tägigen Verabreichung von 200 mg und 100 mg Almorexant an 709 erwachsene Patienten mit chronischer primärer Insomnie. Die Patientenrekrutierung erfolgte in 90 klinischen Prüfzentren in Australien, Europa und Israel. Über diese Studie hinaus soll mit dem RESTORA-Programm (REstore physiological Sleep with The Orexin Receptor antagonist Almorexant) auch das Profil von Almorexant weiter herausgearbeitet werden.
Die detaillierten Studienergebnisse werden anlässlich wissenschaftlicher Kongresse bekannt gegeben und in wissenschaftlichen Fachblättern publiziert, heisst es weiter.
rt/ch
Actelion erreicht mit Almorexant primären Endpunkt in Phase-III-Studie (AF)
Allschwil (awp) - Die Actelion Ltd. hat mit ihrem Schlafmittel-Produktkandidaten Almorexant in einer ersten Phase-III-Studie einen Erfolg erzielt. Im zweiwöchigen RESTORA-1-Test habe der Orexin-Rezeptor-Antagonist Almorexant gegenüber einem Plazebo den primären Endpunkt erreicht. Dabei seien hinsichtlich dem objektiven und subjektiven Schlaferhalt (Aufwachen nach dem Einschlafen) hochsignifikante Resultate erzielt worden, teilt das Pharma-Unternehmen am Montag mit. Auch bei einigen sekundären Endpunkten der Studie seien statistisch hochsignifikante Resultate erreicht worden.
Der Wirkstoff habe sich zudem im Rahmen der nicht zulassungsrelevanten Studie als gut verträglich erwiesen. Allerdings seien "gewisse Nebenwirkungen" beobachtet worden, die genauer analysiert und in längerfristigen Studien untersucht werden sollen. Diese Studien seien in Vorbereitung, so die Mitteilung weiter. Studienziel sei die Erhebung der langfristigen Wirksamkeit und Sicherheit bei Erwachsenen und älteren Patienten mit primärer Insomnie.
"Als besonders ermutigend betrachte ich die Tatsache, dass diese Wirkung (Ein- und Durchschlafen) während der ganzen Nacht und über die gesamte 16-tägige Behandlungsdauer hinweg anhielt", wird Jed Black, Vice-President Sleep Development bei Actelion in der Mitteilung zitiert.
"Da RESTORA 1 einen Studienarm mit 10 mg der Referenzsubstanz Zolpidem umfasste, erhielten wir erste viel versprechende Hinweise auf die Wirkkraft unseres Orexin-Rezeptor-Antagonisten Almorexant im Vergleich zu einem herkömmlichen GABA-Agonisten", so CEO Jean-Paul Clozel in der Mitteilung. Die geplanten, weiteren Studien haben gemäss Clozel das Ziel, die Schlafqualität, das Fehlen von Abhängigkeit und eine verbesserte Leistungsfähigkeit am nächsten Tag zu prüfen.
RESTORA 1 ist eine multizentrische, doppelblinde, randomisierte, plazebokontrollierte, Polysomnographie-Studie in parallelen Gruppen mit einem Referenzwirkstoff (Zolpidem). Die Studie prüft die Wirksamkeit und Sicherheit einer 16tägigen Verabreichung von 200 mg und 100 mg Almorexant an 709 erwachsene Patienten mit chronischer primärer Insomnie. Die Patientenrekrutierung erfolgte in 90 klinischen Prüfzentren in Australien, Europa und Israel. Über diese Studie hinaus soll mit dem RESTORA-Programm (REstore physiological Sleep with The Orexin Receptor antagonist Almorexant) auch das Profil von Almorexant weiter herausgearbeitet werden.
Die detaillierten Studienergebnisse werden anlässlich wissenschaftlicher Kongresse bekannt gegeben und in wissenschaftlichen Fachblättern publiziert, heisst es weiter.
rt/ch
28.12.09, 13:53 HELVEA - A PICTET COMPANY
Actelion "buy"
Genf (aktiencheck.de AG) - Olav Zilian, Analyst von Helvea - A Pictet Company, stuft die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) unverändert mit "buy" ein und bestätigt das Kursziel von 86 CHF.
Die Schätzungen zum Gewinn je Aktie seien für 2009 von 3,27 auf 3,38 CHF, für 2010 von 3,43 auf 3,84 CHF und für 2011 von 4,14 auf 4,34 CHF angehoben worden.
Damit werde einer für das erste Halbjahr 2010 erwarteten Zahlung von Roche Rechnung getragen, nachdem die Zusammenarbeit beim experimentellen Schuppenflechtemittel S1P1 beendet worden sei.
Auf Grund eines weniger scharfen Wettbewerbs würden auch die Annahmen zu den Aufwendungen für Vertrieb, Forschung & Entwicklung sowie Marketing nach unten geschraubt.
Vor diesem Hintergrund bleiben die Analysten von Helvea - A Pictet Company bei ihrer Kaufempfehlung für die Aktie von Actelion. (Analyse vom 28.12.09)
(28.12.2009/ac/a/a)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
Actelion "buy"
Genf (aktiencheck.de AG) - Olav Zilian, Analyst von Helvea - A Pictet Company, stuft die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) unverändert mit "buy" ein und bestätigt das Kursziel von 86 CHF.
Die Schätzungen zum Gewinn je Aktie seien für 2009 von 3,27 auf 3,38 CHF, für 2010 von 3,43 auf 3,84 CHF und für 2011 von 4,14 auf 4,34 CHF angehoben worden.
Damit werde einer für das erste Halbjahr 2010 erwarteten Zahlung von Roche Rechnung getragen, nachdem die Zusammenarbeit beim experimentellen Schuppenflechtemittel S1P1 beendet worden sei.
Auf Grund eines weniger scharfen Wettbewerbs würden auch die Annahmen zu den Aufwendungen für Vertrieb, Forschung & Entwicklung sowie Marketing nach unten geschraubt.
Vor diesem Hintergrund bleiben die Analysten von Helvea - A Pictet Company bei ihrer Kaufempfehlung für die Aktie von Actelion. (Analyse vom 28.12.09)
(28.12.2009/ac/a/a)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
Aus BioCentury Extra
FDA posts Zavesca briefing documents
FDA posted briefing documents ahead of Tuesday's meeting of the Endocrinologic and Metabolic Drugs Advisory Committee to discuss an sNDA from Actelion Ltd. (SIX:ATLN) for Zavesca miglustat to treat progressive neurological manifestations in patients with Niemann-Pick type C disease, a lysosomal storage disease. FDA said the key issue is whether the totality of the submitted data constitutes sufficient evidence to show a clinically meaningful effect for Zavesca. The agency noted that the Phase III Study 007 trial of Zavesca missed the primary endpoint of changes in horizontal saccadic eye movement velocity vs. no treatment. However, FDA said submitted data also included extensive assessments of other endpoints, as well as data from an extension study and retrospective studies that analyzed patients treated with Zavesca outside of clinical trials.
The sNDA is under Priority Review, with a PDUFA date of March 10. The oral N-butyldeoxynojirimycin glucosyltransferase inhibitor is already approved to treat Type I Gaucher's disease. Actelion was up CHF0.20 to CHF56.90 on Friday.
Daten scheinen nicht allzu überzeugend zu sein... evt. reichts ja trotzdem mit den zusätzlich studierten Endpunkten für ne Zulassung... wieviel da das Marktpotential ist,konnte ich leider nicht ausfindig machen, dürfte aber wohl nicht die Welt sein.
FDA posts Zavesca briefing documents
FDA posted briefing documents ahead of Tuesday's meeting of the Endocrinologic and Metabolic Drugs Advisory Committee to discuss an sNDA from Actelion Ltd. (SIX:ATLN) for Zavesca miglustat to treat progressive neurological manifestations in patients with Niemann-Pick type C disease, a lysosomal storage disease. FDA said the key issue is whether the totality of the submitted data constitutes sufficient evidence to show a clinically meaningful effect for Zavesca. The agency noted that the Phase III Study 007 trial of Zavesca missed the primary endpoint of changes in horizontal saccadic eye movement velocity vs. no treatment. However, FDA said submitted data also included extensive assessments of other endpoints, as well as data from an extension study and retrospective studies that analyzed patients treated with Zavesca outside of clinical trials.
The sNDA is under Priority Review, with a PDUFA date of March 10. The oral N-butyldeoxynojirimycin glucosyltransferase inhibitor is already approved to treat Type I Gaucher's disease. Actelion was up CHF0.20 to CHF56.90 on Friday.
Daten scheinen nicht allzu überzeugend zu sein... evt. reichts ja trotzdem mit den zusätzlich studierten Endpunkten für ne Zulassung... wieviel da das Marktpotential ist,konnte ich leider nicht ausfindig machen, dürfte aber wohl nicht die Welt sein.
Hrhr Actelion erklärt heute nachbörslich die Erhöhung der 2009er Guidance 
Bin ich mal gespannt wie der Kurs morgen reagiert
http://www.handelszeitung.ch/artikel/Finanz-AWP_Actelion-200…
Actelion 2009: Wachstum in lokalen Währungen über zuletzt erwarteten 19%
Allschwil/San Francisco (awp) - Die Actelion Ltd rechnet für das abgelaufene Geschäftsjahr mit einer besseren Umsatzentwicklung als zuletzt prognostiziert. Neu wird für das Finanzjahr 2009 mit einem Wachstum von Nettoumsatz und Cash-EBIT über 19% in lokalen Währungen (LW) gerechnet. Dieses gute Ergebnis, zu dem alle drei Produkte - Tracleer, Ventavis und Zavesca - beigetragen hätten, übertreffe die Erwartungen, teilte Actelion am Montagabend anlässlich der in Kalifornien stattfindenden J.P. Morgan Healthcare Conference mit.
Bei der Präsentation der Neumonatszahlen Ende Oktober hatte Actelion bereits die Prognosen erhöht. Gemäss den damaligen Angaben sollte sowohl der Umsatz als auch der Cash-EBIT gegenüber dem Vorjahr in LW um 16 bis 19% wachsen.
Der für 2009 erwartete Betriebs- und Reingewinn gemäss US-GAAP werde allerdings durch die von Actelions Tochtergesellschaft CoTherix an Asahi Kasei Pharma Corporation zu zahlende Entschädigungssumme in Höhe von 91 Mio USD geschmälert, bestätigte das Unternehmen am Montag frühere Angaben.
Gleichzeitig bekräftigte Actelion die positiven Aussichten für 2010 und rechnet somit weiterhin mit einem Umsatzwachstum im tiefen zweistelligen Prozentbereich. Der gute Geschäftsgang ermögliche eine hohe Netto-Umsatzrendite und überdurchschnittliche Investitionen in innovative Wachstumsmöglichkeiten, hiess es.
"Wir gehen davon aus, dass unsere Produkte auch im Jahr 2010 hervorragende Ergebnisse erzielen werden", wird CEO Jean-Paul Clozel in der Mitteilung zitiert. Ausserdem werde die Bekanntgabe wichtiger klinischer Daten von derzeit laufenden klinischen Programmen erwartet, darunter die Ergebnisse der Phase-III-Studie mit Bosentan gegen idiopathische pulmonale Fibrose in den kommenden Wochen.
Im Rahmen einer Präsentation will Actelion zudem einen Überblick über die Produkte und die Entwicklungsprogramme des Unternehmens geben.
ch/cc

Bin ich mal gespannt wie der Kurs morgen reagiert

http://www.handelszeitung.ch/artikel/Finanz-AWP_Actelion-200…
Actelion 2009: Wachstum in lokalen Währungen über zuletzt erwarteten 19%
Allschwil/San Francisco (awp) - Die Actelion Ltd rechnet für das abgelaufene Geschäftsjahr mit einer besseren Umsatzentwicklung als zuletzt prognostiziert. Neu wird für das Finanzjahr 2009 mit einem Wachstum von Nettoumsatz und Cash-EBIT über 19% in lokalen Währungen (LW) gerechnet. Dieses gute Ergebnis, zu dem alle drei Produkte - Tracleer, Ventavis und Zavesca - beigetragen hätten, übertreffe die Erwartungen, teilte Actelion am Montagabend anlässlich der in Kalifornien stattfindenden J.P. Morgan Healthcare Conference mit.
Bei der Präsentation der Neumonatszahlen Ende Oktober hatte Actelion bereits die Prognosen erhöht. Gemäss den damaligen Angaben sollte sowohl der Umsatz als auch der Cash-EBIT gegenüber dem Vorjahr in LW um 16 bis 19% wachsen.
Der für 2009 erwartete Betriebs- und Reingewinn gemäss US-GAAP werde allerdings durch die von Actelions Tochtergesellschaft CoTherix an Asahi Kasei Pharma Corporation zu zahlende Entschädigungssumme in Höhe von 91 Mio USD geschmälert, bestätigte das Unternehmen am Montag frühere Angaben.
Gleichzeitig bekräftigte Actelion die positiven Aussichten für 2010 und rechnet somit weiterhin mit einem Umsatzwachstum im tiefen zweistelligen Prozentbereich. Der gute Geschäftsgang ermögliche eine hohe Netto-Umsatzrendite und überdurchschnittliche Investitionen in innovative Wachstumsmöglichkeiten, hiess es.
"Wir gehen davon aus, dass unsere Produkte auch im Jahr 2010 hervorragende Ergebnisse erzielen werden", wird CEO Jean-Paul Clozel in der Mitteilung zitiert. Ausserdem werde die Bekanntgabe wichtiger klinischer Daten von derzeit laufenden klinischen Programmen erwartet, darunter die Ergebnisse der Phase-III-Studie mit Bosentan gegen idiopathische pulmonale Fibrose in den kommenden Wochen.
Im Rahmen einer Präsentation will Actelion zudem einen Überblick über die Produkte und die Entwicklungsprogramme des Unternehmens geben.
ch/cc
Trotz nicht genügender Daten scheints auf ne Zulassungserweiterung bei Zavesca rauszulaufen:
http://www.handelszeitung.ch/artikel/Unternehmen-AWP_Actelio…
Actelion/FDA-Ausschuss empfiehlt Zavesca bei Niemann-Pick-Typ-C-Krankheit
Washington (awp) - Ein vorberatender Ausschuss der US-Gesundheitsbehörde FDA hat Zavesca zur Zulassung für die Behandlung von Patienten mit Niemann-Pick-Typ-C-Krankheit (NPC) empfohlen. Dabei überwog bei den Mitgliedern des "Endocrine and Metabolic Drugs Advisory Committee" (EMDAC) die Meinung, dass es derzeit keine anderen Optionen gebe und viele Patienten bereits von dem Mittel profitiert hätten, wie die FDA am Dienstagabend auf Anfrage von AWP erklärte.
Allerdings habe sich die Mehrheit der Mitglieder nicht überzeugt gezeigt, dass Actelion "substanzielle Nachweise" für die Wirksamkeit des Mittels vorgelegt habe, hiess es weiter. Dagegen wurde die Sicherheit überwiegend als gegeben angesehen.
In den USA ist Zavesca derzeit als orales Therapeutikum für die Behandlung erwachsener Patienten mit leichter bis mittelschwerer Typ-1-Gaucher-Krankheit zugelassen, bei denen eine Enzymersatztherapie nicht in Betracht kommt.
NPC ist ein sehr seltenes neurodegeneratives, genetisch bedingtes Leiden mit tödlichem Ausgang, das überwiegend Kinder und Jugendliche betrifft, jedoch in jedem Alter einsetzen kann.
http://www.handelszeitung.ch/artikel/Unternehmen-AWP_Actelio…
Actelion/FDA-Ausschuss empfiehlt Zavesca bei Niemann-Pick-Typ-C-Krankheit
Washington (awp) - Ein vorberatender Ausschuss der US-Gesundheitsbehörde FDA hat Zavesca zur Zulassung für die Behandlung von Patienten mit Niemann-Pick-Typ-C-Krankheit (NPC) empfohlen. Dabei überwog bei den Mitgliedern des "Endocrine and Metabolic Drugs Advisory Committee" (EMDAC) die Meinung, dass es derzeit keine anderen Optionen gebe und viele Patienten bereits von dem Mittel profitiert hätten, wie die FDA am Dienstagabend auf Anfrage von AWP erklärte.
Allerdings habe sich die Mehrheit der Mitglieder nicht überzeugt gezeigt, dass Actelion "substanzielle Nachweise" für die Wirksamkeit des Mittels vorgelegt habe, hiess es weiter. Dagegen wurde die Sicherheit überwiegend als gegeben angesehen.
In den USA ist Zavesca derzeit als orales Therapeutikum für die Behandlung erwachsener Patienten mit leichter bis mittelschwerer Typ-1-Gaucher-Krankheit zugelassen, bei denen eine Enzymersatztherapie nicht in Betracht kommt.
NPC ist ein sehr seltenes neurodegeneratives, genetisch bedingtes Leiden mit tödlichem Ausgang, das überwiegend Kinder und Jugendliche betrifft, jedoch in jedem Alter einsetzen kann.
Antwort auf Beitrag Nr.: 38.722.555 von ffdmh am 12.01.10 22:49:5712.01.2010
Actelion/FDA-Ausschuss empfiehlt Zavesca bei Niemann-Pick-Typ-C-Krankheit
Washington (awp) - Ein vorberatender Ausschuss der US-Gesundheitsbehörde FDA hat Zavesca zur Zulassung für die Behandlung von Patienten mit Niemann-Pick-Typ-C-Krankheit (NPC) empfohlen. Dabei überwog bei den Mitgliedern des "Endocrine and Metabolic Drugs Advisory Committee" (EMDAC) die Meinung, dass es derzeit keine anderen Optionen gebe und viele Patienten bereits von dem Mittel profitiert hätten, wie die FDA am Dienstagabend auf Anfrage von AWP erklärte.
Allerdings habe sich die Mehrheit der Mitglieder nicht überzeugt gezeigt, dass Actelion "substanzielle Nachweise" für die Wirksamkeit des Mittels vorgelegt habe, hiess es weiter. Dagegen wurde die Sicherheit überwiegend als gegeben angesehen.
In den USA ist Zavesca derzeit als orales Therapeutikum für die Behandlung erwachsener Patienten mit leichter bis mittelschwerer Typ-1-Gaucher-Krankheit zugelassen, bei denen eine Enzymersatztherapie nicht in Betracht kommt.
NPC ist ein sehr seltenes neurodegeneratives, genetisch bedingtes Leiden mit tödlichem Ausgang, das überwiegend Kinder und Jugendliche betrifft, jedoch in jedem Alter einsetzen kann.
http://www.handelszeitung.ch/artikel/Unternehmen-AWP_Actelio…

Actelion/FDA-Ausschuss empfiehlt Zavesca bei Niemann-Pick-Typ-C-Krankheit
Washington (awp) - Ein vorberatender Ausschuss der US-Gesundheitsbehörde FDA hat Zavesca zur Zulassung für die Behandlung von Patienten mit Niemann-Pick-Typ-C-Krankheit (NPC) empfohlen. Dabei überwog bei den Mitgliedern des "Endocrine and Metabolic Drugs Advisory Committee" (EMDAC) die Meinung, dass es derzeit keine anderen Optionen gebe und viele Patienten bereits von dem Mittel profitiert hätten, wie die FDA am Dienstagabend auf Anfrage von AWP erklärte.
Allerdings habe sich die Mehrheit der Mitglieder nicht überzeugt gezeigt, dass Actelion "substanzielle Nachweise" für die Wirksamkeit des Mittels vorgelegt habe, hiess es weiter. Dagegen wurde die Sicherheit überwiegend als gegeben angesehen.
In den USA ist Zavesca derzeit als orales Therapeutikum für die Behandlung erwachsener Patienten mit leichter bis mittelschwerer Typ-1-Gaucher-Krankheit zugelassen, bei denen eine Enzymersatztherapie nicht in Betracht kommt.
NPC ist ein sehr seltenes neurodegeneratives, genetisch bedingtes Leiden mit tödlichem Ausgang, das überwiegend Kinder und Jugendliche betrifft, jedoch in jedem Alter einsetzen kann.
http://www.handelszeitung.ch/artikel/Unternehmen-AWP_Actelio…

gut getippt 
12.01.2010; 22:33 HUGIN
Zavesca® (miglustat) receives positive vote from the FDA's Endocrinologic and Metabolic Drugs Advisory Committee for the treatment of Niemann-Pick type C disease
Actelion Pharmaceuticals Ltd / Zavesca® (miglustat) receives positive vote from the FDA's Endocrinologic and Metabolic Drugs Advisory Committee for the treatment of Niemann-Pick type C disease processed and transmitted by Hugin AS. The issuer is solely responsible for the content of this announcement.
ALLSCHWIL/BASEL, SWITZERLAND - 12 January 2010 -Actelion Ltd (SIX: ATLN) announced today that United States (US) Food and Drug Administration's (FDA) Endocrinologic and Metabolic Drugs Advisory Committee voted (10 yes to 3 no) in its final vote in question that the benefit/risk profile of Zavesca® (miglustat) supports its approval for the treatment of progressive neurological manifestations in adult patients and pediatric patients with Niemann-Pick type C (NP-C) disease. NP-C disease is a very rare, relentlessly progressive and eventually fatal neurodegenerative genetic disorder for which no specific treatment is currently approved in the US.
The decision was based on results from the clinical trial OGT 918-007 and two multicenter NP-C disease cohort studies as well as other clinical trials in related lysosomal storage disorders for the safety and tolerability evaluation.
Jean-Paul Clozel, M.D. and Chief Executive Officer of Actelion commented: "We are pleased that the Advisory Committee today recognized the importance of this therapeutic advance and voted to recommend approval of the supplemental New Drug Application (sNDA) of Zavesca® for the treatment of NP-C disease. We will continue to work closely with the FDA to facilitate the completion of the priority review of the sNDA."
Zavesca® is the only specific treatment available for patients with NP-C disease. It received approval in the European Union (EU) and other countries in 2009. Zavesca® is also indicated in the US, the EU and other countries for the oral treatment of adult patients with mild to moderate type 1 Gaucher disease for whom enzyme replacement therapy is unsuitable or is not a therapeutic option. The use of Zavesca® is supported by over 10 years of clinical trials and post-marketing experience across indications.
The FDA often seeks the advice of an Advisory Committee when evaluating potential treatments for diseases, for instance when there is no approved therapy available. TheFDA is not bound by the committee's guidance, but takes its recommendation into consideration.
The decision of the FDA for the sNDA is expected in March 2010.
About Niemann-Pick type C disease NP-C disease is a very rare, fatal, neurodegenerative, genetic condition, primarily affecting children and teenagers although the clinical manifestations can become apparent at any age. The symptoms are caused by the storage of some lipids, such as glycosphingolipids and cholesterol, within certain tissues in the body, including the brain. It is invariably progressive and most patients die within five to ten years of diagnosis; for the majority, the disease is fatal during childhood. Neurological deterioration is the key feature of the disease, and can manifest itself as clumsy body movements, balance problems, slow and slurred speech, difficulty in swallowing, problems with eye movements and seizures. Intellectual decline is also common. In the final stages of the disease the child or young adult is frequently bedridden, has little muscle control and is intellectually impaired. Diagnosis of the disease can be difficult and may take years due to the rarity and heterogeneity of this condition. For more information: http://podcasts.mayoclinic.org/2008/07/11/niemann-pick-disea… ###
Notes to the editor About Zavesca® (miglustat) Zavesca® (100 mg miglustat capsule) is indicated for the oral treatment of adult patients with mild to moderate type 1 Gaucher disease. Zavesca® may only be used in the treatment of type 1 Gaucher patients for whom enzyme replacement therapy is unsuitable or is not a therapeutic option. It is approved for this indication in the European Union, the United States, Canada, Switzerland, Brazil, Australia, Turkey, Israel, South Korea, New Zealand and Russia.
In the European Union, South Korea, Brazil and Russia, Zavesca® is also indicated for the treatment of progressive neurological manifestations in adult patients and pediatric patients with Niemann-Pick type C disease.
Zavesca® safety information In clinical studies, the most common adverse events due to Zavesca® included weight loss, diarrhea, and tremor. Other common adverse reactions were flatulence, abdominal pain, headache, and influenza-like symptoms. The most common serious adverse reaction was peripheral neuropathy. Patients should undergo neurological examination at the start of treatment and every 6 months thereafter; Zavesca® should be reassessed in patients who develop symptoms of peripheral neuropathy. Zavesca® should not be used in pregnant woman. Men should maintain reliable contraceptive methods while taking Zavesca® and for 3 months after discontinuing treatment.
Actelion Ltd
Actelion Ltd is a biopharmaceutical company with its corporate headquarters in Allschwil/Basel, Switzerland. Actelion's first drug Tracleer®, an orally available dual endothelin receptor antagonist, has been approved as a therapy for pulmonary arterial hypertension. Actelion markets Tracleer® through its own subsidiaries in key markets worldwide, including the United States (based in South San Francisco), the European Union, Japan, Canada, Australia and Switzerland. Actelion, founded in late 1997, is a leading player in innovative science related to the endothelium - the single layer of cells separating every blood vessel from the blood stream. Actelion's over 1900 employees focus on the discovery, development and marketing of innovative drugs for significant unmet medical needs. Actelion shares are traded on the SIX Swiss Exchange (ticker symbol: ATLN) as part of the Swiss blue-chip index SMI (Swiss Market Index SMI®).
For further information please contact: Roland Haefeli Vice President, Head of Investor Relations & Public Affairs Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil +41 61 565 62 62 +1 650 624 69 36 http://www.actelion.com
[HUG#1372896]
--- End of Message ---
Actelion Pharmaceuticals Ltd Gewerbestrasse 16 Allschwil Switzerland
WKN: 936767;ISIN: CH0010532478;
Press Release PDF: http://hugin.info/131801/R/1372896/336308.pdf
http://www.actelion.com

12.01.2010; 22:33 HUGIN
Zavesca® (miglustat) receives positive vote from the FDA's Endocrinologic and Metabolic Drugs Advisory Committee for the treatment of Niemann-Pick type C disease
Actelion Pharmaceuticals Ltd / Zavesca® (miglustat) receives positive vote from the FDA's Endocrinologic and Metabolic Drugs Advisory Committee for the treatment of Niemann-Pick type C disease processed and transmitted by Hugin AS. The issuer is solely responsible for the content of this announcement.
ALLSCHWIL/BASEL, SWITZERLAND - 12 January 2010 -Actelion Ltd (SIX: ATLN) announced today that United States (US) Food and Drug Administration's (FDA) Endocrinologic and Metabolic Drugs Advisory Committee voted (10 yes to 3 no) in its final vote in question that the benefit/risk profile of Zavesca® (miglustat) supports its approval for the treatment of progressive neurological manifestations in adult patients and pediatric patients with Niemann-Pick type C (NP-C) disease. NP-C disease is a very rare, relentlessly progressive and eventually fatal neurodegenerative genetic disorder for which no specific treatment is currently approved in the US.
The decision was based on results from the clinical trial OGT 918-007 and two multicenter NP-C disease cohort studies as well as other clinical trials in related lysosomal storage disorders for the safety and tolerability evaluation.
Jean-Paul Clozel, M.D. and Chief Executive Officer of Actelion commented: "We are pleased that the Advisory Committee today recognized the importance of this therapeutic advance and voted to recommend approval of the supplemental New Drug Application (sNDA) of Zavesca® for the treatment of NP-C disease. We will continue to work closely with the FDA to facilitate the completion of the priority review of the sNDA."
Zavesca® is the only specific treatment available for patients with NP-C disease. It received approval in the European Union (EU) and other countries in 2009. Zavesca® is also indicated in the US, the EU and other countries for the oral treatment of adult patients with mild to moderate type 1 Gaucher disease for whom enzyme replacement therapy is unsuitable or is not a therapeutic option. The use of Zavesca® is supported by over 10 years of clinical trials and post-marketing experience across indications.
The FDA often seeks the advice of an Advisory Committee when evaluating potential treatments for diseases, for instance when there is no approved therapy available. TheFDA is not bound by the committee's guidance, but takes its recommendation into consideration.
The decision of the FDA for the sNDA is expected in March 2010.
About Niemann-Pick type C disease NP-C disease is a very rare, fatal, neurodegenerative, genetic condition, primarily affecting children and teenagers although the clinical manifestations can become apparent at any age. The symptoms are caused by the storage of some lipids, such as glycosphingolipids and cholesterol, within certain tissues in the body, including the brain. It is invariably progressive and most patients die within five to ten years of diagnosis; for the majority, the disease is fatal during childhood. Neurological deterioration is the key feature of the disease, and can manifest itself as clumsy body movements, balance problems, slow and slurred speech, difficulty in swallowing, problems with eye movements and seizures. Intellectual decline is also common. In the final stages of the disease the child or young adult is frequently bedridden, has little muscle control and is intellectually impaired. Diagnosis of the disease can be difficult and may take years due to the rarity and heterogeneity of this condition. For more information: http://podcasts.mayoclinic.org/2008/07/11/niemann-pick-disea… ###
Notes to the editor About Zavesca® (miglustat) Zavesca® (100 mg miglustat capsule) is indicated for the oral treatment of adult patients with mild to moderate type 1 Gaucher disease. Zavesca® may only be used in the treatment of type 1 Gaucher patients for whom enzyme replacement therapy is unsuitable or is not a therapeutic option. It is approved for this indication in the European Union, the United States, Canada, Switzerland, Brazil, Australia, Turkey, Israel, South Korea, New Zealand and Russia.
In the European Union, South Korea, Brazil and Russia, Zavesca® is also indicated for the treatment of progressive neurological manifestations in adult patients and pediatric patients with Niemann-Pick type C disease.
Zavesca® safety information In clinical studies, the most common adverse events due to Zavesca® included weight loss, diarrhea, and tremor. Other common adverse reactions were flatulence, abdominal pain, headache, and influenza-like symptoms. The most common serious adverse reaction was peripheral neuropathy. Patients should undergo neurological examination at the start of treatment and every 6 months thereafter; Zavesca® should be reassessed in patients who develop symptoms of peripheral neuropathy. Zavesca® should not be used in pregnant woman. Men should maintain reliable contraceptive methods while taking Zavesca® and for 3 months after discontinuing treatment.
Actelion Ltd
Actelion Ltd is a biopharmaceutical company with its corporate headquarters in Allschwil/Basel, Switzerland. Actelion's first drug Tracleer®, an orally available dual endothelin receptor antagonist, has been approved as a therapy for pulmonary arterial hypertension. Actelion markets Tracleer® through its own subsidiaries in key markets worldwide, including the United States (based in South San Francisco), the European Union, Japan, Canada, Australia and Switzerland. Actelion, founded in late 1997, is a leading player in innovative science related to the endothelium - the single layer of cells separating every blood vessel from the blood stream. Actelion's over 1900 employees focus on the discovery, development and marketing of innovative drugs for significant unmet medical needs. Actelion shares are traded on the SIX Swiss Exchange (ticker symbol: ATLN) as part of the Swiss blue-chip index SMI (Swiss Market Index SMI®).
For further information please contact: Roland Haefeli Vice President, Head of Investor Relations & Public Affairs Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil +41 61 565 62 62 +1 650 624 69 36 http://www.actelion.com
[HUG#1372896]
--- End of Message ---
Actelion Pharmaceuticals Ltd Gewerbestrasse 16 Allschwil Switzerland
WKN: 936767;ISIN: CH0010532478;
Press Release PDF: http://hugin.info/131801/R/1372896/336308.pdf
http://www.actelion.com
12.01.2010, 11:31 VONTOBEL RESEARCH
Actelion "buy"
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, stuft die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" unverändert mit dem Rating "buy" ein.
Actelion habe die Umsatz- und Cash-EBIT-Prognose für das GJ09E auf jeweils über 19% in Lokalwährung erhöht. Die vorherige Vorgabe für Actelion habe auf ein Umsatz- und Cash-EBIT-Wachstum von je 16 bis 19% in Lokalwährung gelautet. Die Zahlen für das GJ09 würden am 18. Februar 2010 veröffentlicht.
Anlässlich einer Broker-Konferenz an der Westküste der USA habe der CEO von Actelion die ursprüngliche Schätzung für das Finanzjahr 2009 erneut erhöht. Bis heute gingen die Prognosen der Analysten von Vontobel Research von einem Wachstum von 18,5% in lokalen Währungen aus. Diese Einschätzung liege am oberen Ende der Konsenserwartungen und früherer Unternehmensprognosen.
Die Aufwärtskorrektur der Unternehmensprognose bedeutet, dass die am oberen Ende liegenden Konsenserwartungen der Analysten von Vontobel Research bezüglich Umsatz für das Geschäftsjahr 2009 um 1,2% bzw. 2,8% zu niedrig liegen. Die Analysten von Vontobel Research erhöhen ihre Gewinnerwartung für das GJ09 um ein Prozent. Aussagen des Management zufolge basiere die erhöhte Prognose für das GJ09 auf einer überraschend starken Nachfrage nach den Produkten von Actelion. Dies heiße, dass die Patientenzahl, die diese Medikamente einnehme, auch gewachsen sei. Die Analysten von Vontobel Research erhöhen ihre Gewinnerwartungen für das GJ10 und das GJ11 um jeweils ein Prozent.
Der CEO Dr. Jean-Paul Clozel habe ebenfalls die Prognose für das Geschäftsjahr 2010 bestätigt: ein Umsatzwachstum in Lokalwährung im tiefen zweistelligen Bereich. Die Marktteilnehmer müssten ihre Erwartungen für das GJ09 wahrscheinlich um zwei bis drei Prozent nach oben anpassen. Der CEO habe auch bestätigt, dass die BUILD3-Ergebnisse in den nächsten Wochen bereit sein dürften.
Actelions CEO habe die Vorgabe erneut angehoben. Außerdem sei der Zeitplan für die BUILD3-Studie (Tracleer bei idiopathischer pulmonaler Fibrose) bestätigt worden, d. h. 1Q10. Aus Gesprächen mit dem Management entnehme man, dass die Studie derzeit abgeschlossen werde, da die definierten Ereignisse Ende 2009 eingetreten seien. Man schätze, dass die Ergebnisse Mitte Februar 2010 vorgelegt werden könnten. Die nächsten erwarteten Impulsgeber seien die BUILD3-Daten und die Zahlen für das GJ09 am 18. Februar 2010.
Die Analysten von Vontobel Research bekräftigen ihr "buy"-Rating und das Kursziel von CHF 80,00 für die Aktie von Actelion. (Analyse vom 12.01.2010) (12.01.2010/ac/a/a)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
Actelion "buy"
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, stuft die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" unverändert mit dem Rating "buy" ein.
Actelion habe die Umsatz- und Cash-EBIT-Prognose für das GJ09E auf jeweils über 19% in Lokalwährung erhöht. Die vorherige Vorgabe für Actelion habe auf ein Umsatz- und Cash-EBIT-Wachstum von je 16 bis 19% in Lokalwährung gelautet. Die Zahlen für das GJ09 würden am 18. Februar 2010 veröffentlicht.
Anlässlich einer Broker-Konferenz an der Westküste der USA habe der CEO von Actelion die ursprüngliche Schätzung für das Finanzjahr 2009 erneut erhöht. Bis heute gingen die Prognosen der Analysten von Vontobel Research von einem Wachstum von 18,5% in lokalen Währungen aus. Diese Einschätzung liege am oberen Ende der Konsenserwartungen und früherer Unternehmensprognosen.
Die Aufwärtskorrektur der Unternehmensprognose bedeutet, dass die am oberen Ende liegenden Konsenserwartungen der Analysten von Vontobel Research bezüglich Umsatz für das Geschäftsjahr 2009 um 1,2% bzw. 2,8% zu niedrig liegen. Die Analysten von Vontobel Research erhöhen ihre Gewinnerwartung für das GJ09 um ein Prozent. Aussagen des Management zufolge basiere die erhöhte Prognose für das GJ09 auf einer überraschend starken Nachfrage nach den Produkten von Actelion. Dies heiße, dass die Patientenzahl, die diese Medikamente einnehme, auch gewachsen sei. Die Analysten von Vontobel Research erhöhen ihre Gewinnerwartungen für das GJ10 und das GJ11 um jeweils ein Prozent.
Der CEO Dr. Jean-Paul Clozel habe ebenfalls die Prognose für das Geschäftsjahr 2010 bestätigt: ein Umsatzwachstum in Lokalwährung im tiefen zweistelligen Bereich. Die Marktteilnehmer müssten ihre Erwartungen für das GJ09 wahrscheinlich um zwei bis drei Prozent nach oben anpassen. Der CEO habe auch bestätigt, dass die BUILD3-Ergebnisse in den nächsten Wochen bereit sein dürften.
Actelions CEO habe die Vorgabe erneut angehoben. Außerdem sei der Zeitplan für die BUILD3-Studie (Tracleer bei idiopathischer pulmonaler Fibrose) bestätigt worden, d. h. 1Q10. Aus Gesprächen mit dem Management entnehme man, dass die Studie derzeit abgeschlossen werde, da die definierten Ereignisse Ende 2009 eingetreten seien. Man schätze, dass die Ergebnisse Mitte Februar 2010 vorgelegt werden könnten. Die nächsten erwarteten Impulsgeber seien die BUILD3-Daten und die Zahlen für das GJ09 am 18. Februar 2010.
Die Analysten von Vontobel Research bekräftigen ihr "buy"-Rating und das Kursziel von CHF 80,00 für die Aktie von Actelion. (Analyse vom 12.01.2010) (12.01.2010/ac/a/a)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
13.01.2010, 11:22 VONTOBEL RESEARCH
Actelion "buy"
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, stuft die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" mit dem Rating "buy" ein.
Gestern Abend habe der FDA-Beratungsausschuss (AdCom) zu Endokrinologie- und Metabolismusthemen mit zehn zu drei Stimmen zugunsten von Actelions Medikament Zavesca gestimmt. Der AdCom-Ausschuss habe das Risiko-Nutzenverhältniss befürwortet, das das Medikament Erwachsenen und Kindern biete, die an der genetischen Störung Niemann Pick C leiden würden. Niemann Pick C sei eine sehr seltene genetisch-bedingte Stoffwechselstörung, an der in der entwickelten Welt etwa 1.000 bis 1.500 Patienten leiden würden.
Der AdCom-Entscheid der US-Gesundheitsbehörde FDA bedeute gute Neuigkeiten für Actelion. Man erwarte, dass das Medikament Zavesca im März vom FDA für die Behandlung von Niemann Pick C zugelassen werde. Die AdCom sei zum demselben Ergebnis wie das CHMP der EU gekommen, dass, obwohl die Studie ihren primären Endpunkt verpasst habe, die Ergebnisse verwendet werden könnten, um den Nutzen bei dieser Patientengruppe zu bestimmen. Die AdCom sei jedoch zum Ergebnis gekommen, dass die Studiendaten keine eindeutige Wirksamkeit an den Tag legen würden. Die Sicherheit sei hingegen ausreichend überprüft worden.
Das PDUFA-Datum für Zavesca sei der 10. März 2010. Man erwarte, dass die US-Gesundheitsbehörde FDA ebenso wie die EMEA dem Medikament für diese neue Indikation eine Zulassung erteilen werde. Man erwarte, dass der Umsatz von CHF 56 Mio. (GJ09) in den GJ11/12 auf CHF 110 Mio. ansteigen werde. Danach dürfte der Umsatz aufgrund der auslaufenden Patentrechte abnehmen. Eine Zulassung der US-Behörde ist bereits in die Umsatzprognose der Analysten von Vontobel Research einbezogen. Die Entscheidung der letzten Nacht bedeute also gute Neuigkeiten für Actelion, ändere jedoch nichts an den Erwartungen der Analysten.
Der AdCom-Ausschuss zu Zavesca habe für das Risiko-Nutzenprofil von Zavesca gestimmt. Daher erwarte man, dass die FDA das Medikament Anfang März 2010 für die Behandlung von Niemann Pick C zulassen werde.
Die nächsten Impulsgeber für den Titel seien die Ergebnisse für das Geschäftsjahr 2009, die am 18. Februar 2010 erwartet würden, sowie die Ergebnisse der BUILD-3-Studie. Diese Daten würden für Mitte Februar 2010 erwartet.
Die Analysten von Vontobel Research bewerten die Actelion-Aktie mit dem Rating "buy" und einem Kursziel von CHF 80,00. (Analyse vom 13.01.2010) (13.01.2010/ac/a/a)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
Actelion "buy"
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, stuft die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" mit dem Rating "buy" ein.
Gestern Abend habe der FDA-Beratungsausschuss (AdCom) zu Endokrinologie- und Metabolismusthemen mit zehn zu drei Stimmen zugunsten von Actelions Medikament Zavesca gestimmt. Der AdCom-Ausschuss habe das Risiko-Nutzenverhältniss befürwortet, das das Medikament Erwachsenen und Kindern biete, die an der genetischen Störung Niemann Pick C leiden würden. Niemann Pick C sei eine sehr seltene genetisch-bedingte Stoffwechselstörung, an der in der entwickelten Welt etwa 1.000 bis 1.500 Patienten leiden würden.
Der AdCom-Entscheid der US-Gesundheitsbehörde FDA bedeute gute Neuigkeiten für Actelion. Man erwarte, dass das Medikament Zavesca im März vom FDA für die Behandlung von Niemann Pick C zugelassen werde. Die AdCom sei zum demselben Ergebnis wie das CHMP der EU gekommen, dass, obwohl die Studie ihren primären Endpunkt verpasst habe, die Ergebnisse verwendet werden könnten, um den Nutzen bei dieser Patientengruppe zu bestimmen. Die AdCom sei jedoch zum Ergebnis gekommen, dass die Studiendaten keine eindeutige Wirksamkeit an den Tag legen würden. Die Sicherheit sei hingegen ausreichend überprüft worden.
Das PDUFA-Datum für Zavesca sei der 10. März 2010. Man erwarte, dass die US-Gesundheitsbehörde FDA ebenso wie die EMEA dem Medikament für diese neue Indikation eine Zulassung erteilen werde. Man erwarte, dass der Umsatz von CHF 56 Mio. (GJ09) in den GJ11/12 auf CHF 110 Mio. ansteigen werde. Danach dürfte der Umsatz aufgrund der auslaufenden Patentrechte abnehmen. Eine Zulassung der US-Behörde ist bereits in die Umsatzprognose der Analysten von Vontobel Research einbezogen. Die Entscheidung der letzten Nacht bedeute also gute Neuigkeiten für Actelion, ändere jedoch nichts an den Erwartungen der Analysten.
Der AdCom-Ausschuss zu Zavesca habe für das Risiko-Nutzenprofil von Zavesca gestimmt. Daher erwarte man, dass die FDA das Medikament Anfang März 2010 für die Behandlung von Niemann Pick C zulassen werde.
Die nächsten Impulsgeber für den Titel seien die Ergebnisse für das Geschäftsjahr 2009, die am 18. Februar 2010 erwartet würden, sowie die Ergebnisse der BUILD-3-Studie. Diese Daten würden für Mitte Februar 2010 erwartet.
Die Analysten von Vontobel Research bewerten die Actelion-Aktie mit dem Rating "buy" und einem Kursziel von CHF 80,00. (Analyse vom 13.01.2010) (13.01.2010/ac/a/a)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
ZURICH -(Dow Jones)- Swiss biotech company Actelion Ltd. (ATLN.VX) doesn't expect a significant delay of the study program for its experimental sleeping pill almorexant, company spokesman Roland Haefeli said Friday.
"The safety observations we made in a late-stage trial with almorexant will lead only to a slight delay of the current schedule," he said.
The observations don't change the number of patients needed for the late-stage trials nor the time needed to enroll and treat the patients, Haefeli added.
In December, Actelion said it made "some safety observations" in a short-term, late-stage trial with almorexant. It didn't offer further details.
The company is currently preparing further late-stage trials in adults and elderly patients that will evaluate the long-term efficacy and safety of the drug.
UBS analyst Martin Wales attributes a 65% success rate to the drug, which could be launched in 2013. He sees a sales potential of up to 1.2 billion Swiss francs ($1.12 billion) by 2019.
The next trigger for Actelion's shares will be the release of data of the company's key drug Tracleer in patients that suffer from idiopathic pulmonary fibrosis, or IPF, a fatal lung disease.
"The data should read out over the next weeks," Haefeli said.
Actelion's shares closed Friday down 0.7% at CHF57.60.
Quelle: SQ-News
"The safety observations we made in a late-stage trial with almorexant will lead only to a slight delay of the current schedule," he said.
The observations don't change the number of patients needed for the late-stage trials nor the time needed to enroll and treat the patients, Haefeli added.
In December, Actelion said it made "some safety observations" in a short-term, late-stage trial with almorexant. It didn't offer further details.
The company is currently preparing further late-stage trials in adults and elderly patients that will evaluate the long-term efficacy and safety of the drug.
UBS analyst Martin Wales attributes a 65% success rate to the drug, which could be launched in 2013. He sees a sales potential of up to 1.2 billion Swiss francs ($1.12 billion) by 2019.
The next trigger for Actelion's shares will be the release of data of the company's key drug Tracleer in patients that suffer from idiopathic pulmonary fibrosis, or IPF, a fatal lung disease.
"The data should read out over the next weeks," Haefeli said.
Actelion's shares closed Friday down 0.7% at CHF57.60.
Quelle: SQ-News
27.01.2010, 10:11 VONTOBEL RESEARCH
Actelion "buy"
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, bewertet die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" mit dem Rating "buy".
Gestern Abend nach Marktschluss in den USA habe Gilead seine Zahlen bekannt gegeben. Der Umsatz von Letairis habe sich auf USD 52,2 Mio. belaufen, womit er sehr dicht an der Schätzung der Analysten von USD 53 Mio. gelegen habe.
Gileads Letairis (Ambrisentan), ein einfach wirksamer Endothelin-Rezeptor-Antagonist zur Behandlung von PAH, scheine mit Tracleer von Actelion nicht konkurrieren zu können. Actelion sei auf dem PAH-Markt sehr gut etabliert und unterhalte sehr enge Beziehungen zu den Ärzten in den USA, die das Medikament verschreiben würden. Ebenso habe die Analysten in Europa die Einführung von Volibris (Ambrisentan) durch GlaxoSmithKline nicht beeindrucken können.
Actelion habe vor Kurzem seine Umsatzvorgabe für das Geschäftsjahr 2009 auf mehr als 19% in der Lokalwährung angehoben. Ergebnisse würden am 18. Februar 2010 erwartet.
Die Analysten von Vontobel Research stufen die Actelion-Aktie mit einem Kursziel von CHF 80 und dem Rating "buy" ein. (Analyse vom 27.01.2010) (27.01.2010/ac/a/a)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
Actelion "buy"
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, bewertet die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" mit dem Rating "buy".
Gestern Abend nach Marktschluss in den USA habe Gilead seine Zahlen bekannt gegeben. Der Umsatz von Letairis habe sich auf USD 52,2 Mio. belaufen, womit er sehr dicht an der Schätzung der Analysten von USD 53 Mio. gelegen habe.
Gileads Letairis (Ambrisentan), ein einfach wirksamer Endothelin-Rezeptor-Antagonist zur Behandlung von PAH, scheine mit Tracleer von Actelion nicht konkurrieren zu können. Actelion sei auf dem PAH-Markt sehr gut etabliert und unterhalte sehr enge Beziehungen zu den Ärzten in den USA, die das Medikament verschreiben würden. Ebenso habe die Analysten in Europa die Einführung von Volibris (Ambrisentan) durch GlaxoSmithKline nicht beeindrucken können.
Actelion habe vor Kurzem seine Umsatzvorgabe für das Geschäftsjahr 2009 auf mehr als 19% in der Lokalwährung angehoben. Ergebnisse würden am 18. Februar 2010 erwartet.
Die Analysten von Vontobel Research stufen die Actelion-Aktie mit einem Kursziel von CHF 80 und dem Rating "buy" ein. (Analyse vom 27.01.2010) (27.01.2010/ac/a/a)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
11.02.10, 11:00 HELVEA SA
Actelion "buy"
Rating-Update:
Genf (aktiencheck.de AG) - Olav Zilian, Analyst von Helvea, stuft die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) mit "buy" ein. Das Kursziel sehe man bei CHF 86. (11.02.2010/ac/a/u)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.

Actelion "buy"
Rating-Update:
Genf (aktiencheck.de AG) - Olav Zilian, Analyst von Helvea, stuft die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) mit "buy" ein. Das Kursziel sehe man bei CHF 86. (11.02.2010/ac/a/u)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.

Actelion announces Full year 2009 financial results
2009 Total net revenues of CHF 1,772.6 million, up 23 percent in local currencies - Tracleer® sales of CHF 1,508.0 million, up 19 percent in local currencies - Non-GAAP (cash) EBIT of CHF 567.9 million, up 25 percent in local currencies - Positive outlook for existing business Focus on innovation creates additional growth opportunities - 11 compounds in development - Two Phase III studies to report in 2010
ALLSCHWIL/BASEL, SWITZERLAND - 18 February 2010 - Actelion Ltd (SIX: ATLN) today announced its financial results for the full year 2009. With total net revenues CHF1,772.6 million (FY 2008: CHF 1,473.5 m) and operating expenses of CHF 1,433.2 million (FY 2008: CHF 1,102.2 m), the company reported a full year 2009 operating profit of CHF 339.4 million (FY 2008: CHF 371.4 m).
For the full year 2009, Actelion reported a non-GAAP (cash) EBIT of CHF 567.9 million, an increase of 19 percent compared to 2008. In local currencies, non-GAAP (cash) EBIT increased by 25 percent. Adjusted (non-GAAP) diluted earnings per share for the 2009 were CHF 4.38, compared to CHF 3.38 during the same period last year.
The non-GAAP (cash) EBIT and adjusted non-GAAP diluted earnings per share exclude charges such as In-Process R&D, charges related to employee stock options under ASC 718, non-cash depreciation and amortization charges as well as other one-off items which would distort comparative analysis.
On a US GAAP basis, net profit for the full year 2009 was CHF 311.3 million (FY 2008: CHF 306.1 m). Fully diluted earnings per share (EPS) on a US GAAP basis for the same period were CHF 2.53, compared to CHF 2.48 for 2008.
Jean-Paul Clozel, M.D. and Chief Executive Officer commented: "Actelion has become a stronger company in 2009. The sales of our products continued to grow in an increasingly competitive environment. Our clinical pipeline continues to mature, with five compounds in advanced development stage. By focusing on innovation, we have created a wide range of growth opportunities. Our marketing and sales infrastructure in all key pharmaceutical markets worldwide, will allow us to generate best value for our existing and future products."
Jean-Paul Clozel continued: "In 2009, we have demonstrated our commitment to improve the quality of patients' lives. By introducing a new special pediatric formulation of Tracleer® in the EU, we are helping to treat children with Pulmonary Arterial Hypertension (PAH). In addition, we have introduced Zavesca® in the EU for the treatment of the very rare orphan disease Niemann-Pick type C."
Jean-Paul Clozel concluded: "I view the outlook for 2010 positively. I expect our existing business to continue to grow. I am looking forward to the results of our two pivotal Phase III programs reporting this year.
Andrew J. Oakley, Chief Financial Officer commented: "In 2009, Actelion delivered on its promise to drive growth, in terms of product sales as well as in terms of cash generation, with non-GAAP (cash) EBIT up 25 percent in local currencies. We have continued building a leveragable platform for future growth through ongoing investment in research and development and ongoing investment in infrastructure. Going forward, we will operate from an even stronger base."
Andrew J. Oakley concluded: "We will continue in 2010 to leverage the growth platforms developed over the last few years. Unforeseen events excluded, we believe that total net revenue growth in local currencies will be above 10 percent and non-GAAP (cash) EBIT growth, again in local currencies, will be close to 20 percent."
The full financial statements can be found on http://www.actelion.com.
Continued growth of total net revenues
During the full year 2009, Actelion's total net revenues increased by 20 percent to CHF 1,772.6 million (FY 2008: CHF 1,473.5 m). In local currencies, total net revenues increased by 23 percent compared to 2008.
Contract revenues for 2009 amounted to CHF 74.6 million (FY 2008: CHF 44.6 m).
Product sales
During the full year 2009, Tracleer® (bosentan) sales were CHF 1,508.0 million (FY 2008: CHF 1,294.1 m). In local currencies, this represents an increase of 19 percent compared to the same period last year.
At the end of December 2009, Tracleer® was commercially available in over 55 countries worldwide, including all major pharmaceutical markets.
In August 2009, Tracleer® received a label extension in US for the treatment of patients with mildly symptomatic WHO Functional Class II pulmonary arterial hypertension. This label extension follows the EMEA FC II label approval in 2008 and was based on the EARLY (Endothelin Antagonist tRial in miLdlY symptomatic PAH patients) study, published in the Lancet in June 2008. EARLY, the first study exclusively performed in patients with mildly symptomatic WHO Functional Class II, demonstrated the relentlessly progressive nature of PAH, even in its early stages. It also highlighted the need for earlier treatment and intervention in PAH management. In the EARLY study, although the improvement of 6MWT had not reached statistical significance, Tracleer® had demonstrated a highly significant reduction of disease progression as assessed by clinical worsening events as compared to placebo.
Additionally, 2009 saw the approval of a pediatric formulation of Tracleer® in Europe. This indication makes Tracleer® the first oral PAH treatment with an approved pediatric formulation in children aged from two years.
Otto Schwarz, President Business Operations, commented: "The strong growth momentum of Tracleer® sales is remarkable, reflecting strong demand for innovative treatments in PAH as well as - in the EU - for the prevention of Digital Ulcerations in patients suffering from systemic scleroderma. Sales growth is also the result of our commercial efforts based on strong product labeling, strong relationships with key stakeholders, and excellence in execution on our competitive and market-building strategies."
Ventavis® (iloprost) sales amounted to CHF 136.9 million for the full year 2009
(FY 2008: CHF 94.6 m). This represents an increase of 44 percent in US Dollars.
In early August 2009, the FDA approved a new 20 microgram per milliliter (mcg/ml) formulation of Ventavis® as a therapy for New York Heart Association Class III and IV PAH. This increased-strength formulation delivers the same dose in half the volume, which is expected to both reduce inhalation time and improve convenience for patients. A clinical program to evaluate the use of a higher-powered disk for the delivery device has recently concluded and Actelion is currently reviewing further development options.
Efforts are ongoing to further strengthen our PAH franchise with the forthcoming market introduction of an improved formulation of epoprostenol sodium for the intravenous treatment of primary and scleroderma related PAH. This medication was acquired from privately-held GeneraMedix Inc. in the first half of 2009.
The drug was approved in June 2008 in the United States for the long-term intravenous treatment of primary pulmonary hypertension and pulmonary hypertension associated with the scleroderma spectrum of disease in NYHA Class III and Class IV patients who do not respond adequately to conventional therapy. In France, Actelion has initiated regulatory activities for this product. Further regulatory filings are in preparation in other markets worldwide. Actelion is also starting a dedicated program to generate clinical experience data with this product.
In 2009, sales of Zavesca® (miglustat) grew to CHF 53.1 million - an increase of 38 percent in local currencies (32 percent in CHF). This increase was mainly due to the approval of the new indication Niemann-Pick type C disease (NP-C) by the European Commission in January 2009, with first reimbursements granted by mid-2009. Sales in the type 1 Gaucher disease indication also continued to grow.
Zavesca® is commercially available in over 35 countries including the United States and most European markets for the treatment of adult patients with mild to moderate type 1 Gaucher disease for whom enzyme replacement therapy (ERT) is not a therapeutic option.
In January 2009, Zavesca® received approval in the European Union for the treatment of progressive neurological manifestations in adult and pediatric patients with NP-C. Zavesca® is the first treatment to be approved for patients with NP-C, a very rare and devastating neurodegenerative genetic disorder affecting both children and adults.
At the end of 2009, Zavesca® was also approved for the treatment of patients with NP-C in Brazil, South Korea and Russia, with applications under evaluation in Australia, Canada, Colombia, Switzerland and Thailand.
In November 2009, Actelion announced that the FDA had granted a priority review for a supplemental new drug application (sNDA) concerning an extended indication for Zavesca® - for the treatment of progressive neurological manifestations in adult and pediatric patients with NP-C. The Endocrine and Metabolic Drug Advisory Committee (EMDAC) reviewed the sNDA in early January 2010 and voted that the benefit/risk profile of Zavesca® (miglustat) supports its approval for the treatment of progressive neurological manifestations in adult patients and pediatric patients with Niemann-Pick type C disease. A response from the FDA is expected later in 2010.
Otto Schwarz concluded: "At the end of 2009, our global commercial presence included 28 operational affiliates in all key pharmaceutical markets, including Japan where our efforts to expand the PAH market further generated significant return on investment. With our strong data-driven approach, I am confident that in 2010, we will continue to grow Tracleer® sales in PAH globally and the indication digital ulceration in Europe. In Europe, as well as in other markets where we obtain approval for NP-C, we will accompany market introductions with increased educational efforts to facilitate disease awareness. In the United States, we are fully prepared for the recent change in the competitive landscape, with another inhaled therapeutic option for PAH launched Q3 2009 by a competitor."
In February 2010, the existing collaboration with Nippon Shinyaku and Actelion's position in Japan was further strengthened. The two companies decided that in Japan, they will co‑develop and co-commercialize the highly potent endothelin receptor antagonist macitentan, currently in clinical development. Such an option was part of the initial agreement for the oral, non-prostanoid IP receptor agonist.
Operating expenses
During the full year 2009, operating expenses were CHF 1,433.2 million (FY 2008: CHF 1,102.2 m).
During the same period, research and development expenses increased by 24 percent to CHF 464.1 million (FY 2008: CHF 374.5 m). Full year 2008 operating expenses included milestone payments related to the IP receptor agonist in-licensed from Nippon Shinyaku. A third payment related to the commencement of the Phase III study was made in December 2009.
Selling, general and administrative expenses for 2009 amounted to CHF 645.5 million (FY 2008: CHF 550.0 m), an increase of 17 percent.
Research and Development
At the end of 2009, Actelion's pipeline had 11 compounds in clinical development as well as around 25 active projects in drug discovery.
Actelion is currently pursuing five ongoing Phase III programs:
Almorexant in primary insomnia: Almorexant is investigated in the Phase III program RESTORA (REstore physiological Sleep with The Orexin Receptor antagonist Almorexant). The first Phase III study, RESTORA 1 met its primary endpoint, superiority of the dual orexin receptor antagonist almorexant compared to placebo on objective and subjective wake after sleep onset (WASO). The finding was highly significant (p<0.001). In addition, several secondary endpoints of the study were met with statistical significance.
In RESTORA 1, the use of almorexant was well-tolerated. However, in this study as well as in the ongoing non-pivotal program, certain safety observations were made that will require further evaluation and assessment in longer-term Phase III studies. The Phase III studies are currently in preparation - in both adults and elderly patients suffering from insomnia - and will evaluate long-term efficacy and safety.
Bosentan (Tracleer®) in IPF: This multicenter, double-blind, randomized, placebo-controlled, parallel group, event-driven morbidity/mortality study (BUILD-3) is evaluating the safety and efficacy of bosentan 125mg b.i.d. in patients diagnosed with idiopathic pulmonary fibrosis (IPF). BUILD-3 enrollment was completed in October 2008 with 616 patients.
Upon reaching 202 confirmed events, Actelion started closing procedures at the end of 2009. Top-line results are expected in the first quarter of 2010.
Clazosentan in aSAH: Clazosentan is investigated in the pivotal Phase III study CONSCIOUS-2 (Clazosentan to Overcome Neurological iSChemia and Infarct Occurring after Subarachnoid hemorrhage) in 1,100 patients with aSAH and treated with aneurysmal surgical clipping. The study will measure the clinical benefits of clazosentan through the primary endpoint of vasospasm-related morbidity and all-cause mortality.
CONSCIOUS-2 results are expected to become available in the second half of 2010. If successful, Actelion will approach health authorities for filing.
A second Phase III study with Clazosentan, CONSCIOUS-3, has commenced enrollment, this time evaluating efficacy and safety clazosentan in patients post-aSAH treated by endovascular coiling.
Macitentan in PAH: Macitentan is investigated in the Phase III study SERAPHIN (Study with an Endothelin Receptor Antagonist in Pulmonary arterial Hypertension to Improve cliNical outcome). This study is designed to evaluate the safety and efficacy of this highly potent, tissue-targeting, endothelin receptor antagonist through the primary endpoint of morbidity and all-cause mortality in patients with symptomatic PAH.
Global enrollment was completed in December 2009 with a total of 742 patients. Study results could become available earlier than initially foreseen - which was the end of 2012.
Selexipag (proposed INN) in PAH: At the end of 2009, Actelion has progressed its first-in-class, orally active, non-prostanoid IP receptor agonist, selexipag, into a Phase III morbidity/mortality study in pulmonary arterial hypertension.
In a 43-patient Phase IIa study concluded in mid-2009, the primary endpoint of pulmonary vascular resistance (PVR) change from baseline was met with high statistical significance.
Guy Braunstein, M.D. and head of clinical development at Actelion commented. "In 2009, we have made significant progress in advancing a growing number of our projects. Despite the growing complexity of conducting clinical trials on a global scale, we were able to complete our studies in the timeframe foreseen and with the required quality. In 2010, we will have even more clinical studies ongoing. Naturally, we are also fully prepared for regulatory filings, if warranted, for our two upcoming Phase III studies that will report this year."
The earlier-stage clinical development programs include:
CRTH2 receptor antagonist in asthma: Positive data was obtained in 2009 in a proof-of-mechanism study with Actelion's orally active CRTH2 receptor antagonist in mild asthma.
Plans for initiating a Phase II dose-finding study in asthma are ongoing with further clinical studies in this and other indications planned for 2010, once additional preclinical studies have concluded.
Macitentan in IPF: A pilot clinical development study with this highly potent, tissue-targeting, endothelin receptor antagonist in idiopathic pulmonary fibrosis has commenced enrollment in H1 2009.
Miglustat in Cystic Fibrosis: A first Phase IIa study with miglustat in cystic fibrosis was concluded in mid-2009. Following further preclinical and clinical analysis, a newly designed proof-of-concept study will be initiated in 2010.
Selective S1P1 receptor agonist in multiple sclerosis: Following a successful Phase I program, Actelion's first-in-class selective S1P1 receptor agonist started enrolling patients with multiple sclerosis in a Phase IIb dose-finding study.
Selective S1P1 receptor agonist in psoriasis: Actelion has advanced its selective S1P1 receptor agonist for the treatment of psoriasis based on a Phase IIa proof-of-concept study. While this short term study did not reach statistical significance, sufficient information was obtained to proceed with a first pivotal study in psoriasis.
In 2009, Actelion also commenced Phase I studies for a novel antibiotic and a novel cardiovascular agent.
Martine Clozel, MD and Chief Scientific Officer at Actelion commented: "Actelion's platform approach, combined with our technological capabilities and in-house expertise, has resulted in two novel compounds progressing into clinical development in 2009. Several compounds are currently in full preclinical development."
Martine Clozel concluded: "Actelion Drug Discovery currently works on another 15 projects in lead optimization phase, a clear sign of our high research productivity. The progressive focus on specialized therapeutic areas of cardiovascular/fibrosis, immunology/allergy/inflammation, CNS, anti-infectives and oncology, has created a mature and concentrated Drug Discovery portfolio."
Operating profit
Actelion's operating profit for the full year 2009 was CHF 339.4 million (FY 2008: CHF 371.4 m) impacted by the litigation settlement of CHF 93.7 million announced in December 2009 related to an arbitration proceeding regarding a license agreement to develop Asahi Kasei's rho kinase inhibitor, fasudil. Non-GAAP (cash) EBIT (excluding this settlement) for the same period amounted to CHF 567.9 million (FY 2008: CHF 476.8 m).
Net Profit
The net profit of CHF 311.3 million (FY 2008: CHF 306.1 m) for the full year 2009 includes interest income of CHF 4.4 million, predominantly non-cash interest expense of CHF 7.5 million, non-cash interest and amortization charges on the Convertible Bond of CHF 17.9 million, foreign currency gains of CHF 20.0 million and an income tax expense of CHF 27.3 million.
Cash and cash flow
During 2009, Actelion generated net cash flow from operations of CHF 424.2 million (FY 2008: CHF 513.7 m). As of 31 December 2009, total liquid funds (excluding 9.8 million treasury shares) amounted to CHF 1.3 billion.
Strong talent growth
At the end of 2009, Actelion employed 2,263 employees worldwide, an increase of more than 310 staff compared to the end of 2008. Of those 2,263 employees, 984 were located in Switzerland (2008: 862 employees).
In 2010, Actelion expects to increase its global work force to above 2,500 employees. In Switzerland, Actelion expects to employ by year-end 2010 more than 1,100 employees.
Upcoming Corporate Events
Q1 2010
Thursday, 22 April, 2010
Tuesday, 4 May, 2010
Mid-2010
Thursday, 22 July, 2010
Thursday, 21 October, 2010
- BUILD-3 in IPF
- Q1 Results 2010
- AGM 2010
- CONSCIOUS-2 in clipped aSAH
- Half Year Results 2010
- Q3 Results 2010
###
Actelion Ltd
Actelion Ltd is a biopharmaceutical company with its corporate headquarters in Allschwil/Basel, Switzerland. Actelion's first drug Tracleer®, an orally available dual endothelin receptor antagonist, has been approved as a therapy for pulmonary arterial hypertension. Actelion markets Tracleer® through its own subsidiaries in key markets worldwide, including the United States (based in South San Francisco), the European Union, Japan, Canada, Australia and Switzerland. Actelion, founded in late 1997, is a leading player in innovative science related to the endothelium - the single layer of cells separating every blood vessel from the blood stream. Actelion's over 2,200 employees focus on the discovery, development and marketing of innovative drugs for significant unmet medical needs. Actelion shares are traded on the SIX Swiss Exchange (ticker symbol: ATLN) as part of the Swiss blue-chip index SMI (Swiss Market Index SMI®).
For further information please contact:
Roland Haefeli
Vice President, Head of Investor Relations & Public Affairs
Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil
+41 61 565 62 62
+1 646 737 49 72
http://www.actelion.com
Conference Call
Actelion will host an Investor Conference Call / Webcast as follows:
Date/Time:
18 February 2010
12:30 - 14:30
Basel (CEST)
11:30 - 13:30
U.K. (BST)
06:30 - 08:30
U.S. (EST)
Conference Call Connect #:
Dial-in participants should start calling the number below 10-15 minutes before the Conference is due to start.
2009 Total net revenues of CHF 1,772.6 million, up 23 percent in local currencies - Tracleer® sales of CHF 1,508.0 million, up 19 percent in local currencies - Non-GAAP (cash) EBIT of CHF 567.9 million, up 25 percent in local currencies - Positive outlook for existing business Focus on innovation creates additional growth opportunities - 11 compounds in development - Two Phase III studies to report in 2010
ALLSCHWIL/BASEL, SWITZERLAND - 18 February 2010 - Actelion Ltd (SIX: ATLN) today announced its financial results for the full year 2009. With total net revenues CHF1,772.6 million (FY 2008: CHF 1,473.5 m) and operating expenses of CHF 1,433.2 million (FY 2008: CHF 1,102.2 m), the company reported a full year 2009 operating profit of CHF 339.4 million (FY 2008: CHF 371.4 m).
For the full year 2009, Actelion reported a non-GAAP (cash) EBIT of CHF 567.9 million, an increase of 19 percent compared to 2008. In local currencies, non-GAAP (cash) EBIT increased by 25 percent. Adjusted (non-GAAP) diluted earnings per share for the 2009 were CHF 4.38, compared to CHF 3.38 during the same period last year.
The non-GAAP (cash) EBIT and adjusted non-GAAP diluted earnings per share exclude charges such as In-Process R&D, charges related to employee stock options under ASC 718, non-cash depreciation and amortization charges as well as other one-off items which would distort comparative analysis.
On a US GAAP basis, net profit for the full year 2009 was CHF 311.3 million (FY 2008: CHF 306.1 m). Fully diluted earnings per share (EPS) on a US GAAP basis for the same period were CHF 2.53, compared to CHF 2.48 for 2008.
Jean-Paul Clozel, M.D. and Chief Executive Officer commented: "Actelion has become a stronger company in 2009. The sales of our products continued to grow in an increasingly competitive environment. Our clinical pipeline continues to mature, with five compounds in advanced development stage. By focusing on innovation, we have created a wide range of growth opportunities. Our marketing and sales infrastructure in all key pharmaceutical markets worldwide, will allow us to generate best value for our existing and future products."
Jean-Paul Clozel continued: "In 2009, we have demonstrated our commitment to improve the quality of patients' lives. By introducing a new special pediatric formulation of Tracleer® in the EU, we are helping to treat children with Pulmonary Arterial Hypertension (PAH). In addition, we have introduced Zavesca® in the EU for the treatment of the very rare orphan disease Niemann-Pick type C."
Jean-Paul Clozel concluded: "I view the outlook for 2010 positively. I expect our existing business to continue to grow. I am looking forward to the results of our two pivotal Phase III programs reporting this year.
Andrew J. Oakley, Chief Financial Officer commented: "In 2009, Actelion delivered on its promise to drive growth, in terms of product sales as well as in terms of cash generation, with non-GAAP (cash) EBIT up 25 percent in local currencies. We have continued building a leveragable platform for future growth through ongoing investment in research and development and ongoing investment in infrastructure. Going forward, we will operate from an even stronger base."
Andrew J. Oakley concluded: "We will continue in 2010 to leverage the growth platforms developed over the last few years. Unforeseen events excluded, we believe that total net revenue growth in local currencies will be above 10 percent and non-GAAP (cash) EBIT growth, again in local currencies, will be close to 20 percent."
The full financial statements can be found on http://www.actelion.com.
Continued growth of total net revenues
During the full year 2009, Actelion's total net revenues increased by 20 percent to CHF 1,772.6 million (FY 2008: CHF 1,473.5 m). In local currencies, total net revenues increased by 23 percent compared to 2008.
Contract revenues for 2009 amounted to CHF 74.6 million (FY 2008: CHF 44.6 m).
Product sales
During the full year 2009, Tracleer® (bosentan) sales were CHF 1,508.0 million (FY 2008: CHF 1,294.1 m). In local currencies, this represents an increase of 19 percent compared to the same period last year.
At the end of December 2009, Tracleer® was commercially available in over 55 countries worldwide, including all major pharmaceutical markets.
In August 2009, Tracleer® received a label extension in US for the treatment of patients with mildly symptomatic WHO Functional Class II pulmonary arterial hypertension. This label extension follows the EMEA FC II label approval in 2008 and was based on the EARLY (Endothelin Antagonist tRial in miLdlY symptomatic PAH patients) study, published in the Lancet in June 2008. EARLY, the first study exclusively performed in patients with mildly symptomatic WHO Functional Class II, demonstrated the relentlessly progressive nature of PAH, even in its early stages. It also highlighted the need for earlier treatment and intervention in PAH management. In the EARLY study, although the improvement of 6MWT had not reached statistical significance, Tracleer® had demonstrated a highly significant reduction of disease progression as assessed by clinical worsening events as compared to placebo.
Additionally, 2009 saw the approval of a pediatric formulation of Tracleer® in Europe. This indication makes Tracleer® the first oral PAH treatment with an approved pediatric formulation in children aged from two years.
Otto Schwarz, President Business Operations, commented: "The strong growth momentum of Tracleer® sales is remarkable, reflecting strong demand for innovative treatments in PAH as well as - in the EU - for the prevention of Digital Ulcerations in patients suffering from systemic scleroderma. Sales growth is also the result of our commercial efforts based on strong product labeling, strong relationships with key stakeholders, and excellence in execution on our competitive and market-building strategies."
Ventavis® (iloprost) sales amounted to CHF 136.9 million for the full year 2009
(FY 2008: CHF 94.6 m). This represents an increase of 44 percent in US Dollars.
In early August 2009, the FDA approved a new 20 microgram per milliliter (mcg/ml) formulation of Ventavis® as a therapy for New York Heart Association Class III and IV PAH. This increased-strength formulation delivers the same dose in half the volume, which is expected to both reduce inhalation time and improve convenience for patients. A clinical program to evaluate the use of a higher-powered disk for the delivery device has recently concluded and Actelion is currently reviewing further development options.
Efforts are ongoing to further strengthen our PAH franchise with the forthcoming market introduction of an improved formulation of epoprostenol sodium for the intravenous treatment of primary and scleroderma related PAH. This medication was acquired from privately-held GeneraMedix Inc. in the first half of 2009.
The drug was approved in June 2008 in the United States for the long-term intravenous treatment of primary pulmonary hypertension and pulmonary hypertension associated with the scleroderma spectrum of disease in NYHA Class III and Class IV patients who do not respond adequately to conventional therapy. In France, Actelion has initiated regulatory activities for this product. Further regulatory filings are in preparation in other markets worldwide. Actelion is also starting a dedicated program to generate clinical experience data with this product.
In 2009, sales of Zavesca® (miglustat) grew to CHF 53.1 million - an increase of 38 percent in local currencies (32 percent in CHF). This increase was mainly due to the approval of the new indication Niemann-Pick type C disease (NP-C) by the European Commission in January 2009, with first reimbursements granted by mid-2009. Sales in the type 1 Gaucher disease indication also continued to grow.
Zavesca® is commercially available in over 35 countries including the United States and most European markets for the treatment of adult patients with mild to moderate type 1 Gaucher disease for whom enzyme replacement therapy (ERT) is not a therapeutic option.
In January 2009, Zavesca® received approval in the European Union for the treatment of progressive neurological manifestations in adult and pediatric patients with NP-C. Zavesca® is the first treatment to be approved for patients with NP-C, a very rare and devastating neurodegenerative genetic disorder affecting both children and adults.
At the end of 2009, Zavesca® was also approved for the treatment of patients with NP-C in Brazil, South Korea and Russia, with applications under evaluation in Australia, Canada, Colombia, Switzerland and Thailand.
In November 2009, Actelion announced that the FDA had granted a priority review for a supplemental new drug application (sNDA) concerning an extended indication for Zavesca® - for the treatment of progressive neurological manifestations in adult and pediatric patients with NP-C. The Endocrine and Metabolic Drug Advisory Committee (EMDAC) reviewed the sNDA in early January 2010 and voted that the benefit/risk profile of Zavesca® (miglustat) supports its approval for the treatment of progressive neurological manifestations in adult patients and pediatric patients with Niemann-Pick type C disease. A response from the FDA is expected later in 2010.
Otto Schwarz concluded: "At the end of 2009, our global commercial presence included 28 operational affiliates in all key pharmaceutical markets, including Japan where our efforts to expand the PAH market further generated significant return on investment. With our strong data-driven approach, I am confident that in 2010, we will continue to grow Tracleer® sales in PAH globally and the indication digital ulceration in Europe. In Europe, as well as in other markets where we obtain approval for NP-C, we will accompany market introductions with increased educational efforts to facilitate disease awareness. In the United States, we are fully prepared for the recent change in the competitive landscape, with another inhaled therapeutic option for PAH launched Q3 2009 by a competitor."
In February 2010, the existing collaboration with Nippon Shinyaku and Actelion's position in Japan was further strengthened. The two companies decided that in Japan, they will co‑develop and co-commercialize the highly potent endothelin receptor antagonist macitentan, currently in clinical development. Such an option was part of the initial agreement for the oral, non-prostanoid IP receptor agonist.
Operating expenses
During the full year 2009, operating expenses were CHF 1,433.2 million (FY 2008: CHF 1,102.2 m).
During the same period, research and development expenses increased by 24 percent to CHF 464.1 million (FY 2008: CHF 374.5 m). Full year 2008 operating expenses included milestone payments related to the IP receptor agonist in-licensed from Nippon Shinyaku. A third payment related to the commencement of the Phase III study was made in December 2009.
Selling, general and administrative expenses for 2009 amounted to CHF 645.5 million (FY 2008: CHF 550.0 m), an increase of 17 percent.
Research and Development
At the end of 2009, Actelion's pipeline had 11 compounds in clinical development as well as around 25 active projects in drug discovery.
Actelion is currently pursuing five ongoing Phase III programs:
Almorexant in primary insomnia: Almorexant is investigated in the Phase III program RESTORA (REstore physiological Sleep with The Orexin Receptor antagonist Almorexant). The first Phase III study, RESTORA 1 met its primary endpoint, superiority of the dual orexin receptor antagonist almorexant compared to placebo on objective and subjective wake after sleep onset (WASO). The finding was highly significant (p<0.001). In addition, several secondary endpoints of the study were met with statistical significance.
In RESTORA 1, the use of almorexant was well-tolerated. However, in this study as well as in the ongoing non-pivotal program, certain safety observations were made that will require further evaluation and assessment in longer-term Phase III studies. The Phase III studies are currently in preparation - in both adults and elderly patients suffering from insomnia - and will evaluate long-term efficacy and safety.
Bosentan (Tracleer®) in IPF: This multicenter, double-blind, randomized, placebo-controlled, parallel group, event-driven morbidity/mortality study (BUILD-3) is evaluating the safety and efficacy of bosentan 125mg b.i.d. in patients diagnosed with idiopathic pulmonary fibrosis (IPF). BUILD-3 enrollment was completed in October 2008 with 616 patients.
Upon reaching 202 confirmed events, Actelion started closing procedures at the end of 2009. Top-line results are expected in the first quarter of 2010.
Clazosentan in aSAH: Clazosentan is investigated in the pivotal Phase III study CONSCIOUS-2 (Clazosentan to Overcome Neurological iSChemia and Infarct Occurring after Subarachnoid hemorrhage) in 1,100 patients with aSAH and treated with aneurysmal surgical clipping. The study will measure the clinical benefits of clazosentan through the primary endpoint of vasospasm-related morbidity and all-cause mortality.
CONSCIOUS-2 results are expected to become available in the second half of 2010. If successful, Actelion will approach health authorities for filing.
A second Phase III study with Clazosentan, CONSCIOUS-3, has commenced enrollment, this time evaluating efficacy and safety clazosentan in patients post-aSAH treated by endovascular coiling.
Macitentan in PAH: Macitentan is investigated in the Phase III study SERAPHIN (Study with an Endothelin Receptor Antagonist in Pulmonary arterial Hypertension to Improve cliNical outcome). This study is designed to evaluate the safety and efficacy of this highly potent, tissue-targeting, endothelin receptor antagonist through the primary endpoint of morbidity and all-cause mortality in patients with symptomatic PAH.
Global enrollment was completed in December 2009 with a total of 742 patients. Study results could become available earlier than initially foreseen - which was the end of 2012.
Selexipag (proposed INN) in PAH: At the end of 2009, Actelion has progressed its first-in-class, orally active, non-prostanoid IP receptor agonist, selexipag, into a Phase III morbidity/mortality study in pulmonary arterial hypertension.
In a 43-patient Phase IIa study concluded in mid-2009, the primary endpoint of pulmonary vascular resistance (PVR) change from baseline was met with high statistical significance.
Guy Braunstein, M.D. and head of clinical development at Actelion commented. "In 2009, we have made significant progress in advancing a growing number of our projects. Despite the growing complexity of conducting clinical trials on a global scale, we were able to complete our studies in the timeframe foreseen and with the required quality. In 2010, we will have even more clinical studies ongoing. Naturally, we are also fully prepared for regulatory filings, if warranted, for our two upcoming Phase III studies that will report this year."
The earlier-stage clinical development programs include:
CRTH2 receptor antagonist in asthma: Positive data was obtained in 2009 in a proof-of-mechanism study with Actelion's orally active CRTH2 receptor antagonist in mild asthma.
Plans for initiating a Phase II dose-finding study in asthma are ongoing with further clinical studies in this and other indications planned for 2010, once additional preclinical studies have concluded.
Macitentan in IPF: A pilot clinical development study with this highly potent, tissue-targeting, endothelin receptor antagonist in idiopathic pulmonary fibrosis has commenced enrollment in H1 2009.
Miglustat in Cystic Fibrosis: A first Phase IIa study with miglustat in cystic fibrosis was concluded in mid-2009. Following further preclinical and clinical analysis, a newly designed proof-of-concept study will be initiated in 2010.
Selective S1P1 receptor agonist in multiple sclerosis: Following a successful Phase I program, Actelion's first-in-class selective S1P1 receptor agonist started enrolling patients with multiple sclerosis in a Phase IIb dose-finding study.
Selective S1P1 receptor agonist in psoriasis: Actelion has advanced its selective S1P1 receptor agonist for the treatment of psoriasis based on a Phase IIa proof-of-concept study. While this short term study did not reach statistical significance, sufficient information was obtained to proceed with a first pivotal study in psoriasis.
In 2009, Actelion also commenced Phase I studies for a novel antibiotic and a novel cardiovascular agent.
Martine Clozel, MD and Chief Scientific Officer at Actelion commented: "Actelion's platform approach, combined with our technological capabilities and in-house expertise, has resulted in two novel compounds progressing into clinical development in 2009. Several compounds are currently in full preclinical development."
Martine Clozel concluded: "Actelion Drug Discovery currently works on another 15 projects in lead optimization phase, a clear sign of our high research productivity. The progressive focus on specialized therapeutic areas of cardiovascular/fibrosis, immunology/allergy/inflammation, CNS, anti-infectives and oncology, has created a mature and concentrated Drug Discovery portfolio."
Operating profit
Actelion's operating profit for the full year 2009 was CHF 339.4 million (FY 2008: CHF 371.4 m) impacted by the litigation settlement of CHF 93.7 million announced in December 2009 related to an arbitration proceeding regarding a license agreement to develop Asahi Kasei's rho kinase inhibitor, fasudil. Non-GAAP (cash) EBIT (excluding this settlement) for the same period amounted to CHF 567.9 million (FY 2008: CHF 476.8 m).
Net Profit
The net profit of CHF 311.3 million (FY 2008: CHF 306.1 m) for the full year 2009 includes interest income of CHF 4.4 million, predominantly non-cash interest expense of CHF 7.5 million, non-cash interest and amortization charges on the Convertible Bond of CHF 17.9 million, foreign currency gains of CHF 20.0 million and an income tax expense of CHF 27.3 million.
Cash and cash flow
During 2009, Actelion generated net cash flow from operations of CHF 424.2 million (FY 2008: CHF 513.7 m). As of 31 December 2009, total liquid funds (excluding 9.8 million treasury shares) amounted to CHF 1.3 billion.
Strong talent growth
At the end of 2009, Actelion employed 2,263 employees worldwide, an increase of more than 310 staff compared to the end of 2008. Of those 2,263 employees, 984 were located in Switzerland (2008: 862 employees).
In 2010, Actelion expects to increase its global work force to above 2,500 employees. In Switzerland, Actelion expects to employ by year-end 2010 more than 1,100 employees.
Upcoming Corporate Events
Q1 2010
Thursday, 22 April, 2010
Tuesday, 4 May, 2010
Mid-2010
Thursday, 22 July, 2010
Thursday, 21 October, 2010
- BUILD-3 in IPF
- Q1 Results 2010
- AGM 2010
- CONSCIOUS-2 in clipped aSAH
- Half Year Results 2010
- Q3 Results 2010
###
Actelion Ltd
Actelion Ltd is a biopharmaceutical company with its corporate headquarters in Allschwil/Basel, Switzerland. Actelion's first drug Tracleer®, an orally available dual endothelin receptor antagonist, has been approved as a therapy for pulmonary arterial hypertension. Actelion markets Tracleer® through its own subsidiaries in key markets worldwide, including the United States (based in South San Francisco), the European Union, Japan, Canada, Australia and Switzerland. Actelion, founded in late 1997, is a leading player in innovative science related to the endothelium - the single layer of cells separating every blood vessel from the blood stream. Actelion's over 2,200 employees focus on the discovery, development and marketing of innovative drugs for significant unmet medical needs. Actelion shares are traded on the SIX Swiss Exchange (ticker symbol: ATLN) as part of the Swiss blue-chip index SMI (Swiss Market Index SMI®).
For further information please contact:
Roland Haefeli
Vice President, Head of Investor Relations & Public Affairs
Actelion Pharmaceuticals Ltd, Gewerbestrasse 16, CH-4123 Allschwil
+41 61 565 62 62
+1 646 737 49 72
http://www.actelion.com
Conference Call
Actelion will host an Investor Conference Call / Webcast as follows:
Date/Time:
18 February 2010
12:30 - 14:30
Basel (CEST)
11:30 - 13:30
U.K. (BST)
06:30 - 08:30
U.S. (EST)
Conference Call Connect #:
Dial-in participants should start calling the number below 10-15 minutes before the Conference is due to start.
Antwort auf Beitrag Nr.: 38.963.257 von Fruehrentner am 18.02.10 07:48:11und auf deutsch:
18.02.2010, 07:00 HUGIN
Actelion gibt Finanzergebnisse für das Jahr 2009 bekannt
Actelion Pharmaceuticals Ltd / Actelion gibt Finanzergebnisse für das Jahr 2009 bekannt verarbeitet und übermittelt durch Hugin. Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
Nettoumsatz 2009 bei CHF 1.772,6 Millionen, ein Anstieg um 23 Prozent in lokalen Währungen - Umsatz von Tracleer(®) bei CHF 1.508,0 Millionen, plus 19 Prozent in lokalen Währungen - non-GAAP (Cash) EBIT erreicht CHF 567,9 Millionen, ein Anstieg um 25 Prozent in lokalen Währungen - Günstige Aussichten für bestehendes Geschäft - Konzentration auf Innovationen schafft zusätzliche Wachstumsmöglichkeiten - 11 Substanzen in der klinischen Entwicklung - Bericht zu zwei Phase-III-Studien im Verlauf des Jahres
ALLSCHWIL/BASEL, SCHWEIZ - 18. Februar 2010 - Actelion Ltd (SIX: ATLN) gab heute die Finanzergebnisse des Unternehmens für das Jahr 2009 bekannt. Mit einem Nettoumsatz in Höhe von CHF 1.772,6 Millionen (2008: CHF 1.473,5 Mio.) und einem Betriebsaufwand von CHF 1.433,2 Millionen (2008: CHF 1.102,2 Mio.), meldete das Unternehmen für das Jahr 2009 einen Betriebsgewinn in Höhe von CHF 339,4 Millionen (2008: CHF 371,4 Mio.).
Für 2009 weist Actelion einen non-GAAP (Cash) EBIT von CHF 567,9 Millionen aus, ein Anstieg um 19 Prozent gegenüber 2008. In lokalen Währungen stieg der non-GAAP (Cash) EBIT um 25 Prozent. Der angepasste verwässerte Gewinn (non-US GAAP) pro Aktie betrug 2009 CHF 4,38 gegenüber CHF 3,38 im selben Zeitraum des Vorjahrs.
Das non-GAAP (Cash) Betriebsergebnis und der non-US GAAP verwässerte Gewinn schliessen laufende Forschungs- und Entwicklungskosten, Aufwendungen in Verbindung mit Aktienoptionen für Mitarbeitende nach ASC 718, Aufwendungen für nicht-liquiditätswirksame Abschreibungen und Amortisationen sowie weitere einmalige Belastungen aus, die eine vergleichende Analyse verzerren würden.
Unter Anwendung von US GAAP lag der Reingewinn für das Jahr 2009 bei CHF 311,3 Millionen (2008: CHF 306,1 Mio.). Der vollständig verwässerte Gewinn pro Aktie (EPS) nach US GAAP belief sich für denselben Zeitraum auf CHF 2,53 gegenüber CHF 2,48 im Jahr 2008.
Dr. Jean-Paul Clozel, Chief Executive Officer, kommentierte: "Actelion hat 2009 weiter an Stärke gewonnen. Der Umsatz unserer Produkte ist in einem zunehmend wettbewerbsintensiven Umfeld weiter gewachsen und die Projekte in unserer klinischen Pipeline haben Fortschritte gemacht. Mittlerweile befinden sich fünf Substanzen in der späten Phase der Entwicklung. Durch unsere Konzentration auf Innovation haben wir ein breites Spektrum an Wachstumsmöglichkeiten geschaffen. Unsere Infrastruktur für Vertrieb und Marketing in allen wichtigen pharmazeutischen Märkten weltweit wird es uns ermöglichen, eine optimale Wertschöpfung mit unseren existierenden und zukünftigen Produkten zu erzielen."
Jean-Paul Clozel fuhr fort: "Wir haben uns 2009 weiterhin dafür eingesetzt, die Lebensqualität von Patienten zu verbessern. Durch die Einführung einer neuen pädiatrischen Formulierung von Tracleer(®) in der EU helfen wir Kindern mit PAH bei der Behandlung ihrer Krankheit. Zudem haben wir in der EU Zavesca(®) für die Therapie der sehr seltenen Niemann-Pick Typ C Erkrankung eingeführt."
Jean-Paul Clozel schloss: "Ich beurteile die Aussichten für 2010 positiv. Für unser bestehendes Geschäft gehe ich von weiterem Wachstum aus. Daneben erwarten wir die Ergebnisse von zwei weiteren zulassungsrelevanten Phase-III-Programmen, die in diesem Jahr bekannt gegeben werden."
Andrew J. Oakley, Chief Financial Officer, kommentierte: "Actelion hat 2009 sein Wachstumsversprechen eingehalten. Dies gilt sowohl für die Produkteumsätze als auch für die Erwirtschaftung liquider Mittel. Der non-GAAP (Cash) EBIT stieg in lokalen Währungen um 25 Prozent. Wir haben den Ausbau einer vielfältig nutzbaren Wachstumsplattform mit weiteren Investitionen in Forschung und Entwicklung sowie in die Infrastruktur fortgesetzt. Künftig werden wir daher auf einer noch stärkeren Ausgangsposition aufbauen können."
Andrew J. Oakley schloss: "Basierend auf den in den vergangenen Jahren etablierten Wachstumsplattformen, werden wir unser Geschäft 2010 weiterentwickeln. Unter Ausschluss unvorhersehbarer Ereignisse gehen wir davon aus, dass der Gesamtnettoumsatz in lokalen Währungen um über 10 Prozent steigen wird, und der non-GAAP (Cash) EBIT, ebenfalls in lokalen Währungen, ein Wachstum von nahezu 20 Prozent erreichen wird."
Finanzergebnisse im Überblick - Tabelle 2009 vs. 2008
In CHF Tausend Ergebnisse 2009 Ergebnisse 2008 Veränderung %
Nettoumsatz 1 772 564 1 473 508 299 056 20
Betriebsaufwand 1 433 158 1 102 151 331 007 30
Betriebsgewinn 339 406 371 357 (31 951) (9)
Non-GAAP (Cash) EBIT 567 935 476 833 91 102 19
Reingewinn* 311 270 306 073 5 197 2
Verwässerter Gewinn 2,53 2,48 0,05 2 pro Aktie (EPS) in CHF*
Anzahl Aktien zur 122 880 123 418 - - Berechnung
(Angabe in Tausend)
* Reklassifizierung der Wandelanleihe von 2006 gemäss ASC 470-20 - Vergleichsperiode angepasst.
Die vollständige Konzernrechnung finden Sie unter http://www.actelion.com .
Anhaltendes Wachstum des Nettoumsatzes
Für das Gesamtjahr 2009 verzeichnete Actelion einen Anstieg des Nettoumsatzes um 20 Prozent auf CHF 1.772,6 Millionen (2008: CHF 1.473,5 Mio.). In lokalen Währungen stieg der Nettoumsatz gegenüber 2008 um 23 Prozent.
Die Einkünfte aus vertraglichen Vereinbarungen beliefen sich 2009 auf CHF 74,6 Millionen (2008: CHF 44,6 Mio.).
Produkteumsatz
Im Jahr 2009 belief sich der Umsatz von Tracleer(®) (Bosentan) auf CHF 1.508,0 Millionen (2008: CHF 1.294,1 Mio.). In lokalen Währungen bedeutet dies einen Anstieg um 19 Prozent im Vergleich zum Vorjahr.
Ende Dezember 2009 wurde Tracleer(®) in über 55 Ländern vermarktet, darunter alle wichtigen pharmazeutischen Märkte.
Im August 2009 erhielt Tracleer(®) in den USA eine Indikationserweiterung für die Behandlung von Patienten mit leichteren Symptomen der pulmonalen arteriellen Hypertonie (PAH), die der sogenannten WHO-Funktionsklasse II zugeordnet werden. Diese Indikationserweiterung folgt der Zulassung durch die EMEA für Funktionsklasse II im Jahr 2008 und beruht auf der EARLY-Studie (Endothelin Antagonist tRial in miLdlY symptomatic PAH patients), die im Juni 2008 in "The Lancet" veröffentlicht wurde. Die EARLY-Studie war die erste Studie, die ausschliesslich mit Patienten mit milder symptomatischer PAH der WHO-Funktionsklasse II durchgeführt wurde, und belegte, dass die Krankheit selbst im frühen Stadium unaufhaltsam fortschreitet. Sie zeigte zudem die Notwendigkeit einer früheren Behandlung und Intervention zur Kontrolle der PAH auf. Obwohl die Verbesserung des sechsminütigen Lauftests (6-MWD) statistisch nicht signifikant war, hatte Tracleer(®) im Vergleich zu Plazebo eine hochsignifikante Verringerung des Krankheitsfortschritts, gemessen an Ereignissen einer klinischen Verschlechterung des Zustands, bewiesen.
2009 wurde zudem die pädiatrische Formulierung von Tracleer(®) in Europa zugelassen. Mit dieser Indikation ist Tracleer(®) die erste PAH-Therapie mit einer zugelassenen pädiatrischen Formulierung für Kinder ab zwei Jahren.
Otto Schwarz, Präsident Business Operations, kommentierte: "Die starke Wachstumsdynamik von Tracleer(®) ist bemerkenswert und spiegelt den grossen Bedarf an innovativen Therapien für PAH sowie - in der EU - für digitale Ulzerationen wider. Das Umsatzwachstum ist auch das Ergebnis unserer kommerziellen Anstrengungen, die auf einer starken Indikationsstellung, stabilen Beziehungen zu den wesentlichen Anspruchsgruppen sowie der ausgezeichneten Umsetzung unserer Wettbewerbs- und Marktausweitungsstrategien beruhen."
Der Umsatz von Ventavis(®) (Iloprost) belief sich im Jahr 2009 auf CHF 136,9 Millionen (2008: CHF 94,6 Mio.). Dies bedeutet einen Anstieg um 44 Prozent in US-Dollar.
Anfang August 2009 erteilte die amerikanische Food and Drug Administration (FDA) die Zulassung für eine neue Formulierung von Ventavis(®) in einer Dosisstärke von 20 Mikrogramm pro Milliliter (mcg/ml) zur Behandlung der PAH der Klassen III und IV gemäss New York Heart Association (NYHA). Bei dieser stärker konzentrierten Formulierung kann die gleiche Dosis mit einem um die Hälfte reduzierten Lösungsvolumen verabreicht werden. Dies dürfte sich in einer verkürzten Inhalationszeit niederschlagen und die Verabreichung für die Patienten angenehmer machen. Vor kurzem wurde ein klinisches Programm zur Evaluierung einer leistungsstärkeren Applikationshilfe abgeschlossen und Actelion prüft derzeit weitere Entwicklungsmöglichkeiten.
Mit der anstehenden Markteinführung einer verbesserten Formulierung von Epoprostenol-Natrium zur intravenösen Behandlung von primärer und Sklerodermie-bedingter PAH laufen derzeit weitere Massnahmen zur Stärkung unseres PAH-Geschäfts. Dieses Medikament wurde in der ersten Jahreshälfte 2009 von dem im Privatbesitz befindlichen Unternehmen GeneraMedix Inc. erworben.
Dieses Arzneimittel erhielt im Juni 2008 in den USA die Zulassung für die intravenöse Langzeitbehandlung der primären pulmonalen Hypertonie und für die in Verbindung mit dem Krankheitsbild der Sklerodermie auftretenden Formen der pulmonalen Hypertonie bei Patienten der NYHA-Klassen III und IV, die auf konventionelle Behandlungsformen nicht ausreichend ansprechen. Actelion bereitet derzeit den Zulassungsanstrag für dieses Produkt in Frankreich vor. Weitere Zulassungsanträge für andere Märkte weltweit sind in Vorbereitung. Actelion initiiert zudem ein Programm, das der Gewinnung von Daten beim Einsatz dieses Produkts in der klinischen Praxis gewidmet ist.
Der Umsatz von Zavesca(®) (Miglustat) wuchs 2009 auf 53,1 Millionen an - ein Anstieg um 38 Prozent in lokalen Währungen (32 Prozent in CHF). Dieser Anstieg ergab sich vor allem in Folge der Zulassung für die neue Indikation Niemann-Pick Typ-C-Krankheit (NP-C) durch die europäische Kommission im Januar 2009. Mitte 2009 wurden erste Kostenerstattungen bewilligt. Der Umsatz in der Indikation Typ-1-Gaucher-Krankheit stieg ebenfalls weiter an.
Zavesca(®) ist in über 35 Ländern einschliesslich der USA und den meisten europäischen Ländern für die Behandlung von Erwachsenen mit leichter bis mittelschwerer Typ-1-Gaucher-Krankheit, für die eine Enzymersatztherapie (EET) nicht angezeigt ist, kommerziell erhältlich.
Im Januar 2009 erhielt Zavesca(®) in der Europäischen Union die Zulassung für die Behandlung progressiver neurologischer Symptome bei Erwachsenen und Kindern mit Niemann-Pick Typ-C-Krankheit (NP-C). Zavesca(®) ist die erste zugelassene Therapie für Patienten mit Niemann-Pick Typ C, einer sehr seltenen, genetisch bedingten, mit starken Beeinträchtigungen verbundenen neurodegenerativen Erkrankung, die sowohl Kinder als auch Erwachsene treffen kann.
Ende 2009 wurde Zavesca(®) auch für die Behandlung von Patienten mit Niemann-Pick Typ C in Brasilien, Südkorea und Russland zugelassen. In Australien, Kanada, Kolumbien, der Schweiz und Thailand werden Zulassungsanträge geprüft.
Im November 2009 kündigte Actelion an, dass die FDA ein beschleunigtes Zulassungsverfahren für einen Antrag auf Indikationserweiterung (supplemental new drug application - sNDA) für Zavesca(®) zur Behandlung von progressiven neurologischen Symptomen bei Erwachsenen und Kindern mit NP-C bewilligt hat. Das Endocrine and Metabolic Drug Advisory Committee (EMDAC) hat die sNDA Anfang Januar 2010 geprüft und sich für die Zulassung in der neuen Indikation ausgesprochen. Eine Stellungnahme der FDA wird im weiteren Verlauf dieses Jahres erwartet.
Otto Schwarz schloss: "Ende 2009 waren wir mit 28 operativen Tochtergesellschaften in allen wichtigen pharmazeutischen Märkten präsent, darunter auch Japan, wo sich unsere Anstrengungen für die Ausweitung des PAH-Marktes in bedeutendem Masse auszahlten. Ich bin zuversichtlich, dass wir den Umsatz von Tracleer(®) bei PAH weltweit und in der Indikation digitale Ulzerationen in Europa mit unserem starken, auf Daten gestützten Ansatz weiter steigern werden. In Europa und anderen Märkten, wo wir die Zulassung für NP-C erhalten, werden wir die Markteinführung mit verstärkten Weiterbildungsmassnahmen begleiten, um das Bewusstsein für diese Erkrankung zu schärfen. Wir sind gut vorbereitet auf die Veränderung der Wettbewerbssituation in den USA, die sich durch die Einführung eines Wettbewerbsprodukts zur inhalativen PAH-Therapie im 3. Quartal ergab."
Im Februar 2010 wurde die bestehende Kooperation mit Nippon Shinyaku und damit auch die Position von Actelion in Japan weiter gestärkt. Die beiden Unternehmen beschlossen, den in der klinischen Entwicklung befindlichen hochpotenten Endothelin-Rezeptor-Antagonisten Macicentan in Japan gemeinsam zu entwickeln und zu vermarkten. Diese Option war Bestandteil der ursprünglichen Vereinbarung über den oralen, nicht-prostanoiden IP-Rezeptor-Antagonisten.
Betrieblicher Aufwand
Im Jahr 2009 belief sich der betriebliche Aufwand auf CHF 1.433,2 Millionen (2008: CHF 1.102,2 Mio.).
Im selben Zeitraum stiegen die Kosten für Forschung und Entwicklung um 24 Prozent auf CHF 464,1 Millionen (2008: CHF 374,5 Mio.). Der betriebliche Aufwand für das Jahr 2008 enthielt Meilensteinzahlungen im Zusammenhang mit dem von Nippon Shinyaku einlizenzierten IP-Rezeptor-Agonisten. Eine zweite Zahlung im Zusammenhang mit dem Beginn der Phase-III-Studie wurde im Dezember 2009 geleistet.
Die Aufwendungen für den Verkauf, sowie allgemeine und administrative Ausgaben beliefen sich 2009 auf CHF 645,5 Millionen (2008: CHF 550,0 Mio.), ein Anstieg um 17 Prozent.
Forschung und Entwicklung
Ende 2009 umfasste die Pipeline von Actelion 11 Substanzen in der klinischen Entwicklung sowie rund 25 aktive Projekte in der Forschung.
Actelion führt zurzeit fünf Phase-III-Programme durch:
Almorexant bei primärer Insomnie: Almorexant wird im Rahmen des Phase-III-Programms RESTORA (REstore physiological Sleep with The Orexin Receptor antagonist Almorexant) untersucht. In der ersten Phase-III-Studie RESTORA 1 konnte der primäre Endpunkt erreicht werden, die Überlegenheit des dualen Orexin-Rezeptor-Antagonisten Almorexant im Vergleich zu Plazebo im Hinblick auf objektiven und subjektiven Schlaferhalt (Erwachen nach Einsetzen des Schlafs - WASO). Das Ergebnis war hochsignifikant (p
18.02.2010, 07:00 HUGIN
Actelion gibt Finanzergebnisse für das Jahr 2009 bekannt
Actelion Pharmaceuticals Ltd / Actelion gibt Finanzergebnisse für das Jahr 2009 bekannt verarbeitet und übermittelt durch Hugin. Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
Nettoumsatz 2009 bei CHF 1.772,6 Millionen, ein Anstieg um 23 Prozent in lokalen Währungen - Umsatz von Tracleer(®) bei CHF 1.508,0 Millionen, plus 19 Prozent in lokalen Währungen - non-GAAP (Cash) EBIT erreicht CHF 567,9 Millionen, ein Anstieg um 25 Prozent in lokalen Währungen - Günstige Aussichten für bestehendes Geschäft - Konzentration auf Innovationen schafft zusätzliche Wachstumsmöglichkeiten - 11 Substanzen in der klinischen Entwicklung - Bericht zu zwei Phase-III-Studien im Verlauf des Jahres
ALLSCHWIL/BASEL, SCHWEIZ - 18. Februar 2010 - Actelion Ltd (SIX: ATLN) gab heute die Finanzergebnisse des Unternehmens für das Jahr 2009 bekannt. Mit einem Nettoumsatz in Höhe von CHF 1.772,6 Millionen (2008: CHF 1.473,5 Mio.) und einem Betriebsaufwand von CHF 1.433,2 Millionen (2008: CHF 1.102,2 Mio.), meldete das Unternehmen für das Jahr 2009 einen Betriebsgewinn in Höhe von CHF 339,4 Millionen (2008: CHF 371,4 Mio.).
Für 2009 weist Actelion einen non-GAAP (Cash) EBIT von CHF 567,9 Millionen aus, ein Anstieg um 19 Prozent gegenüber 2008. In lokalen Währungen stieg der non-GAAP (Cash) EBIT um 25 Prozent. Der angepasste verwässerte Gewinn (non-US GAAP) pro Aktie betrug 2009 CHF 4,38 gegenüber CHF 3,38 im selben Zeitraum des Vorjahrs.
Das non-GAAP (Cash) Betriebsergebnis und der non-US GAAP verwässerte Gewinn schliessen laufende Forschungs- und Entwicklungskosten, Aufwendungen in Verbindung mit Aktienoptionen für Mitarbeitende nach ASC 718, Aufwendungen für nicht-liquiditätswirksame Abschreibungen und Amortisationen sowie weitere einmalige Belastungen aus, die eine vergleichende Analyse verzerren würden.
Unter Anwendung von US GAAP lag der Reingewinn für das Jahr 2009 bei CHF 311,3 Millionen (2008: CHF 306,1 Mio.). Der vollständig verwässerte Gewinn pro Aktie (EPS) nach US GAAP belief sich für denselben Zeitraum auf CHF 2,53 gegenüber CHF 2,48 im Jahr 2008.
Dr. Jean-Paul Clozel, Chief Executive Officer, kommentierte: "Actelion hat 2009 weiter an Stärke gewonnen. Der Umsatz unserer Produkte ist in einem zunehmend wettbewerbsintensiven Umfeld weiter gewachsen und die Projekte in unserer klinischen Pipeline haben Fortschritte gemacht. Mittlerweile befinden sich fünf Substanzen in der späten Phase der Entwicklung. Durch unsere Konzentration auf Innovation haben wir ein breites Spektrum an Wachstumsmöglichkeiten geschaffen. Unsere Infrastruktur für Vertrieb und Marketing in allen wichtigen pharmazeutischen Märkten weltweit wird es uns ermöglichen, eine optimale Wertschöpfung mit unseren existierenden und zukünftigen Produkten zu erzielen."
Jean-Paul Clozel fuhr fort: "Wir haben uns 2009 weiterhin dafür eingesetzt, die Lebensqualität von Patienten zu verbessern. Durch die Einführung einer neuen pädiatrischen Formulierung von Tracleer(®) in der EU helfen wir Kindern mit PAH bei der Behandlung ihrer Krankheit. Zudem haben wir in der EU Zavesca(®) für die Therapie der sehr seltenen Niemann-Pick Typ C Erkrankung eingeführt."
Jean-Paul Clozel schloss: "Ich beurteile die Aussichten für 2010 positiv. Für unser bestehendes Geschäft gehe ich von weiterem Wachstum aus. Daneben erwarten wir die Ergebnisse von zwei weiteren zulassungsrelevanten Phase-III-Programmen, die in diesem Jahr bekannt gegeben werden."
Andrew J. Oakley, Chief Financial Officer, kommentierte: "Actelion hat 2009 sein Wachstumsversprechen eingehalten. Dies gilt sowohl für die Produkteumsätze als auch für die Erwirtschaftung liquider Mittel. Der non-GAAP (Cash) EBIT stieg in lokalen Währungen um 25 Prozent. Wir haben den Ausbau einer vielfältig nutzbaren Wachstumsplattform mit weiteren Investitionen in Forschung und Entwicklung sowie in die Infrastruktur fortgesetzt. Künftig werden wir daher auf einer noch stärkeren Ausgangsposition aufbauen können."
Andrew J. Oakley schloss: "Basierend auf den in den vergangenen Jahren etablierten Wachstumsplattformen, werden wir unser Geschäft 2010 weiterentwickeln. Unter Ausschluss unvorhersehbarer Ereignisse gehen wir davon aus, dass der Gesamtnettoumsatz in lokalen Währungen um über 10 Prozent steigen wird, und der non-GAAP (Cash) EBIT, ebenfalls in lokalen Währungen, ein Wachstum von nahezu 20 Prozent erreichen wird."
Finanzergebnisse im Überblick - Tabelle 2009 vs. 2008
In CHF Tausend Ergebnisse 2009 Ergebnisse 2008 Veränderung %
Nettoumsatz 1 772 564 1 473 508 299 056 20
Betriebsaufwand 1 433 158 1 102 151 331 007 30
Betriebsgewinn 339 406 371 357 (31 951) (9)
Non-GAAP (Cash) EBIT 567 935 476 833 91 102 19
Reingewinn* 311 270 306 073 5 197 2
Verwässerter Gewinn 2,53 2,48 0,05 2 pro Aktie (EPS) in CHF*
Anzahl Aktien zur 122 880 123 418 - - Berechnung
(Angabe in Tausend)
* Reklassifizierung der Wandelanleihe von 2006 gemäss ASC 470-20 - Vergleichsperiode angepasst.
Die vollständige Konzernrechnung finden Sie unter http://www.actelion.com .
Anhaltendes Wachstum des Nettoumsatzes
Für das Gesamtjahr 2009 verzeichnete Actelion einen Anstieg des Nettoumsatzes um 20 Prozent auf CHF 1.772,6 Millionen (2008: CHF 1.473,5 Mio.). In lokalen Währungen stieg der Nettoumsatz gegenüber 2008 um 23 Prozent.
Die Einkünfte aus vertraglichen Vereinbarungen beliefen sich 2009 auf CHF 74,6 Millionen (2008: CHF 44,6 Mio.).
Produkteumsatz
Im Jahr 2009 belief sich der Umsatz von Tracleer(®) (Bosentan) auf CHF 1.508,0 Millionen (2008: CHF 1.294,1 Mio.). In lokalen Währungen bedeutet dies einen Anstieg um 19 Prozent im Vergleich zum Vorjahr.
Ende Dezember 2009 wurde Tracleer(®) in über 55 Ländern vermarktet, darunter alle wichtigen pharmazeutischen Märkte.
Im August 2009 erhielt Tracleer(®) in den USA eine Indikationserweiterung für die Behandlung von Patienten mit leichteren Symptomen der pulmonalen arteriellen Hypertonie (PAH), die der sogenannten WHO-Funktionsklasse II zugeordnet werden. Diese Indikationserweiterung folgt der Zulassung durch die EMEA für Funktionsklasse II im Jahr 2008 und beruht auf der EARLY-Studie (Endothelin Antagonist tRial in miLdlY symptomatic PAH patients), die im Juni 2008 in "The Lancet" veröffentlicht wurde. Die EARLY-Studie war die erste Studie, die ausschliesslich mit Patienten mit milder symptomatischer PAH der WHO-Funktionsklasse II durchgeführt wurde, und belegte, dass die Krankheit selbst im frühen Stadium unaufhaltsam fortschreitet. Sie zeigte zudem die Notwendigkeit einer früheren Behandlung und Intervention zur Kontrolle der PAH auf. Obwohl die Verbesserung des sechsminütigen Lauftests (6-MWD) statistisch nicht signifikant war, hatte Tracleer(®) im Vergleich zu Plazebo eine hochsignifikante Verringerung des Krankheitsfortschritts, gemessen an Ereignissen einer klinischen Verschlechterung des Zustands, bewiesen.
2009 wurde zudem die pädiatrische Formulierung von Tracleer(®) in Europa zugelassen. Mit dieser Indikation ist Tracleer(®) die erste PAH-Therapie mit einer zugelassenen pädiatrischen Formulierung für Kinder ab zwei Jahren.
Otto Schwarz, Präsident Business Operations, kommentierte: "Die starke Wachstumsdynamik von Tracleer(®) ist bemerkenswert und spiegelt den grossen Bedarf an innovativen Therapien für PAH sowie - in der EU - für digitale Ulzerationen wider. Das Umsatzwachstum ist auch das Ergebnis unserer kommerziellen Anstrengungen, die auf einer starken Indikationsstellung, stabilen Beziehungen zu den wesentlichen Anspruchsgruppen sowie der ausgezeichneten Umsetzung unserer Wettbewerbs- und Marktausweitungsstrategien beruhen."
Der Umsatz von Ventavis(®) (Iloprost) belief sich im Jahr 2009 auf CHF 136,9 Millionen (2008: CHF 94,6 Mio.). Dies bedeutet einen Anstieg um 44 Prozent in US-Dollar.
Anfang August 2009 erteilte die amerikanische Food and Drug Administration (FDA) die Zulassung für eine neue Formulierung von Ventavis(®) in einer Dosisstärke von 20 Mikrogramm pro Milliliter (mcg/ml) zur Behandlung der PAH der Klassen III und IV gemäss New York Heart Association (NYHA). Bei dieser stärker konzentrierten Formulierung kann die gleiche Dosis mit einem um die Hälfte reduzierten Lösungsvolumen verabreicht werden. Dies dürfte sich in einer verkürzten Inhalationszeit niederschlagen und die Verabreichung für die Patienten angenehmer machen. Vor kurzem wurde ein klinisches Programm zur Evaluierung einer leistungsstärkeren Applikationshilfe abgeschlossen und Actelion prüft derzeit weitere Entwicklungsmöglichkeiten.
Mit der anstehenden Markteinführung einer verbesserten Formulierung von Epoprostenol-Natrium zur intravenösen Behandlung von primärer und Sklerodermie-bedingter PAH laufen derzeit weitere Massnahmen zur Stärkung unseres PAH-Geschäfts. Dieses Medikament wurde in der ersten Jahreshälfte 2009 von dem im Privatbesitz befindlichen Unternehmen GeneraMedix Inc. erworben.
Dieses Arzneimittel erhielt im Juni 2008 in den USA die Zulassung für die intravenöse Langzeitbehandlung der primären pulmonalen Hypertonie und für die in Verbindung mit dem Krankheitsbild der Sklerodermie auftretenden Formen der pulmonalen Hypertonie bei Patienten der NYHA-Klassen III und IV, die auf konventionelle Behandlungsformen nicht ausreichend ansprechen. Actelion bereitet derzeit den Zulassungsanstrag für dieses Produkt in Frankreich vor. Weitere Zulassungsanträge für andere Märkte weltweit sind in Vorbereitung. Actelion initiiert zudem ein Programm, das der Gewinnung von Daten beim Einsatz dieses Produkts in der klinischen Praxis gewidmet ist.
Der Umsatz von Zavesca(®) (Miglustat) wuchs 2009 auf 53,1 Millionen an - ein Anstieg um 38 Prozent in lokalen Währungen (32 Prozent in CHF). Dieser Anstieg ergab sich vor allem in Folge der Zulassung für die neue Indikation Niemann-Pick Typ-C-Krankheit (NP-C) durch die europäische Kommission im Januar 2009. Mitte 2009 wurden erste Kostenerstattungen bewilligt. Der Umsatz in der Indikation Typ-1-Gaucher-Krankheit stieg ebenfalls weiter an.
Zavesca(®) ist in über 35 Ländern einschliesslich der USA und den meisten europäischen Ländern für die Behandlung von Erwachsenen mit leichter bis mittelschwerer Typ-1-Gaucher-Krankheit, für die eine Enzymersatztherapie (EET) nicht angezeigt ist, kommerziell erhältlich.
Im Januar 2009 erhielt Zavesca(®) in der Europäischen Union die Zulassung für die Behandlung progressiver neurologischer Symptome bei Erwachsenen und Kindern mit Niemann-Pick Typ-C-Krankheit (NP-C). Zavesca(®) ist die erste zugelassene Therapie für Patienten mit Niemann-Pick Typ C, einer sehr seltenen, genetisch bedingten, mit starken Beeinträchtigungen verbundenen neurodegenerativen Erkrankung, die sowohl Kinder als auch Erwachsene treffen kann.
Ende 2009 wurde Zavesca(®) auch für die Behandlung von Patienten mit Niemann-Pick Typ C in Brasilien, Südkorea und Russland zugelassen. In Australien, Kanada, Kolumbien, der Schweiz und Thailand werden Zulassungsanträge geprüft.
Im November 2009 kündigte Actelion an, dass die FDA ein beschleunigtes Zulassungsverfahren für einen Antrag auf Indikationserweiterung (supplemental new drug application - sNDA) für Zavesca(®) zur Behandlung von progressiven neurologischen Symptomen bei Erwachsenen und Kindern mit NP-C bewilligt hat. Das Endocrine and Metabolic Drug Advisory Committee (EMDAC) hat die sNDA Anfang Januar 2010 geprüft und sich für die Zulassung in der neuen Indikation ausgesprochen. Eine Stellungnahme der FDA wird im weiteren Verlauf dieses Jahres erwartet.
Otto Schwarz schloss: "Ende 2009 waren wir mit 28 operativen Tochtergesellschaften in allen wichtigen pharmazeutischen Märkten präsent, darunter auch Japan, wo sich unsere Anstrengungen für die Ausweitung des PAH-Marktes in bedeutendem Masse auszahlten. Ich bin zuversichtlich, dass wir den Umsatz von Tracleer(®) bei PAH weltweit und in der Indikation digitale Ulzerationen in Europa mit unserem starken, auf Daten gestützten Ansatz weiter steigern werden. In Europa und anderen Märkten, wo wir die Zulassung für NP-C erhalten, werden wir die Markteinführung mit verstärkten Weiterbildungsmassnahmen begleiten, um das Bewusstsein für diese Erkrankung zu schärfen. Wir sind gut vorbereitet auf die Veränderung der Wettbewerbssituation in den USA, die sich durch die Einführung eines Wettbewerbsprodukts zur inhalativen PAH-Therapie im 3. Quartal ergab."
Im Februar 2010 wurde die bestehende Kooperation mit Nippon Shinyaku und damit auch die Position von Actelion in Japan weiter gestärkt. Die beiden Unternehmen beschlossen, den in der klinischen Entwicklung befindlichen hochpotenten Endothelin-Rezeptor-Antagonisten Macicentan in Japan gemeinsam zu entwickeln und zu vermarkten. Diese Option war Bestandteil der ursprünglichen Vereinbarung über den oralen, nicht-prostanoiden IP-Rezeptor-Antagonisten.
Betrieblicher Aufwand
Im Jahr 2009 belief sich der betriebliche Aufwand auf CHF 1.433,2 Millionen (2008: CHF 1.102,2 Mio.).
Im selben Zeitraum stiegen die Kosten für Forschung und Entwicklung um 24 Prozent auf CHF 464,1 Millionen (2008: CHF 374,5 Mio.). Der betriebliche Aufwand für das Jahr 2008 enthielt Meilensteinzahlungen im Zusammenhang mit dem von Nippon Shinyaku einlizenzierten IP-Rezeptor-Agonisten. Eine zweite Zahlung im Zusammenhang mit dem Beginn der Phase-III-Studie wurde im Dezember 2009 geleistet.
Die Aufwendungen für den Verkauf, sowie allgemeine und administrative Ausgaben beliefen sich 2009 auf CHF 645,5 Millionen (2008: CHF 550,0 Mio.), ein Anstieg um 17 Prozent.
Forschung und Entwicklung
Ende 2009 umfasste die Pipeline von Actelion 11 Substanzen in der klinischen Entwicklung sowie rund 25 aktive Projekte in der Forschung.
Actelion führt zurzeit fünf Phase-III-Programme durch:
Almorexant bei primärer Insomnie: Almorexant wird im Rahmen des Phase-III-Programms RESTORA (REstore physiological Sleep with The Orexin Receptor antagonist Almorexant) untersucht. In der ersten Phase-III-Studie RESTORA 1 konnte der primäre Endpunkt erreicht werden, die Überlegenheit des dualen Orexin-Rezeptor-Antagonisten Almorexant im Vergleich zu Plazebo im Hinblick auf objektiven und subjektiven Schlaferhalt (Erwachen nach Einsetzen des Schlafs - WASO). Das Ergebnis war hochsignifikant (p
Actelion 2009: EBIT 339,4 Mio CHF
Actelion 2009: EBIT 339,4 Mio CHF (AWP-Konsens: 391,2 Mio) - Ausblick präzisiert
Allschwil (awp) - Die Actelion AG hat im Geschäftsjahr 2009 einen Nettoumsatzerlös von insgesamt 1'772,6 (VJ 1'473,5) Mio CHF verbucht. Davon entfielen 1'508,0 (1'294,1) Mio CHF auf das Hauptprodukt Tracleer, das bei Lungenhochdruck (pulmonale arterielle Hypertonie, PAH) eingesetzt wird. Der betriebliche Aufwand stieg auf 1'433,2 (1'102,2) Mio CHF. Das Betriebsergebnis sank entsprechend auf 339,4 (371,4) Mio CHF.
Die Verkäufe von Ventavis konnten auf 136,9 (94,6) Mio CHF gesteigert werden. Und der Umsatz mit Zavesca nahm auf 53,1 Mio CHF zu, was einer Steigerung um 32% in CHF entsprach.
Actelion weist zudem einen non-GAAP-Cash-EBIT aus, der dem Betriebsergebnis ohne nicht-cashwirksame Belastungen wie laufende F&E-Projekte, Belastungen in Verbindung mit Aktienoptionen für Mitarbeitende sowie Amortisationen und Abschreibungen entspricht. Dieser belief sich im Berichtsjahr auf 567,9 (476,Cool Mio CHF.
Unter dem Strich stieg der Reingewinn auf 311,3 (306,1) Mio CHF, wie Actelion am Donnerstag bekannt gab. In der Folge erhöhte sich der verwässerte Gewinn pro Aktie (EPS) nach US-GAAP auf 2,53 (2,4Cool CHF.
Das biopharmazeutische Unternehmen hat die Analystenschätzungen beim Umsatz übertroffen und beim Cash-EBIT knapp verfehlt. Beim EBIT und Reingewinn lag das Unternehmen aber deutlich darunter. Analysten haben im Durchschnitt (AWP-Konsens) mit einem Umsatz von 1'760,1 Mio CHF, Cash-EBIT von 570,1 Mio CHF, EBIT von 391,2 Mio CHF und Reingewinn von 352,7 Mio CHF gerechnet.
Das Unternehmen verzichtet wie bisher auf die Ausschüttung einer Dividende. Der gesamte Gewinn wird reinvestiert.
Für das Geschäftsjahr 2010 hat das Management die zuletzt Mitte Januar abgegebenen Umsatz-Guidance präzisiert. So rechnet CEO Andrew J. Oakley in lokalen Währungen (LW) mit einem Umsatzanstieg um über 10%. Zuvor war von einem Wachstum im tiefen zweistelligen Prozentbereich die Rede. Der non-GAAG-Cash-EBIT soll in LW "ein Wachstum von nahezu 20%" erreichen. CEO Jean-Paul Clozel stellt darüber hinaus die Ergebnisse zweier zulassungsrelevanten Phase-III-Programme in Aussicht.
rt/ch
Actelion 2009: EBIT 339,4 Mio CHF (AWP-Konsens: 391,2 Mio) - Ausblick präzisiert
Allschwil (awp) - Die Actelion AG hat im Geschäftsjahr 2009 einen Nettoumsatzerlös von insgesamt 1'772,6 (VJ 1'473,5) Mio CHF verbucht. Davon entfielen 1'508,0 (1'294,1) Mio CHF auf das Hauptprodukt Tracleer, das bei Lungenhochdruck (pulmonale arterielle Hypertonie, PAH) eingesetzt wird. Der betriebliche Aufwand stieg auf 1'433,2 (1'102,2) Mio CHF. Das Betriebsergebnis sank entsprechend auf 339,4 (371,4) Mio CHF.
Die Verkäufe von Ventavis konnten auf 136,9 (94,6) Mio CHF gesteigert werden. Und der Umsatz mit Zavesca nahm auf 53,1 Mio CHF zu, was einer Steigerung um 32% in CHF entsprach.
Actelion weist zudem einen non-GAAP-Cash-EBIT aus, der dem Betriebsergebnis ohne nicht-cashwirksame Belastungen wie laufende F&E-Projekte, Belastungen in Verbindung mit Aktienoptionen für Mitarbeitende sowie Amortisationen und Abschreibungen entspricht. Dieser belief sich im Berichtsjahr auf 567,9 (476,Cool Mio CHF.
Unter dem Strich stieg der Reingewinn auf 311,3 (306,1) Mio CHF, wie Actelion am Donnerstag bekannt gab. In der Folge erhöhte sich der verwässerte Gewinn pro Aktie (EPS) nach US-GAAP auf 2,53 (2,4Cool CHF.
Das biopharmazeutische Unternehmen hat die Analystenschätzungen beim Umsatz übertroffen und beim Cash-EBIT knapp verfehlt. Beim EBIT und Reingewinn lag das Unternehmen aber deutlich darunter. Analysten haben im Durchschnitt (AWP-Konsens) mit einem Umsatz von 1'760,1 Mio CHF, Cash-EBIT von 570,1 Mio CHF, EBIT von 391,2 Mio CHF und Reingewinn von 352,7 Mio CHF gerechnet.
Das Unternehmen verzichtet wie bisher auf die Ausschüttung einer Dividende. Der gesamte Gewinn wird reinvestiert.
Für das Geschäftsjahr 2010 hat das Management die zuletzt Mitte Januar abgegebenen Umsatz-Guidance präzisiert. So rechnet CEO Andrew J. Oakley in lokalen Währungen (LW) mit einem Umsatzanstieg um über 10%. Zuvor war von einem Wachstum im tiefen zweistelligen Prozentbereich die Rede. Der non-GAAG-Cash-EBIT soll in LW "ein Wachstum von nahezu 20%" erreichen. CEO Jean-Paul Clozel stellt darüber hinaus die Ergebnisse zweier zulassungsrelevanten Phase-III-Programme in Aussicht.
rt/ch
Actelion "buy"
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, bewertet die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" weiterhin mit dem Rating "buy".
Actelion habe heute Morgen das Ergebnis für das 4. Quartal 2009 vorgelegt. Der Umsatz habe CHF 470 Mio. (VontE: CHF 474,2 Mio., Kons.: CHF 468 Mio.) betragen. Das Cash-EBIT habe sich auf Nicht-GAAP-Basis auf CHF 105,2 Mio. (VontE: CHF 118,4 Mio., Kons.: CHF 101,4 Mio.) belaufen, und der Reingewinn habe CHF -15,5 Mio. (VontE: CHF 1,3 Mio.) betragen.
Der Konzernumsatz für das 4. Quartal 2009 habe im Rahmen der Analysten- und der Konsenserwartungen gelegen. Der Umsatz von Tracleer im 4. Quartal 2009 (85% des Gesamtumsatzes) habe CHF 393,3 Mio. (VontE: CHF 400,3 Mio., K: CHF 389 Mio.) betragen und somit leicht hinter den Erwartungen der Analysten zurückgelegen. Tracleer habe jedoch die Konsenserwartungen übertreffen können. Das Wachstum in Lokalwährung für das Geschäftsjahr 2009 habe 23% betragen und entspreche der Prognose der Analysten (22%).
Der Betriebsgewinn für das 4. Quartal 2009 habe hinter den Erwartungen der Analysten zurückgelegen, aufgrund einer Zahlung von CHF 94 Mio. an Asahi Kasei. Actelion habe diese Zahlung Ende Dezember angekündigt und Auswirkungen auf die Zahlen für das Geschäftsjahr 2009 in Höhe von USD 80 Mio. erwartet (VontE: CHF 82 Mio.). Ein Umsatzwachstum über 10% in Lokalwährung sei konservativ. Vontobel erwarte 13% Wachstum in Lokalwährung, die Konsensprognose erwarte ein Wachstum von 10 bis 11% in Lokalwährung. Ein Nicht-GAAP Cash-EBIT-Wachstum von 20% in Lokalwährung sei hoch. Was die Pipeline anbetreffe, würden alle auf die bevorstehenden IPF-Daten warten. Andere Projekte würden um ein bis zwei Quartale verschoben.
Die Finanzergebnisse würden insgesamt den Erwartungen entsprechen. Die Analysten würden nicht davon ausgehen, dass sie ihre Erwartungen wesentlich ändern würden. Starke Cash-EBIT-Prognose auf Nicht-GAAP-Basis dürfte leichte Erhöhungen der EBIT-Zahlen in den Konsens-Erwartungen für das Geschäftsjahr 2010 bewirken.
Die Analysten von Vontobel Research bestätigen ihr "buy"-Rating für die Actelion-Aktie mit einem Kursziel von CHF 80. Der nächste wichtige Katalysator würden die Phase-III-Daten für Tracleer in der Behandlung von idiopathischer Lungenfibrose (IPF) sein. (Analyse vom 18.02.2010) (18.02.2010/ac/a/a)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, bewertet die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" weiterhin mit dem Rating "buy".
Actelion habe heute Morgen das Ergebnis für das 4. Quartal 2009 vorgelegt. Der Umsatz habe CHF 470 Mio. (VontE: CHF 474,2 Mio., Kons.: CHF 468 Mio.) betragen. Das Cash-EBIT habe sich auf Nicht-GAAP-Basis auf CHF 105,2 Mio. (VontE: CHF 118,4 Mio., Kons.: CHF 101,4 Mio.) belaufen, und der Reingewinn habe CHF -15,5 Mio. (VontE: CHF 1,3 Mio.) betragen.
Der Konzernumsatz für das 4. Quartal 2009 habe im Rahmen der Analysten- und der Konsenserwartungen gelegen. Der Umsatz von Tracleer im 4. Quartal 2009 (85% des Gesamtumsatzes) habe CHF 393,3 Mio. (VontE: CHF 400,3 Mio., K: CHF 389 Mio.) betragen und somit leicht hinter den Erwartungen der Analysten zurückgelegen. Tracleer habe jedoch die Konsenserwartungen übertreffen können. Das Wachstum in Lokalwährung für das Geschäftsjahr 2009 habe 23% betragen und entspreche der Prognose der Analysten (22%).
Der Betriebsgewinn für das 4. Quartal 2009 habe hinter den Erwartungen der Analysten zurückgelegen, aufgrund einer Zahlung von CHF 94 Mio. an Asahi Kasei. Actelion habe diese Zahlung Ende Dezember angekündigt und Auswirkungen auf die Zahlen für das Geschäftsjahr 2009 in Höhe von USD 80 Mio. erwartet (VontE: CHF 82 Mio.). Ein Umsatzwachstum über 10% in Lokalwährung sei konservativ. Vontobel erwarte 13% Wachstum in Lokalwährung, die Konsensprognose erwarte ein Wachstum von 10 bis 11% in Lokalwährung. Ein Nicht-GAAP Cash-EBIT-Wachstum von 20% in Lokalwährung sei hoch. Was die Pipeline anbetreffe, würden alle auf die bevorstehenden IPF-Daten warten. Andere Projekte würden um ein bis zwei Quartale verschoben.
Die Finanzergebnisse würden insgesamt den Erwartungen entsprechen. Die Analysten würden nicht davon ausgehen, dass sie ihre Erwartungen wesentlich ändern würden. Starke Cash-EBIT-Prognose auf Nicht-GAAP-Basis dürfte leichte Erhöhungen der EBIT-Zahlen in den Konsens-Erwartungen für das Geschäftsjahr 2010 bewirken.
Die Analysten von Vontobel Research bestätigen ihr "buy"-Rating für die Actelion-Aktie mit einem Kursziel von CHF 80. Der nächste wichtige Katalysator würden die Phase-III-Daten für Tracleer in der Behandlung von idiopathischer Lungenfibrose (IPF) sein. (Analyse vom 18.02.2010) (18.02.2010/ac/a/a)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
18.02.10, 12:07
HELVEA SA
Actelion "buy"
Rating-Update:
Genf (aktiencheck.de AG) - Olav Zilian, Analyst von Helvea, stuft die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) unverändert mit "buy" ein. Das Kursziel sehe man weiterhin bei CHF 86. (18.02.2010/ac/a/u)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
HELVEA SA
Actelion "buy"
Rating-Update:
Genf (aktiencheck.de AG) - Olav Zilian, Analyst von Helvea, stuft die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) unverändert mit "buy" ein. Das Kursziel sehe man weiterhin bei CHF 86. (18.02.2010/ac/a/u)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
19.02.2010, 10:58
VONTOBEL RESEARCH
Actelion "buy"
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, stuft die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" weiterhin mit "buy" ein.
Actelion habe gestern die Zahlen für das Geschäftsjahr 2009 bekannt gegeben. Die Geschäftsleitung habe eine Analystenkonferenz in Zürich abgehalten, um die Ergebnisse, die Prognose und die Pipeline zu diskutieren. Erwartungsgemäß seien keine Daten zu Bosentan bei idiopathischer pulmonaler Fibrose veröffentlicht worden. Die Einnahmen hätten den Analysten- und den Konsenserwartungen entsprochen. Das Cash-EBIT auf Nicht-GAAP-Basis habe den Konsenserwartungen entsprochen, sei aber hauptsächlich wegen der Kosten aus der Einigung im Asahi Kasei-Verfahren hinter der Analystenprognose zurückgeblieben. Der nächste wichtige Impulsgeber seien die Phase-III-Studiendaten aus der BUILD-3-Studie, die in ein bis zwei Wochen erwartet würden.
Die Evaluation der Patienten aus der BUILD-3-Studie sei in der letzten Phase und man erwarte die Daten in den kommenden ein bis zwei Wochen. Nach dem Erreichen von 202 klinischen Ereignissen Ende 2009 seien alle übrig gebliebenen Patienten evaluiert worden. Patienten, deren Zustand sich verändert habe, seien aufgefordert worden, nach ein paar Wochen zurückzukommen, um die Diagnose zu bestätigen. Danach habe die Datenbank bereinigt und die statistische Evaluation durchgeführt werden können.
Die Analysten hätten von der Geschäftsleitung von Actelion erfahren, dass die letzten Patienten evaluiert worden seien und die Datenbank nun bereinigt werde. Die Geschäftsleitung von Actelion habe darauf hingewiesen, dass die statistische Evaluation an einem Freitag stattfinden werde. Dadurch könne der statistische Bericht über das Wochenende analysiert und die Ergebnisse an einem Montag veröffentlicht werden. Man erwarte, dass die Daten frühestens am Montag in einer Woche veröffentlicht würden, da am kommenden Montag in Basel ein Feiertag stattfinde.
Die Analysten von Vontobel Research bestätigen ihre "buy"-Empfehlung und das Kursziel von CHF 80 für die Aktie von Actelion. Der nächste Impulsgeber sei die Veröffentlichung der BUILD-3-Daten zur Untersuchung der Wirksamkeit von Bosentan bei idiopathischer pulmonaler Fibrose. (Analyse vom 19.02.2010) (19.02.2010/ac/a/a)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
VONTOBEL RESEARCH
Actelion "buy"
Zürich (aktiencheck.de AG) - Andrew C. Weiss, Analyst von Vontobel Research, stuft die Aktie von Actelion (ISIN CH0010532478/ WKN 936767) in der aktuellen Ausgabe von "Vontobel Morning Focus" weiterhin mit "buy" ein.
Actelion habe gestern die Zahlen für das Geschäftsjahr 2009 bekannt gegeben. Die Geschäftsleitung habe eine Analystenkonferenz in Zürich abgehalten, um die Ergebnisse, die Prognose und die Pipeline zu diskutieren. Erwartungsgemäß seien keine Daten zu Bosentan bei idiopathischer pulmonaler Fibrose veröffentlicht worden. Die Einnahmen hätten den Analysten- und den Konsenserwartungen entsprochen. Das Cash-EBIT auf Nicht-GAAP-Basis habe den Konsenserwartungen entsprochen, sei aber hauptsächlich wegen der Kosten aus der Einigung im Asahi Kasei-Verfahren hinter der Analystenprognose zurückgeblieben. Der nächste wichtige Impulsgeber seien die Phase-III-Studiendaten aus der BUILD-3-Studie, die in ein bis zwei Wochen erwartet würden.
Die Evaluation der Patienten aus der BUILD-3-Studie sei in der letzten Phase und man erwarte die Daten in den kommenden ein bis zwei Wochen. Nach dem Erreichen von 202 klinischen Ereignissen Ende 2009 seien alle übrig gebliebenen Patienten evaluiert worden. Patienten, deren Zustand sich verändert habe, seien aufgefordert worden, nach ein paar Wochen zurückzukommen, um die Diagnose zu bestätigen. Danach habe die Datenbank bereinigt und die statistische Evaluation durchgeführt werden können.
Die Analysten hätten von der Geschäftsleitung von Actelion erfahren, dass die letzten Patienten evaluiert worden seien und die Datenbank nun bereinigt werde. Die Geschäftsleitung von Actelion habe darauf hingewiesen, dass die statistische Evaluation an einem Freitag stattfinden werde. Dadurch könne der statistische Bericht über das Wochenende analysiert und die Ergebnisse an einem Montag veröffentlicht werden. Man erwarte, dass die Daten frühestens am Montag in einer Woche veröffentlicht würden, da am kommenden Montag in Basel ein Feiertag stattfinde.
Die Analysten von Vontobel Research bestätigen ihre "buy"-Empfehlung und das Kursziel von CHF 80 für die Aktie von Actelion. Der nächste Impulsgeber sei die Veröffentlichung der BUILD-3-Daten zur Untersuchung der Wirksamkeit von Bosentan bei idiopathischer pulmonaler Fibrose. (Analyse vom 19.02.2010) (19.02.2010/ac/a/a)
Offenlegung von möglichen Interessenskonflikten: Mögliche Interessenskonflikte können Sie auf der Site des Erstellers/ der Quelle der Analyse einsehen.
Antwort auf Beitrag Nr.: 38.974.032 von Fruehrentner am 19.02.10 14:07:03
Tracleer bei IPF ist nun endgültig und offiziell gescheitert.
Obschon man diesen Versuch nicht ernsthaft als Hoffnungsträger ansehen durfte, wird der Kurs heute negativ reagieren. Und zwar zu recht. Denn es stellen sich hier wirklich Fragen hinsichtlich des gesamten Pipelinemanagements von Actelion.
-------------
Reuters:
Die Marktteilnehmer dürften ihr Augenmerk dabei auf die Aktien von Actelion richten. Europas grösste Biotechnologiefirma hat mit Tracleer ein wichtiges Ziel nicht erreicht. Actelions Hauptprodukt vermindert die Sterblichkeit bei Lungenfibrose (IPF) nicht. Von der Zulassung für diese Indikation hatte sich Actelion eine Umsatzverdopplung für sein wichtigstes Medikament versprochen.
"Das ist eine Riesenenttäuschung. Auf diese Zusatzanwendung haben viele Anleger gehofft", sagte ein Händler. Dadurch dürfte die Aktie wohl stark unter Druck geraten. "Sollte der Titel stark unter Druck geraten, könnte dies aber längerfristig durchaus eine günstige Gelegenheit sein. "Actelion hat ja nicht nur ein Medikament", sagte ein Händler.
Tracleer bei IPF ist nun endgültig und offiziell gescheitert.
Obschon man diesen Versuch nicht ernsthaft als Hoffnungsträger ansehen durfte, wird der Kurs heute negativ reagieren. Und zwar zu recht. Denn es stellen sich hier wirklich Fragen hinsichtlich des gesamten Pipelinemanagements von Actelion.
-------------
Reuters:
Die Marktteilnehmer dürften ihr Augenmerk dabei auf die Aktien von Actelion richten. Europas grösste Biotechnologiefirma hat mit Tracleer ein wichtiges Ziel nicht erreicht. Actelions Hauptprodukt vermindert die Sterblichkeit bei Lungenfibrose (IPF) nicht. Von der Zulassung für diese Indikation hatte sich Actelion eine Umsatzverdopplung für sein wichtigstes Medikament versprochen.
"Das ist eine Riesenenttäuschung. Auf diese Zusatzanwendung haben viele Anleger gehofft", sagte ein Händler. Dadurch dürfte die Aktie wohl stark unter Druck geraten. "Sollte der Titel stark unter Druck geraten, könnte dies aber längerfristig durchaus eine günstige Gelegenheit sein. "Actelion hat ja nicht nur ein Medikament", sagte ein Händler.
Antwort auf Beitrag Nr.: 39.030.378 von SLGramann am 01.03.10 08:54:21
Actelion zunächst mit 18% im Minus.
Das ist heftiger, als ich dachte. Es scheint wirklich eine Menge Leute zu geben, die sich von Tracleer bei IPF ernsthaft etwas versprochen haben. Na ja...
Worauf es jetzt ankommt, ist, die eigene Pipeline endlich massiv aufzuhübschen. Denn Actelion steht wirklich nicht so gut da. Tracleer bei IPF gescheitert, S1P1 nach dem Rückzug von Roche für mich ein Abschussposten. Verzögerungen und gesteigerte Risiken bei Almorexant. So gut wie nichts in der P 1.
Was kann man tun? Aus meiner Sicht hätte man schon letztes Jahr einen fetten Einlizensierungsdeal abliefern müssen. Da gab es fette Chancen - die fetteste war Incyte. Ich weiß natürlich nicht, ob man es zumindest versucht hat, zumindest hat man aber nichts erreicht.
Die Übernahme eines attraktiven development-stage Unternehmens mit guter Technologie und einigen schönen Projekten in der Klinik wäre eine noch radikalere, aber vielleicht notwenige Maßnahme. Vielleicht hätte man es zur richtigen Zeit bei ArQule versuchen können, aber die Tür dürfte mittlerweile auch zu sein.
Actelion, ihr müsst jetzt echt aufhören, nur Daumen zu lutschen und mal was grundsätzliches machen! So lange ich da nichts sehe, ist das Unternehmen für mich weiterhin kein Investment.
Actelion zunächst mit 18% im Minus.
Das ist heftiger, als ich dachte. Es scheint wirklich eine Menge Leute zu geben, die sich von Tracleer bei IPF ernsthaft etwas versprochen haben. Na ja...
Worauf es jetzt ankommt, ist, die eigene Pipeline endlich massiv aufzuhübschen. Denn Actelion steht wirklich nicht so gut da. Tracleer bei IPF gescheitert, S1P1 nach dem Rückzug von Roche für mich ein Abschussposten. Verzögerungen und gesteigerte Risiken bei Almorexant. So gut wie nichts in der P 1.
Was kann man tun? Aus meiner Sicht hätte man schon letztes Jahr einen fetten Einlizensierungsdeal abliefern müssen. Da gab es fette Chancen - die fetteste war Incyte. Ich weiß natürlich nicht, ob man es zumindest versucht hat, zumindest hat man aber nichts erreicht.
Die Übernahme eines attraktiven development-stage Unternehmens mit guter Technologie und einigen schönen Projekten in der Klinik wäre eine noch radikalere, aber vielleicht notwenige Maßnahme. Vielleicht hätte man es zur richtigen Zeit bei ArQule versuchen können, aber die Tür dürfte mittlerweile auch zu sein.
Actelion, ihr müsst jetzt echt aufhören, nur Daumen zu lutschen und mal was grundsätzliches machen! So lange ich da nichts sehe, ist das Unternehmen für mich weiterhin kein Investment.
aus der NZZ:
Actelions Stern etwas blass
Unter Druck befindet sich auch die Aktie der erfolgsverwöhnten Actelion. Im März scheiterten Versuche, eine weitere seltene Krankheit mit dem Medikament Tracleer zu behandeln. Seitdem fragen sich die Aktionäre, wo der nächste Wachstumsschub herkommen soll. Tracleer hat 2009 1,5 Mrd. Fr. Umsatz erzielt und wächst im Hauptgebiet Lungenhochdruck weiterhin. Aber 2015 droht der Patentablauf. Die Zeit, um einen soliden Nachfolger aus dem Boden zu stampfen, wird knapp. Vor allem, weil auch über dem Hoffnungsträger Nr. 2 von Actelion ein Schatten liegt. Das Schlafmittel zeigte im Dezember 2009 in einer Phase-III-Studie gute Wirksamkeit, aber es traten nicht näher bezeichnete «Sicherheitsbeobachtungen» auf. Bis heute gibt es keine weiteren Details. Firmensprecher Roland Haefeli sagt: «Actelion hofft, im Sommer ein Update zum angepassten Vorgehen in den weiteren Phase-III-Studien geben zu können.» David Kaegi, Analyst der Bank Sarasin für Aktien aus dem Gesundheitsbereich, zeigt sich von Actelions Erfolgsausweis bei der Erprobung neuer Medikamente ernüchtert. Eine Reihe von aufwendigen Studien mit verschiedenen Medikamente-Kandidaten haben keinen Erfolg gebracht. «Möglicherweise ist Actelion bei der Auswahl der Kandidaten für die letzte, teuerste Teststufe nicht streng genug», sagt Kaegi.
----------
Actelion ist mittlerweile deutlich preiswerter geworden. Dennoch sind die Unsicherheiten derzeit zu groß imho. Zunächst muss geklärt werden, ob und wie es mit Almorexant weitergehen kann. Dann stehen die P III-Clazo-Daten an, die jetzt im Oktober erwartet werden. Hier besteht meiner Meinung nach ein überdurchschnittliches Risiko, dass das Projekt scheitern wird.
Ich warte daher weiter ab.
Actelions Stern etwas blass
Unter Druck befindet sich auch die Aktie der erfolgsverwöhnten Actelion. Im März scheiterten Versuche, eine weitere seltene Krankheit mit dem Medikament Tracleer zu behandeln. Seitdem fragen sich die Aktionäre, wo der nächste Wachstumsschub herkommen soll. Tracleer hat 2009 1,5 Mrd. Fr. Umsatz erzielt und wächst im Hauptgebiet Lungenhochdruck weiterhin. Aber 2015 droht der Patentablauf. Die Zeit, um einen soliden Nachfolger aus dem Boden zu stampfen, wird knapp. Vor allem, weil auch über dem Hoffnungsträger Nr. 2 von Actelion ein Schatten liegt. Das Schlafmittel zeigte im Dezember 2009 in einer Phase-III-Studie gute Wirksamkeit, aber es traten nicht näher bezeichnete «Sicherheitsbeobachtungen» auf. Bis heute gibt es keine weiteren Details. Firmensprecher Roland Haefeli sagt: «Actelion hofft, im Sommer ein Update zum angepassten Vorgehen in den weiteren Phase-III-Studien geben zu können.» David Kaegi, Analyst der Bank Sarasin für Aktien aus dem Gesundheitsbereich, zeigt sich von Actelions Erfolgsausweis bei der Erprobung neuer Medikamente ernüchtert. Eine Reihe von aufwendigen Studien mit verschiedenen Medikamente-Kandidaten haben keinen Erfolg gebracht. «Möglicherweise ist Actelion bei der Auswahl der Kandidaten für die letzte, teuerste Teststufe nicht streng genug», sagt Kaegi.
----------
Actelion ist mittlerweile deutlich preiswerter geworden. Dennoch sind die Unsicherheiten derzeit zu groß imho. Zunächst muss geklärt werden, ob und wie es mit Almorexant weitergehen kann. Dann stehen die P III-Clazo-Daten an, die jetzt im Oktober erwartet werden. Hier besteht meiner Meinung nach ein überdurchschnittliches Risiko, dass das Projekt scheitern wird.
Ich warte daher weiter ab.
Antwort auf Beitrag Nr.: 39.552.292 von SLGramann am 20.05.10 08:07:03
Wie bereits im letzten Posting gemutmaßt, ist Clazosentan nun auch gescheitert.
Actelion verfehlt primären Endpunkt mit Clazosentan bei aSAB
Zürich (awp) - Die Actelion Ltd hat mit Clazosentan in einer Phase-III-Studie einen Rückschlag erlitten. Der Produktkandidat hat bei der Indikation aneurysmatischen Subarachnoidalblutung (aSAB) in der Studie CONSCIOUS-2 den primären Endpunkt verfehlt. Mit der Testreihe wurde die Sicherheit und Wirksamkeit von Clazosentan bei der Verminderung von Gefässspasmen-bedingter Morbidität und Gesamtmortalität bei Patienten untersucht, die nach einer aSAB durch chirurgisches Clipping behandelt wurden, teilt das Pharma-Unternehmen am Montag mit.
Der primäre Endpunkt zeigte gemäss Mitteilung eine nicht signifikante relative Verringerung des Risikos von 17% zugunsten von Clazosentan. Das Sicherheitsprofil von Clazosentan in der Studie sei mit den Ergebnissen vorangegangener Tests mit dem Medikament in dieser Indikation vergleichbar gewesen.
CEO Jean-Paul Clozel gibt sich in der Mitteilung enttäuscht über das Studienergebnis. "Actelion wird sich weiterhin auf das Wachstum seiner derzeitigen Geschäftsgrundlage konzentrieren. Mit vier Produkten auf dem Markt erzielt Actelion die erforderlichen Einnahmen, um auch künftig angemessen in die klinischen Studien seiner mehr als zehn Entwicklungssubstanzen zu investieren", wird der CEO in der Mitteilung zitiert.
Das Unternehmen hat derzeit das Hauptprodukt Tracleer sowie die weiteren Produkte Veletri, Ventavis und Zavesca auf dem Markt.
CONSCIOUS-2 war eine in über 100 Zentren durchgeführte globale Studie mit über 1'150 Patienten, deren Subarachnoidalblutung infolge eines Aneurysmas durch chirurgisches Clipping behandelt worden war. Die Patienten erhielten nach dem Zufallsprinzip in einem Verhältnis von 2:1 entweder 5mg/h Clazosentan oder Plazebo.
Über das weitere Vorgehen im Zusammenhang mit der CONSCIOUS-3-Studie bei Patienten, deren Aneurysma nach einer aSAB durch endovaskuläres Coiling behandelt worden seien, werde man sich mit dem Lenkungsausschuss beraten. Über den Stand des Clazosentan-Entwicklungsprogramms soll im Rahmen der Quartalsberichtserstattung am 21.10.2010 informiert werden, heisst es weiter.
In dieser Phase-III-Studie wird die Wirksamkeit und Sicherheit von zwei Dosierungen (5 oder 15 mg/h) von Clazosentan im Vergleich zu Plazebo untersucht. Der primäre Endpunkt entspreche dem von CONSCIOUS-2, so die Mitteilung. Bis Ende September 2010 seien 600 der vorgesehenen 1'500 Patienten rekrutiert worden.
rt/cf
Nach wie vor ist unklar, ob und wie es mit Almorexant weitergeht. Damit ist innerhalb der letzten 12 Monate die gesamte Pipelinespitze mehr oder weniger ausradiert worden. Actelion hätte aus meiner Sicht bereits im vergangenen Jahr alles daran setzen müssen, die Pipeline durch eine Übernahme oder durch Einlizensierungen zu stärken. Viele gute Möglichkeiten sind da verpasst worden. Aber es gibt natürlich immer wieder Chancen, nur muss man sie nutzen. Exelexis ist bspw. einigermaßen preiswert geworden.
Überhaupt sollte die Pipeline endlich auch in Richtung Onkologie erweitert werden! Klar sind da auch alle anderen - aber vielleicht gibts dafür ja gute Gründe?!
Actelion hat (zu) viel zu tun und ist für mich nach wie vor kein Kauf.
Wie bereits im letzten Posting gemutmaßt, ist Clazosentan nun auch gescheitert.
Actelion verfehlt primären Endpunkt mit Clazosentan bei aSAB
Zürich (awp) - Die Actelion Ltd hat mit Clazosentan in einer Phase-III-Studie einen Rückschlag erlitten. Der Produktkandidat hat bei der Indikation aneurysmatischen Subarachnoidalblutung (aSAB) in der Studie CONSCIOUS-2 den primären Endpunkt verfehlt. Mit der Testreihe wurde die Sicherheit und Wirksamkeit von Clazosentan bei der Verminderung von Gefässspasmen-bedingter Morbidität und Gesamtmortalität bei Patienten untersucht, die nach einer aSAB durch chirurgisches Clipping behandelt wurden, teilt das Pharma-Unternehmen am Montag mit.
Der primäre Endpunkt zeigte gemäss Mitteilung eine nicht signifikante relative Verringerung des Risikos von 17% zugunsten von Clazosentan. Das Sicherheitsprofil von Clazosentan in der Studie sei mit den Ergebnissen vorangegangener Tests mit dem Medikament in dieser Indikation vergleichbar gewesen.
CEO Jean-Paul Clozel gibt sich in der Mitteilung enttäuscht über das Studienergebnis. "Actelion wird sich weiterhin auf das Wachstum seiner derzeitigen Geschäftsgrundlage konzentrieren. Mit vier Produkten auf dem Markt erzielt Actelion die erforderlichen Einnahmen, um auch künftig angemessen in die klinischen Studien seiner mehr als zehn Entwicklungssubstanzen zu investieren", wird der CEO in der Mitteilung zitiert.
Das Unternehmen hat derzeit das Hauptprodukt Tracleer sowie die weiteren Produkte Veletri, Ventavis und Zavesca auf dem Markt.
CONSCIOUS-2 war eine in über 100 Zentren durchgeführte globale Studie mit über 1'150 Patienten, deren Subarachnoidalblutung infolge eines Aneurysmas durch chirurgisches Clipping behandelt worden war. Die Patienten erhielten nach dem Zufallsprinzip in einem Verhältnis von 2:1 entweder 5mg/h Clazosentan oder Plazebo.
Über das weitere Vorgehen im Zusammenhang mit der CONSCIOUS-3-Studie bei Patienten, deren Aneurysma nach einer aSAB durch endovaskuläres Coiling behandelt worden seien, werde man sich mit dem Lenkungsausschuss beraten. Über den Stand des Clazosentan-Entwicklungsprogramms soll im Rahmen der Quartalsberichtserstattung am 21.10.2010 informiert werden, heisst es weiter.
In dieser Phase-III-Studie wird die Wirksamkeit und Sicherheit von zwei Dosierungen (5 oder 15 mg/h) von Clazosentan im Vergleich zu Plazebo untersucht. Der primäre Endpunkt entspreche dem von CONSCIOUS-2, so die Mitteilung. Bis Ende September 2010 seien 600 der vorgesehenen 1'500 Patienten rekrutiert worden.
rt/cf
Nach wie vor ist unklar, ob und wie es mit Almorexant weitergeht. Damit ist innerhalb der letzten 12 Monate die gesamte Pipelinespitze mehr oder weniger ausradiert worden. Actelion hätte aus meiner Sicht bereits im vergangenen Jahr alles daran setzen müssen, die Pipeline durch eine Übernahme oder durch Einlizensierungen zu stärken. Viele gute Möglichkeiten sind da verpasst worden. Aber es gibt natürlich immer wieder Chancen, nur muss man sie nutzen. Exelexis ist bspw. einigermaßen preiswert geworden.
Überhaupt sollte die Pipeline endlich auch in Richtung Onkologie erweitert werden! Klar sind da auch alle anderen - aber vielleicht gibts dafür ja gute Gründe?!
Actelion hat (zu) viel zu tun und ist für mich nach wie vor kein Kauf.
Neue Übernahmegerüchte treiben Actelion-Aktie
Spekulationen über eine Übernahme von Actelion haben der Aktie des Schweizer Biotech-Unternehmens am Donnerstag erneut Auftrieb gegeben. Händlern zufolge wurde an den Märkten gemutmaßt, dass der britische Pharmariese GlaxoSmithKline 72 Schweizer Franken je Actelion-Aktie bieten könnte. Actelion-Aktien schlossen 6,6 Prozent höher bei 53 Franken. Die Titel haben in diesem Monat bereits über 30 Prozent hinzugewonnen.
Weder Actelion noch Glaxo wollten sich zu den neuen Marktgerüchten äußern. Eine mit der Situation vertraute Person sagte Reuters jedoch, Glaxo sei nicht an einer Übernahme von Actelion interessiert. Die Schweizer entwickeln gemeinsam mit Glaxo das Schlafmittel Almorexant.
Am Mittwoch hatte Reuters von einer mit der Angelegenheit vertrauten Person erfahren, Actelion stehe kurz vor der Verpflichtung der Investmentbank Moelis & Co als Berater und werde wahrscheinlich auch bei Credit Suisse Rat suchen. Analysten zufolge kommen auch Bristol-Myers Squibb, Amgen, Roche, AstraZeneca, Novartis und Bayer als potenzielle Käufer von Actelion infrage.
Quelle: Reuters
--------------------------------------------------------------------------------
Spekulationen über eine Übernahme von Actelion haben der Aktie des Schweizer Biotech-Unternehmens am Donnerstag erneut Auftrieb gegeben. Händlern zufolge wurde an den Märkten gemutmaßt, dass der britische Pharmariese GlaxoSmithKline 72 Schweizer Franken je Actelion-Aktie bieten könnte. Actelion-Aktien schlossen 6,6 Prozent höher bei 53 Franken. Die Titel haben in diesem Monat bereits über 30 Prozent hinzugewonnen.
Weder Actelion noch Glaxo wollten sich zu den neuen Marktgerüchten äußern. Eine mit der Situation vertraute Person sagte Reuters jedoch, Glaxo sei nicht an einer Übernahme von Actelion interessiert. Die Schweizer entwickeln gemeinsam mit Glaxo das Schlafmittel Almorexant.
Am Mittwoch hatte Reuters von einer mit der Angelegenheit vertrauten Person erfahren, Actelion stehe kurz vor der Verpflichtung der Investmentbank Moelis & Co als Berater und werde wahrscheinlich auch bei Credit Suisse Rat suchen. Analysten zufolge kommen auch Bristol-Myers Squibb, Amgen, Roche, AstraZeneca, Novartis und Bayer als potenzielle Käufer von Actelion infrage.
Quelle: Reuters
--------------------------------------------------------------------------------
Actelion mit massivem Aktienrückkaufprogramm:
ALLSCHWIL/BASEL, SWITZERLAND - 21 October 2010 - Actelion Ltd (SIX: ATLN) announced today that the company's Board of Directors has authorized the repurchase of up to CHF 800 million of the company's common stock over the next three years.
Given the company's solid financial position and robust cash generation, Actelion's Board of Directors and senior management believe that the share repurchase program represents an appropriate use of the company's cash, while allowing sufficient flexibility for continued investments in research and development, in-licensing and potential M&A opportunities.
--------------
Aus meiner Sicht defensiver Schwachsinn. Die 800 Mio. wären in einer Übernahme besser angelegt, wenn das Ziel passen würde. Actelion hat ein Pipeline-Problem und das ist nicht mit Aktienrückkäufen zu lösen!
ALLSCHWIL/BASEL, SWITZERLAND - 21 October 2010 - Actelion Ltd (SIX: ATLN) announced today that the company's Board of Directors has authorized the repurchase of up to CHF 800 million of the company's common stock over the next three years.
Given the company's solid financial position and robust cash generation, Actelion's Board of Directors and senior management believe that the share repurchase program represents an appropriate use of the company's cash, while allowing sufficient flexibility for continued investments in research and development, in-licensing and potential M&A opportunities.
--------------
Aus meiner Sicht defensiver Schwachsinn. Die 800 Mio. wären in einer Übernahme besser angelegt, wenn das Ziel passen würde. Actelion hat ein Pipeline-Problem und das ist nicht mit Aktienrückkäufen zu lösen!
Das Pipeline-Problem von Actelion zeigt sich erneut. Almorexant - einst als der große Hoffnungsträger und künftiger Blockbuster gehandelt - wird jetzt endlich auch offiziell beerdigt.
Actelion hätte in den letzten Jahren genug Chancen für Übernahmen interessanter Biotechs gehabt oder hätte zumindest einzelene Projekte einkaufen können. Nichts wurde genutzt, nichts wurde getan.
Bin gespannt, wie das in Zukunft mit Actelion weitergehen wird...
--------------------
ALLSCHWIL/BASEL, SCHWEIZ - 28. Januar 2011 - Actelion Ltd (SIX: ATLN) und
GlaxoSmithKline (GSK) teilten heute mit, dass die klinische Entwicklung des sich
in Phase III befindenden dualen Orexin-Rezeptor-Antagonisten Almorexant
eingestellt wurde. Diese Entscheidung basiert auf der Auswertung von Daten, die
im Rahmen ergänzender klinischer Studien erhoben wurden. Die Studien waren
durchgeführt worden, um das klinische Profil, unter anderem das
Verträglichkeitsprofil von Almorexant, klarer herauszuarbeiten.
GSK und Actelion sind entschlossen, ihre Forschungsarbeiten auf diesem Gebiet
weiterzuführen, um das Potenzial von Orexin-Rezeptor-Antagonisten bei
Schlafstörungen und anderen Indikationen besser zu verstehen. Basierend auf der
im Juli 2008 eingegangenen Orexin-Partnerschaft werden beide Unternehmen
weiterhin an der Erforschung und Entwicklung neuer Therapien auf der Basis von
Orexin-Rezeptor-Antagonisten arbeiten.
Actelion hätte in den letzten Jahren genug Chancen für Übernahmen interessanter Biotechs gehabt oder hätte zumindest einzelene Projekte einkaufen können. Nichts wurde genutzt, nichts wurde getan.
Bin gespannt, wie das in Zukunft mit Actelion weitergehen wird...
--------------------
ALLSCHWIL/BASEL, SCHWEIZ - 28. Januar 2011 - Actelion Ltd (SIX: ATLN) und
GlaxoSmithKline (GSK) teilten heute mit, dass die klinische Entwicklung des sich
in Phase III befindenden dualen Orexin-Rezeptor-Antagonisten Almorexant
eingestellt wurde. Diese Entscheidung basiert auf der Auswertung von Daten, die
im Rahmen ergänzender klinischer Studien erhoben wurden. Die Studien waren
durchgeführt worden, um das klinische Profil, unter anderem das
Verträglichkeitsprofil von Almorexant, klarer herauszuarbeiten.
GSK und Actelion sind entschlossen, ihre Forschungsarbeiten auf diesem Gebiet
weiterzuführen, um das Potenzial von Orexin-Rezeptor-Antagonisten bei
Schlafstörungen und anderen Indikationen besser zu verstehen. Basierend auf der
im Juli 2008 eingegangenen Orexin-Partnerschaft werden beide Unternehmen
weiterhin an der Erforschung und Entwicklung neuer Therapien auf der Basis von
Orexin-Rezeptor-Antagonisten arbeiten.
Titel ausgebrannt. Eine Übernahme wird es nicht geben da Entwicklungsprogramm zu mager.
Die Zahlen des vergangenen Geschäftsjahres enttäuschten die Analysten. Eine missverständliche Äußerung von CEO Clozel ließ die Aktie zusätzlich einbrechen.
weiterlesen auf transkript.de:
http://www.transkript.de/nachrichten/wirtschaft/2012-01/rede…
weiterlesen auf transkript.de:
http://www.transkript.de/nachrichten/wirtschaft/2012-01/rede…
Actelion: Ende der Zitterpartie
Der Phase III-Erfolg mit dem Lungenmedikament Macitentan lässt Actelion aufatmen. Die positiven Nachrichten gelten als Durchbruch für den zuletzt angeschlagenen Medikamentenentwickler.
Weiterlesen auf www.transkript.de
Der Phase III-Erfolg mit dem Lungenmedikament Macitentan lässt Actelion aufatmen. Die positiven Nachrichten gelten als Durchbruch für den zuletzt angeschlagenen Medikamentenentwickler.
Weiterlesen auf www.transkript.de
Actelion: Weniger Kündigungen
Die Schweizer Actelion AG kommt mit dem im März 2012 angekündigten Sparprogramm gut voran. Weil mehr Mitarbeiter als gedacht freiwillig gehen, kann nun die Zahl der Kündigungen gesenkt werden.
Weiterlesen auf www.transkript.de
Die Schweizer Actelion AG kommt mit dem im März 2012 angekündigten Sparprogramm gut voran. Weil mehr Mitarbeiter als gedacht freiwillig gehen, kann nun die Zahl der Kündigungen gesenkt werden.
Weiterlesen auf www.transkript.de
... ELAFIN ein neuer Wirkstoff ,humanidentisch !, und deshalb wohl ohne Nebenwirkungenen, würde hier gut passen.
Auch die Uni Stanford arbeitet und forscht bereits damit und macht vielen atemwegserkrankten Patienten ( u.a.PAH ) durchaus Hoffnung.
Auch die Uni Stanford arbeitet und forscht bereits damit und macht vielen atemwegserkrankten Patienten ( u.a.PAH ) durchaus Hoffnung.
Actelion: Starke Quartalszahlen unterstützen Aufwärtstrend
16. April 2013 | Von Marc Schmidt | Kategorie: Im Blick
In der Biotech-Branche läuft es – zumindest für Europas größten eigenständigen Biotech-Konzern Actelion (WKN 936767) – sehr gut. Wachsende Umsätze konnten erneut in überproportional steigende Gewinne umgesetzt werden und so die Erwartungen übertreffen. Der Aktie dürfte dies in ihrem fast bilderbuchhaften Aufwärtstrend weiter helfen.
Die Produktverkäufe stiegen im ersten Quartal von 415,8 Mio. CHF auf 432,8 Mio. CHF. Davon entfielen allein 375 Mio. CHF auf das Lungenhochdruckmittel Tracleer. Das operative Ergebnis stieg von 67,1 Mio. CHF auf 124,0 Mio. CHF. Das Nettoergebnis konnte auf 97,9 Mio. CHF mehr als verdoppelt werden. Das Ergebnis je Aktie verbesserte sich von 0,38 CHF auf nun 0,85 CHF.
Doch damit nicht genug, auch für das weitere Geschäftsjahr ist man durchaus zuversichtlich. CFO Andrew Oakley hält es angesichts von Vorbereitungen für zwei Phase-III-Studien und einer bevorstehenden Produkteinführung für möglich, dass ein Teil des für 2014 prognostizierten Gewinnwachstums schon in diesem Jahr erzielt werden kann.
Charttechnisch läuft es bei der Aktie seit einiger Zeit blendend. Die wichtigsten GDs haben deutlich Abstand zum Kurs. Auch fundamental ist die Aktie mit einem 2014er KGV von 13,4 nicht teuer. Wer nicht nur auf eine Biotech-Aktie setzen will, sollte sich mal das Beteiligungsunternehmen BB Biotech anschauen, dort befindet sich Actelion ebenfalls im Portfolio.
http://dieboersenblogger.de/32592/2013/04/actelion-starke-qu…
16. April 2013 | Von Marc Schmidt | Kategorie: Im Blick
In der Biotech-Branche läuft es – zumindest für Europas größten eigenständigen Biotech-Konzern Actelion (WKN 936767) – sehr gut. Wachsende Umsätze konnten erneut in überproportional steigende Gewinne umgesetzt werden und so die Erwartungen übertreffen. Der Aktie dürfte dies in ihrem fast bilderbuchhaften Aufwärtstrend weiter helfen.
Die Produktverkäufe stiegen im ersten Quartal von 415,8 Mio. CHF auf 432,8 Mio. CHF. Davon entfielen allein 375 Mio. CHF auf das Lungenhochdruckmittel Tracleer. Das operative Ergebnis stieg von 67,1 Mio. CHF auf 124,0 Mio. CHF. Das Nettoergebnis konnte auf 97,9 Mio. CHF mehr als verdoppelt werden. Das Ergebnis je Aktie verbesserte sich von 0,38 CHF auf nun 0,85 CHF.
Doch damit nicht genug, auch für das weitere Geschäftsjahr ist man durchaus zuversichtlich. CFO Andrew Oakley hält es angesichts von Vorbereitungen für zwei Phase-III-Studien und einer bevorstehenden Produkteinführung für möglich, dass ein Teil des für 2014 prognostizierten Gewinnwachstums schon in diesem Jahr erzielt werden kann.
Charttechnisch läuft es bei der Aktie seit einiger Zeit blendend. Die wichtigsten GDs haben deutlich Abstand zum Kurs. Auch fundamental ist die Aktie mit einem 2014er KGV von 13,4 nicht teuer. Wer nicht nur auf eine Biotech-Aktie setzen will, sollte sich mal das Beteiligungsunternehmen BB Biotech anschauen, dort befindet sich Actelion ebenfalls im Portfolio.
http://dieboersenblogger.de/32592/2013/04/actelion-starke-qu…
Untersuchung gestoppt: Actelion-Aktie gesucht
Actelion legt am Freitag am SMI zu.
Bild: Reuters
10.01.2014 11:13
Die Einstellung einer Untersuchung in den USA wegen möglicher fragwürdiger Verkaufspraktiken hat den Aktien der Schweizer Biotechfirma Actelion am Freitag kräftig Auftrieb gegeben.
Die Titel stiegen um 1,8 Prozent auf 79,05 Franken - deutlich stärker als der Index der europäischen Gesundheitswerte.
Die Behörden in Amerika hatten untersucht, ob Actelion sein Lungenmedikament Tracleer bei Ärzten mit nicht zutreffenden Argumenten angepriesen habe, etwa zur Behandlung anderer als im Beipackzettel genannter Erkrankungen (Off-Label-Use). Hinweise auf ein Fehlverhalten wurden nicht gefunden und das Verfahren wurde eingestellt. In den USA können Strafen für unethische Verkaufspraktiken sehr hoch ausfallen.
Actelion legt am Freitag am SMI zu.
Bild: Reuters
10.01.2014 11:13
Die Einstellung einer Untersuchung in den USA wegen möglicher fragwürdiger Verkaufspraktiken hat den Aktien der Schweizer Biotechfirma Actelion am Freitag kräftig Auftrieb gegeben.
Die Titel stiegen um 1,8 Prozent auf 79,05 Franken - deutlich stärker als der Index der europäischen Gesundheitswerte.
Die Behörden in Amerika hatten untersucht, ob Actelion sein Lungenmedikament Tracleer bei Ärzten mit nicht zutreffenden Argumenten angepriesen habe, etwa zur Behandlung anderer als im Beipackzettel genannter Erkrankungen (Off-Label-Use). Hinweise auf ein Fehlverhalten wurden nicht gefunden und das Verfahren wurde eingestellt. In den USA können Strafen für unethische Verkaufspraktiken sehr hoch ausfallen.
Actelion ist ein junges Biopharmazie Unternehmen.
Es wurde 1997 gegründet und seit 2000 im SWX Swiss Exchange Index geführt.
Die Aktie zeigt sich 2012 extrem bullish, der Aufwärtsbewegung ist in Takt
seit 2012.
Point & Figure: Kursziel 100 EUR, Stopp 67 EUR, zZ 76 EUR.
Allschwil (awp) - Das Biopharma-Unternehmen Actelion hat sich im Geschäftsjahr 2013 besser entwickelt als erwartet. Zudem wurden mit der Produktpipeline Fortschritte erzielt, wobei vor allem die Zulassung des Tracleer-Nachfolgers Opsumit in den USA und in Europa Glanzlichter waren. Darüber hinaus sind die Produktkandidaten Selexipag und Cadazolid weiter auf Kurs. Für die Geschäftsjahre 2014 und 2015 hat das Management die Guidance angehoben. Die Aktie reagiert indessen kaum auf die News.
Der Produktumsatz stieg im Berichtsjahr um 4% auf 1,78 Mrd CHF, zu konstanten Wechselkursen (kWk) belief sich der Anstieg auf 6%. Davon entfielen 1,53 Mrd (+2%; zu kWk +5%) auf das Hauptprodukt Tracleer zur Therapie von Lungenbluthochdruck (pulmonale arterielle Hypertonie, PAH).
Der Nachfolger von Tracleer - Opsumit - erzielte seit der Markteinführung im November in den USA bis Ende des Geschäftsjahres einen Umsatz von 5 Mio CHF. CEO Jean-Paul Clozel sieht Opsumit als führende Behandlung von PAH, wie er an einer Telefonkonferenz zum Abschluss 2013 am Dienstag sagte. "Deshalb gehen wir davon aus, dass die Umsatzzahlen von Opsumit diejenigen von Tracleer noch überschreiten werden", ergänzte Chief Operating Officer Otto Schwarz und bestätigte damit frühere Aussagen.
Im grössten PAH-Markt Europas, in Deutschland, hat die Markteinführung von Opsumit begonnen, danach folgt Grossbritannien. Bis Ende dieses Jahres oder Anfang nächsten Jahres soll das neue Produkt auch in Frankreich, Spanien und Italien verkauft werden.
Unter den weiteren Produkten erreichten die Verkäufe von Ventavis unverändert 110 Mio CHF, von Zavesca 96 Mio (+13%) und von Veletri 37 Mio (+52%).
PROFITABILITÄT ERHÖHT - MEHR DIVIDENDE
Auf den Ergebnisebenen erzielte Actelion überdurchschnittliche Zuwachsraten. Der US-GAAP-EBIT wuchs um 14% auf 482 Mio CHF, und der Kerngewinn stieg um 15% auf 619 Mio. Der Kernreingewinn wird mit 509 Mio um 13% höher ausgewiesen. Dem stehen ein Kernaufwand für Forschung und Entwicklung von 356 Mio CHF (-11%) gegenüber. Für Vertrieb und Verwaltung wurden mit 601 Mio um 2% mehr ausgegeben, was auf höhere Kosten im Zusammenhang mit Markteinführungen zurückgeführt wird.
An den Fortschritten sollen auch die Aktionäre beteiligt werden. Der Verwaltungsrat schlägt der Generalversammlung für das Berichtsjahr eine erhöhte Dividende von 1,20 CHF je Aktie vor, nach 1,00 CHF im Vorjahr.
Per Ende 2013 verfügte das Unternehmen über liquide Mittel und Bareinlagen von 1,5 Mrd CHF. Zudem hält Actelion 9,1 Mio eigene Aktien.
PRODUKTPIPELINE AUF KURS - SPEZIALITÄTEN-PORTFOLIO IM AUFBAU
Die fortgeschrittene Produktpipeline ist gemäss Management auf Kurs. So werden die ersten Ergebnisse aus der Phase-III-Studie GRIPHON für den PAH-Produktkandidaten Selexipag um Mitte dieses Jahres erwartet. Mit dem Opsumit-Nachfolger habe Actelion einen Vorsprung auf die Konkurrenz von mindestens fünf Jahren, sagte der CEO gegenüber AWP. Des weiteren wird mit Phase-III-Ergebnissen für das Antibiotikum Cadazolid unverändert im Jahr 2016 gerechnet.
Der Aufbau eines Spezialitäten-Portfolios als Ergänzung der PAH-Franchise ist mit der Übernahme des Unternehmens Ceptaris und damit dem Hautmedikament Valchlor voran gekommen. Das Produkt ist in den USA bereits auf dem Markt. Dieser Bereich soll durch eigene Forschung und Übernahmen ausgebaut werden.
AUSBLICK ANGEHOBEN
Für die Geschäftsjahre 2014/15 erhöht das Management die Guidance. So wird für das laufende Jahr neu ein Wachstum des Kerngewinns im niedrigen einstelligen Prozentbereich (zu kWk) erwartet. 2015 wird mit einem Wachstum des Kerngewinns im niedrigen einstelligen Prozentbereich gerechnet, dies wiederum auf einer erhöhten Ausgangsbasis.
In dem seit längerem laufenden Streitfall mit Asahi hat Actelion beim Supreme Court von Kalifornien die Überprüfung des Urteils des Court of Appeal beantragt. Im zweiten Quartal dürfte das Gericht entscheiden, ob es auf den Antrag eintreten will, hiess es.
AKTIE LEGT LEICHT ZU
An der Börse werden die Zahlen von Actelion mit etwas Zurückhaltung gut aufgenommen. Einerseits habe Actelion im Schlussquartal von Einmaleffekten profitiert; andererseits sei die Bewertung der Titel bereits hoch bzw. fair, hiess es in Analystenkommentaren. Um 15.25 Uhr notiert die Actelion-Aktie um 0,4% höher auf 90,10 CHF. Der Gesamtmarkt, gemessen am SMI (-0,06%) zeigt sich kaum verändert. Im bisherigen Jahresverlauf stieg die Aktie bis am Vorabend bereits um 19% und vergangenes Jahr um 73%.
Source: rt/rw
Unser Pivot-Punkt liegt bei 85.
Unsere Meinung: solange die Unterstützung bei 85 hält, sind 96.6 das Ziel
Alternatives Szenario: unter 85 lauten die Kursziele 81.1 und 78.8
Analyse: der RSI liegt über der Neutralitätszone von 50. Der MACD liegt unter der Signallinie und ist positiv. Die Aktie könnte kurzfristig wieder zurückgehen. Es wird darauf hingewiesen, dass die Volumina seit einigen Tagen ansteigen.
Source:CC
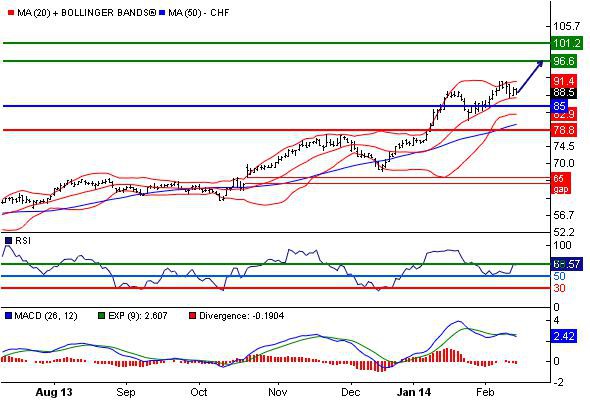
Auf der Watchliste bei mir !
Oberkassler
Es wurde 1997 gegründet und seit 2000 im SWX Swiss Exchange Index geführt.
Die Aktie zeigt sich 2012 extrem bullish, der Aufwärtsbewegung ist in Takt
seit 2012.
Point & Figure: Kursziel 100 EUR, Stopp 67 EUR, zZ 76 EUR.
Allschwil (awp) - Das Biopharma-Unternehmen Actelion hat sich im Geschäftsjahr 2013 besser entwickelt als erwartet. Zudem wurden mit der Produktpipeline Fortschritte erzielt, wobei vor allem die Zulassung des Tracleer-Nachfolgers Opsumit in den USA und in Europa Glanzlichter waren. Darüber hinaus sind die Produktkandidaten Selexipag und Cadazolid weiter auf Kurs. Für die Geschäftsjahre 2014 und 2015 hat das Management die Guidance angehoben. Die Aktie reagiert indessen kaum auf die News.
Der Produktumsatz stieg im Berichtsjahr um 4% auf 1,78 Mrd CHF, zu konstanten Wechselkursen (kWk) belief sich der Anstieg auf 6%. Davon entfielen 1,53 Mrd (+2%; zu kWk +5%) auf das Hauptprodukt Tracleer zur Therapie von Lungenbluthochdruck (pulmonale arterielle Hypertonie, PAH).
Der Nachfolger von Tracleer - Opsumit - erzielte seit der Markteinführung im November in den USA bis Ende des Geschäftsjahres einen Umsatz von 5 Mio CHF. CEO Jean-Paul Clozel sieht Opsumit als führende Behandlung von PAH, wie er an einer Telefonkonferenz zum Abschluss 2013 am Dienstag sagte. "Deshalb gehen wir davon aus, dass die Umsatzzahlen von Opsumit diejenigen von Tracleer noch überschreiten werden", ergänzte Chief Operating Officer Otto Schwarz und bestätigte damit frühere Aussagen.
Im grössten PAH-Markt Europas, in Deutschland, hat die Markteinführung von Opsumit begonnen, danach folgt Grossbritannien. Bis Ende dieses Jahres oder Anfang nächsten Jahres soll das neue Produkt auch in Frankreich, Spanien und Italien verkauft werden.
Unter den weiteren Produkten erreichten die Verkäufe von Ventavis unverändert 110 Mio CHF, von Zavesca 96 Mio (+13%) und von Veletri 37 Mio (+52%).
PROFITABILITÄT ERHÖHT - MEHR DIVIDENDE
Auf den Ergebnisebenen erzielte Actelion überdurchschnittliche Zuwachsraten. Der US-GAAP-EBIT wuchs um 14% auf 482 Mio CHF, und der Kerngewinn stieg um 15% auf 619 Mio. Der Kernreingewinn wird mit 509 Mio um 13% höher ausgewiesen. Dem stehen ein Kernaufwand für Forschung und Entwicklung von 356 Mio CHF (-11%) gegenüber. Für Vertrieb und Verwaltung wurden mit 601 Mio um 2% mehr ausgegeben, was auf höhere Kosten im Zusammenhang mit Markteinführungen zurückgeführt wird.
An den Fortschritten sollen auch die Aktionäre beteiligt werden. Der Verwaltungsrat schlägt der Generalversammlung für das Berichtsjahr eine erhöhte Dividende von 1,20 CHF je Aktie vor, nach 1,00 CHF im Vorjahr.
Per Ende 2013 verfügte das Unternehmen über liquide Mittel und Bareinlagen von 1,5 Mrd CHF. Zudem hält Actelion 9,1 Mio eigene Aktien.
PRODUKTPIPELINE AUF KURS - SPEZIALITÄTEN-PORTFOLIO IM AUFBAU
Die fortgeschrittene Produktpipeline ist gemäss Management auf Kurs. So werden die ersten Ergebnisse aus der Phase-III-Studie GRIPHON für den PAH-Produktkandidaten Selexipag um Mitte dieses Jahres erwartet. Mit dem Opsumit-Nachfolger habe Actelion einen Vorsprung auf die Konkurrenz von mindestens fünf Jahren, sagte der CEO gegenüber AWP. Des weiteren wird mit Phase-III-Ergebnissen für das Antibiotikum Cadazolid unverändert im Jahr 2016 gerechnet.
Der Aufbau eines Spezialitäten-Portfolios als Ergänzung der PAH-Franchise ist mit der Übernahme des Unternehmens Ceptaris und damit dem Hautmedikament Valchlor voran gekommen. Das Produkt ist in den USA bereits auf dem Markt. Dieser Bereich soll durch eigene Forschung und Übernahmen ausgebaut werden.
AUSBLICK ANGEHOBEN
Für die Geschäftsjahre 2014/15 erhöht das Management die Guidance. So wird für das laufende Jahr neu ein Wachstum des Kerngewinns im niedrigen einstelligen Prozentbereich (zu kWk) erwartet. 2015 wird mit einem Wachstum des Kerngewinns im niedrigen einstelligen Prozentbereich gerechnet, dies wiederum auf einer erhöhten Ausgangsbasis.
In dem seit längerem laufenden Streitfall mit Asahi hat Actelion beim Supreme Court von Kalifornien die Überprüfung des Urteils des Court of Appeal beantragt. Im zweiten Quartal dürfte das Gericht entscheiden, ob es auf den Antrag eintreten will, hiess es.
AKTIE LEGT LEICHT ZU
An der Börse werden die Zahlen von Actelion mit etwas Zurückhaltung gut aufgenommen. Einerseits habe Actelion im Schlussquartal von Einmaleffekten profitiert; andererseits sei die Bewertung der Titel bereits hoch bzw. fair, hiess es in Analystenkommentaren. Um 15.25 Uhr notiert die Actelion-Aktie um 0,4% höher auf 90,10 CHF. Der Gesamtmarkt, gemessen am SMI (-0,06%) zeigt sich kaum verändert. Im bisherigen Jahresverlauf stieg die Aktie bis am Vorabend bereits um 19% und vergangenes Jahr um 73%.
Source: rt/rw
Unser Pivot-Punkt liegt bei 85.
Unsere Meinung: solange die Unterstützung bei 85 hält, sind 96.6 das Ziel
Alternatives Szenario: unter 85 lauten die Kursziele 81.1 und 78.8
Analyse: der RSI liegt über der Neutralitätszone von 50. Der MACD liegt unter der Signallinie und ist positiv. Die Aktie könnte kurzfristig wieder zurückgehen. Es wird darauf hingewiesen, dass die Volumina seit einigen Tagen ansteigen.
Source:CC

Auf der Watchliste bei mir !
Oberkassler
Actelion verliert Streitfall endgültig
http://www.cash.ch/news/top_news/actelion_verliert_streitfal…
http://www.cash.ch/news/top_news/actelion_verliert_streitfal…
Dr. Jean-Paul Clozel, CEO von Actelion, kommentierte: "Ich bin vom Resultat dieser langfristigen Morbiditäts-/Mortaliätsstudie überwältigt. Selexipag wurde an Patienten getestet, welche zu 80% bei Beginn der Studie mit PAH-spezifischer Grundmedikation behandelt wurden. Gemeinsam mit unserem Partner Nippon Shinyaku sind wir nun unserem Ziel einen Schritt näher gekommen, der Gemeinschaft von PAH-Betroffenen eine wirksame orale Therapie anbieten zu können, die auf den spezifischen Prostazyklin-Signalweg abzielt. Wir werden die Datenanalyse nun zügig abschliessen, um erste Zulassungsanträge bei den Gesundheitsbehörden so bald wie möglich einreichen zu können."
Selexipag verminderte gemäss den Angaben das Risiko eines Morbiditäts-/Mortalitätsereignis gegenüber Plazebo um 39%. Die beobachtete Wirksamkeit sei ausserdem über wichtige Untergruppen (Alter, Geschlecht, WHO-Funktionsklasse, PAH-Ätiologie und PAH-spezifische Grundmedikation) hinweg konsistent gewesen. Patienten wurden in der Studie für eine Dauer von bis zu 4,3 Jahren behandelt. Das Verträglichkeitsprofil von Selexipag in der Studie habe dabei denjenigen anderer Prostazyklin-Therapien entsprochen, heisst es.
Analysts at Credit Suisse are forecasting 2020 sales of 575 million Swiss francs ($655 million) for Selexipag.


 steigt rasant..... wer hat diese Aktie....
steigt rasant..... wer hat diese Aktie.... 

 In 2 Minuten wurden über 200.000 Aktien gehandelt....
In 2 Minuten wurden über 200.000 Aktien gehandelt....
Fast 1 Mill. Aktien an der Heimatbörse in 20 Minuten umgesetzt. Rekord!
Das ist keine Zockeraktie.
Das ist keine Zockeraktie.
Heute werden einige Fonds steigen nur aufgrund dieser Aktie....
Bereits wechselten 1,1 Mio Aktien die Hand, womit das durchschnittliche Tagesvolumen der vergangenen Wochen (414'437) schon früh bei weitem übertroffen worden ist.
Das Unternehmen ist mit den Ergebnissen sehr zufrieden. Nun sollen möglichst rasch die Zulassungsanträge ausgearbeitet werden. Selexipag ist das erste oral zu verabreichende Medikament dieser Klasse; die bisherigen müssen injiziert werden. Selexipag war ursprünglich von Nippon Shinyaku entdeckt worden; 2008 hatte Actelion eine exklusive Lizenzvereinbarung unterzeichnet.
Zitat von Venturi123: Das Unternehmen ist mit den Ergebnissen sehr zufrieden. Nun sollen möglichst rasch die Zulassungsanträge ausgearbeitet werden. Selexipag ist das erste oral zu verabreichende Medikament dieser Klasse; die bisherigen müssen injiziert werden. Selexipag war ursprünglich von Nippon Shinyaku entdeckt worden; 2008 hatte Actelion eine exklusive Lizenzvereinbarung unterzeichnet.
http://www.handelszeitung.ch/unternehmen/actelion-studiendat…
http://www.fuw.ch/article/santhera-wurde-zu-actelion-und-shi…
Santhera zu Actelion?
Santhera zu Actelion?
Super Zahlen über den Erwartungen !!
Actelion legt starkes erstes Halbjahr hin und erhöht Prognose deutlich
(Meldung erweitert um Details und Angaben des CEO und Aktienkurs, neu gefasst)
Allschwil (awp) - Das Biopharma-Unternehmen Actelion hat nach einem bereits starken ersten Vierteljahr 2014 auch im zweiten Quartal nichts an Dynamik eingebüsst und weist für das Halbjahr markante Zuwachsraten aus. Entgegen den Erwartungen hat der Umsatz des Hauptumsatzträgers Tracleer zugelegt; gleichzeitig hat die Marktlancierung des Nachfolgers Opsumit die Erwartungen übertroffen. Positiv ausgewirkt hat sich auch die Auflösung von Rückstellungen, allerdings stieg auch der Aufwand unterdurchschnittlich. In der Folge hat das Unternehmen die Prognose für 2014 markant angehoben.
Der Produktumsatz stieg in der Berichtsperiode um 12% auf 993 Mio CHF; zu konstanten Wechselkursen (kWk) betrug der Anstieg 17%. Unter Ausschluss der Auflösung von Rückstellungen für Rabatte aus Patientenprogrammen in den USA belief sich die Zuwachsrate zu kWk auf 11%, teilt Actelion am Dienstag mit. Der Einfluss der Auflösung von Rabattrückstellungen wird mit 54 Mio angegeben.
Vom Umsatz entfielen 791 Mio auf Tracleer, das bei Lungenhochdruck (pulmonale arterielle Hypertonie, PAH) eingesetzt wird. Der Tracleer-Absatz sei damit in Schweizer Franken um 3% und zu kWk um 8% gestiegen, hiess es weiter. Das Ende 2013 in den USA am Markt eingeführte Nachfolgeprodukt Opsumit erzielte einen Umsatz von 53 Mio, nach 15 Mio in den ersten drei Monaten. Die übrigen Produkte - Veletri, Ventavis, Valchlor, Zavesca und Sonstiges - kamen auf 149 Mio, nach 117 Mio in der Vorjahresperiode.
ÜBERDURCHSCHNITTLICHE GEWINNENTWICKLUNG
Durch die starke Umsatzentwicklung, inklusive Auflösung von Rabattrückstellungen, einerseits und Kostenkontrolle andererseits, stiegen die Gewinneckdaten überproportional. So wuchs der Kern-Betriebsaufwand nur um 3% (+7% zu kWk) auf 571 Mio. Entsprechend werden der US-GAAP EBIT mit 347 Mio CHF um 32% (+42% kWk) höher ausgewiesen und der Kern-EBIT (von Actelion auch als "Kerngewinn" bezeichnet) erreicht 421 Mio (+27% in CHF; +35% kWk).
Unter dem Strich bleibt ein Kern-Reingewinn von 378 Mio CHF (+40% in CHF; +49% zu kWk). Der Reingewinn wird mit 420 Mio ausgewiesen (+111% in CHF; +126% zu kWk). Mit den Zahlen hat Actelion die Markterwartungen auch bereinigt um die Auflösung von Rückstellungen übertroffen.
OPSUMIT ÜBERTRIFFT ERWARTUNGEN
CEO Jean-Paul Clozel gibt sich entsprechend zufrieden mit dem Berichtshalbjahr: "In der ersten Jahreshälfte 2014 haben wir (...) grosse Fortschritte erzielt (...) mit dem Ausbau unseres PAH-Geschäfts, der Weiterentwicklung unseres Spezialitäten-Portfolios und der Optimierung unserer Rentabilität."
"Opsumit hat unsere Erwartungen an die Markteinführung übertroffen", sagte CEO am im Gespräch mit AWP. Dabei sei der Tracleer-Nachfolger nicht nur bei den PAH-Patienten sondern auch bei den verschreibenden Ärzten "sehr gut" aufgenommen worden, so Clozel weiter. In der zweiten Hälfte 2014 steht gemäss Management die Einführung von Opsumit in Australien und Italien an und 2015 in Frankreich und Spanien. Tracleer sei vor allem in jenen Ländern stark gewachsen, in denen Opsumit noch nicht auf dem Markt sei.
Derweil ist die Entwicklung von Selexipag, der nächsten Generation von PAH-Medikamenten, auf Kurs. Der erste Zulassungsantrag soll Ende dieses Jahr oder Anfang kommenden Jahres eingereicht werden. Im Aktionärsbrief zeigt das Management seine Zuversicht: "Mit dem durch Selexipag zu erwartendem zusätzlichen Cashflow sollten wir in der Lage sein, höhere Renditen (...) zu erzielen und gleichzeitig in künftige Wachstumsmöglichkeiten auf neuen therapeutischen Spezialgebieten zu investieren."
GUIDANCE STARK ANGEHOBEN
Die Ganzjahresprognose wurde, wie bei der Vorlage des Erstquartalsergebnisses angekündigt, angehoben. Allerdings übertrifft die neue Guidance die Erwartungen von Analysten. Neu geht Actelion für 2014 nun von einem Mindestwachstum des Kerngewinns/Kern-EBIT zu kWk zwischen 10 und 20% aus. Unter Ausschluss der Auswirkungen der Rabatte wird ein Anstieg des Kerngewinns mindesten im unteren zweistelligen Bereich prognostiziert. Diese sehr starke Geschäftsentwicklung im 2014 werde eine deutlich höhere Ausgangsbasis für 2015 bilden, deshalb soll die Prognose 2015 Anfang nächsten Jahres neu überdacht werden.
AKTIE DEUTLICH GESUCHT
An der Börse legen die Actelion-Aktien deutlich zu, notieren aber wieder unter dem bisherigen Tageshoch. Um 10.30 Uhr notieren die Titel um 2,8% höher auf 112,70 CHF. Die Umsätze erreichen bereits deutlich mehr als ein halbes Tagesvolumen. Der Gesamtmarkt, gemessen am Swiss Market Index, legt um 0,27% zu.
Source:finanzen.ch
Oberkassler
Actelion legt starkes erstes Halbjahr hin und erhöht Prognose deutlich
(Meldung erweitert um Details und Angaben des CEO und Aktienkurs, neu gefasst)
Allschwil (awp) - Das Biopharma-Unternehmen Actelion hat nach einem bereits starken ersten Vierteljahr 2014 auch im zweiten Quartal nichts an Dynamik eingebüsst und weist für das Halbjahr markante Zuwachsraten aus. Entgegen den Erwartungen hat der Umsatz des Hauptumsatzträgers Tracleer zugelegt; gleichzeitig hat die Marktlancierung des Nachfolgers Opsumit die Erwartungen übertroffen. Positiv ausgewirkt hat sich auch die Auflösung von Rückstellungen, allerdings stieg auch der Aufwand unterdurchschnittlich. In der Folge hat das Unternehmen die Prognose für 2014 markant angehoben.
Der Produktumsatz stieg in der Berichtsperiode um 12% auf 993 Mio CHF; zu konstanten Wechselkursen (kWk) betrug der Anstieg 17%. Unter Ausschluss der Auflösung von Rückstellungen für Rabatte aus Patientenprogrammen in den USA belief sich die Zuwachsrate zu kWk auf 11%, teilt Actelion am Dienstag mit. Der Einfluss der Auflösung von Rabattrückstellungen wird mit 54 Mio angegeben.
Vom Umsatz entfielen 791 Mio auf Tracleer, das bei Lungenhochdruck (pulmonale arterielle Hypertonie, PAH) eingesetzt wird. Der Tracleer-Absatz sei damit in Schweizer Franken um 3% und zu kWk um 8% gestiegen, hiess es weiter. Das Ende 2013 in den USA am Markt eingeführte Nachfolgeprodukt Opsumit erzielte einen Umsatz von 53 Mio, nach 15 Mio in den ersten drei Monaten. Die übrigen Produkte - Veletri, Ventavis, Valchlor, Zavesca und Sonstiges - kamen auf 149 Mio, nach 117 Mio in der Vorjahresperiode.
ÜBERDURCHSCHNITTLICHE GEWINNENTWICKLUNG
Durch die starke Umsatzentwicklung, inklusive Auflösung von Rabattrückstellungen, einerseits und Kostenkontrolle andererseits, stiegen die Gewinneckdaten überproportional. So wuchs der Kern-Betriebsaufwand nur um 3% (+7% zu kWk) auf 571 Mio. Entsprechend werden der US-GAAP EBIT mit 347 Mio CHF um 32% (+42% kWk) höher ausgewiesen und der Kern-EBIT (von Actelion auch als "Kerngewinn" bezeichnet) erreicht 421 Mio (+27% in CHF; +35% kWk).
Unter dem Strich bleibt ein Kern-Reingewinn von 378 Mio CHF (+40% in CHF; +49% zu kWk). Der Reingewinn wird mit 420 Mio ausgewiesen (+111% in CHF; +126% zu kWk). Mit den Zahlen hat Actelion die Markterwartungen auch bereinigt um die Auflösung von Rückstellungen übertroffen.
OPSUMIT ÜBERTRIFFT ERWARTUNGEN
CEO Jean-Paul Clozel gibt sich entsprechend zufrieden mit dem Berichtshalbjahr: "In der ersten Jahreshälfte 2014 haben wir (...) grosse Fortschritte erzielt (...) mit dem Ausbau unseres PAH-Geschäfts, der Weiterentwicklung unseres Spezialitäten-Portfolios und der Optimierung unserer Rentabilität."
"Opsumit hat unsere Erwartungen an die Markteinführung übertroffen", sagte CEO am im Gespräch mit AWP. Dabei sei der Tracleer-Nachfolger nicht nur bei den PAH-Patienten sondern auch bei den verschreibenden Ärzten "sehr gut" aufgenommen worden, so Clozel weiter. In der zweiten Hälfte 2014 steht gemäss Management die Einführung von Opsumit in Australien und Italien an und 2015 in Frankreich und Spanien. Tracleer sei vor allem in jenen Ländern stark gewachsen, in denen Opsumit noch nicht auf dem Markt sei.
Derweil ist die Entwicklung von Selexipag, der nächsten Generation von PAH-Medikamenten, auf Kurs. Der erste Zulassungsantrag soll Ende dieses Jahr oder Anfang kommenden Jahres eingereicht werden. Im Aktionärsbrief zeigt das Management seine Zuversicht: "Mit dem durch Selexipag zu erwartendem zusätzlichen Cashflow sollten wir in der Lage sein, höhere Renditen (...) zu erzielen und gleichzeitig in künftige Wachstumsmöglichkeiten auf neuen therapeutischen Spezialgebieten zu investieren."
GUIDANCE STARK ANGEHOBEN
Die Ganzjahresprognose wurde, wie bei der Vorlage des Erstquartalsergebnisses angekündigt, angehoben. Allerdings übertrifft die neue Guidance die Erwartungen von Analysten. Neu geht Actelion für 2014 nun von einem Mindestwachstum des Kerngewinns/Kern-EBIT zu kWk zwischen 10 und 20% aus. Unter Ausschluss der Auswirkungen der Rabatte wird ein Anstieg des Kerngewinns mindesten im unteren zweistelligen Bereich prognostiziert. Diese sehr starke Geschäftsentwicklung im 2014 werde eine deutlich höhere Ausgangsbasis für 2015 bilden, deshalb soll die Prognose 2015 Anfang nächsten Jahres neu überdacht werden.
AKTIE DEUTLICH GESUCHT
An der Börse legen die Actelion-Aktien deutlich zu, notieren aber wieder unter dem bisherigen Tageshoch. Um 10.30 Uhr notieren die Titel um 2,8% höher auf 112,70 CHF. Die Umsätze erreichen bereits deutlich mehr als ein halbes Tagesvolumen. Der Gesamtmarkt, gemessen am Swiss Market Index, legt um 0,27% zu.
Source:finanzen.ch
Oberkassler
Actelion mit hervorragendem Ergebnis im ersten Quartal 2015
Nachrichtenquelle: GlobeNewswire | 21.04.2015, 07:00
Actelion Pharmaceuticals Ltd / Actelion mit hervorragendem Ergebnis im ersten Quartal 2015 .
Verarbeitet und übermittelt durch NASDAQ OMX Corporate Solutions. Für den Inhalt der Mitteilung ist der Emittent verantwortlich. Source: Globenewswire
ALLSCHWIL/BASEL, SCHWEIZ - 21. April 2015 - Actelion Ltd (SIX: ATLN) gab heute die Ergebnisse für das erste Quartal 2015 bekannt.
OPERATIVE ERGEBNISSE
◦Opsumit (Macitentan) - Umsatz im 1. Quartal 2015 bei CHF 95 Millionen
◦Opsumit (Macitentan) - Zulassung in Japan im März 2015
◦Selexipag (Uptravi) - Präsentation der GRIPHON-Daten anlässlich der Jahreskonferenz des American College of Cardiology
◦Selexipag (Uptravi) - Registrierungsverfahren bei FDA und EMA verlaufen nach Plan
◦Arzneimittelspezialitäten - Immunologie-Portfolio macht Fortschritte
FINANZÜBERBLICK
◦Produktumsatz bei CHF 515 Millionen - Opsumit treibt starkes Umsatzwachstum
◦Kerngewinn bei CHF 218 Millionen - Steigerung der operativen Effizienz
◦Kerngewinn pro Aktie (EPS) bei CHF 1,61 - weitere Wertschöpfung für Aktionäre
◦Starke Leistung erlaubt Anhebung des Ausblicks für 2015 - Wachstum des Kerngewinns bei kWk nun im tiefen zweistelligen Prozentbereich erwartet (unter Ausschluss der im Jahr 2014 in den USA aufgelösten Rabattrückstellungen) ...
Dr. Jean-Paul Clozel, CEO von Actelion, kommentierte: "Wir sind exzellent ins Jahr 2015 gestartet und ich freue mich insbesondere über die anhaltend starke Nachfrage nach Opsumit. Die Präsentation der Daten zu Selexipag anlässlich der Jahreskonferenz des American College of Cardiology wurde sehr gut aufgenommen und die Verfahren zur behördlichen Zulassung verlaufen nach Plan. Wie kürzlich angekündigt, machen wir mit der Weiterentwicklung unseres Immunologie-Portfolios beträchtliche Fortschritte beim Aufbau einer soliden Pipeline für Arzneimittelspezialitäten. Auf der Grundlage der Ergebnisse des ersten Quartals bin ich zuversichtlich, dass wir unsere Zielvorgaben für das ganze Geschäftsjahr übertreffen werden. Deshalb heben wir unseren Ausblick an." ...
Gesamtmeldung unter: http://www.wallstreet-online.de/nachricht/7553150-actelion-m…
Gruß Oberländler
Nachrichtenquelle: GlobeNewswire | 21.04.2015, 07:00
Actelion Pharmaceuticals Ltd / Actelion mit hervorragendem Ergebnis im ersten Quartal 2015 .
Verarbeitet und übermittelt durch NASDAQ OMX Corporate Solutions. Für den Inhalt der Mitteilung ist der Emittent verantwortlich. Source: Globenewswire
ALLSCHWIL/BASEL, SCHWEIZ - 21. April 2015 - Actelion Ltd (SIX: ATLN) gab heute die Ergebnisse für das erste Quartal 2015 bekannt.
OPERATIVE ERGEBNISSE
◦Opsumit (Macitentan) - Umsatz im 1. Quartal 2015 bei CHF 95 Millionen
◦Opsumit (Macitentan) - Zulassung in Japan im März 2015
◦Selexipag (Uptravi) - Präsentation der GRIPHON-Daten anlässlich der Jahreskonferenz des American College of Cardiology
◦Selexipag (Uptravi) - Registrierungsverfahren bei FDA und EMA verlaufen nach Plan
◦Arzneimittelspezialitäten - Immunologie-Portfolio macht Fortschritte
FINANZÜBERBLICK
◦Produktumsatz bei CHF 515 Millionen - Opsumit treibt starkes Umsatzwachstum
◦Kerngewinn bei CHF 218 Millionen - Steigerung der operativen Effizienz
◦Kerngewinn pro Aktie (EPS) bei CHF 1,61 - weitere Wertschöpfung für Aktionäre
◦Starke Leistung erlaubt Anhebung des Ausblicks für 2015 - Wachstum des Kerngewinns bei kWk nun im tiefen zweistelligen Prozentbereich erwartet (unter Ausschluss der im Jahr 2014 in den USA aufgelösten Rabattrückstellungen) ...
Dr. Jean-Paul Clozel, CEO von Actelion, kommentierte: "Wir sind exzellent ins Jahr 2015 gestartet und ich freue mich insbesondere über die anhaltend starke Nachfrage nach Opsumit. Die Präsentation der Daten zu Selexipag anlässlich der Jahreskonferenz des American College of Cardiology wurde sehr gut aufgenommen und die Verfahren zur behördlichen Zulassung verlaufen nach Plan. Wie kürzlich angekündigt, machen wir mit der Weiterentwicklung unseres Immunologie-Portfolios beträchtliche Fortschritte beim Aufbau einer soliden Pipeline für Arzneimittelspezialitäten. Auf der Grundlage der Ergebnisse des ersten Quartals bin ich zuversichtlich, dass wir unsere Zielvorgaben für das ganze Geschäftsjahr übertreffen werden. Deshalb heben wir unseren Ausblick an." ...
Gesamtmeldung unter: http://www.wallstreet-online.de/nachricht/7553150-actelion-m…
Gruß Oberländler
Der Vollständigkeit wegen:
...
Actelion springen nach Übernahmespekulationen um 6,6% auf 140,60 CHF an, nachdem der Basler Biopharmakonzern offenbar ins Visier des britischen Pharmakonzerns Shire geraten ist. Einem Medienbericht zufolge erwägen die Briten eine Übernahme des Biotechnologie-Unternehmens für rund 12 Mrd GBP bzw. 160 CHF je Aktie. Eine formlose Anfrage der Briten sei zwar zurückgewiesen worden.
Analysten halten die Übernahmespekulationen unterdessen für plausibel. Schliesslich hätten die Firmenverantwortlichen von Shire in der Vergangenheit kein Geheimnis daraus gemacht, über grössere Firmenakquisitionen wachsen zu wollen. Dank der starken Produktfranchise sei Actelion ein logisches Ziel für den britischen Rivalen, so heisst es.
...
http://www.finanzen.ch/nachrichten/aktien/SMI-tritt-an-Ort-1…
Gruß Oberländler
...
Actelion springen nach Übernahmespekulationen um 6,6% auf 140,60 CHF an, nachdem der Basler Biopharmakonzern offenbar ins Visier des britischen Pharmakonzerns Shire geraten ist. Einem Medienbericht zufolge erwägen die Briten eine Übernahme des Biotechnologie-Unternehmens für rund 12 Mrd GBP bzw. 160 CHF je Aktie. Eine formlose Anfrage der Briten sei zwar zurückgewiesen worden.
Analysten halten die Übernahmespekulationen unterdessen für plausibel. Schliesslich hätten die Firmenverantwortlichen von Shire in der Vergangenheit kein Geheimnis daraus gemacht, über grössere Firmenakquisitionen wachsen zu wollen. Dank der starken Produktfranchise sei Actelion ein logisches Ziel für den britischen Rivalen, so heisst es.
...
http://www.finanzen.ch/nachrichten/aktien/SMI-tritt-an-Ort-1…
Gruß Oberländler
Hallo Leute,
mit Gerüchte will man immer Kurse manipulieren,
nur wegen Gerüchte eine Aktie zu kaufen kann auch in
die Hose gehen.
mit Gerüchte will man immer Kurse manipulieren,
nur wegen Gerüchte eine Aktie zu kaufen kann auch in
die Hose gehen.
Irgendwie untergegangen:
Actelion delivers excellent first half 2015 results
ALLSCHWIL/BASEL, SWITZERLAND - 21 July 2015 - Actelion Ltd (SIX: ATLN) today announced its results for the first six months of 2015.
OPERATING HIGHLIGHTS
• Opsumit® - Sales of CHF 208 million, increased patient recruitment momentum
• Opsumit - Launched in Japan and Spain in June 2015
• Selexipag (Uptravi®) - FDA, EMA regulatory procedures on track
• Specialty franchise - Immunology portfolio advances
• Creation of vaccine start-up Vaxxilon - Innovating together with Max Planck Society
FINANCIAL HIGHLIGHTS
• Product sales of CHF 1,008 million - Strong growth driven by Opsumit uptake
• Core earnings of CHF 423 million - Driven by commercial performance
• 2015 financial guidance upgrade: Mid- to high-teen percentage core earnings growth at CER (ex 2014 US rebate reversals)
• Return to shareholders: CHF 680 million via share repurchase program and dividend
...
Jean-Paul Clozel, MD, Chief Executive Officer, commented: "We have had an excellent first half of the year with continued strong demand for our PAH products, boosted by Opsumit. Our effort to establish additional specialty franchises from our R&D pipeline, in particular in the field of immunology, is progressing well. We have also been actively pursuing our share repurchase program in order to ensure continued value creation for shareholders. All in all, we have delivered on all key elements of our strategy."
Otto Schwarz, Chief Operating Officer, commented: "We continue to be extremely pleased with the performance of Opsumit as it drives not only sales growth but also an expansion of the ERA market as a whole. Patient recruitment remains strong in all markets where available and at end of June more than 9,800 patients were already profiting from the long-term outcome benefits of Opsumit."
André C. Muller, Chief Financial Officer, commented: "Excellent execution across the commercial organization along with disciplined management of the business resulted in very good half year results. On the back of this strong performance, we are very happy to once again upgrade guidance for the full year. We now expect that, unforeseen events excluded, core earnings will increase in the mid- to high-teen percentage range, at CER and excluding prior year US rebate reversals."
http://www.actelion.com/en/our-company/news-and-events.page?…
Gruß Oberländler
Actelion delivers excellent first half 2015 results
ALLSCHWIL/BASEL, SWITZERLAND - 21 July 2015 - Actelion Ltd (SIX: ATLN) today announced its results for the first six months of 2015.
OPERATING HIGHLIGHTS
• Opsumit® - Sales of CHF 208 million, increased patient recruitment momentum
• Opsumit - Launched in Japan and Spain in June 2015
• Selexipag (Uptravi®) - FDA, EMA regulatory procedures on track
• Specialty franchise - Immunology portfolio advances
• Creation of vaccine start-up Vaxxilon - Innovating together with Max Planck Society
FINANCIAL HIGHLIGHTS
• Product sales of CHF 1,008 million - Strong growth driven by Opsumit uptake
• Core earnings of CHF 423 million - Driven by commercial performance
• 2015 financial guidance upgrade: Mid- to high-teen percentage core earnings growth at CER (ex 2014 US rebate reversals)
• Return to shareholders: CHF 680 million via share repurchase program and dividend
...
Jean-Paul Clozel, MD, Chief Executive Officer, commented: "We have had an excellent first half of the year with continued strong demand for our PAH products, boosted by Opsumit. Our effort to establish additional specialty franchises from our R&D pipeline, in particular in the field of immunology, is progressing well. We have also been actively pursuing our share repurchase program in order to ensure continued value creation for shareholders. All in all, we have delivered on all key elements of our strategy."
Otto Schwarz, Chief Operating Officer, commented: "We continue to be extremely pleased with the performance of Opsumit as it drives not only sales growth but also an expansion of the ERA market as a whole. Patient recruitment remains strong in all markets where available and at end of June more than 9,800 patients were already profiting from the long-term outcome benefits of Opsumit."
André C. Muller, Chief Financial Officer, commented: "Excellent execution across the commercial organization along with disciplined management of the business resulted in very good half year results. On the back of this strong performance, we are very happy to once again upgrade guidance for the full year. We now expect that, unforeseen events excluded, core earnings will increase in the mid- to high-teen percentage range, at CER and excluding prior year US rebate reversals."
http://www.actelion.com/en/our-company/news-and-events.page?…
Gruß Oberländler
Hmm... anscheinend kein großes Interesse für diese Aktie hier und auch im Cash-Forum in der Schweiz geht die Meldung unter:
Actelion delivers strong nine months results
Nachrichtenquelle: GlobeNewswire | 20.10.2015, 07:00 | 129 |
Actelion Pharmaceuticals Ltd / Actelion delivers strong nine months results . Processed and transmitted by NASDAQ OMX Corporate Solutions. The issuer is solely responsible for the content of this announcement.
ALLSCHWIL/BASEL, SWITZERLAND - 20 October 2015 - Actelion Ltd (SIX: ATLN) today announced its results for the first nine months of 2015.
OPERATING HIGHLIGHTS
◦Opsumit (macitentan) - continues strong launch trajectory
◦Opsumit (macitentan) - commercially available in over 30 countries including Japan
◦Selexipag (Uptravi®) - regulatory procedures on track
◦Specialty pipeline - strengthens as several promising compounds advance
FINANCIAL HIGHLIGHTS
◦Product sales of CHF 1,522 million - strong growth driven by Opsumit uptake of CHF 354 million
◦Core earnings of CHF 651 million - increased operational leverage
◦2015 financial guidance upgrade: Crossing the 20% mark for core earnings growth at CER (excluding 2014 US rebate reversals)
◦Return to shareholders: CHF 808 million via share repurchase program and dividend
....
http://www.wallstreet-online.de/nachricht/8041974-actelion-d…
Gruß Oberländler
Actelion delivers strong nine months results
Nachrichtenquelle: GlobeNewswire | 20.10.2015, 07:00 | 129 |
Actelion Pharmaceuticals Ltd / Actelion delivers strong nine months results . Processed and transmitted by NASDAQ OMX Corporate Solutions. The issuer is solely responsible for the content of this announcement.
ALLSCHWIL/BASEL, SWITZERLAND - 20 October 2015 - Actelion Ltd (SIX: ATLN) today announced its results for the first nine months of 2015.
OPERATING HIGHLIGHTS
◦Opsumit (macitentan) - continues strong launch trajectory
◦Opsumit (macitentan) - commercially available in over 30 countries including Japan
◦Selexipag (Uptravi®) - regulatory procedures on track
◦Specialty pipeline - strengthens as several promising compounds advance
FINANCIAL HIGHLIGHTS
◦Product sales of CHF 1,522 million - strong growth driven by Opsumit uptake of CHF 354 million
◦Core earnings of CHF 651 million - increased operational leverage
◦2015 financial guidance upgrade: Crossing the 20% mark for core earnings growth at CER (excluding 2014 US rebate reversals)
◦Return to shareholders: CHF 808 million via share repurchase program and dividend
....
http://www.wallstreet-online.de/nachricht/8041974-actelion-d…
Gruß Oberländler
Jährliche Verdopplung seit über drei Jahren.
Glückwunsch an alle die hier investiert sind.
Wielange geht es so weiter?
Das Management ist ja außerordentlich an hohen Kursen interessiert z.B. um Übernahmen abzuwehren.
Dazu werden ja regelmäßig Aktien zurückgekauft.
Ich finde Actelon verdient hier ein viel größeres Interesse
Glückwunsch an alle die hier investiert sind.
Wielange geht es so weiter?
Das Management ist ja außerordentlich an hohen Kursen interessiert z.B. um Übernahmen abzuwehren.
Dazu werden ja regelmäßig Aktien zurückgekauft.
Ich finde Actelon verdient hier ein viel größeres Interesse
Antwort auf Beitrag Nr.: 52.155.844 von 11up am 10.04.16 09:49:46
Das stimmt. Langfristig hat sich Actelion und natürlich die Aktie sensationell entwickelt.
Zitat von 11up: Jährliche Verdopplung seit über drei Jahren.
Glückwunsch an alle die hier investiert sind.
Wielange geht es so weiter?
Das Management ist ja außerordentlich an hohen Kursen interessiert z.B. um Übernahmen abzuwehren.
Dazu werden ja regelmäßig Aktien zurückgekauft.
Ich finde Actelon verdient hier ein viel größeres Interesse
Das stimmt. Langfristig hat sich Actelion und natürlich die Aktie sensationell entwickelt.
Actelion-Aktie: Anpassung der Zahlen nach einem guten Quartal - Aktienanalyse
25.04.16 12:35
Vontobel Research
Zürich (www.aktiencheck.de) - Actelion-Aktienanalyse von Aktienanalyst Stefan Schneider von Vontobel Research:
Stefan Schneider, Aktienanalyst von Vontobel Research, bestätigt in einer aktuellen Aktienanalyse sein Anlagevotum für die Actelion-Aktie (ISIN: CH0010532478, WKN: 936767, Ticker-Symbol: ACT, SIX Swiss Ex: ATLN, Nasdaq OTC-Symbol: ALIOF).
Da Schneider nun erst anfangs Q4 16 (statt Q3 16) mit generikabedingten Einbussen rechne, erhöhe sich sein Jahresumsatz für Tracleer von CHF 900 Mio. auf CHF 990 Mio. Zugleich berücksichtige er auch das starke erste Quartal von Uptravi. Per Ende dieses Quartals würden deutlich mehr Patienten das Präparat benutzen als von Schneider veranschlagt (650 statt 200). Daher rechne er hier nun für 2016-17 mit einem Umsatz von CHF 167 Mio. (statt CHF 120 Mio.) bzw. CHF 419 Mio. (statt CHF 387 Mio.). Den Spitzenumsatz von CHF 1,7 Mrd. belasse der Analyst fürs Erste jedoch unverändert. Um die starke Umsatzentwicklung und die verzögerten generikabedingten Einbussen zu berücksichtigen, korrigiere er auch die Umsatzerwartungen für Ventavis und Zavescanach nach oben.
Actelions F&E- und Verwaltungsgemeinkosten seien allerdings ebenfalls höher ausgefallen als erwartet. Dies lasse das Margenniveau etwas sinken: So liege die Kernbetriebsmarge in GJ16 neu bei 40,1% (statt 40,4%). Das Kern-EPS hingegen, angekurbelt durch den höheren Umsatz (CHF 2.290 Mio. statt CHF 2.139 Mio.), steige von CHF 6,75 auf CHF 7,26.
PAH-Geschäft von Actelion entwickle sich gut. Während Opsumit Zahlen liefere wie erwartet und weiterhin für ein solides Wachstum sorge, komme Uptravi eben erst in Fahrt. Der Analyst belasse seine Schätzung für den Spitzenumsatz für Uptravi vorerst unverändert, da er zunächst mehr Datenpunkte benötige, um die Einführungsdynamik besser verstehen zu können. Die große Zahl der Patienten, die das Medikament nutzen würden, zeige, dass es bei den Ärzten gut bekannt sein müsse, was für die Marketingaktivitäten von Actelion vor der Einführung spreche.
Stefan Schneider, Aktienanalyst von Vontobel Research, stuft die Actelion-Aktie mit dem Votum "hold" ein. Das Kursziel laute CHF 150. (Analyse vom 25.04.2016)
25.04.16 12:35
Vontobel Research
Zürich (www.aktiencheck.de) - Actelion-Aktienanalyse von Aktienanalyst Stefan Schneider von Vontobel Research:
Stefan Schneider, Aktienanalyst von Vontobel Research, bestätigt in einer aktuellen Aktienanalyse sein Anlagevotum für die Actelion-Aktie (ISIN: CH0010532478, WKN: 936767, Ticker-Symbol: ACT, SIX Swiss Ex: ATLN, Nasdaq OTC-Symbol: ALIOF).
Da Schneider nun erst anfangs Q4 16 (statt Q3 16) mit generikabedingten Einbussen rechne, erhöhe sich sein Jahresumsatz für Tracleer von CHF 900 Mio. auf CHF 990 Mio. Zugleich berücksichtige er auch das starke erste Quartal von Uptravi. Per Ende dieses Quartals würden deutlich mehr Patienten das Präparat benutzen als von Schneider veranschlagt (650 statt 200). Daher rechne er hier nun für 2016-17 mit einem Umsatz von CHF 167 Mio. (statt CHF 120 Mio.) bzw. CHF 419 Mio. (statt CHF 387 Mio.). Den Spitzenumsatz von CHF 1,7 Mrd. belasse der Analyst fürs Erste jedoch unverändert. Um die starke Umsatzentwicklung und die verzögerten generikabedingten Einbussen zu berücksichtigen, korrigiere er auch die Umsatzerwartungen für Ventavis und Zavescanach nach oben.
Actelions F&E- und Verwaltungsgemeinkosten seien allerdings ebenfalls höher ausgefallen als erwartet. Dies lasse das Margenniveau etwas sinken: So liege die Kernbetriebsmarge in GJ16 neu bei 40,1% (statt 40,4%). Das Kern-EPS hingegen, angekurbelt durch den höheren Umsatz (CHF 2.290 Mio. statt CHF 2.139 Mio.), steige von CHF 6,75 auf CHF 7,26.
PAH-Geschäft von Actelion entwickle sich gut. Während Opsumit Zahlen liefere wie erwartet und weiterhin für ein solides Wachstum sorge, komme Uptravi eben erst in Fahrt. Der Analyst belasse seine Schätzung für den Spitzenumsatz für Uptravi vorerst unverändert, da er zunächst mehr Datenpunkte benötige, um die Einführungsdynamik besser verstehen zu können. Die große Zahl der Patienten, die das Medikament nutzen würden, zeige, dass es bei den Ärzten gut bekannt sein müsse, was für die Marketingaktivitäten von Actelion vor der Einführung spreche.
Stefan Schneider, Aktienanalyst von Vontobel Research, stuft die Actelion-Aktie mit dem Votum "hold" ein. Das Kursziel laute CHF 150. (Analyse vom 25.04.2016)
Zur Vorsicht mahnt Goodmood Trader in einer fundamental unterlegten Chartanalyse
https://www.youtube.com/watch?v=wVBXIWsCwQ4&feature=youtu.be
https://www.youtube.com/watch?v=wVBXIWsCwQ4&feature=youtu.be
Antwort auf Beitrag Nr.: 52.276.357 von 11up am 26.04.16 10:45:29
Zitat: Bei den Einzelwerten standen einmal mehr die Aktien von Actelion im Mittelpunkt, weil sich die Gespräche über eine Übernahme durch den französischen Pharmakonzern Sanofi offenbar in einer fortgeschrittenen Phase befinden. Der Verkauf könnte laut der Nachrichtenagentur Bloomberg bereits in der kommenden Woche angekündigt werden.
Mit dieser sehr hoffnunsvollen Nachricht wünsche ich einen sehr schönen 4. Advent.
..nächste Woche wird es spannend!
Der Kursverlauf von Actelion fordert uns starke Nerven. Die heutige Nachricht aus dem Marktbericht der renomierten Börsen-Zeitung macht große Hoffnung für die nächste Woche im Kursverlauf der Actelion.Zitat: Bei den Einzelwerten standen einmal mehr die Aktien von Actelion im Mittelpunkt, weil sich die Gespräche über eine Übernahme durch den französischen Pharmakonzern Sanofi offenbar in einer fortgeschrittenen Phase befinden. Der Verkauf könnte laut der Nachrichtenagentur Bloomberg bereits in der kommenden Woche angekündigt werden.
Mit dieser sehr hoffnunsvollen Nachricht wünsche ich einen sehr schönen 4. Advent.
Schon oft sollte Actelion übernommen werden.
Heute freuen wir uns dass dies nicht geschehen ist.
Heute freuen wir uns dass dies nicht geschehen ist.
Antwort auf Beitrag Nr.: 53.955.818 von 11up am 26.12.16 15:32:03aber heute hat es geklappt. J &J ist dabei
Antwort auf Beitrag Nr.: 54.167.882 von mfierke am 26.01.17 08:11:55
R&D Abteilung
Wie hoch koennte der Emissionspreis der R&D Abteilung sein ? Lohnt es sich seine Actelions zu behalten und anzudienen, ...
Antwort auf Beitrag Nr.: 54.168.551 von Jgersauce am 26.01.17 09:19:57ich glaube es kaum, ein Einstieg zum heutigen Tag für mich undenkbar
Antwort auf Beitrag Nr.: 54.168.704 von mfierke am 26.01.17 09:31:31Hast du micht richtig verstanden : Ich habe schon Actelions seit Dezember und ueberlege zu verkaufen oder anzudienen und noch den Spin-Off mitzunehmen,..verstaending ?
Antwort auf Beitrag Nr.: 54.168.704 von mfierke am 26.01.17 09:31:31
Allen Aktionären liegt es mit 280 USD bzw. 280 sfrs. vor und der Kurs in Eur liegt knapp bei 240.
Wer die Nachrichten gelesen hat, wird einen Widerspruch per heute in der Notierung sehen. Deshalb empfehle ich Euch die Bedingungen noch einmal durchzulesen. Der Kurs müsste mit dem Übernahmekurs bei ca. 260 EUR liegen. Hinzu erhält man nach der Barabfindung von 280 USD noch eine Gratisaktie zu 0 EUR. In ca. 14 Tagen erhalten wir die Bestätigung des Offerte von J&J.
Ein schöneres Geschenk, ohne Risiko, erhält man selten an der Börse. Nur Mut!!!
...klarer Kauf!
Es ist schon interessant, wie das Angebot von J&J vom 26.01. heute an der Börse bezahlt wird.Allen Aktionären liegt es mit 280 USD bzw. 280 sfrs. vor und der Kurs in Eur liegt knapp bei 240.
Wer die Nachrichten gelesen hat, wird einen Widerspruch per heute in der Notierung sehen. Deshalb empfehle ich Euch die Bedingungen noch einmal durchzulesen. Der Kurs müsste mit dem Übernahmekurs bei ca. 260 EUR liegen. Hinzu erhält man nach der Barabfindung von 280 USD noch eine Gratisaktie zu 0 EUR. In ca. 14 Tagen erhalten wir die Bestätigung des Offerte von J&J.
Ein schöneres Geschenk, ohne Risiko, erhält man selten an der Börse. Nur Mut!!!
Antwort auf Beitrag Nr.: 54.234.919 von HKroll am 03.02.17 18:42:24
Johnson & Johnson übernimmt Actelion – und verschafft sich damit wohl saftige Steuervorteile in den USA. Der Deal zeigt auf, wie US-Konzerne zu Zeiten von Donald Trump im Ausland Steuern sparen.
VonMarc Bürgi
06:07
Die Nachricht hat für Schlagzeilen gesorgt: Johnson & Johnson übernimmt nach monatelangen Verhandlungen Actelion. Der US-Pharmakonzern zahlt 30 Milliarden Dollar und erhält im Gegenzug einen Grossteil des Geschäfts des Baselbieter Biotechkonzerns.
Kaum Beachtung fand ein spannender Aspekt der Übernahme: Der amerikanische Konzern zahlt den Kaufpreis mit Bargeld, das er im Ausland gehortet hat. Dass Johnson & Johnson dies ausdrücklich erwähnt, sei ziemlich ungewöhnlich, sagt Bruno Bulic. Der Analyst bei der Bank Baader Helvea hat auch eine Vermutung, was hinter dem Satz in der Medienmitteilung stecken könnte: Gut möglich, dass es ein Signal an die neue US-Regierung sei, ihre Steuerpläne umzusetzen.
Trump verspricht einen Steuerrabatt
Konkret geht es um eine Ansage von Donald Trump. Er hat im Wahlkampf versprochen, das Steuersystem zu reformieren. Fast alle Bürger und Unternehmen sollten weniger Steuern zahlen müssen. Als Teil seiner Reform schlug er auch ein «tax holiday» vor: Unternehmen möchte er die Chance geben, ihre ausländischen Gewinne in die USA zurückzuführen.
Wenn sie das heute machen, zahlen sie darauf bis zu 35 Prozent Steuern – deshalb ziehen es die Konzerne vor, das Vermögen im Ausland zu belassen. Trump will ihnen ausnahmsweise einen viel tieferen Steuersatz offerieren, wenn sie dieses Geld nach Hause verschieben.
Ein konkreter Vorschlag ist in Arbeit
Es geht um riesige Summen: Bis zu 2,5 Billionen Dollar halten die Unternehmen ausser Reichweite der amerikanischen Steuerbehörden. Eigentlich haben sie aber grosses Interesse daran, dieses Vermögen in die USA zurückzuführen – nur so können sie es auch zu Hause verwenden. Beispielsweise, um Aktien zurückzukaufen oder eine amerikanische Firma zu übernehmen.
Offenbar will Trumps Partei tatsächlich einen solchen Steuerrabatt in die Wege leiten. Wie die Agentur Bloomberg berichtet, ist bei den Republikanern im Repräsentantenhaus ein Vorschlag in Arbeit. Der Plan sieht zwei verschiedene Steuersätze vor: Für die Gewinne, welche die Konzerne investiert haben, soll ein tiefer Satz von 3,5 Prozent gelten. Bei jenen Gewinnen, die sie in Bar halten, würde der Fiskus 8,75 Prozent verlangen.
J&J besitzt einen Berg von Cash
Hier kommt nun Johnson & Johnson ins Spiel: Denn auch der Pharmakonzern hortet riesige Summen im Ausland – vor allem in steuergünstigen Ländern wie Irland, Puerto Rico oder der Schweiz. Hierzulande ist J&J der grösste US-Arbeitgeber, im Kanton Zug ist sein Finanz- und Logistikzentrum. Ein Grossteil dieser Auslandsgewinne bewahrt J&J wohl in Bargeld auf: Der Konzern hat laut der Agentur Bloomberg aktuell rund 42 Milliarden Dollar Cash in Übersee.
Dieser Geldberg verschwindet jetzt auf einen Schlag, weil J&J die 30 Milliarden Dollar für Actelion in Bar zahlt. «Aus Steuersicht ist das ein schlaues Vorgehen», sagt der US-Steuerexperte Robert Willens zu handelszeitung.ch. Er vermutet, dass J&J in Hoffnung auf einen Steuerrabatt den Kauf mit Cash finanziert.
Das Beispiel könnte Schule machen
Weil J&J das Bargeld nun für Actelion ausgibt, könnte der Konzern in Zukunft von einem tieferen Steuersatz profitieren. Natürlich stand das Steuersparen beim Kauf von Actelion nicht im Vordergrund. Willens hält aber für gut möglich, dass J&J wegen der Chance auf eine Billig-Steuer den Deal möglichst schnell abgewickelt hat. Er erwartet, dass auch andere Unternehmen solche Deals wie J&J einfädeln. «Sie werden Wege finden, das ausländische Cash aufzubrauchen, um ihren Steuersatz zu senken.»
Ob die Reform zustande kommt, ist nicht sicher – laut Willens stehen die Chancen gut. Der Wall-Street-Anwalt berät seit Jahrzehnten grosse Konzerne in Steuerfragen und lehrt als Dozent an der Columbia Business School.
US-Arbeitsmarkt profitierte nicht
Es fragt sich allerdings, was ein solches Steuergeschenk der US-Wirtschaft bringt. Trump sagt, dass die Konzerne das Geld investieren würden – und dass dadurch Jobs entstünden. Das Versprechen ist allerdings zweifelhaft, wie die Bilanz zu 2004 zeigt, als die US-Konzerne letztmals einen solchen Fiskalrabatt für Auslandsvermögen erhielten.
Artikel aus der Neue Züricher Zeitung vom 4.02.2017:
Nach der Übernahme durch J&J
So viel wert ist das «Actelion-Baby»
Wie soll das von Jean-Paul Clozel geleitete Forschungs- und Entwicklungs-Unternehmen bewertet werden? Die Meinungen dazu gehen auseinander.
Über die Actelion-Aktionäre geht ein warmer Geldregen nieder. Mit dem Kaufangebot vom 27. Januar offeriert der US-Gesundheitskonzern Johnson & Johnson (J&J) 280 $ für jede Actelion-Aktie. Zusätzlich erhalten die Investoren aber pro Actelion-Aktie noch einen Titel der neu zu gründenden Forschungs- und Entwicklungsfirma, die vorerst den Namen R&D Newco trägt. Die Besitzer fragen sich nun, welchen Börsenwert die vom Actelion-CEO Jean-Paul Clozel geleitete Gesellschaft haben wird. Man könnte argumentieren, die Firma sei 1 Mrd. Fr. wert, denn so viel Barmittel erhält Newco mit auf die Reise, hälftig aus Actelion-Beständen und von J&J. Diese rudimentäre Rechnung ist gar nicht so weit vom Resultat entfernt, das eine detaillierte, aber mit vielen Unsicherheitsfaktoren belastete Berechnung ergibt.
Geld für langen Weg
Als Erstes muss man sich vor Augen führen, dass der Cash-Bestand verwendet wird, um die kommenden Jahre zu finanzieren. In diesen wird Newco versuchen, neue Anwendungen auf den Markt zu bringen. Allein die rund 700 Mitarbeiter verursachten Lohnkosten von 80 Mio. bis 100 Mio. Fr. jährlich, erklärt Sibylle Bischofberger, Analytikerin für die ZKB. Die Kosten für die klinischen Tests in der Phase I und II belaufen sich gemäss den Analytikern von Morgan Stanley auf 50 Mio. bis 180 Mio. Fr. jährlich. Bischofberger rechnet mit einem Mittelverzehr von bis zu 250 Mio. Fr. in den ersten Jahren.
Für die Berechnung des Marktpotenzials der einzelnen Anwendungen müsse man zahlreiche Faktoren berücksichtigen, führt die ZKB-Analytikerin an. Es gebe fünf Anwendungen in der Phase I der klinischen Zulassung, von denen man bis vor kurzem kaum den Wirkstoff gekannt habe und für die nur die ungefähren Anwendungsgebiete bekannt seien. Im Schnitt hätten solche Anwendungen eine Chance von 5% bis 10%, nach vielen Jahren eine Marktzulassung zu erhalten. Sehr interessant sei das Schlafmittel, an dem das Unternehmen arbeite, erklärt Bischofberger. Entgegen der landläufigen Meinung gibt es das ideale Medikament ohne Nebenwirkungen bis jetzt noch nicht. Sie rechnet diesem Mittel eine Erfolgschance von 20% zu, obwohl man sonst für Anwendungen in der Phase II eher mit 30% kalkuliert. In der gleichen Phase ist eine Anwendung von Actelion gegen eine System-Erkrankung. Für eine Bluthochdruck-Anwendungen hat J&J eine Option von Actelion erworben, diese erhält im Gegenzug Zahlungen.
Man könne für jede Anwendung ein potenzielles Umsatzziel und eine Wahrscheinlichkeit der Zulassung ausrechnen, sagt Bischofberger, und würde dann einen kalkulatorischen Wert zwischen 0 und 1 Mrd. Fr. erhalten. Sie rechne deshalb mit 500 Mio. Fr. Morgan Stanley, kommt mit einer detaillierten Kalkulation auf 599 Mio. Fr. Im Gegensatz zur ZKB, die nicht sicher ist, ob Newco ohne zusätzliche Mittelaufnahme auskommt, rechnet Morgan Stanley mit einem Cash-Bestand von 258 Mio. Fr. zum Zeitpunkt des Break-even.
Wenn man den erhaltenen, theoretischen Unternehmenswert nun durch die Anzahl ausstehender Aktien teilt, erhält man den rechnerischen Aktienkurs der «neuen» Valoren. Jeder Aktionär von Actelion erhält einen neuen Titel, zudem erhält J&J eine Beteiligung von 16% mit der Option, diese um weitere 16% auszubauen. Also müsste der gegenwärtige Bestand der Actelion-Aktien mit 132% multipliziert werden, um die künftige Anzahl von Newco-Aktien zu erhalten. Wegen der vielen Unwägbarkeiten reicht die Bewertungs-Bandbreite der neuen Aktien von 7 Fr. bis 11 Fr. – von gewissen Brokern werden deutlich höhere Werte herumgereicht.
Zu viel Vorschusslorbeeren?
Überschätzt der Markt CEO Clozel, weil er mit J&J ein derart vorteilhaftes Abkommen schloss? Man dürfe Actelion nicht auf Clozel reduzieren, wirft die ZKB-Analytikerin ein. In der Newco gebe es zahlreiche hochqualifizierte Angestellte. Auch bei Novartis habe man befürchtet, dass es mit dem Abgang von CEO Vasella ein Problem gebe, aber auch Novartis sei mehr als Vasella. Das neue Unternehmen könne man nicht mit irgendeinem Start-up vergleichen, hält Bischofsberger fest. Das Unternehmen starte mit 600 bis 700 Fachleuten, die ihre Fähigkeiten in Forschung und Entwicklung schon bewiesen hätten. Zudem verfügt die Firma über eine ausgezeichnete Infrastruktur in Allschwil und ein dickes Bargeld-Polster, das für einige Jahren ein sorgenfreies Arbeiten ermöglicht. Andere Startup-Gesellschaften nehmen viel kleinere Beträge am Kapitalmarkt auf und müssen dauernd bangen, ob es bis zur nächsten Erfolgsmeldung reicht.
Bis die Transaktion im zweiten Quartal abgeschlossen ist und der Prospekt und die Preisfindung für die Newco vorüber ist, wird auch der Aktienkurs von Actelion etwas unter 280 Fr. oszillieren. Dies wegen Änderungen im Dollarkurs und wegen Nachrichten, welche die Transaktion gefährden könnten, wie etwa Drohungen des neuen US-Präsidenten, die Festlegung von Medikamentenpreisen grundlegend zu ändern.
...weitere interessante Nachrichten zu Actelion!!
Gerne sende ich Euch weitere interessante Nachrichten zu Actelion:Johnson & Johnson übernimmt Actelion – und verschafft sich damit wohl saftige Steuervorteile in den USA. Der Deal zeigt auf, wie US-Konzerne zu Zeiten von Donald Trump im Ausland Steuern sparen.
VonMarc Bürgi
06:07
Die Nachricht hat für Schlagzeilen gesorgt: Johnson & Johnson übernimmt nach monatelangen Verhandlungen Actelion. Der US-Pharmakonzern zahlt 30 Milliarden Dollar und erhält im Gegenzug einen Grossteil des Geschäfts des Baselbieter Biotechkonzerns.
Kaum Beachtung fand ein spannender Aspekt der Übernahme: Der amerikanische Konzern zahlt den Kaufpreis mit Bargeld, das er im Ausland gehortet hat. Dass Johnson & Johnson dies ausdrücklich erwähnt, sei ziemlich ungewöhnlich, sagt Bruno Bulic. Der Analyst bei der Bank Baader Helvea hat auch eine Vermutung, was hinter dem Satz in der Medienmitteilung stecken könnte: Gut möglich, dass es ein Signal an die neue US-Regierung sei, ihre Steuerpläne umzusetzen.
Trump verspricht einen Steuerrabatt
Konkret geht es um eine Ansage von Donald Trump. Er hat im Wahlkampf versprochen, das Steuersystem zu reformieren. Fast alle Bürger und Unternehmen sollten weniger Steuern zahlen müssen. Als Teil seiner Reform schlug er auch ein «tax holiday» vor: Unternehmen möchte er die Chance geben, ihre ausländischen Gewinne in die USA zurückzuführen.
Wenn sie das heute machen, zahlen sie darauf bis zu 35 Prozent Steuern – deshalb ziehen es die Konzerne vor, das Vermögen im Ausland zu belassen. Trump will ihnen ausnahmsweise einen viel tieferen Steuersatz offerieren, wenn sie dieses Geld nach Hause verschieben.
Ein konkreter Vorschlag ist in Arbeit
Es geht um riesige Summen: Bis zu 2,5 Billionen Dollar halten die Unternehmen ausser Reichweite der amerikanischen Steuerbehörden. Eigentlich haben sie aber grosses Interesse daran, dieses Vermögen in die USA zurückzuführen – nur so können sie es auch zu Hause verwenden. Beispielsweise, um Aktien zurückzukaufen oder eine amerikanische Firma zu übernehmen.
Offenbar will Trumps Partei tatsächlich einen solchen Steuerrabatt in die Wege leiten. Wie die Agentur Bloomberg berichtet, ist bei den Republikanern im Repräsentantenhaus ein Vorschlag in Arbeit. Der Plan sieht zwei verschiedene Steuersätze vor: Für die Gewinne, welche die Konzerne investiert haben, soll ein tiefer Satz von 3,5 Prozent gelten. Bei jenen Gewinnen, die sie in Bar halten, würde der Fiskus 8,75 Prozent verlangen.
J&J besitzt einen Berg von Cash
Hier kommt nun Johnson & Johnson ins Spiel: Denn auch der Pharmakonzern hortet riesige Summen im Ausland – vor allem in steuergünstigen Ländern wie Irland, Puerto Rico oder der Schweiz. Hierzulande ist J&J der grösste US-Arbeitgeber, im Kanton Zug ist sein Finanz- und Logistikzentrum. Ein Grossteil dieser Auslandsgewinne bewahrt J&J wohl in Bargeld auf: Der Konzern hat laut der Agentur Bloomberg aktuell rund 42 Milliarden Dollar Cash in Übersee.
Dieser Geldberg verschwindet jetzt auf einen Schlag, weil J&J die 30 Milliarden Dollar für Actelion in Bar zahlt. «Aus Steuersicht ist das ein schlaues Vorgehen», sagt der US-Steuerexperte Robert Willens zu handelszeitung.ch. Er vermutet, dass J&J in Hoffnung auf einen Steuerrabatt den Kauf mit Cash finanziert.
Das Beispiel könnte Schule machen
Weil J&J das Bargeld nun für Actelion ausgibt, könnte der Konzern in Zukunft von einem tieferen Steuersatz profitieren. Natürlich stand das Steuersparen beim Kauf von Actelion nicht im Vordergrund. Willens hält aber für gut möglich, dass J&J wegen der Chance auf eine Billig-Steuer den Deal möglichst schnell abgewickelt hat. Er erwartet, dass auch andere Unternehmen solche Deals wie J&J einfädeln. «Sie werden Wege finden, das ausländische Cash aufzubrauchen, um ihren Steuersatz zu senken.»
Ob die Reform zustande kommt, ist nicht sicher – laut Willens stehen die Chancen gut. Der Wall-Street-Anwalt berät seit Jahrzehnten grosse Konzerne in Steuerfragen und lehrt als Dozent an der Columbia Business School.
US-Arbeitsmarkt profitierte nicht
Es fragt sich allerdings, was ein solches Steuergeschenk der US-Wirtschaft bringt. Trump sagt, dass die Konzerne das Geld investieren würden – und dass dadurch Jobs entstünden. Das Versprechen ist allerdings zweifelhaft, wie die Bilanz zu 2004 zeigt, als die US-Konzerne letztmals einen solchen Fiskalrabatt für Auslandsvermögen erhielten.
Artikel aus der Neue Züricher Zeitung vom 4.02.2017:
Nach der Übernahme durch J&J
So viel wert ist das «Actelion-Baby»
Wie soll das von Jean-Paul Clozel geleitete Forschungs- und Entwicklungs-Unternehmen bewertet werden? Die Meinungen dazu gehen auseinander.
Über die Actelion-Aktionäre geht ein warmer Geldregen nieder. Mit dem Kaufangebot vom 27. Januar offeriert der US-Gesundheitskonzern Johnson & Johnson (J&J) 280 $ für jede Actelion-Aktie. Zusätzlich erhalten die Investoren aber pro Actelion-Aktie noch einen Titel der neu zu gründenden Forschungs- und Entwicklungsfirma, die vorerst den Namen R&D Newco trägt. Die Besitzer fragen sich nun, welchen Börsenwert die vom Actelion-CEO Jean-Paul Clozel geleitete Gesellschaft haben wird. Man könnte argumentieren, die Firma sei 1 Mrd. Fr. wert, denn so viel Barmittel erhält Newco mit auf die Reise, hälftig aus Actelion-Beständen und von J&J. Diese rudimentäre Rechnung ist gar nicht so weit vom Resultat entfernt, das eine detaillierte, aber mit vielen Unsicherheitsfaktoren belastete Berechnung ergibt.
Geld für langen Weg
Als Erstes muss man sich vor Augen führen, dass der Cash-Bestand verwendet wird, um die kommenden Jahre zu finanzieren. In diesen wird Newco versuchen, neue Anwendungen auf den Markt zu bringen. Allein die rund 700 Mitarbeiter verursachten Lohnkosten von 80 Mio. bis 100 Mio. Fr. jährlich, erklärt Sibylle Bischofberger, Analytikerin für die ZKB. Die Kosten für die klinischen Tests in der Phase I und II belaufen sich gemäss den Analytikern von Morgan Stanley auf 50 Mio. bis 180 Mio. Fr. jährlich. Bischofberger rechnet mit einem Mittelverzehr von bis zu 250 Mio. Fr. in den ersten Jahren.
Für die Berechnung des Marktpotenzials der einzelnen Anwendungen müsse man zahlreiche Faktoren berücksichtigen, führt die ZKB-Analytikerin an. Es gebe fünf Anwendungen in der Phase I der klinischen Zulassung, von denen man bis vor kurzem kaum den Wirkstoff gekannt habe und für die nur die ungefähren Anwendungsgebiete bekannt seien. Im Schnitt hätten solche Anwendungen eine Chance von 5% bis 10%, nach vielen Jahren eine Marktzulassung zu erhalten. Sehr interessant sei das Schlafmittel, an dem das Unternehmen arbeite, erklärt Bischofberger. Entgegen der landläufigen Meinung gibt es das ideale Medikament ohne Nebenwirkungen bis jetzt noch nicht. Sie rechnet diesem Mittel eine Erfolgschance von 20% zu, obwohl man sonst für Anwendungen in der Phase II eher mit 30% kalkuliert. In der gleichen Phase ist eine Anwendung von Actelion gegen eine System-Erkrankung. Für eine Bluthochdruck-Anwendungen hat J&J eine Option von Actelion erworben, diese erhält im Gegenzug Zahlungen.
Man könne für jede Anwendung ein potenzielles Umsatzziel und eine Wahrscheinlichkeit der Zulassung ausrechnen, sagt Bischofberger, und würde dann einen kalkulatorischen Wert zwischen 0 und 1 Mrd. Fr. erhalten. Sie rechne deshalb mit 500 Mio. Fr. Morgan Stanley, kommt mit einer detaillierten Kalkulation auf 599 Mio. Fr. Im Gegensatz zur ZKB, die nicht sicher ist, ob Newco ohne zusätzliche Mittelaufnahme auskommt, rechnet Morgan Stanley mit einem Cash-Bestand von 258 Mio. Fr. zum Zeitpunkt des Break-even.
Wenn man den erhaltenen, theoretischen Unternehmenswert nun durch die Anzahl ausstehender Aktien teilt, erhält man den rechnerischen Aktienkurs der «neuen» Valoren. Jeder Aktionär von Actelion erhält einen neuen Titel, zudem erhält J&J eine Beteiligung von 16% mit der Option, diese um weitere 16% auszubauen. Also müsste der gegenwärtige Bestand der Actelion-Aktien mit 132% multipliziert werden, um die künftige Anzahl von Newco-Aktien zu erhalten. Wegen der vielen Unwägbarkeiten reicht die Bewertungs-Bandbreite der neuen Aktien von 7 Fr. bis 11 Fr. – von gewissen Brokern werden deutlich höhere Werte herumgereicht.
Zu viel Vorschusslorbeeren?
Überschätzt der Markt CEO Clozel, weil er mit J&J ein derart vorteilhaftes Abkommen schloss? Man dürfe Actelion nicht auf Clozel reduzieren, wirft die ZKB-Analytikerin ein. In der Newco gebe es zahlreiche hochqualifizierte Angestellte. Auch bei Novartis habe man befürchtet, dass es mit dem Abgang von CEO Vasella ein Problem gebe, aber auch Novartis sei mehr als Vasella. Das neue Unternehmen könne man nicht mit irgendeinem Start-up vergleichen, hält Bischofsberger fest. Das Unternehmen starte mit 600 bis 700 Fachleuten, die ihre Fähigkeiten in Forschung und Entwicklung schon bewiesen hätten. Zudem verfügt die Firma über eine ausgezeichnete Infrastruktur in Allschwil und ein dickes Bargeld-Polster, das für einige Jahren ein sorgenfreies Arbeiten ermöglicht. Andere Startup-Gesellschaften nehmen viel kleinere Beträge am Kapitalmarkt auf und müssen dauernd bangen, ob es bis zur nächsten Erfolgsmeldung reicht.
Bis die Transaktion im zweiten Quartal abgeschlossen ist und der Prospekt und die Preisfindung für die Newco vorüber ist, wird auch der Aktienkurs von Actelion etwas unter 280 Fr. oszillieren. Dies wegen Änderungen im Dollarkurs und wegen Nachrichten, welche die Transaktion gefährden könnten, wie etwa Drohungen des neuen US-Präsidenten, die Festlegung von Medikamentenpreisen grundlegend zu ändern.
Antwort auf Beitrag Nr.: 54.258.503 von HKroll am 07.02.17 12:53:48Der Dollar hält sich gerade ganz gut. Momentan entsprechen 280 Dollar über 263 Euro + die Gratisaktien der neuen Firma. Bis Donnerstag/Freitag nächster Woche erwarte ich eine deutliche Annäherung Richtung Gebotspreis.
Antwort auf Beitrag Nr.: 54.291.452 von Kopflaus am 10.02.17 15:12:51
Schade, dass die bisherige Resonanz im Forum so dünn ist. Wichtig ist, wir beide sind dabei und haben uns eine tolle Performance in 2017 eingekauft!! Die neue Gratisaktie wird die nächste Überraschung in den nächsten drei Jahren. Da wir sie umsonst als Actelion Aktionäre erhalten können wir uns auf die nächste Kursrakete freuen.
Die Nachrichten über den Zeitrahmen der Pbernahme und die Daten der Notierung an der Schweizer Börse erhalten wir nächsten Donnerstag, den 16. Februar. Ich rechne dann mit Kursen bis 257-258 EUR.
Mit den heutigen schönen Kursanstieg wünsche ich Dir ein schönes Wochenende.
Kleiner Tipp: Die nächste Übernahme von Bayer vs Monsanto. Schau bitte nicht auf den USD sondern nur auf die Kursdifferenz.
..scheinbar macht keiner bei dieser Übernahme im Forum mit.
Vielen Dank für Deinen Beitrag. Schade, dass die bisherige Resonanz im Forum so dünn ist. Wichtig ist, wir beide sind dabei und haben uns eine tolle Performance in 2017 eingekauft!! Die neue Gratisaktie wird die nächste Überraschung in den nächsten drei Jahren. Da wir sie umsonst als Actelion Aktionäre erhalten können wir uns auf die nächste Kursrakete freuen.
Die Nachrichten über den Zeitrahmen der Pbernahme und die Daten der Notierung an der Schweizer Börse erhalten wir nächsten Donnerstag, den 16. Februar. Ich rechne dann mit Kursen bis 257-258 EUR.
Mit den heutigen schönen Kursanstieg wünsche ich Dir ein schönes Wochenende.
Kleiner Tipp: Die nächste Übernahme von Bayer vs Monsanto. Schau bitte nicht auf den USD sondern nur auf die Kursdifferenz.
Antwort auf Beitrag Nr.: 54.292.061 von HKroll am 10.02.17 16:18:16Bei Monsanto halte ich das Risiko eines Scheiterns deutlich höher, zum einen wegen der Kartellbehörden und wegen Trump. Ausländer will US Unternehmen kaufen, das gefällt ihm nicht, umgekehrt so wie bei J$J mit Actelion wird er dies wohl eher begrüßen, so meine Einschätzung.
Auch der Infineon Deal mit Wolfspeed ist noch geplatzt.
Auch der Infineon Deal mit Wolfspeed ist noch geplatzt.
Antwort auf Beitrag Nr.: 54.292.154 von Kopflaus am 10.02.17 16:25:26
Bei Monsanto sehe ich es etwas anders. Hier lieg die Zustimmung der Geellschaft und Aktionäre vor.
Die Behörde in den USA ist für mich der wichtige Entscheider, der zu dieser Übernahme seinen Segen geben muss. Mal schauen wär Recht behält.
..Chipmarkt wird anders gesehen...
Ich gebe Dir recht bei Infineon, weil die USA es nicht zulassen werden, dass so interessante Chipfirmen von Ausländern aufgekauft werden.Bei Monsanto sehe ich es etwas anders. Hier lieg die Zustimmung der Geellschaft und Aktionäre vor.
Die Behörde in den USA ist für mich der wichtige Entscheider, der zu dieser Übernahme seinen Segen geben muss. Mal schauen wär Recht behält.
Antwort auf Beitrag Nr.: 54.301.295 von HKroll am 12.02.17 14:45:00Nicht falsch verstehen, denke schon dass der Monsanto Deal durchgeht, nur etwas unsicherer als bei Actelion. Bin mal gespannt was so gegen Ende der Woche geht.
Antwort auf Beitrag Nr.: 54.301.331 von Kopflaus am 12.02.17 15:05:10
...Donnerstag, der 16. Februar.
Für uns ist der 16. Februar ganz wichtig. Dann erhalten wir die Einzelheiten und zuküftigen Daten der Abwicklung aus der Übernahme von J&J.
Warnung für deutsche Anleger :
Die neue Gesellschaft R & D New Co. soll laut "der aktionär" als Sachdividende erfolgen.
Damit droht eine volle Versteuerung !
Die neue Gesellschaft R & D New Co. soll laut "der aktionär" als Sachdividende erfolgen.
Damit droht eine volle Versteuerung !
Antwort auf Beitrag Nr.: 54.308.075 von happymuck am 13.02.17 16:10:34Damit habe ich auch gerechnet. Wird eben wie eine normale Bardividende gerechnet.
Bei Wert von 10 € sind 3,50 € als Steuer weg.
Bleibt immer noch eine Summe von 6,50 € übrig.
Also Übernahmepreis 263 € bei derzeitigem Eurokurs und dazu noch der Wert der Gratisaktien in Höhe von 6,50 €. Alles in allem haben wir dann ca. 270 €.
Kurs derzeit 253 €, also es gibt noch was drauf!
Bei Wert von 10 € sind 3,50 € als Steuer weg.
Bleibt immer noch eine Summe von 6,50 € übrig.
Also Übernahmepreis 263 € bei derzeitigem Eurokurs und dazu noch der Wert der Gratisaktien in Höhe von 6,50 €. Alles in allem haben wir dann ca. 270 €.
Kurs derzeit 253 €, also es gibt noch was drauf!
Antwort auf Beitrag Nr.: 54.308.075 von happymuck am 13.02.17 16:10:34
Sachdividende ist doch positiv. Schlecht wäre Aktien+Cash-Komponente. Dann zählt die Cash-Komponente als Dividende und die Aktien-Komponente steht mit dem ursprünglichen Kaufkurs (also fett im minus) im Depot ==> Cash-Komponente wird sofort mit 28% besteuert und Aktien-Komponente erzeugt einen Aktienverlust bei Verkauf, den man nur mit Aktiengewinnen verrechnen kann.
Und Trump ist sicher über den Deal nicht begeistert, da er ja die US-Unternehmen zur Rückfuhr der ausl. Cash-Bestände zwingen will. Daher betont JNJ ja, dass es sich um Cash, der im Ausland unversteuert liegt handelt.
Zitat von happymuck: Warnung für deutsche Anleger :
Die neue Gesellschaft R & D New Co. soll laut "der aktionär" als Sachdividende erfolgen.
Damit droht eine volle Versteuerung !
Sachdividende ist doch positiv. Schlecht wäre Aktien+Cash-Komponente. Dann zählt die Cash-Komponente als Dividende und die Aktien-Komponente steht mit dem ursprünglichen Kaufkurs (also fett im minus) im Depot ==> Cash-Komponente wird sofort mit 28% besteuert und Aktien-Komponente erzeugt einen Aktienverlust bei Verkauf, den man nur mit Aktiengewinnen verrechnen kann.
Und Trump ist sicher über den Deal nicht begeistert, da er ja die US-Unternehmen zur Rückfuhr der ausl. Cash-Bestände zwingen will. Daher betont JNJ ja, dass es sich um Cash, der im Ausland unversteuert liegt handelt.
Übernahme
So bei mir liegt das Übernahmeangebot zu 280$ entsprechend aktuell 263,60 € auf dem Tisch.Dazu noch Aktien der neuen Actelion 2.
Von diesen werde ich dann auch noch einige zukaufen weil ich das Management, gerade auch in der heutigen Zeit selten, für absolut Top und nicht so geldgeil halte.
Dazu kommt ein gutes Mitarbeiterteam und eine mehr wie gute Kapitalausstattung zum Start.
Antwort auf Beitrag Nr.: 54.464.733 von Kopflaus am 04.03.17 11:19:19Habe noch keine Angebot erhalten aber nachgefragt. Werden die neuen R&D schon gehandelt unter welcher WKN? ...., finde ich auch sehr interessant
Antwort auf Beitrag Nr.: 54.519.414 von Jgersauce am 12.03.17 08:39:21Das Übernahmeangebot war bei mir am 04. März im Posteingang von Comdirect.
Dieses musste ich dann unterschrieben zurücksenden. Meine Aktien werden im Depot zwar noch angezeigt, können jetzt aber nicht mehr verkauft werden.
Die neuen Aktien werden erst zum Ende des zweiten Quartals gehandelt, wenn alle Formalitäten durch sind. Also Ende Anfang Juni.
Dieses musste ich dann unterschrieben zurücksenden. Meine Aktien werden im Depot zwar noch angezeigt, können jetzt aber nicht mehr verkauft werden.
Die neuen Aktien werden erst zum Ende des zweiten Quartals gehandelt, wenn alle Formalitäten durch sind. Also Ende Anfang Juni.
Antwort auf Beitrag Nr.: 54.519.414 von Jgersauce am 12.03.17 08:39:21
Allschwil (awp) - Nach monatelangen Verhandlungen wird die Übernahme des Allschwiler Biopharmaunternehmens Actelion durch Johnson&Johnson (J&J) nun Tatsache. Der US-Konzern hat den Actelion-Aktionären ein Übernahmeangebot von 280 USD je Aktie gemacht, was einem Kaufpreis für das Unternehmen von insgesamt 30 Mrd USD entspricht. Ausserdem werden die Forschung- und Entwicklungsaktivitäten in ein börsenkotiertes Unternehmen unter Führung von CEO Jean-Paul Clozel abgespalten.
Die am Donnerstag erfolgte Kaufofferte für die auf die Behandlung der Krankheit Lungenbluthochdruck (pulmonale arterielle Hypertonie, PAH) spezialisierte Actelion war keine Überraschung. Erste Gespräche hatten die Unternehmen bereits Ende November 2016 bestätigt. Nach einem Verhandlungsabbruch und Spekulationen über ein Gegenangebot des französischen Sanofi-Konzerns verpflichteten sich die Parteien dann am 21. Dezember offiziell zu "exklusiven Gesprächen".
Sowohl Actelion-CEO Clozel wie auch die Vertreter von J&J zeigten sich vor den Medien in Allschwil zufrieden mit der Vereinbarung. Für den US-Konzern ist das hochprofitable Actelion-Geschäft "komplementär" zu seinen bestehenden Aktivitäten. J&J will den Actelion-Hauptsitz in der Schweiz aufrechterhalten. Überschneidungen, aber auch Möglichkeiten für Synergien gebe es kaum, meinte J&J-Vertreter Paul Stoffels.
AKTIONÄRE ERHALTEN AUCH AKTIEN FÜR NEUE GESELLSCHAFT
Wie bereits aus den Übernahmeverhandlungen durchgesickert war, wird die vorklinischen Forschung sowie die klinischen Pipeline ("R&D New Co") in eine neue Gesellschaft unter der Führung von Actelion-Mitgründer und CEO Jean-Paul Clozel abgespalten, die an der Schweizer Börse SIX kotiert sein wird. Ausgenommen davon sind das MS-Präparat Ponesimod und das Antibiotikum Cadazolid. Die Actelion-Aktionäre sollen Aktien der "R&D New Co" in Form einer Sachdividende erhalten.
Die Vereinbarung einer Akquisition mit gleichzeitigem Forschungs-Spin-off bezeichnete Clozel als äussert interessantes Modell. Denn Actelion habe über die Jahre neben dem PAH-Geschäft auch eine "einmalige Medikamentenentdeckungs-Maschine" aufgebaut. Für diese hätte es gemäss den Befürchtungen des Actelion-CEO bei einer Integration in den grossen Johnson&Johnson-Konzern wegen Überlappungen keinen Platz gegeben.
RUND 600 PERSONEN IN NEUEM UNTERNEHMEN
Die neue Forschungs-Gesellschaft kann mit Mitteln von 1 Mrd CHF starten. Zudem werde sie bereits Einnahmen aus Lizenzgebühren für Ponesimod und Cadazolid erhalten. Laut Clozel wird sie 600 bis 700 Personen der heute rund 2'500 Mitarbeitenden von Actelion umfassen.
An der neuen Gesellschaft wird der J&J beteiligt bleiben. So umfasst die Vereinbarung ein Wandeldarlehen des US-Konzerns an der "R&D New Co". Eine erste Tranche wird nach dem Vollzug der Abspaltungstransaktion gewandelt und führt dazu, dass J&J einen Anteil von 16% halten wird. J&J will während der kommenden fünf Jahre grundsätzlich einen Anteil von 32% nicht überschreiten.
HOHER KURSAUFSCHLAG
Die Actelion-Aktionäre erhalten mit dem offerierten Preis von 280 USD einen Aufschlag von 46% gegenüber dem Durchschnittskurs der Actelion-Aktie vor der Voranmeldung des Kaufangebots (191,20 CHF). Noch grösser ist der Aufschlag mit Sicht auf den Kurs vor Jahresfrist: Anfang 2016 hatte die Actelion-Aktie noch bei knapp 139 CHF notiert.
Die Angebotsfrist soll voraussichtlich vom 3. März bis zum 30. März dauern. Die Actelion-Aktionäre sollen an einer ausserordentlichen Generalversammlung im zweiten Quartal 2017 über die Fusion befinden. Clozel rechnet nach eigenen Angaben mit dem Vollzug der Transaktion und dem Start des neuen Unternehmens an der Schweizer Börse SIX etwa im Juni dieses Jahres.
Meldung vom 16.02.2017 :Quelle: Handelszeitung
Actelion geht an Johnson&Johnson - Abspaltung von ForschungsunternehmenAllschwil (awp) - Nach monatelangen Verhandlungen wird die Übernahme des Allschwiler Biopharmaunternehmens Actelion durch Johnson&Johnson (J&J) nun Tatsache. Der US-Konzern hat den Actelion-Aktionären ein Übernahmeangebot von 280 USD je Aktie gemacht, was einem Kaufpreis für das Unternehmen von insgesamt 30 Mrd USD entspricht. Ausserdem werden die Forschung- und Entwicklungsaktivitäten in ein börsenkotiertes Unternehmen unter Führung von CEO Jean-Paul Clozel abgespalten.
Die am Donnerstag erfolgte Kaufofferte für die auf die Behandlung der Krankheit Lungenbluthochdruck (pulmonale arterielle Hypertonie, PAH) spezialisierte Actelion war keine Überraschung. Erste Gespräche hatten die Unternehmen bereits Ende November 2016 bestätigt. Nach einem Verhandlungsabbruch und Spekulationen über ein Gegenangebot des französischen Sanofi-Konzerns verpflichteten sich die Parteien dann am 21. Dezember offiziell zu "exklusiven Gesprächen".
Sowohl Actelion-CEO Clozel wie auch die Vertreter von J&J zeigten sich vor den Medien in Allschwil zufrieden mit der Vereinbarung. Für den US-Konzern ist das hochprofitable Actelion-Geschäft "komplementär" zu seinen bestehenden Aktivitäten. J&J will den Actelion-Hauptsitz in der Schweiz aufrechterhalten. Überschneidungen, aber auch Möglichkeiten für Synergien gebe es kaum, meinte J&J-Vertreter Paul Stoffels.
AKTIONÄRE ERHALTEN AUCH AKTIEN FÜR NEUE GESELLSCHAFT
Wie bereits aus den Übernahmeverhandlungen durchgesickert war, wird die vorklinischen Forschung sowie die klinischen Pipeline ("R&D New Co") in eine neue Gesellschaft unter der Führung von Actelion-Mitgründer und CEO Jean-Paul Clozel abgespalten, die an der Schweizer Börse SIX kotiert sein wird. Ausgenommen davon sind das MS-Präparat Ponesimod und das Antibiotikum Cadazolid. Die Actelion-Aktionäre sollen Aktien der "R&D New Co" in Form einer Sachdividende erhalten.
Die Vereinbarung einer Akquisition mit gleichzeitigem Forschungs-Spin-off bezeichnete Clozel als äussert interessantes Modell. Denn Actelion habe über die Jahre neben dem PAH-Geschäft auch eine "einmalige Medikamentenentdeckungs-Maschine" aufgebaut. Für diese hätte es gemäss den Befürchtungen des Actelion-CEO bei einer Integration in den grossen Johnson&Johnson-Konzern wegen Überlappungen keinen Platz gegeben.
RUND 600 PERSONEN IN NEUEM UNTERNEHMEN
Die neue Forschungs-Gesellschaft kann mit Mitteln von 1 Mrd CHF starten. Zudem werde sie bereits Einnahmen aus Lizenzgebühren für Ponesimod und Cadazolid erhalten. Laut Clozel wird sie 600 bis 700 Personen der heute rund 2'500 Mitarbeitenden von Actelion umfassen.
An der neuen Gesellschaft wird der J&J beteiligt bleiben. So umfasst die Vereinbarung ein Wandeldarlehen des US-Konzerns an der "R&D New Co". Eine erste Tranche wird nach dem Vollzug der Abspaltungstransaktion gewandelt und führt dazu, dass J&J einen Anteil von 16% halten wird. J&J will während der kommenden fünf Jahre grundsätzlich einen Anteil von 32% nicht überschreiten.
HOHER KURSAUFSCHLAG
Die Actelion-Aktionäre erhalten mit dem offerierten Preis von 280 USD einen Aufschlag von 46% gegenüber dem Durchschnittskurs der Actelion-Aktie vor der Voranmeldung des Kaufangebots (191,20 CHF). Noch grösser ist der Aufschlag mit Sicht auf den Kurs vor Jahresfrist: Anfang 2016 hatte die Actelion-Aktie noch bei knapp 139 CHF notiert.
Die Angebotsfrist soll voraussichtlich vom 3. März bis zum 30. März dauern. Die Actelion-Aktionäre sollen an einer ausserordentlichen Generalversammlung im zweiten Quartal 2017 über die Fusion befinden. Clozel rechnet nach eigenen Angaben mit dem Vollzug der Transaktion und dem Start des neuen Unternehmens an der Schweizer Börse SIX etwa im Juni dieses Jahres.
@Kopflaus,...ok danke. Jetzt hab ich das Angebot auch,..du schreibst du hast auch schon die neuen Actelion 2, damit meinst du sicher die angedienten Actelionaktien ,..oder hast du etwa schon die Spin-Off Stuecke ?
Antwort auf Beitrag Nr.: 54.541.336 von Jgersauce am 15.03.17 17:47:26Die Spinoff Aktien werden erst gegen Enden Juni zugeteilt bzw. an die Börse gebracht.
So lange brauchts noch etwas Geduld.
So lange brauchts noch etwas Geduld.
Antwort auf Beitrag Nr.: 54.541.370 von Kopflaus am 15.03.17 17:53:56Aha danke. Weisst du auch ungefaehr wann der Stichtag also die Ex-Neueaktien Notierung sein wird ? Weil ich ueberlege immernoch evtl. zu verkaufen, weil ich bis Juni einen Anstieg der E/$ erwarte (wegen Draghi steht unter Druck das Eurodumping (QE) zu beenden,..ueberlege immernoch was guenstiger ist ...
Antwort auf Beitrag Nr.: 54.541.448 von Jgersauce am 15.03.17 18:07:33Also ab oberhalb E/$ 1,09 kriegst du schon weniger als wo der Kurs jetzt steht (allerdings ohne die Spin-Offstuecke gerechnet) Habe etwas von einem Wert ca. 7 Euro gelesen als Kalkulation fuer die R&D Divisionaktien, dann waere der Break Even d.h. Aequivalent E/$ 1,11 ,..wenn der Euro bis Juni darueber steigt wuerdest du da nnweniger bekommen als jetzt wenn man die Stuecke verkauft ...das sind so meine Ueberlegungen
Aslo am 05.04.2017 ist zur HV von Actelion geladen, wenn alles abgesegnet wird , dann gibt es die Idorsia.Ltd. als Stockdividende
Antwort auf Beitrag Nr.: 54.545.212 von Jgersauce am 16.03.17 09:57:38So hat sich also meine E/$ Prognose erfuellt bisher ...
Soeee....am 16 Juni solls soweit sein Indorsion wird gehandelt ,..die schaue i mir mal an ...Jo !
Antwort auf Beitrag Nr.: 55.130.474 von Jgersauce am 13.06.17 11:20:00
Heute in Frankfurt erster Handel und weiterer Anstieg schon auf 13,80 €.
Freitag konnte ich leider nicht nachkaufen da nur an der Schweizer Börse gehandelt wurde. Die Vorraussage von einigen Experten dass einige Fonds die Actelion hielten Ihre Idorsia Aktien zu jedem Preis auf den Markt werfen bestätigt sich also nicht.
Bei mir geniesst das Management und ihre Mitarbeiter großes Vertrauen. Wo gibts das denn heute noch. Das Ehepaar Clozel hätte schon längst verkaufen können. Geld hatte aber nicht allein den Vorrang sondern hier stehen auch noch andere Werte im Vordergrund. Da kann sich so manch ein Manager mal eine Scheibe abschneiden, man denke nur an die Herren Ackermann oder Winterkorn. Da kann man die Liste ja noch ewig verlängern.
Deshalb von mir ein kräftiges Daumen hoch dem Ehepaar Clozel und lange Gesundheit!
Idorsia
In der Schweiz am Freitag mit 10 Franken rund 9 € gestartet und gleich mit 30 % Kurspluss am Schluss.Heute in Frankfurt erster Handel und weiterer Anstieg schon auf 13,80 €.
Freitag konnte ich leider nicht nachkaufen da nur an der Schweizer Börse gehandelt wurde. Die Vorraussage von einigen Experten dass einige Fonds die Actelion hielten Ihre Idorsia Aktien zu jedem Preis auf den Markt werfen bestätigt sich also nicht.
Bei mir geniesst das Management und ihre Mitarbeiter großes Vertrauen. Wo gibts das denn heute noch. Das Ehepaar Clozel hätte schon längst verkaufen können. Geld hatte aber nicht allein den Vorrang sondern hier stehen auch noch andere Werte im Vordergrund. Da kann sich so manch ein Manager mal eine Scheibe abschneiden, man denke nur an die Herren Ackermann oder Winterkorn. Da kann man die Liste ja noch ewig verlängern.
Deshalb von mir ein kräftiges Daumen hoch dem Ehepaar Clozel und lange Gesundheit!
Das habe ich nicht erwartet. Die Idorsia Einbuchung wurde heute abgerechnet und es wurde keine Quellensteuer abgezogen.
GlobeNewswire | 31.10.2017, 07:00 | 121 | 0 | 0 Actelion Pharmaceuticals Ltd / Cancellation of publicly held Actelion shares and delisting from SIX Swiss Exchange as of November 7, 2017 . Verarbeitet und übermittelt durch Nasdaq Corporate Solutions. Für den Inhalt der Mitteilung ist der Emittent verantwortlich. Source: Globenewswire ALLSCHWIL/BASEL, SWITZERLAND - October 31, 2017 - By decision dated October 25, 2017, the Cantonal Court of the Canton of Basel-Landschaft cancelled all publicly held registered shares of Actelion Ltd (Actelion) with a nominal value of CHF 0.50 each (the Actelion Shares) based on article 137 of the Federal Act on Financial Market Infrastructures and Market Conduct in Securities and Derivatives Trading
The holders of the cancelled Actelion Shares will be paid a cash compensation in the amount of USD 280 for each cancelled Actelion Share, corresponding to the offer price paid by Janssen Holding GmbH, an indirect subsidiary of Johnson & Johnson, in its public tender offer for all publicly held Actelion Shares. The settlement and payment of the compensation to the remaining minority shareholders of Actelion will take place on or around November 10, 2017.
Cancellation of publicly held Actelion shares and delisting from SIX Swiss Exchange as of November 7, 2017 | wallstreet-online.de - Vollständiger Artikel unter:
https://www.wallstreet-online.de/nachricht/10017461-cancella…
The holders of the cancelled Actelion Shares will be paid a cash compensation in the amount of USD 280 for each cancelled Actelion Share, corresponding to the offer price paid by Janssen Holding GmbH, an indirect subsidiary of Johnson & Johnson, in its public tender offer for all publicly held Actelion Shares. The settlement and payment of the compensation to the remaining minority shareholders of Actelion will take place on or around November 10, 2017.
Cancellation of publicly held Actelion shares and delisting from SIX Swiss Exchange as of November 7, 2017 | wallstreet-online.de - Vollständiger Artikel unter:
https://www.wallstreet-online.de/nachricht/10017461-cancella…
Beitrag zu dieser Diskussion schreiben
Zu dieser Diskussion können keine Beiträge mehr verfasst werden, da der letzte Beitrag vor mehr als zwei Jahren verfasst wurde und die Diskussion daraufhin archiviert wurde.
Bitte wenden Sie sich an feedback@wallstreet-online.de und erfragen Sie die Reaktivierung der Diskussion oder starten Sie eine neue Diskussion.
Investoren beobachten auch:
| Wertpapier | Perf. % |
|---|---|
| -0,65 | |
| +0,36 | |
| +0,13 | |
| +0,17 | |
| -0,37 | |
| -1,61 | |
| -0,14 | |
| +0,57 | |
| +1,09 | |
| -0,32 |
Meistdiskutiert
| Wertpapier | Beiträge | |
|---|---|---|
| 229 | ||
| 108 | ||
| 104 | ||
| 68 | ||
| 57 | ||
| 41 | ||
| 39 | ||
| 37 | ||
| 37 | ||
| 35 |



















