Igxt (Mkap 32 M$) 1x US-NDA abgeschickt + 3x NDA/ANDA folgen in 2013 - 500 Beiträge pro Seite
eröffnet am 01.04.13 12:53:50 von
neuester Beitrag 27.07.16 12:51:36 von
neuester Beitrag 27.07.16 12:51:36 von
Beiträge: 155
ID: 1.180.465
ID: 1.180.465
Aufrufe heute: 0
Gesamt: 22.709
Gesamt: 22.709
Aktive User: 0
ISIN: US45822R1014 · WKN: A0RP0X
0,1500
EUR
-1,32 %
-0,0020 EUR
Letzter Kurs 15:27:10 Lang & Schwarz
Neuigkeiten
08.04.24 · globenewswire |
05.04.24 · globenewswire |
21.03.24 · globenewswire |
14.03.24 · globenewswire |
Werte aus der Branche Pharmaindustrie
| Wertpapier | Kurs | Perf. % |
|---|---|---|
| 3,5800 | +922,86 | |
| 1,0400 | +48,57 | |
| 50,80 | +40,72 | |
| 0,5400 | +38,46 | |
| 0,8800 | +31,34 |
| Wertpapier | Kurs | Perf. % |
|---|---|---|
| 6,3900 | -17,65 | |
| 0,7500 | -21,05 | |
| 28,18 | -32,62 | |
| 100,00 | -37,50 | |
| 0,5660 | -40,42 |
Hier ist eine der günstigsten und aussichtsreichste Bioaktie die an der Börse gelistet ist .
Intelgenx hat bereits seit Oktober 2012 ein Produkt(Antidepressant)am US Markt und dank der sehr sehr niedrigen Burn-Rate von gerade mal 1,2 Mio Dollar pro Jahr wird die Profitabilität schon dieses Jahr erwartet .
Letzte Woche wurde die Zulassung für ein weiteres Produkt (gegen Migräne) beantragt . In den nächsten 3-6 Monaten sollen weitere 3x Zulassungsanträge folgen darunter auch für ein Potenzmittel das besser ist als Viagra .
Diese Goldmine hat 9 Produkte in der Pipeline darunter viele potentielle Kassenschlager die alle innerhalb der nächsten 3 Jahre am Markt erhältich sein werden (falls keine rückschläge) .
IGXT hat keine Schulden und die aktuelle Markt Kap von 32 Mio $ ist wirklich lachhaft .
Der größte Investor (hält 6++ Mio Aktien) sieht in IGXT einen potentiellen 10 Bagger den Artikel dazu findet ihr ganz unten .Ich persönlich halte die Aktie selbst nach einer Verzehnfachung für billig gemessen an der gigantischen Produkt Pipeline .
Intelgenx (IGXT)
Markt Kap : $32 M
Cash: $3.5 M
Burn-Rate : $1.2 M pro year
Kurs : $0.64
Shares Out : 50 M ( 27 Mio Aktien werden von Insiders & Institutions gehalten)
"We are very excited that our first FDA-approved product, Forfivo XL(TM), has been launched in the USA in early October by our partner Edgemont Pharmaceuticals. We believe that ForFivo XL(TM), as the only single tablet 450mg bupropion HCl available in the U.S., will be a valuable tool for physicians in their management of patients with major depressive disorders," stated Dr. Horst G. Zerbe, President and CEO of IntelGenx.
March 27, 2013 IntelGenx Corp. a Canadian drug delivery company focusing on oral drug delivery, today announced that, together with its co-development partner RedHill Biopharma ("RedHill"), it has submitted a 505(b)(2) New Drug Application ("NDA") to the U.S. Food and Drug Administration ("FDA") for the Company's anti-migraine oral film product, a novel oral thin-film formulation based on its proprietary VersaFilm(TM) technology containing Rizatriptan, the active drug in Merck's Maxalt-MLT(R) orally disintegrating tablets.
Produkt Pipeline

Ausblick 2013-2015

Neue Präsentaion März 2013
http://de.slideshare.net/ViralNetwork/intelgenx-corporate-pr…
Insiderkäufe
http://finance.yahoo.com/q/it?s=IGXT+Insider+Transactions
Analyst Coverage:
IGXT gets 18 month $3.00 Price Target from AEGIS CAPITAL CORP on October 5th, 2012
http://image.slidesharecdn.com/aegisupdate-oct-52012-1210101…
ide-1-1024.jpg?1349900345" target="_blank" rel="nofollow ugc noopener">http://image.slidesharecdn.com/aegisupdate-oct-52012-1210101…
ide-1-1024.jpg?1349900345
Cleland shares the names of a handful of small companies that could return tenfold or greater multiples to investors.
http://www.thelifesciencesreport.com/pub/na/14076
TLSR: What types of healthcare companies are you looking for? Do you lean toward specialty pharma, where you can monetize more quickly? What are your preferences?
I have at least two investments in this area—is in the FDA's 505(b)(2) pathway, also known as the rapid approval route. This pathway can be used by companies taking an existing drug with hundreds of millions or several billion dollars in sales and porting that drug onto a different delivery technology. Biovail Corp. (now part of Valeant Pharmaceuticals International Inc. [VRX:NYSE]) followed this pathway when it made Wellbutrin XL, a one-a-day version of Wellbutrin (bupropion hydrochloride). IntelGenx (IGX:TSX.V; IGXT:OTCQX) is my poster child in this area, with eight drugs in various stages of the 505(b)(2) approval process, and one 505(b)(2) drug that will be commercially launched this fall, having received FDA approval in November 2011.
TLSR: What's the next company you'd like to talk about?
HC: IntelGenx is the company through which I learned about the 505(b)(2) pathway, and why that pathway is so attractive to me. It's a drug delivery company that takes existing, commercialized drugs and ports them onto different delivery modalities, making them better from a patient compliance perspective or from a time-to-onset-of-action perspective. The existing drugs the company is working with have commercial revenues in the hundreds of millions to several billion-dollar range.
IntelGenx is about to launch its antidepressant drug, having received FDA approval in November 2011, and has a pipeline of eight drugs being developed via the 505(b)(2) pathway. The company is a table-pounder, simply on the basis that it has an approved drug and a market cap of only $30M. It is truly one of the most dramatic valuation disconnects that I am aware of. Full disclosure: Funds that I manage control about 12% of the company.
A migraine drug called rizatriptan is a good example of one of IntelGenx's pipeline drug applications. The time to onset of action of a migraine medication is very important. If the medication is delivered in time, it can cut a migraine off at its knees and save the patient from an ugly 12–36 hours. On the other hand, if a patient pops a pill and it takes 45 minutes to kick in, a migraine may get the foothold it needs to overwhelm the medication.
IntelGenx is moving rizatriptan onto a thin film strip. The time to onset of action for a drug delivered via sublingual strip is much faster than for the pill form. Annual sales of prescription migraine drugs on a global basis are probably more than $5B; annual sales of rizatriptan were over $600M in 2011. If IntelGenx can introduce a better form of the drug, cutting the time to onset of action in half or more—or even if the film cuts it by a third—doctors and patients will be very attracted. IntelGenx's drug could gain market share quickly in the migraine medication area. In another example, the company is moving an erectile dysfunction drug onto a strip. You can imagine reasons you may want quicker onset of action with that.
The bottom line from an investor perspective is that, as of the close on Aug. 3, 2012, the stock is lower than it was before the company's antidepressant received FDA approval on Nov. 11, 2011; lower than it was before its December 2011 codevelopment and commercialization deal with Par Pharmaceutical Inc.; and lower than it was before the announcement of a commercialization partner for its antidepressant. I would argue that at $0.80 or lower, the only thing an investor is paying for is the antidepressant, meaning that you are getting the entire thin-film delivery platform and eight pipeline drugs for free.
I suggest that investors check out the analyst report published two weeks ago by Ram Selvaraju of Aegis Capital Corp., initiating coverage on IntelGenx with a $2.50/share, 18-month target. Ram is known as one of the few analysts willing to pick up coverage on sub-$50M market cap companies—as long as he thinks that he can make investors significant returns. One of his more notable sub-$50M initiations was Amarin, back in 2009, when it had a market cap of about $40M.
Intelgenx hat bereits seit Oktober 2012 ein Produkt(Antidepressant)am US Markt und dank der sehr sehr niedrigen Burn-Rate von gerade mal 1,2 Mio Dollar pro Jahr wird die Profitabilität schon dieses Jahr erwartet .
Letzte Woche wurde die Zulassung für ein weiteres Produkt (gegen Migräne) beantragt . In den nächsten 3-6 Monaten sollen weitere 3x Zulassungsanträge folgen darunter auch für ein Potenzmittel das besser ist als Viagra .
Diese Goldmine hat 9 Produkte in der Pipeline darunter viele potentielle Kassenschlager die alle innerhalb der nächsten 3 Jahre am Markt erhältich sein werden (falls keine rückschläge) .
IGXT hat keine Schulden und die aktuelle Markt Kap von 32 Mio $ ist wirklich lachhaft .
Der größte Investor (hält 6++ Mio Aktien) sieht in IGXT einen potentiellen 10 Bagger den Artikel dazu findet ihr ganz unten .Ich persönlich halte die Aktie selbst nach einer Verzehnfachung für billig gemessen an der gigantischen Produkt Pipeline .
Intelgenx (IGXT)
Markt Kap : $32 M
Cash: $3.5 M
Burn-Rate : $1.2 M pro year
Kurs : $0.64
Shares Out : 50 M ( 27 Mio Aktien werden von Insiders & Institutions gehalten)
"We are very excited that our first FDA-approved product, Forfivo XL(TM), has been launched in the USA in early October by our partner Edgemont Pharmaceuticals. We believe that ForFivo XL(TM), as the only single tablet 450mg bupropion HCl available in the U.S., will be a valuable tool for physicians in their management of patients with major depressive disorders," stated Dr. Horst G. Zerbe, President and CEO of IntelGenx.
March 27, 2013 IntelGenx Corp. a Canadian drug delivery company focusing on oral drug delivery, today announced that, together with its co-development partner RedHill Biopharma ("RedHill"), it has submitted a 505(b)(2) New Drug Application ("NDA") to the U.S. Food and Drug Administration ("FDA") for the Company's anti-migraine oral film product, a novel oral thin-film formulation based on its proprietary VersaFilm(TM) technology containing Rizatriptan, the active drug in Merck's Maxalt-MLT(R) orally disintegrating tablets.
Produkt Pipeline
Ausblick 2013-2015
Neue Präsentaion März 2013
http://de.slideshare.net/ViralNetwork/intelgenx-corporate-pr…
Insiderkäufe
http://finance.yahoo.com/q/it?s=IGXT+Insider+Transactions
Analyst Coverage:
IGXT gets 18 month $3.00 Price Target from AEGIS CAPITAL CORP on October 5th, 2012
http://image.slidesharecdn.com/aegisupdate-oct-52012-1210101…
ide-1-1024.jpg?1349900345" target="_blank" rel="nofollow ugc noopener">http://image.slidesharecdn.com/aegisupdate-oct-52012-1210101…
ide-1-1024.jpg?1349900345
Cleland shares the names of a handful of small companies that could return tenfold or greater multiples to investors.
http://www.thelifesciencesreport.com/pub/na/14076
TLSR: What types of healthcare companies are you looking for? Do you lean toward specialty pharma, where you can monetize more quickly? What are your preferences?
I have at least two investments in this area—is in the FDA's 505(b)(2) pathway, also known as the rapid approval route. This pathway can be used by companies taking an existing drug with hundreds of millions or several billion dollars in sales and porting that drug onto a different delivery technology. Biovail Corp. (now part of Valeant Pharmaceuticals International Inc. [VRX:NYSE]) followed this pathway when it made Wellbutrin XL, a one-a-day version of Wellbutrin (bupropion hydrochloride). IntelGenx (IGX:TSX.V; IGXT:OTCQX) is my poster child in this area, with eight drugs in various stages of the 505(b)(2) approval process, and one 505(b)(2) drug that will be commercially launched this fall, having received FDA approval in November 2011.
TLSR: What's the next company you'd like to talk about?
HC: IntelGenx is the company through which I learned about the 505(b)(2) pathway, and why that pathway is so attractive to me. It's a drug delivery company that takes existing, commercialized drugs and ports them onto different delivery modalities, making them better from a patient compliance perspective or from a time-to-onset-of-action perspective. The existing drugs the company is working with have commercial revenues in the hundreds of millions to several billion-dollar range.
IntelGenx is about to launch its antidepressant drug, having received FDA approval in November 2011, and has a pipeline of eight drugs being developed via the 505(b)(2) pathway. The company is a table-pounder, simply on the basis that it has an approved drug and a market cap of only $30M. It is truly one of the most dramatic valuation disconnects that I am aware of. Full disclosure: Funds that I manage control about 12% of the company.
A migraine drug called rizatriptan is a good example of one of IntelGenx's pipeline drug applications. The time to onset of action of a migraine medication is very important. If the medication is delivered in time, it can cut a migraine off at its knees and save the patient from an ugly 12–36 hours. On the other hand, if a patient pops a pill and it takes 45 minutes to kick in, a migraine may get the foothold it needs to overwhelm the medication.
IntelGenx is moving rizatriptan onto a thin film strip. The time to onset of action for a drug delivered via sublingual strip is much faster than for the pill form. Annual sales of prescription migraine drugs on a global basis are probably more than $5B; annual sales of rizatriptan were over $600M in 2011. If IntelGenx can introduce a better form of the drug, cutting the time to onset of action in half or more—or even if the film cuts it by a third—doctors and patients will be very attracted. IntelGenx's drug could gain market share quickly in the migraine medication area. In another example, the company is moving an erectile dysfunction drug onto a strip. You can imagine reasons you may want quicker onset of action with that.
The bottom line from an investor perspective is that, as of the close on Aug. 3, 2012, the stock is lower than it was before the company's antidepressant received FDA approval on Nov. 11, 2011; lower than it was before its December 2011 codevelopment and commercialization deal with Par Pharmaceutical Inc.; and lower than it was before the announcement of a commercialization partner for its antidepressant. I would argue that at $0.80 or lower, the only thing an investor is paying for is the antidepressant, meaning that you are getting the entire thin-film delivery platform and eight pipeline drugs for free.
I suggest that investors check out the analyst report published two weeks ago by Ram Selvaraju of Aegis Capital Corp., initiating coverage on IntelGenx with a $2.50/share, 18-month target. Ram is known as one of the few analysts willing to pick up coverage on sub-$50M market cap companies—as long as he thinks that he can make investors significant returns. One of his more notable sub-$50M initiations was Amarin, back in 2009, when it had a market cap of about $40M.
Die Potenzmittel Viagra ,Cialis und Levitra gibt es nur in tablettenform und haben den Nachteil das die Wirkung erst nach ca 30 minuten und länger einsetzt . Intelgenz´s Potenzmittel hingegen basiert auf die Versafilm platform das so ähnlich wie die frische Mundstreifen gegen Mundgeruch ist (siehe fotos unten ) das sich sofort im Mund auflöst und so schneller wirkung zeigt .
Intelgenz befindet sich bereits in gesprächen mit möglichen Vermarktungsartner die hohes intresse an diesem einzigartigen Produkt haben .
Der Zulassungsantrag für das Potenzmittel soll noch im 1H 2013 gestellt werden .
Allein dieses Produkt ist um ein vielfaches mehr Wert als die aktuelle Markt Kap von lächerlichen 32 million $ .
-------
Tadalafil film – indicated for Erectile Dysfunction
IntelGenx’ tadalafil film is a new product opportunity formulated using VersaFilm, IntelGenx’ proprietary thin film technology. Tadalafil is one of the three major PDE5 inhibitors in the erectile dysfunction market. Compared with the competitors, tadalafil shows longer duration of action and less food effect. IntelGenx’ tadalafil film offers an improved discrete dosage form that does not require water intake. IntelGenx tadalafil film formulations have been tested in various clinical trials to improve the pharmacokinetics and optimize the formulation. The latest formulation is planned to be tested in a pilot study in Q4 2012. IntelGenx is currently looking for a partnership or alliance opportunity to complete development and commercialize the tadalafil film.

...............................................
Wafer Viagra For Instant Results
One of the big challenges for erectile dysfunction medicine manufacturers is to quicken the time between the application of the medicine and its response. Men want instant results when they take Viagra, Cialis or Levitra and complain that having to wait as much as thirty minutes before the active ingredient is effective can burst the bubble of spontaneity and passion which are often essential requirements of good sex.
Well a solution could be at hand following research done by a Canadian research company called IntelGenx who have developed wafers [like the common breath freshness ones] that are designed to melt on your tongue which they say will get the medicine into your bloodstream around 30% faster than by using conventional tablets.
IntelGenx say that because the mouth is lined with tiny blood vessels applying the wafer Viagra here can give a very fast application of the drug directly into the bloodstream. IntelGenx said that they would be conducting more clinical trials to corroborate this and they hoped to develop a whole range of fast acting wafer medications to treat not only erectile dysfunction but also pain relief, depression and hypertension.
Sometimes men complain that if they have eaten a large meal it can take an even longer time for the Viagra, Cialis and Levitra to take effect. If on the other hand they made use of erectile dysfunction medication in a wafer form applied directly to the mouth and therefore bypassing their digestive system this problem would disappear.
Using a wafer type of Viagra would also mean that you wouldn't have to go and get a glass of water in the middle of a passionate encounter in order to swallow your pill. Wafer Viagra would be a much more discreet application of impotence medication and Ukmedix News will be looking out for updates on the IntelGenx clinical testing done on this new idea.

Intelgenz befindet sich bereits in gesprächen mit möglichen Vermarktungsartner die hohes intresse an diesem einzigartigen Produkt haben .
Der Zulassungsantrag für das Potenzmittel soll noch im 1H 2013 gestellt werden .
Allein dieses Produkt ist um ein vielfaches mehr Wert als die aktuelle Markt Kap von lächerlichen 32 million $ .
-------
Tadalafil film – indicated for Erectile Dysfunction
IntelGenx’ tadalafil film is a new product opportunity formulated using VersaFilm, IntelGenx’ proprietary thin film technology. Tadalafil is one of the three major PDE5 inhibitors in the erectile dysfunction market. Compared with the competitors, tadalafil shows longer duration of action and less food effect. IntelGenx’ tadalafil film offers an improved discrete dosage form that does not require water intake. IntelGenx tadalafil film formulations have been tested in various clinical trials to improve the pharmacokinetics and optimize the formulation. The latest formulation is planned to be tested in a pilot study in Q4 2012. IntelGenx is currently looking for a partnership or alliance opportunity to complete development and commercialize the tadalafil film.

...............................................
Wafer Viagra For Instant Results
One of the big challenges for erectile dysfunction medicine manufacturers is to quicken the time between the application of the medicine and its response. Men want instant results when they take Viagra, Cialis or Levitra and complain that having to wait as much as thirty minutes before the active ingredient is effective can burst the bubble of spontaneity and passion which are often essential requirements of good sex.
Well a solution could be at hand following research done by a Canadian research company called IntelGenx who have developed wafers [like the common breath freshness ones] that are designed to melt on your tongue which they say will get the medicine into your bloodstream around 30% faster than by using conventional tablets.
IntelGenx say that because the mouth is lined with tiny blood vessels applying the wafer Viagra here can give a very fast application of the drug directly into the bloodstream. IntelGenx said that they would be conducting more clinical trials to corroborate this and they hoped to develop a whole range of fast acting wafer medications to treat not only erectile dysfunction but also pain relief, depression and hypertension.
Sometimes men complain that if they have eaten a large meal it can take an even longer time for the Viagra, Cialis and Levitra to take effect. If on the other hand they made use of erectile dysfunction medication in a wafer form applied directly to the mouth and therefore bypassing their digestive system this problem would disappear.
Using a wafer type of Viagra would also mean that you wouldn't have to go and get a glass of water in the middle of a passionate encounter in order to swallow your pill. Wafer Viagra would be a much more discreet application of impotence medication and Ukmedix News will be looking out for updates on the IntelGenx clinical testing done on this new idea.

Die 0.70 könnte mit etwas glück schon heute fallen ...
http://www.otcmarkets.com/stock/IGXT/quote
ASK :
NITE 0.65 1000 13:45
CDEL 0.67 60000 13:45
ARCA 0.68 10000 12:57
UBSS 0.689 5000 11:55
ETRF 0.70 2500 11:53
BMAKN 0.70 1000 03/19
CSTI 0.71 2500 11:41
TEJS 0.71 1000 13:13
MAXM 0.75 1000 03/07
http://www.otcmarkets.com/stock/IGXT/quote
ASK :
NITE 0.65 1000 13:45
CDEL 0.67 60000 13:45
ARCA 0.68 10000 12:57
UBSS 0.689 5000 11:55
ETRF 0.70 2500 11:53
BMAKN 0.70 1000 03/19
CSTI 0.71 2500 11:41
TEJS 0.71 1000 13:13
MAXM 0.75 1000 03/07
Ich denke wir werden locker die $1.50++ noch vor der FDA Entscheidung sehen ...
Neue Partnerdeals für das Anti-Migräne und Potenzmittel stehen unmittelbar bevor was weitere upfront zahlungen für IGXT bedeutet .
Ausblick für das 1H 2013 :
FDA akzeptanz für den Zulassungsantrag (Anti-Migräne)
Partnerschaft für das Anti-Migräne produkt
Partnerschaft für das Potenzmittel
Zulassungsantrag für das Potenzmittel
Ausblick für das 1H 2013 :
FDA akzeptanz für den Zulassungsantrag (Anti-Migräne)
Partnerschaft für das Anti-Migräne produkt
Partnerschaft für das Potenzmittel
Zulassungsantrag für das Potenzmittel
In den letzten Tagen war etwas verkaufsdruck weil einige warrants verkauft worden sind die wiederum geld in die Kasse gespült haben . Dürfte also bald losgehen mit der Rally
Antwort auf Beitrag Nr.: 44.411.773 von Biohero am 11.04.13 17:19:10... woher weißt Du das mit den warrants: nur weil die das im yahoo-board erzählen?: wie kann man denn sowas belegen? Ich wüsste das nicht... Grüsse
Antwort auf Beitrag Nr.: 44.415.693 von Morgenrte am 12.04.13 09:25:31@Morgenrte
Das in Yahoo Board stamm von mir weil schon in den letzten Monaten Warrants verkauft worden sind und belegen kann man das indem man die 10Q filing liest .
---
Die ersten fangen an über diese Perle zuschreiben interessant wird es aber erst wenn wir das genaue datum (PDUFA DATE) von der FDA bekommen was schon innerhalb der nächsten 4 Wochen der fall sein wird .
Intel About IntelGenx
Apr 24 10:45 AM
http://seekingalpha.com/instablog/192072-ccamire/1790501-int…
Das in Yahoo Board stamm von mir weil schon in den letzten Monaten Warrants verkauft worden sind und belegen kann man das indem man die 10Q filing liest .
---
Die ersten fangen an über diese Perle zuschreiben interessant wird es aber erst wenn wir das genaue datum (PDUFA DATE) von der FDA bekommen was schon innerhalb der nächsten 4 Wochen der fall sein wird .
Intel About IntelGenx
Apr 24 10:45 AM
http://seekingalpha.com/instablog/192072-ccamire/1790501-int…
Sieht gut aus vielleicht klappts heute mit der .70 marke
Momentan ist es noch ein hin und her in der 0.60-0.70 range but sobald die NDA akzeptanz news von der FDA kommt (vor ende des Monats) dann wird es aufwärts gehen . Es ist meistens so das Investoren erst nach bekanntgabe des PDUFA date (FDA Entscheidungstag) auf diese Biotechs aufmerksam werden .
TTNP zum beispiel ist von 0.70 auf über $2.30 gestiegen ähnliches erwarte ich auch von IGXT natürlich sollte man nicht so gierig werden und auch rechtzeitig gewinne realisieren .
TTNP zum beispiel ist von 0.70 auf über $2.30 gestiegen ähnliches erwarte ich auch von IGXT natürlich sollte man nicht so gierig werden und auch rechtzeitig gewinne realisieren .
Heute gabs Quartalszahlen die mittelmässig waren was einige schwache hände veranlasst hat zu verkaufen .
Das ist die Chance nachzulegen bzw neu einzusteigen erst recht bei den News die kurz bevorstehen .
Innerhalb der nächsten 2 Wochen wird die FDA akzeptanz kommen und einen Partnerdeal für das potenzmittel steht auch unmittelbar bevor .
http://finance.yahoo.com/news/intelgenx-reports-q1-2013-resu…
Corporate Development Update
Anti-migraine VersaFilm(TM) (rizatriptan)
In March 2013 we announced that, together with our co-development partner RedHill Biopharma Ltd. ("RedHill"), we submitted a 505(b)(2) New Drug Application ("NDA") to the U.S. Food and Drug Administration ("FDA") for our anti-migraine oral film product, a novel oral thin-film formulation based on our proprietary VersaFilm(TM) technology containing rizatriptan, the active drug in Merck & Co. ("Merck's") Maxalt-MLT(R) orally disintegrating tablets. According to Merck's most recent annual report, sales of Maxalt(R) were $638 million in 2012.
Erectile Dysfunction VersaFilm(TM) (tadalafil)
In February 2013 we successfully completed a pilot bioequivalence study on our erectile dysfunction VersaFilm(TM) product. In a previous study, we had already demonstrated that we are able to formulate a bioequivalent product. In the recently completed study, we showed that we were additionally able to develop a faster formulation with a significantly shorter Tmax which will address the potential need for a faster tadalafil product. We are in active discussions for the licensing of this product.
Development and Commercialization Agreement with Par Pharmaceutical, Inc.
In December 2011 we announced the execution of a co-development and commercialization agreement with Par Pharmaceutical, Inc. ("Par") for a new product utilizing one of our proprietary oral drug delivery platform technologies. This program continues to make progress. For commercial reasons, and in order to protect both Par's and IntelGenx' competitive advantage, the agreement stipulates that all information pertaining to the product, together with financial terms of the agreement, are to remain confidential.
Antihypertensive VersaTab(TM) product
We recently completed a pilot bioequivalence study for our antihypertensive project, INT0001, a generic equivalent to a major cardiovascular product, using our proprietary VersaTab(TM) delivery technology. We continue to make progress with the project and, together with our strategic partner, Dava Pharmaceuticals Inc., are working diligently towards the filing of an ANDA with the FDA.
Das ist die Chance nachzulegen bzw neu einzusteigen erst recht bei den News die kurz bevorstehen .
Innerhalb der nächsten 2 Wochen wird die FDA akzeptanz kommen und einen Partnerdeal für das potenzmittel steht auch unmittelbar bevor .
http://finance.yahoo.com/news/intelgenx-reports-q1-2013-resu…
Corporate Development Update
Anti-migraine VersaFilm(TM) (rizatriptan)
In March 2013 we announced that, together with our co-development partner RedHill Biopharma Ltd. ("RedHill"), we submitted a 505(b)(2) New Drug Application ("NDA") to the U.S. Food and Drug Administration ("FDA") for our anti-migraine oral film product, a novel oral thin-film formulation based on our proprietary VersaFilm(TM) technology containing rizatriptan, the active drug in Merck & Co. ("Merck's") Maxalt-MLT(R) orally disintegrating tablets. According to Merck's most recent annual report, sales of Maxalt(R) were $638 million in 2012.
Erectile Dysfunction VersaFilm(TM) (tadalafil)
In February 2013 we successfully completed a pilot bioequivalence study on our erectile dysfunction VersaFilm(TM) product. In a previous study, we had already demonstrated that we are able to formulate a bioequivalent product. In the recently completed study, we showed that we were additionally able to develop a faster formulation with a significantly shorter Tmax which will address the potential need for a faster tadalafil product. We are in active discussions for the licensing of this product.
Development and Commercialization Agreement with Par Pharmaceutical, Inc.
In December 2011 we announced the execution of a co-development and commercialization agreement with Par Pharmaceutical, Inc. ("Par") for a new product utilizing one of our proprietary oral drug delivery platform technologies. This program continues to make progress. For commercial reasons, and in order to protect both Par's and IntelGenx' competitive advantage, the agreement stipulates that all information pertaining to the product, together with financial terms of the agreement, are to remain confidential.
Antihypertensive VersaTab(TM) product
We recently completed a pilot bioequivalence study for our antihypertensive project, INT0001, a generic equivalent to a major cardiovascular product, using our proprietary VersaTab(TM) delivery technology. We continue to make progress with the project and, together with our strategic partner, Dava Pharmaceuticals Inc., are working diligently towards the filing of an ANDA with the FDA.
Bis spätestens nächsten Mittwoch müssten wir die NDA akzeptanz von der FDA bekommen .
Neues Update von Aegis Capital mit $3 kursziel .
https://aegis.bluematrix.com/sellside/EmailDocViewer?encrypt…
IntelGenx: Looking Towards A Pivotal Year Ahead
May 20, 2013
Forfivo™ Traction Expected To Accelerate. We note that Forfivo™ has now been available in the U.S. for roughly six months, and that IntelGenx's partner Edgemont Pharmaceuticals appears to have dealt with most of the initial snags that impacted the launch of the drug. Accordingly, therefore, we anticipate meaningful acceleration in Forfivo™ prescription volumes in the coming months. While we do not expect the drug to become a massive seller, we note that even a relatively modest revenue base would likely have substantial impact on IntelGenx's bottom line, and should be sufficient to drive the company towards profitability. We note that IntelGenx continues to exhibit a cost-effective operational approach, burning roughly $2mm or less per year. We reiterate our Buy rating and 18-month price target of $3.00 per share on IGXT.
Rizatriptan 505(b)(2) Application Filed. In March 2013, IntelGenx reported that it had filed for approval of an oral film-based proprietary formulation of rizatriptan, a well-known anti-migraine drug belonging to the triptan class. Rizatriptan, which was originally developed and commercialized by Merck & Co. (MRK/NYSE, Not Rated) under the trade name Maxalt, had sales of $638mm in 2012. The patent protection on Maxalt has now expired. We believe that, even in the face of generic competition, it should be possible for IntelGenx's oral film formulation to eke out a solid niche in the migraine market, particularly as the company's delivery approach provides substantial advantages from an absorbability perspective.
Management Transition Announced. IntelGenx recently appointed Dr. Rajiv Khosla, a widely-respected industry veteran who previously spent several years at Biovail Corporation - now Valeant Pharmaceuticals International (VRX/NYSE, Buy) - as Chief Scientific Officer and Chief Operating Officer. Dr. Khosla is also slated to assume the post of CEO effective January 2014. Horst Zerbe, the company's founder and current CEO, is expected to stay on as Chairman of the Board of Directors and is slated to continue to provide expertise on formulation, drug manufacturing and R&D. From our perspective, the appointment of Dr. Khosla is a solid step forward for IntelGenx and should enable the firm to operate more aggressively from an out-licensing and partnership standpoint.
Additional Catalysts Expected Near-Term. We believe that 2013 is likely to be a watershed year for IntelGenx because this is the first time that the company is in position to reap rewards from a marketed product - Forfivo - which is in full ramp mode, while simultaneously filing other drug candidates for approval with the FDA. In our view, even one or two regulatory submissions should catch the eye of discerning investors, the majority of whom we continue to believe are unaware of the potential inherent in IntelGenx's diversified product candidate portfolio and capital-efficient business model.
Neues Update von Aegis Capital mit $3 kursziel .
https://aegis.bluematrix.com/sellside/EmailDocViewer?encrypt…
IntelGenx: Looking Towards A Pivotal Year Ahead
May 20, 2013
Forfivo™ Traction Expected To Accelerate. We note that Forfivo™ has now been available in the U.S. for roughly six months, and that IntelGenx's partner Edgemont Pharmaceuticals appears to have dealt with most of the initial snags that impacted the launch of the drug. Accordingly, therefore, we anticipate meaningful acceleration in Forfivo™ prescription volumes in the coming months. While we do not expect the drug to become a massive seller, we note that even a relatively modest revenue base would likely have substantial impact on IntelGenx's bottom line, and should be sufficient to drive the company towards profitability. We note that IntelGenx continues to exhibit a cost-effective operational approach, burning roughly $2mm or less per year. We reiterate our Buy rating and 18-month price target of $3.00 per share on IGXT.
Rizatriptan 505(b)(2) Application Filed. In March 2013, IntelGenx reported that it had filed for approval of an oral film-based proprietary formulation of rizatriptan, a well-known anti-migraine drug belonging to the triptan class. Rizatriptan, which was originally developed and commercialized by Merck & Co. (MRK/NYSE, Not Rated) under the trade name Maxalt, had sales of $638mm in 2012. The patent protection on Maxalt has now expired. We believe that, even in the face of generic competition, it should be possible for IntelGenx's oral film formulation to eke out a solid niche in the migraine market, particularly as the company's delivery approach provides substantial advantages from an absorbability perspective.
Management Transition Announced. IntelGenx recently appointed Dr. Rajiv Khosla, a widely-respected industry veteran who previously spent several years at Biovail Corporation - now Valeant Pharmaceuticals International (VRX/NYSE, Buy) - as Chief Scientific Officer and Chief Operating Officer. Dr. Khosla is also slated to assume the post of CEO effective January 2014. Horst Zerbe, the company's founder and current CEO, is expected to stay on as Chairman of the Board of Directors and is slated to continue to provide expertise on formulation, drug manufacturing and R&D. From our perspective, the appointment of Dr. Khosla is a solid step forward for IntelGenx and should enable the firm to operate more aggressively from an out-licensing and partnership standpoint.
Additional Catalysts Expected Near-Term. We believe that 2013 is likely to be a watershed year for IntelGenx because this is the first time that the company is in position to reap rewards from a marketed product - Forfivo - which is in full ramp mode, while simultaneously filing other drug candidates for approval with the FDA. In our view, even one or two regulatory submissions should catch the eye of discerning investors, the majority of whom we continue to believe are unaware of the potential inherent in IntelGenx's diversified product candidate portfolio and capital-efficient business model.
Gibt es bereits News, dass bei W der Kurs so gestellt ist?
der Kurs so gestellt ist?
Und gibt es irgendwo ein Orderbook / Real-time?
0,475CAD -0,185 CAD
- 28,03 %
MfG 00ps
 der Kurs so gestellt ist?
der Kurs so gestellt ist?Und gibt es irgendwo ein Orderbook / Real-time?
0,475CAD -0,185 CAD
- 28,03 %
MfG 00ps
Sorry, hat sich alles geklärt...
http://ih.advfn.com/p.php?pid=squote&symbol=TSXV:IGX
Bid war bei 0.475CAD^^
http://ih.advfn.com/p.php?pid=squote&symbol=TSXV:IGX
Bid war bei 0.475CAD^^
Antwort auf Beitrag Nr.: 44.691.247 von 00ps am 22.05.13 14:55:08Bloss nicht an der TSX kaufen weil es dort sogut wie kein Volumen gibt und der Spread hoch ist . Wenn man welche haben will dann nur an der OTC kaufen .
Nur ganz kurz betreffend NDA Akzeptanz... Diese wird im 1H 2013 erwartet, also Zeit bis 30.06.2013?
MfG 00ps
MfG 00ps
Antwort auf Beitrag Nr.: 44.703.361 von 00ps am 23.05.13 20:35:54Nein schon nächste Woche vermutlich Montag oder Dienstag .
Schauen wir mal, wann die NDA Akzeptank kommt... Auf jeden Fall sollten so weitere Investoren auf diese Perle aufmerksam werden! ;-)
Ich hab den CEO heute geschrieben der übrigens Deutscher ist bezüglich der NDA akzeptanz und hab ihn auch wegen der schlechten kursperformance angesprochen .
Hier ist seine Antwort ...
Guten Tag, Herr xxxxxxx,
Erstmal stimme ich mit Ihnen ueberein, dass die Aktie enormes Steigerungspotential hat. Was den Kauf von Aktien anlangt, das habe ich bereits getan. Nicht nur habe ich keine einzige meiner Aktien seit Gruendung des Unternehmens verkauft, ich habe darueber hinaus ca. eine halbe Million Aktien durch Ausuebung von Optionen gekauft und nicht wieder verkauft. Das ist auch entsprechend publiziert worden.
Was die NDA-Akzeptanz anlangt, der Brief von der FDA liegt einfach noch nicht vor, obgleich er seit Wochen ueberfaellig ist. Wir wissen aus sicherer Quelle, dass die NDA akzeptiert ist aber koennen eine Presseveroeffentlichung nicht riskieren, ohne das Dokument in Haenden zu haben.
Ein Problem ist sicherlich der Markt, auf dem unsere Aktie gehandelt wird. Unser Eindruck ist, das seine Reihe von hoch spekulativen OTC-Investoren das Umfeld, in dem wir operieren, nicht versteht und auf einen unrealistisch schnellen Return wartet. Par ist ein gutes Beispiel. Wir haben eine ausserordentlich erfolgreiche Kooperation mit Par, einem der fuehrenden Generikaunternehmen in den USA. Da der Erfolg einer Generikaentwicklung wesentlich davon abhaengt, laufende Entwiklungsprojekt vor der Konkurrenz geheimzuhalten, haben wir eine strikte Geheimhaltungsverpflichtung gegenueber unserem Partner und publizieren keine Einzelheiten des Projektes. Das fuehrt auf den verschiedenen Messageboards staendig zu unfundierten Meinungsaeusserungen, die das Projekt und den Projektfortschritt anzweifeln und den Sharepreis negativ beeinflussen. Ich koennte Ihnen eine Reihe anderer Beispiele anfuehren, wo durch uninformierte und unfundierte Spekulationen der Preis grundlos heruntergeredet wird. Ich glaube, dass seine breitere Basis von “sophisticated” Investoren diesen Trend aufhalten koennte.
Wir machen uns sehr viele Gedanken darueber, wir wir den Aktienkurs verbessern koennen, und ich bin fuer konstruktive Vorschlaege immer dankbar und aufgeschlossen. Ich glaube aber auch, dass wir mit unseren Hauptentwicklungsprojekten mittlerweile so gute Fortschritte gemacht haben, dass der Preis in absehbarer Zeit diese Entwicklung reflektieren sollte.
Mit freundlichen Gruessen,
H. Zerbe
Hier ist seine Antwort ...
Guten Tag, Herr xxxxxxx,
Erstmal stimme ich mit Ihnen ueberein, dass die Aktie enormes Steigerungspotential hat. Was den Kauf von Aktien anlangt, das habe ich bereits getan. Nicht nur habe ich keine einzige meiner Aktien seit Gruendung des Unternehmens verkauft, ich habe darueber hinaus ca. eine halbe Million Aktien durch Ausuebung von Optionen gekauft und nicht wieder verkauft. Das ist auch entsprechend publiziert worden.
Was die NDA-Akzeptanz anlangt, der Brief von der FDA liegt einfach noch nicht vor, obgleich er seit Wochen ueberfaellig ist. Wir wissen aus sicherer Quelle, dass die NDA akzeptiert ist aber koennen eine Presseveroeffentlichung nicht riskieren, ohne das Dokument in Haenden zu haben.
Ein Problem ist sicherlich der Markt, auf dem unsere Aktie gehandelt wird. Unser Eindruck ist, das seine Reihe von hoch spekulativen OTC-Investoren das Umfeld, in dem wir operieren, nicht versteht und auf einen unrealistisch schnellen Return wartet. Par ist ein gutes Beispiel. Wir haben eine ausserordentlich erfolgreiche Kooperation mit Par, einem der fuehrenden Generikaunternehmen in den USA. Da der Erfolg einer Generikaentwicklung wesentlich davon abhaengt, laufende Entwiklungsprojekt vor der Konkurrenz geheimzuhalten, haben wir eine strikte Geheimhaltungsverpflichtung gegenueber unserem Partner und publizieren keine Einzelheiten des Projektes. Das fuehrt auf den verschiedenen Messageboards staendig zu unfundierten Meinungsaeusserungen, die das Projekt und den Projektfortschritt anzweifeln und den Sharepreis negativ beeinflussen. Ich koennte Ihnen eine Reihe anderer Beispiele anfuehren, wo durch uninformierte und unfundierte Spekulationen der Preis grundlos heruntergeredet wird. Ich glaube, dass seine breitere Basis von “sophisticated” Investoren diesen Trend aufhalten koennte.
Wir machen uns sehr viele Gedanken darueber, wir wir den Aktienkurs verbessern koennen, und ich bin fuer konstruktive Vorschlaege immer dankbar und aufgeschlossen. Ich glaube aber auch, dass wir mit unseren Hauptentwicklungsprojekten mittlerweile so gute Fortschritte gemacht haben, dass der Preis in absehbarer Zeit diese Entwicklung reflektieren sollte.
Mit freundlichen Gruessen,
H. Zerbe
Hi Bio-Joshi,
danke für Deine Mühe mit Herrn Zerbe etc. - erstaunlich ist es schon, dass er Dir so lange Antworten schreibt und auch, dass er die NDA-Akzeptanz aus "sicherer Quelle" bestätigt; das ist ja schon eine durchaus kursrelevante Insiderinformation (von höchster Stelle dazu!) in einem Message-Board, was m.E. so aktienrechtlich nicht i.O. ist - aber gut: wenn so der Kurs steigt... ;-) - wer sollte ihn verklagen? Aber warum streitest Du Dich mit den Amis auf Yahoo? Was ist denn Dein Interesse? Warum behälst Du die Info nicht für Dich, kaufst billig nach und freust Dich dann über die kommenden Gewinne...? Good luck in any case :-)!
danke für Deine Mühe mit Herrn Zerbe etc. - erstaunlich ist es schon, dass er Dir so lange Antworten schreibt und auch, dass er die NDA-Akzeptanz aus "sicherer Quelle" bestätigt; das ist ja schon eine durchaus kursrelevante Insiderinformation (von höchster Stelle dazu!) in einem Message-Board, was m.E. so aktienrechtlich nicht i.O. ist - aber gut: wenn so der Kurs steigt... ;-) - wer sollte ihn verklagen? Aber warum streitest Du Dich mit den Amis auf Yahoo? Was ist denn Dein Interesse? Warum behälst Du die Info nicht für Dich, kaufst billig nach und freust Dich dann über die kommenden Gewinne...? Good luck in any case :-)!
Antwort auf Beitrag Nr.: 44.857.795 von Morgenrte am 16.06.13 12:17:02danke für Deine Mühe mit Herrn Zerbe etc. - erstaunlich ist es schon, dass er Dir so lange Antworten schreibt und auch, dass er die NDA-Akzeptanz aus "sicherer Quelle" bestätigt
Wenn man was bei dem Management was erreichen will muss man angeben das man eine Aktiengruppe vertritt nur so klappt das .
nur so klappt das .
--
Die lang erwartete News ist endlich da :
IntelGenx Announces FDA Acceptance of New Drug Application for Anti-Migraine VersaFilm(TM) Oral Film Product
Release: IntelGenx Corp. – 59 minutes ago
[img]http://finance.yahoo.com/news/intelgenx-announces-fda-accept…
Wenn man was bei dem Management was erreichen will muss man angeben das man eine Aktiengruppe vertritt
 nur so klappt das .
nur so klappt das .--
Die lang erwartete News ist endlich da :
IntelGenx Announces FDA Acceptance of New Drug Application for Anti-Migraine VersaFilm(TM) Oral Film Product
Release: IntelGenx Corp. – 59 minutes ago
[img]http://finance.yahoo.com/news/intelgenx-announces-fda-accept…
Soviel ich weiß gibts kein einziges vergleichbares Migräne Produkt das auf Oral-Film basiert . Die Versafilm Platform von IGXT ist fast konkurrenzlos der CEO hat mal erwähnt das nur ca 3 weitere Unternehmen etwas ähnliches haben deshalb ist IGXT auch ein super Übernahmekandidat .
On announcing the news, IntelGenx' President and CEO Dr. Horst Zerbe commented, "We are very pleased with the FDA's confirmation that our anti-migraine film application has been accepted for review. We believe that our Rizatriptan film is the first oral film product for the treatment of migraine for which a 505(b)(2) NDA has been submitted to FDA. We consider that the product has significant market potential as it is therapeutically equivalent to Maxalt-MLT(R) orally disintegrating tablets, is easy to use, and offers significant cost advantages over orally disintegrating tablets."
Maxalt MLT(R), a leading branded anti-migraine product manufactured by Merck. According to Merck's most recent annual report, sales of Maxalt(R) were $638 million in 2012.
On announcing the news, IntelGenx' President and CEO Dr. Horst Zerbe commented, "We are very pleased with the FDA's confirmation that our anti-migraine film application has been accepted for review. We believe that our Rizatriptan film is the first oral film product for the treatment of migraine for which a 505(b)(2) NDA has been submitted to FDA. We consider that the product has significant market potential as it is therapeutically equivalent to Maxalt-MLT(R) orally disintegrating tablets, is easy to use, and offers significant cost advantages over orally disintegrating tablets."
Maxalt MLT(R), a leading branded anti-migraine product manufactured by Merck. According to Merck's most recent annual report, sales of Maxalt(R) were $638 million in 2012.
Wirklich Schwung ist trotz NDA-Akzeptanz nicht in die Aktie gekommen... Warten wir halt bis Februar 2014 und hoffen auf einen positiven FDA-Entscheid. Dann sollte definitiv die Post abgehen... ;-)
Small-Cap Biotechs with Blockbuster Potential: Hugh Cleland
http://www.thelifesciencesreport.com/pub/na/15406
TLSR: Go to your next idea.
HC: My funds own almost 13% of IntelGenx Corp. (IGXT:OTCQX; IGX:TSX.V). I cannot believe the stock is trading where it's at, considering its achievements in the last 12 months. Its drug Forfivo (bupropion extended-release), for major depressive disorder, has been approved by the U.S. Food and Drug Administration (FDA). Forfivo is now being marketed by IntelGenx's partner Edgemont Pharmaceuticals LLC (private).
In December 2011, a partnership with Par Pharmaceutical Companies Inc. (PRX:NYSE) was announced, and we're expecting a regulatory filing for that drug sometime soon. The name of the drug and the details are confidential for competitive reasons. IntelGenx's CEO has continued to emphasize the size and importance of this project without being specific.
If you look at a research report from Ram Selvaraju, who is head of equity research at Aegis Capital, you'll see he hasn't given this unnamed product any value whatsoever, but he still has a $3 target price on the stock, which is more than a 400% implied return from IntelGenx's current price ($0.60). I'm expecting Ram will raise his target quite significantly after we see the filing for that undisclosed product. It should be a significant catalyst for the stock, as investors see what a large drug we're dealing with.
Then there is the company's thin-film rizatriptan migraine drug. This drug is being developed in partnership with RedHill Biopharma (RDHL:NASDAQ). The FDA accepted the new drug application (NDA) filing for this drug on June 18, and we now have Feb. 3, 2014, specified as the Prescription Drug User Fee Act (PDUFA) date.
Prescription migraine drugs have global sales of over $5B per year. Maxalt, the drug that IntelGenx has ported to a thin film, had sales of well over $600M in 2012, so this is not a small opportunity, although I get the sense that the Par project has significantly more upside.
Somehow, with this great pipeline and all this success, we are talking about a company with a market cap of $30M. A table-pounding buy, in my view.
TLSR: Why have IntelGenx's shares been weak over the past month?
HC: It got hit fairly hard the last few days of May; a small overhang of warrants remains from a financing a few years ago. I expect that will get chewed through shortly, and we'll have that cash on the balance sheet.
http://www.thelifesciencesreport.com/pub/na/15406
TLSR: Go to your next idea.
HC: My funds own almost 13% of IntelGenx Corp. (IGXT:OTCQX; IGX:TSX.V). I cannot believe the stock is trading where it's at, considering its achievements in the last 12 months. Its drug Forfivo (bupropion extended-release), for major depressive disorder, has been approved by the U.S. Food and Drug Administration (FDA). Forfivo is now being marketed by IntelGenx's partner Edgemont Pharmaceuticals LLC (private).
In December 2011, a partnership with Par Pharmaceutical Companies Inc. (PRX:NYSE) was announced, and we're expecting a regulatory filing for that drug sometime soon. The name of the drug and the details are confidential for competitive reasons. IntelGenx's CEO has continued to emphasize the size and importance of this project without being specific.
If you look at a research report from Ram Selvaraju, who is head of equity research at Aegis Capital, you'll see he hasn't given this unnamed product any value whatsoever, but he still has a $3 target price on the stock, which is more than a 400% implied return from IntelGenx's current price ($0.60). I'm expecting Ram will raise his target quite significantly after we see the filing for that undisclosed product. It should be a significant catalyst for the stock, as investors see what a large drug we're dealing with.
Then there is the company's thin-film rizatriptan migraine drug. This drug is being developed in partnership with RedHill Biopharma (RDHL:NASDAQ). The FDA accepted the new drug application (NDA) filing for this drug on June 18, and we now have Feb. 3, 2014, specified as the Prescription Drug User Fee Act (PDUFA) date.
Prescription migraine drugs have global sales of over $5B per year. Maxalt, the drug that IntelGenx has ported to a thin film, had sales of well over $600M in 2012, so this is not a small opportunity, although I get the sense that the Par project has significantly more upside.
Somehow, with this great pipeline and all this success, we are talking about a company with a market cap of $30M. A table-pounding buy, in my view.
TLSR: Why have IntelGenx's shares been weak over the past month?
HC: It got hit fairly hard the last few days of May; a small overhang of warrants remains from a financing a few years ago. I expect that will get chewed through shortly, and we'll have that cash on the balance sheet.
Vielleicht sollte man einfach mal im yahoo-board sämtliche Biotechboards mit Infos über IGXT zuspammen, damit die Aktie mal bekannter wird. Nur so ne Idee, nicht das jemand ernsthaft auf die Idee kommt, sowas zu tun! 

@Kami
Ja da sind einige die ziemlich ungeduldig sind und deshalb rumspammen mich jedenfalls störts nicht ab und zu mache ich auch mit .
----
Neues Update von Aegis mit kursziel $3 !!!
http://www.thelifesciencesreport.com/cs/user/download/co_fil…
IntelGenx Technologies Corp. Rating: Buy
FDA Accepts IntelGenx Migraine Drug Application
Investment Highlights:
■
FDA Accepts IntelGenx New Drug Application.
This morning, IntelGenx
announced that it had received notice from the FDA of the acceptance for
review of the company's New Drug Application (NDA) on rizatriptan, an
anti-migraine drug. Investors should note that rizatriptan was until recently
being marketed under the brand name Maxalt by Merck & Co. (MRK/NYSE,
Not Rated) in the U.S. and that peak sales of Maxalt exceeded $600mm per
year at peak. IntelGenx's product is based on the firm's proprietary thin-film
technology platform and, in our view, should be able to eke out a niche in
the triptan market even in the face of multiple potential generic versions of
Maxalt itself. We reiterate our Buy rating and 18-month price target of $3.00
per share on IGXT.
■
Rizatriptan Thin-Film Approval Expected In Early 2014.
In March 2013,
IntelGenx originally reported that it had filed for approval of its rizatriptan
drug candidate via the 505(b)(2) pathway. The FDA has assigned a formal
Prescription Drug User Fee Act (PDUFA) approval decision date to the
drug of February 3, 2014. This implies a standard review process, as we
anticipated. In our view, while sales of the IntelGenx drug are unlikely to ever
approach the peak levels achieved by Maxalt, they could exceed $100mm
annually by the 2020 / 2021 time frame.
■
RedHill Biopharma Partnership.
The rizatriptan thin-film product,
formally designated INT0008, is partnered with RedHill Biopharma
(RDHL.NASDAQ, Not Rated), an emerging Israeli firm developing several
drug candidates in the domains of pain, neurodegenerative disease, oncology
and cardiovascular disorders. While RedHill is not a mature company and
does not currently possess a sales and marketing infrastructure, we believe
that it is likely to be a motivated partner for IntelGenx and that it will likely
elect to either sell the rizatriptan thin-film product using a contract sales force
or license the rights to the product on to a more established entity.
■
Additional Catalysts Expected Near-Term.
We believe that 2013 is likely
to be a watershed year for IntelGenx because this is the first time that
the company is in position to reap rewards from a marketed product -
Forfivo™ - which is in full ramp mode, while simultaneously filing other
drug candidates for approval with the FDA. In our view, even one or two
regulatory submissions should catch the eye of discerning investors, the
majority of whom we continue to believe are unaware of the potential inherent
in IntelGenx's diversified product candidate portfolio and capital-efficient
business model
Ja da sind einige die ziemlich ungeduldig sind und deshalb rumspammen mich jedenfalls störts nicht ab und zu mache ich auch mit .

----
Neues Update von Aegis mit kursziel $3 !!!
http://www.thelifesciencesreport.com/cs/user/download/co_fil…
IntelGenx Technologies Corp. Rating: Buy
FDA Accepts IntelGenx Migraine Drug Application
Investment Highlights:
■
FDA Accepts IntelGenx New Drug Application.
This morning, IntelGenx
announced that it had received notice from the FDA of the acceptance for
review of the company's New Drug Application (NDA) on rizatriptan, an
anti-migraine drug. Investors should note that rizatriptan was until recently
being marketed under the brand name Maxalt by Merck & Co. (MRK/NYSE,
Not Rated) in the U.S. and that peak sales of Maxalt exceeded $600mm per
year at peak. IntelGenx's product is based on the firm's proprietary thin-film
technology platform and, in our view, should be able to eke out a niche in
the triptan market even in the face of multiple potential generic versions of
Maxalt itself. We reiterate our Buy rating and 18-month price target of $3.00
per share on IGXT.
■
Rizatriptan Thin-Film Approval Expected In Early 2014.
In March 2013,
IntelGenx originally reported that it had filed for approval of its rizatriptan
drug candidate via the 505(b)(2) pathway. The FDA has assigned a formal
Prescription Drug User Fee Act (PDUFA) approval decision date to the
drug of February 3, 2014. This implies a standard review process, as we
anticipated. In our view, while sales of the IntelGenx drug are unlikely to ever
approach the peak levels achieved by Maxalt, they could exceed $100mm
annually by the 2020 / 2021 time frame.
■
RedHill Biopharma Partnership.
The rizatriptan thin-film product,
formally designated INT0008, is partnered with RedHill Biopharma
(RDHL.NASDAQ, Not Rated), an emerging Israeli firm developing several
drug candidates in the domains of pain, neurodegenerative disease, oncology
and cardiovascular disorders. While RedHill is not a mature company and
does not currently possess a sales and marketing infrastructure, we believe
that it is likely to be a motivated partner for IntelGenx and that it will likely
elect to either sell the rizatriptan thin-film product using a contract sales force
or license the rights to the product on to a more established entity.
■
Additional Catalysts Expected Near-Term.
We believe that 2013 is likely
to be a watershed year for IntelGenx because this is the first time that
the company is in position to reap rewards from a marketed product -
Forfivo™ - which is in full ramp mode, while simultaneously filing other
drug candidates for approval with the FDA. In our view, even one or two
regulatory submissions should catch the eye of discerning investors, the
majority of whom we continue to believe are unaware of the potential inherent
in IntelGenx's diversified product candidate portfolio and capital-efficient
business model
Ausbruch richtung $1++ steht hier unmittelbar bevor ...
Fantastische entwickelung bei Cipher Pharma übrigens auch ne Aktie die ich lange bei rund 0.50 € empfohlen habe ...Trotzdem ist IGXT lichtjahre besser als DND .
http://chart.finance.yahoo.com/z?s=DND.TO&t=5y&q=&l=&z=l&a=v…
http://chart.finance.yahoo.com/z?s=DND.TO&t=5y&q=&l=&z=l&a=v…
Die $1 Marke könnten wir in den nächsten 2-3 Wochen sehen wenn nichts besonderes an den Märkten passiert .
Ausblick 2013
2x Neue Partnerships für Anti-Migraine & ED Drug in 2H 2013 (Upfront Cash für IGXT)
1x NDA filing for Erectile Dysfunctions Drug 2H 2013
1x ANDA filing for Hypertension Drug in 2H 2013
1X ANDA filing for Undisclosed Drug in 2H 2013 Partnered with Par Pharma
Ausblick 2013
2x Neue Partnerships für Anti-Migraine & ED Drug in 2H 2013 (Upfront Cash für IGXT)
1x NDA filing for Erectile Dysfunctions Drug 2H 2013
1x ANDA filing for Hypertension Drug in 2H 2013
1X ANDA filing for Undisclosed Drug in 2H 2013 Partnered with Par Pharma
Hatte bei 0.70++ profit mitgenommen und hab in den letzten tagen wieder unter 0.60 kräftig eingesammelt .
ANDA für ein weiteren potentiellen Kassenschlager wurde bei der FDA eingereicht .
IntelGenx Announces Submission of ANDA for Buprenorphine/Naloxone Sublingual Film Product for the Treatment of Opiate Addiction
http://finance.yahoo.com/news/intelgenx-announces-submission…
According to IMS Health, U.S. retail sales of Suboxone(R) Sublingual Film were approximately $1.5 billion in 2012.
ANDA für ein weiteren potentiellen Kassenschlager wurde bei der FDA eingereicht .
IntelGenx Announces Submission of ANDA for Buprenorphine/Naloxone Sublingual Film Product for the Treatment of Opiate Addiction
http://finance.yahoo.com/news/intelgenx-announces-submission…
According to IMS Health, U.S. retail sales of Suboxone(R) Sublingual Film were approximately $1.5 billion in 2012.
Hier kann man die Umsätze sehen die das Management für die nächsten Jahre erwartet .Das alles bei einer lächerlichen Marktkap von nur $29 Million .


Antwort auf Beitrag Nr.: 45.172.287 von Biohero am 02.08.13 19:48:25Sie beginnt wieder zu steigen habe aber diesmal ein gutes gefühl das es nachhaltig sein wird ....
IGXT war letztes Quartal profitabel man sieht das sie nur ganz wenig revenue brauchen um schwarze zahlen zu schreiben und das mit nur einem Produkt am Markt bald folgt noch das zweite  . Hier dürfte bald die Post abgehen ...
. Hier dürfte bald die Post abgehen ...
IntelGenx Reports Q2, 2013 Results and Corporate Development Highlights
http://finance.yahoo.com/news/intelgenx-reports-q2-2013-resu…
Und eine Empfehlung von Bullinvestor
http://bullinvestor.com/
 . Hier dürfte bald die Post abgehen ...
. Hier dürfte bald die Post abgehen ... IntelGenx Reports Q2, 2013 Results and Corporate Development Highlights
http://finance.yahoo.com/news/intelgenx-reports-q2-2013-resu…
Und eine Empfehlung von Bullinvestor
http://bullinvestor.com/
Antwort auf Beitrag Nr.: 45.206.829 von Biohero am 08.08.13 12:28:35Knacken wir die 0.72 dann gehts ab hier
Guten Zusammenfassung (http://www.northernriversfunds.com/assets/downloads/Cleland%…)
INTELGENX: the filing of the ANDA for the ‘Par project’ would have been a major
catalyst, except that $0.50 warrants and an S-1 filing has been a major overhang.
Once those overhangs are out of the way within a week or two, IntelGenx should be
able to move substantially higher to reflect a more fundamentally-driven valuation.
Frustratingly, IntelGenx continues to present a significantly undervalued opportunity for
investors, with an FDA-approved drug that is currently on the market, an advanced pipeline of
7 clinical stage drugs (including two which are “post-Phase III”—one is a 505b2 drug, the other
is a generic), and a cash burn of only about $2million per year (which should eventually be
more than offset by royalties and milestone payments from their approved drug). All yours for
the ridiculously low valuation of US$28million! It’s actually kind of embarrassing to be giving
new investors such a depressed valuation as an entry point.
The most advanced drugs in the pipeline include:
1) Maxalt-on-a-strip, for which an NDA was filed in March and accepted by the FDA in June;
the FDA granted a PDUFA date3 of February 3, 2014. (Maxalt is a migraine pill which
sold over $600millon for Merck in 2012.)
2) a generic version of Suboxone-on-a-strip for which an ANDA was filed in July. (U.S.
retail sales of Suboxone Sublingual Film were ~$1.5b in 2012 for Reckitt Benckiser.)
3) Cialis-on-a-strip, for which an NDA filing is expected before the end of the year. (Cialis
sells over $2billion/year globally for Eli Lilly.)
For those not familiar with the FDA process, this is an extremely advanced pipeline: all but the
3rd drug listed above have already finished the equivalent of their Phase III trials (!!),
and have NO toxicity risk and NO efficacy risk.
So why is the stock so ridiculously depressed (especially in relation to any other companies that
have successful Phase III trials under their belts), and sitting at a market cap of under
US$30million? Two non-fundamental reasons are among the main drivers:
3 PDUFA Date: Prescription Drug User Fee Act action date, the date that the FDA gives final approval for a drug (so that
it can be marketed in the USA as a prescription drug).
- 9 -
1) Purchase warrants with an exercise price of $0.50 expire at the end of August; the
exercise and sale of these warrants has exerted a depressing effect on the stock since
the beginning of this year when the company started to receive exercise notices.
2) The company filed an S-1 on July 22, which was the same day that the ANDA filing for
the ‘Par project’ was announced. (An S-1 is a registration statement for a US financing,
meaning the company is planning on raising money in the near future.)
These two factors have caused a market dislocation/valuation disparity which is about to be
taken advantage of by some very sophisticated US healthcare investors.
How big is this valuation disparity? Look at BDSI on NASDAQ and DND on the TSX
A quick look at these two comparables will give readers an idea of the massive valuation
disparity:
1) With IntelGenx (IGXT on OTCQX) having filed an ANDA for Suboxone-on-a-strip,
Biodelivery Sciences (BDSI on NASDAQ, with a market cap of US$176million, and a
505b2 buccal version of Suboxone-on-a-strip as its lead compound) becomes the clear
US comp for IntelGenx. IntelGenx announced the filing of its ANDA for Suboxone-on-astrip
on July 22, while Biodelivery announced the filing of its NDA for 505b2 buccal
Suboxone on August 1, meaning that their pipeline here is directly comparable—yet
IntelGenx has a sub-$30million market cap, while BDSI carries a $176million market
cap. (I will do a more detailed, drug-by-drug pipeline comparison in a future letter,
making the argument that IntelGenx’s pipeline is bigger, better and (most importantly)
more advanced than Biodelivery Science’s pipeline, meaning that the market cap for
IGXT should be much closer to the market cap for BDSI.)
2) The recent success of Cipher Pharmaceutical’s 505b2 drug Absorica (which is a branded,
505b2 version of acne drug Accutane, with generic company Ranbaxy as their marketing
partner) makes Cipher (DND on the TSX, with a $227million market cap) the clear comp
in Canada. What “made” Cipher was signing the right marketing partner for their 505b2
version of Accutane; I submit that IntelGenx’s partnership with generic company Par
Pharmaceuticals ($1.8billion market cap upon takeout by private equity firm TPG in
October 2012) is as much a “company-maker” as Cipher’s partnership with generic
company Ranbaxy (US$1.8billion market cap).
For all my frustration around IntelGenx’ depressed valuation, it is somewhat comforting that
Ram Selvaraju of Aegis Capital still shares my belief that IntelGenx is a deeply undervalued
stock, having put out this comment reiterating his $3 target after the release of the results
for the fiscal year ended March 31, 2013:
http://blumontcapital.com/doc_bin/IGXT_Aegis_Comment_Post_FY…
013.pdf
- 10 -
Both Ram and I share an affinity for IntelGenx’s business model and proven abilities:
1) IntelGenx primarily uses the FDA’s 505b2 pathway to approval, which minimizes toxicity
risk and efficacy risk (which is what kills almost all biotech companies). Efficacy risk and
toxicity risk are minimized because IntelGenx is taking existing drugs that sell hundreds
of millions (or billions) of dollars a year and moving them onto delivery platforms which
make them better/faster/easier (like what Biovail did with Wellbutrin when Biovail
developed Wellbutrin XL).
2) IntelGenx’s ability to bring a drug all the way through the FDA’s 505b2 pathway and to
launch an approved drug has been tested and proven. There are few companies
with an FDA approved drug with a market cap under $100million; at US$0.54,
IntelGenx’s market cap is under US$30million.
3) IntelGenx’s intellectual property and patent strengths have been tested and proven, with
Biovail having lost a patent suit against IntelGenx in court.
To summarize:
1) IntelGenx has a branded drug (ForFivo) which they successfully negotiated through to
FDA approval. Although ForFivo is not a “big” drug, royalties and milestones from this
drug should end up covering IntelGenx’s $2million/year operating burn; the industry
credibility that IntelGenx earned just from this accomplishment should not be
underestimated, because few companies of IntelGenx’s size are able to get drugs all the
way through the approval process.
2) By the end of 2013, IntelGenx will have successfully cleared the equivalent of Phase III
trials in the generic or 505b2 form of 4 branded drugs that together register annual
sales of over $4.5billion. (What we don’t know is how big a piece of that $4.5billion pie
will IntelGenx’s marketing partners be able to take…)
3) IntelGenx has partnered with Par Pharmaceuticals—a large and well-respected generic
drug company—for a generic form of thin-film Suboxone, a drug which currently sells
over $1.5billion/year. With Par as a partner, it is reasonable to expect that IntelGenx
should share in sales somewhere in the $100million-$300million range, allowing it to
generate EPS which should be in the $0.50/share-$1+/share range from this drug alone.
4) It is also a reasonable expectation that Par’s satisfaction with IntelGenx’s drug
formulation and development capabilities (proven in the Suboxone project) means that
IntelGenx should be brought into more Par projects in the near future. If we see that
happen, it will be fair to say that IntelGenx has become Par’s de facto partner for thinfilm
drug delivery and development, and that IntelGenx would be a natural takeout
candidate for Par.
5) With an approved drug on the market, proven delivery capabilities across 3 delivery
platforms (including thin-film strips), a clinical pipeline of 7 drugs that includes 2 “post-
PhaseIII” drugs, IntelGenx should be a natural takeout candidate for any number of
generics manufacturers. (I believe that generics manufacturers are being increasingly
drawn to the 505b2 pathway, and are likely to make acquisitions of 505b2 companies,
as they seek to expand both their product offerings and their profit margins.) IntelGenx
should also be a takeout candidate for specialty pharma companies, and perhaps even
BioDelivery Sciences, if the valuation gap remains as ridiculous as it currently is.
- 11 -
Frankly, my target (first stated in July, 2011) of realizing $3-$8/share from IntelGenx over the
life of the BIPES Fund has never seemed more reasonable—the company has put in place more
than enough building blocks to see that kind of stock price by the of 2016, as it becomes
recognized as a world leader in the growing area of thin-film drug delivery and development. I
like the fact that my $3 low end corresponds to the already-existing 1-year target of Ram
Selvaraju, a well-respected and sophisticated Wall Street biotech analyst. If the PAR
partnership blossoms into something special (which is what I expect), the $5-$10 range
becomes a real possibility.
INTELGENX: the filing of the ANDA for the ‘Par project’ would have been a major
catalyst, except that $0.50 warrants and an S-1 filing has been a major overhang.
Once those overhangs are out of the way within a week or two, IntelGenx should be
able to move substantially higher to reflect a more fundamentally-driven valuation.
Frustratingly, IntelGenx continues to present a significantly undervalued opportunity for
investors, with an FDA-approved drug that is currently on the market, an advanced pipeline of
7 clinical stage drugs (including two which are “post-Phase III”—one is a 505b2 drug, the other
is a generic), and a cash burn of only about $2million per year (which should eventually be
more than offset by royalties and milestone payments from their approved drug). All yours for
the ridiculously low valuation of US$28million! It’s actually kind of embarrassing to be giving
new investors such a depressed valuation as an entry point.
The most advanced drugs in the pipeline include:
1) Maxalt-on-a-strip, for which an NDA was filed in March and accepted by the FDA in June;
the FDA granted a PDUFA date3 of February 3, 2014. (Maxalt is a migraine pill which
sold over $600millon for Merck in 2012.)
2) a generic version of Suboxone-on-a-strip for which an ANDA was filed in July. (U.S.
retail sales of Suboxone Sublingual Film were ~$1.5b in 2012 for Reckitt Benckiser.)
3) Cialis-on-a-strip, for which an NDA filing is expected before the end of the year. (Cialis
sells over $2billion/year globally for Eli Lilly.)
For those not familiar with the FDA process, this is an extremely advanced pipeline: all but the
3rd drug listed above have already finished the equivalent of their Phase III trials (!!),
and have NO toxicity risk and NO efficacy risk.
So why is the stock so ridiculously depressed (especially in relation to any other companies that
have successful Phase III trials under their belts), and sitting at a market cap of under
US$30million? Two non-fundamental reasons are among the main drivers:
3 PDUFA Date: Prescription Drug User Fee Act action date, the date that the FDA gives final approval for a drug (so that
it can be marketed in the USA as a prescription drug).
- 9 -
1) Purchase warrants with an exercise price of $0.50 expire at the end of August; the
exercise and sale of these warrants has exerted a depressing effect on the stock since
the beginning of this year when the company started to receive exercise notices.
2) The company filed an S-1 on July 22, which was the same day that the ANDA filing for
the ‘Par project’ was announced. (An S-1 is a registration statement for a US financing,
meaning the company is planning on raising money in the near future.)
These two factors have caused a market dislocation/valuation disparity which is about to be
taken advantage of by some very sophisticated US healthcare investors.
How big is this valuation disparity? Look at BDSI on NASDAQ and DND on the TSX
A quick look at these two comparables will give readers an idea of the massive valuation
disparity:
1) With IntelGenx (IGXT on OTCQX) having filed an ANDA for Suboxone-on-a-strip,
Biodelivery Sciences (BDSI on NASDAQ, with a market cap of US$176million, and a
505b2 buccal version of Suboxone-on-a-strip as its lead compound) becomes the clear
US comp for IntelGenx. IntelGenx announced the filing of its ANDA for Suboxone-on-astrip
on July 22, while Biodelivery announced the filing of its NDA for 505b2 buccal
Suboxone on August 1, meaning that their pipeline here is directly comparable—yet
IntelGenx has a sub-$30million market cap, while BDSI carries a $176million market
cap. (I will do a more detailed, drug-by-drug pipeline comparison in a future letter,
making the argument that IntelGenx’s pipeline is bigger, better and (most importantly)
more advanced than Biodelivery Science’s pipeline, meaning that the market cap for
IGXT should be much closer to the market cap for BDSI.)
2) The recent success of Cipher Pharmaceutical’s 505b2 drug Absorica (which is a branded,
505b2 version of acne drug Accutane, with generic company Ranbaxy as their marketing
partner) makes Cipher (DND on the TSX, with a $227million market cap) the clear comp
in Canada. What “made” Cipher was signing the right marketing partner for their 505b2
version of Accutane; I submit that IntelGenx’s partnership with generic company Par
Pharmaceuticals ($1.8billion market cap upon takeout by private equity firm TPG in
October 2012) is as much a “company-maker” as Cipher’s partnership with generic
company Ranbaxy (US$1.8billion market cap).
For all my frustration around IntelGenx’ depressed valuation, it is somewhat comforting that
Ram Selvaraju of Aegis Capital still shares my belief that IntelGenx is a deeply undervalued
stock, having put out this comment reiterating his $3 target after the release of the results
for the fiscal year ended March 31, 2013:
http://blumontcapital.com/doc_bin/IGXT_Aegis_Comment_Post_FY…
013.pdf
- 10 -
Both Ram and I share an affinity for IntelGenx’s business model and proven abilities:
1) IntelGenx primarily uses the FDA’s 505b2 pathway to approval, which minimizes toxicity
risk and efficacy risk (which is what kills almost all biotech companies). Efficacy risk and
toxicity risk are minimized because IntelGenx is taking existing drugs that sell hundreds
of millions (or billions) of dollars a year and moving them onto delivery platforms which
make them better/faster/easier (like what Biovail did with Wellbutrin when Biovail
developed Wellbutrin XL).
2) IntelGenx’s ability to bring a drug all the way through the FDA’s 505b2 pathway and to
launch an approved drug has been tested and proven. There are few companies
with an FDA approved drug with a market cap under $100million; at US$0.54,
IntelGenx’s market cap is under US$30million.
3) IntelGenx’s intellectual property and patent strengths have been tested and proven, with
Biovail having lost a patent suit against IntelGenx in court.
To summarize:
1) IntelGenx has a branded drug (ForFivo) which they successfully negotiated through to
FDA approval. Although ForFivo is not a “big” drug, royalties and milestones from this
drug should end up covering IntelGenx’s $2million/year operating burn; the industry
credibility that IntelGenx earned just from this accomplishment should not be
underestimated, because few companies of IntelGenx’s size are able to get drugs all the
way through the approval process.
2) By the end of 2013, IntelGenx will have successfully cleared the equivalent of Phase III
trials in the generic or 505b2 form of 4 branded drugs that together register annual
sales of over $4.5billion. (What we don’t know is how big a piece of that $4.5billion pie
will IntelGenx’s marketing partners be able to take…)
3) IntelGenx has partnered with Par Pharmaceuticals—a large and well-respected generic
drug company—for a generic form of thin-film Suboxone, a drug which currently sells
over $1.5billion/year. With Par as a partner, it is reasonable to expect that IntelGenx
should share in sales somewhere in the $100million-$300million range, allowing it to
generate EPS which should be in the $0.50/share-$1+/share range from this drug alone.
4) It is also a reasonable expectation that Par’s satisfaction with IntelGenx’s drug
formulation and development capabilities (proven in the Suboxone project) means that
IntelGenx should be brought into more Par projects in the near future. If we see that
happen, it will be fair to say that IntelGenx has become Par’s de facto partner for thinfilm
drug delivery and development, and that IntelGenx would be a natural takeout
candidate for Par.
5) With an approved drug on the market, proven delivery capabilities across 3 delivery
platforms (including thin-film strips), a clinical pipeline of 7 drugs that includes 2 “post-
PhaseIII” drugs, IntelGenx should be a natural takeout candidate for any number of
generics manufacturers. (I believe that generics manufacturers are being increasingly
drawn to the 505b2 pathway, and are likely to make acquisitions of 505b2 companies,
as they seek to expand both their product offerings and their profit margins.) IntelGenx
should also be a takeout candidate for specialty pharma companies, and perhaps even
BioDelivery Sciences, if the valuation gap remains as ridiculous as it currently is.
- 11 -
Frankly, my target (first stated in July, 2011) of realizing $3-$8/share from IntelGenx over the
life of the BIPES Fund has never seemed more reasonable—the company has put in place more
than enough building blocks to see that kind of stock price by the of 2016, as it becomes
recognized as a world leader in the growing area of thin-film drug delivery and development. I
like the fact that my $3 low end corresponds to the already-existing 1-year target of Ram
Selvaraju, a well-respected and sophisticated Wall Street biotech analyst. If the PAR
partnership blossoms into something special (which is what I expect), the $5-$10 range
becomes a real possibility.
der Faktor Zeit und der Faktor Kurs sind jetzt viel vorteilhafter als vor etwa 1/2 Jahr, also fundamental sollte es sich jetzt mehr lohnen. Aber unsere Experten haben sich verabschiedet.
Was kann und soll man daraus schliessen?
Eine Pille haben die schon auf dem Markt, und im letzten Beitrag heißt es
PDUFA date3 of February 3, 2014
spätestens zu diesem Datum sollte es eine enorme Ralley geben. Wie dort auch beschrieben ist, ist die Marktkapitalisierung noch immer unter 30 Mio$
Da frag ich mich in der Tat. Was ist hier schief gelaufen? Oder wo ist da der Haken?
Aber angesichts der zusammengetragenen Daten, könnte ich mir nur so etwas vorstellen, wie dass Cialis noch unter Patentschutz steht und eine Vermarktung erst nach dessen Ablauf infrage käme. Da bzgl. Cialis die Phase III noch nicht abgeschlossen ist, sollte das aber kein Problem sein. Wie ist das mit Maxalt?
Weiß ich nicht und habe ich nicht recherchiert. Aber der 3. Februar ist doch schon recht nahe und wenn da Patentrechte eine Rolle spielen sollten, dann käme es auf eine geschickte Verpartnerung an ...
Ich bin jedenfalls mit ner großen Hand voll eingestiegen. Der Kurs ist deutlich niedriger als zu Zeiten der Pusher hier im Board.
Was kann und soll man daraus schliessen?
Eine Pille haben die schon auf dem Markt, und im letzten Beitrag heißt es
PDUFA date3 of February 3, 2014
spätestens zu diesem Datum sollte es eine enorme Ralley geben. Wie dort auch beschrieben ist, ist die Marktkapitalisierung noch immer unter 30 Mio$
Da frag ich mich in der Tat. Was ist hier schief gelaufen? Oder wo ist da der Haken?
Aber angesichts der zusammengetragenen Daten, könnte ich mir nur so etwas vorstellen, wie dass Cialis noch unter Patentschutz steht und eine Vermarktung erst nach dessen Ablauf infrage käme. Da bzgl. Cialis die Phase III noch nicht abgeschlossen ist, sollte das aber kein Problem sein. Wie ist das mit Maxalt?
Weiß ich nicht und habe ich nicht recherchiert. Aber der 3. Februar ist doch schon recht nahe und wenn da Patentrechte eine Rolle spielen sollten, dann käme es auf eine geschickte Verpartnerung an ...
Ich bin jedenfalls mit ner großen Hand voll eingestiegen. Der Kurs ist deutlich niedriger als zu Zeiten der Pusher hier im Board.
Antwort auf Beitrag Nr.: 46.174.729 von dottore am 07.01.14 17:29:40Mit der fundamentalem Betrachtung ist es so eine Sache. Einerseits erscheint die Aktie günstig andererseits steckt auch wenig dahinter. Ich kann mich erinnern, wie die Zulassung des Medikaments gegen Depression hier gepusht und gefeiert wurde. Es stellte sich aber heraus, dass es sich nur um eine 150mg Version eines Generikums handelte. Der Vorteil ist also nur, dass einige Patienten, dann eine 100mg Tablette nicht mehr teilen müssen. Wow! Dementsprechend gering sind auch jetzt die Umsätze.
Was den Kurs momentan auch belastet sind die Konditionen der KE, die es gewissen Leuten ermöglichen billig zu kaufen und dann teuerer zu verkaufen. Man kann hier sicherlich auf einen Runup spekulieren. (bin mit Mini Position dabei) Langfristig sehe ich hier aber so gar kein Potenzial...
Was den Kurs momentan auch belastet sind die Konditionen der KE, die es gewissen Leuten ermöglichen billig zu kaufen und dann teuerer zu verkaufen. Man kann hier sicherlich auf einen Runup spekulieren. (bin mit Mini Position dabei) Langfristig sehe ich hier aber so gar kein Potenzial...
jetzt steht erst einmal der 3. Februar als Stichtag. Da können noch einige Prozente Aufschlag kommen. Ich rechne sogar mit der 1 vor dem Komma.
ab gehts 

In Canada ist der Dollar heute erreicht worden. In USA kommt das auch noch.
Bin nachwievor in IGXT investiert, plane aber bei 1.09 den Ausstieg. Naütrlich kann es noch weiter gen Norden gehen, jedoch habe ich gelernt, Gewinne zu realisieren! ;-) Wünsche weiterhin viel Glück.
mit 1.09 lagst ja Goldrichtig.
Hat irgendwer eine Idee, wieso die so dramatisch einstürzt? und wieder auf dem Niveau von vor dem Anstieg zurücj geflogen ist, obwohl doch durch die Nachricht vom 14.Jan. die Ampeln weiter auf grün stehen sollten
Hat irgendwer eine Idee, wieso die so dramatisch einstürzt? und wieder auf dem Niveau von vor dem Anstieg zurücj geflogen ist, obwohl doch durch die Nachricht vom 14.Jan. die Ampeln weiter auf grün stehen sollten
außer Stopploss fishing habe ich nichts gefunden. So rasch abwärts und wieder rauf... aber ins Plus schaffen die es heute nicht mehr. Eigentlich eine2. Chance um am 3. Februar dabei zu sein.
Wenn da wirklich Stopploss abgefischt wurden, dann wäre das ein positives Zeichen für die bevorstehende Zulassung
Wenn da wirklich Stopploss abgefischt wurden, dann wäre das ein positives Zeichen für die bevorstehende Zulassung
ja schön, wie es wieder rauf geht. Schon gestern, nach Absturz unter 70 Cent wieder im Plus und heute nach einigem Hin und Her jetzt doch deutlich hoch.
Am Montag könnte eine Kursexplosion bis 1,40-1,50 Cad$, bzw 1,40 US-$ anstehen.
Ich bin schon drin, und du?
Gibt es extrem selten, dass man so kurzfristig auf eine richtig gute Chance aufmerksam gemacht wird.
Was krieg ich dafür? Wenigstens viele grüne Daumen
Am Montag könnte eine Kursexplosion bis 1,40-1,50 Cad$, bzw 1,40 US-$ anstehen.
Ich bin schon drin, und du?
Gibt es extrem selten, dass man so kurzfristig auf eine richtig gute Chance aufmerksam gemacht wird.
Was krieg ich dafür? Wenigstens viele grüne Daumen
Wie kommst du auf 1,40????
Montag ist zwar die FDA Entscheidung, welche wohl auch positiv ausfällt - aber deshalb + 40% halte ich für zu hoch.
Ich gehe von 1,15 - 1,20 USD aus.
Montag ist zwar die FDA Entscheidung, welche wohl auch positiv ausfällt - aber deshalb + 40% halte ich für zu hoch.
Ich gehe von 1,15 - 1,20 USD aus.
Ich bin gestern mit der letzten Position ausgestiegen, auch wenn eine Zulassung wahrscheinlich ist. Fundamental bin ich keinesfalls von der Firma überzeugt, von daher möchte ich das Risko der FDA Entscheidung vermeiden.
@ kmastra
Fundamental bin ich bei dir, dass man durch die Verbesserung von bestehenden Medikamenten "groß" am Honigtopf mit naschen darf glaube ich auch nicht. Gerade bei Medikamenten nehmen doch die Leute eher dass was sie kennen (meine Meinung).
Trotzdem, wird die (hoch-) wahrscheinliche Zulassung der Aktie nochmal einen kleinen Stups geben, ob's nachhaltig ist oder nur im intraday .... ????????????????
Fundamental bin ich bei dir, dass man durch die Verbesserung von bestehenden Medikamenten "groß" am Honigtopf mit naschen darf glaube ich auch nicht. Gerade bei Medikamenten nehmen doch die Leute eher dass was sie kennen (meine Meinung).
Trotzdem, wird die (hoch-) wahrscheinliche Zulassung der Aktie nochmal einen kleinen Stups geben, ob's nachhaltig ist oder nur im intraday .... ????????????????
Zitat von Roboterotze: Wie kommst du auf 1,40????
Montag ist zwar die FDA Entscheidung, welche wohl auch positiv ausfällt - aber deshalb + 40% halte ich für zu hoch.
Ich gehe von 1,15 - 1,20 USD aus.
schon wieder scheinst du richtiger zu liegen als ich. Aber es sind noch 3 Stunden bis Handelsschluss
Und hoffentlich nur noch 30-60 min bis zum approval ;-)
ob der Kurs wieder wie Freitag abtaucht und eine gute Nachkaufgelegenheit bietet?
Selbst wenn sie "nur" bis 1,20 US-Dollar wieder ansteigt, wären das im Moment auch schon wieder über 10 %
Selbst wenn sie "nur" bis 1,20 US-Dollar wieder ansteigt, wären das im Moment auch schon wieder über 10 %
übrigens, Redhill steigt um gute 10% heute. Das liegt an der Verpartnerung mit IGXT
Quelle, weiter oben im Thread mit Originalquellenangabe (keine Lust zum suchen)
Könnte sein, dass es hier also noch einmal richtig hoch geht.
http://www.wallstreet-online.de/aktien/23501708
Quelle, weiter oben im Thread mit Originalquellenangabe (keine Lust zum suchen)
Könnte sein, dass es hier also noch einmal richtig hoch geht.
http://www.wallstreet-online.de/aktien/23501708
Zitat von dottore:Zitat von Roboterotze: Wie kommst du auf 1,40????
Montag ist zwar die FDA Entscheidung, welche wohl auch positiv ausfällt - aber deshalb + 40% halte ich für zu hoch.
Ich gehe von 1,15 - 1,20 USD aus.
schon wieder scheinst du richtiger zu liegen als ich. Aber es sind noch 3 Stunden bis Handelsschluss
wie gut, dass ich auf dich hörte. Kurz nach meinem Posting stieg der Kurs auf sein Tageshoch bei 1,18US-$ und als er 2 Cent fiel, dachte ich mir, der Roboter hat recht und habe schnell verkauft. Bin noch zu 1,12 und zum Teil 1,11 raus.
Bei ungefähr 1 $ angelangt, habe ich überlegt wieder rein zu gehen. Aber das negative Börsenumfeld hat mich davon abgehalten. Jetzt bin ich froh darüber.
Man sieht, dass die Diskussionen hier auch mal vor Verlusten schützen können.
Naja im Nachhinein ist man immer klüger, oder wie heißt es so schön. Der Kursrückgang wird auch mit der Bekanntgabe von Insiderverkäufen am 29.1. (!!!!) zusammenhängen, die kurz vor Handelsende gemeldet wurden. Betrifft CEO und seine Frau. Hier muss man echt mit allem rechnen. Seriös geht anders!
http://secfilings.com/searchresultswide.aspx?link=1&filingid…
http://secfilings.com/searchresultswide.aspx?link=1&filingid…
Morgen kann die Welt aber schon wieder ganz anders aussehen...
http://secfilings.com/searchresultswide.aspx?link=1&filingid…
http://secfilings.com/searchresultswide.aspx?link=1&filingid…
Morgen kann die Welt aber schon wieder ganz anders aussehen...
Verkauf war vom Ex-CEO (Hr. Zerbe + Frau) & auch nur rd. 1 Mio. Akien, dieser wurde auch schon letzte Woche Mi. bekannt gegeben.
Der Knackpunkt heute war m.E. das ausbleibende approval der FDA + das nervöse Börsenumfeld.
Warum nichts von der FDA kam ??? Keine Ahnung ???
Das approval für Dexcom wurde auch erst gegen 4:30pm (22:30 MEZ) bekannt gegeben...
Ich glaube morgen geht der ganze Spaß wieder von vorne los.... aber was soll's letztendlich ist die Aktie nahezu uvä. gegenüber gestern.
Der Knackpunkt heute war m.E. das ausbleibende approval der FDA + das nervöse Börsenumfeld.
Warum nichts von der FDA kam ??? Keine Ahnung ???
Das approval für Dexcom wurde auch erst gegen 4:30pm (22:30 MEZ) bekannt gegeben...
Ich glaube morgen geht der ganze Spaß wieder von vorne los.... aber was soll's letztendlich ist die Aktie nahezu uvä. gegenüber gestern.
Antwort auf Beitrag Nr.: 46.371.013 von Roboterotze am 03.02.14 23:10:45Nein. Wurde heute erst bekannt gegeben. Steht Unten: Date: 2/3/2014.
Verkäufe waren beim CEO am 29. 30. und 31.
Letztlich jetzt eh Wurscht: wieso, weshalb, warum?
Verkäufe waren beim CEO am 29. 30. und 31.
Letztlich jetzt eh Wurscht: wieso, weshalb, warum?
Keine Garantie auf Richtigkeit!!! Auf ihub hat jemand folgendes geschrieben: I spoke to IGXT PR will be tomorrow probably during trading hours, Can see a + PDUFA
-> News werden wahrscheinlich heute veröffentlicht! Ich wünsche allen investierten viel Erfolg!
MfG 00ps
-> News werden wahrscheinlich heute veröffentlicht! Ich wünsche allen investierten viel Erfolg!
MfG 00ps
Ich hatte gestern abend den IR Kontakt von IntelgenX angeschrieben bezüglich des ausbleibenden - aber laut letztem Quartalbericht erwarteten - FDA-Bescheids, und bekam folgende Rückmeldung:
"I haven't been informed of the fda decision as yet. Sometimes the FDA sends the response in the evening in which case the press release may not go out until tomorrow morning."
Heute morgen 8 - 9 Uhr ,würde einer MEZ von 14-15 Uhr entsprechen...
"I haven't been informed of the fda decision as yet. Sometimes the FDA sends the response in the evening in which case the press release may not go out until tomorrow morning."
Heute morgen 8 - 9 Uhr ,würde einer MEZ von 14-15 Uhr entsprechen...
Bin gestern abend zum Handelsschluss nicht wieder eingestiegen, habe es nur in Erwägung gezogen.
@kmastra
im nachhinein ist man immer klüger
Das stimmt. Aber in diesem Fall war Roboterotze vorher schon richtig. Und ich habe davon profitiert, weil ich auf ihn hörte.
Glaube nicht, dass man heute noch welche bekommt unter 1 $, wenn die Meldung positiv sein sollte und schon vor Marktbeginn kommt.
Und das Marktgeschehen ist nicht rosig genug, um für potentielle 10-20 % zu riskieren, dass die FDA-Zulassung nicht kommt, oder Sell by good news praktiziert wird.
Wenn der Laden gut läuft, kann man später auch noch einsteigen.
@kmastra
im nachhinein ist man immer klüger
Das stimmt. Aber in diesem Fall war Roboterotze vorher schon richtig. Und ich habe davon profitiert, weil ich auf ihn hörte.
Glaube nicht, dass man heute noch welche bekommt unter 1 $, wenn die Meldung positiv sein sollte und schon vor Marktbeginn kommt.
Und das Marktgeschehen ist nicht rosig genug, um für potentielle 10-20 % zu riskieren, dass die FDA-Zulassung nicht kommt, oder Sell by good news praktiziert wird.
Wenn der Laden gut läuft, kann man später auch noch einsteigen.
Boom! CRL.
http://finance.yahoo.com/news/intelgenx-redhill-biopharma-re…
Im Nachhinein ist man eben immer schlauer und deshalb ist es m.E. einfach der beste Weg das Risiko einer FDA Entscheidung nur bei ganz sicheren Sachen mitzugehen.
Hoffe hier sind alle (zumindest teilweise) rechzeitig raus gegangen!?
http://finance.yahoo.com/news/intelgenx-redhill-biopharma-re…
Im Nachhinein ist man eben immer schlauer und deshalb ist es m.E. einfach der beste Weg das Risiko einer FDA Entscheidung nur bei ganz sicheren Sachen mitzugehen.
Hoffe hier sind alle (zumindest teilweise) rechzeitig raus gegangen!?
Nach der ersten Panikattacke beruhigt sich's wieder..
Das Medikamt selbst wurde bestätigt es sind "nur" Kleinigkeiten zu beantworten.... Trotzdem ärgerlich, dass dies nicht mit einem lauten "KAWUMM" glatt durchgelaufen ist.
Das Medikamt selbst wurde bestätigt es sind "nur" Kleinigkeiten zu beantworten.... Trotzdem ärgerlich, dass dies nicht mit einem lauten "KAWUMM" glatt durchgelaufen ist.
Abwarten und Tee trinken!!!
....in ca. 6 Wochen ist die Genehmigung durch und weitere positive Überraschungen werden definitiv folgen!!!!!



....in ca. 6 Wochen ist die Genehmigung durch und weitere positive Überraschungen werden definitiv folgen!!!!!



Wie kommst du auf 6 Wochen ?
Antwort auf Beitrag Nr.: 46.377.926 von Roboterotze am 04.02.14 20:12:41FDA verlangt keine Klinischen Studien sondern nur kleine infos über Verpackung ,Herstellung und Etikettierung sollte schnell geklärt werden .
Das müsste unter der Class 1 fallen das heißt die FDA wird innerhalb von 60 tagen nach einreichen der infos über die Zulassung entscheiden (höchstwarscheinlich noch im 2Q) .
"FDA's letter accepted the bioequivalence study and safety information submitted and requires no additional clinical studies; IntelGenx and RedHill plan to address remaining issues, primarily related to third party manufacturing, packaging and labeling, within weeks based on available data"
Das müsste unter der Class 1 fallen das heißt die FDA wird innerhalb von 60 tagen nach einreichen der infos über die Zulassung entscheiden (höchstwarscheinlich noch im 2Q) .
"FDA's letter accepted the bioequivalence study and safety information submitted and requires no additional clinical studies; IntelGenx and RedHill plan to address remaining issues, primarily related to third party manufacturing, packaging and labeling, within weeks based on available data"
Bin überrascht, dass die Reaktion so heftig negativ ausgeht. Kann es mir nur so erklären, dass der Kurs im Vorfeld schon gut angesprungen war (Ich bin ja auch im Januar so um die 60 Cent eingestiegen)
Irgendwie spielt wohl noch der bisherige Kursverlauf und die Gesamtmarktstimmung mit hinein.
Werde auf der Lauer liegen und prüfen, ob der Wiedereinstieg passt.
Irgendwie spielt wohl noch der bisherige Kursverlauf und die Gesamtmarktstimmung mit hinein.
Werde auf der Lauer liegen und prüfen, ob der Wiedereinstieg passt.
Selbst wenn die Fragen, für deren Beantwortung man sich sicherlich die nötige Zeit nehmen wird, umgehend beantwortet werden. Wo stand IGXT vor 60 Tagen? 0,5$!
Ich bleibe bei meiner Einschätzung, dass IGXT eine Aktie für Zocker ist und wenn sie dann - wann auch immer - wieder raufgezockt werden soll, muss sie erstmal wieder runtergezockt werden. Ich rechne hier mit weiter fallenden Kursen...
Ich bleibe bei meiner Einschätzung, dass IGXT eine Aktie für Zocker ist und wenn sie dann - wann auch immer - wieder raufgezockt werden soll, muss sie erstmal wieder runtergezockt werden. Ich rechne hier mit weiter fallenden Kursen...
Antwort auf Beitrag Nr.: 46.378.444 von kmastra am 04.02.14 21:17:54ich glaube da liegst Du ganz falsch kmastra
ich hab einfach mal ganz frech eine Kauforder mit Limit 60 Cent in NY reingestellt.
Glaube, die wird nicht bedient, und wenn doch, dann im Sturzflug
Glaube, die wird nicht bedient, und wenn doch, dann im Sturzflug
Bin auch wieder raus, habe viele Gewinne liegen gelassen, aber immerhin etwas Gewinn gemacht. Dachte würde jetzt erstmal noch weiter runter gehen, tut es aber nicht mal -.-
Kauforder zu 62 Cent wurde nicht bedient, habe das Geld anders verschossen.
mit nichten besser bei Infineon.
mit nichten besser bei Infineon.
der heute deutlich anziehende Kurs spiegelt die Hoffnung, dass die Auflagen der FDA erfüllt werden und die Zulassung durchgewinkt wird.
Wer noch schnell unter 80 US-Cent einsteigt, kann schnelle 20-30% mitnehmen.
OTC soll liquider sein als Canada
Wer noch schnell unter 80 US-Cent einsteigt, kann schnelle 20-30% mitnehmen.
OTC soll liquider sein als Canada
noch etwas Geduld und ihr werdet schon sehen das der Kurs sogar den 1,00 USD durchschlägt.....
hoffentlich war es kein Fehler. Um hier einzusteigen, musste ich umschichten. Bin zu 76 Cent eingestiegen und hoffe ebenfalls auf Kurse über 1 US-Dollar. Das wird allerdings heute nichts mehr.
nicht einmal eine Stunde her und schon steht fest: Es war ein Unfall, weil der andere Wert auf einmal wunderbar ansteigt und dieser hier still steht bzw minimal nachgibt, Dazu die Kosten ...
mit umschichten tu ich mich auch noch schwer. überlege ich gerade bei einen anderen wert. kann man halt einiges mit falsch machen, gerade durch die kosten wenn man otc etc. handelt 

News vom 5. Feb, eher algemeines Gelaber, jedenfalls noch nicht die endgültige Zulassung.
http://www.otcmarkets.com/stock/IGXT/news/IntelGenx-Technolo…
Warum? Wahrscheinlich ist man mit dem momentanen Kurs unzufrieden. Zu Recht! Aber ein höherer Kurs verlockt auch zur Kapitalerhöhung.
Ist diese Meldung so zu interpretieren, dass man eine Kapitalerhöhung zu einem höheren Kurs durchführen will? Dann, wie hoch? Und schafft man es, noch vorher schnell rauszugehen?
Ich stelle einfacj mal Zahlen in den Raum, die keine klaren Berechnungsgrundlagen haben, sondern reine Zahlenspielrei sind. Bezugspunkte gibt es aber schon zu vorangegangenen Kursen.
Mit der zu erwartenden positiven Meldung der endgültigen Zulassung wird es einen Kursschub geben, der wahrscheinlich in den Bereich der vorherigen Höchstkurse bei 1,18 landen. In einem Ansturm könnte ich mir vorstellen, dass Intraday der Kurs auch 1,30 toppt.
Dann wird eine Kapitalerhöhung platziert, wahrscheinlich zum Preis von ungefähr 1$ und der Kurs wird dorthin, und etwas tiefer fallen.
Da ich davon ausgehe, dass der Kurs in USA gemacht wird und mein Gechreibsel keinen Einfluss darauf haben wird, werde ich meine Verkaufsorder bei ungefähr 1,30 aufgeben. Vielleicht gehe ich noch etwas runter oder rauf, je nachdem wie dynamisch sich der Kurs in en nächsten Tagen verhält.
Nach der Kapitalmaßnahme ist dieser Wert wieder ein Kauf mit langfristiger Orientierung.
http://www.otcmarkets.com/stock/IGXT/news/IntelGenx-Technolo…
Warum? Wahrscheinlich ist man mit dem momentanen Kurs unzufrieden. Zu Recht! Aber ein höherer Kurs verlockt auch zur Kapitalerhöhung.
Ist diese Meldung so zu interpretieren, dass man eine Kapitalerhöhung zu einem höheren Kurs durchführen will? Dann, wie hoch? Und schafft man es, noch vorher schnell rauszugehen?
Ich stelle einfacj mal Zahlen in den Raum, die keine klaren Berechnungsgrundlagen haben, sondern reine Zahlenspielrei sind. Bezugspunkte gibt es aber schon zu vorangegangenen Kursen.
Mit der zu erwartenden positiven Meldung der endgültigen Zulassung wird es einen Kursschub geben, der wahrscheinlich in den Bereich der vorherigen Höchstkurse bei 1,18 landen. In einem Ansturm könnte ich mir vorstellen, dass Intraday der Kurs auch 1,30 toppt.
Dann wird eine Kapitalerhöhung platziert, wahrscheinlich zum Preis von ungefähr 1$ und der Kurs wird dorthin, und etwas tiefer fallen.
Da ich davon ausgehe, dass der Kurs in USA gemacht wird und mein Gechreibsel keinen Einfluss darauf haben wird, werde ich meine Verkaufsorder bei ungefähr 1,30 aufgeben. Vielleicht gehe ich noch etwas runter oder rauf, je nachdem wie dynamisch sich der Kurs in en nächsten Tagen verhält.
Nach der Kapitalmaßnahme ist dieser Wert wieder ein Kauf mit langfristiger Orientierung.
weiter gehts...
SAINT LAURENT, Quebec, Feb. 24, 2014 (GLOBE NEWSWIRE) -- IntelGenx Corp. (IGX.V) (IGXT) ("IntelGenx"), a Canadian drug delivery company focusing on oral drug delivery, today announced the completion of a pilot biostudy with its proprietary VersaFilm(TM) tadalafil product for erectile dysfunction that indicated bioequivalence with the leading brand reference listed drug (RLD) tadalafil product.
This was a randomized, two-period, two-way crossover study in healthy male subjects. The study was designed to determine whether VersaFilm(TM) tadalafil was bioequivalent as measured by industry standard pharmacokinetic measures of peak plasma concentration (Cmax) and area under the curve (AUC). The study results demonstrated that VersaFilm(TM) tadalafil was within an acceptable range of bioequivalency with the RLD on both of these measures.
"The completion of this pilot biostudy confirms that we can continue the development of our VersaFilm(TM) tadalafil product," said Rajiv Khosla, IntelGenx' President and CEO. "We now plan to progress this project, leading to a pivotal bioequivalence study, with the objective of filing a 505(b)(2) NDA with the U.S. Food and Drug Administration."
SAINT LAURENT, Quebec, Feb. 24, 2014 (GLOBE NEWSWIRE) -- IntelGenx Corp. (IGX.V) (IGXT) ("IntelGenx"), a Canadian drug delivery company focusing on oral drug delivery, today announced the completion of a pilot biostudy with its proprietary VersaFilm(TM) tadalafil product for erectile dysfunction that indicated bioequivalence with the leading brand reference listed drug (RLD) tadalafil product.
This was a randomized, two-period, two-way crossover study in healthy male subjects. The study was designed to determine whether VersaFilm(TM) tadalafil was bioequivalent as measured by industry standard pharmacokinetic measures of peak plasma concentration (Cmax) and area under the curve (AUC). The study results demonstrated that VersaFilm(TM) tadalafil was within an acceptable range of bioequivalency with the RLD on both of these measures.
"The completion of this pilot biostudy confirms that we can continue the development of our VersaFilm(TM) tadalafil product," said Rajiv Khosla, IntelGenx' President and CEO. "We now plan to progress this project, leading to a pivotal bioequivalence study, with the objective of filing a 505(b)(2) NDA with the U.S. Food and Drug Administration."
Moin....
Ich sagte Euch ja, da wird noch einiges kommen....
....und das Sage ich jetzt nochmal!!!!
Es wird definitiv noch einiges von IntelgenX kommen!!!!!!
Ich sagte Euch ja, da wird noch einiges kommen....
....und das Sage ich jetzt nochmal!!!!
Es wird definitiv noch einiges von IntelgenX kommen!!!!!!
Ging ziemlich zügig mit den Daten die die FDA verlangt hat ,die Zulassung müsste jetzt innerhalb 60 tagen erfolgen (Class 1 review) .
IntelGenx and RedHill Biopharma Submit Response to FDA CRL for VersaFilm(TM) Product for Migraines
http://finance.yahoo.com/news/intelgenx-redhill-biopharma-su…
IntelGenx and RedHill Biopharma Submit Response to FDA CRL for VersaFilm(TM) Product for Migraines
http://finance.yahoo.com/news/intelgenx-redhill-biopharma-su…
eigentlich wollte ich nur schnell nachzocken. Bin zu 76 rein und wollte so ungefähr bei 1 $ wieder raus. Nun beißt sie sich bei 90-95 Cent fest.
Also raus damit ... NEIN! Da kommen ja ständig gute NEWS. Der Kurs zwischen 90 und 95 Cent ist ein Boden! Keine Pause im Absturz. Hier fehlt ein kleines Nichts und der Kurs wird nach oben schießen.
http://www.otcmarkets.com/stock/IGXT/news" target="_blank" rel="nofollow ugc noopener">
http://www.otcmarkets.com/stock/IGXT/news
Mit dieser Einschätzung habe ich kurzerhand mein Engagement verdoppelt.
Also raus damit ... NEIN! Da kommen ja ständig gute NEWS. Der Kurs zwischen 90 und 95 Cent ist ein Boden! Keine Pause im Absturz. Hier fehlt ein kleines Nichts und der Kurs wird nach oben schießen.
http://www.otcmarkets.com/stock/IGXT/news" target="_blank" rel="nofollow ugc noopener">
http://www.otcmarkets.com/stock/IGXT/news
Mit dieser Einschätzung habe ich kurzerhand mein Engagement verdoppelt.
Hat man nicht Interesse auf kurz oder lang aus dem OTC rauszugehen und in einen anderen Index zu wechseln?
IntelGenx Reports 2013 Annual Results and Provides Corporate Development Update
Saint Laurent, Quebec--(Newsfile Corp. - March 11, 2014) - IntelGenx Corp. (TSXV: IGX) (OTCQX: IGXT) (the "Company") today announced financial results for its fiscal year ended December 31, 2013 and provided an update on operational developments. All amounts are in U.S. Dollars, unless otherwise stated.
"2013 was a challenging and exciting year for IntelGenx," said Rajiv Khosla, President and CEO of IntelGenx. "We made significant progress with the filing of the NDA for our anti-migraine film and the subsequent filing of an ANDA by our partner, Par Pharmaceutical, for our opioid dependence film. Also, subsequent to the end of the year, in early January, we reached agreement with Par for the development of another two products. One of the challenges throughout 2013 was the disappointing sales performance of Forfivo XL®, our high strength anti-depressant tablet. We continue to work together with Edgemont Pharmaceuticals, our commercialization partner for this product, to address the Forfivo XL® business. At the corporate-level we successfully completed a public offering in December, raising net funds of $3.0 million, which strengthened our cash position at December 31, 2013 to $5.0 million. These funds will enable us to move forward with the next important phase of our development, which is to expand into a new facility and establish a pilot plant for VersaFilm™ manufacturing, whilst continuing to further our product portfolio."
Corporate Development Update
Product-related
Anti-depressant tablet, Forfivo XL®
Forfivo XL®, our first FDA approved product, was launched in October 2012 and is being marketed in the United States under the terms of a license agreement between us and Edgemont Pharmaceuticals. Forfivo XL® is indicated for the treatment of Major Depressive Disorder ("MDD") and is the only extended-release bupropion HCl product to provide a once-daily, 450mg dose in a single tablet. The active ingredient in Forfivo XL® is bupropion, the same active ingredient used in the well-known antidepressant product Wellbutrin XL®. Prior to the launch of Forfivo XL®, most patients in the US requiring a 450mg dose of bupropion had been taking multiple tablets to achieve their 450mg dose requirement. With Forfivo XL® now available in the US, these patients can simplify their dosing regimen to a single Forfivo XL tablet, once-daily.
The commercialization of Forfivo XL® triggered launch-related milestone payments to us of up to $4.0 million, of which $1 million was received in Q1, 2013, and additional milestones upon achieving certain sales and exclusivity targets of up to a further $23.5 million. We also receive tiered, double-digit, royalties on net sales of Forfivo XL®. We recorded total revenue for Forfivo in 2013 of approximately $492 thousand.
In August, 2013 we announced receipt of a Paragraph IV Certification Letter from Wockhardt Bio AG, advising of the submission of an ANDA to the FDA requesting authorization to manufacture and market generic versions of Forfivo XL® 450 mg capsules in the United States. We intend to vigorously enforce our intellectual property rights for Forfivo XL® and will pursue all available legal and regulatory pathways in defense of the product, which is currently protected by an issued patent listed in the FDA's Approved Drug Products List (Orange Book).
Anti-migraine Film
In March, 2013 we submitted a 505(b)(2) NDA to the FDA for our novel oral thin-film formulation of Rizatriptan, the active drug in Maxalt-MLT® orally disintegrating tablets. Maxalt-MLT® is a leading branded anti-migraine product manufactured by Merck & Co. The thin-film formulation of Rizatriptan was developed in accordance with the co-development and commercialization agreement with RedHill Biopharma Ltd. using IntelGenx' proprietary immediate release VersaFilm™ oral drug delivery technology. In December 2011, we received approval by Health Canada to conduct a pivotal bioequivalence study to determine if our product is safe and bioequivalent with the FDA approved reference product, Maxalt-MLT®. The trial was conducted in the second quarter of 2012 and was a randomized, two-period, two-way crossover study in healthy male and female subjects. The study results indicate that the product is safe, and that the 90% confidence intervals of the three relevant parameters Cmax, AUC(0-t) and AUC(0-infinity) are well within the 80 - 125 acceptance range for bioequivalency.
In June, 2013 the FDA assigned a PDUFA action date of February 3, 2014 for the review of the NDA for marketing approval.
Subsequent to the end of the year, in February, 2014 we received a Complete Response Letter ("CRL") from the FDA. A CRL is issued by the FDA's Center for Drug Evaluation and Research to inform companies that certain questions and deficiencies remain that preclude the approval of the application in its present form. The questions raised by the FDA in the CRL regarding the NDA for our anti-migraine VersaFilm™ product primarily relate to third party Chemistry, Manufacturing and Controls ("CMC") and to the packaging and labeling of the product. No questions or deficiencies were raised relating to the product's safety and the FDA's CRL does not require additional clinical studies. We believe that the majority of issues raised by the FDA were addressed in an amendment submitted by us to the FDA in January, 2014 that has yet to be reviewed.
On March 3, 2014 we announced that we submitted a response to the CRL which, we believe, addresses all the issues raised in the CRL.
Opioid dependence Film
In accordance with a co-development and commercialization agreement with Par, we developed an oral controlled-release film product based on our proprietary VersaFilm™ technology. The product is a generic formulation of buprenorphine and naloxone Sublingual Film, indicated for maintenance treatment of opioid dependence. The reference listed drug is Suboxone® Sublingual Film. A bioequivalent film formulation was developed, scaled-up, and pivotal batches manufactured and tested during a subsequent pivotal clinical study. An ANDA was filed with the FDA by Par in July 2013.
In August, 2013 we learned that, in response to filing of the ANDA, we were named as a codefendant in a lawsuit pursuant to Paragraph IV litigation filed by Reckitt Benckiser Pharmaceuticals and Monosol RX in the U.S. District Court for the District of Delaware alleging infringement of U.S. Patent Nos. 8,475,832 and 8,017,150, each of which relate to Suboxone®. We believe the ANDA product does not infringe those or any other patents, and will vigorously defend ourselves in this matter. In accordance with the terms of the co-development and commercialization agreement, Par is financially responsible for the costs of this defense. Since Paragraph IV litigation is a regular part of the ANDA process, we do not expect any unanticipated impact on our already planned development schedule.
Two new (undisclosed) projects
Subsequent to the end of the year, in January, 2014 we announced the signing of another development and commercialization agreement with Par Pharmaceutical, Inc. for two new products.
Under the terms of the agreement, Par has obtained certain exclusive rights to market and sell our products in the USA. In exchange we will receive upfront and milestone payments, together with a share of the profits upon commercialization. In accordance with confidentiality clauses contained in the agreement, the specifics of the product descriptions, platform technologies and financial terms remain confidential.
Corporate
Leadership succession
In April, 2013 we announced that Rajiv Khosla, RPh, PhD, MBA would assume the role of President and Chief Executive Officer, succeeding Horst G. Zerbe, PhD, with effect from January 1, 2014. Dr. Zerbe will remain as Chairman of the Board of Directors and continue to provide expertise in research and development, and manufacturing.
Dr. Khosla held the positions of Chief Operating Officer and Chief Scientific Officer throughout the transitional period of 2013 and was a member of the our Board of Directors for the previous two years. Dr. Khosla has remarkable experience and credentials including, among other senior positions, five years as Vice President of Business Development at Biovail Corporation, a Canadian pharmaceutical company operating internationally. Whilst there, he successfully led the transaction process for more than 75 deal opportunities in a variety of therapeutic areas.
Dr. Khosla holds a Ph.D. in pharmaceutical science, with a thesis on Oral Drug Delivery Technology; an Executive MBA from the Henley Business School in England, a Bachelor of Pharmacy (Honours) from the University of Nottingham, England and is a registered pharmacist in the UK.
Dr. Khosla's biography can be found on our website at Http://Www.Intelgenx.Com/Aboutus/Mngmt.Html.
$3.5 Million Public Offering
In December, 2013 we announced the closing of a registered public offering raising gross proceeds of approximately $3.5 million.
Earlier in the same month we entered into securities purchase agreements with certain accredited investors for the issuance and sale of an aggregate of 7,920,346 shares of its common stock at $0.4419 per share. Additionally, investors received warrants to purchase up to 7,920,346 shares of common stock at an exercise price of $0.5646 per share for a term of five years.
Net proceeds, after deducting the placement agent's fee and other estimated offering expenses payable by us were approximately $3.0 million. We intend to use the net proceeds from the offering for capital investments in VersaFilm™ manufacturing equipment, leasehold improvements on a new facility, working capital and other general corporate purposes.
H.C. Wainwright & Co., LLC acted as the exclusive placement agent for the transaction.
Financial Results:
Cash on hand at December 31, 2013 increased to $5.0 million compared with the cash balance of $2.1 million as at December 31, 2012. The increase in cash on hand relates to net cash provided by financing activities of $4.5 million (2012 - $0.4 million), partly offset by net cash used in operating activities of $1.1 million (2012 - $1.6 million), net cash used in investing activities of $0.3 million (2012 - $0.3 million), and an unrealized foreign exchange loss of $0.1 million (2012 - unrealized foreign exchange gain of $0.1 million). The net cash provided by financing activities consists of approximately $3.0 million from a registered public offering that we completed in December 2013, together with approximately $1.5 million in proceeds received from the exercise of warrants and stock options.
We intend to use the net proceeds from the registered public offering for capital investments in VersaFilm™ manufacturing equipment, new facility leasehold improvements, working capital and other general corporate purposes.
Accounts receivable totaled $0.1 million as at December 31, 2013 compared with $1.3 million at December 31, 2012. The accounts receivable balance at December 31, 2012 included an amount of $1.0 million related to the launch of Forfivo XL®™ that was invoiced to our commercialization partner for Forfivo XL®, Edgemont Pharmaceuticals, in the fourth quarter of 2012. Payment against the invoice was received in February 2013.
Revenue for the year ended December 31, 2013 decreased to $0.9 million from $1.2 million in the previous year. In fiscal 2013, we recorded approximately $0.5 million of revenue related to commercial sales of Forfivo XL®, compared with a milestone of $1.0 million that was recorded as revenue in 2012 related to the launch of Forfivo XL®.
Total expenses decreased from $3.5 million in fiscal 2012 to $2.6 million in 2013, representing a reduction of $0.9 million, or 25%. The decrease is primarily attributable to a reduction in R&D expenses that we incurred in 2012 for a) the development of our buprenorphine and naloxone Sublingual Film of approximately $0.7 million, b) the technical transfer of activities in preparation for manufacturing of Forfivo XL® to our Contract Manufacturing Organization, Pillar5 Pharma, of approximately $0.3 million (of which, approximately $0.1 million were credited to us in fiscal 2013), and a Product Fee that we paid to the FDA for Forfivo XL® of approximately $0.1 million, partly offset by an increase in SG&A expenses attributable to the addition of Dr. Rajiv Khosla to our management team.
The net loss decreased from $2.3 million in fiscal 2012 to a loss of $1.6 million in 2013, and the loss per share decreased from $0.04 per share in 2012 to $0.03 per share in 2013.
About IntelGenx:
IntelGenx is a drug delivery company focused on the development of oral controlled-release products as well as novel rapidly disintegrating delivery systems. IntelGenx uses its unique multiple layer delivery system to provide zero-order release of active drugs in the gastrointestinal tract. IntelGenx has also developed novel delivery technologies for the rapid delivery of pharmaceutically active substances in the oral cavity based on its experience with rapidly disintegrating films. IntelGenx' development pipeline includes products for the treatment of indications such as severe depression, hypertension, erectile dysfunction, migraine, insomnia, CNS indications, idiopathic pulmonary fibrosis, oncology and pain, as well as animal health products. More information is available about the company at Www.Intelgenx.Com.
Forward Looking Statements:
This document may contain forward-looking information about IntelGenx' operating results and business prospects that involve substantial risks and uncertainties. Statements that are not purely historical are forward-looking statements within the meaning of Section 21E of the Securities Exchange Act of 1934, as amended, and Section 27A of the Securities Act of 1933, as amended. These statements include, but are not limited to, statements about IntelGenx' plans, objectives, expectations, strategies, intentions or other characterizations of future events or circumstances and are generally identified by the words "may," "expects," "anticipates," "intends," "plans," "believes," "seeks," "estimates," "could," "would," and similar expressions. All forward looking statements are expressly qualified in their entirety by this cautionary statement. Because these forward-looking statements are subject to a number of risks and uncertainties, IntelGenx' actual results could differ materially from those expressed or implied by these forward looking statements. Factors that could cause or contribute to such differences include, but are not limited to, those discussed under the heading "Risk Factors" in IntelGenx' annual report on Form 10-K for the fiscal year ended December 31, 2013, filed with the United States Securities and Exchange Commission and available at Www.Sec.Gov, and also filed with Canadian securities regulatory authorities and Www.Sedar.Com. IntelGenx assumes no obligation to update any such forward-looking statements.
Each of the TSX Venture Exchange and OTCQX has neither approved nor disapproved the contents of this press release.
CONTACT:
Dr. Horst G. Zerbe,
President and CEO
IntelGenx Technologies Corp.
T: +1 514-331-7440 (ext. 201)
F: +1 514-331-0436
Horst@Intelgenx.Com
Www.Intelgenx.Com
Saint Laurent, Quebec--(Newsfile Corp. - March 11, 2014) - IntelGenx Corp. (TSXV: IGX) (OTCQX: IGXT) (the "Company") today announced financial results for its fiscal year ended December 31, 2013 and provided an update on operational developments. All amounts are in U.S. Dollars, unless otherwise stated.
"2013 was a challenging and exciting year for IntelGenx," said Rajiv Khosla, President and CEO of IntelGenx. "We made significant progress with the filing of the NDA for our anti-migraine film and the subsequent filing of an ANDA by our partner, Par Pharmaceutical, for our opioid dependence film. Also, subsequent to the end of the year, in early January, we reached agreement with Par for the development of another two products. One of the challenges throughout 2013 was the disappointing sales performance of Forfivo XL®, our high strength anti-depressant tablet. We continue to work together with Edgemont Pharmaceuticals, our commercialization partner for this product, to address the Forfivo XL® business. At the corporate-level we successfully completed a public offering in December, raising net funds of $3.0 million, which strengthened our cash position at December 31, 2013 to $5.0 million. These funds will enable us to move forward with the next important phase of our development, which is to expand into a new facility and establish a pilot plant for VersaFilm™ manufacturing, whilst continuing to further our product portfolio."
Corporate Development Update
Product-related
Anti-depressant tablet, Forfivo XL®
Forfivo XL®, our first FDA approved product, was launched in October 2012 and is being marketed in the United States under the terms of a license agreement between us and Edgemont Pharmaceuticals. Forfivo XL® is indicated for the treatment of Major Depressive Disorder ("MDD") and is the only extended-release bupropion HCl product to provide a once-daily, 450mg dose in a single tablet. The active ingredient in Forfivo XL® is bupropion, the same active ingredient used in the well-known antidepressant product Wellbutrin XL®. Prior to the launch of Forfivo XL®, most patients in the US requiring a 450mg dose of bupropion had been taking multiple tablets to achieve their 450mg dose requirement. With Forfivo XL® now available in the US, these patients can simplify their dosing regimen to a single Forfivo XL tablet, once-daily.
The commercialization of Forfivo XL® triggered launch-related milestone payments to us of up to $4.0 million, of which $1 million was received in Q1, 2013, and additional milestones upon achieving certain sales and exclusivity targets of up to a further $23.5 million. We also receive tiered, double-digit, royalties on net sales of Forfivo XL®. We recorded total revenue for Forfivo in 2013 of approximately $492 thousand.
In August, 2013 we announced receipt of a Paragraph IV Certification Letter from Wockhardt Bio AG, advising of the submission of an ANDA to the FDA requesting authorization to manufacture and market generic versions of Forfivo XL® 450 mg capsules in the United States. We intend to vigorously enforce our intellectual property rights for Forfivo XL® and will pursue all available legal and regulatory pathways in defense of the product, which is currently protected by an issued patent listed in the FDA's Approved Drug Products List (Orange Book).
Anti-migraine Film
In March, 2013 we submitted a 505(b)(2) NDA to the FDA for our novel oral thin-film formulation of Rizatriptan, the active drug in Maxalt-MLT® orally disintegrating tablets. Maxalt-MLT® is a leading branded anti-migraine product manufactured by Merck & Co. The thin-film formulation of Rizatriptan was developed in accordance with the co-development and commercialization agreement with RedHill Biopharma Ltd. using IntelGenx' proprietary immediate release VersaFilm™ oral drug delivery technology. In December 2011, we received approval by Health Canada to conduct a pivotal bioequivalence study to determine if our product is safe and bioequivalent with the FDA approved reference product, Maxalt-MLT®. The trial was conducted in the second quarter of 2012 and was a randomized, two-period, two-way crossover study in healthy male and female subjects. The study results indicate that the product is safe, and that the 90% confidence intervals of the three relevant parameters Cmax, AUC(0-t) and AUC(0-infinity) are well within the 80 - 125 acceptance range for bioequivalency.
In June, 2013 the FDA assigned a PDUFA action date of February 3, 2014 for the review of the NDA for marketing approval.
Subsequent to the end of the year, in February, 2014 we received a Complete Response Letter ("CRL") from the FDA. A CRL is issued by the FDA's Center for Drug Evaluation and Research to inform companies that certain questions and deficiencies remain that preclude the approval of the application in its present form. The questions raised by the FDA in the CRL regarding the NDA for our anti-migraine VersaFilm™ product primarily relate to third party Chemistry, Manufacturing and Controls ("CMC") and to the packaging and labeling of the product. No questions or deficiencies were raised relating to the product's safety and the FDA's CRL does not require additional clinical studies. We believe that the majority of issues raised by the FDA were addressed in an amendment submitted by us to the FDA in January, 2014 that has yet to be reviewed.
On March 3, 2014 we announced that we submitted a response to the CRL which, we believe, addresses all the issues raised in the CRL.
Opioid dependence Film
In accordance with a co-development and commercialization agreement with Par, we developed an oral controlled-release film product based on our proprietary VersaFilm™ technology. The product is a generic formulation of buprenorphine and naloxone Sublingual Film, indicated for maintenance treatment of opioid dependence. The reference listed drug is Suboxone® Sublingual Film. A bioequivalent film formulation was developed, scaled-up, and pivotal batches manufactured and tested during a subsequent pivotal clinical study. An ANDA was filed with the FDA by Par in July 2013.
In August, 2013 we learned that, in response to filing of the ANDA, we were named as a codefendant in a lawsuit pursuant to Paragraph IV litigation filed by Reckitt Benckiser Pharmaceuticals and Monosol RX in the U.S. District Court for the District of Delaware alleging infringement of U.S. Patent Nos. 8,475,832 and 8,017,150, each of which relate to Suboxone®. We believe the ANDA product does not infringe those or any other patents, and will vigorously defend ourselves in this matter. In accordance with the terms of the co-development and commercialization agreement, Par is financially responsible for the costs of this defense. Since Paragraph IV litigation is a regular part of the ANDA process, we do not expect any unanticipated impact on our already planned development schedule.
Two new (undisclosed) projects
Subsequent to the end of the year, in January, 2014 we announced the signing of another development and commercialization agreement with Par Pharmaceutical, Inc. for two new products.
Under the terms of the agreement, Par has obtained certain exclusive rights to market and sell our products in the USA. In exchange we will receive upfront and milestone payments, together with a share of the profits upon commercialization. In accordance with confidentiality clauses contained in the agreement, the specifics of the product descriptions, platform technologies and financial terms remain confidential.
Corporate
Leadership succession
In April, 2013 we announced that Rajiv Khosla, RPh, PhD, MBA would assume the role of President and Chief Executive Officer, succeeding Horst G. Zerbe, PhD, with effect from January 1, 2014. Dr. Zerbe will remain as Chairman of the Board of Directors and continue to provide expertise in research and development, and manufacturing.
Dr. Khosla held the positions of Chief Operating Officer and Chief Scientific Officer throughout the transitional period of 2013 and was a member of the our Board of Directors for the previous two years. Dr. Khosla has remarkable experience and credentials including, among other senior positions, five years as Vice President of Business Development at Biovail Corporation, a Canadian pharmaceutical company operating internationally. Whilst there, he successfully led the transaction process for more than 75 deal opportunities in a variety of therapeutic areas.
Dr. Khosla holds a Ph.D. in pharmaceutical science, with a thesis on Oral Drug Delivery Technology; an Executive MBA from the Henley Business School in England, a Bachelor of Pharmacy (Honours) from the University of Nottingham, England and is a registered pharmacist in the UK.
Dr. Khosla's biography can be found on our website at Http://Www.Intelgenx.Com/Aboutus/Mngmt.Html.
$3.5 Million Public Offering
In December, 2013 we announced the closing of a registered public offering raising gross proceeds of approximately $3.5 million.
Earlier in the same month we entered into securities purchase agreements with certain accredited investors for the issuance and sale of an aggregate of 7,920,346 shares of its common stock at $0.4419 per share. Additionally, investors received warrants to purchase up to 7,920,346 shares of common stock at an exercise price of $0.5646 per share for a term of five years.
Net proceeds, after deducting the placement agent's fee and other estimated offering expenses payable by us were approximately $3.0 million. We intend to use the net proceeds from the offering for capital investments in VersaFilm™ manufacturing equipment, leasehold improvements on a new facility, working capital and other general corporate purposes.
H.C. Wainwright & Co., LLC acted as the exclusive placement agent for the transaction.
Financial Results:
Cash on hand at December 31, 2013 increased to $5.0 million compared with the cash balance of $2.1 million as at December 31, 2012. The increase in cash on hand relates to net cash provided by financing activities of $4.5 million (2012 - $0.4 million), partly offset by net cash used in operating activities of $1.1 million (2012 - $1.6 million), net cash used in investing activities of $0.3 million (2012 - $0.3 million), and an unrealized foreign exchange loss of $0.1 million (2012 - unrealized foreign exchange gain of $0.1 million). The net cash provided by financing activities consists of approximately $3.0 million from a registered public offering that we completed in December 2013, together with approximately $1.5 million in proceeds received from the exercise of warrants and stock options.
We intend to use the net proceeds from the registered public offering for capital investments in VersaFilm™ manufacturing equipment, new facility leasehold improvements, working capital and other general corporate purposes.
Accounts receivable totaled $0.1 million as at December 31, 2013 compared with $1.3 million at December 31, 2012. The accounts receivable balance at December 31, 2012 included an amount of $1.0 million related to the launch of Forfivo XL®™ that was invoiced to our commercialization partner for Forfivo XL®, Edgemont Pharmaceuticals, in the fourth quarter of 2012. Payment against the invoice was received in February 2013.
Revenue for the year ended December 31, 2013 decreased to $0.9 million from $1.2 million in the previous year. In fiscal 2013, we recorded approximately $0.5 million of revenue related to commercial sales of Forfivo XL®, compared with a milestone of $1.0 million that was recorded as revenue in 2012 related to the launch of Forfivo XL®.
Total expenses decreased from $3.5 million in fiscal 2012 to $2.6 million in 2013, representing a reduction of $0.9 million, or 25%. The decrease is primarily attributable to a reduction in R&D expenses that we incurred in 2012 for a) the development of our buprenorphine and naloxone Sublingual Film of approximately $0.7 million, b) the technical transfer of activities in preparation for manufacturing of Forfivo XL® to our Contract Manufacturing Organization, Pillar5 Pharma, of approximately $0.3 million (of which, approximately $0.1 million were credited to us in fiscal 2013), and a Product Fee that we paid to the FDA for Forfivo XL® of approximately $0.1 million, partly offset by an increase in SG&A expenses attributable to the addition of Dr. Rajiv Khosla to our management team.
The net loss decreased from $2.3 million in fiscal 2012 to a loss of $1.6 million in 2013, and the loss per share decreased from $0.04 per share in 2012 to $0.03 per share in 2013.
About IntelGenx:
IntelGenx is a drug delivery company focused on the development of oral controlled-release products as well as novel rapidly disintegrating delivery systems. IntelGenx uses its unique multiple layer delivery system to provide zero-order release of active drugs in the gastrointestinal tract. IntelGenx has also developed novel delivery technologies for the rapid delivery of pharmaceutically active substances in the oral cavity based on its experience with rapidly disintegrating films. IntelGenx' development pipeline includes products for the treatment of indications such as severe depression, hypertension, erectile dysfunction, migraine, insomnia, CNS indications, idiopathic pulmonary fibrosis, oncology and pain, as well as animal health products. More information is available about the company at Www.Intelgenx.Com.
Forward Looking Statements:
This document may contain forward-looking information about IntelGenx' operating results and business prospects that involve substantial risks and uncertainties. Statements that are not purely historical are forward-looking statements within the meaning of Section 21E of the Securities Exchange Act of 1934, as amended, and Section 27A of the Securities Act of 1933, as amended. These statements include, but are not limited to, statements about IntelGenx' plans, objectives, expectations, strategies, intentions or other characterizations of future events or circumstances and are generally identified by the words "may," "expects," "anticipates," "intends," "plans," "believes," "seeks," "estimates," "could," "would," and similar expressions. All forward looking statements are expressly qualified in their entirety by this cautionary statement. Because these forward-looking statements are subject to a number of risks and uncertainties, IntelGenx' actual results could differ materially from those expressed or implied by these forward looking statements. Factors that could cause or contribute to such differences include, but are not limited to, those discussed under the heading "Risk Factors" in IntelGenx' annual report on Form 10-K for the fiscal year ended December 31, 2013, filed with the United States Securities and Exchange Commission and available at Www.Sec.Gov, and also filed with Canadian securities regulatory authorities and Www.Sedar.Com. IntelGenx assumes no obligation to update any such forward-looking statements.
Each of the TSX Venture Exchange and OTCQX has neither approved nor disapproved the contents of this press release.
CONTACT:
Dr. Horst G. Zerbe,
President and CEO
IntelGenx Technologies Corp.
T: +1 514-331-7440 (ext. 201)
F: +1 514-331-0436
Horst@Intelgenx.Com
Www.Intelgenx.Com
keine Nachrichten. 10-17% Plus. Kleine Entschädigung. Hoffentlich kommt da nun endlich die Bestätigung durch die FDA.
Dann können da noch 20-30% drin sein auf kurze Sicht (die ich eigentlich schon haben wollte)
Dann können da noch 20-30% drin sein auf kurze Sicht (die ich eigentlich schon haben wollte)
IntelGenx Announces Receipt of an Additional U.S. Patent Allowance Related To Proprietary Technology
Saint Laurent, Quebec--(Newsfile Corp. - April 16, 2014) - IntelGenx Corp. (TSXV: IGX) (OTCQX: IGXT) ("IntelGenx"), a Canadian drug delivery company focusing on oral drug delivery, today announced that it has received a Notice of Allowance ("NOA") from the United States Patent and Trademark Office ("USPTO") for U.S. Patent Application Serial No. 12/836,810 entitled "Oral mucoadhesive dosage form" which covers IntelGenx' proprietary AdVersa™ mucoadhesive drug delivery technology. This NOA concludes the examination of the U.S. patent application and will result in the issuance of a U.S. patent after the administrative process is completed.
"This patent allowance by the USPTO is another important achievement in protecting the innovation and commercial potential of IntelGenx drug delivery technologies and products" said Rajiv Khosla, IntelGenx' President and Chief Executive Officer. "This NOA is the latest example of how our scientific innovation continues to establish IntelGenx as a leader in pharmaceutical drug delivery."
About IntelGenx:
IntelGenx is a drug delivery company focused on the development of oral controlled-release products as well as novel rapidly disintegrating delivery systems. IntelGenx uses its unique multiple layer delivery system to provide zero-order release of active drugs in the gastrointestinal tract. IntelGenx has also developed novel delivery technologies for the rapid delivery of pharmaceutically active substances in the oral cavity based on its experience with rapidly disintegrating films. IntelGenx' development pipeline includes products for the treatment of indications such as severe depression, hypertension, erectile dysfunction, migraine, insomnia, CNS indications, idiopathic pulmonary fibrosis, oncology and pain, as well as animal health products. More information is available about the company at Www.Intelgenx.Com.
Forward Looking Statements:
This document may contain forward-looking information about IntelGenx' operating results and business prospects that involve substantial risks and uncertainties. Statements that are not purely historical are forward-looking statements within the meaning of Section 21E of the Securities Exchange Act of 1934, as amended, and Section 27A of the Securities Act of 1933, as amended. These statements include, but are not limited to, statements about IntelGenx' plans, objectives, expectations, strategies, intentions or other characterizations of future events or circumstances and are generally identified by the words "may," "expects," "anticipates," "intends," "plans," "believes," "seeks," "estimates," "could," "would," and similar expressions. All forward looking statements are expressly qualified in their entirety by this cautionary statement. Because these forward-looking statements are subject to a number of risks and uncertainties, IntelGenx' actual results could differ materially from those expressed or implied by these forward looking statements. Factors that could cause or contribute to such differences include, but are not limited to, those discussed under the heading "Risk Factors" in IntelGenx' annual report on Form 10-K for the fiscal year ended December 31, 2013, filed with the United States Securities and Exchange Commission and available at Www.Sec.Gov, and also filed with Canadian securities regulatory authorities and Www.Sedar.Com. IntelGenx assumes no obligation to update any such forward-looking statements.
Each of the TSX Venture Exchange and OTCQX has neither approved nor disapproved the contents of this press release.
CONTACT:
Dr. Rajiv Khosla
President and CEO
IntelGenx Corp.
T: +1 514-331-7440
F: +1 514-331-0436
Www.Intelgenx.Com
Saint Laurent, Quebec--(Newsfile Corp. - April 16, 2014) - IntelGenx Corp. (TSXV: IGX) (OTCQX: IGXT) ("IntelGenx"), a Canadian drug delivery company focusing on oral drug delivery, today announced that it has received a Notice of Allowance ("NOA") from the United States Patent and Trademark Office ("USPTO") for U.S. Patent Application Serial No. 12/836,810 entitled "Oral mucoadhesive dosage form" which covers IntelGenx' proprietary AdVersa™ mucoadhesive drug delivery technology. This NOA concludes the examination of the U.S. patent application and will result in the issuance of a U.S. patent after the administrative process is completed.
"This patent allowance by the USPTO is another important achievement in protecting the innovation and commercial potential of IntelGenx drug delivery technologies and products" said Rajiv Khosla, IntelGenx' President and Chief Executive Officer. "This NOA is the latest example of how our scientific innovation continues to establish IntelGenx as a leader in pharmaceutical drug delivery."
About IntelGenx:
IntelGenx is a drug delivery company focused on the development of oral controlled-release products as well as novel rapidly disintegrating delivery systems. IntelGenx uses its unique multiple layer delivery system to provide zero-order release of active drugs in the gastrointestinal tract. IntelGenx has also developed novel delivery technologies for the rapid delivery of pharmaceutically active substances in the oral cavity based on its experience with rapidly disintegrating films. IntelGenx' development pipeline includes products for the treatment of indications such as severe depression, hypertension, erectile dysfunction, migraine, insomnia, CNS indications, idiopathic pulmonary fibrosis, oncology and pain, as well as animal health products. More information is available about the company at Www.Intelgenx.Com.
Forward Looking Statements:
This document may contain forward-looking information about IntelGenx' operating results and business prospects that involve substantial risks and uncertainties. Statements that are not purely historical are forward-looking statements within the meaning of Section 21E of the Securities Exchange Act of 1934, as amended, and Section 27A of the Securities Act of 1933, as amended. These statements include, but are not limited to, statements about IntelGenx' plans, objectives, expectations, strategies, intentions or other characterizations of future events or circumstances and are generally identified by the words "may," "expects," "anticipates," "intends," "plans," "believes," "seeks," "estimates," "could," "would," and similar expressions. All forward looking statements are expressly qualified in their entirety by this cautionary statement. Because these forward-looking statements are subject to a number of risks and uncertainties, IntelGenx' actual results could differ materially from those expressed or implied by these forward looking statements. Factors that could cause or contribute to such differences include, but are not limited to, those discussed under the heading "Risk Factors" in IntelGenx' annual report on Form 10-K for the fiscal year ended December 31, 2013, filed with the United States Securities and Exchange Commission and available at Www.Sec.Gov, and also filed with Canadian securities regulatory authorities and Www.Sedar.Com. IntelGenx assumes no obligation to update any such forward-looking statements.
Each of the TSX Venture Exchange and OTCQX has neither approved nor disapproved the contents of this press release.
CONTACT:
Dr. Rajiv Khosla
President and CEO
IntelGenx Corp.
T: +1 514-331-7440
F: +1 514-331-0436
Www.Intelgenx.Com
IntelGenx and RedHill Biopharma Provide an Update on FDA's Ongoing Review of the NDA for Migraine VersaFilm(TM) Product
GlobeNewswire IntelGenx Corp.
2 hours ago
SAINT LAURENT, Quebec, April 24, 2014 (GLOBE NEWSWIRE) -- IntelGenx Corp. (IGX.V) (IGXT) ("IntelGenx"), a Canadian drug delivery company focusing on oral drug delivery, together with RedHill Biopharma Ltd. (RDHL) (RDHL) ("RedHill"), an emerging Israeli biopharmaceutical company focused primarily on the development and acquisition of late clinical-stage proprietary drugs, today reported that the U.S. Food and Drug Administration ("FDA") acknowledged receipt of their response to the Complete Response Letter ("CRL") for the VersaFilm(TM) Oral Film Product New Drug Application ("NDA") and has requested further clarifications. The VersaFilm(TM) Oral Film Product is a proprietary oral thin film formulation of rizatriptan for the treatment of acute migraines.
IntelGenx and RedHill (the "Companies") reported on March 3, 2014 that they had submitted their response to the FDA's CRL for the VersaFilm(TM) Oral Film Product NDA, which had raised questions primarily related to Chemistry, Manufacturing and Controls (CMC). In response, the FDA has requested from the Companies additional CMC data, which the Companies believe they can supply within several weeks based on available information.
The Companies further report that a supplier of raw material for the VersaFilm(TM) Oral Film Product is currently holding compliance discussions with the FDA, which are independent of RedHill and IntelGenx and are not specific to the VersaFilm(TM) Oral Film Product. The Companies are diligently working on a variety of options to ensure continued supply of the raw material regardless of the result of these compliance discussions.
The Companies believe that FDA approval of the VersaFilm(TM) Oral Film Product NDA is subject to the satisfactory resolution of the remaining CMC questions, as well as securing a compliant source of the raw material. Therefore, IntelGenx and RedHill continue to work with the FDA in order to submit all the data requested, and will provide an update as and when applicable.
About the VersaFilm(TM) Oral Film Product:
The product is a proprietary oral thin film formulation of rizatriptan benzoate, a 5-HT1 receptor agonist and the active drug in Merck & Co.'s Maxalt(R). Rizatriptan is considered one of the most effective oral triptans, a class of molecules that constrict blood vessels in the brain to relieve swelling and other migraine symptoms. The worldwide annual sales of triptans were estimated to have exceeded $1 billion in 20131.
The product is based on IntelGenx' proprietary "VersaFilm(TM)" technology. It dissolves rapidly in the mouth, leading to the absorption of the drug through the gastro intestinal track and into the bloodstream. The administration method of the oral thin film does not require the patient to swallow a pill or consume water, and presents a potentially attractive therapeutic alternative for many migraine patients, including those who suffer from migraine-related nausea, estimated at approximately 80% of the total migraine patient population2.
About IntelGenx:
IntelGenx is a drug delivery company focused on the development of oral controlled-release products as well as novel rapidly disintegrating delivery systems. IntelGenx uses its unique multiple layer delivery system to provide zero-order release of active drugs in the gastrointestinal tract. IntelGenx has also developed novel delivery technologies for the rapid delivery of pharmaceutically active substances in the oral cavity based on its experience with rapidly disintegrating films. IntelGenx' development pipeline includes products for the treatment of indications such as severe depression, hypertension, erectile dysfunction, migraine, insomnia, CNS indications, idiopathic pulmonary fibrosis, oncology and pain, as well as animal health products. More information is available about the company at www.intelgenx.com.
About RedHill Biopharma Ltd.:
RedHill Biopharma Ltd. (RDHL) (RDHL) is an emerging Israeli biopharmaceutical company focused primarily on the development and acquisition of late clinical-stage, proprietary formulations and combinations of existing drugs for the treatment of inflammatory and gastrointestinal diseases, including cancer and related conditions. RedHill's current pipeline of proprietary products includes: (i) RHB-104 - an oral combination therapy for the treatment of Crohn's disease, with an ongoing Phase III study, (ii) RHB-105 - an oral combination therapy for Helicobacter pylori infection, with an ongoing Phase III study; (iii) RHB-106 - an encapsulated formulation for bowel preparation licensed to Salix Pharmaceuticals Ltd.; (iv) RHB-103 - an oral thin film formulation of rizatriptan for acute migraines with a U.S. NDA under FDA review; (v) RHB-102 - a once-daily oral pill formulation of ondansetron for the prevention of nausea and vomiting, in advanced development stages for multiple indications and, (vi) RHB-101 - a once-daily oral pill formulation of the cardio drug carvedilol. For more information please visit: www.redhillbio.com
Forward-Looking Statements:
This document may contain forward-looking information about IntelGenx' operating results and business prospects that involve substantial risks and uncertainties. Statements that are not purely historical are forward-looking statements within the meaning of Section 21E of the Securities Exchange Act of 1934, as amended, and Section 27A of the Securities Act of 1933, as amended. These statements include, but are not limited to, statements about IntelGenx' plans, objectives, expectations, strategies, intentions or other characterizations of future events or circumstances and are generally identified by the words "may," "expects," "anticipates," "intends," "plans," "believes," "seeks," "estimates," "could," "would," and similar expressions. All forward-looking statements are expressly qualified in their entirety by this cautionary statement. Because these forward-looking statements are subject to a number of risks and uncertainties, IntelGenx' actual results could differ materially from those expressed or implied by these forward-looking statements. Factors that could cause or contribute to such differences include, but are not limited to, those discussed under the heading "Risk Factors" in IntelGenx' annual report on Form 10-K for the fiscal year ended December 31, 2013, filed with the United States Securities and Exchange Commission and available at www.sec.gov, and also filed with Canadian securities regulatory authorities and www.sedar.com. IntelGenx assumes no obligation to update any such forward-looking statements.
Each of the TSX Venture Exchange and OTCQX has neither approved nor disapproved the contents of this press release.
1 EvaluatePharma, 2013, WW annual sales by pharmacological class, 5-HT1B (serotonin) & 5HT1D (serotonin) agonist
2 Lipton RB, Buse DC, Saiers J, Fanning KM, Serrano D, Reed ML. (2013) Frequency and burden of headache-related nausea: results from the American Migraine Prevalence and Prevention (AMPP) study, Headache. 2013 Jan;53(1):93-103. doi: 10.1111/j.1526-4610.2012.02292.x. Epub 2012 Nov 13
Contact:
Dr. Rajiv Khosla
President and CEO
IntelGenx Corp.
T: +1 514-331-7440
F: +1 514-331-0436
www.intelgenx.com
GlobeNewswire IntelGenx Corp.
2 hours ago
SAINT LAURENT, Quebec, April 24, 2014 (GLOBE NEWSWIRE) -- IntelGenx Corp. (IGX.V) (IGXT) ("IntelGenx"), a Canadian drug delivery company focusing on oral drug delivery, together with RedHill Biopharma Ltd. (RDHL) (RDHL) ("RedHill"), an emerging Israeli biopharmaceutical company focused primarily on the development and acquisition of late clinical-stage proprietary drugs, today reported that the U.S. Food and Drug Administration ("FDA") acknowledged receipt of their response to the Complete Response Letter ("CRL") for the VersaFilm(TM) Oral Film Product New Drug Application ("NDA") and has requested further clarifications. The VersaFilm(TM) Oral Film Product is a proprietary oral thin film formulation of rizatriptan for the treatment of acute migraines.
IntelGenx and RedHill (the "Companies") reported on March 3, 2014 that they had submitted their response to the FDA's CRL for the VersaFilm(TM) Oral Film Product NDA, which had raised questions primarily related to Chemistry, Manufacturing and Controls (CMC). In response, the FDA has requested from the Companies additional CMC data, which the Companies believe they can supply within several weeks based on available information.
The Companies further report that a supplier of raw material for the VersaFilm(TM) Oral Film Product is currently holding compliance discussions with the FDA, which are independent of RedHill and IntelGenx and are not specific to the VersaFilm(TM) Oral Film Product. The Companies are diligently working on a variety of options to ensure continued supply of the raw material regardless of the result of these compliance discussions.
The Companies believe that FDA approval of the VersaFilm(TM) Oral Film Product NDA is subject to the satisfactory resolution of the remaining CMC questions, as well as securing a compliant source of the raw material. Therefore, IntelGenx and RedHill continue to work with the FDA in order to submit all the data requested, and will provide an update as and when applicable.
About the VersaFilm(TM) Oral Film Product:
The product is a proprietary oral thin film formulation of rizatriptan benzoate, a 5-HT1 receptor agonist and the active drug in Merck & Co.'s Maxalt(R). Rizatriptan is considered one of the most effective oral triptans, a class of molecules that constrict blood vessels in the brain to relieve swelling and other migraine symptoms. The worldwide annual sales of triptans were estimated to have exceeded $1 billion in 20131.
The product is based on IntelGenx' proprietary "VersaFilm(TM)" technology. It dissolves rapidly in the mouth, leading to the absorption of the drug through the gastro intestinal track and into the bloodstream. The administration method of the oral thin film does not require the patient to swallow a pill or consume water, and presents a potentially attractive therapeutic alternative for many migraine patients, including those who suffer from migraine-related nausea, estimated at approximately 80% of the total migraine patient population2.
About IntelGenx:
IntelGenx is a drug delivery company focused on the development of oral controlled-release products as well as novel rapidly disintegrating delivery systems. IntelGenx uses its unique multiple layer delivery system to provide zero-order release of active drugs in the gastrointestinal tract. IntelGenx has also developed novel delivery technologies for the rapid delivery of pharmaceutically active substances in the oral cavity based on its experience with rapidly disintegrating films. IntelGenx' development pipeline includes products for the treatment of indications such as severe depression, hypertension, erectile dysfunction, migraine, insomnia, CNS indications, idiopathic pulmonary fibrosis, oncology and pain, as well as animal health products. More information is available about the company at www.intelgenx.com.
About RedHill Biopharma Ltd.:
RedHill Biopharma Ltd. (RDHL) (RDHL) is an emerging Israeli biopharmaceutical company focused primarily on the development and acquisition of late clinical-stage, proprietary formulations and combinations of existing drugs for the treatment of inflammatory and gastrointestinal diseases, including cancer and related conditions. RedHill's current pipeline of proprietary products includes: (i) RHB-104 - an oral combination therapy for the treatment of Crohn's disease, with an ongoing Phase III study, (ii) RHB-105 - an oral combination therapy for Helicobacter pylori infection, with an ongoing Phase III study; (iii) RHB-106 - an encapsulated formulation for bowel preparation licensed to Salix Pharmaceuticals Ltd.; (iv) RHB-103 - an oral thin film formulation of rizatriptan for acute migraines with a U.S. NDA under FDA review; (v) RHB-102 - a once-daily oral pill formulation of ondansetron for the prevention of nausea and vomiting, in advanced development stages for multiple indications and, (vi) RHB-101 - a once-daily oral pill formulation of the cardio drug carvedilol. For more information please visit: www.redhillbio.com
Forward-Looking Statements:
This document may contain forward-looking information about IntelGenx' operating results and business prospects that involve substantial risks and uncertainties. Statements that are not purely historical are forward-looking statements within the meaning of Section 21E of the Securities Exchange Act of 1934, as amended, and Section 27A of the Securities Act of 1933, as amended. These statements include, but are not limited to, statements about IntelGenx' plans, objectives, expectations, strategies, intentions or other characterizations of future events or circumstances and are generally identified by the words "may," "expects," "anticipates," "intends," "plans," "believes," "seeks," "estimates," "could," "would," and similar expressions. All forward-looking statements are expressly qualified in their entirety by this cautionary statement. Because these forward-looking statements are subject to a number of risks and uncertainties, IntelGenx' actual results could differ materially from those expressed or implied by these forward-looking statements. Factors that could cause or contribute to such differences include, but are not limited to, those discussed under the heading "Risk Factors" in IntelGenx' annual report on Form 10-K for the fiscal year ended December 31, 2013, filed with the United States Securities and Exchange Commission and available at www.sec.gov, and also filed with Canadian securities regulatory authorities and www.sedar.com. IntelGenx assumes no obligation to update any such forward-looking statements.
Each of the TSX Venture Exchange and OTCQX has neither approved nor disapproved the contents of this press release.
1 EvaluatePharma, 2013, WW annual sales by pharmacological class, 5-HT1B (serotonin) & 5HT1D (serotonin) agonist
2 Lipton RB, Buse DC, Saiers J, Fanning KM, Serrano D, Reed ML. (2013) Frequency and burden of headache-related nausea: results from the American Migraine Prevalence and Prevention (AMPP) study, Headache. 2013 Jan;53(1):93-103. doi: 10.1111/j.1526-4610.2012.02292.x. Epub 2012 Nov 13
Contact:
Dr. Rajiv Khosla
President and CEO
IntelGenx Corp.
T: +1 514-331-7440
F: +1 514-331-0436
www.intelgenx.com
warum ist es denn hier so kalt?
it is important to understand the world has evolved
Antwort auf Beitrag Nr.: 49.582.799 von Popeye82 am 16.04.15 20:13:00Trollst du wieder durch sämtliche Foren und kippst deinen Müll ab?
!
Dieser Beitrag wurde von CloudMOD moderiert. Grund: kein Bezug zum Threadthema
6420 Abrams, St-Laurent, Quebec
1.800.268.3793
Auch wenn die eine oder andere Entscheidung vom CEO mir nicht so gut gefallen hat, hat er dennoch sich an etwas gehalten was mir sehr gut gefällt und das ist die Burn-Rate sehr niedrig zuhalten also er geht sehr sorgsam mit dem geld der Investoren um.
Mit der heutigen Zulassung (zunächst in Deutschland weitere EU-Staaten werden folgen) ist die Zukunft von Intelgenx sogut wie gesichert denn die Burn-rate ist mit knapp $500k pro Quartal ziemlich gering da braucht es nicht viel um die Firma in die Gewinnzone zu hieven. In USA wurde die Zulassung beim ersten Anlauf abgelehnt aber nur wegen Probleme bei der Herstellung des Produktes an den klinischen Daten hatte die FDA nichts auszusetzen . Intelgenx hat sich deshalb eine eigne Anlage bauen lassen mit der sie die Produkte die auf der Oralfilm Technologie basieren selber herstellen kann ,das war auf jedenfall eine gute Entscheidung und hat seine Vorteile. Die Anlage steht kurz vor der fertigstellung nach der begutachtung können Intelgenx und Redhill den Zulassungsantrag erneut einreichen diesmal wird wohl die Zulassung sogut wie sicher durchgehen . Wenns gut läuft kann man im 2Q oder anfang 3Q 2016 mit der US-Zulassung rechnen .
Der Game Changer für Intelgenx bleibt die Generik version (int0027) vom ehemaligen blockbuster suboxone für die Behandlung von Opiatabhängigkeit . Die Zulassung wird für ca mitte 2016 erwartet der Partner für das Produkt ist Par Pharma ein erfolgreicher Player im Generikbereich .
According to IMS Health, U.S. retail sales of Suboxone® Sublingual Film were approximately $1.5 billion in 2012.
Halten wir fest die Burn-rate liegt bei sehr niedrigen $500k pro Quartal mit der Zulassung von Rizaport in Europa anschließend in USA und dann noch die Generik version von Suboxone auch USA dürfte die kasse nicht nur klingeln sondern überlaufen .
Intelgenx ist massivst Unterbewertet mit einer Marktkap von nur $36 Millionen ,der Cashbestand liegt aktuell bei $2.3 Millionen das dürfte für über 12 monate ausreichen .Die Performance in den letzten 2 Jahre war nicht so besonders aber die nächsten 6-9 monate dürften die wichtigsten von Intelgenx werden deshalb ist die Aktie auch wieder in meinem fokus .
Intelgenx und Pediapharm sind so Unternehmen bei denen das Risiko minimal ist aber das Potential enorm ist und sowas ist heutzutage nicht einfach an der Börse zufinden .

Mit der heutigen Zulassung (zunächst in Deutschland weitere EU-Staaten werden folgen) ist die Zukunft von Intelgenx sogut wie gesichert denn die Burn-rate ist mit knapp $500k pro Quartal ziemlich gering da braucht es nicht viel um die Firma in die Gewinnzone zu hieven. In USA wurde die Zulassung beim ersten Anlauf abgelehnt aber nur wegen Probleme bei der Herstellung des Produktes an den klinischen Daten hatte die FDA nichts auszusetzen . Intelgenx hat sich deshalb eine eigne Anlage bauen lassen mit der sie die Produkte die auf der Oralfilm Technologie basieren selber herstellen kann ,das war auf jedenfall eine gute Entscheidung und hat seine Vorteile. Die Anlage steht kurz vor der fertigstellung nach der begutachtung können Intelgenx und Redhill den Zulassungsantrag erneut einreichen diesmal wird wohl die Zulassung sogut wie sicher durchgehen . Wenns gut läuft kann man im 2Q oder anfang 3Q 2016 mit der US-Zulassung rechnen .
Der Game Changer für Intelgenx bleibt die Generik version (int0027) vom ehemaligen blockbuster suboxone für die Behandlung von Opiatabhängigkeit . Die Zulassung wird für ca mitte 2016 erwartet der Partner für das Produkt ist Par Pharma ein erfolgreicher Player im Generikbereich .
According to IMS Health, U.S. retail sales of Suboxone® Sublingual Film were approximately $1.5 billion in 2012.
Halten wir fest die Burn-rate liegt bei sehr niedrigen $500k pro Quartal mit der Zulassung von Rizaport in Europa anschließend in USA und dann noch die Generik version von Suboxone auch USA dürfte die kasse nicht nur klingeln sondern überlaufen .
Intelgenx ist massivst Unterbewertet mit einer Marktkap von nur $36 Millionen ,der Cashbestand liegt aktuell bei $2.3 Millionen das dürfte für über 12 monate ausreichen .Die Performance in den letzten 2 Jahre war nicht so besonders aber die nächsten 6-9 monate dürften die wichtigsten von Intelgenx werden deshalb ist die Aktie auch wieder in meinem fokus .
Intelgenx und Pediapharm sind so Unternehmen bei denen das Risiko minimal ist aber das Potential enorm ist und sowas ist heutzutage nicht einfach an der Börse zufinden .

Antwort auf Beitrag Nr.: 51.047.040 von Biohero am 09.11.15 22:56:54
spar dir einfach manchmal dein massivst unterbewertet
ich brauch event. einen von der auswechselbank
IntelGenx sitzt bei mir auch drauf
Zitat von Biohero: Intelgenx ist massivst Unterbewertet mit einer Marktkap von nur $36 Millionen ...blablabla
spar dir einfach manchmal dein massivst unterbewertet
ich brauch event. einen von der auswechselbank
IntelGenx sitzt bei mir auch drauf
Antwort auf Beitrag Nr.: 51.047.460 von Popeye82 am 10.11.15 01:47:12Warum ist die denn nur an der otc?
Antwort auf Beitrag Nr.: 51.047.460 von Popeye82 am 10.11.15 01:47:12Wer sich hier etwas sparen sollte steht ja wohl ausser Frage!
Bei den Aussichten kann man nur von MASSIVST UNTERBEWERTET sprechen, alles andere wäre reine Verharmlosung!
Bei den Aussichten kann man nur von MASSIVST UNTERBEWERTET sprechen, alles andere wäre reine Verharmlosung!
Antwort auf Beitrag Nr.: 51.088.875 von gnaraloo79 am 14.11.15 11:24:36
neee,
falsch
ich weiss dass er euer Jesus ist
meiner nicht
neee,
falsch
ich weiss dass er euer Jesus ist
meiner nicht
Biohero's Recherchen sind eben einfach tiefgründig und daraus ausgerichtet Börsennotierte Pharmaunternehmen ausfindig zu machen bei den die Pipline, die ausstehenden Aktien und die Markkapitalisierung in einem Erfolgsversprechenden Verhältniss stehen. Und das er dabei schon einige Perlen auf WO vorgestellt hat ist bewiesen. Natürlich hängt es immer von einer Reihe Faktoren ab ob die vorgestellten Aktien bzw. der Unternehmen die Erwartungen der Investoren erfüllt. Logisch oder? Deshalb kann ich dich nicht verstehen das du ihn in einer ungerechtfertigten Weise angehst.
Schönes WE und gute Trades
Schönes WE und gute Trades

Antwort auf Beitrag Nr.: 51.089.316 von gnaraloo79 am 14.11.15 12:58:58
dann eine kleine denkaufgabe
warum war IntelGenx am 01.04.13
lachhaft bewertet, selbst nach ver10fachung noch billig uswblabla, steht heute aber nahezu gleich?
ps
Du verstehst mich falsch,
hast ein bisschen schnell geschossen
mein Punkt ist ein anderer
ebenso gute trades
mfG
dann eine kleine denkaufgabe

warum war IntelGenx am 01.04.13
Zitat von Biohero: Hier ist eine der günstigsten und aussichtsreichste Bioaktie die an der Börse gelistet ist .
die aktuelle Markt Kap von 32 Mio $ ist wirklich lachhaft .
Ich persönlich halte die Aktie selbst nach einer Verzehnfachung für billig gemessen an der gigantischen Produkt Pipeline
lachhaft bewertet, selbst nach ver10fachung noch billig uswblabla, steht heute aber nahezu gleich?
ps
Du verstehst mich falsch,
hast ein bisschen schnell geschossen
mein Punkt ist ein anderer
ebenso gute trades

mfG
Antwort auf Beitrag Nr.: 51.089.508 von Popeye82 am 14.11.15 13:40:30Oh jesses nei popeye
Wie fange ich an hm .. Das riesige Potential ist nach wie vor da aber das Hauptproblem das es nicht sogut gelaufen ist wie erhofft lag daran dass das Management sich an ihrem angegebenen Zeitplan nicht gehalten haben und auch teilweise an der FDA .Ich kann mich nur an den Daten die das Management angibt halten ich bin kein Hellseher um irgendwelche verzögerungen vorherzusehen .
Ich sehe das hohe Potential hier vorallem in dem Generik Version von Suboxone und natürlich in dem potentiellem "best in class" Potenzmittel das auf das schnell löslichem Oralfim Technologie basiert (ähnlich wie auf dem foto unten) .Wer Viagra oder Cialis kennt weiß das es sich hier um ein Milliarden Markt handelt und deshalb rede ich auch vom 10 Bagger . Der Zulassungsantrag hätte laut Management schon ende 2014 erfolgen sollen und aktuell heißt es erst in 2016 .Hätte sich also das Management an ihrem Zeitplan gehalten dann wäre die Aktie bestimmt nicht da wo sie jetzt ist .Trotzdem gab es genug gelegenheiten in der zwischenzeit die Aktie mit profit zu verkaufen .

Und zum wiederholten male ich will kein jesus kein messias kein zeus kein robin hood sein und auch nicht gelobt werden von mir aus könnt ihr mich auch loser nennen das interessiert mich alles nicht .
Wie fange ich an hm .. Das riesige Potential ist nach wie vor da aber das Hauptproblem das es nicht sogut gelaufen ist wie erhofft lag daran dass das Management sich an ihrem angegebenen Zeitplan nicht gehalten haben und auch teilweise an der FDA .Ich kann mich nur an den Daten die das Management angibt halten ich bin kein Hellseher um irgendwelche verzögerungen vorherzusehen .
Ich sehe das hohe Potential hier vorallem in dem Generik Version von Suboxone und natürlich in dem potentiellem "best in class" Potenzmittel das auf das schnell löslichem Oralfim Technologie basiert (ähnlich wie auf dem foto unten) .Wer Viagra oder Cialis kennt weiß das es sich hier um ein Milliarden Markt handelt und deshalb rede ich auch vom 10 Bagger . Der Zulassungsantrag hätte laut Management schon ende 2014 erfolgen sollen und aktuell heißt es erst in 2016 .Hätte sich also das Management an ihrem Zeitplan gehalten dann wäre die Aktie bestimmt nicht da wo sie jetzt ist .Trotzdem gab es genug gelegenheiten in der zwischenzeit die Aktie mit profit zu verkaufen .

Und zum wiederholten male ich will kein jesus kein messias kein zeus kein robin hood sein und auch nicht gelobt werden von mir aus könnt ihr mich auch loser nennen das interessiert mich alles nicht .
Weisst du woran es lag, dass über ein Jahr Verzug entstanden ist?
Antwort auf Beitrag Nr.: 51.090.309 von Biohero am 14.11.15 17:02:42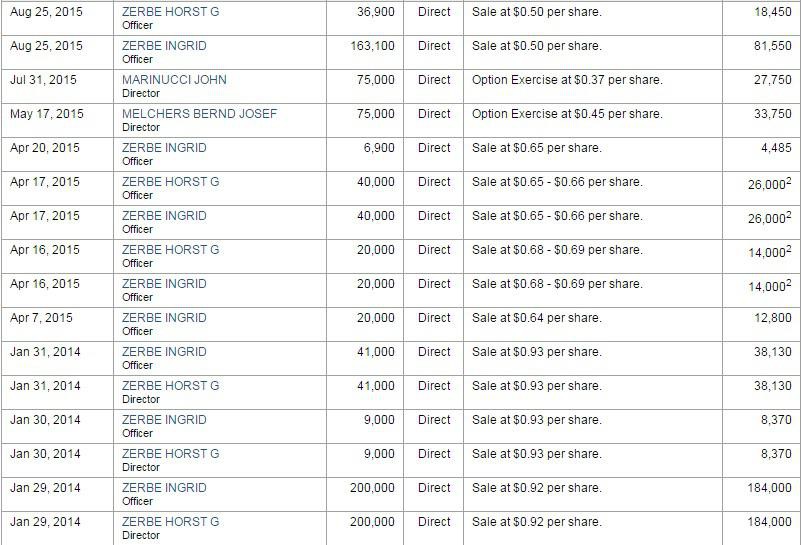
Das hört sich alles sehr interessant an, aber wenn ich das Bild sehe, dann kriegt man schon Angst wieso man das so macht.

Das hört sich alles sehr interessant an, aber wenn ich das Bild sehe, dann kriegt man schon Angst wieso man das so macht.
Antwort auf Beitrag Nr.: 51.091.365 von kalpchen am 14.11.15 21:11:13Seh ich auch kritisch: pipeline superinteressant, aber das Management erinnert mich an AEternaZentaris...nicht berechenbar...schade
Antwort auf Beitrag Nr.: 51.091.512 von calvin1977 am 14.11.15 21:49:42Seh ich auch kritisch: pipeline superinteressant, aber das Management erinnert mich an AEternaZentaris...nicht berechenbar...schade
Das ist ja direkt eine beleidigung für IGXT mit diesen Versagern von AEZS verglichen zu werden .Hier gibt es einen wesentlichen Unterschied und zwar ist CEO Zerbe auch gleichzeitig der Gründer von Intelgenx und Eigentümer gehen in der Regel viel Verantwortungsvoller mit ihrem Unternehmen um .
Der komplett Versager CEO Dodd ist nur ein Geschäftsführer von AEZS und hat in kaum 2 Jahren die Firma ruiniert .Ich hätte niemals in AEZS investiert weil auch die vorgänger schon eine Schande waren mit dem Wechsel und den damals attraktiven Fundamentaldaten dachte ich das könnte jetzt was werden tja leider hat er sich als eine noch größere Enttäuschung herausgestellt seine Vorgänger .
----
@kalpchen
Die meisten Verkäufe fanden statt als die Aktie ein Mehrjahreshoch erreicht hatte da ging es kurzfristig über die $1 Marke das weiß ich noch ganz genau weil ich auch in diesem Zeitraum verkauft habe warum also sollte das Management nicht auch ein paar Aktien abstossen ? Der Gründer und seine Frau sitzen immer noch auf einen riesigen Aktienpaket das was verkauft wurde ist nicht mehr als peanuts .
Horst G. Zerbe 4,754,644 <<<<
Ingrid Zerbe 5,721,356.5 <<<<
Bernard J. Boudreau 101,250
Ian Troup 37,500
Paul A. Simmon 310,000
Bernd J. Melcher 120,000
John Marinucc 75,000
All directors and officers as a group (7 persons) 11,119,751 17.52%
Das ist ja direkt eine beleidigung für IGXT mit diesen Versagern von AEZS verglichen zu werden .Hier gibt es einen wesentlichen Unterschied und zwar ist CEO Zerbe auch gleichzeitig der Gründer von Intelgenx und Eigentümer gehen in der Regel viel Verantwortungsvoller mit ihrem Unternehmen um .
Der komplett Versager CEO Dodd ist nur ein Geschäftsführer von AEZS und hat in kaum 2 Jahren die Firma ruiniert .Ich hätte niemals in AEZS investiert weil auch die vorgänger schon eine Schande waren mit dem Wechsel und den damals attraktiven Fundamentaldaten dachte ich das könnte jetzt was werden tja leider hat er sich als eine noch größere Enttäuschung herausgestellt seine Vorgänger .
----
@kalpchen
Die meisten Verkäufe fanden statt als die Aktie ein Mehrjahreshoch erreicht hatte da ging es kurzfristig über die $1 Marke das weiß ich noch ganz genau weil ich auch in diesem Zeitraum verkauft habe warum also sollte das Management nicht auch ein paar Aktien abstossen ? Der Gründer und seine Frau sitzen immer noch auf einen riesigen Aktienpaket das was verkauft wurde ist nicht mehr als peanuts .
Horst G. Zerbe 4,754,644 <<<<
Ingrid Zerbe 5,721,356.5 <<<<
Bernard J. Boudreau 101,250
Ian Troup 37,500
Paul A. Simmon 310,000
Bernd J. Melcher 120,000
John Marinucc 75,000
All directors and officers as a group (7 persons) 11,119,751 17.52%
Ist es IDT eigentlich überhaupt nicht mehr wert, darüber ein paar Zeilen zu verlieren ? 
Kann man IDT mit TELESTA oder PEDIAPHARM überhaupt vergleichen ?
mfg
skipper

Kann man IDT mit TELESTA oder PEDIAPHARM überhaupt vergleichen ?
mfg
skipper
Antwort auf Beitrag Nr.: 51.092.241 von skipper2004 am 15.11.15 08:59:23Probiert es mal zusammenzufassen:
idt lizenziert/kauft bestehende zugelassene medikamente und produziert.
Pediapharm kümmert sich i.w. um Medikamente usw die noch nicht in canada zugelassen sind, treibt den Zulassungsprozess canada (&aktuell eine Lizenzierungsgeschichte für USA), auch mit dem Risiko, dass es auch mal nicht klappt. Aber relativ sicher da die Medikamente schon in anderen Ländern zugelassen sind.
Telesta will aktuell EIN Medikament zulassen und ist i.w. ein ein Produktunternehmem (haben abgeleitet von ihrem Wirkstoff noch ein paar Ableger in petto, für mich aber folgend vom Wirkstoff). ...hier heisst es alles oder wenig :-)
...Tipp von mir: mache (auch wenn es aufwändig ist) immer deine eigene research (website, geschäftsbericht usw...) würde mein Geld nicht auf Basis reiner Forenaussagen investieren (wenn es dann weg ist, kannst dir zumindest das im nachhinein nicht vorwerfen)
idt lizenziert/kauft bestehende zugelassene medikamente und produziert.
Pediapharm kümmert sich i.w. um Medikamente usw die noch nicht in canada zugelassen sind, treibt den Zulassungsprozess canada (&aktuell eine Lizenzierungsgeschichte für USA), auch mit dem Risiko, dass es auch mal nicht klappt. Aber relativ sicher da die Medikamente schon in anderen Ländern zugelassen sind.
Telesta will aktuell EIN Medikament zulassen und ist i.w. ein ein Produktunternehmem (haben abgeleitet von ihrem Wirkstoff noch ein paar Ableger in petto, für mich aber folgend vom Wirkstoff). ...hier heisst es alles oder wenig :-)
...Tipp von mir: mache (auch wenn es aufwändig ist) immer deine eigene research (website, geschäftsbericht usw...) würde mein Geld nicht auf Basis reiner Forenaussagen investieren (wenn es dann weg ist, kannst dir zumindest das im nachhinein nicht vorwerfen)
Antwort auf Beitrag Nr.: 51.092.424 von calvin1977 am 15.11.15 09:55:24Vielen Dank erstmal  ....kennst du dich auch mit IDT AUSTRALIA ein wenig aus ?
....kennst du dich auch mit IDT AUSTRALIA ein wenig aus ?
mfg
skipper
 ....kennst du dich auch mit IDT AUSTRALIA ein wenig aus ?
....kennst du dich auch mit IDT AUSTRALIA ein wenig aus ?mfg
skipper
Ich mein ein wenig genauer  )))
)))
 )))
)))
sagen wir mal bzgl. Chancen auf mögliche Kursentwicklung 
mfg

mfg
sagen wir mal bzgl. Chancen auf mögliche Kursentwicklung und Potential 
mfg

mfg
Sehe es ähnlich wie Biohero (den ich hochgradig schätze...wo der die interessanten Werte findet...keine Ahnung...aber ohne ihn wäre so einiges an mir vorbeigegangen):
Kurzfristig ist pediapharm interessanter.
Mittel bis langfristig machst mit idt nix falsch. Gehe davon azs, dass die für ihre Einlizenzierung nochmal irgendwann Kapital brauchen und etwas verwässern. Kursziel: bin leider kein Prophet ;-)
Kurzfristig ist pediapharm interessanter.
Mittel bis langfristig machst mit idt nix falsch. Gehe davon azs, dass die für ihre Einlizenzierung nochmal irgendwann Kapital brauchen und etwas verwässern. Kursziel: bin leider kein Prophet ;-)
Antwort auf Beitrag Nr.: 51.092.562 von calvin1977 am 15.11.15 10:14:33Ich bin in PEDIAPHARM drin (rel.wenig), bei TELESTA raus ( is mir im Moment zu heikel - auch wenn ich ev. den Zug verpasse, was ich nicht glaube ) und bei ID wart ich nochmal ab.
Ich wünsch dir viel Glück.
fg
skipper
Ich wünsch dir viel Glück.
fg
skipper
aja...und INTELGENX steht ganz knapp vor einem Engagement meinerseits 

Antwort auf Beitrag Nr.: 51.092.631 von skipper2004 am 15.11.15 10:28:17Good luck ;-)
Die haben wir ja fast vergessen 

New Laboratory and Manufacturing Facilitie 19.12.2015
Habe mir hier einmal die Seite angeschaut und durch die Pipeline gelesen.Auf der HP sind ein paar Bilder der Neuen Produktionsanlage sowie des Labors das eingerichtet wurde.
Finde die Pipeline und Story sehr interessant und werde denke ich auch einmal ein Körbchen aufstellen.
http://www.intelgenx.com/Home/default.aspx





so long
Nantor

Intelgenx ist neben Redhill so meine Topfavoriten die ich sofort ins Depot legen würde wenn die Marktlage nicht so miserabel wäre . Für 2016 erwartet IGXT die Zulassung für ihren Game Changer das mit Par Pharma verpartnert ist und weiterhin rechnet man den Zulassungsantrag für das Potenzmittel . Hinzu kommt eine Partnerschaft für Rizaport und dessen Markteinführung in Europa .
All das kriegt man für eine Marktkap von nur $31 Million also man muss wirklich kein Experte sein um zu erkennen das die Aktie spottbillig ist . Wie gesagt wenn die Marktlage nicht so desaströs wäre hätte ich diese Aktie sofort ins Depot gelegt .
Intelgenx (IGXT)
Marktkap: $31 M
Cash:2.3 M
Insiderkäufe
https://www.canadianinsider.com/company?menu_tickersearch=ig…
Neue Präsentation
http://s2.q4cdn.com/790425727/files/doc_presentations/2016/I…

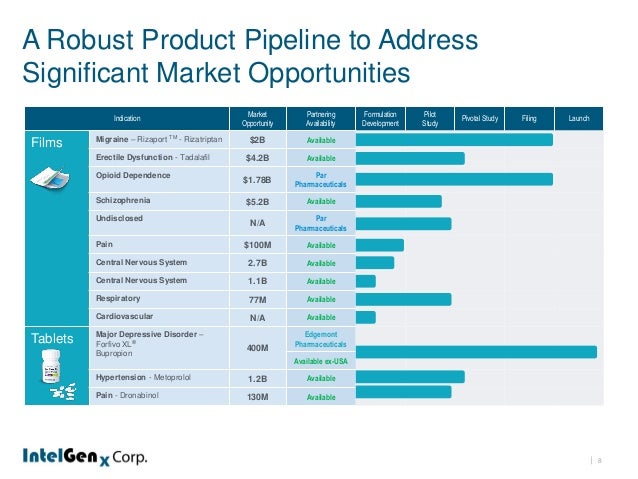
All das kriegt man für eine Marktkap von nur $31 Million also man muss wirklich kein Experte sein um zu erkennen das die Aktie spottbillig ist . Wie gesagt wenn die Marktlage nicht so desaströs wäre hätte ich diese Aktie sofort ins Depot gelegt .
Intelgenx (IGXT)
Marktkap: $31 M
Cash:2.3 M
Insiderkäufe
https://www.canadianinsider.com/company?menu_tickersearch=ig…
Neue Präsentation
http://s2.q4cdn.com/790425727/files/doc_presentations/2016/I…


Kennt sich jemand mit diesem Zeugs aus?
Mein Englisch ist dafür leider nicht gut genug für die Details...
SUBOXONE® SUBLINGUAL FILM
14. Plaintiff RBP is the holder of New Drug Application (“NDA”) No. 22-410 for
Suboxone® (buprenorphine hydrochloride and naloxone hydrochloride) sublingual film.
15. On August 30, 2010, the FDA approved NDA No. 22-410 for the manufacture,
marketing, and sale of Suboxone® sublingual film for the maintenance treatment of opioid
dependence. Plaintiff RBP has sold Suboxone® sublingual film under NDA No. 22-410 since its
approval.
https://search.rpxcorp.com/litigation_documents/11102666
so long
Nantor
Mein Englisch ist dafür leider nicht gut genug für die Details...
SUBOXONE® SUBLINGUAL FILM
14. Plaintiff RBP is the holder of New Drug Application (“NDA”) No. 22-410 for
Suboxone® (buprenorphine hydrochloride and naloxone hydrochloride) sublingual film.
15. On August 30, 2010, the FDA approved NDA No. 22-410 for the manufacture,
marketing, and sale of Suboxone® sublingual film for the maintenance treatment of opioid
dependence. Plaintiff RBP has sold Suboxone® sublingual film under NDA No. 22-410 since its
approval.
https://search.rpxcorp.com/litigation_documents/11102666
so long
Nantor

Ich habe mir in den letzten tagen ein paar Aktien zugelegt konnte den unverschämt niedrigen Kurs einfach nicht widerstehen .Warum bin ich gerade jetzt eingestiegen ? Ganz einfach weil IGXT kurz davor steht einige Deals abzuschließen, für 3 Produkte hat man eine Absichtserklärung(Therm Sheet) von einem Pharmakonzern und man ist in Gesprächen für 2 weitere Produkte mit Interessenten . Außerdem werden bald die US-Zulassungsanträge (4Q) für Rizaport (Migräne) und Tadalafil (Potenzmittel /version von Cialis ) eingereicht unten sind die Folien dazu abgebildet .
Desweiteren könnte jederzeit für das Produkt (opioid dependence) das an Par Pharma lizenziert ist das "tentative approval" von der FDA kommen .
IGXT ist auf meiner favoritenliste ganz ganz weit oben was Risiko ,Pipeline und Potenzial angeht ist diese Aktie fast unschlagbar . Ich halte die Aktie nach wie vor für einen potentiellen 10 bagger .
http://www.intelgenx.com/investors/press-releases/press-rele…
Announced a development and commercialization term sheet with a global pharmaceutical company for up to three products. If entered into, IntelGenx expects the definitive agreement to be finalized in the second quarter of 2016
Marktkap : $30.5 Million
Cash: $2.1 M
Kurs: $0.48
Burn-rate: ca $400k per Quartal
Presentation Juli 2016
http://s2.q4cdn.com/790425727/files/doc_presentations/2016/I…

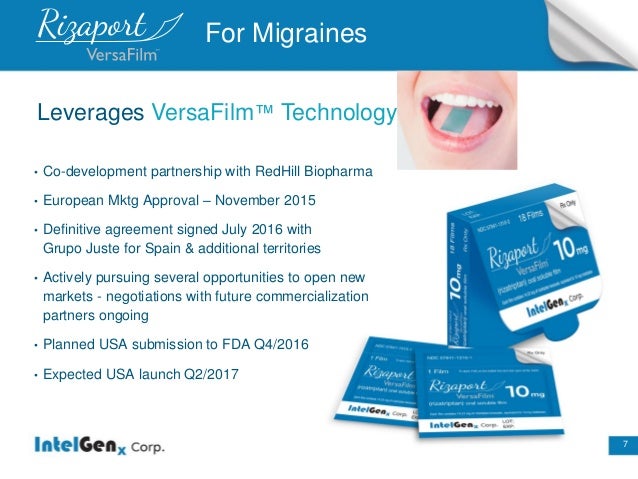
IntelGenx to Initiate Phase 1 Trial of Montelukast....July 13, 2016
http://www.intelgenx.com/investors/press-releases/press-rele…
IntelGenx Corp., (TSX VENTURE:IGX)(OTCQX:IGXT), today announced the recent initiation of a phase 1 clinical trial of montelukast, a unique drug repurposing opportunity for the treatment of degenerative diseases of the brain, such as: mild cognitive impairment and Alzheimers disease, the most prominent form of dementia.
IntelGenx expects results from the phase 1 trial to be available in September 2016. Following the completion of the phase 1 results, the Company will begin preparation work to initiate a phase 2 study where patients will be enrolled. IntelGenx will be actively seeking a partnership or alliance opportunity to complete the remaining developmental work and commercialization of this product.

Desweiteren könnte jederzeit für das Produkt (opioid dependence) das an Par Pharma lizenziert ist das "tentative approval" von der FDA kommen .
IGXT ist auf meiner favoritenliste ganz ganz weit oben was Risiko ,Pipeline und Potenzial angeht ist diese Aktie fast unschlagbar . Ich halte die Aktie nach wie vor für einen potentiellen 10 bagger .
http://www.intelgenx.com/investors/press-releases/press-rele…
Announced a development and commercialization term sheet with a global pharmaceutical company for up to three products. If entered into, IntelGenx expects the definitive agreement to be finalized in the second quarter of 2016
Marktkap : $30.5 Million
Cash: $2.1 M
Kurs: $0.48
Burn-rate: ca $400k per Quartal
Presentation Juli 2016
http://s2.q4cdn.com/790425727/files/doc_presentations/2016/I…


IntelGenx to Initiate Phase 1 Trial of Montelukast....July 13, 2016
http://www.intelgenx.com/investors/press-releases/press-rele…
IntelGenx Corp., (TSX VENTURE:IGX)(OTCQX:IGXT), today announced the recent initiation of a phase 1 clinical trial of montelukast, a unique drug repurposing opportunity for the treatment of degenerative diseases of the brain, such as: mild cognitive impairment and Alzheimers disease, the most prominent form of dementia.
IntelGenx expects results from the phase 1 trial to be available in September 2016. Following the completion of the phase 1 results, the Company will begin preparation work to initiate a phase 2 study where patients will be enrolled. IntelGenx will be actively seeking a partnership or alliance opportunity to complete the remaining developmental work and commercialization of this product.

Antwort auf Beitrag Nr.: 52.859.287 von Biohero am 18.07.16 20:25:57Achso hab noch vergessen zu erwähnen das eigentlich der mögliche Partnerdeal schon im 2Q abgeschlossen werden sollte aber es ist nicht ungewöhnlich das sich sowas etwas verzögert es könnte also jeden tag die News dazu kommen .
Announced a development and commercialization term sheet with a global pharmaceutical company for up to three products. If entered into, IntelGenx expects the definitive agreement to be finalized in the second quarter of 2016
Announced a development and commercialization term sheet with a global pharmaceutical company for up to three products. If entered into, IntelGenx expects the definitive agreement to be finalized in the second quarter of 2016
Antwort auf Beitrag Nr.: 52.859.356 von Biohero am 18.07.16 20:40:50Diese Aktie dümpelt seit 10 Jahres auf diesem Niveau herum. Warum soll die steigen? Cash ist extrem dünn, wenn Du mich fragst....
Antwort auf Beitrag Nr.: 52.867.039 von Radiesel2008 am 19.07.16 17:12:32er hats beschrieben, warum...
Antwort auf Beitrag Nr.: 52.867.795 von giesarazu am 19.07.16 18:49:12Das sind immer die "super" Kommentare....
Wenn Du Dir die Threads zu diesem Thema anschaust, bis zurück zu 2009 (!!!) dann wirst evtl. auch Du erkennen, dass schon da von anstehenden Verpartnerungen etc. geredet wurde. Trotz alledem hat die Aktie sich nicht vom Fleck bewegt.
Deshalb meine Frage: Warum ausgerechnet jetzt ?
Wenn Du Dir die Threads zu diesem Thema anschaust, bis zurück zu 2009 (!!!) dann wirst evtl. auch Du erkennen, dass schon da von anstehenden Verpartnerungen etc. geredet wurde. Trotz alledem hat die Aktie sich nicht vom Fleck bewegt.
Deshalb meine Frage: Warum ausgerechnet jetzt ?
Antwort auf Beitrag Nr.: 52.868.089 von Radiesel2008 am 19.07.16 19:43:54Vom Apfelkern bis zum Apfelbaum der Früchte trägt dauert es ein paar Jahre entwicklungszeit genauso wie bei IGXT . IPO war glaube ich 2007 mit nichts in der Pipeline hat es ein paar Jahre gedauert um die Pipeline auszubauen und die Produkte bis zur Marktreife zu bringen . Interessant ist die Firma jetzt eben deshalb weil mehrere Produkte nahe der Zulassung sind und einige Deals anstehen . Außerdem erhielt IGXT vor kurzem die Zulassung für Rizaport in Deutschland weitere EU Staaten werden bald folgen , der Verkaufsstart in Europa ist in naher Zukunft heißt also ein weiteres Produkt wird bald für Umsatz sorgen .
Mit Deals und den US Zulassungsanträgen könnte hier wieder einiges an Action reinkommen vorausgesetzt das Management hält sich an ihren eignen Zeitplan .
Mit Deals und den US Zulassungsanträgen könnte hier wieder einiges an Action reinkommen vorausgesetzt das Management hält sich an ihren eignen Zeitplan .
Antwort auf Beitrag Nr.: 52.868.467 von Biohero am 19.07.16 20:40:07Danke sehr !
Ach, ich kann sie eh nicht kaufen.... 

Hab nochmal nach gefragt was mit dem Deal ist und es ist so wie ich es schon erwähnt habe es verzögert sich etwas das ist nichts ungewöhnliches.
Dear xxxxxx,
Thank you for your email and support as a shareholder.
IntelGenx has gone through an extensive due diligence process which we have completed on our side all the work required. We are working hard with the major pharmaceutical company to finalize a definitive agreement. As soon as the agreement is finalized we will announce. Going forward we will not be announcing term sheets, only definitive agreements. We just closed Grupo Juste and instead of people being pleased by IntelGenx closing its first commercialization deal, we were reminded that we were a month late. Agreements take considerable amount of time. We have to make sure they are closed properly that IntelGenx is protected with a long term plan in mind.
Please do not hesitate to contact me.
Best regards,
Edward
cid:image001.png@01D1D22B.22A3C580
Edward Miller
Director, IR & Corporate Communications
6420 Abrams
St-Laurent (Quebec) H4S 1Y2
( Direct: (514) 331-7440 ext 217
( Mobile: (514) 824-6300
* Email: edward@intelgenx.com
m Web: www.intelgenx.com
(OTCQX:IGXT; TSX-V:IGX)
Dear xxxxxx,
Thank you for your email and support as a shareholder.
IntelGenx has gone through an extensive due diligence process which we have completed on our side all the work required. We are working hard with the major pharmaceutical company to finalize a definitive agreement. As soon as the agreement is finalized we will announce. Going forward we will not be announcing term sheets, only definitive agreements. We just closed Grupo Juste and instead of people being pleased by IntelGenx closing its first commercialization deal, we were reminded that we were a month late. Agreements take considerable amount of time. We have to make sure they are closed properly that IntelGenx is protected with a long term plan in mind.
Please do not hesitate to contact me.
Best regards,
Edward
cid:image001.png@01D1D22B.22A3C580
Edward Miller
Director, IR & Corporate Communications
6420 Abrams
St-Laurent (Quebec) H4S 1Y2
( Direct: (514) 331-7440 ext 217
( Mobile: (514) 824-6300
* Email: edward@intelgenx.com
m Web: www.intelgenx.com
(OTCQX:IGXT; TSX-V:IGX)
Hier ein Überblick über das was an News ansteht :
•Announced a development and commercialization term sheet with a global pharmaceutical company for up to three products. If entered into, IntelGenx expects the definitive agreement to be finalized in the second quarter of 2016
IntelGenx Corp., today announced the recent initiation of a phase 1 clinical trial of montelukast, a unique drug repurposing opportunity for the treatment of degenerative diseases of the brain, such as: mild cognitive impairment and Alzheimers disease, the most prominent form of dementia.
IntelGenx expects results from the phase 1 trial to be available in September 2016.
Product :Rizaport (Migraine)
•European Mktg Approval–November 2015
•Planned USA submission to FDA Q4/2016
•Expected USA launch Q2/2017
Product :Tadalafil (Erectile Dysfunction) a better Oral thin-film version of Blockbuster Drug Cialis
•505(b)(2) USA NDA submission in Q4/2016
•Expected USA launch Q4/2017
Product :Indicated for Opioid Dependence
•Awaiting FDA approval
•According to IMS data, the oral film market for opioid dependence was worth more than $1.4B US in 2014.
•Announced a development and commercialization term sheet with a global pharmaceutical company for up to three products. If entered into, IntelGenx expects the definitive agreement to be finalized in the second quarter of 2016
IntelGenx Corp., today announced the recent initiation of a phase 1 clinical trial of montelukast, a unique drug repurposing opportunity for the treatment of degenerative diseases of the brain, such as: mild cognitive impairment and Alzheimers disease, the most prominent form of dementia.
IntelGenx expects results from the phase 1 trial to be available in September 2016.
Product :Rizaport (Migraine)
•European Mktg Approval–November 2015
•Planned USA submission to FDA Q4/2016
•Expected USA launch Q2/2017
Product :Tadalafil (Erectile Dysfunction) a better Oral thin-film version of Blockbuster Drug Cialis
•505(b)(2) USA NDA submission in Q4/2016
•Expected USA launch Q4/2017
Product :Indicated for Opioid Dependence
•Awaiting FDA approval
•According to IMS data, the oral film market for opioid dependence was worth more than $1.4B US in 2014.
Antwort auf Beitrag Nr.: 52.877.455 von Biohero am 20.07.16 20:59:51Hier im Orderbuch kann man sehen wie dünn der ASK ist das heißt ein kleiner käufer kann die Aktie schnell in die höhe treiben und erst recht wenn gute News kommen .
http://www.otcmarkets.com/stock/IGXT/quote
http://www.otcmarkets.com/stock/IGXT/quote

Antwort auf Beitrag Nr.: 52.884.193 von Biohero am 21.07.16 16:27:39Nach Unten scheint eine leichte Absicherung zu sein laut Orderbuch.
Antwort auf Beitrag Nr.: 52.889.290 von Maggi110 am 22.07.16 09:35:20Die Aktie wird von den Market Maker manipuliert da bin ich mir ganz sicher das ist nicht selten an der OTC vor allem wenn das Volumen schwach ist .Es braucht mehr Volumen oder News um denen einen strich durch die rechnung zumachen .
Ein paar Infos über das neue Produkt in der Pipeline das wenn es in den klinischen Studien erfolgreich ist mit hoher sicherheit Blockbuster Potential hat .
Montelukast
http://arznei-news.de/montelukast/
Montelukast
http://arznei-news.de/montelukast/
Antwort auf Beitrag Nr.: 52.909.471 von Biohero am 25.07.16 16:05:50
Mit Sicherheit nicht. Singulair ist längst generisch. Wo siehts du da Blockbuster Potenzial?
http://www.onmeda.de/Medikament/SINGULAIR+10mg+Filmtabletten…
Zitat von Biohero: Ein paar Infos über das neue Produkt in der Pipeline das wenn es in den klinischen Studien erfolgreich ist mit hoher sicherheit Blockbuster Potential hat .
Montelukast
http://arznei-news.de/montelukast/
Mit Sicherheit nicht. Singulair ist längst generisch. Wo siehts du da Blockbuster Potenzial?
http://www.onmeda.de/Medikament/SINGULAIR+10mg+Filmtabletten…
Antwort auf Beitrag Nr.: 52.909.645 von kmastra am 25.07.16 16:23:48
24.07.2016 IntelGenx hat eine Phase-1-Studie zu Montelukast gestartet, das als neues potentielles Medikament zur Behandlung von degenerativen Erkrankungen des Gehirns, wie leichte kognitive Beeinträchtigung und Alzheimer-Krankheit ausgewertet werden soll.
Montelukast ist ein oral wirksamer Arzneistoff zur Behandlung von leichtem bis mittelschwerem Asthma und allergischer Rhinitis. Er kam 1998 in Deutschland als Singulair auf den Markt.
24.07.2016 IntelGenx hat eine Phase-1-Studie zu Montelukast gestartet, das als neues potentielles Medikament zur Behandlung von degenerativen Erkrankungen des Gehirns, wie leichte kognitive Beeinträchtigung und Alzheimer-Krankheit ausgewertet werden soll.
Montelukast ist ein oral wirksamer Arzneistoff zur Behandlung von leichtem bis mittelschwerem Asthma und allergischer Rhinitis. Er kam 1998 in Deutschland als Singulair auf den Markt.
Antwort auf Beitrag Nr.: 52.909.723 von Biohero am 25.07.16 16:33:00Alles klar. Das hatte ich überlesen.
Bei Erfolg wäre Blockbuster Potenzial drin. Doch wie wahrscheinlich ein Erfolg ist - da bin ich eher skeptisch!
Bei Erfolg wäre Blockbuster Potenzial drin. Doch wie wahrscheinlich ein Erfolg ist - da bin ich eher skeptisch!
Antwort auf Beitrag Nr.: 52.910.044 von kmastra am 25.07.16 17:09:01Deshalb ist es gut wenn man eine ziemlich breite Pipeline hat . Es braucht nur die Zulassung für das Produkt (gegen Opiatabhängigkeit) das mit Par Pharma ( jetzt Endo Pharma ENDP) verpartnert ist und IGXT ist innerhalb kürzester Zeit profitabel dann stehen noch Rizaport und Tadalafil (Potenzmittel) kurz vor dem Eintritt in den US Markt das hier kann sich zu einer Rakete entwickeln .


Hallo Biohero,
Ich hätte eine Frage bezüglich Rizaport:
Es wurde ja mit Redhill zusammen entwickelt. Weist du wie die Einnahmen aufgeteilt sind? Habe dazu nichts gefunden. Könnte man von 50:50 ausgehen?
Ich hätte eine Frage bezüglich Rizaport:
Es wurde ja mit Redhill zusammen entwickelt. Weist du wie die Einnahmen aufgeteilt sind? Habe dazu nichts gefunden. Könnte man von 50:50 ausgehen?
Antwort auf Beitrag Nr.: 52.910.713 von vautee am 25.07.16 18:10:28License Agreement for RHB-103
In addition, we are required to make royalty payments to IntelGenx Corp. of 20% of net sales if the product is marketed by us and 60% of the first $2 million of net sublicense fees, and 40% of net sublicensing fees thereafter, in if the product is marketed by sublicensees. However, if we bear the regulatory costs in a sublicense arrangement, royalties will be 20% of net sublicense fees until we recover these costs, plus 10% interest, and if IntelGenx Corp. bears such costs, royalties will be 70% of net sublicense fees.
The agreement provides that all intellectual property developed or to be developed exclusively by IntelGenx Corp. will belong exclusively to IntelGenx Corp. and will be licensed to us, and the intellectual property to be developed or financed jointly by IntelGenx Corp. and us will be jointly owned by us and IntelGenx Corp., and each party may make use of such joint intellectual property for uses not competing with either the product or the other party.
The agreement is of unlimited duration and will remain in force until terminated in accordance with its terms.
-------
Nochmal als kleiner Hinweis die FDA hatte damals Rizaport weder Wirksamkeit noch das Sicherheitsprofil in Frage gestellt sondern nur die Herstellung für das eine andere Firma (hab den namen vergessen) bis zu dem Zeitpunkt verantwortlich war . Inzwischen hat IGXT die Herstellung selbst in die hand genommen und sich neue Maschinen gekauft um diese ThinFilm selber zu produzieren das war aufjedenfall ein feiner zug und wird sich langfristig bezahlt machen . Die Zulassung dürfte also bei einem erneuertem Antrag flüssig durchgehen .
BfArM-Genehmigung für Behandlung von Migräne
http://arznei-news.de/rizatriptan/
RedHill Biopharma und IntelGenx reichten eine New Drug Application (NDA) bei der US Food and Drug Administration im Jahr 2013 ein.
Sie erhielten einen Complete Response Letter von der FDA im Jahr 2014 unter Verweis auf offene Fragen im Zusammenhang mit Chemie, Herstellung und Kontrollen
In addition, we are required to make royalty payments to IntelGenx Corp. of 20% of net sales if the product is marketed by us and 60% of the first $2 million of net sublicense fees, and 40% of net sublicensing fees thereafter, in if the product is marketed by sublicensees. However, if we bear the regulatory costs in a sublicense arrangement, royalties will be 20% of net sublicense fees until we recover these costs, plus 10% interest, and if IntelGenx Corp. bears such costs, royalties will be 70% of net sublicense fees.
The agreement provides that all intellectual property developed or to be developed exclusively by IntelGenx Corp. will belong exclusively to IntelGenx Corp. and will be licensed to us, and the intellectual property to be developed or financed jointly by IntelGenx Corp. and us will be jointly owned by us and IntelGenx Corp., and each party may make use of such joint intellectual property for uses not competing with either the product or the other party.
The agreement is of unlimited duration and will remain in force until terminated in accordance with its terms.
-------
Nochmal als kleiner Hinweis die FDA hatte damals Rizaport weder Wirksamkeit noch das Sicherheitsprofil in Frage gestellt sondern nur die Herstellung für das eine andere Firma (hab den namen vergessen) bis zu dem Zeitpunkt verantwortlich war . Inzwischen hat IGXT die Herstellung selbst in die hand genommen und sich neue Maschinen gekauft um diese ThinFilm selber zu produzieren das war aufjedenfall ein feiner zug und wird sich langfristig bezahlt machen . Die Zulassung dürfte also bei einem erneuertem Antrag flüssig durchgehen .
BfArM-Genehmigung für Behandlung von Migräne
http://arznei-news.de/rizatriptan/
RedHill Biopharma und IntelGenx reichten eine New Drug Application (NDA) bei der US Food and Drug Administration im Jahr 2013 ein.
Sie erhielten einen Complete Response Letter von der FDA im Jahr 2014 unter Verweis auf offene Fragen im Zusammenhang mit Chemie, Herstellung und Kontrollen
Danke für die schnelle Antwort!
Das hört sich ja schonmal gut an. Ende des Jahres soll ja ein neuer PDUFA Termin für Rizaport kommen.
Vielleicht sind die Aktien bis dahin auch bei meiner Bank handelbar..
Das hört sich ja schonmal gut an. Ende des Jahres soll ja ein neuer PDUFA Termin für Rizaport kommen.
Vielleicht sind die Aktien bis dahin auch bei meiner Bank handelbar..
Ein Überblick über die größten Aktionäre ....
Insider Ownership :
Horst G. Zerbe 4,670,243.5 7.34%
Ingrid Zerbe 5,471,356.5 8.60%
Bernard J. Boudreau 287,500
Bernd Melcher 232,500
Andre Godin 214,500
Ian Troup 187,500
John Marinucc 175,000
Nadine Paiement 135,000
Clemens Mayr 68,750
John Durham 50,000
Robert Bechard 10,000
All directors and officers as a group (11 persons) 11,502,351 18.08%
Institutional Holders :
Alpha Capital ...3.2M
Roadmap Capital Inc. 3.1M
Insiderkäufe
BECHARD ROBERT J.
Officer
Purchase at $0.47 - $0.51 per share. Direct 4,900 Jan 22, 2016 10,000
BOUDREAU BERNARD
Director
Purchase at $0.51 - $0.51 per share. Indirect 6,120 Jan 22, 2016 12,000
BOUDREAU BERNARD
Director
Purchase at $0.51 - $0.51 per share. Direct 19,000 Jan 22, 2016 38,000
BOUDREAU BERNARD
Director
Purchase at $0.45 - $0.45 per share. Indirect 3,375 Jan 21, 2016 7,500
GODIN ANDRE
Officer
Purchase at $0.40 - $0.4 per share. Direct 8,000 Jan 20, 2016 20,000
BOUDREAU BERNARD
Director
Purchase at $0.41 - $0.41 per share. Indirect 3,075 Jan 20, 2016 7,500
PAIEMENT NADINE
Officer
Statement of Ownership Direct Jan 19, 2016 50,000
GODIN ANDRE
Officer
Purchase at $0.52 - $0.52 per share. Direct 4,940 Dec 30, 2015 9,500
GODIN ANDRE
Officer
Purchase at $0.51 - $0.51 per share. Direct 7,828 Dec 23, 2015 15,350
GODIN ANDRE
Officer
Purchase at $0.50 - $0.51 per share. Direct 6,640 Dec 22, 2015 13,150
GODIN ANDRE
Officer
Purchase at $0.50 - $0.5 per share. Direct 3,250 Dec 21, 2015 6,500
Insider Ownership :
Horst G. Zerbe 4,670,243.5 7.34%
Ingrid Zerbe 5,471,356.5 8.60%
Bernard J. Boudreau 287,500
Bernd Melcher 232,500
Andre Godin 214,500
Ian Troup 187,500
John Marinucc 175,000
Nadine Paiement 135,000
Clemens Mayr 68,750
John Durham 50,000
Robert Bechard 10,000
All directors and officers as a group (11 persons) 11,502,351 18.08%
Institutional Holders :
Alpha Capital ...3.2M
Roadmap Capital Inc. 3.1M
Insiderkäufe
BECHARD ROBERT J.
Officer
Purchase at $0.47 - $0.51 per share. Direct 4,900 Jan 22, 2016 10,000
BOUDREAU BERNARD
Director
Purchase at $0.51 - $0.51 per share. Indirect 6,120 Jan 22, 2016 12,000
BOUDREAU BERNARD
Director
Purchase at $0.51 - $0.51 per share. Direct 19,000 Jan 22, 2016 38,000
BOUDREAU BERNARD
Director
Purchase at $0.45 - $0.45 per share. Indirect 3,375 Jan 21, 2016 7,500
GODIN ANDRE
Officer
Purchase at $0.40 - $0.4 per share. Direct 8,000 Jan 20, 2016 20,000
BOUDREAU BERNARD
Director
Purchase at $0.41 - $0.41 per share. Indirect 3,075 Jan 20, 2016 7,500
PAIEMENT NADINE
Officer
Statement of Ownership Direct Jan 19, 2016 50,000
GODIN ANDRE
Officer
Purchase at $0.52 - $0.52 per share. Direct 4,940 Dec 30, 2015 9,500
GODIN ANDRE
Officer
Purchase at $0.51 - $0.51 per share. Direct 7,828 Dec 23, 2015 15,350
GODIN ANDRE
Officer
Purchase at $0.50 - $0.51 per share. Direct 6,640 Dec 22, 2015 13,150
GODIN ANDRE
Officer
Purchase at $0.50 - $0.5 per share. Direct 3,250 Dec 21, 2015 6,500
Antwort auf Beitrag Nr.: 52.918.471 von Biohero am 26.07.16 15:24:24Der lästige 60K+ Block wurde beseitigt jetzt dürfte der weg frei sein
http://www.otcmarkets.com/stock/IGXT/quote
http://www.otcmarkets.com/stock/IGXT/quote
Antwort auf Beitrag Nr.: 52.918.888 von Biohero am 26.07.16 16:04:32Leider ein neuer Block im Weg.
Antwort auf Beitrag Nr.: 52.919.092 von Maggi110 am 26.07.16 16:33:15Hab ich gesehen jemand versucht krampfhaft die Aktie unten zuhalten womöglich im auftrag eines größeren Investors der sich noch billig eindecken will ist aber nur eine vermutung .
Antwort auf Beitrag Nr.: 52.919.239 von Biohero am 26.07.16 16:48:50So jetzt ist mal ein ordentliches Bid drin , hab jetzt auch begonnen ein paar Analysten anzuschreiben mal sehen was draus wird .
Ich werde später einen neuen thread zu dieser Aktie eröffenen da es laut Moderator nicht möglich ist das erste Posting vorne zu aktualisieren wo die Daten einfach veraltet sind .Daran sollte WO mal arbeiten das wäre eine gute Verbesserung .
Beitrag zu dieser Diskussion schreiben
Zu dieser Diskussion können keine Beiträge mehr verfasst werden, da der letzte Beitrag vor mehr als zwei Jahren verfasst wurde und die Diskussion daraufhin archiviert wurde.
Bitte wenden Sie sich an feedback@wallstreet-online.de und erfragen Sie die Reaktivierung der Diskussion oder starten Sie eine neue Diskussion.
Investoren beobachten auch:
| Wertpapier | Perf. % |
|---|---|
| +0,93 | |
| +0,07 | |
| +0,83 | |
| +0,18 | |
| +1,23 | |
| +9,65 | |
| +13,04 | |
| +1,62 | |
| -48,15 | |
| +3,77 |
Meistdiskutiert
| Wertpapier | Beiträge | |
|---|---|---|
| 178 | ||
| 147 | ||
| 71 | ||
| 51 | ||
| 49 | ||
| 39 | ||
| 34 | ||
| 32 | ||
| 31 | ||
| 31 |





















