Mast Therapeutics MSTX FDA designation !!! - 500 Beiträge pro Seite
eröffnet am 13.11.13 13:14:20 von
neuester Beitrag 10.08.18 17:20:57 von
neuester Beitrag 10.08.18 17:20:57 von
Beiträge: 132
ID: 1.188.250
ID: 1.188.250
Aufrufe heute: 0
Gesamt: 19.990
Gesamt: 19.990
Aktive User: 0
ISIN: US8051111016 · WKN: A2DQ2B · Symbol: SVRA
4,8100
USD
+0,42 %
+0,0200 USD
Letzter Kurs 19.04.24 Nasdaq
Neuigkeiten
08.04.24 · Business Wire (engl.) |
22.03.24 · Business Wire (engl.) |
07.03.24 · Business Wire (engl.) |
06.03.24 · Business Wire (engl.) |
02.02.24 · Business Wire (engl.) |
Werte aus der Branche Pharmaindustrie
| Wertpapier | Kurs | Perf. % |
|---|---|---|
| 3,5800 | +922,86 | |
| 0,5400 | +38,46 | |
| 1,9900 | +32,67 | |
| 5,4000 | +27,06 | |
| 1,8250 | +25,86 |
| Wertpapier | Kurs | Perf. % |
|---|---|---|
| 5,0100 | -26,54 | |
| 14,510 | -32,32 | |
| 3,6400 | -38,62 | |
| 0,5660 | -40,42 | |
| 84,75 | -74,50 |
Antwort auf Beitrag Nr.: 45.823.412 von fortuna924 am 13.11.13 13:14:20VB plus 21% 

Antwort auf Beitrag Nr.: 45.823.428 von fortuna924 am 13.11.13 13:15:35heute sind m.M. nach 100% möglich
Antwort auf Beitrag Nr.: 45.823.434 von fortuna924 am 13.11.13 13:16:01http://www.streetinsider.com/FDA/Mast+Therapeutics+%28MSTX%2…

Antwort auf Beitrag Nr.: 45.823.476 von fortuna924 am 13.11.13 13:20:41http://www.nasdaq.com/press-release/fda-designates-mst-188-a…
mal schauen, wie der Kurs reagiert
mal schauen, wie der Kurs reagiert
Hallo Fortuna,
100% halte ich jetzt mal nicht für realistisch aber passt schon. Wer sich über die Vorgeschichte von Mast Therapeutics informieren möchte kann sich gern den alten Thread unter dem alten Namen "Adventrex Pharm." anschauen, zu finden hier -> http://www.wallstreet-online.de/diskussion/1157423-1-10/adve…
Viel Spass
Tommi
100% halte ich jetzt mal nicht für realistisch aber passt schon. Wer sich über die Vorgeschichte von Mast Therapeutics informieren möchte kann sich gern den alten Thread unter dem alten Namen "Adventrex Pharm." anschauen, zu finden hier -> http://www.wallstreet-online.de/diskussion/1157423-1-10/adve…
Viel Spass
Tommi
Antwort auf Beitrag Nr.: 45.824.928 von Tommi33 am 13.11.13 16:00:05rohrkrepierer!!!!!!!!!!!!!

Antwort auf Beitrag Nr.: 45.827.626 von ultrawuffsn am 13.11.13 20:36:27Na,na nur nicht gehässig werden.
Tommi
Tommi
Antwort auf Beitrag Nr.: 45.827.748 von Tommi33 am 13.11.13 20:50:03eher minus 100%

Antwort auf Beitrag Nr.: 45.827.832 von ultrawuffsn am 13.11.13 21:00:46Nein, nach unten sind sie ziemlich abgesichert da passiert so schnell nix.
Guck dir an wo sie herkommen.
Tommi
Guck dir an wo sie herkommen.
Tommi
Mast have statt must have ? push it, baby
http://www.macroaxis.com/invest/compare/MSTX
http://www.macroaxis.com/invest/compare/MSTX
der DOLLAR kommt

Antwort auf Beitrag Nr.: 46.172.793 von gerdass am 07.01.14 14:31:41Die Aktie steigt und steigt, aber keiner merkt's.
Soll nicht morgen eine PK steigen?
Mit guten News heißt es: anschnallen!
Soll nicht morgen eine PK steigen?
Mit guten News heißt es: anschnallen!
Antwort auf Beitrag Nr.: 46.220.397 von wegith am 13.01.14 19:54:02
doch doch, ich habe seit gestern gemerkt und ich spiele seit gestern mit.
schön, dass auch der gerdass dabei ist. warum er aber nicht bashen tut, ist mir erstaunlich.




doch doch, ich habe seit gestern gemerkt und ich spiele seit gestern mit.
schön, dass auch der gerdass dabei ist. warum er aber nicht bashen tut, ist mir erstaunlich.





Da gibt es gaaaaaar nix zu bashen, weil
1. ziehen wir hoffentlich an einem strang
2. pushed die Aktie heut Abend von ganz allein!!!!!!
Willkommen im "Club" G1 !!!!

1. ziehen wir hoffentlich an einem strang
2. pushed die Aktie heut Abend von ganz allein!!!!!!
Willkommen im "Club" G1 !!!!

Antwort auf Beitrag Nr.: 46.223.971 von wegith am 14.01.14 13:37:52
das kommt davon, weil ich überall wo ich den gerdass treffe, nur bashen tut, weil er immer und überall short ist



das kommt davon, weil ich überall wo ich den gerdass treffe, nur bashen tut, weil er immer und überall short ist




Antwort auf Beitrag Nr.: 46.223.971 von wegith am 14.01.14 13:37:52
67k im bid zu 0,99
wenn die eg sind, dann geht es weiter
67k im bid zu 0,99
wenn die eg sind, dann geht es weiter
fakeorder ist weg
Antwort auf Beitrag Nr.: 46.224.993 von gauner1 am 14.01.14 15:33:29Gauner, heute machen wir Beute!
Keine Quelle, aber SEHR freudige Annahme
Keine Quelle, aber SEHR freudige Annahme
auch hier braucht man dicke nerven
jezz bin ich auch drin.
mit einem pusher, einem shorter und einem gauner.
denke, das geht nicht gut
mit einem pusher, einem shorter und einem gauner.
denke, das geht nicht gut
Antwort auf Beitrag Nr.: 46.225.199 von BELGIEN am 14.01.14 15:55:14du siehst also, in welche gesellschaft du eingetreten bist






















Antwort auf Beitrag Nr.: 46.225.199 von BELGIEN am 14.01.14 15:55:14Hallo Belgien!
Pusher, was für ein Pusher?
Schau dir die Umsätze in NYSE an, MAST pusht sich von allein!
Einziges Problem: hier kriegts scheinbar keiner mit!
Warten wir die PK heute Abend ab...
Viel Glück,
Paul.
Pusher, was für ein Pusher?
Schau dir die Umsätze in NYSE an, MAST pusht sich von allein!
Einziges Problem: hier kriegts scheinbar keiner mit!
Warten wir die PK heute Abend ab...
Viel Glück,
Paul.

Antwort auf Beitrag Nr.: 46.225.857 von wegith am 14.01.14 16:57:27
weißt du, was diese firma überhaupt herstellt ?
haarwuchsmittel ?
potenzmittel ?
pillen gegen armut ?
NA; WAS DENN ß
weißt du, was diese firma überhaupt herstellt ?
haarwuchsmittel ?
potenzmittel ?
pillen gegen armut ?
NA; WAS DENN ß
ist der anstieg von gestern nur hochzockerei gewesen, oder steckt was erntes dahinter ?
wieso war gestern der kurs stundenlang in minus und endete mit deutlichen plus ?
könnte gute news unterwegs sein ?
wieso war gestern der kurs stundenlang in minus und endete mit deutlichen plus ?
könnte gute news unterwegs sein ?
Antwort auf Beitrag Nr.: 46.226.757 von gauner1 am 14.01.14 18:18:53Es IST (so weit ich gelesen habe) gute News unterwegs.
Um 23.10h gips eine PK, und die wird wohl (hoffentlich) kaum eine Blase werden.
Vorstellung medikamentstudie etc.
Schau dir mal die Umsatzzahlen NYSE an, der Hammer......
Um 23.10h gips eine PK, und die wird wohl (hoffentlich) kaum eine Blase werden.
Vorstellung medikamentstudie etc.
Schau dir mal die Umsatzzahlen NYSE an, der Hammer......
wenn jemand weiss worum es hier bei der 4 ma geht, so möge er was posten.
Guckst du hier!!
Zitat von Tommi33: Hallo Fortuna,
100% halte ich jetzt mal nicht für realistisch aber passt schon. Wer sich über die Vorgeschichte von Mast Therapeutics informieren möchte kann sich gern den alten Thread unter dem alten Namen "Adventrex Pharm." anschauen, zu finden hier -> http://www.wallstreet-online.de/diskussion/1157423-1-10/adve…
Viel Spass
Tommi
Antwort auf Beitrag Nr.: 46.227.289 von BELGIEN am 14.01.14 19:22:33http://ih.advfn.com/p.php?pid=nmona&article=60575127
Hoffe, der Link funzt.
Abs. 1: Termin der PK, heute.
Abs. 4/5: Vorstellung Unternehmen sowie Produkt.
Hoffe, das hilft weiter!
Hoffe, der Link funzt.
Abs. 1: Termin der PK, heute.
Abs. 4/5: Vorstellung Unternehmen sowie Produkt.
Hoffe, das hilft weiter!
Antwort auf Beitrag Nr.: 46.227.425 von wegith am 14.01.14 19:41:24Nicht Abs 4/5, sondern 3 u. 4 NAT., dry.
wenn pk positiv läuft, dann werden wir in der nachbörse sehen. die nachbörse läuft bis 2 uhr nachts unsererseits
das ergebnis der pk könnte der grund sein, warum der kurs seit stunden nur aufgehalten bzw. gebremst und nur gesammelt wird. also gutes zeichen
wo hast du gelesen, dass heute um 23 uhr eine pk stattfinden soll ?
Antwort auf Beitrag Nr.: 46.228.381 von gauner1 am 14.01.14 21:40:35Gauner, schau mal auf meinen Link im obigen Beitrag.
Im ersten Absatz steht 14. Januar 2014, 2:10 Uhr San Franzisco Zeit, bei uns 23:10 Uhr

Im ersten Absatz steht 14. Januar 2014, 2:10 Uhr San Franzisco Zeit, bei uns 23:10 Uhr

schlußkurs 0,80
ich habe in website von mast gefunden
danke
danke
Wo gehts hin?? Meinungen??
Antwort auf Beitrag Nr.: 46.228.877 von roemm am 14.01.14 22:51:14
keine ahnung, man hofft - wie es in der börse üblich ist - dass der kurs aus fundamentalen gründen steigt
keine ahnung, man hofft - wie es in der börse üblich ist - dass der kurs aus fundamentalen gründen steigt
Antwort auf Beitrag Nr.: 46.228.877 von roemm am 14.01.14 22:51:14Ganz einfach: gute Performance heute und der Kurs steht bei > 1$.
Schlechte News, Sauerstoffmaske.
Schlechte News, Sauerstoffmaske.

bis jetzt hat sich ja nichts bewegt
schlechte performance glaube ich nicht, sonst würde man ja keine pk veranstalten. höchstens neutral
gute nacht allerseits.
morgen werden wir sehen, ob man sich bei pk gut verkauft hat oder nicht
morgen werden wir sehen, ob man sich bei pk gut verkauft hat oder nicht
Kann momentan 0 einschätzen, was in USA läuft.
Die schlafen noch, also warten wir bis Nachmittag......
Auf jeden Fall ist der Kurs drüben nicht gefallen!
Die schlafen noch, also warten wir bis Nachmittag......
Auf jeden Fall ist der Kurs drüben nicht gefallen!
guten morgen
doch, der kurs ist um 1 cent gefallen. also weltuntergang. sauerstoffmaske ??
doch, der kurs ist um 1 cent gefallen. also weltuntergang. sauerstoffmaske ??
Große Chance vertan worden, LEIDER!!!
Warum?? Finde ich nicht
der weg zu 6 $ wird auch hier dornig sein. attacken auf den kurs sollte sich jeder investierte bewußt sein.
ich denke, die 6 $ können noch vor ende der phase 3 erreicht werden, wie bei jedem pharma-explorer deren
aktien solch einen umsatz in vergleichbarer situation haben. an schwachen tagen im gesamtmarkt gab es bei
solchen titeln of ein plus im tageschart.
für mich mal wieder ein deja-vue.
ich denke, die 6 $ können noch vor ende der phase 3 erreicht werden, wie bei jedem pharma-explorer deren
aktien solch einen umsatz in vergleichbarer situation haben. an schwachen tagen im gesamtmarkt gab es bei
solchen titeln of ein plus im tageschart.
für mich mal wieder ein deja-vue.
Zitat von BELGIEN: der weg zu 6 $ wird auch hier dornig sein. attacken auf den kurs sollte sich jeder investierte bewußt sein.
ich denke, die 6 $ können noch vor ende der phase 3 erreicht werden, wie bei jedem pharma-explorer deren
aktien solch einen umsatz in vergleichbarer situation haben. an schwachen tagen im gesamtmarkt gab es bei
solchen titeln of ein plus im tageschart.
für mich mal wieder ein deja-vue.
der erste $ ist da !

muss nur noch bis tagesende gehalten werden. einen sprung um 30 cent gab es bereits vor einigen tagen.
halber-dollar-sprung wäre nun irgendwann schön...

Antwort auf Beitrag Nr.: 46.280.405 von BELGIEN am 22.01.14 18:32:12stay long

" Signal Update Our system’s recommendation today is to STAY LONG. The previous BUY recommendation was issued on 13.01.2014, 8 days ago, when the stock price was 0,5811. Since then MSTX has risen by +63,48%.Market Outlook You may relax since our STAY LONG position is secure. The market action does not cast a serious doubt on the wisdom of going long. "
so sah es bis gestern aus.
" Signal Update Our system’s recommendation today is to STAY LONG. The previous BUY recommendation was issued on 13.01.2014, 8 days ago, when the stock price was 0,5811. Since then MSTX has risen by +63,48%.Market Outlook You may relax since our STAY LONG position is secure. The market action does not cast a serious doubt on the wisdom of going long. "
so sah es bis gestern aus.
Hallo bist dh mit der materie mast therap. Vertraut?
auch heute wieder schöner plus. ich freue mich erst mal auf 2. über 6 sprechen wir später
Antwort auf Beitrag Nr.: 46.280.631 von BELGIEN am 22.01.14 18:55:11Hi Belgien,
dachte du traust "uns" gaunern und pushern nicht, schön daß du noch da bist, viel glück weiter !!!

dachte du traust "uns" gaunern und pushern nicht, schön daß du noch da bist, viel glück weiter !!!

@ roemm
bissl schon. mich interessiert hier hauptsächlich anx-188 deren studie, sich phase 3 befindet
im mai 2013 begann und nächstes jahr abgeschlossen sein soll. der weg dorthin sollte
spannend sein.
@ wegith




bissl schon. mich interessiert hier hauptsächlich anx-188 deren studie, sich phase 3 befindet
im mai 2013 begann und nächstes jahr abgeschlossen sein soll. der weg dorthin sollte
spannend sein.
@ wegith




Ok was bringt der kurs bis dahin? Chancen auf fantasie? Kläre mich auf das fände ich äusserst nett lg
Antwort auf Beitrag Nr.: 46.287.285 von roemm am 23.01.14 13:56:25ich möchte niemanden überzeugen hier zu investieren. jedoch sehe ich gewisse chancen wenn die studie keine
überraschungen bringt, die zeitlich nicht ins fenster passen, mal vorsichtig ausgedrückt. unverträglichkeit,
keine wirkung, ausstieg einer uniklinik oder ähnliches würden die shortquote steigern. senken wird diese
quote wenns lange newsmäßig gut läuft. könnte gar einen squeeze bei z.b. ausweitung der behandelten personen geben.
das sind so meine überlegungen ohne auf die " hundertmillionen " bei " marktreife " zu schielen.
wie ich lese gibt es nun ein erstes kursziel von $ 2,55
überraschungen bringt, die zeitlich nicht ins fenster passen, mal vorsichtig ausgedrückt. unverträglichkeit,
keine wirkung, ausstieg einer uniklinik oder ähnliches würden die shortquote steigern. senken wird diese
quote wenns lange newsmäßig gut läuft. könnte gar einen squeeze bei z.b. ausweitung der behandelten personen geben.
das sind so meine überlegungen ohne auf die " hundertmillionen " bei " marktreife " zu schielen.
wie ich lese gibt es nun ein erstes kursziel von $ 2,55

gewinnmitnahmen beendet. es geht wieder aufwärts.
Besten dank für den crash kurs... Lass mich neuigkeiten wissen
was wird denn erwartet von MST-188? blockbusterpotenzial?
seh ich das richtig das die nur dieses eine in der pipeline haben?
seh ich das richtig das die nur dieses eine in der pipeline haben?
na ja ist ja schon über 100 % gelaufen
hab das tail als aventrix oder so ähnlich schon vor Jahren gekauft
wurde dann umbenannt in Mast
und ein paarmal gesplittet
hab das tail als aventrix oder so ähnlich schon vor Jahren gekauft
wurde dann umbenannt in Mast
und ein paarmal gesplittet
paarmal gleich...meide solche aktien...aber mit nur 1 produkt schön sehr ärmlich :-/
erstes bid in usa 1 usd
sieht also sehr gut aus. ich denke eröffnung mindestens 1,05
sieht also sehr gut aus. ich denke eröffnung mindestens 1,05
in bid 500900 st. zu 0,90
scheint auch kein fakeorder zu sein
scheint auch kein fakeorder zu sein
wieso bröckelt der kurs ab ? ich finde nichts negatives
vorbörslich bissl im plus.
liegt wohl an der übernahme von aires pharmaceuticles. meldung von heute.
könnte aber auch daran liegen das die studien für mst-188 in q1 für mindestens drei ländern außerhalb der usa ausgeweitet wird.
40 studienzentren in den usa plus 30 zentren außerhalb. auch sollen die eingangskriterien geändert werden, so
eine meldung vom 7.2.2014.
das ist für mich eine erhöhung der teilnehmenden personen. liest sich alles für mich gut.
die 4ma is in action
liegt wohl an der übernahme von aires pharmaceuticles. meldung von heute.
könnte aber auch daran liegen das die studien für mst-188 in q1 für mindestens drei ländern außerhalb der usa ausgeweitet wird.
40 studienzentren in den usa plus 30 zentren außerhalb. auch sollen die eingangskriterien geändert werden, so
eine meldung vom 7.2.2014.
das ist für mich eine erhöhung der teilnehmenden personen. liest sich alles für mich gut.
die 4ma is in action

Ist vielleicht aber auch nur eine Tagesschwankung.
The Bull Case For Mast Therapeutics Just Got Even Brighter With Its Recent Acquisition

sieht vorbörslich ganz gut aus. 100k im bid bei 0,80 $.vielleicht läuft es diese woche ein wenig
weil man hofft, daß sich die firma am montag auf der healthcare conference gut präsentiert
und inverstoren anzieht.
Consensus Ratings for Mast Therapeutics (NASDAQ:MSTX)
Ratings Breakdown: 4 Buy Rating(s)
Consensus Rating: Buy (Score: 3.00)
Consensus Price Target: $2.50 (208.64% upside)
weil man hofft, daß sich die firma am montag auf der healthcare conference gut präsentiert
und inverstoren anzieht.
Consensus Ratings for Mast Therapeutics (NASDAQ:MSTX)
Ratings Breakdown: 4 Buy Rating(s)
Consensus Rating: Buy (Score: 3.00)
Consensus Price Target: $2.50 (208.64% upside)
Krasse Kursziele bin auch mal mit ein wenig Spielgeld drin auf den Ami Seiten auch fast nur positives, mal schaun, viel Glück allen investierten
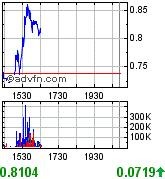
ist doch immer wieder erstaunlich, was für umsätze plötzlich rein kommen.
hier das gerücht: pending results
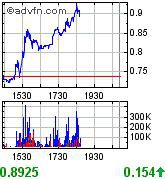
wahnsinns umsätze ohne news
So kanns weiter gehen...
19:02:24 0,87335 $. wahnsinn. 5 stellen nach dem komma. was nen geschacher
Anyone home....

0.6498 0.0448(7.40%)
von 14.04.14 (falls vorher nicht gesichtet)
http://finance.yahoo.com/news/mast-therapeutics-announces-da…

0.6498 0.0448(7.40%)
von 14.04.14 (falls vorher nicht gesichtet)
http://finance.yahoo.com/news/mast-therapeutics-announces-da…
hier der Fahrplan und Ergebnisse.
etwas schlecht Übersetzung aber doch verständlich
t.1
Brian M. Culley , Chief Executive Officer, sagte: "Dies ist eine wichtige Zeit für Mast Wir führen ein. Phase-3-Studie in einer seltenen Krankheit mit mehr als ein 18-Monats-Vorsprung auf unseren nächsten Konkurrenten Wir haben einen laufenden Phase-2-Studie, dass Will. zeigen, ob MST-188 verbessert die Wirksamkeit eines Thrombolytikums, die überall von der akuten Extremitäten-Ischämie zu einer Lungenembolie zu Herzinfarkt und Schlaganfall verwendet wird. Wir haben eine weitere Phase-2-Studie bei Herzinsuffizienz, die häufigste Ursache für Krankenhausaufenthalte bei Patienten über 65 Jahren und geplanten , haben wir Geld, um diese und unsere anderen Programme zu großen Wert Wendepunkte zu bewegen. "
Bevorstehende News und Events
Phase-2-Studie (pulmonale arterielle Hypertonie): vorläufige Daten
Q3 2014
Phase-2-Studie (Herzversagen): Vereinbarung mit der FDA auf Protokoll
Q4 2014
Nicht-klinischen Studie (Herzversagen): Daten
Q1 2015
Nicht-klinischen Studie (embolischen Schlaganfall): Daten
Q2 2015
Phase-2-Studie (Herzversagen): initiieren Einschreibung
1H 2015
Phase-2-Studie (akute Ischämie der Gliedmaßen): alle Einschreibung
Q4 2015
EPIC-Studie (Sichelzellanämie): alle Einschreibung
Q4 2015
Phase-2-Studie (WHO Gruppe 2 Lungenhochdruck): Daten
2H 2015
Phase-2-Studie (Herzversagen): Daten (Zwischenanalyse)
2H 2015
Weitere Informationen zu diesen Veranstaltungen und jede Programme der Gesellschaft ist im Abschnitt "Corporate Update" zur Verfügung gestellt, unten.
Unternehmens-Update
MST-188 - Sichelzellenanämie (SCD)
Das Unternehmen weiterhin für die Patienten in einschreiben EPIC , seine Phase-3-Studie von MST-188 in SCD, und bekräftigt seine Führung, die vor Einschreibung wird am Ende des Jahres 2015 abzuschließen MST-188 hat den Orphan-Drug-Status für SCD in den USA und EU, sowie Fast-Track-Status der FDA.
Das Unternehmen gab kürzlich abgeschlossen oder mehrere der zahlreichen Initiativen im Gange, um MST-188, die meisten klinisch fortgeschrittenen neues Medikament in der Entwicklung, um eine fortlaufende Krise in SCD, einschließlich Behandlung zu unterstützen:
Angekündigt Daten von einem Ex-vivo-Studie, durchgeführt an Loyola University Medical Center Gegebenen MST-188 reduzierte mittlere Blutsenkungsgeschwindigkeit, ein Maß der Entzündung um 50%, bezogen auf im Blut von Individuen mit Sichelzellanämie, die an dem Körper der Datenträger MST-188 Potential addiert gesammelt zu steuern, um die Dauer der Sichel verkürzen Zellkrise;
Initiiert Patientenaufnahme in einer Teilstudie innerhalb EPIC, um die Wirkung von MST-188 auf Sauerstoffversorgung des Gewebes zu quantifizieren, die einen Einblick in das Potenzial für MST-188 bis Ende Organversagen und der damit verbundenen vorzeitigen Tod bei Patienten mit Sichelzellkrankheit verringern wird; und
Berichtet, dass nach einer Überprüfung der klinischen Daten aus eingeschlossene Probanden empfahl der EPIC unabhängige Data Safety Monitoring Board der EPIC-Studie weiterhin ohne Änderung.
MST-188 - arterielle Verschlusskrankheit
Im Jahr 2014 erzielte das Unternehmen mehrere Meilensteine seiner klinischen Phase-Programm in arterieller Verschlusskrankheit, einschließlich:
Leitete eine Phase-2-Studie, die zeigen wird, ob MST-188 verbessert die Wirksamkeit von rekombinantem Gewebe-Plasminogen-Aktivator (rt-PA) bei Patienten mit akutem Extremitäten-Ischämie, eine Komplikation der arteriellen Verschlusskrankheit;
Initiierte eine präklinische Studie in einem gut validierten Modell der embolischen Schlaganfall, die zeigen wird, ob und in welchem Maße MST-188 erweitert das therapeutische Fenster von rt-PA, das Potenzial, für die sich auf Studien, die zeigen, dass auf der Basis MST-188 rettet Gewebe in der "ischämischen Penumbra," schützt die Blut-Hirn-Schranke, verbessert die Thrombolyse, und verbessert den Blutfluss in Sicherheiten (nicht gesperrten) Schiffe; und
Aus der erhaltenen FDA Orphan Drug Status für MST-188 für die Behandlung von akuten Extremitäten-Ischämie ( November 2013 ) Und einen Antrag für die Orphan Drug Designation in der EU.
Schätzungsweise 800.000 Menschen einen Schlaganfall erleiden jedes Jahr in den USA (15 Millionen weltweit), über 85% davon sind ischämische Schlaganfälle, doch die American Heart Association schätzt, dass nur 7% aller Krankenhauseinweisungen bei akuten ischämischen Schlaganfall rt-PA erhalten, die nur FDA -zugelassene Droge. Ein wesentlicher Grund für den begrenzten Einsatz von rt-PA ist die enge therapeutische Fenster (innerhalb von 3 Stunden nach Auftreten der Schlaganfall-Symptome), sowie die Gefahr der Hirnblutung. Ein Agent, der die Wirksamkeit von rt-PA (die die Gesellschaft ist die Bewertung in der laufenden Phase-2-Studie) seine therapeutische Fenster (die die Gesellschaft ist die Bewertung in der laufenden nicht-klinischen Studie) verbessert und / oder erweitert hat das Potenzial, um die Ergebnisse zu verbessern und rt-PA eine Option in der geschätzten 93% der Krankenhauseinweisungen, wo sie nicht verwendet wird.
MST-188 - Heart Failure
Anfang dieses Jahres meldete das Unternehmen positive Ergebnisse aus einer nicht-klinischen Studie in einem gut validiertes Modell der chronischen Herzinsuffizienz, bei der eine einzelne, 2-Stunden-Infusion von MST-188 zeigte statistisch signifikante, progressive und dauerhafte (bis zu 2 Wochen) Verbesserungen in wichtigen hämodynamischen Parameter und Marker der Herzschädigung und Stress. Basierend auf dem Feedback von Herz-Kreislauf Vordenker, plant das Unternehmen, MST-188 bei Herzinsuffizienz zu entwickeln. Kurzfristige Aktivitäten umfassen:
Einleitung zusätzliche nicht-klinischen Studie (n) zu bewerten, wie lange (über 2 Wochen) zuvor beobachteten Verbesserungen bestehen und kann die Wirkung von wiederholter Verabreichung von MST-188, als auch, um den Mechanismus zu Grunde liegenden beobachteten Verbesserungen zu charakterisieren;
Einigung mit FDA über die Anforderungen, um eine Phase-2-Studie von MST-188 bei Patienten mit Herzinsuffizienz zu initiieren; und
Initiierung der Phase-2-Studie bei Herzinsuffizienz, die zeigen, dass kann MST-188 reduziert Biomarker mit erhöhter 180-Tages-Gesamtmortalität bei Patienten mit Herzinsuffizienz assoziiert.
Über 25% der Medicare Patienten nach Krankenhausaufenthalt für Herzinsuffizienz entladen wird innerhalb von 30 Tagen wieder aufgenommen werden. Diese hohe Rate kann die Grenzen der vorhandenen Behandlungsmöglichkeiten (zB Vasodilatatoren, Diuretika), die effektiv bei der Lösung der Symptome der Herzinsuffizienz (zB Ödeme) sind, aber nicht direkt verbessern Herzfunktion zu reflektieren. Im Gegensatz dazu das Unternehmen glaubt, dass die Membran-Dicht Aktivität der MST-188 direkt verbessern Herzkontraktilität und Funktion. Ferner wird die laufenden nicht-klinischen Studie des Unternehmens zu bestimmen, ob eine zweite Dosis von MST-188 dupliziert die nach der ersten Dosis beobachtet Vorteile und erstreckt Verbesserungen bis 4 Wochen (oder darüber hinaus), die in einen positiven Einfluss auf rehospitalization Raten übersetzen kann, wie 30 -Day Rückübernahme.
MST-188 - Trauma
Kürzlich unterzeichnete die Gesellschaft eine Cooperative Research und Entwicklungsvereinbarung mit einem Zweig des US-Militärs, um den Nutzen der MST-188 in bestimmten Modellen von Trauma von Interesse für die US-Regierung zu bewerten. Pilotstudien werden voraussichtlich im Jahr 2014 Wenn die Ergebnisse positiv sind, erwartet das Unternehmen die US-Regierung sein Interesse an weiteren Erforschung des Potentials von MST-188 als Behandlung nach einem schweren Trauma beginnt.
AIR001 - Lungenhochdruck
In Februar 2014 Schloss das Unternehmen die Übernahme von Aires Pharmaceuticals , Eine klinische Phase-biopharmazeutisches Unternehmen und seine führenden Produktkandidaten AIR001. Kurzfristige Nachrichten und Veranstaltungen zu AIR001 Zusammenhang sind:
Meldedaten von den 29 Patienten in einer Phase-2-Studie bei pulmonaler arterieller Hypertonie eingeschrieben;
Einleitung Einschreibung von Patienten mit pulmonaler Hypertonie mit Linksherzerkrankung ( WHO-Gruppe 2 PH) in einer laufenden Universität geförderte Phase 2-Studie von AIR001; und
Ankündigung Gesamtentwicklungsstrategie des Unternehmens mit AIR001.
Vorstand
Im Juni hat das Unternehmen sein Know-how erweitert und Tiefe mit der Begrüßung Dr. Howard Dittrich in sein Board of Directors. Dr. Dittrich bringt eine bewährte Erfolgsbilanz bei kardiovaskulären Erkrankungen, zum Teil belegt durch den Verkauf von NovaCardia zu Merck & Co. im Jahr 2007 für $ 350.000.000 .
Zweites Quartal 2014 Financial Results
Nettoverlust des Unternehmens für das zweite Quartal 2014 war $ 7.200.000 Oder 0,06 $ je Aktie (unverwässert und verwässert), verglichen mit einem Nettoverlust von $ 4.900.000 Oder 0,09 $ je Aktie (unverwässert und verwässert), für den gleichen Zeitraum im Jahr 2013.
Forschung und Entwicklungsaufwendungen für das zweite Quartal 2014 waren $ 4.800.000 , Ein Anstieg von 2,0 Millionen US-Dollar Oder 70%, verglichen mit $ 2.800.000 für den gleichen Zeitraum im Jahr 2013 Der Anstieg war vor allem auf eine $ 1.100.000 erhöhen in externen klinischen Studie Gebühren und Aufwendungen, ein $ 0.600.000 Erhöhung der nicht-klinischen Studie externe Gebühren und Kosten und eine $ 0.300.000 Anstieg der Personalkosten. Der Anstieg der externen klinischen Studiengebühren und Aufwendungen weitgehend auf laufende Phase-3-Studie des Unternehmens bei der Sichelzellkrankheit (der EPIC-Studie) und Phase-2-Studie in ALI stehen. Der Anstieg der nicht-klinischen Studie externe Gebühren und Kosten wurde in erster Linie auf die Herstellung zusätzlicher MST-188-Studie Materials.
Verkauf, allgemeine und Verwaltungskosten für das zweite Quartal 2014 waren $ 2.400.000 , Ein Anstieg von $ 0.300.000 Oder 13%, im Vergleich zu $ 2.100.000 für den gleichen Zeitraum im Jahr 2013 Der Anstieg resultierte vor allem aus einem Anstieg der Personalkosten.
Year-to-Date Finanzergebnisse
Nettoverlust des Unternehmens für die sechs Monate zum 30. Juni 2014 war $ 13.500.000 Oder 0,12 $ je Aktie (unverwässert und verwässert), verglichen mit einem Nettoverlust von $ 10.500.000 Oder 0,21 $ je Aktie (unverwässert und verwässert), für den gleichen Zeitraum im Jahr 2013.
Forschung und Entwicklungskosten für die sechs Monate zum 30. Juni 2014 waren $ 9.100.000 , Ein Anstieg von $ 2.800.000 Bzw. 45%, verglichen mit $ 6.300.000 für den gleichen Zeitraum im Jahr 2013 Der Anstieg war vor allem auf eine $ 1.100.000 erhöhen in externen klinischen Studie Gebühren und Aufwendungen, ein $ 1.100.000 Erhöhung der nicht-klinischen Studie externe Gebühren und Kosten und eine $ 0.600.000 Anstieg der Personalkosten. Der Anstieg der externen klinischen Studiengebühren und Aufwendungen wurde vor allem auf die laufenden EPIC-Studie und der Phase-2-Studie in ALI, sowie den Wind-down der AIR001 Studien bei PAH, die Kosten wurden von der Abwesenheit jeglicher Materialgebühren ausgeglichen Zahl erhöhen und Aufwendungen, seine gründliche QT / QTc-klinischen Studie von MST-188, die im Jahr 2013 abgeschlossen war die Zunahme der nicht-klinischen Studie externe Gebühren und Kosten im Zusammenhang war in erster Linie auf die Herstellung zusätzlicher MST-188-Studie Material. Der Anstieg der Personalkosten war in erster Linie auf zusätzliche klinische und forschungsbezogene Fertigung Personal nach der ersten Hälfte des Jahres 2013 eingestellt.
Vertriebskosten und allgemeine Verwaltungskosten für die sechs Monate zum 30. Juni 2014 waren $ 4.600.000 , Ein Anstieg von $ 0.400.000 Oder 10%, im Vergleich zu $ 4.200.000 für den gleichen Zeitraum im Jahr 2013 Der Anstieg resultierte vor allem aus einem Anstieg der Personalkosten.
Das Unternehmen erkannte ein $ 0.500.000 Bargain Purchase Zunahme während der sechs Monate zum 30. Juni 2014 mit der Übernahme von Aires, die in den sonstigen Erträgen enthalten war verbunden.
Bilanz-Highlights
Ab 30. Juni 2014 Hatte die Gesellschaft über liquide Mittel und Wertpapiere in Höhe von insgesamt $ 46.400.000 . Das Eigenkapital belief sich auf $ 50.200.000 ab 30. Juni 2014.
Über Mast Therapeutics
Mast Therapeutics, Inc. hat seinen Hauptsitz ein börsennotiertes biopharmazeutisches Unternehmen, San Diego , Kalifornien. Das Unternehmen nutzt die MAST (Molecular Haftkleber und Dichtmittel-Technologie)-Plattform von mehr als zwei Jahrzehnten von klinischen, nicht-klinischen und Herstellungserfahrung mit gereinigten und ungereinigten Poloxameren abgeleitet, um MST-188, seinen führenden Produktkandidaten für schwerwiegende oder lebens entwickeln -threatening Krankheiten und Leiden in der Regel durch eine Störung der mikrovaskulären Blutfluss und beschädigte Zellmembranen aus.
Das Unternehmen ist die Einschreibung in Fächern EPIC, einer Phase-3-Studie von MST-188 bei der Sichelzellkrankheit, und in einer Phase-2-Studie zu bewerten, ob MST-188 verbessert die Wirksamkeit von rekombinantem Gewebe-Plasminogen-Aktivator-Therapie bei Patienten mit akuter Extremitätenischämie. Das Unternehmen plant auch, eine klinische Phase-2-Studie von MST-188 bei Patienten mit akut dekompensierter Herzinsuffizienz in der ersten Hälfte des Jahres 2015 zu initiieren und Details der Studie Design noch in diesem Jahr bekannt zu geben. Weitere Informationen finden Sie auf der Website des Unternehmens finden Sie unter www.masttherapeutics.com . (Twitter: MastThera )
Mast Therapeutics ™ und das Firmenlogo sind Marken von Mast Therapeutics, Inc.
Zukunftsgerichtete Aussagen
Mast Therapeutics warnt Sie, dass Aussagen in dieser Pressemitteilung, die nicht eine Beschreibung der historischen Tatsachen, sind zukunftsgerichtete Aussagen, die auf gegenwärtigen Erwartungen und Annahmen des Unternehmens basieren. Solche zukunftsgerichteten Aussagen umfassen, sind aber nicht beschränkt auf, Aussagen in Bezug auf die Aussichten für eine erfolgreiche Entwicklung von MST-188 bei der Sichelzellkrankheit, arterielle Verschlusskrankheit, einschließlich ALI, Herzversagen und Trauma, und der voraussichtlichen Zeitpunkt der Erreichung von Entwicklungs Meilensteine für Produktkandidaten, einschließlich Beginn und Abschluss von klinischen und nicht-klinischen Studien. Zu den Faktoren, die dazu führen oder dazu beitragen, wesentliche Unterschiede zwischen tatsächlichen Ergebnisse des Unternehmens und den von den zukunftsgerichteten Aussagen angegebenen Erwartungen konnten, sind Risiken und Unsicherheiten, umfassen, sind aber nicht beschränkt auf: die Unsicherheit der Ergebnisse in den laufenden und künftigen Studien der Produktkandidaten des Unternehmens, und das Risiko, dass Produktkandidaten, darunter MST-188, kann eine ausreichende Sicherheit, Wirksamkeit oder Verträglichkeit in einer oder mehreren solcher Studien, einschließlich EPIC nicht nachweisen; Verzögerungen bei dem Beginn oder Abschluss von klinischen Studien, einschließlich der als Folge der Schwierigkeiten bei der Beschaffung Regulierungsbehörde Vereinbarung über klinische Entwicklungspläne oder klinische Studiendesign, Öffnungs Prüfzentren, die Einschreibung Studienteilnehmer, die Herstellung ausreichender Mengen an klinischen Studie Material, Gegenstand eines "klinischen halten," und / oder die Aussetzung oder Beendigung einer klinischen Studie, einschließlich aufgrund von Patientensicherheitsbedenken oder fehlender finanzieller Mittel; das Potenzial für institutionelle Review Boards oder die FDA oder anderen Aufsichtsbehörden, zusätzliche präklinische und klinische Studien vor Beginn der geplanten klinischen Studie eines Produktkandidaten verlangen; das Risiko, dass, auch wenn klinische Studien erfolgreich sind, die FDA oder anderen Aufsichtsbehörden kann bestimmen, sie sind nicht ausreichend, um ein neues Medikament Anwendung zu unterstützen; Das Potenzial, das, auch wenn klinische Studien eines Produktkandidaten in einer Anzeige sind erfolgreich, klinische Studien in einem anderen Anzeige kann nicht erfolgreich sein; der Gesellschaft Vertrauen auf Auftragsforschungsinstituten (CROs), Vertragsfertigungsorganisationen (GMO) und andere dritte Parteien bei der Durchführung der wichtigen Aspekte der Entwicklung der Produktkandidaten, darunter klinische Studien, Herstellung und regulatorische Aktivitäten für die Produktkandidaten unterstützen und dass diesen Parteien möglicherweise nicht wie erwartet durchzuführen; die Fähigkeit des Unternehmens, zusätzliche Mittel zeitnah oder zu akzeptablen Bedingungen oder überhaupt zu erhalten; das Potenzial für das Unternehmen zu verzögern, zu reduzieren oder einzustellen Strom und / oder geplanten Entwicklungsaktivitäten, einschließlich klinischer Studien, Partner seiner Produktkandidaten zu einem ungünstigen Zeitpunkt oder weniger teuer, aber mit höherem Risiko und / oder geringere Rendite Entwicklungspfade zu verfolgen, wenn sie nicht in der Lage ist, heben ausreichend zusätzliches Kapital nach Bedarf; das Risiko, dass, auch wenn das Unternehmen erfolgreich entwickelt eine Produktkandidaten in einem oder mehreren Indikationen, kann es nicht kommerzieller Erfolg mit seinen Produkten zu realisieren und können nie Einnahmen ausreichen, um die Profitabilität zu erreichen erzeugen; das Risiko, dass die Gesellschaft nicht in der Lage, angemessen zu schützen ihre geistigen Eigentumsrechte im Zusammenhang mit der MAST-Plattform und MST-188 oder AIR001 und verhindern, dass Wettbewerber aus Duplizieren oder der Entwicklung gleichwertiger Versionen seiner Produktkandidaten; und andere Risiken und Ungewissheiten, die in den Pressemitteilungen des Unternehmens und regelmäßigen Einreichungen bei der beschriebenen Securities and Exchange Commission . Öffentlichen Einreichungen des Unternehmens bei der Securities and Exchange Commission sind verfügbar unter www.sec.gov .
Sie sind daher nicht unangemessen auf zukunftsgerichtete Aussagen, die nur für den Zeitpunkt, wenn das Wort ergreifen zu platzieren. Mast Therapeutics beabsichtigt nicht, zu revidieren oder zu zukunftsgerichteten Aussagen in dieser Pressemitteilung, um Ereignisse oder Umstände, die nach dem Datum dieser, sofern dies nicht gesetzlich vorgeschrieben ist, zu dokumentieren.
[Tabellen zu folgen]
Mast Therapeutics, Inc.
Verkürzte Konzern-Gewinn-und-
(In Tausend, außer Angaben je Aktie)
Drei Monate zum
30. Juni
(Ungeprüft)
Sechs Monate zum
30. Juni
(Ungeprüft)
2014
2013
2014
2013
Gesamtnettoumsatz
$ -
$ -
$ -
$ -
Betriebsaufwand:
Forschung und Entwicklung
4.820
2.837
9.101
6.280
Vertriebskosten und allgemeine Verwaltungs
2.370
2.100
4.636
4.213
Transaktionsbezogene Aufwendungen
(11)
7
269
35
Abschreibungen und Amortisationen
23
9
35
18
Total Betriebsaufwand
7.202
4.953
14.041
10.546
Betriebsverlust
(7.202)
(4.953)
(14.041)
(10.546)
Zinsen und sonstige Erträge, netto
50
12
518
24
Nettoverlust
$ (7.152)
$ (4.941)
$ (13.523)
$ (10.522)
Der Nettoverlust pro Aktie - unverwässert und verwässert
$ (0,06)
$ (0,09)
$ (0,12)
$ (0,21)
Gewichteter Durchschnitt der Aktien - unverwässert und verwässert
115.587
53.750
110.350
50.028
Mast Therapeutics, Inc.
Bilanzdaten
(In Tausend)
30. Juni
2014
(Ungeprüft)
31. Dezember
2013
Liquide Mittel und Wertpapiere
$ 46.438
$ 44.393
Working Capital
41.819
40.695
Gesamtvermögen
59.370
55.250
Die Summe der Verbindlichkeiten
9149
7.442
Eigenkapital
50.221
Aktien
47.808
etwas schlecht Übersetzung aber doch verständlich
t.1
Brian M. Culley , Chief Executive Officer, sagte: "Dies ist eine wichtige Zeit für Mast Wir führen ein. Phase-3-Studie in einer seltenen Krankheit mit mehr als ein 18-Monats-Vorsprung auf unseren nächsten Konkurrenten Wir haben einen laufenden Phase-2-Studie, dass Will. zeigen, ob MST-188 verbessert die Wirksamkeit eines Thrombolytikums, die überall von der akuten Extremitäten-Ischämie zu einer Lungenembolie zu Herzinfarkt und Schlaganfall verwendet wird. Wir haben eine weitere Phase-2-Studie bei Herzinsuffizienz, die häufigste Ursache für Krankenhausaufenthalte bei Patienten über 65 Jahren und geplanten , haben wir Geld, um diese und unsere anderen Programme zu großen Wert Wendepunkte zu bewegen. "
Bevorstehende News und Events
Phase-2-Studie (pulmonale arterielle Hypertonie): vorläufige Daten
Q3 2014
Phase-2-Studie (Herzversagen): Vereinbarung mit der FDA auf Protokoll
Q4 2014
Nicht-klinischen Studie (Herzversagen): Daten
Q1 2015
Nicht-klinischen Studie (embolischen Schlaganfall): Daten
Q2 2015
Phase-2-Studie (Herzversagen): initiieren Einschreibung
1H 2015
Phase-2-Studie (akute Ischämie der Gliedmaßen): alle Einschreibung
Q4 2015
EPIC-Studie (Sichelzellanämie): alle Einschreibung
Q4 2015
Phase-2-Studie (WHO Gruppe 2 Lungenhochdruck): Daten
2H 2015
Phase-2-Studie (Herzversagen): Daten (Zwischenanalyse)
2H 2015
Weitere Informationen zu diesen Veranstaltungen und jede Programme der Gesellschaft ist im Abschnitt "Corporate Update" zur Verfügung gestellt, unten.
Unternehmens-Update
MST-188 - Sichelzellenanämie (SCD)
Das Unternehmen weiterhin für die Patienten in einschreiben EPIC , seine Phase-3-Studie von MST-188 in SCD, und bekräftigt seine Führung, die vor Einschreibung wird am Ende des Jahres 2015 abzuschließen MST-188 hat den Orphan-Drug-Status für SCD in den USA und EU, sowie Fast-Track-Status der FDA.
Das Unternehmen gab kürzlich abgeschlossen oder mehrere der zahlreichen Initiativen im Gange, um MST-188, die meisten klinisch fortgeschrittenen neues Medikament in der Entwicklung, um eine fortlaufende Krise in SCD, einschließlich Behandlung zu unterstützen:
Angekündigt Daten von einem Ex-vivo-Studie, durchgeführt an Loyola University Medical Center Gegebenen MST-188 reduzierte mittlere Blutsenkungsgeschwindigkeit, ein Maß der Entzündung um 50%, bezogen auf im Blut von Individuen mit Sichelzellanämie, die an dem Körper der Datenträger MST-188 Potential addiert gesammelt zu steuern, um die Dauer der Sichel verkürzen Zellkrise;
Initiiert Patientenaufnahme in einer Teilstudie innerhalb EPIC, um die Wirkung von MST-188 auf Sauerstoffversorgung des Gewebes zu quantifizieren, die einen Einblick in das Potenzial für MST-188 bis Ende Organversagen und der damit verbundenen vorzeitigen Tod bei Patienten mit Sichelzellkrankheit verringern wird; und
Berichtet, dass nach einer Überprüfung der klinischen Daten aus eingeschlossene Probanden empfahl der EPIC unabhängige Data Safety Monitoring Board der EPIC-Studie weiterhin ohne Änderung.
MST-188 - arterielle Verschlusskrankheit
Im Jahr 2014 erzielte das Unternehmen mehrere Meilensteine seiner klinischen Phase-Programm in arterieller Verschlusskrankheit, einschließlich:
Leitete eine Phase-2-Studie, die zeigen wird, ob MST-188 verbessert die Wirksamkeit von rekombinantem Gewebe-Plasminogen-Aktivator (rt-PA) bei Patienten mit akutem Extremitäten-Ischämie, eine Komplikation der arteriellen Verschlusskrankheit;
Initiierte eine präklinische Studie in einem gut validierten Modell der embolischen Schlaganfall, die zeigen wird, ob und in welchem Maße MST-188 erweitert das therapeutische Fenster von rt-PA, das Potenzial, für die sich auf Studien, die zeigen, dass auf der Basis MST-188 rettet Gewebe in der "ischämischen Penumbra," schützt die Blut-Hirn-Schranke, verbessert die Thrombolyse, und verbessert den Blutfluss in Sicherheiten (nicht gesperrten) Schiffe; und
Aus der erhaltenen FDA Orphan Drug Status für MST-188 für die Behandlung von akuten Extremitäten-Ischämie ( November 2013 ) Und einen Antrag für die Orphan Drug Designation in der EU.
Schätzungsweise 800.000 Menschen einen Schlaganfall erleiden jedes Jahr in den USA (15 Millionen weltweit), über 85% davon sind ischämische Schlaganfälle, doch die American Heart Association schätzt, dass nur 7% aller Krankenhauseinweisungen bei akuten ischämischen Schlaganfall rt-PA erhalten, die nur FDA -zugelassene Droge. Ein wesentlicher Grund für den begrenzten Einsatz von rt-PA ist die enge therapeutische Fenster (innerhalb von 3 Stunden nach Auftreten der Schlaganfall-Symptome), sowie die Gefahr der Hirnblutung. Ein Agent, der die Wirksamkeit von rt-PA (die die Gesellschaft ist die Bewertung in der laufenden Phase-2-Studie) seine therapeutische Fenster (die die Gesellschaft ist die Bewertung in der laufenden nicht-klinischen Studie) verbessert und / oder erweitert hat das Potenzial, um die Ergebnisse zu verbessern und rt-PA eine Option in der geschätzten 93% der Krankenhauseinweisungen, wo sie nicht verwendet wird.
MST-188 - Heart Failure
Anfang dieses Jahres meldete das Unternehmen positive Ergebnisse aus einer nicht-klinischen Studie in einem gut validiertes Modell der chronischen Herzinsuffizienz, bei der eine einzelne, 2-Stunden-Infusion von MST-188 zeigte statistisch signifikante, progressive und dauerhafte (bis zu 2 Wochen) Verbesserungen in wichtigen hämodynamischen Parameter und Marker der Herzschädigung und Stress. Basierend auf dem Feedback von Herz-Kreislauf Vordenker, plant das Unternehmen, MST-188 bei Herzinsuffizienz zu entwickeln. Kurzfristige Aktivitäten umfassen:
Einleitung zusätzliche nicht-klinischen Studie (n) zu bewerten, wie lange (über 2 Wochen) zuvor beobachteten Verbesserungen bestehen und kann die Wirkung von wiederholter Verabreichung von MST-188, als auch, um den Mechanismus zu Grunde liegenden beobachteten Verbesserungen zu charakterisieren;
Einigung mit FDA über die Anforderungen, um eine Phase-2-Studie von MST-188 bei Patienten mit Herzinsuffizienz zu initiieren; und
Initiierung der Phase-2-Studie bei Herzinsuffizienz, die zeigen, dass kann MST-188 reduziert Biomarker mit erhöhter 180-Tages-Gesamtmortalität bei Patienten mit Herzinsuffizienz assoziiert.
Über 25% der Medicare Patienten nach Krankenhausaufenthalt für Herzinsuffizienz entladen wird innerhalb von 30 Tagen wieder aufgenommen werden. Diese hohe Rate kann die Grenzen der vorhandenen Behandlungsmöglichkeiten (zB Vasodilatatoren, Diuretika), die effektiv bei der Lösung der Symptome der Herzinsuffizienz (zB Ödeme) sind, aber nicht direkt verbessern Herzfunktion zu reflektieren. Im Gegensatz dazu das Unternehmen glaubt, dass die Membran-Dicht Aktivität der MST-188 direkt verbessern Herzkontraktilität und Funktion. Ferner wird die laufenden nicht-klinischen Studie des Unternehmens zu bestimmen, ob eine zweite Dosis von MST-188 dupliziert die nach der ersten Dosis beobachtet Vorteile und erstreckt Verbesserungen bis 4 Wochen (oder darüber hinaus), die in einen positiven Einfluss auf rehospitalization Raten übersetzen kann, wie 30 -Day Rückübernahme.
MST-188 - Trauma
Kürzlich unterzeichnete die Gesellschaft eine Cooperative Research und Entwicklungsvereinbarung mit einem Zweig des US-Militärs, um den Nutzen der MST-188 in bestimmten Modellen von Trauma von Interesse für die US-Regierung zu bewerten. Pilotstudien werden voraussichtlich im Jahr 2014 Wenn die Ergebnisse positiv sind, erwartet das Unternehmen die US-Regierung sein Interesse an weiteren Erforschung des Potentials von MST-188 als Behandlung nach einem schweren Trauma beginnt.
AIR001 - Lungenhochdruck
In Februar 2014 Schloss das Unternehmen die Übernahme von Aires Pharmaceuticals , Eine klinische Phase-biopharmazeutisches Unternehmen und seine führenden Produktkandidaten AIR001. Kurzfristige Nachrichten und Veranstaltungen zu AIR001 Zusammenhang sind:
Meldedaten von den 29 Patienten in einer Phase-2-Studie bei pulmonaler arterieller Hypertonie eingeschrieben;
Einleitung Einschreibung von Patienten mit pulmonaler Hypertonie mit Linksherzerkrankung ( WHO-Gruppe 2 PH) in einer laufenden Universität geförderte Phase 2-Studie von AIR001; und
Ankündigung Gesamtentwicklungsstrategie des Unternehmens mit AIR001.
Vorstand
Im Juni hat das Unternehmen sein Know-how erweitert und Tiefe mit der Begrüßung Dr. Howard Dittrich in sein Board of Directors. Dr. Dittrich bringt eine bewährte Erfolgsbilanz bei kardiovaskulären Erkrankungen, zum Teil belegt durch den Verkauf von NovaCardia zu Merck & Co. im Jahr 2007 für $ 350.000.000 .
Zweites Quartal 2014 Financial Results
Nettoverlust des Unternehmens für das zweite Quartal 2014 war $ 7.200.000 Oder 0,06 $ je Aktie (unverwässert und verwässert), verglichen mit einem Nettoverlust von $ 4.900.000 Oder 0,09 $ je Aktie (unverwässert und verwässert), für den gleichen Zeitraum im Jahr 2013.
Forschung und Entwicklungsaufwendungen für das zweite Quartal 2014 waren $ 4.800.000 , Ein Anstieg von 2,0 Millionen US-Dollar Oder 70%, verglichen mit $ 2.800.000 für den gleichen Zeitraum im Jahr 2013 Der Anstieg war vor allem auf eine $ 1.100.000 erhöhen in externen klinischen Studie Gebühren und Aufwendungen, ein $ 0.600.000 Erhöhung der nicht-klinischen Studie externe Gebühren und Kosten und eine $ 0.300.000 Anstieg der Personalkosten. Der Anstieg der externen klinischen Studiengebühren und Aufwendungen weitgehend auf laufende Phase-3-Studie des Unternehmens bei der Sichelzellkrankheit (der EPIC-Studie) und Phase-2-Studie in ALI stehen. Der Anstieg der nicht-klinischen Studie externe Gebühren und Kosten wurde in erster Linie auf die Herstellung zusätzlicher MST-188-Studie Materials.
Verkauf, allgemeine und Verwaltungskosten für das zweite Quartal 2014 waren $ 2.400.000 , Ein Anstieg von $ 0.300.000 Oder 13%, im Vergleich zu $ 2.100.000 für den gleichen Zeitraum im Jahr 2013 Der Anstieg resultierte vor allem aus einem Anstieg der Personalkosten.
Year-to-Date Finanzergebnisse
Nettoverlust des Unternehmens für die sechs Monate zum 30. Juni 2014 war $ 13.500.000 Oder 0,12 $ je Aktie (unverwässert und verwässert), verglichen mit einem Nettoverlust von $ 10.500.000 Oder 0,21 $ je Aktie (unverwässert und verwässert), für den gleichen Zeitraum im Jahr 2013.
Forschung und Entwicklungskosten für die sechs Monate zum 30. Juni 2014 waren $ 9.100.000 , Ein Anstieg von $ 2.800.000 Bzw. 45%, verglichen mit $ 6.300.000 für den gleichen Zeitraum im Jahr 2013 Der Anstieg war vor allem auf eine $ 1.100.000 erhöhen in externen klinischen Studie Gebühren und Aufwendungen, ein $ 1.100.000 Erhöhung der nicht-klinischen Studie externe Gebühren und Kosten und eine $ 0.600.000 Anstieg der Personalkosten. Der Anstieg der externen klinischen Studiengebühren und Aufwendungen wurde vor allem auf die laufenden EPIC-Studie und der Phase-2-Studie in ALI, sowie den Wind-down der AIR001 Studien bei PAH, die Kosten wurden von der Abwesenheit jeglicher Materialgebühren ausgeglichen Zahl erhöhen und Aufwendungen, seine gründliche QT / QTc-klinischen Studie von MST-188, die im Jahr 2013 abgeschlossen war die Zunahme der nicht-klinischen Studie externe Gebühren und Kosten im Zusammenhang war in erster Linie auf die Herstellung zusätzlicher MST-188-Studie Material. Der Anstieg der Personalkosten war in erster Linie auf zusätzliche klinische und forschungsbezogene Fertigung Personal nach der ersten Hälfte des Jahres 2013 eingestellt.
Vertriebskosten und allgemeine Verwaltungskosten für die sechs Monate zum 30. Juni 2014 waren $ 4.600.000 , Ein Anstieg von $ 0.400.000 Oder 10%, im Vergleich zu $ 4.200.000 für den gleichen Zeitraum im Jahr 2013 Der Anstieg resultierte vor allem aus einem Anstieg der Personalkosten.
Das Unternehmen erkannte ein $ 0.500.000 Bargain Purchase Zunahme während der sechs Monate zum 30. Juni 2014 mit der Übernahme von Aires, die in den sonstigen Erträgen enthalten war verbunden.
Bilanz-Highlights
Ab 30. Juni 2014 Hatte die Gesellschaft über liquide Mittel und Wertpapiere in Höhe von insgesamt $ 46.400.000 . Das Eigenkapital belief sich auf $ 50.200.000 ab 30. Juni 2014.
Über Mast Therapeutics
Mast Therapeutics, Inc. hat seinen Hauptsitz ein börsennotiertes biopharmazeutisches Unternehmen, San Diego , Kalifornien. Das Unternehmen nutzt die MAST (Molecular Haftkleber und Dichtmittel-Technologie)-Plattform von mehr als zwei Jahrzehnten von klinischen, nicht-klinischen und Herstellungserfahrung mit gereinigten und ungereinigten Poloxameren abgeleitet, um MST-188, seinen führenden Produktkandidaten für schwerwiegende oder lebens entwickeln -threatening Krankheiten und Leiden in der Regel durch eine Störung der mikrovaskulären Blutfluss und beschädigte Zellmembranen aus.
Das Unternehmen ist die Einschreibung in Fächern EPIC, einer Phase-3-Studie von MST-188 bei der Sichelzellkrankheit, und in einer Phase-2-Studie zu bewerten, ob MST-188 verbessert die Wirksamkeit von rekombinantem Gewebe-Plasminogen-Aktivator-Therapie bei Patienten mit akuter Extremitätenischämie. Das Unternehmen plant auch, eine klinische Phase-2-Studie von MST-188 bei Patienten mit akut dekompensierter Herzinsuffizienz in der ersten Hälfte des Jahres 2015 zu initiieren und Details der Studie Design noch in diesem Jahr bekannt zu geben. Weitere Informationen finden Sie auf der Website des Unternehmens finden Sie unter www.masttherapeutics.com . (Twitter: MastThera )
Mast Therapeutics ™ und das Firmenlogo sind Marken von Mast Therapeutics, Inc.
Zukunftsgerichtete Aussagen
Mast Therapeutics warnt Sie, dass Aussagen in dieser Pressemitteilung, die nicht eine Beschreibung der historischen Tatsachen, sind zukunftsgerichtete Aussagen, die auf gegenwärtigen Erwartungen und Annahmen des Unternehmens basieren. Solche zukunftsgerichteten Aussagen umfassen, sind aber nicht beschränkt auf, Aussagen in Bezug auf die Aussichten für eine erfolgreiche Entwicklung von MST-188 bei der Sichelzellkrankheit, arterielle Verschlusskrankheit, einschließlich ALI, Herzversagen und Trauma, und der voraussichtlichen Zeitpunkt der Erreichung von Entwicklungs Meilensteine für Produktkandidaten, einschließlich Beginn und Abschluss von klinischen und nicht-klinischen Studien. Zu den Faktoren, die dazu führen oder dazu beitragen, wesentliche Unterschiede zwischen tatsächlichen Ergebnisse des Unternehmens und den von den zukunftsgerichteten Aussagen angegebenen Erwartungen konnten, sind Risiken und Unsicherheiten, umfassen, sind aber nicht beschränkt auf: die Unsicherheit der Ergebnisse in den laufenden und künftigen Studien der Produktkandidaten des Unternehmens, und das Risiko, dass Produktkandidaten, darunter MST-188, kann eine ausreichende Sicherheit, Wirksamkeit oder Verträglichkeit in einer oder mehreren solcher Studien, einschließlich EPIC nicht nachweisen; Verzögerungen bei dem Beginn oder Abschluss von klinischen Studien, einschließlich der als Folge der Schwierigkeiten bei der Beschaffung Regulierungsbehörde Vereinbarung über klinische Entwicklungspläne oder klinische Studiendesign, Öffnungs Prüfzentren, die Einschreibung Studienteilnehmer, die Herstellung ausreichender Mengen an klinischen Studie Material, Gegenstand eines "klinischen halten," und / oder die Aussetzung oder Beendigung einer klinischen Studie, einschließlich aufgrund von Patientensicherheitsbedenken oder fehlender finanzieller Mittel; das Potenzial für institutionelle Review Boards oder die FDA oder anderen Aufsichtsbehörden, zusätzliche präklinische und klinische Studien vor Beginn der geplanten klinischen Studie eines Produktkandidaten verlangen; das Risiko, dass, auch wenn klinische Studien erfolgreich sind, die FDA oder anderen Aufsichtsbehörden kann bestimmen, sie sind nicht ausreichend, um ein neues Medikament Anwendung zu unterstützen; Das Potenzial, das, auch wenn klinische Studien eines Produktkandidaten in einer Anzeige sind erfolgreich, klinische Studien in einem anderen Anzeige kann nicht erfolgreich sein; der Gesellschaft Vertrauen auf Auftragsforschungsinstituten (CROs), Vertragsfertigungsorganisationen (GMO) und andere dritte Parteien bei der Durchführung der wichtigen Aspekte der Entwicklung der Produktkandidaten, darunter klinische Studien, Herstellung und regulatorische Aktivitäten für die Produktkandidaten unterstützen und dass diesen Parteien möglicherweise nicht wie erwartet durchzuführen; die Fähigkeit des Unternehmens, zusätzliche Mittel zeitnah oder zu akzeptablen Bedingungen oder überhaupt zu erhalten; das Potenzial für das Unternehmen zu verzögern, zu reduzieren oder einzustellen Strom und / oder geplanten Entwicklungsaktivitäten, einschließlich klinischer Studien, Partner seiner Produktkandidaten zu einem ungünstigen Zeitpunkt oder weniger teuer, aber mit höherem Risiko und / oder geringere Rendite Entwicklungspfade zu verfolgen, wenn sie nicht in der Lage ist, heben ausreichend zusätzliches Kapital nach Bedarf; das Risiko, dass, auch wenn das Unternehmen erfolgreich entwickelt eine Produktkandidaten in einem oder mehreren Indikationen, kann es nicht kommerzieller Erfolg mit seinen Produkten zu realisieren und können nie Einnahmen ausreichen, um die Profitabilität zu erreichen erzeugen; das Risiko, dass die Gesellschaft nicht in der Lage, angemessen zu schützen ihre geistigen Eigentumsrechte im Zusammenhang mit der MAST-Plattform und MST-188 oder AIR001 und verhindern, dass Wettbewerber aus Duplizieren oder der Entwicklung gleichwertiger Versionen seiner Produktkandidaten; und andere Risiken und Ungewissheiten, die in den Pressemitteilungen des Unternehmens und regelmäßigen Einreichungen bei der beschriebenen Securities and Exchange Commission . Öffentlichen Einreichungen des Unternehmens bei der Securities and Exchange Commission sind verfügbar unter www.sec.gov .
Sie sind daher nicht unangemessen auf zukunftsgerichtete Aussagen, die nur für den Zeitpunkt, wenn das Wort ergreifen zu platzieren. Mast Therapeutics beabsichtigt nicht, zu revidieren oder zu zukunftsgerichteten Aussagen in dieser Pressemitteilung, um Ereignisse oder Umstände, die nach dem Datum dieser, sofern dies nicht gesetzlich vorgeschrieben ist, zu dokumentieren.
[Tabellen zu folgen]
Mast Therapeutics, Inc.
Verkürzte Konzern-Gewinn-und-
(In Tausend, außer Angaben je Aktie)
Drei Monate zum
30. Juni
(Ungeprüft)
Sechs Monate zum
30. Juni
(Ungeprüft)
2014
2013
2014
2013
Gesamtnettoumsatz
$ -
$ -
$ -
$ -
Betriebsaufwand:
Forschung und Entwicklung
4.820
2.837
9.101
6.280
Vertriebskosten und allgemeine Verwaltungs
2.370
2.100
4.636
4.213
Transaktionsbezogene Aufwendungen
(11)
7
269
35
Abschreibungen und Amortisationen
23
9
35
18
Total Betriebsaufwand
7.202
4.953
14.041
10.546
Betriebsverlust
(7.202)
(4.953)
(14.041)
(10.546)
Zinsen und sonstige Erträge, netto
50
12
518
24
Nettoverlust
$ (7.152)
$ (4.941)
$ (13.523)
$ (10.522)
Der Nettoverlust pro Aktie - unverwässert und verwässert
$ (0,06)
$ (0,09)
$ (0,12)
$ (0,21)
Gewichteter Durchschnitt der Aktien - unverwässert und verwässert
115.587
53.750
110.350
50.028
Mast Therapeutics, Inc.
Bilanzdaten
(In Tausend)
30. Juni
2014
(Ungeprüft)
31. Dezember
2013
Liquide Mittel und Wertpapiere
$ 46.438
$ 44.393
Working Capital
41.819
40.695
Gesamtvermögen
59.370
55.250
Die Summe der Verbindlichkeiten
9149
7.442
Eigenkapital
50.221
Aktien
47.808
MAST THERAPEUTICS GIBT POSITIVE TOP LINE ERGEBNISSE AUS PHASE-2-STUDIE VON AIR001 DER PULMONALEN ARTERIELLEN HYPERTONIE UND AIR001 KLINISCHE ENTWICKLUNGSPLAN
- Verbesserungen Daten zeigen, in hämodynamischen Parameter und der körperlichen Leistungsfähigkeit
- AIR001 gut vertragen, ohne behandlungsbedingte schwerwiegende unerwünschte Ereignisse
- Datenunterstützung weitere klinische Entwicklung bei pulmonaler Hypertonie (PH)
SAN DIEGO , 8. September 2014 / PRNewswire / - Mast Therapeutics, Inc . (NYSE MKT: MSTX) meldete heute Top-Line-Ergebnisse aus einer Phase-2-Studie von AIR001 (Natriumnitrit) Inhalationslösung für die Behandlung der pulmonalen arteriellen Hypertonie (PAH). Mast erhalten die Rechte an der AIR001 Programm durch die Übernahme der in Privatbesitz Aires Pharmaceuticals, Inc. Anfang dieses Jahres. In der primären Wirksamkeitsanalyse der Phase-2-Studie zeigten alle Dosen Verbesserung der medianen pulmonalen Gefässwiderstands (PVR). In der sekundären Wirksamkeitsanalyse zeigten alle Dosen Verbesserungen in den in der 6-Minuten-Gehtest erhalten Median Strecken, einschließlich klinisch bedeutsame Verbesserungen bei der höchsten Dosis. Zusätzlich AIR001 wurde gut vertragen, ohne Behandlung bedingte schwerwiegende unerwünschte Ereignisse. Insbesondere Methämoglobin Ebenen blieb normal (<1,5%), was AIR001 von Sicherheitsbedenken mit intravenös verabreichten Nitrit verbunden unterscheidet.
Edwin L. Petersilie , Do, Zwischen Chief Medical Officer, sagte: "Diese Ergebnisse sind vielversprechend und im Einklang mit früheren Befunden von AIR001 als Mittel, die einen positiven Effekt auf die hämodynamischen Parameter in einem pH-Bevölkerung haben können Bis heute haben mehr als 120 Personen AIR001 empfangen. einschließlich Patienten, die wiederholte Gabe für bis zu 12 Monaten erhalten haben, Patienten, die Behandlung naiv waren, und die Patienten auf PAH krankheitsspezifische Hintergrundtherapie. Sichts der hämodynamischen Verbesserungen beobachtet, fühlen wir uns AIR001 kann eindeutig geeignet, um den schweren ungedeckten Bedarf gegen Adresse die große Zahl von Patienten mit pulmonaler Hypertonie mit Linksherzerkrankungen. Folglich werden wir verfolgen klinische Entwicklung von AIR001 in dieser Indikation und planen, mehrere, Institution geförderte Phase-2a-Studien, die 1) akute hämodynamische Effekte zu evaluieren wird unterstützt, 2) Akute Effekte im Vergleich zu Placebo auf die maximale Sauerstoffaufnahme und Bewegung Hämodynamik und 3) gegenüber inhalierten intravenöse Verabreichung von Nitrit, wie auch die Sicherheit der mehrere Dosen AIR001, bei Patienten mit PH mit Linksherzerkrankungen. "
Brian M. Culley , Chief Executive Officer, sagte: "Wir sind von den Ergebnissen der Phase-2-Studie von AIR001 gesehen ermutigt und glauben, dass sie weiter zu validieren Nahme von Aires die Daten aus der Studie zeigen, Vorteile im Einklang mit früheren Studien und unterstützen die weitere Entwicklung von AIR001.. Wir freuen uns, mit den Phase-2a-Studien in PH mit Linksherzerkrankungen voran und erwarten Berichterstattung vorläufigen Ergebnisse der Studie bereits in der zweiten Jahreshälfte 2015 "
Über die Phase-2-Studie (AIR001-CS05)
Die Phase-2-Studie war eine multizentrische, open-label, randomisierte, parallele Dosis-Studie, um die Sicherheit und Wirksamkeit von AIR001 bei Patienten mit PAH zu bestimmen. Die Probanden wurden in eine von drei Behandlungsarme randomisiert und mit AIR001 16 Wochen behandelt: 80 mg einmal täglich nach einer 2-wöchigen "run-in" Zeitraum von 46 mg einmal täglich; 46 mg viermal täglich nach einer 2-wöchigen Run-in-Periode von 46 mg viermal täglich; oder 80 mg viermal täglich nach einer 2-wöchigen Run-in-Periode von 46 mg viermal täglich. Das primäre Ziel der Studie war es, die Wirksamkeit von inhaliertem vernebelten AIR001 zu bewerten, wie durch Veränderung des pulmonalen Gefässwiderstands (PVR) vom Ausgangswert bis Woche 16 bestimmt, gemessen unmittelbar nach dem Abschluss der AIR001 Vernebelung. Sekundäre Endpunkte waren die Veränderung vom Ausgangswert bis Woche 16 in: 6-Minuten-Gehstrecke (6MWD) bewertet sofort nach Abschluss der AIR001 Vernebelung (Peak), aber nicht mehr als 40 Minuten nach Beendigung der AIR001 Vernebelung; hämodynamische Messungen der Herzleistung, mittlerer Druck im rechten Vorhof und Lungenkapillardruck zu Spitzen; N-Terminal-Pro-Brain Natriuretic Peptide (NT-proBNP); Hämodynamik und 6MWD am Trog; und der Lebensqualität.
Die Studie wurde betrieben, um 90 Patienten aufgenommen, jedoch vor der Übernahme durch Mast, Aires brachen die Studie aufgrund von Kapitalbeschränkungen. Daten ist von 29 Patienten, die in die Studie aufgenommen.
Über AIR001
AIR001 (Natriumnitrit) Inhalationslösung, die auch als Aironite ® bekannt, ist eine zeitweise vernebelt Formulierung von Nitrit. Unter hypoxischen Bedingungen wird AIR001 Stickstoffmonoxid umgewandelt. Nitrit vermittelten Stickoxidbildung hat mehrere vorteilhafte Wirkungen, einschließlich Erweiterung der Blutgefäße und die Verringerung der Entzündung und eine unerwünschte Zellwachstum.
AIR001 wurde Orphan-Drug-Status durch die gewährten US Food and Drug Administration und die Europäischen Arzneimittel-Agentur für die Behandlung der pulmonalen arteriellen Hypertonie.
deshalb der nette anstieg….
grüße t.1
- Verbesserungen Daten zeigen, in hämodynamischen Parameter und der körperlichen Leistungsfähigkeit
- AIR001 gut vertragen, ohne behandlungsbedingte schwerwiegende unerwünschte Ereignisse
- Datenunterstützung weitere klinische Entwicklung bei pulmonaler Hypertonie (PH)
SAN DIEGO , 8. September 2014 / PRNewswire / - Mast Therapeutics, Inc . (NYSE MKT: MSTX) meldete heute Top-Line-Ergebnisse aus einer Phase-2-Studie von AIR001 (Natriumnitrit) Inhalationslösung für die Behandlung der pulmonalen arteriellen Hypertonie (PAH). Mast erhalten die Rechte an der AIR001 Programm durch die Übernahme der in Privatbesitz Aires Pharmaceuticals, Inc. Anfang dieses Jahres. In der primären Wirksamkeitsanalyse der Phase-2-Studie zeigten alle Dosen Verbesserung der medianen pulmonalen Gefässwiderstands (PVR). In der sekundären Wirksamkeitsanalyse zeigten alle Dosen Verbesserungen in den in der 6-Minuten-Gehtest erhalten Median Strecken, einschließlich klinisch bedeutsame Verbesserungen bei der höchsten Dosis. Zusätzlich AIR001 wurde gut vertragen, ohne Behandlung bedingte schwerwiegende unerwünschte Ereignisse. Insbesondere Methämoglobin Ebenen blieb normal (<1,5%), was AIR001 von Sicherheitsbedenken mit intravenös verabreichten Nitrit verbunden unterscheidet.
Edwin L. Petersilie , Do, Zwischen Chief Medical Officer, sagte: "Diese Ergebnisse sind vielversprechend und im Einklang mit früheren Befunden von AIR001 als Mittel, die einen positiven Effekt auf die hämodynamischen Parameter in einem pH-Bevölkerung haben können Bis heute haben mehr als 120 Personen AIR001 empfangen. einschließlich Patienten, die wiederholte Gabe für bis zu 12 Monaten erhalten haben, Patienten, die Behandlung naiv waren, und die Patienten auf PAH krankheitsspezifische Hintergrundtherapie. Sichts der hämodynamischen Verbesserungen beobachtet, fühlen wir uns AIR001 kann eindeutig geeignet, um den schweren ungedeckten Bedarf gegen Adresse die große Zahl von Patienten mit pulmonaler Hypertonie mit Linksherzerkrankungen. Folglich werden wir verfolgen klinische Entwicklung von AIR001 in dieser Indikation und planen, mehrere, Institution geförderte Phase-2a-Studien, die 1) akute hämodynamische Effekte zu evaluieren wird unterstützt, 2) Akute Effekte im Vergleich zu Placebo auf die maximale Sauerstoffaufnahme und Bewegung Hämodynamik und 3) gegenüber inhalierten intravenöse Verabreichung von Nitrit, wie auch die Sicherheit der mehrere Dosen AIR001, bei Patienten mit PH mit Linksherzerkrankungen. "
Brian M. Culley , Chief Executive Officer, sagte: "Wir sind von den Ergebnissen der Phase-2-Studie von AIR001 gesehen ermutigt und glauben, dass sie weiter zu validieren Nahme von Aires die Daten aus der Studie zeigen, Vorteile im Einklang mit früheren Studien und unterstützen die weitere Entwicklung von AIR001.. Wir freuen uns, mit den Phase-2a-Studien in PH mit Linksherzerkrankungen voran und erwarten Berichterstattung vorläufigen Ergebnisse der Studie bereits in der zweiten Jahreshälfte 2015 "
Über die Phase-2-Studie (AIR001-CS05)
Die Phase-2-Studie war eine multizentrische, open-label, randomisierte, parallele Dosis-Studie, um die Sicherheit und Wirksamkeit von AIR001 bei Patienten mit PAH zu bestimmen. Die Probanden wurden in eine von drei Behandlungsarme randomisiert und mit AIR001 16 Wochen behandelt: 80 mg einmal täglich nach einer 2-wöchigen "run-in" Zeitraum von 46 mg einmal täglich; 46 mg viermal täglich nach einer 2-wöchigen Run-in-Periode von 46 mg viermal täglich; oder 80 mg viermal täglich nach einer 2-wöchigen Run-in-Periode von 46 mg viermal täglich. Das primäre Ziel der Studie war es, die Wirksamkeit von inhaliertem vernebelten AIR001 zu bewerten, wie durch Veränderung des pulmonalen Gefässwiderstands (PVR) vom Ausgangswert bis Woche 16 bestimmt, gemessen unmittelbar nach dem Abschluss der AIR001 Vernebelung. Sekundäre Endpunkte waren die Veränderung vom Ausgangswert bis Woche 16 in: 6-Minuten-Gehstrecke (6MWD) bewertet sofort nach Abschluss der AIR001 Vernebelung (Peak), aber nicht mehr als 40 Minuten nach Beendigung der AIR001 Vernebelung; hämodynamische Messungen der Herzleistung, mittlerer Druck im rechten Vorhof und Lungenkapillardruck zu Spitzen; N-Terminal-Pro-Brain Natriuretic Peptide (NT-proBNP); Hämodynamik und 6MWD am Trog; und der Lebensqualität.
Die Studie wurde betrieben, um 90 Patienten aufgenommen, jedoch vor der Übernahme durch Mast, Aires brachen die Studie aufgrund von Kapitalbeschränkungen. Daten ist von 29 Patienten, die in die Studie aufgenommen.
Über AIR001
AIR001 (Natriumnitrit) Inhalationslösung, die auch als Aironite ® bekannt, ist eine zeitweise vernebelt Formulierung von Nitrit. Unter hypoxischen Bedingungen wird AIR001 Stickstoffmonoxid umgewandelt. Nitrit vermittelten Stickoxidbildung hat mehrere vorteilhafte Wirkungen, einschließlich Erweiterung der Blutgefäße und die Verringerung der Entzündung und eine unerwünschte Zellwachstum.
AIR001 wurde Orphan-Drug-Status durch die gewährten US Food and Drug Administration und die Europäischen Arzneimittel-Agentur für die Behandlung der pulmonalen arteriellen Hypertonie.
deshalb der nette anstieg….

grüße t.1
Mast Announces Plans For Development Of Vepoloxamer (MST-188) In Heart Failure
- IND cleared by U.S. Food and Drug Administration
- Phase 2 study planned for first-half 2015
- Data from first patient cohort expected second-half 2015
SAN DIEGO, Dec. 9, 2014 /PRNewswire/ -- Mast Therapeutics, Inc. (NYSE MKT: MSTX), a clinical-stage biopharmaceutical company, today provided details of its plan to develop vepoloxamer (MST-188), its lead product candidate, in heart failure.
Consistent with prior guidance, earlier this year, Mast Therapeutics submitted an Investigational New Drug application (IND) to the U.S. Food and Drug Administration (FDA), together with the protocol for a Phase 2 clinical study in patients hospitalized for acute decompensated heart failure. FDA has completed its 30-day safety review and informed the Company that it may proceed with its proposed clinical study. The Company is finalizing the study protocol and expects to begin recruiting patients in the Phase 2 study in the first half of 2015.
Brian M. Culley, Chief Executive Officer, said: "Since we first announced data from our nonclinical proof-of-concept study in the first quarter, vepoloxamer data has been presented at meetings of the European Society of Cardiology, the Heart Failure Society of America and the American Heart Association. Interest from the leading medical conferences and thought leaders in this field reflects the potentially novel way that vepoloxamer may improve heart failure. We believe its membrane-sealing activity helps restore damaged cardiac cell membranes, thus minimizing calcium overload injury, preserving cardiomyocytes and directly improving heart contractility and function. In contrast to most approved drugs, which have not been shown to improve long-term outcomes, by salvaging cardiac tissue, vepoloxamer may have the potential to reduce the high rates of near-term hospital readmission and mortality associated with heart failure hospitalization."
Mr. Culley continued: "Our planned study will evaluate the safety and efficacy of multiple doses of vepoloxamer in patients hospitalized for acute decompensated heart failure, including its effect on markers of cardiac injury (troponin) and wall stress (NT-proBNP), as well as clinical outcomes. As demonstrated by our rapid progress in this area of significant unmet medical need, we continue to identify new ways to create additional value from our vepoloxamer franchise."
http://www.masttherapeutics.com/investors/news/?releaseid=19…
- IND cleared by U.S. Food and Drug Administration
- Phase 2 study planned for first-half 2015
- Data from first patient cohort expected second-half 2015
SAN DIEGO, Dec. 9, 2014 /PRNewswire/ -- Mast Therapeutics, Inc. (NYSE MKT: MSTX), a clinical-stage biopharmaceutical company, today provided details of its plan to develop vepoloxamer (MST-188), its lead product candidate, in heart failure.
Consistent with prior guidance, earlier this year, Mast Therapeutics submitted an Investigational New Drug application (IND) to the U.S. Food and Drug Administration (FDA), together with the protocol for a Phase 2 clinical study in patients hospitalized for acute decompensated heart failure. FDA has completed its 30-day safety review and informed the Company that it may proceed with its proposed clinical study. The Company is finalizing the study protocol and expects to begin recruiting patients in the Phase 2 study in the first half of 2015.
Brian M. Culley, Chief Executive Officer, said: "Since we first announced data from our nonclinical proof-of-concept study in the first quarter, vepoloxamer data has been presented at meetings of the European Society of Cardiology, the Heart Failure Society of America and the American Heart Association. Interest from the leading medical conferences and thought leaders in this field reflects the potentially novel way that vepoloxamer may improve heart failure. We believe its membrane-sealing activity helps restore damaged cardiac cell membranes, thus minimizing calcium overload injury, preserving cardiomyocytes and directly improving heart contractility and function. In contrast to most approved drugs, which have not been shown to improve long-term outcomes, by salvaging cardiac tissue, vepoloxamer may have the potential to reduce the high rates of near-term hospital readmission and mortality associated with heart failure hospitalization."
Mr. Culley continued: "Our planned study will evaluate the safety and efficacy of multiple doses of vepoloxamer in patients hospitalized for acute decompensated heart failure, including its effect on markers of cardiac injury (troponin) and wall stress (NT-proBNP), as well as clinical outcomes. As demonstrated by our rapid progress in this area of significant unmet medical need, we continue to identify new ways to create additional value from our vepoloxamer franchise."
http://www.masttherapeutics.com/investors/news/?releaseid=19…
Frohes Neues Jahr an allen!
Sehr interessanter Wert mit sehr hohen Kurszielen!
Geht mal auf die Homepage von Mast Therapeutics dort haben sich gestern die Vorstände Optionen zu dem 0,58 $ gesichert! Schaut unter Sicfiles
Am Dienstag ist eine größere Konferenz ob die da mehr wissen?
Sehr interessanter Wert mit sehr hohen Kurszielen!
Geht mal auf die Homepage von Mast Therapeutics dort haben sich gestern die Vorstände Optionen zu dem 0,58 $ gesichert! Schaut unter Sicfiles
Am Dienstag ist eine größere Konferenz ob die da mehr wissen?
Wow über 3 Mio Shares die Kaufen gut ein, morgen ist eine Conference Call angesetzt da kanns spannend werden die Vorstände haben sich einige Shares zu 0,58 im Oktober 2015 gesichert!
Mast Therapeutics Provides Update On Epic Study Enrollment And 2015 Milestones
-- EPIC Study More Than One-Third Complete
-- Enrollment On Track to Complete in 2015
-- Top Line Data Anticipated in the First Quarter of 2016
-- Conference Call Scheduled for 8:00am ET / 5:00am PT on Tuesday January 6, 2015
SAN DIEGO, Jan. 5, 2015 /PRNewswire/ -- Mast Therapeutics, Inc. (NYSE MKT: MSTX), a clinical-stage biopharmaceutical company, today reported that enrollment in its pivotal EPIC study of its lead product candidate vepoloxamer (MST-188) in sickle cell disease surpassed the one-third enrollment milestone, ahead of internal projections. The Company remains on-track to complete enrollment by the end of 2015 and, consistent with prior guidance, anticipates reporting top line results in the first quarter of 2016.
"We are extremely pleased to report that, as of today, 130 patients have been randomized to the EPIC study, which is ahead of the enrollment projections we set for ourselves more than a year ago," stated Brian M. Culley, Chief Executive Officer. "We now have opened almost 70 sites in ten countries, with more than 50 of those sites located in the U.S. I am pleased to affirm that we remain on-track to complete enrollment this year, which means we expect to announce top line data in the first quarter of 2016. As there has never been a drug approved for sickle cell patients to treat an ongoing crisis, we are both hopeful and excited for a positive outcome from the EPIC study."
"We have built a sense of camaraderie with the sickle cell medical community and are enjoying a groundswell of momentum that is helping to drive enrollment," added Edwin L. Parsley, D.O., Chief Medical Officer. "Of note, approximately 60% of the sites we have opened in EPIC have enrolled at least one subject and two-thirds of those sites have enrolled two or more subjects. This broad activity indicates that investigators worldwide are excited about the study and are encouraging their patients to participate."
"I am also pleased to highlight that the EPIC study's independent Data and Safety Monitoring Board ("DSMB") has held multiple pre-planned meetings and recommended that the study proceed without any changes," added Dr. Parsley.
Additional milestones anticipated from the Company in 2015 include:
Reporting data from a repeat-dose nonclinical study of vepoloxamer in heart failure;
Initiating a Phase 2 clinical study of vepoloxamer in acute decompensated heart failure;
Initiating enrollment in an open-label EPIC extension study, referred to as EPIC-E, to expand the Company's existing safety database regarding repeat exposure to vepoloxamer;
Reporting data from a nonclinical study of vepoloxamer in embolic stroke; and
Reporting data from one or more of the Phase 2a studies of AIR001 in patients suffering heart failure with preserved ejection fraction (HFpEF).
Conference Call Information
Interested parties may access the conference call on Tuesday, January 6, 2015 by dialing (877) 870-4263 from the U.S. and (412) 317-0790 from outside the U.S. and should request the Mast Therapeutics, Inc. Corporate Update Call. The webcast will be available live via the Internet by accessing the Investors section of Mast's website at http://www.masttherapeutics.com/investors/events/. Replays of the webcast will be available on the Company's website for 30 days and a phone replay will be available through January 15, 2015 by dialing (877) 344-7529 from the U.S. and (412) 317-0088 from outside the U.S. and entering conference reference number 10057420.
http://www.masttherapeutics.com/investors/news/?releaseid=20…
Dann warten wirs mal ab was da an News rumkommt, bei ConferenceCall.
-- EPIC Study More Than One-Third Complete
-- Enrollment On Track to Complete in 2015
-- Top Line Data Anticipated in the First Quarter of 2016
-- Conference Call Scheduled for 8:00am ET / 5:00am PT on Tuesday January 6, 2015
SAN DIEGO, Jan. 5, 2015 /PRNewswire/ -- Mast Therapeutics, Inc. (NYSE MKT: MSTX), a clinical-stage biopharmaceutical company, today reported that enrollment in its pivotal EPIC study of its lead product candidate vepoloxamer (MST-188) in sickle cell disease surpassed the one-third enrollment milestone, ahead of internal projections. The Company remains on-track to complete enrollment by the end of 2015 and, consistent with prior guidance, anticipates reporting top line results in the first quarter of 2016.
"We are extremely pleased to report that, as of today, 130 patients have been randomized to the EPIC study, which is ahead of the enrollment projections we set for ourselves more than a year ago," stated Brian M. Culley, Chief Executive Officer. "We now have opened almost 70 sites in ten countries, with more than 50 of those sites located in the U.S. I am pleased to affirm that we remain on-track to complete enrollment this year, which means we expect to announce top line data in the first quarter of 2016. As there has never been a drug approved for sickle cell patients to treat an ongoing crisis, we are both hopeful and excited for a positive outcome from the EPIC study."
"We have built a sense of camaraderie with the sickle cell medical community and are enjoying a groundswell of momentum that is helping to drive enrollment," added Edwin L. Parsley, D.O., Chief Medical Officer. "Of note, approximately 60% of the sites we have opened in EPIC have enrolled at least one subject and two-thirds of those sites have enrolled two or more subjects. This broad activity indicates that investigators worldwide are excited about the study and are encouraging their patients to participate."
"I am also pleased to highlight that the EPIC study's independent Data and Safety Monitoring Board ("DSMB") has held multiple pre-planned meetings and recommended that the study proceed without any changes," added Dr. Parsley.
Additional milestones anticipated from the Company in 2015 include:
Reporting data from a repeat-dose nonclinical study of vepoloxamer in heart failure;
Initiating a Phase 2 clinical study of vepoloxamer in acute decompensated heart failure;
Initiating enrollment in an open-label EPIC extension study, referred to as EPIC-E, to expand the Company's existing safety database regarding repeat exposure to vepoloxamer;
Reporting data from a nonclinical study of vepoloxamer in embolic stroke; and
Reporting data from one or more of the Phase 2a studies of AIR001 in patients suffering heart failure with preserved ejection fraction (HFpEF).
Conference Call Information
Interested parties may access the conference call on Tuesday, January 6, 2015 by dialing (877) 870-4263 from the U.S. and (412) 317-0790 from outside the U.S. and should request the Mast Therapeutics, Inc. Corporate Update Call. The webcast will be available live via the Internet by accessing the Investors section of Mast's website at http://www.masttherapeutics.com/investors/events/. Replays of the webcast will be available on the Company's website for 30 days and a phone replay will be available through January 15, 2015 by dialing (877) 344-7529 from the U.S. and (412) 317-0088 from outside the U.S. and entering conference reference number 10057420.
http://www.masttherapeutics.com/investors/news/?releaseid=20…
Dann warten wirs mal ab was da an News rumkommt, bei ConferenceCall.
Mast Therapeutics Announces Initiation Of Phase 2a Studies Of AIR001 In Patients With Heart Failure With Preserved Ejection Fraction (HFpEF)
Mayo Clinic & University of Pittsburgh have initiated patient dosing in AIR001 studies
SAN DIEGO, Feb. 4, 2015 /PRNewswire/ -- Mast Therapeutics, Inc. (NYSE MKT: MSTX) today reported the initiation of patient dosing in two institutional-sponsored Phase 2a studies of AIR001 for the treatment of patients experiencing heart failure with preserved ejection fraction (HFpEF). The Phase 2a studies, currently underway at Mayo Clinic and the University of Pittsburgh, are evaluating the hemodynamic effects of AIR001 in both acute and exercise conditions, as well as change in submaximal oxygen consumption before and after AIR001 versus placebo. A third clinical study designed to compare the hemodynamic benefits versus the formation of methemoglobin comparing intravenous nitrite to AIR001 is expected to begin later this year.
Brian M. Culley, Chief Executive Officer, stated: "We are pleased to report that patient dosing recently began in these Phase 2a studies of AIR001. Last year, we reported positive top-line results from a Phase 2 study of AIR001 which demonstrated improvements in hemodynamic parameters and exercise capacity and showed that AIR001 was well-tolerated, with no treatment-related serious adverse events. That data showed benefits consistent with prior studies of AIR001, supporting our plans for continued development. We believe the hemodynamic benefits of AIR001 are particularly suited to a HFpEF population with elevated pulmonary artery and pulmonary capillary wedge pressures, for which no FDA-approved therapies are currently available. We anticipate reporting preliminary data from these Phase 2a studies beginning the second half of this year."
About AIR001
AIR001 is a sodium nitrite solution for intermittent inhalation via nebulizer. Nitrite is a physiological signaling molecule with roles in intravascular endocrine nitric oxide (NO) production, hypoxic vasodilation signaling, and cytoprotection after ischemia-reperfusion. Nitrite serves as the largest physiologic reservoir of NO and can be converted to NO independent of nitric oxide synthase (NOS) activity. In experimental models, nitrite use has demonstrated improved remodeling both in the pulmonary vasculature and right ventricle. Hemodynamic effects include venodilation with reductions in right atrial pressures, pulmonary and systemic vasodilation with reductions in pulmonary vascular resistance and left atrial pressures, and improved cardiac relaxation. Mast Therapeutics obtained the AIR001 program through its acquisition of privately-held Aires Pharmaceuticals, Inc. in 2014.
About Mast Therapeutics
Mast Therapeutics, Inc. is a publicly traded biopharmaceutical company headquartered in San Diego, California. The Company is leveraging the MAST (Molecular Adhesion and Sealant Technology) platform, derived from over two decades of clinical, nonclinical and manufacturing experience with purified and non-purified poloxamers, to develop vepoloxamer (MST-188), its lead product candidate, for serious or life-threatening diseases and conditions typically characterized by impaired microvascular blood flow and damaged cell membranes.
The Company is enrolling subjects in EPIC, a pivotal Phase 3 study of vepoloxamer in sickle cell disease, and in a Phase 2 study to evaluate whether vepoloxamer improves the effectiveness of recombinant tissue plasminogen activator therapy in patients with acute limb ischemia. The Company also is planning to initiate a Phase 2 study of vepoloxamer in patients with acute decompensated heart failure in the second quarter of 2015. More information can be found on the Company's web site at www.masttherapeutics.com. (Twitter: @MastThera)
http://www.masttherapeutics.com/investors/news/?releaseid=20…
Mayo Clinic & University of Pittsburgh have initiated patient dosing in AIR001 studies
SAN DIEGO, Feb. 4, 2015 /PRNewswire/ -- Mast Therapeutics, Inc. (NYSE MKT: MSTX) today reported the initiation of patient dosing in two institutional-sponsored Phase 2a studies of AIR001 for the treatment of patients experiencing heart failure with preserved ejection fraction (HFpEF). The Phase 2a studies, currently underway at Mayo Clinic and the University of Pittsburgh, are evaluating the hemodynamic effects of AIR001 in both acute and exercise conditions, as well as change in submaximal oxygen consumption before and after AIR001 versus placebo. A third clinical study designed to compare the hemodynamic benefits versus the formation of methemoglobin comparing intravenous nitrite to AIR001 is expected to begin later this year.
Brian M. Culley, Chief Executive Officer, stated: "We are pleased to report that patient dosing recently began in these Phase 2a studies of AIR001. Last year, we reported positive top-line results from a Phase 2 study of AIR001 which demonstrated improvements in hemodynamic parameters and exercise capacity and showed that AIR001 was well-tolerated, with no treatment-related serious adverse events. That data showed benefits consistent with prior studies of AIR001, supporting our plans for continued development. We believe the hemodynamic benefits of AIR001 are particularly suited to a HFpEF population with elevated pulmonary artery and pulmonary capillary wedge pressures, for which no FDA-approved therapies are currently available. We anticipate reporting preliminary data from these Phase 2a studies beginning the second half of this year."
About AIR001
AIR001 is a sodium nitrite solution for intermittent inhalation via nebulizer. Nitrite is a physiological signaling molecule with roles in intravascular endocrine nitric oxide (NO) production, hypoxic vasodilation signaling, and cytoprotection after ischemia-reperfusion. Nitrite serves as the largest physiologic reservoir of NO and can be converted to NO independent of nitric oxide synthase (NOS) activity. In experimental models, nitrite use has demonstrated improved remodeling both in the pulmonary vasculature and right ventricle. Hemodynamic effects include venodilation with reductions in right atrial pressures, pulmonary and systemic vasodilation with reductions in pulmonary vascular resistance and left atrial pressures, and improved cardiac relaxation. Mast Therapeutics obtained the AIR001 program through its acquisition of privately-held Aires Pharmaceuticals, Inc. in 2014.
About Mast Therapeutics
Mast Therapeutics, Inc. is a publicly traded biopharmaceutical company headquartered in San Diego, California. The Company is leveraging the MAST (Molecular Adhesion and Sealant Technology) platform, derived from over two decades of clinical, nonclinical and manufacturing experience with purified and non-purified poloxamers, to develop vepoloxamer (MST-188), its lead product candidate, for serious or life-threatening diseases and conditions typically characterized by impaired microvascular blood flow and damaged cell membranes.
The Company is enrolling subjects in EPIC, a pivotal Phase 3 study of vepoloxamer in sickle cell disease, and in a Phase 2 study to evaluate whether vepoloxamer improves the effectiveness of recombinant tissue plasminogen activator therapy in patients with acute limb ischemia. The Company also is planning to initiate a Phase 2 study of vepoloxamer in patients with acute decompensated heart failure in the second quarter of 2015. More information can be found on the Company's web site at www.masttherapeutics.com. (Twitter: @MastThera)
http://www.masttherapeutics.com/investors/news/?releaseid=20…
Mast Announces Results From Nonclinical Study Investigating Repeat Treatment With Vepoloxamer In Advanced Heart Failure
- Study reproduced earlier findings that a single, 2-hour intravenous administration of vepoloxamer resulted in robust improvements in key parameters of heart function that persisted for up to 2 weeks
- New findings demonstrated that retreatment at 3 weeks resulted in improvements in ventricular function similar to the first administration and that the treatment effect was sustained for at least 3 additional weeks (to end of 6-week study)
SAN DIEGO, March 2, 2015 /PRNewswire/ -- Mast Therapeutics, Inc. (NYSE MKT: MSTX), a clinical-stage biopharmaceutical company, today announced preliminary findings from a randomized, placebo-controlled, nonclinical study of vepoloxamer (MST-188) in a model of chronic, stable heart failure produced by intracoronary microembolizations. The primary objective of this study was to examine the effects of repeat intravenous administration of vepoloxamer on left ventricular (LV) systolic and diastolic function.
Consistent with results of a previously reported study, in this study, a single, two-hour administration of vepoloxamer resulted in robust improvements that persisted for 1 - 2 weeks in key parameters of heart function, including LV end-systolic volume, ejection fraction, stroke volume, and cardiac output. Notably, LV ejection fraction was improved by approximately 20% for up to two weeks, returning to baseline values by three weeks post-administration. Diastolic function also was improved. Following a second administration (three weeks after the first), similar improvements in LV systolic and diastolic function were again observed. The effects observed after the second administration persisted for at least three weeks post-administration to the end of the six-week study. Notably, after the second administration, LV ejection fraction had not returned to baseline values by the end of the six-week study, but was still improved by approximately 20% above baseline. Vepoloxamer had no statistically significant effect on heart rate or blood pressure compared to control.
Dr. Hani N. Sabbah, Professor of Medicine & Director of Cardiovascular Research at Henry Ford Health System, said: "The membrane-sealing activity of vepoloxamer may be helping restore damaged cardiac cell membrane integrity, thus minimizing calcium overload injury, preserving cardiomyocytes, and directly improving LV contractile function. These results support clinical testing of pulsed therapy with vepoloxamer in patients with chronic heart failure as well as acute administration in acute heart failure. Therapy with vepoloxamer may be particularly useful in treating heart failure patients after discharge from the hospital following an acute heart failure exacerbation event."
Dr. R. Martin Emanuele, the Company's Senior Vice President, Development, said: "Because vepoloxamer is administered by intravenous injection, we initially believed the clinical utility would be limited to acute heart failure. However, these new findings are supportive of use in chronic heart failure and, in particular, during the period following hospital discharge, which is considered a 'high vulnerability' period for chronic heart failure patients as it is associated with high re-hospitalization and mortality rates, or in patients with continued myocardial injury as evidenced by biomarker testing. In addition, the dose that was used in these nonclinical studies is approximately one-third of the dose that is administered in our ongoing Phase 3 study in sickle cell crisis. Accordingly, we believe this dose will translate well to future clinical studies conducted in heart failure patients."
To view the original version on PR Newswire, visit:http://www.prnewswire.com/news-releases/mast-announces-resul…
- Study reproduced earlier findings that a single, 2-hour intravenous administration of vepoloxamer resulted in robust improvements in key parameters of heart function that persisted for up to 2 weeks
- New findings demonstrated that retreatment at 3 weeks resulted in improvements in ventricular function similar to the first administration and that the treatment effect was sustained for at least 3 additional weeks (to end of 6-week study)
SAN DIEGO, March 2, 2015 /PRNewswire/ -- Mast Therapeutics, Inc. (NYSE MKT: MSTX), a clinical-stage biopharmaceutical company, today announced preliminary findings from a randomized, placebo-controlled, nonclinical study of vepoloxamer (MST-188) in a model of chronic, stable heart failure produced by intracoronary microembolizations. The primary objective of this study was to examine the effects of repeat intravenous administration of vepoloxamer on left ventricular (LV) systolic and diastolic function.
Consistent with results of a previously reported study, in this study, a single, two-hour administration of vepoloxamer resulted in robust improvements that persisted for 1 - 2 weeks in key parameters of heart function, including LV end-systolic volume, ejection fraction, stroke volume, and cardiac output. Notably, LV ejection fraction was improved by approximately 20% for up to two weeks, returning to baseline values by three weeks post-administration. Diastolic function also was improved. Following a second administration (three weeks after the first), similar improvements in LV systolic and diastolic function were again observed. The effects observed after the second administration persisted for at least three weeks post-administration to the end of the six-week study. Notably, after the second administration, LV ejection fraction had not returned to baseline values by the end of the six-week study, but was still improved by approximately 20% above baseline. Vepoloxamer had no statistically significant effect on heart rate or blood pressure compared to control.
Dr. Hani N. Sabbah, Professor of Medicine & Director of Cardiovascular Research at Henry Ford Health System, said: "The membrane-sealing activity of vepoloxamer may be helping restore damaged cardiac cell membrane integrity, thus minimizing calcium overload injury, preserving cardiomyocytes, and directly improving LV contractile function. These results support clinical testing of pulsed therapy with vepoloxamer in patients with chronic heart failure as well as acute administration in acute heart failure. Therapy with vepoloxamer may be particularly useful in treating heart failure patients after discharge from the hospital following an acute heart failure exacerbation event."
Dr. R. Martin Emanuele, the Company's Senior Vice President, Development, said: "Because vepoloxamer is administered by intravenous injection, we initially believed the clinical utility would be limited to acute heart failure. However, these new findings are supportive of use in chronic heart failure and, in particular, during the period following hospital discharge, which is considered a 'high vulnerability' period for chronic heart failure patients as it is associated with high re-hospitalization and mortality rates, or in patients with continued myocardial injury as evidenced by biomarker testing. In addition, the dose that was used in these nonclinical studies is approximately one-third of the dose that is administered in our ongoing Phase 3 study in sickle cell crisis. Accordingly, we believe this dose will translate well to future clinical studies conducted in heart failure patients."
To view the original version on PR Newswire, visit:http://www.prnewswire.com/news-releases/mast-announces-resul…
0.59 0.07 (12.12%)
LAST UPDATED 4:59 PM EST MAR 4

LAST UPDATED 4:59 PM EST MAR 4

Mast To Develop Vepoloxamer (MST-188) In Chronic Heart Failure
- Positive nonclinical study results and medical experts in heart failure support clinical development in chronic heart failure
- New patent claims filed for methods of treating chronic heart failure with vepoloxamer
- Phase 2 study planned to begin enrolling in Q3 2015
SAN DIEGO, March 23, 2015 /PRNewswire/ -- Mast Therapeutics, Inc. (NYSE MKT: MSTX), a clinical-stage biopharmaceutical company leveraging its molecular adhesion and sealant technology (MAST) platform to develop novel therapies for sickle cell disease, arterial disease and heart failure, today announced its plans to develop vepoloxamer (MST-188) for the treatment of patients with chronic heart failure. Encouraged by recently reported nonclinical results and input from experts in the field, the Company expects to begin dosing in a Phase 2 study of vepoloxamer in patients with chronic heart failure in the third quarter of this year.
Wilson S. Colucci M.D., Professor of Medicine and Physiology and Chief of Cardiovascular Medicine at Boston University School of Medicine said: "The results from studies in experimental heart failure are encouraging and support clinical testing in patients with chronic heart failure. If shown to translate to patients with clinical heart failure, vepoloxamer may offer a way of directly improving LV contractile function by restoring cardiomyocyte membrane integrity and increasing their survival. Such a novel mechanism offers great potential for our patients."
Brian M. Culley, Chief Executive Officer of the Company, said: "While we are still in the planning process, we expect the Phase 2 study will be a randomized, double-blind, two-arm, placebo-controlled study of the safety and efficacy of a single administration of vepoloxamer in patients with chronic heart failure, including its effect on markers of cardiac injury (troponin) and wall stress (NT-proBNP), as well as clinical outcomes. We anticipate that the study will be conducted on an outpatient basis and enroll approximately 150 patients at sites in and outside of the U.S. Of note, we recently filed new patent applications claiming the use of vepoloxamer in this and other clinical settings of heart failure and will continue to identify ways to create additional value and protect the sizeable market opportunity of our vepoloxamer pipeline."
The Company previously reported results from two randomized, placebo-controlled nonclinical studies of vepoloxamer in a model of chronic, stable heart failure produced by intracoronary microembolizations. In the first study, as reported last year, a single, two-hour administration of vepoloxamer resulted in robust improvements in key parameters of heart function, including left ventricular (LV) end-systolic volume, ejection fraction, stroke volume and cardiac output, which persisted for one to two weeks. In the second study, vepoloxamer was administered at the start of the study and a repeat treatment was administered three weeks after the first. The study concluded after a total of six weeks. As the Company reported earlier this month, the second study not only reproduced the treatment effect of the first study, but also showed that retreatment with vepoloxamer at three weeks after the initial administration improved upon the effects observed after the first administration. The effects observed after the second administration persisted for at least three weeks, until the end of the six-week study. Notably, after the second administration, LV ejection fraction had not returned to baseline values by the end of the study, but was still improved by approximately 20% above baseline. Vepoloxamer had no statistically significant effect on heart rate or blood pressure compared to control.
http://www.masttherapeutics.com/investors/news/?releaseid=20…
- Positive nonclinical study results and medical experts in heart failure support clinical development in chronic heart failure
- New patent claims filed for methods of treating chronic heart failure with vepoloxamer
- Phase 2 study planned to begin enrolling in Q3 2015
SAN DIEGO, March 23, 2015 /PRNewswire/ -- Mast Therapeutics, Inc. (NYSE MKT: MSTX), a clinical-stage biopharmaceutical company leveraging its molecular adhesion and sealant technology (MAST) platform to develop novel therapies for sickle cell disease, arterial disease and heart failure, today announced its plans to develop vepoloxamer (MST-188) for the treatment of patients with chronic heart failure. Encouraged by recently reported nonclinical results and input from experts in the field, the Company expects to begin dosing in a Phase 2 study of vepoloxamer in patients with chronic heart failure in the third quarter of this year.
Wilson S. Colucci M.D., Professor of Medicine and Physiology and Chief of Cardiovascular Medicine at Boston University School of Medicine said: "The results from studies in experimental heart failure are encouraging and support clinical testing in patients with chronic heart failure. If shown to translate to patients with clinical heart failure, vepoloxamer may offer a way of directly improving LV contractile function by restoring cardiomyocyte membrane integrity and increasing their survival. Such a novel mechanism offers great potential for our patients."
Brian M. Culley, Chief Executive Officer of the Company, said: "While we are still in the planning process, we expect the Phase 2 study will be a randomized, double-blind, two-arm, placebo-controlled study of the safety and efficacy of a single administration of vepoloxamer in patients with chronic heart failure, including its effect on markers of cardiac injury (troponin) and wall stress (NT-proBNP), as well as clinical outcomes. We anticipate that the study will be conducted on an outpatient basis and enroll approximately 150 patients at sites in and outside of the U.S. Of note, we recently filed new patent applications claiming the use of vepoloxamer in this and other clinical settings of heart failure and will continue to identify ways to create additional value and protect the sizeable market opportunity of our vepoloxamer pipeline."
The Company previously reported results from two randomized, placebo-controlled nonclinical studies of vepoloxamer in a model of chronic, stable heart failure produced by intracoronary microembolizations. In the first study, as reported last year, a single, two-hour administration of vepoloxamer resulted in robust improvements in key parameters of heart function, including left ventricular (LV) end-systolic volume, ejection fraction, stroke volume and cardiac output, which persisted for one to two weeks. In the second study, vepoloxamer was administered at the start of the study and a repeat treatment was administered three weeks after the first. The study concluded after a total of six weeks. As the Company reported earlier this month, the second study not only reproduced the treatment effect of the first study, but also showed that retreatment with vepoloxamer at three weeks after the initial administration improved upon the effects observed after the first administration. The effects observed after the second administration persisted for at least three weeks, until the end of the six-week study. Notably, after the second administration, LV ejection fraction had not returned to baseline values by the end of the study, but was still improved by approximately 20% above baseline. Vepoloxamer had no statistically significant effect on heart rate or blood pressure compared to control.
http://www.masttherapeutics.com/investors/news/?releaseid=20…
Enrollment In Mast Therapeutics' Phase 3 "EPIC" Study In Sickle Cell Disease Surpasses Halfway Mark
On Track for Top-Line Data in Q1 2016
SAN DIEGO, April 21, 2015 /PRNewswire/ -- Mast Therapeutics, Inc. (NYSE MKT: MSTX), a clinical-stage biopharmaceutical company leveraging its molecular adhesion and sealant technology (MAST) platform to develop novel therapies for sickle cell disease, heart failure, and arterial disease, today reported that patient enrollment in its pivotal EPIC study of its lead product candidate, vepoloxamer (MST-188), in sickle cell disease has surpassed the halfway point. Consistent with prior guidance, the Company anticipates reporting top-line results in the first quarter of 2016.
"We are extremely pleased to report that, as of yesterday, 205 patients had been randomized to the EPIC study," stated Brian M. Culley, Chief Executive Officer. "Consistent with projections we set for ourselves more than 18 months ago, we remain on track to announce top-line data in the first quarter of 2016. Our clinical operations team has opened more than 70 sites in ten countries, with more than two-thirds of those sites located in the U.S. In the next few months, we will be opening new sites in at least four additional countries."
"We have cultivated relationships with the sickle cell medical and patient communities and continued to add new sites, which has increased awareness about our study. As a result, we are seeing consistent growth in enthusiasm and enrollment," stated Dr. Edwin L. Parsley, the Company's Chief Medical Officer. "Of note, more than 70% of the EPIC sites have enrolled at least one subject and 75% of those sites have enrolled two or more subjects. A majority of patients have come from our U.S. sites and we believe that at the conclusion of EPIC, the majority of the study population will have come from the U.S."
"Notably, although EPIC is open to patients aged 4-65, the average age of randomized patients is 14. We believe the potential benefits of vepoloxamer are not limited to age, but that younger patients may experience a more distinct crisis, providing the opportunity to assess differences accross age groups. In additon, approximately 20% of the randomized patients are 18 and over. Exposures to vepoloxamer across a wide age range will provide safety and efficacy data supportive of a broad label," continued Dr. Parsley.
Mr. Culley added, "There has never been a drug approved to treat an ongoing sickle cell crisis, however, there have been hundreds of clinical administrations with vepoloxamer even prior to this Phase 3 and it is years ahead of other new treatments being developed for sickle cell disease, so I am confident the sickle cell community is hopeful and excited for a positive outcome from this important study."
http://www.masttherapeutics.com/investors/news/?releaseid=20…
On Track for Top-Line Data in Q1 2016
SAN DIEGO, April 21, 2015 /PRNewswire/ -- Mast Therapeutics, Inc. (NYSE MKT: MSTX), a clinical-stage biopharmaceutical company leveraging its molecular adhesion and sealant technology (MAST) platform to develop novel therapies for sickle cell disease, heart failure, and arterial disease, today reported that patient enrollment in its pivotal EPIC study of its lead product candidate, vepoloxamer (MST-188), in sickle cell disease has surpassed the halfway point. Consistent with prior guidance, the Company anticipates reporting top-line results in the first quarter of 2016.
"We are extremely pleased to report that, as of yesterday, 205 patients had been randomized to the EPIC study," stated Brian M. Culley, Chief Executive Officer. "Consistent with projections we set for ourselves more than 18 months ago, we remain on track to announce top-line data in the first quarter of 2016. Our clinical operations team has opened more than 70 sites in ten countries, with more than two-thirds of those sites located in the U.S. In the next few months, we will be opening new sites in at least four additional countries."
"We have cultivated relationships with the sickle cell medical and patient communities and continued to add new sites, which has increased awareness about our study. As a result, we are seeing consistent growth in enthusiasm and enrollment," stated Dr. Edwin L. Parsley, the Company's Chief Medical Officer. "Of note, more than 70% of the EPIC sites have enrolled at least one subject and 75% of those sites have enrolled two or more subjects. A majority of patients have come from our U.S. sites and we believe that at the conclusion of EPIC, the majority of the study population will have come from the U.S."
"Notably, although EPIC is open to patients aged 4-65, the average age of randomized patients is 14. We believe the potential benefits of vepoloxamer are not limited to age, but that younger patients may experience a more distinct crisis, providing the opportunity to assess differences accross age groups. In additon, approximately 20% of the randomized patients are 18 and over. Exposures to vepoloxamer across a wide age range will provide safety and efficacy data supportive of a broad label," continued Dr. Parsley.
Mr. Culley added, "There has never been a drug approved to treat an ongoing sickle cell crisis, however, there have been hundreds of clinical administrations with vepoloxamer even prior to this Phase 3 and it is years ahead of other new treatments being developed for sickle cell disease, so I am confident the sickle cell community is hopeful and excited for a positive outcome from this important study."
http://www.masttherapeutics.com/investors/news/?releaseid=20…
Mast Therapeutics Announces Positive Top-Line Results From Phase 2a Study Of AIR001 In Patients With Heart Failure With Preserved Ejection Fraction (HFpEF) Conducted At Mayo Clinic
Mon February 1, 2016 7:30 AM|PR Newswire | About: MSTX
SAN DIEGO, Feb. 1, 2016 /PRNewswire/ -- Mast Therapeutics, Inc. (MSTX) (NYSE MKT: MSTX), a biopharmaceutical company developing novel clinical-stage therapies for sickle cell disease and heart failure, today reported positive top-line results from a blinded Phase 2a study of AIR001 for the treatment of heart failure with preserved ejection fraction (HFpEF) conducted at Mayo Clinic by lead investigator Barry A. Borlaug, M.D., Associate Professor of Medicine and Director, Circulatory Failure Research, Division of Cardiovascular Diseases, Department of Internal Medicine. In the Phase 2a study, AIR001 showed statistically significant improvement for the pre-specified primary endpoint: change in pulmonary capillary wedge pressure (PCWP) at 20 Watts exercise after drug treatment relative to PCWP at 20 Watts exercise in the initial assessment prior to drug treatment, compared to placebo-treated patients. Study data show that nebulized AIR001 attenuates the hemodynamic derangements of cardiac failure that occur during exercise in HFpEF patients. AIR001 was generally well-tolerated. Detailed study results are expected to be submitted for presentation at a scientific conference later this year.
"Heart failure with preserved ejection fraction is a major public health problem that has no proven effective treatment, yet currently afflicts 2 to 3 million Americans," stated Dr. Borlaug. "One factor that complicates treatment is that the hemodynamic perturbations causing morbidity such as high filling pressures and low cardiac output are typically present only intermittentlybeing absent at rest but observed during stress such as exercise. As such, an ideal therapy would become more effective during stress, without untoward effects on resting cardiovascular function. The results observed with AIR001 in this study support our hypothesis that acute administration of nebulized inhaled sodium nitrite unloads the heart during exercise without excessive reduction in resting pressures or arterial blood pressure."
"These results are an important step in validating our second asset and establishing the potential clinical utility of AIR001 in HFpEF," stated Brian M. Culley, Chief Executive Officer of Mast Therapeutics. "Mayo Clinic is a well-known leader in the characterization and treatment of heart failure and we thank Dr. Borlaug for working with us and leading this study," continued Mr. Culley. "We look forward to advancing AIR001 in this area of high unmet medical need for which there is no FDA-approved therapy available. We also anticipate reporting interim data from a second investigator-sponsored Phase 2a study of AIR001 in HFpEF patients around the middle of this year."
http://seekingalpha.com/pr/16034136-mast-therapeutics-announ…
Gruß Oberländler
Mon February 1, 2016 7:30 AM|PR Newswire | About: MSTX
SAN DIEGO, Feb. 1, 2016 /PRNewswire/ -- Mast Therapeutics, Inc. (MSTX) (NYSE MKT: MSTX), a biopharmaceutical company developing novel clinical-stage therapies for sickle cell disease and heart failure, today reported positive top-line results from a blinded Phase 2a study of AIR001 for the treatment of heart failure with preserved ejection fraction (HFpEF) conducted at Mayo Clinic by lead investigator Barry A. Borlaug, M.D., Associate Professor of Medicine and Director, Circulatory Failure Research, Division of Cardiovascular Diseases, Department of Internal Medicine. In the Phase 2a study, AIR001 showed statistically significant improvement for the pre-specified primary endpoint: change in pulmonary capillary wedge pressure (PCWP) at 20 Watts exercise after drug treatment relative to PCWP at 20 Watts exercise in the initial assessment prior to drug treatment, compared to placebo-treated patients. Study data show that nebulized AIR001 attenuates the hemodynamic derangements of cardiac failure that occur during exercise in HFpEF patients. AIR001 was generally well-tolerated. Detailed study results are expected to be submitted for presentation at a scientific conference later this year.
"Heart failure with preserved ejection fraction is a major public health problem that has no proven effective treatment, yet currently afflicts 2 to 3 million Americans," stated Dr. Borlaug. "One factor that complicates treatment is that the hemodynamic perturbations causing morbidity such as high filling pressures and low cardiac output are typically present only intermittentlybeing absent at rest but observed during stress such as exercise. As such, an ideal therapy would become more effective during stress, without untoward effects on resting cardiovascular function. The results observed with AIR001 in this study support our hypothesis that acute administration of nebulized inhaled sodium nitrite unloads the heart during exercise without excessive reduction in resting pressures or arterial blood pressure."
"These results are an important step in validating our second asset and establishing the potential clinical utility of AIR001 in HFpEF," stated Brian M. Culley, Chief Executive Officer of Mast Therapeutics. "Mayo Clinic is a well-known leader in the characterization and treatment of heart failure and we thank Dr. Borlaug for working with us and leading this study," continued Mr. Culley. "We look forward to advancing AIR001 in this area of high unmet medical need for which there is no FDA-approved therapy available. We also anticipate reporting interim data from a second investigator-sponsored Phase 2a study of AIR001 in HFpEF patients around the middle of this year."
http://seekingalpha.com/pr/16034136-mast-therapeutics-announ…
Gruß Oberländler
Guten Morgen ,das Hoch vom 11.6.16 bei 0,50$ Dollar scheinen nun doch wieder stärker abzubröckeln!.Mal schauen ob die Marke von 0,30$ Dollargehalten werden kann?. Nun sollen doch erst im Sept. Ergebnisse gezeigt werden.
Mast Therapeutics Announces Initiation Of Phase 2 Study Of AIR001 Conducted By The Heart Failure Clinical Research Network
http://masttherapeutics.com/investors/news/?releaseid=219134…
http://masttherapeutics.com/investors/news/?releaseid=219134…
http://bigcharts.marketwatch.com/advchart/frames/frames.asp?…
Dieses Bild ist nicht SSL-verschlüsselt: [url]http://bigcharts.marketwatch.com/kaavio.Webhost/charts/big.chart?nosettings=1&symb=mstx&uf=0&type=4&size=2&sid=4788360&style=320&freq=1&entitlementtoken=0c33378313484ba9b46b8e24ded87dd6&time=4&rand=1583561967&compidx=aaaaa%3a0&ma=0&maval=9&lf=1&lf2=2&lf3=65536&height=553&width=579&mocktick=1
[/url]
Das war leider nix...
Mast Therapeutics phase-3 trial fails, shares down 78% AH
Sep 20 2016, 17:14 ET | About: Mast Therapeutics, Inc. (MSTX) | By: SA Eli Hoffmann, SA News Editor
Mast Therapeutics (NYSEMKT:MSTX) says phase-3 EPIC trial of vepoloxamer, which treats individuals with sickle cell disease experiencing vaso-occlusive crisis, did not meet its primary efficacy endpoint.
Endpoint was statistically significant reduction in the mean duration of VOC (82 hours in the vepoloxamer group compared to 78 hours in the placebo group in the intent-to-treat population (p=0.09)). There were no statistically significant differences between treatment groups in the intent-to-treat population across the two secondary efficacy endpoints, rate of re-hospitalization for VOC and the occurrence of acute chest syndrome.
Company: "We are exceedingly disappointed with these top-line results... These analyses are limited to just top-line data, so in the coming weeks the Company intends to review the full data set from EPIC. In addition, we plan to perform an interim analysis of the ongoing heart failure trial of vepoloxamer.
"However, based on the data we've seen to date, we expect we will terminate all clinical development of vepoloxamer. Consequently, while we evaluate our options, we intend to significantly and immediately reduce our operating expenses and continue our efforts with AIR001, our lead asset in heart failure with preserved ejection fraction, which currently is the subject of a 100-patient phase 2 study expected to complete enrollment by the end of 2017."
Conference call tomorrow, September 21, 2016, at 8:00 a.m. ET / 5:00 a.m. PT to discuss the results.
Shares -78% to $0.13 AH.
http://seekingalpha.com/news/3209955-mast-therapeutics-phase…
Gruß Oberländler
Mast Therapeutics phase-3 trial fails, shares down 78% AH
Sep 20 2016, 17:14 ET | About: Mast Therapeutics, Inc. (MSTX) | By: SA Eli Hoffmann, SA News Editor
Mast Therapeutics (NYSEMKT:MSTX) says phase-3 EPIC trial of vepoloxamer, which treats individuals with sickle cell disease experiencing vaso-occlusive crisis, did not meet its primary efficacy endpoint.
Endpoint was statistically significant reduction in the mean duration of VOC (82 hours in the vepoloxamer group compared to 78 hours in the placebo group in the intent-to-treat population (p=0.09)). There were no statistically significant differences between treatment groups in the intent-to-treat population across the two secondary efficacy endpoints, rate of re-hospitalization for VOC and the occurrence of acute chest syndrome.
Company: "We are exceedingly disappointed with these top-line results... These analyses are limited to just top-line data, so in the coming weeks the Company intends to review the full data set from EPIC. In addition, we plan to perform an interim analysis of the ongoing heart failure trial of vepoloxamer.
"However, based on the data we've seen to date, we expect we will terminate all clinical development of vepoloxamer. Consequently, while we evaluate our options, we intend to significantly and immediately reduce our operating expenses and continue our efforts with AIR001, our lead asset in heart failure with preserved ejection fraction, which currently is the subject of a 100-patient phase 2 study expected to complete enrollment by the end of 2017."
Conference call tomorrow, September 21, 2016, at 8:00 a.m. ET / 5:00 a.m. PT to discuss the results.
Shares -78% to $0.13 AH.
http://seekingalpha.com/news/3209955-mast-therapeutics-phase…
Gruß Oberländler
Antwort auf Beitrag Nr.: 45.823.412 von fortuna924 am 13.11.13 13:14:20Sorry, nix zu sehen.
Page Not Found
Tommi
Page Not Found
Tommi
Antwort auf Beitrag Nr.: 53.319.756 von Tommi33 am 21.09.16 15:53:30Huch, das war ja 2013, da hat mir meine Telefon nen Streich gespielt.
Tommi
Tommi
in kürze kommt ein neuer US Börsenpltz in D

Antwort auf Beitrag Nr.: 53.862.319 von gerdass am 09.12.16 12:55:24meinst du da kann noch was gehen?
In der Vorbörse geht es erst einmal rückwärts
LG Printi
In der Vorbörse geht es erst einmal rückwärts

LG Printi
Antwort auf Beitrag Nr.: 53.863.357 von printguru am 09.12.16 14:33:57
da wird doch nur gespielt
ich denke hier langfristig
Zitat von printguru: meinst du da kann noch was gehen?
In der Vorbörse geht es erst einmal rückwärts
LG Printi
da wird doch nur gespielt
ich denke hier langfristig
gutes Volumen
Antwort auf Beitrag Nr.: 53.864.179 von gerdass am 09.12.16 15:59:36ja aber leider kraftlos da wird nur abverkauft

was hälst du von Peregrine?
hab heute sonst nichts auf dem Radar das knallen könnte...
LG Printi
hab heute sonst nichts auf dem Radar das knallen könnte...
LG Printi
Antwort auf Beitrag Nr.: 53.864.281 von printguru am 09.12.16 16:12:26wir haben aber jetzt schon das Volumen vom ganzen letzten Handelstag ereicht
https://www.maxblue.de/maerkte-analysen/boersen-kurse/aktien…

https://www.maxblue.de/maerkte-analysen/boersen-kurse/aktien…
es wurden bereits 4,63 Mio. Dollar gehandelt
Antwort auf Beitrag Nr.: 53.864.530 von printguru am 09.12.16 16:38:46
versuch es doch mal mit
Sunshine Heart Inc Common (SSH)
Zitat von printguru: was hälst du von Peregrine?
hab heute sonst nichts auf dem Radar das knallen könnte...
LG Printi
versuch es doch mal mit
Sunshine Heart Inc Common (SSH)

Antwort auf Beitrag Nr.: 53.865.202 von gerdass am 09.12.16 17:34:07glaube nicht dass da heute noch was geht...
in der letzten Handelsstunde wird was gehen
wir haben heute bereits ca 2 Mio. Dollar mehr gehandeld als am gestiegen Handelstag



http://theindependentrepublic.com/2016/12/13/analysts-advise-about-mast-therapeutics-inc-nysemktmstx/
http://theindependentrepublic.com/2016/12/13/analysts-advise… Montag gut festhalten......
=2234807http://masttherapeutics.com/investors/news/?releaseid=223480… Es geht los....
MAST THERAPEUTICS AND SAVARA SIGN MERGER AGREEMENTProposed Merger Creates Specialty Pharmaceutical Company with Three Clinical-Stage Inhaled Product Candidates for Serious and Life-Threatening Diseases
Conference Call Scheduled for Monday, January 9 at 8:30 a.m. ET / 5:30 a.m. PT
SAN DIEGO and AUSTIN, Texas, Jan. 7, 2017 /PRNewswire/ -- Mast Therapeutics, Inc. (Mast, NYSE MKT: MSTX) and Savara Inc. (Savara), a privately-held emerging specialty pharmaceutical company focused on the treatment of rare respiratory diseases, today announced that the two companies have entered into a definitive merger agreement, under which the stockholders of Savara would become the majority owners of Mast, and the operations of Mast and Savara would be combined. Subject to stockholder approval, the combined company will advance a pipeline of novel inhalation therapies for the treatment of diseases with significant unmet medical needs, featuring three product candidates, each in advanced clinical development.
Savara Inc.
The combined company pipeline will include:
AeroVanc, an inhaled dry-powder vancomycin to treat chronic methicillin-resistant Staphylococcus aureus (MRSA) pulmonary infection in cystic fibrosis (CF) in preparation for a pivotal Phase 3 study
Molgradex, an inhaled nebulized GM-CSF to treat pulmonary alveolar proteinosis (PAP) currently in Phase 2/3 development
AIR001, an inhaled nebulized sodium nitrite solution to treat heart failure with preserved ejection fraction (HFpEF) currently in Phase 2 development
"Following an extensive review of strategic alternatives and a thorough process, the Mast Board of Directors chose to combine with Savara because we believe the proposed merger provides an attractive opportunity for our shareholders to obtain value appreciation from a diversified pipeline and positions the company for more rapid short- and long-term growth via a triad of late-stage clinical assets with important forthcoming milestones," stated Brian M. Culley, current Chief Executive Officer and Director of Mast Therapeutics. "We are excited for the prospects of the combined company and believe that Savara's management team is well equipped to advance the pipeline toward regulatory approvals and commercialization in the US and EU."
Rob Neville, Chairman and CEO of Savara added, "This merger is transformative for Savara and marks our second transaction in a year, each expanding Savara's pipeline of inhaled therapies for serious and life-threatening diseases. AeroVanc and Molgradex are orphan-designated product candidates in late-stage development, and we see Mast's AIR001 program potentially adding significant value to our pipeline with a modest capital outlay in 2017. We believe the favorable risk profile of our product candidates combined with their market potential provides a unique opportunity for Savara to become the next breakout company in orphan pulmonary diseases."
Select Anticipated Upcoming Development Milestones
Initiate a pivotal Phase 3 study of AeroVanc for the treatment of MRSA in CF patients in Q3/2017.
Announce top-line results from a registration-enabling Phase 2/3 study of Molgradex for the treatment of PAP currently ongoing for Europe and Japan in Q1/2018.
Complete negotiations with the U.S. Food and Drug Administration (FDA) on the requirements for a pivotal clinical study of Molgradex in the U.S. in Q3/2017.
Announce results from an ongoing 100-patient Phase 2 study of AIR001 for the treatment of HFpEF being conducted by the Heart Failure Clinical Research Network in Q1/2018.
About the Proposed Merger
Under the terms of the merger agreement, pending stockholder approval of the transaction, Savara stockholders will receive newly issued shares of Mast common stock in exchange for their Savara stock. The exchange ratio was determined using a pre-transaction valuation of $115 million for Savara's business, based on its latest priced investment round and an acquisition of assets of Serendex Pharmaceuticals A/S, and $36.5 million for Mast's business, a premium to the 20-day volume weighted average share price of Mast. As a result, current Mast stockholders will collectively own approximately 24%, and Savara stockholders will collectively own approximately 76%, of the combined company on a pro-forma basis, subject to adjustment based on Mast's net cash balance and Mast's and Savara's capitalization at closing.
The combined company, led by Savara's current management team, is expected to be named Savara Inc. and be headquartered in Austin, TX. Prior to closing, Mast will seek stockholder approval to conduct a reverse split of its outstanding shares to satisfy listing requirements of the NYSE MKT. The combined company is expected to trade on the NYSE MKT under a new ticker symbol. At closing, the combined company's board of directors is expected to consist of seven members, including five members of Savara's current board and two members of Mast's current board. The merger agreement has been unanimously approved by the board of directors of each company. The transaction is expected to close by the second quarter of 2017, subject to approvals by the stockholders of Mast and Savara, and other customary closing conditions.
Mast's financial advisor in the transaction is Roth Capital Partners. Canaccord Genuity Inc. is acting as financial advisor to Savara. DLA Piper LLP (US) is serving as legal counsel to Mast and Wilson Sonsini Goodrich & Rosati, P.C. is serving as legal counsel to Savara.
Conference Call and Webcast
Mast and Savara will hold a conference call Monday, January 9, 2017, at 8:30 a.m. Eastern Time / 5:30 a.m. Pacific Time to discuss the proposed transaction. Interested parties may access the conference call by dialing (855) 239-3120 from the U.S., (855) 669-9657 from Canada, and (412) 542-4127 from outside the U.S. and should request the Mast-Savara Conference Call. A live webcast of the conference call will be available online from the Investors section of Mast's website at http://www.masttherapeutics.com/investors/events/. Replays of the webcast will be available on Mast's website for 30 days.
About Savara
Savara Inc. is an emerging specialty pharmaceutical company developing treatments for rare respiratory diseases. The company has two product candidates in late stage clinical trials including AeroVanc – the first dry powder inhaled antibiotic being developed for the treatment of persistent MRSA infection in people with CF – and Molgradex – a proprietary, nebulized formulation of recombinant human GM-CSF for the treatment of PAP. More information can be found at www.savarapharma.com.
Savara acquired the assets of Copenhagen-based Serendex Pharmaceuticals A/S on July 15, 2016. Serendex was established in 2008 and listed on the Oslo Stock Exchange in 2014. Serendex operated as a public company until their delisting on May 4, 2016, ahead of its acquisition by Savara.
About Mast Therapeutics
Mast Therapeutics, Inc. is a publicly traded biopharmaceutical company headquartered in San Diego, California. Mast's lead product candidate, AIR001, is a sodium nitrite solution for intermittent inhalation via nebulization in Phase 2 clinical development for the treatment of HFpEF. More information can be found at www.masttherapeutics.com.
Safe Harbor Statements
Additional Information about the Proposed Merger and Where to Find It
In connection with the proposed merger, Mast intends to file relevant materials with the Securities and Exchange Commission, or the SEC, including a registration statement on Form S‑4 that will contain a prospectus and a joint proxy statement. Investors and security holders of Mast and Savara are urged to read these materials when they become available because they will contain important information about Mast, Savara and the proposed merger. The joint proxy statement, prospectus and other relevant materials (when they become available), and any other documents filed by Mast with the SEC, may be obtained free of charge at the SEC web site at www.sec.gov. In addition, investors and security holders may obtain free copies of the documents filed with the SEC by Mast by directing a written request to: Mast Therapeutics, Inc. 3611 Valley Centre Drive, Suite 500, San Diego, California 92130, Attn: Investor Relations. Investors and security holders are urged to read the joint proxy statement, prospectus and the other relevant materials when they become available before making any voting or investment decision with respect to the proposed merger.
This communication shall not constitute an offer to sell or the solicitation of an offer to sell or the solicitation of an offer to buy any securities, nor shall there be any sale of securities in any jurisdiction in which such offer, solicitation or sale would be unlawful prior to registration or qualification under the securities laws of any such jurisdiction. No offering of securities in connection with the proposed merger shall be made except by means of a prospectus meeting the requirements of Section 10 of the Securities Act of 1933, as amended.
Participants in the Solicitation
Mast and its directors and executive officers and Savara and its directors and executive officers may be deemed to be participants in the solicitation of proxies from the stockholders of Mast and Savara in connection with the proposed transaction. Information regarding the special interests of these directors and executive officers in the proposed merger will be included in the joint proxy statement/prospectus referred to above. Additional information regarding the directors and executive officers of Mast is also included in Mast Annual Report on Form 10-K for the year ended December 31, 2015 and the proxy statement for Mast's 2016 Annual Meeting of Stockholders. These documents are available free of charge at the SEC web site (www.sec.gov) and from Investor Relations at Mast at the address described above.
Forward Looking Statements
Mast cautions you that statements in this press release that are not a description of historical fact are forward-looking statements within the meaning of the Private Securities Litigation Reform Act of 1995. Forward-looking statements may be identified by the use of words referencing future events or circumstances such as "expect," "intend," "plan," "anticipate," "believe," and "will," among others. Such statements include, but are not limited to, statements regarding the structure, timing and completion of our proposed merger with Savara; our continued listing on NYSE MKT prior to and after the proposed merger; our expectations regarding the capitalization, resources and ownership structure of the combined organization; our expectations regarding the sufficiency of the combined organization's resources to fund the advancement of any development program or the completion of any clinical trial; the nature, strategy and focus of the combined organization; the safety, efficacy and projected development timeline and commercial potential of any product candidates; the executive officer and board structure of the combined organization; and the expectations regarding voting by Mast and Savara stockholders. Mast and/or Savara may not actually achieve the proposed merger, or any plans or product development goals in a timely manner, if at all, or otherwise carry out the intentions or meet the expectations or projections disclosed in our forward-looking statements, and you should not place undue reliance on these forward-looking statements. Because such statements are subject to risks and uncertainties, actual results may differ materially from those expressed or implied by such forward-looking statements. These forward-looking statements are based upon Mast's and Savara's current expectations and involve assumptions that may never materialize or may prove to be incorrect. Actual results and the timing of events could differ materially from those anticipated in such forward-looking statements as a result of various risks and uncertainties, which include, without limitation, risks and uncertainties associated with stockholder approval of and the ability to consummate the proposed merger through the process being conducted by Mast and Savara, the ability to project future cash utilization and reserves needed for contingent future liabilities and business operations, the availability of sufficient resources for combined company operations and to conduct or continue planned clinical development programs, the timing and ability of Mast or Savara to raise additional equity capital to fund continued operations; the ability to successfully develop any of Savara's product candidates, and the risks associated with the process of developing, obtaining regulatory approval for and commercializing drug candidates that are safe and effective for use as human therapeutics. Risks and uncertainties facing Mast are described more fully in Mast's periodic reports filed with the SEC available at www.sec.gov. You are cautioned not to place undue reliance on forward-looking statements, which speak only as of the date on which they were made. Mast undertakes no obligation to update such statements to reflect events that occur or circumstances that exist after the date on which they were made, except as may be required by law.
To view the original version on PR Newswire, visit:http://www.prnewswire.com/news-releases/mast-therapeutics-an…
SOURCE Mast Therapeutics
Mast Therapeutics, Ioana C. Hone (ir@mastthera.com), 858-552-0866 Ext. 303










Hat sich bestimmt einer vertippt beim Ordern.
So nun aber mal raus mit den Infos ihr Langinvestierten. Es gibt ne Firmen Fusion und ein neues Lungenkrebs Identifikationsverfahren oder was???
So nun aber mal raus mit den Infos ihr Langinvestierten. Es gibt ne Firmen Fusion und ein neues Lungenkrebs Identifikationsverfahren oder was???
http://seekingalpha.com/instablog/44479986-leny-hettmansperg…Vielleicht interessiert es
Antwort auf Beitrag Nr.: 54.068.633 von Belu1972 am 12.01.17 14:28:46komisch, wenn ich auf der Boerse Stuttgart website in meinem Depot auf MAST klicke, kommt jetzt ein Fact sheet zu
Adventrx Pharmaceuticals Aktie
WKN A1JSMM | ISIN US5763141083
Ich dachte die wolten sich Savara Inc nennen? ist der Merger und die Namens-Umstellung schon durch? Scheint so, dass der alter ticker name schon freigegeben wurde?
Adventrx Pharmaceuticals Aktie
WKN A1JSMM | ISIN US5763141083
Ich dachte die wolten sich Savara Inc nennen? ist der Merger und die Namens-Umstellung schon durch? Scheint so, dass der alter ticker name schon freigegeben wurde?
da wird ja heute schwer gekämpft, um noch billig rein zu kommen. sieht so aus, als ob der zug langsam
fahrt gewinnt
fahrt gewinnt

Savara to Present at the Rodman & Renshaw 19th Annual Global Investment Conference on September 11th
von der Ankündigung am 5. September bis dato ist sie schon ziemlich geklettert. Hoffe aber noch auf mehr Zug - weiter so!
von der Ankündigung am 5. September bis dato ist sie schon ziemlich geklettert. Hoffe aber noch auf mehr Zug - weiter so!
und heute schon mal die 8$ Mquer eingerissen - immer gut zu wissen was möglich ist. Quch wenn der Kurs jetzt wieder abgeprallt ist, die 9$ und 10$ sind in Schlagdistanz
Antwort auf Beitrag Nr.: 55.734.666 von gbecker am 13.09.17 17:48:21so wieder über 8US$. aber irres volume - 5x mehr als normal! 

Antwort auf Beitrag Nr.: 55.737.126 von gbecker am 13.09.17 22:31:13Sauber. Die 9$ auch schon mit Bravour genommen! mal gespannt wo es hingeht und wann mal die News dazu kommt. Zieh Savara
News Flow
Ich verstehe die ersten Reaktionen auf die QT-Zahlen von heute nicht wirklich…für mich gab es da keinen negativen Überraschungen. Wenn ich den mir vor allem den Ausblick so anschaue, dann rechne ich für den Rest des Jahre noch mit einem positiven und durchaus potentiell kurstreibenden News Flow…ich denke, hier kann man durchaus den Dip nutzen und einsteigen…
Savara Reports Second Quarter 2018 Financial Results and Provides Positive Business Update
Molgradex Phase 3 IMPALA study enrollment on track for completion in Q3 2018
AeroVanc Phase 3 AVAIL study enrollment on track for completion in Q1 2019
Molgradex Phase 2a OPTIMA study enrollment on track for completion in Q3 2018; Interim results expected in Q4 2018
Molgradex commercialization preparations underway
Launched exploratory product pipeline
Conference call scheduled for today at 5:30 p.m. E.T.
AUSTIN, Texas, Aug. 09, 2018 (GLOBE NEWSWIRE) -- Savara Inc. (NASDAQ: SVRA), an orphan lung disease company, today reported financial results for the second quarter ended June 30, 2018 and provided a business update.
“We have had an incredibly eventful and productive quarter,” said Rob Neville, chief executive officer of Savara. “With two product candidates approaching pivotal data reads and our exploratory NTM program well underway, we believe we are heading into the most exciting twelve months in Savara’s history. Furthermore, the recent acquisition of the assets of Cardeas Pharma Corporation underlines our commitment to our vision to build a prominent orphan lung disease company. With the closing of our recent public offering, we have initiated preparations for Molgradex commercial launch for aPAP, as well as for a new clinical study in CF-affected individuals with chronic NTM infection, and will support our exploratory pipeline.”
Upcoming Milestones and Recent Developments
Anticipating completion of enrollment in the Molgradex Phase 3 IMPALA study in Q3 2018. The IMPALA study is evaluating our inhaled formulation of granulocyte-macrophage colony-stimulating factor, or GM-CSF, for the treatment of autoimmune pulmonary alveolar proteinosis, or aPAP. At the end of Q2, enrollment was at 106 patients out of a total target of 135 patients, with completion of enrollment currently on track for Q3 2018 and topline data anticipated in Q2 2019.
Encouraging patient enrollment in the Molgradex IMPALA-X safety extension study. The IMPALA-X study is an open-label, multicenter study designed to determine the long-term safety and utilization of Molgradex in patients with aPAP. IMPALA-X offers patients the opportunity to continue treatment with Molgradex for up to three years after completion of the pivotal Phase 3 IMPALA study. Of the 14 subjects eligible to enroll into IMPALA-X at the end of Q2, 12 have enrolled to date, while the remaining 2 subjects are expected to enroll shortly.
Anticipating completion of enrollment in the Molgradex Phase 2a OPTIMA study in Q3 2018. The OPTIMA study is evaluating our inhaled GM-CSF for the treatment of nontuberculous mycobacterial (NTM) lung infection. At the end of Q2, enrollment was at 17 patients out of a total target of 30 patients, and completion of enrollment remains on track for Q3 2018. Interim results are anticipated in Q4 2018, and topline data anticipated in Q2 2019.
Anticipating completion of enrollment in the AeroVanc Phase 3 AVAIL study in Q1 2019. The AVAIL study is evaluating our vancomycin hydrochloride inhalation powder for the treatment of persistent methicillin-resistant Staphylococcus aureus (MRSA) lung infection in individuals affected by cystic fibrosis. At the end of Q2, enrollment was at 107 patients out of a total target of 200 patients, with completion of enrollment currently on track for Q1 2019 and topline data anticipated in H2 2019.
Provided positive update on the development and commercialization of Molgradex. Savara has received positive investigator feedback on treatment with Molgradex in the open label portion of the IMPALA study, as well as a high interest in participation in the IMPALA-X study. The Company believes the high enrollment rates into the IMPALA-X study gives important insight into the level of satisfaction with Molgradex. Driven by its confidence in the outcome of the IMPALA study, Savara will expedite its preparation for potential commercial launch with investments into core commercial leadership and staff, as well as external activities required for a successful launch. Assuming robust results from the IMPALA study and subsequent breakthrough and/or fast track designation, submission of the Molgradex Biologic License Application, or BLA, is anticipated in the first half of 2020, with a resultant commercial launch in late 2020 or early 2021.
Announced expansion of the Molgradex program, with a Phase 2a clinical study in the U.S. in CF-affected individuals with chronic NTM lung infection expected to begin in Q1 2019. Savara is preparing to initiate a new open-label study in the U.S., which will enroll 30 subjects with chronic Mycobacterium abscessus (M. abscessus) or Mycobacterium avium complex (MAC) infection. The study will comprise a 48-week treatment period and a 24-week follow-up period. The primary endpoint in the study will be NTM sputum culture conversion to negative.
Launched exploratory product pipeline, announced the acquisition of the assets of Cardeas Pharma Corporation and the appointment of A. Bruce Montgomery, M.D., as strategic advisor. As part of Savara’s commitment to growth through innovation and acquisition, the Company launched its exploratory pipeline, focused on pre-proof-of-concept, high-potential programs in difficult-to-treat lung diseases, and announced the acquisition of Cardeas Pharma’s Phase 2 ready aerosolized amikacin/fosfomycin, a proprietary combination antibiotic. In connection with the acquisition, Savara appointed Dr. A. Bruce Montgomery, a leading pioneer in the field of inhaled antibiotics and other orphan lung disease products, as strategic advisor.
Successfully closed a public offering with gross proceeds of approximately $48.9 million. The offering was led largely by existing shareholders along with new institutional healthcare investors. The proceeds of the offering will be used for working capital and general corporate purposes, including helping to fund commercial preparatory efforts for Molgradex in aPAP, launching a new clinical study in CF-affected individuals with chronic NTM infection, and supporting Savara’s exploratory pipeline.
Second Quarter Financial Results
Savara’s net loss attributable to common shareholders for the three months ended June 30, 2018 was $11.6 million, or $(0.38) per share, compared with a net loss attributable to common shareholders of $12.5 million, or $(0.90) per share, for the three months ended June 30, 2017.
Research and development expenses were $9.3 million for the three months ended June 30, 2018, compared with $4.2 million for the three months ended June 30, 2017. This increase was due to several factors, including $2.3 million in additional expenses associated with the AeroVanc Phase 3 study activities; $1.8 million in development costs of Molgradex, including the expansion of the aPAP study in the U.S. and costs associated with the Phase 2 NTM study; and $1 million in expense related to the acquisition of assets from Cardeas.
General and administrative expenses for the three months ended June 30, 2018 were $2.5 million, compared with $5.1 million for the three months ended June 30, 2017. For the three months ended June 30, 2017, the Company recorded a $1.9 million change in fair value of the contingent consideration associated with its acquisition of Serendex compared to only $0.1 million for the three months ended June 30, 2018. In the second quarter of 2017, the Company incurred $1.7 million in expense associated with its merger transaction with Mast Therapeutics, Inc. (the “Merger”) in April 2017, none of which was incurred in the second quarter of 2018. In the second quarter of 2018, Savara incurred approximately $0.9 million in additional costs related to personnel and other expenditures associated with public company requirements and activities. Other expense decreased by $2.7 million for the three months ended June 30, 2018 as compared to the same period in 2017. This decrease was primarily due to the second quarter of 2017 having $1.8 million of expense associated with the extinguishment of certain pre-Merger convertible promissory notes.
As of June 30, 2018, Savara had a debt balance of approximately $15.0 million and had cash, cash equivalents and short-term investments of approximately $74.8 million.
Conference Call and Webcast
Savara will hold a conference call today beginning at 5:30pm Eastern Time / 4:30pm Central Time to provide a business update. Shareholders and other interested parties may access the conference call by dialing (855) 239-3120 from the U.S., (855) 669-9657 from Canada, and (412) 542-4127 from elsewhere outside the U.S. and request the Savara Inc. call. A live webcast of the conference call will be available online in the Investors section of Savara's website at https://www.savarapharma.com/investors/events/. Replays of the webcast will be available on Savara's website for 30 days and a telephone replay will be available through August 16, 2018 by dialing (877) 344-7529 from the U.S., (855) 669-9658 from Canada, and (412) 317-0088 from elsewhere outside the U.S. and entering replay access code 10122221.
About Savara
Savara is an orphan lung disease company. Savara's pipeline comprises Molgradex, an inhaled granulocyte-macrophage colony-stimulating factor, or GM-CSF, in Phase 3 development for autoimmune pulmonary alveolar proteinosis, or aPAP, in Phase 2a development for nontuberculous mycobacteria, or NTM, lung infection, and in preparation for Phase 2a development in cystic fibrosis, or CF, affected individuals with chronic NTM lung infection; and AeroVanc, a Phase 3 stage inhaled vancomycin for treatment of persistent methicillin resistant staphylococcus aureus, or MRSA, lung infection in CF. Savara's strategy involves expanding its pipeline of potentially best-in-class products through indication expansion, strategic development partnerships and product acquisitions, with the goal of becoming a leading company in its field. The most recent acquisition is aerosolized amikacin/fosfomycin, a Phase 2 ready, proprietary combination antibiotic, which has demonstrated potent and broad-spectrum antibacterial activity against highly drug resistant pathogens. Savara's management team has significant experience in orphan drug development and pulmonary medicine, identifying unmet needs, developing and acquiring new product candidates, and effectively advancing them to approvals and commercialization. More information can be found at www.savarapharma.com. (Twitter: @SavaraPharma)
Beitrag zu dieser Diskussion schreiben
Zu dieser Diskussion können keine Beiträge mehr verfasst werden, da der letzte Beitrag vor mehr als zwei Jahren verfasst wurde und die Diskussion daraufhin archiviert wurde.
Bitte wenden Sie sich an feedback@wallstreet-online.de und erfragen Sie die Reaktivierung der Diskussion oder starten Sie eine neue Diskussion.
Investoren beobachten auch:
| Wertpapier | Perf. % |
|---|---|
| -6,22 | |
| +1,48 | |
| -1,46 | |
| -0,90 | |
| +5,44 | |
| +0,91 | |
| +0,03 | |
| -2,04 | |
| -0,77 | |
| +0,94 |
Meistdiskutiert
| Wertpapier | Beiträge | |
|---|---|---|
| 196 | ||
| 93 | ||
| 65 | ||
| 50 | ||
| 46 | ||
| 43 | ||
| 42 | ||
| 37 | ||
| 33 | ||
| 27 |























