Antikörper-Optimierung durch Xencor - 500 Beiträge pro Seite
eröffnet am 24.10.17 21:42:12 von
neuester Beitrag 21.03.21 13:28:14 von
neuester Beitrag 21.03.21 13:28:14 von
Beiträge: 268
ID: 1.264.899
ID: 1.264.899
Aufrufe heute: 0
Gesamt: 38.019
Gesamt: 38.019
Aktive User: 0
ISIN: US98401F1057 · WKN: A1W96L · Symbol: XNCR
19,070
USD
+0,79 %
+0,150 USD
Letzter Kurs 02:00:00 Nasdaq
Neuigkeiten
09.04.24 · Business Wire (engl.) |
28.02.24 · Business Wire (engl.) |
27.02.24 · Business Wire (engl.) |
20.02.24 · Business Wire (engl.) |
03.01.24 · Business Wire (engl.) |
Werte aus der Branche Biotechnologie
| Wertpapier | Kurs | Perf. % |
|---|---|---|
| 3.000,00 | +74.900,00 | |
| 0,9300 | +54,46 | |
| 2,3300 | +35,61 | |
| 2,4700 | +33,51 | |
| 1,9100 | +29,93 |
| Wertpapier | Kurs | Perf. % |
|---|---|---|
| 2,3000 | -20,96 | |
| 2,5000 | -21,88 | |
| 1,4300 | -24,34 | |
| 2,2000 | -31,25 | |
| 2,0900 | -40,52 |
Wie gestern Abend gemeldet wurde, hat die Morphosys AG von der FDA für den anti-CD19-Antikörper MOR208 den Status "Therapiedurchbruch" in der Blutkrebsindikation des rezidivierenden oder refraktären DLBCL erhalten. Der Morphosys-Kurs hat daraufhin einen kräftigen Satz um 8 % nach oben gemacht.
Bei MOR208 handelt es sich allerdings nicht um eine Eigenentwicklung der Morphosys AG, MOR208 wurde vielmehr von Xencor entwickelt und später von Morphosys einlizensiert. Im Gegenzug wird Xencor von Morphosys im Fall einer Zulassung eine Meilensteinzahlung in Höhe von 187 Mio. USD (zzgl. 50 Mio. USD bei Erreichen bestimmter Umsatzziele) und später Tantiemen im hohen einstelligen bis niedrigen zweistelligen Prozentbereich (bezogen auf die Nettoumsätze) erhalten.
Die jüngsten Ereignisse sind Anlass, diesen Thread zu eröffnen, da offensichtlich Interesse an Informationen zu Xencor besteht.
Kurz vorab: Xencor hat sich darauf spezialisiert, das Fc-Fragment therapeutischer Antikörper (z.B. durch Austausch bestimmter Aminosäuren) so zu verändern, dass spezielle Eigenschaften optimiert werden (z.B. verstärkte Zytotoxizität oder verlängerte Halbwertszeit). Etwas detaillierter sind die verschiedenen Techniken auf der Unternehmenshomepage beschrieben, ausführliche Angaben finden sich wie üblich in den einschlägigen Patenten.
Nachdem ich mir heute einzelne Präparate der Pipeline etwas näher angesehen und aus Patent- und Studiendatenbanken die jeweiligen Einzelheiten (z.B. Targets) extrahiert habe (Xencor selbst gibt zu einigen Präparaten keine näheren Informationen preis), starte ich jetzt formlos die Besprechung einzelner Präparate und beginne dabei am besten mit den am weitesten fortgeschrittenen Entwicklungsprojekten.
Weit fortgeschritten und interessant scheint ALXN12, ein Anti-C5-Antikörper, dessen Halbwertszeit durch Optimierung des Fc-Segment deutlich verlängert worden ist. ALXN12 wurde für Alexion entwickelt und befindet sich in mehreren P3-Studien. ALXN12 soll nach Zulassung eculizumab ablösen, dessen Patentzeit 2020/21 ablaufen wird. Infolge der verlängerten HWZ muss ALXN12 nur alle 8 Wochen gegeben werden, während eculizumab alle 2 Wochen appliziert werden muss. eculizumab (Soliris) ist eines der teuersten Medikamente der Welt und generiert jährliche Milliardenumsätze in den Nischenindikationen "atypisches urämische Syndrom" und "paroxysmale nächtliche Hämaturie". Falls die P3-Phasen für ALXN12 erfolgreich verlaufen und es zur Zulassung kommen sollte, wird Xencor Tantiemen im niedrigen einstelligen Prozentbereich erhalten. Bei einem geschätzten Umsatz von ca. 4 Mrd. USD und einer Royalties-Rate von 2,5 % wären das 100 Mio. USD pro Jahr.
Ich mach jetzt erst einmal eine Pause, Fortsetzung folgt mit talacotuzumab, wenn ich wieder eine Zeitlücke habe.
Kritische Anregungen und Diskussionsbeiträge sind wie immer willkommen.
Bei MOR208 handelt es sich allerdings nicht um eine Eigenentwicklung der Morphosys AG, MOR208 wurde vielmehr von Xencor entwickelt und später von Morphosys einlizensiert. Im Gegenzug wird Xencor von Morphosys im Fall einer Zulassung eine Meilensteinzahlung in Höhe von 187 Mio. USD (zzgl. 50 Mio. USD bei Erreichen bestimmter Umsatzziele) und später Tantiemen im hohen einstelligen bis niedrigen zweistelligen Prozentbereich (bezogen auf die Nettoumsätze) erhalten.
Die jüngsten Ereignisse sind Anlass, diesen Thread zu eröffnen, da offensichtlich Interesse an Informationen zu Xencor besteht.
Kurz vorab: Xencor hat sich darauf spezialisiert, das Fc-Fragment therapeutischer Antikörper (z.B. durch Austausch bestimmter Aminosäuren) so zu verändern, dass spezielle Eigenschaften optimiert werden (z.B. verstärkte Zytotoxizität oder verlängerte Halbwertszeit). Etwas detaillierter sind die verschiedenen Techniken auf der Unternehmenshomepage beschrieben, ausführliche Angaben finden sich wie üblich in den einschlägigen Patenten.
Nachdem ich mir heute einzelne Präparate der Pipeline etwas näher angesehen und aus Patent- und Studiendatenbanken die jeweiligen Einzelheiten (z.B. Targets) extrahiert habe (Xencor selbst gibt zu einigen Präparaten keine näheren Informationen preis), starte ich jetzt formlos die Besprechung einzelner Präparate und beginne dabei am besten mit den am weitesten fortgeschrittenen Entwicklungsprojekten.
Weit fortgeschritten und interessant scheint ALXN12, ein Anti-C5-Antikörper, dessen Halbwertszeit durch Optimierung des Fc-Segment deutlich verlängert worden ist. ALXN12 wurde für Alexion entwickelt und befindet sich in mehreren P3-Studien. ALXN12 soll nach Zulassung eculizumab ablösen, dessen Patentzeit 2020/21 ablaufen wird. Infolge der verlängerten HWZ muss ALXN12 nur alle 8 Wochen gegeben werden, während eculizumab alle 2 Wochen appliziert werden muss. eculizumab (Soliris) ist eines der teuersten Medikamente der Welt und generiert jährliche Milliardenumsätze in den Nischenindikationen "atypisches urämische Syndrom" und "paroxysmale nächtliche Hämaturie". Falls die P3-Phasen für ALXN12 erfolgreich verlaufen und es zur Zulassung kommen sollte, wird Xencor Tantiemen im niedrigen einstelligen Prozentbereich erhalten. Bei einem geschätzten Umsatz von ca. 4 Mrd. USD und einer Royalties-Rate von 2,5 % wären das 100 Mio. USD pro Jahr.
Ich mach jetzt erst einmal eine Pause, Fortsetzung folgt mit talacotuzumab, wenn ich wieder eine Zeitlücke habe.
Kritische Anregungen und Diskussionsbeiträge sind wie immer willkommen.
Antwort auf Beitrag Nr.: 56.018.484 von Joschka Schröder am 24.10.17 21:42:12Die Studie mit Talacotuzumab wurde doch von Janssen beendet das drückte den Kurs auch die letzten Tage.
http://www.marketwatch.com/story/johnson-johnson-discards-tw…
http://www.marketwatch.com/story/johnson-johnson-discards-tw…
Antwort auf Beitrag Nr.: 56.019.012 von schnappi am 24.10.17 22:59:37Das ist richtig, der aktuelle Status ist "discontinued", über das weitere Vorgehen ist noch nicht entschieden. Im letzten Conference Call (J&J) hieß es dazu "Regarding talacotuzumab, based on a recommendation from the independent data monitoring committee we have discontinued treatment with talacotuzumab in AML 2002 as the phase 3 results did not demonstrate a positive benefit risk ratio. We continued to assess the data to determine next steps in the clinical development program“.
Ich hatte vor, mit talacotuzumab fortzufahren, weil ich die Xencor-Pipeline der Einfachheit und Übersicht halber von oben nach unten durchgehen wollte. Um die Pipeline einigermaßen bewerten zu können, interessieren auch Hintergründe zu den jeweiligen Entwicklungspräparaten. Man möchte ja wissen, ob ein Problem ggf. Target-bezogen war, ob die Optimierungstechnik versagt hat oder ob es andere Gründe gab. In diesem Kontext ist es wichtig, Vergleichspräparate anderer Biotechs zu betrachten, die dasselbe Target adressieren. Ich weiß aber noch nicht, wie ausführlich ich das hier machen werde. Auch wenn ich den Text meiner Beiträge regelmäßig im Schnellverfahren tippe und nicht mehr gegenlese (deshalb bestimmt viele grammatikalische Fehler, sorry!), kostet es doch immer wieder Zeit, die Informationen aus den eigenen Excel-Dateien zu extrahieren. Und an Zeit mangelt es mir leider.
Ich hatte vor, mit talacotuzumab fortzufahren, weil ich die Xencor-Pipeline der Einfachheit und Übersicht halber von oben nach unten durchgehen wollte. Um die Pipeline einigermaßen bewerten zu können, interessieren auch Hintergründe zu den jeweiligen Entwicklungspräparaten. Man möchte ja wissen, ob ein Problem ggf. Target-bezogen war, ob die Optimierungstechnik versagt hat oder ob es andere Gründe gab. In diesem Kontext ist es wichtig, Vergleichspräparate anderer Biotechs zu betrachten, die dasselbe Target adressieren. Ich weiß aber noch nicht, wie ausführlich ich das hier machen werde. Auch wenn ich den Text meiner Beiträge regelmäßig im Schnellverfahren tippe und nicht mehr gegenlese (deshalb bestimmt viele grammatikalische Fehler, sorry!), kostet es doch immer wieder Zeit, die Informationen aus den eigenen Excel-Dateien zu extrahieren. Und an Zeit mangelt es mir leider.
Antwort auf Beitrag Nr.: 56.018.484 von Joschka Schröder am 24.10.17 21:42:12Kurze Anmerkung zu ALXN1210:
Alexion hat heute bekanntgegeben, dass Soliris (eculizumab) net product sales in Höhe von $756 million in Q3/2017 erwirtschaftet. Tendenz aufgrund weiterer Zulassungen steigend.
Insoweit dürfte es in 2018 spannend werden, wenn Alexion Ergebnisse der Phase 3-Studien in PNH und aHUS des Präparats ALXN1210 bekanntgibt.
Sollte ALXN1210 eculizumab ablösen, so stünde Xencor aufgrund der Tantieme m.E. vor einer absoluten Neubewertung.
Alexion hat heute bekanntgegeben, dass Soliris (eculizumab) net product sales in Höhe von $756 million in Q3/2017 erwirtschaftet. Tendenz aufgrund weiterer Zulassungen steigend.
Insoweit dürfte es in 2018 spannend werden, wenn Alexion Ergebnisse der Phase 3-Studien in PNH und aHUS des Präparats ALXN1210 bekanntgibt.
Sollte ALXN1210 eculizumab ablösen, so stünde Xencor aufgrund der Tantieme m.E. vor einer absoluten Neubewertung.
Antwort auf Beitrag Nr.: 56.031.645 von biopadawan am 26.10.17 12:51:56Ich habe mir nun doch mal die Mühe gemacht und eine (nicht ganz aktuelle) Unternehmensstudie der Credit Suisse gelesen. ALXN1210 hat man dort überhaupt nicht identifiziert, es heißt nur - wie auf der Xencor-Homepage - target not disclosed, eine Bewertung des Antikörpers hat man erst gar nicht vorgenommen.
Ich erlaube mir, Villes Abbildung aus dem MOR-Thread hierhin zu kopieren, weil es themaisch ja genauso zu Xencor (= Entwickler des MOR208) passt
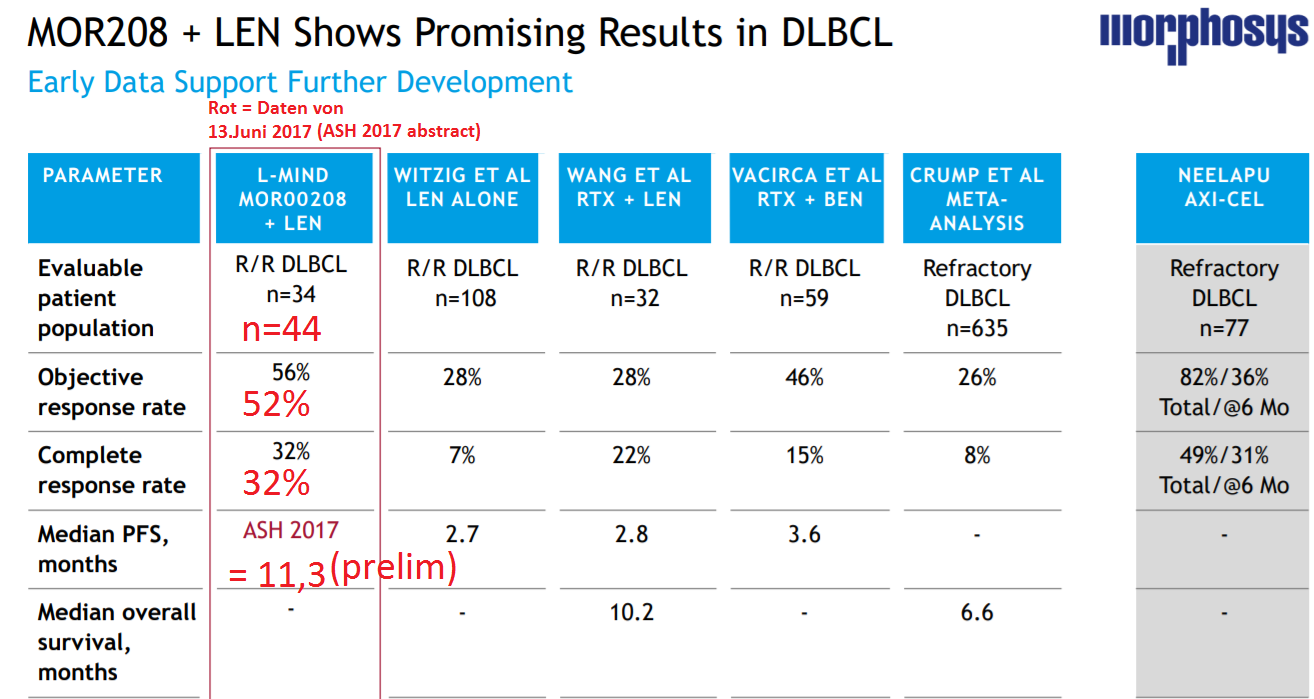

Die Konkurrenz schläft nicht
PFS bei der Zuma-1 Studie (NEELAPU AXI-CEL) ist wohl im Bereich um nur ca. 6 Monate. Das wäre ein weiterer Punkt für die MOR208-LEN-Kombi, sollte sich das PFS > 10 Monate bestätigen.
Ein zweites Update betraf die sogenannte ZUMA-1-Studie zum Einsatz des Anti-CD19-CAR-TZellkonstrukts axi-cel [12]. Zum Zeitpunkt der Zwischenanalyse waren 111 Patienten eingeschlossen und Daten von 101 Patienten waren verfügbar (77 DLBCL, 24 PMBCL). Die Ansprechrate lag insgesamt bei 82% mit einer CR-Rate von 54%. Es gab keine signifikanten Unterschiede bei der Analyse nach COO. Das mediane PFS lag bei 5,9 Monaten.
https://www.hematooncology.com/berichte/pdf/icml-2017.pdf
Ein zweites Update betraf die sogenannte ZUMA-1-Studie zum Einsatz des Anti-CD19-CAR-TZellkonstrukts axi-cel [12]. Zum Zeitpunkt der Zwischenanalyse waren 111 Patienten eingeschlossen und Daten von 101 Patienten waren verfügbar (77 DLBCL, 24 PMBCL). Die Ansprechrate lag insgesamt bei 82% mit einer CR-Rate von 54%. Es gab keine signifikanten Unterschiede bei der Analyse nach COO. Das mediane PFS lag bei 5,9 Monaten.
https://www.hematooncology.com/berichte/pdf/icml-2017.pdf
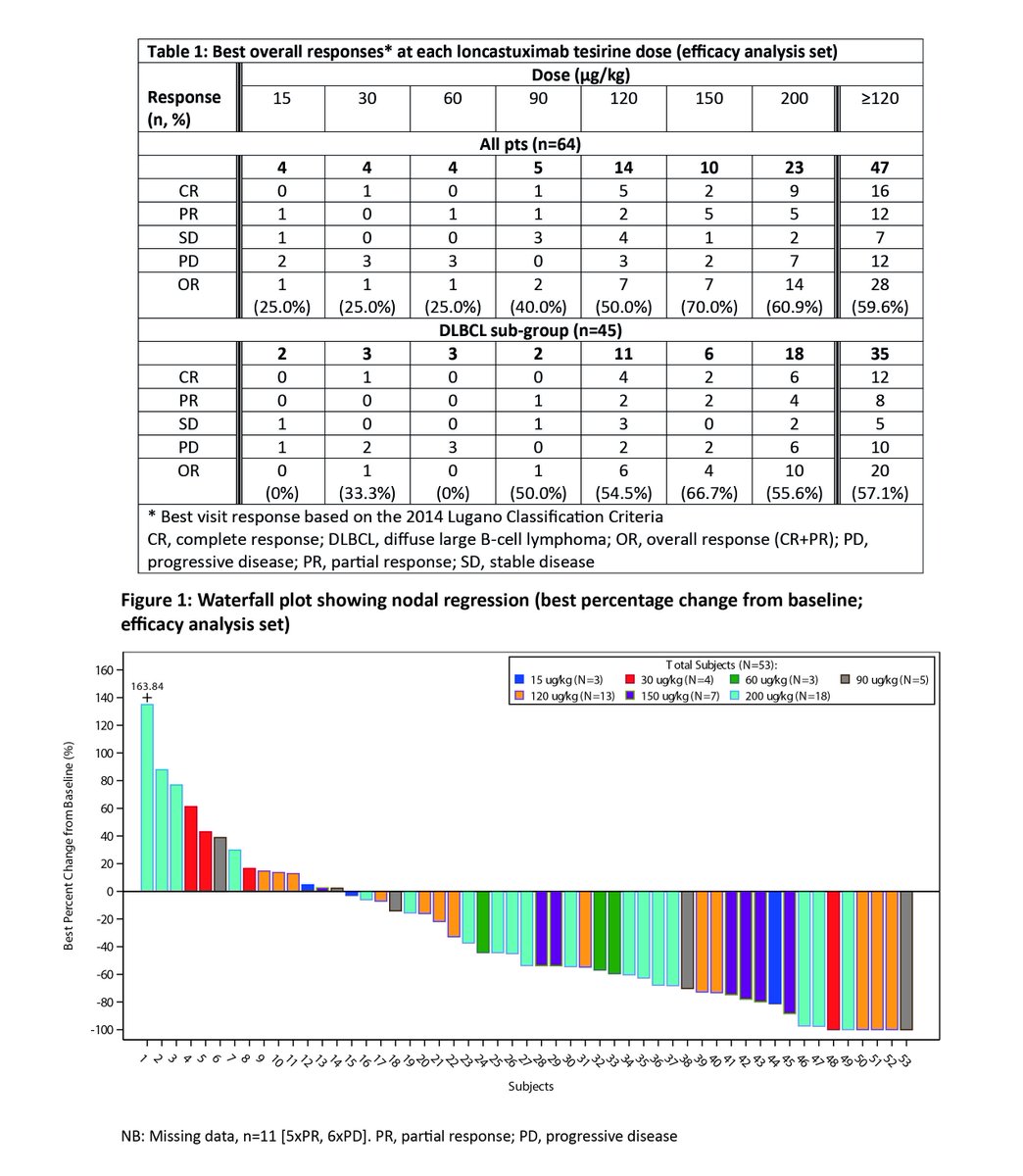
Antwort auf Beitrag Nr.: 56.078.300 von Ville7 am 02.11.17 07:59:06Ville, vielen Dank für den interessanten Hinweis! Damit hat ADCT-402 die beim diesjährigen ICML-Meeting präsentierten Daten nochmals verbessert. ORR 57 % und CR 34 % bei ADC-Monotherapie ist wirklich überragend. Leider sind die Anzahl der Vorbehandlungen für das DLBCL-Kollektiv im Abstract nicht angegeben, für das Gesamtkollektiv war die mittlere Anzahl der Vorbehandlungen 3, mithin waren die Patienten stärker vorbehandelt (i.A. schwerer therapierbar) als die Patienten in den MOR208-Studien.
Für Xencor entscheidend ist zunächst einmal, dass MOR208 zugelssen wird, weil dann 187 Mio. USD an Xencor fließen werden. Und in dieser Hinsicht sieht es gut aus.
Für Xencor entscheidend ist zunächst einmal, dass MOR208 zugelssen wird, weil dann 187 Mio. USD an Xencor fließen werden. Und in dieser Hinsicht sieht es gut aus.
Antwort auf Beitrag Nr.: 56.079.044 von Joschka Schröder am 02.11.17 09:17:53Ich kann deine Begeisterung über die Zuma-1 Daten nicht so ganz nachvollziehen. Klar sind das stark vorbehandelte oder austherapierte Patienten. Aber das PFS ist doch trotzdem eher schwach. Bei den im April vorgestellten Daten war die Duration of Response 8 Monate. Eigentlich profitieren nur die Patienten mit CR, die anderen haben nach im Median gut einem Monat schon wieder nen Progress. Das ist von Kosten-Nutzen-Seite alles ziemlich fragwürdig. Man kann schon in Frage stellen, ob das wirklich ne Konkurrenz für MOR 208 ist, oder ob das nicht ne andere Zielgruppe sein wird, nämlich die, bei denen gar nichts mehr hilft. Finde das PFS von MOR 208 ziemlich sensationell, grad auch im Vergleich zu LEN+Rituximab.
Antwort auf Beitrag Nr.: 56.080.160 von deadflowers am 02.11.17 11:00:30
Hast Du möglicherweise etwas verwechselt? Zu den Zuma-1-Daten habe ich mich doch überhaupt nicht geäußert und Villes Beitrag zu Zuma-1 war eher verhalten.
Mein Kommentar bezog sich auf die Dosisekalation von ADCT-402, PFS-Daten sind in diesem Kontext sind in diesem Kontext nicht veröffentlicht worden!
Zitat von deadflowers: Ich kann deine Begeisterung über die Zuma-1 Daten nicht so ganz nachvollziehen.
Hast Du möglicherweise etwas verwechselt? Zu den Zuma-1-Daten habe ich mich doch überhaupt nicht geäußert und Villes Beitrag zu Zuma-1 war eher verhalten.
Mein Kommentar bezog sich auf die Dosisekalation von ADCT-402, PFS-Daten sind in diesem Kontext sind in diesem Kontext nicht veröffentlicht worden!
Ja, hab deinen Beitrag zu schnell gelesen und dachte, er bezieht auf Zuma-1, weil Ville darüber gesprochen hat. Dann besteht ja gar kein Dissens!
Xencor Presents Final Results from Phase 2 Study of XmAb(R)5871 in IgG4-Related Disease (IgG4-RD) at the American College of Rheumatology 2017 Annual Meeting
- 12 of 15 (80%) patients completed the study and achieved the primary endpoint of at least a two-point reduction in the IgG4-RD Responder Index on Day 169 -
- Eight patients achieved remission (IgG4-RD RI of zero) -
- XmAb5871 well tolerated in patients with active IgG4-RD -
MONROVIA, Calif., Nov. 4, 2017 /PRNewswire/ -- Xencor, Inc. (NASDAQ: XNCR), a clinical-stage biopharmaceutical company developing engineered monoclonal antibodies for the treatment of autoimmune diseases, asthma and allergic diseases and cancer, today announced the final results from a Phase 2 study of XmAb5871 in patients with active IgG4-RD. Data show that 12 of 15 patients completed the study, and all 12 achieved the primary endpoint of at least a two-point reduction in the IgG4-RD Responder Index (IgG4-RD RI) on Day 169. The data are being presented by John H. Stone, M.D., MPH, director of rheumatology at Massachusetts General Hospital, at the American College of Rheumatology (ACR) 2017 Annual Meeting in the Late-breaking Abstract session on Tuesday, November 7, 2017 from 7:30 p.m. - 9:00 p.m. EST.
"We are very encouraged by multiple clear signals of treatment benefit in this study - the achievement of the primary endpoint in all 12 patients that completed the study, the achievement of disease remission in more than 50% of patients, and the achievement of at least a five-point reduction in disease activity in 14 of 15 patients," said Paul Foster, M.D., chief medical officer of Xencor. "We expect to advance development of XmAb5871 into a Phase 3 trial in the second half of 2018."
"The clinical response in IgG4-RD patients treated with XmAb5871 is very impressive and reinforces my belief that this is a promising potential therapy," said Dr. John H. Stone, the principal investigator of the study. "We have learned a great deal about how to study this disease in the context of this trial."
Final Efficacy Data:
Twelve of 15 patients (80%) completed the study and all 12 achieved the primary endpoint of at least a two-point reduction in the IgG4-RD RI on Day 169. None of the 12 required corticosteroids (CS) after month two. Eight patients achieved remission (IgG4-RD RI of 0 and no CS after two months) and the other four achieved IgG4-RD RI scores of ≤4 at Day 169. Fourteen of 15 patients (93%) achieved a decrease of ≥ 5 in the IgG4-RD RI. One patient had been on baseline CS for two years (15 mg/day) and was able to discontinue CS within two months. Four others received CS at the start of the trial and tapered off within two months.
Safety and Tolerability Data:
XmAb5871 was well tolerated. Three patients had minor, transient GI side-effects during the first infusion; all completed the study. Two serious adverse events (SAEs) unrelated to XmAb5871 were observed in one patient, pneumonia and recurrence of pneumonia due to non-compliance (patient completed study). Three patients discontinued the study, as disclosed previously. One discontinued patient was atypical with laryngeal involvement only who did not respond to XmAb5871 or to subsequent rituximab. A second patient responded, but flared at 12 weeks and did not respond to subsequent rituximab therapy. The third patient responded but developed infusion-related symptoms including transient rash and arthralgias following the fifth infusion.
Plasmablasts were reduced 70-80% from baseline and B cells were reduced 40-55% from baseline, with decreases occurring within the first two weeks.
The presentation will be available on the 'Investors' page of Xencor's website under 'Events and Presentations' at www.xencor.com.
- 12 of 15 (80%) patients completed the study and achieved the primary endpoint of at least a two-point reduction in the IgG4-RD Responder Index on Day 169 -
- Eight patients achieved remission (IgG4-RD RI of zero) -
- XmAb5871 well tolerated in patients with active IgG4-RD -
MONROVIA, Calif., Nov. 4, 2017 /PRNewswire/ -- Xencor, Inc. (NASDAQ: XNCR), a clinical-stage biopharmaceutical company developing engineered monoclonal antibodies for the treatment of autoimmune diseases, asthma and allergic diseases and cancer, today announced the final results from a Phase 2 study of XmAb5871 in patients with active IgG4-RD. Data show that 12 of 15 patients completed the study, and all 12 achieved the primary endpoint of at least a two-point reduction in the IgG4-RD Responder Index (IgG4-RD RI) on Day 169. The data are being presented by John H. Stone, M.D., MPH, director of rheumatology at Massachusetts General Hospital, at the American College of Rheumatology (ACR) 2017 Annual Meeting in the Late-breaking Abstract session on Tuesday, November 7, 2017 from 7:30 p.m. - 9:00 p.m. EST.
"We are very encouraged by multiple clear signals of treatment benefit in this study - the achievement of the primary endpoint in all 12 patients that completed the study, the achievement of disease remission in more than 50% of patients, and the achievement of at least a five-point reduction in disease activity in 14 of 15 patients," said Paul Foster, M.D., chief medical officer of Xencor. "We expect to advance development of XmAb5871 into a Phase 3 trial in the second half of 2018."
"The clinical response in IgG4-RD patients treated with XmAb5871 is very impressive and reinforces my belief that this is a promising potential therapy," said Dr. John H. Stone, the principal investigator of the study. "We have learned a great deal about how to study this disease in the context of this trial."
Final Efficacy Data:
Twelve of 15 patients (80%) completed the study and all 12 achieved the primary endpoint of at least a two-point reduction in the IgG4-RD RI on Day 169. None of the 12 required corticosteroids (CS) after month two. Eight patients achieved remission (IgG4-RD RI of 0 and no CS after two months) and the other four achieved IgG4-RD RI scores of ≤4 at Day 169. Fourteen of 15 patients (93%) achieved a decrease of ≥ 5 in the IgG4-RD RI. One patient had been on baseline CS for two years (15 mg/day) and was able to discontinue CS within two months. Four others received CS at the start of the trial and tapered off within two months.
Safety and Tolerability Data:
XmAb5871 was well tolerated. Three patients had minor, transient GI side-effects during the first infusion; all completed the study. Two serious adverse events (SAEs) unrelated to XmAb5871 were observed in one patient, pneumonia and recurrence of pneumonia due to non-compliance (patient completed study). Three patients discontinued the study, as disclosed previously. One discontinued patient was atypical with laryngeal involvement only who did not respond to XmAb5871 or to subsequent rituximab. A second patient responded, but flared at 12 weeks and did not respond to subsequent rituximab therapy. The third patient responded but developed infusion-related symptoms including transient rash and arthralgias following the fifth infusion.
Plasmablasts were reduced 70-80% from baseline and B cells were reduced 40-55% from baseline, with decreases occurring within the first two weeks.
The presentation will be available on the 'Investors' page of Xencor's website under 'Events and Presentations' at www.xencor.com.
Antwort auf Beitrag Nr.: 56.102.252 von Joschka Schröder am 05.11.17 09:13:17Einen wichtigen Satz habe ich leider vergessen:
Based on these results, Xencor plans to initiate a Phase 3 trial of XmAb5871 in IgG4-RD in 2H18.
Based on these results, Xencor plans to initiate a Phase 3 trial of XmAb5871 in IgG4-RD in 2H18.
Ich bin gespannt, wie der Markt die Ergebnisse bewertet. Ich tue mich schwer damit. Wahrscheinlich muss man die Präsentation am Dienstag erstmal abwarten. Neugierig bin ich auf jeden Fall!
Eine gute Übersicht:
https://www.aerzteblatt.de/archiv/168130/IgG4-assoziierte-Au…
Eine gute Übersicht:
https://www.aerzteblatt.de/archiv/168130/IgG4-assoziierte-Au…
Das sind doch mal richtig erfreuliche Nachrichten!
Die XmAb5871-Ergebnisse waren bereits im wesentlichen bekannt, hier soll die Zulassungsstudie im nächsten Jahr starten. Die Wahrscheinlichkeit einer späteren Zulassung schätze ich als hoch ein.
Die große positive Überraschung ist jedoch die gute Verträglichkeit des anti-IgE-Antikörpers XmAb7195!!! Diesen Mab hatte ich trotz überzeugendem theoretischen Ansatz schon abgeschrieben, weil er bei intravenöser Gabe grenzwertig verträglich schien und als Nebenwirkung ein Teil derjenigen Symptomatik (-> Urticaria) erzeugt hat, die er eigentlich lindern sollte. Bei subcutaner Applikation sind derartige Nebenwirkungen nun nicht mehr aufgetreten!
Der Wirkmechanismus des XAB7195 ist demjenigen des von Genentech entwickelten omalizumab in mehrerlei Hinsicht überlegen: Verstärkte Absenkung des freien IgE durch höhere Affinität und zusätzliche Mechanismen wie z.B. die Hemmung der Synthese IgE-bildender Plasmazellen. Unter den veränderten Bedingungen (s.o.) hat XmAb7195 großes Marktpotential. Ich bin richtig begeistert. XmAb7195 muss wegen der geringeren Halbwertszeit öfters gegeben werden als omalizumab, seine therapeutische Wirkung sollte gleichzeitig jedoch deutlich besser sein, was letztlich der entscheidende Punkt ist. Und mit XmAb7195 dürfte erstmals auch eine Antikörpertherapie bei stark erhöhtem IgE möglich sein. Abzuwarten bleibt, ob die Absenkung des freien IgE unter die Nachweisgrenze neben dem beabsichtigten therapeutischen Effekt (-> Symptomatik der Typ-1-Allergie dürfte weitgehend verschwinden) auch zu etwaigen Nebenwirkungen führen kann, an die man derzeit vielleicht noch nicht denkt.
Ich hatte neulich erwähnt, dass die Entwicklung des anti-CD123-Mabs talacotuzumab gestoppt worden ist. Gegen dasselbe Target hat Xencor mit dem bispezifischen anti-CD123 x CD3-Antikörper XmAb14045 (Kooperation mit Novartis) ein Präparat in der klinischen Entwicklung, dessen Wirksamkeit derjenigen des talacotuzmab überlegen sein sollte. XmAb14045 steht u.a. in Konkurrenz zu Immunogens IMGN632. Beide Präparate befinden sich in der klinischen P1 gegen AML, ein Vergleich wird interessant sein.
Im bevorstehenden Jahr wird Xencor zudem mehrere interessante Immunoncologica (anti-PD-1 x CTLA-4, anti-CTLA4 x LAG3, anti PD-1 x ICOS) in die klinische Studienphase bringen, für Unterhaltung ist also gesorgt.
Warum der nachbörsliche Nasdaq-Kurs nicht anzieht, ist mir ein Rätsel. Xencor gehört zu den am meisten unterschätzten Biotech-Aktien. Es ist zudem eine der wenigen Biotech-Aktien, bei denen der Großaktionär in der jüngsten Zeit aggressiv hinzugekauft hat. Aus meiner Sicht ein aussichtsreiches Investment mit spannenden Fc-Optimierungstechniken.
Xencor wird derzeit mit einem Enterprise Value von 556 Mio. USD bewertet, das ist deutlich zu wenig.
Xencor Reports Third Quarter 2017 Financial Results and Provides Clinical Pipeline Update
-- Announced Final Results from Phase 2 Trial of XmAb®5871 in IgG4-Related Disease (IgG4-RD); Plan to Initiate Phase 3 Trial in 2H18 --
-- Phase 1b Data from Subcutaneous Administration Trial of XmAb®7195 Show Potent IgE Reduction with Improved Tolerability --
-- Management to Host Conference Call Today at 4:30 p.m. ET -
MONROVIA, Calif., Nov. 7, 2017 /PRNewswire/ -- Xencor, Inc. (NASDAQ:XNCR), a clinical-stage biopharmaceutical company developing engineered monoclonal antibodies for the treatment of autoimmune disease, asthma and allergic diseases, and cancer, today reported financial results for the third quarter ended September 30, 2017 and provided a review of business and clinical highlights.
Xencor, Inc. Logo
"Our third quarter results highlight the promise of our XmAb® technology to create a broad pipeline of engineered antibodies with improved performance across a range of unmet needs," said Bassil Dahiyat, Ph.D., president and chief executive officer of Xencor. "We recently announced promising, final results from our Phase 2 trial of XmAb5871 in IgG4-RD, which suggest that XmAb5871 may offer patients the first approved therapy for this newly-defined autoimmune disease and support advancement of the program into a Phase 3 trial. Today, we are pleased to announce data from our Phase 1b trial of subcutaneously administered XmAb7195, which shows potent IgE reduction with improved tolerability compared to intravenous administration, and supports subcutaneous administration in future development. In addition, we continue to advance our bispecific oncology pipeline targeting the tumor microenvironment, have opened the IND for XmAb®18087, our first solid tumor targeting bispecific, and expect to report the first clinical data from our oncology pipeline in 2018."
Recent Business Highlights and Upcoming Clinical Plans
XmAb5871: XmAb5871 is a first-in-class monoclonal antibody that targets CD19 with its variable domain, and uses Xencor's XmAb immune inhibitor Fc domain to target FcyRIIb, a receptor that inhibits B-cell function. XmAb5871 is currently in a Phase 2 clinical study for the treatment of systemic lupus erythematosus (SLE).
Initiation of Phase 3 trial in IgG4-RD expected in 2H18.
Initial data from SLE Phase 2 trial expected in late 2018.
In November 2017, Xencor announced the final results from its Phase 2 trial of XmAb5871 in IgG4-RD. 12 of 15 patients (80%) dosed completed the study, and all 12 achieved the primary endpoint of at least a two-point reduction in the IgG4-RD Responder Index (IgG4-RD RI) on Day 169. None of the 12 required corticosteroids (CS) after month two, and eight patients (53%) achieved disease remission (IgG4-RD of 0 and no CS after two months) and the other four achieved IgG4-RD RI scores of ≤4 at Day 169. Fourteen of 15 patients (93%) achieved a decrease of ≥ 5 in the IgG4-RD RI. XmAb5871 was well-tolerated, with all XmAb5871-related adverse events (AEs) graded as mild to moderate and no XmAb5871-related serious AEs reported. These results will be presented today at 8:15 pm ET during a late-breaking oral presentation at the American College of Rheumatology (ACR) 2017 Annual Meeting titled, "Final Results of an Open Label Phase 2 Study of a Reversible B Cell Inhibitor, Xmab®5871 in IgG4-Related Disease."
Xencor met with the Division of Pulmonary, Allergy and Respiratory Products (DPARP) of the Food and Drug Administration (FDA) in a Type B End of Phase 2 meeting in July 2017 to discuss the optimal pathway to advance XmAb5871 into Phase 3 development in IgG4-RD. The meeting resulted in guidance on endpoint definition and a path forward for Phase 3 development in IgG4-RD, which the FDA recognizes as a new disease entity with no regulatory precedence for an approval pathway. Based on the Phase 2 results and these preliminary discussions with DPARP, a randomized, placebo-controlled, double-blinded Phase 3 trial of approximately 250-350 patients evaluating the addition of XmAb5871 to standard of care is planned to be initiated in the second half of 2018. Xencor also intends to seek scientific advice from the European Medicines Agency in early 2018.
XmAb7195: XmAb7195 is a first-in-class monoclonal antibody that targets IgE with its variable domain and uses Xencor's XmAb immune inhibitor Fc domain to target FcyRIIb, resulting in three distinct mechanisms of action for reducing IgE levels.
Xencor recently completed its subcutaneous (SC) administration Phase 1b study of XmAb7195 evaluating four once-weekly doses of SC XmAb7195. The first part of this study was an open-label bioequivalence trial ranging from 0.1 to 1.0 mg/kg in cohorts of six healthy volunteers. The second part of the trial was a randomized, double-blinded, placebo-controlled multiple-ascending dose study in atopic patients at doses of 1.5 and 2.0 mg/kg. The half-life of SC XmAb7195 ranged from 3.6 - 4.9 days, comparable to the previously reported half-life of 3.9 days of intravenously administered XmAb7195. Bioavailability after the fourth dose exceeded 50%, which is typical for monoclonal antibodies, and drug concentration levels increased with successive doses.
Subcutaneous administration of XmAb7195 was well tolerated. No severe AEs or serious treatment-emergent AEs occurred during the study. The most frequently occurring treatment-emergent AEs were injection-site related and most were mild. No diffuse urticaria or other systemic hypersensitivity reactions were reported. No apparent effect of SC XmAb7195 on platelet count was seen when dosed at 0.1 - 1.0 mg/kg weekly for four weeks. At 1.5 - 2.0 mg/kg weekly for four weeks, mild platelet count reductions were observed. Four of 15 patients in the 2.0 mg/kg group had at least one platelet count of less than 150 x 103/mL at some time point. The lowest count observed was 126 x 103/mL, and recovery to within normal range occurred within a few days.
In 23 of 27 (85%) subjects with detectable baseline free IgE (≥ 9.59 ng/mL limit of quantitation); (median 76.2 ng/mL, range: 17.4-846 ng/mL), treated with four weekly SC XmAb7195 doses of 0.3 to 2.0 mg/kg, free IgE was suppressed to below the limit of quantitation (BLQ) at some time point during the treatment period. In 20 (74%) subjects, BLQ values were maintained for the remainder of the treatment period and for at least seven days following the last dose. Similarly, in the subgroup of atopic subjects, 14 of 14 (100%) subjects with detectable baseline free IgE (median 150.0 ng/mL, range: 46.4-846 ng/mL) treated with four weekly SC XmAb7195 doses of 1.5 to 2.0 mg/kg, free IgE was suppressed to BLQ at some time point during the treatment period. In 12 (86%) atopic subjects, BLQ values were maintained for the remainder of the treatment period and for at least seven days following the last dose. Similarly, total IgE was profoundly suppressed in nearly all subjects for at least seven days following the last dose.
These results support subcutaneous delivery for future development, and analysis of the data is proceeding to determine the optimal dosing schedule. Xencor is seeking a development partner for XmAb7195.
Bispecific Oncology Pipeline: Xencor's initial bispecific antibody programs are tumor-targeted antibodies that contain both a tumor antigen binding domain and a cytotoxic T-cell binding domain (CD3). These bispecific antibodies activate T cells for highly potent and targeted killing of malignant cells. Their XmAb Fc domains confer long circulating half-lives, stability and ease of manufacture. XmAb®14045 is currently in a Phase 1 study for the treatment of acute myeloid leukemia (AML) and other CD123-expressing hematologic malignancies, and XmAb®13676 is currently in a Phase 1 study for the treatment of B-cell malignancies.
Initial data from XmAb14045 Phase 1 trial expected in 2018, pending alignment on timing with Novartis.
Initial data from XmAb13676 Phase 1 trial expected in 2018, pending alignment on timing with Novartis.
The Investigational New Drug (IND) application for XmAb18087, a somatostatin receptor 2 (SSTR2) x CD3 bispecific antibody for the treatment of neuroendocrine tumors and gastrointestinal stromal tumors, was approved in October 2017; clinical trial start expected in the first quarter of 2018.
Xencor is expanding its bispecific pipeline to build a suite of tumor microenvironment activators that engage multiple targets, such as T-cell checkpoints or agonists, with three IND's scheduled to be filed over the next 12 months:
IND application filing for XmAb®20717, a PD-1 x CTLA-4 dual checkpoint inhibitor for the treatment of multiple oncology indications, expected in 2018.
IND application filing for XmAb®22841, a CTLA-4 x LAG-3 dual checkpoint inhibitor for the treatment of multiple oncology indications, expected in 2018.
IND application filing for XmAb®23104, a PD-1 x ICOS bispecific antibody for the treatment of multiple oncology indications, expected in 2018.
At the Society for Immunotherapy of Cancer (SITC) 2017 Annual Meeting in November, Xencor will present preclinical data on XmAb20717 and XmAb23104.
Partnered XmAb Programs: Nine pharmaceutical companies and the National Institutes of Health are advancing novel drug candidates either discovered at Xencor or that rely on Xencor's proprietary XmAb technology. Seven such programs are currently undergoing clinical testing, including two in Phase 3 studies.
Third Quarter Ended September 30, 2017 Financial Results:
Cash, cash equivalents and marketable securities totaled $373.0 million as of September 30, 2017, compared to $403.5 million on December 31, 2016. The decrease reflects net spending on operations in the nine months ended September 30, 2017.
Revenues for the third quarter ended September 30, 2017 were $7.1 million, compared to $7.8 million for the same period in 2016. Revenues for the nine months ended September 30, 2017 were $24.8 million, compared to $81.1 million for the same period in 2016. Revenues in the three and nine-month period ended September 30, 2017 were earned primarily from the Company's Amgen and MorphoSys collaborations, compared to revenues from the same period in 2016, which were earned primarily from the Company's Novartis and Amgen collaborations.
Research and development expenditures for the third quarter ended September 30, 2017 were $19.4 million, compared to $14.1 million for the same period in 2016. Total research and development expenses for the nine-month period ended September 30, 2017 were $51.4 million, compared to $38.5 million for the same period in 2016. The increased research and development spending for the three and nine months ended September 30, 2017 is primarily due to increased spending on the Company's bispecific pipeline and development candidates.
General and administrative expenses for the third quarter ended September 30, 2017 were $4.2 million, compared to $3.0 million in the same period in 2016. Total general and administrative expenses for the nine-month period ended September 30, 2017 were $13.1 million, compared to $10.0 million for the same period in 2016. Increased spending on general and administrative expenses for the three and nine months ended September 30, 2017 reflects increased staffing and stock-based compensation charges.
Non-cash, share based compensation expense for the nine months ended September 30, 2017 was $10.2 million, compared to $5.9 million for the same period in 2016.
Net loss for the third quarter ended September 30, 2017 was $15.6 million, or $(0.33) on a fully diluted per share basis, compared to a net loss of $8.1 million, or $(0.20) on a fully diluted per share basis, for the same period in 2016. For the nine months ended September 30, 2017, net loss was $37.1 million, or $(0.79) on a fully diluted per share basis, compared to a net income of $32.7 million, or $0.78 on a fully diluted per share basis, for the same period in 2016. The higher loss for the three months ended September 30, 2017 over the loss reported for the same period in 2016 is primarily due to additional research and development expenses on the Company's bispecific pipeline and development candidates, while the loss reported for the nine months ended September 30, 2017 compared to the income earned over the same period in 2016 is primarily due to revenue reported from the Company's Novartis collaboration in 2016 and additional research and development expenses in 2017.
The total shares outstanding was 46,955,365 as of September 30, 2017, compared to 41,138,851 as of September 30, 2016. The increase in total shares at September 30, 2017 reflects the sale of shares in the December 2016 financing.
Financial Guidance:
Based on current operating plans, Xencor expects to have cash to fund research and development programs and operations beyond 2020. Xencor expects to end 2017 with approximately $340 million in cash, cash equivalents and marketable securities.
Conference Call and Webcast:
Xencor will host a conference call today at 4:30 p.m. ET (1:30 p.m. PT) to discuss these third quarter 2017 financial results and provide a corporate update.
The live call may be accessed by dialing (877) 359-9508 for domestic callers or (224) 357-2393 for international callers, and referencing conference ID number: 99272433. A live webcast of the conference call will be available online from the investor relations section of the company's website at www.xencor.com. The webcast will be archived on the company's website for 30 days.
About Xencor, Inc.:
Xencor is a clinical-stage biopharmaceutical company developing engineered monoclonal antibodies for the treatment of autoimmune diseases, asthma and allergic diseases and cancer. Currently, 11 candidates engineered with Xencor's XmAb® technology are in clinical development internally and with partners. Xencor's internal programs include: XmAb®5871 in Phase 2 development for the treatment of IgG4-Related Disease, and also for the treatment of Systemic Lupus Erythematosus; XmAb®7195 in Phase 1 development for the treatment of asthma and allergic diseases; XmAb®14045 in Phase 1 development for acute myeloid leukemia; XmAb®13676 in Phase 1 development for B-cell malignancies; XmAb®18087 in pre-clinical development for the treatment of neuroendocrine tumors; and XmAb®20717 in pre-clinical development for the treatment of multiple cancers. Xencor's XmAb antibody engineering technology enables small changes to the structure of monoclonal antibodies resulting in new mechanisms of therapeutic action. Xencor partners include Novartis, Amgen, MorphoSys, Merck, CSL/Janssen, Alexion and Boehringer Ingelheim. For more information, please visit www.xencor.com.
Die XmAb5871-Ergebnisse waren bereits im wesentlichen bekannt, hier soll die Zulassungsstudie im nächsten Jahr starten. Die Wahrscheinlichkeit einer späteren Zulassung schätze ich als hoch ein.
Die große positive Überraschung ist jedoch die gute Verträglichkeit des anti-IgE-Antikörpers XmAb7195!!! Diesen Mab hatte ich trotz überzeugendem theoretischen Ansatz schon abgeschrieben, weil er bei intravenöser Gabe grenzwertig verträglich schien und als Nebenwirkung ein Teil derjenigen Symptomatik (-> Urticaria) erzeugt hat, die er eigentlich lindern sollte. Bei subcutaner Applikation sind derartige Nebenwirkungen nun nicht mehr aufgetreten!
Der Wirkmechanismus des XAB7195 ist demjenigen des von Genentech entwickelten omalizumab in mehrerlei Hinsicht überlegen: Verstärkte Absenkung des freien IgE durch höhere Affinität und zusätzliche Mechanismen wie z.B. die Hemmung der Synthese IgE-bildender Plasmazellen. Unter den veränderten Bedingungen (s.o.) hat XmAb7195 großes Marktpotential. Ich bin richtig begeistert. XmAb7195 muss wegen der geringeren Halbwertszeit öfters gegeben werden als omalizumab, seine therapeutische Wirkung sollte gleichzeitig jedoch deutlich besser sein, was letztlich der entscheidende Punkt ist. Und mit XmAb7195 dürfte erstmals auch eine Antikörpertherapie bei stark erhöhtem IgE möglich sein. Abzuwarten bleibt, ob die Absenkung des freien IgE unter die Nachweisgrenze neben dem beabsichtigten therapeutischen Effekt (-> Symptomatik der Typ-1-Allergie dürfte weitgehend verschwinden) auch zu etwaigen Nebenwirkungen führen kann, an die man derzeit vielleicht noch nicht denkt.
Ich hatte neulich erwähnt, dass die Entwicklung des anti-CD123-Mabs talacotuzumab gestoppt worden ist. Gegen dasselbe Target hat Xencor mit dem bispezifischen anti-CD123 x CD3-Antikörper XmAb14045 (Kooperation mit Novartis) ein Präparat in der klinischen Entwicklung, dessen Wirksamkeit derjenigen des talacotuzmab überlegen sein sollte. XmAb14045 steht u.a. in Konkurrenz zu Immunogens IMGN632. Beide Präparate befinden sich in der klinischen P1 gegen AML, ein Vergleich wird interessant sein.
Im bevorstehenden Jahr wird Xencor zudem mehrere interessante Immunoncologica (anti-PD-1 x CTLA-4, anti-CTLA4 x LAG3, anti PD-1 x ICOS) in die klinische Studienphase bringen, für Unterhaltung ist also gesorgt.
Warum der nachbörsliche Nasdaq-Kurs nicht anzieht, ist mir ein Rätsel. Xencor gehört zu den am meisten unterschätzten Biotech-Aktien. Es ist zudem eine der wenigen Biotech-Aktien, bei denen der Großaktionär in der jüngsten Zeit aggressiv hinzugekauft hat. Aus meiner Sicht ein aussichtsreiches Investment mit spannenden Fc-Optimierungstechniken.
Xencor wird derzeit mit einem Enterprise Value von 556 Mio. USD bewertet, das ist deutlich zu wenig.
Xencor Reports Third Quarter 2017 Financial Results and Provides Clinical Pipeline Update
-- Announced Final Results from Phase 2 Trial of XmAb®5871 in IgG4-Related Disease (IgG4-RD); Plan to Initiate Phase 3 Trial in 2H18 --
-- Phase 1b Data from Subcutaneous Administration Trial of XmAb®7195 Show Potent IgE Reduction with Improved Tolerability --
-- Management to Host Conference Call Today at 4:30 p.m. ET -
MONROVIA, Calif., Nov. 7, 2017 /PRNewswire/ -- Xencor, Inc. (NASDAQ:XNCR), a clinical-stage biopharmaceutical company developing engineered monoclonal antibodies for the treatment of autoimmune disease, asthma and allergic diseases, and cancer, today reported financial results for the third quarter ended September 30, 2017 and provided a review of business and clinical highlights.
Xencor, Inc. Logo
"Our third quarter results highlight the promise of our XmAb® technology to create a broad pipeline of engineered antibodies with improved performance across a range of unmet needs," said Bassil Dahiyat, Ph.D., president and chief executive officer of Xencor. "We recently announced promising, final results from our Phase 2 trial of XmAb5871 in IgG4-RD, which suggest that XmAb5871 may offer patients the first approved therapy for this newly-defined autoimmune disease and support advancement of the program into a Phase 3 trial. Today, we are pleased to announce data from our Phase 1b trial of subcutaneously administered XmAb7195, which shows potent IgE reduction with improved tolerability compared to intravenous administration, and supports subcutaneous administration in future development. In addition, we continue to advance our bispecific oncology pipeline targeting the tumor microenvironment, have opened the IND for XmAb®18087, our first solid tumor targeting bispecific, and expect to report the first clinical data from our oncology pipeline in 2018."
Recent Business Highlights and Upcoming Clinical Plans
XmAb5871: XmAb5871 is a first-in-class monoclonal antibody that targets CD19 with its variable domain, and uses Xencor's XmAb immune inhibitor Fc domain to target FcyRIIb, a receptor that inhibits B-cell function. XmAb5871 is currently in a Phase 2 clinical study for the treatment of systemic lupus erythematosus (SLE).
Initiation of Phase 3 trial in IgG4-RD expected in 2H18.
Initial data from SLE Phase 2 trial expected in late 2018.
In November 2017, Xencor announced the final results from its Phase 2 trial of XmAb5871 in IgG4-RD. 12 of 15 patients (80%) dosed completed the study, and all 12 achieved the primary endpoint of at least a two-point reduction in the IgG4-RD Responder Index (IgG4-RD RI) on Day 169. None of the 12 required corticosteroids (CS) after month two, and eight patients (53%) achieved disease remission (IgG4-RD of 0 and no CS after two months) and the other four achieved IgG4-RD RI scores of ≤4 at Day 169. Fourteen of 15 patients (93%) achieved a decrease of ≥ 5 in the IgG4-RD RI. XmAb5871 was well-tolerated, with all XmAb5871-related adverse events (AEs) graded as mild to moderate and no XmAb5871-related serious AEs reported. These results will be presented today at 8:15 pm ET during a late-breaking oral presentation at the American College of Rheumatology (ACR) 2017 Annual Meeting titled, "Final Results of an Open Label Phase 2 Study of a Reversible B Cell Inhibitor, Xmab®5871 in IgG4-Related Disease."
Xencor met with the Division of Pulmonary, Allergy and Respiratory Products (DPARP) of the Food and Drug Administration (FDA) in a Type B End of Phase 2 meeting in July 2017 to discuss the optimal pathway to advance XmAb5871 into Phase 3 development in IgG4-RD. The meeting resulted in guidance on endpoint definition and a path forward for Phase 3 development in IgG4-RD, which the FDA recognizes as a new disease entity with no regulatory precedence for an approval pathway. Based on the Phase 2 results and these preliminary discussions with DPARP, a randomized, placebo-controlled, double-blinded Phase 3 trial of approximately 250-350 patients evaluating the addition of XmAb5871 to standard of care is planned to be initiated in the second half of 2018. Xencor also intends to seek scientific advice from the European Medicines Agency in early 2018.
XmAb7195: XmAb7195 is a first-in-class monoclonal antibody that targets IgE with its variable domain and uses Xencor's XmAb immune inhibitor Fc domain to target FcyRIIb, resulting in three distinct mechanisms of action for reducing IgE levels.
Xencor recently completed its subcutaneous (SC) administration Phase 1b study of XmAb7195 evaluating four once-weekly doses of SC XmAb7195. The first part of this study was an open-label bioequivalence trial ranging from 0.1 to 1.0 mg/kg in cohorts of six healthy volunteers. The second part of the trial was a randomized, double-blinded, placebo-controlled multiple-ascending dose study in atopic patients at doses of 1.5 and 2.0 mg/kg. The half-life of SC XmAb7195 ranged from 3.6 - 4.9 days, comparable to the previously reported half-life of 3.9 days of intravenously administered XmAb7195. Bioavailability after the fourth dose exceeded 50%, which is typical for monoclonal antibodies, and drug concentration levels increased with successive doses.
Subcutaneous administration of XmAb7195 was well tolerated. No severe AEs or serious treatment-emergent AEs occurred during the study. The most frequently occurring treatment-emergent AEs were injection-site related and most were mild. No diffuse urticaria or other systemic hypersensitivity reactions were reported. No apparent effect of SC XmAb7195 on platelet count was seen when dosed at 0.1 - 1.0 mg/kg weekly for four weeks. At 1.5 - 2.0 mg/kg weekly for four weeks, mild platelet count reductions were observed. Four of 15 patients in the 2.0 mg/kg group had at least one platelet count of less than 150 x 103/mL at some time point. The lowest count observed was 126 x 103/mL, and recovery to within normal range occurred within a few days.
In 23 of 27 (85%) subjects with detectable baseline free IgE (≥ 9.59 ng/mL limit of quantitation); (median 76.2 ng/mL, range: 17.4-846 ng/mL), treated with four weekly SC XmAb7195 doses of 0.3 to 2.0 mg/kg, free IgE was suppressed to below the limit of quantitation (BLQ) at some time point during the treatment period. In 20 (74%) subjects, BLQ values were maintained for the remainder of the treatment period and for at least seven days following the last dose. Similarly, in the subgroup of atopic subjects, 14 of 14 (100%) subjects with detectable baseline free IgE (median 150.0 ng/mL, range: 46.4-846 ng/mL) treated with four weekly SC XmAb7195 doses of 1.5 to 2.0 mg/kg, free IgE was suppressed to BLQ at some time point during the treatment period. In 12 (86%) atopic subjects, BLQ values were maintained for the remainder of the treatment period and for at least seven days following the last dose. Similarly, total IgE was profoundly suppressed in nearly all subjects for at least seven days following the last dose.
These results support subcutaneous delivery for future development, and analysis of the data is proceeding to determine the optimal dosing schedule. Xencor is seeking a development partner for XmAb7195.
Bispecific Oncology Pipeline: Xencor's initial bispecific antibody programs are tumor-targeted antibodies that contain both a tumor antigen binding domain and a cytotoxic T-cell binding domain (CD3). These bispecific antibodies activate T cells for highly potent and targeted killing of malignant cells. Their XmAb Fc domains confer long circulating half-lives, stability and ease of manufacture. XmAb®14045 is currently in a Phase 1 study for the treatment of acute myeloid leukemia (AML) and other CD123-expressing hematologic malignancies, and XmAb®13676 is currently in a Phase 1 study for the treatment of B-cell malignancies.
Initial data from XmAb14045 Phase 1 trial expected in 2018, pending alignment on timing with Novartis.
Initial data from XmAb13676 Phase 1 trial expected in 2018, pending alignment on timing with Novartis.
The Investigational New Drug (IND) application for XmAb18087, a somatostatin receptor 2 (SSTR2) x CD3 bispecific antibody for the treatment of neuroendocrine tumors and gastrointestinal stromal tumors, was approved in October 2017; clinical trial start expected in the first quarter of 2018.
Xencor is expanding its bispecific pipeline to build a suite of tumor microenvironment activators that engage multiple targets, such as T-cell checkpoints or agonists, with three IND's scheduled to be filed over the next 12 months:
IND application filing for XmAb®20717, a PD-1 x CTLA-4 dual checkpoint inhibitor for the treatment of multiple oncology indications, expected in 2018.
IND application filing for XmAb®22841, a CTLA-4 x LAG-3 dual checkpoint inhibitor for the treatment of multiple oncology indications, expected in 2018.
IND application filing for XmAb®23104, a PD-1 x ICOS bispecific antibody for the treatment of multiple oncology indications, expected in 2018.
At the Society for Immunotherapy of Cancer (SITC) 2017 Annual Meeting in November, Xencor will present preclinical data on XmAb20717 and XmAb23104.
Partnered XmAb Programs: Nine pharmaceutical companies and the National Institutes of Health are advancing novel drug candidates either discovered at Xencor or that rely on Xencor's proprietary XmAb technology. Seven such programs are currently undergoing clinical testing, including two in Phase 3 studies.
Third Quarter Ended September 30, 2017 Financial Results:
Cash, cash equivalents and marketable securities totaled $373.0 million as of September 30, 2017, compared to $403.5 million on December 31, 2016. The decrease reflects net spending on operations in the nine months ended September 30, 2017.
Revenues for the third quarter ended September 30, 2017 were $7.1 million, compared to $7.8 million for the same period in 2016. Revenues for the nine months ended September 30, 2017 were $24.8 million, compared to $81.1 million for the same period in 2016. Revenues in the three and nine-month period ended September 30, 2017 were earned primarily from the Company's Amgen and MorphoSys collaborations, compared to revenues from the same period in 2016, which were earned primarily from the Company's Novartis and Amgen collaborations.
Research and development expenditures for the third quarter ended September 30, 2017 were $19.4 million, compared to $14.1 million for the same period in 2016. Total research and development expenses for the nine-month period ended September 30, 2017 were $51.4 million, compared to $38.5 million for the same period in 2016. The increased research and development spending for the three and nine months ended September 30, 2017 is primarily due to increased spending on the Company's bispecific pipeline and development candidates.
General and administrative expenses for the third quarter ended September 30, 2017 were $4.2 million, compared to $3.0 million in the same period in 2016. Total general and administrative expenses for the nine-month period ended September 30, 2017 were $13.1 million, compared to $10.0 million for the same period in 2016. Increased spending on general and administrative expenses for the three and nine months ended September 30, 2017 reflects increased staffing and stock-based compensation charges.
Non-cash, share based compensation expense for the nine months ended September 30, 2017 was $10.2 million, compared to $5.9 million for the same period in 2016.
Net loss for the third quarter ended September 30, 2017 was $15.6 million, or $(0.33) on a fully diluted per share basis, compared to a net loss of $8.1 million, or $(0.20) on a fully diluted per share basis, for the same period in 2016. For the nine months ended September 30, 2017, net loss was $37.1 million, or $(0.79) on a fully diluted per share basis, compared to a net income of $32.7 million, or $0.78 on a fully diluted per share basis, for the same period in 2016. The higher loss for the three months ended September 30, 2017 over the loss reported for the same period in 2016 is primarily due to additional research and development expenses on the Company's bispecific pipeline and development candidates, while the loss reported for the nine months ended September 30, 2017 compared to the income earned over the same period in 2016 is primarily due to revenue reported from the Company's Novartis collaboration in 2016 and additional research and development expenses in 2017.
The total shares outstanding was 46,955,365 as of September 30, 2017, compared to 41,138,851 as of September 30, 2016. The increase in total shares at September 30, 2017 reflects the sale of shares in the December 2016 financing.
Financial Guidance:
Based on current operating plans, Xencor expects to have cash to fund research and development programs and operations beyond 2020. Xencor expects to end 2017 with approximately $340 million in cash, cash equivalents and marketable securities.
Conference Call and Webcast:
Xencor will host a conference call today at 4:30 p.m. ET (1:30 p.m. PT) to discuss these third quarter 2017 financial results and provide a corporate update.
The live call may be accessed by dialing (877) 359-9508 for domestic callers or (224) 357-2393 for international callers, and referencing conference ID number: 99272433. A live webcast of the conference call will be available online from the investor relations section of the company's website at www.xencor.com. The webcast will be archived on the company's website for 30 days.
About Xencor, Inc.:
Xencor is a clinical-stage biopharmaceutical company developing engineered monoclonal antibodies for the treatment of autoimmune diseases, asthma and allergic diseases and cancer. Currently, 11 candidates engineered with Xencor's XmAb® technology are in clinical development internally and with partners. Xencor's internal programs include: XmAb®5871 in Phase 2 development for the treatment of IgG4-Related Disease, and also for the treatment of Systemic Lupus Erythematosus; XmAb®7195 in Phase 1 development for the treatment of asthma and allergic diseases; XmAb®14045 in Phase 1 development for acute myeloid leukemia; XmAb®13676 in Phase 1 development for B-cell malignancies; XmAb®18087 in pre-clinical development for the treatment of neuroendocrine tumors; and XmAb®20717 in pre-clinical development for the treatment of multiple cancers. Xencor's XmAb antibody engineering technology enables small changes to the structure of monoclonal antibodies resulting in new mechanisms of therapeutic action. Xencor partners include Novartis, Amgen, MorphoSys, Merck, CSL/Janssen, Alexion and Boehringer Ingelheim. For more information, please visit www.xencor.com.
Eine schon etwas ältere Übersicht mit Schwerpunkt auf IO:
https://loncarfunds.com/qa-with-xencor-ceo-bassil-dahiyat/
https://loncarfunds.com/qa-with-xencor-ceo-bassil-dahiyat/
Antwort auf Beitrag Nr.: 56.126.441 von Joschka Schröder am 07.11.17 23:20:23zu XmAb7195: Im Auge behalten muss man z.B. die Frage möglicher Thrombozytopenien nach wiederholter Gabe des Antikörpers.
talacotuzmuab wird übrigens außerhalb der Indikation AML weiterentwickelt.
talacotuzmuab wird übrigens außerhalb der Indikation AML weiterentwickelt.
Hallo Joschka, einige Fragen nach eigenen Gedanken:
1. Ich komme natürlich mal wieder mit meiner Immunogenicity Frage. Durch die FC-Veränderungen ist doch eine erhöhte Rate bei den Xencor Antikörpern zu erwarten, oder? Im Call gestern wurde von einem derartigen Fall berichtet, das hat mich aufhorchen lassen. Ich habe noch keine Zeit gefunden mir einzelne, bisher veröffentlichte Studienergebnisse diesbezüglich genauer anzuschauen.
2. Bezüglich 7195 und Thrombozytopenien: Gibt es denn hierzu schon erste Daten, die auf eine permantente Verminderung der Blutplättchen schließen lassen?
3. Bezüglich der bispezifischen Antikörper habe ich mir die Frage gestellt, ob die Aussage der Firma, dass ein anti-CTLA-4 und anti-PD-L1 als Bispecific den Vorteil hat vorwiegend im Tumor seine Wirkung zu entfalten und nicht in Healthy Tissue, da es nur im Tumor entsprechende T-Zellen mit den beiden exprimierten Targets gäbe. Wenn ich versuche logisch zu denken, dann halte ich diese Aussage für nicht nachvollziehbar. Denn erstens bindet ein deratiger Bispecific auch an ein Target, das nur einfach exprimiert ist (anti-CTLA4 oder amti-PD-L1) und hat somit doch keinen denkbaren Sicherheits-Vorteil gegenüber zwei normalen Antikörpern für CTLA-4 und PD-L1, die in Kombination verabreicht werden. Also ich habe das "rationale" dahinter noch nicht kapiert.
1. Ich komme natürlich mal wieder mit meiner Immunogenicity Frage. Durch die FC-Veränderungen ist doch eine erhöhte Rate bei den Xencor Antikörpern zu erwarten, oder? Im Call gestern wurde von einem derartigen Fall berichtet, das hat mich aufhorchen lassen. Ich habe noch keine Zeit gefunden mir einzelne, bisher veröffentlichte Studienergebnisse diesbezüglich genauer anzuschauen.
2. Bezüglich 7195 und Thrombozytopenien: Gibt es denn hierzu schon erste Daten, die auf eine permantente Verminderung der Blutplättchen schließen lassen?
3. Bezüglich der bispezifischen Antikörper habe ich mir die Frage gestellt, ob die Aussage der Firma, dass ein anti-CTLA-4 und anti-PD-L1 als Bispecific den Vorteil hat vorwiegend im Tumor seine Wirkung zu entfalten und nicht in Healthy Tissue, da es nur im Tumor entsprechende T-Zellen mit den beiden exprimierten Targets gäbe. Wenn ich versuche logisch zu denken, dann halte ich diese Aussage für nicht nachvollziehbar. Denn erstens bindet ein deratiger Bispecific auch an ein Target, das nur einfach exprimiert ist (anti-CTLA4 oder amti-PD-L1) und hat somit doch keinen denkbaren Sicherheits-Vorteil gegenüber zwei normalen Antikörpern für CTLA-4 und PD-L1, die in Kombination verabreicht werden. Also ich habe das "rationale" dahinter noch nicht kapiert.
Antwort auf Beitrag Nr.: 56.133.149 von Ville7 am 08.11.17 16:22:02Disclosure: Ich bin übrigens nun (seit 2 Stunden) auch hier dabei. Ich habe meine Due Diligence zwar noch nicht komplett abgeschlossen, aber was ich bisher sehe beeindruckt schon.
a) die Pipeline ist gut gefüllt mit aussichtsreichen und potentiell wirtschaftlich einträglichen Projekten.
b) die Firma ist mit unter 1Mrd USD noch recht moderat bewertet
c) sie haben Cash über das Jahr 2020 hinaus. Das Phase 3 Alexion- und das Morphosys-Programm sollten weitere große Cash-Mengen in die Pipeline strömen lassen. Zudem weitere Meilensteine aus der Pipeline und dann irgendwann einsetzende Tantiemen. Somit sollte eine Kapitalerhöhung nicht notwendig sein.
d) die Ansätze sind sehr innovativ und nicht wie bei anderen einfach nur "me-too". Zudem gefallen mir die bisher präsentierten Daten, bei denen erkennbar ist, dass die Optimierungen einen echten Mehrwert zu liefern scheinen. Ein Differenzierungspotential, welches später den Unterschied zwischen wirtschaftlichem Erfolg oder Nicht-Erfolg ausmacht.
a) die Pipeline ist gut gefüllt mit aussichtsreichen und potentiell wirtschaftlich einträglichen Projekten.
b) die Firma ist mit unter 1Mrd USD noch recht moderat bewertet
c) sie haben Cash über das Jahr 2020 hinaus. Das Phase 3 Alexion- und das Morphosys-Programm sollten weitere große Cash-Mengen in die Pipeline strömen lassen. Zudem weitere Meilensteine aus der Pipeline und dann irgendwann einsetzende Tantiemen. Somit sollte eine Kapitalerhöhung nicht notwendig sein.
d) die Ansätze sind sehr innovativ und nicht wie bei anderen einfach nur "me-too". Zudem gefallen mir die bisher präsentierten Daten, bei denen erkennbar ist, dass die Optimierungen einen echten Mehrwert zu liefern scheinen. Ein Differenzierungspotential, welches später den Unterschied zwischen wirtschaftlichem Erfolg oder Nicht-Erfolg ausmacht.
Antwort auf Beitrag Nr.: 56.133.149 von Ville7 am 08.11.17 16:22:02Wie gewohnt intelligente Fragen, die zum nachdenken anregen.
Zur Immunogenität: Im Gegensatz zu anderen Unternehmen reicht bei Xencors Technik der Austausch weniger Aminosäuren im Fc-Fragment aus, um die gewünschte Wirkung zu erzielen. Bei MOR208 beispielsweise wurde die Zytotoxizität allein durch Austausch zweier Aminosäuren an Position S239D und I332E erreicht. Das Glykosylierungsmuster wurde nicht geändert. Insoweit dürfte die Wahrscheinlichkeit einer veränderten Immunogenität mit Bildung von Antikörpern gegen den therapeutischen Antikörper im Vergleich zu konventionellen Antikörperpräparaten nicht nennenswert erhöht sein.
Zum Thema Thrombozytopenie: Bislang gibt es keine Hinweise darauf, dass es bei längerer Anwendung des XmAb7195 zu einem ausgeprägten Abfall der Thrombozyten kommen kann. Ein harmloser, leichterer Abfall wurde in der laufenden Studie beobachtet, man kennt das Phänomen aber auch von Genentechs omalizumab. Dennoch habe ich diesen Punkt im Hinterkopf, weil ich immer nach potentiellen Mängeln suche ... und XmAb7195 ist bislang eben noch nicht über längere Zeiträume getestet worden.
Zur Frage nach dem bispezifischen Mab schreibe ich später etwas, wenn ich wieder online bin.
PS: Irgendwie leuchtet mir die aktuelle Kursentwicklung nicht ein. Der Xencor-Kurs scheint nun wenigstens (bei geringen Umsätzen) etwas zuzulegen, bei CytomX hingegen gibt der Kurs aktuell deutlich nach, obwohl beide Unternehmen gestern abend sehr Erfreuliches gemeldet haben. Keine Ahnung, was in den Investorenköpfen vor sich geht ...
Zur Immunogenität: Im Gegensatz zu anderen Unternehmen reicht bei Xencors Technik der Austausch weniger Aminosäuren im Fc-Fragment aus, um die gewünschte Wirkung zu erzielen. Bei MOR208 beispielsweise wurde die Zytotoxizität allein durch Austausch zweier Aminosäuren an Position S239D und I332E erreicht. Das Glykosylierungsmuster wurde nicht geändert. Insoweit dürfte die Wahrscheinlichkeit einer veränderten Immunogenität mit Bildung von Antikörpern gegen den therapeutischen Antikörper im Vergleich zu konventionellen Antikörperpräparaten nicht nennenswert erhöht sein.
Zum Thema Thrombozytopenie: Bislang gibt es keine Hinweise darauf, dass es bei längerer Anwendung des XmAb7195 zu einem ausgeprägten Abfall der Thrombozyten kommen kann. Ein harmloser, leichterer Abfall wurde in der laufenden Studie beobachtet, man kennt das Phänomen aber auch von Genentechs omalizumab. Dennoch habe ich diesen Punkt im Hinterkopf, weil ich immer nach potentiellen Mängeln suche ... und XmAb7195 ist bislang eben noch nicht über längere Zeiträume getestet worden.
Zur Frage nach dem bispezifischen Mab schreibe ich später etwas, wenn ich wieder online bin.
PS: Irgendwie leuchtet mir die aktuelle Kursentwicklung nicht ein. Der Xencor-Kurs scheint nun wenigstens (bei geringen Umsätzen) etwas zuzulegen, bei CytomX hingegen gibt der Kurs aktuell deutlich nach, obwohl beide Unternehmen gestern abend sehr Erfreuliches gemeldet haben. Keine Ahnung, was in den Investorenköpfen vor sich geht ...
Antwort auf Beitrag Nr.: 56.134.643 von Joschka Schröder am 08.11.17 18:27:24
Danke für deine bisherigen Antworten.
Für dein "PS" möchte ich dir gerne eine nicht-fundamentale Begründung liefern, die meinen langjährigen Beobachtungen nach sehr sehr häufig valide ist: Aktien, die in einem bestimmten Jahr im Plus sind werden gegen Jahresende weiter hochgekauft, auch wenn es fundamental keinen Grund dafür gibt. Aktien, die wie Xencor ein Jahres-Minus ausweisen haben es schwer zu drehen und scheinen oft bis zu Jahresende wie Blei liegenzubleiben. Der Grund ist, dass ein gewisses Tax-Loss-Selling und bei Funds auch ein gewisses Window Dressing eine Rolle spielt. Diese Aktien werden zu Jahresende einfach nicht angefasst, auch wenn sie fundamental aussichtsreich und ggfs. auch unterbewertet sind.
Zitat von Joschka Schröder: PS: Irgendwie leuchtet mir die aktuelle Kursentwicklung nicht ein. Der Xencor-Kurs scheint nun wenigstens (bei geringen Umsätzen) etwas zuzulegen, bei CytomX hingegen gibt der Kurs aktuell deutlich nach, obwohl beide Unternehmen gestern abend sehr Erfreuliches gemeldet haben. Keine Ahnung, was in den Investorenköpfen vor sich geht ...
Danke für deine bisherigen Antworten.
Für dein "PS" möchte ich dir gerne eine nicht-fundamentale Begründung liefern, die meinen langjährigen Beobachtungen nach sehr sehr häufig valide ist: Aktien, die in einem bestimmten Jahr im Plus sind werden gegen Jahresende weiter hochgekauft, auch wenn es fundamental keinen Grund dafür gibt. Aktien, die wie Xencor ein Jahres-Minus ausweisen haben es schwer zu drehen und scheinen oft bis zu Jahresende wie Blei liegenzubleiben. Der Grund ist, dass ein gewisses Tax-Loss-Selling und bei Funds auch ein gewisses Window Dressing eine Rolle spielt. Diese Aktien werden zu Jahresende einfach nicht angefasst, auch wenn sie fundamental aussichtsreich und ggfs. auch unterbewertet sind.
Antwort auf Beitrag Nr.: 56.134.937 von Ville7 am 08.11.17 18:53:59Ville, kurz noch zu Deiner letzten Frage. Der XmAb20717 bindet stabil nur an Zellen, die sowohl PD-1 als auch CTLA-4 exprimieren. XmAb20717 ist anders aufgebaut, als man dies von konventionellen bispezifischen Mabs gewohnt ist. Ich verlinke jetzt eine Posterpräsentation, die den XmAb20717 kurz und anschaulich beschreibt -> http://files.shareholder.com/downloads/AMDA-2B2V8N/0x0x91628…
PS: Ich habe heute weiter zugekauft.
PS: Ich habe heute weiter zugekauft.
Antwort auf Beitrag Nr.: 56.134.937 von Ville7 am 08.11.17 18:53:59Das konnte man Ende letztes Jahr bei IMGN sehr gut sehen.
Ich habe keine Zweifel, dass ALXN1210 der Soloris Nachfolger werden wird. Soloris = 3+Mrd USD in 2017, prognostiziert 5.6Mrd USD in 2020.
Mehr als dreifache Halbwertszeit als Soloris und ich könnte mir vorstellen, dass sie an Soloris nur eines verändert haben um den ALXN1210 zu erstellen. Dessen FC domain gegen die XTEND domain getauscht.
Und der Markt hat durch die vertraglich vereinbarte Verschwiegenheit noch gar noch geschnallt, dass XNCR da mit im Boot sitzt und Meilensteine und Tantiemen erhalten wird (leider keine Auskunft über die potentiellen Höhen).
Mehr als dreifache Halbwertszeit als Soloris und ich könnte mir vorstellen, dass sie an Soloris nur eines verändert haben um den ALXN1210 zu erstellen. Dessen FC domain gegen die XTEND domain getauscht.
Und der Markt hat durch die vertraglich vereinbarte Verschwiegenheit noch gar noch geschnallt, dass XNCR da mit im Boot sitzt und Meilensteine und Tantiemen erhalten wird (leider keine Auskunft über die potentiellen Höhen).
Antwort auf Beitrag Nr.: 56.137.601 von Ville7 am 09.11.17 06:29:53
Die Antwort steht im Eröffnungsbeitrag ("low single digits", s.u.). Meilensteine 66,5 Mio. USD.
Zitat von Ville7: Ich habe keine Zweifel, dass ALXN1210 der Soloris Nachfolger werden wird. Soloris = 3+Mrd USD in 2017, prognostiziert 5.6Mrd USD in 2020.
...
Und der Markt hat durch die vertraglich vereinbarte Verschwiegenheit noch gar noch geschnallt, dass XNCR da mit im Boot sitzt und Meilensteine und Tantiemen erhalten wird (leider keine Auskunft über die potentiellen Höhen).
Die Antwort steht im Eröffnungsbeitrag ("low single digits", s.u.). Meilensteine 66,5 Mio. USD.
Zitat von Joschka Schröder: Falls die P3-Phasen für ALXN12 erfolgreich verlaufen und es zur Zulassung kommen sollte, wird Xencor Tantiemen im niedrigen einstelligen Prozentbereich erhalten. Bei einem geschätzten Umsatz von ca. 4 Mrd. USD und einer Royalties-Rate von 2,5 % wären das 100 Mio. USD pro Jahr.
@ville
Das hört sich schlüssig an.
Ergänzen möchte ich jedoch, daß eculizumab/soliris Jahrestherapiekosten von 600.000 Dollar hat und amgen ein biosimilar herstellt, welches seinen Marktanteil finden wird.
Der Druck auf payers/Krankenkassen, gerade bei seltenen Krankheiten mit exorbitanten Kosten für die Allgemeinheit, sparsam zu handeln, wird neue Produkte, die ( nur) die convenience/Anwenderfreundlichkeit erhöhen, limitieren.
Das hört sich schlüssig an.
Ergänzen möchte ich jedoch, daß eculizumab/soliris Jahrestherapiekosten von 600.000 Dollar hat und amgen ein biosimilar herstellt, welches seinen Marktanteil finden wird.
Der Druck auf payers/Krankenkassen, gerade bei seltenen Krankheiten mit exorbitanten Kosten für die Allgemeinheit, sparsam zu handeln, wird neue Produkte, die ( nur) die convenience/Anwenderfreundlichkeit erhöhen, limitieren.
@Joschka: Danke für die Info. Wo bist du da bezüglich der finanziellen Details fündig geworden? Hatte nichts gefunden. Hab ich das im annual report übersehen?
@StefanR: Biosimilars haben bisher noch nicht sehr viel gerissen und die branded Produkte wurden dennoch meist vorgezogen. Ich kenne (noch) keine Bereiche wo Biosimilars den branded Produkten massiv das Wasser abgegraben haben. Aber vielleicht bin ich ja nicht gut genug informiert.
Natürlich kann sich das bei steigendem Druck der Payers noch ändern. Bezüglich der längerwirkenden Variante gebe ich dir Recht, da wird Alexion Probleme bekommen den aktuellen Preis je Verabreichung noch einmal zu verdreifachen bzw. die jährlichen Kosten auf diesem Niveau zu halten. Aber prinzipiell werdend die Ärzte die längerwirkende Variante bevorzugen. Beispiel hierfür aus einem anderen Bereich: Pegfilgrastim gegenüber Filgrastim.
@StefanR: Biosimilars haben bisher noch nicht sehr viel gerissen und die branded Produkte wurden dennoch meist vorgezogen. Ich kenne (noch) keine Bereiche wo Biosimilars den branded Produkten massiv das Wasser abgegraben haben. Aber vielleicht bin ich ja nicht gut genug informiert.
Natürlich kann sich das bei steigendem Druck der Payers noch ändern. Bezüglich der längerwirkenden Variante gebe ich dir Recht, da wird Alexion Probleme bekommen den aktuellen Preis je Verabreichung noch einmal zu verdreifachen bzw. die jährlichen Kosten auf diesem Niveau zu halten. Aber prinzipiell werdend die Ärzte die längerwirkende Variante bevorzugen. Beispiel hierfür aus einem anderen Bereich: Pegfilgrastim gegenüber Filgrastim.
Antwort auf Beitrag Nr.: 56.138.663 von Ville7 am 09.11.17 08:57:07Ich glaube, das war ein SEC-file zum Lizenzvertrag (Jahr 2013?), habe die genaue Quelle in meiner Datenbank aber leider nicht notiert.
Antwort auf Beitrag Nr.: 56.138.891 von Joschka Schröder am 09.11.17 09:11:09Danke, ich habs (war im annual report und ich habs überlesen):
Under the agreement, we received an upfront payment of $3.0 million. Alexion is also required to pay an annual maintenance fee of $0.5 million during the research term of the agreement and $1.0 million during any extension of the research term. In addition, if certain development, regulatory and commercial milestones are achieved, we are eligible to receive up to $66.5 million for the first product to achieve such milestones on a target‑by‑target basis. If licensed products are successfully commercialized, we are also entitled to receive royalties based on a percentage of net sales of such products sold by Alexion, its affiliates or its sub licensees, which percentage is in the low single digits. Alexion’s royalty obligations continue on a product‑by‑product and country‑by‑ country basis until the expiration of the last‑to‑expire valid claim in a licensed patent covering the applicable product in such country.
Under the agreement, we received an upfront payment of $3.0 million. Alexion is also required to pay an annual maintenance fee of $0.5 million during the research term of the agreement and $1.0 million during any extension of the research term. In addition, if certain development, regulatory and commercial milestones are achieved, we are eligible to receive up to $66.5 million for the first product to achieve such milestones on a target‑by‑target basis. If licensed products are successfully commercialized, we are also entitled to receive royalties based on a percentage of net sales of such products sold by Alexion, its affiliates or its sub licensees, which percentage is in the low single digits. Alexion’s royalty obligations continue on a product‑by‑product and country‑by‑ country basis until the expiration of the last‑to‑expire valid claim in a licensed patent covering the applicable product in such country.
Antwort auf Beitrag Nr.: 56.138.891 von Joschka Schröder am 09.11.17 09:11:09Habe noch mal schnell nachgesehen. Z.B. findest Du die Angaben auch auf S.99 im Geschäftsbericht 2013 -> http://investors.xencor.com/secfiling.cfm?filingid=1047469-1…
" In addition, if certain development, regulatory and commercial milestones are achieved, we are eligible to receive up to $66.5 million for the first product to achieve such milestones on a target-by-target basis. If licensed products are successfully commercialized, we are also entitled to receive royalties based on a percentage of net sales of such products sold by Alexion, its affiliates or its sublicensees, which percentage is in the low single digits. "
" In addition, if certain development, regulatory and commercial milestones are achieved, we are eligible to receive up to $66.5 million for the first product to achieve such milestones on a target-by-target basis. If licensed products are successfully commercialized, we are also entitled to receive royalties based on a percentage of net sales of such products sold by Alexion, its affiliates or its sublicensees, which percentage is in the low single digits. "
@ville
Zwar etwas überzeichnet, da Tenderverhandlung durch norwegischen Gesundheitsfonds:
90% Anteil infliximab biosimilar in Vergleich zu remicade.
Weiterhin die Epo-Biosimilars in Europa beherrschen gegenüber den verschiedenen Originalia den Markt.
Filgrastim als kurzwirksames Moleül in Europa ebenfalls.
Peg-Filgrastim Aufrollprozeß in den Anfängen.
Enbrel in EU steht massiv unter Druck (Benepali et al)
Remicade US hat 2 vertriebsfähige (celltrion/samsungbioepis Produzenten) bekommen.
Du hast recht, die Moment-Aufnahme (insbesondere in USA) ist bei den mabs eine andere, das muß jedoch nichts heißen.
Biosimilars sind ein gamechanger für aus dem Patent gefallene Biotechnologika und deren Biobetters.
Zwar etwas überzeichnet, da Tenderverhandlung durch norwegischen Gesundheitsfonds:
90% Anteil infliximab biosimilar in Vergleich zu remicade.
Weiterhin die Epo-Biosimilars in Europa beherrschen gegenüber den verschiedenen Originalia den Markt.
Filgrastim als kurzwirksames Moleül in Europa ebenfalls.
Peg-Filgrastim Aufrollprozeß in den Anfängen.
Enbrel in EU steht massiv unter Druck (Benepali et al)
Remicade US hat 2 vertriebsfähige (celltrion/samsungbioepis Produzenten) bekommen.
Du hast recht, die Moment-Aufnahme (insbesondere in USA) ist bei den mabs eine andere, das muß jedoch nichts heißen.
Biosimilars sind ein gamechanger für aus dem Patent gefallene Biotechnologika und deren Biobetters.
freut mich dass hier mehr leute auf XNCR aufmerksam werden. bin selber seit ca. EUR 9 dabei, hab allerdings knapp die hälfte vor ein paar monaten schon wieder geschmissen.... wenn ich mir eure beiträge so lese, dann denk ich vielleicht muss ich gleich wieder nachkaufen...!
bin dazumals über den MOR/XNCR-deal darauf aufmerksam geworden, und dann gibt's natürlich auch diesen hammer NOV-deal.
schätze u.a. auch XNCR als sehr spannende aktie für die nächsten jahre ein. der allgemeine markt wird allerdings einiges mitzusprechen haben...
jedenfalls alles gute allen hier mit dem investment.
PS: bin nicht sehr dicht an XNCR dran, aber neu war für mich die info "Xencor is seeking a development partner for XmAb7195"; denke das hat man vorher noch nicht so veröffentlicht.
bin dazumals über den MOR/XNCR-deal darauf aufmerksam geworden, und dann gibt's natürlich auch diesen hammer NOV-deal.
schätze u.a. auch XNCR als sehr spannende aktie für die nächsten jahre ein. der allgemeine markt wird allerdings einiges mitzusprechen haben...
jedenfalls alles gute allen hier mit dem investment.
PS: bin nicht sehr dicht an XNCR dran, aber neu war für mich die info "Xencor is seeking a development partner for XmAb7195"; denke das hat man vorher noch nicht so veröffentlicht.
Antwort auf Beitrag Nr.: 56.161.856 von PathFinder2 am 11.11.17 19:04:31Schön, Dich hier zu sehen, Pathfinder2! Würde mich freuen, wenn Du wieder aktiver an den Diskussionen teilnimmst.
Antwort auf Beitrag Nr.: 56.162.153 von Joschka Schröder am 11.11.17 20:33:02Hallo Joschka!
Ich befürchte dass ich nur wenig beitragen kann.. Hauptfaktor Zeit. Früher war ich ganz dick in MorphoSys investiert und hab mich daher auch recht intensiv mit der Firma beschäftigt/beschäftigen müssen. Mittlerweile bin ich dagegen recht breit aufgestellt (rund 25 Biotechtitel) - aber dafür weiß ich über die einzelnen Firmen oft nur wenig . Eigentlich sollte ich die Anzahl der Investments reduzieren, aber ich finde es gibt einfach viele spannende Sachen im Biotechbereich. Und wenn nur ein kleiner Teil davon aufgeht, dann reicht das auch für eine gute Performance.
. Eigentlich sollte ich die Anzahl der Investments reduzieren, aber ich finde es gibt einfach viele spannende Sachen im Biotechbereich. Und wenn nur ein kleiner Teil davon aufgeht, dann reicht das auch für eine gute Performance.
Ich freue mich auf jeden Fall auf deine und andere Beiträgte zu XNCR!
OFF TOPIC: Joschka, was hältst du von den OncoSec-Daten?? Kleines n, aber wenn sich das bestätigt dann sollte das für diesen Microcap gewaltig sein?!
https://ir.oncosec.com/press-releases/detail/1925/oncosec-an…
Ich befürchte dass ich nur wenig beitragen kann.. Hauptfaktor Zeit. Früher war ich ganz dick in MorphoSys investiert und hab mich daher auch recht intensiv mit der Firma beschäftigt/beschäftigen müssen. Mittlerweile bin ich dagegen recht breit aufgestellt (rund 25 Biotechtitel) - aber dafür weiß ich über die einzelnen Firmen oft nur wenig
 . Eigentlich sollte ich die Anzahl der Investments reduzieren, aber ich finde es gibt einfach viele spannende Sachen im Biotechbereich. Und wenn nur ein kleiner Teil davon aufgeht, dann reicht das auch für eine gute Performance.
. Eigentlich sollte ich die Anzahl der Investments reduzieren, aber ich finde es gibt einfach viele spannende Sachen im Biotechbereich. Und wenn nur ein kleiner Teil davon aufgeht, dann reicht das auch für eine gute Performance.Ich freue mich auf jeden Fall auf deine und andere Beiträgte zu XNCR!
OFF TOPIC: Joschka, was hältst du von den OncoSec-Daten?? Kleines n, aber wenn sich das bestätigt dann sollte das für diesen Microcap gewaltig sein?!
https://ir.oncosec.com/press-releases/detail/1925/oncosec-an…
Antwort auf Beitrag Nr.: 56.162.615 von PathFinder2 am 11.11.17 23:00:58(OFF TOPIC ERGÄNZUNG: Link Präsentation: https://content.equisolve.net/_cccf0395bc21ba1e67b40d366c1a8… )
Antwort auf Beitrag Nr.: 56.139.353 von StefanR am 09.11.17 09:42:58StefanR, danke für die Hinweise und Beispiele. Scheint tatsächlich so als gäbe es in Europa schon mehr Druck und dadurch Akzeptanz für biosimilars.
Antwort auf Beitrag Nr.: 56.161.856 von PathFinder2 am 11.11.17 19:04:31pathfinder, lange nicht mehr gesehen. 
Man hätte schon früher ab und zu auf die Partner von Morphosys schauen sollen, da steckte manchmal mehr Potential drin. Wenn ich zum Beispiel daran denke, dass ich kurz davor war bei Galapagos zuzuschlagen zu dem Zeitpunkt als sie den die mit Morphosys machten (da waren sie um ein paar EUR herum) und sehe wo sie jetzt sind, könnt ich mich im Nachhinein ärgern. Ich weiß nicht mehr was mich damals davon abhielt, aber dann habe ich sie aus den Augen verloren..
Wenn ich auch meinen Senf zu Oncosec geben darf: die Daten sind natürlich hervorragend und wahrscheinlich wird man da noch mit Geld machen können. Nur für einen breiten Einsatz halte ich die Technologie nicht für einsetzbar. Erst wird DNA-based interleukin-12 in den Tumor injiziert (da muss man ja jeden Tumor und jede Metastase erwischen) und dann mit dem "Applikator" nochmal in den Tumor rein um elektrische Impulse zu erzeugen. Das klingt für mich nicht besonders breit anwendbar und im Endeffekt auch nicht wirtschaftlich. Ich kann mich täuschen, aber das wäre der erste Eindruck von mir. Ich bin eher auf der Suche nach systemisch verabreichbaren Off-the-shelf Produkten, die nach Möglichkeit universell anwendbar sind. Bedeutet hohes Marktpotential.

Man hätte schon früher ab und zu auf die Partner von Morphosys schauen sollen, da steckte manchmal mehr Potential drin. Wenn ich zum Beispiel daran denke, dass ich kurz davor war bei Galapagos zuzuschlagen zu dem Zeitpunkt als sie den die mit Morphosys machten (da waren sie um ein paar EUR herum) und sehe wo sie jetzt sind, könnt ich mich im Nachhinein ärgern. Ich weiß nicht mehr was mich damals davon abhielt, aber dann habe ich sie aus den Augen verloren..
Wenn ich auch meinen Senf zu Oncosec geben darf: die Daten sind natürlich hervorragend und wahrscheinlich wird man da noch mit Geld machen können. Nur für einen breiten Einsatz halte ich die Technologie nicht für einsetzbar. Erst wird DNA-based interleukin-12 in den Tumor injiziert (da muss man ja jeden Tumor und jede Metastase erwischen) und dann mit dem "Applikator" nochmal in den Tumor rein um elektrische Impulse zu erzeugen. Das klingt für mich nicht besonders breit anwendbar und im Endeffekt auch nicht wirtschaftlich. Ich kann mich täuschen, aber das wäre der erste Eindruck von mir. Ich bin eher auf der Suche nach systemisch verabreichbaren Off-the-shelf Produkten, die nach Möglichkeit universell anwendbar sind. Bedeutet hohes Marktpotential.
Gestern gab es das Analyst & Investor Event at SITC 2017 Annual Meeting: http://edge.media-server.com/m/p/7m4fj965
Die präklinischen Daten zum bispezifischen AK, der zugleich PD-1 und ICOS(=CD278?) adressiert sehen ja nicht schlecht aus (ab ca. Minute 22:xx) .
Ich frage mich, ob es da jemand in der Klinik gibt, der dieses Target bereits adressiert?
Die präklinischen Daten zum bispezifischen AK, der zugleich PD-1 und ICOS(=CD278?) adressiert sehen ja nicht schlecht aus (ab ca. Minute 22:xx) .
Ich frage mich, ob es da jemand in der Klinik gibt, der dieses Target bereits adressiert?
Antwort auf Beitrag Nr.: 56.164.353 von Ville7 am 12.11.17 15:10:01hi Ville
nice to hear from you
Ja, bei Galapagos muss ich mich auch ärgern. War auch knapp dran zu kaufen. Nochmehr ärgert mich allerdings dass ich Regeneron bei 2 Mrd. USD nicht gekauft habe, weil sie mir zu teuer schienen (kein MOR-Partner aber dazumals als Konkurrenzfirma etwas angesehen).
(kein MOR-Partner aber dazumals als Konkurrenzfirma etwas angesehen).
Zwecks Oncosec, da hast du sicher recht mit der nicht einfachen Applikation von Tavo. Allerdings würde es ja angesichts der mikrigen Market Cap schon zu einem Vervielfacher führen, wenn man "nur" mit der PISCES-Studienindikation durchstartet.
nice to hear from you

Ja, bei Galapagos muss ich mich auch ärgern. War auch knapp dran zu kaufen. Nochmehr ärgert mich allerdings dass ich Regeneron bei 2 Mrd. USD nicht gekauft habe, weil sie mir zu teuer schienen
 (kein MOR-Partner aber dazumals als Konkurrenzfirma etwas angesehen).
(kein MOR-Partner aber dazumals als Konkurrenzfirma etwas angesehen).Zwecks Oncosec, da hast du sicher recht mit der nicht einfachen Applikation von Tavo. Allerdings würde es ja angesichts der mikrigen Market Cap schon zu einem Vervielfacher führen, wenn man "nur" mit der PISCES-Studienindikation durchstartet.
Antwort auf Beitrag Nr.: 56.164.842 von PathFinder2 am 12.11.17 17:35:00(sorry für off topic Joschka!)
Antwort auf Beitrag Nr.: 56.164.371 von Ville7 am 12.11.17 15:14:36also bei XNCR tut sich ja wirklich einiges. hab vor ein paar tagen wieder nachgekauft.
der PD1-ICOS bispecific klingt gut. natürlich noch ziemlich early, aber spannend allemal.
das baukastenprinzip von XNCR gefällt mir gut. wenn's läuft dann läufts.... war für mich dazumals einer der beewebum zu investieren.
bin mal gespannt ob sie für den subq. xmab7195 (asthma) einen entwicklungspartner finden. weitere studien werden sie ja nicht eigentständig machen lt. aussage, was ich auch gut finde in so einer indikation.
=====
was weitere bispecific etc. bastler angeht, habt ihr meinungen zu (willkürlich durcheinander und unterschiedlich vom entwicklungsstand und market cap....):
- AFMD (DE)
- PIRS (DE)
- ZYME
- MGNX
- CTMX
der PD1-ICOS bispecific klingt gut. natürlich noch ziemlich early, aber spannend allemal.
das baukastenprinzip von XNCR gefällt mir gut. wenn's läuft dann läufts.... war für mich dazumals einer der beewebum zu investieren.
bin mal gespannt ob sie für den subq. xmab7195 (asthma) einen entwicklungspartner finden. weitere studien werden sie ja nicht eigentständig machen lt. aussage, was ich auch gut finde in so einer indikation.
=====
was weitere bispecific etc. bastler angeht, habt ihr meinungen zu (willkürlich durcheinander und unterschiedlich vom entwicklungsstand und market cap....):
- AFMD (DE)
- PIRS (DE)
- ZYME
- MGNX
- CTMX
Joschka, Ville u.a., glaubt ihr im allgemeinen an die überlegenheit von bispecifics gegenüber konventionellen mabs? (vor allem im krebsbereich...)
ich denke dass etlichen dieser spannenden entwicklungen die safety zum verhängnis werden wird. aber allgemein sollten bispecific-ansätze überlegen sein.
wie sie sich gegenüber CARTs positionieren werden?
was ist eure meinung?
ich denke dass etlichen dieser spannenden entwicklungen die safety zum verhängnis werden wird. aber allgemein sollten bispecific-ansätze überlegen sein.
wie sie sich gegenüber CARTs positionieren werden?
was ist eure meinung?
Antwort auf Beitrag Nr.: 56.220.059 von PathFinder2 am 19.11.17 18:15:19Hallo Pathfinder,
ich versuche nur eine ganz kurze Antwort darauf zu geben. Ja, ich glaube an die überlegene Wirksamkeit von ADC oder bispezifischen Antikörpern gegenüber konventionellen Ansätzen in der Krebstherapie.
Allerdings geht überlegene Wirksamkeit stark korrelierend mit unterlegener Verträglichkeit daher, da die erhöhte Wirksamkeit auch an gesundem Gewebe seine Wirkung entfaltet und dadurch die unerwünschte Toxizität auslöst. Ein Niedrigstdosierung eines bispezifischen AKs wäre dann ein Nullsummenspiel.
Daher wird in Zukunft in diesem Feld nur der Biotechinvestor erfolgreich sein, der es schafft Firmen zu identifizieren, die es erreichen die erhöhte Wirksamkeit und die dadurch mangelnde Verträglichkeit dahingehend zu trennen, dass sie das therapeutische Fenster erhöhen. Bei bispezifischen Antikörpern und soliden Tumoren zudem eine m.E. Grundvorraussetzung um diese dort einsetzen zu können.
Aus diesem Gesichtspunkt erhoffe ich mir von CTMX einen PoC und damit einen Durchbruch durch deren Maskierungstechnologie. XNCR erhofft sich durch die Kombination zweier Targets, die nur im Tumor erhöht exprimiert sind, einen Vorteil. Ich denke diese Stragegie wird auch ABLX mit seinen (ich nenne es mal) multi-spezifischen Nanobody-AKs fahren.
Kannst du mir bei den anderen von dir genannten Firmen sagen, ob sie in ihrer Technologie oder ihren Produktkandidaten explizit Strategien zur Erweiterung des therapeutischen Fensters haben? Wenn ja, dann würde ich mir diese gerne näher anschauen.
Viele Grüße
Ville
ich versuche nur eine ganz kurze Antwort darauf zu geben. Ja, ich glaube an die überlegene Wirksamkeit von ADC oder bispezifischen Antikörpern gegenüber konventionellen Ansätzen in der Krebstherapie.
Allerdings geht überlegene Wirksamkeit stark korrelierend mit unterlegener Verträglichkeit daher, da die erhöhte Wirksamkeit auch an gesundem Gewebe seine Wirkung entfaltet und dadurch die unerwünschte Toxizität auslöst. Ein Niedrigstdosierung eines bispezifischen AKs wäre dann ein Nullsummenspiel.
Daher wird in Zukunft in diesem Feld nur der Biotechinvestor erfolgreich sein, der es schafft Firmen zu identifizieren, die es erreichen die erhöhte Wirksamkeit und die dadurch mangelnde Verträglichkeit dahingehend zu trennen, dass sie das therapeutische Fenster erhöhen. Bei bispezifischen Antikörpern und soliden Tumoren zudem eine m.E. Grundvorraussetzung um diese dort einsetzen zu können.
Aus diesem Gesichtspunkt erhoffe ich mir von CTMX einen PoC und damit einen Durchbruch durch deren Maskierungstechnologie. XNCR erhofft sich durch die Kombination zweier Targets, die nur im Tumor erhöht exprimiert sind, einen Vorteil. Ich denke diese Stragegie wird auch ABLX mit seinen (ich nenne es mal) multi-spezifischen Nanobody-AKs fahren.
Kannst du mir bei den anderen von dir genannten Firmen sagen, ob sie in ihrer Technologie oder ihren Produktkandidaten explizit Strategien zur Erweiterung des therapeutischen Fensters haben? Wenn ja, dann würde ich mir diese gerne näher anschauen.
Viele Grüße
Ville
Wir hatten neulich (im MOR-Thread?) überlegt, wie sich wohl die (in Summe) 187 Mio. USD-Meilensteinzahlung zusammensetzt, die Xencor im Fall einer MOR208-Zulassung von Morphosys erhalten wird.
Aufgrund bisheriger Erfahrungen bin ich eigentlich davon ausgegangen, dass die Zahlung aus drei Anteilen (Zulassung USA, Zulassung Europa, Zulassung JPN bzw. RoW) bestehen und indikationsunabhängig erfolgen wird.
Heute hatte ich nun in anderem Kontext eine Vereinbarung auf dem Schreibtisch, bei der die Zahlung bei Zulassung ziemlich irre geregelt war: Neben den üblichen Regelungen für Ländergruppen (s.o.) gab es noch diverse Zahlungsverpflichtungen für den Fall einer Zulassung in vorab definierten Zusatzindikationen, die jedoch auf bestimmte Regionen beschränkt waren. Ich habe nur noch gestaunt.
Lange Rede, kurzer Sinn: So lange die Details des Lizensierungsvertrags für MOR208 nicht bekannt sind, muss man wohl mit allem Möglichen rechnen. Fest steht nur, dass die Meilensteinzahlungen bei Zulassung in toto maximal 187 Mio. USD betragen.
Aufgrund bisheriger Erfahrungen bin ich eigentlich davon ausgegangen, dass die Zahlung aus drei Anteilen (Zulassung USA, Zulassung Europa, Zulassung JPN bzw. RoW) bestehen und indikationsunabhängig erfolgen wird.
Heute hatte ich nun in anderem Kontext eine Vereinbarung auf dem Schreibtisch, bei der die Zahlung bei Zulassung ziemlich irre geregelt war: Neben den üblichen Regelungen für Ländergruppen (s.o.) gab es noch diverse Zahlungsverpflichtungen für den Fall einer Zulassung in vorab definierten Zusatzindikationen, die jedoch auf bestimmte Regionen beschränkt waren. Ich habe nur noch gestaunt.
Lange Rede, kurzer Sinn: So lange die Details des Lizensierungsvertrags für MOR208 nicht bekannt sind, muss man wohl mit allem Möglichen rechnen. Fest steht nur, dass die Meilensteinzahlungen bei Zulassung in toto maximal 187 Mio. USD betragen.
Antwort auf Beitrag Nr.: 56.225.333 von Ville7 am 20.11.17 13:22:34Hi Ville!
ich kenne die erwähnten Firmen teilweise nur sehr oberflächlich, und du weißt dass meine molekularbiologischen Kenntnisse recht beschränkt sind.... Trotzdem ein paar kurze Kommentare zu den beiden deutschen Firmen:
PIRS
Grundidee der Firma: Die Vorteile von Anticalins(R) wie Inhalierbarkeit, Größe (1/8 von normalen mabs), flexible Formatierung etc. nutzen, um bessere Biologics für bewährte Targets zu nutzen.
Leadprogram in ImmunoOnc ist PRS-343, das vor kurzem in die Klinik gekommen ist. Dieses Konstrukt aus mab+anticalin (fusioniert) dockt einerseits an HER2-exprimierenden Tumoren an, und führt in der Theorie nur dort über 4-1BB Clustering zur lokalen T-Zell-Aktivierung. Sollte also lt. Theorie effektiver und sicherer sein als reine 4-1BB mabs. Siehe Video: https://vimeo.com/214891684
Leadprogramm im Bereich Respiratory ist PRS-060 in Asthma (mit AZ verpartnert!), das die nächsten Tagen in Klinik geht (12,5 mio. Meilenstein wird fällig). Selbes Target wie Dupilumab (IL4r mab von Regeneron/Sanofi), aber im Gegensatz zu Dupilumab inhalierbar -> lokale Applikation in der Lunge dort wo es gebraucht wird, leichtere Anwendung, Kostenvorteil.
Mir gefallen u.a. Management (CEO Yoder kommt von MorphoSys, wo er Chef für IP u legal affairs war / auch einige weitere Leute von MOR sind an Board) und Verpartnerungsstärke (2017 durch die Kooperationen mit Servier und AZ knapp 100 Mio. Upfronts; ca 4,5 Mrd theoretisches Biobuck-Milestonespotenzial) - market cap aktuell knapp 250 Mio EUR., also nicht mehr ganz sooo billig für das doch noch frühe Stadium, aber wenn AntiCalins halten was sie versprechen, dann gibt es hier einiges Potenzial.
AFMD
Sind auf ImmunoOnc spezialisert, und sehen sich selber als führender im NK-cell-engager Bereich, d.h. bispecifics mit CD16A als an NK-Zellen bindendes Ende + CD30 (lead-program) oder BCMA oder EGFRwt am anderen Ende.
Sie machen auf bispecifis im T-Zell Bereich, sprich CD3 am einen Ende und CD19 bzw. andere am anderen Ende. Was ich mitbekommen habe ist aber ihr Fokus auf NK-Zellen (bessere Sicherheit).
Auch Trispecifics sind möglich, was immer es bringens mag..
Eher schlecht finanziert, und Management ist bei Investoren sehr unbeliebt (relativ schlechte Kapitalmarktansprache, Termine für readouts werden versprochen aber nicht gehalten....). Market cap daher recht gering mit rund 85 Mio. EUR aktuell.
ich kenne die erwähnten Firmen teilweise nur sehr oberflächlich, und du weißt dass meine molekularbiologischen Kenntnisse recht beschränkt sind.... Trotzdem ein paar kurze Kommentare zu den beiden deutschen Firmen:
PIRS
Grundidee der Firma: Die Vorteile von Anticalins(R) wie Inhalierbarkeit, Größe (1/8 von normalen mabs), flexible Formatierung etc. nutzen, um bessere Biologics für bewährte Targets zu nutzen.
Leadprogram in ImmunoOnc ist PRS-343, das vor kurzem in die Klinik gekommen ist. Dieses Konstrukt aus mab+anticalin (fusioniert) dockt einerseits an HER2-exprimierenden Tumoren an, und führt in der Theorie nur dort über 4-1BB Clustering zur lokalen T-Zell-Aktivierung. Sollte also lt. Theorie effektiver und sicherer sein als reine 4-1BB mabs. Siehe Video: https://vimeo.com/214891684
Leadprogramm im Bereich Respiratory ist PRS-060 in Asthma (mit AZ verpartnert!), das die nächsten Tagen in Klinik geht (12,5 mio. Meilenstein wird fällig). Selbes Target wie Dupilumab (IL4r mab von Regeneron/Sanofi), aber im Gegensatz zu Dupilumab inhalierbar -> lokale Applikation in der Lunge dort wo es gebraucht wird, leichtere Anwendung, Kostenvorteil.
Mir gefallen u.a. Management (CEO Yoder kommt von MorphoSys, wo er Chef für IP u legal affairs war / auch einige weitere Leute von MOR sind an Board) und Verpartnerungsstärke (2017 durch die Kooperationen mit Servier und AZ knapp 100 Mio. Upfronts; ca 4,5 Mrd theoretisches Biobuck-Milestonespotenzial) - market cap aktuell knapp 250 Mio EUR., also nicht mehr ganz sooo billig für das doch noch frühe Stadium, aber wenn AntiCalins halten was sie versprechen, dann gibt es hier einiges Potenzial.
AFMD
Sind auf ImmunoOnc spezialisert, und sehen sich selber als führender im NK-cell-engager Bereich, d.h. bispecifics mit CD16A als an NK-Zellen bindendes Ende + CD30 (lead-program) oder BCMA oder EGFRwt am anderen Ende.
Sie machen auf bispecifis im T-Zell Bereich, sprich CD3 am einen Ende und CD19 bzw. andere am anderen Ende. Was ich mitbekommen habe ist aber ihr Fokus auf NK-Zellen (bessere Sicherheit).
Auch Trispecifics sind möglich, was immer es bringens mag..
Eher schlecht finanziert, und Management ist bei Investoren sehr unbeliebt (relativ schlechte Kapitalmarktansprache, Termine für readouts werden versprochen aber nicht gehalten....). Market cap daher recht gering mit rund 85 Mio. EUR aktuell.
Antwort auf Beitrag Nr.: 56.251.433 von PathFinder2 am 22.11.17 22:25:17Zu Affimed: Das Thema "innate immunity" kommt aktuell in Mode, sogar CytomX konzentriert sich bei seiner CAR-Kooperation mit MD Anderson auf natürliche Killerzellen. Brauchbare Ergebnisse und insbesondere ein Wirksamkeitsnachweis für Affimeds bispezifischen anti-CD30xCD26A-TandAb AFM13 stehen aber noch aus! Ich warte gespannt auf die Präsentation beim ASH-Meeting. Aktuell wird das Unternehmen mit 56 Mio. USD bewertet (93 Mio. Marktkapitalisierung abzgl. 37 mio. NetCash).
Der Xencor-Kurs gibt heute unter hohen Umsätzen deutlich nach, aktuell um 9 % auf 19,85 USD. Einen Grund für den Kursverfall habe ich nicht finden können und daher die Gelegenheit genutzt, meinen Xencor-Bestand deutlich aufzustocken. Keine Ahnung, wer da mit welcher Motivation verkauft.
Antwort auf Beitrag Nr.: 56.251.433 von PathFinder2 am 22.11.17 22:25:17nochmal zu PIRS (lese gerade letztes 10Q)
wenn man das mit MOR vergleicht ist das schon hammer
z.B ein Deal mit Roche, wo PIRS einen anticalin auf ein Roche-target generieren soll (weitere entwicklung dann durch Roche)
"In addition to the upfront payment (ergänzung: 6,5 Mio. USD), related to the Roche Agreement, the Company is eligible to receive research, development, and sales
milestone payments up to approximately $413.5 million, plus royalties on future sales of any commercial products. The total potential
milestones are categorized as follows: research and development milestones—$290.4 million; and sales milestones of $123.1 million"
das ist ein vielfaches verglichen mir MOR-mabs... (aber ok hier geht es nur um 1 programm gesamt zur Zeit)
wenn man das mit MOR vergleicht ist das schon hammer
z.B ein Deal mit Roche, wo PIRS einen anticalin auf ein Roche-target generieren soll (weitere entwicklung dann durch Roche)
"In addition to the upfront payment (ergänzung: 6,5 Mio. USD), related to the Roche Agreement, the Company is eligible to receive research, development, and sales
milestone payments up to approximately $413.5 million, plus royalties on future sales of any commercial products. The total potential
milestones are categorized as follows: research and development milestones—$290.4 million; and sales milestones of $123.1 million"
das ist ein vielfaches verglichen mir MOR-mabs... (aber ok hier geht es nur um 1 programm gesamt zur Zeit)
Antwort auf Beitrag Nr.: 56.274.794 von PathFinder2 am 25.11.17 19:28:09(ergänzung: höhe der royalties nicht bekannt, könnte natürlich auch unter den ca. 5% von MOR liegen. nevertheless hut ab bei solchen konditionen)
Antwort auf Beitrag Nr.: 56.274.815 von PathFinder2 am 25.11.17 19:35:05wie du selbst schon schreibst: ohne die hoehe der royalties zu kennen ist ein vergleich nicht moeglich. die aelteren deals von morphosys sind/waren sehr backloaded. Dagegen koennte der PIRS deal einfach nur extrem frontloaded sein und die royalties hoehe dann gering...
Antwort auf Beitrag Nr.: 56.251.748 von Joschka Schröder am 22.11.17 23:10:52ist zwar offtopic, aber ich finde zu ash 17 keinen abstract zu AFM13. Haettest du mir evtl. einen link?
Antwort auf Beitrag Nr.: 56.251.433 von PathFinder2 am 22.11.17 22:25:17PIRS werde ich mir bei Gelegenheit mal anschaun...danke fuer die anregungen
Antwort auf Beitrag Nr.: 56.276.084 von Ville7 am 26.11.17 09:04:19weiterhin OT: den Abstract zu AFM13 habe ich gefunden.
https://ash.confex.com/ash/2017/webprogram/Paper107455.html" target="_blank" rel="nofollow ugc noopener">
https://ash.confex.com/ash/2017/webprogram/Paper107455.html
Das größte Problem bei AFM13, m.E. ein sehr guter Ansatz, ist die sehr geringe Halbwertszeit. Weekly dosing ist da einfach zu wenig häufig. Deswegen ja auch die P2.
Zum Vergleich mit Xencor um wieder Ontopic zu werden:
Halbwertszeiten AFM13: 13-19 Stunden!
Halbwertszeiten der bispezifischen Antikörper: 6,2 Tage; 6,7 Tage und 7,6 Tage für ausgewählte bispezifische AKs (siehe letzte Präsentation).
Das bedeutet eine ca. 10mal längere Halbwertszeit als die des Affimed TandAbs.
https://ash.confex.com/ash/2017/webprogram/Paper107455.html" target="_blank" rel="nofollow ugc noopener">
https://ash.confex.com/ash/2017/webprogram/Paper107455.html
Das größte Problem bei AFM13, m.E. ein sehr guter Ansatz, ist die sehr geringe Halbwertszeit. Weekly dosing ist da einfach zu wenig häufig. Deswegen ja auch die P2.
Zum Vergleich mit Xencor um wieder Ontopic zu werden:
Halbwertszeiten AFM13: 13-19 Stunden!
Halbwertszeiten der bispezifischen Antikörper: 6,2 Tage; 6,7 Tage und 7,6 Tage für ausgewählte bispezifische AKs (siehe letzte Präsentation).
Das bedeutet eine ca. 10mal längere Halbwertszeit als die des Affimed TandAbs.
Antwort auf Beitrag Nr.: 56.276.504 von Ville7 am 26.11.17 10:35:59"Halbwertszeiten der bispezifischen Antikörper" sollte heißen "Halbwertszeiten der bispezifischen Antikörper bei XENCOR"
Der Vergleich war also zu XNCR.
Der Vergleich war also zu XNCR.
Vergleich Halbwertszeiten bispezifischer mabs:
Blinatumomab: 2 Stunden
AFM13: 13-19 Stunden
Xencor: 6-8 Tage
@Joschka: Hast du Zahlen bzw. Aussagen für die bispezischen AKs von ABLX? Wie werden sich die Halbwertszeiten dort darstellen? Ich vermute ebenfalls recht kurz..
Blinatumomab: 2 Stunden
AFM13: 13-19 Stunden
Xencor: 6-8 Tage
@Joschka: Hast du Zahlen bzw. Aussagen für die bispezischen AKs von ABLX? Wie werden sich die Halbwertszeiten dort darstellen? Ich vermute ebenfalls recht kurz..
@pathfinder: Bei PIRS habe ich noch nicht verstanden,
1. was der Vorteil der Verwendung von Anticalinen gegenüber fAb Fragmenten, wie sie z.B. Ablynx benutzt, ist
2. was der Vorteil der Verwendung von pegylierten Anticalinen (für eine mAb-like Halbwertszeit) gegenüber konventionellen Antikörpern ist
Kannst du mir mit deinem tieferen Wissen einen Einblick geben?
1. was der Vorteil der Verwendung von Anticalinen gegenüber fAb Fragmenten, wie sie z.B. Ablynx benutzt, ist
2. was der Vorteil der Verwendung von pegylierten Anticalinen (für eine mAb-like Halbwertszeit) gegenüber konventionellen Antikörpern ist
Kannst du mir mit deinem tieferen Wissen einen Einblick geben?
Antwort auf Beitrag Nr.: 56.276.078 von Ville7 am 26.11.17 09:01:55hi nochmal ville, die royalties bei diesem Roche single target deal aus 2015 sind doch bekannt (aus 10K):
"as well as mid-single-digit to low double-digit royalties on any future product sales"
"as well as mid-single-digit to low double-digit royalties on any future product sales"
Antwort auf Beitrag Nr.: 56.276.741 von Ville7 am 26.11.17 11:22:44hi Ville,
ich erlaube mir das hier aus dem letzten 10K herauszukopieren; Hervorhebungen durch mich
===============
While often compared to monoclonal antibodies, Anticalin proteins, we believe, offer several advantages over antibodies, including:
•
Small size and biophysical stability
. Anticalin proteins are small in size and are monomeric. Therefore, we believe Anticalins are
generally more stable biophysically than tetrameric monoclonal antibodies, which will potentially enable unique routes of
administration to target diseases, such as pulmonary delivery. Higher-molecular-weight entities such as antibodies are often too
large to be delivered effectively through these methods. We believe Anticalin proteins will also be less expensive to manufacture
than antibodies due to their lower molecular weight and less bulky structure as well as the ability to use the prokaryotic-based
manufacturing systems, a less costly manufacturing system than mammalian cell-based manufacturing systems, to create them.
•
Optimization of half-life
. Anticalin proteins can be engineered to have a half-life that is optimal for the indication area and a
desired dosing schedule. Antibodies typically have half-lives of two weeks or longer, whereas Anticalin proteins can be
engineered to have half-lives from hours to weeks, depending on the half-life extension technology employed, if any. This
optionality allows us to exert greater control over the amount of circulating Anticalin protein in the blood and the amount of time
such Anticalin proteins circulate in the blood, depending on the underlying biology we are trying to address.
•
Modular platform for higher-order multispecificity and avoidance of cross-linking
. Our Anticalin technology is modular, allowing
for monovalent or multivalent target engagement, including multispecificity within a single protein. We believe that a monovalent
“backbone” is an advantage in situations where pure antagonism of certain cellular receptors is desired. The dual-binding nature
of monoclonal antibodies, which have two “arms,” can be a disadvantage in cases when the antibodies bind to and cross-link cell-
surface receptors. Such cross-linking often leads to undesirable activation of the cells bearing those receptors. Single-action
(monovalent) Anticalin proteins have only a single binding site and are thus not subject to cross-linking. Further, when it is called
for by the biology we are addressing, we can create multispecific Anticalin proteins that can simultaneously bind (i) two or more
different targets or (ii) different epitopes, the specific piece of an antigen to which an antibody binds, on the same target by
genetically linking Anticalin proteins with distinct specificities on a common cDNA strand. We believe this multispecificity offers
advantages in biological settings where binding to multiple targets can enhance the ability of a drug to achieve its desired effects,
such as killing cancer cells. Unique Anticalin proteins can be pieced together and undergo simultaneous target engagement as a
single fusion protein, without generally compromising on manufacturability.
=====
PRS-060 unf PRS-060 sind reine Anticalins (Vorteil daher zb eben bakterielle Produktionsmethoden bzw. Inhalierbarkeit bei 060)
Die anderen wie PRS-343 sind fusion proteins, im Fall von 343 zB Trastuzumab + CD137 Anticalin
ich erlaube mir das hier aus dem letzten 10K herauszukopieren; Hervorhebungen durch mich
===============
While often compared to monoclonal antibodies, Anticalin proteins, we believe, offer several advantages over antibodies, including:
•
Small size and biophysical stability
. Anticalin proteins are small in size and are monomeric. Therefore, we believe Anticalins are
generally more stable biophysically than tetrameric monoclonal antibodies, which will potentially enable unique routes of
administration to target diseases, such as pulmonary delivery. Higher-molecular-weight entities such as antibodies are often too
large to be delivered effectively through these methods. We believe Anticalin proteins will also be less expensive to manufacture
than antibodies due to their lower molecular weight and less bulky structure as well as the ability to use the prokaryotic-based
manufacturing systems, a less costly manufacturing system than mammalian cell-based manufacturing systems, to create them.
•
Optimization of half-life
. Anticalin proteins can be engineered to have a half-life that is optimal for the indication area and a
desired dosing schedule. Antibodies typically have half-lives of two weeks or longer, whereas Anticalin proteins can be
engineered to have half-lives from hours to weeks, depending on the half-life extension technology employed, if any. This
optionality allows us to exert greater control over the amount of circulating Anticalin protein in the blood and the amount of time
such Anticalin proteins circulate in the blood, depending on the underlying biology we are trying to address.
•
Modular platform for higher-order multispecificity and avoidance of cross-linking
. Our Anticalin technology is modular, allowing
for monovalent or multivalent target engagement, including multispecificity within a single protein. We believe that a monovalent
“backbone” is an advantage in situations where pure antagonism of certain cellular receptors is desired. The dual-binding nature
of monoclonal antibodies, which have two “arms,” can be a disadvantage in cases when the antibodies bind to and cross-link cell-
surface receptors. Such cross-linking often leads to undesirable activation of the cells bearing those receptors. Single-action
(monovalent) Anticalin proteins have only a single binding site and are thus not subject to cross-linking. Further, when it is called
for by the biology we are addressing, we can create multispecific Anticalin proteins that can simultaneously bind (i) two or more
different targets or (ii) different epitopes, the specific piece of an antigen to which an antibody binds, on the same target by
genetically linking Anticalin proteins with distinct specificities on a common cDNA strand. We believe this multispecificity offers
advantages in biological settings where binding to multiple targets can enhance the ability of a drug to achieve its desired effects,
such as killing cancer cells. Unique Anticalin proteins can be pieced together and undergo simultaneous target engagement as a
single fusion protein, without generally compromising on manufacturability.
=====
PRS-060 unf PRS-060 sind reine Anticalins (Vorteil daher zb eben bakterielle Produktionsmethoden bzw. Inhalierbarkeit bei 060)
Die anderen wie PRS-343 sind fusion proteins, im Fall von 343 zB Trastuzumab + CD137 Anticalin
Antwort auf Beitrag Nr.: 56.278.772 von PathFinder2 am 26.11.17 17:48:34noch eine Sache zu PIRS, wenn ich es richtig gelesen habe, dann laufen die allgemeinen Patente zu Anticalins an sich schon 2018 ab. Daneben gibt es natürlich eigene Patente für die einzelnen Produktkandidaten.
Antwort auf Beitrag Nr.: 56.278.772 von PathFinder2 am 26.11.17 17:48:34Hallo Pathfinder,
Genannte Vorteile zu "tetrameric monoclonal antibodies":
* "small in size" -> sind fab Fragmente oder Nanobodies auch
* "monomeric" -> sind fab Fragmente oder Nanobodies m.W. in dieser Definition auch
* "generally more stable biophysically" -> da mach ich ein fettes Fragezeichen ran, wenn man sich die Halbwertszeit eines reinen (nicht pegylierten) Anticalins anschaut
* "pulmonary delivery" -> kann man mit fab Fragmenten oder Nanobodies auch
* "prokaryotic-based manufacturing systems", "without generally compromising on manufacturability" -> hierzu kann ich nichts sagen, halte diesen Punkt auch nicht für so wichtig
* "engineered to have a half-life that is optimal", "half-lives from hours to weeks" -> Pegylierung ist nicht neu, das könnte man auch mit fab Fragmenten oder Nanobodies
* "monovalent or multivalent target engagement", "multispecificity", "Unique Anticalin proteins can be pieced together and undergo simultaneous target engagement as a
single fusion protein" -> bi-, tri- oder multispezifische mABs kann man mit fab Fragmenten oder Nanobodie auch
* "have only a single binding site and are thus not subject to cross-linking" -> sind fab Fragmente oder Nanobodies auch
Einen entscheidenden Vorteil, was nicht auch ein anderer mit fab Fragmenten oder Nanobodies erreichen kann, kann ich irgendwie nicht erkennnen. Sicherlich ein guter Ansatz, aber nicht einzigartig. Den entscheidenden, marktverdrängenden Vorteil von Anticalinen gegenüber fab Fragmenten oder Nanobodies kann ich hier leider nicht erkennnen.
@Joschka: Was ist deine Einschätzung hierzu?
Genannte Vorteile zu "tetrameric monoclonal antibodies":
* "small in size" -> sind fab Fragmente oder Nanobodies auch
* "monomeric" -> sind fab Fragmente oder Nanobodies m.W. in dieser Definition auch
* "generally more stable biophysically" -> da mach ich ein fettes Fragezeichen ran, wenn man sich die Halbwertszeit eines reinen (nicht pegylierten) Anticalins anschaut
* "pulmonary delivery" -> kann man mit fab Fragmenten oder Nanobodies auch
* "prokaryotic-based manufacturing systems", "without generally compromising on manufacturability" -> hierzu kann ich nichts sagen, halte diesen Punkt auch nicht für so wichtig
* "engineered to have a half-life that is optimal", "half-lives from hours to weeks" -> Pegylierung ist nicht neu, das könnte man auch mit fab Fragmenten oder Nanobodies
* "monovalent or multivalent target engagement", "multispecificity", "Unique Anticalin proteins can be pieced together and undergo simultaneous target engagement as a
single fusion protein" -> bi-, tri- oder multispezifische mABs kann man mit fab Fragmenten oder Nanobodie auch
* "have only a single binding site and are thus not subject to cross-linking" -> sind fab Fragmente oder Nanobodies auch
Einen entscheidenden Vorteil, was nicht auch ein anderer mit fab Fragmenten oder Nanobodies erreichen kann, kann ich irgendwie nicht erkennnen. Sicherlich ein guter Ansatz, aber nicht einzigartig. Den entscheidenden, marktverdrängenden Vorteil von Anticalinen gegenüber fab Fragmenten oder Nanobodies kann ich hier leider nicht erkennnen.
@Joschka: Was ist deine Einschätzung hierzu?
Antwort auf Beitrag Nr.: 56.281.049 von Ville7 am 27.11.17 07:03:36Hi Ville
Ich denke von Verdrängung kann keinesfalls die Rede sein. Als interessante scaffolds könnten sich Anticalins aber durchaus erweisen, wobei die gezeigten Vorteile erst in den klinischen Studien bewiesen werden müssen (teilweise schon geschehen, zB macht PRS080 was er soll und ist gut verträglich
)
Was denkst du Joschka?
Ich denke von Verdrängung kann keinesfalls die Rede sein. Als interessante scaffolds könnten sich Anticalins aber durchaus erweisen, wobei die gezeigten Vorteile erst in den klinischen Studien bewiesen werden müssen (teilweise schon geschehen, zB macht PRS080 was er soll und ist gut verträglich
)
Was denkst du Joschka?
Zum Thema "innate immune system" ...
... habe ich hier eine etwas befremdliche Firma gefunden, die eine "cure" für Cancer finden möchte. Angeblich haben sie in "Supermäusen" Granulozyten gefunden, die diese Mäuse immun gegen Krebs machen und auch auf andere Mäuse übertragen werden konnten und diese dort den implantierten Krebs vollkommen geheilt haben. Nun wollen sie quasi nach "Supermenschen" suchen, die so ein verändertes Immunsystem haben, das per deren künstlich vermehrten Granulozyten übertragen auf andere Menschen bestimmte Krebsarten heilen kann. Und wollen nun Menschen danach screenen.https://www.liftbiosciences.com/
Video: https://www.liftbiosciences.com/about
Seltsam das alles: Die Firma versucht sich gerade über eine Crowd Funding platform mind. 205.000 Pfund zu leihen und will bis 2021 eine Cure gegen Pankreaskrebs gefunden haben. Eigentlich ein lächerlich geringer Mindestfundingbetrag für so ein Vorhaben.
Das ganze kommt mir recht komisch vor und die Firma stellt außer ein paar reißerische Artikel und Projektionen, einem Video und ein paar Artikeln in Online-Zeitungen keine bis kaum Informationen bereit.
Andererseits sollte man alle Entwicklungen immer im Auge behalten, denn sofern es jemand schafft Wege zur Heilung zu finden ist in kurzer Zeit mit anderen Behandlungsmethoden keinen Cent mehr zu machen und eine eigene Übergewichtung in Onkologie kann ein grober Fehler sein. Auch wenn man sich das heute nicht vorstellen kann, sollte man niemals nie sagen.
@Joschka, was ist deine Meinung zu diesem Ansatz?
Heute wieder ungewöhnlich hohe Volumina und Verkaufsdruck obwohl keine negativen News vorliegen.
Über die Ursachen kann man nur spekulieren.
Über die Ursachen kann man nur spekulieren.
@Ville und Pathfinder: Ich muss mir das noch in Ruhe durchlesen.
Von LIfT BioSciences hatte ich bislang noch nie etwas gehört.
Von LIfT BioSciences hatte ich bislang noch nie etwas gehört.
Antwort auf Beitrag Nr.: 56.304.005 von biopadawan am 28.11.17 22:06:36Tatsache ist, dass es aktuell bei kaum einem anderen Biotech-Unternehmen in dieser Regelmäßigkeit und in solchem Umfang Insiderkäufe gibt. Allein im Zeitraum ab dem 25.10.2017 hat John Stafford über die Börse 285.006 Xencor-Aktien erworben. Vorhin lief wieder eine entsprechende Meldung über den Ticker.
Antwort auf Beitrag Nr.: 56.304.005 von biopadawan am 28.11.17 22:06:36Die 20$ Marke hat schon öfters gehalten ich werde wohl wieder einsteigen hier.

Ich finde es toll, daß ihr auch auf $PIRS und $AFMD aufmerksam geworden seid.
Die beiden habe ich schon länger Depot.
Ich finde es toll, daß ihr auch auf $PIRS und $AFMD aufmerksam geworden seid.
Die beiden habe ich schon länger Depot.
Offtopic
Da ich ja nicht viel fachliches hier Beitragen kann.
Hier eine Aktie die ich auch im Depot habe und interessant finde evt.
auch für den ein oder anderen http://www.miragen.com/.
Da ich ja nicht viel fachliches hier Beitragen kann.
Hier eine Aktie die ich auch im Depot habe und interessant finde evt.
auch für den ein oder anderen http://www.miragen.com/.
betrifft Amphivenia - somit auch AFMD
http://www.businesswire.com/news/home/20171129005628/en/Amph…
http://www.businesswire.com/news/home/20171129005628/en/Amph…
Antwort auf Beitrag Nr.: 56.315.816 von PathFinder2 am 29.11.17 19:41:23speziell das klingt gut
"Given the unique safety and efficacy profile that is emerging in the clinic"
"Given the unique safety and efficacy profile that is emerging in the clinic"
Antwort auf Beitrag Nr.: 56.315.816 von PathFinder2 am 29.11.17 19:41:23Bei den bispezifischen Mabs, die NK binden, habe ich die Befürchtung, dass die Wirksamkeit unbefriedigend sein könnte.
AMV564 halte ich für das spannendeste Produkt in der erweiterten Affimed-Pipeline (Affimed ist ja zu 18,5 % an Amphivena beteiligt), wobei man sich allerdings vor Augen führen muss, dass bislang die meisten Ansätze, die CD33 adressieren, als mehr oder weniger gescheitert betrachtet werden müssen (zuletzt SGN-CD33A). Ein unmittelbarer Konkurrent ist AMG330, ein bispezif. anti-CD33xCD3-mab (BitE) von Amgen, aktuell ebenfalls in Phase 1.
AMV564 halte ich für das spannendeste Produkt in der erweiterten Affimed-Pipeline (Affimed ist ja zu 18,5 % an Amphivena beteiligt), wobei man sich allerdings vor Augen führen muss, dass bislang die meisten Ansätze, die CD33 adressieren, als mehr oder weniger gescheitert betrachtet werden müssen (zuletzt SGN-CD33A). Ein unmittelbarer Konkurrent ist AMG330, ein bispezif. anti-CD33xCD3-mab (BitE) von Amgen, aktuell ebenfalls in Phase 1.
Um endlich mal wieder zum eigentlichen Thema des Threads zurückzukommen: Heute Erstanalyse zu Xencor, herausgegeben von Cantor Fitzgerald mit Kursziel 33 USD.
Antwort auf Beitrag Nr.: 56.304.566 von Joschka Schröder am 28.11.17 22:56:22
Ich habe mir zwischenzeitlich mal einige Publikationen zu LIfT BioSciences und von Zhen Cui angesehen. Insgesamt ist das aus meiner Sicht zu dürftig, um sich ein Urteil bilden zu können. Entsprechende Patente habe ich auch nicht gefunden, wobei meine Suche zugegebenermaßen nicht besonders gründlich war. Ich würde mich mit dem Thema wohl nur dann weiter befassen, wenn die Erfinder ein stringentes pathophysiologisches Konzept präsentieren würden/könnten, das mit experimentellen Daten unterfüttert ist. So scheint das alles viel zu vage und schwammig.
Zitat von Joschka Schröder: @Ville und Pathfinder: Ich muss mir das noch in Ruhe durchlesen.
Von LIfT BioSciences hatte ich bislang noch nie etwas gehört.
Ich habe mir zwischenzeitlich mal einige Publikationen zu LIfT BioSciences und von Zhen Cui angesehen. Insgesamt ist das aus meiner Sicht zu dürftig, um sich ein Urteil bilden zu können. Entsprechende Patente habe ich auch nicht gefunden, wobei meine Suche zugegebenermaßen nicht besonders gründlich war. Ich würde mich mit dem Thema wohl nur dann weiter befassen, wenn die Erfinder ein stringentes pathophysiologisches Konzept präsentieren würden/könnten, das mit experimentellen Daten unterfüttert ist. So scheint das alles viel zu vage und schwammig.
Argenx rockt ja auch ganz schön heute am Nasendax. Die sind mittlerweile mit beachtlichen 900 mio USD bewertet, also nicht weit weg von XNCR!
Joschka, was hältst du von diesem ARGX-113 programm in igG-related diseases?
ein Readout in Myastehnia Gravis sollte hier kurz bevorstehen.
Außerdem gibt es nächste Woche ein Update zu ARGX-110 (anti CD70) in AML
Angesichts des jungen Alters dieser Firma (Gründung 2008) haben es die Leute - etliche sind von Ablynx - schon ganz schön weit gebracht muss ich sagen.
Joschka, was hältst du von diesem ARGX-113 programm in igG-related diseases?
ein Readout in Myastehnia Gravis sollte hier kurz bevorstehen.
Außerdem gibt es nächste Woche ein Update zu ARGX-110 (anti CD70) in AML
Angesichts des jungen Alters dieser Firma (Gründung 2008) haben es die Leute - etliche sind von Ablynx - schon ganz schön weit gebracht muss ich sagen.
10 Mio. USD Meilensteinzahlung von Amgen - der bispezifische Antikörper AMG 424 (CD38xCD3) wird in Konkurrenz treten zu Daratumumab, MOR208 und isatuximab.
MONROVIA, Calif., Dec. 5, 2017 /PRNewswire/ -- Xencor, Inc. (NASDAQ: XNCR), a clinical-stage biopharmaceutical company developing engineered monoclonal antibodies for the treatment of autoimmune diseases, asthma and allergic diseases and cancer, today announced that the Company has earned a $10 million milestone payment from Amgen. The payment is triggered by the submission of the Investigational New Drug (IND) Application for AMG 424, a novel humanized T cell-recruiting bispecific antibody targeting CD38 and CD3, which uses Xencor's Bispecific XmAb® Technology.
Xencor, Inc. Logo
"XmAb antibody Fc domains continue to enable our partners to create a broad range of drug candidates, in addition to driving our internal programs," said Bassil Dahiyat, Ph.D., president and chief executive officer of Xencor. "Our XmAb Fc domains, each providing unique functional improvements to antibodies, open the door to new targets and new biology previously difficult to access. By selectively licensing our XmAb technology, we believe we create value in non-core areas, while we focus on advancing our key internal development programs."
Entered in September 2015, the agreement with Amgen licensed the use of XmAb Bispecific technology for five internal Amgen programs, as well as the Xencor preclinical bispecific T cell engager program directed at CD38 and CD3 for multiple myeloma.
MONROVIA, Calif., Dec. 5, 2017 /PRNewswire/ -- Xencor, Inc. (NASDAQ: XNCR), a clinical-stage biopharmaceutical company developing engineered monoclonal antibodies for the treatment of autoimmune diseases, asthma and allergic diseases and cancer, today announced that the Company has earned a $10 million milestone payment from Amgen. The payment is triggered by the submission of the Investigational New Drug (IND) Application for AMG 424, a novel humanized T cell-recruiting bispecific antibody targeting CD38 and CD3, which uses Xencor's Bispecific XmAb® Technology.
Xencor, Inc. Logo
"XmAb antibody Fc domains continue to enable our partners to create a broad range of drug candidates, in addition to driving our internal programs," said Bassil Dahiyat, Ph.D., president and chief executive officer of Xencor. "Our XmAb Fc domains, each providing unique functional improvements to antibodies, open the door to new targets and new biology previously difficult to access. By selectively licensing our XmAb technology, we believe we create value in non-core areas, while we focus on advancing our key internal development programs."
Entered in September 2015, the agreement with Amgen licensed the use of XmAb Bispecific technology for five internal Amgen programs, as well as the Xencor preclinical bispecific T cell engager program directed at CD38 and CD3 for multiple myeloma.
Antwort auf Beitrag Nr.: 56.368.273 von Joschka Schröder am 05.12.17 14:44:01Jep. Schöne Summe auch..
PS: du meintest bestimmt MOR202...
PS: du meintest bestimmt MOR202...
Antwort auf Beitrag Nr.: 56.368.759 von Ville7 am 05.12.17 17:18:28
Klar doch, Danke.
Zitat von Ville7: PS: du meintest bestimmt MOR202...
Klar doch, Danke.
Ich habe zwischenzeitlich im Vorfeld des ASH-Meetings meine Investition in Xencor weiter aufgestockt und wundere mich etwas, dass die Aktie nicht weiter anzieht.
Am 11.12.2017 wird Alexion, das im übrigen als Top-Übernahmekandidat gehandelt wird, Daten zum neuen Complemet C5-Inhibitor ALXN1210 präsentieren, der mit Hilfe von Xencors Fc-Technologie entwickelt worden ist und eine "Xtend Fc Domain" besitzt. -> https://ash.confex.com/ash/2017/webprogram/Paper100715.html
Gegenwärtig laufen verschiedene Phase 3-Studien mit ALXN1210. Das Präparat soll Soliris ablösen und 2019 auf den Markt kommen. Für 2018 ist parallel eine Zulassungsstudie in subcutaner Applikation geplant, wodurch die Behandlung weiter vereinfacht werden soll. Geplant ist zudem, ALXN1210 nicht nur in den Kernindikationen "paroxysmale nächtliche Hämoglobinurie" und "atypisches hämalotisch-urämisches Syndrom" anzuwenden, sondern auch in der Indikation "myasthenia gravis" zu testen. Im Fall einer Zulassung (2019) sollten die Jahrespitzenumsätze mehr als 3 Mrd. USD betragen.
Gestern sind im Übrigen Studienergebnisse (Phase II) eines anders konzipierten Konkurrenzpräparates der Firma RA Pharma veröffentlicht worden. Da besagtem Konkurrenzpräparat im Vergleich zu ALXN1210 keine Chancen eingeräumt werden (-> https://endpts.com/ra-pharma-puts-its-best-foot-forward-with…), ist der Börsenkurs der RA Pharma anschließend von 14,24 USD auf 7,97 USD (heutiger Schlusskurs) abgestürzt.
Im jüngsten Conference Call hieß es seitens Alexions Unternehmensführung zu ALXN1210 u.a. "... we are rapidly progressing the development of ALXN1210, our innovative, next generation C5 antibody that has the potential to address important patient needs" und "our ambition is to establish ALXN1210 as the new standard of care for patients with PNH and aHUS".
Dadurch, dass Alexion viele Patienten in die ALXN1210-Studien leitet, nimmt man gleichzeitig bei den Solaris-Umsätzen enorme finanzielle Einbußen in Kauf (knapp 100 Mio. USD allein im laufenden Geschäftsjahr).
Neben ALXN1210 (von dem die meisten Investoren noch nicht einmal wissen, dass das Präparat von Xencor entwickelt worden ist), könnte der ebenfalls von Xencor entwickelte und später von Morphosys einlizensierte Antikörper MOR208 demnächst als Kurstrigger dienen. Morphosys wird im Rahmen des bevorstehenden ASH-Meetings eigens eine Investorenkonferenz zu MOR208 durchführen (ebenfalls am 11.12.2017).
Die heutige Meilensteinzahlung für AMG 424 und dessen bevorstehender Klinikeintritt sind da nur nette Zugaben.
Ich habe es mit Stafford/Xencor gehalten und zuletzt stetig XNCR-Aktien zugekauft, so dass Xencor mittlerweile ein Kerninvestment ist.
Am 11.12.2017 wird Alexion, das im übrigen als Top-Übernahmekandidat gehandelt wird, Daten zum neuen Complemet C5-Inhibitor ALXN1210 präsentieren, der mit Hilfe von Xencors Fc-Technologie entwickelt worden ist und eine "Xtend Fc Domain" besitzt. -> https://ash.confex.com/ash/2017/webprogram/Paper100715.html
Gegenwärtig laufen verschiedene Phase 3-Studien mit ALXN1210. Das Präparat soll Soliris ablösen und 2019 auf den Markt kommen. Für 2018 ist parallel eine Zulassungsstudie in subcutaner Applikation geplant, wodurch die Behandlung weiter vereinfacht werden soll. Geplant ist zudem, ALXN1210 nicht nur in den Kernindikationen "paroxysmale nächtliche Hämoglobinurie" und "atypisches hämalotisch-urämisches Syndrom" anzuwenden, sondern auch in der Indikation "myasthenia gravis" zu testen. Im Fall einer Zulassung (2019) sollten die Jahrespitzenumsätze mehr als 3 Mrd. USD betragen.
Gestern sind im Übrigen Studienergebnisse (Phase II) eines anders konzipierten Konkurrenzpräparates der Firma RA Pharma veröffentlicht worden. Da besagtem Konkurrenzpräparat im Vergleich zu ALXN1210 keine Chancen eingeräumt werden (-> https://endpts.com/ra-pharma-puts-its-best-foot-forward-with…), ist der Börsenkurs der RA Pharma anschließend von 14,24 USD auf 7,97 USD (heutiger Schlusskurs) abgestürzt.
Im jüngsten Conference Call hieß es seitens Alexions Unternehmensführung zu ALXN1210 u.a. "... we are rapidly progressing the development of ALXN1210, our innovative, next generation C5 antibody that has the potential to address important patient needs" und "our ambition is to establish ALXN1210 as the new standard of care for patients with PNH and aHUS".
Dadurch, dass Alexion viele Patienten in die ALXN1210-Studien leitet, nimmt man gleichzeitig bei den Solaris-Umsätzen enorme finanzielle Einbußen in Kauf (knapp 100 Mio. USD allein im laufenden Geschäftsjahr).
Neben ALXN1210 (von dem die meisten Investoren noch nicht einmal wissen, dass das Präparat von Xencor entwickelt worden ist), könnte der ebenfalls von Xencor entwickelte und später von Morphosys einlizensierte Antikörper MOR208 demnächst als Kurstrigger dienen. Morphosys wird im Rahmen des bevorstehenden ASH-Meetings eigens eine Investorenkonferenz zu MOR208 durchführen (ebenfalls am 11.12.2017).
Die heutige Meilensteinzahlung für AMG 424 und dessen bevorstehender Klinikeintritt sind da nur nette Zugaben.
Ich habe es mit Stafford/Xencor gehalten und zuletzt stetig XNCR-Aktien zugekauft, so dass Xencor mittlerweile ein Kerninvestment ist.
Antwort auf Beitrag Nr.: 56.370.056 von Joschka Schröder am 05.12.17 22:39:56heißt natürlich "Complement"
Bitte um Nachsicht wegen der holprigen Grammatik -> Zeitmangel
Bitte um Nachsicht wegen der holprigen Grammatik -> Zeitmangel
Antwort auf Beitrag Nr.: 56.370.056 von Joschka Schröder am 05.12.17 22:39:56Hallo Joschka,
bezüglich ALXN1210: ich denke dass das Investoren relativ bekannt ist, bzw. kann man es sehr leicht herausfinden nach kurzer Recherche. Heißt natürlich nicht, dass die offizielle Bekanntgabe nichts im Kurs bewirken wird, nur rechne ich eher nicht mit einem dauerhaften hohen Kurssprung deswegen. Jeder ernsthafte Investor hat es jetzt schon am Schirm.
Die Frage ist was die Tantiemen wert sind. 2,5% sind es ja soweit ich es richtig im Kopf habe... hmmm, ich werf jetzt einfach Mal die Zahl 300 Mio. EUR in den Raum (Annahme dass zugelassen wird). Was war deine Rechnung für ALXN1210 Xencor-Wert?
bezüglich ALXN1210: ich denke dass das Investoren relativ bekannt ist, bzw. kann man es sehr leicht herausfinden nach kurzer Recherche. Heißt natürlich nicht, dass die offizielle Bekanntgabe nichts im Kurs bewirken wird, nur rechne ich eher nicht mit einem dauerhaften hohen Kurssprung deswegen. Jeder ernsthafte Investor hat es jetzt schon am Schirm.
Die Frage ist was die Tantiemen wert sind. 2,5% sind es ja soweit ich es richtig im Kopf habe... hmmm, ich werf jetzt einfach Mal die Zahl 300 Mio. EUR in den Raum (Annahme dass zugelassen wird). Was war deine Rechnung für ALXN1210 Xencor-Wert?
Zu welchem Anteil die Aktionäre Alxn1220 aauf dem Schirm haben, und ob die Einschätzung des Wertanteils realistisch ist, läßt sich schwer feststellen.
Schon das erwartete Marktpotential für soliris 2022 ist nur mit Unsicherheit abzuschätzen. Evaluate geht hier von 4,5-5,5 billion Dollars aus.
Bekannt ist, daß amgen bis dahin mit einem eigenen eculizumab biosimilar sich einen Teil des Kuchens abschneiden will. Auch andere Nachahmer hatten das orphan drug im Fokus. Aufgrund der schwierigen Patientenrekrutierung für die Phase 3 als Biosimilaritätsnachweis gehe ich jedoch nicht von weiteren erfolgreichen Zulassungen aus.
Das bedeutet, daß es beim Altmolekül keinen gravierenden Preisverfall geben wird. Die neue Applikationsform des Alxn1220 als subkutane Spritze zu Hause applizierbar, im Vergleich zur 45Minuteninfusion in der Klinik mit darauffolgender Nachüberwachung, und das verlängerte Dosierungsschema, sind ein erheblicher Vorteil gegnüber der alten Eculizumab-Variante.
Aus diesem Grund und der erweiterten Indikation (m.g.) sollte der von evaluate für das Altmolekül von alexion geschilderte Zielumsatz von über 4 billion auch auf das Biobetter übertragbar sein. Ich gehe somit von 100 mio royalties für xencor aus, und damit auch von einem proof of concept der xtend Technologie. Das ist gerade auch für die attraktive bispecifics Pipeline von Bedeutung.
Aus diesen Erwägungen heraus scheint mir der xencor Kurs schon wegen dieses einen pipeline-Produkts gut nach unten abgesichert zu sein😀
Schon das erwartete Marktpotential für soliris 2022 ist nur mit Unsicherheit abzuschätzen. Evaluate geht hier von 4,5-5,5 billion Dollars aus.
Bekannt ist, daß amgen bis dahin mit einem eigenen eculizumab biosimilar sich einen Teil des Kuchens abschneiden will. Auch andere Nachahmer hatten das orphan drug im Fokus. Aufgrund der schwierigen Patientenrekrutierung für die Phase 3 als Biosimilaritätsnachweis gehe ich jedoch nicht von weiteren erfolgreichen Zulassungen aus.
Das bedeutet, daß es beim Altmolekül keinen gravierenden Preisverfall geben wird. Die neue Applikationsform des Alxn1220 als subkutane Spritze zu Hause applizierbar, im Vergleich zur 45Minuteninfusion in der Klinik mit darauffolgender Nachüberwachung, und das verlängerte Dosierungsschema, sind ein erheblicher Vorteil gegnüber der alten Eculizumab-Variante.
Aus diesem Grund und der erweiterten Indikation (m.g.) sollte der von evaluate für das Altmolekül von alexion geschilderte Zielumsatz von über 4 billion auch auf das Biobetter übertragbar sein. Ich gehe somit von 100 mio royalties für xencor aus, und damit auch von einem proof of concept der xtend Technologie. Das ist gerade auch für die attraktive bispecifics Pipeline von Bedeutung.
Aus diesen Erwägungen heraus scheint mir der xencor Kurs schon wegen dieses einen pipeline-Produkts gut nach unten abgesichert zu sein😀
Antwort auf Beitrag Nr.: 56.375.311 von PathFinder2 am 06.12.17 12:32:04Mit rund 300 Mio. EUR für ALXN1210 könnte mich auf den ersten Blick gut anfreunden (einen pseudogenauen Berechnungsversuch kann man sich zum jetzigen Zeitpunkt wohl sparen).
Enterprise Value aktuell ca. 660 Mio. USD bei einer Marktkapitalisierung von 1.040 Mio. USD.
660 Mio. USD abzgl. 300 Mio. EUR für ALXN1210 entspräche ca. 305 Mio. USD Unternehmensrestwert. Diesem Restwert stehen die Werte für die XmAb-Plattform und eine interessante Produktpipeline (inkl. Kooperationen mit Novartis, Amgen etc.) gegenüber. Sollte MOR208 zugelassen werden, reduzierte sich der Restwert durch die entsprechende/n Zulassungs-Meilensteinzahlung/en auf nicht einmal 120 Mio. USD. Das ist entschieden zuwenig.
Enterprise Value aktuell ca. 660 Mio. USD bei einer Marktkapitalisierung von 1.040 Mio. USD.
660 Mio. USD abzgl. 300 Mio. EUR für ALXN1210 entspräche ca. 305 Mio. USD Unternehmensrestwert. Diesem Restwert stehen die Werte für die XmAb-Plattform und eine interessante Produktpipeline (inkl. Kooperationen mit Novartis, Amgen etc.) gegenüber. Sollte MOR208 zugelassen werden, reduzierte sich der Restwert durch die entsprechende/n Zulassungs-Meilensteinzahlung/en auf nicht einmal 120 Mio. USD. Das ist entschieden zuwenig.
Alexion macht im Hinblick auf die subcutane Formulierung des mit Xencor´s Fc-Technologie entwickelten ALXN1210 weiter ernst:
NEW HAVEN, Conn. & SAN DIEGO--(BUSINESS WIRE)--Alexion Pharmaceuticals, Inc. (NASDAQ:ALXN) and Halozyme Therapeutics, Inc. (NASDAQ:HALO) announced today a collaboration and license agreement that enables Alexion to use Halozyme’s ENHANZE® drug-delivery technology in the development of subcutaneous formulations for their portfolio of products. The agreement provides Alexion with the opportunity for exclusive development of up to four targets, including a next generation subcutaneous formulation of ALXN1210 (ALXN1210 SC), the company’s investigational long-acting C5 complement inhibitor, to potentially further extend the dosing interval of ALXN1210 SC to once every two weeks or once per month.
“Alexion’s goal is to provide continued innovation and more treatment options that can significantly improve the lives of patients with rare diseases,” said John Orloff, M.D., Executive Vice President and Head of Research & Development at Alexion. “We are excited to partner with Halozyme and look forward to utilizing its ENHANZE technology, which enables rapid injection of subcutaneous treatments and potentially increases bioavailablity, in our development programs.”
“We are delighted to support Alexion’s innovative development initiatives focused on improving the lives of patients with rare diseases,” said Dr. Helen Torley, president and CEO of Halozyme. “ENHANZE has become the industry standard for converting intravenous therapies to a subcutaneous delivery, helping partners and health care providers reduce the treatment burden and administration time for patients.”
Under the terms of the agreement, Halozyme will receive an initial $40 million with the potential to earn additional payments of up to $160 million for each target developed, subject to achievement of specified development, regulatory and sales-based milestones. Halozyme will also receive mid-single digit royalties on sales of commercialized products.
The Halozyme ENHANZE technology is based on a proprietary recombinant human hyaluronidase enzyme (rHuPH20) that temporarily degrades hyaluronan -- a glycosaminoglycan or chain of natural sugars in the body -- to aid in the dispersion and absorption of other injected therapeutic drugs. For Halozyme partners, this technology may allow for more rapid delivery of injectable medications through subcutaneous injection (just under the skin). This delivery has been shown in studies to reduce health care practitioner time required for administration and shorten time for drug administration.
Alexion is Halozyme’s eighth global collaboration and license partner for the ENHANZE technology, and the third partnership formed in 2017. These partnerships cover nearly 50 therapeutic targets and include three commercialized products.
About Alexion
Alexion is a global biopharmaceutical company focused on developing and delivering life-transforming therapies for patients with devastating and rare disorders. Alexion is the global leader in complement inhibition and has developed and commercializes the first and only approved complement inhibitor to treat patients with paroxysmal nocturnal hemoglobinuria (PNH), atypical hemolytic uremic syndrome (aHUS), and anti-acetylcholine receptor (AchR) antibody-positive generalized myasthenia gravis (gMG). In addition, Alexion has two highly innovative enzyme replacement therapies for patients with life-threatening and ultra-rare metabolic disorders, hypophosphatasia (HPP) and lysosomal acid lipase deficiency (LAL-D).
As the leader in complement biology for over 20 years, Alexion focuses its research efforts on novel molecules and targets in the complement cascade, and its development efforts on the core therapeutic areas of hematology, nephrology, neurology, and metabolic disorders. Alexion’s lead development program is ALXN1210, an innovative, long-acting C5 inhibitor that is currently being evaluated in Phase 3 clinical studies as a potential treatment for patients with paroxysmal nocturnal hemoglobinuria (PNH) and atypical hemolytic uremic syndrome (aHUS) administered intravenously every eight weeks. Alexion also plans to initiate a single, PK-based Phase 3 clinical study of ALXN1210 delivered subcutaneously once per week as a potential treatment for patients with PNH or aHUS. In addition, Alexion plans to explore studying longer dosing intervals of subcutaneous administration of ALXN1210, including every other week and once per month, using the ENHANZE technology. This press release and further information about Alexion can be found at: www.alexion.com.
NEW HAVEN, Conn. & SAN DIEGO--(BUSINESS WIRE)--Alexion Pharmaceuticals, Inc. (NASDAQ:ALXN) and Halozyme Therapeutics, Inc. (NASDAQ:HALO) announced today a collaboration and license agreement that enables Alexion to use Halozyme’s ENHANZE® drug-delivery technology in the development of subcutaneous formulations for their portfolio of products. The agreement provides Alexion with the opportunity for exclusive development of up to four targets, including a next generation subcutaneous formulation of ALXN1210 (ALXN1210 SC), the company’s investigational long-acting C5 complement inhibitor, to potentially further extend the dosing interval of ALXN1210 SC to once every two weeks or once per month.
“Alexion’s goal is to provide continued innovation and more treatment options that can significantly improve the lives of patients with rare diseases,” said John Orloff, M.D., Executive Vice President and Head of Research & Development at Alexion. “We are excited to partner with Halozyme and look forward to utilizing its ENHANZE technology, which enables rapid injection of subcutaneous treatments and potentially increases bioavailablity, in our development programs.”
“We are delighted to support Alexion’s innovative development initiatives focused on improving the lives of patients with rare diseases,” said Dr. Helen Torley, president and CEO of Halozyme. “ENHANZE has become the industry standard for converting intravenous therapies to a subcutaneous delivery, helping partners and health care providers reduce the treatment burden and administration time for patients.”
Under the terms of the agreement, Halozyme will receive an initial $40 million with the potential to earn additional payments of up to $160 million for each target developed, subject to achievement of specified development, regulatory and sales-based milestones. Halozyme will also receive mid-single digit royalties on sales of commercialized products.
The Halozyme ENHANZE technology is based on a proprietary recombinant human hyaluronidase enzyme (rHuPH20) that temporarily degrades hyaluronan -- a glycosaminoglycan or chain of natural sugars in the body -- to aid in the dispersion and absorption of other injected therapeutic drugs. For Halozyme partners, this technology may allow for more rapid delivery of injectable medications through subcutaneous injection (just under the skin). This delivery has been shown in studies to reduce health care practitioner time required for administration and shorten time for drug administration.
Alexion is Halozyme’s eighth global collaboration and license partner for the ENHANZE technology, and the third partnership formed in 2017. These partnerships cover nearly 50 therapeutic targets and include three commercialized products.
About Alexion
Alexion is a global biopharmaceutical company focused on developing and delivering life-transforming therapies for patients with devastating and rare disorders. Alexion is the global leader in complement inhibition and has developed and commercializes the first and only approved complement inhibitor to treat patients with paroxysmal nocturnal hemoglobinuria (PNH), atypical hemolytic uremic syndrome (aHUS), and anti-acetylcholine receptor (AchR) antibody-positive generalized myasthenia gravis (gMG). In addition, Alexion has two highly innovative enzyme replacement therapies for patients with life-threatening and ultra-rare metabolic disorders, hypophosphatasia (HPP) and lysosomal acid lipase deficiency (LAL-D).
As the leader in complement biology for over 20 years, Alexion focuses its research efforts on novel molecules and targets in the complement cascade, and its development efforts on the core therapeutic areas of hematology, nephrology, neurology, and metabolic disorders. Alexion’s lead development program is ALXN1210, an innovative, long-acting C5 inhibitor that is currently being evaluated in Phase 3 clinical studies as a potential treatment for patients with paroxysmal nocturnal hemoglobinuria (PNH) and atypical hemolytic uremic syndrome (aHUS) administered intravenously every eight weeks. Alexion also plans to initiate a single, PK-based Phase 3 clinical study of ALXN1210 delivered subcutaneously once per week as a potential treatment for patients with PNH or aHUS. In addition, Alexion plans to explore studying longer dosing intervals of subcutaneous administration of ALXN1210, including every other week and once per month, using the ENHANZE technology. This press release and further information about Alexion can be found at: www.alexion.com.
Antwort auf Beitrag Nr.: 56.370.056 von Joschka Schröder am 05.12.17 22:39:56Ist Alexion damit für Dich auch kaufenswert?
Antwort auf Beitrag Nr.: 56.392.654 von watchingtheflood am 07.12.17 16:39:03Alexion ist für mich nur im Zusammenhang mit Xencor von Interesse, nicht jedoch als mögliches Investment.
hallo Joschka
was hältst du von den AFMD-Daten auf der ASH?
was hältst du von den AFMD-Daten auf der ASH?
Antwort auf Beitrag Nr.: 56.413.642 von PathFinder2 am 09.12.17 18:54:29Ich habe mir das Poster zur AFM13-Kombistudie angesehen und den Vergleich mit Daten anderer Studien fast abgeschlossen. Am Sonntag oder Montag werde ich etwas zum Thema schreiben, momentan fehlt leider die Zeit, weil es beim ASH-Meeting Schlag auf Schlag geht. Ich komme kaum nach, die Präsentationen durchzuarbeiten und zu katalogisieren.
Die AFMD sind derzeit leider noch rudimentär. Es bleibt das 6 Month Assessment abzuwarten.
Die Daten regen aber durchaus zu „etwas“ Phantasie an... bin auch gespannt, was Joschka hierzu meint.
Das c/r Profil dürfte sich aber deutlich verbessert haben.
Die Daten regen aber durchaus zu „etwas“ Phantasie an... bin auch gespannt, was Joschka hierzu meint.
Das c/r Profil dürfte sich aber deutlich verbessert haben.
Antwort auf Beitrag Nr.: 56.414.905 von biopadawan am 10.12.17 08:33:49Ich eröffne nachher einen Thread zu Affimed (einen brauchbaren Diskussionsfaden gibt es zu diesem Unternehmen noch nicht), wir sollten die Affimed-Diskussionen anschließend dorthin auslagern.
Xencor
Beim diesjährigen ASH-Meeting gibt es mal wieder eine Datenflut zu klinischen Studien in der Indikation DLBCL. Bekanntlich ist auch der von Xencor entwickelte und später von Morphosys einlizensierte anti-CD19-Antikörper MOR208 in dieser Indikation im Einsatz.
In meinem Morphosys-Thread kommentiere ich hin und wieder (so auch heute) Ergebnisse von MOR208-Konkurrenzstudien.
An dieser Stelle soll ein vorläufiges Fazit ausreichen:
MOR208 zeichnet sich im Vergleich zu vielen anderen Therapien in einem wesentlichen Punkt aus: Die Dauer der klinischen Antwort! Beispiel: DoR (duration of response) bei Monotherapie mit MOR208 zuletzt 20,1 Monate (s. Präsentation zum letztjährigen ASH-Meeting). In einer heute von Roche publizierten Dreifachkombinationsstudie mit polatuzumab vedotin plus rituximab plus bendamustine beträgt die DoR hingegen "nur" 8,8 Monate, Venetoclax, der Hoffungsträger von Roche/AbbVie hat es gerade mal auf 3,3 Monate gebracht (s. Präsentation ASH 2015), bei Adcetris (anti-CD30-ADC von SGEN) war die klinische Antwort bereits nach 1,6 Monaten vorbei ... nur um ein paar Beispiele zu nennen.
Die bisherigen Daten zur Dauer der klinischen Antwort und des progressionsfreien Überlebens zeigen, dass es MOR208 gelingen kann, durchaus ein größeres Stück des DLBCL-Marktes für sich zu gewinnen.
Für Xencor, einen meiner Biotech-Favoriten, bedeutet dies: 187 Mio. USD Meilensteinzahlung von Morphosys an Xencor bei Zulassung des MOR208, anschließend Royalties im hohen einstelligen bis niedrigen zweistelligen Prozentbereich.
Beim diesjährigen ASH-Meeting gibt es mal wieder eine Datenflut zu klinischen Studien in der Indikation DLBCL. Bekanntlich ist auch der von Xencor entwickelte und später von Morphosys einlizensierte anti-CD19-Antikörper MOR208 in dieser Indikation im Einsatz.
In meinem Morphosys-Thread kommentiere ich hin und wieder (so auch heute) Ergebnisse von MOR208-Konkurrenzstudien.
An dieser Stelle soll ein vorläufiges Fazit ausreichen:
MOR208 zeichnet sich im Vergleich zu vielen anderen Therapien in einem wesentlichen Punkt aus: Die Dauer der klinischen Antwort! Beispiel: DoR (duration of response) bei Monotherapie mit MOR208 zuletzt 20,1 Monate (s. Präsentation zum letztjährigen ASH-Meeting). In einer heute von Roche publizierten Dreifachkombinationsstudie mit polatuzumab vedotin plus rituximab plus bendamustine beträgt die DoR hingegen "nur" 8,8 Monate, Venetoclax, der Hoffungsträger von Roche/AbbVie hat es gerade mal auf 3,3 Monate gebracht (s. Präsentation ASH 2015), bei Adcetris (anti-CD30-ADC von SGEN) war die klinische Antwort bereits nach 1,6 Monaten vorbei ... nur um ein paar Beispiele zu nennen.
Die bisherigen Daten zur Dauer der klinischen Antwort und des progressionsfreien Überlebens zeigen, dass es MOR208 gelingen kann, durchaus ein größeres Stück des DLBCL-Marktes für sich zu gewinnen.
Für Xencor, einen meiner Biotech-Favoriten, bedeutet dies: 187 Mio. USD Meilensteinzahlung von Morphosys an Xencor bei Zulassung des MOR208, anschließend Royalties im hohen einstelligen bis niedrigen zweistelligen Prozentbereich.
Antwort auf Beitrag Nr.: 56.417.649 von Joschka Schröder am 10.12.17 18:21:46hallo Joschka,
bist du dir sicher, dass da 187 mio USD bei erster Zulassung (in nur einer Indikation?) fällig werden? Ich hab das nicht mehr im Kopf, dachte mir aber schon dass das inidikationsabhängig und länderabhängig ist wieviel MOR rausrücken muss.
bist du dir sicher, dass da 187 mio USD bei erster Zulassung (in nur einer Indikation?) fällig werden? Ich hab das nicht mehr im Kopf, dachte mir aber schon dass das inidikationsabhängig und länderabhängig ist wieviel MOR rausrücken muss.
Antwort auf Beitrag Nr.: 56.418.216 von PathFinder2 am 10.12.17 20:07:45Die genauen Konditionen kenne ich nicht. Ich gehe davon aus, dass sich die 187 Mio. auf verschiedene Regionen aufteilen (üblich wäre US/EUR/RoW). Es kann nicht ausgeschlossen werden, dass es auch zusätzliche Indikationsregelungen gibt. Davon würde ich zwar nicht unbedingt ausgehen, andererseits sind der Phantasie keine Grenzen gesetzt und ich habe schon die verrücktesten Vertragswerke gesehen. Letztlich werden wir abwarten müssen, wann welcher Betrag fließt.
Antwort auf Beitrag Nr.: 56.331.143 von PathFinder2 am 30.11.17 21:43:29Glückwunsch, Pathfinder, bei Argenx hast Du ein gutes Näschen bewiesen. Aktuell nach zwei Unternehmensmeldungen im Kontext des ASH-Meetigs Kursanstieg um 20 %.
Der Wert steht bei mir auf der Watchlist, seitdem Du ihn erwähnt hast, hatte bislang nur leider keine Zeit, mir Details anzusehen. Kommt aber noch.
Der Wert steht bei mir auf der Watchlist, seitdem Du ihn erwähnt hast, hatte bislang nur leider keine Zeit, mir Details anzusehen. Kommt aber noch.
Antwort auf Beitrag Nr.: 56.421.162 von Joschka Schröder am 11.12.17 09:58:19Ja, wahnsinn! Auch meinen Glückwunsch an Pathfinder! Wieder mal ne richtigen Riecher gehabt!! Das Ding hüpft inzwischen 60% nach oben!! Kurs über 40 EUR. Deren Leadprogramm scheint ne Goldminde zu sein (hab ich mir noch gar nicht angesehen, renne aber auch ungern fortgefahrenen Strassenbahnen hinterher) oder der Markt dreht durch...
Antwort auf Beitrag Nr.: 56.424.393 von Ville7 am 11.12.17 16:30:53danke Joschka und ville, ab und zu braucht man einfach Glück.... war bei ARGX schon sehr früh dabei, hab aber leider nicht sonderlich viel investiert ursprünglich (bedeutend weniger als XNCR beispielsweise). naja heute ist es zumindest noch eingies mehr geworden ;-)
Die Daten in MG sehen zumindest für mich als Laie sehr überzeugend aus. ARGX-113 könnte wirklich eine bedeutende Neuerung in igG related diseases werden.
Die Daten in MG sehen zumindest für mich als Laie sehr überzeugend aus. ARGX-113 könnte wirklich eine bedeutende Neuerung in igG related diseases werden.
Antwort auf Beitrag Nr.: 56.425.847 von PathFinder2 am 11.12.17 19:19:22OFFTOPIC zu ARGX
das hat nicht lange gedauert - sie sind schon wieder am geld einsammeln... 150 mio USD von US-investoren. bin mal gespannt wo da der kurs zu liegen kommt, nach den +79% von heute....
jedenfalls soll man KEs machen wenn es geht, also sicher kein schlechter zeitpunkt
das hat nicht lange gedauert - sie sind schon wieder am geld einsammeln... 150 mio USD von US-investoren. bin mal gespannt wo da der kurs zu liegen kommt, nach den +79% von heute....
jedenfalls soll man KEs machen wenn es geht, also sicher kein schlechter zeitpunkt
Antwort auf Beitrag Nr.: 56.427.487 von PathFinder2 am 11.12.17 23:12:05Man hat´s gesehen, gegen Ende der Börsensitzung haben sie in den USA den Kurs noch einmal richtig hochgezogen, wie üblich in solchen Situationen ...
Der Xencor-Aktie ist das ASH-Meeting definitiv nicht bekommen.
Antwort auf Beitrag Nr.: 56.433.281 von Joschka Schröder am 12.12.17 17:48:14also hab nochmal nachgesehen, leider keine konkrete Info wie sich die Meilensteine zusammensetzen; ich gehe aber eher nicht davon aus, dass 187 mio auf einmal fällig werden, sondern aufgeteilt nach Regionen/Indikationen. Ein kleiner Hinweis darauf mag sein "regulatory approval milestones", also Mehrzahl.
Under the terms of the MorphoSys Agreement, we received a $13 million upfront payment and $3 million for
development milestone payments in 2013. If certain developmental, regulatory and sales milestones are achieved, we are also
eligible to receive up to an additional $299 million in milestone payments which are comprised as follows: $62.0 million in
clinical development milestones, $187 million in regulatory approval milestones and $50 million of aggregate milestone
payments for the achievement of certain product sale goals. If licensed products are commercialized, we are also entitled to
receive tiered royalties in the high single
‑
digit to low
‑
teen percent range.
Under the terms of the MorphoSys Agreement, we received a $13 million upfront payment and $3 million for
development milestone payments in 2013. If certain developmental, regulatory and sales milestones are achieved, we are also
eligible to receive up to an additional $299 million in milestone payments which are comprised as follows: $62.0 million in
clinical development milestones, $187 million in regulatory approval milestones and $50 million of aggregate milestone
payments for the achievement of certain product sale goals. If licensed products are commercialized, we are also entitled to
receive tiered royalties in the high single
‑
digit to low
‑
teen percent range.
Antwort auf Beitrag Nr.: 56.434.235 von PathFinder2 am 12.12.17 19:40:08Aufteilung nach Regionen (z.B. USA. Europa und RoW) ist üblich, ob es zusätzlich eine Indikationsregelung gibt, wird man sehen.
Mich würde interessieren, wie von der Allgemeinheit der aktuelle Kursverlauf interpretiert wird. Ich habe meine eigene Theorie, würde aber zunächst gerne wissen, was Andere denken.
Mich würde interessieren, wie von der Allgemeinheit der aktuelle Kursverlauf interpretiert wird. Ich habe meine eigene Theorie, würde aber zunächst gerne wissen, was Andere denken.
Antwort auf Beitrag Nr.: 56.434.287 von Joschka Schröder am 12.12.17 19:46:06Also eine fundamentale Begründung habe ich nicht.
Ich denke z.B. nicht, dass die luschige Morphosys-Präsentation irgendeinen Einfluss hatte.
Nicht abschätzen kann ich aktuell, ob ARGX-113 irgendeine Konkurrenz zu XmAb7195 darstellen könnte, also eine Überlappung der Indikationen trotz unterschiedlicher Immunglobulin-Hemmung sein könnte. Der eine reguziert IgG, der andere IgE.
Wenn ich aber in den Chart sehe, dann kann man mit wenig Fantasie eine Flaggenformation erkennen. Der Anstieg von 10 könnte damit auskonsolidiert werden, bevor es wieder ansteigt. Bedeutet: hier könnten gerade einfach die Algos und die charttechnisch Orientierten Marktteilnehmer dran sein...
Ich denke z.B. nicht, dass die luschige Morphosys-Präsentation irgendeinen Einfluss hatte.
Nicht abschätzen kann ich aktuell, ob ARGX-113 irgendeine Konkurrenz zu XmAb7195 darstellen könnte, also eine Überlappung der Indikationen trotz unterschiedlicher Immunglobulin-Hemmung sein könnte. Der eine reguziert IgG, der andere IgE.
Wenn ich aber in den Chart sehe, dann kann man mit wenig Fantasie eine Flaggenformation erkennen. Der Anstieg von 10 könnte damit auskonsolidiert werden, bevor es wieder ansteigt. Bedeutet: hier könnten gerade einfach die Algos und die charttechnisch Orientierten Marktteilnehmer dran sein...
Antwort auf Beitrag Nr.: 56.434.499 von Ville7 am 12.12.17 20:13:42in der tat war dass ganze jahr über ein mittelabfluss zu erkennen, ist aber 2016 halt gut gelaufen. die doch bedeutenden insiderkäufe sind positiv. hab mir heute noch ein paar gegönnt.
Antwort auf Beitrag Nr.: 56.434.721 von PathFinder2 am 12.12.17 20:50:48Oh Gott entschuldigt bitte mein "Deutsch" *grrr*. Ich werde versuchen mich zu bessern ;-))
Das hat man davon wenn man drei Dinge gleichzeitig macht, oder besser gesagt machen will.
Das hat man davon wenn man drei Dinge gleichzeitig macht, oder besser gesagt machen will.
Antwort auf Beitrag Nr.: 56.427.509 von Joschka Schröder am 11.12.17 23:18:32OT
ARGX zeigt vor wie man KEs durchzieht....
$231M in Offering; Priced 4.44M ADS Offering @$52.00/ADS
(upsized from $150M)
ARGX zeigt vor wie man KEs durchzieht....
$231M in Offering; Priced 4.44M ADS Offering @$52.00/ADS
(upsized from $150M)
Antwort auf Beitrag Nr.: 56.446.718 von PathFinder2 am 14.12.17 11:52:16Argenx ist ein richtig gutes Unternehmen, Top-Management, intelligente F&E, von der Technk her quasi eine Abspaltung von Ablynx, der extreme Kursanstieg ist absolut nachvollziehbar.
PS: Pathfinder, vielen Dank nochmals, dass Du mich auf ARGX aufmerksam gemacht hast! Die Kursentwicklung sieht schon heftig aus, ist aber durch die F&E absolut gerechtfertigt. Ich hoffe, dass wir bei CTMX im nächsten Jahr eine ähnliche Entwicklung sehen werden.
Glückwunsch Euch beiden zu der ARGX Entwicklung! Da kommt man aus dem Staunen nicht mehr heraus.
Großaktionär Stafford (Rosin Capital) kauft weiter Aktien über die Börse zu ->http://investors.xencor.com/secfiling.cfm?filingid=1179110-1…
Ich bin inzwischen auch kräftig bei Xencor eingestiegen.
Bassil Dahiyat (CEO) und sein Team haben mich als Führungskräfte überzeugt.
Die aller Wahrscheinlichkeit nach werthaltigen Auslizenzierungsprodukte Alxn1201 sowie Mor208
bringen die Liquidität für die Entwicklung der eigenen Pipeline.
Bei den Bispecifics scheint Xencor eine wichtige Veredelungstechnik entwickelt zu haben (HWZ, Stabilität), die darüber hinaus noch ökonomischere Produktions-und Aufreinigungsmethoden verspricht, als bisherige Bispecifics.
Das Toxizitätsthema scheint aber auch hier noch nicht gelöst zu sein.
Für den CEO war die Kooperation mit Amgen auch eine Chance, vom Marktführer in Bispecifics zu lernen.
Im Link ist ein interessantes Interview mit Bassil Dahiyat, der die Entwicklung von Xencor schildert.
http://www.nature.com/bioent/2012/120801/full/bioe.2012.8.ht…
Der Link müßte doch für unseren Hobbyhistoriker ville (vgl. cytomx-Thema) doch ganz interessant sein!
(vgl. cytomx-Thema) doch ganz interessant sein!
LG
Stefan
Bassil Dahiyat (CEO) und sein Team haben mich als Führungskräfte überzeugt.
Die aller Wahrscheinlichkeit nach werthaltigen Auslizenzierungsprodukte Alxn1201 sowie Mor208
bringen die Liquidität für die Entwicklung der eigenen Pipeline.
Bei den Bispecifics scheint Xencor eine wichtige Veredelungstechnik entwickelt zu haben (HWZ, Stabilität), die darüber hinaus noch ökonomischere Produktions-und Aufreinigungsmethoden verspricht, als bisherige Bispecifics.
Das Toxizitätsthema scheint aber auch hier noch nicht gelöst zu sein.
Für den CEO war die Kooperation mit Amgen auch eine Chance, vom Marktführer in Bispecifics zu lernen.
Im Link ist ein interessantes Interview mit Bassil Dahiyat, der die Entwicklung von Xencor schildert.
http://www.nature.com/bioent/2012/120801/full/bioe.2012.8.ht…
Der Link müßte doch für unseren Hobbyhistoriker ville
 (vgl. cytomx-Thema) doch ganz interessant sein!
(vgl. cytomx-Thema) doch ganz interessant sein!LG
Stefan
Antwort auf Beitrag Nr.: 56.555.041 von StefanR am 28.12.17 01:01:35Sehr interessant. Danke, Stefan!
pathfinder, dein guter Riecher ist erstaunlich. Glückwunsch auch zu der PIRS Performance.
Antwort auf Beitrag Nr.: 56.564.293 von Ville7 am 29.12.17 06:52:03danke für die Loorbeeren. Börse ist immer auch Glück... schaun wir Mal was heuer für eine Performance drinnen ist.
Bei PIRS wird's vermutlich schwer nach der guten 2017er-Performance. Ich bleib jedenfalls mit dem Großteil vorerst drinnen.
Weiter zum Thema bispecs, hab heute ZYME gekauft. Meine simplen Überlegungen: gesamt 6 Partnerschaften, davon starke mit Celgene, GSK und J&J. Theoretische Meileinsteinsumme (biobucks) aktuell 5,5 Mrd. USD (wohlgemerkt der größte Teil davon commercial milestones); dazu wie üblich Royalties. Ich denke die Partnerschaften und das Eigenprogramm in fortgeschrittener PI validieren die Azymetric bispecs-Plattform und die Efector-Optimierungsplattform weitgehend. Daneben gib's noch eine ADC-Technologie und eine HSA-Technologie, wie ausgereift immer diese auch sind. Und die Eigenpipe, die wohl nicht so extrem spannend ist (?), aber vielleicht ist ja doch noch ein Platz im HER2-low und HER2-intermediate Bereich?
ZYME war der schlechteste IPO-Performer in US letztes Jahr, und kommt aktuell auf eine Market Cap von USD 200 Mio, davon ca. USD 100 Mio Cash. Scheint mir jetzt nicht so teuer.... Ich kann mir vorstellen, dass sie sich heuer etwas erholen und ein paar nette Prozenterl drinnen sind Aber wissen tut man es immer erst nachher
Aber wissen tut man es immer erst nachher 
Bei PIRS wird's vermutlich schwer nach der guten 2017er-Performance. Ich bleib jedenfalls mit dem Großteil vorerst drinnen.
Weiter zum Thema bispecs, hab heute ZYME gekauft. Meine simplen Überlegungen: gesamt 6 Partnerschaften, davon starke mit Celgene, GSK und J&J. Theoretische Meileinsteinsumme (biobucks) aktuell 5,5 Mrd. USD (wohlgemerkt der größte Teil davon commercial milestones); dazu wie üblich Royalties. Ich denke die Partnerschaften und das Eigenprogramm in fortgeschrittener PI validieren die Azymetric bispecs-Plattform und die Efector-Optimierungsplattform weitgehend. Daneben gib's noch eine ADC-Technologie und eine HSA-Technologie, wie ausgereift immer diese auch sind. Und die Eigenpipe, die wohl nicht so extrem spannend ist (?), aber vielleicht ist ja doch noch ein Platz im HER2-low und HER2-intermediate Bereich?
ZYME war der schlechteste IPO-Performer in US letztes Jahr, und kommt aktuell auf eine Market Cap von USD 200 Mio, davon ca. USD 100 Mio Cash. Scheint mir jetzt nicht so teuer.... Ich kann mir vorstellen, dass sie sich heuer etwas erholen und ein paar nette Prozenterl drinnen sind
 Aber wissen tut man es immer erst nachher
Aber wissen tut man es immer erst nachher 
Antwort auf Beitrag Nr.: 56.590.034 von PathFinder2 am 02.01.18 17:13:39falls es jemanden interessiert, hier der Link zur Firmenpräsentation
http://ir.zymeworks.com/~/media/Files/Z/ZymeWorks-IR/reports…
http://ir.zymeworks.com/~/media/Files/Z/ZymeWorks-IR/reports…
Antwort auf Beitrag Nr.: 56.590.034 von PathFinder2 am 02.01.18 17:13:39
Wie kommst Du auf 100 Mio. USD Cash? Zum 30.9.2017 waren es 49,1 Mio. USD. 2018 dürfte eine KP-Erhöhung fällig werden.
Ich habe die aktuelle Unternehmenspräsentation schnell durchgesehen. Die ZW25-Daten sehen bislang bescheiden aus. Zymeworks steht hier in Konkurrenz zu Mersana, deren Daten zu XMT-1522 eigentlich überfällig sind. Sonst kann ich zum Unternehmen aber nichts sagen, werde mir den Emissionsprospekt und die Patente gelegentlich genauer anschauen.
Zitat von PathFinder2: ZYME war der schlechteste IPO-Performer in US letztes Jahr, und kommt aktuell auf eine Market von USD 200 Mio, davon ca. USD 100 Mio Cash.
Wie kommst Du auf 100 Mio. USD Cash? Zum 30.9.2017 waren es 49,1 Mio. USD. 2018 dürfte eine KP-Erhöhung fällig werden.
Ich habe die aktuelle Unternehmenspräsentation schnell durchgesehen. Die ZW25-Daten sehen bislang bescheiden aus. Zymeworks steht hier in Konkurrenz zu Mersana, deren Daten zu XMT-1522 eigentlich überfällig sind. Sonst kann ich zum Unternehmen aber nichts sagen, werde mir den Emissionsprospekt und die Patente gelegentlich genauer anschauen.
Antwort auf Beitrag Nr.: 56.605.442 von Joschka Schröder am 03.01.18 20:31:33hallo Joschka
zwecks Cash, es kommen noch die 50 mio. Upfront vom J&J Deal dazu. Guidance für Cashende ist (ohne Einrechnung neuer Deals) Ende 2018.
Lt. CC von der letzten Kooperation soll man sich für weitere Deals mind. die Konditionen des letzten Deals erwarten - die Konditionen der älteren Deals waren bescheiden und wurden mit der Zeit immer besser.
Freue mich auf deine Meinung zu den Patenten!
zwecks Cash, es kommen noch die 50 mio. Upfront vom J&J Deal dazu. Guidance für Cashende ist (ohne Einrechnung neuer Deals) Ende 2018.
Lt. CC von der letzten Kooperation soll man sich für weitere Deals mind. die Konditionen des letzten Deals erwarten - die Konditionen der älteren Deals waren bescheiden und wurden mit der Zeit immer besser.
Freue mich auf deine Meinung zu den Patenten!
Antwort auf Beitrag Nr.: 56.605.442 von Joschka Schröder am 03.01.18 20:31:33Der jüngste Deal (gerade mal einen Monat alt) hat $50 Mio in die Kassen gespült, daher hat pathi recht mit den $100 M.
Bei ZYME ist sehr seltsam, dass man kaum Stücke kaufen kann - weder in Toronto noch an der NASDAQ. Es wird kaum gehandelt, Bid und Ask zudem weit auseinander. D.h. ich könnte hier auch nicht mal läppische 1000 Stücke oder mehr kaufen ohne den Kurs ein bis mehrere Dollar nach oben zu treiben.
Die vielen Partnerschaften in Verbindung mit der extrem niedrigen Marktkapitalisierung und dem kaum gehandelt werden ist schon seltsam. Die ZW25 Daten kann ich wenig beurteilen, die Firma sagte bei ESMO sie wären bisher gut (weil bei extrem mit HER2 agents vorbehandelten Patienten, die MTD noch nicht erreicht und dennoch viele (unconfirmed) Responses (Ergänzung Ville: mit kurzer DoR). Vorteil sei die zwei unterschiedlichen HER2 Epitope Targets, die entweder auch noch bei stark mutierten HER2 Cancer funktionieren oder irgendeinen immuneffect auslösen würden. Kann ich alles nicht beurteilen...
Bei ZYME ist sehr seltsam, dass man kaum Stücke kaufen kann - weder in Toronto noch an der NASDAQ. Es wird kaum gehandelt, Bid und Ask zudem weit auseinander. D.h. ich könnte hier auch nicht mal läppische 1000 Stücke oder mehr kaufen ohne den Kurs ein bis mehrere Dollar nach oben zu treiben.
Die vielen Partnerschaften in Verbindung mit der extrem niedrigen Marktkapitalisierung und dem kaum gehandelt werden ist schon seltsam. Die ZW25 Daten kann ich wenig beurteilen, die Firma sagte bei ESMO sie wären bisher gut (weil bei extrem mit HER2 agents vorbehandelten Patienten, die MTD noch nicht erreicht und dennoch viele (unconfirmed) Responses (Ergänzung Ville: mit kurzer DoR). Vorteil sei die zwei unterschiedlichen HER2 Epitope Targets, die entweder auch noch bei stark mutierten HER2 Cancer funktionieren oder irgendeinen immuneffect auslösen würden. Kann ich alles nicht beurteilen...
Antwort auf Beitrag Nr.: 56.606.267 von Ville7 am 03.01.18 21:36:07January 5, 2018 8:10 AM
Xencor, Inc. (NASDAQ: XNCR), a clinical-stage biopharmaceutical company developing engineered monoclonal antibodies for the treatment of autoimmune disease, asthma and allergic diseases, and cancer, today announced the company's 2018 priorities and expected clinical development and research milestones.
"Xencor has long been committed to leveraging the plug-and-play nature of our XmAb® Fc domains to develop a broad pipeline of antibody therapeutics, and ultimately deliver new medicines to patients with life-threatening and debilitating diseases," said Bassil Dahiyat, Ph.D., president and chief executive officer of Xencor. "In 2018, we will make important strides toward achieving this vision. We expect several milestones across the 11 wholly-owned and partnered XmAb antibody programs currently in clinical development. Our lead internal program, XmAb®5871, is expected to begin its first Phase 3 trial, joining partnered programs ALXN1210 and MOR208 -- being developed by Alexion and MorphoSys, respectively -- in late-stage development. We also expect initial data from our Phase 2 trial of XmAb®5871 in systemic lupus erythematosus (SLE)."
"Turning to our bispecific oncology pipeline, we look forward to announcing first-in-human data for our two most advanced candidates, XmAb®14045 and XmAb®13676. We also plan to expand our clinical-stage bispecific pipeline in 2018, initiating Phase 1 trials of two programs and filing investigational new drug (IND) applications for two others, both of which target the tumor microenvironment. With a broad and prolific antibody engineering platform and deep antibody drug development pipeline, we have a number of robust catalysts ahead in 2018."
The Company's expected clinical development and research milestones are outlined below.
XmAb5871: XmAb5871 is a first-in-class monoclonal antibody that targets CD19 with its variable domain, and uses Xencor's XmAb immune inhibitor Fc domain to target FcyRIIb, a receptor that inhibits B-cell function. Final data from a Phase 2 trial in IgG4-Related Disease were presented in November 2017, and enrollment was completed in the Phase 2 trial in SLE in December.
Expected milestones for XmAb5871 in IgG4-RD:
Initiate Phase 3 trial in the second half of 2018. Following a Type B End of Phase 2 meeting with the U.S. Food and Drug Administration (FDA), Xencor expects this randomized, placebo-controlled, double-blinded trial to evaluate the addition of XmAb5871 to standard-of-care in approximately 250 to 350 patients with IgG4-RD.
Seek scientific advice from the European Medicines Agency in early 2018.
Expected milestones for XmAb5871 in SLE:
Announce initial data from Phase 2 trial in the fourth quarter of 2018.
Bispecific Oncology Pipeline: Xencor's initial bispecific antibody programs are tumor-targeted antibodies that contain both a tumor antigen binding domain and a cytotoxic T-cell binding domain (CD3). These bispecific antibodies activate T cells for highly potent and targeted killing of malignant cells. Their XmAb Fc domains confer long circulating half-lives, stability and ease of manufacture. Xencor is also expanding its bispecific pipeline to include a suite of tumor microenvironment activators that engage multiple targets, such as T-cell checkpoints or agonists.
Expected milestones for tumor-targeted bispecific antibodies:
Announce initial data from Phase 1 study of XmAb14045 for the treatment of AML and other CD123-expressing hematologic malignancies in 2018, pending alignment on timing with Novartis.
Announce initial data from Phase 1 study of XmAb13676 for the treatment of B-cell malignancies in 2018, pending alignment on timing with Novartis.
Initiate Phase 1 trial evaluating XmAb®18087 for the treatment of neuroendocrine tumors and GIST in the first quarter of 2018.
Expected milestones for tumor microenvironment-targeting bispecific antibodies:
Initiate Phase 1 trial evaluating XmAb®20717, a PD-1 x CTLA-4 dual checkpoint inhibitor for the treatment of multiple oncology indications in 2018.
File IND for XmAb®22841, a CTLA-4 x LAG-3 dual checkpoint inhibitor for the treatment of multiple oncology indications in 2018 and initiate a Phase 1 trial in 2019.
File IND for XmAb®23104, a PD-1 x ICOS bispecific antibody for the treatment of multiple oncology indications in 2018 and initiate a Phase 1 trial in 2019.
XmAb®7195: XmAb7195 is a first-in-class monoclonal antibody that targets IgE with its variable domain and uses Xencor's XmAb immune inhibitor Fc domain to target FcyRIIb, resulting in three distinct mechanisms of action for reducing IgE. Data from the subcutaneous Phase 1b study were announced in November 2017 and Xencor is currently seeking a development partner for XmAb7195.
Pipeline Expansion: Xencor continues to apply the XmAb platform to create new drug candidates and is focused on developing additional bispecific molecules for the treatment of cancer.
Expected milestones for pipeline expansion:
File IND for IL-15/IL-15Ra candidate for the treatment of multiple oncology indications in 2019;
Create additional development candidates activating cytotoxic T-cells against tumor antigens and targeting the tumor microenvironment.
A slide presentation describing these research and development goals and other information will be available on the Investor page of the Company's website at www.xencor.com on Monday, January 8, 2018.
Ziele für 2018
Xencor, Inc. (NASDAQ: XNCR), a clinical-stage biopharmaceutical company developing engineered monoclonal antibodies for the treatment of autoimmune disease, asthma and allergic diseases, and cancer, today announced the company's 2018 priorities and expected clinical development and research milestones.
"Xencor has long been committed to leveraging the plug-and-play nature of our XmAb® Fc domains to develop a broad pipeline of antibody therapeutics, and ultimately deliver new medicines to patients with life-threatening and debilitating diseases," said Bassil Dahiyat, Ph.D., president and chief executive officer of Xencor. "In 2018, we will make important strides toward achieving this vision. We expect several milestones across the 11 wholly-owned and partnered XmAb antibody programs currently in clinical development. Our lead internal program, XmAb®5871, is expected to begin its first Phase 3 trial, joining partnered programs ALXN1210 and MOR208 -- being developed by Alexion and MorphoSys, respectively -- in late-stage development. We also expect initial data from our Phase 2 trial of XmAb®5871 in systemic lupus erythematosus (SLE)."
"Turning to our bispecific oncology pipeline, we look forward to announcing first-in-human data for our two most advanced candidates, XmAb®14045 and XmAb®13676. We also plan to expand our clinical-stage bispecific pipeline in 2018, initiating Phase 1 trials of two programs and filing investigational new drug (IND) applications for two others, both of which target the tumor microenvironment. With a broad and prolific antibody engineering platform and deep antibody drug development pipeline, we have a number of robust catalysts ahead in 2018."
The Company's expected clinical development and research milestones are outlined below.
XmAb5871: XmAb5871 is a first-in-class monoclonal antibody that targets CD19 with its variable domain, and uses Xencor's XmAb immune inhibitor Fc domain to target FcyRIIb, a receptor that inhibits B-cell function. Final data from a Phase 2 trial in IgG4-Related Disease were presented in November 2017, and enrollment was completed in the Phase 2 trial in SLE in December.
Expected milestones for XmAb5871 in IgG4-RD:
Initiate Phase 3 trial in the second half of 2018. Following a Type B End of Phase 2 meeting with the U.S. Food and Drug Administration (FDA), Xencor expects this randomized, placebo-controlled, double-blinded trial to evaluate the addition of XmAb5871 to standard-of-care in approximately 250 to 350 patients with IgG4-RD.
Seek scientific advice from the European Medicines Agency in early 2018.
Expected milestones for XmAb5871 in SLE:
Announce initial data from Phase 2 trial in the fourth quarter of 2018.
Bispecific Oncology Pipeline: Xencor's initial bispecific antibody programs are tumor-targeted antibodies that contain both a tumor antigen binding domain and a cytotoxic T-cell binding domain (CD3). These bispecific antibodies activate T cells for highly potent and targeted killing of malignant cells. Their XmAb Fc domains confer long circulating half-lives, stability and ease of manufacture. Xencor is also expanding its bispecific pipeline to include a suite of tumor microenvironment activators that engage multiple targets, such as T-cell checkpoints or agonists.
Expected milestones for tumor-targeted bispecific antibodies:
Announce initial data from Phase 1 study of XmAb14045 for the treatment of AML and other CD123-expressing hematologic malignancies in 2018, pending alignment on timing with Novartis.
Announce initial data from Phase 1 study of XmAb13676 for the treatment of B-cell malignancies in 2018, pending alignment on timing with Novartis.
Initiate Phase 1 trial evaluating XmAb®18087 for the treatment of neuroendocrine tumors and GIST in the first quarter of 2018.
Expected milestones for tumor microenvironment-targeting bispecific antibodies:
Initiate Phase 1 trial evaluating XmAb®20717, a PD-1 x CTLA-4 dual checkpoint inhibitor for the treatment of multiple oncology indications in 2018.
File IND for XmAb®22841, a CTLA-4 x LAG-3 dual checkpoint inhibitor for the treatment of multiple oncology indications in 2018 and initiate a Phase 1 trial in 2019.
File IND for XmAb®23104, a PD-1 x ICOS bispecific antibody for the treatment of multiple oncology indications in 2018 and initiate a Phase 1 trial in 2019.
XmAb®7195: XmAb7195 is a first-in-class monoclonal antibody that targets IgE with its variable domain and uses Xencor's XmAb immune inhibitor Fc domain to target FcyRIIb, resulting in three distinct mechanisms of action for reducing IgE. Data from the subcutaneous Phase 1b study were announced in November 2017 and Xencor is currently seeking a development partner for XmAb7195.
Pipeline Expansion: Xencor continues to apply the XmAb platform to create new drug candidates and is focused on developing additional bispecific molecules for the treatment of cancer.
Expected milestones for pipeline expansion:
File IND for IL-15/IL-15Ra candidate for the treatment of multiple oncology indications in 2019;
Create additional development candidates activating cytotoxic T-cells against tumor antigens and targeting the tumor microenvironment.
A slide presentation describing these research and development goals and other information will be available on the Investor page of the Company's website at www.xencor.com on Monday, January 8, 2018.
Ziele für 2018

Antwort auf Beitrag Nr.: 56.628.323 von Gustl24 am 05.01.18 14:34:27Danke
Übrigens, ALXN1210 wird hier denke ich das erste mal offiziell erwähnt.
Für ALXN ist es ein sehr wichtiges Projekt
Übrigens, ALXN1210 wird hier denke ich das erste mal offiziell erwähnt.
Für ALXN ist es ein sehr wichtiges Projekt
OFF TOPIC
Joschka, Ville, was macht ihr eigentlich im Gentherapie-Bereich, seid ihr hier investiert?
Hab selber noch seh limitiertes Investment (XENE, ADVM), da mir hier noch Basiswissen fehlt. Irgendwie möchte ich mich stärker engangieren, aber so ganz wohl ist mir nicht dabei. Es wird in diesem Bereich wohl sehr viele Flopps geben. Andererseits scheinen die Chancen in dem Bereich sehr hoch. Eure Einschätzung zu diesem Bereich würde mich interessieren.
Und noch ein Off-Topic an Joschka (ich glaube du hast dich in Zusammenhang mit einem MOR-mab mal damit auseinandergesetzt wenn ich mich richtig erinnere): fändest du für die Indikation von hip-fractures ein Medikament mit einem Effekt von ca. 9% auf die lean body mass less head bzw. 8% auf die total lean body mass grundsätzlich interessant (gut verträglich, klare dose-response, small molecule)? Wär das nicht auch ein super Dopingmittel...?
Danke für eure Einschätzung, auch wenn es so gar nicht in diesen Thread passt!
Joschka, Ville, was macht ihr eigentlich im Gentherapie-Bereich, seid ihr hier investiert?
Hab selber noch seh limitiertes Investment (XENE, ADVM), da mir hier noch Basiswissen fehlt. Irgendwie möchte ich mich stärker engangieren, aber so ganz wohl ist mir nicht dabei. Es wird in diesem Bereich wohl sehr viele Flopps geben. Andererseits scheinen die Chancen in dem Bereich sehr hoch. Eure Einschätzung zu diesem Bereich würde mich interessieren.
Und noch ein Off-Topic an Joschka (ich glaube du hast dich in Zusammenhang mit einem MOR-mab mal damit auseinandergesetzt wenn ich mich richtig erinnere): fändest du für die Indikation von hip-fractures ein Medikament mit einem Effekt von ca. 9% auf die lean body mass less head bzw. 8% auf die total lean body mass grundsätzlich interessant (gut verträglich, klare dose-response, small molecule)? Wär das nicht auch ein super Dopingmittel...?
Danke für eure Einschätzung, auch wenn es so gar nicht in diesen Thread passt!
Antwort auf Beitrag Nr.: 56.847.691 von PathFinder2 am 27.01.18 11:45:33richtigerweise lt. einem WO-user ist XENE natürlich nicht gene therapy.
das sollte ein interessantes paper zum thema sein
http://science.sciencemag.org/content/359/6372/eaan4672
das sollte ein interessantes paper zum thema sein
http://science.sciencemag.org/content/359/6372/eaan4672
Antwort auf Beitrag Nr.: 56.656.196 von PathFinder2 am 08.01.18 23:09:17
Einige der früheren Studienergebnisse mit ALXN1210 haben mich nicht restlos überzeugt. Nachdem für die P3-Studien die Dosis geändert worden ist, scheint es nun aber zu laufen. Der extreme Optimismus, den das Alexion-Management verbreitet, spricht dafür, immerhin handelt es sich um open-label-Studien, deren Ergebnisse von Unternehmensseite kontiniuierlich verfolgt werden können.
Die Studienergebnisse der P3 in PNH sollen offiziell im zweiten Quartal 2018 vorliegen, Zulassungsanträge für die USA, Europa und Japan sind für das zweite Halbjahr 2018 geplant.
Mittlerweile wird bereits die zweite Generation der subcutanen Verabreichungsform von ALXN1210 entwickelt, dabei kommt Halozymes Technik zum Einsatz. Außerdem soll ALXN1210 zusätzlich bei Myasthenia gravis und IgA-Nephropathie zum Einsatz kommen. Der Jahresumsatz des Vorgängerpräparates Soliris, das Alexion durch ALXN1210 ersetzen möchte, betrug im abgelaufenen GJ ca. 3,1 Mrd. USD, ohne die Patientenumverteilung in die ALXN1210-Studien wären es ca. 3,2 Mrd. USD gewesen.
Xencor ist stark unterbewertet, spätestens wenn die ALXN1210-Zulassung naht, erwarte ich eine Neubewertung an der Börse.
Zitat von PathFinder2: Danke
Übrigens, ALXN1210 wird hier denke ich das erste mal offiziell erwähnt.
Für ALXN ist es ein sehr wichtiges Projekt
Einige der früheren Studienergebnisse mit ALXN1210 haben mich nicht restlos überzeugt. Nachdem für die P3-Studien die Dosis geändert worden ist, scheint es nun aber zu laufen. Der extreme Optimismus, den das Alexion-Management verbreitet, spricht dafür, immerhin handelt es sich um open-label-Studien, deren Ergebnisse von Unternehmensseite kontiniuierlich verfolgt werden können.
Die Studienergebnisse der P3 in PNH sollen offiziell im zweiten Quartal 2018 vorliegen, Zulassungsanträge für die USA, Europa und Japan sind für das zweite Halbjahr 2018 geplant.
Mittlerweile wird bereits die zweite Generation der subcutanen Verabreichungsform von ALXN1210 entwickelt, dabei kommt Halozymes Technik zum Einsatz. Außerdem soll ALXN1210 zusätzlich bei Myasthenia gravis und IgA-Nephropathie zum Einsatz kommen. Der Jahresumsatz des Vorgängerpräparates Soliris, das Alexion durch ALXN1210 ersetzen möchte, betrug im abgelaufenen GJ ca. 3,1 Mrd. USD, ohne die Patientenumverteilung in die ALXN1210-Studien wären es ca. 3,2 Mrd. USD gewesen.
Xencor ist stark unterbewertet, spätestens wenn die ALXN1210-Zulassung naht, erwarte ich eine Neubewertung an der Börse.
Antwort auf Beitrag Nr.: 56.847.691 von PathFinder2 am 27.01.18 11:45:33Der Gentherapie Bereich ist einer meiner blinden Flecken im Bereich Biotech. Ich hatte mal IONS besessen, als sie noch den Ticker ISIS hatten. Ansonsten halte ich mich da fern, da mir der tiefere Einblick fehlt.
Zudem bin ich gar nicht investiert im CAR-T Bereich, da es mir da ähnlich geht. Ich kann z.B. nicht beurteilen bzw. abschätzen, welche Methode (Zincfinger, TALEN, CRISPR) sich da durchsetzen wird.
Beides wird sich wahrscheinlich irgendwann rächen ...
Ansonsten habe ich heute ein bisschen des zu erwartenden ABLX Geldstromes in die Erhöhung u.a. meines Xencor Bestandes gesteckt.
Zudem bin ich gar nicht investiert im CAR-T Bereich, da es mir da ähnlich geht. Ich kann z.B. nicht beurteilen bzw. abschätzen, welche Methode (Zincfinger, TALEN, CRISPR) sich da durchsetzen wird.
Beides wird sich wahrscheinlich irgendwann rächen ...
Ansonsten habe ich heute ein bisschen des zu erwartenden ABLX Geldstromes in die Erhöhung u.a. meines Xencor Bestandes gesteckt.
ALXN
Q4 Soliris net sales $792M. Full year 2017 net sales $3.14B.
Q4 Soliris net sales $792M. Full year 2017 net sales $3.14B.
$PIRS mit weiterem tollen deal, diesmal mig SGEN. 2ter deal in immuno-onc (nach Servier), 3 targets, für 1 davon co-dev/prom option in US, 30 mio upfront, 1,2 mrd biobucks, bis zu niedrige 2stellige royalties.
nicht schlecht...
https://www.yahoo.com/amphtml/finance/news/pieris-pharmaceut…
hoffe auch bei XNCR geht mal wieder was an der partnerfront
nicht schlecht...
https://www.yahoo.com/amphtml/finance/news/pieris-pharmaceut…
hoffe auch bei XNCR geht mal wieder was an der partnerfront
Antwort auf Beitrag Nr.: 56.983.793 von PathFinder2 am 09.02.18 13:12:35
Webcast und Telefonkonferenz zum vierten Quartal und zum vollständigen Finanzergebnis 2017 veranstalten Dienstag, 20.02.2018 14:01 von PR Newswire
PR Newswire MONROVIA, Kalifornien, 20. Februar 2018 MONROVIA, Kalifornien, 20. Februar 2018 / PRNewswire / - Xencor, Inc. (NASDAQ: XNCR), ein biopharmazeutisches Unternehmen im klinischen Entwicklungsstadium, entwickelt monoklonale Antikörper zur Behandlung von Autoimmunkrankheiten, Asthma, allergischen Erkrankungen und Krebs
Es wird die Finanzergebnisse für das vierte Quartal und das Gesamtjahr 2017 veröffentlichen, nachdem der Markt am Dienstag, den 27. Februar 2018 geschlossen wurde.
Das Xencor-Management wird am selben Tag um 16:30 Uhr einen Webcast und eine Telefonkonferenz abhalten ET (13:30 Uhr PT), um die finanziellen Ergebnisse zu besprechen und ein Corporate Update zu erstellen.
Xencor, Inc. Logo Der Live-Anruf kann unter (877) 359-9508 für Anrufer im Inland oder (224) 357-2393 für internationale Anrufer unter Angabe der Konferenz-ID-Nummer 3991218 abgerufen werden.
Ein Live-Webcast der Telefonkonferenz steht unter "Events & Presentations" zur Verfügung "im Bereich Investoren auf der Website des Unternehmens unter http://investors.xencor.com/events.cfm.
Quelle: https://www.prnewswire.com/news-releases/xencor-to-host-four…
Gruss RS
Xencor
Xencor wird am 27.Februar 2018 Webcast und Telefonkonferenz zum vierten Quartal und zum vollständigen Finanzergebnis 2017 veranstalten Dienstag, 20.02.2018 14:01 von PR Newswire
PR Newswire MONROVIA, Kalifornien, 20. Februar 2018 MONROVIA, Kalifornien, 20. Februar 2018 / PRNewswire / - Xencor, Inc. (NASDAQ: XNCR), ein biopharmazeutisches Unternehmen im klinischen Entwicklungsstadium, entwickelt monoklonale Antikörper zur Behandlung von Autoimmunkrankheiten, Asthma, allergischen Erkrankungen und Krebs
Es wird die Finanzergebnisse für das vierte Quartal und das Gesamtjahr 2017 veröffentlichen, nachdem der Markt am Dienstag, den 27. Februar 2018 geschlossen wurde.
Das Xencor-Management wird am selben Tag um 16:30 Uhr einen Webcast und eine Telefonkonferenz abhalten ET (13:30 Uhr PT), um die finanziellen Ergebnisse zu besprechen und ein Corporate Update zu erstellen.
Xencor, Inc. Logo Der Live-Anruf kann unter (877) 359-9508 für Anrufer im Inland oder (224) 357-2393 für internationale Anrufer unter Angabe der Konferenz-ID-Nummer 3991218 abgerufen werden.
Ein Live-Webcast der Telefonkonferenz steht unter "Events & Presentations" zur Verfügung "im Bereich Investoren auf der Website des Unternehmens unter http://investors.xencor.com/events.cfm.
Quelle: https://www.prnewswire.com/news-releases/xencor-to-host-four…
Gruss RS
Xencor wird am 27.Februar 2018
Webcast und Telefonkonferenz zum vierten Quartal und zum vollständigen Finanzergebnis 2017 veranstalten Dienstag, 20.02.2018 14:01 von PR Newswire
https://www.prnewswire.com/news-releases/xencor-to-host-four…
PR Newswire MONROVIA, Kalifornien, 20. Februar 2018 MONROVIA, Kalifornien, 20. Februar 2018 / PRNewswire / - Xencor, Inc. (NASDAQ: XNCR), ein biopharmazeutisches Unternehmen im klinischen Entwicklungsstadium, entwickelt monoklonale Antikörper zur Behandlung von Autoimmunkrankheiten, Asthma, allergischen Erkrankungen und Krebs
Es wird die Finanzergebnisse für das vierte Quartal und das Gesamtjahr 2017 veröffentlichen, nachdem der Markt am Dienstag, den 27. Februar 2018 geschlossen wurde.
Das Xencor-Management wird am selben Tag um 16:30 Uhr einen Webcast und eine Telefonkonferenz abhalten ET (13:30 Uhr PT), um die finanziellen Ergebnisse zu besprechen und ein Corporate Update zu erstellen.
Xencor, Inc. Logo Der Live-Anruf kann unter (877) 359-9508 für Anrufer im Inland oder (224) 357-2393 für internationale Anrufer unter Angabe der Konferenz-ID-Nummer 3991218 abgerufen werden.
Ein Live-Webcast der Telefonkonferenz steht unter "Events & Presentations" zur Verfügung "im Bereich Investoren auf der Website des Unternehmens unter
http://investors.xencor.com/events.cfm.
Gruss RS
Webcast und Telefonkonferenz zum vierten Quartal und zum vollständigen Finanzergebnis 2017 veranstalten Dienstag, 20.02.2018 14:01 von PR Newswire
https://www.prnewswire.com/news-releases/xencor-to-host-four…
PR Newswire MONROVIA, Kalifornien, 20. Februar 2018 MONROVIA, Kalifornien, 20. Februar 2018 / PRNewswire / - Xencor, Inc. (NASDAQ: XNCR), ein biopharmazeutisches Unternehmen im klinischen Entwicklungsstadium, entwickelt monoklonale Antikörper zur Behandlung von Autoimmunkrankheiten, Asthma, allergischen Erkrankungen und Krebs
Es wird die Finanzergebnisse für das vierte Quartal und das Gesamtjahr 2017 veröffentlichen, nachdem der Markt am Dienstag, den 27. Februar 2018 geschlossen wurde.
Das Xencor-Management wird am selben Tag um 16:30 Uhr einen Webcast und eine Telefonkonferenz abhalten ET (13:30 Uhr PT), um die finanziellen Ergebnisse zu besprechen und ein Corporate Update zu erstellen.
Xencor, Inc. Logo Der Live-Anruf kann unter (877) 359-9508 für Anrufer im Inland oder (224) 357-2393 für internationale Anrufer unter Angabe der Konferenz-ID-Nummer 3991218 abgerufen werden.
Ein Live-Webcast der Telefonkonferenz steht unter "Events & Presentations" zur Verfügung "im Bereich Investoren auf der Website des Unternehmens unter
http://investors.xencor.com/events.cfm.
Gruss RS
Paul Foster, chief medical officer von Xencor, hat am 19.2 und 22.2.2018
5000 und 10000 Aktien verkauft.
Auf die Telefonkonferenz am 27.2. bin ich gespannt.
Alxn 1210 wird in der klinischen Studie nach Ablauf der Studie weiterhin aus ethischen Gründen für die durch die klinische Studie von soliris auf alxn 1210 umgestellten, sich nicht mehr in der Studie befindenden Patienten verwendet.
Spannend wird sein, in welcher Dosis und in welchem Zeitintervall alxn 1210 s.c. im Endeffekt verwendet werden kann.
Anscheinend gibt es Begrenzungen in der mg Menge pro Applikation, welche längere, gewünschte, Zeitintervalle ausschließen könnten.
Aus meiner jüngsten Erfahrung heraus registriere ich eine zunehmende Vertrautheit der Ärzte mit xolair ( IG E) in der Asthmatherapie, einem Wegbereiter für den gleichgerichteten Xencor Antibody.
5000 und 10000 Aktien verkauft.
Auf die Telefonkonferenz am 27.2. bin ich gespannt.
Alxn 1210 wird in der klinischen Studie nach Ablauf der Studie weiterhin aus ethischen Gründen für die durch die klinische Studie von soliris auf alxn 1210 umgestellten, sich nicht mehr in der Studie befindenden Patienten verwendet.
Spannend wird sein, in welcher Dosis und in welchem Zeitintervall alxn 1210 s.c. im Endeffekt verwendet werden kann.
Anscheinend gibt es Begrenzungen in der mg Menge pro Applikation, welche längere, gewünschte, Zeitintervalle ausschließen könnten.
Aus meiner jüngsten Erfahrung heraus registriere ich eine zunehmende Vertrautheit der Ärzte mit xolair ( IG E) in der Asthmatherapie, einem Wegbereiter für den gleichgerichteten Xencor Antibody.
Antwort auf Beitrag Nr.: 57.099.483 von StefanR am 23.02.18 10:48:52
Zunächst einmal läuft mittlerweile die Phase-1-Studie mit XmAb18087, einem bispezifischen SSTR2 x CD3-Antikörper (SSTR2 = somatostatin receptor 2). Indikation: Neuroendokrinale und bestimmte gastrointestionale Tumoren.
Drei weitere bispezifische Tumoren sollen im laufenden Jahr in die klinische Studienphase eintreten (Indikation jeweils solide Tumoren).
Da Xencor eine ungewöhnlich große präklinische Pipeline generiert hat, liegt es eigentlich nahe, dass Xencor nach Abschluss der jeweiligen P1 Präparate partiell auslizensieren wird, so ähnlich, wie man es mit XmAb14045 und XmAb13676 getan hat. In diesen Fällen sind die EX-US-Rechte (sogar schon vor Eintritt in P1) zu ausgezeichneten Konditionen an Novartis verkauft worden (150 Mio. USD Upfront, 700 Mio. Milestones - in anderen Präsentationen ist von 2,4 Mrd. USd die Rede, dort sind m.E. aber noch andere Lizenzabkommen mit Novartis berücksichtigt worden, Royalties im zweistelligen Prozentbereich) usw.
Speziell die immun-onoklogischen Präparate XmAb20717, XmAb22841 und XmAb23104 bieten sich für lukrative Partnerschaften an.
zu Punkt 1)
Die aktuelle P3-Dosis ist offensichtlich mehr oder weniger theoretisch aus den PK-Daten der in früheren Studien verwendeten (aus meiner Sicht nicht besonders überzeugenden) Dosierungen abgeleitet worden. Um so gespannter bin auch ich auf die Phase-3-Daten. Es gibt einige Punkte, die dafür sprechen, dass die aktuelle Dosis zu den gewünschten Ergebnissen geführt hat (einen Punkt hast Du schon selbst genannt, dazu kommen noch die durch und durch optimistische Berichterstattung durch die Unternehmensführung, die ja permanent in die Ergebnisse der laufenden open-label-Studien Einblick hat, und der Start weiterer Studien in anderen Indikationen).
zu Punkt 2)
Der anti-IgE-Antikörper XmAb7195 besitzt bekanntlich im Vergleich zu Xolair einige zusätzliche Mechanismen, die zu einer deutlich verstärkten Absenkung des freien IgE führen (z.B. via Hemmung der Bildung IgE-produzierender Plasmazellen). Insoweit verfolgt Xencor mit XmAb7195 einen umfassenden Ansatz, vergleichbar mit QGE-031 von Novartis, dessen Entwicklung (trotz ausgezeichneter Ergebnisse) aus unternehmenspolitischen Gründen auf Eis gelegt worden ist. Da nach Umstellung von XmAb7195 auf die subcutan-Formulierung keinerlei urtikariellen Nebenwirkungen mehr aufgetreten sind (waren für mich in der i.v.-Formulierung ein Grund, dem Antikörper zunächst keinen Wert beizumessen), ist XmAb7195 zu einem sehr interessanten Präparat geworden. Mit XmAB7195 könnten auch Patienten behandelt werden, die sehr hohe IgE-Titer aufweisen (dafür ist Xolair nicht zugelassen).
Zitat von PathFinder2: hoffe auch bei XNCR geht mal wieder was an der partnerfront
Zunächst einmal läuft mittlerweile die Phase-1-Studie mit XmAb18087, einem bispezifischen SSTR2 x CD3-Antikörper (SSTR2 = somatostatin receptor 2). Indikation: Neuroendokrinale und bestimmte gastrointestionale Tumoren.
Drei weitere bispezifische Tumoren sollen im laufenden Jahr in die klinische Studienphase eintreten (Indikation jeweils solide Tumoren).
Da Xencor eine ungewöhnlich große präklinische Pipeline generiert hat, liegt es eigentlich nahe, dass Xencor nach Abschluss der jeweiligen P1 Präparate partiell auslizensieren wird, so ähnlich, wie man es mit XmAb14045 und XmAb13676 getan hat. In diesen Fällen sind die EX-US-Rechte (sogar schon vor Eintritt in P1) zu ausgezeichneten Konditionen an Novartis verkauft worden (150 Mio. USD Upfront, 700 Mio. Milestones - in anderen Präsentationen ist von 2,4 Mrd. USd die Rede, dort sind m.E. aber noch andere Lizenzabkommen mit Novartis berücksichtigt worden, Royalties im zweistelligen Prozentbereich) usw.
Speziell die immun-onoklogischen Präparate XmAb20717, XmAb22841 und XmAb23104 bieten sich für lukrative Partnerschaften an.
Zitat von StefanR: Spannend wird sein, in welcher Dosis und in welchem Zeitintervall alxn 1210 s.c. im Endeffekt verwendet werden kann.
Anscheinend gibt es Begrenzungen in der mg Menge pro Applikation, welche längere, gewünschte, Zeitintervalle ausschließen könnten.
Aus meiner jüngsten Erfahrung heraus registriere ich eine zunehmende Vertrautheit der Ärzte mit xolair ( IG E) in der Asthmatherapie, einem Wegbereiter für den gleichgerichteten Xencor Antibody.
zu Punkt 1)
Die aktuelle P3-Dosis ist offensichtlich mehr oder weniger theoretisch aus den PK-Daten der in früheren Studien verwendeten (aus meiner Sicht nicht besonders überzeugenden) Dosierungen abgeleitet worden. Um so gespannter bin auch ich auf die Phase-3-Daten. Es gibt einige Punkte, die dafür sprechen, dass die aktuelle Dosis zu den gewünschten Ergebnissen geführt hat (einen Punkt hast Du schon selbst genannt, dazu kommen noch die durch und durch optimistische Berichterstattung durch die Unternehmensführung, die ja permanent in die Ergebnisse der laufenden open-label-Studien Einblick hat, und der Start weiterer Studien in anderen Indikationen).
zu Punkt 2)
Der anti-IgE-Antikörper XmAb7195 besitzt bekanntlich im Vergleich zu Xolair einige zusätzliche Mechanismen, die zu einer deutlich verstärkten Absenkung des freien IgE führen (z.B. via Hemmung der Bildung IgE-produzierender Plasmazellen). Insoweit verfolgt Xencor mit XmAb7195 einen umfassenden Ansatz, vergleichbar mit QGE-031 von Novartis, dessen Entwicklung (trotz ausgezeichneter Ergebnisse) aus unternehmenspolitischen Gründen auf Eis gelegt worden ist. Da nach Umstellung von XmAb7195 auf die subcutan-Formulierung keinerlei urtikariellen Nebenwirkungen mehr aufgetreten sind (waren für mich in der i.v.-Formulierung ein Grund, dem Antikörper zunächst keinen Wert beizumessen), ist XmAb7195 zu einem sehr interessanten Präparat geworden. Mit XmAB7195 könnten auch Patienten behandelt werden, die sehr hohe IgE-Titer aufweisen (dafür ist Xolair nicht zugelassen).
Antwort auf Beitrag Nr.: 57.100.281 von Joschka Schröder am 23.02.18 11:42:04
Muss natürlich heissen "drei weitere bispezifische Antikörper". Sorry wegen der Flüchtigkeitsfehler. Lassen sich leider nicht ganz vermeiden, wenn man unter Zeitdruck schnell einen Beitrag tippt.
Zitat von Joschka Schröder: Drei weitere bispezifische Tumoren sollen im laufenden Jahr in die klinische Studienphase eintreten (Indikation jeweils solide Tumoren).
Muss natürlich heissen "drei weitere bispezifische Antikörper". Sorry wegen der Flüchtigkeitsfehler. Lassen sich leider nicht ganz vermeiden, wenn man unter Zeitdruck schnell einen Beitrag tippt.
Antwort auf Beitrag Nr.: 57.107.187 von Joschka Schröder am 23.02.18 23:02:24cell lines agreement Xencor - Selexis
https://www.businesswire.com/news/home/20180226005049/en/Xen…" target="_blank" rel="nofollow ugc noopener">
https://www.businesswire.com/news/home/20180226005049/en/Xen…
https://www.businesswire.com/news/home/20180226005049/en/Xen…" target="_blank" rel="nofollow ugc noopener">
https://www.businesswire.com/news/home/20180226005049/en/Xen…
Morgen gibt´s nachbörslich die Zahlen für 2017. Mittlerweile kommt nun auch allmählich Bewegung in den Aktienkurs, über 40 % plus während der letzten drei Monate und das Potential ist noch lange nicht ausgereizt.
Derzeit wäre ein Börsenkurs von mindestens 50 USD angemessen, das entspräche einem Unternehmenswert von knapp 2 Mrd USD. Stark unterschätzt wird XmAb5871, der an CD19 bindet und inhibierende Wirkung hat, nicht aber zu einer unerwünschten Depletion führt. Die Phase 2-Ergebnisse in der Indikation IgG4-related diseases waren bereits überzeugend und in der schwierig zu behandelnden Indikation Lupus erythematodes sollte der Antikörper nach meinem theoretischen Verständnis ebenfalls wirken. Ergebnisse gibts in Q4. Sobald die Entwicklungen für Aussenstehende nicht mehr zu übersehen sind, erwarte ich eine ähnliche Kursentwicklung wie jüngst bei Ablynx.
Antwort auf Beitrag Nr.: 57.127.284 von Joschka Schröder am 26.02.18 23:25:35Sehe ich fundamental ähnlich - könnte mir gut 2,5-3 Mrd USD MK bis 2021 vorstellen. Die Unbekannte ist der Kapitalbedarf und ob es noch weitere Verwässerungen geben muss.
Wenn ich auf den Chart, die treppenartigen Anstiege zuvor und den Ausbruch aus dem Dreieck schaue, dann könnte das mittelfristig erst mal nach USD 40-45 aussehen.
Wenn ich auf den Chart, die treppenartigen Anstiege zuvor und den Ausbruch aus dem Dreieck schaue, dann könnte das mittelfristig erst mal nach USD 40-45 aussehen.
link zur quartalsmeldung:
https://finance.yahoo.com/news/xencor-reports-fourth-quarter…
da tut sich schon einiges...
https://finance.yahoo.com/news/xencor-reports-fourth-quarter…
da tut sich schon einiges...
Antwort auf Beitrag Nr.: 57.138.948 von PathFinder2 am 27.02.18 22:21:04Die wissenschaftliche Produktivität ist beeindruckend. Plattformentwicklung, Targetselektion und Entwicklungsgeschwindigkeit der Präparate top, gleichzeitig enormes Kostenbewusstsein ... eine derartige Konstellation findet man selten. Die aktuellen Cashreserven werden bis über das Jahr 2020 hinaus reichen ... bis dahin werden vermutlich allein aus den Verträgen mit Morphosys und Alexion weitere Beträge im dreistelligen Millionenbereich an Xencor fließen. Ins Bild paßt, dass die Analystenschätzungen für 2017 deutlich übertroffen worden sind. Als Aktionär kann man derzeit einfach nur zufrieden sein.
Antwort auf Beitrag Nr.: 57.139.434 von Joschka Schröder am 28.02.18 00:34:23ein charttechnischer Leckerbissen - schöner Ausbruch und viel Luft nach oben.
Da wird jetzt das Hunderl dem Herrchen wieder Mal davonlaufen ;-)
Da wird jetzt das Hunderl dem Herrchen wieder Mal davonlaufen ;-)
Bei anderen Firmen mit einer guten Technologie und diesen Wertentwicklungschancen reden wir öfter mal über eine mögliche Übernahme. Hier war das bis jetzt aus meiner Erinnerung noch nicht richtig ein Thema.
Wie seht ihr die Möglichkeit/Gefahr/Chance einer Übernahme von Xencor?
Wie seht ihr die Möglichkeit/Gefahr/Chance einer Übernahme von Xencor?
Antwort auf Beitrag Nr.: 57.175.516 von hinz12 am 03.03.18 09:47:32Ich glaube der nächste Schritt werden die P3 Studienergebnisse ALXN1210 sein.
Wie bereits mehrfach geschrieben ist das Alexion-Management recht euphorisch in ihren letzten Äußerungen. Dann nahende Zulassungsbemühungen in H2 2018.
Ob dann diese Entwicklung bzgl. einer Übernahme realistischer wird ist pure Spekulation- meist wird man ja doch überrascht...
Erstaunlich finde ich hier und auch bei CytomX, dass Verkäufe aus dem Vorstand absolut keinen Einfluss auf nahende Kurssprünge haben bei beiden Aktien wurden unmittelbar vor den rel. großen Kurszuwächsen der letzten Tage Aktien (auch aus Optionsprogrammen) über den Markt verkauft und unmittelbar wenige Tage später bei höheren Umsätzen >10%.
bei beiden Aktien wurden unmittelbar vor den rel. großen Kurszuwächsen der letzten Tage Aktien (auch aus Optionsprogrammen) über den Markt verkauft und unmittelbar wenige Tage später bei höheren Umsätzen >10%.
Hoffentlich hält diese erfreuliche Entwicklung an.
Wie bereits mehrfach geschrieben ist das Alexion-Management recht euphorisch in ihren letzten Äußerungen. Dann nahende Zulassungsbemühungen in H2 2018.
Ob dann diese Entwicklung bzgl. einer Übernahme realistischer wird ist pure Spekulation- meist wird man ja doch überrascht...
Erstaunlich finde ich hier und auch bei CytomX, dass Verkäufe aus dem Vorstand absolut keinen Einfluss auf nahende Kurssprünge haben
 bei beiden Aktien wurden unmittelbar vor den rel. großen Kurszuwächsen der letzten Tage Aktien (auch aus Optionsprogrammen) über den Markt verkauft und unmittelbar wenige Tage später bei höheren Umsätzen >10%.
bei beiden Aktien wurden unmittelbar vor den rel. großen Kurszuwächsen der letzten Tage Aktien (auch aus Optionsprogrammen) über den Markt verkauft und unmittelbar wenige Tage später bei höheren Umsätzen >10%.Hoffentlich hält diese erfreuliche Entwicklung an.
Antwort auf Beitrag Nr.: 57.181.125 von Gustl24 am 04.03.18 12:02:19http://news.alexionpharma.com/press-release/product-news/ale…
Antwort auf Beitrag Nr.: 57.286.417 von biopadawan am 15.03.18 11:50:47Sehr schön. Non-Inferior zu Soliris ohne Wenn und Aber.
Und darüber hinaus sogar: "In addition, numeric results for all six endpoints favored ALXN1210."
Und darüber hinaus sogar: "In addition, numeric results for all six endpoints favored ALXN1210."
Antwort auf Beitrag Nr.: 57.286.936 von Ville7 am 15.03.18 12:44:02
Dazu noch der Vorteil bei der Verabreichung! Mal sehen, ob der Markt das heute auch mit XNCR in Verbindung bringt...

Dazu noch der Vorteil bei der Verabreichung! Mal sehen, ob der Markt das heute auch mit XNCR in Verbindung bringt...
Antwort auf Beitrag Nr.: 56.860.670 von Joschka Schröder am 29.01.18 12:43:07
Respekt, Alexion ist mit einem veränderten Dosisregime in die Phase 3 gegangen, das aus PK-Daten theoretisch hergegeleitet bzw. berechnet worden ist ... und es hat in diesem Fall tatsächlich überzeugend funktioniert. Das war keineswegs selbstverständlich. Xencor steht damit vor der ersten Zulassung eines mit der eigenen Xtend-Technik entwickelten Antikörpers. Ein Meilenstein in der Unternehmensgeschichte.
Zitat von Joschka Schröder: Einige der früheren Studienergebnisse mit ALXN1210 haben mich nicht restlos überzeugt. Nachdem für die P3-Studien die Dosis geändert worden ist, scheint es nun aber zu laufen. Der extreme Optimismus, den das Alexion-Management verbreitet, spricht dafür, immerhin handelt es sich um open-label-Studien, deren Ergebnisse von Unternehmensseite kontiniuierlich verfolgt werden können.
Die Studienergebnisse der P3 in PNH sollen offiziell im zweiten Quartal 2018 vorliegen, Zulassungsanträge für die USA, Europa und Japan sind für das zweite Halbjahr 2018 geplant.
Respekt, Alexion ist mit einem veränderten Dosisregime in die Phase 3 gegangen, das aus PK-Daten theoretisch hergegeleitet bzw. berechnet worden ist ... und es hat in diesem Fall tatsächlich überzeugend funktioniert. Das war keineswegs selbstverständlich. Xencor steht damit vor der ersten Zulassung eines mit der eigenen Xtend-Technik entwickelten Antikörpers. Ein Meilenstein in der Unternehmensgeschichte.
Ich habe mir mal den Call von Alexion zu den Ergebnissen heute angehört. Bei Minute 40 kommt man auf die Pricing-Frage von ALXN1210 und den Zusammenhang mit Soliris zu sprechen. Alexion wollte dazu keine konkreten Aussagen machen. Sie meinten aber, dass sie jedes Medikament einzeln betrachten und jedes für sich wertvoll ist.
Ich weiß nicht, ob ich das missverstanden habe, aber es klang meiner Meinung nach nicht danach das ALXN1210 Soliris komplett ersetzt. Auch wenn es ja mit der 8-wöchigen Gabe einen großen Vorteil zu der zweiwöchigen von Soliris hat und die Daten auch sonst etwas besser waren.
Es wurde mehrfach betont, dass sie mit ALXN1210 einen starken "Case" haben. Ob das allerdings heißt, dass die 4 Mrd. Umsatz von Soliris zu ALXN1210 wandern, da bin ich mir nicht so sicher.
Wer selber reinhören möchte http://ir.alexion.com/events.cfm
Einfach eine E-Mail-Adresse angeben und los gehts.
Ich weiß nicht, ob ich das missverstanden habe, aber es klang meiner Meinung nach nicht danach das ALXN1210 Soliris komplett ersetzt. Auch wenn es ja mit der 8-wöchigen Gabe einen großen Vorteil zu der zweiwöchigen von Soliris hat und die Daten auch sonst etwas besser waren.
Es wurde mehrfach betont, dass sie mit ALXN1210 einen starken "Case" haben. Ob das allerdings heißt, dass die 4 Mrd. Umsatz von Soliris zu ALXN1210 wandern, da bin ich mir nicht so sicher.
Wer selber reinhören möchte http://ir.alexion.com/events.cfm
Einfach eine E-Mail-Adresse angeben und los gehts.
hat jemand eine Information, wie das Lizenzabkommen mit Alexion gestrickt sein könnte?
Antwort auf Beitrag Nr.: 57.302.758 von infomi am 16.03.18 19:33:13
"Under the agreement, we received an upfront payment of $3.0 million. Alexion is also required to pay an annual maintenance fee of $0.5 million during the research term of the agreement and $1.0 million during any extension of the research term. In addition, if certain development, regulatory and commercial milestones are achieved, we are eligible to receive up to $66.5 million for the first product to achieve such milestones on a target‑by‑target basis. If licensed products are successfully commercialized, we are also entitled to receive royalties based on a percentage of net sales of such products sold by Alexion, its affiliates or its sub licensees, which percentage is in the low single digits. Alexion’s royalty obligations continue on a product‑by‑product and country‑by‑ country basis until the expiration of the last‑to‑expire valid claim in a licensed patent covering the applicable product in such country..."
Royalties wohl 2-3% Bereich, d.h. könnten ca. jährlich 40-50 Mio. für Xencor bedeuten...
Zitat von infomi: hat jemand eine Information, wie das Lizenzabkommen mit Alexion gestrickt sein könnte?
"Under the agreement, we received an upfront payment of $3.0 million. Alexion is also required to pay an annual maintenance fee of $0.5 million during the research term of the agreement and $1.0 million during any extension of the research term. In addition, if certain development, regulatory and commercial milestones are achieved, we are eligible to receive up to $66.5 million for the first product to achieve such milestones on a target‑by‑target basis. If licensed products are successfully commercialized, we are also entitled to receive royalties based on a percentage of net sales of such products sold by Alexion, its affiliates or its sub licensees, which percentage is in the low single digits. Alexion’s royalty obligations continue on a product‑by‑product and country‑by‑ country basis until the expiration of the last‑to‑expire valid claim in a licensed patent covering the applicable product in such country..."
Royalties wohl 2-3% Bereich, d.h. könnten ca. jährlich 40-50 Mio. für Xencor bedeuten...
Antwort auf Beitrag Nr.: 57.304.813 von Gustl24 am 17.03.18 04:54:44
Danke, dann wäre das heutige Market Cap schon alleine durch diese Royalties gerechtfertigt. Kommt natürlich auch darauf an, wie man wie man das Produkt neben Soliris im Markt positioniert.
Schaut mir dennoch recht unterbewertet aus das Unternehmen.
Zitat von Gustl24:Zitat von infomi: hat jemand eine Information, wie das Lizenzabkommen mit Alexion gestrickt sein könnte?
"Under the agreement, we received an upfront payment of $3.0 million. Alexion is also required to pay an annual maintenance fee of $0.5 million during the research term of the agreement and $1.0 million during any extension of the research term. In addition, if certain development, regulatory and commercial milestones are achieved, we are eligible to receive up to $66.5 million for the first product to achieve such milestones on a target‑by‑target basis. If licensed products are successfully commercialized, we are also entitled to receive royalties based on a percentage of net sales of such products sold by Alexion, its affiliates or its sub licensees, which percentage is in the low single digits. Alexion’s royalty obligations continue on a product‑by‑product and country‑by‑ country basis until the expiration of the last‑to‑expire valid claim in a licensed patent covering the applicable product in such country..."
Royalties wohl 2-3% Bereich, d.h. könnten ca. jährlich 40-50 Mio. für Xencor bedeuten...
Danke, dann wäre das heutige Market Cap schon alleine durch diese Royalties gerechtfertigt. Kommt natürlich auch darauf an, wie man wie man das Produkt neben Soliris im Markt positioniert.
Schaut mir dennoch recht unterbewertet aus das Unternehmen.
Kapitalerhöhung
http://investors.xencor.com/news-releases/news-release-detai…
MONROVIA, Calif., March 19, 2018 /PRNewswire/ -- Xencor, Inc. (XNCR) today announced that it intends to offer and sell, subject to market and other conditions, 5,000,000 shares of its common stock in an underwritten public offering. Xencor expects to grant the underwriters a 30-day option to purchase up to an additional 750,000 shares of common stock. All of the shares are being offered by Xencor. There can be no assurance as to whether or when the offering may be completed, or as to the actual size or terms of the offering.
Xencor anticipates using the net proceeds from the offering for working capital and general corporate purposes, including for research and development expenses, general and administrative expenses, manufacturing and clinical development expenses.
Leerink Partners and Piper Jaffray & Co. are acting as joint book-running managers in the offering.
A shelf registration statement relating to the shares was previously filed with and became effective by rule of the Securities and Exchange Commission. The offering is being made solely by means of a prospectus. A preliminary prospectus supplement and accompanying prospectus relating to the offering will be filed with the Securities and Exchange Commission (SEC) and will be available on the SEC's website located at http://www.sec.gov. A copy of the preliminary prospectus supplement and accompanying prospectus relating to the offering, when available, may be obtained from Leerink Partners LLC, Attention: Syndicate Department, One Federal Street, 37th Floor, Boston, MA 02110, or by telephone at (800) 808-7525 x6132 or by email at syndicate@leerink.com; or Piper Jaffray & Co., Attention: Prospectus Department, 800 Nicollet Mall, J12S03, Minneapolis, MN 55402, or by telephone at 800-747-3924, or by email at prospectus@pjc.com.
This press release shall not constitute an offer to sell or the solicitation of an offer to buy these securities, nor shall there be any sale of these securities in any state or jurisdiction in which such offer, solicitation or sale would be unlawful prior to registration or qualification under the securities laws of any such state or jurisdiction.
Ca. 150 Mio. Dollar Einnahmen. Also etwas mehr als 10 %. Wenn Xencor damit groß wird meinetwegen. War wohl nicht zu vermeiden. Wenigstens nutzen sie den hohen Kurs.
http://investors.xencor.com/news-releases/news-release-detai…
MONROVIA, Calif., March 19, 2018 /PRNewswire/ -- Xencor, Inc. (XNCR) today announced that it intends to offer and sell, subject to market and other conditions, 5,000,000 shares of its common stock in an underwritten public offering. Xencor expects to grant the underwriters a 30-day option to purchase up to an additional 750,000 shares of common stock. All of the shares are being offered by Xencor. There can be no assurance as to whether or when the offering may be completed, or as to the actual size or terms of the offering.
Xencor anticipates using the net proceeds from the offering for working capital and general corporate purposes, including for research and development expenses, general and administrative expenses, manufacturing and clinical development expenses.
Leerink Partners and Piper Jaffray & Co. are acting as joint book-running managers in the offering.
A shelf registration statement relating to the shares was previously filed with and became effective by rule of the Securities and Exchange Commission. The offering is being made solely by means of a prospectus. A preliminary prospectus supplement and accompanying prospectus relating to the offering will be filed with the Securities and Exchange Commission (SEC) and will be available on the SEC's website located at http://www.sec.gov. A copy of the preliminary prospectus supplement and accompanying prospectus relating to the offering, when available, may be obtained from Leerink Partners LLC, Attention: Syndicate Department, One Federal Street, 37th Floor, Boston, MA 02110, or by telephone at (800) 808-7525 x6132 or by email at syndicate@leerink.com; or Piper Jaffray & Co., Attention: Prospectus Department, 800 Nicollet Mall, J12S03, Minneapolis, MN 55402, or by telephone at 800-747-3924, or by email at prospectus@pjc.com.
This press release shall not constitute an offer to sell or the solicitation of an offer to buy these securities, nor shall there be any sale of these securities in any state or jurisdiction in which such offer, solicitation or sale would be unlawful prior to registration or qualification under the securities laws of any such state or jurisdiction.
Ca. 150 Mio. Dollar Einnahmen. Also etwas mehr als 10 %. Wenn Xencor damit groß wird meinetwegen. War wohl nicht zu vermeiden. Wenigstens nutzen sie den hohen Kurs.
Hier mal alle Kapitalmaßnahmen:
2013 IPO
14,639,500 shares - Preis $5.50 - Erlös: $72.4 million
MONROVIA, Calif., December 6, 2013- Xencor, Inc. (NASDAQ: XNCR) today announced the closing of its initial public offering of 14,639,500 shares of its common stock at an initial public offering price of $5.50 per share, which includes the exercise in full by the underwriters of their option to purchase up to 1,909,500 additional shares of common stock. Xencor's common stock is listed on The NASDAQ Global Market under the trading symbol "XNCR." All of the shares in the offering were offered by Xencor. Xencor estimates net proceeds from the offering to be approximately $72.4 million, after deducting underwriting discounts and commissions and estimated offering expenses.
2015 1. Kapitalerhöhung
8,625,000 shares - Preis $14.25 - Erlös: $122.9 million
MONROVIA, Calif., March 2, 2015 /PRNewswire/ -- Xencor, Inc. (NASDAQ: XNCR) today announced the completion of an underwritten public offering of 8,625,000 shares of its common stock, including 1,125,000 shares sold pursuant to the full exercise of an option previously granted to the underwriters to purchase additional shares of common stock. All of the shares were offered by Xencor at a price to the public of $14.25 per share. The gross proceeds to Xencor from this offering, before deducting underwriting discounts and commissions and other offering expenses payable by Xencor, were approximately $122.9 million.
Xencor anticipates using the net proceeds from the offering for general corporate purposes, which may include clinical development of its lead drug candidates, product candidate discovery, technology development, patent prosecution activities, working capital and other general corporate purposes.
2016 2. Kapitalerhöhung
5,272,750 shares - Preis $24.00 - Erlös: $126.5 million
MONROVIA, Calif., Dec. 6, 2016 /PRNewswire/ -- Xencor, Inc. (NASDAQ: XNCR) today announced the completion of an underwritten public offering of 5,272,750 shares of its common stock, including 687,750 shares sold pursuant to the full exercise of an option previously granted to the underwriters to purchase additional shares of common stock. All of the shares were offered by Xencor at a price to the public of $24.00 per share. The gross proceeds to Xencor from this offering, before deducting underwriting discounts and commissions and other offering expenses payable by Xencor, were approximately $126.5 million.
Xencor anticipates using the net proceeds from the offering for working capital and general corporate purposes, including additional investments in advancing its lead compound XmAb®5871 through later stages of clinical development and additional investment in its immune-oncology pipeline and technology.
2018 3. Kapitalerhöhung
max. 5,750,00 shares - Preis ca. $30.00 - Erlös: max $172.5 million
MONROVIA, Calif., March 19, 2018 /PRNewswire/ -- Xencor, Inc. (NASDAQ: XNCR) today announced that it intends to offer and sell, subject to market and other conditions, 5,000,000 shares of its common stock in an underwritten public offering. Xencor expects to grant the underwriters a 30-day option to purchase up to an additional 750,000 shares of common stock. All of the shares are being offered by Xencor. There can be no assurance as to whether or when the offering may be completed, or as to the actual size or terms of the offering.
Xencor anticipates using the net proceeds from the offering for working capital and general corporate purposes, including for research and development expenses, general and administrative expenses, manufacturing and clinical development expenses.
Immer mehr Geld für weniger Verwässerung. Hoffentlich war dies die letzte Kapitalerhöhung, bevor richtig Geld verdient wird. Das Geld sollte jetzt mit ca. 400 - 410 Mio. Dollar (ohne Extra-Zahlung von Partnern) am Ende 2018 eigentlich reichen.
2013 IPO
14,639,500 shares - Preis $5.50 - Erlös: $72.4 million
MONROVIA, Calif., December 6, 2013- Xencor, Inc. (NASDAQ: XNCR) today announced the closing of its initial public offering of 14,639,500 shares of its common stock at an initial public offering price of $5.50 per share, which includes the exercise in full by the underwriters of their option to purchase up to 1,909,500 additional shares of common stock. Xencor's common stock is listed on The NASDAQ Global Market under the trading symbol "XNCR." All of the shares in the offering were offered by Xencor. Xencor estimates net proceeds from the offering to be approximately $72.4 million, after deducting underwriting discounts and commissions and estimated offering expenses.
2015 1. Kapitalerhöhung
8,625,000 shares - Preis $14.25 - Erlös: $122.9 million
MONROVIA, Calif., March 2, 2015 /PRNewswire/ -- Xencor, Inc. (NASDAQ: XNCR) today announced the completion of an underwritten public offering of 8,625,000 shares of its common stock, including 1,125,000 shares sold pursuant to the full exercise of an option previously granted to the underwriters to purchase additional shares of common stock. All of the shares were offered by Xencor at a price to the public of $14.25 per share. The gross proceeds to Xencor from this offering, before deducting underwriting discounts and commissions and other offering expenses payable by Xencor, were approximately $122.9 million.
Xencor anticipates using the net proceeds from the offering for general corporate purposes, which may include clinical development of its lead drug candidates, product candidate discovery, technology development, patent prosecution activities, working capital and other general corporate purposes.
2016 2. Kapitalerhöhung
5,272,750 shares - Preis $24.00 - Erlös: $126.5 million
MONROVIA, Calif., Dec. 6, 2016 /PRNewswire/ -- Xencor, Inc. (NASDAQ: XNCR) today announced the completion of an underwritten public offering of 5,272,750 shares of its common stock, including 687,750 shares sold pursuant to the full exercise of an option previously granted to the underwriters to purchase additional shares of common stock. All of the shares were offered by Xencor at a price to the public of $24.00 per share. The gross proceeds to Xencor from this offering, before deducting underwriting discounts and commissions and other offering expenses payable by Xencor, were approximately $126.5 million.
Xencor anticipates using the net proceeds from the offering for working capital and general corporate purposes, including additional investments in advancing its lead compound XmAb®5871 through later stages of clinical development and additional investment in its immune-oncology pipeline and technology.
2018 3. Kapitalerhöhung
max. 5,750,00 shares - Preis ca. $30.00 - Erlös: max $172.5 million
MONROVIA, Calif., March 19, 2018 /PRNewswire/ -- Xencor, Inc. (NASDAQ: XNCR) today announced that it intends to offer and sell, subject to market and other conditions, 5,000,000 shares of its common stock in an underwritten public offering. Xencor expects to grant the underwriters a 30-day option to purchase up to an additional 750,000 shares of common stock. All of the shares are being offered by Xencor. There can be no assurance as to whether or when the offering may be completed, or as to the actual size or terms of the offering.
Xencor anticipates using the net proceeds from the offering for working capital and general corporate purposes, including for research and development expenses, general and administrative expenses, manufacturing and clinical development expenses.
Immer mehr Geld für weniger Verwässerung. Hoffentlich war dies die letzte Kapitalerhöhung, bevor richtig Geld verdient wird. Das Geld sollte jetzt mit ca. 400 - 410 Mio. Dollar (ohne Extra-Zahlung von Partnern) am Ende 2018 eigentlich reichen.
Antwort auf Beitrag Nr.: 57.324.551 von hinz12 am 19.03.18 22:18:40Sehr gut zusammengefasst. Danke!
Eine KE kann auch gut sein, wenn damit Werte geschaffen werden. Doof ist es vor allem dann, wenn man Geld benötigt und der Kurs Unten ist. (Die Marktreaktion heute überrascht mich allerdings. Man scheint einen guten Preis zu antizipieren.)
Neulich hat das mal jemand für Juno und Kite in einer Grafik dargestellt.
Eine KE kann auch gut sein, wenn damit Werte geschaffen werden. Doof ist es vor allem dann, wenn man Geld benötigt und der Kurs Unten ist. (Die Marktreaktion heute überrascht mich allerdings. Man scheint einen guten Preis zu antizipieren.)
Neulich hat das mal jemand für Juno und Kite in einer Grafik dargestellt.

Jetzt waren es doch plötzlich 7,3 Mio Aktien (plus weitere 1,1 sind möglich), anstelle von 5 Mio Aktien. Zu 31 USD.
Scheint so als haben sie durch die hohe Nachfrage das Angebot kurzfristig ausgeweitet.
Wie bei Ablynx sollte die (voraussichtlich letzte) KE aber nun eigentlich positiv sein und mittelfristig zu einer Angebotsverknappung und einem weiteren Anstieg führen.
Scheint so als haben sie durch die hohe Nachfrage das Angebot kurzfristig ausgeweitet.
Wie bei Ablynx sollte die (voraussichtlich letzte) KE aber nun eigentlich positiv sein und mittelfristig zu einer Angebotsverknappung und einem weiteren Anstieg führen.
Antwort auf Beitrag Nr.: 57.339.866 von Ville7 am 21.03.18 10:52:21Die aktuellen Turbulenzen an den Kapitalmärkten scheinen auch Xencors Kapitalerhöhung zu tangieren. Unter normalen Umständen wären die Kapitalmassnahmen vermutlich bereits abgeschlossen.
"The offering is expected to close on or about March 23, 2018, subject to customary closing condition."
"The offering is expected to close on or about March 23, 2018, subject to customary closing condition."
Antwort auf Beitrag Nr.: 57.382.547 von Joschka Schröder am 25.03.18 19:38:56Bis zum Abschluss der KP-Erhöhung werden die Konsortialbanken den Kurs nun über 31 USD halten.
Antwort auf Beitrag Nr.: 57.389.591 von Joschka Schröder am 26.03.18 17:40:03Starker Kurseinbruch der Xencor-Aktieauf unter 29 USD. Möglicherweise ist die Kapitalmassnahme abgeschlossen (dann müsste es allmählich eine entsprechende Meldung geben) und der Kurs wird [deshalb] wieder den Marktkräften überlassen. Andernfalls hätten alle Beteiligten ein ernsthaftes Problem.
Antwort auf Beitrag Nr.: 57.403.601 von Joschka Schröder am 27.03.18 21:43:35Ist wohl eher der allgemeinen Großwetterlage geschuldet.
Schaut man sich den NBI an wird gnadenlos abverkauft, was in den letzten Wochen und Monaten gut performt hat: auch eine Immunogen, CRiSPR etc. weit zweistellig im Minus...
Die See wird rauher...
Schaut man sich den NBI an wird gnadenlos abverkauft, was in den letzten Wochen und Monaten gut performt hat: auch eine Immunogen, CRiSPR etc. weit zweistellig im Minus...
Die See wird rauher...
Antwort auf Beitrag Nr.: 57.403.799 von Gustl24 am 27.03.18 21:55:39Das ist schon richtig, im Normalfall stützen die Konsortialbanken aber den Kurs bis zum Abschluss der Kapitalmassnahme.
Antwort auf Beitrag Nr.: 57.404.084 von Joschka Schröder am 27.03.18 22:13:17Dabei haben sie sich ja echt Mühe gegeben und Piper Jaffray während der KE noch schnell das Price target von 40$ auf 46$ für Xencor erhöht

Und dann noch die komische Aktion, dass eigentlich 5 Mio neue Aktien angekündigt waren (+Mehrzuteilungsoption) und beim Pricing dann die Rede von 7.3 Mio Aktien (+Mehrzuteilungsoption) war. Ich hätte erwartet, dass sie die Zusagen dazu bereits im Sack haben, wenn sie so eine Aktion machen.
Da hat sich möglicherweise aber jemand übernommen.
Da hat sich möglicherweise aber jemand übernommen.
Antwort auf Beitrag Nr.: 57.403.799 von Gustl24 am 27.03.18 21:55:39
Heute geht's bei oben genannten Werten inkl. CytomX aber knackig weiter nach unten, relevante Nachrichten bzgl. solcher Abschläge Fehlanzeige...das sieht jetzt doch nach einer konzertierten Aktion des Kapitals aus:-(
Zitat von Gustl24: Ist wohl eher der allgemeinen Großwetterlage geschuldet.
Schaut man sich den NBI an wird gnadenlos abverkauft, was in den letzten Wochen und Monaten gut performt hat: auch eine Immunogen, CRiSPR etc. weit zweistellig im Minus...
Die See wird rauher...
Heute geht's bei oben genannten Werten inkl. CytomX aber knackig weiter nach unten, relevante Nachrichten bzgl. solcher Abschläge Fehlanzeige...das sieht jetzt doch nach einer konzertierten Aktion des Kapitals aus:-(
Antwort auf Beitrag Nr.: 57.413.495 von Gustl24 am 28.03.18 17:51:59Gustl24, ja das trifft gerade v.a. die Aktien, die in den letzten Monaten massiv gestiegen waren, dazu gehören auch GLYC, SGMO, IMGN, ATRA und viele weitere...
Antwort auf Beitrag Nr.: 57.406.736 von Ville7 am 28.03.18 09:38:27
Zitat von Ville7: Und dann noch die komische Aktion, dass eigentlich 5 Mio neue Aktien angekündigt waren (+Mehrzuteilungsoption) und beim Pricing dann die Rede von 7.3 Mio Aktien (+Mehrzuteilungsoption) war. Ich hätte erwartet, dass sie die Zusagen dazu bereits im Sack haben, wenn sie so eine Aktion machen.Wie lange kann sich denn die Kapitalerhöhung noch ziehen? Das muss doch schon lange durch sein. Es kommt überhaupt keine Meldung.
Da hat sich möglicherweise aber jemand übernommen.
Antwort auf Beitrag Nr.: 57.464.717 von hinz12 am 04.04.18 22:28:51Kann ich dir nicht mal einfach so beantworten. Vielleicht ist im prospectus dazu was zu finden.
Keine Ahnung wie lange sie sich Zeit lassen und das auszusitzen versuchen koennen. Endlich sicher nicht. Schaden waere dann da..
Keine Ahnung wie lange sie sich Zeit lassen und das auszusitzen versuchen koennen. Endlich sicher nicht. Schaden waere dann da..
Antwort auf Beitrag Nr.: 57.468.245 von Ville7 am 05.04.18 11:03:52Können Sie die Aktien nicht einfach für 28 Dollar verkaufen? Ist immer noch ein okayer Kurs. So wird das doch nichts.
Antwort auf Beitrag Nr.: 57.473.681 von hinz12 am 05.04.18 19:44:30Laut Info der Xencor IR konnten sie den 7.3 Mio Aktienverkauf am 23.3. "closen". Wohl eine Fehlinterpretation unsererseits...
zu 31 USD selbstverständlich
Antwort auf Beitrag Nr.: 57.492.211 von Ville7 am 08.04.18 13:36:09Hattest du Sie angeschrieben? Eine Pressemeldung hatten sie (noch) nicht rausgegeben...Danke nochmals für die Information!
Antwort auf Beitrag Nr.: 57.495.242 von Gustl24 am 09.04.18 08:12:01Ja ich habe eine Antwort der IR. Allerdings war diese widersprüchlich, denn der IR Mensch hatte das Closing zu 31 bestätigt und dabei auch auf eine Kommunikation des Closings verwiesen, die aber nach nochmaligem Prüfen meinerseits gar nicht stattgefunden hat. Daher habe ich nochmals bei der IR nachgehakt und erhoffe heute Antwort. Entweder sie haben die Kommunikation schlichtweg vergessen oder falsch formuliert gehabt oder der IR Mensch hat mir eine falsche Auskunft gegeben.
Mittlerweile hat sich das Problem klären lassen. Closing war am 23.3.2018, eine anschließende Meldung war nicht erforderlich, weil es im Vergleich zur 8K-Meldung vom 20.3.2018 keine Änderungen gab. Die Kapitalerhöhung zu 31 USD je Aktie ist also - mit gutem Timing - vollzogen. Offen ist noch, in welchem Umfang die Mehrzuteilungsoption ausgeübt wird.
Nach der nun (erfolgreich) durchgeführten KE stellt sich die Frage was sie mit dem gut gefüllten Geldspeicher nun anstellen. Zwingend erforderlich wäre eine mittelfristige Finanzierung bis 2020 nicht notwendig gewesen...gut, man hat zu guten Kursen Cashreserven generiert, die Mittelverwendung wurde mit einer Standardformulierung publiziert.
Sollte einer (möglichen) Übernahme entgegengewirkt werden, wird akquiriert oder die Forschung "beschleunigt"? Eine weitere KE sollte nun auf lange Sicht ausgeschlossen sein nmM.
Sollte einer (möglichen) Übernahme entgegengewirkt werden, wird akquiriert oder die Forschung "beschleunigt"? Eine weitere KE sollte nun auf lange Sicht ausgeschlossen sein nmM.
Antwort auf Beitrag Nr.: 57.523.808 von Gustl24 am 12.04.18 08:49:03Xencor besitzt eine sehr große Antikörper-Pipeline, die klinischen Studien werden einiges kosten:
P3-Start XmAb5871, Co-Development XmAb14045 und XmAb13676, P1 XmAb18087 und XmAb20717, ab 2019 zusätzlich XmAb22841, XmAb23104 und XmAb24306 u.v.a.m.
P3-Start XmAb5871, Co-Development XmAb14045 und XmAb13676, P1 XmAb18087 und XmAb20717, ab 2019 zusätzlich XmAb22841, XmAb23104 und XmAb24306 u.v.a.m.
Xencor Presents Preclinical Data on XmAb®24306, Introduces XmAb® IL15 Bispecific Platform
Xencor Presents Preclinical Data on XmAb®24306, Introduces XmAb® IL15 Bispecific Platform at American Association for Cancer Research (AACR) 2018 Annual MeetingApr 18, 2018
MONROVIA, Calif. , April 18, 2018 /PRNewswire/ -- Xencor , Inc. (NASDAQ: XNCR), a clinical-stage biopharmaceutical company developing engineered monoclonal antibodies for the treatment of autoimmune diseases, asthma and allergic diseases and cancer, announced preclinical data on XmAb24306, an
MONROVIA, Calif., April 18, 2018 /PRNewswire/ -- Xencor, Inc. (NASDAQ: XNCR), a clinical-stage biopharmaceutical company developing engineered monoclonal antibodies for the treatment of autoimmune diseases, asthma and allergic diseases and cancer, announced preclinical data on XmAb24306, an IL15/IL15-receptor alpha complex fused to a bispecific XmAb Fc domain (IL15/IL15Rα-Fc) for the treatment of multiple oncology indications. Data show that the engineered complex enhanced the duration and magnitude of T and NK cell proliferation in vitro and in vivo. XmAb24306 is designed for reduced potency and extended half-life, and exhibited a steady, tolerable and sustained increase in T-cells in primates.
Key findings from the study presented today at the American Association for Cancer Research (AACR) 2018 Annual Meeting include:
Fusing IL15/IL15Rα with Xencor's highly stable heterodimer Fc platform and Xtend Fc domain creates a long-acting CD122 agonist, without targeting CD25
Potency reduction of the complex promotes improved exposure and sustained pharmacodynamics
Preserves native CD122/CD132 signaling despite potency reduction
Marked and sustained peripheral NK and T cell expansion at well-tolerated doses
"The plug and play nature of our XmAb technology provides tremendous opportunity to build a suite of tumor microenvironment activators with tunable potency and sustained activity, which have the potential for improved performance over current approaches," said Bassil Dahiyat, president and chief executive officer of Xencor. "With the IL15/IL15Rα-Fc platform, we have an engine to develop these candidates quickly, and are on track to file an IND for XmAb24306 in 2019."
XmAb24306 is the first of a suite of tumor microenvironment activators using the IL15 bispecific platform. Additional IL15 bispecific candidates, which target specific sub-populations of T cells, in preclinical development include:
A PD1 targeted IL15/IL15Rα (PD1 x IL15) candidate to promote selective expansion and activation of exhausted T cells
Additional targeted IL15/IL15Rα candidates
About XmAb® IL15 Bispecific Platform
Xencor's XmAb® IL15 bispecific antibody platform provides a more druggable version of IL15 with reduced potency to improve tolerability, slow receptor-mediated clearance, and prolong half-life. IL15 is an extremely potent cytokine that stimulates the proliferation of lymphocytes, however its potential as a therapeutic has been limited by low tolerability and very fast clearance that limits therapeutic window. IL15 naturally targets CD122 without targeting CD25. Xencor has engineered the IL15/IL15Rα-Fc complex to create lead candidate XmAb24306 and to provide a basis for rapid generation of targeted T-cell activators. These Fc-fusions have been tuned for enhanced in vivo lymphocyte proliferation as a result of more sustained exposure.
About Xencor, Inc.
Xencor is a clinical-stage biopharmaceutical company developing engineered monoclonal antibodies for the treatment of autoimmune diseases, asthma and allergic diseases and cancer. Currently, 11 candidates engineered with Xencor's XmAb® technology are in clinical development internally and with partners. Xencor's internal programs include: XmAb®5871 in Phase 2 development for the treatment of IgG4-Related Disease, and also for the treatment of Systemic Lupus Erythematosus; XmAb®7195 in Phase 1 development for the treatment of asthma and allergic diseases; XmAb®14045 in Phase 1 development for acute myeloid leukemia; XmAb®13676 in Phase 1 development for B-cell malignancies; XmAb®18087 in Phase 1 development for the treatment of neuroendocrine tumors and gastrointestinal stromal tumors; and XmAb®20717, XmAb®22841, XmAb®23104 and XmAb®24306 in pre-clinical development for the treatment of multiple cancers. Xencor's XmAb antibody engineering technology enables small changes to the structure of monoclonal antibodies resulting in new mechanisms of therapeutic action. Xencor partners include Novartis, Amgen, MorphoSys, CSL/Janssen, Alexion and Boehringer Ingelheim. For more information, please visit www.xencor.com.
Antwort auf Beitrag Nr.: 57.573.858 von Ville7 am 18.04.18 15:13:27Das ist mal eine wirklich intelligente Entwicklung, bin richtig begeistert.
Etwas off topic (ich stell's in den Xencor-Thread, weil Alexions Soliris betroffen ist, das bekanntlich demnächst von ALX1210 abgelöst werden soll).
Nun ist auch Brasilien dazu übergegangen, sich über wichtige Patente Dritter hinwegzusetzen. Ein komplexes Thema. Wenn solche Praktiken einreißen und nicht auf absolute Ausnahmefälle beschränkt bleiben, bedeutet dies den Untergang der forschenden Pharmaindustrie. Welcher Investor wird hier noch ins Risiko gehen, wenn er befürchten muss, im Erfolgsfall später enteignet zu werden.
https://seekingalpha.com/news/3347333-brazil-breaks-patent-a…" target="_blank" rel="nofollow ugc noopener">
https://seekingalpha.com/news/3347333-brazil-breaks-patent-a…
Nun ist auch Brasilien dazu übergegangen, sich über wichtige Patente Dritter hinwegzusetzen. Ein komplexes Thema. Wenn solche Praktiken einreißen und nicht auf absolute Ausnahmefälle beschränkt bleiben, bedeutet dies den Untergang der forschenden Pharmaindustrie. Welcher Investor wird hier noch ins Risiko gehen, wenn er befürchten muss, im Erfolgsfall später enteignet zu werden.
https://seekingalpha.com/news/3347333-brazil-breaks-patent-a…" target="_blank" rel="nofollow ugc noopener">
https://seekingalpha.com/news/3347333-brazil-breaks-patent-a…
Antwort auf Beitrag Nr.: 57.594.675 von Joschka Schröder am 20.04.18 20:48:38Hallo Joschka,
in den Schwellenländern werden Patente bekanntermaßen auch in anderen Bereichen nicht respektiert.
Dort wären eigentlich Sanktionen angebracht.
Die Information, daß bayer in China eylea zugelassen hat, und damit sich Marktchancen ausrechnet, hat mich in letzter Zeit jedoch eher positiv gestimmt für echte Innovationen.
Auf der anderen Seite ist das Verhalten von big pharma, mit immer neuen Taschenspielertricks, die großzügig gewährten Patentzeiten zu verlängern, auch nicht die feine englische Art.
Zu erwähnen sind hier die submarine Patente, die auf Vorrat angemeldet wurden, und dann nach langer Zeit aus dem Hut gezaubert werden.
(Vergleiche Humira US, enbrel Formulierungspatente, lucentis Prozesspatent neuerdings, gegen eylea).
Die Alexion-Führung hat im letzten conference call ebenfalls ihre Strategie erläutert, die sowohl konservativ ausgerichtet ist ( Versuch, das soliris Patent mit „Tricks“ über die 12 Jahre zu verlängern), als auch mit alxn1210 progressiv und innovativ ist (switch der soliris Patienten zum viel besser anwendbaren alxn1210).
In Brasilien, und insbesondere in Indien, scheint es dagegen noch drunter und drüber zu gehen.
Hier ist das Qualitätsniveau der lokal entwickelten Produkte oft noch erschreckend!
in den Schwellenländern werden Patente bekanntermaßen auch in anderen Bereichen nicht respektiert.
Dort wären eigentlich Sanktionen angebracht.
Die Information, daß bayer in China eylea zugelassen hat, und damit sich Marktchancen ausrechnet, hat mich in letzter Zeit jedoch eher positiv gestimmt für echte Innovationen.
Auf der anderen Seite ist das Verhalten von big pharma, mit immer neuen Taschenspielertricks, die großzügig gewährten Patentzeiten zu verlängern, auch nicht die feine englische Art.
Zu erwähnen sind hier die submarine Patente, die auf Vorrat angemeldet wurden, und dann nach langer Zeit aus dem Hut gezaubert werden.
(Vergleiche Humira US, enbrel Formulierungspatente, lucentis Prozesspatent neuerdings, gegen eylea).
Die Alexion-Führung hat im letzten conference call ebenfalls ihre Strategie erläutert, die sowohl konservativ ausgerichtet ist ( Versuch, das soliris Patent mit „Tricks“ über die 12 Jahre zu verlängern), als auch mit alxn1210 progressiv und innovativ ist (switch der soliris Patienten zum viel besser anwendbaren alxn1210).
In Brasilien, und insbesondere in Indien, scheint es dagegen noch drunter und drüber zu gehen.
Hier ist das Qualitätsniveau der lokal entwickelten Produkte oft noch erschreckend!
hallo Joschka,
konntest du schon einen Blick auf die Zymeworks-Patente werfen?
Die Partner scheinen sehr zufrieden zu sein; Celgene hat gestern auch wieder eine Erweiterung bekannt gegeben.
Auf der ASCO gibt es eine oral presentation zu ZW25. ZW49 sollte heuer IND erreichen, und Partnermabs auch ab heuer.
konntest du schon einen Blick auf die Zymeworks-Patente werfen?
Die Partner scheinen sehr zufrieden zu sein; Celgene hat gestern auch wieder eine Erweiterung bekannt gegeben.
Auf der ASCO gibt es eine oral presentation zu ZW25. ZW49 sollte heuer IND erreichen, und Partnermabs auch ab heuer.
Antwort auf Beitrag Nr.: 57.624.093 von PathFinder2 am 25.04.18 12:41:51Ich muß leider zugeben, dass ich dazu bislang keine Zeit hatte. Werde ich aber möglichst bald in Angriff nehmen, da die positiven Nachrichten zu Zymeworks zunehmen und das Unternehmen vergleichsweise niedrig bewertet ist. Die Güte der bisherigen Kooperationsverträge läßt zu wünschen übrig (s. Zymeworks-Thread), zuletzt gabe es aber erstmals eine deutliche Verbesserung der Konditionen (Upfront JNJ).
Zu ZW25: Gestern wurde in den ClinicalTrials gemeldet, dass die Studie mit dem Konkurrenzpräparat ADCT502 aus Sicherheitsgründen abgebrochen worden ist.
Zu ZW25: Gestern wurde in den ClinicalTrials gemeldet, dass die Studie mit dem Konkurrenzpräparat ADCT502 aus Sicherheitsgründen abgebrochen worden ist.
Antwort auf Beitrag Nr.: 57.624.342 von Joschka Schröder am 25.04.18 13:09:50danke!
Ja die ersten Deals waren von den Konditionen recht mau, und ein großer Anteil der milestones sind commercial/sales. Die letzteren Deals deuten aber auf gute Konditionen hin, und laut Aussage vom Unternehmen kann man mit mindestens gleichen Konditionen rechnen für weitere Deals. Das hat u.a. mit ZW25 zu tun. Was bemerkenswert ist: lt. Unternehmensaussage sind alle 6 Kooperationspartner aktiv; einige wurden schon erweitert.
Mein Schnittkurs ist bei < 9 USD und ich leg die Position schlafen für ein paar Jahre - hoffentlich ;-)
Ja die ersten Deals waren von den Konditionen recht mau, und ein großer Anteil der milestones sind commercial/sales. Die letzteren Deals deuten aber auf gute Konditionen hin, und laut Aussage vom Unternehmen kann man mit mindestens gleichen Konditionen rechnen für weitere Deals. Das hat u.a. mit ZW25 zu tun. Was bemerkenswert ist: lt. Unternehmensaussage sind alle 6 Kooperationspartner aktiv; einige wurden schon erweitert.
Mein Schnittkurs ist bei < 9 USD und ich leg die Position schlafen für ein paar Jahre - hoffentlich ;-)
Antwort auf Beitrag Nr.: 57.626.433 von PathFinder2 am 25.04.18 16:58:21Ich schlage vor, die Diskussionen zu Zymeworks nicht hier, sondern im dortigen Thread fortzusetzen, damit es thematisch kein zu großes Durcheinander gibt.
ZW25 hat zu ASCO 2018 eine oral poster session. Nicht schlecht.
In Alexions heutiger Unternehmenspräsentation werden die für ALX1210 (mithin auch für Xencor) positiven Ergebnisse der beiden Phase-3-PNH-Studien (naiv und switch) ausführlich besprochen.
ALX1210 soll später auch zur Therapie der Myasthenia gravis eingesetzt werden (Rituximab dort gerade in Phase 2 gescheitert), in dieser Indikation ist allerdings ARGX-113 von Argenx mein Favorit.
ALX1210 soll später auch zur Therapie der Myasthenia gravis eingesetzt werden (Rituximab dort gerade in Phase 2 gescheitert), in dieser Indikation ist allerdings ARGX-113 von Argenx mein Favorit.
Antwort auf Beitrag Nr.: 57.574.056 von Joschka Schröder am 18.04.18 15:35:06An XmAb24306 gefällt mir besonders, dass er bei positivem Studienausgang in Kombination mit allen Präparaten eingesetzt werden könnte, die Natürliche Killerzellen aktivieren (Antikörper, CAR-NK usw.). Das wäre eine viel elegantere Methode als den Patienten unterstützend Spender-NK oder Interleukin-2 und Interleukin-15 zu verabreichen, wie man es beispielsweise am MD Anderson Cancer Center in Texas versucht.
Aus meiner Sicht hat der Xencor-Kurs weiterhin deutlich Potential. Nächste Trigger könnten z.B. eine Verpartnerung des XmAb5871, neue Studiendaten zu MOR208 oder ein Zulassungsantrag für ALX1210 sein.
Aus meiner Sicht hat der Xencor-Kurs weiterhin deutlich Potential. Nächste Trigger könnten z.B. eine Verpartnerung des XmAb5871, neue Studiendaten zu MOR208 oder ein Zulassungsantrag für ALX1210 sein.
Quartalszahlen von Xencor
http://investors.xencor.com/news-releases/news-release-detai…
Zum Conference Call hab ichs nicht geschafft.
Ich finde die Pipeline in Phase 2 etwas dünn. Nach XmAb5871 kommt erstmal nichts. Die anderen Programme sind weiter zurück, wenn auch aussichtsreich.
Bzw. von Talacotuzumab hört man nichts mehr. Was ist mit dem Programm?
Auch zu BI 836826 und 836858 hört man nichts. Beides waren laut Präsentation aus dem November 2017 Phase 2 Programme. Jetzt ist da Stille.
Für XmAb7195 sucht Xencor einen Partner. Das wäre für mich noch mal ein Kurstreiber, wenn da ein starker gefunden wird. Wie seht ihr da die Chancen?
http://investors.xencor.com/news-releases/news-release-detai…
Zum Conference Call hab ichs nicht geschafft.
Ich finde die Pipeline in Phase 2 etwas dünn. Nach XmAb5871 kommt erstmal nichts. Die anderen Programme sind weiter zurück, wenn auch aussichtsreich.
Bzw. von Talacotuzumab hört man nichts mehr. Was ist mit dem Programm?
Auch zu BI 836826 und 836858 hört man nichts. Beides waren laut Präsentation aus dem November 2017 Phase 2 Programme. Jetzt ist da Stille.
Für XmAb7195 sucht Xencor einen Partner. Das wäre für mich noch mal ein Kurstreiber, wenn da ein starker gefunden wird. Wie seht ihr da die Chancen?
Zunächst einmal bin ich angenehm überrascht, dass im Rahmen der Kapitalerhöhung alle 8,395 Mio. Aktien (zu 31 USD je Aktie) abgerufen worden sind, von Xencor also trotz der fragilen Börsenlage das Maximum ausgeschöpft werden konnte.
Die Phase 3-Studie mit Talacotuzumab in der Indikation AML wurde am 12.2.2018 regulär beendet (wenn ich mich recht erinnere, hatte es im Okt. 2017 eine Unterbrechung gegeben). Details wird man sicherlich zu einem späteren Zeitpunkt von Janssen erfahren. Zu den beiden Projekten aus der Boehringer-Kooperation gab es noch nie Wasserstandsmeldungen. Auch hier waren heute also keine Informationen zu erwarten.
Die Phase 3-Studie mit Talacotuzumab in der Indikation AML wurde am 12.2.2018 regulär beendet (wenn ich mich recht erinnere, hatte es im Okt. 2017 eine Unterbrechung gegeben). Details wird man sicherlich zu einem späteren Zeitpunkt von Janssen erfahren. Zu den beiden Projekten aus der Boehringer-Kooperation gab es noch nie Wasserstandsmeldungen. Auch hier waren heute also keine Informationen zu erwarten.
Antwort auf Beitrag Nr.: 57.713.458 von hinz12 am 07.05.18 23:09:07
Nachdem Novartis die Entwicklung des eigenen Präparats (und ursprünglich geplanten Omalizumab-Nachfolgers) QGE-31 eingestellt hat und Medimmune die Weiterentwicklung des MEDI4212 nicht mehr verfolgt, hat Xencor mit dem XmAb7195 ein Alleinstellungsmerkmal. Da die subcutane Version des XmAb7195 zudem gut verträglich war, sollten die Chancen auf eine lukrative Verpartnerung eigentlich gut stehen.
Zitat von hinz12: Für XmAb7195 sucht Xencor einen Partner. Das wäre für mich noch mal ein Kurstreiber, wenn da ein starker gefunden wird. Wie seht ihr da die Chancen?
Nachdem Novartis die Entwicklung des eigenen Präparats (und ursprünglich geplanten Omalizumab-Nachfolgers) QGE-31 eingestellt hat und Medimmune die Weiterentwicklung des MEDI4212 nicht mehr verfolgt, hat Xencor mit dem XmAb7195 ein Alleinstellungsmerkmal. Da die subcutane Version des XmAb7195 zudem gut verträglich war, sollten die Chancen auf eine lukrative Verpartnerung eigentlich gut stehen.
Der aktuelle Kursrückgang auf 28,40 USD ist absolut irrational und stellt meines Erachtens eine gute Kaufgelegenheit dar. Was haben die Aktionäre denn von der Telefonkonferenz erwartet?
Antwort auf Beitrag Nr.: 57.718.480 von Joschka Schröder am 08.05.18 16:18:45Bei Momenta (MNTA) ebenfalls -12% bei börsenbeginn. Diese Veräußerungen bei Veröffentlichung der Quartalszahlen sind absolut überzogen.
Trumps kommende Ansprache zu "drug prices" sorgt nicht gerade für Biotech-Kauflaune.
Xencor erwischt es heute schon deutlich stärker als die Konkurrenz. Vielleicht waren die Zuhörer des gestrigen CC von den geringen zu erwartenden Meilensteinzahlungen für Zulassung und Sales von ALX1210 enttäuscht (55 Mio. USD - danach wurde gefragt, obwohl alle Daten in früheren SEC-files zu finden sind) oder weil auf Nachfrage keine entsprechenden Zahlen zu MOR208 genannt worden sind (stehen auch in diversen SEC-Mitteilungen), keine Ahnung. In der Telefonkonferrenz gab es aus meiner Sicht jedenfalls keinerlei Überraschungen.
wer von euch hat sich MGNX (heute - 10%) mal näher angesehen?
die breite der pipeline ist beeindruckend, der cashburn auch ;-)
die breite der pipeline ist beeindruckend, der cashburn auch ;-)
Antwort auf Beitrag Nr.: 57.713.689 von Joschka Schröder am 08.05.18 00:23:14
Das Xencor XmAb7195 verpartnern will, sagen sie allerdings seit dem Q3 Call 2017 im November. Sollte da nicht langsam ein Erfolg vermeldet werden oder ist das normal, dass das so lange dauert? Mein Eindruck ist auch, dass zurzeit nicht an dem Programm gearbeitet wird. Da verliert man doch wichtige Zeit.
Wenn man sich die anderen Deals mit Novartis anschaut, dann sollte hier ein Upfront von über 150 Mio und um die 20 Prozent Royalities drin sein. Immerhin ist die Phase 1b abgeschlossen. Oder liege ich da zu hoch?
Zitat von Joschka Schröder:Zitat von hinz12: Für XmAb7195 sucht Xencor einen Partner. Das wäre für mich noch mal ein Kurstreiber, wenn da ein starker gefunden wird. Wie seht ihr da die Chancen?
Nachdem Novartis die Entwicklung des eigenen Präparats (und ursprünglich geplanten Omalizumab-Nachfolgers) QGE-31 eingestellt hat und Medimmune die Weiterentwicklung des MEDI4212 nicht mehr verfolgt, hat Xencor mit dem XmAb7195 ein Alleinstellungsmerkmal. Da die subcutane Version des XmAb7195 zudem gut verträglich war, sollten die Chancen auf eine lukrative Verpartnerung eigentlich gut stehen.
Das Xencor XmAb7195 verpartnern will, sagen sie allerdings seit dem Q3 Call 2017 im November. Sollte da nicht langsam ein Erfolg vermeldet werden oder ist das normal, dass das so lange dauert? Mein Eindruck ist auch, dass zurzeit nicht an dem Programm gearbeitet wird. Da verliert man doch wichtige Zeit.
Wenn man sich die anderen Deals mit Novartis anschaut, dann sollte hier ein Upfront von über 150 Mio und um die 20 Prozent Royalities drin sein. Immerhin ist die Phase 1b abgeschlossen. Oder liege ich da zu hoch?
Antwort auf Beitrag Nr.: 57.722.767 von hinz12 am 09.05.18 06:48:35Zeitrahmen ist völlig normal, Deine Upfront-Erwartung jedoch unrealistisch. Die 150 Mio. USD gab es für XmAb14044 und XmAb13676 zusammen zuzüglich vier weiterer bispezifischer Programme, wobei NOV für die beiden erstgenannten Mabs nur Ex-US-Lizenz erhält, Xencor sich aber an den Entwicklungskosten beteiligen muss.
Antwort auf Beitrag Nr.: 57.723.679 von Joschka Schröder am 09.05.18 08:39:58Kann sich die Verpartnerung von XmAb7195 also noch bis Ende des Jahres ziehen? Immerhin verliert man dann ein Jahr.
Oh sorry, da hab nicht richtig nachgeschaut, dass das so viele Programme waren. Ich hatte nur noch die 150 Mio. von Novartis im Kopf. Was meinst du wie hoch die Upfrontzahlung und die Royalities sein werden?
Oh sorry, da hab nicht richtig nachgeschaut, dass das so viele Programme waren. Ich hatte nur noch die 150 Mio. von Novartis im Kopf. Was meinst du wie hoch die Upfrontzahlung und die Royalities sein werden?
kommt mal auf die Liste
Vermutlich wird es Xencor früher oder später so ergehen wie Ablynx (spätestens, wenn die bevorstehende Phase 3-Studie mit XmAb5871 beendet ist, möglicherweise aber auch schon deutlich früher). Die Fc-Optimierungsplattform ist mittlerweile für verschiedene Techniken voll validiert (Xtend durch ALXN1210, Cytotoxic durch MOR208, im Dez. 2018 vermutlich auch Bispecific), im nächsten Jahr wird mit an Sicherheit grenzender Wahrscheinlichkeit der erste von Xencor entwickelte Antikörper zugelassen sein, woraus ein künftiger Royalty-Zustrom resultiert ... und Xencor ist in einem Sektor tätig, der für andere Pharmafirmen besonders interessant ist. Erst jüngst ist Armo Biosciences von Lilly übernommen worden. Kaufpreis 1,6 Mrd. USD für eine Pipeline, die im Vergleich zur Xencor-Pipeline ein blasses Würmchen ist.
Antwort auf Beitrag Nr.: 57.741.490 von Joschka Schröder am 11.05.18 15:54:54Wie siehst du denn die Chance das XmAb5871 zugelassen wird und wann könnte das ungefähr sein? Wie groß ist das Marktpotenzial?
Ich glaube übrigens nicht, dass Xencor XmAb5871 verpartnern will. Das werden sie alleine zu Ende bringen. Dann brauchen sie allerdings auch eine Vertriebsmannschaft. Davon hat noch keiner gesprochen.
Ich glaube übrigens nicht, dass Xencor XmAb5871 verpartnern will. Das werden sie alleine zu Ende bringen. Dann brauchen sie allerdings auch eine Vertriebsmannschaft. Davon hat noch keiner gesprochen.
Antwort auf Beitrag Nr.: 57.741.490 von Joschka Schröder am 11.05.18 15:54:54Sehe ich auch so. Sehr grosses Übernahmerisiko.
Aber manchmal schafft es auch eine Firma über den kritischen Übernahmepunkt hinaus, z.b. weil der Kurs zu hoch gehypt wurde oder weil zu Pivotentwicklungen innerhalb einer Wirtschaftskrise keine Interessenten da sind.
Aber manchmal schafft es auch eine Firma über den kritischen Übernahmepunkt hinaus, z.b. weil der Kurs zu hoch gehypt wurde oder weil zu Pivotentwicklungen innerhalb einer Wirtschaftskrise keine Interessenten da sind.
Antwort auf Beitrag Nr.: 57.743.014 von hinz12 am 11.05.18 19:30:57Mit aktuell Cash bis ins Jahr 2023 ( !!!! ... und den zu erwartenden Mittelzuflüssen weit darüber hinaus) dürfte der Aufbau einer Vertriebsmannschaft kein Problem darstellen.
Antwort auf Beitrag Nr.: 57.743.014 von hinz12 am 11.05.18 19:30:57@hinz12
Zu Deinen Fragen bzgl. XmAb5871
Ganz grob: Prävalenz ca. 60 bis 100 je 1 Mio. Einwohner, Häufigkeit vermutlich deutlich unterschätzt. 98 % Remission unter Kortikosteroidbehandlung, trotz Steroiden Rezidive in 24 % der Fälle.
Vorausgesetzt, Einsatz nur, wenn refraktär oder rezidivierend, und geschätzte Behandlungskosten von 50.000 USD je Fall ergibt für USA 360.000.000 x 80/1.000.000 x 0,26 x 50.000 USD = 340 Mio. USD
Für Europa kann man etwa denselben Betrag ansetzen, ebenso für den Rest der Welt. Insgesamt landete man so bei 1 Mrd. USD Umsatzpotential.
Die Marktdurchdringung wird aber deutlich geringer sein. Andererseits ist die Prävalenz vermutlich deutlich höher, außerdem würde man den Antikörper in bestimmten Fällen (nicht generell, weil zu teuer) auch als Steroid-sparendes Therapeutikum einsetzen.
Lange Rede, kurzer Sinn: In der Indikation "IgG4 assoziierte Erkrankungen" könnten die Peak Sales grob (!!) geschätzt in der Größenordnung von etwa 400 Mio. USD liegen.
Falls Xencor XmAb5871 noch vor Beginn der Phase 3 verpartnern wollte (wovon nicht auszugehen ist), hätte Amgen - vertraglich geregelt - ein Erstzugriffsrecht.
Zu Deinen Fragen bzgl. XmAb5871
Ganz grob: Prävalenz ca. 60 bis 100 je 1 Mio. Einwohner, Häufigkeit vermutlich deutlich unterschätzt. 98 % Remission unter Kortikosteroidbehandlung, trotz Steroiden Rezidive in 24 % der Fälle.
Vorausgesetzt, Einsatz nur, wenn refraktär oder rezidivierend, und geschätzte Behandlungskosten von 50.000 USD je Fall ergibt für USA 360.000.000 x 80/1.000.000 x 0,26 x 50.000 USD = 340 Mio. USD
Für Europa kann man etwa denselben Betrag ansetzen, ebenso für den Rest der Welt. Insgesamt landete man so bei 1 Mrd. USD Umsatzpotential.
Die Marktdurchdringung wird aber deutlich geringer sein. Andererseits ist die Prävalenz vermutlich deutlich höher, außerdem würde man den Antikörper in bestimmten Fällen (nicht generell, weil zu teuer) auch als Steroid-sparendes Therapeutikum einsetzen.
Lange Rede, kurzer Sinn: In der Indikation "IgG4 assoziierte Erkrankungen" könnten die Peak Sales grob (!!) geschätzt in der Größenordnung von etwa 400 Mio. USD liegen.
Falls Xencor XmAb5871 noch vor Beginn der Phase 3 verpartnern wollte (wovon nicht auszugehen ist), hätte Amgen - vertraglich geregelt - ein Erstzugriffsrecht.
Antwort auf Beitrag Nr.: 57.750.241 von Joschka Schröder am 13.05.18 19:57:30Vielen Dank für deine Ausführungen Joschka. Ich habe auch noch mal nachgeschaut und Xencor selbst hatte mal von zehn bis zwanzigtausend Patienten in den USA gesprochen
http://investors.xencor.com/news-releases/news-release-detai….
Ich finde die konservative Schätzung aber auch angemessener.
Wann meinst du, dass eine Zulassung erfolgen könnte und wie schätzt du die Zulassungschancen ein?
Was ist mit der SLE-Indikation?
http://investors.xencor.com/news-releases/news-release-detai….
Ich finde die konservative Schätzung aber auch angemessener.
Wann meinst du, dass eine Zulassung erfolgen könnte und wie schätzt du die Zulassungschancen ein?
Was ist mit der SLE-Indikation?
Antwort auf Beitrag Nr.: 57.755.899 von hinz12 am 14.05.18 17:14:44ich denke in der Indikation SLE wird es extrem schwierig (hier floppt sehr vieles); für mich wäre es eine ziemliche Überraschung, wenn hier die XNCR-Studie Erfolg zeigt
OFF TOPIC:
in Zusammenhang mit SLE finde ich das Unternehmen AUPH (Aurinia Pharma) interessant. LN (Lupus Neprithis) ist eine Folgeerkrankung von SLE; hier gibt es nix Zugelassenes, sondern nur eine recht wenig wirksame standard-of-care (MMF+steroids), und die Behandlungskosten für LN sind enorm hoch. AUPH ist hier in einer zulassungsrelevanten P3-Studie, die Ende 2018 fertig rekrutiert haben soll und bis Ende 2019 Ergebnisse liefern sollte. WENN die positiv durchkommt, dann handelt es sich hier wohl um einen Blockbuster und um einen Vervielfacher von AUPH - Übernahme nach erfolgreicher P3-Studie extrem wahrscheinlich. Die P2b Daten waren beeindruckend, das Management ist im Bereich LN "zu Hause".
Es gibt allerdings etliche Risikopunkte, die ich hier erwähne:
- P2b bedeutend größere Zahl von Toten in der niedrigeren Behandlungsgruppe im ersten Studienabschnitt im Vergleich mit Plazebo-Gruppe und höher dosierter Gruppe (wurde vom Unternehmen relativ gut erklärt und Gegenmaßnahmen für die P3 getroffen - es bleibt aber ein Risikopunkt)
- P2b inverse dose response (höhere Dosierung mit schlechterem Ergebnis als niedrige Dosierung; die niedrige Dosierung ist in die P3 gegangen)
- wird Patent für Voclosporin tatsächlich verlängert? Falls nicht würde es die kommerziellen Aussichten bedeutend trüben
- Risiko, dass andere calcium neurine inhibitors (Tacrolimus, Cyclosporin, alle off patent) off-label verwendet werden und einen Teil des Marktes wegnehmen
Jedenfalls eine spannende Story zum Verfolgen. Ich hoffe, dass der Kurs in Erwartung der P3-Ergebnisse in 2019 anzieht und man vor dem Readout das Risiko reduzieren kann
OFF TOPIC:
in Zusammenhang mit SLE finde ich das Unternehmen AUPH (Aurinia Pharma) interessant. LN (Lupus Neprithis) ist eine Folgeerkrankung von SLE; hier gibt es nix Zugelassenes, sondern nur eine recht wenig wirksame standard-of-care (MMF+steroids), und die Behandlungskosten für LN sind enorm hoch. AUPH ist hier in einer zulassungsrelevanten P3-Studie, die Ende 2018 fertig rekrutiert haben soll und bis Ende 2019 Ergebnisse liefern sollte. WENN die positiv durchkommt, dann handelt es sich hier wohl um einen Blockbuster und um einen Vervielfacher von AUPH - Übernahme nach erfolgreicher P3-Studie extrem wahrscheinlich. Die P2b Daten waren beeindruckend, das Management ist im Bereich LN "zu Hause".
Es gibt allerdings etliche Risikopunkte, die ich hier erwähne:
- P2b bedeutend größere Zahl von Toten in der niedrigeren Behandlungsgruppe im ersten Studienabschnitt im Vergleich mit Plazebo-Gruppe und höher dosierter Gruppe (wurde vom Unternehmen relativ gut erklärt und Gegenmaßnahmen für die P3 getroffen - es bleibt aber ein Risikopunkt)
- P2b inverse dose response (höhere Dosierung mit schlechterem Ergebnis als niedrige Dosierung; die niedrige Dosierung ist in die P3 gegangen)
- wird Patent für Voclosporin tatsächlich verlängert? Falls nicht würde es die kommerziellen Aussichten bedeutend trüben
- Risiko, dass andere calcium neurine inhibitors (Tacrolimus, Cyclosporin, alle off patent) off-label verwendet werden und einen Teil des Marktes wegnehmen
Jedenfalls eine spannende Story zum Verfolgen. Ich hoffe, dass der Kurs in Erwartung der P3-Ergebnisse in 2019 anzieht und man vor dem Readout das Risiko reduzieren kann
Schöner, energischer Ausbruch von XNCR auf Allzeithoch, aktuell 35,75 USD. Entspricht Marktkap. 2,0 Mrd. US und EV 1,4 Mrd. USD.
Weiterhin positive Kursentwicklung von Xencor (aktuell ca. 39,40 USD). War etwas verwunderlich, dass es so lange gedauert hat. Wenn Analysten für Morphosys' MOR208 mit Peak Sales von 1 Mrd. EUR oder USD (je nach Autor) rechnen, hätte man eigentlich erwarten können, dass dann auch auffällt, dass geschätzte 100 Mio. davon an Xencor fließen werden, von den bis zu 187 Mio. USD bei Zulassung von MOR208 mal abgesehen.
Daneben gibt es dann noch ALXN1210 usw.
Daneben gibt es dann noch ALXN1210 usw.
Antwort auf Beitrag Nr.: 57.130.434 von Ville7 am 27.02.18 11:08:49Oftmals erstaunlich was ein Chart oft vorab verrät; ging sogar leicht schneller als von mir erwartet...um 40-45 könnte es nun in die Konsolidierung gehen....
Zitat von Ville7: Sehe ich fundamental ähnlich - könnte mir gut 2,5-3 Mrd USD MK bis 2021 vorstellen. Die Unbekannte ist der Kapitalbedarf und ob es noch weitere Verwässerungen geben muss.
Wenn ich auf den Chart, die treppenartigen Anstiege zuvor und den Ausbruch aus dem Dreieck schaue, dann könnte das mittelfristig erst mal nach USD 40-45 aussehen.
Antwort auf Beitrag Nr.: 57.835.898 von Ville7 am 25.05.18 21:09:54Was mich erstaunt ist das diese erfreuliche Kursentwicklung ohne nennenswerte Volumina stattfindet, Xencor ist ja in vielen Blogs noch völlig unter dem Radar, oder als kleiner Appendix von MOR (und selbst da wohl nicht jeder ...).
...).
Sollten mal die Umsätze merklich anziehen bin ich auf die Kursreaktion gespannt- es scheinen zu diesen Kursen aber wenige bereit zu sein ihre Aktien abzugeben.
 ...).
...).Sollten mal die Umsätze merklich anziehen bin ich auf die Kursreaktion gespannt- es scheinen zu diesen Kursen aber wenige bereit zu sein ihre Aktien abzugeben.
Hallo zusammen, bin neu hier und möchte mich zunächst für die fundierten Beiträge bedanken, vor allem bei Joschka und Ville! Detailliertes Pharmawissen habe ich leider nicht, dafür genug Erfahrung an der Börse.
Könnte es sein, das wir hier einen kleinen Short Sqeeze erleben? immerhin sind per 15.05. ca. 20% des Free Floats Short. Und bei den jetzigen Kursen sind alle im Verlust, die auf fallende Xencor-Kurse gesetzt haben.
Bei aktuellen Umsätzen bräuchten sie rechnerisch 13 Handelstage um ihre Bestände zu covern. Und wenn der Börsenumsatz nicht steigt und dafür die Kurse weiter anziehen.... Dann wird die Lage für die Shortseller immer verzweifelter und Sie müssen sich zu jedem Kurs eindecken
Könnte es sein, das wir hier einen kleinen Short Sqeeze erleben? immerhin sind per 15.05. ca. 20% des Free Floats Short. Und bei den jetzigen Kursen sind alle im Verlust, die auf fallende Xencor-Kurse gesetzt haben.
Bei aktuellen Umsätzen bräuchten sie rechnerisch 13 Handelstage um ihre Bestände zu covern. Und wenn der Börsenumsatz nicht steigt und dafür die Kurse weiter anziehen.... Dann wird die Lage für die Shortseller immer verzweifelter und Sie müssen sich zu jedem Kurs eindecken

Noch eine Ergänzung: Short Positionen werden auch oft von Anlegern eingegangen, die Wandelanleihen halten und diese Position neutralisieren wollen. Das sind dann keine echten Shorts, denn die Anleger können sich über Wandelung ja jederzeit die Aktien beschaffen, müssen sich also nicht über die Börse eindecken.
Xencor hat aber keine Wandelanleihe ausstehen, d.h. das sind alles echte, ungedeckte Short-Positionen!
Insofern müssen wir hoffen, das die ersten Shorties nervös werden, weil bei über 40 $ schon er erste Margin-Call droht und dann ist zuerst der Ferrari und dann das Haus - und es droht das Schicksal von Duke&Duke im Film "die Glücksritter". Und dann schließt man die Position halt lieber bei 40$, oder 50$, oder ?? $
Xencor hat aber keine Wandelanleihe ausstehen, d.h. das sind alles echte, ungedeckte Short-Positionen!
Insofern müssen wir hoffen, das die ersten Shorties nervös werden, weil bei über 40 $ schon er erste Margin-Call droht und dann ist zuerst der Ferrari und dann das Haus - und es droht das Schicksal von Duke&Duke im Film "die Glücksritter". Und dann schließt man die Position halt lieber bei 40$, oder 50$, oder ?? $

Antwort auf Beitrag Nr.: 57.837.953 von Rehauer am 26.05.18 10:59:13
Nach meiner Rechnung beträgt die Short-Quote knapp 5 % (2,7 Mio. von 55,6 Mio. Aktien). Vermögensverwalter wie Blackrock, T Rowe etc. kann man eigentlich nicht als Ankeraktionäre betrachten, für mich zählen sie daher zum Free Float.
Zitat von Rehauer: Könnte es sein, das wir hier einen kleinen Short Sqeeze erleben? immerhin sind per 15.05. ca. 20% des Free Floats Short.
Nach meiner Rechnung beträgt die Short-Quote knapp 5 % (2,7 Mio. von 55,6 Mio. Aktien). Vermögensverwalter wie Blackrock, T Rowe etc. kann man eigentlich nicht als Ankeraktionäre betrachten, für mich zählen sie daher zum Free Float.
Antwort auf Beitrag Nr.: 57.838.436 von Joschka Schröder am 26.05.18 13:05:44Ja stimmt, die Institutionellenquote von 80% täuscht da. Zu hohen Kursen besteht da sicher Abgabebereitschaft. Insofern wird es - wenn überhaupt - nur ein kleiner Short Squeeze.
Aber die Aussichten von Xencor sind ja ohnehin sehr gut, und die Aktie ist noch nicht "entdeckt".
Da kann man komfortabel abwarten.
Aber die Aussichten von Xencor sind ja ohnehin sehr gut, und die Aktie ist noch nicht "entdeckt".
Da kann man komfortabel abwarten.
Antwort auf Beitrag Nr.: 57.838.544 von Rehauer am 26.05.18 13:33:19Sehr erstaunliches - hohes - Handelsvolumen in der letzten Viertelstunde an der Nasdaq.
Der Umsatz eines halben Monats in den letzten Minuten...anstehende News oder ein größerer Fond der sich eindeckt...
Der Umsatz eines halben Monats in den letzten Minuten...anstehende News oder ein größerer Fond der sich eindeckt...
https://www.biopharmadive.com/news/how-badly-does-alexion-wa…
Alexion
"After this presentation it's clear to us that '1210 is even more differentiated than we had anticipated ... and is likely to dominate treatment of newly diagnosed PNH," Leerink analyst Geoffrey Porges wrote in a June 18 note.
"We also find this data supportive of our expectation that ravulizumab will achieve a majority overall share in this indication, through both capturing new patients and through switches of established Soliris patients," he wrote.
Leerink estimates combined sales of Soliris and ALXN1210 will hit $5.2 billion in 2022, and will then grow by low single-digit percentages to reach $5.6 billion in 2025“
Xencor hat einen royalty Anteil von ca. 2,5% an den ravulizumab Umsätzen und müßte hierdurch ca. 100 mio Dollar pro Jahr generieren.
Wie sich die neue Indikation generalized myasthenia gravis umsatzmäßig auswirkt, bleibt abzuwarten.
Alexion
"After this presentation it's clear to us that '1210 is even more differentiated than we had anticipated ... and is likely to dominate treatment of newly diagnosed PNH," Leerink analyst Geoffrey Porges wrote in a June 18 note.
"We also find this data supportive of our expectation that ravulizumab will achieve a majority overall share in this indication, through both capturing new patients and through switches of established Soliris patients," he wrote.
Leerink estimates combined sales of Soliris and ALXN1210 will hit $5.2 billion in 2022, and will then grow by low single-digit percentages to reach $5.6 billion in 2025“
Xencor hat einen royalty Anteil von ca. 2,5% an den ravulizumab Umsätzen und müßte hierdurch ca. 100 mio Dollar pro Jahr generieren.
Wie sich die neue Indikation generalized myasthenia gravis umsatzmäßig auswirkt, bleibt abzuwarten.
Antwort auf Beitrag Nr.: 58.055.734 von StefanR am 24.06.18 18:03:33Damit wir wenigstens die wichtigsten Dinge mal zusammentragen.
Im Post von StefanR stand es schon an, Alexion hat ALXN1210 in den USA eingereicht und dafür einen Priority Voucher ausgegeben.
http://news.alexion.com/press-release/product-news/alexion-s…
Das war am 19.06. Sie sind sich der Sache sehr sicher. Würde mich sehr überraschen, wenn die Zulassung nicht erfolgt.
Zudem haben sie den Zulassungsantrag in Europa am 28.06. eingereicht
http://news.alexion.com/press-release/product-news/alexion-s…
Japan soll im zweiten Halbjahr folgen.
Die Aktie reagiert mehr oder weniger gar nicht. Ich frage mich, ob das schon alles eingepreist ist. Ich denke, bei Zulassung wird es dann auch der Letzte merken. Vielleicht sollte Xencor das Ganze auch mal kommunizieren. Ich verstehe gar nicht, wieso die das nicht melden.
Im Post von StefanR stand es schon an, Alexion hat ALXN1210 in den USA eingereicht und dafür einen Priority Voucher ausgegeben.
http://news.alexion.com/press-release/product-news/alexion-s…
Das war am 19.06. Sie sind sich der Sache sehr sicher. Würde mich sehr überraschen, wenn die Zulassung nicht erfolgt.
Zudem haben sie den Zulassungsantrag in Europa am 28.06. eingereicht
http://news.alexion.com/press-release/product-news/alexion-s…
Japan soll im zweiten Halbjahr folgen.
Die Aktie reagiert mehr oder weniger gar nicht. Ich frage mich, ob das schon alles eingepreist ist. Ich denke, bei Zulassung wird es dann auch der Letzte merken. Vielleicht sollte Xencor das Ganze auch mal kommunizieren. Ich verstehe gar nicht, wieso die das nicht melden.
MONROVIA, Calif., July 12, 2018 /PRNewswire/ -- Xencor, Inc. (XNCR), a clinical-stage biopharmaceutical company developing engineered monoclonal antibodies for the treatment of autoimmune diseases, asthma and allergic diseases and cancer, today announced that the first patient has been dosed in XmAb20717-01 (DUET-2), a Phase 1, first-in-human, clinical trial of XmAb®20717, a bispecific antibody that simultaneously targets PD-1 and CTLA-4 immune checkpoints for the treatment of multiple advanced solid tumors.
"Built on the scaffold of Xencor's XmAb® bispecific Fc domain, XmAb20717 is the most advanced candidate in our suite of tumor microenvironment activators," said Paul Foster, M.D., chief medical officer at Xencor. "The dual blockade of PD-1 and CTLA-4 with XmAb20717 may promote superior T cell activation and proliferation compared to anti-PD-1 alone, and we look forward to studying its safety, tolerability and therapeutic activity in clinical trials."
By the end of 2018, Xencor expects to file Investigational New Drug applications for two additional tumor microenvironment activators including XmAb®23104, a PD-1 x ICOS bispecific antibody, as well as XmAb®22841, a CTLA-4 x LAG-3 dual checkpoint inhibitor.
DUET-2 is a Phase 1 multiple-dose, dose-escalation study that will characterize the safety and tolerability, pharmacokinetics, pharmacodynamics, immunogenicity and preliminary anti-tumor activity of intravenous administration of XmAb20717 in patients with selected advanced solid tumors. For more information about DUET-2 please visit to https://clinicaltrials.gov (identifier:NCT03517488).
Die eigene Pipeline wird nun Step by Step in die ersten klinischen Phasen überführt. Damit beginnt neben den weit fortgeschrittenen Partnerprojekten ein neues Zeitalter bei Xencor. Die Kapitaldecke ist ja nun im Überfluss vorhanden...
"Built on the scaffold of Xencor's XmAb® bispecific Fc domain, XmAb20717 is the most advanced candidate in our suite of tumor microenvironment activators," said Paul Foster, M.D., chief medical officer at Xencor. "The dual blockade of PD-1 and CTLA-4 with XmAb20717 may promote superior T cell activation and proliferation compared to anti-PD-1 alone, and we look forward to studying its safety, tolerability and therapeutic activity in clinical trials."
By the end of 2018, Xencor expects to file Investigational New Drug applications for two additional tumor microenvironment activators including XmAb®23104, a PD-1 x ICOS bispecific antibody, as well as XmAb®22841, a CTLA-4 x LAG-3 dual checkpoint inhibitor.
DUET-2 is a Phase 1 multiple-dose, dose-escalation study that will characterize the safety and tolerability, pharmacokinetics, pharmacodynamics, immunogenicity and preliminary anti-tumor activity of intravenous administration of XmAb20717 in patients with selected advanced solid tumors. For more information about DUET-2 please visit to https://clinicaltrials.gov (identifier:NCT03517488).
Die eigene Pipeline wird nun Step by Step in die ersten klinischen Phasen überführt. Damit beginnt neben den weit fortgeschrittenen Partnerprojekten ein neues Zeitalter bei Xencor. Die Kapitaldecke ist ja nun im Überfluss vorhanden...
Antwort auf Beitrag Nr.: 58.214.084 von Gustl24 am 14.07.18 13:27:48https://seekingalpha.com/article/4195559-xencor-inc-xncr-ceo…
Skript zum gestrigen CC...
Durchaus beeindruckende Performance der Aktie gestern zum ATH bis knapp 45$...
Dann kam der Kurs etwas zurück...evtl. z.T. durch einen kritischen Analystenkommentar von Chr. Marai, welcher die Kurstrigger noch zu weit in der Zukunft sieht
NmM. gibt Xencor nun mächtig Gas die Pipeline in den klin. Studien voranzutreiben. Ich habe gestern Abend etwas akkumuliert...
Skript zum gestrigen CC...
Durchaus beeindruckende Performance der Aktie gestern zum ATH bis knapp 45$...
Dann kam der Kurs etwas zurück...evtl. z.T. durch einen kritischen Analystenkommentar von Chr. Marai, welcher die Kurstrigger noch zu weit in der Zukunft sieht

NmM. gibt Xencor nun mächtig Gas die Pipeline in den klin. Studien voranzutreiben. Ich habe gestern Abend etwas akkumuliert...
Antwort auf Beitrag Nr.: 58.397.928 von Gustl24 am 08.08.18 10:09:49Hat jemand eine Idee zu den ausufernden Insiderverkäufen der letzten Wochen?
Einfach mal Kasse machen oder steckt etwas anderes dahinter...
Einfach mal Kasse machen oder steckt etwas anderes dahinter...
https://www.investors.com/news/technology/alexion-blood-dise…
"ALLISON GATLIN8/20/2018
Alexion Pharmaceuticals (ALXN) could add a fourth approved drug to its portfolio as soon as February 2019 after the Food and Drug Administration accepted its priority review application for a blood-disease drug on Monday.
Shares of Alexion lifted as much as 2.1% in early trading on the stock market today. Alexion stock ended the regular session up 0.2%, at 116.17. Shares have been consolidating since last September with a buy point at 149.44.
The priority review voucher came as a surprise, RBC analyst Kennen MacKay said in a report to clients. Drugs approved under priority review undergo an expedited eight-month process. The standard review period is 12 months.
This could allow the drug ALXN1210 to launch earlier than expected. ALXN1210 was studied as a treatment for paroxysmal nocturnal hemoglobinuria, or PNH. PNH is a chronic, progressive and potentially life-threatening blood disease.
"We model $34 million in U.S. 2019 ALXN1210 sales vs. global Street estimates of $35 million in PNH," he said. "While 2019 consensus estimates are not split by quarter, our U.S. estimate is based on a midyear launch, and we see an early launch likely leading to upside revisions."
Immune System Problems
Alexion already sells a treatment for PNH known as Soliris. ALXN1210 is meant to be a follow-up to Soliris, which also treats another blood disease and a neuromuscular condition. Both drugs work to prevent abnormal activity within the complement system, a part of the immune system.
If approved, ALXN1210 would be the first and only long-activity complement inhibitor for patients with PNH, Alexion said in a news release. In patients with PNH, the complement system becomes activated in an uncontrolled way. That could lead to the destruction of red blood cells.
The studies for ALXN1210 built on Alexion's work with Soliris, Alexion spokesman John Orloff said in a written statement. The FDA set a Feb. 18, 2019, review date for ALXN1210.
"Building on comprehensive results from the largest-ever Phase 3 development program in PNH, 11 years of proven (effectiveness) and safety with Soliris and 25 years of leadership in complement biology, we are on track with our efforts to establish ALXN1210 as the standard of care for patients with PNH," he said."
Die zu erwartende Zulassung von alxn1210 Anfang 2019 löst milestones-Zahlungen bei Xencor aus. Die royalty-Zahlungen werden 2019 jedoch noch sehr überschaubar bleiben.
Dennoch untermauert das die Aussage auf dem letzten conference call, daß die Liquidität bis in 2023 reicht.
Viele Grüsse
StefanR
"ALLISON GATLIN8/20/2018
Alexion Pharmaceuticals (ALXN) could add a fourth approved drug to its portfolio as soon as February 2019 after the Food and Drug Administration accepted its priority review application for a blood-disease drug on Monday.
Shares of Alexion lifted as much as 2.1% in early trading on the stock market today. Alexion stock ended the regular session up 0.2%, at 116.17. Shares have been consolidating since last September with a buy point at 149.44.
The priority review voucher came as a surprise, RBC analyst Kennen MacKay said in a report to clients. Drugs approved under priority review undergo an expedited eight-month process. The standard review period is 12 months.
This could allow the drug ALXN1210 to launch earlier than expected. ALXN1210 was studied as a treatment for paroxysmal nocturnal hemoglobinuria, or PNH. PNH is a chronic, progressive and potentially life-threatening blood disease.
"We model $34 million in U.S. 2019 ALXN1210 sales vs. global Street estimates of $35 million in PNH," he said. "While 2019 consensus estimates are not split by quarter, our U.S. estimate is based on a midyear launch, and we see an early launch likely leading to upside revisions."
Immune System Problems
Alexion already sells a treatment for PNH known as Soliris. ALXN1210 is meant to be a follow-up to Soliris, which also treats another blood disease and a neuromuscular condition. Both drugs work to prevent abnormal activity within the complement system, a part of the immune system.
If approved, ALXN1210 would be the first and only long-activity complement inhibitor for patients with PNH, Alexion said in a news release. In patients with PNH, the complement system becomes activated in an uncontrolled way. That could lead to the destruction of red blood cells.
The studies for ALXN1210 built on Alexion's work with Soliris, Alexion spokesman John Orloff said in a written statement. The FDA set a Feb. 18, 2019, review date for ALXN1210.
"Building on comprehensive results from the largest-ever Phase 3 development program in PNH, 11 years of proven (effectiveness) and safety with Soliris and 25 years of leadership in complement biology, we are on track with our efforts to establish ALXN1210 as the standard of care for patients with PNH," he said."
Die zu erwartende Zulassung von alxn1210 Anfang 2019 löst milestones-Zahlungen bei Xencor aus. Die royalty-Zahlungen werden 2019 jedoch noch sehr überschaubar bleiben.
Dennoch untermauert das die Aussage auf dem letzten conference call, daß die Liquidität bis in 2023 reicht.
Viele Grüsse
StefanR
Antwort auf Beitrag Nr.: 58.509.906 von StefanR am 22.08.18 17:53:44Aha! Ich hatte nur via Twitter das PDUFA Datum (18.02.) gesehen und mich gewundert, weil das so früh ist. Das mit dem voucher erklärt es - Danke!
Mal sehen, wie es mit MOR208 weitergeht. Eventuell kommen 2019 dann sogar 2 Medikamente auf den Markt an denen XNCR mit Meilensteinen und Royalties beteiligt wäre!
Mal sehen, wie es mit MOR208 weitergeht. Eventuell kommen 2019 dann sogar 2 Medikamente auf den Markt an denen XNCR mit Meilensteinen und Royalties beteiligt wäre!
Antwort auf Beitrag Nr.: 58.512.126 von kmastra am 22.08.18 22:21:12Auch hier - neben CTMX - gehts leider deutlich bergab. SLE study failed.
Antwort auf Beitrag Nr.: 58.878.297 von biopadawan am 05.10.18 14:25:05Mich wundert das Xencor selbst von einer erfolgreichen Studie spricht.
Xencor completed this study to efficiently assess the potential of XmAb5871 in SLE, now the third indication where a promising treatment effect has been seen, after rheumatoid arthritis and IgG4-Related Disease.
Auch Dr. Merrill sagt These encouraging results support further study of XmAb5871 in SLE.
Wieso redet Xencor das Ergebnis so positiv?
Allerdings sagen sie auch, dass sie SLE wohl verpartnern wollen.
By year end, we plan to initiate a Phase 3 study of XmAb5871 in IgG4-RD, and we are exploring further development in SLE in the context of partnering.
Ob das klappt?
Xencor completed this study to efficiently assess the potential of XmAb5871 in SLE, now the third indication where a promising treatment effect has been seen, after rheumatoid arthritis and IgG4-Related Disease.
Auch Dr. Merrill sagt These encouraging results support further study of XmAb5871 in SLE.
Wieso redet Xencor das Ergebnis so positiv?
Allerdings sagen sie auch, dass sie SLE wohl verpartnern wollen.
By year end, we plan to initiate a Phase 3 study of XmAb5871 in IgG4-RD, and we are exploring further development in SLE in the context of partnering.
Ob das klappt?
Antwort auf Beitrag Nr.: 58.879.218 von hinz12 am 05.10.18 15:47:14Noch mal ein Gedanke.
Wenn eine Studie als Late Breaking Abstract ausgewählt wird, dann kann sie doch gar nicht so schlecht sein oder werden auch gescheiterte Studien als Late Breaking Abstracts ausgewählt!?
Wenn eine Studie als Late Breaking Abstract ausgewählt wird, dann kann sie doch gar nicht so schlecht sein oder werden auch gescheiterte Studien als Late Breaking Abstracts ausgewählt!?
Antwort auf Beitrag Nr.: 58.878.297 von biopadawan am 05.10.18 14:25:05Naja, study failed...erkläre mir mal bitte dein kurzes Statement. Wenn man sich dumpf auf den primary endpoint bezieht mag dem so sein...
Was mich unheimlich ärgert: ich konnte bei 31$ nicht nachlegen, man muss ja auch mal arbeiten und kann nicht immer aktuell das Kursgeschehen verfolgen...
Was mich unheimlich ärgert: ich konnte bei 31$ nicht nachlegen, man muss ja auch mal arbeiten und kann nicht immer aktuell das Kursgeschehen verfolgen...
Mist, ich wollte gestern in der Schwäche noch nachkaufen...dann anderes Papier studiert und heut ist es gleich teurer aufgrund der Kongressdaten.
Ich glaube ich werde in den sauren Apfel beißen müssen und zu diesen Kursen akkumulieren, die Aussichten sind ja nicht unbedingt schlechter geworden
Ich glaube ich werde in den sauren Apfel beißen müssen und zu diesen Kursen akkumulieren, die Aussichten sind ja nicht unbedingt schlechter geworden

Bei MOR machen sie ja regelrechte Euphoriesprünge...da ist es hier noch ruhig.
Xencor to Present Initial Data from Phase 1 Study of XmAb®14045 Bispecific Antibody in Acute Myeloid Leukemia at the 2018 ASH Annual Meeting
PR Newswire PR NewswireNovember 1, 2018
MONROVIA, Calif., Nov. 1, 2018 /PRNewswire/ -- Xencor, Inc. (XNCR), a clinical-stage biopharmaceutical company developing monoclonal antibodies for the treatment of autoimmune disease, asthma and allergic diseases, and cancer, today announced that initial data from its ongoing Phase 1 dose-escalation study of XmAb®14045, a CD123 x CD3 bispecific antibody, in patients with relapsed/refractory acute myeloid leukemia (AML) will be presented in an oral session at the 2018 American Society of Hematology (ASH) Annual Meeting on Monday, December 3, 2018.
Key Highlights from the Abstract
At data cut off on June 27, 2018, 63 patients with relapsed/refractory AML and one patient with B cell acute lymphoblastic leukemia had received XmAb®14045. Patients had a median age of 61 years and were heavily pretreated, having a median of three prior therapies, and 30% (n=19/64) had undergone prior allogeneic stem cell transplantation.
No MTD was identified, and cytokine release syndrome (CRS) was the most common toxicity occurring in 49 of 64 patients (77%). Seven patients (11%) experienced Grade 3 or 4 CRS. CRS was generally manageable with premedication.
23% of evaluable patients with AML achieved either complete remission (CR) or CR with incomplete hematologic recovery (CRi) at the two highest dose levels studied to date (1.3 and 2.3 mcg/kg weekly; n=3/13).
Two patients with responses were bridged to stem cell transplantation, and the third was ineligible but remained in remission at 14+ weeks after initiating therapy.
"Initial results from the ongoing study of our lead bispecific antibody XmAb14045 in heavily pretreated patients with acute myeloid leukemia demonstrate that several patients achieved complete remissions," said Paul Foster, M.D., senior vice president and chief medical offer at Xencor. "XmAb14045 is a full-length immunoglobulin designed to be dosed intermittently. We continue to optimize dosing regimen as we advance the Phase 1 study."
Presentation Details
•
Abstract:
763
•
Title:
Complete Responses in Relapsed/Refractory Acute Myeloid Leukemia (AML) Patients on a Weekly Dosing Schedule of XmAb®14045, a CD123 x CD3 T Cell-Engaging Bispecific Antibody: Initial Results of a Phase 1 Study
•
Presenter:
Farhad Ravandi, M.D., Professor of Medicine and Chief of Section of Developmental Therapeutics in the Department of Leukemia at the University of Texas – M.D. Anderson Cancer Center
PR Newswire PR NewswireNovember 1, 2018
MONROVIA, Calif., Nov. 1, 2018 /PRNewswire/ -- Xencor, Inc. (XNCR), a clinical-stage biopharmaceutical company developing monoclonal antibodies for the treatment of autoimmune disease, asthma and allergic diseases, and cancer, today announced that initial data from its ongoing Phase 1 dose-escalation study of XmAb®14045, a CD123 x CD3 bispecific antibody, in patients with relapsed/refractory acute myeloid leukemia (AML) will be presented in an oral session at the 2018 American Society of Hematology (ASH) Annual Meeting on Monday, December 3, 2018.
Key Highlights from the Abstract
At data cut off on June 27, 2018, 63 patients with relapsed/refractory AML and one patient with B cell acute lymphoblastic leukemia had received XmAb®14045. Patients had a median age of 61 years and were heavily pretreated, having a median of three prior therapies, and 30% (n=19/64) had undergone prior allogeneic stem cell transplantation.
No MTD was identified, and cytokine release syndrome (CRS) was the most common toxicity occurring in 49 of 64 patients (77%). Seven patients (11%) experienced Grade 3 or 4 CRS. CRS was generally manageable with premedication.
23% of evaluable patients with AML achieved either complete remission (CR) or CR with incomplete hematologic recovery (CRi) at the two highest dose levels studied to date (1.3 and 2.3 mcg/kg weekly; n=3/13).
Two patients with responses were bridged to stem cell transplantation, and the third was ineligible but remained in remission at 14+ weeks after initiating therapy.
"Initial results from the ongoing study of our lead bispecific antibody XmAb14045 in heavily pretreated patients with acute myeloid leukemia demonstrate that several patients achieved complete remissions," said Paul Foster, M.D., senior vice president and chief medical offer at Xencor. "XmAb14045 is a full-length immunoglobulin designed to be dosed intermittently. We continue to optimize dosing regimen as we advance the Phase 1 study."
Presentation Details
•
Abstract:
763
•
Title:
Complete Responses in Relapsed/Refractory Acute Myeloid Leukemia (AML) Patients on a Weekly Dosing Schedule of XmAb®14045, a CD123 x CD3 T Cell-Engaging Bispecific Antibody: Initial Results of a Phase 1 Study
•
Presenter:
Farhad Ravandi, M.D., Professor of Medicine and Chief of Section of Developmental Therapeutics in the Department of Leukemia at the University of Texas – M.D. Anderson Cancer Center
Antwort auf Beitrag Nr.: 59.120.069 von Gustl24 am 02.11.18 07:51:25Die Papers im Zusammenhang mit MOR sind ja wohl bekannt oder im diesbzgl. Thread abrufbar

Termin heute:
MONROVIA, Calif., Nov. 20, 2018 /PRNewswire/ -- Xencor, Inc. (XNCR), a clinical-stage biopharmaceutical company developing engineered monoclonal antibodies for the treatment of autoimmune diseases, asthma and allergic diseases and cancer, today announced that Bassil Dahiyat, Ph.D., president and chief executive officer, will participate in a fireside chat at the 30th Annual Piper Jaffray Healthcare Conference on Tuesday, November 27, 2018 at 10:30 a.m. ET in New York, NY.
A live webcast of the presentation will be available under "Events & Presentations" in the Investors section of the Company's website located at http://investors.xencor.com/events.cfm. A replay of the presentation will be posted on the Xencor website approximately one hour after the live event and will be available for 90 days following the presentation.
MONROVIA, Calif., Nov. 20, 2018 /PRNewswire/ -- Xencor, Inc. (XNCR), a clinical-stage biopharmaceutical company developing engineered monoclonal antibodies for the treatment of autoimmune diseases, asthma and allergic diseases and cancer, today announced that Bassil Dahiyat, Ph.D., president and chief executive officer, will participate in a fireside chat at the 30th Annual Piper Jaffray Healthcare Conference on Tuesday, November 27, 2018 at 10:30 a.m. ET in New York, NY.
A live webcast of the presentation will be available under "Events & Presentations" in the Investors section of the Company's website located at http://investors.xencor.com/events.cfm. A replay of the presentation will be posted on the Xencor website approximately one hour after the live event and will be available for 90 days following the presentation.
Antwort auf Beitrag Nr.: 58.509.906 von StefanR am 22.08.18 17:53:44https://news.alexion.com
https://news.alexion.com/press-release/product-news/alexion-receives-early-fda-approval-ultomiris-ravulizumab-cwvz-adults-par
https://news.alexion.com/press-release/product-news/alexion-receives-early-fda-approval-ultomiris-ravulizumab-cwvz-adults-par
Antwort auf Beitrag Nr.: 59.500.480 von Aler01 am 23.12.18 15:15:01Die Nachricht der Zulassung von ALXN1210 war erwartet, aber ist trotzdem super, da zwei Monate früher als erwartet. Ich bin etwas erstaunt, dass die Aktie von Xencor nicht stärker anzieht.
Gestern gab es eine Investorenkonferenz von Alexion. Dort wurde gesagt, dass Alexion in den nächsten zwei Jahren 70 Prozent des Soliris Umsatzes für Pnh und nach Zulassung wohl auch von ahus auf Ultomiris also ALXN1210 shiften möchte. Soliris macht dieses Jahr ungefähr 3,5 Mrd Dollar Umsatz. Darin ist ein kleiner Teil für die Indikation gMG. Für gMG strebt man auch eine Zulassung von Ultomiris an, das kann aber noch etwas dauern.
Konservativ gerechnet haben wir also Ende 2020 mindestens 2 Mrd Umsatz für Ultomiris. Das sind bei 2,5 Prozent Royalities 50 Mio. Dollar für Xencor. In 2019 werden wir wohl schon knapp eine Mrd. Umsatz also ca. 25 Mio Royalities sehen. Dazu kommen noch 58 Mio Zulassungsmeilensteine in 2019 spätestens aber 2020.
in den Folgejahren gehe ich von steigenden Umsätzen aus. Alexion ist sehr sehr zuversichtlich.
Dazu noch eine Zulassung von MOR 208, die zu 80 Prozent sicher sein sollte. Das sind in 2019/2020 nochmal locker 100 Mio Dollar Meilensteinzahlungen für die Zulassung. Plus später mindestens 10% Royalities auf die Umsätze von MOR 208. Wenn wir da von konservativ 200 Mio Dollar im Jahr ausgehen, sind das weitere 20 Mio im Jahr.
Also kommen 2019/2020 ca. 228 Mio Dollar Umsatz, der gleichzeitig Gewinn ist, in die Kassen von Xencor. Und ab 2021 sicherlich 70 Mio Dollar jedes Jahr. Das ist alles eher konservativ geschätzt. Eine Kapitalerhöhung wird Xencor auf absehbare Zeit nicht benötigen.
Ich frage mich echt, wieso der Markt das noch nicht sieht. Irgendwann wird die Ernte aber kommen. Würde sehr wundern, wenn nicht. Oder übersehe ich habe irgendetwas und die Zukunft ist nicht so rosig?
Gestern gab es eine Investorenkonferenz von Alexion. Dort wurde gesagt, dass Alexion in den nächsten zwei Jahren 70 Prozent des Soliris Umsatzes für Pnh und nach Zulassung wohl auch von ahus auf Ultomiris also ALXN1210 shiften möchte. Soliris macht dieses Jahr ungefähr 3,5 Mrd Dollar Umsatz. Darin ist ein kleiner Teil für die Indikation gMG. Für gMG strebt man auch eine Zulassung von Ultomiris an, das kann aber noch etwas dauern.
Konservativ gerechnet haben wir also Ende 2020 mindestens 2 Mrd Umsatz für Ultomiris. Das sind bei 2,5 Prozent Royalities 50 Mio. Dollar für Xencor. In 2019 werden wir wohl schon knapp eine Mrd. Umsatz also ca. 25 Mio Royalities sehen. Dazu kommen noch 58 Mio Zulassungsmeilensteine in 2019 spätestens aber 2020.
in den Folgejahren gehe ich von steigenden Umsätzen aus. Alexion ist sehr sehr zuversichtlich.
Dazu noch eine Zulassung von MOR 208, die zu 80 Prozent sicher sein sollte. Das sind in 2019/2020 nochmal locker 100 Mio Dollar Meilensteinzahlungen für die Zulassung. Plus später mindestens 10% Royalities auf die Umsätze von MOR 208. Wenn wir da von konservativ 200 Mio Dollar im Jahr ausgehen, sind das weitere 20 Mio im Jahr.
Also kommen 2019/2020 ca. 228 Mio Dollar Umsatz, der gleichzeitig Gewinn ist, in die Kassen von Xencor. Und ab 2021 sicherlich 70 Mio Dollar jedes Jahr. Das ist alles eher konservativ geschätzt. Eine Kapitalerhöhung wird Xencor auf absehbare Zeit nicht benötigen.
Ich frage mich echt, wieso der Markt das noch nicht sieht. Irgendwann wird die Ernte aber kommen. Würde sehr wundern, wenn nicht. Oder übersehe ich habe irgendetwas und die Zukunft ist nicht so rosig?
Antwort auf Beitrag Nr.: 59.562.740 von hinz12 am 04.01.19 22:54:22Das hört sich doch nach einer guten Basis laufender Einnahmen an. Neben dem Gesamtmarkt in den letzten Monaten könnten Dinge, wie die fehlende Verpartnerung von XMab7195( gestaltet sich schwierig wegen Konkurrenz) ein Hindernis für eine bessere Entwicklung darstellen. Mit talacotuzumab geht es auch nicht voran.
Antwort auf Beitrag Nr.: 59.563.568 von Aler01 am 05.01.19 09:06:53Die Programme sind beide mehr oder weniger tot.
Bei Xmab7195 hat Xencor selber gesagt, dass es sehr schwer wird mit einer Verpartnerung und auch nichts werden könnte.
talacotuzumab Hat j&j gestoppt. Ist also auch tot.
https://clinicaltrials.gov/ct2/show/NCT02992860?term=JNJ-560…
https://www.genengnews.com/topics/translational-medicine/jj-…
[https://endpts.com/jj-is-jettisoning-two-of-its-promised-bl…
Die beiden Programme würde ich abschreiben bzw. der Markt hat das wohl schon.
Bei Xmab7195 hat Xencor selber gesagt, dass es sehr schwer wird mit einer Verpartnerung und auch nichts werden könnte.
talacotuzumab Hat j&j gestoppt. Ist also auch tot.
https://clinicaltrials.gov/ct2/show/NCT02992860?term=JNJ-560…
https://www.genengnews.com/topics/translational-medicine/jj-…
[https://endpts.com/jj-is-jettisoning-two-of-its-promised-bl…
Die beiden Programme würde ich abschreiben bzw. der Markt hat das wohl schon.
Antwort auf Beitrag Nr.: 59.563.880 von hinz12 am 05.01.19 10:23:41In der Pipelineübersicht von Xencor wurde die Zulassung nunmehr auch eingepfegt. Wenn man XmAb7195 und talacotuzumab weglässt, wird es in den fortgeschrittenen Studien eng. Bleibt abzuwarten, wann zu XmAb5871 der Studienstart beginnt.
Antwort auf Beitrag Nr.: 59.564.192 von Aler01 am 05.01.19 11:37:43Die Studie von XmAb 5871 in IgG4-Rd startet im ersten Quartal 2019. Eigentlich sollte sie im Q4 starten. Da es in der Indikation aber noch keine Erfahrungswerte bzw. Studien gibt, dauert die Besprechung des Studiendesigns mit der FDA etwas länger. Das heißt auch, dass man bei Erfolg der Studie First-in-class ist.
Da hat Xencor also in ein paar Wochen eine Phase 3 Studie. Danach wird es etwas dünn, das stimmt. Die Phase 1 Studien werden immer mehr. Da kommt also einiges nach. Wie die ausgehen, wird man sehen. Das Setup sieht für mich allerdings vielversprechend aus.
Da hat Xencor also in ein paar Wochen eine Phase 3 Studie. Danach wird es etwas dünn, das stimmt. Die Phase 1 Studien werden immer mehr. Da kommt also einiges nach. Wie die ausgehen, wird man sehen. Das Setup sieht für mich allerdings vielversprechend aus.
Antwort auf Beitrag Nr.: 59.565.245 von hinz12 am 05.01.19 15:02:03Ich sehe die Pipeline auch positiv( nur halt nach XmAb 5871 aktuell erstmal etwas dünn) ggf. sind die Entwicklungen der letzten Zeit( Stichwort: Gesamtmarkt, XmAb 5871 SLE, die negativen Aussagen zum Stand der Auslizensierungsbemühungen für XmAb7195) aber für die Kursentwicklung ausschlaggebend . Auf Sicht fühle ich mich gerade mit dem vorhandenen Cash und den zukünftig zu Erwartenden Einnahmen wirklich wohl in dieser Unternehmung. Ich bin gespannt, wie sich die Cashburnrate entwicklen wird.Mit Beginn der Phase ||| -Studie dürfte da ja doch einiges an Forschungskosten hinzukommen. Es bleibt jedenfalls spannend.
Antwort auf Beitrag Nr.: 59.565.533 von Aler01 am 05.01.19 16:17:10Die Phase 3 Studie soll 200-250 Patienten umfassen.
We expect to initiate a randomized placebo-controlled, double blinded Phase III study evaluating the addition of 5871 to the standard of care corticosteroids in approximately 200 to 250 patients with IgG4-RD by early in 2019.
Das ist nicht so groß. Ich habe mal ein wenig zu den Kosten so einer Studie recheriert, was nicht ganz einfach ist, da es tausend Meinung dazu gibt. Hier mal eine
https://www.liaison.com/blog/2017/05/02/cost-drug-developmen…
Ich wage eine Schätzung und tippe, dass die Phase 3 Studie für IgG4-RD ganz grob zwischen 150 - 300 Mio Dollar liegen wird.
Ich weiß, dass das unter der Zahl von der verlinkten Seite liegt, aber ich kann mir nicht vorstellen, dass Xencor 500 Mio ausgeben würde. Das wäre ihnen zu groß zu diesem Zeitpunkt der Unternehmensentwicklung. Da sind sie sehr konservativ.
We expect to initiate a randomized placebo-controlled, double blinded Phase III study evaluating the addition of 5871 to the standard of care corticosteroids in approximately 200 to 250 patients with IgG4-RD by early in 2019.
Das ist nicht so groß. Ich habe mal ein wenig zu den Kosten so einer Studie recheriert, was nicht ganz einfach ist, da es tausend Meinung dazu gibt. Hier mal eine
https://www.liaison.com/blog/2017/05/02/cost-drug-developmen…
Ich wage eine Schätzung und tippe, dass die Phase 3 Studie für IgG4-RD ganz grob zwischen 150 - 300 Mio Dollar liegen wird.
Ich weiß, dass das unter der Zahl von der verlinkten Seite liegt, aber ich kann mir nicht vorstellen, dass Xencor 500 Mio ausgeben würde. Das wäre ihnen zu groß zu diesem Zeitpunkt der Unternehmensentwicklung. Da sind sie sehr konservativ.
XmAb13676 ist wieder vollständig bei Xencor
Xencor Regains ex-U.S. Commercial Rights to XmAb®13676, CD20 x CD3 Bispecific Antibody
-- Initial data from the ongoing Phase 1 study in patients with B-cell malignancies expected in 2019 --
-- Xencor and Novartis to continue co-developing XmAb®14045, a CD123 x CD3 bispecific antibody, in relapsed/refractory acute myeloid leukemia --
MONROVIA, Calif., Jan. 7, 2019 /PRNewswire/ -- Xencor, Inc. (NASDAQ: XNCR), a clinical-stage biopharmaceutical company developing engineered monoclonal antibodies for the treatment of autoimmune disease, asthma and allergic disease and cancer, today announced it will regain rights to develop and commercialize XmAb13676, a CD20 x CD3 bispecific antibody, from Novartis effective June 20, 2019, due to strategic pipeline reprioritization by Novartis. Xencor granted Novartis co-development and ex-U.S. commercial rights in June 2016 through a collaboration and license agreement to develop and commercialize novel bispecific antibodies, including XmAb13676 and XmAb14045, and to access Xencor's XmAb® bispecific Fc and other Fc technologies. Currently XmAb13676 is being evaluated in an open-label Phase 1, multiple-dose, dose-escalation study to assess its safety, tolerability and preliminary anti-tumor activity in patients with B-cell malignancies, and initial data are expected in 2019.
"We continue to work closely with Novartis across multiple programs in the collaboration, and both companies are eager to advance XmAb14045 in clinical development. Recently we presented encouraging early data from our Phase 1 study in patients with relapsed/refractory AML, observing multiple complete remissions on a weekly dosing schedule, and we continue to optimize dose in that study. Novartis also has internal XmAb preclinical bispecific programs progressing," said Bassil Dahiyat, Ph.D., president and chief executive officer at Xencor. "Xencor will continue to develop XmAb13676 as planned, and we believe its tuned potency holds potential for the treatment of patients with B-cell malignancies."
Under the terms of the collaboration agreement, Xencor and Novartis continue to share costs for the worldwide development of XmAb14045 with Xencor maintaining U.S. commercialization rights and Novartis having commercialization rights in the rest of the world, and worldwide development costs for XmAb13676 will be shared until June 2020. Novartis received worldwide rights to Xencor's bispecific technology to develop and commercialize four additional targets selected by Novartis. Xencor is eligible to receive clinical, regulatory and sales milestone payments for successful programs, as well as tiered, low double-digit royalties for sales of XmAb14045 outside of the U.S. and mid single-digit tiered royalties for worldwide sales of the four proprietary Novartis bispecific molecules.
----------
Ist schwer zu sagen, was das für ein Zeichen ist. Wenn man Xencor glaubt, dann ist es nur eine strategische Repriorisierung der Pipeline von Novartis. Jetzt kann man natürlich spekulieren, ob der Schritt gemacht worden wäre, wenn die Daten überragend wären. Novartis wird ja Einblick haben.
Immerhin werden die Entwicklungskosten für XmAb13676 noch bis Juni 2020 geteilt. Bis dahin kann sich Xencor entscheiden, ob sie den Weg auch alleine gehen wollen oder einen neuen Partner finden. Die Daten sollten bis dahin eine Aussage geben und im Falle eines neuen Partners können gute Konditionen erzielt werden. Was aber auch klar ist, ist das nicht jede Studie von Xencor ein Erfolg werden kann. Das ist ganz normal. Hier würde ich noch nicht final urteilen, aber eher vom schlechten ausgehen.
Xencor Regains ex-U.S. Commercial Rights to XmAb®13676, CD20 x CD3 Bispecific Antibody
-- Initial data from the ongoing Phase 1 study in patients with B-cell malignancies expected in 2019 --
-- Xencor and Novartis to continue co-developing XmAb®14045, a CD123 x CD3 bispecific antibody, in relapsed/refractory acute myeloid leukemia --
MONROVIA, Calif., Jan. 7, 2019 /PRNewswire/ -- Xencor, Inc. (NASDAQ: XNCR), a clinical-stage biopharmaceutical company developing engineered monoclonal antibodies for the treatment of autoimmune disease, asthma and allergic disease and cancer, today announced it will regain rights to develop and commercialize XmAb13676, a CD20 x CD3 bispecific antibody, from Novartis effective June 20, 2019, due to strategic pipeline reprioritization by Novartis. Xencor granted Novartis co-development and ex-U.S. commercial rights in June 2016 through a collaboration and license agreement to develop and commercialize novel bispecific antibodies, including XmAb13676 and XmAb14045, and to access Xencor's XmAb® bispecific Fc and other Fc technologies. Currently XmAb13676 is being evaluated in an open-label Phase 1, multiple-dose, dose-escalation study to assess its safety, tolerability and preliminary anti-tumor activity in patients with B-cell malignancies, and initial data are expected in 2019.
"We continue to work closely with Novartis across multiple programs in the collaboration, and both companies are eager to advance XmAb14045 in clinical development. Recently we presented encouraging early data from our Phase 1 study in patients with relapsed/refractory AML, observing multiple complete remissions on a weekly dosing schedule, and we continue to optimize dose in that study. Novartis also has internal XmAb preclinical bispecific programs progressing," said Bassil Dahiyat, Ph.D., president and chief executive officer at Xencor. "Xencor will continue to develop XmAb13676 as planned, and we believe its tuned potency holds potential for the treatment of patients with B-cell malignancies."
Under the terms of the collaboration agreement, Xencor and Novartis continue to share costs for the worldwide development of XmAb14045 with Xencor maintaining U.S. commercialization rights and Novartis having commercialization rights in the rest of the world, and worldwide development costs for XmAb13676 will be shared until June 2020. Novartis received worldwide rights to Xencor's bispecific technology to develop and commercialize four additional targets selected by Novartis. Xencor is eligible to receive clinical, regulatory and sales milestone payments for successful programs, as well as tiered, low double-digit royalties for sales of XmAb14045 outside of the U.S. and mid single-digit tiered royalties for worldwide sales of the four proprietary Novartis bispecific molecules.
----------
Ist schwer zu sagen, was das für ein Zeichen ist. Wenn man Xencor glaubt, dann ist es nur eine strategische Repriorisierung der Pipeline von Novartis. Jetzt kann man natürlich spekulieren, ob der Schritt gemacht worden wäre, wenn die Daten überragend wären. Novartis wird ja Einblick haben.
Immerhin werden die Entwicklungskosten für XmAb13676 noch bis Juni 2020 geteilt. Bis dahin kann sich Xencor entscheiden, ob sie den Weg auch alleine gehen wollen oder einen neuen Partner finden. Die Daten sollten bis dahin eine Aussage geben und im Falle eines neuen Partners können gute Konditionen erzielt werden. Was aber auch klar ist, ist das nicht jede Studie von Xencor ein Erfolg werden kann. Das ist ganz normal. Hier würde ich noch nicht final urteilen, aber eher vom schlechten ausgehen.
In der Q4 2018 von Amgen habe ich ein neues Programm von Xencor gefunden.
AMG 509 prostate bispecificAb (XmAb®)
http://investors.amgen.com/phoenix.zhtml?c=61656&p=irol-pres… ) - Seite 30
Das Ganze scheint das zweite Programm von Amgen im Rahmen der Kooperation aus 2015 zu sein. Xencor hat das Ganze meines Wissens noch nicht vermeldet.
Zudem sind für AMG 424 Daten in 2019 möglich (linke Seite der Folie unter Multiple Myeloma).
Sehr spannend beides.
AMG 509 prostate bispecificAb (XmAb®)

http://investors.amgen.com/phoenix.zhtml?c=61656&p=irol-pres… ) - Seite 30
Das Ganze scheint das zweite Programm von Amgen im Rahmen der Kooperation aus 2015 zu sein. Xencor hat das Ganze meines Wissens noch nicht vermeldet.
Zudem sind für AMG 424 Daten in 2019 möglich (linke Seite der Folie unter Multiple Myeloma).
Sehr spannend beides.
Antwort auf Beitrag Nr.: 59.772.894 von hinz12 am 01.02.19 22:05:47Sorry, so unbekannt ist AMG509 doch nicht. Ist in der neuen Unternehmenspräsentation von Xencor vom 7. Januar 2019 auf Folie 20. hatte ich übersehen. Trotzdem erfreulich.
Mit Pressemitteilungen ist Xencor ja eh eher sparsam. Gab auch keine Mitteilung zu Ultomiris.
Mit Pressemitteilungen ist Xencor ja eh eher sparsam. Gab auch keine Mitteilung zu Ultomiris.
Das Programm, von dem der gute alte Joschka so begeistert war, ist verpartnert.
Xencor to Develop and Commercialize Novel IL-15 Immune Activating Cytokines with Genentech
On February 4, 2019, Xencor, Inc. (“Xencor”) entered into a Collaboration and License Agreement (the “Agreement”) with Genentech, Inc. and Hoffmann-LaRoche Ltd. (collectively, “Genentech”) pursuant to which Xencor and Genentech expect to develop and commercialize novel IL-15 cytokine therapeutics that use Xencor’s bispecific Fc technology, including XmAb®24306 (the “Collaboration Products”), in the areas of cancer immunotherapy. The parties will jointly collaborate on the worldwide development of XmAb24306 and other Collaboration Products with Genentech maintaining all worldwide commercialization rights, subject to Xencor having a co-promotion option in the United States. Xencor has the right to perform clinical studies of Collaboration Products in combination with other therapeutic agents, subject to certain requirements. Genentech received a worldwide exclusive license to the Collaboration Products.
Under the terms of the Agreement, Xencor will receive a $120 million upfront payment and is eligible to receive up to an aggregate of $160 million in clinical milestone payments for each Collaboration Product that advances to Phase 3 clinical trials. Xencor is eligible to receive a 45% share of net profits for sales of XmAb24306 and other Collaboration Products, while also sharing in the net losses at the same percentage rate. The companies will also jointly share development and commercialization costs at the same percentage rate, while Genentech will bear launch costs entirely. The profit/cost share is subject to ratchet at Xencor’s discretion and convertible to a royalty under certain circumstances.
Xencor and Genentech will also conduct joint research activities for a two-year period to discover additional IL-15 candidates developed from Xencor’s cytokine and bispecific Fc technologies. Xencor will receive a $20 million development milestone for each new Collaboration Product that is identified from the research efforts and advances into Phase 1 clinical trials.
The term of the Agreement will continue on a program-by-program and country-by-country basis until there are no remaining payment obligations from Genentech to Xencor with respect to Collaboration Products. Genentech may terminate the Agreement in its entirety or on a Collaboration Product-by-Collaboration Product basis by providing prior written notice. Xencor may terminate the Agreement on a Collaboration Product-by-Collaboration Product basis if Genentech fails to spend a defined minimum amount on research, development or commercialization activities for that Collaboration Product. Either party may also terminate the agreement with written notice upon a bankruptcy of the other party or for a material breach by the other party, if such breach has not been cured within a defined period of receiving such notice. In the event of a termination of any individual Collaboration Product or the Agreement in its entirety, the relevant rights revert to Xencor.
The Agreement is subject to customary closing conditions, including clearance under the Hart-Scott-Rodino Antitrust Improvements Act, and closing is expected to occur in the first half of 2019.
The foregoing description of the Agreement is only a summary and is qualified in its entirety by reference to the Agreement. Xencor intends to file a copy of the Agreement as an exhibit to its Quarterly Report on Form 10-Q for its fiscal quarter ending March 31, 2019, portions of which will be subject to a FOIA Confidential Treatment Request to the Securities and Exchange Commission pursuant to Rule 24b-2 under the Securities Exchange Act of 1934, as amended, for certain portions of the Agreement. The omitted material will be included in the request for confidential treatment.
Ich habe mal den Text aus dem 8-K Filing und nicht die Pressemeldung reingestellt, weil ich den informativer finde.
https://investors.xencor.com/node/11026/html
Der Deal läßt sich sehen. 120 Mio Upfront plus 160 Mio Dollar Milestones. Für jedes neue Programm neben XmAb24306 gibs noch mal 20 Mio. Dollar zum Phase 1 Start. Plus 160 Mio Dollar, wenn es einen Phase 3 Start gibt. Ich finde, das liest sich komisch, weil es dann gar keine Zahlung mehr beim Filing gäbe, aber scheint so zu sein. Xencor kann unter bestimmten Umständen statt 45% Beteiligung am Vertriebsgewinn auch ein Royality Deal daraus machen.
Jetzt hat Xencor weit über 600 Mio Dollar Cash bei einer Bewertung von ca. 2,2 Mrd Dollar. Dazu kommen in Zukunft regelmäßige Einnahmen von Ultomiris, vielleicht noch von MOR208 von Morphosys. Ferner sollte die Phase 3 Studie mit XmAb5871 bald starten. Ich bin echt überrascht, dass der Kurs noch so tief steht, aber irgendwann wird sich das ändern.
Ein Update der Pipeline und die Ziele 2019 wirds mit den Zahlen am 01. März geben.
Xencor to Develop and Commercialize Novel IL-15 Immune Activating Cytokines with Genentech
On February 4, 2019, Xencor, Inc. (“Xencor”) entered into a Collaboration and License Agreement (the “Agreement”) with Genentech, Inc. and Hoffmann-LaRoche Ltd. (collectively, “Genentech”) pursuant to which Xencor and Genentech expect to develop and commercialize novel IL-15 cytokine therapeutics that use Xencor’s bispecific Fc technology, including XmAb®24306 (the “Collaboration Products”), in the areas of cancer immunotherapy. The parties will jointly collaborate on the worldwide development of XmAb24306 and other Collaboration Products with Genentech maintaining all worldwide commercialization rights, subject to Xencor having a co-promotion option in the United States. Xencor has the right to perform clinical studies of Collaboration Products in combination with other therapeutic agents, subject to certain requirements. Genentech received a worldwide exclusive license to the Collaboration Products.
Under the terms of the Agreement, Xencor will receive a $120 million upfront payment and is eligible to receive up to an aggregate of $160 million in clinical milestone payments for each Collaboration Product that advances to Phase 3 clinical trials. Xencor is eligible to receive a 45% share of net profits for sales of XmAb24306 and other Collaboration Products, while also sharing in the net losses at the same percentage rate. The companies will also jointly share development and commercialization costs at the same percentage rate, while Genentech will bear launch costs entirely. The profit/cost share is subject to ratchet at Xencor’s discretion and convertible to a royalty under certain circumstances.
Xencor and Genentech will also conduct joint research activities for a two-year period to discover additional IL-15 candidates developed from Xencor’s cytokine and bispecific Fc technologies. Xencor will receive a $20 million development milestone for each new Collaboration Product that is identified from the research efforts and advances into Phase 1 clinical trials.
The term of the Agreement will continue on a program-by-program and country-by-country basis until there are no remaining payment obligations from Genentech to Xencor with respect to Collaboration Products. Genentech may terminate the Agreement in its entirety or on a Collaboration Product-by-Collaboration Product basis by providing prior written notice. Xencor may terminate the Agreement on a Collaboration Product-by-Collaboration Product basis if Genentech fails to spend a defined minimum amount on research, development or commercialization activities for that Collaboration Product. Either party may also terminate the agreement with written notice upon a bankruptcy of the other party or for a material breach by the other party, if such breach has not been cured within a defined period of receiving such notice. In the event of a termination of any individual Collaboration Product or the Agreement in its entirety, the relevant rights revert to Xencor.
The Agreement is subject to customary closing conditions, including clearance under the Hart-Scott-Rodino Antitrust Improvements Act, and closing is expected to occur in the first half of 2019.
The foregoing description of the Agreement is only a summary and is qualified in its entirety by reference to the Agreement. Xencor intends to file a copy of the Agreement as an exhibit to its Quarterly Report on Form 10-Q for its fiscal quarter ending March 31, 2019, portions of which will be subject to a FOIA Confidential Treatment Request to the Securities and Exchange Commission pursuant to Rule 24b-2 under the Securities Exchange Act of 1934, as amended, for certain portions of the Agreement. The omitted material will be included in the request for confidential treatment.
Ich habe mal den Text aus dem 8-K Filing und nicht die Pressemeldung reingestellt, weil ich den informativer finde.
https://investors.xencor.com/node/11026/html
Der Deal läßt sich sehen. 120 Mio Upfront plus 160 Mio Dollar Milestones. Für jedes neue Programm neben XmAb24306 gibs noch mal 20 Mio. Dollar zum Phase 1 Start. Plus 160 Mio Dollar, wenn es einen Phase 3 Start gibt. Ich finde, das liest sich komisch, weil es dann gar keine Zahlung mehr beim Filing gäbe, aber scheint so zu sein. Xencor kann unter bestimmten Umständen statt 45% Beteiligung am Vertriebsgewinn auch ein Royality Deal daraus machen.
Jetzt hat Xencor weit über 600 Mio Dollar Cash bei einer Bewertung von ca. 2,2 Mrd Dollar. Dazu kommen in Zukunft regelmäßige Einnahmen von Ultomiris, vielleicht noch von MOR208 von Morphosys. Ferner sollte die Phase 3 Studie mit XmAb5871 bald starten. Ich bin echt überrascht, dass der Kurs noch so tief steht, aber irgendwann wird sich das ändern.
Ein Update der Pipeline und die Ziele 2019 wirds mit den Zahlen am 01. März geben.
Antwort auf Beitrag Nr.: 59.798.361 von hinz12 am 05.02.19 18:26:18Ja sehr schöner Deal. Mit einem Top Partner! Die Konditionen sprechen für eine starke Verhandlungsposition. Wenn ich das richtig verstehe: Co Promotion Rechte in den USA und für den Rest der Welt 45% vom Profit (oder royalties). Die Konditionen sind definitiv so, dass Roche bei Erfolg in den Studien XNCR übernehmen dürfte. Risiko ist natürlich aber erstmal, dass auch die Entwicklungskosten aufgeteilt werden. Aber wie du schreibst: Cash ist da.
Die Firma Inmune Bio (Ticker: INMB) an der Xencor beteiligt ist, ist am 04. Februar an die Nasdaq gegangen.
https://inmunebio.com/index.php/en/news-2/2019/189-inmune-bi…
Inmune Bio hatte 2017 den Wirkstoff INB03 von Xencor einlizensiert. Xencor hatte dafür eine Beteiligung an der Firma bekommen.
-------------------
INmune Bio Licenses INB03, a First-in Class Innate Immune System Check-Point Inhibitor that Targets Myeloid Derived Suppressor Cells in Cancer
LA JOLLA, CA--(Marketwired - Oct 10, 2017) - INmune Bio, Inc., a cancer immunotherapy company focused on developing therapies that harness the patient's innate immune system to attack their cancer, announces that it has licensed INB03, a novel innate immune system check-point inhibitor that targets Myeloid Derived Suppressor Cells, from Xencor, Inc.
Myeloid Derived Suppressor Cells (MDSC) of the innate immune system are often increased in patients with cancer. The level of MDSC in the blood or the tumor microenvironment predict severity of disease, risk of dying from the cancer, and the failure of other immunotherapy treatment strategies such as currently available check point inhibitors. The MDSC secrete immunosuppressive cytokines that protect the tumor from attack by the patient's immune system. Strategies that target MDSC are needed to continue to make progress in the treatment of cancer.
Dr. RJ Tesi, MD, CEO and co-founder of INmune Bio, commented, "INB03 is a novel drug with a unique mechanism-of-action. Xencor has provided us with a complete pre-clinical and manufacturing package that will allow us to enter the clinic quickly."
Dr. Bassil Dahiyat, CEO and founder of Xencor said, "INB03 has novel immune modulating activity and we are excited that the team at INmune Bio are studying its potential in the tumor microenvironment and advancing its development."
The terms of the deal have not been made public. Xencor received an ownership position in INmune Bio and a seat on the Board of Directors.
https://inmunebio.com/index.php/en/news-2/2017/96-inmune-bio…
-----------------
David Szymkowski von Xencor sitzt als Folge des Deals im Aufsichtsrat von Inmune Bio.
Insgesamt hält Xencor zurzeit 1.585.000 Aktien
https://investors.xencor.com/node/11061/html
Dies kommt mir zwar im Verhältnis zu den jetzt ausgegebenen Aktien etwas viel vor, da jetzt nur knapp 1 Mio Aktien für einen Preis von $8 an die Börse gekommen sind. Andererseits wären ca. 12 Mio Dollar für einen Wirkstoff auch billig, aber eben mit Aussicht auf Beteiligung an der Unternehmensentwicklung. Vielleicht kann man mich hier berichtigen, falls ich die Form 3 da falsch lese.
Der Wirkstoff INB03 befindet sich einer Phase 1 Studie. Am 19. März sollen erste Daten aus der Phase 1 Studie veröffentlicht werden. Leider habe ich diese nicht bei Clinical Trials gefunden. Vielleicht kann auch hier jemand helfen.
Eine Unternehmenspräsentation mit einem guten Überblick findet man hier
https://inmunebio.com/images/INMB_Bio_CEO_Investor.Feb.2019_…
Am Montag geben sie noch mal eine Investorenkonferenz
https://inmunebio.com/index.php/en/news-2/2019/222-muneiotor…
Alles in allem eine sehr positive Sache. Es gibt nur Potenzial nach oben ohne Risiko. Entweder werden die Aktien bzw. die Beteiligung irgendwann richtig was wert sein oder sie werden wertlos und man verliert Stand jetzt 12 Mio Dollar.
https://inmunebio.com/index.php/en/news-2/2019/189-inmune-bi…
Inmune Bio hatte 2017 den Wirkstoff INB03 von Xencor einlizensiert. Xencor hatte dafür eine Beteiligung an der Firma bekommen.
-------------------
INmune Bio Licenses INB03, a First-in Class Innate Immune System Check-Point Inhibitor that Targets Myeloid Derived Suppressor Cells in Cancer
LA JOLLA, CA--(Marketwired - Oct 10, 2017) - INmune Bio, Inc., a cancer immunotherapy company focused on developing therapies that harness the patient's innate immune system to attack their cancer, announces that it has licensed INB03, a novel innate immune system check-point inhibitor that targets Myeloid Derived Suppressor Cells, from Xencor, Inc.
Myeloid Derived Suppressor Cells (MDSC) of the innate immune system are often increased in patients with cancer. The level of MDSC in the blood or the tumor microenvironment predict severity of disease, risk of dying from the cancer, and the failure of other immunotherapy treatment strategies such as currently available check point inhibitors. The MDSC secrete immunosuppressive cytokines that protect the tumor from attack by the patient's immune system. Strategies that target MDSC are needed to continue to make progress in the treatment of cancer.
Dr. RJ Tesi, MD, CEO and co-founder of INmune Bio, commented, "INB03 is a novel drug with a unique mechanism-of-action. Xencor has provided us with a complete pre-clinical and manufacturing package that will allow us to enter the clinic quickly."
Dr. Bassil Dahiyat, CEO and founder of Xencor said, "INB03 has novel immune modulating activity and we are excited that the team at INmune Bio are studying its potential in the tumor microenvironment and advancing its development."
The terms of the deal have not been made public. Xencor received an ownership position in INmune Bio and a seat on the Board of Directors.
https://inmunebio.com/index.php/en/news-2/2017/96-inmune-bio…
-----------------
David Szymkowski von Xencor sitzt als Folge des Deals im Aufsichtsrat von Inmune Bio.
Insgesamt hält Xencor zurzeit 1.585.000 Aktien
https://investors.xencor.com/node/11061/html
Dies kommt mir zwar im Verhältnis zu den jetzt ausgegebenen Aktien etwas viel vor, da jetzt nur knapp 1 Mio Aktien für einen Preis von $8 an die Börse gekommen sind. Andererseits wären ca. 12 Mio Dollar für einen Wirkstoff auch billig, aber eben mit Aussicht auf Beteiligung an der Unternehmensentwicklung. Vielleicht kann man mich hier berichtigen, falls ich die Form 3 da falsch lese.
Der Wirkstoff INB03 befindet sich einer Phase 1 Studie. Am 19. März sollen erste Daten aus der Phase 1 Studie veröffentlicht werden. Leider habe ich diese nicht bei Clinical Trials gefunden. Vielleicht kann auch hier jemand helfen.
Eine Unternehmenspräsentation mit einem guten Überblick findet man hier
https://inmunebio.com/images/INMB_Bio_CEO_Investor.Feb.2019_…
Am Montag geben sie noch mal eine Investorenkonferenz
https://inmunebio.com/index.php/en/news-2/2019/222-muneiotor…
Alles in allem eine sehr positive Sache. Es gibt nur Potenzial nach oben ohne Risiko. Entweder werden die Aktien bzw. die Beteiligung irgendwann richtig was wert sein oder sie werden wertlos und man verliert Stand jetzt 12 Mio Dollar.
Hier noch mal auf einer Folie, was Alexion alles mit ALXN1210 (Ultomiris) vor hat. Das kann bei ca. 2,5 Prozent Royalities groß werden für Xencor.

http://ir.alexion.com/static-files/f0da9ad0-a6c8-4dfa-8c61-4…
Als nächstes kommt die Zulassung PNH in Europa. Dann werden die Änträge für aHus in USA, Europa und Japan eingereicht.
Die Indikationen gMG und NMOSD sind, wenn ich das noch richtig im Ohr habe, von der Größenordnung noch mal ganz andere Hausnummern als PNH und aHus. Ich bin auch sehr zuversichtlich, dass das in beiden Indikationen klappt. Ultomiris scheint ja wie Soliris nur besser. Warten wirs ab. Aber das dauert auch noch. Die Phase 3 Studien starten ja erst.

http://ir.alexion.com/static-files/f0da9ad0-a6c8-4dfa-8c61-4…
Als nächstes kommt die Zulassung PNH in Europa. Dann werden die Änträge für aHus in USA, Europa und Japan eingereicht.
Die Indikationen gMG und NMOSD sind, wenn ich das noch richtig im Ohr habe, von der Größenordnung noch mal ganz andere Hausnummern als PNH und aHus. Ich bin auch sehr zuversichtlich, dass das in beiden Indikationen klappt. Ultomiris scheint ja wie Soliris nur besser. Warten wirs ab. Aber das dauert auch noch. Die Phase 3 Studien starten ja erst.
Antwort auf Beitrag Nr.: 59.835.750 von hinz12 am 10.02.19 12:43:49Ich hab noch einmal geschaut weiter zu Inmune Bio geschaut. Es waren 1 - 2,5 Mio. Aktien im Angebot. Leider wurden nur knapp über 1 Mio. verkauft, so dass die Firma jetzt mit ein wenig Cashproblemen darsteht bzw. nicht alles machen kann, was sie sich vorgenommen hatte. Die eingenommenen 8 Mio. Dollar sollen für folgendes verwendet werden.
If just the minimum is raised, we will conduct only two clinical trials, the Ovarian Cancer Phase I/II and MDSC INB03 Phase I trials and depend on existing drug supplies to support those clinical trials. The Ovarian Cancer Phase I/II trial for the minimum and maximum offering are identical planned programs.
approximately $4,000,000 for our Phase I/II clinical trial for our INKmune product candidate for Ovarian Cancer;
approximately $1,500,000 for our Phase I clinical trial with INB03 in patients with advanced cancer and elevated MDSC in their blood;
the remaining $1,398,571 for working capital and general corporate purposes.
The Company anticipates that the existing cash on hand plus the expected R&D cash credits from the UK and Australian trials and net proceeds from the Minimum Offering Amount will be enough to complete the INKmune Phase I/II trial in women with ovarian cancer and the Phase I trial using INB03 in ovarian cancer patients.
http://www.edgarmaster.com/Inet/main/DataFeedHtml1.jsp (komplettes Prospekt des IPOs)
Xencor besitzt tatsächlich 1,585,000 Aktien, was 18,81% der gesamten Aktien vor dem IPO waren. Auch nach dem IPO befindet sich der Großteil der Aktien also noch in "alten Händen" und bei Xencor.
Xencor bekommt 5% Royalites auf Verkäufe von INB03 und auch Prozente aus Sublizenzierungen, die gestaffelt sind. Bei Sublizenzierung in Phase 1 sind es zum Beispiel 30 Prozent.
Im Prinzip könnte Xencor auch ein bisschen Geld aus der Portokasse nachschießen. Aber da wird man mindestens die Daten aus der Phase 1 Studie im März abwarten.
Ist aber alles sehr wage und noch nicht der große Knaller. Ich bezweifele auch, dass es was wird. Die Investoren waren beim IPO ja sehr zurückhaltend mit Käufen. Aber es gibt wie gesagt auch nicht viel zu verlieren.
If just the minimum is raised, we will conduct only two clinical trials, the Ovarian Cancer Phase I/II and MDSC INB03 Phase I trials and depend on existing drug supplies to support those clinical trials. The Ovarian Cancer Phase I/II trial for the minimum and maximum offering are identical planned programs.
approximately $4,000,000 for our Phase I/II clinical trial for our INKmune product candidate for Ovarian Cancer;
approximately $1,500,000 for our Phase I clinical trial with INB03 in patients with advanced cancer and elevated MDSC in their blood;
the remaining $1,398,571 for working capital and general corporate purposes.
The Company anticipates that the existing cash on hand plus the expected R&D cash credits from the UK and Australian trials and net proceeds from the Minimum Offering Amount will be enough to complete the INKmune Phase I/II trial in women with ovarian cancer and the Phase I trial using INB03 in ovarian cancer patients.
http://www.edgarmaster.com/Inet/main/DataFeedHtml1.jsp (komplettes Prospekt des IPOs)
Xencor besitzt tatsächlich 1,585,000 Aktien, was 18,81% der gesamten Aktien vor dem IPO waren. Auch nach dem IPO befindet sich der Großteil der Aktien also noch in "alten Händen" und bei Xencor.
Xencor bekommt 5% Royalites auf Verkäufe von INB03 und auch Prozente aus Sublizenzierungen, die gestaffelt sind. Bei Sublizenzierung in Phase 1 sind es zum Beispiel 30 Prozent.
Im Prinzip könnte Xencor auch ein bisschen Geld aus der Portokasse nachschießen. Aber da wird man mindestens die Daten aus der Phase 1 Studie im März abwarten.
Ist aber alles sehr wage und noch nicht der große Knaller. Ich bezweifele auch, dass es was wird. Die Investoren waren beim IPO ja sehr zurückhaltend mit Käufen. Aber es gibt wie gesagt auch nicht viel zu verlieren.
Antwort auf Beitrag Nr.: 59.919.914 von schnappi am 20.02.19 13:19:32Natürlich nicht gut, aber Fehlschläge sind nunmal normal. Eventuell sogar heute eine Kaufgelegenheit, weil m.E. andere Kandidaten sich sehr gut entwickeln.
Zudem ist CD123 ein schwieriges Target, s. STML etc. Sprich scheint mir mit dem Target zusammenzuhängen und nicht mit der Technologie...

https://twitter.com/JacobPlieth/status/920279210740117505
Zudem ist CD123 ein schwieriges Target, s. STML etc. Sprich scheint mir mit dem Target zusammenzuhängen und nicht mit der Technologie...

https://twitter.com/JacobPlieth/status/920279210740117505
Antwort auf Beitrag Nr.: 59.920.307 von kmastra am 20.02.19 13:48:50Habe ein Limit drin mal sehen ob es so weit runter geht ...
Antwort auf Beitrag Nr.: 59.920.307 von kmastra am 20.02.19 13:48:50$STML ist aber durch und am Markt nur der Kurs ist 

Antwort auf Beitrag Nr.: 59.920.403 von schnappi am 20.02.19 13:56:44Ja. Die haben die Nebenwirkungen einigermaßen in den Griff bekommen. Zudem ist das natürlich immer eine Nutzen-Risiko Abwägung. Und hier hat der Nutzen wohl klar überwogen. War nur ein Beispiel das Target betreffend. Und Limit hat gegriffen?
Antwort auf Beitrag Nr.: 59.922.236 von kmastra am 20.02.19 16:11:45Nein so tief ging es nun doch nicht runter 24 Euro, dafür gab es $CVS heute wieder günstiger ..
Heute gehts richtig schön bergab
Antwort auf Beitrag Nr.: 59.942.355 von biopadawan am 22.02.19 15:44:35Liegt an einer Verkaufsempfehlung: downgraded to Reduce at Nomura. PT $21
Für mich ein Nonevent und habe deshalb heute zugekauft. Man konzentriert sich momentan sehr auf das was nicht funktioniert und vergisst dabei das was gut funktioniert. Wie im echten Leben halt! Ha!

Für mich ein Nonevent und habe deshalb heute zugekauft. Man konzentriert sich momentan sehr auf das was nicht funktioniert und vergisst dabei das was gut funktioniert. Wie im echten Leben halt! Ha!
Antwort auf Beitrag Nr.: 59.942.783 von kmastra am 22.02.19 16:25:15Ich warte noch ab denke die 25$ sehen wir mind. noch mal.
Auf jeden Fall dann kaufenswert.
Auf jeden Fall dann kaufenswert.
Antwort auf Beitrag Nr.: 59.943.341 von schnappi am 22.02.19 17:25:17Das kann natürlich sein. Oft kaufe ich tatsächlich zu früh nach. 
Aber fundamental gibt der Clinical Hold m.E. einen solchen Absturz nicht her. Hängt natürlich auch viel vom Gesamtmarkt ab...

Aber fundamental gibt der Clinical Hold m.E. einen solchen Absturz nicht her. Hängt natürlich auch viel vom Gesamtmarkt ab...
Man hat sich jetzt entschieden, die weitere Entwicklung zu xmab-5871 nun doch nur mit einem Partner voranzubringen und ist entsprechend auf der Suche. Ggf. Werden Lizenzgebühren aus Ultomoris-Verkäufen inQ2-3 gesondert ausgewiesen( wenn ich das richtig verstanden habe). Kann jemand einschätzen, wie die Chancen einer Verpartnerung stehen?
Kurs ist ganz schön angeschlagen. Momentan gibts für 1B EV eine nette Pipeline im Ausverkauf.
Antwort auf Beitrag Nr.: 59.943.341 von schnappi am 22.02.19 17:25:17Könnte klappen mit der 25$ Marke evt. zahlt sich das warten noch aus ...

Antwort auf Beitrag Nr.: 60.101.443 von schnappi am 14.03.19 16:40:41In der Tat! Das man sich entschlossen hat für XmAb5871 nun doch keine P3 zu starten kam für mich überraschend und wird seinen Anteil haben. Hoffe mal dass das mit der Verpartnerung klappt - so recht glauben tue ich aber nicht dran. Denn das hätte man ja schon längst tun können...
Seit ein paar Tagen gehts bei hohen Volumen Richtung Norden. Starker Kursanstieg. Endlich wacht der Markt mal auf. Ich hoffe nicht, dass Xencor übernommen wird.
Die 100 Dollar will ich hier noch irgendwann sehen😄 Is aber noch ein Weg dahin. Wenn wäre am besten, wenn Morphosys Xencor übernimmt. Sparen sie sich die Meilensteine und Royalities. Leider fehlt da wohl das Kleingeld.
Aber genug gesponnen und wirres Zeug geschrieben. Hier mal eine schöne Story über Xencor
https://www.lifescienceleader.com/doc/bassil-dahiyat-s-two-d…
Die 100 Dollar will ich hier noch irgendwann sehen😄 Is aber noch ein Weg dahin. Wenn wäre am besten, wenn Morphosys Xencor übernimmt. Sparen sie sich die Meilensteine und Royalities. Leider fehlt da wohl das Kleingeld.
Aber genug gesponnen und wirres Zeug geschrieben. Hier mal eine schöne Story über Xencor
https://www.lifescienceleader.com/doc/bassil-dahiyat-s-two-d…
Antwort auf Beitrag Nr.: 60.941.212 von hinz12 am 02.07.19 23:17:58
danke, ein toller Artikel über den CEO mit viel Hintergrund.
Du bist also auch in der Anti Körper Scene unterwegs.
Ja , es ist schon spannend.
Du hast eine" Beziehung" zu dieser Branche ? - denn ich kenne Dein Usernamen aus verschieden Berichten.
Ich habe nur noch ein paar Stücke nach dem VK mit neuen Hoch aus 2018 !
Es kommt die Frage, ein neues Produkt / Erkenntnis ? Sehr schöner Umsatz
Ich habe leider keine neuen Nachrichten gefunden, aber bei diesem Umsatz ist etwas in der Pipelaine.
Für den weiteren Einstieg ? ich warte erst einmal ab.
Gruss RS
Xenon im Aufwind
@Hinz12danke, ein toller Artikel über den CEO mit viel Hintergrund.
Du bist also auch in der Anti Körper Scene unterwegs.
Ja , es ist schon spannend.
Du hast eine" Beziehung" zu dieser Branche ? - denn ich kenne Dein Usernamen aus verschieden Berichten.
Ich habe nur noch ein paar Stücke nach dem VK mit neuen Hoch aus 2018 !
Es kommt die Frage, ein neues Produkt / Erkenntnis ? Sehr schöner Umsatz
Ich habe leider keine neuen Nachrichten gefunden, aber bei diesem Umsatz ist etwas in der Pipelaine.
Für den weiteren Einstieg ? ich warte erst einmal ab.
Gruss RS
Die Umsätze haben nachgelassen bzw. waren heute nur etwas über dem Volumen der letzten drei Monate, aber es ging noch mal 3 Prozent hoch.
Heute dann auch die nicht überraschende Meldung der Zulassung von Ultomiris in PNH in Europa.
https://ir.alexion.com/news-releases/news-release-details/ul…
Für PNH ist Ultomiris jetzt in USA, Japan und Europa zugelassen. Die Royalities werden also kommen. Auch wenn es wohl nur ca 2,5 Prozent sein werden. 25 Mio. pro Jahr sollten es spätestens 2020 sein.
Die Bewertung Xencors ist mit 2,5 Mrd Dollar noch nicht zu hoch.
Heute dann auch die nicht überraschende Meldung der Zulassung von Ultomiris in PNH in Europa.
https://ir.alexion.com/news-releases/news-release-details/ul…
Für PNH ist Ultomiris jetzt in USA, Japan und Europa zugelassen. Die Royalities werden also kommen. Auch wenn es wohl nur ca 2,5 Prozent sein werden. 25 Mio. pro Jahr sollten es spätestens 2020 sein.
Die Bewertung Xencors ist mit 2,5 Mrd Dollar noch nicht zu hoch.
Antwort auf Beitrag Nr.: 60.950.821 von hinz12 am 04.07.19 00:00:52@Hinz12
ja Danke, eine neue sehr umfangreiche Information für verschiedene Medikamente.
Auch wenn schwerwiegenden seltenen Krankheiten nicht der Renner sind, aber jede Info
und Roaltyzahlung wird gerne angenommen.
Ich warte allerdings eine Konsolidierung nach dem Anstieg zum Nachlegen ab.
Gruss RS
ja Danke, eine neue sehr umfangreiche Information für verschiedene Medikamente.
Auch wenn schwerwiegenden seltenen Krankheiten nicht der Renner sind, aber jede Info
und Roaltyzahlung wird gerne angenommen.
Ich warte allerdings eine Konsolidierung nach dem Anstieg zum Nachlegen ab.
Gruss RS
Mir ist ehrlich gesagt nicht so richtig klar, was der Grund für den heutigen Absturz sind. Gibt negative Analystenstimmen, aber ist es das allein?
Und noch ne Frage: Kennt jemand ein gutes amerikansiches Börsenforum, in dem Biotech-Aktien diskutiert werden?
Und noch ne Frage: Kennt jemand ein gutes amerikansiches Börsenforum, in dem Biotech-Aktien diskutiert werden?
Antwort auf Beitrag Nr.: 61.201.961 von deadflowers am 07.08.19 21:28:01Gab doch gestern Zahlen und heute auch Downgrade
Vielleicht deshalb
Vielleicht deshalb
Nach den Zahlen gestern https://investors.xencor.com/news-releases/news-release-deta…
gabs heute richtig auf die Mütze. Minus 20 Prozent ist schon krass.
Zwei Sachen gefallen mir nicht.
1. Für Ultomiris wurden für das 1. Halbjahr nur 1,1 Mio Dollar Royalities verbucht. Alexion hat einen Umsatz von 78,8 Mio Dollar gemacht (Q1: 24,4 Mio Dollar + Q2: 54,2 Mio Dollar). Das sind also 1,4 Prozent. Ich war immer von 2,5 Prozent ausgegangen. Hoffentlich steigt die prozentuale Beteiligung noch an. Meistens steigen die Prozente mit höheren Umsatz, ob wir auf die 2,5 Prozent wage ich aber zu bezweifeln. Das ist schon enttäuschend.
2. Es wurde weder in der Pressemitteilung noch im Call über XmAb5871 gesprochen. Auch hat kein Analyst danach gefragt in der Q&A-Session. Irgendwie wirkt es als wenn das Programm tot ist. Bei XmAb7195 hab ich mich schon damit abgefunden, dass da nichts mehr kommt. Bei XmAb5871 habe ich schon noch auf was gehofft. Die Hoffnung wird nun aber kleiner.
Neben den beiden Sachen sieht es aber weiter gut aus. Gerade die Cashposition ist beeindruckend und wird durch den Zulassungsantrag und die wahrscheinliche Zulassung von MOR208 spätestens im Q1 2020 weiter gestärkt.
Es sind viele Pfeile im Köcher, wenn auch im frühen Stadium. Irgendeiner wird davon treffen.
gabs heute richtig auf die Mütze. Minus 20 Prozent ist schon krass.
Zwei Sachen gefallen mir nicht.
1. Für Ultomiris wurden für das 1. Halbjahr nur 1,1 Mio Dollar Royalities verbucht. Alexion hat einen Umsatz von 78,8 Mio Dollar gemacht (Q1: 24,4 Mio Dollar + Q2: 54,2 Mio Dollar). Das sind also 1,4 Prozent. Ich war immer von 2,5 Prozent ausgegangen. Hoffentlich steigt die prozentuale Beteiligung noch an. Meistens steigen die Prozente mit höheren Umsatz, ob wir auf die 2,5 Prozent wage ich aber zu bezweifeln. Das ist schon enttäuschend.
2. Es wurde weder in der Pressemitteilung noch im Call über XmAb5871 gesprochen. Auch hat kein Analyst danach gefragt in der Q&A-Session. Irgendwie wirkt es als wenn das Programm tot ist. Bei XmAb7195 hab ich mich schon damit abgefunden, dass da nichts mehr kommt. Bei XmAb5871 habe ich schon noch auf was gehofft. Die Hoffnung wird nun aber kleiner.
Neben den beiden Sachen sieht es aber weiter gut aus. Gerade die Cashposition ist beeindruckend und wird durch den Zulassungsantrag und die wahrscheinliche Zulassung von MOR208 spätestens im Q1 2020 weiter gestärkt.
Es sind viele Pfeile im Köcher, wenn auch im frühen Stadium. Irgendeiner wird davon treffen.
Die Zahlen war ja ok. Auch im CC-Transcript hab ich keine gute Erklärung gefunden. Bleibt ja nur dieses Downgrade, aber -20% find ich schon erstaunlich. Zumal ja bei Tafasitmab auch alles on track scheint. Das wird irgendwie sehr wenig beachtet bei Xencor.
Antwort auf Beitrag Nr.: 61.202.531 von deadflowers am 07.08.19 22:44:07
vielleicht;
NET/GIST P1 with its $STR2/CD3 bispecific delayed from end 19 to 1H20?
Zitat von deadflowers: Die Zahlen war ja ok. Auch im CC-Transcript hab ich keine gute Erklärung gefunden. Bleibt ja nur dieses Downgrade, aber -20% find ich schon erstaunlich. Zumal ja bei Tafasitmab auch alles on track scheint. Das wird irgendwie sehr wenig beachtet bei Xencor.
vielleicht;
NET/GIST P1 with its $STR2/CD3 bispecific delayed from end 19 to 1H20?
Vielleicht waren die Erwartungen im Vorfeld wieder einmal sehr hoch, bis auf eine Abstufung von buy auf neutral (Grund: Zur Zeit ist ihnen die Aktie zu teuer) haben die Analysten keine Abstufungen vorgenommen, im Gegenteil, die Kursziele heraufgesetzt.
Xencor gab heute die Auslizenzierung von XmAb7195 bekannt.
upfront payment to Xencor of $5 million in cash and $5 million in equity.
Xencor also is eligible to receive up to $385 million based on the achievement of certain clinical development, regulatory and commercialization milestones – beginning with the initiation of a Phase 2 clinical trial – and is eligible to receive a high single-digit to mid-teen percentage of royalties upon commercialization of AIMab7195. Aimmune will be solely responsible for costs related to the development of AIMab7195 and plans to provide a development plan in the coming months.
https://investors.xencor.com/news-releases/news-release-deta…
Die Auslizenzierung kam für mich doch überraschend, vielleicht kann auch für XmAb5871 noch ein Lizenzpartner gefunden werden.
Für Ultomiris erzielte Alexion Umsatzerlöse in q4/2019 in Höhe von $170.2 million i Und in 2019 insgesamt $338.9 million
Gleichzeitig testet man Ultomiris in diversen weiteren Studien, so dass weitere Indikationserweiterungen möglich erscheinen.
Alles in allem ist hier noch jede Menge Geduld gefragt.
upfront payment to Xencor of $5 million in cash and $5 million in equity.
Xencor also is eligible to receive up to $385 million based on the achievement of certain clinical development, regulatory and commercialization milestones – beginning with the initiation of a Phase 2 clinical trial – and is eligible to receive a high single-digit to mid-teen percentage of royalties upon commercialization of AIMab7195. Aimmune will be solely responsible for costs related to the development of AIMab7195 and plans to provide a development plan in the coming months.
https://investors.xencor.com/news-releases/news-release-deta…
Die Auslizenzierung kam für mich doch überraschend, vielleicht kann auch für XmAb5871 noch ein Lizenzpartner gefunden werden.
Für Ultomiris erzielte Alexion Umsatzerlöse in q4/2019 in Höhe von $170.2 million i Und in 2019 insgesamt $338.9 million
Gleichzeitig testet man Ultomiris in diversen weiteren Studien, so dass weitere Indikationserweiterungen möglich erscheinen.
Alles in allem ist hier noch jede Menge Geduld gefragt.
Antwort auf Beitrag Nr.: 62.595.544 von Aler01 am 05.02.20 19:53:55Die Aktie ist ja mittlerweile völlig vom Radar verschwunden, wenn es zu Zulassung von MOR208 kommen sollte, wird es sich vielleicht wieder etwas beleben? Habe aus den guten alten Joschka-Sch.-Zeiten noch eine erkleckliche Zahl an Papieren. Da tut sich nicht viel, aber eben auch nicht nach unten, was in nachrichtenarmen Zeiten keine Selbstverständlichkeit bei Biotechs ist.
Antwort auf Beitrag Nr.: 64.298.831 von watchingtheflood am 05.07.20 18:55:52@watchingtheflood
na dann hoffen wir einmal , auf die alten Zeiten von Joschka:
nur noch den Restbestand im Depot, aber es kommt Bewegung in die Aktie.
Xencor Aktie........WKN: A1W96L........ ISIN: US98401F1057
Auszug: auf den Weg zum Ausbruch
Bassil I. Dahiyat - Präsident, Chief Executive Officer und Direktor
Aber das ist natürlich in PD1 - das sind Indikationen, bei denen die PD1-Therapie bekanntermaßen wirkt - Workflow-Indikationen, bei denen sie nicht unbedingt [Sprachüberlappung] sind.
Allen Yang - Senior Vice President und Chief Medical Officer
Ja, das ist genau richtig, Bassil, es ist bekannt, dass es funktioniert, aber dann wurde es nicht behandelt, weil es sich um US-Patienten handelt, weil es keinen Hinweis auf diese Menge gibt. Mit anderen Worten, es gibt eine kleine klinische Studie, die Aktivität zeigt. Aber dann gibt es noch keine Zulassung für diese Indikation und diese Patienten sind gerade [technische Probleme] in der Studie.
https://www.fool.com/earnings/call-transcripts/2020/08/05/xe…

Gruss RS 😎
na dann hoffen wir einmal , auf die alten Zeiten von Joschka:
nur noch den Restbestand im Depot, aber es kommt Bewegung in die Aktie.
Xencor Aktie........WKN: A1W96L........ ISIN: US98401F1057
Auszug: auf den Weg zum Ausbruch
Bassil I. Dahiyat - Präsident, Chief Executive Officer und Direktor
Aber das ist natürlich in PD1 - das sind Indikationen, bei denen die PD1-Therapie bekanntermaßen wirkt - Workflow-Indikationen, bei denen sie nicht unbedingt [Sprachüberlappung] sind.
Allen Yang - Senior Vice President und Chief Medical Officer
Ja, das ist genau richtig, Bassil, es ist bekannt, dass es funktioniert, aber dann wurde es nicht behandelt, weil es sich um US-Patienten handelt, weil es keinen Hinweis auf diese Menge gibt. Mit anderen Worten, es gibt eine kleine klinische Studie, die Aktivität zeigt. Aber dann gibt es noch keine Zulassung für diese Indikation und diese Patienten sind gerade [technische Probleme] in der Studie.
https://www.fool.com/earnings/call-transcripts/2020/08/05/xe…

Gruss RS 😎
Der MACD hat im Daily die Signallinie nach oben gekreuzt:

💡
Beitrag zu dieser Diskussion schreiben
Zu dieser Diskussion können keine Beiträge mehr verfasst werden, da der letzte Beitrag vor mehr als zwei Jahren verfasst wurde und die Diskussion daraufhin archiviert wurde.
Bitte wenden Sie sich an feedback@wallstreet-online.de und erfragen Sie die Reaktivierung der Diskussion oder starten Sie eine neue Diskussion.
Investoren beobachten auch:
| Wertpapier | Perf. % |
|---|---|
| -1,52 | |
| -2,29 | |
| +32,33 | |
| -0,27 | |
| -5,38 | |
| -0,82 | |
| +0,16 | |
| +1,58 | |
| -0,41 | |
| +0,23 |
Meistdiskutiert
| Wertpapier | Beiträge | |
|---|---|---|
| 212 | ||
| 116 | ||
| 101 | ||
| 85 | ||
| 77 | ||
| 46 | ||
| 44 | ||
| 41 | ||
| 31 | ||
| 30 |





















