NOXXON - Was kann die Spiegelmer-Technologie? - 500 Beiträge pro Seite
eröffnet am 12.10.09 22:50:42 von
neuester Beitrag 31.05.17 22:07:33 von
neuester Beitrag 31.05.17 22:07:33 von
Beiträge: 276
ID: 1.153.611
ID: 1.153.611
Aufrufe heute: 0
Gesamt: 47.953
Gesamt: 47.953
Aktive User: 0
ISIN: NL0015000YE1 · WKN: A3DMC3
0,2535
EUR
+0,80 %
+0,0020 EUR
Letzter Kurs 23.04.24 Lang & Schwarz
Neuigkeiten
23.04.24 · Business Wire (engl.) |
02.04.24 · Business Wire (engl.) |
28.03.24 · Business Wire (engl.) |
05.03.24 · Business Wire (engl.) |
Werte aus der Branche Biotechnologie
| Wertpapier | Kurs | Perf. % |
|---|---|---|
| 1,3500 | +29,82 | |
| 1,5700 | +25,60 | |
| 0,6000 | +25,26 | |
| 4,5700 | +24,18 | |
| 1,8300 | +23,65 |
| Wertpapier | Kurs | Perf. % |
|---|---|---|
| 0,7603 | -15,56 | |
| 0,7008 | -15,56 | |
| 2,8600 | -19,21 | |
| 27,00 | -49,30 | |
| 3,4100 | -53,67 |
====================================================================================
NOXXON Pharma AG - Turning Spiegelmers® into Drugs
http://www.noxxon.com
====================================================================================
Motivation: Mit der heutigen Veröffentlichung vorläufiger Daten aus ihrer ersten klinischen P1-Studie ist die Zeit reif, einer weiteren großen Biotech-Hoffnung aus Deutschland einen eigenen Thread zu widmen. Es handelt sich um die Noxxon Pharma AG aus Berlin. Ich würde mich freuen, wenn wir hier zu einer ausführlichen und fundierten Diskussion zum Potenzial von Noxxon und seiner Spiegelmer-Technologie kommen. Das Wichtigste vorweg:
Börsennotierung: Noxxon ist (noch) nicht börsennotiert. Die einzige Möglichkeit, in Noxxon zu investieren, besteht indirekt über die Aktie (ISIN: DE0008041005) oder Wandelanleihe (ISIN: DE000A0S83U6) der DEWB. Wichtige Links zur DEWB stehen am Ende dieses Postings.
Technologie: Noxxon entwickelt sogenannte Spiegelmere, eine spezielle Klasse von Oligonukleotiden (Nukleinsäure-Fäden), die aus der Spiegelung von Aptameren hervorgehen. Aptamere allgemein gelten als eine neue Wirkstoff-Generation mit zahlreichen Vorteilen gegenüber herkömmlichen Antikörpern. Aptamere werden im menschlichen Körper jedoch in wenigen Sekunden durch Spaltenzyme abgebaut. Durch die Spiegelung entsteht dagegen eine Molekülform, die von den Spaltenzymen nicht erkannt wird, quasi ein Aptamer mit Tarnkappe. Dadurch erreichen Spiegelmere eine hohe Biostabilität.
Anwendungsspektrum: Die Spiegelmer-Technologie deckt praktisch das gesamte Anwendungsspektrum von Antikörpern ab. Spiegelmere können theoretisch gegen jedes Zielprotein (Target) entwickelt werden, sowohl extra- als auch intrazellulär. Allerdings steht man erst am Anfang der praktischen Erprobung. Gerade hat Noxxon eine P1-Studie mit seinem ersten Wirkstoff-Kandidaten NOX-E36 zur Behandlung von Nierenentzündungen bei Typ-2-Diabetes mit sehr guten vorläufigen Daten abgeschlossen. Eine P1-Studie mit dem zweiten aktuellen Wirkstoff-Kandidaten NOX-A12 zur Stammzellenmobilisierung bei Lymphsystemerkrankungen und Knochenmarkkrebs soll noch im Oktober 2009 starten.
Patentsituation: Noxxon betreibt seit Jahren eine aggressive Patentstrategie, die die Spiegelmer-Technologie zu einer der umfangreichsten und am besten geschützten Plattformen in der gesamten Biotechbranche gemacht hat. Noxxon hat damit das Exklusiv-Recht auf die Nutzung von Spiegelmeren.
Geschäftsstrategie: Noxxon treibt zum einen die eigene klinische Entwicklung von Spiegelmeren zur Behandlung von Entzündungs- und hämatologischen Erkrankungen voran. Über die eigenen Entwicklungsprogramme hinaus werden Spiegelmere in Zusammenarbeit mit Partnern aus der Pharmaindustrie identifiziert und entwickelt (Auslizenzierung).
Partnerschaften: Derzeit hat Noxxon Entwicklungspartnerschaften mit Pfizer (verschiedenste Indikationen), Hoffmann-LaRoche (Entzündungskrankheiten) und Eli Lilly (Migräne) abgeschlossen.
Management: CEO von Noxxon ist Dr. Frank Morich, einst Vorstandsmitglied der Bayer AG und ehemals Mitglied im Senat der Fraunhofer-Gesellschaft. Das zweite Vorstandsmitglied ist Dr. Sven Klussman, der als Vater der Spiegelmer-Technologie gilt. Der Aufsichtsrat wird von Dr. Walter Wenninger, ebenfalls früheres Vorstandsmitglied von Bayer und jetzt u.a. AR-Mitglied bei Evotec und Paion, angeführt.
Finanzierung/Investoren: Die letzte Finanzierungsrunde fand im Mai 2007 über 37 Mio Euro statt. Damit ist die Finanzierung bis Ende 2010 gesichert. Anschließend soll es eine weitere Runde geben oder der Exit (IPO / Trade Sale) erfolgen. Derzeitige Haupt-Investoren sind namhafte Biotech-VC-Fonds wie Edmond de Rothschild Investment Partners (Paris), Sofinnova Partners (Paris), TVM Capital (München/Boston), Seventure (Paris). Größter Aktionär mit knapp 20% Anteil an Noxxon ist jedoch die DEWB (Jena).
Wichtige Links:
Noxxons Homepage: http://www.noxxon.com
Noxxons klinische Studien: http://clinicaltrials.gov/ct2/results?term=noxxon&flds=Xabeo
DEWB-Homepage: http://www.dewb-vc.com/index.php
Ausführliche Analystenstudie zur DEWB aus 2007 (pdf): http://www.dewb-vc.com/images/dokumente/fairesearch_070907.p…
w:o-Thread zur DEWB-Aktie: Thread: DEWB-Fakten und Vermutungen
w:o-Thread zu den DEWB-Beteiligungen: Thread: DEWB-Beteiligungen - neuer SACHORIENTIERTER Thread ! Zumüllen mit Frustakne verboten!!!
Ich freue mich auf eine hoffentlich rege und interessante Diskussion!
Saaletaler
NOXXON Pharma AG - Turning Spiegelmers® into Drugs
http://www.noxxon.com
====================================================================================
Motivation: Mit der heutigen Veröffentlichung vorläufiger Daten aus ihrer ersten klinischen P1-Studie ist die Zeit reif, einer weiteren großen Biotech-Hoffnung aus Deutschland einen eigenen Thread zu widmen. Es handelt sich um die Noxxon Pharma AG aus Berlin. Ich würde mich freuen, wenn wir hier zu einer ausführlichen und fundierten Diskussion zum Potenzial von Noxxon und seiner Spiegelmer-Technologie kommen. Das Wichtigste vorweg:
Börsennotierung: Noxxon ist (noch) nicht börsennotiert. Die einzige Möglichkeit, in Noxxon zu investieren, besteht indirekt über die Aktie (ISIN: DE0008041005) oder Wandelanleihe (ISIN: DE000A0S83U6) der DEWB. Wichtige Links zur DEWB stehen am Ende dieses Postings.
Technologie: Noxxon entwickelt sogenannte Spiegelmere, eine spezielle Klasse von Oligonukleotiden (Nukleinsäure-Fäden), die aus der Spiegelung von Aptameren hervorgehen. Aptamere allgemein gelten als eine neue Wirkstoff-Generation mit zahlreichen Vorteilen gegenüber herkömmlichen Antikörpern. Aptamere werden im menschlichen Körper jedoch in wenigen Sekunden durch Spaltenzyme abgebaut. Durch die Spiegelung entsteht dagegen eine Molekülform, die von den Spaltenzymen nicht erkannt wird, quasi ein Aptamer mit Tarnkappe. Dadurch erreichen Spiegelmere eine hohe Biostabilität.
Anwendungsspektrum: Die Spiegelmer-Technologie deckt praktisch das gesamte Anwendungsspektrum von Antikörpern ab. Spiegelmere können theoretisch gegen jedes Zielprotein (Target) entwickelt werden, sowohl extra- als auch intrazellulär. Allerdings steht man erst am Anfang der praktischen Erprobung. Gerade hat Noxxon eine P1-Studie mit seinem ersten Wirkstoff-Kandidaten NOX-E36 zur Behandlung von Nierenentzündungen bei Typ-2-Diabetes mit sehr guten vorläufigen Daten abgeschlossen. Eine P1-Studie mit dem zweiten aktuellen Wirkstoff-Kandidaten NOX-A12 zur Stammzellenmobilisierung bei Lymphsystemerkrankungen und Knochenmarkkrebs soll noch im Oktober 2009 starten.
Patentsituation: Noxxon betreibt seit Jahren eine aggressive Patentstrategie, die die Spiegelmer-Technologie zu einer der umfangreichsten und am besten geschützten Plattformen in der gesamten Biotechbranche gemacht hat. Noxxon hat damit das Exklusiv-Recht auf die Nutzung von Spiegelmeren.
Geschäftsstrategie: Noxxon treibt zum einen die eigene klinische Entwicklung von Spiegelmeren zur Behandlung von Entzündungs- und hämatologischen Erkrankungen voran. Über die eigenen Entwicklungsprogramme hinaus werden Spiegelmere in Zusammenarbeit mit Partnern aus der Pharmaindustrie identifiziert und entwickelt (Auslizenzierung).
Partnerschaften: Derzeit hat Noxxon Entwicklungspartnerschaften mit Pfizer (verschiedenste Indikationen), Hoffmann-LaRoche (Entzündungskrankheiten) und Eli Lilly (Migräne) abgeschlossen.
Management: CEO von Noxxon ist Dr. Frank Morich, einst Vorstandsmitglied der Bayer AG und ehemals Mitglied im Senat der Fraunhofer-Gesellschaft. Das zweite Vorstandsmitglied ist Dr. Sven Klussman, der als Vater der Spiegelmer-Technologie gilt. Der Aufsichtsrat wird von Dr. Walter Wenninger, ebenfalls früheres Vorstandsmitglied von Bayer und jetzt u.a. AR-Mitglied bei Evotec und Paion, angeführt.
Finanzierung/Investoren: Die letzte Finanzierungsrunde fand im Mai 2007 über 37 Mio Euro statt. Damit ist die Finanzierung bis Ende 2010 gesichert. Anschließend soll es eine weitere Runde geben oder der Exit (IPO / Trade Sale) erfolgen. Derzeitige Haupt-Investoren sind namhafte Biotech-VC-Fonds wie Edmond de Rothschild Investment Partners (Paris), Sofinnova Partners (Paris), TVM Capital (München/Boston), Seventure (Paris). Größter Aktionär mit knapp 20% Anteil an Noxxon ist jedoch die DEWB (Jena).
Wichtige Links:
Noxxons Homepage: http://www.noxxon.com
Noxxons klinische Studien: http://clinicaltrials.gov/ct2/results?term=noxxon&flds=Xabeo
DEWB-Homepage: http://www.dewb-vc.com/index.php
Ausführliche Analystenstudie zur DEWB aus 2007 (pdf): http://www.dewb-vc.com/images/dokumente/fairesearch_070907.p…
w:o-Thread zur DEWB-Aktie: Thread: DEWB-Fakten und Vermutungen
w:o-Thread zu den DEWB-Beteiligungen: Thread: DEWB-Beteiligungen - neuer SACHORIENTIERTER Thread ! Zumüllen mit Frustakne verboten!!!
Ich freue mich auf eine hoffentlich rege und interessante Diskussion!
Saaletaler
Nach dem Eingangsposting werde ich nun schreitweise weitere Informationen und Einschätzungen zu Noxxon zusammentragen, die wir bislang größtenteils in den DEWB-Threads gesammelt haben. Den besten Überblick zum Unternehmen bekommt man natürlich, wenn man sich durch die Noxxon-Homepage durcharbeitet. Am schnellsten geht es mit dem Noxxon-Factsheet:
pdf: http://145.253.103.53/noxxon15/downloads/FactSheet.pdf
Wirklich informativ sind auch die Analysteneinschätzungen von fairesearch aus 2007 und 2008 zu DEWB, die zu einem großen Teil der Analyse von Noxxon gewidmet sind. Alle Studien findet man auf der DEWB-Homepage unter folgendem Link:
http://www.dewb-vc.com/index.php?option=com_content&task=vie…
Leider hat die DEWB seit Ende 2008 keine weiteren Studien bei fairesearch in Auftrag gegeben, vermutlich aus Kostengründen.
Mein Anliegen ist, dass wir in diesem Thread wirklich nur über die Entwicklung und den potentiellen Wert von Noxxon diskutieren. Beiträge oder Fragen zur DEWB-Aktie und ihren anderen Beteiligungen sollen bitte in den DEWB-Threads erfolgen, insbesondere im Thread "DEWB - Fakten und Vermutungen", siehe hier: Thread: DEWB-Fakten und Vermutungen.
pdf: http://145.253.103.53/noxxon15/downloads/FactSheet.pdf
Wirklich informativ sind auch die Analysteneinschätzungen von fairesearch aus 2007 und 2008 zu DEWB, die zu einem großen Teil der Analyse von Noxxon gewidmet sind. Alle Studien findet man auf der DEWB-Homepage unter folgendem Link:
http://www.dewb-vc.com/index.php?option=com_content&task=vie…
Leider hat die DEWB seit Ende 2008 keine weiteren Studien bei fairesearch in Auftrag gegeben, vermutlich aus Kostengründen.
Mein Anliegen ist, dass wir in diesem Thread wirklich nur über die Entwicklung und den potentiellen Wert von Noxxon diskutieren. Beiträge oder Fragen zur DEWB-Aktie und ihren anderen Beteiligungen sollen bitte in den DEWB-Threads erfolgen, insbesondere im Thread "DEWB - Fakten und Vermutungen", siehe hier: Thread: DEWB-Fakten und Vermutungen.
Hier nun die aktuelle Meldung von heute zu vorläufigen Daten aus der P1-Studie mit NOX-E36. Es handelt sich wie erwähnt um die erste klinische Studie von Noxxon überhaupt (First Spiegelmer in Human).
-----------------------------------------------------------------------------------------------------------------------
12.10.2009 - NOXXON gibt exzellente erste Ergebnisse aus der klinischen Phase I für NOX-E36 bekannt,
Gutes Sicherheits- und pharmakodynamisches Profil sowie gute Bioverfügbarkeit nach subkutaner Verabreichung
Berlin, Deutschland, 12. Oktober 2009 – Die NOXXON Pharma AG, ein biopharmazeutisches Unternehmen, das sich auf die Entwicklung neuartiger Arzneimittel auf Basis der selbst entwickelten Spiegelmer®-Technologie spezialisiert hat, gab heute den erfolgreichen Abschluss der ersten Phase-I-Studie mit dem entzündungshemmenden Spiegelmer® NOX-E36 bekannt. Dieses Prüfpräparat wird zur Behandlung von Komplikationen des Typ 2 Diabetes mellitus entwickelt. Hierzu zählen vor allem die diabetische Nephropathie, aber auch andere Krankheitsbilder.
Die in Großbritannien durchgeführte Phase-I-Studie wurde durchgeführt, um die Sicherheit und Verträglichkeit sowie die pharmakokinetischen und pharmakodynamischen Eigenschaften des Chemokin-Inhibitors NOX-E36 in 72 gesunden Probanden zu bewerten. In einem doppelblinden, und placebo-kontrollierten Studiendesign wurden steigende intravenös verabreichte Dosierungen, die Bioverfügbarkeit von subkutan verabreichten Dosierungen sowie potenzielle geschlechtsspezifische Unterschiede in der Pharmakokinetik untersucht.
Die vorläufigen Studienergebnisse zeigen, dass NOX-E36 in allen Dosierungen nach intravenöser und subkutaner Verabreichung sicher und gut verträglich war. Die Pharmakokinetik von NOX-E36 war dosis-linear und führte zu Plasma-Konzentrationen, die deutlich über jenen lagen, bei denen sich in präklinischen Tiermodellen Wirksamkeit zeigte. Die pharmakodynamische Auswertung deutet auf einen dosisabhängigen Rückgang von Monozyten im peripheren Blut hin, was übereinstimmend ist mit der Wirkungsweise von NOX-E36 – also der Neutralisierung des Chemokins MCP-1 (monocyte chemoattractant protein-1). Dieses Protein ist ein spezifisches Zielmolekül in der Kaskade von Entzündungsreaktionen, welches die Migration von Monozyten an den Entzündungsherd auslöst. Dieses Protein wurde kürzlich als „Adipokin“ bezeichnet, welches bei Fettleibigkeit und Komplikationen bei Typ 2 Diabetes mellitus eine wichtige Rolle spielt. Seine Antagonisierung wird vielfach als wichtigster neuer therapeutischer Ansatz in diesem Gebiet bewertet.
Darüber hinaus zeigte NOX-E36 eine hohe Bioverfügbarkeit nach subkutaner Verabreichung. Diese Tatsache sollte wöchentliche oder noch längere Dosierungsintervalle ermöglichen. Die endgültigen Auswertungen dieser Phase-I-Studie werden für Anfang 2010 erwartet. Hiermit wird die Grundlage für nachfolgende klinische Prüfungen geschaffen, in denen die Mehrfachgabe von NOX-E36 bei gesunden Probanden sowie Patienten mit verschiedenen Komplikationen des Typ 2 Diabetes untersucht werden soll. Die Rekrutierungsphase für diese Studien soll Anfang 2010 beginnen.
Dr. Frank Morich, Vorstandsvorsitzender der NOXXON Pharma AG, kommentierte dazu: „Die vorläufigen Ergebnisse dieser Phase-I-Studie sind beeindruckend und verdeutlichen, dass Spiegelmere® das Potenzial haben, als innovative und breit einsetzbare Arzneimittel therapeutische Lücken zu schließen. Zudem deutet sich an, dass Spiegelmere® in für Patienten sehr komfortablen Dosisformen und Intervallen eingesetzt werden können. In der Zwischenzeit bewegen sich auch unsere anderen Arzneimittelkandidaten zügig in Richtung der klinischen Entwicklung vorwärts.“
NOXXON im Kurzprofil
Die in Berlin ansässige NOXXON Pharma AG ist ein Biotechnologie-Unternehmen, das sich auf die Entwicklung von Spiegelmeren® zur Behandlung von Entzündungskrankheiten und hämatologischen Erkrankungen spezialisiert hat. Sowohl die Spiegelmerprodukte, als auch die Spiegelmertechnologieplattform sind über ein breites Patentportfolio abgesichert. Über die eigenen Entwicklungsprogramme hinaus identifiziert und entwickelt NOXXON Spiegelmere® in Zusammenarbeit mit Partnern aus der Pharmaindustrie wie Eli Lilly, Hoffmann La-Roche und Pfizer. Die Geschäftsstrategie von NOXXON ist darauf ausgerichtet, diese Bandbreite an Kooperationen durch Entwicklungs- und Lizenzabkommen für eigene klinische und präklinische Produkte sowie durch technologiebasierte Partnerschaften zu erweitern. Aktuell hat das Unternehmen einen Wirkstoff in der klinischen Entwicklung. Erklärtes Ziel von NOXXON ist es, die Spiegelmer®-Plattform als die führende „Scaffold“-Technologie zu etablieren, die nicht-peptidische Wirkstoffe mit überlegenen Eigenschaften bereitstellt.
Die Hauptinvestoren von NOXXON sind TVM Capital, Sofinnova Partners, Edmond de Rothschild Investment Partners, Deutsche Effecten- und Wechsel-Beteiligungsgesellschaft (DEWB), Seventure Partners, Dow Venture Capital, Dieckell Group, FCP OP Medical BioHe@lth-Trends, IBG Risikokapitalfonds, VC Fonds Berlin und andere.
Über Spiegelmere®
Spiegelmere® (L-Aptamere) sind chemische Substanzen, die auf synthetischen, spiegelbildlich entwickelten Oligonukleotiden basieren, welche sehr selektiv für ihre pharmakologischen Zielmoleküle sind und sehr wirksame Inhibitoren dieser Zielmoleküle darstellen. Sie vereinen die Vorzüge von niedermolekularen Substanzen und Biopharmazeutika. Aufgrund ihrer einzigartigen spiegelbildlichen Struktur werden Spiegelmere® in Stoffwechselprozessen nicht abgebaut und binden nicht an die natürlich vorkommenden Nukleinsäuren. Darüber hinaus lösen Spiegelmere® auch nicht die angeborene Immunantwort über Toll-like Rezeptoren (TLR) aus und zeigten in präklinischen Versuchsreihen ein überaus vorteilhaftes Immunogenitätsprofil.
Über NOX-E36
NOX-E36 ist ein neues Arzneimittel, das spezifisch das entzündungsfördernde Chemokin MCP-1 (monocyte chemoattractant protein-1), welches auch als CCL2 bekannt ist, blockiert. Bereits abgeschlossene Studien in verschiedenen Tiermodellen zeigten, dass die Behandlung mit Spiegelmer®-MCP-1-Antagonisten u.a. die Minderung der Nierenfunktion wie auch das Fortschreiten der Krankheit signifikant verzögert. Die präklinische Profilierung und die Studien, die Voraussetzung für die Anwendung am Menschen waren, wurden durch einen Zuschuss des Bundesministeriums für Bildung und Forschung unterstützt.
http://www.dewb-vc.com/index.php?option=com_content&task=vie…
http://www.noxxon.com/noxxon15/downloads/pressrel/091012_NOX…
Details zum Studiendesign findet man unter: http://clinicaltrials.gov/ct2/show/NCT00976729?term=noxxon&r…
-----------------------------------------------------------------------------------------------------------------------
12.10.2009 - NOXXON gibt exzellente erste Ergebnisse aus der klinischen Phase I für NOX-E36 bekannt,
Gutes Sicherheits- und pharmakodynamisches Profil sowie gute Bioverfügbarkeit nach subkutaner Verabreichung
Berlin, Deutschland, 12. Oktober 2009 – Die NOXXON Pharma AG, ein biopharmazeutisches Unternehmen, das sich auf die Entwicklung neuartiger Arzneimittel auf Basis der selbst entwickelten Spiegelmer®-Technologie spezialisiert hat, gab heute den erfolgreichen Abschluss der ersten Phase-I-Studie mit dem entzündungshemmenden Spiegelmer® NOX-E36 bekannt. Dieses Prüfpräparat wird zur Behandlung von Komplikationen des Typ 2 Diabetes mellitus entwickelt. Hierzu zählen vor allem die diabetische Nephropathie, aber auch andere Krankheitsbilder.
Die in Großbritannien durchgeführte Phase-I-Studie wurde durchgeführt, um die Sicherheit und Verträglichkeit sowie die pharmakokinetischen und pharmakodynamischen Eigenschaften des Chemokin-Inhibitors NOX-E36 in 72 gesunden Probanden zu bewerten. In einem doppelblinden, und placebo-kontrollierten Studiendesign wurden steigende intravenös verabreichte Dosierungen, die Bioverfügbarkeit von subkutan verabreichten Dosierungen sowie potenzielle geschlechtsspezifische Unterschiede in der Pharmakokinetik untersucht.
Die vorläufigen Studienergebnisse zeigen, dass NOX-E36 in allen Dosierungen nach intravenöser und subkutaner Verabreichung sicher und gut verträglich war. Die Pharmakokinetik von NOX-E36 war dosis-linear und führte zu Plasma-Konzentrationen, die deutlich über jenen lagen, bei denen sich in präklinischen Tiermodellen Wirksamkeit zeigte. Die pharmakodynamische Auswertung deutet auf einen dosisabhängigen Rückgang von Monozyten im peripheren Blut hin, was übereinstimmend ist mit der Wirkungsweise von NOX-E36 – also der Neutralisierung des Chemokins MCP-1 (monocyte chemoattractant protein-1). Dieses Protein ist ein spezifisches Zielmolekül in der Kaskade von Entzündungsreaktionen, welches die Migration von Monozyten an den Entzündungsherd auslöst. Dieses Protein wurde kürzlich als „Adipokin“ bezeichnet, welches bei Fettleibigkeit und Komplikationen bei Typ 2 Diabetes mellitus eine wichtige Rolle spielt. Seine Antagonisierung wird vielfach als wichtigster neuer therapeutischer Ansatz in diesem Gebiet bewertet.
Darüber hinaus zeigte NOX-E36 eine hohe Bioverfügbarkeit nach subkutaner Verabreichung. Diese Tatsache sollte wöchentliche oder noch längere Dosierungsintervalle ermöglichen. Die endgültigen Auswertungen dieser Phase-I-Studie werden für Anfang 2010 erwartet. Hiermit wird die Grundlage für nachfolgende klinische Prüfungen geschaffen, in denen die Mehrfachgabe von NOX-E36 bei gesunden Probanden sowie Patienten mit verschiedenen Komplikationen des Typ 2 Diabetes untersucht werden soll. Die Rekrutierungsphase für diese Studien soll Anfang 2010 beginnen.
Dr. Frank Morich, Vorstandsvorsitzender der NOXXON Pharma AG, kommentierte dazu: „Die vorläufigen Ergebnisse dieser Phase-I-Studie sind beeindruckend und verdeutlichen, dass Spiegelmere® das Potenzial haben, als innovative und breit einsetzbare Arzneimittel therapeutische Lücken zu schließen. Zudem deutet sich an, dass Spiegelmere® in für Patienten sehr komfortablen Dosisformen und Intervallen eingesetzt werden können. In der Zwischenzeit bewegen sich auch unsere anderen Arzneimittelkandidaten zügig in Richtung der klinischen Entwicklung vorwärts.“
NOXXON im Kurzprofil
Die in Berlin ansässige NOXXON Pharma AG ist ein Biotechnologie-Unternehmen, das sich auf die Entwicklung von Spiegelmeren® zur Behandlung von Entzündungskrankheiten und hämatologischen Erkrankungen spezialisiert hat. Sowohl die Spiegelmerprodukte, als auch die Spiegelmertechnologieplattform sind über ein breites Patentportfolio abgesichert. Über die eigenen Entwicklungsprogramme hinaus identifiziert und entwickelt NOXXON Spiegelmere® in Zusammenarbeit mit Partnern aus der Pharmaindustrie wie Eli Lilly, Hoffmann La-Roche und Pfizer. Die Geschäftsstrategie von NOXXON ist darauf ausgerichtet, diese Bandbreite an Kooperationen durch Entwicklungs- und Lizenzabkommen für eigene klinische und präklinische Produkte sowie durch technologiebasierte Partnerschaften zu erweitern. Aktuell hat das Unternehmen einen Wirkstoff in der klinischen Entwicklung. Erklärtes Ziel von NOXXON ist es, die Spiegelmer®-Plattform als die führende „Scaffold“-Technologie zu etablieren, die nicht-peptidische Wirkstoffe mit überlegenen Eigenschaften bereitstellt.
Die Hauptinvestoren von NOXXON sind TVM Capital, Sofinnova Partners, Edmond de Rothschild Investment Partners, Deutsche Effecten- und Wechsel-Beteiligungsgesellschaft (DEWB), Seventure Partners, Dow Venture Capital, Dieckell Group, FCP OP Medical BioHe@lth-Trends, IBG Risikokapitalfonds, VC Fonds Berlin und andere.
Über Spiegelmere®
Spiegelmere® (L-Aptamere) sind chemische Substanzen, die auf synthetischen, spiegelbildlich entwickelten Oligonukleotiden basieren, welche sehr selektiv für ihre pharmakologischen Zielmoleküle sind und sehr wirksame Inhibitoren dieser Zielmoleküle darstellen. Sie vereinen die Vorzüge von niedermolekularen Substanzen und Biopharmazeutika. Aufgrund ihrer einzigartigen spiegelbildlichen Struktur werden Spiegelmere® in Stoffwechselprozessen nicht abgebaut und binden nicht an die natürlich vorkommenden Nukleinsäuren. Darüber hinaus lösen Spiegelmere® auch nicht die angeborene Immunantwort über Toll-like Rezeptoren (TLR) aus und zeigten in präklinischen Versuchsreihen ein überaus vorteilhaftes Immunogenitätsprofil.
Über NOX-E36
NOX-E36 ist ein neues Arzneimittel, das spezifisch das entzündungsfördernde Chemokin MCP-1 (monocyte chemoattractant protein-1), welches auch als CCL2 bekannt ist, blockiert. Bereits abgeschlossene Studien in verschiedenen Tiermodellen zeigten, dass die Behandlung mit Spiegelmer®-MCP-1-Antagonisten u.a. die Minderung der Nierenfunktion wie auch das Fortschreiten der Krankheit signifikant verzögert. Die präklinische Profilierung und die Studien, die Voraussetzung für die Anwendung am Menschen waren, wurden durch einen Zuschuss des Bundesministeriums für Bildung und Forschung unterstützt.
http://www.dewb-vc.com/index.php?option=com_content&task=vie…
http://www.noxxon.com/noxxon15/downloads/pressrel/091012_NOX…
Details zum Studiendesign findet man unter: http://clinicaltrials.gov/ct2/show/NCT00976729?term=noxxon&r…
Übrigens findet man auf der Homepage derzeit auch eine Unternehmens-Präsentation vom Juni 2009 von CEO Morich auf der BioEquity-Tagung. Diese enthält detaillierte wissenschaftliche Erkenntnisse aus den Tierversuchen mit den beiden Wirkstoff-Kandidaten NOX-E36 und NOX-A12. Das dürfte vor allem für "Leute vom Fach" interessant sein.
pdf: http://145.253.103.53/noxxon15/downloads/090610_NOXXON_BioEq…
pdf: http://145.253.103.53/noxxon15/downloads/090610_NOXXON_BioEq…
Schön mal ein deutsches Biotech (börsennotiert) zu sehen, welches an der Forschung von Oligonukleotiden arbeitet. Gab/gibt zwar noch andere, aber die wurden übernommen. (Coley von Pfizer, Ribopharma von Alnylam, Girindus von Solvay)
Also man sieht, wenn das Zeug was taugt, dann kann es fix gehen. Bei Oligos ist iM sowieso ein regelrechter Run großer Konzerne auf kleine Läden.
Muss mich mit Noxxon selber erstmal beschäftigen, ob auch alles koscher ist.
Also man sieht, wenn das Zeug was taugt, dann kann es fix gehen. Bei Oligos ist iM sowieso ein regelrechter Run großer Konzerne auf kleine Läden.
Muss mich mit Noxxon selber erstmal beschäftigen, ob auch alles koscher ist.

Antwort auf Beitrag Nr.: 38.163.308 von Berliner_Landstreicher am 12.10.09 23:58:44Bei Oligos ist iM sowieso ein regelrechter Run großer Konzerne auf kleine Läden.
Wenn Du da noch weitere (internationale) Beispiele für Übernahmen oder Deals aus diesem Bereich nennen kannst, wäre ich dankbar. Daraus könnte man dann mal versuchen, eine groben Unternehmenswert für Noxxon abzuleiten.
Muss mich mit Noxxon selber erstmal beschäftigen, ob auch alles koscher ist.
Ja, nur zu. Bislang führte Noxxon ein Forums-Schattendasein bei frustrierten DEWB-Aktionären. Der neue Thread soll vor allem "Biotech-Kenner und -Fachleute" anlocken, um zu einer fundierten Diskussion über die Entwicklung und den potenziellen Wert von Noxxon zu kommen. Es sind also auch kritische Beiträge willkommen
Wenn Du da noch weitere (internationale) Beispiele für Übernahmen oder Deals aus diesem Bereich nennen kannst, wäre ich dankbar. Daraus könnte man dann mal versuchen, eine groben Unternehmenswert für Noxxon abzuleiten.
Muss mich mit Noxxon selber erstmal beschäftigen, ob auch alles koscher ist.
Ja, nur zu. Bislang führte Noxxon ein Forums-Schattendasein bei frustrierten DEWB-Aktionären. Der neue Thread soll vor allem "Biotech-Kenner und -Fachleute" anlocken, um zu einer fundierten Diskussion über die Entwicklung und den potenziellen Wert von Noxxon zu kommen. Es sind also auch kritische Beiträge willkommen

Antwort auf Beitrag Nr.: 38.163.386 von Saaletaler am 13.10.09 00:24:07Zusätzlich zu den oben bereits genannten 3 deutsch Bsp.:
Spontan zu später Stunde fällt mir Santaris ein. Dit sind Dänen und da tummeln sich mit Enzon, Glaxo Smith Kline, Wyeth und Shire richtig dicke Brocken in der Pipeline. Der GSK und Wyeth Deal kann zusammen bis zu 2 Mrd. bringen. Die Betonung liegt aber auf "kann" und "bis zu."
http://www.santaris.com/Pipeline/Default.aspx
Dann die Klassiker Alnylam, Regulus, Isis oder aktuell MDRNA.
Hier mal ein Bsp.
http://www.fiercebiotech.com/story/gsk-tests-the-mirna-water…
Aber in DL ist wirklich relativ wenig los und die genannten Biotechs sind halt vergeben.
Morgen werd ich mal Noxxon ein bisschen unter die Lupe nehmen. Aber heute nicht mehr.
Jute Nacht!
Spontan zu später Stunde fällt mir Santaris ein. Dit sind Dänen und da tummeln sich mit Enzon, Glaxo Smith Kline, Wyeth und Shire richtig dicke Brocken in der Pipeline. Der GSK und Wyeth Deal kann zusammen bis zu 2 Mrd. bringen. Die Betonung liegt aber auf "kann" und "bis zu."
http://www.santaris.com/Pipeline/Default.aspx
Dann die Klassiker Alnylam, Regulus, Isis oder aktuell MDRNA.
Hier mal ein Bsp.
http://www.fiercebiotech.com/story/gsk-tests-the-mirna-water…
Aber in DL ist wirklich relativ wenig los und die genannten Biotechs sind halt vergeben.

Morgen werd ich mal Noxxon ein bisschen unter die Lupe nehmen. Aber heute nicht mehr.
Jute Nacht!
Scheint mir, dass Noxxon alle Voraussetzugen für ne "normale" Entwicklung eines Biotechs hat. Venture Capital ist da und mit guten Studienergebnissen, ein wenig Glück, könnte auch Noxxon ein ähnliches Schicksal blühen wie den anderen Oligo-Forschern. Und da Noxxon noch was Neues "mitbringt", vielleicht noch leichter.
101 Patent belegen, dass es schützenswerte Thechnologien gibt.
101 Patent belegen, dass es schützenswerte Thechnologien gibt.
Antwort auf Beitrag Nr.: 38.163.411 von Berliner_Landstreicher am 13.10.09 00:39:08Ein Dankeschön zunächst für die Auflistung der Deals bzw. Übernahmen. Werde mir das mal näher anschauen, um mögliche Parallelen zu Noxxon zu finden.
Obwohl es in diesem Thread keine (ausführliche) Diskussion zur DEWB-Aktie geben soll, will ich denjenigen, die sich ein paar Stücke ins Depot legen wollen, ein paar Infos zukommen lassen:
Nach meinen Recherchen, die ich für recht belastbar halte, steht der 19,2%ige Anteil, den DEWB an Noxxon hält, derzeit mit etwa 10 bis 12 Mio Euro Buchwert in der DEWB-Bilanz. Der NAV der DEWB wird nach der Abschreibungsmeldung vom 8. Oktober 2009 derzeit bei knapp 2 Euro je Aktie liegen, der Kurs bei etwa 1,70 Euro, also etwa 10% unter NAV. DEWB hat derzeit etwa 15 Mio Aktien ausgegeben.
Das heißt: Im jetzigen DEWB-Kurs ist Noxxon m.E. etwa mit 50 bis 60 Mio Euro Unternehmenswert enthalten. Man kann sich nun leicht ausrechnen, wie sich der NAV von DEWB entwickelt, sollte Noxxon der Durchbruch gelingen. Nur zwei Beispiele:
Beispiel 1: Bei einem hypothetischen Exitwert von 200 Mio für Noxxon entspricht dies einem DEWB-Erlösanteil von etwa 40 Mio Euro. Bei einem angenommenen Buchwert von 10 Mio Euro, entstünden für DEWB also etwa 30 Mio Euro / 15 Mio Aktien = 2 Euro Gewinn je Aktie (vor Steuern und Dealkosten). Der NAV je Aktie würde also von jetzt knapp 2 Euro auf dann knapp 4 Euro steigen.
Beispiel 2: Bei einem hypothetischen Exitwert von 500 Mio für Noxxon entspricht dies einem DEWB-Erlösanteil von etwa 100 Mio Euro. Bei einem angenommenen Buchwert von 10 Mio Euro, entstünden für DEWB also etwa 90 Mio Euro / 15 Mio Aktien = 6 Euro Gewinn je Aktie (vor Steuern und Dealkosten). Der NAV je Aktie würde also von jetzt knapp 2 Euro auf dann knapp 8 Euro steigen.
Folgende wichtige Aspekte sind in den Beispielrechnungen nicht berücksichtigt, haben aber Einfluss auf den NAV nach Exit:
A) Noxxon braucht etwa Ende 2010 frisches Kapital. Sollte es dann noch nicht zu einem Exit, sondern zu einer weiteren VC-Finanzierungsrunde kommen, wird sich DEWB daran vermutlich nur (deutlich) unterproportional beteiligen (können). Daraus droht also eine mehr oder weniger deutliche Verwässerung des DEWB-Anteils an Noxxon.
B) DEWB hat eine Wandelanleihe (WA) aufgelegt. Der Wandlungspreis beträgt 3,20 Euro. Sollte die DEWB-Aktie im Zuge eines Exits also signifikant und dauerhaft über 3,20 Euro steigen, werden etwa 6 Mio neue Aktien durch Wandlung der WA entstehen. Das würde den Gewinn pro Aktie aus dem Exit verwässern.
C) Obige Rechnungen gelten vor Steuern. Eine fundierte Rechnung unter Einbeziehung von Steuern maße ich mir nicht, das ist mir zu komplex. Wichtig in diesem Zusammenhang ist jedoch, dass DEWB einen riesigen Berg an Verlustvorträgen vor sich her schiebt. Die steuerliche Belastung aus einem hohen Exitgewinn sollte also überschaubar sein.
Dass der Noxxon-Wert bei DEWB (komplett) abzuschreiben ist, wird übrigens mit jeder positiven Nachricht zu den klinischen Studien immer unwahrscheinlicher. Insofern ist das Risiko in der DEWB-Aktie halbwegs beherrschbar, zumindest was Noxxon angeht.
Gleichwohl weise ich ausdrücklich darauf hin, dass DEWB weitere Unternehmen im Portfolio hat, die von sich aus Chancen und natürlich auch Risiken für die Aktie beinhalten. Nachrichten und Einschätzungen zu allen Beteiligungen werden insbesondere im DEWB-Beteiligungs-Thread gesammelt, siehe Link dazu in Posting #1.
Ich lege also Wert darauf, hier explizit keine Kaufempfehlung für DEWB abzugeben, obwohl ich selbst seit geraumer Zeit Aktionär bin und insbesondere auf einen Kursanstieg durch die Noxxon-Entwicklung spekuliere. Trotzdem würde ich mich freuen, wenn sich durch diesen Thread neue Freunde und Interessenten für Noxxon und die DEWB finden.
Nach meinen Recherchen, die ich für recht belastbar halte, steht der 19,2%ige Anteil, den DEWB an Noxxon hält, derzeit mit etwa 10 bis 12 Mio Euro Buchwert in der DEWB-Bilanz. Der NAV der DEWB wird nach der Abschreibungsmeldung vom 8. Oktober 2009 derzeit bei knapp 2 Euro je Aktie liegen, der Kurs bei etwa 1,70 Euro, also etwa 10% unter NAV. DEWB hat derzeit etwa 15 Mio Aktien ausgegeben.
Das heißt: Im jetzigen DEWB-Kurs ist Noxxon m.E. etwa mit 50 bis 60 Mio Euro Unternehmenswert enthalten. Man kann sich nun leicht ausrechnen, wie sich der NAV von DEWB entwickelt, sollte Noxxon der Durchbruch gelingen. Nur zwei Beispiele:
Beispiel 1: Bei einem hypothetischen Exitwert von 200 Mio für Noxxon entspricht dies einem DEWB-Erlösanteil von etwa 40 Mio Euro. Bei einem angenommenen Buchwert von 10 Mio Euro, entstünden für DEWB also etwa 30 Mio Euro / 15 Mio Aktien = 2 Euro Gewinn je Aktie (vor Steuern und Dealkosten). Der NAV je Aktie würde also von jetzt knapp 2 Euro auf dann knapp 4 Euro steigen.
Beispiel 2: Bei einem hypothetischen Exitwert von 500 Mio für Noxxon entspricht dies einem DEWB-Erlösanteil von etwa 100 Mio Euro. Bei einem angenommenen Buchwert von 10 Mio Euro, entstünden für DEWB also etwa 90 Mio Euro / 15 Mio Aktien = 6 Euro Gewinn je Aktie (vor Steuern und Dealkosten). Der NAV je Aktie würde also von jetzt knapp 2 Euro auf dann knapp 8 Euro steigen.
Folgende wichtige Aspekte sind in den Beispielrechnungen nicht berücksichtigt, haben aber Einfluss auf den NAV nach Exit:
A) Noxxon braucht etwa Ende 2010 frisches Kapital. Sollte es dann noch nicht zu einem Exit, sondern zu einer weiteren VC-Finanzierungsrunde kommen, wird sich DEWB daran vermutlich nur (deutlich) unterproportional beteiligen (können). Daraus droht also eine mehr oder weniger deutliche Verwässerung des DEWB-Anteils an Noxxon.
B) DEWB hat eine Wandelanleihe (WA) aufgelegt. Der Wandlungspreis beträgt 3,20 Euro. Sollte die DEWB-Aktie im Zuge eines Exits also signifikant und dauerhaft über 3,20 Euro steigen, werden etwa 6 Mio neue Aktien durch Wandlung der WA entstehen. Das würde den Gewinn pro Aktie aus dem Exit verwässern.
C) Obige Rechnungen gelten vor Steuern. Eine fundierte Rechnung unter Einbeziehung von Steuern maße ich mir nicht, das ist mir zu komplex. Wichtig in diesem Zusammenhang ist jedoch, dass DEWB einen riesigen Berg an Verlustvorträgen vor sich her schiebt. Die steuerliche Belastung aus einem hohen Exitgewinn sollte also überschaubar sein.
Dass der Noxxon-Wert bei DEWB (komplett) abzuschreiben ist, wird übrigens mit jeder positiven Nachricht zu den klinischen Studien immer unwahrscheinlicher. Insofern ist das Risiko in der DEWB-Aktie halbwegs beherrschbar, zumindest was Noxxon angeht.
Gleichwohl weise ich ausdrücklich darauf hin, dass DEWB weitere Unternehmen im Portfolio hat, die von sich aus Chancen und natürlich auch Risiken für die Aktie beinhalten. Nachrichten und Einschätzungen zu allen Beteiligungen werden insbesondere im DEWB-Beteiligungs-Thread gesammelt, siehe Link dazu in Posting #1.
Ich lege also Wert darauf, hier explizit keine Kaufempfehlung für DEWB abzugeben, obwohl ich selbst seit geraumer Zeit Aktionär bin und insbesondere auf einen Kursanstieg durch die Noxxon-Entwicklung spekuliere. Trotzdem würde ich mich freuen, wenn sich durch diesen Thread neue Freunde und Interessenten für Noxxon und die DEWB finden.
hallo saaletaler.. feine sache..
kleinen beitrag leisten will..
hier der link zu den Testphasen von Noxxon bei Clinical Trials.com
http://clinicaltrials.gov/ct2/results?term=Noxxon
und als Schmankerl alle, WO, EU, US usw Patente von Noxxon.. das ganze (der Link) ist so konfiguriert, das das aktuellste, bzw neueste Patent stets am Anfang der Liste erscheint..
http://www.freepatentsonline.com/result.html?p=1&edit_alert=…
hoffe die links funktionieren..
grüße vom sternenkrieger aus medigeneianien
werd mir das "treiben" hier "genaustens" betrachten und weiterverfolgen..
kleinen beitrag leisten will..
hier der link zu den Testphasen von Noxxon bei Clinical Trials.com
http://clinicaltrials.gov/ct2/results?term=Noxxon
und als Schmankerl alle, WO, EU, US usw Patente von Noxxon.. das ganze (der Link) ist so konfiguriert, das das aktuellste, bzw neueste Patent stets am Anfang der Liste erscheint..
http://www.freepatentsonline.com/result.html?p=1&edit_alert=…
hoffe die links funktionieren..
grüße vom sternenkrieger aus medigeneianien

werd mir das "treiben" hier "genaustens" betrachten und weiterverfolgen..

Antwort auf Beitrag Nr.: 38.170.420 von starwarrior03 am 13.10.09 21:18:39Links funktionieren 

Antwort auf Beitrag Nr.: 38.170.420 von starwarrior03 am 13.10.09 21:18:39Danke für das Einstellen der Links, star, vor allem zu den Patenten (Link zu den Studien gab es auch schon in Posting #1, aber doppelt hält besser). Nochmal zur Patentsituation:
Noxxon selbst betont immer wieder, dass man sich die exklusive Nutzung der Spiegelmer-Technologie durch ein extrem umfangreiches Patentportfolio gesichert hat. Bislang gibt es m.W. auch noch niemand, der das anzweifelt. Und das ist das eigentlich Verlockende an Noxxon: Während andere Biotech-Unternehmen ihren Marktwert bzw. ihre Hoffnung auf ein paar Wirkstoff-Kandidaten (z.B drei, vier Antikörper) begründen, steht Noxxon theoretisch die gesamte Bandbreite von Protein-Bindungen zur Verfügung. Bislang wurdn z.B. schon Spiegelmere für Entzündungs-, Blut- und Krebserkrankungen sowie für Fettleibigkeit und Migräne entwickelt.
Vielleicht ist das ganz gut mit der umfangreichen Antikörper-Bibliothek von Morphosys vergleichbar. Wobei die Spekulation bei Noxxon darauf beruht, dass Spiegelmere den therapeutischen Antikörpern überlegen sind, was aber noch zu beweisen sein wird. Zu einem Vergleich zwischen Antikörpern und Spiegelmeren kommen wir sicher im Laufe der Diskussion noch ausführlich.
Noxxon selbst betont immer wieder, dass man sich die exklusive Nutzung der Spiegelmer-Technologie durch ein extrem umfangreiches Patentportfolio gesichert hat. Bislang gibt es m.W. auch noch niemand, der das anzweifelt. Und das ist das eigentlich Verlockende an Noxxon: Während andere Biotech-Unternehmen ihren Marktwert bzw. ihre Hoffnung auf ein paar Wirkstoff-Kandidaten (z.B drei, vier Antikörper) begründen, steht Noxxon theoretisch die gesamte Bandbreite von Protein-Bindungen zur Verfügung. Bislang wurdn z.B. schon Spiegelmere für Entzündungs-, Blut- und Krebserkrankungen sowie für Fettleibigkeit und Migräne entwickelt.
Vielleicht ist das ganz gut mit der umfangreichen Antikörper-Bibliothek von Morphosys vergleichbar. Wobei die Spekulation bei Noxxon darauf beruht, dass Spiegelmere den therapeutischen Antikörpern überlegen sind, was aber noch zu beweisen sein wird. Zu einem Vergleich zwischen Antikörpern und Spiegelmeren kommen wir sicher im Laufe der Diskussion noch ausführlich.
Antwort auf Beitrag Nr.: 38.169.447 von Saaletaler am 13.10.09 19:04:15hallo saaletaler,
war wegen noxxon, und zwar nur wegen noxxon auch schon in DEWB investiert,
das Problem ist aber: ein Investment in DEWB bleibt ein Investment in DEWB und da ist Noxxon nur ein Teil
an der letzten Kapitalerhöhung von Noxxon hat DEWB nicht teilgenommen und dadurch ist aus über 50% Anteil an Noxxon eine Minderheitsbeteiligung von den von dir erwähnten 19% geworden
leider kann ich nicht einschätzen, wie sich DEWB hier in Zukunft verhält und dann nützt es mir als DEWB Aktionär (Noxxon Aktionär kann ich ja nicht werden) nichts, wenn DEWB am Ende, wenn die Technologie sich durchsetzten sollte, dann noch mit 0,0008 % beteiligt ist
zur Technologie (nur meine einschätzung):
der Kniff mit den Spiegelmeren den körpereigenen Abbau in den Griff zu bekommen, finde ich genial, ist aber nur ein Punkt der bei Oligo-Medikamenten zu lösen ist, hier sehe ich 3 wichtige Aufgaben:
1) Delivery (momentan am schwierigsten, am meisten Arbeit notwendig, da Aptamere auch ausserhalb der Zellen wirken koennen, sind Spiegelmere hier eher mit MABs als mit anderen Oligo Ansätzen vergleichbar, also vorteilhaft)
2) Wirkung, d.h. ist das Medikament nur theoretisch wirksam oder kann der Körper, die designte Wirkung auch umsetzen, hier denke ich ist RNAI (und, mit Einschränkungen, da [evtl. als Medikament zu] komplex: miRNA)von allen Oligo-basierten Ansätzen unschlagbar, da nur hierfür der Koerper in der Evolution eine weitergehende Vorgehensweise nach Bindung an das Ziel entwickelt hat
3) ungewünschter Abbau der Oligos im Körper: ist eigentlich gelöst für alle Ansätze, hier liegt aber sozusagen der spezielle Reiz der Spiegelmere, da besonderst elegant gelöst
war wegen noxxon, und zwar nur wegen noxxon auch schon in DEWB investiert,
das Problem ist aber: ein Investment in DEWB bleibt ein Investment in DEWB und da ist Noxxon nur ein Teil
an der letzten Kapitalerhöhung von Noxxon hat DEWB nicht teilgenommen und dadurch ist aus über 50% Anteil an Noxxon eine Minderheitsbeteiligung von den von dir erwähnten 19% geworden
leider kann ich nicht einschätzen, wie sich DEWB hier in Zukunft verhält und dann nützt es mir als DEWB Aktionär (Noxxon Aktionär kann ich ja nicht werden) nichts, wenn DEWB am Ende, wenn die Technologie sich durchsetzten sollte, dann noch mit 0,0008 % beteiligt ist
zur Technologie (nur meine einschätzung):
der Kniff mit den Spiegelmeren den körpereigenen Abbau in den Griff zu bekommen, finde ich genial, ist aber nur ein Punkt der bei Oligo-Medikamenten zu lösen ist, hier sehe ich 3 wichtige Aufgaben:
1) Delivery (momentan am schwierigsten, am meisten Arbeit notwendig, da Aptamere auch ausserhalb der Zellen wirken koennen, sind Spiegelmere hier eher mit MABs als mit anderen Oligo Ansätzen vergleichbar, also vorteilhaft)
2) Wirkung, d.h. ist das Medikament nur theoretisch wirksam oder kann der Körper, die designte Wirkung auch umsetzen, hier denke ich ist RNAI (und, mit Einschränkungen, da [evtl. als Medikament zu] komplex: miRNA)von allen Oligo-basierten Ansätzen unschlagbar, da nur hierfür der Koerper in der Evolution eine weitergehende Vorgehensweise nach Bindung an das Ziel entwickelt hat
3) ungewünschter Abbau der Oligos im Körper: ist eigentlich gelöst für alle Ansätze, hier liegt aber sozusagen der spezielle Reiz der Spiegelmere, da besonderst elegant gelöst
Hallo,
ich habe 30 veröffentlichte Patente zu Noxxon gefunden.
Die neusten sind vom
4.Juni 2009
2.April 2009
12.Febr. 2009
Noxxon hat in der Vergangenheit u.a. gemeinsame Patente mit den folgenden Firmen veröffentlicht:
SUPRAMOL PARENTERAL COLLOIDS GMBH SUPR-C
GRUENENTHAL GMBH CHEF-S
Grüße
ich habe 30 veröffentlichte Patente zu Noxxon gefunden.
Die neusten sind vom
4.Juni 2009
2.April 2009
12.Febr. 2009
Noxxon hat in der Vergangenheit u.a. gemeinsame Patente mit den folgenden Firmen veröffentlicht:
SUPRAMOL PARENTERAL COLLOIDS GMBH SUPR-C
GRUENENTHAL GMBH CHEF-S
Grüße
Antwort auf Beitrag Nr.: 38.173.390 von mitleser3108 am 14.10.09 11:27:25Hallo mitleser3108, vielen Dank für Deine Einschätzung.
das Problem ist aber: ein Investment in DEWB bleibt ein Investment in DEWB und da ist Noxxon nur ein Teil
Richtig, deswegen ist mir wichtig, darauf hinzuweisen, dass DEWB auch Risiken aus anderen Beteiligungen in sich birgt. Ich will hier niemand ins Verderben stürzen. Fakt ist aber: Wer jetzt schon in Noxxon investieren will, muss es über DEWB machen, egal ob Aktie oder WA. Die Entscheidung muss jeder Anleger selbst treffen.
leider kann ich nicht einschätzen, wie sich DEWB hier in Zukunft verhält und dann nützt es mir als DEWB Aktionär (Noxxon Aktionär kann ich ja nicht werden) nichts, wenn DEWB am Ende, wenn die Technologie sich durchsetzten sollte, dann noch mit 0,0008 % beteiligt ist
Ja, das ist ein Problem. DEWB hat momentan nicht die finanziellen Ressourcen, um eine weitere große VC-Finanzierungsrunde bei Noxxon komplett mitzutragen. Hier ist aber das letzte Wort auch noch nicht gesprochen. Folgende Punkte halte ich für wichtig:
1) Der DEWB-Vorstand weiß, dass Noxxon die größte Perle im eigenen Portfolio ist. Insofern wird man alles daran setzen, das Noxxon-Potenzial soweit wie möglich auszureizen.
2) Bis Ende 2010, wenn die nächste Finanzierung nötig wird, kann bei DEWB noch viel passieren. Zum Beispiel könnte Mitte 2010 ein Exit einer anderen größeren Beteiligung gelingen, der die Kasse von DEWB wieder auffüllt, so dass man bei Noxxon weiter mitfinanzieren kann. Genauso denkbar wäre, dass DEWB bis dahin noch eine Kapitalerhöhung gebacken bekommt, wobei dafür erst noch eine HV-Genehmigung aussteht.
3) Es ist auch denkbar, dass es gar keine weitere VC-Runde gibt, sondern schon Ende 2010 der Exit erfolgt.
Zu Deiner Technologie-Einschätzung:
Mit jeder weiteren abgeschlosssenen Studie wird man mehr Erkenntnisse zum Zusammenspiel zwischen menschlichem Organismus und den Spiegelmeren bekommen, bislang war alles noch sehr theoretisch bzw. fußte auf den Tierversuchen.
Deswegen hat Noxxon die derzeitige Pipeline auch so ausgerichtet, dass man möglichst schnell zu ersten Erkenntnissen kommt. Denn: Bei NOX-E36 liegen bereits sehr gute präklinische Ergebnisse vor. Bei der Stammzellenmobilierung mit NOX-A12 handelt es sich um ein validiertes Target. Hier ist also eine Abkürzung des üblichen langen Studien-Weges möglich, da es bereits Erkenntnisse zum Wirkmechanismus des Zielmoleküls aus anderen Studien gibt.
das Problem ist aber: ein Investment in DEWB bleibt ein Investment in DEWB und da ist Noxxon nur ein Teil
Richtig, deswegen ist mir wichtig, darauf hinzuweisen, dass DEWB auch Risiken aus anderen Beteiligungen in sich birgt. Ich will hier niemand ins Verderben stürzen. Fakt ist aber: Wer jetzt schon in Noxxon investieren will, muss es über DEWB machen, egal ob Aktie oder WA. Die Entscheidung muss jeder Anleger selbst treffen.
leider kann ich nicht einschätzen, wie sich DEWB hier in Zukunft verhält und dann nützt es mir als DEWB Aktionär (Noxxon Aktionär kann ich ja nicht werden) nichts, wenn DEWB am Ende, wenn die Technologie sich durchsetzten sollte, dann noch mit 0,0008 % beteiligt ist
Ja, das ist ein Problem. DEWB hat momentan nicht die finanziellen Ressourcen, um eine weitere große VC-Finanzierungsrunde bei Noxxon komplett mitzutragen. Hier ist aber das letzte Wort auch noch nicht gesprochen. Folgende Punkte halte ich für wichtig:
1) Der DEWB-Vorstand weiß, dass Noxxon die größte Perle im eigenen Portfolio ist. Insofern wird man alles daran setzen, das Noxxon-Potenzial soweit wie möglich auszureizen.
2) Bis Ende 2010, wenn die nächste Finanzierung nötig wird, kann bei DEWB noch viel passieren. Zum Beispiel könnte Mitte 2010 ein Exit einer anderen größeren Beteiligung gelingen, der die Kasse von DEWB wieder auffüllt, so dass man bei Noxxon weiter mitfinanzieren kann. Genauso denkbar wäre, dass DEWB bis dahin noch eine Kapitalerhöhung gebacken bekommt, wobei dafür erst noch eine HV-Genehmigung aussteht.
3) Es ist auch denkbar, dass es gar keine weitere VC-Runde gibt, sondern schon Ende 2010 der Exit erfolgt.
Zu Deiner Technologie-Einschätzung:
Mit jeder weiteren abgeschlosssenen Studie wird man mehr Erkenntnisse zum Zusammenspiel zwischen menschlichem Organismus und den Spiegelmeren bekommen, bislang war alles noch sehr theoretisch bzw. fußte auf den Tierversuchen.
Deswegen hat Noxxon die derzeitige Pipeline auch so ausgerichtet, dass man möglichst schnell zu ersten Erkenntnissen kommt. Denn: Bei NOX-E36 liegen bereits sehr gute präklinische Ergebnisse vor. Bei der Stammzellenmobilierung mit NOX-A12 handelt es sich um ein validiertes Target. Hier ist also eine Abkürzung des üblichen langen Studien-Weges möglich, da es bereits Erkenntnisse zum Wirkmechanismus des Zielmoleküls aus anderen Studien gibt.
hallo liebe dewb-fans,
seit langer zeit verfolge ich eure fundierten und interessanten diskussionen. ich möchte eure aufmerksamkeit nur ganz kurz einmal auf eine weitere beteiligung lenken, nämlich die www.my-sen.de. m. e. ist deren akustischer ansatz zum rechtzeitigen erkennen von entstehenden schäden an windkraftanlagen sehr innovativ.
warum gelingt es dem vorstand der dewb nicht, diese beteiligung an einen der großen windkraftkonzerne oder an herrn koffler (der sich doch nun in der innovativen energiewirtschaft engagiert) zu veräußern? dann könnte auch bei einer neuen finanzierungsrunde bei der hoffnungs-perle noxxon nochmal mitgehalten werden.
wie können wir denn den wert unseres eigentums gemeinsam steigern? - m. e. müssten wir ggf. im zusammenwirken mit weiteren (groß)aktionären den vorstand der dewb doch mit nachdruck zur erfüllung seiner satzungsmäßigen aufgaben i. s. eines shareholder value anhalten.
seit langer zeit verfolge ich eure fundierten und interessanten diskussionen. ich möchte eure aufmerksamkeit nur ganz kurz einmal auf eine weitere beteiligung lenken, nämlich die www.my-sen.de. m. e. ist deren akustischer ansatz zum rechtzeitigen erkennen von entstehenden schäden an windkraftanlagen sehr innovativ.
warum gelingt es dem vorstand der dewb nicht, diese beteiligung an einen der großen windkraftkonzerne oder an herrn koffler (der sich doch nun in der innovativen energiewirtschaft engagiert) zu veräußern? dann könnte auch bei einer neuen finanzierungsrunde bei der hoffnungs-perle noxxon nochmal mitgehalten werden.
wie können wir denn den wert unseres eigentums gemeinsam steigern? - m. e. müssten wir ggf. im zusammenwirken mit weiteren (groß)aktionären den vorstand der dewb doch mit nachdruck zur erfüllung seiner satzungsmäßigen aufgaben i. s. eines shareholder value anhalten.
Antwort auf Beitrag Nr.: 38.180.144 von FOGL76 am 14.10.09 22:37:21Hallo FOGL76,
ich freue mich, Dich als neuen DEWB-Mitdiskutierer begrüßen zu können. Ich bitte jedoch darum, diesen Thread für Noxxon freizuhalten. Für alles andere, z.B. die wirklich interessante Beteiligung an my-sen oder die Diskussion über Aktionärseinfluss auf das DEWB-Management gibt es die beiden anderen Threads, die Du vermutlich kennst, ansonsten siehe Ende von Posting #1. Ist nicht bös gemeint, aber Ordnung muss sein
Grüße von Saaletaler
PS: Ich greife mal Deine Anregung zu my-sen im Nachbarthread auf. Wäre schön, wenn wir da weiter ins Gespräch kommen.
Thread: DEWB-Fakten und Vermutungen
ich freue mich, Dich als neuen DEWB-Mitdiskutierer begrüßen zu können. Ich bitte jedoch darum, diesen Thread für Noxxon freizuhalten. Für alles andere, z.B. die wirklich interessante Beteiligung an my-sen oder die Diskussion über Aktionärseinfluss auf das DEWB-Management gibt es die beiden anderen Threads, die Du vermutlich kennst, ansonsten siehe Ende von Posting #1. Ist nicht bös gemeint, aber Ordnung muss sein

Grüße von Saaletaler
PS: Ich greife mal Deine Anregung zu my-sen im Nachbarthread auf. Wäre schön, wenn wir da weiter ins Gespräch kommen.
Thread: DEWB-Fakten und Vermutungen
Wieder ne interessante Partnerschaft aus der "Welt der Oligonukleotide."
Prosensa and GlaxoSmithKline form alliance to fight Duchenne Muscular Dystrophy
http://prosensa.eu/news/Press%20Release%20GSK%20-%20Prosensa…
Sogar bei einer Krankheit wie DMD, der nicht soooo gewaltiges kommerzielles Potential nachgesagt wird, sind derart große Partner keine Utopie. Aber DMD als unheilbare Erbkrankeit, ist ein klassisches Anwendungsfeld der Oligos. Aber wenn es zum Medikament reift, dann werden die Leute das ihr Lebbe lang nehmen müssen.
Prosensa and GlaxoSmithKline form alliance to fight Duchenne Muscular Dystrophy
http://prosensa.eu/news/Press%20Release%20GSK%20-%20Prosensa…
Sogar bei einer Krankheit wie DMD, der nicht soooo gewaltiges kommerzielles Potential nachgesagt wird, sind derart große Partner keine Utopie. Aber DMD als unheilbare Erbkrankeit, ist ein klassisches Anwendungsfeld der Oligos. Aber wenn es zum Medikament reift, dann werden die Leute das ihr Lebbe lang nehmen müssen.
Auf der Noxxon-Homepage ist die Präsentation von CEO Morich auf der "Bio Partnering Europe" vom 13. Oktober 2009 in London hinterlegt.
pdf: http://145.253.103.53/noxxon15/downloads/091013_NOXXON_BioPa…
Interessant zum einen ist ein detaillierter Entwicklungszeitplan für die eigenen Medikamentenkandidaten (Folien 5 und 6). NOX-A12 (validiertes Target) bspw. soll bereits 2014 am Markt sein. Außerdem sind erste Messergebnisse aus den vorläufigen Daten der P1 mit NOX-E36 enthalten.
pdf: http://145.253.103.53/noxxon15/downloads/091013_NOXXON_BioPa…
Interessant zum einen ist ein detaillierter Entwicklungszeitplan für die eigenen Medikamentenkandidaten (Folien 5 und 6). NOX-A12 (validiertes Target) bspw. soll bereits 2014 am Markt sein. Außerdem sind erste Messergebnisse aus den vorläufigen Daten der P1 mit NOX-E36 enthalten.
Corporate News übermittelt durch euro adhoc. Für den Inhalt ist der
Emittent/Meldungsgeber verantwortlich.
Berlin, 2. November 2009 (euro adhoc) - Die NOXXON Pharma AG, das
biopharmazeutische Unternehmen, das sich auf die Entwicklung von neuen
Arzneimitteln auf Basis seiner Spiegelmer®-Technologie spezialisiert hat, gab
heute die erste Dosierung gesunder freiwilliger Probanden in einer klinischen
Phase-I-Studie mit dem Spiegelmer® NOX A12 bekannt. NOX A12 ist innerhalb von
nur fünf Monaten der zweite Wirkstoff von NOXXON, welcher die Phase der
klinischen Arzneimittelentwicklung erreicht.
Nach Prüfung und Genehmigung des Antrags zur Durchführung der Phase I-Studie
durch das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) wird die
Studie derzeit in Deutschland durchgeführt. Die monozentrische Studie untersucht
Sicherheit, Verträglichkeit, Pharmakokinetik und Pharmakodynamik des
Blutstammzell-mobilisierenden Spiegelmers® NOX A12 in bis zu 42 Probanden nach
intravenöser Gabe. Weitere Informationen zu dieser Studie sind im Internet unter
www.clinicaltrials.gov (ID: NCT00976378) zu finden.
Dr. Frank Morich, Vorstandsvorsitzender von NOXXON, kommentierte: "Wir sind fest
davon überzeugt, dass NOX-A12 über das Potenzial verfügt, sich zu einer deutlich
verbesserten Alternative bei der Mobilisierung von hämatopoetischen Stammzellen
zu entwickeln. Die außerordentlich positiven präklinischen Daten untermauern
unsere Einschätzung. Es ist unser Ziel, die Zulassung für NOX-A12 im Jahr 2014
zu erreichen. In der laufenden klinischen Studie erwarten wir, ein sehr gutes
Sicherheitsprofil zu sehen und erste Wirksamkeitshinweise zu erhalten. Damit
wird sich der wertvolle Beitrag der Spiegelmer®-Technologie für die
Arzneimittelentwicklung in Bereichen mit hohem medizinischem Bedarf weiter
bestätigen."
NOX-A12 bindet und neutralisiert das Chemokin Stromal Cell-Derived Factor-1
(SDF-1, auch als CXCL12 beschrieben), dem eine Schlüsselrolle bei der
Mobilisierung und zielgerichteten Wanderung von hämatopoetischen Stammzellen ins
Knochenmark zukommt. Aus dem Knochenmark freigesetzte Stammzellen können mit
Hilfe der Leukapherese, einem Verfahren zur Separation der im Blut enthaltenen
weißen Blutkörperchen, gesammelt werden. Die Kombination aus
Stammzellmobilisierung und Leukapherese stellt mittlerweile die bevorzugte
Methode dar, da sie weniger invasiv als eine Knochenmarkentnahme ist. NOXXON´s
präklinische Untersuchungen zeigen, dass die pharmakodynamischen und
pharmakokinetischen Eigenschaften von NOX-A12 den zurzeit verfügbaren
Stammzell-mobilisierenden Arzneimitteln überlegen sind.
Die Ergebnisse der nun begonnenen klinischen Studie bilden die Grundlage für das
klinische Phase-II-Programm, das Mitte 2010 beginnen soll. NOX-A12 wird dann für
die Stammzellmobilisierung bei Patienten mit Multiplem Myelom oder
Non-Hodgkin-Lymphom eingesetzt.
Über NOX-A12
NOX-A12 mobilisiert hämatopoetische Stammzellen aus dem Knochenmark, indem es
das Chemokin SDF-1, welches diese Zellen normalerweise im Knochenmark hält,
bindet und blockiert. In kürzlich beendeten Studien in Tiermodellen konnte
gezeigt werden, dass eine einmalige Gabe des Spiegelmers® NOX-A12 zu einer
dosisabhängigen Mobilisierung der hämatopoetischen Vorläuferzellen führt. Für
die Durchführung des präklinischen Programms und der ersten klinischen Studie
(First-in-human) mit NOX-A12 erhält NOXXON Fördermittel des Bundesministeriums
für Bildung und Forschung (BMBF).
Über Hämatopoetische Stammzelltransplantation
Die hämatopoetische Stamzelltransplantation wird als bevorzugte Behandlungsform
für viele Patienten betrachtet, die an schweren Formen von bösartigen oder
nicht-bösartigen Störungen des hämatopoetischen Systems, seien sie erworben oder
angeboren, leiden. Sie wird auch für Patienten mit chemosensitiven,
radiosensitiven und immunosensitiven Tumoren eingesetzt. Eine bessere Betreuung
der Patienten, verbesserte Pflegeunterstützung, vergrößerte Spender-Datenbanken
sowie neuartige Ansätze zur Vorbehandlung der Patienten haben die Anwendung auf
neue Patientengruppen und Erkrankungen erweitert.
Über Spiegelmere®
Spiegelmere® (L-Aptamere) sind chemische Substanzen, die auf synthetischen,
spiegelbildlichen Oligonukleotiden basieren, welche sehr selektiv für ihre
pharmakologischen Zielmoleküle sind und sehr wirksame Inhibitoren dieser
Zielmoleküle darstellen. Sie vereinen die Vorzüge von niedermolekularen
Substanzen und Biopharmazeutika. Aufgrund ihrer einzigartigen spiegelbildlichen
Struktur werden Spiegelmere® in Stoffwechselprozessen nicht abgebaut und binden
nicht an die natürlich vorkommenden Nukleinsäuren. Im Gegensatz zu einer Reihe
von konventionellen Oligonukleotiden lösen Spiegelmere® nicht die angeborene
Immunantwort über Toll-like Rezeptoren (TLR) aus. Darüber hinaus zeigten sie in
präklinischen Versuchsreihen ein überaus vorteilhaftes Immunogenitätsprofil.
NOXXON im Kurzprofil
Die in Berlin ansässige NOXXON Pharma AG ist ein Biotechnologie-Unternehmen, das
sich auf die Entwicklung von Spiegelmeren® zur Behandlung von
Entzündungskrankheiten und hämatologischen Erkrankungen spezialisiert hat.
Sowohl die Spiegelmerprodukte, als auch die Spiegelmer®-Technologieplattform
sind über ein breites Patentportfolio abgesichert. NOXXON hat Zugang zu einer
skalierbaren GMP Produktion. Über die eigenen Entwicklungsprogramme hinaus
identifiziert und entwickelt NOXXON Spiegelmere® in Zusammenarbeit mit Partnern
aus der Pharmaindustrie wie Eli Lilly, Hoffmann La-Roche und Pfizer. Die
Geschäftsstrategie von NOXXON ist darauf ausgerichtet, diese Bandbreite an
Kooperationen durch Entwicklungs- und Lizenzabkommen für eigene klinische und
präklinische Produkte sowie durch technologiebasierte Partnerschaften zu
erweitern. Aktuell hat das Unternehmen zwei Wirkstoffe in der klinischen
Entwicklung. Erklärtes Ziel von NOXXON ist es, die auf Oligonukleotiden
basierende Spiegelmer®-Plattform als die führende "Scaffold"-Technologie zu
etablieren, welche neuartige chemische Substanzen mit überlegenen Fähigkeiten
liefert.
Die Investoren von NOXXON sind TVM Capital, Sofinnova Partners, Edmond de
Rothschild Investment Partners, Deutsche Effecten- und
Wechsel-Beteiligungsgesellschaft (DEWB), Seventure Partners, Dow Venture
Capital, Dieckell Group, FCP OP Medical BioHealth-Trends, IBG
Risikokapitalfonds, VC Fonds Berlin und andere. Website: http://www.noxxon.com
Emittent/Meldungsgeber verantwortlich.
Berlin, 2. November 2009 (euro adhoc) - Die NOXXON Pharma AG, das
biopharmazeutische Unternehmen, das sich auf die Entwicklung von neuen
Arzneimitteln auf Basis seiner Spiegelmer®-Technologie spezialisiert hat, gab
heute die erste Dosierung gesunder freiwilliger Probanden in einer klinischen
Phase-I-Studie mit dem Spiegelmer® NOX A12 bekannt. NOX A12 ist innerhalb von
nur fünf Monaten der zweite Wirkstoff von NOXXON, welcher die Phase der
klinischen Arzneimittelentwicklung erreicht.
Nach Prüfung und Genehmigung des Antrags zur Durchführung der Phase I-Studie
durch das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) wird die
Studie derzeit in Deutschland durchgeführt. Die monozentrische Studie untersucht
Sicherheit, Verträglichkeit, Pharmakokinetik und Pharmakodynamik des
Blutstammzell-mobilisierenden Spiegelmers® NOX A12 in bis zu 42 Probanden nach
intravenöser Gabe. Weitere Informationen zu dieser Studie sind im Internet unter
www.clinicaltrials.gov (ID: NCT00976378) zu finden.
Dr. Frank Morich, Vorstandsvorsitzender von NOXXON, kommentierte: "Wir sind fest
davon überzeugt, dass NOX-A12 über das Potenzial verfügt, sich zu einer deutlich
verbesserten Alternative bei der Mobilisierung von hämatopoetischen Stammzellen
zu entwickeln. Die außerordentlich positiven präklinischen Daten untermauern
unsere Einschätzung. Es ist unser Ziel, die Zulassung für NOX-A12 im Jahr 2014
zu erreichen. In der laufenden klinischen Studie erwarten wir, ein sehr gutes
Sicherheitsprofil zu sehen und erste Wirksamkeitshinweise zu erhalten. Damit
wird sich der wertvolle Beitrag der Spiegelmer®-Technologie für die
Arzneimittelentwicklung in Bereichen mit hohem medizinischem Bedarf weiter
bestätigen."
NOX-A12 bindet und neutralisiert das Chemokin Stromal Cell-Derived Factor-1
(SDF-1, auch als CXCL12 beschrieben), dem eine Schlüsselrolle bei der
Mobilisierung und zielgerichteten Wanderung von hämatopoetischen Stammzellen ins
Knochenmark zukommt. Aus dem Knochenmark freigesetzte Stammzellen können mit
Hilfe der Leukapherese, einem Verfahren zur Separation der im Blut enthaltenen
weißen Blutkörperchen, gesammelt werden. Die Kombination aus
Stammzellmobilisierung und Leukapherese stellt mittlerweile die bevorzugte
Methode dar, da sie weniger invasiv als eine Knochenmarkentnahme ist. NOXXON´s
präklinische Untersuchungen zeigen, dass die pharmakodynamischen und
pharmakokinetischen Eigenschaften von NOX-A12 den zurzeit verfügbaren
Stammzell-mobilisierenden Arzneimitteln überlegen sind.
Die Ergebnisse der nun begonnenen klinischen Studie bilden die Grundlage für das
klinische Phase-II-Programm, das Mitte 2010 beginnen soll. NOX-A12 wird dann für
die Stammzellmobilisierung bei Patienten mit Multiplem Myelom oder
Non-Hodgkin-Lymphom eingesetzt.
Über NOX-A12
NOX-A12 mobilisiert hämatopoetische Stammzellen aus dem Knochenmark, indem es
das Chemokin SDF-1, welches diese Zellen normalerweise im Knochenmark hält,
bindet und blockiert. In kürzlich beendeten Studien in Tiermodellen konnte
gezeigt werden, dass eine einmalige Gabe des Spiegelmers® NOX-A12 zu einer
dosisabhängigen Mobilisierung der hämatopoetischen Vorläuferzellen führt. Für
die Durchführung des präklinischen Programms und der ersten klinischen Studie
(First-in-human) mit NOX-A12 erhält NOXXON Fördermittel des Bundesministeriums
für Bildung und Forschung (BMBF).
Über Hämatopoetische Stammzelltransplantation
Die hämatopoetische Stamzelltransplantation wird als bevorzugte Behandlungsform
für viele Patienten betrachtet, die an schweren Formen von bösartigen oder
nicht-bösartigen Störungen des hämatopoetischen Systems, seien sie erworben oder
angeboren, leiden. Sie wird auch für Patienten mit chemosensitiven,
radiosensitiven und immunosensitiven Tumoren eingesetzt. Eine bessere Betreuung
der Patienten, verbesserte Pflegeunterstützung, vergrößerte Spender-Datenbanken
sowie neuartige Ansätze zur Vorbehandlung der Patienten haben die Anwendung auf
neue Patientengruppen und Erkrankungen erweitert.
Über Spiegelmere®
Spiegelmere® (L-Aptamere) sind chemische Substanzen, die auf synthetischen,
spiegelbildlichen Oligonukleotiden basieren, welche sehr selektiv für ihre
pharmakologischen Zielmoleküle sind und sehr wirksame Inhibitoren dieser
Zielmoleküle darstellen. Sie vereinen die Vorzüge von niedermolekularen
Substanzen und Biopharmazeutika. Aufgrund ihrer einzigartigen spiegelbildlichen
Struktur werden Spiegelmere® in Stoffwechselprozessen nicht abgebaut und binden
nicht an die natürlich vorkommenden Nukleinsäuren. Im Gegensatz zu einer Reihe
von konventionellen Oligonukleotiden lösen Spiegelmere® nicht die angeborene
Immunantwort über Toll-like Rezeptoren (TLR) aus. Darüber hinaus zeigten sie in
präklinischen Versuchsreihen ein überaus vorteilhaftes Immunogenitätsprofil.
NOXXON im Kurzprofil
Die in Berlin ansässige NOXXON Pharma AG ist ein Biotechnologie-Unternehmen, das
sich auf die Entwicklung von Spiegelmeren® zur Behandlung von
Entzündungskrankheiten und hämatologischen Erkrankungen spezialisiert hat.
Sowohl die Spiegelmerprodukte, als auch die Spiegelmer®-Technologieplattform
sind über ein breites Patentportfolio abgesichert. NOXXON hat Zugang zu einer
skalierbaren GMP Produktion. Über die eigenen Entwicklungsprogramme hinaus
identifiziert und entwickelt NOXXON Spiegelmere® in Zusammenarbeit mit Partnern
aus der Pharmaindustrie wie Eli Lilly, Hoffmann La-Roche und Pfizer. Die
Geschäftsstrategie von NOXXON ist darauf ausgerichtet, diese Bandbreite an
Kooperationen durch Entwicklungs- und Lizenzabkommen für eigene klinische und
präklinische Produkte sowie durch technologiebasierte Partnerschaften zu
erweitern. Aktuell hat das Unternehmen zwei Wirkstoffe in der klinischen
Entwicklung. Erklärtes Ziel von NOXXON ist es, die auf Oligonukleotiden
basierende Spiegelmer®-Plattform als die führende "Scaffold"-Technologie zu
etablieren, welche neuartige chemische Substanzen mit überlegenen Fähigkeiten
liefert.
Die Investoren von NOXXON sind TVM Capital, Sofinnova Partners, Edmond de
Rothschild Investment Partners, Deutsche Effecten- und
Wechsel-Beteiligungsgesellschaft (DEWB), Seventure Partners, Dow Venture
Capital, Dieckell Group, FCP OP Medical BioHealth-Trends, IBG
Risikokapitalfonds, VC Fonds Berlin und andere. Website: http://www.noxxon.com
Antwort auf Beitrag Nr.: 38.302.012 von dg6nds am 02.11.09 14:13:43Wunderbar, damit liegt Noxxon derzeit zeitlich voll im Plan. Die Roadmap im aktuellen Factsheet hat folgendes Bild (Quelle: noxxon.com):

Konkreter für 2010:
- NOX-E36 Start P1b- und P2a-Studien vermutlich in Q1/Q2 2010
- NOX-A12 finale Daten P1-Studie vermutlich Q1 2010
- NOX-A12 Start P2-Studie vermutlich in Q2/Q3 2010
- NOX-A12 vorläufige Daten (Mobilisierung) zur P2-Studie vermutlich Q4 2010
Damit dürfte man Ende 2010 einen ersten Einblick haben, ob es Komplikationen/Schwachstellen im Technologieansatz gibt oder ob bis dahin mit NOX-A12 und NOX-E36 alles glatt durchläuft. Dann wird auch spannend werden, wie und durch wen die weitere Finanzierung sichergestellt werden wird (weitere VC-Runde / IPO / Trade Sale).

Konkreter für 2010:
- NOX-E36 Start P1b- und P2a-Studien vermutlich in Q1/Q2 2010
- NOX-A12 finale Daten P1-Studie vermutlich Q1 2010
- NOX-A12 Start P2-Studie vermutlich in Q2/Q3 2010
- NOX-A12 vorläufige Daten (Mobilisierung) zur P2-Studie vermutlich Q4 2010
Damit dürfte man Ende 2010 einen ersten Einblick haben, ob es Komplikationen/Schwachstellen im Technologieansatz gibt oder ob bis dahin mit NOX-A12 und NOX-E36 alles glatt durchläuft. Dann wird auch spannend werden, wie und durch wen die weitere Finanzierung sichergestellt werden wird (weitere VC-Runde / IPO / Trade Sale).
Es gibt eine weitere Präsentation, diesmal von CSO Klussmann auf der "Bio Europe" in Wien am heutigen Tage.
pdf: http://145.253.103.53/noxxon15/downloads/091104_NOXXON_prese…
Neu und interessant ist eine Übersicht über die Wirksamkeit von NOX-E36 bei diversen Krankheitsbildern in den Tierversuchen. Noxxon will NOX-E36 bei Komplikationen bei Typ-2-Diabetes einsetzen. Mit der P2a-Studie, die 2010 starten soll, wird man vermutlich erkennen, worauf es Noxxon dabei konkret abgesehen hat. Hier die entsprechende Folie aus der Präsentation (Quelle: noxxon.com):

pdf: http://145.253.103.53/noxxon15/downloads/091104_NOXXON_prese…
Neu und interessant ist eine Übersicht über die Wirksamkeit von NOX-E36 bei diversen Krankheitsbildern in den Tierversuchen. Noxxon will NOX-E36 bei Komplikationen bei Typ-2-Diabetes einsetzen. Mit der P2a-Studie, die 2010 starten soll, wird man vermutlich erkennen, worauf es Noxxon dabei konkret abgesehen hat. Hier die entsprechende Folie aus der Präsentation (Quelle: noxxon.com):

03.12.2009 - NOXXON Pharma AG erreicht Meilenstein in der Kooperation mit Eli Lilly and Company
Berlin, den 3. Dezember, 2009 - Die NOXXON Pharma AG, das biopharmazeutische Unternehmen, das sich auf die Entwicklung von neuen Arzneimitteln auf Basis seiner Spiegelmer®-Technologie spezialisiert hat, gab heute die Erreichung eines wichtigen Meilensteins im Rahmen der Partnerschaft mit Eli Lilly and Company (NYSE:LLY) bekannt. NOXXONs erfolgreiche Identifizierung eines Spiegelmers® mit pikomolarer Affinität und hoher Targetselektivität erfüllt die vertraglich festgelegten Qualitätskriterien und löst eine Meilensteinzahlung aus. Die Kooperation zwischen Lilly und NOXXON begann im vergangenen Jahr mit dem Ziel, Spiegelmere zur Behandlung von Migräne zu entwickeln.
NOXXONs Forschungsvorstand Dr. Sven Klussmann kommentierte: “Die schnelle Identifizierung eines hochpotenten Spiegelmers® demonstriert die Leistungsfähigkeit der Spiegelmer® Plattform und ist ein entscheidender Fortschritt in unserer Partnerschaft. Wir gehen davon aus, daß mit Lillys großer Expertise auf dem Forschungsgebiet Migräne das Spiegelmer® zügig die nächste Entwicklungsstufe erreichen wird.“
Dr. William Chin, Lillys Vice President of Discovery and Clinical Research, fügte hinzu: “NOXXONs Identifizierung eines Lead-Kandidaten ist eine außerordentliche Leistung. Die Entwicklung von Spiegelmeren® zur Behandlung von Migräne ist ein neuartiger und vielversprechender Ansatz. Wir freuen uns auf die weitere Zusammenarbeit mit NOXXON mit dem Ziel, Spiegelmere® so schnell wie möglich Patienten zugänglich zu machen.“
Mit der Beendigung der Arbeiten zur Wirkstoffindung beginnt für das identifizierte Spiegelmer® nun die nächste Forschungsphase in Form von pharmakologischen Studien und präklinischer Entwicklung. Lilly ist zuständig für die präklinische und klinische Entwicklung des Spiegelmer® Produkts sowie, im Falle der Zulassung durch die verantwortlichen Behörden, dessen Kommerzialisierung.
Berlin, den 3. Dezember, 2009 - Die NOXXON Pharma AG, das biopharmazeutische Unternehmen, das sich auf die Entwicklung von neuen Arzneimitteln auf Basis seiner Spiegelmer®-Technologie spezialisiert hat, gab heute die Erreichung eines wichtigen Meilensteins im Rahmen der Partnerschaft mit Eli Lilly and Company (NYSE:LLY) bekannt. NOXXONs erfolgreiche Identifizierung eines Spiegelmers® mit pikomolarer Affinität und hoher Targetselektivität erfüllt die vertraglich festgelegten Qualitätskriterien und löst eine Meilensteinzahlung aus. Die Kooperation zwischen Lilly und NOXXON begann im vergangenen Jahr mit dem Ziel, Spiegelmere zur Behandlung von Migräne zu entwickeln.
NOXXONs Forschungsvorstand Dr. Sven Klussmann kommentierte: “Die schnelle Identifizierung eines hochpotenten Spiegelmers® demonstriert die Leistungsfähigkeit der Spiegelmer® Plattform und ist ein entscheidender Fortschritt in unserer Partnerschaft. Wir gehen davon aus, daß mit Lillys großer Expertise auf dem Forschungsgebiet Migräne das Spiegelmer® zügig die nächste Entwicklungsstufe erreichen wird.“
Dr. William Chin, Lillys Vice President of Discovery and Clinical Research, fügte hinzu: “NOXXONs Identifizierung eines Lead-Kandidaten ist eine außerordentliche Leistung. Die Entwicklung von Spiegelmeren® zur Behandlung von Migräne ist ein neuartiger und vielversprechender Ansatz. Wir freuen uns auf die weitere Zusammenarbeit mit NOXXON mit dem Ziel, Spiegelmere® so schnell wie möglich Patienten zugänglich zu machen.“
Mit der Beendigung der Arbeiten zur Wirkstoffindung beginnt für das identifizierte Spiegelmer® nun die nächste Forschungsphase in Form von pharmakologischen Studien und präklinischer Entwicklung. Lilly ist zuständig für die präklinische und klinische Entwicklung des Spiegelmer® Produkts sowie, im Falle der Zulassung durch die verantwortlichen Behörden, dessen Kommerzialisierung.
Antwort auf Beitrag Nr.: 38.306.521 von Saaletaler am 03.11.09 00:22:55Bei NOX-A12 geht es laut aktuellem Factshet etwas langsamer voran. Möglicherweise läuft die P1-Rekrutierung schleppender als gedacht. Die aktuelle Planung:
- NOX-A12 finale Daten P1-Studie vermutlich Q2 2010
- NOX-A12 Start P2-Studie vermutlich in Q3 2010
- NOX-A12 vorläufige Daten (Mobilisierung) zur P2-Studie vermutlich Q4 2010
- NOX-A12 finale Daten P1-Studie vermutlich Q2 2010
- NOX-A12 Start P2-Studie vermutlich in Q3 2010
- NOX-A12 vorläufige Daten (Mobilisierung) zur P2-Studie vermutlich Q4 2010
Antwort auf Beitrag Nr.: 38.532.363 von Saaletaler am 08.12.09 22:40:21Die P1-Studie mit NOX-A12 ist jetzt geschlossen, läuft aber scheinbar noch. Für das Studienende ist nun März 2010 angegeben. Eine Meldung zu den Ergebnissen sollte also innerhalb der nächsten 4 Wochen kommen.
Quelle: http://clinicaltrials.gov/show/NCT00976378
Quelle: http://clinicaltrials.gov/show/NCT00976378
Es gibt die nächste Präsentation, gehalten von Dr. Klussmann auf der "Bio Europe" am 9. März 2010 in Barcelona. Außerdem wurde das Noxxon-Factsheet aktualisiert.
Präsentation (pdf): http://145.253.103.53/noxxon15/downloads/100309_NOXXON_BioEu…
Factsheet (pdf): http://145.253.103.53/noxxon15/downloads/FactSheet.pdf
Die Präsentation enthält die von uns sehnlich erwarteten ersten Ergebnisse zur P1-Studie mit NOX-A12 (Folien 32 bis 36)! Danach scheint es in allen Dosierungen keine Komplikationen bei Sicherheit und Verträglichkeit gegeben zu haben (Folie 33). Häufigste Nebenwirkung waren Kopfschmerzen. Die anderen aufgelisteten Beschwerden bzw. Ereignisse muss man wohl nicht zwingend mit der Darreichung des Spiegelmers in Verbindung bringen. Neben der guten Verträglichkeit wurde zudem bereits Wirksamkeit nachgewiesen!
Statt der geplanten 42 Probanden (7 Gruppen zu je 6 Personen) wurden insgesamt 54 Personen getestet. Bei den zusätzlichen 12 Probanden (Gruppe 8) hat man eine Blutwäsche vorgenommen, möglicherweise um eine Herausfilterung der Stammzellen zu testen (Folie 32).
Neu ist, dass Noxxon die P1-Studie erweitern will und wird, und zwar auf Mehrfachgabe von NOX-A12 (multiple dosing). Deswegen wurde möglicherweise bisher keine Pressemitteilung veröffentlicht, weil man erst die gesamte P1-Studie beenden will. Das könnte noch ein paar Wochen dauern. Aber dafür liegt ja die Präsentation mit den beruhigenden und erfreulichen Aussagen vor!
Außerdem erwägt man die Erweiterung der Anwendung von NOX-A12 auf diverse Krebs-Erkrankungen (Folie 35).
Der aktuelle Fahrplan für NOX-A12 sieht jetzt wie folgt aus:
- Erweiterung und Abschluss der P1-Studie mit Mehrfach-Dosierung in Q2 2010
- Start P2-Studie in HJ2 2010
- Zwischendaten aus P2-Studie in 2011
Hier die beiden letzten Folien der Präsentation mit dem aktuellen Stand der Noxxon-Entwicklung. Ich meine, das kann sich sehen lassen


Präsentation (pdf): http://145.253.103.53/noxxon15/downloads/100309_NOXXON_BioEu…
Factsheet (pdf): http://145.253.103.53/noxxon15/downloads/FactSheet.pdf
Die Präsentation enthält die von uns sehnlich erwarteten ersten Ergebnisse zur P1-Studie mit NOX-A12 (Folien 32 bis 36)! Danach scheint es in allen Dosierungen keine Komplikationen bei Sicherheit und Verträglichkeit gegeben zu haben (Folie 33). Häufigste Nebenwirkung waren Kopfschmerzen. Die anderen aufgelisteten Beschwerden bzw. Ereignisse muss man wohl nicht zwingend mit der Darreichung des Spiegelmers in Verbindung bringen. Neben der guten Verträglichkeit wurde zudem bereits Wirksamkeit nachgewiesen!
Statt der geplanten 42 Probanden (7 Gruppen zu je 6 Personen) wurden insgesamt 54 Personen getestet. Bei den zusätzlichen 12 Probanden (Gruppe 8) hat man eine Blutwäsche vorgenommen, möglicherweise um eine Herausfilterung der Stammzellen zu testen (Folie 32).
Neu ist, dass Noxxon die P1-Studie erweitern will und wird, und zwar auf Mehrfachgabe von NOX-A12 (multiple dosing). Deswegen wurde möglicherweise bisher keine Pressemitteilung veröffentlicht, weil man erst die gesamte P1-Studie beenden will. Das könnte noch ein paar Wochen dauern. Aber dafür liegt ja die Präsentation mit den beruhigenden und erfreulichen Aussagen vor!
Außerdem erwägt man die Erweiterung der Anwendung von NOX-A12 auf diverse Krebs-Erkrankungen (Folie 35).
Der aktuelle Fahrplan für NOX-A12 sieht jetzt wie folgt aus:
- Erweiterung und Abschluss der P1-Studie mit Mehrfach-Dosierung in Q2 2010
- Start P2-Studie in HJ2 2010
- Zwischendaten aus P2-Studie in 2011
Hier die beiden letzten Folien der Präsentation mit dem aktuellen Stand der Noxxon-Entwicklung. Ich meine, das kann sich sehen lassen



!
Dieser Beitrag wurde moderiert. Grund: Spammposting
Noxxon und Pfizer haben ihre Zusammenarbeit offenbar (vorerst) beendet. Zumindest wird Pfizer auf der Noxxon-Homepage nicht mehr als Forschungspartner aufgeführt. Das sieht auf den ersten Blick nach einer schlechten Nachricht aus. Ich würde sie allerdings vor folgendem Hintergrund sehen:
Der Pfizer-Deal im März 2006 war die erste große Pharma-Kooperation von Noxxon überhaupt und Voraussetzung, um anschließend Investoren für die große Runde-C-Finanzierung gewinnen zu können. Ohne diese damalige Vereinbarung würde es Noxxon heute evtl. gar nicht mehr geben. Dementsprechend groß waren die Zugeständnisse, die Noxxon an Pfizer hinsichtlich der Konditionen des Deals machen musste. Hohe Meilensteinzahlungen hätte es erst in den Endphasen der klinischen Studien mit einzelnen Spiegelmeren gegeben. Noxxon hatte somit hohen Aufwand und hohes Risiko zu tragen.
Diese Konditionen waren für Noxxon also äußerst unattraktiv. Entsprechend dürfte die Motivation ziemlich niedrig für Noxxon in den Pfizer-Projekten gewesen sein. Ausdruck dafür ist m.E. auch, dass es Pfizer in den 4 Jahren der Zusammenarbeit nicht geschafft hat, ein einziges Spiegelmer in die klinische Phase zu bringen. Noxxon selbst hat in der gleichen Zeit schon 2 Spiegelmere in Phase 1 (NOX-A12, NOX-E36), ein weiteres kommt demnächst hinzu (NOX-H94). Auch mit Eli Lilly ist man in kurzer Zeit - nach eineinhalb Jahren Zusammenarbeit - schon deutlich weiter (s. Meilenstein-Meldung vom Dezember 2009).
Außerdem war zu hören, dass Noxxon derzeit bemüht ist, weitere attraktivere Forschungskooperationen mit Pharmafirmen abzuschließen, auch um durch höhere Vorabzahlungen die Höhe der anstehenden VC-Finanzierungsrunde und damit die Verwässerung der Altaktionäre, zu denen auch das Noxxon-Management gehört, gering zu halten.
Trotzdem wird das Thema Pfizer-Kooperation sicherlich auf der DEWB-HV zur Sprache kommen. Dann werden wir mehr über die Hintergünde erfahren.
Der Pfizer-Deal im März 2006 war die erste große Pharma-Kooperation von Noxxon überhaupt und Voraussetzung, um anschließend Investoren für die große Runde-C-Finanzierung gewinnen zu können. Ohne diese damalige Vereinbarung würde es Noxxon heute evtl. gar nicht mehr geben. Dementsprechend groß waren die Zugeständnisse, die Noxxon an Pfizer hinsichtlich der Konditionen des Deals machen musste. Hohe Meilensteinzahlungen hätte es erst in den Endphasen der klinischen Studien mit einzelnen Spiegelmeren gegeben. Noxxon hatte somit hohen Aufwand und hohes Risiko zu tragen.
Diese Konditionen waren für Noxxon also äußerst unattraktiv. Entsprechend dürfte die Motivation ziemlich niedrig für Noxxon in den Pfizer-Projekten gewesen sein. Ausdruck dafür ist m.E. auch, dass es Pfizer in den 4 Jahren der Zusammenarbeit nicht geschafft hat, ein einziges Spiegelmer in die klinische Phase zu bringen. Noxxon selbst hat in der gleichen Zeit schon 2 Spiegelmere in Phase 1 (NOX-A12, NOX-E36), ein weiteres kommt demnächst hinzu (NOX-H94). Auch mit Eli Lilly ist man in kurzer Zeit - nach eineinhalb Jahren Zusammenarbeit - schon deutlich weiter (s. Meilenstein-Meldung vom Dezember 2009).
Außerdem war zu hören, dass Noxxon derzeit bemüht ist, weitere attraktivere Forschungskooperationen mit Pharmafirmen abzuschließen, auch um durch höhere Vorabzahlungen die Höhe der anstehenden VC-Finanzierungsrunde und damit die Verwässerung der Altaktionäre, zu denen auch das Noxxon-Management gehört, gering zu halten.
Trotzdem wird das Thema Pfizer-Kooperation sicherlich auf der DEWB-HV zur Sprache kommen. Dann werden wir mehr über die Hintergünde erfahren.
Antwort auf Beitrag Nr.: 39.361.399 von Saaletaler am 19.04.10 15:39:03Danke! Nun ja... Deshalb haben wir heute die hohen Umsätze gesehen.
Die Antwort auf meine mail-Anfrage:
Sehr geehrter Herr ,
vielen Dank für Ihre E-Mail.
Bezüglich Ihrer Frage zu NOXXON können wir Ihnen mitteilen, dass die derzeit in Internetforen umlaufenden Informationen über einen Ausstieg von Pfizer falsch sind und jeglicher Grundlage entbehren. Der strategische Investor Pfizer ist weiterhin als Aktionär bei NOXXON engagiert.
Die Gerüchte die Sie ansprechen, beziehen sich wahrscheinlich auf die Laufzeit des 2006 mit Pfizer abgeschlossenen Forschungs- und Entwicklungskooperationsvertrags, dem ersten größeren Corporate Deal durch NOXXON. Nach mehrmaliger Verlängerung durch Pfizer lief dieser im März 2010 nunmehr fristgerecht aus. In den Jahren 2008 und 2009 akquirierte NOXXON daher mit Roche und Eli Lilly weitere Partner für die Wirkstoffentwicklung und Kommerzialisierung ihrer Spiegelmere. Aufgrund des zwischenzeitlichen Fortschritts in der Unternehmensentwicklung der NOXXON konnten die Kooperationen mit Roche und Eli Lilly zu deutlich besseren Konditionen abgeschlossen werden, als dies in der frühen Partnerschaft mit Pfizer möglich war.
Das Auslaufen des Pfizer-Vertrags bietet NOXXON wieder Ressourcen für neue Forschungs- und Entwicklungsprojekte. Mit der weiteren sehr guten Entwicklung NOXXONs in den letzten Monaten (u.a. Phase I Daten für zwei Wirkstoffe, und damit Proof of Concept der Technologieplattform) ist davon auszugehen, dass das Unternehmen in der Lage sein wird, weitere Partner der Pharmabranche zu nochmals verbesserten Konditionen zu gewinnen und damit das Wertpotenzial weiter zu steigern. Für die Werthaltigkeit des DEWB-Anteils an NOXXON ist dies daher sehr positiv zu sehen.
Für weitere Fragen stehe ich Ihnen gern zur Verfügung.
Mit freundlichen Grüßen
Marco Scheidler
Deutsche Effecten- und Wechsel-
Beteiligungsgesellschaft AG
Leutragraben 1
07743 Jena
Tel.: +49 (0)3641 573-3617
Fax: +49 (0)3641 573-3610
Mobil: +49 (0)171 7626 217
E-Mail: marco.scheidler@dewb-vc.com
www.dewb-vc.com
Sehr geehrter Herr ,
vielen Dank für Ihre E-Mail.
Bezüglich Ihrer Frage zu NOXXON können wir Ihnen mitteilen, dass die derzeit in Internetforen umlaufenden Informationen über einen Ausstieg von Pfizer falsch sind und jeglicher Grundlage entbehren. Der strategische Investor Pfizer ist weiterhin als Aktionär bei NOXXON engagiert.
Die Gerüchte die Sie ansprechen, beziehen sich wahrscheinlich auf die Laufzeit des 2006 mit Pfizer abgeschlossenen Forschungs- und Entwicklungskooperationsvertrags, dem ersten größeren Corporate Deal durch NOXXON. Nach mehrmaliger Verlängerung durch Pfizer lief dieser im März 2010 nunmehr fristgerecht aus. In den Jahren 2008 und 2009 akquirierte NOXXON daher mit Roche und Eli Lilly weitere Partner für die Wirkstoffentwicklung und Kommerzialisierung ihrer Spiegelmere. Aufgrund des zwischenzeitlichen Fortschritts in der Unternehmensentwicklung der NOXXON konnten die Kooperationen mit Roche und Eli Lilly zu deutlich besseren Konditionen abgeschlossen werden, als dies in der frühen Partnerschaft mit Pfizer möglich war.
Das Auslaufen des Pfizer-Vertrags bietet NOXXON wieder Ressourcen für neue Forschungs- und Entwicklungsprojekte. Mit der weiteren sehr guten Entwicklung NOXXONs in den letzten Monaten (u.a. Phase I Daten für zwei Wirkstoffe, und damit Proof of Concept der Technologieplattform) ist davon auszugehen, dass das Unternehmen in der Lage sein wird, weitere Partner der Pharmabranche zu nochmals verbesserten Konditionen zu gewinnen und damit das Wertpotenzial weiter zu steigern. Für die Werthaltigkeit des DEWB-Anteils an NOXXON ist dies daher sehr positiv zu sehen.
Für weitere Fragen stehe ich Ihnen gern zur Verfügung.
Mit freundlichen Grüßen
Marco Scheidler
Deutsche Effecten- und Wechsel-
Beteiligungsgesellschaft AG
Leutragraben 1
07743 Jena
Tel.: +49 (0)3641 573-3617
Fax: +49 (0)3641 573-3610
Mobil: +49 (0)171 7626 217
E-Mail: marco.scheidler@dewb-vc.com
www.dewb-vc.com
Die Phase 1 Ergebnisse für Nox A 12 sollen lt.Köhler auch bald veröffentlicht werden!
Alles wird gut...
Alles wird gut...
Antwort auf Beitrag Nr.: 39.369.014 von Swiftnick am 20.04.10 17:25:4303.05.2010 12:24
EANS-News: DEWB Beteiligung: NOXXON's Phase I Studie (Erstanwendung am Menschen) mit dem Spiegelmer® NOX-A12 erfolgreich beendet
-----------------------------------------------------------------Corporate News übermittelt durch euro adhoc. Für den Inhalt ist der Emittent/Meldungsgeber verantwortlich. -----------------------------------------------------------------
Berlin, 03. Mai, 2010 (euro adhoc) - Die NOXXON Pharma AG, das biopharmazeutische Unternehmen, das sich auf die Entwicklung von neuen Arzneimitteln auf Basis seiner Spiegelmer®-Technologie spezialisiert hat, gab heute den erfolgreichen Abschluss der ersten Phase I Studie mit dem Spiegelmer® NOX-A12 bekannt.
Ziel der Studie war es neben Sicherheit, Verträglichkeit und Pharmakokinetik auch erste Daten zur pharmakodynamischen Wirkung von NOX-A12 nach intravenöser Gabe an gesunden Freiwilligen zu erheben.
Die endgültigen klinischen Ergebnisse zeigen bis zur höchsten getesteten Dosis von 10,8 mg/kg ein exzellentes Sicherheits- und Verträglichkeitsprofil. Darüber hinaus ergaben sog. "durchflusszytometrische" Messungen eine langanhaltende und dosisabhängige Mobilisierung von weißen Blutkörperchen und CD34-positiven Zellen im peripheren Blut. Gemäß Prüfplan war vorgesehen, dass bei Erreichen bestimmter Schwellenwerte für zirkulierende CD34-positive Zellen bei einer zusätzlichen Gruppe von gesunden Freiwilligen nach Dosierung eine sog. Leukapherese (d. h. die Isolierung weißer Blutzellen) durchgeführt werden sollte, um die mobilisierten Zellen weiter zu charakterisieren. Auch dieses Studienziel wurde erreicht. Weitere Informationen zu dieser Studie können unter www.clinicaltrials.gov (ID: NCT00976378) eingesehen werden.
Dr. Frank Morich, Vorstandsvorsitzender der NOXXON Pharma AG, kommentierte: "Nach NOX-E36 hat mit NOX-A12 jetzt schon das zweite Spiegelmer® erfolgreich die Erstanwendung durchlaufen. Erneut haben wir ein exzellentes Sicherheitsprofil gesehen, aber darüber hinaus auch erste Hinweise auf klinische Wirksamkeit mit regulatorischer Relevanz. Wir glauben, dass NOX-A12 in hämatologischen und onkologischen Indikationen ein hohes Potential hat. Mitte des Jahres werden wir zunächst eine Studie zur Mehrfachanwendung an gesunden Freiwilligen durchführen, und dann schnellstmöglich die Phase II an Patienten initiieren."
Über NOX-A12 NOX-A12 ist ein hochspezifischer Antagonist des Chemokins stromal cell-derived factor-1 (SDF-1), der verschiedene Zellen des Immunsystems (aber auch andere) anlocken und aktivieren kann. SDF-1 bindet mit hoher Affinität an die Rezeptoren CXCR4 und CXCR7. Diese Achse spielt eine Rolle bei der Stammzellmobilisierung, der Neubildung von Blutgefäßen im Zusammenhang mit Tumoren, beim Tumorwachstum und bei der Bildung von Metastasen. Darüber hinaus werden Tumorzellen sensibler gegenüber verschiedenen etablierten Therapeutika, wenn die Bindung von SDF-1 an CXCR4 verhindert wird.
NOX-A12 hat präklinisch in verschiedenen Modellen von der Stammzellmobilisierung bis zur Angiogenese Wirksamkeit gezeigt.
Die präklinischen Sicherheitsstudien zeigten bei einer Behandlungsdauer von bis zu zwei Wochen keine Organtoxizität und ein insgesamt hervorragendes Verträglichkeitsprofil.
NOXXON hat im Rahmen des Programms "KMU-innovativ" Förderung (Förderkennzeichen 0315118) vom Bundesministerium für Bildung und Forschung (BMBF) für die präklinische Entwicklung und die Erstanwendung von NOX-A12 am Menschen erhalten.
Über Spiegelmere® Spiegelmere® (auch L-Aptamere genannt) sind chemische Substanzen, die auf synthetischen, spiegelbildlichen Oligonukleotiden basieren, welche sehr selektiv für ihre pharmakologischen Zielmoleküle sind und sehr wirksame Inhibitoren dieser Zielmoleküle darstellen. Sie vereinen die Vorzüge von niedermolekularen Substanzen und Biopharmazeutika. Aufgrund ihrer einzigartigen spiegelbildlichen Struktur werden Spiegelmere® in Stoffwechselprozessen nicht abgebaut und binden nicht an die natürlich vorkommenden Nukleinsäuren. Im Gegensatz zu einer Reihe von konventionellen Oligonukleotiden lösen Spiegelmere® nicht die angeborene Immunantwort über Toll-like-Rezeptoren (TLR) aus. Darüber hinaus zeigte sich in präklinische Versuchsreihen ein überaus vorteilhaftes Immunogenitätsprofil.
NOXXON im Kurzprofil Die in Berlin ansässige NOXXON Pharma AG ist ein klinisch forschendes Biotechnologie-Unternehmen, das es sich zum Ziel gesetzt hat, Spiegelmere® zur Behandlung entzündlicher und hämatologischer Erkrankungen zu entwickeln. Neben den firmeneigenen Entwicklungsprojekten arbeitet NOXXON auch in Kooperation mit Partnern der pharmazeutischen Industrie, wie zum Beispiel Eli Lilly und Hoffmann La-Roche.
NOXXONs Investoren sind unter anderem TVM Capital, Sofinnova Partners, Edmond de Rothschild Investment Partners, Deutsche Effecten- und Wechsel-Beteiligungsgesellschaft (DEWB), Seventure Partners, Dow Venture Capital, Dieckell Group, FCP OP MEDICAL BioHealth- Trends, IBG Risikokapitalfonds und VC Fonds Berlin.
Webseite: http://www.noxxon.com
Kontakt: Emmanuelle Delabre NOXXON Pharma AG Max-Dohrn-Strasse 8-10 10589 Berlin Tel: + 49-30-726247-100 FAX: + 49-30-726247-225 Email: edelabre@noxxon.com
Rückfragehinweis: Marco Scheidler
Tel.: +49 (0) 3641 573-3600
EANS-News: DEWB Beteiligung: NOXXON's Phase I Studie (Erstanwendung am Menschen) mit dem Spiegelmer® NOX-A12 erfolgreich beendet
-----------------------------------------------------------------Corporate News übermittelt durch euro adhoc. Für den Inhalt ist der Emittent/Meldungsgeber verantwortlich. -----------------------------------------------------------------
Berlin, 03. Mai, 2010 (euro adhoc) - Die NOXXON Pharma AG, das biopharmazeutische Unternehmen, das sich auf die Entwicklung von neuen Arzneimitteln auf Basis seiner Spiegelmer®-Technologie spezialisiert hat, gab heute den erfolgreichen Abschluss der ersten Phase I Studie mit dem Spiegelmer® NOX-A12 bekannt.
Ziel der Studie war es neben Sicherheit, Verträglichkeit und Pharmakokinetik auch erste Daten zur pharmakodynamischen Wirkung von NOX-A12 nach intravenöser Gabe an gesunden Freiwilligen zu erheben.
Die endgültigen klinischen Ergebnisse zeigen bis zur höchsten getesteten Dosis von 10,8 mg/kg ein exzellentes Sicherheits- und Verträglichkeitsprofil. Darüber hinaus ergaben sog. "durchflusszytometrische" Messungen eine langanhaltende und dosisabhängige Mobilisierung von weißen Blutkörperchen und CD34-positiven Zellen im peripheren Blut. Gemäß Prüfplan war vorgesehen, dass bei Erreichen bestimmter Schwellenwerte für zirkulierende CD34-positive Zellen bei einer zusätzlichen Gruppe von gesunden Freiwilligen nach Dosierung eine sog. Leukapherese (d. h. die Isolierung weißer Blutzellen) durchgeführt werden sollte, um die mobilisierten Zellen weiter zu charakterisieren. Auch dieses Studienziel wurde erreicht. Weitere Informationen zu dieser Studie können unter www.clinicaltrials.gov (ID: NCT00976378) eingesehen werden.
Dr. Frank Morich, Vorstandsvorsitzender der NOXXON Pharma AG, kommentierte: "Nach NOX-E36 hat mit NOX-A12 jetzt schon das zweite Spiegelmer® erfolgreich die Erstanwendung durchlaufen. Erneut haben wir ein exzellentes Sicherheitsprofil gesehen, aber darüber hinaus auch erste Hinweise auf klinische Wirksamkeit mit regulatorischer Relevanz. Wir glauben, dass NOX-A12 in hämatologischen und onkologischen Indikationen ein hohes Potential hat. Mitte des Jahres werden wir zunächst eine Studie zur Mehrfachanwendung an gesunden Freiwilligen durchführen, und dann schnellstmöglich die Phase II an Patienten initiieren."
Über NOX-A12 NOX-A12 ist ein hochspezifischer Antagonist des Chemokins stromal cell-derived factor-1 (SDF-1), der verschiedene Zellen des Immunsystems (aber auch andere) anlocken und aktivieren kann. SDF-1 bindet mit hoher Affinität an die Rezeptoren CXCR4 und CXCR7. Diese Achse spielt eine Rolle bei der Stammzellmobilisierung, der Neubildung von Blutgefäßen im Zusammenhang mit Tumoren, beim Tumorwachstum und bei der Bildung von Metastasen. Darüber hinaus werden Tumorzellen sensibler gegenüber verschiedenen etablierten Therapeutika, wenn die Bindung von SDF-1 an CXCR4 verhindert wird.
NOX-A12 hat präklinisch in verschiedenen Modellen von der Stammzellmobilisierung bis zur Angiogenese Wirksamkeit gezeigt.
Die präklinischen Sicherheitsstudien zeigten bei einer Behandlungsdauer von bis zu zwei Wochen keine Organtoxizität und ein insgesamt hervorragendes Verträglichkeitsprofil.
NOXXON hat im Rahmen des Programms "KMU-innovativ" Förderung (Förderkennzeichen 0315118) vom Bundesministerium für Bildung und Forschung (BMBF) für die präklinische Entwicklung und die Erstanwendung von NOX-A12 am Menschen erhalten.
Über Spiegelmere® Spiegelmere® (auch L-Aptamere genannt) sind chemische Substanzen, die auf synthetischen, spiegelbildlichen Oligonukleotiden basieren, welche sehr selektiv für ihre pharmakologischen Zielmoleküle sind und sehr wirksame Inhibitoren dieser Zielmoleküle darstellen. Sie vereinen die Vorzüge von niedermolekularen Substanzen und Biopharmazeutika. Aufgrund ihrer einzigartigen spiegelbildlichen Struktur werden Spiegelmere® in Stoffwechselprozessen nicht abgebaut und binden nicht an die natürlich vorkommenden Nukleinsäuren. Im Gegensatz zu einer Reihe von konventionellen Oligonukleotiden lösen Spiegelmere® nicht die angeborene Immunantwort über Toll-like-Rezeptoren (TLR) aus. Darüber hinaus zeigte sich in präklinische Versuchsreihen ein überaus vorteilhaftes Immunogenitätsprofil.
NOXXON im Kurzprofil Die in Berlin ansässige NOXXON Pharma AG ist ein klinisch forschendes Biotechnologie-Unternehmen, das es sich zum Ziel gesetzt hat, Spiegelmere® zur Behandlung entzündlicher und hämatologischer Erkrankungen zu entwickeln. Neben den firmeneigenen Entwicklungsprojekten arbeitet NOXXON auch in Kooperation mit Partnern der pharmazeutischen Industrie, wie zum Beispiel Eli Lilly und Hoffmann La-Roche.
NOXXONs Investoren sind unter anderem TVM Capital, Sofinnova Partners, Edmond de Rothschild Investment Partners, Deutsche Effecten- und Wechsel-Beteiligungsgesellschaft (DEWB), Seventure Partners, Dow Venture Capital, Dieckell Group, FCP OP MEDICAL BioHealth- Trends, IBG Risikokapitalfonds und VC Fonds Berlin.
Webseite: http://www.noxxon.com
Kontakt: Emmanuelle Delabre NOXXON Pharma AG Max-Dohrn-Strasse 8-10 10589 Berlin Tel: + 49-30-726247-100 FAX: + 49-30-726247-225 Email: edelabre@noxxon.com
Rückfragehinweis: Marco Scheidler
Tel.: +49 (0) 3641 573-3600
NOXXON Pharma AG ernennt Dr. Aram Mangasarian zum „Chief Business Officer“
http://www.dewb-vc.com/index.php?option=com_content&task=vie…
Berlin, 18. Mai 2010 - Die NOXXON Pharma AG (NOXXON), ein biopharmazeutisches Unternehmen, das auf die Entwicklung von neuen Arzneimitteln auf Basis seiner Spiegelmer®-Technologie spezialisiert ist, gab heute die Ernennung von Dr. Aram Mangasarian zum Chief Business Officer und Vorstandsmitglied bekannt. Der Aufgabenbereich von Dr. Mangasarian beinhaltet kommerzielle und strategische Aspekte der Geschäftsführung sowie das Business Development.
Dr. Mangasarian verstärkt den Vorstand der NOXXON mit mehr als 10 jähriger Erfahrung im Business Development und in der strategischen Planung für die Biotechnologie und die pharmazeutische Industrie. Dr. Mangasarian war zuletzt als Vice President Business Development bei Novexel tätig, einer mit Risiko-Kapital finanzierten Firma in Frankreich, die kürzlich von AstraZeneca (NYSE:AZN) gekauft wurde. Davor war Dr. Mangasarian Vice President Business Development bei ExonHit Therapeutics (Alternext:ALEHT). Dr. Mangasarian hat den PhD an der University of California, San Diego, in Biologie mit Arbeiten über HIV erworben. Zusätzlich hat er das INSEAD MBA Programm erfolgreich abgeschlossen. In den letzen Jahren hat Dr. Mangasarian erfolgreich zahlreiche Lizenzverträge und strategische Allianzen mit großen Pharmafirmen verhandelt und umgesetzt.
In seinem neuen Verantwortungsbereich wird Dr. Mangasarian im Vorstand an der Seite von Dr. Frank Morich, NOXXON’s Chief Executive Officer, und Dr. Sven Klußmann, Chief Scientific Officer, tätig sein. „Dr. Mangasarian bringt eine sehr wichtige Kombination von Erfahrungen im geschäftlichen und wissenschaftlichen Bereich mit.“ sagt Dr. Morich. „Ich bin sehr zuversichtlich, dass Dr. Mangasarian die strategische Entwicklung der NOXXON Pharma AG und damit die weitere Entwicklung der Spiegelmere® als neue Substanzklasse entscheidend vorantreiben wird. Wir freuen uns auf eine erfolgreiche Zusammenarbeit mit ihm.“
„Die jüngsten positiven Phase I-Daten mit NOX-E36 und NOX-A12 machen NOXXON zu einer hochattraktiven Firma. Ich freue mich darauf, die Unternehmensstrategie weiter zu entwickeln und NOXXON und NOXXON’s Entwicklungsprojekte im Markt zu positionieren.“ kommentierte Dr. Aram Mangasarian als neuer Chief Business Officer der NOXXON.
http://www.dewb-vc.com/index.php?option=com_content&task=vie…
Berlin, 18. Mai 2010 - Die NOXXON Pharma AG (NOXXON), ein biopharmazeutisches Unternehmen, das auf die Entwicklung von neuen Arzneimitteln auf Basis seiner Spiegelmer®-Technologie spezialisiert ist, gab heute die Ernennung von Dr. Aram Mangasarian zum Chief Business Officer und Vorstandsmitglied bekannt. Der Aufgabenbereich von Dr. Mangasarian beinhaltet kommerzielle und strategische Aspekte der Geschäftsführung sowie das Business Development.
Dr. Mangasarian verstärkt den Vorstand der NOXXON mit mehr als 10 jähriger Erfahrung im Business Development und in der strategischen Planung für die Biotechnologie und die pharmazeutische Industrie. Dr. Mangasarian war zuletzt als Vice President Business Development bei Novexel tätig, einer mit Risiko-Kapital finanzierten Firma in Frankreich, die kürzlich von AstraZeneca (NYSE:AZN) gekauft wurde. Davor war Dr. Mangasarian Vice President Business Development bei ExonHit Therapeutics (Alternext:ALEHT). Dr. Mangasarian hat den PhD an der University of California, San Diego, in Biologie mit Arbeiten über HIV erworben. Zusätzlich hat er das INSEAD MBA Programm erfolgreich abgeschlossen. In den letzen Jahren hat Dr. Mangasarian erfolgreich zahlreiche Lizenzverträge und strategische Allianzen mit großen Pharmafirmen verhandelt und umgesetzt.
In seinem neuen Verantwortungsbereich wird Dr. Mangasarian im Vorstand an der Seite von Dr. Frank Morich, NOXXON’s Chief Executive Officer, und Dr. Sven Klußmann, Chief Scientific Officer, tätig sein. „Dr. Mangasarian bringt eine sehr wichtige Kombination von Erfahrungen im geschäftlichen und wissenschaftlichen Bereich mit.“ sagt Dr. Morich. „Ich bin sehr zuversichtlich, dass Dr. Mangasarian die strategische Entwicklung der NOXXON Pharma AG und damit die weitere Entwicklung der Spiegelmere® als neue Substanzklasse entscheidend vorantreiben wird. Wir freuen uns auf eine erfolgreiche Zusammenarbeit mit ihm.“
„Die jüngsten positiven Phase I-Daten mit NOX-E36 und NOX-A12 machen NOXXON zu einer hochattraktiven Firma. Ich freue mich darauf, die Unternehmensstrategie weiter zu entwickeln und NOXXON und NOXXON’s Entwicklungsprojekte im Markt zu positionieren.“ kommentierte Dr. Aram Mangasarian als neuer Chief Business Officer der NOXXON.
Antwort auf Beitrag Nr.: 39.539.123 von Saaletaler am 18.05.10 14:23:49Aus meiner Sicht ein guter und wichtiger Schritt. Denn Noxxon kommt jetzt in die Phase der Unternehmensentwicklung, wo größere Verpartnerungsdeals mit Pharmas/Biotechs verhandelt werden müssen, z.B. die P2 mit NOX-E36, aber auch weitere Forschungskooperationen. Da ist es von Vorteil, neben den beiden Vollblutwissenschaftlern Morich und Klussmann auch einen erfahrenen Mann in Sachen Business Development im Vorstand zu haben, der schon große Deals eingetütet hat.
Antwort auf Beitrag Nr.: 39.539.193 von Saaletaler am 18.05.10 14:33:18... hoffen wir das Beste. Allerdings hat bei/für KSW doch auch so ein vermeintlicher Superstar angefangen, der "so toll vernetzt" sein soll (Name ist mir entfallen). Eine (+3) Pfeife/n reicht/reichen mir. Wir brauchen Profis und dann einen höheren Kurs bei DEWB!!!
NOXXON Pharma AG schließt Finanzrunde über 33 Millionen Euro
http://www.dewb-vc.com/index.php?option=com_content&task=vie…
Berlin, 27. Mai 2010 – NOXXON Pharma AG (NOXXON), eine Biotechnologiefirma, die sich auf die Entwicklung von spiegelbildlichen Oligonukleotiden, auch Spiegelmere® genannt, fokussiert, gab heute den erfolgreichen Abschluss einer Finanzierungsrunde (D-Runde) über 33 Millionen Euro bekannt. Die Runde wurde angeführt durch NGN Capital und komplementiert durch die Altinvestoren TVM Capital, Sofinnova Partners, Edmond de Rothschild Investment Partners, Seventure Partners, VC Fonds Technologie Berlin GmbH, Dow Venture Capital (einen Teil der Dow Chemical Company), FCP OP MEDICAL BioHealth-Trends (vertreten durch Medical Strategy GmbH), IBG Beteiligungsgesellschaft Sachsen-Anhalt mbH, die Dieckell-Gruppe und andere.
Das eingeworbene Kapital wird primär in die weitere klinische und präklinische Entwicklung von NOXXON’s Entwicklungskandidaten NOX-E36, NOX-A12 und NOX-H94 auf den Gebieten der diabetischen Folgeerscheinungen, Onkologie und Hämatologie investiert werden. Diese Entwicklungskandidaten sind jeweils hochaktive und –spezifische Inhibitoren für die jeweiligen molekularen Targets, die mit Hilfe der NOXXON’s propriertärer Spiegelmer®-Technologie produziert worden sind. Spiegelmere® zeichnen sich durch ihre hohe Biostabilität und ihre geringe Gefahr für toxische oder immunologische Nebenwirkungen aus.
“Diese Investition gibt NOXXON die Mittel an die Hand, die klinische Entwicklung der drei internen Hauptprojekte weiter voranzubringen. NGN’s Entscheidung, diese Runde anzuführen, ist ein weiterer Indikator für den Wert der Spiegelmer®-Technologie und das kommerzielle Potential von NOXXON’s Entwicklungsprogrammen.“ sagte NOXXON’s CEO Dr. Frank Morich.
Peter Johann, Managing General Partner bei NGN Capital, erklärte: „Wir sind sehr beeindruckt von NOXXON’s Technologieplattform und von den Produkten, die damit generiert werden können. NOXXON und sein erfahrenes Management hat in den letzten Jahren signifikante Fortschritte erzielt, nicht zuletzt mit der Überführung von zwei Lead-Substanzen in die klinischen Entwicklung sowie der Profilierung eines dritten Kandidaten, der kurz vor dem Eintritt in die klinische Entwicklung steht. Mit den eingeworbenen Finanzmitteln wird NOXXON in der Lage sein, die Technologieplattform zu validieren und für die Entwicklungskandidaten die klinische Wirksamkeit nachzuweisen.“ Dr. Johann wird auch dem Aufsichtsrat der NOXXON angehören.
NOXXON im Kurzprofil
Die in Berlin ansässige NOXXON Pharma AG ist ein klinisch forschendes Biotechnologie-Unternehmen, das es sich zum Ziel gesetzt hat, Spiegelmere® zur Behandlung verschiedener bisher nicht- oder nur ungenügend heilbarer Erkrankungen zu entwickeln. Neben den firmeneigenen Entwicklungsprojekten arbeitet NOXXON auch in Kooperation mit Partnern der pharmazeutischen Industrie, wie zum Beispiel Eli Lilly und Hoffmann La-Roche. NOXXONs Investoren sind unter anderem TVM Capital, Sofinnova Partners, Edmond de Rothschild Investment Partners, Deutsche Effecten- und Wechsel-Beteiligungsgesellschaft (DEWB), Seventure Partners, Dow Venture Capital, Dieckell Gruppe, FCP OP MEDICAL BioHealth-Trends, IBG Risikokapitalfonds und VC Fonds Berlin.
NGN Capital im Kurzprofil
NGN Capital ist ein auf den Gesundheitsbereich fokussierter Risikokapitalinvestor. Der Fokus liegt dabei auf Firmen mit Produkten in späteren Phasen der Entwicklung und dem Potential, überdurchschnittliche Renditen zu erwirtschaften. Die Fonds investieren breit in Gesundheits- und Biotechnologiefirmen in den Bereichen Pharmazeutika, Medizinprodukte und Services. Neben dieser Diversifikation nach Entwicklungstand und Branchen investiert NGN auch global in unterschiedlichen Regionen, allerdings mit Schwerpunkt in den USA und Europa von späten bis ausgewählten Frühfinanzierungsmöglichkeiten, als auch nach geographischen Gesichtspunkten, die vorwiegend die USA und Europa beinhalten. NGN Capital operiert in Nordamerika von New York, NY, und Greenwich, CT, aus; der deutsche Standort ist in Heidelberg.
TVM Capital im Kurzprofil
TVM Capital Life Science & Healthcare verwaltet ein Fondsvermögen von 860 Millionen Euro von über fünfzig Investoren. Die verantwortlichen Beteiligungsmanager verfügen über die gesammelte Erfahrung von 110 Beteiligungen mit 70 Unternehmensverkäufen, unter anderem 37 Börsengängen (an der NASDAQ und den Börsen in London, Frankfurt, Wien und Zürich) sowie 24 industriellen Transaktionen in unserer 25-jährigen erfolgreichen Unternehmensgeschichte. Die beiden Beteiligungsteams für Life Science Venture und Healthcare Private Equity verbinden langjährige internationale Erfahrung mit exzellenten Branchenkenntnissen und einem engen, internationalen Netzwerk von Industriespezialisten. Seit unserer Gründung beteiligen wir uns an Unternehmen, die das Potenzial zum Marktführer in ihrem Marktsegment haben und unterstützen diese Wachstumsunternehmen aktiv bei ihrer Entwicklung - als branchenkundige und strategisch agierende Gesellschafter aus dem Aufsichtsrat oder Beirat der Gesellschaft. TVM Capital wurde 2009 zur "German Private Equity Firm of the Year 2008" der Zeitschrift Private Equity International gewählt, erreichte Platz 18 auf der Liste der führenden 100 VC Unternehmen des Red Herring Magazins im September 2009 und erhielt den M&A Advisor Corporate/Strategic Acquisition of the Year Award im Dezember 2009 in Anerkennung des Verkaufs der Direvo Biotech AG an die Bayer Healthcare AG im September 2008. Die Managementgesellschaft der TVM Capital Life Science und Healthcare Gruppe für Beteiligungen an Unternehmen der Gesundheitswirtschaft im Nahen und Mittleren Osten sowie Nordafrika ist TVM Capital MENA Limited mit Sitz in Dubai, Vereinigte Arabische Emirate. www.tvm-capital.de
Sofinnova Partners im Kurzprofil
Sofinnova Partners ist ein unabhängiger Risikokapitalinvestor mit Sitz in Paris, Frankreich. Seit mehr als 35 Jahren hat Sofinnova fast 500 Unternehmen in verschiedenen Entwicklungsphasen mitfinanziert – Neugründungen, Ausgliederungen, aber auch „Turnarounds“ – und dabei eng mit Europas wichtigsten Entrepreneuren aus den Bereichen IT, Gesundheit und Umwelttechnik zusammengearbeitet. Mit 1,1 Milliarden Euro Fondvolumen verfügt Sofinnova über ein sachkundiges und praktisch orientiertes Team, das eng mit den Portfoliofirmen zusammenarbeitet und so zur Gründung internationaler „Champions“ wie Genentech, Actelion, Vistaprint und, in jüngerer Vergangenheit, auch CoreValve, Novexel, Fovea und Sensitive Object beigetragen hat. Die Firma ist auch International vertreten mit einer „Schwestergesellschaft“ in San Francisco, Kalifornien. Weiter Information über Sofinnova’s Team und Portfolio finden sie unter: www.sofinnova.fr
Edmond de Rothschild Investment Partners im Kurzprofil
Edmond de Rothschild Investment Partners (EdRIP) mit Sitz in Paris, konzentriert sich auf die Beteiligung an privat gehaltenen Firmen. Zur Zeit beträgt das Gesamtinvestitionsvolumen 750 Millionen Euro und ist auf die Bereiche Life Sciences und Growth Capital konzentriert. Zusammen verfügt das siebenköpfige EDRIP-Team im Bereich Life Sciences über 90 Jahren Erfahrung im Bereich Gesundheit und hat einen weiten Erfahrungsschatz bei Investitionen in die Bio- und Medizintechnologie. Dieses Team managt derzeit über 270 Millionen Euro, und konnte kürzlich den BioDiscovery 3 Fond mit einem Volumen von 155 Millionen Euro erfolgreich schließen, der in den kommenden Jahren für neue Investitionen genutzt werden soll. EdRIP ist Teil der Edmond de Rothschild Gruppe in Paris, Frankreich. Weitere Information: www.edrip.fr
Seventure im Kurzprofil
Mit einem Gesamtinvestitionsvolumen von 500 Millionen Euro gehört Seventure zu den führen Risikokapitalfirmen in Europa. Seventure investiert seit 1997 in innovative Geschäftsmodelle in den Bereichen Informationstechnologie und Gesundheit in Europa. Die bevorzugten Investitionsbereiche sind Biotechnologie und Pharmazeutika, Medizinprodukte, industrielle Biotechnologie und Umwelttechnologie, sowie Lifestyle-Produkte und Ernährung. Die Investitionsvolumina reichen von 500.000 Euro bis zu 10 Millionen Euro pro Runde, und erreichen pro Firma maximal 20 Millionen Euro. Seventure ist eine Tochterfirma von Natixis Private Equity, mit einem Gesamtinvestitionsvolumen von 4.2 Milliarden Euro. www.seventure.com
http://www.dewb-vc.com/index.php?option=com_content&task=vie…
Berlin, 27. Mai 2010 – NOXXON Pharma AG (NOXXON), eine Biotechnologiefirma, die sich auf die Entwicklung von spiegelbildlichen Oligonukleotiden, auch Spiegelmere® genannt, fokussiert, gab heute den erfolgreichen Abschluss einer Finanzierungsrunde (D-Runde) über 33 Millionen Euro bekannt. Die Runde wurde angeführt durch NGN Capital und komplementiert durch die Altinvestoren TVM Capital, Sofinnova Partners, Edmond de Rothschild Investment Partners, Seventure Partners, VC Fonds Technologie Berlin GmbH, Dow Venture Capital (einen Teil der Dow Chemical Company), FCP OP MEDICAL BioHealth-Trends (vertreten durch Medical Strategy GmbH), IBG Beteiligungsgesellschaft Sachsen-Anhalt mbH, die Dieckell-Gruppe und andere.
Das eingeworbene Kapital wird primär in die weitere klinische und präklinische Entwicklung von NOXXON’s Entwicklungskandidaten NOX-E36, NOX-A12 und NOX-H94 auf den Gebieten der diabetischen Folgeerscheinungen, Onkologie und Hämatologie investiert werden. Diese Entwicklungskandidaten sind jeweils hochaktive und –spezifische Inhibitoren für die jeweiligen molekularen Targets, die mit Hilfe der NOXXON’s propriertärer Spiegelmer®-Technologie produziert worden sind. Spiegelmere® zeichnen sich durch ihre hohe Biostabilität und ihre geringe Gefahr für toxische oder immunologische Nebenwirkungen aus.
“Diese Investition gibt NOXXON die Mittel an die Hand, die klinische Entwicklung der drei internen Hauptprojekte weiter voranzubringen. NGN’s Entscheidung, diese Runde anzuführen, ist ein weiterer Indikator für den Wert der Spiegelmer®-Technologie und das kommerzielle Potential von NOXXON’s Entwicklungsprogrammen.“ sagte NOXXON’s CEO Dr. Frank Morich.
Peter Johann, Managing General Partner bei NGN Capital, erklärte: „Wir sind sehr beeindruckt von NOXXON’s Technologieplattform und von den Produkten, die damit generiert werden können. NOXXON und sein erfahrenes Management hat in den letzten Jahren signifikante Fortschritte erzielt, nicht zuletzt mit der Überführung von zwei Lead-Substanzen in die klinischen Entwicklung sowie der Profilierung eines dritten Kandidaten, der kurz vor dem Eintritt in die klinische Entwicklung steht. Mit den eingeworbenen Finanzmitteln wird NOXXON in der Lage sein, die Technologieplattform zu validieren und für die Entwicklungskandidaten die klinische Wirksamkeit nachzuweisen.“ Dr. Johann wird auch dem Aufsichtsrat der NOXXON angehören.
NOXXON im Kurzprofil
Die in Berlin ansässige NOXXON Pharma AG ist ein klinisch forschendes Biotechnologie-Unternehmen, das es sich zum Ziel gesetzt hat, Spiegelmere® zur Behandlung verschiedener bisher nicht- oder nur ungenügend heilbarer Erkrankungen zu entwickeln. Neben den firmeneigenen Entwicklungsprojekten arbeitet NOXXON auch in Kooperation mit Partnern der pharmazeutischen Industrie, wie zum Beispiel Eli Lilly und Hoffmann La-Roche. NOXXONs Investoren sind unter anderem TVM Capital, Sofinnova Partners, Edmond de Rothschild Investment Partners, Deutsche Effecten- und Wechsel-Beteiligungsgesellschaft (DEWB), Seventure Partners, Dow Venture Capital, Dieckell Gruppe, FCP OP MEDICAL BioHealth-Trends, IBG Risikokapitalfonds und VC Fonds Berlin.
NGN Capital im Kurzprofil
NGN Capital ist ein auf den Gesundheitsbereich fokussierter Risikokapitalinvestor. Der Fokus liegt dabei auf Firmen mit Produkten in späteren Phasen der Entwicklung und dem Potential, überdurchschnittliche Renditen zu erwirtschaften. Die Fonds investieren breit in Gesundheits- und Biotechnologiefirmen in den Bereichen Pharmazeutika, Medizinprodukte und Services. Neben dieser Diversifikation nach Entwicklungstand und Branchen investiert NGN auch global in unterschiedlichen Regionen, allerdings mit Schwerpunkt in den USA und Europa von späten bis ausgewählten Frühfinanzierungsmöglichkeiten, als auch nach geographischen Gesichtspunkten, die vorwiegend die USA und Europa beinhalten. NGN Capital operiert in Nordamerika von New York, NY, und Greenwich, CT, aus; der deutsche Standort ist in Heidelberg.
TVM Capital im Kurzprofil
TVM Capital Life Science & Healthcare verwaltet ein Fondsvermögen von 860 Millionen Euro von über fünfzig Investoren. Die verantwortlichen Beteiligungsmanager verfügen über die gesammelte Erfahrung von 110 Beteiligungen mit 70 Unternehmensverkäufen, unter anderem 37 Börsengängen (an der NASDAQ und den Börsen in London, Frankfurt, Wien und Zürich) sowie 24 industriellen Transaktionen in unserer 25-jährigen erfolgreichen Unternehmensgeschichte. Die beiden Beteiligungsteams für Life Science Venture und Healthcare Private Equity verbinden langjährige internationale Erfahrung mit exzellenten Branchenkenntnissen und einem engen, internationalen Netzwerk von Industriespezialisten. Seit unserer Gründung beteiligen wir uns an Unternehmen, die das Potenzial zum Marktführer in ihrem Marktsegment haben und unterstützen diese Wachstumsunternehmen aktiv bei ihrer Entwicklung - als branchenkundige und strategisch agierende Gesellschafter aus dem Aufsichtsrat oder Beirat der Gesellschaft. TVM Capital wurde 2009 zur "German Private Equity Firm of the Year 2008" der Zeitschrift Private Equity International gewählt, erreichte Platz 18 auf der Liste der führenden 100 VC Unternehmen des Red Herring Magazins im September 2009 und erhielt den M&A Advisor Corporate/Strategic Acquisition of the Year Award im Dezember 2009 in Anerkennung des Verkaufs der Direvo Biotech AG an die Bayer Healthcare AG im September 2008. Die Managementgesellschaft der TVM Capital Life Science und Healthcare Gruppe für Beteiligungen an Unternehmen der Gesundheitswirtschaft im Nahen und Mittleren Osten sowie Nordafrika ist TVM Capital MENA Limited mit Sitz in Dubai, Vereinigte Arabische Emirate. www.tvm-capital.de
Sofinnova Partners im Kurzprofil
Sofinnova Partners ist ein unabhängiger Risikokapitalinvestor mit Sitz in Paris, Frankreich. Seit mehr als 35 Jahren hat Sofinnova fast 500 Unternehmen in verschiedenen Entwicklungsphasen mitfinanziert – Neugründungen, Ausgliederungen, aber auch „Turnarounds“ – und dabei eng mit Europas wichtigsten Entrepreneuren aus den Bereichen IT, Gesundheit und Umwelttechnik zusammengearbeitet. Mit 1,1 Milliarden Euro Fondvolumen verfügt Sofinnova über ein sachkundiges und praktisch orientiertes Team, das eng mit den Portfoliofirmen zusammenarbeitet und so zur Gründung internationaler „Champions“ wie Genentech, Actelion, Vistaprint und, in jüngerer Vergangenheit, auch CoreValve, Novexel, Fovea und Sensitive Object beigetragen hat. Die Firma ist auch International vertreten mit einer „Schwestergesellschaft“ in San Francisco, Kalifornien. Weiter Information über Sofinnova’s Team und Portfolio finden sie unter: www.sofinnova.fr
Edmond de Rothschild Investment Partners im Kurzprofil
Edmond de Rothschild Investment Partners (EdRIP) mit Sitz in Paris, konzentriert sich auf die Beteiligung an privat gehaltenen Firmen. Zur Zeit beträgt das Gesamtinvestitionsvolumen 750 Millionen Euro und ist auf die Bereiche Life Sciences und Growth Capital konzentriert. Zusammen verfügt das siebenköpfige EDRIP-Team im Bereich Life Sciences über 90 Jahren Erfahrung im Bereich Gesundheit und hat einen weiten Erfahrungsschatz bei Investitionen in die Bio- und Medizintechnologie. Dieses Team managt derzeit über 270 Millionen Euro, und konnte kürzlich den BioDiscovery 3 Fond mit einem Volumen von 155 Millionen Euro erfolgreich schließen, der in den kommenden Jahren für neue Investitionen genutzt werden soll. EdRIP ist Teil der Edmond de Rothschild Gruppe in Paris, Frankreich. Weitere Information: www.edrip.fr
Seventure im Kurzprofil
Mit einem Gesamtinvestitionsvolumen von 500 Millionen Euro gehört Seventure zu den führen Risikokapitalfirmen in Europa. Seventure investiert seit 1997 in innovative Geschäftsmodelle in den Bereichen Informationstechnologie und Gesundheit in Europa. Die bevorzugten Investitionsbereiche sind Biotechnologie und Pharmazeutika, Medizinprodukte, industrielle Biotechnologie und Umwelttechnologie, sowie Lifestyle-Produkte und Ernährung. Die Investitionsvolumina reichen von 500.000 Euro bis zu 10 Millionen Euro pro Runde, und erreichen pro Firma maximal 20 Millionen Euro. Seventure ist eine Tochterfirma von Natixis Private Equity, mit einem Gesamtinvestitionsvolumen von 4.2 Milliarden Euro. www.seventure.com
!
Dieser Beitrag wurde moderiert. Grund: Spammposting
Antwort auf Beitrag Nr.: 39.592.669 von Saaletaler am 27.05.10 13:35:47Wenn die DEWB nicht dabei war, wovon ich ausgehe, wird der DEWB-Anteil dadurch weiter verwässert.
Antwort auf Beitrag Nr.: 39.592.729 von Fooling-Industries am 27.05.10 13:48:00siehe #19329 im Hauptthread
Grüße @ saaletaler... auch mal wieder melde..
Es besteht ein gewisses Maß der Unsicherheit, ob Teile der seit 2007 bis zum heutigen Tag ausgegebenen Vorzugsaktien der Serie A wirksam aus genehmigtem Kapital ausgegeben wurden und, wenn nein, ob mögliche Mängel der Ausgabe gemäß § 242 Abs. 2 AktG am 7. Juni 2010 geheilt werden. Um jegliches verbleibende Restrisiko auszuschließen, sollen die betroffenen Aktien mit Einverständnis der jeweiligen Aktionäre eingezogen und, soweit es sich nicht bereits heute um eigene Aktien der Gesellschaft handelt, durch neu auszugebende Vorzugsaktien der Serie A ersetzt werden.
Da an verschiedene Aktionäre außer Dr. Thomas van Aubel sowohl Vorzugsaktien der Serie A mit dem beschriebenen potentiellen Mangel ausgegeben wurden als auch Vorzugsaktien der Serie A, die diesen Mangel nicht aufweisen, die Vorzugsaktien der Serie A aber nicht nummeriert sind, bestünde bei der Einziehung nur eines Teiles der Vorzugsaktien der Serie A die Gefahr, dass entweder die einzuziehenden Aktien nicht hinreichend bestimmbar sind oder nicht alle potentiell nicht wirksam ausgegebenen Aktien, sondern teilweise auch wirksam ausgegebene Aktien eingezogen werden. Um insofern Rechtsunsicherheit zu vermeiden, sollen sämtliche Vorzugsaktien der Serie A, die nicht von Dr. Thomas van Aubel gehalten werden, eingezogen werden. Dies betrifft auch die schon heute von der Gesellschaft gehaltenen eigenen Vorzugsaktien der Serie A.
Im Gegenzug sollen die betroffenen Aktionäre (außer der Gesellschaft) wieder die Anzahl von Vorzugsaktien der Serie A erhalten, die ihnen gegenwärtig zusteht. Dies kann nur durch die Ausgabe neuer Aktien im Wege einer Kapitalerhöhung unter Ausschluss des Bezugsrechtes der übrigen Aktionäre erfolgen, da anderenfalls die Beteiligungshöhe der betroffenen Vorzugsaktionäre der Serie A nicht erhalten werden kann.
Da letztere bereits im Zuge der ursprünglichen Ausgabe von Vorzugsaktien der Serie A den damals festgesetzten Ausgabebetrag vollständig geleistet haben, hat eine Ausgabe der ersatzweise zu liefernden Vorzugsaktien der Serie A zum gesetzlich zulässigen niedrigsten Ausgabebetrag in Höhe von EURO 1,00 zu erfolgen, um die Folgen der möglicherweise nicht wirksamen Ausgabe von Aktien nicht einseitig den betroffenen Aktionären aufzubürden, die der Gesellschaft ihre bestehenden Vorzugsaktien der Serie A kostenlos zur Verfügung zu stellen haben, wenn sie neue Vorzugsaktien der Serie A zeichnen möchten.
Eine Verwässerung der übrigen Aktionäre erfolgt dadurch nicht, da nur der Stand rechtswirksam wieder hergestellt wird, der auch vor der Beschlussfassung zu TOP 8 bestand oder bestehen sollte....
........
und - wer hat eigenlich was?
Das Grundkapital der Gesellschaft beträgt EURO 222.633,00 und ist eingeteilt in 45.606 nennwertlose Stammaktien und 132.060 nennwertlose stimmberechtigte Vorzugsaktien der Serie A sowie 44.967 (sind das die "neuen" Aktien"?) nennwertlose stimmberechtigte Vorzugsaktien der Serie B.
Es besteht ein gewisses Maß der Unsicherheit, ob Teile der seit 2007 bis zum heutigen Tag ausgegebenen Vorzugsaktien der Serie A wirksam aus genehmigtem Kapital ausgegeben wurden und, wenn nein, ob mögliche Mängel der Ausgabe gemäß § 242 Abs. 2 AktG am 7. Juni 2010 geheilt werden. Um jegliches verbleibende Restrisiko auszuschließen, sollen die betroffenen Aktien mit Einverständnis der jeweiligen Aktionäre eingezogen und, soweit es sich nicht bereits heute um eigene Aktien der Gesellschaft handelt, durch neu auszugebende Vorzugsaktien der Serie A ersetzt werden.
Da an verschiedene Aktionäre außer Dr. Thomas van Aubel sowohl Vorzugsaktien der Serie A mit dem beschriebenen potentiellen Mangel ausgegeben wurden als auch Vorzugsaktien der Serie A, die diesen Mangel nicht aufweisen, die Vorzugsaktien der Serie A aber nicht nummeriert sind, bestünde bei der Einziehung nur eines Teiles der Vorzugsaktien der Serie A die Gefahr, dass entweder die einzuziehenden Aktien nicht hinreichend bestimmbar sind oder nicht alle potentiell nicht wirksam ausgegebenen Aktien, sondern teilweise auch wirksam ausgegebene Aktien eingezogen werden. Um insofern Rechtsunsicherheit zu vermeiden, sollen sämtliche Vorzugsaktien der Serie A, die nicht von Dr. Thomas van Aubel gehalten werden, eingezogen werden. Dies betrifft auch die schon heute von der Gesellschaft gehaltenen eigenen Vorzugsaktien der Serie A.
Im Gegenzug sollen die betroffenen Aktionäre (außer der Gesellschaft) wieder die Anzahl von Vorzugsaktien der Serie A erhalten, die ihnen gegenwärtig zusteht. Dies kann nur durch die Ausgabe neuer Aktien im Wege einer Kapitalerhöhung unter Ausschluss des Bezugsrechtes der übrigen Aktionäre erfolgen, da anderenfalls die Beteiligungshöhe der betroffenen Vorzugsaktionäre der Serie A nicht erhalten werden kann.
Da letztere bereits im Zuge der ursprünglichen Ausgabe von Vorzugsaktien der Serie A den damals festgesetzten Ausgabebetrag vollständig geleistet haben, hat eine Ausgabe der ersatzweise zu liefernden Vorzugsaktien der Serie A zum gesetzlich zulässigen niedrigsten Ausgabebetrag in Höhe von EURO 1,00 zu erfolgen, um die Folgen der möglicherweise nicht wirksamen Ausgabe von Aktien nicht einseitig den betroffenen Aktionären aufzubürden, die der Gesellschaft ihre bestehenden Vorzugsaktien der Serie A kostenlos zur Verfügung zu stellen haben, wenn sie neue Vorzugsaktien der Serie A zeichnen möchten.
Eine Verwässerung der übrigen Aktionäre erfolgt dadurch nicht, da nur der Stand rechtswirksam wieder hergestellt wird, der auch vor der Beschlussfassung zu TOP 8 bestand oder bestehen sollte....
........
und - wer hat eigenlich was?
Das Grundkapital der Gesellschaft beträgt EURO 222.633,00 und ist eingeteilt in 45.606 nennwertlose Stammaktien und 132.060 nennwertlose stimmberechtigte Vorzugsaktien der Serie A sowie 44.967 (sind das die "neuen" Aktien"?) nennwertlose stimmberechtigte Vorzugsaktien der Serie B.
Antwort auf Beitrag Nr.: 39.597.234 von starwarrior03 am 28.05.10 07:20:46Hallo star,
es ist so, dass beginnend mit der Finanzierungsrunde C (Anfang 2007) ausschließlich Vorzugsaktien Typ A ausgegeben wurden (derzeit 132.060). Mit Beginn der Runde D werden jetzt erstmals Vorzugsaktien Typ B (44.967 1. Tranche laut HV-Antrag) emittiert. Alle vor 2007 ausgegebenen Aktien waren und sind Stammaktien (45.606). Wen es genau interessiert, der kann alle Noxxon-KE der letzten Jahre unter unternehmensregister.de recherchieren.
DEWB besitzt überwiegend Stammaktien, da man sich an der D-Runde bislang gar nicht und an der C-Runde nur in kleinem Umfang beteiligt hat.
Grüße von Saaletaler
es ist so, dass beginnend mit der Finanzierungsrunde C (Anfang 2007) ausschließlich Vorzugsaktien Typ A ausgegeben wurden (derzeit 132.060). Mit Beginn der Runde D werden jetzt erstmals Vorzugsaktien Typ B (44.967 1. Tranche laut HV-Antrag) emittiert. Alle vor 2007 ausgegebenen Aktien waren und sind Stammaktien (45.606). Wen es genau interessiert, der kann alle Noxxon-KE der letzten Jahre unter unternehmensregister.de recherchieren.
DEWB besitzt überwiegend Stammaktien, da man sich an der D-Runde bislang gar nicht und an der C-Runde nur in kleinem Umfang beteiligt hat.
Grüße von Saaletaler
Sehr geehrte Damen und Herren,
das DEWB-Portfoliounternehmen NOXXON Pharma AG hat heute Veränderungen im Vorstand bekannt gegeben. Der bisherige CEO, Dr. Frank Morich, wird im vierten Quartal 2010 als Vorstandsmitglied zum japanischen Pharmariesen Takeda Pharmaceutical wechseln. Takeda ist mit einem Umsatz von rund 16 Milliarden US-Dollar das größte Pharmaunternehmen Asiens und zählt weltweit zu den Top 15.
Die Nachfolge von Dr. Morich als CEO der NOXXON übernimmt das bisherige Aufsichtsratsmitglied Iain Buchanan. Buchanan gilt mit seiner über 30-jährigen Berufserfahrung und herausragenden Exitkompetenz als erste Wahl im Investorenkreis. In seiner Karriere war er bei verschiedenen Unternehmen der Pharma- und Biotechnologie-Industrie in Management- und Business Development-Funktionen tätig, u.a. Vertex, Johnson & Johnson, Biogen und Merck & Co. Zuletzt war Iain Buchanan CEO der französischen Novexel, die unter seiner Verantwortung zu Beginn des Jahres für über 500 Millionen US-Dollar an Astra Zeneca verkauft wurde.
Iain Buchanan wird den Vorstandsvorsitz ab 1. September 2010 interimistisch übernehmen und die weitere Entwicklung der NOXXON auch im Hinblick auf einen Exit intensiv vorantreiben.
Die heute veröffentlichte NOXXON-Pressemitteilung ist dieser E-Mail beigefügt.
Für Rückfragen stehen wir Ihnen gerne zur Verfügung.
das DEWB-Portfoliounternehmen NOXXON Pharma AG hat heute Veränderungen im Vorstand bekannt gegeben. Der bisherige CEO, Dr. Frank Morich, wird im vierten Quartal 2010 als Vorstandsmitglied zum japanischen Pharmariesen Takeda Pharmaceutical wechseln. Takeda ist mit einem Umsatz von rund 16 Milliarden US-Dollar das größte Pharmaunternehmen Asiens und zählt weltweit zu den Top 15.
Die Nachfolge von Dr. Morich als CEO der NOXXON übernimmt das bisherige Aufsichtsratsmitglied Iain Buchanan. Buchanan gilt mit seiner über 30-jährigen Berufserfahrung und herausragenden Exitkompetenz als erste Wahl im Investorenkreis. In seiner Karriere war er bei verschiedenen Unternehmen der Pharma- und Biotechnologie-Industrie in Management- und Business Development-Funktionen tätig, u.a. Vertex, Johnson & Johnson, Biogen und Merck & Co. Zuletzt war Iain Buchanan CEO der französischen Novexel, die unter seiner Verantwortung zu Beginn des Jahres für über 500 Millionen US-Dollar an Astra Zeneca verkauft wurde.
Iain Buchanan wird den Vorstandsvorsitz ab 1. September 2010 interimistisch übernehmen und die weitere Entwicklung der NOXXON auch im Hinblick auf einen Exit intensiv vorantreiben.
Die heute veröffentlichte NOXXON-Pressemitteilung ist dieser E-Mail beigefügt.
Für Rückfragen stehen wir Ihnen gerne zur Verfügung.
NOXXON vor Initiierung einer klinischen Phase-Ib-Studie mit dem MCP-1-Inhibitor NOX-E36
Studie soll gesunde Freiwillige und Diabetespatienten umfassen
http://www.dewb-vc.com/index.php?option=com_content&task=vie…
Berlin, 7. Juli 2010 – Die NOXXON Pharma AG gab heute bekannt, dass sie die Genehmigung für den Beginn einer Studie mit steigenden Mehrfachdosen des gegen MCP-1 (Monocyte Chemoattractant Protein-1) gerichteten, entzündungshemmenden Spiegelmers® NOX-E36 erhalten hat. NOXXON plant die Entwicklung von NOX-E36 zur Behandlung von diabetischer Nephropathie und anderen Komplikationen im Zusammenhang mit Diabetes.
Die doppelblinde, placebokontrollierte Phase-I-Studie wird die Sicherheit, Verträglichkeit, Pharmakokinetik und Pharmakodynamik des MCP-1-Inhibitors NOX-E36 bei vier Gruppen von Studienteilnehmern beurteilen. Die erste Gruppe umfasst gesunde Freiwillige, die 15 Tage lang jeden zweiten Tag NOX-E36 intravenös erhalten. Die anderen drei Gruppen mit Typ-2-Diabetikern erhalten intravenös jeden zweiten Tag steigende Dosen von NOX-E36 über 27 Tage.
Dazu Dr. Frank Morich, Vorstandsvorsitzender der NOXXON Pharma AG: „Mithilfe der pharmakokinetischen und pharmakodynamischen Daten von Diabetespatienten in dieser Studie zu NOX-E36 kann NOXXON die Dosierungen und Endpunkte auswählen, die in einem Phase-II-Programm am wahrscheinlichsten das therapeutische Potenzial von NOX-E36 offenbaren. Angesichts des Mangels an Therapien in den Indikationen, auf die NOX-E36 abzielt, ist die Aufnahme von Diabetikern ein entscheidender Schritt für die weitere Entwicklung.“
Die Studie mit steigenden Mehrfachdosen von NOX-E36 soll im August 2010 mit der Behandlung der ersten Gruppe von Probanden beginnen. Weitere Informationen zu dieser Studie können unter www.clinicaltrials.gov (ID: NCT01085292) eingesehen werden.
Studie soll gesunde Freiwillige und Diabetespatienten umfassen
http://www.dewb-vc.com/index.php?option=com_content&task=vie…
Berlin, 7. Juli 2010 – Die NOXXON Pharma AG gab heute bekannt, dass sie die Genehmigung für den Beginn einer Studie mit steigenden Mehrfachdosen des gegen MCP-1 (Monocyte Chemoattractant Protein-1) gerichteten, entzündungshemmenden Spiegelmers® NOX-E36 erhalten hat. NOXXON plant die Entwicklung von NOX-E36 zur Behandlung von diabetischer Nephropathie und anderen Komplikationen im Zusammenhang mit Diabetes.
Die doppelblinde, placebokontrollierte Phase-I-Studie wird die Sicherheit, Verträglichkeit, Pharmakokinetik und Pharmakodynamik des MCP-1-Inhibitors NOX-E36 bei vier Gruppen von Studienteilnehmern beurteilen. Die erste Gruppe umfasst gesunde Freiwillige, die 15 Tage lang jeden zweiten Tag NOX-E36 intravenös erhalten. Die anderen drei Gruppen mit Typ-2-Diabetikern erhalten intravenös jeden zweiten Tag steigende Dosen von NOX-E36 über 27 Tage.
Dazu Dr. Frank Morich, Vorstandsvorsitzender der NOXXON Pharma AG: „Mithilfe der pharmakokinetischen und pharmakodynamischen Daten von Diabetespatienten in dieser Studie zu NOX-E36 kann NOXXON die Dosierungen und Endpunkte auswählen, die in einem Phase-II-Programm am wahrscheinlichsten das therapeutische Potenzial von NOX-E36 offenbaren. Angesichts des Mangels an Therapien in den Indikationen, auf die NOX-E36 abzielt, ist die Aufnahme von Diabetikern ein entscheidender Schritt für die weitere Entwicklung.“
Die Studie mit steigenden Mehrfachdosen von NOX-E36 soll im August 2010 mit der Behandlung der ersten Gruppe von Probanden beginnen. Weitere Informationen zu dieser Studie können unter www.clinicaltrials.gov (ID: NCT01085292) eingesehen werden.
Antwort auf Beitrag Nr.: 39.787.963 von Saaletaler am 07.07.10 14:49:59Hier ist der direkte Link zur Infoseite der Studie: http://clinicaltrials.gov/ct2/show/NCT01085292
Da steht zwar noch "not yet recruiting", aber das wird sicher in Kürze geändert.
Mit Ergebnissen kann man Anfang kommenden Jahres rechnen, da die Studie bis Januar 2011 laufen soll. Das Entscheidende wird sein, dass neben den gesunden Probanden nun auch die eigentliche Zielgruppe, die Typ-2-Diabetiker, gute Verträglichkeit bei verschiedener Dosierung nachweist und es wiederum erste Hinweise auf Wirksamkeit gibt.
Der weitere Fahrplan für NOX-E36 sieht aktuell so aus:
P1b-Studie in HJ2 2010: Verträglichkeit bei Mehrfachdosierung von Gesunden und Diabetikern
P2a-Studie in 2011: Wirksamkeit bei Diabetis verschiedener Komplikationen, kleine Gruppe (Proof of Efficacy!)
P2-Studie Start 2012: Wirksamkeit bei Diabetis verschiedener Komplikationen, große Gruppe (nach Verpartnerung)
Zeitliches Ziel müsste sein, vor dem Exit in 2011 (erste) vielversprechende Wirksamkeitsdaten aus der P1b- bzw. der folgenden P2a-Studie zu haben. Mal schauen, ob das klappt.
Da steht zwar noch "not yet recruiting", aber das wird sicher in Kürze geändert.
Mit Ergebnissen kann man Anfang kommenden Jahres rechnen, da die Studie bis Januar 2011 laufen soll. Das Entscheidende wird sein, dass neben den gesunden Probanden nun auch die eigentliche Zielgruppe, die Typ-2-Diabetiker, gute Verträglichkeit bei verschiedener Dosierung nachweist und es wiederum erste Hinweise auf Wirksamkeit gibt.
Der weitere Fahrplan für NOX-E36 sieht aktuell so aus:
P1b-Studie in HJ2 2010: Verträglichkeit bei Mehrfachdosierung von Gesunden und Diabetikern
P2a-Studie in 2011: Wirksamkeit bei Diabetis verschiedener Komplikationen, kleine Gruppe (Proof of Efficacy!)
P2-Studie Start 2012: Wirksamkeit bei Diabetis verschiedener Komplikationen, große Gruppe (nach Verpartnerung)
Zeitliches Ziel müsste sein, vor dem Exit in 2011 (erste) vielversprechende Wirksamkeitsdaten aus der P1b- bzw. der folgenden P2a-Studie zu haben. Mal schauen, ob das klappt.
Hallo,
ich finde die Nachricht äußerst positiv! Auch wenn der Kurs der DEWB mal wieder nicht auf diese Meldung reagiert ist das doch eine sehr gute Meldung und Basis für einen kurzfristig/mittelfristigen Exit.
PS: Von der Börsebiusfront gibt es etwas neues (eine Art Entwarnung). Habe es im ABAG Thread eingestellt!
Grüße
ich finde die Nachricht äußerst positiv! Auch wenn der Kurs der DEWB mal wieder nicht auf diese Meldung reagiert ist das doch eine sehr gute Meldung und Basis für einen kurzfristig/mittelfristigen Exit.
PS: Von der Börsebiusfront gibt es etwas neues (eine Art Entwarnung). Habe es im ABAG Thread eingestellt!
Grüße

NOXXON Pharma Aktiengesellschaft
Berlin
Einladung zur ordentlichen Hauptversammlung
am 22. September 2010, um 09.00 Uhr
in den Geschäftsräumen der Gesellschaft, Max-Dohrn-Str. 8–10, 10589 Berlin
Tagesordnung:
TOP 1: Vorlage und Erläuterung des festgestellten Jahresabschlusses für das Geschäftsjahr 2009 nebst Lagebericht des Vorstandes und Bericht des Aufsichtsrates
Die genannten Unterlagen können ab sofort in den Geschäftsräumen am Sitz der NOXXON Pharma Aktiengesellschaft, Max-Dohrn-Str. 8–10, 10589 Berlin, eingesehen werden. Sie werden auch während der Hauptversammlung zur Einsichtnahme zugänglich sein. Auf Verlangen wird jedem Aktionär unverzüglich kostenlos eine Abschrift der Unterlagen übersandt.
TOP 2: Beschlussfassung über die Entlastung der Mitglieder des Vorstandes für das Geschäftsjahr 2009
Vorstand und Aufsichtsrat schlagen vor, dem Vorstand Entlastung für das Geschäftsjahr 2009 zu erteilen.
TOP 3: Beschlussfassung über die Entlastung der Mitglieder des Aufsichtsrates für das Geschäftsjahr 2009
Vorstand und Aufsichtsrat schlagen vor, dem Aufsichtsrat Entlastung für das Geschäftsjahr 2009 zu erteilen.
TOP 4: Wahl des Abschlussprüfers für das Geschäftsjahr 2010
Der Aufsichtsrat schlägt vor, die Ernst & Young GmbH Wirtschaftsprüfungsgesellschaft, Berlin zum Abschlussprüfer für das Geschäftsjahr 2010 zu bestellen.
TOP 5: D&O-Versicherung zugunsten des Vorstandes und des Aufsichtsrates
Der Vorstand wird ermächtigt, zugunsten der Vorstands- und Aufsichtsratsmitglieder im Rahmen der gesetzlichen Vorschriften eine Vermögensschadenshaftpflichtversicherung (sog. D&O-Versicherung) für die Geschäftsjahre 2010 bis 2014 mit folgenden Eckdaten abzuschließen:
1) Deckungssumme: EUR 7,5 Mio.
2) Jährliche Versicherungsprämie: bis zu EUR 16.000,00 zuzüglich Versicherungssteuer.
* * *
Zur Teilnahme an der Hauptversammlung und zur Ausübung des Stimmrechts sind nach § 17 Abs. 1 der Satzung die Aktionäre berechtigt, die am Tage der Hauptversammlung im Aktienregister eingetragen sind und die sich spätestens am fünften Tage vor der Hauptversammlung bei der Gesellschaft angemeldet haben, soweit der Vorstand keine kürzere Frist bestimmt oder auf das Erfordernis einer Anmeldung verzichtet. Die Anmeldung muss der Gesellschaft in Textform spätestens am 17. September 2010 unter der folgenden Adresse zugehen:
NOXXON Pharma Aktiengesellschaft
Max-Dohrn-Str. 8–10
10589 Berlin
Vertreter haben ihre Legitimation durch Vollmacht nachzuweisen. Für die Vollmacht ist Textform erforderlich, es sei denn, die Vollmachtserteilung erfolgt an ein Kreditinstitut, an eine Aktionärsvereinigung oder an eine andere der in § 135 AktG gleichgestellten Institutionen oder Personen. Wenn ein Kreditinstitut, eine Aktionärsvereinigung oder eine andere der in § 135 AktG gleichgestellten Institutionen oder Personen bevollmächtigt werden soll, muss die Vollmacht gemäß § 135 Abs. 1 Satz 3 AktG vollständig sein und darf nur mit der Stimmrechtsvertretung verbundene Erklärungen enthalten. Wir weisen jedoch darauf hin, dass in diesen Fällen die zu bevollmächtigenden Institutionen oder Personen möglicherweise eine besondere Form der Vollmacht verlangen, weil sie gemäß § 135 Abs. 1 Satz 2 AktG die Vollmacht nachprüfbar festhalten müssen. Bitte stimmen Sie sich daher, wenn Sie ein Kreditinstitut, eine Aktionärsvereinigung oder eine andere der in § 135 AktG gleichgestellten Institutionen oder Personen bevollmächtigen wollen, mit diesen Institutionen oder Personen über eine mögliche Form der Vollmacht ab.
Anträge von Aktionären gemäß § 126 AktG und Wahlvorschläge gemäß § 127 AktG müssen innerhalb der gesetzlichen Fristen an folgende Anschrift gerichtet werden:
NOXXON Pharma Aktiengesellschaft
z.Hd. Karen Christine Ophoff
Max-Dohrn-Str. 8–10,
10589 Berlin
Telefax: 030 72 62 47 383
E-Mail: kophoff@noxxon.com
Anderweitig adressierte Anträge und Wahlvorschläge werden für die Zugänglichmachung nach §§ 126, 127 AktG nicht berücksichtigt.
Berlin, im August 2010
NOXXON Pharma Aktiengesellschaft
– Der Vorstand –
Inzwischen läuft die Mehrfach-Dosis-P1-Studie mit NOX-A12, die neben der alleinigen Gabe von NOX-A12 auch eine Kombination mit Filgrastim (G-CSF) vorsieht. Die Gabe von Filgrastim ist - soweit ich das richtig sehe - die/eine derzeitige Standardmethode, um blutbildende Stammzellen für eine autologe Stammzellentransplantation aus dem Knochenmark zu lösen. Es stellt sich somit die Frage, ob NOX-A12 bessere Ergebnisse (Verträglichkeit + Ertrag an abgelösten Stammzellen) liefert als Filgrastim bzw. wie beide Stoffe zusammen wirken (ebenfalls Verträglichkeit + Ertrag).
Zu Filgrastim (G-CSF): http://de.wikipedia.org/wiki/Filgrastim
Zum Design der Studie: http://clinicaltrials.gov/ct2/show/NCT01194934?term=noxxon&r…
Das Studiendesign kurz zusammengefasst:
1) Es wird 4 Gruppen mit jeweils 6 gesunden Testpersonen geben.
2) Zunächst wird in den Gruppen A und B an 5 aufeinander folgenden Tagen einmal pro Tag NOX-A12 verabreicht, Dosis 2 mg/kg (Gruppe A) bzw. 4 mg/kg (Gruppe B). Zm Vergleich: In der Vorgängerstudie mit einfachen Dosen wurden zwischen 0,05 und 10,8 mg/kg gespritzt. Gruppe-A-Probanden kommen somit insgesamt auf 10 mg/kg, Gruppe-B-Probanden auf 20.
3) In Gruppe D wird später 5 Tage lang NOX-A12 zusammen mit Filgrastim gegeben. Die Dosis richtet sich dabei nach den Ergebnissen der Gruppen A und B und steht noch nicht fest. Zum Vergleich der Gruppen A, B und D dient die Gruppe C, in der die Probanden 5 Tage lang ausschließlich Filgrastim erhalten.
Die Studie wird an der Charite in Berlin durchgeführt. Ein Termin für das Studienende ist noch nicht angegeben. Der Abschluss sollte/könnte m.E. noch in Q4 möglich sein. Mit dem Resultat wird man einen Entscheidungspunkt haben, ob es sich lohnt, NOX-A12 in der Indikation autologe Stammzellentransplantation weiter zu entwickeln (P2-Studie). Alternativ/zusätzlich hat Noxxon die Einsatzgebiete hämatologische und solide Tumore genannt.
Zu Filgrastim (G-CSF): http://de.wikipedia.org/wiki/Filgrastim
Zum Design der Studie: http://clinicaltrials.gov/ct2/show/NCT01194934?term=noxxon&r…
Das Studiendesign kurz zusammengefasst:
1) Es wird 4 Gruppen mit jeweils 6 gesunden Testpersonen geben.
2) Zunächst wird in den Gruppen A und B an 5 aufeinander folgenden Tagen einmal pro Tag NOX-A12 verabreicht, Dosis 2 mg/kg (Gruppe A) bzw. 4 mg/kg (Gruppe B). Zm Vergleich: In der Vorgängerstudie mit einfachen Dosen wurden zwischen 0,05 und 10,8 mg/kg gespritzt. Gruppe-A-Probanden kommen somit insgesamt auf 10 mg/kg, Gruppe-B-Probanden auf 20.
3) In Gruppe D wird später 5 Tage lang NOX-A12 zusammen mit Filgrastim gegeben. Die Dosis richtet sich dabei nach den Ergebnissen der Gruppen A und B und steht noch nicht fest. Zum Vergleich der Gruppen A, B und D dient die Gruppe C, in der die Probanden 5 Tage lang ausschließlich Filgrastim erhalten.
Die Studie wird an der Charite in Berlin durchgeführt. Ein Termin für das Studienende ist noch nicht angegeben. Der Abschluss sollte/könnte m.E. noch in Q4 möglich sein. Mit dem Resultat wird man einen Entscheidungspunkt haben, ob es sich lohnt, NOX-A12 in der Indikation autologe Stammzellentransplantation weiter zu entwickeln (P2-Studie). Alternativ/zusätzlich hat Noxxon die Einsatzgebiete hämatologische und solide Tumore genannt.
NOXXON erweitert Vorstand
http://www.dewb-vc.com/index.php?option=com_content&task=vie…
Berlin, 03. Februar 2011 – Die NOXXON Pharma AG gab heute die Ernennung von Dr. Matthias Baumann als Chief Medical Officer und Vorstandsmitglied des Unternehmens bekannt.
Dr. Baumann war zuvor acht Jahre als Chief Scientific Officer und Geschäftsführer für FOCUS Clinical Drug Development in Neuss/Düsseldorf tätig. Vor dieser Tätigkeit bei FOCUS hatte Dr. Baumann mehrere Positionen in der präklinischen und klinischen Entwicklung von Hoffmann La Roche und Boehringer Mannheim inne.
Zu seiner Ernennung erklärte Iain Buchanan, Vorstandsvorsitzender von NOXXON: „Ich freue mich, Matthias im Führungsteam von NOXXON begrüßen zu dürfen. Er bringt wichtige Erfahrungen aus der Klinischen Entwicklung in das Unternehmen ein und das zu einer Zeit, wo wir mehrere Pipeline-Projekte durch klinische Machbarkeitsstudien in den kommenden 24 Monaten voranbringen wollen.“
„Ich freue mich darauf, an der Umsetzung der bahnbrechenden Spiegelmer-Technologie in klinisch wirksame Therapeutika mitzuwirken“, so Dr. Matthias Baumann.
http://www.dewb-vc.com/index.php?option=com_content&task=vie…
Berlin, 03. Februar 2011 – Die NOXXON Pharma AG gab heute die Ernennung von Dr. Matthias Baumann als Chief Medical Officer und Vorstandsmitglied des Unternehmens bekannt.
Dr. Baumann war zuvor acht Jahre als Chief Scientific Officer und Geschäftsführer für FOCUS Clinical Drug Development in Neuss/Düsseldorf tätig. Vor dieser Tätigkeit bei FOCUS hatte Dr. Baumann mehrere Positionen in der präklinischen und klinischen Entwicklung von Hoffmann La Roche und Boehringer Mannheim inne.
Zu seiner Ernennung erklärte Iain Buchanan, Vorstandsvorsitzender von NOXXON: „Ich freue mich, Matthias im Führungsteam von NOXXON begrüßen zu dürfen. Er bringt wichtige Erfahrungen aus der Klinischen Entwicklung in das Unternehmen ein und das zu einer Zeit, wo wir mehrere Pipeline-Projekte durch klinische Machbarkeitsstudien in den kommenden 24 Monaten voranbringen wollen.“
„Ich freue mich darauf, an der Umsetzung der bahnbrechenden Spiegelmer-Technologie in klinisch wirksame Therapeutika mitzuwirken“, so Dr. Matthias Baumann.
Einladung zur außerordentlichen Hauptversammlung der NOXXON Pharma AG, Berlin
www.unternehmensregister.de
am 31. März 2011, um 09.00 Uhr
in den Geschäftsräumen der Gesellschaft, Max-Dohrn-Str. 8-10, 10589 Berlin
Tagesordnung:
TOP 1: Aufhebung des bestehenden und Schaffung eines neuen genehmigten Kapitals sowie korrespondierende Satzungsänderung
Vorstand und Aufsichtsrat schlagen vor, folgende Beschlüsse zu fassen:
1. Das bestehende genehmigte Kapital wird aufgehoben.
2. Es wird ein neues genehmigtes Kapital (genehmigtes Kapital 2011/I) wie folgt geschaffen:
Der Vorstand ist ermächtigt, mit Zustimmung des Aufsichtsrats das Grundkapital der Gesellschaft bis zum 29. Februar 2016 durch Ausgabe von bis zu 88.840 neuen, nennwertlosen, vinkulierten, auf den Namen lautenden stimmberechtigten Vorzugsaktien der Serien A oder B gegen Bareinlagen einmalig oder mehrmals um bis zu insgesamt Euro 88.840,00 zu erhöhen (genehmigtes Kapital) und dabei einen vom Gesetz abweichenden Beginn der Gewinnbeteiligung zu bestimmen.
Der Vorstand ist ermächtigt, mit Zustimmung des Aufsichtsrats über den Ausschluss des Bezugsrechts der Aktionäre zu entscheiden und die weiteren Einzelheiten der jeweiligen Kapitalerhöhung sowie die Bedingungen der Aktienausgabe festzulegen.
Ein Bezugsrechtsausschluss ist jedoch nur zulässig für eine Ausgabe von Aktien (i) an Mitarbeiter des Unternehmens, Vorstands- und Aufsichtsratsmitglieder sowie Berater und freie Mitarbeiter der Gesellschaft oder eines verbundenen Unternehmens oder (ii) für Spitzenbeträge oder (iii) an Aktionäre, jeweils in dem Umfang und zu den Konditionen, in dem bzw. zu denen sie im Rahmen der durch die Hauptversammlung am 26. Mai 2010 unter TOP 1 beschlossenen Kapitalerhöhung oder bis zum 31. Juli 2010 zu identischen Konditionen Aktien gezeichnet haben.
Der Aufsichtsrat ist ermächtigt, die Fassung von § 4 Abs. 1 und Abs. 2 der Satzung entsprechend dem Umfang der Kapitalerhöhung aus Genehmigtem Kapital zu ändern sowie alle sonstigen damit im Zusammenhang stehenden Anpassungen der Satzung vorzunehmen, die nur die Fassung betreffen.
3. § 4 Abs. 2 der Satzung wird wie folgt neu gefasst:
...
Bericht über die Gründe für den Ausschluss des Bezugsrechts gemäß §§ 203 Abs. 2 Satz 2, 186 Abs. 4 Satz 2 AktG:
...
Schließlich soll der Vorstand ermächtigt werden, das gesetzliche Bezugsrecht der Aktionäre mit Zustimmung des Aufsichtsrats für die Ausgabe an Aktionäre jeweils in dem Umfang auszuschließen, in dem sie im Rahmen der durch die Hauptversammlung am 26. Mai 2010 unter TOP 1 beschlossenen Kapitalerhöhung oder bis zum 31. Juli 2010 zu identischen Konditionen Aktien gezeichnet haben. Die Gesellschaft hatte im Frühjahr 2010 Verhandlungen über eine Finanzierungsrunde abgeschlossen, die für die erfolgreiche Zukunft der Gesellschaft unerlässlich war. In diesem Zusammenhang haben sich die Investoren bereit erklärt, der Gesellschaft die vereinbarten Mittel in zwei identischen Tranchen zur Verfügung zu stellen, wobei die Einzahlung der zweiten Tranche von der Erreichung bestimmter Meilensteine der Gesellschaft oder einer entsprechenden Beschlussfassung der Investoren abhängig ist. Jeder der Investoren hat sich jedoch zur Einzahlung der ersten Tranche nur unter der Bedingung bereit erklärt, dass er bei Erreichen der Meilensteine oder im Falle einer entsprechenden Beschlussfassung der Investoren auch zur Zeichnung der zweiten Tranche in identischer Höhe wie der ersten Tranche zugelassen wird. Die Gesellschaft erhielt daher die von ihr benötigten Mittel aus der ersten Tranche nur, weil die Investoren Gewissheit hatten, dass sie ohne Verwässerung durch die Zeichnung weiterer Aktionäre auch im Rahmen der zweiten Tranche Aktien der Gesellschaft zeichnen können. Für die Gesellschaft ist es daher unerlässlich sicherzustellen, dass weiterhin aus dem genehmigten Kapital an Aktionäre Aktien ausgegeben werden können, die auch im Rahmen der ersten Tranche eine entsprechende Anzahl von Aktien gezeichnet haben. Da noch nicht endgültig feststeht, ob die Voraussetzungen, unter denen die Aktien der zweiten Tranche ausgegeben werden können, erfüllt werden, ist zum Zwecke der flexiblen Ausgabe der Aktien an die Investoren bei Erfüllung dieser Voraussetzungen das Bezugsrecht der Aktionäre auszuschließen.
Der Umfang der Ermächtigung zum Ausschluss des Bezugsrechts der Aktionäre im Rahmen der vorgeschlagenen Schaffung des Genehmigten Kapitals entspricht mit weniger als 50 % des Grundkapitals der Gesellschaft der gesetzlichen Regelung. Über die Einzelheiten der Ausnutzung des genehmigten Kapitals wird der Vorstand in der Hauptversammlung berichten, die auf eine etwaige Ausgabe von Aktien der Gesellschaft folgt.
TOP 2: Anpassung des bedingten Kapitals infolge Ablaufes von Bezugsrechten sowie korrespondierende Satzungsänderung
Die Anleihebedingungen der 3,75% Optionsanleihe II 1999/2004 der Gesellschaft bestimmen in § 9 Abs. 6, dass das entsprechende Bezugsrecht spätestens, sofern nicht eine Verlängerung der Ausübungsfrist seitens der Gesellschaft bekanntgegeben wird, binnen 10 Jahren nach seiner Ausgabe einzulösen ist und nach Ablauf der Frist entschädigungslos verfällt. Mit Beschluss der Hauptversammlung am 5. März 2001 zu TOP 4 wurde beschlossen, keine weiteren Bezugsrechte unter dieser Optionsanleihe auszugeben. Zuletzt bestanden nur noch am 6. November 1999 ausgegebene Bezugsrechte, hinsichtlich derer eine Verlängerung der Ausübungsfrist nicht erfolgte.
Die Anleihebedingungen der 3,00% Optionsanleihe IV 2002/2005 der Gesellschaft bestimmen in § 9 Abs. 5, dass die entsprechenden Bezugsrechte bis Ablauf des 31. Dezembers 2010 ausgeübt werden können und nach Ablauf der Frist entschädigungslos verfallen.
Bezugsrechte aus diesen Optionsanleihen sind nicht ausgeübt worden, und sie können auch künftig nicht mehr ausgeübt werden. Das bedingte Kapital wird zur Schaffung von Aktien zwecks Bedienung dieser Bezugsrechte folglich nicht mehr benötigt.
Vorstand und Aufsichtsrat schlagen daher vor, folgende Beschlüsse zu fassen:
1. Das bestehende bedingte Kapital wird dahingehend geändert, dass die bedingte Kapitalerhöhung nunmehr nicht mehr zur Einlösung von Bezugsrechten gemäß § 192 Abs. 2 Nr. 1 AktG, die mit der Optionsanleihe II 1999 (in der Fassung der Beschlüsse der Hauptversammlung vom 11. Mai 2001) oder der Optionsanleihe 2002 (in der Fassung der Beschlüsse der Hauptversammlung vom 22. November 2002) ausgegeben wurden, dient.
2. Die übrigen Regelungen des bedingten Kapitals bleiben hierdurch unberührt.
3. § 4 Abs. 3 Satz 2 der Satzung wird geändert und lautet nunmehr wie folgt:
"Die bedingte Kapitalerhöhung dient der Einlösung von Aktienoptionen gemäß § 192 Abs. 2 Nr. 3 AktG, die im Rahmen des Stock Option Programm 2002 (in der Fassung der Beschlüsse der Hauptversammlung vom 27. Juni 2003) ausgegeben wurden und zur Einlösung von Bezugsrechten gemäß § 192 Abs. 2 Nr. 1 AktG, die mit der Optionsanleihe III 2001 (in der Fassung der Beschlüsse der Hauptversammlung vom 25. März 2004) ausgegeben wurden."
TOP 3: Sonderbeschlüsse der Inhaber von Stammaktien: Zustimmungsbeschlüsse
Vorstand und Aufsichtsrat schlagen vor, folgende Beschlüsse zu fassen:
1. Die Inhaber von Stammaktien stimmen den Beschlüssen zu TOP 1 über die Aufhebung des bestehenden und Schaffung eines neuen genehmigtes Kapitals sowie eine korrespondierende Satzungsänderung gemäß §§ 202 Abs. 2 Satz 4, 182 Abs. 2 AktG zu.
2. Die Inhaber von Stammaktien stimmen den Beschlüssen zu TOP 2 über die Anpassung des bedingten Kapitals sowie korrespondierende Satzungsänderung gemäß §§ 193 Abs. 1 Satz 3, 182 Abs. 2 AktG zu.
TOP 4: Sonderbeschlüsse der Inhaber von Vorzugsaktien der Serie A: Zustimmungsbeschlüsse
Vorstand und Aufsichtsrat schlagen vor, folgende Beschlüsse zu fassen:
1. Die Inhaber von Vorzugsaktien der Serie A stimmen den Beschlüssen zu TOP 1 über die Aufhebung des bestehenden und Schaffung eines neuen genehmigtes Kapitals sowie eine korrespondierende Satzungsänderung gemäß §§ 202 Abs. 2 Satz 4, 182 Abs. 2 AktG zu.
2. Die Inhaber von Vorzugsaktien der Serie A stimmen den Beschlüssen zu TOP 2 über die Anpassung des bedingten Kapitals sowie korrespondierende Satzungsänderung gemäß §§ 193 Abs. 1 Satz 3, 182 Abs. 2 AktG zu.
TOP 5: Sonderbeschlüsse der Inhaber von Vorzugsaktien der Serie B: Zustimmungsbeschlüsse
Vorstand und Aufsichtsrat schlagen vor, folgende Beschlüsse zu fassen:
1. Die Inhaber von Vorzugsaktien der Serie B stimmen den Beschlüssen zu TOP 1 über die Aufhebung des bestehenden und Schaffung eines neuen genehmigtes Kapitals sowie eine korrespondierende Satzungsänderung gemäß §§ 202 Abs. 2 Satz 4, 182 Abs. 2 AktG i.V.m. § 19 Abs. 3 lit. a) der Satzung zu.
2. Die Inhaber von Vorzugsaktien der Serie B stimmen den Beschlüssen zu TOP 2 über die Anpassung des bedingten Kapitals sowie korrespondierende Satzungsänderung gemäß §§ 193 Abs. 1 Satz 3, 182 Abs. 2 AktG AktG i.V.m. § 19 Abs. 3 lit. a) der Satzung zu.
* * *
...
Berlin, im Februar 2011
NOXXON Pharma Aktiengesellschaft
- Der Vorstand -
www.unternehmensregister.de
am 31. März 2011, um 09.00 Uhr
in den Geschäftsräumen der Gesellschaft, Max-Dohrn-Str. 8-10, 10589 Berlin
Tagesordnung:
TOP 1: Aufhebung des bestehenden und Schaffung eines neuen genehmigten Kapitals sowie korrespondierende Satzungsänderung
Vorstand und Aufsichtsrat schlagen vor, folgende Beschlüsse zu fassen:
1. Das bestehende genehmigte Kapital wird aufgehoben.
2. Es wird ein neues genehmigtes Kapital (genehmigtes Kapital 2011/I) wie folgt geschaffen:
Der Vorstand ist ermächtigt, mit Zustimmung des Aufsichtsrats das Grundkapital der Gesellschaft bis zum 29. Februar 2016 durch Ausgabe von bis zu 88.840 neuen, nennwertlosen, vinkulierten, auf den Namen lautenden stimmberechtigten Vorzugsaktien der Serien A oder B gegen Bareinlagen einmalig oder mehrmals um bis zu insgesamt Euro 88.840,00 zu erhöhen (genehmigtes Kapital) und dabei einen vom Gesetz abweichenden Beginn der Gewinnbeteiligung zu bestimmen.
Der Vorstand ist ermächtigt, mit Zustimmung des Aufsichtsrats über den Ausschluss des Bezugsrechts der Aktionäre zu entscheiden und die weiteren Einzelheiten der jeweiligen Kapitalerhöhung sowie die Bedingungen der Aktienausgabe festzulegen.
Ein Bezugsrechtsausschluss ist jedoch nur zulässig für eine Ausgabe von Aktien (i) an Mitarbeiter des Unternehmens, Vorstands- und Aufsichtsratsmitglieder sowie Berater und freie Mitarbeiter der Gesellschaft oder eines verbundenen Unternehmens oder (ii) für Spitzenbeträge oder (iii) an Aktionäre, jeweils in dem Umfang und zu den Konditionen, in dem bzw. zu denen sie im Rahmen der durch die Hauptversammlung am 26. Mai 2010 unter TOP 1 beschlossenen Kapitalerhöhung oder bis zum 31. Juli 2010 zu identischen Konditionen Aktien gezeichnet haben.
Der Aufsichtsrat ist ermächtigt, die Fassung von § 4 Abs. 1 und Abs. 2 der Satzung entsprechend dem Umfang der Kapitalerhöhung aus Genehmigtem Kapital zu ändern sowie alle sonstigen damit im Zusammenhang stehenden Anpassungen der Satzung vorzunehmen, die nur die Fassung betreffen.
3. § 4 Abs. 2 der Satzung wird wie folgt neu gefasst:
...
Bericht über die Gründe für den Ausschluss des Bezugsrechts gemäß §§ 203 Abs. 2 Satz 2, 186 Abs. 4 Satz 2 AktG:
...
Schließlich soll der Vorstand ermächtigt werden, das gesetzliche Bezugsrecht der Aktionäre mit Zustimmung des Aufsichtsrats für die Ausgabe an Aktionäre jeweils in dem Umfang auszuschließen, in dem sie im Rahmen der durch die Hauptversammlung am 26. Mai 2010 unter TOP 1 beschlossenen Kapitalerhöhung oder bis zum 31. Juli 2010 zu identischen Konditionen Aktien gezeichnet haben. Die Gesellschaft hatte im Frühjahr 2010 Verhandlungen über eine Finanzierungsrunde abgeschlossen, die für die erfolgreiche Zukunft der Gesellschaft unerlässlich war. In diesem Zusammenhang haben sich die Investoren bereit erklärt, der Gesellschaft die vereinbarten Mittel in zwei identischen Tranchen zur Verfügung zu stellen, wobei die Einzahlung der zweiten Tranche von der Erreichung bestimmter Meilensteine der Gesellschaft oder einer entsprechenden Beschlussfassung der Investoren abhängig ist. Jeder der Investoren hat sich jedoch zur Einzahlung der ersten Tranche nur unter der Bedingung bereit erklärt, dass er bei Erreichen der Meilensteine oder im Falle einer entsprechenden Beschlussfassung der Investoren auch zur Zeichnung der zweiten Tranche in identischer Höhe wie der ersten Tranche zugelassen wird. Die Gesellschaft erhielt daher die von ihr benötigten Mittel aus der ersten Tranche nur, weil die Investoren Gewissheit hatten, dass sie ohne Verwässerung durch die Zeichnung weiterer Aktionäre auch im Rahmen der zweiten Tranche Aktien der Gesellschaft zeichnen können. Für die Gesellschaft ist es daher unerlässlich sicherzustellen, dass weiterhin aus dem genehmigten Kapital an Aktionäre Aktien ausgegeben werden können, die auch im Rahmen der ersten Tranche eine entsprechende Anzahl von Aktien gezeichnet haben. Da noch nicht endgültig feststeht, ob die Voraussetzungen, unter denen die Aktien der zweiten Tranche ausgegeben werden können, erfüllt werden, ist zum Zwecke der flexiblen Ausgabe der Aktien an die Investoren bei Erfüllung dieser Voraussetzungen das Bezugsrecht der Aktionäre auszuschließen.
Der Umfang der Ermächtigung zum Ausschluss des Bezugsrechts der Aktionäre im Rahmen der vorgeschlagenen Schaffung des Genehmigten Kapitals entspricht mit weniger als 50 % des Grundkapitals der Gesellschaft der gesetzlichen Regelung. Über die Einzelheiten der Ausnutzung des genehmigten Kapitals wird der Vorstand in der Hauptversammlung berichten, die auf eine etwaige Ausgabe von Aktien der Gesellschaft folgt.
TOP 2: Anpassung des bedingten Kapitals infolge Ablaufes von Bezugsrechten sowie korrespondierende Satzungsänderung
Die Anleihebedingungen der 3,75% Optionsanleihe II 1999/2004 der Gesellschaft bestimmen in § 9 Abs. 6, dass das entsprechende Bezugsrecht spätestens, sofern nicht eine Verlängerung der Ausübungsfrist seitens der Gesellschaft bekanntgegeben wird, binnen 10 Jahren nach seiner Ausgabe einzulösen ist und nach Ablauf der Frist entschädigungslos verfällt. Mit Beschluss der Hauptversammlung am 5. März 2001 zu TOP 4 wurde beschlossen, keine weiteren Bezugsrechte unter dieser Optionsanleihe auszugeben. Zuletzt bestanden nur noch am 6. November 1999 ausgegebene Bezugsrechte, hinsichtlich derer eine Verlängerung der Ausübungsfrist nicht erfolgte.
Die Anleihebedingungen der 3,00% Optionsanleihe IV 2002/2005 der Gesellschaft bestimmen in § 9 Abs. 5, dass die entsprechenden Bezugsrechte bis Ablauf des 31. Dezembers 2010 ausgeübt werden können und nach Ablauf der Frist entschädigungslos verfallen.
Bezugsrechte aus diesen Optionsanleihen sind nicht ausgeübt worden, und sie können auch künftig nicht mehr ausgeübt werden. Das bedingte Kapital wird zur Schaffung von Aktien zwecks Bedienung dieser Bezugsrechte folglich nicht mehr benötigt.
Vorstand und Aufsichtsrat schlagen daher vor, folgende Beschlüsse zu fassen:
1. Das bestehende bedingte Kapital wird dahingehend geändert, dass die bedingte Kapitalerhöhung nunmehr nicht mehr zur Einlösung von Bezugsrechten gemäß § 192 Abs. 2 Nr. 1 AktG, die mit der Optionsanleihe II 1999 (in der Fassung der Beschlüsse der Hauptversammlung vom 11. Mai 2001) oder der Optionsanleihe 2002 (in der Fassung der Beschlüsse der Hauptversammlung vom 22. November 2002) ausgegeben wurden, dient.
2. Die übrigen Regelungen des bedingten Kapitals bleiben hierdurch unberührt.
3. § 4 Abs. 3 Satz 2 der Satzung wird geändert und lautet nunmehr wie folgt:
"Die bedingte Kapitalerhöhung dient der Einlösung von Aktienoptionen gemäß § 192 Abs. 2 Nr. 3 AktG, die im Rahmen des Stock Option Programm 2002 (in der Fassung der Beschlüsse der Hauptversammlung vom 27. Juni 2003) ausgegeben wurden und zur Einlösung von Bezugsrechten gemäß § 192 Abs. 2 Nr. 1 AktG, die mit der Optionsanleihe III 2001 (in der Fassung der Beschlüsse der Hauptversammlung vom 25. März 2004) ausgegeben wurden."
TOP 3: Sonderbeschlüsse der Inhaber von Stammaktien: Zustimmungsbeschlüsse
Vorstand und Aufsichtsrat schlagen vor, folgende Beschlüsse zu fassen:
1. Die Inhaber von Stammaktien stimmen den Beschlüssen zu TOP 1 über die Aufhebung des bestehenden und Schaffung eines neuen genehmigtes Kapitals sowie eine korrespondierende Satzungsänderung gemäß §§ 202 Abs. 2 Satz 4, 182 Abs. 2 AktG zu.
2. Die Inhaber von Stammaktien stimmen den Beschlüssen zu TOP 2 über die Anpassung des bedingten Kapitals sowie korrespondierende Satzungsänderung gemäß §§ 193 Abs. 1 Satz 3, 182 Abs. 2 AktG zu.
TOP 4: Sonderbeschlüsse der Inhaber von Vorzugsaktien der Serie A: Zustimmungsbeschlüsse
Vorstand und Aufsichtsrat schlagen vor, folgende Beschlüsse zu fassen:
1. Die Inhaber von Vorzugsaktien der Serie A stimmen den Beschlüssen zu TOP 1 über die Aufhebung des bestehenden und Schaffung eines neuen genehmigtes Kapitals sowie eine korrespondierende Satzungsänderung gemäß §§ 202 Abs. 2 Satz 4, 182 Abs. 2 AktG zu.
2. Die Inhaber von Vorzugsaktien der Serie A stimmen den Beschlüssen zu TOP 2 über die Anpassung des bedingten Kapitals sowie korrespondierende Satzungsänderung gemäß §§ 193 Abs. 1 Satz 3, 182 Abs. 2 AktG zu.
TOP 5: Sonderbeschlüsse der Inhaber von Vorzugsaktien der Serie B: Zustimmungsbeschlüsse
Vorstand und Aufsichtsrat schlagen vor, folgende Beschlüsse zu fassen:
1. Die Inhaber von Vorzugsaktien der Serie B stimmen den Beschlüssen zu TOP 1 über die Aufhebung des bestehenden und Schaffung eines neuen genehmigtes Kapitals sowie eine korrespondierende Satzungsänderung gemäß §§ 202 Abs. 2 Satz 4, 182 Abs. 2 AktG i.V.m. § 19 Abs. 3 lit. a) der Satzung zu.
2. Die Inhaber von Vorzugsaktien der Serie B stimmen den Beschlüssen zu TOP 2 über die Anpassung des bedingten Kapitals sowie korrespondierende Satzungsänderung gemäß §§ 193 Abs. 1 Satz 3, 182 Abs. 2 AktG AktG i.V.m. § 19 Abs. 3 lit. a) der Satzung zu.
* * *
...
Berlin, im Februar 2011
NOXXON Pharma Aktiengesellschaft
- Der Vorstand -
Es gab inzwischen weitere Präsentationen von Noxxon auf internationalen Biotech-Konferenzen. Die jüngste ist von Mitte Januar 2011 auf der JP Morgan Healthcare Conference in San Francisco.
Quelle (pdf): http://145.253.103.53/noxxon16/downloads/2011-01-07_NOXXON-J…
Aktueller Status / Fahrplan 2011:
------------------------------------------
NOX-E36: Abschluss der laufenden P1b/2a-Studie bei Gesunden/Typ2-Diabetikern in Q2/11
NOX-E36: Durchführung einer Nierenschädigung-Studie in HJ2/11 - Frage: Was heißt das konkret?
NOX-E36: Start einer P2-Studie in diabetischer Nephropathie in Q4/11 - Frage: Mit Partner oder als P2a noch ohne?
http://de.wikipedia.org/wiki/Diabetische_Nephropathie
NOX-A12: Abschluss der laufenden Mehrfach-Dosis-P1-Studie zur Stammzellmobilisierung - Frage: Wann?
NOX-A12: Abschluss einer umfassenden Analyse für Einsatzmöglichkeiten bei diversen Krebserkrankungen in Q2/11
NOX-A12: Vorbereitung/Start von P2-Studie(n) in HJ2/11 - Fragen: Welche Indikation wird gewählt? Mit Partner?
NOX-H94: Start einer "First in Human"-P1-Studie in Q2/11
Pipeline: Aufstieg von 2 weiteren Spiegelmeren zu Kandidaten für klinische Studien
Anbei die Pipeline-Folie aus der oben erwähnten aktuellen Präsentation. Interessant ist, dass bei allen Spiegelmeren das ophthalmologische (= Augenheilkunde) Potenzial ausgewiesen wurde. Möglicherweise will sich Noxxon in dieser Richtung spezialisieren oder zumindest eine gewisse Spezialisierung andeuten.

Quelle (pdf): http://145.253.103.53/noxxon16/downloads/2011-01-07_NOXXON-J…
Aktueller Status / Fahrplan 2011:
------------------------------------------
NOX-E36: Abschluss der laufenden P1b/2a-Studie bei Gesunden/Typ2-Diabetikern in Q2/11
NOX-E36: Durchführung einer Nierenschädigung-Studie in HJ2/11 - Frage: Was heißt das konkret?
NOX-E36: Start einer P2-Studie in diabetischer Nephropathie in Q4/11 - Frage: Mit Partner oder als P2a noch ohne?
http://de.wikipedia.org/wiki/Diabetische_Nephropathie
NOX-A12: Abschluss der laufenden Mehrfach-Dosis-P1-Studie zur Stammzellmobilisierung - Frage: Wann?
NOX-A12: Abschluss einer umfassenden Analyse für Einsatzmöglichkeiten bei diversen Krebserkrankungen in Q2/11
NOX-A12: Vorbereitung/Start von P2-Studie(n) in HJ2/11 - Fragen: Welche Indikation wird gewählt? Mit Partner?
NOX-H94: Start einer "First in Human"-P1-Studie in Q2/11
Pipeline: Aufstieg von 2 weiteren Spiegelmeren zu Kandidaten für klinische Studien
Anbei die Pipeline-Folie aus der oben erwähnten aktuellen Präsentation. Interessant ist, dass bei allen Spiegelmeren das ophthalmologische (= Augenheilkunde) Potenzial ausgewiesen wurde. Möglicherweise will sich Noxxon in dieser Richtung spezialisieren oder zumindest eine gewisse Spezialisierung andeuten.

Blockbuster-Kandidat NOX-H94
NOX-H94 ist nach eigenen Angaben der kommerziell lukrativste Medikamenten-Kandidat von Noxxon und soll noch in HJ1 dieses Jahres mit einer "First-in-Human"-Studie in die klinische Phase übertreten. Mit einer Meldung seitens Noxxon zum Klinikstart können wir m.E. in den nächsten Wochen rechnen. Vorab schon ein paar Infos dazu.
Zielmolekül von NOX-H94 ist Hepcidin, ein Protein (eigentlich zwei), das die Eisenverfügbarkeit im Körper unterdrückt. Eisen ist jedoch elementar wichtig für die Bildung roter Blutkörperchen, die so genannte Erythropoese.
Bei chronischen Entzündungen (= Inflammation) wird im Körper vermehrt Interleukin-6 (IL-6) ausgeschüttet. Dieses IL-6 führt wiederum zu einer erhöhten Konzentration von Hepcidin, damit zu mangelhafter Eisenverfügbarkeit und in der Folge zu Blutarmut (= Anämie) und einer generellen Unterversorgung des gesamten Organismus mit Sauerstoff.
Um bei Blutarmut die Blutbildung therapeutisch anzuregen, werden Erythropoese-stimulierende Agenten (ESA) verabreicht. Bekanntester ESA ist Erythropoetin (EPO), das gern auch als blutauffrischendes Dopingmittel im Profisport eingesetzt wird. ESA können jedoch - insbesondere bei einem Einsatz bei Krebspatienten - gravierende Nebenwirkungen hervorrufen (beschleunigtes Tumorwachstum, verkürzte Lebenserwartung).
Deshalb soll ein hoher Bedarf an Alternativen für ESA vorliegen, die bereits an der Ursache der Blutarmut, nämlich des übermäßigen Vorhandenseins von Hepcidin, ansetzen. Dies ist die Aufgabe von NOX-H94, das an Hepcidin bindet und damit neutralisiert.
Der Markt für ESA soll 2009 über 7 Mrd. $ schwer gewesen sein. Insofern kann man sich vorstellen, dass ein Erfolg von NOX-H94 Blockbuster-Potenzial bietet.
Weitere Informationen können wir vermutlich bei Meldung des P1-Starts erwarten.
Quellen:
Noxxon-Präsentation vom Januar 2011 (pdf): http://145.253.103.53/noxxon16/downloads/2011-01-07_NOXXON-J…
Hepcidin: http://de.wikipedia.org/wiki/Hepcidin
Interleukin-6: http://de.wikipedia.org/wiki/Interleukin-6
Anämie: http://de.wikipedia.org/wiki/An%C3%A4mie
Erythropoese: http://de.wikipedia.org/wiki/Erythropoese
Erythropoetin (EPO): http://de.wikipedia.org/wiki/Erythropoetin
NOX-H94 ist nach eigenen Angaben der kommerziell lukrativste Medikamenten-Kandidat von Noxxon und soll noch in HJ1 dieses Jahres mit einer "First-in-Human"-Studie in die klinische Phase übertreten. Mit einer Meldung seitens Noxxon zum Klinikstart können wir m.E. in den nächsten Wochen rechnen. Vorab schon ein paar Infos dazu.
Zielmolekül von NOX-H94 ist Hepcidin, ein Protein (eigentlich zwei), das die Eisenverfügbarkeit im Körper unterdrückt. Eisen ist jedoch elementar wichtig für die Bildung roter Blutkörperchen, die so genannte Erythropoese.
Bei chronischen Entzündungen (= Inflammation) wird im Körper vermehrt Interleukin-6 (IL-6) ausgeschüttet. Dieses IL-6 führt wiederum zu einer erhöhten Konzentration von Hepcidin, damit zu mangelhafter Eisenverfügbarkeit und in der Folge zu Blutarmut (= Anämie) und einer generellen Unterversorgung des gesamten Organismus mit Sauerstoff.
Um bei Blutarmut die Blutbildung therapeutisch anzuregen, werden Erythropoese-stimulierende Agenten (ESA) verabreicht. Bekanntester ESA ist Erythropoetin (EPO), das gern auch als blutauffrischendes Dopingmittel im Profisport eingesetzt wird. ESA können jedoch - insbesondere bei einem Einsatz bei Krebspatienten - gravierende Nebenwirkungen hervorrufen (beschleunigtes Tumorwachstum, verkürzte Lebenserwartung).
Deshalb soll ein hoher Bedarf an Alternativen für ESA vorliegen, die bereits an der Ursache der Blutarmut, nämlich des übermäßigen Vorhandenseins von Hepcidin, ansetzen. Dies ist die Aufgabe von NOX-H94, das an Hepcidin bindet und damit neutralisiert.
Der Markt für ESA soll 2009 über 7 Mrd. $ schwer gewesen sein. Insofern kann man sich vorstellen, dass ein Erfolg von NOX-H94 Blockbuster-Potenzial bietet.
Weitere Informationen können wir vermutlich bei Meldung des P1-Starts erwarten.
Quellen:
Noxxon-Präsentation vom Januar 2011 (pdf): http://145.253.103.53/noxxon16/downloads/2011-01-07_NOXXON-J…
Hepcidin: http://de.wikipedia.org/wiki/Hepcidin
Interleukin-6: http://de.wikipedia.org/wiki/Interleukin-6
Anämie: http://de.wikipedia.org/wiki/An%C3%A4mie
Erythropoese: http://de.wikipedia.org/wiki/Erythropoese
Erythropoetin (EPO): http://de.wikipedia.org/wiki/Erythropoetin
Antwort auf Beitrag Nr.: 41.155.490 von Saaletaler am 06.03.11 22:12:18Blockbuster-Kandidat NOX-H94 (Ergänzungen)
Besser beschrieben ist die (bis heute bekannte) Funktionsweise von Hepcidin in der englischen Version von wikipedia. Auch über die Zielindikation "Anemia of Inflammation" bzw. "Anemia of chronic disease" gibt die englische Seite mehr Auskunft.
Hepcidin (engl.): http://en.wikipedia.org/wiki/Hepcidin
Anemia of chronic disease (engl.): http://en.wikipedia.org/wiki/Anemia_of_chronic_disease
Die Entdeckung von Hepcidin und vor allem dessen Bedeutung für den Eisen-Stoffwechsel und damit die Blutbildung erfolgte übrigens erst in den letzten paar Jahren. Insofern ist Noxxon mit NOX-H94 hier wirklich an einem ganz "heißen Eisen" dran, was man fast wörtlich nehmen kann. Dafür ist m.E. allerdings auch das Risiko erhöht, da die Wirkungsweise von Hepcidin bislang noch nicht abschließend erforscht scheint.
Noxxon arbeitet laut eigener Homepage bei NOX-H94 mit Prof. Weiss von der Uni Innsbruck zusammen, der in den letzten Jahren wesentliche Ergebnisse bei der Erforschung von Hepcidin publiziert hat.
Link zu Prof. Weiss (Uni Innsbruck): http://www3.i-med.ac.at/innere1/forschung/infektiologie.html
Besser beschrieben ist die (bis heute bekannte) Funktionsweise von Hepcidin in der englischen Version von wikipedia. Auch über die Zielindikation "Anemia of Inflammation" bzw. "Anemia of chronic disease" gibt die englische Seite mehr Auskunft.
Hepcidin (engl.): http://en.wikipedia.org/wiki/Hepcidin
Anemia of chronic disease (engl.): http://en.wikipedia.org/wiki/Anemia_of_chronic_disease
Die Entdeckung von Hepcidin und vor allem dessen Bedeutung für den Eisen-Stoffwechsel und damit die Blutbildung erfolgte übrigens erst in den letzten paar Jahren. Insofern ist Noxxon mit NOX-H94 hier wirklich an einem ganz "heißen Eisen" dran, was man fast wörtlich nehmen kann. Dafür ist m.E. allerdings auch das Risiko erhöht, da die Wirkungsweise von Hepcidin bislang noch nicht abschließend erforscht scheint.
Noxxon arbeitet laut eigener Homepage bei NOX-H94 mit Prof. Weiss von der Uni Innsbruck zusammen, der in den letzten Jahren wesentliche Ergebnisse bei der Erforschung von Hepcidin publiziert hat.
Link zu Prof. Weiss (Uni Innsbruck): http://www3.i-med.ac.at/innere1/forschung/infektiologie.html
Präsentation auf der "Bio-Europe Spring" in Mailand (15. März 2011)
http://145.253.103.53/noxxon16/downloads/2011-03-11_NOXXON_B…
Den Folien sind keine wesentlichen Neuheiten, aber einige Konkretisierungen zum Fahrplan für 2011 zu entnehmen (vgl. Posting 49).
Aktueller Status / Fahrplan 2011 (Konkretisierung):
----------------------------------------------------------------------------------
NOX-E36: Abschluss der P1b-Studie weiterhin für Q2/11 erwartet; es läuft nur noch Gruppe B
NOX-E36: Abschluss einer Nierenschwäche-Studie in Q3/11 - Frage weiterhin: Was genau untersucht diese Studie?
NOX-E36: Start/Einleitung einer P2a-Studie in Diabetischer Nephropathie in Q4/11
NOX-A12: Start/Einleitung einer P1b/2a-Studie in Q3/11 - Frage weiterhin: Welche Indikation?
----------------------------------------------------------------------------------
Anmerkungen:
Bei NOX-E36 scheint alles nach Plan zu laufen, wenn man von einer gewissen zeitlichen Verzögerung absieht. Die vorgesehene P2a in Diabetischer Nephropathie wird wohl ohne Partner laufen, das lässt sich stemmen. Endpunkt der P2a wäre der Proof of Concept für NOX-E36, zumindest in dieser Indikation.
Bei NOX-A12 scheint man vom ursprünglichen Einsatzziel Stammzellenmobilisierung weg zu gehen, davon ist in der Präsentation auch keine Rede mehr. Möglicherweise reicht der Umfang der freigesetzten Stammzellen nicht aus. Stattdessen soll NOX-A12 zur (ergänzenden) Behandlung bei Krebs eingesetzt werden, da dem (zu neutralisierenden) Zielmolekül SDF-1 (= CXCL12) eine Unterstützung von Tumorwachstum und Metastasenbildung anhängt. Die derzeit laufende interne Evaluation wird als Ergebnis das konkrete Untersuchungsfeld liefern müssen, mit dem man die P1b/2a in Q3/11 einleiten will.
http://de.wikipedia.org/wiki/SDF-1
Bei NOX-H94 gibt es keine Neuigkeiten, der P1-Start wurde für Q2/11 bestätigt.
Kernaussage der Präsentation ist m.E. das Ziel von Noxxon, in 2012 den Proof of Concept sowohl für NOX-E36 als auch für NOX-A12 zu erreichen, wenn die (vorläufigen) Daten der jeweiligen P2a-Studie vorliegen (s. Folie 17 unten). Zusammen mit den P1-Ergebnissen von NOX-H94 entsteht dann ein neuer Bewertungsmeilenstein, der zum Exit (IPO oder Trade Sale) führen dürfte.

http://145.253.103.53/noxxon16/downloads/2011-03-11_NOXXON_B…
Den Folien sind keine wesentlichen Neuheiten, aber einige Konkretisierungen zum Fahrplan für 2011 zu entnehmen (vgl. Posting 49).
Aktueller Status / Fahrplan 2011 (Konkretisierung):
----------------------------------------------------------------------------------
NOX-E36: Abschluss der P1b-Studie weiterhin für Q2/11 erwartet; es läuft nur noch Gruppe B
NOX-E36: Abschluss einer Nierenschwäche-Studie in Q3/11 - Frage weiterhin: Was genau untersucht diese Studie?
NOX-E36: Start/Einleitung einer P2a-Studie in Diabetischer Nephropathie in Q4/11
NOX-A12: Start/Einleitung einer P1b/2a-Studie in Q3/11 - Frage weiterhin: Welche Indikation?
----------------------------------------------------------------------------------
Anmerkungen:
Bei NOX-E36 scheint alles nach Plan zu laufen, wenn man von einer gewissen zeitlichen Verzögerung absieht. Die vorgesehene P2a in Diabetischer Nephropathie wird wohl ohne Partner laufen, das lässt sich stemmen. Endpunkt der P2a wäre der Proof of Concept für NOX-E36, zumindest in dieser Indikation.
Bei NOX-A12 scheint man vom ursprünglichen Einsatzziel Stammzellenmobilisierung weg zu gehen, davon ist in der Präsentation auch keine Rede mehr. Möglicherweise reicht der Umfang der freigesetzten Stammzellen nicht aus. Stattdessen soll NOX-A12 zur (ergänzenden) Behandlung bei Krebs eingesetzt werden, da dem (zu neutralisierenden) Zielmolekül SDF-1 (= CXCL12) eine Unterstützung von Tumorwachstum und Metastasenbildung anhängt. Die derzeit laufende interne Evaluation wird als Ergebnis das konkrete Untersuchungsfeld liefern müssen, mit dem man die P1b/2a in Q3/11 einleiten will.
http://de.wikipedia.org/wiki/SDF-1
Bei NOX-H94 gibt es keine Neuigkeiten, der P1-Start wurde für Q2/11 bestätigt.
Kernaussage der Präsentation ist m.E. das Ziel von Noxxon, in 2012 den Proof of Concept sowohl für NOX-E36 als auch für NOX-A12 zu erreichen, wenn die (vorläufigen) Daten der jeweiligen P2a-Studie vorliegen (s. Folie 17 unten). Zusammen mit den P1-Ergebnissen von NOX-H94 entsteht dann ein neuer Bewertungsmeilenstein, der zum Exit (IPO oder Trade Sale) führen dürfte.

Danke für deine Infos!!
Konferenz: TIDES 2011 - Boston - 22.-25. Mai 2011
Noxxon ist gleich mit 3 Leuten vor Ort. Die Präsentationen:
Dr. Stefan Vonhoff (May 22, 2.15 pm): Analytical Method Transfer and Validation - Is There an Easy Way?
Dr. Sven Klussmann (May 24, 4.45 pm): Update on Mirror-Image RNA Oligonucleotides in Clinical Trials
Dr. Christian Schmidt (May 25, 10.00 am): Points to Consider in Formulation Development for Spiegelmers and Other Structured Oligonucleotides
Link zur Tagungs-HP: http://www.ibclifesciences.com/TIDES/overview.xml
Noxxon ist gleich mit 3 Leuten vor Ort. Die Präsentationen:
Dr. Stefan Vonhoff (May 22, 2.15 pm): Analytical Method Transfer and Validation - Is There an Easy Way?
Dr. Sven Klussmann (May 24, 4.45 pm): Update on Mirror-Image RNA Oligonucleotides in Clinical Trials
Dr. Christian Schmidt (May 25, 10.00 am): Points to Consider in Formulation Development for Spiegelmers and Other Structured Oligonucleotides
Link zur Tagungs-HP: http://www.ibclifesciences.com/TIDES/overview.xml
Präsentation von Dr. Mangasarian auf dem Euro-Biotech-Forum in Paris (24. Mai 2011)
Folien (pdf): http://www.noxxon.com/downloads/2011-05-24_NOXXON_EuroBiotec…
Folien (pdf): http://www.noxxon.com/downloads/2011-05-24_NOXXON_EuroBiotec…
Die Pipeline füllt sich. Aussagen zu allen Spiegelmere in 2012 angekündigt...
Danke!
Danke!
Konferenz: 10th World Congress on Inflammation - Paris - 25.-29. Juni 2011
Noxxon mit 2 Postern vor Ort:
Schwöbel et al. (P-593): New evidence for the role of MCP-1/CCL2 in copd. Spiegelmer mNOX-E36 is effective in a subchronic smoke mouse model.
Schwöbel et al. (P-594): Effects of the hepcidin binding Spiegelmer NOX-H94 in a model of IL-6 induced anemia.
NOX-E36 kommt scheinbar weiterhin für mehrere Indikationen in Frage. Neben der geplanten P2a-Studie in Diabetischer Nephropathie, die Ende des Jahres starten soll, z.B. auch bei COPD (vgl. auch Folie in Posting #23).
Bei NOX-H94 warten wir auf weitere Infos mit dem P1-Start, der laut Fahrplan unmittelbar bevorstehen müsste.
Link zur Tagungs-HP: http://www.inflammation2011.com/
Noxxon mit 2 Postern vor Ort:
Schwöbel et al. (P-593): New evidence for the role of MCP-1/CCL2 in copd. Spiegelmer mNOX-E36 is effective in a subchronic smoke mouse model.
Schwöbel et al. (P-594): Effects of the hepcidin binding Spiegelmer NOX-H94 in a model of IL-6 induced anemia.
NOX-E36 kommt scheinbar weiterhin für mehrere Indikationen in Frage. Neben der geplanten P2a-Studie in Diabetischer Nephropathie, die Ende des Jahres starten soll, z.B. auch bei COPD (vgl. auch Folie in Posting #23).
Bei NOX-H94 warten wir auf weitere Infos mit dem P1-Start, der laut Fahrplan unmittelbar bevorstehen müsste.
Link zur Tagungs-HP: http://www.inflammation2011.com/
Aktualisierungen des Studien-Tableaus bei clinicaltrials.gov
1) Aufgelistet wird nun die First-in-Human-Studie mit NOX-H94, allerdings wird noch nicht rekrutiert. Diese P1 soll im Juli starten und bis Februar 2012 laufen, und zwar bei Hammersmith Medicines Research in London, einer Klinik, die sich offenbar auf die professionelle Durchführung von (komplexeren) P1-Studien spezialisiert hat. Laut Plan sind sowohl gesunde als auch erkrankte Testpersonen in verschiedenen Dosierungen eingeschlossen.
Sobald die Studie startet, können wir m.E. mit einer ausführlichen Pressemeldung von Noxxon rechnen, die zusätzliche Informationen enthält.
Link zur Studie: http://clinicaltrials.gov/ct2/show/NCT01372137?term=noxxon&r…
--------------------------
2) Ebenfalls neu ist die angekündigte (zusätzliche) Studie mit NOX-E36 bei Patienten mit Nierenschwäche (Nierenversagen, Niereninsuffizienz). Dabei geht es weniger um Verträglichkeit oder Wirksamkeit, sondern vor allem um die Pharmakokinetik, also darum, welchen Einfluss die Nierenschwäche auf den Wirkstoff nimmt (z.B. Dauer und Umfang der Verfügbarkeit im Körper, Ablauf des Ausscheidungsprozesses). Da Nierenschwäche ein wesentlicher Faktor bei Diabetes- bzw. Nephropathie-Patienten ist, soll die Studie Hinweise auf die günstigste NOX-E36-Dosierung in späteren Studien geben.
Diese (offene) P1/2 soll mit 32 Patienten von Juni bis Oktober 2011 in Ungarn und Moldawien laufen. Die Rekrutierung dürfte also in Kürze starten.
Link zur Studie: http://clinicaltrials.gov/ct2/show/NCT01372124?term=noxxon&r…
--------------------------
3) Bei der Mehrfach-Dosis-Studie mit NOX-E36 wurde das Abschluss-Datum jetzt deutlich auf Dezember 2011 erhöht. Außerdem wurde die Liste der behandelnden Kliniken ergänzt.
Vermutlich habe ich Folie 13 in der Präsentation von der "Bio-Europe Spring" (s. Posting #52) falsch interpretiert, als ich schrieb, dass "nur noch" Gruppe B laufe. Auf der Folie steht "Group B ongoing". Das dürfte bedeuten, dass man im März erst bei Gruppe B angekommen war und die beiden Gruppen C und D noch folgen werden. Denn logisch wäre, dass die nächste Gruppe mit der jeweils höheren Dosierung erst starten darf, wenn die laufende Gruppe sicher und verträglich abgeschlossen wurde.
Dann verstehe ich allerdings nicht, wieso auf Folie 14 steht, dass man das Ende der Studie für Q2 2011 erwartete, das konnte dann ja zeitlich gar nicht reichen.
Link zur Präsentation vom März: http://www.noxxon.com/downloads/2011-03-11_NOXXON_BioEurope_…
Link zur Studie: http://clinicaltrials.gov/ct2/show/study/NCT01085292?term=no…
Inwieweit es Probleme gibt und welcher Art die sind (z.B. schleppende Rekrutierung), lässt sich zur DEWB-HV anfragen.
Auch wenn Noxxon die Einleitung der geplanten P2a in Diabetischer Nephropathie noch für Q4 2011 in Aussicht stellt, sollte man m.E. davon ausgehen, dass sich der Start der P2a (Rekrutierung) mindestens in Q1 2012 verschiebt. Denn sowohl die Mehrfach-Dosis-P1b als auch die zusätzliche Nierenschwäche-Studie müssen erst termingerecht beendet und dann umfassend ausgewertet sein.
1) Aufgelistet wird nun die First-in-Human-Studie mit NOX-H94, allerdings wird noch nicht rekrutiert. Diese P1 soll im Juli starten und bis Februar 2012 laufen, und zwar bei Hammersmith Medicines Research in London, einer Klinik, die sich offenbar auf die professionelle Durchführung von (komplexeren) P1-Studien spezialisiert hat. Laut Plan sind sowohl gesunde als auch erkrankte Testpersonen in verschiedenen Dosierungen eingeschlossen.
Sobald die Studie startet, können wir m.E. mit einer ausführlichen Pressemeldung von Noxxon rechnen, die zusätzliche Informationen enthält.
Link zur Studie: http://clinicaltrials.gov/ct2/show/NCT01372137?term=noxxon&r…
--------------------------
2) Ebenfalls neu ist die angekündigte (zusätzliche) Studie mit NOX-E36 bei Patienten mit Nierenschwäche (Nierenversagen, Niereninsuffizienz). Dabei geht es weniger um Verträglichkeit oder Wirksamkeit, sondern vor allem um die Pharmakokinetik, also darum, welchen Einfluss die Nierenschwäche auf den Wirkstoff nimmt (z.B. Dauer und Umfang der Verfügbarkeit im Körper, Ablauf des Ausscheidungsprozesses). Da Nierenschwäche ein wesentlicher Faktor bei Diabetes- bzw. Nephropathie-Patienten ist, soll die Studie Hinweise auf die günstigste NOX-E36-Dosierung in späteren Studien geben.
Diese (offene) P1/2 soll mit 32 Patienten von Juni bis Oktober 2011 in Ungarn und Moldawien laufen. Die Rekrutierung dürfte also in Kürze starten.
Link zur Studie: http://clinicaltrials.gov/ct2/show/NCT01372124?term=noxxon&r…
--------------------------
3) Bei der Mehrfach-Dosis-Studie mit NOX-E36 wurde das Abschluss-Datum jetzt deutlich auf Dezember 2011 erhöht. Außerdem wurde die Liste der behandelnden Kliniken ergänzt.
Vermutlich habe ich Folie 13 in der Präsentation von der "Bio-Europe Spring" (s. Posting #52) falsch interpretiert, als ich schrieb, dass "nur noch" Gruppe B laufe. Auf der Folie steht "Group B ongoing". Das dürfte bedeuten, dass man im März erst bei Gruppe B angekommen war und die beiden Gruppen C und D noch folgen werden. Denn logisch wäre, dass die nächste Gruppe mit der jeweils höheren Dosierung erst starten darf, wenn die laufende Gruppe sicher und verträglich abgeschlossen wurde.
Dann verstehe ich allerdings nicht, wieso auf Folie 14 steht, dass man das Ende der Studie für Q2 2011 erwartete, das konnte dann ja zeitlich gar nicht reichen.
Link zur Präsentation vom März: http://www.noxxon.com/downloads/2011-03-11_NOXXON_BioEurope_…
Link zur Studie: http://clinicaltrials.gov/ct2/show/study/NCT01085292?term=no…
Inwieweit es Probleme gibt und welcher Art die sind (z.B. schleppende Rekrutierung), lässt sich zur DEWB-HV anfragen.
Auch wenn Noxxon die Einleitung der geplanten P2a in Diabetischer Nephropathie noch für Q4 2011 in Aussicht stellt, sollte man m.E. davon ausgehen, dass sich der Start der P2a (Rekrutierung) mindestens in Q1 2012 verschiebt. Denn sowohl die Mehrfach-Dosis-P1b als auch die zusätzliche Nierenschwäche-Studie müssen erst termingerecht beendet und dann umfassend ausgewertet sein.
Konferenz: BIO International Convention - Washington D.C. - 30. Juni 2011
NOXXON Pharma AG to provide Update on Three Development Programs based on proprietary Spiegelmer® Technology at the BIO International Conference on June 30th
Phase II study data for diabetic nephropathy, oncology and anemia of inflammation expected in 2012
Berlin, Germany, 27 June 2011 – NOXXON Pharma AG today will discuss progress of its three development programs including the on-going Phase Ib study of NOX-E36 for the treatment of diabetic nephropathy at the BIO International Convention BIO Business Forum from 9:45-10:00 AM (EDT) in the Capitol Hill room on June 30th.
Spiegelmers® are injectable therapeutics which are chemically and biologically stable, nonimmunogenic and relatively easy to produce. The entire NOXXON Pharma pipeline is based on this proprietary technology. NOXXON also has an ongoing Phase I study of NOX-A12 which will be developed for treatment of hematological and solid tumors. Additionally, next month the company will begin its first clinical study of its Spieglemer® NOX-H94 which will be developed for anemia of inflammation.
“We expect to have Phase II data for our three lead programs in 2012,” said Aram Mangasarian, Chief Business Officer of NOXXON Pharma AG. “This positions NOXXON as a strong candidate for international partnership opportunities in diabetes, oncology and anemia management.”
Both Dr. Aram Mangasarian and Dr. Sven Klussmann, Chief Scientific Officer of NOXXON Pharma will be available during the International BIO Convention for one-on-one meetings.
Quelle (pdf): http://www.noxxon.com/downloads/pressrel/2011-06-27-NOXXON+P…
NOXXON Pharma AG to provide Update on Three Development Programs based on proprietary Spiegelmer® Technology at the BIO International Conference on June 30th
Phase II study data for diabetic nephropathy, oncology and anemia of inflammation expected in 2012
Berlin, Germany, 27 June 2011 – NOXXON Pharma AG today will discuss progress of its three development programs including the on-going Phase Ib study of NOX-E36 for the treatment of diabetic nephropathy at the BIO International Convention BIO Business Forum from 9:45-10:00 AM (EDT) in the Capitol Hill room on June 30th.
Spiegelmers® are injectable therapeutics which are chemically and biologically stable, nonimmunogenic and relatively easy to produce. The entire NOXXON Pharma pipeline is based on this proprietary technology. NOXXON also has an ongoing Phase I study of NOX-A12 which will be developed for treatment of hematological and solid tumors. Additionally, next month the company will begin its first clinical study of its Spieglemer® NOX-H94 which will be developed for anemia of inflammation.
“We expect to have Phase II data for our three lead programs in 2012,” said Aram Mangasarian, Chief Business Officer of NOXXON Pharma AG. “This positions NOXXON as a strong candidate for international partnership opportunities in diabetes, oncology and anemia management.”
Both Dr. Aram Mangasarian and Dr. Sven Klussmann, Chief Scientific Officer of NOXXON Pharma will be available during the International BIO Convention for one-on-one meetings.
Quelle (pdf): http://www.noxxon.com/downloads/pressrel/2011-06-27-NOXXON+P…
Antwort auf Beitrag Nr.: 41.646.687 von Saaletaler am 14.06.11 21:47:11Mehrfach-Dosis-Studie mit NOX-E36
Auf der DEWB-HV wurde heute gesagt, dass die zeitliche Verzögerung dadurch entstanden ist, dass nicht genügend weibliche Testpersonen gefunden werden konnten, die die speziellen Einschluss- bzw. Ausschluss-Kriterien der Studie erfüllen. Deswegen wurde/wird nun die Zahl der Rekrutierungskliniken erhöht.
Generell soll derzeit jedoch alles nach Plan laufen. NOX-A12 soll in Q3 in die P1b/2a starten. Gewisse Verzögerungen muss man einfach prinzipiell einkalkulieren. Wenn tatsächlich in 2012 bei allen 3 Wirkstoffen erste P2-Daten vorliegen würden, wäre das schon phantastisch. Wie gut diese dann sein werden, muss man eh abwarten.
Auf der DEWB-HV wurde heute gesagt, dass die zeitliche Verzögerung dadurch entstanden ist, dass nicht genügend weibliche Testpersonen gefunden werden konnten, die die speziellen Einschluss- bzw. Ausschluss-Kriterien der Studie erfüllen. Deswegen wurde/wird nun die Zahl der Rekrutierungskliniken erhöht.
Generell soll derzeit jedoch alles nach Plan laufen. NOX-A12 soll in Q3 in die P1b/2a starten. Gewisse Verzögerungen muss man einfach prinzipiell einkalkulieren. Wenn tatsächlich in 2012 bei allen 3 Wirkstoffen erste P2-Daten vorliegen würden, wäre das schon phantastisch. Wie gut diese dann sein werden, muss man eh abwarten.
Forschung an intrazellulären Targets
Ebenfalls auf der DEWB-HV wurde erwähnt, dass Noxxon inzwischen auch Spiegelmere für intrazelluläre Targets entwickelt bzw. daran forscht. Noxxon will damit das Potenzial der eigenen Technologie-Plattform noch deutlicher herausstellen und sich zudem von Wettbewerbern abgrenzen, die mit ihren Technologien nur auf extrazelluläre Ziele zugreifen können.
Mag sein, dass Meldungen dazu noch eine Weile auf sich warten lassen werden, je nachdem, wie weit die Entwicklung bereits voran geschritten ist bzw. ob man überhaupt zu guten (präklinischen) Ergebnissen kommt. Dieses Thema sollte man aber zumindest im Hinterkopf behalten, da sich beim Verkauf/IPO von Noxxon die Frage stellen wird, was die Plattform als Ganzes zu leisten in der Lage ist und nicht primär, was ein einzelnes Spiegelmer in einer einzelnen Indikation bei einer potenziellen Zulassung in etwa 5 bis 7 Jahren möglicherweise an Umsatzerlösen generieren wird.
Ebenfalls auf der DEWB-HV wurde erwähnt, dass Noxxon inzwischen auch Spiegelmere für intrazelluläre Targets entwickelt bzw. daran forscht. Noxxon will damit das Potenzial der eigenen Technologie-Plattform noch deutlicher herausstellen und sich zudem von Wettbewerbern abgrenzen, die mit ihren Technologien nur auf extrazelluläre Ziele zugreifen können.
Mag sein, dass Meldungen dazu noch eine Weile auf sich warten lassen werden, je nachdem, wie weit die Entwicklung bereits voran geschritten ist bzw. ob man überhaupt zu guten (präklinischen) Ergebnissen kommt. Dieses Thema sollte man aber zumindest im Hinterkopf behalten, da sich beim Verkauf/IPO von Noxxon die Frage stellen wird, was die Plattform als Ganzes zu leisten in der Lage ist und nicht primär, was ein einzelnes Spiegelmer in einer einzelnen Indikation bei einer potenziellen Zulassung in etwa 5 bis 7 Jahren möglicherweise an Umsatzerlösen generieren wird.
Kombination von NOX-E36 und NOX-A12 bei Diabetischer Nephropathie (?)
In einer aktuellen Publikation (s. unten) unter Beteiligung eines Noxxon-Forschungsteams wird beschrieben, dass es einen zusätzlichen positiven Effekt bei Mäusen mit diabetischen Nierenleiden hat, wenn neben der ursprünglich angedachten Blockade von CCL2/MCP-1 (mit NOX-E36) auch das Protein CXCL12/SDF-1 (mit NOX-A12) neutralisiert wird.
Es würde daher m.E. nicht überraschen, wenn Noxxon in der für 2012 vorgesehenen P2-Studie mit NOX-E36 gegen Diabetische Nephropathie (mindestens) eine Testgruppe einbaut, die sowohl NOX-E36 als auch NOX-A12 verabreicht bekommt, um zu überprüfen, ob auch bei menschlichen Erkrankten dieser positiv verstärkende Doppeleffekt auftritt.
Unabhängig von den Testindikationen im onkologischen Bereich, die bislang noch nicht benannt wurden, könnte NOX-A12 somit einen Nutzen bei der Behandlung von Nierenerkrankungen bei Typ-2-Diabetes aufzeigen. Mein Eindruck ist, dass Noxxon - nachdem der alleinige Einsatz von NOX-A12 zur Stammzellenmobilisierung offenbar verworfen wurde - nun verstärkt nach Kombinationsmöglichkeiten von NOX-A12 mit anderen Wirkstoffen sucht, die gemeinsam einen höheren positiven Effekt erzielen als eine Monotherapie.
Insofern darf man gespannt sein, wie die P1b/2a-Studie mit NOX-A12 konzipiert ist, die laut Fahrplan in Q3/11 starten soll.
------------------------------------------------------------
Darisipudi, M.N. et al. (2011): Dual Blockade of the Homeostatic Chemokine CXCL12 and the Proinflammatory Chemokine CCL2 Has Additive Protective Effects on Diabetic Kidney Disease
http://www.ncbi.nlm.nih.gov/pubmed/21703397
Abstract: Monocyte/ chemoattractant protein-1/chemokine ligand (CCL) 2 and stromal cell-derived factor-1/CXCL12 both contribute to glomerulosclerosis in mice with type 2 diabetes mellitus, through different mechanisms. CCL2 mediates macrophage-related inflammation, whereas CXCL12 contributes to podocyte loss. Therefore, we hypothesized that dual antagonism of these chemokines might have additive protective effects on the progression of diabetic nephropathy. We used chemokine antagonists based on structured l-enantiomeric RNA (so-called Spiegelmers) ie, the CCL2-specific mNOX-E36 and the CXCL12-specific NOX-A12. Male db/db mice, uninephrectomized at the age of 6 weeks, received injections of Spiegelmer, both Spiegelmers, nonfunctional control Spiegelmer, or vehicle from the age of 4 months for 8 weeks. Dual blockade was significantly more effective than monotherapy in preventing glomerulosclerosis. CCL2 blockade reduced glomerular leukocyte counts and renal-inducible nitric oxide synthase or IL-6 mRNA expression. CXCL12 blockade maintained podocyte numbers and renal nephrin and podocin mRNA expression. Consistently, CXCL12 blockade suppressed nephrin mRNA up-regulation in primary cultures of human glomerular progenitors induced to differentiate toward the podocyte lineage. All previously mentioned parameters were significantly improved in the dual-blockade group, which also suppressed proteinuria and was associated with the highest levels of glomerular filtration rate. Blood glucose levels and body weight were identical in all treatment groups. Dual chemokine blockade can have additive effects on the progression of diabetic kidney disease when the respective chemokine targets mediate different pathomechanisms of disease (ie, inflammation and progenitor differentiation toward the podocyte lineage).
In einer aktuellen Publikation (s. unten) unter Beteiligung eines Noxxon-Forschungsteams wird beschrieben, dass es einen zusätzlichen positiven Effekt bei Mäusen mit diabetischen Nierenleiden hat, wenn neben der ursprünglich angedachten Blockade von CCL2/MCP-1 (mit NOX-E36) auch das Protein CXCL12/SDF-1 (mit NOX-A12) neutralisiert wird.
Es würde daher m.E. nicht überraschen, wenn Noxxon in der für 2012 vorgesehenen P2-Studie mit NOX-E36 gegen Diabetische Nephropathie (mindestens) eine Testgruppe einbaut, die sowohl NOX-E36 als auch NOX-A12 verabreicht bekommt, um zu überprüfen, ob auch bei menschlichen Erkrankten dieser positiv verstärkende Doppeleffekt auftritt.
Unabhängig von den Testindikationen im onkologischen Bereich, die bislang noch nicht benannt wurden, könnte NOX-A12 somit einen Nutzen bei der Behandlung von Nierenerkrankungen bei Typ-2-Diabetes aufzeigen. Mein Eindruck ist, dass Noxxon - nachdem der alleinige Einsatz von NOX-A12 zur Stammzellenmobilisierung offenbar verworfen wurde - nun verstärkt nach Kombinationsmöglichkeiten von NOX-A12 mit anderen Wirkstoffen sucht, die gemeinsam einen höheren positiven Effekt erzielen als eine Monotherapie.
Insofern darf man gespannt sein, wie die P1b/2a-Studie mit NOX-A12 konzipiert ist, die laut Fahrplan in Q3/11 starten soll.
------------------------------------------------------------
Darisipudi, M.N. et al. (2011): Dual Blockade of the Homeostatic Chemokine CXCL12 and the Proinflammatory Chemokine CCL2 Has Additive Protective Effects on Diabetic Kidney Disease
http://www.ncbi.nlm.nih.gov/pubmed/21703397
Abstract: Monocyte/ chemoattractant protein-1/chemokine ligand (CCL) 2 and stromal cell-derived factor-1/CXCL12 both contribute to glomerulosclerosis in mice with type 2 diabetes mellitus, through different mechanisms. CCL2 mediates macrophage-related inflammation, whereas CXCL12 contributes to podocyte loss. Therefore, we hypothesized that dual antagonism of these chemokines might have additive protective effects on the progression of diabetic nephropathy. We used chemokine antagonists based on structured l-enantiomeric RNA (so-called Spiegelmers) ie, the CCL2-specific mNOX-E36 and the CXCL12-specific NOX-A12. Male db/db mice, uninephrectomized at the age of 6 weeks, received injections of Spiegelmer, both Spiegelmers, nonfunctional control Spiegelmer, or vehicle from the age of 4 months for 8 weeks. Dual blockade was significantly more effective than monotherapy in preventing glomerulosclerosis. CCL2 blockade reduced glomerular leukocyte counts and renal-inducible nitric oxide synthase or IL-6 mRNA expression. CXCL12 blockade maintained podocyte numbers and renal nephrin and podocin mRNA expression. Consistently, CXCL12 blockade suppressed nephrin mRNA up-regulation in primary cultures of human glomerular progenitors induced to differentiate toward the podocyte lineage. All previously mentioned parameters were significantly improved in the dual-blockade group, which also suppressed proteinuria and was associated with the highest levels of glomerular filtration rate. Blood glucose levels and body weight were identical in all treatment groups. Dual chemokine blockade can have additive effects on the progression of diabetic kidney disease when the respective chemokine targets mediate different pathomechanisms of disease (ie, inflammation and progenitor differentiation toward the podocyte lineage).
Centocor-Studien zu CCL2-Blockade mit Morphosys-Antikörper / Bezug zu NOX-E36
Neben NOX-E36 von Noxxon wird die Blockade von CCL2/MCP-1 auch durch die US-amerikanische Biotech-Firma Centocor, einer Tochter von Johnson & Johnson, getestet. Der Wirkstoff heißt CNTO-888 und basiert auf einem humanen monoklonalen Antikörper von Morphosys.
Centocor hat jedoch mit der Erprobung bei soliden Tumoren und Idiopathischer pulmonaler Fibrose derzeit andere Indikationen auf der Agenda als Noxxon mit Diabetes-Erkrankungen (und evt. COPD). Damit stellt sich die Frage, ob dies patentrechtliche Ursachen hat oder man sich bei den Indikationen gezielt aus dem Weg geht. (Müsste man mal erkunden.)
Denn grob gesprochen dürfte es für die Wirksamkeit des Ansatzes letztlich egal sein, ob CCL2 durch ein Spiegelmer oder durch einen Antikörper ausgeschaltet wird. Die entscheidende Frage ist nämlich, welche Prozesse die Blockade des Zielmoleküls CCL2 im Körper unterbindet oder auslöst. Sollte also CNTO-888 gute Wirksamkeit bei z.B. soliden Tumoren zeigen, dürfte das auch für die Anwendung von NOX-E36 bei soliden Tumoren gelten. Dann entscheiden andere Kriterien (z.B. Verträglichkeit, Kosten, Wirkstoff-Handling), ob man einen Antikörper oder ein Spiegelmer zur Behandlung wählen sollte.
Letzteres führt in der Konsequenz zu einem auf Dauer unvermeidlichen Vergleich zwischen Spiegelmeren und (humanen monoklonalen) Antikörpern bei identischem Zielmolekül und identischer Indikation, der zeigen müsste, ob die eine Wirkstoffklasse der anderen prinzipiell (?) vorzuziehen ist. Diese Frage dürfte bei der Exit-Bewertung von Noxxon m.E. eine massive Rolle spielen.
Link zu den CNTO-888-Studien: http://clinicaltrials.gov/ct2/results?term=CNTO+888
Special Thanks an die "Kollegen" in den Morphosys-Threads für die Recherchen.
Neben NOX-E36 von Noxxon wird die Blockade von CCL2/MCP-1 auch durch die US-amerikanische Biotech-Firma Centocor, einer Tochter von Johnson & Johnson, getestet. Der Wirkstoff heißt CNTO-888 und basiert auf einem humanen monoklonalen Antikörper von Morphosys.
Centocor hat jedoch mit der Erprobung bei soliden Tumoren und Idiopathischer pulmonaler Fibrose derzeit andere Indikationen auf der Agenda als Noxxon mit Diabetes-Erkrankungen (und evt. COPD). Damit stellt sich die Frage, ob dies patentrechtliche Ursachen hat oder man sich bei den Indikationen gezielt aus dem Weg geht. (Müsste man mal erkunden.)
Denn grob gesprochen dürfte es für die Wirksamkeit des Ansatzes letztlich egal sein, ob CCL2 durch ein Spiegelmer oder durch einen Antikörper ausgeschaltet wird. Die entscheidende Frage ist nämlich, welche Prozesse die Blockade des Zielmoleküls CCL2 im Körper unterbindet oder auslöst. Sollte also CNTO-888 gute Wirksamkeit bei z.B. soliden Tumoren zeigen, dürfte das auch für die Anwendung von NOX-E36 bei soliden Tumoren gelten. Dann entscheiden andere Kriterien (z.B. Verträglichkeit, Kosten, Wirkstoff-Handling), ob man einen Antikörper oder ein Spiegelmer zur Behandlung wählen sollte.
Letzteres führt in der Konsequenz zu einem auf Dauer unvermeidlichen Vergleich zwischen Spiegelmeren und (humanen monoklonalen) Antikörpern bei identischem Zielmolekül und identischer Indikation, der zeigen müsste, ob die eine Wirkstoffklasse der anderen prinzipiell (?) vorzuziehen ist. Diese Frage dürfte bei der Exit-Bewertung von Noxxon m.E. eine massive Rolle spielen.
Link zu den CNTO-888-Studien: http://clinicaltrials.gov/ct2/results?term=CNTO+888
Special Thanks an die "Kollegen" in den Morphosys-Threads für die Recherchen.
Antwort auf Beitrag Nr.: 41.767.031 von Saaletaler am 10.07.11 17:05:30Centocor-Studien zu CCL2-Blockade mit Morphosys-Antikörper / Bezug zu NOX-E36 (Ergänzung)
Centocor hat mit seinem CCL2-Antikörper CNTO-888 vielversprechende präklinische Ergebnisse in einer weiteren bedeutenden Indikation publiziert, und zwar bei metastasierendem Brustkrebs.
http://www.nature.com/scibx/journal/v4/n25/full/scibx.2011.6…
Damit erhöht sich die Attraktivität des Targets CCL2 weiter. Es liegen somit inzwischen zu folgenden Indikationen hoffnungsvolle Ergebnisse vor (ohne Anspruch auf Vollständigkeit):
NOX-E36: Komplikationen bei Typ-2-Diabetes (z.B. Diabetische Nephropathie) - P1/2-Studien laufen
NOX-E36: COPD - Präklinische Daten
CNTO-888: solide Tumore (z.B. Prostatakrebs) - P1/2-Studien laufen
CNTO-888: Idiopathische Pulmonale Fibrose - P2-Studie läuft
CNTO-888: metastasierender Brustkrebs - Präklinische Daten
Spannend ist die (bis auf Weiteres) theoretische Frage, wie NOX-E36 und CNTO-888 im direkten Wettbewerb abschneiden würden, also bei gleicher Indikation, z.B. in einer Vergleichsstudie. Momentan sieht es nicht danach aus, als ob es in absehbarer Zeit zu einem solchen direkten Vergleich kommen sollte. Ursache könnten Patentansprüche, strategisches Kalkül, Kostenfragen oder doch medizinisch-pharmakologische Hindernisse sein. Das ist extern nicht einschätzbar.
Centocor hat mit seinem CCL2-Antikörper CNTO-888 vielversprechende präklinische Ergebnisse in einer weiteren bedeutenden Indikation publiziert, und zwar bei metastasierendem Brustkrebs.
http://www.nature.com/scibx/journal/v4/n25/full/scibx.2011.6…
Damit erhöht sich die Attraktivität des Targets CCL2 weiter. Es liegen somit inzwischen zu folgenden Indikationen hoffnungsvolle Ergebnisse vor (ohne Anspruch auf Vollständigkeit):
NOX-E36: Komplikationen bei Typ-2-Diabetes (z.B. Diabetische Nephropathie) - P1/2-Studien laufen
NOX-E36: COPD - Präklinische Daten
CNTO-888: solide Tumore (z.B. Prostatakrebs) - P1/2-Studien laufen
CNTO-888: Idiopathische Pulmonale Fibrose - P2-Studie läuft
CNTO-888: metastasierender Brustkrebs - Präklinische Daten
Spannend ist die (bis auf Weiteres) theoretische Frage, wie NOX-E36 und CNTO-888 im direkten Wettbewerb abschneiden würden, also bei gleicher Indikation, z.B. in einer Vergleichsstudie. Momentan sieht es nicht danach aus, als ob es in absehbarer Zeit zu einem solchen direkten Vergleich kommen sollte. Ursache könnten Patentansprüche, strategisches Kalkül, Kostenfragen oder doch medizinisch-pharmakologische Hindernisse sein. Das ist extern nicht einschätzbar.
Antwort auf Beitrag Nr.: 41.646.687 von Saaletaler am 14.06.11 21:47:11First-in-Human-Studie mit NOX-H94
Die Rekrutierung am HMR in London ist jetzt offenbar angelaufen, siehe Bildchen. Die knappe Beschreibung passt zum Studiendesign. Sobald der erste Proband behandelt wurde, sollte eigentlich die offizielle Meldung von Noxxon kommen.

Quelle: http://www.londontrials.com/
Die Rekrutierung am HMR in London ist jetzt offenbar angelaufen, siehe Bildchen. Die knappe Beschreibung passt zum Studiendesign. Sobald der erste Proband behandelt wurde, sollte eigentlich die offizielle Meldung von Noxxon kommen.

Quelle: http://www.londontrials.com/
Antwort auf Beitrag Nr.: 41.870.354 von Saaletaler am 31.07.11 15:11:32First-in-Human-Studie mit NOX-H94
Habe die Information erhalten, dass die erste Dosierung der Studie bereits Anfang Juli erfolgt ist. Das ist prima und vielleicht geht es flott voran. Schade, dass es bislang keine offizielle PM gab und der Studienstatus bei clinicaltrials.gov noch nicht aktualisiert wurde.
Link zur Studie: http://clinicaltrials.gov/ct2/show/NCT01372137?term=noxxon&r…
Habe die Information erhalten, dass die erste Dosierung der Studie bereits Anfang Juli erfolgt ist. Das ist prima und vielleicht geht es flott voran. Schade, dass es bislang keine offizielle PM gab und der Studienstatus bei clinicaltrials.gov noch nicht aktualisiert wurde.
Link zur Studie: http://clinicaltrials.gov/ct2/show/NCT01372137?term=noxxon&r…
NOXXON beginnt Phase I Studie von NOX-H94 für die Anämie der chronischen Erkrankung
Erstanwendungsstudie für ein drittes Spiegelmer® im Menschen
Berlin, 6. September 2011 - NOXXON Pharma gab heute den Start einer klinischen Phase I Studie für NOX-H94 bekannt; damit geht der dritte Wirkstoffkandidat der Firma in die klinische Testphase. Das Spiegelmer® NOX-H94 wird zur Behandlung der Anämie bei chronischen Erkrankungen entwickelt. NOX-H94 bindet und inhibiert das Peptidhormon Hepcidin, den zentralen Regulator des Eisenstoffwechsels. Der Hepcidinspiegel steigt bei akuten und chronischen Entzündungsreaktionen an und führt so zu einem sogenannten „funktionellen Eisenmangel“. In diesem Zustand ist das Eisen zwar in Körperzellen gespeichert, kann aber nicht freigesetzt werden und steht somit nicht für die Hämoglobin-Synthese zur Verfügung (1). Dies steht im Gegensatz zum klassischen Eisenmangel, bei dem die Eisenspeicher des Körpers leer sind.
Den Studienteilnehmern werden zunächst ansteigende Einzeldosen von NOX-H94 verabreicht, anschließend wird auch eine Mehrfachgabe stattfinden. Dabei wird sowohl die intravenöse als auch die subkutane Verabreichungsform untersucht. Das primäre Ziel der Studie ist es, die Sicherheit und Verträglichkeit von NOX-H94 zu prüfen. Darüber hinaus sollen die Pharmakokinetik und pharmakodynamische Effekte der Substanz untersucht werden.
Iain Buchanan, der Chief Executive Officer von NOXXON, sagte dazu: „Der vor kurzem erfolgte Start von NOX-H94 Studien am Menschen bringt das dritte Spiegelmer® Produkt in die klinische Erprobung. Dies unterstreicht die Weiterentwicklung von NOXXON zu einer Firma mit einem attraktiven Portfolio von Projekten in der klinischen Entwicklungsphase. Vorläufige Daten aus dieser Studie legen nahe, dass NOX-H94 sicher und gut verträglich ist und die aus den präklinischen Studien vorhergesagten pharmakodynamischen Effekte zeigt. NOXXON wird im Laufe des Jahres ein weiteres Update über den Fortschritt bei NOX-H94 und anderen Verbindungen aus seiner Pipeline geben.“
Die Ursachen der Anämie der chronischen Erkrankung sind vor allem Infektionen, Krebs, Autoimmunerkrankungen und chronische Nierenerkrankungen. Die geschätzte Prävalenz bei bestimmten Krebsarten und Autoimmunerkrankungen liegt bei ca. 70% und somit besteht ein bedeutender medizinischer Bedarf auf diesem Gebiet. Es wird geschätzt, dass mehr als 1 Million Menschen in den USA an Anämie der chronischen Erkrankung leiden (2).
Über NOXXON Pharma AG
NOXXON Pharma ist ein biopharmazeutisches Unternehmen und Pionier bei der Entwicklung von Spiegelmeren®, einer patentierten neuen Wirkstoffklasse. Spiegelmere® stellen chemisch synthetisierte, nicht-immunogene Alternativen zu Antikörpern dar. NOXXON verfügt über ein diversifiziertes Portfolio von Spiegelmer®-Wirkstoffen im klinischen Entwicklungsstadium:
- NOX-E36 inhibiert das entzündungsfördernde Chemokin MCP-1
(CCL2) und befindet sich derzeit in einer Phase Ib Studie für
diabetische Nephropathie.
- NOX-A12 inhibiert SDF-1 (CXCL12), ein Chemokin, das bei der
Metastasierung und Chemotherapieresistenz bei Krebs eine
Rolle spielt. Es befindet sich derzeit in Phase I.
- NOX-H94 wird derzeit in Phase I getestet und wirkt auf Hepcidin,
einen zentralen Regulator des Eisenstoffwechsels und Vermittler
des funktionellen Eisenmangels bei der Anämie der chronischen
Erkrankung.
Mit der Spiegelmer®-Technologie verfügt das Unternehmen über eine leistungsstarke und einzigartige Plattform für die Identifizierung neuer Wirkstoffkandidaten, von denen sich einige weitere bereits in präklinischen Untersuchungen befinden. NOXXON hat seinen Firmensitz in Berlin und ist ein gut finanziertes und etabliertes Biotechnologieunternehmen mit einem starken Konsortium internationaler Investoren, ca. 60 Mitarbeitern und einem erfahrenen Management-Team.
Für weitere Informationen besuchen Sie bitte: www.noxxon.com
Über NOX-H94
NOX-H94 ist ein Spiegelmer®-Wirkstoff, der das eisenregulierende Protein Hepcidin bindet. Hepcidin ist über seine Wirkung auf Ferroportin, dem einzigen bekannten Eisen-Export-Protein, der Hauptregulator der Eisen-Homöostase. Die Cytokin-induzierte Synthese von Hepcidin spielt eine entscheidende Rolle bei der Eisenretention in Makrophagen, wodurch eine Anämie bei Entzündungen entsteht, da nicht genug Eisen für blutbildende Vorläuferzellen zur Verfügung steht. Patienten mit Entzündungsanämien zeigen auch eine gestörte Reaktion auf Erythropoietin (EPO). Der Wirkstoff ist ein 44-Nukleotid-L-RNA-Oligonukleotid in Verbindung mit 40 kDa PEG (Polyethylenglykol). Präklinische Studien haben gezeigt, dass dieser Wirkstoff IL-6-induzierte Anämien verhindert und eine ähnliche Pharmakokinetik wie andere Spiegelmere® hat. Die Verbindung kann intravenös oder subkutan verabreicht werden. NOXXON erhält Forschungszuschüsse im Rahmen des Programms „KMU-innovativ“ des deutschen Bundesministeriums für Bildung und Forschung (BMBF) für die präklinische Entwicklung und die erste klinische Studie im Menschen mit NOX-H94.
Literaturangaben:
1) Guenter Weiss, M.D., and Lawrence T. Goodnough, M.D., (2005) Anemia of Chronic Disease, N Engl J Med 2005; 352:1011-1023.
2) Gary J. Vanasse and Nancy Berliner (2010) Anemia in Elderly Patients: An Emerging Problem for the 21st Century, Hematology, 2010:271-5).
Erstanwendungsstudie für ein drittes Spiegelmer® im Menschen
Berlin, 6. September 2011 - NOXXON Pharma gab heute den Start einer klinischen Phase I Studie für NOX-H94 bekannt; damit geht der dritte Wirkstoffkandidat der Firma in die klinische Testphase. Das Spiegelmer® NOX-H94 wird zur Behandlung der Anämie bei chronischen Erkrankungen entwickelt. NOX-H94 bindet und inhibiert das Peptidhormon Hepcidin, den zentralen Regulator des Eisenstoffwechsels. Der Hepcidinspiegel steigt bei akuten und chronischen Entzündungsreaktionen an und führt so zu einem sogenannten „funktionellen Eisenmangel“. In diesem Zustand ist das Eisen zwar in Körperzellen gespeichert, kann aber nicht freigesetzt werden und steht somit nicht für die Hämoglobin-Synthese zur Verfügung (1). Dies steht im Gegensatz zum klassischen Eisenmangel, bei dem die Eisenspeicher des Körpers leer sind.
Den Studienteilnehmern werden zunächst ansteigende Einzeldosen von NOX-H94 verabreicht, anschließend wird auch eine Mehrfachgabe stattfinden. Dabei wird sowohl die intravenöse als auch die subkutane Verabreichungsform untersucht. Das primäre Ziel der Studie ist es, die Sicherheit und Verträglichkeit von NOX-H94 zu prüfen. Darüber hinaus sollen die Pharmakokinetik und pharmakodynamische Effekte der Substanz untersucht werden.
Iain Buchanan, der Chief Executive Officer von NOXXON, sagte dazu: „Der vor kurzem erfolgte Start von NOX-H94 Studien am Menschen bringt das dritte Spiegelmer® Produkt in die klinische Erprobung. Dies unterstreicht die Weiterentwicklung von NOXXON zu einer Firma mit einem attraktiven Portfolio von Projekten in der klinischen Entwicklungsphase. Vorläufige Daten aus dieser Studie legen nahe, dass NOX-H94 sicher und gut verträglich ist und die aus den präklinischen Studien vorhergesagten pharmakodynamischen Effekte zeigt. NOXXON wird im Laufe des Jahres ein weiteres Update über den Fortschritt bei NOX-H94 und anderen Verbindungen aus seiner Pipeline geben.“
Die Ursachen der Anämie der chronischen Erkrankung sind vor allem Infektionen, Krebs, Autoimmunerkrankungen und chronische Nierenerkrankungen. Die geschätzte Prävalenz bei bestimmten Krebsarten und Autoimmunerkrankungen liegt bei ca. 70% und somit besteht ein bedeutender medizinischer Bedarf auf diesem Gebiet. Es wird geschätzt, dass mehr als 1 Million Menschen in den USA an Anämie der chronischen Erkrankung leiden (2).
Über NOXXON Pharma AG
NOXXON Pharma ist ein biopharmazeutisches Unternehmen und Pionier bei der Entwicklung von Spiegelmeren®, einer patentierten neuen Wirkstoffklasse. Spiegelmere® stellen chemisch synthetisierte, nicht-immunogene Alternativen zu Antikörpern dar. NOXXON verfügt über ein diversifiziertes Portfolio von Spiegelmer®-Wirkstoffen im klinischen Entwicklungsstadium:
- NOX-E36 inhibiert das entzündungsfördernde Chemokin MCP-1
(CCL2) und befindet sich derzeit in einer Phase Ib Studie für
diabetische Nephropathie.
- NOX-A12 inhibiert SDF-1 (CXCL12), ein Chemokin, das bei der
Metastasierung und Chemotherapieresistenz bei Krebs eine
Rolle spielt. Es befindet sich derzeit in Phase I.
- NOX-H94 wird derzeit in Phase I getestet und wirkt auf Hepcidin,
einen zentralen Regulator des Eisenstoffwechsels und Vermittler
des funktionellen Eisenmangels bei der Anämie der chronischen
Erkrankung.
Mit der Spiegelmer®-Technologie verfügt das Unternehmen über eine leistungsstarke und einzigartige Plattform für die Identifizierung neuer Wirkstoffkandidaten, von denen sich einige weitere bereits in präklinischen Untersuchungen befinden. NOXXON hat seinen Firmensitz in Berlin und ist ein gut finanziertes und etabliertes Biotechnologieunternehmen mit einem starken Konsortium internationaler Investoren, ca. 60 Mitarbeitern und einem erfahrenen Management-Team.
Für weitere Informationen besuchen Sie bitte: www.noxxon.com
Über NOX-H94
NOX-H94 ist ein Spiegelmer®-Wirkstoff, der das eisenregulierende Protein Hepcidin bindet. Hepcidin ist über seine Wirkung auf Ferroportin, dem einzigen bekannten Eisen-Export-Protein, der Hauptregulator der Eisen-Homöostase. Die Cytokin-induzierte Synthese von Hepcidin spielt eine entscheidende Rolle bei der Eisenretention in Makrophagen, wodurch eine Anämie bei Entzündungen entsteht, da nicht genug Eisen für blutbildende Vorläuferzellen zur Verfügung steht. Patienten mit Entzündungsanämien zeigen auch eine gestörte Reaktion auf Erythropoietin (EPO). Der Wirkstoff ist ein 44-Nukleotid-L-RNA-Oligonukleotid in Verbindung mit 40 kDa PEG (Polyethylenglykol). Präklinische Studien haben gezeigt, dass dieser Wirkstoff IL-6-induzierte Anämien verhindert und eine ähnliche Pharmakokinetik wie andere Spiegelmere® hat. Die Verbindung kann intravenös oder subkutan verabreicht werden. NOXXON erhält Forschungszuschüsse im Rahmen des Programms „KMU-innovativ“ des deutschen Bundesministeriums für Bildung und Forschung (BMBF) für die präklinische Entwicklung und die erste klinische Studie im Menschen mit NOX-H94.
Literaturangaben:
1) Guenter Weiss, M.D., and Lawrence T. Goodnough, M.D., (2005) Anemia of Chronic Disease, N Engl J Med 2005; 352:1011-1023.
2) Gary J. Vanasse and Nancy Berliner (2010) Anemia in Elderly Patients: An Emerging Problem for the 21st Century, Hematology, 2010:271-5).
Aktueller Interview-basierter Internet-Artikel mit sehr interessanten Aussagen zur Strategie!
--------------------------------------------------------------------------------------------------------------------------
EP Vantage Interview – Noxxon's transformation entering pivotal phase
http://www.evaluatepharma.com/Universal/View.aspx?type=Story…
Source: EP Vantage
Company: NOXXON Pharma
Date: September 15, 2011
Noxxon Pharma’s transition from a technology platform based company to one developing its own product portfolio is reaching a pivotal phase. With contract research style deals with the likes of Pfizer, Roche and Eli Lilly having come and gone, the private German biotech now has three internally-derived and unpartnered candidates in the clinic.
Early-stage trial results over the next 12 months could provide Noxxon with that all-important proof-of-principle data, which Iain Buchanan, chief executive, hopes will spark some serious partnership discussions: “The burden of proof in today’s market falls a great deal on the companies. We’ve had to invest in our pipeline to generate data that will persuade people that this is a valid approach.” That approach, based on developing chemically synthesised RNA oligonucleotides, presents another challenge with Mr Buchanan keen to distance Noxxon’s technology from the somewhat stuttering field of RNAi and antisense based therapeutics.
Mirror image
Established in 1997, Noxxon has developed a technology platform which produces so-called ‘spiegelmers’, essentially mirror images of RNA molecules. These compounds are comparable to proteins in structure, bind to molecular targets in a similar manner to antibodies, yet are chemically synthesised and therefore do not require complex biological production processes.
The potential in the technology received validation of sorts through a number of deals struck with big pharma companies. Pfizer in 2006, Roche in 2007 and Eli Lilly in 2008 all signed broad research collaborations with Noxxon, but these were contract research in nature, with the German company tasked with applying its spiegelmer technology to identify candidates against specific targets provided by its partners.
However, all these partnerships fizzled out, prompting Noxxon’s switch to developing its own spiegelmer candidates and initiating its first clinical trial in June 2009 with NOX-E36, which remains its most advanced product.
NOX-E36 – which targets monocyte chemotactic protein-1 (MCP-1, also known as CCL2), a key pro-inflammatory chemokine – is currently undergoing a phase Ib trial in diabetic nephropathy. Results should be available by the end of the year, with the aim of starting a phase II trial in the first quarter of 2012 which should then read out by the third quarter.
Noxxon’s has two other phase I candidates. NOX-A12 also entered the clinic in 2009 and holds potential to treat a range of cancers, but initially is being developed for haematological tumours such as chronic lymphocytic leukaemia and multiple myeloma. A phase I trial of NOX-H94 started last week, with the intention to treat anaemia of chronic disease by targeting the peptide hormone hepcidin. Phase II trials of both these compounds should also start early next year.
Proof in the pudding
The results from these trials with all three candidates will go a long way to providing greater validation of Noxxon’s technology, which is likely to have a significant bearing on partnership discussions.
Having completed a €35m ($44m) series D financing round last year, the company is reasonably placed to fulfil its short-term commitments to developing its three clinical candidates across multiple indications. “Our cash balance is certainly sufficient to take us through to the first quarter of 2013,” says Mr Buchanan, a prediction which excludes any potential cash flow from partnerships.
As for those potential partners, Mr Buchanan is naturally keen to collaborate with companies which offer clinical trial expertise in the therapeutic areas that match Noxxon’s candidates. “We’re at an interesting stage and certainly getting some preliminary interest from some of the people who have been tracking us.”
Given Noxxon’s relative maturity, some longer-term investors might be hoping positive trial data could lead to an exit in the form of a trade sale or IPO, although the latter remains a long shot according to Mr Buchanan: “Never say never, but I don’t spend a great deal of my time worrying about preparing a prospectus for a public offering.”
And although the company has been around for almost 15 years, Noxxon underwent a major re-financing in 2007 through a series C, which brought in the likes of TVM Capital, Sofinnova Partners and Edmond de Rothschild Investment Partners, followed by NGN Capital who led the series D last year. As such, investor pressure to exit will have been eased somewhat.
Antibody like
Aside from the challenges of generating positive clinical data, in terms of attracting broad partnership interest it seems the company has a bit of re-branding to do with regard to how it positions its technology, which has some similarities to both antibody and RNAi products.
Given the disappointment of the RNAi and antisense field so far to meet lofty expectations (Vantage Point - Clinical progress required to reignite RNAi field, May 20, 2011), Mr Buchanan is nailing Noxxon’s flag firmly to the antibody mast.
“There is healthy scepticism around sRNA and antisense molecules, that there has not been the dramatic success that some people had anticipated many years ago when investments were being made. People falsely put Noxxon in the same bucket as Alnylam Pharmaceuticals or Silence Therapeutics, but we’re not, we’re far more in the same (antibody-alternative) space as the likes of F-Star, Ablynx and Bicycle Therapeutics.”
By positioning its spiegelmers more as chemical antibodies, Noxxon will be hoping to mimic the relative success so far of MorphoSys rather than suffer the setbacks Alnylam has experienced. Both companies are also attempting to make that tough transition from technology platform to internal product development.
How successful Noxxon will be in making its transformation depends heavily on the ability of its three clinical candidates to deliver safe and effective data.
“Whichever way you cut it, 2012 will certainly be a year of transition for the company,” says Mr Buchanan. “We will have clinical results which will hopefully enhance the value of the company. What the company does thereafter, and how it manages that through partnerships in the future, we’ll have to see.”
--------------------------------------------------------------------------------------------------------------------------
EP Vantage Interview – Noxxon's transformation entering pivotal phase
http://www.evaluatepharma.com/Universal/View.aspx?type=Story…
Source: EP Vantage
Company: NOXXON Pharma
Date: September 15, 2011
Noxxon Pharma’s transition from a technology platform based company to one developing its own product portfolio is reaching a pivotal phase. With contract research style deals with the likes of Pfizer, Roche and Eli Lilly having come and gone, the private German biotech now has three internally-derived and unpartnered candidates in the clinic.
Early-stage trial results over the next 12 months could provide Noxxon with that all-important proof-of-principle data, which Iain Buchanan, chief executive, hopes will spark some serious partnership discussions: “The burden of proof in today’s market falls a great deal on the companies. We’ve had to invest in our pipeline to generate data that will persuade people that this is a valid approach.” That approach, based on developing chemically synthesised RNA oligonucleotides, presents another challenge with Mr Buchanan keen to distance Noxxon’s technology from the somewhat stuttering field of RNAi and antisense based therapeutics.
Mirror image
Established in 1997, Noxxon has developed a technology platform which produces so-called ‘spiegelmers’, essentially mirror images of RNA molecules. These compounds are comparable to proteins in structure, bind to molecular targets in a similar manner to antibodies, yet are chemically synthesised and therefore do not require complex biological production processes.
The potential in the technology received validation of sorts through a number of deals struck with big pharma companies. Pfizer in 2006, Roche in 2007 and Eli Lilly in 2008 all signed broad research collaborations with Noxxon, but these were contract research in nature, with the German company tasked with applying its spiegelmer technology to identify candidates against specific targets provided by its partners.
However, all these partnerships fizzled out, prompting Noxxon’s switch to developing its own spiegelmer candidates and initiating its first clinical trial in June 2009 with NOX-E36, which remains its most advanced product.
NOX-E36 – which targets monocyte chemotactic protein-1 (MCP-1, also known as CCL2), a key pro-inflammatory chemokine – is currently undergoing a phase Ib trial in diabetic nephropathy. Results should be available by the end of the year, with the aim of starting a phase II trial in the first quarter of 2012 which should then read out by the third quarter.
Noxxon’s has two other phase I candidates. NOX-A12 also entered the clinic in 2009 and holds potential to treat a range of cancers, but initially is being developed for haematological tumours such as chronic lymphocytic leukaemia and multiple myeloma. A phase I trial of NOX-H94 started last week, with the intention to treat anaemia of chronic disease by targeting the peptide hormone hepcidin. Phase II trials of both these compounds should also start early next year.
Proof in the pudding
The results from these trials with all three candidates will go a long way to providing greater validation of Noxxon’s technology, which is likely to have a significant bearing on partnership discussions.
Having completed a €35m ($44m) series D financing round last year, the company is reasonably placed to fulfil its short-term commitments to developing its three clinical candidates across multiple indications. “Our cash balance is certainly sufficient to take us through to the first quarter of 2013,” says Mr Buchanan, a prediction which excludes any potential cash flow from partnerships.
As for those potential partners, Mr Buchanan is naturally keen to collaborate with companies which offer clinical trial expertise in the therapeutic areas that match Noxxon’s candidates. “We’re at an interesting stage and certainly getting some preliminary interest from some of the people who have been tracking us.”
Given Noxxon’s relative maturity, some longer-term investors might be hoping positive trial data could lead to an exit in the form of a trade sale or IPO, although the latter remains a long shot according to Mr Buchanan: “Never say never, but I don’t spend a great deal of my time worrying about preparing a prospectus for a public offering.”
And although the company has been around for almost 15 years, Noxxon underwent a major re-financing in 2007 through a series C, which brought in the likes of TVM Capital, Sofinnova Partners and Edmond de Rothschild Investment Partners, followed by NGN Capital who led the series D last year. As such, investor pressure to exit will have been eased somewhat.
Antibody like
Aside from the challenges of generating positive clinical data, in terms of attracting broad partnership interest it seems the company has a bit of re-branding to do with regard to how it positions its technology, which has some similarities to both antibody and RNAi products.
Given the disappointment of the RNAi and antisense field so far to meet lofty expectations (Vantage Point - Clinical progress required to reignite RNAi field, May 20, 2011), Mr Buchanan is nailing Noxxon’s flag firmly to the antibody mast.
“There is healthy scepticism around sRNA and antisense molecules, that there has not been the dramatic success that some people had anticipated many years ago when investments were being made. People falsely put Noxxon in the same bucket as Alnylam Pharmaceuticals or Silence Therapeutics, but we’re not, we’re far more in the same (antibody-alternative) space as the likes of F-Star, Ablynx and Bicycle Therapeutics.”
By positioning its spiegelmers more as chemical antibodies, Noxxon will be hoping to mimic the relative success so far of MorphoSys rather than suffer the setbacks Alnylam has experienced. Both companies are also attempting to make that tough transition from technology platform to internal product development.
How successful Noxxon will be in making its transformation depends heavily on the ability of its three clinical candidates to deliver safe and effective data.
“Whichever way you cut it, 2012 will certainly be a year of transition for the company,” says Mr Buchanan. “We will have clinical results which will hopefully enhance the value of the company. What the company does thereafter, and how it manages that through partnerships in the future, we’ll have to see.”
Antwort auf Beitrag Nr.: 42.097.720 von Saaletaler am 16.09.11 15:49:26Hallo Saaletaler,
zunächst mal vielen Dank für diesen sehr interessanten und immer lesenswerten Thread!
Aus dem letzten Beitrag zwei Zitate:
"Noxxon will be hoping to mimic the relative success so far of MorphoSys rather than suffer the setbacks Alnylam has experienced."
"Pfizer in 2006, Roche in 2007 and Eli Lilly in 2008 all signed broad research collaborations with Noxxon, but these were contract research in nature, with the German company tasked with applying its spiegelmer technology to identify candidates against specific targets provided by its partners.
However, all these partnerships fizzled out"
Basis des bisherigen Erfolges von MorphoSys sind insbesondere auch die vielen produktiven Partnerschaften, vor allem natürlich die strategische Partnerschaft mit Novartis.
Nicht nur, dass diese Partnerschaften für regelmäßige Einnahmen sorgen, sie haben aus Sicht des Investors auch die Technologieplattform von MorphoSys validiert.
Die Frage ist, warum Noxxon keine erfolgreichen Partnerschaften vorweisen kann. Liegt es am mangelnden Interesse der Pharmaindustrie? Sind die ignorant? Oder ist man dort der Ansicht, dass der ganze Ansatz nicht das leisten kann, was Noxxon sich davon verspricht?
Oder sehe ich das grundsätzlich falsch?
Gruß
zunächst mal vielen Dank für diesen sehr interessanten und immer lesenswerten Thread!
Aus dem letzten Beitrag zwei Zitate:
"Noxxon will be hoping to mimic the relative success so far of MorphoSys rather than suffer the setbacks Alnylam has experienced."
"Pfizer in 2006, Roche in 2007 and Eli Lilly in 2008 all signed broad research collaborations with Noxxon, but these were contract research in nature, with the German company tasked with applying its spiegelmer technology to identify candidates against specific targets provided by its partners.
However, all these partnerships fizzled out"
Basis des bisherigen Erfolges von MorphoSys sind insbesondere auch die vielen produktiven Partnerschaften, vor allem natürlich die strategische Partnerschaft mit Novartis.
Nicht nur, dass diese Partnerschaften für regelmäßige Einnahmen sorgen, sie haben aus Sicht des Investors auch die Technologieplattform von MorphoSys validiert.
Die Frage ist, warum Noxxon keine erfolgreichen Partnerschaften vorweisen kann. Liegt es am mangelnden Interesse der Pharmaindustrie? Sind die ignorant? Oder ist man dort der Ansicht, dass der ganze Ansatz nicht das leisten kann, was Noxxon sich davon verspricht?
Oder sehe ich das grundsätzlich falsch?
Gruß
Antwort auf Beitrag Nr.: 42.098.555 von SLGramann am 16.09.11 17:57:14Hallo SLGramann,
zunächst freue ich mich sehr, dass sich seit langer Zeit wieder jemand in die "Diskussion" einklinkt, zumal ich Deine Biotech-Expertise sehr schätze.
Da Noxxon komplett in VC-Hand liegt, ist es noch schwieriger, an konkrete strategische Informationen zu gelangen, als das bei börsennotierten Biotechs ohnehin schon der Fall ist. Auch DEWB hat sich (mir gegenüber) klar geäußert, dass man nicht befugt ist, Noxxon-Interna (z.B. aus den AR-Sitzungen) an die DEWB-Aktionäre weiterzugeben. Insofern sind wir auf die offiziellen PM von Noxxon angewiesen bzw. auf das, was man im Netz so findet. Alles, was über das "Zitierbare" hinaus geht, ist letztlich meine eigene Meinung.
Insofern können wir/ich nur spekulieren, warum die Partnerschaften ausgelaufen sind. Zumindest bei der Pfizer-Vereinbarung 2006 ist m.E. offensichtlich, dass Noxxon zu sehr schlechten Konditionen abgeschlossen haben dürfte. Denn damals war die Kasse leer, und ohne den Pfizer-Deal wäre die Runde-C-Finanzierung möglicherweise gar nicht zustande gekommen. Die Deals mit Roche und Eli Lilly kann ich überhaupt nicht beurteilen. Bei Lilly wurde später eine Meilenstein-Zahlung vermeldet. Keine Ahnung, ob das Projekt noch läuft.
Ich vermute, dass die Big Boys beim Auslaufen der Partnerschaften nicht bereit waren, (deutlich) bessere Konditionen für eine Verlängerung zu akzeptieren, da noch kein PoC der Technologie vorlag. Noxxon seinerseits hatte genug Geld in der Kasse und war deswegen möglicherweise nicht bereit, auf schlechte Konditionen einzugehen. Stattdessen zieht Noxxon nun allein die 3 Lead-Kandidaten bis zur P2 durch.
Sofern sich die PoC-Entscheidung 2012 positiv abzeichnet - wobei man m.E. zwingend zwischen dem PoC der Technologie ansich und dem PoC bei einzelnen Targets unterscheiden muss -, ist Noxxon ein hoch attraktiver Exit-Kandidat für einen Big Player, weil dann eben in der gesamten Spiegelmer-Technologie kein anderer Pharma seine Finger im Spiel hat. Diese Exklusivität dürfte bei der strategischen Planung, die wohl auf einen maximalen Exit-Wert für einen Trade Sale hinaus läuft, eine wichtige Rolle spielen.
Außerdem sind im Aktionärskreis immerhin einige Pharmas vertreten, u.a. weiterhin Pfizer (s. Posting #31) und jüngst auch BI Venture.
Sollte sich wider erwarten ein IPO abzeichnen, wäre ein Modell a la MOR natürlich sehr anstrebenswert, um die Finanzierung auf breite Beine zu stellen. Aber auch bei MOR läuft ja die Forums-Diskussion darauf hinaus, dass eine (wahrscheinliche) Übernahme für Novartis umso lukrativer wird, je weniger Kooperationen MOR mit anderen Pharmas zu laufen hat. Das könnte eben auch das entscheidende Argument für Noxxon sein, möglichst wenige Partner ins Boot zu holen. Und wenn doch, dann nur zu top Konditionen (z.B. erst nach PoC).
M.E. lässt sich extern bislang nicht beurteilen, ob die Spiegelmer-Technologie Vorteile ggb. Antikörpern hat oder nicht (z.B. Immunogenität, Handling, Kosten, Zellgängigkeit). Wenn Noxxon intern davon überzeugt ist, dann wird man wohl versuchen, diese Vorteile in den nächsten Präsentationen darzustellen und die Spiegelmere als Alternative zu Antikörpern zu positionieren. Vielleicht bekommen wir demnächst mal ein paar solche Folien zu sehen, Noxxon präsentiert im Herbst auf einigen Konferenzen.
Grüße
zunächst freue ich mich sehr, dass sich seit langer Zeit wieder jemand in die "Diskussion" einklinkt, zumal ich Deine Biotech-Expertise sehr schätze.
Da Noxxon komplett in VC-Hand liegt, ist es noch schwieriger, an konkrete strategische Informationen zu gelangen, als das bei börsennotierten Biotechs ohnehin schon der Fall ist. Auch DEWB hat sich (mir gegenüber) klar geäußert, dass man nicht befugt ist, Noxxon-Interna (z.B. aus den AR-Sitzungen) an die DEWB-Aktionäre weiterzugeben. Insofern sind wir auf die offiziellen PM von Noxxon angewiesen bzw. auf das, was man im Netz so findet. Alles, was über das "Zitierbare" hinaus geht, ist letztlich meine eigene Meinung.
Insofern können wir/ich nur spekulieren, warum die Partnerschaften ausgelaufen sind. Zumindest bei der Pfizer-Vereinbarung 2006 ist m.E. offensichtlich, dass Noxxon zu sehr schlechten Konditionen abgeschlossen haben dürfte. Denn damals war die Kasse leer, und ohne den Pfizer-Deal wäre die Runde-C-Finanzierung möglicherweise gar nicht zustande gekommen. Die Deals mit Roche und Eli Lilly kann ich überhaupt nicht beurteilen. Bei Lilly wurde später eine Meilenstein-Zahlung vermeldet. Keine Ahnung, ob das Projekt noch läuft.
Ich vermute, dass die Big Boys beim Auslaufen der Partnerschaften nicht bereit waren, (deutlich) bessere Konditionen für eine Verlängerung zu akzeptieren, da noch kein PoC der Technologie vorlag. Noxxon seinerseits hatte genug Geld in der Kasse und war deswegen möglicherweise nicht bereit, auf schlechte Konditionen einzugehen. Stattdessen zieht Noxxon nun allein die 3 Lead-Kandidaten bis zur P2 durch.
Sofern sich die PoC-Entscheidung 2012 positiv abzeichnet - wobei man m.E. zwingend zwischen dem PoC der Technologie ansich und dem PoC bei einzelnen Targets unterscheiden muss -, ist Noxxon ein hoch attraktiver Exit-Kandidat für einen Big Player, weil dann eben in der gesamten Spiegelmer-Technologie kein anderer Pharma seine Finger im Spiel hat. Diese Exklusivität dürfte bei der strategischen Planung, die wohl auf einen maximalen Exit-Wert für einen Trade Sale hinaus läuft, eine wichtige Rolle spielen.
Außerdem sind im Aktionärskreis immerhin einige Pharmas vertreten, u.a. weiterhin Pfizer (s. Posting #31) und jüngst auch BI Venture.
Sollte sich wider erwarten ein IPO abzeichnen, wäre ein Modell a la MOR natürlich sehr anstrebenswert, um die Finanzierung auf breite Beine zu stellen. Aber auch bei MOR läuft ja die Forums-Diskussion darauf hinaus, dass eine (wahrscheinliche) Übernahme für Novartis umso lukrativer wird, je weniger Kooperationen MOR mit anderen Pharmas zu laufen hat. Das könnte eben auch das entscheidende Argument für Noxxon sein, möglichst wenige Partner ins Boot zu holen. Und wenn doch, dann nur zu top Konditionen (z.B. erst nach PoC).
M.E. lässt sich extern bislang nicht beurteilen, ob die Spiegelmer-Technologie Vorteile ggb. Antikörpern hat oder nicht (z.B. Immunogenität, Handling, Kosten, Zellgängigkeit). Wenn Noxxon intern davon überzeugt ist, dann wird man wohl versuchen, diese Vorteile in den nächsten Präsentationen darzustellen und die Spiegelmere als Alternative zu Antikörpern zu positionieren. Vielleicht bekommen wir demnächst mal ein paar solche Folien zu sehen, Noxxon präsentiert im Herbst auf einigen Konferenzen.
Grüße
Hepcidin-Blockierung - Konkurrenzsituation zu NOX-H94
Neben Noxxon sind auch andere Unternehmen dabei, den Effekt der Blockierung von Hepcidin bei Anämie chronischer Erkrankungen zu untersuchen. Auf die Schnelle bin ich auf Amgen und Eli Lilly gestoßen, die mit monoklonalen Antikörpern (mAb) auf Hepcidin losgehen.
Eli Lilly weist ein solches mAb-Projekt in seiner Pipeline-Übersicht als P1 aus, allerdings ohne konkrete Angaben zu machen. Auch eine Studie bei clinicaltrials.gov habe ich nicht gefunden. Immerhin hat Lilly einige Patente zur mAb-Anwendung gegen Hepcidin angemeldet.
Lilly-Pipeline: http://www.lilly.com/SiteCollectionDocuments/FlashFiles/Pipe…
Lilly-Patente zu Hepcidin: http://www.freepatentsonline.com/result.html?query_txt=lilly…
Bei Amgen habe ich neben einigen Patenten zwei Publikationen gefunden, in denen der Test von mAb in Tierversuchen beschrieben ist.
Amgen-Publikation zu mAb in Affen: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2977007/
Amgen-Publikation zu mAb in Mäusen: http://bloodjournal.hematologylibrary.org/content/115/17/361…
Amgen-Patente zu Hepcidin: http://www.freepatentsonline.com/result.html?query_txt=amgen…
Außerdem ist ein aktueller Übersichtsartikel zur inzwischen 10-jährigen Entdeckungsgeschichte von Hepcidin von Tomas Ganz verfügbar. Interessant aus therapeutischer Sicht bei Anämie sind die Quellen 96 bis 100.
Ganz-Artikel: http://bloodjournal.hematologylibrary.org/content/117/17/442…
Möglicherweise gibt es weitere Studien von anderen Pharmas/Biotechs, die sich mit der Hepcidin-Inhibierung befassen. Die wenigen Quellenverweise zu Therapie-Publikationen im Ganz-Artikel lassen jedoch m.E. darauf schließen, dass bislang kaum/keine abgeschlossenen klinischen Studien vorliegen. Insofern scheint Noxxon mit der aktuell laufenden P1 zur Speerspitze zu gehören (möglicherweise parallel zu Lilly). Umso interessanter werden die Ergebnisse, insbesondere dann die P2-Daten.
Neben Noxxon sind auch andere Unternehmen dabei, den Effekt der Blockierung von Hepcidin bei Anämie chronischer Erkrankungen zu untersuchen. Auf die Schnelle bin ich auf Amgen und Eli Lilly gestoßen, die mit monoklonalen Antikörpern (mAb) auf Hepcidin losgehen.
Eli Lilly weist ein solches mAb-Projekt in seiner Pipeline-Übersicht als P1 aus, allerdings ohne konkrete Angaben zu machen. Auch eine Studie bei clinicaltrials.gov habe ich nicht gefunden. Immerhin hat Lilly einige Patente zur mAb-Anwendung gegen Hepcidin angemeldet.
Lilly-Pipeline: http://www.lilly.com/SiteCollectionDocuments/FlashFiles/Pipe…
Lilly-Patente zu Hepcidin: http://www.freepatentsonline.com/result.html?query_txt=lilly…
Bei Amgen habe ich neben einigen Patenten zwei Publikationen gefunden, in denen der Test von mAb in Tierversuchen beschrieben ist.
Amgen-Publikation zu mAb in Affen: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2977007/
Amgen-Publikation zu mAb in Mäusen: http://bloodjournal.hematologylibrary.org/content/115/17/361…
Amgen-Patente zu Hepcidin: http://www.freepatentsonline.com/result.html?query_txt=amgen…
Außerdem ist ein aktueller Übersichtsartikel zur inzwischen 10-jährigen Entdeckungsgeschichte von Hepcidin von Tomas Ganz verfügbar. Interessant aus therapeutischer Sicht bei Anämie sind die Quellen 96 bis 100.
Ganz-Artikel: http://bloodjournal.hematologylibrary.org/content/117/17/442…
Möglicherweise gibt es weitere Studien von anderen Pharmas/Biotechs, die sich mit der Hepcidin-Inhibierung befassen. Die wenigen Quellenverweise zu Therapie-Publikationen im Ganz-Artikel lassen jedoch m.E. darauf schließen, dass bislang kaum/keine abgeschlossenen klinischen Studien vorliegen. Insofern scheint Noxxon mit der aktuell laufenden P1 zur Speerspitze zu gehören (möglicherweise parallel zu Lilly). Umso interessanter werden die Ergebnisse, insbesondere dann die P2-Daten.
Hepcidin-Blockierung - Konkurrenzsituation zu NOX-H94 (Ergänzung)
Da ist das Ding:
P1 von Lilly mit Anti-Hepcidin-mAb: http://clinicaltrials.gov/ct2/show/NCT01340976
Sie umfasst Krebspatienten mit Anämie und läuft laut Plan noch bis Ende 2013. Offenbar will Lilly das nicht an die große Glocke hängen, denn von einem Anti-Hepcidin-mAb ist nichts zu lesen. Man findet den Beweis jedoch in folgendem Word-Dokument:
http://www.moasc.org/2010/CLINICAL%20TRIAL%20SUMMARY.doc
Lilly hat übrigens jüngst auch eine P1-Studie mit einem mAb gegen Ferroportin in der Indikation Anämie abgeschlossen. Ferroportin spielt ebenfalls eine wichtige Rolle im Eisenstoffwechsel. Vermutlich hängen diese beiden Studien über ein R&D-Projekt zu Anämie zusammen.
P1 von Lilly mit Anti-Ferroportin-mAb: http://clinicaltrials.gov/ct2/show/NCT01330953
Damit stehen nun ein Spiegelmer und ein Antikörper bei gleichem Target (Hepcidin) und gleicher Indikation (Anämie) in direktem Wettbewerb. Allerdings werden die Ergebnisse von Lilly nicht vor Ende 2013 erwartet. Bis dahin soll Noxxon bereits verkauft sein.
Zitat von Saaletaler: Eli Lilly weist ein solches mAb-Projekt in seiner Pipeline-Übersicht als P1 aus, allerdings ohne konkrete Angaben zu machen. Auch eine Studie bei clinicaltrials.gov habe ich nicht gefunden.
Da ist das Ding:
P1 von Lilly mit Anti-Hepcidin-mAb: http://clinicaltrials.gov/ct2/show/NCT01340976
Sie umfasst Krebspatienten mit Anämie und läuft laut Plan noch bis Ende 2013. Offenbar will Lilly das nicht an die große Glocke hängen, denn von einem Anti-Hepcidin-mAb ist nichts zu lesen. Man findet den Beweis jedoch in folgendem Word-Dokument:
http://www.moasc.org/2010/CLINICAL%20TRIAL%20SUMMARY.doc
Lilly hat übrigens jüngst auch eine P1-Studie mit einem mAb gegen Ferroportin in der Indikation Anämie abgeschlossen. Ferroportin spielt ebenfalls eine wichtige Rolle im Eisenstoffwechsel. Vermutlich hängen diese beiden Studien über ein R&D-Projekt zu Anämie zusammen.
P1 von Lilly mit Anti-Ferroportin-mAb: http://clinicaltrials.gov/ct2/show/NCT01330953
Damit stehen nun ein Spiegelmer und ein Antikörper bei gleichem Target (Hepcidin) und gleicher Indikation (Anämie) in direktem Wettbewerb. Allerdings werden die Ergebnisse von Lilly nicht vor Ende 2013 erwartet. Bis dahin soll Noxxon bereits verkauft sein.
Aktualisierungen des Studien-Tableaus für NOX-E36 bei clinicaltrials.gov
Der Status wurde auf "currently recruiting" geändert, allerdings nur noch in Ungarn. Das erwartete Studienende ist nun auf Dezember 2011 terminiert. Die Verzögerung ist kein Beinbruch, da auch die parallele MAD-P1b/2a-Studie noch bis Dezember laufen soll (s. unten).
Link zur Nierenschwäche-Studie: http://clinicaltrials.gov/ct2/show/NCT01372124?term=noxxon&r…
Hier wurden alle Behandlungszentren auf "Recruiting" gesetzt. Scheinbar läuft die Studie noch in vollem Gange. Der Abschlusstermin Dezember 2011 wurde jedoch nicht verändert.
Link zur MAD-P1b/2a: http://clinicaltrials.gov/ct2/show/NCT01085292?term=noxxon&r…
Beide Studien mit NOX-E36 sollen jetzt also im Dezember 2011 abgeschlossen werden. Ich nehme an, dass man anschließend die Ergebnisse beider gemeinsam auswertet und anschließend die P2 in Diabetischer Nephropathie beantragt. Der P2-Start könnte somit m.E. in HJ1/12 erfolgen. Aus meiner Sicht noch unklar ist die Frage, ob P2 mit oder ohne Partner.
Zitat von Saaletaler: 2) Ebenfalls neu ist die angekündigte (zusätzliche) Studie mit NOX-E36 bei Patienten mit Nierenschwäche (Nierenversagen, Niereninsuffizienz). Dabei geht es weniger um Verträglichkeit oder Wirksamkeit, sondern vor allem um die Pharmakokinetik, also darum, welchen Einfluss die Nierenschwäche auf den Wirkstoff nimmt (z.B. Dauer und Umfang der Verfügbarkeit im Körper, Ablauf des Ausscheidungsprozesses). Da Nierenschwäche ein wesentlicher Faktor bei Diabetes- bzw. Nephropathie-Patienten ist, soll die Studie Hinweise auf die günstigste NOX-E36-Dosierung in späteren Studien geben.
Diese (offene) P1/2 soll mit 32 Patienten von Juni bis Oktober 2011 in Ungarn und Moldawien laufen. Die Rekrutierung dürfte also in Kürze starten.
Der Status wurde auf "currently recruiting" geändert, allerdings nur noch in Ungarn. Das erwartete Studienende ist nun auf Dezember 2011 terminiert. Die Verzögerung ist kein Beinbruch, da auch die parallele MAD-P1b/2a-Studie noch bis Dezember laufen soll (s. unten).
Link zur Nierenschwäche-Studie: http://clinicaltrials.gov/ct2/show/NCT01372124?term=noxxon&r…
Zitat von Saaletaler: 3) Bei der Mehrfach-Dosis-Studie mit NOX-E36 wurde das Abschluss-Datum jetzt deutlich auf Dezember 2011 erhöht. Außerdem wurde die Liste der behandelnden Kliniken ergänzt.
Hier wurden alle Behandlungszentren auf "Recruiting" gesetzt. Scheinbar läuft die Studie noch in vollem Gange. Der Abschlusstermin Dezember 2011 wurde jedoch nicht verändert.
Link zur MAD-P1b/2a: http://clinicaltrials.gov/ct2/show/NCT01085292?term=noxxon&r…
Zitat von Saaletaler: Auch wenn Noxxon die Einleitung der geplanten P2a in Diabetischer Nephropathie noch für Q4 2011 in Aussicht stellt, sollte man m.E. davon ausgehen, dass sich der Start der P2a (Rekrutierung) mindestens in Q1 2012 verschiebt. Denn sowohl die Mehrfach-Dosis-P1b als auch die zusätzliche Nierenschwäche-Studie müssen erst termingerecht beendet und dann umfassend ausgewertet sein.
Beide Studien mit NOX-E36 sollen jetzt also im Dezember 2011 abgeschlossen werden. Ich nehme an, dass man anschließend die Ergebnisse beider gemeinsam auswertet und anschließend die P2 in Diabetischer Nephropathie beantragt. Der P2-Start könnte somit m.E. in HJ1/12 erfolgen. Aus meiner Sicht noch unklar ist die Frage, ob P2 mit oder ohne Partner.
Danke für deine Infos!
Antwort auf Beitrag Nr.: 42.238.008 von dg6nds am 20.10.11 17:09:38Na gerne doch 
Laut Meldung vom 6. September (s. Posting #69) will sich Noxxon in diesem Jahr noch offiziell per PM zum Fortschritt der Pipeline äußern. Darauf darf man gespannt sein. Es würde sich m.E. anbieten, dies kurz vor der Noxxon-Präsentation auf der "BioEurope" am 2. November zu tun. Mal schauen.
"BioEurope": http://www.ebdgroup.com/bioeurope/presenters/prs_comps.php#1…
Interessant ist momentan insbesondere, wie es mit NOX-A12 weitergeht. In welcher Krebs-Indikation wird NOX-A12 in die P2 geschickt?
Grüße

Laut Meldung vom 6. September (s. Posting #69) will sich Noxxon in diesem Jahr noch offiziell per PM zum Fortschritt der Pipeline äußern. Darauf darf man gespannt sein. Es würde sich m.E. anbieten, dies kurz vor der Noxxon-Präsentation auf der "BioEurope" am 2. November zu tun. Mal schauen.
"BioEurope": http://www.ebdgroup.com/bioeurope/presenters/prs_comps.php#1…
Interessant ist momentan insbesondere, wie es mit NOX-A12 weitergeht. In welcher Krebs-Indikation wird NOX-A12 in die P2 geschickt?
Grüße
Klussmann in der FAZ: "Mindestens einer der 3 Wirkstoffe soll verpartnert werden."
----------------------------------------------------------------------------------------------------------
Geschäftsanbahnung im Kabuff
Pharmakonzerne und Biotechunternehmen suchen auf der Messe Bio Europe nach der perfekten Verbindung.
http://www.faz.net/aktuell/wirtschaft/messe-bio-europe-gesch…
Kabuff? Kabine? Büdchen? Wabe? Die Bezeichnungen für den Treffpunkt variieren je nach Gemüt und Herkunft, aber den Nutzen der von schmucklosen Stellwänden umschlossenen, viereckigen Räume bestreitet unter den Teilnehmern der Messe Bio Europe niemand. Rund 3000 Besucher aus 1700 Unternehmen der Pharma- und Biotechbranche haben sich zur größten Veranstaltung ihrer Art auf dem Kontinent angekündigt; bis zum Mittwochabend haben sie noch Zeit, sich in einem der 512 nummerierten Behelfsbesprechungszimmer in der Düsseldorfer Messehalle kennenzulernen. „Man fühlt sich dabei ein bisschen wie beim Speed-Dating“, räumt Sean McCarthy vom amerikanischen Antikörperhersteller Cytom-X ein, der aus San Francisco angereist ist. „Aber es ist die beste Gelegenheit, Kontakte zu sehr vielen Firmen zu knüpfen.“ Tatsächlich erinnert das Rezept an Partnerbörsen im Internet: Über eine Website ließen sich vorab die Gesprächspartner der Wahl aussuchen, im Fall von gegenseitigem Interesse ermittelte eine Software die passende Zeit und eine freie Kabine für den Plausch. 30 Minuten je Gespräch sind vorgesehen. Das Interieur fördert die Konzentration auf das Wesentliche: Neun Quadratmeter, roter Teppichboden, ein Tisch, vier Stühle, Vorhänge statt Türen, nach oben sind die Räume offen.
Für Anfänger gibt es am ersten Morgen einen anderthalbstündigen Crash-Kurs im Hochgeschwindigkeitsverhandeln. Unter dem Titel „The Perfect Pitch“ verrät ein Kommunikationsberater seine Tipps für die berüchtigte Fahrstuhlsituation, in der 30 Sekunden genügen müssen, um die Aufmerksamkeit des Gegenübers zu gewinnen. Die Mutigen unter den Zuhörern wagen sich vor und präsentieren zu einer tickenden Uhr ihr Anliegen, vielleicht sitzt der perfekte Partner ja sogar im Publikum vor ihnen. „Die 08/15-Unternehmenspräsentation könnt ihr euch sparen“, mahnt der Berater. „Aber vergesst nicht, deutlich euer Ziel zu formulieren. Zum Beispiel: Ich brauche Geld. Oder: Ich suche nach einer geeigneten Kooperation. Dann erinnert sich das Gegenüber besser an euch.“
Wer sich nicht regelgerecht vorstellt, muss mit Minuspunkten rechnen; wer einen ungewöhnlichen Einstieg wählt, ist im Vorteil: Eine Jury begutachtet die Vorträge, die drei Besten gewinnen einen Kabinentermin mit einem der acht Preisrichter. Dass es sich bei ihnen um Manager der großen Pharmahersteller handelt – aus Deutschland sind Merck Serono und Boehringer Ingelheim vertreten –, spiegelt die Machtverhältnisse in der Branche und erklärt die Mechanik dieser Messe: Viele kleine Entwicklungsunternehmen mit wenig Kapital und guten Ideen suchen für die Fortsetzung ihrer Projekte – neuartige Wirkstoffe, aus denen in einigen Jahren ein umsatzstarkes Medikament werden könnte – finanzstarke Partner.
Auf die Rolle als Bittsteller allerdings seien die Entwickler nicht beschränkt, betont Alexander Schuth, der heute für Genentech in der Jury sitzt, ein Vorzeigeunternehmen der amerikanischen Biotechzunft, dessen Neurologiegeschäft er ausbauen soll. 40 Termine hat der gebürtige Deutsche für die drei Tage in Düsseldorf zugesagt. „Wenn ihre Projekte gut sind, dann sitzen dabei die Verkäufer am längeren Hebel“, berichtet er. Denn in vielen Pharmakonzernen ist der Nachschub aus den eigenen Laboren in den vergangenen Jahren wenig ergiebig gewesen, sie kaufen daher externe Projekte ein. „Wir selbst machen rund 50 Prozent unseres Umsatzes mit Produkten, die aus Partnerschaften entstanden sind.“
Und während Konzerne, die mit herkömmlichen Medikamenten groß geworden sind, erst dann in ein Projekt einsteigen, wenn es schon die ersten beiden der drei vorgeschriebenen klinischen Studienphasen erfolgreich absolviert hat, verfolgt Genentech eine andere Strategie. „Wenn wir vom Konzept und von den Daten überzeugt sind, schließen wir sehr früh einen Vertrag ab“, sagt Schuth. „Auch wenn statistisch von zehn Neuentwicklungen nur eine später als Medikament auf den Markt kommt.“
Mit drei solchen frühen Entwicklungsprojekten in der Mappe ist Sven Klussmann nach Düsseldorf gekommen, der Wissenschaftsvorstand des Berliner Biotechunternehmens Noxxon Pharma. Diabetes, Blutkrebs und Anämie sind die Indikationsgebiete. „Alle drei sollen 2012 in die zweite klinische Prüfungsphase gehen. Wenigstens für eins suchen wir einen Partner mit tieferen Taschen.“ Klussmann selbst, ein promovierter Biochemiker, hat in seiner Doktorarbeit die theoretische Grundlage der drei Substanzen beschrieben und dann das Unternehmen mitgegründet, um daraus Praxis zu machen – eine klassische Gründungsgeschichte also. 14 Jahre ist das nun her, die Branche verlangt einen langen Atem. „Wenn diese Stoffe jetzt im Patienten wirken“, sagt Klussmann vor seinem ersten Rendezvous in Düsseldorf, „fängt sich ein Traum zu erfüllen an.“
Mit dem Kalender in der Hand von Kabine zu Kabine eilen, das hat Helmut Haning nicht nötig. Er verantwortet für Bayer die Zusammenarbeit mit externen Innovationspartnern, und als einer der Hauptsponsoren der Bio Europe verfügt der Leverkusener Chemie- und Pharmakonzern in der Messehalle gleich über drei Besprechungsräume. Sie sind größer als die Standardkabinen, die Stühle darin sind bequemer, eine Glastür sorgt für eine vertraulichere Atmosphäre. „Wir mussten erst lernen, dass viele Biotechunternehmen eine andere Sprache sprechen als in der Pharmabranche üblich“, berichtet er. „Da dominiert oft die Wissenschaft und nicht die Wirtschaft.“ Deshalb habe Bayer vor einem Jahr eigens die mit Naturwissenschaftlern besetzte Abteilung gebildet, an deren Spitze Haning steht.
Drei Entwicklungskooperationen wurden 2010 abgeschlossen, insgesamt stammt die Hälfte der 40 klinischen Entwicklungsprojekte des Konzerns aus Partnerschaften. „Die Vertragsmodelle dafür werden flexibler“, sagt Haning. „Geld ist dabei eine wichtige Komponente, aber nicht die einzige.“ So wünschten sich manche Biotechanbieter, Vertrieb und Marketing in bestimmten Regionen selbst aufzubauen; anderen sei ein Mitspracherecht bei der weiteren Entwicklung besonders wichtig. „Es geht darum, dem kleineren Partner Luft zum Atmen zu lassen.“ Ob hinter Vorhängen oder Glastüren, Verträge werden in den Messekabinen noch nicht unterzeichnet, da sind sich die Kleinen und die Großen einig.
Aber zum Beschnuppern sind neun Quadratmeter offenbar groß genug. Vielleicht führt die halbe Stunde unter vier oder acht Augen zu einem Anschlusstermin in der Konzernzentrale. Vielleicht trifft man sich auch im nächsten Jahr wieder und setzt, mit neuen Daten im Gepäck, das Date fort. Und im schlimmsten Fall? Sean McCarthy, der Mann aus San Francisco, hält für seine Antwort an seinem Vergleich mit der privaten Partnersuche fest. „Dann glaubst du nach dem Treffen, dein Gegenüber hat sich in dich verliebt, tauschst Nummern aus – und wirst nie zurückgerufen.“
Frankfurter Allgemeine Zeitung vom 02.11.2011, Seite 18

----------------------------------------------------------------------------------------------------------
Geschäftsanbahnung im Kabuff
Pharmakonzerne und Biotechunternehmen suchen auf der Messe Bio Europe nach der perfekten Verbindung.
http://www.faz.net/aktuell/wirtschaft/messe-bio-europe-gesch…
Kabuff? Kabine? Büdchen? Wabe? Die Bezeichnungen für den Treffpunkt variieren je nach Gemüt und Herkunft, aber den Nutzen der von schmucklosen Stellwänden umschlossenen, viereckigen Räume bestreitet unter den Teilnehmern der Messe Bio Europe niemand. Rund 3000 Besucher aus 1700 Unternehmen der Pharma- und Biotechbranche haben sich zur größten Veranstaltung ihrer Art auf dem Kontinent angekündigt; bis zum Mittwochabend haben sie noch Zeit, sich in einem der 512 nummerierten Behelfsbesprechungszimmer in der Düsseldorfer Messehalle kennenzulernen. „Man fühlt sich dabei ein bisschen wie beim Speed-Dating“, räumt Sean McCarthy vom amerikanischen Antikörperhersteller Cytom-X ein, der aus San Francisco angereist ist. „Aber es ist die beste Gelegenheit, Kontakte zu sehr vielen Firmen zu knüpfen.“ Tatsächlich erinnert das Rezept an Partnerbörsen im Internet: Über eine Website ließen sich vorab die Gesprächspartner der Wahl aussuchen, im Fall von gegenseitigem Interesse ermittelte eine Software die passende Zeit und eine freie Kabine für den Plausch. 30 Minuten je Gespräch sind vorgesehen. Das Interieur fördert die Konzentration auf das Wesentliche: Neun Quadratmeter, roter Teppichboden, ein Tisch, vier Stühle, Vorhänge statt Türen, nach oben sind die Räume offen.
Für Anfänger gibt es am ersten Morgen einen anderthalbstündigen Crash-Kurs im Hochgeschwindigkeitsverhandeln. Unter dem Titel „The Perfect Pitch“ verrät ein Kommunikationsberater seine Tipps für die berüchtigte Fahrstuhlsituation, in der 30 Sekunden genügen müssen, um die Aufmerksamkeit des Gegenübers zu gewinnen. Die Mutigen unter den Zuhörern wagen sich vor und präsentieren zu einer tickenden Uhr ihr Anliegen, vielleicht sitzt der perfekte Partner ja sogar im Publikum vor ihnen. „Die 08/15-Unternehmenspräsentation könnt ihr euch sparen“, mahnt der Berater. „Aber vergesst nicht, deutlich euer Ziel zu formulieren. Zum Beispiel: Ich brauche Geld. Oder: Ich suche nach einer geeigneten Kooperation. Dann erinnert sich das Gegenüber besser an euch.“
Wer sich nicht regelgerecht vorstellt, muss mit Minuspunkten rechnen; wer einen ungewöhnlichen Einstieg wählt, ist im Vorteil: Eine Jury begutachtet die Vorträge, die drei Besten gewinnen einen Kabinentermin mit einem der acht Preisrichter. Dass es sich bei ihnen um Manager der großen Pharmahersteller handelt – aus Deutschland sind Merck Serono und Boehringer Ingelheim vertreten –, spiegelt die Machtverhältnisse in der Branche und erklärt die Mechanik dieser Messe: Viele kleine Entwicklungsunternehmen mit wenig Kapital und guten Ideen suchen für die Fortsetzung ihrer Projekte – neuartige Wirkstoffe, aus denen in einigen Jahren ein umsatzstarkes Medikament werden könnte – finanzstarke Partner.
Auf die Rolle als Bittsteller allerdings seien die Entwickler nicht beschränkt, betont Alexander Schuth, der heute für Genentech in der Jury sitzt, ein Vorzeigeunternehmen der amerikanischen Biotechzunft, dessen Neurologiegeschäft er ausbauen soll. 40 Termine hat der gebürtige Deutsche für die drei Tage in Düsseldorf zugesagt. „Wenn ihre Projekte gut sind, dann sitzen dabei die Verkäufer am längeren Hebel“, berichtet er. Denn in vielen Pharmakonzernen ist der Nachschub aus den eigenen Laboren in den vergangenen Jahren wenig ergiebig gewesen, sie kaufen daher externe Projekte ein. „Wir selbst machen rund 50 Prozent unseres Umsatzes mit Produkten, die aus Partnerschaften entstanden sind.“
Und während Konzerne, die mit herkömmlichen Medikamenten groß geworden sind, erst dann in ein Projekt einsteigen, wenn es schon die ersten beiden der drei vorgeschriebenen klinischen Studienphasen erfolgreich absolviert hat, verfolgt Genentech eine andere Strategie. „Wenn wir vom Konzept und von den Daten überzeugt sind, schließen wir sehr früh einen Vertrag ab“, sagt Schuth. „Auch wenn statistisch von zehn Neuentwicklungen nur eine später als Medikament auf den Markt kommt.“
Mit drei solchen frühen Entwicklungsprojekten in der Mappe ist Sven Klussmann nach Düsseldorf gekommen, der Wissenschaftsvorstand des Berliner Biotechunternehmens Noxxon Pharma. Diabetes, Blutkrebs und Anämie sind die Indikationsgebiete. „Alle drei sollen 2012 in die zweite klinische Prüfungsphase gehen. Wenigstens für eins suchen wir einen Partner mit tieferen Taschen.“ Klussmann selbst, ein promovierter Biochemiker, hat in seiner Doktorarbeit die theoretische Grundlage der drei Substanzen beschrieben und dann das Unternehmen mitgegründet, um daraus Praxis zu machen – eine klassische Gründungsgeschichte also. 14 Jahre ist das nun her, die Branche verlangt einen langen Atem. „Wenn diese Stoffe jetzt im Patienten wirken“, sagt Klussmann vor seinem ersten Rendezvous in Düsseldorf, „fängt sich ein Traum zu erfüllen an.“
Mit dem Kalender in der Hand von Kabine zu Kabine eilen, das hat Helmut Haning nicht nötig. Er verantwortet für Bayer die Zusammenarbeit mit externen Innovationspartnern, und als einer der Hauptsponsoren der Bio Europe verfügt der Leverkusener Chemie- und Pharmakonzern in der Messehalle gleich über drei Besprechungsräume. Sie sind größer als die Standardkabinen, die Stühle darin sind bequemer, eine Glastür sorgt für eine vertraulichere Atmosphäre. „Wir mussten erst lernen, dass viele Biotechunternehmen eine andere Sprache sprechen als in der Pharmabranche üblich“, berichtet er. „Da dominiert oft die Wissenschaft und nicht die Wirtschaft.“ Deshalb habe Bayer vor einem Jahr eigens die mit Naturwissenschaftlern besetzte Abteilung gebildet, an deren Spitze Haning steht.
Drei Entwicklungskooperationen wurden 2010 abgeschlossen, insgesamt stammt die Hälfte der 40 klinischen Entwicklungsprojekte des Konzerns aus Partnerschaften. „Die Vertragsmodelle dafür werden flexibler“, sagt Haning. „Geld ist dabei eine wichtige Komponente, aber nicht die einzige.“ So wünschten sich manche Biotechanbieter, Vertrieb und Marketing in bestimmten Regionen selbst aufzubauen; anderen sei ein Mitspracherecht bei der weiteren Entwicklung besonders wichtig. „Es geht darum, dem kleineren Partner Luft zum Atmen zu lassen.“ Ob hinter Vorhängen oder Glastüren, Verträge werden in den Messekabinen noch nicht unterzeichnet, da sind sich die Kleinen und die Großen einig.
Aber zum Beschnuppern sind neun Quadratmeter offenbar groß genug. Vielleicht führt die halbe Stunde unter vier oder acht Augen zu einem Anschlusstermin in der Konzernzentrale. Vielleicht trifft man sich auch im nächsten Jahr wieder und setzt, mit neuen Daten im Gepäck, das Date fort. Und im schlimmsten Fall? Sean McCarthy, der Mann aus San Francisco, hält für seine Antwort an seinem Vergleich mit der privaten Partnersuche fest. „Dann glaubst du nach dem Treffen, dein Gegenüber hat sich in dich verliebt, tauschst Nummern aus – und wirst nie zurückgerufen.“
Frankfurter Allgemeine Zeitung vom 02.11.2011, Seite 18

Aktualisierungen des Studien-Tableaus für NOX-A12 bei clinicaltrials.gov
Die (offene) MAD-P1b-Studie mit NOX-A12 wurde beendet, und zwar bereits im Januar dieses Jahres, die Aktualisierung erfolgte jedoch erst jetzt. Statt ursprünglich geplanter 24 (gesunder) Probanden wurden nur 12 getestet. Möglicherweise reichten die Erkenntnisse daraus bereits aus.
Link zur (fertigen) MAD-P1b mit NOX-A12: http://clinicaltrials.gov/ct2/show/NCT01194934?term=noxxon&r…
Die Vorbereitungen der P2 sollten m.E. fortgeschritten sein. Die entscheidenden Fragen lauten jetzt:
Welche Indikation(en)?
Mit oder ohne Partner?
Wann geht es los?
Sollte das offizielle Studien-Update von Noxxon wie angekündigt noch 2011 kommen, werden wir vermutlich in Kürze Näheres erfahren.
Zitat von Saaletaler: Aktueller Status / Fahrplan 2011:
------------------------------------------
...
NOX-A12: Abschluss der laufenden Mehrfach-Dosis-P1-Studie zur Stammzellmobilisierung - Frage: Wann?
NOX-A12: Abschluss einer umfassenden Analyse für Einsatzmöglichkeiten bei diversen Krebserkrankungen in Q2/11
NOX-A12: Vorbereitung/Start von P2-Studie(n) in HJ2/11 - Fragen: Welche Indikation wird gewählt? Mit Partner?
Die (offene) MAD-P1b-Studie mit NOX-A12 wurde beendet, und zwar bereits im Januar dieses Jahres, die Aktualisierung erfolgte jedoch erst jetzt. Statt ursprünglich geplanter 24 (gesunder) Probanden wurden nur 12 getestet. Möglicherweise reichten die Erkenntnisse daraus bereits aus.
Link zur (fertigen) MAD-P1b mit NOX-A12: http://clinicaltrials.gov/ct2/show/NCT01194934?term=noxxon&r…
Die Vorbereitungen der P2 sollten m.E. fortgeschritten sein. Die entscheidenden Fragen lauten jetzt:
Welche Indikation(en)?
Mit oder ohne Partner?
Wann geht es los?
Sollte das offizielle Studien-Update von Noxxon wie angekündigt noch 2011 kommen, werden wir vermutlich in Kürze Näheres erfahren.
Konferenz: American Society of Hematology (ASH) Annual Meeting and Exposition - San Diego - 10.-13. Dezember
http://www.hematology.org/Meetings/Annual-Meeting/
Noxxon mit einem Vortrag und zwei Postern vor Ort, jeweils mit NOX-A12-Daten:
1) Roccaro et al. (Vortrag): L-Stereoisomer RNA Oligonucleotide Anti-SDF-1 (Nox-A12) Disrupts the Interaction of Multiple Myeloma Cells with the Bone Marrow Milieu In Vivo, Leading to Enhanced Sensitivity to Bortezomib.
http://ash.confex.com/ash/2011/webprogram/Paper39149.html
2) Hoellenriegel et al. (Poster): The Spiegelmer Nox-A12, a Novel SDF-1 (CXCL12) Inhibitor, and Its Effects on Chronic Lymphocytic Leukemia (CLL) Cell Migration.
http://ash.confex.com/ash/2011/webprogram/Paper39798.html
3) Scheller et al. (Poster): Rapid and Efficient Mobilization of Murine Hematopoietic Stem and Progenitor Cells with Nox-A12, a New Spiegelmers®-Based CXCR4/SDF-1(CXCL12) Antagonist.
http://ash.confex.com/ash/2011/webprogram/Paper41113.html
1) und 2) legen nahe, dass Noxxon für NOX-A12 die Indikationen Chronische Lymphatische Leukämie (CLL) und Multiples Myelom (MM) für P2-Studien in Betracht zieht. Da auch CBO Mangasarian vor Ort ist, wird m.E. auf der ASH die Partnersuche vorangetrieben.
CLL: http://de.wikipedia.org/wiki/CLL
MM: http://de.wikipedia.org/wiki/Multiples_Myelom
http://www.hematology.org/Meetings/Annual-Meeting/
Noxxon mit einem Vortrag und zwei Postern vor Ort, jeweils mit NOX-A12-Daten:
1) Roccaro et al. (Vortrag): L-Stereoisomer RNA Oligonucleotide Anti-SDF-1 (Nox-A12) Disrupts the Interaction of Multiple Myeloma Cells with the Bone Marrow Milieu In Vivo, Leading to Enhanced Sensitivity to Bortezomib.
http://ash.confex.com/ash/2011/webprogram/Paper39149.html
2) Hoellenriegel et al. (Poster): The Spiegelmer Nox-A12, a Novel SDF-1 (CXCL12) Inhibitor, and Its Effects on Chronic Lymphocytic Leukemia (CLL) Cell Migration.
http://ash.confex.com/ash/2011/webprogram/Paper39798.html
3) Scheller et al. (Poster): Rapid and Efficient Mobilization of Murine Hematopoietic Stem and Progenitor Cells with Nox-A12, a New Spiegelmers®-Based CXCR4/SDF-1(CXCL12) Antagonist.
http://ash.confex.com/ash/2011/webprogram/Paper41113.html
1) und 2) legen nahe, dass Noxxon für NOX-A12 die Indikationen Chronische Lymphatische Leukämie (CLL) und Multiples Myelom (MM) für P2-Studien in Betracht zieht. Da auch CBO Mangasarian vor Ort ist, wird m.E. auf der ASH die Partnersuche vorangetrieben.
CLL: http://de.wikipedia.org/wiki/CLL
MM: http://de.wikipedia.org/wiki/Multiples_Myelom
P2-Kombi-Studie mit NOX-A12 in CLL
Unter clinicaltrials.gov wurde das Protokoll für eine P2-Studie zur Behandlung von CLL-Patienten mit NOX-A12 in Kombination mit Bendamustin und Rituximab eingestellt. Die alte DDR-Errungenschaft Bendamustin ist ein Chemo-Therapeutikum, Rituximab ein mAb gegen das Zelloberflächenmolekül CD20; beide werden bei Blutkrebs-Erkrankungen häufig zusammen verabreicht. Die Studie soll zeigen, ob sich der Erfolg der Bendamustin/Rituximab-Therapie bei CLL durch die zusätzliche Gabe von NOX-A12 verbessern lässt.
Die Rekrutierung beginnt Anfang 2012. Die Studie ist offen und soll mit 33 Patienten bis 2015 laufen, Anfang 2013 jedoch erste Zwischenergebnisse liefern.
P2-Kombi-Studie mit NOX-A12 in CLL: http://clinicaltrials.gov/ct2/show/NCT01486797
Bendamustin: http://de.wikipedia.org/wiki/Bendamustin
Rituximab: http://de.wikipedia.org/wiki/Rituximab
CLL: http://de.wikipedia.org/wiki/Chronische_lymphatische_Leuk%C3…
Vermutlich bleibt dies nicht die einzige P2 mit NOX-A12, s. ASH-Konferenz. Details dürfte Noxxon zu gegebener Zeit in einem offiziellen Pipeline-Update bekannt geben, angekündigt war es noch für 2011 (s. Posting #69).
Zitat von Saaletaler: 2) Hoellenriegel et al. (Poster): The Spiegelmer Nox-A12, a Novel SDF-1 (CXCL12) Inhibitor, and Its Effects on Chronic Lymphocytic Leukemia (CLL) Cell Migration.
http://ash.confex.com/ash/2011/webprogram/Paper39798.html
1) und 2) legen nahe, dass Noxxon für NOX-A12 die Indikationen Chronische Lymphatische Leukämie (CLL) und Multiples Myelom (MM) für P2-Studien in Betracht zieht.
Unter clinicaltrials.gov wurde das Protokoll für eine P2-Studie zur Behandlung von CLL-Patienten mit NOX-A12 in Kombination mit Bendamustin und Rituximab eingestellt. Die alte DDR-Errungenschaft Bendamustin ist ein Chemo-Therapeutikum, Rituximab ein mAb gegen das Zelloberflächenmolekül CD20; beide werden bei Blutkrebs-Erkrankungen häufig zusammen verabreicht. Die Studie soll zeigen, ob sich der Erfolg der Bendamustin/Rituximab-Therapie bei CLL durch die zusätzliche Gabe von NOX-A12 verbessern lässt.
Die Rekrutierung beginnt Anfang 2012. Die Studie ist offen und soll mit 33 Patienten bis 2015 laufen, Anfang 2013 jedoch erste Zwischenergebnisse liefern.
P2-Kombi-Studie mit NOX-A12 in CLL: http://clinicaltrials.gov/ct2/show/NCT01486797
Bendamustin: http://de.wikipedia.org/wiki/Bendamustin
Rituximab: http://de.wikipedia.org/wiki/Rituximab
CLL: http://de.wikipedia.org/wiki/Chronische_lymphatische_Leuk%C3…
Vermutlich bleibt dies nicht die einzige P2 mit NOX-A12, s. ASH-Konferenz. Details dürfte Noxxon zu gegebener Zeit in einem offiziellen Pipeline-Update bekannt geben, angekündigt war es noch für 2011 (s. Posting #69).
EANS-News: DEWB Beteiligung NOXXON schließt Phase I für SDF-1
Inhibitor NOX-A12 ab
--------------------------------------------------------------------------------
Corporate News übermittelt durch euro adhoc. Für den Inhalt ist der
Emittent/Meldungsgeber verantwortlich.
--------------------------------------------------------------------------------
Unternehmen
Utl.: Vorstellung präklinischer Ergebnisse mit hämatologischen
Tumormodellen auf der ASH-Konferenz
Berlin, 12. Dezember 2011 (euro adhoc) - NOXXON Pharma AG, ein
biopharmazeutisches Unternehmen und Pionier bei der Entwicklung der
eigenen, patentierten neuen Wirkstoffklasse der Spiegelmere, gab
heute den Abschluss der klinischen Phase I Studien mit Einzel- und
Mehrfachdosierung seines SDF-1-Hemmers NOX A12 bekannt. In Studien
der Phase I hatten sich NOX-A12-Einzeldosen bis zu 10,8 mg/kg und
tägliche Dosen bis zu 2 mg/kg über fünf Tage bei freiwilligen
gesunden Probanden als sicher und gut verträglich erwiesen. Es zeigte
sich eine dosisabhängige Mobilisation weißer Blutkörperchen und
CD34-positiver Zellen, wie präklinische Studien bereits vermuten
ließen.
Die präklinischen Ergebnisse von NOX-A12 bei hämatologischen
Krebserkrankungen werden in Vorträgen auf der jährlichen Konferenz
der ASH (American Society of Hematology) vorgestellt, die vom 10. bis
13. Dezember 2011 in San Diego, USA, stattfindet. Mitglieder des
Arzneimittelentwicklungsteams von NOXXON und Kollaborationspartner
werden an der ASH-Konferenz teilnehmen und die Wirkweise sowie das
klinische Potenzial dieses innovativen Arzneimittelkandidaten
vorstellen.
Folgende drei Präsentationen über NOX-A12 werden auf der
ASH-Konferenz vorgestellt:
- Vortrag am Montag, 12. Dezember, 19.15 Uhr; Sitzung 652; Raum 6A
L-Stereoisomer RNA Oligonucleotide Anti-SDF-1 (NOX-A12) Disrupts the
Interaction of Multiple Myeloma Cells with the Bone Marrow Milieu In
Vivo, Leading to Enhanced Sensitivity to Bortezomib. A. M. Roccaro,
A. Sacco, P. Qaung, A. Azab, P. Maiso, F. Azab, Y. Zhang, G. C. Issa,
Y. Liu, H. T. Ngo, A. Kruschinski, I. M. Ghobrial
- Poster-Präsentation am Sonntag, 11. Dezember, 18-20 Uhr; Sitzung
711; Poster II in Halle GH Rapid and Efficient Mobilization of Murine
Hematopoietic Stem and Progenitor Cells with NOX-A12, a New
Spiegelmers-Based CXCR4/SDF-1(CXCL12) Antagonist M. Scheller, F.
Schwoebel, D. Vossmeyer, A. Leutz
- Poster-Präsentation am Montag, 12. Dezember, 18-20 Uhr; Sitzung
641; Poster III in Halle GH The Spiegelmer NOX-A12, a novel SDF-1
(CXCL12) inhibitor, and its effects on Chronic Lymphocytic Leukemia
(CLL) cell migration. J. Hoellenriegel, D. Zboralski, Z. Estrov, W.
G. Wierda, M. Keating, A. Kruschinski, J. A. Burger
Basierend auf den überzeugenden präklinischen Ergebnissen bei
hämatologischen und soliden Tumoren ist NOXXON überzeugt davon, dass
NOX-A12 das nötige Potenzial für die Weiterentwicklung zu einer
Therapie für verschiedene Anwendungen in der Onkologie hat. Nach
Genehmigung durch die regulatorischen Behörden und die
Ethikkommission ist der Beginn der ersten Phase IIa Studie mit
NOX-A12 in der Indikation hämatologische Tumore für Anfang 2012
geplant.
- Ende -
Über NOXXON Pharma AG NOXXON Pharma ist ein biopharmazeutisches
Unternehmen und Pionier bei der Entwicklung von Spiegelmeren, einer
patentierten neuen Wirkstoffklasse. Spiegelmere stellen chemisch
synthetisierte, nicht-immunogene Alternativen zu Antikörpern dar.
NOXXON verfügt über ein diversifiziertes Portfolio von
Spiegelmer®-Wirkstoffen im klinischen Entwicklungsstadium:
- NOX-E36 inhibiert das entzündungsfördernde Chemokin MCP-1 (CCL2)
und befindet sich derzeit in einer Phase Ib Studie zur Behandlung von
Komplikationen des Typ-2-Diabetes wie Nephropathie. Eine Phase IIa
Studie an Diabetikern mit eingeschränkter Nierenfunktion wird gerade
vorbereitet. - NOX-A12 inhibiert SDF-1 (CXCL12), ein Chemokin, das
die Metastasierung und Chemotherapieresistenz bei Krebs beeinflusst.
Phase I wurde bereits abgeschlossen. Klinische Studien der Phase IIa
für Anwendungen in der hämatologischen Onkologie sind beantragt. -
NOX-H94 wirkt auf Hepcidin, einen zentralen Regulator des
Eisenstoffwechsels und Vermittler des funktionellen Eisenmangels der
Anämie bei chronischer Erkrankung. Es wird derzeit in einer
umfassenden Phase I Studie mit gesteigerten Einzel- und
Mehrfachdosierungen getestet.
Mit der Spiegelmer®-Technologie verfügt das Unternehmen über eine
leistungsstarke und einzigartige Plattform für die Identifizierung
neuer Wirkstoffkandidaten, von denen sich einige weitere bereits in
präklinischen Untersuchungen befinden. NOXXON hat seinen Firmensitz
in Berlin und ist ein gut finanziertes und etabliertes
Biotechnologieunternehmen mit einem starken Konsortium
internationaler Investoren, etwa 60 Mitarbeitern und einer erfahrenen
Geschäftsleitung.
Für weitere Informationen besuchen Sie bitte: www.noxxon.com
Kontakt:
NOXXON Pharma AG College Hill Life Sciences
Emmanuelle Delabre Dr. Robert Mayer
T: +49-(0)30-726247100 T: +49-(0)89 57001806
edelabre@noxxon.com robert.mayer@collegehill.com
Hinweis für Redaktionen:
Über NOX-A12
NOX-A12 bindet spezifisch an SDF-1 (stromal cell-derived factor-1)
und wirkt als Antagonist. SDF-1 ist ein Chemokin, das verschiedene
Zellen des Immunsystems sowie auch andere Zellen anlocken und
aktivieren kann. SDF-1 bindet mit hoher Affinität an die
Chemokinrezeptoren CXCR4 und CXCR7. Die Achse SDF-1/CXCR4/CXCR7
spielt eine Rolle bei der Stammzellmobilisierung, der Neubildung von
Blutgefäßen, dem Tumorwachstum und bei der Metastasierung. Wird die
Bindung von SDF-1 an seine Rezeptoren verhindert, werden Tumorzellen
empfindlicher gegenüber Chemotherapeutika, und bei einigen soliden
Tumoren wird invasives Wachstum und Metastasierung verhindert. Dies
legt nahe, dass NOX A12 in Kombination mit einer Chemotherapie bei
der Behandlung verschiedener Krebsarten von Nutzen sein könnte.
NOX-A12 zeigte eine vielversprechende Aktivität bei der
Stammzellmobilisierung und in Modellen sowohl hämatologischer als
auch solider Tumoren. Die Phase I Studien zeigten, dass NOX-A12 bis
zu einer Einzeldosis von 10,8 mg/kg sowie bei täglichen Dosen von bis
zu 2 mg/kg über fünf Tage sicher und gut verträglich war. Es kam zu
einer dosisabhängigen Mobilisierung weißer Blutkörperchen und
CD34-positiver Zellen, wie präklinische Studien bereits vermuten
ließen.
NOXXON erhält Forschungszuschüsse im Rahmen des Programms
"KMU-innovativ" des deutschen Bundesministeriums für Bildung und
Forschung (BMBF) für die präklinische Entwicklung und die
Erstanwendung von NOX-A12 am Menschen.
Weitere Informationen über die geplante klinische Studie an Patienten
mit rezidivierender CLL sind unter ClinicalTrials.gov (ID:
NCT01486797) verfügbar.
Inhibitor NOX-A12 ab
--------------------------------------------------------------------------------
Corporate News übermittelt durch euro adhoc. Für den Inhalt ist der
Emittent/Meldungsgeber verantwortlich.
--------------------------------------------------------------------------------
Unternehmen
Utl.: Vorstellung präklinischer Ergebnisse mit hämatologischen
Tumormodellen auf der ASH-Konferenz
Berlin, 12. Dezember 2011 (euro adhoc) - NOXXON Pharma AG, ein
biopharmazeutisches Unternehmen und Pionier bei der Entwicklung der
eigenen, patentierten neuen Wirkstoffklasse der Spiegelmere, gab
heute den Abschluss der klinischen Phase I Studien mit Einzel- und
Mehrfachdosierung seines SDF-1-Hemmers NOX A12 bekannt. In Studien
der Phase I hatten sich NOX-A12-Einzeldosen bis zu 10,8 mg/kg und
tägliche Dosen bis zu 2 mg/kg über fünf Tage bei freiwilligen
gesunden Probanden als sicher und gut verträglich erwiesen. Es zeigte
sich eine dosisabhängige Mobilisation weißer Blutkörperchen und
CD34-positiver Zellen, wie präklinische Studien bereits vermuten
ließen.
Die präklinischen Ergebnisse von NOX-A12 bei hämatologischen
Krebserkrankungen werden in Vorträgen auf der jährlichen Konferenz
der ASH (American Society of Hematology) vorgestellt, die vom 10. bis
13. Dezember 2011 in San Diego, USA, stattfindet. Mitglieder des
Arzneimittelentwicklungsteams von NOXXON und Kollaborationspartner
werden an der ASH-Konferenz teilnehmen und die Wirkweise sowie das
klinische Potenzial dieses innovativen Arzneimittelkandidaten
vorstellen.
Folgende drei Präsentationen über NOX-A12 werden auf der
ASH-Konferenz vorgestellt:
- Vortrag am Montag, 12. Dezember, 19.15 Uhr; Sitzung 652; Raum 6A
L-Stereoisomer RNA Oligonucleotide Anti-SDF-1 (NOX-A12) Disrupts the
Interaction of Multiple Myeloma Cells with the Bone Marrow Milieu In
Vivo, Leading to Enhanced Sensitivity to Bortezomib. A. M. Roccaro,
A. Sacco, P. Qaung, A. Azab, P. Maiso, F. Azab, Y. Zhang, G. C. Issa,
Y. Liu, H. T. Ngo, A. Kruschinski, I. M. Ghobrial
- Poster-Präsentation am Sonntag, 11. Dezember, 18-20 Uhr; Sitzung
711; Poster II in Halle GH Rapid and Efficient Mobilization of Murine
Hematopoietic Stem and Progenitor Cells with NOX-A12, a New
Spiegelmers-Based CXCR4/SDF-1(CXCL12) Antagonist M. Scheller, F.
Schwoebel, D. Vossmeyer, A. Leutz
- Poster-Präsentation am Montag, 12. Dezember, 18-20 Uhr; Sitzung
641; Poster III in Halle GH The Spiegelmer NOX-A12, a novel SDF-1
(CXCL12) inhibitor, and its effects on Chronic Lymphocytic Leukemia
(CLL) cell migration. J. Hoellenriegel, D. Zboralski, Z. Estrov, W.
G. Wierda, M. Keating, A. Kruschinski, J. A. Burger
Basierend auf den überzeugenden präklinischen Ergebnissen bei
hämatologischen und soliden Tumoren ist NOXXON überzeugt davon, dass
NOX-A12 das nötige Potenzial für die Weiterentwicklung zu einer
Therapie für verschiedene Anwendungen in der Onkologie hat. Nach
Genehmigung durch die regulatorischen Behörden und die
Ethikkommission ist der Beginn der ersten Phase IIa Studie mit
NOX-A12 in der Indikation hämatologische Tumore für Anfang 2012
geplant.
- Ende -
Über NOXXON Pharma AG NOXXON Pharma ist ein biopharmazeutisches
Unternehmen und Pionier bei der Entwicklung von Spiegelmeren, einer
patentierten neuen Wirkstoffklasse. Spiegelmere stellen chemisch
synthetisierte, nicht-immunogene Alternativen zu Antikörpern dar.
NOXXON verfügt über ein diversifiziertes Portfolio von
Spiegelmer®-Wirkstoffen im klinischen Entwicklungsstadium:
- NOX-E36 inhibiert das entzündungsfördernde Chemokin MCP-1 (CCL2)
und befindet sich derzeit in einer Phase Ib Studie zur Behandlung von
Komplikationen des Typ-2-Diabetes wie Nephropathie. Eine Phase IIa
Studie an Diabetikern mit eingeschränkter Nierenfunktion wird gerade
vorbereitet. - NOX-A12 inhibiert SDF-1 (CXCL12), ein Chemokin, das
die Metastasierung und Chemotherapieresistenz bei Krebs beeinflusst.
Phase I wurde bereits abgeschlossen. Klinische Studien der Phase IIa
für Anwendungen in der hämatologischen Onkologie sind beantragt. -
NOX-H94 wirkt auf Hepcidin, einen zentralen Regulator des
Eisenstoffwechsels und Vermittler des funktionellen Eisenmangels der
Anämie bei chronischer Erkrankung. Es wird derzeit in einer
umfassenden Phase I Studie mit gesteigerten Einzel- und
Mehrfachdosierungen getestet.
Mit der Spiegelmer®-Technologie verfügt das Unternehmen über eine
leistungsstarke und einzigartige Plattform für die Identifizierung
neuer Wirkstoffkandidaten, von denen sich einige weitere bereits in
präklinischen Untersuchungen befinden. NOXXON hat seinen Firmensitz
in Berlin und ist ein gut finanziertes und etabliertes
Biotechnologieunternehmen mit einem starken Konsortium
internationaler Investoren, etwa 60 Mitarbeitern und einer erfahrenen
Geschäftsleitung.
Für weitere Informationen besuchen Sie bitte: www.noxxon.com
Kontakt:
NOXXON Pharma AG College Hill Life Sciences
Emmanuelle Delabre Dr. Robert Mayer
T: +49-(0)30-726247100 T: +49-(0)89 57001806
edelabre@noxxon.com robert.mayer@collegehill.com
Hinweis für Redaktionen:
Über NOX-A12
NOX-A12 bindet spezifisch an SDF-1 (stromal cell-derived factor-1)
und wirkt als Antagonist. SDF-1 ist ein Chemokin, das verschiedene
Zellen des Immunsystems sowie auch andere Zellen anlocken und
aktivieren kann. SDF-1 bindet mit hoher Affinität an die
Chemokinrezeptoren CXCR4 und CXCR7. Die Achse SDF-1/CXCR4/CXCR7
spielt eine Rolle bei der Stammzellmobilisierung, der Neubildung von
Blutgefäßen, dem Tumorwachstum und bei der Metastasierung. Wird die
Bindung von SDF-1 an seine Rezeptoren verhindert, werden Tumorzellen
empfindlicher gegenüber Chemotherapeutika, und bei einigen soliden
Tumoren wird invasives Wachstum und Metastasierung verhindert. Dies
legt nahe, dass NOX A12 in Kombination mit einer Chemotherapie bei
der Behandlung verschiedener Krebsarten von Nutzen sein könnte.
NOX-A12 zeigte eine vielversprechende Aktivität bei der
Stammzellmobilisierung und in Modellen sowohl hämatologischer als
auch solider Tumoren. Die Phase I Studien zeigten, dass NOX-A12 bis
zu einer Einzeldosis von 10,8 mg/kg sowie bei täglichen Dosen von bis
zu 2 mg/kg über fünf Tage sicher und gut verträglich war. Es kam zu
einer dosisabhängigen Mobilisierung weißer Blutkörperchen und
CD34-positiver Zellen, wie präklinische Studien bereits vermuten
ließen.
NOXXON erhält Forschungszuschüsse im Rahmen des Programms
"KMU-innovativ" des deutschen Bundesministeriums für Bildung und
Forschung (BMBF) für die präklinische Entwicklung und die
Erstanwendung von NOX-A12 am Menschen.
Weitere Informationen über die geplante klinische Studie an Patienten
mit rezidivierender CLL sind unter ClinicalTrials.gov (ID:
NCT01486797) verfügbar.
A-12 wird als erstes Spiegelmer in die klinische Phase II eintreten.
Nach
Genehmigung durch die regulatorischen Behörden und die
Ethikkommission ist der Beginn der ersten Phase IIa Studie mit
NOX-A12 in der Indikation hämatologische Tumore für Anfang 2012
geplant.
Positiv ist, dass A12 das Immunsystem aktiviert (dosisabhängige Mobilisation weißer Blutkörperchen und CD34-positiver Zellen).
Nach
Genehmigung durch die regulatorischen Behörden und die
Ethikkommission ist der Beginn der ersten Phase IIa Studie mit
NOX-A12 in der Indikation hämatologische Tumore für Anfang 2012
geplant.
Positiv ist, dass A12 das Immunsystem aktiviert (dosisabhängige Mobilisation weißer Blutkörperchen und CD34-positiver Zellen).
Antwort auf Beitrag Nr.: 42.470.013 von dg6nds am 12.12.11 20:25:56Obwohl die Meldung für uns nicht die ganz großen Neuigkeiten enthält, freue ich mich vor allem über die beiden folgenden Passagen:
NOX-A12: Klinische Studien der Phase IIa für Anwendungen in der hämatologischen Onkologie sind beantragt.
NOX-E36: Eine Phase IIa Studie an Diabetikern mit eingeschränkter Nierenfunktion wird gerade vorbereitet.
Wenn sich zudem NOX-H94 wie erwartet entwickelt, könnten im Laufe von 2012 durchaus vier, fünf P2a-Studien laufen. Dazu (mindestens) eine Verpartnerung und die heiße Phase der Exit-Verhandlungen könnte allmählich beginnen. Ist allerdings noch ein weiter Weg.
Grüße
NOX-A12: Klinische Studien der Phase IIa für Anwendungen in der hämatologischen Onkologie sind beantragt.
NOX-E36: Eine Phase IIa Studie an Diabetikern mit eingeschränkter Nierenfunktion wird gerade vorbereitet.
Wenn sich zudem NOX-H94 wie erwartet entwickelt, könnten im Laufe von 2012 durchaus vier, fünf P2a-Studien laufen. Dazu (mindestens) eine Verpartnerung und die heiße Phase der Exit-Verhandlungen könnte allmählich beginnen. Ist allerdings noch ein weiter Weg.
Grüße
Antwort auf Beitrag Nr.: 42.049.212 von Saaletaler am 06.09.11 13:53:04First-in-Human-Studie mit NOX-H94 - Aktualisierung des Protokolls
Das Protokoll zur P1 mit NOX-H94 auf clinicaltrials.gov wurde Ende Dezember aktualisiert. Es wird nun mit dem Ende der Studie für März 2012 (statt Februar) bei unveränderter Anzahl von 58 Testpersonen gerechnet.
Damit kann man m.E. sehr zufrieden sein, denn es gibt offenbar keine Probleme mit der Rekrutierung, und hinsichtlich Verträglichkeit scheinen gravierende Nebenwirkungen auszubleiben. Bekanntlich sollten in dieser Studie neben Gesunden bereits (erkrankte) Patienten in Mehrfach-Dosen behandelt werden.
Da NOX-H94 weiterhin der lukrativste der bislang 3 klinischen Wirkstoffe für Noxxon sein dürfte, wäre ein rascher und befriedigender Abschluss der P1 besonders erfreulich.
P1 mit NOX-H94: http://clinicaltrials.gov/ct2/show/NCT01372137
Das Protokoll zur P1 mit NOX-H94 auf clinicaltrials.gov wurde Ende Dezember aktualisiert. Es wird nun mit dem Ende der Studie für März 2012 (statt Februar) bei unveränderter Anzahl von 58 Testpersonen gerechnet.
Damit kann man m.E. sehr zufrieden sein, denn es gibt offenbar keine Probleme mit der Rekrutierung, und hinsichtlich Verträglichkeit scheinen gravierende Nebenwirkungen auszubleiben. Bekanntlich sollten in dieser Studie neben Gesunden bereits (erkrankte) Patienten in Mehrfach-Dosen behandelt werden.
Da NOX-H94 weiterhin der lukrativste der bislang 3 klinischen Wirkstoffe für Noxxon sein dürfte, wäre ein rascher und befriedigender Abschluss der P1 besonders erfreulich.
P1 mit NOX-H94: http://clinicaltrials.gov/ct2/show/NCT01372137
NOXXON 2012 Milestones
NOX-H94 Proof-of-principle study in healthy volunteers completion: 2Q-2012
NOX-E36 Phase IIa study in diabetics with nephropathy, interim assessment 3Q-2012
NOX-H94 Phase II study in anemia of chronic disease patients, initiation: 3Q-2012
NOX-A12 Phase I/II study of in haematological cancer patients, interim assessment 4Q-2012
http://www.noxxon.com/downloads/FactSheet.pdf
NOX-H94 Proof-of-principle study in healthy volunteers completion: 2Q-2012
NOX-E36 Phase IIa study in diabetics with nephropathy, interim assessment 3Q-2012
NOX-H94 Phase II study in anemia of chronic disease patients, initiation: 3Q-2012
NOX-A12 Phase I/II study of in haematological cancer patients, interim assessment 4Q-2012
http://www.noxxon.com/downloads/FactSheet.pdf
Antwort auf Beitrag Nr.: 42.565.209 von dg6nds am 08.01.12 11:37:39Das Factsheet wurde tatsächlich kürzlich überarbeitet, es lassen sich ein paar weitere kleinere Neuigkeiten entdecken. Interessant wäre zu wissen, ob die P2a-Zwischenanalyse bei NOX-E36 in Q3/12 und NOX-A12 in Q4/12 für Verpartnerungsverhandlungen oder schon für Exit-Gespräche genutzt werden sollen.
Ich hoffe, dass Noxxon die Präsentation auf der JPMorgan-Konferenz diese Woche online stellt. Die derzeitige vom Mai 2011 ist inzwischen etwas angestaubt.
Grüße
Ich hoffe, dass Noxxon die Präsentation auf der JPMorgan-Konferenz diese Woche online stellt. Die derzeitige vom Mai 2011 ist inzwischen etwas angestaubt.
Grüße
Centocor-Studien mit anti-CCL2-mAb / Bezug zu NOX-E36
Es liegt eine Veröffentlichung zur (Nicht-)Wirksamkeit der 3 Tumor-Studien, die bislang mit CNTO-888 gelaufen sind, vor:
---------------------------------------------------
Molecular Cancer Therapeutics: November 2011; Volume 10, Issue 11, Supplement 1
Abstract A37: Development of biologics targeting soluble ligands: Novel biomarker and PK-PD analyzes examining free and total ligand profile following treatment with carlumab (anti-CCL2 mAb)
http://mct.aacrjournals.org/cgi/content/short/10/11_MeetingA…
...
Methods: Carlumab was evaluated in three oncology clinical studies (as monotherapy in a Phase 1 first-in-human trial in patients with solid tumors, a Phase 1b chemotherapy combination study, and as a single agent Phase 2a study in patients with advanced prostate cancer) ...
Results: Analysis of CCL2 levels following carlumab administration revealed a rapid fall in free CCL2 as expected; however, post-treatment free CCL2 levels rapidly rebounded and quickly exceeded pretreatment serum concentrations. Two different analytical methods showed that carlumab suppressed CCL2 levels for only 24 hrs followed by a sustained increase in CCL2 concentration with subsequent treatment. These surprising results suggest that carlumab was ineffective at neutralizing free CCL2. PK-PD modeling confirmed the transient suppression of free CCL2 consistent with a higher carlumab dissociation constant (Kd) for CCL2 binding in vivo. Finally, carlumab did not affect other biomarkers including bone turnover markers or CTC numbers, consistent with an inability to impact CCL2 signaling. No evidence of clinical efficacy was observed in any of carlumab clinical trials.
Conclusion: Development of robust analytical assays to measure free and total CCL2 concentration and utilization of mechanistic PK-PD modeling facilitated the clinical evaluation of POC for carlumab. The unexpected increase in free CCL2 concentration and the lack of CCL2 target suppression likely explain the absence of carlumab clinical activity. Supportive biomarker analyzes and mechanistic PK-PD modeling are important components of the early development clinical plan for developing biologics against soluble ligands.
---------------------------------------------------
Centocor hat mit seinem mAb CNTO-888 (= Carlumab) also offenbar Probleme, das Zielmolekül CCL2 (= MCP-1) dauerhaft auszuschalten. Zumindest scheint die Dosierungshäufigkeit (Gabe nur alle 2 bis 4 Wochen) in den bisherigen klinischen Studien vollkommen ungeeignet zu sein, da die CCL2-Blockierung nur etwa einen Tag lang anhält. Resultat ist die in dem Artikel aufgeführte fehlende Wirksamkeit bei den Krebspatienten. Es ist m.E. naheliegend, dass das gleiche Problem bei der laufenden IPF-Studie auftritt und auch diese scheitern wird.
Auch in den Studien mit NOX-E36 scheint dieser Prozess der automatischen Hochregulierung des blockierten CCL2 abzulaufen. Noxxon dosiert jedoch viel öfter, nämlich alle 2 Tage, so dass auch die körpereigene Nachproduktion von CCL2 gebunden werden kann. Zumindest lässt folgende Folie diese Interpretation m.E. zu (s. roter Kasten ganz unten):
Quelle: Präsentation auf der JP Morgan Healthcare Conference 2011 (s. Beitrag #51)

In meinem Verständnis dürfte bei den NOX-E36-Studien das Problem der CNTO-888-Studien also nicht auftreten. Eine ganz andere Frage ist jedoch, ob die (dauerhaft) erfolgreiche Blockierung von CCL2 auch zu einer Wirksamkeit bei Patienten führt. Das bleibt abzuwarten.
Centocor könnte nun versuchen, neue Studien zu starten, in denen die Dosierungshäufigkeit deutlich erhöht wird, z.B. täglich oder alle 2 Tage, ähnlich wie bei Noxxon. Dazu weiß man noch nichts.
Ohnehin waren CNTO-888 und NOX-E36 keine wirklichen Konkurrenten, da sich die gewählten Indikationen nicht überschnitten haben (s. oben bzw. #66). Allerdings könnte CNTO-888 nun das Aus drohen bzw. zumindest ein Re-Start mit P1. In diesem Fall würde der NOX-E36-Wirkstoff m.E. eine Aufwertung erfahren, da eventuell auch die ursprünglich von CNTO-888 auserkorenen Indikationen (Tumore, IPF) nun für NOX-E36 infrage kommen könnten. Vorausgesetzt, es lässt sich Wirksamkeit nachweisen!
Zitat von Saaletaler: Es liegen somit inzwischen zu folgenden Indikationen hoffnungsvolle Ergebnisse vor (ohne Anspruch auf Vollständigkeit):
NOX-E36: Komplikationen bei Typ-2-Diabetes (z.B. Diabetische Nephropathie) - P1/2-Studien laufen
NOX-E36: COPD - Präklinische Daten
CNTO-888: solide Tumore (z.B. Prostatakrebs) - P1/2-Studien laufen
CNTO-888: Idiopathische Pulmonale Fibrose - P2-Studie läuft
CNTO-888: metastasierender Brustkrebs - Präklinische Daten
Es liegt eine Veröffentlichung zur (Nicht-)Wirksamkeit der 3 Tumor-Studien, die bislang mit CNTO-888 gelaufen sind, vor:
---------------------------------------------------
Molecular Cancer Therapeutics: November 2011; Volume 10, Issue 11, Supplement 1
Abstract A37: Development of biologics targeting soluble ligands: Novel biomarker and PK-PD analyzes examining free and total ligand profile following treatment with carlumab (anti-CCL2 mAb)
http://mct.aacrjournals.org/cgi/content/short/10/11_MeetingA…
...
Methods: Carlumab was evaluated in three oncology clinical studies (as monotherapy in a Phase 1 first-in-human trial in patients with solid tumors, a Phase 1b chemotherapy combination study, and as a single agent Phase 2a study in patients with advanced prostate cancer) ...
Results: Analysis of CCL2 levels following carlumab administration revealed a rapid fall in free CCL2 as expected; however, post-treatment free CCL2 levels rapidly rebounded and quickly exceeded pretreatment serum concentrations. Two different analytical methods showed that carlumab suppressed CCL2 levels for only 24 hrs followed by a sustained increase in CCL2 concentration with subsequent treatment. These surprising results suggest that carlumab was ineffective at neutralizing free CCL2. PK-PD modeling confirmed the transient suppression of free CCL2 consistent with a higher carlumab dissociation constant (Kd) for CCL2 binding in vivo. Finally, carlumab did not affect other biomarkers including bone turnover markers or CTC numbers, consistent with an inability to impact CCL2 signaling. No evidence of clinical efficacy was observed in any of carlumab clinical trials.
Conclusion: Development of robust analytical assays to measure free and total CCL2 concentration and utilization of mechanistic PK-PD modeling facilitated the clinical evaluation of POC for carlumab. The unexpected increase in free CCL2 concentration and the lack of CCL2 target suppression likely explain the absence of carlumab clinical activity. Supportive biomarker analyzes and mechanistic PK-PD modeling are important components of the early development clinical plan for developing biologics against soluble ligands.
---------------------------------------------------
Centocor hat mit seinem mAb CNTO-888 (= Carlumab) also offenbar Probleme, das Zielmolekül CCL2 (= MCP-1) dauerhaft auszuschalten. Zumindest scheint die Dosierungshäufigkeit (Gabe nur alle 2 bis 4 Wochen) in den bisherigen klinischen Studien vollkommen ungeeignet zu sein, da die CCL2-Blockierung nur etwa einen Tag lang anhält. Resultat ist die in dem Artikel aufgeführte fehlende Wirksamkeit bei den Krebspatienten. Es ist m.E. naheliegend, dass das gleiche Problem bei der laufenden IPF-Studie auftritt und auch diese scheitern wird.
Auch in den Studien mit NOX-E36 scheint dieser Prozess der automatischen Hochregulierung des blockierten CCL2 abzulaufen. Noxxon dosiert jedoch viel öfter, nämlich alle 2 Tage, so dass auch die körpereigene Nachproduktion von CCL2 gebunden werden kann. Zumindest lässt folgende Folie diese Interpretation m.E. zu (s. roter Kasten ganz unten):
Quelle: Präsentation auf der JP Morgan Healthcare Conference 2011 (s. Beitrag #51)

In meinem Verständnis dürfte bei den NOX-E36-Studien das Problem der CNTO-888-Studien also nicht auftreten. Eine ganz andere Frage ist jedoch, ob die (dauerhaft) erfolgreiche Blockierung von CCL2 auch zu einer Wirksamkeit bei Patienten führt. Das bleibt abzuwarten.
Centocor könnte nun versuchen, neue Studien zu starten, in denen die Dosierungshäufigkeit deutlich erhöht wird, z.B. täglich oder alle 2 Tage, ähnlich wie bei Noxxon. Dazu weiß man noch nichts.
Ohnehin waren CNTO-888 und NOX-E36 keine wirklichen Konkurrenten, da sich die gewählten Indikationen nicht überschnitten haben (s. oben bzw. #66). Allerdings könnte CNTO-888 nun das Aus drohen bzw. zumindest ein Re-Start mit P1. In diesem Fall würde der NOX-E36-Wirkstoff m.E. eine Aufwertung erfahren, da eventuell auch die ursprünglich von CNTO-888 auserkorenen Indikationen (Tumore, IPF) nun für NOX-E36 infrage kommen könnten. Vorausgesetzt, es lässt sich Wirksamkeit nachweisen!
Präklinische Pipeline
Aus aktuellem Anlass kurz zu den Entwicklungen in der Präklinik, soweit von Noxxon via Homepage kommuniziert:
http://www.noxxon.com/index.php?option=com_content&view=arti…
-----------------------------------------------------------------
1) NOX-B11 mit dem Target Ghrelin wurde aus der Präklinik-Liste entfernt. Schon 2006 hatte sich Pfizer an dessen Entwicklung versucht, das Molekül aber scheinbar zurückgegeben. Indikation ist/war Adipositas.
Erst 2011 gab es dazu eine weitere Publikation mit Noxxon-Beteiligung. Das Target scheint also weiter untersucht zu werden, vielleicht nun nicht mehr in erster Front.
Sangiao-Alvarellos et al.: Ghrelin neutralization during fasting-refeeding cycle impairs the recuperation of body weight and alters hepatic energy metabolism. Mol. Cell. Endocrinol. 2011 Jan 15
-----------------------------------------------------------------
2) Neu in der Liste ist dafür NOX-G15 mit dem Target Glucagon in der Indikation Diabetes.
Lilly hat mehrere Studien mit LY2409021 laufen, einem Wirkstoff gegen den Glucagon-Rezeptor. Nach mehr Konkurrenz müsste man suchen.
http://lilly.com/SiteCollectionDocuments/FlashFiles/PipeLine…
-----------------------------------------------------------------
3) Weiterhin in der Liste ist NOX-S93 gegen das Target S1P (sphingosine-1-phosphate), Indikationen sind angiogenesis in cancer, ocular diseases, autoimmune disorders.
Einen Konkurrenz-Wirkstoff hat Lpath in Partnerschaft mit Pfizer in P2-Studien. Nach mehr Konkurrenz müsste man suchen.
http://www.lpath.com/about-lpath/pipeline/
-----------------------------------------------------------------
4) Drittes Spiegelmer in der Liste ist NOX-D19 mit dem Target C5a. Nach Konkurrenz müsste man suchen.
-----------------------------------------------------------------
Möglicherweise versucht Noxxon, einen dieser Kandidaten zu verpartnern. Eine eigene Überführung in die klinische Phase noch vor dem Exit halte ich für unwahrscheinlich. Noxxon dürfte sich auf die P2-Studien der aktuellen 3 Haupt-Wirkstoffe konzentrieren.
Aus aktuellem Anlass kurz zu den Entwicklungen in der Präklinik, soweit von Noxxon via Homepage kommuniziert:
http://www.noxxon.com/index.php?option=com_content&view=arti…
-----------------------------------------------------------------
1) NOX-B11 mit dem Target Ghrelin wurde aus der Präklinik-Liste entfernt. Schon 2006 hatte sich Pfizer an dessen Entwicklung versucht, das Molekül aber scheinbar zurückgegeben. Indikation ist/war Adipositas.
Erst 2011 gab es dazu eine weitere Publikation mit Noxxon-Beteiligung. Das Target scheint also weiter untersucht zu werden, vielleicht nun nicht mehr in erster Front.
Sangiao-Alvarellos et al.: Ghrelin neutralization during fasting-refeeding cycle impairs the recuperation of body weight and alters hepatic energy metabolism. Mol. Cell. Endocrinol. 2011 Jan 15
-----------------------------------------------------------------
2) Neu in der Liste ist dafür NOX-G15 mit dem Target Glucagon in der Indikation Diabetes.
Lilly hat mehrere Studien mit LY2409021 laufen, einem Wirkstoff gegen den Glucagon-Rezeptor. Nach mehr Konkurrenz müsste man suchen.
http://lilly.com/SiteCollectionDocuments/FlashFiles/PipeLine…
-----------------------------------------------------------------
3) Weiterhin in der Liste ist NOX-S93 gegen das Target S1P (sphingosine-1-phosphate), Indikationen sind angiogenesis in cancer, ocular diseases, autoimmune disorders.
Einen Konkurrenz-Wirkstoff hat Lpath in Partnerschaft mit Pfizer in P2-Studien. Nach mehr Konkurrenz müsste man suchen.
http://www.lpath.com/about-lpath/pipeline/
-----------------------------------------------------------------
4) Drittes Spiegelmer in der Liste ist NOX-D19 mit dem Target C5a. Nach Konkurrenz müsste man suchen.
-----------------------------------------------------------------
Möglicherweise versucht Noxxon, einen dieser Kandidaten zu verpartnern. Eine eigene Überführung in die klinische Phase noch vor dem Exit halte ich für unwahrscheinlich. Noxxon dürfte sich auf die P2-Studien der aktuellen 3 Haupt-Wirkstoffe konzentrieren.
Antwort auf Beitrag Nr.: 42.451.585 von Saaletaler am 07.12.11 18:56:44P2-Kombi-Studie mit NOX-A12 bei (wiederkehrendem) Multiplen Myelom (MM)
Neben der P2-Kombi-Studie in CLL wurde jetzt das Protokoll für die zweite P2-Kombi-Studie mit NOX-A12 online gestellt, diesmal in der Indikation Multiples Myelom. Auch hierbei handelt es sich um eine relativ kleine, offene Studie mit nur 28 Patienten. Dadurch kommt man relativ zügig zu Zwischenergebnissen, so wird das Auslesen des primären Studienziels bereits Anfang 2013 erwartet. Start soll im Februar 2012 sein.
NOX-A12 wird dabei - analog der CLL-Studie - in Kombination mit zwei MM-Standard-Medikamenten, Bortezomib + Dexamethason, verabreicht und soll deren Wirkung durch die CXCL12-Blockierung verstärken.
P2-Kombi-Studie mit NOX-A12 in MM: http://clinicaltrials.gov/ct2/show/NCT01521533
P2-Kombi-Studie mit NOX-A12 in CLL: http://clinicaltrials.gov/ct2/show/NCT01486797
Bortezomib: http://de.wikipedia.org/wiki/Bortezomib
Dexamethason: http://de.wikipedia.org/wiki/Dexamethason
MM: http://de.wikipedia.org/wiki/Multiples_Myelom
Damit sind die ersten beiden P2-Studien offenbar genehmigt. Dazu dürfte in Kürze die P2 mit NOX-E36 in Diabetische Nephropathie kommen. Außerdem soll NOX-H94 laut letzter Pressemeldung nach Abschluss der P1 in zwei Indikationen bei Anämie chronischer Erkrankungen (ACD) auf Wirksamkeit getestet werden. Das wären dann fünf P2-Studien als Vorbereitung auf den Exit!
Neben der P2-Kombi-Studie in CLL wurde jetzt das Protokoll für die zweite P2-Kombi-Studie mit NOX-A12 online gestellt, diesmal in der Indikation Multiples Myelom. Auch hierbei handelt es sich um eine relativ kleine, offene Studie mit nur 28 Patienten. Dadurch kommt man relativ zügig zu Zwischenergebnissen, so wird das Auslesen des primären Studienziels bereits Anfang 2013 erwartet. Start soll im Februar 2012 sein.
NOX-A12 wird dabei - analog der CLL-Studie - in Kombination mit zwei MM-Standard-Medikamenten, Bortezomib + Dexamethason, verabreicht und soll deren Wirkung durch die CXCL12-Blockierung verstärken.
P2-Kombi-Studie mit NOX-A12 in MM: http://clinicaltrials.gov/ct2/show/NCT01521533
P2-Kombi-Studie mit NOX-A12 in CLL: http://clinicaltrials.gov/ct2/show/NCT01486797
Bortezomib: http://de.wikipedia.org/wiki/Bortezomib
Dexamethason: http://de.wikipedia.org/wiki/Dexamethason
MM: http://de.wikipedia.org/wiki/Multiples_Myelom
Damit sind die ersten beiden P2-Studien offenbar genehmigt. Dazu dürfte in Kürze die P2 mit NOX-E36 in Diabetische Nephropathie kommen. Außerdem soll NOX-H94 laut letzter Pressemeldung nach Abschluss der P1 in zwei Indikationen bei Anämie chronischer Erkrankungen (ACD) auf Wirksamkeit getestet werden. Das wären dann fünf P2-Studien als Vorbereitung auf den Exit!
Antwort auf Beitrag Nr.: 42.669.921 von Saaletaler am 30.01.12 18:56:20Aktuelle Übersicht zu den (erwarteten) P2-Studien von Noxxon in 2012
Spiegelmer --------------- NOX-A12 NOX-A12 NOX-E36 NOX-H94 NOX-H94 | Indikation --------------------------- CLL (Kombi) MM (Kombi) Diabet. Nephropathie ACD #1 ACD #2 | Anz. Pers. ------- 33 28 ? ? ? | Start --------- Feb/12 Feb/12 ? ? ? | Abschluss Primärziel ------------- Feb/13 Feb/13 ? ? ? | Link zu clinicaltrials.gov -------------------------------------------------------------- http://clinicaltrials.gov/ct2/show/NCT01486797 http://clinicaltrials.gov/ct2/show/NCT01521533 ? ? ? |
Antwort auf Beitrag Nr.: 42.540.000 von Saaletaler am 02.01.12 17:15:58Vorgelagerte P2-Simulationsstudie mit NOX-H94 an Gesunden
Bevor die eigentlichen P2-Studien mit NOX-H94 bei typischen ACD-Erkrankungen beginnen, hat Noxxon eine Teststudie vorgeschaltet. Dabei wird gesunden Freiwilligen Endotoxin injiziert, ein Stoff, der einen Entzündungsprozess im Körper auslöst und damit über die IL6-Aktivierung auch die Hepcidin-Produktion anregt, was zu Eisenentzug führt. Es findet also (grob gesagt) die Simulation einer ACD-Erkrankung bei gesunden Testpersonen statt. Anschließend wird NOX-H94 verabreicht, um zu sehen, ob die Hepcidin-Neutralisierung zur erhofften Eisen-Freigabe und damit zur gesteigerten Blutbildung führt.
Die Studie mit 24 Probanden an der Uni Nijmegen hat im Januar begonnen, ist doppelt verblindet mit Placebo-Kontrolle und soll nur bis März 2012 laufen, so dass sie parallel zur umfangreichen P1 enden würde. Läuft alles glatt, könnten anschließend die eigentlichen P2-Studien beantragt werden.
P2-Simulationsstudie mit NOX-H94: http://clinicaltrials.gov/ct2/show/NCT01522794
Endotoxin: http://en.wikipedia.org/wiki/Endotoxin
Anemia of chronic disease (ACD): http://en.wikipedia.org/wiki/Anemia_of_chronic_disease
In meiner bescheidenen Einschätzung eine ganz wichtige Studie, da man dadurch mit wenig Aufwand bereits eine erste Wirksamkeitsindikation erhalten dürfte, quasi einen Mini-Proof-of-Concept, womit Noxxon hausieren gehen könnte, sofern die Daten positiv ausfallen. Ich bezweifle aber, dass Noxxon Daten dazu veröffentlichen wird.
Schöne Nebenerkenntnis: Die P1 scheint ohne große Probleme gelaufen zu sein.
Bevor die eigentlichen P2-Studien mit NOX-H94 bei typischen ACD-Erkrankungen beginnen, hat Noxxon eine Teststudie vorgeschaltet. Dabei wird gesunden Freiwilligen Endotoxin injiziert, ein Stoff, der einen Entzündungsprozess im Körper auslöst und damit über die IL6-Aktivierung auch die Hepcidin-Produktion anregt, was zu Eisenentzug führt. Es findet also (grob gesagt) die Simulation einer ACD-Erkrankung bei gesunden Testpersonen statt. Anschließend wird NOX-H94 verabreicht, um zu sehen, ob die Hepcidin-Neutralisierung zur erhofften Eisen-Freigabe und damit zur gesteigerten Blutbildung führt.
Die Studie mit 24 Probanden an der Uni Nijmegen hat im Januar begonnen, ist doppelt verblindet mit Placebo-Kontrolle und soll nur bis März 2012 laufen, so dass sie parallel zur umfangreichen P1 enden würde. Läuft alles glatt, könnten anschließend die eigentlichen P2-Studien beantragt werden.
P2-Simulationsstudie mit NOX-H94: http://clinicaltrials.gov/ct2/show/NCT01522794
Endotoxin: http://en.wikipedia.org/wiki/Endotoxin
Anemia of chronic disease (ACD): http://en.wikipedia.org/wiki/Anemia_of_chronic_disease
In meiner bescheidenen Einschätzung eine ganz wichtige Studie, da man dadurch mit wenig Aufwand bereits eine erste Wirksamkeitsindikation erhalten dürfte, quasi einen Mini-Proof-of-Concept, womit Noxxon hausieren gehen könnte, sofern die Daten positiv ausfallen. Ich bezweifle aber, dass Noxxon Daten dazu veröffentlichen wird.
Schöne Nebenerkenntnis: Die P1 scheint ohne große Probleme gelaufen zu sein.

Antwort auf Beitrag Nr.: 42.670.097 von Saaletaler am 30.01.12 19:30:20Übersicht zu den (erwarteten) P2-Studien von Noxxon in 2012 (Aktualisierung)
Ich nehme zusätzlich die Endotoxin-Simulationsstudie mit NOX-H94 (s. Beitrag #92) auf, da sie als P2 deklariert ist. Mit dem kompletten Ende dieser Studie wird im März 2012 gerechnet.
(neue oder veränderte Eintragungen in kursiv)
Ich nehme zusätzlich die Endotoxin-Simulationsstudie mit NOX-H94 (s. Beitrag #92) auf, da sie als P2 deklariert ist. Mit dem kompletten Ende dieser Studie wird im März 2012 gerechnet.
Spiegelmer --------------- NOX-A12 NOX-A12 NOX-E36 NOX-H94 NOX-H94 NOX-H94 | Indikation --------------------------- CLL (Kombi) MM (Kombi) Diabet. Nephropathie Endotoxin-Simulation ACD #1 ACD #2 | Anz. Pers. ------- 33 28 ? 24 ? ? | Start --------- Feb/12 Feb/12 ? Jan/12 ? ? | Abschluss Primärziel ------------- Feb/13 Feb/13 ? Mär/12 ? ? | Link zu clinicaltrials.gov -------------------------------------------------------------- http://clinicaltrials.gov/ct2/show/NCT01486797 http://clinicaltrials.gov/ct2/show/NCT01521533 ? http://clinicaltrials.gov/ct2/show/NCT01522794 ? ? |
(neue oder veränderte Eintragungen in kursiv)
Antwort auf Beitrag Nr.: 42.683.227 von Saaletaler am 01.02.12 20:00:33Noxxon schreibt im aktuellen Factsheet: "Two human efficacy trials of NOX-H94 are currently in preparation." Das könnte bedeuten, dass die Endotoxin-Studie bereits eine dieser beiden Wirksamkeitsstudien ist. Denn obwohl dabei keine wirklich Erkrankten untersucht werden, findet eine Art Wirksamkeitstest durch die "künstlich" hervorgerufene Entzündung statt, siehe #92.
Insofern wäre es gut möglich, dass in meiner Tabelle die Endotoxin-Simulation bereits die ADC#1-Indikation darstellt. Muss man mal abwarten, bis sich Noxxon detailliert dazu äußert.
Noxxon-Factsheet (pdf): http://www.noxxon.com/downloads/FactSheet.pdf
Insofern wäre es gut möglich, dass in meiner Tabelle die Endotoxin-Simulation bereits die ADC#1-Indikation darstellt. Muss man mal abwarten, bis sich Noxxon detailliert dazu äußert.
Noxxon-Factsheet (pdf): http://www.noxxon.com/downloads/FactSheet.pdf
Jahresabschluss/Lagebericht für 2010 - R&D-Partnerschaften mit Roche bzw. Lilly
Im eBundesanzeiger wurde der Jahresabschluss samt Lagebericht für 2010 veröffentlicht. Interessant darin sind u.a. die Angaben zu den beendeten R&D-Partnerschaften mit Roche und Lilly (s. auch Postings #70 ff.). Noxxon schreibt dazu:
--------------------------------
Die Partnerschaft mit Roche ist ausgelaufen. Diese Entscheidung ist vor dem weiteren Hintergrund der von Roche am 17. November 2010 angekündigten Entscheidung, die sIRNA-Forschungsarbeiten zu beenden, zu sehen, was zur Schließung der Einheit in Nutley, New Jersey, führte, mit der NOXXON zusammenarbeitete.
Der im Juni 2008 abgeschlossene Kooperationsvertrag mit Eli Lilly and Company zur Lizenzierung und Entwicklung von Spiegelmeren wurde beendet. Das Ende der Vereinbarung mit Eli Lilly war enttäuschend, da NOXXON Ende 2009 ein Spiegelmer® mit hoher Affinität und Spezifität für das von Eli Lilly gewählte Zielmolekül geliefert hat.
--------------------------------
Bei der Roche-Partnerschaft scheint es also höchstens bedingt Noxxon-spezifische Gründe zu geben. Noxxon war möglicherweise einfach in der falschen R&D-Abteilung eingegliedert, denn mit siRNA haben die Spiegelmere (soweit ich das einschätzen kann) nicht viel zu tun. Unter wikipedia gibt es dazu noch folgende Aussage:
Auch die therapeutische Anwendung von siRNA in der Medizin ist Gegenstand der Forschung. Einige siRNA-basierte potenzielle Arzneistoffe befinden sich in späten Phasen der klinischen Erprobung. Nach dem Scheitern von Bevasiranib stellten mehrere große pharmazeutische Unternehmen, darunter Hoffmann-La Roche, ihre auf siRNA basierenden Entwicklungsprogramme ein.
Quelle: http://de.wikipedia.org/wiki/Small_interfering_RNA
Warum Lilly seine Partnerschaft mit Noxxon beendet hat, ist dagegen unklar. Ich habe dazu nach kurzer Recherche nur gefunden, dass Dr. William Chin, seinerzeit Vice President of Discovery and Clinical Research bei Lilly, der sowohl den Abschluss der Partnerschaft 2008 als auch den Meilenstein Ende 2009 für Lilly kommentiert hat, Lilly Anfang 2010 verlassen und Forschungschef an der Harvard Medical School wurde. Das könnte m.E. bedeuten, dass es bei Lilly 2010 eine Umstrukturierung der R&D-Aktivitäten inklusive neuer Verantwortlichkeiten gegeben hat, der die Noxxon-Kooperation zum Opfer gefallen ist.
Wenn dieses Migräne-Projekt, für das bereits ein passendes Spiegelmer geliefert wurde, tatsächlich verheißungsvoll war/ist, sollte m.E. weiterhin die (theoretische) Möglichkeit bestehen, es weiter zu entwickeln, entweder bei Lilly selbst oder bei Noxxon, sofern man die Rechte dafür zurückbekommt. Wurde das Projekt jedoch eingestellt, weil die präklinischen Studien bei Lilly enttäuscht haben, so muss man dem Ende des Projektes auch nicht hinterher weinen.
Wie man das Ende der Kooperationen mit Pfizer, Roche bzw. Lilly auch bewertet, Fakt ist, dass Noxxon derzeit (zumindest nach außen hin) keine Partnerschaften mit Big Pharma aufweisen kann. Dass dies insbesondere bei (potentiellen) DEWB-Aktionären Zweifel am Erfolg der Spiegelmere weckt, ist nachvollziehbar.
Eine Verpartnerung eines der 3 Haupt-Spiegelmere vor dem Vorliegen von P2-Daten scheint äußerst unwahrscheinlich. Überhaupt wird Noxxon m.E. diese 3 dem späteren Übernehmer vorbehalten, um den Exit-Wert zu maximieren. Nur bei einem angestrebten IPO könnte es m.E. zu Einzelverpartnerungen an verschiedene Pharmas kommen. So oder so dürfte dies jedoch erst 2013 konkret werden.
Für 2012 bleibt somit meine Hoffnung, dass es Noxxon gelingt, eines der präklinischen Spiegelmere zu verpartnern oder auszulizensieren, sofern man dies möchte. Dies würde nach außen hin dokumentieren, dass Big Pharma weiterhin Interesse an der Spiegelmer-Technologie besitzt und m.E. einen Schub in der DEWB-Aktie nach oben auslösen.
Im eBundesanzeiger wurde der Jahresabschluss samt Lagebericht für 2010 veröffentlicht. Interessant darin sind u.a. die Angaben zu den beendeten R&D-Partnerschaften mit Roche und Lilly (s. auch Postings #70 ff.). Noxxon schreibt dazu:
--------------------------------
Die Partnerschaft mit Roche ist ausgelaufen. Diese Entscheidung ist vor dem weiteren Hintergrund der von Roche am 17. November 2010 angekündigten Entscheidung, die sIRNA-Forschungsarbeiten zu beenden, zu sehen, was zur Schließung der Einheit in Nutley, New Jersey, führte, mit der NOXXON zusammenarbeitete.
Der im Juni 2008 abgeschlossene Kooperationsvertrag mit Eli Lilly and Company zur Lizenzierung und Entwicklung von Spiegelmeren wurde beendet. Das Ende der Vereinbarung mit Eli Lilly war enttäuschend, da NOXXON Ende 2009 ein Spiegelmer® mit hoher Affinität und Spezifität für das von Eli Lilly gewählte Zielmolekül geliefert hat.
--------------------------------
Bei der Roche-Partnerschaft scheint es also höchstens bedingt Noxxon-spezifische Gründe zu geben. Noxxon war möglicherweise einfach in der falschen R&D-Abteilung eingegliedert, denn mit siRNA haben die Spiegelmere (soweit ich das einschätzen kann) nicht viel zu tun. Unter wikipedia gibt es dazu noch folgende Aussage:
Auch die therapeutische Anwendung von siRNA in der Medizin ist Gegenstand der Forschung. Einige siRNA-basierte potenzielle Arzneistoffe befinden sich in späten Phasen der klinischen Erprobung. Nach dem Scheitern von Bevasiranib stellten mehrere große pharmazeutische Unternehmen, darunter Hoffmann-La Roche, ihre auf siRNA basierenden Entwicklungsprogramme ein.
Quelle: http://de.wikipedia.org/wiki/Small_interfering_RNA
Warum Lilly seine Partnerschaft mit Noxxon beendet hat, ist dagegen unklar. Ich habe dazu nach kurzer Recherche nur gefunden, dass Dr. William Chin, seinerzeit Vice President of Discovery and Clinical Research bei Lilly, der sowohl den Abschluss der Partnerschaft 2008 als auch den Meilenstein Ende 2009 für Lilly kommentiert hat, Lilly Anfang 2010 verlassen und Forschungschef an der Harvard Medical School wurde. Das könnte m.E. bedeuten, dass es bei Lilly 2010 eine Umstrukturierung der R&D-Aktivitäten inklusive neuer Verantwortlichkeiten gegeben hat, der die Noxxon-Kooperation zum Opfer gefallen ist.
Wenn dieses Migräne-Projekt, für das bereits ein passendes Spiegelmer geliefert wurde, tatsächlich verheißungsvoll war/ist, sollte m.E. weiterhin die (theoretische) Möglichkeit bestehen, es weiter zu entwickeln, entweder bei Lilly selbst oder bei Noxxon, sofern man die Rechte dafür zurückbekommt. Wurde das Projekt jedoch eingestellt, weil die präklinischen Studien bei Lilly enttäuscht haben, so muss man dem Ende des Projektes auch nicht hinterher weinen.
Wie man das Ende der Kooperationen mit Pfizer, Roche bzw. Lilly auch bewertet, Fakt ist, dass Noxxon derzeit (zumindest nach außen hin) keine Partnerschaften mit Big Pharma aufweisen kann. Dass dies insbesondere bei (potentiellen) DEWB-Aktionären Zweifel am Erfolg der Spiegelmere weckt, ist nachvollziehbar.
Eine Verpartnerung eines der 3 Haupt-Spiegelmere vor dem Vorliegen von P2-Daten scheint äußerst unwahrscheinlich. Überhaupt wird Noxxon m.E. diese 3 dem späteren Übernehmer vorbehalten, um den Exit-Wert zu maximieren. Nur bei einem angestrebten IPO könnte es m.E. zu Einzelverpartnerungen an verschiedene Pharmas kommen. So oder so dürfte dies jedoch erst 2013 konkret werden.
Für 2012 bleibt somit meine Hoffnung, dass es Noxxon gelingt, eines der präklinischen Spiegelmere zu verpartnern oder auszulizensieren, sofern man dies möchte. Dies würde nach außen hin dokumentieren, dass Big Pharma weiterhin Interesse an der Spiegelmer-Technologie besitzt und m.E. einen Schub in der DEWB-Aktie nach oben auslösen.
Antwort auf Beitrag Nr.: 42.774.322 von Saaletaler am 19.02.12 18:05:50Link vergessen: Eli Lilly’s William Chin to Head Harvard’s Research
So, nun auch für diesen speziellen Noxxon-Thread das Video zu unserer nun wichtigsten Beteiligung mit Blockbuster-Potential:
Antwort auf Beitrag Nr.: 42.237.183 von Saaletaler am 20.10.11 14:58:25P2-Studie mit NOX-E36 bei Typ-2-Diabetes und Albuminurie
Das Protokoll für die angekündigte P2 mit NOX-E36 ist nun online. Es wird bereits rekrutiert. Die Studie soll 75 Patienten umfassen, sie ist verblindet und soll bis Mitte 2014 laufen. Das Primärziel wird jedoch laut Plan bereits im Mai 2013 erreicht. Noxxon hat eine Zwischenbegutachtung der Daten in Q3/12 angekündigt (s. #86)
Getestet wird an Diabetes-Patienten mit Albuminurie. Albuminurie ist eine spezielle Form der Proteinurie und bezeichnet ein erhöhtes Ausscheiden von Eiweißen (speziell von Albumin) über den Urin, was auf eine eingeschränkte Nierenfunktion hindeutet. Unter wikipedia.de steht dazu:
------------------
Menschen, bei denen eine vermehrte Ausscheidung von Albumin im Urin nachgewiesen wird, haben ein erhöhtes Risiko, im weiteren Verlauf einen fortschreitenden Verlust der Nierenfunktion bis hin zum dialysepflichtigen Nierenversagen zu erleiden. Bei gegebener Nierenfunktion steigt mit zunehmender Proteinurie die Mortalität sowie das Risiko, einen Herzinfarkt zu erleiden.
------------------
Albuminurie ist häufig die Folge einer diabetischen Nephropathie, einer Nierenerkrankung bei langjährigen Diabetikern, die häufig zur Dialyse führt.
Ziel von NOX-E36 ist, über die Blockierung des Targets CCL2 die bei den Patienten eingeschränkte Nierenfunktion zu verbessern. Ist das Wirkprinzip erfolgreich, müsste es sich in einer weniger starken Ausscheidung von Albumin im Urin messen lassen (s. Primärziel der Studie).
P2-Studie mit NOX-E36: http://clinicaltrials.gov/ct2/show/NCT01547897
Proteinurie (bzw. Albuminurie): http://de.wikipedia.org/wiki/Proteinurie
Diabetische Nephropathie: http://de.wikipedia.org/wiki/Diabetische_Nephropathie
Die MAD-P1 mit NOX-E36 rekrutiert inzwischen nicht mehr. Offiziell läuft die Studie aber noch bis April. Dort wurden ja bereits Diabetes-Patienten behandelt, primär zum Zwecke der Untersuchung der Verträglichkeit des Spiegelmers.
MAD-P1 mit NOX-E36: http://clinicaltrials.gov/ct2/show/NCT01085292
Ich nehme an, dass Noxxon demnächst eine offizielle Meldung zum P1-Abschluss und dem P2-Start veröffentlicht. Dort erfährt man vielleicht Details zu den P1-Erkenntnissen oder zum Potenzial von NOX-E36 in dieser Indikation.
Das Protokoll für die angekündigte P2 mit NOX-E36 ist nun online. Es wird bereits rekrutiert. Die Studie soll 75 Patienten umfassen, sie ist verblindet und soll bis Mitte 2014 laufen. Das Primärziel wird jedoch laut Plan bereits im Mai 2013 erreicht. Noxxon hat eine Zwischenbegutachtung der Daten in Q3/12 angekündigt (s. #86)
Getestet wird an Diabetes-Patienten mit Albuminurie. Albuminurie ist eine spezielle Form der Proteinurie und bezeichnet ein erhöhtes Ausscheiden von Eiweißen (speziell von Albumin) über den Urin, was auf eine eingeschränkte Nierenfunktion hindeutet. Unter wikipedia.de steht dazu:
------------------
Menschen, bei denen eine vermehrte Ausscheidung von Albumin im Urin nachgewiesen wird, haben ein erhöhtes Risiko, im weiteren Verlauf einen fortschreitenden Verlust der Nierenfunktion bis hin zum dialysepflichtigen Nierenversagen zu erleiden. Bei gegebener Nierenfunktion steigt mit zunehmender Proteinurie die Mortalität sowie das Risiko, einen Herzinfarkt zu erleiden.
------------------
Albuminurie ist häufig die Folge einer diabetischen Nephropathie, einer Nierenerkrankung bei langjährigen Diabetikern, die häufig zur Dialyse führt.
Ziel von NOX-E36 ist, über die Blockierung des Targets CCL2 die bei den Patienten eingeschränkte Nierenfunktion zu verbessern. Ist das Wirkprinzip erfolgreich, müsste es sich in einer weniger starken Ausscheidung von Albumin im Urin messen lassen (s. Primärziel der Studie).
P2-Studie mit NOX-E36: http://clinicaltrials.gov/ct2/show/NCT01547897
Proteinurie (bzw. Albuminurie): http://de.wikipedia.org/wiki/Proteinurie
Diabetische Nephropathie: http://de.wikipedia.org/wiki/Diabetische_Nephropathie
Die MAD-P1 mit NOX-E36 rekrutiert inzwischen nicht mehr. Offiziell läuft die Studie aber noch bis April. Dort wurden ja bereits Diabetes-Patienten behandelt, primär zum Zwecke der Untersuchung der Verträglichkeit des Spiegelmers.
MAD-P1 mit NOX-E36: http://clinicaltrials.gov/ct2/show/NCT01085292
Ich nehme an, dass Noxxon demnächst eine offizielle Meldung zum P1-Abschluss und dem P2-Start veröffentlicht. Dort erfährt man vielleicht Details zu den P1-Erkenntnissen oder zum Potenzial von NOX-E36 in dieser Indikation.
Übersicht zu den (erwarteten) P2-Studien von Noxxon in 2012 (Aktualisierung)
Aufgenommen wird die P2 mit NOX-E36 bei Typ-2-Diabetikern mit Albuminurie (s. Beitrag #98).
*) Zwischenbegutachtung in HJ2/12 geplant (s. Noxxon-Factsheet)
(neue oder veränderte Eintragungen in kursiv)
Aufgenommen wird die P2 mit NOX-E36 bei Typ-2-Diabetikern mit Albuminurie (s. Beitrag #98).
Spiegelmer --------------- NOX-A12 NOX-A12 NOX-E36 NOX-H94 NOX-H94 NOX-H94 | Indikation --------------------------- CLL (Kombi) MM (Kombi) Diabetes+Albuminurie Endotoxin-Simulation ACD #1 ACD #2 | Anz. Pers. ------- 33 28 75 24 ? ? | Maskierung --------------- offen offen verblindet * verblindet ? ? | Start ------------- Feb/12 Feb/12 Mär/12 Jan/12 ? ? | Abschluss Primärziel ------------- Feb/13 Feb/13 Mai/13 Mär/12 ? ? | Abschluss Studie ------------- Dez/15 Dez/14 Mai/14 Mär/12 ? ? | Protokoll ------------ Klick Klick Klick Klick ? ? |
*) Zwischenbegutachtung in HJ2/12 geplant (s. Noxxon-Factsheet)
(neue oder veränderte Eintragungen in kursiv)
Quelle DEWB AG:
04.04.12 - NOXXONs NOX-A12 verzögert die Rezidivbildung im präklinischen Glioblastom-Modell
Präsentation aktueller Daten auf dem Jahrestreffen der American Association for Cancer Research (AACR)
Berlin – 4. April 2012- NOXXON Pharma AG, ein biopharmazeutisches Unternehmen und Pionier bei der Entwicklung der eigenen, patentierten neuen Wirkstoffklasse der Spiegelmere, gab heute bekannt, dass in einer präklinischen Studie die Rezidivbildung von Glioblastomen nach Bestrahlung durch die Gabe des SDF-1-hemmenden Spiegelmers NOX-A12 deutlich verzögert werden konnte. Die Daten aus dieser Studie wurden gerade auf dem Jahrestreffen der American Association for Cancer Research (AACR) in Chicago präsentiert. Das vorgestellte Poster trägt den Titel "Inhibition of SDF-1 (CXCL12) using the Spiegelmer NOX-A12 markedly delays the recurrence of ENU-induced rat brain tumors following irradiation".
Die Studie, die in Zusammenarbeit mit der Stanford University School of Medicine durchgeführt wurde, untersuchte im Tiermodell die Wirksamkeit von NOX-A12 auf Gehirntumor-Rezidive nach der Bestrahlung. In diesem Modell entwickeln Ratten progressiv Hirntumore, an denen sie ab ca. Tag 120 versterben. Diese tumortragenden Ratten wurden mit einer einzelnen Dosis von Ganzhirnbestrahlung (20 Gy) behandelt, unmittelbar gefolgt von zwei verschiedenen, subkutan injizierten Dosen NOX-A12 für eine Dauer von entweder 4 oder 8 Wochen. Während weder die Bestrahlung noch NOX-A12 allein die Lebenserwartung der tumortragenden Ratten signifikant beeinflussen konnten, führte die Kombination aus Bestrahlung und NOX-A12 (hohe und niedrige Dosis) für 8 Wochen zu einer signifikant verlängerten Lebensdauer. Für die höhere Dosis betrug die mediane Lebensdauer der Ratten 349 Tage, verglichen mit 189 Tagen bei Kontrolltieren (p-Wert <0,0001).
In dieser präklinischen Studie wurden die NOX-A12-Dosierungen und die Behandlungsdauer so gewählt, dass sie denen entsprechen, die sich am Menschen als sicher und gut verträglich erwiesen haben. Aufgrund der vielversprechenden Ergebnisse dieser Studie gehen die beteiligten Forscher davon aus, dass eine klinische Studie in Patienten mit erstmaliger Diagnose eines Glioblastoms gerechtfertigt wäre. Dabei würde NOX-A12 zusätzlich zur Standard-Behandlung eingesetzt werden.
Die Zusammenfassung der Posterpräsentation ist auf der Webseite des AACR Annual Meeting 2012 verfügbar:http://www.abstractsonline.com/Plan/ViewAbstract.aspx?sKey=0…
Über NOX-A12
NOX-A12 bindet spezifisch an SDF-1 (stromal cell-derived factor-1) und wirkt als Antagonist. SDF-1 ist ein Chemokin, das verschiedene Zellen des Immunsystems sowie auch andere Zellen anlocken und aktivieren kann. SDF-1 bindet mit hoher Affinität an die Chemokinrezeptoren CXCR4 und CXCR7. Die Achse SDF- 1/CXCR4/CXCR7 spielt eine Rolle bei der Stammzellmobilisierung, der Neubildung von Blutgefäßen, dem Tumorwachstum und bei der Metastasierung. Wird die Bindung von SDF-1 an seine Rezeptoren verhindert, werden Tumorzellen empfindlicher gegenüber Chemotherapeutika, und bei einigen soliden Tumoren wird invasives Wachstum und Metastasierung verhindert. Dies legt nahe, dass NOX-A12 in Kombination mit einer Chemotherapie bei der Behandlung verschiedener Krebsarten von Nutzen sein könnte.
NOX-A12 zeigte eine vielversprechende Aktivität bei der Stammzellmobilisierung und in Modellen sowohl hämatologischer als auch solider Tumoren. Die Phase I Studien zeigten, dass NOX-A12 bis zu einer Einzeldosis von 10,8 mg/kg sowie bei täglichen Dosen von bis zu 2 mg/kg über fünf Tage sicher und gut verträglich war. Es kam zu einer dosisabhängigen Mobilisierung weißer Blutkörperchen und CD34-positiver Zellen, wie präklinische Studien bereits vermuten ließen.
NOXXON erhält Forschungszuschüsse im Rahmen des Programms „KMU-innovativ“ des deutschen Bundesministeriums für Bildung und Forschung (BMBF) für die präklinische Entwicklung und die Erstanwendung von NOX-A12 am Menschen. Weitere Informationen zu den geplanten klinischen Studien für multiple Myelome und chronische lymphatische Leukämie stehen unter ClinicalTrials.gov (IDs: NCT01521533 und NCT01486797) zur Verfügung.
« Zur vorherigen Seite wechseln.
04.04.12 - NOXXONs NOX-A12 verzögert die Rezidivbildung im präklinischen Glioblastom-Modell
Präsentation aktueller Daten auf dem Jahrestreffen der American Association for Cancer Research (AACR)
Berlin – 4. April 2012- NOXXON Pharma AG, ein biopharmazeutisches Unternehmen und Pionier bei der Entwicklung der eigenen, patentierten neuen Wirkstoffklasse der Spiegelmere, gab heute bekannt, dass in einer präklinischen Studie die Rezidivbildung von Glioblastomen nach Bestrahlung durch die Gabe des SDF-1-hemmenden Spiegelmers NOX-A12 deutlich verzögert werden konnte. Die Daten aus dieser Studie wurden gerade auf dem Jahrestreffen der American Association for Cancer Research (AACR) in Chicago präsentiert. Das vorgestellte Poster trägt den Titel "Inhibition of SDF-1 (CXCL12) using the Spiegelmer NOX-A12 markedly delays the recurrence of ENU-induced rat brain tumors following irradiation".
Die Studie, die in Zusammenarbeit mit der Stanford University School of Medicine durchgeführt wurde, untersuchte im Tiermodell die Wirksamkeit von NOX-A12 auf Gehirntumor-Rezidive nach der Bestrahlung. In diesem Modell entwickeln Ratten progressiv Hirntumore, an denen sie ab ca. Tag 120 versterben. Diese tumortragenden Ratten wurden mit einer einzelnen Dosis von Ganzhirnbestrahlung (20 Gy) behandelt, unmittelbar gefolgt von zwei verschiedenen, subkutan injizierten Dosen NOX-A12 für eine Dauer von entweder 4 oder 8 Wochen. Während weder die Bestrahlung noch NOX-A12 allein die Lebenserwartung der tumortragenden Ratten signifikant beeinflussen konnten, führte die Kombination aus Bestrahlung und NOX-A12 (hohe und niedrige Dosis) für 8 Wochen zu einer signifikant verlängerten Lebensdauer. Für die höhere Dosis betrug die mediane Lebensdauer der Ratten 349 Tage, verglichen mit 189 Tagen bei Kontrolltieren (p-Wert <0,0001).
In dieser präklinischen Studie wurden die NOX-A12-Dosierungen und die Behandlungsdauer so gewählt, dass sie denen entsprechen, die sich am Menschen als sicher und gut verträglich erwiesen haben. Aufgrund der vielversprechenden Ergebnisse dieser Studie gehen die beteiligten Forscher davon aus, dass eine klinische Studie in Patienten mit erstmaliger Diagnose eines Glioblastoms gerechtfertigt wäre. Dabei würde NOX-A12 zusätzlich zur Standard-Behandlung eingesetzt werden.
Die Zusammenfassung der Posterpräsentation ist auf der Webseite des AACR Annual Meeting 2012 verfügbar:http://www.abstractsonline.com/Plan/ViewAbstract.aspx?sKey=0…
Über NOX-A12
NOX-A12 bindet spezifisch an SDF-1 (stromal cell-derived factor-1) und wirkt als Antagonist. SDF-1 ist ein Chemokin, das verschiedene Zellen des Immunsystems sowie auch andere Zellen anlocken und aktivieren kann. SDF-1 bindet mit hoher Affinität an die Chemokinrezeptoren CXCR4 und CXCR7. Die Achse SDF- 1/CXCR4/CXCR7 spielt eine Rolle bei der Stammzellmobilisierung, der Neubildung von Blutgefäßen, dem Tumorwachstum und bei der Metastasierung. Wird die Bindung von SDF-1 an seine Rezeptoren verhindert, werden Tumorzellen empfindlicher gegenüber Chemotherapeutika, und bei einigen soliden Tumoren wird invasives Wachstum und Metastasierung verhindert. Dies legt nahe, dass NOX-A12 in Kombination mit einer Chemotherapie bei der Behandlung verschiedener Krebsarten von Nutzen sein könnte.
NOX-A12 zeigte eine vielversprechende Aktivität bei der Stammzellmobilisierung und in Modellen sowohl hämatologischer als auch solider Tumoren. Die Phase I Studien zeigten, dass NOX-A12 bis zu einer Einzeldosis von 10,8 mg/kg sowie bei täglichen Dosen von bis zu 2 mg/kg über fünf Tage sicher und gut verträglich war. Es kam zu einer dosisabhängigen Mobilisierung weißer Blutkörperchen und CD34-positiver Zellen, wie präklinische Studien bereits vermuten ließen.
NOXXON erhält Forschungszuschüsse im Rahmen des Programms „KMU-innovativ“ des deutschen Bundesministeriums für Bildung und Forschung (BMBF) für die präklinische Entwicklung und die Erstanwendung von NOX-A12 am Menschen. Weitere Informationen zu den geplanten klinischen Studien für multiple Myelome und chronische lymphatische Leukämie stehen unter ClinicalTrials.gov (IDs: NCT01521533 und NCT01486797) zur Verfügung.
« Zur vorherigen Seite wechseln.
Antwort auf Beitrag Nr.: 42.999.604 von dg6nds am 04.04.12 10:40:19Präklinische Daten mit NOX-A12 in der Indikation Glioblastom
Die Meldung klingt erfreulich. Hirntumore wären damit bereits die 3. Indikation für NOX-A12 als Kombinationstherapie. Die Meldung gibt leider keine Auskunft, ob Noxxon eine solche P1b/P2-Studie noch in Eigenregie startet oder man dafür den Exit (oder eine Verpartnerung) abwartet. Ich tippe mal auf Letzteres.
Inwieweit diese präklinischen Daten konkurrenzfähig zu anderen laufenden Hirntumor-Studien bzw. -daten sind, müsste man recherchieren. Die Überlebensprognose bei Glioblastom-Diagnose ist m.W. immer noch ziemlich schlecht. Die Aussichten auf Zulassung/Durchsetzung einer solchen Kombi-Therapie scheinen m.E. relativ günstig zu sein, da Bestrahlung eine der Haupttherapien bei Hirntumor ist und somit in Medizinerkreisen kein Anerkennungsproblem bestehen dürfte, sofern die Kombination mit NOX-A12 gut verträglich und deutlich lebensverlängernd ist. Vielleicht kann das jemand der Mitleser besser einschätzen.
Glioblastom: de.wikipedia.org/wiki/Glioblastom
Beachtlich ist m.E. auch, mit welchen renommierten Forschungseinrichtungen die präklinischen Untersuchungen von NOX-A12 durchgeführt wurden (s. Postings #80 bzw. #100). Einen zukünftigen Erfolg von NOX-A12 kann man daraus sicher nicht ableiten, es zeigt jedoch m.E., dass der Wirkmechanismus der SDF-1-Blockade als viel versprechender Ansatz in Forscherkreisen eingeschätzt wird:
Glioblastom: Stanford University (School of Medicine)
MM: Harvard Medical School (Dana-Farber Cancer Institute)
CLL: University of Texas (MD Anderson Cancer Center)
Die Meldung klingt erfreulich. Hirntumore wären damit bereits die 3. Indikation für NOX-A12 als Kombinationstherapie. Die Meldung gibt leider keine Auskunft, ob Noxxon eine solche P1b/P2-Studie noch in Eigenregie startet oder man dafür den Exit (oder eine Verpartnerung) abwartet. Ich tippe mal auf Letzteres.
Inwieweit diese präklinischen Daten konkurrenzfähig zu anderen laufenden Hirntumor-Studien bzw. -daten sind, müsste man recherchieren. Die Überlebensprognose bei Glioblastom-Diagnose ist m.W. immer noch ziemlich schlecht. Die Aussichten auf Zulassung/Durchsetzung einer solchen Kombi-Therapie scheinen m.E. relativ günstig zu sein, da Bestrahlung eine der Haupttherapien bei Hirntumor ist und somit in Medizinerkreisen kein Anerkennungsproblem bestehen dürfte, sofern die Kombination mit NOX-A12 gut verträglich und deutlich lebensverlängernd ist. Vielleicht kann das jemand der Mitleser besser einschätzen.
Glioblastom: de.wikipedia.org/wiki/Glioblastom
Beachtlich ist m.E. auch, mit welchen renommierten Forschungseinrichtungen die präklinischen Untersuchungen von NOX-A12 durchgeführt wurden (s. Postings #80 bzw. #100). Einen zukünftigen Erfolg von NOX-A12 kann man daraus sicher nicht ableiten, es zeigt jedoch m.E., dass der Wirkmechanismus der SDF-1-Blockade als viel versprechender Ansatz in Forscherkreisen eingeschätzt wird:
Glioblastom: Stanford University (School of Medicine)
MM: Harvard Medical School (Dana-Farber Cancer Institute)
CLL: University of Texas (MD Anderson Cancer Center)
Interessant wären jetzt noch die Kaplan-Meier Überlebenskurven und z.B. die Anzahl der Versuchstiere, um die Signifikanz der Ergebnisse zu überprüfen.
Vermutlich muss man aber noch auf das Paper warten, um an diese Daten zu kommen. Die Angaben in der Mitteilung klingen aber nicht schlecht.
Vermutlich muss man aber noch auf das Paper warten, um an diese Daten zu kommen. Die Angaben in der Mitteilung klingen aber nicht schlecht.
Antwort auf Beitrag Nr.: 43.004.367 von dg6nds am 04.04.12 23:17:27Solche veröffentlichten Daten wären natürlich super, nicht nur bei dieser Studie. Es ist aber m.E. schwer zu befürchten, dass wir so etwas nie zu sehen bekommen werden, zumindest nicht vor dem Exit. Noxxon stellt ja schon lange keine aktuellen Präsentationen mehr online.
Vermutlich wird es auch keine Publikation zu den präklinischen Daten geben. In allen drei NOX-A12-Indikationen wurden die Ergebnisse als Poster bzw. Vortrag auf einer Konferenz präsentiert und es gab jeweils nur ein Abstract dazu.
Schade, aber so läuft das Business, alles hinter verschlossenen Türen.
Grüße
Vermutlich wird es auch keine Publikation zu den präklinischen Daten geben. In allen drei NOX-A12-Indikationen wurden die Ergebnisse als Poster bzw. Vortrag auf einer Konferenz präsentiert und es gab jeweils nur ein Abstract dazu.
Schade, aber so läuft das Business, alles hinter verschlossenen Türen.

Grüße
Präsentation der P1-Daten mit NOX-E36 (Tagung)
FDA Oligonucleotide-based Therapeutics 2012: Leveraging Regulatory and Industry Knowledge for Future Advancements
Apr 16 2012 9:00AM - Apr 18 2012 12:30PM
Washington Marriott Metro Center 775 12th Street, NW, Washington, DC 20005 USA
Phase I / Ib Clinical Data of NOX-E36, A Mirror-image RNA Oligonucleotide for the Treatment of Diabetic Nephropathy
Sven Klussmann, PhD
Chief Scientific Officer
NOXXON Pharma AG, Germany
Tuesday, April 17, 2012, 1:30PM - 3:00PM, Session Liver/Kidney
http://www.diahome.org/Meetings-and-Training/Find-Meetings-a…
FDA Oligonucleotide-based Therapeutics 2012: Leveraging Regulatory and Industry Knowledge for Future Advancements
Apr 16 2012 9:00AM - Apr 18 2012 12:30PM
Washington Marriott Metro Center 775 12th Street, NW, Washington, DC 20005 USA
Phase I / Ib Clinical Data of NOX-E36, A Mirror-image RNA Oligonucleotide for the Treatment of Diabetic Nephropathy
Sven Klussmann, PhD
Chief Scientific Officer
NOXXON Pharma AG, Germany
Tuesday, April 17, 2012, 1:30PM - 3:00PM, Session Liver/Kidney
http://www.diahome.org/Meetings-and-Training/Find-Meetings-a…
Übersicht zu den (erwarteten) P2-Studien von Noxxon in 2012 (Aktualisierung)
1) Die Teststudie mit NOX-H94 im Endotoxin-Modell ist inzwischen abgeschlossen. Dazu könnte/sollte demnächst eine PM kommen mit Hinweisen, wie es mit NOX-H94 konkret weitergeht. Laut jüngster Meldung ist eine P2 in ACD bei Lymphom-/Myelom-Erkrankung in Planung.
2) Obwohl sich Noxxon nicht geäußert hat, ob bzw. wann eine P1b/P2-Studie mit NOX-A12 bei Glioblastom-Patienten gestartet werden soll, nehme ich diese Indikation nach den hoffnungsvollen präklinischen Daten mit in die Liste auf (s. #100).
grün = Studie läuft; rot = Studie beendet; kursiv = veränderter Eintrag
* = Zwischenbegutachtung der Daten in HJ2/12 geplant (s. Noxxon-Factsheet)
1) Die Teststudie mit NOX-H94 im Endotoxin-Modell ist inzwischen abgeschlossen. Dazu könnte/sollte demnächst eine PM kommen mit Hinweisen, wie es mit NOX-H94 konkret weitergeht. Laut jüngster Meldung ist eine P2 in ACD bei Lymphom-/Myelom-Erkrankung in Planung.
2) Obwohl sich Noxxon nicht geäußert hat, ob bzw. wann eine P1b/P2-Studie mit NOX-A12 bei Glioblastom-Patienten gestartet werden soll, nehme ich diese Indikation nach den hoffnungsvollen präklinischen Daten mit in die Liste auf (s. #100).
Spiegelmer --------------- NOX-A12 NOX-A12 NOX-A12 --------------- NOX-E36 --------------- NOX-H94 NOX-H94 NOX-H94 --------------- | Indikation --------------------------- CLL (Kombi) MM (Kombi) Glioblastom --------------------------- Diabetes+Albuminurie --------------------------- Endotoxin-Simulation Lymphom/Myelom ACD #2 --------------------------- | Anz. Pers. ------- 33 28 ? ------- 75 ------- 24 ? ? ------- | Maskierung --------------- offen * offen * ? --------------- verblindet * --------------- verblindet ? ? --------------- | Start ------------- Mär/12 Mär/12 ? ------------- Mär/12 ------------- Jan/12 Q3/12 ? ------------- | Abschluss Primärziel ------------- Feb/13 Feb/13 ? ------------- Mai/13 ------------- Mär/12 ? ? ------------- | Abschluss Studie ------------- Dez/15 Dez/14 ? ------------- Mai/14 ------------- Apr/12 ? ? ------------- | Protokoll ------------ Klick Klick ? ------------ Klick ------------ Klick ? ? ------------ |
grün = Studie läuft; rot = Studie beendet; kursiv = veränderter Eintrag
* = Zwischenbegutachtung der Daten in HJ2/12 geplant (s. Noxxon-Factsheet)
Präklinische Daten mit NOX-A12 in der Indikation Chronische Transplantatvaskulopathie
Es gibt eine weitere präklinische Untersuchung mit NOX-A12. Wissenschaftler der LMU München haben die Auswirkung der SDF-1-Blockade auf Abstoßungsreaktionen bei Organtransplantationen (insb. Herz) in einem Maus-Modell getestet. Die Ergebnisse klingen positiv:
Thomas et al. (2012): Spiegelmer based blockade of SDF1/CXCR4-interaction inhibits chronic transplant vasculopathy by inhibition of vascular smooth muscle cell proliferation.
http://www.egms.de/static/en/meetings/dgch2012/12dgch151.sht…
Möglicherweise verfolgen die LMU-Leute diesen Ansatz vorerst eigenständig weiter, vielleicht zunächst in einer klinischen P1b mit (öffentlichen) Forschungsgeldern, falls die Daten das hergeben. Denn Noxxon hat sich derzeit auf den Einsatz von NOX-A12 bei der Krebs-Therapie fokussiert und war personell an dieser LMU-Studie anscheinend nicht beteiligt (s. Publikation). Trotzdem interessant, dass das Einsatzspektrum von NOX-A12 recht breit zu sein scheint.
Link zur LMU-Herzklinik (Transplantation): http://www.herzklinik-muenchen.de/en/experts/adult-cardiac-s…
Chronische Transplantatabstoßung: http://de.wikipedia.org/wiki/Absto%C3%9Fungsreaktion#Immunre…
Es gibt eine weitere präklinische Untersuchung mit NOX-A12. Wissenschaftler der LMU München haben die Auswirkung der SDF-1-Blockade auf Abstoßungsreaktionen bei Organtransplantationen (insb. Herz) in einem Maus-Modell getestet. Die Ergebnisse klingen positiv:
Thomas et al. (2012): Spiegelmer based blockade of SDF1/CXCR4-interaction inhibits chronic transplant vasculopathy by inhibition of vascular smooth muscle cell proliferation.
http://www.egms.de/static/en/meetings/dgch2012/12dgch151.sht…
Möglicherweise verfolgen die LMU-Leute diesen Ansatz vorerst eigenständig weiter, vielleicht zunächst in einer klinischen P1b mit (öffentlichen) Forschungsgeldern, falls die Daten das hergeben. Denn Noxxon hat sich derzeit auf den Einsatz von NOX-A12 bei der Krebs-Therapie fokussiert und war personell an dieser LMU-Studie anscheinend nicht beteiligt (s. Publikation). Trotzdem interessant, dass das Einsatzspektrum von NOX-A12 recht breit zu sein scheint.
Link zur LMU-Herzklinik (Transplantation): http://www.herzklinik-muenchen.de/en/experts/adult-cardiac-s…
Chronische Transplantatabstoßung: http://de.wikipedia.org/wiki/Absto%C3%9Fungsreaktion#Immunre…
Interview von PharmaTV mit CBO Mangasarian
Auf der Noxxon-HP ist ein Video über ein Interview eingestellt, das PharmaTV mit Aram Mangasarian auf der BioEurope Spring 2012 Mitte März geführt hat.
Link zum Video: http://www.noxxon.com/index.php?option=com_content&view=arti…
Mangasarian erklärt im ersten Teil u.a. die Funktionsweise der Spiegelmer-Technologie und den Stand der klinischen Studien, was wir hier im Thread schon ausführlich dargestellt haben. Spannender wird es gegen Ende des Videos, wo sich Mangasarian zu den bisherigen Allianzen mit Big Pharma und geplanten Verpartnerungsaktivitäten speziell bezüglich NOX-E36 äußert.
Da das Viedo möglicherweise nicht ewig online stehen wird und es an einigen Stellen nicht ganz leicht zu verstehen ist, haben dg6nds (besten Dank für die Unterstützung!) und ich für den letzten Teil ein Transkript erstellt. Wir haben uns größte Mühe gegeben, dennoch übernehmen wir keine Garantie für Korrektheit und/oder Vollständigkeit der Transkription.
Start des Transkripts ab Minute 9:00, Ende Minute 13:05. Fragen fettgedruckt, Antworten normal.
--------------------------------------------------------------------------------------------------------------------------------------------------
Doing drug development is an expensive game. You've got some nice Ven-Investors peeling off their Dollar notes or Euro notes, whatever they put into your company. But in the end you need to have partners as well. Where are you with those?
Those discussions are ongoing. I think, in the past, so there was a long period, 1997 really to 2007, which was a technology development period. I think the company was learning the ropes, was understanding where its technology could be used best, we’ve got into the sweet spot now of outside the cell, small proteins, although we have a compound that binds at sphingosin one phosphat as well. But these soluble small proteins that work at a distance, that form gradients, seem to be really the ideal place to use our technology.
We had a number of alliances; we had alliances with Lilly, with Pfizer, for example. But I think in retrospect what we found was, these companies of course all have their own internal platforms. And the targets we got with their ones, they couldn’t make good inhibitors to, with all of their existing technology. So they were willing to give it another shot, and these were often not ideal for Spiegelmers.
So 2007 there was a big refinancing led by TVM, they brought in some French investors, Sofinnova, Edmond de Rothschild. There was another round in 2010, which brought in NGN from New York. So between those two rounds, which were essentially kind of a refocusing of the company on its own products, getting us into the clinic, advancing those, we’ve raised 72 Mio Euro. So, that will fund us through end of first quarter next year. And I think that is within the time frame of getting some of the Phase 2 data from all 3 programs that are currently in the clinic.
And also looking for new partners in the same process?
Of course. So, the Diabetic Nephropathy product has generated a firm amount of interest. We have a number of companies that have indicated as soon as the data are unblinded from Phase 1b, where we treated diabetics for one month, they would very much like to see that. And we have also scheduled interim unblinded data review into the Phase 2. So we will actually get 25 patients out of the 75 reporting in September of this year, another 25 in November and the full 75 in January/February of next year. So we will know how things are going, we will be able to share that with partners and hopefully generate the interest we need to seal a partnership quite quickly.
So, going into the future. Business strategy, business model very typical of a biotech, these stage you got. You are in a fortunate stage of having reasonal funding going into your company to take these far in the next important inflection point, we called it - traditional model just look for partners?
Yes. I think, we are reasonably conservative. We think people want to see we understand in indications like cancer, Diabetic Nephropathy. People would like to see some efficacy data. We also understand that it’s a new platform. And in that sense, people are reluctant to move before they see evidence of efficacy and safety. And so we are not expecting people to jump at this before we can provide that type of data. And then we are happy to move into partnerships. I think the idea there is to keep some markets, some geography or co-promotion rights somewhere to get some upside for the company and find a good partner that will help us developing.
--------------------------------------------------------------------------------------------------------------------------------------------------
Einige Anmerkungen dazu meinerseits:
1) Die Finanzierung wird als bis Ende Q1/13 gesichert genannt. Ich gehe dennoch davon aus, dass Noxxon vor dem Exit weiteres Kapital eintreiben wird - durch eine weitere, kleine Finanzierungsrunde oder einen Upfront-Cash-Deal mit einem (präklinischen) Spiegelmer -, um in den Exit-Verhandlungen nicht unter Druck zu geraten.
2) Bei NOX-E36 steht Noxxon also schon in regem Kontakt mit Big Pharma, um fortlaufend klinische Zwischendaten zu präsentieren. Laut Noxxon-Factsheet ist eine Begutachtung von Interimsdaten auch bei den beiden P2a-Studien mit NOX-A12 in HJ2/12 vorgesehen. Das legt nahe, dass bei NOX-A12 ebenfalls Interesse von Big Pharma vorhanden ist.
3) Es scheint so zu sein, dass die Spiegelmere nicht für alle Klassen von Zielmolekülen gleichermaßen gut geeignet sind. In den bisherigen R&D-Allianzen wurden Noxxon offenbar Targets geliefert, mit denen die Spiegelmere nicht so gut zurecht kamen, was zu gewissen Enttäuschungen/Ernüchterungen geführt und dem Ende der Partnerschaften beigetragen haben dürfte.
Letztlich zählen nun aber die Wirksamkeitsdaten in den P2-Studien der 3 Haupt-Wirkstoffe. Sollte sich eine deutliche Verbesserung gegenüber der jeweiligen bisherigen Standard-Therapie andeuten bei guter Verträglichkeit und akzeptablem Wirkstoff-Handling (inkl. Kosten), steht Verpartnerungen bzw. einem erfolgreichen Exit m.E. nichts im Wege.
Auf der Noxxon-HP ist ein Video über ein Interview eingestellt, das PharmaTV mit Aram Mangasarian auf der BioEurope Spring 2012 Mitte März geführt hat.
Link zum Video: http://www.noxxon.com/index.php?option=com_content&view=arti…
Mangasarian erklärt im ersten Teil u.a. die Funktionsweise der Spiegelmer-Technologie und den Stand der klinischen Studien, was wir hier im Thread schon ausführlich dargestellt haben. Spannender wird es gegen Ende des Videos, wo sich Mangasarian zu den bisherigen Allianzen mit Big Pharma und geplanten Verpartnerungsaktivitäten speziell bezüglich NOX-E36 äußert.
Da das Viedo möglicherweise nicht ewig online stehen wird und es an einigen Stellen nicht ganz leicht zu verstehen ist, haben dg6nds (besten Dank für die Unterstützung!) und ich für den letzten Teil ein Transkript erstellt. Wir haben uns größte Mühe gegeben, dennoch übernehmen wir keine Garantie für Korrektheit und/oder Vollständigkeit der Transkription.
Start des Transkripts ab Minute 9:00, Ende Minute 13:05. Fragen fettgedruckt, Antworten normal.
--------------------------------------------------------------------------------------------------------------------------------------------------
Doing drug development is an expensive game. You've got some nice Ven-Investors peeling off their Dollar notes or Euro notes, whatever they put into your company. But in the end you need to have partners as well. Where are you with those?
Those discussions are ongoing. I think, in the past, so there was a long period, 1997 really to 2007, which was a technology development period. I think the company was learning the ropes, was understanding where its technology could be used best, we’ve got into the sweet spot now of outside the cell, small proteins, although we have a compound that binds at sphingosin one phosphat as well. But these soluble small proteins that work at a distance, that form gradients, seem to be really the ideal place to use our technology.
We had a number of alliances; we had alliances with Lilly, with Pfizer, for example. But I think in retrospect what we found was, these companies of course all have their own internal platforms. And the targets we got with their ones, they couldn’t make good inhibitors to, with all of their existing technology. So they were willing to give it another shot, and these were often not ideal for Spiegelmers.
So 2007 there was a big refinancing led by TVM, they brought in some French investors, Sofinnova, Edmond de Rothschild. There was another round in 2010, which brought in NGN from New York. So between those two rounds, which were essentially kind of a refocusing of the company on its own products, getting us into the clinic, advancing those, we’ve raised 72 Mio Euro. So, that will fund us through end of first quarter next year. And I think that is within the time frame of getting some of the Phase 2 data from all 3 programs that are currently in the clinic.
And also looking for new partners in the same process?
Of course. So, the Diabetic Nephropathy product has generated a firm amount of interest. We have a number of companies that have indicated as soon as the data are unblinded from Phase 1b, where we treated diabetics for one month, they would very much like to see that. And we have also scheduled interim unblinded data review into the Phase 2. So we will actually get 25 patients out of the 75 reporting in September of this year, another 25 in November and the full 75 in January/February of next year. So we will know how things are going, we will be able to share that with partners and hopefully generate the interest we need to seal a partnership quite quickly.
So, going into the future. Business strategy, business model very typical of a biotech, these stage you got. You are in a fortunate stage of having reasonal funding going into your company to take these far in the next important inflection point, we called it - traditional model just look for partners?
Yes. I think, we are reasonably conservative. We think people want to see we understand in indications like cancer, Diabetic Nephropathy. People would like to see some efficacy data. We also understand that it’s a new platform. And in that sense, people are reluctant to move before they see evidence of efficacy and safety. And so we are not expecting people to jump at this before we can provide that type of data. And then we are happy to move into partnerships. I think the idea there is to keep some markets, some geography or co-promotion rights somewhere to get some upside for the company and find a good partner that will help us developing.
--------------------------------------------------------------------------------------------------------------------------------------------------
Einige Anmerkungen dazu meinerseits:
1) Die Finanzierung wird als bis Ende Q1/13 gesichert genannt. Ich gehe dennoch davon aus, dass Noxxon vor dem Exit weiteres Kapital eintreiben wird - durch eine weitere, kleine Finanzierungsrunde oder einen Upfront-Cash-Deal mit einem (präklinischen) Spiegelmer -, um in den Exit-Verhandlungen nicht unter Druck zu geraten.
2) Bei NOX-E36 steht Noxxon also schon in regem Kontakt mit Big Pharma, um fortlaufend klinische Zwischendaten zu präsentieren. Laut Noxxon-Factsheet ist eine Begutachtung von Interimsdaten auch bei den beiden P2a-Studien mit NOX-A12 in HJ2/12 vorgesehen. Das legt nahe, dass bei NOX-A12 ebenfalls Interesse von Big Pharma vorhanden ist.
3) Es scheint so zu sein, dass die Spiegelmere nicht für alle Klassen von Zielmolekülen gleichermaßen gut geeignet sind. In den bisherigen R&D-Allianzen wurden Noxxon offenbar Targets geliefert, mit denen die Spiegelmere nicht so gut zurecht kamen, was zu gewissen Enttäuschungen/Ernüchterungen geführt und dem Ende der Partnerschaften beigetragen haben dürfte.
Letztlich zählen nun aber die Wirksamkeitsdaten in den P2-Studien der 3 Haupt-Wirkstoffe. Sollte sich eine deutliche Verbesserung gegenüber der jeweiligen bisherigen Standard-Therapie andeuten bei guter Verträglichkeit und akzeptablem Wirkstoff-Handling (inkl. Kosten), steht Verpartnerungen bzw. einem erfolgreichen Exit m.E. nichts im Wege.
Zitat von Saaletaler: And the targets we got with their ones, they couldn’t make good inhibitors to, with all of their existing technology.
Sorry, es sollte heißen "too":
And the targets we got with their ones, they couldn’t make good inhibitors too, with all of their existing technology.
Sprich, Noxxon wurden anscheinend Targets geliefert, mit denen Big Pharma bereits vorher seine eigenen Probleme hatte, einen Inhibitor zu entwickeln, und man es dann alternativ mit einem Spiegelmer probieren wollte, was aber auch nicht klappte.
Quelle: DEWB HP
19.06.12 - NOXXON startet Phase IIa Studie mit Anti-CCL2/MCP-1 Spiegelmer® NOX-E36 zur Behandlung der diabetischen Nephropathie
Berlin - 19. Juni 2012 - NOXXON Pharma AG gab heute die Behandlung des ersten Patienten in einer Phase IIa-Studie mit dem Anti-CCL2/MCP-1 (C-C Chemokin Ligand 2 bzw. Monocyte Chemoattractant Protein-1) Spiegelmer® NOX-E36 zur Behandlung von Patienten mit diabetischer Nephropathie bekannt. Etwa ein Drittel aller Patienten mit Diabetes mellitus entwickelt eine diabetische Nephropathie. Dabei handelt es sich um eine fortschreitende Erkrankung, die eine der Hauptursachen für das terminale Nierenversagen und die damit verbundene Dialysepflichtigkeit ist. Die Rekrutierung von Immunzellen durch das Chemokin CCL2 in die Niere sowie direkte Effekte von CCL2 auf bestimmte Nierenzellen spielen vermutlich eine entscheidende Rolle für den Verlauf dieser Erkrankung.
Die doppelblinde Multicenterstudie wird mit 75 Patienten, die an Typ-2-Diabetes mit Albuminurie erkrankt sind, über einen Behandlungszeitraum von 12 Wochen durchgeführt. 50 Patienten erhalten zweimal wöchentlich eine Dosis von 0,5 mg/kg NOX-E36 subkutan verabreicht. Die übrigen 25 Patienten erhalten ein Placebo. Die gewählte Dosis von 0,5 mg/kg NOX-E36 basiert auf Daten aus einer früheren Phase Ib-Studie, in der pharmakodynamische Effekte von drei unterschiedlichen NOX-E36-Dosen bei Diabetikern während eines vierwöchigen Behandlungszeitraums untersucht wurden. Alle Patienten der jetzt initiierten Phase IIa-Studie erhalten darüber hinaus die derzeitigen Standardtherapien zur Behandlung von Bluthochdruck, Hyperglykämie und Dyslipidämie.
Die Studie untersucht die Wirksamkeit, Pharmakokinetik, Sicherheit und Verträglichkeit der Behandlung mit NOX-E36. Die primäre Wirksamkeitsanalyse stützt sich dabei auf Veränderungen des Albumin-Kreatinin-Quotienten (ACR) im Vergleich zum Ausgangswert zu Beginn der Studie. Darüber hinaus wird der Einfluss auf Nieren-, Blutzucker- und Entzündungsparameter im Verlauf der Studie überprüft. Eine Zwischenbewertung der primären und sekundären Wirksamkeitsparameter ist nach Abschluss der Behandlung von 25, 50 und 75 Patienten vorgesehen.
Die Wirkung von NOX-E36 beruht auf der spezifischen Bindung und einer damit verbundenen Hemmung des entzündungsfördernden Chemokins CCL2/MCP-1. Generell rekrutiert dieses Protein Immunzellen zu Entzündungsherden und es spielt damit eine entscheidende Rolle für die Komplikationen des Typ-2-Diabetes. Hier werden Immunzellen vermehrt im Fettgewebe, den Langerhans-Inseln und den Nieren gefunden. CCL2 löst zudem eine verminderte Bereitstellung von Nephrin aus, eines Proteins, das in spezialisierten Nierenzellen, den Podozyten, gebildet wird und das eine Schlüsselrolle im Filtrationsmechanismus der Niere spielt. Es wird daher erwartet, dass die Hemmung von CCL2 einen Nutzen für Typ-2-Diabetiker mit Nephropathie darstellt. Präklinische Studien in entsprechenden Tiermodellen haben bereits gezeigt, dass die Behandlung mit einem Spiegelmer® CCL2-Hemmer die Progredienz der Erkrankung und damit den Verlust der Nierenfunktion entscheidend verzögern kann.
Diese Phase IIa-Studie ist die vierte klinische Studie mit NOX-E36, die NOXXON Pharma initiiert und mit der das Unternehmen eine Datenbank aufbaut, die das Potenzial dieses Wirkstoffs für die Therapie von Patienten mit Nierenfunktionsstörungen belegen soll. NOXXON plant im späteren Verlauf des Jahres die Veröffentlichung von Zwischenergebnissen.
Über NOX-E36 und diabetische Nephropathie
NOX-E36 ist ein neuartiger Wirkstoff, der spezifisch an das entzündungsfördernde Chemokin CCL2, auch bekannt als Monocyte Chemoattractant Protein-1 (MCP-1), bindet und es neutralisiert. CCL2 ist bei der Rekrutierung von Monozyten in entzündetes Gewebe beteiligt, in dem sich diese in Makrophagen ausdifferenzieren. Die Infiltration von Monozyten/Makrophagen in die Niere ist charakteristisch für die diabetische Nephropathie. Die Anhäufung von Makrophagen in der Niere geht mit einem Fortschreiten des Diabetes (Hyperglykämie, HbA1c), der Entstehung von Nierenschäden (Gewebsverletzung, Albuminurie), Nierenfibrose und der Verminderung der glomerulären Filtrationsrate (GFR) einher, was den Schluss nahe legt, dass diese entzündlichen Prozesse den Krankheitsverlauf verstärken[ii]. Aktivierte Makrophagen geben lysosomale Enzyme, Stickoxid (NO), reaktive Sauerstoffspezies (ROS) sowie den transformierenden Wachstumsfaktor Beta (TGF-β) ab, die alle eine maßgebliche Rolle bei der Schädigung der Nieren spielen[iii].
Studien mit diabetischen Mäusen haben gezeigt, dass dabei fast alle in den Nieren angereicherten Leukozyten Makrophagen sind. Ihre Anreicherung steht in direkter Beziehung zum Verlauf des Diabetes sowie auch zur Schwere der Nierenschädigung[iv]. Sowohl experimentelle als auch klinische Belege unterstützen die Hypothese, dass die diabetische Nephropathie eine Entzündungserkrankung ist, die wiederum durch Störungen des Metabolismus hervorgerufen wird[v].
Glomeruläre Epithelzellen, sogenannte Podozyten, sind ein wesentlicher Teil der Filtrationsbarriere der Niere. Mit ihren sich verzahnenden Fortsätzen und in Verbindung mit einer speziellen Filterstruktur, der sogenannten Schlitzmembran, deren Hauptbestandteil das Protein Nephrin ist, bilden die Podozyten eine engmaschige Geflechtstuktur[vi]. Podozyten tragen auch den Rezeptor (CCR2) für CCL2 und reagieren auf CCL2 mit der Veränderung ihres Zytoskeletts, erhöhter Motilität und verminderter Nephrinproduktion[vii]. Diese Veränderungen im Filtersystem der Niere bieten eine mögliche Erklärung für den Zusammenhang zwischen CCL2 und der erhöhten Durchlässigkeit , die bei Diabetikern Proteinurie hervorruft.
Bereits abgeschlossene Tierstudien konnten zeigen, dass die Behandlung mit einem Spiegelmer® CCL2-Hemmer nephroprotektive Wirkungen in Modellen zur diabetischen Nephropathie und im Lupus nephritis hat[viii].
Aufgrund epidemiologischer Daten der „International Diabetes Foundation“ und des amerikanischen „Center for Disease Control“ schätzt NOXXON die Zahl der Patienten mit diabetischer Nephropathie auf circa 9 Millionen in den USA, 7 Millionen in Europa und 2 Millionen in Japan. Eine jüngere Untersuchung mit 3.431 Diabetes-Patienten in Großbritannien zeigte, dass die Einschränkung der Nierenfunktion mit der Albuminausscheidung im Urin korreliert. In dieser Studie verloren Diabetiker mit Mikroalbuminurie (30-300 mg Albumin/g Kreatinin) durchschnittlich 1,5% der Filtrationsleistung ihrer Nieren pro Jahr, während jene mit Makroalbuminurie (> 300 mg Albumin/g Kreatinin) durchschnittlich 5,7% der Filtrationsleistung ihrer Nieren pro Jahr verloren[ix].
Literatur
Furuta 1993, Am J Kidney Dis 21:480; Wada 2003, Nephrol Dial Transplant 18:457
[ii] Nguyen 2006, Nephrology (Carlton) 11:226; Eardley 2008, Kidney Int 74:495
[iii] Tesch 2008, Am J Physiol Renal Physiol 294:F697
[iv] Chow 2004, Kidney Int 65:116
[v] Fornoni 2008, Curr Diabetes Rev 4:10
[vi] Kestilä 1998, Molecular Cell 1:575; Ruotsalainen 1999, PNAS 96:7962
[vii] Tarabra 2009, Diabetes 58:2109; Dai 2009, J Am Soc Nephrol 20:1997; Schiffer 2001, J Clin Invest 108:807
[viii] Darisipudi 2011, Am J Pathol 179:116; Kulkarni 2009, J Pharmacol Exp Ther 328:371; Ninichuk 2008, Am J Pathol 172:628; Kulkarni 2007, J Am Soc Nephrol 18:2350
[ix] Hoefield 2011, Nephrol Dial Transplant 26:887
19.06.12 - NOXXON startet Phase IIa Studie mit Anti-CCL2/MCP-1 Spiegelmer® NOX-E36 zur Behandlung der diabetischen Nephropathie
Berlin - 19. Juni 2012 - NOXXON Pharma AG gab heute die Behandlung des ersten Patienten in einer Phase IIa-Studie mit dem Anti-CCL2/MCP-1 (C-C Chemokin Ligand 2 bzw. Monocyte Chemoattractant Protein-1) Spiegelmer® NOX-E36 zur Behandlung von Patienten mit diabetischer Nephropathie bekannt. Etwa ein Drittel aller Patienten mit Diabetes mellitus entwickelt eine diabetische Nephropathie. Dabei handelt es sich um eine fortschreitende Erkrankung, die eine der Hauptursachen für das terminale Nierenversagen und die damit verbundene Dialysepflichtigkeit ist. Die Rekrutierung von Immunzellen durch das Chemokin CCL2 in die Niere sowie direkte Effekte von CCL2 auf bestimmte Nierenzellen spielen vermutlich eine entscheidende Rolle für den Verlauf dieser Erkrankung.
Die doppelblinde Multicenterstudie wird mit 75 Patienten, die an Typ-2-Diabetes mit Albuminurie erkrankt sind, über einen Behandlungszeitraum von 12 Wochen durchgeführt. 50 Patienten erhalten zweimal wöchentlich eine Dosis von 0,5 mg/kg NOX-E36 subkutan verabreicht. Die übrigen 25 Patienten erhalten ein Placebo. Die gewählte Dosis von 0,5 mg/kg NOX-E36 basiert auf Daten aus einer früheren Phase Ib-Studie, in der pharmakodynamische Effekte von drei unterschiedlichen NOX-E36-Dosen bei Diabetikern während eines vierwöchigen Behandlungszeitraums untersucht wurden. Alle Patienten der jetzt initiierten Phase IIa-Studie erhalten darüber hinaus die derzeitigen Standardtherapien zur Behandlung von Bluthochdruck, Hyperglykämie und Dyslipidämie.
Die Studie untersucht die Wirksamkeit, Pharmakokinetik, Sicherheit und Verträglichkeit der Behandlung mit NOX-E36. Die primäre Wirksamkeitsanalyse stützt sich dabei auf Veränderungen des Albumin-Kreatinin-Quotienten (ACR) im Vergleich zum Ausgangswert zu Beginn der Studie. Darüber hinaus wird der Einfluss auf Nieren-, Blutzucker- und Entzündungsparameter im Verlauf der Studie überprüft. Eine Zwischenbewertung der primären und sekundären Wirksamkeitsparameter ist nach Abschluss der Behandlung von 25, 50 und 75 Patienten vorgesehen.
Die Wirkung von NOX-E36 beruht auf der spezifischen Bindung und einer damit verbundenen Hemmung des entzündungsfördernden Chemokins CCL2/MCP-1. Generell rekrutiert dieses Protein Immunzellen zu Entzündungsherden und es spielt damit eine entscheidende Rolle für die Komplikationen des Typ-2-Diabetes. Hier werden Immunzellen vermehrt im Fettgewebe, den Langerhans-Inseln und den Nieren gefunden. CCL2 löst zudem eine verminderte Bereitstellung von Nephrin aus, eines Proteins, das in spezialisierten Nierenzellen, den Podozyten, gebildet wird und das eine Schlüsselrolle im Filtrationsmechanismus der Niere spielt. Es wird daher erwartet, dass die Hemmung von CCL2 einen Nutzen für Typ-2-Diabetiker mit Nephropathie darstellt. Präklinische Studien in entsprechenden Tiermodellen haben bereits gezeigt, dass die Behandlung mit einem Spiegelmer® CCL2-Hemmer die Progredienz der Erkrankung und damit den Verlust der Nierenfunktion entscheidend verzögern kann.
Diese Phase IIa-Studie ist die vierte klinische Studie mit NOX-E36, die NOXXON Pharma initiiert und mit der das Unternehmen eine Datenbank aufbaut, die das Potenzial dieses Wirkstoffs für die Therapie von Patienten mit Nierenfunktionsstörungen belegen soll. NOXXON plant im späteren Verlauf des Jahres die Veröffentlichung von Zwischenergebnissen.
Über NOX-E36 und diabetische Nephropathie
NOX-E36 ist ein neuartiger Wirkstoff, der spezifisch an das entzündungsfördernde Chemokin CCL2, auch bekannt als Monocyte Chemoattractant Protein-1 (MCP-1), bindet und es neutralisiert. CCL2 ist bei der Rekrutierung von Monozyten in entzündetes Gewebe beteiligt, in dem sich diese in Makrophagen ausdifferenzieren. Die Infiltration von Monozyten/Makrophagen in die Niere ist charakteristisch für die diabetische Nephropathie. Die Anhäufung von Makrophagen in der Niere geht mit einem Fortschreiten des Diabetes (Hyperglykämie, HbA1c), der Entstehung von Nierenschäden (Gewebsverletzung, Albuminurie), Nierenfibrose und der Verminderung der glomerulären Filtrationsrate (GFR) einher, was den Schluss nahe legt, dass diese entzündlichen Prozesse den Krankheitsverlauf verstärken[ii]. Aktivierte Makrophagen geben lysosomale Enzyme, Stickoxid (NO), reaktive Sauerstoffspezies (ROS) sowie den transformierenden Wachstumsfaktor Beta (TGF-β) ab, die alle eine maßgebliche Rolle bei der Schädigung der Nieren spielen[iii].
Studien mit diabetischen Mäusen haben gezeigt, dass dabei fast alle in den Nieren angereicherten Leukozyten Makrophagen sind. Ihre Anreicherung steht in direkter Beziehung zum Verlauf des Diabetes sowie auch zur Schwere der Nierenschädigung[iv]. Sowohl experimentelle als auch klinische Belege unterstützen die Hypothese, dass die diabetische Nephropathie eine Entzündungserkrankung ist, die wiederum durch Störungen des Metabolismus hervorgerufen wird[v].
Glomeruläre Epithelzellen, sogenannte Podozyten, sind ein wesentlicher Teil der Filtrationsbarriere der Niere. Mit ihren sich verzahnenden Fortsätzen und in Verbindung mit einer speziellen Filterstruktur, der sogenannten Schlitzmembran, deren Hauptbestandteil das Protein Nephrin ist, bilden die Podozyten eine engmaschige Geflechtstuktur[vi]. Podozyten tragen auch den Rezeptor (CCR2) für CCL2 und reagieren auf CCL2 mit der Veränderung ihres Zytoskeletts, erhöhter Motilität und verminderter Nephrinproduktion[vii]. Diese Veränderungen im Filtersystem der Niere bieten eine mögliche Erklärung für den Zusammenhang zwischen CCL2 und der erhöhten Durchlässigkeit , die bei Diabetikern Proteinurie hervorruft.
Bereits abgeschlossene Tierstudien konnten zeigen, dass die Behandlung mit einem Spiegelmer® CCL2-Hemmer nephroprotektive Wirkungen in Modellen zur diabetischen Nephropathie und im Lupus nephritis hat[viii].
Aufgrund epidemiologischer Daten der „International Diabetes Foundation“ und des amerikanischen „Center for Disease Control“ schätzt NOXXON die Zahl der Patienten mit diabetischer Nephropathie auf circa 9 Millionen in den USA, 7 Millionen in Europa und 2 Millionen in Japan. Eine jüngere Untersuchung mit 3.431 Diabetes-Patienten in Großbritannien zeigte, dass die Einschränkung der Nierenfunktion mit der Albuminausscheidung im Urin korreliert. In dieser Studie verloren Diabetiker mit Mikroalbuminurie (30-300 mg Albumin/g Kreatinin) durchschnittlich 1,5% der Filtrationsleistung ihrer Nieren pro Jahr, während jene mit Makroalbuminurie (> 300 mg Albumin/g Kreatinin) durchschnittlich 5,7% der Filtrationsleistung ihrer Nieren pro Jahr verloren[ix].
Literatur
Furuta 1993, Am J Kidney Dis 21:480; Wada 2003, Nephrol Dial Transplant 18:457
[ii] Nguyen 2006, Nephrology (Carlton) 11:226; Eardley 2008, Kidney Int 74:495
[iii] Tesch 2008, Am J Physiol Renal Physiol 294:F697
[iv] Chow 2004, Kidney Int 65:116
[v] Fornoni 2008, Curr Diabetes Rev 4:10
[vi] Kestilä 1998, Molecular Cell 1:575; Ruotsalainen 1999, PNAS 96:7962
[vii] Tarabra 2009, Diabetes 58:2109; Dai 2009, J Am Soc Nephrol 20:1997; Schiffer 2001, J Clin Invest 108:807
[viii] Darisipudi 2011, Am J Pathol 179:116; Kulkarni 2009, J Pharmacol Exp Ther 328:371; Ninichuk 2008, Am J Pathol 172:628; Kulkarni 2007, J Am Soc Nephrol 18:2350
[ix] Hoefield 2011, Nephrol Dial Transplant 26:887
Konferenz: BIO International Convention - Boston - 18.-21. Juni 2012
http://convention.bio.org/
Aktuelle Noxxon-Präsentation (pdf): http://www.noxxon.com/downloads/NOXXON_presentation2012.pdf
Viele interessante Aspekte zu den 3 klinischen Programmen, insbesondere die Informationen zu jeweils konkurrierenden Ansätzen. Feine Sache und sehr empfehlenswert für alle, die sich intensiv damit beschäftigen wollen!
http://convention.bio.org/
Aktuelle Noxxon-Präsentation (pdf): http://www.noxxon.com/downloads/NOXXON_presentation2012.pdf
Viele interessante Aspekte zu den 3 klinischen Programmen, insbesondere die Informationen zu jeweils konkurrierenden Ansätzen. Feine Sache und sehr empfehlenswert für alle, die sich intensiv damit beschäftigen wollen!
NOXXON startet Phase IIa Studie mit Anti-CXCL12/SDF-1 Spiegelmer® NOX A12 zur Behandlung der chronischen lymphatischen Leukämie
http://www.dewb-vc.de/de/portfolio/newsarchiv/901-11-07-12-n…
Berlin - 11. Juli 2012- NOXXON Pharma gab heute die Behandlung der ersten Kohorte von drei Patienten mit chronischer lymphatischer Leukämie (CLL) in einer Phase IIa-Studie mit seinem NOX‑A12 Anti-CXCL12/SDF-1 (CXC-Motiv-Chemokin 12 / Stromal Cell-Derived Factor-1) Spiegelmer® bekannt. Die durch CXCL12 ausgelösten zellulären Signale spielen in der Pathophysiologie der CLL eine wichtige Rolle, speziell bei den Interaktionen von leukämischen Zellen mit dem sie umgebenden Gewebe. Der therapeutische Ansatz von NOX-A12 zielt auf die Hemmung dieses tumorfördernden Zusammenspiels ab, wodurch CLL-Zellen für die Chemotherapie sensibilisiert werden sollen.
In diese offene, unkontrollierte Multicenterstudie sollen 33 vorbehandelte Patienten mit einem CLL-Rezidiv eingeschlossen werden. Die Patienten erhalten NOX-A12 in Kombination mit einer Standardtherapie bestehend aus Bendamustin und Rituximab (BR). Die Kombinationsbehandlung mit NOX-A12 und BR erstreckt sich über 6 Zyklen mit jeweils 28 Tagen und eine Nachbeobachtungsphase von 30 Monaten. Jeder Patient durchläuft eine individualisierte Dosistitration mit bis zu drei unterschiedlichen Dosen von NOX-A12. Die Anzahl der kompletten Remissionen (CR) stellt den primären Wirksamkeitsendpunkt der Studie dar. NOXXON geht davon aus, dass Zwischenergebnisse bereits zum nächsten Jahrestreffen der „American Society of Hematology“ in Atlanta vom 8. bis 11. Dezember 2012 verfügbar sein werden.
Obwohl BR eine etablierte Therapie bei CLL ist, gibt es noch einen erheblichen Verbesserungsbedarf bei der Behandlung von Rezidivpatienten. Neuere Veröffentlichungen zeigen, dass die komplette Remissionsrate der BR-Therapie bei diesen Patienten etwa 15% beträgt[1].
NOX-A12 ist gegenwärtig der einzige Antitumor-Wirkstoff in klinischer Entwicklung der den Liganden CXCL12 neutralisiert, wodurch die von CXCL12 induzierte Signalübertragung über seine beiden Rezeptoren CXCR4 und CXCR7 blockiert wird. Konkurrenztherapeutika wirken auf Rezeptorebene und hemmen jeweils nur einen der beiden CXCL12-Rezeptoren.
Über NOX-A12
NOX-A12 ist ein spezifischer Antagonist zu CXCL12/SDF-1 (CXC-Motiv-Chemokin 12 / Stromal Cell-Derived Factor-1), einem Chemokin, das Immun- und Nicht-Immunzellen sowie Stammzellen aus dem Knochenmark anzieht und aktiviert. CXCL12 bindet mit hoher Affinität an die zwei Chemokinrezeptoren CXCR4 und CXCR7. Die Interaktion zwischen CXCL12, CXCR4 und CXCR7 spielt bei der Mobilisierung von Stammzellen, Vaskulogenese, Tumorwachstum und Metastasierung eine Rolle. Die Hemmung der CXCL12-Bindung an seine Rezeptoren sensibilisiert Tumorzellen für die Chemotherapie und verhindert bei manchen soliden Tumoren Invasivität und Metastasierung, was nahe legt, dass NOX-A12 in Kombination mit Chemotherapie hilfreich bei der Behandlung verschiedener Krebsarten sein könnte.
NOX-A12 zeigte auch eine vielversprechende Wirksamkeit in Modellen von soliden und hämatologischen Tumoren sowie bezüglich der Mobilisierung von Stammzellen. Präklinische Studien der NOXXON-Partner haben gezeigt, dass in einem Glioblastom-Tiermodell, NOX-A12 eine signifikant höhere Lebenserwartung der Tiere erzielen konnte, wenn es in Kombinationsbehandlung mit einer Strahlentherapie verabreicht wurde[2]. NOX-A12 zeigte ebenso, dass es die Chemotaxis der Primärzellen von CLL-Patienten entlang eines CXCL12-Gradienten hemmt und dabei spezifische Eigenschaften eines CXCR4-Antagonisten besitzt[3]. In Modellen mit multiplem Myelom löste NOX-A12 Myelomzellen von Bindegewebszellen ab und sensibilisierte sie so, dass sie schließlich sowohl in vitro als auch in vivo von Velcade®/Bortezomib abgetötet wurden[4].
In Phase I-Studien mit gesunden Probanden waren Einzeldosen des von NOXXON entwickelten CXCL12-Hemmers, NOX-A12, bis zu 10,8 mg/kg und Tagesdosen von bis zu 2 mg/kg über fünf Tage sicher und gut verträglich. Wie in präklinischen Studien bereits gezeigt konnte auch im Menschen eine dosisabhängige Mobilisierung weißer Blutkörperchen und CD34-positiver Blutstammzellen gezeigt werden.
Über das Programm „KMU-innovativ“ des Bundesministeriums für Bildung und Forschung (BMBF) erhielt NOXXON Fördermittel für das präklinische Studienprogramm und Phase I-Studien mit NOX-A12.
Weitere Informationen über die aktuelle klinische Studie bei Patienten mit rezidivierender CLL finden Sie auf ClinicalTrials.gov (ID: NCT01486797).
Über CLL
Chronisch lymphatische Leukämie (CLL) ist die in westlichen Ländern am häufigsten verbreitete Form der Leukämie und macht dabei etwa 30% aller Leukämiearten aus. CLL ist im allgemeinen nicht heilbar, da verbliebene Leukämiezellen zu einem Wiederausbrechen der Krankheit führen Klone der Leukämiezellen wieder zurückkehren, wenngleich manche Patienten, die eine allogene Stammzelltransplantation hatten, längere Zeit ohne Zeichen einer Erkrankung überleben. Basierend auf Informationen des amerikanischen Krebsinstituts, der amerikanischen Krebsgesellschaft und der GLOBOCAN-Datenbank schätzt NOXXON, dass jährlich insgesamt etwa 130.000 CLL-Patienten in den EU-5-Ländern (Frankreich, Deutschland, Italien, Spanien und Großbritannien), Japan und den USA eine Behandlung benötigen.
[1] Fischer K (2011) J Clin Oncol. 29(26):3559-66 & Waldthaler C (2011) Wien Klin Wochenschr, 123(9-10):269-75
[2] C. Liu (2012) AACR, 3. April 2012 (Abstract # 4382)
[3] Hoellenriegel J (2011) ASH 53rd Annual Meeting, Poster 3878, Session 652
[4] Roccaro AM (2011) ASH 53rd Annual Meeting, Vortrag 887, Session 652
http://www.dewb-vc.de/de/portfolio/newsarchiv/901-11-07-12-n…
Berlin - 11. Juli 2012- NOXXON Pharma gab heute die Behandlung der ersten Kohorte von drei Patienten mit chronischer lymphatischer Leukämie (CLL) in einer Phase IIa-Studie mit seinem NOX‑A12 Anti-CXCL12/SDF-1 (CXC-Motiv-Chemokin 12 / Stromal Cell-Derived Factor-1) Spiegelmer® bekannt. Die durch CXCL12 ausgelösten zellulären Signale spielen in der Pathophysiologie der CLL eine wichtige Rolle, speziell bei den Interaktionen von leukämischen Zellen mit dem sie umgebenden Gewebe. Der therapeutische Ansatz von NOX-A12 zielt auf die Hemmung dieses tumorfördernden Zusammenspiels ab, wodurch CLL-Zellen für die Chemotherapie sensibilisiert werden sollen.
In diese offene, unkontrollierte Multicenterstudie sollen 33 vorbehandelte Patienten mit einem CLL-Rezidiv eingeschlossen werden. Die Patienten erhalten NOX-A12 in Kombination mit einer Standardtherapie bestehend aus Bendamustin und Rituximab (BR). Die Kombinationsbehandlung mit NOX-A12 und BR erstreckt sich über 6 Zyklen mit jeweils 28 Tagen und eine Nachbeobachtungsphase von 30 Monaten. Jeder Patient durchläuft eine individualisierte Dosistitration mit bis zu drei unterschiedlichen Dosen von NOX-A12. Die Anzahl der kompletten Remissionen (CR) stellt den primären Wirksamkeitsendpunkt der Studie dar. NOXXON geht davon aus, dass Zwischenergebnisse bereits zum nächsten Jahrestreffen der „American Society of Hematology“ in Atlanta vom 8. bis 11. Dezember 2012 verfügbar sein werden.
Obwohl BR eine etablierte Therapie bei CLL ist, gibt es noch einen erheblichen Verbesserungsbedarf bei der Behandlung von Rezidivpatienten. Neuere Veröffentlichungen zeigen, dass die komplette Remissionsrate der BR-Therapie bei diesen Patienten etwa 15% beträgt[1].
NOX-A12 ist gegenwärtig der einzige Antitumor-Wirkstoff in klinischer Entwicklung der den Liganden CXCL12 neutralisiert, wodurch die von CXCL12 induzierte Signalübertragung über seine beiden Rezeptoren CXCR4 und CXCR7 blockiert wird. Konkurrenztherapeutika wirken auf Rezeptorebene und hemmen jeweils nur einen der beiden CXCL12-Rezeptoren.
Über NOX-A12
NOX-A12 ist ein spezifischer Antagonist zu CXCL12/SDF-1 (CXC-Motiv-Chemokin 12 / Stromal Cell-Derived Factor-1), einem Chemokin, das Immun- und Nicht-Immunzellen sowie Stammzellen aus dem Knochenmark anzieht und aktiviert. CXCL12 bindet mit hoher Affinität an die zwei Chemokinrezeptoren CXCR4 und CXCR7. Die Interaktion zwischen CXCL12, CXCR4 und CXCR7 spielt bei der Mobilisierung von Stammzellen, Vaskulogenese, Tumorwachstum und Metastasierung eine Rolle. Die Hemmung der CXCL12-Bindung an seine Rezeptoren sensibilisiert Tumorzellen für die Chemotherapie und verhindert bei manchen soliden Tumoren Invasivität und Metastasierung, was nahe legt, dass NOX-A12 in Kombination mit Chemotherapie hilfreich bei der Behandlung verschiedener Krebsarten sein könnte.
NOX-A12 zeigte auch eine vielversprechende Wirksamkeit in Modellen von soliden und hämatologischen Tumoren sowie bezüglich der Mobilisierung von Stammzellen. Präklinische Studien der NOXXON-Partner haben gezeigt, dass in einem Glioblastom-Tiermodell, NOX-A12 eine signifikant höhere Lebenserwartung der Tiere erzielen konnte, wenn es in Kombinationsbehandlung mit einer Strahlentherapie verabreicht wurde[2]. NOX-A12 zeigte ebenso, dass es die Chemotaxis der Primärzellen von CLL-Patienten entlang eines CXCL12-Gradienten hemmt und dabei spezifische Eigenschaften eines CXCR4-Antagonisten besitzt[3]. In Modellen mit multiplem Myelom löste NOX-A12 Myelomzellen von Bindegewebszellen ab und sensibilisierte sie so, dass sie schließlich sowohl in vitro als auch in vivo von Velcade®/Bortezomib abgetötet wurden[4].
In Phase I-Studien mit gesunden Probanden waren Einzeldosen des von NOXXON entwickelten CXCL12-Hemmers, NOX-A12, bis zu 10,8 mg/kg und Tagesdosen von bis zu 2 mg/kg über fünf Tage sicher und gut verträglich. Wie in präklinischen Studien bereits gezeigt konnte auch im Menschen eine dosisabhängige Mobilisierung weißer Blutkörperchen und CD34-positiver Blutstammzellen gezeigt werden.
Über das Programm „KMU-innovativ“ des Bundesministeriums für Bildung und Forschung (BMBF) erhielt NOXXON Fördermittel für das präklinische Studienprogramm und Phase I-Studien mit NOX-A12.
Weitere Informationen über die aktuelle klinische Studie bei Patienten mit rezidivierender CLL finden Sie auf ClinicalTrials.gov (ID: NCT01486797).
Über CLL
Chronisch lymphatische Leukämie (CLL) ist die in westlichen Ländern am häufigsten verbreitete Form der Leukämie und macht dabei etwa 30% aller Leukämiearten aus. CLL ist im allgemeinen nicht heilbar, da verbliebene Leukämiezellen zu einem Wiederausbrechen der Krankheit führen Klone der Leukämiezellen wieder zurückkehren, wenngleich manche Patienten, die eine allogene Stammzelltransplantation hatten, längere Zeit ohne Zeichen einer Erkrankung überleben. Basierend auf Informationen des amerikanischen Krebsinstituts, der amerikanischen Krebsgesellschaft und der GLOBOCAN-Datenbank schätzt NOXXON, dass jährlich insgesamt etwa 130.000 CLL-Patienten in den EU-5-Ländern (Frankreich, Deutschland, Italien, Spanien und Großbritannien), Japan und den USA eine Behandlung benötigen.
[1] Fischer K (2011) J Clin Oncol. 29(26):3559-66 & Waldthaler C (2011) Wien Klin Wochenschr, 123(9-10):269-75
[2] C. Liu (2012) AACR, 3. April 2012 (Abstract # 4382)
[3] Hoellenriegel J (2011) ASH 53rd Annual Meeting, Poster 3878, Session 652
[4] Roccaro AM (2011) ASH 53rd Annual Meeting, Vortrag 887, Session 652
Auf der Roche Seite:
http://www.roche.de/forschung/innovation.htm?sid=693bfdeb5f3…
Mit Aktualisierung von Januar 2012 steht, dass Roche weiterhin eine Kooperationsvereinbarung mit Noxxon hat.
Auf dem Gebiet der Spiegelmere hat Roche eine Kooperationsvereinbarung mit Noxxon abgeschlossen. Spiegelmere sind unnatürliche Moleküle (D-RNA), die biologisch stabil und nicht immunogen sind. Sie binden mit hoher Affinität und Spezifität an extrazelluläre Zielmoleküle, fast wie ein Antikörper. Leitstrukturen können mittels In-vitro-Evolution (1015 Moleküle gegen ein bestimmtes Zielmolekül) rasch selektiert werden. Roche prüft auch andere Therapieansätze auf RNA-Basis (persönliche Anmerkung evt. siRNA oder mRNA?).
http://www.roche.de/forschung/innovation.htm?sid=693bfdeb5f3…
Mit Aktualisierung von Januar 2012 steht, dass Roche weiterhin eine Kooperationsvereinbarung mit Noxxon hat.
Auf dem Gebiet der Spiegelmere hat Roche eine Kooperationsvereinbarung mit Noxxon abgeschlossen. Spiegelmere sind unnatürliche Moleküle (D-RNA), die biologisch stabil und nicht immunogen sind. Sie binden mit hoher Affinität und Spezifität an extrazelluläre Zielmoleküle, fast wie ein Antikörper. Leitstrukturen können mittels In-vitro-Evolution (1015 Moleküle gegen ein bestimmtes Zielmolekül) rasch selektiert werden. Roche prüft auch andere Therapieansätze auf RNA-Basis (persönliche Anmerkung evt. siRNA oder mRNA?).
Antwort auf Beitrag Nr.: 43.376.340 von dg6nds am 11.07.12 22:45:11Puh, ob die wissen, was sie da auf ihrer HP schreiben? Schön wäre es ja, aber dass das tatsächlich aktuell ist, würde ich stark anzweifeln. Noxxon selbst hat das Ende der Roche-Kooperation im JA für 2010 mitgeteilt (s. #95). Etwas ganz Ähnliches kann man übrigens auch auf der deutschen HP von Pfizer lesen:
"Zu unseren Kooperationspartnern zählt auch die in Berlin ansässige NOXXON Pharma AG, die biotechnologische Medikamente der nächsten Generation auf der Basis ihrer Spiegelmer®-Technologie entwickelt. NOXXON unterstützt Pfizer bei der Entwicklung neuer Arzneimittel."
http://www.pfizer.de/forschung/kooperationen.htm
Bei Pfizer wissen wir laut Montega-Studie vom Januar immerhin, dass sie noch 3%-Aktionär bei Noxxon sind.
Grüße
"Zu unseren Kooperationspartnern zählt auch die in Berlin ansässige NOXXON Pharma AG, die biotechnologische Medikamente der nächsten Generation auf der Basis ihrer Spiegelmer®-Technologie entwickelt. NOXXON unterstützt Pfizer bei der Entwicklung neuer Arzneimittel."
http://www.pfizer.de/forschung/kooperationen.htm
Bei Pfizer wissen wir laut Montega-Studie vom Januar immerhin, dass sie noch 3%-Aktionär bei Noxxon sind.
Grüße
Übersicht zu den P2-Studien von Noxxon (Aktualisierung)
1) Mittlerweile steht das Protokoll der angekündigten P2a mit NOX-H94 bei Myelom- oder Lymphom-Patienten mit Anämie (ACD) online. Die Studie ist placebo-kontrolliert, sieht 48 Patienten vor und soll etwa ein Jahr lang laufen. Begonnen wird mit einer unmaskierten Pilot-Phase (s. Protokoll). Daraus wird Noxxon anscheinend die ersten Zwischenergebnisse ziehen wollen, die man für Ende 2012 in Aussicht gestellt hatte. Ich denke, wir werden demnächst eine Meldung mit Details zu dieser Studie bekommen.
P2a bei Patienten mit Lymphom (HL/NHL) oder Myelom (MM) und Anämie: http://clinicaltrials.gov/ct2/show/NCT01691040
2) Laut Factsheet wird eine P2-Studie mit NOX-A12 bei Glioblastom-Patienten vorbereitet, auch wenn derzeit unklar ist, wann bzw. unter welchen Umständen (Partner?) sie starten soll. Ich belasse sie daher in der Übersicht.
grün = Studie läuft; rot = Studie beendet; kursiv = veränderter Eintrag
* = Zwischenbegutachtung der Daten in Q4/12 geplant (s. Noxxon-Factsheet/-Meldungen)
1) Mittlerweile steht das Protokoll der angekündigten P2a mit NOX-H94 bei Myelom- oder Lymphom-Patienten mit Anämie (ACD) online. Die Studie ist placebo-kontrolliert, sieht 48 Patienten vor und soll etwa ein Jahr lang laufen. Begonnen wird mit einer unmaskierten Pilot-Phase (s. Protokoll). Daraus wird Noxxon anscheinend die ersten Zwischenergebnisse ziehen wollen, die man für Ende 2012 in Aussicht gestellt hatte. Ich denke, wir werden demnächst eine Meldung mit Details zu dieser Studie bekommen.
P2a bei Patienten mit Lymphom (HL/NHL) oder Myelom (MM) und Anämie: http://clinicaltrials.gov/ct2/show/NCT01691040
2) Laut Factsheet wird eine P2-Studie mit NOX-A12 bei Glioblastom-Patienten vorbereitet, auch wenn derzeit unklar ist, wann bzw. unter welchen Umständen (Partner?) sie starten soll. Ich belasse sie daher in der Übersicht.
Spiegelmer --------------- NOX-A12 NOX-A12 NOX-A12 --------------- NOX-E36 --------------- NOX-H94 NOX-H94 --------------- | Indikation --------------------------- CLL (Kombi) MM (Kombi) Glioblastom --------------------------- Diabetes+Albuminurie --------------------------- Endotoxin-Simulation ACD bei HL/NHL/MM --------------------------- | Anz. Pers. ------- 33 28 ? ------- 75 ------- 24 48 ------- | Maskierung --------------- offen * offen * ? --------------- verblindet * --------------- verblindet verblindet * --------------- | Start ------------- Mär/12 Mär/12 ? ------------- Mär/12 ------------- Jan/12 Sep/12 ------------- | Abschluss Primärziel ------------- Feb/13 Feb/13 ? ------------- Mai/13 ------------- Mär/12 Juli/13 ------------- | Abschluss Studie ------------- Dez/15 Dez/14 ? ------------- Mai/14 ------------- Apr/12 Sep/13 ------------- | Protokoll ------------ Klick Klick ? ------------ Klick ------------ Klick Klick ------------ |
grün = Studie läuft; rot = Studie beendet; kursiv = veränderter Eintrag
* = Zwischenbegutachtung der Daten in Q4/12 geplant (s. Noxxon-Factsheet/-Meldungen)
NOXXON startet Phase IIa-Studie mit Anti-CXCL12/SDF-1 Spiegelmer® NOX-A12 in zweiter onkologischer Indikation: Multiples Myelom
http://www.dewb-vc.de/de/portfolio/newsarchiv/905-26-09-12-n…
Berlin – 26. September 2012- NOXXON Pharma gab heute die Behandlung der ersten Kohorte von drei Patienten mit Multiplem Myelom (MM) in einer Phase IIa-Studie mit seinem Anti-CXCL12/SDF-1 (CXC-Motiv-Chemokin 12 / Stromal Cell-Derived Factor-1) Spiegelmer® NOX-A12 bekannt. Die durch CXCL12 ausgelösten zellulären Signale spielen eine wichtige Rolle in der Pathophysiologie des MM, speziell bei der Interaktion von MM-Zellen mit den sie umgebenden Knochenmarkstromazellen. NOX-A12 sensibilisiert die Tumorzellen für die Chemotherapie durch die Hemmung dieser Interaktion.
Nach der Phase IIa-Studie mit NOX-E36 zur Behandlung der diabetischen Nephropathie im Juni und der Phase IIa-Studie mit NOX-A12 zur Behandlung der chronisch lymphatischen Leukämie im Juli ist dies nun die dritte Phase IIa-Studie, die NOXXON in diesem Jahr gestartet hat.
MM ist ein hämatologischer Tumor, ein Blutkrebs, der sich im Knochenmark entwickelt und bei dem sich gesunde antikörperbildende Zellen in bösartige Myelomzellen umwandeln. Das Wachstum der Krebszellen im Knochenmark unterdrückt die Produktion normaler Blutzellen und damit die Bildung von Antikörpern und verursacht zudem Läsionen, die den Knochen schwächen. Laut dem amerikanischen Krebsinstitut (NCI) ist das Multiple Myelom die zweithäufigste Blutkrebsart in den USA und macht etwa ein Prozent aller Krebsfälle aus.
Die von NOXXON durchgeführte offene, unkontrollierte, europäische Multicenterstudie umfasst 28 vorbehandelte Patienten mit einem MM-Rezidiv. Die Patienten erhalten NOX-A12 in Kombination mit einer Standardtherapie bestehend aus Velcade®/Bortezomib und Dexamethason (VD). Die Kombinationsbehandlung mit NOX-A12 und VD erstreckt sich über 8 Zyklen mit jeweils 21 Tagen und einer Nachbeobachtungsphase von einem Jahr. Jeder Patient durchläuft eine individualisierte Dosistitration mit bis zu drei unterschiedlichen NOX-A12 Dosen. Die Gesamtansprechrate, welche alle Patienten umfasst, die vollständig oder teilweise auf die Therapie angesprochen haben, stellt den primären Wirksamkeitsendpunkt dieser Studie dar. NOXXON geht davon aus, dass Zwischenergebnisse Ende 2012 verfügbar sein werden.
Obwohl VD eine etablierte Therapie bei MM ist, gibt es noch einen erheblichen Verbesserungsbedarf bei der Behandlung von Rezidivpatienten. Neuere Veröffentlichungen zeigen, dass die komplette Remissionsrate der VD-Therapie bei diesen Patienten etwa 17% beträgt [1].
NOX-A12 ist gegenwärtig der einzige Antitumor-Wirkstoff in klinischer Entwicklung, der CXCL12 neutralisiert, wodurch die von CXCL12 induzierte Signalübertragung über seine beiden Rezeptoren CXCR4 und CXCR7 blockiert wird. Konkurrenztherapeutika, die sich gegenwärtig in klinischen Studien befinden, wirken auf der Rezeptorebene und hemmen nur CXCR4.
Basierend auf Informationen des amerikanischen Krebsinstituts, der amerikanischen Krebsgesellschaft und der GLOBOCAN-Datenbank schätzt NOXXON, dass jährlich insgesamt etwa 100.000 MM-Patienten in den EU-5-Ländern (Frankreich, Deutschland, Italien, Spanien und Großbritannien), Japan und den USA eine Behandlung benötigen.
Über NOXXON Pharma AG
NOXXON Pharma ist ein biopharmazeutisches Unternehmen, das bei der Entwicklung von Spiegelmeren, einer neuen Wirkstoffklasse, wegbereitend ist. Spiegelmere stellen chemisch synthetisierte, nicht-immunogene Alternativen zu Antikörpern dar. NOXXON besitzt ein breitgefächertes Portfolio von Spiegelmer®-Wirkstoffen im klinischen Entwicklungsstadium:
NOX-E36, ein Anti-CCL2/MCP-1 (C-C Chemokin Ligand 2 / Monocyte Chemoattractant Protein-1) Spiegelmer®, befindet sich gegenwärtig in einer Phase IIa-Studie zur Behandlung von Typ-2-Diabetikern mit diabetischer Nephropathie. CCL2 ist ein entzündungsförderndes Chemokin, das an der Rekrutierung von Immunzellen bei entzündlichen Prozessen in Geweben beteiligt ist.
NOX-A12, ein Anti-CXCL12/SDF-1 (CXC-Motiv-Chemokin 12 / Stromal Cell-Derived Factor-1) Spiegelmer®, befindet sich gegenwärtig in Phase IIa-Studien von zwei Arten hämatologischer Krebserkrankungen, Multiplem Myelom (MM) sowie chronisch lymphatischer Leukämie (CLL). CXCL12 ist ein Chemokin, das eine Rolle bei der Invasivität, Metastasierung und Chemotherapieresistenz spielt.
NOX-H94 ist ein Anti-Hepcidin Spiegelmer®, das bereits eine umfassende Phase I-Studie bei gesunden Probanden mit ansteigender Einfach- und Mehrfachdosierung durchlaufen hat. Des Weiteren wurde eine Endotoxin-Belastungsstudie abgeschlossen, die konzipiert wurde, um zu untersuchen, ob NOX-H94 in der Lage ist, eine durch Hepcidin ausgelöste Hyposiderinämie zu unterdrücken. Eine Phase IIa-Studie mit NOX-H94 bei anämischen Patienten mit Myelom und Lymphom ist für das zweite Halbjahr 2012 geplant. Hepcidin ist der zentrale Regulator des Eisenmetabolismus und der Eisenrestriktion in Anämie bei chronischen Erkrankungen.
Mit der Spiegelmer®-Technologie besitzt das Unternehmen eine leistungsstarke und einzigartige Plattform für die Identifizierung neuer Wirkstoffkandidaten, von denen sich einige weitere bereits in präklinischen Untersuchungen befinden. Die in Berlin ansässige NOXXON Pharma AG ist ein etabliertes und gut finanziertes Biotechnologie-Unternehmen mit einem starken Konsortium internationaler Investoren, ca. 60 Mitarbeitern und einem erfahrenem Management. Für weitere Information besuchen Sie bitte: www.noxxon.com
Über NOX-A12
NOX-A12 ist ein spezifischer Inhibitor des CXCL12/SDF-1 (CXC-Motiv-Chemokin 12 / Stromal Cell-Derived Factor-1), einem Chemokin, das Immun- und Nicht-Immunzellen sowie Stammzellen aus dem Knochenmark anlockt (Chemotaxis) und aktiviert. CXCL12 bindet mit hoher Affinität an die zwei Chemokinrezeptoren CXCR4 und CXCR7. Die Interaktion zwischen CXCL12, CXCR4 und CXCR7 spielt bei der Mobilisierung von Stammzellen, Vaskulogenese, Tumorwachstum und Metastasierung eine Rolle. Die Hemmung der CXCL12-Bindung an seine Rezeptoren sensibilisiert Tumorzellen für die Chemotherapie und verhindert bei manchen soliden Tumoren deren Invasivität und Metastasierung, was nahe legt, dass NOX-A12 in Kombination mit Chemotherapie bei der Behandlung verschiedener Krebsarten hilfreich sein könnte.
NOX-A12 zeigte auch eine vielversprechende Wirksamkeit in Modellen von hämatologischen und soliden Tumoren sowie bezüglich der Mobilisierung von Stammzellen. Untersuchungen von NOXXONs Kollaborationspartnern haben gezeigt, dass in Modellen des multiplen Myeloms NOX-A12 Myelomzellen von Knochenmarkstromazellen ablöste und sie dahingehend sensibilisierte, dass diese schließlich sowohl in vitro als auch in vivo von Velcade®/Bortezomib abgetötet wurden [2]. NOX-A12 zeigte ebenso, dass es die Chemotaxis der Primärzellen von CLL-Patienten in Richtung höherer CXCL12-Konzentrationen hemmt und dass es unterschiedliche Eigenschaften im Vergleich zu einem CXCR4-Antagonisten besitzt [3]. NOX-A12 konnte in einem Glioblastom-Tiermodell eine signifikant höhere Lebenserwartung der Tiere erzielen, wenn es in Kombinationsbehandlung mit einer Strahlentherapie verabreicht wurde [4].
In Phase I-Studien mit gesunden Probanden waren Einzeldosen von NOX-A12 bis zu 10,8 mg/kg, und Tagesdosen von bis zu 2 mg/kg über fünf Tage sicher und gut verträglich. Wie bereits zuvor in präklinischen Studien konnte auch im Menschen eine dosisabhängige Mobilisierung weißer Blutkörperchen und CD34-positiver hämatopoetischer Stammzellen gezeigt werden.
Über das Programm „KMU-innovativ“ des Bundesministeriums für Bildung und Forschung (BMBF) erhielt NOXXON Fördermittel für das präklinische Studienprogramm und Phase I-Studien mit NOX-A12.
Weitere Informationen über die aktuelle Phase IIa-Studie von NOX-A12 finden Sie auf ClinicalTrials.gov: MM-Rezidiv (ID: NCT01521533) und CLL-Rezidiv (ID: NCT01486797).
[1] Corso A, Eur J of Haematol. 2009, 83 (449–454) ; Dimopoulos MA, International Myeloma Foundation, 2010 ; Igarashi N, Int J Hematol 2010, 92:518–523 & Kobayashi T, Int J Hematol. 2010 Nov;92(4):579-8
[2] Roccaro AM (2011) ASH 53rd Annual Meeting, Vortrag 887, Session 652
[3] Hoellenriegel J (2011) ASH 53rd Annual Meeting, Poster 3878, Session 652
[4] C. Liu (2012) AACR, 3. April 2012 (Abstract # 4382)
http://www.dewb-vc.de/de/portfolio/newsarchiv/905-26-09-12-n…
Berlin – 26. September 2012- NOXXON Pharma gab heute die Behandlung der ersten Kohorte von drei Patienten mit Multiplem Myelom (MM) in einer Phase IIa-Studie mit seinem Anti-CXCL12/SDF-1 (CXC-Motiv-Chemokin 12 / Stromal Cell-Derived Factor-1) Spiegelmer® NOX-A12 bekannt. Die durch CXCL12 ausgelösten zellulären Signale spielen eine wichtige Rolle in der Pathophysiologie des MM, speziell bei der Interaktion von MM-Zellen mit den sie umgebenden Knochenmarkstromazellen. NOX-A12 sensibilisiert die Tumorzellen für die Chemotherapie durch die Hemmung dieser Interaktion.
Nach der Phase IIa-Studie mit NOX-E36 zur Behandlung der diabetischen Nephropathie im Juni und der Phase IIa-Studie mit NOX-A12 zur Behandlung der chronisch lymphatischen Leukämie im Juli ist dies nun die dritte Phase IIa-Studie, die NOXXON in diesem Jahr gestartet hat.
MM ist ein hämatologischer Tumor, ein Blutkrebs, der sich im Knochenmark entwickelt und bei dem sich gesunde antikörperbildende Zellen in bösartige Myelomzellen umwandeln. Das Wachstum der Krebszellen im Knochenmark unterdrückt die Produktion normaler Blutzellen und damit die Bildung von Antikörpern und verursacht zudem Läsionen, die den Knochen schwächen. Laut dem amerikanischen Krebsinstitut (NCI) ist das Multiple Myelom die zweithäufigste Blutkrebsart in den USA und macht etwa ein Prozent aller Krebsfälle aus.
Die von NOXXON durchgeführte offene, unkontrollierte, europäische Multicenterstudie umfasst 28 vorbehandelte Patienten mit einem MM-Rezidiv. Die Patienten erhalten NOX-A12 in Kombination mit einer Standardtherapie bestehend aus Velcade®/Bortezomib und Dexamethason (VD). Die Kombinationsbehandlung mit NOX-A12 und VD erstreckt sich über 8 Zyklen mit jeweils 21 Tagen und einer Nachbeobachtungsphase von einem Jahr. Jeder Patient durchläuft eine individualisierte Dosistitration mit bis zu drei unterschiedlichen NOX-A12 Dosen. Die Gesamtansprechrate, welche alle Patienten umfasst, die vollständig oder teilweise auf die Therapie angesprochen haben, stellt den primären Wirksamkeitsendpunkt dieser Studie dar. NOXXON geht davon aus, dass Zwischenergebnisse Ende 2012 verfügbar sein werden.
Obwohl VD eine etablierte Therapie bei MM ist, gibt es noch einen erheblichen Verbesserungsbedarf bei der Behandlung von Rezidivpatienten. Neuere Veröffentlichungen zeigen, dass die komplette Remissionsrate der VD-Therapie bei diesen Patienten etwa 17% beträgt [1].
NOX-A12 ist gegenwärtig der einzige Antitumor-Wirkstoff in klinischer Entwicklung, der CXCL12 neutralisiert, wodurch die von CXCL12 induzierte Signalübertragung über seine beiden Rezeptoren CXCR4 und CXCR7 blockiert wird. Konkurrenztherapeutika, die sich gegenwärtig in klinischen Studien befinden, wirken auf der Rezeptorebene und hemmen nur CXCR4.
Basierend auf Informationen des amerikanischen Krebsinstituts, der amerikanischen Krebsgesellschaft und der GLOBOCAN-Datenbank schätzt NOXXON, dass jährlich insgesamt etwa 100.000 MM-Patienten in den EU-5-Ländern (Frankreich, Deutschland, Italien, Spanien und Großbritannien), Japan und den USA eine Behandlung benötigen.
Über NOXXON Pharma AG
NOXXON Pharma ist ein biopharmazeutisches Unternehmen, das bei der Entwicklung von Spiegelmeren, einer neuen Wirkstoffklasse, wegbereitend ist. Spiegelmere stellen chemisch synthetisierte, nicht-immunogene Alternativen zu Antikörpern dar. NOXXON besitzt ein breitgefächertes Portfolio von Spiegelmer®-Wirkstoffen im klinischen Entwicklungsstadium:
NOX-E36, ein Anti-CCL2/MCP-1 (C-C Chemokin Ligand 2 / Monocyte Chemoattractant Protein-1) Spiegelmer®, befindet sich gegenwärtig in einer Phase IIa-Studie zur Behandlung von Typ-2-Diabetikern mit diabetischer Nephropathie. CCL2 ist ein entzündungsförderndes Chemokin, das an der Rekrutierung von Immunzellen bei entzündlichen Prozessen in Geweben beteiligt ist.
NOX-A12, ein Anti-CXCL12/SDF-1 (CXC-Motiv-Chemokin 12 / Stromal Cell-Derived Factor-1) Spiegelmer®, befindet sich gegenwärtig in Phase IIa-Studien von zwei Arten hämatologischer Krebserkrankungen, Multiplem Myelom (MM) sowie chronisch lymphatischer Leukämie (CLL). CXCL12 ist ein Chemokin, das eine Rolle bei der Invasivität, Metastasierung und Chemotherapieresistenz spielt.
NOX-H94 ist ein Anti-Hepcidin Spiegelmer®, das bereits eine umfassende Phase I-Studie bei gesunden Probanden mit ansteigender Einfach- und Mehrfachdosierung durchlaufen hat. Des Weiteren wurde eine Endotoxin-Belastungsstudie abgeschlossen, die konzipiert wurde, um zu untersuchen, ob NOX-H94 in der Lage ist, eine durch Hepcidin ausgelöste Hyposiderinämie zu unterdrücken. Eine Phase IIa-Studie mit NOX-H94 bei anämischen Patienten mit Myelom und Lymphom ist für das zweite Halbjahr 2012 geplant. Hepcidin ist der zentrale Regulator des Eisenmetabolismus und der Eisenrestriktion in Anämie bei chronischen Erkrankungen.
Mit der Spiegelmer®-Technologie besitzt das Unternehmen eine leistungsstarke und einzigartige Plattform für die Identifizierung neuer Wirkstoffkandidaten, von denen sich einige weitere bereits in präklinischen Untersuchungen befinden. Die in Berlin ansässige NOXXON Pharma AG ist ein etabliertes und gut finanziertes Biotechnologie-Unternehmen mit einem starken Konsortium internationaler Investoren, ca. 60 Mitarbeitern und einem erfahrenem Management. Für weitere Information besuchen Sie bitte: www.noxxon.com
Über NOX-A12
NOX-A12 ist ein spezifischer Inhibitor des CXCL12/SDF-1 (CXC-Motiv-Chemokin 12 / Stromal Cell-Derived Factor-1), einem Chemokin, das Immun- und Nicht-Immunzellen sowie Stammzellen aus dem Knochenmark anlockt (Chemotaxis) und aktiviert. CXCL12 bindet mit hoher Affinität an die zwei Chemokinrezeptoren CXCR4 und CXCR7. Die Interaktion zwischen CXCL12, CXCR4 und CXCR7 spielt bei der Mobilisierung von Stammzellen, Vaskulogenese, Tumorwachstum und Metastasierung eine Rolle. Die Hemmung der CXCL12-Bindung an seine Rezeptoren sensibilisiert Tumorzellen für die Chemotherapie und verhindert bei manchen soliden Tumoren deren Invasivität und Metastasierung, was nahe legt, dass NOX-A12 in Kombination mit Chemotherapie bei der Behandlung verschiedener Krebsarten hilfreich sein könnte.
NOX-A12 zeigte auch eine vielversprechende Wirksamkeit in Modellen von hämatologischen und soliden Tumoren sowie bezüglich der Mobilisierung von Stammzellen. Untersuchungen von NOXXONs Kollaborationspartnern haben gezeigt, dass in Modellen des multiplen Myeloms NOX-A12 Myelomzellen von Knochenmarkstromazellen ablöste und sie dahingehend sensibilisierte, dass diese schließlich sowohl in vitro als auch in vivo von Velcade®/Bortezomib abgetötet wurden [2]. NOX-A12 zeigte ebenso, dass es die Chemotaxis der Primärzellen von CLL-Patienten in Richtung höherer CXCL12-Konzentrationen hemmt und dass es unterschiedliche Eigenschaften im Vergleich zu einem CXCR4-Antagonisten besitzt [3]. NOX-A12 konnte in einem Glioblastom-Tiermodell eine signifikant höhere Lebenserwartung der Tiere erzielen, wenn es in Kombinationsbehandlung mit einer Strahlentherapie verabreicht wurde [4].
In Phase I-Studien mit gesunden Probanden waren Einzeldosen von NOX-A12 bis zu 10,8 mg/kg, und Tagesdosen von bis zu 2 mg/kg über fünf Tage sicher und gut verträglich. Wie bereits zuvor in präklinischen Studien konnte auch im Menschen eine dosisabhängige Mobilisierung weißer Blutkörperchen und CD34-positiver hämatopoetischer Stammzellen gezeigt werden.
Über das Programm „KMU-innovativ“ des Bundesministeriums für Bildung und Forschung (BMBF) erhielt NOXXON Fördermittel für das präklinische Studienprogramm und Phase I-Studien mit NOX-A12.
Weitere Informationen über die aktuelle Phase IIa-Studie von NOX-A12 finden Sie auf ClinicalTrials.gov: MM-Rezidiv (ID: NCT01521533) und CLL-Rezidiv (ID: NCT01486797).
[1] Corso A, Eur J of Haematol. 2009, 83 (449–454) ; Dimopoulos MA, International Myeloma Foundation, 2010 ; Igarashi N, Int J Hematol 2010, 92:518–523 & Kobayashi T, Int J Hematol. 2010 Nov;92(4):579-8
[2] Roccaro AM (2011) ASH 53rd Annual Meeting, Vortrag 887, Session 652
[3] Hoellenriegel J (2011) ASH 53rd Annual Meeting, Poster 3878, Session 652
[4] C. Liu (2012) AACR, 3. April 2012 (Abstract # 4382)
Antwort auf Beitrag Nr.: 43.647.909 von Saaletaler am 26.09.12 14:49:07http://www.gesundheitsforschung-bmbf.de/de/4632.php
BMBF: Spieglein, Spieglein an der Wand: Wer ist der neue Wirkstoffkandidat? - Nierenversagen bei Diabetikern verhindern
BMBF: Spieglein, Spieglein an der Wand: Wer ist der neue Wirkstoffkandidat? - Nierenversagen bei Diabetikern verhindern
Zwei Vorträge zu NOX-A12 auf ASH-Meeting (8.-11. Dezember 2012 in Atlanta)
1) Roccaro et al.: In Vivo Targeting of Stromal-Derived Factor-1 As a Strategy to Prevent Myeloma Cell Dissemination to Distant Bone Marrow Niches.
https://ash.confex.com/ash/2012/webprogram/Paper48599.html
2) Zboralski et al.: Mode of Action of the SDF-1/CXCL12 Inhibiting Spiegelmer® Nox-A12 and Its Impact On Chronic Lymphocytic Leukemia (CLL) Cell Motility and Chemosensitization.
https://ash.confex.com/ash/2012/webprogram/Paper49301.html
Diese beiden Beiträge liefern weitere Erkenntnisse aus Labor-Untersuchungen zur Anwendung von NOX-A12 bei MM bzw. CLL (s. auch Posting #80). Die Attraktivität von CXCL12 als Zielmolekül bei diesen Blutkrebserkrankungen in Kombination mit einer Chemotherapie wird bestätigt.
Es handelt sich hierbei noch nicht um Zwischenergebnisse aus den beiden laufenden klinischen P2a-Studien mit NOX-A12. Denkbar wäre jedoch, dass Noxxon erste Daten daraus kurz vor der ASH-Konferenz meldet oder dort mündlich anfügt.
1) Roccaro et al.: In Vivo Targeting of Stromal-Derived Factor-1 As a Strategy to Prevent Myeloma Cell Dissemination to Distant Bone Marrow Niches.
https://ash.confex.com/ash/2012/webprogram/Paper48599.html
2) Zboralski et al.: Mode of Action of the SDF-1/CXCL12 Inhibiting Spiegelmer® Nox-A12 and Its Impact On Chronic Lymphocytic Leukemia (CLL) Cell Motility and Chemosensitization.
https://ash.confex.com/ash/2012/webprogram/Paper49301.html
Diese beiden Beiträge liefern weitere Erkenntnisse aus Labor-Untersuchungen zur Anwendung von NOX-A12 bei MM bzw. CLL (s. auch Posting #80). Die Attraktivität von CXCL12 als Zielmolekül bei diesen Blutkrebserkrankungen in Kombination mit einer Chemotherapie wird bestätigt.
Es handelt sich hierbei noch nicht um Zwischenergebnisse aus den beiden laufenden klinischen P2a-Studien mit NOX-A12. Denkbar wäre jedoch, dass Noxxon erste Daten daraus kurz vor der ASH-Konferenz meldet oder dort mündlich anfügt.
Antwort auf Beitrag Nr.: 43.790.976 von Saaletaler am 06.11.12 13:08:52Funktionierende Links zu #117:
1) http://ash.confex.com/ash/2012/webprogram/Paper48599.html
2) http://ash.confex.com/ash/2012/webprogram/Paper49301.html
1) http://ash.confex.com/ash/2012/webprogram/Paper48599.html
2) http://ash.confex.com/ash/2012/webprogram/Paper49301.html
Zwei Poster zu NOX-H94 auf ASH-Meeting (8.-11. Dezember 2012 in Atlanta)
3) Riecke et al.: Single and Repeated Dose First-in-Human Study with the Anti-Hepcidin Spiegelmer Nox‑H94.
http://ash.confex.com/ash/2012/webprogram/Paper52683.html
4) van Eijk et al.: Randomized Double Blind Placebo Controlled PK/PD Study On the Effects of a Single Intravenous Dose of the Anti-Hepcidin Spiegelmer Nox‑H94 On Serum Iron During Experimental Human Endotoxemia.
http://ash.confex.com/ash/2012/webprogram/Paper50672.html
------------------------------------------------------------------------------------------------------------------------------
Es werden hiermit m.W. erstmals Daten aus den beiden abgeschlossenen klinischen Studien mit NOX-H94 öffentlich präsentiert, zur First-in-Human-P1 in 3), zur Endotoxin-Simulation in 4). Die Abstracts sind verständlich geschrieben, daher nur einige zusammenfassende Anmerkungen meinerseits (ohne Garantie auf Korrektheit oder Vollständigkeit):
a) Kritische Nebenwirkungen sind bislang nicht aufgetreten. NOX-H94 war sicher und gut verträglich. Wie sich das Nebenwirkungsprofil bei einer mittel/-langfristigen Verabreichung bei einer chronischen Erkrankung (ACD) darstellt, muss man abwarten.
b) In 3) wird nur von 56 intravenös-Teilnehmern berichtet. Laut Studienprotokoll gab es jedoch auch eine 8-köpfige subkutan-Gruppe. Was ist damit?
c) Die Eisen-Konzentration im Blutserum war im Endotoxin-Modell bei NOX-H94-Gabe über mehrere Stunden deutlich höher als in der Vergleichsgruppe. Insofern war ein Wirksamkeitseffekt sichtbar.
d) Die Halbwertszeit von NOX-H94 im Körper beträgt nur etwa 1 Tag. Deshalb ließ die Wirkung im Endotoxin-Modell bereits innerhalb von 24 Stunden deutlich nach, zumal sich bei NOX-H94-Gabe eine massiv erhöhte Hepcidin-Konzentration ("Nachproduktion") im Vergleich zur Placebo-Gruppe eingestellt hat, die sich anschließend nur langsam über mehrere Tage hinweg abgebaut hat.
------------------------------------------------------------------------------------------------------------------------------
Inwieweit die Ergebnisse aus der Endotoxin-Studie hinsichtlich des Ausmaßes der Wirksamkeit positiv oder eher ernüchternd sind, kann ich nicht einschätzen. Dazu müsste man Fachleute des menschlichen Eisenstoffwechsels befragen.
Eine m.E. wichtige Rolle könnte spielen, dass es sich bei der Endotoxin-Simulation um eine akut hervorgerufene Entzündungsreaktion handelt. Bei einer Anämie von chronisch erkrankten Patienten (ACD), wie von Noxxon fokussiert, sehen die Ergebnisse zu Intensität und Dauer der Wirksamkeit möglicherweise deutlich anders aus. Insofern sollte man die Endotoxin-Daten m.E. weder über- noch unterbewerten. Sie zeigen bisher nur, dass das Konzept der Hepcidin-Blockierung prinzipiell funktioniert.
Immerhin, das Projekt lebt und ist jetzt in Phase 2!
3) Riecke et al.: Single and Repeated Dose First-in-Human Study with the Anti-Hepcidin Spiegelmer Nox‑H94.
http://ash.confex.com/ash/2012/webprogram/Paper52683.html
4) van Eijk et al.: Randomized Double Blind Placebo Controlled PK/PD Study On the Effects of a Single Intravenous Dose of the Anti-Hepcidin Spiegelmer Nox‑H94 On Serum Iron During Experimental Human Endotoxemia.
http://ash.confex.com/ash/2012/webprogram/Paper50672.html
------------------------------------------------------------------------------------------------------------------------------
Es werden hiermit m.W. erstmals Daten aus den beiden abgeschlossenen klinischen Studien mit NOX-H94 öffentlich präsentiert, zur First-in-Human-P1 in 3), zur Endotoxin-Simulation in 4). Die Abstracts sind verständlich geschrieben, daher nur einige zusammenfassende Anmerkungen meinerseits (ohne Garantie auf Korrektheit oder Vollständigkeit):
a) Kritische Nebenwirkungen sind bislang nicht aufgetreten. NOX-H94 war sicher und gut verträglich. Wie sich das Nebenwirkungsprofil bei einer mittel/-langfristigen Verabreichung bei einer chronischen Erkrankung (ACD) darstellt, muss man abwarten.
b) In 3) wird nur von 56 intravenös-Teilnehmern berichtet. Laut Studienprotokoll gab es jedoch auch eine 8-köpfige subkutan-Gruppe. Was ist damit?
c) Die Eisen-Konzentration im Blutserum war im Endotoxin-Modell bei NOX-H94-Gabe über mehrere Stunden deutlich höher als in der Vergleichsgruppe. Insofern war ein Wirksamkeitseffekt sichtbar.
d) Die Halbwertszeit von NOX-H94 im Körper beträgt nur etwa 1 Tag. Deshalb ließ die Wirkung im Endotoxin-Modell bereits innerhalb von 24 Stunden deutlich nach, zumal sich bei NOX-H94-Gabe eine massiv erhöhte Hepcidin-Konzentration ("Nachproduktion") im Vergleich zur Placebo-Gruppe eingestellt hat, die sich anschließend nur langsam über mehrere Tage hinweg abgebaut hat.
------------------------------------------------------------------------------------------------------------------------------
Inwieweit die Ergebnisse aus der Endotoxin-Studie hinsichtlich des Ausmaßes der Wirksamkeit positiv oder eher ernüchternd sind, kann ich nicht einschätzen. Dazu müsste man Fachleute des menschlichen Eisenstoffwechsels befragen.
Eine m.E. wichtige Rolle könnte spielen, dass es sich bei der Endotoxin-Simulation um eine akut hervorgerufene Entzündungsreaktion handelt. Bei einer Anämie von chronisch erkrankten Patienten (ACD), wie von Noxxon fokussiert, sehen die Ergebnisse zu Intensität und Dauer der Wirksamkeit möglicherweise deutlich anders aus. Insofern sollte man die Endotoxin-Daten m.E. weder über- noch unterbewerten. Sie zeigen bisher nur, dass das Konzept der Hepcidin-Blockierung prinzipiell funktioniert.
Immerhin, das Projekt lebt und ist jetzt in Phase 2!
NOXXON will attend the following events:
• Deutsches Eigenkapital Forum
Iain Buchanan, November 12 - 14, Frankfurt am Main, Germany
November 13, 11h30, room: München
• Bio Europe 2012
Aram Mangasarian, November 12 - 14, Hamburg, Germany
November 13, 10h45, level 1, room: B2
• 13th annual EuroTides 2012
Axel Vater, Christian Schmidt, Johannes Hoos
November 27 - 28, Berlin, Germany
• Deutsches Eigenkapital Forum
Iain Buchanan, November 12 - 14, Frankfurt am Main, Germany
November 13, 11h30, room: München
• Bio Europe 2012
Aram Mangasarian, November 12 - 14, Hamburg, Germany
November 13, 10h45, level 1, room: B2
• 13th annual EuroTides 2012
Axel Vater, Christian Schmidt, Johannes Hoos
November 27 - 28, Berlin, Germany
Antwort auf Beitrag Nr.: 43.820.415 von dg6nds am 13.11.12 21:49:37Twitter-Foto von der gestrigen Noxxon-Präsentation auf der der Bio Europe (CBO Aram Mangasarian am Pult).
Deutlich mehr Andrang als auf der letzten DEWB-HV. Da ist ja gar kein Platz mehr frei.

Quelle: twitter.com/EBDgroup
Deutlich mehr Andrang als auf der letzten DEWB-HV. Da ist ja gar kein Platz mehr frei.


Quelle: twitter.com/EBDgroup
Antwort auf Beitrag Nr.: 43.823.785 von Saaletaler am 14.11.12 16:17:30... dafür waren bei der Präsentation auf dem Deutschen Eigenkapitalform umso mehr Plätze frei, vielleicht nicht das richtige Publikum. Ich muss für meine Seite zugeben, dass ich pharmatechnisch nur Bahnhof verstanden habe.
Wichtige Dinge die ich mitgenommen habe:
- alle 3 Phase II Studien werden erst ab Q2 2013 berichten
- es soll zeitnah eine weitere Kapitalerhöhung im Volumen von 15-20 Mio.€ geben, die auch "open for new investors" ist (d.h. nicht alle Altaktionäre werden im Rahmen ihrer Beteiligungsquote mitziehen).
Viele Grüße
il
Wichtige Dinge die ich mitgenommen habe:
- alle 3 Phase II Studien werden erst ab Q2 2013 berichten
- es soll zeitnah eine weitere Kapitalerhöhung im Volumen von 15-20 Mio.€ geben, die auch "open for new investors" ist (d.h. nicht alle Altaktionäre werden im Rahmen ihrer Beteiligungsquote mitziehen).
Viele Grüße
il
Antwort auf Beitrag Nr.: 43.839.501 von ilsubstanzinvestore am 19.11.12 13:49:13Besten Dank für die Informationen, il!
Dass eine weitere Finanzierungsrunde vor der Tür steht, war abzusehen, da das Kapital in Q1/13 zur Neige geht (s. #107) und Noxxon bislang noch keinen Deal auf die Reihe bekommen hat. Man darf gespannt sein, wer sich wie hoch beteiligen wird.
P2-Daten: Im Factsheet ist derzeit noch von "Interim assessment" in Q4/12 die Rede. Kann aber sein, dass dies ein interner Termin ist, z.B. für interessierte Pharmas (s. #107), oder sich die Studien wie üblich zeitlich verzögern.
Grüße
Dass eine weitere Finanzierungsrunde vor der Tür steht, war abzusehen, da das Kapital in Q1/13 zur Neige geht (s. #107) und Noxxon bislang noch keinen Deal auf die Reihe bekommen hat. Man darf gespannt sein, wer sich wie hoch beteiligen wird.
P2-Daten: Im Factsheet ist derzeit noch von "Interim assessment" in Q4/12 die Rede. Kann aber sein, dass dies ein interner Termin ist, z.B. für interessierte Pharmas (s. #107), oder sich die Studien wie üblich zeitlich verzögern.
Grüße
Quelle: DEWB HP
04.12.12 - NOXXON startet Phase IIa-Studie mit Anti-Hepcidin Spiegelmer® NOX-H94
Die Studie zur Anämie der chronischen Erkrankung ist die inzwischen vierte von NOXXON im Jahr 2012 initiierte Phase II-Studie
Berlin - 04. Dezember 2012 - NOXXON Pharma gab heute die Behandlung der ersten Patienten, die an einer funktionellen Eisenmangelanämie, der sogenannten Anämie der chronischen Erkrankung, leiden, mit seinem Anti-Hepcidin Spiegelmer® NOX-H94 bekannt. Der Start dieser Phase IIa-Studie folgt auf den erfolgreichen Abschluss einer Phase I-Studie, deren Ergebnisse während des kommenden Jahrestreffens der American Society of Hematology (ASH) in Atlanta vom 8. bis 11. Dezember 2012 vorgestellt werden. Im Rahmen eines Phase I-Programms nahmen gesunde Probanden u.a. an einer umfangreichen Studie teil, bei der ansteigende Dosen NOX-H94 durch Einfach- und Mehrfachgabe verabreicht wurden. Weiterhin wurde in einem humanen Pharmakologiemodell erfolgreich die Fähigkeit von NOX‑H94 geprüft, bei gesunden Probanden eine durch Endotoxine ausgelöste Hyposiderinämie zu verhindern. Diese sog. Endotoxinämie-Studie lieferte die ersten Daten dafür, dass NOX-H94 auch im Menschen in der Lage ist, erhöhte Hepcidinspiegel zu neutralisieren und dadurch höhere Serumeisenkonzentrationen aufrecht zu erhalten, als dies bei placebobehandelten Probanden der Fall ist.
NOX-H94 ist das dritte Spiegelmer®, das sich nun in einer Phase II-Studie befindet. Zudem ist diese Studie die vierte Phase IIa-Studie, die NOXXON in diesem Jahr gestartet hat. Die anderen Phase IIa-Studien untersuchen NOX-E36 zur Behandlung der diabetischen Nephropathie, NOX-A12 zur Behandlung der chronisch lymphatischen Leukämie sowie NOX-A12 zur Behandlung des Multiplen Myeloms.
Erhöhte Konzentrationen des Peptidhormons Hepcidin, das auch als Hauptregulator der Eisenhomöostase bezeichnet wird, treten besonders bei chronischen Erkrankungen wie Krebs- und Nierenleiden bzw. entzündlichen Erkrankungen auf. Der hohe Hepcidinspiegel führt zu einer Eisenrestriktion, die auch als „funktioneller Eisenmangel“ bezeichnet wird. Bei diesem Zustand akkumuliert Eisen in den zellulären Speichern und steht somit nicht zur Hämoglobin-Synthese zur Verfügung. Über die Zeit führt dies zu einer sog. Anämie der chronischen Erkrankung. Durch Bindung und Inaktivierung des Hepcidins greift NOX-H94 in diesen Entstehungsmechanismus der Erkrankung ein.
Diese Phase IIa-Studie soll zeigen, ob NOX-H94 durch die Hemmung von Hepcidin in der Lage ist, pathologisch erniedrigte Hämoglobinspiegel bei Patienten, die an einer Anämie der chronischen Erkrankung leiden, erhöhen kann. Dabei werden anämische Krebspatienten innerhalb einer europäische Multicenterstudie über vier Wochen mit wiederholten Dosierungen behandelt. Nach einer offenen Pilotphase folgt eine randomisierte, doppelblinde, placebokontrollierte Hauptphase, in der zwei unterschiedliche Behandlungsschemata von NOX-H94 jeweils mit Placebo verglichen werden.
Hepcidinhemmer wie NOX-H94 bieten potenziell die Möglichkeit zu einer gezielten Behandlung der Anämie der chronischen Erkrankung und damit eine Alternative zu den gegenwärtigen unspezifischen Behandlungsformen. Damit könnten auch einige der Nachteile der heute angewandten Therapieformen wie Erythropoese-stimulierende Substanzen (ESAs) sowie intravenöse Verabreichungen von Eisen bzw. Bluttransfusionen, die häufig in hoher Dosierung gegeben werden, vermieden werden.
Die potenziellen Risiken von ESAs bei der Behandlung von Krebspatienten und solchen mit chronischen Nierenleiden sind in den von der amerikanischen FDA geforderten „Black-Box“-Warnungen dokumentiert und umfassen beispielsweise ein erhöhtes Risiko von Tumorwachstum oder Rückfällen.
Die Häufigkeit der intravenösen Verabreichung von Eisen ist aufgrund der Bedenken bezüglich einer ESA-Therapie entsprechend angestiegen. Jedoch ist diese Behandlungsart wegen der Gefahr der Eisenüberladung ebenfalls nur eingeschränkt einsetzbar. Außerdem führt die intravenöse Verabreichung von Eisen zu einem kontraproduktiven Anstieg des Hepcidinspiegels.
Bluttransfusionen erhöhen ebenfalls den Eisenspiegel im Körper. Sie bergen zudem das Risiko von übertragbaren Krankheiten und Immunsuppression.
NOX-H94 ist der erste Hepcidinhemmer, der die Phase II erreicht.
Basierend auf Informationen der GLOBOCAN-Datenbank und wissenschaftlicher Publikationen zu Häufigkeit und Arten der Anämie bei Patienten mit Krebs oder chronischen Nierenleiden schätzt NOXXON, dass in den EU-5-Ländern (Frankreich, Deutschland, Italien, Spanien und Großbritannien), Japan und den USA jährlich insgesamt etwa 230.000 Krebspatienten und 3,6 Millionen Patienten mit chronischem Nierenleiden, die sich wegen Anämie der chronischen Erkrankung in Behandlung befinden, potenziell von einem Hepcidinhemmer profitieren könnten.
Über NOX-H94 & Anämie bei chronischen Erkrankungen
NOX-H94 ist ein Spiegelmer®- Wirkstoff, der das eisenregulierende Protein Hepcidin bindet. Hepcidin ist der körpereigene Hauptregulator der Eisenhomöostase und wirkt über seine Bindung an Ferroportin, dem einzigen bekannten Eisen-Export-Protein, das sich auf eisenspeichernden Zellen, wie z.B. Makrophagen, befindet. Die Entzündungs-induzierte Synthese von Hepcidin spielt eine entscheidende Rolle bei der Eisenretention in Makrophagen, wodurch eine Anämie bei Entzündungen entsteht, da nicht genug Eisen für Vorläuferzellen der roten Blutkörperchen zur Verfügung steht. Patienten mit Entzündungsanämien zeigen auch eine gestörte Reaktion auf Erythropoietin (EPO). Der Wirkstoff NOX-H94 ist ein L-RNA-Oligonukleotid in Verbindung mit 40 kDa PEG (Polyethylenglykol). Präklinische Studien haben gezeigt, dass dieser Wirkstoff IL-6-induzierte Anämien verhindert und eine ähnliche Pharmakokinetik wie andere Spiegelmere hat. Die Verbindung kann intravenös oder subkutan verabreicht werden.
Über das Programm „KMU-innovativ“ des Bundesministeriums für Bildung und Forschung (BMBF) erhielt NOXXON Fördermittel für die präklinische und frühe klinische Phase der Studien mit NOX-H94.
Weitere Informationen über die aktuelle Phase IIa-Studie von NOX-H94 finden Sie auf ClinicalTrials.gov: ID: NCT01691040.
04.12.12 - NOXXON startet Phase IIa-Studie mit Anti-Hepcidin Spiegelmer® NOX-H94
Die Studie zur Anämie der chronischen Erkrankung ist die inzwischen vierte von NOXXON im Jahr 2012 initiierte Phase II-Studie
Berlin - 04. Dezember 2012 - NOXXON Pharma gab heute die Behandlung der ersten Patienten, die an einer funktionellen Eisenmangelanämie, der sogenannten Anämie der chronischen Erkrankung, leiden, mit seinem Anti-Hepcidin Spiegelmer® NOX-H94 bekannt. Der Start dieser Phase IIa-Studie folgt auf den erfolgreichen Abschluss einer Phase I-Studie, deren Ergebnisse während des kommenden Jahrestreffens der American Society of Hematology (ASH) in Atlanta vom 8. bis 11. Dezember 2012 vorgestellt werden. Im Rahmen eines Phase I-Programms nahmen gesunde Probanden u.a. an einer umfangreichen Studie teil, bei der ansteigende Dosen NOX-H94 durch Einfach- und Mehrfachgabe verabreicht wurden. Weiterhin wurde in einem humanen Pharmakologiemodell erfolgreich die Fähigkeit von NOX‑H94 geprüft, bei gesunden Probanden eine durch Endotoxine ausgelöste Hyposiderinämie zu verhindern. Diese sog. Endotoxinämie-Studie lieferte die ersten Daten dafür, dass NOX-H94 auch im Menschen in der Lage ist, erhöhte Hepcidinspiegel zu neutralisieren und dadurch höhere Serumeisenkonzentrationen aufrecht zu erhalten, als dies bei placebobehandelten Probanden der Fall ist.
NOX-H94 ist das dritte Spiegelmer®, das sich nun in einer Phase II-Studie befindet. Zudem ist diese Studie die vierte Phase IIa-Studie, die NOXXON in diesem Jahr gestartet hat. Die anderen Phase IIa-Studien untersuchen NOX-E36 zur Behandlung der diabetischen Nephropathie, NOX-A12 zur Behandlung der chronisch lymphatischen Leukämie sowie NOX-A12 zur Behandlung des Multiplen Myeloms.
Erhöhte Konzentrationen des Peptidhormons Hepcidin, das auch als Hauptregulator der Eisenhomöostase bezeichnet wird, treten besonders bei chronischen Erkrankungen wie Krebs- und Nierenleiden bzw. entzündlichen Erkrankungen auf. Der hohe Hepcidinspiegel führt zu einer Eisenrestriktion, die auch als „funktioneller Eisenmangel“ bezeichnet wird. Bei diesem Zustand akkumuliert Eisen in den zellulären Speichern und steht somit nicht zur Hämoglobin-Synthese zur Verfügung. Über die Zeit führt dies zu einer sog. Anämie der chronischen Erkrankung. Durch Bindung und Inaktivierung des Hepcidins greift NOX-H94 in diesen Entstehungsmechanismus der Erkrankung ein.
Diese Phase IIa-Studie soll zeigen, ob NOX-H94 durch die Hemmung von Hepcidin in der Lage ist, pathologisch erniedrigte Hämoglobinspiegel bei Patienten, die an einer Anämie der chronischen Erkrankung leiden, erhöhen kann. Dabei werden anämische Krebspatienten innerhalb einer europäische Multicenterstudie über vier Wochen mit wiederholten Dosierungen behandelt. Nach einer offenen Pilotphase folgt eine randomisierte, doppelblinde, placebokontrollierte Hauptphase, in der zwei unterschiedliche Behandlungsschemata von NOX-H94 jeweils mit Placebo verglichen werden.
Hepcidinhemmer wie NOX-H94 bieten potenziell die Möglichkeit zu einer gezielten Behandlung der Anämie der chronischen Erkrankung und damit eine Alternative zu den gegenwärtigen unspezifischen Behandlungsformen. Damit könnten auch einige der Nachteile der heute angewandten Therapieformen wie Erythropoese-stimulierende Substanzen (ESAs) sowie intravenöse Verabreichungen von Eisen bzw. Bluttransfusionen, die häufig in hoher Dosierung gegeben werden, vermieden werden.
Die potenziellen Risiken von ESAs bei der Behandlung von Krebspatienten und solchen mit chronischen Nierenleiden sind in den von der amerikanischen FDA geforderten „Black-Box“-Warnungen dokumentiert und umfassen beispielsweise ein erhöhtes Risiko von Tumorwachstum oder Rückfällen.
Die Häufigkeit der intravenösen Verabreichung von Eisen ist aufgrund der Bedenken bezüglich einer ESA-Therapie entsprechend angestiegen. Jedoch ist diese Behandlungsart wegen der Gefahr der Eisenüberladung ebenfalls nur eingeschränkt einsetzbar. Außerdem führt die intravenöse Verabreichung von Eisen zu einem kontraproduktiven Anstieg des Hepcidinspiegels.
Bluttransfusionen erhöhen ebenfalls den Eisenspiegel im Körper. Sie bergen zudem das Risiko von übertragbaren Krankheiten und Immunsuppression.
NOX-H94 ist der erste Hepcidinhemmer, der die Phase II erreicht.
Basierend auf Informationen der GLOBOCAN-Datenbank und wissenschaftlicher Publikationen zu Häufigkeit und Arten der Anämie bei Patienten mit Krebs oder chronischen Nierenleiden schätzt NOXXON, dass in den EU-5-Ländern (Frankreich, Deutschland, Italien, Spanien und Großbritannien), Japan und den USA jährlich insgesamt etwa 230.000 Krebspatienten und 3,6 Millionen Patienten mit chronischem Nierenleiden, die sich wegen Anämie der chronischen Erkrankung in Behandlung befinden, potenziell von einem Hepcidinhemmer profitieren könnten.
Über NOX-H94 & Anämie bei chronischen Erkrankungen
NOX-H94 ist ein Spiegelmer®- Wirkstoff, der das eisenregulierende Protein Hepcidin bindet. Hepcidin ist der körpereigene Hauptregulator der Eisenhomöostase und wirkt über seine Bindung an Ferroportin, dem einzigen bekannten Eisen-Export-Protein, das sich auf eisenspeichernden Zellen, wie z.B. Makrophagen, befindet. Die Entzündungs-induzierte Synthese von Hepcidin spielt eine entscheidende Rolle bei der Eisenretention in Makrophagen, wodurch eine Anämie bei Entzündungen entsteht, da nicht genug Eisen für Vorläuferzellen der roten Blutkörperchen zur Verfügung steht. Patienten mit Entzündungsanämien zeigen auch eine gestörte Reaktion auf Erythropoietin (EPO). Der Wirkstoff NOX-H94 ist ein L-RNA-Oligonukleotid in Verbindung mit 40 kDa PEG (Polyethylenglykol). Präklinische Studien haben gezeigt, dass dieser Wirkstoff IL-6-induzierte Anämien verhindert und eine ähnliche Pharmakokinetik wie andere Spiegelmere hat. Die Verbindung kann intravenös oder subkutan verabreicht werden.
Über das Programm „KMU-innovativ“ des Bundesministeriums für Bildung und Forschung (BMBF) erhielt NOXXON Fördermittel für die präklinische und frühe klinische Phase der Studien mit NOX-H94.
Weitere Informationen über die aktuelle Phase IIa-Studie von NOX-H94 finden Sie auf ClinicalTrials.gov: ID: NCT01691040.
P1-Studie von Eli Lilly mit Anti-Hepcidin-mAb LY2787106 - Konkurrenz zu NOX-H94 (Aktualisierung)
Nachdem der P2-Start mit NOX-H94 in der Indikation "ACD bei Myelom/Lymphom-Patienten" offiziell vermeldet wurde (s. #124) und zudem auf der ASH-Konferenz erstmals Daten aus den beiden abgeschlossenen klinischen Studien mit NOX-H94 vorgestellt werden (s. #119), bietet sich ein Blick auf die laufende Lilly-Studie mit dem Anti-Hepcidin-mAb LY2787106 an (s. #74).
P1 von Lilly mit Anti-Hepcidin-mAb: http://clinicaltrials.gov/ct2/show/NCT01340976
Das Studiendesign wurde kürzlich wesentlich verändert, insbesondere:
a) Die Anzahl der vorgesehenen Testpatienten wurde von ursprünglich 99 über 56 auf nun 51 abgespeckt.
b) Das erwartete Studienende verschiebt sich um 1 Jahr nach hinten auf August 2014.
c) Waren nach einer vorangestellten Dosis-Eskalationsgruppe (Teil A) im Teil B der Studie zunächst zwei randomisierte Arme mit verschiedenen Wirkstoff-Dosen ("niedrig" vs. "hoch") vorgesehen, so wird nun in Teil B mit einer festen Dosis von 10 mg/kg und ohne Verblindung getestet. Ein Arm appliziert ausschließlich den Anti-Hepcidin-mAb, der andere Arm zusätzlich "orales Eisen" in Form einer Nahrungsergänzung.
d) Sollte der mAb ursprünglich alle 3 Wochen über 5 Zyklen appliziert werden (Behandlungsdauer also 15 Wochen), so erfolgt die Gabe nach Umstellung des Designs nun alle 7 Tage über einen Zeitraum von (mindestens) acht Wochen.
e) Als zu empfehlende Dosis für weitere Studien wird nun gezielt nach der maximal tolerierten Dosis (MTD) gesucht.
Die Design-Veränderungen sind insofern interessant, als Lilly in dieser P1 bereits ausschließlich Patienten mit verschiedenen Krebserkrankungen untersucht, wenn auch primär unter Aspekten der Sicherheit und Verträglichkeit.
Ohne allzu viel in der Veränderungen hinein interpretieren zu wollen, drängt sich m.E. die Vermutung auf, dass Lilly im Verlauf der Studie ähnliche Erkenntnisse gewonnen hat, wie sie von Noxxon in der Auswertung der Endotoxin-Simulation beschrieben werden, nämlich die körpereigene Hochregulierung von Hepcidin nach erfolgter Initial-Inhibition (s. Punkt d in #119). Das könnte bedeuten, dass der einsetzende "Hepcidin-Sturm" die anfängliche Blockade-Wirkung des mAb mit der Zeit egalisiert hat und damit verpuffen ließ. Für diese Vermutung spricht die nun wöchentliche mAb-Applikation in einer mit 10 mg/kg hoch erscheinenden Dosis und die gezielte Suche nach der MTD.
Außerdem legt die zusätzliche orale Gabe von Eisen in Arm 2 von Teil B nahe, dass die alleinige Hepcidin-Blockierung mit dem mAb nicht den gewünschten Therapie-Effekt einer Anämie-Verbesserung zeigt, zumindest nicht im nötigen Ausmaß, und Lilly daher auch diese Kombination testet.
Nebenbei: Probleme mit einer einsetzenden Target-Hochregulierung nach Inhibition hatte auch der Anti-CCL2-mAb CNTO-888 von Janssen (s. #88), was inzwischen zur Einstellung des Studienprogramms von CNTO-888 bei Krebsindikationen geführt hat. Bekanntlich ist CCL2 das Zielmolekül von NOX-E36.
Fazit: Sowohl die veränderte P1-Studie von Lilly als auch die bisher berichteten Ergebnisse von NOX-H94 (s. #119) lassen eine Menge Spielraum über die Effektivität einer Hepcidin-Blockierung als Therapieansatz bei ACD. Eine Tendenz ist m.E. noch nicht zu erkennen. Allerdings wurden bislang keine Daten aus einer echten Wirksamkeitsstudie veröffentlicht.
Abschließend für alle Interessierten eine Grafik zur Veranschaulichung des Hepcidin-Pathways.
Quelle: http://www.lillyoncologypipeline.com/Pages/hepcidin-antibody… bzw. die dort angegebenen Literaturstellen

Offizielle Noxxon-PM zum ASH-Meeting (vgl. #117-#119): http://www.dewb-vc.de/de/portfolio/newsarchiv/910-06-12-12-z…
Nachdem der P2-Start mit NOX-H94 in der Indikation "ACD bei Myelom/Lymphom-Patienten" offiziell vermeldet wurde (s. #124) und zudem auf der ASH-Konferenz erstmals Daten aus den beiden abgeschlossenen klinischen Studien mit NOX-H94 vorgestellt werden (s. #119), bietet sich ein Blick auf die laufende Lilly-Studie mit dem Anti-Hepcidin-mAb LY2787106 an (s. #74).
P1 von Lilly mit Anti-Hepcidin-mAb: http://clinicaltrials.gov/ct2/show/NCT01340976
Das Studiendesign wurde kürzlich wesentlich verändert, insbesondere:
a) Die Anzahl der vorgesehenen Testpatienten wurde von ursprünglich 99 über 56 auf nun 51 abgespeckt.
b) Das erwartete Studienende verschiebt sich um 1 Jahr nach hinten auf August 2014.
c) Waren nach einer vorangestellten Dosis-Eskalationsgruppe (Teil A) im Teil B der Studie zunächst zwei randomisierte Arme mit verschiedenen Wirkstoff-Dosen ("niedrig" vs. "hoch") vorgesehen, so wird nun in Teil B mit einer festen Dosis von 10 mg/kg und ohne Verblindung getestet. Ein Arm appliziert ausschließlich den Anti-Hepcidin-mAb, der andere Arm zusätzlich "orales Eisen" in Form einer Nahrungsergänzung.
d) Sollte der mAb ursprünglich alle 3 Wochen über 5 Zyklen appliziert werden (Behandlungsdauer also 15 Wochen), so erfolgt die Gabe nach Umstellung des Designs nun alle 7 Tage über einen Zeitraum von (mindestens) acht Wochen.
e) Als zu empfehlende Dosis für weitere Studien wird nun gezielt nach der maximal tolerierten Dosis (MTD) gesucht.
Die Design-Veränderungen sind insofern interessant, als Lilly in dieser P1 bereits ausschließlich Patienten mit verschiedenen Krebserkrankungen untersucht, wenn auch primär unter Aspekten der Sicherheit und Verträglichkeit.
Ohne allzu viel in der Veränderungen hinein interpretieren zu wollen, drängt sich m.E. die Vermutung auf, dass Lilly im Verlauf der Studie ähnliche Erkenntnisse gewonnen hat, wie sie von Noxxon in der Auswertung der Endotoxin-Simulation beschrieben werden, nämlich die körpereigene Hochregulierung von Hepcidin nach erfolgter Initial-Inhibition (s. Punkt d in #119). Das könnte bedeuten, dass der einsetzende "Hepcidin-Sturm" die anfängliche Blockade-Wirkung des mAb mit der Zeit egalisiert hat und damit verpuffen ließ. Für diese Vermutung spricht die nun wöchentliche mAb-Applikation in einer mit 10 mg/kg hoch erscheinenden Dosis und die gezielte Suche nach der MTD.
Außerdem legt die zusätzliche orale Gabe von Eisen in Arm 2 von Teil B nahe, dass die alleinige Hepcidin-Blockierung mit dem mAb nicht den gewünschten Therapie-Effekt einer Anämie-Verbesserung zeigt, zumindest nicht im nötigen Ausmaß, und Lilly daher auch diese Kombination testet.
Nebenbei: Probleme mit einer einsetzenden Target-Hochregulierung nach Inhibition hatte auch der Anti-CCL2-mAb CNTO-888 von Janssen (s. #88), was inzwischen zur Einstellung des Studienprogramms von CNTO-888 bei Krebsindikationen geführt hat. Bekanntlich ist CCL2 das Zielmolekül von NOX-E36.
Fazit: Sowohl die veränderte P1-Studie von Lilly als auch die bisher berichteten Ergebnisse von NOX-H94 (s. #119) lassen eine Menge Spielraum über die Effektivität einer Hepcidin-Blockierung als Therapieansatz bei ACD. Eine Tendenz ist m.E. noch nicht zu erkennen. Allerdings wurden bislang keine Daten aus einer echten Wirksamkeitsstudie veröffentlicht.
Abschließend für alle Interessierten eine Grafik zur Veranschaulichung des Hepcidin-Pathways.
Quelle: http://www.lillyoncologypipeline.com/Pages/hepcidin-antibody… bzw. die dort angegebenen Literaturstellen

Offizielle Noxxon-PM zum ASH-Meeting (vgl. #117-#119): http://www.dewb-vc.de/de/portfolio/newsarchiv/910-06-12-12-z…
Quelle: DEWB AG Homepage
06.12.12 - Zwei Poster-Präsentationen und zwei Vorträge zu NOXXON-Wirkstoffen auf der ASH (American Society of Hematology) Konferenz 2012
Phase-I-Studien mit anti-Hepcidin Spiegelmer® NOX-H94 Wirkmechanismus des anti-SDF-1/CXCL12 Spiegelmers NOX-A12 bei hämatologischen Krebserkrankungen
Berlin, 06. Dezember 2012 - NOXXON Pharma AG gab die Teilnahme am 54. Jahrestreffen der Amerikanischen Gesellschaft für Hämatologie (ASH) vom 8. bis 11. Dezember in Atlanta, USA bekannt.
Es werden zwei Poster zu den Ergebnissen zweier unabhängiger klinischer Studien der Phase I mit dem Spiegelmer® NOX-H94 präsentiert. Diese adressieren sowohl dessen Sicherheit und Verträglichkeit bei der erstmaligen Anwendung am Menschen als auch sein Potential zur Verhinderung eines entzündungsbedingten Abfalles des Serum-Eisengehaltes in einem humanpharmakologischen Modell für Endotoxämie. NOX‑H94 ist ein Kandidat zur Behandlung der Entzündungsanämie.
Zusätzlich werden zwei Vorträge zum Wirkungsmechanismus des Spiegelmers NOX‑A12 in zwei hämatologischen Krebserkrankungen, chronischer lymphatischer Leukämie (CLL) und multiplem Myelom (MM), gehalten, welche in innovativen präklinischen Modellen untersucht wurden.
Die Titel und die Autoren der beiden NOX-H94 Poster-Präsentationen lauten:
•Sonntag, 9. Dezember, 18-20 Uhr; Halle B1-B2; Session 504; Publikationsnummer 2342 Single and Repeated Dose First-in-Human Study with the Anti-Hepcidin Spiegelmer® NOX‑H94 Kai Riecke, Stefan Zöllner, Malcolm Boyce, Stéphanie Vauléon, Dorine W. Swinkels, Thomas Dümmler, Luciana Summo, Coby Laarakkers, Frank Schwoebel, Frank Fliegert
•Montag, 10. Dezember, 18 – 20 Uhr; Halle B1-B2; Session 504; Publikationsnummer 3452 Randomized Double Blind Placebo Controlled PK/PD Study on the Effects of a Single Intravenous Dose of the Anti-Hepcidin Spiegelmer® NOX‑H94 on Serum Iron during Experimental Human Endotoxemia Lucas van Eijk, Dorine W. Swinkels, John Aaron, Frank Schwoebel, Frank Fliegert, Luciana Summo, Stéphanie Vauléon, Coby Laarakkers, Kai Riecke, Peter Pickkers
Die Titel und die Autoren der beiden NOX-A12 Vorträge lauten:
•Montag, 10. Dezember, 8.15 Uhr; Raum B216-217; Session 641; Publikationsnummer 318 Mode of Action of the SDF-1/CXCL12 Inhibiting Spiegelmer® NOX‑A12 and its Impact on Chronic Lymphocytic Leukemia (CLL) Cell Motility and Chemosensitization Dirk Zboralski,Julia Hoellenriegel, Christian Maasch, Anna Kruschinski, Jan A. Burger
•Montag, 10. Dezember, 10.45 Uhr; Thomas Murphy Festsaal 1; Session 651; Publikationsnummer 440 In Vivo Targeting of Stromal-Derived Factor-1 as a Strategy to Prevent Myeloma Cell Dissemination to Distant Bone Marrow Niches Aldo M. Roccaro, Antonio Sacco, Marco Ungari, Patricia Maiso, Salomon Manier, Phong Quang, Yosra Aljaway, Dirk Zboralski, Anna Kruschinski, Fabio Facchetti, Giuseppe Rossi, Irene M. Ghobrial
Mitglieder des Arzneimittelentwicklungsteams von NOXXON und Kollaborationspartner werden an der ASH-Konferenz teilnehmen und den Wirkungsmechanismus sowie das klinische Potenzial dieser innovativen Arzneimittelkandidaten erläutern.
Über NOX-H94 & Anämie bei chronischen Erkrankungen
NOX-H94 ist ein Spiegelmer®-Wirkstoff, der das eisenregulierende Protein Hepcidin bindet. Hepcidin ist der körpereigene Hauptregulator der Eisenhomöostase und wirkt über seine Bindung an Ferroportin, dem einzigen bekannten Eisen-Export-Protein, das sich auf eisenspeichernden Zellen, wie z.B. Makrophagen, befindet. Die Entzündungs-induzierte Synthese von Hepcidin spielt eine entscheidende Rolle bei der Eisenretention in Makrophagen, wodurch die sogenannte Entzündungsanämie entsteht, da nicht genug Eisen bei der Bildung der roter Blutkörperchen zur Verfügung steht. Patienten mit Entzündungsanämien zeigen auch eine gestörte Reaktion auf Erythropoietin (EPO). Der Wirkstoff NOX-H94 ist ein l-RNA-Oligonukleotid, konjugiert mit 40 kDa PEG (Polyethylenglykol). Präklinische Studien haben gezeigt, dass dieser Wirkstoff IL-6-induzierte Anämien verhindert und eine ähnliche Pharmakokinetik wie andere Spiegelmere hat. Der Wirkstoff kann intravenös oder subkutan verabreicht werden.
In klinischen Studien der Phase I hat sich NOX-H94 als sicher und gut verträglich erwiesen und konnte in einem humanpharmakologischen Modell im Vergleich zu Placebo einen durch Endotoxingabe ausgelösten Abfall des Serumeisens verhindern. Diese Endotoxinämie-Studie lieferte damit einen ersten klinischen Hinweis, dass NOX-H94 auch im Menschen in der Lage ist, erhöhte Hepcidinspiegel zu neutralisieren und höhere Serum-Eisenkonzentrationen aufrecht zu erhalten.
Über das Programm „KMU-innovativ“ des Bundesministeriums für Bildung und Forschung (BMBF) erhielt NOXXON Fördermittel für die präklinische und frühe klinische Phase der Studien mit NOX-H94.
Weitere Informationen über die aktuelle Phase IIa-Studie von NOX-H94 finden Sie auf ClinicalTrials.gov: ID: NCT01691040.
Über NOX-A12
NOX-A12 ist ein spezifischer Inhibitor des CXCL12/SDF-1 (CXC-Motiv-Chemokin 12 / Stromal Cell-Derived Factor-1), einem Chemokin, das Immun- und Nicht-Immunzellen sowie Stammzellen aus dem Knochenmark anlockt (Chemotaxis) und aktiviert. CXCL12 bindet mit hoher Affinität an die zwei Chemokinrezeptoren CXCR4 und CXCR7. Die Interaktion zwischen CXCL12, CXCR4 und CXCR7 spielt bei der Mobilisierung von Stammzellen, Vaskulogenese, Tumorwachstum und Metastasierung eine Rolle. Die Hemmung der CXCL12-Bindung an seine Rezeptoren sensibilisiert Tumorzellen für die Chemotherapie und verhindert bei manchen soliden Tumoren deren Invasivität und Metastasierung, was nahe legt, dass NOX-A12 in Kombination mit Chemotherapie bei der Behandlung verschiedener Krebsarten hilfreich sein könnte.
NOX-A12 zeigte auch eine vielversprechende Wirksamkeit in Modellen von hämatologischen und soliden Tumoren sowie bezüglich der Mobilisierung von Stammzellen. Untersuchungen von NOXXONs Kollaborationspartnern haben gezeigt, dass in Modellen des multiplen Myeloms NOX-A12 Myelomzellen von Knochenmarkstromazellen ablöste und sie dahingehend sensibilisierte, dass diese schließlich sowohl in vitro als auch in vivo von Velcade®/Bortezomib abgetötet wurden[1]. NOX-A12 zeigte ebenso, dass es die Chemotaxis der Primärzellen von CLL-Patienten in Richtung höherer CXCL12-Konzentrationen hemmt und dass es unterschiedliche Eigenschaften im Vergleich zu einem CXCR4-Antagonisten besitzt[2]. NOX-A12 konnte in einem Glioblastom-Tiermodell eine signifikant höhere Lebenserwartung der Tiere erzielen, wenn es in Kombinationsbehandlung mit einer Strahlentherapie verabreicht wurde[3].
In Phase I-Studien mit gesunden Probanden waren Einzeldosen von NOX-A12 bis zu 10,8 mg/kg, und Tagesdosen von bis zu 2 mg/kg über fünf Tage sicher und gut verträglich. Wie bereits zuvor in präklinischen Studien konnte auch im Menschen eine dosisabhängige Mobilisierung weißer Blutkörperchen und CD34-positiver hämatopoetischer Stammzellen gezeigt werden.
Über das Programm „KMU-innovativ“ des Bundesministeriums für Bildung und Forschung (BMBF) erhielt NOXXON Fördermittel für das präklinische Studienprogramm und Phase I-Studien mit NOX-A12.
Weitere Informationen über die aktuelle Phase IIa-Studie von NOX-A12 finden Sie auf ClinicalTrials.gov: MM-Rezidiv (ID: NCT01521533) und CLL-Rezidiv (ID: NCT01486797).
--------------------------------------------------------------------------------
[1] Roccaro AM (2011) ASH 53rd Annual Meeting, Vortrag 887, Session 652
[2] Hoellenriegel J (2011) ASH 53rd Annual Meeting, Poster 3878, Session 652
[3] C. Liu (2012) AACR, 3. April 2012 (Abstract # 4382)
06.12.12 - Zwei Poster-Präsentationen und zwei Vorträge zu NOXXON-Wirkstoffen auf der ASH (American Society of Hematology) Konferenz 2012
Phase-I-Studien mit anti-Hepcidin Spiegelmer® NOX-H94 Wirkmechanismus des anti-SDF-1/CXCL12 Spiegelmers NOX-A12 bei hämatologischen Krebserkrankungen
Berlin, 06. Dezember 2012 - NOXXON Pharma AG gab die Teilnahme am 54. Jahrestreffen der Amerikanischen Gesellschaft für Hämatologie (ASH) vom 8. bis 11. Dezember in Atlanta, USA bekannt.
Es werden zwei Poster zu den Ergebnissen zweier unabhängiger klinischer Studien der Phase I mit dem Spiegelmer® NOX-H94 präsentiert. Diese adressieren sowohl dessen Sicherheit und Verträglichkeit bei der erstmaligen Anwendung am Menschen als auch sein Potential zur Verhinderung eines entzündungsbedingten Abfalles des Serum-Eisengehaltes in einem humanpharmakologischen Modell für Endotoxämie. NOX‑H94 ist ein Kandidat zur Behandlung der Entzündungsanämie.
Zusätzlich werden zwei Vorträge zum Wirkungsmechanismus des Spiegelmers NOX‑A12 in zwei hämatologischen Krebserkrankungen, chronischer lymphatischer Leukämie (CLL) und multiplem Myelom (MM), gehalten, welche in innovativen präklinischen Modellen untersucht wurden.
Die Titel und die Autoren der beiden NOX-H94 Poster-Präsentationen lauten:
•Sonntag, 9. Dezember, 18-20 Uhr; Halle B1-B2; Session 504; Publikationsnummer 2342 Single and Repeated Dose First-in-Human Study with the Anti-Hepcidin Spiegelmer® NOX‑H94 Kai Riecke, Stefan Zöllner, Malcolm Boyce, Stéphanie Vauléon, Dorine W. Swinkels, Thomas Dümmler, Luciana Summo, Coby Laarakkers, Frank Schwoebel, Frank Fliegert
•Montag, 10. Dezember, 18 – 20 Uhr; Halle B1-B2; Session 504; Publikationsnummer 3452 Randomized Double Blind Placebo Controlled PK/PD Study on the Effects of a Single Intravenous Dose of the Anti-Hepcidin Spiegelmer® NOX‑H94 on Serum Iron during Experimental Human Endotoxemia Lucas van Eijk, Dorine W. Swinkels, John Aaron, Frank Schwoebel, Frank Fliegert, Luciana Summo, Stéphanie Vauléon, Coby Laarakkers, Kai Riecke, Peter Pickkers
Die Titel und die Autoren der beiden NOX-A12 Vorträge lauten:
•Montag, 10. Dezember, 8.15 Uhr; Raum B216-217; Session 641; Publikationsnummer 318 Mode of Action of the SDF-1/CXCL12 Inhibiting Spiegelmer® NOX‑A12 and its Impact on Chronic Lymphocytic Leukemia (CLL) Cell Motility and Chemosensitization Dirk Zboralski,Julia Hoellenriegel, Christian Maasch, Anna Kruschinski, Jan A. Burger
•Montag, 10. Dezember, 10.45 Uhr; Thomas Murphy Festsaal 1; Session 651; Publikationsnummer 440 In Vivo Targeting of Stromal-Derived Factor-1 as a Strategy to Prevent Myeloma Cell Dissemination to Distant Bone Marrow Niches Aldo M. Roccaro, Antonio Sacco, Marco Ungari, Patricia Maiso, Salomon Manier, Phong Quang, Yosra Aljaway, Dirk Zboralski, Anna Kruschinski, Fabio Facchetti, Giuseppe Rossi, Irene M. Ghobrial
Mitglieder des Arzneimittelentwicklungsteams von NOXXON und Kollaborationspartner werden an der ASH-Konferenz teilnehmen und den Wirkungsmechanismus sowie das klinische Potenzial dieser innovativen Arzneimittelkandidaten erläutern.
Über NOX-H94 & Anämie bei chronischen Erkrankungen
NOX-H94 ist ein Spiegelmer®-Wirkstoff, der das eisenregulierende Protein Hepcidin bindet. Hepcidin ist der körpereigene Hauptregulator der Eisenhomöostase und wirkt über seine Bindung an Ferroportin, dem einzigen bekannten Eisen-Export-Protein, das sich auf eisenspeichernden Zellen, wie z.B. Makrophagen, befindet. Die Entzündungs-induzierte Synthese von Hepcidin spielt eine entscheidende Rolle bei der Eisenretention in Makrophagen, wodurch die sogenannte Entzündungsanämie entsteht, da nicht genug Eisen bei der Bildung der roter Blutkörperchen zur Verfügung steht. Patienten mit Entzündungsanämien zeigen auch eine gestörte Reaktion auf Erythropoietin (EPO). Der Wirkstoff NOX-H94 ist ein l-RNA-Oligonukleotid, konjugiert mit 40 kDa PEG (Polyethylenglykol). Präklinische Studien haben gezeigt, dass dieser Wirkstoff IL-6-induzierte Anämien verhindert und eine ähnliche Pharmakokinetik wie andere Spiegelmere hat. Der Wirkstoff kann intravenös oder subkutan verabreicht werden.
In klinischen Studien der Phase I hat sich NOX-H94 als sicher und gut verträglich erwiesen und konnte in einem humanpharmakologischen Modell im Vergleich zu Placebo einen durch Endotoxingabe ausgelösten Abfall des Serumeisens verhindern. Diese Endotoxinämie-Studie lieferte damit einen ersten klinischen Hinweis, dass NOX-H94 auch im Menschen in der Lage ist, erhöhte Hepcidinspiegel zu neutralisieren und höhere Serum-Eisenkonzentrationen aufrecht zu erhalten.
Über das Programm „KMU-innovativ“ des Bundesministeriums für Bildung und Forschung (BMBF) erhielt NOXXON Fördermittel für die präklinische und frühe klinische Phase der Studien mit NOX-H94.
Weitere Informationen über die aktuelle Phase IIa-Studie von NOX-H94 finden Sie auf ClinicalTrials.gov: ID: NCT01691040.
Über NOX-A12
NOX-A12 ist ein spezifischer Inhibitor des CXCL12/SDF-1 (CXC-Motiv-Chemokin 12 / Stromal Cell-Derived Factor-1), einem Chemokin, das Immun- und Nicht-Immunzellen sowie Stammzellen aus dem Knochenmark anlockt (Chemotaxis) und aktiviert. CXCL12 bindet mit hoher Affinität an die zwei Chemokinrezeptoren CXCR4 und CXCR7. Die Interaktion zwischen CXCL12, CXCR4 und CXCR7 spielt bei der Mobilisierung von Stammzellen, Vaskulogenese, Tumorwachstum und Metastasierung eine Rolle. Die Hemmung der CXCL12-Bindung an seine Rezeptoren sensibilisiert Tumorzellen für die Chemotherapie und verhindert bei manchen soliden Tumoren deren Invasivität und Metastasierung, was nahe legt, dass NOX-A12 in Kombination mit Chemotherapie bei der Behandlung verschiedener Krebsarten hilfreich sein könnte.
NOX-A12 zeigte auch eine vielversprechende Wirksamkeit in Modellen von hämatologischen und soliden Tumoren sowie bezüglich der Mobilisierung von Stammzellen. Untersuchungen von NOXXONs Kollaborationspartnern haben gezeigt, dass in Modellen des multiplen Myeloms NOX-A12 Myelomzellen von Knochenmarkstromazellen ablöste und sie dahingehend sensibilisierte, dass diese schließlich sowohl in vitro als auch in vivo von Velcade®/Bortezomib abgetötet wurden[1]. NOX-A12 zeigte ebenso, dass es die Chemotaxis der Primärzellen von CLL-Patienten in Richtung höherer CXCL12-Konzentrationen hemmt und dass es unterschiedliche Eigenschaften im Vergleich zu einem CXCR4-Antagonisten besitzt[2]. NOX-A12 konnte in einem Glioblastom-Tiermodell eine signifikant höhere Lebenserwartung der Tiere erzielen, wenn es in Kombinationsbehandlung mit einer Strahlentherapie verabreicht wurde[3].
In Phase I-Studien mit gesunden Probanden waren Einzeldosen von NOX-A12 bis zu 10,8 mg/kg, und Tagesdosen von bis zu 2 mg/kg über fünf Tage sicher und gut verträglich. Wie bereits zuvor in präklinischen Studien konnte auch im Menschen eine dosisabhängige Mobilisierung weißer Blutkörperchen und CD34-positiver hämatopoetischer Stammzellen gezeigt werden.
Über das Programm „KMU-innovativ“ des Bundesministeriums für Bildung und Forschung (BMBF) erhielt NOXXON Fördermittel für das präklinische Studienprogramm und Phase I-Studien mit NOX-A12.
Weitere Informationen über die aktuelle Phase IIa-Studie von NOX-A12 finden Sie auf ClinicalTrials.gov: MM-Rezidiv (ID: NCT01521533) und CLL-Rezidiv (ID: NCT01486797).
--------------------------------------------------------------------------------
[1] Roccaro AM (2011) ASH 53rd Annual Meeting, Vortrag 887, Session 652
[2] Hoellenriegel J (2011) ASH 53rd Annual Meeting, Poster 3878, Session 652
[3] C. Liu (2012) AACR, 3. April 2012 (Abstract # 4382)
Quelle: Bundesanzeiger
NOX-E36: Der Studienabschluss ist für Mitte 2013 geplant.
NOX-A12: Es ist geplant, die Behandlung der letzten Patienten in der ersten Jahreshälfte 2013 abzuschließen.
5.3 Prognosebericht
Die Zielsetzung für 2012 und 2013 ist es, in Phase II - Studien Wirksamkeitsnachweise von Spiegelmer® -Kandidaten im Menschen zu erbringen. Für das Geschäftsjahr 2012 ist geplant, dass für drei Spiegelmere® Phase II - Studien in insgesamt vier Indikationen durchgeführt werden. Darüber hinaus werden signifikante Einnahmen aus einer Partnerschaft mit einem größeren Pharmaunternehmen, dessen strategisches Interesse den ausgewählten Molekülen gilt, angestrebt.
NOXXON plant für das Geschäftsjahr 2012 weiterhin signifikante Aufwendungen in Forschung und Entwicklung, die maßgeblich zu dem prognostizierten Verlust in Höhe von ca. € 16,7 Mio. führen. Für das darauffolgende Geschäftsjahr 2013 geht die Gesellschaft von einem Verlust in Höhe von ca. € 12,3 Mio. aus. In den nächsten Jahren sind Investitionen in einem mit den Vorjahren vergleichbaren Volumen vorgesehen. Die Finanzierung erfolgt weitestgehend über Eigenkapital sowie über Investitionszuschüsse und -zulagen.
Mit den Mittelzuflüssen aus der Finanzierungsrunde 2010 ist die Finanzierung des Geschäftsbetriebes bis Ende des ersten Quartals 2013 gesichert. Die Finanzierung der Gesellschaft darüber hinaus erfordert weitere Mittelzuflüsse durch Eigenkapital bzw. Einnahmen aus den Business Development Aktivitäten.
NOX-E36: Der Studienabschluss ist für Mitte 2013 geplant.
NOX-A12: Es ist geplant, die Behandlung der letzten Patienten in der ersten Jahreshälfte 2013 abzuschließen.
5.3 Prognosebericht
Die Zielsetzung für 2012 und 2013 ist es, in Phase II - Studien Wirksamkeitsnachweise von Spiegelmer® -Kandidaten im Menschen zu erbringen. Für das Geschäftsjahr 2012 ist geplant, dass für drei Spiegelmere® Phase II - Studien in insgesamt vier Indikationen durchgeführt werden. Darüber hinaus werden signifikante Einnahmen aus einer Partnerschaft mit einem größeren Pharmaunternehmen, dessen strategisches Interesse den ausgewählten Molekülen gilt, angestrebt.
NOXXON plant für das Geschäftsjahr 2012 weiterhin signifikante Aufwendungen in Forschung und Entwicklung, die maßgeblich zu dem prognostizierten Verlust in Höhe von ca. € 16,7 Mio. führen. Für das darauffolgende Geschäftsjahr 2013 geht die Gesellschaft von einem Verlust in Höhe von ca. € 12,3 Mio. aus. In den nächsten Jahren sind Investitionen in einem mit den Vorjahren vergleichbaren Volumen vorgesehen. Die Finanzierung erfolgt weitestgehend über Eigenkapital sowie über Investitionszuschüsse und -zulagen.
Mit den Mittelzuflüssen aus der Finanzierungsrunde 2010 ist die Finanzierung des Geschäftsbetriebes bis Ende des ersten Quartals 2013 gesichert. Die Finanzierung der Gesellschaft darüber hinaus erfordert weitere Mittelzuflüsse durch Eigenkapital bzw. Einnahmen aus den Business Development Aktivitäten.
Antwort auf Beitrag Nr.: 43.912.374 von dg6nds am 10.12.12 21:50:37Der JA wurde zwei Monate früher veröffentlicht als im vergangenen Jahr. Das könnte mit der anstehenden Finanzierungsrunde zusammen hängen, (neue) Investoren wollen schließlich genau informiert sein. 
Den im Lagebericht prognostizierten Endterminen für die P2-Studien von NOX-E36 und NOX-A12 schenke ich nicht sonderlich viel Vertrauen. Die Angaben sind von Februar 2012, da hatten die Studien noch gar nicht begonnen. Bislang gab es fast immer Verzögerungen. Eine aktuelle Einschätzung wäre mir deutlich lieber, vielleicht Anfang 2013 mit dem DEWB-JA für 2012 oder einer zugänglichen Noxxon-Präsentation.
Ansonsten ist alles im Lot. Der Cashburn liegt bei etwa 15 Mio pro Jahr, angesichts von 3 laufenden P2-Programmen m.E. angemessen. Die entscheidenden Fragen bleiben, welche P2-Daten Noxxon in 2013 vorlegen wird und was Big Pharma davon hält.
Grüße

Den im Lagebericht prognostizierten Endterminen für die P2-Studien von NOX-E36 und NOX-A12 schenke ich nicht sonderlich viel Vertrauen. Die Angaben sind von Februar 2012, da hatten die Studien noch gar nicht begonnen. Bislang gab es fast immer Verzögerungen. Eine aktuelle Einschätzung wäre mir deutlich lieber, vielleicht Anfang 2013 mit dem DEWB-JA für 2012 oder einer zugänglichen Noxxon-Präsentation.
Ansonsten ist alles im Lot. Der Cashburn liegt bei etwa 15 Mio pro Jahr, angesichts von 3 laufenden P2-Programmen m.E. angemessen. Die entscheidenden Fragen bleiben, welche P2-Daten Noxxon in 2013 vorlegen wird und was Big Pharma davon hält.
Grüße
Antwort auf Beitrag Nr.: 43.916.611 von Saaletaler am 11.12.12 18:42:11Hallo Saaletaler,
Ich würde es auch sehr begrüßen, wenn die Jahreshauptversammlung der DEWB AG erst nach der Veröffentlichung der Noxxon Studien stattfindet. Habe auch kein Problem damit wenn die DEWB erst für August oder September den Tag terminiert.
Mir als Aktionär ist es sehr wichtig auf der Grundlage wesentlicher Informationen und Entscheidungen abstimmen zu können um nicht dann noch ein Jahr warten zu müssen. Das sehen hoffentlich andere Aktionäre mit einem Stimmenanteil > 500.000 Euro ähnlich.
Ich würde es auch sehr begrüßen, wenn die Jahreshauptversammlung der DEWB AG erst nach der Veröffentlichung der Noxxon Studien stattfindet. Habe auch kein Problem damit wenn die DEWB erst für August oder September den Tag terminiert.
Mir als Aktionär ist es sehr wichtig auf der Grundlage wesentlicher Informationen und Entscheidungen abstimmen zu können um nicht dann noch ein Jahr warten zu müssen. Das sehen hoffentlich andere Aktionäre mit einem Stimmenanteil > 500.000 Euro ähnlich.
Noxxon lädt zur außerordentlichen Hauptversammlung am 21.01.2013 ein. Noch vermisse ich den TOP zur Kapitalerhöhung gegen Bareinlage. Dieser Beschluss müsste an der HV gefasst werden, sodass die KE Ende Februar eingetragen werden kann. Für das GJ 2013 geht Noxxon von einem Verlust von 12,3 Mio. Euro aus. Bei einer "kleinen KE" sollte diese bei ca. 15-20 Mio. Euro liegen, sodass der Anteil der DEWB daran und unter Berücksichtigung keiner zusätzlichen Verwässerung bei max. 2 Mio. Euro liegen sollte.
Erste interne Wirksamkeitsdaten sollten der Noxxon bis zum Ende diesen Geschäftsjahres vorliegen und auch einen Einfluß auf die KE haben. Sollten sich Altinvestoren eher zurückhalten könnte dies negativ gewertet werden. Ab Ende Januar könnte der Newsflow ansteigen.
Erste interne Wirksamkeitsdaten sollten der Noxxon bis zum Ende diesen Geschäftsjahres vorliegen und auch einen Einfluß auf die KE haben. Sollten sich Altinvestoren eher zurückhalten könnte dies negativ gewertet werden. Ab Ende Januar könnte der Newsflow ansteigen.
Antwort auf Beitrag Nr.: 43.955.229 von dg6nds am 22.12.12 00:40:41Für eine gewöhnliche BZR-KE braucht es m.W. keinen neuen HV-Beschluss. Denn es ist noch genehmigtes Kapital in Höhe von 30.215 Euro vorhanden (s. Eintrag vom 12. Januar 2012 im Unternehmensregister bzw. Noxxon-JA für 2011). Aufgrund der deutlichen Fortschritte in der klinischen Entwicklung sollte m.E. eine Höherbewertung gegenüber der letzten großen Finanzierungsrunde aus 2010 möglich sein.
Grüße
Grüße
!
Dieser Beitrag wurde von m.klemm moderiert. Grund: Drohung/Beleidigung/Provokation
Neuer HV Termin 22.02.2013
Aktuelle Publikationen zu präklinischen Untersuchungen mit NOX-H94 (Indikation: ACI) bzw. NOX-A12 (Indikation: IPAH)
Schwoebel et al. (Blood, 2013): The effects of the anti-hepcidin Spiegelmer NOX H94 on inflammation-induced anemia in cynomolgus monkeys.
http://bloodjournal.hematologylibrary.org/content/early/2013…
Abstract:
Anemia of chronic inflammation is the most prevalent form of anemia in hospitalized patients. A hallmark of this disease is the intracellular sequestration of iron. This is a consequence of hepcidin-induced internalization and subsequent degradation of ferroportin, the hepcidin receptor and only known iron-export protein. This study describes the characterization of the novel anti-hepcidin compound NOX H94, a structured L oligoribonucleotide that binds human hepcidin with high affinity (Kd=0.65±0.06 nmol/L). In J774A.1 macrophages, NOX H94 blocked hepcidin-induced ferroportin degradation and ferritin expression (IC50=19.8±4.6 nmol/L). In an acute cynomolgus monkey model of interleukin 6-induced hypoferremia, NOX H94 inhibited serum iron reduction completely. In a subchronic model of interleukin-6-induced anemia NOX H94 inhibited the decrease in hemoglobin concentration. We conclude that NOX H94 protects ferroportin from hepcidin-induced degradation. Therefore, this pharmacological approach may represent an interesting treatment option for patients suffering from anemia of chronic inflammation.
------------------------------------------------------------------------------------------------
Savai et al. (Am. J. Respir. Crit. Care Med., 2012): Immune and Inflammatory Cell Involvement in the Pathology of Idiopathic Pulmonary Arterial Hypertension.
http://ajrccm.atsjournals.org/content/186/9/897.abstract
Abstract:
Rationale: Pulmonary arterial hypertension (PAH) is characterized by vasoconstriction and vascular remodeling. Recent studies have revealed that immune and inflammatory responses play a crucial role in pathogenesis of idiopathic PAH.
Objectives: To systematically evaluate the number and cross-sectional distribution of inflammatory cells in different sizes of pulmonary arteries from explanted lungs of patients with idiopathic PAH versus healthy donor lungs and to demonstrate functional relevance by blocking stromal-derived factor-1 by the Spiegelmer NOX-A12 in monocrotaline-induced pulmonary hypertension in rats.
Methods: Immunohistochemistry was performed on lung tissue sections from patients with idiopathic PAH and healthy donors. All positively stained cells in whole-lung tissue sections, surrounding the vessels, and in the different compartments of the vessels were counted. To study the effects of blocking SDF-1, rats with monocrotaline-induced pulmonary hypertension were treated with NOX-A12 from Day 21 to Day 35 after monocrotaline administration.
Measurements and Main Results: We found a significant increase of the perivascular number of macrophages (CD68+), macrophages/monocytes (CD14+), mast cells (toluidine blue+), dendritic cells (CD209+), T cells (CD3+), cytotoxic T cells (CD8+), and helper T cells (CD4+) in vessels of idiopathic PAH lungs compared with control subjects. FoxP3+ mononuclear cells were significantly decreased. In the monocrotaline model, the NOX-A12–induced reduction of mast cells, CD68+ macrophages, and CD3+ T cells was associated with improvement of hemodynamics and pulmonary vascular remodeling.
Conclusions: Our findings reveal altered perivascular inflammatory cell infiltration in pulmonary vascular lesions of patients with idiopathic pulmonary arterial hypertension. Targeting attraction of inflammatory cells by blocking stromal-derived factor-1 may be a novel approach for treatment of PAH.
Schwoebel et al. (Blood, 2013): The effects of the anti-hepcidin Spiegelmer NOX H94 on inflammation-induced anemia in cynomolgus monkeys.
http://bloodjournal.hematologylibrary.org/content/early/2013…
Abstract:
Anemia of chronic inflammation is the most prevalent form of anemia in hospitalized patients. A hallmark of this disease is the intracellular sequestration of iron. This is a consequence of hepcidin-induced internalization and subsequent degradation of ferroportin, the hepcidin receptor and only known iron-export protein. This study describes the characterization of the novel anti-hepcidin compound NOX H94, a structured L oligoribonucleotide that binds human hepcidin with high affinity (Kd=0.65±0.06 nmol/L). In J774A.1 macrophages, NOX H94 blocked hepcidin-induced ferroportin degradation and ferritin expression (IC50=19.8±4.6 nmol/L). In an acute cynomolgus monkey model of interleukin 6-induced hypoferremia, NOX H94 inhibited serum iron reduction completely. In a subchronic model of interleukin-6-induced anemia NOX H94 inhibited the decrease in hemoglobin concentration. We conclude that NOX H94 protects ferroportin from hepcidin-induced degradation. Therefore, this pharmacological approach may represent an interesting treatment option for patients suffering from anemia of chronic inflammation.
------------------------------------------------------------------------------------------------
Savai et al. (Am. J. Respir. Crit. Care Med., 2012): Immune and Inflammatory Cell Involvement in the Pathology of Idiopathic Pulmonary Arterial Hypertension.
http://ajrccm.atsjournals.org/content/186/9/897.abstract
Abstract:
Rationale: Pulmonary arterial hypertension (PAH) is characterized by vasoconstriction and vascular remodeling. Recent studies have revealed that immune and inflammatory responses play a crucial role in pathogenesis of idiopathic PAH.
Objectives: To systematically evaluate the number and cross-sectional distribution of inflammatory cells in different sizes of pulmonary arteries from explanted lungs of patients with idiopathic PAH versus healthy donor lungs and to demonstrate functional relevance by blocking stromal-derived factor-1 by the Spiegelmer NOX-A12 in monocrotaline-induced pulmonary hypertension in rats.
Methods: Immunohistochemistry was performed on lung tissue sections from patients with idiopathic PAH and healthy donors. All positively stained cells in whole-lung tissue sections, surrounding the vessels, and in the different compartments of the vessels were counted. To study the effects of blocking SDF-1, rats with monocrotaline-induced pulmonary hypertension were treated with NOX-A12 from Day 21 to Day 35 after monocrotaline administration.
Measurements and Main Results: We found a significant increase of the perivascular number of macrophages (CD68+), macrophages/monocytes (CD14+), mast cells (toluidine blue+), dendritic cells (CD209+), T cells (CD3+), cytotoxic T cells (CD8+), and helper T cells (CD4+) in vessels of idiopathic PAH lungs compared with control subjects. FoxP3+ mononuclear cells were significantly decreased. In the monocrotaline model, the NOX-A12–induced reduction of mast cells, CD68+ macrophages, and CD3+ T cells was associated with improvement of hemodynamics and pulmonary vascular remodeling.
Conclusions: Our findings reveal altered perivascular inflammatory cell infiltration in pulmonary vascular lesions of patients with idiopathic pulmonary arterial hypertension. Targeting attraction of inflammatory cells by blocking stromal-derived factor-1 may be a novel approach for treatment of PAH.
Antwort auf Beitrag Nr.: 44.064.932 von Saaletaler am 25.01.13 15:51:20Aktuelle Publikation zu präklinischen Untersuchungen mit NOX-E36 (Indikation: Leberentzündung/NASH)
Bäck et al. (GUT, 2012): Pharmacological inhibition of the chemokine CCL2 (MCP-1) diminishes liver macrophage infiltration and steatohepatitis in chronic hepatic injury.
http://gut.bmj.com/content/61/3/416.abstract?sid=f3e93aa4-d6…
Abstract:
Objective: Monocyte chemoattractant protein-1 (MCP-1, CCL2), the primary ligand for chemokine receptor C–C chemokine receptor 2 (CCR2), is increased in livers of patients with non-alcoholic steatohepatitis (NASH) and murine models of steatohepatitis and fibrosis. It was recently shown that monocyte/macrophage infiltration into the liver upon injury is critically regulated by the CCL2/CCR2 axis and is functionally important for perpetuating hepatic inflammation and fibrogenesis. The structured L-enantiomeric RNA oligonucleotide mNOX-E36 (a so-called Spiegelmer) potently binds and inhibits murine MCP-1. Pharmacological inhibition of MCP-1 with mNOX-E36 was investigated in two murine models of chronic liver diseases.
Methods: Pharmacological inhibition of MCP-1 by thrice-weekly mNOX-E36 subcutaneously was tested in murine models of acute or chronic carbon tetrachloride (CCl4)- and methionine–choline-deficient (MCD) diet-induced chronic hepatic injury in vivo.
Results: Antagonising MCP-1 by mNOX-E36 efficiently inhibited murine monocyte chemotaxis in vitro as well as migration of Gr1+ (Ly6C+) blood monocytes into the liver upon acute toxic injury in vivo. In murine models of CCl4- and MCD diet-induced hepatic injury, the infiltration of macrophages into the liver was significantly decreased in anti-MCP-1-treated mice as found by fluorescence-activated cell sorting (FACS) analysis and immunohistochemistry. In line with lower levels of intrahepatic macrophages, proinflammatory cytokines (tumour necrosis factor α, interferon γ and interleukin 6) were significantly reduced in liver tissue. Overall fibrosis progression over 6 (CCl4) or 8 weeks (MCD diet) was not significantly altered by anti-MCP-1 treatment. However, upon MCD diet challenge a lower level of fatty liver degeneration (histology score, Oil red O staining, hepatic triglyceride content, lipogenesis genes) was detected in mNOX-E36-treated animals. mNOX-E36 also ameliorated hepatic steatosis upon therapeutic administration.
Conclusions: These results demonstrate the successful pharmacological inhibition of hepatic monocyte/macrophage infiltration by blocking MCP-1 during chronic liver damage in two in vivo models. The associated ameliorated steatosis development suggests that inhibition of MCP-1 is an interesting novel approach for pharmacological treatment in liver inflammation and steatohepatitis.
Bäck et al. (GUT, 2012): Pharmacological inhibition of the chemokine CCL2 (MCP-1) diminishes liver macrophage infiltration and steatohepatitis in chronic hepatic injury.
http://gut.bmj.com/content/61/3/416.abstract?sid=f3e93aa4-d6…
Abstract:
Objective: Monocyte chemoattractant protein-1 (MCP-1, CCL2), the primary ligand for chemokine receptor C–C chemokine receptor 2 (CCR2), is increased in livers of patients with non-alcoholic steatohepatitis (NASH) and murine models of steatohepatitis and fibrosis. It was recently shown that monocyte/macrophage infiltration into the liver upon injury is critically regulated by the CCL2/CCR2 axis and is functionally important for perpetuating hepatic inflammation and fibrogenesis. The structured L-enantiomeric RNA oligonucleotide mNOX-E36 (a so-called Spiegelmer) potently binds and inhibits murine MCP-1. Pharmacological inhibition of MCP-1 with mNOX-E36 was investigated in two murine models of chronic liver diseases.
Methods: Pharmacological inhibition of MCP-1 by thrice-weekly mNOX-E36 subcutaneously was tested in murine models of acute or chronic carbon tetrachloride (CCl4)- and methionine–choline-deficient (MCD) diet-induced chronic hepatic injury in vivo.
Results: Antagonising MCP-1 by mNOX-E36 efficiently inhibited murine monocyte chemotaxis in vitro as well as migration of Gr1+ (Ly6C+) blood monocytes into the liver upon acute toxic injury in vivo. In murine models of CCl4- and MCD diet-induced hepatic injury, the infiltration of macrophages into the liver was significantly decreased in anti-MCP-1-treated mice as found by fluorescence-activated cell sorting (FACS) analysis and immunohistochemistry. In line with lower levels of intrahepatic macrophages, proinflammatory cytokines (tumour necrosis factor α, interferon γ and interleukin 6) were significantly reduced in liver tissue. Overall fibrosis progression over 6 (CCl4) or 8 weeks (MCD diet) was not significantly altered by anti-MCP-1 treatment. However, upon MCD diet challenge a lower level of fatty liver degeneration (histology score, Oil red O staining, hepatic triglyceride content, lipogenesis genes) was detected in mNOX-E36-treated animals. mNOX-E36 also ameliorated hepatic steatosis upon therapeutic administration.
Conclusions: These results demonstrate the successful pharmacological inhibition of hepatic monocyte/macrophage infiltration by blocking MCP-1 during chronic liver damage in two in vivo models. The associated ameliorated steatosis development suggests that inhibition of MCP-1 is an interesting novel approach for pharmacological treatment in liver inflammation and steatohepatitis.
Antwort auf Beitrag Nr.: 44.039.997 von dg6nds am 19.01.13 00:06:30Finanzierungsrunde / aoHV zur Begebung einer WA
Unter unternehmensregister.de wurde am 19. Februar 2013 folgender Eintrag veröffentlicht:
Noxxon Pharma Aktiengesellschaft, Berlin, Max-Dohrn-Str. 8-10, 10589 Berlin. Rechtsform: Durch Beschluss der Hauptversammlung vom 08.02.2013 ist die Satzung geändert § 4 durch Einfügung eines neuen Absatzes 4 (Bedingtes Kapital 2013/I); der bisherige Absatz 4 ist jetzt Absatz 5. Rechtsverhaeltnis: Das Grundkapital der Gesellschaft ist durch Beschluss der Hauptversammlung vom 08.02.2013 um 38.720 EUR bedingt erhöht. (Bedingtes Kapital 2013/I).
Damit ist formal der Weg für die Begebung einer BZR-Wandelanleihe frei, wie sie in der Einladung zur aoHV vom 8. Februar 2013 beschrieben wurde (s. Eintrag unter unternehmensregister.de vom 7. Januar 2013).
Unter unternehmensregister.de wurde am 19. Februar 2013 folgender Eintrag veröffentlicht:
Noxxon Pharma Aktiengesellschaft, Berlin, Max-Dohrn-Str. 8-10, 10589 Berlin. Rechtsform: Durch Beschluss der Hauptversammlung vom 08.02.2013 ist die Satzung geändert § 4 durch Einfügung eines neuen Absatzes 4 (Bedingtes Kapital 2013/I); der bisherige Absatz 4 ist jetzt Absatz 5. Rechtsverhaeltnis: Das Grundkapital der Gesellschaft ist durch Beschluss der Hauptversammlung vom 08.02.2013 um 38.720 EUR bedingt erhöht. (Bedingtes Kapital 2013/I).
Damit ist formal der Weg für die Begebung einer BZR-Wandelanleihe frei, wie sie in der Einladung zur aoHV vom 8. Februar 2013 beschrieben wurde (s. Eintrag unter unternehmensregister.de vom 7. Januar 2013).
Hallo Saaletaler,
danke für den Hinweis. Im Handelsregister habe ich gelesen, dass bereits am 21.01. HV war. Nach der nachfolgenden Meldung dann nochmal am 08.02. und die vom 22.02. gab es gar nicht. Dazu habe ich noch folgende Meldungen gefunden.
------
Noxxon Pharma Aktiengesellschaft, Berlin, Max-Dohrn-Str. 8-10, 10589 Berlin. Rechtsform: Durch Beschluss der Hauptversammlung vom 21.01.12013 ist die Satzung geändert in § 4 Abs. 3 (Bedingtes Kapital 2003/I). Rechtsverhaeltnis: Das am 27.06.2003 beschlossene bedingte Kapital beträgt nach dem Beschluss der Hauptversammlung vom 21.01.2013 noch 17.000 EUR. (Bedingtes Kapital 2003/I).
Dann Änderung weil wohl das Datum falsch eingetragen wurde.
Noxxon Pharma Aktiengesellschaft, Berlin, Max-Dohrn-Str. 8-10, 10589 Berlin. Rechtsform: Die Eintragung betreffend die Änderung des Bedingten Kapitals 2003/I ist von Amts wegen berichtigt und wird wie folgt berichtigt eingetragen:; Durch Beschluss der Hauptversammlung vom 21.01.2013 ist die Satzung geändert in § 4 Abs. 3 (Bedingtes Kapital 2003/I)..
-----
Noxxon Pharma Aktiengesellschaft, Berlin, Max-Dohrn-Str. 8-10, 10589 Berlin. Rechtsform: Durch Beschluss der Hauptversammlung vom 08.02.2013 ist die Satzung geändert § 4 durch Einfügung eines neuen Absatzes 4 (Bedingtes Kapital 2013/I); der bisherige Absatz 4 ist jetzt Absatz 5. Rechtsverhaeltnis: Das Grundkapital der Gesellschaft ist durch Beschluss der Hauptversammlung vom 08.02.2013 um 38.720 EUR bedingt erhöht. (Bedingtes Kapital 2013/I).
danke für den Hinweis. Im Handelsregister habe ich gelesen, dass bereits am 21.01. HV war. Nach der nachfolgenden Meldung dann nochmal am 08.02. und die vom 22.02. gab es gar nicht. Dazu habe ich noch folgende Meldungen gefunden.
------
Noxxon Pharma Aktiengesellschaft, Berlin, Max-Dohrn-Str. 8-10, 10589 Berlin. Rechtsform: Durch Beschluss der Hauptversammlung vom 21.01.12013 ist die Satzung geändert in § 4 Abs. 3 (Bedingtes Kapital 2003/I). Rechtsverhaeltnis: Das am 27.06.2003 beschlossene bedingte Kapital beträgt nach dem Beschluss der Hauptversammlung vom 21.01.2013 noch 17.000 EUR. (Bedingtes Kapital 2003/I).
Dann Änderung weil wohl das Datum falsch eingetragen wurde.
Noxxon Pharma Aktiengesellschaft, Berlin, Max-Dohrn-Str. 8-10, 10589 Berlin. Rechtsform: Die Eintragung betreffend die Änderung des Bedingten Kapitals 2003/I ist von Amts wegen berichtigt und wird wie folgt berichtigt eingetragen:; Durch Beschluss der Hauptversammlung vom 21.01.2013 ist die Satzung geändert in § 4 Abs. 3 (Bedingtes Kapital 2003/I)..
-----
Noxxon Pharma Aktiengesellschaft, Berlin, Max-Dohrn-Str. 8-10, 10589 Berlin. Rechtsform: Durch Beschluss der Hauptversammlung vom 08.02.2013 ist die Satzung geändert § 4 durch Einfügung eines neuen Absatzes 4 (Bedingtes Kapital 2013/I); der bisherige Absatz 4 ist jetzt Absatz 5. Rechtsverhaeltnis: Das Grundkapital der Gesellschaft ist durch Beschluss der Hauptversammlung vom 08.02.2013 um 38.720 EUR bedingt erhöht. (Bedingtes Kapital 2013/I).
Hallo,
ich bin in solchen Dingen nicht sehr bewandert, aber vermutlich ist die spannende Frage jetzt erst einmal, zu welchen Konditionen die Wandelanleihe herausgegeben wird und an wen, oder?
momos
ich bin in solchen Dingen nicht sehr bewandert, aber vermutlich ist die spannende Frage jetzt erst einmal, zu welchen Konditionen die Wandelanleihe herausgegeben wird und an wen, oder?
momos
Hallo,
nach den Einträgen im Handelsregister besteht für die Gesellschaft nun formal auch die Möglichkeit eine entsprechende Anleihe zu begeben. Wann, in welcher Höhe und wie sich die unterschiedlichen Eigentümer daran beteiligen ist nicht bekannt. Hier müssen wir auf eine entsprechende Mitteilung warten.
nach den Einträgen im Handelsregister besteht für die Gesellschaft nun formal auch die Möglichkeit eine entsprechende Anleihe zu begeben. Wann, in welcher Höhe und wie sich die unterschiedlichen Eigentümer daran beteiligen ist nicht bekannt. Hier müssen wir auf eine entsprechende Mitteilung warten.
Gemäß dem HV Protokoll sind alle Tagesordnungspunkte mit 100% Zustimmung angenommen worden. Die Gesellschaft wurde berechtigt eine Wandelanleihe bis zu 13,5 Mio. Euro Nennbetrag zu begeben.
Anwesenheit nach Aktiengattungen:
Stammaktien: 71,39%
Serie A: 96,45%
Serie B: 95,24%
Gesamt: 92,07%
Anwesenheit nach Aktiengattungen:
Stammaktien: 71,39%
Serie A: 96,45%
Serie B: 95,24%
Gesamt: 92,07%
Am 14.02.2013 wude eine neue Patentanmeldung von Noxxon zu SDF-1 veröffentlicht, siehe
http://www.freepatentsonline.com/20130041019.pdf
Am 07.02.2013 wurde eine neue Patentanmeldung zu MCP-1 veröffentlicht, siehe
http://www.freepatentsonline.com/y2013/0035376.html
05.02.2013 Anmeldung mit Status B1
Title:
MCP-1 binding nucleic acids and use thereof
Document Type and Number:
United States Patent 8367629
http://www.freepatentsonline.com/20130041019.pdf
Am 07.02.2013 wurde eine neue Patentanmeldung zu MCP-1 veröffentlicht, siehe
http://www.freepatentsonline.com/y2013/0035376.html
05.02.2013 Anmeldung mit Status B1
Title:
MCP-1 binding nucleic acids and use thereof
Document Type and Number:
United States Patent 8367629
Quelle: Bundesanzeiger
Meldung vom 27.02.2013
Aufforderung zur Ausübung des Bezugsrechts
Die Hauptversammlung der NOXXON Pharma AG, Berlin, hat unter TOP 1 der außerordentlichen Hauptversammlung vom 8. Februar 2013 den Vorstand der NOXXON Pharma AG ermächtigt, mit Zustimmung des Aufsichtsrats Wandelschuldverschreibungen auszugeben.
Auf Grundlage dieser Ermächtigung hat der Vorstand der NOXXON Pharma AG mit Zustimmung des Aufsichtsrats die Begebung von insgesamt bis zu 38.720 Wandelschuldverschreibungen (Wandelschuldverschreibung 2013) zu den Anleihebedingungen der Wandelschuldverschreibung 2013 (Terms and Conditions of Convertible Bonds relating to NOXXON Pharma Aktiengesellschaft, Berlin, dated February 2013) beschlossen.
Hiermit wird die Wandelschuldverschreibung 2013 den Aktionären im folgenden Verhältnis zum Bezug angeboten: Die Aktionäre können für je 7,53 alte Aktien eine Wandelschuldverschreibung zum Ausgabebetrag von EUR 348,65 je Wandelschuldverschreibung beziehen. Die Wandelschuldverschreibungen können innerhalb von 14 Tagen nach der Veröffentlichung dieser Aufforderung im elektronischen Bundesanzeiger zur Ausübung des Bezugsrechts gezeichnet werden. Danach verfällt das gesetzliche Bezugsrecht.
Der Ausgabebetrag ist gemäß den Anleihebedingungen der Wandelschuldverschreibung 2013 (Terms and Conditions of Convertible Bonds relating to NOXXON Pharma Aktiengesellschaft, Berlin, dated February 2013) einzuzahlen.
Zur Vermeidung des Ausschlusses des gesetzlichen Bezugsrechtes fordern wir unsere Aktionäre auf, ihr Bezugsrecht auf die Wandelschuldverschreibungen
innerhalb von 14 Tagen nach der Veröffentlichung dieser Aufforderung zur Ausübung des Bezugsrechts bei der Gesellschaft während der üblichen Geschäftsstunden unter Benutzung der dort erhältlichen Vordrucke für die Zeichnungsscheine durch Erklärung gegenüber der Gesellschaft auszuüben. Zeichnungsscheine und Anleihebedingungen werden den Aktionären auch auf Verlangen durch die Gesellschaft übermittelt. Das Verlangen ist an folgende Anschrift zu richten:
NOXXON Pharma Aktiengesellschaft
z.Hd. Karen Christine Ophoff
Max-Dohrn-Str. 8-10,
10589 Berlin
Telefax: 030 72 62 47 383
E-Mail: kophoff@noxxon.com
Meldung vom 28.02.2013
Bekanntmachung gemäß § 221 Abs. 2 Satz 3 AktG
Die Hauptversammlung der NOXXON Pharma AG, Berlin, vom 8. Februar 2013 hat eine Ermächtigung zur Ausgabe von Wandelschuldverschreibungen im Gesamtnennbetrag von bis zu EUR 13.500.000,00 beschlossen. Der Beschluss der Hauptversammlung ist beim Handelsregister des Amtsgerichts Berlin-Charlottenburg hinterlegt worden.
Berlin, im Februar 2013
Der Vorstand
Der Vorsitzende des Aufsichtsrats
Meldung vom 27.02.2013
Aufforderung zur Ausübung des Bezugsrechts
Die Hauptversammlung der NOXXON Pharma AG, Berlin, hat unter TOP 1 der außerordentlichen Hauptversammlung vom 8. Februar 2013 den Vorstand der NOXXON Pharma AG ermächtigt, mit Zustimmung des Aufsichtsrats Wandelschuldverschreibungen auszugeben.
Auf Grundlage dieser Ermächtigung hat der Vorstand der NOXXON Pharma AG mit Zustimmung des Aufsichtsrats die Begebung von insgesamt bis zu 38.720 Wandelschuldverschreibungen (Wandelschuldverschreibung 2013) zu den Anleihebedingungen der Wandelschuldverschreibung 2013 (Terms and Conditions of Convertible Bonds relating to NOXXON Pharma Aktiengesellschaft, Berlin, dated February 2013) beschlossen.
Hiermit wird die Wandelschuldverschreibung 2013 den Aktionären im folgenden Verhältnis zum Bezug angeboten: Die Aktionäre können für je 7,53 alte Aktien eine Wandelschuldverschreibung zum Ausgabebetrag von EUR 348,65 je Wandelschuldverschreibung beziehen. Die Wandelschuldverschreibungen können innerhalb von 14 Tagen nach der Veröffentlichung dieser Aufforderung im elektronischen Bundesanzeiger zur Ausübung des Bezugsrechts gezeichnet werden. Danach verfällt das gesetzliche Bezugsrecht.
Der Ausgabebetrag ist gemäß den Anleihebedingungen der Wandelschuldverschreibung 2013 (Terms and Conditions of Convertible Bonds relating to NOXXON Pharma Aktiengesellschaft, Berlin, dated February 2013) einzuzahlen.
Zur Vermeidung des Ausschlusses des gesetzlichen Bezugsrechtes fordern wir unsere Aktionäre auf, ihr Bezugsrecht auf die Wandelschuldverschreibungen
innerhalb von 14 Tagen nach der Veröffentlichung dieser Aufforderung zur Ausübung des Bezugsrechts bei der Gesellschaft während der üblichen Geschäftsstunden unter Benutzung der dort erhältlichen Vordrucke für die Zeichnungsscheine durch Erklärung gegenüber der Gesellschaft auszuüben. Zeichnungsscheine und Anleihebedingungen werden den Aktionären auch auf Verlangen durch die Gesellschaft übermittelt. Das Verlangen ist an folgende Anschrift zu richten:
NOXXON Pharma Aktiengesellschaft
z.Hd. Karen Christine Ophoff
Max-Dohrn-Str. 8-10,
10589 Berlin
Telefax: 030 72 62 47 383
E-Mail: kophoff@noxxon.com
Meldung vom 28.02.2013
Bekanntmachung gemäß § 221 Abs. 2 Satz 3 AktG
Die Hauptversammlung der NOXXON Pharma AG, Berlin, vom 8. Februar 2013 hat eine Ermächtigung zur Ausgabe von Wandelschuldverschreibungen im Gesamtnennbetrag von bis zu EUR 13.500.000,00 beschlossen. Der Beschluss der Hauptversammlung ist beim Handelsregister des Amtsgerichts Berlin-Charlottenburg hinterlegt worden.
Berlin, im Februar 2013
Der Vorstand
Der Vorsitzende des Aufsichtsrats
Antwort auf Beitrag Nr.: 42.649.060 von Saaletaler am 26.01.12 01:22:18Centocor/Janssen-Studien mit anti-CCL2-mAb / Bezug zu NOX-E36
Der Vollständigkeit halber: Janssen hat nun seine Untersuchungen mit CNTO888 auch in der Indikation IPF abgebrochen und damit vermutlich das gesamte Programm mit diesem anti-CCL2-mAb eingestellt (s. Morphosys-GB 2012, S.19). Das kommt wenig überraschend, s. Argumentation in #88.
Die Auswirkungen dessen auf das anti-CCL2-Programm von Noxxon dürften allenfalls darin bestehen, dass eventuell jene Indikationen für NOX-E36 potenziell interessant werden, die Janssen mit CNTO888 adressiert hatte. Spielt allerdings auf absehbare Zeit keine Rolle.
Der Vollständigkeit halber: Janssen hat nun seine Untersuchungen mit CNTO888 auch in der Indikation IPF abgebrochen und damit vermutlich das gesamte Programm mit diesem anti-CCL2-mAb eingestellt (s. Morphosys-GB 2012, S.19). Das kommt wenig überraschend, s. Argumentation in #88.
Die Auswirkungen dessen auf das anti-CCL2-Programm von Noxxon dürften allenfalls darin bestehen, dass eventuell jene Indikationen für NOX-E36 potenziell interessant werden, die Janssen mit CNTO888 adressiert hatte. Spielt allerdings auf absehbare Zeit keine Rolle.
Es gibt weitere Offenlegungen von Patentanmeldungen
C5a binding nucleic acids vom 27.02.2013
http://www.freepatentsonline.com/EP2562256A2.html
Lipid binding nucleic acids vom 27.02.2013
http://www.freepatentsonline.com/EP2561079A1.html
Vasopressing-binding L-nucleic acid vom 26.02.2013
http://www.freepatentsonline.com/8383789.html
Anmerkung: Die Patentanmeldungen und entsprechende Jahresgebühren dürften einen nicht unerheblichen Kostenblock darstellen. Auf der anderen Seite sichert das IP Portfolio die Technologie ab was für einen möglichen Erwerber nicht unwichtig sein dürfte.
C5a binding nucleic acids vom 27.02.2013
http://www.freepatentsonline.com/EP2562256A2.html
Lipid binding nucleic acids vom 27.02.2013
http://www.freepatentsonline.com/EP2561079A1.html
Vasopressing-binding L-nucleic acid vom 26.02.2013
http://www.freepatentsonline.com/8383789.html
Anmerkung: Die Patentanmeldungen und entsprechende Jahresgebühren dürften einen nicht unerheblichen Kostenblock darstellen. Auf der anderen Seite sichert das IP Portfolio die Technologie ab was für einen möglichen Erwerber nicht unwichtig sein dürfte.
Antwort auf Beitrag Nr.: 44.218.344 von dg6nds am 06.03.13 00:02:27Gebührenart Euro
Anmeldegebühr bei elektronischer Anmeldung (inklusive 10 Patentansprüche) 40,00 Euro
- für jeden weiteren Anspruch erhöht sich die Gebühr um 20,00 Euro
Anmeldegebühr bei Anmeldung in Papierform (inklusive 10 Patentansprüche) 60,00 Euro
- für jeden weiteren Anspruch erhöht sich die Gebühr um 30,00 Euro
Rechercheantragsgebühr 250,00 Euro
Prüfungsgebühr nach gestelltem Rechercheantrag 150,00 Euro
Prüfungsgebühr ohne vorherigen Rechercheantrag 350,00 Euro
Jahresgebühr 3. Patentjahr 70,00 Euro
Jahresgebühr 4. Patentjahr 70,00 Euro
Jahresgebühr 5. Patentjahr 90,00 Euro
Jahresgebühr 6. Patentjahr 130,00 Euro
Einspruchsverfahren 200,00 Euro
Die Jahresgebühren verringern sich bei Lizenzbereitschaft nach § 23 Abs. 1 PatG jeweils um die Hälfte.
quelle: http://www.dpma.de/patent/gebuehren/index.html
Die jährlichen Gebühren sind eher Peanuts. Der Patentantwalt dürfte einmalig nochmal mit einem hohen 4-stelligen Betrag zu Buche schlagen.
Anmeldegebühr bei elektronischer Anmeldung (inklusive 10 Patentansprüche) 40,00 Euro
- für jeden weiteren Anspruch erhöht sich die Gebühr um 20,00 Euro
Anmeldegebühr bei Anmeldung in Papierform (inklusive 10 Patentansprüche) 60,00 Euro
- für jeden weiteren Anspruch erhöht sich die Gebühr um 30,00 Euro
Rechercheantragsgebühr 250,00 Euro
Prüfungsgebühr nach gestelltem Rechercheantrag 150,00 Euro
Prüfungsgebühr ohne vorherigen Rechercheantrag 350,00 Euro
Jahresgebühr 3. Patentjahr 70,00 Euro
Jahresgebühr 4. Patentjahr 70,00 Euro
Jahresgebühr 5. Patentjahr 90,00 Euro
Jahresgebühr 6. Patentjahr 130,00 Euro
Einspruchsverfahren 200,00 Euro
Die Jahresgebühren verringern sich bei Lizenzbereitschaft nach § 23 Abs. 1 PatG jeweils um die Hälfte.
quelle: http://www.dpma.de/patent/gebuehren/index.html
Die jährlichen Gebühren sind eher Peanuts. Der Patentantwalt dürfte einmalig nochmal mit einem hohen 4-stelligen Betrag zu Buche schlagen.
Hallo Badesalzig,
die reinen Anmeldegebühren sind wirklich Peanuts. Hier mal mein Wissen zu den Kosten ohne Anspruch auf Vollständigkeit:
Für eine Patentanmeldung dürfte ein niedriger bis mittlerer 4-stelliger Euro Betrag für den Patentanwalt zur Prüfung und Aufbereitung aufzuwenden sein (abhängig vom Umfang der Anmeldung). Das Problem ist jedoch, dass ein Patent ja nicht nur in Deutschland angemeldet werden soll, sondern in verschiedenen Ländern, in ganz Europa oder weltweit. Hier fallen natürlich weitere Anmelde- und vor allem Jahresgebühren an. Je länger die Laufzeit des Patents ist, umso mehr steigert sich die Jahresgebühr, was man auch schön anhand deiner Tabelle sehen kann. Im 15 oder gar 20ten Jahr kostet das richtig Geld und das dann in allen Ländern der Anmeldung.
Weiter benötigt man normalerweise im Ausland eine Kanzlei welche für einen den Schriftverkehr erledigt oder Einsprüche weiterleitet. Die Kosten für "einfache" Sachverhalte können dabei bereits mehrere hundert Euro kosten und das pro Patent bzw. Anmeldung. Aus diesem Grund werden oftmals Patente nur in einem "Schlüsselland" mit großem Markt wie z.B. USA, DE, Japan und nicht als Patentfamilie angemeldet.
die reinen Anmeldegebühren sind wirklich Peanuts. Hier mal mein Wissen zu den Kosten ohne Anspruch auf Vollständigkeit:
Für eine Patentanmeldung dürfte ein niedriger bis mittlerer 4-stelliger Euro Betrag für den Patentanwalt zur Prüfung und Aufbereitung aufzuwenden sein (abhängig vom Umfang der Anmeldung). Das Problem ist jedoch, dass ein Patent ja nicht nur in Deutschland angemeldet werden soll, sondern in verschiedenen Ländern, in ganz Europa oder weltweit. Hier fallen natürlich weitere Anmelde- und vor allem Jahresgebühren an. Je länger die Laufzeit des Patents ist, umso mehr steigert sich die Jahresgebühr, was man auch schön anhand deiner Tabelle sehen kann. Im 15 oder gar 20ten Jahr kostet das richtig Geld und das dann in allen Ländern der Anmeldung.
Weiter benötigt man normalerweise im Ausland eine Kanzlei welche für einen den Schriftverkehr erledigt oder Einsprüche weiterleitet. Die Kosten für "einfache" Sachverhalte können dabei bereits mehrere hundert Euro kosten und das pro Patent bzw. Anmeldung. Aus diesem Grund werden oftmals Patente nur in einem "Schlüsselland" mit großem Markt wie z.B. USA, DE, Japan und nicht als Patentfamilie angemeldet.
Übersicht zu den P2-Studien von Noxxon (Aktualisierung)
Bei den beiden laufenden PoC-Studien mit NOX-A12 wurden im Protokoll die Abschluss-Termine teilweise nach hinten gesetzt. Die Behandlung der jeweils 9-köpfigen Pilotgruppe müsste so langsam durch sein. Zumindest will Noxxon Mitte Mai erste Daten auf der Tides-Konferenz vorstellen, wie man der Programm-Ankündigung entnehmen kann:
http://www.ibclifesciences.com/TIDES/oligo.xml
grün = Studie läuft; rot = Studie beendet; kursiv = veränderter Eintrag
Bei den beiden laufenden PoC-Studien mit NOX-A12 wurden im Protokoll die Abschluss-Termine teilweise nach hinten gesetzt. Die Behandlung der jeweils 9-köpfigen Pilotgruppe müsste so langsam durch sein. Zumindest will Noxxon Mitte Mai erste Daten auf der Tides-Konferenz vorstellen, wie man der Programm-Ankündigung entnehmen kann:
http://www.ibclifesciences.com/TIDES/oligo.xml
Spiegelmer --------------- NOX-A12 NOX-A12 NOX-A12 --------------- NOX-E36 --------------- NOX-H94 NOX-H94 --------------- | Indikation --------------------------- CLL (Kombi) MM (Kombi) Glioblastom --------------------------- Diabetes+Albuminurie --------------------------- Endotoxin-Simulation ACD bei HL/NHL/MM --------------------------- | Anz. Pers. ------- 33 28 ? ------- 75 ------- 24 48 ------- | Maskierung --------------- offen offen ? --------------- verblindet --------------- verblindet verblindet --------------- | Start ------------- Mär/12 Mär/12 ? ------------- Mär/12 ------------- Jan/12 Sep/12 ------------- | Abschluss Primärziel ------------- Jun/14 Mär/14 ? ------------- Mai/13 ------------- Mär/12 Jul/13 ------------- | Abschluss Studie ------------- Dez/15 Mär/15 ? ------------- Mai/14 ------------- Apr/12 Sep/13 ------------- | Protokoll ------------ Klick Klick ? ------------ Klick ------------ Klick Klick ------------ |
grün = Studie läuft; rot = Studie beendet; kursiv = veränderter Eintrag
The effects of the anti-hepcidin Spiegelmer NOX-H94 on inflammation-induced anemia in cynomolgus monkeys
http://bloodjournal.hematologylibrary.org/content/121/12/231…
Targeting complement component 5a promotes
vascular integrity and limits airway remodeling
http://www.pnas.org/content/early/2013/03/19/1217991110.full…" target="_blank" rel="nofollow ugc noopener">http://www.pnas.org/content/early/2013/03/19/1217991110.full…
Hematopoietic stem and progenitor cell mobilization in mouse and man by a first-in-class mirror-image oligonucleotide inhibitor of CXCL12.
http://www.nature.com/clpt/journal/vaop/naam/pdf/clpt201358a…
Artikel bei Nature (!)
http://bloodjournal.hematologylibrary.org/content/121/12/231…
Targeting complement component 5a promotes
vascular integrity and limits airway remodeling
http://www.pnas.org/content/early/2013/03/19/1217991110.full…" target="_blank" rel="nofollow ugc noopener">http://www.pnas.org/content/early/2013/03/19/1217991110.full…
Hematopoietic stem and progenitor cell mobilization in mouse and man by a first-in-class mirror-image oligonucleotide inhibitor of CXCL12.
http://www.nature.com/clpt/journal/vaop/naam/pdf/clpt201358a…
Artikel bei Nature (!)
Die Höhe der WA dürfte damit EUR 6.189.932 betragen
Aufgrund des Cash-Burns dürfte diese Finanzierung für weitere 6 Monate reichen (ca. Oktober 2013). Bei Noxxon kommen wir somit in die heiße Phase.
---
Quelle: Bundesanzeiger
Bekanntmachung gemäß § 221 Abs. 2 Satz 3 AktG
Die Gesellschaft hat aufgrund des Ermächtigungsbeschlusses der Hauptversammlung vom 8. Februar 2013 durch Beschluss des Vorstands vom 12. Februar 2013 mit Zustimmung des Aufsichtsrats vom 18. Februar 2013 bis zu 38.720 Wandelschuldverschreibungen im Nennbetrag von je EUR 348,65 (Gesamtnennbetrag EUR 13.499.728,00) ausgegeben.
Von den bis zu 38.720 ausgegebenen Wandelschuldverschreibungen sind insgesamt 17.754 Wandelschuldverschreibungen gezeichnet worden.
Der Beschluss der Hauptversammlung und die Erklärung über die Ausgabe der Wandelschuldverschreibungen sind beim Handelsregister des Amtsgerichts Berlin-Charlottenburg hinterlegt worden.
Berlin, im April 2013
Der Vorstand
Der Vorsitzende des Aufsichtsrats
Aufgrund des Cash-Burns dürfte diese Finanzierung für weitere 6 Monate reichen (ca. Oktober 2013). Bei Noxxon kommen wir somit in die heiße Phase.
---
Quelle: Bundesanzeiger
Bekanntmachung gemäß § 221 Abs. 2 Satz 3 AktG
Die Gesellschaft hat aufgrund des Ermächtigungsbeschlusses der Hauptversammlung vom 8. Februar 2013 durch Beschluss des Vorstands vom 12. Februar 2013 mit Zustimmung des Aufsichtsrats vom 18. Februar 2013 bis zu 38.720 Wandelschuldverschreibungen im Nennbetrag von je EUR 348,65 (Gesamtnennbetrag EUR 13.499.728,00) ausgegeben.
Von den bis zu 38.720 ausgegebenen Wandelschuldverschreibungen sind insgesamt 17.754 Wandelschuldverschreibungen gezeichnet worden.
Der Beschluss der Hauptversammlung und die Erklärung über die Ausgabe der Wandelschuldverschreibungen sind beim Handelsregister des Amtsgerichts Berlin-Charlottenburg hinterlegt worden.
Berlin, im April 2013
Der Vorstand
Der Vorsitzende des Aufsichtsrats
Wenn der DEWB, aufgrund ihrer Anteilshöhe an Noxxon, auch in gleicher Höhe Zeichnungsrechte der WA zustanden, so könnte die DEWB 4.452 Stück = 1,6 Mio. Euro gezeichnet haben.
Bei der Gesamtzeichnungsquote ist eine Zeichnung über pro rata nicht notwendig (z.B. durch Übernahme fremder Bezugsrechte), um möglicherweise den späteren Anteil an Noxxon zu erhöhen. Hier müsste DEWB nur mehr als 45,9%, der eigenen zustehenden Bezugsrechte ausüben, damit dieser Effekt eintritt.
Eine spätere Verwässerung des Anteils würde nicht eintreten wenn die DEWB Anteile i.H. von 0,71 Mio. Euro gezeichnet hätte. Ich gehe davon aus, dass die Wahrheit irgendwo in der Mitte zwischen 0,7 - 1,6 Mio. Euro liegt. Hier dürfte sowohl das MA-AOP sowie die Ausstattung der möglicherweise zu beziehenden Aktien einen Einfluss gehabt haben.
Bei der Gesamtzeichnungsquote ist eine Zeichnung über pro rata nicht notwendig (z.B. durch Übernahme fremder Bezugsrechte), um möglicherweise den späteren Anteil an Noxxon zu erhöhen. Hier müsste DEWB nur mehr als 45,9%, der eigenen zustehenden Bezugsrechte ausüben, damit dieser Effekt eintritt.
Eine spätere Verwässerung des Anteils würde nicht eintreten wenn die DEWB Anteile i.H. von 0,71 Mio. Euro gezeichnet hätte. Ich gehe davon aus, dass die Wahrheit irgendwo in der Mitte zwischen 0,7 - 1,6 Mio. Euro liegt. Hier dürfte sowohl das MA-AOP sowie die Ausstattung der möglicherweise zu beziehenden Aktien einen Einfluss gehabt haben.
Noxxon lädt zur Hauptversammlung am 17.Mai 2013 ein.
Quelle: Bundesanzeiger
Quelle: Bundesanzeiger
DEWB hat sich mit 3 Mio. Euro deutlich über pro rats an der WA bei Noxxon beteiligt.
Quelle: GB2012
Quelle: GB2012
Antwort auf Beitrag Nr.: 42.655.324 von Saaletaler am 27.01.12 00:29:34Präklinische Pipeline
Aktuelle Publikationen zu S1P-Spiegelmer NOX-S93 bzw. Glucagon-Spiegelmer NOX-G15:
Schneider et al. (Mol Cancer Res, 2013): Bioactive lipids S1P and C1P are pro-metastatic factors in human rhabdomyosarcomas cell lines, and their tissue level increases in response to radio/chemotherapy.
http://www.ncbi.nlm.nih.gov/pubmed/23615526
Vater et al. (J Biol Chem, 2013): A Mixed Mirror-image DNA/RNA Aptamer Inhibits Glucagon and Acutely Improves Glucose Tolerance in Models of Type 1 and Type 2 Diabetes
pdf: http://www.jbc.org/content/early/2013/06/06/jbc.M112.444414.…
---------------------------------------------------------------------------
Auf der Noxxon-Homepage wurde kürzlich Spiegelmer NOX-L41 mit dem Target CGRP und der Indikation Schmerzen/Migräne in die Preclinical Pipeline aufgenommen.
Dabei handelt es sich m.E. mit hoher Wahrscheinlichkeit um das Spiegelmer, das Noxxon 2009 für Eli Lilly zur Behandlung von Migräne entwickelt hatte (s. #24). Details wurden damals nicht bekannt gegeben. Dieses Projekt wurde jedoch bekanntermaßen 2010 abgebrochen. Ich hatte in diesem Kontext ins Spiel gebracht, dass Noxxon die Rechte für dieses Migräne-Spiegelmer zurück erwerben könnte, um es in Eigenregie weiter zu entwickeln bzw. es neu zu verpartnern (s. #95). Das ist offenbar geschehen. Zumindest ist dieses Spiegelmer noch nicht vom Tisch.
Allerdings hat Noxxon inzwischen viel Zeit verloren. Es gibt eine Reihe von Pharmas, die sich an der Entwicklung von CGRP-Blockern versuchen, entweder über den Rezeptor oder mit CGRP als direktem Target. So hat sich Lilly 2010 statt des Spiegelmers für einen anti-GCRP-mAb (LY2951742) entschieden, den man zusammen mit Arteaus Therapeutics entwickelt und der inzwischen Phase 2 erreicht hat.
Arteaus Therapeutics: http://www.arteaus.com/
CGRP: http://de.wikipedia.org/wiki/CGRP
Aktuelle Publikationen zu S1P-Spiegelmer NOX-S93 bzw. Glucagon-Spiegelmer NOX-G15:
Schneider et al. (Mol Cancer Res, 2013): Bioactive lipids S1P and C1P are pro-metastatic factors in human rhabdomyosarcomas cell lines, and their tissue level increases in response to radio/chemotherapy.
http://www.ncbi.nlm.nih.gov/pubmed/23615526
Vater et al. (J Biol Chem, 2013): A Mixed Mirror-image DNA/RNA Aptamer Inhibits Glucagon and Acutely Improves Glucose Tolerance in Models of Type 1 and Type 2 Diabetes
pdf: http://www.jbc.org/content/early/2013/06/06/jbc.M112.444414.…
---------------------------------------------------------------------------
Auf der Noxxon-Homepage wurde kürzlich Spiegelmer NOX-L41 mit dem Target CGRP und der Indikation Schmerzen/Migräne in die Preclinical Pipeline aufgenommen.
Dabei handelt es sich m.E. mit hoher Wahrscheinlichkeit um das Spiegelmer, das Noxxon 2009 für Eli Lilly zur Behandlung von Migräne entwickelt hatte (s. #24). Details wurden damals nicht bekannt gegeben. Dieses Projekt wurde jedoch bekanntermaßen 2010 abgebrochen. Ich hatte in diesem Kontext ins Spiel gebracht, dass Noxxon die Rechte für dieses Migräne-Spiegelmer zurück erwerben könnte, um es in Eigenregie weiter zu entwickeln bzw. es neu zu verpartnern (s. #95). Das ist offenbar geschehen. Zumindest ist dieses Spiegelmer noch nicht vom Tisch.
Allerdings hat Noxxon inzwischen viel Zeit verloren. Es gibt eine Reihe von Pharmas, die sich an der Entwicklung von CGRP-Blockern versuchen, entweder über den Rezeptor oder mit CGRP als direktem Target. So hat sich Lilly 2010 statt des Spiegelmers für einen anti-GCRP-mAb (LY2951742) entschieden, den man zusammen mit Arteaus Therapeutics entwickelt und der inzwischen Phase 2 erreicht hat.
Arteaus Therapeutics: http://www.arteaus.com/
CGRP: http://de.wikipedia.org/wiki/CGRP
Aptamers Market worth $2.1 Billion By 2018
http://www.marketsandmarkets.com/PressReleases/aptamers-tech…
Die Studie zählt Noxxon zu den ein Dutzend Unternehmen umfassenden globalen Keyplayern im stark wachsenden Aptamer-Markt.
http://www.marketsandmarkets.com/PressReleases/aptamers-tech…
Die Studie zählt Noxxon zu den ein Dutzend Unternehmen umfassenden globalen Keyplayern im stark wachsenden Aptamer-Markt.
Neben den DEWB Aktionären schaut auch noch die restliche Welt auf den möglichen Blockbuster-Kandidaten...
Die Studie hat ein "Publishing Date" von Juli 2013 und soll im "Sale" schlappe 4.650 US $ kosten (oder 2.100 Aktien der DEWB :cool . Für das Geld kann man sicherlich einiges erwarten und die Studie wird vermutlich auch nicht unentdeckt bei möglichen Investoren bleiben.
. Für das Geld kann man sicherlich einiges erwarten und die Studie wird vermutlich auch nicht unentdeckt bei möglichen Investoren bleiben.
Quelle: http://www.marketsandmarkets.com/Market-Reports/aptamers-tec…
Die Studie hat ein "Publishing Date" von Juli 2013 und soll im "Sale" schlappe 4.650 US $ kosten (oder 2.100 Aktien der DEWB :cool
 . Für das Geld kann man sicherlich einiges erwarten und die Studie wird vermutlich auch nicht unentdeckt bei möglichen Investoren bleiben.
. Für das Geld kann man sicherlich einiges erwarten und die Studie wird vermutlich auch nicht unentdeckt bei möglichen Investoren bleiben. Quelle: http://www.marketsandmarkets.com/Market-Reports/aptamers-tec…
NOXXON Pharma schließt Patientenrekrutierung für Phase IIa-Studie in diabetischer Nephropathie ab
http://www.dewb-vc.de/de/portfolio/newsarchiv/926-24-07-13-n…
Vielversprechende Interimanalyse der Wirksamkeit von NOX-E36
Berlin, Deutschland - 24. Juli 2013 - NOXXON Pharma gab heute den erfolgreichen Abschluss der Patientenrekrutierung für die klinische Studie der Phase IIa mit NOX-E36 zur Behandlung der diabetischen Nephropathie bekannt. NOX-E36 ist ein Spiegelmer®, das CCL2/MCP-1 (CC Chemokin Ligand 2 bzw. Monocyte Chemoattractant Protein-1) bindet und neutralisiert. CCL2/MCP-1 ist ein pro-inflammatorisches Chemokin, das eine wichtige Rolle bei dem progredienten Verlauf der diabetischen Nephropathie spielt, die wiederum die häufigste Einzelursache für chronisches Nierenversagen und die terminale Niereninsuffizienz darstellt.
Das Ziel dieser randomisierten, doppelblinden, Placebo-kontrollierten Phase IIa-Studie ist es, die Wirksamkeit, Pharmakokinetik, Sicherheit und Verträglichkeit der Behandlung mit NOX-E36 zu bewerten. Die Rekrutierung der angestrebten 75 Patienten mit Typ-2-Diabetes und Albuminurie, die für 12 Wochen zweimal wöchentlich mit subkutanen Dosen von NOX-E36 (50 Patienten) oder Placebo (25 Patienten) behandelt werden, ist nun abgeschlossen. Alle Patienten erhielten darüber hinaus die derzeitigen Standardtherapien zur Behandlung von Bluthochdruck, Hyperglykämie und Dyslipidämie.
Diese Behandlung beinhaltet die stabile Blockade des Renin-Angiotensin-Systems, wofür in randomisierten, kontrollierten Studien nachgewiesen wurde, dass es den Grad des Fortschreitens der diabetischen Nephropathie bei Typ-2-Diabetikern mit Bluthochdruck, erhöhtem Serum-Kreatinin und Albuminurie reduziert.
Die geplante Zwischenanalyse des ersten Drittels der Patienten dieser Phase IIa-Studie, welche die Therapie bereits abgeschlossen haben, hat vielversprechende Ergebnisse geliefert. Die primäre Wirksamkeitsanalyse stützt sich dabei auf Veränderungen der Albuminurie am Ende der Behandlungszeit im Vergleich zum Ausgangswert zu Beginn der Studie, gemessen durch den Albumin-Kreatinin-Quotienten (ACR). Im Verlauf der Studie wird zusätzlich zu den Nierenparametern der Einfluss auf die Blutzuckersituation und auf Entzündungsparameter überprüft. Weitere Analysen der Wirksamkeitsparameter sind nach Abschluss der Behandlung von 51 und 75 Patienten vorgesehen.
Dr. Matthias Baumann, Chief Medical Officer von NOXXON Pharma, kommentiert: "Wir sind sehr zufrieden mit der bisher in dieser Studie gezeigten hervorragenden Sicherheit und Verträglichkeit. Die unlängst beschleunigte Patientenrekrutierung wird die Wirksamkeitsanalyse aller 75 Patienten im Laufe dieses Jahres und die vollständige Auswertung der Studie Anfang 2014 ermöglichen. Wir planen, Zwischenergebnisse in einer der kommenden, großen internationalen wissenschaftlichen Konferenzen zu präsentieren."
http://www.dewb-vc.de/de/portfolio/newsarchiv/926-24-07-13-n…
Vielversprechende Interimanalyse der Wirksamkeit von NOX-E36
Berlin, Deutschland - 24. Juli 2013 - NOXXON Pharma gab heute den erfolgreichen Abschluss der Patientenrekrutierung für die klinische Studie der Phase IIa mit NOX-E36 zur Behandlung der diabetischen Nephropathie bekannt. NOX-E36 ist ein Spiegelmer®, das CCL2/MCP-1 (CC Chemokin Ligand 2 bzw. Monocyte Chemoattractant Protein-1) bindet und neutralisiert. CCL2/MCP-1 ist ein pro-inflammatorisches Chemokin, das eine wichtige Rolle bei dem progredienten Verlauf der diabetischen Nephropathie spielt, die wiederum die häufigste Einzelursache für chronisches Nierenversagen und die terminale Niereninsuffizienz darstellt.
Das Ziel dieser randomisierten, doppelblinden, Placebo-kontrollierten Phase IIa-Studie ist es, die Wirksamkeit, Pharmakokinetik, Sicherheit und Verträglichkeit der Behandlung mit NOX-E36 zu bewerten. Die Rekrutierung der angestrebten 75 Patienten mit Typ-2-Diabetes und Albuminurie, die für 12 Wochen zweimal wöchentlich mit subkutanen Dosen von NOX-E36 (50 Patienten) oder Placebo (25 Patienten) behandelt werden, ist nun abgeschlossen. Alle Patienten erhielten darüber hinaus die derzeitigen Standardtherapien zur Behandlung von Bluthochdruck, Hyperglykämie und Dyslipidämie.
Diese Behandlung beinhaltet die stabile Blockade des Renin-Angiotensin-Systems, wofür in randomisierten, kontrollierten Studien nachgewiesen wurde, dass es den Grad des Fortschreitens der diabetischen Nephropathie bei Typ-2-Diabetikern mit Bluthochdruck, erhöhtem Serum-Kreatinin und Albuminurie reduziert.
Die geplante Zwischenanalyse des ersten Drittels der Patienten dieser Phase IIa-Studie, welche die Therapie bereits abgeschlossen haben, hat vielversprechende Ergebnisse geliefert. Die primäre Wirksamkeitsanalyse stützt sich dabei auf Veränderungen der Albuminurie am Ende der Behandlungszeit im Vergleich zum Ausgangswert zu Beginn der Studie, gemessen durch den Albumin-Kreatinin-Quotienten (ACR). Im Verlauf der Studie wird zusätzlich zu den Nierenparametern der Einfluss auf die Blutzuckersituation und auf Entzündungsparameter überprüft. Weitere Analysen der Wirksamkeitsparameter sind nach Abschluss der Behandlung von 51 und 75 Patienten vorgesehen.
Dr. Matthias Baumann, Chief Medical Officer von NOXXON Pharma, kommentiert: "Wir sind sehr zufrieden mit der bisher in dieser Studie gezeigten hervorragenden Sicherheit und Verträglichkeit. Die unlängst beschleunigte Patientenrekrutierung wird die Wirksamkeitsanalyse aller 75 Patienten im Laufe dieses Jahres und die vollständige Auswertung der Studie Anfang 2014 ermöglichen. Wir planen, Zwischenergebnisse in einer der kommenden, großen internationalen wissenschaftlichen Konferenzen zu präsentieren."
Antwort auf Beitrag Nr.: 45.105.881 von Saaletaler am 24.07.13 15:10:46Die Meldung ist etwas unspezifisch. Mehr war nach den ersten Zwischendaten des ersten Patientendrittels aber wohl nicht zu erwarten, zumal große Konferenzen oft nur unveröffentlichte Daten für Präsentationen akzeptieren.
Erfreulich ist, dass das Ende der Studie greifbar wird und sich mit den vorliegenden Daten die Gespräche/Verhandlungen mit den interessierten Pharmas intensivieren werden (s. #107).
Die folgenden Zahlen aus der heutigen PM von Noxxon zeigen, welch riesigen Markt NOX-E36 adressiert. Entsprechend lukrativ sollte NOX-E36 für potenzielle Partner sein, sofern sich lang anhaltende Wirksamkeit zeigen lässt:
Aufgrund epidemiologischer Daten der International Diabetes Foundation und der amerikanischen Centers for Disease Control schätzt NOXXON die Zahl der Patienten mit diabetischer Nephropathie auf circa 9 Millionen in den USA, 7 Millionen in Europa und 2 Millionen in Japan.
Quelle (pdf): http://www.noxxon.com/downloads/pressrel/2013-07-24_NOXXON_s…
Erfreulich ist, dass das Ende der Studie greifbar wird und sich mit den vorliegenden Daten die Gespräche/Verhandlungen mit den interessierten Pharmas intensivieren werden (s. #107).
Die folgenden Zahlen aus der heutigen PM von Noxxon zeigen, welch riesigen Markt NOX-E36 adressiert. Entsprechend lukrativ sollte NOX-E36 für potenzielle Partner sein, sofern sich lang anhaltende Wirksamkeit zeigen lässt:
Aufgrund epidemiologischer Daten der International Diabetes Foundation und der amerikanischen Centers for Disease Control schätzt NOXXON die Zahl der Patienten mit diabetischer Nephropathie auf circa 9 Millionen in den USA, 7 Millionen in Europa und 2 Millionen in Japan.
Quelle (pdf): http://www.noxxon.com/downloads/pressrel/2013-07-24_NOXXON_s…
Antwort auf Beitrag Nr.: 44.356.185 von dg6nds am 03.04.13 18:16:06Noxxon hat die 2. Tranche der WA emittiert. Wird es die letzte VC-Runde gewesen sein?
Bekanntmachung gemäß § 221 Abs. 2 Satz 3 AktG
Die Gesellschaft hat aufgrund des Ermächtigungsbeschlusses der Hauptversammlung vom 8. Februar 2013, ausgenutzt durch Beschlüsse des Vorstands und des Aufsichtsrats vom 12. Februar 2013 und vom 18. Februar 2013, weitere 17.715 Wandelschuldverschreibungen im Nennbetrag von je EUR 348,65 (Gesamtnennbetrag EUR 6.176.334,75) ausgegeben.
Der Beschluss der Hauptversammlung und die Erklärung über die Ausgabe der Wandelschuldverschreibungen sind beim Handelsregister des Amtsgerichts Berlin-Charlottenburg hinterlegt.
Berlin, im August 2013
Quelle: Bundesanzeiger
Bekanntmachung gemäß § 221 Abs. 2 Satz 3 AktG
Die Gesellschaft hat aufgrund des Ermächtigungsbeschlusses der Hauptversammlung vom 8. Februar 2013, ausgenutzt durch Beschlüsse des Vorstands und des Aufsichtsrats vom 12. Februar 2013 und vom 18. Februar 2013, weitere 17.715 Wandelschuldverschreibungen im Nennbetrag von je EUR 348,65 (Gesamtnennbetrag EUR 6.176.334,75) ausgegeben.
Der Beschluss der Hauptversammlung und die Erklärung über die Ausgabe der Wandelschuldverschreibungen sind beim Handelsregister des Amtsgerichts Berlin-Charlottenburg hinterlegt.
Berlin, im August 2013
Quelle: Bundesanzeiger
Aptamers Market Poise $2.1 Billion by 2018
[171 Slides Report] Aptamers Market categories the global market By Applications - Biosensors , Biomarker Discovery , Therapeutics , Diagnostics, Drug Discovery, by Technology Trends & by Geography.
Dallas, TX -- (SBWIRE) -- 09/13/2013 -- The "Aptamers Market - Technology Trend Analysis By Applications - Therapeutics, Diagnostics, Biosensors, Drug Discovery, Biomarker Discovery, Research Applications with Market Landscape Analysis - Global Forecasts to 2018 " analyzes and studies the major market drivers, restraints, and opportunities in North America, Europe, Asia, and Rest of the World.
Browse 14 market data tables with 29 figures spread through 171 Slides and in-depth TOC of "Aptamers Market - Technology Trend Analysis By Applications - Therapeutics, Diagnostics, Biosensors, Drug Discovery, Biomarker Discovery, Research Applications with Market Landscape Analysis - Global Forecasts to 2018".
http://www.marketsandmarkets.com/Market-Reports/aptamers-tec…
Early buyers will receive 10% customization on this report.
This report studies the global aptamers market, with forecast to 2018.
The global healthcare industry is witnessing a paradigm shift, skewed towards point-of-care diagnostics, cost-effective treatment modalities, and personalized medicine, which not only offers efficient early diagnosis, but also treats serious illnesses in order to reduce the cost and disease burden. Aptamers is one such technology with the potential to revolutionize medical diagnostics and therapeutics in healthcare.
This market research report evaluates the global market of aptamers by geography, applications, and aptamer type. Further, the applications market is divided into six segments, namely, therapeutics, diagnostics, biosensors, drug discovery, biomarker discovery, and research applications. Of the above mentioned application segments, research applications is the largest revenue segment; however, biomarker discovery and diagnostics will be the fastest-growing segment.
The global aptamers market was valued at $200 million in the year 2012. At the end of 2013, the market is expected to be $287 million and is poised to reach approximately $2.1 billion by 2018, growing at a CAGR of 49.24% from 2013 to 2018.
The biomarker discovery, drug discovery and diagnostics segments offer vast opportunities for key players in this market. The launch of the first aptamer drug, Macugen, and the first diagnostic test for testing mycotoxins in grains has acknowledged the potential of aptamers in therapeutics and diagnostics. This scenario is expected to further revolutionize the industry towards massive growth in the next 5 to 10 years.
The global market for aptamers is expected to grow, backed by technological advancements with respect to selection processes and synthesis. The market will experience continuous improvements in aptamer synthesis and its applicability in drug discovery and routine research. The market is witnessing a trend toward development of personalized medicine and point-of-care diagnostic tests. Additionally, the demand for safe and cost-effective drugs for treatment of cancer (which can be fulfilled by aptamer therapeutics), will remarkably fuel market growth. North America is the largest hub for aptamers market, accounting for the largest share, followed by Europe and Asia. North America and Europe are expected to
grow at a steady pace. However, the Asia-Pacific market, particularly India and China, is expected to witness a boost in demand and is poised to register maximum growth over the next five years, owing to the increased purchasing power of patients.
The key players in the aptamers market are AM Biotechnologies, LLC (U.S.), Aptagen, LLC (U.S.), Aptamer Sciences Inc. (South Korea), Aptamer Solutions Ltd (U.K.), Base Pair Biotechnologies (U.S.), Bioapter S.L. (Spain), Integrated Biotechnologies, Inc. (U.S.), NOXXON Pharma AG (Germany), OTC Biotech (U.S.), Regado Biosciences, Inc. (U.S.), Somalogic, Inc. (U.S.), and TriLink BioTechnologies, Inc. (U.S.).
http://www.sbwire.com/press-releases/new-market-study-gliobl…
[171 Slides Report] Aptamers Market categories the global market By Applications - Biosensors , Biomarker Discovery , Therapeutics , Diagnostics, Drug Discovery, by Technology Trends & by Geography.
Dallas, TX -- (SBWIRE) -- 09/13/2013 -- The "Aptamers Market - Technology Trend Analysis By Applications - Therapeutics, Diagnostics, Biosensors, Drug Discovery, Biomarker Discovery, Research Applications with Market Landscape Analysis - Global Forecasts to 2018 " analyzes and studies the major market drivers, restraints, and opportunities in North America, Europe, Asia, and Rest of the World.
Browse 14 market data tables with 29 figures spread through 171 Slides and in-depth TOC of "Aptamers Market - Technology Trend Analysis By Applications - Therapeutics, Diagnostics, Biosensors, Drug Discovery, Biomarker Discovery, Research Applications with Market Landscape Analysis - Global Forecasts to 2018".
http://www.marketsandmarkets.com/Market-Reports/aptamers-tec…
Early buyers will receive 10% customization on this report.
This report studies the global aptamers market, with forecast to 2018.
The global healthcare industry is witnessing a paradigm shift, skewed towards point-of-care diagnostics, cost-effective treatment modalities, and personalized medicine, which not only offers efficient early diagnosis, but also treats serious illnesses in order to reduce the cost and disease burden. Aptamers is one such technology with the potential to revolutionize medical diagnostics and therapeutics in healthcare.
This market research report evaluates the global market of aptamers by geography, applications, and aptamer type. Further, the applications market is divided into six segments, namely, therapeutics, diagnostics, biosensors, drug discovery, biomarker discovery, and research applications. Of the above mentioned application segments, research applications is the largest revenue segment; however, biomarker discovery and diagnostics will be the fastest-growing segment.
The global aptamers market was valued at $200 million in the year 2012. At the end of 2013, the market is expected to be $287 million and is poised to reach approximately $2.1 billion by 2018, growing at a CAGR of 49.24% from 2013 to 2018.
The biomarker discovery, drug discovery and diagnostics segments offer vast opportunities for key players in this market. The launch of the first aptamer drug, Macugen, and the first diagnostic test for testing mycotoxins in grains has acknowledged the potential of aptamers in therapeutics and diagnostics. This scenario is expected to further revolutionize the industry towards massive growth in the next 5 to 10 years.
The global market for aptamers is expected to grow, backed by technological advancements with respect to selection processes and synthesis. The market will experience continuous improvements in aptamer synthesis and its applicability in drug discovery and routine research. The market is witnessing a trend toward development of personalized medicine and point-of-care diagnostic tests. Additionally, the demand for safe and cost-effective drugs for treatment of cancer (which can be fulfilled by aptamer therapeutics), will remarkably fuel market growth. North America is the largest hub for aptamers market, accounting for the largest share, followed by Europe and Asia. North America and Europe are expected to
grow at a steady pace. However, the Asia-Pacific market, particularly India and China, is expected to witness a boost in demand and is poised to register maximum growth over the next five years, owing to the increased purchasing power of patients.
The key players in the aptamers market are AM Biotechnologies, LLC (U.S.), Aptagen, LLC (U.S.), Aptamer Sciences Inc. (South Korea), Aptamer Solutions Ltd (U.K.), Base Pair Biotechnologies (U.S.), Bioapter S.L. (Spain), Integrated Biotechnologies, Inc. (U.S.), NOXXON Pharma AG (Germany), OTC Biotech (U.S.), Regado Biosciences, Inc. (U.S.), Somalogic, Inc. (U.S.), and TriLink BioTechnologies, Inc. (U.S.).
http://www.sbwire.com/press-releases/new-market-study-gliobl…
Antwort auf Beitrag Nr.: 45.603.171 von mondstein81 am 10.10.13 15:11:25Hi!
Wir hatten den Aptamers-Report schon verlinkt bzw. kurz andiskutiert (s. 154 f.). Wäre sicher interessant, darin zu lesen. Ebenso in den regelmäßig erscheinenden Pipeline-Reviews zu diversen Indikationen, da bekommt man einen guten Überblick über die Konkurrenzsituation, was man sich ansonsten mühsam im Internet zusammensuchen muss. Ist halt leider zu teuer.
Über Noxxon steht jedoch m.W. nicht viel mehr drin als das, was Noxxon offiziell publiziert/veröffentlicht hat. Ich habe aber inzwischen einige interessante Neuigkeiten gesammelt, kommt hier in Kürze.
Grüße
Wir hatten den Aptamers-Report schon verlinkt bzw. kurz andiskutiert (s. 154 f.). Wäre sicher interessant, darin zu lesen. Ebenso in den regelmäßig erscheinenden Pipeline-Reviews zu diversen Indikationen, da bekommt man einen guten Überblick über die Konkurrenzsituation, was man sich ansonsten mühsam im Internet zusammensuchen muss. Ist halt leider zu teuer.
Über Noxxon steht jedoch m.W. nicht viel mehr drin als das, was Noxxon offiziell publiziert/veröffentlicht hat. Ich habe aber inzwischen einige interessante Neuigkeiten gesammelt, kommt hier in Kürze.
Grüße
Zwischendaten (Pilotgruppe) der P2a von NOX-A12 bei MM auf dem ASH-Meeting 2013
Studienprotokoll: http://clinicaltrials.gov/ct2/show/NCT01521533
Abstract von Heinz Ludwig et al.: https://ash.confex.com/ash/2013/webprogram/Paper61412.html
Anti-CXCL12/SDF-1 Spiegelmer® Nox-A12 Alone and In Combination With Bortezomib and Dexamethasone In Patients With Relapsed Multiple Myeloma: Results From A Phase IIa Study
Background: NOX-A12 is a novel, potent, L-stereoisomer RNA aptamer (Spiegelmer®) that binds and neutralizes CXCL12/SDF-1, a chemokine which attracts and activates immune- and non-immune cells via interaction with its receptors, CXCR4 and CXCR7. CXCL12 plays an important role in homing and trafficking of multiple myeloma (MM) cells to the bone marrow (BM). Here, we evaluate the capacity of NOX-A12 to mobilize plasma cells into the circulation. Furthermore, we analyze a possible therapeutic impact of NOX-A12 which disrupts the interaction of MM cells with the BM stroma resulting in enhanced chemosensitivity to established therapies such as bortezomib and dexamethasone (VD).
Methods: To date, 21/28 planned patients have been enrolled into a multicenter Phase IIa study of NOX-A12 alone and in combination with VD in relapsed MM patients. Here we report interim data on PK, PD and preliminary efficacy of a pilot group consisting of 3 cohorts of 3 patients each. In the pilot phase, cohorts received single doses of 1, 2 or 4 mg/kg NOX-A12 alone, respectively, two weeks prior to 8 planned cycles of combined treatment with NOX-A12 and VD repeated every 21 days. During combination therapy, NOX-A12 was administered 1-2 hours prior to bortezomib following a dose titration design for all patients: NOX-A12 doses were increased from 1 mg/kg to 2 mg/kg and 4mg/kg at cycles 1, 2 and 3, respectively. During cycles 4-6, doses of NOX-A12 were kept at the highest individually titrated dose. Bortezomib (1.3 mg/m2) was given on days 1, 4, 8 and 11 as intravenous injection. Oral dexamethasone (20 mg) was added on the day of and the day after bortezomib administration. Response was evaluated by applying the uniform response criteria of the IMWG 2011.
Results: In total, 10 patients were enrolled into the pilot group (one patient was replaced after withdrawal of consent). The median age was 63 years (range 56-78) with 7 women and 3 men being included. Median prior therapies were 2 (range 1-5), with 9 patients having been pretreated with dexamethasone and 3 with bortezomib prior to enrollment. At screening 1, 7 and 2 patients presented with ISS stage I, II and III, respectively. IgG, IgA and LC M-components were present in 6, 3 and 1 patients, respectively. Six patients had cytogenetic aberrations, which were high risk (t(4;14) or del17p) in 2 patients. Plasma profiles of NOX-A12 in the patient population of the pilot group (Figure 1) were similar to healthy volunteers in which a plasma half-life of approximately 38 hours was observed. After single doses of NOX-A12, a dose-linear exposure with peak plasma levels of 2.1, 3.9, and 6.7 µM was found in the corresponding cohorts. Furthermore, an increase of plasma cells in peripheral blood by approximately 200% was detected which lasted throughout the observation period of 3 days (Figure 2). NOX-A12 as single agent was safe and very well tolerated.
Of nine evaluable patients who received the combination treatment of NOX-A12 and VD, 2 (22%) achieved a VGPR and 4 (44%) PR, resulting in an ORR (≥ PR) of 67%. In combination with VD, NOX-A12 was equally safe and well tolerated.
Conclusion: Proof of principle was achieved as single doses of NOX-A12 reached the expected plasma exposure and translated into an effective and prolonged mobilization of plasma cells into the peripheral blood. In addition, responses (PR or better) were noted in 6/9 (67%) patients of this pilot group. Single agent NOX-A12 was not associated with any relevant toxicity and the combination of VD with NOX-A12 was well tolerated and not associated with additional toxicity on top of VD. Provided that these promising findings will be confirmed in the total sample of 28 patients, further development of this novel anti-CXCL12/SDF-1 Spiegelmer® seems warranted.
Studienprotokoll: http://clinicaltrials.gov/ct2/show/NCT01521533
Abstract von Heinz Ludwig et al.: https://ash.confex.com/ash/2013/webprogram/Paper61412.html
Anti-CXCL12/SDF-1 Spiegelmer® Nox-A12 Alone and In Combination With Bortezomib and Dexamethasone In Patients With Relapsed Multiple Myeloma: Results From A Phase IIa Study
Background: NOX-A12 is a novel, potent, L-stereoisomer RNA aptamer (Spiegelmer®) that binds and neutralizes CXCL12/SDF-1, a chemokine which attracts and activates immune- and non-immune cells via interaction with its receptors, CXCR4 and CXCR7. CXCL12 plays an important role in homing and trafficking of multiple myeloma (MM) cells to the bone marrow (BM). Here, we evaluate the capacity of NOX-A12 to mobilize plasma cells into the circulation. Furthermore, we analyze a possible therapeutic impact of NOX-A12 which disrupts the interaction of MM cells with the BM stroma resulting in enhanced chemosensitivity to established therapies such as bortezomib and dexamethasone (VD).
Methods: To date, 21/28 planned patients have been enrolled into a multicenter Phase IIa study of NOX-A12 alone and in combination with VD in relapsed MM patients. Here we report interim data on PK, PD and preliminary efficacy of a pilot group consisting of 3 cohorts of 3 patients each. In the pilot phase, cohorts received single doses of 1, 2 or 4 mg/kg NOX-A12 alone, respectively, two weeks prior to 8 planned cycles of combined treatment with NOX-A12 and VD repeated every 21 days. During combination therapy, NOX-A12 was administered 1-2 hours prior to bortezomib following a dose titration design for all patients: NOX-A12 doses were increased from 1 mg/kg to 2 mg/kg and 4mg/kg at cycles 1, 2 and 3, respectively. During cycles 4-6, doses of NOX-A12 were kept at the highest individually titrated dose. Bortezomib (1.3 mg/m2) was given on days 1, 4, 8 and 11 as intravenous injection. Oral dexamethasone (20 mg) was added on the day of and the day after bortezomib administration. Response was evaluated by applying the uniform response criteria of the IMWG 2011.
Results: In total, 10 patients were enrolled into the pilot group (one patient was replaced after withdrawal of consent). The median age was 63 years (range 56-78) with 7 women and 3 men being included. Median prior therapies were 2 (range 1-5), with 9 patients having been pretreated with dexamethasone and 3 with bortezomib prior to enrollment. At screening 1, 7 and 2 patients presented with ISS stage I, II and III, respectively. IgG, IgA and LC M-components were present in 6, 3 and 1 patients, respectively. Six patients had cytogenetic aberrations, which were high risk (t(4;14) or del17p) in 2 patients. Plasma profiles of NOX-A12 in the patient population of the pilot group (Figure 1) were similar to healthy volunteers in which a plasma half-life of approximately 38 hours was observed. After single doses of NOX-A12, a dose-linear exposure with peak plasma levels of 2.1, 3.9, and 6.7 µM was found in the corresponding cohorts. Furthermore, an increase of plasma cells in peripheral blood by approximately 200% was detected which lasted throughout the observation period of 3 days (Figure 2). NOX-A12 as single agent was safe and very well tolerated.
Of nine evaluable patients who received the combination treatment of NOX-A12 and VD, 2 (22%) achieved a VGPR and 4 (44%) PR, resulting in an ORR (≥ PR) of 67%. In combination with VD, NOX-A12 was equally safe and well tolerated.
Conclusion: Proof of principle was achieved as single doses of NOX-A12 reached the expected plasma exposure and translated into an effective and prolonged mobilization of plasma cells into the peripheral blood. In addition, responses (PR or better) were noted in 6/9 (67%) patients of this pilot group. Single agent NOX-A12 was not associated with any relevant toxicity and the combination of VD with NOX-A12 was well tolerated and not associated with additional toxicity on top of VD. Provided that these promising findings will be confirmed in the total sample of 28 patients, further development of this novel anti-CXCL12/SDF-1 Spiegelmer® seems warranted.
Zwischendaten (Pilotgruppe) der P2a von NOX-A12 bei CLL auf dem ASH-Meeting 2013
Studienprotokoll: http://clinicaltrials.gov/ct2/show/NCT01486797
Abstract von Marco Gobbi et al.: https://ash.confex.com/ash/2013/webprogram/Paper61218.html
Anti-CXCL12/SDF-1 Spiegelmer® Nox-A12 Alone and In Combination With Bendamustine and Rituximab In Patients With Relapsed Chronic Lymphocytic Leukemia (CLL): Results From A Phase IIa Study
Background: NOX-A12 is a novel, potent, L-stereoisomer RNA aptamer (Spiegelmer®) that binds and neutralizes CXCL12/SDF-1, a chemokine which attracts and activates immune- and non-immune cells via interaction with its receptors, CXCR4 and CXCR7. The signaling of CXCL12 has been shown to play an important role in the pathophysiology of chronic lymphocytic leukemia (CLL), especially in the interaction of leukemic cells with tissue microenvironment. The therapeutic concept of NOX-A12 is to mobilize these bone marrow- and tissue-resident CLL cells into the blood, thereby removing CLL cells from the nurturing milieu and sensitizing them to cytotoxic drugs such as bendamustine and rituximab (BR).
Methods: To date, 19/33 planned patients have been enrolled into a multicenter Phase IIa study of NOX-A12 alone and in combination with BR in relapsed CLL patients. Here we report interim data on PK, PD and preliminary efficacy of a pilot group consisting of 3 cohorts of 3 patients each. In the pilot phase, cohorts received single doses of 1, 2 or 4 mg/kg NOX-A12 alone, respectively, two weeks prior to 6 cycles of combined treatment of NOX-A12 with BR repeated every 28 days. During combination therapy, NOX-A12 was administered 1-2 hours prior to rituximab following a dose titration design for all patients: NOX-A12 doses were increased from 1 mg/kg to 2 mg/kg and 4mg/kg at cycles 1, 2 and 3, respectively. During cycles 4-6, doses of NOX-A12 were kept at the highest individually titrated dose. Bendamustine (70 - 100 mg/m², according to SPC) was given on day 2 and 3 (cycle 1) or 1 and 2 (cycle 2-6), combined with 375 mg/m2 rituximab on day 1 for the first cycle and 500 mg/m2 for subsequent cycles. Tumor response was assessed according to NCI-WG 1996 criteria (updated by iwCLL 2008).
Results: In total, 10 patients were enrolled in the pilot group (one additional patient was enrolled due to one patients’ under dosing). The median age was 69 years (range 57-77) with 8 women and 2 men being included. Median prior therapies were 2 (range 1-2), whereby all patients were bendamustine naïve and 6 patients had received rituximab treatment prior to enrolment. 2, 4 and 4 patients presented at screening with Binet stage A, B, and C, respectively. 8 patients showed at least 1 cytogenetic aberration at the beginning of treatment. Tumor assessments before enrolment and at end of cycles 3 and 6 were evaluated.
Plasma profiles of NOX-A12 in the patient population of the pilot group (Figure 1) were similar to those of healthy volunteers in which a plasma half-life of approximately 38 h was observed. After single doses of NOX-A12, the exposure was dose-linear with peak plasma concentrations of 1.7, 3.5, and 6.7 µM in the corresponding cohorts. CLL cells in the peripheral blood were found to be increased throughout the observational period of 3 days (Figure 2). In all patients presenting with lymphadenopathy, the lymph node size decreased markedly. NOX-A12 as single agent was safe and very well tolerated.
All patients responded to the combination treatment of NOX-A12 and BR (ORR 100%); one patient had to be withdrawn from treatment due to multiple infections during cycle 4 having achieved a partial response (PR). At the end of cycle 6, seven patients (78%) showed a PR and two patients (22%) achieved a complete remission (CR). In combination with BR, NOX-A12 was equally safe and well tolerated.
Conclusions: Proof of principle was achieved as single doses of NOX-A12 reached the expected plasma exposure which translated into an effective and prolonged mobilization of CLL cells into the peripheral blood. In addition, the 100% ORR and 22% CR as well as the virtual absence of additional toxicity on top of BR observed in this pilot group compares very favorably with historical controls. Provided that this promising clinical picture will be maintained in the total sample of 33 patients, further development of this novel anti-CXCL12/SDF-1 Spiegelmer® seems warranted.
Studienprotokoll: http://clinicaltrials.gov/ct2/show/NCT01486797
Abstract von Marco Gobbi et al.: https://ash.confex.com/ash/2013/webprogram/Paper61218.html
Anti-CXCL12/SDF-1 Spiegelmer® Nox-A12 Alone and In Combination With Bendamustine and Rituximab In Patients With Relapsed Chronic Lymphocytic Leukemia (CLL): Results From A Phase IIa Study
Background: NOX-A12 is a novel, potent, L-stereoisomer RNA aptamer (Spiegelmer®) that binds and neutralizes CXCL12/SDF-1, a chemokine which attracts and activates immune- and non-immune cells via interaction with its receptors, CXCR4 and CXCR7. The signaling of CXCL12 has been shown to play an important role in the pathophysiology of chronic lymphocytic leukemia (CLL), especially in the interaction of leukemic cells with tissue microenvironment. The therapeutic concept of NOX-A12 is to mobilize these bone marrow- and tissue-resident CLL cells into the blood, thereby removing CLL cells from the nurturing milieu and sensitizing them to cytotoxic drugs such as bendamustine and rituximab (BR).
Methods: To date, 19/33 planned patients have been enrolled into a multicenter Phase IIa study of NOX-A12 alone and in combination with BR in relapsed CLL patients. Here we report interim data on PK, PD and preliminary efficacy of a pilot group consisting of 3 cohorts of 3 patients each. In the pilot phase, cohorts received single doses of 1, 2 or 4 mg/kg NOX-A12 alone, respectively, two weeks prior to 6 cycles of combined treatment of NOX-A12 with BR repeated every 28 days. During combination therapy, NOX-A12 was administered 1-2 hours prior to rituximab following a dose titration design for all patients: NOX-A12 doses were increased from 1 mg/kg to 2 mg/kg and 4mg/kg at cycles 1, 2 and 3, respectively. During cycles 4-6, doses of NOX-A12 were kept at the highest individually titrated dose. Bendamustine (70 - 100 mg/m², according to SPC) was given on day 2 and 3 (cycle 1) or 1 and 2 (cycle 2-6), combined with 375 mg/m2 rituximab on day 1 for the first cycle and 500 mg/m2 for subsequent cycles. Tumor response was assessed according to NCI-WG 1996 criteria (updated by iwCLL 2008).
Results: In total, 10 patients were enrolled in the pilot group (one additional patient was enrolled due to one patients’ under dosing). The median age was 69 years (range 57-77) with 8 women and 2 men being included. Median prior therapies were 2 (range 1-2), whereby all patients were bendamustine naïve and 6 patients had received rituximab treatment prior to enrolment. 2, 4 and 4 patients presented at screening with Binet stage A, B, and C, respectively. 8 patients showed at least 1 cytogenetic aberration at the beginning of treatment. Tumor assessments before enrolment and at end of cycles 3 and 6 were evaluated.
Plasma profiles of NOX-A12 in the patient population of the pilot group (Figure 1) were similar to those of healthy volunteers in which a plasma half-life of approximately 38 h was observed. After single doses of NOX-A12, the exposure was dose-linear with peak plasma concentrations of 1.7, 3.5, and 6.7 µM in the corresponding cohorts. CLL cells in the peripheral blood were found to be increased throughout the observational period of 3 days (Figure 2). In all patients presenting with lymphadenopathy, the lymph node size decreased markedly. NOX-A12 as single agent was safe and very well tolerated.
All patients responded to the combination treatment of NOX-A12 and BR (ORR 100%); one patient had to be withdrawn from treatment due to multiple infections during cycle 4 having achieved a partial response (PR). At the end of cycle 6, seven patients (78%) showed a PR and two patients (22%) achieved a complete remission (CR). In combination with BR, NOX-A12 was equally safe and well tolerated.
Conclusions: Proof of principle was achieved as single doses of NOX-A12 reached the expected plasma exposure which translated into an effective and prolonged mobilization of CLL cells into the peripheral blood. In addition, the 100% ORR and 22% CR as well as the virtual absence of additional toxicity on top of BR observed in this pilot group compares very favorably with historical controls. Provided that this promising clinical picture will be maintained in the total sample of 33 patients, further development of this novel anti-CXCL12/SDF-1 Spiegelmer® seems warranted.
Wichtige Meldung heute -> http://www.dewb-vc.com/de/portfolio/newsarchiv/940-09-12-13-…
Gruß Schulzi
Gruß Schulzi
Antwort auf Beitrag Nr.: 46.012.826 von Schulzi64 am 09.12.13 17:30:25Servus Schulzi,
leider ist die heutige Meldung nur ein Abklatsch auf die bereits publizierten ASH-Abstracts. Ich hatte auf ein paar zusätzliche Informationen gehofft. Noxxon gibt aber offenbar nur noch das Allernötigste preis. Insbesondere Präsentationen von Tagungen/Meetings fehlen inzwischen vollständig. Damit wird es immer schwieriger, hier eine Diskussion bzw. den Fortschritt der Studien halbwegs zu begleiten zu führen. Schade!
Neu in der Meldung von heute ist, dass bei NOX-H94 offenbar eine weitere P2a-Studie bei Dialyse-Patienten geplant ist, die nicht hinreichend auf ESA reagieren.
Die 3 klinischen Wirkstoffe haben jetzt "Namen" bekommen. Ich werde aber bei den bisherigen Bezeichnungen bleiben. Das Leben ist schon kompliziert genug.
Grüße,
Saaletaler
leider ist die heutige Meldung nur ein Abklatsch auf die bereits publizierten ASH-Abstracts. Ich hatte auf ein paar zusätzliche Informationen gehofft. Noxxon gibt aber offenbar nur noch das Allernötigste preis. Insbesondere Präsentationen von Tagungen/Meetings fehlen inzwischen vollständig. Damit wird es immer schwieriger, hier eine Diskussion bzw. den Fortschritt der Studien halbwegs zu begleiten zu führen. Schade!
Neu in der Meldung von heute ist, dass bei NOX-H94 offenbar eine weitere P2a-Studie bei Dialyse-Patienten geplant ist, die nicht hinreichend auf ESA reagieren.
Die 3 klinischen Wirkstoffe haben jetzt "Namen" bekommen. Ich werde aber bei den bisherigen Bezeichnungen bleiben. Das Leben ist schon kompliziert genug.

Grüße,
Saaletaler
Danke für die Info, ich sehe das weiterhin positiv.
Die WA müsste jetzt in Aktien von Noxxon gewandelt werden. Ich hoffe, dass hier demnächst weitere News bezüglich der Vergabe von Lizenzen oder Verpartnerungen kommen. Big Pharma geht es im Moment richtig gut, die haben genügend finanzielle Mittel um sich das näher anzusehen.
Die WA müsste jetzt in Aktien von Noxxon gewandelt werden. Ich hoffe, dass hier demnächst weitere News bezüglich der Vergabe von Lizenzen oder Verpartnerungen kommen. Big Pharma geht es im Moment richtig gut, die haben genügend finanzielle Mittel um sich das näher anzusehen.
Konkurrenzsituation bei NOX-A12 (GBM) bzw. NOX-L41 (Migräne)
Apogenix' APG101 zeigt signifikante Verlängerung des Gesamtüberlebens in Biomarker-positiven Patienten in Phase II-Studie zur Zweitlinienbehandlung des Glioblastoms
http://apogenix.de/medien/pressemitteilungen/
Lilly Announces Acquisition of CGRP Antibody for Migraine Prevention from Arteaus Therapeutics
https://investor.lilly.com/releasedetail.cfm?ReleaseID=81878…
Apogenix' APG101 zeigt signifikante Verlängerung des Gesamtüberlebens in Biomarker-positiven Patienten in Phase II-Studie zur Zweitlinienbehandlung des Glioblastoms
http://apogenix.de/medien/pressemitteilungen/
Lilly Announces Acquisition of CGRP Antibody for Migraine Prevention from Arteaus Therapeutics
https://investor.lilly.com/releasedetail.cfm?ReleaseID=81878…
Präsentation auf der JP Morgan Healthcare Conference in San Francisco
http://jpmorgan.metameetings.com/confbook/healthcare14/compa…
Presenting: Tuesday, January 14, 2014 at 02:30 PM
Location: Elizabethan D
Speaker: Iain Buchanan, CEO
NOXXON Pharma AG is a biopharmaceutical company pioneering the development of a new class of proprietary therapeutics called Spiegelmers, which are chemically synthesized L-stereoisomer RNA aptamers and a non-immunogenic alternative to antibodies. NOXXON is approaching completion of multiple proof-of-concept studies with a diversified portfolio of clinical-stage Spiegelmer therapeutics displaying good safety, tolerability and promising signs of efficacy:
• Emapticap pegol (NOX-E36), an anti-CCL2/MCP-1 Spiegelmer, is currently in a Phase IIa study in patients with diabetic nephropathy. Interim data analysis suggests a positive influence on albuminuria and glycemic control.
• Olaptesed pegol (NOX-A12), an anti-CXCL12/SDF-1 Spiegelmer, is currently in Phase IIa studies in two hematological cancers, multiple myeloma (MM) and chronic lymphocytic leukemia (CLL). Results to date have shown that NOX-A12 neutralizes CXCL12 which leads to the mobilization of cancer cells in patients. Current clinical tumor response data and the very benign safety profile compare favourably with historical controls.
• Lexaptepid pegol (NOX-H94), an anti-hepcidin Spiegelmer, has shown efficacy in a subset of anemic cancer patients with functional iron deficiency in a pilot study where pharmacodynamic parameters of iron metabolism and erythropoiesis were positively influenced and hemoglobin levels increased following NOX-H94 mono-therapy. The product will also be evaluated in a Phase IIa study in dialysis patients with ESA-hyporesponsive anemia.
The proprietary Spiegelmer platform provides NOXXON with powerful and unique discovery capabilities, which have generated a number of additional leads such as NOX-S93, NOX-G15, NOX-D19 and NOX-L41 in the fields of inflammation, diabetes, metastasis and pain.
Located in Berlin, Germany, NOXXON is a well-financed mature biotech company with a strong syndicate of international investors, and approximately 60 employees.
http://jpmorgan.metameetings.com/confbook/healthcare14/compa…
Presenting: Tuesday, January 14, 2014 at 02:30 PM
Location: Elizabethan D
Speaker: Iain Buchanan, CEO
NOXXON Pharma AG is a biopharmaceutical company pioneering the development of a new class of proprietary therapeutics called Spiegelmers, which are chemically synthesized L-stereoisomer RNA aptamers and a non-immunogenic alternative to antibodies. NOXXON is approaching completion of multiple proof-of-concept studies with a diversified portfolio of clinical-stage Spiegelmer therapeutics displaying good safety, tolerability and promising signs of efficacy:
• Emapticap pegol (NOX-E36), an anti-CCL2/MCP-1 Spiegelmer, is currently in a Phase IIa study in patients with diabetic nephropathy. Interim data analysis suggests a positive influence on albuminuria and glycemic control.
• Olaptesed pegol (NOX-A12), an anti-CXCL12/SDF-1 Spiegelmer, is currently in Phase IIa studies in two hematological cancers, multiple myeloma (MM) and chronic lymphocytic leukemia (CLL). Results to date have shown that NOX-A12 neutralizes CXCL12 which leads to the mobilization of cancer cells in patients. Current clinical tumor response data and the very benign safety profile compare favourably with historical controls.
• Lexaptepid pegol (NOX-H94), an anti-hepcidin Spiegelmer, has shown efficacy in a subset of anemic cancer patients with functional iron deficiency in a pilot study where pharmacodynamic parameters of iron metabolism and erythropoiesis were positively influenced and hemoglobin levels increased following NOX-H94 mono-therapy. The product will also be evaluated in a Phase IIa study in dialysis patients with ESA-hyporesponsive anemia.
The proprietary Spiegelmer platform provides NOXXON with powerful and unique discovery capabilities, which have generated a number of additional leads such as NOX-S93, NOX-G15, NOX-D19 and NOX-L41 in the fields of inflammation, diabetes, metastasis and pain.
Located in Berlin, Germany, NOXXON is a well-financed mature biotech company with a strong syndicate of international investors, and approximately 60 employees.
Aktie der Woche bei BörseOnline! Weiß der Georg Pröbstl mehr als wir? Auf jeden Fall empfahl er heute in den MorningNews bei einem Kurs von 1,70 € die DEWB! Die Aktie machte 20 % Plus in 5 Wochen und das Handelsvolumen hat sich verdoppelt. Er vermutet einen Exit und hier speziell Noxxon, die Mitte Dezember über Phase II-Entwicklungserfolge berichtet haben. Noxxon ist unterwegs in den Bereichen Krebs, Gehirntumor und Nierenleiden. der DEWB-Chef Köhler ist am Verkauf und nicht an der Weiterentwicklung dieser Projekte interessiert. Ein Verkauf könnte den Buchwert in Richtung 3,50 € pushen. Gut informierte Kreise wissen, dass dann eine hohe Sonderdividende zwischen 0,25 und 1,00 € drin ist.
Antwort auf Beitrag Nr.: 46.290.509 von Minelli1962 am 23.01.14 18:34:00An der Sonderdividende möchte ich Zweifel anmelden. Nicht jedoch daran, dass bei Noxxon der Exit vorbereitet wird. 
Danke für die Information.
Grüße

Danke für die Information.
Grüße
Antwort auf Beitrag Nr.: 46.290.853 von Saaletaler am 23.01.14 19:07:12@Saaletaler,
Deine Zweifel sind nicht angebracht. Es ist für mich sonnenklar, dass nach erfolgreichen Exits der Noxxon und Nanotron evtl. 2014, die Aktionäre mit einer angemessenen Sonderausschüttung beteiligt werden. Nichts anderes hat Herr Pröbstl geschrieben. Dies hat mir Herr Scheidler übrigens schon Mitte letzten Jahres in einer Anfrage schriftlich bestätigt. Allenfalls die Höhe, wäre zu diskutieren. Für mich also keine neuen Erkenntnisse!
Gruß Schulzi
Deine Zweifel sind nicht angebracht. Es ist für mich sonnenklar, dass nach erfolgreichen Exits der Noxxon und Nanotron evtl. 2014, die Aktionäre mit einer angemessenen Sonderausschüttung beteiligt werden. Nichts anderes hat Herr Pröbstl geschrieben. Dies hat mir Herr Scheidler übrigens schon Mitte letzten Jahres in einer Anfrage schriftlich bestätigt. Allenfalls die Höhe, wäre zu diskutieren. Für mich also keine neuen Erkenntnisse!
Gruß Schulzi
Antwort auf Beitrag Nr.: 46.291.861 von Schulzi64 am 23.01.14 20:51:38"Wo der Vorteil einer einmaligen Sonderausschüttung liegen soll, erschließt sich uns nicht so ganz."
Obige Aussage bekam ich von Herrn Scheidler schriftlich im Jahr 2012.
Herr Scheidler erklärte mir gegenüber auch, ein Aktienrückkaufprogramm wäre mangels Gewinnrücklage nicht möglich.
Hatte ich schon mal erwähnt, dass ich den Leuten bei DEWB nicht traue?
Obige Aussage bekam ich von Herrn Scheidler schriftlich im Jahr 2012.
Herr Scheidler erklärte mir gegenüber auch, ein Aktienrückkaufprogramm wäre mangels Gewinnrücklage nicht möglich.
Hatte ich schon mal erwähnt, dass ich den Leuten bei DEWB nicht traue?
Wer ist der neue Wirkstoffkandidat! Nierenversagen bei Diabetikern verhindern! Erklärung der Spiegelmere (NOX-E36).
www.gesundheitsforschung-bmbf.de/de/4632
www.gesundheitsforschung-bmbf.de/de/4632
http://www.noxxon.com/index.php?option=com_content&view=arti…
Termin in der nächsten Woche:
Asia TIDES
Sven Klussmann
January 25-27, Tokyo, Japan
Termin in der nächsten Woche:
Asia TIDES
Sven Klussmann
January 25-27, Tokyo, Japan
Value-Wert der Woche bei €uro am Sonntag mit Kursziel 3,50 € und KGV 2014 von 1,3! Laut DEWB-Chef Köhler hat man 4 Projekte bei Noxxon mit guter Wirksamkeit und fast keinen Nebenwirkungen. Man spricht mit einigen Pharmakonzernen. Ab Ende Februar sollen alle Daten der Phase-II -Studien vorliegen und die Gespräche werden intensiviert. Er glaubt nicht, dass die anderen Aktionäre Noxxon für unter 300 Mio € verkaufen wollen. Damit wäre der DEWB-Anteil von 11,3 % an Noxxon mindestens 35 Mio € wert. In den Büchern steht er mit ca. 12 Mio €, was bei einem Verkauf 20-25 Mio € in die Kassen spülen würde. Ein Börsengang in den USA wäre denkbar und würde wahrscheinlich noch mehr bringen. Dort gibt es einen IPO-Boom (30 Biotech-IPO's in 2013 mit 2,5 Mrd $) bei Pharmafirmen und man wäre schon von Banken angesprochen worden. DEWB hat eine EK-Quote von 94,8 % und man notiert 20 % unter dem EK je Aktie von 2,09 €. Eine Sonderdividende zwischen 0,25 und 1 € je Aktie ist laut gut informierten Kreisen im Gespräch.
SMC-Research Kursziel 3,46 €. Auch hier kommt man auf ein KGV in 2014 von 1,2! (Studie vom 9.12.2013) http://www.aktien-global.de/investment-news/?id=1506 Die 21-seitige Studie kann man sich übrigens nach Registrierung kostenlos runterladen! Hier findet man auch die Begründung für den Exit von Noxxon: Es handelt sich um das letzte große Investment außerhalb des Kernsektors Photonik und Sensorik! Die DEWB war beim Einstieg in 2000 noch breiter aufgestellt und hat dort am meisten investiert. Man hat dort in 2013 nochmal eine Folgefinanzierung von 3 Mio € gemacht. Am weitesten fortgeschritten ist man beim NOX-E36 (Behandlung von Nierenerkrankungen als Folge der Wohlstandskrankheit Diabetes). Hierfür gab es auch Bundeszuschüsse. Ach ja: Dow Chemical und Pfizer gehören mit kleineren Positionen zum Aktionärskreis von Noxxon neben TVM Capital und E. de Rothschild. Als weiterer möglicher Exitkandidat neben Noxxon wird Nanotron (Hersteller von drahtlosen Sensornetzwerken) gehandelt.
Pharmabranche: Akquisitionen sollen Wachstum auf die Sprünge helfen2014 mehr M&A-Aktivitäten erwartet! Ernst & Young ist also der Meinung, dass Pharmakonzerne Unternehmen zukaufen müssen, um nicht abgehängt zu werden und das ziemlich schnell, weil die Objekte der Begierde schneller wachsen und damit immer teurer werden. Wenn das mal keine guten Aussichten für deutsche Pharmafirmen sind. http://www.bionity.com/de/news/146611/pharmabranche-akquisit… Und Warren Buffet's Nachrichtendienstleister businesswire.de hat Noxxon auch schon unter Beobachtung! http://www.businesswire.com/news/home/20121204005919/de
Zitat von Minelli1962: Value-Wert der Woche bei €uro am Sonntag mit Kursziel 3,50 € und KGV 2014 von 1,3! Laut DEWB-Chef Köhler hat man 4 Projekte bei Noxxon mit guter Wirksamkeit und fast keinen Nebenwirkungen. Man spricht mit einigen Pharmakonzernen. Ab Ende Februar sollen alle Daten der Phase-II -Studien vorliegen und die Gespräche werden intensiviert. Er glaubt nicht, dass die anderen Aktionäre Noxxon für unter 300 Mio € verkaufen wollen. Damit wäre der DEWB-Anteil von 11,3 % an Noxxon mindestens 35 Mio € wert. In den Büchern steht er mit ca. 12 Mio €, was bei einem Verkauf 20-25 Mio € in die Kassen spülen würde. Ein Börsengang in den USA wäre denkbar und würde wahrscheinlich noch mehr bringen. Dort gibt es einen IPO-Boom (30 Biotech-IPO's in 2013 mit 2,5 Mrd $) bei Pharmafirmen und man wäre schon von Banken angesprochen worden. DEWB hat eine EK-Quote von 94,8 % und man notiert 20 % unter dem EK je Aktie von 2,09 €. Eine Sonderdividende zwischen 0,25 und 1 € je Aktie ist laut gut informierten Kreisen im Gespräch.
Laut Chef...- ein Autohändler preist auch seine Ware an.
Man spricht mit einigen Pharmaunternehmen - warum nicht mit einem konkreten Interessenten?
...sollen alle Daten vorliegen- sollen!
Gespräche sollen intensiviert werden - also bisher oberflächlich/unverbindlich?
Er glaubt nicht... - glaubt!
wäre - würde - wäre
gut informierte Kreise? - Der Chef? Sein Stellvertreter? Frau Meier?
...ist im Gespräch -
Zitat von Minelli1962: SMC-Research Kursziel 3,46 €. Auch hier kommt man auf ein KGV in 2014 von 1,2! (Studie vom 9.12.2013) http://www.aktien-global.de/investment-news/?id=1506 Die 21-seitige Studie kann man sich übrigens nach Registrierung kostenlos runterladen! Hier findet man auch die Begründung für den Exit von Noxxon: Es handelt sich um das letzte große Investment außerhalb des Kernsektors Photonik und Sensorik! Die DEWB war beim Einstieg in 2000 noch breiter aufgestellt und hat dort am meisten investiert. Man hat dort in 2013 nochmal eine Folgefinanzierung von 3 Mio € gemacht. Am weitesten fortgeschritten ist man beim NOX-E36 (Behandlung von Nierenerkrankungen als Folge der Wohlstandskrankheit Diabetes). Hierfür gab es auch Bundeszuschüsse. Ach ja: Dow Chemical und Pfizer gehören mit kleineren Positionen zum Aktionärskreis von Noxxon neben TVM Capital und E. de Rothschild. Als weiterer möglicher Exitkandidat neben Noxxon wird Nanotron (Hersteller von drahtlosen Sensornetzwerken) gehandelt.
Der Disclaimer relativiert all die schönen Aussagen.
Voller Terminkalender:
Asia TIDES
Sven Klussmann
January 25-27, Tokyo, Japan
Bio Europe Spring
Aram Mangasarian
March 10-13, Turin, Italy
Aptamers 2014
Sven Klussmann
March 24-25, Oxford, UK
Drug Discovery Summit
Axel Vater
March 31-April 1, Lisbon, Portugal
TIDES
Sven Klussmann
May 12-15, Rhode Island, USA
Asia TIDES
Sven Klussmann
January 25-27, Tokyo, Japan
Bio Europe Spring
Aram Mangasarian
March 10-13, Turin, Italy
Aptamers 2014
Sven Klussmann
March 24-25, Oxford, UK
Drug Discovery Summit
Axel Vater
March 31-April 1, Lisbon, Portugal
TIDES
Sven Klussmann
May 12-15, Rhode Island, USA
JA 2012 / 7-Mio-Darlehn
Der Jahresabschluss für 2012 wurde im Bundesanzeiger veröffentlicht. Wesentliche Neuigkeiten sind mir nicht aufgefallen. Der Cashburn liegt weiterhin ziemlich konstant bei grob 1 Mio Euro pro Monat.
Eine aoHV im März soll den Weg für ein FK-Darlehn über 7 Mio Euro frei machen (s. ebenfalls Bundesanzeiger) als weitere, kurzfristige Brückenfinanzierung nach der WA in 2013. Art und Weise der Ausgestaltung - Noxxon gewährt bspw. seine gesamten bilanziellen Vermögenswerte als Sicherheit - lassen m.E. den Schluss zu, dass Noxxon innerhalb der nächsten Monate fest mit einem Corporate Deal bzw. dem Exit plant. Anonsten hätte man vermutlich eine BZR-KE-Finanzierungsrunde gewählt.
Der Jahresabschluss für 2012 wurde im Bundesanzeiger veröffentlicht. Wesentliche Neuigkeiten sind mir nicht aufgefallen. Der Cashburn liegt weiterhin ziemlich konstant bei grob 1 Mio Euro pro Monat.
Eine aoHV im März soll den Weg für ein FK-Darlehn über 7 Mio Euro frei machen (s. ebenfalls Bundesanzeiger) als weitere, kurzfristige Brückenfinanzierung nach der WA in 2013. Art und Weise der Ausgestaltung - Noxxon gewährt bspw. seine gesamten bilanziellen Vermögenswerte als Sicherheit - lassen m.E. den Schluss zu, dass Noxxon innerhalb der nächsten Monate fest mit einem Corporate Deal bzw. dem Exit plant. Anonsten hätte man vermutlich eine BZR-KE-Finanzierungsrunde gewählt.
Übersicht zu den P2-Studien von Noxxon (Aktualisierung)
Bei den Protokollen hat sich einiges getan:
NOX-A12: Die MM-Studie hat die Rekrutierung abgeschlossen. Erste Ergebnisse für das gesamte Kollektiv sind im August/September dieses Jahres zu erwarten, Endergebnisse im Herbst 2015. Vermutlich wird auch die CLL-Studie demnächst die Rekrutierung beenden. Beide Studien hatten auf der ASH/2013 bereits konkrete Zwischendaten aus der jeweiligen Pilotgruppe vorgestellt (s. #161 f.).
Von der erwarteten Glioblastom-Studie gab es keine Neuigkeiten zu lesen.
NOX-E36: Die Studie mit 76 Diabetes-Patienten wurde auf "completed" gestellt. M.E. können wir in Kürze (März) mit einer offiziellen PM rechnen, in der die wichtigsten Ergebnisse vorgestellt werden. Die PM im Juli 2013 enthielt nur qualitative Aussagen nach Behandlung des ersten Patienten-Drittels (s. #156).
NOX-H94: Die PoC-Studie bei Krebspatienten mit Anämie wurde bereits nach 12 statt der geplanten 48 Patienten abgeschlossen. Noxxon hat verkündet, dass in Kürze eine weitere PoC-Studie bei Dialyse-Patienten mit Anämie beginnen soll (s. #167). Beides lässt m.E. vermuten, dass die Krebs-Studie nicht so günstig verlief wie erwartet und man nun einen zweiten Versuch in einer anderen Indikation startet. Es sei auf möglicherweise ähnliche Probleme von Eli Lilly mit seinem Anti-Hepcidin-mAb bei Krebs-ACD verwiesen (s. #125).
grün = Studie läuft; rot = Studie beendet; kursiv = veränderter Eintrag
Das Bild zeigt die Pipeline, wie Noxxon sie momentan darstellt (Quelle). Damit es schwungvoll weitergehen kann (Glioblastom, P2b-Studien, INDs), braucht es nun einen großen Deal, der Geld in die Kasse spült und einen potenten Partner ins Boot holt!

Bei den Protokollen hat sich einiges getan:
NOX-A12: Die MM-Studie hat die Rekrutierung abgeschlossen. Erste Ergebnisse für das gesamte Kollektiv sind im August/September dieses Jahres zu erwarten, Endergebnisse im Herbst 2015. Vermutlich wird auch die CLL-Studie demnächst die Rekrutierung beenden. Beide Studien hatten auf der ASH/2013 bereits konkrete Zwischendaten aus der jeweiligen Pilotgruppe vorgestellt (s. #161 f.).
Von der erwarteten Glioblastom-Studie gab es keine Neuigkeiten zu lesen.
NOX-E36: Die Studie mit 76 Diabetes-Patienten wurde auf "completed" gestellt. M.E. können wir in Kürze (März) mit einer offiziellen PM rechnen, in der die wichtigsten Ergebnisse vorgestellt werden. Die PM im Juli 2013 enthielt nur qualitative Aussagen nach Behandlung des ersten Patienten-Drittels (s. #156).
NOX-H94: Die PoC-Studie bei Krebspatienten mit Anämie wurde bereits nach 12 statt der geplanten 48 Patienten abgeschlossen. Noxxon hat verkündet, dass in Kürze eine weitere PoC-Studie bei Dialyse-Patienten mit Anämie beginnen soll (s. #167). Beides lässt m.E. vermuten, dass die Krebs-Studie nicht so günstig verlief wie erwartet und man nun einen zweiten Versuch in einer anderen Indikation startet. Es sei auf möglicherweise ähnliche Probleme von Eli Lilly mit seinem Anti-Hepcidin-mAb bei Krebs-ACD verwiesen (s. #125).
Spiegelmer --------------- NOX-A12 NOX-A12 NOX-A12 --------------- NOX-E36 --------------- NOX-H94 NOX-H94 NOX-H94 --------------- | Indikation --------------------------- CLL (Kombi) MM (Kombi) Glioblastom --------------------------- Diabetes+Albuminurie --------------------------- Endotoxin-Simulation ACD bei HL/NHL/MM ACD bei Dialyse --------------------------- | Anz. Pers. ------- 33 29 ? ------- 76 ------- 24 12 ? ------- | Maskierung --------------- offen offen ? --------------- verblindet --------------- verblindet offen ? --------------- | Start ------------- Mär/12 Mär/12 ? ------------- Mär/12 ------------- Jan/12 Sep/12 ? ------------- | Abschluss Primärziel ------------- Jun/14 Aug/14 ? ------------- Sep/13 ------------- Mär/12 Nov/13 ? ------------- | Abschluss Studie ------------- Dez/15 Aug/15 ? ------------- Dez/13 ------------- Apr/12 Dez/13 ? ------------- | Protokoll ------------ Klick Klick ? ------------ Klick ------------ Klick Klick ? ------------ |
grün = Studie läuft; rot = Studie beendet; kursiv = veränderter Eintrag
Das Bild zeigt die Pipeline, wie Noxxon sie momentan darstellt (Quelle). Damit es schwungvoll weitergehen kann (Glioblastom, P2b-Studien, INDs), braucht es nun einen großen Deal, der Geld in die Kasse spült und einen potenten Partner ins Boot holt!

Antwort auf Beitrag Nr.: 46.523.873 von Saaletaler am 26.02.14 01:33:28danke für die schöne Übersicht!
Antwort auf Beitrag Nr.: 46.523.873 von Saaletaler am 26.02.14 01:33:28Saaletaler,
Top Beitrag von Dir und herzlichen Dank dafür!
Gruß Schulzi
Top Beitrag von Dir und herzlichen Dank dafür!
Gruß Schulzi
Übersicht zu den P2-Studien von Noxxon (Aktualisierung)
NOX-A12: Für die CLL-Studie wurde das Datum für das Primärziel (CR-/Ansprechrate) auf November 2014 korrigiert. Die Rekrutierung dürfte demnach im Mai auslaufen.
NOX-H94: Das Protokoll für die angekündigte PoC-Studie bei Dialyse ist online. Es sollen 20 Patienten (Placebo-kontrolliert) getestet werden, bei denen die Anämie nur unzureichend auf eine ESA-Behandlung anspricht. Der Abschluss der Studie ist bereits für Ende 2014 vorgesehen.
grün = Studie läuft; rot = Studie beendet; kursiv = veränderter Eintrag
NOX-A12: Für die CLL-Studie wurde das Datum für das Primärziel (CR-/Ansprechrate) auf November 2014 korrigiert. Die Rekrutierung dürfte demnach im Mai auslaufen.
NOX-H94: Das Protokoll für die angekündigte PoC-Studie bei Dialyse ist online. Es sollen 20 Patienten (Placebo-kontrolliert) getestet werden, bei denen die Anämie nur unzureichend auf eine ESA-Behandlung anspricht. Der Abschluss der Studie ist bereits für Ende 2014 vorgesehen.
Spiegelmer --------------- NOX-A12 NOX-A12 NOX-A12 --------------- NOX-E36 --------------- NOX-H94 NOX-H94 NOX-H94 --------------- | Indikation --------------------------- CLL (Kombi) MM (Kombi) Glioblastom --------------------------- Diabetes+Albuminurie --------------------------- Endotoxin-Simulation ACD bei HL/NHL/MM ACD bei Dialyse --------------------------- | Anz. Pers. ------- 33 29 ? ------- 76 ------- 24 12 20 ------- | Maskierung --------------- offen offen ? --------------- verblindet --------------- verblindet offen verblindet --------------- | Start ------------- Mär/12 Mär/12 ? ------------- Mär/12 ------------- Jan/12 Sep/12 Mär/14 ------------- | Abschluss Primärziel ------------- Nov/14 Aug/14 ? ------------- Sep/13 ------------- Mär/12 Nov/13 Okt/14 ------------- | Abschluss Studie ------------- Dez/15 Aug/15 ? ------------- Dez/13 ------------- Apr/12 Dez/13 Dez/14 ------------- | Protokoll ------------ Klick Klick ? ------------ Klick ------------ Klick Klick Klick ------------ |
grün = Studie läuft; rot = Studie beendet; kursiv = veränderter Eintrag
NOXXON präsentiert positive Ergebnisse einer Phase-IIa-Studie mit Emapticap Pegol in diabetischer Nephropathie
http://www.dewb.de/de/portfolio/newsarchiv/947-04-04-14-noxx…
Anti-CCL2/MCP-1 Spiegelmer® Emapticap Pegol (NOX-E36) zeigt positive und dauerhafte Effekte auf Albuminurie und Blutzuckerkontrolle
Berlin, Deutschland - 4. April 2014 - NOXXON Pharma AG gab bekannt, dass Proof-of-Concept-Daten einer Phase-IIa-Studie mit Emapticap Pegol (NOX-E36) in diabetischer Nephropathie heute beim ISN Nexus Symposium in Bergamo (Italien) vorgestellt wurden.
Emapticap Pegol ist ein Spiegelmer®, das CCL2/MCP-1 (CC Chemokin Ligand 2 bzw. Monocyte Chemoattractant Protein-1) bindet und neutralisiert. CCL2/MCP-1 ist ein pro-inflammatorisches Chemokin, das eine wichtige Rolle bei dem progredienten Verlauf der diabetischen Nephropathie spielt, die wiederum die häufigste Einzelursache für chronisches Nierenversagen und die terminale Niereninsuffizienz darstellt.
Das Ziel dieser randomisierten, doppelblinden, Placebo-kontrollierten Phase IIa-Studie war es, die Wirksamkeit, die Pharmakokinetik, und die Sicherheit und Verträglichkeit der Behandlung mit Emapticap Pegol zu untersuchen. 75 Patienten mit Typ-2-Diabetes und Albuminurie, die mit den derzeitigen Standardtherapien für Bluthochdruck, Hyperglykämie und Dyslipidämie behandelt wurden, erhielten für 12 Wochen zweimal wöchentlich subkutane Dosen von Emapticap Pegol oder Placebo. Diesem Behandlungszeitraum folgte eine zwölfwöchige Beobachtungszeit, um die langfristige Auswirkung der Behandlung mit Emapticap Pegol auf die Albuminurie zu untersuchen. Ein wichtiger Aspekt im Zusammenhang mit der erwähnten Standardtherapie war, dass diese eine anhaltende Blockade des Renin-Angiotensin-Systems (RAS) beinhalten musste, denn eine solche Behandlung führt nachweislich zu einer Verringerung der Albuminurie und verlangsamt das Fortschreiten der diabetischen Nephropathie. Emapticap Pegol erwies sich als sicher und gut verträglich, mit keinen behandlungsbedingten schwerwiegenden Nebenwirkungen. Für die primäre Wirksamkeitsanalyse wurden Patienten mit schweren Protokollverletzungen, mit doppelter RAS-Blockade oder mit gleichzeitiger Hämaturie und Leukozyturie ausgeschlossen.
Die Ergebnisse zeigten eine relevante und statistisch signifikante Reduktion der Albuminausscheidung im Urin und eine verbesserte Blutzuckerkontrolle. Besonders wichtig ist in diesem Zusammenhang, dass diese Effekte nicht von hämodynamischen Veränderungen begleitet waren und auch nach Beendigung der Behandlung anhielten. Das deutet darauf hin, dass Emapticap Pegol in die zugrunde liegende Pathophysiologie der diabetischen Nephropathie eingreift. Lang anhaltende Effekte auf die Albuminausscheidung nach Behandlungsende sind mit derzeit für die diabetische Nephropathie zugelassenen Wirkstoffen (ACE-Hemmer und ARB) oder mit anderen Ansätzen, die vor allem über einen hämodynamischen Mechanismus wirken, wie z.B. Endothelin-A-Rezeptor-Antagonisten, nicht zu beobachten.
Professor Dr. Hermann Haller, Direktor der Abteilung für Nephrologie und Hypertonie der Medizinischen Hochschule Hannover und ärztlicher Leiter der Studie, meinte dazu: „Diese Phase-IIa-Studie zeigt klar, dass Emapticap Pegol außergewöhnlich sicher und gut verträglich ist, und eine nur dreimonatige Behandlung zu signifikanten und klinisch relevanten positiven Effekten auf die Albuminurie und die Blutzuckersituation führt. Die Beobachtung, dass diese Effekte auch nach Beendigung der Behandlung fortbestehen, lässt vermuten, dass Emapticap Pegol die zugrunde liegende Pathophysiologie beeinflusst und somit das erste Medikament in dieser Indikation sein könnte, das den eigentlichen Krankheitsverlauf beeinflusst.“
Dr. George Bakris, Professor für Medizin und Direktor des ASH Comprehensive Hypertension Centers an der University of Chicago Medicine, bemerkte: „Von den Daten, die ich gesehen habe, beeindruckt mich insbesondere die Beobachtung, dass die Verringerung der Albuminurie durch Emapticap Pegol nicht mit hämodynamischen Änderungen einher geht. Die Tatsache, dass diese positive Wirkung außerdem von einer verbesserten Blutzuckerkontrolle begleitet wird, ist eine einzigartige Eigenschaft und unterscheidet dieses Medikament von anderen Ansätzen, die sich derzeit in der Entwicklung befinden.“
http://www.dewb.de/de/portfolio/newsarchiv/947-04-04-14-noxx…
Anti-CCL2/MCP-1 Spiegelmer® Emapticap Pegol (NOX-E36) zeigt positive und dauerhafte Effekte auf Albuminurie und Blutzuckerkontrolle
Berlin, Deutschland - 4. April 2014 - NOXXON Pharma AG gab bekannt, dass Proof-of-Concept-Daten einer Phase-IIa-Studie mit Emapticap Pegol (NOX-E36) in diabetischer Nephropathie heute beim ISN Nexus Symposium in Bergamo (Italien) vorgestellt wurden.
Emapticap Pegol ist ein Spiegelmer®, das CCL2/MCP-1 (CC Chemokin Ligand 2 bzw. Monocyte Chemoattractant Protein-1) bindet und neutralisiert. CCL2/MCP-1 ist ein pro-inflammatorisches Chemokin, das eine wichtige Rolle bei dem progredienten Verlauf der diabetischen Nephropathie spielt, die wiederum die häufigste Einzelursache für chronisches Nierenversagen und die terminale Niereninsuffizienz darstellt.
Das Ziel dieser randomisierten, doppelblinden, Placebo-kontrollierten Phase IIa-Studie war es, die Wirksamkeit, die Pharmakokinetik, und die Sicherheit und Verträglichkeit der Behandlung mit Emapticap Pegol zu untersuchen. 75 Patienten mit Typ-2-Diabetes und Albuminurie, die mit den derzeitigen Standardtherapien für Bluthochdruck, Hyperglykämie und Dyslipidämie behandelt wurden, erhielten für 12 Wochen zweimal wöchentlich subkutane Dosen von Emapticap Pegol oder Placebo. Diesem Behandlungszeitraum folgte eine zwölfwöchige Beobachtungszeit, um die langfristige Auswirkung der Behandlung mit Emapticap Pegol auf die Albuminurie zu untersuchen. Ein wichtiger Aspekt im Zusammenhang mit der erwähnten Standardtherapie war, dass diese eine anhaltende Blockade des Renin-Angiotensin-Systems (RAS) beinhalten musste, denn eine solche Behandlung führt nachweislich zu einer Verringerung der Albuminurie und verlangsamt das Fortschreiten der diabetischen Nephropathie. Emapticap Pegol erwies sich als sicher und gut verträglich, mit keinen behandlungsbedingten schwerwiegenden Nebenwirkungen. Für die primäre Wirksamkeitsanalyse wurden Patienten mit schweren Protokollverletzungen, mit doppelter RAS-Blockade oder mit gleichzeitiger Hämaturie und Leukozyturie ausgeschlossen.
Die Ergebnisse zeigten eine relevante und statistisch signifikante Reduktion der Albuminausscheidung im Urin und eine verbesserte Blutzuckerkontrolle. Besonders wichtig ist in diesem Zusammenhang, dass diese Effekte nicht von hämodynamischen Veränderungen begleitet waren und auch nach Beendigung der Behandlung anhielten. Das deutet darauf hin, dass Emapticap Pegol in die zugrunde liegende Pathophysiologie der diabetischen Nephropathie eingreift. Lang anhaltende Effekte auf die Albuminausscheidung nach Behandlungsende sind mit derzeit für die diabetische Nephropathie zugelassenen Wirkstoffen (ACE-Hemmer und ARB) oder mit anderen Ansätzen, die vor allem über einen hämodynamischen Mechanismus wirken, wie z.B. Endothelin-A-Rezeptor-Antagonisten, nicht zu beobachten.
Professor Dr. Hermann Haller, Direktor der Abteilung für Nephrologie und Hypertonie der Medizinischen Hochschule Hannover und ärztlicher Leiter der Studie, meinte dazu: „Diese Phase-IIa-Studie zeigt klar, dass Emapticap Pegol außergewöhnlich sicher und gut verträglich ist, und eine nur dreimonatige Behandlung zu signifikanten und klinisch relevanten positiven Effekten auf die Albuminurie und die Blutzuckersituation führt. Die Beobachtung, dass diese Effekte auch nach Beendigung der Behandlung fortbestehen, lässt vermuten, dass Emapticap Pegol die zugrunde liegende Pathophysiologie beeinflusst und somit das erste Medikament in dieser Indikation sein könnte, das den eigentlichen Krankheitsverlauf beeinflusst.“
Dr. George Bakris, Professor für Medizin und Direktor des ASH Comprehensive Hypertension Centers an der University of Chicago Medicine, bemerkte: „Von den Daten, die ich gesehen habe, beeindruckt mich insbesondere die Beobachtung, dass die Verringerung der Albuminurie durch Emapticap Pegol nicht mit hämodynamischen Änderungen einher geht. Die Tatsache, dass diese positive Wirkung außerdem von einer verbesserten Blutzuckerkontrolle begleitet wird, ist eine einzigartige Eigenschaft und unterscheidet dieses Medikament von anderen Ansätzen, die sich derzeit in der Entwicklung befinden.“
Antwort auf Beitrag Nr.: 46.766.537 von Saaletaler am 04.04.14 13:15:32NOX-E36 P2a-Studie in Diabetische Nephropathie
Anbei einige Studien-Details aus der Präsentation auf dem ISN Nexus Symposium. Die Daten sehen m.E. wirklich gut aus. Störend ist eigentlich nur, dass die umfangreichere P2b-Studie erst in HJ2/15 starten kann. Trotzdem sollte der erfolgte PoC für einen lukrativen Partner-Deal dicke reichen; ich schätze mal 3 bis 6 Monate (spätestens Q4/14) als Zeitrahmen, je nachdem, wie viele Interessenten in der Schlange stehen.
-----------------------------------------------------------------------------------------------------
Noxxon's NOX-E36 meets in diabetic nephropathy trial
http://www.biocentury.com/dailynews/clinical/2014-04-04/noxx…
Published on Friday, April 4, 2014
Noxxon Pharma AG (Berlin, Germany) said twice-weekly subcutaneous NOX-E36 met the primary endpoint vs. placebo in a Phase IIa trial to treat diabetic nephropathy. NOX-E36 reduced urinary albumin excretion as measured by the change from baseline to week 12 in mean albumin-to-creatinine ratio (ACR) vs. placebo (30% vs. an increase of 2%, p=0.014). Additionally, 31% of patients receiving NOX-E36 achieved a 50% or greater reduction in mean ACR vs. 6% for placebo. The double-blind, international trial enrolled 75 Type II diabetics with albuminuria on current standard of care to control hypertension, hyperglycemia and dyslipidemia. Data were presented at the ISN Nexus Symposium in Bergamo.
Noxxon plans to start a Phase IIb trial to evaluate multiple-dose regimens and a longer duration of treatment with NOX-E36, but said it needs to complete a nine-month animal toxicology study first. The company hopes to start the Phase IIb trial in 2H15. NOX-E36 is an L-aptamer monocyte chemoattractant protein-1 (MCP-1; CCL2) inhibitor.
Anbei einige Studien-Details aus der Präsentation auf dem ISN Nexus Symposium. Die Daten sehen m.E. wirklich gut aus. Störend ist eigentlich nur, dass die umfangreichere P2b-Studie erst in HJ2/15 starten kann. Trotzdem sollte der erfolgte PoC für einen lukrativen Partner-Deal dicke reichen; ich schätze mal 3 bis 6 Monate (spätestens Q4/14) als Zeitrahmen, je nachdem, wie viele Interessenten in der Schlange stehen.
-----------------------------------------------------------------------------------------------------
Noxxon's NOX-E36 meets in diabetic nephropathy trial
http://www.biocentury.com/dailynews/clinical/2014-04-04/noxx…
Published on Friday, April 4, 2014
Noxxon Pharma AG (Berlin, Germany) said twice-weekly subcutaneous NOX-E36 met the primary endpoint vs. placebo in a Phase IIa trial to treat diabetic nephropathy. NOX-E36 reduced urinary albumin excretion as measured by the change from baseline to week 12 in mean albumin-to-creatinine ratio (ACR) vs. placebo (30% vs. an increase of 2%, p=0.014). Additionally, 31% of patients receiving NOX-E36 achieved a 50% or greater reduction in mean ACR vs. 6% for placebo. The double-blind, international trial enrolled 75 Type II diabetics with albuminuria on current standard of care to control hypertension, hyperglycemia and dyslipidemia. Data were presented at the ISN Nexus Symposium in Bergamo.
Noxxon plans to start a Phase IIb trial to evaluate multiple-dose regimens and a longer duration of treatment with NOX-E36, but said it needs to complete a nine-month animal toxicology study first. The company hopes to start the Phase IIb trial in 2H15. NOX-E36 is an L-aptamer monocyte chemoattractant protein-1 (MCP-1; CCL2) inhibitor.
Quelle DEWB
08.04.14 - NOXXON präsentiert Phase IIa-Daten von NOX-H94
Anti-Hepcidin Spiegelmer® Lexaptepid Pegol erhöht die Hämoglobinwerte bei einer Untergruppe anämischer Patienten in Phase IIa-Pilotstudie
Mögliche prädiktive Marker identifiziert
Berlin, 8. April 2014 - NOXXON Pharma AG gibt bekannt, dass die Ergebnisse einer Phase IIa-Studie mit Lexaptepid Pegol (NOX-H94) in anämischen Krebspatienten heute auf dem Jahrestreffen der American Association for Cancer Research (AACR) in San Diego vorgestellt werden.
Lexaptepid Pegol ist ein Spiegelmer®, das Hepcidin bindet und neutralisiert. Hepcidin ist ein Peptidhormon, das den Serumeisenspiegel vermindert. Hohe Hepcidinspiegel, wie sie häufig bei Krebs- oder Dialyse-Patienten gefunden werden, führen zu einer Eisenrestriktion, die auch als „funktioneller Eisenmangel“ bezeichnet wird. In diesem Zustand akkumuliert Eisen in den Speicherzellen und steht somit nicht zur Hämoglobinsynthese zur Verfügung. Über die Zeit führt dies zu einer sog. Entzündungsanämie.
Diese offene, einarmige, multizentrische Studie diente der Untersuchung der Wirksamkeit, Pharmakokinetik, Sicherheit und Verträglichkeit der Behandlung mit Lexaptepid Pegol. Zwölf Krebspatienten mit Anämie (Hämoglobin < 10 g/dL) erhielten über einen Zeitraum von vier Wochen jeweils zweimal wöchentlich Lexaptepid Pegol intravenös verabreicht. Nach dieser Behandlungszeit wurden die Patienten noch einen Monat beobachtet. Während der gesamten Studiendauer war die Gabe von Erythropoese-stimulierenden Substanzen (ESAs) sowie von Erythropoietin (EPO) oder die intravenöse Verabreichungen von Eisenprodukten nicht gestattet.
Die Ergebnisse zeigten eine signifikante Zunahme der Hämoglobinkonzentration (>1 g/dL) bei 5 von 12 (42%) Patienten als Reaktion auf die Monotherapie mit Lexaptepid Pegol. Der erhöhte Hämoglobinspiegel blieb über den gesamten Beobachtungszeitraum bestehen. Zum Vergleich: Die Kombination von EPO und intravenösem Eisen in einer vergleichbaren Patientengruppe zeigte eine Ansprechrate von 65%¹.
Patienten, die auf Lexaptepid Pegol ansprachen, zeigten eine steigende Anzahl roter Blutzellen, eine Zunahme des retikulozytären Hämoglobins und eine Abnahme des löslichen Transferrinrezeptors im Serum (soluble transferrin receptor, sTfR). Dieser sTfR-Spiegel ist ein Marker für gesteigerten Eisenbedarf und er wurde zusammen mit dem Gehalt an retikulozytärem Hämoglobin als einer der beiden positiven diagnostischen Prädiktoren identifiziert.
Nach diesen positiven Ergebnissen der Pilotstudie plant NOXXON zügig eine neue Studie mit Lexaptepid Pegol in EPO-hyporesponsiven Dialysepatienten zu beginnen.
Der Titel und die Autoren der Posterpräsentation bei der AACR Konferenz lauten:
Abstract 3847, Poster 8: The anti-hepcidin Spiegelmer® lexaptepid pegol (NOX H94) as treatment of anemia of chronic disease in patients with multiple myeloma, low grade lymphoma, and CLL: A phase II pilot study
Pencho Georgiev, Mihaela Lazaroiu, Luminita Ocroteala, Janet Grudeva-Popova, Emanuil Gheorghita, Mariana Vasilica, Sanda M Popescu, Andrei Cucuianu, Luciana Summo, Frank Schwoebel, Kai Riecke, Heinz Ludwig
Präsentiert am Dienstag, den 8. April 2014, von 8:00 -12:00 Uhr in der Halle A-E.
Mitglieder des Arzneimittelentwicklungsteams von NOXXON nehmen an der AACR Konferenz teil, um den Wirkungsmechanismus sowie das klinische Potenzial dieses innovativen Arzneimittelkandidaten zu erläutern.
¹ Ludwig H, et al. European Journal of Cancer, Vol. 45(9), 1603-1615, 2009.
08.04.14 - NOXXON präsentiert Phase IIa-Daten von NOX-H94
Anti-Hepcidin Spiegelmer® Lexaptepid Pegol erhöht die Hämoglobinwerte bei einer Untergruppe anämischer Patienten in Phase IIa-Pilotstudie
Mögliche prädiktive Marker identifiziert
Berlin, 8. April 2014 - NOXXON Pharma AG gibt bekannt, dass die Ergebnisse einer Phase IIa-Studie mit Lexaptepid Pegol (NOX-H94) in anämischen Krebspatienten heute auf dem Jahrestreffen der American Association for Cancer Research (AACR) in San Diego vorgestellt werden.
Lexaptepid Pegol ist ein Spiegelmer®, das Hepcidin bindet und neutralisiert. Hepcidin ist ein Peptidhormon, das den Serumeisenspiegel vermindert. Hohe Hepcidinspiegel, wie sie häufig bei Krebs- oder Dialyse-Patienten gefunden werden, führen zu einer Eisenrestriktion, die auch als „funktioneller Eisenmangel“ bezeichnet wird. In diesem Zustand akkumuliert Eisen in den Speicherzellen und steht somit nicht zur Hämoglobinsynthese zur Verfügung. Über die Zeit führt dies zu einer sog. Entzündungsanämie.
Diese offene, einarmige, multizentrische Studie diente der Untersuchung der Wirksamkeit, Pharmakokinetik, Sicherheit und Verträglichkeit der Behandlung mit Lexaptepid Pegol. Zwölf Krebspatienten mit Anämie (Hämoglobin < 10 g/dL) erhielten über einen Zeitraum von vier Wochen jeweils zweimal wöchentlich Lexaptepid Pegol intravenös verabreicht. Nach dieser Behandlungszeit wurden die Patienten noch einen Monat beobachtet. Während der gesamten Studiendauer war die Gabe von Erythropoese-stimulierenden Substanzen (ESAs) sowie von Erythropoietin (EPO) oder die intravenöse Verabreichungen von Eisenprodukten nicht gestattet.
Die Ergebnisse zeigten eine signifikante Zunahme der Hämoglobinkonzentration (>1 g/dL) bei 5 von 12 (42%) Patienten als Reaktion auf die Monotherapie mit Lexaptepid Pegol. Der erhöhte Hämoglobinspiegel blieb über den gesamten Beobachtungszeitraum bestehen. Zum Vergleich: Die Kombination von EPO und intravenösem Eisen in einer vergleichbaren Patientengruppe zeigte eine Ansprechrate von 65%¹.
Patienten, die auf Lexaptepid Pegol ansprachen, zeigten eine steigende Anzahl roter Blutzellen, eine Zunahme des retikulozytären Hämoglobins und eine Abnahme des löslichen Transferrinrezeptors im Serum (soluble transferrin receptor, sTfR). Dieser sTfR-Spiegel ist ein Marker für gesteigerten Eisenbedarf und er wurde zusammen mit dem Gehalt an retikulozytärem Hämoglobin als einer der beiden positiven diagnostischen Prädiktoren identifiziert.
Nach diesen positiven Ergebnissen der Pilotstudie plant NOXXON zügig eine neue Studie mit Lexaptepid Pegol in EPO-hyporesponsiven Dialysepatienten zu beginnen.
Der Titel und die Autoren der Posterpräsentation bei der AACR Konferenz lauten:
Abstract 3847, Poster 8: The anti-hepcidin Spiegelmer® lexaptepid pegol (NOX H94) as treatment of anemia of chronic disease in patients with multiple myeloma, low grade lymphoma, and CLL: A phase II pilot study
Pencho Georgiev, Mihaela Lazaroiu, Luminita Ocroteala, Janet Grudeva-Popova, Emanuil Gheorghita, Mariana Vasilica, Sanda M Popescu, Andrei Cucuianu, Luciana Summo, Frank Schwoebel, Kai Riecke, Heinz Ludwig
Präsentiert am Dienstag, den 8. April 2014, von 8:00 -12:00 Uhr in der Halle A-E.
Mitglieder des Arzneimittelentwicklungsteams von NOXXON nehmen an der AACR Konferenz teil, um den Wirkungsmechanismus sowie das klinische Potenzial dieses innovativen Arzneimittelkandidaten zu erläutern.
¹ Ludwig H, et al. European Journal of Cancer, Vol. 45(9), 1603-1615, 2009.
Antwort auf Beitrag Nr.: 46.785.865 von dg6nds am 08.04.14 14:14:08Prima! Jetzt haben wir also (erste) Daten von allen 4 PoC-Studien beisammen. NOX-E36 und NOX-A12 sehen in meinen Augen gut bis sehr gut aus, soweit man das den bisherigen Veröffentlichungen entnehmen kann.
Bei NOX-H94 ist das Ergebnis m.E. "durchwachsen", ohne es wirklich fundiert einschätzen zu können. Es wird aber seinen Grund haben, dass Noxxon gleich die nächste Studie in einer zweiten Indikation (ACD bei Dialyse-Patienten) nachschiebt. Nachfolgend das offizielle Abstract von Pencho Georgiev et al. auf dem AACR-Meeting:
--------------------------------------------------------------------------------------------------
The anti-hepcidin Spiegelmer® Lexaptepid Pegol (NOX-H94) as treatment of anemia of chronic disease in patients with multiple myeloma, low grade lymphoma, and CLL: A phase II pilot study
http://www.abstractsonline.com/Plan/ViewAbstract.aspx?sKey=4…
Lexaptepid pegol (LP) is a PEGylated L-stereoisomer RNA aptamer that binds and neutralizes hepcidin. Hepcidin, a 25 amino acid peptide induced by inflammatory stimuli is a pivotal regulator of iron resorption and iron release from intracellular stores, which are severely impaired in anemia of chronic disease. Disturbances in iron metabolism resulting in functional iron deficiency are a key component of anemia of chronic disease which frequently complicates malignant disease. We evaluated the pharmacokinetics, pharmacodynamics, safety and efficacy of hepcidin blockade by LP as sole treatment of anemia of chronic disease in patients with multiple myeloma, low grade Non-, or Hodgkin lymphoma.
Twelve patients with functional iron deficiency anemia with the following baseline characteristics, presented as median (range), were enrolled: age 64 years (35-77), Hb 9.6 g/dL (8.0-10.7), serum ferritin 317 µg/L (193-2805), serum iron 29 µg/dL (18-97), TSAT 12% (6-46). LP was injected i.v. at a dose of 1.2 mg/mg, TIW for 4 weeks. Blood counts, serum biochemistry, and iron status were evaluated weekly until two weeks post treatment and at week four after the end of therapy. The primary endpoint was increase in Hb by ≥1 g/dL at any time between start of therapy until 1 week after end of treatment. The study has the clinicaltrials.gov identifier NCT 01691040.
Five of the 12 patients reached the target Hb increase of ≥1 g/dL, 3 patients achieved this goal within 2 weeks. Four of the 5 responding patients had hypochromic anemia (MCH 22-26 pg) and moderately increased baseline ferritin levels (200-350 µg/L). Median serum ferritin decreased from 317 to 232 µg/L (p=0.014) in the entire cohort of patients, and from 253 to 203 µg/L in responders (p=n.s). Reticulocyte hemoglobin increased from 22.0 to 25.2 pg (p=0.019) in responding patients, while in non-responders no increase was noted (30.0 to 30.1 pg). Similarly, a trend to increased reticulocyte index was observed in the responding patients (median: 0.9 to 1.3, p=n.s.) only. Soluble transferrin receptor levels (sTFR) showed a trend to decrease in responders (10.6 to 10.3 mg/L, p=n.s.), but remained unchanged in non-responders. Treatment with LP was well tolerated without major adverse reactions.
In conclusion, LP induced a significant increase in Hb levels (≥1 g/dL) in 5 of 12 patients. Responding patients showed an increase in red cell and reticulocyte hemoglobin, and decrease in sTFR. These results support the concept of hepcidin inhibition for treatment of cancer associated anemia with functional iron deficiency. Patients with signs of iron deficiency as documented by hypochromic anemia, no excessive increase in ferritin and high sTFR levels showed a higher likelihood to respond to LP.
Bei NOX-H94 ist das Ergebnis m.E. "durchwachsen", ohne es wirklich fundiert einschätzen zu können. Es wird aber seinen Grund haben, dass Noxxon gleich die nächste Studie in einer zweiten Indikation (ACD bei Dialyse-Patienten) nachschiebt. Nachfolgend das offizielle Abstract von Pencho Georgiev et al. auf dem AACR-Meeting:
--------------------------------------------------------------------------------------------------
The anti-hepcidin Spiegelmer® Lexaptepid Pegol (NOX-H94) as treatment of anemia of chronic disease in patients with multiple myeloma, low grade lymphoma, and CLL: A phase II pilot study
http://www.abstractsonline.com/Plan/ViewAbstract.aspx?sKey=4…
Lexaptepid pegol (LP) is a PEGylated L-stereoisomer RNA aptamer that binds and neutralizes hepcidin. Hepcidin, a 25 amino acid peptide induced by inflammatory stimuli is a pivotal regulator of iron resorption and iron release from intracellular stores, which are severely impaired in anemia of chronic disease. Disturbances in iron metabolism resulting in functional iron deficiency are a key component of anemia of chronic disease which frequently complicates malignant disease. We evaluated the pharmacokinetics, pharmacodynamics, safety and efficacy of hepcidin blockade by LP as sole treatment of anemia of chronic disease in patients with multiple myeloma, low grade Non-, or Hodgkin lymphoma.
Twelve patients with functional iron deficiency anemia with the following baseline characteristics, presented as median (range), were enrolled: age 64 years (35-77), Hb 9.6 g/dL (8.0-10.7), serum ferritin 317 µg/L (193-2805), serum iron 29 µg/dL (18-97), TSAT 12% (6-46). LP was injected i.v. at a dose of 1.2 mg/mg, TIW for 4 weeks. Blood counts, serum biochemistry, and iron status were evaluated weekly until two weeks post treatment and at week four after the end of therapy. The primary endpoint was increase in Hb by ≥1 g/dL at any time between start of therapy until 1 week after end of treatment. The study has the clinicaltrials.gov identifier NCT 01691040.
Five of the 12 patients reached the target Hb increase of ≥1 g/dL, 3 patients achieved this goal within 2 weeks. Four of the 5 responding patients had hypochromic anemia (MCH 22-26 pg) and moderately increased baseline ferritin levels (200-350 µg/L). Median serum ferritin decreased from 317 to 232 µg/L (p=0.014) in the entire cohort of patients, and from 253 to 203 µg/L in responders (p=n.s). Reticulocyte hemoglobin increased from 22.0 to 25.2 pg (p=0.019) in responding patients, while in non-responders no increase was noted (30.0 to 30.1 pg). Similarly, a trend to increased reticulocyte index was observed in the responding patients (median: 0.9 to 1.3, p=n.s.) only. Soluble transferrin receptor levels (sTFR) showed a trend to decrease in responders (10.6 to 10.3 mg/L, p=n.s.), but remained unchanged in non-responders. Treatment with LP was well tolerated without major adverse reactions.
In conclusion, LP induced a significant increase in Hb levels (≥1 g/dL) in 5 of 12 patients. Responding patients showed an increase in red cell and reticulocyte hemoglobin, and decrease in sTFR. These results support the concept of hepcidin inhibition for treatment of cancer associated anemia with functional iron deficiency. Patients with signs of iron deficiency as documented by hypochromic anemia, no excessive increase in ferritin and high sTFR levels showed a higher likelihood to respond to LP.
Antwort auf Beitrag Nr.: 46.782.607 von Saaletaler am 07.04.14 21:56:20NOX-E36 P2a-Studie in Diabetische Nephropathie
Unten stehend das offizielle Abstract zur Präsentation der NOX-E36-Daten von Hermann Haller et al. auf dem ISN Nexus Symposium. Das positive Bild verfestigt sich weiter.
-----------------------------------------------------------------------------------------------------
CCL2 INHIBITION WITH EMAPTICAP PEGOL (NOX-E36) IN TYPE 2 DIABETIC PATIENTS WITH ALBUMINURIA
http://www.isnnexus.org/bergamo/abstracts
H.G. Haller1, S. Zöllner2, S. VaulÈon2, K. Riecke2, D. Beyer2, M. Baumann2, D. Eulberg2
1Clinic of Hypertension and Nephrology, Hannover Medical School, Hannover, Germany
2Drug Development, NOXXON Pharma AG, Berlin, Germany
Introduction: Emapticap pegol (NOX-E36) is a Spiegelmer® that specifically binds and inhibits the pro-inflammatory chemokine CCL2 (MCP-1). Emapticap was safe and well tolerated and first hints indicating a reno-protective effect were obtained in single and repeat dose Phase I studies in healthy volunteers and diabetics. A renal impairment study showed that no dose adjustment is required in subjects with up to severe renal impairment.
Methods: A randomized, double blind, placebo-controlled phase IIa POC study was initiated in 75 albuminuric type 2 diabetics. Patients in the study had an ACR >100 mg/g, an eGFR >25 mL/min × 1.73 m2 and an HbA1c from 6.0% to 10.5%. Emapticap was administered SC at 0.5 mg/kg twice weekly for 12 weeks, followed by a treatment-free phase of another 12 weeks. Here we present interim data from the 51 patients that have completed the study.
Results: Emapticap pegol was safe and well tolerated. Plasma concentrations reached pharmacologically relevant levels of 300-400 nM. Accordingly, the expected pharmacodynamic effect was observed, i.e., a change in the number of monocytes in peripheral blood which express CCR2. Treatment with emapticap resulted in a statistically significant decrease from baseline ACR at Day 85 (primary endpoint) with low volatility and a steady decrease until end of treatment, whereas the placebo group showed a non-significant decrease and high volatility throughout the whole treatment and follow-up period. Follow-up data showed that the favorable trend for patients treated with emapticap was maintained after the end of the dosing period. The maximum effect on ACR (-39 % vs. baseline) was observed during follow-up. The beneficial effect on ACR was not accompanied by a drop in eGFR, suggesting that the mode of action is independent from modulation of glomerular hemodynamics. For the secondary endpoint HbA1c, a statistically significant decrease from baseline was observed in patients treated with emapticap at Day 85 and further improvement, up to a maximum of -0.54%, was observed during follow-up.
Conclusion: 12-week SC treatment with emapticap pegol was safe and well tolerated in diabetic patients with albuminuria. The observed beneficial effect on ACR persisted during the follow-up phase and was not associated with a change of glomerular hemodynamics. Furthermore, glycemic control was improved which persisted during follow-up. These findings suggest that emapticap pegol might possess disease modifying activity.
Unten stehend das offizielle Abstract zur Präsentation der NOX-E36-Daten von Hermann Haller et al. auf dem ISN Nexus Symposium. Das positive Bild verfestigt sich weiter.
-----------------------------------------------------------------------------------------------------
CCL2 INHIBITION WITH EMAPTICAP PEGOL (NOX-E36) IN TYPE 2 DIABETIC PATIENTS WITH ALBUMINURIA
http://www.isnnexus.org/bergamo/abstracts
H.G. Haller1, S. Zöllner2, S. VaulÈon2, K. Riecke2, D. Beyer2, M. Baumann2, D. Eulberg2
1Clinic of Hypertension and Nephrology, Hannover Medical School, Hannover, Germany
2Drug Development, NOXXON Pharma AG, Berlin, Germany
Introduction: Emapticap pegol (NOX-E36) is a Spiegelmer® that specifically binds and inhibits the pro-inflammatory chemokine CCL2 (MCP-1). Emapticap was safe and well tolerated and first hints indicating a reno-protective effect were obtained in single and repeat dose Phase I studies in healthy volunteers and diabetics. A renal impairment study showed that no dose adjustment is required in subjects with up to severe renal impairment.
Methods: A randomized, double blind, placebo-controlled phase IIa POC study was initiated in 75 albuminuric type 2 diabetics. Patients in the study had an ACR >100 mg/g, an eGFR >25 mL/min × 1.73 m2 and an HbA1c from 6.0% to 10.5%. Emapticap was administered SC at 0.5 mg/kg twice weekly for 12 weeks, followed by a treatment-free phase of another 12 weeks. Here we present interim data from the 51 patients that have completed the study.
Results: Emapticap pegol was safe and well tolerated. Plasma concentrations reached pharmacologically relevant levels of 300-400 nM. Accordingly, the expected pharmacodynamic effect was observed, i.e., a change in the number of monocytes in peripheral blood which express CCR2. Treatment with emapticap resulted in a statistically significant decrease from baseline ACR at Day 85 (primary endpoint) with low volatility and a steady decrease until end of treatment, whereas the placebo group showed a non-significant decrease and high volatility throughout the whole treatment and follow-up period. Follow-up data showed that the favorable trend for patients treated with emapticap was maintained after the end of the dosing period. The maximum effect on ACR (-39 % vs. baseline) was observed during follow-up. The beneficial effect on ACR was not accompanied by a drop in eGFR, suggesting that the mode of action is independent from modulation of glomerular hemodynamics. For the secondary endpoint HbA1c, a statistically significant decrease from baseline was observed in patients treated with emapticap at Day 85 and further improvement, up to a maximum of -0.54%, was observed during follow-up.
Conclusion: 12-week SC treatment with emapticap pegol was safe and well tolerated in diabetic patients with albuminuria. The observed beneficial effect on ACR persisted during the follow-up phase and was not associated with a change of glomerular hemodynamics. Furthermore, glycemic control was improved which persisted during follow-up. These findings suggest that emapticap pegol might possess disease modifying activity.
Antwort auf Beitrag Nr.: 46.804.325 von Saaletaler am 10.04.14 22:09:25Guten Abend zusammen,
Danke, Saaletaler, für die einwandfreie Analyse.
Ich bin die Abstracts und Pressemeldungen ebenfalls durchgegangen. Es gibt aus meiner Sicht nun tatsächlich nichts mehr dran zu rütteln: Noxxon Pharma hat drei erfolgreiche Proof-of-Concept Studien vorzuweisen. Die Studienprotokolle sind einwandfrei.
Wie gehts es nun weiter? Ein Blick auf den amerikanischen Biotech-Markt:
- Epizyme: 2 Kandidaten in Phase 1 f. onkologische Indikationen, erste Hinweise auf Wirksamkeit, noch kein PoC. Marktkapitalisierung: 700 Mio US$
- Agios: 3 Kandidaten in Phase 1, f. onkologische Indikationen, erste gute Hinweise auf Wirksamkeit, noch kein PoC. Marktkapitalisierung: 1.5 Mrd US$
Aus meiner Sicht ist Noxxon auch mit 300 Mio € ziemlich günstig bewertet. Wenn ich CEO von Noxxon wäre, würde ich alles daran setzen, ein IPO zu vollziehen. Es bleibt spannend.
VG
ndbus
Danke, Saaletaler, für die einwandfreie Analyse.
Ich bin die Abstracts und Pressemeldungen ebenfalls durchgegangen. Es gibt aus meiner Sicht nun tatsächlich nichts mehr dran zu rütteln: Noxxon Pharma hat drei erfolgreiche Proof-of-Concept Studien vorzuweisen. Die Studienprotokolle sind einwandfrei.
Wie gehts es nun weiter? Ein Blick auf den amerikanischen Biotech-Markt:
- Epizyme: 2 Kandidaten in Phase 1 f. onkologische Indikationen, erste Hinweise auf Wirksamkeit, noch kein PoC. Marktkapitalisierung: 700 Mio US$
- Agios: 3 Kandidaten in Phase 1, f. onkologische Indikationen, erste gute Hinweise auf Wirksamkeit, noch kein PoC. Marktkapitalisierung: 1.5 Mrd US$
Aus meiner Sicht ist Noxxon auch mit 300 Mio € ziemlich günstig bewertet. Wenn ich CEO von Noxxon wäre, würde ich alles daran setzen, ein IPO zu vollziehen. Es bleibt spannend.
VG
ndbus
Antwort auf Beitrag Nr.: 46.914.946 von ndbus am 02.05.14 21:56:50Hallo ndbus und besten Dank für die anregenden Argumente. Ich teile die Einschätzung, dass ein IPO im momentanen Marktumfeld für Biotechs die vermutlich lukrativste Exitform wäre. Allerdings mit zwei Einschränkungen:
1. Das Biotech-Sentiment in Deutschland ist weiterhin mies. Außer Morphosys und Evotech gibt es bislang keine nennenswerten Erfolgsgeschichten. Im Gegenteil: Die Enttäuschungen überwiegen bei Weitem. Aus vielen einstigen Hoffnungsträgern sind inzwischen Bruchbuden geworden, die ums Überleben kämpfen. Ein Noxxon-IPO würde m.E. wohl nur in den USA Sinn machen. In wie weit dies organisatorisch/regulatorisch umzusetzen ist, kann ich nicht einschätzen.
2. Noxxon fehlt bislang die externe Evaluierung seiner Technologie durch mindestens einen großen Partner-Abschluss. Dass Pfizer, Roche und Lilly die Kooperationen mit Noxxon beendet haben, hat großes Misstrauen hervorgerufen. Das kann man nicht wegdiskutieren. Dies löst sich erst auf, wenn eines der klinischen Spiegelmere verpartnert werden kann. Die Voraussetzungen sind durch die erfolgten PoC gegeben. Aber ein IPO macht erst Sinn, wenn ein Deal präsentiert wird, der die Zweifel wegwischt. Herr Mangasarian muss also endlich mal einen raus hauen!
Meine Erwartungen sehen daher wie folgt aus: Partner-Deal in 2014 (vermutlich mit NOX-E36), dann zügig IPO als präferierte Exit-Option. Jedenfalls muss - wie wir wissen - bald frisches Geld in die Kasse.
Grüße
1. Das Biotech-Sentiment in Deutschland ist weiterhin mies. Außer Morphosys und Evotech gibt es bislang keine nennenswerten Erfolgsgeschichten. Im Gegenteil: Die Enttäuschungen überwiegen bei Weitem. Aus vielen einstigen Hoffnungsträgern sind inzwischen Bruchbuden geworden, die ums Überleben kämpfen. Ein Noxxon-IPO würde m.E. wohl nur in den USA Sinn machen. In wie weit dies organisatorisch/regulatorisch umzusetzen ist, kann ich nicht einschätzen.
2. Noxxon fehlt bislang die externe Evaluierung seiner Technologie durch mindestens einen großen Partner-Abschluss. Dass Pfizer, Roche und Lilly die Kooperationen mit Noxxon beendet haben, hat großes Misstrauen hervorgerufen. Das kann man nicht wegdiskutieren. Dies löst sich erst auf, wenn eines der klinischen Spiegelmere verpartnert werden kann. Die Voraussetzungen sind durch die erfolgten PoC gegeben. Aber ein IPO macht erst Sinn, wenn ein Deal präsentiert wird, der die Zweifel wegwischt. Herr Mangasarian muss also endlich mal einen raus hauen!
Meine Erwartungen sehen daher wie folgt aus: Partner-Deal in 2014 (vermutlich mit NOX-E36), dann zügig IPO als präferierte Exit-Option. Jedenfalls muss - wie wir wissen - bald frisches Geld in die Kasse.

Grüße
Analyse von Montega Equity Research
In einer aktuellen Research-Studie zu DEWB hat Montega erstmals eine Pipeline-Bewertung von Noxxon auf Basis der jüngst vorgestellten P2a-Daten vorgenommen. Ergebnis ist ein aktueller Barwert (rNPV) von 414 Mio Euro. Die ins Modell gesteckten Annahmen sind beim derzeitigen Stand der klinischen Studien natürlich extrem vage und mit Vorsicht zu genießen. Dennoch lässt sich dieser erste Bewertungsversuch ganz gut als grobe Orientierung bzw. Diskussionsgrundlage verwenden. Vielleicht kommen wir hier darauf zurück, falls die IPO-Option real werden sollte.
Link zur Montega-Studie (pdf): http://www.dewb-vc.de/images/dokumente/research/2014-05-26%2…
Außerdem enthält die Analyse bisher unveröffentlichte Grafiken aus der Auswertung der PoC-Studien. Anschaulich sind insbesondere zwei Diagramme (s. unten) aus der P2a mit NOX-E36 (= Emapticap Pegol), die den durchschnittlichen Verlauf der beiden wichtigsten Wirksamkeitskriterien ACR (Maß für Nierenfunktionsstörung) und HbA1c (Maß für Blutzuckeranteil) bei behandelten Patienten und der Placebo-Gruppe darstellen. Bilder sagen ja bekanntlich mehr aus als 1000 Worte.
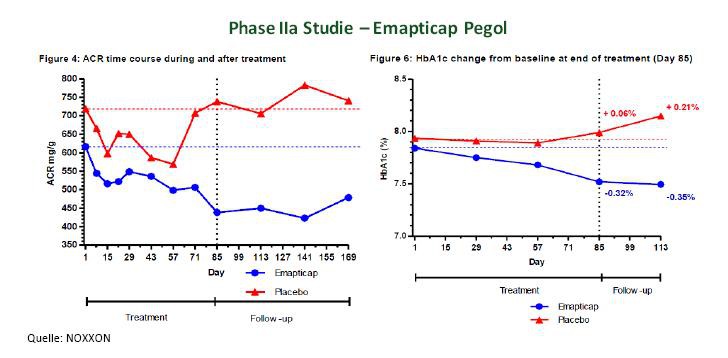
In einer aktuellen Research-Studie zu DEWB hat Montega erstmals eine Pipeline-Bewertung von Noxxon auf Basis der jüngst vorgestellten P2a-Daten vorgenommen. Ergebnis ist ein aktueller Barwert (rNPV) von 414 Mio Euro. Die ins Modell gesteckten Annahmen sind beim derzeitigen Stand der klinischen Studien natürlich extrem vage und mit Vorsicht zu genießen. Dennoch lässt sich dieser erste Bewertungsversuch ganz gut als grobe Orientierung bzw. Diskussionsgrundlage verwenden. Vielleicht kommen wir hier darauf zurück, falls die IPO-Option real werden sollte.
Link zur Montega-Studie (pdf): http://www.dewb-vc.de/images/dokumente/research/2014-05-26%2…
Außerdem enthält die Analyse bisher unveröffentlichte Grafiken aus der Auswertung der PoC-Studien. Anschaulich sind insbesondere zwei Diagramme (s. unten) aus der P2a mit NOX-E36 (= Emapticap Pegol), die den durchschnittlichen Verlauf der beiden wichtigsten Wirksamkeitskriterien ACR (Maß für Nierenfunktionsstörung) und HbA1c (Maß für Blutzuckeranteil) bei behandelten Patienten und der Placebo-Gruppe darstellen. Bilder sagen ja bekanntlich mehr aus als 1000 Worte.

02.06.14 - NOXXON: Emapticap Pegol Studie für „Late Breaking Clinical Trials Symposium“ der ERA-EDTA-Konferenz ausgewählt
Präsentation umfassender klinischer Daten für anti-CCL2 /MCP-1 Spiegelmer® Emapticap Pegol (NOX-E36)
Berlin, Deutschland - 2. Juni 2014 - NOXXON Pharma AG gab bekannt, dass Herr Prof. Dr. Hermann Haller, Direktor der Abteilung für Nephrologie und Hypertonie der Medizinischen Hochschule Hannover, in seiner Rolle als Studienleiter eingeladen wurde, die vollständigen Ergebnisse der klinischen Phase IIa-Studie mit Emapticap Pegol (NOX-E36) für die Behandlung der diabetischen Nephropathie auf dem Kongress der „European Renal Association“ und der „European Dialysis and Transplant Association“ (ERA-EDTA) vorzustellen.
Die Präsentation mit dem Titel „CCL2 inhibition with emapticap pegol (NOX‐E36) in type 2 diabetic patients with albuminuria” wurde im Rahmen des ersten „Late Breaking Clinical Trials Symposiums“ am Sonntag, den 1. Juni gehalten. Der ERA-EDTA-Kongress ist Europas wichtigste nephrologische Fachkonferenz, die sich u.a. mit Themen aus den Bereichen Physiologie, klinische Nephrologie, Dialyse und Transplantation befasst.
Emapticap Pegol (NOX-E36) ist ein Spiegelmer®, welches an das Chemokin CCL2 (MCP-1) bindet und dieses neutralisiert. Basierend auf vorklinischen Arbeiten wird angenommen, dass diese Neutralisierung die Infiltration inflammatorischer Immunzellen in die Niere verhindert und dadurch eine existierende Entzündung mit der Zeit abklingen kann. Als Konsequenz werden u.a. die Erhaltung der Podozytenzahl sowie der Nierenstruktur und -funktion erwartet. Das Ziel der Studie war es, das renoprotektive und das antidiabetische Potenzial von Emapticap Pegol bei Typ-2-Diabetikern mit Albuminurie zu untersuchen.
Die explorative klinische Studie wurde als randomisierte, doppelblinde, Placebo-kontrollierte Phase IIa-Studie angelegt und rekrutierte 75 albuminurische Typ-2-Diabetiker auf stabiler Standardtherapie einschließlich obligatorischer RAS*-Blockade. Emapticap Pegol wurde zweimal wöchentlich subkutan mit 0,5 mg/kg über 12 Wochen verabreicht, gefolgt von einer behandlungsfreien Beobachtungsphase von 12 Wochen.
In der Gesamtgruppe/ Intent-to-Treat (ITT) Population ergab sich ein starker Trend für eine Reduktion der im Urin ausgeschiedenen Proteinmenge, gemessen anhand des Albumin/Kreatinin Verhältnisses (Albumin-Creatinine-Ratio, ACR) sowie für die Erniedrigung des an Glukose gebundenen Hämoglobins (HbA1c) im Blut. In einer als „Primary Efficacy Analysis Set“ (PEAS) definierten Untergruppe von 49 Patienten, die von NOXXON als relevanteste für zukünftige Studien in dieser Indikation angesehen wird, erreichten diese Effekte statistische Signifikanz (siehe Tabelle). Der PEAS Datensatz schließt Patienten mit schweren Abweichungen vom Studienprotokoll, Patienten mit doppelter RAS*-Blockade, die nunmehr allgemein als kontraindiziert angesehen wird, und Patienten mit gleichzeitiger Hämaturie und Leukozyturie – ein Hinweis auf andere Nierenerkrankungen als diabetische Nephropathie – aus. Generell erwies sich Emapticap Pegol in dieser Studie als sicher und gut verträglich.
TABELLE SIEHE DEWB PM
Besonders erwähnenswert ist in diesem Zusammenhang, dass die Effekte auf ACR und HbA1c nicht von relevanten hämodynamischen Veränderungen begleitet wurden. Dies deutet auf einen neuartigen Wirkmechanismus hin und unterscheidet Emapticap Pegol von bereits zugelassenen Medikamenten.
Prof. Haller fasst zusammen: „Die Inhibierung der CCL2:CCR2 Bindung durch Emapticap Pegol ist gut verträglich und reduziert ACR und HbA1c bei Typ-2-Diabetikern mit Albuminurie. Die Aufrechterhaltung der Wirkung auch nach Beendigung der Behandlung lässt vermuten, dass die CCL2-Blockade die zugrunde liegende Pathophysiologie beeinflusst. Emapticap Pegol könnte daher das erste krankheitsmodifizierende Medikament für diese Indikation darstellen.“
Präsentation umfassender klinischer Daten für anti-CCL2 /MCP-1 Spiegelmer® Emapticap Pegol (NOX-E36)
Berlin, Deutschland - 2. Juni 2014 - NOXXON Pharma AG gab bekannt, dass Herr Prof. Dr. Hermann Haller, Direktor der Abteilung für Nephrologie und Hypertonie der Medizinischen Hochschule Hannover, in seiner Rolle als Studienleiter eingeladen wurde, die vollständigen Ergebnisse der klinischen Phase IIa-Studie mit Emapticap Pegol (NOX-E36) für die Behandlung der diabetischen Nephropathie auf dem Kongress der „European Renal Association“ und der „European Dialysis and Transplant Association“ (ERA-EDTA) vorzustellen.
Die Präsentation mit dem Titel „CCL2 inhibition with emapticap pegol (NOX‐E36) in type 2 diabetic patients with albuminuria” wurde im Rahmen des ersten „Late Breaking Clinical Trials Symposiums“ am Sonntag, den 1. Juni gehalten. Der ERA-EDTA-Kongress ist Europas wichtigste nephrologische Fachkonferenz, die sich u.a. mit Themen aus den Bereichen Physiologie, klinische Nephrologie, Dialyse und Transplantation befasst.
Emapticap Pegol (NOX-E36) ist ein Spiegelmer®, welches an das Chemokin CCL2 (MCP-1) bindet und dieses neutralisiert. Basierend auf vorklinischen Arbeiten wird angenommen, dass diese Neutralisierung die Infiltration inflammatorischer Immunzellen in die Niere verhindert und dadurch eine existierende Entzündung mit der Zeit abklingen kann. Als Konsequenz werden u.a. die Erhaltung der Podozytenzahl sowie der Nierenstruktur und -funktion erwartet. Das Ziel der Studie war es, das renoprotektive und das antidiabetische Potenzial von Emapticap Pegol bei Typ-2-Diabetikern mit Albuminurie zu untersuchen.
Die explorative klinische Studie wurde als randomisierte, doppelblinde, Placebo-kontrollierte Phase IIa-Studie angelegt und rekrutierte 75 albuminurische Typ-2-Diabetiker auf stabiler Standardtherapie einschließlich obligatorischer RAS*-Blockade. Emapticap Pegol wurde zweimal wöchentlich subkutan mit 0,5 mg/kg über 12 Wochen verabreicht, gefolgt von einer behandlungsfreien Beobachtungsphase von 12 Wochen.
In der Gesamtgruppe/ Intent-to-Treat (ITT) Population ergab sich ein starker Trend für eine Reduktion der im Urin ausgeschiedenen Proteinmenge, gemessen anhand des Albumin/Kreatinin Verhältnisses (Albumin-Creatinine-Ratio, ACR) sowie für die Erniedrigung des an Glukose gebundenen Hämoglobins (HbA1c) im Blut. In einer als „Primary Efficacy Analysis Set“ (PEAS) definierten Untergruppe von 49 Patienten, die von NOXXON als relevanteste für zukünftige Studien in dieser Indikation angesehen wird, erreichten diese Effekte statistische Signifikanz (siehe Tabelle). Der PEAS Datensatz schließt Patienten mit schweren Abweichungen vom Studienprotokoll, Patienten mit doppelter RAS*-Blockade, die nunmehr allgemein als kontraindiziert angesehen wird, und Patienten mit gleichzeitiger Hämaturie und Leukozyturie – ein Hinweis auf andere Nierenerkrankungen als diabetische Nephropathie – aus. Generell erwies sich Emapticap Pegol in dieser Studie als sicher und gut verträglich.
TABELLE SIEHE DEWB PM
Besonders erwähnenswert ist in diesem Zusammenhang, dass die Effekte auf ACR und HbA1c nicht von relevanten hämodynamischen Veränderungen begleitet wurden. Dies deutet auf einen neuartigen Wirkmechanismus hin und unterscheidet Emapticap Pegol von bereits zugelassenen Medikamenten.
Prof. Haller fasst zusammen: „Die Inhibierung der CCL2:CCR2 Bindung durch Emapticap Pegol ist gut verträglich und reduziert ACR und HbA1c bei Typ-2-Diabetikern mit Albuminurie. Die Aufrechterhaltung der Wirkung auch nach Beendigung der Behandlung lässt vermuten, dass die CCL2-Blockade die zugrunde liegende Pathophysiologie beeinflusst. Emapticap Pegol könnte daher das erste krankheitsmodifizierende Medikament für diese Indikation darstellen.“
... kann jemand von euch diese Daten für mich als Laien mal näher erläutern, sind diese wirklich signifikant? Ich habe immer das Gefühl, dass solche Daten speziell von den betroffenen Unternehmen immer sehr positiv dargestellt werden. Deshalb war ich letztes Jahr extra auf einer Präsentation von NOXXON auf dem Deutschen Eigenkapitalforum. Ich verstand als Nichtmediziner leider nur "railway station" (also Bahnhof, aber die Präsentation war in ja in Englisch
Viele Grüße
il

Viele Grüße
il
Zitat von ilsubstanzinvestore: ... kann jemand von euch diese Daten für mich als Laien mal näher erläutern, sind diese wirklich signifikant?
Kurze Antwort: JA!
Albuminurie (=Eiweissverlust über die Niere) ist ein rel. frühes Zeichen der Schädigung durch die Zuckerkrankheit. Wiederum die Hemmung des weiteren Albuminverlustes (z.B. mit ACE-Hemmern = "Blockade des RAS") bessert die Aussichten des Patienten, insbesondere auch längerfristig nicht an der Dialyse zu landen. Ist interessant, braucht aber noch mind. 1 große, langlaufende Studie bis zu einem Wirkbeweis/Zulassung, ich denke dass 5 Jahre frühestmöglich sind. Und das kostet bis dahin locker nochmal 20-50 Mio €. Chance, dass die Substanz wirklich am Markt ankommt, würde ich derzeit mit 30-40% einschätzen.
Antwort auf Beitrag Nr.: 47.085.656 von ilsubstanzinvestore am 02.06.14 13:14:56Hallo il,
Statistik ist in der Tat eine ziemlich heikle Angelegenheit, bei der man mit Argusaugen auf Aussagen/Behauptungen schauen muss, um keiner Fehlinterpretation aufzusitzen.
Ein gemessener Parameter in einer klinischen Studie, der die Wirksamkeit eines Medikamentes belegen soll - wie z.B. die Parameter ACR bzw. HbA1c bei der NOX-E36-Studie -, gilt dann im Vergleich zu Placebo als statistisch signifikant unterschiedlich, wenn der ermittelte p-Wert kleiner als 0,05 ist. Wie man der Tabelle entnehmen kann, ist dies in der PEAS-Gruppe der Fall (bei HbA1c allerdings erst im Peak-Effekt nach 113 Tagen). In der gesamten Gruppe (ITT) ist dagegen keine Signifikanz gegeben, die p-Werte sind zu groß.
Dieser p-Wert, der in klinischen Studien immer als Signifikanzargument angegeben wird, sagt theoretisch jedoch nur sehr wenig aus und ist unter Statistikern höchst umstritten. Er gibt nur an, wie groß die Wahrscheinlichkeit ist, dass man ein solches real gemessenes Studienergebnis erhält, obwohl es tatsächlich keine Wirksamkeit gibt, man also einem zufälligen Irrtum aufsitzt. Je kleiner der p-Wert ist, desto unwahrscheinlicher ist ein zufälliger Irrtum. Ist p kleiner als 0,05, so geht man davon aus, dass die in der Studie gemessene Wirksamkeit kein Irrtum ist.
Allerdings sagt dieser p-Wert nichts darüber aus, wie stark der Wirksamkeitseffekt tatsächlich ist, er gibt keine Auskunft über die medizinische Relevanz der erhobenen Patienten-Ergebnisse. Das muss man anhand anderer Kenngrößen messen/beurteilen bzw. in zusätzlichen Studien weiter überprüfen.
Konkret auf die P2a-Daten bei NOX-E36 bezogen heißt das: Die Studie war erfolgreich in dem Sinne, dass eine Wirksamkeit von NOX-E36 gegenüber Placebo anhand der Kriterien ACR und HbA1c in der PEAS-Gruppe nachgewiesen werden konnte, die als statistisch signifikant belegt ist (p < 0,05). Außerdem gab es weitere positive Erkenntnisse (z.B. keine bedeutenden Nebenwirkungen, keine relevanten hämodynamischen Veränderungen). Eine Verpartnerung/Auslizensierung von NOX-E36 auf Basis dieser Ergebnisse sollte m.E. möglich sein. Eine Garantie gibt es dafür jedoch nicht. Jedes interessierte Pharma wird sich die Daten aller Patienten jetzt in aller Ausführlichkeit anschauen (Due Diligence) und dann in Verhandlungen mit Noxxon eintreten oder auch nicht. Das Ergebnis kann man beim besten Willen nicht vorhersagen. Meine Meinung: Die bisherigen Ergebnisse sind nahe am oberen positiven Rand dessen, was alles passieren konnte.
Erklärung p-Wert: http://de.wikipedia.org/wiki/P-Wert
Diskussion zum p-Wert: http://www.spektrum.de/alias/umstrittene-statistik/wenn-fors…
Grüße
Tabelle: Ergebnisse der P2a mit NOX-E36 (Quelle: http://www.dewb-vc.de/de/portfolio/newsarchiv/959-02-06-14-n…)
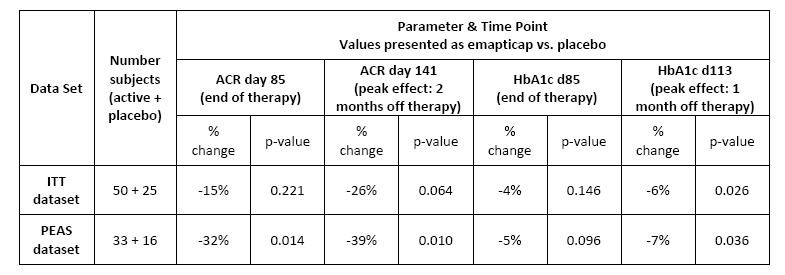
Statistik ist in der Tat eine ziemlich heikle Angelegenheit, bei der man mit Argusaugen auf Aussagen/Behauptungen schauen muss, um keiner Fehlinterpretation aufzusitzen.
Ein gemessener Parameter in einer klinischen Studie, der die Wirksamkeit eines Medikamentes belegen soll - wie z.B. die Parameter ACR bzw. HbA1c bei der NOX-E36-Studie -, gilt dann im Vergleich zu Placebo als statistisch signifikant unterschiedlich, wenn der ermittelte p-Wert kleiner als 0,05 ist. Wie man der Tabelle entnehmen kann, ist dies in der PEAS-Gruppe der Fall (bei HbA1c allerdings erst im Peak-Effekt nach 113 Tagen). In der gesamten Gruppe (ITT) ist dagegen keine Signifikanz gegeben, die p-Werte sind zu groß.
Dieser p-Wert, der in klinischen Studien immer als Signifikanzargument angegeben wird, sagt theoretisch jedoch nur sehr wenig aus und ist unter Statistikern höchst umstritten. Er gibt nur an, wie groß die Wahrscheinlichkeit ist, dass man ein solches real gemessenes Studienergebnis erhält, obwohl es tatsächlich keine Wirksamkeit gibt, man also einem zufälligen Irrtum aufsitzt. Je kleiner der p-Wert ist, desto unwahrscheinlicher ist ein zufälliger Irrtum. Ist p kleiner als 0,05, so geht man davon aus, dass die in der Studie gemessene Wirksamkeit kein Irrtum ist.
Allerdings sagt dieser p-Wert nichts darüber aus, wie stark der Wirksamkeitseffekt tatsächlich ist, er gibt keine Auskunft über die medizinische Relevanz der erhobenen Patienten-Ergebnisse. Das muss man anhand anderer Kenngrößen messen/beurteilen bzw. in zusätzlichen Studien weiter überprüfen.
Konkret auf die P2a-Daten bei NOX-E36 bezogen heißt das: Die Studie war erfolgreich in dem Sinne, dass eine Wirksamkeit von NOX-E36 gegenüber Placebo anhand der Kriterien ACR und HbA1c in der PEAS-Gruppe nachgewiesen werden konnte, die als statistisch signifikant belegt ist (p < 0,05). Außerdem gab es weitere positive Erkenntnisse (z.B. keine bedeutenden Nebenwirkungen, keine relevanten hämodynamischen Veränderungen). Eine Verpartnerung/Auslizensierung von NOX-E36 auf Basis dieser Ergebnisse sollte m.E. möglich sein. Eine Garantie gibt es dafür jedoch nicht. Jedes interessierte Pharma wird sich die Daten aller Patienten jetzt in aller Ausführlichkeit anschauen (Due Diligence) und dann in Verhandlungen mit Noxxon eintreten oder auch nicht. Das Ergebnis kann man beim besten Willen nicht vorhersagen. Meine Meinung: Die bisherigen Ergebnisse sind nahe am oberen positiven Rand dessen, was alles passieren konnte.
Erklärung p-Wert: http://de.wikipedia.org/wiki/P-Wert
Diskussion zum p-Wert: http://www.spektrum.de/alias/umstrittene-statistik/wenn-fors…
Grüße
Tabelle: Ergebnisse der P2a mit NOX-E36 (Quelle: http://www.dewb-vc.de/de/portfolio/newsarchiv/959-02-06-14-n…)

Weiß nicht, ob in diesem Thread auch eher businesslastige Postings erwünscht/geduldet sind, gehe das Risiko aber mal ein:
Was haltet Ihr von der jüngsten Wandelanleihen-Finanzierung über KREOS Capital?
7 MEUR sind nicht besonders viel, aber der Datenpunkt 366,95 Wandlungspreis pro Aktie ist ganz interessant für mich:
Mit der Aktienanzahl 286.162 vom 31.12.2012 multipliziert ergibt sich daraus eine Bewertung von 105 Mio.
Was haltet Ihr von der jüngsten Wandelanleihen-Finanzierung über KREOS Capital?
7 MEUR sind nicht besonders viel, aber der Datenpunkt 366,95 Wandlungspreis pro Aktie ist ganz interessant für mich:
Mit der Aktienanzahl 286.162 vom 31.12.2012 multipliziert ergibt sich daraus eine Bewertung von 105 Mio.
Antwort auf Beitrag Nr.: 47.090.150 von Saaletaler am 03.06.14 00:33:05... ich danke euch beiden!
... na dann hoffen wir mal, dass eine Auslizensierung an einen Big Pharma stattfindet (lt. GB der DEWB scheint es zumindest diesbezüglich Bestrebungen zu geben) und damit die Beendigungen aus der Vergangenheit revidiert werden und wieder Vertrauen in NOXXON gefasst wird. Der Rest wäre dann Phantasie!
Viele Grüße
il

... na dann hoffen wir mal, dass eine Auslizensierung an einen Big Pharma stattfindet (lt. GB der DEWB scheint es zumindest diesbezüglich Bestrebungen zu geben) und damit die Beendigungen aus der Vergangenheit revidiert werden und wieder Vertrauen in NOXXON gefasst wird. Der Rest wäre dann Phantasie!
Viele Grüße
il
Antwort auf Beitrag Nr.: 47.092.282 von R-BgO am 03.06.14 11:42:01Hallo R-BgO,
hier ist im Prinzip alles willkommen, was mit Noxxon zu tun. Auf Diskussion zu DEWB würde ich gern verzichten, dafür gibt es ja die beiden anderen Threads.
Zur Kreos-Finanzierung habe ich meine Meinung in #181 geschrieben. Andere Ansichten dazu gab es im DEWB-Thread.
Die aktuelle Anzahl ausgegebener Aktien lautet 291.624 Stück (s. Eintrag im Unternehmensregister vom 13.6.2013).
Hinzu kommen aktuell 37.567 ausgegebene Wandelschuldverschreibungen (BZR-WA aus 2013 plus Kreos aus 2014).
Unter der Annahme vollständiger Wandlung wären somit 329.191 Aktien im Umlauf.
Die Kreos-Bewertung (366,95 € je Aktie) unterstellt, läge die interne Gesamtbewertung für Noxxon somit bei 121 Mio.
Ich denke, Bewertungsfragen werden richtig akut, falls es zum IPO kommt. Das dürfte sich innerhalb der nächsten 3 bis 6 Monate entscheiden.
Grüße
hier ist im Prinzip alles willkommen, was mit Noxxon zu tun. Auf Diskussion zu DEWB würde ich gern verzichten, dafür gibt es ja die beiden anderen Threads.
Zur Kreos-Finanzierung habe ich meine Meinung in #181 geschrieben. Andere Ansichten dazu gab es im DEWB-Thread.
Die aktuelle Anzahl ausgegebener Aktien lautet 291.624 Stück (s. Eintrag im Unternehmensregister vom 13.6.2013).
Hinzu kommen aktuell 37.567 ausgegebene Wandelschuldverschreibungen (BZR-WA aus 2013 plus Kreos aus 2014).
Unter der Annahme vollständiger Wandlung wären somit 329.191 Aktien im Umlauf.
Die Kreos-Bewertung (366,95 € je Aktie) unterstellt, läge die interne Gesamtbewertung für Noxxon somit bei 121 Mio.
Ich denke, Bewertungsfragen werden richtig akut, falls es zum IPO kommt. Das dürfte sich innerhalb der nächsten 3 bis 6 Monate entscheiden.
Grüße
Zitat von ilsubstanzinvestore: ... kann jemand von euch diese Daten für mich als Laien mal näher erläutern, sind diese wirklich signifikant? Ich habe immer das Gefühl, dass solche Daten speziell von den betroffenen Unternehmen immer sehr positiv dargestellt werden. Deshalb war ich letztes Jahr extra auf einer Präsentation von NOXXON auf dem Deutschen Eigenkapitalforum. Ich verstand als Nichtmediziner leider nur "railway station" (also Bahnhof, aber die Präsentation war in ja in Englisch
Viele Grüße
il
Die Änderung des HbA1c ist zwar teilweise statistisch signifikant, allerdings relativ gering ausgeprägt, macht bei "üblichen" Werten eines Diabetikers von (absolut) 7% also einen Abfall auf z.B. 6,7%. Das ist allein betrachtet nur ein mäßiger Effekt und braucht der Bestätigung in größeren Studien. Ich finde auf diesen Marker bezogen interessant, dass die Substanz von NOXXON darauf überhaupt einen positiven Effekt hat, der Wirkmechanismus ist zunächst nicht einleuchtend. Die Kombination beider Effekte (geringere Eiweissverluste und bessere Zuckereinstellung) kann dann doch schon wieder für den Patienten spannend an.
NOXXON präsentiert aktualisierte Zwischenergebnisse der Phase II-Studien mit Olaptesed Pegol (NOX-A12) in CLL und MM sowie Daten einer Pilotstudie zu Lexaptepid Pegol (NOX H94) in anämischen Krebspatienten
http://www.dewb-vc.de/de/portfolio/newsarchiv/960-13-06-14-n…
Vier Posterpräsentationen zu Wirkstoffen von NOXXON auf dem Kongress der „European Hematology Association” (EHA)
Berlin, Deutschland - 13. Juni 2014 - NOXXON Pharma präsentiert aktualisierte Zwischenergebnisse aus zwei unabhängigen klinischen Phase IIa-Studien des anti-CXCL12/SDF-1 Spiegelmers Olaptesed Pegol (NOX-A12) und das Ergebnis einer Phase IIa-Pilotstudie mit dem anti-Hepcidin Spiegelmer® Lexaptepid Pegol (NOX H94) zur Behandlung von Anämie bei chronischen Erkrankungen auf dem 19. Kongress der „European Hematology Association“ (EHA), der vom 12. bis 15. Juni in Mailand, Italien stattfindet.
In der ersten Studie wurden Patienten mit rezidivierender chronischer lymphatischer Leukämie (CLL) mit Olaptesed Pegol in Kombination mit Bendamustin und Rituximab (BR) behandelt. Olaptesed Pegol führte zu einer effektiven und anhaltenden Mobilisierung von CLL-Zellen in das periphere Blut. Diese Mobilisierung spiegelt die Fähigkeit von Olaptesed Pegol wider, Wechselwirkungen zwischen dem Tumor und seinem umgebenden Mikromilieu zu blockieren. Man geht davon aus, dass dadurch die Empfindlichkeit der Tumorzellen gegenüber Chemotherapeutika erhöht wird. Bisher wurde die Ansprechrate von 20 Patienten nach Beendigung der Therapie ausgewertet, wobei vier Patienten (20%) eine komplette Remission und 13 Patienten (65%) eine partielle Remission erreichten. Die Gesamtansprechrate betrug 85%. Im Vergleich zu historischen Kontrollen unter BR Basistherapie schneidet Olaptesed Pegol in Bezug auf die Gesamtansprechrate positiv ab und zeigt eine erhöhte komplette Remissionsrate. Zusätzlich zeigte die Auswertung der Baseline-Charakteristika, dass rezidivierte / refraktäre Patienten in die Studie eingeschlossen waren, was die klinische Relevanz der beobachteten Effekte unterstreicht und die weitere Entwicklung dieses anti-CXCL12 Spiegelmers für CLL rechtfertigt.
In einer zweiten Studie mit 28 Patienten mit rezidiviertem Multiplem Myelom (MM) wurde Olaptesed Pegol mit Velcade®/Bortezomib und Dexamethason (VD) kombiniert. Olaptesed Pegol führte zu einer effektiven und langanhaltenden Mobilisierung von Plasmazellen in das periphere Blut. Ergebnisse von 20 Patienten ergaben eine Gesamtansprechrate von 70%, sechs der Patienten zeigten ein sehr gutes partielles Ansprechen und acht ein partielles Ansprechen, im Vergleich zu publizierten Ergebnissen nach VD Therapie ein positives Ergebnis. Ein weiterer wichtiger Aspekt ist, dass die Behandlung mit Olaptesed Pegol nicht mit zusätzlicher Toxizität im Vergleich zu einer alleinigen VD Therapie verbunden war. Besonders in Anbetracht der Tatsache, dass die Studienpopulation sowohl Patienten, die wiederholt mit Bortezomib behandelt wurden, als auch Patienten mit ungünstiger Zytogenetik umfasste, unterstützen diese Ergebnisse die weitere Entwicklung von Olaptesed Pegol in MM.
Eine zusätzliche präklinische Studie mit Olaptesed Pegol legt nahe, dass die Inhibition von CXCL12 die Ausbreitung von Multiplen Myelom-Zellen in entfernte Knochenmarknischen und den Übergang von MGUS (mikrometastatische Stufe) zu aktiver MM (makrometastatische Stufe) verhindern könnte.
Die Ergebnisse einer Pilotstudie mit einer Monotherapie von Lexaptepid Pegol bei anämischen Krebspatienten zeigten einen pharmakodynamischen Effekt (Abnahme von Ferritin im Blut) bei 10 von 12 Patienten und eine Zunahme der Hämoglobinkonzentration von 1 g/dl oder mehr bei 5 von 12 Patienten. Diese Daten unterstützen das Konzept der Hepcidininhibition als vielversprechende Behandlungsoption bei krebsbedingter Anämie. Hohe Hepcidinspiegel, wie sie häufig bei Krebs- oder Dialysepatienten gefunden werden, führen zu einem funktionellen Eisenmangel. Bei diesem Zustand, auch Eisenrestriktion genannt, akkumuliert Eisen in den entsprechenden Speicherzellen, kann aber nicht freigesetzt werden und steht somit nicht zur Hämoglobinsynthese zur Verfügung.
...
(Die vier Abstracts folgen ausführlich.)
http://www.dewb-vc.de/de/portfolio/newsarchiv/960-13-06-14-n…
Vier Posterpräsentationen zu Wirkstoffen von NOXXON auf dem Kongress der „European Hematology Association” (EHA)
Berlin, Deutschland - 13. Juni 2014 - NOXXON Pharma präsentiert aktualisierte Zwischenergebnisse aus zwei unabhängigen klinischen Phase IIa-Studien des anti-CXCL12/SDF-1 Spiegelmers Olaptesed Pegol (NOX-A12) und das Ergebnis einer Phase IIa-Pilotstudie mit dem anti-Hepcidin Spiegelmer® Lexaptepid Pegol (NOX H94) zur Behandlung von Anämie bei chronischen Erkrankungen auf dem 19. Kongress der „European Hematology Association“ (EHA), der vom 12. bis 15. Juni in Mailand, Italien stattfindet.
In der ersten Studie wurden Patienten mit rezidivierender chronischer lymphatischer Leukämie (CLL) mit Olaptesed Pegol in Kombination mit Bendamustin und Rituximab (BR) behandelt. Olaptesed Pegol führte zu einer effektiven und anhaltenden Mobilisierung von CLL-Zellen in das periphere Blut. Diese Mobilisierung spiegelt die Fähigkeit von Olaptesed Pegol wider, Wechselwirkungen zwischen dem Tumor und seinem umgebenden Mikromilieu zu blockieren. Man geht davon aus, dass dadurch die Empfindlichkeit der Tumorzellen gegenüber Chemotherapeutika erhöht wird. Bisher wurde die Ansprechrate von 20 Patienten nach Beendigung der Therapie ausgewertet, wobei vier Patienten (20%) eine komplette Remission und 13 Patienten (65%) eine partielle Remission erreichten. Die Gesamtansprechrate betrug 85%. Im Vergleich zu historischen Kontrollen unter BR Basistherapie schneidet Olaptesed Pegol in Bezug auf die Gesamtansprechrate positiv ab und zeigt eine erhöhte komplette Remissionsrate. Zusätzlich zeigte die Auswertung der Baseline-Charakteristika, dass rezidivierte / refraktäre Patienten in die Studie eingeschlossen waren, was die klinische Relevanz der beobachteten Effekte unterstreicht und die weitere Entwicklung dieses anti-CXCL12 Spiegelmers für CLL rechtfertigt.
In einer zweiten Studie mit 28 Patienten mit rezidiviertem Multiplem Myelom (MM) wurde Olaptesed Pegol mit Velcade®/Bortezomib und Dexamethason (VD) kombiniert. Olaptesed Pegol führte zu einer effektiven und langanhaltenden Mobilisierung von Plasmazellen in das periphere Blut. Ergebnisse von 20 Patienten ergaben eine Gesamtansprechrate von 70%, sechs der Patienten zeigten ein sehr gutes partielles Ansprechen und acht ein partielles Ansprechen, im Vergleich zu publizierten Ergebnissen nach VD Therapie ein positives Ergebnis. Ein weiterer wichtiger Aspekt ist, dass die Behandlung mit Olaptesed Pegol nicht mit zusätzlicher Toxizität im Vergleich zu einer alleinigen VD Therapie verbunden war. Besonders in Anbetracht der Tatsache, dass die Studienpopulation sowohl Patienten, die wiederholt mit Bortezomib behandelt wurden, als auch Patienten mit ungünstiger Zytogenetik umfasste, unterstützen diese Ergebnisse die weitere Entwicklung von Olaptesed Pegol in MM.
Eine zusätzliche präklinische Studie mit Olaptesed Pegol legt nahe, dass die Inhibition von CXCL12 die Ausbreitung von Multiplen Myelom-Zellen in entfernte Knochenmarknischen und den Übergang von MGUS (mikrometastatische Stufe) zu aktiver MM (makrometastatische Stufe) verhindern könnte.
Die Ergebnisse einer Pilotstudie mit einer Monotherapie von Lexaptepid Pegol bei anämischen Krebspatienten zeigten einen pharmakodynamischen Effekt (Abnahme von Ferritin im Blut) bei 10 von 12 Patienten und eine Zunahme der Hämoglobinkonzentration von 1 g/dl oder mehr bei 5 von 12 Patienten. Diese Daten unterstützen das Konzept der Hepcidininhibition als vielversprechende Behandlungsoption bei krebsbedingter Anämie. Hohe Hepcidinspiegel, wie sie häufig bei Krebs- oder Dialysepatienten gefunden werden, führen zu einem funktionellen Eisenmangel. Bei diesem Zustand, auch Eisenrestriktion genannt, akkumuliert Eisen in den entsprechenden Speicherzellen, kann aber nicht freigesetzt werden und steht somit nicht zur Hämoglobinsynthese zur Verfügung.
...
(Die vier Abstracts folgen ausführlich.)
Antwort auf Beitrag Nr.: 47.150.050 von Saaletaler am 13.06.14 15:47:47Daten der P2a-Pilotstudie mit NOX-H94 bei anämischen Krebspatienten auf dem EHA-Meeting 2014
Studienprotokoll: http://clinicaltrials.gov/ct2/show/NCT01691040
Abstract von Pencho Georgiev et al.: https://b-com.mci-group.com/EventProgramme/EHA19.aspx
THE ANTI-HEPCIDIN SPIEGELMER® LEXAPTEPID PEGOL (NOX-H94) AS TREATMENT OF ANEMIA OF CHRONIC DISEASE IN PATIENTS WITH MULTIPLE MYELOMA, LOW GRADE LYMPHOMA, AND CLL: A PHASE II PILOT STUDY
Background: Lexaptepid pegol (LP) is a PEGylated L-stereoisomer RNA aptamer that binds and neutralizes hepcidin. Hepcidin, a 25 amino acid peptide induced by inflammatory stimuli is a pivotal regulator of iron resorption and iron release from intracellular stores, which are severely impaired in anemia of chronic disease. Disturbances in iron metabolism resulting in functional iron deficiency are a key component of anemia of chronic disease which frequently complicates malignant disease.
Aims: We evaluated the pharmacokinetics, pharmacodynamics, safety and efficacy of hepcidin blockade by LP as sole treatment of anemia of chronic disease in patients with multiple myeloma, low grade lymphoma, and CLL.
Methods: Twelve patients with functional iron deficiency anemia with the following baseline characteristics, presented as median (range), were enrolled: age 64 years (35‑77), hemoglobin (Hb) 9.6 g/dL (8.0‑10.7), serum ferritin 317 µg/L (193‑2805), serum iron 29 µg/dL (18‑97), and transferrin saturation 12% (6‑46). LP was injected i.v. at a dose of 1.2 mg/mg, TIW for 4 weeks. Blood counts, serum biochemistry, and iron status were evaluated weekly until two weeks post treatment and at week four after the end of therapy. The primary endpoint was increase in Hb by ≥1 g/dL at any time between start of therapy until 1 week after end of treatment. The study has the clinicaltrials.gov identifier NCT 01691040.
Summary/Conclusion: Treatment with LP resulted in a significant increase in Hb levels (≥1 g/dL) in 5 of 12 patients supporting the concept of hepcidin inhibition as valuable treatment of chronic anemia of cancer. Responding patients showed an increase in reticulocyte hemoglobin. Baseline levels of MCV, Chr and sTfR were identified as potential diagnostic predictors that could support the selection of patients with an increased susceptibility for this therapy. After confirmation in additional clinical trials these predictive markers could help to increase response rates in this indication.
Studienprotokoll: http://clinicaltrials.gov/ct2/show/NCT01691040
Abstract von Pencho Georgiev et al.: https://b-com.mci-group.com/EventProgramme/EHA19.aspx
THE ANTI-HEPCIDIN SPIEGELMER® LEXAPTEPID PEGOL (NOX-H94) AS TREATMENT OF ANEMIA OF CHRONIC DISEASE IN PATIENTS WITH MULTIPLE MYELOMA, LOW GRADE LYMPHOMA, AND CLL: A PHASE II PILOT STUDY
Background: Lexaptepid pegol (LP) is a PEGylated L-stereoisomer RNA aptamer that binds and neutralizes hepcidin. Hepcidin, a 25 amino acid peptide induced by inflammatory stimuli is a pivotal regulator of iron resorption and iron release from intracellular stores, which are severely impaired in anemia of chronic disease. Disturbances in iron metabolism resulting in functional iron deficiency are a key component of anemia of chronic disease which frequently complicates malignant disease.
Aims: We evaluated the pharmacokinetics, pharmacodynamics, safety and efficacy of hepcidin blockade by LP as sole treatment of anemia of chronic disease in patients with multiple myeloma, low grade lymphoma, and CLL.
Methods: Twelve patients with functional iron deficiency anemia with the following baseline characteristics, presented as median (range), were enrolled: age 64 years (35‑77), hemoglobin (Hb) 9.6 g/dL (8.0‑10.7), serum ferritin 317 µg/L (193‑2805), serum iron 29 µg/dL (18‑97), and transferrin saturation 12% (6‑46). LP was injected i.v. at a dose of 1.2 mg/mg, TIW for 4 weeks. Blood counts, serum biochemistry, and iron status were evaluated weekly until two weeks post treatment and at week four after the end of therapy. The primary endpoint was increase in Hb by ≥1 g/dL at any time between start of therapy until 1 week after end of treatment. The study has the clinicaltrials.gov identifier NCT 01691040.
| Results: Five of the 12 patients reached the target Hb increase of ≥1 g/dL, 3 patients achieved this goal within 2 weeks. Four of the 5 responding patients had hypochromic red cells (MCH 22‑26 pg) and moderately increased baseline ferritin levels (200‑350 µg/L). Median serum ferritin decreased from 317 to 232 µg/L (p=0.014) in the entire cohort of patients, and from 253 to 203 µg/L in responders (p=n.s). Reticulocyte hemoglobin (Chr) increased from 22.0 to 25.2 pg (p=0.019) in responding patients, while in non-responders no increase was noted (30.0 to 30.1 pg). Similarly, a tendency towards increased reticulocyte indices was observed in the responding patients (0.9 to 1.3, p=n.s.) only. Soluble transferrin receptor levels (sTfR) did not vary significantly in the entire group and in the responders as well (10.6 to 10.3 mg/L, p=n.s.). Baseline hepcidin levels of 12.7 nM (4.9‑54.5) were increased in patients in comparison to those obtained in healthy volunteers in former clinical trials (1.78 nM (0.37‑7.26). Patients with mean corpuscular volume (MCV) or Chr baseline levels below the lower limit of the normal range (MCV < 82fL, Chr < 28pg) represent 75% of the responders, respectively, and all patients with high baseline sTfR levels (> 8 mg/L) reached the primary endpoint. Treatment with LP was well tolerated without major adverse reactions. | 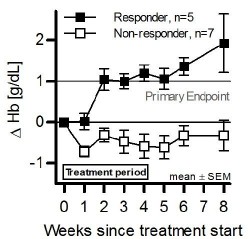 |
Summary/Conclusion: Treatment with LP resulted in a significant increase in Hb levels (≥1 g/dL) in 5 of 12 patients supporting the concept of hepcidin inhibition as valuable treatment of chronic anemia of cancer. Responding patients showed an increase in reticulocyte hemoglobin. Baseline levels of MCV, Chr and sTfR were identified as potential diagnostic predictors that could support the selection of patients with an increased susceptibility for this therapy. After confirmation in additional clinical trials these predictive markers could help to increase response rates in this indication.
Antwort auf Beitrag Nr.: 47.150.050 von Saaletaler am 13.06.14 15:47:47Zwischendaten der P2a mit NOX-A12 bei MM auf dem EHA-Meeting 2014
Studienprotokoll: http://clinicaltrials.gov/ct2/show/NCT01521533
Abstract von Heinz Ludwig et al.: https://b-com.mci-group.com/EventProgramme/EHA19.aspx
INTERIM RESULTS FROM A PHASE IIA STUDY OF THE ANTI-CXCL12 SPIEGELMER OLAPTESED PEGOL (NOX-A12) IN COMBINATION WITH BORTEZOMIB AND DEXAMETHASONE IN PATIENTS WITH MULTIPLE MYELOMA
Background: Olaptesed pegol (NOX-A12) is a novel L-stereoisomer RNA aptamer (Spiegelmer®) that binds and neutralizes the chemokine CXCL12 with high affinity. CXCL12, through interaction with the chemokine receptors CXCR4 and CXCR7, is responsible for homing and trafficking of healthy and malignant blood cells to the bone marrow (BM) stroma. Preclinical studies have shown synergistic activity of CXCL12-targeting and anti-myeloma agents, specifically bortezomib, suggesting that targeting of the myeloma niche may enhance treatment efficacy.
Aims: Here we aim to assess the activity and safety of olaptesed in combination with bortezomib and dexamethasone in patients with relapsed/refractory multiple myeloma (MM).
Methods: Twenty-nine patients with relapsed or refractory MM were enrolled. At this time, data from 20 patients (10 males and 10 females) are evaluable. Median (range) age was 65 years (48-79). Patients had received 2 (1-6) prior treatment lines. Pre-treatment consisted of dexamethasone in 19, lenalidomide in 15, bortezomib in 10 and carfilzomib in 1 patient. Seven patients underwent stem cell transplantation. Four patients presented with ISS stage I, 8 with stage 2 and 8 with stage III. Twelve patients had IgG, 2 presented with IgA and 6 with light chain myeloma. Thirteen patients had “high-risk” cytogenetic aberrations, defined by the presence of t(4;14) or del17p. Six patients were refractory to their last prior treatment, 10 were progressing during or shortly after maintenance therapy, mostly lenalidomide-dexamethasone.
Patients were treated using a dose titration design with intravenous olaptesed at doses increasing from 1 mg/kg to 2 mg/kg and 4 mg/kg at cycles 1, 2 and 3, respectively, at 1 hour prior to bortezomib administration. During cycles 4 to 8, olaptesed was dosed at the highest individually titrated dose. Bortezomib (1.3 mg/m2) was given on days 1, 4, 8 and 11 as intravenous injection. Oral dexamethasone (20 mg) was added on the day of and the day after bortezomib administration. Response was evaluated based on the uniform response criteria of the IMWG (Rajkumar SV et. al. Blood 2011; 117: 4691-5). To study PK/PD, a pilot dose of 1 to 4 mg/kg olaptesed alone was administered to the initial 10 patients before the start of the regular treatment regimen.
Summary/Conclusion: The analysis of 20 evaluable patients documented an ORR of 70%, which is comparable to published data of the VD regimen. Considering that the study population included patients retreated with bortezomib and a marked proportion of patients with unfavorable cytogenetics, these results support the further development of olaptesed pegol in MM.
------------------------------------------------------------------------------------------------------------------------------------------------------
Ergebnisse einer präklinischen Studie mit NOX-A12 bei MM auf dem EHA-Meeting 2014
Abstract von Aldo Roccaro et al.: https://b-com.mci-group.com/EventProgramme/EHA19.aspx
IN VIVO TARGETING OF STROMAL-DERIVED FACTOR-1 AS A STRATEGY TO PREVENT MYELOMA CELL BONE TO BONE DISSEMINATION
Background: Multiple myeloma (MM) patients present with multiple lytic lesions at diagnosis, indicating the presence of continuous dissemination of MM cells from the primary site of tumor development to multiple distant bone marrow (BM) niches. We hypothesized that stromal-derived factor-1 (SDF1) may represent a target for preventing transition from MGUS (micrometastatic-stage) to active-MM (macrometastatic-stage). We therefore evaluated SDF1 expression in the BM of patients with MGUS, MM, compared to healthy individuals; and tested the effect of SDF1 neutralization withing the bone marrow niches as a strategu to precent MM cell homing and disease progression.
Aims: 1) To evaluate the level of SDF-1 in MM cell-colonized bone marrow niches. 2) To evaluate the effect of SDF-1 neutralization on modulating the bone marrow niches and its effect on preventing MM cell colonization and growth.
Methods: SDF1 levels were evaluated by immunohistochemistry on BM specimens of patients with MGUS, active-MM, or healthy individuals; and confirmed by ELISA, using conditioned-medium of BM-mesenchymal stromal cells (BM-MSCs) from MGUS, active-MM and healthy individuals. BM metastatic lesions from primary epithelial tumors were also evaluated, including medullary thyroid-, gastric-, renal-carcinoma, lung adenocarcinoma. Co-localization of SDF1 with MM cell (MM.1S-GFP+)-enriched BM niches was evaluated using in vivo confocal microscopy. Effect of NOX-A12 on modulating MM cell dissemination was tested in vivo, by using an in vivo MM metastasis model. In vivo homing and in vivo tumor growth of MM cells (MM.1S-GFP+/luc+) was assessed by using in vivo confocal microscopy and bioluminescence, in mice treated with 1) vehicle; 2) NOX-A12; 3) bortezomib; 4) NOX-A12+bortezomib. Effects of drug combination on dissemination of MM cells to distant BM niches was evaluated ex vivo by immunofluorescence on explanted femurs. DNA synthesis and adhesion of MM cells in the context of NOX-A12 treated primary MM BM-MSCs in presence or absence of bortezomib were tested by thymidine uptake and adhesion in vitro assay. Synergism was calculated by using CalcuSyn software.
Results: Patients with active-MM present with higher BM SDF1 expression vs MGUS patients and healthy individuals. Similarly, BM presenting with metastasis from epithelial primary tumors had higher SDF1 levels compared to healthy subjects, thus suggesting the importance of SDF1 in favoring tumor cell metastasis to BM niches. SDF1 co-localized at BM level with MM tumor cells in vivo. In vitro, NOX-A12 induced a dose-dependent de-adhesion of MM cells from the BMSCs supported by inhibition of BM-MSC-mediated phosphorylation of ERK1/2 and cofilin. Importantly, NOX-A12 induced MM cell mobilization from the BM to the peripheral blood (PB) as shown ex vivo by reduction of MM cells in the BM and increased number of MM cells within the PB compared to control mice (P<0.05). This was supported by inhibited homing and dissemination of MM cells to the BM of those mice pre-treated with NOX-A12. Similarly, NOX-A12-pre-treatred mice presented with inhibited dissemination of MM cells from bone to bone, as shown by using an in vivo model of MM metastasis (P<0.05). NOX-A12 enhanced MM cell sensitivity to bortezomib, in vivo: tumor burden was similar between NOX-A12- and control mice whereas bortezomib-treated mice showed significant reduction in tumor growth vs. control (P<0.05); importantly, significant reduction of tumor burden in those mice treated with sequential administration of NOX-A12 and bortezomib was observed, compared to bortezomib-treated mice (P <0.05). Similarly, NOX-A12+bortezomib combination induced significant inhibition of MM cell homing, as shown by in vivo confocal microscopy. In vitro studies confirmed synergism between NOX-A12 and bortezomib in modulating MM cell survival and adhesion to BM-MSCs.
Summary/Conclusion: SDF-1 represents a valid target for inhibiting MM cell dissemination to distant BM niches, thus providing the rationale for using the SDF1 inhibiting spiegelmer NOX-A12 to target MM cells at the stage of micrometastasis (MGUS), thus preventing development of macrometastatic MM.
Studienprotokoll: http://clinicaltrials.gov/ct2/show/NCT01521533
Abstract von Heinz Ludwig et al.: https://b-com.mci-group.com/EventProgramme/EHA19.aspx
INTERIM RESULTS FROM A PHASE IIA STUDY OF THE ANTI-CXCL12 SPIEGELMER OLAPTESED PEGOL (NOX-A12) IN COMBINATION WITH BORTEZOMIB AND DEXAMETHASONE IN PATIENTS WITH MULTIPLE MYELOMA
Background: Olaptesed pegol (NOX-A12) is a novel L-stereoisomer RNA aptamer (Spiegelmer®) that binds and neutralizes the chemokine CXCL12 with high affinity. CXCL12, through interaction with the chemokine receptors CXCR4 and CXCR7, is responsible for homing and trafficking of healthy and malignant blood cells to the bone marrow (BM) stroma. Preclinical studies have shown synergistic activity of CXCL12-targeting and anti-myeloma agents, specifically bortezomib, suggesting that targeting of the myeloma niche may enhance treatment efficacy.
Aims: Here we aim to assess the activity and safety of olaptesed in combination with bortezomib and dexamethasone in patients with relapsed/refractory multiple myeloma (MM).
Methods: Twenty-nine patients with relapsed or refractory MM were enrolled. At this time, data from 20 patients (10 males and 10 females) are evaluable. Median (range) age was 65 years (48-79). Patients had received 2 (1-6) prior treatment lines. Pre-treatment consisted of dexamethasone in 19, lenalidomide in 15, bortezomib in 10 and carfilzomib in 1 patient. Seven patients underwent stem cell transplantation. Four patients presented with ISS stage I, 8 with stage 2 and 8 with stage III. Twelve patients had IgG, 2 presented with IgA and 6 with light chain myeloma. Thirteen patients had “high-risk” cytogenetic aberrations, defined by the presence of t(4;14) or del17p. Six patients were refractory to their last prior treatment, 10 were progressing during or shortly after maintenance therapy, mostly lenalidomide-dexamethasone.
Patients were treated using a dose titration design with intravenous olaptesed at doses increasing from 1 mg/kg to 2 mg/kg and 4 mg/kg at cycles 1, 2 and 3, respectively, at 1 hour prior to bortezomib administration. During cycles 4 to 8, olaptesed was dosed at the highest individually titrated dose. Bortezomib (1.3 mg/m2) was given on days 1, 4, 8 and 11 as intravenous injection. Oral dexamethasone (20 mg) was added on the day of and the day after bortezomib administration. Response was evaluated based on the uniform response criteria of the IMWG (Rajkumar SV et. al. Blood 2011; 117: 4691-5). To study PK/PD, a pilot dose of 1 to 4 mg/kg olaptesed alone was administered to the initial 10 patients before the start of the regular treatment regimen.
Results: The median number of completed cycles was 7.5 (0-8). The overall response rate was 70% with 6 patients achieving VGPR and 8 PR. Minimal response was noted in 1 patient, and 3 patients had progressive disease. Levels of circulating CD138+/CD38+ plasma cells were studied for 72 hours in the pilot phase and for 24 hours at cycles 1 and 4. A 2-fold increase of plasma cells compared to baseline was noted already after one hour and an increased mobilization persisted throughout the observation period (Figure). Treatment with olaptesed in combination with VD was safe and well tolerated without a significant increase in adverse events compared to VD-treated MM patients. The dose of olaptesed was titrated up to 4 mg/kg in all 15 patients treated beyond cycle 3. | 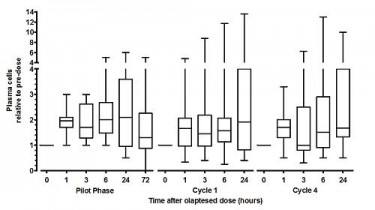 |
Summary/Conclusion: The analysis of 20 evaluable patients documented an ORR of 70%, which is comparable to published data of the VD regimen. Considering that the study population included patients retreated with bortezomib and a marked proportion of patients with unfavorable cytogenetics, these results support the further development of olaptesed pegol in MM.
------------------------------------------------------------------------------------------------------------------------------------------------------
Ergebnisse einer präklinischen Studie mit NOX-A12 bei MM auf dem EHA-Meeting 2014
Abstract von Aldo Roccaro et al.: https://b-com.mci-group.com/EventProgramme/EHA19.aspx
IN VIVO TARGETING OF STROMAL-DERIVED FACTOR-1 AS A STRATEGY TO PREVENT MYELOMA CELL BONE TO BONE DISSEMINATION
Background: Multiple myeloma (MM) patients present with multiple lytic lesions at diagnosis, indicating the presence of continuous dissemination of MM cells from the primary site of tumor development to multiple distant bone marrow (BM) niches. We hypothesized that stromal-derived factor-1 (SDF1) may represent a target for preventing transition from MGUS (micrometastatic-stage) to active-MM (macrometastatic-stage). We therefore evaluated SDF1 expression in the BM of patients with MGUS, MM, compared to healthy individuals; and tested the effect of SDF1 neutralization withing the bone marrow niches as a strategu to precent MM cell homing and disease progression.
Aims: 1) To evaluate the level of SDF-1 in MM cell-colonized bone marrow niches. 2) To evaluate the effect of SDF-1 neutralization on modulating the bone marrow niches and its effect on preventing MM cell colonization and growth.
Methods: SDF1 levels were evaluated by immunohistochemistry on BM specimens of patients with MGUS, active-MM, or healthy individuals; and confirmed by ELISA, using conditioned-medium of BM-mesenchymal stromal cells (BM-MSCs) from MGUS, active-MM and healthy individuals. BM metastatic lesions from primary epithelial tumors were also evaluated, including medullary thyroid-, gastric-, renal-carcinoma, lung adenocarcinoma. Co-localization of SDF1 with MM cell (MM.1S-GFP+)-enriched BM niches was evaluated using in vivo confocal microscopy. Effect of NOX-A12 on modulating MM cell dissemination was tested in vivo, by using an in vivo MM metastasis model. In vivo homing and in vivo tumor growth of MM cells (MM.1S-GFP+/luc+) was assessed by using in vivo confocal microscopy and bioluminescence, in mice treated with 1) vehicle; 2) NOX-A12; 3) bortezomib; 4) NOX-A12+bortezomib. Effects of drug combination on dissemination of MM cells to distant BM niches was evaluated ex vivo by immunofluorescence on explanted femurs. DNA synthesis and adhesion of MM cells in the context of NOX-A12 treated primary MM BM-MSCs in presence or absence of bortezomib were tested by thymidine uptake and adhesion in vitro assay. Synergism was calculated by using CalcuSyn software.
Results: Patients with active-MM present with higher BM SDF1 expression vs MGUS patients and healthy individuals. Similarly, BM presenting with metastasis from epithelial primary tumors had higher SDF1 levels compared to healthy subjects, thus suggesting the importance of SDF1 in favoring tumor cell metastasis to BM niches. SDF1 co-localized at BM level with MM tumor cells in vivo. In vitro, NOX-A12 induced a dose-dependent de-adhesion of MM cells from the BMSCs supported by inhibition of BM-MSC-mediated phosphorylation of ERK1/2 and cofilin. Importantly, NOX-A12 induced MM cell mobilization from the BM to the peripheral blood (PB) as shown ex vivo by reduction of MM cells in the BM and increased number of MM cells within the PB compared to control mice (P<0.05). This was supported by inhibited homing and dissemination of MM cells to the BM of those mice pre-treated with NOX-A12. Similarly, NOX-A12-pre-treatred mice presented with inhibited dissemination of MM cells from bone to bone, as shown by using an in vivo model of MM metastasis (P<0.05). NOX-A12 enhanced MM cell sensitivity to bortezomib, in vivo: tumor burden was similar between NOX-A12- and control mice whereas bortezomib-treated mice showed significant reduction in tumor growth vs. control (P<0.05); importantly, significant reduction of tumor burden in those mice treated with sequential administration of NOX-A12 and bortezomib was observed, compared to bortezomib-treated mice (P <0.05). Similarly, NOX-A12+bortezomib combination induced significant inhibition of MM cell homing, as shown by in vivo confocal microscopy. In vitro studies confirmed synergism between NOX-A12 and bortezomib in modulating MM cell survival and adhesion to BM-MSCs.
Summary/Conclusion: SDF-1 represents a valid target for inhibiting MM cell dissemination to distant BM niches, thus providing the rationale for using the SDF1 inhibiting spiegelmer NOX-A12 to target MM cells at the stage of micrometastasis (MGUS), thus preventing development of macrometastatic MM.
Antwort auf Beitrag Nr.: 47.150.050 von Saaletaler am 13.06.14 15:47:47Zwischendaten der P2a mit NOX-A12 bei CLL auf dem EHA-Meeting 2014
Studienprotokoll: http://clinicaltrials.gov/ct2/show/NCT01486797
Abstract von Michael Steurer et al.: https://b-com.mci-group.com/EventProgramme/EHA19.aspx
INTERIM RESULTS FROM A PHASE IIA STUDY OF THE ANTI-CXCL12 SPIEGELMER OLAPTESED PEGOL (NOX-A12) IN COMBINATION WITH BENDAMUSTINE/RITUXIMAB IN PATIENTS WITH CHRONIC LYMPHOCYTIC LEUKEMIA
Background: Olaptesed pegol (NOX-A12) is a novel, potent, L-stereoisomer RNA aptamer that binds and neutralizes CXCL12/SDF-1, a chemokine which attracts and activates immune- and non-immune cells via interaction with the receptors, CXCR4 and CXCR7. The signaling of CXCL12 is pivotal to the interactions of leukemic cells with bone marrow microenvironment. The therapeutic concept of olaptesed is to inhibit such tumor-supporting pathways and thereby mobilizing and sensitizing CLL cells to chemotherapy.
Aims: Here we aim to assess the activity and safety of olaptesed in combination with rituximab and bendamustine in patients with relapsed / refractory CLL.
Methods: This multicenter Phase IIa study investigates olaptesed alone and in combination with BR in relapsed / refractory CLL patients. The study population was split into a pilot and expansion group. Patients were treated using a dose titration design with intravenous (IV) olaptesed at doses increasing from 1 mg/kg to 2 mg/kg and 4 mg/kg at cycles 1, 2 and 3, respectively at 1 hour before rituximab treatment. During cycles 4 to 6, olaptesed was dosed at the highest individually titrated dose. Rituximab was administered IV at doses of 375 mg/m² on day 1 of 1st 28-day cycle and 500 mg/m on day 1 of subsequent cycles. Bendamustine (70 - 100 mg/m²) was given IV on days 2-3 (cycle 1) or days 1-2 (cycles 2-6) of each 28-day cycle following administration of rituximab. To study PK/PD, a pilot dose of 1 to 4 mg/kg olaptesed alone was administered to the initial 10 patients before start of the regular treatment regimen. Clinical response was assessed according to NCI-WG Guidelines (Hallek M et al. Blood 111; 2008: 5446-56).
To date, 20 patients are evaluable (11 women, 9 men) with a median age of 67 years (range 52 to 79). At screening 4, 7 and 9 patients presented with Binet stage A, B and C, respectively. The median prior treatment line was one. 7 patients presented an unfavorable disease state being relapsed within 24 months after fludarabine or bendamustine treatment (4 patients) or presenting a deletion/mutation of the TP53 gene (3 patients). Most patients (15 of 20) were previously treated with fludarabine or bendamustine.
Results: Flow cytometric analysis of CD19+/CD5high CLL cells showed a rapid mobilization of these cells into the peripheral blood which lasted throughout the observational time of 72h. Reduction of lymphadenopathy by ≥ 50% occurred in 11 out of 14 evaluable patients by the end of treatment. Concomitantly, rapid reduction of lymphocytosis in peripheral blood with normalization by treatment cycle 2 – 3 was observed. Also, the CLL to leukocyte ratio improved on average from > 60% in cycle 1 to < 2% at cycle 4. Olaptesed at 1, 2 and 4 mg/kg BW at a single dose and in combination with BR was safe and well tolerated. The maximum tolerated dose was not reached and all patients could have been titrated up to 4 mg/kg. With 4 patients (20%) achieving a complete response and 14 patients (70%) achieving a partial response, the overall response rate was 90%.
Summary/Conclusion: Olaptesed as a single dose and in combination with BR was safe and well tolerated. Compared to historical data, olaptesed shows superiority over baseline therapy with regards to overall response rate and increasing rates of high quality responses. Moreover, the evaluation of the baseline characteristics indicates that “relapsed / refractory patients“, a hard-to-treat patient population, were enrolled in the study, which underlines the clinical relevance of the observed effects and warrants further development of this Spiegelmer in CLL.
Studienprotokoll: http://clinicaltrials.gov/ct2/show/NCT01486797
Abstract von Michael Steurer et al.: https://b-com.mci-group.com/EventProgramme/EHA19.aspx
INTERIM RESULTS FROM A PHASE IIA STUDY OF THE ANTI-CXCL12 SPIEGELMER OLAPTESED PEGOL (NOX-A12) IN COMBINATION WITH BENDAMUSTINE/RITUXIMAB IN PATIENTS WITH CHRONIC LYMPHOCYTIC LEUKEMIA
Background: Olaptesed pegol (NOX-A12) is a novel, potent, L-stereoisomer RNA aptamer that binds and neutralizes CXCL12/SDF-1, a chemokine which attracts and activates immune- and non-immune cells via interaction with the receptors, CXCR4 and CXCR7. The signaling of CXCL12 is pivotal to the interactions of leukemic cells with bone marrow microenvironment. The therapeutic concept of olaptesed is to inhibit such tumor-supporting pathways and thereby mobilizing and sensitizing CLL cells to chemotherapy.
Aims: Here we aim to assess the activity and safety of olaptesed in combination with rituximab and bendamustine in patients with relapsed / refractory CLL.
Methods: This multicenter Phase IIa study investigates olaptesed alone and in combination with BR in relapsed / refractory CLL patients. The study population was split into a pilot and expansion group. Patients were treated using a dose titration design with intravenous (IV) olaptesed at doses increasing from 1 mg/kg to 2 mg/kg and 4 mg/kg at cycles 1, 2 and 3, respectively at 1 hour before rituximab treatment. During cycles 4 to 6, olaptesed was dosed at the highest individually titrated dose. Rituximab was administered IV at doses of 375 mg/m² on day 1 of 1st 28-day cycle and 500 mg/m on day 1 of subsequent cycles. Bendamustine (70 - 100 mg/m²) was given IV on days 2-3 (cycle 1) or days 1-2 (cycles 2-6) of each 28-day cycle following administration of rituximab. To study PK/PD, a pilot dose of 1 to 4 mg/kg olaptesed alone was administered to the initial 10 patients before start of the regular treatment regimen. Clinical response was assessed according to NCI-WG Guidelines (Hallek M et al. Blood 111; 2008: 5446-56).
To date, 20 patients are evaluable (11 women, 9 men) with a median age of 67 years (range 52 to 79). At screening 4, 7 and 9 patients presented with Binet stage A, B and C, respectively. The median prior treatment line was one. 7 patients presented an unfavorable disease state being relapsed within 24 months after fludarabine or bendamustine treatment (4 patients) or presenting a deletion/mutation of the TP53 gene (3 patients). Most patients (15 of 20) were previously treated with fludarabine or bendamustine.
Results: Flow cytometric analysis of CD19+/CD5high CLL cells showed a rapid mobilization of these cells into the peripheral blood which lasted throughout the observational time of 72h. Reduction of lymphadenopathy by ≥ 50% occurred in 11 out of 14 evaluable patients by the end of treatment. Concomitantly, rapid reduction of lymphocytosis in peripheral blood with normalization by treatment cycle 2 – 3 was observed. Also, the CLL to leukocyte ratio improved on average from > 60% in cycle 1 to < 2% at cycle 4. Olaptesed at 1, 2 and 4 mg/kg BW at a single dose and in combination with BR was safe and well tolerated. The maximum tolerated dose was not reached and all patients could have been titrated up to 4 mg/kg. With 4 patients (20%) achieving a complete response and 14 patients (70%) achieving a partial response, the overall response rate was 90%.
Summary/Conclusion: Olaptesed as a single dose and in combination with BR was safe and well tolerated. Compared to historical data, olaptesed shows superiority over baseline therapy with regards to overall response rate and increasing rates of high quality responses. Moreover, the evaluation of the baseline characteristics indicates that “relapsed / refractory patients“, a hard-to-treat patient population, were enrolled in the study, which underlines the clinical relevance of the observed effects and warrants further development of this Spiegelmer in CLL.
NOXXON Pharma Aktiengesellschaft
Berlin
Einladung zur außerordentlichen Hauptversammlungam 12. August 2014, um 9.00 Uhr,in den Geschäftsräumen der Gesellschaft, Max-Dohrn-Str. 8–10, 10589 Berlin
Tagesordnung:
TOP 1:Beschlussfassung über eine Ermächtigung zur Ausgabe von Wandelschuldverschreibungen im Gesamtnennbetrag von bis zu EURO 1,0 Millionen, über Änderung des bestehenden bedingten Kapitals 2013/I sowie korrespondierende SatzungsänderungDer Vorstand soll ermächtigt werden, mit Zustimmung des Aufsichtsrats Wandelschuldverschreibungen im Gesamtnennbetrag von bis zu EURO 1,0 Millionen auszugeben. Zur Bedienung der Wandelschuldverschreibungen ist das bestehende bedingte Kapital 2013/I zu ändern.Vorstand und Aufsichtsrat schlagen daher vor, folgende Beschlüsse zu fassen:I. Ermächtigung zur Ausgabe von WandelschuldverschreibungenDer Vorstand der NOXXON Pharma AG wird ermächtigt, mit Zustimmung des Aufsichtsrats bis zum 31. Dezember 2015 einmalig oder mehrmals auf den Namen lautende Wandelschuldverschreibungen im Gesamtnennbetrag von bis zu EURO 1,0 Millionen mit Laufzeitbegrenzung zu begeben und den Inhabern der jeweiligen, unter sich gleichberechtigten Wandelschuldverschreibungen Wandlungsrechte auf auf den Namen lautende nennwertlose stimmberechtigte Vorzugsaktien der Serie B der Gesellschaft mit einem anteiligen Betrag des Grundkapitals von insgesamt bis zu EURO 2.868,00 nach näherer Maßgabe der Bedingungen der Wandelschuldverschreibungen zu gewähren.Die Inhaber der Wandelschuldverschreibungen erhalten das Recht, ihre Wandelschuldverschreibungen nach näherer Maßgabe der Wandelschuldverschreibungsbedingungen in auf den Namen lautende nennwertlose stimmberechtigte Vorzugsaktien der Serie B der Gesellschaft umzutauschen. Die Ausgabe der neuen Vorzugsaktien der Serie B erfolgt zu einem anfänglichen Wandlungspreis von EURO 348,65 je Vorzugsaktie. Das Wandlungsverhältnis ergibt sich aus der Division des Nennbetrages aller Wandelschuldverschreibungen eines Inhabers durch den Wandlungspreis. Soweit dabei Bruchteile von Aktien entstehen, werden diese auf die nächste ganze Aktie abgerundet.Erhöht sich bei einer Kapitalerhöhung aus Gesellschaftsmitteln die Anzahl der Stückaktien der Gesellschaft, so erhöht sich auch die Anzahl der Stückaktien der Gesellschaft, die den Inhabern von Wandelschuldverschreibungen bei Ausübung ihrer Wandlungsrechte zu gewähren sind, in demselben Verhältnis wie das Grundkapital. Wird eine Kapitalherabsetzung durch Zusammenlegung oder Einziehung von Aktien bei der Gesellschaft durchgeführt, wird das Umtauschverhältnis automatisch dergestalt angepasst, dass das Wandlungsrecht der Inhaber von Wandelschuldverschreibungen, d.h., die Anzahl von Aktien, die die Inhaber von Wandelschuldverschreibungen je Wandelschuldverschreibung beziehen können, sich in demselben Verhältnis reduziert wie die Anzahl der ausgegebenen Aktien der Gesellschaft. Für den Fall, dass der anteilige Betrag einer Aktie am Grundkapital geändert wird ohne Durchführung einer Kapitalerhöhung oder Kapitalherabsetzung (Aktiensplit, Zusammenlegung von Aktien), wird das Umtauschverhältnis automatisch dergestalt angepasst, dass das Wandlungsrecht der Inhaber von Wandelschuldverschreibungen, d.h., die Anzahl von Aktien, die die Inhaber von Wandelschuldverschreibungen je Wandelschuldverschreibung beziehen können, sich in demselben Verhältnis erhöht bzw. reduziert wie sich die Anzahl der ausgegebenen Aktien der Gesellschaft erhöht bzw. reduziert. Im Falle von vergleichbaren oder anderen gesellschaftsrechtlichen Transaktionen oder Maßnahmen mit demselben oder ähnlichen Effekt wie die vorangegangenen Maßnahmen gelten die vorstehenden Sätze entsprechend. § 9 Abs. 1 AktG bleibt unberührt.Zur Zeichnung der Wandelschuldverschreibungen werden nur Aktionäre zugelassen. Den Aktionären steht das gesetzliche Bezugsrecht zu. Der Vorstand wird mit Zustimmung des Aufsichtsrats für die Ausübung des Bezugsrechts eine Frist von mindestens zwei Wochen festlegen.Der Vorstand wird ermächtigt, mit Zustimmung des Aufsichtsrats die weiteren Einzelheiten der Ausgabe und Ausstattung der Wandelschuldverschreibungen und Wandlungsrechte, insbesondere Laufzeit, Kündigungsmöglichkeiten, Wandlungszeitraum zu bestimmen.II. Das bestehende bedingte Kapital 2013/I wird geändert und lautet nunmehr wie folgt as Grundkapital wird um bis zu EURO 38.720,00 durch Ausgabe von bis zu 38.720 neuen, auf den Namen lautenden nennwertlosen stimmberechtigten Vorzugsaktien der Serie B mit einem anteiligen Betrag des Grundkapitals von je EURO 1,00 bedingt erhöht (Bedingtes Kapital 2013/I). Die bedingte Kapitalerhöhung dient der Einlösung von Wandlungsrechten nach Maßgabe der Wandelschuldverschreibungsbedingungen zugunsten der Inhaber von Wandelschuldverschreibungen, die aufgrund des Ermächtigungsbeschlusses der Hauptversammlung vom 8. Februar 2013 oder aufgrund des Ermächtigungsbeschlusses der Hauptversammlung vom 12. August 2014 ausgegeben werden. Die Ausgabe der neuen Vorzugsaktien der Serie B erfolgt zu einem anfänglichen Wandlungspreis von EUR 348,65 je Vorzugsaktie (Ausgabebetrag i.S.v. § 193 Abs. 2 Nr. 3 AktG). Der anfängliche Wandlungspreis passt sich aufgrund der im vorstehend bezeichneten Ermächtigungsbeschluss enthaltenen Verwässerungsschutzklauseln an.Die bedingte Kapitalerhöhung ist nur im Falle der Begebung der Wandelschuldverschreibungen und nur insoweit durchzuführen, als die Inhaber der Wandelschuldverschreibungen von ihren Wandlungsrechten Gebrauch machen. Die aufgrund der Ausübung des Wandlungsrechts ausgegebenen neuen Aktien nehmen vom Beginn des Geschäftsjahres an, in dem sie entstehen, am Gewinn teil.Der Vorstand wird ermächtigt, mit Zustimmung des Aufsichtsrats die weiteren Einzelheiten der Durchführung der bedingten Kapitalerhöhung festzusetzen.Der Aufsichtsrat wird ermächtigt, die Fassung von § 4 Abs. 1 und 4 der Satzung entsprechend der jeweiligen Ausgabe der Bezugsaktien anzupassen sowie alle sonstigen damit in Zusammenhang stehenden Anpassungen der Satzung vorzunehmen, die nur die Fassung betreffen. Entsprechendes gilt im Falle der Nichtausnutzung der Ermächtigung zur Ausgabe von Wandelschuldverschreibungen nach Ablauf des Ermächtigungszeitraums sowie im Falle der Nichtausnutzung des Bedingten Kapitals 2013/I nach Ablauf der Fristen für die Ausübung von Wandlungsrechten.III. § 4 Absatz 4 der Satzung wird geändert und lautet nunmehr wie folgt
as Grundkapital wird um bis zu EURO 38.720,00 durch Ausgabe von bis zu 38.720 neuen, auf den Namen lautenden nennwertlosen stimmberechtigten Vorzugsaktien der Serie B mit einem anteiligen Betrag des Grundkapitals von je EURO 1,00 bedingt erhöht (Bedingtes Kapital 2013/I). Die bedingte Kapitalerhöhung dient der Einlösung von Wandlungsrechten nach Maßgabe der Wandelschuldverschreibungsbedingungen zugunsten der Inhaber von Wandelschuldverschreibungen, die aufgrund des Ermächtigungsbeschlusses der Hauptversammlung vom 8. Februar 2013 oder aufgrund des Ermächtigungsbeschlusses der Hauptversammlung vom 12. August 2014 ausgegeben werden. Die Ausgabe der neuen Vorzugsaktien der Serie B erfolgt zu einem anfänglichen Wandlungspreis von EUR 348,65 je Vorzugsaktie (Ausgabebetrag i.S.v. § 193 Abs. 2 Nr. 3 AktG). Der anfängliche Wandlungspreis passt sich aufgrund der im vorstehend bezeichneten Ermächtigungsbeschluss enthaltenen Verwässerungsschutzklauseln an.Die bedingte Kapitalerhöhung ist nur im Falle der Begebung der Wandelschuldverschreibungen und nur insoweit durchzuführen, als die Inhaber der Wandelschuldverschreibungen von ihren Wandlungsrechten Gebrauch machen. Die aufgrund der Ausübung des Wandlungsrechts ausgegebenen neuen Aktien nehmen vom Beginn des Geschäftsjahres an, in dem sie entstehen, am Gewinn teil.Der Vorstand wird ermächtigt, mit Zustimmung des Aufsichtsrats die weiteren Einzelheiten der Durchführung der bedingten Kapitalerhöhung festzusetzen.Der Aufsichtsrat wird ermächtigt, die Fassung von § 4 Abs. 1 und 4 der Satzung entsprechend der jeweiligen Ausgabe der Bezugsaktien anzupassen sowie alle sonstigen damit in Zusammenhang stehenden Anpassungen der Satzung vorzunehmen, die nur die Fassung betreffen. Entsprechendes gilt im Falle der Nichtausnutzung der Ermächtigung zur Ausgabe von Wandelschuldverschreibungen nach Ablauf des Ermächtigungszeitraums sowie im Falle der Nichtausnutzung des Bedingten Kapitals 2013/I nach Ablauf der Fristen für die Ausübung von Wandlungsrechten.III. § 4 Absatz 4 der Satzung wird geändert und lautet nunmehr wie folgt as Grundkapital ist um bis zu EURO 38.720,00 durch Ausgabe von bis zu 38.720 neuen, auf den Namen lautenden nennwertlosen stimmberechtigten Vorzugsaktien der Serie B mit einem anteiligen Betrag des Grundkapitals von je EURO 1,00 bedingt erhöht (Bedingtes Kapital 2013/I). Die bedingte Kapitalerhöhung dient der Einlösung von Wandlungsrechten nach Maßgabe der Wandelschuldverschreibungsbedingungen zugunsten der Inhaber von Wandelschuldverschreibungen, die aufgrund des Ermächtigungsbeschlusses der Hauptversammlung vom 8. Februar 2013 oder aufgrund des Ermächtigungsbeschlusses der Hauptversammlung vom 12. August 2014 ausgegeben werden. Die Ausgabe der neuen Vorzugsaktien der Serie B erfolgt zu einem anfänglichen Wandlungspreis von EUR 348,65 je Vorzugsaktie (Ausgabebetrag i.S.v. § 193 Abs. 2 Nr. 3 AktG). Der anfängliche Wandlungspreis passt sich aufgrund der im vorstehend bezeichneten Ermächtigungsbeschluss enthaltenen Verwässerungsschutzklauseln an. Die bedingte Kapitalerhöhung ist nur im Falle der Begebung der Wandelschuldverschreibungen und nur insoweit durchzuführen, als die Inhaber der Wandelschuldverschreibungen von ihren Wandlungsrechten Gebrauch machen. Die aufgrund der Ausübung des Wandlungsrechts ausgegebenen neuen Aktien nehmen vom Beginn des Geschäftsjahres an, in dem sie entstehen, am Gewinn teil. Der Vorstand ist ermächtigt, mit Zustimmung des Aufsichtsrats die weiteren Einzelheiten der Durchführung der bedingten Kapitalerhöhung festzusetzen. Der Aufsichtsrat ist ermächtigt, die Fassung von § 4 Abs. 1 und 4 der Satzung entsprechend der jeweiligen Ausgabe der Bezugsaktien anzupassen sowie alle sonstigen damit in Zusammenhang stehenden Anpassungen der Satzung vorzunehmen, die nur die Fassung betreffen. Entsprechendes gilt im Falle der Nichtausnutzung der Ermächtigung zur Ausgabe von Wandelschuldverschreibungen nach Ablauf des Ermächtigungszeitraums sowie im Falle der Nichtausnutzung des Bedingten Kapitals 2013/I nach Ablauf der Fristen für die Ausübung von Wandlungsrechten.TOP 2:Sonderbeschluss der Inhaber von Stammaktien: ZustimmungsbeschlussVorstand und Aufsichtsrat schlagen vor, folgenden Beschluss zu fassen
as Grundkapital ist um bis zu EURO 38.720,00 durch Ausgabe von bis zu 38.720 neuen, auf den Namen lautenden nennwertlosen stimmberechtigten Vorzugsaktien der Serie B mit einem anteiligen Betrag des Grundkapitals von je EURO 1,00 bedingt erhöht (Bedingtes Kapital 2013/I). Die bedingte Kapitalerhöhung dient der Einlösung von Wandlungsrechten nach Maßgabe der Wandelschuldverschreibungsbedingungen zugunsten der Inhaber von Wandelschuldverschreibungen, die aufgrund des Ermächtigungsbeschlusses der Hauptversammlung vom 8. Februar 2013 oder aufgrund des Ermächtigungsbeschlusses der Hauptversammlung vom 12. August 2014 ausgegeben werden. Die Ausgabe der neuen Vorzugsaktien der Serie B erfolgt zu einem anfänglichen Wandlungspreis von EUR 348,65 je Vorzugsaktie (Ausgabebetrag i.S.v. § 193 Abs. 2 Nr. 3 AktG). Der anfängliche Wandlungspreis passt sich aufgrund der im vorstehend bezeichneten Ermächtigungsbeschluss enthaltenen Verwässerungsschutzklauseln an. Die bedingte Kapitalerhöhung ist nur im Falle der Begebung der Wandelschuldverschreibungen und nur insoweit durchzuführen, als die Inhaber der Wandelschuldverschreibungen von ihren Wandlungsrechten Gebrauch machen. Die aufgrund der Ausübung des Wandlungsrechts ausgegebenen neuen Aktien nehmen vom Beginn des Geschäftsjahres an, in dem sie entstehen, am Gewinn teil. Der Vorstand ist ermächtigt, mit Zustimmung des Aufsichtsrats die weiteren Einzelheiten der Durchführung der bedingten Kapitalerhöhung festzusetzen. Der Aufsichtsrat ist ermächtigt, die Fassung von § 4 Abs. 1 und 4 der Satzung entsprechend der jeweiligen Ausgabe der Bezugsaktien anzupassen sowie alle sonstigen damit in Zusammenhang stehenden Anpassungen der Satzung vorzunehmen, die nur die Fassung betreffen. Entsprechendes gilt im Falle der Nichtausnutzung der Ermächtigung zur Ausgabe von Wandelschuldverschreibungen nach Ablauf des Ermächtigungszeitraums sowie im Falle der Nichtausnutzung des Bedingten Kapitals 2013/I nach Ablauf der Fristen für die Ausübung von Wandlungsrechten.TOP 2:Sonderbeschluss der Inhaber von Stammaktien: ZustimmungsbeschlussVorstand und Aufsichtsrat schlagen vor, folgenden Beschluss zu fassen ie Inhaber von Stammaktien stimmen den Beschlüssen zu TOP 1 über die Ermächtigung zur Ausgabe von Wandelschuldverschreibungen, die Änderung des bestehenden bedingten Kapitals 2013/I sowie über die korrespondierende Satzungsänderung gemäß §§ 221 Abs. 1 Satz 4, 182 Abs. 2 AktG und §§ 193 Abs. 1 Satz 3, 182 Abs. 2 AktG zu.TOP 3:Sonderbeschluss der Inhaber von Vorzugsaktien der Serie A: ZustimmungsbeschlussVorstand und Aufsichtsrat schlagen vor, folgenden Beschluss zu fassen
ie Inhaber von Stammaktien stimmen den Beschlüssen zu TOP 1 über die Ermächtigung zur Ausgabe von Wandelschuldverschreibungen, die Änderung des bestehenden bedingten Kapitals 2013/I sowie über die korrespondierende Satzungsänderung gemäß §§ 221 Abs. 1 Satz 4, 182 Abs. 2 AktG und §§ 193 Abs. 1 Satz 3, 182 Abs. 2 AktG zu.TOP 3:Sonderbeschluss der Inhaber von Vorzugsaktien der Serie A: ZustimmungsbeschlussVorstand und Aufsichtsrat schlagen vor, folgenden Beschluss zu fassen ie Inhaber von Vorzugsaktien der Serie A stimmen den Beschlüssen zu TOP 1 über die Ermächtigung zur Ausgabe von Wandelschuldverschreibungen, die Änderung des bestehenden bedingten Kapitals 2013/I sowie über die korrespondierende Satzungsänderung gemäß §§ 221 Abs. 1 Satz 4, 182 Abs. 2 AktG und §§ 193 Abs. 1 Satz 3, 182 Abs. 2 AktG zu.TOP 4:Sonderbeschluss der Inhaber von Vorzugsaktien der Serie B: ZustimmungsbeschlussVorstand und Aufsichtsrat schlagen vor, folgenden Beschluss zu fassen
ie Inhaber von Vorzugsaktien der Serie A stimmen den Beschlüssen zu TOP 1 über die Ermächtigung zur Ausgabe von Wandelschuldverschreibungen, die Änderung des bestehenden bedingten Kapitals 2013/I sowie über die korrespondierende Satzungsänderung gemäß §§ 221 Abs. 1 Satz 4, 182 Abs. 2 AktG und §§ 193 Abs. 1 Satz 3, 182 Abs. 2 AktG zu.TOP 4:Sonderbeschluss der Inhaber von Vorzugsaktien der Serie B: ZustimmungsbeschlussVorstand und Aufsichtsrat schlagen vor, folgenden Beschluss zu fassen ie Inhaber von Vorzugsaktien der Serie B stimmen den Beschlüssen zu TOP 1 über die Ermächtigung zur Ausgabe von Wandelschuldverschreibungen, die Änderung des bestehenden bedingten Kapitals 2013/I sowie über die korrespondierende Satzungsänderung gemäß §§ 221 Abs. 1 Satz 4, 182 Abs. 2 AktG und §§ 193 Abs. 1 Satz 3, 182 Abs. 2 AktG und § 19 Abs. 3 der Satzung zu.TOP 5:Wahl von AufsichtsratsmitgliedDer Aufsichtsrat besteht gemäß §§ 95 Abs. 1 Satz 1 und 2, 96 Abs. 1 letzte Variante AktG und § 9 Abs. 1 Satz 1 der Satzung aus neun Mitgliedern, von denen jedoch aktuell nur sieben bestellt sind. Das Aufsichtsratsmitglied Dr. Axel Polack hat sein Mandat mit Wirkung zum Ablauf des 30. Juli 2014 niedergelegt. Es soll ein Nachfolger für Dr. Polack bestellt werden.Vor diesem Hintergrund schlägt der Aufsichtsrat vor, folgenden Beschluss zu fassen:Mit Wirkung zum Ablauf der heutigen Hauptversammlung wird Dr. Jochen Knolle, selbstständiger Unternehmensberater, Frankfurt a. M., bis zum Ablauf der Hauptversammlung, die über die Entlastung für das Geschäftsjahr zum 31. Dezember 2014 beschließt, zum Mitglied des Aufsichtsrates der Gesellschaft gewählt.Die Hauptversammlung ist an Wahlvorschläge nicht gebunden.
ie Inhaber von Vorzugsaktien der Serie B stimmen den Beschlüssen zu TOP 1 über die Ermächtigung zur Ausgabe von Wandelschuldverschreibungen, die Änderung des bestehenden bedingten Kapitals 2013/I sowie über die korrespondierende Satzungsänderung gemäß §§ 221 Abs. 1 Satz 4, 182 Abs. 2 AktG und §§ 193 Abs. 1 Satz 3, 182 Abs. 2 AktG und § 19 Abs. 3 der Satzung zu.TOP 5:Wahl von AufsichtsratsmitgliedDer Aufsichtsrat besteht gemäß §§ 95 Abs. 1 Satz 1 und 2, 96 Abs. 1 letzte Variante AktG und § 9 Abs. 1 Satz 1 der Satzung aus neun Mitgliedern, von denen jedoch aktuell nur sieben bestellt sind. Das Aufsichtsratsmitglied Dr. Axel Polack hat sein Mandat mit Wirkung zum Ablauf des 30. Juli 2014 niedergelegt. Es soll ein Nachfolger für Dr. Polack bestellt werden.Vor diesem Hintergrund schlägt der Aufsichtsrat vor, folgenden Beschluss zu fassen:Mit Wirkung zum Ablauf der heutigen Hauptversammlung wird Dr. Jochen Knolle, selbstständiger Unternehmensberater, Frankfurt a. M., bis zum Ablauf der Hauptversammlung, die über die Entlastung für das Geschäftsjahr zum 31. Dezember 2014 beschließt, zum Mitglied des Aufsichtsrates der Gesellschaft gewählt.Die Hauptversammlung ist an Wahlvorschläge nicht gebunden.
Berlin
Einladung zur außerordentlichen Hauptversammlungam 12. August 2014, um 9.00 Uhr,in den Geschäftsräumen der Gesellschaft, Max-Dohrn-Str. 8–10, 10589 Berlin
Tagesordnung:
TOP 1:Beschlussfassung über eine Ermächtigung zur Ausgabe von Wandelschuldverschreibungen im Gesamtnennbetrag von bis zu EURO 1,0 Millionen, über Änderung des bestehenden bedingten Kapitals 2013/I sowie korrespondierende SatzungsänderungDer Vorstand soll ermächtigt werden, mit Zustimmung des Aufsichtsrats Wandelschuldverschreibungen im Gesamtnennbetrag von bis zu EURO 1,0 Millionen auszugeben. Zur Bedienung der Wandelschuldverschreibungen ist das bestehende bedingte Kapital 2013/I zu ändern.Vorstand und Aufsichtsrat schlagen daher vor, folgende Beschlüsse zu fassen:I. Ermächtigung zur Ausgabe von WandelschuldverschreibungenDer Vorstand der NOXXON Pharma AG wird ermächtigt, mit Zustimmung des Aufsichtsrats bis zum 31. Dezember 2015 einmalig oder mehrmals auf den Namen lautende Wandelschuldverschreibungen im Gesamtnennbetrag von bis zu EURO 1,0 Millionen mit Laufzeitbegrenzung zu begeben und den Inhabern der jeweiligen, unter sich gleichberechtigten Wandelschuldverschreibungen Wandlungsrechte auf auf den Namen lautende nennwertlose stimmberechtigte Vorzugsaktien der Serie B der Gesellschaft mit einem anteiligen Betrag des Grundkapitals von insgesamt bis zu EURO 2.868,00 nach näherer Maßgabe der Bedingungen der Wandelschuldverschreibungen zu gewähren.Die Inhaber der Wandelschuldverschreibungen erhalten das Recht, ihre Wandelschuldverschreibungen nach näherer Maßgabe der Wandelschuldverschreibungsbedingungen in auf den Namen lautende nennwertlose stimmberechtigte Vorzugsaktien der Serie B der Gesellschaft umzutauschen. Die Ausgabe der neuen Vorzugsaktien der Serie B erfolgt zu einem anfänglichen Wandlungspreis von EURO 348,65 je Vorzugsaktie. Das Wandlungsverhältnis ergibt sich aus der Division des Nennbetrages aller Wandelschuldverschreibungen eines Inhabers durch den Wandlungspreis. Soweit dabei Bruchteile von Aktien entstehen, werden diese auf die nächste ganze Aktie abgerundet.Erhöht sich bei einer Kapitalerhöhung aus Gesellschaftsmitteln die Anzahl der Stückaktien der Gesellschaft, so erhöht sich auch die Anzahl der Stückaktien der Gesellschaft, die den Inhabern von Wandelschuldverschreibungen bei Ausübung ihrer Wandlungsrechte zu gewähren sind, in demselben Verhältnis wie das Grundkapital. Wird eine Kapitalherabsetzung durch Zusammenlegung oder Einziehung von Aktien bei der Gesellschaft durchgeführt, wird das Umtauschverhältnis automatisch dergestalt angepasst, dass das Wandlungsrecht der Inhaber von Wandelschuldverschreibungen, d.h., die Anzahl von Aktien, die die Inhaber von Wandelschuldverschreibungen je Wandelschuldverschreibung beziehen können, sich in demselben Verhältnis reduziert wie die Anzahl der ausgegebenen Aktien der Gesellschaft. Für den Fall, dass der anteilige Betrag einer Aktie am Grundkapital geändert wird ohne Durchführung einer Kapitalerhöhung oder Kapitalherabsetzung (Aktiensplit, Zusammenlegung von Aktien), wird das Umtauschverhältnis automatisch dergestalt angepasst, dass das Wandlungsrecht der Inhaber von Wandelschuldverschreibungen, d.h., die Anzahl von Aktien, die die Inhaber von Wandelschuldverschreibungen je Wandelschuldverschreibung beziehen können, sich in demselben Verhältnis erhöht bzw. reduziert wie sich die Anzahl der ausgegebenen Aktien der Gesellschaft erhöht bzw. reduziert. Im Falle von vergleichbaren oder anderen gesellschaftsrechtlichen Transaktionen oder Maßnahmen mit demselben oder ähnlichen Effekt wie die vorangegangenen Maßnahmen gelten die vorstehenden Sätze entsprechend. § 9 Abs. 1 AktG bleibt unberührt.Zur Zeichnung der Wandelschuldverschreibungen werden nur Aktionäre zugelassen. Den Aktionären steht das gesetzliche Bezugsrecht zu. Der Vorstand wird mit Zustimmung des Aufsichtsrats für die Ausübung des Bezugsrechts eine Frist von mindestens zwei Wochen festlegen.Der Vorstand wird ermächtigt, mit Zustimmung des Aufsichtsrats die weiteren Einzelheiten der Ausgabe und Ausstattung der Wandelschuldverschreibungen und Wandlungsrechte, insbesondere Laufzeit, Kündigungsmöglichkeiten, Wandlungszeitraum zu bestimmen.II. Das bestehende bedingte Kapital 2013/I wird geändert und lautet nunmehr wie folgt
 as Grundkapital wird um bis zu EURO 38.720,00 durch Ausgabe von bis zu 38.720 neuen, auf den Namen lautenden nennwertlosen stimmberechtigten Vorzugsaktien der Serie B mit einem anteiligen Betrag des Grundkapitals von je EURO 1,00 bedingt erhöht (Bedingtes Kapital 2013/I). Die bedingte Kapitalerhöhung dient der Einlösung von Wandlungsrechten nach Maßgabe der Wandelschuldverschreibungsbedingungen zugunsten der Inhaber von Wandelschuldverschreibungen, die aufgrund des Ermächtigungsbeschlusses der Hauptversammlung vom 8. Februar 2013 oder aufgrund des Ermächtigungsbeschlusses der Hauptversammlung vom 12. August 2014 ausgegeben werden. Die Ausgabe der neuen Vorzugsaktien der Serie B erfolgt zu einem anfänglichen Wandlungspreis von EUR 348,65 je Vorzugsaktie (Ausgabebetrag i.S.v. § 193 Abs. 2 Nr. 3 AktG). Der anfängliche Wandlungspreis passt sich aufgrund der im vorstehend bezeichneten Ermächtigungsbeschluss enthaltenen Verwässerungsschutzklauseln an.Die bedingte Kapitalerhöhung ist nur im Falle der Begebung der Wandelschuldverschreibungen und nur insoweit durchzuführen, als die Inhaber der Wandelschuldverschreibungen von ihren Wandlungsrechten Gebrauch machen. Die aufgrund der Ausübung des Wandlungsrechts ausgegebenen neuen Aktien nehmen vom Beginn des Geschäftsjahres an, in dem sie entstehen, am Gewinn teil.Der Vorstand wird ermächtigt, mit Zustimmung des Aufsichtsrats die weiteren Einzelheiten der Durchführung der bedingten Kapitalerhöhung festzusetzen.Der Aufsichtsrat wird ermächtigt, die Fassung von § 4 Abs. 1 und 4 der Satzung entsprechend der jeweiligen Ausgabe der Bezugsaktien anzupassen sowie alle sonstigen damit in Zusammenhang stehenden Anpassungen der Satzung vorzunehmen, die nur die Fassung betreffen. Entsprechendes gilt im Falle der Nichtausnutzung der Ermächtigung zur Ausgabe von Wandelschuldverschreibungen nach Ablauf des Ermächtigungszeitraums sowie im Falle der Nichtausnutzung des Bedingten Kapitals 2013/I nach Ablauf der Fristen für die Ausübung von Wandlungsrechten.III. § 4 Absatz 4 der Satzung wird geändert und lautet nunmehr wie folgt
as Grundkapital wird um bis zu EURO 38.720,00 durch Ausgabe von bis zu 38.720 neuen, auf den Namen lautenden nennwertlosen stimmberechtigten Vorzugsaktien der Serie B mit einem anteiligen Betrag des Grundkapitals von je EURO 1,00 bedingt erhöht (Bedingtes Kapital 2013/I). Die bedingte Kapitalerhöhung dient der Einlösung von Wandlungsrechten nach Maßgabe der Wandelschuldverschreibungsbedingungen zugunsten der Inhaber von Wandelschuldverschreibungen, die aufgrund des Ermächtigungsbeschlusses der Hauptversammlung vom 8. Februar 2013 oder aufgrund des Ermächtigungsbeschlusses der Hauptversammlung vom 12. August 2014 ausgegeben werden. Die Ausgabe der neuen Vorzugsaktien der Serie B erfolgt zu einem anfänglichen Wandlungspreis von EUR 348,65 je Vorzugsaktie (Ausgabebetrag i.S.v. § 193 Abs. 2 Nr. 3 AktG). Der anfängliche Wandlungspreis passt sich aufgrund der im vorstehend bezeichneten Ermächtigungsbeschluss enthaltenen Verwässerungsschutzklauseln an.Die bedingte Kapitalerhöhung ist nur im Falle der Begebung der Wandelschuldverschreibungen und nur insoweit durchzuführen, als die Inhaber der Wandelschuldverschreibungen von ihren Wandlungsrechten Gebrauch machen. Die aufgrund der Ausübung des Wandlungsrechts ausgegebenen neuen Aktien nehmen vom Beginn des Geschäftsjahres an, in dem sie entstehen, am Gewinn teil.Der Vorstand wird ermächtigt, mit Zustimmung des Aufsichtsrats die weiteren Einzelheiten der Durchführung der bedingten Kapitalerhöhung festzusetzen.Der Aufsichtsrat wird ermächtigt, die Fassung von § 4 Abs. 1 und 4 der Satzung entsprechend der jeweiligen Ausgabe der Bezugsaktien anzupassen sowie alle sonstigen damit in Zusammenhang stehenden Anpassungen der Satzung vorzunehmen, die nur die Fassung betreffen. Entsprechendes gilt im Falle der Nichtausnutzung der Ermächtigung zur Ausgabe von Wandelschuldverschreibungen nach Ablauf des Ermächtigungszeitraums sowie im Falle der Nichtausnutzung des Bedingten Kapitals 2013/I nach Ablauf der Fristen für die Ausübung von Wandlungsrechten.III. § 4 Absatz 4 der Satzung wird geändert und lautet nunmehr wie folgt as Grundkapital ist um bis zu EURO 38.720,00 durch Ausgabe von bis zu 38.720 neuen, auf den Namen lautenden nennwertlosen stimmberechtigten Vorzugsaktien der Serie B mit einem anteiligen Betrag des Grundkapitals von je EURO 1,00 bedingt erhöht (Bedingtes Kapital 2013/I). Die bedingte Kapitalerhöhung dient der Einlösung von Wandlungsrechten nach Maßgabe der Wandelschuldverschreibungsbedingungen zugunsten der Inhaber von Wandelschuldverschreibungen, die aufgrund des Ermächtigungsbeschlusses der Hauptversammlung vom 8. Februar 2013 oder aufgrund des Ermächtigungsbeschlusses der Hauptversammlung vom 12. August 2014 ausgegeben werden. Die Ausgabe der neuen Vorzugsaktien der Serie B erfolgt zu einem anfänglichen Wandlungspreis von EUR 348,65 je Vorzugsaktie (Ausgabebetrag i.S.v. § 193 Abs. 2 Nr. 3 AktG). Der anfängliche Wandlungspreis passt sich aufgrund der im vorstehend bezeichneten Ermächtigungsbeschluss enthaltenen Verwässerungsschutzklauseln an. Die bedingte Kapitalerhöhung ist nur im Falle der Begebung der Wandelschuldverschreibungen und nur insoweit durchzuführen, als die Inhaber der Wandelschuldverschreibungen von ihren Wandlungsrechten Gebrauch machen. Die aufgrund der Ausübung des Wandlungsrechts ausgegebenen neuen Aktien nehmen vom Beginn des Geschäftsjahres an, in dem sie entstehen, am Gewinn teil. Der Vorstand ist ermächtigt, mit Zustimmung des Aufsichtsrats die weiteren Einzelheiten der Durchführung der bedingten Kapitalerhöhung festzusetzen. Der Aufsichtsrat ist ermächtigt, die Fassung von § 4 Abs. 1 und 4 der Satzung entsprechend der jeweiligen Ausgabe der Bezugsaktien anzupassen sowie alle sonstigen damit in Zusammenhang stehenden Anpassungen der Satzung vorzunehmen, die nur die Fassung betreffen. Entsprechendes gilt im Falle der Nichtausnutzung der Ermächtigung zur Ausgabe von Wandelschuldverschreibungen nach Ablauf des Ermächtigungszeitraums sowie im Falle der Nichtausnutzung des Bedingten Kapitals 2013/I nach Ablauf der Fristen für die Ausübung von Wandlungsrechten.TOP 2:Sonderbeschluss der Inhaber von Stammaktien: ZustimmungsbeschlussVorstand und Aufsichtsrat schlagen vor, folgenden Beschluss zu fassen
as Grundkapital ist um bis zu EURO 38.720,00 durch Ausgabe von bis zu 38.720 neuen, auf den Namen lautenden nennwertlosen stimmberechtigten Vorzugsaktien der Serie B mit einem anteiligen Betrag des Grundkapitals von je EURO 1,00 bedingt erhöht (Bedingtes Kapital 2013/I). Die bedingte Kapitalerhöhung dient der Einlösung von Wandlungsrechten nach Maßgabe der Wandelschuldverschreibungsbedingungen zugunsten der Inhaber von Wandelschuldverschreibungen, die aufgrund des Ermächtigungsbeschlusses der Hauptversammlung vom 8. Februar 2013 oder aufgrund des Ermächtigungsbeschlusses der Hauptversammlung vom 12. August 2014 ausgegeben werden. Die Ausgabe der neuen Vorzugsaktien der Serie B erfolgt zu einem anfänglichen Wandlungspreis von EUR 348,65 je Vorzugsaktie (Ausgabebetrag i.S.v. § 193 Abs. 2 Nr. 3 AktG). Der anfängliche Wandlungspreis passt sich aufgrund der im vorstehend bezeichneten Ermächtigungsbeschluss enthaltenen Verwässerungsschutzklauseln an. Die bedingte Kapitalerhöhung ist nur im Falle der Begebung der Wandelschuldverschreibungen und nur insoweit durchzuführen, als die Inhaber der Wandelschuldverschreibungen von ihren Wandlungsrechten Gebrauch machen. Die aufgrund der Ausübung des Wandlungsrechts ausgegebenen neuen Aktien nehmen vom Beginn des Geschäftsjahres an, in dem sie entstehen, am Gewinn teil. Der Vorstand ist ermächtigt, mit Zustimmung des Aufsichtsrats die weiteren Einzelheiten der Durchführung der bedingten Kapitalerhöhung festzusetzen. Der Aufsichtsrat ist ermächtigt, die Fassung von § 4 Abs. 1 und 4 der Satzung entsprechend der jeweiligen Ausgabe der Bezugsaktien anzupassen sowie alle sonstigen damit in Zusammenhang stehenden Anpassungen der Satzung vorzunehmen, die nur die Fassung betreffen. Entsprechendes gilt im Falle der Nichtausnutzung der Ermächtigung zur Ausgabe von Wandelschuldverschreibungen nach Ablauf des Ermächtigungszeitraums sowie im Falle der Nichtausnutzung des Bedingten Kapitals 2013/I nach Ablauf der Fristen für die Ausübung von Wandlungsrechten.TOP 2:Sonderbeschluss der Inhaber von Stammaktien: ZustimmungsbeschlussVorstand und Aufsichtsrat schlagen vor, folgenden Beschluss zu fassen ie Inhaber von Stammaktien stimmen den Beschlüssen zu TOP 1 über die Ermächtigung zur Ausgabe von Wandelschuldverschreibungen, die Änderung des bestehenden bedingten Kapitals 2013/I sowie über die korrespondierende Satzungsänderung gemäß §§ 221 Abs. 1 Satz 4, 182 Abs. 2 AktG und §§ 193 Abs. 1 Satz 3, 182 Abs. 2 AktG zu.TOP 3:Sonderbeschluss der Inhaber von Vorzugsaktien der Serie A: ZustimmungsbeschlussVorstand und Aufsichtsrat schlagen vor, folgenden Beschluss zu fassen
ie Inhaber von Stammaktien stimmen den Beschlüssen zu TOP 1 über die Ermächtigung zur Ausgabe von Wandelschuldverschreibungen, die Änderung des bestehenden bedingten Kapitals 2013/I sowie über die korrespondierende Satzungsänderung gemäß §§ 221 Abs. 1 Satz 4, 182 Abs. 2 AktG und §§ 193 Abs. 1 Satz 3, 182 Abs. 2 AktG zu.TOP 3:Sonderbeschluss der Inhaber von Vorzugsaktien der Serie A: ZustimmungsbeschlussVorstand und Aufsichtsrat schlagen vor, folgenden Beschluss zu fassen ie Inhaber von Vorzugsaktien der Serie A stimmen den Beschlüssen zu TOP 1 über die Ermächtigung zur Ausgabe von Wandelschuldverschreibungen, die Änderung des bestehenden bedingten Kapitals 2013/I sowie über die korrespondierende Satzungsänderung gemäß §§ 221 Abs. 1 Satz 4, 182 Abs. 2 AktG und §§ 193 Abs. 1 Satz 3, 182 Abs. 2 AktG zu.TOP 4:Sonderbeschluss der Inhaber von Vorzugsaktien der Serie B: ZustimmungsbeschlussVorstand und Aufsichtsrat schlagen vor, folgenden Beschluss zu fassen
ie Inhaber von Vorzugsaktien der Serie A stimmen den Beschlüssen zu TOP 1 über die Ermächtigung zur Ausgabe von Wandelschuldverschreibungen, die Änderung des bestehenden bedingten Kapitals 2013/I sowie über die korrespondierende Satzungsänderung gemäß §§ 221 Abs. 1 Satz 4, 182 Abs. 2 AktG und §§ 193 Abs. 1 Satz 3, 182 Abs. 2 AktG zu.TOP 4:Sonderbeschluss der Inhaber von Vorzugsaktien der Serie B: ZustimmungsbeschlussVorstand und Aufsichtsrat schlagen vor, folgenden Beschluss zu fassen ie Inhaber von Vorzugsaktien der Serie B stimmen den Beschlüssen zu TOP 1 über die Ermächtigung zur Ausgabe von Wandelschuldverschreibungen, die Änderung des bestehenden bedingten Kapitals 2013/I sowie über die korrespondierende Satzungsänderung gemäß §§ 221 Abs. 1 Satz 4, 182 Abs. 2 AktG und §§ 193 Abs. 1 Satz 3, 182 Abs. 2 AktG und § 19 Abs. 3 der Satzung zu.TOP 5:Wahl von AufsichtsratsmitgliedDer Aufsichtsrat besteht gemäß §§ 95 Abs. 1 Satz 1 und 2, 96 Abs. 1 letzte Variante AktG und § 9 Abs. 1 Satz 1 der Satzung aus neun Mitgliedern, von denen jedoch aktuell nur sieben bestellt sind. Das Aufsichtsratsmitglied Dr. Axel Polack hat sein Mandat mit Wirkung zum Ablauf des 30. Juli 2014 niedergelegt. Es soll ein Nachfolger für Dr. Polack bestellt werden.Vor diesem Hintergrund schlägt der Aufsichtsrat vor, folgenden Beschluss zu fassen:Mit Wirkung zum Ablauf der heutigen Hauptversammlung wird Dr. Jochen Knolle, selbstständiger Unternehmensberater, Frankfurt a. M., bis zum Ablauf der Hauptversammlung, die über die Entlastung für das Geschäftsjahr zum 31. Dezember 2014 beschließt, zum Mitglied des Aufsichtsrates der Gesellschaft gewählt.Die Hauptversammlung ist an Wahlvorschläge nicht gebunden.
ie Inhaber von Vorzugsaktien der Serie B stimmen den Beschlüssen zu TOP 1 über die Ermächtigung zur Ausgabe von Wandelschuldverschreibungen, die Änderung des bestehenden bedingten Kapitals 2013/I sowie über die korrespondierende Satzungsänderung gemäß §§ 221 Abs. 1 Satz 4, 182 Abs. 2 AktG und §§ 193 Abs. 1 Satz 3, 182 Abs. 2 AktG und § 19 Abs. 3 der Satzung zu.TOP 5:Wahl von AufsichtsratsmitgliedDer Aufsichtsrat besteht gemäß §§ 95 Abs. 1 Satz 1 und 2, 96 Abs. 1 letzte Variante AktG und § 9 Abs. 1 Satz 1 der Satzung aus neun Mitgliedern, von denen jedoch aktuell nur sieben bestellt sind. Das Aufsichtsratsmitglied Dr. Axel Polack hat sein Mandat mit Wirkung zum Ablauf des 30. Juli 2014 niedergelegt. Es soll ein Nachfolger für Dr. Polack bestellt werden.Vor diesem Hintergrund schlägt der Aufsichtsrat vor, folgenden Beschluss zu fassen:Mit Wirkung zum Ablauf der heutigen Hauptversammlung wird Dr. Jochen Knolle, selbstständiger Unternehmensberater, Frankfurt a. M., bis zum Ablauf der Hauptversammlung, die über die Entlastung für das Geschäftsjahr zum 31. Dezember 2014 beschließt, zum Mitglied des Aufsichtsrates der Gesellschaft gewählt.Die Hauptversammlung ist an Wahlvorschläge nicht gebunden.
Antwort auf Beitrag Nr.: 47.293.958 von mondstein81 am 11.07.14 08:13:54Mensch mondstein, es macht doch keinen Sinn, hier einen ewig langen Text reinzuknallen, den man in dieser Form überhaupt nicht erfassen kann. Zumal der Informationsgehalt der HV-Einladung für Noxxon-Interessierte wirklich gering ist. Und eine Quellenangabe fehlt auch. Man muss doch an die Leute denken, die unsere Postings lesen wollen/sollen. 
Letztlich geht es in der aoHV darum, dass Noxxon nochmals bis zu 1 Mio Euro durch die Ausgabe weiterer Wandelschuldverschreibungen einsammeln will (mit Bezugsrecht der Aktionäre). Außerdem soll Herr Dr. Jochen Knolle Herrn Dr. Axel Polack als Vetreter von TVM Capital im AR ersetzen.
Quelle: Bundesanzeiger-Eintrag vom 10. Juli 2014

Letztlich geht es in der aoHV darum, dass Noxxon nochmals bis zu 1 Mio Euro durch die Ausgabe weiterer Wandelschuldverschreibungen einsammeln will (mit Bezugsrecht der Aktionäre). Außerdem soll Herr Dr. Jochen Knolle Herrn Dr. Axel Polack als Vetreter von TVM Capital im AR ersetzen.
Quelle: Bundesanzeiger-Eintrag vom 10. Juli 2014
NOXXON startet Phase IIa-Studie mit anti-Hepcidin Spiegelmer® Lexaptepid Pegol (NOX-H94) in Dialysepatienten mit EPO-hyporesponsiver Anämie
http://www.dewb-vc.de/de/portfolio/newsarchiv/968-31-07-14-n…
Berlin - 31. Juli 2014 - NOXXON Pharma gab heute die Behandlung eines ersten Patienten in einer klinischen Proof of Concept Studie der Phase IIa mit dem anti-Hepcidin Spiegelmer® Lexaptepid Pegol (NOX-H94) bekannt. In der Studie werden Dialysepatienten behandelt, die nicht adäquat auf EPO ansprechen. Dies ist die vierte klinische Studie mit Lexaptepid Pegol. Dabei handelt es sich um eine multizentrische, Placebo-kontrollierte Studie, in der die Pharmakokinetik, die Pharmakodynamik, die Wirksamkeit und die Sicherheit von Einzel- und Mehrfachgaben von Lexaptepid Pegol in anämischen Dialysepatienten mit einer sogenannten EPO-hyporesponsiven Anämie untersucht werden.
Ungefähr 10% aller dialysepflichtigen Patienten haben eine spezielle Form der Anämie, die nicht adäquat mit Erythropoese-stimulierende-Agenzien (ESA) behandelt werden kann. NOXXON adressiert nun den hohen medizinischen Bedarf diese unzureichende Behandlungsmöglichkeit zu verbessern. Anämische Dialysepatienten, die nicht angemessen auf ESA ansprechen, könnten durch Bindung und Neutralisierung von Hepcidin durch Lexaptepid Pegol profitieren. In einer kürzlich beim AACR-Meeting und auf der EHA-Konferenz veröffentlichten Studie konnte NOXXON bereits einen relevanten Anstieg des Hämoglobinspiegels (>1 g/dL), als Behandlungseffekt einer Monotherapie mit Lexaptepid Pegol, bei einer Untergruppe von anämischen Krebspatienten zeigen.
Lexaptepid Pegol ist ein Spiegelmer®, das Hepcidin bindet und damit seine Wirkung neutralisiert. Hepcidin ist ein Peptidhormon, das den Serumeisenspiegel senkt. Hohe Hepcidinspiegel, wie sie häufig bei Krebs- oder Dialyse-Patienten gefunden werden, führen zu einer Eisenrestriktion, die auch als „funktioneller Eisenmangel“ bezeichnet wird. In diesem Zustand akkumuliert Eisen in den Speicherzellen und steht somit nicht zur Hämoglobinsynthese zur Verfügung, was mit der Zeit zu einer Anämie führt.
http://www.dewb-vc.de/de/portfolio/newsarchiv/968-31-07-14-n…
Berlin - 31. Juli 2014 - NOXXON Pharma gab heute die Behandlung eines ersten Patienten in einer klinischen Proof of Concept Studie der Phase IIa mit dem anti-Hepcidin Spiegelmer® Lexaptepid Pegol (NOX-H94) bekannt. In der Studie werden Dialysepatienten behandelt, die nicht adäquat auf EPO ansprechen. Dies ist die vierte klinische Studie mit Lexaptepid Pegol. Dabei handelt es sich um eine multizentrische, Placebo-kontrollierte Studie, in der die Pharmakokinetik, die Pharmakodynamik, die Wirksamkeit und die Sicherheit von Einzel- und Mehrfachgaben von Lexaptepid Pegol in anämischen Dialysepatienten mit einer sogenannten EPO-hyporesponsiven Anämie untersucht werden.
Ungefähr 10% aller dialysepflichtigen Patienten haben eine spezielle Form der Anämie, die nicht adäquat mit Erythropoese-stimulierende-Agenzien (ESA) behandelt werden kann. NOXXON adressiert nun den hohen medizinischen Bedarf diese unzureichende Behandlungsmöglichkeit zu verbessern. Anämische Dialysepatienten, die nicht angemessen auf ESA ansprechen, könnten durch Bindung und Neutralisierung von Hepcidin durch Lexaptepid Pegol profitieren. In einer kürzlich beim AACR-Meeting und auf der EHA-Konferenz veröffentlichten Studie konnte NOXXON bereits einen relevanten Anstieg des Hämoglobinspiegels (>1 g/dL), als Behandlungseffekt einer Monotherapie mit Lexaptepid Pegol, bei einer Untergruppe von anämischen Krebspatienten zeigen.
Lexaptepid Pegol ist ein Spiegelmer®, das Hepcidin bindet und damit seine Wirkung neutralisiert. Hepcidin ist ein Peptidhormon, das den Serumeisenspiegel senkt. Hohe Hepcidinspiegel, wie sie häufig bei Krebs- oder Dialyse-Patienten gefunden werden, führen zu einer Eisenrestriktion, die auch als „funktioneller Eisenmangel“ bezeichnet wird. In diesem Zustand akkumuliert Eisen in den Speicherzellen und steht somit nicht zur Hämoglobinsynthese zur Verfügung, was mit der Zeit zu einer Anämie führt.
Two Presentations at International Conferences of Preclinical Data on NOXXON’s anti-C5a Spiegelmer®, a Potential Drug in Pneumococcal Pneumonia-Induced Sepsis
http://www.noxxon.com/index.php?option=com_content&view=arti…
Berlin, Germany - 04 September 2014 - Scientists of Charité - Universitätsmedizin Berlin and NOXXON Pharma are invited to present new preclinical data about effects of NOX-D19, a Spiegelmer® neutralizing the complement component C5a, in pneumococcal pneumonia-induced sepsis.
The talks with the title “Neutralizing the Complement Component C5a Protects Against Lung Injury and Extrapulmonary Organ Injury in Pneumococcal Pneumonia-Induced Sepsis” will be held by Dr. Holger Mueller-Redetzky on Sunday, September 7 (Session 150) at the annual European Respiratory Society International Congress in Munich and by Dr. Axel Vater at the XXV International Complement Workshop in Rio de Janeiro on Tuesday, September 16 during Session V.
Severe community-acquired pneumonia is mostly caused by Streptococcus pneumoniae and often leads to sepsis with high lethality despite adequate antibiotic treatment. The likely reason for the unfavorable outcome is an uncontrolled inflammatory host response that causes additional injury to the lung and subsequently other organs.
NOX-D19, a PEGylated L-RNA aptamer (Spiegelmer®) binds and neutralizes the complement fragment C5a, a major mediator of the complement system which is involved in the immune response against infections but also contributes to hyperinflammation, vascular barrier dysfunction, microcirculatory failure, and organ failure. Hypothetically the inhibition of C5a-signaling by NOX-D19 in pneumococcal pneumonia could prevent pulmonary vascular barrier failure and protect against extrapulmonary organ failure.
The preclinical studies involving Streptococcus pneumoniae-infected mice were performed by Dr. Holger Mueller-Redetzky, Prof. Dr. Martin Witzenrath and coworkers at the Department of Infectious Diseases and Pulmonary Medicine at the Charité - Universitätsmedizin Berlin in cooperation with the Institute of Anatomy and Cell Biology and the Institute for Clinical and Experimental Surgery at the Faculty of Medicine of Saarland University in Homburg. Mice were infected with Streptococcus pneumoniae and the Spiegelmer® NOX-D19 was applied at the time of infection and 24 hours later. The pulmonary permeability, pulmonary and blood leukocyte count, and levels of IL-1β, G-CSF, KC and IL-6, bacterial load in lung, spleen and blood, markers of liver and kidney function (AST, BUN) and histological analyses of fibrin deposition and apoptosis in the liver were analyzed.
24 hours after infection, C5a levels reached a maximum in lung and blood. Lung failure and septic extrapulmonary organ injury developed within 48 hours post infection, as well as apoptosis of hepatocytes and microcirculatory failure. In contrast, in mice that received NOX-D19, neutralization of the pro-inflammatory factor C5a attenuated pulmonary permeability and reduced blood cytokine levels. Furthermore protection from liver injury was observed.
The senior investigator of the study Prof. Dr. Martin Witzenrath from from Charité - Universitätsmedizin Berlin, concluded: “These first results in animal models are very promising. NOX-D19 seems to effectively neutralize C5a and have an effect on the overwhelming immune response that leads to unnecessary damage. NOX-D19 could thus give protection against lung and extra-pulmonary organ failure in pneumococcal pneumonia-induced sepsis and may offer an important adjuvant treatment strategy for improved survival in pneumococcal sepsis.”
http://www.noxxon.com/index.php?option=com_content&view=arti…
Berlin, Germany - 04 September 2014 - Scientists of Charité - Universitätsmedizin Berlin and NOXXON Pharma are invited to present new preclinical data about effects of NOX-D19, a Spiegelmer® neutralizing the complement component C5a, in pneumococcal pneumonia-induced sepsis.
The talks with the title “Neutralizing the Complement Component C5a Protects Against Lung Injury and Extrapulmonary Organ Injury in Pneumococcal Pneumonia-Induced Sepsis” will be held by Dr. Holger Mueller-Redetzky on Sunday, September 7 (Session 150) at the annual European Respiratory Society International Congress in Munich and by Dr. Axel Vater at the XXV International Complement Workshop in Rio de Janeiro on Tuesday, September 16 during Session V.
Severe community-acquired pneumonia is mostly caused by Streptococcus pneumoniae and often leads to sepsis with high lethality despite adequate antibiotic treatment. The likely reason for the unfavorable outcome is an uncontrolled inflammatory host response that causes additional injury to the lung and subsequently other organs.
NOX-D19, a PEGylated L-RNA aptamer (Spiegelmer®) binds and neutralizes the complement fragment C5a, a major mediator of the complement system which is involved in the immune response against infections but also contributes to hyperinflammation, vascular barrier dysfunction, microcirculatory failure, and organ failure. Hypothetically the inhibition of C5a-signaling by NOX-D19 in pneumococcal pneumonia could prevent pulmonary vascular barrier failure and protect against extrapulmonary organ failure.
The preclinical studies involving Streptococcus pneumoniae-infected mice were performed by Dr. Holger Mueller-Redetzky, Prof. Dr. Martin Witzenrath and coworkers at the Department of Infectious Diseases and Pulmonary Medicine at the Charité - Universitätsmedizin Berlin in cooperation with the Institute of Anatomy and Cell Biology and the Institute for Clinical and Experimental Surgery at the Faculty of Medicine of Saarland University in Homburg. Mice were infected with Streptococcus pneumoniae and the Spiegelmer® NOX-D19 was applied at the time of infection and 24 hours later. The pulmonary permeability, pulmonary and blood leukocyte count, and levels of IL-1β, G-CSF, KC and IL-6, bacterial load in lung, spleen and blood, markers of liver and kidney function (AST, BUN) and histological analyses of fibrin deposition and apoptosis in the liver were analyzed.
24 hours after infection, C5a levels reached a maximum in lung and blood. Lung failure and septic extrapulmonary organ injury developed within 48 hours post infection, as well as apoptosis of hepatocytes and microcirculatory failure. In contrast, in mice that received NOX-D19, neutralization of the pro-inflammatory factor C5a attenuated pulmonary permeability and reduced blood cytokine levels. Furthermore protection from liver injury was observed.
The senior investigator of the study Prof. Dr. Martin Witzenrath from from Charité - Universitätsmedizin Berlin, concluded: “These first results in animal models are very promising. NOX-D19 seems to effectively neutralize C5a and have an effect on the overwhelming immune response that leads to unnecessary damage. NOX-D19 could thus give protection against lung and extra-pulmonary organ failure in pneumococcal pneumonia-induced sepsis and may offer an important adjuvant treatment strategy for improved survival in pneumococcal sepsis.”
Orphan-Drug-Status der FDA für NOX-A12 bei GBM
NOX-A12 hat im August Orphan Drug Designation (ODD) von der FDA in der Indikation Glioblastom in Kombination mit Strahlentherapie erhalten. Das wäre eigentlich eine PM seitens Noxxon wert (gewesen), kommt vermutlich noch zu gegebener Zeit bzw. in einem passenden Kontext. Jedenfalls wird der ODD-Status die Verpartnerung/Weiterentwicklung von NOX-A12 nicht erschweren, ganz im Gegenteil. Auch für das IPO-Szenario ist dies von Vorteil. Leider fehlt bislang eine Aussage von Noxxon, wann eine P2-Studie in GBM gestartet werden soll. Die überzeugenden präklinischen Daten liegen nun schon seit geraumer Zeit vor (s. unten).
Quelle 1: http://orphandruganaut.wordpress.com/2014/09/01/fda-august-2…
Quelle 2: http://www.accessdata.fda.gov/scripts/opdlisting/oopd/OOPD_R…
Orphan Drug: http://en.wikipedia.org/wiki/Orphan_drug
FDA: http://www.fda.gov/ForIndustry/DevelopingProductsforRareDise…
-------------------------------------------------------------------------------------------------
Anbei einige Publikationen/Abstracts zu diesem Thema:
Shie-Chau Liu et al. (AACR-Meeting 2013): Inhibition of recurrences of experimental brain tumors after irradiation by blocking the activity of SDF-1 (CXCL12) using the Spiegelmer® NOX-A12
http://www.abstractsonline.com/Plan/ViewAbstract.aspx?sKey=8…
Martin Brown (ECCO-Meeting 2013): Vasculogenesis: A new target to improve the radiotherapy of solid tumors
http://2013.europeancancercongress.org/Scientific-Programme/…
Shie-Chau Liu et al. (Neuro-Oncology 2014): Blockade of SDF-1 after irradiation inhibits tumor recurrences of autochthonous brain tumors in rats
http://neuro-oncology.oxfordjournals.org/content/16/1/21.ful…
NOX-A12 hat im August Orphan Drug Designation (ODD) von der FDA in der Indikation Glioblastom in Kombination mit Strahlentherapie erhalten. Das wäre eigentlich eine PM seitens Noxxon wert (gewesen), kommt vermutlich noch zu gegebener Zeit bzw. in einem passenden Kontext. Jedenfalls wird der ODD-Status die Verpartnerung/Weiterentwicklung von NOX-A12 nicht erschweren, ganz im Gegenteil. Auch für das IPO-Szenario ist dies von Vorteil. Leider fehlt bislang eine Aussage von Noxxon, wann eine P2-Studie in GBM gestartet werden soll. Die überzeugenden präklinischen Daten liegen nun schon seit geraumer Zeit vor (s. unten).
Quelle 1: http://orphandruganaut.wordpress.com/2014/09/01/fda-august-2…
Quelle 2: http://www.accessdata.fda.gov/scripts/opdlisting/oopd/OOPD_R…
Orphan Drug: http://en.wikipedia.org/wiki/Orphan_drug
FDA: http://www.fda.gov/ForIndustry/DevelopingProductsforRareDise…
-------------------------------------------------------------------------------------------------
Anbei einige Publikationen/Abstracts zu diesem Thema:
Shie-Chau Liu et al. (AACR-Meeting 2013): Inhibition of recurrences of experimental brain tumors after irradiation by blocking the activity of SDF-1 (CXCL12) using the Spiegelmer® NOX-A12
http://www.abstractsonline.com/Plan/ViewAbstract.aspx?sKey=8…
Martin Brown (ECCO-Meeting 2013): Vasculogenesis: A new target to improve the radiotherapy of solid tumors
http://2013.europeancancercongress.org/Scientific-Programme/…
Shie-Chau Liu et al. (Neuro-Oncology 2014): Blockade of SDF-1 after irradiation inhibits tumor recurrences of autochthonous brain tumors in rats
http://neuro-oncology.oxfordjournals.org/content/16/1/21.ful…
NOX-H94 - Nachlese zur Endotoxin-Studie
Im Blood-Journal sind vor Kurzem von van Eijk et al. die Daten aus der Endotoxin-Studie publiziert worden. Die wesentlichen Ergebnisse wurden bereits auf dem ASH-Meeting 2012 vorgestellt, s. Beitrag #119 (bzw. folgender Link).
Abstract von van Eijk et al. in Blood 2014: http://www.bloodjournal.org/content/early/2014/08/26/blood-2…
Abstract von van Eijk et al. auf ASH 2012: http://ash.confex.com/ash/2012/webprogram/Paper50672.html
------------------------------------------------------------------------------
Einige zusätzliche Einschätzungen aus einer Reuters-Korrespondenz enthält folgender Web-Artikel (Auszüge). Insbesondere die Einschätzung von Tomas Ganz, eine der Hepcidin-Koryphäen, sollte man im Hinterkopf behalten.
New Drug Shows Promise Against Anemia of Inflammation
http://www.pharmacylearningnetwork.com/articles/new-drug-sho…
NEW YORK - Lexaptepid, a new compound that inactivates the iron regulator hepcidin, may be able to reverse inflammation-induced decreases in serum iron level, researchers from the Netherlands report.
"Our study provided proof-of principle in healthy volunteers that it is actually possible to counteract the effects of inflammation-induced increased hepcidin levels on serum iron," said Dr. Lucas T. van Eijk from Radboud University Medical Center in Nijmegen.
"The pathophysiology of the hepcidin-ferroportin axis is amenable to pharmacologic treatments that may be more effective and better tolerated than the high-dose erythropoietin and IV iron treatments currently used in this patient group," he told Reuters Health by email. ...
"The initial increase in serum iron is the result of the acute state of inflammation that is induced by LPS, and is not something which is seen in patients suffering from anemia of chronic disease," Dr. van Eijk said. "They are typically in a continuous state of low serum iron and low transferrin saturation. Our expectation is that by targeting hepcidin, their serum iron levels can be brought into the normal range, but will not result in high serum iron values as observed in our trial in healthy subjects, and thus no compensatory response is to be expected."
Lexaptepid did not alter the parameters of inflammation caused by LPS. "This means that we have no reason to believe that the underlying inflammatory condition of patients suffering from anemia of inflammation would be aggravated by treatment with lexaptepid," Dr. van Eijk explained. ...
Dr. Elizabeta Nemeth and Dr. Tomas Ganz from David Geffen School of Medicine at the University of California, Los Angeles, recently reviewed the literature on anemia of inflammation.
"Antagonizing hepcidin is a reasonable approach for treating anemia of chronic disease (ACD) (although antagonizing hepcidin will not address other mechanisms underlying ACD, such as the direct effect of cytokines on erythroid precursors), Dr. Nemeth told Reuters Health by email. "Using a hepcidin binder such as lexaptepid is a good idea, although the long-term efficacy remains to be demonstrated."
"This company has two Phase 2 trials using this drug," she said. "They are the most advanced in terms of human testing in the hepcidin space, so hopefully we will see the results soon."
Dr. Ganz cautioned, "Although this approach is reasonable, anemia of chronic disease is usually not severe, so the treatment must be essentially free of side effects and can't be expensive."
Im Blood-Journal sind vor Kurzem von van Eijk et al. die Daten aus der Endotoxin-Studie publiziert worden. Die wesentlichen Ergebnisse wurden bereits auf dem ASH-Meeting 2012 vorgestellt, s. Beitrag #119 (bzw. folgender Link).
Abstract von van Eijk et al. in Blood 2014: http://www.bloodjournal.org/content/early/2014/08/26/blood-2…
Abstract von van Eijk et al. auf ASH 2012: http://ash.confex.com/ash/2012/webprogram/Paper50672.html
------------------------------------------------------------------------------
Einige zusätzliche Einschätzungen aus einer Reuters-Korrespondenz enthält folgender Web-Artikel (Auszüge). Insbesondere die Einschätzung von Tomas Ganz, eine der Hepcidin-Koryphäen, sollte man im Hinterkopf behalten.
New Drug Shows Promise Against Anemia of Inflammation
http://www.pharmacylearningnetwork.com/articles/new-drug-sho…
NEW YORK - Lexaptepid, a new compound that inactivates the iron regulator hepcidin, may be able to reverse inflammation-induced decreases in serum iron level, researchers from the Netherlands report.
"Our study provided proof-of principle in healthy volunteers that it is actually possible to counteract the effects of inflammation-induced increased hepcidin levels on serum iron," said Dr. Lucas T. van Eijk from Radboud University Medical Center in Nijmegen.
"The pathophysiology of the hepcidin-ferroportin axis is amenable to pharmacologic treatments that may be more effective and better tolerated than the high-dose erythropoietin and IV iron treatments currently used in this patient group," he told Reuters Health by email. ...
"The initial increase in serum iron is the result of the acute state of inflammation that is induced by LPS, and is not something which is seen in patients suffering from anemia of chronic disease," Dr. van Eijk said. "They are typically in a continuous state of low serum iron and low transferrin saturation. Our expectation is that by targeting hepcidin, their serum iron levels can be brought into the normal range, but will not result in high serum iron values as observed in our trial in healthy subjects, and thus no compensatory response is to be expected."
Lexaptepid did not alter the parameters of inflammation caused by LPS. "This means that we have no reason to believe that the underlying inflammatory condition of patients suffering from anemia of inflammation would be aggravated by treatment with lexaptepid," Dr. van Eijk explained. ...
Dr. Elizabeta Nemeth and Dr. Tomas Ganz from David Geffen School of Medicine at the University of California, Los Angeles, recently reviewed the literature on anemia of inflammation.
"Antagonizing hepcidin is a reasonable approach for treating anemia of chronic disease (ACD) (although antagonizing hepcidin will not address other mechanisms underlying ACD, such as the direct effect of cytokines on erythroid precursors), Dr. Nemeth told Reuters Health by email. "Using a hepcidin binder such as lexaptepid is a good idea, although the long-term efficacy remains to be demonstrated."
"This company has two Phase 2 trials using this drug," she said. "They are the most advanced in terms of human testing in the hepcidin space, so hopefully we will see the results soon."
Dr. Ganz cautioned, "Although this approach is reasonable, anemia of chronic disease is usually not severe, so the treatment must be essentially free of side effects and can't be expensive."
NOXXON Pharma erweitert das Management mit der Ernennung von Don Munoz zum Chief Financial Officer -
Die Ernennung fällt zusammen mit dem Aufbau einer US Präsenz in Boston
http://www.noxxon.com/index.php?option=com_content&view=arti…
Berlin, Deutschland und Boston, Massachusetts - 18. September 2014 - Die NOXXON Pharma hat Don Munoz zum Chief Financial Officer ernannt. Herr Munoz wird die Geschäftsleitung in der neuen Zweigstelle der NOXXON Pharma in Boston (Massachusetts) verstärken.
Vor seinem Wechsel zur NOXXON Pharma war Don Munoz Leiter des Investment Banking bei Summer Street Research Partners, einer Investmentbank und institutionellen Wertpapieranalysefirma, die sich auf den Gesundheitssektor spezialisiert hat. Davor hat er bei Cowen & Company und Leerink Swann im Investment Banking den Bereich Medizintechnik geleitet. Bei der Investmentbankgruppe Alex Brown & Sons und dessen Nachfolger, der Deutschen Bank Securities, war er 10 Jahre tätig. Insgesamt hat er über 21 Jahre Erfahrung im Investment Banking, davon war er 19 Jahre ausschließlich auf den Gesundheitssektor spezialisiert.
Während seiner Laufbahn hat er mehr als 100 Finanzierungen und M&A-Transaktionen begleitet und durchgeführt. Er hat einen BA vom Dartmouth College und einen MBA in Finanz- und Rechnungswesen der Columbia University, wo er bei Beta Gamma Sigma aufgenommen wurde.
Herr Munoz sagt dazu: „Es reizt mich sehr, mich NOXXON in dieser wichtigen Zeit der Firmengeschichte anschließen zu dürfen und ich freue mich darauf, die Geschäftsleitung in der Firmenentwicklung zu unterstützen. NOXXON ist mit seinem breiten Portfolio an vielversprechenden Wirkstoffkandidaten genau die Gelegenheit, nach der ich gesucht habe, um meine breite Erfahrung im Finanz- und Gesundheitssektor einbringen zu können.“
Iain Buchanan, Geschäftsführer der NOXXON Pharma AG, erklärt dazu: „Ich freue mich sehr, Don in NOXXONs Management-Team begrüßen zu dürfen. Wir werden in den kommenden Monaten unsere Aufmerksamkeit verstärkt auf den amerikanischen Markt richten. Dons Erfahrungen mit dem dortigen Investoren- und Bankenwesen wird für uns von unschätzbarem Wert sein. Unser Ziel ist es, eine Präsenz in der Gegend von Boston aufzubauen, damit NOXXON ein integraler Bestandteil des dort hochaktiven biowissenschaftlichen Netzwerks werden kann. Dons Berufung ist ein erster wichtiger Schritt in dieser Richtung.“
Die Ernennung fällt zusammen mit dem Aufbau einer US Präsenz in Boston
http://www.noxxon.com/index.php?option=com_content&view=arti…
Berlin, Deutschland und Boston, Massachusetts - 18. September 2014 - Die NOXXON Pharma hat Don Munoz zum Chief Financial Officer ernannt. Herr Munoz wird die Geschäftsleitung in der neuen Zweigstelle der NOXXON Pharma in Boston (Massachusetts) verstärken.
Vor seinem Wechsel zur NOXXON Pharma war Don Munoz Leiter des Investment Banking bei Summer Street Research Partners, einer Investmentbank und institutionellen Wertpapieranalysefirma, die sich auf den Gesundheitssektor spezialisiert hat. Davor hat er bei Cowen & Company und Leerink Swann im Investment Banking den Bereich Medizintechnik geleitet. Bei der Investmentbankgruppe Alex Brown & Sons und dessen Nachfolger, der Deutschen Bank Securities, war er 10 Jahre tätig. Insgesamt hat er über 21 Jahre Erfahrung im Investment Banking, davon war er 19 Jahre ausschließlich auf den Gesundheitssektor spezialisiert.
Während seiner Laufbahn hat er mehr als 100 Finanzierungen und M&A-Transaktionen begleitet und durchgeführt. Er hat einen BA vom Dartmouth College und einen MBA in Finanz- und Rechnungswesen der Columbia University, wo er bei Beta Gamma Sigma aufgenommen wurde.
Herr Munoz sagt dazu: „Es reizt mich sehr, mich NOXXON in dieser wichtigen Zeit der Firmengeschichte anschließen zu dürfen und ich freue mich darauf, die Geschäftsleitung in der Firmenentwicklung zu unterstützen. NOXXON ist mit seinem breiten Portfolio an vielversprechenden Wirkstoffkandidaten genau die Gelegenheit, nach der ich gesucht habe, um meine breite Erfahrung im Finanz- und Gesundheitssektor einbringen zu können.“
Iain Buchanan, Geschäftsführer der NOXXON Pharma AG, erklärt dazu: „Ich freue mich sehr, Don in NOXXONs Management-Team begrüßen zu dürfen. Wir werden in den kommenden Monaten unsere Aufmerksamkeit verstärkt auf den amerikanischen Markt richten. Dons Erfahrungen mit dem dortigen Investoren- und Bankenwesen wird für uns von unschätzbarem Wert sein. Unser Ziel ist es, eine Präsenz in der Gegend von Boston aufzubauen, damit NOXXON ein integraler Bestandteil des dort hochaktiven biowissenschaftlichen Netzwerks werden kann. Dons Berufung ist ein erster wichtiger Schritt in dieser Richtung.“
Antwort auf Beitrag Nr.: 47.709.915 von Saaletaler am 05.09.14 23:59:56NOXXONs Spiegelmer® Olaptesed Pegol erhält den FDA Orphan Drug-Status für Glioblastombehandlung
http://www.dewb-vc.de/de/portfolio/newsarchiv/975-23-09-14-n…
Berlin, Deutschland und Boston, USA - 23. September 2014 - NOXXON Pharma teilte heute mit, dass der Spiegelmer® Wirkstoff Olaptesed Pegol (NOX-A12) von der US-amerikanischen Food and Drug Administration (FDA) den sog. Orphan Drug-Status für die Behandlung von Glioblastomen in Verbindung mit Bestrahlung erteilt bekommen hat.
Das Glioblastom ist der häufigste und aggressivste unter den primären bösartigen Gehirntumoren, verbunden mit einer schlechten Prognose und nur kurzer Überlebenszeit. Standardmäßig kommen Chemotherapie, Bestrahlung und operative Eingriffe zur Anwendung. Die Behandlung ist aber aufgrund der hohen Widerstandsfähigkeit der Tumorzellen, einem nahezu unvermeidlichen Rückfall und dem Risiko von Beschädigungen des Gehirns mit konventionellen Therapien äußerst schwierig.
Olaptesed Pegol ist ein PEGyliertes, gespiegeltes (L )Oligonukleotid, das an das Chemokin CXCL12/SDF-1 bindet und so eine Interaktion mit dessen Rezeptoren CXCR4 und CXCR7 verhindert. Der CXCL12/CXCR4/CXCR7 Signalweg ist direkt an der Tumorentwicklung beteiligt, indem er das Überleben, die Vermehrung und die Migration der Krebszellen kontrolliert und indirekt Einfluss auf das Wachstum von Blutgefäßen (Angiogenese) und die Rekrutierung von Immunzellen nimmt.
Die Neutralisierung von CXCL12 durch Olaptesed Pegol führt zu einer gesteigerten Empfindlichkeit des Tumors für die Wirkungen von Chemotherapie und Bestrahlung. Eine Behandlung mit Olaptesed Pegol wirkt darüber hinaus gegen den Krebs, indem Tumorreparaturmechanismen blockiert werden, welche sonst von CXCL12-rekrutierten Knochenmarkszellen initiiert werden. In Glioblastom-Tiermodellen führte eine Olaptesed Pegol Therapie zu einer signifikanten Wirksamkeitssteigerung der gegen den Krebs eingesetzten Bestrahlung (Liu et al., Neuro Oncol. 2014).
Momentan wird Olaptesed Pegol in Phase IIa-Studien bei zwei Arten von Blutkrebs untersucht: Multiples Myelom (MM) und chronisch lymphatische Leukämie (CLL). Die Erteilung des Orphan Drug-Status durch die FDA stellt eine Unterstützung von NOXXONs Entwicklungsarbeit zur Glioblastombehandlung mit Olaptesed Pegol dar.
Chief Medical Officer Dr. Matthias Baumann von NOXXON Pharma sagte dazu: „Die Erteilung des Orphan Drug-Status für Olaptesed Pegol durch die FDA ist ein bedeutender regulatorischer Meilenstein für NOXXON. Zusammen mit unseren Zwischenergebnissen aus den laufenden Phase IIa-Studien bei Multiplem Myelom und chronisch lymphatischer Leukämie untermauern die präklinischen Glioblastom-Ergebnisse das breite therapeutische Potential von Olaptesed Pegol.“
Über den Orphan Drug-Status
Der Orphan Drug-Status bietet regulatorische Unterstützung für Entwicklungen von Medikamenten, die möglicherweise Patienten, die an seltenen, lebensbedrohenden Krankheiten leiden, einen signifikanten Nutzen bringen. Nach Erteilung des Status bekommen Firmen Hilfestellung bei der Erstellung von Zulassungsprotokollen und sie zahlen niedrigere Zulassungsgebühren, außerdem sind steuerliche Anreize und Marktexklusivität nach der Zulassung möglich.
http://www.dewb-vc.de/de/portfolio/newsarchiv/975-23-09-14-n…
Berlin, Deutschland und Boston, USA - 23. September 2014 - NOXXON Pharma teilte heute mit, dass der Spiegelmer® Wirkstoff Olaptesed Pegol (NOX-A12) von der US-amerikanischen Food and Drug Administration (FDA) den sog. Orphan Drug-Status für die Behandlung von Glioblastomen in Verbindung mit Bestrahlung erteilt bekommen hat.
Das Glioblastom ist der häufigste und aggressivste unter den primären bösartigen Gehirntumoren, verbunden mit einer schlechten Prognose und nur kurzer Überlebenszeit. Standardmäßig kommen Chemotherapie, Bestrahlung und operative Eingriffe zur Anwendung. Die Behandlung ist aber aufgrund der hohen Widerstandsfähigkeit der Tumorzellen, einem nahezu unvermeidlichen Rückfall und dem Risiko von Beschädigungen des Gehirns mit konventionellen Therapien äußerst schwierig.
Olaptesed Pegol ist ein PEGyliertes, gespiegeltes (L )Oligonukleotid, das an das Chemokin CXCL12/SDF-1 bindet und so eine Interaktion mit dessen Rezeptoren CXCR4 und CXCR7 verhindert. Der CXCL12/CXCR4/CXCR7 Signalweg ist direkt an der Tumorentwicklung beteiligt, indem er das Überleben, die Vermehrung und die Migration der Krebszellen kontrolliert und indirekt Einfluss auf das Wachstum von Blutgefäßen (Angiogenese) und die Rekrutierung von Immunzellen nimmt.
Die Neutralisierung von CXCL12 durch Olaptesed Pegol führt zu einer gesteigerten Empfindlichkeit des Tumors für die Wirkungen von Chemotherapie und Bestrahlung. Eine Behandlung mit Olaptesed Pegol wirkt darüber hinaus gegen den Krebs, indem Tumorreparaturmechanismen blockiert werden, welche sonst von CXCL12-rekrutierten Knochenmarkszellen initiiert werden. In Glioblastom-Tiermodellen führte eine Olaptesed Pegol Therapie zu einer signifikanten Wirksamkeitssteigerung der gegen den Krebs eingesetzten Bestrahlung (Liu et al., Neuro Oncol. 2014).
Momentan wird Olaptesed Pegol in Phase IIa-Studien bei zwei Arten von Blutkrebs untersucht: Multiples Myelom (MM) und chronisch lymphatische Leukämie (CLL). Die Erteilung des Orphan Drug-Status durch die FDA stellt eine Unterstützung von NOXXONs Entwicklungsarbeit zur Glioblastombehandlung mit Olaptesed Pegol dar.
Chief Medical Officer Dr. Matthias Baumann von NOXXON Pharma sagte dazu: „Die Erteilung des Orphan Drug-Status für Olaptesed Pegol durch die FDA ist ein bedeutender regulatorischer Meilenstein für NOXXON. Zusammen mit unseren Zwischenergebnissen aus den laufenden Phase IIa-Studien bei Multiplem Myelom und chronisch lymphatischer Leukämie untermauern die präklinischen Glioblastom-Ergebnisse das breite therapeutische Potential von Olaptesed Pegol.“
Über den Orphan Drug-Status
Der Orphan Drug-Status bietet regulatorische Unterstützung für Entwicklungen von Medikamenten, die möglicherweise Patienten, die an seltenen, lebensbedrohenden Krankheiten leiden, einen signifikanten Nutzen bringen. Nach Erteilung des Status bekommen Firmen Hilfestellung bei der Erstellung von Zulassungsprotokollen und sie zahlen niedrigere Zulassungsgebühren, außerdem sind steuerliche Anreize und Marktexklusivität nach der Zulassung möglich.
"Cell Reports"-Veröffentlichung über den Wirkmechanismus von NOXXONs Anti-SDF-1 Spiegelmer® Olaptesed Pegol (NOX-A12) in einer präklinischen Studie zum Multiplem Myelom
http://www.noxxon.com/index.php?option=com_content&view=arti…
Berlin, Deutschland und Boston, USA - 26. September 2014 - NOXXON Pharma teilte heute mit, dass eine neue Studie mit dem Titel „SDF-1 Inhibition Targets the Bone Marrow Niche for Cancer Therapy” in der Zeitschrift Cell Reports veröffentlicht wurde. Die Studie über den Blutkrebs Multiples Myelom im Mausmodell wurde von Wissenschaftlern des Dana-Farber Cancer Instituts der Harvard Medical School in Boston (USA) und der NOXXON Pharma durchgeführt.
Die Metastasierung, bei der sich ein Tumor auf andere Körperteile ausweitet, ist einer der tödlichsten Aspekte von Krebs. Forscher haben sich bei der Behandlung bisher meist auf die Krebszellen an sich konzentriert, mittlerweile erfahren aber auch die Interaktionen zwischen dem Tumor und dem umgebenden Gewebe, dem sogenannten Mikromilieu, eine erhöhte Aufmerksamkeit.
Dr. Irene Ghobrial, Professorin an der Harvard Medical School und ihr Team fanden heraus, dass im Knochenmark von Patienten mit einem aktiven Multiplen Myelom, aber auch in Patienten mit Knochenmarksmetastasen solider Tumoren, der Tumorzellen anlockende Botenstoff stromal cell derived factor-1 (SDF-1/CXCL12) hoch exprimiert wird. Das Spiegelmer® Olaptesed Pegol, ein von NOXXON Pharma entwickeltes PEGyliertes, gespiegeltes (L-)Oligonukleotid, bindet fest und spezifisch an SDF-1. Die Hypothese der Forscher war, dass eine Blockade von SDF-1 mit Olaptesed Pegol das Anziehungssignal des Knochenmarks für Tumorzellen deutlich reduzieren könnte. Tatsächlich führte die Behandlung mit Olaptesed Pegol zu einer Verlangsamung des Krankheitsverlaufs und einem verlängerten Überleben im Mausmodell des Multiplen Myeloms.
Dr. Aldo Roccaro, einer der beiden Erstautoren gemeinsam mit Antonio Sacco vom Dana Farber Institut, sagte dazu: „Wir wissen, dass Myelomzellen im Blutkreislauf nicht lange überleben können, wenn sie sich nicht an anderes Gewebe anheften können. Daraus schließen wir, dass eine Neutralisation von SDF-1 zu einer Veränderung des Knochenmarksmilieus führen könnte, wodurch es weniger empfänglich für Myelomzellen wird. Wenn die Affinität von Myelomzellen für das Knochenmark gesenkt wird, könnte die Ausbreitung des Krebses gehemmt werden.”
Die Seniorautorin der Studie, Dr. Irene Ghobrial, fügt hinzu: „Die Metastasierung bleibt nach wie vor die wichtigste Komplikation, mit der wir es als Mediziner und Krebsforscher zu tun haben, aber unsere Erkenntnisse dokumentieren nun einen klaren therapeutischen Effekt von Olaptesed Pegol im Mausmodell eines Myeloms im fortgeschrittenem Stadium.”
Dr. Matthias Baumann, Chief Medical Officer von NOXXON Pharma, fasst zusammen: „Die Ergebnisse legen nahe, dass die Neutralisierung von SDF-1 eine zuverlässige Strategie sein könnte, um eine Kolonisierung des Knochenmarks mit Myelomzellen zu verhindern - möglicherweise auch die Entstehung von Knochenmarksmetastasen. Zusammen mit den Zwischenergebnissen unserer laufenden Phase IIa-Studien in Patienten mit Multiplem Myelom und chronisch lymphatischer Leukämie (CLL) unterstützen die Erkenntnisse das therapeutische Potential von Olaptesed Pegol.”
Zugang zur (online-) Publikation in Cell Reports erhalten Sie über folgenden Link (pdf):
http://www.cell.com/cell-reports/pdf/S2211-1247(14)00718-9.p…
Über Multiples Myelom
Multiples Myelom ist ein Blutkrebs, der sich im Knochenmark entwickelt und normale antikörperproduzierende Zellen in maligne Myelomazellen verwandelt. Das Wachstum der Krebszellen im Knochenmark verhindert die Produktion von normalen Blutzellen und Antikörpern, führt aber auch zu Läsionen, die die Knochenstabilität vermindern. Laut dem amerikanischen National Cancer Institute (NCI) ist Multiples Myelom der zweithäufigste Blutkrebs in den USA und ist für etwa ein Prozent aller Krebsfälle verantwortlich.
Über das Dana-Farber Cancer Institute
Das Dana-Farber Cancer Institute ist ein weltweit bekanntes Krebsforschungs- und -behandlungszentrum für Erwachsene und Kinder in den USA. Es gehört zur Harvard Medical School in Boston und ist einer der größten Empfänger von Fördermitteln des NCI und des National Institutes of Health.
Weitere Informationen unter www.dana-farber.org
----------------------------------------------------------------------------------------------------------------
Zu weiteren Publikationen/Abstracts des MM-Teams um Roccaro/Sacco/Ghobrial siehe folgende Beiträge:
#80: http://www.wallstreet-online.de/diskussion/1153611-201-210/n…
#117: http://www.wallstreet-online.de/diskussion/1153611-201-210/n…
#204: http://www.wallstreet-online.de/diskussion/1153611-201-210/n…
http://www.noxxon.com/index.php?option=com_content&view=arti…
Berlin, Deutschland und Boston, USA - 26. September 2014 - NOXXON Pharma teilte heute mit, dass eine neue Studie mit dem Titel „SDF-1 Inhibition Targets the Bone Marrow Niche for Cancer Therapy” in der Zeitschrift Cell Reports veröffentlicht wurde. Die Studie über den Blutkrebs Multiples Myelom im Mausmodell wurde von Wissenschaftlern des Dana-Farber Cancer Instituts der Harvard Medical School in Boston (USA) und der NOXXON Pharma durchgeführt.
Die Metastasierung, bei der sich ein Tumor auf andere Körperteile ausweitet, ist einer der tödlichsten Aspekte von Krebs. Forscher haben sich bei der Behandlung bisher meist auf die Krebszellen an sich konzentriert, mittlerweile erfahren aber auch die Interaktionen zwischen dem Tumor und dem umgebenden Gewebe, dem sogenannten Mikromilieu, eine erhöhte Aufmerksamkeit.
Dr. Irene Ghobrial, Professorin an der Harvard Medical School und ihr Team fanden heraus, dass im Knochenmark von Patienten mit einem aktiven Multiplen Myelom, aber auch in Patienten mit Knochenmarksmetastasen solider Tumoren, der Tumorzellen anlockende Botenstoff stromal cell derived factor-1 (SDF-1/CXCL12) hoch exprimiert wird. Das Spiegelmer® Olaptesed Pegol, ein von NOXXON Pharma entwickeltes PEGyliertes, gespiegeltes (L-)Oligonukleotid, bindet fest und spezifisch an SDF-1. Die Hypothese der Forscher war, dass eine Blockade von SDF-1 mit Olaptesed Pegol das Anziehungssignal des Knochenmarks für Tumorzellen deutlich reduzieren könnte. Tatsächlich führte die Behandlung mit Olaptesed Pegol zu einer Verlangsamung des Krankheitsverlaufs und einem verlängerten Überleben im Mausmodell des Multiplen Myeloms.
Dr. Aldo Roccaro, einer der beiden Erstautoren gemeinsam mit Antonio Sacco vom Dana Farber Institut, sagte dazu: „Wir wissen, dass Myelomzellen im Blutkreislauf nicht lange überleben können, wenn sie sich nicht an anderes Gewebe anheften können. Daraus schließen wir, dass eine Neutralisation von SDF-1 zu einer Veränderung des Knochenmarksmilieus führen könnte, wodurch es weniger empfänglich für Myelomzellen wird. Wenn die Affinität von Myelomzellen für das Knochenmark gesenkt wird, könnte die Ausbreitung des Krebses gehemmt werden.”
Die Seniorautorin der Studie, Dr. Irene Ghobrial, fügt hinzu: „Die Metastasierung bleibt nach wie vor die wichtigste Komplikation, mit der wir es als Mediziner und Krebsforscher zu tun haben, aber unsere Erkenntnisse dokumentieren nun einen klaren therapeutischen Effekt von Olaptesed Pegol im Mausmodell eines Myeloms im fortgeschrittenem Stadium.”
Dr. Matthias Baumann, Chief Medical Officer von NOXXON Pharma, fasst zusammen: „Die Ergebnisse legen nahe, dass die Neutralisierung von SDF-1 eine zuverlässige Strategie sein könnte, um eine Kolonisierung des Knochenmarks mit Myelomzellen zu verhindern - möglicherweise auch die Entstehung von Knochenmarksmetastasen. Zusammen mit den Zwischenergebnissen unserer laufenden Phase IIa-Studien in Patienten mit Multiplem Myelom und chronisch lymphatischer Leukämie (CLL) unterstützen die Erkenntnisse das therapeutische Potential von Olaptesed Pegol.”
Zugang zur (online-) Publikation in Cell Reports erhalten Sie über folgenden Link (pdf):
http://www.cell.com/cell-reports/pdf/S2211-1247(14)00718-9.p…
Über Multiples Myelom
Multiples Myelom ist ein Blutkrebs, der sich im Knochenmark entwickelt und normale antikörperproduzierende Zellen in maligne Myelomazellen verwandelt. Das Wachstum der Krebszellen im Knochenmark verhindert die Produktion von normalen Blutzellen und Antikörpern, führt aber auch zu Läsionen, die die Knochenstabilität vermindern. Laut dem amerikanischen National Cancer Institute (NCI) ist Multiples Myelom der zweithäufigste Blutkrebs in den USA und ist für etwa ein Prozent aller Krebsfälle verantwortlich.
Über das Dana-Farber Cancer Institute
Das Dana-Farber Cancer Institute ist ein weltweit bekanntes Krebsforschungs- und -behandlungszentrum für Erwachsene und Kinder in den USA. Es gehört zur Harvard Medical School in Boston und ist einer der größten Empfänger von Fördermitteln des NCI und des National Institutes of Health.
Weitere Informationen unter www.dana-farber.org
----------------------------------------------------------------------------------------------------------------
Zu weiteren Publikationen/Abstracts des MM-Teams um Roccaro/Sacco/Ghobrial siehe folgende Beiträge:
#80: http://www.wallstreet-online.de/diskussion/1153611-201-210/n…
#117: http://www.wallstreet-online.de/diskussion/1153611-201-210/n…
#204: http://www.wallstreet-online.de/diskussion/1153611-201-210/n…
!
Dieser Beitrag wurde von m.klemm moderiert. Grund: Doppelposting
Antwort auf Beitrag Nr.: 47.888.030 von Saaletaler am 26.09.14 20:17:43NOX-A12 bei MM
Zu den jüngsten Erkenntnissen über die Wirkung von NOX-A12 in einer präklinischen Studie bei MM-Mäusen gibt es einen weiteren Web-Artikel, direkt von der "Dana-Faber"-Pressestelle. Die Grundproblematik wird darin nochmals recht verständlich beschrieben. Anscheinend sind bereits weitere klinische Studien mit NOX-A12 bei MM-Patienten in der konkreten Planung, s. Ende des Artikels.
-------------------------------------------------------------------------------------------------------------
Spread of multiple myeloma halted in mice
http://news.harvard.edu/gazette/story/2014/09/spread-of-mult…
In an advance against cancer metastasis, scientists at the Harvard-affiliated Dana-Farber Cancer Institute have shown that a specially developed compound can impede multiple myeloma in mice from spreading to the bones.
The findings, published in the Sept. 25 online edition of Cell Reports, suggest the compound may also be able to protect human patients from one of the deadliest effects of cancer.
The research involves a new approach to metastasis, the process by which cancer tumors spread to and colonize distant parts of the body. While traditionally research has focused on the cancer cells themselves, scientists are increasingly studying the interactions between tumor cells and the tissues around them — the so-called microenvironment. In the current study, researchers explored why errant myeloma cells often settle in bones, and whether the bones could be made less hospitable to such malignant homesteading.
“While cure and survival rates have increased for many types of cancers in recent decades, most of these gains have been made in patients with primary cancers — cancers that have not spread beyond their initial site,” said the study’s senior author, Irene Ghobrial of Dana-Farber’s Center for Hematologic Oncology. “Metastasis remains one of the most formidable complications we face as cancer researchers and physicians. Improvements in the treatment of metastatic cancers have, for the most part, not been nearly as dramatic as in primary disease.”
The current study focused on multiple myeloma because it is metastatic by nature. Myeloma cells originate in the bone marrow, depart for the bloodstream, and eventually return to the bones, where they form numerous colonies — hence the name.
Ghobrial and her team knew that a substance called stromal cell-derived factor-1 (SDF-1) is a kind of protein Pied Piper, attracting certain cells to new locations within the bone marrow. They found that mice with advanced stages of myeloma had sharply higher levels of SDF-1 at the sites in the bones where metastasis had occurred.
“We reasoned that by neutralizing SDF-1, we could change the bone marrow environment to make it less receptive for multiple myeloma cells, reduce myeloma cells’ affinity for the marrow, and thereby inhibit the progression of the disease,” said Aldo Roccaro, the study’s co-first author with Dana-Farber colleague Antonio Sacco.
Working with the German biotechnology company NOXXON Pharma, the researchers tested a substance called olaptesed pegol (a PEGylated mirror-image L-oligonucleotide), which binds tightly and specifically to SDF-1. Laboratory experiments suggested that olaptesed pegol blocked the activity of SDF-1, making it a less alluring signal for tumor cells. In mice, the researchers found that olaptesed pegol altered the bone marrow, rendering it uninviting to myeloma cells. The result was slower disease progression and prolonged survival of the animals.
It isn’t completely clear what becomes of the blood-borne myeloma cells that are prevented from metastasizing to the bones, the researchers said. “We know that myeloma cells can’t survive for long if they’re circulating in the blood and can’t adhere to other tissue,” Ghobrial noted. “We saw no evidence that they had metastasized and begun to grow in other tissue, either.
“Our findings clearly document a therapeutic effect of olaptesed pegol in a mouse model of advanced myeloma,” she continued. “It is now being tested in a clinical trial of multiple myeloma patients, with more trials to come.”
Zu den jüngsten Erkenntnissen über die Wirkung von NOX-A12 in einer präklinischen Studie bei MM-Mäusen gibt es einen weiteren Web-Artikel, direkt von der "Dana-Faber"-Pressestelle. Die Grundproblematik wird darin nochmals recht verständlich beschrieben. Anscheinend sind bereits weitere klinische Studien mit NOX-A12 bei MM-Patienten in der konkreten Planung, s. Ende des Artikels.
-------------------------------------------------------------------------------------------------------------
Spread of multiple myeloma halted in mice
http://news.harvard.edu/gazette/story/2014/09/spread-of-mult…
In an advance against cancer metastasis, scientists at the Harvard-affiliated Dana-Farber Cancer Institute have shown that a specially developed compound can impede multiple myeloma in mice from spreading to the bones.
The findings, published in the Sept. 25 online edition of Cell Reports, suggest the compound may also be able to protect human patients from one of the deadliest effects of cancer.
The research involves a new approach to metastasis, the process by which cancer tumors spread to and colonize distant parts of the body. While traditionally research has focused on the cancer cells themselves, scientists are increasingly studying the interactions between tumor cells and the tissues around them — the so-called microenvironment. In the current study, researchers explored why errant myeloma cells often settle in bones, and whether the bones could be made less hospitable to such malignant homesteading.
“While cure and survival rates have increased for many types of cancers in recent decades, most of these gains have been made in patients with primary cancers — cancers that have not spread beyond their initial site,” said the study’s senior author, Irene Ghobrial of Dana-Farber’s Center for Hematologic Oncology. “Metastasis remains one of the most formidable complications we face as cancer researchers and physicians. Improvements in the treatment of metastatic cancers have, for the most part, not been nearly as dramatic as in primary disease.”
The current study focused on multiple myeloma because it is metastatic by nature. Myeloma cells originate in the bone marrow, depart for the bloodstream, and eventually return to the bones, where they form numerous colonies — hence the name.
Ghobrial and her team knew that a substance called stromal cell-derived factor-1 (SDF-1) is a kind of protein Pied Piper, attracting certain cells to new locations within the bone marrow. They found that mice with advanced stages of myeloma had sharply higher levels of SDF-1 at the sites in the bones where metastasis had occurred.
“We reasoned that by neutralizing SDF-1, we could change the bone marrow environment to make it less receptive for multiple myeloma cells, reduce myeloma cells’ affinity for the marrow, and thereby inhibit the progression of the disease,” said Aldo Roccaro, the study’s co-first author with Dana-Farber colleague Antonio Sacco.
Working with the German biotechnology company NOXXON Pharma, the researchers tested a substance called olaptesed pegol (a PEGylated mirror-image L-oligonucleotide), which binds tightly and specifically to SDF-1. Laboratory experiments suggested that olaptesed pegol blocked the activity of SDF-1, making it a less alluring signal for tumor cells. In mice, the researchers found that olaptesed pegol altered the bone marrow, rendering it uninviting to myeloma cells. The result was slower disease progression and prolonged survival of the animals.
It isn’t completely clear what becomes of the blood-borne myeloma cells that are prevented from metastasizing to the bones, the researchers said. “We know that myeloma cells can’t survive for long if they’re circulating in the blood and can’t adhere to other tissue,” Ghobrial noted. “We saw no evidence that they had metastasized and begun to grow in other tissue, either.
“Our findings clearly document a therapeutic effect of olaptesed pegol in a mouse model of advanced myeloma,” she continued. “It is now being tested in a clinical trial of multiple myeloma patients, with more trials to come.”
aoHV zur Ausgabe weiterer Wandelschuldverschreibungen von bis zu 8 Mio Euro
Eine aoHV am 24. November soll den Weg frei machen für die Ausgabe weiterer Wandelanleihen (WA) im Umfang von bis zu 8 Mio Euro. Der Wandlungspreis für alle neuen und die in 2013 und 2014 bereits ausgegebenen WA soll von 348,65 Euro auf 311,91 Euro gesenkt werden. Zugelassen zur Zeichnung der neuen WA sind nur (Alt-)Aktionäre.
Quelle: Eintrag im Bundesanzeiger vom 24. Oktober 2014
Damit dürfte die Finanzierung unabhängig von einem Partner-Deal und einem IPO bis Mitte 2015 gesichert sein.
Eine aoHV am 24. November soll den Weg frei machen für die Ausgabe weiterer Wandelanleihen (WA) im Umfang von bis zu 8 Mio Euro. Der Wandlungspreis für alle neuen und die in 2013 und 2014 bereits ausgegebenen WA soll von 348,65 Euro auf 311,91 Euro gesenkt werden. Zugelassen zur Zeichnung der neuen WA sind nur (Alt-)Aktionäre.
Quelle: Eintrag im Bundesanzeiger vom 24. Oktober 2014
Damit dürfte die Finanzierung unabhängig von einem Partner-Deal und einem IPO bis Mitte 2015 gesichert sein.
Antwort auf Beitrag Nr.: 47.174.764 von Saaletaler am 19.06.14 10:11:09Zwischendaten der P2a mit NOX-A12 bei CLL auf dem ASH-Meeting 2014
Studienprotokoll: http://clinicaltrials.gov/ct2/show/NCT01486797
Abstract von Michael Steurer et al.: https://ash.confex.com/ash/2014/webprogram/Paper69970.html
Results from a Phase IIa Study of the Anti-CXCL12 Spiegelmer Olaptesed Pegol (NOX-A12) in Combination with Bendamustine/Rituximab in Patients with Chronic Lymphocytic Leukemia
Background: Olaptesed pegol (NOX-A12) is a novel, potent, L-stereoisomer RNA aptamer that binds and neutralizes CXCL12/SDF-1, a chemokine which attracts and activates immune- and non-immune cells via interaction with the receptors CXCR4 and CXCR7. Signaling of CXCL12 is pivotal to the interactions of leukemic cells with bone marrow microenvironment. The therapeutic concept of olaptesed is to inhibit such tumor-supporting pathways and thereby mobilizing and sensitizing CLL cells to therapy.
Aims: Here we aim to assess the activity and safety of olaptesed in combination with rituximab and bendamustine in patients with relapsed / refractory CLL.
Methods: Twenty-eight relapsed or refractory CLL patients were enrolled and treated in this open-label, single-arm Phase IIa study. To investigate PK/PD, a pilot dose of 1 to 4 mg/kg olaptesed alone was administered to 3 patients per dose group (plus one additional replacement pt) before start of the regular treatment regimen (pilot group). Patients were treated using a dose titration design with intravenous (IV) olaptesed at doses increasing from 1 mg/kg to 2 mg/kg and 4 mg/kg at cycles 1, 2 and 3, respectively, at 1 hour before rituximab treatment. During cycles 4 to 6, olaptesed was dosed at the highest individually titrated dose. Rituximab was administered IV at doses of 375 mg/m² on day 1 of the 1st28-day cycle and 500 mg/m² on day 1 of subsequent cycles. Bendamustine (70 - 100 mg/m²) was given IV on days 2-3 (cycle 1) or days 1-2 (cycles 2-6) of each 28-day cycle following administration of rituximab. Clinical response was assessed according to NCI-WG Guidelines (Hallek M et al. Blood 111; 2008: 5446-56).
To date, 24 patients completed treatment (12 women, 12 men) with a median age of 68.5 years (range 52 to 79). At screening 5, 9 and 10 patients presented with Binet stage A, B and C, respectively. The median number of prior treatment lines was 1 (range 1-2). Seven high-risk patients presented an unfavorable disease state being relapsed within 24 months after fludarabine/bendamustine treatment (5 pts) and/or presenting a deletion/mutation of the TP53 gene (3 pts). Most patients (19 of 24) were previously treated with fludarabine or bendamustine.
Results: A flow cytometric analysis of CD19+/CD5+CLL cells showed a rapid mobilization into the peripheral blood by a single dose of olaptesed which lasted throughout the observational time of 72h. Interestingly, CXCR4 expression levels increased on CLL cell surface in the periphery after olaptesed treatment. This increase, which peaked at 24h, likely reflects the extended circulation of CLL cells in the periphery due to the sustained blockade of CXCL12 by olaptesed. Reduction of lymphadenopathy by ≥ 50% was achieved in 14 out of 21 evaluable patients with reported enlarged lymph nodes by the end of treatment. Concomitantly, rapid reduction of lymphocytosis in peripheral blood with normalization by treatment cycle 2 – 3 was observed and the CLL to leukocyte ratio significantly improved.
Efficacy was assessed at the end of cycles 3 and 6. In the full-analysis-set, which excludes two non-evaluable patients (drop-out after the 1st cycle due to adverse events), the overall response rate was 96%: Three patients (14%) achieved a complete response at end of cycle 6 (2 confirmed, 1 investigator reported) and eighteen patients (82%) achieved a partial response (fifteen at end of cycle 6 and three at end of cycle 3). Notably, all seven high-risk patients (defined as relapsed within 24 months after fludarabine/bendamustine treatment and/or presenting a deletion/mutation of the TP53 gene) responded to treatment with olaptesed + BR with a partial response. One patient had a progressive disease. Olaptesed at 1, 2 and 4 mg/kg at a single dose and in combination with BR was safe and well tolerated. The observed adverse reactions were qualitatively and quantitatively as expected for patients treated with BR.
Conclusion: Olaptesed in combination with BR was safe and well tolerated. Compared with historical data, olaptesed showed superiority over baseline therapy with regards to overall response rate and increasing rates of complete remission, warranting further development of this Spiegelmer in CLL.
Studienprotokoll: http://clinicaltrials.gov/ct2/show/NCT01486797
Abstract von Michael Steurer et al.: https://ash.confex.com/ash/2014/webprogram/Paper69970.html
Results from a Phase IIa Study of the Anti-CXCL12 Spiegelmer Olaptesed Pegol (NOX-A12) in Combination with Bendamustine/Rituximab in Patients with Chronic Lymphocytic Leukemia
Background: Olaptesed pegol (NOX-A12) is a novel, potent, L-stereoisomer RNA aptamer that binds and neutralizes CXCL12/SDF-1, a chemokine which attracts and activates immune- and non-immune cells via interaction with the receptors CXCR4 and CXCR7. Signaling of CXCL12 is pivotal to the interactions of leukemic cells with bone marrow microenvironment. The therapeutic concept of olaptesed is to inhibit such tumor-supporting pathways and thereby mobilizing and sensitizing CLL cells to therapy.
Aims: Here we aim to assess the activity and safety of olaptesed in combination with rituximab and bendamustine in patients with relapsed / refractory CLL.
Methods: Twenty-eight relapsed or refractory CLL patients were enrolled and treated in this open-label, single-arm Phase IIa study. To investigate PK/PD, a pilot dose of 1 to 4 mg/kg olaptesed alone was administered to 3 patients per dose group (plus one additional replacement pt) before start of the regular treatment regimen (pilot group). Patients were treated using a dose titration design with intravenous (IV) olaptesed at doses increasing from 1 mg/kg to 2 mg/kg and 4 mg/kg at cycles 1, 2 and 3, respectively, at 1 hour before rituximab treatment. During cycles 4 to 6, olaptesed was dosed at the highest individually titrated dose. Rituximab was administered IV at doses of 375 mg/m² on day 1 of the 1st28-day cycle and 500 mg/m² on day 1 of subsequent cycles. Bendamustine (70 - 100 mg/m²) was given IV on days 2-3 (cycle 1) or days 1-2 (cycles 2-6) of each 28-day cycle following administration of rituximab. Clinical response was assessed according to NCI-WG Guidelines (Hallek M et al. Blood 111; 2008: 5446-56).
To date, 24 patients completed treatment (12 women, 12 men) with a median age of 68.5 years (range 52 to 79). At screening 5, 9 and 10 patients presented with Binet stage A, B and C, respectively. The median number of prior treatment lines was 1 (range 1-2). Seven high-risk patients presented an unfavorable disease state being relapsed within 24 months after fludarabine/bendamustine treatment (5 pts) and/or presenting a deletion/mutation of the TP53 gene (3 pts). Most patients (19 of 24) were previously treated with fludarabine or bendamustine.
Results: A flow cytometric analysis of CD19+/CD5+CLL cells showed a rapid mobilization into the peripheral blood by a single dose of olaptesed which lasted throughout the observational time of 72h. Interestingly, CXCR4 expression levels increased on CLL cell surface in the periphery after olaptesed treatment. This increase, which peaked at 24h, likely reflects the extended circulation of CLL cells in the periphery due to the sustained blockade of CXCL12 by olaptesed. Reduction of lymphadenopathy by ≥ 50% was achieved in 14 out of 21 evaluable patients with reported enlarged lymph nodes by the end of treatment. Concomitantly, rapid reduction of lymphocytosis in peripheral blood with normalization by treatment cycle 2 – 3 was observed and the CLL to leukocyte ratio significantly improved.
Efficacy was assessed at the end of cycles 3 and 6. In the full-analysis-set, which excludes two non-evaluable patients (drop-out after the 1st cycle due to adverse events), the overall response rate was 96%: Three patients (14%) achieved a complete response at end of cycle 6 (2 confirmed, 1 investigator reported) and eighteen patients (82%) achieved a partial response (fifteen at end of cycle 6 and three at end of cycle 3). Notably, all seven high-risk patients (defined as relapsed within 24 months after fludarabine/bendamustine treatment and/or presenting a deletion/mutation of the TP53 gene) responded to treatment with olaptesed + BR with a partial response. One patient had a progressive disease. Olaptesed at 1, 2 and 4 mg/kg at a single dose and in combination with BR was safe and well tolerated. The observed adverse reactions were qualitatively and quantitatively as expected for patients treated with BR.
Conclusion: Olaptesed in combination with BR was safe and well tolerated. Compared with historical data, olaptesed showed superiority over baseline therapy with regards to overall response rate and increasing rates of complete remission, warranting further development of this Spiegelmer in CLL.
Antwort auf Beitrag Nr.: 48.276.760 von Saaletaler am 10.11.14 18:15:00Ergebnisse einer präklinischen Studie mit NOX-A12 auf dem ASH-Meeting 2014
Abstract von Dirk Zboralski et al.: https://ash.confex.com/ash/2014/webprogram/Paper72394.html
Comparison of Ibrutinib, Idelalisib and Olaptesed Pegol on the Immune Effector Function Mediated By Rituximab
Olaptesed pegol (NOX-A12), an SDF-1 binding Spiegelmer® was found to detach SDF-1 from the surface of BMSCs (Hoellenriegel et al., Blood 2013) and to mobilize CXCR4 expressing, malignant cells from protective niches in the bone marrow or other secondary lymphoid tissues, thereby sensitizing them to the action of standard therapy. In addition to malignant cells CXCR4 expressing immune cells, e.g. T cells, neutrophils and monocytes are effectively mobilized by olaptesed (Vater et al., Clin Pharmacol Ther 2013). Here we investigated the combination of olaptesed with an immunotherapeutic agent, in particular rituximab (RTX). Several mechanisms of action (MoA) of RTX have been described including antibody-dependent cellular cytotoxicity (ADCC) and phagocytosis (ADCP). The aim was to analyze whether olaptesed influences the immune effector cell activation by RTX as has been shown for the Btk or PI3Kd inhibitors ibrutinib and idelalisib, respectively.
ADCC activity was measured by the calcein release assay. Raji lymphoma cells were labeled with calcein, treated with 10 µg/mL RTX and co-cultured for 4 hours with various ratios of PBMCs as effector cells, which have been incubated with either 10 µM olaptesed, 1 µM ibrutinib or 1 µM idelalisib, respectively, overnight. In order to analyze the impact on phagocyte function, ADCP assays with neutrophils and monocytes were performed. Phagocytes were preincubated with either 10 µM olaptesed, 1 µM ibrutinib or 1 µM idelalisib, respectively, for 6 hours, and cocultured overnight with DiD-labeled primary B-cells or Raji cells which were opsonized with different concentrations of RTX. ADCP was quantified in a guava easyCyte flow cytometer by counting the CD15+ (or CD14+) and DiD+ population (gated on CD19-negative cells) and normalizing to total phagocyte counts. To analyze B-cell depletion, heparinized whole blood from healthy volunteers was diluted with HBSS (1:2.5) and incubated with either 10 µM olaptesed, 1 µM ibrutinib or 1µM idelalisib, respectively, for 6 hours followed by the addition of different RTX concentrations. After incubation for 16 hours B-cell depletion was evaluated by determining the CD19+ B-cell and CD3+ T-cell populations.
We found that preincubation of PBMCs with 1 µM ibrutinib significantly decreased calcein release. 1 µM idelalisib led to a slight decrease of calcein release, while 10 µM olaptesed did not influence ADCC activity (Figure 1A). Preliminary results from ADCP assays point to a decreased phagocytic activity in terms of maximal ADCP for neutrophils after preincubation with ibrutinib or idelalisib (Figure 1B). Importantly, although olaptesed is being endocytosed by phagocytes, the uptake of the drug did not inhibit ADCP. In accordance, the whole blood assay showed that olaptesed had no negative impact on RTX-mediated B-cell depletion, while ibrutinib and idelalisib were found to decrease B-cell depletion regarding EC50 and maximal killing (Figure 1C).
Taken together, we found that olaptesed retains the immune functional repertoire of RTX, whereas ibrutinib and idelalisib decrease the immune effector function. These small molecule kinase inhibitors possess low specificity and are inhibiting also other kinases which may be important for immune cell activation, such as ITK which is blocked by ibrutinib. The MoA of olaptesed is partially overlapping with kinase inhibitors with regard to lymphoid cell mobilization; however, olaptesed is highly selective and therefore does not impair immune-cell mediated contribution to monoclonal antibody efficacy. Instead, olaptesed may further enhance the contribution of immune effector cells through mobilization of T cells from the bone marrow which are described to be exhausted in the peripheral blood of hematological malignancies like CLL. Furthermore, neutrophils and monocytes which contribute to ADCP are effectively mobilized with olaptesed.
Based on their complementary mechanisms of action involving direct and immune-mediated cell death (RTX) or long-term mobilization of not only the malignant cells but also effector immune cells (olaptesed), the combination has the potential for greater efficacy in treating B lymphoid malignancies without impairing immune effector activity. Olaptesed is currently being tested in a Phase 2a clinical trial in combination with RTX and bendamustine in patients with relapsed/refractory CLL (#NCT01486797).
(Zur Ansicht der Grafiken dem angegebenen Link folgen.)
Abstract von Dirk Zboralski et al.: https://ash.confex.com/ash/2014/webprogram/Paper72394.html
Comparison of Ibrutinib, Idelalisib and Olaptesed Pegol on the Immune Effector Function Mediated By Rituximab
Olaptesed pegol (NOX-A12), an SDF-1 binding Spiegelmer® was found to detach SDF-1 from the surface of BMSCs (Hoellenriegel et al., Blood 2013) and to mobilize CXCR4 expressing, malignant cells from protective niches in the bone marrow or other secondary lymphoid tissues, thereby sensitizing them to the action of standard therapy. In addition to malignant cells CXCR4 expressing immune cells, e.g. T cells, neutrophils and monocytes are effectively mobilized by olaptesed (Vater et al., Clin Pharmacol Ther 2013). Here we investigated the combination of olaptesed with an immunotherapeutic agent, in particular rituximab (RTX). Several mechanisms of action (MoA) of RTX have been described including antibody-dependent cellular cytotoxicity (ADCC) and phagocytosis (ADCP). The aim was to analyze whether olaptesed influences the immune effector cell activation by RTX as has been shown for the Btk or PI3Kd inhibitors ibrutinib and idelalisib, respectively.
ADCC activity was measured by the calcein release assay. Raji lymphoma cells were labeled with calcein, treated with 10 µg/mL RTX and co-cultured for 4 hours with various ratios of PBMCs as effector cells, which have been incubated with either 10 µM olaptesed, 1 µM ibrutinib or 1 µM idelalisib, respectively, overnight. In order to analyze the impact on phagocyte function, ADCP assays with neutrophils and monocytes were performed. Phagocytes were preincubated with either 10 µM olaptesed, 1 µM ibrutinib or 1 µM idelalisib, respectively, for 6 hours, and cocultured overnight with DiD-labeled primary B-cells or Raji cells which were opsonized with different concentrations of RTX. ADCP was quantified in a guava easyCyte flow cytometer by counting the CD15+ (or CD14+) and DiD+ population (gated on CD19-negative cells) and normalizing to total phagocyte counts. To analyze B-cell depletion, heparinized whole blood from healthy volunteers was diluted with HBSS (1:2.5) and incubated with either 10 µM olaptesed, 1 µM ibrutinib or 1µM idelalisib, respectively, for 6 hours followed by the addition of different RTX concentrations. After incubation for 16 hours B-cell depletion was evaluated by determining the CD19+ B-cell and CD3+ T-cell populations.
We found that preincubation of PBMCs with 1 µM ibrutinib significantly decreased calcein release. 1 µM idelalisib led to a slight decrease of calcein release, while 10 µM olaptesed did not influence ADCC activity (Figure 1A). Preliminary results from ADCP assays point to a decreased phagocytic activity in terms of maximal ADCP for neutrophils after preincubation with ibrutinib or idelalisib (Figure 1B). Importantly, although olaptesed is being endocytosed by phagocytes, the uptake of the drug did not inhibit ADCP. In accordance, the whole blood assay showed that olaptesed had no negative impact on RTX-mediated B-cell depletion, while ibrutinib and idelalisib were found to decrease B-cell depletion regarding EC50 and maximal killing (Figure 1C).
Taken together, we found that olaptesed retains the immune functional repertoire of RTX, whereas ibrutinib and idelalisib decrease the immune effector function. These small molecule kinase inhibitors possess low specificity and are inhibiting also other kinases which may be important for immune cell activation, such as ITK which is blocked by ibrutinib. The MoA of olaptesed is partially overlapping with kinase inhibitors with regard to lymphoid cell mobilization; however, olaptesed is highly selective and therefore does not impair immune-cell mediated contribution to monoclonal antibody efficacy. Instead, olaptesed may further enhance the contribution of immune effector cells through mobilization of T cells from the bone marrow which are described to be exhausted in the peripheral blood of hematological malignancies like CLL. Furthermore, neutrophils and monocytes which contribute to ADCP are effectively mobilized with olaptesed.
Based on their complementary mechanisms of action involving direct and immune-mediated cell death (RTX) or long-term mobilization of not only the malignant cells but also effector immune cells (olaptesed), the combination has the potential for greater efficacy in treating B lymphoid malignancies without impairing immune effector activity. Olaptesed is currently being tested in a Phase 2a clinical trial in combination with RTX and bendamustine in patients with relapsed/refractory CLL (#NCT01486797).
(Zur Ansicht der Grafiken dem angegebenen Link folgen.)
Antwort auf Beitrag Nr.: 47.174.690 von Saaletaler am 19.06.14 10:01:45Abschlussdaten der P2a mit NOX-A12 bei MM auf dem ASH-Meeting 2014
Studienprotokoll: http://clinicaltrials.gov/ct2/show/NCT01521533
Abstract von Heinz Ludwig et al.: https://ash.confex.com/ash/2014/webprogram/Paper69872.html
Final Results from the Phase IIa Study of the Anti-CXCL12 Spiegelmer® Olaptesed Pegol (NOX-A12) in Combination with Bortezomib and Dexamethasone in Patients with Multiple Myeloma
Background: Olaptesed, an L-stereo-isomer RNA aptamer, binds and neutralizes the chemokine CXCL12. By interaction with the chemokine receptors CXCR4 and CXCR7, CXCL12 is responsible for trafficking and homing of normal and malignant blood cells to the bone marrow. Preclinical studies have shown synergistic activity of CXCL12-targeting and anti-myeloma agents, specifically bortezomib (BTZ). Thus, targeting the myeloma niche may increase treatment efficacy.
Aims: This open label single arm study was conducted to assess the activity and safety of olaptesed when added to the combination of BTZ and dexamethasone (DEX) in patients with relapsed / refractory multiple myeloma (MM).
Methods: Twenty-eight relapsed or refractory MM patients (males:females 14:14) were enrolled and treated according to a dose titration design. Olaptesed was administered intravenously at doses increasing from 1 mg/kg to 2 mg/kg and 4 mg/kg in cycles 1, 2 and 3, respectively, at 1 hour prior to bortezomib administration. During cycles 4 to 8, olaptesed was dosed at the highest individually titrated dose. BTZ (1.3 mg/m²) was given on days 1, 4, 8 and 11 as intravenous injection. Oral DEX (20 mg) was added on the day of and on the day after BTZ administration. Response was evaluated based on the uniform IMWG response criteria (Rajkumar SV et. al. Blood 2011; 117: 4691-5). Plasma cell mobilization was studied after a pilot dose of 1 to 4 mg/kg olaptesed administered to the initial 10 patients before start of the regular treatment regimen.
Results: From Aug 2012 to Feb 2014 we enrolled 28 patients who had received a median of 2 (range 1-6) lines of prior therapy. Pretreatments were lenalidomide (LEN) in 20, BTZ in 14 and carfilzomib in 1 patient. Ten patients had autologous stem cell transplantations prior to entering this study.
The patient population enrolled presented predominantly with advanced disease and with adverse outcome predictors. Ten patients had ISS stage III. High-risk cytogenetics were identified in 9 of the 20 patients (45%) with FISH testing available for t(4;14), t(14;16) and/or del17p. Eleven patients were refractory to their last prior treatment, which contained BTZ in 8 cases.
After two early withdrawals, 26 patients were available for outcome evaluations. The median number of completed cycles was 8. Progression led to treatment termination in 8 patients. The dose of olaptesed was titrated to 4 mg/kg in all 18 patients treated for 3 or more cycles.
The single dose of olaptesed administered to 10 pilot-patients effectively mobilized plasma cells, which increased by approximately 200% for up to 3 days.
Based on “best response” of the 26 evaluable patients, the overall response rate was 73%: Two patients (8%) achieved a complete response (CR), 6 patients (23%) a very good partial response (VGPR) and 11 patients (42%) a partial response (PR). Minimal response was recorded in 2 patients (8%), 4 patients (15%) had stable disease and 1 patient (4%) progressive disease. In the 9 evaluable patients with high-risk cytogenetics, the clinical responses were similar. The ORR was 67% with VGPR in 3 (33%) and PR in 3 (33%) patients. Of the 14 patients pre-treated with BTZ, 1 had a CR and 8 a PR (ORR 64%).
M-protein decreased rapidly from treatment cycle 1 to cycle 4 with a decrease of ≥50% being observed in 15 of the 26 evaluable patients. Figure 1 shows a waterfall plot of the maximum observed decrease in M-protein.
Median progression-free survival (PFS) of the evaluable population was 6.5 months. It was also 6.5 months in the 9 patients with high-risk cytogenetics and 6.3 months in the 14 patients pre-treated with BTZ (Figure 2). The median follow-up was 6.3 months.
Treatment with olaptesed in combination with BTZ-DEX was safe and well tolerated without any appreciable increase in adverse events.
Conclusion: A single dose of olaptesed effectively mobilized plasma cells. Olaptesed in combination with BTZ and DEX resulted in an ORR rate of 73% and PFS of 6.5 months. Response rates and PFS were similar in patients with or without high risk cytogenetic features or with or without previous exposure to BTZ. The combination regimen was well tolerated. These findings merit further exploration of this strategy in randomized trials.
(Zur Ansicht der Grafiken dem angegebenen Link folgen.)
Studienprotokoll: http://clinicaltrials.gov/ct2/show/NCT01521533
Abstract von Heinz Ludwig et al.: https://ash.confex.com/ash/2014/webprogram/Paper69872.html
Final Results from the Phase IIa Study of the Anti-CXCL12 Spiegelmer® Olaptesed Pegol (NOX-A12) in Combination with Bortezomib and Dexamethasone in Patients with Multiple Myeloma
Background: Olaptesed, an L-stereo-isomer RNA aptamer, binds and neutralizes the chemokine CXCL12. By interaction with the chemokine receptors CXCR4 and CXCR7, CXCL12 is responsible for trafficking and homing of normal and malignant blood cells to the bone marrow. Preclinical studies have shown synergistic activity of CXCL12-targeting and anti-myeloma agents, specifically bortezomib (BTZ). Thus, targeting the myeloma niche may increase treatment efficacy.
Aims: This open label single arm study was conducted to assess the activity and safety of olaptesed when added to the combination of BTZ and dexamethasone (DEX) in patients with relapsed / refractory multiple myeloma (MM).
Methods: Twenty-eight relapsed or refractory MM patients (males:females 14:14) were enrolled and treated according to a dose titration design. Olaptesed was administered intravenously at doses increasing from 1 mg/kg to 2 mg/kg and 4 mg/kg in cycles 1, 2 and 3, respectively, at 1 hour prior to bortezomib administration. During cycles 4 to 8, olaptesed was dosed at the highest individually titrated dose. BTZ (1.3 mg/m²) was given on days 1, 4, 8 and 11 as intravenous injection. Oral DEX (20 mg) was added on the day of and on the day after BTZ administration. Response was evaluated based on the uniform IMWG response criteria (Rajkumar SV et. al. Blood 2011; 117: 4691-5). Plasma cell mobilization was studied after a pilot dose of 1 to 4 mg/kg olaptesed administered to the initial 10 patients before start of the regular treatment regimen.
Results: From Aug 2012 to Feb 2014 we enrolled 28 patients who had received a median of 2 (range 1-6) lines of prior therapy. Pretreatments were lenalidomide (LEN) in 20, BTZ in 14 and carfilzomib in 1 patient. Ten patients had autologous stem cell transplantations prior to entering this study.
The patient population enrolled presented predominantly with advanced disease and with adverse outcome predictors. Ten patients had ISS stage III. High-risk cytogenetics were identified in 9 of the 20 patients (45%) with FISH testing available for t(4;14), t(14;16) and/or del17p. Eleven patients were refractory to their last prior treatment, which contained BTZ in 8 cases.
After two early withdrawals, 26 patients were available for outcome evaluations. The median number of completed cycles was 8. Progression led to treatment termination in 8 patients. The dose of olaptesed was titrated to 4 mg/kg in all 18 patients treated for 3 or more cycles.
The single dose of olaptesed administered to 10 pilot-patients effectively mobilized plasma cells, which increased by approximately 200% for up to 3 days.
Based on “best response” of the 26 evaluable patients, the overall response rate was 73%: Two patients (8%) achieved a complete response (CR), 6 patients (23%) a very good partial response (VGPR) and 11 patients (42%) a partial response (PR). Minimal response was recorded in 2 patients (8%), 4 patients (15%) had stable disease and 1 patient (4%) progressive disease. In the 9 evaluable patients with high-risk cytogenetics, the clinical responses were similar. The ORR was 67% with VGPR in 3 (33%) and PR in 3 (33%) patients. Of the 14 patients pre-treated with BTZ, 1 had a CR and 8 a PR (ORR 64%).
M-protein decreased rapidly from treatment cycle 1 to cycle 4 with a decrease of ≥50% being observed in 15 of the 26 evaluable patients. Figure 1 shows a waterfall plot of the maximum observed decrease in M-protein.
Median progression-free survival (PFS) of the evaluable population was 6.5 months. It was also 6.5 months in the 9 patients with high-risk cytogenetics and 6.3 months in the 14 patients pre-treated with BTZ (Figure 2). The median follow-up was 6.3 months.
Treatment with olaptesed in combination with BTZ-DEX was safe and well tolerated without any appreciable increase in adverse events.
Conclusion: A single dose of olaptesed effectively mobilized plasma cells. Olaptesed in combination with BTZ and DEX resulted in an ORR rate of 73% and PFS of 6.5 months. Response rates and PFS were similar in patients with or without high risk cytogenetic features or with or without previous exposure to BTZ. The combination regimen was well tolerated. These findings merit further exploration of this strategy in randomized trials.
(Zur Ansicht der Grafiken dem angegebenen Link folgen.)
NOX-H94 in ACD bei Dialyse / Fibrogen
US-Biotech Fibrogen ist beim heutigen IPO mit einer Marketcap. von etwa 1,2 Mrd. $ gestartet. Lead-Produkt ist Roxadustat (FG-4592), ein oral applizierbarer HIF-Inhibitor zur Behandlung von Anämie bei chronischen Nierenerkrankungen, inkl. Dialyse. Roxadustat ist derzeit in Phase 3 und bereits verpartnert.
Auch wenn Fibrogen zwei, drei Gewichtsklassen über Noxxon ringt, kann man die Ergebnisse aus den jeweiligen Anämie-Studien bei Dialyse-Patienten miteinander vergleichen, sobald Noxxon die Ergebnisse veröffentlicht. Eigentlich sollte die P2a mit NOX-H94 bis Jahresende abgeschlossen sein.
Fibrogen: http://www.fibrogen.com/
P2a mit NOX-H94 bei Dialyse-Patienten: http://clinicaltrials.gov/ct2/show/NCT02079896
US-Biotech Fibrogen ist beim heutigen IPO mit einer Marketcap. von etwa 1,2 Mrd. $ gestartet. Lead-Produkt ist Roxadustat (FG-4592), ein oral applizierbarer HIF-Inhibitor zur Behandlung von Anämie bei chronischen Nierenerkrankungen, inkl. Dialyse. Roxadustat ist derzeit in Phase 3 und bereits verpartnert.
Auch wenn Fibrogen zwei, drei Gewichtsklassen über Noxxon ringt, kann man die Ergebnisse aus den jeweiligen Anämie-Studien bei Dialyse-Patienten miteinander vergleichen, sobald Noxxon die Ergebnisse veröffentlicht. Eigentlich sollte die P2a mit NOX-H94 bis Jahresende abgeschlossen sein.
Fibrogen: http://www.fibrogen.com/
P2a mit NOX-H94 bei Dialyse-Patienten: http://clinicaltrials.gov/ct2/show/NCT02079896
Antwort auf Beitrag Nr.: 47.950.696 von Saaletaler am 06.10.14 10:22:30NOX-A12 bei MM - Interview mit Irene Ghobrial von Dana-Farber
Im Netz ist ein großartiges Gespräch hinterlegt, das mpatient.org, ein Internetradio für MM-Patienten, mit Dr. Irene Ghobrial vom Dana Farber Cancer Institute geführt hat. Hauptthema dieses Gespräches sind die kürzlich von Roccaro et al. in "Cell Reports" veröffentlichten neuen Erkenntnisse über die Bedeutung des Signalproteins SDF-1 (= CXCL12) für die Wanderung von MM-Zellen bzw. die Bildung von Knochenmark-Metastasen bei Krebs allgemein (s. #214 und #216). NOX-A12 kann SDF-1 bekanntlich wirkungsvoll und ohne wesentliche Nebenwirkungen neutralisieren und somit die Krebsbekämpfung unterstützen, wie die jüngsten Studien gezeigt haben.
Das Interview ist sehr ausführlich und ist sowohl als Webcast als auch als Transkript online, siehe Link. Aufgrund der enormen Länge kopiere ich nur einige wesentliche Abschnitte hierher. Wer sich intensiv mit der Materie befassen möchte, für den lohnt sich jedoch das Lesen/Hören des gesamten Gespräches.
Link zum Webcast/Transkript: http://www.mpatient.org/dr-irene-ghobrial-2/
-----------------------------------------------------------------------------------------------------
Jenny: We’re very, very excited to have you on, Dr. Ghobrial. I just read a bio for you so thank you very much and we’ll have you go back and listen to what I said about you but it’s all good.
Dr. Ghobrial: Oh, thank you.
Jenny: So maybe we start – you just recently published in a journal called Cell Reports, a publication about a new compound to prevent bone damage and many, many patients are very, very interested in this topic. And there was something mentioned in the article called SDF-1. So maybe if you give us a little bit of background on that research and then explain what SDF-1 is and a little more about that.
Dr. Ghobrial: Sure.
So we always think that multiple myeloma cells love to live in the bone marrow and we ask the question well, what is inside that bone marrow that makes them so happy to live there because we believe that the cancer cells don’t just live on their own. They need the microenvironment, they need the soil to be able to grow and proliferate. And there’s a lot of research being done on the cancer cells themselves but we ignore so many times the microenvironment or the soil around them.
And we ask the question, well can you use a drug that changes the soil and make it less receptive for the tumor cells to grow and if so, then can we potentially use it in patients in early disease like in early MGUS and Smoldering Myeloma and prevent progression to active Multiple Myeloma?
So we know that there is something called chemokine ligands and chemokines and chemokine receptors which are basically ways for cells to hone (Anm.: home) or to get into the bone marrow and adhere and stick to the bone marrow in that area. And one of the very well-known ones is this SDF-1 and it’s been known for years as it goes up inside the bone marrow, it increases when cancer gets there.
So we collaborated with this company in Germany to take from them a small molecule (Anm.: Spiegelmer) that inhibits SDF-1. And we tested it in multiple mouse models as well as patient samples of bone marrow metastasis not only myeloma but even other cancers that go to the bone marrow will SDF-1 be high in that area and the answer was yes in certain areas where the cancer cells and (Anm.: are) localized, the SDF-1 will be very high. Then we ask the question well if you prevent that SDF-1 from going up, can you change the bone marrow niche and prevent Myeloma from growing, and we found indeed that with different types of models of mice, we were able to prevent progression of Multiple Myeloma by just treating the bone marrow niche and making it less receptive.
So this doesn’t even attack the cancer cells. The cancer cells are exactly the same ones, we don’t treat them, but just by being in an environment that’s not receptive, that’s hostile for them, they cannot keep growing and cannot disseminate and cause Myeloma to progress. So it was the first time targeting the bone marrow niche drug for Myeloma or for bone cancer in general.
Jenny: I think it’s unbelievable. It’s really a new way of studying it and a new way of attacking Myeloma in a roundabout way.
Dr. Ghobrial: We’re very excited about this, we’re hoping to start developing with the company clinical trials for our patients and then this could be used in conjunction with so many other drugs that attack the cancer cells themselves.
...
Jenny: And how do you translate a discovery like this to other cancers? I know you’re working with other hematology cancers, is there a way of using it in other solid tumor cancers or does it not apply to those?
Dr. Ghobrial: It absolutely applies because bone metastasis happens in so many solid cancers so the question will be can we use the same drug to prevent bone metastasis in breast cancer, prostate cancer, other cancers that love to go to the bone marrow.
We are also trying to see will that also affect the bone lytic lesions or not, what is the effect on normal cells or the cells that have been affected by myeloma cells. It also is the same pathway that other hematological cancers, leukemia, CLL, and other cells, Waldenstrom cells, will use to traffic to the bone marrow. So this applies actually in general to so many different cancers.
...
Im Netz ist ein großartiges Gespräch hinterlegt, das mpatient.org, ein Internetradio für MM-Patienten, mit Dr. Irene Ghobrial vom Dana Farber Cancer Institute geführt hat. Hauptthema dieses Gespräches sind die kürzlich von Roccaro et al. in "Cell Reports" veröffentlichten neuen Erkenntnisse über die Bedeutung des Signalproteins SDF-1 (= CXCL12) für die Wanderung von MM-Zellen bzw. die Bildung von Knochenmark-Metastasen bei Krebs allgemein (s. #214 und #216). NOX-A12 kann SDF-1 bekanntlich wirkungsvoll und ohne wesentliche Nebenwirkungen neutralisieren und somit die Krebsbekämpfung unterstützen, wie die jüngsten Studien gezeigt haben.
Das Interview ist sehr ausführlich und ist sowohl als Webcast als auch als Transkript online, siehe Link. Aufgrund der enormen Länge kopiere ich nur einige wesentliche Abschnitte hierher. Wer sich intensiv mit der Materie befassen möchte, für den lohnt sich jedoch das Lesen/Hören des gesamten Gespräches.
Link zum Webcast/Transkript: http://www.mpatient.org/dr-irene-ghobrial-2/
-----------------------------------------------------------------------------------------------------
Jenny: We’re very, very excited to have you on, Dr. Ghobrial. I just read a bio for you so thank you very much and we’ll have you go back and listen to what I said about you but it’s all good.
Dr. Ghobrial: Oh, thank you.
Jenny: So maybe we start – you just recently published in a journal called Cell Reports, a publication about a new compound to prevent bone damage and many, many patients are very, very interested in this topic. And there was something mentioned in the article called SDF-1. So maybe if you give us a little bit of background on that research and then explain what SDF-1 is and a little more about that.
Dr. Ghobrial: Sure.
So we always think that multiple myeloma cells love to live in the bone marrow and we ask the question well, what is inside that bone marrow that makes them so happy to live there because we believe that the cancer cells don’t just live on their own. They need the microenvironment, they need the soil to be able to grow and proliferate. And there’s a lot of research being done on the cancer cells themselves but we ignore so many times the microenvironment or the soil around them.
And we ask the question, well can you use a drug that changes the soil and make it less receptive for the tumor cells to grow and if so, then can we potentially use it in patients in early disease like in early MGUS and Smoldering Myeloma and prevent progression to active Multiple Myeloma?
So we know that there is something called chemokine ligands and chemokines and chemokine receptors which are basically ways for cells to hone (Anm.: home) or to get into the bone marrow and adhere and stick to the bone marrow in that area. And one of the very well-known ones is this SDF-1 and it’s been known for years as it goes up inside the bone marrow, it increases when cancer gets there.
So we collaborated with this company in Germany to take from them a small molecule (Anm.: Spiegelmer) that inhibits SDF-1. And we tested it in multiple mouse models as well as patient samples of bone marrow metastasis not only myeloma but even other cancers that go to the bone marrow will SDF-1 be high in that area and the answer was yes in certain areas where the cancer cells and (Anm.: are) localized, the SDF-1 will be very high. Then we ask the question well if you prevent that SDF-1 from going up, can you change the bone marrow niche and prevent Myeloma from growing, and we found indeed that with different types of models of mice, we were able to prevent progression of Multiple Myeloma by just treating the bone marrow niche and making it less receptive.
So this doesn’t even attack the cancer cells. The cancer cells are exactly the same ones, we don’t treat them, but just by being in an environment that’s not receptive, that’s hostile for them, they cannot keep growing and cannot disseminate and cause Myeloma to progress. So it was the first time targeting the bone marrow niche drug for Myeloma or for bone cancer in general.
Jenny: I think it’s unbelievable. It’s really a new way of studying it and a new way of attacking Myeloma in a roundabout way.
Dr. Ghobrial: We’re very excited about this, we’re hoping to start developing with the company clinical trials for our patients and then this could be used in conjunction with so many other drugs that attack the cancer cells themselves.
...
Jenny: And how do you translate a discovery like this to other cancers? I know you’re working with other hematology cancers, is there a way of using it in other solid tumor cancers or does it not apply to those?
Dr. Ghobrial: It absolutely applies because bone metastasis happens in so many solid cancers so the question will be can we use the same drug to prevent bone metastasis in breast cancer, prostate cancer, other cancers that love to go to the bone marrow.
We are also trying to see will that also affect the bone lytic lesions or not, what is the effect on normal cells or the cells that have been affected by myeloma cells. It also is the same pathway that other hematological cancers, leukemia, CLL, and other cells, Waldenstrom cells, will use to traffic to the bone marrow. So this applies actually in general to so many different cancers.
...
Antwort auf Beitrag Nr.: 47.850.302 von Saaletaler am 23.09.14 10:18:55Orphan-Drug-Status der EMA für NOX-A12 in der Indikation Gliom
Nach der US-amerikanischen FDA (s. #210 und #213) wurde NOX-A12 nun auch von der europäischen Gesundheitsbehörde EMA bzw. der EU als "Arzneimittel für seltene Leiden" eingestuft, und zwar ebenfalls zur Behandlung von Hirntumoren, speziell von Gliomen. Der Orphan-Status der EMA ermöglicht u.a. Unterstützung beim Zulassungsprozess und Marktexklusivität in Europa.
Quelle: http://ec.europa.eu/health/documents/community-register/html…
EMA Orphan Designation: http://www.ema.europa.eu/ema/index.jsp?curl=pages/regulation…
Gliom: http://de.wikipedia.org/wiki/Gliom
Nach der US-amerikanischen FDA (s. #210 und #213) wurde NOX-A12 nun auch von der europäischen Gesundheitsbehörde EMA bzw. der EU als "Arzneimittel für seltene Leiden" eingestuft, und zwar ebenfalls zur Behandlung von Hirntumoren, speziell von Gliomen. Der Orphan-Status der EMA ermöglicht u.a. Unterstützung beim Zulassungsprozess und Marktexklusivität in Europa.
Quelle: http://ec.europa.eu/health/documents/community-register/html…
EMA Orphan Designation: http://www.ema.europa.eu/ema/index.jsp?curl=pages/regulation…
Gliom: http://de.wikipedia.org/wiki/Gliom
Phase IIa-Ergebnisse zu Spiegelmer® Olaptesed Pegol (NOX-A12) in MM und CLL vorgestellt auf der American Society of Hematology (ASH) Konferenz 2014
http://www.dewb-vc.de/de/portfolio/newsarchiv/980-05-12-14-p…
Berlin, Deutschland und Boston, USA - 05. Dezember 2014 - NOXXON Pharma stellt vielversprechende Daten zweier unabhängiger klinischer Phase IIa-Studien über das anti-CXCL12/SDF-1 Spiegelmer® Olaptesed Pegol (NOX-A12) auf dem 56. jährlichen Treffen der American Society of Hematology (ASH) in San Francisco vom 06.-09. Dezember vor. Dort werden ebenfalls präklinische Daten präsentiert, die einen breiten Einsatz von Olaptesed Pegol in Kombination mit therapeutischen Krebs-Antikörpern untermauern.
In der ersten Studie wurde Patienten mit rezidivierendem multiplem Myelom (MM) Olaptesed Pegol in Kombination mit Bortezomib und Dexamethason (VD) verabreicht. In einer zweiten Studie wurden Patienten mit rezidivierender chronisch lymphatischer Leukämie (CLL) mit einer Kombination von Olaptesed Pegol und Bendamustin und Rituximab (BR) behandelt. Vorgestellt werden die Daten aller 28 Patienten, die jeweils an den beiden Studien teilnahmen.
In beiden Studien war das anti-CXCL12/SDF-1 Spiegelmer® Olaptesed Pegol in der Lage, Krebszellen aus protektiven Nischen im Körper zu mobilisieren. Diese Mobilisierung zeigt die Fähigkeit von Olaptesed Pegol, die Wechselwirkungen zwischen dem eigentlichen Tumor und seinem umgebenden Mikro-Milieu zu blockieren und das Knochenmark so zu verändern, dass es weniger empfänglich für maligne Zellen wird.
Bei den 28 Patienten mit rezidivierendem MM wurde eine Gesamtansprechrate (ORR) von 68% erreicht. Darin enthalten sind 18% der Patienten, die ein sehr gutes partielles (vgPR) und 7%, die sogar ein komplettes Ansprechen (CR) zeigten. Ein wichtiger Aspekt ist dabei, dass die Kombinationsbehandlung mit Olaptesed Pegol und VD nicht zu einer zusätzlichen Toxizität im Vergleich zur VD-Behandlung führt. Bemerkenswert ist weiterhin, dass auch bei Patienten mit hohem zytogenetischen Risiko die Ansprechrate praktisch gleich hoch ist wie bei Patienten ohne diese Hochrisikomutationen bzw. Translokationen.
Bei Patienten mit einer rezidivierenden CLL wurde eine Gesamtansprechrate (ORR) von 82% beobachtet, darin enthalten sind 14% der Patienten, die ein komplettes Ansprechen (CR) zeigten. Diese Daten unterscheiden sich positiv von historischen Kontrolldaten der zugrundeliegenden BR Therapie. Darüber hinaus zeigten alle Hochrisikopatienten (1) ein teilweises (PR) oder ein komplettes Ansprechen (CR).
Präklinische Arbeiten konnten zeigen, dass - im Gegensatz zu den im Vergleich getesteten Inhibitoren von BTK (Ibrutinib) und PI3Kδ (Idelalisib) - Olaptesed Pegol die durch Rituximab vermittelte zelluläre Zytotoxizität bzw. Phagozytose nicht inhibiert. Des Weiteren mobilisiert es nicht nur maligne Zellen, sondern erhöht auch die Anzahl von zirkulierenden Immuneffektor-Zellen (2). Olaptesed Pegol könnte auch deswegen als Kombinationspartner der Wahl mit monoklonalen Krebs-Antikörpern verabreicht werden.
1) Definition laut Stilgenbauer und Zenz (2010)
2) Vater A. et al. (2013), Clinical Pharmacology & Therapeutics
----------------------------------------------------------------------------------------------
Die drei ASH-Abstract sind in #218 bis #220 zu finden.
http://www.dewb-vc.de/de/portfolio/newsarchiv/980-05-12-14-p…
Berlin, Deutschland und Boston, USA - 05. Dezember 2014 - NOXXON Pharma stellt vielversprechende Daten zweier unabhängiger klinischer Phase IIa-Studien über das anti-CXCL12/SDF-1 Spiegelmer® Olaptesed Pegol (NOX-A12) auf dem 56. jährlichen Treffen der American Society of Hematology (ASH) in San Francisco vom 06.-09. Dezember vor. Dort werden ebenfalls präklinische Daten präsentiert, die einen breiten Einsatz von Olaptesed Pegol in Kombination mit therapeutischen Krebs-Antikörpern untermauern.
In der ersten Studie wurde Patienten mit rezidivierendem multiplem Myelom (MM) Olaptesed Pegol in Kombination mit Bortezomib und Dexamethason (VD) verabreicht. In einer zweiten Studie wurden Patienten mit rezidivierender chronisch lymphatischer Leukämie (CLL) mit einer Kombination von Olaptesed Pegol und Bendamustin und Rituximab (BR) behandelt. Vorgestellt werden die Daten aller 28 Patienten, die jeweils an den beiden Studien teilnahmen.
In beiden Studien war das anti-CXCL12/SDF-1 Spiegelmer® Olaptesed Pegol in der Lage, Krebszellen aus protektiven Nischen im Körper zu mobilisieren. Diese Mobilisierung zeigt die Fähigkeit von Olaptesed Pegol, die Wechselwirkungen zwischen dem eigentlichen Tumor und seinem umgebenden Mikro-Milieu zu blockieren und das Knochenmark so zu verändern, dass es weniger empfänglich für maligne Zellen wird.
Bei den 28 Patienten mit rezidivierendem MM wurde eine Gesamtansprechrate (ORR) von 68% erreicht. Darin enthalten sind 18% der Patienten, die ein sehr gutes partielles (vgPR) und 7%, die sogar ein komplettes Ansprechen (CR) zeigten. Ein wichtiger Aspekt ist dabei, dass die Kombinationsbehandlung mit Olaptesed Pegol und VD nicht zu einer zusätzlichen Toxizität im Vergleich zur VD-Behandlung führt. Bemerkenswert ist weiterhin, dass auch bei Patienten mit hohem zytogenetischen Risiko die Ansprechrate praktisch gleich hoch ist wie bei Patienten ohne diese Hochrisikomutationen bzw. Translokationen.
Bei Patienten mit einer rezidivierenden CLL wurde eine Gesamtansprechrate (ORR) von 82% beobachtet, darin enthalten sind 14% der Patienten, die ein komplettes Ansprechen (CR) zeigten. Diese Daten unterscheiden sich positiv von historischen Kontrolldaten der zugrundeliegenden BR Therapie. Darüber hinaus zeigten alle Hochrisikopatienten (1) ein teilweises (PR) oder ein komplettes Ansprechen (CR).
Präklinische Arbeiten konnten zeigen, dass - im Gegensatz zu den im Vergleich getesteten Inhibitoren von BTK (Ibrutinib) und PI3Kδ (Idelalisib) - Olaptesed Pegol die durch Rituximab vermittelte zelluläre Zytotoxizität bzw. Phagozytose nicht inhibiert. Des Weiteren mobilisiert es nicht nur maligne Zellen, sondern erhöht auch die Anzahl von zirkulierenden Immuneffektor-Zellen (2). Olaptesed Pegol könnte auch deswegen als Kombinationspartner der Wahl mit monoklonalen Krebs-Antikörpern verabreicht werden.
1) Definition laut Stilgenbauer und Zenz (2010)
2) Vater A. et al. (2013), Clinical Pharmacology & Therapeutics
----------------------------------------------------------------------------------------------
Die drei ASH-Abstract sind in #218 bis #220 zu finden.
NOXXON ernennt neues Aufsichtsratsmitglied mit großer Erfahrung auf dem amerikanischen Kapitalmarkt -
Don deBethizy tritt NOXXONs Aufsichtsrat bei
http://www.dewb-vc.de/de/portfolio/newsarchiv/982-10-12-14-n…
Berlin und Boston, USA - 10. Dezember 2014 - NOXXON Pharma gibt die Ernennung von Dr. Don deBethizy als neues Aufsichtsratsmitglied bekannt.
Dr. deBethizy war zuletzt Vorstandsvorsitzender der Santaris Pharma A/S und initiierte und leitete in dieser Funktion die erfolgreiche Übernahme der Firma durch Roche. Zuvor war er Aufsichtsratsvorsitzender der dänischen Bio-Venture Firma Contera Pharma und managte deren Verkauf an die koreanische Bukwang Pharmaceutical. Von 1997 bis 2012 war Dr. deBethizy Mitgründer und CEO von Targacept, Inc. (NASDAQ:TRGT). Er ist zurzeit auch Aufsichtsratsmitglied bei Newron Pharmaceuticals (SIX: NWRN).
Don deBethizy hat einen Bachelor of Science in Biologie an der Universität von Maryland erworben und im Anschluss daran an der Utah State University in Toxikologie promoviert. Er tritt nun in den Aufsichtsrat von NOXXON ein, der gegenwärtig aus sieben Mitgliedern aus der Industrie und dem Investorenkreis besteht.
„Ich freue mich sehr, Don als neues Teammitglied bei NOXXON Pharma begrüßen zu dürfen. Er ist eine äußerst qualifizierte und erfahrene Führungspersönlichkeit aus der Pharmaindustrie und sehr beschlagen in der Entwicklung von Medikamenten und Technologien“, sagte Iain Buchanan, CEO bei NOXXON Pharma dazu. „Seine Erfahrungen mit der locked nucleic acid (LNA) Plattform von Santaris und Targacepts NNR Therapeutics sind dabei besonders relevant und werden für NOXXON in der zukünftigen Firmenentwicklung und bei der Fortentwicklung des Produktportfolios von großem Wert sein.“
„NOXXON hat sehr vielversprechende Produktkandidaten in der Entwicklung, die auf der einzigartigen Spiegelmer®-Technologie basieren“, sagte Dr. deBethizy. „Die Firma ist jetzt an einem sehr interessanten Punkt ihrer Entwicklung angelangt, und ich freue mich darauf, meinen Beitrag im Aufsichtsrat zu leisten und das Management bei der strategischen Ausrichtung und der Produktentwicklung zu unterstützen.“
Don deBethizy tritt NOXXONs Aufsichtsrat bei
http://www.dewb-vc.de/de/portfolio/newsarchiv/982-10-12-14-n…
Berlin und Boston, USA - 10. Dezember 2014 - NOXXON Pharma gibt die Ernennung von Dr. Don deBethizy als neues Aufsichtsratsmitglied bekannt.
Dr. deBethizy war zuletzt Vorstandsvorsitzender der Santaris Pharma A/S und initiierte und leitete in dieser Funktion die erfolgreiche Übernahme der Firma durch Roche. Zuvor war er Aufsichtsratsvorsitzender der dänischen Bio-Venture Firma Contera Pharma und managte deren Verkauf an die koreanische Bukwang Pharmaceutical. Von 1997 bis 2012 war Dr. deBethizy Mitgründer und CEO von Targacept, Inc. (NASDAQ:TRGT). Er ist zurzeit auch Aufsichtsratsmitglied bei Newron Pharmaceuticals (SIX: NWRN).
Don deBethizy hat einen Bachelor of Science in Biologie an der Universität von Maryland erworben und im Anschluss daran an der Utah State University in Toxikologie promoviert. Er tritt nun in den Aufsichtsrat von NOXXON ein, der gegenwärtig aus sieben Mitgliedern aus der Industrie und dem Investorenkreis besteht.
„Ich freue mich sehr, Don als neues Teammitglied bei NOXXON Pharma begrüßen zu dürfen. Er ist eine äußerst qualifizierte und erfahrene Führungspersönlichkeit aus der Pharmaindustrie und sehr beschlagen in der Entwicklung von Medikamenten und Technologien“, sagte Iain Buchanan, CEO bei NOXXON Pharma dazu. „Seine Erfahrungen mit der locked nucleic acid (LNA) Plattform von Santaris und Targacepts NNR Therapeutics sind dabei besonders relevant und werden für NOXXON in der zukünftigen Firmenentwicklung und bei der Fortentwicklung des Produktportfolios von großem Wert sein.“
„NOXXON hat sehr vielversprechende Produktkandidaten in der Entwicklung, die auf der einzigartigen Spiegelmer®-Technologie basieren“, sagte Dr. deBethizy. „Die Firma ist jetzt an einem sehr interessanten Punkt ihrer Entwicklung angelangt, und ich freue mich darauf, meinen Beitrag im Aufsichtsrat zu leisten und das Management bei der strategischen Ausrichtung und der Produktentwicklung zu unterstützen.“
Kann sich jemand vorstellen, wofür NOXXON die 8 Mio. braucht?
Antwort auf Beitrag Nr.: 48.548.123 von SCHerford am 11.12.14 16:17:54Laufender Geschäftsbetrieb. Von den genehmigten 8 Mio der WA wurde allerdings bislang nur eine erste Tranche zum Bezug angeboten, s. Bundesanzeiger vom 2. Dezember. Ob später weitere Tranchen ausgegeben werden, wird davon abhängen, ob anderweitig Geld in die Kasse kommt (IPO oder Deal).
Habe den heutigen Kurseinbruch zum Einstieg genutzt.
Ich denke das Jahr 2015 kann sehr spannend werden.
Ein Verkauf bzw. Börsengang von Noxxon würde wohl deutlich mehr Geld in die Kasse bringen als die gesamte MK zur Zeit hergibt.
Ich denke das Jahr 2015 kann sehr spannend werden.
Ein Verkauf bzw. Börsengang von Noxxon würde wohl deutlich mehr Geld in die Kasse bringen als die gesamte MK zur Zeit hergibt.

NOX-E36 in Diabetischer Nephropathie / P2-Daten von Chemocentryx' CCX140
US-Biotech Chemocentryx (CCXI.NAS) hat vor ein paar Tagen erste Daten aus seiner 52-Wochen-P2-Studie in Diabetischer Nephropathie veröffentlicht. Dies ist inbesondere vor dem Hintergrund interessant, dass CCXI mit seinem Small Molecule CCX140 den gleichen Wirkungsansatz verfolgt wie Noxxon mit NOX-E36, nämlich die Blockierung der CCR2/CCL2-Bindung. Während sich CCX140 gegen den Rezeptor CCR2 stellt, neutralisiert NOX-E36 den Liganden CCL2. Bildlich gesprochen handelt es sich um zwei Seiten einer Medaille bzw. das Schlüssel-Schloss-Prinzip: Ein bestimmtes biochemisches Signal kann nur ausgelöst werden, wenn Rezeptor und Ligand eine Verbindung eingehen. Ist einer dieser beiden blockiert, findet keine Signalübertragung an die Zelle statt.
Aus diesem Grund sind die P2-Studiendaten von CCX140 und NOX-E36 sehr gut miteinander vergleichbar, zumal sich die Patientenkollektive - soweit ich dies erkennen kann - sehr ähnlich sind. Wesentlicher Unterschied ist, dass für CCX140 nun Daten aus einer 52-Wochen-Behandlung vorliegen, während NOX-E36 erst eine 12-wöchige Gabe untersucht hat, gefolgt von einer ebenfalls 12-wöchigen Nachbeobachtung.
Sowohl Noxxon als auch CCXI haben als primäres Wirksamkeitsmaß das Albumin-Kreatinin-Verhältnis (ACR) gewählt, das Auskunft über das mit dem Urin ausgeschiedene Eiweiß und somit die Funktionsfähigkeit der Nieren gibt. Je größer das ACR, desto stärker ist die Niere geschädigt. Schreitet die Nierenschädigung fort, drohen dem Diabetiker Dialyse und Transplantation (Nierenversagen).
Konkret hat CCXI gemeldet, dass sich das ACR seiner mit 5mg-Dosis CCX140 behandelten Patienten um durchschnittlich 17% im Vergleich zur Placebo-Gruppe verbessert hat. Der maximale Wirkungseffekt beträgt 24% Verbesserung versus Placebo und wurde bereits nach 12 Wochen erzielt. Anschließend ließ der Effekt trotz weiterer Verabreichung nach. Der mit einer 10mg-Dosis getestete Arm der Studie schnitt schlechter ab als der 5mg-Arm, was CCXI im Conference Call mit einem durch die höhere Dosis provozierten CCL2-Anstieg begründete, welcher den Effekt der höheren Dosierung überlagerte.
Zum Vergleich: Noxxon berichtete aus seiner abgeschlossenen P2a-Studie mit NOX-E36 von 32% ACR-Verbesserung nach 12 Wochen Behandlung gegenüber Placebo. Diese erhöhte sich sogar auf maximale 39% während der Nachbeobachtungszeit. Wie sich das ACR bei NOX-E36 in einer 52-Wochen-Studie entwickelt hätte, kann man natürlich nicht sagen. Eine länger applizierende P2b ist bekanntlich in Planung.
Hinsichtlich ACR hat also Noxxon - zumindest auf den ersten Blick - die bislang überzeugenderen Daten vorzuweisen. CCXI ist zugutezuhalten, dass in dessen Ergebnissen alle auswertbaren Patienten enthalten sind, während Noxxon bestimmte Patienten (u.a. doppelte RAS-Blockade) für die Analyse ausgeschlossen hat. Möglicherweise wird CCXI ebenfalls noch bestimmte Subgruppen herausfiltern, die bessere Wirksamkeit zeigen als die Gesamtpopulation. Anhand der Aussagen von CCXI zum schlechten Abschneiden des 10mg-Arms lässt sich jedoch vermuten, dass CCX140 Probleme hat, die CCR2/CCL2-Verbindung wirklich effektiv zu blockieren, speziell bei stark ansteigender CCL2-Konzentration. Wegen der hohen Bindungsstärke eines Spiegelmers an sein Zielmolekül ist NOX-E36 m.E. im Vorteil gegenüber CCX140.
Detaillierte Daten hat CCXI für Konferenzen in Q1/15 angekündigt. CCXI plant zudem fest mit einer P3-Studie und will dafür nun die Partnersuche intensivieren. Es wird spannend sein, dies zu verfolgen, da ein Partner-Abschluss und die darin ausgehandelten Konditionen ein klarer Indikator für den Wert von NOX-E36 haben dürften. Der Aktienkurs von CCXI legte übrigens seit Veröffentlichung der Daten um etwa 60% zu, allerdings auf niedrigem absoluten Niveau (entspricht etwa 100 Mio $ Wertzuwachs).
Sorry für den langen, trockenen Text. Schaubilder von CCXI liegen leider bislang nicht vor. Die Grafiken/Tabellen aus der P2a mit NOX-E36 finden sich in #193 und #197. Mitlesende Med-Profis seien bezüglich der laienhaften Darstellung bitte nachsichtig, Ergänzungen/Anmerkungen sind wie immer willkommen. Zuletzt ein paar Quellenangaben/Links:
Studienprotokoll zur P2b von CCX140: https://clinicaltrials.gov/ct2/show/NCT01447147
Pressemitteilungen von CCXI: http://ir.chemocentryx.com/releases.cfm
Finanzdaten zu CCXI: http://finance.yahoo.com/q?s=CCXI
Abstract zu den P2a-Ergebnissen mit NOX-E36 von Hermann Haller et al. auf dem ERA-EDTA-Meeting Jun/14 (pdf): http://www.era-edta.org/press/4079_Haller_CCL2_Inhibition.pd…
Diabetische Nephropathie: http://de.wikipedia.org/wiki/Diabetische_Nephropathie
US-Biotech Chemocentryx (CCXI.NAS) hat vor ein paar Tagen erste Daten aus seiner 52-Wochen-P2-Studie in Diabetischer Nephropathie veröffentlicht. Dies ist inbesondere vor dem Hintergrund interessant, dass CCXI mit seinem Small Molecule CCX140 den gleichen Wirkungsansatz verfolgt wie Noxxon mit NOX-E36, nämlich die Blockierung der CCR2/CCL2-Bindung. Während sich CCX140 gegen den Rezeptor CCR2 stellt, neutralisiert NOX-E36 den Liganden CCL2. Bildlich gesprochen handelt es sich um zwei Seiten einer Medaille bzw. das Schlüssel-Schloss-Prinzip: Ein bestimmtes biochemisches Signal kann nur ausgelöst werden, wenn Rezeptor und Ligand eine Verbindung eingehen. Ist einer dieser beiden blockiert, findet keine Signalübertragung an die Zelle statt.
Aus diesem Grund sind die P2-Studiendaten von CCX140 und NOX-E36 sehr gut miteinander vergleichbar, zumal sich die Patientenkollektive - soweit ich dies erkennen kann - sehr ähnlich sind. Wesentlicher Unterschied ist, dass für CCX140 nun Daten aus einer 52-Wochen-Behandlung vorliegen, während NOX-E36 erst eine 12-wöchige Gabe untersucht hat, gefolgt von einer ebenfalls 12-wöchigen Nachbeobachtung.
Sowohl Noxxon als auch CCXI haben als primäres Wirksamkeitsmaß das Albumin-Kreatinin-Verhältnis (ACR) gewählt, das Auskunft über das mit dem Urin ausgeschiedene Eiweiß und somit die Funktionsfähigkeit der Nieren gibt. Je größer das ACR, desto stärker ist die Niere geschädigt. Schreitet die Nierenschädigung fort, drohen dem Diabetiker Dialyse und Transplantation (Nierenversagen).
Konkret hat CCXI gemeldet, dass sich das ACR seiner mit 5mg-Dosis CCX140 behandelten Patienten um durchschnittlich 17% im Vergleich zur Placebo-Gruppe verbessert hat. Der maximale Wirkungseffekt beträgt 24% Verbesserung versus Placebo und wurde bereits nach 12 Wochen erzielt. Anschließend ließ der Effekt trotz weiterer Verabreichung nach. Der mit einer 10mg-Dosis getestete Arm der Studie schnitt schlechter ab als der 5mg-Arm, was CCXI im Conference Call mit einem durch die höhere Dosis provozierten CCL2-Anstieg begründete, welcher den Effekt der höheren Dosierung überlagerte.
Zum Vergleich: Noxxon berichtete aus seiner abgeschlossenen P2a-Studie mit NOX-E36 von 32% ACR-Verbesserung nach 12 Wochen Behandlung gegenüber Placebo. Diese erhöhte sich sogar auf maximale 39% während der Nachbeobachtungszeit. Wie sich das ACR bei NOX-E36 in einer 52-Wochen-Studie entwickelt hätte, kann man natürlich nicht sagen. Eine länger applizierende P2b ist bekanntlich in Planung.
Hinsichtlich ACR hat also Noxxon - zumindest auf den ersten Blick - die bislang überzeugenderen Daten vorzuweisen. CCXI ist zugutezuhalten, dass in dessen Ergebnissen alle auswertbaren Patienten enthalten sind, während Noxxon bestimmte Patienten (u.a. doppelte RAS-Blockade) für die Analyse ausgeschlossen hat. Möglicherweise wird CCXI ebenfalls noch bestimmte Subgruppen herausfiltern, die bessere Wirksamkeit zeigen als die Gesamtpopulation. Anhand der Aussagen von CCXI zum schlechten Abschneiden des 10mg-Arms lässt sich jedoch vermuten, dass CCX140 Probleme hat, die CCR2/CCL2-Verbindung wirklich effektiv zu blockieren, speziell bei stark ansteigender CCL2-Konzentration. Wegen der hohen Bindungsstärke eines Spiegelmers an sein Zielmolekül ist NOX-E36 m.E. im Vorteil gegenüber CCX140.
Detaillierte Daten hat CCXI für Konferenzen in Q1/15 angekündigt. CCXI plant zudem fest mit einer P3-Studie und will dafür nun die Partnersuche intensivieren. Es wird spannend sein, dies zu verfolgen, da ein Partner-Abschluss und die darin ausgehandelten Konditionen ein klarer Indikator für den Wert von NOX-E36 haben dürften. Der Aktienkurs von CCXI legte übrigens seit Veröffentlichung der Daten um etwa 60% zu, allerdings auf niedrigem absoluten Niveau (entspricht etwa 100 Mio $ Wertzuwachs).
Sorry für den langen, trockenen Text. Schaubilder von CCXI liegen leider bislang nicht vor. Die Grafiken/Tabellen aus der P2a mit NOX-E36 finden sich in #193 und #197. Mitlesende Med-Profis seien bezüglich der laienhaften Darstellung bitte nachsichtig, Ergänzungen/Anmerkungen sind wie immer willkommen. Zuletzt ein paar Quellenangaben/Links:
Studienprotokoll zur P2b von CCX140: https://clinicaltrials.gov/ct2/show/NCT01447147
Pressemitteilungen von CCXI: http://ir.chemocentryx.com/releases.cfm
Finanzdaten zu CCXI: http://finance.yahoo.com/q?s=CCXI
Abstract zu den P2a-Ergebnissen mit NOX-E36 von Hermann Haller et al. auf dem ERA-EDTA-Meeting Jun/14 (pdf): http://www.era-edta.org/press/4079_Haller_CCL2_Inhibition.pd…
Diabetische Nephropathie: http://de.wikipedia.org/wiki/Diabetische_Nephropathie
Antwort auf Beitrag Nr.: 48.588.674 von Saaletaler am 16.12.14 20:01:17Ergänzungen zu #229
1) Die Berechnung der Wirksamkeit bzw. Vorteilhaftigkeit anhand der ACR-Veränderung ist etwas sonderbar und auf den ersten Blick nicht ganz einfach nachvollziehbar, deswegen ein Beispiel anhand der Daten von NOX-E36 (abgelesen aus der unten links stehenden Grafik), bevor auch ich es wieder vergesse:
Am Ende der Behandlung nach 12 Wochen (= Day 85) beträgt der durchschnittliche ACR-Wert in der NOX-E36-Gruppe (blaue Kurve) 440 mg/g. Als Referenzwert (= Baseline, blau gestrichelt) dient der durchschnittliche ACR-Wert in dieser Gruppe zu Beginn der Behandlung, also 620 mg/g. Daraus ergibt sich im behandelten Arm eine mittlere Verbesserung von (620 - 440) / 620 = 29,0% nach zwölf Wochen. In der Placebo-Gruppe (rote Kurve) liegt der durchschnittliche ACR-Wert nach zwölf Wochen bei 740 mg/g, der Vergleichswert (rot gestrichelte Linie) beträgt 720 mg/g, woraus sich eine durchschnittliche Verschlechterung von (740 - 720) / 720 = 2,8% errechnet. Die Vorteilhaftigkeit von NOX-E36 im Vergleich zu Placebo zu diesem speziellen Zeitpunkt wird nun als Abstand dieser beiden Werte angegeben, also der Abstand zwischen 29% Verbesserung bei NOX-E36 und 3% Verschlechterung bei Placebo, was zu einer Maßangabe für die Wirksamkeit von 32% führt.
Im Zeitpunkt der maximalen Wirksamkeit (= Peak Effect) am Tag 141, also acht Wochen nach Behandlungsende, liegt der mittlere ACR-Wert in der NOX-E36-Gruppe bei 430 mg/g (= 30,6% Verbesserung vs Baseline) und in der Placebo-Gruppe bei 780 mg/g (= 8,3% Verschlechterung vs Baseline). Damit ergibt sich für die Vorteilhaftigkeit von NOX-E36 zu Placebo zu diesem Zeitpunkt der Wert 39%.
--------------------------------------------------------------------------------------------
2) CCXI hat im CC eine durchschnittliche Vorteilhaftigkeit von 17% von CCX140 zum Placebo-Arm in der 5mg-Dosis genannt (s. #229, vierter Absatz). Dieser Durchschnittswert ist als mittlere Vorteilhaftigkeit über mehrere Messzeitpunkte gemäß 1) zu verstehen.
CCXI nennt bspw. folgende ACR-Veränderungen zu diversen Zeitpunkten: -10% CCX140 vs. +12% Placebo nach zwei Wochen (= 22% Vorteilhaftigkeit), -20% vs. -5% nach acht Wochen (= 15%), -24% vs. 0% nach zwölf Wochen (= 24%) und -20% vs. -3% nach 52 Wochen (= 17%). Die größte Vorteilhaftigkeit wurde wie erwähnt mit 24% nach zwölf Wochen erreicht.
--------------------------------------------------------------------------------------------
3) Zu einem weiteren wichtigen Wirksamkeitsmaß hat CCXI im CC eine erste Aussage gemacht: Das als langfristiger Blutzucker-Anteil interpretierbare HbA1c hat sich durch CCX140 um 0,2%-Punkte im Vergleich zur Placebo-Gruppe verbessert (p = 0.06). Auch hier sehen die Ergebnisse von NOX-E36 trotz deutlich kürzerer Behandlung besser aus (s. rechte Grafik).

Quelle der Grafik: Montega-Studie zu DEWB vom 26. Mai 2014 (pdf)
http://www.dewb-vc.de/images/dokumente/research/2014-05-26%2…
1) Die Berechnung der Wirksamkeit bzw. Vorteilhaftigkeit anhand der ACR-Veränderung ist etwas sonderbar und auf den ersten Blick nicht ganz einfach nachvollziehbar, deswegen ein Beispiel anhand der Daten von NOX-E36 (abgelesen aus der unten links stehenden Grafik), bevor auch ich es wieder vergesse:
Am Ende der Behandlung nach 12 Wochen (= Day 85) beträgt der durchschnittliche ACR-Wert in der NOX-E36-Gruppe (blaue Kurve) 440 mg/g. Als Referenzwert (= Baseline, blau gestrichelt) dient der durchschnittliche ACR-Wert in dieser Gruppe zu Beginn der Behandlung, also 620 mg/g. Daraus ergibt sich im behandelten Arm eine mittlere Verbesserung von (620 - 440) / 620 = 29,0% nach zwölf Wochen. In der Placebo-Gruppe (rote Kurve) liegt der durchschnittliche ACR-Wert nach zwölf Wochen bei 740 mg/g, der Vergleichswert (rot gestrichelte Linie) beträgt 720 mg/g, woraus sich eine durchschnittliche Verschlechterung von (740 - 720) / 720 = 2,8% errechnet. Die Vorteilhaftigkeit von NOX-E36 im Vergleich zu Placebo zu diesem speziellen Zeitpunkt wird nun als Abstand dieser beiden Werte angegeben, also der Abstand zwischen 29% Verbesserung bei NOX-E36 und 3% Verschlechterung bei Placebo, was zu einer Maßangabe für die Wirksamkeit von 32% führt.
Im Zeitpunkt der maximalen Wirksamkeit (= Peak Effect) am Tag 141, also acht Wochen nach Behandlungsende, liegt der mittlere ACR-Wert in der NOX-E36-Gruppe bei 430 mg/g (= 30,6% Verbesserung vs Baseline) und in der Placebo-Gruppe bei 780 mg/g (= 8,3% Verschlechterung vs Baseline). Damit ergibt sich für die Vorteilhaftigkeit von NOX-E36 zu Placebo zu diesem Zeitpunkt der Wert 39%.
--------------------------------------------------------------------------------------------
2) CCXI hat im CC eine durchschnittliche Vorteilhaftigkeit von 17% von CCX140 zum Placebo-Arm in der 5mg-Dosis genannt (s. #229, vierter Absatz). Dieser Durchschnittswert ist als mittlere Vorteilhaftigkeit über mehrere Messzeitpunkte gemäß 1) zu verstehen.
CCXI nennt bspw. folgende ACR-Veränderungen zu diversen Zeitpunkten: -10% CCX140 vs. +12% Placebo nach zwei Wochen (= 22% Vorteilhaftigkeit), -20% vs. -5% nach acht Wochen (= 15%), -24% vs. 0% nach zwölf Wochen (= 24%) und -20% vs. -3% nach 52 Wochen (= 17%). Die größte Vorteilhaftigkeit wurde wie erwähnt mit 24% nach zwölf Wochen erreicht.
--------------------------------------------------------------------------------------------
3) Zu einem weiteren wichtigen Wirksamkeitsmaß hat CCXI im CC eine erste Aussage gemacht: Das als langfristiger Blutzucker-Anteil interpretierbare HbA1c hat sich durch CCX140 um 0,2%-Punkte im Vergleich zur Placebo-Gruppe verbessert (p = 0.06). Auch hier sehen die Ergebnisse von NOX-E36 trotz deutlich kürzerer Behandlung besser aus (s. rechte Grafik).

Quelle der Grafik: Montega-Studie zu DEWB vom 26. Mai 2014 (pdf)
http://www.dewb-vc.de/images/dokumente/research/2014-05-26%2…
Antwort auf Beitrag Nr.: 46.588.405 von Saaletaler am 07.03.14 22:09:36Übersicht zu den klinischen Studien von Noxxon (Aktualisierung)
Um nicht mit Altlasten ins neue Jahr zu gehen, anbei ein kurzer Rückblick darauf, was sich bei den klinischen Studien in den vergangenen Monaten getan hat, und wie es weitergehen wird bzw. könnte:
------------------------------------------------------------------------------------------------------------------------
NOX-A12 ("Ola-Peg"): Laut PM von Anfang Dezember sind die beiden P2a-Studien in CLL bzw. MM inzwischen abgeschlossen. Noxxon spricht von jeweils 28 behandelten Patienten. Die Studienprotokolle weisen dagegen (noch) 33 bzw. 29 Teilnehmer aus. Obwohl jeweils eine Nachbeobachtungszeit bis Ende 2015 deklariert ist, setze ich die Studien in der Tabelle auf den Status "beendet" (rot). Wie es konkret weitergeht, wurde bislang nicht öffentlich kommuniziert.
Einschätzung/Ausblick: Die verbesserten Ansprechraten in beiden Studien sind positiv zu werten, wenn auch nicht sensationell. Zu beachten ist, dass NOX-A12 letztlich nur für die Mobilisierung von "versteckten" Krebszellen verantwortlich ist, was funktioniert. Die Wirksamkeit der Behandlung kann anschließend nur so gut sein wie die Leistungsstärke der eigentlichen Medikamente (B+R bzw. V+D).
Für NOX-A12 spricht die vielfältige Kombinierbarkeit mit anderen Substanzen bei einer ganzen Palette verschiedener Krebsarten und die bisherige Nebenwirkungsfreiheit. Zusammen mit den verheißungsvollen präklinischen Daten bei den Hirntumoren (s. u.a. #210) sowie den neuen Erkenntnissen der Dana-Farber-Gruppe um Irene Ghobrial zum MM-Mikromilieu (s. #214, #216 und #222) hat NOX-A12 m.E. allemal Zukunft. Zum Sterben sind die Ergebnisse jedenfalls deutlich zu viel.
------------------------------------------------------------------------------------------------------------------------
NOX-E36 ("Ema-Peg"): Die 12-wöchige P2a bei Diabetikern mit Nephropathie ist bekanntlich seit geraumer Zeit abgeschlossen. Eine P2b ist laut Noxxon in Vorbereitung, die ich mit einem vermuteten Start in HJ2/15 neu in die Tabelle aufnehme.
Einschätzung/Ausblick: Auch wenn Noxxon bislang noch keinen Partner für die weitere Entwicklung präsentieren konnte, sind die vorgelegten Daten aus der P2a m.E. nicht so schlecht. Ich halte es für gut möglich, dass interessierten Pharmas die Daten aus der 12-Wochen-Behandlung nicht ausreichen, zumal die jüngst von Chemocentryx vorgestellten Ergebnisse aus deren 52-Wochen-Studie die höchste Wirksamkeit beim ACR-Maß bereits nach 12 Wochen gezeigt haben und sich trotz längerer Behandlung keine weitere Verbesserung eingestellt hat (s. #229 f.). Dies könnte potenzielle Noxxon-Partner zögern lassen.
Eine Weiterentwicklung von NOX-E36 ist in meinen Augen jedoch sicher, ob mit oder zunächst ohne Partner. Dafür sind die präsentierten 12-Wochen-Daten zu aussichtsreich, zumal bislang keine wesentlichen Nebenwirkungen auftraten.
------------------------------------------------------------------------------------------------------------------------
NOX-H94 ("Lexa-Peg"): Die P2a-Studie bei Dialyse-Patienten mit Anämie wurde laut Protokoll auf 32 zu behandelnde Patienten erweitert. Dadurch verschiebt sich das erwartete Studienende auf August 2015.
Einschätzung/Ausblick: Die Mini-Studie bei Krebspatienten mit Anämie hat gezeigt, dass das Prinzip der Eisenfreisetzung durch die Hepcidin-Blockade prinzipiell funktioniert, wenn auch nur in einer Subgruppe (s. u.a. #203). Es bleibt abzuwarten, ob sich die erhoffte Wirkung auch in anderen großen ACD-Indikationen wie Diabetes einstellt und ob die Daten konkurrenzfähig bzw. die Behandlung kosteneffizient im Vergleich zu derzeitigen Standardtherapien gestaltet werden kann. Dies lässt sich m.E. bislang nicht einschätzen.
Allerdings sei nochmals auf die aktuelle Marktbewertung von US-Biotech Fibrogen über derzeit etwa 1,6 Mrd. Dollar hingewiesen (s. #221). Daran erkennt man, welches enorme Potenzial der Markt in einem möglicherweise erfolgreichen neuen Medikament gegen ACD sieht.
------------------------------------------------------------------------------------------------------------------------
Fazit: Alle drei Spiegelmere in der klinischen Entwicklung sind weiterhin im Spiel. NOX-A12 und NOX-E36 sehen für das frühe P2-Stadium in meinen Augen gut bis sehr gut aus, bei NOX-H94 muss man die Dialyse-Studie abwarten. Der entscheidende Punkt ist, dass nun ziemlich zügig Geld in die Kasse kommen muss, und zwar ein ganzer Batzen, damit weitere, größere Studien angeschoben werden können. Das geht nur über einen lukrativen Partner-Abschluss oder ein IPO.
------------------------------------------------------------------------------------------------------------------------
Tabellarische Übersicht der Studien ab Phase 2
grün = Studie läuft; rot = Studie beendet; kursiv = veränderter Eintrag
Aktuelle Pipeline-Darstellung (Quelle: http://www.noxxon.com/index.php?option=com_content&view=arti…)
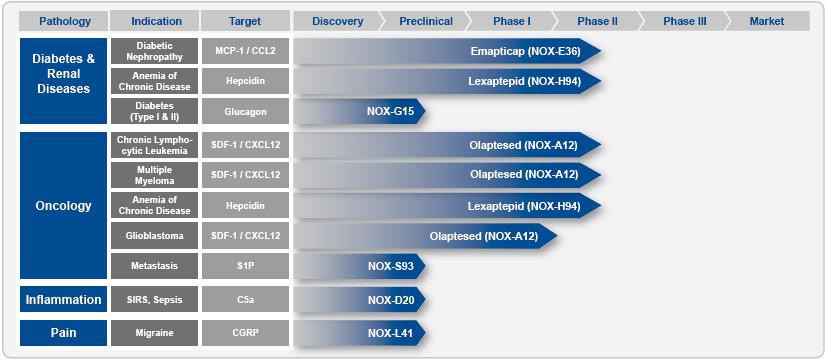
Alle Angaben ohne Anspruch auf Vollständigkeit und ohne Gewähr!
Um nicht mit Altlasten ins neue Jahr zu gehen, anbei ein kurzer Rückblick darauf, was sich bei den klinischen Studien in den vergangenen Monaten getan hat, und wie es weitergehen wird bzw. könnte:
------------------------------------------------------------------------------------------------------------------------
NOX-A12 ("Ola-Peg"): Laut PM von Anfang Dezember sind die beiden P2a-Studien in CLL bzw. MM inzwischen abgeschlossen. Noxxon spricht von jeweils 28 behandelten Patienten. Die Studienprotokolle weisen dagegen (noch) 33 bzw. 29 Teilnehmer aus. Obwohl jeweils eine Nachbeobachtungszeit bis Ende 2015 deklariert ist, setze ich die Studien in der Tabelle auf den Status "beendet" (rot). Wie es konkret weitergeht, wurde bislang nicht öffentlich kommuniziert.
Einschätzung/Ausblick: Die verbesserten Ansprechraten in beiden Studien sind positiv zu werten, wenn auch nicht sensationell. Zu beachten ist, dass NOX-A12 letztlich nur für die Mobilisierung von "versteckten" Krebszellen verantwortlich ist, was funktioniert. Die Wirksamkeit der Behandlung kann anschließend nur so gut sein wie die Leistungsstärke der eigentlichen Medikamente (B+R bzw. V+D).
Für NOX-A12 spricht die vielfältige Kombinierbarkeit mit anderen Substanzen bei einer ganzen Palette verschiedener Krebsarten und die bisherige Nebenwirkungsfreiheit. Zusammen mit den verheißungsvollen präklinischen Daten bei den Hirntumoren (s. u.a. #210) sowie den neuen Erkenntnissen der Dana-Farber-Gruppe um Irene Ghobrial zum MM-Mikromilieu (s. #214, #216 und #222) hat NOX-A12 m.E. allemal Zukunft. Zum Sterben sind die Ergebnisse jedenfalls deutlich zu viel.
------------------------------------------------------------------------------------------------------------------------
NOX-E36 ("Ema-Peg"): Die 12-wöchige P2a bei Diabetikern mit Nephropathie ist bekanntlich seit geraumer Zeit abgeschlossen. Eine P2b ist laut Noxxon in Vorbereitung, die ich mit einem vermuteten Start in HJ2/15 neu in die Tabelle aufnehme.
Einschätzung/Ausblick: Auch wenn Noxxon bislang noch keinen Partner für die weitere Entwicklung präsentieren konnte, sind die vorgelegten Daten aus der P2a m.E. nicht so schlecht. Ich halte es für gut möglich, dass interessierten Pharmas die Daten aus der 12-Wochen-Behandlung nicht ausreichen, zumal die jüngst von Chemocentryx vorgestellten Ergebnisse aus deren 52-Wochen-Studie die höchste Wirksamkeit beim ACR-Maß bereits nach 12 Wochen gezeigt haben und sich trotz längerer Behandlung keine weitere Verbesserung eingestellt hat (s. #229 f.). Dies könnte potenzielle Noxxon-Partner zögern lassen.
Eine Weiterentwicklung von NOX-E36 ist in meinen Augen jedoch sicher, ob mit oder zunächst ohne Partner. Dafür sind die präsentierten 12-Wochen-Daten zu aussichtsreich, zumal bislang keine wesentlichen Nebenwirkungen auftraten.
------------------------------------------------------------------------------------------------------------------------
NOX-H94 ("Lexa-Peg"): Die P2a-Studie bei Dialyse-Patienten mit Anämie wurde laut Protokoll auf 32 zu behandelnde Patienten erweitert. Dadurch verschiebt sich das erwartete Studienende auf August 2015.
Einschätzung/Ausblick: Die Mini-Studie bei Krebspatienten mit Anämie hat gezeigt, dass das Prinzip der Eisenfreisetzung durch die Hepcidin-Blockade prinzipiell funktioniert, wenn auch nur in einer Subgruppe (s. u.a. #203). Es bleibt abzuwarten, ob sich die erhoffte Wirkung auch in anderen großen ACD-Indikationen wie Diabetes einstellt und ob die Daten konkurrenzfähig bzw. die Behandlung kosteneffizient im Vergleich zu derzeitigen Standardtherapien gestaltet werden kann. Dies lässt sich m.E. bislang nicht einschätzen.
Allerdings sei nochmals auf die aktuelle Marktbewertung von US-Biotech Fibrogen über derzeit etwa 1,6 Mrd. Dollar hingewiesen (s. #221). Daran erkennt man, welches enorme Potenzial der Markt in einem möglicherweise erfolgreichen neuen Medikament gegen ACD sieht.
------------------------------------------------------------------------------------------------------------------------
Fazit: Alle drei Spiegelmere in der klinischen Entwicklung sind weiterhin im Spiel. NOX-A12 und NOX-E36 sehen für das frühe P2-Stadium in meinen Augen gut bis sehr gut aus, bei NOX-H94 muss man die Dialyse-Studie abwarten. Der entscheidende Punkt ist, dass nun ziemlich zügig Geld in die Kasse kommen muss, und zwar ein ganzer Batzen, damit weitere, größere Studien angeschoben werden können. Das geht nur über einen lukrativen Partner-Abschluss oder ein IPO.
------------------------------------------------------------------------------------------------------------------------
Tabellarische Übersicht der Studien ab Phase 2
Spiegelmer ------------- NOX-A12 NOX-A12 NOX-A12 ------------- NOX-E36 NOX-E36 ------------- NOX-H94 NOX-H94 NOX-H94 ------------- | Phase ------- 2a 2a ? ------- 2a 2b ------- 1b/2a 2a 1b/2a ------- | Indikation --------------------------- CLL (Kombi) MM (Kombi) Glioblastom (ODD) --------------------------- Diabetes+Albuminurie Diabet. Nephropathie --------------------------- Endotoxin-Simulation ACD bei HL/NHL/MM ACD bei Dialyse --------------------------- | Anz. Pat. ------- 33 29 ? ------- 76 ? ------- 24 12 32 ------- | Maske --------- offen offen ? --------- blind ? --------- blind offen blind --------- | Start ------------- Mär/12 Mär/12 ? ------------- Mär/12 HJ2/15 ------------- Jan/12 Sep/12 Mär/14 ------------- | Abschluss Primärziel ------------- Nov/14 Aug/14 ? ------------- Sep/13 ? ------------- Mär/12 Nov/13 Aug/15 ------------- | Abschluss Studie ------------- Dez/15 Aug/15 ? ------------- Dez/13 ? ------------- Apr/12 Dez/13 Aug/15 ------------- | Protokoll ------------ Klick Klick ? ------------ Klick ? ------------ Klick Klick Klick ------------ |
grün = Studie läuft; rot = Studie beendet; kursiv = veränderter Eintrag
Aktuelle Pipeline-Darstellung (Quelle: http://www.noxxon.com/index.php?option=com_content&view=arti…)

Alle Angaben ohne Anspruch auf Vollständigkeit und ohne Gewähr!
Antwort auf Beitrag Nr.: 48.668.963 von Saaletaler am 30.12.14 17:51:32@Saaletaler,
super Beitrag von Dir. Hab herzlichen Dank. Es bleibt spannend, auch 2015!
Gruß Schulzi64
super Beitrag von Dir. Hab herzlichen Dank. Es bleibt spannend, auch 2015!
Gruß Schulzi64
Antwort auf Beitrag Nr.: 48.668.963 von Saaletaler am 30.12.14 17:51:32Hallo Saaletaler,
auch von mir vielen Dank für Deine viele Arbeit, die hier mit uns teilst und dass es Dir dabei gelingt, die Dinge wirklich gut lesbar und verständlich darzustellen. Ein klasse Thread ist das hier!
Es wäre zu wünschen, dass Noxxon in 2015 einen IPO schafft, damit man dort endlich mal eine vernünftige Finanzausstattung in die Hand bekommt. Undd wenn, dann sollte man es richtig machen und den IPO direkt an der NASDAQ durchführen. Deutschland ist dafür einfach Mist. Die Verpflichtung von Don Munoz könnte in diese Richtung weisen.
Alles Gute für 2015 mit einer hoffentlich US-börsennotierten NOXXON.
Gruß
SLG
auch von mir vielen Dank für Deine viele Arbeit, die hier mit uns teilst und dass es Dir dabei gelingt, die Dinge wirklich gut lesbar und verständlich darzustellen. Ein klasse Thread ist das hier!
Es wäre zu wünschen, dass Noxxon in 2015 einen IPO schafft, damit man dort endlich mal eine vernünftige Finanzausstattung in die Hand bekommt. Undd wenn, dann sollte man es richtig machen und den IPO direkt an der NASDAQ durchführen. Deutschland ist dafür einfach Mist. Die Verpflichtung von Don Munoz könnte in diese Richtung weisen.
Alles Gute für 2015 mit einer hoffentlich US-börsennotierten NOXXON.
Gruß
SLG
Antwort auf Beitrag Nr.: 48.671.750 von SLGramann am 31.12.14 11:48:59Hallo Schulzi und SLG,
besten Dank für eure Resonanz, das tut gut. Gelegentlich frage ich mich, ob mein Gewürge - sofern es überhaupt jemand liest - Fragezeichen über Fragezeichen oder nur Kopfschütteln auslöst bzw. ob die Seite überhaupt online ist.
Sollte ein IPO kommen, würde es sicher deutlich munterer hier werden. Hätte nichts dagegen - sofern die Market Cap stimmt!
Euch und allen Thread-Begleitern einen guten Start ins neue Jahr!
Saaletaler
besten Dank für eure Resonanz, das tut gut. Gelegentlich frage ich mich, ob mein Gewürge - sofern es überhaupt jemand liest - Fragezeichen über Fragezeichen oder nur Kopfschütteln auslöst bzw. ob die Seite überhaupt online ist.

Sollte ein IPO kommen, würde es sicher deutlich munterer hier werden. Hätte nichts dagegen - sofern die Market Cap stimmt!
Euch und allen Thread-Begleitern einen guten Start ins neue Jahr!
Saaletaler
Viele grüne Däumchen hoch!
Vielen Dank und uns alles Gute für 2015!
Vielen Dank und uns alles Gute für 2015!
Antwort auf Beitrag Nr.: 48.668.963 von Saaletaler am 30.12.14 17:51:32Saaletaler,
ganz speziell für dich ein Gesundes Neues Jahr 2015, verbunden mit viel Gesundheit, Glück und natürlich grossen Spaß bei unserem Lieblingsthema. Ich persönlich glaube, es sollte ein turbulentes Jahr werden und das nicht nur bei NOXXON AG.
Als langjähriger Begleiter der DEWB habe nicht nur ich, ein allergrößtes Interesse an der Weiterentwicklung dieses noch jungen Pharmawertes. Personell sind die Weichen bei NOXXON ohnehin schon gestellt. Nun gilt es abzuwarten, wie die nächsten Monaten verlaufen. Ob nun NASDAQ Börsengang oder Verkauf an einen Pharmariesen, da lassen wir uns mal überraschen. Hoffentlich ist das Zeitfenster für IPOs immer Sommer diesen Jahres immer noch soweit geöffnet?
Für Leute wie mich (mit wenig Verständnis für diese medizinischen Daten) ist deine Arbeit hier unwahrscheinlich hilfreich.
Dafür meinen ganz herzlichen Dank, bitte weiter so!
Gruß Schulzi64
ganz speziell für dich ein Gesundes Neues Jahr 2015, verbunden mit viel Gesundheit, Glück und natürlich grossen Spaß bei unserem Lieblingsthema. Ich persönlich glaube, es sollte ein turbulentes Jahr werden und das nicht nur bei NOXXON AG.
Als langjähriger Begleiter der DEWB habe nicht nur ich, ein allergrößtes Interesse an der Weiterentwicklung dieses noch jungen Pharmawertes. Personell sind die Weichen bei NOXXON ohnehin schon gestellt. Nun gilt es abzuwarten, wie die nächsten Monaten verlaufen. Ob nun NASDAQ Börsengang oder Verkauf an einen Pharmariesen, da lassen wir uns mal überraschen. Hoffentlich ist das Zeitfenster für IPOs immer Sommer diesen Jahres immer noch soweit geöffnet?
Für Leute wie mich (mit wenig Verständnis für diese medizinischen Daten) ist deine Arbeit hier unwahrscheinlich hilfreich.
Dafür meinen ganz herzlichen Dank, bitte weiter so!
Gruß Schulzi64
Antwort auf Beitrag Nr.: 48.697.199 von Schulzi64 am 05.01.15 15:11:11
Lieber Autor (ggf auch Autorin) Saaletaler, ich verneige mich vor dem unermüdlichen Einsatz in diesem threat.
Seit der Emission der Anleihe bin ich in DEWB investiert, weil mich das längerfristig bei der Beteiligungsgesellschaft bleibende Portfolio interessiert hat. Nachdem ich diesen threat vollständig nachgelesen habe, meine ich die Bedeutung der Spiegelmere verstanden zu haben und es ist mein Interesse an den Wirkstoffmöglichkeiten geweckt.
Ich bedanke mich als eifriger Nutzer dieses Forums. Deine Beiträge (beginnend mit dem ersten threat,) sind einerseits Aufforderung sie als Massstab für meine eigene threat-Beteiligung werden zu lassen und darüber hinaus veranlassen sie mich in die Aktie von DEWB zu investieren.
Nochmals recht herzlichen Dank
Tratsch
Anerkennung für eine großartige Leistung
@SaaletalerLieber Autor (ggf auch Autorin) Saaletaler, ich verneige mich vor dem unermüdlichen Einsatz in diesem threat.
Seit der Emission der Anleihe bin ich in DEWB investiert, weil mich das längerfristig bei der Beteiligungsgesellschaft bleibende Portfolio interessiert hat. Nachdem ich diesen threat vollständig nachgelesen habe, meine ich die Bedeutung der Spiegelmere verstanden zu haben und es ist mein Interesse an den Wirkstoffmöglichkeiten geweckt.
Ich bedanke mich als eifriger Nutzer dieses Forums. Deine Beiträge (beginnend mit dem ersten threat,) sind einerseits Aufforderung sie als Massstab für meine eigene threat-Beteiligung werden zu lassen und darüber hinaus veranlassen sie mich in die Aktie von DEWB zu investieren.
Nochmals recht herzlichen Dank
Tratsch
Antwort auf Beitrag Nr.: 48.839.144 von Tratsch am 21.01.15 15:57:43@Tratsch: Vielen Dank für die Komplimente und herzlich willkommen!
Zuletzt waren die öffentlich bereit gestellten Informationen seitens Noxxon so spärlich, dass man dies in sehr kleinem Kreis verarbeiten konnte. Falls das Nasdaq-Listing kommt, wird es jede Menge Forum-Arbeit geben, das kann man dann nur gemeinsam bewältigen. Es wäre z.B. hilfreich, wenn sich jemand im US-Aktienrecht bzw. den SEC-Regularien auskennt. Jedes Mal, wenn ich ein Form 8-K öffne, wird mir schwarz vor Augen.
Übrigens ist mir neulich aufgefallen, dass nicht mehr alle Grafiken aus älteren Beiträgen hier im Thread online sind. Auf dem PC habe ich sie noch. Falls jemand an der einen oder anderen davon Interesse hat, einfach melden!
Grüße
Zuletzt waren die öffentlich bereit gestellten Informationen seitens Noxxon so spärlich, dass man dies in sehr kleinem Kreis verarbeiten konnte. Falls das Nasdaq-Listing kommt, wird es jede Menge Forum-Arbeit geben, das kann man dann nur gemeinsam bewältigen. Es wäre z.B. hilfreich, wenn sich jemand im US-Aktienrecht bzw. den SEC-Regularien auskennt. Jedes Mal, wenn ich ein Form 8-K öffne, wird mir schwarz vor Augen.
Übrigens ist mir neulich aufgefallen, dass nicht mehr alle Grafiken aus älteren Beiträgen hier im Thread online sind. Auf dem PC habe ich sie noch. Falls jemand an der einen oder anderen davon Interesse hat, einfach melden!
Grüße
FK-Finanzierung über 3 Mio
Noxxon will sich von Kreos Capital weitere 3 Mio Euro Fremdkapital holen (s. aoHV-Einladung im Bundesanzeiger vom 11. Februar 2015). Die Konditionen ähneln der ersten Vereinbarung mit Kreos über 7 Mio FK von vor einem Jahr (s. aoHV-Einladung im Bundesanzeiger vom 7. Februar 2014 bzw. #181).
https://www.bundesanzeiger.de
Noxxon will sich von Kreos Capital weitere 3 Mio Euro Fremdkapital holen (s. aoHV-Einladung im Bundesanzeiger vom 11. Februar 2015). Die Konditionen ähneln der ersten Vereinbarung mit Kreos über 7 Mio FK von vor einem Jahr (s. aoHV-Einladung im Bundesanzeiger vom 7. Februar 2014 bzw. #181).
https://www.bundesanzeiger.de
Antwort auf Beitrag Nr.: 49.049.621 von Saaletaler am 12.02.15 12:37:41NOXXON ist im aktuellen "Diabetic Nephropathy Pipeline Drugs and Companies Review H1 2015 Research Report" mit "Ema-Peg" erwähnt, was drin steht kann ich nicht sagen, ist mir ein wenig zu teuer für einen Blick.
Schafft aber immerhin Aufmerksamkeit ...
Quelle:
http://www.itbusinessnet.com/article/Diabetic-Nephropathy-Pi…
Viele Grüße
il
Schafft aber immerhin Aufmerksamkeit ...
Quelle:
http://www.itbusinessnet.com/article/Diabetic-Nephropathy-Pi…
Viele Grüße
il
Antwort auf Beitrag Nr.: 49.397.279 von ilsubstanzinvestore am 23.03.15 11:56:04Solche Reports gibt es regelmäßig zu allen möglichen Indikationen. Interessant ist es vor allem, weil man einen raschen Überblick über die Wettbewerbssituation erhält. Das Geld dafür kann man sich aber sparen, beim IPO bekommen wir diese Infos über den Zulassungsprospekt frei Haus geliefert.
Grüße
Grüße
Jahresabschluss und Lagebericht für GJ 2013
Der JA für 2013 wurde im Bundesanzeiger veröffentlicht. Das meiste dürfte den Forumbegleitern bekannt sein, und es ist ja bereits ein weiteres Jahr mit zahlreichen Neuigkeiten vergangen.
Interessant: Bei den Wandelanleihen aus dem 2013er Programm wurde seitens Noxxon das Recht auf Pflichtwandlung spätestens zum 31.12.2014 ausgeübt.
Der JA für 2013 wurde im Bundesanzeiger veröffentlicht. Das meiste dürfte den Forumbegleitern bekannt sein, und es ist ja bereits ein weiteres Jahr mit zahlreichen Neuigkeiten vergangen.
Interessant: Bei den Wandelanleihen aus dem 2013er Programm wurde seitens Noxxon das Recht auf Pflichtwandlung spätestens zum 31.12.2014 ausgeübt.
Deutscher Biotechnologie-Report 2015
http://www.ey.com/DE/de/Newsroom/News-releases/20150413-EY-N…Die jährliche Studie von Ernst & Young enthält einen großen Block zum Thema IPO für deutsche bzw. europäische Biotech-Unternehmen. Durchaus lesenswert.
Ein größeres Problem bei einem US-Börsengang für hiesige Unternehmen stellt die Vereinbarung von deutschem und amerikanischem Aktienrecht dar, was nichts Neues ist, aber halt eine Sache für Juristen bzw. echte Kenner. Die Heidelberger Affimed, die 2014 den Nasdaq-IPO vollzogen hat, hat sich deshalb vorher in eine Gesellschaft niederländischen Rechts gewandelt. Gut möglich, dass sich Noxxon etwas Ähnliches einfallen lassen muss, falls man das US-Listing durchziehen will.
Antwort auf Beitrag Nr.: 49.586.957 von Saaletaler am 17.04.15 11:29:13Da scheint es schon irgendwas zu geben:
http://www.kvk.nl/zoeken/#!zoeken&q=NOXXON%20Pharma&index=4&…
http://www.kvk.nl/zoeken/#!zoeken&q=NOXXON%20Pharma&index=4&…
Antwort auf Beitrag Nr.: 49.618.103 von siggiM55 am 22.04.15 12:44:00@siggiM55,
danke für diesen tollen Hinweis. Wie man sieht, ist man schon weiter als bisher mitgeteilt. Dann kann es ja bald losgehen !
!
Gruß Schulzi64
danke für diesen tollen Hinweis. Wie man sieht, ist man schon weiter als bisher mitgeteilt. Dann kann es ja bald losgehen
 !
!Gruß Schulzi64
Nature Communications Publications on the First X-ray Crystal Structures of Spiegelmers Bound to Protein Targets
http://noxxon.com/index.php?option=com_content&view=article&…

Bild: Stereo figure of the NOX-E36 L-aptamer/CCL2 complex (aus Oberthür et al. (2015): Crystal structure of a mirror-image L-RNA aptamer (Spiegelmer) in complex with the natural L-protein target CCL2)
http://www.nature.com/ncomms/2015/150422/ncomms7923/full/nco…
http://noxxon.com/index.php?option=com_content&view=article&…

Bild: Stereo figure of the NOX-E36 L-aptamer/CCL2 complex (aus Oberthür et al. (2015): Crystal structure of a mirror-image L-RNA aptamer (Spiegelmer) in complex with the natural L-protein target CCL2)
http://www.nature.com/ncomms/2015/150422/ncomms7923/full/nco…
Antwort auf Beitrag Nr.: 49.627.940 von Saaletaler am 23.04.15 13:19:19Wenn die Noxxon-HP mal wieder offline ist: Die PM von heute findet man auch auf der Seite von DEWB.
http://dewb.de/de/portfolio/newsarchiv/989-23-04-15-noxxon-n…
http://dewb.de/de/portfolio/newsarchiv/989-23-04-15-noxxon-n…
NOXXON stellt erste Ergebnisse aus klinischer Studie mit NOX-H94 (Lexaptepid Pegol) in ESA-hyporesponsiven Dialysepatienten auf der ERA-EDTA Konferenz vor
http://noxxon.com/index.php?option=com_content&view=article&…
Berlin und Boston, USA – 29. Mai 2015 - NOXXON Pharma gab bekannt, dass die Ergebnisse des ersten Teils der zweiteiligen Phase 2a Studie mit dem anti-Hepcidin Spiegelmer® NOX-H94 in ESA (Erythropoese-stimulierenden Agenzien) hyporesponsiven Dialysepatienten heute auf der 52. Jahreskonferenz der European Renal Association – European Dialysis and Transplant Association (ERA-EDTA) in London vorgestellt wurden. Diese Studie untersuchte die Verträglichkeit, Pharmakokinetik, Eisenmobilisierung und Wirksamkeit von NOX-H94 bei der Behandlung von ESA-hyporesponsiver Anämie.
Etwa 10 % der an einer Anämie leidenden Dialysepatienten in den USA sprechen zu wenig auf eine Behandlung mit ESAs an (d.h. sie sind ESA hyporesponsiv), was dazu führt, dass sie höhere Dosen dieser Anämiemedikamente verabreicht bekommen. Entsprechend benötigen diese 10 % schlecht auf ESA ansprechenden Patienten etwa 40 % des in der Behandlung von Dialysepatienten verabreichten Erythropoetins, ein üblicherweise verwendetes ESA. Hepcidin, ein Peptidhormon, scheint am schlechten Ansprechen auf die ESA-Therapie beteiligt zu sein. Es wird vermehrt bei Entzündungsreaktionen ausgeschüttet und ist ein Schlüsselregulator für den Eisenhaushalt im menschlichen Körper. Hepcidin kann die Eisenversorgung für die Blutbildung unterbinden und die Eisenresorption aus der Nahrung blockieren, so dass zu wenig Eisen für den Einbau in das Sauerstoff tragende Protein Hämoglobin zur Verfügung steht. NOX-H94 hat das Potential für eine effektivere Behandlung der betroffenen Patienten, indem es Hepcidin bindet und neutralisiert.
Neun Patienten nahmen an diesem ersten Teil der einfach-verblindeten, kontrollierten Cross-Over Studie teil. Jeder Patient bekam nacheinander einmal NOX-H94 und ein Placebo verabreicht. Die Behandlung mit NOX-H94 wurde generell gut vertragen und alle auftretenden Nebenwirkungen wurden als nicht in Zusammenhang mit der Behandlung stehend eingestuft. Die Auswertung hat ergeben, dass eine Dosisanpassung für die Mehrfachbehandlung der Dialysepatienten im zweiten Teil der Studie nicht nötig ist und dass nach der Behandlung mit NOX-H94 der erwartete Effekt eines erhöhten Eisengehalts im Blut eintrat.
Basierend auf diesen Daten hat sich NOXXON entschieden den zweiten Teil der Studie zu beginnen. Die Behandlung der ersten von 24 Patienten erfolgte bereits. Darin erhält eine Hälfte der Studienteilnehmer NOX-H94, die andere Hälfte erhält Placebo, je zweimal wöchentlich über einen Zeitraum von 4 Wochen. Patienten, die darauf mit einem definierten Anstieg des Hämoglobinwerts ansprechen, werden als sog. Responder betrachtet. NOXXON erwartet, die Daten im vierten Quartal 2015 bekannt geben zu können.
Matthias Baumann, Chief Medical Officer bei NOXXON, sagte dazu: “Nach den vielversprechenden Ergebnisse des ersten Teils dieser Phase 2a Studie und unter der Voraussetzung, dass der zweite Teil ebenso gute Ergebnisse liefert, werden wir eine randomisierte, doppel-blinde Phase 2b Studie anschließen, bei der NOX-H94 gegen Placebo bei anämischen ESA-hyporesponsiven Dialysepatienten getestet wird. Diese Studie ermöglicht einen statistisch signifikanten Anstieg des Hämoglobinwerts zu zeigen und erfasst in welchem Umfang durch die Behandlung mit NOX-H94 eine Reduktion des ESA-Bedarfs erreicht werden kann.”
http://noxxon.com/index.php?option=com_content&view=article&…
Berlin und Boston, USA – 29. Mai 2015 - NOXXON Pharma gab bekannt, dass die Ergebnisse des ersten Teils der zweiteiligen Phase 2a Studie mit dem anti-Hepcidin Spiegelmer® NOX-H94 in ESA (Erythropoese-stimulierenden Agenzien) hyporesponsiven Dialysepatienten heute auf der 52. Jahreskonferenz der European Renal Association – European Dialysis and Transplant Association (ERA-EDTA) in London vorgestellt wurden. Diese Studie untersuchte die Verträglichkeit, Pharmakokinetik, Eisenmobilisierung und Wirksamkeit von NOX-H94 bei der Behandlung von ESA-hyporesponsiver Anämie.
Etwa 10 % der an einer Anämie leidenden Dialysepatienten in den USA sprechen zu wenig auf eine Behandlung mit ESAs an (d.h. sie sind ESA hyporesponsiv), was dazu führt, dass sie höhere Dosen dieser Anämiemedikamente verabreicht bekommen. Entsprechend benötigen diese 10 % schlecht auf ESA ansprechenden Patienten etwa 40 % des in der Behandlung von Dialysepatienten verabreichten Erythropoetins, ein üblicherweise verwendetes ESA. Hepcidin, ein Peptidhormon, scheint am schlechten Ansprechen auf die ESA-Therapie beteiligt zu sein. Es wird vermehrt bei Entzündungsreaktionen ausgeschüttet und ist ein Schlüsselregulator für den Eisenhaushalt im menschlichen Körper. Hepcidin kann die Eisenversorgung für die Blutbildung unterbinden und die Eisenresorption aus der Nahrung blockieren, so dass zu wenig Eisen für den Einbau in das Sauerstoff tragende Protein Hämoglobin zur Verfügung steht. NOX-H94 hat das Potential für eine effektivere Behandlung der betroffenen Patienten, indem es Hepcidin bindet und neutralisiert.
Neun Patienten nahmen an diesem ersten Teil der einfach-verblindeten, kontrollierten Cross-Over Studie teil. Jeder Patient bekam nacheinander einmal NOX-H94 und ein Placebo verabreicht. Die Behandlung mit NOX-H94 wurde generell gut vertragen und alle auftretenden Nebenwirkungen wurden als nicht in Zusammenhang mit der Behandlung stehend eingestuft. Die Auswertung hat ergeben, dass eine Dosisanpassung für die Mehrfachbehandlung der Dialysepatienten im zweiten Teil der Studie nicht nötig ist und dass nach der Behandlung mit NOX-H94 der erwartete Effekt eines erhöhten Eisengehalts im Blut eintrat.
Basierend auf diesen Daten hat sich NOXXON entschieden den zweiten Teil der Studie zu beginnen. Die Behandlung der ersten von 24 Patienten erfolgte bereits. Darin erhält eine Hälfte der Studienteilnehmer NOX-H94, die andere Hälfte erhält Placebo, je zweimal wöchentlich über einen Zeitraum von 4 Wochen. Patienten, die darauf mit einem definierten Anstieg des Hämoglobinwerts ansprechen, werden als sog. Responder betrachtet. NOXXON erwartet, die Daten im vierten Quartal 2015 bekannt geben zu können.
Matthias Baumann, Chief Medical Officer bei NOXXON, sagte dazu: “Nach den vielversprechenden Ergebnisse des ersten Teils dieser Phase 2a Studie und unter der Voraussetzung, dass der zweite Teil ebenso gute Ergebnisse liefert, werden wir eine randomisierte, doppel-blinde Phase 2b Studie anschließen, bei der NOX-H94 gegen Placebo bei anämischen ESA-hyporesponsiven Dialysepatienten getestet wird. Diese Studie ermöglicht einen statistisch signifikanten Anstieg des Hämoglobinwerts zu zeigen und erfasst in welchem Umfang durch die Behandlung mit NOX-H94 eine Reduktion des ESA-Bedarfs erreicht werden kann.”
Antwort auf Beitrag Nr.: 49.873.483 von Saaletaler am 29.05.15 12:17:14Zwischendaten der P2a mit NOX-H94 bei Dialyse-ACD auf dem ERA-EDTA-Meeting 2015
Anbei das Abstract der Poster-Präsentation auf der ERA-EDTA-Konferenz (s. auch Noxxon-PM in #248). Für robuste Schlussfolgerungen ist es zu früh, man muss mindestens den zweiten Teil der Studie mit der 4-Wochen-Medikation abwarten, besser noch die P2b.
----------------------------------------------------------------------------------------------------
Studienprotokoll: https://clinicaltrials.gov/ct2/show/NCT02079896
Abstract von Macdougall et al.: http://www.abstracts2view.com/era/view.php?nu=ERA15L1_574&te…
PHARMACOKINETICS AND PHARMACODYNAMICS OF LEXAPTEPID, A NOVEL ANTI-HEPCIDIN MOLECULE, IN ESA-RESISTANT HAEMODIALYSIS PATIENTS
INTRODUCTION AND AIMS: Hepcidin levels are known to be grossly elevated in haemodialysis patients, and this contributes to ESA-resistant anaemia. Inhibiting hepcidin may therefore improve resistance to ESA therapy and anaemia. We therefore studied the pharmacokinetics (PK) and pharmacodynamics of lexaptepid, a novel anti-hepcidin L-RNA aptamer (Spiegelmer®), in a small cohort of chronic haemodialysis patients with ESA-resistant anaemia.
METHODS: This was a single-blind, placebo-controlled crossover trial with a single intravenous dose of both lexaptepid (1.2 mg/kg) and placebo at the end of a routine dialysis session, with a 1-week washout period. Blood samples were taken at 3, 6, 9, 12, 18, and 24 hours post-dosing, and then at 2, 4, 7, 14, and 28 days, for measurement of lexaptepid levels, hepcidin, iron, TIBC, ferritin, TSAT, Hb, RBC, MCH, retics, CHr, %HRC, and sTfR. Safety and adverse events were recorded.
RESULTS: Nine patients, 3 M; 6 F, mean age 58 ± 10 (SD) years, were enrolled. Eight patients completed the study as scheduled; one patient, who discontinued early for an unrelated adverse event, was replaced. Compared to healthy subjects, the dialysis patients in this study showed a similar early elimination until about 8 to 12 h post-dose (t1/2α 4.9 vs. 4.1 h) but an approximately 2-fold higher terminal elimination half-life (t1/2β 52.0 vs. 22.4 h) and a systemic clearance reduced by half. This resulted in a 2-times higher systemic exposure for the dialysis patients compared to healthy subjects (AUC0-96: 55.6 vs. 29.5 h). The simulation of these data to repeated, twice-weekly administrations indicates that Cmax in dialysis patients should not exceed Cmax in healthy subjects (Table).
Baseline serum iron levels were similar prior to placebo (7.7±2.5 µM) and lexaptepid administration (7.4±2.5 µM). Three hours after lexaptepid administration, serum iron started to increase, reaching peak levels at 12 hours that were 69% higher than baseline; no significant changes were evident following placebo injection (Figure). There were no treatment-related adverse events or other safety concerns in this study.
CONCLUSIONS: This study is the first to examine an anti-hepcidin strategy in haemodialysis patients. The PK data suggest that the elimination of lexaptepid is slower than in healthy controls, but dose adjustments may not be necessary for repeated administration. Compared to placebo, there were significant increases in serum iron concentrations following lexaptepid administration, consistent with its anti-hepcidin action. This molecule merits further assessment in ESA-resistant anaemia.


Anbei das Abstract der Poster-Präsentation auf der ERA-EDTA-Konferenz (s. auch Noxxon-PM in #248). Für robuste Schlussfolgerungen ist es zu früh, man muss mindestens den zweiten Teil der Studie mit der 4-Wochen-Medikation abwarten, besser noch die P2b.
----------------------------------------------------------------------------------------------------
Studienprotokoll: https://clinicaltrials.gov/ct2/show/NCT02079896
Abstract von Macdougall et al.: http://www.abstracts2view.com/era/view.php?nu=ERA15L1_574&te…
PHARMACOKINETICS AND PHARMACODYNAMICS OF LEXAPTEPID, A NOVEL ANTI-HEPCIDIN MOLECULE, IN ESA-RESISTANT HAEMODIALYSIS PATIENTS
INTRODUCTION AND AIMS: Hepcidin levels are known to be grossly elevated in haemodialysis patients, and this contributes to ESA-resistant anaemia. Inhibiting hepcidin may therefore improve resistance to ESA therapy and anaemia. We therefore studied the pharmacokinetics (PK) and pharmacodynamics of lexaptepid, a novel anti-hepcidin L-RNA aptamer (Spiegelmer®), in a small cohort of chronic haemodialysis patients with ESA-resistant anaemia.
METHODS: This was a single-blind, placebo-controlled crossover trial with a single intravenous dose of both lexaptepid (1.2 mg/kg) and placebo at the end of a routine dialysis session, with a 1-week washout period. Blood samples were taken at 3, 6, 9, 12, 18, and 24 hours post-dosing, and then at 2, 4, 7, 14, and 28 days, for measurement of lexaptepid levels, hepcidin, iron, TIBC, ferritin, TSAT, Hb, RBC, MCH, retics, CHr, %HRC, and sTfR. Safety and adverse events were recorded.
RESULTS: Nine patients, 3 M; 6 F, mean age 58 ± 10 (SD) years, were enrolled. Eight patients completed the study as scheduled; one patient, who discontinued early for an unrelated adverse event, was replaced. Compared to healthy subjects, the dialysis patients in this study showed a similar early elimination until about 8 to 12 h post-dose (t1/2α 4.9 vs. 4.1 h) but an approximately 2-fold higher terminal elimination half-life (t1/2β 52.0 vs. 22.4 h) and a systemic clearance reduced by half. This resulted in a 2-times higher systemic exposure for the dialysis patients compared to healthy subjects (AUC0-96: 55.6 vs. 29.5 h). The simulation of these data to repeated, twice-weekly administrations indicates that Cmax in dialysis patients should not exceed Cmax in healthy subjects (Table).
Baseline serum iron levels were similar prior to placebo (7.7±2.5 µM) and lexaptepid administration (7.4±2.5 µM). Three hours after lexaptepid administration, serum iron started to increase, reaching peak levels at 12 hours that were 69% higher than baseline; no significant changes were evident following placebo injection (Figure). There were no treatment-related adverse events or other safety concerns in this study.
CONCLUSIONS: This study is the first to examine an anti-hepcidin strategy in haemodialysis patients. The PK data suggest that the elimination of lexaptepid is slower than in healthy controls, but dose adjustments may not be necessary for repeated administration. Compared to placebo, there were significant increases in serum iron concentrations following lexaptepid administration, consistent with its anti-hepcidin action. This molecule merits further assessment in ESA-resistant anaemia.


Antwort auf Beitrag Nr.: 48.276.760 von Saaletaler am 10.11.14 18:15:00NOX-A12 in BR-Kombi bei CLL / Vergleich mit Ibrutinib in BR-Kombi
Pharmacyclics (PCYC) hat Ergebnisse einer P3-Studie mit Ibrutinib in Kombination mit Bendamustin (B) und Rituximab (R) in der Indikation CLL/SLL vorgestellt. Das ist insofern interessant, als sich ein Vergleich mit den P2a-Ergebnissen von NOX-A12 in der BR-Kombination aufdrängt. Die Aussagekraft der kleinen Studie mit NOX-A12 ist natürlich beschränkt, außerdem waren die zuletzt gemeldeten Daten auf der ASH/14 m.W. noch keine Endergebnisse.
Ich stelle mal die Ansprechraten kommentarlos gegenüber. Man muss sich die Studien sehr viel genauer ansehen, wenn man handfeste Schlussfolgerungen ziehen möchte. Vielleicht kommen wir darauf zurück, sobald klar ist, wie NOX-A12 weiterentwickelt werden soll.
Quellen:
P2a-Daten mit NOX-A12 von Steurer et al. auf ASH/14: http://noxxon.com/index.php?option=com_content&view=article&…
P3-Daten mit Ibrutinib von Chanan-Khan et al. auf ASCO/15: http://abstracts.asco.org/156/AbstView_156_145722.html
PM von PCYC: http://finance.yahoo.com/news/phase-iii-helios-study-results…
Angaben ohne Gewähr!
Pharmacyclics (PCYC) hat Ergebnisse einer P3-Studie mit Ibrutinib in Kombination mit Bendamustin (B) und Rituximab (R) in der Indikation CLL/SLL vorgestellt. Das ist insofern interessant, als sich ein Vergleich mit den P2a-Ergebnissen von NOX-A12 in der BR-Kombination aufdrängt. Die Aussagekraft der kleinen Studie mit NOX-A12 ist natürlich beschränkt, außerdem waren die zuletzt gemeldeten Daten auf der ASH/14 m.W. noch keine Endergebnisse.
Ich stelle mal die Ansprechraten kommentarlos gegenüber. Man muss sich die Studien sehr viel genauer ansehen, wenn man handfeste Schlussfolgerungen ziehen möchte. Vielleicht kommen wir darauf zurück, sobald klar ist, wie NOX-A12 weiterentwickelt werden soll.
Studie -------------------------- P2a von Noxxon P3 von PCYC/Janssen P3 von PCYC/Janssen Fisher et al. (2011) | Medikation -------------------------- NOX-A12 + BR Ibrutinib + BR Placebo + BR BR | # Ptn. ----------- 28 289 289 78 | ORR ----------- 82% 83% 68% 59% | CR ----------- 14% 10% 3% 9% |
Quellen:
P2a-Daten mit NOX-A12 von Steurer et al. auf ASH/14: http://noxxon.com/index.php?option=com_content&view=article&…
P3-Daten mit Ibrutinib von Chanan-Khan et al. auf ASCO/15: http://abstracts.asco.org/156/AbstView_156_145722.html
PM von PCYC: http://finance.yahoo.com/news/phase-iii-helios-study-results…
Angaben ohne Gewähr!
Antwort auf Beitrag Nr.: 49.884.736 von Saaletaler am 31.05.15 20:16:15Cell Reports Publication on the Mechanism of Action of NOXXON's Anti-SDF-1 Spiegelmer® Olaptesed Pegol (NOX-A12) in Preclinical Multiple Myeloma Models
(PresseBox) (Berlin, Germany / Boston, USA, 26.09.2014) NOXXON Pharma announced today the publication of a new study in Cell Reports, entitled "SDF-1 Inhibition Targets the Bone Marrow Niche for Cancer Therapy". The study of the hematological malignancy multiple myeloma in a mouse model was conducted by scientists from Dana-Farber Cancer Institute at Harvard Medical School, Boston, USA and NOXXON Pharma.
Metastasis, the process of tumors spreading and colonizing distant parts of the body, is one of the most deadly aspects of cancer. Traditionally, researchers have focused on the cancer cells themselves, however, the interactions between tumor cells and the tissues around them, the so-called microenvironment, is attracting increasing attention.
Dr. Irene Ghobrial, Associate Professor of Medicine at Harvard Medical School and her team, discovered that there is a high expression of a tumor cell-attracting messenger protein called stromal cell derived factor-1 (SDF-1/CXCL12) in bone marrow of patients with active multiple myeloma as well as in metastatic bone marrow niches of patients with solid malignancies. The Spiegelmer® olaptesed pegol (a PEGylated mirror-image (L-)oligonucleotide) was identified at NOXXON Pharma to bind tightly and specifically to SDF-1. It was hypothesized that blocking SDF-1 with olaptesed pegol could lead to a less alluring signal coming from bone marrow niches, thereby attracting fewer tumor cells. Indeed, olaptesed pegol treatment resulted in a decrease of disease progression and a prolonged survival in translational mouse models of multiple myeloma.
Dr. Aldo Roccaro, the study's co-first author with Dana-Farber colleague Antonio Sacco, said: "We know that myeloma cells can't survive for long if they are circulating in the blood and can't adhere to other tissue, so we think that neutralizing SDF-1 could change the bone marrow environment to make it less receptive for multiple myeloma cells, reduce myeloma cells' affinity for the marrow, and thereby inhibit the progression of the disease."
Senior author Dr. Irene Ghobrial added: "Metastasis remains one of the most important complications we face as physicians and cancer researchers, but our findings clearly document a therapeutic effect of olaptesed pegol in a mouse model of advanced myeloma."
Dr. Matthias Baumann, Chief Medical Officer of NOXXON Pharma, concluded: "These results suggest that targeting SDF-1 may represent a valid strategy to prevent or disrupt bone marrow colonization by multiple myeloma cells and possibly other tumors. In conjunction with interim results of our ongoing Phase IIa studies in multiple myeloma and chronic lymphocytic leukemia, these findings further support the therapeutic potential of olaptesed pegol."
To access the (online) publication in Cell Reports, please follow this link: [http://www.cell.com/cell-reports/pdf/S2211-1247(14)00718-9.p…
Viele Grüße
il
(PresseBox) (Berlin, Germany / Boston, USA, 26.09.2014) NOXXON Pharma announced today the publication of a new study in Cell Reports, entitled "SDF-1 Inhibition Targets the Bone Marrow Niche for Cancer Therapy". The study of the hematological malignancy multiple myeloma in a mouse model was conducted by scientists from Dana-Farber Cancer Institute at Harvard Medical School, Boston, USA and NOXXON Pharma.
Metastasis, the process of tumors spreading and colonizing distant parts of the body, is one of the most deadly aspects of cancer. Traditionally, researchers have focused on the cancer cells themselves, however, the interactions between tumor cells and the tissues around them, the so-called microenvironment, is attracting increasing attention.
Dr. Irene Ghobrial, Associate Professor of Medicine at Harvard Medical School and her team, discovered that there is a high expression of a tumor cell-attracting messenger protein called stromal cell derived factor-1 (SDF-1/CXCL12) in bone marrow of patients with active multiple myeloma as well as in metastatic bone marrow niches of patients with solid malignancies. The Spiegelmer® olaptesed pegol (a PEGylated mirror-image (L-)oligonucleotide) was identified at NOXXON Pharma to bind tightly and specifically to SDF-1. It was hypothesized that blocking SDF-1 with olaptesed pegol could lead to a less alluring signal coming from bone marrow niches, thereby attracting fewer tumor cells. Indeed, olaptesed pegol treatment resulted in a decrease of disease progression and a prolonged survival in translational mouse models of multiple myeloma.
Dr. Aldo Roccaro, the study's co-first author with Dana-Farber colleague Antonio Sacco, said: "We know that myeloma cells can't survive for long if they are circulating in the blood and can't adhere to other tissue, so we think that neutralizing SDF-1 could change the bone marrow environment to make it less receptive for multiple myeloma cells, reduce myeloma cells' affinity for the marrow, and thereby inhibit the progression of the disease."
Senior author Dr. Irene Ghobrial added: "Metastasis remains one of the most important complications we face as physicians and cancer researchers, but our findings clearly document a therapeutic effect of olaptesed pegol in a mouse model of advanced myeloma."
Dr. Matthias Baumann, Chief Medical Officer of NOXXON Pharma, concluded: "These results suggest that targeting SDF-1 may represent a valid strategy to prevent or disrupt bone marrow colonization by multiple myeloma cells and possibly other tumors. In conjunction with interim results of our ongoing Phase IIa studies in multiple myeloma and chronic lymphocytic leukemia, these findings further support the therapeutic potential of olaptesed pegol."
To access the (online) publication in Cell Reports, please follow this link: [http://www.cell.com/cell-reports/pdf/S2211-1247(14)00718-9.p…
Viele Grüße
il
Dr. Aram Mangasarian neuer Vorstandsvorsitzender bei NOXXON
http://noxxon.com/index.php?option=com_content&view=article&…
Berlin und Boston, USA - 14. Juli 2015 - Die NOXXON Pharma AG hat Dr. Aram Mangasarian zum neuen Vorstandsvorsitzenden ernannt. Er übernimmt die Position von Iain Buchanan, der in den Aufsichtsrat gewählt werden soll. Dr. Mangasarian leitet seit Mai 2010 den Bereich Business Development als Chief Business Officer bei NOXXON und arbeitete seitdem eng mit Iain Buchanan in der Führung des Unternehmens zusammen. Iain Buchanan, der den Vorstandsvorsitz im September 2010 übernahm, scheidet aus dem operativen Tagesgeschäft aus, wird aber bis zu seiner Rückkehr in den Aufsichtsrat weiterhin mit dem Managementteam zusammenarbeiten.
Dr. Mangasarian sagt dazu: "Ich nehme die neue Herausforderung als Vorstandsvorsitzender von NOXXON gerne an. Die Firma hat mit den Spiegelmeren eine neue Wirkstoffklasse von Therapeutika entwickelt, deren spezielle Eigenschaften vielen Patienten eine bessere Anti-Krebs-Therapie ermöglichen könnte. In Zukunft werden wir unsere Bemühungen in der Entwicklung von Produkten verstärkt auf das Thema Krebs lenken, da sie in diesem Gebiet meiner Auffassung nach ihre größte Wirkung entfalten könnten."
http://noxxon.com/index.php?option=com_content&view=article&…
Berlin und Boston, USA - 14. Juli 2015 - Die NOXXON Pharma AG hat Dr. Aram Mangasarian zum neuen Vorstandsvorsitzenden ernannt. Er übernimmt die Position von Iain Buchanan, der in den Aufsichtsrat gewählt werden soll. Dr. Mangasarian leitet seit Mai 2010 den Bereich Business Development als Chief Business Officer bei NOXXON und arbeitete seitdem eng mit Iain Buchanan in der Führung des Unternehmens zusammen. Iain Buchanan, der den Vorstandsvorsitz im September 2010 übernahm, scheidet aus dem operativen Tagesgeschäft aus, wird aber bis zu seiner Rückkehr in den Aufsichtsrat weiterhin mit dem Managementteam zusammenarbeiten.
Dr. Mangasarian sagt dazu: "Ich nehme die neue Herausforderung als Vorstandsvorsitzender von NOXXON gerne an. Die Firma hat mit den Spiegelmeren eine neue Wirkstoffklasse von Therapeutika entwickelt, deren spezielle Eigenschaften vielen Patienten eine bessere Anti-Krebs-Therapie ermöglichen könnte. In Zukunft werden wir unsere Bemühungen in der Entwicklung von Produkten verstärkt auf das Thema Krebs lenken, da sie in diesem Gebiet meiner Auffassung nach ihre größte Wirkung entfalten könnten."
Antwort auf Beitrag Nr.: 50.183.859 von Saaletaler am 14.07.15 14:16:18Nix wesentliches passiert - es können alle wieder einsteigen :o)
Boah, nix wesentliches passiert, aber eine grottige Kommunikation, wenn zunächst per Handelsregistereintrag und ohne weitere Erklärung das Ausscheiden des CEO bekannt wird.
<momos>
<momos>
Antwort auf Beitrag Nr.: 50.185.305 von dg6nds am 14.07.15 17:05:23Interessanter als den Wechsel des CEO finde ich sogar die angekündigte Priorisierung hin zur Krebstherapie. Dass die überzeugenden präklinischen Ergebnisse mit NOX-A12 bei den Hirntumoren und zum MM-Mikromilieu bisher nicht zu weiteren Studien geführt haben, fand ich wirklich bedauerlich. Vermutlich wird es in erster Linie an der begrenzten Kapitalausstattung gelegen haben. Aber wenn hoch renommierte US-Forschungsinstitute wie die Stanford University (Team um Martin Brown) oder Dana-Farber (Team um Irene Ghobrial), die diese Studien durchgeführt haben, Begeisterung über die Resultate zeigen, kann das wohl keine Luftnummer sein.
Dass es vielfältige (theoretische) Kombinationsmöglichkeiten von NOX-A12 mit etablierten oder neuen Krebstherapien gibt, liegt auf der Hand. Die Neugier ist groß, welche Kombi-Studien in welchen Indikationen Noxxon nun konkret starten möchte. Zuerst muss jedoch die Finanzierung geklärt werden!
Grüße
Dass es vielfältige (theoretische) Kombinationsmöglichkeiten von NOX-A12 mit etablierten oder neuen Krebstherapien gibt, liegt auf der Hand. Die Neugier ist groß, welche Kombi-Studien in welchen Indikationen Noxxon nun konkret starten möchte. Zuerst muss jedoch die Finanzierung geklärt werden!
Grüße
Antwort auf Beitrag Nr.: 50.188.113 von Saaletaler am 14.07.15 22:56:20Auf der überarbeiteten Noxxon-HP kann man jetzt einen ersten, groben Einblick in die künftige, auf Krebstherapie fokussierte Strategie gewinnen. Geplant ist demnach die Weiterentwicklung von NOX-A12 als Kombinationswirkstoff in den Indikationen MM, Hirntumore sowie bei weiteren soliden Tumoren wie Lungen- und Darmkrebs. Mehr dazu siehe:
http://noxxon.com/index.php?option=com_content&view=article&… und
http://noxxon.com/index.php?option=com_content&view=article&…
Vielleicht kommt in Kürze eine PM dazu mit Details, wie bspw. einer konkreten Studienplanung - und einem Finanzierungskonzept!
Außerdem wurde die Rekrutierung in der P1b/2a-Studie mit NOX-H94 laut Protokoll inzwischen beendet (s. hier). Ergebnisse müssten demnach spätestens in Q1/16 vorliegen.
http://noxxon.com/index.php?option=com_content&view=article&… und
http://noxxon.com/index.php?option=com_content&view=article&…
Vielleicht kommt in Kürze eine PM dazu mit Details, wie bspw. einer konkreten Studienplanung - und einem Finanzierungskonzept!
Außerdem wurde die Rekrutierung in der P1b/2a-Studie mit NOX-H94 laut Protokoll inzwischen beendet (s. hier). Ergebnisse müssten demnach spätestens in Q1/16 vorliegen.
Antwort auf Beitrag Nr.: 50.799.210 von Saaletaler am 07.10.15 23:40:20
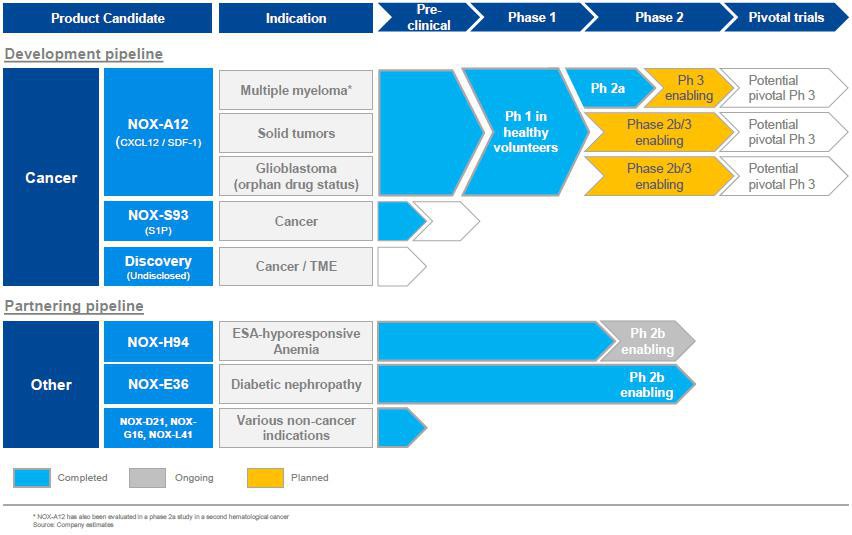
Grafik: Noxxon Pharma AG (Oktober 2015)
Neue Pipeline-Übersicht
Jetzt gibt es auf der Noxxon-HP auch eine frische Pipeline-Grafik (s. hier). Wenn ich es richtig interpretiere, sind also mindestens drei neue P2-Studien mit NOX-A12 konkret in Vorbereitung, die Noxxon ohne Partner durchziehen würde/wird. 
Grafik: Noxxon Pharma AG (Oktober 2015)
Bonjour!
-------------------------------------------NOXXON Pharma Announces Intention to Launch an Initial Public Offering on Euronext Amsterdam and Euronext Paris
http://dewb.de/de/portfolio/newsarchiv/1001-20-10-15-noxxon-…
Berlin, Germany, 20 October 2015 - NOXXON Pharma N.V. (“NOXXON” or the “Company”), a clinical-stage biopharmaceutical company primarily focused on cancer treatment development, announces today its intention to raise new funds through an Initial Public Offering (“IPO” or the “Offering”) and the listing of its ordinary shares (the “Shares”) on Euronext Amsterdam and Euronext Paris. The Offering and listing, and their timing, are subject to, among other matters, market conditions.
Company highlights
· Lead product candidate NOX-A12 is positioned as a must-have combination therapy in cancer: The Company believes that the future of cancer treatment lies in finding optimal combinations of drugs to fight cancer in multiple ways. The Company believes its lead product candidate NOX-A12 is well positioned to become a must-have combination partner for a wide range of cancer treatments, based on its complementary mode of action targeting the tumor microenvironment. As part of a combination, the Company believes NOX-A12 has broad potential in hematological and solid tumor cancers.
· NOX-A12 has a clear route to market: NOX-A12 is currently being developed for treatment of multiple myeloma (a form of blood cancer), advanced solid tumor cancers and brain cancer. NOXXON has generated promising pre-clinical and clinical data, including its most recent phase 2a trials in multiple myeloma and a second hematological cancer that showed a safety profile that supports further development and first signs of efficacy. The Company believes that its planned clinical studies in multiple myeloma, brain cancer and advanced solid tumor cancers position the Company for a clear route to market of NOX-A12.
· Mature pipeline of drug candidates with near term milestones: In addition to NOX-A12, the Company has a broad pipeline of drug candidates, which in the Company’s view is an indication of the versatility of the Company’s core technology. NOX-H94, which is in development to treat anemia of chronic disease, i.e. functional iron deficiency, is expected to deliver phase 2a data in Q1’2016. The Company is focused on developing cancer drug candidates and aims to optimize the value of its pipeline by selective partnering of certain programs.
· Proprietary Spiegelmer platform generates drug candidates: NOXXON’s product candidates, including NOX-A12, are so-called Spiegelmers. Spiegelmers are a new class of drugs that combine the strengths of small-molecules and antibodies. The Company has established a proprietary technology to discover and create its Spiegelmer drug candidates against a variety of targets. With its Spiegelmer platform, the Company intends to continue to generate additional drug candidates and to expand its pipeline focusing on tumor microenvironment targets.
· Strong leadership team and a reputable investor base: NOXXON is led by a management team with broad experience in drug development. Furthermore, the Company is supported by reputable investor base, including TVM Capital, Sofinnova Partners, Edmond de Rothschild Investment Partners, DEWB and NGN.
Aram Mangasarian, PhD, Chief Executive Officer of NOXXON commented: “Our lead product candidate NOX-A12 has the potential to become a cornerstone of combination therapy by significantly improving the efficacy of current and future cancer treatments. The funds raised through this public offering will primarily be used to advance NOX-A12 and other oncology focused product candidates in NOXXON’s broad and innovative pipeline.”
Dr. Hubert Birner, Chairman of NOXXON, added: "We believe NOXXON has a tremendous opportunity to develop a series of new products to improve cancer treatment. With our unique and broadly applicable Spiegelmer platform, a strong IP position and growing clinical and pre-clinical pipeline we believe we are well positioned to further build our future and become a leading biopharmaceutical company."
Highlights of the Offering
· The intended Offering would consist of newly issued Shares only.
· NOXXON intends to seek admission to listing and trading of the Shares on Euronext Amsterdam and Euronext Paris.
· The Offering is expected to be available to institutional investors and retail investors in the Netherlands and France, and to institutional investors in various other jurisdictions.
· The Offering and the listing, and their timing, are subject to, among other matters, market conditions.
· Kempen & Co N.V. is acting as Sole Global Coordinator and, together with Gilbert Dupont SNC as the Joint Bookrunners, for the Offering.
· Certain of NOXXON’s current shareholders have indicated their intention to subscribe for Shares in the Offering to underline their further support of the Company and its strategy.
Rationale for the Offering
The Company intends to use the net proceeds of the Offering for the further clinical development of its lead product candidate NOX-A12 in various oncology indications, advancement of its pre-clinical pipeline and discovery efforts to identify new immuno-oncology and tumor microenvironment-targeting product candidates, completion of the on-going NOX-H94 trial and general corporate purposes.
More about Spiegelmers
Spiegelmers are a new class of drug designed to combine the benefits of small chemical molecules and biologicals such as antibodies. They have been administered to more than 300 human subjects to date, with a good safety and tolerability profile. By using ‘mirror image’ chemistry, Spiegelmers solve two key problems that have limited the development of aptamer therapeutics. Spiegelmers have high stability in biological fluids since they are not recognized by naturally occurring enzymes that degrade RNA or DNA. Spiegelmers are also unlikely to elicit an immune reaction since they escape innate immune system surveillance. Spiegelmers can be manufactured chemically and therefore do not require complex biological production processes and NOXXON has established optimized production and quality control methods in-house and with partners for production in accordance with good manufacturing practice.
More about NOX-A12
NOX-A12 is a Spiegelmer drug candidate under development as a combination therapy in multiple cancer indications. It has shown promising results in pre-clinical and clinical studies, including in two Phase 2a trials. NOXXON intends to develop NOX-A12 in multiple myeloma, in advanced solid tumor cancers, such as lung and colorectal cancer, and in brain cancer. NOX-A12 has received orphan drug designation for two types of brain cancer; glioblastoma in the United States and glioma in Europe. NOX-A12 targets CXCL12, a key chemokine (signaling) protein, which promotes tumor proliferation, new blood vessel formation to the tumor, spread of the tumor and reduces tumor apoptosis (cell death). NOX-A12 is designed to be combined with other cancer targeting therapies to fight tumors by modulating the tumor microenvironment in three distinct ways:
· Expose hidden tumor cells: NOX-A12’s target, called CXCL12, attracts blood cancer cells to protective niches in the bone marrow. NOX-A12 is intended to expel tumor cells from these niches leaving cancer cells in the blood stream where they are more susceptible to tumor-killing drugs.
· Break tumor protection: CXCL12 forms a protective biochemical ‘wall’ around certain solid tumors, blocking entry of immune system cells that can kill tumor cells. NOX-A12 has the potential to destroy the ‘wall,’ enabling active immune cells, such as killer T-cells, to enter the tumor with the aim of unleashing the full potential of immuno-oncology approaches such as immune checkpoint inhibitors.
· Block tumor repair: CXCL12 attracts ‘repair cells’ to tumors damaged by anti-cancer therapy, for instance following radiotherapy. NOX-A12 is aimed at blocking this effect to prevent tumor re-growth.
For more information, please contact:
NOXXON Pharma N.V.
Aram Mangasarian, PhD, Chief Executive Officer
Tel. +49 (0) 30 726 2470
amangasarian@noxxon.com
Consilium Strategic Communications
Chris Gardner, Mary-Jane Elliott, Jonathan Birt, Lindsey Neville and Hendrik Thys
Tel. +44 (0) 203 709 5708
noxxon@consilium-comms.com
HuijskensBickerton
Ian Bickerton and Andrew Beh
Tel. +31 (0) 20 685 5955
ian@huijskensbickerton.com
NewCap
Pierre Laurent, Emmanuel Huynh, Florent Alba and Tristan Roquet Montegon
Tel. +33 (0) 14 471 9497
plaurent@newcap.fr
MC Services
Dorothea Schneider and Raimund Gabriel
Tel. +49 (0) 89 2102 2860
dorothea.schneider@mc-services.eu
About NOXXON
NOXXON Pharma N.V. is a clinical-stage biopharmaceutical company focused on cancer treatment. NOXXON is using its proprietary class of drugs, “Spiegelmers”, to target the tumor microenvironment, the new frontier in cancer treatment. NOXXON’s goal is to significantly enhance the effectiveness of cancer treatments including immuno-oncology approaches (such as immune checkpoint inhibitors) and current standards of care (such as chemotherapy and radiotherapy). NOXXON’s Spiegelmer platform has generated a broad proprietary pipeline of clinical-stage product candidates including its lead cancer drug candidate NOX-A12. NOXXON is supported by a strong group of leading international investors, including TVM Capital, Sofinnova Partners, Edmond de Rothschild Investment Partners, DEWB and NGN. NOXXON has its statutory seat in Amsterdam, The Netherlands and its office in Berlin, Germany. Further information can be found at: www.noxxon.com.
Important
Legal Information
This announcement is not an advertisement within the meaning of the Prospectus Directive and does not constitute a prospectus. The offer to acquire Shares pursuant to the proposed offering will be made, and any investor should make his investment decision, solely on the basis of information that will be contained in the prospectus to be made available in connection with such offering. When made available, copies of the prospectus may be obtained at no cost from the Company and through the website of the Company.
These materials are for informational purposes only and are not intended to constitute, and should not be construed as, an offer to sell or subscribe for, or the announcement of a forthcoming offer to sell or subscribe for, or a solicitation of any offer to buy or subscribe for, or the announcement of a forthcoming solicitation of any offer to buy or subscribe for, ordinary Shares in the share capital of the Company in the United States, Australia, Canada, Japan or in any jurisdiction to whom or in which such offer or solicitation is unlawful. Persons into whose possession this communication comes should inform themselves about and observe any such restrictions. Any failure to comply with these restrictions may constitute a violation of the security laws of any such jurisdiction.
The Shares have not been and will not be registered under the U.S. Securities Act of 1933, as amended (the “Securities Act”) and may only be offered or sold in the United States pursuant to registration or an exemption from registration under the Securities Act. The Company does not intend to register any portion of the contemplated offering of Shares in the United States or to conduct a public offering of Shares in the United States. The securities referred to herein may not be offered or sold in Australia, Canada or Japan or to, or for the account or benefit of, any national, resident or citizen of Australia, Canada or Japan.
The Company has not authorized any offer to the public of Shares in any Member State of the European Economic Area, except in the Netherlands and France. With respect to any Member State of the European Economic Area which has implemented the Prospectus Directive (each a “Relevant Member State”), none of the Shares may be offered or sold to the public in that Relevant Member State prior to the publication of a prospectus in relation to the Shares, which has been approved by the competent authority in that Relevant Member State or, where appropriate, approved in another Relevant Member State and notified to the competent authority in that Relevant Member State, all in accordance with the Prospectus Directive, except that an offer of such Shares may be made to the public in Relevant Member States:
(i) to any legal entity which is a “qualified investor” as defined in the Prospectus Directive;
(ii) to fewer than 150 natural or legal persons (other than qualified investors as defined in the Prospectus Directive), as permitted under the Prospectus Directive; or
(iii) in any other circumstances falling within Article 3(2) of the Prospectus Directive,
provided that no such offer of Shares shall require the Company to publish a prospectus or a supplement to an existing prospectus pursuant to Article 3 of the Prospectus Directive or any measure implementing the Prospectus Directive in a Relevant Member State and each person who initially acquires any Shares or to whom any offer is made under the offering of the Shares will be deemed to have represented, acknowledged, and agreed that it is a “qualified investor” within the meaning of Article 2(1)(e) of the Prospectus Directive. For the purpose of this paragraph, the expression “offer of securities to the public” means the communication in any form and by any means of sufficient information on the terms of the offer and the Shares to be offered so as to enable the investor to decide to exercise, purchase or subscribe for the Shares, as the same may be varied in that Relevant Member State by any measure implementing the Prospectus Directive in that Relevant Member State and the expression “Prospectus Directive” means Directive 2003/71/EC (as amended, including by Directive 2010/73/EU), and includes any relevant implementing measure in the Relevant Member State.
In the United Kingdom, this document and any other materials in relation to the Shares is only being distributed to, and is only directed at, and any investment or investment activity to which this document relates is available only to, and will be engaged in only with, “qualified investors” (as defined in section 86(7) of the Financial Services and Markets Act 2000) and who are (i) persons having professional experience in matters relating to investments who fall within the definition of “investment professionals” in Article 19(5) of the Financial Services and Markets Act 2000 (“Financial Promotion”) Order 2005 (the “Order”); or (ii) high net worth entities falling within Article 49(2)(a) to (d) of the Order (all such persons together being referred to as “relevant persons”). This communication is directed only at relevant persons. Persons who are not relevant persons should not take any action on the basis of this document and should not act or rely on it. No action has been taken by the Company that would permit an offer of the Shares or the possession or distribution of this press release or any other offering or publicity material relating to such Shares in any jurisdiction where action for that purpose is required. Any investment activity to which this communication relates will only be available to and will only be engaged with, relevant persons.
Some of the information in these materials may contain projections or other forward-looking statements regarding future events or the future financial performance of the Company. You can identify forward-looking statements by terms such as “expect”, “believe”, “anticipate”, “estimate”, “intend”, “will”, “could”, “may” or “might”, the negative of such terms or other similar expressions. These statements are only predictions, actual events or results may differ materially and will not be updated to reflect events and circumstances occurring after the date hereof or to reflect the occurrence of unanticipated events. Many factors could cause the actual results to differ materially from those contained in projections or forward-looking statements of the Company, including, among others, general economic conditions, the competitive environment, rapid technological and market change in the industries the Company operates in, as well as many other risks specifically related to the Company and its operations.
Priiiimaaaa!
Antwort auf Beitrag Nr.: 50.884.869 von dg6nds am 20.10.15 08:05:35So,
jetzt heißt es warten auf die IPO-Unterlagen, welche sicherlich bald eingestellt werden.
Ich rechne mit einem IPO noch im Dezember. Die Unterlagen werden vermutlich hier eingestellt: http://noxxon-ipo.com/
jetzt heißt es warten auf die IPO-Unterlagen, welche sicherlich bald eingestellt werden.
Ich rechne mit einem IPO noch im Dezember. Die Unterlagen werden vermutlich hier eingestellt: http://noxxon-ipo.com/
Antwort auf Beitrag Nr.: 50.885.382 von dg6nds am 20.10.15 09:09:31Wie wird sich das auf DEWB auswirken ? Würdet ihr raten noch nicht zu verkaufen ? 

Antwort auf Beitrag Nr.: 50.885.424 von Morpheusz am 20.10.15 09:14:04
Für DEWB-Aktionäre wird das jetzt eine sehr spannende Zeit! Ich möchte aber darum bitten, die Diskussion um die Auswirkungen des Noxxon-IPO auf DEWB ausschließlich im
Thread: DEWB-Fakten und Vermutungen
zu führen. Hier bitte nur Infos und Diskussion über Noxxon. Denn es wird hoffentlich in Kürze jede Menge neue Noxxon-Aktionäre geben, die mit DEWB nichts am Hut haben.
Vielen Dank!
Saaletaler
Zitat von Morpheusz: Wie wird sich das auf DEWB auswirken ? Würdet ihr raten noch nicht zu verkaufen ?
Für DEWB-Aktionäre wird das jetzt eine sehr spannende Zeit! Ich möchte aber darum bitten, die Diskussion um die Auswirkungen des Noxxon-IPO auf DEWB ausschließlich im
Thread: DEWB-Fakten und Vermutungen
zu führen. Hier bitte nur Infos und Diskussion über Noxxon. Denn es wird hoffentlich in Kürze jede Menge neue Noxxon-Aktionäre geben, die mit DEWB nichts am Hut haben.
Vielen Dank!
Saaletaler
Die Mitteilung über einen möglichen IPO hat sich positiv auf den Kurs ausgewirkt. Danach ist die Aktie wieder zurückgefallen und nun gibt es eine offizielle IPO Ankündigung - schau dir den Chart an.
Mehr kann man sagen sobald die IPO Unterlagen eingestellt sind.
Mehr kann man sagen sobald die IPO Unterlagen eingestellt sind.
Antwort auf Beitrag Nr.: 50.885.595 von Saaletaler am 20.10.15 09:28:25Jawohl Meister 
Also rüber in den DEWB - Fakten und Vermutungen Thread


Also rüber in den DEWB - Fakten und Vermutungen Thread

Nochmal auf Deutsch und einige Gedanken dazu warum der Börsengang nicht in D stattfindet:
http://www.biotechnologie.de/183880
http://www.biotechnologie.de/183880
Antwort auf Beitrag Nr.: 50.897.085 von kmastra am 21.10.15 13:10:11Danke, @kmastra! Würde mich sehr freuen, wenn sich weitere erfahrene Biotech-Leute an der Diskussion beteiligen, @SLGramann hat ja schon ein paar Mal vorbeigeschaut. 
Gern verweise ich in diesem Zusammenhang auf eine exzellente Biotech-Diskussionsrunde, wobei die in den USA gelisteten Schwergewichte im Vordergrund stehen:
Thread: Biotech Depot - verschiede Werte und Strategien
Selbstverständlich sind hier auch alle anderen herzlich willkommen, die Interesse an Noxxon bzw. dem IPO haben.
----------------------------------------------------------------------------
Für alle neuen Leser: Momentan ist diesem Thread die DEWB-Aktie als Wertpapier zugeordnet. Solange Noxxon nicht börsenhandelbar ist, kann man als Anleger über DEWB an der Entwicklung teilhaben. Auf die entsprechende Diskussion zu DEWB wurde gestern bereits verwiesen, hier soll nur das Unternehmen Noxxon besprochen werden.
Sobald das IPO richtig konkret wird und eine ISIN für Noxxon vorliegt, werde ich WSO natürlich bitten, die Zuordnung auf die Noxxon-Aktie umzustellen.
----------------------------------------------------------------------------
Ich selbst bin mit der Börse Euronext und deren Regularien/Gepflogenheiten bislang gar nicht vertraut. Den Link zum Biotech-Index der Euronext habe ich immerhin schon gefunden. Er heißt "Next Biotech" und hat das Kürzel BIOTK:
https://www.euronext.com/en/products/indices/QS0011095955-XP…
Unter dem Reiter "Market Information" sind die im Index enthaltenen Biotech-Unternehmen aufgelistet, bspw. Galapagos oder Ablynx.
----------------------------------------------------------------------------
Kempen & Co N.V. als Sole Gobal Coordinator und Bookrunner hat auch das IPO der deutschen Probiodrug vor einem Jahr an der Euronext Amsterdam als Konsortialführer begleitet (s. Probiodrug-PM vom 23. Oktober 2014 hier).
http://www.kempen.nl/Default.aspx?langtype=1033
Gilbert Dupont SNC als Joint Bookrunner gemeinsam mit Kempen & Co ist eine Investmentbank bzw. ein Anbieter/Vermittler von Finanzdienstleistungen in Frankreich:
https://www.gilbertdupont.fr/en?language=en
----------------------------------------------------------------------------
Es ist verlockend, bereits jetzt Fakten zu denjenigen Indikationen zusammenzutragen, in denen NOX-A12 weiterentwickelt werden soll, insb. Glioblastom und MM. Es scheint jedoch zweckmäßig, auf die Veröffentlichung des Börsenzulassungsprospektes zu warten. Dieser wird jede Menge Informationen enthalten, welche die Diskussion in Schwung bringen werden. Momentan ist mir der Rechercheaufwand zu groß.
Das soll aber niemanden davon abhalten, weitere Nachrichten/Einschätzungen zum IPO oder zu den Aussichten der Spiegelmere einzustellen. Ganz im Gegenteil!
Grüße

Gern verweise ich in diesem Zusammenhang auf eine exzellente Biotech-Diskussionsrunde, wobei die in den USA gelisteten Schwergewichte im Vordergrund stehen:
Thread: Biotech Depot - verschiede Werte und Strategien
Selbstverständlich sind hier auch alle anderen herzlich willkommen, die Interesse an Noxxon bzw. dem IPO haben.
----------------------------------------------------------------------------
Für alle neuen Leser: Momentan ist diesem Thread die DEWB-Aktie als Wertpapier zugeordnet. Solange Noxxon nicht börsenhandelbar ist, kann man als Anleger über DEWB an der Entwicklung teilhaben. Auf die entsprechende Diskussion zu DEWB wurde gestern bereits verwiesen, hier soll nur das Unternehmen Noxxon besprochen werden.
Sobald das IPO richtig konkret wird und eine ISIN für Noxxon vorliegt, werde ich WSO natürlich bitten, die Zuordnung auf die Noxxon-Aktie umzustellen.
----------------------------------------------------------------------------
Ich selbst bin mit der Börse Euronext und deren Regularien/Gepflogenheiten bislang gar nicht vertraut. Den Link zum Biotech-Index der Euronext habe ich immerhin schon gefunden. Er heißt "Next Biotech" und hat das Kürzel BIOTK:
https://www.euronext.com/en/products/indices/QS0011095955-XP…
Unter dem Reiter "Market Information" sind die im Index enthaltenen Biotech-Unternehmen aufgelistet, bspw. Galapagos oder Ablynx.
----------------------------------------------------------------------------
Kempen & Co N.V. als Sole Gobal Coordinator und Bookrunner hat auch das IPO der deutschen Probiodrug vor einem Jahr an der Euronext Amsterdam als Konsortialführer begleitet (s. Probiodrug-PM vom 23. Oktober 2014 hier).
http://www.kempen.nl/Default.aspx?langtype=1033
Gilbert Dupont SNC als Joint Bookrunner gemeinsam mit Kempen & Co ist eine Investmentbank bzw. ein Anbieter/Vermittler von Finanzdienstleistungen in Frankreich:
https://www.gilbertdupont.fr/en?language=en
----------------------------------------------------------------------------
Es ist verlockend, bereits jetzt Fakten zu denjenigen Indikationen zusammenzutragen, in denen NOX-A12 weiterentwickelt werden soll, insb. Glioblastom und MM. Es scheint jedoch zweckmäßig, auf die Veröffentlichung des Börsenzulassungsprospektes zu warten. Dieser wird jede Menge Informationen enthalten, welche die Diskussion in Schwung bringen werden. Momentan ist mir der Rechercheaufwand zu groß.
Das soll aber niemanden davon abhalten, weitere Nachrichten/Einschätzungen zum IPO oder zu den Aussichten der Spiegelmere einzustellen. Ganz im Gegenteil!
Grüße
Antwort auf Beitrag Nr.: 50.898.819 von Saaletaler am 21.10.15 15:41:40Hallo Saaletaler,
also vorbeischauen tue ich hier auch recht regelmäßig Ich finde du machst hier einen Klasse-Job! Ich hatte ja auch mal lange Zeit eine Art "Tagebuch" zu Ligand geführt und von daher weiß ich wie es ist und drück dir die Daumen. Wenn ich mal was finde, poste ich es hier...
Ich finde du machst hier einen Klasse-Job! Ich hatte ja auch mal lange Zeit eine Art "Tagebuch" zu Ligand geführt und von daher weiß ich wie es ist und drück dir die Daumen. Wenn ich mal was finde, poste ich es hier...
Ich beschäftige mich zwar auch schon eine Weile mit Biotech aber ich will es mal so sagen: Wenn Biotech der Ozean ist, dann bin ich am schnorcheln. User wie SLG oder ipollit sind da ganz anders unterwegs. Mindestens mit Sauerstoffgerät - um da mal im Bild zu bleiben. Der Austausch in einem allgemeinen Bord ist für mich sehr Gewinn bringend. Aber ich denke ein thematisch sauberes Bord (ich kann gut verstehen das du es clean halten willst) zu einem Wert hat auch große Vorteile. Man kann dann wie eine Zeitleiste sein Investment sehr genau verfolgen, auch mal zurückblättern und reflektieren. Deshalb überleg ich sogar zu einigen Werten wieder eine eigene Diskussion zu eröffnen.
Sorry - ist im Grunde ja alles offtopic!
SG kmastra
also vorbeischauen tue ich hier auch recht regelmäßig
 Ich finde du machst hier einen Klasse-Job! Ich hatte ja auch mal lange Zeit eine Art "Tagebuch" zu Ligand geführt und von daher weiß ich wie es ist und drück dir die Daumen. Wenn ich mal was finde, poste ich es hier...
Ich finde du machst hier einen Klasse-Job! Ich hatte ja auch mal lange Zeit eine Art "Tagebuch" zu Ligand geführt und von daher weiß ich wie es ist und drück dir die Daumen. Wenn ich mal was finde, poste ich es hier...Ich beschäftige mich zwar auch schon eine Weile mit Biotech aber ich will es mal so sagen: Wenn Biotech der Ozean ist, dann bin ich am schnorcheln. User wie SLG oder ipollit sind da ganz anders unterwegs. Mindestens mit Sauerstoffgerät - um da mal im Bild zu bleiben. Der Austausch in einem allgemeinen Bord ist für mich sehr Gewinn bringend. Aber ich denke ein thematisch sauberes Bord (ich kann gut verstehen das du es clean halten willst) zu einem Wert hat auch große Vorteile. Man kann dann wie eine Zeitleiste sein Investment sehr genau verfolgen, auch mal zurückblättern und reflektieren. Deshalb überleg ich sogar zu einigen Werten wieder eine eigene Diskussion zu eröffnen.
Sorry - ist im Grunde ja alles offtopic!
SG kmastra
NOXXON PHARMA hosts Key Opinion Leader symposium
http://noxxon.com/index.php?option=com_content&view=article&…
Berlin, Germany, 20 January 2016, NOXXON Pharma AG (“NOXXON” or the “Company”), a clinical-stage biopharmaceutical company primarily focused on cancer treatment development, today announces that the Company hosted a Key Opinion Leader symposium focused on current advances in the treatment of multiple myeloma. The symposium focused on the relevance of the tumor microenvironment in multiple myeloma, including the role of the CXCL12/CXCR4/CXCR7 axis, as well as an overview of key developments from The American Society of Hematology (ASH) Annual Conference.
The meeting featured keynote presentations by the following Key Opinion Leaders:
Kenneth C. Anderson, MD Kraft Family Professor of Medicine at Harvard Medical School, Director of Jerome Lipper Multiple Myeloma Center at Dana-Farber Cancer Institute, Director of the LeBow Institute for Myeloma Therapeutics and Vice President of ASH 2015. He also serves as the Kraft Family Professor of Medicine and Vice Chair of the Joint Program in Transfusion Medicine at Harvard Medical School. Dr. Anderson earned his medical degree from Johns Hopkins School of Medicine, where he also completed his residency, and completed his fellowship in medical oncology at DFCI.
Dr. Anderson has received several prestigious awards including the ASH William Dameshek Prize as well as awards from organizations such as the International Myeloma Foundation, American Association for Cancer Research, and the American Cancer Society. He is currently a member of the Johns Hopkins Society of Scholars, the Institute of Medicine of the National Academy of Sciences, and the Royal Colleges of Physicians and of Pathologists in the United Kingdom.
Irene Ghobrial, MD is the attending Physician, Medical Oncology at Dana-Farber Cancer Institute, Associate Professor of Medicine and Harvard Medical School and Director, Michele & Stephen Kirsch Laboratory.
Aram Mangasarian, PhD, Chief Executive Officer of NOXXON Pharma, commented: “There is an increasing body of evidence which points towards the critical role that the tumor microenvironment plays in how cancer tumors grow and spread. Our unique Spiegelmer® platform has generated a broad proprietary pipeline of clinical-stage assets, including our lead product candidate, NOX-A12, which are able to target the tumor microenvironment and therefore have the potential to significantly enhance the effectiveness of current cancer treatments. We are pleased to have gathered such a prestigious group of experts to discuss advances in this area.”
--------------------------------------------------------------------------------------------------------------------
Ohne Zweifel hochgradig renommierte Wissenschaftler und bedeutendes Thema. Allerdings dachte ich, Noxxon sei bereits etwas weiter, als nur darüber zu diskutieren. Das Potenzial von NOX-A12 bei MM oder auch GBM ist seit langem dokumentiert. Konkret gefragt:
Wann kommen die neuen Studien?
http://noxxon.com/index.php?option=com_content&view=article&…
Berlin, Germany, 20 January 2016, NOXXON Pharma AG (“NOXXON” or the “Company”), a clinical-stage biopharmaceutical company primarily focused on cancer treatment development, today announces that the Company hosted a Key Opinion Leader symposium focused on current advances in the treatment of multiple myeloma. The symposium focused on the relevance of the tumor microenvironment in multiple myeloma, including the role of the CXCL12/CXCR4/CXCR7 axis, as well as an overview of key developments from The American Society of Hematology (ASH) Annual Conference.
The meeting featured keynote presentations by the following Key Opinion Leaders:
Kenneth C. Anderson, MD Kraft Family Professor of Medicine at Harvard Medical School, Director of Jerome Lipper Multiple Myeloma Center at Dana-Farber Cancer Institute, Director of the LeBow Institute for Myeloma Therapeutics and Vice President of ASH 2015. He also serves as the Kraft Family Professor of Medicine and Vice Chair of the Joint Program in Transfusion Medicine at Harvard Medical School. Dr. Anderson earned his medical degree from Johns Hopkins School of Medicine, where he also completed his residency, and completed his fellowship in medical oncology at DFCI.
Dr. Anderson has received several prestigious awards including the ASH William Dameshek Prize as well as awards from organizations such as the International Myeloma Foundation, American Association for Cancer Research, and the American Cancer Society. He is currently a member of the Johns Hopkins Society of Scholars, the Institute of Medicine of the National Academy of Sciences, and the Royal Colleges of Physicians and of Pathologists in the United Kingdom.
Irene Ghobrial, MD is the attending Physician, Medical Oncology at Dana-Farber Cancer Institute, Associate Professor of Medicine and Harvard Medical School and Director, Michele & Stephen Kirsch Laboratory.
Aram Mangasarian, PhD, Chief Executive Officer of NOXXON Pharma, commented: “There is an increasing body of evidence which points towards the critical role that the tumor microenvironment plays in how cancer tumors grow and spread. Our unique Spiegelmer® platform has generated a broad proprietary pipeline of clinical-stage assets, including our lead product candidate, NOX-A12, which are able to target the tumor microenvironment and therefore have the potential to significantly enhance the effectiveness of current cancer treatments. We are pleased to have gathered such a prestigious group of experts to discuss advances in this area.”
--------------------------------------------------------------------------------------------------------------------
Ohne Zweifel hochgradig renommierte Wissenschaftler und bedeutendes Thema. Allerdings dachte ich, Noxxon sei bereits etwas weiter, als nur darüber zu diskutieren. Das Potenzial von NOX-A12 bei MM oder auch GBM ist seit langem dokumentiert. Konkret gefragt:
Wann kommen die neuen Studien?
Antwort auf Beitrag Nr.: 51.534.678 von Saaletaler am 20.01.16 09:09:13die frage bei noxon, welches über venture capital finanziert ist und ANGEBLICH demnächst an die börse soll, welche news betreffend studien und datenlage gibt man wann raus.
man befindet sich ja in einem satdium, indem die eigentümer einen bestmöglichen exit erzielen wollen. insofern dürften auch news und studiendaten hier gezielt auf diese situation an die öffentlichkeit gehen.
damit auch zusammenhängend, welche studiendaten und infos benötigt man im vorfeld des börsengangs, um diesen bestmöglich zu plazieren. plaziert man news zeitnah zum termin des börsengangs oder aber, wenn sie anfallen.
leider sind das fragen, auf die man keine antwort bekommen kann und wird.
man befindet sich ja in einem satdium, indem die eigentümer einen bestmöglichen exit erzielen wollen. insofern dürften auch news und studiendaten hier gezielt auf diese situation an die öffentlichkeit gehen.
damit auch zusammenhängend, welche studiendaten und infos benötigt man im vorfeld des börsengangs, um diesen bestmöglich zu plazieren. plaziert man news zeitnah zum termin des börsengangs oder aber, wenn sie anfallen.
leider sind das fragen, auf die man keine antwort bekommen kann und wird.
NOXXON Pharma NV lists its shares on Alternext Paris
http://dewb.de/de/portfolio/newsarchiv/1029-28-09-16-noxxon-…
Berlin, Germany, 28 September 2016 - NOXXON Pharma N.V. (“NOXXON” or the “Company”), a clinical-stage biopharmaceutical company primarily focused on cancer treatment development, today announces the listing of its ordinary shares (the “Shares”) on Alternext Paris. The Shares will trade under the symbol ALNOX (ISIN: NL0012044762).
Company highlights
• Lead product candidate NOX-A12 is positioned as a combination therapy in cancer: The Company believes that the future of cancer treatment lies in finding optimal combinations of drugs to fight cancer in multiple ways. The Company believes its lead product candidate NOX-A12 is well positioned to become a combination partner for a wide range of cancer treatments, based on its complementary mode of action targeting the tumor microenvironment. As part of a combination, the Company believes NOX-A12 has broad potential in both solid and hematological tumors.
• NOX-A12 may be a key partner for IO (immuno-oncology) agents: The Company’s first priority is development of NOX-A12 in advanced solid tumors that do not respond to checkpoint inhibitor monotherapy, and the Company has mapped out further potential for the compound in brain cancer and multiple myeloma. NOXXON has generated promising pre-clinical and clinical data, including recent animal data showing synergy with a checkpoint inhibitor as well as recent phase 2a trials in multiple myeloma and a second hematological cancer that showed a safety profile that supports further development and first signs of efficacy. The Company believes that its planned clinical study in advanced solid tumors positions the Company for a clear route to market of NOX-A12.
• Second clinical-stage tumor microenvironment drug candidate: In addition to NOX-A12, the Company has another clinical-stage asset: NOX-E36. This compound has completed a 75 patient exploratory Phase 2a in diabetic nephropathy and is now being studied for applications in cancer therapy following recent promising clinical results obtained by another compound acting on the same pathway as part of a combination therapy in pancreatic cancer. The Group believes that these data suggest significant potential to increase efficacy in this solid tumors by tumor microenvironment modulation of the pathway targeted by NOX-E36.
• Experienced senior management team and a reputable investor base: NOXXON is led by a management team with broad experience in drug development. Furthermore, the Company is supported by reputable investor base, including TVM Capital, Sofinnova Partners, Edmond de Rothschild Investment Partners, DEWB, NGN Capital and Seventure.
Aram Mangasarian, PhD, Chief Executive Officer of NOXXON commented: “The listing of NOXXON shares on Alternext is an important step for the Company. Our lead product candidate, NOX-A12, as well as our other clinical stage compound NOX-E36, target the tumor microenvironment and are designed to significantly improve the efficacy of current and future cancer treatments. The funds raised in a private placement just prior to our listing will allow us to initiate a clinical trial NOX-A12 in patients with advanced solid tumors that do not normally respond to currently approved checkpoint inhibitors.”
Advisors
• Invest Securities : Listing Sponsor
• Freshfields Bruckhaus Deringer : Lawyers
• NewCap : Financial Communication
For more information, please contact:
NOXXON Pharma N.V.
Aram Mangasarian, Ph.D., Chief Executive Officer
Tel. +49 (0) 30 726 2470
amangasarian@noxxon.com
NewCap
Florent Alba
Tel. +33 (0) 1 44 71 98 55
falba@newcap.fr
About NOXXON
NOXXON Pharma N.V. is a clinical-stage biopharmaceutical company focused on cancer treatment. NOXXON’s goal is to significantly enhance the effectiveness of cancer treatments including immuno-oncology approaches (such as immune checkpoint inhibitors) and current standards of care (such as chemotherapy and radiotherapy). NOXXON’s Spiegelmer platform has generated a proprietary pipeline of clinical-stage product candidates including its lead cancer drug candidate NOX-A12. NOXXON is supported by a strong group of leading international investors, including TVM Capital, Sofinnova Partners, Edmond de Rothschild Investment Partners, DEWB, NGN and Seventure. NOXXON has its statutory seat in Amsterdam, The Netherlands and its office in Berlin, Germany. Further information can be found at: www.noxxon.com.
Important Legal Information
This announcement is not an advertisement within the meaning of the Prospectus Directive and does not constitute a prospectus.
These materials are for informational purposes only and are not intended to constitute, and should not be construed as, an offer to sell or subscribe for, or the announcement of a forthcoming offer to sell or subscribe for, or a solicitation of any offer to buy or subscribe for, or the announcement of a forthcoming solicitation of any offer to buy or subscribe for, Shares in the United States, Australia, Canada, Japan or in any jurisdiction to whom or in which such offer or solicitation is unlawful. Persons into whose possession this communication comes should inform themselves about and observe any such restrictions. Any failure to comply with these restrictions may constitute a violation of the security laws of any such jurisdiction.
The Shares have not been and will not be registered under the U.S. Securities Act of 1933, as amended (the “Securities Act”) and may only be offered or sold in the United States pursuant to registration or an exemption from registration under the Securities Act. The Company does not intend to register any portion of the contemplated offering of Shares in the United States or to conduct a public offering of Shares in the United States. The securities referred to herein may not be offered or sold in Australia, Canada or Japan or to, or for the account or benefit of, any national, resident or citizen of Australia, Canada or Japan.
Some of the information in these materials may contain projections or other forward-looking statements regarding future events or the future financial performance of the Company. You can identify forward-looking statements by terms such as “expect”, “believe”, “anticipate”, “estimate”, “intend”, “will”, “could”, “may” or “might”, the negative of such terms or other similar expressions. These statements are only predictions, actual events or results may differ materially and will not be updated to reflect events and circumstances occurring after the date hereof or to reflect the occurrence of unanticipated events. Many factors could cause the actual results to differ materially from those contained in projections or forward-looking statements of the Company, including, among others, general economic conditions, the competitive environment, rapid technological and market change in the industries the Company operates in, as well as many other risks specifically related to the Company and its operations.
http://dewb.de/de/portfolio/newsarchiv/1029-28-09-16-noxxon-…
Berlin, Germany, 28 September 2016 - NOXXON Pharma N.V. (“NOXXON” or the “Company”), a clinical-stage biopharmaceutical company primarily focused on cancer treatment development, today announces the listing of its ordinary shares (the “Shares”) on Alternext Paris. The Shares will trade under the symbol ALNOX (ISIN: NL0012044762).
Company highlights
• Lead product candidate NOX-A12 is positioned as a combination therapy in cancer: The Company believes that the future of cancer treatment lies in finding optimal combinations of drugs to fight cancer in multiple ways. The Company believes its lead product candidate NOX-A12 is well positioned to become a combination partner for a wide range of cancer treatments, based on its complementary mode of action targeting the tumor microenvironment. As part of a combination, the Company believes NOX-A12 has broad potential in both solid and hematological tumors.
• NOX-A12 may be a key partner for IO (immuno-oncology) agents: The Company’s first priority is development of NOX-A12 in advanced solid tumors that do not respond to checkpoint inhibitor monotherapy, and the Company has mapped out further potential for the compound in brain cancer and multiple myeloma. NOXXON has generated promising pre-clinical and clinical data, including recent animal data showing synergy with a checkpoint inhibitor as well as recent phase 2a trials in multiple myeloma and a second hematological cancer that showed a safety profile that supports further development and first signs of efficacy. The Company believes that its planned clinical study in advanced solid tumors positions the Company for a clear route to market of NOX-A12.
• Second clinical-stage tumor microenvironment drug candidate: In addition to NOX-A12, the Company has another clinical-stage asset: NOX-E36. This compound has completed a 75 patient exploratory Phase 2a in diabetic nephropathy and is now being studied for applications in cancer therapy following recent promising clinical results obtained by another compound acting on the same pathway as part of a combination therapy in pancreatic cancer. The Group believes that these data suggest significant potential to increase efficacy in this solid tumors by tumor microenvironment modulation of the pathway targeted by NOX-E36.
• Experienced senior management team and a reputable investor base: NOXXON is led by a management team with broad experience in drug development. Furthermore, the Company is supported by reputable investor base, including TVM Capital, Sofinnova Partners, Edmond de Rothschild Investment Partners, DEWB, NGN Capital and Seventure.
Aram Mangasarian, PhD, Chief Executive Officer of NOXXON commented: “The listing of NOXXON shares on Alternext is an important step for the Company. Our lead product candidate, NOX-A12, as well as our other clinical stage compound NOX-E36, target the tumor microenvironment and are designed to significantly improve the efficacy of current and future cancer treatments. The funds raised in a private placement just prior to our listing will allow us to initiate a clinical trial NOX-A12 in patients with advanced solid tumors that do not normally respond to currently approved checkpoint inhibitors.”
Advisors
• Invest Securities : Listing Sponsor
• Freshfields Bruckhaus Deringer : Lawyers
• NewCap : Financial Communication
For more information, please contact:
NOXXON Pharma N.V.
Aram Mangasarian, Ph.D., Chief Executive Officer
Tel. +49 (0) 30 726 2470
amangasarian@noxxon.com
NewCap
Florent Alba
Tel. +33 (0) 1 44 71 98 55
falba@newcap.fr
About NOXXON
NOXXON Pharma N.V. is a clinical-stage biopharmaceutical company focused on cancer treatment. NOXXON’s goal is to significantly enhance the effectiveness of cancer treatments including immuno-oncology approaches (such as immune checkpoint inhibitors) and current standards of care (such as chemotherapy and radiotherapy). NOXXON’s Spiegelmer platform has generated a proprietary pipeline of clinical-stage product candidates including its lead cancer drug candidate NOX-A12. NOXXON is supported by a strong group of leading international investors, including TVM Capital, Sofinnova Partners, Edmond de Rothschild Investment Partners, DEWB, NGN and Seventure. NOXXON has its statutory seat in Amsterdam, The Netherlands and its office in Berlin, Germany. Further information can be found at: www.noxxon.com.
Important Legal Information
This announcement is not an advertisement within the meaning of the Prospectus Directive and does not constitute a prospectus.
These materials are for informational purposes only and are not intended to constitute, and should not be construed as, an offer to sell or subscribe for, or the announcement of a forthcoming offer to sell or subscribe for, or a solicitation of any offer to buy or subscribe for, or the announcement of a forthcoming solicitation of any offer to buy or subscribe for, Shares in the United States, Australia, Canada, Japan or in any jurisdiction to whom or in which such offer or solicitation is unlawful. Persons into whose possession this communication comes should inform themselves about and observe any such restrictions. Any failure to comply with these restrictions may constitute a violation of the security laws of any such jurisdiction.
The Shares have not been and will not be registered under the U.S. Securities Act of 1933, as amended (the “Securities Act”) and may only be offered or sold in the United States pursuant to registration or an exemption from registration under the Securities Act. The Company does not intend to register any portion of the contemplated offering of Shares in the United States or to conduct a public offering of Shares in the United States. The securities referred to herein may not be offered or sold in Australia, Canada or Japan or to, or for the account or benefit of, any national, resident or citizen of Australia, Canada or Japan.
Some of the information in these materials may contain projections or other forward-looking statements regarding future events or the future financial performance of the Company. You can identify forward-looking statements by terms such as “expect”, “believe”, “anticipate”, “estimate”, “intend”, “will”, “could”, “may” or “might”, the negative of such terms or other similar expressions. These statements are only predictions, actual events or results may differ materially and will not be updated to reflect events and circumstances occurring after the date hereof or to reflect the occurrence of unanticipated events. Many factors could cause the actual results to differ materially from those contained in projections or forward-looking statements of the Company, including, among others, general economic conditions, the competitive environment, rapid technological and market change in the industries the Company operates in, as well as many other risks specifically related to the Company and its operations.
Antwort auf Beitrag Nr.: 53.362.806 von Saaletaler am 28.09.16 09:00:54Information Document / Zulassungsprospekt: http://noxxon.com/index.php?option=com_content&view=article&…
NOXXON Pharma demonstrates synergies between NOX-A12 and therapies working through T cells or NK cells
http://noxxon.com/index.php?option=com_content&view=article&…
ESMO-Poster: www.noxxon.com/downloads/poster/ESMO2016.pdf
http://noxxon.com/index.php?option=com_content&view=article&…
ESMO-Poster: www.noxxon.com/downloads/poster/ESMO2016.pdf
Die AG hat die Einladung zur ordentlichen HV für das GJ 2015 im Bundesanzeiger veröffentlicht. Bei der Entlastung des Vorstands wird über jedes Mitglied einzeln abgestimmt. Aus dem derzeitigen AR sollen die Verteter von NGN und Sofinnova per Abstimmung abberufen werden.
Sieht so aus, als wären nach dem "grandiosen" IPO-Prozedere noch einige Rechnungen zu begleichen.
Sieht so aus, als wären nach dem "grandiosen" IPO-Prozedere noch einige Rechnungen zu begleichen.
DEWB AG Deutsche Effecten- und Wechsel-Beteiligungsgesellschaft AG: NOXXON Pharma announces experienced industry cancer clinician Dr. Jarl Ulf Jungnelius to serve as NOXXON CMO
Focus on oncology allows recruitment of specialist involved in approval of multiple oncology agents
Berlin (pta/10.02.2017/10:10) February 10, 2017 -
NOXXON Pharma N.V. (Alternext Paris: ALNOX), a biotechnology company whose core focus is on cancer treatment, has today announced that Jarl Ulf Jungnelius, M.D., Ph.D. will take over the role of Chief Medical Officer. Dr. Jungnelius, who is already familiar with the company's programs in a consulting capacity, will now increase his involvement with NOXXON, allowing for a period of overlap with Dr. Matthias Baumann whose current contract as Chief Medical Officer expires in June 2017.
Dr. Jungnelius' career includes leadership positions at Celgene, Pfizer, Takeda and Eli Lilly & Company and significant roles in the approval of several successful oncology drugs including Abraxane®, Gemzar®, Alimta® and Revlimid®.
Of particular relevance to NOXXON is his prior experience in immune-oncology and his involvement with two agents that have been approved for pancreatic cancer, one of the indications pursued in the upcoming clinical trial of NOX-A12 in combination with Keytruda® which will be conducted in collaboration with Merck & Co. / MSD.
"I am pleased to take on the role of CMO to work with the NOXXON team and excited by the opportunity to work with agents targeting the tumor microenvironment which I believe is an approach with significant potential for patients," commented Dr. Jarl Ulf Jungnelius.
"Jarl Ulf is a great fit for NOXXON as we continue our transition to a clinical oncology company. His extensive experience in oncology clinical development in the US and Europe will be invaluable as we develop NOX-A12 to target the tumor microenvironment," commented Dr. Aram Mangasarian, CEO of NOXXON.
"On behalf of the board I want to thank Matthias for all excellent work he has done for NOXXON Pharma across multiple programs in the last years and for the professional and pragmatic way he is managing this transition," commented Dr. Hubert Birner, Chairman of NOXXON.
Focus on oncology allows recruitment of specialist involved in approval of multiple oncology agents
Berlin (pta/10.02.2017/10:10) February 10, 2017 -
NOXXON Pharma N.V. (Alternext Paris: ALNOX), a biotechnology company whose core focus is on cancer treatment, has today announced that Jarl Ulf Jungnelius, M.D., Ph.D. will take over the role of Chief Medical Officer. Dr. Jungnelius, who is already familiar with the company's programs in a consulting capacity, will now increase his involvement with NOXXON, allowing for a period of overlap with Dr. Matthias Baumann whose current contract as Chief Medical Officer expires in June 2017.
Dr. Jungnelius' career includes leadership positions at Celgene, Pfizer, Takeda and Eli Lilly & Company and significant roles in the approval of several successful oncology drugs including Abraxane®, Gemzar®, Alimta® and Revlimid®.
Of particular relevance to NOXXON is his prior experience in immune-oncology and his involvement with two agents that have been approved for pancreatic cancer, one of the indications pursued in the upcoming clinical trial of NOX-A12 in combination with Keytruda® which will be conducted in collaboration with Merck & Co. / MSD.
"I am pleased to take on the role of CMO to work with the NOXXON team and excited by the opportunity to work with agents targeting the tumor microenvironment which I believe is an approach with significant potential for patients," commented Dr. Jarl Ulf Jungnelius.
"Jarl Ulf is a great fit for NOXXON as we continue our transition to a clinical oncology company. His extensive experience in oncology clinical development in the US and Europe will be invaluable as we develop NOX-A12 to target the tumor microenvironment," commented Dr. Aram Mangasarian, CEO of NOXXON.
"On behalf of the board I want to thank Matthias for all excellent work he has done for NOXXON Pharma across multiple programs in the last years and for the professional and pragmatic way he is managing this transition," commented Dr. Hubert Birner, Chairman of NOXXON.
Olaptesed (NOX-A12) Alone and in Combination With Pembrolizumab in Colorectal and Pancreatic Cancer
https://clinicaltrials.gov/ct2/show/NCT03168139
https://clinicaltrials.gov/ct2/show/NCT03168139
Beitrag zu dieser Diskussion schreiben
Zu dieser Diskussion können keine Beiträge mehr verfasst werden, da der letzte Beitrag vor mehr als zwei Jahren verfasst wurde und die Diskussion daraufhin archiviert wurde.
Bitte wenden Sie sich an feedback@wallstreet-online.de und erfragen Sie die Reaktivierung der Diskussion oder starten Sie eine neue Diskussion.
Investoren beobachten auch:
| Wertpapier | Perf. % |
|---|---|
| +2,44 | |
| -0,26 | |
| +0,96 | |
| +0,32 | |
| -1,90 | |
| +0,51 | |
| +2,30 | |
| -0,27 | |
| -8,38 | |
| +0,55 |
Meistdiskutiert
| Wertpapier | Beiträge | |
|---|---|---|
| 218 | ||
| 156 | ||
| 78 | ||
| 59 | ||
| 49 | ||
| 45 | ||
| 43 | ||
| 41 | ||
| 36 | ||
| 29 |
| Zeit | Titel |
|---|---|
| 03.04.24 |



















