Soligenix Registered - Meinungen zu dieser Aktie? - 500 Beiträge pro Seite
eröffnet am 04.11.16 16:25:57 von
neuester Beitrag 08.01.24 14:33:39 von
neuester Beitrag 08.01.24 14:33:39 von
Beiträge: 341
ID: 1.240.929
ID: 1.240.929
Aufrufe heute: 1
Gesamt: 32.125
Gesamt: 32.125
Aktive User: 0
ISIN: US8342235053 · WKN: A3D506 · Symbol: SNGX
0,5095
USD
+7,58 %
+0,0359 USD
Letzter Kurs 22:30:00 NYSE
Werte aus der Branche Pharmaindustrie
| Wertpapier | Kurs | Perf. % |
|---|---|---|
| 1,0400 | +48,57 | |
| 50,80 | +40,72 | |
| 12,810 | +39,69 | |
| 0,5400 | +38,46 | |
| 0,9425 | +31,86 |
| Wertpapier | Kurs | Perf. % |
|---|---|---|
| 0,6610 | -24,02 | |
| 1,1450 | -27,94 | |
| 28,18 | -32,62 | |
| 0,5660 | -40,42 | |
| 2,8100 | -48,72 |
Noch hier jemand investiert, und vielleicht eine Meinung? Ich habe hier schon so viel verloren auch durch das 1:10, und im Moment kennt die Aktie nur eine Richtung. 
 ,
,

 ,
,
die aktie hat ein kgv von 133!!!!!!schmeiss den krempel weg ..+rette was noch zu retten ist ..
im übrigen , wenns nur ein split 1:10 war ..hast dadurch nix verloren ..denn die endsumme bleibtgleich nur die stückzahl änderte sich
im übrigen , wenns nur ein split 1:10 war ..hast dadurch nix verloren ..denn die endsumme bleibtgleich nur die stückzahl änderte sich
Aktien auf ......nix enden so, wie es der Name schon ankündigt.
Was ist hier los? Riesen Volumen. Die Aktie ist bei der Pipeline unterbewertet aber dieser Riesensprung??? Heute war diese Konferenz, sollten da mal ein paar Investoren auf das Unternehemn aufmerksam geworden sein?
Antwort auf Beitrag Nr.: 54.760.501 von Steel21x am 19.04.17 16:30:19Hier ist der Grund.
https://www.smarteranalyst.com/2017/04/19/soligenix-inc-sngx…
Die Ergebnisse sind eigentlich schon länger bekannt.
Auch ein krasser Umsatz, bis jetzt ca. 25 Mio Stücke gehandelt bei ca 5,5 Mio Gesamt Shares.
http://finance.yahoo.com/quote/SNGX/key-statistics?p=SNGX
Kleiner Überblick
http://finance.yahoo.com/news/statistically-significant-data…
https://www.smarteranalyst.com/2017/04/19/soligenix-inc-sngx…
Die Ergebnisse sind eigentlich schon länger bekannt.
Auch ein krasser Umsatz, bis jetzt ca. 25 Mio Stücke gehandelt bei ca 5,5 Mio Gesamt Shares.
http://finance.yahoo.com/quote/SNGX/key-statistics?p=SNGX
Kleiner Überblick
http://finance.yahoo.com/news/statistically-significant-data…
Endlich geht es wieder nach oben, aber 26 Mil. gehandelte Aktien bei einer Aktienzahl vo gerade mal 5,5 Mil.?
Antwort auf Beitrag Nr.: 54.762.439 von vinod am 19.04.17 21:28:22Na klar, warum soll das nicht möglich sein. Die Vormittagskäufer sind wieder raus usw. Ich halte das Teil auch schon länger, werde auch weiter halten. Habe vor kurzen mal nachgekauft und jetzt bleiben die Shares erst mal 2 Jahre mindestens liegen. Wenn Ende des Jahres die P3 erfolgreich ist, geht hier richtig die Post ab bei der doch sehr niedrigen Bewertung.
So langsam bewegt sich der Kurs wieder nach unten. Bin hier schon wirklich viele Jahre investiert, habe viel verloren, mal sehen ob es noch was wird. Aber das wird noch dauern
Antwort auf Beitrag Nr.: 54.825.334 von vinod am 28.04.17 08:07:12Diesen Monat sollen ja nach den langen Verzögerungen ja endlich mal Zwischenergebnisse zur Phase 3 kommen. Der Kurs hat zwar seit dem Tief im Sommer gut angzogen aber die langfristige Performance ist unterirdisch. bin seit letzter Woche mit 1,5 K Dabei und speckuliere auf gute Daten. Mal schauen ob es gut geht.
Antwort auf Beitrag Nr.: 58.864.728 von Steel21x am 03.10.18 23:21:24kann sich jemand den absturz erklären



Antwort auf Beitrag Nr.: 58.864.728 von Steel21x am 03.10.18 23:21:24Hallo Steel, schön, dass hier noch jemand anders investiert hat. weiß Du warum die Aktie wieder so eingebrochen ist? ich habe keine negativen Nachrichten gefunden.
Antwort auf Beitrag Nr.: 58.940.001 von vinod am 12.10.18 10:05:34ich beobachte auch schon sehr lange. War zwischenzeitlich drausseb. Der jetzige Absturz war denke ich dem allgemeinem Umfeld geschuldet. Leider ging es ja trotz viel Versprechender Pipeline nur nach unten die letzten Jahre. Wenn jetzt die Ergebnisse mal endlich kommen und gut sind konnte es sich vielleicht mal dauerhaft nach oben bewegen.
Antwort auf Beitrag Nr.: 58.944.198 von Steel21x am 12.10.18 16:14:03Ich bin hier schon mehrere Jahre invetiert und habe viel verloren. Hoffe aber trotzdem , dass es wieder besser wird. Wo siehst Du den Kurs , wenn positive Nachrichten kommen? Der Vorteil ist im Moment noch, dass es verhätnismässig wenig Aktien gibt. Ich war schon invetiert, bevor man aus 10 Aktien eine gemacht hat. Hätte damals vorher verkaufen sollen, aber im Nachhinein ist man immer schlauer. jetz brauche ich mindestens einen Kurs von 12 Euro, um einen Gewinn zu machen. Habe allerdings am Freitag nochmal 200 gekauft.
Antwort auf Beitrag Nr.: 58.950.915 von vinod am 13.10.18 15:12:17Ja dass von dir habe ich mitbekommen. Ich war zwischenzeitlich auch mal raus. Eigentlich unglaublich die bisherige Kurs Entwicklung. Man muss sich ja immer vot Augen halten dass im Vergleich zu anderen Unternehmen Soligenix eigentlich zu gunstig ist. Aber nun ja, es ist halt so. Ich schätze dass bei guten Daten erstmal ca 4 bis 6 Dollar moglich sind. Auf 1 bis 2 Jahre gesehen dann natürlich mehr. Aber ich weiss es auch nicht was passieren wird. Wenn ich mir die letzten Ausschlaäge nach oben anschaue, ist vielleicht auch mehr drin. Bei schlechten Daten wird es bestimmt wieder ein Pennystock.
Antwort auf Beitrag Nr.: 58.951.527 von Steel21x am 13.10.18 18:00:08Gut die Nachricht ist raus. Die Studie lauft weiter mit noch zusatzlichen Probanden. Weiss ich jetzt auch nicht was ich von halten soll.
Antwort auf Beitrag Nr.: 58.961.640 von Steel21x am 15.10.18 14:49:40Wahrscheinlich waren die Ergebnisse noch nicht gut genug. Bei MaximGroup ist der Zielkurs bei 4$. Heute ist kein Handel in den USA, mal shen wie der Markt morgen reagiert
Naja es ist halt typisch Soligenix 😉 Wieder mal ne Verschiebung. Ursprunglich sollten die Ergebnisse Ende 2016 kommen... Naja hauptsache es kommen am Ende gute Ergebnisse... Dank kleiner Position bin ich hier entspannt und es ist ja kein One Trick Pony.
Antwort auf Beitrag Nr.: 58.966.200 von Steel21x am 15.10.18 23:36:13Was für ein Absturz vielleicht ist hinter der Verschiebung mehr, ich bin mal gespannt, wie sich der Kurs in den nächsten 2 Tagen entwickelt
vielleicht ist hinter der Verschiebung mehr, ich bin mal gespannt, wie sich der Kurs in den nächsten 2 Tagen entwickelt
 vielleicht ist hinter der Verschiebung mehr, ich bin mal gespannt, wie sich der Kurs in den nächsten 2 Tagen entwickelt
vielleicht ist hinter der Verschiebung mehr, ich bin mal gespannt, wie sich der Kurs in den nächsten 2 Tagen entwickelt
Soo könnte jetzt mal im Herbst wieder interessant werden. Der Kurs ist schon ne Weile nach oben gelaufen.
Bewertung ca. 20. Mio Dollar
Cash ca. 7 Mio Dollar
2 P3 Studien
Mit geplanten Read Out im September und im 1Q 2020
https://finance.yahoo.com/news/soligenix-incs-nasdaq-sngx-tw…
http://ir.soligenix.com/download/Soligenix+Corporate+Presena…
In der Vergangenheit ist der Kurs allerdings stetig gefallen und die Studie zu SGX 301 wurde stark verzögert.
Eine Verzögerung kann auch bei der P3 zu SGX 942 passieren, dass sollte man Bedenken.
Bewertung ca. 20. Mio Dollar
Cash ca. 7 Mio Dollar
2 P3 Studien
Mit geplanten Read Out im September und im 1Q 2020
https://finance.yahoo.com/news/soligenix-incs-nasdaq-sngx-tw…
http://ir.soligenix.com/download/Soligenix+Corporate+Presena…
In der Vergangenheit ist der Kurs allerdings stetig gefallen und die Studie zu SGX 301 wurde stark verzögert.
Eine Verzögerung kann auch bei der P3 zu SGX 942 passieren, dass sollte man Bedenken.
Soligenix: High Risk, High Reward https://seekingalpha.com/article/4283350?source=ansh $SNGX
Eine etwas kritischere Betrachtung des Unternehmens.
Eine etwas kritischere Betrachtung des Unternehmens.
Antwort auf Beitrag Nr.: 61.210.982 von Steel21x am 08.08.19 21:45:44 Ich habe hier schon seit Jahren Aktien, und bisher wirklichnur verloren. Im Moment denke ich, wird der Kurs mit geringer Stückzahl nach unten gezogen. Überlegen beim nächsten wirklichen Hoch, auszusteigen.
Die Phase 3 Daten für SGX301 in CTCL sollen jetzt in Q1 2020 kommen. Der Kurs hat auch schon einen guten Run Up hingelegt.
Zweiter Pfeil im Köcher ist 2 Halbjahr 2020 auch Phase 3 Daten Sgx942 in oral mucositis.
Beides seltene Krankheiten mit keinen guten Behandlungsmethoden.
Im Erfolgsfall der 1 P3 sollte eine Marketcap von 200 Mio USD und bei 2 erfolgreichen P3 sogar ohne Probleme mehr möglich sein.
https://finance.yahoo.com/news/soligenix-shares-power-higher…
Schauen wir mal ob die jahrelange Forschungen in einem Erfolg für Patienten und Investoren enden.
Zweiter Pfeil im Köcher ist 2 Halbjahr 2020 auch Phase 3 Daten Sgx942 in oral mucositis.
Beides seltene Krankheiten mit keinen guten Behandlungsmethoden.
Im Erfolgsfall der 1 P3 sollte eine Marketcap von 200 Mio USD und bei 2 erfolgreichen P3 sogar ohne Probleme mehr möglich sein.
https://finance.yahoo.com/news/soligenix-shares-power-higher…
Schauen wir mal ob die jahrelange Forschungen in einem Erfolg für Patienten und Investoren enden.
Antwort auf Beitrag Nr.: 62.456.739 von Steel21x am 22.01.20 20:39:40Wie schon letztes Jahr erwähnt, bin ich schon lange investiert und freue mich im Moment, dass es nach oben geht. Nach dem Split, hatten wir ja für kurze Zeit einen Kurs von ca. 9 Euro. Mal sehen, was sich heute tut.
Antwort auf Beitrag Nr.: 62.477.391 von vinod am 24.01.20 15:00:38Hi vinod ....lange nicht gelesen .....aber es wird werden ....👍👍👍
PRESSEMITTEILUNG
Soligenix-Aktie steigt im Jahresvergleich um 95% vor Veröffentlichung der Topline-Daten für SGX301; Wir streben eine Marktchance von 250 Millionen US-Dollar an, um CTCL zu behandeln
Durch
Veröffentlicht: 30. Januar 2020, 8:14 Uhr ET
TEILEN
Positive Ergebnisse, die für das erste Quartal 2020 erwartet werden, können SGX301 als erste von der FDA zugelassene Front-Line-Therapie zur Behandlung des kutanen T-Zell-Lymphoms (CTCL) positionieren.
Miami Beach, Florida, 30. Januar 2020 (Newsfile Corp. über COMTEX) - Miami Beach, Florida - (Newsfile Corp. - 30. Januar 2020) - Soligenix SNGX, -6,82% Die Aktie setzte ihren Kursanstieg mit einem Plus von über 95% seit Jahresbeginn fort *. Investoren haben die kurzfristige Veröffentlichung von Topline-Daten für den Medikamentenkandidaten SGX301 im Spätstadium im Auge, der auf die Behandlung von CTCL abzielt. Wenn die Ergebnisse mit den Erwartungen der Interimsanalyse übereinstimmen, kann das Medikament die erste zugelassene Front-Line-Therapie für die Krankheit sein und einen ungedeckten medizinischen Bedarf decken. Nach Angaben von Soligenix werden zusätzliche Daten zu den Behandlungsergebnissen am Ende des zweiten und dritten offenen Zyklus der Studie sowie zu den Sicherheitsergebnissen am Ende des sechsmonatigen Nachbeobachtungszeitraums im Internet verfügbar sein Annäherung an Viertel.(Um eine umfassende Übersicht über frühere Soligenix-Nachrichten und -Artikel zu erhalten, klicken Sie bitte HIER. )
Zwischenergebnisse deuten bereits darauf hin, dass sich das Medikament möglicherweise auf dem Weg befindet, unwirksame CTCL-Behandlungsoptionen zu verdrängen, die in erster Linie die durch die Krankheit verursachten Beschwerden der assoziierten Läsionen lindern können extrem schmerzhaft, juckend und kosmetisch unangenehm sein. Darüber hinaus positioniert sich SGX301 als Ersatz für aktuelle Medikamente, von denen bekannt ist, dass sie das Risiko erhöhen, zur Entstehung von Krebserkrankungen beizutragen, die durch die Mutation von DNA in gesunden Hautzellen verursacht werden. Diese Mutationen wurden mit einem erhöhten Risiko für Folgeerkrankungen wie Melanome in Verbindung gebracht. SGX301 weist nicht dieselben DNA-schädigenden Eigenschaften auf.
Infolge der bekannten Risiken der gegenwärtigen Behandlungsoptionen wirft die erhöhte Wahrscheinlichkeit, dass Folgekomplikationen fortbestehen, sowohl bei Patienten als auch bei Pflegepersonen häufig Bedenken auf und wirft eine ethische Entscheidung darüber auf, ob die Behandlung der Auswirkungen dieses chronischen Krebses das Risiko einer möglichen Einführung zusätzlicher Krebserkrankungen überwiegt zum Patienten. Im Gegensatz zu jeder marktüblichen CTCL-Behandlung kann SGX301 jedoch möglicherweise
nachweisen, dass es nicht nur einen therapeutischen Nutzen für die Patienten bietet, sondern dies auch, ohne das Risiko von Komplikationen bei Folgeerkrankungen zu erhöhen.
Kannst du dieses Video nicht sehen? Besuchen Sie:
https://www.youtube.com/watch?v=JEoHgdMTW1w
Verwendung der photodynamischen Therapie zur Behandlung von CTCL
Die Wissenschaft, die zum Wert von SGX301 beiträgt, ist faszinierend. Im Gegensatz zu derzeit verfügbaren Behandlungen ist SGX301 (synthetisches Hypericin) eine topische Drogensalbe, die ein Patient auf seine Läsionen aufträgt, gefolgt von der Aktivierung des Hypericins mit einer sicheren Therapie mit sichtbarem Fluoreszenzlicht. Die Technologie ist nicht neu und wird oft als photodynamische Therapie bezeichnet, was unter Dermatologen eine weit verbreitete und bekannte Behandlung ist. Es ist auch ein einfacher und direkter Prozess, um eine komplexe Krankheit zu bekämpfen.
Der erste Schritt besteht darin, dass der Patient die Salbe am Tag vor dem erwarteten Arztbesuch zu Hause auf seine Läsionen aufträgt. Durch dieses Verfahren kann das Hypericin bevorzugt von den bösartigen T-Zellen absorbiert werden. Am nächsten Tag besucht der Patient die Arztpraxis und sitzt oder steht vor einem geschützten, sicheren Fluoreszenzlichtgerät, bei dem die Läsionen durchschnittlich 5 bis 7 Minuten einer bestimmten Lichtwellenlänge ausgesetzt werden. Diese Kombination aus Salbenapplikation und Belichtung bildet eine einzige Behandlung. Der Behandlungsverlauf in der Phase-3-Studie des Unternehmens ist durch zwei dieser Behandlungen pro Woche für mindestens 6 Wochen gekennzeichnet. Insbesondere ist die Patientenretention in der Studie hoch, was ein guter Indikator für die potenzielle Wirksamkeit ist.
SGX301 als Kombinationsprodukt mit fluoreszierendem Licht kann jedoch nicht nur einfach, sondern auch sicher und kostengünstig eingesetzt werden und zeigt die Fähigkeit, freie Radikale freizusetzen, die Apoptose auslösen (programmierter Zelltod der Läsionen). Wichtig ist jedoch, dass die SGX301-Daten zeigen, dass der Tod von Krebszellen NICHT durch eine DNA-Mutation verursacht wird, was unterstreicht, dass das Hypericin kein mutagenes Agens ist. Darüber hinaus ist die mit der Behandlung verbundene Lichtquelle nicht krebserzeugend, und Kollateralschäden an gesundem Gewebe werden durch Auftragen von Salbe nur auf die Krebsläsionen selbst minimiert und die selektive Aufnahme des Arzneimittels bevorzugt durch maligne T-Zellen gefördert.
Im Vergleich zu anderen CTCL-Therapien könnte die Zwischenanalyse daher darauf hindeuten, dass das Medikament einzigartig positioniert ist, um für Pflegepersonen zur ersten Wahl zu werden, was durch die Tatsache verstärkt wird, dass die kombinierte Behandlung weder mit einem erhöhten Risiko für bösartige Erkrankungen noch mit einem erhöhten Risiko verbunden war langfristige Schädigung der Hautzellen. Letztendlich kann SGX301, wenn es für die Verwendung zugelassen ist, möglicherweise einen erheblichen Einfluss auf die Behandlung von CTCL haben und wird wahrscheinlich zu einer bevorzugten sicheren und wirksamen Behandlungsoption, wenn derzeit keine Front-Line-Therapie existiert. Darüber hinaus kann es eine Reihe von Sekundärtherapien ersetzen, die mit erheblichen Sicherheitsbedenken verbunden sind.
Mögliche Hinweise aus der Zwischenanalyse
Obwohl die Daten der Zwischenstudie für Soligenix verblindet sind, hat das Data Monitoring Committee (DMC) denjenigen, die der Studie folgen, möglicherweise Hinweise darauf gegeben, dass der therapeutische Nutzen von SGX301 günstig ist. Da die Phase-3-Studie als adaptive Studie konzipiert wurde, dh eine Zwischenanalyse zur potenziellen Risikominderung bei der Extrapolation von Daten aus der kleineren Phase-2-Studie umfasste, hat das nicht blinde DMC das Recht, die tatsächlichen Versuchsdaten zu einem bestimmten Zeitpunkt und zu überprüfen Empfehlungen aussprechen, wie z. B. Anpassungen der Stichprobengröße, um die vordefinierte statistische Leistungsfähigkeit von 90% beizubehalten.
Das Lesen zwischen den Zeilen erfolgte, nachdem das DMC die Empfehlung ausgesprochen hatte, weitere Probanden in die Studie aufzunehmen, was den Beobachtern nahe legte, dass sie bei der Behandlung einen vielversprechenden Arzneimitteleffekt sahen. Insbesondere hatte das DMC die Befugnis, die Studie aufgrund von Sinnlosigkeit zu beenden, insbesondere wenn das Medikament die statistische Schwelle von 90% bei einer Größenänderung nicht erreichen konnte. Es hat keines dieser Dinge getan. Stattdessen glauben viele, dass die Empfehlung eine verhaltene Bestätigung der Zwischenergebnisse war, andernfalls wäre es eine unnötige und möglicherweise unethische medizinische Entscheidung, neue Patienten der Behandlung auszusetzen.
Unter der Annahme, dass die DMC-Empfehlung korrekt ist, können positive Testergebnisse zu einer endgültigen FDA-Zulassung für SGX301 und einer neuen Front-Line-Arzneimitteltherapie für Patienten führen, die gegen CTCL kämpfen.
SGX301 bietet eine Marktchance von 250 Millionen US-Dollar
Wie bereits erwähnt, gibt es derzeit keine Heilung für CTCL und keine zugelassene Erstbehandlung. Da CTCL als chronischer Krebs klassifiziert ist, können Patienten während ihres gesamten Lebens zwischen verfügbaren Behandlungen wechseln, um die Krankheit zu behandeln und das Fortschreiten zu einer tödlicheren fortgeschrittenen Krankheit zu verhindern. Letztendlich und weil es keinen wirklichen Marktführer auf dem Gebiet der Behandlung gibt, ist ein systematischer Ansatz zur Behandlung der Krankheit kompliziert, insbesondere wenn die Ergebnisse der verfügbaren Medikamente keinen signifikanten Nutzen zeigen. Diese Variablen können die Voraussetzungen dafür schaffen, dass SGX301 möglicherweise diesen Bereich des nicht gedeckten medizinischen Bedarfs ausfüllt und den Patienten ein sicheres, tolerierbares und wirksames Medikament zur Verfügung stellt.
Die primäre und entscheidende Differenzierung von SGX301 auf dem Markt für CTCL-Behandlungen ist das erwartete Sicherheitsprofil. Das Medikament verwendet eine Verbindung, die nicht mutagen ist, von den malignen T-Zellen bevorzugt absorbiert wird und hochgradig lichtempfindlich ist. Von Natur aus vorteilhaft für die Behandlung ist, dass das Arzneimittel über einen kürzeren Zeitraum mit einer sicheren Lichtquelle (fluoreszierendes Licht im Vergleich zu ultraviolettem Licht) kombiniert wird, wodurch das signifikante Risiko von Hautschäden oder sekundären Krebsarten verringert wird. Das bekannte Sicherheitsprofil des Arzneimittels bedeutet, dass SGX301 für viele Patienten in verschiedenen Krankheitsstadien, einschließlich Patienten oder Pflegepersonen, die möglicherweise die gesamte Behandlung aufgrund des Risikos für sekundäre Krebserkrankungen verzögern, ein bevorzugter Ansatz für die Langzeitbehandlung sein kann.
Unter Hinweis auf die kombinierten Vorteile eines zugelassenen SGX301 haben Analysten vonUntersuchungen von Zacks Small Cap legen nahe, dass SGX301 das Potenzial und die Chance hat, ein bevorzugtes Medikament für die CTCL-Behandlung zu werden und eine weltweite Marktchance von bis zu 250 Millionen US-Dollar zu bieten. Sie scheinen auch dem Hinweis vieler teilnehmender Forscher zuzustimmen, dass das Medikament bei der Zulassung von SGX301 einen festen Platz im CTCL-Rüstzeug haben wird, wo eine sichere, gut verträgliche Therapie an vorderster Front erforderlich ist.
Auf Kurs für die Veröffentlichung der Topline-Daten für das erste Quartal 2020
Soligenix hat erneut darauf hingewiesen, dass die Topline-Daten aus der SGX301-Studie voraussichtlich in diesem Quartal veröffentlicht werden. Im Vorfeld der abgeschlossenen Studie hat das Unternehmen seine kaufmännische und geschäftliche Expertise sowohl auf Vorstandsebene als auch auf Führungsebene gestärkt, um das Unternehmen nach erfolgreichen Phase-3-Ergebnissen für ein beschleunigtes Wachstum zu positionieren.
Das Unternehmen hat auf verschiedene Optionen für die Kommerzialisierung zugelassener Arzneimittel hingewiesen, darunter potenzielle Marketing- und Entwicklungspartnerschaften. Darüber hinaus können strategische Alternativen, die dem Unternehmen zur Verfügung stehen, Fusionen, Übernahmen sowie Lizenzvereinbarungen für die gemeinsame Entwicklung und / oder Vermarktung umfassen. Angesichts des Potenzials des Arzneimittels, eine erste Wahl für Pflegepersonen zu sein, ist der Markt mit 250 Millionen US-Dollar pro Jahr ein attraktiver Anreiz für Unternehmen, sich einen langfristigen Umsatzstrom zu sichern.
Mit einem Anstieg der Aktie um mehr als 95% im Jahresvergleich vor der ersten von zwei Phase-3-Versuchsdaten liegt die Aktie nun nahe am Kursziel von 5,00 USD je Aktie, das mit den Preismodellen von Zacks Small Cap Research erzielt wurde. Darüber hinaus hängt der Anstieg wahrscheinlich nur mit dem Versprechen der SGX301-Studie zusammen. Der nächste potenzielle Katalysator des Unternehmens, der aus der Veröffentlichung der Daten seiner zweiten Phase-3-Studie zu SGX942 zur Behandlung der oralen Mukositis bei Patienten mit Kopf- und Halskrebs resultiert, muss noch mehrfach anerkannt werden. Die wichtigsten Daten aus dieser Studie werden für das
zweite Quartal 2020 erwartet. Ab Januar verfügte Soligenix über ein Bargeldvolumen von rund 7 Millionen US-Dollar und verfügt mit den vorhandenen Vermögenswerten über das Potenzial, genügend Kapital bereitzustellen, um beide Phase-3-Studien abzuschließen.
Angesichts der Performance des YTD-Aktienkurses sind die Anleger zweifelsohne vor der kurzfristigen Veröffentlichung der SGX301-Daten begeistert. Durch die Kombination der Marktchance, des aus der DMC-Empfehlung abgeleiteten Werts und der Kapitalposition des Unternehmens ist Soligenix möglicherweise in der Tat in der besten Position in seiner bisherigen Geschichte. Und aus der Sicht der Patienten kann die Wissenschaft hinter zwei vielversprechenden Wirkstoffen von Soligenix letztendlich Linderung bei Krankheiten bringen, für die keine wirksame Behandlung verfügbar ist.
Wie sie sagen ... das kann ein Gewinn-Gewinn-Vorschlag sein.
* YTD-Daten zur Aufwertung des Aktienkurses zwischen dem 02.01.2020 und dem 28.01.2020
Kontaktinformationen
Ken Ellis
Soulstring Media Group ken@soulstringmedia.com
Disclaimers:Soulstring Media Group and its parent company is not operated by a licensed broker, a dealer, or a registered investment adviser. It should be expressly understood that under no circumstances does any information posted on Soulstring Media Group, or its affiliated website, Soulstringreport.com, represent a recommendation to buy or sell a security. The information on available on Soulstring Media Group, and in its related newsletters, videos, and correspondence, is not intended to be, nor does it constitute, investment advice or recommendations. The contributors may buy and sell securities before and after any particular article and report and information herein is published, with respect to the securities discussed in any article and report posted herein. In no event shall Soulstring Media Group be liable to any member, guest or third party for any damages of any kind arising out of the use of any content or other material published or available on Soulstring Media Group, or relating to the use of, or inability to use, Soulstring Media Group or any content, including, without limitation, any investment losses, lost profits, lost opportunity, special, incidental, indirect, consequential or punitive damages. Past performance is a poor indicator of future performance. The information on this site, and in its related newsletters and videos, is not intended to be, nor does it constitute, investment advice or recommendations. The information on this site is in no way guaranteed for completeness, accuracy or in any other way be determined as a reliable determining factor for investment choices. Some contributors listed in this website are not affiliated with Soulstring Media Group. Stock quotes, crypto currency quotes and index information is provided by Trading View, TC 2000, and CoinDesk. Soulstring Media Group cannot provide assurance as to the validity or timeliness of quotes provided by secondary sources and directs users of posted information to conduct thorough research before acting on information that may be timely in nature. Soulstring Report produces regular sponsored and non-sponsored reports, articles, stock market blogs, videos and popular investment newsletters covering small and micro-cap equity markets. Soulstring Media Group has two distinct and independent departments. One department produces non-sponsored content generally in the form of press releases, articles and reports covering equities listed on NYSE, NASDAQ and OTC exchanges. The other produces sponsored content (in most cases not reviewed by a registered analyst), which typically consists of compensated investment newsletters, articles, videos and reports covering listed stocks and micro-caps. Soulstring Media Group and its parent company receive monthly compensation by PCG Advisory for the preparation and release of video content, general research work, coverage of company news, and for editorial preparation and review for its clients. Soulstring Media Group has no direct financial relationship and has received no compensation from Soligenix, Inc. for any produced content. The non-sponsored written content contained herein has been prepared by a writer (the "Author") and is fact checked and reviewed by a third-party company (the "Reviewer"). The reviewer, proofreader or final editorial approval may not be offered through a chartered CPA or Certified Financial Adviser. In some cases, the Reviewer has reviewed and revised the content, as necessary, based on publicly available information which is believed to be reliable. Content is researched, written, and reviewed on a reasonable effort basis. The Reviewer has not performed any independent investigations or forensic audits to validate the information herein. The Reviewer has only independently reviewed the information provided by the Author per the procedures outlined by Soulstring Media Group. Soulstring Media Group is not entitled to veto or interfere in the application of such procedures by the third-party research service company to the articles, documents, or reports. Unless otherwise noted, any content outside of this document has no association with the Author or the Reviewer in any way. Video presentations may contain forward-looking statements that involve a number of risks and uncertainties associated with the business featured. Investors are advised to always read the featured company's most recently filed for 10-K or 10-Q for information. We undertake no obligation to revise any of these statements to reflect future circumstance or the occurrence of unanticipated events. Stock ownership disclosure: Author is LONG Soligenix stock.
To view the source version of this press release, please visit https://www.newsfilecorp.com/release/51933
copyright (c) newsfile corp. 2020. all rights reserved
Soligenix-Aktie steigt im Jahresvergleich um 95% vor Veröffentlichung der Topline-Daten für SGX301; Wir streben eine Marktchance von 250 Millionen US-Dollar an, um CTCL zu behandeln
Durch
Veröffentlicht: 30. Januar 2020, 8:14 Uhr ET
TEILEN
Positive Ergebnisse, die für das erste Quartal 2020 erwartet werden, können SGX301 als erste von der FDA zugelassene Front-Line-Therapie zur Behandlung des kutanen T-Zell-Lymphoms (CTCL) positionieren.
Miami Beach, Florida, 30. Januar 2020 (Newsfile Corp. über COMTEX) - Miami Beach, Florida - (Newsfile Corp. - 30. Januar 2020) - Soligenix SNGX, -6,82% Die Aktie setzte ihren Kursanstieg mit einem Plus von über 95% seit Jahresbeginn fort *. Investoren haben die kurzfristige Veröffentlichung von Topline-Daten für den Medikamentenkandidaten SGX301 im Spätstadium im Auge, der auf die Behandlung von CTCL abzielt. Wenn die Ergebnisse mit den Erwartungen der Interimsanalyse übereinstimmen, kann das Medikament die erste zugelassene Front-Line-Therapie für die Krankheit sein und einen ungedeckten medizinischen Bedarf decken. Nach Angaben von Soligenix werden zusätzliche Daten zu den Behandlungsergebnissen am Ende des zweiten und dritten offenen Zyklus der Studie sowie zu den Sicherheitsergebnissen am Ende des sechsmonatigen Nachbeobachtungszeitraums im Internet verfügbar sein Annäherung an Viertel.(Um eine umfassende Übersicht über frühere Soligenix-Nachrichten und -Artikel zu erhalten, klicken Sie bitte HIER. )
Zwischenergebnisse deuten bereits darauf hin, dass sich das Medikament möglicherweise auf dem Weg befindet, unwirksame CTCL-Behandlungsoptionen zu verdrängen, die in erster Linie die durch die Krankheit verursachten Beschwerden der assoziierten Läsionen lindern können extrem schmerzhaft, juckend und kosmetisch unangenehm sein. Darüber hinaus positioniert sich SGX301 als Ersatz für aktuelle Medikamente, von denen bekannt ist, dass sie das Risiko erhöhen, zur Entstehung von Krebserkrankungen beizutragen, die durch die Mutation von DNA in gesunden Hautzellen verursacht werden. Diese Mutationen wurden mit einem erhöhten Risiko für Folgeerkrankungen wie Melanome in Verbindung gebracht. SGX301 weist nicht dieselben DNA-schädigenden Eigenschaften auf.
Infolge der bekannten Risiken der gegenwärtigen Behandlungsoptionen wirft die erhöhte Wahrscheinlichkeit, dass Folgekomplikationen fortbestehen, sowohl bei Patienten als auch bei Pflegepersonen häufig Bedenken auf und wirft eine ethische Entscheidung darüber auf, ob die Behandlung der Auswirkungen dieses chronischen Krebses das Risiko einer möglichen Einführung zusätzlicher Krebserkrankungen überwiegt zum Patienten. Im Gegensatz zu jeder marktüblichen CTCL-Behandlung kann SGX301 jedoch möglicherweise
nachweisen, dass es nicht nur einen therapeutischen Nutzen für die Patienten bietet, sondern dies auch, ohne das Risiko von Komplikationen bei Folgeerkrankungen zu erhöhen.
Kannst du dieses Video nicht sehen? Besuchen Sie:
https://www.youtube.com/watch?v=JEoHgdMTW1w
Verwendung der photodynamischen Therapie zur Behandlung von CTCL
Die Wissenschaft, die zum Wert von SGX301 beiträgt, ist faszinierend. Im Gegensatz zu derzeit verfügbaren Behandlungen ist SGX301 (synthetisches Hypericin) eine topische Drogensalbe, die ein Patient auf seine Läsionen aufträgt, gefolgt von der Aktivierung des Hypericins mit einer sicheren Therapie mit sichtbarem Fluoreszenzlicht. Die Technologie ist nicht neu und wird oft als photodynamische Therapie bezeichnet, was unter Dermatologen eine weit verbreitete und bekannte Behandlung ist. Es ist auch ein einfacher und direkter Prozess, um eine komplexe Krankheit zu bekämpfen.
Der erste Schritt besteht darin, dass der Patient die Salbe am Tag vor dem erwarteten Arztbesuch zu Hause auf seine Läsionen aufträgt. Durch dieses Verfahren kann das Hypericin bevorzugt von den bösartigen T-Zellen absorbiert werden. Am nächsten Tag besucht der Patient die Arztpraxis und sitzt oder steht vor einem geschützten, sicheren Fluoreszenzlichtgerät, bei dem die Läsionen durchschnittlich 5 bis 7 Minuten einer bestimmten Lichtwellenlänge ausgesetzt werden. Diese Kombination aus Salbenapplikation und Belichtung bildet eine einzige Behandlung. Der Behandlungsverlauf in der Phase-3-Studie des Unternehmens ist durch zwei dieser Behandlungen pro Woche für mindestens 6 Wochen gekennzeichnet. Insbesondere ist die Patientenretention in der Studie hoch, was ein guter Indikator für die potenzielle Wirksamkeit ist.
SGX301 als Kombinationsprodukt mit fluoreszierendem Licht kann jedoch nicht nur einfach, sondern auch sicher und kostengünstig eingesetzt werden und zeigt die Fähigkeit, freie Radikale freizusetzen, die Apoptose auslösen (programmierter Zelltod der Läsionen). Wichtig ist jedoch, dass die SGX301-Daten zeigen, dass der Tod von Krebszellen NICHT durch eine DNA-Mutation verursacht wird, was unterstreicht, dass das Hypericin kein mutagenes Agens ist. Darüber hinaus ist die mit der Behandlung verbundene Lichtquelle nicht krebserzeugend, und Kollateralschäden an gesundem Gewebe werden durch Auftragen von Salbe nur auf die Krebsläsionen selbst minimiert und die selektive Aufnahme des Arzneimittels bevorzugt durch maligne T-Zellen gefördert.
Im Vergleich zu anderen CTCL-Therapien könnte die Zwischenanalyse daher darauf hindeuten, dass das Medikament einzigartig positioniert ist, um für Pflegepersonen zur ersten Wahl zu werden, was durch die Tatsache verstärkt wird, dass die kombinierte Behandlung weder mit einem erhöhten Risiko für bösartige Erkrankungen noch mit einem erhöhten Risiko verbunden war langfristige Schädigung der Hautzellen. Letztendlich kann SGX301, wenn es für die Verwendung zugelassen ist, möglicherweise einen erheblichen Einfluss auf die Behandlung von CTCL haben und wird wahrscheinlich zu einer bevorzugten sicheren und wirksamen Behandlungsoption, wenn derzeit keine Front-Line-Therapie existiert. Darüber hinaus kann es eine Reihe von Sekundärtherapien ersetzen, die mit erheblichen Sicherheitsbedenken verbunden sind.
Mögliche Hinweise aus der Zwischenanalyse
Obwohl die Daten der Zwischenstudie für Soligenix verblindet sind, hat das Data Monitoring Committee (DMC) denjenigen, die der Studie folgen, möglicherweise Hinweise darauf gegeben, dass der therapeutische Nutzen von SGX301 günstig ist. Da die Phase-3-Studie als adaptive Studie konzipiert wurde, dh eine Zwischenanalyse zur potenziellen Risikominderung bei der Extrapolation von Daten aus der kleineren Phase-2-Studie umfasste, hat das nicht blinde DMC das Recht, die tatsächlichen Versuchsdaten zu einem bestimmten Zeitpunkt und zu überprüfen Empfehlungen aussprechen, wie z. B. Anpassungen der Stichprobengröße, um die vordefinierte statistische Leistungsfähigkeit von 90% beizubehalten.
Das Lesen zwischen den Zeilen erfolgte, nachdem das DMC die Empfehlung ausgesprochen hatte, weitere Probanden in die Studie aufzunehmen, was den Beobachtern nahe legte, dass sie bei der Behandlung einen vielversprechenden Arzneimitteleffekt sahen. Insbesondere hatte das DMC die Befugnis, die Studie aufgrund von Sinnlosigkeit zu beenden, insbesondere wenn das Medikament die statistische Schwelle von 90% bei einer Größenänderung nicht erreichen konnte. Es hat keines dieser Dinge getan. Stattdessen glauben viele, dass die Empfehlung eine verhaltene Bestätigung der Zwischenergebnisse war, andernfalls wäre es eine unnötige und möglicherweise unethische medizinische Entscheidung, neue Patienten der Behandlung auszusetzen.
Unter der Annahme, dass die DMC-Empfehlung korrekt ist, können positive Testergebnisse zu einer endgültigen FDA-Zulassung für SGX301 und einer neuen Front-Line-Arzneimitteltherapie für Patienten führen, die gegen CTCL kämpfen.
SGX301 bietet eine Marktchance von 250 Millionen US-Dollar
Wie bereits erwähnt, gibt es derzeit keine Heilung für CTCL und keine zugelassene Erstbehandlung. Da CTCL als chronischer Krebs klassifiziert ist, können Patienten während ihres gesamten Lebens zwischen verfügbaren Behandlungen wechseln, um die Krankheit zu behandeln und das Fortschreiten zu einer tödlicheren fortgeschrittenen Krankheit zu verhindern. Letztendlich und weil es keinen wirklichen Marktführer auf dem Gebiet der Behandlung gibt, ist ein systematischer Ansatz zur Behandlung der Krankheit kompliziert, insbesondere wenn die Ergebnisse der verfügbaren Medikamente keinen signifikanten Nutzen zeigen. Diese Variablen können die Voraussetzungen dafür schaffen, dass SGX301 möglicherweise diesen Bereich des nicht gedeckten medizinischen Bedarfs ausfüllt und den Patienten ein sicheres, tolerierbares und wirksames Medikament zur Verfügung stellt.
Die primäre und entscheidende Differenzierung von SGX301 auf dem Markt für CTCL-Behandlungen ist das erwartete Sicherheitsprofil. Das Medikament verwendet eine Verbindung, die nicht mutagen ist, von den malignen T-Zellen bevorzugt absorbiert wird und hochgradig lichtempfindlich ist. Von Natur aus vorteilhaft für die Behandlung ist, dass das Arzneimittel über einen kürzeren Zeitraum mit einer sicheren Lichtquelle (fluoreszierendes Licht im Vergleich zu ultraviolettem Licht) kombiniert wird, wodurch das signifikante Risiko von Hautschäden oder sekundären Krebsarten verringert wird. Das bekannte Sicherheitsprofil des Arzneimittels bedeutet, dass SGX301 für viele Patienten in verschiedenen Krankheitsstadien, einschließlich Patienten oder Pflegepersonen, die möglicherweise die gesamte Behandlung aufgrund des Risikos für sekundäre Krebserkrankungen verzögern, ein bevorzugter Ansatz für die Langzeitbehandlung sein kann.
Unter Hinweis auf die kombinierten Vorteile eines zugelassenen SGX301 haben Analysten vonUntersuchungen von Zacks Small Cap legen nahe, dass SGX301 das Potenzial und die Chance hat, ein bevorzugtes Medikament für die CTCL-Behandlung zu werden und eine weltweite Marktchance von bis zu 250 Millionen US-Dollar zu bieten. Sie scheinen auch dem Hinweis vieler teilnehmender Forscher zuzustimmen, dass das Medikament bei der Zulassung von SGX301 einen festen Platz im CTCL-Rüstzeug haben wird, wo eine sichere, gut verträgliche Therapie an vorderster Front erforderlich ist.
Auf Kurs für die Veröffentlichung der Topline-Daten für das erste Quartal 2020
Soligenix hat erneut darauf hingewiesen, dass die Topline-Daten aus der SGX301-Studie voraussichtlich in diesem Quartal veröffentlicht werden. Im Vorfeld der abgeschlossenen Studie hat das Unternehmen seine kaufmännische und geschäftliche Expertise sowohl auf Vorstandsebene als auch auf Führungsebene gestärkt, um das Unternehmen nach erfolgreichen Phase-3-Ergebnissen für ein beschleunigtes Wachstum zu positionieren.
Das Unternehmen hat auf verschiedene Optionen für die Kommerzialisierung zugelassener Arzneimittel hingewiesen, darunter potenzielle Marketing- und Entwicklungspartnerschaften. Darüber hinaus können strategische Alternativen, die dem Unternehmen zur Verfügung stehen, Fusionen, Übernahmen sowie Lizenzvereinbarungen für die gemeinsame Entwicklung und / oder Vermarktung umfassen. Angesichts des Potenzials des Arzneimittels, eine erste Wahl für Pflegepersonen zu sein, ist der Markt mit 250 Millionen US-Dollar pro Jahr ein attraktiver Anreiz für Unternehmen, sich einen langfristigen Umsatzstrom zu sichern.
Mit einem Anstieg der Aktie um mehr als 95% im Jahresvergleich vor der ersten von zwei Phase-3-Versuchsdaten liegt die Aktie nun nahe am Kursziel von 5,00 USD je Aktie, das mit den Preismodellen von Zacks Small Cap Research erzielt wurde. Darüber hinaus hängt der Anstieg wahrscheinlich nur mit dem Versprechen der SGX301-Studie zusammen. Der nächste potenzielle Katalysator des Unternehmens, der aus der Veröffentlichung der Daten seiner zweiten Phase-3-Studie zu SGX942 zur Behandlung der oralen Mukositis bei Patienten mit Kopf- und Halskrebs resultiert, muss noch mehrfach anerkannt werden. Die wichtigsten Daten aus dieser Studie werden für das
zweite Quartal 2020 erwartet. Ab Januar verfügte Soligenix über ein Bargeldvolumen von rund 7 Millionen US-Dollar und verfügt mit den vorhandenen Vermögenswerten über das Potenzial, genügend Kapital bereitzustellen, um beide Phase-3-Studien abzuschließen.
Angesichts der Performance des YTD-Aktienkurses sind die Anleger zweifelsohne vor der kurzfristigen Veröffentlichung der SGX301-Daten begeistert. Durch die Kombination der Marktchance, des aus der DMC-Empfehlung abgeleiteten Werts und der Kapitalposition des Unternehmens ist Soligenix möglicherweise in der Tat in der besten Position in seiner bisherigen Geschichte. Und aus der Sicht der Patienten kann die Wissenschaft hinter zwei vielversprechenden Wirkstoffen von Soligenix letztendlich Linderung bei Krankheiten bringen, für die keine wirksame Behandlung verfügbar ist.
Wie sie sagen ... das kann ein Gewinn-Gewinn-Vorschlag sein.
* YTD-Daten zur Aufwertung des Aktienkurses zwischen dem 02.01.2020 und dem 28.01.2020
Kontaktinformationen
Ken Ellis
Soulstring Media Group ken@soulstringmedia.com
Disclaimers:Soulstring Media Group and its parent company is not operated by a licensed broker, a dealer, or a registered investment adviser. It should be expressly understood that under no circumstances does any information posted on Soulstring Media Group, or its affiliated website, Soulstringreport.com, represent a recommendation to buy or sell a security. The information on available on Soulstring Media Group, and in its related newsletters, videos, and correspondence, is not intended to be, nor does it constitute, investment advice or recommendations. The contributors may buy and sell securities before and after any particular article and report and information herein is published, with respect to the securities discussed in any article and report posted herein. In no event shall Soulstring Media Group be liable to any member, guest or third party for any damages of any kind arising out of the use of any content or other material published or available on Soulstring Media Group, or relating to the use of, or inability to use, Soulstring Media Group or any content, including, without limitation, any investment losses, lost profits, lost opportunity, special, incidental, indirect, consequential or punitive damages. Past performance is a poor indicator of future performance. The information on this site, and in its related newsletters and videos, is not intended to be, nor does it constitute, investment advice or recommendations. The information on this site is in no way guaranteed for completeness, accuracy or in any other way be determined as a reliable determining factor for investment choices. Some contributors listed in this website are not affiliated with Soulstring Media Group. Stock quotes, crypto currency quotes and index information is provided by Trading View, TC 2000, and CoinDesk. Soulstring Media Group cannot provide assurance as to the validity or timeliness of quotes provided by secondary sources and directs users of posted information to conduct thorough research before acting on information that may be timely in nature. Soulstring Report produces regular sponsored and non-sponsored reports, articles, stock market blogs, videos and popular investment newsletters covering small and micro-cap equity markets. Soulstring Media Group has two distinct and independent departments. One department produces non-sponsored content generally in the form of press releases, articles and reports covering equities listed on NYSE, NASDAQ and OTC exchanges. The other produces sponsored content (in most cases not reviewed by a registered analyst), which typically consists of compensated investment newsletters, articles, videos and reports covering listed stocks and micro-caps. Soulstring Media Group and its parent company receive monthly compensation by PCG Advisory for the preparation and release of video content, general research work, coverage of company news, and for editorial preparation and review for its clients. Soulstring Media Group has no direct financial relationship and has received no compensation from Soligenix, Inc. for any produced content. The non-sponsored written content contained herein has been prepared by a writer (the "Author") and is fact checked and reviewed by a third-party company (the "Reviewer"). The reviewer, proofreader or final editorial approval may not be offered through a chartered CPA or Certified Financial Adviser. In some cases, the Reviewer has reviewed and revised the content, as necessary, based on publicly available information which is believed to be reliable. Content is researched, written, and reviewed on a reasonable effort basis. The Reviewer has not performed any independent investigations or forensic audits to validate the information herein. The Reviewer has only independently reviewed the information provided by the Author per the procedures outlined by Soulstring Media Group. Soulstring Media Group is not entitled to veto or interfere in the application of such procedures by the third-party research service company to the articles, documents, or reports. Unless otherwise noted, any content outside of this document has no association with the Author or the Reviewer in any way. Video presentations may contain forward-looking statements that involve a number of risks and uncertainties associated with the business featured. Investors are advised to always read the featured company's most recently filed for 10-K or 10-Q for information. We undertake no obligation to revise any of these statements to reflect future circumstance or the occurrence of unanticipated events. Stock ownership disclosure: Author is LONG Soligenix stock.
To view the source version of this press release, please visit https://www.newsfilecorp.com/release/51933
copyright (c) newsfile corp. 2020. all rights reserved
Antwort auf Beitrag Nr.: 62.539.508 von silvesterstrike am 31.01.20 07:08:04
vielen Dank für den Text. Moment hält sich Soligenix bei dem schlechten Umfeld wegen des Virus ganz gut.
Mal sehen was die nächste Woche bringt, lanistig sehe ich sehr gute Chancen
Gute Nachrichten
Hallo strikevielen Dank für den Text. Moment hält sich Soligenix bei dem schlechten Umfeld wegen des Virus ganz gut.
Mal sehen was die nächste Woche bringt, lanistig sehe ich sehr gute Chancen
Antwort auf Beitrag Nr.: 62.545.949 von vinod am 31.01.20 16:47:18Die Chancen waren hier schon immer sehr hoch ......es kommt halt jetzt auf die Phase 3 Ergebnisse an ...und es sieht derzeit besser aus ....als in den Jahren davor ....Es wurden ja noch Probanden der Studie zugeführt ....und das ist schon ein deutliches Zeichen für das Medikament ....
MARKETWATCH DURCHSUCHEN
Laut Powell der Fed bleiben die Risiken für die US-Wirtschaft bestehen, insbesondere durch das Coronavirus
Sprint-T-Mobile-Deal vom Bundesrichter genehmigt; beide aktien legen im vormarkt zu
TEILEN
Zuhause
PRESSEMITTEILUNG
Soligenix kündigt Präsentation der SGX301-Patientenfallstudie auf dem 4. Weltkongress für kutane Lymphome an
Durch
Veröffentlicht: 11. Februar 2020, 7:00 Uhr MEZ
TEILEN
Klinisch bedeutsames Ansprechen bei schwer zu behandelnder CTCL
PRINCETON, NJ, 11. Februar 2020 / PRNewswire / - Soligenix, Inc. SNGX, -2,91% (Soligenix oder das Unternehmen), ein biopharmazeutisches Unternehmen im Spätstadium, das sich auf die Entwicklung und Vermarktung von Produkten zur Behandlung seltener Krankheiten konzentriert, bei denen ein medizinischer Bedarf nicht gedeckt werden kann, gab heute bekannt, dass Dr. (Fluorescent Light Activated Synthetic Hypericin) -Studie zur Bewertung von SGX301 bei der Behandlung von kutanen T-Zell-Lymphomen im Frühstadium (CTCL) wird eine Patienten-Fallstudie aus der Studie präsentieren. Die Präsentation wird auf dem bevorstehenden 4. Weltkongress für kutane Lymphome vom 12. bis 14. Februar in Barcelona, Spanien, gehalten.
Mündliche Präsentation:
Response in a patient with refractory folliculotropic mycosis fungoides to a topical hypericin ointment activated with fluorescent light presented by Brian Poligone, MD, PhD, an Investigator in the FLASH study and Director of the Rochester Skin Lymphoma Medical Group, Fairport, NY, USA, on February 13th, 2020 at 8:00 AM CET. Abstract will be available on corporate website following the conference.
Folliculotropic mycosis fungoides (FMF) is a type of CTCL that is very difficult to treat. FMF is generally considered more severe and aggressive than other types of CTCL due to its greater risk of disease progression and worse prognosis. Treatment usually includes early consideration of systemic therapies, as topical therapies are often not beneficial. The presented case study focuses on a single patient with FMF who has completed the Phase 3 FLASH trial, including the open-label cycles and 6-month follow-up. The patient had previously failed at least five therapies, including topical treatments, oral medications and phototherapy. While in the study, the patient received at least 12 weeks of SGX301 treatment and experienced significant improvement, eventually leading to complete clearance of disease that has been sustained for at least 4 years.
"I'm happy to be presenting this important case study at the world congress," stated Dr. Brian Poligone, Director of the Rochester Skin Lymphoma Group. "This patient community needs safe, skin directed therapies to treat this difficult lymphoma and I'm very excited that SGX301 may be one such therapy. I know I can speak for the other clinical study sites participating in the FLASH study, when I say, we are eager for the topline results this quarter."
About the 4th World Congress of Cutaneous Lymphomas
The 4th World Congress is designed to promote the exchange of scientific ideas and foster interactions between physicians, researchers and anyone engaged in the field of cutaneous lymphomas. The program will include discussions of basic, translational and clinical research and discuss new developments in the diagnosis, practice and management of cutaneous lymphomas. More information about the Congress is found here and the final programme is available here.
About SGX301
SGX301 is a novel first-in-class photodynamic therapy utilizing safe visible light for activation. The active ingredient in SGX301 is synthetic hypericin, a potent photosensitizer that is topically applied to skin lesions, is taken up by the malignant T-cells, and then activated by fluorescent light 16 to 24 hours later. This treatment approach avoids the risk of secondary malignancies (including melanoma) inherent with the frequently employed DNA-damaging chemotherapeutic drugs and other photodynamic therapies that are dependent on ultraviolet exposure. Combined with photoactivation, hypericin has demonstrated significant anti-proliferative effects on activated normal human lymphoid cells and inhibited growth of malignant T-cells isolated from CTCL patients. In a published Phase 2 clinical study in CTCL, patients experienced a statistically significant (p ≤ 0.04) improvement with topical hypericin treatment whereas the placebo was ineffective: 58.3% compared to 8.3%, respectively.
The Phase 3 FLASH trial enrolled 169 patients with Stage IA, IB or IIA CTCL. Enrollment of the trial is completed and topline primary endpoint results are expected to be available in Q1 2020. The trial consists of three treatment cycles, each of 8 weeks duration. Treatments are administered twice weekly for the first 6 weeks and treatment response is determined at the end of Week 8. In the first treatment cycle, approximately 107 subjects receive SGX301 treatment (0.25% synthetic hypericin) and 53 receive placebo treatment of their index lesions. In the second cycle, all subjects receive SGX301 treatment of their index lesions and in the third (optional) cycle all subjects receive SGX301 treatment of all their lesions. Subjects are followed for an additional 6 months after the completion of treatment. The majority of patients enrolled have elected to continue with the optional, open-label component of the study.
The Phase 3 CTCL clinical study was partially funded with this NCI Phase II SBIR grant (#1R44CA210848-01A1) awarded to Soligenix, Inc.
SGX301 has received orphan drug and fast track designations from the US Food and Drug Administration (FDA), as well as orphan designation from the European Medicines Agency (EMA).
About Cutaneous T-Cell Lymphoma (CTCL)
CTCL is a class of non-Hodgkin's lymphoma (NHL), a type of cancer of the white blood cells that are an integral part of the immune system. Unlike most NHLs which generally involve B-cell lymphocytes (involved in producing antibodies), CTCL is caused by an expansion of malignant T-cell lymphocytes (involved in cell-mediated immunity) normally programmed to migrate to the skin. These malignant cells migrate to the skin where they form various lesions, typically beginning as a rash and eventually forming raised plaques and tumors as the disease progresses. Mortality is related to the stage of CTCL, with median survival generally ranging from about 12 years in the early stages to only 2.5 years when the disease has advanced. There is currently no cure for CTCL. Typically, CTCL lesions are treated and regress but usually return either in the same part of the body or in new areas.
CTCL constitutes a rare group of NHLs, occurring in about 4% of the approximate 700,000 individuals living with the disease. It is estimated, based upon review of historic published studies and reports and an interpolation of data on the incidence of CTCL that it affects over 25,000 individuals in the US, with approximately 3,000 new cases seen annually.
About Soligenix, Inc.
Soligenix is a late-stage biopharmaceutical company focused on developing and commercializing products to treat rare diseases where there is an unmet medical need. Our Specialized BioTherapeutics business segment is developing SGX301 as a novel photodynamic therapy utilizing safe visible light for the treatment of cutaneous T-cell lymphoma, our first-in-class innate defense regulator (IDR) technology, dusquetide (SGX942) for the treatment of oral mucositis in head and neck cancer, and proprietary formulations of oral beclomethasone 17,21-dipropionate (BDP) for the prevention/treatment of gastrointestinal (GI) disorders characterized by severe inflammation including pediatric Crohn's disease (SGX203) and acute radiation enteritis (SGX201).
Our Public Health Solutions business segment includes active development programs for RiVax [®] , our ricin toxin vaccine candidate, OrbeShield [®] , our GI acute radiation syndrome therapeutic candidate and SGX943, our therapeutic candidate for antibiotic resistant and emerging infectious disease. The development of our vaccine programs incorporates the use of our proprietary heat stabilization platform technology, known as ThermoVax [®] . To date, this business segment has been supported with government grant and contract funding from the National Institute of Allergy and Infectious Diseases (NIAID), the Defense Threat Reduction Agents (DTRA) and the Biomedical Advanced Research and Development Authority (BARDA).
For further information regarding Soligenix, Inc., please visit the Company's website at www.soligenix.com.
This press release may contain forward-looking statements that reflect Soligenix, Inc.'s current expectations about its future results, performance, prospects and opportunities, including but not limited to, potential market sizes, patient populations and clinical trial enrollment. Statements that are not historical facts, such as "anticipates," "estimates," "believes," "hopes," "intends," "plans," "expects," "goal," "may," "suggest," "will," "potential," or similar expressions, are forward-looking statements. These statements are subject to a number of risks, uncertainties and other factors that could cause actual events or results in future periods to differ materially from what is expressed in, or implied by, these statements. Soligenix cannot assure you that it will be able to successfully develop, achieve regulatory approval for or commercialize products based on its technologies, particularly in light of the significant uncertainty inherent in developing therapeutics and vaccines against bioterror threats, conducting preclinical and clinical trials of therapeutics and vaccines, obtaining regulatory approvals and manufacturing therapeutics and vaccines, that product development and commercialization efforts will not be reduced or discontinued due to difficulties or delays in clinical trials or due to lack of progress or positive results from research and development efforts, that it will be able to successfully obtain any further funding to support product development and commercialization efforts, including grants and awards, maintain its existing grants which are subject to performance requirements, enter into any biodefense procurement contracts with the US Government or other countries, that it will be able to compete with larger and better financed competitors in the biotechnology industry, that changes in health care practice, third party reimbursement limitations and Federal and/or state health care reform initiatives will not negatively affect its business, or that the US Congress may not pass any legislation that would provide additional funding for the Project BioShield program. In addition, there can be no assurance as to timing or success of the Phase 3 clinical trial of SGX942 (dusquetide) as a treatment for oral mucositis in patients with head and neck cancer receiving chemoradiation therapy (including the outcome of the interim analysis) or the Phase 3 clinical trial of SGX301 (synthetic hypericin) for the treatment of cutaneous T-cell lymphoma. Further, there can be no assurance that RiVax [®] will qualify for a biodefense Priority Review Voucher (PRV) or that the prior sales of PRVs will be indicative of any potential sales price for a PRV for RiVax [®] . These and other risk factors are described from time to time in filings with the Securities and Exchange Commission, including, but not limited to, Soligenix's reports on Forms 10-Q and 10-K. Unless required by law, Soligenix assumes no obligation to update or revise any forward-looking statements as a result of new information or future events.
View original content:http://www.prnewswire.com/news-releases/soligenix-announces-…
SOURCE Soligenix, Inc.
Copyright (C) 2020 PR Newswire. All rights reserved
FROM MARKETWATCH
Goldman Sachs says impact of coronavirus will be ‘limited,’ and these are the stocks to buy if it’s right
Prank shows how some Russians really feel about Putin — now people want to see the same prank but with Trump
Two years after the Tax Cuts and Jobs Act — who are the winners and the losers?
MARKETWATCHPARTNER CENTER
RECOMMENDED

INSIDE-SCOOP
New Jersey’s Pension Sold Apple, AT&T, and Microsoft Stock. Here’s What It’s Buying.


ENTERTAINMENT
Billie Eilish is a meme queen for her disgusted Oscars 2020 reactions


NEWS
Trump pays tribute to 2 soldiers killed in Afghanistan


STOCKS-TO-WATCH
European Stocks Register Broad Gains Ahead of Powell Testimony

BACK TO TOP
Copyright © 2020 MarketWatch, Inc. All rights reserved.
Durch die Nutzung dieser Website erklären Sie sich mit den
Nutzungsbedingungen , der Datenschutzerklärung vom 23.01.20 und der Cookie-Mitteilung vom 23.01.20 EINVERSTANDEN .
Meine persönlichen Daten nicht verkaufen .
Facebook
Twitter
Linkedin
 
Intraday-Daten werden von FACTSET bereitgestellt und unterliegen den Nutzungsbedingungen . Historische und aktuelle Tagesenddaten von FACTSET . Alle Zitate sind in Ortszeit. Die Echtzeitdaten der letzten Verkäufe für US-Börsenkurse spiegeln nur Trades wider, die über Nasdaq gemeldet wurden. Intraday-Daten verzögern sich um mindestens 15 Minuten oder je nach Austauschanforderungen.
Laut Powell der Fed bleiben die Risiken für die US-Wirtschaft bestehen, insbesondere durch das Coronavirus
Sprint-T-Mobile-Deal vom Bundesrichter genehmigt; beide aktien legen im vormarkt zu
TEILEN
Zuhause
PRESSEMITTEILUNG
Soligenix kündigt Präsentation der SGX301-Patientenfallstudie auf dem 4. Weltkongress für kutane Lymphome an
Durch
Veröffentlicht: 11. Februar 2020, 7:00 Uhr MEZ
TEILEN
Klinisch bedeutsames Ansprechen bei schwer zu behandelnder CTCL
PRINCETON, NJ, 11. Februar 2020 / PRNewswire / - Soligenix, Inc. SNGX, -2,91% (Soligenix oder das Unternehmen), ein biopharmazeutisches Unternehmen im Spätstadium, das sich auf die Entwicklung und Vermarktung von Produkten zur Behandlung seltener Krankheiten konzentriert, bei denen ein medizinischer Bedarf nicht gedeckt werden kann, gab heute bekannt, dass Dr. (Fluorescent Light Activated Synthetic Hypericin) -Studie zur Bewertung von SGX301 bei der Behandlung von kutanen T-Zell-Lymphomen im Frühstadium (CTCL) wird eine Patienten-Fallstudie aus der Studie präsentieren. Die Präsentation wird auf dem bevorstehenden 4. Weltkongress für kutane Lymphome vom 12. bis 14. Februar in Barcelona, Spanien, gehalten.
Mündliche Präsentation:
Response in a patient with refractory folliculotropic mycosis fungoides to a topical hypericin ointment activated with fluorescent light presented by Brian Poligone, MD, PhD, an Investigator in the FLASH study and Director of the Rochester Skin Lymphoma Medical Group, Fairport, NY, USA, on February 13th, 2020 at 8:00 AM CET. Abstract will be available on corporate website following the conference.
Folliculotropic mycosis fungoides (FMF) is a type of CTCL that is very difficult to treat. FMF is generally considered more severe and aggressive than other types of CTCL due to its greater risk of disease progression and worse prognosis. Treatment usually includes early consideration of systemic therapies, as topical therapies are often not beneficial. The presented case study focuses on a single patient with FMF who has completed the Phase 3 FLASH trial, including the open-label cycles and 6-month follow-up. The patient had previously failed at least five therapies, including topical treatments, oral medications and phototherapy. While in the study, the patient received at least 12 weeks of SGX301 treatment and experienced significant improvement, eventually leading to complete clearance of disease that has been sustained for at least 4 years.
"I'm happy to be presenting this important case study at the world congress," stated Dr. Brian Poligone, Director of the Rochester Skin Lymphoma Group. "This patient community needs safe, skin directed therapies to treat this difficult lymphoma and I'm very excited that SGX301 may be one such therapy. I know I can speak for the other clinical study sites participating in the FLASH study, when I say, we are eager for the topline results this quarter."
About the 4th World Congress of Cutaneous Lymphomas
The 4th World Congress is designed to promote the exchange of scientific ideas and foster interactions between physicians, researchers and anyone engaged in the field of cutaneous lymphomas. The program will include discussions of basic, translational and clinical research and discuss new developments in the diagnosis, practice and management of cutaneous lymphomas. More information about the Congress is found here and the final programme is available here.
About SGX301
SGX301 is a novel first-in-class photodynamic therapy utilizing safe visible light for activation. The active ingredient in SGX301 is synthetic hypericin, a potent photosensitizer that is topically applied to skin lesions, is taken up by the malignant T-cells, and then activated by fluorescent light 16 to 24 hours later. This treatment approach avoids the risk of secondary malignancies (including melanoma) inherent with the frequently employed DNA-damaging chemotherapeutic drugs and other photodynamic therapies that are dependent on ultraviolet exposure. Combined with photoactivation, hypericin has demonstrated significant anti-proliferative effects on activated normal human lymphoid cells and inhibited growth of malignant T-cells isolated from CTCL patients. In a published Phase 2 clinical study in CTCL, patients experienced a statistically significant (p ≤ 0.04) improvement with topical hypericin treatment whereas the placebo was ineffective: 58.3% compared to 8.3%, respectively.
The Phase 3 FLASH trial enrolled 169 patients with Stage IA, IB or IIA CTCL. Enrollment of the trial is completed and topline primary endpoint results are expected to be available in Q1 2020. The trial consists of three treatment cycles, each of 8 weeks duration. Treatments are administered twice weekly for the first 6 weeks and treatment response is determined at the end of Week 8. In the first treatment cycle, approximately 107 subjects receive SGX301 treatment (0.25% synthetic hypericin) and 53 receive placebo treatment of their index lesions. In the second cycle, all subjects receive SGX301 treatment of their index lesions and in the third (optional) cycle all subjects receive SGX301 treatment of all their lesions. Subjects are followed for an additional 6 months after the completion of treatment. The majority of patients enrolled have elected to continue with the optional, open-label component of the study.
The Phase 3 CTCL clinical study was partially funded with this NCI Phase II SBIR grant (#1R44CA210848-01A1) awarded to Soligenix, Inc.
SGX301 has received orphan drug and fast track designations from the US Food and Drug Administration (FDA), as well as orphan designation from the European Medicines Agency (EMA).
About Cutaneous T-Cell Lymphoma (CTCL)
CTCL is a class of non-Hodgkin's lymphoma (NHL), a type of cancer of the white blood cells that are an integral part of the immune system. Unlike most NHLs which generally involve B-cell lymphocytes (involved in producing antibodies), CTCL is caused by an expansion of malignant T-cell lymphocytes (involved in cell-mediated immunity) normally programmed to migrate to the skin. These malignant cells migrate to the skin where they form various lesions, typically beginning as a rash and eventually forming raised plaques and tumors as the disease progresses. Mortality is related to the stage of CTCL, with median survival generally ranging from about 12 years in the early stages to only 2.5 years when the disease has advanced. There is currently no cure for CTCL. Typically, CTCL lesions are treated and regress but usually return either in the same part of the body or in new areas.
CTCL constitutes a rare group of NHLs, occurring in about 4% of the approximate 700,000 individuals living with the disease. It is estimated, based upon review of historic published studies and reports and an interpolation of data on the incidence of CTCL that it affects over 25,000 individuals in the US, with approximately 3,000 new cases seen annually.
About Soligenix, Inc.
Soligenix is a late-stage biopharmaceutical company focused on developing and commercializing products to treat rare diseases where there is an unmet medical need. Our Specialized BioTherapeutics business segment is developing SGX301 as a novel photodynamic therapy utilizing safe visible light for the treatment of cutaneous T-cell lymphoma, our first-in-class innate defense regulator (IDR) technology, dusquetide (SGX942) for the treatment of oral mucositis in head and neck cancer, and proprietary formulations of oral beclomethasone 17,21-dipropionate (BDP) for the prevention/treatment of gastrointestinal (GI) disorders characterized by severe inflammation including pediatric Crohn's disease (SGX203) and acute radiation enteritis (SGX201).
Our Public Health Solutions business segment includes active development programs for RiVax [®] , our ricin toxin vaccine candidate, OrbeShield [®] , our GI acute radiation syndrome therapeutic candidate and SGX943, our therapeutic candidate for antibiotic resistant and emerging infectious disease. The development of our vaccine programs incorporates the use of our proprietary heat stabilization platform technology, known as ThermoVax [®] . To date, this business segment has been supported with government grant and contract funding from the National Institute of Allergy and Infectious Diseases (NIAID), the Defense Threat Reduction Agents (DTRA) and the Biomedical Advanced Research and Development Authority (BARDA).
For further information regarding Soligenix, Inc., please visit the Company's website at www.soligenix.com.
This press release may contain forward-looking statements that reflect Soligenix, Inc.'s current expectations about its future results, performance, prospects and opportunities, including but not limited to, potential market sizes, patient populations and clinical trial enrollment. Statements that are not historical facts, such as "anticipates," "estimates," "believes," "hopes," "intends," "plans," "expects," "goal," "may," "suggest," "will," "potential," or similar expressions, are forward-looking statements. These statements are subject to a number of risks, uncertainties and other factors that could cause actual events or results in future periods to differ materially from what is expressed in, or implied by, these statements. Soligenix cannot assure you that it will be able to successfully develop, achieve regulatory approval for or commercialize products based on its technologies, particularly in light of the significant uncertainty inherent in developing therapeutics and vaccines against bioterror threats, conducting preclinical and clinical trials of therapeutics and vaccines, obtaining regulatory approvals and manufacturing therapeutics and vaccines, that product development and commercialization efforts will not be reduced or discontinued due to difficulties or delays in clinical trials or due to lack of progress or positive results from research and development efforts, that it will be able to successfully obtain any further funding to support product development and commercialization efforts, including grants and awards, maintain its existing grants which are subject to performance requirements, enter into any biodefense procurement contracts with the US Government or other countries, that it will be able to compete with larger and better financed competitors in the biotechnology industry, that changes in health care practice, third party reimbursement limitations and Federal and/or state health care reform initiatives will not negatively affect its business, or that the US Congress may not pass any legislation that would provide additional funding for the Project BioShield program. In addition, there can be no assurance as to timing or success of the Phase 3 clinical trial of SGX942 (dusquetide) as a treatment for oral mucositis in patients with head and neck cancer receiving chemoradiation therapy (including the outcome of the interim analysis) or the Phase 3 clinical trial of SGX301 (synthetic hypericin) for the treatment of cutaneous T-cell lymphoma. Further, there can be no assurance that RiVax [®] will qualify for a biodefense Priority Review Voucher (PRV) or that the prior sales of PRVs will be indicative of any potential sales price for a PRV for RiVax [®] . These and other risk factors are described from time to time in filings with the Securities and Exchange Commission, including, but not limited to, Soligenix's reports on Forms 10-Q and 10-K. Unless required by law, Soligenix assumes no obligation to update or revise any forward-looking statements as a result of new information or future events.
View original content:http://www.prnewswire.com/news-releases/soligenix-announces-…
SOURCE Soligenix, Inc.
Copyright (C) 2020 PR Newswire. All rights reserved
FROM MARKETWATCH
Goldman Sachs says impact of coronavirus will be ‘limited,’ and these are the stocks to buy if it’s right
Prank shows how some Russians really feel about Putin — now people want to see the same prank but with Trump
Two years after the Tax Cuts and Jobs Act — who are the winners and the losers?
MARKETWATCHPARTNER CENTER
RECOMMENDED

INSIDE-SCOOP
New Jersey’s Pension Sold Apple, AT&T, and Microsoft Stock. Here’s What It’s Buying.


ENTERTAINMENT
Billie Eilish is a meme queen for her disgusted Oscars 2020 reactions


NEWS
Trump pays tribute to 2 soldiers killed in Afghanistan


STOCKS-TO-WATCH
European Stocks Register Broad Gains Ahead of Powell Testimony

BACK TO TOP
Copyright © 2020 MarketWatch, Inc. All rights reserved.
Durch die Nutzung dieser Website erklären Sie sich mit den
Nutzungsbedingungen , der Datenschutzerklärung vom 23.01.20 und der Cookie-Mitteilung vom 23.01.20 EINVERSTANDEN .
Meine persönlichen Daten nicht verkaufen .
 
Intraday-Daten werden von FACTSET bereitgestellt und unterliegen den Nutzungsbedingungen . Historische und aktuelle Tagesenddaten von FACTSET . Alle Zitate sind in Ortszeit. Die Echtzeitdaten der letzten Verkäufe für US-Börsenkurse spiegeln nur Trades wider, die über Nasdaq gemeldet wurden. Intraday-Daten verzögern sich um mindestens 15 Minuten oder je nach Austauschanforderungen.
Antwort auf Beitrag Nr.: 62.645.698 von silvesterstrike am 11.02.20 14:38:32Hallo Silverstrike
danke für die Info, bin gespannt, ob sich das Ganze langsam auf den Kurs auswirkt. Wäre schön🙃🙂🙂
danke für die Info, bin gespannt, ob sich das Ganze langsam auf den Kurs auswirkt. Wäre schön🙃🙂🙂
MARKETWATCH DURCHSUCHEN
Berichte: Der britische Kanzler ist zurückgetreten
TEILEN
Zuhause
PRESSEMITTEILUNG
FDA erteilt Soligenix die Bezeichnung "Fast Track" für RiVax® zur Vorbeugung von Ricin-Vergiftungen
Durch
Veröffentlicht: 13. Februar 2020, 7:00 Uhr MEZ
TEILEN
PRINCETON, NJ, 13. Februar 2020 / PRNewswire / - Soligenix, Inc. SNGX, -2,96% (Soligenix oder das Unternehmen), ein biopharmazeutisches Unternehmen im Spätstadium, das sich auf die Entwicklung und Vermarktung von Produkten zur Behandlung seltener Krankheiten konzentriert, bei denen ein medizinischer Bedarf nicht gedeckt werden kann, gab heute das Entwicklungsprogramm RiVax [®] (hitzestabiler Rizin-Toxin-Impfstoff) zur Vorbeugung bekannt Die US-amerikanische Arzneimittelbehörde FDA (Food and Drug Administration) hat die Auszeichnung "Fast Track" erhalten.
Fast Track ist eine Bezeichnung, die die FDA für ein Medikament reserviert, das zur Behandlung einer schwerwiegenden oder lebensbedrohlichen Erkrankung bestimmt ist und das die Möglichkeit aufzeigt, einen nicht gedeckten medizinischen Bedarf für die Erkrankung zu decken. Die Bezeichnung "Fast Track" soll die Entwicklung neuer Arzneimittel und Biologika erleichtern und deren Überprüfung beschleunigen. Soligenix ist beispielsweise berechtigt, im Falle von Ereignissen einen Antrag auf Erteilung einer Biologielizenz (BLA) für RiVax [®] fortlaufend einzureichen, damit die FDA Abschnitte der BLA überprüfen kann, bevor die vollständige Einreichung eingeht. Darüber hinaus können BLAs für Fast-Track-Entwicklungsprogramme in der Regel vorrangig überprüft werden, was eine verkürzte Überprüfungszeit von ungefähr sechs Monaten ergibt.
"We are very pleased to have been granted fast track designation from the FDA to go along with the orphan drug designation previously received," stated Christopher J. Schaber, PhD, President and Chief Executive Officer of Soligenix. "We believe that the FDA's action in granting fast track designation validates the unmet medical need that currently exists for a vaccine providing protection against lethal ricin toxin exposure and for the potential key role RiVax [®] can serve as a part of the US Strategic National Stockpile."
The development of RiVax [®] has been funded through a series of grants from both the National Institute of Allergy and Infectious Diseases (NIAID) and the FDA and ongoing development is sponsored by NIAID contract #HHSN272201400039C. Non-dilutive funding for the development of RiVax [®] has exceeded $40 million to date.
About Ricin Toxin
Ricin toxin is a lethal plant-derived toxin and potential biological weapon because of its stability and high potency, and the fact that it is readily extracted from by-products of castor oil production. Ricin comes in many forms including powder, mist or pellet. Ricin can also be dissolved in water and other liquids. The US Centers for Disease Control and Prevention estimates that the lethal dose in humans is about the size of a grain of salt. Ricin toxin illness causes tissue necrosis and general organ failure leading to death within several days of exposure. Ricin is especially toxic when inhaled. Ricin works by entering cells of the body and preventing the cells from making the proteins they need. Without the proteins, cells die, which is eventually harmful to the entire body.
There are currently no effective treatments for ricin poisoning. The successful development of an effective vaccine against ricin toxin may act as a deterrent against the actual use of ricin as a biological weapon and could be used to vaccinate military personnel and civilian emergency responders at high risk of potential exposure in the event of a biological attack.
About RiVax [®]
RiVax [®] is Soligenix's proprietary heat stable recombinant subunit vaccine developed to protect against exposure to ricin toxin, the threat of which has been highlighted recently in the news with an envelope addressed to President Trump that was thought to contain this potent and potentially lethal toxin. With RiVax [®] , Soligenix is a world leader in the area of ricin toxin vaccine research.
RiVax [®] contains a genetically altered version of a Ricin Toxin A (RTA) chain containing two mutations that inactivate the toxicity of the ricin molecule. A Phase 1A clinical trial was conducted with a formulation of RiVax [®] that did not contain an adjuvant. This trial revealed dose dependent seroconversion as well as lack of toxicity of the molecule when administered intramuscularly to human volunteers. The adjuvant-free formulation of RiVax [®] induced toxin neutralizing antibodies that lasted up to 127 days after the third vaccination in several individuals.
To increase the longevity and magnitude of toxin neutralizing antibodies, RiVax [®] was subsequently formulated with an adjuvant of aluminum salts (known colloquially as alum) for a Phase 1B clinical trial. Alum is an adjuvant that is used in many human vaccines, including most vaccines used in infants. The results of the Phase 1B study indicated that alum-adjuvanted RiVax [®] was safe and well tolerated, and induced greater ricin neutralizing antibody levels in humans than adjuvant-free RiVax [®] . In animal studies, the alum formulation of RiVax [®] also induced higher titers and longer-lasting antibodies than the adjuvant-free vaccine. Vaccination with the thermostabilized alum-adjuvanted RiVax [®] formulation in a large animal model provided 100% protection (p<0.0001) against acute exposure to aerosolized ricin, the most lethal route of exposure for ricin. The protected animals also had no signs of gross lung damage, a serious and enduring ramification with long-term consequences for survivors of ricin exposure. These results are described in a publication available here.
Heat stabilization of RiVax [®] is achieved with the Company's proprietary ThermoVax [®] technology, designed to eliminate the cold-chain production, distribution and storage logistics required for most vaccines. The technology utilizes precise lyophilization of protein immunogens with conventional aluminum adjuvants in combination with secondary adjuvants for rapid onset of protective immunity with the fewest number of vaccinations. By employing ThermoVax [®] during the final formulation of RiVax [®] , the vaccine has demonstrated enhanced stability and the ability to withstand temperatures at least as high as 40 degrees Celsius (104 degrees Fahrenheit) for up to one year. These results are described in a publication available here.
The development of RiVax [®] has been funded through a series of grants from both the National Institute of Allergy and Infectious Diseases (NIAID) and the FDA and ongoing development is sponsored by NIAID contract #HHSN272201400039C. Non-dilutive funding for the development of RiVax [®] has exceeded $40 million to date. RiVax [®] is being developed under the FDA "Animal Rule" and potentially would be added to the Strategic National Stockpile and dispensed in the event of a terrorist threat. RiVax [®] has received orphan drug designation in the US and in Europe.
As a new chemical entity, an FDA approved RiVax [®] vaccine has the potential to qualify for a biodefense Priority Review Voucher (PRV), which allows the holder accelerated review of a drug application. Approved under the 21st Century Health Cures Act in late 2016, the biodefense PRV is awarded upon approval as a medical countermeasure when the active ingredient(s) have not been otherwise approved for use in any context. PRVs are transferable and can be sold, with sales in recent years in excess of $100 million. When redeemed, PRVs entitle the user to an accelerated review period of six months, saving a median of seven months' review time as calculated in 2009. However, the FDA must be advised 90 days in advance of the use of the PRV and the use of a PRV is associated with an additional user fee ($2.1 million in 2020).
About Soligenix, Inc.
Soligenix is a late-stage biopharmaceutical company focused on developing and commercializing products to treat rare diseases where there is an unmet medical need. Our Specialized BioTherapeutics business segment is developing SGX301 as a novel photodynamic therapy utilizing safe visible light for the treatment of cutaneous T-cell lymphoma, our first-in-class innate defense regulator (IDR) technology, dusquetide (SGX942) for the treatment of oral mucositis in head and neck cancer, and proprietary formulations of oral beclomethasone 17,21-dipropionate (BDP) for the prevention/treatment of gastrointestinal (GI) disorders characterized by severe inflammation including pediatric Crohn's disease (SGX203) and acute radiation enteritis (SGX201).
Our Public Health Solutions business segment includes active development programs for RiVax [®] , our ricin toxin vaccine candidate, OrbeShield [®] , our GI acute radiation syndrome therapeutic candidate and SGX943, our therapeutic candidate for antibiotic resistant and emerging infectious disease. The development of our vaccine programs incorporates the use of our proprietary heat stabilization platform technology, known as ThermoVax [®] . To date, this business segment has been supported with government grant and contract funding from the National Institute of Allergy and Infectious Diseases (NIAID), the Defense Threat Reduction Agents (DTRA) and the Biomedical Advanced Research and Development Authority (BARDA).
For further information regarding Soligenix, Inc., please visit the Company's website at www.soligenix.com.
This press release may contain forward-looking statements that reflect Soligenix, Inc.'s current expectations about its future results, performance, prospects and opportunities, including but not limited to, potential market sizes, patient populations and clinical trial enrollment. Statements that are not historical facts, such as "anticipates," "estimates," "believes," "hopes," "intends," "plans," "expects," "goal," "may," "suggest," "will," "potential," or similar expressions, are forward-looking statements. These statements are subject to a number of risks, uncertainties and other factors that could cause actual events or results in future periods to differ materially from what is expressed in, or implied by, these statements. Soligenix cannot assure you that it will be able to successfully develop, achieve regulatory approval for or commercialize products based on its technologies, particularly in light of the significant uncertainty inherent in developing therapeutics and vaccines against bioterror threats, conducting preclinical and clinical trials of therapeutics and vaccines, obtaining regulatory approvals and manufacturing therapeutics and vaccines, that product development and commercialization efforts will not be reduced or discontinued due to difficulties or delays in clinical trials or due to lack of progress or positive results from research and development efforts, that it will be able to successfully obtain any further funding to support product development and commercialization efforts, including grants and awards, maintain its existing grants which are subject to performance requirements, enter into any biodefense procurement contracts with the U.S. Government or other countries, that it will be able to compete with larger and better financed competitors in the biotechnology industry, that changes in health care practice, third party reimbursement limitations and Federal and/or state health care reform initiatives will not negatively affect its business, or that the U.S. Congress may not pass any legislation that would provide additional funding for the Project BioShield program. In addition, there can be no assurance as to the timing or success of the Phase 3 clinical trial of SGX942 (dusquetide) as a treatment for oral mucositis in patients with head and neck cancer receiving chemoradiation therapy or the Phase 3 clinical trial of SGX301 (synthetic hypericin) for the treatment of cutaneous T-cell lymphoma. Further, there can be no assurance that RiVax [®] will qualify for a biodefense Priority Review Voucher (PRV) or that the prior sales of PRVs will be indicative of any potential sales price for a PRV for RiVax [®] . Also, no assurance can be provided that the Company will receive or continue to receive non-dilutive government funding from grants and contracts that have been or may be awarded or for which the Company will apply in the future. These and other risk factors are described from time to time in filings with the Securities and Exchange Commission, including, but not limited to, Soligenix's reports on Forms 10-Q and 10-K. Unless required by law, Soligenix assumes no obligation to update or revise any forward-looking statements as a result of new information or future events.
View original content:http://www.prnewswire.com/news-releases/fda-grants-soligenix…
SOURCE Soligenix, Inc.
Copyright (C) 2020 PR Newswire. All rights reserved
FROM MARKETWATCH
This one change can improve retirement wealth by 50%
Asian markets pressured as number of new COVID-19 cases spikes in China
Aurora Cannabis earnings: Here comes a billion-dollar loss
MARKETWATCHPARTNER CENTER
BACK TO TOP
Copyright © 2020 MarketWatch, Inc. All rights reserved.
By using this site you agree to the
Terms of Use, Privacy NoticeUPDATED 1/23/20, and Cookie NoticeUPDATED 1/23/20.
Meine persönlichen Daten nicht verkaufen .
Facebook
Twitter
Linkedin
 
Intraday-Daten werden von FACTSET bereitgestellt und unterliegen den Nutzungsbedingungen . Historische und aktuelle Tagesenddaten von FACTSET . Alle Zitate sind in Ortszeit. Die Echtzeitdaten der letzten Verkäufe für US-Börsenkurse spiegeln nur Trades wider, die über Nasdaq gemeldet wurden. Intraday-Daten verzögern sich um mindestens 15 Minuten oder je nach Austauschanforderungen.
Berichte: Der britische Kanzler ist zurückgetreten
TEILEN
Zuhause
PRESSEMITTEILUNG
FDA erteilt Soligenix die Bezeichnung "Fast Track" für RiVax® zur Vorbeugung von Ricin-Vergiftungen
Durch
Veröffentlicht: 13. Februar 2020, 7:00 Uhr MEZ
TEILEN
PRINCETON, NJ, 13. Februar 2020 / PRNewswire / - Soligenix, Inc. SNGX, -2,96% (Soligenix oder das Unternehmen), ein biopharmazeutisches Unternehmen im Spätstadium, das sich auf die Entwicklung und Vermarktung von Produkten zur Behandlung seltener Krankheiten konzentriert, bei denen ein medizinischer Bedarf nicht gedeckt werden kann, gab heute das Entwicklungsprogramm RiVax [®] (hitzestabiler Rizin-Toxin-Impfstoff) zur Vorbeugung bekannt Die US-amerikanische Arzneimittelbehörde FDA (Food and Drug Administration) hat die Auszeichnung "Fast Track" erhalten.
Fast Track ist eine Bezeichnung, die die FDA für ein Medikament reserviert, das zur Behandlung einer schwerwiegenden oder lebensbedrohlichen Erkrankung bestimmt ist und das die Möglichkeit aufzeigt, einen nicht gedeckten medizinischen Bedarf für die Erkrankung zu decken. Die Bezeichnung "Fast Track" soll die Entwicklung neuer Arzneimittel und Biologika erleichtern und deren Überprüfung beschleunigen. Soligenix ist beispielsweise berechtigt, im Falle von Ereignissen einen Antrag auf Erteilung einer Biologielizenz (BLA) für RiVax [®] fortlaufend einzureichen, damit die FDA Abschnitte der BLA überprüfen kann, bevor die vollständige Einreichung eingeht. Darüber hinaus können BLAs für Fast-Track-Entwicklungsprogramme in der Regel vorrangig überprüft werden, was eine verkürzte Überprüfungszeit von ungefähr sechs Monaten ergibt.
"We are very pleased to have been granted fast track designation from the FDA to go along with the orphan drug designation previously received," stated Christopher J. Schaber, PhD, President and Chief Executive Officer of Soligenix. "We believe that the FDA's action in granting fast track designation validates the unmet medical need that currently exists for a vaccine providing protection against lethal ricin toxin exposure and for the potential key role RiVax [®] can serve as a part of the US Strategic National Stockpile."
The development of RiVax [®] has been funded through a series of grants from both the National Institute of Allergy and Infectious Diseases (NIAID) and the FDA and ongoing development is sponsored by NIAID contract #HHSN272201400039C. Non-dilutive funding for the development of RiVax [®] has exceeded $40 million to date.
About Ricin Toxin
Ricin toxin is a lethal plant-derived toxin and potential biological weapon because of its stability and high potency, and the fact that it is readily extracted from by-products of castor oil production. Ricin comes in many forms including powder, mist or pellet. Ricin can also be dissolved in water and other liquids. The US Centers for Disease Control and Prevention estimates that the lethal dose in humans is about the size of a grain of salt. Ricin toxin illness causes tissue necrosis and general organ failure leading to death within several days of exposure. Ricin is especially toxic when inhaled. Ricin works by entering cells of the body and preventing the cells from making the proteins they need. Without the proteins, cells die, which is eventually harmful to the entire body.
There are currently no effective treatments for ricin poisoning. The successful development of an effective vaccine against ricin toxin may act as a deterrent against the actual use of ricin as a biological weapon and could be used to vaccinate military personnel and civilian emergency responders at high risk of potential exposure in the event of a biological attack.
About RiVax [®]
RiVax [®] is Soligenix's proprietary heat stable recombinant subunit vaccine developed to protect against exposure to ricin toxin, the threat of which has been highlighted recently in the news with an envelope addressed to President Trump that was thought to contain this potent and potentially lethal toxin. With RiVax [®] , Soligenix is a world leader in the area of ricin toxin vaccine research.
RiVax [®] contains a genetically altered version of a Ricin Toxin A (RTA) chain containing two mutations that inactivate the toxicity of the ricin molecule. A Phase 1A clinical trial was conducted with a formulation of RiVax [®] that did not contain an adjuvant. This trial revealed dose dependent seroconversion as well as lack of toxicity of the molecule when administered intramuscularly to human volunteers. The adjuvant-free formulation of RiVax [®] induced toxin neutralizing antibodies that lasted up to 127 days after the third vaccination in several individuals.
To increase the longevity and magnitude of toxin neutralizing antibodies, RiVax [®] was subsequently formulated with an adjuvant of aluminum salts (known colloquially as alum) for a Phase 1B clinical trial. Alum is an adjuvant that is used in many human vaccines, including most vaccines used in infants. The results of the Phase 1B study indicated that alum-adjuvanted RiVax [®] was safe and well tolerated, and induced greater ricin neutralizing antibody levels in humans than adjuvant-free RiVax [®] . In animal studies, the alum formulation of RiVax [®] also induced higher titers and longer-lasting antibodies than the adjuvant-free vaccine. Vaccination with the thermostabilized alum-adjuvanted RiVax [®] formulation in a large animal model provided 100% protection (p<0.0001) against acute exposure to aerosolized ricin, the most lethal route of exposure for ricin. The protected animals also had no signs of gross lung damage, a serious and enduring ramification with long-term consequences for survivors of ricin exposure. These results are described in a publication available here.
Heat stabilization of RiVax [®] is achieved with the Company's proprietary ThermoVax [®] technology, designed to eliminate the cold-chain production, distribution and storage logistics required for most vaccines. The technology utilizes precise lyophilization of protein immunogens with conventional aluminum adjuvants in combination with secondary adjuvants for rapid onset of protective immunity with the fewest number of vaccinations. By employing ThermoVax [®] during the final formulation of RiVax [®] , the vaccine has demonstrated enhanced stability and the ability to withstand temperatures at least as high as 40 degrees Celsius (104 degrees Fahrenheit) for up to one year. These results are described in a publication available here.
The development of RiVax [®] has been funded through a series of grants from both the National Institute of Allergy and Infectious Diseases (NIAID) and the FDA and ongoing development is sponsored by NIAID contract #HHSN272201400039C. Non-dilutive funding for the development of RiVax [®] has exceeded $40 million to date. RiVax [®] is being developed under the FDA "Animal Rule" and potentially would be added to the Strategic National Stockpile and dispensed in the event of a terrorist threat. RiVax [®] has received orphan drug designation in the US and in Europe.
As a new chemical entity, an FDA approved RiVax [®] vaccine has the potential to qualify for a biodefense Priority Review Voucher (PRV), which allows the holder accelerated review of a drug application. Approved under the 21st Century Health Cures Act in late 2016, the biodefense PRV is awarded upon approval as a medical countermeasure when the active ingredient(s) have not been otherwise approved for use in any context. PRVs are transferable and can be sold, with sales in recent years in excess of $100 million. When redeemed, PRVs entitle the user to an accelerated review period of six months, saving a median of seven months' review time as calculated in 2009. However, the FDA must be advised 90 days in advance of the use of the PRV and the use of a PRV is associated with an additional user fee ($2.1 million in 2020).
About Soligenix, Inc.
Soligenix is a late-stage biopharmaceutical company focused on developing and commercializing products to treat rare diseases where there is an unmet medical need. Our Specialized BioTherapeutics business segment is developing SGX301 as a novel photodynamic therapy utilizing safe visible light for the treatment of cutaneous T-cell lymphoma, our first-in-class innate defense regulator (IDR) technology, dusquetide (SGX942) for the treatment of oral mucositis in head and neck cancer, and proprietary formulations of oral beclomethasone 17,21-dipropionate (BDP) for the prevention/treatment of gastrointestinal (GI) disorders characterized by severe inflammation including pediatric Crohn's disease (SGX203) and acute radiation enteritis (SGX201).
Our Public Health Solutions business segment includes active development programs for RiVax [®] , our ricin toxin vaccine candidate, OrbeShield [®] , our GI acute radiation syndrome therapeutic candidate and SGX943, our therapeutic candidate for antibiotic resistant and emerging infectious disease. The development of our vaccine programs incorporates the use of our proprietary heat stabilization platform technology, known as ThermoVax [®] . To date, this business segment has been supported with government grant and contract funding from the National Institute of Allergy and Infectious Diseases (NIAID), the Defense Threat Reduction Agents (DTRA) and the Biomedical Advanced Research and Development Authority (BARDA).
For further information regarding Soligenix, Inc., please visit the Company's website at www.soligenix.com.
This press release may contain forward-looking statements that reflect Soligenix, Inc.'s current expectations about its future results, performance, prospects and opportunities, including but not limited to, potential market sizes, patient populations and clinical trial enrollment. Statements that are not historical facts, such as "anticipates," "estimates," "believes," "hopes," "intends," "plans," "expects," "goal," "may," "suggest," "will," "potential," or similar expressions, are forward-looking statements. These statements are subject to a number of risks, uncertainties and other factors that could cause actual events or results in future periods to differ materially from what is expressed in, or implied by, these statements. Soligenix cannot assure you that it will be able to successfully develop, achieve regulatory approval for or commercialize products based on its technologies, particularly in light of the significant uncertainty inherent in developing therapeutics and vaccines against bioterror threats, conducting preclinical and clinical trials of therapeutics and vaccines, obtaining regulatory approvals and manufacturing therapeutics and vaccines, that product development and commercialization efforts will not be reduced or discontinued due to difficulties or delays in clinical trials or due to lack of progress or positive results from research and development efforts, that it will be able to successfully obtain any further funding to support product development and commercialization efforts, including grants and awards, maintain its existing grants which are subject to performance requirements, enter into any biodefense procurement contracts with the U.S. Government or other countries, that it will be able to compete with larger and better financed competitors in the biotechnology industry, that changes in health care practice, third party reimbursement limitations and Federal and/or state health care reform initiatives will not negatively affect its business, or that the U.S. Congress may not pass any legislation that would provide additional funding for the Project BioShield program. In addition, there can be no assurance as to the timing or success of the Phase 3 clinical trial of SGX942 (dusquetide) as a treatment for oral mucositis in patients with head and neck cancer receiving chemoradiation therapy or the Phase 3 clinical trial of SGX301 (synthetic hypericin) for the treatment of cutaneous T-cell lymphoma. Further, there can be no assurance that RiVax [®] will qualify for a biodefense Priority Review Voucher (PRV) or that the prior sales of PRVs will be indicative of any potential sales price for a PRV for RiVax [®] . Also, no assurance can be provided that the Company will receive or continue to receive non-dilutive government funding from grants and contracts that have been or may be awarded or for which the Company will apply in the future. These and other risk factors are described from time to time in filings with the Securities and Exchange Commission, including, but not limited to, Soligenix's reports on Forms 10-Q and 10-K. Unless required by law, Soligenix assumes no obligation to update or revise any forward-looking statements as a result of new information or future events.
View original content:http://www.prnewswire.com/news-releases/fda-grants-soligenix…
SOURCE Soligenix, Inc.
Copyright (C) 2020 PR Newswire. All rights reserved
FROM MARKETWATCH
This one change can improve retirement wealth by 50%
Asian markets pressured as number of new COVID-19 cases spikes in China
Aurora Cannabis earnings: Here comes a billion-dollar loss
MARKETWATCHPARTNER CENTER
BACK TO TOP
Copyright © 2020 MarketWatch, Inc. All rights reserved.
By using this site you agree to the
Terms of Use, Privacy NoticeUPDATED 1/23/20, and Cookie NoticeUPDATED 1/23/20.
Meine persönlichen Daten nicht verkaufen .
 
Intraday-Daten werden von FACTSET bereitgestellt und unterliegen den Nutzungsbedingungen . Historische und aktuelle Tagesenddaten von FACTSET . Alle Zitate sind in Ortszeit. Die Echtzeitdaten der letzten Verkäufe für US-Börsenkurse spiegeln nur Trades wider, die über Nasdaq gemeldet wurden. Intraday-Daten verzögern sich um mindestens 15 Minuten oder je nach Austauschanforderungen.
Antwort auf Beitrag Nr.: 62.668.816 von silvesterstrike am 13.02.20 13:06:36Hallo Silverstrike
was mich ein wenig wundert ist, dass der Kurs nicht reagiert😟🙃
was mich ein wenig wundert ist, dass der Kurs nicht reagiert😟🙃
Antwort auf Beitrag Nr.: 62.671.558 von vinod am 13.02.20 16:31:08So lange wird es nicht mehr dauern ...bis der reagiert ..... das sieht alles mehr als nur gut aus ...👍👍👍
PRESSEMITTEILUNG
Unabhängige Fallstudie für Soligenix 'CTCL-Medikament SGX301 treibt bullische Stimmung an; Topline "FLASH" -Studiendaten für das erste Quartal 2020 erwartet
Durch
Veröffentlicht: 20. Februar 2020, 8:50 Uhr ET
TEILEN
Miami Beach, Florida, 20. Februar 2020 (Newsfile Corp. über COMTEX) - Miami Beach, Florida - (Newsfile Corp. - 20. Februar 2020) - Soligenix nähert sich möglicherweise einem Transformationspunkt in seiner Geschichte als Daten aus seiner Phase 3 Die SGX301 (FLASH) -Studie zur Behandlung des kutanen T-Zell-Lymphoms (CTCL) nähert sich seiner Freisetzung. Die Topline-Daten dieser Spätstudie werden in weniger als 40 Tagen erwartet. Und wenn diese Veröffentlichung Daten validieren kann, die aus einer kürzlich von Dr. Brian Poligone, MD, Ph.D., durchgeführten Soligenix SNGX bekannt sind, kann +3.03% den ersten von mehreren potenziellen Katalysatoren verdienen, die den Shareholder Value steigern können.
Die klinische Phase-3-Studie zielt auf das kutane T-Zell-Lymphom (CTCL) ab und ist eine doppelblinde, randomisierte, placebokontrollierte Studie mit drei 6-wöchigen Behandlungszyklen. Die Studie wird mit einer Behandlung von rund 169 Patienten abgeschlossen. Die wichtigsten Ergebnisse des doppelblinden Behandlungszyklus 1 werden voraussichtlich vor Ende des ersten Quartals 2020 veröffentlicht.
Über den Nutzen für das Unternehmen hinaus möchte Soligenix mit SGX301 und anderen Pipeline-Produkten Behandlungen auf den Markt bringen, die auf ungedeckte medizinische Bedürfnisse bei schwerwiegenden Erkrankungen abzielen. Diese Unterscheidung kann das Unternehmen in eine hervorragende Position bringen, um Partnerschaften zu gewinnen und möglicherweise den Status einer FDA-Prioritätsprüfung für einige seiner Pipeline-Produkte zu erhalten. Für die nächsten 40 Tage ist jedoch alles auf SGX301 gerichtet.
Kannst du dieses Video nicht sehen? Besuchen Sie:
https://www.youtube.com/watch?v=QQoE_S91jYI
Positives Ergebnis in der unabhängigen SGX301-Fallstudie
Soligenix-Aktie steigt seit Jahresbeginn, wobei die Aktien ab Dienstag um mehr als 100% gestiegen sind. Insbesondere scheint der Preisanstieg durch positive Kommentare für mindestens zwei der späten Phase-3-Studien des Unternehmens, SGX301 und SGX942, gerechtfertigt zu sein. Außerdem wurde auf dem 4. Weltkongress eine aktuelle Fallstudie für das CTCL-Medikament des Unternehmens vorgestellt, die das Interesse des Arzneimittels weckte, eine Front-Line-Behandlung gegen CTCL im Frühstadium zu werden. Wenn dies der Fall ist, wird das Medikament den Patienten die notwendige Linderung bringen und als erstes Unternehmen eine "sichere und wirksame" Front-Line-Therapie auf den Markt bringen, die die mit CTCL verbundenen Läsionen erheblich reduzieren oder beseitigen kann.
Auch Soligenix hat den Aktionären gute Gründe gegeben, optimistisch über die bevorstehenden SGX301-Topline-Daten zu sein. Erstens hat das Unternehmen eine produktive Zwischenanalyse mit positiver Empfehlung des Independent Data Monitoring Committee (DMC) durchgeführt. Zweitens hat Soligenix in Erwartung positiver Ergebnisse sein C-Level-Team verstärkt. Und drittens hat das Unternehmen mehrfach erklärt, dass das Unternehmen ausreichend finanziert ist, um in den beiden Phase-3-Studien zu Top-Line-Ergebnissen zu gelangen. Darüber hinaus war Soligenix außerordentlich transparent und zeitnah für die Bereitstellung von Studienaktualisierungen und beweist, dass das Management über die erforderlichen Fähigkeiten verfügt, um Studien effizient durch jede Phase einer klinischen Studie zu navigieren.
Zuletzt hat Soligenix ein Interview veröffentlichtDies unterstreicht mindestens eine der Meinungen des Prüfers zu SGX301. Unnötig zu erwähnen, dass der potenzielle therapeutische Wert des Arzneimittels ziemlich optimistisch ist. Das Interview stammt aus einer Fallstudienpräsentation, die im Februar dieses Jahres von Dr. Brian Poligone, dem Direktor der Rochester Skin Lymphoma Medical Group, in Fairfort, New York, gehalten wurde. Dr. Poligone bringt nicht nur mehr als 15 Jahre Erfahrung in der Behandlung von CTCL-Patienten mit, es ist auch wichtig zu beachten, dass er als "FLASH" -Studienprüfer möglicherweise gesehen hat, was andere nicht gesehen haben. Wenn er also über SGX301 spricht, hören die Leute zu.
SGX301 bei 4 präsentiert [th] World Congress im Februar
klar, Dr. Poligone des optimistische Stimmung fügt das Niveau des Vertrauens für positive vorläufige Topline - Ergebnisse. Während eines Forschungsinterviews von Zack am 18. Februar wurden mehrere Kommentare abgegeben, die zu einem wachsenden Soundtrack beeindruckender Rückmeldungen beitragen. Darüber hinaus lässt das Vertrauen in seine Ausführungen wenig Raum für eine ambivalente Interpretation. Aus diesem Interview sagte Dr. Poligone:
"Die Sicherheit von SGX301 in Verbindung mit dem Langzeitbehandlungseffekt war äußerst beeindruckend." [seine Antwort auf eine Frage zu den Ergebnissen der Patientenfallstudie]
"Unser Hauptziel ist es, die Krankheit auf die Therapie ansprechen zu lassen, ohne dem Patienten neue Risiken oder Nebenwirkungen aufzuerlegen."
"Es (SGX301) wäre eine Front-Line-Option für Patienten im Frühstadium."
"SGX301 könnte für eine Mehrheit meiner Patienten im Frühstadium eine geeignete Option sein."
Es ist wichtig zu bedenken, dass diese Kommentare von einem führenden CTCL-Behandlungsanbieter stammen. Darüber hinaus gilt Dr. Poligone als Autorität im Bereich der Behandlung von CTCL. Am wichtigsten für seinen Beitrag ist jedoch seine kürzlich abgeschlossene Fallstudie zu SGX301, in der er einen Patienten behandelte, der von den derzeit verfügbaren Medikamenten für die Krankheit nur einen geringen bis keinen therapeutischen Nutzen gezeigt hat. Als Reaktion auf das Fehlen von Ergebnissen aus fünf früheren Therapien verabreichte er diesem Patienten die SGX301-Kombinationstherapie mit Licht und es wurde ein robustes Ansprechen erzielt. Er präsentierte seine Ergebnisse auf dem 4. Weltkongress. Und die Präsentation war für das SGX301-Profil ausgesprochen günstig. Zurück dazu gleich.
Wenn Sie jedoch einen Schritt zurücktreten, ist es wichtig, den Effektmechanismus zu verstehen sowie zu verstehen, warum und wie SGX301 im Vergleich zu Wettbewerbsprodukten möglicherweise Überlegenheit zeigen kann. Wie bereits erwähnt, ist die derzeitige Behandlung von CTCL mit erheblichen Herausforderungen behaftet, die erhebliche und frustrierende Mängel mit sich bringen, die sowohl bei Patienten als auch bei Ärzten zu Problemen führen können. Während die Fälle unterschiedlich umfangreich sein können, manifestiert sich das kutane T-Zell-Lymphom für die meisten als unansehnliche und oft schmerzhafte Hautläsionen, die bis zu 80% der Hautoberfläche betreffen können. Es ist wichtig zu beachten, dass CTCL zwar normalerweise nicht tödlich verläuft, es jedoch keine kurative Behandlung für die Krankheit gibt.
Darüber hinaus behandeln Ärzte bei aktuellen Behandlungsoptionen häufig nicht nur die Läsionen des Patienten, sondern behandeln auch die Nebenwirkungen von CTCL-Medikamenten, wobei sie sich weiterhin auf die potenziellen chronischen Probleme konzentrieren, die diese Medikamente verursachen können. Diese Zustände treten tendenziell bei der späteren Behandlung der Krankheit auf.
Behandlungen im Frühstadium sind jedoch ebenfalls eine Herausforderung und beschränken sich meist auf topischen Stickstoffsenf, topische Steroide und schädliche Phototherapie. Topische Behandlungen können bei der Verringerung der Größe von Hautläsionen nützlich sein, führen jedoch mit ziemlicher Sicherheit zu einem Krankheitsrückfall.
Zusätzliche Arten von topischen Medikamenten können bestenfalls kurzfristig Linderung bringen, aber die meisten verursachen bekanntermaßen erhebliche Hautreizungen, die manchmal dazu führen, dass der Patient die Behandlung nicht einhält. Im Gegensatz dazu wird angenommen, dass SGX301 das toleranteste Sicherheitsprofil aufweist und aus der vorgestellten Patientenfallstudie möglicherweise einen 12-wöchigen Behandlungsprozess erfordert.
Obwohl sich eine schmalbandige Phototherapie bei der Behandlung größerer Oberflächen in den frühen Stadien der Krankheit als nützlich erweisen kann, besteht in der Praxis immer noch die Möglichkeit eines Rückfalls und ein signifikant erhöhtes Risiko für sekundären Hautkrebs. Diese knappe Kombination der verfügbaren Behandlungen und ihrer schwächenden Nebenwirkungen unterstreicht nur, wie wichtig es ist, sicherere und erträglichere hautbezogene Ganzkörpertherapien zu entdecken, und SGX301 zeigt das Potenzial, für viele potenzielle Kandidaten eine praktische Option zu werden.
Zurück zu dem Grund, warum die Fallstudie wichtig ist.
Wie und warum ist SGX301 besser?
In der von Dr. Poligone, Soligenix und seinen Investoren vorgelegten Fallstudie vom Februar wurde möglicherweise ein Einblick in den Erfolg des Phase-3-SGX301 gegeben. Und viele spekulieren, dass die Ergebnisse dieser Fallstudie der Vorläufer für kurzfristig positive Datennachrichten sein könnten.
In der unabhängigen Fallstudie hatte SGX301 bemerkenswerte Aussichten gezeigt und sich sowohl hinsichtlich der Wirksamkeit als auch des Sicherheitsprofils von anderen Behandlungen getrennt. Die Ergebnisse können mit anderen im Handel erhältlichen CTCL-Behandlungsmedikamenten verglichen werden, und das Ergebnis würde Bestand haben - SGX301 ist deutlich besser.
Darüber hinaus wird die Wirksamkeit herkömmlicher Front-Line-Lösungen beeinträchtigt, da die Behandlung von CTCL in einem frühen Stadium aufgrund von Einschränkungen bei der Standortzustellung besonders schwierig sein kann. Die Hauptherausforderung ist jedoch das Fehlen von Front-Line-Therapien und das betreffende Sicherheitsprofil der Therapien, die derzeit für eine längere Behandlung mit Wiederauftreten von Läsionen verwendet werden.
Darüber hinaus müssen diese konkurrierenden Therapien über viele Jahre verabreicht werden und führen häufig zu chronischen Hautschäden. Im Gegensatz dazu kann SGX301 sowohl die Behandlungsdauer als auch das Sicherheitsprofil der Kombinationstherapie von SGX301 letztendlich dazu führen, dass sich das Medikament als erstklassige CTCL-Behandlungsoption herausstellt. Hier ist der Grund:
Insbesondere wurde der von Dr. Poligone vorgestellte Fall SGX301 zur Behandlung eines Patienten mit FMF (folliculotropic mycosis fungoides), einem hochresistenten CTCL-Typ, verwendet, der zuvor nicht auf topische, orale und phototherapeutische Behandlungen und Medikamente angesprochen hatte. Dieser Patient war Teilnehmer an der Phase-3-FLASH-Studie (Fluorescent Light Activated Synthetic Hypericin) des Unternehmens, die mindestens 12 Wochen lang mit SGX301 behandelt wurde und eine signifikante Verbesserung erlebte, die schließlich zu einer vollständigen Beseitigung der Krankheit führte, die seit etwa vier Jahren anhält. Ist dieser Patient eine Anomalie? Die meisten denken nicht, vor allem, weil CTCL weit weniger verzeihend ist als eine vollständige Clearance-Diagnose zu ermöglichen. Und es gibt ein gleiches Argument, dass, wenn die Topline-Ergebnisse die Fallstudie imitieren,
Die SGX301-Therapie klingt komplex, aber ihr Erfolg liegt in ihrer Einfachheit
Einfach ausgedrückt ist SGX301 eine photodynamische Therapie mit nicht-UV-Licht, ein Teil der kombinierten Technologie, die das erhöhte Risiko für sekundäre Hautkrebserkrankungen, die mit UV-Behandlungen verbunden sind, nicht erhöht. Und im Gegensatz zur herkömmlichen UVA- und UVB-Phototherapie scheint der SGX301 das Langzeitrisiko für sekundäre Hautkrebserkrankungen nicht zu erhöhen, da er keine genetische Mutation verursacht.
Das Starten des Behandlungsprozesses ist einfach. Der erste Schritt besteht darin, dass der Patient die Salbe am Tag vor einem erwarteten Arztbesuch zu Hause auf seine Läsionen aufträgt. Dieses Verfahren ermöglicht es, das Hypericin bevorzugt von den malignen T-Zellen zu absorbieren. Am nächsten Tag besucht der Patient die Arztpraxis und sitzt oder steht vor einem proprietären, sicheren Fluoreszenzlichtgerät, bei dem die Läsionen durchschnittlich 5 bis 7 Minuten lang einer bestimmten Lichtwellenlänge ausgesetzt werden. Diese Kombination aus Salbenanwendung und Belichtung bildet eine einzige Behandlung.
Der Behandlungsverlauf in der Phase-3-Studie des Unternehmens ist durch zwei dieser Behandlungen pro Woche für mindestens 6 Wochen gekennzeichnet. Insbesondere scheint die Patientenbindung in der Studie hoch zu sein, was ein guter Indikator für die potenzielle Sicherheit und Wirksamkeit ist. Für diejenigen, die aufgrund bereits bestehender Erkrankungen einem höheren Risiko für die Nebenwirkungen der traditionellen Phototherapie ausgesetzt sind, ist dies jedoch ein noch wichtigerer Vorteil. Und da das Management von CTCL ein Prozess ist, der wahrscheinlich für den Rest des Lebens eines Patienten andauern wird, ist die Verfügbarkeit einer Behandlung, die seine störenden Eigenschaften minimiert, ohne eigene Nebenwirkungen zu verursachen, entscheidend, um die Aufmerksamkeit von Patienten und Ärzten auf sich zu ziehen.
Positivere Hinweise unterstützen die Fallstudie
Obwohl die vorläufigen "FLASH" -Studiendaten für Soligenix verblindet sind, können mehrere Hinweise des Data Monitoring Committee (DMC), die zwischen den Zeilen gelesen werden, das Vertrauen wecken, dass der therapeutische Nutzen von SGX301 günstig ist. Warum? Da die Phase-3-Studie als adaptive Studie konzipiert wurde, umfasste sie eine Zwischenanalyse, um das Risiko bei der Extrapolation von Daten aus der kleineren Phase-2-Studie potenziell zu verringern. Im weiteren Verlauf des Versuchs kann der nicht blinde DMC jedoch die tatsächlichen Versuchsdaten zu einem bestimmten Zeitpunkt überprüfen und Empfehlungen abgeben, z. B. Anpassungen der Stichprobengröße, um die vordefinierte strenge statistische Leistung von 90% beizubehalten.
Der Moment des Ablesens zwischen den Zeilen wurde bedeutender, nachdem das DMC die Empfehlung ausgesprochen hatte, zusätzliche Probanden in die Studie aufzunehmen, was den Beobachtern implizierte, dass sie bei der Behandlung einen vielversprechenden Arzneimitteleffekt sahen. Insbesondere hatte das DMC gleichzeitig die Befugnis, die Studie aufgrund von Sinnlosigkeit abzubrechen, insbesondere wenn das Medikament die statistische Schwelle von 90% bei einer Größenänderung nicht erreichen konnte. Es hat keines dieser Dinge getan. Stattdessen glauben viele, dass die Empfehlung eine gedämpfte Bestätigung der Zwischenergebnisse war, andernfalls wäre es eine unnötige und möglicherweise unethische medizinische Entscheidung, neue Probanden der Behandlung auszusetzen. Das haben sie auch nicht getan.
Vorbereitungen für die geplante Genehmigung
Soligenix hat wiederholt, dass die Topline-Daten aus der SGX301-Studie voraussichtlich in diesem Quartal veröffentlicht werden. Im Vorfeld der abgeschlossenen Studie hat das Unternehmen seine kaufmännische und geschäftliche Expertise sowohl auf der Ebene des Verwaltungsrats als auch der Geschäftsleitung gestärkt, um das Unternehmen nach erfolgreichen Ergebnissen der Phase 3 für ein beschleunigtes Wachstum zu positionieren.
Darüber hinaus hat Soligenix auf verschiedene strategische Optionen für die Vermarktung zugelassener Arzneimittel hingewiesen, einschließlich potenzieller Marketing- und Entwicklungspartnerschaften. Darüber hinaus können dem Unternehmen zur Verfügung stehende strategische Alternativen Fusionen, Übernahmen sowie Lizenzvereinbarungen für die gemeinsame Entwicklung und / oder Vermarktung umfassen. Und mit dem Potenzial des Arzneimittels, eine Front-Line-Option für Pflegekräfte zu werden, dem weltweiten Marktpotenzial von 250 Millionen US-Dollar pro Jahrist ein attraktiver Anreiz für Unternehmen, die eine langfristige Einnahmequelle sichern möchten.
Mit einer scheinbar starken Leistung in der Fallstudie nähert sich die Phase-3-Studie "FLASH" ihrem Endstadium und wird voraussichtlich im ersten Quartal 2020 abgeschlossen sein. Die endgültigen Ergebnisse aus Behandlungszyklus 1 liegen jedoch noch vor Das derzeit verstandene Sicherheitsprofil von SGX301 kann Ärzten an und für sich eine sichere Behandlung von CTCL an vorderster Front ermöglichen.
Das Vertrauen erhöhen?
Insbesondere die SNGX-Aktie ist seit Januar um über 100% gestiegen, da die Anleger gespannt auf die endgültigen Ergebnisse der klinischen Studien des Unternehmens warten. Dies ist ein Argument dafür, dass die aktuelle Marktbewertung des Unternehmens weit unter dem Potenzial einer wirksamen, gut verträglichen Behandlung liegt für kutanes T-Zell-Lymphom. Da sich die Ergebnisse der Phase-3-Studie von SGX301 dem geplanten Veröffentlichungsdatum nähern, möchten Anleger möglicherweise die Trends und Handelsaktivitäten der Aktie genau beobachten. Beide vermitteln eine Nachricht.
Und trotz des Kursanstiegs von rund 100% glaubt ein Research-Analyst von Zack, dass die Aktie massiv unterbewertet ist, und hat sein 12-Monats-Kursziel auf 8,00 USD pro Aktie festgelegt, was einem Anstieg des Aktienkurses um mehr als 195% gegenüber dem Vorjahr entspricht aktuelle Niveaus.
Dies sind eindeutig aufregende Zeiten für CTCL-Patienten, ihre Anbieter und für Soligenix. Und da die SGX301 "FLASH" -Studie nur die erste einer potenziellen katalysatorgefüllten Frühjahrssaison für das Unternehmen ist, ist es möglicherweise am sichersten, von der langen Seite des Handels in dieses Unternehmen zu investieren. Es können zu viele gute Dinge passieren, und der Zeitplan für diese Ereignisse steht unmittelbar bevor. Normalerweise tun Anleger gut daran, dem Geld zu folgen, und in diesem Fall sind die Anleger optimistisch in Bezug auf die Unternehmensaussichten.
Medienkontakt:
Kenny Ellis
Soulstring Media Group
ken@soulstringmedia.com
Offenlegung
PCG Advisory (PCG) -Forschungsberichte, Unternehmensprofile, Videos und andere Investor Relations-Materialien, Veröffentlichungen oder Präsentationen, einschließlich Webinhalte und Social Media-Beiträge, basieren auf Daten, die aus Quellen stammen, die wir für zuverlässig halten, für deren Richtigkeit und Gewährleistung jedoch keine Garantie übernommen wird sollen nicht vollständig sein. Daher sollten die Informationen nicht als Beratung ausgelegt werden, die auf die besonderen Anlagebedürfnisse eines Anlegers zugeschnitten ist. Alle in den Berichten, Unternehmensprofilen, Videos oder anderen Investor-Relations-Materialien und Präsentationen von PCG geäußerten Meinungen können sich ändern. PCG und seine verbundenen Unternehmen können jederzeit Aktien von Wertpapieren oder Optionen der auf dieser Website genannten Emittenten kaufen und verkaufen.
PCG Research ist ein Geschäftsbereich von PCG und bietet zahlenden Kunden Forschungsdienstleistungen an. PCG Digital ist ein weiterer Geschäftsbereich von PCG. Und bietet zahlenden Kunden Multimedia-Dienste an, einschließlich Videopräsentationen auf www.ceo3in60.com. (Informationen auf der vorstehenden Website werden nicht in diese Website aufgenommen.) Im Sinne von Abschnitt 17 (b) des Wertpapiergesetzes und im Interesse einer vollständigen Offenlegung machen wir den Leser darauf aufmerksam, dass PCG eine Investor-Relations-Firma ist von bestimmten Unternehmen eingestellt, um das Bewusstsein der Anleger für die Small-Cap-Aktiengemeinschaft zu stärken.
Da wir eine Entschädigung für die Verbreitung der Informationen über unsere Kunden erhalten, sollten unsere öffentlich verbreiteten Veröffentlichungen in keiner Weise als unabhängig angesehen werden. Wir bestätigen hiermit, dass kein Teil unserer Vergütung direkt oder indirekt mit der spezifischen Empfehlung oder den Ansichten in Berichten verbunden war, ist oder sein wird. Unsere erbrachten Dienstleistungen und kommerziellen Anzeigen stehen in keinem Zusammenhang mit der Aktienkursentwicklung eines Kunden und sind auch nicht von dieser abhängig. Wir werden manchmal für kommerzielle Werbung und Ausschüttungen in bar, in Aktien, nach Regel 144, Optionsscheinen, Optionen oder anderen Wertpapieren anstelle oder zusätzlich zu unserem angegebenen Vergütungsplan bezahlt. Diese Entschädigung und das Eigentum an Wertpapieren eines Kunden Die Stammaktien stellen einen Interessenkonflikt hinsichtlich unserer Fähigkeit dar, in unserer Kommunikation über unsere profilierten Unternehmen objektiv zu bleiben. Weitere Informationen erhalten Sie auf der Website unseres Kundenunternehmens. Bei anderen Gelegenheiten können wir kommerzielle Werbung schreiben oder ein bestimmtes Unternehmen bewerben. Weitere finanzielle Angaben, falls vorhanden, finden Sie hier Link .
Begründen Sie eine Investitionsentscheidung niemals auf Informationen auf dieser Website oder auf E-Mails, die Sie möglicherweise von PCG erhalten. PCG wurde möglicherweise entschädigt, und unsere Mitarbeiter und verbundenen Unternehmen besitzen möglicherweise Aktien, die sie entweder vor, während oder nach der Veröffentlichung des Unternehmensprofils auf dem freien Markt gekauft haben. Dies ist ein inhärenter Interessenkonflikt in unseren Aussagen und Meinungen und solchen Aussagen und Meinungen können nicht als unabhängig angesehen werden. PCG und sein Management können von einer Erhöhung des Aktienkurses der profilierten Unternehmen profitieren und das Recht behalten, die zu einem bestimmten Zeitpunkt gekauften Aktien zu verkaufen, auch kurz nach der Veröffentlichung des entsprechenden Unternehmensprofils. Wenn Sie Aktien kaufen oder verkaufen, gehen Sie bitte davon aus, dass PCG vor, während und / oder nach der Veröffentlichung des besprochenen Unternehmens kauft und / oder verkauft. Wir werden nicht beraten, wann wir uns für den Kauf oder Verkauf entscheiden, und wir werden keine Meinung dazu abgeben, wann andere verkaufen sollten. Jeder Anleger muss diese Entscheidung auf der Grundlage seiner Beurteilung des Marktes treffen.
Aktienmarktinvestitionen sind von Natur aus riskant. PCG ist nicht verantwortlich für Gewinne oder Verluste, die sich aus den auf dieser Website, in ihren Forschungsberichten, Unternehmensprofilen oder in anderen Investor-Relations-Materialien oder Präsentationen, die es elektronisch oder in gedruckter Form veröffentlicht, geäußerten Meinungen ergeben.
Wir empfehlen allen Anlegern nachdrücklich, ihre eigenen Untersuchungen durchzuführen, bevor sie eine Anlageentscheidung treffen. Weitere Informationen zu Börseninvestitionen finden Sie bei der Securities and Exchange Commission ("SEC") unter www.sec.gov.
Nachfolgend finden Sie eine Liste unserer 17 (b) Angaben gemäß der SEC-Regel:
Mitarbeiter und Mitarbeiter von PCG können von Zeit zu Zeit Wertpapiere von Kundenunternehmen und Unternehmen handeln, die Gegenstand von von PCG Research veröffentlichten Forschungsergebnissen und verwandten Veröffentlichungen sind. Die Veröffentlichung von Informationen über zukünftige Berichterstattung, Ratingänderungen und / oder Änderungen der Gewinnschätzungen vor der Veröffentlichung ist in keiner Weise untersagt.
Die Quellversion dieser Pressemitteilung finden Sie unter https://www.newsfilecorp.com/release/52613
copyright (c) newsfile corp. 2020. Alle Rechte vorbehalten
Unabhängige Fallstudie für Soligenix 'CTCL-Medikament SGX301 treibt bullische Stimmung an; Topline "FLASH" -Studiendaten für das erste Quartal 2020 erwartet
Durch
Veröffentlicht: 20. Februar 2020, 8:50 Uhr ET
TEILEN
Miami Beach, Florida, 20. Februar 2020 (Newsfile Corp. über COMTEX) - Miami Beach, Florida - (Newsfile Corp. - 20. Februar 2020) - Soligenix nähert sich möglicherweise einem Transformationspunkt in seiner Geschichte als Daten aus seiner Phase 3 Die SGX301 (FLASH) -Studie zur Behandlung des kutanen T-Zell-Lymphoms (CTCL) nähert sich seiner Freisetzung. Die Topline-Daten dieser Spätstudie werden in weniger als 40 Tagen erwartet. Und wenn diese Veröffentlichung Daten validieren kann, die aus einer kürzlich von Dr. Brian Poligone, MD, Ph.D., durchgeführten Soligenix SNGX bekannt sind, kann +3.03% den ersten von mehreren potenziellen Katalysatoren verdienen, die den Shareholder Value steigern können.
Die klinische Phase-3-Studie zielt auf das kutane T-Zell-Lymphom (CTCL) ab und ist eine doppelblinde, randomisierte, placebokontrollierte Studie mit drei 6-wöchigen Behandlungszyklen. Die Studie wird mit einer Behandlung von rund 169 Patienten abgeschlossen. Die wichtigsten Ergebnisse des doppelblinden Behandlungszyklus 1 werden voraussichtlich vor Ende des ersten Quartals 2020 veröffentlicht.
Über den Nutzen für das Unternehmen hinaus möchte Soligenix mit SGX301 und anderen Pipeline-Produkten Behandlungen auf den Markt bringen, die auf ungedeckte medizinische Bedürfnisse bei schwerwiegenden Erkrankungen abzielen. Diese Unterscheidung kann das Unternehmen in eine hervorragende Position bringen, um Partnerschaften zu gewinnen und möglicherweise den Status einer FDA-Prioritätsprüfung für einige seiner Pipeline-Produkte zu erhalten. Für die nächsten 40 Tage ist jedoch alles auf SGX301 gerichtet.
Kannst du dieses Video nicht sehen? Besuchen Sie:
https://www.youtube.com/watch?v=QQoE_S91jYI
Positives Ergebnis in der unabhängigen SGX301-Fallstudie
Soligenix-Aktie steigt seit Jahresbeginn, wobei die Aktien ab Dienstag um mehr als 100% gestiegen sind. Insbesondere scheint der Preisanstieg durch positive Kommentare für mindestens zwei der späten Phase-3-Studien des Unternehmens, SGX301 und SGX942, gerechtfertigt zu sein. Außerdem wurde auf dem 4. Weltkongress eine aktuelle Fallstudie für das CTCL-Medikament des Unternehmens vorgestellt, die das Interesse des Arzneimittels weckte, eine Front-Line-Behandlung gegen CTCL im Frühstadium zu werden. Wenn dies der Fall ist, wird das Medikament den Patienten die notwendige Linderung bringen und als erstes Unternehmen eine "sichere und wirksame" Front-Line-Therapie auf den Markt bringen, die die mit CTCL verbundenen Läsionen erheblich reduzieren oder beseitigen kann.
Auch Soligenix hat den Aktionären gute Gründe gegeben, optimistisch über die bevorstehenden SGX301-Topline-Daten zu sein. Erstens hat das Unternehmen eine produktive Zwischenanalyse mit positiver Empfehlung des Independent Data Monitoring Committee (DMC) durchgeführt. Zweitens hat Soligenix in Erwartung positiver Ergebnisse sein C-Level-Team verstärkt. Und drittens hat das Unternehmen mehrfach erklärt, dass das Unternehmen ausreichend finanziert ist, um in den beiden Phase-3-Studien zu Top-Line-Ergebnissen zu gelangen. Darüber hinaus war Soligenix außerordentlich transparent und zeitnah für die Bereitstellung von Studienaktualisierungen und beweist, dass das Management über die erforderlichen Fähigkeiten verfügt, um Studien effizient durch jede Phase einer klinischen Studie zu navigieren.
Zuletzt hat Soligenix ein Interview veröffentlichtDies unterstreicht mindestens eine der Meinungen des Prüfers zu SGX301. Unnötig zu erwähnen, dass der potenzielle therapeutische Wert des Arzneimittels ziemlich optimistisch ist. Das Interview stammt aus einer Fallstudienpräsentation, die im Februar dieses Jahres von Dr. Brian Poligone, dem Direktor der Rochester Skin Lymphoma Medical Group, in Fairfort, New York, gehalten wurde. Dr. Poligone bringt nicht nur mehr als 15 Jahre Erfahrung in der Behandlung von CTCL-Patienten mit, es ist auch wichtig zu beachten, dass er als "FLASH" -Studienprüfer möglicherweise gesehen hat, was andere nicht gesehen haben. Wenn er also über SGX301 spricht, hören die Leute zu.
SGX301 bei 4 präsentiert [th] World Congress im Februar
klar, Dr. Poligone des optimistische Stimmung fügt das Niveau des Vertrauens für positive vorläufige Topline - Ergebnisse. Während eines Forschungsinterviews von Zack am 18. Februar wurden mehrere Kommentare abgegeben, die zu einem wachsenden Soundtrack beeindruckender Rückmeldungen beitragen. Darüber hinaus lässt das Vertrauen in seine Ausführungen wenig Raum für eine ambivalente Interpretation. Aus diesem Interview sagte Dr. Poligone:
"Die Sicherheit von SGX301 in Verbindung mit dem Langzeitbehandlungseffekt war äußerst beeindruckend." [seine Antwort auf eine Frage zu den Ergebnissen der Patientenfallstudie]
"Unser Hauptziel ist es, die Krankheit auf die Therapie ansprechen zu lassen, ohne dem Patienten neue Risiken oder Nebenwirkungen aufzuerlegen."
"Es (SGX301) wäre eine Front-Line-Option für Patienten im Frühstadium."
"SGX301 könnte für eine Mehrheit meiner Patienten im Frühstadium eine geeignete Option sein."
Es ist wichtig zu bedenken, dass diese Kommentare von einem führenden CTCL-Behandlungsanbieter stammen. Darüber hinaus gilt Dr. Poligone als Autorität im Bereich der Behandlung von CTCL. Am wichtigsten für seinen Beitrag ist jedoch seine kürzlich abgeschlossene Fallstudie zu SGX301, in der er einen Patienten behandelte, der von den derzeit verfügbaren Medikamenten für die Krankheit nur einen geringen bis keinen therapeutischen Nutzen gezeigt hat. Als Reaktion auf das Fehlen von Ergebnissen aus fünf früheren Therapien verabreichte er diesem Patienten die SGX301-Kombinationstherapie mit Licht und es wurde ein robustes Ansprechen erzielt. Er präsentierte seine Ergebnisse auf dem 4. Weltkongress. Und die Präsentation war für das SGX301-Profil ausgesprochen günstig. Zurück dazu gleich.
Wenn Sie jedoch einen Schritt zurücktreten, ist es wichtig, den Effektmechanismus zu verstehen sowie zu verstehen, warum und wie SGX301 im Vergleich zu Wettbewerbsprodukten möglicherweise Überlegenheit zeigen kann. Wie bereits erwähnt, ist die derzeitige Behandlung von CTCL mit erheblichen Herausforderungen behaftet, die erhebliche und frustrierende Mängel mit sich bringen, die sowohl bei Patienten als auch bei Ärzten zu Problemen führen können. Während die Fälle unterschiedlich umfangreich sein können, manifestiert sich das kutane T-Zell-Lymphom für die meisten als unansehnliche und oft schmerzhafte Hautläsionen, die bis zu 80% der Hautoberfläche betreffen können. Es ist wichtig zu beachten, dass CTCL zwar normalerweise nicht tödlich verläuft, es jedoch keine kurative Behandlung für die Krankheit gibt.
Darüber hinaus behandeln Ärzte bei aktuellen Behandlungsoptionen häufig nicht nur die Läsionen des Patienten, sondern behandeln auch die Nebenwirkungen von CTCL-Medikamenten, wobei sie sich weiterhin auf die potenziellen chronischen Probleme konzentrieren, die diese Medikamente verursachen können. Diese Zustände treten tendenziell bei der späteren Behandlung der Krankheit auf.
Behandlungen im Frühstadium sind jedoch ebenfalls eine Herausforderung und beschränken sich meist auf topischen Stickstoffsenf, topische Steroide und schädliche Phototherapie. Topische Behandlungen können bei der Verringerung der Größe von Hautläsionen nützlich sein, führen jedoch mit ziemlicher Sicherheit zu einem Krankheitsrückfall.
Zusätzliche Arten von topischen Medikamenten können bestenfalls kurzfristig Linderung bringen, aber die meisten verursachen bekanntermaßen erhebliche Hautreizungen, die manchmal dazu führen, dass der Patient die Behandlung nicht einhält. Im Gegensatz dazu wird angenommen, dass SGX301 das toleranteste Sicherheitsprofil aufweist und aus der vorgestellten Patientenfallstudie möglicherweise einen 12-wöchigen Behandlungsprozess erfordert.
Obwohl sich eine schmalbandige Phototherapie bei der Behandlung größerer Oberflächen in den frühen Stadien der Krankheit als nützlich erweisen kann, besteht in der Praxis immer noch die Möglichkeit eines Rückfalls und ein signifikant erhöhtes Risiko für sekundären Hautkrebs. Diese knappe Kombination der verfügbaren Behandlungen und ihrer schwächenden Nebenwirkungen unterstreicht nur, wie wichtig es ist, sicherere und erträglichere hautbezogene Ganzkörpertherapien zu entdecken, und SGX301 zeigt das Potenzial, für viele potenzielle Kandidaten eine praktische Option zu werden.
Zurück zu dem Grund, warum die Fallstudie wichtig ist.
Wie und warum ist SGX301 besser?
In der von Dr. Poligone, Soligenix und seinen Investoren vorgelegten Fallstudie vom Februar wurde möglicherweise ein Einblick in den Erfolg des Phase-3-SGX301 gegeben. Und viele spekulieren, dass die Ergebnisse dieser Fallstudie der Vorläufer für kurzfristig positive Datennachrichten sein könnten.
In der unabhängigen Fallstudie hatte SGX301 bemerkenswerte Aussichten gezeigt und sich sowohl hinsichtlich der Wirksamkeit als auch des Sicherheitsprofils von anderen Behandlungen getrennt. Die Ergebnisse können mit anderen im Handel erhältlichen CTCL-Behandlungsmedikamenten verglichen werden, und das Ergebnis würde Bestand haben - SGX301 ist deutlich besser.
Darüber hinaus wird die Wirksamkeit herkömmlicher Front-Line-Lösungen beeinträchtigt, da die Behandlung von CTCL in einem frühen Stadium aufgrund von Einschränkungen bei der Standortzustellung besonders schwierig sein kann. Die Hauptherausforderung ist jedoch das Fehlen von Front-Line-Therapien und das betreffende Sicherheitsprofil der Therapien, die derzeit für eine längere Behandlung mit Wiederauftreten von Läsionen verwendet werden.
Darüber hinaus müssen diese konkurrierenden Therapien über viele Jahre verabreicht werden und führen häufig zu chronischen Hautschäden. Im Gegensatz dazu kann SGX301 sowohl die Behandlungsdauer als auch das Sicherheitsprofil der Kombinationstherapie von SGX301 letztendlich dazu führen, dass sich das Medikament als erstklassige CTCL-Behandlungsoption herausstellt. Hier ist der Grund:
Insbesondere wurde der von Dr. Poligone vorgestellte Fall SGX301 zur Behandlung eines Patienten mit FMF (folliculotropic mycosis fungoides), einem hochresistenten CTCL-Typ, verwendet, der zuvor nicht auf topische, orale und phototherapeutische Behandlungen und Medikamente angesprochen hatte. Dieser Patient war Teilnehmer an der Phase-3-FLASH-Studie (Fluorescent Light Activated Synthetic Hypericin) des Unternehmens, die mindestens 12 Wochen lang mit SGX301 behandelt wurde und eine signifikante Verbesserung erlebte, die schließlich zu einer vollständigen Beseitigung der Krankheit führte, die seit etwa vier Jahren anhält. Ist dieser Patient eine Anomalie? Die meisten denken nicht, vor allem, weil CTCL weit weniger verzeihend ist als eine vollständige Clearance-Diagnose zu ermöglichen. Und es gibt ein gleiches Argument, dass, wenn die Topline-Ergebnisse die Fallstudie imitieren,
Die SGX301-Therapie klingt komplex, aber ihr Erfolg liegt in ihrer Einfachheit
Einfach ausgedrückt ist SGX301 eine photodynamische Therapie mit nicht-UV-Licht, ein Teil der kombinierten Technologie, die das erhöhte Risiko für sekundäre Hautkrebserkrankungen, die mit UV-Behandlungen verbunden sind, nicht erhöht. Und im Gegensatz zur herkömmlichen UVA- und UVB-Phototherapie scheint der SGX301 das Langzeitrisiko für sekundäre Hautkrebserkrankungen nicht zu erhöhen, da er keine genetische Mutation verursacht.
Das Starten des Behandlungsprozesses ist einfach. Der erste Schritt besteht darin, dass der Patient die Salbe am Tag vor einem erwarteten Arztbesuch zu Hause auf seine Läsionen aufträgt. Dieses Verfahren ermöglicht es, das Hypericin bevorzugt von den malignen T-Zellen zu absorbieren. Am nächsten Tag besucht der Patient die Arztpraxis und sitzt oder steht vor einem proprietären, sicheren Fluoreszenzlichtgerät, bei dem die Läsionen durchschnittlich 5 bis 7 Minuten lang einer bestimmten Lichtwellenlänge ausgesetzt werden. Diese Kombination aus Salbenanwendung und Belichtung bildet eine einzige Behandlung.
Der Behandlungsverlauf in der Phase-3-Studie des Unternehmens ist durch zwei dieser Behandlungen pro Woche für mindestens 6 Wochen gekennzeichnet. Insbesondere scheint die Patientenbindung in der Studie hoch zu sein, was ein guter Indikator für die potenzielle Sicherheit und Wirksamkeit ist. Für diejenigen, die aufgrund bereits bestehender Erkrankungen einem höheren Risiko für die Nebenwirkungen der traditionellen Phototherapie ausgesetzt sind, ist dies jedoch ein noch wichtigerer Vorteil. Und da das Management von CTCL ein Prozess ist, der wahrscheinlich für den Rest des Lebens eines Patienten andauern wird, ist die Verfügbarkeit einer Behandlung, die seine störenden Eigenschaften minimiert, ohne eigene Nebenwirkungen zu verursachen, entscheidend, um die Aufmerksamkeit von Patienten und Ärzten auf sich zu ziehen.
Positivere Hinweise unterstützen die Fallstudie
Obwohl die vorläufigen "FLASH" -Studiendaten für Soligenix verblindet sind, können mehrere Hinweise des Data Monitoring Committee (DMC), die zwischen den Zeilen gelesen werden, das Vertrauen wecken, dass der therapeutische Nutzen von SGX301 günstig ist. Warum? Da die Phase-3-Studie als adaptive Studie konzipiert wurde, umfasste sie eine Zwischenanalyse, um das Risiko bei der Extrapolation von Daten aus der kleineren Phase-2-Studie potenziell zu verringern. Im weiteren Verlauf des Versuchs kann der nicht blinde DMC jedoch die tatsächlichen Versuchsdaten zu einem bestimmten Zeitpunkt überprüfen und Empfehlungen abgeben, z. B. Anpassungen der Stichprobengröße, um die vordefinierte strenge statistische Leistung von 90% beizubehalten.
Der Moment des Ablesens zwischen den Zeilen wurde bedeutender, nachdem das DMC die Empfehlung ausgesprochen hatte, zusätzliche Probanden in die Studie aufzunehmen, was den Beobachtern implizierte, dass sie bei der Behandlung einen vielversprechenden Arzneimitteleffekt sahen. Insbesondere hatte das DMC gleichzeitig die Befugnis, die Studie aufgrund von Sinnlosigkeit abzubrechen, insbesondere wenn das Medikament die statistische Schwelle von 90% bei einer Größenänderung nicht erreichen konnte. Es hat keines dieser Dinge getan. Stattdessen glauben viele, dass die Empfehlung eine gedämpfte Bestätigung der Zwischenergebnisse war, andernfalls wäre es eine unnötige und möglicherweise unethische medizinische Entscheidung, neue Probanden der Behandlung auszusetzen. Das haben sie auch nicht getan.
Vorbereitungen für die geplante Genehmigung
Soligenix hat wiederholt, dass die Topline-Daten aus der SGX301-Studie voraussichtlich in diesem Quartal veröffentlicht werden. Im Vorfeld der abgeschlossenen Studie hat das Unternehmen seine kaufmännische und geschäftliche Expertise sowohl auf der Ebene des Verwaltungsrats als auch der Geschäftsleitung gestärkt, um das Unternehmen nach erfolgreichen Ergebnissen der Phase 3 für ein beschleunigtes Wachstum zu positionieren.
Darüber hinaus hat Soligenix auf verschiedene strategische Optionen für die Vermarktung zugelassener Arzneimittel hingewiesen, einschließlich potenzieller Marketing- und Entwicklungspartnerschaften. Darüber hinaus können dem Unternehmen zur Verfügung stehende strategische Alternativen Fusionen, Übernahmen sowie Lizenzvereinbarungen für die gemeinsame Entwicklung und / oder Vermarktung umfassen. Und mit dem Potenzial des Arzneimittels, eine Front-Line-Option für Pflegekräfte zu werden, dem weltweiten Marktpotenzial von 250 Millionen US-Dollar pro Jahrist ein attraktiver Anreiz für Unternehmen, die eine langfristige Einnahmequelle sichern möchten.
Mit einer scheinbar starken Leistung in der Fallstudie nähert sich die Phase-3-Studie "FLASH" ihrem Endstadium und wird voraussichtlich im ersten Quartal 2020 abgeschlossen sein. Die endgültigen Ergebnisse aus Behandlungszyklus 1 liegen jedoch noch vor Das derzeit verstandene Sicherheitsprofil von SGX301 kann Ärzten an und für sich eine sichere Behandlung von CTCL an vorderster Front ermöglichen.
Das Vertrauen erhöhen?
Insbesondere die SNGX-Aktie ist seit Januar um über 100% gestiegen, da die Anleger gespannt auf die endgültigen Ergebnisse der klinischen Studien des Unternehmens warten. Dies ist ein Argument dafür, dass die aktuelle Marktbewertung des Unternehmens weit unter dem Potenzial einer wirksamen, gut verträglichen Behandlung liegt für kutanes T-Zell-Lymphom. Da sich die Ergebnisse der Phase-3-Studie von SGX301 dem geplanten Veröffentlichungsdatum nähern, möchten Anleger möglicherweise die Trends und Handelsaktivitäten der Aktie genau beobachten. Beide vermitteln eine Nachricht.
Und trotz des Kursanstiegs von rund 100% glaubt ein Research-Analyst von Zack, dass die Aktie massiv unterbewertet ist, und hat sein 12-Monats-Kursziel auf 8,00 USD pro Aktie festgelegt, was einem Anstieg des Aktienkurses um mehr als 195% gegenüber dem Vorjahr entspricht aktuelle Niveaus.
Dies sind eindeutig aufregende Zeiten für CTCL-Patienten, ihre Anbieter und für Soligenix. Und da die SGX301 "FLASH" -Studie nur die erste einer potenziellen katalysatorgefüllten Frühjahrssaison für das Unternehmen ist, ist es möglicherweise am sichersten, von der langen Seite des Handels in dieses Unternehmen zu investieren. Es können zu viele gute Dinge passieren, und der Zeitplan für diese Ereignisse steht unmittelbar bevor. Normalerweise tun Anleger gut daran, dem Geld zu folgen, und in diesem Fall sind die Anleger optimistisch in Bezug auf die Unternehmensaussichten.
Medienkontakt:
Kenny Ellis
Soulstring Media Group
ken@soulstringmedia.com
Offenlegung
PCG Advisory (PCG) -Forschungsberichte, Unternehmensprofile, Videos und andere Investor Relations-Materialien, Veröffentlichungen oder Präsentationen, einschließlich Webinhalte und Social Media-Beiträge, basieren auf Daten, die aus Quellen stammen, die wir für zuverlässig halten, für deren Richtigkeit und Gewährleistung jedoch keine Garantie übernommen wird sollen nicht vollständig sein. Daher sollten die Informationen nicht als Beratung ausgelegt werden, die auf die besonderen Anlagebedürfnisse eines Anlegers zugeschnitten ist. Alle in den Berichten, Unternehmensprofilen, Videos oder anderen Investor-Relations-Materialien und Präsentationen von PCG geäußerten Meinungen können sich ändern. PCG und seine verbundenen Unternehmen können jederzeit Aktien von Wertpapieren oder Optionen der auf dieser Website genannten Emittenten kaufen und verkaufen.
PCG Research ist ein Geschäftsbereich von PCG und bietet zahlenden Kunden Forschungsdienstleistungen an. PCG Digital ist ein weiterer Geschäftsbereich von PCG. Und bietet zahlenden Kunden Multimedia-Dienste an, einschließlich Videopräsentationen auf www.ceo3in60.com. (Informationen auf der vorstehenden Website werden nicht in diese Website aufgenommen.) Im Sinne von Abschnitt 17 (b) des Wertpapiergesetzes und im Interesse einer vollständigen Offenlegung machen wir den Leser darauf aufmerksam, dass PCG eine Investor-Relations-Firma ist von bestimmten Unternehmen eingestellt, um das Bewusstsein der Anleger für die Small-Cap-Aktiengemeinschaft zu stärken.
Da wir eine Entschädigung für die Verbreitung der Informationen über unsere Kunden erhalten, sollten unsere öffentlich verbreiteten Veröffentlichungen in keiner Weise als unabhängig angesehen werden. Wir bestätigen hiermit, dass kein Teil unserer Vergütung direkt oder indirekt mit der spezifischen Empfehlung oder den Ansichten in Berichten verbunden war, ist oder sein wird. Unsere erbrachten Dienstleistungen und kommerziellen Anzeigen stehen in keinem Zusammenhang mit der Aktienkursentwicklung eines Kunden und sind auch nicht von dieser abhängig. Wir werden manchmal für kommerzielle Werbung und Ausschüttungen in bar, in Aktien, nach Regel 144, Optionsscheinen, Optionen oder anderen Wertpapieren anstelle oder zusätzlich zu unserem angegebenen Vergütungsplan bezahlt. Diese Entschädigung und das Eigentum an Wertpapieren eines Kunden Die Stammaktien stellen einen Interessenkonflikt hinsichtlich unserer Fähigkeit dar, in unserer Kommunikation über unsere profilierten Unternehmen objektiv zu bleiben. Weitere Informationen erhalten Sie auf der Website unseres Kundenunternehmens. Bei anderen Gelegenheiten können wir kommerzielle Werbung schreiben oder ein bestimmtes Unternehmen bewerben. Weitere finanzielle Angaben, falls vorhanden, finden Sie hier Link .
Begründen Sie eine Investitionsentscheidung niemals auf Informationen auf dieser Website oder auf E-Mails, die Sie möglicherweise von PCG erhalten. PCG wurde möglicherweise entschädigt, und unsere Mitarbeiter und verbundenen Unternehmen besitzen möglicherweise Aktien, die sie entweder vor, während oder nach der Veröffentlichung des Unternehmensprofils auf dem freien Markt gekauft haben. Dies ist ein inhärenter Interessenkonflikt in unseren Aussagen und Meinungen und solchen Aussagen und Meinungen können nicht als unabhängig angesehen werden. PCG und sein Management können von einer Erhöhung des Aktienkurses der profilierten Unternehmen profitieren und das Recht behalten, die zu einem bestimmten Zeitpunkt gekauften Aktien zu verkaufen, auch kurz nach der Veröffentlichung des entsprechenden Unternehmensprofils. Wenn Sie Aktien kaufen oder verkaufen, gehen Sie bitte davon aus, dass PCG vor, während und / oder nach der Veröffentlichung des besprochenen Unternehmens kauft und / oder verkauft. Wir werden nicht beraten, wann wir uns für den Kauf oder Verkauf entscheiden, und wir werden keine Meinung dazu abgeben, wann andere verkaufen sollten. Jeder Anleger muss diese Entscheidung auf der Grundlage seiner Beurteilung des Marktes treffen.
Aktienmarktinvestitionen sind von Natur aus riskant. PCG ist nicht verantwortlich für Gewinne oder Verluste, die sich aus den auf dieser Website, in ihren Forschungsberichten, Unternehmensprofilen oder in anderen Investor-Relations-Materialien oder Präsentationen, die es elektronisch oder in gedruckter Form veröffentlicht, geäußerten Meinungen ergeben.
Wir empfehlen allen Anlegern nachdrücklich, ihre eigenen Untersuchungen durchzuführen, bevor sie eine Anlageentscheidung treffen. Weitere Informationen zu Börseninvestitionen finden Sie bei der Securities and Exchange Commission ("SEC") unter www.sec.gov.
Nachfolgend finden Sie eine Liste unserer 17 (b) Angaben gemäß der SEC-Regel:
Mitarbeiter und Mitarbeiter von PCG können von Zeit zu Zeit Wertpapiere von Kundenunternehmen und Unternehmen handeln, die Gegenstand von von PCG Research veröffentlichten Forschungsergebnissen und verwandten Veröffentlichungen sind. Die Veröffentlichung von Informationen über zukünftige Berichterstattung, Ratingänderungen und / oder Änderungen der Gewinnschätzungen vor der Veröffentlichung ist in keiner Weise untersagt.
Die Quellversion dieser Pressemitteilung finden Sie unter https://www.newsfilecorp.com/release/52613
copyright (c) newsfile corp. 2020. Alle Rechte vorbehalten
Schon erstaunlich, wie sich die Aktie im negativen Umfeld hält
PRESSEMITTEILUNG
Soligenix kündigt erfolgreiche Demonstration der Wärmestabilisierung für die Filovirus-Impfstoffplattform an
Durch
Veröffentlicht: 27. Februar 2020, 7:00 Uhr ET
TEILEN
Fokus auf das Marburg-Virus als Reaktion auf Regierungsprioritäten
PRINCETON, NJ, 27. Februar 2020 / PRNewswire / - Soligenix, Inc. SNGX, +12.72% (Soligenix oder das Unternehmen), ein biopharmazeutisches Unternehmen im Spätstadium, das sich auf die Entwicklung und Vermarktung von Produkten zur Behandlung seltener Krankheiten konzentriert, bei denen ein ungedeckter medizinischer Bedarf besteht, gab heute seine laufende Zusammenarbeit mit der Universität von Hawaii in Manoa (UHM) und bekannt Hawaii Biotech Inc. (HBI) hat nach Ansicht des Unternehmens einen bedeutenden Meilenstein in der Entwicklung von hitzebeständigen Filovirus-Impfstoffen erreicht, bei denen die Plattform in nicht-menschlichen Primatenmodellen mit monovalenten und zweiwertigen Impfstoffen praktikable thermostabile Formulierungen und Schutz gezeigt hat Kandidaten für die drei tödlichsten humanpathogenen Filoviren (Ebola-Virus, Sudan-Virus und Marburg-Virus).
Im Geschäftsbereich Public Health Solutions des Unternehmens haben laufende Kooperationen mit Axel Lehrer, PhD der Abteilung für Tropenmedizin, Medizinische Mikrobiologie und Pharmakologie, der Medizinischen Fakultät John A. Burns (JABSOM), UHM und HBI, die Machbarkeit der Entwicklung einer Wärmestabilität gezeigt Untereinheit-Protein-Impfstoffe gegen Filovirus. Die Schutzwirkung wurde bei nichtmenschlichen Primaten gegen eine Infektion mit dem Ebola-Virus, dem Sudan-Virus und dem Marburg-Virus nachgewiesen. Der Schutz wurde sowohl mit einwertigen als auch mit zweiwertigen Impfstoffkombinationen erreicht. Es wurden Formulierungsbedingungen identifiziert, um eine Wärmestabilisierung jedes Antigens allein oder in Kombination für mindestens 12 Wochen bei 40 Grad Celsius (104 Grad Fahrenheit) zu ermöglichen.
"Filoviren sind in Gebieten der Welt endemisch, in denen die Stromversorgung ungewiss sein kann, was einen thermostabilen Impfstoff besonders wertvoll macht", erklärte Dr. Lehrer, Assistenzprofessor an der Abteilung für Tropenmedizin, Medizinische Mikrobiologie und Pharmakologie der JABSOM. "Unsere bisherigen Arbeiten haben nicht nur die Machbarkeit einer schnellen und effizienten Herstellung gezeigt, sondern auch das Potenzial für einen breit anwendbaren und leicht zu verteilenden Impfstoff. Da das Marburg-Virus für die US-Regierung weiterhin ein ungedeckter medizinischer Bedarf ist, sind wir es jetzt gezielte Fokussierung und Beschleunigung der Evaluierung des Marburg-Virus-Impfstoffs. "
"Wir glauben, dass die Entwicklung eines Impfstoffs mit verbesserter Stabilität bei erhöhten Temperaturen, der die mit der Lagerung und Verteilung der Kühlkette verbundenen Kosten und logistischen Belastungen vermeiden kann, einen deutlichen Vorteil gegenüber anderen derzeit in der Entwicklung befindlichen Impfstoffen bieten kann", erklärte Christopher J. Schaber, PhD, Präsident und Chief Executive Officer von Soligenix. "In Übereinstimmung mit dem Feedback der US-Regierung werden wir uns nun speziell auf das Marburg-Virus konzentrieren."
Informationen zur Filovirus-Infektion
Die Ebola-Virus-Krankheit wird durch eine von fünf Ebolavirus-Arten verursacht, von denen vier beim Menschen Krankheiten verursachen, darunter das bekannteste Mitglied, das Zaire-Ebolavirus (Ebola-Virus). Alle Arten des Ebolavirus gehören zur Familie der Filoviridae, einer Familie, die außerdem das ebenso humanpathogene Marburg-Virus enthält. Es wird angenommen, dass das Ebola-Virus in verschiedenen Tierarten in Afrika beheimatet ist, obwohl der spezifische Wirt des Reservoirs noch unbekannt ist. Seit 1967 sind mehrere Ausbrüche der Ebola- und Marburg-Viruskrankheit bekannt, wobei der größte Ausbruch 2014 in Westafrika begann. Laut den Centers for Disease waren über 26.000 bestätigte / wahrscheinliche / vermutete Fälle mit einer geschätzten Zahl von über 11.000 Todesopfern betroffen Kontrolle und Prävention (CDC), einschließlich einiger Fälle in Europa und den Vereinigten Staaten.
Die Übertragung von Filoviren erfordert den direkten Kontakt mit Körperflüssigkeiten einer infizierten Person oder den Kontakt mit infizierten Tieren. Die Sterblichkeitsrate aufgrund von Filovirus-Infektionen ist extrem hoch und kann manchmal durch die Qualität der verfügbaren unterstützenden Versorgung beeinflusst werden, wobei der Schwerpunkt auf dem frühen Beginn der Behandlung liegt. Die Auflösung der Krankheit hängt weitgehend vom eigenen Immunsystem des Patienten ab. Es gibt keine zugelassene Behandlung für Ebola oder Marburg, obwohl sich die Forschung zu beiden seit Beginn des Ausbruchs 2014 beschleunigt hat und bei fortgeschrittenen klinischen Tests von Immuntherapeutika gegen Zaire-Ebolavirus erhebliche Fortschritte erzielt wurden . Es gibt einen zugelassenen Impfstoff, der für das Ebola-Virus ( Zaire-Ebolavirus) bei weniger als -60 ° C gelagert werden muss), aber für das Marburg-Virus ( Marburg- Marburg-Virus ) oder das Sudan-Virus ( Sudan-Ebolavirus ) ist noch kein Schutz verfügbar .
Über die John A. Burns School of Medicine der Universität von Hawaii in Manoa
Die Universität von Hawaii in Manoa ist eine der ethnisch vielfältigsten Hochschulen. Hawaiis kulturelle Vielfalt und geografische Lage bieten der John A. Burns School of Medicine (JABSOM) ein einzigartiges Forschungsumfeld, das sich in der Forschung zu gesundheitlichen Ungleichheiten auszeichnet. Die JABSOM-Fakultät bringt jährlich externe Mittel in Höhe von rund 40 Millionen US-Dollar nach Hawaii.
Über Hawaii Biotech, Inc.
Hawaii Biotech (HBI) is a privately held biotechnology company focused on the development of prophylactic vaccines for established and emerging infectious diseases and anti-toxin drugs for biological threats. HBI has developed proprietary expertise in the production of recombinant proteins that have application to the manufacture of safe and effective vaccines, diagnostic kits, and as research tools. HBI completed successful first-in-human Phase 1 clinical studies with both West Nile virus and dengue vaccines in healthy human subjects. HBI has developed a product pipeline of recombinant subunit vaccines, including vaccine candidates for West Nile virus, tick-borne flavivirus, malaria, Crimean-Congo hemorrhagic fever, and Ebola. The company is also continuing the development of small molecule anti-toxin drugs for anthrax and botulism. HBI, founded in Hawaii in 1982, is headquartered in Honolulu. For more information, please visit: www.hibiotech.com.
About Soligenix, Inc.
Soligenix is a late-stage biopharmaceutical company focused on developing and commercializing products to treat rare diseases where there is an unmet medical need. Our Specialized BioTherapeutics business segment is developing SGX301 as a novel photodynamic therapy utilizing safe visible light for the treatment of cutaneous T-cell lymphoma, our first-in-class innate defense regulator (IDR) technology, dusquetide (SGX942) for the treatment of oral mucositis in head and neck cancer, and proprietary formulations of oral beclomethasone 17,21-dipropionate (BDP) for the prevention/treatment of gastrointestinal (GI) disorders characterized by severe inflammation including pediatric Crohn's disease (SGX203) and acute radiation enteritis (SGX201).
Our Public Health Solutions business segment includes active development programs for RiVax [®] , our ricin toxin vaccine candidate, OrbeShield [®] , our GI acute radiation syndrome therapeutic candidate and SGX943, our therapeutic candidate for antibiotic resistant and emerging infectious disease. The development of our vaccine programs incorporates the use of our proprietary heat stabilization platform technology, known as ThermoVax [®] . To date, this business segment has been supported with government grant and contract funding from the National Institute of Allergy and Infectious Diseases (NIAID), the Defense Threat Reduction Agents (DTRA) and the Biomedical Advanced Research and Development Authority (BARDA).
For further information regarding Soligenix, Inc., please visit the Company's website at www.soligenix.com.
This press release may contain forward-looking statements that reflect Soligenix, Inc.'s current expectations about its future results, performance, prospects and opportunities, including but not limited to, potential market sizes, patient populations and clinical trial enrollment. Statements that are not historical facts, such as "anticipates," "estimates," "believes," "hopes," "intends," "plans," "expects," "goal," "may," "suggest," "will," "potential," or similar expressions, are forward-looking statements. These statements are subject to a number of risks, uncertainties and other factors that could cause actual events or results in future periods to differ materially from what is expressed in, or implied by, these statements. Soligenix cannot assure you that it will be able to successfully develop, achieve regulatory approval for or commercialize products based on its technologies, particularly in light of the significant uncertainty inherent in developing therapeutics and vaccines against bioterror threats, conducting preclinical and clinical trials of therapeutics and vaccines, obtaining regulatory approvals and manufacturing therapeutics and vaccines, that product development and commercialization efforts will not be reduced or discontinued due to difficulties or delays in clinical trials or due to lack of progress or positive results from research and development efforts, that it will be able to successfully obtain any further funding to support product development and commercialization efforts, including grants and awards, maintain its existing grants which are subject to performance requirements, enter into any biodefense procurement contracts with the US Government or other countries, that it will be able to compete with larger and better financed competitors in the biotechnology industry, that changes in health care practice, third party reimbursement limitations and Federal and/or state health care reform initiatives will not negatively affect its business, or that the US Congress may not pass any legislation that would provide additional funding for the Project BioShield program. In addition, there can be no assurance as to timing or success of the Phase 3 clinical trial of SGX942 (dusquetide) as a treatment for oral mucositis in patients with head and neck cancer receiving chemoradiation therapy (including the outcome of the interim analysis) or the Phase 3 clinical trial of SGX301 (synthetic hypericin) for the treatment of cutaneous T-cell lymphoma. Further, there can be no assurance that RiVax [®] will qualify for a biodefense Priority Review Voucher (PRV) or that the prior sales of PRVs will be indicative of any potential sales price for a PRV for RiVax [®] . These and other risk factors are described from time to time in filings with the Securities and Exchange Commission, including, but not limited to, Soligenix's reports on Forms 10-Q and 10-K. Unless required by law, Soligenix assumes no obligation to update or revise any forward-looking statements as a result of new information or future events.
View original content:http://www.prnewswire.com/news-releases/soligenix-announces-…
SOURCE Soligenix, Inc.
Copyright (C) 2020 PR Newswire. All rights reserved
FROM MARKETWATCH
Soligenix kündigt erfolgreiche Demonstration der Wärmestabilisierung für die Filovirus-Impfstoffplattform an
Durch
Veröffentlicht: 27. Februar 2020, 7:00 Uhr ET
TEILEN
Fokus auf das Marburg-Virus als Reaktion auf Regierungsprioritäten
PRINCETON, NJ, 27. Februar 2020 / PRNewswire / - Soligenix, Inc. SNGX, +12.72% (Soligenix oder das Unternehmen), ein biopharmazeutisches Unternehmen im Spätstadium, das sich auf die Entwicklung und Vermarktung von Produkten zur Behandlung seltener Krankheiten konzentriert, bei denen ein ungedeckter medizinischer Bedarf besteht, gab heute seine laufende Zusammenarbeit mit der Universität von Hawaii in Manoa (UHM) und bekannt Hawaii Biotech Inc. (HBI) hat nach Ansicht des Unternehmens einen bedeutenden Meilenstein in der Entwicklung von hitzebeständigen Filovirus-Impfstoffen erreicht, bei denen die Plattform in nicht-menschlichen Primatenmodellen mit monovalenten und zweiwertigen Impfstoffen praktikable thermostabile Formulierungen und Schutz gezeigt hat Kandidaten für die drei tödlichsten humanpathogenen Filoviren (Ebola-Virus, Sudan-Virus und Marburg-Virus).
Im Geschäftsbereich Public Health Solutions des Unternehmens haben laufende Kooperationen mit Axel Lehrer, PhD der Abteilung für Tropenmedizin, Medizinische Mikrobiologie und Pharmakologie, der Medizinischen Fakultät John A. Burns (JABSOM), UHM und HBI, die Machbarkeit der Entwicklung einer Wärmestabilität gezeigt Untereinheit-Protein-Impfstoffe gegen Filovirus. Die Schutzwirkung wurde bei nichtmenschlichen Primaten gegen eine Infektion mit dem Ebola-Virus, dem Sudan-Virus und dem Marburg-Virus nachgewiesen. Der Schutz wurde sowohl mit einwertigen als auch mit zweiwertigen Impfstoffkombinationen erreicht. Es wurden Formulierungsbedingungen identifiziert, um eine Wärmestabilisierung jedes Antigens allein oder in Kombination für mindestens 12 Wochen bei 40 Grad Celsius (104 Grad Fahrenheit) zu ermöglichen.
"Filoviren sind in Gebieten der Welt endemisch, in denen die Stromversorgung ungewiss sein kann, was einen thermostabilen Impfstoff besonders wertvoll macht", erklärte Dr. Lehrer, Assistenzprofessor an der Abteilung für Tropenmedizin, Medizinische Mikrobiologie und Pharmakologie der JABSOM. "Unsere bisherigen Arbeiten haben nicht nur die Machbarkeit einer schnellen und effizienten Herstellung gezeigt, sondern auch das Potenzial für einen breit anwendbaren und leicht zu verteilenden Impfstoff. Da das Marburg-Virus für die US-Regierung weiterhin ein ungedeckter medizinischer Bedarf ist, sind wir es jetzt gezielte Fokussierung und Beschleunigung der Evaluierung des Marburg-Virus-Impfstoffs. "
"Wir glauben, dass die Entwicklung eines Impfstoffs mit verbesserter Stabilität bei erhöhten Temperaturen, der die mit der Lagerung und Verteilung der Kühlkette verbundenen Kosten und logistischen Belastungen vermeiden kann, einen deutlichen Vorteil gegenüber anderen derzeit in der Entwicklung befindlichen Impfstoffen bieten kann", erklärte Christopher J. Schaber, PhD, Präsident und Chief Executive Officer von Soligenix. "In Übereinstimmung mit dem Feedback der US-Regierung werden wir uns nun speziell auf das Marburg-Virus konzentrieren."
Informationen zur Filovirus-Infektion
Die Ebola-Virus-Krankheit wird durch eine von fünf Ebolavirus-Arten verursacht, von denen vier beim Menschen Krankheiten verursachen, darunter das bekannteste Mitglied, das Zaire-Ebolavirus (Ebola-Virus). Alle Arten des Ebolavirus gehören zur Familie der Filoviridae, einer Familie, die außerdem das ebenso humanpathogene Marburg-Virus enthält. Es wird angenommen, dass das Ebola-Virus in verschiedenen Tierarten in Afrika beheimatet ist, obwohl der spezifische Wirt des Reservoirs noch unbekannt ist. Seit 1967 sind mehrere Ausbrüche der Ebola- und Marburg-Viruskrankheit bekannt, wobei der größte Ausbruch 2014 in Westafrika begann. Laut den Centers for Disease waren über 26.000 bestätigte / wahrscheinliche / vermutete Fälle mit einer geschätzten Zahl von über 11.000 Todesopfern betroffen Kontrolle und Prävention (CDC), einschließlich einiger Fälle in Europa und den Vereinigten Staaten.
Die Übertragung von Filoviren erfordert den direkten Kontakt mit Körperflüssigkeiten einer infizierten Person oder den Kontakt mit infizierten Tieren. Die Sterblichkeitsrate aufgrund von Filovirus-Infektionen ist extrem hoch und kann manchmal durch die Qualität der verfügbaren unterstützenden Versorgung beeinflusst werden, wobei der Schwerpunkt auf dem frühen Beginn der Behandlung liegt. Die Auflösung der Krankheit hängt weitgehend vom eigenen Immunsystem des Patienten ab. Es gibt keine zugelassene Behandlung für Ebola oder Marburg, obwohl sich die Forschung zu beiden seit Beginn des Ausbruchs 2014 beschleunigt hat und bei fortgeschrittenen klinischen Tests von Immuntherapeutika gegen Zaire-Ebolavirus erhebliche Fortschritte erzielt wurden . Es gibt einen zugelassenen Impfstoff, der für das Ebola-Virus ( Zaire-Ebolavirus) bei weniger als -60 ° C gelagert werden muss), aber für das Marburg-Virus ( Marburg- Marburg-Virus ) oder das Sudan-Virus ( Sudan-Ebolavirus ) ist noch kein Schutz verfügbar .
Über die John A. Burns School of Medicine der Universität von Hawaii in Manoa
Die Universität von Hawaii in Manoa ist eine der ethnisch vielfältigsten Hochschulen. Hawaiis kulturelle Vielfalt und geografische Lage bieten der John A. Burns School of Medicine (JABSOM) ein einzigartiges Forschungsumfeld, das sich in der Forschung zu gesundheitlichen Ungleichheiten auszeichnet. Die JABSOM-Fakultät bringt jährlich externe Mittel in Höhe von rund 40 Millionen US-Dollar nach Hawaii.
Über Hawaii Biotech, Inc.
Hawaii Biotech (HBI) is a privately held biotechnology company focused on the development of prophylactic vaccines for established and emerging infectious diseases and anti-toxin drugs for biological threats. HBI has developed proprietary expertise in the production of recombinant proteins that have application to the manufacture of safe and effective vaccines, diagnostic kits, and as research tools. HBI completed successful first-in-human Phase 1 clinical studies with both West Nile virus and dengue vaccines in healthy human subjects. HBI has developed a product pipeline of recombinant subunit vaccines, including vaccine candidates for West Nile virus, tick-borne flavivirus, malaria, Crimean-Congo hemorrhagic fever, and Ebola. The company is also continuing the development of small molecule anti-toxin drugs for anthrax and botulism. HBI, founded in Hawaii in 1982, is headquartered in Honolulu. For more information, please visit: www.hibiotech.com.
About Soligenix, Inc.
Soligenix is a late-stage biopharmaceutical company focused on developing and commercializing products to treat rare diseases where there is an unmet medical need. Our Specialized BioTherapeutics business segment is developing SGX301 as a novel photodynamic therapy utilizing safe visible light for the treatment of cutaneous T-cell lymphoma, our first-in-class innate defense regulator (IDR) technology, dusquetide (SGX942) for the treatment of oral mucositis in head and neck cancer, and proprietary formulations of oral beclomethasone 17,21-dipropionate (BDP) for the prevention/treatment of gastrointestinal (GI) disorders characterized by severe inflammation including pediatric Crohn's disease (SGX203) and acute radiation enteritis (SGX201).
Our Public Health Solutions business segment includes active development programs for RiVax [®] , our ricin toxin vaccine candidate, OrbeShield [®] , our GI acute radiation syndrome therapeutic candidate and SGX943, our therapeutic candidate for antibiotic resistant and emerging infectious disease. The development of our vaccine programs incorporates the use of our proprietary heat stabilization platform technology, known as ThermoVax [®] . To date, this business segment has been supported with government grant and contract funding from the National Institute of Allergy and Infectious Diseases (NIAID), the Defense Threat Reduction Agents (DTRA) and the Biomedical Advanced Research and Development Authority (BARDA).
For further information regarding Soligenix, Inc., please visit the Company's website at www.soligenix.com.
This press release may contain forward-looking statements that reflect Soligenix, Inc.'s current expectations about its future results, performance, prospects and opportunities, including but not limited to, potential market sizes, patient populations and clinical trial enrollment. Statements that are not historical facts, such as "anticipates," "estimates," "believes," "hopes," "intends," "plans," "expects," "goal," "may," "suggest," "will," "potential," or similar expressions, are forward-looking statements. These statements are subject to a number of risks, uncertainties and other factors that could cause actual events or results in future periods to differ materially from what is expressed in, or implied by, these statements. Soligenix cannot assure you that it will be able to successfully develop, achieve regulatory approval for or commercialize products based on its technologies, particularly in light of the significant uncertainty inherent in developing therapeutics and vaccines against bioterror threats, conducting preclinical and clinical trials of therapeutics and vaccines, obtaining regulatory approvals and manufacturing therapeutics and vaccines, that product development and commercialization efforts will not be reduced or discontinued due to difficulties or delays in clinical trials or due to lack of progress or positive results from research and development efforts, that it will be able to successfully obtain any further funding to support product development and commercialization efforts, including grants and awards, maintain its existing grants which are subject to performance requirements, enter into any biodefense procurement contracts with the US Government or other countries, that it will be able to compete with larger and better financed competitors in the biotechnology industry, that changes in health care practice, third party reimbursement limitations and Federal and/or state health care reform initiatives will not negatively affect its business, or that the US Congress may not pass any legislation that would provide additional funding for the Project BioShield program. In addition, there can be no assurance as to timing or success of the Phase 3 clinical trial of SGX942 (dusquetide) as a treatment for oral mucositis in patients with head and neck cancer receiving chemoradiation therapy (including the outcome of the interim analysis) or the Phase 3 clinical trial of SGX301 (synthetic hypericin) for the treatment of cutaneous T-cell lymphoma. Further, there can be no assurance that RiVax [®] will qualify for a biodefense Priority Review Voucher (PRV) or that the prior sales of PRVs will be indicative of any potential sales price for a PRV for RiVax [®] . These and other risk factors are described from time to time in filings with the Securities and Exchange Commission, including, but not limited to, Soligenix's reports on Forms 10-Q and 10-K. Unless required by law, Soligenix assumes no obligation to update or revise any forward-looking statements as a result of new information or future events.
View original content:http://www.prnewswire.com/news-releases/soligenix-announces-…
SOURCE Soligenix, Inc.
Copyright (C) 2020 PR Newswire. All rights reserved
FROM MARKETWATCH
Hallo silverstrike, gute Nachrichten, nur das Umfeld ist schwierig, und ich habe das Gefühl, dass es sich nicht so schnell ändert
Hallo Silverstrike
bist Du noch da? Der Absturz ist ja grauenvoll, wie aucj der Rest der Börse. Jetzt kann man wieder mal nur abwarten, bin gespannt wie lange es dauert, bis sich alles beruhigt
bist Du noch da? Der Absturz ist ja grauenvoll, wie aucj der Rest der Börse. Jetzt kann man wieder mal nur abwarten, bin gespannt wie lange es dauert, bis sich alles beruhigt
Antwort auf Beitrag Nr.: 62.983.397 von vinod am 12.03.20 17:41:38Klar..
bin ich noch da ....abwarten ist doch nix schlimmes .....alles gut 👍
bin ich noch da ....abwarten ist doch nix schlimmes .....alles gut 👍
SUCHE MARKETWATCH
EU-Top-Verhandlungsführer für den Brexit testet positiv auf Coronavirus
US-Aktien-Futures schreiben wieder rote Zahlen, wobei Dow-Futures über 300 Punkte verlieren
TEILEN
Zuhause
PRESSEMITTEILUNG
Soligenix gibt positive Ergebnisse für seine zentrale Phase-3-FLASH-Studie zur Bewertung von SGX301 bei der Behandlung des kutanen T-Zell-Lymphoms bekannt
Durch
Veröffentlicht: 19. März 2020, 6:00 Uhr ET
TEILEN
- Statistisch signifikantes Ansprechen auf die Behandlung im primären Endpunkt erreicht - Unternehmen veranstaltet heute um 8:30 Uhr EDT eine Telefonkonferenz für Investoren
PRINCETON, NJ, 19. März 2020 / PRNewswire / - Soligenix, Inc. SNGX, -7,06% (Soligenix oder das Unternehmen), ein biopharmazeutisches Unternehmen im Spätstadium, das sich auf die Entwicklung und Vermarktung von Produkten zur Behandlung seltener Krankheiten konzentriert, bei denen ein ungedeckter medizinischer Bedarf besteht, gab heute positive vorläufige Ergebnisse für sein zentrales Phase-3-FLASH (Fluorescent Light Activated Synthetic) bekannt Hypericin) -Studie zur Bewertung von SGX301 (synthetisches Hypericin) bei der Behandlung des kutanen T-Zell-Lymphoms (CTCL). Die Studie umfasste 169 Patienten, die 2: 1 randomisiert wurden, um entweder SGX301 oder Placebo zu erhalten, was ein statistisch signifikantes Ansprechen auf die Behandlung (p = 0,04) in der primären Endpunktbewertung des Composite Assessment of Index Lesion Score (CAILS) nach 8 Wochen für Zyklus 1 zeigte. Die vorläufige Bewertung der Open-Label-Ergebnisse von Zyklus 2 deutet auf eine signifikant robustere Ansprechrate nach 12-wöchiger SGX301-Behandlung hin. Diese Daten werden voraussichtlich im Juni 2020 bekannt gegeben.
"Dies ist ein wichtiges Ergebnis für Patienten mit CTCL. SGX301 hat erfolgreich die Wirksamkeit bei diesem herausfordernden chronischen Krebs ohne Sicherheitsbedenken nachgewiesen und ist daher eine potenziell bevorzugte First-Line-Option für die Behandlung von CTCL im Frühstadium, bei der es sich um die große Mehrheit handelt." von Patienten, die an dieser Krankheit leiden ", erklärte Dr. Ellen Kim, Direktorin der Dermatologieklinik, Perelman Center for Advanced Medicine und leitende Ermittlerin der FLASH-Studie. "Die Behandlung zeigte bereits nach 6 Wochen eine statistisch signifikante Verbesserung. Dies beweist erfolgreich, dass das Medikament in einem relativ kurzen Zeitfenster eine biologische Aktivität bei der Bekämpfung dieser Krankheit aufweist, wobei vorläufige Daten darauf hindeuten, dass die Verbesserung mit einer längeren Behandlung weiter zunimmt zusätzlich zu der nachgewiesenen Wirksamkeit,
"Im Namen aller Mitarbeiter von Soligenix möchte ich den Patienten, Familienangehörigen, Prüfärzten und Beratern, die an der zentralen Phase-3-FLASH-Studie beteiligt sind, meinen aufrichtigen Dank aussprechen", erklärte Christopher J. Schaber, PhD, President und Chief Executive Officer von Soligenix. "Wir sind äußerst zufrieden mit den Ergebnissen, die eine erfolgreiche Behandlung mit SGX301 belegen und das Potenzial verstärken, eine wichtige neue Behandlung für CTCL im Frühstadium zu sein. Wir werden uns nun bemühen, so schnell wie möglich eine vollständige Analyse der Daten zur Veröffentlichung durchzuführen sowie mit den Vorbereitungen für eine gründliche Diskussion mit der FDA über diesen wichtigen Datensatz zu beginnen. "
Dr. Schaber fuhr fort: "Mit ungefähr 7,6 Mio. USD in bar, ohne den erwarteten Verkauf unserer Nettoverlustvorträge in New Jersey und der Steueranreizforderung des Vereinigten Königreichs in Höhe von ca. 1,0 Mio. USD oder unserer nicht verwässernden staatlichen Finanzierung, werden wir den potenziellen Bedarf bewerten Für eine größere Kapitalerhöhung nur nach den wichtigsten Ergebnissen unserer Phase-3-Studie zur oralen Mukositis. Dies bietet uns die Möglichkeit, die Kommerzialisierung und / oder Partnerschaft von SGX301 in Verbindung mit der Vorbereitung der Einreichung des neuen Arzneimittelantrags bei der FDA eingehender zu bewerten. Diese Ergebnisse stützen unsere langjährige Überzeugung, dass SGX301 das Potenzial hat, eine wertvolle Therapie bei der Behandlung von CTCL im Frühstadium zu sein, einer Orphan-Krankheit und einem Bereich mit ungedecktem medizinischen Bedarf. "
Telefonkonferenz Donnerstag, 19. März um 8:30 Uhr Eastern Time
Das Unternehmen wird die Versuchsergebnisse am Donnerstag, dem 19. März 2020, während einer Telefonkonferenz für Investoren veröffentlichen. Anleger können Fragen mindestens 15 Minuten vor dem geplanten Beginn des Aufrufs elektronisch unter ir@soligenix.com einreichen .
US gebührenfrei: 1-866-652-5200
International: 1-412-317-6060
Bitte fordern Sie die Teilnahme am Soligenix-Anruf an.
Eine Abschrift der Telefonkonferenz wird 30 Tage nach der Veranstaltung archiviert.
An der Phase-3-FLASH-Studie nahmen 169 Patienten (166 auswertbar) mit CTCL im Stadium IA, IB oder IIA teil. Die Studie besteht aus drei Behandlungszyklen mit einer Dauer von jeweils 8 Wochen. Die Behandlungen wurden in den ersten 6 Wochen zweimal wöchentlich verabreicht, und das Ansprechen auf die Behandlung wurde am Ende der 8. Woche jedes Zyklus bestimmt. Im ersten doppelblinden Behandlungszyklus erhielten 116 Probanden eine SGX301-Behandlung (0,25% synthetisches Hypericin) und 50 eine Placebo-Behandlung ihrer Indexläsionen. Insgesamt 16% der Patienten, die SGX301 erhielten, erreichten eine Reduktion ihrer Läsionen um mindestens 50% (bewertet anhand einer Standardmessung dermatologischer Läsionen, dem CAILS-Score), verglichen mit nur 4% der Patienten in der Placebogruppe nach 8 Wochen (p = 0,04). Die Behandlung mit SGX301 im ersten Zyklus war sicher und gut verträglich. Im zweiten offenen Behandlungszyklus (Zyklus 2) Alle Patienten erhielten eine SGX301-Behandlung. Vorläufige Ergebnisse aus verblindeten Daten deuten auf eine Ansprechrate von mehr als 35% hin (einschließlich Patienten, die sowohl eine 12-wöchige als auch eine 6-wöchige Therapie erhalten), was darauf hinweist, dass das Ansprechen mit fortgesetzter Behandlung zunimmt. Eine weitere unabhängige Überprüfung von Läsionsfotos kann durchgeführt werden, um eine einheitlichere Bestätigung der Reaktion zu gewährleisten. Die Ergebnisse von Zyklus 2 werden voraussichtlich im Juni 2020 bekannt gegeben.
Im dritten (optionalen) Behandlungszyklus (Zyklus 3) konnten alle Probanden eine SGX301-Behandlung aller ihrer Läsionen erhalten. Bemerkenswerterweise hat sich die Mehrheit der eingeschlossenen Patienten dafür entschieden, diesen optionalen Zyklus der Studie fortzusetzen. Darüber hinaus wurde bei einer Untergruppe von Patienten, die in diesem Zyklus untersucht wurden, gezeigt, dass SGX301 nicht systemisch verfügbar ist, was mit der bisher beobachteten allgemeinen Sicherheit dieses topischen Produkts übereinstimmt. Die Ergebnisse aus Zyklus 3 und dem anschließenden 6-monatigen Follow-up nach Abschluss der Behandlung werden weiter bekannt gegeben, da die endgültigen Patienten ihre vorgesehenen Besuche weiterhin abschließen.
Über das kutane T-Zell-Lymphom (CTCL)
CTCL is a class of non-Hodgkin's lymphoma (NHL), a type of cancer of the white blood cells that are an integral part of the immune system. Unlike most NHLs which generally involve B-cell lymphocytes (involved in producing antibodies), CTCL is caused by an expansion of malignant T-cell lymphocytes (involved in cell-mediated immunity) normally programmed to migrate to the skin. These malignant cells migrate to the skin where they form various lesions, typically beginning as a rash and eventually forming raised plaques and tumors as the disease progresses. Mortality is related to the stage of CTCL, with median survival generally ranging from about 12 years in the early stages to only 2.5 years when the disease has advanced. There is currently no cure for CTCL. Typically, CTCL lesions are treated and regress but usually return either in the same part of the body or in new areas.
CTCL constitutes a rare group of NHLs, occurring in about 4% of the approximate 700,000 individuals living with the disease. It is estimated, based upon review of historic published studies and reports and an interpolation of data on the incidence of CTCL that it affects over 25,000 individuals in the US, with approximately 3,000 new cases seen annually.
About SGX301
SGX301 is a novel first-in-class photodynamic therapy utilizing safe visible light for activation. The active ingredient in SGX301 is synthetic hypericin, a potent photosensitizer that is topically applied to skin lesions, is taken up by the malignant T-cells, and then activated by fluorescent light 16 to 24 hours later. This treatment approach avoids the risk of secondary malignancies (including melanoma) inherent with the frequently employed DNA-damaging chemotherapeutic drugs and other photodynamic therapies that are dependent on ultraviolet exposure. Combined with photoactivation, hypericin has demonstrated significant anti-proliferative effects on activated normal human lymphoid cells and inhibited growth of malignant T-cells isolated from CTCL patients. In a published Phase 2 clinical study in CTCL, patients experienced a statistically significant (p=0.04) improvement with topical hypericin treatment whereas the placebo was ineffective. SGX301 has received orphan drug and fast track designations from the US Food and Drug Administration (FDA), as well as orphan designation from the European Medicines Agency (EMA).
Based on the positive results demonstrated in the Phase 2 study of SGX301, the Phase 3 protocol is a highly powered, double-blind, randomized, placebo-controlled, multicenter trial targeted to enroll 160 evaluable subjects. The trial consists of three treatment cycles, each of 8 weeks duration. Treatments are administered twice weekly for the first 6 weeks and treatment response will be determined at the end of Week 8. In the first treatment cycle, 116 subjects received SGX301 and 50 subjects received placebo treatment of their index lesions. In the second cycle, all subjects received SGX301 treatment of their index lesions and in the third cycle all subjects could receive SGX301 treatment of all their lesions. Subjects are followed for an additional 6 months after the completion of treatment. The primary efficacy endpoint was assessed on the percent of patients in each of the two treatment groups (i.e., SGX301 and placebo) achieving a Partial or Complete Response (yes/no) of the treated lesions defined as a ≥ 50% reduction in the total Composite Assessment of Index Lesion Disease Severity (CAILS) score for three index lesions at the Cycle 1 evaluation visit (Week 8) compared to the total CAILS score at baseline. Assessment of the primary endpoint revealed that 16% patients receiving SGX301 responded (i.e., had ≥ 50% reduction in index lesion size) while only 4% receiving placebo responded (p=0.04). Preliminary results from blinded data to date suggest more than a 35% response rate (inclusive of patients receiving both 12 weeks and 6 weeks of therapy), indicating the response increases with continued treatment.
Other secondary measures assessed are treatment response (including duration), degree of improvement, time to relapse and safety, and will be available as the subsequent cycles and follow-up visits are completed for all subjects.
Overall safety of SGX301 is a critical attribute of this treatment and will continue to be monitored throughout the additional treatment cycles and the 6-month follow-up period. SGX301's mechanism of action is not associated with DNA damage, making it a safer alternative than currently available therapies, all of which are associated with significant and sometimes fatal, side effects. Predominantly these include the risk of melanoma and other malignancies, as well as the risk of significant skin damage and premature skin aging. Currently available treatments are only approved in the context of previous treatment failure with other modalities and there is no approved front-line therapy available. Within this landscape, treatment of CTCL is strongly motivated by the safety risk of each product. SGX301 potentially represents the safest available efficacious treatment for CTCL. With no systemic absorption, a compound that is not mutagenic and a light source that is not carcinogenic, there is no evidence to date of any potential safety issues.
The Phase 3 CTCL clinical study was partially funded by the National Cancer Institute via a Phase II SBIR grant (#1R44CA210848-01A1) awarded to Soligenix, Inc.
About Soligenix, Inc.
Soligenix is a late-stage biopharmaceutical company focused on developing and commercializing products to treat rare diseases where there is an unmet medical need. Our Specialized BioTherapeutics business segment is developing SGX301 as a novel photodynamic therapy utilizing safe visible light for the treatment of cutaneous T-cell lymphoma, our first-in-class innate defense regulator (IDR) technology, dusquetide (SGX942) for the treatment of oral mucositis in head and neck cancer, and proprietary formulations of oral beclomethasone 17,21-dipropionate (BDP) for the prevention/treatment of gastrointestinal (GI) disorders characterized by severe inflammation including pediatric Crohn's disease (SGX203) and acute radiation enteritis (SGX201).
Our Public Health Solutions business segment includes active development programs for RiVax [®] , our ricin toxin vaccine candidate, OrbeShield [®] , our GI acute radiation syndrome therapeutic candidate and SGX943, our therapeutic candidate for antibiotic resistant and emerging infectious disease. The development of our vaccine programs incorporates the use of our proprietary heat stabilization platform technology, known as ThermoVax [®] . To date, this business segment has been supported with government grant and contract funding from the National Institute of Allergy and Infectious Diseases (NIAID), the Defense Threat Reduction Agents (DTRA) and the Biomedical Advanced Research and Development Authority (BARDA).
For further information regarding Soligenix, Inc., please visit the Company's website at www.soligenix.com.
This press release may contain forward-looking statements that reflect Soligenix, Inc.'s current expectations about its future results, performance, prospects and opportunities, including but not limited to, potential market sizes, patient populations and clinical trial enrollment. Statements that are not historical facts, such as "anticipates," "estimates," "believes," "hopes," "intends," "plans," "expects," "goal," "may," "suggest," "will," "potential," or similar expressions, are forward-looking statements. These statements are subject to a number of risks, uncertainties and other factors that could cause actual events or results in future periods to differ materially from what is expressed in, or implied by, these statements. Soligenix cannot assure you that it will be able to successfully develop, achieve regulatory approval for or commercialize products based on its technologies, particularly in light of the significant uncertainty inherent in developing therapeutics and vaccines against bioterror threats, conducting preclinical and clinical trials of therapeutics and vaccines, obtaining regulatory approvals and manufacturing therapeutics and vaccines, that product development and commercialization efforts will not be reduced or discontinued due to difficulties or delays in clinical trials or due to lack of progress or positive results from research and development efforts, that it will be able to successfully obtain any further funding to support product development and commercialization efforts, including grants and awards, maintain its existing grants which are subject to performance requirements, enter into any biodefense procurement contracts with the U.S. Government or other countries, that it will be able to compete with larger and better financed competitors in the biotechnology industry, that changes in health care practice, third party reimbursement limitations and Federal and/or state health care reform initiatives will not negatively affect its business, or that the U.S. Congress may not pass any legislation that would provide additional funding for the Project BioShield program. In addition, there can be no assurance as to the timing or success of the Phase 3 clinical trial of SGX942 (dusquetide) as a treatment for oral mucositis in patients with head and neck cancer receiving chemoradiation therapy, or any of our other clinical/preclinical trials. Further, there can be no assurance that RiVax [®] will qualify for a biodefense Priority Review Voucher (PRV) or that the prior sales of PRVs will be indicative of any potential sales price for a PRV for RiVax [®] . Also, no assurance can be provided that the Company will receive or continue to receive non-dilutive government funding from grants and contracts that have been or may be awarded or for which the Company will apply in the future. These and other risk factors are described from time to time in filings with the Securities and Exchange Commission, including, but not limited to, Soligenix's reports on Forms 10-Q and 10-K. Unless required by law, Soligenix assumes no obligation to update or revise any forward-looking statements as a result of new information or future events.
View original content:http://www.prnewswire.com/news-releases/soligenix-announces-…
SOURCE Soligenix, Inc.
Copyright (C) 2020 PR Newswire. All rights reserved
EU-Top-Verhandlungsführer für den Brexit testet positiv auf Coronavirus
US-Aktien-Futures schreiben wieder rote Zahlen, wobei Dow-Futures über 300 Punkte verlieren
TEILEN
Zuhause
PRESSEMITTEILUNG
Soligenix gibt positive Ergebnisse für seine zentrale Phase-3-FLASH-Studie zur Bewertung von SGX301 bei der Behandlung des kutanen T-Zell-Lymphoms bekannt
Durch
Veröffentlicht: 19. März 2020, 6:00 Uhr ET
TEILEN
- Statistisch signifikantes Ansprechen auf die Behandlung im primären Endpunkt erreicht - Unternehmen veranstaltet heute um 8:30 Uhr EDT eine Telefonkonferenz für Investoren
PRINCETON, NJ, 19. März 2020 / PRNewswire / - Soligenix, Inc. SNGX, -7,06% (Soligenix oder das Unternehmen), ein biopharmazeutisches Unternehmen im Spätstadium, das sich auf die Entwicklung und Vermarktung von Produkten zur Behandlung seltener Krankheiten konzentriert, bei denen ein ungedeckter medizinischer Bedarf besteht, gab heute positive vorläufige Ergebnisse für sein zentrales Phase-3-FLASH (Fluorescent Light Activated Synthetic) bekannt Hypericin) -Studie zur Bewertung von SGX301 (synthetisches Hypericin) bei der Behandlung des kutanen T-Zell-Lymphoms (CTCL). Die Studie umfasste 169 Patienten, die 2: 1 randomisiert wurden, um entweder SGX301 oder Placebo zu erhalten, was ein statistisch signifikantes Ansprechen auf die Behandlung (p = 0,04) in der primären Endpunktbewertung des Composite Assessment of Index Lesion Score (CAILS) nach 8 Wochen für Zyklus 1 zeigte. Die vorläufige Bewertung der Open-Label-Ergebnisse von Zyklus 2 deutet auf eine signifikant robustere Ansprechrate nach 12-wöchiger SGX301-Behandlung hin. Diese Daten werden voraussichtlich im Juni 2020 bekannt gegeben.
"Dies ist ein wichtiges Ergebnis für Patienten mit CTCL. SGX301 hat erfolgreich die Wirksamkeit bei diesem herausfordernden chronischen Krebs ohne Sicherheitsbedenken nachgewiesen und ist daher eine potenziell bevorzugte First-Line-Option für die Behandlung von CTCL im Frühstadium, bei der es sich um die große Mehrheit handelt." von Patienten, die an dieser Krankheit leiden ", erklärte Dr. Ellen Kim, Direktorin der Dermatologieklinik, Perelman Center for Advanced Medicine und leitende Ermittlerin der FLASH-Studie. "Die Behandlung zeigte bereits nach 6 Wochen eine statistisch signifikante Verbesserung. Dies beweist erfolgreich, dass das Medikament in einem relativ kurzen Zeitfenster eine biologische Aktivität bei der Bekämpfung dieser Krankheit aufweist, wobei vorläufige Daten darauf hindeuten, dass die Verbesserung mit einer längeren Behandlung weiter zunimmt zusätzlich zu der nachgewiesenen Wirksamkeit,
"Im Namen aller Mitarbeiter von Soligenix möchte ich den Patienten, Familienangehörigen, Prüfärzten und Beratern, die an der zentralen Phase-3-FLASH-Studie beteiligt sind, meinen aufrichtigen Dank aussprechen", erklärte Christopher J. Schaber, PhD, President und Chief Executive Officer von Soligenix. "Wir sind äußerst zufrieden mit den Ergebnissen, die eine erfolgreiche Behandlung mit SGX301 belegen und das Potenzial verstärken, eine wichtige neue Behandlung für CTCL im Frühstadium zu sein. Wir werden uns nun bemühen, so schnell wie möglich eine vollständige Analyse der Daten zur Veröffentlichung durchzuführen sowie mit den Vorbereitungen für eine gründliche Diskussion mit der FDA über diesen wichtigen Datensatz zu beginnen. "
Dr. Schaber fuhr fort: "Mit ungefähr 7,6 Mio. USD in bar, ohne den erwarteten Verkauf unserer Nettoverlustvorträge in New Jersey und der Steueranreizforderung des Vereinigten Königreichs in Höhe von ca. 1,0 Mio. USD oder unserer nicht verwässernden staatlichen Finanzierung, werden wir den potenziellen Bedarf bewerten Für eine größere Kapitalerhöhung nur nach den wichtigsten Ergebnissen unserer Phase-3-Studie zur oralen Mukositis. Dies bietet uns die Möglichkeit, die Kommerzialisierung und / oder Partnerschaft von SGX301 in Verbindung mit der Vorbereitung der Einreichung des neuen Arzneimittelantrags bei der FDA eingehender zu bewerten. Diese Ergebnisse stützen unsere langjährige Überzeugung, dass SGX301 das Potenzial hat, eine wertvolle Therapie bei der Behandlung von CTCL im Frühstadium zu sein, einer Orphan-Krankheit und einem Bereich mit ungedecktem medizinischen Bedarf. "
Telefonkonferenz Donnerstag, 19. März um 8:30 Uhr Eastern Time
Das Unternehmen wird die Versuchsergebnisse am Donnerstag, dem 19. März 2020, während einer Telefonkonferenz für Investoren veröffentlichen. Anleger können Fragen mindestens 15 Minuten vor dem geplanten Beginn des Aufrufs elektronisch unter ir@soligenix.com einreichen .
US gebührenfrei: 1-866-652-5200
International: 1-412-317-6060
Bitte fordern Sie die Teilnahme am Soligenix-Anruf an.
Eine Abschrift der Telefonkonferenz wird 30 Tage nach der Veranstaltung archiviert.
An der Phase-3-FLASH-Studie nahmen 169 Patienten (166 auswertbar) mit CTCL im Stadium IA, IB oder IIA teil. Die Studie besteht aus drei Behandlungszyklen mit einer Dauer von jeweils 8 Wochen. Die Behandlungen wurden in den ersten 6 Wochen zweimal wöchentlich verabreicht, und das Ansprechen auf die Behandlung wurde am Ende der 8. Woche jedes Zyklus bestimmt. Im ersten doppelblinden Behandlungszyklus erhielten 116 Probanden eine SGX301-Behandlung (0,25% synthetisches Hypericin) und 50 eine Placebo-Behandlung ihrer Indexläsionen. Insgesamt 16% der Patienten, die SGX301 erhielten, erreichten eine Reduktion ihrer Läsionen um mindestens 50% (bewertet anhand einer Standardmessung dermatologischer Läsionen, dem CAILS-Score), verglichen mit nur 4% der Patienten in der Placebogruppe nach 8 Wochen (p = 0,04). Die Behandlung mit SGX301 im ersten Zyklus war sicher und gut verträglich. Im zweiten offenen Behandlungszyklus (Zyklus 2) Alle Patienten erhielten eine SGX301-Behandlung. Vorläufige Ergebnisse aus verblindeten Daten deuten auf eine Ansprechrate von mehr als 35% hin (einschließlich Patienten, die sowohl eine 12-wöchige als auch eine 6-wöchige Therapie erhalten), was darauf hinweist, dass das Ansprechen mit fortgesetzter Behandlung zunimmt. Eine weitere unabhängige Überprüfung von Läsionsfotos kann durchgeführt werden, um eine einheitlichere Bestätigung der Reaktion zu gewährleisten. Die Ergebnisse von Zyklus 2 werden voraussichtlich im Juni 2020 bekannt gegeben.
Im dritten (optionalen) Behandlungszyklus (Zyklus 3) konnten alle Probanden eine SGX301-Behandlung aller ihrer Läsionen erhalten. Bemerkenswerterweise hat sich die Mehrheit der eingeschlossenen Patienten dafür entschieden, diesen optionalen Zyklus der Studie fortzusetzen. Darüber hinaus wurde bei einer Untergruppe von Patienten, die in diesem Zyklus untersucht wurden, gezeigt, dass SGX301 nicht systemisch verfügbar ist, was mit der bisher beobachteten allgemeinen Sicherheit dieses topischen Produkts übereinstimmt. Die Ergebnisse aus Zyklus 3 und dem anschließenden 6-monatigen Follow-up nach Abschluss der Behandlung werden weiter bekannt gegeben, da die endgültigen Patienten ihre vorgesehenen Besuche weiterhin abschließen.
Über das kutane T-Zell-Lymphom (CTCL)
CTCL is a class of non-Hodgkin's lymphoma (NHL), a type of cancer of the white blood cells that are an integral part of the immune system. Unlike most NHLs which generally involve B-cell lymphocytes (involved in producing antibodies), CTCL is caused by an expansion of malignant T-cell lymphocytes (involved in cell-mediated immunity) normally programmed to migrate to the skin. These malignant cells migrate to the skin where they form various lesions, typically beginning as a rash and eventually forming raised plaques and tumors as the disease progresses. Mortality is related to the stage of CTCL, with median survival generally ranging from about 12 years in the early stages to only 2.5 years when the disease has advanced. There is currently no cure for CTCL. Typically, CTCL lesions are treated and regress but usually return either in the same part of the body or in new areas.
CTCL constitutes a rare group of NHLs, occurring in about 4% of the approximate 700,000 individuals living with the disease. It is estimated, based upon review of historic published studies and reports and an interpolation of data on the incidence of CTCL that it affects over 25,000 individuals in the US, with approximately 3,000 new cases seen annually.
About SGX301
SGX301 is a novel first-in-class photodynamic therapy utilizing safe visible light for activation. The active ingredient in SGX301 is synthetic hypericin, a potent photosensitizer that is topically applied to skin lesions, is taken up by the malignant T-cells, and then activated by fluorescent light 16 to 24 hours later. This treatment approach avoids the risk of secondary malignancies (including melanoma) inherent with the frequently employed DNA-damaging chemotherapeutic drugs and other photodynamic therapies that are dependent on ultraviolet exposure. Combined with photoactivation, hypericin has demonstrated significant anti-proliferative effects on activated normal human lymphoid cells and inhibited growth of malignant T-cells isolated from CTCL patients. In a published Phase 2 clinical study in CTCL, patients experienced a statistically significant (p=0.04) improvement with topical hypericin treatment whereas the placebo was ineffective. SGX301 has received orphan drug and fast track designations from the US Food and Drug Administration (FDA), as well as orphan designation from the European Medicines Agency (EMA).
Based on the positive results demonstrated in the Phase 2 study of SGX301, the Phase 3 protocol is a highly powered, double-blind, randomized, placebo-controlled, multicenter trial targeted to enroll 160 evaluable subjects. The trial consists of three treatment cycles, each of 8 weeks duration. Treatments are administered twice weekly for the first 6 weeks and treatment response will be determined at the end of Week 8. In the first treatment cycle, 116 subjects received SGX301 and 50 subjects received placebo treatment of their index lesions. In the second cycle, all subjects received SGX301 treatment of their index lesions and in the third cycle all subjects could receive SGX301 treatment of all their lesions. Subjects are followed for an additional 6 months after the completion of treatment. The primary efficacy endpoint was assessed on the percent of patients in each of the two treatment groups (i.e., SGX301 and placebo) achieving a Partial or Complete Response (yes/no) of the treated lesions defined as a ≥ 50% reduction in the total Composite Assessment of Index Lesion Disease Severity (CAILS) score for three index lesions at the Cycle 1 evaluation visit (Week 8) compared to the total CAILS score at baseline. Assessment of the primary endpoint revealed that 16% patients receiving SGX301 responded (i.e., had ≥ 50% reduction in index lesion size) while only 4% receiving placebo responded (p=0.04). Preliminary results from blinded data to date suggest more than a 35% response rate (inclusive of patients receiving both 12 weeks and 6 weeks of therapy), indicating the response increases with continued treatment.
Other secondary measures assessed are treatment response (including duration), degree of improvement, time to relapse and safety, and will be available as the subsequent cycles and follow-up visits are completed for all subjects.
Overall safety of SGX301 is a critical attribute of this treatment and will continue to be monitored throughout the additional treatment cycles and the 6-month follow-up period. SGX301's mechanism of action is not associated with DNA damage, making it a safer alternative than currently available therapies, all of which are associated with significant and sometimes fatal, side effects. Predominantly these include the risk of melanoma and other malignancies, as well as the risk of significant skin damage and premature skin aging. Currently available treatments are only approved in the context of previous treatment failure with other modalities and there is no approved front-line therapy available. Within this landscape, treatment of CTCL is strongly motivated by the safety risk of each product. SGX301 potentially represents the safest available efficacious treatment for CTCL. With no systemic absorption, a compound that is not mutagenic and a light source that is not carcinogenic, there is no evidence to date of any potential safety issues.
The Phase 3 CTCL clinical study was partially funded by the National Cancer Institute via a Phase II SBIR grant (#1R44CA210848-01A1) awarded to Soligenix, Inc.
About Soligenix, Inc.
Soligenix is a late-stage biopharmaceutical company focused on developing and commercializing products to treat rare diseases where there is an unmet medical need. Our Specialized BioTherapeutics business segment is developing SGX301 as a novel photodynamic therapy utilizing safe visible light for the treatment of cutaneous T-cell lymphoma, our first-in-class innate defense regulator (IDR) technology, dusquetide (SGX942) for the treatment of oral mucositis in head and neck cancer, and proprietary formulations of oral beclomethasone 17,21-dipropionate (BDP) for the prevention/treatment of gastrointestinal (GI) disorders characterized by severe inflammation including pediatric Crohn's disease (SGX203) and acute radiation enteritis (SGX201).
Our Public Health Solutions business segment includes active development programs for RiVax [®] , our ricin toxin vaccine candidate, OrbeShield [®] , our GI acute radiation syndrome therapeutic candidate and SGX943, our therapeutic candidate for antibiotic resistant and emerging infectious disease. The development of our vaccine programs incorporates the use of our proprietary heat stabilization platform technology, known as ThermoVax [®] . To date, this business segment has been supported with government grant and contract funding from the National Institute of Allergy and Infectious Diseases (NIAID), the Defense Threat Reduction Agents (DTRA) and the Biomedical Advanced Research and Development Authority (BARDA).
For further information regarding Soligenix, Inc., please visit the Company's website at www.soligenix.com.
This press release may contain forward-looking statements that reflect Soligenix, Inc.'s current expectations about its future results, performance, prospects and opportunities, including but not limited to, potential market sizes, patient populations and clinical trial enrollment. Statements that are not historical facts, such as "anticipates," "estimates," "believes," "hopes," "intends," "plans," "expects," "goal," "may," "suggest," "will," "potential," or similar expressions, are forward-looking statements. These statements are subject to a number of risks, uncertainties and other factors that could cause actual events or results in future periods to differ materially from what is expressed in, or implied by, these statements. Soligenix cannot assure you that it will be able to successfully develop, achieve regulatory approval for or commercialize products based on its technologies, particularly in light of the significant uncertainty inherent in developing therapeutics and vaccines against bioterror threats, conducting preclinical and clinical trials of therapeutics and vaccines, obtaining regulatory approvals and manufacturing therapeutics and vaccines, that product development and commercialization efforts will not be reduced or discontinued due to difficulties or delays in clinical trials or due to lack of progress or positive results from research and development efforts, that it will be able to successfully obtain any further funding to support product development and commercialization efforts, including grants and awards, maintain its existing grants which are subject to performance requirements, enter into any biodefense procurement contracts with the U.S. Government or other countries, that it will be able to compete with larger and better financed competitors in the biotechnology industry, that changes in health care practice, third party reimbursement limitations and Federal and/or state health care reform initiatives will not negatively affect its business, or that the U.S. Congress may not pass any legislation that would provide additional funding for the Project BioShield program. In addition, there can be no assurance as to the timing or success of the Phase 3 clinical trial of SGX942 (dusquetide) as a treatment for oral mucositis in patients with head and neck cancer receiving chemoradiation therapy, or any of our other clinical/preclinical trials. Further, there can be no assurance that RiVax [®] will qualify for a biodefense Priority Review Voucher (PRV) or that the prior sales of PRVs will be indicative of any potential sales price for a PRV for RiVax [®] . Also, no assurance can be provided that the Company will receive or continue to receive non-dilutive government funding from grants and contracts that have been or may be awarded or for which the Company will apply in the future. These and other risk factors are described from time to time in filings with the Securities and Exchange Commission, including, but not limited to, Soligenix's reports on Forms 10-Q and 10-K. Unless required by law, Soligenix assumes no obligation to update or revise any forward-looking statements as a result of new information or future events.
View original content:http://www.prnewswire.com/news-releases/soligenix-announces-…
SOURCE Soligenix, Inc.
Copyright (C) 2020 PR Newswire. All rights reserved
All eyes.....on SNGX....
Soligenix Announces Positive Top-line Results for its Pivotal Phase 3 FLASH Trial Evaluating SGX301 in Treatment of Cutaneous T-Cell Lymphoma https://seekingalpha.com/pr/17813321?source=ansh $SNGX
Soligenix's Upcoming Catalyst For Pipeline Product SGX301 Could Offer A Nice Trade Opportunity https://seekingalpha.com/article/4338559?source=ansh $SNGX
Antwort auf Beitrag Nr.: 63.632.806 von silvesterstrike am 11.05.20 14:07:44Hallo silverstrike, wie schätzt Du die Weiterentwicklung ein? Im momentanigen Umfeld ist der Kurs vielleicht noch okay, obwohl es auch schon wieder Verluste gab. Ich befürchte, dass es global auf den Aktienmärkten zu einem zweite Einbruch kommt und überlege zuverkaufen, um dann neu einzukaufen. Was meinst Du?
Ich kann mr vorstellen, wenn es zu einem weiteren globalen Einbruch kommt, dannn sehen wir hier einen Wert unter 1 €
Antwort auf Beitrag Nr.: 63.736.513 von vinod am 19.05.20 14:15:57Hi Vinod ...ich wer auf jeden Fall keine einzige Aktie verkaufen ....der Kurs ist verglichen mit den Möglichkeiten und dem derzeit Erreichten ....einfach unterirdisch .....grüsse
Salut
Ich bin investiert
Chart sieht gut aus-->Ausbruch aus dem 3eck nach oben...Möglich KZ 2,5 $
à bientôt
OC
Ich bin investiert
Chart sieht gut aus-->Ausbruch aus dem 3eck nach oben...Möglich KZ 2,5 $
à bientôt
OC
Antwort auf Beitrag Nr.: 63.764.959 von occitania am 21.05.20 20:00:16Hier ist sehr viel Luft nach oben ......die Chancen sind enorm.....
Soligenix Inc. Heat-Stabilization Platform Evaluating Use With COVID-19 Vaccine; Zacks Small-Cap Research Increases Valuation To $12.00 Per Share
Hallo silverstrike, 12 $ wäre wirklich ein Träumschen
Da könnte man in Versuchung nochmals aufzustocken
Antwort auf Beitrag Nr.: 63.771.241 von silvesterstrike am 22.05.20 14:11:11
Welche Nachricht wird in welcher Reihenfolge kommen ...
hab hier keine tiefere Einsicht, aber der Wert wird Spass machen, denke ich ...
market cap 54 Millionen 👍🏻
3 Phase 3 Programs mit Daten im 2 Halbjahr 👍🏻
Nicht vergessen Covid 19 vaccine Program Daten auch im 2 Halbjahr 👍🏻
Überzeugen mich und SNGX ist meiner Meinung nach noch immer eine grosse Kaufgelegeheit
Bin heute bei 1.97 $ eingestiegen 😀
Grüsse aus der Schweiz
Zubi
3 Phase 3 Programs mit Daten im 2 Halbjahr 👍🏻
Nicht vergessen Covid 19 vaccine Program Daten auch im 2 Halbjahr 👍🏻
Überzeugen mich und SNGX ist meiner Meinung nach noch immer eine grosse Kaufgelegeheit
Bin heute bei 1.97 $ eingestiegen 😀
Grüsse aus der Schweiz
Zubi
Antwort auf Beitrag Nr.: 63.821.927 von zubi1955 am 27.05.20 17:19:48Servus ....✌
Antwort auf Beitrag Nr.: 63.764.959 von occitania am 21.05.20 20:00:16Spannende Aktie, und heute aus dem überkauften Bereich auf angenehme $ 1,90 abgekühlt.
Bin jetzt mal drin. Yeah Baby !
Bin jetzt mal drin. Yeah Baby !

Antwort auf Beitrag Nr.: 63.848.645 von Faktisch am 29.05.20 21:47:14Salut Faktisch
Freue mich dich hier zu lesen...Kompetenz und Humor ...Hat hier nur 1 bisschen gefehlt
Habe bei mir 1 Analyse reingestellt...

à bientôt
OC

Freue mich dich hier zu lesen...Kompetenz und Humor ...Hat hier nur 1 bisschen gefehlt
Habe bei mir 1 Analyse reingestellt...


à bientôt
OC

Antwort auf Beitrag Nr.: 63.852.953 von occitania am 30.05.20 19:24:50Salut
Soligenix - BioNJ COVID 19 Rapid Fire Research Showcase - June 5, 2020
à bientôt
OC
Soligenix - BioNJ COVID 19 Rapid Fire Research Showcase - June 5, 2020
à bientôt
OC
SNGX ist auch ziemlich attraktiv auf diesem Niveau mit Phase 3 Daten im 4Q und dem Covid 19 Vaccine Programm
Marktkap $49 Million / Cash $8 Million oder ausreichen bis mitte 2021 /
Neue Präsentation
http://ir.soligenix.com/download/Soligenix+Corporate+Present…
Soligenix Completes Enrollment in its Pivotal Phase 3 Clinical Trial of SGX942 for the Treatment of Oral Mucositis
https://finance.yahoo.com/news/soligenix-completes-enrollmen…
Final top-line results expected Q4 2020
SNGX: Q&A on COVID-19 Vaccine Candidate CiVax™…
https://finance.yahoo.com/news/sngx-q-covid-19-vaccine-09390…
As a reminder, following the positive topline data presented by the company for SGX-301 in CTCL, we continue to anticipate Phase 3 data for SGX-942 in oral mucositis in the fourth quarter of 2020. The company will also be joining the Russell Microcap Index effective June 29th, 2020, which should help to increase visibility within the investment community. Our current valuation is $12 per share.
Marktkap $49 Million / Cash $8 Million oder ausreichen bis mitte 2021 /
Neue Präsentation
http://ir.soligenix.com/download/Soligenix+Corporate+Present…
Soligenix Completes Enrollment in its Pivotal Phase 3 Clinical Trial of SGX942 for the Treatment of Oral Mucositis
https://finance.yahoo.com/news/soligenix-completes-enrollmen…
Final top-line results expected Q4 2020
SNGX: Q&A on COVID-19 Vaccine Candidate CiVax™…
https://finance.yahoo.com/news/sngx-q-covid-19-vaccine-09390…
As a reminder, following the positive topline data presented by the company for SGX-301 in CTCL, we continue to anticipate Phase 3 data for SGX-942 in oral mucositis in the fourth quarter of 2020. The company will also be joining the Russell Microcap Index effective June 29th, 2020, which should help to increase visibility within the investment community. Our current valuation is $12 per share.
der Run beginnt ......
Antwort auf Beitrag Nr.: 64.222.552 von silvesterstrike am 29.06.20 16:25:35
Absolut, wir haben Volumen und Momentum...bin ja mal gespannt ...
Zitat von silvesterstrike: der Run beginnt ......
Absolut, wir haben Volumen und Momentum...bin ja mal gespannt ...
es ist schon seltsam ...dass bei jeder größeren Bewegung nach oben ....ein starkes Volumen (+ ca.5 Mill/Stück...Tag ) eintritt ...dass den Kurs wieder zurück fallen lässt....
vor einem halben Jahr noch .....hatten wir ein durchschnittliches Volumen von 200k -300k Stück /Tag ......derzeit liegen wir bereits bei ca.1Mill Stück /Tag
Ich finde ....daran erkennt man ....ein wachsendes Interesse an SNGX ....ist gut erkennbar 👍......
vor einem halben Jahr noch .....hatten wir ein durchschnittliches Volumen von 200k -300k Stück /Tag ......derzeit liegen wir bereits bei ca.1Mill Stück /Tag
Ich finde ....daran erkennt man ....ein wachsendes Interesse an SNGX ....ist gut erkennbar 👍......
Antwort auf Beitrag Nr.: 64.225.720 von silvesterstrike am 29.06.20 19:51:56 hi,
klar, gesteigertes Verkaufinteresse denn der 3monatschart ist definitif abwärtsgerichtet..........
sehe hier erst mal, besonders im Fall einer Korrektur an den Märkten, weiteren abwärtsbedarf.
Kommt es anders, ums so besser.
M.
klar, gesteigertes Verkaufinteresse denn der 3monatschart ist definitif abwärtsgerichtet..........
sehe hier erst mal, besonders im Fall einer Korrektur an den Märkten, weiteren abwärtsbedarf.
Kommt es anders, ums so besser.
M.
die nächste Rakete hebt ab...
Antwort auf Beitrag Nr.: 64.477.386 von denndannwo am 20.07.20 18:57:10
Unser Depot muss identisch sein 😂
Grüsse aus der Schweiz
Zubi
Unser Depot muss identisch sein 😂
Grüsse aus der Schweiz
Zubi
Antwort auf Beitrag Nr.: 64.478.340 von zubi1955 am 20.07.20 19:59:14
naja ich hab ein schweizer Depot 😆
Zitat von zubi1955: Unser Depot muss identisch sein 😂
Grüsse aus der Schweiz
Zubi
naja ich hab ein schweizer Depot 😆
Antwort auf Beitrag Nr.: 64.478.391 von denndannwo am 20.07.20 20:02:01
😂 bei KTOV bin ich auch dabei 😉
Grüsse aus der Schweiz
Zubi
😂 bei KTOV bin ich auch dabei 😉
Grüsse aus der Schweiz
Zubi
Antwort auf Beitrag Nr.: 64.478.526 von zubi1955 am 20.07.20 20:13:15
DFFN hebt auch gerade ab
Zitat von zubi1955: 😂 bei KTOV bin ich auch dabei 😉
Grüsse aus der Schweiz
Zubi
DFFN hebt auch gerade ab
Antwort auf Beitrag Nr.: 64.479.540 von denndannwo am 20.07.20 21:15:55
Habe ich nicht 😢
Grüsse aus der Schweiz
Zubi
Habe ich nicht 😢
Grüsse aus der Schweiz
Zubi
CYDY
IBIO
NK
SNGX
Alles rennt und rennt.....
IBIO
NK
SNGX
Alles rennt und rennt.....

ein guter Run ....today 👍👍👍
Pressemitteilung
Soligenix veröffentlicht Corporate Update - hebt wichtige Katalysatoren für das zweite Halbjahr 2020 hervor
PRINCETON, NJ, 20. Juli 2020 / PRNewswire über COMTEX / - PRINCETON, NJ, 20. Juli 2020 / PRNewswire / - Soligenix, Inc. (Nasdaq: SNGX) (Soligenix oder das Unternehmen), ein biopharmazeutisches Unternehmen im Spätstadium Das Unternehmen konzentrierte sich auf die Entwicklung und Vermarktung von Produkten zur Behandlung seltener Krankheiten, bei denen ein ungedeckter medizinischer Bedarf besteht, und gab heute ein Update-Schreiben seines Präsidenten und Chief Executive Officer, Dr. Christopher J. Schaber, heraus. Der Inhalt dieses Schreibens ist unten angegeben.
Liebe Freunde und Aktionäre,
Ich hoffe, dieser Brief findet Sie und Ihre Familien sicher und gesund. Seit meinem letzten Update Anfang dieses Jahres hat sich in der Welt viel verändert. Wir erleben jetzt eine Pandemie, die uns alle sowohl persönlich als auch beruflich auf die Probe stellt. Wie viele Life-Science-Unternehmen stehen wir vor der Herausforderung, die Auswirkungen von COVID-19 auf unsere Geschäftstätigkeit und die künftige öffentliche Führung vorherzusagen. Wie vielen von Ihnen bekannt ist, haben wir mit unseren klinischen Phase-3-Programmen einen konservativen Ansatz gewählt, um ihre statistische Integrität in diesen beispiellosen Zeiten aufrechtzuerhalten. Ich freue mich jedoch, Ihnen mitteilen zu können, dass die negativen Auswirkungen der Pandemie auf unsere Studien viel weniger bedeutend waren als ursprünglich angenommen, und dass alle Zeitpläne auf dem richtigen Weg bleiben. Trotzdem werden wir weiterhin wachsam bleiben und alle Herausforderungen melden, die durch die COVID-19-Pandemie verursacht werden und möglicherweise Auswirkungen auf unsere aktuellen Leitlinien haben.
Wir setzen unsere Strategie mit einer Reihe positiver Erfolge fort. Im März gaben wir positive Daten in unserer zentralen Phase-3-FLASH-Studie ("Fluorescent Light Activated Synthetic Hypericin") mit SGX301 (synthetisches Hypericin) zur Behandlung des kutanen T-Zell-Lymphoms (CTCL) bekannt. Im doppelblinden, placebokontrollierten Teil der Studie (Zyklus 1) wurde nach 6-wöchiger Therapie ein statistisch signifikantes Ansprechen auf die Behandlung (p = 0,04) am primären Endpunkt erreicht (Pressemitteilung hier verfügbar ). Dieses positive Ansprechen auf die Behandlung verbesserte sich mit der verlängerten SGX301-Behandlung im offenen Behandlungszyklus, der als Zyklus 2 bezeichnet wird, mit einer zusätzlichen 6-wöchigen Therapie weiter dramatisch (p <0,0001 im Vergleich zu Placebo und p <0,0001 im Vergleich zur 6-wöchigen Behandlung ;;hier ). Als nächstes folgen die erweiterten Sicherheitsergebnisse aus dem optionalen Behandlungszyklus mit Mitgefühl (Zyklus 3) und dem anschließenden 6-monatigen Follow-up, das im vierten Quartal 2020 erwartet wird. In Zyklus 3 Probanden, die die Zyklen 1 und 2 abgeschlossen haben hatten die Möglichkeit, die SGX301-Behandlung von bis zu allen Läsionen für weitere 6 Wochen fortzusetzen. Ich freue mich, Ihnen mitteilen zu können, dass sich die Mehrheit der eingeschriebenen Patienten dafür entschieden hat, diesen optionalen Zyklus der Studie fortzusetzen - ein klarer Hinweis auf ihre Zufriedenheit. Dieser Erfolg bei klinischen Studien war eine enorme Leistung für das Unternehmen, und wir erwarten mit Spannung weitere wichtige Meilensteine für den Rest des Jahres 2020.
Unsere andere entscheidende Phase - 3 - Studie mit SGX942 (dusquetide), bezeichnete als das DOM-INNATE ( „ D usquetide Behandlung in O ral M ucositis - durch Angeborene Immunität Modulation“) Studie, die Behandlung von oraler Mukositis bei Patienten mit Kopf- und Halskrebs, Die Patientenrekrutierung wurde im Juni abgeschlossen (Pressemitteilung hier verfügbar)). Die Studie umfasste erfolgreich 268 Probanden nach einer positiven Zwischenanalyse, die eine prospektiv definierte, nicht verblindete Bewertung des primären Wirksamkeitsendpunkts der Studie durch ein unabhängiges Datenüberwachungskomitee (DMC) beinhaltete. Wie Sie sich vielleicht erinnern, wurde die Studieneinschreibung vorübergehend verlängert, da wir die möglichen Auswirkungen von COVID-19 auf die Studie bewertet haben (z. B. Einhaltung der Patientenbehandlung und Abschluss der erforderlichen Bewertungen). Mit zusätzlichen Anstrengungen der teilnehmenden Patienten, Ärzte und des klinischen Personals konnten wir erfolgreich berichten, dass die negativen Auswirkungen der Pandemie auf die Gesamtstudie viel geringer waren als ursprünglich angenommen. Nach Abschluss der Registrierung werden im vierten Quartal 2020 Top-Line-Ergebnisse erwartet.
In unserem Geschäftsbereich Public Health Solutions treiben wir unsere Arbeit mit der University of Hawaii in Manoa (UH Manoa) und Hawaii Biotech Inc. (HBI) im Bereich Filovirus-Impfstoffe (Schutz vor Viren wie Ebola und Marburg) weiter voran. Wir haben dieses Programm auch auf die Entwicklung von Impfstoffen zur potenziellen Bekämpfung von Coronaviren ausgedehnt, einschließlich SARS-CoV-2, der Ursache von COVID-19 (aktuelle Konferenzpräsentation hier verfügbar ). Wir unterstützen weiterhin unsere FDA Fast Tracked (Pressemitteilung hier verfügbar ). Der hitzestabile Ricin-Impfstoff RiVax ® wurde mit einem Auftrag des National Institute of Allergy and Infectious Disease in Höhe von 21,2 Mio. USD ausgezeichnet.
Mit ungefähr 9 Millionen US-Dollar in bar, ohne unsere nicht verwässernde staatliche Finanzierung, sowie der Verkaufsemissionsvereinbarung mit B. Riley FBR, Inc. am Markt (ATM), um unsere Cash Runway bei Bedarf vernünftig zu ergänzen, erwarten wir dies Ausreichendes Kapital, um mehrere Wendepunkte in unserer Pipeline für seltene Krankheiten zu erreichen, einschließlich der wichtigsten Ergebnisse unserer klinischen Phase-3-Studie SGX942 bei oraler Mukositis.
Unternehmenshighlights
Seit unserem letzten Update im Januar haben wir uns weiterhin auf die Qualitätsausführung unserer zahlreichen Entwicklungsprogramme in unserer Pipeline für seltene Krankheiten konzentriert, in der wir derzeit davon ausgehen , dass wir in der zweiten Hälfte des Jahres 2020 mehrere wichtige Meilensteine erreichen werden .
Geschäftsfeld Spezialisierte Biotherapeutika
Wir entwickeln unsere beiden zentralen klinischen Phase-3-Programme weiter.
1. Am 19. März 2020 gaben wir positive vorläufige Top-Line-Ergebnisse für unsere zentrale Phase-3-FLASH-Studie zur Bewertung von SGX301 bei der Behandlung der Stadien IA, IB und IIA CTCL bekannt. Die Studie umfasste 169 Patienten, die 2: 1 randomisiert wurden, um entweder SGX301 oder Placebo zu erhalten, was ein statistisch signifikantes Ansprechen auf die Behandlung (p = 0,04) in der primären Endpunktbewertung des Composite Assessment of Index Lesion Score (CAILS) nach 8 Wochen für Zyklus 1 zeigte.
Ellen Kim, MD, Direktorin der Dermatologieklinik, Perelman Center for Advanced Medicine und leitende Forscherin der FLASH-Studie, erklärte in der Ankündigung: "Dies ist ein wichtiges Ergebnis für Patienten mit CTCL. SGX301 hat erfolgreich die Wirksamkeit bei dieser herausfordernden chronischen Erkrankung nachgewiesen Krebs ohne Sicherheitsbedenken, was ihn zu einer potenziell bevorzugten First-Line-Option für die Behandlung von CTCL im Frühstadium macht. Dies ist die große Mehrheit der Patienten, die an dieser Krankheit leiden. Dies beweist erfolgreich, dass das Medikament eine biologische Aktivität bei der Bekämpfung dieser Krankheit aufweist ein relativ kurzes Zeitfenster mit vorläufigen Daten, die darauf hindeuten, dass die Verbesserung mit einer längeren Behandlung weiter zunimmt. Zusätzlich zu der nachgewiesenen WirksamkeitSGX301 wurde gut vertragen und sein Wirkungsmechanismus ist nicht wie andere derzeit verfügbare Therapien mit DNA-Schäden verbunden. "
Am 30. April 2020 gaben wir bekannt, dass eine fortgesetzte Behandlung mit SGX301 (synthetisches Hypericin) zweimal wöchentlich über 12 Wochen die positive Ansprechrate auf 40% erhöhte (p <0,0001 im Vergleich zu Placebo und p <0,0001 im Vergleich zu 6 Wochen Behandlung) offener Behandlungszyklus (als Zyklus 2 bezeichnet) der zentralen Phase-3-Studie zur Behandlung von CTCL im Frühstadium. Diese statistisch hoch signifikanten Ergebnisse bestätigen den Nutzen einer fortgesetzten SGX301-Behandlung bei CTCL-Patienten.
Wie Frau Susan Thornton, Geschäftsführerin der Cutaneous Lymphoma Foundation, der größten Patientenvertretung für CTCL, in der Ankündigung feststellte: "Die Verfügbarkeit einer sicheren, schnell wirkenden Behandlung für CTCL ist für Patienten äußerst wichtig Patientenperspektive, Sie möchten eine Behandlung, die sicher und effektiv mit den geringsten Nebenwirkungen ist. Viele der heute verfügbaren Therapien wirken entweder nicht bei allen Patienten, wirken nicht über einen längeren Zeitraum, können es nicht sein Als Leiter der Patientenorganisation und selbst als Patient weiß ich aus erster Hand, wie wichtig es ist, mehr Therapien und Optionen zu entwickeln, um Menschen zu unterstützen, mit denen ich zusammen lebe dieser seltene Krebs. "
Wir warten nun auf die Sicherheitsdaten aus dem optionalen (mitfühlenden) Behandlungszyklus (Zyklus 3) der Studie, in dem Patienten eine SGX301-Behandlung von bis zu allen ihren Läsionen erhalten konnten, sowie auf die einmalige 6-monatige Sicherheitsüberwachung Alle Behandlungen sind beendet. Bemerkenswert ist, dass nicht nur die Mehrheit der eingeschriebenen Patienten gewählt wurde, um diesen optionalen Zyklus der Studie fortzusetzen, sondern in einer Analyse einer Untergruppe von Patienten in Zyklus 3 wurde gezeigt, dass SGX301 nicht systemisch verfügbar ist, was mit dem Allgemeinen übereinstimmt Sicherheit mit diesem aktuellen Produkt bis heute beobachtet. Die Ergebnisse aus Zyklus 3 und dem anschließenden 6-Monats-Follow-up werden im vierten Quartal 2020 erwartet.
SGX301 wurde von der US-amerikanischen Food and Drug Administration (FDA) als Orphan Drug sowie als Fast Track ausgezeichnet. Darüber hinaus wurde SGX301 von der Europäischen Arzneimittel-Agentur (EMA) als Orphan Drug und von der Regulierungsbehörde für Arzneimittel und Gesundheitsprodukte (MHRA) im Vereinigten Königreich (UK) als vielversprechende innovative Medizin (PIM) ausgezeichnet.
2. Am 24. Juni 2020 gaben wir bekannt, dass wir die vollständige Aufnahme von 268 Patienten abgeschlossen haben, die randomisiert in die zentrale multinationale doppelblinde, placebokontrollierte klinische Studie der Phase 3 mit SGX942 (Dusquetid) zur Behandlung der oralen Mukositis bei Patienten mit Kopf aufgenommen wurden und Halskrebs (HNC), der eine Radiochemotherapie (CRT) erhält. Angesichts der zuvor gemeldeten positiven Zwischenanalyse (Pressemitteilung hier verfügbar ) freuen wir uns auf die endgültigen Ergebnisse der DOM-INNATE-Studie im vierten Quartal 2020.
Dusquetid ist eine neue chemische Einheit mit einem neuartigen Wirkmechanismus, der die Reaktion des Körpers auf Verletzungen und Infektionen in Richtung einer entzündungshemmenden und einer infektionshemmenden Reaktion moduliert. Es beschleunigt auch die Auflösung von Gewebeschäden nach Exposition gegenüber einer Vielzahl von Wirkstoffen, einschließlich bakterieller Krankheitserreger, Trauma und Chemo- und / oder Strahlentherapie. Die Daten der Phase 2 zeigten eine signifikante Verkürzung der Dauer der oralen Mukositis sowie eine Verringerung der Infektionsraten, wie 2016 im Journal of Biotechnology ( hier verfügbar ) veröffentlicht. Langzeit-Follow-up-Daten aus der Phase-2-Studie, die 2017 in Biotechnology Reports ( hier verfügbar) veröffentlicht wurden) wiesen ferner auf die Sicherheit und Verträglichkeit der SGX942-Behandlung hin, mit einem anhaltenden Trend zu einer verringerten Mortalität und einer erhöhten Tumorauflösung im Vergleich zu Placebo. SGX942 hat von der FDA die Fast-Track-Kennzeichnung für die Behandlung der oralen Mukositis infolge von CRT bei HNC-Patienten sowie die PIM-Kennzeichnung von der MHRA in Großbritannien erhalten.
Geschäftsbereich Public Health Solutions
Zuletzt haben wir spannende Entwicklungen im Bereich neu auftretender Infektionskrankheiten angekündigt. In Zusammenarbeit mit UH Manoa und HBI treiben wir die Entwicklung von Filovirus-Impfstoffen (Schutz vor Viren wie Ebola und Marburg) weiter voran. In Zusammenarbeit mit Axel Lehrer, PhD der Abteilung für Tropenmedizin, Medizinische Mikrobiologie und Pharmakologie, John A. Burns School of Medicine (JABSOM), UH Manoa, haben wir die Machbarkeit der Entwicklung hitzestabiler Filovirus-Impfstoffe für Untereinheiten, einschließlich der Ebola-Virus-Krankheit, demonstriert sowie Marburg-Virus-Krankheit, mit sowohl einwertigen als auch zweiwertigen Impfstoffkombinationen. Es wurden Formulierungsbedingungen identifiziert, die eine Wärmestabilisierung jedes Antigens allein oder in Kombination für mindestens 12 Wochen bei 40 Grad Celsius (104 Grad Fahrenheit) ermöglichen.
Die Formulierungsentwicklungsarbeit mit der UH Manoa an einem dreiwertigen thermostabilisierten Ebola-Impfstoff wird derzeit von NIAID über einen Zeitraum von fünf Jahren mit einem Sub-Award in Höhe von 700.000 USD unterstützt. Der Impfstoff für Untereinheiten bietet eine breitere Abdeckung für verschiedene Filoviren, einschließlich Ebola, Marburg und Sudan, und bietet das Potenzial für eine einfachere Lieferkette, ohne dass Kühlbedingungen erforderlich sind. Frühere Arbeiten zum Nachweis der Thermostabilisierung des einwertigen Impfstoffs wurden kürzlich im European Journal of Pharmaceutics and Biopharmaceutics ( hier verfügbar ) veröffentlicht.
Wir haben unsere Glykoprotein-Impfstoffplattform mit UH Manoa erweitert und kürzlich Anstrengungen angekündigt, um einen sicheren, breit anwendbaren Impfstoff für Untereinheiten zur Behandlung von COVID-19 zu entwickeln. Unser COVID-19-Impfstoffkandidat CiVax ™ verwendet ein neuartiges Adjuvans, CoVaccine HT ™, das wir exklusiv von BTG Specialty Pharmaceuticals ("BTG"), einem Geschäftsbereich der Boston Scientific Corporation (NYSE: BSX), in den Bereichen lizenziert haben Coronavirus und Pandemie-Grippe (Pressemitteilung hier verfügbar). Proof-of-Concept-Studien an Mäusen mit der Plattform haben bereits ein starkes Potenzial für die COVID-19-Immunogenität gezeigt. Die Immunantwort besteht aus zwei Komponenten: der Antikörperantwort und der zellvermittelten Antwort (an der T-Zellen beteiligt sind). Beide können durch Impfstoffe aktiviert werden. Typischerweise zeichnen sich Impfstoffe durch ihre Fähigkeit aus, Antikörper und insbesondere neutralisierende Antikörper zu erzeugen (dh Antikörper, die die Bindung und den Eintritt von Viren verhindern und das Virus für die Zerstörung markieren können). Prototypstudien mit dem CoVaccine-Adjuvans mit einem SARS-CoV-2-Antigen haben gezeigt, dass beide Arten der Immunität signifikant verbessert werden können. Einige dieser Ergebnisse sind in einer aktuellen Konferenzpräsentation verfügbar ( hier verfügbar)). Wir werden versuchen, weitere Daten offenzulegen, sobald diese verfügbar sind.
Wir entwickeln unseren hitzestabilen Ricin-Impfstoff RiVax ® mit Unterstützung von bis zu 21,2 Millionen US-Dollar über einen Zeitraum von sechs Jahren weiter, der von NIAID vergeben wurde. Dort haben wir erfolgreich Biomarker für RiVax ® -Tests identifiziert , die 2018 in der Zeitschrift Vaccine veröffentlicht wurden ( hier verfügbar) und in jüngerer Zeit hier), wodurch eine mögliche Zulassung gemäß der FDA-Tierregel erleichtert wird. Die FDA-Tierregel wird auf Produkte angewendet, bei denen Tests in klinischen Studien am Menschen unethisch und im Fall von Ricintoxin tödlich wären. Die Tierregel kombiniert Sicherheitsstudien am Menschen und Wirksamkeitstests bei Tieren, um die Zulassung zu erleichtern. Der Schlüssel zur Anwendung der Tierregel ist das Erfordernis, eine Korrelation zwischen der in klinischen Studien bei gesunden Freiwilligen beobachteten Immunantwort und der in Tierwirksamkeitsstudien nachgewiesenen Immunantwort herzustellen.
RiVax ® hat von der FDA die Orphan Drug-Kennzeichnung sowie die Fast Track-Kennzeichnung erhalten und kann sich nach der Zulassung in den USA als neues chemisches Unternehmen für einen Biodfense Priority Review Voucher (PRV) qualifizieren. PRVs sind übertragbar und können verkauft werden. In den letzten Jahren wurde ein Umsatz von ca. 100 Millionen US-Dollar erzielt. Zusätzlich wurde RiVax ® von der EMA die Orphan Drug- Auszeichnung verliehen. Jüngste Ereignisse, einschließlich der Nachricht von einem an Präsident Trump gerichteten Umschlag, der dieses potente und möglicherweise tödliche Toxin enthalten soll, sowie eines vereitelten Bioangriffs mit Ricin in Deutschland lassen darauf schließen, dass der RiVax ® -Impfstoff für mehrere Länder von zunehmendem Interesse sein könnte .
Zusätzliche Mittel für Dusquetid (Wirkstoff in SGX942) wurden auch durch eine Subvention der Defense Threat Reduction Agency (DTRA) in Höhe von ca. 600.000 USD über einen Zeitraum von drei Jahren erhalten (Zugang zur Pressemitteilung hier ). Diese Studien werden die therapeutische antiinfektiöse Wirkung von Dusquetid in Tiermodellen von Infektionserregern im Zusammenhang mit der biologischen Abwehr weiter untersuchen.
Nicht verwässernde Finanzierung
Wie oben erwähnt, verfolgen wir aggressiv nicht verwässernde Finanzierungsquellen, um unsere Pipeline für seltene Krankheiten zu unterstützen. Für zwei unserer Entwicklungsprogramme für Biotherapeutika haben wir zwei NIH SBIR-Zuschüsse in Höhe von insgesamt ca. 3 Mio. USD erhalten. Wir arbeiten auch mit staatlichen Zuschüssen und Auftragsvergaben in Höhe von bis zu 22,5 Mio. USD in unserem Geschäftsbereich Public Health Solutions , um die Entwicklung von RiVax ® , unsere Zusammenarbeit mit UH Manoa und HBI bei der Entwicklung eines dreiwertigen thermostabilisierten Ebola-Impfstoffs sowie die Bewertung von zu unterstützen Dusquetid als Breitbandtherapeutikum zur Behandlung von bakteriellen Infektionskrankheiten. Diese bisher nicht verwässernde Finanzierung hat unsere Entwicklungskosten erheblich ausgeglichen und uns gleichzeitig besser positioniert, um unseren gesamten Cash-Burn effektiv zu steuern.
Werbung
Bilanz und Kapital
Bis Juni hatten wir ungefähr 9 Millionen US-Dollar in bar. Zusätzlich zu den bisher nicht verwässernden Finanzmitteln verfügen wir mit B. Riley FBR, Inc. über ein Geldautomateninstrument, mit dem Bargeld bei Bedarf mit Bedacht ergänzt werden kann, wenn / falls dies erforderlich ist und das Aktienvolumen und der Preis dies zulassen Durchführung bestimmter CTCL-Aktivitäten vor der Kommerzialisierung, um möglicherweise die Einreichung eines neuen Arzneimittelantrags bei der FDA zu unterstützen. Mit einer soliden Bilanz und den verfügbaren Ressourcen erwägen wir derzeit keine größere Kapitalerhöhung, bis die endgültigen Ergebnisse der oralen Mukositis bekannt sind.
Soligenix veröffentlicht Corporate Update - hebt wichtige Katalysatoren für das zweite Halbjahr 2020 hervor
PRINCETON, NJ, 20. Juli 2020 / PRNewswire über COMTEX / - PRINCETON, NJ, 20. Juli 2020 / PRNewswire / - Soligenix, Inc. (Nasdaq: SNGX) (Soligenix oder das Unternehmen), ein biopharmazeutisches Unternehmen im Spätstadium Das Unternehmen konzentrierte sich auf die Entwicklung und Vermarktung von Produkten zur Behandlung seltener Krankheiten, bei denen ein ungedeckter medizinischer Bedarf besteht, und gab heute ein Update-Schreiben seines Präsidenten und Chief Executive Officer, Dr. Christopher J. Schaber, heraus. Der Inhalt dieses Schreibens ist unten angegeben.
Liebe Freunde und Aktionäre,
Ich hoffe, dieser Brief findet Sie und Ihre Familien sicher und gesund. Seit meinem letzten Update Anfang dieses Jahres hat sich in der Welt viel verändert. Wir erleben jetzt eine Pandemie, die uns alle sowohl persönlich als auch beruflich auf die Probe stellt. Wie viele Life-Science-Unternehmen stehen wir vor der Herausforderung, die Auswirkungen von COVID-19 auf unsere Geschäftstätigkeit und die künftige öffentliche Führung vorherzusagen. Wie vielen von Ihnen bekannt ist, haben wir mit unseren klinischen Phase-3-Programmen einen konservativen Ansatz gewählt, um ihre statistische Integrität in diesen beispiellosen Zeiten aufrechtzuerhalten. Ich freue mich jedoch, Ihnen mitteilen zu können, dass die negativen Auswirkungen der Pandemie auf unsere Studien viel weniger bedeutend waren als ursprünglich angenommen, und dass alle Zeitpläne auf dem richtigen Weg bleiben. Trotzdem werden wir weiterhin wachsam bleiben und alle Herausforderungen melden, die durch die COVID-19-Pandemie verursacht werden und möglicherweise Auswirkungen auf unsere aktuellen Leitlinien haben.
Wir setzen unsere Strategie mit einer Reihe positiver Erfolge fort. Im März gaben wir positive Daten in unserer zentralen Phase-3-FLASH-Studie ("Fluorescent Light Activated Synthetic Hypericin") mit SGX301 (synthetisches Hypericin) zur Behandlung des kutanen T-Zell-Lymphoms (CTCL) bekannt. Im doppelblinden, placebokontrollierten Teil der Studie (Zyklus 1) wurde nach 6-wöchiger Therapie ein statistisch signifikantes Ansprechen auf die Behandlung (p = 0,04) am primären Endpunkt erreicht (Pressemitteilung hier verfügbar ). Dieses positive Ansprechen auf die Behandlung verbesserte sich mit der verlängerten SGX301-Behandlung im offenen Behandlungszyklus, der als Zyklus 2 bezeichnet wird, mit einer zusätzlichen 6-wöchigen Therapie weiter dramatisch (p <0,0001 im Vergleich zu Placebo und p <0,0001 im Vergleich zur 6-wöchigen Behandlung ;;hier ). Als nächstes folgen die erweiterten Sicherheitsergebnisse aus dem optionalen Behandlungszyklus mit Mitgefühl (Zyklus 3) und dem anschließenden 6-monatigen Follow-up, das im vierten Quartal 2020 erwartet wird. In Zyklus 3 Probanden, die die Zyklen 1 und 2 abgeschlossen haben hatten die Möglichkeit, die SGX301-Behandlung von bis zu allen Läsionen für weitere 6 Wochen fortzusetzen. Ich freue mich, Ihnen mitteilen zu können, dass sich die Mehrheit der eingeschriebenen Patienten dafür entschieden hat, diesen optionalen Zyklus der Studie fortzusetzen - ein klarer Hinweis auf ihre Zufriedenheit. Dieser Erfolg bei klinischen Studien war eine enorme Leistung für das Unternehmen, und wir erwarten mit Spannung weitere wichtige Meilensteine für den Rest des Jahres 2020.
Unsere andere entscheidende Phase - 3 - Studie mit SGX942 (dusquetide), bezeichnete als das DOM-INNATE ( „ D usquetide Behandlung in O ral M ucositis - durch Angeborene Immunität Modulation“) Studie, die Behandlung von oraler Mukositis bei Patienten mit Kopf- und Halskrebs, Die Patientenrekrutierung wurde im Juni abgeschlossen (Pressemitteilung hier verfügbar)). Die Studie umfasste erfolgreich 268 Probanden nach einer positiven Zwischenanalyse, die eine prospektiv definierte, nicht verblindete Bewertung des primären Wirksamkeitsendpunkts der Studie durch ein unabhängiges Datenüberwachungskomitee (DMC) beinhaltete. Wie Sie sich vielleicht erinnern, wurde die Studieneinschreibung vorübergehend verlängert, da wir die möglichen Auswirkungen von COVID-19 auf die Studie bewertet haben (z. B. Einhaltung der Patientenbehandlung und Abschluss der erforderlichen Bewertungen). Mit zusätzlichen Anstrengungen der teilnehmenden Patienten, Ärzte und des klinischen Personals konnten wir erfolgreich berichten, dass die negativen Auswirkungen der Pandemie auf die Gesamtstudie viel geringer waren als ursprünglich angenommen. Nach Abschluss der Registrierung werden im vierten Quartal 2020 Top-Line-Ergebnisse erwartet.
In unserem Geschäftsbereich Public Health Solutions treiben wir unsere Arbeit mit der University of Hawaii in Manoa (UH Manoa) und Hawaii Biotech Inc. (HBI) im Bereich Filovirus-Impfstoffe (Schutz vor Viren wie Ebola und Marburg) weiter voran. Wir haben dieses Programm auch auf die Entwicklung von Impfstoffen zur potenziellen Bekämpfung von Coronaviren ausgedehnt, einschließlich SARS-CoV-2, der Ursache von COVID-19 (aktuelle Konferenzpräsentation hier verfügbar ). Wir unterstützen weiterhin unsere FDA Fast Tracked (Pressemitteilung hier verfügbar ). Der hitzestabile Ricin-Impfstoff RiVax ® wurde mit einem Auftrag des National Institute of Allergy and Infectious Disease in Höhe von 21,2 Mio. USD ausgezeichnet.
Mit ungefähr 9 Millionen US-Dollar in bar, ohne unsere nicht verwässernde staatliche Finanzierung, sowie der Verkaufsemissionsvereinbarung mit B. Riley FBR, Inc. am Markt (ATM), um unsere Cash Runway bei Bedarf vernünftig zu ergänzen, erwarten wir dies Ausreichendes Kapital, um mehrere Wendepunkte in unserer Pipeline für seltene Krankheiten zu erreichen, einschließlich der wichtigsten Ergebnisse unserer klinischen Phase-3-Studie SGX942 bei oraler Mukositis.
Unternehmenshighlights
Seit unserem letzten Update im Januar haben wir uns weiterhin auf die Qualitätsausführung unserer zahlreichen Entwicklungsprogramme in unserer Pipeline für seltene Krankheiten konzentriert, in der wir derzeit davon ausgehen , dass wir in der zweiten Hälfte des Jahres 2020 mehrere wichtige Meilensteine erreichen werden .
Geschäftsfeld Spezialisierte Biotherapeutika
Wir entwickeln unsere beiden zentralen klinischen Phase-3-Programme weiter.
1. Am 19. März 2020 gaben wir positive vorläufige Top-Line-Ergebnisse für unsere zentrale Phase-3-FLASH-Studie zur Bewertung von SGX301 bei der Behandlung der Stadien IA, IB und IIA CTCL bekannt. Die Studie umfasste 169 Patienten, die 2: 1 randomisiert wurden, um entweder SGX301 oder Placebo zu erhalten, was ein statistisch signifikantes Ansprechen auf die Behandlung (p = 0,04) in der primären Endpunktbewertung des Composite Assessment of Index Lesion Score (CAILS) nach 8 Wochen für Zyklus 1 zeigte.
Ellen Kim, MD, Direktorin der Dermatologieklinik, Perelman Center for Advanced Medicine und leitende Forscherin der FLASH-Studie, erklärte in der Ankündigung: "Dies ist ein wichtiges Ergebnis für Patienten mit CTCL. SGX301 hat erfolgreich die Wirksamkeit bei dieser herausfordernden chronischen Erkrankung nachgewiesen Krebs ohne Sicherheitsbedenken, was ihn zu einer potenziell bevorzugten First-Line-Option für die Behandlung von CTCL im Frühstadium macht. Dies ist die große Mehrheit der Patienten, die an dieser Krankheit leiden. Dies beweist erfolgreich, dass das Medikament eine biologische Aktivität bei der Bekämpfung dieser Krankheit aufweist ein relativ kurzes Zeitfenster mit vorläufigen Daten, die darauf hindeuten, dass die Verbesserung mit einer längeren Behandlung weiter zunimmt. Zusätzlich zu der nachgewiesenen WirksamkeitSGX301 wurde gut vertragen und sein Wirkungsmechanismus ist nicht wie andere derzeit verfügbare Therapien mit DNA-Schäden verbunden. "
Am 30. April 2020 gaben wir bekannt, dass eine fortgesetzte Behandlung mit SGX301 (synthetisches Hypericin) zweimal wöchentlich über 12 Wochen die positive Ansprechrate auf 40% erhöhte (p <0,0001 im Vergleich zu Placebo und p <0,0001 im Vergleich zu 6 Wochen Behandlung) offener Behandlungszyklus (als Zyklus 2 bezeichnet) der zentralen Phase-3-Studie zur Behandlung von CTCL im Frühstadium. Diese statistisch hoch signifikanten Ergebnisse bestätigen den Nutzen einer fortgesetzten SGX301-Behandlung bei CTCL-Patienten.
Wie Frau Susan Thornton, Geschäftsführerin der Cutaneous Lymphoma Foundation, der größten Patientenvertretung für CTCL, in der Ankündigung feststellte: "Die Verfügbarkeit einer sicheren, schnell wirkenden Behandlung für CTCL ist für Patienten äußerst wichtig Patientenperspektive, Sie möchten eine Behandlung, die sicher und effektiv mit den geringsten Nebenwirkungen ist. Viele der heute verfügbaren Therapien wirken entweder nicht bei allen Patienten, wirken nicht über einen längeren Zeitraum, können es nicht sein Als Leiter der Patientenorganisation und selbst als Patient weiß ich aus erster Hand, wie wichtig es ist, mehr Therapien und Optionen zu entwickeln, um Menschen zu unterstützen, mit denen ich zusammen lebe dieser seltene Krebs. "
Wir warten nun auf die Sicherheitsdaten aus dem optionalen (mitfühlenden) Behandlungszyklus (Zyklus 3) der Studie, in dem Patienten eine SGX301-Behandlung von bis zu allen ihren Läsionen erhalten konnten, sowie auf die einmalige 6-monatige Sicherheitsüberwachung Alle Behandlungen sind beendet. Bemerkenswert ist, dass nicht nur die Mehrheit der eingeschriebenen Patienten gewählt wurde, um diesen optionalen Zyklus der Studie fortzusetzen, sondern in einer Analyse einer Untergruppe von Patienten in Zyklus 3 wurde gezeigt, dass SGX301 nicht systemisch verfügbar ist, was mit dem Allgemeinen übereinstimmt Sicherheit mit diesem aktuellen Produkt bis heute beobachtet. Die Ergebnisse aus Zyklus 3 und dem anschließenden 6-Monats-Follow-up werden im vierten Quartal 2020 erwartet.
SGX301 wurde von der US-amerikanischen Food and Drug Administration (FDA) als Orphan Drug sowie als Fast Track ausgezeichnet. Darüber hinaus wurde SGX301 von der Europäischen Arzneimittel-Agentur (EMA) als Orphan Drug und von der Regulierungsbehörde für Arzneimittel und Gesundheitsprodukte (MHRA) im Vereinigten Königreich (UK) als vielversprechende innovative Medizin (PIM) ausgezeichnet.
2. Am 24. Juni 2020 gaben wir bekannt, dass wir die vollständige Aufnahme von 268 Patienten abgeschlossen haben, die randomisiert in die zentrale multinationale doppelblinde, placebokontrollierte klinische Studie der Phase 3 mit SGX942 (Dusquetid) zur Behandlung der oralen Mukositis bei Patienten mit Kopf aufgenommen wurden und Halskrebs (HNC), der eine Radiochemotherapie (CRT) erhält. Angesichts der zuvor gemeldeten positiven Zwischenanalyse (Pressemitteilung hier verfügbar ) freuen wir uns auf die endgültigen Ergebnisse der DOM-INNATE-Studie im vierten Quartal 2020.
Dusquetid ist eine neue chemische Einheit mit einem neuartigen Wirkmechanismus, der die Reaktion des Körpers auf Verletzungen und Infektionen in Richtung einer entzündungshemmenden und einer infektionshemmenden Reaktion moduliert. Es beschleunigt auch die Auflösung von Gewebeschäden nach Exposition gegenüber einer Vielzahl von Wirkstoffen, einschließlich bakterieller Krankheitserreger, Trauma und Chemo- und / oder Strahlentherapie. Die Daten der Phase 2 zeigten eine signifikante Verkürzung der Dauer der oralen Mukositis sowie eine Verringerung der Infektionsraten, wie 2016 im Journal of Biotechnology ( hier verfügbar ) veröffentlicht. Langzeit-Follow-up-Daten aus der Phase-2-Studie, die 2017 in Biotechnology Reports ( hier verfügbar) veröffentlicht wurden) wiesen ferner auf die Sicherheit und Verträglichkeit der SGX942-Behandlung hin, mit einem anhaltenden Trend zu einer verringerten Mortalität und einer erhöhten Tumorauflösung im Vergleich zu Placebo. SGX942 hat von der FDA die Fast-Track-Kennzeichnung für die Behandlung der oralen Mukositis infolge von CRT bei HNC-Patienten sowie die PIM-Kennzeichnung von der MHRA in Großbritannien erhalten.
Geschäftsbereich Public Health Solutions
Zuletzt haben wir spannende Entwicklungen im Bereich neu auftretender Infektionskrankheiten angekündigt. In Zusammenarbeit mit UH Manoa und HBI treiben wir die Entwicklung von Filovirus-Impfstoffen (Schutz vor Viren wie Ebola und Marburg) weiter voran. In Zusammenarbeit mit Axel Lehrer, PhD der Abteilung für Tropenmedizin, Medizinische Mikrobiologie und Pharmakologie, John A. Burns School of Medicine (JABSOM), UH Manoa, haben wir die Machbarkeit der Entwicklung hitzestabiler Filovirus-Impfstoffe für Untereinheiten, einschließlich der Ebola-Virus-Krankheit, demonstriert sowie Marburg-Virus-Krankheit, mit sowohl einwertigen als auch zweiwertigen Impfstoffkombinationen. Es wurden Formulierungsbedingungen identifiziert, die eine Wärmestabilisierung jedes Antigens allein oder in Kombination für mindestens 12 Wochen bei 40 Grad Celsius (104 Grad Fahrenheit) ermöglichen.
Die Formulierungsentwicklungsarbeit mit der UH Manoa an einem dreiwertigen thermostabilisierten Ebola-Impfstoff wird derzeit von NIAID über einen Zeitraum von fünf Jahren mit einem Sub-Award in Höhe von 700.000 USD unterstützt. Der Impfstoff für Untereinheiten bietet eine breitere Abdeckung für verschiedene Filoviren, einschließlich Ebola, Marburg und Sudan, und bietet das Potenzial für eine einfachere Lieferkette, ohne dass Kühlbedingungen erforderlich sind. Frühere Arbeiten zum Nachweis der Thermostabilisierung des einwertigen Impfstoffs wurden kürzlich im European Journal of Pharmaceutics and Biopharmaceutics ( hier verfügbar ) veröffentlicht.
Wir haben unsere Glykoprotein-Impfstoffplattform mit UH Manoa erweitert und kürzlich Anstrengungen angekündigt, um einen sicheren, breit anwendbaren Impfstoff für Untereinheiten zur Behandlung von COVID-19 zu entwickeln. Unser COVID-19-Impfstoffkandidat CiVax ™ verwendet ein neuartiges Adjuvans, CoVaccine HT ™, das wir exklusiv von BTG Specialty Pharmaceuticals ("BTG"), einem Geschäftsbereich der Boston Scientific Corporation (NYSE: BSX), in den Bereichen lizenziert haben Coronavirus und Pandemie-Grippe (Pressemitteilung hier verfügbar). Proof-of-Concept-Studien an Mäusen mit der Plattform haben bereits ein starkes Potenzial für die COVID-19-Immunogenität gezeigt. Die Immunantwort besteht aus zwei Komponenten: der Antikörperantwort und der zellvermittelten Antwort (an der T-Zellen beteiligt sind). Beide können durch Impfstoffe aktiviert werden. Typischerweise zeichnen sich Impfstoffe durch ihre Fähigkeit aus, Antikörper und insbesondere neutralisierende Antikörper zu erzeugen (dh Antikörper, die die Bindung und den Eintritt von Viren verhindern und das Virus für die Zerstörung markieren können). Prototypstudien mit dem CoVaccine-Adjuvans mit einem SARS-CoV-2-Antigen haben gezeigt, dass beide Arten der Immunität signifikant verbessert werden können. Einige dieser Ergebnisse sind in einer aktuellen Konferenzpräsentation verfügbar ( hier verfügbar)). Wir werden versuchen, weitere Daten offenzulegen, sobald diese verfügbar sind.
Wir entwickeln unseren hitzestabilen Ricin-Impfstoff RiVax ® mit Unterstützung von bis zu 21,2 Millionen US-Dollar über einen Zeitraum von sechs Jahren weiter, der von NIAID vergeben wurde. Dort haben wir erfolgreich Biomarker für RiVax ® -Tests identifiziert , die 2018 in der Zeitschrift Vaccine veröffentlicht wurden ( hier verfügbar) und in jüngerer Zeit hier), wodurch eine mögliche Zulassung gemäß der FDA-Tierregel erleichtert wird. Die FDA-Tierregel wird auf Produkte angewendet, bei denen Tests in klinischen Studien am Menschen unethisch und im Fall von Ricintoxin tödlich wären. Die Tierregel kombiniert Sicherheitsstudien am Menschen und Wirksamkeitstests bei Tieren, um die Zulassung zu erleichtern. Der Schlüssel zur Anwendung der Tierregel ist das Erfordernis, eine Korrelation zwischen der in klinischen Studien bei gesunden Freiwilligen beobachteten Immunantwort und der in Tierwirksamkeitsstudien nachgewiesenen Immunantwort herzustellen.
RiVax ® hat von der FDA die Orphan Drug-Kennzeichnung sowie die Fast Track-Kennzeichnung erhalten und kann sich nach der Zulassung in den USA als neues chemisches Unternehmen für einen Biodfense Priority Review Voucher (PRV) qualifizieren. PRVs sind übertragbar und können verkauft werden. In den letzten Jahren wurde ein Umsatz von ca. 100 Millionen US-Dollar erzielt. Zusätzlich wurde RiVax ® von der EMA die Orphan Drug- Auszeichnung verliehen. Jüngste Ereignisse, einschließlich der Nachricht von einem an Präsident Trump gerichteten Umschlag, der dieses potente und möglicherweise tödliche Toxin enthalten soll, sowie eines vereitelten Bioangriffs mit Ricin in Deutschland lassen darauf schließen, dass der RiVax ® -Impfstoff für mehrere Länder von zunehmendem Interesse sein könnte .
Zusätzliche Mittel für Dusquetid (Wirkstoff in SGX942) wurden auch durch eine Subvention der Defense Threat Reduction Agency (DTRA) in Höhe von ca. 600.000 USD über einen Zeitraum von drei Jahren erhalten (Zugang zur Pressemitteilung hier ). Diese Studien werden die therapeutische antiinfektiöse Wirkung von Dusquetid in Tiermodellen von Infektionserregern im Zusammenhang mit der biologischen Abwehr weiter untersuchen.
Nicht verwässernde Finanzierung
Wie oben erwähnt, verfolgen wir aggressiv nicht verwässernde Finanzierungsquellen, um unsere Pipeline für seltene Krankheiten zu unterstützen. Für zwei unserer Entwicklungsprogramme für Biotherapeutika haben wir zwei NIH SBIR-Zuschüsse in Höhe von insgesamt ca. 3 Mio. USD erhalten. Wir arbeiten auch mit staatlichen Zuschüssen und Auftragsvergaben in Höhe von bis zu 22,5 Mio. USD in unserem Geschäftsbereich Public Health Solutions , um die Entwicklung von RiVax ® , unsere Zusammenarbeit mit UH Manoa und HBI bei der Entwicklung eines dreiwertigen thermostabilisierten Ebola-Impfstoffs sowie die Bewertung von zu unterstützen Dusquetid als Breitbandtherapeutikum zur Behandlung von bakteriellen Infektionskrankheiten. Diese bisher nicht verwässernde Finanzierung hat unsere Entwicklungskosten erheblich ausgeglichen und uns gleichzeitig besser positioniert, um unseren gesamten Cash-Burn effektiv zu steuern.
Werbung
Bilanz und Kapital
Bis Juni hatten wir ungefähr 9 Millionen US-Dollar in bar. Zusätzlich zu den bisher nicht verwässernden Finanzmitteln verfügen wir mit B. Riley FBR, Inc. über ein Geldautomateninstrument, mit dem Bargeld bei Bedarf mit Bedacht ergänzt werden kann, wenn / falls dies erforderlich ist und das Aktienvolumen und der Preis dies zulassen Durchführung bestimmter CTCL-Aktivitäten vor der Kommerzialisierung, um möglicherweise die Einreichung eines neuen Arzneimittelantrags bei der FDA zu unterstützen. Mit einer soliden Bilanz und den verfügbaren Ressourcen erwägen wir derzeit keine größere Kapitalerhöhung, bis die endgültigen Ergebnisse der oralen Mukositis bekannt sind.
Antwort auf Beitrag Nr.: 64.480.431 von silvesterstrike am 20.07.20 22:11:00 hi,
.
einfach superb.... diese Nachrichten aus dem Hause SOLIGENX dürften für einen weiteren positiven Kursverlauf gut sein.
M.
.
einfach superb.... diese Nachrichten aus dem Hause SOLIGENX dürften für einen weiteren positiven Kursverlauf gut sein.
M.
Soligenix gibt Veröffentlichung positiver präklinischer Ergebnisse für einen neuartigen COVID-19-Impfstoff bekannt
Veröffentlicht: 28. Juli 2020 um 7:00 Uhr ET
Die MarketWatch-Nachrichtenabteilung war an der Erstellung dieser Inhalte nicht beteiligt.
PRINCETON, NJ, 28. Juli 2020 / PRNewswire über COMTEX / - PRINCETON, NJ, 28. Juli 2020 / PRNewswire / - Soligenix, Inc. (Nasdaq: SNGX) (Soligenix oder das Unternehmen), ein biopharmazeutisches Unternehmen im Spätstadium konzentrierte sich auf die Entwicklung und Vermarktung von Produkten zur Behandlung seltener Krankheiten, bei denen ein ungedeckter medizinischer Bedarf besteht, und gab heute die Veröffentlichung vorklinischer Immunogenitätsstudien für sein CiVax ™ -Programm (hitzestabiler COVID-19-Impfstoff) bekannt, die die Immunität sowohl von Breitbandantikörpern als auch von Mit dem Adjuvans CoVaccine HT ™ (CoVaccine) ist eine zellvermittelte, schnell einsetzende Immunität möglich. Der Artikel, der von Mitarbeitern der University of Hawaii in Manoa (UHM) verfasst wurde, trägt den Titel "CoVaccine HT ™ -Adjuvans potenziert robuste Immunantworten auf die rekombinante SARS-CoV-2-Spike-S1-Immunisierung".npj Impfstoffe. Eine beschleunigte Preprint des Manuskripts wurde zur Verfügung gestellt hier .
CiVax ™ ist der hitzebeständige Impfstoffkandidat der Untereinheit des Unternehmens zur Vorbeugung von COVID-19, der durch SARS-CoV-2 verursachten Infektion. Die kontinuierliche Zusammenarbeit mit Axel Lehrer, PhD, Assistenzprofessor in der Abteilung für Tropenmedizin, Medizinische Mikrobiologie und Pharmakologie der John A. Burns School of Medicine (JABSOM), UHM, hat die Machbarkeit der Entwicklung eines weitgehend immunogenen Impfstoffs für COVID-19 gezeigt. Angesichts der weltweit bedeutenden Forschung zur Erzeugung von COVID-19-Impfstoffen ist es bemerkenswert, dass die wesentlichen Eigenschaften eines Impfstoffs, der die anhaltende Pandemie erfolgreich bekämpft, vermutlich die Fähigkeit umfassen, eine ausgewogene Antikörperantwort, einschließlich einer verstärkten Th1-Antwort, schnell zu stimulieren. Dazu gehören die Erhöhung signifikanter virusneutralisierender Antikörper und eine starke zellvermittelte Immunität. gezeigt durch T-Zell-Aktivierung. Frühere Arbeiten mit dem CoVaccine-Adjuvans, das Soligenix von BTG Specialty Pharmaceuticals, einem Geschäftsbereich der Boston Scientific Corporation, lizenziert hat, haben gezeigt, dass CoVaccine diese kritischen Eigenschaften aufweist. In diesen Ergebnissen demonstrieren Lehrer und seine Kollegen nun diese Eigenschaften von CoVaccine, insbesondere im Zusammenhang mit SARS-CoV-2. Darüber hinaus zeigen diese Ergebnisse unter Verwendung eines Prototyp-Antigens auch einen raschen Beginn der Immunität mit Antikörperantworten, die innerhalb von 14 Tagen nach der ersten Impfung nachgewiesen wurden. Lehrer und seine Kollegen demonstrieren nun diese Eigenschaften von CoVaccine, insbesondere im Zusammenhang mit SARS-CoV-2. Darüber hinaus zeigen diese Ergebnisse unter Verwendung eines Prototyp-Antigens auch einen raschen Beginn der Immunität mit Antikörperantworten, die innerhalb von 14 Tagen nach der ersten Impfung nachgewiesen wurden. Lehrer und seine Kollegen demonstrieren nun diese Eigenschaften von CoVaccine, insbesondere im Zusammenhang mit SARS-CoV-2. Darüber hinaus zeigen diese Ergebnisse unter Verwendung eines Prototyp-Antigens auch einen raschen Beginn der Immunität mit Antikörperantworten, die innerhalb von 14 Tagen nach der ersten Impfung nachgewiesen wurden.
Werbung
Es wurden viele Programme zur Suche nach einem Impfstoff gegen COVID-19 initiiert, aber die Neuheit des Virus und frühere Herausforderungen bei der Entwicklung wirksamer Impfstoffe gegen das verwandte SARS-CoV (Coronavirus mit schwerem akutem respiratorischem Syndrom) und MERS-CoV (Coronavirus mit respiratorischem Syndrom im Nahen Osten), schlagen vor, dass eine zeitnahe Lösung parallele Ansätze erfordert. Die Gesamtzahl der zur Bekämpfung der anhaltenden Pandemie erforderlichen Impfstoffdosen lässt auch darauf schließen, dass mehrere Impfstoffe auf der Grundlage verschiedener Herstellungsplattformen erforderlich sein werden, um die Weltbevölkerung effizient zu impfen. Impfstoffe gegen Untereinheiten gelten als Goldstandard für die Sicherheit von Impfstoffen, sind jedoch bei schnell verfolgten COVID-19-Impfstoffkandidaten bislang relativ unterrepräsentiert. Im Gegensatz zu Impfstoffen mit viralem Vektor Die Häufigkeit, mit der das Adjuvans und das Antigen verwendet werden können, ist unbegrenzt. Das typische Sicherheitsprofil eines Impfstoffs gegen Untereinheiten führt zu einem Impfstoff, der auch für immungeschwächte oder ältere Bevölkerungsgruppen geeignet ist. Während RNA- und DNA-Impfstoffe schnell hergestellt werden können, fehlt es dagegen an regulatorischen Präzedenzfällen (bisher wurde kein RNA- oder DNA-Impfstoff zugelassen).
"Unsere bisherigen Arbeiten haben nicht nur die Machbarkeit einer schnellen und effizienten Herstellung der erforderlichen Impfstoffantigene gezeigt, sondern auch das Potenzial für einen breit anwendbaren und leicht verteilbaren Impfstoff", erklärte Dr. Lehrer. "Wir freuen uns über unsere früheren Erfolge bei der Entwicklung von Filovirus- und Flavivirus-Impfstoffen mit dieser Plattform. Die Ergebnisse in unserem neuesten Manuskript bestätigen, dass die Vorteile unserer Impfstoffplattform mit dem CoVaccine-Adjuvans auch im Zusammenhang mit SARS-CoV-2 realisiert werden können , während wir unsere Arbeit fortsetzen, um die Entwicklung eines hitzestabilen COVID-19-Impfstoffs für Untereinheiten in Zusammenarbeit mit Soligenix rasch voranzutreiben. "
"We believe that creating a vaccine with enhanced stability at elevated temperatures that can obviate the costs and logistical burdens associated with cold chain storage and distribution has the potential to provide a distinct advantage over other COVID-19 vaccines currently in development and simplifies worldwide distribution," stated Christopher J. Schaber, PhD, President and Chief Executive Officer of Soligenix. "Our approach appears to be unique in its use of a well-established, well-understood, and safe, subunit platform coupled with a novel adjuvant and a thermostabilizing formulation. We are very encouraged with the latest results and look forward to continuing to advance development of CiVax™."
About Coronavirus Infection
Coronavirus-Infektionen können beim Menschen ein breites Krankheitsspektrum verursachen, das von einer Erkältung bis zu einer schwereren Atemwegsinfektion reicht, wie z. B. das schwere akute respiratorische Syndrom (SARS) und das nahöstliche respiratorische Syndrom (MERS), bei denen die Sterblichkeitsrate bei Patienten ungefähr liegt 10% bzw. 30%. Ähnlich wie Filoviren sind auch Coronaviren in Wildtierpopulationen endemisch und können bei engem Kontakt auf Menschen übertragen werden. Der durch SARS-CoV-2 verursachte COVID-19-Ausbruch ist das jüngste Beispiel für einen vermuteten Artenübergang, der bei dieser Virusfamilie beobachtet wurde. Obwohl die Todesrate von COVID-19 noch untersucht wird, wurde COVID-19 von der Weltgesundheitsorganisation zu einer globalen Pandemie erklärt. Die globalen Auswirkungen dieser neu auftretenden Infektion zeigen, dass dringend robuste Technologieplattformen erforderlich sind, um rasch neue Impfstoffe für neuartige Krankheiten zu entwickeln. Die einzigen von der FDA genehmigten Behandlungen für COVID-19 sind unter "Emergency Use Authorization" verfügbar. Derzeit gibt es keinen zugelassenen Impfstoff.
Über die John A. Burns School of Medicine der Universität von Hawaii in Manoa
Die John A. Burns School of Medicine (JABSOM) an der UHM ist eine der führenden medizinischen Ausbildungseinrichtungen in den USA. In den letzten drei Jahren war JABSOM führend bei den Forschungspreisen der National Institutes of Health an öffentlichen medizinischen Fakultäten in der Gemeinde (dh an öffentlichen medizinischen Fakultäten ohne Universitätsklinikum). JABSOM war auch führend in der Zahl der MD-Absolventen (die auch in einem Staat ausgebildet sind), die als Praktiker im Staat gehalten werden. Darüber hinaus bietet Hawaiis kulturelle Vielfalt und geografische Lage JABSOM ein einzigartiges Forschungsumfeld, das sich in der Forschung zu gesundheitlichen Ungleichheiten auszeichnet. Die JABSOM-Fakultät bringt dem Staat jährlich externe Mittel in Höhe von rund 40 Millionen US-Dollar ein.
Werbung
Über Soligenix, Inc.
Soligenix ist ein biopharmazeutisches Unternehmen im Spätstadium, das sich auf die Entwicklung und Vermarktung von Produkten zur Behandlung seltener Krankheiten konzentriert, bei denen ein ungedeckter medizinischer Bedarf besteht. Unser Geschäftsbereich Specialized BioTherapeutics entwickelt SGX301 als neuartige photodynamische Therapie unter Verwendung von sicherem sichtbarem Licht zur Behandlung des kutanen T-Zell-Lymphoms, unserer erstklassigen IDR-Technologie (Innate Defense Regulator), Dusquetid (SGX942) zur oralen Behandlung Mukositis bei Kopf- und Halskrebs sowie firmeneigene Formulierungen von oralem Beclomethason 17,21-Dipropionat (BDP) zur Vorbeugung / Behandlung von Magen-Darm-Erkrankungen (GI), die durch schwere Entzündungen gekennzeichnet sind, einschließlich pädiatrischer Morbus Crohn (SGX203) und akuter Strahlenenteritis (SGX201) .
Unser Geschäftsbereich Public Health Solutions umfasst aktive Entwicklungsprogramme für RiVax ® , unseren Ricin-Toxin-Impfstoffkandidaten SGX943, unseren therapeutischen Kandidaten für antibiotikaresistente und neu auftretende Infektionskrankheiten, sowie Impfprogramme für Filoviren (wie Marburg und Ebola) und Coronaviren. Die Entwicklung unserer Impfprogramme beinhaltet die Verwendung unserer proprietären Wärmestabilisierungsplattform-Technologie, bekannt als ThermoVax ® . Bisher wurde dieses Geschäftsfeld mit staatlichen Zuschüssen und Vertragsmitteln des Nationalen Instituts für Allergien und Infektionskrankheiten (NIAID), der Behörde für fortgeschrittene biomedizinische Forschung und Entwicklung (BARDA) und der Defense Threat Reduction Agency (DTRA) unterstützt.
Werbung
Weitere Informationen zu Soligenix, Inc. finden Sie auf der Website des Unternehmens unter www.soligenix.com .
Diese Pressemitteilung enthält möglicherweise zukunftsgerichtete Aussagen, die die aktuellen Erwartungen von Soligenix, Inc. hinsichtlich der zukünftigen Ergebnisse, Leistung, Aussichten und Chancen widerspiegeln, einschließlich, aber nicht beschränkt auf potenzielle Marktgrößen, Patientenpopulationen und die Teilnahme an klinischen Studien. Aussagen, die keine historischen Tatsachen sind, wie "antizipieren", "schätzen", "glauben", "hoffen", "beabsichtigen", "planen", "erwarten", "zielen", "können", "vorschlagen", " will, "" Potential "oder ähnliche Ausdrücke sind zukunftsgerichtete Aussagen. Diese Aussagen unterliegen einer Reihe von Risiken, Ungewissheiten und anderen Faktoren, die dazu führen können, dass tatsächliche Ereignisse oder Ergebnisse in zukünftigen Perioden wesentlich von den in oder implizierten Aussagen abweichen. diese Aussagen, wie sie beispielsweise beim COVID-19-Ausbruch aufgetreten sind. Soligenix kann Ihnen nicht versichern, dass es in der Lage sein wird, Produkte auf der Grundlage seiner Technologien erfolgreich zu entwickeln, behördliche Zulassungen zu erhalten oder zu vermarkten, insbesondere angesichts der erheblichen Unsicherheit, die mit der Entwicklung von Therapeutika und Impfstoffen gegen Bioterror-Bedrohungen, der Durchführung präklinischer und klinischer Studien mit Therapeutika und Arzneimitteln verbunden ist Impfstoffe, die behördliche Zulassungen erhalten und Therapeutika und Impfstoffe herstellen, dass die Produktentwicklungs- und Vermarktungsbemühungen aufgrund von Schwierigkeiten oder Verzögerungen bei klinischen Studien oder aufgrund mangelnder Fortschritte oder positiver Ergebnisse aus Forschungs- und Entwicklungsbemühungen nicht reduziert oder eingestellt werden weitere Mittel zur Unterstützung der Produktentwicklung und Vermarktung erfolgreich erhalten können, einschließlich Zuschüssen und Auszeichnungen, Beibehaltung der bestehenden Zuschüsse, die Leistungsanforderungen unterliegen, Abschluss von Biodefense-Beschaffungsverträgen mit der US-Regierung oder anderen Ländern, damit diese mit größeren und besser finanzierten Wettbewerbern in der Biotechnologiebranche konkurrieren können, die sich ändern In der Gesundheitspraxis wirken sich Erstattungsbeschränkungen Dritter und Initiativen zur Reform des Gesundheitswesens auf Bundes- und / oder Landesebene nicht negativ auf das Geschäft aus, oder der US-Kongress verabschiedet möglicherweise keine Gesetze, die zusätzliche Mittel für das Projekt BioShield-Programm bereitstellen würden. Darüber hinaus kann keine Zusicherung hinsichtlich des Zeitpunkts oder des Erfolgs der klinischen Phase-3-Studie mit SGX942 (Dusquetid) zur Behandlung der oralen Mukositis bei Patienten mit Kopf- und Halskrebs, die eine Radiochemotherapie erhalten, gegeben werden. oder eine unserer anderen klinischen / präklinischen Studien. Trotz des statistisch signifikanten Ergebnisses, das in der klinischen Phase-3-Studie SGX301 zur Behandlung des kutanen T-Zell-Lymphoms erzielt wurde, kann nicht garantiert werden, dass eine Genehmigung für das Inverkehrbringen durch die FDA oder die EMA erfolgreich sein wird. Darüber hinaus kann nicht garantiert werden, dass RiVax® für einen Biodfense Priority Review Voucher (PRV) qualifiziert ist oder dass der vorherige Verkauf von PRVs einen potenziellen Verkaufspreis für einen PRV für RiVax anzeigt® . Es kann auch nicht garantiert werden, dass das Unternehmen nicht verwässernde staatliche Mittel aus Zuschüssen und Verträgen erhält oder erhält, die vergeben wurden oder werden oder für die das Unternehmen in Zukunft einen Antrag stellen wird. Diese und andere Risikofaktoren werden von Zeit zu Zeit in den bei der Securities and Exchange Commission eingereichten Unterlagen beschrieben, einschließlich, aber nicht beschränkt auf die Berichte von Soligenix auf den Formularen 10-Q und 10-K. Sofern nicht gesetzlich vorgeschrieben, übernimmt Soligenix keine Verpflichtung, zukunftsgerichtete Aussagen aufgrund neuer Informationen oder zukünftiger Ereignisse zu aktualisieren oder zu überarbeiten.
Werbung
Originalinhalt anzeigen: http://www.prnewswire.com/news-releases/soligenix-announces-…
QUELLE Soligenix, Inc.


COMTEX_368536319 / 2454 / 2020-07-28T07: 00: 22
Gibt es ein Problem mit dieser Pressemitteilung? Wenden Sie sich unter editorial@comtex.com an den Quellanbieter Comtex . Sie können den MarketWatch-Kundendienst auch über unser Kundencenter kontaktieren .
Copyright (C) 2020 PR Newswire. Alle Rechte
Veröffentlicht: 28. Juli 2020 um 7:00 Uhr ET
Die MarketWatch-Nachrichtenabteilung war an der Erstellung dieser Inhalte nicht beteiligt.
PRINCETON, NJ, 28. Juli 2020 / PRNewswire über COMTEX / - PRINCETON, NJ, 28. Juli 2020 / PRNewswire / - Soligenix, Inc. (Nasdaq: SNGX) (Soligenix oder das Unternehmen), ein biopharmazeutisches Unternehmen im Spätstadium konzentrierte sich auf die Entwicklung und Vermarktung von Produkten zur Behandlung seltener Krankheiten, bei denen ein ungedeckter medizinischer Bedarf besteht, und gab heute die Veröffentlichung vorklinischer Immunogenitätsstudien für sein CiVax ™ -Programm (hitzestabiler COVID-19-Impfstoff) bekannt, die die Immunität sowohl von Breitbandantikörpern als auch von Mit dem Adjuvans CoVaccine HT ™ (CoVaccine) ist eine zellvermittelte, schnell einsetzende Immunität möglich. Der Artikel, der von Mitarbeitern der University of Hawaii in Manoa (UHM) verfasst wurde, trägt den Titel "CoVaccine HT ™ -Adjuvans potenziert robuste Immunantworten auf die rekombinante SARS-CoV-2-Spike-S1-Immunisierung".npj Impfstoffe. Eine beschleunigte Preprint des Manuskripts wurde zur Verfügung gestellt hier .
CiVax ™ ist der hitzebeständige Impfstoffkandidat der Untereinheit des Unternehmens zur Vorbeugung von COVID-19, der durch SARS-CoV-2 verursachten Infektion. Die kontinuierliche Zusammenarbeit mit Axel Lehrer, PhD, Assistenzprofessor in der Abteilung für Tropenmedizin, Medizinische Mikrobiologie und Pharmakologie der John A. Burns School of Medicine (JABSOM), UHM, hat die Machbarkeit der Entwicklung eines weitgehend immunogenen Impfstoffs für COVID-19 gezeigt. Angesichts der weltweit bedeutenden Forschung zur Erzeugung von COVID-19-Impfstoffen ist es bemerkenswert, dass die wesentlichen Eigenschaften eines Impfstoffs, der die anhaltende Pandemie erfolgreich bekämpft, vermutlich die Fähigkeit umfassen, eine ausgewogene Antikörperantwort, einschließlich einer verstärkten Th1-Antwort, schnell zu stimulieren. Dazu gehören die Erhöhung signifikanter virusneutralisierender Antikörper und eine starke zellvermittelte Immunität. gezeigt durch T-Zell-Aktivierung. Frühere Arbeiten mit dem CoVaccine-Adjuvans, das Soligenix von BTG Specialty Pharmaceuticals, einem Geschäftsbereich der Boston Scientific Corporation, lizenziert hat, haben gezeigt, dass CoVaccine diese kritischen Eigenschaften aufweist. In diesen Ergebnissen demonstrieren Lehrer und seine Kollegen nun diese Eigenschaften von CoVaccine, insbesondere im Zusammenhang mit SARS-CoV-2. Darüber hinaus zeigen diese Ergebnisse unter Verwendung eines Prototyp-Antigens auch einen raschen Beginn der Immunität mit Antikörperantworten, die innerhalb von 14 Tagen nach der ersten Impfung nachgewiesen wurden. Lehrer und seine Kollegen demonstrieren nun diese Eigenschaften von CoVaccine, insbesondere im Zusammenhang mit SARS-CoV-2. Darüber hinaus zeigen diese Ergebnisse unter Verwendung eines Prototyp-Antigens auch einen raschen Beginn der Immunität mit Antikörperantworten, die innerhalb von 14 Tagen nach der ersten Impfung nachgewiesen wurden. Lehrer und seine Kollegen demonstrieren nun diese Eigenschaften von CoVaccine, insbesondere im Zusammenhang mit SARS-CoV-2. Darüber hinaus zeigen diese Ergebnisse unter Verwendung eines Prototyp-Antigens auch einen raschen Beginn der Immunität mit Antikörperantworten, die innerhalb von 14 Tagen nach der ersten Impfung nachgewiesen wurden.
Werbung
Es wurden viele Programme zur Suche nach einem Impfstoff gegen COVID-19 initiiert, aber die Neuheit des Virus und frühere Herausforderungen bei der Entwicklung wirksamer Impfstoffe gegen das verwandte SARS-CoV (Coronavirus mit schwerem akutem respiratorischem Syndrom) und MERS-CoV (Coronavirus mit respiratorischem Syndrom im Nahen Osten), schlagen vor, dass eine zeitnahe Lösung parallele Ansätze erfordert. Die Gesamtzahl der zur Bekämpfung der anhaltenden Pandemie erforderlichen Impfstoffdosen lässt auch darauf schließen, dass mehrere Impfstoffe auf der Grundlage verschiedener Herstellungsplattformen erforderlich sein werden, um die Weltbevölkerung effizient zu impfen. Impfstoffe gegen Untereinheiten gelten als Goldstandard für die Sicherheit von Impfstoffen, sind jedoch bei schnell verfolgten COVID-19-Impfstoffkandidaten bislang relativ unterrepräsentiert. Im Gegensatz zu Impfstoffen mit viralem Vektor Die Häufigkeit, mit der das Adjuvans und das Antigen verwendet werden können, ist unbegrenzt. Das typische Sicherheitsprofil eines Impfstoffs gegen Untereinheiten führt zu einem Impfstoff, der auch für immungeschwächte oder ältere Bevölkerungsgruppen geeignet ist. Während RNA- und DNA-Impfstoffe schnell hergestellt werden können, fehlt es dagegen an regulatorischen Präzedenzfällen (bisher wurde kein RNA- oder DNA-Impfstoff zugelassen).
"Unsere bisherigen Arbeiten haben nicht nur die Machbarkeit einer schnellen und effizienten Herstellung der erforderlichen Impfstoffantigene gezeigt, sondern auch das Potenzial für einen breit anwendbaren und leicht verteilbaren Impfstoff", erklärte Dr. Lehrer. "Wir freuen uns über unsere früheren Erfolge bei der Entwicklung von Filovirus- und Flavivirus-Impfstoffen mit dieser Plattform. Die Ergebnisse in unserem neuesten Manuskript bestätigen, dass die Vorteile unserer Impfstoffplattform mit dem CoVaccine-Adjuvans auch im Zusammenhang mit SARS-CoV-2 realisiert werden können , während wir unsere Arbeit fortsetzen, um die Entwicklung eines hitzestabilen COVID-19-Impfstoffs für Untereinheiten in Zusammenarbeit mit Soligenix rasch voranzutreiben. "
"We believe that creating a vaccine with enhanced stability at elevated temperatures that can obviate the costs and logistical burdens associated with cold chain storage and distribution has the potential to provide a distinct advantage over other COVID-19 vaccines currently in development and simplifies worldwide distribution," stated Christopher J. Schaber, PhD, President and Chief Executive Officer of Soligenix. "Our approach appears to be unique in its use of a well-established, well-understood, and safe, subunit platform coupled with a novel adjuvant and a thermostabilizing formulation. We are very encouraged with the latest results and look forward to continuing to advance development of CiVax™."
About Coronavirus Infection
Coronavirus-Infektionen können beim Menschen ein breites Krankheitsspektrum verursachen, das von einer Erkältung bis zu einer schwereren Atemwegsinfektion reicht, wie z. B. das schwere akute respiratorische Syndrom (SARS) und das nahöstliche respiratorische Syndrom (MERS), bei denen die Sterblichkeitsrate bei Patienten ungefähr liegt 10% bzw. 30%. Ähnlich wie Filoviren sind auch Coronaviren in Wildtierpopulationen endemisch und können bei engem Kontakt auf Menschen übertragen werden. Der durch SARS-CoV-2 verursachte COVID-19-Ausbruch ist das jüngste Beispiel für einen vermuteten Artenübergang, der bei dieser Virusfamilie beobachtet wurde. Obwohl die Todesrate von COVID-19 noch untersucht wird, wurde COVID-19 von der Weltgesundheitsorganisation zu einer globalen Pandemie erklärt. Die globalen Auswirkungen dieser neu auftretenden Infektion zeigen, dass dringend robuste Technologieplattformen erforderlich sind, um rasch neue Impfstoffe für neuartige Krankheiten zu entwickeln. Die einzigen von der FDA genehmigten Behandlungen für COVID-19 sind unter "Emergency Use Authorization" verfügbar. Derzeit gibt es keinen zugelassenen Impfstoff.
Über die John A. Burns School of Medicine der Universität von Hawaii in Manoa
Die John A. Burns School of Medicine (JABSOM) an der UHM ist eine der führenden medizinischen Ausbildungseinrichtungen in den USA. In den letzten drei Jahren war JABSOM führend bei den Forschungspreisen der National Institutes of Health an öffentlichen medizinischen Fakultäten in der Gemeinde (dh an öffentlichen medizinischen Fakultäten ohne Universitätsklinikum). JABSOM war auch führend in der Zahl der MD-Absolventen (die auch in einem Staat ausgebildet sind), die als Praktiker im Staat gehalten werden. Darüber hinaus bietet Hawaiis kulturelle Vielfalt und geografische Lage JABSOM ein einzigartiges Forschungsumfeld, das sich in der Forschung zu gesundheitlichen Ungleichheiten auszeichnet. Die JABSOM-Fakultät bringt dem Staat jährlich externe Mittel in Höhe von rund 40 Millionen US-Dollar ein.
Werbung
Über Soligenix, Inc.
Soligenix ist ein biopharmazeutisches Unternehmen im Spätstadium, das sich auf die Entwicklung und Vermarktung von Produkten zur Behandlung seltener Krankheiten konzentriert, bei denen ein ungedeckter medizinischer Bedarf besteht. Unser Geschäftsbereich Specialized BioTherapeutics entwickelt SGX301 als neuartige photodynamische Therapie unter Verwendung von sicherem sichtbarem Licht zur Behandlung des kutanen T-Zell-Lymphoms, unserer erstklassigen IDR-Technologie (Innate Defense Regulator), Dusquetid (SGX942) zur oralen Behandlung Mukositis bei Kopf- und Halskrebs sowie firmeneigene Formulierungen von oralem Beclomethason 17,21-Dipropionat (BDP) zur Vorbeugung / Behandlung von Magen-Darm-Erkrankungen (GI), die durch schwere Entzündungen gekennzeichnet sind, einschließlich pädiatrischer Morbus Crohn (SGX203) und akuter Strahlenenteritis (SGX201) .
Unser Geschäftsbereich Public Health Solutions umfasst aktive Entwicklungsprogramme für RiVax ® , unseren Ricin-Toxin-Impfstoffkandidaten SGX943, unseren therapeutischen Kandidaten für antibiotikaresistente und neu auftretende Infektionskrankheiten, sowie Impfprogramme für Filoviren (wie Marburg und Ebola) und Coronaviren. Die Entwicklung unserer Impfprogramme beinhaltet die Verwendung unserer proprietären Wärmestabilisierungsplattform-Technologie, bekannt als ThermoVax ® . Bisher wurde dieses Geschäftsfeld mit staatlichen Zuschüssen und Vertragsmitteln des Nationalen Instituts für Allergien und Infektionskrankheiten (NIAID), der Behörde für fortgeschrittene biomedizinische Forschung und Entwicklung (BARDA) und der Defense Threat Reduction Agency (DTRA) unterstützt.
Werbung
Weitere Informationen zu Soligenix, Inc. finden Sie auf der Website des Unternehmens unter www.soligenix.com .
Diese Pressemitteilung enthält möglicherweise zukunftsgerichtete Aussagen, die die aktuellen Erwartungen von Soligenix, Inc. hinsichtlich der zukünftigen Ergebnisse, Leistung, Aussichten und Chancen widerspiegeln, einschließlich, aber nicht beschränkt auf potenzielle Marktgrößen, Patientenpopulationen und die Teilnahme an klinischen Studien. Aussagen, die keine historischen Tatsachen sind, wie "antizipieren", "schätzen", "glauben", "hoffen", "beabsichtigen", "planen", "erwarten", "zielen", "können", "vorschlagen", " will, "" Potential "oder ähnliche Ausdrücke sind zukunftsgerichtete Aussagen. Diese Aussagen unterliegen einer Reihe von Risiken, Ungewissheiten und anderen Faktoren, die dazu führen können, dass tatsächliche Ereignisse oder Ergebnisse in zukünftigen Perioden wesentlich von den in oder implizierten Aussagen abweichen. diese Aussagen, wie sie beispielsweise beim COVID-19-Ausbruch aufgetreten sind. Soligenix kann Ihnen nicht versichern, dass es in der Lage sein wird, Produkte auf der Grundlage seiner Technologien erfolgreich zu entwickeln, behördliche Zulassungen zu erhalten oder zu vermarkten, insbesondere angesichts der erheblichen Unsicherheit, die mit der Entwicklung von Therapeutika und Impfstoffen gegen Bioterror-Bedrohungen, der Durchführung präklinischer und klinischer Studien mit Therapeutika und Arzneimitteln verbunden ist Impfstoffe, die behördliche Zulassungen erhalten und Therapeutika und Impfstoffe herstellen, dass die Produktentwicklungs- und Vermarktungsbemühungen aufgrund von Schwierigkeiten oder Verzögerungen bei klinischen Studien oder aufgrund mangelnder Fortschritte oder positiver Ergebnisse aus Forschungs- und Entwicklungsbemühungen nicht reduziert oder eingestellt werden weitere Mittel zur Unterstützung der Produktentwicklung und Vermarktung erfolgreich erhalten können, einschließlich Zuschüssen und Auszeichnungen, Beibehaltung der bestehenden Zuschüsse, die Leistungsanforderungen unterliegen, Abschluss von Biodefense-Beschaffungsverträgen mit der US-Regierung oder anderen Ländern, damit diese mit größeren und besser finanzierten Wettbewerbern in der Biotechnologiebranche konkurrieren können, die sich ändern In der Gesundheitspraxis wirken sich Erstattungsbeschränkungen Dritter und Initiativen zur Reform des Gesundheitswesens auf Bundes- und / oder Landesebene nicht negativ auf das Geschäft aus, oder der US-Kongress verabschiedet möglicherweise keine Gesetze, die zusätzliche Mittel für das Projekt BioShield-Programm bereitstellen würden. Darüber hinaus kann keine Zusicherung hinsichtlich des Zeitpunkts oder des Erfolgs der klinischen Phase-3-Studie mit SGX942 (Dusquetid) zur Behandlung der oralen Mukositis bei Patienten mit Kopf- und Halskrebs, die eine Radiochemotherapie erhalten, gegeben werden. oder eine unserer anderen klinischen / präklinischen Studien. Trotz des statistisch signifikanten Ergebnisses, das in der klinischen Phase-3-Studie SGX301 zur Behandlung des kutanen T-Zell-Lymphoms erzielt wurde, kann nicht garantiert werden, dass eine Genehmigung für das Inverkehrbringen durch die FDA oder die EMA erfolgreich sein wird. Darüber hinaus kann nicht garantiert werden, dass RiVax® für einen Biodfense Priority Review Voucher (PRV) qualifiziert ist oder dass der vorherige Verkauf von PRVs einen potenziellen Verkaufspreis für einen PRV für RiVax anzeigt® . Es kann auch nicht garantiert werden, dass das Unternehmen nicht verwässernde staatliche Mittel aus Zuschüssen und Verträgen erhält oder erhält, die vergeben wurden oder werden oder für die das Unternehmen in Zukunft einen Antrag stellen wird. Diese und andere Risikofaktoren werden von Zeit zu Zeit in den bei der Securities and Exchange Commission eingereichten Unterlagen beschrieben, einschließlich, aber nicht beschränkt auf die Berichte von Soligenix auf den Formularen 10-Q und 10-K. Sofern nicht gesetzlich vorgeschrieben, übernimmt Soligenix keine Verpflichtung, zukunftsgerichtete Aussagen aufgrund neuer Informationen oder zukünftiger Ereignisse zu aktualisieren oder zu überarbeiten.
Werbung
Originalinhalt anzeigen: http://www.prnewswire.com/news-releases/soligenix-announces-…
QUELLE Soligenix, Inc.


COMTEX_368536319 / 2454 / 2020-07-28T07: 00: 22
Gibt es ein Problem mit dieser Pressemitteilung? Wenden Sie sich unter editorial@comtex.com an den Quellanbieter Comtex . Sie können den MarketWatch-Kundendienst auch über unser Kundencenter kontaktieren .
Copyright (C) 2020 PR Newswire. Alle Rechte
heute schon über 30 mill gehandelte Stücke......
Pressemitteilung
Soligenix kündigt heute das Webcast-Event und die Präsentation für Investoren an: Vorteile des CiVax ™ -Programms für die Entwicklung eines breit verteilten wärmestabilen COVID-19-Impfstoffs
Veröffentlicht: 10. September 2020 um 7:30 Uhr
Die MarketWatch-Nachrichtenabteilung war an der Erstellung dieser Inhalte nicht beteiligt.
PRINCETON, NJ, 10. September 2020 / PRNewswire über COMTEX / - PRINCETON, NJ, 10. September 2020 / PRNewswire / - Soligenix, Inc. (Nasdaq: SNGX) (Soligenix oder das Unternehmen), ein spätes Stadium Das biopharmazeutische Unternehmen, das sich auf die Entwicklung und Vermarktung von Produkten zur Behandlung seltener Krankheiten konzentriert, bei denen ein ungedeckter medizinischer Bedarf besteht, veröffentlichte heute von 16:00 bis 17:00 Uhr Eastern Time die Präsentation für seine Investor Webcast-Veranstaltung zur Verwendung seiner thermostabilisierten Glykoprotein-Impfstoffplattform für die Entwicklung eines COVID-19-Impfstoffs namens CiVax ™.
Die Entwicklung von CiVax ™ basiert auf der thermostabilisierten Glykoprotein-Impfstoffplattform, die Soligenix in Zusammenarbeit mit der University of Hawaii in Manoa entwickelt hat und die sich auf multivalente thermostabilisierte Impfstoffe gegen Filovirus-Infektionen wie Ebola konzentriert.
Die Impfstoffplattform umfasst drei wesentliche Komponenten:
1) ein oder mehrere Proteinantigene, insbesondere ein virales Oberflächenglykoprotein, das den Eintritt und die Fusion des Virus mit Wirtszellen vermittelt und mit einem proprietären Expressionssystem für Insektenzellen hergestellt wird, das mit einer proteinspezifischen Affinitätsreinigung gekoppelt ist;
2) ein Adjuvans (CoVaccine HT ™ - lizenziert von BTG Specialty Pharmaceuticals ("BTG"), einer Abteilung der Boston Scientific Corporation), von dem gezeigt wurde, dass es sowohl die zellvermittelte als auch die humorale Immunität verbessert; und
3) eine Formulierung, die eine Thermostabilisierung der resultierenden Mischung ermöglicht, wodurch die Notwendigkeit einer Lagerung und eines Versands der Kühlkette vermieden wird.
Der resultierende Impfstoff ist allgemein anwendbar, auch für Personen, die häufig von üblichen viralen Vektorimpfstoffansätzen ausgeschlossen sind, wie Kinder, ältere Menschen und immungeschwächte Personen. Dieselben Komponenten können nun auf einen COVID-19-Impfstoff angewendet werden, wobei genau definierte Oberflächenglykoproteine aus einem oder mehreren Coronaviren verwendet werden. Der Schutz älterer und immungeschwächter Bevölkerungsgruppen ist im Zusammenhang mit COVID-19 besonders wichtig.
Daten mit einem Prototyp-Impfstoff haben das Potenzial bestätigt, sowohl eine starke zellvermittelte Immunität als auch ausgewogene humorale (Antikörper-) Reaktionen hervorzurufen. Sehr starke neutralisierende Antikörperreaktionen, ähnlich denen, die im Rekonvaleszenzplasma gefunden wurden, wurden auch bei Mäusen gezeigt. Diese Ergebnisse wurden in einem vorab gedruckten Artikel veröffentlicht, der hier verfügbar ist . Neuere Studien haben gezeigt, dass bei Verwendung eines vollständigeren Spike-Protein-Antigens (wie in der endgültigen CiVax ™ -Formulierung vorgesehen) starke Antikörperreaktionen bereits 7 Tage nach der ersten Impfung erkennbar sind und sich bereits 7 Tage nach der zweiten Impfung rasch verstärken Impfung. Gleichzeitig haben sowohl Antikörperantworten als auch zellvermittelte Immunantworten die gewünschte Th1-Verzerrung gezeigt.
Telefonkonferenz Donnerstag, 10. September um 16:00 Uhr Eastern Time
Das Unternehmen wird am Donnerstag, dem 10. September 2020, während einer Webcast-Veranstaltung Informationen über seine thermostabilisierte Glykoprotein-Impfstoffplattform für die Entwicklung eines COVID-19-Impfstoffs austauschen. Eine Frage-und-Antwort-Sitzung (Q & A) mit den vorgestellten Experten und dem Management wird den Präsentationen folgen. Wenn Sie während der Fragen und Antworten eine Frage stellen möchten, senden Sie Ihre Anfrage mindestens 15 Minuten vor dem geplanten Beginn des Anrufs per E-Mail an ir@soligenix.com .
Live-Event: https://www.webcaster4.com/Webcast/Page/2498/37323
Gebührenfrei in den USA : 1-866-652-5200
International: 1-412-317-6060
Bitte fordern Sie die Teilnahme am Soligenix-Anruf an.
Eine Audioaufnahme und ein Transkript der Präsentation werden 30 Tage nach der Veranstaltung archiviert.
Das Investor Event wird Präsentationen von Folgendem beinhalten:
Dr. Axel Lehrer , außerordentlicher Professor, Abteilung. für Tropenmedizin, Medizinische Mikrobiologie und Pharmakologie, Universität von Hawaii in Manoa, John A. Burns School of Medicine
Dr. Oreola Donini , wissenschaftlicher Leiter von Soligenix
Herr Dan Ring, Vizepräsident, Geschäftsentwicklung von Soligenix
Dr. Christopher J Schaber, Präsident und Chief Executive Officer von Soligenix
Ausgewählter biografischer Hintergrund für Experten
Axel Lehrer, PhD
Axel Lehrer, Dr. rer. nat., außerordentlicher Professor, Abteilung für Tropenmedizin, Medizinische Mikrobiologie und Pharmakologie, John A. Burns School of Medicine, Universität von Hawaii in Manoa. Dr. Lehrer erforscht seit 2002 Impfstoffe sowohl im kommerziellen als auch im akademischen Umfeld hat hauptsächlich an der Entwicklung von Impfstoffen gegen Filoviren wie das Ebola-Virus gearbeitet, aber auch zur Entwicklung von Flavivirus-Impfstoffen (Zika-Virus, Tick-Borne-Encephalitis (TBE) -Virus, West-Nil-Virus und Dengue-Virus) beigetragen. Seine Forschung verwendet hauptsächlich rekombinante virale Untereinheiten Dr. Lehrer's ist in Biochemie, Molekularbiologie, Virologie sowie Immunologie ausgebildet und seine Forschung wurde vom NIH und anderen Bundesquellen finanziert.
Über CiVax ™
CiVax ™ ist der hitzebeständige Impfstoffkandidat der Untereinheit des Unternehmens zur Vorbeugung von COVID-19, der durch SARS-CoV-2 verursachten Infektion. Im Geschäftsbereich Public Health Solutions des Unternehmens haben laufende Kooperationen mit Axel Lehrer, PhD der Abteilung für Tropenmedizin, Medizinische Mikrobiologie und Pharmakologie, JABSOM, UHM, die Machbarkeit der Entwicklung hitzestabiler Filovirus-Impfstoffe für Untereinheiten, einschließlich hämorrhagischer Erkrankungen, die durch das Zaire-Ebolavirus verursacht werden, gezeigt , Sudan Ebolavirus sowie Marburg Marburgvirusmit sowohl einwertigen als auch zweiwertigen Impfstoffkombinationen. Es wurden Formulierungsbedingungen identifiziert, die eine Wärmestabilisierung jedes Antigens allein oder in Kombination für mindestens 12 Wochen bei 40 Grad Celsius (104 Grad Fahrenheit) ermöglichen. Im März 2020 erweiterten Soligenix und seine Mitarbeiter die Technologieplattform, um die Kompatibilität mit Impfstoffkandidaten gegen SARS-CoV-2, die Ursache von COVID-19, zu bewerten.
Die Impfstoffplattform umfasst drei wesentliche Komponenten:
1) ein Proteinantigen, insbesondere ein virales Oberflächenglykoprotein, das den Eintritt und die Fusion des Virus mit Wirtszellen vermittelt und mit einem proprietären Insektenzell-Expressionssystem hergestellt wird, das mit einer proteinspezifischen Affinitätsreinigung gekoppelt ist;
2) ein Adjuvans, von dem gezeigt wurde, dass es sowohl die zellvermittelte als auch die humorale Immunität verbessert; und
3) eine Formulierung, die eine Thermostabilisierung der resultierenden Mischung ermöglicht, wodurch die Notwendigkeit einer Kühlkettenlagerung und eines Kühlkettenversands vermieden wird.
Der resultierende Impfstoff ist allgemein anwendbar, auch für Personen, die häufig von gängigen viralen Vektorimpfstoffansätzen ausgeschlossen sind, wie Kinder, ältere Menschen und immungeschwächte Personen. Der Schutz älterer und immungeschwächter Bevölkerungsgruppen ist im Zusammenhang mit COVID-19 besonders wichtig. Die Fähigkeit, einen thermostabilisierten Einzelfläschchen-Impfstoff bereitzustellen, ist im Zusammenhang mit einer schnellen und breiten Impfstoffverteilung besonders wichtig.
Dieselben Komponenten werden jetzt auf den Coronavirus-Impfstoff angewendet, wobei das genau definierte Oberflächenglykoprotein, das als Spike-Protein bekannt ist, als Antigen verwendet wird. Vor kurzem wurden präklinische Arbeiten an Mäusen mit einem Prototyp-Impfstoff zur Verfügung gestellt , die die Fähigkeit des CoVaccine-Adjuvans in Kombination mit einem Prototyp-Antigen demonstrieren,
die Immunität innerhalb von 14 Tagen nach der ersten Impfung stimulieren;
eine ausgeglichene Immunantwort mit einer signifikanten Th1-Komponente induzieren, von der angenommen wird, dass sie für die Induktion der Immunität kritisch ist, ohne das Risiko einer Verschlimmerung der Krankheitspathologie;
eine neutralisierende Antikörperantwort induzieren; und
induzieren eine zellvermittelte Immunantwort.
Kürzlich haben präklinische Studien mit einem vollständigeren Spike-Protein (wie in der endgültigen Formulierung vorgesehen) dieselben Eigenschaften gezeigt, einschließlich eines raschen Einsetzens der Immunogenität innerhalb von 7 Tagen nach der ersten Impfung.
Informationen zur Coronavirus-Infektion
Coronavirus-Infektionen können beim Menschen ein breites Krankheitsspektrum verursachen, das von einer Erkältung bis zu einer schwereren Atemwegsinfektion reicht, wie z. B. das schwere akute respiratorische Syndrom (SARS) und das nahöstliche respiratorische Syndrom (MERS), bei denen die Sterblichkeitsrate bei Patienten ungefähr liegt 10% bzw. 30%. Ähnlich wie Filoviren sind auch Coronaviren in Wildtierpopulationen endemisch und können bei engem Kontakt auf Menschen übertragen werden. Der durch SARS-CoV-2 verursachte COVID-19-Ausbruch ist das jüngste Beispiel für einen vermuteten Artenübergang, der bei dieser Virusfamilie beobachtet wurde. Obwohl die Sterblichkeitsrate von COVID-19 noch untersucht wird, wurde COVID-19 von der Weltgesundheitsorganisation zu einer globalen Pandemie erklärt. Die globalen Auswirkungen dieser neu auftretenden Infektion zeigen, dass dringend robuste Technologieplattformen erforderlich sind, um rasch neue Impfstoffe für neuartige Krankheiten zu entwickeln. Die einzigen von der FDA genehmigten Behandlungen für COVID-19 sind unter "Emergency Use Authorization" verfügbar. Derzeit gibt es keinen zugelassenen Impfstoff.
Über Soligenix, Inc.
Soligenix ist ein biopharmazeutisches Unternehmen im Spätstadium, das sich auf die Entwicklung und Vermarktung von Produkten zur Behandlung seltener Krankheiten konzentriert, bei denen ein ungedeckter medizinischer Bedarf besteht. Unser Geschäftsbereich Specialized BioTherapeutics entwickelt SGX301 als neuartige photodynamische Therapie mit sicherem sichtbarem Licht zur Behandlung des kutanen T-Zell-Lymphoms. unsere erstklassige IDR-Technologie (Innate Defense Regulator), Dusquetid (SGX942), zur Behandlung der oralen Mukositis bei Kopf- und Halskrebs; und firmeneigene Formulierungen von oralem Beclomethason 17,21-Dipropionat (BDP) zur Vorbeugung / Behandlung von Magen-Darm-Erkrankungen (GI), die durch schwere Entzündungen gekennzeichnet sind, einschließlich pädiatrischem Morbus Crohn (SGX203) und akuter Strahlenenteritis (SGX201).
Unser Geschäftsbereich Public Health Solutions umfasst aktive Entwicklungsprogramme für RiVax ® , unseren Kandidaten für Ricin-Toxin-Impfstoffe. SGX943, unser therapeutischer Kandidat für antibiotikaresistente und neu auftretende Infektionskrankheiten; und unsere Forschungsprogramme zur Identifizierung und Entwicklung neuartiger Impfstoffkandidaten gegen Virusinfektionen, einschließlich Ebola, Marburg und SARS-CoV-2 (die Ursache von COVID-19). Die Entwicklung unserer Impfprogramme beinhaltet die Verwendung unserer proprietären Wärmestabilisierungsplattform-Technologie, bekannt als ThermoVax ®. Bisher wurde dieses Geschäftsfeld mit staatlichen Zuschüssen und Vertragsmitteln des Nationalen Instituts für Allergie und Infektionskrankheiten (NIAID), der Mittel zur Reduzierung von Verteidigungsbedrohungen (DTRA) und der Biomedical Advanced Research and Development Authority (BARDA) unterstützt.
Weitere Informationen zu Soligenix, Inc. finden Sie auf der Website des Unternehmens unter www.soligenix.com .
Diese Pressemitteilung enthält möglicherweise zukunftsgerichtete Aussagen, die die aktuellen Erwartungen von Soligenix, Inc. hinsichtlich der zukünftigen Ergebnisse, Leistung, Aussichten und Chancen widerspiegeln, einschließlich, aber nicht beschränkt auf potenzielle Marktgrößen, Patientenpopulationen und die Teilnahme an klinischen Studien. Aussagen, die keine historischen Tatsachen sind, wie "antizipieren", "schätzen", "glauben", "hoffen", "beabsichtigen", "planen", "erwarten", "zielen", "können", "vorschlagen", " Wille, "" Potenzial "oder ähnliche Ausdrücke sind zukunftsgerichtete Aussagen. Diese Aussagen unterliegen einer Reihe von Risiken, Ungewissheiten und anderen Faktoren, die dazu führen können, dass tatsächliche Ereignisse oder Ergebnisse in zukünftigen Perioden wesentlich von den in oder implizierten Aussagen abweichen. diese Aussagen, wie sie beispielsweise beim COVID-19-Ausbruch aufgetreten sind. Soligenix kann Ihnen nicht versichern, dass es in der Lage sein wird, Produkte auf der Grundlage seiner Technologien erfolgreich zu entwickeln, behördliche Zulassungen zu erhalten oder zu vermarkten, insbesondere angesichts der erheblichen Unsicherheit, die mit der Entwicklung von Therapeutika und Impfstoffen gegen Bioterror-Bedrohungen, der Durchführung präklinischer und klinischer Studien mit Therapeutika und Arzneimitteln verbunden ist Impfstoffe, die behördliche Zulassungen erhalten und Therapeutika und Impfstoffe herstellen, dass die Produktentwicklungs- und Vermarktungsbemühungen aufgrund von Schwierigkeiten oder Verzögerungen bei klinischen Studien oder aufgrund mangelnder Fortschritte oder positiver Ergebnisse aus Forschungs- und Entwicklungsbemühungen nicht reduziert oder eingestellt werden weitere Mittel zur Unterstützung der Produktentwicklung und Vermarktung erfolgreich erhalten können, einschließlich Zuschüssen und Auszeichnungen, Beibehaltung der bestehenden Zuschüsse, die Leistungsanforderungen unterliegen, Abschluss von Verträgen zur biologischen Verteidigung mit der US-Regierung oder anderen Ländern, damit diese mit größeren und besser finanzierten Wettbewerbern in der Biotechnologiebranche konkurrieren können, die sich ändern In der Gesundheitspraxis wirken sich Erstattungsbeschränkungen Dritter und Initiativen zur Reform des Gesundheitswesens des Bundes und / oder der Bundesstaaten nicht negativ auf das Geschäft aus, oder der US-Kongress verabschiedet möglicherweise keine Gesetze, die zusätzliche Mittel für das Projekt BioShield-Programm bereitstellen würden. Darüber hinaus kann keine Zusicherung hinsichtlich des Zeitpunkts oder des Erfolgs der klinischen Phase-3-Studie mit SGX942 (Dusquetid) zur Behandlung der oralen Mukositis bei Patienten mit Kopf- und Halskrebs, die eine Radiochemotherapie erhalten, gegeben werden. oder eine unserer anderen klinischen / präklinischen Studien. Trotz des statistisch signifikanten Ergebnisses, das in der klinischen Phase-3-Studie SGX301 zur Behandlung des kutanen T-Zell-Lymphoms erzielt wurde, kann nicht garantiert werden, dass eine Genehmigung für das Inverkehrbringen durch die FDA oder die EMA erfolgreich sein wird. Darüber hinaus kann nicht garantiert werden, dass RiVax® für einen Biodfense Priority Review Voucher (PRV) qualifiziert ist oder dass der vorherige Verkauf von PRVs einen potenziellen Verkaufspreis für einen PRV für RiVax anzeigt® . Es kann auch nicht garantiert werden, dass das Unternehmen nicht verwässernde staatliche Mittel aus Zuschüssen und Verträgen erhält oder erhält, die vergeben wurden oder werden oder für die das Unternehmen in Zukunft einen Antrag stellen wird. Diese und andere Risikofaktoren werden von Zeit zu Zeit in den bei der Securities and Exchange Commission eingereichten Unterlagen beschrieben, einschließlich, aber nicht beschränkt auf die Berichte von Soligenix auf den Formularen 10-Q und 10-K. Sofern nicht gesetzlich vorgeschrieben, übernimmt Soligenix keine Verpflichtung, zukunftsgerichtete Aussagen aufgrund neuer Informationen oder zukünftiger Ereignisse zu aktualisieren oder zu überarbeiten.
Soligenix kündigt heute das Webcast-Event und die Präsentation für Investoren an: Vorteile des CiVax ™ -Programms für die Entwicklung eines breit verteilten wärmestabilen COVID-19-Impfstoffs
Veröffentlicht: 10. September 2020 um 7:30 Uhr
Die MarketWatch-Nachrichtenabteilung war an der Erstellung dieser Inhalte nicht beteiligt.
PRINCETON, NJ, 10. September 2020 / PRNewswire über COMTEX / - PRINCETON, NJ, 10. September 2020 / PRNewswire / - Soligenix, Inc. (Nasdaq: SNGX) (Soligenix oder das Unternehmen), ein spätes Stadium Das biopharmazeutische Unternehmen, das sich auf die Entwicklung und Vermarktung von Produkten zur Behandlung seltener Krankheiten konzentriert, bei denen ein ungedeckter medizinischer Bedarf besteht, veröffentlichte heute von 16:00 bis 17:00 Uhr Eastern Time die Präsentation für seine Investor Webcast-Veranstaltung zur Verwendung seiner thermostabilisierten Glykoprotein-Impfstoffplattform für die Entwicklung eines COVID-19-Impfstoffs namens CiVax ™.
Die Entwicklung von CiVax ™ basiert auf der thermostabilisierten Glykoprotein-Impfstoffplattform, die Soligenix in Zusammenarbeit mit der University of Hawaii in Manoa entwickelt hat und die sich auf multivalente thermostabilisierte Impfstoffe gegen Filovirus-Infektionen wie Ebola konzentriert.
Die Impfstoffplattform umfasst drei wesentliche Komponenten:
1) ein oder mehrere Proteinantigene, insbesondere ein virales Oberflächenglykoprotein, das den Eintritt und die Fusion des Virus mit Wirtszellen vermittelt und mit einem proprietären Expressionssystem für Insektenzellen hergestellt wird, das mit einer proteinspezifischen Affinitätsreinigung gekoppelt ist;
2) ein Adjuvans (CoVaccine HT ™ - lizenziert von BTG Specialty Pharmaceuticals ("BTG"), einer Abteilung der Boston Scientific Corporation), von dem gezeigt wurde, dass es sowohl die zellvermittelte als auch die humorale Immunität verbessert; und
3) eine Formulierung, die eine Thermostabilisierung der resultierenden Mischung ermöglicht, wodurch die Notwendigkeit einer Lagerung und eines Versands der Kühlkette vermieden wird.
Der resultierende Impfstoff ist allgemein anwendbar, auch für Personen, die häufig von üblichen viralen Vektorimpfstoffansätzen ausgeschlossen sind, wie Kinder, ältere Menschen und immungeschwächte Personen. Dieselben Komponenten können nun auf einen COVID-19-Impfstoff angewendet werden, wobei genau definierte Oberflächenglykoproteine aus einem oder mehreren Coronaviren verwendet werden. Der Schutz älterer und immungeschwächter Bevölkerungsgruppen ist im Zusammenhang mit COVID-19 besonders wichtig.
Daten mit einem Prototyp-Impfstoff haben das Potenzial bestätigt, sowohl eine starke zellvermittelte Immunität als auch ausgewogene humorale (Antikörper-) Reaktionen hervorzurufen. Sehr starke neutralisierende Antikörperreaktionen, ähnlich denen, die im Rekonvaleszenzplasma gefunden wurden, wurden auch bei Mäusen gezeigt. Diese Ergebnisse wurden in einem vorab gedruckten Artikel veröffentlicht, der hier verfügbar ist . Neuere Studien haben gezeigt, dass bei Verwendung eines vollständigeren Spike-Protein-Antigens (wie in der endgültigen CiVax ™ -Formulierung vorgesehen) starke Antikörperreaktionen bereits 7 Tage nach der ersten Impfung erkennbar sind und sich bereits 7 Tage nach der zweiten Impfung rasch verstärken Impfung. Gleichzeitig haben sowohl Antikörperantworten als auch zellvermittelte Immunantworten die gewünschte Th1-Verzerrung gezeigt.
Telefonkonferenz Donnerstag, 10. September um 16:00 Uhr Eastern Time
Das Unternehmen wird am Donnerstag, dem 10. September 2020, während einer Webcast-Veranstaltung Informationen über seine thermostabilisierte Glykoprotein-Impfstoffplattform für die Entwicklung eines COVID-19-Impfstoffs austauschen. Eine Frage-und-Antwort-Sitzung (Q & A) mit den vorgestellten Experten und dem Management wird den Präsentationen folgen. Wenn Sie während der Fragen und Antworten eine Frage stellen möchten, senden Sie Ihre Anfrage mindestens 15 Minuten vor dem geplanten Beginn des Anrufs per E-Mail an ir@soligenix.com .
Live-Event: https://www.webcaster4.com/Webcast/Page/2498/37323
Gebührenfrei in den USA : 1-866-652-5200
International: 1-412-317-6060
Bitte fordern Sie die Teilnahme am Soligenix-Anruf an.
Eine Audioaufnahme und ein Transkript der Präsentation werden 30 Tage nach der Veranstaltung archiviert.
Das Investor Event wird Präsentationen von Folgendem beinhalten:
Dr. Axel Lehrer , außerordentlicher Professor, Abteilung. für Tropenmedizin, Medizinische Mikrobiologie und Pharmakologie, Universität von Hawaii in Manoa, John A. Burns School of Medicine
Dr. Oreola Donini , wissenschaftlicher Leiter von Soligenix
Herr Dan Ring, Vizepräsident, Geschäftsentwicklung von Soligenix
Dr. Christopher J Schaber, Präsident und Chief Executive Officer von Soligenix
Ausgewählter biografischer Hintergrund für Experten
Axel Lehrer, PhD
Axel Lehrer, Dr. rer. nat., außerordentlicher Professor, Abteilung für Tropenmedizin, Medizinische Mikrobiologie und Pharmakologie, John A. Burns School of Medicine, Universität von Hawaii in Manoa. Dr. Lehrer erforscht seit 2002 Impfstoffe sowohl im kommerziellen als auch im akademischen Umfeld hat hauptsächlich an der Entwicklung von Impfstoffen gegen Filoviren wie das Ebola-Virus gearbeitet, aber auch zur Entwicklung von Flavivirus-Impfstoffen (Zika-Virus, Tick-Borne-Encephalitis (TBE) -Virus, West-Nil-Virus und Dengue-Virus) beigetragen. Seine Forschung verwendet hauptsächlich rekombinante virale Untereinheiten Dr. Lehrer's ist in Biochemie, Molekularbiologie, Virologie sowie Immunologie ausgebildet und seine Forschung wurde vom NIH und anderen Bundesquellen finanziert.
Über CiVax ™
CiVax ™ ist der hitzebeständige Impfstoffkandidat der Untereinheit des Unternehmens zur Vorbeugung von COVID-19, der durch SARS-CoV-2 verursachten Infektion. Im Geschäftsbereich Public Health Solutions des Unternehmens haben laufende Kooperationen mit Axel Lehrer, PhD der Abteilung für Tropenmedizin, Medizinische Mikrobiologie und Pharmakologie, JABSOM, UHM, die Machbarkeit der Entwicklung hitzestabiler Filovirus-Impfstoffe für Untereinheiten, einschließlich hämorrhagischer Erkrankungen, die durch das Zaire-Ebolavirus verursacht werden, gezeigt , Sudan Ebolavirus sowie Marburg Marburgvirusmit sowohl einwertigen als auch zweiwertigen Impfstoffkombinationen. Es wurden Formulierungsbedingungen identifiziert, die eine Wärmestabilisierung jedes Antigens allein oder in Kombination für mindestens 12 Wochen bei 40 Grad Celsius (104 Grad Fahrenheit) ermöglichen. Im März 2020 erweiterten Soligenix und seine Mitarbeiter die Technologieplattform, um die Kompatibilität mit Impfstoffkandidaten gegen SARS-CoV-2, die Ursache von COVID-19, zu bewerten.
Die Impfstoffplattform umfasst drei wesentliche Komponenten:
1) ein Proteinantigen, insbesondere ein virales Oberflächenglykoprotein, das den Eintritt und die Fusion des Virus mit Wirtszellen vermittelt und mit einem proprietären Insektenzell-Expressionssystem hergestellt wird, das mit einer proteinspezifischen Affinitätsreinigung gekoppelt ist;
2) ein Adjuvans, von dem gezeigt wurde, dass es sowohl die zellvermittelte als auch die humorale Immunität verbessert; und
3) eine Formulierung, die eine Thermostabilisierung der resultierenden Mischung ermöglicht, wodurch die Notwendigkeit einer Kühlkettenlagerung und eines Kühlkettenversands vermieden wird.
Der resultierende Impfstoff ist allgemein anwendbar, auch für Personen, die häufig von gängigen viralen Vektorimpfstoffansätzen ausgeschlossen sind, wie Kinder, ältere Menschen und immungeschwächte Personen. Der Schutz älterer und immungeschwächter Bevölkerungsgruppen ist im Zusammenhang mit COVID-19 besonders wichtig. Die Fähigkeit, einen thermostabilisierten Einzelfläschchen-Impfstoff bereitzustellen, ist im Zusammenhang mit einer schnellen und breiten Impfstoffverteilung besonders wichtig.
Dieselben Komponenten werden jetzt auf den Coronavirus-Impfstoff angewendet, wobei das genau definierte Oberflächenglykoprotein, das als Spike-Protein bekannt ist, als Antigen verwendet wird. Vor kurzem wurden präklinische Arbeiten an Mäusen mit einem Prototyp-Impfstoff zur Verfügung gestellt , die die Fähigkeit des CoVaccine-Adjuvans in Kombination mit einem Prototyp-Antigen demonstrieren,
die Immunität innerhalb von 14 Tagen nach der ersten Impfung stimulieren;
eine ausgeglichene Immunantwort mit einer signifikanten Th1-Komponente induzieren, von der angenommen wird, dass sie für die Induktion der Immunität kritisch ist, ohne das Risiko einer Verschlimmerung der Krankheitspathologie;
eine neutralisierende Antikörperantwort induzieren; und
induzieren eine zellvermittelte Immunantwort.
Kürzlich haben präklinische Studien mit einem vollständigeren Spike-Protein (wie in der endgültigen Formulierung vorgesehen) dieselben Eigenschaften gezeigt, einschließlich eines raschen Einsetzens der Immunogenität innerhalb von 7 Tagen nach der ersten Impfung.
Informationen zur Coronavirus-Infektion
Coronavirus-Infektionen können beim Menschen ein breites Krankheitsspektrum verursachen, das von einer Erkältung bis zu einer schwereren Atemwegsinfektion reicht, wie z. B. das schwere akute respiratorische Syndrom (SARS) und das nahöstliche respiratorische Syndrom (MERS), bei denen die Sterblichkeitsrate bei Patienten ungefähr liegt 10% bzw. 30%. Ähnlich wie Filoviren sind auch Coronaviren in Wildtierpopulationen endemisch und können bei engem Kontakt auf Menschen übertragen werden. Der durch SARS-CoV-2 verursachte COVID-19-Ausbruch ist das jüngste Beispiel für einen vermuteten Artenübergang, der bei dieser Virusfamilie beobachtet wurde. Obwohl die Sterblichkeitsrate von COVID-19 noch untersucht wird, wurde COVID-19 von der Weltgesundheitsorganisation zu einer globalen Pandemie erklärt. Die globalen Auswirkungen dieser neu auftretenden Infektion zeigen, dass dringend robuste Technologieplattformen erforderlich sind, um rasch neue Impfstoffe für neuartige Krankheiten zu entwickeln. Die einzigen von der FDA genehmigten Behandlungen für COVID-19 sind unter "Emergency Use Authorization" verfügbar. Derzeit gibt es keinen zugelassenen Impfstoff.
Über Soligenix, Inc.
Soligenix ist ein biopharmazeutisches Unternehmen im Spätstadium, das sich auf die Entwicklung und Vermarktung von Produkten zur Behandlung seltener Krankheiten konzentriert, bei denen ein ungedeckter medizinischer Bedarf besteht. Unser Geschäftsbereich Specialized BioTherapeutics entwickelt SGX301 als neuartige photodynamische Therapie mit sicherem sichtbarem Licht zur Behandlung des kutanen T-Zell-Lymphoms. unsere erstklassige IDR-Technologie (Innate Defense Regulator), Dusquetid (SGX942), zur Behandlung der oralen Mukositis bei Kopf- und Halskrebs; und firmeneigene Formulierungen von oralem Beclomethason 17,21-Dipropionat (BDP) zur Vorbeugung / Behandlung von Magen-Darm-Erkrankungen (GI), die durch schwere Entzündungen gekennzeichnet sind, einschließlich pädiatrischem Morbus Crohn (SGX203) und akuter Strahlenenteritis (SGX201).
Unser Geschäftsbereich Public Health Solutions umfasst aktive Entwicklungsprogramme für RiVax ® , unseren Kandidaten für Ricin-Toxin-Impfstoffe. SGX943, unser therapeutischer Kandidat für antibiotikaresistente und neu auftretende Infektionskrankheiten; und unsere Forschungsprogramme zur Identifizierung und Entwicklung neuartiger Impfstoffkandidaten gegen Virusinfektionen, einschließlich Ebola, Marburg und SARS-CoV-2 (die Ursache von COVID-19). Die Entwicklung unserer Impfprogramme beinhaltet die Verwendung unserer proprietären Wärmestabilisierungsplattform-Technologie, bekannt als ThermoVax ®. Bisher wurde dieses Geschäftsfeld mit staatlichen Zuschüssen und Vertragsmitteln des Nationalen Instituts für Allergie und Infektionskrankheiten (NIAID), der Mittel zur Reduzierung von Verteidigungsbedrohungen (DTRA) und der Biomedical Advanced Research and Development Authority (BARDA) unterstützt.
Weitere Informationen zu Soligenix, Inc. finden Sie auf der Website des Unternehmens unter www.soligenix.com .
Diese Pressemitteilung enthält möglicherweise zukunftsgerichtete Aussagen, die die aktuellen Erwartungen von Soligenix, Inc. hinsichtlich der zukünftigen Ergebnisse, Leistung, Aussichten und Chancen widerspiegeln, einschließlich, aber nicht beschränkt auf potenzielle Marktgrößen, Patientenpopulationen und die Teilnahme an klinischen Studien. Aussagen, die keine historischen Tatsachen sind, wie "antizipieren", "schätzen", "glauben", "hoffen", "beabsichtigen", "planen", "erwarten", "zielen", "können", "vorschlagen", " Wille, "" Potenzial "oder ähnliche Ausdrücke sind zukunftsgerichtete Aussagen. Diese Aussagen unterliegen einer Reihe von Risiken, Ungewissheiten und anderen Faktoren, die dazu führen können, dass tatsächliche Ereignisse oder Ergebnisse in zukünftigen Perioden wesentlich von den in oder implizierten Aussagen abweichen. diese Aussagen, wie sie beispielsweise beim COVID-19-Ausbruch aufgetreten sind. Soligenix kann Ihnen nicht versichern, dass es in der Lage sein wird, Produkte auf der Grundlage seiner Technologien erfolgreich zu entwickeln, behördliche Zulassungen zu erhalten oder zu vermarkten, insbesondere angesichts der erheblichen Unsicherheit, die mit der Entwicklung von Therapeutika und Impfstoffen gegen Bioterror-Bedrohungen, der Durchführung präklinischer und klinischer Studien mit Therapeutika und Arzneimitteln verbunden ist Impfstoffe, die behördliche Zulassungen erhalten und Therapeutika und Impfstoffe herstellen, dass die Produktentwicklungs- und Vermarktungsbemühungen aufgrund von Schwierigkeiten oder Verzögerungen bei klinischen Studien oder aufgrund mangelnder Fortschritte oder positiver Ergebnisse aus Forschungs- und Entwicklungsbemühungen nicht reduziert oder eingestellt werden weitere Mittel zur Unterstützung der Produktentwicklung und Vermarktung erfolgreich erhalten können, einschließlich Zuschüssen und Auszeichnungen, Beibehaltung der bestehenden Zuschüsse, die Leistungsanforderungen unterliegen, Abschluss von Verträgen zur biologischen Verteidigung mit der US-Regierung oder anderen Ländern, damit diese mit größeren und besser finanzierten Wettbewerbern in der Biotechnologiebranche konkurrieren können, die sich ändern In der Gesundheitspraxis wirken sich Erstattungsbeschränkungen Dritter und Initiativen zur Reform des Gesundheitswesens des Bundes und / oder der Bundesstaaten nicht negativ auf das Geschäft aus, oder der US-Kongress verabschiedet möglicherweise keine Gesetze, die zusätzliche Mittel für das Projekt BioShield-Programm bereitstellen würden. Darüber hinaus kann keine Zusicherung hinsichtlich des Zeitpunkts oder des Erfolgs der klinischen Phase-3-Studie mit SGX942 (Dusquetid) zur Behandlung der oralen Mukositis bei Patienten mit Kopf- und Halskrebs, die eine Radiochemotherapie erhalten, gegeben werden. oder eine unserer anderen klinischen / präklinischen Studien. Trotz des statistisch signifikanten Ergebnisses, das in der klinischen Phase-3-Studie SGX301 zur Behandlung des kutanen T-Zell-Lymphoms erzielt wurde, kann nicht garantiert werden, dass eine Genehmigung für das Inverkehrbringen durch die FDA oder die EMA erfolgreich sein wird. Darüber hinaus kann nicht garantiert werden, dass RiVax® für einen Biodfense Priority Review Voucher (PRV) qualifiziert ist oder dass der vorherige Verkauf von PRVs einen potenziellen Verkaufspreis für einen PRV für RiVax anzeigt® . Es kann auch nicht garantiert werden, dass das Unternehmen nicht verwässernde staatliche Mittel aus Zuschüssen und Verträgen erhält oder erhält, die vergeben wurden oder werden oder für die das Unternehmen in Zukunft einen Antrag stellen wird. Diese und andere Risikofaktoren werden von Zeit zu Zeit in den bei der Securities and Exchange Commission eingereichten Unterlagen beschrieben, einschließlich, aber nicht beschränkt auf die Berichte von Soligenix auf den Formularen 10-Q und 10-K. Sofern nicht gesetzlich vorgeschrieben, übernimmt Soligenix keine Verpflichtung, zukunftsgerichtete Aussagen aufgrund neuer Informationen oder zukünftiger Ereignisse zu aktualisieren oder zu überarbeiten.
Soligenix Announces Publication Demonstrating Thermostabilization of Filovirus Vaccine Antigens
- Protein antigen stability after lyophilization demonstrated- Key analytical assays identified
http://ir.soligenix.com/2020-09-15-Soligenix-Announces-Publi…
Antwort auf Beitrag Nr.: 65.084.839 von Schuro am 15.09.20 13:59:41Gute Neuigkeiten, aber mal sehen wie stark das den Kurs bewegen kann. Es ist jedoch nicht von der Hand zu weisen, dass Soligenix weiterhin einen guten Newsflow hat und weitere größere Milestones anstehen. Ich denke hier ist in den nächsten Monaten noch viel möglich!
Wann stehen hier welche Milestones an?
Danke
Danke
Soligenix 'RiVax (R) -Programm ist wieder im Fokus, nachdem tödliches Ricin-Toxin abgefangen wurde, bevor es das Weiße Haus erreichte
NEW YORK, NY - ( NewMediaWire ) - 21. September 2020
https://www.otcmarkets.com/stock/SNGX/news/story?e&id=169651…
NEW YORK, NY - ( NewMediaWire ) - 21. September 2020
https://www.otcmarkets.com/stock/SNGX/news/story?e&id=169651…
Pressemitteilung
Soligenix kündigt Phase-3-FLASH-Studie an, die weiterhin positive Vorteile bei Patienten mit kutanem T-Zell-Lymphom zeigt
Veröffentlicht: 22. Oktober 2020 um 9:00 Uhr ET
Die MarketWatch-Nachrichtenabteilung war an der Erstellung dieser Inhalte nicht beteiligt.
PRINCETON, NJ, 22. Oktober 2020 / PRNewswire über COMTEX / - PRINCETON, NJ, 22. Oktober 2020 / PRNewswire / - Soligenix, Inc. (Nasdaq: SNGX) (Soligenix oder das Unternehmen), ein spätes Stadium Das biopharmazeutische Unternehmen konzentrierte sich auf die Entwicklung und Vermarktung von Produkten zur Behandlung seltener Krankheiten, bei denen ein ungedeckter medizinischer Bedarf besteht. Insgesamt 6 Monate in der Studie verbesserte sich das Ansprechen weiter signifikant und blieb in der FLASH-Studie (Fluorescent Light Activated Synthetic Hypericin) sicher und gut verträglich. Diese Daten verstärken das positive Ansprechen der primären SGX301-Endpunktbehandlung, das in Zyklus 1 gezeigt wurde. Die SGX30l-Behandlung in Zyklus 3 verbesserte die Ansprechraten weiter. 49% der Patienten, die sich für insgesamt 18 Wochen für SGX301 entschieden haben, zeigten eine 50% ige oder höhere Reduktion ihres kombinierten CAILS-Läsionsscores (Composite Assessment of Index Lesion Score) im Vergleich zu 40% der Patienten, die nach 12 Wochen eine solche Reduktion zeigten der SGX301-Behandlung in Zyklus 2 (p = 0,046). Darüber hinaus hat eine fortgesetzte Analyse der Ergebnisse der protokollgebundenen Wirksamkeitszyklen (Zyklen 1 und 2) der Studie ergeben, dass eine 12-wöchige Behandlung (Zyklus 2) mit SGX301 bei beiden Pflastern gleich wirksam ist (Ansprechen 37%, p = 0,0009). und Plaque-Läsionen (Reaktion 42%, p <0,0001) des kutanen T-Zell-Lymphoms (CTCL) im Vergleich zu Placebo-Läsionsreaktionen von Zyklus 1, was die einzigartigen Vorteile der tiefer eindringenden Aktivierung von Hypericin durch sichtbares Licht weiter demonstriert. SGX301 wurde weiterhin sehr gut vertragen,
"Neben der schnellen Reaktionszeit und dem Sicherheitsprofil von SGX301 sind die Patch- und Plaquedaten aus der Studie äußerst überzeugend", erklärte Dr. Brian Poligone, leitender Forscher in der FLASH-Studie und Direktor der Rochester Skin Lymphoma Medical Group, Fairport , NY, USA. "Gegenwärtige Behandlungen für CTCL sind im Allgemeinen weniger wirksam gegen Plaques und tiefere Läsionen, was dem bei Psoriasis beobachteten Problem sehr ähnlich ist. Die Fähigkeit von SGX301, sowohl Pflaster als auch dickere Plaques bei CTCL zu behandeln, ist ein wichtiges Merkmal für diese Therapie und wird, falls genehmigt, dies auch tun." unabhängig von ihrer Präsentation von Nutzen für die Patienten sein. Diese Ergebnisse stimmen mit den positiven Ergebnissen überein, die in einer kürzlich berichteten Fallstudie hervorgehoben wurden von follikulotropen Mykose-Fungoiden, einer schwer zu behandelnden Variante von CTCL, bei der Läsionen mit den Haarfollikeln tief in der Haut assoziiert und resistenter gegen Phototherapie sind. "
"Im Namen aller Mitarbeiter von Soligenix möchte ich den Patienten, Familienangehörigen, Ermittlern und Beratern, die an der zentralen Phase-3-FLASH-Studie beteiligt sind, meinen aufrichtigen Dank aussprechen", erklärte Dr. Richard Straube, Chief Medical Officer von Soligenix. "Bei der Behandlung von CTCL, einem chronischen Krebs ohne Heilung, ist die langfristige Sicherheit von größter Bedeutung. Die Behandlung mit SGX301 zeigt weiterhin eine starke Wirksamkeit und ein sehr harmloses Sicherheitsprofil, was für Patienten mit dieser schwierigen Krankheit von erheblichem Nutzen ist. Obwohl der Schwerpunkt des zusätzlichen optionalen Zyklus auf der Sicherheit lag, sehen wir weiterhin eine Verbesserung der CTCL-Läsionen mit erweiterter SGX301-Behandlung, die auf dem robusten Wirksamkeitssignal in früheren Zyklen aufbaut. Die Wirksamkeit sowohl gegen Patch- als auch Plaque-Läsionen, z.
"Diese Ergebnisse bestätigen weiterhin unsere langjährige Überzeugung, dass SGX301 das Potenzial hat, eine wertvolle und lebensverändernde Therapie für Patienten zu sein, die an CTCL leiden, einer Orphan-Krankheit und einem Bereich mit ungedecktem medizinischen Bedarf", erklärte Christopher J. Schaber. PhD, President und Chief Executive Officer von Soligenix. "Mit dem Abschluss der Studie prüfen wir die Kommerzialisierung und / oder Partnerschaft von SGX301 weiterhin gründlich, während wir uns gleichzeitig auf die Einreichung des neuen Arzneimittelantrags bei der FDA vorbereiten. Trotz der Herausforderungen, die sich aus der COVID-19-Pandemie ergeben,
Soligenix kündigte zuvor positive Top-Line-Ergebnisse an, als die FLASH-Studie über den ersten 6-wöchigen doppelblinden Behandlungszyklus (Zyklus 1) ( hier verfügbar ) eine statistische Signifikanz (p = 0,04) in ihrem primären Endpunkt erreichte . Die Studie umfasste 169 Patienten, die 2: 1 randomisiert wurden, um entweder SGX301 oder Placebo in Zyklus 1 zu erhalten. Nach der anschließenden zusätzlichen 6-wöchigen Behandlung im offenen Zyklus 2 erhöhte sich die Ansprechrate bei Patienten, die insgesamt 12 Wochen Behandlung erhielten, um zwei und zwei eine Hälfte (40% mit p <0,0001 im Vergleich zu Placebo und p <0,0001 im Vergleich zu 6-wöchiger Behandlung). Diese statistisch hoch signifikanten Ergebnisse bestätigen den Nutzen einer fortgesetzten SGX301-Behandlung bei CTCL-Patienten (Pressemitteilung hier verfügbar)). Das Ansprechen auf die Behandlung wurde in Woche 8 (nach 6 Wochen Behandlung) und in Woche 16 (nach 12 Wochen Behandlung) bewertet. Eine positive Reaktion wurde als eine Verbesserung der CAILS um mindestens 50% für drei bewertete Indexläsionen definiert. Eine weitere Analyse der Patienten, die SGX301 über 12 Wochen erhielten, ergab, dass die Behandlung sowohl von Patch- als auch von Plaque-Läsionen gleichermaßen wirksam war. Ähnlich wie bei den Gesamtergebnissen waren die Reaktionen einzelner Läsionen nach 12-wöchiger Behandlung im Vergleich zu 6-wöchiger Behandlung mit SGX301 oder Placebo statistisch signifikant verbessert. Wichtig ist, dass diese Verbesserung sowohl für Pflaster (Reaktion 37%, p = 0,0009) als auch für Plaques (Reaktion 42%, p <0,0001) gleichermaßen beobachtet wurde, ein Unterscheidungsmerkmal von SGX301 im Vergleich zu anderen Behandlungsmodalitäten bei CTCL.
Zyklus 3 der Studie wurde als optionaler Zyklus mit Mitgefühl entwickelt, bei dem die Patienten die SGX301-Behandlung für weitere 6 Wochen (bis zu insgesamt 18 Wochen) für alle ihre Läsionen fortsetzen konnten. Sechsundsechzig Prozent (66%) der Patienten entschieden sich für die Fortsetzung von Zyklus 3. Während dieses Zyklus wurde SGX301 auf mehrere krebsartige Hautläsionen am Körper angewendet, um die Exposition gegenüber dem Medikament zu maximieren. Die Einbeziehung von Zyklus 3 in die Studie ermöglichte eine strengere Sicherheitsbewertung im Zusammenhang mit einer längeren und erhöhten Exposition gegenüber SGX301. Ähnlich wie bei den Gesamtergebnissen war das Ansprechen einzelner Läsionen nach drei Behandlungszyklen mit SGX301 nach Zyklus 3 im Vergleich zu den Ergebnissen nach Zyklus 1 und 2 statistisch signifikant (49% aller Läsionen reagierten mit einer CAILS-Score-Reduktion von mindestens 50%, mit einer statistisch signifikanten Veränderung gegenüber dem Ende von Zyklus 2 [p = 0,0009] und verglichen mit Patienten, die nur in Zyklus 1 ein Placebo erhielten [p <0,0001]). Ferner wurde kein synthetisches Hypericin im Blutkreislauf von Patienten nachgewiesen, wodurch Sicherheitsbedenken hinsichtlich Arzneimittelwirkungen außerhalb des Tumorbereichs minimiert wurden. Alle Sicherheitsdaten weisen weiterhin darauf hin, dass die Behandlung mit SGX301 sicher und gut verträglich ist, im deutlichen Gegensatz zu anderen verfügbaren Zweitlinien- und Off-Label-Therapien für CTCL.
Über das kutane T-Zell-Lymphom (CTCL)
CTCL ist eine Klasse von Non-Hodgkin-Lymphomen (NHL), einer Krebsart der weißen Blutkörperchen, die ein wesentlicher Bestandteil des Immunsystems sind. Im Gegensatz zu den meisten NHLs, an denen im Allgemeinen B-Zell-Lymphozyten beteiligt sind (die an der Produktion von Antikörpern beteiligt sind), wird CTCL durch eine Expansion von malignen T-Zell-Lymphozyten (die an der zellvermittelten Immunität beteiligt sind) verursacht, die normalerweise so programmiert sind, dass sie zur Haut wandern. Diese bösartigen Zellen wandern auf die Haut, wo sie verschiedene Läsionen bilden, die typischerweise als Flecken beginnen, die sich möglicherweise zu einer schwierigeren Behandlung von erhöhten Plaques und Tumoren entwickeln. Die Mortalität hängt mit dem Stadium der CTCL zusammen, wobei das mediane Überleben im Allgemeinen zwischen etwa 12 Jahren im Frühstadium und nur 2,5 Jahren nach Fortschreiten der Krankheit liegt. Derzeit gibt es keine Heilung für CTCL und keine von der FDA zugelassene Erstlinientherapie. In der Regel
CTCL stellt eine seltene Gruppe von NHLs dar, die bei etwa 4% der ungefähr 700.000 mit der Krankheit lebenden Personen auftritt. Basierend auf der Überprüfung historischer veröffentlichter Studien und Berichte und einer Interpolation von Daten zur Inzidenz von CTCL wird geschätzt, dass mehr als 25.000 Personen in den USA betroffen sind, wobei jährlich etwa 3.000 neue Fälle auftreten.
Über SGX301
SGX301 ist eine neuartige photodynamische Therapie der Spitzenklasse, bei der sicheres sichtbares Licht zur Aktivierung verwendet wird. Der Wirkstoff in SGX301 ist synthetisches Hypericin, ein starker Photosensibilisator, der topisch auf Hautläsionen angewendet wird, von den malignen T-Zellen aufgenommen und 16 bis 24 Stunden später durch fluoreszierendes Licht aktiviert wird. Die Verwendung von sichtbarem Licht im rot-gelben Spektrum hat den Vorteil, dass es tiefer in die Haut eindringt (viel stärker als ultraviolettes Licht) und daher möglicherweise tiefere Hauterkrankungen und dickere Läsionen behandelt. Dieser Behandlungsansatz vermeidet das Risiko von sekundären Malignitäten (einschließlich Melanomen), die mit den häufig verwendeten DNA-schädigenden Arzneimitteln und anderen Phototherapien verbunden sind, die von der UV-Exposition abhängig sind. Kombiniert mit Photoaktivierung, Hypericin hat signifikante antiproliferative Wirkungen auf aktivierte normale humane lymphoide Zellen gezeigt und das Wachstum von aus CTCL-Patienten isolierten malignen T-Zellen gehemmt. In einer veröffentlichten klinischen Phase-2-Studie bei CTCL zeigten die Patienten eine statistisch signifikante (p = 0,04) Verbesserung bei topischer Hypericin-Behandlung, während das Placebo unwirksam war. SGX301 wurde von der FDA als Orphan Drug und Fast Track sowie von der European Medicines Agency (EMA) als Orphan bezeichnet.
An der Phase-3-FLASH-Studie nahmen insgesamt 169 Patienten (166 auswertbar) mit CTCL im Stadium IA, IB oder IIA teil. Die Studie besteht aus drei Behandlungszyklen. Die Behandlungen wurden in den ersten 6 Wochen zweimal wöchentlich verabreicht und das Ansprechen auf die Behandlung wurde am Ende der 8. Woche jedes Zyklus bestimmt. Im ersten doppelblinden Behandlungszyklus erhielten 116 Patienten eine SGX301-Behandlung (0,25% synthetisches Hypericin) und 50 eine Placebo-Behandlung ihrer Indexläsionen. Insgesamt 16% der Patienten, die SGX301 erhielten, erreichten eine Reduktion ihrer Läsionen um mindestens 50% (bewertet anhand einer Standardmessung dermatologischer Läsionen, dem CAILS-Score), verglichen mit nur 4% der Patienten in der Placebogruppe nach 8 Wochen (p = 0,04) während des ersten Behandlungszyklus (primärer Endpunkt). Die Behandlung mit SGX301 im ersten Zyklus war sicher und gut verträglich.
Im zweiten offenen Behandlungszyklus (Zyklus 2) erhielten alle Patienten eine SGX301-Behandlung ihrer Indexläsionen. Die Auswertung von 155 Patienten in diesem Zyklus (110 erhielten 12 Wochen SGX301-Behandlung und 45 erhielten 6 Wochen Placebo-Behandlung, gefolgt von 6 Wochen SGX301-Behandlung) ergab, dass die Ansprechrate in der 12-wöchigen Behandlungsgruppe 40% betrug (p < 0,0001 gegenüber der Placebo-Behandlungsrate in Zyklus 1). Ein Vergleich der 12-wöchigen und 6-wöchigen Behandlungsgruppen ergab auch eine statistisch signifikante Verbesserung (p <0,0001) zwischen den beiden Gruppen, was darauf hinweist, dass eine fortgesetzte Behandlung zu besseren Ergebnissen führt. SGX301 war weiterhin sicher und gut verträglich. Zusätzliche Analysen zeigten auch, dass SGX301 bei der Behandlung beider Plaques gleich wirksam ist (Reaktion 42%, p <0).
0,0001 gegenüber der Placebo-Behandlungsrate in Zyklus 1). Ein Vergleich der 12-wöchigen und 6-wöchigen Behandlungsgruppen ergab auch eine statistisch signifikante Verbesserung (p <0,0001) zwischen den beiden Gruppen, was darauf hinweist, dass eine fortgesetzte Behandlung zu besseren Ergebnissen führt. SGX301 war weiterhin sicher und gut verträglich. Zusätzliche Analysen zeigten auch, dass SGX301 bei der Behandlung beider Plaques gleich wirksam ist (Reaktion 42%, p <0).
Der dritte (optionale) Behandlungszyklus (Zyklus 3) konzentrierte sich auf die Sicherheit und alle Patienten konnten sich für eine SGX301-Behandlung aller ihrer Läsionen entscheiden. Bemerkenswerterweise entschieden sich 66% der Patienten dafür, diesen optionalen Zyklus der Studie mitfühlender Nutzung / Sicherheit fortzusetzen. Von der Untergruppe der Patienten, die SGX301 während aller drei Behandlungszyklen erhielten, zeigten 49% ein Ansprechen auf die Behandlung (p <0,0001 gegenüber Patienten, die in Zyklus 1 ein Placebo erhielten). Darüber hinaus wurde bei einer Untergruppe von Patienten, die in diesem Zyklus untersucht wurden, gezeigt, dass SGX301 nicht systemisch verfügbar ist, was mit der bisher beobachteten allgemeinen Sicherheit dieses topischen Produkts übereinstimmt. Am Ende von Zyklus 3 wurde SGX301 trotz längerer und vermehrter Verwendung des Produkts zur Behandlung mehrerer Läsionen weiterhin gut vertragen. Follow-up-Besuche werden voraussichtlich im Jahr 2020 abgeschlossen sein.
Die Gesamtsicherheit von SGX301 ist ein kritisches Merkmal dieser Behandlung und wurde während der drei Behandlungszyklen (Zyklen 1, 2 und 3) und der 6-monatigen Nachbeobachtungszeit überwacht. Der Wirkmechanismus von SGX301 ist nicht mit DNA-Schäden verbunden, was es zu einer sichereren Alternative als derzeit verfügbare Therapien macht, die alle mit signifikanten und manchmal tödlichen Nebenwirkungen verbunden sind. Dazu gehören vor allem das Risiko für Melanome und andere bösartige Erkrankungen sowie das Risiko erheblicher Hautschäden und vorzeitiger Hautalterung. Derzeit verfügbare Behandlungen werden nur im Zusammenhang mit früheren Behandlungsfehlern mit anderen Modalitäten zugelassen, und es ist keine zugelassene Front-Line-Therapie verfügbar. In dieser Landschaft ist die Behandlung von CTCL stark vom Sicherheitsrisiko jedes Produkts motiviert. SGX301 ist möglicherweise die sicherste verfügbare wirksame Behandlung für CTCL. Ohne systemische Absorption, eine Verbindung, die nicht mutagen ist, und eine Lichtquelle, die nicht krebserregend ist, gibt es bisher keine Hinweise auf mögliche Sicherheitsprobleme.
Die klinische Phase-3-CTCL-Studie wurde teilweise vom National Cancer Institute über einen Phase-II-SBIR-Zuschuss (Nr. 1R44CA210848-01A1) finanziert, der an Soligenix, Inc. vergeben wurde.
Über Soligenix, Inc.
Soligenix ist ein biopharmazeutisches Unternehmen im Spätstadium, das sich auf die Entwicklung und Vermarktung von Produkten zur Behandlung seltener Krankheiten konzentriert, bei denen ein ungedeckter medizinischer Bedarf besteht. Unser Geschäftsbereich Specialized BioTherapeutics entwickelt SGX301 als neuartige photodynamische Therapie mit sicherem sichtbarem Licht zur Behandlung des kutanen T-Zell-Lymphoms, unserer erstklassigen IDR-Technologie (Innate Defense Regulator), Dusquetid (SGX942) zur oralen Behandlung Mukositis bei Kopf- und Halskrebs sowie firmeneigene Formulierungen von oralem Beclomethason 17,21-Dipropionat (BDP) zur Vorbeugung / Behandlung von Magen-Darm-Erkrankungen (GI), die durch schwere Entzündungen gekennzeichnet sind, einschließlich pädiatrischer Morbus Crohn (SGX203) und akuter Strahlenenteritis (SGX201) .
Unser Geschäftsbereich Public Health Solutions umfasst aktive Entwicklungsprogramme für RiVax ® , unseren Ricin-Toxin-Impfstoffkandidaten SGX943, unseren therapeutischen Kandidaten für antibiotikaresistente und neu auftretende Infektionskrankheiten, sowie unsere Forschungsprogramme zur Identifizierung und Entwicklung neuartiger Impfstoffkandidaten gegen Virusinfektionen, einschließlich Ebola, Marburg und SARS-CoV-2 (die Ursache von COVID-19). Die Entwicklung unserer Impfprogramme beinhaltet die Verwendung unserer proprietären Wärmestabilisierungsplattform-Technologie, bekannt als ThermoVax ®. Bisher wurde dieses Geschäftsfeld mit staatlichen Zuschüssen und Vertragsmitteln des Nationalen Instituts für Allergien und Infektionskrankheiten (NIAID), der Mittel zur Reduzierung von Verteidigungsbedrohungen (DTRA) und der Biomedical Advanced Research and Development Authority (BARDA) unterstützt.
Weitere Informationen zu Soligenix, Inc. finden Sie auf der Website des Unternehmens unter www.soligenix.com .
Diese Pressemitteilung enthält möglicherweise zukunftsgerichtete Aussagen, die die aktuellen Erwartungen von Soligenix, Inc. hinsichtlich der zukünftigen Ergebnisse, Leistung, Aussichten und Chancen widerspiegeln, einschließlich, aber nicht beschränkt auf potenzielle Marktgrößen, Patientenpopulationen und die Teilnahme an klinischen Studien. Aussagen, die keine historischen Tatsachen sind, wie "antizipieren", "schätzen", "glauben", "hoffen", "beabsichtigen", "planen", "erwarten", "zielen", "können", "vorschlagen", " Wille, "" Potenzial "oder ähnliche Ausdrücke sind zukunftsgerichtete Aussagen. Diese Aussagen unterliegen einer Reihe von Risiken, Ungewissheiten und anderen Faktoren, die dazu führen können, dass tatsächliche Ereignisse oder Ergebnisse in zukünftigen Perioden wesentlich von den in oder implizierten Aussagen abweichen. diese Aussagen, wie sie beispielsweise beim COVID-19-Ausbruch aufgetreten sind. Soligenix kann Ihnen nicht versichern, dass es in der Lage sein wird, Produkte auf der Grundlage seiner Technologien erfolgreich zu entwickeln, behördliche Zulassungen zu erhalten oder zu vermarkten, insbesondere angesichts der erheblichen Unsicherheit, die mit der Entwicklung von Therapeutika und Impfstoffen gegen Bioterror-Bedrohungen, der Durchführung präklinischer und klinischer Studien mit Therapeutika und Arzneimitteln verbunden ist Impfstoffe, die behördliche Zulassungen erhalten und Therapeutika und Impfstoffe herstellen, dass die Produktentwicklungs- und Vermarktungsbemühungen aufgrund von Schwierigkeiten oder Verzögerungen bei klinischen Studien oder aufgrund mangelnder Fortschritte oder positiver Ergebnisse aus Forschungs- und Entwicklungsbemühungen nicht reduziert oder eingestellt werden weitere Mittel zur Unterstützung der Produktentwicklung und Vermarktung erfolgreich erhalten können, einschließlich Zuschüssen und Auszeichnungen, Beibehaltung der bestehenden Zuschüsse, die Leistungsanforderungen unterliegen, Abschluss von Biodefense-Beschaffungsverträgen mit der US-Regierung oder anderen Ländern, damit diese mit größeren und besser finanzierten Wettbewerbern in der Biotechnologiebranche konkurrieren können, die sich ändern In der Gesundheitspraxis wirken sich Erstattungsbeschränkungen Dritter und Initiativen zur Reform des Gesundheitswesens auf Bundes- und / oder Landesebene nicht negativ auf das Geschäft aus, oder der US-Kongress verabschiedet möglicherweise keine Gesetze, die zusätzliche Mittel für das Projekt BioShield-Programm bereitstellen würden. Darüber hinaus kann keine Zusicherung hinsichtlich des Zeitpunkts oder des Erfolgs der klinischen Phase-3-Studie mit SGX942 (Dusquetid) zur Behandlung der oralen Mukositis bei Patienten mit Kopf- und Halskrebs, die eine Radiochemotherapie erhalten, gegeben werden. oder eine unserer anderen klinischen / präklinischen Studien. Trotz des statistisch signifikanten Ergebnisses, das in der klinischen Phase-3-Studie SGX301 zur Behandlung des kutanen T-Zell-Lymphoms erzielt wurde, kann nicht garantiert werden, dass eine Genehmigung für das Inverkehrbringen durch die FDA oder die EMA erfolgreich sein wird. Darüber hinaus kann nicht garantiert werden, dass RiVax® qualifiziert sich für einen Biodefense Priority Review Voucher (PRV) oder dass der vorherige Verkauf von PRVs einen potenziellen Verkaufspreis für einen PRV für RiVax ® anzeigt . Es kann auch keine Zusicherung gegeben werden, dass das Unternehmen nicht verwässernde staatliche Mittel aus Zuschüssen und Verträgen erhält oder erhält, die vergeben wurden oder werden oder für die das Unternehmen in Zukunft einen Antrag stellen wird. Diese und andere Risikofaktoren werden von Zeit zu Zeit in den bei der Securities and Exchange Commission eingereichten Unterlagen beschrieben, einschließlich, aber nicht beschränkt auf die Berichte von Soligenix auf den Formularen 10-Q und 10-K. Sofern nicht gesetzlich vorgeschrieben, übernimmt Soligenix keine Verpflichtung, zukunftsgerichtete Aussagen aufgrund neuer Informationen oder zukünftiger Ereignisse zu aktualisieren oder zu überarbeiten.
Soligenix kündigt Phase-3-FLASH-Studie an, die weiterhin positive Vorteile bei Patienten mit kutanem T-Zell-Lymphom zeigt
Veröffentlicht: 22. Oktober 2020 um 9:00 Uhr ET
Die MarketWatch-Nachrichtenabteilung war an der Erstellung dieser Inhalte nicht beteiligt.
PRINCETON, NJ, 22. Oktober 2020 / PRNewswire über COMTEX / - PRINCETON, NJ, 22. Oktober 2020 / PRNewswire / - Soligenix, Inc. (Nasdaq: SNGX) (Soligenix oder das Unternehmen), ein spätes Stadium Das biopharmazeutische Unternehmen konzentrierte sich auf die Entwicklung und Vermarktung von Produkten zur Behandlung seltener Krankheiten, bei denen ein ungedeckter medizinischer Bedarf besteht. Insgesamt 6 Monate in der Studie verbesserte sich das Ansprechen weiter signifikant und blieb in der FLASH-Studie (Fluorescent Light Activated Synthetic Hypericin) sicher und gut verträglich. Diese Daten verstärken das positive Ansprechen der primären SGX301-Endpunktbehandlung, das in Zyklus 1 gezeigt wurde. Die SGX30l-Behandlung in Zyklus 3 verbesserte die Ansprechraten weiter. 49% der Patienten, die sich für insgesamt 18 Wochen für SGX301 entschieden haben, zeigten eine 50% ige oder höhere Reduktion ihres kombinierten CAILS-Läsionsscores (Composite Assessment of Index Lesion Score) im Vergleich zu 40% der Patienten, die nach 12 Wochen eine solche Reduktion zeigten der SGX301-Behandlung in Zyklus 2 (p = 0,046). Darüber hinaus hat eine fortgesetzte Analyse der Ergebnisse der protokollgebundenen Wirksamkeitszyklen (Zyklen 1 und 2) der Studie ergeben, dass eine 12-wöchige Behandlung (Zyklus 2) mit SGX301 bei beiden Pflastern gleich wirksam ist (Ansprechen 37%, p = 0,0009). und Plaque-Läsionen (Reaktion 42%, p <0,0001) des kutanen T-Zell-Lymphoms (CTCL) im Vergleich zu Placebo-Läsionsreaktionen von Zyklus 1, was die einzigartigen Vorteile der tiefer eindringenden Aktivierung von Hypericin durch sichtbares Licht weiter demonstriert. SGX301 wurde weiterhin sehr gut vertragen,
"Neben der schnellen Reaktionszeit und dem Sicherheitsprofil von SGX301 sind die Patch- und Plaquedaten aus der Studie äußerst überzeugend", erklärte Dr. Brian Poligone, leitender Forscher in der FLASH-Studie und Direktor der Rochester Skin Lymphoma Medical Group, Fairport , NY, USA. "Gegenwärtige Behandlungen für CTCL sind im Allgemeinen weniger wirksam gegen Plaques und tiefere Läsionen, was dem bei Psoriasis beobachteten Problem sehr ähnlich ist. Die Fähigkeit von SGX301, sowohl Pflaster als auch dickere Plaques bei CTCL zu behandeln, ist ein wichtiges Merkmal für diese Therapie und wird, falls genehmigt, dies auch tun." unabhängig von ihrer Präsentation von Nutzen für die Patienten sein. Diese Ergebnisse stimmen mit den positiven Ergebnissen überein, die in einer kürzlich berichteten Fallstudie hervorgehoben wurden von follikulotropen Mykose-Fungoiden, einer schwer zu behandelnden Variante von CTCL, bei der Läsionen mit den Haarfollikeln tief in der Haut assoziiert und resistenter gegen Phototherapie sind. "
"Im Namen aller Mitarbeiter von Soligenix möchte ich den Patienten, Familienangehörigen, Ermittlern und Beratern, die an der zentralen Phase-3-FLASH-Studie beteiligt sind, meinen aufrichtigen Dank aussprechen", erklärte Dr. Richard Straube, Chief Medical Officer von Soligenix. "Bei der Behandlung von CTCL, einem chronischen Krebs ohne Heilung, ist die langfristige Sicherheit von größter Bedeutung. Die Behandlung mit SGX301 zeigt weiterhin eine starke Wirksamkeit und ein sehr harmloses Sicherheitsprofil, was für Patienten mit dieser schwierigen Krankheit von erheblichem Nutzen ist. Obwohl der Schwerpunkt des zusätzlichen optionalen Zyklus auf der Sicherheit lag, sehen wir weiterhin eine Verbesserung der CTCL-Läsionen mit erweiterter SGX301-Behandlung, die auf dem robusten Wirksamkeitssignal in früheren Zyklen aufbaut. Die Wirksamkeit sowohl gegen Patch- als auch Plaque-Läsionen, z.
"Diese Ergebnisse bestätigen weiterhin unsere langjährige Überzeugung, dass SGX301 das Potenzial hat, eine wertvolle und lebensverändernde Therapie für Patienten zu sein, die an CTCL leiden, einer Orphan-Krankheit und einem Bereich mit ungedecktem medizinischen Bedarf", erklärte Christopher J. Schaber. PhD, President und Chief Executive Officer von Soligenix. "Mit dem Abschluss der Studie prüfen wir die Kommerzialisierung und / oder Partnerschaft von SGX301 weiterhin gründlich, während wir uns gleichzeitig auf die Einreichung des neuen Arzneimittelantrags bei der FDA vorbereiten. Trotz der Herausforderungen, die sich aus der COVID-19-Pandemie ergeben,
Soligenix kündigte zuvor positive Top-Line-Ergebnisse an, als die FLASH-Studie über den ersten 6-wöchigen doppelblinden Behandlungszyklus (Zyklus 1) ( hier verfügbar ) eine statistische Signifikanz (p = 0,04) in ihrem primären Endpunkt erreichte . Die Studie umfasste 169 Patienten, die 2: 1 randomisiert wurden, um entweder SGX301 oder Placebo in Zyklus 1 zu erhalten. Nach der anschließenden zusätzlichen 6-wöchigen Behandlung im offenen Zyklus 2 erhöhte sich die Ansprechrate bei Patienten, die insgesamt 12 Wochen Behandlung erhielten, um zwei und zwei eine Hälfte (40% mit p <0,0001 im Vergleich zu Placebo und p <0,0001 im Vergleich zu 6-wöchiger Behandlung). Diese statistisch hoch signifikanten Ergebnisse bestätigen den Nutzen einer fortgesetzten SGX301-Behandlung bei CTCL-Patienten (Pressemitteilung hier verfügbar)). Das Ansprechen auf die Behandlung wurde in Woche 8 (nach 6 Wochen Behandlung) und in Woche 16 (nach 12 Wochen Behandlung) bewertet. Eine positive Reaktion wurde als eine Verbesserung der CAILS um mindestens 50% für drei bewertete Indexläsionen definiert. Eine weitere Analyse der Patienten, die SGX301 über 12 Wochen erhielten, ergab, dass die Behandlung sowohl von Patch- als auch von Plaque-Läsionen gleichermaßen wirksam war. Ähnlich wie bei den Gesamtergebnissen waren die Reaktionen einzelner Läsionen nach 12-wöchiger Behandlung im Vergleich zu 6-wöchiger Behandlung mit SGX301 oder Placebo statistisch signifikant verbessert. Wichtig ist, dass diese Verbesserung sowohl für Pflaster (Reaktion 37%, p = 0,0009) als auch für Plaques (Reaktion 42%, p <0,0001) gleichermaßen beobachtet wurde, ein Unterscheidungsmerkmal von SGX301 im Vergleich zu anderen Behandlungsmodalitäten bei CTCL.
Zyklus 3 der Studie wurde als optionaler Zyklus mit Mitgefühl entwickelt, bei dem die Patienten die SGX301-Behandlung für weitere 6 Wochen (bis zu insgesamt 18 Wochen) für alle ihre Läsionen fortsetzen konnten. Sechsundsechzig Prozent (66%) der Patienten entschieden sich für die Fortsetzung von Zyklus 3. Während dieses Zyklus wurde SGX301 auf mehrere krebsartige Hautläsionen am Körper angewendet, um die Exposition gegenüber dem Medikament zu maximieren. Die Einbeziehung von Zyklus 3 in die Studie ermöglichte eine strengere Sicherheitsbewertung im Zusammenhang mit einer längeren und erhöhten Exposition gegenüber SGX301. Ähnlich wie bei den Gesamtergebnissen war das Ansprechen einzelner Läsionen nach drei Behandlungszyklen mit SGX301 nach Zyklus 3 im Vergleich zu den Ergebnissen nach Zyklus 1 und 2 statistisch signifikant (49% aller Läsionen reagierten mit einer CAILS-Score-Reduktion von mindestens 50%, mit einer statistisch signifikanten Veränderung gegenüber dem Ende von Zyklus 2 [p = 0,0009] und verglichen mit Patienten, die nur in Zyklus 1 ein Placebo erhielten [p <0,0001]). Ferner wurde kein synthetisches Hypericin im Blutkreislauf von Patienten nachgewiesen, wodurch Sicherheitsbedenken hinsichtlich Arzneimittelwirkungen außerhalb des Tumorbereichs minimiert wurden. Alle Sicherheitsdaten weisen weiterhin darauf hin, dass die Behandlung mit SGX301 sicher und gut verträglich ist, im deutlichen Gegensatz zu anderen verfügbaren Zweitlinien- und Off-Label-Therapien für CTCL.
Über das kutane T-Zell-Lymphom (CTCL)
CTCL ist eine Klasse von Non-Hodgkin-Lymphomen (NHL), einer Krebsart der weißen Blutkörperchen, die ein wesentlicher Bestandteil des Immunsystems sind. Im Gegensatz zu den meisten NHLs, an denen im Allgemeinen B-Zell-Lymphozyten beteiligt sind (die an der Produktion von Antikörpern beteiligt sind), wird CTCL durch eine Expansion von malignen T-Zell-Lymphozyten (die an der zellvermittelten Immunität beteiligt sind) verursacht, die normalerweise so programmiert sind, dass sie zur Haut wandern. Diese bösartigen Zellen wandern auf die Haut, wo sie verschiedene Läsionen bilden, die typischerweise als Flecken beginnen, die sich möglicherweise zu einer schwierigeren Behandlung von erhöhten Plaques und Tumoren entwickeln. Die Mortalität hängt mit dem Stadium der CTCL zusammen, wobei das mediane Überleben im Allgemeinen zwischen etwa 12 Jahren im Frühstadium und nur 2,5 Jahren nach Fortschreiten der Krankheit liegt. Derzeit gibt es keine Heilung für CTCL und keine von der FDA zugelassene Erstlinientherapie. In der Regel
CTCL stellt eine seltene Gruppe von NHLs dar, die bei etwa 4% der ungefähr 700.000 mit der Krankheit lebenden Personen auftritt. Basierend auf der Überprüfung historischer veröffentlichter Studien und Berichte und einer Interpolation von Daten zur Inzidenz von CTCL wird geschätzt, dass mehr als 25.000 Personen in den USA betroffen sind, wobei jährlich etwa 3.000 neue Fälle auftreten.
Über SGX301
SGX301 ist eine neuartige photodynamische Therapie der Spitzenklasse, bei der sicheres sichtbares Licht zur Aktivierung verwendet wird. Der Wirkstoff in SGX301 ist synthetisches Hypericin, ein starker Photosensibilisator, der topisch auf Hautläsionen angewendet wird, von den malignen T-Zellen aufgenommen und 16 bis 24 Stunden später durch fluoreszierendes Licht aktiviert wird. Die Verwendung von sichtbarem Licht im rot-gelben Spektrum hat den Vorteil, dass es tiefer in die Haut eindringt (viel stärker als ultraviolettes Licht) und daher möglicherweise tiefere Hauterkrankungen und dickere Läsionen behandelt. Dieser Behandlungsansatz vermeidet das Risiko von sekundären Malignitäten (einschließlich Melanomen), die mit den häufig verwendeten DNA-schädigenden Arzneimitteln und anderen Phototherapien verbunden sind, die von der UV-Exposition abhängig sind. Kombiniert mit Photoaktivierung, Hypericin hat signifikante antiproliferative Wirkungen auf aktivierte normale humane lymphoide Zellen gezeigt und das Wachstum von aus CTCL-Patienten isolierten malignen T-Zellen gehemmt. In einer veröffentlichten klinischen Phase-2-Studie bei CTCL zeigten die Patienten eine statistisch signifikante (p = 0,04) Verbesserung bei topischer Hypericin-Behandlung, während das Placebo unwirksam war. SGX301 wurde von der FDA als Orphan Drug und Fast Track sowie von der European Medicines Agency (EMA) als Orphan bezeichnet.
An der Phase-3-FLASH-Studie nahmen insgesamt 169 Patienten (166 auswertbar) mit CTCL im Stadium IA, IB oder IIA teil. Die Studie besteht aus drei Behandlungszyklen. Die Behandlungen wurden in den ersten 6 Wochen zweimal wöchentlich verabreicht und das Ansprechen auf die Behandlung wurde am Ende der 8. Woche jedes Zyklus bestimmt. Im ersten doppelblinden Behandlungszyklus erhielten 116 Patienten eine SGX301-Behandlung (0,25% synthetisches Hypericin) und 50 eine Placebo-Behandlung ihrer Indexläsionen. Insgesamt 16% der Patienten, die SGX301 erhielten, erreichten eine Reduktion ihrer Läsionen um mindestens 50% (bewertet anhand einer Standardmessung dermatologischer Läsionen, dem CAILS-Score), verglichen mit nur 4% der Patienten in der Placebogruppe nach 8 Wochen (p = 0,04) während des ersten Behandlungszyklus (primärer Endpunkt). Die Behandlung mit SGX301 im ersten Zyklus war sicher und gut verträglich.
Im zweiten offenen Behandlungszyklus (Zyklus 2) erhielten alle Patienten eine SGX301-Behandlung ihrer Indexläsionen. Die Auswertung von 155 Patienten in diesem Zyklus (110 erhielten 12 Wochen SGX301-Behandlung und 45 erhielten 6 Wochen Placebo-Behandlung, gefolgt von 6 Wochen SGX301-Behandlung) ergab, dass die Ansprechrate in der 12-wöchigen Behandlungsgruppe 40% betrug (p <
 0,0001 gegenüber der Placebo-Behandlungsrate in Zyklus 1). Ein Vergleich der 12-wöchigen und 6-wöchigen Behandlungsgruppen ergab auch eine statistisch signifikante Verbesserung (p <0,0001) zwischen den beiden Gruppen, was darauf hinweist, dass eine fortgesetzte Behandlung zu besseren Ergebnissen führt. SGX301 war weiterhin sicher und gut verträglich. Zusätzliche Analysen zeigten auch, dass SGX301 bei der Behandlung beider Plaques gleich wirksam ist (Reaktion 42%, p <0).
0,0001 gegenüber der Placebo-Behandlungsrate in Zyklus 1). Ein Vergleich der 12-wöchigen und 6-wöchigen Behandlungsgruppen ergab auch eine statistisch signifikante Verbesserung (p <0,0001) zwischen den beiden Gruppen, was darauf hinweist, dass eine fortgesetzte Behandlung zu besseren Ergebnissen führt. SGX301 war weiterhin sicher und gut verträglich. Zusätzliche Analysen zeigten auch, dass SGX301 bei der Behandlung beider Plaques gleich wirksam ist (Reaktion 42%, p <0).Der dritte (optionale) Behandlungszyklus (Zyklus 3) konzentrierte sich auf die Sicherheit und alle Patienten konnten sich für eine SGX301-Behandlung aller ihrer Läsionen entscheiden. Bemerkenswerterweise entschieden sich 66% der Patienten dafür, diesen optionalen Zyklus der Studie mitfühlender Nutzung / Sicherheit fortzusetzen. Von der Untergruppe der Patienten, die SGX301 während aller drei Behandlungszyklen erhielten, zeigten 49% ein Ansprechen auf die Behandlung (p <0,0001 gegenüber Patienten, die in Zyklus 1 ein Placebo erhielten). Darüber hinaus wurde bei einer Untergruppe von Patienten, die in diesem Zyklus untersucht wurden, gezeigt, dass SGX301 nicht systemisch verfügbar ist, was mit der bisher beobachteten allgemeinen Sicherheit dieses topischen Produkts übereinstimmt. Am Ende von Zyklus 3 wurde SGX301 trotz längerer und vermehrter Verwendung des Produkts zur Behandlung mehrerer Läsionen weiterhin gut vertragen. Follow-up-Besuche werden voraussichtlich im Jahr 2020 abgeschlossen sein.
Die Gesamtsicherheit von SGX301 ist ein kritisches Merkmal dieser Behandlung und wurde während der drei Behandlungszyklen (Zyklen 1, 2 und 3) und der 6-monatigen Nachbeobachtungszeit überwacht. Der Wirkmechanismus von SGX301 ist nicht mit DNA-Schäden verbunden, was es zu einer sichereren Alternative als derzeit verfügbare Therapien macht, die alle mit signifikanten und manchmal tödlichen Nebenwirkungen verbunden sind. Dazu gehören vor allem das Risiko für Melanome und andere bösartige Erkrankungen sowie das Risiko erheblicher Hautschäden und vorzeitiger Hautalterung. Derzeit verfügbare Behandlungen werden nur im Zusammenhang mit früheren Behandlungsfehlern mit anderen Modalitäten zugelassen, und es ist keine zugelassene Front-Line-Therapie verfügbar. In dieser Landschaft ist die Behandlung von CTCL stark vom Sicherheitsrisiko jedes Produkts motiviert. SGX301 ist möglicherweise die sicherste verfügbare wirksame Behandlung für CTCL. Ohne systemische Absorption, eine Verbindung, die nicht mutagen ist, und eine Lichtquelle, die nicht krebserregend ist, gibt es bisher keine Hinweise auf mögliche Sicherheitsprobleme.
Die klinische Phase-3-CTCL-Studie wurde teilweise vom National Cancer Institute über einen Phase-II-SBIR-Zuschuss (Nr. 1R44CA210848-01A1) finanziert, der an Soligenix, Inc. vergeben wurde.
Über Soligenix, Inc.
Soligenix ist ein biopharmazeutisches Unternehmen im Spätstadium, das sich auf die Entwicklung und Vermarktung von Produkten zur Behandlung seltener Krankheiten konzentriert, bei denen ein ungedeckter medizinischer Bedarf besteht. Unser Geschäftsbereich Specialized BioTherapeutics entwickelt SGX301 als neuartige photodynamische Therapie mit sicherem sichtbarem Licht zur Behandlung des kutanen T-Zell-Lymphoms, unserer erstklassigen IDR-Technologie (Innate Defense Regulator), Dusquetid (SGX942) zur oralen Behandlung Mukositis bei Kopf- und Halskrebs sowie firmeneigene Formulierungen von oralem Beclomethason 17,21-Dipropionat (BDP) zur Vorbeugung / Behandlung von Magen-Darm-Erkrankungen (GI), die durch schwere Entzündungen gekennzeichnet sind, einschließlich pädiatrischer Morbus Crohn (SGX203) und akuter Strahlenenteritis (SGX201) .
Unser Geschäftsbereich Public Health Solutions umfasst aktive Entwicklungsprogramme für RiVax ® , unseren Ricin-Toxin-Impfstoffkandidaten SGX943, unseren therapeutischen Kandidaten für antibiotikaresistente und neu auftretende Infektionskrankheiten, sowie unsere Forschungsprogramme zur Identifizierung und Entwicklung neuartiger Impfstoffkandidaten gegen Virusinfektionen, einschließlich Ebola, Marburg und SARS-CoV-2 (die Ursache von COVID-19). Die Entwicklung unserer Impfprogramme beinhaltet die Verwendung unserer proprietären Wärmestabilisierungsplattform-Technologie, bekannt als ThermoVax ®. Bisher wurde dieses Geschäftsfeld mit staatlichen Zuschüssen und Vertragsmitteln des Nationalen Instituts für Allergien und Infektionskrankheiten (NIAID), der Mittel zur Reduzierung von Verteidigungsbedrohungen (DTRA) und der Biomedical Advanced Research and Development Authority (BARDA) unterstützt.
Weitere Informationen zu Soligenix, Inc. finden Sie auf der Website des Unternehmens unter www.soligenix.com .
Diese Pressemitteilung enthält möglicherweise zukunftsgerichtete Aussagen, die die aktuellen Erwartungen von Soligenix, Inc. hinsichtlich der zukünftigen Ergebnisse, Leistung, Aussichten und Chancen widerspiegeln, einschließlich, aber nicht beschränkt auf potenzielle Marktgrößen, Patientenpopulationen und die Teilnahme an klinischen Studien. Aussagen, die keine historischen Tatsachen sind, wie "antizipieren", "schätzen", "glauben", "hoffen", "beabsichtigen", "planen", "erwarten", "zielen", "können", "vorschlagen", " Wille, "" Potenzial "oder ähnliche Ausdrücke sind zukunftsgerichtete Aussagen. Diese Aussagen unterliegen einer Reihe von Risiken, Ungewissheiten und anderen Faktoren, die dazu führen können, dass tatsächliche Ereignisse oder Ergebnisse in zukünftigen Perioden wesentlich von den in oder implizierten Aussagen abweichen. diese Aussagen, wie sie beispielsweise beim COVID-19-Ausbruch aufgetreten sind. Soligenix kann Ihnen nicht versichern, dass es in der Lage sein wird, Produkte auf der Grundlage seiner Technologien erfolgreich zu entwickeln, behördliche Zulassungen zu erhalten oder zu vermarkten, insbesondere angesichts der erheblichen Unsicherheit, die mit der Entwicklung von Therapeutika und Impfstoffen gegen Bioterror-Bedrohungen, der Durchführung präklinischer und klinischer Studien mit Therapeutika und Arzneimitteln verbunden ist Impfstoffe, die behördliche Zulassungen erhalten und Therapeutika und Impfstoffe herstellen, dass die Produktentwicklungs- und Vermarktungsbemühungen aufgrund von Schwierigkeiten oder Verzögerungen bei klinischen Studien oder aufgrund mangelnder Fortschritte oder positiver Ergebnisse aus Forschungs- und Entwicklungsbemühungen nicht reduziert oder eingestellt werden weitere Mittel zur Unterstützung der Produktentwicklung und Vermarktung erfolgreich erhalten können, einschließlich Zuschüssen und Auszeichnungen, Beibehaltung der bestehenden Zuschüsse, die Leistungsanforderungen unterliegen, Abschluss von Biodefense-Beschaffungsverträgen mit der US-Regierung oder anderen Ländern, damit diese mit größeren und besser finanzierten Wettbewerbern in der Biotechnologiebranche konkurrieren können, die sich ändern In der Gesundheitspraxis wirken sich Erstattungsbeschränkungen Dritter und Initiativen zur Reform des Gesundheitswesens auf Bundes- und / oder Landesebene nicht negativ auf das Geschäft aus, oder der US-Kongress verabschiedet möglicherweise keine Gesetze, die zusätzliche Mittel für das Projekt BioShield-Programm bereitstellen würden. Darüber hinaus kann keine Zusicherung hinsichtlich des Zeitpunkts oder des Erfolgs der klinischen Phase-3-Studie mit SGX942 (Dusquetid) zur Behandlung der oralen Mukositis bei Patienten mit Kopf- und Halskrebs, die eine Radiochemotherapie erhalten, gegeben werden. oder eine unserer anderen klinischen / präklinischen Studien. Trotz des statistisch signifikanten Ergebnisses, das in der klinischen Phase-3-Studie SGX301 zur Behandlung des kutanen T-Zell-Lymphoms erzielt wurde, kann nicht garantiert werden, dass eine Genehmigung für das Inverkehrbringen durch die FDA oder die EMA erfolgreich sein wird. Darüber hinaus kann nicht garantiert werden, dass RiVax® qualifiziert sich für einen Biodefense Priority Review Voucher (PRV) oder dass der vorherige Verkauf von PRVs einen potenziellen Verkaufspreis für einen PRV für RiVax ® anzeigt . Es kann auch keine Zusicherung gegeben werden, dass das Unternehmen nicht verwässernde staatliche Mittel aus Zuschüssen und Verträgen erhält oder erhält, die vergeben wurden oder werden oder für die das Unternehmen in Zukunft einen Antrag stellen wird. Diese und andere Risikofaktoren werden von Zeit zu Zeit in den bei der Securities and Exchange Commission eingereichten Unterlagen beschrieben, einschließlich, aber nicht beschränkt auf die Berichte von Soligenix auf den Formularen 10-Q und 10-K. Sofern nicht gesetzlich vorgeschrieben, übernimmt Soligenix keine Verpflichtung, zukunftsgerichtete Aussagen aufgrund neuer Informationen oder zukünftiger Ereignisse zu aktualisieren oder zu überarbeiten.
Antwort auf Beitrag Nr.: 65.631.572 von silvesterstrike am 08.11.20 12:38:49Ich denke hier wird die nächste KE vorbereitet, aber ich bin zuversichtlich, dass Diese erst nach hoffentlich erfolgreichen Studiendaten kommen wird. Zur Erinnerung, bei Soligenix stehen in den nächsten knapp 2 Monaten massiv kurstreibende News an!
2 Phase 3 Daten zu:
SGX301 Cutaneous T-Cell Lymphoma (CTCL)
SGX942 Oral Mucositis in Head & Neck Cancer
Dazu sind noch die preclinical Daten zu ThermoVax® –Vaccine Heat Stabilization Technology für 2020 angekündigt, welches auch für Covid-19 getestet wird. Hier könnte ganz schnell ein Hype entstehen :-)
Das alles für eine MC von knapp 50 Mio. US Dollar, ich werde hier nochmal nachlegen ;-)
2 Phase 3 Daten zu:
SGX301 Cutaneous T-Cell Lymphoma (CTCL)
SGX942 Oral Mucositis in Head & Neck Cancer
Dazu sind noch die preclinical Daten zu ThermoVax® –Vaccine Heat Stabilization Technology für 2020 angekündigt, welches auch für Covid-19 getestet wird. Hier könnte ganz schnell ein Hype entstehen :-)
Das alles für eine MC von knapp 50 Mio. US Dollar, ich werde hier nochmal nachlegen ;-)
Soligenix, Inc. (Nasdaq: SNGX) (Soligenix oder das Unternehmen), ein biopharmazeutisches Unternehmen im Spätstadium, das sich auf die Entwicklung und Vermarktung von Produkten zur Behandlung seltener Krankheiten konzentriert, bei denen ein ungedeckter medizinischer Bedarf besteht, gab heute seine jüngsten Erfolge und finanziellen Ergebnisse für das Unternehmen bekannt Quartal endete am 30. September 2020.
"Mit unserem Geschäftsbereich Specialized BioTherapeutics blicken wir weiterhin in die Zukunft", sagte Christopher J. Schaber, PhD, President und Chief Executive Officer von Soligenix. "Mit dem kürzlich erfolgten erfolgreichen Abschluss unserer zentralen Phase-3-FLASH-Studie (Fluorescent Light Activated Synthetic Hypericin) hat SGX301 das Potenzial einer signifikanten neuen Behandlung für kutanes T-Zell-Lymphom (CTCL) im Frühstadium im Doppelblind nachgewiesen , Placebo-kontrollierter Zyklus 1 Teil der Studie, ein statistisch signifikantes Ansprechen auf die Behandlung (p = 0,04) wurde am primären Endpunkt nach nur 6 Wochen Therapie erreicht. Dieses positive Ansprechen auf die Behandlung verbesserte sich mit der verlängerten SGX301-Behandlung im offenen Bereich weiter signifikant Behandlungszyklen nach 12 Wochen (Zyklus 2) und 18 Wochen (Zyklus 3), wodurch das in Zyklus 1 gezeigte positive Ansprechen auf die primäre SGX301-Endpunktbehandlung verstärkt wird. Nach Abschluss der Studie werden wir mit der Vorbereitung unseres neuen Arzneimittelantrags für die Einreichung bei der FDA beginnen. Wir setzen auch unsere zentrale Phase-3-Studie DOM-INNATE (Dusquetid-Behandlung bei oraler Mukositis - durch Modulation der INNATE-Immunität) für SGX942 (Dusquetid) für den Trea fort Behandlung der oralen Mukositis bei Patienten mit Kopf- und Halskrebs, die eine Radiochemotherapie erhalten. Nach Abschluss der Einschreibung von 268 Probanden werden noch vor Jahresende Top-Line-Endergebnisse erwartet. "
Dr. Schaber fuhr fort: "In unserem Geschäftsbereich Public Health Solutions, der von nicht verwässernden staatlichen Mitteln unterstützt wird, treiben wir unsere Arbeit mit der Universität von Hawaii in Mānoa (UHM) und Hawaii Biotech Inc. im Bereich Filovirus-Impfstoffe (Schutz vor Viren) weiter voran wie Ebola und Marburg) und die Entwicklung von Impfstoffen zur potenziellen Bekämpfung von Coronaviren, einschließlich SARS-CoV-2, der Ursache von COVID-19. Wir haben kürzlich die Veröffentlichung positiver präklinischer Daten aus Immunogenitätsstudien mit CiVax ™ (hitzestabilem COVID) angekündigt -19 Impfstoffkandidat), der die Immunität sowohl von Breitbandantikörpern als auch von zellvermittelter, schnell einsetzender Immunität nachweist, ist mit dem neuartigen CoVaccine HT ™ -Adjuvans möglich, das von BTG Specialty Pharmaceuticals (einem Geschäftsbereich der Boston Scientific Corporation) lizenziert wurde Der Ricin-Impfstoff RiVax® wird weiterhin mit einer Auftragsvergabe des National Institute of Allergy and Infectious Disease unterstützt. Mit über 11 Mio. USD in bar, ohne unsere nicht verwässernden Mittel Zusammen mit der Vereinbarung über die Emission von Verkäufen am Markt mit B. Riley FBR, Inc., um unsere Cash Runway bei Bedarf sinnvoll zu ergänzen, erwarten wir, dass wir über ausreichend Kapital verfügen, um mehrere Wendepunkte in unserer Pipeline für seltene Krankheiten zu erreichen, einschließlich der endgültigen Spitze -Linienergebnisse in unserer klinischen SGX942-Phase-3-Studie bei oraler Mukositis. "
Soligenix Neueste Erfolge
Am 22. Oktober 2020 kündigte das Unternehmen an, dass die fortgesetzte optionale Behandlung mit SGX301 (synthetisches Hypericin) über alle Läsionen hinweg während der mitfühlenden Anwendung fortgesetzt wurde. Der Sicherheitsanteil der Studie (Zyklus 3) für insgesamt 6 Monate in der Studie wurde weiterhin signifikant fortgesetzt Verbesserung der Reaktionen und blieb in seiner FLASH-Studie sicher und gut verträglich. Diese Daten verstärken das positive Ansprechen auf die primäre SGX301-Endpunktbehandlung, das in Zyklus 1 gezeigt wurde. Die SGX30l-Behandlung in Zyklus 3 verbesserte die Ansprechraten weiter, wobei 49% der Patienten, die sich für insgesamt 18 Wochen für SGX301 entschieden, eine 50% ige oder höhere Reduktion ihrer kombinierten Behandlung zeigten CAILS (Composite Assessment of Index Läsion Score) Läsionsscore im Vergleich zu 40% der Patienten, die nach 12-wöchiger SGX301-Behandlung in Zyklus 2 eine solche Reduktion zeigten (p = 0,046). Darüber hinaus hat eine fortgesetzte Analyse der Ergebnisse gezeigt, dass eine 12-wöchige SGX301-Behandlung (Zyklus 2) im Vergleich zu Patch- (Antwort 37%, p = 0,0009) und Plaque-Läsionen (Antwort 42%, p <0,0001) von CTCL gleichermaßen wirksam ist zu Zyklus 1 Placebo-Läsionsantworten. SGX301 wurde weiterhin sehr gut vertragen und profitierte von der mangelnden Hypericin-Zirkulation im Blutstrom nach gezielter topischer Anwendung auf die Läsionen sowie der Verwendung von sichtbarem Licht. Um diese Pressemitteilung anzuzeigen, klicken Sie bitte hier.
Am 15. September 2020 gab das Unternehmen die Veröffentlichung nichtklinischer Ergebnisse bekannt, die Filovirus-Proteinantigene (einschließlich Ebola- und Marburg-Viren) und deren Thermostabilisierung charakterisieren. Der Artikel, der von Mitarbeitern der University of Colorado, der University of Hawaii in Mānoa (UHM) und Soligenix verfasst wurde, trägt den Titel "Erhaltung der quaternären Struktur in thermostabilen, lyophilisierten Filovirus-Glykoprotein-Impfstoffen: Eine Suche nach stabilitätsanzeigenden Assays" zur Veröffentlichung im Journal of Pharmaceutical Sciences angenommen. Eine Kopie des Manuskripts wurde hier zur Verfügung gestellt. Um diese Pressemitteilung anzuzeigen, klicken Sie bitte hier.
Am 10. September 2020 führte das Unternehmen eine Investor-Webcast-Präsentation zur Verwendung seiner thermostabilisierten Glykoprotein-Impfstoffplattform für die Entwicklung eines COVID-19-Impfstoffs namens CiVax ™ durch. Um dieses Webcast-Ereignis anzuhören, klicken Sie bitte hier und um die Pressemitteilung anzuzeigen, klicken Sie bitte hier.
Finanzergebnisse - Quartalsende 30. September 2020
Der Umsatz von Soligenix für das am 30. September 2020 endende Quartal belief sich auf 0,6 Mio. USD gegenüber 1,3 Mio. USD für das am 30. September 2019 endende Quartal. Die Einnahmen beinhalteten Zahlungen für einen Vertrag zur Unterstützung von RiVax®, unserem Kandidaten für Ricin-Toxin-Impfstoffe, Zuschüsse zur Unterstützung des Entwicklung von SGX943 zur Behandlung neu auftretender und / oder antibiotikaresistenter Infektionskrankheiten, ThermoVax®, unserer Thermostabilisierungstechnologie, und Bewertung der Sicherheit von SGX942 bei Jungtieren.
Der grundlegende Nettoverlust von Soligenix betrug für das am 30. September 2020 endende Quartal 1,8 Mio. USD oder (0,06 USD) pro Aktie, verglichen mit 2,7 Mio. USD oder (0,14 USD) pro Aktie für das am 30. September 2019 endende Quartal Der Verlust war hauptsächlich auf geringere Forschungs- und Entwicklungsausgaben aufgrund des Abschlusses der CTCL-Studie zurückzuführen.
Die Forschungs- und Entwicklungskosten beliefen sich auf 1,3 Mio. USD gegenüber 2,3 Mio. USD in den Quartalen zum 30. September 2020 bzw. 2019. Der Rückgang der Forschungs- und Entwicklungsausgaben für das am 30. September 2020 endende Quartal war hauptsächlich auf die Reduzierung der Kosten aufgrund des Abschlusses der CTCL-Studie zurückzuführen.
Die allgemeinen Verwaltungskosten beliefen sich in den drei Monaten zum 30. September 2020 und 2019 auf 0,8 Mio. USD.
Zum 30. September 2020 belief sich die Liquiditätsposition des Unternehmens auf ca. 11,3 Mio. USD.
Über Soligenix, Inc.
Soligenix ist ein biopharmazeutisches Unternehmen im Spätstadium, das sich auf die Entwicklung und Vermarktung von Produkten zur Behandlung seltener Krankheiten konzentriert, bei denen ein ungedeckter medizinischer Bedarf besteht. Unser Geschäftsbereich Specialized BioTherapeutics entwickelt SGX301 als neuartige photodynamische Therapie unter Verwendung von sicherem sichtbarem Licht zur Behandlung des kutanen T-Zell-Lymphoms, unserer erstklassigen IDR-Technologie (Innate Defense Regulator), Dusquetid (SGX942) zur oralen Behandlung Mukositis bei Kopf- und Halskrebs sowie firmeneigene Formulierungen von oralem Beclomethason 17,21-Dipropionat (BDP) zur Vorbeugung / Behandlung von Magen-Darm-Erkrankungen (GI), die durch schwere Entzündungen gekennzeichnet sind, einschließlich pädiatrischer Morbus Crohn (SGX203) und akuter Strahlenenteritis (SGX201) .
Unser Geschäftsbereich Public Health Solutions umfasst aktive Entwicklungsprogramme für RiVax®, unseren Ricin-Toxin-Impfstoffkandidaten SGX943, unseren therapeutischen Kandidaten für antibiotikaresistente und neu auftretende Infektionskrankheiten, sowie unsere Forschungsprogramme zur Identifizierung und Entwicklung neuartiger Impfstoffkandidaten gegen Virusinfektionen, einschließlich Ebola, Marburg und SARS-CoV-2 (die Ursache von COVID-19). Die Entwicklung unserer Impfprogramme beinhaltet die Verwendung unserer proprietären Wärmestabilisierungsplattform-Technologie, bekannt als ThermoVax®. Bisher wurde dieses Geschäftsfeld mit staatlichen Zuschüssen und Vertragsmitteln des Nationalen Instituts für Allergien und Infektionskrankheiten (NIAID), der Mittel zur Reduzierung von Verteidigungsbedrohungen (DTRA) und der Biomedical Advanced Research and Development Authority (BARDA) unterstützt.
Weitere Informationen zu Soligenix, Inc. finden Sie auf der Website des Unternehmens unter www.soligenix.com.
"Mit unserem Geschäftsbereich Specialized BioTherapeutics blicken wir weiterhin in die Zukunft", sagte Christopher J. Schaber, PhD, President und Chief Executive Officer von Soligenix. "Mit dem kürzlich erfolgten erfolgreichen Abschluss unserer zentralen Phase-3-FLASH-Studie (Fluorescent Light Activated Synthetic Hypericin) hat SGX301 das Potenzial einer signifikanten neuen Behandlung für kutanes T-Zell-Lymphom (CTCL) im Frühstadium im Doppelblind nachgewiesen , Placebo-kontrollierter Zyklus 1 Teil der Studie, ein statistisch signifikantes Ansprechen auf die Behandlung (p = 0,04) wurde am primären Endpunkt nach nur 6 Wochen Therapie erreicht. Dieses positive Ansprechen auf die Behandlung verbesserte sich mit der verlängerten SGX301-Behandlung im offenen Bereich weiter signifikant Behandlungszyklen nach 12 Wochen (Zyklus 2) und 18 Wochen (Zyklus 3), wodurch das in Zyklus 1 gezeigte positive Ansprechen auf die primäre SGX301-Endpunktbehandlung verstärkt wird. Nach Abschluss der Studie werden wir mit der Vorbereitung unseres neuen Arzneimittelantrags für die Einreichung bei der FDA beginnen. Wir setzen auch unsere zentrale Phase-3-Studie DOM-INNATE (Dusquetid-Behandlung bei oraler Mukositis - durch Modulation der INNATE-Immunität) für SGX942 (Dusquetid) für den Trea fort Behandlung der oralen Mukositis bei Patienten mit Kopf- und Halskrebs, die eine Radiochemotherapie erhalten. Nach Abschluss der Einschreibung von 268 Probanden werden noch vor Jahresende Top-Line-Endergebnisse erwartet. "
Dr. Schaber fuhr fort: "In unserem Geschäftsbereich Public Health Solutions, der von nicht verwässernden staatlichen Mitteln unterstützt wird, treiben wir unsere Arbeit mit der Universität von Hawaii in Mānoa (UHM) und Hawaii Biotech Inc. im Bereich Filovirus-Impfstoffe (Schutz vor Viren) weiter voran wie Ebola und Marburg) und die Entwicklung von Impfstoffen zur potenziellen Bekämpfung von Coronaviren, einschließlich SARS-CoV-2, der Ursache von COVID-19. Wir haben kürzlich die Veröffentlichung positiver präklinischer Daten aus Immunogenitätsstudien mit CiVax ™ (hitzestabilem COVID) angekündigt -19 Impfstoffkandidat), der die Immunität sowohl von Breitbandantikörpern als auch von zellvermittelter, schnell einsetzender Immunität nachweist, ist mit dem neuartigen CoVaccine HT ™ -Adjuvans möglich, das von BTG Specialty Pharmaceuticals (einem Geschäftsbereich der Boston Scientific Corporation) lizenziert wurde Der Ricin-Impfstoff RiVax® wird weiterhin mit einer Auftragsvergabe des National Institute of Allergy and Infectious Disease unterstützt. Mit über 11 Mio. USD in bar, ohne unsere nicht verwässernden Mittel Zusammen mit der Vereinbarung über die Emission von Verkäufen am Markt mit B. Riley FBR, Inc., um unsere Cash Runway bei Bedarf sinnvoll zu ergänzen, erwarten wir, dass wir über ausreichend Kapital verfügen, um mehrere Wendepunkte in unserer Pipeline für seltene Krankheiten zu erreichen, einschließlich der endgültigen Spitze -Linienergebnisse in unserer klinischen SGX942-Phase-3-Studie bei oraler Mukositis. "
Soligenix Neueste Erfolge
Am 22. Oktober 2020 kündigte das Unternehmen an, dass die fortgesetzte optionale Behandlung mit SGX301 (synthetisches Hypericin) über alle Läsionen hinweg während der mitfühlenden Anwendung fortgesetzt wurde. Der Sicherheitsanteil der Studie (Zyklus 3) für insgesamt 6 Monate in der Studie wurde weiterhin signifikant fortgesetzt Verbesserung der Reaktionen und blieb in seiner FLASH-Studie sicher und gut verträglich. Diese Daten verstärken das positive Ansprechen auf die primäre SGX301-Endpunktbehandlung, das in Zyklus 1 gezeigt wurde. Die SGX30l-Behandlung in Zyklus 3 verbesserte die Ansprechraten weiter, wobei 49% der Patienten, die sich für insgesamt 18 Wochen für SGX301 entschieden, eine 50% ige oder höhere Reduktion ihrer kombinierten Behandlung zeigten CAILS (Composite Assessment of Index Läsion Score) Läsionsscore im Vergleich zu 40% der Patienten, die nach 12-wöchiger SGX301-Behandlung in Zyklus 2 eine solche Reduktion zeigten (p = 0,046). Darüber hinaus hat eine fortgesetzte Analyse der Ergebnisse gezeigt, dass eine 12-wöchige SGX301-Behandlung (Zyklus 2) im Vergleich zu Patch- (Antwort 37%, p = 0,0009) und Plaque-Läsionen (Antwort 42%, p <0,0001) von CTCL gleichermaßen wirksam ist zu Zyklus 1 Placebo-Läsionsantworten. SGX301 wurde weiterhin sehr gut vertragen und profitierte von der mangelnden Hypericin-Zirkulation im Blutstrom nach gezielter topischer Anwendung auf die Läsionen sowie der Verwendung von sichtbarem Licht. Um diese Pressemitteilung anzuzeigen, klicken Sie bitte hier.
Am 15. September 2020 gab das Unternehmen die Veröffentlichung nichtklinischer Ergebnisse bekannt, die Filovirus-Proteinantigene (einschließlich Ebola- und Marburg-Viren) und deren Thermostabilisierung charakterisieren. Der Artikel, der von Mitarbeitern der University of Colorado, der University of Hawaii in Mānoa (UHM) und Soligenix verfasst wurde, trägt den Titel "Erhaltung der quaternären Struktur in thermostabilen, lyophilisierten Filovirus-Glykoprotein-Impfstoffen: Eine Suche nach stabilitätsanzeigenden Assays" zur Veröffentlichung im Journal of Pharmaceutical Sciences angenommen. Eine Kopie des Manuskripts wurde hier zur Verfügung gestellt. Um diese Pressemitteilung anzuzeigen, klicken Sie bitte hier.
Am 10. September 2020 führte das Unternehmen eine Investor-Webcast-Präsentation zur Verwendung seiner thermostabilisierten Glykoprotein-Impfstoffplattform für die Entwicklung eines COVID-19-Impfstoffs namens CiVax ™ durch. Um dieses Webcast-Ereignis anzuhören, klicken Sie bitte hier und um die Pressemitteilung anzuzeigen, klicken Sie bitte hier.
Finanzergebnisse - Quartalsende 30. September 2020
Der Umsatz von Soligenix für das am 30. September 2020 endende Quartal belief sich auf 0,6 Mio. USD gegenüber 1,3 Mio. USD für das am 30. September 2019 endende Quartal. Die Einnahmen beinhalteten Zahlungen für einen Vertrag zur Unterstützung von RiVax®, unserem Kandidaten für Ricin-Toxin-Impfstoffe, Zuschüsse zur Unterstützung des Entwicklung von SGX943 zur Behandlung neu auftretender und / oder antibiotikaresistenter Infektionskrankheiten, ThermoVax®, unserer Thermostabilisierungstechnologie, und Bewertung der Sicherheit von SGX942 bei Jungtieren.
Der grundlegende Nettoverlust von Soligenix betrug für das am 30. September 2020 endende Quartal 1,8 Mio. USD oder (0,06 USD) pro Aktie, verglichen mit 2,7 Mio. USD oder (0,14 USD) pro Aktie für das am 30. September 2019 endende Quartal Der Verlust war hauptsächlich auf geringere Forschungs- und Entwicklungsausgaben aufgrund des Abschlusses der CTCL-Studie zurückzuführen.
Die Forschungs- und Entwicklungskosten beliefen sich auf 1,3 Mio. USD gegenüber 2,3 Mio. USD in den Quartalen zum 30. September 2020 bzw. 2019. Der Rückgang der Forschungs- und Entwicklungsausgaben für das am 30. September 2020 endende Quartal war hauptsächlich auf die Reduzierung der Kosten aufgrund des Abschlusses der CTCL-Studie zurückzuführen.
Die allgemeinen Verwaltungskosten beliefen sich in den drei Monaten zum 30. September 2020 und 2019 auf 0,8 Mio. USD.
Zum 30. September 2020 belief sich die Liquiditätsposition des Unternehmens auf ca. 11,3 Mio. USD.
Über Soligenix, Inc.
Soligenix ist ein biopharmazeutisches Unternehmen im Spätstadium, das sich auf die Entwicklung und Vermarktung von Produkten zur Behandlung seltener Krankheiten konzentriert, bei denen ein ungedeckter medizinischer Bedarf besteht. Unser Geschäftsbereich Specialized BioTherapeutics entwickelt SGX301 als neuartige photodynamische Therapie unter Verwendung von sicherem sichtbarem Licht zur Behandlung des kutanen T-Zell-Lymphoms, unserer erstklassigen IDR-Technologie (Innate Defense Regulator), Dusquetid (SGX942) zur oralen Behandlung Mukositis bei Kopf- und Halskrebs sowie firmeneigene Formulierungen von oralem Beclomethason 17,21-Dipropionat (BDP) zur Vorbeugung / Behandlung von Magen-Darm-Erkrankungen (GI), die durch schwere Entzündungen gekennzeichnet sind, einschließlich pädiatrischer Morbus Crohn (SGX203) und akuter Strahlenenteritis (SGX201) .
Unser Geschäftsbereich Public Health Solutions umfasst aktive Entwicklungsprogramme für RiVax®, unseren Ricin-Toxin-Impfstoffkandidaten SGX943, unseren therapeutischen Kandidaten für antibiotikaresistente und neu auftretende Infektionskrankheiten, sowie unsere Forschungsprogramme zur Identifizierung und Entwicklung neuartiger Impfstoffkandidaten gegen Virusinfektionen, einschließlich Ebola, Marburg und SARS-CoV-2 (die Ursache von COVID-19). Die Entwicklung unserer Impfprogramme beinhaltet die Verwendung unserer proprietären Wärmestabilisierungsplattform-Technologie, bekannt als ThermoVax®. Bisher wurde dieses Geschäftsfeld mit staatlichen Zuschüssen und Vertragsmitteln des Nationalen Instituts für Allergien und Infektionskrankheiten (NIAID), der Mittel zur Reduzierung von Verteidigungsbedrohungen (DTRA) und der Biomedical Advanced Research and Development Authority (BARDA) unterstützt.
Weitere Informationen zu Soligenix, Inc. finden Sie auf der Website des Unternehmens unter www.soligenix.com.
Hier könnte sich demnächst etwas anbahnen, der Kurs sollte auf jeden Fall erstmal die 2 Dollar anlaufen, wenn dann noch gute Daten folgen kann es ganz schnell gehen. Soligenix ist extrem unterbewertet mit 3 Phase 3 Produkten in der Pipeline bei gerade einmal 56 Mio Dollar Market Cap!
Sie rennt und rennt, selten war ich glücklicher über einen Nachkauf ;-) Es scheint als würde hier wie prognostiziert ein Hype einsetzen und alle wollen plötzlich mitmachen, mir ist es recht :-)
Bei aller Freude das es gut läuft sieht der Chart aber schon sehr stark überkauft aus. Bin mal gespannt wann der Rücksetzer kommt und ob es nochmals unter 2$ geht. Vielleicht kommen ja auch super news, die eine völlige Neubewertung nach sich ziehen. Auf jeden Fall bleibt es weiterhin hoch interessant.
Antwort auf Beitrag Nr.: 65.770.641 von Raudy am 19.11.20 16:16:26Bitte nicht im 5 min Chart schauen......hier ist nichts überkauft. Bei solchen Zocks schaut man auf Fundamentale Daten.....ich mache das jedenfalls so.
DAs Volumen bei dem Kurs ist so gesehen auch noch recht lächerlich.... Ferner sind derzeit gerade mal 65 Millionen Marktbewertung bei sogar nur 29 Millionen im Freefloat auch immens wenig.
Direkt auf der Homepage sieht man auch, wo welches Produkt steht. CiVax ist da nicht mal mitgelistet, wird aber dran gearbeitet.
Wenn die ganzen P3er durchgehen und CiVax das hält, was es möglicherweise verspricht, dann wäre locker eine 5-10 fache Bewertung gerechtfertigt.
Überkauft ist da bei dem Volumen auch absolut nichts.
Direkt auf der Homepage sieht man auch, wo welches Produkt steht. CiVax ist da nicht mal mitgelistet, wird aber dran gearbeitet.
Wenn die ganzen P3er durchgehen und CiVax das hält, was es möglicherweise verspricht, dann wäre locker eine 5-10 fache Bewertung gerechtfertigt.
Überkauft ist da bei dem Volumen auch absolut nichts.
Auch ohne signifikante News sehe ich hier ein Pumppotential von locker 3-4$, bevor die Korrektur startet...
Mit News sicherlich um einiges höher mit Potential zu einem 10-bagger.
Mit News sicherlich um einiges höher mit Potential zu einem 10-bagger.
... und sollte das mit CiVax was werden, dann steigen hier auch die größeren Investoren ein und dann kann's ganz schnell gehen 

Kann mir jemand sagen wann die FDA Termine anstehen... Gibt es da ein genaues Datum... Danke im voraus für eure Antworten
Es gibt aktuell keine anstehenden FDA Termine.
Der NDA ( Zulassungs Antrag) für SGX301 wird vorbereitet wird aber erst im nächsten Jahr stattfinden, wahrscheinlich im 2 Quartal.
Vielleicht finden Sie dieses Jahr noch einen Partner für Produktion und Vertrieb, ist meiner Meinung nach aber zeitlich bis Ende des Jahres unwahrscheinlich.
Ansonsten stehen wahrscheinlich bis Ende des Jahres Phase 3 Ergebnisse in Oraler Mucositis an.
Ansonsten hoffe ich persönlich noch auf ein funding für Civax von staatlicher Seite.
http://ir.soligenix.com/image/Soligenix+Corporate+Presentati…
Vielleicht gibt es es noch
Der NDA ( Zulassungs Antrag) für SGX301 wird vorbereitet wird aber erst im nächsten Jahr stattfinden, wahrscheinlich im 2 Quartal.
Vielleicht finden Sie dieses Jahr noch einen Partner für Produktion und Vertrieb, ist meiner Meinung nach aber zeitlich bis Ende des Jahres unwahrscheinlich.
Ansonsten stehen wahrscheinlich bis Ende des Jahres Phase 3 Ergebnisse in Oraler Mucositis an.
Ansonsten hoffe ich persönlich noch auf ein funding für Civax von staatlicher Seite.
http://ir.soligenix.com/image/Soligenix+Corporate+Presentati…
Vielleicht gibt es es noch
Jetzt wieder mit dabei...allen Investitierten eine glückliche Hand!
Typischer Freitag, Gewinnmitnahmen!
Da lag ich ja gestern mit meiner Vermutung gar nicht so schlecht, dass ein Pullback kommen würde. Bin dann auch bei 2,41$ ausgestiegen. Schaue mir das vorerst von der Seitenlinie an.
Das es heute wieder massiv down geht, ist nicht zu verstehen .
Bin wieder mit einer Position zu 2,08 $ eingestiegen. Denke mal die 2 sollte halten.
Ich glaube wir sehen noch die 1,85 $
Antwort auf Beitrag Nr.: 65.837.763 von silvesterstrike am 25.11.20 13:18:22https://last10k.com/sec-filings/sngx/0001213900-20-039219.ht…
Stammaktien werden von 50 auf 70Mio erhöht.
Stammaktien werden von 50 auf 70Mio erhöht.
Antwort auf Beitrag Nr.: 65.842.272 von arnold11 am 25.11.20 18:06:15So wie ich das lese, hat man sich die Genehmigung eingeholt auf 75 Mio zu erhöhen, wenn nötig....bis jetzt habe ich nichts von einer tatsächlichen Erhöhung gelesen...
Antwort auf Beitrag Nr.: 65.844.849 von coronus am 25.11.20 20:48:37Dies gibt ihnen die Möglichkeit in Zukunft weitere Kapitalerhöhungen druchzuführen, eben die issued shared bis auf 75 Mio auszuweiten. Momentan bleibt es bei "there were 29,847,288 shares of the Company’s Common Stock issued and outstanding", aber eine Kapitalerhöhung im neuen Jahr erachte ich für sehr wahrscheinlich.
Zieht vorbörslich wieder an, momentan rund 5% im plus:
https://www.nasdaq.com/market-activity/stocks/sngx/pre-marke…
Da könnte die nächsten Tage was kommen, eigentlich muss es ja, denn das Jahr ist bald um...
https://www.nasdaq.com/market-activity/stocks/sngx/pre-marke…
Da könnte die nächsten Tage was kommen, eigentlich muss es ja, denn das Jahr ist bald um...
Scheint aufgrund dieses ratings anzuspringen. https://quantdata.us/news/18649991
Wobei mir 4$ sehr konservativ erscheinen für das was alles in der pipeline ist. Zacks rating beträgt 15$. Analysten halt. Vorbörsliches Volumen auch sehr gering. Sehen wir mal wie es läuft.
Wobei mir 4$ sehr konservativ erscheinen für das was alles in der pipeline ist. Zacks rating beträgt 15$. Analysten halt. Vorbörsliches Volumen auch sehr gering. Sehen wir mal wie es läuft.
Antwort auf Beitrag Nr.: 65.949.081 von Niller84 am 04.12.20 14:35:57Absolutly 👍
Antwort auf Beitrag Nr.: 65.949.372 von Raudy am 04.12.20 14:55:48Es kommt jetzt halt auf die Ergebnisse an ....und das Volumen an sich war schonmal prima ....auch ...das dieses Mal der Kurs stabil blieb.....💪
Antwort auf Beitrag Nr.: 65.966.942 von silvesterstrike am 07.12.20 07:44:10Hallo,
wie ist deine Einschätzung zur der Aktie? Geht es jetzt erstmal nach oben weil ja einiges ansteht oder nochmal runter? Lohnt es sich jetzt einzusteigen? Danke LG
wie ist deine Einschätzung zur der Aktie? Geht es jetzt erstmal nach oben weil ja einiges ansteht oder nochmal runter? Lohnt es sich jetzt einzusteigen? Danke LG
Antwort auf Beitrag Nr.: 65.969.543 von Normalo46 am 07.12.20 11:44:35Das kommt doch wie schon gesagt auf die Ergebnisse an, die sehr bald kommen sollten! Sind sie gut geht es rauf, sind sie schlecht, geht es runter, so einfach ist das ;-) Das hier ist ein Zock wo dir keiner eine seriöse Vorhersehung machen kann. Es geht einzig und allein um Wahrscheinlichkeiten und die sehe ich positiv, deshalb bin ich drin.
Antwort auf Beitrag Nr.: 65.969.543 von Normalo46 am 07.12.20 11:44:35Da schließe ich mich meinem Vorredner Niller84 gerne an ....mit dem Zusatz....dass die vorhergehenden Ergebnisse ....nur gutes erwarten lassen .....warten wir es ab .....maybe a Great Christmas......für uns alle ......
Danke für eure Antwort 👍
Da Ergebnisse anstehen, sollte sie nicht nach oben gehen. Volumen auch Bescheiden
PRINCETON, NJ, 8. Dezember 2020 / PRNewswire / - Soligenix, Inc. (Nasdaq: SNGX) (Soligenix oder das Unternehmen), ein biopharmazeutisches Unternehmen im Spätstadium, das sich auf die Entwicklung und Vermarktung von Produkten zur Behandlung seltener Krankheiten konzentriert, bei denen es eine gibt Unbefriedigter medizinischer Bedarf, gab heute bekannt, dass es mit seinem hitzebeständigen Ricin-Toxin-Impfstoff RiVax® einen erweiterten Schutz bewiesen hat. Mäuse, die an den Tagen 1 und 21 zweimal geimpft wurden, wurden mindestens 365 Tage lang gegen nachfolgende Ricin-Exposition geschützt. Diese Ergebnisse zeigen, dass die thermostabilisierte Impfstoffformulierung in der Lage ist, bei Mäusen einen dauerhaften Schutz hervorzurufen. Zusammen mit früheren Nachweisen der Wirksamkeit bei Mäusen und nichtmenschlichen Primaten (NHPs) sowie der langfristigen Thermostabilität (mindestens 1 Jahr bei 40 ° C oder 104 ° F) verstärken diese Ergebnisse die Praktikabilität der Bevorratung und potenziellen Verwendung von RiVax ® Impfstoff bei Kriegskämpfern und zivilen Ersthelfern ohne die Komplexität von Impfstoffen, die eine Kühlkettenbehandlung erfordern. Dieser Ansatz der Thermostabilisierung wird auch bei der Entwicklung des CiVax ™ -Impfstoffs von Soligenix für COVID-19 weiterentwickelt.
RiVax® ist der Impfstoffkandidat des Unternehmens zur Verhinderung des Todes nach Exposition gegenüber einer tödlichen Dosis Ricin-Toxin unter Verwendung eines einzigartigen Antigens, das vollständig frei von der toxischen Aktivität von Ricin ist. RiVax® wurde von Soligenix für eine verbesserte Thermostabilität formuliert und hat bei Mäusen und NHPs einen bis zu 100% igen Schutz gezeigt, der anschließend entweder systemisch oder durch Aerosol tödlichen Dosen von Ricin-Toxin ausgesetzt wurde. In jüngster Zeit wurde gezeigt, dass Mäuse mindestens 12 Monate nach der Impfung mit der 10-fachen tödlichen Dosis vor einer Ricin-Exposition geschützt sind.
"Diese Ergebnisse verstärken weiterhin die Bequemlichkeit und Praktikabilität des RiVax®-Impfstoffs", erklärte Dr. Oreola Donini, wissenschaftlicher Leiter von Soligenix. "Diese und andere laufende Arbeiten haben die Wirksamkeit von RiVax® weiterhin bestätigt und werden seine potenzielle Zulassung erleichtern."
Die Zulassung für RiVax® wird gemäß der "Animal Rule" der US-amerikanischen Food and Drug Administration (FDA) angestrebt, die auf Produkte angewendet wird, bei denen Tests in klinischen Wirksamkeitsstudien unethisch wären. Im Fall eines Ricin-Toxin-Impfstoffs ist eine klinische Wirksamkeitsprüfung des Impfstoffs unethisch, da der Mensch absichtlich Ricin-Toxin ausgesetzt werden müsste. Die Tierregel ist im Allgemeinen mit der Genehmigung medizinischer Gegenmaßnahmen zur biologischen Verteidigung verbunden. Die Tierregel verlangt die Bewertung der Wirksamkeit bei Tieren (RiVax® hat einen bis zu 100% igen Schutz bei NHPs gezeigt, die tödlichem aerosolisiertem Ricin ausgesetzt sind) und der Sicherheit beim Menschen (das RiVax®-Antigen hat sich in der klinischen Phase 1 des Menschen als gut verträglich erwiesen Studien) und Immunogenität korrelierten zwischen Tiermodellen und Menschen (Biomarker wurden identifiziert, siehe Veröffentlichung hier).
RiVax®-Studien werden durch eine Auftragsvergabe (# HHSN272201400039C) in Höhe von ca. 21,2 Mio. USD vom Nationalen Institut für Allergie und Infektionskrankheiten (NIAID) unterstützt. Die nicht verwässernde Finanzierung für die Entwicklung von RiVax® hat bisher 40 Millionen US-Dollar überschritten.
RiVax® hat von der FDA die Orphan Drug- und Fast Track-Kennzeichnung erhalten und kann sich nach Genehmigung für einen Biodefense Priority Review Voucher (PRV) qualifizieren. Darüber hinaus hat RiVax® von der Europäischen Arzneimittel-Agentur (EMA) die Orphan Drug-Kennzeichnung erhalten.
Über Ricin Toxin
Ricin-Toxin ist ein tödliches pflanzliches Toxin und wird aufgrund seiner Stabilität und hohen Wirksamkeit sowie der Tatsache, dass es leicht aus Nebenprodukten der Rizinusölproduktion gewonnen werden kann, sowohl als Bioterrorismus-Mittel als auch als chemisches Kampfmittel angesehen. Ricin kommt in vielen Formen vor, einschließlich Pulver, Nebel oder Pellet. Ricin kann auch in Wasser und anderen Flüssigkeiten gelöst werden. Die US-amerikanischen Zentren für die Kontrolle und Prävention von Krankheiten schätzen, dass die tödliche Dosis beim Menschen etwa die Größe eines Salzkorns hat. Die Ricin-Toxin-Krankheit verursacht eine Gewebenekrose und ein allgemeines Organversagen, die innerhalb einiger Tage nach der Exposition zum Tod führen. Ricin ist beim Einatmen besonders giftig. Ricin wirkt, indem es in die Zellen des Körpers eindringt und verhindert, dass die Zellen die Proteine herstellen, die sie benötigen. Ohne die Proteine sterben Zellen ab, was schließlich für den gesamten Körper schädlich ist.
Derzeit gibt es keine wirksamen Behandlungen für eine Ricinvergiftung. Die erfolgreiche Entwicklung eines wirksamen Impfstoffs gegen Ricintoxin kann die tatsächliche Verwendung von Ricin als biologische Waffe abschrecken und zur Impfung von Militärpersonal und zivilen Einsatzkräften mit hohem Risiko einer möglichen Exposition im Falle eines biologischen Angriffs eingesetzt werden .
Über RiVax®
RiVax® ist Soligenix 'firmeneigener hitzebeständiger Impfstoff gegen rekombinante Untereinheiten, der zum Schutz vor der Exposition gegenüber Ricin-Toxin entwickelt wurde. Die Bedrohung wurde in den Nachrichten durch einen an Präsident Trump gerichteten Umschlag hervorgehoben, der dieses potente und potenziell tödliche Toxin enthalten soll. Mit RiVax® ist Soligenix weltweit führend auf dem Gebiet der Forschung zu Ricintoxin-Impfstoffen.
RiVax® enthält eine genetisch veränderte Version einer Ricin Toxin A (RTA) -Kette, die zwei Mutationen enthält, die die Toxizität des Ricinmoleküls inaktivieren, das ursprünglich an der University of Texas Southwestern erfunden wurde. Bisherige klinische Phase-1-Studien haben die Sicherheit des Antigens und des Adjuvans sowie die Bildung von Ricin-neutralisierenden Antikörpern gezeigt, die in Gegenwart des Alaun-Adjuvans erhöht sind. Im Tierversuch induzierte die Alaunformulierung von RiVax® auch höhere Titer und länger anhaltende Antikörper als der adjuvanzfreie Impfstoff. Die Impfung mit der thermostabilisierten RiVax®-Formulierung mit Alaun-Adjuvans in einem Großtiermodell bot einen 100% igen Schutz (p <0,0001) gegen akute Exposition gegenüber aerosolisiertem Ricin, dem tödlichsten Expositionsweg für Ricin. Die geschützten Tiere hatten auch keine Anzeichen einer groben Lungenschädigung, eine schwerwiegende und dauerhafte Konsequenz mit langfristigen Konsequenzen für die Überlebenden der Ricinexposition. Diese Ergebnisse werden in einer hier verfügbaren Publikation beschrieben.
Die Wärmestabilisierung von RiVax® wird mit der firmeneigenen ThermoVax®-Technologie erreicht, mit der die für die meisten Impfstoffe erforderliche Kühlkettenproduktions-, Vertriebs- und Lagerlogistik entfällt. Die Technologie nutzt die präzise Gefriertrocknung von Proteinimmunogenen mit herkömmlichen Aluminium-Adjuvantien in Kombination mit sekundären Adjuvanzien, um mit der geringsten Anzahl von Impfungen schnell eine schützende Immunität zu erreichen. Durch die Verwendung von ThermoVax® während der endgültigen Formulierung von RiVax® hat der Impfstoff eine verbesserte Stabilität und die Fähigkeit bewiesen, Temperaturen von mindestens 40 Grad Celsius (104 Grad Fahrenheit) für bis zu einem Jahr standzuhalten. Diese Ergebnisse werden in einer hier verfügbaren Publikation beschrieben.
Die Entwicklung von RiVax® wurde durch eine Reihe von Zuschüssen sowohl von der NIAID als auch von der FDA finanziert. Die laufende Entwicklung wird durch den NIAID-Vertrag Nr. HHSN272201400039C gesponsert. Die nicht verwässernde Finanzierung für die Entwicklung von RiVax® hat bisher 40 Millionen US-Dollar überschritten. RiVax® wird unter der FDA "Animal Rule" entwickelt und möglicherweise in den Strategic National Stockpile aufgenommen und im Falle einer terroristischen Bedrohung abgegeben. RiVax® wurde in den USA und in Europa als Orphan Drug ausgezeichnet.
Als neues chemisches Unternehmen kann sich ein von der FDA zugelassener RiVax®-Impfstoff für ein PRV mit biologischer Abwehr qualifizieren, wodurch der Inhaber eine beschleunigte Überprüfung eines Arzneimittelantrags ermöglicht. Das nach dem 21st Century Health Cures Act Ende 2016 zugelassene Biodefense PRV wird nach seiner Zulassung als medizinische Gegenmaßnahme vergeben, wenn der / die Wirkstoff (e) in keinem Zusammenhang anderweitig zur Verwendung zugelassen wurden. PRVs sind übertragbar und können verkauft werden. In den letzten Jahren wurden mehr als 100 Millionen US-Dollar verkauft. Bei Einlösung berechtigen PRVs den Benutzer zu einem beschleunigten Überprüfungszeitraum von sechs Monaten, wodurch ein Median von sieben Monaten Überprüfungszeit eingespart wird, wie im Jahr 2009 berechnet. Die FDA muss jedoch 90 Tage vor der Verwendung des PRV und der Verwendung informiert werden eines PRV ist mit einer zusätzlichen Nutzungsgebühr verbunden (2,1 Mio. USD im Jahr 2020).
Über Soligenix, Inc.
RiVax® ist der Impfstoffkandidat des Unternehmens zur Verhinderung des Todes nach Exposition gegenüber einer tödlichen Dosis Ricin-Toxin unter Verwendung eines einzigartigen Antigens, das vollständig frei von der toxischen Aktivität von Ricin ist. RiVax® wurde von Soligenix für eine verbesserte Thermostabilität formuliert und hat bei Mäusen und NHPs einen bis zu 100% igen Schutz gezeigt, der anschließend entweder systemisch oder durch Aerosol tödlichen Dosen von Ricin-Toxin ausgesetzt wurde. In jüngster Zeit wurde gezeigt, dass Mäuse mindestens 12 Monate nach der Impfung mit der 10-fachen tödlichen Dosis vor einer Ricin-Exposition geschützt sind.
"Diese Ergebnisse verstärken weiterhin die Bequemlichkeit und Praktikabilität des RiVax®-Impfstoffs", erklärte Dr. Oreola Donini, wissenschaftlicher Leiter von Soligenix. "Diese und andere laufende Arbeiten haben die Wirksamkeit von RiVax® weiterhin bestätigt und werden seine potenzielle Zulassung erleichtern."
Die Zulassung für RiVax® wird gemäß der "Animal Rule" der US-amerikanischen Food and Drug Administration (FDA) angestrebt, die auf Produkte angewendet wird, bei denen Tests in klinischen Wirksamkeitsstudien unethisch wären. Im Fall eines Ricin-Toxin-Impfstoffs ist eine klinische Wirksamkeitsprüfung des Impfstoffs unethisch, da der Mensch absichtlich Ricin-Toxin ausgesetzt werden müsste. Die Tierregel ist im Allgemeinen mit der Genehmigung medizinischer Gegenmaßnahmen zur biologischen Verteidigung verbunden. Die Tierregel verlangt die Bewertung der Wirksamkeit bei Tieren (RiVax® hat einen bis zu 100% igen Schutz bei NHPs gezeigt, die tödlichem aerosolisiertem Ricin ausgesetzt sind) und der Sicherheit beim Menschen (das RiVax®-Antigen hat sich in der klinischen Phase 1 des Menschen als gut verträglich erwiesen Studien) und Immunogenität korrelierten zwischen Tiermodellen und Menschen (Biomarker wurden identifiziert, siehe Veröffentlichung hier).
RiVax®-Studien werden durch eine Auftragsvergabe (# HHSN272201400039C) in Höhe von ca. 21,2 Mio. USD vom Nationalen Institut für Allergie und Infektionskrankheiten (NIAID) unterstützt. Die nicht verwässernde Finanzierung für die Entwicklung von RiVax® hat bisher 40 Millionen US-Dollar überschritten.
RiVax® hat von der FDA die Orphan Drug- und Fast Track-Kennzeichnung erhalten und kann sich nach Genehmigung für einen Biodefense Priority Review Voucher (PRV) qualifizieren. Darüber hinaus hat RiVax® von der Europäischen Arzneimittel-Agentur (EMA) die Orphan Drug-Kennzeichnung erhalten.
Über Ricin Toxin
Ricin-Toxin ist ein tödliches pflanzliches Toxin und wird aufgrund seiner Stabilität und hohen Wirksamkeit sowie der Tatsache, dass es leicht aus Nebenprodukten der Rizinusölproduktion gewonnen werden kann, sowohl als Bioterrorismus-Mittel als auch als chemisches Kampfmittel angesehen. Ricin kommt in vielen Formen vor, einschließlich Pulver, Nebel oder Pellet. Ricin kann auch in Wasser und anderen Flüssigkeiten gelöst werden. Die US-amerikanischen Zentren für die Kontrolle und Prävention von Krankheiten schätzen, dass die tödliche Dosis beim Menschen etwa die Größe eines Salzkorns hat. Die Ricin-Toxin-Krankheit verursacht eine Gewebenekrose und ein allgemeines Organversagen, die innerhalb einiger Tage nach der Exposition zum Tod führen. Ricin ist beim Einatmen besonders giftig. Ricin wirkt, indem es in die Zellen des Körpers eindringt und verhindert, dass die Zellen die Proteine herstellen, die sie benötigen. Ohne die Proteine sterben Zellen ab, was schließlich für den gesamten Körper schädlich ist.
Derzeit gibt es keine wirksamen Behandlungen für eine Ricinvergiftung. Die erfolgreiche Entwicklung eines wirksamen Impfstoffs gegen Ricintoxin kann die tatsächliche Verwendung von Ricin als biologische Waffe abschrecken und zur Impfung von Militärpersonal und zivilen Einsatzkräften mit hohem Risiko einer möglichen Exposition im Falle eines biologischen Angriffs eingesetzt werden .
Über RiVax®
RiVax® ist Soligenix 'firmeneigener hitzebeständiger Impfstoff gegen rekombinante Untereinheiten, der zum Schutz vor der Exposition gegenüber Ricin-Toxin entwickelt wurde. Die Bedrohung wurde in den Nachrichten durch einen an Präsident Trump gerichteten Umschlag hervorgehoben, der dieses potente und potenziell tödliche Toxin enthalten soll. Mit RiVax® ist Soligenix weltweit führend auf dem Gebiet der Forschung zu Ricintoxin-Impfstoffen.
RiVax® enthält eine genetisch veränderte Version einer Ricin Toxin A (RTA) -Kette, die zwei Mutationen enthält, die die Toxizität des Ricinmoleküls inaktivieren, das ursprünglich an der University of Texas Southwestern erfunden wurde. Bisherige klinische Phase-1-Studien haben die Sicherheit des Antigens und des Adjuvans sowie die Bildung von Ricin-neutralisierenden Antikörpern gezeigt, die in Gegenwart des Alaun-Adjuvans erhöht sind. Im Tierversuch induzierte die Alaunformulierung von RiVax® auch höhere Titer und länger anhaltende Antikörper als der adjuvanzfreie Impfstoff. Die Impfung mit der thermostabilisierten RiVax®-Formulierung mit Alaun-Adjuvans in einem Großtiermodell bot einen 100% igen Schutz (p <0,0001) gegen akute Exposition gegenüber aerosolisiertem Ricin, dem tödlichsten Expositionsweg für Ricin. Die geschützten Tiere hatten auch keine Anzeichen einer groben Lungenschädigung, eine schwerwiegende und dauerhafte Konsequenz mit langfristigen Konsequenzen für die Überlebenden der Ricinexposition. Diese Ergebnisse werden in einer hier verfügbaren Publikation beschrieben.
Die Wärmestabilisierung von RiVax® wird mit der firmeneigenen ThermoVax®-Technologie erreicht, mit der die für die meisten Impfstoffe erforderliche Kühlkettenproduktions-, Vertriebs- und Lagerlogistik entfällt. Die Technologie nutzt die präzise Gefriertrocknung von Proteinimmunogenen mit herkömmlichen Aluminium-Adjuvantien in Kombination mit sekundären Adjuvanzien, um mit der geringsten Anzahl von Impfungen schnell eine schützende Immunität zu erreichen. Durch die Verwendung von ThermoVax® während der endgültigen Formulierung von RiVax® hat der Impfstoff eine verbesserte Stabilität und die Fähigkeit bewiesen, Temperaturen von mindestens 40 Grad Celsius (104 Grad Fahrenheit) für bis zu einem Jahr standzuhalten. Diese Ergebnisse werden in einer hier verfügbaren Publikation beschrieben.
Die Entwicklung von RiVax® wurde durch eine Reihe von Zuschüssen sowohl von der NIAID als auch von der FDA finanziert. Die laufende Entwicklung wird durch den NIAID-Vertrag Nr. HHSN272201400039C gesponsert. Die nicht verwässernde Finanzierung für die Entwicklung von RiVax® hat bisher 40 Millionen US-Dollar überschritten. RiVax® wird unter der FDA "Animal Rule" entwickelt und möglicherweise in den Strategic National Stockpile aufgenommen und im Falle einer terroristischen Bedrohung abgegeben. RiVax® wurde in den USA und in Europa als Orphan Drug ausgezeichnet.
Als neues chemisches Unternehmen kann sich ein von der FDA zugelassener RiVax®-Impfstoff für ein PRV mit biologischer Abwehr qualifizieren, wodurch der Inhaber eine beschleunigte Überprüfung eines Arzneimittelantrags ermöglicht. Das nach dem 21st Century Health Cures Act Ende 2016 zugelassene Biodefense PRV wird nach seiner Zulassung als medizinische Gegenmaßnahme vergeben, wenn der / die Wirkstoff (e) in keinem Zusammenhang anderweitig zur Verwendung zugelassen wurden. PRVs sind übertragbar und können verkauft werden. In den letzten Jahren wurden mehr als 100 Millionen US-Dollar verkauft. Bei Einlösung berechtigen PRVs den Benutzer zu einem beschleunigten Überprüfungszeitraum von sechs Monaten, wodurch ein Median von sieben Monaten Überprüfungszeit eingespart wird, wie im Jahr 2009 berechnet. Die FDA muss jedoch 90 Tage vor der Verwendung des PRV und der Verwendung informiert werden eines PRV ist mit einer zusätzlichen Nutzungsgebühr verbunden (2,1 Mio. USD im Jahr 2020).
Über Soligenix, Inc.
Die Nachrichten sind doch gut ... Wieso fällt der Kurs?
Antwort auf Beitrag Nr.: 65.993.315 von Tambi83 am 08.12.20 22:08:40Ich nehme mal an ....dass es daran liegt ....dass die Ergebnisse der Phase 3 Studie erwartet werden .....und nichts anderes ....Ich sehe es deutlich positiver .....es ist einfach noch ein wirklich guter Zusatz ....zu allem was bei Sngx gerade läuft ......
Ich sehr es auch als sehr positiv....dass andere News vorgeschoben werden ....das bedeutet für mich ein positiver Abschluss von der Phase3 Studie sitzt in den Startlöchern ....wenn dem nicht so wäre ....hätten sie die jetzige Nachricht nicht " kommen" lassen .....
Ich bin sehr gespannt ....auf die nächsten Tage .....
Ich sehr es auch als sehr positiv....dass andere News vorgeschoben werden ....das bedeutet für mich ein positiver Abschluss von der Phase3 Studie sitzt in den Startlöchern ....wenn dem nicht so wäre ....hätten sie die jetzige Nachricht nicht " kommen" lassen .....
Ich bin sehr gespannt ....auf die nächsten Tage .....
Pressemitteilung
Der COVID-19-Impfstoffkandidat von Soligenix, Inc. (NASDAQ: SNGX), CiVax, könnte eine rentablere Alternative zu Moderna und Pfizer sein
Veröffentlicht: 9. Dezember 2020 um 8:38 Uhr ET
Die MarketWatch-Nachrichtenabteilung war an der Erstellung dieser Inhalte nicht beteiligt.
09. Dezember 2020 (NewMediaWire über COMTEX) - New York, NY - (NewMediaWire (https://www.newmediawire.com)) - 9. Dezember 2020 - Die COVID-19-Pandemie war eine der bedeutendsten „schwarzen“ Schwan ”Ereignisse in der jüngeren Geschichte. Bis Anfang Dezember 2020 (http://nmw.bz/UVue)" target="_blank" rel="nofollow ugc noopener">http://nmw.bz/UVue) sind weltweit rund 1,5 Millionen Menschen an dem Coronavirus gestorben, darunter über 274.000 Todesfälle in den USA. Gleichzeitig haben Millionen von Menschen ihren Arbeitsplatz, ihr Geschäft und andere Einkommensquellen verloren. Die einzige Möglichkeit, sich wirklich von dieser Pandemie zu erholen, besteht in einer weit verbreiteten Impfung und der fortgesetzten Einhaltung sozialer Distanzierung, Händewaschen und anderer vorbeugender Maßnahmen.
Pfizer und Moderna sind zwei der am meisten gehypten Unternehmen, die Coronavirus-Impfstoffe entwickeln. Beide Impfstoffe sollen eine Wirksamkeit von mehr als 90% beim Schutz des Individuums vor schweren Coronavirus-Symptomen aufweisen.
Sowohl bei den Pfizer- als auch bei den Moderna-Impfstoffen bleiben jedoch zahlreiche Sicherheits- und Wirksamkeitsfragen sowie der drohende logistische Albtraum der Lagerung offen. Soligenix, Inc. (NASDAQ: SNGX) ist ein Unternehmen (https://www.soligenix.com/), das einen Coronavirus-Impfstoffkandidaten entwickelt, der möglicherweise die Antwort auf mehrere dieser Probleme hat.
Fragen rund um Moderna & Pfizer Impfstoffe
Moderna und Pfizer sind nur einige Biotechnologieunternehmen, die Impfstoffe zur Bekämpfung der Pandemie entwickeln. Ihre Bemühungen und ihre Fähigkeit, in Rekordzeit einen lebensfähigen Impfstoff herzustellen, sind äußerst bedeutsam und ein wichtiger Meilenstein in der Medizin.
Neue Impfstofftechnologie
Beide Unternehmen setzen jedoch eine neue Impfstofftechnologie ein, die keinen langfristigen Sicherheits- und Wirksamkeitstests unterzogen wurde. Es wurde noch nie ein Impfstoff mit mRNA-Technologie zugelassen (http://nmw.bz/Y1uA)." target="_blank" rel="nofollow ugc noopener">http://nmw.bz/Y1uA).
Mithilfe der synthetischen mRNA-Technologie versuchen die Impfstoffe Moderna und Pfizer, eine Immunantwort gegen das Coronavirus zu aktivieren. Frühe klinische Studiendaten zeigen, dass beide Impfstoffe eine Wirksamkeit von über 90% aufweisen. Der wichtige zu verstehende Faktor ist, dass diese Impfstoffe wirksam verhindern, dass die geimpfte Person eine schwere COVID-Infektion erleidet. Es schützt jedoch möglicherweise nicht vor derselben geimpften Person davor, das Virus weiterhin zu tragen und auf andere zu übertragen. Um die Sache noch schlimmer zu machen, benötigen diejenigen, die Impfstoffe auf mRNA-Basis erhalten, zwei Schüsse im Abstand von mehreren Wochen.
Logistischer Alptraum zur Lagerung von mRNA-Impfstoffen
Ein weiteres Problem bei diesen mRNA-Impfstoffen besteht darin, dass sie bei -94 Grad Fahrenheit oder darunter aufbewahrt werden müssen und keine lange Haltbarkeit haben, wenn sie aus dem Gefrierschrank genommen werden. Laut Time Magazine (http://nmw.bz/z9Mk)" target="_blank" rel="nofollow ugc noopener">http://nmw.bz/z9Mk) kann der Pfizer-Impfstoff nur ungefähr fünf Tage halten, wenn er aus dem Kühlraum genommen und in einen Standardkühlschrank gestellt wird.
Selbst die renommiertesten Krankenhäuser und Gesundheitsorganisationen wie die Mayo-Klinik verfügen derzeit nicht über die Lagerfähigkeit, um diese Impfstoffe bei einer so kalten Temperatur zu halten. Wenn die Mayo-Klinik nicht über die richtige Lagerung verfügt, können Sie sich darauf verlassen, dass Ihre örtliche Apotheke und die Kliniken auch nicht über die richtige Lagerung verfügen. Dies erfordert massive Kühlhaus-Upgrades, die hohe Kosten verursachen.
Bedenken Sie auch, dass UPS, FedEx und alle anderen Transportunternehmen, die mit dem Versand der Impfstoffe beauftragt sind, ihre Lastwagen aufrüsten und große Mengen Trockeneis aufkaufen müssen, was derzeit ebenfalls Mangelware ist.
Die strengen Lagerungsanforderungen stellen mit ziemlicher Sicherheit sicher, dass Entwicklungsländer die Pfizer- oder Moderna-Impfstoffe wahrscheinlich nicht verwenden können. Laut dem Borgen-Projekt (http://nmw.bz/MDxg)" target="_blank" rel="nofollow ugc noopener">http://nmw.bz/MDxg) gelten 166 Länder als Teil der Entwicklungsländer, 52 davon in Afrika. Um die Pandemie zu besiegen, müssen alle Länder Zugang zum Impfstoff haben.
https://youtu.be/-fm3RCFAwxU
Soligenix 'CiVax ist Next-Gen ohne logistische Kopfschmerzen
Soligenix erhält möglicherweise nicht die gleiche Aufmerksamkeit in der Presse wie Pfizer oder Moderna, aber sein COVID-Impfstoffkandidat ist ebenso, wenn nicht sogar beeindruckender. Das Potenzial von CiVax (http://nmw.bz/TPpE)" target="_blank" rel="nofollow ugc noopener">http://nmw.bz/TPpE) wird nicht gewürdigt, wenn man bedenkt, dass der Impfstoff bei Raumtemperatur aufbewahrt werden kann, möglicherweise nur einen Schuss erfordert und auf einer Impfstofftechnologie basiert, deren Sicherheit und Wirksamkeit in der Vergangenheit getestet wurde.
CiVax ist ein Impfstoff gegen Untereinheiten, der sich auf die Th1-Antikörperantwort konzentriert
CiVax ist ein Impfstoff gegen Untereinheiten und verwendet daher kein lebendes oder totes Virus. Impfstoffe gegen Untereinheiten (http://nmw.bz/KSnt)" target="_blank" rel="nofollow ugc noopener">http://nmw.bz/KSnt) stammen von den Proteinen oder Glykoproteinen eines Virus. Diese Proteine sind die Schlüsselkomponenten bei der Erzeugung einer schützenden Immunantwort.
Die Impfstofftechnologie für Untereinheiten hat bereits eine lange Sicherheitsgeschichte und wurde im Gegensatz zur mRNA-Technologie bereits von der US-amerikanischen FDA zugelassen. Der Hepatitis-B-Impfstoff war der erste Impfstoff gegen Untereinheiten, der in den USA zugelassen wurde.
"Impfstoffe gegen Untereinheiten gelten als vielversprechende Kandidaten für die Entwicklung von Impfungen gegen Malaria, Tetanus, humanes Cytomegalievirus, Infektionen mit Salmonella enterica serovar Enteritidis und sogar gegen das neuartige schwere akute respiratorische Syndrom Coronavirus 2", so News Medical (http://nmw.bz) / hNP8).
Nehmen Sie jedoch nicht an, dass CiVax der typische Impfstoff für Untereinheiten ist. CiVax hat die Fähigkeit gezeigt, Th1-Antikörperantworten zu stimulieren. Th1-Antikörper haben sich als wirksam bei der Behandlung von SARS und MERS erwiesen, zwei eng verwandten Viren von COVID-19. Unter der Annahme, dass die Th1-Antikörperantworten konsistent gegen das neue neuartige Coronavirus erzeugt werden können, könnte es wahrscheinlich sein, dass CiVax eine ähnliche Wirksamkeit wie die Pfizer- oder Moderna-Impfstoffe aufweist.
CiVax zeigt in einem Schuss Fähigkeiten zur Neutralisierung von Antikörpern und zur Immunität von Zellen
CiVax scheint den Impfstoffen von Pfizer und Moderna überlegen zu sein, da es die Fähigkeit gezeigt hat, Antikörper zu neutralisieren (http://nmw.bz/Rmr3) und Zellimmunität zu erzeugen. Beide Faktoren werden allgemein als Schlüssel zur Entwicklung einer notwendigen und aussagekräftigen Immunantwort angesehen.
Im Gegensatz zu den mRNA-Impfstoffen zeigte CiVax diese Fähigkeiten nach nur einer Impfung, anstatt sich mit der Notwendigkeit zu befassen, zwei Schüsse über einen bestimmten Zeitraum zu erhalten.
CiVax kann bei Raumtemperatur gelagert werden und ist für den weltweiten Einsatz geeignet
Wie bereits erwähnt, werden die Impfstoffe von Moderna und Pfizer anscheinend nur Industrieländern helfen, die die Kühlkapazität verbessern können. Dies bedeutet, dass Entwicklungsländer extrem benachteiligt werden.
Mit CiVax sind keine teuren Kühlhaus-Upgrades erforderlich. Der Impfstoff ist thermostabilisiert und kann daher bei Raumtemperatur gelagert werden, ohne an Wirksamkeit zu verlieren. Dies macht CiVax nicht nur für den Einsatz in Industrieländern, sondern auch in Entwicklungsländern weitaus praktikabler.
Insgesamt ist ein COVID-19-Impfstoff erforderlich, wenn die Welt jemals zu irgendeiner Art von Normalität zurückkehren soll. Die mRNA-Impfstoffe, wie sie in Pfizers und Modernas Impfstoffen verwendet werden, scheinen jedoch noch Fragen und Bedenken zu haben (http://nmw.bz/Qq48), die erst beantwortet werden, wenn es zu spät ist. Die langfristigen Sicherheits- und potenziellen Wirksamkeitsprobleme werden wahrscheinlich erst entdeckt, wenn Millionen oder sogar Milliarden von Menschen bereits geimpft wurden.
CiVax von Soligenix soll ein wenig mehr Sicherheit und Vertrautheit mit der COVID-Impfstoff-Arena bieten. Durch die Verwendung der Impfstofftechnologie für Untereinheiten mit einer nachgewiesenen Erfolgsbilanz in Bezug auf Sicherheit und Wirksamkeit könnte CiVax denjenigen helfen, die sich Sorgen über die Unbekannten der mRNA-Technologie machen. Die thermostabilisierte Natur von CiVax ist eine Win-Win-Win-Situation für Patienten, Krankenhäuser und Versender, die sich nicht auf teure Kühlhaus-Upgrades, Haltbarkeit des Impfstoffs und Potenzprobleme verlassen müssen. Auch der thermostabilisierte Zustand von CiVax macht dies zu einem Gewinn für Entwicklungsländer und belebt damit die Initiative, die Welt gegen die COVID-Pandemie zu impfen.
Haftungsausschluss
Diese Mitteilung wurde von PCG Digital Holdings, LLC und einer Tochtergesellschaft von PCG Advisory Inc. (zusammen „PCG“) erstellt. PCG ist eine integrierte Investor Relations-, Kommunikations- und strategische Beratungsfirma. Die hierin enthaltenen Informationen können "bezahlte Werbung" im Sinne von Abschnitt 17 (b) des Securities Act von 1933 in der jeweils gültigen Fassung sein (zusammen mit den dortigen Regeln und Vorschriften des "Securities Act"). PCG kann von den jeweiligen Kunden für die Veröffentlichung von Informationen in Bezug auf die Wertpapiere ihres Kunden entschädigt werden. Weitere Informationen zur Vergütung der von PCG erbrachten Dienstleistungen finden Sie in den entsprechenden Werbematerialien zum jeweiligen Kunden. Durch den Zugriff auf diese Website und deren Seiten erklären Sie sich mit den Nutzungsbedingungen und den Datenschutzbestimmungen einverstanden.
PCG ist weder ein registrierter oder lizenzierter Broker, Händler, Broker-Dealer, Anlageberater oder Anlageverwalter, noch übt PCG Aktivitäten aus, die solche Registrierungen erfordern würden. PCG bietet keine Anlageberatung, Billigung, Analyse oder Empfehlung in Bezug auf Wertpapiere an, und seine Dienstleistungen oder Aussagen über seine Kunden sollten niemals als Billigung oder Meinung über die Sicherheit eines Kunden ausgelegt werden. Keine in dieser Mitteilung enthaltenen Informationen stellen ein Verkaufsangebot, eine Aufforderung zur Abgabe eines Kaufangebots oder eine Empfehlung eines Wertpapiers oder eines ähnlichen Produkts oder einer ähnlichen Dienstleistung dar, unabhängig davon, ob in dieser Mitteilung auf diese Sicherheit, dieses Produkt oder diese Dienstleistung Bezug genommen wird. Darüber hinaus soll nichts in dieser Mitteilung steuerliche, rechtliche, oder Anlageberatung und nichts in dieser Mitteilung sollte als Empfehlung zum Kauf, Verkauf oder Halten von Anlagen oder Wertpapieren oder zum Eingehen einer Anlagestrategie oder -transaktion ausgelegt werden. Vollständige Haftungsausschlüsse, einschließlich der Entschädigung für professionelle Dienstleistungen, finden Sie unter www.pcgadvisory.com/disclosures.
PCG Digital
Der COVID-19-Impfstoffkandidat von Soligenix, Inc. (NASDAQ: SNGX), CiVax, könnte eine rentablere Alternative zu Moderna und Pfizer sein
Veröffentlicht: 9. Dezember 2020 um 8:38 Uhr ET
Die MarketWatch-Nachrichtenabteilung war an der Erstellung dieser Inhalte nicht beteiligt.
09. Dezember 2020 (NewMediaWire über COMTEX) - New York, NY - (NewMediaWire (https://www.newmediawire.com)) - 9. Dezember 2020 - Die COVID-19-Pandemie war eine der bedeutendsten „schwarzen“ Schwan ”Ereignisse in der jüngeren Geschichte. Bis Anfang Dezember 2020 (http://nmw.bz/UVue)" target="_blank" rel="nofollow ugc noopener">http://nmw.bz/UVue) sind weltweit rund 1,5 Millionen Menschen an dem Coronavirus gestorben, darunter über 274.000 Todesfälle in den USA. Gleichzeitig haben Millionen von Menschen ihren Arbeitsplatz, ihr Geschäft und andere Einkommensquellen verloren. Die einzige Möglichkeit, sich wirklich von dieser Pandemie zu erholen, besteht in einer weit verbreiteten Impfung und der fortgesetzten Einhaltung sozialer Distanzierung, Händewaschen und anderer vorbeugender Maßnahmen.
Pfizer und Moderna sind zwei der am meisten gehypten Unternehmen, die Coronavirus-Impfstoffe entwickeln. Beide Impfstoffe sollen eine Wirksamkeit von mehr als 90% beim Schutz des Individuums vor schweren Coronavirus-Symptomen aufweisen.
Sowohl bei den Pfizer- als auch bei den Moderna-Impfstoffen bleiben jedoch zahlreiche Sicherheits- und Wirksamkeitsfragen sowie der drohende logistische Albtraum der Lagerung offen. Soligenix, Inc. (NASDAQ: SNGX) ist ein Unternehmen (https://www.soligenix.com/), das einen Coronavirus-Impfstoffkandidaten entwickelt, der möglicherweise die Antwort auf mehrere dieser Probleme hat.
Fragen rund um Moderna & Pfizer Impfstoffe
Moderna und Pfizer sind nur einige Biotechnologieunternehmen, die Impfstoffe zur Bekämpfung der Pandemie entwickeln. Ihre Bemühungen und ihre Fähigkeit, in Rekordzeit einen lebensfähigen Impfstoff herzustellen, sind äußerst bedeutsam und ein wichtiger Meilenstein in der Medizin.
Neue Impfstofftechnologie
Beide Unternehmen setzen jedoch eine neue Impfstofftechnologie ein, die keinen langfristigen Sicherheits- und Wirksamkeitstests unterzogen wurde. Es wurde noch nie ein Impfstoff mit mRNA-Technologie zugelassen (http://nmw.bz/Y1uA)." target="_blank" rel="nofollow ugc noopener">http://nmw.bz/Y1uA).
Mithilfe der synthetischen mRNA-Technologie versuchen die Impfstoffe Moderna und Pfizer, eine Immunantwort gegen das Coronavirus zu aktivieren. Frühe klinische Studiendaten zeigen, dass beide Impfstoffe eine Wirksamkeit von über 90% aufweisen. Der wichtige zu verstehende Faktor ist, dass diese Impfstoffe wirksam verhindern, dass die geimpfte Person eine schwere COVID-Infektion erleidet. Es schützt jedoch möglicherweise nicht vor derselben geimpften Person davor, das Virus weiterhin zu tragen und auf andere zu übertragen. Um die Sache noch schlimmer zu machen, benötigen diejenigen, die Impfstoffe auf mRNA-Basis erhalten, zwei Schüsse im Abstand von mehreren Wochen.
Logistischer Alptraum zur Lagerung von mRNA-Impfstoffen
Ein weiteres Problem bei diesen mRNA-Impfstoffen besteht darin, dass sie bei -94 Grad Fahrenheit oder darunter aufbewahrt werden müssen und keine lange Haltbarkeit haben, wenn sie aus dem Gefrierschrank genommen werden. Laut Time Magazine (http://nmw.bz/z9Mk)" target="_blank" rel="nofollow ugc noopener">http://nmw.bz/z9Mk) kann der Pfizer-Impfstoff nur ungefähr fünf Tage halten, wenn er aus dem Kühlraum genommen und in einen Standardkühlschrank gestellt wird.
Selbst die renommiertesten Krankenhäuser und Gesundheitsorganisationen wie die Mayo-Klinik verfügen derzeit nicht über die Lagerfähigkeit, um diese Impfstoffe bei einer so kalten Temperatur zu halten. Wenn die Mayo-Klinik nicht über die richtige Lagerung verfügt, können Sie sich darauf verlassen, dass Ihre örtliche Apotheke und die Kliniken auch nicht über die richtige Lagerung verfügen. Dies erfordert massive Kühlhaus-Upgrades, die hohe Kosten verursachen.
Bedenken Sie auch, dass UPS, FedEx und alle anderen Transportunternehmen, die mit dem Versand der Impfstoffe beauftragt sind, ihre Lastwagen aufrüsten und große Mengen Trockeneis aufkaufen müssen, was derzeit ebenfalls Mangelware ist.
Die strengen Lagerungsanforderungen stellen mit ziemlicher Sicherheit sicher, dass Entwicklungsländer die Pfizer- oder Moderna-Impfstoffe wahrscheinlich nicht verwenden können. Laut dem Borgen-Projekt (http://nmw.bz/MDxg)" target="_blank" rel="nofollow ugc noopener">http://nmw.bz/MDxg) gelten 166 Länder als Teil der Entwicklungsländer, 52 davon in Afrika. Um die Pandemie zu besiegen, müssen alle Länder Zugang zum Impfstoff haben.
https://youtu.be/-fm3RCFAwxU
Soligenix 'CiVax ist Next-Gen ohne logistische Kopfschmerzen
Soligenix erhält möglicherweise nicht die gleiche Aufmerksamkeit in der Presse wie Pfizer oder Moderna, aber sein COVID-Impfstoffkandidat ist ebenso, wenn nicht sogar beeindruckender. Das Potenzial von CiVax (http://nmw.bz/TPpE)" target="_blank" rel="nofollow ugc noopener">http://nmw.bz/TPpE) wird nicht gewürdigt, wenn man bedenkt, dass der Impfstoff bei Raumtemperatur aufbewahrt werden kann, möglicherweise nur einen Schuss erfordert und auf einer Impfstofftechnologie basiert, deren Sicherheit und Wirksamkeit in der Vergangenheit getestet wurde.
CiVax ist ein Impfstoff gegen Untereinheiten, der sich auf die Th1-Antikörperantwort konzentriert
CiVax ist ein Impfstoff gegen Untereinheiten und verwendet daher kein lebendes oder totes Virus. Impfstoffe gegen Untereinheiten (http://nmw.bz/KSnt)" target="_blank" rel="nofollow ugc noopener">http://nmw.bz/KSnt) stammen von den Proteinen oder Glykoproteinen eines Virus. Diese Proteine sind die Schlüsselkomponenten bei der Erzeugung einer schützenden Immunantwort.
Die Impfstofftechnologie für Untereinheiten hat bereits eine lange Sicherheitsgeschichte und wurde im Gegensatz zur mRNA-Technologie bereits von der US-amerikanischen FDA zugelassen. Der Hepatitis-B-Impfstoff war der erste Impfstoff gegen Untereinheiten, der in den USA zugelassen wurde.
"Impfstoffe gegen Untereinheiten gelten als vielversprechende Kandidaten für die Entwicklung von Impfungen gegen Malaria, Tetanus, humanes Cytomegalievirus, Infektionen mit Salmonella enterica serovar Enteritidis und sogar gegen das neuartige schwere akute respiratorische Syndrom Coronavirus 2", so News Medical (http://nmw.bz) / hNP8).
Nehmen Sie jedoch nicht an, dass CiVax der typische Impfstoff für Untereinheiten ist. CiVax hat die Fähigkeit gezeigt, Th1-Antikörperantworten zu stimulieren. Th1-Antikörper haben sich als wirksam bei der Behandlung von SARS und MERS erwiesen, zwei eng verwandten Viren von COVID-19. Unter der Annahme, dass die Th1-Antikörperantworten konsistent gegen das neue neuartige Coronavirus erzeugt werden können, könnte es wahrscheinlich sein, dass CiVax eine ähnliche Wirksamkeit wie die Pfizer- oder Moderna-Impfstoffe aufweist.
CiVax zeigt in einem Schuss Fähigkeiten zur Neutralisierung von Antikörpern und zur Immunität von Zellen
CiVax scheint den Impfstoffen von Pfizer und Moderna überlegen zu sein, da es die Fähigkeit gezeigt hat, Antikörper zu neutralisieren (http://nmw.bz/Rmr3) und Zellimmunität zu erzeugen. Beide Faktoren werden allgemein als Schlüssel zur Entwicklung einer notwendigen und aussagekräftigen Immunantwort angesehen.
Im Gegensatz zu den mRNA-Impfstoffen zeigte CiVax diese Fähigkeiten nach nur einer Impfung, anstatt sich mit der Notwendigkeit zu befassen, zwei Schüsse über einen bestimmten Zeitraum zu erhalten.
CiVax kann bei Raumtemperatur gelagert werden und ist für den weltweiten Einsatz geeignet
Wie bereits erwähnt, werden die Impfstoffe von Moderna und Pfizer anscheinend nur Industrieländern helfen, die die Kühlkapazität verbessern können. Dies bedeutet, dass Entwicklungsländer extrem benachteiligt werden.
Mit CiVax sind keine teuren Kühlhaus-Upgrades erforderlich. Der Impfstoff ist thermostabilisiert und kann daher bei Raumtemperatur gelagert werden, ohne an Wirksamkeit zu verlieren. Dies macht CiVax nicht nur für den Einsatz in Industrieländern, sondern auch in Entwicklungsländern weitaus praktikabler.
Insgesamt ist ein COVID-19-Impfstoff erforderlich, wenn die Welt jemals zu irgendeiner Art von Normalität zurückkehren soll. Die mRNA-Impfstoffe, wie sie in Pfizers und Modernas Impfstoffen verwendet werden, scheinen jedoch noch Fragen und Bedenken zu haben (http://nmw.bz/Qq48), die erst beantwortet werden, wenn es zu spät ist. Die langfristigen Sicherheits- und potenziellen Wirksamkeitsprobleme werden wahrscheinlich erst entdeckt, wenn Millionen oder sogar Milliarden von Menschen bereits geimpft wurden.
CiVax von Soligenix soll ein wenig mehr Sicherheit und Vertrautheit mit der COVID-Impfstoff-Arena bieten. Durch die Verwendung der Impfstofftechnologie für Untereinheiten mit einer nachgewiesenen Erfolgsbilanz in Bezug auf Sicherheit und Wirksamkeit könnte CiVax denjenigen helfen, die sich Sorgen über die Unbekannten der mRNA-Technologie machen. Die thermostabilisierte Natur von CiVax ist eine Win-Win-Win-Situation für Patienten, Krankenhäuser und Versender, die sich nicht auf teure Kühlhaus-Upgrades, Haltbarkeit des Impfstoffs und Potenzprobleme verlassen müssen. Auch der thermostabilisierte Zustand von CiVax macht dies zu einem Gewinn für Entwicklungsländer und belebt damit die Initiative, die Welt gegen die COVID-Pandemie zu impfen.
Haftungsausschluss
Diese Mitteilung wurde von PCG Digital Holdings, LLC und einer Tochtergesellschaft von PCG Advisory Inc. (zusammen „PCG“) erstellt. PCG ist eine integrierte Investor Relations-, Kommunikations- und strategische Beratungsfirma. Die hierin enthaltenen Informationen können "bezahlte Werbung" im Sinne von Abschnitt 17 (b) des Securities Act von 1933 in der jeweils gültigen Fassung sein (zusammen mit den dortigen Regeln und Vorschriften des "Securities Act"). PCG kann von den jeweiligen Kunden für die Veröffentlichung von Informationen in Bezug auf die Wertpapiere ihres Kunden entschädigt werden. Weitere Informationen zur Vergütung der von PCG erbrachten Dienstleistungen finden Sie in den entsprechenden Werbematerialien zum jeweiligen Kunden. Durch den Zugriff auf diese Website und deren Seiten erklären Sie sich mit den Nutzungsbedingungen und den Datenschutzbestimmungen einverstanden.
PCG ist weder ein registrierter oder lizenzierter Broker, Händler, Broker-Dealer, Anlageberater oder Anlageverwalter, noch übt PCG Aktivitäten aus, die solche Registrierungen erfordern würden. PCG bietet keine Anlageberatung, Billigung, Analyse oder Empfehlung in Bezug auf Wertpapiere an, und seine Dienstleistungen oder Aussagen über seine Kunden sollten niemals als Billigung oder Meinung über die Sicherheit eines Kunden ausgelegt werden. Keine in dieser Mitteilung enthaltenen Informationen stellen ein Verkaufsangebot, eine Aufforderung zur Abgabe eines Kaufangebots oder eine Empfehlung eines Wertpapiers oder eines ähnlichen Produkts oder einer ähnlichen Dienstleistung dar, unabhängig davon, ob in dieser Mitteilung auf diese Sicherheit, dieses Produkt oder diese Dienstleistung Bezug genommen wird. Darüber hinaus soll nichts in dieser Mitteilung steuerliche, rechtliche, oder Anlageberatung und nichts in dieser Mitteilung sollte als Empfehlung zum Kauf, Verkauf oder Halten von Anlagen oder Wertpapieren oder zum Eingehen einer Anlagestrategie oder -transaktion ausgelegt werden. Vollständige Haftungsausschlüsse, einschließlich der Entschädigung für professionelle Dienstleistungen, finden Sie unter www.pcgadvisory.com/disclosures.
PCG Digital
Nach wie vor stehen hier in den nächsten 3 Wochen massive News an, es wird ganz spannend mit Soligenix! Ich bin guter Dinge das wir hier locker 100-200% machen können wenn es gut läuftund die Daten überzeugen können :-)
Dann hoffen wir mal auf gute News
Wie schnell es gehen kann haben wir ja gestern bei Greenwich gesehen👍
Wie schnell es gehen kann haben wir ja gestern bei Greenwich gesehen👍
ist doch ziemlich interessant....Was meint ihr?
3 Insidertrades ....so kurz vor den Daten ......hmm.....
it looks good.......also meiner Meinung nach....
3 Insidertrades ....so kurz vor den Daten ......hmm.....
it looks good.......also meiner Meinung nach....
Dass sind Optionen ( right to buy) die bis 2030 gültig sind.
Wahrscheinlich Teil vom Jahres Gehalt.
Wahrscheinlich Teil vom Jahres Gehalt.
Antwort auf Beitrag Nr.: 66.051.715 von Steel21x am 13.12.20 20:51:29Ahh...okay ....aber dann schonmal schön zurecht gelegt ....auf eine schöne Woche .....
Pressemitteilung
Soligenix gibt mit Pontifax Medison Debt Financing einen Finanzierungsvertrag über 20 Millionen US-Dollar für strategische Wandelanleihen bekannt
Veröffentlicht: 16. Dezember 2020 um 9:01 Uhr ET
Die MarketWatch-Nachrichtenabteilung war an der Erstellung dieser Inhalte nicht beteiligt.
PRINCETON, NJ, 16. Dezember 2020 / PRNewswire über COMTEX / - PRINCETON, NJ, 16. Dezember 2020 / PRNewswire / - Soligenix, Inc. (Nasdaq: SNGX) (Soligenix oder das Unternehmen), ein spätes Stadium Das biopharmazeutische Unternehmen, das sich auf die Entwicklung und Vermarktung von Produkten zur Behandlung seltener Krankheiten konzentriert, bei denen ein ungedeckter medizinischer Bedarf besteht, gab heute bekannt, dass es mit Pontifax Medison Debt Financing (Pontifax), dem im Gesundheitswesen tätigen Unternehmen und Schulden, einen Vertrag über die Finanzierung von Wandelschuldverschreibungen in Höhe von 20 Mio. USD abgeschlossen hat Fonds der Pontifax Life Science Funds.
"Der Zugang zu weniger verwässerndem Kapital durch diese Einrichtung soll unsere finanzielle Flexibilität erhöhen, da wir unsere Pipeline für seltene Krankheiten weiter vorantreiben und die Kommerzialisierung in den USA mit SGX301 zur Behandlung des kutanen T-Zell-Lymphoms (CTCL) vorantreiben. und SGX942 zur Behandlung der oralen Mukositis bei Patienten mit Kopf- und Halskrebs ", erklärte Christopher J. Schaber, PhD, President und Chief Executive Officer von Soligenix.
"Pontifax freut sich, diese strategische Finanzierungspartnerschaft mit Soligenix einzugehen, da die Pipeline klinisch bedeutsamer Produkte zur Behandlung seltener Krankheiten weiter ausgebaut wird", sagte Momi Karako, Partner bei Pontifax. "Soligenix verfügt über umfassende Erfahrung in der Entwicklung von Produkten zur Behandlung von Krankheiten wie CTCL und oraler Mukositis bei Patienten mit Kopf- und Halskrebs. Dies passt perfekt zu unserem Portfolio transformativer, innovativer Life-Science-Unternehmen."
Gemäß den Bedingungen der Vereinbarung mit Pontifax wird Soligenix in drei Tranchen Zugang zu Wandelschuldverschreibungen in Höhe von bis zu 20 Mio. USD haben, die über einen Zeitraum von viereinhalb Jahren fällig werden und in den ersten zwei Jahren nur Zinsen enthalten. Nach Abschluss dieser Transaktion hat das Unternehmen auf die erste Tranche von 10 Mio. USD zugegriffen und hat die Möglichkeit, die zweite Tranche von 5 Mio. USD jederzeit in den nächsten 12 Monaten und die dritte Tranche von 5 Mio. USD bei Einreichung des SGX301 zu ziehen neue Arzneimittelanwendung unter bestimmten Bedingungen.
Pontifax kann das ausstehende Darlehen aus den ersten beiden Tranchen jederzeit vor der Rückzahlung zu einem Wandlungspreis von 4,10 USD je Aktie in Stammaktien von Soligenix umwandeln. Soligenix kann unter bestimmten Bedingungen auch die Umwandlung des Darlehens in Stammaktien zu einem Wandlungspreis von 4,92 USD je Aktie erzwingen.
Über Pontifax Ventures
Pontifax wurde 2004 gegründet und ist ein Risikokapitalunternehmen für das Gesundheitswesen mit einem verwalteten Vermögen von über 775 Millionen US-Dollar. Es sucht nach transformativen, hochmodernen Biowissenschaftstechnologien in allen Entwicklungsstadien. Das Portfolio umfasst rund 80 Unternehmen, die bahnbrechende Lösungen für erhebliche unerfüllte Bedürfnisse entwickeln.
Über Soligenix, Inc.
Soligenix ist ein biopharmazeutisches Unternehmen im Spätstadium, das sich auf die Entwicklung und Vermarktung von Produkten zur Behandlung seltener Krankheiten konzentriert, bei denen ein ungedeckter medizinischer Bedarf besteht. Unser Geschäftsbereich Specialized BioTherapeutics entwickelt SGX301 als neuartige photodynamische Therapie unter Verwendung von sicherem sichtbarem Licht zur Behandlung des kutanen T-Zell-Lymphoms, unserer erstklassigen IDR-Technologie (Innate Defense Regulator), Dusquetid (SGX942) zur oralen Behandlung Mukositis bei Kopf- und Halskrebs sowie firmeneigene Formulierungen von oralem Beclomethason 17,21-Dipropionat (BDP) zur Vorbeugung / Behandlung von Magen-Darm-Erkrankungen (GI), die durch schwere Entzündungen gekennzeichnet sind, einschließlich Morbus Crohn bei Kindern (SGX203) und akuter Strahlenenteritis (SGX201) .
Unser Geschäftsbereich Public Health Solutions umfasst aktive Entwicklungsprogramme für RiVax ® , unseren Ricin-Toxin-Impfstoffkandidaten SGX943, unseren therapeutischen Kandidaten für antibiotikaresistente und neu auftretende Infektionskrankheiten, sowie unsere Forschungsprogramme zur Identifizierung und Entwicklung neuartiger Impfstoffkandidaten gegen Virusinfektionen, einschließlich Ebola, Marburg und SARS-CoV-2 (die Ursache von COVID-19). Die Entwicklung unserer Impfprogramme beinhaltet die Verwendung unserer proprietären Wärmestabilisierungsplattform-Technologie, bekannt als ThermoVax ®. Bisher wurde dieses Geschäftsfeld mit staatlichen Zuschüssen und Vertragsmitteln des Nationalen Instituts für Allergien und Infektionskrankheiten (NIAID), der Mittel zur Reduzierung von Verteidigungsbedrohungen (DTRA) und der Biomedical Advanced Research and Development Authority (BARDA) unterstützt.
Weitere Informationen zu Soligenix, Inc. finden Sie auf der Website des Unternehmens unter www.soligenix.com .
Diese Pressemitteilung enthält möglicherweise zukunftsgerichtete Aussagen, die die aktuellen Erwartungen von Soligenix, Inc. hinsichtlich der zukünftigen Ergebnisse, Leistung, Aussichten und Chancen widerspiegeln, einschließlich, aber nicht beschränkt auf potenzielle Marktgrößen, Patientenpopulationen und die Teilnahme an klinischen Studien. Aussagen, die keine historischen Tatsachen sind, wie "antizipieren", "schätzen", "glauben", "hoffen", "beabsichtigen", "planen", "erwarten", "zielen", "können", "vorschlagen", " Wille, "" Potenzial "oder ähnliche Ausdrücke sind zukunftsgerichtete Aussagen. Diese Aussagen unterliegen einer Reihe von Risiken, Ungewissheiten und anderen Faktoren, die dazu führen können, dass tatsächliche Ereignisse oder Ergebnisse in zukünftigen Perioden wesentlich von den in oder implizierten Aussagen abweichen. diese Aussagen, wie sie beispielsweise beim COVID-19-Ausbruch aufgetreten sind. Soligenix kann Ihnen nicht versichern, dass es in der Lage sein wird, Produkte auf der Grundlage seiner Technologien erfolgreich zu entwickeln, eine behördliche Zulassung zu erlangen oder zu vermarkten, insbesondere angesichts der erheblichen Unsicherheit, die mit der Entwicklung von Therapeutika und Impfstoffen gegen Bioterror-Bedrohungen, der Durchführung präklinischer und klinischer Studien mit Therapeutika und Arzneimitteln verbunden ist Impfstoffe, die behördliche Zulassungen erhalten und Therapeutika und Impfstoffe herstellen, dass die Produktentwicklungs- und Vermarktungsbemühungen aufgrund von Schwierigkeiten oder Verzögerungen bei klinischen Studien oder aufgrund mangelnder Fortschritte oder positiver Ergebnisse aus Forschungs- und Entwicklungsbemühungen nicht reduziert oder eingestellt werden weitere Mittel zur Unterstützung der Produktentwicklung und Vermarktung erfolgreich erhalten können, einschließlich Zuschüssen und Auszeichnungen, Beibehaltung der bestehenden Zuschüsse, die Leistungsanforderungen unterliegen, Abschluss von Biodefense-Beschaffungsverträgen mit der US-Regierung oder anderen Ländern, damit diese mit größeren und besser finanzierten Wettbewerbern in der Biotechnologiebranche konkurrieren können, die sich ändern In der Gesundheitspraxis wirken sich Erstattungsbeschränkungen Dritter und Initiativen zur Reform des Gesundheitswesens auf Bundes- und / oder Landesebene nicht negativ auf das Geschäft aus, oder der US-Kongress verabschiedet möglicherweise keine Gesetze, die zusätzliche Mittel für das Projekt BioShield-Programm bereitstellen würden. Darüber hinaus kann keine Zusicherung hinsichtlich des Zeitpunkts oder des Erfolgs der klinischen Phase-3-Studie mit SGX942 (Dusquetid) zur Behandlung der oralen Mukositis bei Patienten mit Kopf- und Halskrebs, die eine Radiochemotherapie erhalten, gegeben werden. oder eine unserer anderen klinischen / präklinischen Studien. Trotz des statistisch signifikanten Ergebnisses, das in der klinischen HYBRYTE-Phase-3-Studie zur Behandlung des kutanen T-Zell-Lymphoms erzielt wurde, kann nicht garantiert werden, dass eine Genehmigung für das Inverkehrbringen durch die FDA oder die EMA erfolgreich sein wird. Darüber hinaus kann nicht garantiert werden, dass RiVax® für einen Biodfense Priority Review Voucher (PRV) qualifiziert ist oder dass der vorherige Verkauf von PRVs einen potenziellen Verkaufspreis für einen PRV für RiVax anzeigt® . Es kann auch nicht garantiert werden, dass das Unternehmen nicht verwässernde staatliche Mittel aus Zuschüssen und Verträgen erhält oder erhält, die vergeben wurden oder werden oder für die das Unternehmen in Zukunft einen Antrag stellen wird. Diese und andere Risikofaktoren werden von Zeit zu Zeit in den bei der Securities and Exchange Commission eingereichten Unterlagen beschrieben, einschließlich, aber nicht beschränkt auf die Berichte von Soligenix auf den Formularen 10-Q und 10-K. Sofern nicht gesetzlich vorgeschrieben, übernimmt Soligenix keine Verpflichtung, zukunftsgerichtete Aussagen aufgrund neuer Informationen oder zukünftiger Ereignisse zu aktualisieren oder zu überarbeiten.
Soligenix gibt mit Pontifax Medison Debt Financing einen Finanzierungsvertrag über 20 Millionen US-Dollar für strategische Wandelanleihen bekannt
Veröffentlicht: 16. Dezember 2020 um 9:01 Uhr ET
Die MarketWatch-Nachrichtenabteilung war an der Erstellung dieser Inhalte nicht beteiligt.
PRINCETON, NJ, 16. Dezember 2020 / PRNewswire über COMTEX / - PRINCETON, NJ, 16. Dezember 2020 / PRNewswire / - Soligenix, Inc. (Nasdaq: SNGX) (Soligenix oder das Unternehmen), ein spätes Stadium Das biopharmazeutische Unternehmen, das sich auf die Entwicklung und Vermarktung von Produkten zur Behandlung seltener Krankheiten konzentriert, bei denen ein ungedeckter medizinischer Bedarf besteht, gab heute bekannt, dass es mit Pontifax Medison Debt Financing (Pontifax), dem im Gesundheitswesen tätigen Unternehmen und Schulden, einen Vertrag über die Finanzierung von Wandelschuldverschreibungen in Höhe von 20 Mio. USD abgeschlossen hat Fonds der Pontifax Life Science Funds.
"Der Zugang zu weniger verwässerndem Kapital durch diese Einrichtung soll unsere finanzielle Flexibilität erhöhen, da wir unsere Pipeline für seltene Krankheiten weiter vorantreiben und die Kommerzialisierung in den USA mit SGX301 zur Behandlung des kutanen T-Zell-Lymphoms (CTCL) vorantreiben. und SGX942 zur Behandlung der oralen Mukositis bei Patienten mit Kopf- und Halskrebs ", erklärte Christopher J. Schaber, PhD, President und Chief Executive Officer von Soligenix.
"Pontifax freut sich, diese strategische Finanzierungspartnerschaft mit Soligenix einzugehen, da die Pipeline klinisch bedeutsamer Produkte zur Behandlung seltener Krankheiten weiter ausgebaut wird", sagte Momi Karako, Partner bei Pontifax. "Soligenix verfügt über umfassende Erfahrung in der Entwicklung von Produkten zur Behandlung von Krankheiten wie CTCL und oraler Mukositis bei Patienten mit Kopf- und Halskrebs. Dies passt perfekt zu unserem Portfolio transformativer, innovativer Life-Science-Unternehmen."
Gemäß den Bedingungen der Vereinbarung mit Pontifax wird Soligenix in drei Tranchen Zugang zu Wandelschuldverschreibungen in Höhe von bis zu 20 Mio. USD haben, die über einen Zeitraum von viereinhalb Jahren fällig werden und in den ersten zwei Jahren nur Zinsen enthalten. Nach Abschluss dieser Transaktion hat das Unternehmen auf die erste Tranche von 10 Mio. USD zugegriffen und hat die Möglichkeit, die zweite Tranche von 5 Mio. USD jederzeit in den nächsten 12 Monaten und die dritte Tranche von 5 Mio. USD bei Einreichung des SGX301 zu ziehen neue Arzneimittelanwendung unter bestimmten Bedingungen.
Pontifax kann das ausstehende Darlehen aus den ersten beiden Tranchen jederzeit vor der Rückzahlung zu einem Wandlungspreis von 4,10 USD je Aktie in Stammaktien von Soligenix umwandeln. Soligenix kann unter bestimmten Bedingungen auch die Umwandlung des Darlehens in Stammaktien zu einem Wandlungspreis von 4,92 USD je Aktie erzwingen.
Über Pontifax Ventures
Pontifax wurde 2004 gegründet und ist ein Risikokapitalunternehmen für das Gesundheitswesen mit einem verwalteten Vermögen von über 775 Millionen US-Dollar. Es sucht nach transformativen, hochmodernen Biowissenschaftstechnologien in allen Entwicklungsstadien. Das Portfolio umfasst rund 80 Unternehmen, die bahnbrechende Lösungen für erhebliche unerfüllte Bedürfnisse entwickeln.
Über Soligenix, Inc.
Soligenix ist ein biopharmazeutisches Unternehmen im Spätstadium, das sich auf die Entwicklung und Vermarktung von Produkten zur Behandlung seltener Krankheiten konzentriert, bei denen ein ungedeckter medizinischer Bedarf besteht. Unser Geschäftsbereich Specialized BioTherapeutics entwickelt SGX301 als neuartige photodynamische Therapie unter Verwendung von sicherem sichtbarem Licht zur Behandlung des kutanen T-Zell-Lymphoms, unserer erstklassigen IDR-Technologie (Innate Defense Regulator), Dusquetid (SGX942) zur oralen Behandlung Mukositis bei Kopf- und Halskrebs sowie firmeneigene Formulierungen von oralem Beclomethason 17,21-Dipropionat (BDP) zur Vorbeugung / Behandlung von Magen-Darm-Erkrankungen (GI), die durch schwere Entzündungen gekennzeichnet sind, einschließlich Morbus Crohn bei Kindern (SGX203) und akuter Strahlenenteritis (SGX201) .
Unser Geschäftsbereich Public Health Solutions umfasst aktive Entwicklungsprogramme für RiVax ® , unseren Ricin-Toxin-Impfstoffkandidaten SGX943, unseren therapeutischen Kandidaten für antibiotikaresistente und neu auftretende Infektionskrankheiten, sowie unsere Forschungsprogramme zur Identifizierung und Entwicklung neuartiger Impfstoffkandidaten gegen Virusinfektionen, einschließlich Ebola, Marburg und SARS-CoV-2 (die Ursache von COVID-19). Die Entwicklung unserer Impfprogramme beinhaltet die Verwendung unserer proprietären Wärmestabilisierungsplattform-Technologie, bekannt als ThermoVax ®. Bisher wurde dieses Geschäftsfeld mit staatlichen Zuschüssen und Vertragsmitteln des Nationalen Instituts für Allergien und Infektionskrankheiten (NIAID), der Mittel zur Reduzierung von Verteidigungsbedrohungen (DTRA) und der Biomedical Advanced Research and Development Authority (BARDA) unterstützt.
Weitere Informationen zu Soligenix, Inc. finden Sie auf der Website des Unternehmens unter www.soligenix.com .
Diese Pressemitteilung enthält möglicherweise zukunftsgerichtete Aussagen, die die aktuellen Erwartungen von Soligenix, Inc. hinsichtlich der zukünftigen Ergebnisse, Leistung, Aussichten und Chancen widerspiegeln, einschließlich, aber nicht beschränkt auf potenzielle Marktgrößen, Patientenpopulationen und die Teilnahme an klinischen Studien. Aussagen, die keine historischen Tatsachen sind, wie "antizipieren", "schätzen", "glauben", "hoffen", "beabsichtigen", "planen", "erwarten", "zielen", "können", "vorschlagen", " Wille, "" Potenzial "oder ähnliche Ausdrücke sind zukunftsgerichtete Aussagen. Diese Aussagen unterliegen einer Reihe von Risiken, Ungewissheiten und anderen Faktoren, die dazu führen können, dass tatsächliche Ereignisse oder Ergebnisse in zukünftigen Perioden wesentlich von den in oder implizierten Aussagen abweichen. diese Aussagen, wie sie beispielsweise beim COVID-19-Ausbruch aufgetreten sind. Soligenix kann Ihnen nicht versichern, dass es in der Lage sein wird, Produkte auf der Grundlage seiner Technologien erfolgreich zu entwickeln, eine behördliche Zulassung zu erlangen oder zu vermarkten, insbesondere angesichts der erheblichen Unsicherheit, die mit der Entwicklung von Therapeutika und Impfstoffen gegen Bioterror-Bedrohungen, der Durchführung präklinischer und klinischer Studien mit Therapeutika und Arzneimitteln verbunden ist Impfstoffe, die behördliche Zulassungen erhalten und Therapeutika und Impfstoffe herstellen, dass die Produktentwicklungs- und Vermarktungsbemühungen aufgrund von Schwierigkeiten oder Verzögerungen bei klinischen Studien oder aufgrund mangelnder Fortschritte oder positiver Ergebnisse aus Forschungs- und Entwicklungsbemühungen nicht reduziert oder eingestellt werden weitere Mittel zur Unterstützung der Produktentwicklung und Vermarktung erfolgreich erhalten können, einschließlich Zuschüssen und Auszeichnungen, Beibehaltung der bestehenden Zuschüsse, die Leistungsanforderungen unterliegen, Abschluss von Biodefense-Beschaffungsverträgen mit der US-Regierung oder anderen Ländern, damit diese mit größeren und besser finanzierten Wettbewerbern in der Biotechnologiebranche konkurrieren können, die sich ändern In der Gesundheitspraxis wirken sich Erstattungsbeschränkungen Dritter und Initiativen zur Reform des Gesundheitswesens auf Bundes- und / oder Landesebene nicht negativ auf das Geschäft aus, oder der US-Kongress verabschiedet möglicherweise keine Gesetze, die zusätzliche Mittel für das Projekt BioShield-Programm bereitstellen würden. Darüber hinaus kann keine Zusicherung hinsichtlich des Zeitpunkts oder des Erfolgs der klinischen Phase-3-Studie mit SGX942 (Dusquetid) zur Behandlung der oralen Mukositis bei Patienten mit Kopf- und Halskrebs, die eine Radiochemotherapie erhalten, gegeben werden. oder eine unserer anderen klinischen / präklinischen Studien. Trotz des statistisch signifikanten Ergebnisses, das in der klinischen HYBRYTE-Phase-3-Studie zur Behandlung des kutanen T-Zell-Lymphoms erzielt wurde, kann nicht garantiert werden, dass eine Genehmigung für das Inverkehrbringen durch die FDA oder die EMA erfolgreich sein wird. Darüber hinaus kann nicht garantiert werden, dass RiVax® für einen Biodfense Priority Review Voucher (PRV) qualifiziert ist oder dass der vorherige Verkauf von PRVs einen potenziellen Verkaufspreis für einen PRV für RiVax anzeigt® . Es kann auch nicht garantiert werden, dass das Unternehmen nicht verwässernde staatliche Mittel aus Zuschüssen und Verträgen erhält oder erhält, die vergeben wurden oder werden oder für die das Unternehmen in Zukunft einen Antrag stellen wird. Diese und andere Risikofaktoren werden von Zeit zu Zeit in den bei der Securities and Exchange Commission eingereichten Unterlagen beschrieben, einschließlich, aber nicht beschränkt auf die Berichte von Soligenix auf den Formularen 10-Q und 10-K. Sofern nicht gesetzlich vorgeschrieben, übernimmt Soligenix keine Verpflichtung, zukunftsgerichtete Aussagen aufgrund neuer Informationen oder zukünftiger Ereignisse zu aktualisieren oder zu überarbeiten.
Was ist denn jetzt passiert
boom was los
Antwort auf Beitrag Nr.: 66.159.820 von sneakee am 22.12.20 12:38:31http://ir.soligenix.com/2020-12-22-Soligenix-Announces-Topli…
Soligenix Announces Topline Results from its Phase 3 Clinical Trial of SGX942 for the Treatment of Oral Mucositis in Head and Neck Cancer Patients
Company to Host Investor Conference Call Today at 8:30AM EST
PRINCETON, N.J., Dec. 22, 2020 /PRNewswire/ -- Soligenix, Inc. (NASDAQ: SNGX) (Soligenix or the Company), a late-stage biopharmaceutical company focused on developing and commercializing products to treat rare diseases where there is an unmet medical need, announced today preliminary top-line results for its pivotal Phase 3 DOM-INNATE (Dusquetide treatment in Oral Mucositis – by modulating INNATE Immunity) trial evaluating SGX942 (dusquetide) in the treatment of severe oral mucositis (SOM) in patients with head and neck cancer (HNC) receiving chemoradiation. The study enrolled 268 patients randomized 1:1 to receive either SGX942 or placebo. The primary endpoint of median duration of SOM did not achieve the pre-specified criterion for statistical significance (p≤0.05); although biological activity was observed with a 56% reduction in the median duration of SOM from 18 days in the placebo group to 8 days in the SGX942 treatment group. Despite this clinically meaningful improvement, the variability in the distribution of the data yielded a p-value that was not statistically significant.
Other secondary endpoints supported the biological activity of dusquetide, including a statistically significant 50% reduction in the duration of SOM in the per-protocol population, which decreased from 18 days in the placebo group to 9 days in the SGX942 treatment group (p=0.049), consistent with the findings in the Phase 2 trial. Similarly, incidence of SOM also followed this biological trend as seen in the Phase 2 study, decreasing by 16% in the SGX942 treatment group relative to the placebo group in the per-protocol population. The per-protocol population was defined as the population receiving a minimum of 55 Gy radiation and at least 10
Company to Host Investor Conference Call Today at 8:30AM EST
PRINCETON, N.J., Dec. 22, 2020 /PRNewswire/ -- Soligenix, Inc. (NASDAQ: SNGX) (Soligenix or the Company), a late-stage biopharmaceutical company focused on developing and commercializing products to treat rare diseases where there is an unmet medical need, announced today preliminary top-line results for its pivotal Phase 3 DOM-INNATE (Dusquetide treatment in Oral Mucositis – by modulating INNATE Immunity) trial evaluating SGX942 (dusquetide) in the treatment of severe oral mucositis (SOM) in patients with head and neck cancer (HNC) receiving chemoradiation. The study enrolled 268 patients randomized 1:1 to receive either SGX942 or placebo. The primary endpoint of median duration of SOM did not achieve the pre-specified criterion for statistical significance (p≤0.05); although biological activity was observed with a 56% reduction in the median duration of SOM from 18 days in the placebo group to 8 days in the SGX942 treatment group. Despite this clinically meaningful improvement, the variability in the distribution of the data yielded a p-value that was not statistically significant.
Other secondary endpoints supported the biological activity of dusquetide, including a statistically significant 50% reduction in the duration of SOM in the per-protocol population, which decreased from 18 days in the placebo group to 9 days in the SGX942 treatment group (p=0.049), consistent with the findings in the Phase 2 trial. Similarly, incidence of SOM also followed this biological trend as seen in the Phase 2 study, decreasing by 16% in the SGX942 treatment group relative to the placebo group in the per-protocol population. The per-protocol population was defined as the population receiving a minimum of 55 Gy radiation and at least 10
Antwort auf Beitrag Nr.: 66.159.841 von sneakee am 22.12.20 12:39:40hier der link
https://finance.yahoo.com/news/soligenix-announces-topline-r…
https://finance.yahoo.com/news/soligenix-announces-topline-r…
Bin zu 1,40 mal raus. Das war mein letzter nachkaufkurs. Hoffe das war die richtige Entscheidung
Antwort auf Beitrag Nr.: 66.160.051 von Zunrise am 22.12.20 12:53:10Ups übersehen...aber auch etwas übertrieben der Abschlag
Antwort auf Beitrag Nr.: 66.160.213 von coronus am 22.12.20 13:05:27ja aber typisch für biotec. jedenfalls günstig jetzt. aber wahrscheinlich bleibt das auf dem niveau ne weile. 

Hab paar Stücke nachgekauft.
gehts in pennystock rein? mal sehen was die amis sagen
Ich hab für 1,08 aufgedoppelt
dann fällt eine Phase 3 Studie weg ......damn.....
aber die 301er ist noch da..für 1 euro kann man nix falsche machen langfrsitig denk ich mal.
Mein Beileid allerseits....
Antwort auf Beitrag Nr.: 66.161.590 von bcgk am 22.12.20 14:32:24Tja nun...kann man vorher nie wissen...
Antwort auf Beitrag Nr.: 66.161.590 von bcgk am 22.12.20 14:32:24
😂
Zitat von bcgk: Mein Beileid allerseits....
😂
vorbörslich 1.3400 -1.40 (-51.09%)
Na geil mal wieder.. war nach 2 Monaten im Minus 1 Woche im Plus und jetzt das. Läuft.
Wollte zwar für 1 Euro rein ...aber 1.09 tuts auch. Chance is 50/50 . Mal sehn könn ja nicht alle beide Phase 3 Studien schlecht sein
Wenn man jetzt das cash von 20 Mio aus dem Börsenwert herausnimmt, sind wir bei noch 19,7 Mio USD... Insofern tatsächlich auch, bzw. gerade jetzt ein echtes Schnäppchen...auf eine glückliche Hand allen Investierten und ein frohes Fest
@StellaVella
Wann rechnest Du mit Ergebnissen zur Phase III Studie SGX301 for Cutaneous T-Cell Lymphoma (CTCL)?
Wann rechnest Du mit Ergebnissen zur Phase III Studie SGX301 for Cutaneous T-Cell Lymphoma (CTCL)?
Antwort auf Beitrag Nr.: 66.253.197 von bcgk am 01.01.21 12:27:35?
Die sind doch schon längst da...
http://ir.soligenix.com/2020-10-22-Soligenix-Announces-Phase…
Die sind doch schon längst da...
http://ir.soligenix.com/2020-10-22-Soligenix-Announces-Phase…
Antwort auf Beitrag Nr.: 66.253.197 von bcgk am 01.01.21 12:27:35
Ja, Lorbas hat recht. Die Ergebnisse waren positiv. Deshalb ist Soligenix auch ziemlich derisked. Das NDA für CTL fehlt noch, ist aber für H1 2021 angekündigt, d.h. PDUFA noch in 2021.
Zitat von bcgk: @StellaVella
Wann rechnest Du mit Ergebnissen zur Phase III Studie SGX301 for Cutaneous T-Cell Lymphoma (CTCL)?
Ja, Lorbas hat recht. Die Ergebnisse waren positiv. Deshalb ist Soligenix auch ziemlich derisked. Das NDA für CTL fehlt noch, ist aber für H1 2021 angekündigt, d.h. PDUFA noch in 2021.
@bcgk: besonders gefällt mir der Orphan Drug-Status für CTL. Letztlich ist der Wirkstoff alternativlos, im Fall der Zulassung. Bedeutet auch, dass der Business Case recht realistische Patientenzahlen beinhaltet.
Antwort auf Beitrag Nr.: 66.253.254 von lorbas95 am 01.01.21 12:39:03Ich bin hier gerade völlig durcheinander gekommen, sorry. Versuche mich gerade in der Implementierung meiner Biotech-Portfolio Datenbank. Neues Jahr, altes Leid 

Antwort auf Beitrag Nr.: 66.253.437 von StellaVella am 01.01.21 13:09:30Was ich bei den OM-Ergebnissen nicht verstehe, ist wie eine so große Reduktion gegenüber dem Placebo nicht in einem stat. sig. p-Wert resultieren konnte... numerisch war das Ergebnis ja hervorragend... Was soll "Variabilität in der Verteilung der Daten" genau bedeuten? Finde ich sehr schade... sieht so aus, als ob SGX942 in OM wirken würde und man nur die Studie in leicht modifizierter Form oder mit größerer Stichprobe wiederholen müsste...
"The primary endpoint of median duration of SOM did not achieve the pre-specified criterion for statistical significance (p≤0.05); although biological activity was observed with a 56% reduction in the median duration of SOM from 18 days in the placebo group to 8 days in the SGX942 treatment group. Despite this clinically meaningful improvement, the variability in the distribution of the data yielded a p-value that was not statistically significant."
"The primary endpoint of median duration of SOM did not achieve the pre-specified criterion for statistical significance (p≤0.05); although biological activity was observed with a 56% reduction in the median duration of SOM from 18 days in the placebo group to 8 days in the SGX942 treatment group. Despite this clinically meaningful improvement, the variability in the distribution of the data yielded a p-value that was not statistically significant."
Antwort auf Beitrag Nr.: 66.262.542 von lorbas95 am 02.01.21 20:39:50ich interpretiere es so, dass die Varianz der Daten (d.h. im Prinzip die Standardabweichung aufgrund von starken Schwankungen der Datenpunkte um den Median herum) zu groß war, um mit dem gesetzten N (Studienteilnehmern) beim Hypothesentest auf einen p-Wert von <0.05 zu kommen, d.h. es ist kein statistisch signifikanter Unterschied zwischen Verum und Placebo herausgekommen.
Ist mir selbst ebenfalls schon ein paarmal passiert, allerdings in anderem Zusammenhang. Die Varianz hat einen erheblichen Einfluss beim Hypothesentest.
Ich vermute es folgen seitens Soligenix weitere Abklärungen mit der FDA. Schwer zu sagen wie es bei OM weitergeht, wenn es weitergeht.
Ist mir selbst ebenfalls schon ein paarmal passiert, allerdings in anderem Zusammenhang. Die Varianz hat einen erheblichen Einfluss beim Hypothesentest.
Ich vermute es folgen seitens Soligenix weitere Abklärungen mit der FDA. Schwer zu sagen wie es bei OM weitergeht, wenn es weitergeht.
Antwort auf Beitrag Nr.: 66.262.626 von StellaVella am 02.01.21 20:51:05Die Differenz wird am Median in den beiden Gruppen festgemacht. Der Median ist robust gegenüber Ausreißern bzw. Extremwerten, die stärker in die Standardabweichung und darauf basierenden Signifikanztests eingehen.
Antwort auf Beitrag Nr.: 66.262.542 von lorbas95 am 02.01.21 20:39:50Hier habe ich noch ein paar Infos dazu gefunden:
"Given the interim analysis you conducted, which advised enrolling an additional 70 subjects, it is surprising that the patient numbers were still not sufficient to see a statistically significant response. What do you think caused this?
Dr. Donini stated that the company was surprised as well that the additional patients did not result in a statistically significant outcome. However, there is a high degree of variability in an OM patient population, and group comparisons had to be done with a comparison of distributions, which is also more susceptible to variability. While the company is still investigating this, the initial thought is that the variability changed between the first approximately 100 subjects and the final 160 subjects in the trial."
Quelle: https://finance.yahoo.com/news/sngx-phase-3-trial-sgx942-095…
"Given the interim analysis you conducted, which advised enrolling an additional 70 subjects, it is surprising that the patient numbers were still not sufficient to see a statistically significant response. What do you think caused this?
Dr. Donini stated that the company was surprised as well that the additional patients did not result in a statistically significant outcome. However, there is a high degree of variability in an OM patient population, and group comparisons had to be done with a comparison of distributions, which is also more susceptible to variability. While the company is still investigating this, the initial thought is that the variability changed between the first approximately 100 subjects and the final 160 subjects in the trial."
Quelle: https://finance.yahoo.com/news/sngx-phase-3-trial-sgx942-095…
Antwort auf Beitrag Nr.: 66.263.091 von StellaVella am 02.01.21 22:01:05Vielen Dank!
Antwort auf Beitrag Nr.: 66.326.621 von StellaVella am 07.01.21 13:34:16Danke! Kommt pre in USA gut an... +16%
https://www.daavlin.com/
Hier kann sich jeder mal ein Bild davon machen wie so eine Therapie ausschaut.
Hier kann sich jeder mal ein Bild davon machen wie so eine Therapie ausschaut.
Hm dee Markt hat wohl eine andere Art Partnerschaft erwartet.
Mit Upfront und Milestones.
So in die Richtung hatte ich mir das ehrlich gesagt gewünscht.
Mit Upfront und Milestones.
So in die Richtung hatte ich mir das ehrlich gesagt gewünscht.
Antwort auf Beitrag Nr.: 66.330.200 von Steel21x am 07.01.21 16:14:04Die wollen es wahrscheinlich selbst vermarkten....gefällt mir persönlich besser. Ist eben eine Kombinationstherapie.
Daavlin besteht ja schon länger auf dem Markt und hat dementsprechend Kunden. Denke es bleibt ja auch nicht nur bei Daavlin.
Daavlin besteht ja schon länger auf dem Markt und hat dementsprechend Kunden. Denke es bleibt ja auch nicht nur bei Daavlin.
Bei Soligenix Inc hat der MACD im Daily die Signallinie nach oben gekreuzt:

Es gibt eine solide Kurslücke nach oben.
Heute kam noch folgender Artikel:
Soligenix – Consensus Indicates Potential 135.4% Upside
Soligenix found using ticker (SNGX) have now 5 analysts in total covering the stock. The consensus rating is ‘Buy’. The range between the high target price and low target price is between 15 and 2 and has a mean target at 6.45. Now with the previous closing price of 2.74 this indicates there is a potential upside of 135.4%.
https://www.directorstalkinterviews.com/soligenix---consensu…
💡
Soligenix Announces Investor Webcast Event: U.S. Commercialization of SGX301 in the Treatment of Cutaneous T-Cell Lymphoma
Conference Call Tuesday, January 26, 2021 at 2:30 PM EST
Conference Call Tuesday, January 26, 2021 at 2:30 PM EST
"Now with the previous closing price of 2.74..."
wann soll denn das gewesen sein? vielleicht bevor es runter rauschte....
wann soll denn das gewesen sein? vielleicht bevor es runter rauschte....
Na da geht doch noch was 😶.der Anfang ist gemacht
Antwort auf Beitrag Nr.: 66.495.968 von Malecon am 18.01.21 22:38:23
So, Leute,
heute wurde die Lückenschließung gestartet, zumindest erstmal ein Versuch:
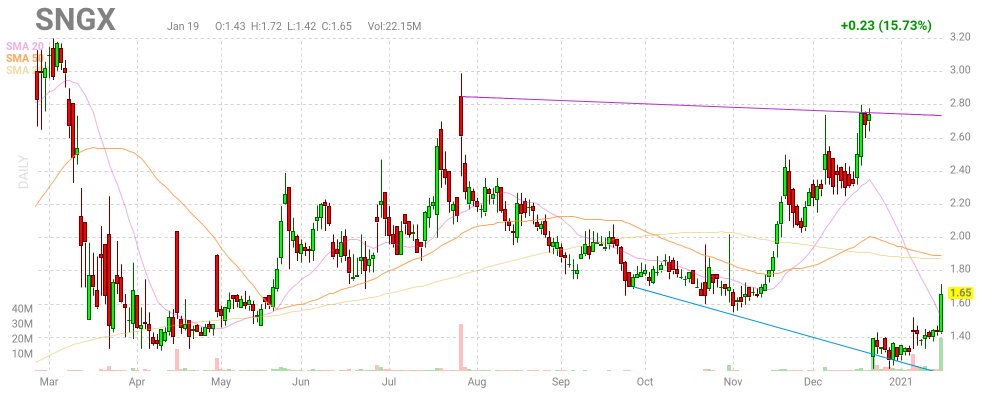
🎵
Zitat von Malecon:![]()
Bei Soligenix Inc hat der MACD im Daily die Signallinie nach oben gekreuzt:
Es gibt eine solide Kurslücke nach oben.
So, Leute,
heute wurde die Lückenschließung gestartet, zumindest erstmal ein Versuch:

🎵
Hab mir mal eine kleine Tradingposi geladen, könnte nächste Woche beim Conf. Call ein kleiner Schub kommen...
Nix mit deiner kurslücke.sag immer das Charts nur Spielerei sind.
Nächster Versuch der Lücke wieder näher zu kommen
schönes klettern .....und schönes Volumen ...
Antwort auf Beitrag Nr.: 66.910.793 von silvesterstrike am 09.02.21 18:21:06Wenn die NDA ohne Verzögerung durchgeht, ist Soligenix ist klarer Verdreifacher vom heutigen Niveau aus. Minimum.
Antwort auf Beitrag Nr.: 66.495.968 von Malecon am 18.01.21 22:38:23
Nach 3 Wochen tut sich was.
Zitat von Malecon:![]()
Bei Soligenix Inc hat der MACD im Daily die Signallinie nach oben gekreuzt:
Es gibt eine solide Kurslücke nach oben.
Heute kam noch folgender Artikel:
Soligenix – Consensus Indicates Potential 135.4% Upside
Soligenix found using ticker (SNGX) have now 5 analysts in total covering the stock. The consensus rating is ‘Buy’. The range between the high target price and low target price is between 15 and 2 and has a mean target at 6.45. Now with the previous closing price of 2.74 this indicates there is a potential upside of 135.4%.
https://www.directorstalkinterviews.com/soligenix---consensu…
💡
Nach 3 Wochen tut sich was.
Nachbörslich gehts weiter. Schon $2.22.
Nachbörslich $2.60 

Antwort auf Beitrag Nr.: 66.916.862 von bcgk am 09.02.21 23:01:55
Dieser Post war der Anstoß mich mit dem Wert zu befassen und am gleichen Tag rein bin. Dafür erst mal thx😊
Auf gute Trades.
S
Zitat von bcgk: Wenn die NDA ohne Verzögerung durchgeht, ist Soligenix ist klarer Verdreifacher vom heutigen Niveau aus. Minimum.
Dieser Post war der Anstoß mich mit dem Wert zu befassen und am gleichen Tag rein bin. Dafür erst mal thx😊
Auf gute Trades.
S
Antwort auf Beitrag Nr.: 66.988.973 von bcgk am 13.02.21 07:01:29Und das bei knapp..1 Mio gehandelte Aktien ....starkes Signal .....👍
Antwort auf Beitrag Nr.: 66.989.324 von Schaeffi am 13.02.21 08:23:17Welcome .....✌
Das riecht nach FOMO am Montag und in den USA dann am Dienstag. Ärgerlich dass ich nicht mehr investiert bin 🤯
Bin auch seit 2 Tagen mit von der Partie. AH sah ja super aus gestern. Any news zum Wochenende?
Hier mal ein Video zu SNGX. Beginnt ab 1:53. Der Typ hat ein Kursziel von 56$ 



Antwort auf Beitrag Nr.: 66.990.476 von Raudy am 13.02.21 10:42:19
Mega!!! Hat sich der nachkauf nach dem letzten kursrutsch doch gelohnt
Zitat von Raudy: Hier mal ein Video zu SNGX. Beginnt ab 1:53. Der Typ hat ein Kursziel von 56$
Mega!!! Hat sich der nachkauf nach dem letzten kursrutsch doch gelohnt
Was man derzeit am markt sehen kann das einige biotecs total steil gehen.warum auch nicht hier....derzeit alles möglich.und das gute ist....von anfang an!! 🤑🤑🤑
Antwort auf Beitrag Nr.: 66.990.476 von Raudy am 13.02.21 10:42:19Dann muss es ja stimmen. 
Vielleicht wäre es sinnvoller folgende Fragen zu stellen:
1. welche Risiken bestehen für ein kleines Unternehmen in der Finalisierung einer NDA?
2. welche Zulassungschancen bestehen auf Basis der P3 Ergebnisse?
3. welche annual peak sales sind zu erwarten?
Aber in der heutigen Zeit reicht es vielen einfach nur irgendwelchen Marktschreiern auf YouTube hinterherzulaufen.
Kommen wir nun mal zur Realität. Ein Artikel, der lesenswert ist:
https://www.marketwatch.com/press-release/soligenixs-upcomin…
Annual Peak Sales von 90m$, bei entsprechendem Marktanteil könnte die MK hier auf ca. 200m laufen. Wären 7$, was sich ganz gut mit Zacks Research deckt. Aber die Finalisierung der NDA in time bleibt die große Herausforderung für Soligenix.

Vielleicht wäre es sinnvoller folgende Fragen zu stellen:
1. welche Risiken bestehen für ein kleines Unternehmen in der Finalisierung einer NDA?
2. welche Zulassungschancen bestehen auf Basis der P3 Ergebnisse?
3. welche annual peak sales sind zu erwarten?
Aber in der heutigen Zeit reicht es vielen einfach nur irgendwelchen Marktschreiern auf YouTube hinterherzulaufen.
Kommen wir nun mal zur Realität. Ein Artikel, der lesenswert ist:
https://www.marketwatch.com/press-release/soligenixs-upcomin…
Annual Peak Sales von 90m$, bei entsprechendem Marktanteil könnte die MK hier auf ca. 200m laufen. Wären 7$, was sich ganz gut mit Zacks Research deckt. Aber die Finalisierung der NDA in time bleibt die große Herausforderung für Soligenix.
Antwort auf Beitrag Nr.: 66.495.968 von Malecon am 18.01.21 22:38:23
Nach einem Monat wurde die Lücke fast geschlossen, aber eben nur fast:
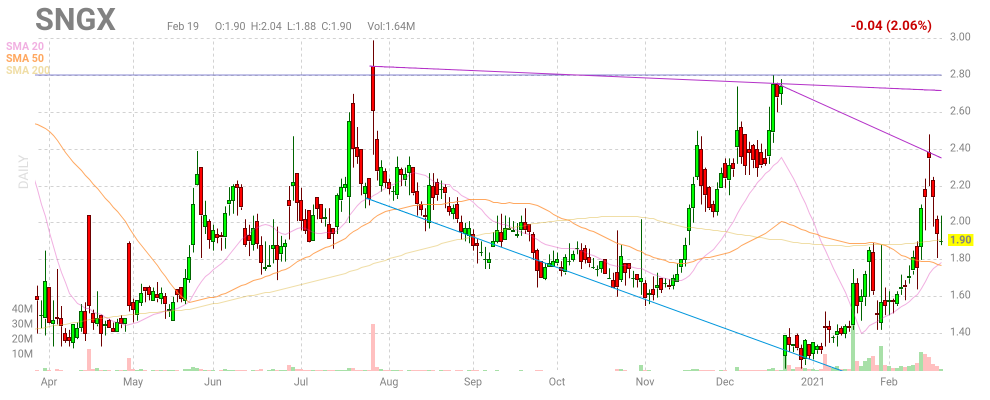
Mittlerweile läuft eine moderate Konsolidierung.
Zitat von Malecon:![]()
Bei Soligenix Inc hat der MACD im Daily die Signallinie nach oben gekreuzt:
Es gibt eine solide Kurslücke nach oben.
Heute kam noch folgender Artikel:
Soligenix – Consensus Indicates Potential 135.4% Upside
Soligenix found using ticker (SNGX) have now 5 analysts in total covering the stock. The consensus rating is ‘Buy’. The range between the high target price and low target price is between 15 and 2 and has a mean target at 6.45. Now with the previous closing price of 2.74 this indicates there is a potential upside of 135.4%.
https://www.directorstalkinterviews.com/soligenix---consensu…
💡
Nach einem Monat wurde die Lücke fast geschlossen, aber eben nur fast:

Mittlerweile läuft eine moderate Konsolidierung.
Soligenix Provides Important Highlights and Upcoming Catalysts in Corporate Update Letter
PRINCETON, N.J., Feb. 24, 2021 /PRNewswire/ -- Soligenix, Inc. (Nasdaq: SNGX) (Soligenix or the Company), a late-stage biopharmaceutical company focused on developing and commercializing products to treat rare diseases where there is an unmet medical need, today issued an update letter from its President and Chief Executive Officer, Dr. Christopher J. Schaber. The content of this letter is provided below.
Dear Friends and Shareholders,
I would like to start by thanking you for your continued support, and hope that you and your families are all healthy and well. As 2020 recedes in the rearview mirror, we seem to be turning a corner on the challenges the COVID-19 pandemic has imposed on our everyday lives with promising coronavirus vaccines and a hope to return to a more normal existence in the not too distant future. Hope and recovery appear to be the early theme of 2021, and we are energized by the promise of the coming year. Last year posed a number of challenges and some disappointment for Soligenix, but more importantly a number of successes. Most notably, our positive Phase 3 study of SGX301 (synthetic hypericin) in the treatment of cutaneous T-cell lymphoma (CTCL), allowing us to advance toward a new drug application (NDA) with the U.S. Food and Drug Administration (FDA) for marketing authorization in the not too distant future. We also debuted new opportunities in our robust pipeline, such as our novel heat stable COVID-19 vaccine candidate, CiVax™, where we announced positive preclinical results and expect more data to follow shortly. Additionally, we have followed through on our efficient and shareholder-friendly financing strategies, providing us with sufficient capital and cash runway to meet our goals through 2022 as we move towards U.S. commercialization of SGX301 in CTCL. We expect peak annual net sales of SGX301 in the U.S. to exceed $90 million, with the total addressable worldwide market estimated at approximately $250 million annually. Overall, we are excited about our near-term and future upcoming catalytic milestones.
Corporate Highlights
Since our last update, we have continued to advance our development programs across both the Specialized BioTherapeutics and Public Health Solutions business segments of our rare disease pipeline, where we currently anticipate achieving multiple important milestones in 2021 and 2022.
Specialized Biotherapeutics Business Segment
In late October, we were very happy to announce completion of our pivotal Phase 3 FLASH ("Fluorescent Light Activated Synthetic Hypericin") study with SGX301 and share the continued positive benefits for our CTCL patients. Compared to the currently approved CTCL therapies for early disease, the treatment response to SGX301 was very rapid, being detected in as little as 6 weeks of treatment (Cycle 1, p=0.0416). Responses continued to improve through 12 weeks of treatment (Cycle 2, p<0.0001 vs end Cycle 1) and 18 weeks of treatment (Cycle 3, p<0.0001 vs end Cycle 1), ultimately enabling nearly half of patients who continued treatment to see sustained and significant improvement in their response rates. SGX301 also demonstrated statistically significant responses in both patch (Cycle 2 response 37%, p=0.0009) and plaque (Cycle 2 response 42%, p<0.0001) lesions, highlighting the unique benefits of the more deeply penetrating visible light activation of hypericin. Unlike other second line and off-label therapies for CTCL, SGX301 was both better tolerated with a reduced dropout rate and more broadly effective, with equal efficacy against both plaque and patch lesions. Further, no synthetic hypericin was detected in the bloodstream of patients, minimizing safety concerns of drug effects outside of the tumor area.
As Brian Poligone, MD, PhD, Lead Enrolling Investigator in the FLASH study and Director of the Rochester Skin Lymphoma Medical Group, Fairport, NY, USA stated in the announcement, "Along with SGX301's rapid response time and safety profile, the patch and plaque data from the study are extremely compelling. Current treatments for CTCL are generally less effective against plaques and deeper lesions, very similar to the problem observed in psoriasis. The ability of SGX301 to target both patches and thicker plaques in CTCL is an important feature for this therapy and, if approved, will be of benefit to patients, regardless of their presentation. These results are consistent with the positive findings highlighted in a recently reported case study of folliculotropic mycosis fungoides, a hard to treat variant of CTCL where lesions are associated with the hair follicles deep in the skin and more resistant to phototherapy."
With the study complete, we are now preparing to begin submission of the rolling NDA in 2Q 2021 for this first-in-class therapy. SGX301 has received Orphan Drug and Fast Track designations from the FDA. Additionally, SGX301 was granted Orphan Drug designation from the European Medicines Agency (EMA) and Promising Innovative Medicine designation from the Medicines and Healthcare products Regulatory Agency in the United Kingdom.
January 2021 was a busy month for us. We announced a strategic partnership with Daavlin, a leading manufacturer of phototherapy products used worldwide by dermatologists and patients, for supply and distribution of our SGX301 companion light device. This exclusive supply, distribution and services agreement with Daavlin will secure long-term supply and distribution of a commercially ready light device that is an integral component of the regulatory and commercial strategy for SGX301 for the treatment of CTCL. We also held an investor webcast event to discuss the unique U.S. commercialization opportunity for SGX301 in the treatment of CTCL. During the webcast, we reviewed in some detail the disease, competitive landscape, and our intent to commercialize SGX301 ourselves in a cost efficient and most profitable manner. As CTCL is a highly specialized orphan market with a discrete prescriber base, it presents a tailor-made market opportunity for us, where peak annual net sales in the U.S. are expected to exceed $90 million, with total U.S. revenues during the 10-year forecast period projected to be greater than $700 million.
As Michael Young our acting Chief Marketing Officer and Principal, biomedwoRx: Life Sciences Consulting and a Board member of the Cutaneous Lymphoma Foundation stated, "The value proposition for SGX301 is designed around maximizing the opportunity while minimizing the needed commercial investment, and represents a significant therapeutic opportunity in changing the landscape for treatment of early stage CTCL disease."
During this webcast, we also discussed at a high level the analysis that went into our determination to ultimately commercialize in the U.S. versus partnership. This decision was, in large part, based on maintaining 100% of SGX301's value with a very reasonable commercial build and launch expense of approximately $7 million compared to us retaining less than half of its value with partnering. I would urge all those that want to better understand what a unique value proposition SGX301 in CTCL represents to listen to the full webcast here.
We remain steadfast in our plans for partnership in the ex-U.S. markets and are in a number of active discussions with potential partners with similar reputation and expertise in this therapeutic area. We anticipate receiving marketing approval in the U.S. first, and with this approval in hand we will aggressively pursue marketing authorizations in other key markets worldwide. Given SGX301's success in CTCL, we are now evaluating other potential cutaneous oncology indications that might similarly benefit from the use of our first-in-class synthetic hypericin.
As many of you know, in December, we announced preliminary top-line results for our pivotal Phase 3 DOM-INNATE (Dusquetide treatment in Oral Mucositis – by modulating INNATE Immunity) trial evaluating SGX942 (dusquetide) in the treatment of severe oral mucositis (SOM) in patients with head and neck cancer (HNC) receiving chemoradiation. The study enrolled 268 patients randomized 1:1 to receive either SGX942 or placebo. The primary endpoint of median duration of SOM did not achieve the pre-specified criterion for statistical significance (p≤0.05); although biological activity was clearly observed with a 56% reduction in the median duration of SOM from 18 days in the placebo group to 8 days in the SGX942 treatment group. Other secondary endpoints supported the biological activity of dusquetide as well, including a statistically significant 50% reduction in the duration of SOM in the per-protocol population, which decreased from 18 days in the placebo group to 9 days in the SGX942 treatment group (p=0.049), consistent with the findings in the Phase 2 trial.
As I noted during our investor call, we are very disappointed with this unanticipated outcome of the study. Despite the fact that SGX942 demonstrated clinically meaningful reductions in oral mucositis consistent with the previous Phase 2 study, the Phase 3 trial did not achieve the statistically significant benefit we expected. We are continuing to analyze the full dataset to better understand why the study did not meet expectations. Any clarity gained from further analysis of the dataset, especially with respect to specific subsets of patients that may benefit from SGX942 therapy, will be communicated to and discussed with the FDA and the EMA.
Public Health Solutions Business Segment
We most recently announced a number of exciting developments in the area of emerging infectious diseases. We were awarded a Direct to Phase II Small Business Innovation Research grant of approximately $1.5 million from the National Institute of Allergy and Infectious Diseases (NIAID), part of the National Institutes of Health (NIH), to support manufacture, formulation (including thermostabilization) and characterization of COVID-19 (Coronavirus Disease 2019) and Ebola Virus Disease vaccine candidates in conjunction with our CoVaccine HT™ (CoVaccine) adjuvant. This award also will support immune characterization of this novel, emulsified adjuvant that has unique potency and compatibility with lyophilization strategies to enable thermostabilization of subunit vaccines.
Ongoing collaborations with Axel Lehrer, PhD, Associate Professor (Vaccinology) in the Department of Tropical Medicine, Medical Microbiology and Pharmacology, John A. Burns School of Medicine (JABSOM), University of Hawaiʻi at Mānoa (UHM), have demonstrated the feasibility of developing a highly immunogenic vaccine for COVID-19, the infection caused by SARS-CoV-2. This heat stable subunit vaccine program, we call CiVax™, demonstrated immunity of both broad-spectrum antibody and cell-mediated, rapid onset immunity using the CoVaccine adjuvant in-licensed from BTG Specialty Pharmaceuticals, a division of Boston Scientific Corporation. With significant research dedicated worldwide to the generation of COVID-19 vaccines, it is noteworthy that the essential attributes of a vaccine successful in controlling the ongoing pandemic are believed to include the ability to rapidly stimulate a Th1/Th2 balanced antibody response, raising significant virus neutralizing antibodies, as well as induce potent cell-mediated immunity. Previous work with the CoVaccine adjuvant has indicated that it has these critical characteristics. In addition, unlike other vaccines that have logistical challenges due to cold chain requirements (in some cases requiring maintenance of temperatures less than –70 degrees Celsius), the underlying technology platform has demonstrated the ability to produce single vial vaccines which are stable up to temperatures at least as high as 40 degrees Celsius (104 degrees Fahrenheit). We expect to have proof of concept data in non-human primates (NHPs) no later than the end of Q2 this year.
We followed this up with an announcement that we had demonstrated feasibility of developing heat stable subunit protein vaccine formulations for filovirus vaccines, including Ebola virus, Sudan virus, and Marburg virus. Protective efficacy has been demonstrated in NHPs, the gold standard animal model, against infection with Ebola virus, Sudan virus, and Marburg virus. Formulation conditions have been identified to enable heat stabilization of each antigen, alone or in combination, for at least 12 weeks at 40 degrees Celsius. These most recent results demonstrate the thermostabilization of three virus glycoproteins (from Zaire ebolavirus, Sudan ebolavirus and Marburg marburgvirus), and the identification of key stability-indicating assays to further support mono-, bi- and tri-valent vaccine formulations.
In December, we demonstrated extended protection with our heat stable ricin toxin vaccine candidate, RiVax®. Mice, vaccinated twice on Days 1 and 21 were protected for at least 365 days against subsequent ricin challenge. These results demonstrate that the thermostabilized vaccine formulation is capable of eliciting enduring protection in mice. Coupled with previous demonstration of efficacy in mice and NHPs as well as long-term thermostability (at least 1 year at 40 degrees Celsius or 104 degrees Fahrenheit), these results reinforce the practicality of stockpiling and potentially utilizing the RiVax® vaccine in warfighters and civilian first responders without the complexities that arise for vaccines that require cold chain handling. This same thermostabilization approach is also being advanced in the development of Soligenix's CiVax™ vaccine for COVID-19.
RiVax® has received Orphan Drug designation as well as Fast Track designation from the FDA, and, as a new chemical entity, upon approval in the US, has the potential to qualify for a biodefense Priority Review Voucher (PRV). PRVs are transferable and can be sold, with sales in recent years of approximately $100 million. Additionally, RiVax® was granted Orphan Drug designation from the EMA. Recent events, including the news of an envelope addressed to President Trump that was thought to contain this potent and potentially lethal toxin, as well as a foiled bio attack with ricin in Germany, suggest that the RiVax® vaccine may be of increasing interest to multiple countries.
Balance Sheet and Capital
With more than $30 million in cash as of February 2021, not including our non-dilutive government funding, we are now sufficiently capitalized to achieve multiple key inflection points across our rare disease pipeline, including moving towards NDA and commercialization of SGX301. This increase in capital was due to two important events.
A $20 million strategic partnership with Pontifax Medison, the healthcare-dedicated venture and debt fund of the Pontifax life science funds, in December. Under the terms of the partnership with Pontifax, Soligenix will have access to up to $20 million in convertible debt financing in three tranches, which will mature over a four-and-a-half-year period and have an interest-only period for the first two years. Upon the closing of this transaction, we accessed the first tranche of $10 million, and have the option to draw the second tranche of $5 million at any time over the next 12 months and the third tranche of $5 million upon filing of the SGX301 NDA, subject to certain conditions. Pontifax may elect to convert the outstanding loan drawn under the first two tranches into shares of Soligenix's common stock at any time prior to repayment at a conversion price of $4.10 per share. We also have the ability to force the conversion of the loan into shares of our common stock at a conversion price of $4.92 per share, subject to certain conditions.
The use of our at-the-market (ATM) sales issuance agreement with B. Riley Securities, Inc. over the last two months to supplement our cash runway. Given the significant increase in both stock price and volume, with more than 186 million shares traded so far during 2021, we were able to add capital to our balance sheet judiciously while limiting sales to an extremely small percentage (approximately 4.6%) of the overall volume.
The combination of these two facilities provides significant cash runway through 2022. With a solid balance sheet and other available resources at our disposal, such as non-dilutive government funding, we are well positioned to aggressively advance and expand our pipeline. We also continue to have ongoing confidential business development discussions, which may lead to more favorable capital inflows, including the potential to receive additional non-dilutive capital. Overall, we continue to remain mindful of dilution and will look at all future capital inflow initiatives in the most efficient and shareholder-friendly manner as possible.
In closing, thank you for your interest and your ongoing support of Soligenix. It continues to be a very exciting time in our life cycle and late stage pipeline. We look forward to 2021 being even more productive than 2020, with the potential for multiple near-term catalysts on the horizon as we further advance our development programs towards commercialization. Best wishes!
Dr. Christopher J. Schaber
President and Chief Executive Officer
Soligenix, Inc.
February 24, 2021
https://www.prnewswire.com/news-releases/soligenix-provides-…
PRINCETON, N.J., Feb. 24, 2021 /PRNewswire/ -- Soligenix, Inc. (Nasdaq: SNGX) (Soligenix or the Company), a late-stage biopharmaceutical company focused on developing and commercializing products to treat rare diseases where there is an unmet medical need, today issued an update letter from its President and Chief Executive Officer, Dr. Christopher J. Schaber. The content of this letter is provided below.
Dear Friends and Shareholders,
I would like to start by thanking you for your continued support, and hope that you and your families are all healthy and well. As 2020 recedes in the rearview mirror, we seem to be turning a corner on the challenges the COVID-19 pandemic has imposed on our everyday lives with promising coronavirus vaccines and a hope to return to a more normal existence in the not too distant future. Hope and recovery appear to be the early theme of 2021, and we are energized by the promise of the coming year. Last year posed a number of challenges and some disappointment for Soligenix, but more importantly a number of successes. Most notably, our positive Phase 3 study of SGX301 (synthetic hypericin) in the treatment of cutaneous T-cell lymphoma (CTCL), allowing us to advance toward a new drug application (NDA) with the U.S. Food and Drug Administration (FDA) for marketing authorization in the not too distant future. We also debuted new opportunities in our robust pipeline, such as our novel heat stable COVID-19 vaccine candidate, CiVax™, where we announced positive preclinical results and expect more data to follow shortly. Additionally, we have followed through on our efficient and shareholder-friendly financing strategies, providing us with sufficient capital and cash runway to meet our goals through 2022 as we move towards U.S. commercialization of SGX301 in CTCL. We expect peak annual net sales of SGX301 in the U.S. to exceed $90 million, with the total addressable worldwide market estimated at approximately $250 million annually. Overall, we are excited about our near-term and future upcoming catalytic milestones.
Corporate Highlights
Since our last update, we have continued to advance our development programs across both the Specialized BioTherapeutics and Public Health Solutions business segments of our rare disease pipeline, where we currently anticipate achieving multiple important milestones in 2021 and 2022.
Specialized Biotherapeutics Business Segment
In late October, we were very happy to announce completion of our pivotal Phase 3 FLASH ("Fluorescent Light Activated Synthetic Hypericin") study with SGX301 and share the continued positive benefits for our CTCL patients. Compared to the currently approved CTCL therapies for early disease, the treatment response to SGX301 was very rapid, being detected in as little as 6 weeks of treatment (Cycle 1, p=0.0416). Responses continued to improve through 12 weeks of treatment (Cycle 2, p<0.0001 vs end Cycle 1) and 18 weeks of treatment (Cycle 3, p<0.0001 vs end Cycle 1), ultimately enabling nearly half of patients who continued treatment to see sustained and significant improvement in their response rates. SGX301 also demonstrated statistically significant responses in both patch (Cycle 2 response 37%, p=0.0009) and plaque (Cycle 2 response 42%, p<0.0001) lesions, highlighting the unique benefits of the more deeply penetrating visible light activation of hypericin. Unlike other second line and off-label therapies for CTCL, SGX301 was both better tolerated with a reduced dropout rate and more broadly effective, with equal efficacy against both plaque and patch lesions. Further, no synthetic hypericin was detected in the bloodstream of patients, minimizing safety concerns of drug effects outside of the tumor area.
As Brian Poligone, MD, PhD, Lead Enrolling Investigator in the FLASH study and Director of the Rochester Skin Lymphoma Medical Group, Fairport, NY, USA stated in the announcement, "Along with SGX301's rapid response time and safety profile, the patch and plaque data from the study are extremely compelling. Current treatments for CTCL are generally less effective against plaques and deeper lesions, very similar to the problem observed in psoriasis. The ability of SGX301 to target both patches and thicker plaques in CTCL is an important feature for this therapy and, if approved, will be of benefit to patients, regardless of their presentation. These results are consistent with the positive findings highlighted in a recently reported case study of folliculotropic mycosis fungoides, a hard to treat variant of CTCL where lesions are associated with the hair follicles deep in the skin and more resistant to phototherapy."
With the study complete, we are now preparing to begin submission of the rolling NDA in 2Q 2021 for this first-in-class therapy. SGX301 has received Orphan Drug and Fast Track designations from the FDA. Additionally, SGX301 was granted Orphan Drug designation from the European Medicines Agency (EMA) and Promising Innovative Medicine designation from the Medicines and Healthcare products Regulatory Agency in the United Kingdom.
January 2021 was a busy month for us. We announced a strategic partnership with Daavlin, a leading manufacturer of phototherapy products used worldwide by dermatologists and patients, for supply and distribution of our SGX301 companion light device. This exclusive supply, distribution and services agreement with Daavlin will secure long-term supply and distribution of a commercially ready light device that is an integral component of the regulatory and commercial strategy for SGX301 for the treatment of CTCL. We also held an investor webcast event to discuss the unique U.S. commercialization opportunity for SGX301 in the treatment of CTCL. During the webcast, we reviewed in some detail the disease, competitive landscape, and our intent to commercialize SGX301 ourselves in a cost efficient and most profitable manner. As CTCL is a highly specialized orphan market with a discrete prescriber base, it presents a tailor-made market opportunity for us, where peak annual net sales in the U.S. are expected to exceed $90 million, with total U.S. revenues during the 10-year forecast period projected to be greater than $700 million.
As Michael Young our acting Chief Marketing Officer and Principal, biomedwoRx: Life Sciences Consulting and a Board member of the Cutaneous Lymphoma Foundation stated, "The value proposition for SGX301 is designed around maximizing the opportunity while minimizing the needed commercial investment, and represents a significant therapeutic opportunity in changing the landscape for treatment of early stage CTCL disease."
During this webcast, we also discussed at a high level the analysis that went into our determination to ultimately commercialize in the U.S. versus partnership. This decision was, in large part, based on maintaining 100% of SGX301's value with a very reasonable commercial build and launch expense of approximately $7 million compared to us retaining less than half of its value with partnering. I would urge all those that want to better understand what a unique value proposition SGX301 in CTCL represents to listen to the full webcast here.
We remain steadfast in our plans for partnership in the ex-U.S. markets and are in a number of active discussions with potential partners with similar reputation and expertise in this therapeutic area. We anticipate receiving marketing approval in the U.S. first, and with this approval in hand we will aggressively pursue marketing authorizations in other key markets worldwide. Given SGX301's success in CTCL, we are now evaluating other potential cutaneous oncology indications that might similarly benefit from the use of our first-in-class synthetic hypericin.
As many of you know, in December, we announced preliminary top-line results for our pivotal Phase 3 DOM-INNATE (Dusquetide treatment in Oral Mucositis – by modulating INNATE Immunity) trial evaluating SGX942 (dusquetide) in the treatment of severe oral mucositis (SOM) in patients with head and neck cancer (HNC) receiving chemoradiation. The study enrolled 268 patients randomized 1:1 to receive either SGX942 or placebo. The primary endpoint of median duration of SOM did not achieve the pre-specified criterion for statistical significance (p≤0.05); although biological activity was clearly observed with a 56% reduction in the median duration of SOM from 18 days in the placebo group to 8 days in the SGX942 treatment group. Other secondary endpoints supported the biological activity of dusquetide as well, including a statistically significant 50% reduction in the duration of SOM in the per-protocol population, which decreased from 18 days in the placebo group to 9 days in the SGX942 treatment group (p=0.049), consistent with the findings in the Phase 2 trial.
As I noted during our investor call, we are very disappointed with this unanticipated outcome of the study. Despite the fact that SGX942 demonstrated clinically meaningful reductions in oral mucositis consistent with the previous Phase 2 study, the Phase 3 trial did not achieve the statistically significant benefit we expected. We are continuing to analyze the full dataset to better understand why the study did not meet expectations. Any clarity gained from further analysis of the dataset, especially with respect to specific subsets of patients that may benefit from SGX942 therapy, will be communicated to and discussed with the FDA and the EMA.
Public Health Solutions Business Segment
We most recently announced a number of exciting developments in the area of emerging infectious diseases. We were awarded a Direct to Phase II Small Business Innovation Research grant of approximately $1.5 million from the National Institute of Allergy and Infectious Diseases (NIAID), part of the National Institutes of Health (NIH), to support manufacture, formulation (including thermostabilization) and characterization of COVID-19 (Coronavirus Disease 2019) and Ebola Virus Disease vaccine candidates in conjunction with our CoVaccine HT™ (CoVaccine) adjuvant. This award also will support immune characterization of this novel, emulsified adjuvant that has unique potency and compatibility with lyophilization strategies to enable thermostabilization of subunit vaccines.
Ongoing collaborations with Axel Lehrer, PhD, Associate Professor (Vaccinology) in the Department of Tropical Medicine, Medical Microbiology and Pharmacology, John A. Burns School of Medicine (JABSOM), University of Hawaiʻi at Mānoa (UHM), have demonstrated the feasibility of developing a highly immunogenic vaccine for COVID-19, the infection caused by SARS-CoV-2. This heat stable subunit vaccine program, we call CiVax™, demonstrated immunity of both broad-spectrum antibody and cell-mediated, rapid onset immunity using the CoVaccine adjuvant in-licensed from BTG Specialty Pharmaceuticals, a division of Boston Scientific Corporation. With significant research dedicated worldwide to the generation of COVID-19 vaccines, it is noteworthy that the essential attributes of a vaccine successful in controlling the ongoing pandemic are believed to include the ability to rapidly stimulate a Th1/Th2 balanced antibody response, raising significant virus neutralizing antibodies, as well as induce potent cell-mediated immunity. Previous work with the CoVaccine adjuvant has indicated that it has these critical characteristics. In addition, unlike other vaccines that have logistical challenges due to cold chain requirements (in some cases requiring maintenance of temperatures less than –70 degrees Celsius), the underlying technology platform has demonstrated the ability to produce single vial vaccines which are stable up to temperatures at least as high as 40 degrees Celsius (104 degrees Fahrenheit). We expect to have proof of concept data in non-human primates (NHPs) no later than the end of Q2 this year.
We followed this up with an announcement that we had demonstrated feasibility of developing heat stable subunit protein vaccine formulations for filovirus vaccines, including Ebola virus, Sudan virus, and Marburg virus. Protective efficacy has been demonstrated in NHPs, the gold standard animal model, against infection with Ebola virus, Sudan virus, and Marburg virus. Formulation conditions have been identified to enable heat stabilization of each antigen, alone or in combination, for at least 12 weeks at 40 degrees Celsius. These most recent results demonstrate the thermostabilization of three virus glycoproteins (from Zaire ebolavirus, Sudan ebolavirus and Marburg marburgvirus), and the identification of key stability-indicating assays to further support mono-, bi- and tri-valent vaccine formulations.
In December, we demonstrated extended protection with our heat stable ricin toxin vaccine candidate, RiVax®. Mice, vaccinated twice on Days 1 and 21 were protected for at least 365 days against subsequent ricin challenge. These results demonstrate that the thermostabilized vaccine formulation is capable of eliciting enduring protection in mice. Coupled with previous demonstration of efficacy in mice and NHPs as well as long-term thermostability (at least 1 year at 40 degrees Celsius or 104 degrees Fahrenheit), these results reinforce the practicality of stockpiling and potentially utilizing the RiVax® vaccine in warfighters and civilian first responders without the complexities that arise for vaccines that require cold chain handling. This same thermostabilization approach is also being advanced in the development of Soligenix's CiVax™ vaccine for COVID-19.
RiVax® has received Orphan Drug designation as well as Fast Track designation from the FDA, and, as a new chemical entity, upon approval in the US, has the potential to qualify for a biodefense Priority Review Voucher (PRV). PRVs are transferable and can be sold, with sales in recent years of approximately $100 million. Additionally, RiVax® was granted Orphan Drug designation from the EMA. Recent events, including the news of an envelope addressed to President Trump that was thought to contain this potent and potentially lethal toxin, as well as a foiled bio attack with ricin in Germany, suggest that the RiVax® vaccine may be of increasing interest to multiple countries.
Balance Sheet and Capital
With more than $30 million in cash as of February 2021, not including our non-dilutive government funding, we are now sufficiently capitalized to achieve multiple key inflection points across our rare disease pipeline, including moving towards NDA and commercialization of SGX301. This increase in capital was due to two important events.
A $20 million strategic partnership with Pontifax Medison, the healthcare-dedicated venture and debt fund of the Pontifax life science funds, in December. Under the terms of the partnership with Pontifax, Soligenix will have access to up to $20 million in convertible debt financing in three tranches, which will mature over a four-and-a-half-year period and have an interest-only period for the first two years. Upon the closing of this transaction, we accessed the first tranche of $10 million, and have the option to draw the second tranche of $5 million at any time over the next 12 months and the third tranche of $5 million upon filing of the SGX301 NDA, subject to certain conditions. Pontifax may elect to convert the outstanding loan drawn under the first two tranches into shares of Soligenix's common stock at any time prior to repayment at a conversion price of $4.10 per share. We also have the ability to force the conversion of the loan into shares of our common stock at a conversion price of $4.92 per share, subject to certain conditions.
The use of our at-the-market (ATM) sales issuance agreement with B. Riley Securities, Inc. over the last two months to supplement our cash runway. Given the significant increase in both stock price and volume, with more than 186 million shares traded so far during 2021, we were able to add capital to our balance sheet judiciously while limiting sales to an extremely small percentage (approximately 4.6%) of the overall volume.
The combination of these two facilities provides significant cash runway through 2022. With a solid balance sheet and other available resources at our disposal, such as non-dilutive government funding, we are well positioned to aggressively advance and expand our pipeline. We also continue to have ongoing confidential business development discussions, which may lead to more favorable capital inflows, including the potential to receive additional non-dilutive capital. Overall, we continue to remain mindful of dilution and will look at all future capital inflow initiatives in the most efficient and shareholder-friendly manner as possible.
In closing, thank you for your interest and your ongoing support of Soligenix. It continues to be a very exciting time in our life cycle and late stage pipeline. We look forward to 2021 being even more productive than 2020, with the potential for multiple near-term catalysts on the horizon as we further advance our development programs towards commercialization. Best wishes!
Dr. Christopher J. Schaber
President and Chief Executive Officer
Soligenix, Inc.
February 24, 2021
https://www.prnewswire.com/news-releases/soligenix-provides-…
gestern auch noch ne news :
Soligenix is Ready for Commercialization of SGX301 (HyBryte(TM)); FDA Has Approval Process on Fast Track
https://finance.yahoo.com/news/soligenix-ready-commercializa…
Soligenix is Ready for Commercialization of SGX301 (HyBryte(TM)); FDA Has Approval Process on Fast Track
https://finance.yahoo.com/news/soligenix-ready-commercializa…
Es geht wieder los, gute Daten aus der CiVax Studie :-)
http://ir.soligenix.com/2021-03-04-Soligenix-Announces-Posit…
http://ir.soligenix.com/2021-03-04-Soligenix-Announces-Posit…
Antwort auf Beitrag Nr.: 67.303.647 von Niller84 am 04.03.21 13:15:04
Hoffe mal nachhaltig
Zitat von Niller84: Es geht wieder los, gute Daten aus der CiVax Studie :-)
http://ir.soligenix.com/2021-03-04-Soligenix-Announces-Posit…
Hoffe mal nachhaltig

Mal schauen , was aus der Studie wird, schaue mir das noch Long an. Werde aber auch bei Algernon einsteigen, die präsentieren die Woche ihre Ergebnisse aus der COVID Phase 2 Studie
Soligenix erhält die bedingte FDA-Zulassung des vorgeschlagenen Markennamens HyBryte ™ für SGX301 in CTCL.
https://finance.yahoo.com/news/soligenix-receives-conditiona…
https://finance.yahoo.com/news/soligenix-receives-conditiona…
Mal wieder grün hier nach langer zeit
Schon seit Tagen kennt der Kurs nur eine Richtung, wobei die Anzahl der Aktien zu den Tarades niedrig sind, Kann sich hier einer einen Reim darauf machen?
Nur warten ist hier angesagt
Soligenix, Inc. (the “Company”) recently had discussions with the U.S. Food and Drug Administration (“FDA”) regarding the HyBryte™ (SGX301) new drug application (“NDA”) submission. Based upon these discussions and given delays in manufacturing, in part caused by the global COVID-19 pandemic, on May 7, 2021, the Company decided not to pursue a rolling NDA submission at this time, in order to provide additional supportive data for inclusion in the NDA filing. The Company now plans to submit the NDA in the first half of 2022 with corresponding potential FDA approval adjusted to the first half of 2023.
Current report pursuant to Section 13 or 15(d) - Form 8-K
kam gestern moch nachbörslich, der kurs fiel noch unter 1 dollar.
gibt am montag einen schönen ausverkauf.
Current report pursuant to Section 13 or 15(d) - Form 8-K
kam gestern moch nachbörslich, der kurs fiel noch unter 1 dollar.
gibt am montag einen schönen ausverkauf.
Antwort auf Beitrag Nr.: 66.996.425 von bcgk am 13.02.21 21:40:49
Man ist erwartungsgemäß daran gescheitert. Die Verschiebung um fast 1 Jahr ist natürlich ein Joke. Wer die Aktie noch hat, sollte sie spätestens Montag verkaufen.
JMHO.
Zitat von bcgk: Vielleicht wäre es sinnvoller folgende Fragen zu stellen:
1. welche Risiken bestehen für ein kleines Unternehmen in der Finalisierung einer NDA?
2. welche Zulassungschancen bestehen auf Basis der P3 Ergebnisse?
3. welche annual peak sales sind zu erwarten?
[...]
Aber die Finalisierung der NDA in time bleibt die große Herausforderung für Soligenix.
Man ist erwartungsgemäß daran gescheitert. Die Verschiebung um fast 1 Jahr ist natürlich ein Joke. Wer die Aktie noch hat, sollte sie spätestens Montag verkaufen.
JMHO.
bin mit kleinem geld noch drin ,und hab jetzt nochmal für montag ein kleines körbchen aufgestellt bei 0,58$ ,für den fall der absoluten übertreibung nach unten.
Sollte am Montag der Kurs wirklich drastisch falle, macht es im Moment auch keinen Sinn mehr zu verkaufen. Jetzt kann man nur noch wieder 1 Jahr warten, mindestens. Ich bin hier schon lange invesiert, mit größerer Postion, und ärgere mich natürlich.
Es würde trotzdem Sinn machen, erst einmal Verluste realisieren. Die kann man mit anderen Aktien verrechnen. Später wieder günstig einsteigen ist immer möglich. Aber kurzfristig bieten andere Aktien mehr Chancen. 2 Jahre auf den Buchverlusten sitzenbleiben macht auch keinen Sinn.
Wäre höchstens noch zu prüfen, ob noch andere Sachen in der Pipeline sind, welche kurzfristig für positive Signale sorgen könnten. Es gab ja mehrere Meilensteine dieses Jahr, die sie erreichen wollten.
Wäre höchstens noch zu prüfen, ob noch andere Sachen in der Pipeline sind, welche kurzfristig für positive Signale sorgen könnten. Es gab ja mehrere Meilensteine dieses Jahr, die sie erreichen wollten.
Also ich bleibe weiterhin investiert....und es wäre auch nicht das 1.Mal ...wenn wir bereits in kurzer Zeit (6 Monate ) einen deutlichem Anstieg aufgrund anderer positiver News sehen werden...
Die Suppe wird nie so heiss gegessen...wie sie gekocht wird ....
I'm waiting (again) ....
Die Suppe wird nie so heiss gegessen...wie sie gekocht wird ....
I'm waiting (again) ....
Habe gestern nachgekauft, hoffentlich nicht zu früh. EK nun etwas geringer.
Antwort auf Beitrag Nr.: 68.121.541 von vinod am 09.05.21 17:57:33Und für uns beide...kommt es doch jetzt wirklich nicht auf 1 oder 2 Jahre an ....✌
Antwort auf Beitrag Nr.: 68.172.325 von rokz am 13.05.21 08:39:58Aber sowas von alles richtig gemacht. Heute geht es wirklich ordentlich nach oben. Da kommt garantiert morgen wieder ein Rücksetzer.
https://finance.yahoo.com/news/soligenix-receives-pediatric-…
Pediatric waiver der EMA.... gute Nachrichten, da die Kosten für eine Zulassung in der EU damit deutlich kleiner werden. Dem Markt scheint es bisher zu gefallen
Pediatric waiver der EMA.... gute Nachrichten, da die Kosten für eine Zulassung in der EU damit deutlich kleiner werden. Dem Markt scheint es bisher zu gefallen
Antwort auf Beitrag Nr.: 68.467.934 von StellaVella am 10.06.21 13:42:13Spart Zeit und Geld 👌
https://seekingalpha.com/news/3704944-soligenix-soars-13-aft…
https://seekingalpha.com/news/3704944-soligenix-soars-13-aft…
Looks good 👍👍👍
Ich weiß es ist schon etwas spät, aber weiß jemand was los ist? 25% im plus?
Hallo Zusammen, weiß jemand warum es hier wieder nach unten geht? Der Gesamtmarkt sieht doch eigentlich ganz gut aus.
Antwort auf Beitrag Nr.: 68.798.690 von vinod am 16.07.21 15:41:19Nein .....es gibt nichts negatives zu berichten....wenigstens haben wir mal wieder grün geschlossen .....ist ein Anfang 👍
Weiß jemand warum der Kurs jetzt nach unten geht, bei dem Volumen?
Antwort auf Beitrag Nr.: 69.087.119 von vinod am 18.08.21 16:29:36Newstrading und Gewinnmitnahmen würde ich mal vermuten.
Und es geht wieder nach oben ....AH +7%....
Ich hoffe, dass der Anstieg diesesmal bleibt, würde mich freuen
Antwort auf Beitrag Nr.: 69.279.864 von ELKO82 am 09.09.21 13:47:37
aehm, Orphan Drug Designation für T-cell lymphoma, neben CTCL. Sicherlich sehr positiv, da es die Patientenpopulation vergrößert sowie mit einigen finanziellen Benefits verbunden ist. Aber: kein Approval.
Zitat von ELKO82: FDA Approval
https://ir.soligenix.com/2021-09-09-FDA-Grants-Soligenix-Orp…
aehm, Orphan Drug Designation für T-cell lymphoma, neben CTCL. Sicherlich sehr positiv, da es die Patientenpopulation vergrößert sowie mit einigen finanziellen Benefits verbunden ist. Aber: kein Approval.
Antwort auf Beitrag Nr.: 69.280.251 von StellaVella am 09.09.21 14:15:49Danke für die Klarstellung.
Schöner Anstieg heute, weiß jemand was los ist? Mal sehen, wie lange es diesmal hält🤔🤔
Antwort auf Beitrag Nr.: 69.543.807 von vinod am 08.10.21 13:34:15
Was soll man davon halten?
Marburg
https://uncutnews.ch/eine-moegliche-marburg-rivax-endloesung…Was soll man davon halten?
Antwort auf Beitrag Nr.: 69.543.807 von vinod am 08.10.21 13:34:15
Was soll man davon halten?
Fake, oder?
Marburg
https://uncutnews.ch/eine-moegliche-marburg-rivax-endloesung…Was soll man davon halten?
Fake, oder?
Antwort auf Beitrag Nr.: 69.545.664 von DarkSideOfTheBoom am 08.10.21 16:06:05Hmm, ich hab gerade ein Video erhalten wo ein Typ darüber spricht. Deswegen meine Recherche. In der heutigen Zeit weiß man ja nie 😂 Wenn ich Bill Gates auf der Seite finde dann läuten die Alarmglocken.
WIE DER MATCHING-FONDS FINANZIERT WIRD
Der Gavi Matching Fund wurde in Partnerschaft mit der Bill & Melinda Gates Foundation (BMGF) und dem britischen Ministerium für internationale Entwicklung gegründet. Zusammen versprachen sie das Äquivalent von 111 Millionen US-Dollar1 für den Zeitraum 2011-2015 (50 Millionen US-Dollar bzw. 61 Millionen US-Dollar). Diese Verpflichtungen wurden verwendet, um die Beiträge von Unternehmen und ihren Mitarbeitern, Stiftungen und anderen Organisationen abzugleichen, was zu insgesamt 210 Millionen US-Dollar führte, die Gavi für den Zeitraum 2011-2015 zugesagt wurden.
https://www.gavi.org/vaccineswork/next-pandemic/marburg
WIE DER MATCHING-FONDS FINANZIERT WIRD
Der Gavi Matching Fund wurde in Partnerschaft mit der Bill & Melinda Gates Foundation (BMGF) und dem britischen Ministerium für internationale Entwicklung gegründet. Zusammen versprachen sie das Äquivalent von 111 Millionen US-Dollar1 für den Zeitraum 2011-2015 (50 Millionen US-Dollar bzw. 61 Millionen US-Dollar). Diese Verpflichtungen wurden verwendet, um die Beiträge von Unternehmen und ihren Mitarbeitern, Stiftungen und anderen Organisationen abzugleichen, was zu insgesamt 210 Millionen US-Dollar führte, die Gavi für den Zeitraum 2011-2015 zugesagt wurden.
https://www.gavi.org/vaccineswork/next-pandemic/marburg
Schließt sich der Kreis? Puh 🙄
Über IDRI
Das Infectious Disease Research Institute (IDRI) ist eine in Seattle ansässige gemeinnützige Organisation, die sich der Anwendung innovativer Wissenschaft auf die Forschung und Entwicklung von Produkten zur Prävention, Erkennung und Behandlung von Infektionskrankheiten der Armut verschrieben hat. Durch die Integration von Fähigkeiten, einschließlich der Entdeckung von Medikamenten im Frühstadium, präklinischen Tests, Herstellung und klinischen Studien, ist IDRI bestrebt, einen effizienten Weg zu schaffen, der wissenschaftliche Innovationen vom Labor zu den Menschen bringt, die sie am dringendsten benötigen. IDRI erhält zahlreiche Zuschüsse der Pharmaindustrie, der US-Regierung und der Bill & Melinda Gates Foundation für die Entwicklung neuer Medikamente, Impfstoffe und verwandter Technologien. Weitere Informationen finden Sie unter www.idri.org.
https://ir.soligenix.com/2012-06-27-soligenix-announces-coll…
Über IDRI
Das Infectious Disease Research Institute (IDRI) ist eine in Seattle ansässige gemeinnützige Organisation, die sich der Anwendung innovativer Wissenschaft auf die Forschung und Entwicklung von Produkten zur Prävention, Erkennung und Behandlung von Infektionskrankheiten der Armut verschrieben hat. Durch die Integration von Fähigkeiten, einschließlich der Entdeckung von Medikamenten im Frühstadium, präklinischen Tests, Herstellung und klinischen Studien, ist IDRI bestrebt, einen effizienten Weg zu schaffen, der wissenschaftliche Innovationen vom Labor zu den Menschen bringt, die sie am dringendsten benötigen. IDRI erhält zahlreiche Zuschüsse der Pharmaindustrie, der US-Regierung und der Bill & Melinda Gates Foundation für die Entwicklung neuer Medikamente, Impfstoffe und verwandter Technologien. Weitere Informationen finden Sie unter www.idri.org.
https://ir.soligenix.com/2012-06-27-soligenix-announces-coll…
Was war der Auslöser bei der Aktie für den Kursverlust von einst 20$ +?
Weiß jemand, was wir den Anstieg verdanken? freue mich zwar nach der langen Talfahrt, bin allerdings skeptisch, wie lange das hält
https://ir.soligenix.com/2021-12-02-Soligenix-Announces-Successful-Protection-using-a-Bivalent-Thermostabilized-Filovirus-Vaccine
hi, also ich finde das sind schon mal news in die richtige Richtung
Antwort auf Beitrag Nr.: 70.104.800 von Ulimit1L am 02.12.21 20:16:03So isses 👍
warum fällt aber der Kurs trotz guter Nachrichten ?🙄😟🤔
Antwort auf Beitrag Nr.: 70.116.503 von vinod am 03.12.21 19:34:35Im Moment ist das einfach kein normaler Handel ...und zwar nirgends ...
Hier fällts doch immer.
Antwort auf Beitrag Nr.: 70.388.737 von StellaVella am 04.01.22 13:45:12Vielen Dank StellaVella! Endlich mal gute Nachrichten...
Antwort auf Beitrag Nr.: 70.390.429 von biostar1 am 04.01.22 15:43:19
wurde auch langsam mal Zeit für gute Nachrichten, auch wenn es sich nur um eine Tierstudie handelt.
Zitat von biostar1: Vielen Dank StellaVella! Endlich mal gute Nachrichten...
wurde auch langsam mal Zeit für gute Nachrichten, auch wenn es sich nur um eine Tierstudie handelt.
Aktionärs-Update-Brief - 10. Januar 2022
Bilanz und KapitalMit den in unserem Formblatt 10-Q für das am 30. September endende Quartal ausgewiesenen Barmitteln in Höhe von etwa 29 Millionen US-Dollar
kompletter Info . zu lesen unter Soligenix Shareholder Update 10.01.2022
https://ir.soligenix.com/2022-02-08-Soligenix-to-Present-at-…
Vielleicht logt sich jemand ein und informiert uns.
Vielleicht logt sich jemand ein und informiert uns.
Kann mir jemand sagen, was hier los ist und warum es wieder nach unten geht? Am Gesamtmarkt kann es nicht liegen.
Antwort auf Beitrag Nr.: 71.397.635 von vinod am 21.04.22 19:00:22doch...diesmal ist es der gesamte Markt ...vinod ...
Das ist jetzt aber nicht der gesamte Markt🤔🙄
Das stimmt dann jetzt auch 🙈😂
warten wir es einfach weiter ab ...ich habe noch immer keinen Zeitdruck ...und irgendwie bin ich mir sicher...das SNGX wieder auf die Beine kommt ....
In naher Zukunfz sollten wir aber zumindest mal wieder über 1 $ kommen ...da haben wir schon Zeitdruck ...oder vielmehr die Börse ...🙈
In naher Zukunfz sollten wir aber zumindest mal wieder über 1 $ kommen ...da haben wir schon Zeitdruck ...oder vielmehr die Börse ...🙈
https://ir.soligenix.com/2022-04-19-Soligenix-Receives-1-4M-in-Non-Dilutive-Government-Funding
Das Unternehmen das so eine Unterstützung erhält, muss m.E. etwas vorweisen können. Mitteilung vom 19.04.22.
Antwort auf Beitrag Nr.: 71.427.179 von Ulimit1L am 26.04.22 15:55:47So isses 👍
Antwort auf Beitrag Nr.: 71.419.958 von vinod am 25.04.22 17:52:19Aber heute ist es wieder der ganze Markt ...damn shit...🙈😂
Trotzdem habe ich das Gefühl, dass der Kurs mit wenigen Aktien nach unten gebracht wir. Schau Dir das Volumen von gestern an, und da gab es zeitweise 13% minus. Heute auch wenig gehandelte Aktien und 8% minus🙄🤔🤔🤔
Antwort auf Beitrag Nr.: 71.429.360 von vinod am 26.04.22 18:54:56Ja ...von einem wirklichen Handel kann man nicht sprechen
Bedeutet irgendwie auch ...dass keiner seine Anteile für nen halben Dollar herschenken will ...
Bedeutet irgendwie auch ...dass keiner seine Anteile für nen halben Dollar herschenken will ...
so langsam ist es apokaliptisch, das lässt sich auch nicht mehr mit Marktumfeld erklären. Wenn ich nicht daran glauben würde, dass es mal anders wird, wäre ich jetzt wirklich verzweifelt. Denke sogar daran, ein wenig nachzukaufen, alles oder nichts.🙃🤔🙂
Antwort auf Beitrag Nr.: 71.551.866 von vinod am 11.05.22 20:38:37Viel weniger kann es kaum noch werden...🙈😂
Das Umfeld ist ängstlich... und das ist noch gepralt...
Na endlich mal eine gute Nachricht heute
 . Schaut bei Soligenix Investor vorbei.
. Schaut bei Soligenix Investor vorbei.

 . Schaut bei Soligenix Investor vorbei.
. Schaut bei Soligenix Investor vorbei.
Na endlich mal eine gute Nachricht heute
 . Schaut bei Soligenix Investor vorbei.
. Schaut bei Soligenix Investor vorbei.
https://ir.soligenix.com/2022-05-23-Soligenix-Receives-US-Pa…

 . Schaut bei Soligenix Investor vorbei.
. Schaut bei Soligenix Investor vorbei. https://ir.soligenix.com/2022-05-23-Soligenix-Receives-US-Pa…
https://ir.soligenix.com/2022-06-01-Key-Binding-Characteristics-of-Dusquetide-to-Important-Intracellular-Protein-Identified
hört sich doch gut an ..😇
Antwort auf Beitrag Nr.: 71.842.682 von Ulimit1L am 23.06.22 16:58:23Good morning....ich finde ...ja ...👍
NEWS es geht voran
Das kutane T-Zell-Lymphom (CTCL) ist eine seltene Krebsart, von der etwa 27.000 Amerikaner betroffen sind. Es ist nicht heilbar und muss als chronische Erkrankung von Patienten und ihren Ärzten über Jahre und manchmal Jahrzehnte behandelt werden. Heutzutage sind die meisten Behandlungsoptionen für CTCL mit erheblichen Sicherheitsbedenken verbunden.Die Behandlung von Soligenix, HyBryte, wurde in klinischen Studien der Phasen 1, 2 und 3 bewertet und hat sich als sicher und gut verträglich erwiesen und reduziert die Größe der CTCL-Läsionen erheblich. Es hat auch einen Vorteil gegenüber der herkömmlichen Phototherapie, die DNA-schädigendes ultraviolettes (UV) Licht verwendet. HyBryte (topisches synthetisches Hypericin) wird direkt auf die kanzerösen Hautläsionen aufgetragen, gefolgt von einer Aktivierung mit sicherem, sichtbarem fluoreszierendem Licht, sodass das Risiko der Entwicklung von aktinischen Hautschäden und Hautkrebs kein Problem darstellt, wie es bei UV-Licht der Fall ist. Kurzfristige Nebenwirkungen sind auch weniger häufig und milder als bei der herkömmlichen Phototherapie.
Es ist eine aufregende Zeit für CTCL-Patienten, die möglicherweise bald Zugang zu einer sichereren und wirksameren Behandlungsoption haben werden. Wir haben uns mit Dr. Richard Straube, Chief Medical Officer von Soligenix, getroffen, um mehr über HyBryte und den bisherigen klinischen Weg zu erfahren.
Alles unter 1 EURO ist ein Witz
Soligenix gibt strategische Partnerschaft mit SERB Pharmaceuticals zur Lieferung seines neuartigen Ricin-Antigens bekannt25. Juli 2022
Nachdrucke bestellen
Artikel drucken
Textgröße
SERB Pharmaceuticals verfolgt eine therapeutische Behandlung gegen Ricinvergiftung mit Soligenix Ricin-Antigen
PRINCETON, N.J., 25. Juli 2022 /PRNewswire/ -- Soligenix, Inc. (Nasdaq: SNGX) (Soligenix oder das Unternehmen), ein biopharmazeutisches Unternehmen im Spätstadium, das sich auf die Entwicklung und Vermarktung von Produkten zur Behandlung seltener Krankheiten konzentriert, bei denen ein ungedeckter Bedarf besteht Medical Need, gab heute bekannt, dass es eine weltweite Exklusivlizenz zur Lieferung seines Ricin-Antigens an SERB Pharmaceuticals (SERB) für die Entwicklung einer neuartigen therapeutischen Behandlung gegen Ricin-Toxin-Vergiftung unterzeichnet hat. Es besteht ein ungedeckter Schutzbedarf gegen dieses hochwirksame Toxin, für das es weder einen Impfstoff noch eine therapeutische Intervention gibt.
"Wir freuen uns über die Partnerschaft mit Soligenix bei der Verwendung ihres Antigens zur Beschleunigung unseres Ricin-Therapieprogramms. Da derzeit keine therapeutischen Optionen zur Verfügung stehen, stellt die Bedrohung durch Ricin einen erheblichen ungedeckten Bedarf auf dem Gebiet der biologischen Verteidigung und der medizinischen Gegenmaßnahmen dar", sagte Anthony Higham , CEO von SERB Pharmaceuticals. "Unsere Expertise in der Antikörperentwicklung und die mit BTG erworbenen Produktionskapazitäten im kommerziellen Maßstab zusammen mit der Erfolgsbilanz von SERB bei der zuverlässigen Bereitstellung eines Portfolios hochwertiger chemischer, biologischer, radiologischer und nuklearer (CBRN) Gegenmittel versetzen uns in die einzigartige Position, erfolgreich eine Lösung anzubieten ."
„Neben unserer eigenen Entwicklung eines hitzestabilen Ricin-Impfstoffs (RiVax(R) ) zum Schutz vor tödlicher Ricin-Vergiftung, die bisher von der US-Regierung mit mehr als 30 Millionen Dollar unterstützt wurde, hielten wir es für wichtig, auch mit SERB zusammenzuarbeiten bei der Entwicklung seines therapeutischen Wirkstoffkandidaten Ricin", sagte Christopher J. Schaber, PhD, President und CEO von Soligenix. "SERB ist führend auf dem Gebiet medizinischer Gegenmaßnahmen zum Schutz der Öffentlichkeit und der Streitkräfte. Wir hoffen, dass wir durch die Bereitstellung unseres neuartigen Ricin-Antigens als wichtigen Bestandteil ihrer Formulierung dazu beitragen werden, die Entwicklung dieses Programms im Frühstadium zu beschleunigen. "
Bei der Suche nach einem Ricin-Gegenmittel wird SERB seine einzigartige polyklonale Breitband-Antikörperplattform nutzen, die es bei der Übernahme von BTG Specialty Pharmaceuticals erworben hat. Dieser spezialisierte Herstellungsprozess erzeugt Bindungsfragmente aus Antikörpern, die für ein bestimmtes Antigen spezifisch sind, und trägt dazu bei, Wirksamkeit und Reinheit sicherzustellen. Diese Plattform wird derzeit zur Herstellung von zwei der derzeit vermarkteten Produkte des Unternehmens, CroFab(R) und DigiFab(R), verwendet.
Die Antikörper werden unter Verwendung einer modifizierten Form des von Soligenix entwickelten Ricin-Toxins erzeugt. Die Modifikationen haben die biologische Aktivität des Proteins entfernt, so dass es nicht toxisch ist, während es dennoch seine Form behält, um eine wirksame Antikörperantwort auszulösen.
Die spezifischen Lizenzbedingungen wurden zu diesem Zeitpunkt noch nicht bekannt gegeben, bestehen jedoch aus einem Herstellungsliefervertrag und einem geringen Prozentsatz an Lizenzgebühren bei der Kommerzialisierung.
30.000.000 Dollar von der US Regierung

 „Neben unserer eigenen Entwicklung eines hitzestabilen Ricin-Impfstoffs (RiVax®) zum Schutz vor tödlicher Ricin-Vergiftung, die bisher von der US-Regierung mit mehr als 30 Millionen Dollar unterstützt wurde, hielten wir es für wichtig, auch mit SERB in der Partnerschaft zusammenzuarbeiten Entwicklung seines therapeutischen Wirkstoffkandidaten Ricin“, sagte Christopher J. Schaber, PhD, President und CEO von Soligenix. „SERB ist führend auf dem Gebiet medizinischer Gegenmaßnahmen zum Schutz der Öffentlichkeit und der Streitkräfte.
„Neben unserer eigenen Entwicklung eines hitzestabilen Ricin-Impfstoffs (RiVax®) zum Schutz vor tödlicher Ricin-Vergiftung, die bisher von der US-Regierung mit mehr als 30 Millionen Dollar unterstützt wurde, hielten wir es für wichtig, auch mit SERB in der Partnerschaft zusammenzuarbeiten Entwicklung seines therapeutischen Wirkstoffkandidaten Ricin“, sagte Christopher J. Schaber, PhD, President und CEO von Soligenix. „SERB ist führend auf dem Gebiet medizinischer Gegenmaßnahmen zum Schutz der Öffentlichkeit und der Streitkräfte. TOP
INCETON, N.J., 27. Juli 2022 /PRNewswire/ -- Soligenix, Inc. (Nasdaq: SNGX) (Soligenix oder das Unternehmen), ein biopharmazeutisches Unternehmen im Spätstadium, das sich auf die Entwicklung und Vermarktung von Produkten zur Behandlung seltener Krankheiten konzentriert, bei denen ein ungedeckter Bedarf besteht medizinischen Bedarf, gab heute bekannt, dass es von der US-amerikanischen Food & Drug Administration (FDA) die Zustimmung zu einem ersten pädiatrischen Studienplan (iPSP) für HyBryte™ (synthetisches Hypericin) zur Behandlung des kutanen T-Zell-Lymphoms (CTCL) erhalten hat. Das vereinbarte iPSP sieht vor, dass Soligenix beabsichtigt, bei Einreichung eines neuen Arzneimittelantrags (NDA) einen vollständigen Verzicht auf pädiatrische Studien zu beantragen. Die Vereinbarung mit der FDA über einen iPSP ist eine der regulatorischen Anforderungen, die vor der Einreichung eines NDA erfüllt werden müssen.HyBryte (PRNewsfoto/Soligenix, Inc.)
"Wir freuen uns über die Zustimmung der FDA zu unserem Vorschlag, einen vollständigen Verzicht auf pädiatrische Studien zum Zeitpunkt unserer NDA-Einreichung für HyBryte™ später in diesem Jahr zu beantragen", sagte Christopher J. Schaber, PhD, President und Chief Executive Officer von Soligenix. „Dies steht im Einklang mit Entscheidungen der Europäischen Arzneimittel-Agentur (EMA) und der Regulierungsbehörde für Arzneimittel und Gesundheitsprodukte (MHRA) im Vereinigten Königreich, die zuvor produktspezifische Ausnahmen von der Anforderung für pädiatrische Studien in Anträgen auf Marktzulassung von HyBryte™ gewährt haben in Großbritannien und Europa."
The Vanguard Group, Inc, und BlackRock
The Vanguard Group, Inc. 3.80% 1,627,288 BlackRock Fund Advisors 0.25% 108,162
Vanguard Total Stock Market Index...2.84% 1,217,959
Wenn das nicht POSITIV ist....
Antwort auf Beitrag Nr.: 72.060.089 von pipsii am 26.07.22 17:27:57RiVax...da klingelt etwas in meinen Ohren...
Soligenix positive Phase-3-Ergebnisse
2. August 2022Kaitlyn Bader, Mitherausgeberin
Soligenix gibt positive Phase-3-Ergebnisse der FLASH-Studie zur Verwendung von synthetischem Hypericin zur Reduzierung von kutanen T-Zell-Lymphom-Läsionen bekannt.
Phase-3-Ergebnisse der FLASH-Studie (Fluorescent Light Activated Synthetic Hypericin)1 zeigten eine signifikante Verringerung der Läsionsgröße des kutanen T-Zell-Lymphoms (CTCL) durch die Behandlung mit synthetischem Hypericin (HyBryte; Soligenix). Diese Ergebnisse geben Hoffnung auf eine neue Behandlung für Patienten, bei denen die lebensverändernde Krankheit diagnostiziert wurde. Als chronische Krebsart, die die Lebensqualität der Patienten stark beeinträchtigt, besteht ein ungedeckter Bedarf an einer gut verträglichen und sicheren Behandlungsoption. Die FLASH-Studie ist die bisher größte doppelblinde, randomisierte, placebokontrollierte klinische Studie für CTCL.
Die Studiendaten zeigten auch, dass sich das Ansprechen auf die Behandlung über 6-wöchige Behandlungszyklen weiter verbesserte. Der Hauptendpunkt der Studie bewertete die Composite Assessment of Index Lesion Severity (CAILS) von drei spezifischen Läsionen und der Erfolg wurde als ≥50 % Reduktion des CAILS-Scores im Vergleich zum Ausgangswert bestimmt. Die Patienten berichteten, dass sich ihre Läsionen während des gesamten Behandlungszyklus weiter verringerten. Nach dem ersten 6-wöchigen Behandlungszyklus zeigten 16 % der Patienten ein Ansprechen (p = 0,04 gegenüber Patienten mit 6-wöchiger Placebo-Behandlung). Die Ansprechrate stieg während der 18-wöchigen Behandlung weiter auf 49 % (p < 0,0001 gegenüber Patienten mit 6-wöchiger Behandlung mit Hypericin oder Placebo).
Synthetisches Hypericin ist eine neuartige photodynamische Therapie, die sicheres, sichtbares Licht zur Aktivierung verwendet. Das Medikament wird topisch auf Hautläsionen aufgetragen und 16-24 Stunden danach mit sichtbarem Licht aktiviert. Die US-amerikanische Food and Drug Administration hat der bahnbrechenden Behandlung Orphan-Drug- und Fast-Track-Status zuerkannt.2
Die Daten während der gesamten Studie zeigten, dass synthetisches Hypericin sicher und gut verträglich war, während die aktuellen Behandlungsoptionen für CTCL erhebliche Sicherheitsbedenken und Black-Box-Warnungen aufweisen. Synthetisches Hypericin wird den Patienten sicherere Langzeitoptionen bieten. CTCL ist eine Klasse von Non-Hodgkin-Lymphomen (NHL), einem Krebs der weißen Blutkörperchen. Im Gegensatz zu anderen NIHLs wird CTCL durch eine Expansion bösartiger T-Zell-Lymphozyten verursacht, die normalerweise in die Haut wandern. Es gibt derzeit keine Heilung für CTCL
Führende Hauptakteure auf dem Markt für die Auftragsherstellung von Impfstoffen Soligenix Inc
„ Marktbericht zur Auftragsherstellung von Impfstoffen: 2022-2026Markt für Auftragsfertigung von Impfstoffen (neu veröffentlichter Bericht), der Marktübersicht, zukünftige wirtschaftliche Auswirkungen, Wettbewerb durch Hersteller, Angebot (Produktion) und Verbrauchsanalyse abdeckt
Der Marktforschungsbericht über die globale Branche der Auftragsfertigung von Impfstoffen bietet eine umfassende Studie der verschiedenen Techniken und Materialien, die bei der Herstellung von Marktprodukten für die Auftragsfertigung von Impfstoffen verwendet werden. Angefangen von der Analyse der Industriekette bis hin zur Kostenstrukturanalyse analysiert der Bericht mehrere Aspekte, einschließlich der Produktions- und Endverbrauchssegmente der Impfstoff-Auftragsherstellung-Marktprodukte. Die neuesten Trends in der Branche wurden in dem Bericht detailliert beschrieben, um ihre Auswirkungen auf die Produktion von Marktprodukten für die Herstellung von Impfstoffen zu messen.
Die Ergebnisse der jüngsten wissenschaftlichen Unternehmungen zur Entwicklung neuer Impfstoff-Auftragsherstellungsprodukte wurden untersucht. Dennoch wurden in diesem statistischen Erhebungsbericht auch die Faktoren untersucht, die die führenden Akteure der Branche dazu veranlassen, die synthetische Beschaffung der Marktprodukte einzuführen. Die Schlussfolgerungen in diesem Bericht sind für die führenden Akteure der Branche von großem Wert. Alle Organisationen, die an der globalen Produktion von Marktprodukten für die Auftragsherstellung von Impfstoffen beteiligt sind, wurden in diesem Bericht erwähnt, um die Erkenntnisse zu kosteneffizienten Herstellungsmethoden, der Wettbewerbslandschaft und neuen Wegen für Anwendungen zu untersuchen.
Holen Sie sich ein Muster dieses Berichts unter https://www.marketresearchupdate.com/sample/237725
Führende Hauptakteure auf dem Markt für die Auftragsherstellung von Impfstoffen sind –
Diosynth, Emergent BioSolutions, Goodwin Biotechnology, Bavarian Nordic, Soligenix Inc, Catalent Biologics
Soligenix gibt jüngste Erfolge und Finanzergebnisse für das zweite Quartal 2022 bekannt
PRINCETON, NJ , 12. August 2022 / PRNewswire / -- Soligenix, Inc. (Nasdaq: SNGX) (Soligenix oder das Unternehmen), ein biopharmazeutisches Unternehmen im Spätstadium, das sich auf die Entwicklung und Vermarktung von Produkten zur Behandlung seltener Krankheiten konzentriert, wo es eine gibt ungedeckter medizinischer Bedarf, gab heute seine jüngsten Erfolge und Finanzergebnisse für das am 30. Juni 2022 endende Quartal bekannt .„Wir haben bis jetzt im Jahr 2022 eine Reihe wichtiger Meilensteine erreicht, wobei weitere bedeutende Meilensteine noch vor Jahresende erwartet werden“, sagte Christopher J. Schaber , PhD, President und Chief Executive Officer von Soligenix. „In unserem Geschäftssegment Spezialisierte Biotherapeutika wurden die Ergebnisse unserer erfolgreichen Phase-3-FLASH-Studie ( F luorescent Light A ctivated S ynthetic H ypericin ) veröffentlicht , in der HyBryte™ (synthetisches Hypericin) zur Behandlung des kutanen T-Zell-Lymphoms (CTCL) untersucht wurde in der renommierten JAMA Dermatologie. Wir haben von der US-amerikanischen Food & Drug Administration (FDA) die Zustimmung zu einem ersten pädiatrischen Studienplan für HyBryte™ erhalten, der unsere Absicht festlegt, einen vollständigen Verzicht auf pädiatrische Studien nach Einreichung des HyBryte™ New Drug Application (NDA) im vierten Quartal zu beantragen dieses Jahres. Darüber hinaus expandieren wir in neue Krankheitsindikationen mit synthetischem Hypericin (SGX302), nachdem wir die FDA-Zulassung für ein neues Prüfpräparat (IND) für eine klinische Phase-2a-Studie bei leichter bis mittelschwerer Psoriasis erhalten haben, die ebenfalls voraussichtlich im vierten Quartal dieses Jahres beginnen wird .
Unser Geschäftssegment Public Health Solutions, unterstützt durch Mittel des National Institute of Allergy and Infectious Diseases, erreicht weiterhin wichtige Ziele, die das Potenzial haben, eine wichtige Rolle in den Initiativen der Biden-Harris-Administration zur Pandemievorsorge zu spielen . Kürzlich haben wir einen 100-prozentigen Schutz von nichtmenschlichen Primaten sowohl gegen das tödliche Sudan - Ebolavirus als auch gegen das Marburg-Marburgvirus nachgewiesenProvokation mit einem bivalenten, thermostabilisierten Impfstoff, der in einem einzigen Fläschchen formuliert ist. Dieselbe hitzestabile Subunit-Impfstoffplattformtechnologie wurde bei der Entwicklung unseres COVID-19-Impfstoffs CiVax™ angewendet, der schnelle und breit funktionelle Impfstoff- und Auffrischungsreaktionen gezeigt hat, einschließlich gegen Delta- und Omicron-Varianten. Wir sind auch eine strategische Partnerschaft mit SERB Pharmaceuticals eingegangen, um unser neuartiges Ricin-Antigen zur Unterstützung ihres therapeutischen Entwicklungsprogramms für Ricin in der Frühphase bereitzustellen."
Dr. Schaber fuhr fort: „Mit etwa 20,2 Millionen US -Dollar in bar, ohne unsere nicht verwässernde staatliche Finanzierung, gehen wir davon aus, dass wir über das Kapital verfügen, das erforderlich ist, um unsere kurzfristigen Meilensteine zu erreichen, einschließlich der NDA-Einreichung und der Einleitung der Psoriasis-Studie der Phase 2a, während wir weiterhin verschiedene strategische Optionen prüfen, einschließlich, aber nicht beschränkt auf Partnerschaften sowie Fusions- und Übernahmemöglichkeiten."
Antwort auf Beitrag Nr.: 72.197.457 von pipsii am 15.08.22 15:26:19Super - danke!!
Soligenix hat eine Technologie von VitriVax lizenziert, um die Thermostabilität seines Ricin-Impfstoffkandidaten in der klinischen Phase zu verbessern.
VitriVax hat eine Serie-A-Runde durchgeführt, um die Entwicklung einer thermostabilen Einzeldosis-Impfstofftechnologie zu unterstützen. Die Plattform wurde entwickelt, um die Notwendigkeit einer Kühllagerung zu eliminieren und Mehrfachdosis-Schemata in einer einzigen Impfung zusammenzufassen, um Impfkampagnen zu vereinfachen.Wie die COVID-19-Impfkampagne beispielhaft gezeigt hat, stellte die Notwendigkeit, Impfstoffe unter kontrollierten Bedingungen zu versenden und die Menschen dazu zu bringen, Wochen oder Monate später für eine zweite Impfung zurückzukehren, eine Herausforderung für die Gesundheitsbehörden dar. Fünfzehn Millionen Menschen in den USA haben ihre zweite Dosis verpasst . Aufgrund der Anforderungen an die Kühlkette ist es in einigen Teilen der Welt eine Herausforderung, Menschen mit Dosen zu versorgen.
VitriVax will diese beiden Probleme angehen – und hat Adjuvant Capital davon überzeugt, seine Pläne zu finanzieren. Adjuvant Capital, das Novartis, Merck und die Bill & Melinda Gates Foundation
 zu seinen Unterstützern zählt, hat einen nicht genannten Betrag an Serie-A-Finanzierung zur Unterstützung der Entwicklung bereitgestellt.
zu seinen Unterstützern zählt, hat einen nicht genannten Betrag an Serie-A-Finanzierung zur Unterstützung der Entwicklung bereitgestellt.Das Geld wird es VitriVax ermöglichen, an einer Technologie zu arbeiten, die in Zusammenarbeit zwischen Robert Garcea, MD, und Theodore Randolph, Ph.D., an der University of Colorado Boulder entwickelt wurde. In einem im letzten Jahr veröffentlichten Artikel beschreiben die Forscher und ihre Mitarbeiter die Entwicklung von thermostabilen humanen Papillomavirus-Impfstoffen zur einmaligen Verabreichung unter Verwendung von beschichteten glasartigen Mikropartikeln.
Die Plattform trägt jetzt den Markennamen ALTA, ein Akronym für Atomic Layering Thermostable Antigen and Adjuvant, und weist zwei Hauptmerkmale auf. Zum einen werden durch Sprühtrocknung Antigene und Adjuvantien in eine Matrix eingebettet, die sie vor Hitze und Chemikalien schützen soll. Laut VitriVax werden Impfstoffe monatelang bei Temperaturen von bis zu 70 Grad Celsius aufbewahrt.
Das zweite Merkmal erleichtert die zeitgesteuerte Abgabe von Impfstoffdosen. Durch die Beschichtung von Antigen- und Adjuvans-Mikropartikeln mit schützenden Metalloxiden versucht VitriVax, die zeitgesteuerte Freisetzung von Impfstoffdosen bis zu sechs Monate nach der Injektion zu ermöglichen. Der Ansatz könnte die Abgabe von Dosen ermöglichen, die das Immunsystem in einem einzigen Schuss vorbereiten und stärken.
„Die Verringerung der Temperaturanforderungen und die Zusammenfassung von Mehrfachdosis-Schemata zu einem einzigen Berührungspunkt mit dem Gesundheitssystem ist seit langem ein Ziel der Impfstoffbereitstellung innerhalb der öffentlichen Gesundheitsgemeinschaft. Wir glauben, dass die ALTA-Plattform das Potenzial hat, diese Probleme in großem Maßstab zu lösen“, Charlie Petty, Mitbegründer und Direktor bei Adjuvant Capital, sagte in einer Erklärung.
Soligenix hat eine Technologie von VitriVax lizenziert, um die Thermostabilität seines Ricin-Impfstoffkandidaten in der klinischen Phase zu verbessern. VitriVax sagte, es habe „eine Reihe von Partnerschaften mit pharmazeutischen Partnern in der klinischen und kommerziellen Phase in einem breiten Spektrum von Krankheitsbereichen und Modalitäten“.
Es bleibt spannend
MIAMI, 16. August 2022 (GLOBE NEWSWIRE) -- EmergingGrowth.com, ein führendes unabhängiges Small-Cap-Medienportal mit einer langjährigen Erfahrung in der Bereitstellung beispielloser Inhalte für aufstrebende Wachstumsunternehmen und -märkte, gibt den Zeitplan der 37. Konferenz für aufstrebendes Wachstum bekannt.Die Emerging Growth Conference identifiziert Unternehmen in einer Vielzahl von Wachstumssektoren mit starken Managementteams, innovativen Produkten und Dienstleistungen, fokussierter Strategie, Umsetzung und dem Gesamtpotenzial für langfristiges Wachstum.
Melden Sie sich hier für die Konferenz an.
Senden Sie Ihre Fragen für eines der präsentierenden Unternehmen im Voraus an: Questions@EmergingGrowth.com
Achten Sie darauf, das Unternehmen anzugeben, an das die Frage gerichtet ist.
Der Zeitplan für den 17. August 2022 sieht wie folgt aus:
(Alle Zeiten sind Eastern Time Zone)
Möglicherweise sehen wir am Mittwoch einige Zeitplanänderungen. Um über den Zeitplan auf dem Laufenden zu bleiben, folgen Sie uns bitte auf Twitter: https://twitter.com/EmergingGrowthC
9:00 – 9:30
Soligenix, Inc. (SNGX)
Hauptredner: Jonathan L. Guarino, Senior VP & CFO
Soligenix • US-Militärmarkt Biodefense-Marktgröße 2022 Globale Trends
Biodefense-Marktgröße 2022 Globale Trends, COVID-19-Auswirkungsanalyse, Branchenwachstum, Typen, Anwendungen, zukünftiger Umfang, führende Akteure, Aktien, Forschung mit Regionen, Prognose bis 2028Kei Tara 18. August 2022 Biodefense-Marktgröße 2022 Globale Trends, COVID-19-Auswirkungsanalyse, Branchenwachstum, Typen, Anwendungen, zukünftiger Umfang, führende Akteure, Aktien, Forschung mit Regionen, Prognose bis 2028 2022-08-18T12:45:00+00:00 Nicht kategorisiert
Der Abschlussbericht wird die Analyse der Auswirkungen von Covid-19 auf diesen Sektor hinzufügen.
Der Global Biodefense Market bietet qualitative und quantitative Einblicke in Wachstumsraten, Marktsegmentierung, Marktgröße, zukünftige Trends und regionale Aussichten. Der Bericht präsentiert eine zeitgenössische Perspektive, die darauf abzielt, das zukünftige Potenzial des Biodefense-Marktes zu sichern. Dieser Bericht analysiert und bewertet die neuesten Erkenntnisse über die aufstrebenden Einzelhandelsflächen sowie die allgemeine und zukünftige Leistung des Covid-19-Marktes. Außerdem bietet dieser Bericht einen detaillierten Überblick über den Wettbewerb zwischen bestimmten Branchen und anderen.
Musterbericht als PDF abrufen – www.precisionreports.co/enquiry/request-sample/19886785
Mit der Erholung der Weltwirtschaft wird sich das Wachstum von Biodefense gegenüber dem Vorjahr deutlich verschieben. Gemäß unserer jüngsten Analyse beträgt die globale Marktgröße für Bioverteidigung im Jahr 2021 1.119,1 Millionen US-Dollar. Die globale Marktgröße für Bioverteidigung wird 2028 1.865,5 Millionen US-Dollar erreichen, mit einer CAGR von 7,6 % im Analysezeitraum.
Analyse der Wettbewerbslandschaft und des Marktanteils
von Biodefense Die Wettbewerbslandschaft auf dem Markt für Biodefense liefert Details und Dateninformationen von Unternehmen. Der Bericht bietet umfassende Analysen und genaue Umsatzstatistiken nach Spielern für den Zeitraum 2017-2022. Es bietet auch eine detaillierte Analyse, die durch zuverlässige Statistiken zu Verkäufen und Einnahmen der Spieler von 2017 bis 2022 unterstützt wird. Enthaltene Details sind Unternehmensbeschreibung, wichtige Unternehmen, Produkteinführung von Biodefense, aktuelle Entwicklungen, Biodefense-Verkäufe nach Region, Typ, Anwendung und Vertriebskanal.
Hauptakteure, die im Biodefense-Marktbericht behandelt werden, sind:
•Emergent Biosolutions
•Hytest
•GSK
•Sanofi
•PharmAthene
•Bavarian Nordic
•SIGA Technologies
•Arbutus Biopharma
•DynPort Vaccine
•Xoma Corporation
•Ichor Medical Systems
•Aeolus Pharmaceuticals
•Achaogen
• Elusys Therapeutics
•Dynavax Technologien
•Cleveland BioLabs
•Soligenix
•Alnylam Pharmaceuticals
Um zu verstehen, wie die Auswirkungen von Covid-19 in diesem Bericht behandelt werden – www.precisionreports.co/enquiry/request-covid19/19886785
Der Biodefense-Markt wird voraussichtlich im Jahr 2022 Millionen erreichen und während des Prognosezeitraums voraussichtlich mit einer CAG von etwa expandieren. China ist ein globaler Markt für Biodefense und wird bis 2028 Millionen von USD erreichen, Deutschlands Biodefense-Ökosystem wird voraussichtlich Millionen von Dollar wert sein. Andere wichtige Märkte im asiatisch-pazifischen Raum (Japan und Südkorea) werden in den nächsten fünf Jahren voraussichtlich mit ähnlichen Raten wachsen.
Marktumfang und Marktgröße für Bioabwehr
Der Umfang des Berichts umfasst globale und regionale Märkte mit einer detaillierten Analyse der allgemeinen Marktwachstumsaussichten. Es unterstreicht auch das enorme Wettbewerbsumfeld auf dem globalen Markt. Dieser Bericht bietet auch einen Überblick über führende Unternehmen mit den neuesten erfolgreichen Marketingstrategien, Marktbeiträgen sowie aktuellem und historischem Hintergrund. Hier wird der Biodefense-Markt nach Typ, Endbenutzerbranche und Anwendung segmentiert. Das Wachstum zwischen verschiedenen Segmenten wird verwendet, um die verschiedenen Wachstumsfaktoren zu verstehen, von denen erwartet wird, dass sie den Markt als Ganzes dominieren, und um verschiedene Strategien zu entwickeln, um Schlüsselanwendungen und Zielmärkte zu differenzieren.
Auf der Grundlage des Produkts zeigt dieser Bericht die Produktion, den Umsatz, den Preis, den Marktanteil und die Wachstumsrate jedes Typs an, hauptsächlich unterteilt in:
• Milzbrand
• Pocken
• Botulismus
• Strahlung/Kernkraft
• Andere
Auf der Grundlage der Endbenutzer/Anwendungen konzentriert sich dieser Bericht auf den Status und die Aussichten für wichtige Anwendungen/Endbenutzer, den Verbrauch (Umsatz), den Marktanteil und die Wachstumsrate für jede Anwendung, einschließlich:
• US-Militärmarkt
• US-Zivilmarkt
• Nicht-US-Markt
Der Bericht bietet eine detaillierte Bewertung des Marktes und hebt Informationen zu verschiedenen Aspekten hervor, darunter Treiber, Beschränkungen, Chancen und Risiken. Diese Informationen können Stakeholdern helfen, die richtigen Entscheidungen zu treffen, bevor sie investieren.
Erkundigen Sie sich oder teilen Sie Ihre Fallfragen, bevor Sie diesen Bericht kaufen – www.precisionreports.co/enquiry/pre-order-enquiry/19886785
Analyse des Biodefense-Marktes auf regionaler und Länderebene:
Der Länderabschnitt des Berichts enthält auch eine Auswahl von Markteinflussfaktoren, die aktuelle und zukünftige Markttrends beeinflussen, sowie Änderungen der Marktregeln auf Länderebene. Datenpunkte wie Verbrauch, Produktionsstandort und -menge, Import-/Exportanalyse, Preisanalyse, Rohstoffkosten, vorgelagerte und nachgelagerte Wertschöpfungskettenanalyse sind einige der wichtigsten Metriken, die zur Vorhersage von Inlandsmarktszenarien verwendet werden. Es berücksichtigt auch die Präsenz und Verfügbarkeit globaler Marken, das Problem des starken oder schwachen Wettbewerbs mit lokalen und nationalen Marken und die Auswirkungen nationaler Zölle und Handelsrouten auf Länderdatenprojektionen.
Die vom Biodefense-Marktbericht abgedeckte Region ist:
– Amerika
– APAC
– Europa?
– Mittlerer Osten und Afrika
Hauptgründe für den Kauf:
- Analyse von Markteinblicken und gründliches Verständnis des globalen Biodefense-Marktes und des Geschäftsumfelds.
– Um das Entwicklungsrisiko zu mindern, bewertet der Produktionsprozess Schlüsselprobleme und Lösungen.
– Erkennen der treibenden Kräfte und Hindernisse, die den größten Einfluss auf Covid-19 auf dem Biodefense-Markt sowie auf seinem weltweiten Markt haben.
– erläutert die Marktstrategien der einzelnen großen Institutionen.
– Verstehen Sie die Zukunftsvision und -prognose des Biodefense-Marktes.
– Neben Standard-Strukturberichten bieten wir auch kundenspezifische Studien an, die auf spezifische Anforderungen zugeschnitten sind.
Emerging Growth Conference
Soligenix überschreitet den gleitenden Zweihundert-Tage-Durchschnitt von 0,66 $
Die Aktie von  Soligenix (NASDAQ:SNGX) überschreitet den gleitenden Zweihundert-Tage-Durchschnitt von 0,66 $
Soligenix (NASDAQ:SNGX) überschreitet den gleitenden Zweihundert-Tage-Durchschnitt von 0,66 $Gepostet von MarketBeat News am 24. August 2022
Auf Twitter teilen Auf Facebook teilen Auf
 LinkedIn teilen
LinkedIn teilenTeilen Sie auf Stocktwits
Soligenix-LogoSoligenix, Inc. ( NASDAQ:SNGX – Get Rating ) überschritt während des Handels am Dienstag seinen 200-tägigen gleitenden Durchschnitt. Die Aktie hat einen gleitenden 200-Tage-Durchschnitt von 0,66 $ und wurde bis zu 0,85 $ gehandelt. Soligenix-Aktien wurden zuletzt bei 0,82 $ gehandelt, mit einem Volumen von 112.613 gehandelten Aktien.
Soligenix-Aktie um 1,5 % gesunken
Das Unternehmen hat ein Current Ratio von 2,36, ein Quick Ratio von 2,36 und ein Debt-to-Equity-Ratio von 1,87. Das Unternehmen hat eine Marktkapitalisierung von 35,13 Millionen US-Dollar, ein KGV von -2,26 und ein Beta von 1,35. Der einfache gleitende 50-Tage-Durchschnitt des Unternehmens beträgt 0,73 $ und der einfache gleitende 200-Tage-Durchschnitt 0,66 $.
Erhalten Sie Soligenix- Warnungen:
Institutionelle Zu- und Abflüsse
Mehrere institutionelle Investoren haben kürzlich ihre Anteile an SNGX aufgestockt oder reduziert. ARGI Investment Services LLC baute seine Position in Soligenix-Aktien im 1. Quartal um 127,6 % aus. ARGI Investment Services LLC besitzt nun 46.836 Aktien des biopharmazeutischen Unternehmens im Wert von 34.000 $, nachdem es während des Zeitraums weitere 26.262 Aktien gekauft hat. Renaissance Technologies LLC baute seine Position in Soligenix-Aktien im 2. Quartal um 45,5 % aus. Renaissance Technologies LLC besitzt nun 52.800 Aktien des biopharmazeutischen Unternehmens im Wert von 32.000 $, nachdem es in diesem Zeitraum weitere 16.500 Aktien gekauft hat. Schließlich baute State Street Corp seine Position in Soligenix-Aktien im 2. Quartal um 54,0 % aus. State Street Corp besitzt nun 72.964 Aktien des biopharmazeutischen Unternehmens im Wert von 44.000 USD, nachdem weitere 25 gekauft wurden. 594 Aktien während des Zeitraums. 7,90 % der Aktien befinden sich derzeit im Besitz von institutionellen Investoren.
Thymus (T)-Zell-Lymphomen wird bis 2029 mit einer CAGR von 9,02 % wachsen
TOPDer Markt für die Behandlung von Thymus (T)-Zell-Lymphomen wird bis 2029 mit einer CAGR von 9,02 % wachsen
Nachrichten bereitgestellt von
Data Bridge-Marktforschung
25. August 2022, 13:28 Uhr GMT
Teile diesen Artikel
Globaler Markt für die Behandlung von Thymus (T)-Zell-Lymphomen
Globaler Markt für die Behandlung von Thymus (T)-Zell-Lymphomen
Thymus (T)-Zell-Lymphom-Behandlung Marktanteil, Trends, Haupttreiber, Größe, Entwicklungen, Zukunftsprognose 2029
PUNE, MAHARASHTRA, INDIEN, 25. August 2022 / EINPresswire.com / -- Eine All-Inclusive- Behandlung des Thymus (T)-Zell -LymphomsDer Bericht enthält eine umfassende statistische Analyse der kontinuierlichen Entwicklungen des Marktes, der Kapazität, der Produktion, des Produktionswerts, der Kosten/Gewinne, des Angebots/der Nachfrage und des Imports/Exports. Darüber hinaus können Unternehmen die in diesem Branchenbericht enthaltenen Informationen nutzen, um über ihre Produktions- und Marketingstrategien zu entscheiden. Die Hauptthemen wie Marktdefinition, Marktsegmentierung, Wettbewerbsanalyse und Forschungsmethodik werden in diesem Branchenanalysedokument ausführlich untersucht. Durch die Nutzung der globalen Erfahrung von Branchenanalysten, Beratern und Domänenexperten wurde dieser Werbebericht mit Exzellenz erstellt und geliefert. Unternehmen können mit Hilfe des Thymus (T)-Zell-Lymphom-Behandlung Marktes konkurrenzlose Einblicke und Bekanntschaft mit den besten Marktchancen in ihren jeweiligen Märkten gewinnenBericht.
Mit der Marktgröße und den Bemühungen zur Bestimmung der Prognose wurde zunächst eine umfangreiche Sekundärrecherche durchgeführt, um einen guten Überblick über den Markt in jeder Region zu erhalten. Ein einflussreicher Thymus (T)-Zell-Lymphom-Behandlung Marktbericht spart nicht nur Stunden Zeit, sondern verleiht der geleisteten Arbeit auch Glaubwürdigkeit, sei es bei der Verfeinerung des Geschäftsplans, der Vorbereitung einer Präsentation für einen wichtigen Kunden oder der Abgabe von Empfehlungen an einen Exekutive. Hier werden traditionelle Forschungsmethoden durch innovative Ansätze ergänzt, um evidenzbasierte Erkenntnisse zu bieten. Das erfolgreiche Marktdokument zur Behandlung von Thymus (T)-Zell-Lymphomen unterstützt das Unternehmen auch bei der Erschließung neuer Märkte für seine Produkte.
Das T-Zell-Lymphom ist eine Art Blutkrebs, der durch das unkontrollierte Wachstum und die Vermehrung von T-Zell-Lymphozyten im menschlichen Immunsystem verursacht wird. Das periphere T-Zell-Lymphom und das lymphoblastische T-Zell-Lymphom sind die beiden Hauptarten des T-Zell-Lymphoms. Chemotherapie, Bestrahlung, Immuntherapie, antivirale Therapie, Stammzelltransplantation und andere Behandlungen stehen für T-Zell-Lymphom zur Verfügung.
Wettbewerbslandschaft und Marktanteilsanalyse von Thymus (T)-Zell-Lymphom-Behandlung
Einige der Hauptakteure auf dem Markt für die Behandlung von Thymus (T)-Zell-Lymphomen sind BIOCRYST PHARMACEUTICALS, INC., Kyowa Kirin Co., Ltd., Genmab A/S, Seagen Inc., Johnson & Johnson Private Limited, F. Hoffmann -La Roche Ltd, Pfizer Inc., GlaxoSmithKline plc, Merck & Co., Inc., Bausch Health Companies Inc., Elorac, Acrotech Biopharma, Novartis AG, Spectrum Pharmaceuticals, Inc., SHIONOGI & Co., Ltd., Autolus Therapeutics , Bristol-Myers Squibb Company, Sorrento Therapeutics, Inc., Amgen Inc. und Shenzhen Chipscreen Biosciences Co., unter anderem.
Holen Sie sich eine Musterkopie des Berichts: https://www.databridgemarketresearch.com/request-a-sample/?d…
Data Bridge Market Research analysiert, dass der Markt für die Behandlung von Thymus (T)-Zell-Lymphomen im Prognosezeitraum von 2022 bis 2029 mit einer CAGR von 9,02 % wachsen wird. Aufgrund der hohen Inzidenz- und Prävalenzrate wird erwartet, dass „Chemotherapie“ die größten Anteil am Thymus (T)-Zell-Lymphom-Behandlungsmarkt.
Treiber
Hohe Lymphom-Krebsinzidenzrate
Der Anstieg der Inzidenzrate von Lymphomkrebs wird als wichtiger Treiber fungieren, der im Prognosezeitraum zu einer Ausweitung der Wachstumsrate des Marktes führen wird.
Steigende Investitionen in die Infrastruktur des Gesundheitswesens
Ein weiterer wichtiger Faktor, der die Wachstumsrate des Marktes für die Behandlung von Thymus (T)-Zell-Lymphomen beeinflusst, sind die steigenden Gesundheitsausgaben, die zur Verbesserung der Infrastruktur beitragen.
Darüber hinaus sind die steigende Zahl der geriatrischen Bevölkerung und das zunehmende Lymphomrisiko aufgrund von Autoimmunerkrankungen die Faktoren, die den Markt für die Behandlung von Thymus (T)-Zell-Lymphomen erweitern werden. Andere Faktoren wie der sich ständig ändernde Lebensstil und steigende Investitionen in die Entwicklung fortschrittlicher und technischer Lösungen werden sich positiv auf die Wachstumsrate des Marktes für die Behandlung von Thymus (T)-Zell-Lymphomen auswirken. Darüber hinaus werden ein hohes verfügbares Einkommen und Fortschritte bei T-Zell-Lymphom-spezifischen Therapien den Markt für die Behandlung von Thymus (T)-Zell-Lymphomen erweitern.
Gelegenheiten
Steigende Investitionen und Forschungsgelder für die Behandlung des Thymus (T)-Zell-Lymphoms werden die Wachstumsrate ankurbeln
Darüber hinaus wird der Anstieg der Investitionen und Mittel für die Forschung auf dem Gebiet der T-Zell-Lymphom-Therapeutika neue Möglichkeiten für die Wachstumsrate des Marktes schaffen.
Auch eine Zunahme strategischer Partnerschaften mit verschiedenen öffentlichen und privaten Organisationen und eine Zunahme der Produktzulassungen und -einführungen werden dem Markt für die Behandlung von Thymus (T)-Zell-Lymphomen im Jahr 2022 2029 vorteilhafte Möglichkeiten bieten.
Die neueste Entwicklung
Im September 2021 hatte Soligenix Inc. bekannt gegeben, dass der Wirkstoff namens Hypericin vom Office of Orphan Products Development der US-amerikanischen Food and Drug Administration (FDA) für die Behandlung von T-Zell-Lymphomen mit der Orphan-Drug-Klassifizierung ausgezeichnet wurde, wodurch die Zielpopulation darüber hinaus erweitert wird das zuvor zugelassene kutane T-Zell-Lymphom (CTCL).
Globaler Thymus (T)-Zell-Lymphom-Behandlung Marktumfang
Der Markt für die Behandlung von Thymus (T)-Zell-Lymphomen ist nach Art, Behandlung, Diagnose, Dosierung, Verabreichungsweg, Endverbrauchern und Vertriebskanal segmentiert. Das Wachstum in diesen Segmenten hilft Ihnen bei der Analyse magerer Wachstumssegmente in den Branchen und bietet den Benutzern einen wertvollen Marktüberblick und Markteinblicke, um ihnen zu helfen, strategische Entscheidungen zur Identifizierung von Kernmarktanwendungen zu treffen.
Typ
Peripheres T-Zell-Lymphom
Kutanes T-Zell-Lymphom
Anaplastisches großzelliges Lymphom
Andere
Auf der Grundlage der Typen wird der Markt für die Behandlung von Thymus (T)-Zell-Lymphomen in peripheres T-Zell-Lymphom, kutanes T-Zell-Lymphom, anaplastisches großzelliges Lymphom und andere unterteilt.
Behandlung
Bestrahlung
Chemotherapie
Lichttherapie
Chirurgie
Medikamente
Andere
Auf der Grundlage der Behandlung wird der Markt für die Behandlung von Thymus (T)-Zell-Lymphomen in Bestrahlung, Chemotherapie, Lichttherapie, Chirurgie, Medikamente und andere unterteilt. Das Medikamentensegment ist weiter in Retinoide, Kortikosteroide und andere unterteilt. Lichttherapie
Diagnose
Blutzellenzählung
Gewebebiopsie
Computertomographie (CT) Scan
Positronenemissionstomographie (PET) Scan
Magnetresonanztomographie (MRI) Scan
Andere
Auf der Grundlage der Diagnose wird der Markt für die Behandlung von Thymus (T)-Zell-Lymphomen in Blutzellzählungen, Gewebebiopsie, Computertomographie (CT), Positronen-Emissions-Tomographie (PET), Magnetresonanztomographie (MRT) und andere unterteilt .
Zugriff auf den vollständigen Bericht: https://www.databridgemarketresearch.com/reports/global-t-ce…
Dosierung
Injektionstabletten
Sonstiges
_
Auf der Grundlage der Dosierung wird der Markt für die Behandlung von Thymus (T)-Zell-Lymphomen in Injektionen, Tabletten und andere unterteilt.
Weg der Verwaltung
Oral
Parenteral
Topisch
Andere
Auf der Grundlage des Verabreichungswegs wird der Markt für die Behandlung von Thymus (T)-Zell-Lymphomen in oral, parenteral, topisch und andere unterteilt.
Verwendung beenden
Klinik
Krankenhaus
Andere
Auf der Grundlage der Endbenutzer wird der Markt für die Behandlung von Thymus (T)-Zell-Lymphomen in Kliniken, Krankenhäuser und andere unterteilt.
Vertriebsweg
Krankenhausapotheke
Einzelhandelsapotheke
Online-Apotheke
Der Markt für die Behandlung von Thymus (T)-Zell-Lymphomen ist auch auf der Grundlage des Vertriebskanals in Krankenhausapotheke, Einzelhandelsapotheke und Online-Apotheke unterteilt.
Thymus (T)-Zell-Lymphom-Behandlung Marktregionale Analyse / Einblicke
Der Markt für die Behandlung von Thymus (T)-Zell-Lymphomen wird analysiert und Einblicke in die Marktgröße und Trends werden nach Land, Art, Behandlung, Diagnose, Dosierung, Verabreichungsweg, Endbenutzern und Vertriebskanal wie oben angegeben bereitgestellt.
Die im Marktbericht zur Behandlung von Thymus (T)-Zell-Lymphomen behandelten Länder sind die USA, Kanada und Mexiko in Nordamerika, Deutschland, Frankreich, Großbritannien, die Niederlande, die Schweiz, Belgien, Russland, Italien, Spanien, die Türkei und das übrige Europa in Europa , China, Japan, Indien, Südkorea, Singapur, Malaysia, Australien, Thailand, Indonesien, Philippinen, Rest des asiatisch-pazifischen Raums (APAC), Saudi-Arabien, Vereinigte Arabische Emirate, Südafrika, Ägypten, Israel , Rest des Nahen Ostens und Afrikas (MEA) als Teil von Naher Osten und Afrika (MEA), Brasilien, Argentinien und Rest von Südamerika als Teil von Südamerika.
Nordamerika dominiert den Markt für die Behandlung von Thymus (T)-Zell-Lymphomen in Bezug auf Marktanteil und Umsatz und wird seine Dominanz im Prognosezeitraum weiter ausbauen. Dies liegt an der Präsenz wichtiger Schlüsselakteure und der gut entwickelten Gesundheitsinfrastruktur in dieser Region.
Der asiatisch-pazifische Raum hingegen wird aufgrund der steigenden Prävalenzrate, der steigenden Investitionen im Gesundheitssektor und der wachsenden staatlichen Unterstützung voraussichtlich im Prognosezeitraum die höchste Wachstumsrate aufweisen.
Holen Sie sich das vollständige Inhaltsverzeichnis: https://www.databridgemarketresearch.com/toc/?dbmr=global-t-…
Ziele und Ziele der Thymus (T)-Zell-Lymphom-Behandlung-Marktstudie
Verständnis der Chancen und Fortschritte der Thymus (T)-Zell-Lymphom-Behandlung Markthighlights sowie der wichtigsten Regionen und Länder, die am Marktwachstum beteiligt sind.
Untersuchen Sie die verschiedenen Segmente des Thymus (T)-Zell-Lymphom-Behandlung-Marktes und die Dynamik der Thymus (T)-Zell-Lymphom-Behandlung auf dem Markt.
Segmente der Thymus (T)-Zell-Lymphom-Behandlung mit zunehmendem Wachstumspotenzial kategorisieren und den futuristischen Segmentmarkt bewerten
Analyse der wichtigsten Trends in Bezug auf die verschiedenen Segmente, die helfen, den Thymus (T)-Zell-Lymphom-Behandlung-Markt zu entschlüsseln und zu überzeugen.
Überprüfung des regionsspezifischen Wachstums und der Entwicklung auf dem Markt für die Behandlung von Thymus (T)-Zell-Lymphomen.
Verstehen Sie die Hauptakteure auf dem Markt für Thymus (T)-Zell-Lymphom-Behandlung und den Wert des Wettbewerbsimages der Marktführer für Thymus (T)-Zell-Lymphom-Behandlung.
Untersuchung wichtiger Pläne, Initiativen und Strategien für die Entwicklung des Thymus (T)-Zell-Lymphom-Behandlung Marktes.
Was DBMR von anderen Marktforschungsanbietern unterscheidet:
Die Gründung von DBMR wurde unterstützt, indem Kunden eine ganzheitliche Sicht auf Marktbedingungen und zukünftige Möglichkeiten/Gelegenheiten geboten wurde, um maximale Gewinne aus ihren Unternehmen zu ziehen und bei der Entscheidungsfindung zu helfen. Unser Team aus internen Analysten und Beratern arbeitet unermüdlich daran, Ihre Bedürfnisse zu verstehen und die bestmöglichen Lösungen zur Erfüllung Ihrer Forschungsanforderungen vorzuschlagen.
0,80 Dollar gute Untestützung
Die 0,80 Dollar scheint zu halten,die nächsten Wochen,sollten sich positiv gestalten. Ich rechne mit einer schnellen überwindung der 1 Dollar Marke.Alles aber nur meine Meinung
Soligenix Inc. im nächsten Jahr durchschnittlich 3,75 $
Soligenix Inc. [SNGX] – Wer sind die größten Aktionäre?Aus Unterlagen von The Vanguard Group, Inc. geht hervor, dass das Unternehmen nun 1.624.521 Aktien oder etwa 3,79 % der ausstehenden SNGX-Aktien besitzt. Mit anderen Worten, die Aktien des Investors sind gegenüber seiner vorherigen 13-F-Einreichung von 1627288,0 um -2.767 gefallen. Derzeit hält Plante Moran Financial Advisors L 71.658 Aktien im Wert von 62.701,0 $. IHT Wealth Management LLC besaß zum Zeitpunkt der letzten 13F-Anmeldung 70.150 Aktien des Unternehmens im Wert von 61381,0 USD.
Laut FactSet wird der Aktienkurs von Soligenix Inc. im nächsten Jahr durchschnittlich 3,75 $ betragen, basierend auf Meinungen von Analysten, die von der Firma befragt wurden. Dies ist ein Anstieg von fast 387,01 Prozent gegenüber dem vorherigen Schlusskurs von 0,77 $. Analysten erwarten, dass die Aktien von Soligenix Inc. den höheren Preis von 3,75 $ erreichen werden, während die niedrigste Preisschätzung bei 3,75 $ liegt. 1 Analyst hat die SNGX-Aktie in ihren Prognosen für 2022 jedoch mit „Kaufen“ bewertet
Präsentationen
PRINCETON, NJ , 8. September 2022 / PRNewswire / -- Soligenix, Inc. (Nasdaq: SNGX) (Soligenix oder das Unternehmen), ein biopharmazeutisches Unternehmen im Spätstadium, das sich auf die Entwicklung und Vermarktung von Produkten zur Behandlung seltener Krankheiten konzentriert, wo es eine gibt ungedeckter medizinischer Bedarf, gab heute bekannt, dass das Unternehmen auf der bevorstehenden HC Wainwright 24. Annual Global Investment Conference eine Unternehmenspräsentation halten wird . Die Konferenz findet vom 12. bis 14. September 2022 mit Präsentationen, Einzelgesprächen und Networking statt. Die On-Demand-Präsentation wird am Montag, den 12. September um 7:00 Uhr ET verfügbar sein. Die Präsentation ist für registrierte Teilnehmer über die Konferenzplattform verfügbar. Die Präsentation wird dort für 30 Tage archiviert. Weitere Informationen über die HC Wainwright Global Investment Conference finden Sie auf der Konferenz-Website unter https://hcwevents.com/annualconference/ . news vom 25.1022
https://ir.soligenix.com/2022-10-25-Soligenix-Announces-Form… NEWS es geht voran
27. Oktober 2022Soligenix wird eingeladen, einen BARDA-Vertragsvorschlag für die Entwicklung von thermostabilisierten Subunit-Impfstoffen gegen Sudan-Ebola- und Marburg-Viren einzureichen
Neu auftretende Infektionskrankheiten, für die derzeit keine schützenden Impfstoffe verfügbar sind SuVax™ zielt auf das Sudan-Ebolavirus ab, Ursprung eines aktuellen Krankheitsausbruchs in Uganda
Gepostet von MarketBeat News am 8. November 2022
T
Soligenix-LogoDer Aktienkurs von Soligenix, Inc. ( NASDAQ:SNGX – Get Rating ) überschritt während des Handels am Montag seinen gleitenden 200-Tage-Durchschnitt. Die Aktie hat einen gleitenden 200-Tage-Durchschnitt von 0,64 $ und wurde bis zu 0,66 $ gehandelt. Soligenix-Aktien wurden zuletzt bei 0,65 $ gehandelt, mit einem Volumen von 46.436 Aktien.
Soligenix-Aktienperformance
Das Unternehmen hat einen Verschuldungsgrad von 1,87, ein schnelles Verhältnis von 2,36 und ein aktuelles Verhältnis von 2,36. Der gleitende 50-Tage-Durchschnittskurs der Aktie beträgt 0,63 $ und der gleitende 200-Tage-Durchschnittskurs 0,64 $. Das Unternehmen hat eine Marktkapitalisierung von 28,01 Millionen US-Dollar, ein KGV von -1,81 und ein Beta von 1,76.
Erhalten Sie Soligenix- Warnungen:
Soligenix ( NASDAQ:SNGX – Get Rating ) hat zuletzt am Freitag, den 12. August, seine Gewinnergebnisse veröffentlicht. Das biopharmazeutische Unternehmen meldete für das Quartal einen Gewinn je Aktie (EPS) von (0,06 $) und übertraf damit die Konsensschätzungen der Analysten von (0,07 $) um 0,01 $. Das Unternehmen erzielte im Quartal einen Umsatz von 0,23 Millionen US-Dollar, verglichen mit den Erwartungen der Analysten von 0,20 Millionen US-Dollar. Soligenix hatte eine negative Nettomarge von 1.709,67 % und eine negative Eigenkapitalrendite von 139,31 %. Als Gruppe gehen Research-Analysten davon aus, dass Soligenix, Inc. für das laufende Geschäftsjahr -0,34 EPS veröffentlichen wird.
Institutionelle Investoren setzen auf Soligenix
Eine Reihe von institutionellen Anlegern und Hedgefonds haben kürzlich ihre Bestände an SNGX geändert. Renaissance Technologies LLC erhöhte seine Beteiligung an Soligenix im 2. Quartal um 45,5 %. Renaissance Technologies LLC besitzt nun 52.800 Aktien des biopharmazeutischen Unternehmens im Wert von 32.000 $, nachdem es während des Zeitraums weitere 16.500 Aktien erworben hat. ARGI Investment Services LLC erhöhte seine Beteiligung an Soligenix im 1. Quartal um 127,6 %. ARGI Investment Services LLC besitzt nun 46.836 Aktien des biopharmazeutischen Unternehmens im Wert von 34.000 $, nachdem es während des Zeitraums weitere 26.262 Aktien erworben hat. Schließlich stockte State Street Corp seine Beteiligung an Soligenix im 2. Quartal um 54,0 % auf. State Street Corp besitzt nun 72.964 Aktien des biopharmazeutischen Unternehmens im Wert von 44.000 $ nach dem Erwerb von weiteren 25, 594 Aktien während des Zeitraums. 7,39 % der Aktien befinden sich im Besitz von institutionellen Investoren.
T
Soligenix-LogoDer Aktienkurs von Soligenix, Inc. ( NASDAQ:SNGX – Get Rating ) überschritt während des Handels am Montag seinen gleitenden 200-Tage-Durchschnitt. Die Aktie hat einen gleitenden 200-Tage-Durchschnitt von 0,64 $ und wurde bis zu 0,66 $ gehandelt. Soligenix-Aktien wurden zuletzt bei 0,65 $ gehandelt, mit einem Volumen von 46.436 Aktien.
Soligenix-Aktienperformance
Das Unternehmen hat einen Verschuldungsgrad von 1,87, ein schnelles Verhältnis von 2,36 und ein aktuelles Verhältnis von 2,36. Der gleitende 50-Tage-Durchschnittskurs der Aktie beträgt 0,63 $ und der gleitende 200-Tage-Durchschnittskurs 0,64 $. Das Unternehmen hat eine Marktkapitalisierung von 28,01 Millionen US-Dollar, ein KGV von -1,81 und ein Beta von 1,76.
Erhalten Sie Soligenix- Warnungen:
Soligenix ( NASDAQ:SNGX – Get Rating ) hat zuletzt am Freitag, den 12. August, seine Gewinnergebnisse veröffentlicht. Das biopharmazeutische Unternehmen meldete für das Quartal einen Gewinn je Aktie (EPS) von (0,06 $) und übertraf damit die Konsensschätzungen der Analysten von (0,07 $) um 0,01 $. Das Unternehmen erzielte im Quartal einen Umsatz von 0,23 Millionen US-Dollar, verglichen mit den Erwartungen der Analysten von 0,20 Millionen US-Dollar. Soligenix hatte eine negative Nettomarge von 1.709,67 % und eine negative Eigenkapitalrendite von 139,31 %. Als Gruppe gehen Research-Analysten davon aus, dass Soligenix, Inc. für das laufende Geschäftsjahr -0,34 EPS veröffentlichen wird.
Institutionelle Investoren setzen auf Soligenix
Eine Reihe von institutionellen Anlegern und Hedgefonds haben kürzlich ihre Bestände an SNGX geändert. Renaissance Technologies LLC erhöhte seine Beteiligung an Soligenix im 2. Quartal um 45,5 %. Renaissance Technologies LLC besitzt nun 52.800 Aktien des biopharmazeutischen Unternehmens im Wert von 32.000 $, nachdem es während des Zeitraums weitere 16.500 Aktien erworben hat. ARGI Investment Services LLC erhöhte seine Beteiligung an Soligenix im 1. Quartal um 127,6 %. ARGI Investment Services LLC besitzt nun 46.836 Aktien des biopharmazeutischen Unternehmens im Wert von 34.000 $, nachdem es während des Zeitraums weitere 26.262 Aktien erworben hat. Schließlich stockte State Street Corp seine Beteiligung an Soligenix im 2. Quartal um 54,0 % auf. State Street Corp besitzt nun 72.964 Aktien des biopharmazeutischen Unternehmens im Wert von 44.000 $ nach dem Erwerb von weiteren 25, 594 Aktien während des Zeitraums. 7,39 % der Aktien befinden sich im Besitz von institutionellen Investoren.
Soligenix gibt jüngste Erfolge und Finanzergebnisse für das dritte Quartal 2022 bekannt
PRINCETON, NJ , 10. November 2022 / PRNewswire / -- Soligenix, Inc. (Nasdaq: SNGX) (Soligenix oder das Unternehmen), ein biopharmazeutisches Unternehmen im Spätstadium, das sich auf die Entwicklung und Vermarktung von Produkten zur Behandlung seltener Krankheiten konzentriert, wo es eine gibt ungedeckter medizinischer Bedarf, gab heute seine jüngsten Erfolge und Finanzergebnisse für das am 30. September 2022 endende Quartal bekannt .
„Wir haben im Jahr 2022 weiterhin bedeutende Meilensteine in unserer Entwicklungspipeline erreicht. Der wichtigste steht noch in diesem Quartal mit der Einreichung unseres neuen Arzneimittelantrags (NDA) bei der US-amerikanischen Food and Drug Administration (FDA) für HyBryte™ (synthetisch Hypericin) bei der Behandlung des kutanen T-Zell-Lymphoms (CTCL)", sagte Christopher J. Schaber , PhD, President und Chief Executive Officer von Soligenix. „Wir haben uns auch über die Förderzusage der FDA für die Entwicklung von Orphan-Produkten in Höhe von 2,6 Millionen US-Dollar gefreutüber 4 Jahre zur Unterstützung der Bewertung von HyBryte™ für eine erweiterte Behandlung bei Patienten mit CTCL im Frühstadium, einschließlich in der häuslichen Umgebung. Darüber hinaus treiben wir die Entwicklung von synthetischem Hypericin in anderen Krankheitsindikationen wie Psoriasis voran, wo wir beabsichtigen, in Zusammenarbeit mit unserem kürzlich eingerichteten Medical Advisory Board (MAB) eine klinische Studie der Phase 2a zur Behandlung von leichter bis mittelschwerer Erkrankung zu initiieren Psoriasis im Dezember.
Mit Unterstützung des National Institute of Allergy and Infectious Diseases konnten wir mit unseren SuVax™- bzw. MarVax™-Impfstoffen einen 100-prozentigen Schutz von nichtmenschlichen Primaten sowohl vor dem tödlichen Sudan - Ebolavirus als auch vor dem Marburg-Marburgvirus nachweisen. Mit dem Erreichen dieser wichtigen Meilensteine hatten wir das Glück, von der Abteilung für chemische, biologische, radiologische und nukleare (CBRN) medizinische Gegenmaßnahmen der Biomedical Advanced Research and Development Authority (BARDA) eine Einladung zur Einreichung eines vollständigen Vertragsvorschlags für die weitere Entwicklung zu erhalten dieser neuartigen Impfstoffkandidaten als medizinische Gegenmaßnahmen zum Einsatz im Falle eines Sudan -Ebolavirus bzwAusbruch des Marburg-Marburgvirus . Eine Aufforderung zur Einreichung eines Vertragsvorschlags ist zwar keine Garantie für die Finanzierung, wir glauben jedoch, dass wir gut positioniert sind, um Entwicklungsunterstützung von BARDA für diese Indikation zu erhalten, die es uns ermöglicht, die wachsende Zahl überzeugender wissenschaftlicher Beweise für unsere hitzestabile Filovirus-Impfstoffplattform weiter zu demonstrieren , einschließlich Impfstoffkandidaten, die gegen das Sudan - Ebolavirus und das Marburg-Marburgvirus gerichtet sind .
Dr. Schaber fuhr fort: „Mit ungefähr 16,9 Millionen US -Dollar in bar, ohne unsere nicht verwässernde staatliche Finanzierung, gehen wir davon aus, dass wir über das notwendige Kapital verfügen, um unsere kurzfristigen Meilensteine zu erreichen, während wir weiterhin verschiedene strategische Optionen prüfen, einschließlich, aber nicht beschränkt auf , Partnerschaften sowie Fusions- und Übernahmemöglichkeiten."
Jüngste Errungenschaften von Soligenix
PRINCETON, NJ , 10. November 2022 / PRNewswire / -- Soligenix, Inc. (Nasdaq: SNGX) (Soligenix oder das Unternehmen), ein biopharmazeutisches Unternehmen im Spätstadium, das sich auf die Entwicklung und Vermarktung von Produkten zur Behandlung seltener Krankheiten konzentriert, wo es eine gibt ungedeckter medizinischer Bedarf, gab heute seine jüngsten Erfolge und Finanzergebnisse für das am 30. September 2022 endende Quartal bekannt .
„Wir haben im Jahr 2022 weiterhin bedeutende Meilensteine in unserer Entwicklungspipeline erreicht. Der wichtigste steht noch in diesem Quartal mit der Einreichung unseres neuen Arzneimittelantrags (NDA) bei der US-amerikanischen Food and Drug Administration (FDA) für HyBryte™ (synthetisch Hypericin) bei der Behandlung des kutanen T-Zell-Lymphoms (CTCL)", sagte Christopher J. Schaber , PhD, President und Chief Executive Officer von Soligenix. „Wir haben uns auch über die Förderzusage der FDA für die Entwicklung von Orphan-Produkten in Höhe von 2,6 Millionen US-Dollar gefreutüber 4 Jahre zur Unterstützung der Bewertung von HyBryte™ für eine erweiterte Behandlung bei Patienten mit CTCL im Frühstadium, einschließlich in der häuslichen Umgebung. Darüber hinaus treiben wir die Entwicklung von synthetischem Hypericin in anderen Krankheitsindikationen wie Psoriasis voran, wo wir beabsichtigen, in Zusammenarbeit mit unserem kürzlich eingerichteten Medical Advisory Board (MAB) eine klinische Studie der Phase 2a zur Behandlung von leichter bis mittelschwerer Erkrankung zu initiieren Psoriasis im Dezember.
Mit Unterstützung des National Institute of Allergy and Infectious Diseases konnten wir mit unseren SuVax™- bzw. MarVax™-Impfstoffen einen 100-prozentigen Schutz von nichtmenschlichen Primaten sowohl vor dem tödlichen Sudan - Ebolavirus als auch vor dem Marburg-Marburgvirus nachweisen. Mit dem Erreichen dieser wichtigen Meilensteine hatten wir das Glück, von der Abteilung für chemische, biologische, radiologische und nukleare (CBRN) medizinische Gegenmaßnahmen der Biomedical Advanced Research and Development Authority (BARDA) eine Einladung zur Einreichung eines vollständigen Vertragsvorschlags für die weitere Entwicklung zu erhalten dieser neuartigen Impfstoffkandidaten als medizinische Gegenmaßnahmen zum Einsatz im Falle eines Sudan -Ebolavirus bzwAusbruch des Marburg-Marburgvirus . Eine Aufforderung zur Einreichung eines Vertragsvorschlags ist zwar keine Garantie für die Finanzierung, wir glauben jedoch, dass wir gut positioniert sind, um Entwicklungsunterstützung von BARDA für diese Indikation zu erhalten, die es uns ermöglicht, die wachsende Zahl überzeugender wissenschaftlicher Beweise für unsere hitzestabile Filovirus-Impfstoffplattform weiter zu demonstrieren , einschließlich Impfstoffkandidaten, die gegen das Sudan - Ebolavirus und das Marburg-Marburgvirus gerichtet sind .
Dr. Schaber fuhr fort: „Mit ungefähr 16,9 Millionen US -Dollar in bar, ohne unsere nicht verwässernde staatliche Finanzierung, gehen wir davon aus, dass wir über das notwendige Kapital verfügen, um unsere kurzfristigen Meilensteine zu erreichen, während wir weiterhin verschiedene strategische Optionen prüfen, einschließlich, aber nicht beschränkt auf , Partnerschaften sowie Fusions- und Übernahmemöglichkeiten."
Jüngste Errungenschaften von Soligenix
Soligenix erhält unverwässerte Finanzierung in Höhe von 1,2 Mio. USD
PRINCETON, NJ , 15. November 2022 / PRNewswire / -- Soligenix, Inc. (Nasdaq: SNGX) (Soligenix oder das Unternehmen), ein biopharmazeutisches Unternehmen im Spätstadium, das sich auf die Entwicklung und Vermarktung von Produkten zur Behandlung seltener Krankheiten konzentriert, wo es eine gibt ungedeckten medizinischen Bedarf, gab heute bekannt, dass es eine vorläufige Genehmigung für eine Steuergutschrift vom New Jersey Technology Business Tax Certificate Transfer Program der New Jersey Economic Development Authority (NJEDA) erhalten hat. Infolgedessen geht das Unternehmen davon aus, dieses Guthaben übertragen zu können und einenNettoerlös von etwa 1,2 Millionen US-Dollar zu erhalten.„Dies ist unser dreizehntes Jahr, in dem wir eine NOL-Finanzierung (Net Operating Loss) erhalten“, sagte Christopher J. Schaber , PhD, President und Chief Executive Officer von Soligenix, „In diesem Zeitraum haben wir fast 9 Millionen US -Dollar an unverwässerter NOL-Finanzierung erhalten Dadurch konnten wir unsere Pipeline für seltene Krankheiten vorantreiben und erweitern.Noch vor Ende dieses Jahres werden wir bei der US-amerikanischen Food and Drug Administration unseren neuen Arzneimittelantrag (NDA) für HyBryte™ (synthetisches Hypericin) zur Behandlung von kutanem T. einreichen -Zell-Lymphom (CTCL) sowie den Beginn einer klinischen Phase-2a-Studie mit SGX302 (synthetisches Hypericin) zur Behandlung von leichter bis mittelschwerer Psoriasis ."
Dr. Schaber fuhr fort: „Da wir immer nach nicht verwässernden Möglichkeiten suchen, unser Unternehmen zu finanzieren, freuen wir uns erneut sehr über die kontinuierliche Unterstützung der Biotechnologiebranche durch NJEDA. Mit über 16 Millionen US -Dollar in bar, ohne unsere nicht verwässernde Finanzierung , konzentrieren wir uns weiterhin darauf, die US-Kommerzialisierung von HyBryte™ in CTCL voranzutreiben, wo ein jährlicher Spitzenumsatz von über 90 Millionen US-Dollar erwartet wird, wobei der gesamte adressierbare weltweite Markt auf etwa 250 Millionen US-Dollar pro Jahr geschätzt wird."
Dieses wettbewerbsfähige NJEDA-Programm ermöglicht zugelassenen Technologie- und Biotechnologieunternehmen, ihre ungenutzten NOL-Überträge und ungenutzten Steuergutschriften für Forschung und Entwicklung (F&E) an unabhängige, profitable Körperschaftsteuerzahler im Bundesstaat New Jersey zu verkaufen . Dies ermöglicht es Unternehmen mit NOLs, ihre steuerlichen Verluste und Gutschriften in Bareinnahmen umzuwandeln, um zusätzliche F&E zu finanzieren, Ausrüstung und/oder Einrichtungen zu kaufen oder andere zulässige Ausgaben zu decken. Die NJEDA bestimmt die Eignung für das Programm, die New Jersey Division of Taxation bestimmt den Wert der verfügbaren Steuervorteile (NOLs und R&D Tax Credits) und die New Jersey Commission on Science and Technology bewertet die Technologie und ihre Realisierbarkeit. Der Bundesstaat New Jerseywar der Urheber dieses Programms und der erste Staat, der es umsetzte und finanzierte.
Was ist passiert
weiss hier jemand was passiert ist, warum der urs so nach unten geht? Ich habe keine negative Nachricht gefunden

Antwort auf Beitrag Nr.: 72.980.977 von vinod am 27.12.22 17:32:42
Daher müssen wir jetzt einen umgekehrten Aktiensplit in Betracht ziehen
ich bin mit plus minus 0 mal raus
Soligenix gibt die Verteilung von Vorzugsaktien der Serie D an die Inhaber seiner Stammaktien bekannt
PRINCETON, NJ , 23. Dezember 2022 / PRNewswire / -- Soligenix, Inc. (Nasdaq: SNGX) (Soligenix oder das Unternehmen), ein biopharmazeutisches Unternehmen im Spätstadium, das sich auf die Entwicklung und Vermarktung von Produkten zur Behandlung seltener Krankheiten konzentriert, wo es eine gibt ungedeckter medizinischer Bedarf, gab heute bekannt, dass sein Board of Directors eine Dividende von einem Tausendstel einer Aktie neu benannter Vorzugsaktien der Serie D mit einem Nennwert von 0,001 $ pro Aktie für jede ausstehende Aktie der Stammaktien des Unternehmens beschlossen hat, die zum Stand der Aufzeichnungen gehalten werden 17:00 Uhr Eastern Standard Time am 3. Januar 2023 . Die Anteile der Vorzugsaktien der Serie D werden um 17:00 Uhr Eastern Standard Time andiese Empfänger verteilt4. Januar 2023 . Die ausstehenden Aktien der Vorzugsaktien der Serie D stimmen zusammen mit den ausstehenden Aktien der Stammaktien des Unternehmens als eine einzige Klasse ausschließlich in Bezug auf einen umgekehrten Aktiensplit sowie jeden Vorschlag zur Vertagung einer zu diesem Zweck einberufenen Versammlung der Aktionäre ab über den umgekehrten Aktiensplit abzustimmen, und ist nicht berechtigt, über andere Angelegenheiten abzustimmen, außer in dem Umfang, der nach dem Delaware General Corporation Law erforderlich ist. Vorbehaltlich bestimmter Beschränkungen verfügt jede ausstehende Aktie der Vorzugsaktie der Serie D über 1.000.000 Stimmen pro Aktie (oder 1.000 Stimmen pro ein Tausendstel einer Aktie der Vorzugsaktie der Serie D).
„Die aktuellen Marktbedingungen sind für viele große und kleine Unternehmen extrem schwierig, und Soligenix ist da keine Ausnahme“, sagte Christopher J. Schaber , PhD, President und Chief Executive Officer von Soligenix. „Nachdem wir das Nasdaq-Defizitschreiben erhalten hatten, aus dem hervorgeht, dass das Unternehmen den erforderlichen Mindestgebotspreis von 1,00 $ nicht mehr erreicht hat, waren wir zuversichtlich, dass unsere wichtigen Meilensteine im Jahr 2022 wie die Einreichung des HyBryte™-Antrags auf ein neues Medikament erreicht werden(NDA), hatte das Potenzial, das Unternehmen wieder in Übereinstimmung mit den Nasdaq-Anforderungen zu bringen. Leider reagierte unser Aktienkurs trotz des Erreichens dieser wichtigen Meilensteine nicht so, wie wir es uns in diesen schwierigen globalen Marktbedingungen erhofft hatten. Daher müssen wir jetzt einen umgekehrten Aktiensplit in Betracht ziehen, um unsere Nasdaq-Notierung aufrechtzuerhalten, die für den zukünftigen Erfolg des Unternehmens sehr wichtig ist, während wir uns auf eine mögliche NDA-Zulassung und den US-Start zubewegen, und um die Partnerschaftsgespräche fortzusetzen. Es sollte unsere Aktie auch für größere institutionelle Investoren attraktiver machen."
Alle Vorzugsaktien der Serie D, die nicht persönlich oder durch einen Bevollmächtigten bei der Aktionärsversammlung anwesend sind, die zur Abstimmung über den umgekehrten Aktiensplit unmittelbar vor der Eröffnung der Wahllokale bei einer solchen Versammlung abgehalten wird, werden automatisch von der Gesellschaft zurückgenommen. Alle ausstehenden Vorzugsaktien der Serie D, die nicht auf diese Weise zurückgenommen wurden, werden zurückgenommen, wenn eine solche Rücknahme vom Board of Directors des Unternehmens angeordnet wird, oder automatisch nach Zustimmung der Aktionäre des Unternehmens zu einer Änderung der Gründungsurkunde des Unternehmens, die die Umkehrung der Aktien bewirkt bei einem solchen Treffen getrennt.
Die Vorzugsaktien der Serie D sind unverbrieft, und keine Aktien der Vorzugsaktien der Serie D können von einem ihrer Inhaber übertragen werden, außer in Verbindung mit einer Übertragung von Stammaktien des Unternehmens durch diesen Inhaber durch diesen Inhaber. In diesem Fall würde eine Anzahl von einem Tausendstel einer Aktie der Serie D-Vorzugsaktien, die der Anzahl der von diesem Inhaber zu übertragenden Stammaktien der Gesellschaft entspricht, auf den Erwerber dieser Stammaktien übertragen.
Weitere Einzelheiten zu den Vorzugsaktien der Serie D werden in einem Bericht auf Formular 8-K enthalten sein, der vom Unternehmen bei der Securities and Exchange Commission einzureichen ist.
Daher müssen wir jetzt einen umgekehrten Aktiensplit in Betracht ziehen
ich bin mit plus minus 0 mal raus
Soligenix gibt die Verteilung von Vorzugsaktien der Serie D an die Inhaber seiner Stammaktien bekannt
PRINCETON, NJ , 23. Dezember 2022 / PRNewswire / -- Soligenix, Inc. (Nasdaq: SNGX) (Soligenix oder das Unternehmen), ein biopharmazeutisches Unternehmen im Spätstadium, das sich auf die Entwicklung und Vermarktung von Produkten zur Behandlung seltener Krankheiten konzentriert, wo es eine gibt ungedeckter medizinischer Bedarf, gab heute bekannt, dass sein Board of Directors eine Dividende von einem Tausendstel einer Aktie neu benannter Vorzugsaktien der Serie D mit einem Nennwert von 0,001 $ pro Aktie für jede ausstehende Aktie der Stammaktien des Unternehmens beschlossen hat, die zum Stand der Aufzeichnungen gehalten werden 17:00 Uhr Eastern Standard Time am 3. Januar 2023 . Die Anteile der Vorzugsaktien der Serie D werden um 17:00 Uhr Eastern Standard Time andiese Empfänger verteilt4. Januar 2023 . Die ausstehenden Aktien der Vorzugsaktien der Serie D stimmen zusammen mit den ausstehenden Aktien der Stammaktien des Unternehmens als eine einzige Klasse ausschließlich in Bezug auf einen umgekehrten Aktiensplit sowie jeden Vorschlag zur Vertagung einer zu diesem Zweck einberufenen Versammlung der Aktionäre ab über den umgekehrten Aktiensplit abzustimmen, und ist nicht berechtigt, über andere Angelegenheiten abzustimmen, außer in dem Umfang, der nach dem Delaware General Corporation Law erforderlich ist. Vorbehaltlich bestimmter Beschränkungen verfügt jede ausstehende Aktie der Vorzugsaktie der Serie D über 1.000.000 Stimmen pro Aktie (oder 1.000 Stimmen pro ein Tausendstel einer Aktie der Vorzugsaktie der Serie D).
„Die aktuellen Marktbedingungen sind für viele große und kleine Unternehmen extrem schwierig, und Soligenix ist da keine Ausnahme“, sagte Christopher J. Schaber , PhD, President und Chief Executive Officer von Soligenix. „Nachdem wir das Nasdaq-Defizitschreiben erhalten hatten, aus dem hervorgeht, dass das Unternehmen den erforderlichen Mindestgebotspreis von 1,00 $ nicht mehr erreicht hat, waren wir zuversichtlich, dass unsere wichtigen Meilensteine im Jahr 2022 wie die Einreichung des HyBryte™-Antrags auf ein neues Medikament erreicht werden(NDA), hatte das Potenzial, das Unternehmen wieder in Übereinstimmung mit den Nasdaq-Anforderungen zu bringen. Leider reagierte unser Aktienkurs trotz des Erreichens dieser wichtigen Meilensteine nicht so, wie wir es uns in diesen schwierigen globalen Marktbedingungen erhofft hatten. Daher müssen wir jetzt einen umgekehrten Aktiensplit in Betracht ziehen, um unsere Nasdaq-Notierung aufrechtzuerhalten, die für den zukünftigen Erfolg des Unternehmens sehr wichtig ist, während wir uns auf eine mögliche NDA-Zulassung und den US-Start zubewegen, und um die Partnerschaftsgespräche fortzusetzen. Es sollte unsere Aktie auch für größere institutionelle Investoren attraktiver machen."
Alle Vorzugsaktien der Serie D, die nicht persönlich oder durch einen Bevollmächtigten bei der Aktionärsversammlung anwesend sind, die zur Abstimmung über den umgekehrten Aktiensplit unmittelbar vor der Eröffnung der Wahllokale bei einer solchen Versammlung abgehalten wird, werden automatisch von der Gesellschaft zurückgenommen. Alle ausstehenden Vorzugsaktien der Serie D, die nicht auf diese Weise zurückgenommen wurden, werden zurückgenommen, wenn eine solche Rücknahme vom Board of Directors des Unternehmens angeordnet wird, oder automatisch nach Zustimmung der Aktionäre des Unternehmens zu einer Änderung der Gründungsurkunde des Unternehmens, die die Umkehrung der Aktien bewirkt bei einem solchen Treffen getrennt.
Die Vorzugsaktien der Serie D sind unverbrieft, und keine Aktien der Vorzugsaktien der Serie D können von einem ihrer Inhaber übertragen werden, außer in Verbindung mit einer Übertragung von Stammaktien des Unternehmens durch diesen Inhaber durch diesen Inhaber. In diesem Fall würde eine Anzahl von einem Tausendstel einer Aktie der Serie D-Vorzugsaktien, die der Anzahl der von diesem Inhaber zu übertragenden Stammaktien der Gesellschaft entspricht, auf den Erwerber dieser Stammaktien übertragen.
Weitere Einzelheiten zu den Vorzugsaktien der Serie D werden in einem Bericht auf Formular 8-K enthalten sein, der vom Unternehmen bei der Securities and Exchange Commission einzureichen ist.
Eine Frage
Hallo Pipsii, eine Frage, ich habe 7000 Aktien und verstehe im Moment aus dem Text heraus nicht, was es für meine Aktien bedeuten wird. Bin nur mir dieser einen Aktien investiert. Macht wahrscheinlich keinen Sinn sie jetzt noch zu verkaufen ?
Hallo vinod
Da der Kurs schon längere Zeit unter einen Euro steht,kann sie die Nasdaq Notierung nicht mehr aufrechterhalten. Darum muss wahrscheinlich ein Resplit vollzogen werden. Das heißt nach den Resplit muss sie über einen Euro stehen. Zum jetzigen Zeitpunkt mindestens 1 zu 2 . In deinen Fall aus 7000 werden 3500 Aktien. Kann natürlich auch höher angestetz werden.
Da der Kurs schon längere Zeit unter einen Euro steht,kann sie die Nasdaq Notierung nicht mehr aufrechterhalten. Darum muss wahrscheinlich ein Resplit vollzogen werden. Das heißt nach den Resplit muss sie über einen Euro stehen. Zum jetzigen Zeitpunkt mindestens 1 zu 2 . In deinen Fall aus 7000 werden 3500 Aktien. Kann natürlich auch höher angestetz werden.
Antwort auf Beitrag Nr.: 72.982.480 von pipsii am 27.12.22 21:52:27Wie siehst du die Zukunft von Soligenix? Hat der Laden eine Chance?
Soligenix ist eine Wette, auf die eventuelle nächste Plandemie " Ebola,Marburgfieber " darum war ich investiert. Aber so wie es aussieht, kommt die nächste erst 2025 mit dem Namen SEERS25....erst mal abwarten,was 2023 mit dem Resplit passiert.... ist halt eine Risiko Aktie
Antwort auf Beitrag Nr.: 72.983.698 von pipsii am 28.12.22 08:57:03Danke für dein Statement. Stichwort Risikoaktie - welche Aktie ist das nicht?
Hallo pisii
vielen Dank für deine Antwort. Für mich lohnt es sich im Moment leider nicht mehr zu verkaufen. Werde abwarten, was passiert. Glaube daran, das wir hier doch nochmal andere Kurse sehen werden, wenn auch vielleicht erst in 2-3 Jahren.
vielen Dank für deine Antwort. Für mich lohnt es sich im Moment leider nicht mehr zu verkaufen. Werde abwarten, was passiert. Glaube daran, das wir hier doch nochmal andere Kurse sehen werden, wenn auch vielleicht erst in 2-3 Jahren.
Antwort auf Beitrag Nr.: 72.992.179 von vinod am 29.12.22 16:06:24Geht mir genauso
was mich ein wenig wundert; es gibt über 40 Mil, Aktien. Nacg der Bekanntgabe des neg. Split wurden jedoch nur ca. 600 000 Aktien gehamdelt. Ist verhältnissmässig wenig, oder was meint ihr.
Hallo.... die Bekanntgabe war am 23.12. Heute ist kein Handel in der USA. Viele sind zwischen den Feiertagen im Urlaub. Mal schauen, was ab Morgen an Umsätzen kommen.
Hallo... wiß schon jemand bezüglich des Splits? Der Handel ist ja eher bescheiden.
Soligenix wurde eingeladen, beim Virtual Investor Summit Event zu präsentieren
PRINCETON, NJ , 19. Januar 2023 / PRNewswire / -- Soligenix, Inc. (Nasdaq: SNGX) (Soligenix oder das Unternehmen), ein biopharmazeutisches Unternehmen im Spätstadium, das sich auf die Entwicklung und Vermarktung von Produkten zur Behandlung seltener Krankheiten konzentriert, wo es eine gibt ungedeckten medizinischen Bedarf, gab heute bekannt, dass es auf dem bevorstehenden Virtual Investor Summit am 26. Januar 2023 präsentieren wird . Die Präsentation findet um 9:00 Uhr ET statt . Um die Präsentation anzusehen, besuchen Sie bitte https://us06web.zoom.us/webinar/register/WN_BWAFeDdXTuOpaC0g… . Das Unternehmen war eines von 25 Unternehmen, die ausgewählt wurden, um an dieser Konferenz teilzunehmen, basierend auf seinen wichtigsten Katalysatoren, einschließlich der Einreichung eines neuen Arzneimittelantrags für seinen führenden Produktkandidaten,HyBryte ™ bei der Behandlung von kutanem T-Zell-Lymphom. Weitere Informationen zum Investor Summit finden Sie auf der Website unter https://investorsummitgroup.com/ . Die Konferenz ist für qualifizierte Investoren kostenlos und die Registrierung ist über die Konferenz-Website möglich.Wichtige Mitglieder des Managements von Soligenix werden während der Konferenz Einzelgespräche führen. Wenn Sie nicht an der Konferenz teilnehmen können und ein separates Treffen mit dem Management vereinbaren möchten, wenden Sie sich bitte an ir@soligenix.com .
Aktiensplit im Verhältnis 1:15
Die Stammaktien von Soligenix werden weiterhin am Nasdaq Capital Market unter dem Symbol SNGX gehandelt und beginnen den Handel auf splitbereinigter Basis, wenn der Markt am Freitag, den 10. Februar 2023 öffnet. Die neue CUSIP-Nummer für die Stammaktien des Unternehmens nach dem umgekehrten Aktiensplit lautet 834223505.
Hallo Pipsi
vielen Dank für die Info, der Split 1:15 ist allerdings schon sehr hoch. Dann wird es danach insgesamt nur ca. 2,8 Mil. Gesamtaktien geben. Mal sehen zu welchem Kurs.
vielen Dank für die Info, der Split 1:15 ist allerdings schon sehr hoch. Dann wird es danach insgesamt nur ca. 2,8 Mil. Gesamtaktien geben. Mal sehen zu welchem Kurs.
https://www.berliner-zeitung.de/news/aequatorialguinea-hochgefaehrliches-marburg-virus-ausgebrochen-li.317536
Könnte unsere Soligenix gemeint sein. Test an Primaten erfolgreich? Was meint ihr.
Gut möglich. Ich hatte im letzten Jahr mal Verbindungen zu Bill Gates, Gavi und Soligenix gepostet.
Vorbörslich knapp 12% im Plus
Das ist der Grund
Soligenix erhält von der US-Zulassungsbehörde FDA die Weigerung, ein Schreiben für die Anwendung des neuen Arzneimittels HyBryte™ zur Behandlung des kutanen T-Zell-Lymphoms einzureichen .PRINCETON, NJ , 14. Februar 2023 / PRNewswire / -- Soligenix, Inc. (Nasdaq: SNGX) (Soligenix oder das Unternehmen), ein biopharmazeutisches Unternehmen im Spätstadium, das sich auf die Entwicklung und Vermarktung von Produkten zur Behandlung seltener Krankheiten konzentriert, wo es eine gibt ungedeckter medizinischer Bedarf, gab heute bekannt, dassFood and Drug Administration (FDA) der Vereinigten Staaten (US) dem Unternehmen ein RTF-Schreiben (Refusal to File) für seinen neuen Arzneimittelantrag (NDA) HyBryte ™ (synthetisches Hypericin) zur Behandlung vorgelegt hat des kutanen T-Zell-Lymphoms (CTCL) im Frühstadium
Nach einer vorläufigen Prüfung stellte die FDA fest, dass die am 14. Dezember 2022 eingereichte NDA nicht vollständig genug war, um eine inhaltliche Prüfung zu ermöglichen. Soligenix erfuhr zuerst durch dieses Schreiben von der RTF-Entscheidung und prüft ihren Inhalt, um die angemessenen nächsten Schritte festzulegen, einschließlich, aber nicht beschränkt auf die Beantragung eines Typ-A-Treffens mit der FDA, um die in dem Schreiben genannten Probleme zu klären und darauf zu reagieren und um zusätzliche Anleitungen zu Informationen einzuholen, die die Behörde benötigen würde, damit eine erneut eingereichte NDA als akzeptabel für die Einreichung angesehen wird.
"Wir sind fest entschlossen, so schnell wie möglich mit den Mitarbeitern der FDA zusammenzuarbeiten, um die offenen Fragen besser zu verstehen und den potenziellen Weg zur erfolgreichen erneuten Einreichung unseres Antrags zu klären", sagte Christopher J. Schaber, PhD, President und Chief Executive Officer von Soligenix. „Wir konzentrieren uns weiterhin darauf, HyBryte™ als potenzielle neue erstklassige Behandlungsoption für die CTCL-Gemeinschaft von Patienten, Familien und medizinischem Fachpersonal weiterzuentwickeln.“
Über HyBryte™
Moin,
für mich ist das eine schlechte News. Der Antrag muß neu gestellt werden und das dauert wieder!!
für mich ist das eine schlechte News. Der Antrag muß neu gestellt werden und das dauert wieder!!
Immer das gleiche, bald wieder unter 1 $. Hab meine Kohle hier gedanklich abgeschrieben.
Antwort auf Beitrag Nr.: 73.291.070 von rokz am 14.02.23 13:59:11ist gerade bei 40% minus.
Sorry, aber echt amateurhaft von der Firma.
Sorry, aber echt amateurhaft von der Firma.
Ok, gut runter korrigiert
Bedeutet wahrscheinlich 6-12 Monate Verzögerung.
So ein Antrag ist für kleinere Firmen nicht zu unterschätzen. Es ist eine sehr gute große Menge an Daten die eingereicht werden müssen und da können sich natürlich hier und da Fehler ergeben.
Und wenn der Antrag dann nicht korrekt ist, passiert genau das.
Mit dem Risiko muss man rechnen.
Am Ende wenn die Zulassung kommt, ist es natürlich trotzdem okay aber die Opportuniäts Kosten sind jetzt leider hoch.
Zum Glück habe ich hier nur den Rest Bestand
Drinnen
So ein Antrag ist für kleinere Firmen nicht zu unterschätzen. Es ist eine sehr gute große Menge an Daten die eingereicht werden müssen und da können sich natürlich hier und da Fehler ergeben.
Und wenn der Antrag dann nicht korrekt ist, passiert genau das.
Mit dem Risiko muss man rechnen.
Am Ende wenn die Zulassung kommt, ist es natürlich trotzdem okay aber die Opportuniäts Kosten sind jetzt leider hoch.
Zum Glück habe ich hier nur den Rest Bestand
Drinnen
Im Moment kennt der Kurs nur eine Richtung, und zwar nach unten. Inzwischen bereue ich es bei der Bekanntgabe des Aktiensplits nicht verkauft zu haben. was für Verluste. I ch bin mir sicher <, das die Firma zur Zeit des ssSplits schon von der negativen Nachricht durch die FDA wußte, daher ein Split1:15. Was ich nur hoffe ist, dass sich der Kurs beim der Antragzusage erholt, dann bin ich hier aber raus. Habe scho nicht wenig verloren.
was mich auch wundert ist, dass die Aktie seit 15.2. in deutscland an den Handelsplätzen nicht mehr gelistet ist, weiß jemand warum
.
.
Antwort auf Beitrag Nr.: 73.380.210 von vinod am 28.02.23 21:13:02Sollst am neuen Impfstoff Rivax nicht partizipieren kônnen in D
Soligenix.com siehe news
Soligenix reicht Typ-A-Meeting-Antrag bei der US-Zulassungsbehörde FDA für HyBryte™ Zulassung als neues Medikament zur Behandlung von kutanem T-Zell-Lymphom ein
Habe ich auch schon gelesen, bin gespannt, ob sich das auf den Kurs auswirkt. Kann es sein, dass es seit dem 15.2. keinen neuen Kurs in Frankfurt und Co gibt? Weiß da jemand Näheres?
news releases
Update on FDA Meeting Outcome Expected by End of April
Das war es jetzt wahrscheinlich erstmal für längere Zeit. Es wird eine zusätzliche Phase 3 für Hybryte von der FDA gefordert.
Das bedeutet Jahrelange Verzögerung und zusätzlicher Finanz Bedarf.
https://www.prnewswire.com/news-releases/soligenix-provides-…
Das bedeutet Jahrelange Verzögerung und zusätzlicher Finanz Bedarf.
https://www.prnewswire.com/news-releases/soligenix-provides-…
Habt ihr im Moment eine Möglichkeit, die Aktie in Deutschland zu handeln?
Bzw. habt ihr Informationen, wann dies wieder möglich sein sollte?
Danke!
Bzw. habt ihr Informationen, wann dies wieder möglich sein sollte?
Danke!
Antwort auf Beitrag Nr.: 73.672.394 von Wombat12 am 14.04.23 16:42:23
Bekanntmachung Freiverkehr (Open Market) Aussetzung der Preisfeststellung, da die ordnungsgemäße Abwicklung nicht gewährleistet XFRA EUR US8342235053 Aussetzung ab Aussetzung bis SOLIGENIX INC.NEW DL,001 Frankfurt am Main, 13.02.2023 Frankfurter Wertpapierbörse i.A. Kocher Jochen i.A. Herold Ines USA 13.02.2023 08:19 bleibt auf weiteres ausgesetzt
Bekanntmachung Freiverkehr (Open Market) Aussetzung der Preisfeststellung, da die ordnungsgemäße Abwicklung nicht gewährleistet XFRA EUR US8342235053 Aussetzung ab Aussetzung bis SOLIGENIX INC.NEW DL,001 Frankfurt am Main, 13.02.2023 Frankfurter Wertpapierbörse i.A. Kocher Jochen i.A. Herold Ines USA 13.02.2023 08:19 bleibt auf weiteres ausgesetzt
Bei Consors Bank kannst du an der Nasdaq handeln.
Danke!
Nur wie handelt ihr Aktien, welche ihr in Euro bzw. an deutschen Handelsplattformen gekauft habt?
Oder anders: wie kann ich meine in D gekauften Aktien in den USA wieder verkaufen?
Nur wie handelt ihr Aktien, welche ihr in Euro bzw. an deutschen Handelsplattformen gekauft habt?
Oder anders: wie kann ich meine in D gekauften Aktien in den USA wieder verkaufen?
Antwort auf Beitrag Nr.: 73.672.967 von Wombat12 am 14.04.23 18:06:51Bei Consors Bank geht das unkompliziert.
Antwort auf Beitrag Nr.: 73.672.967 von Wombat12 am 14.04.23 18:06:51Bei ING auch ,kannst einfach über Ausländischen Börsen verkaufen.
Es passsiert was
Endlich mal ein ordentlicher Kursanstieg , Achtung festhalten!
weiß jemand warum? mich freut es, allerdings um die vergangenen verluste nur einigermaßen wieder auszugleichen braucht es noch mehr.
Es wurden auch 10 mal soviele Aktien gehandelt, wie auf dem Markt sind. Ich bin gespannt wie es weiter geht.
Gibt halt Neuigkeiten von Soligenix , das wird wohl der Grund sein.
Soligenix Announces Positive Clinical Results from Compatibility Study of HyBryte™ in the Treatment of Cutaneous T-Cell LymphomaAn Vinod ;, geht mir genauso, muß noch ordentlich steigen bis man die Kohle wieder hat, aber der Anfang ist vielleicht gemacht! Bleibe drin.
Bei dem Umsatz könnten sich auch größere eingedeckt haben, kann mir nicht vorstellen, das das Tagesgeschäfte waren? Gruß
Das ist aber nun nicht so schön ...oder!
Soligenix Announces Pricing of $8.5 Million Public OfferingAddThis Sharing Buttons
Share to Facebook
Share to TwitterShare to LinkedInShare to Pinterest
PRINCETON, N.J., May 5, 2023 /PRNewswire/ -- Soligenix, Inc. (Nasdaq: SNGX) (Soligenix or the Company), a late-stage biopharmaceutical company focused on developing and commercializing products to treat rare diseases where there is an unmet medical need, today announced the pricing of its public offering of 6,538,500 shares of common stock (or common stock equivalents in lieu thereof) and warrants to purchase up to 6,538,500 shares of common stock at a combined public offering price of $1.30 per share and accompanying warrant for aggregate gross proceeds of approximately $8.5 million, before deducting placement agent fees and other offering expenses. The warrants will have an exercise price of $1.50 per share, will be exercisable immediately and will expire five years from the issuance date.
Ganzer Text bei Soligenix.com
Lächerlich diese Aktie
nein, das ist nicht schön. Ich denke gestern wurde die Aktie kurz hochgeputscht und so manch haben zum guten Pries verkauft. Jetzt wird es erst einmal nach unten gehen. Hier wird es noch lange dauern, bis man mit einem geringeren Verlust raus kann.



das Einzige was mich wundert, ist die hohe Zahl der gehandelten Aktien, beinah doppelt so viele Aktien wurden gehandelt, wie eigentlich auf dem Markt sind. Was bedeutet, dass gewisse Aktien am gleichen Tag verkauft und wieder gekauft wurden, sonst würde es nicht funktionieren. Es müssen Leute ihre Aktien verkauft haben und wieder welche gekauft haben, macht aber eigentlich keinen Sinn, oder ?e
Antwort auf Beitrag Nr.: 73.797.639 von vinod am 05.05.23 22:22:47Warum soll das keinen Sinn machen? Genau so ist es gelaufen. Irgend welche Trader sind rein und raus und wiederum andere Marktteilnehmer sind rein und ggf. Wieder raus und so weiter.
Hohes Volumen
Vinod: ob das Sinn macht, weiß ich nicht, aber wenn ich für 1,30 gekauft hätte wäre die Aktie bei mir auch bei 2,50 weg. Da wir aber hohe Verluste haben, haben wir gehofft, dass es weiter nach oben geht, nach dieser Explosion. Frage dich: wer hätte gedacht, das gleich am nächsten Tag so eine Nachricht kommt. Soligenix hätte nächste Woche mehr für die neuen Aktien bekommen. Nun wäre eine Übernahme außerordentlich billig. Bleibt nur noch die Hoffnung. Die Hoffnung das da ein gutes Management agiert, schwindet bei mir. Forward looking Statements
Da möchte man gerne dran glauben: https://filecache.investorroom.com/mr5ir_soligenix/247/Solig…
Depotleiche
Der Kurs ist mehr als eine Katastrophe. Die Entwicklung seit dem Split 1:15 einfach nur mies. Egal wann ich hier rausgehe, es wird immer mit einem riesigen Verlust.l
Wer steigt denn hier langsam ein?
Auch wenn die Zahlen noch sehr gering sind, tut sich hier was. Wie weit wir Aktionäre noch gemolken werden kann ich nicht sagen, aber wieso findet diese Aktie nun doch Interesse siehe selbst:https://de.finance.yahoo.com/quote/SNGX/holders?p=SNGX
Soligenix (SNGX) erhält die IND-Genehmigung der FDA für die klinische Phase-2-Studie mit Dusquetid zur Behandlung von Aphthen bei Morbus Behçet
https://www.streetinsider.com/dr/news.php?id=22473273
https://www.streetinsider.com/dr/news.php?id=22473273
Positive news von Soligenix!!!
https://ir.soligenix.com/2024-01-02-Soligenix-Announces-Publ… FDA gewährt Soligenix „Fast Track“-Status für Dusquetide zur Behandlung oraler Läsionen bei Morbus Behçet
Siehe selbst unter Soligenix.comMeine persönliche Meinung ist, dass nun langsam die Abwärtsspirale vorbei ist. Dies ist keine Kaufempfehlung!
Beitrag zu dieser Diskussion schreiben
Investoren beobachten auch:
| Wertpapier | Perf. % |
|---|---|
| +0,25 | |
| -0,68 | |
| -0,15 | |
| -0,45 | |
| -1,35 | |
| -8,21 | |
| +2,92 | |
| -4,39 | |
| +1,18 | |
| -11,96 |
Meistdiskutiert
| Wertpapier | Beiträge | |
|---|---|---|
| 215 | ||
| 113 | ||
| 98 | ||
| 95 | ||
| 86 | ||
| 77 | ||
| 44 | ||
| 42 | ||
| 33 | ||
| 32 |





















