Heidelberg Pharma AG - 500 Beiträge pro Seite
eröffnet am 26.10.17 20:25:27 von
neuester Beitrag 25.04.24 07:31:39 von
neuester Beitrag 25.04.24 07:31:39 von
Beiträge: 5.173
ID: 1.265.064
ID: 1.265.064
Aufrufe heute: 121
Gesamt: 586.189
Gesamt: 586.189
Aktive User: 0
ISIN: DE000A11QVV0 · WKN: A11QVV · Symbol: HPHA
2,9500
EUR
-2,64 %
-0,0800 EUR
Letzter Kurs 08:25:39 Tradegate
Meistbewertete Beiträge
| Datum | Beiträge | Bewertungen |
|---|---|---|
| 24.04.24 | ||
| 24.04.24 | ||
| 24.04.24 | ||
| 07:31 Uhr | ||
| 24.04.24 |
| Datum | Beiträge | Bewertungen |
|---|---|---|
| 24.04.24 | ||
| 18.04.24 | ||
| 22.04.24 | ||
| 23.04.24 | ||
| 23.04.24 |
| Datum | Beiträge | Bewertungen |
|---|---|---|
| 27.03.24 | ||
| 27.03.24 | ||
| 27.03.24 | ||
| 09.04.24 | ||
| 05.04.24 |
Werte aus der Branche Biotechnologie
| Wertpapier | Kurs | Perf. % |
|---|---|---|
| 1,9000 | +59,66 | |
| 0,6000 | +57,48 | |
| 1,9200 | +23,87 | |
| 5,4500 | +19,00 | |
| 6,9300 | +17,46 |
| Wertpapier | Kurs | Perf. % |
|---|---|---|
| 1,6900 | -14,50 | |
| 2,8150 | -15,21 | |
| 2,2900 | -17,63 | |
| 2,2600 | -30,25 | |
| 4,9200 | -31,67 |
Diskussions und Newsthread zu Heidelberg Pharma AG. Ehemals Wilex AG.
Heidelberg Pharma AG Webseite: http://www.wilex.de/de/
In den letzten Tagen wurde Wilex AG in Heidelberg Pharma umbenannt, um so der Neuausrichtung besser gerecht zu werden.
ATAC Pipeline: http://www.wilex.de/de/forschung-entwicklung/ueberblick-port…
Die erste Meldung kommt aber noch zu dem Wilex Erbe Mesupron.
Heidelberg Pharma AG: Partner RedHill erhält Orphan Drug-Status für MESUPRON
- Amerikanische Zulassungsbehörde FDA gewährt Orphan Drug-Status für MESUPRON für die Behandlung von Bauchspeicheldrüsenkrebs
- MESUPRON wurde von Heidelberg Pharma bis zur klinischen Phase II entwickelt, dann exklusiv an RedHill auslizenziert.
http://www.finanznachrichten.de/nachrichten-2017-10/42060002…
Heidelberg Pharma AG Webseite: http://www.wilex.de/de/
In den letzten Tagen wurde Wilex AG in Heidelberg Pharma umbenannt, um so der Neuausrichtung besser gerecht zu werden.
ATAC Pipeline: http://www.wilex.de/de/forschung-entwicklung/ueberblick-port…
Die erste Meldung kommt aber noch zu dem Wilex Erbe Mesupron.
Heidelberg Pharma AG: Partner RedHill erhält Orphan Drug-Status für MESUPRON
- Amerikanische Zulassungsbehörde FDA gewährt Orphan Drug-Status für MESUPRON für die Behandlung von Bauchspeicheldrüsenkrebs
- MESUPRON wurde von Heidelberg Pharma bis zur klinischen Phase II entwickelt, dann exklusiv an RedHill auslizenziert.
http://www.finanznachrichten.de/nachrichten-2017-10/42060002…
Antwort auf Beitrag Nr.: 56.036.529 von BICYPAPA am 26.10.17 20:25:27
Webseite: https://www.redhillbio.com/RedHill/index.asp?DBID=1&LNGID=1
RedHill Biopharma Receives Notice of Allowance for a New U.S. Patent Covering its Combination Therapy for Hard-to-Treat Cancers
18 September, 2017
TEL-AVIV, Israel / RALEIGH, NC, September 18, 2017 RedHill Biopharma Ltd. (NASDAQ: RDHL) (Tel-Aviv Stock Exchange: RDHL) (“RedHill” or the “Company”), a specialty biopharmaceutical company primarily focused on late clinical-stage development and commercialization of proprietary, orally-administered, small molecule drugs for gastrointestinal and inflammatory diseases and cancer, today announced that it has received a Notice of Allowance from the United States Patent and Trademark Office (USPTO) for a new patent covering the use of two of RedHill’s Phase II-stage proprietary investigational compounds, YELIVA® and MESUPRON in combination with a known antibiotic.
https://www.redhillbio.com/RedHill/Templates/showpage.asp?DB…
[/https://www.redhillbio.com/RedHill/Templates/showpage.asp?DB…
RedHill Biopharma Receives FDA Orphan Drug Designation for MESUPRON for Pancreatic Cancer
20 October, 2017
RedHill to benefit from various incentives to develop MESUPRON (upamostat) for the adjuvant treatment of pancreatic cancer, including a seven-year marketing exclusivity period for the indication, if approved
MESUPRON is a proprietary, first-in-class, orally-administered protease inhibitor, with several potential mechanisms of action to inhibit tumor invasion and metastasis
Pancreatic cancer is the third leading cause of cancer mortality in the U.S. and is characterized as a disease with a very high unmet medical need
The 2017 Worldwide sales of pancreatic cancer therapies are estimated to reach approximately $1.6 billion
Recently identified high-affinity molecular targets suggest additional applications in inflammatory gastrointestinal diseases
TEL-AVIV, Israel / RALEIGH, NC, October 20, 2017 RedHill Biopharma Ltd. (NASDAQ: RDHL) (Tel-Aviv Stock Exchange: RDHL) (“RedHill” or the “Company”), a specialty biopharmaceutical company primarily focused on late clinical-stage development and commercialization of proprietary, orally-administered, small molecule drugs for gastrointestinal and inflammatory diseases and cancer, today announced that the U.S. Food and Drug Administration (FDA) has granted MESUPRON (upamostat) Orphan Drug designation for the adjuvant treatment of pancreatic cancer.
The Orphan Drug designation allows RedHill to benefit from various development incentives to develop MESUPRON for this indication, including tax credits for qualified clinical testing, waiver of a prescription drug user fee (PDUFA fee) upon submission of a potential marketing application and, if approved, a seven-year marketing exclusivity period.
MESUPRON is a proprietary, first-in-class, orally-administered protease inhibitor, with several potential mechanisms of action to inhibit tumor invasion and metastasis. MESUPRON presents a new, non-cytotoxic approach to cancer therapy. MESUPRON has undergone several Phase I studies and two Phase II proof-of-concept studies.
RedHill recently announced the receipt of a Notice of Allowance from the United States Patent and Trademark Office (USPTO) for a new patent covering the use of MESUPRON and RedHill’s Phase II-stage investigational compound, YELIVA®, in combination with a known antibiotic, for hard-to-treat cancers.
https://www.redhillbio.com/RedHill/Templates/showpage.asp?DB…" target="_blank" rel="nofollow ugc noopener">
RedHill Biopharma Announces Poster Presentation at the 2017 AACR-NCI-EORTC Molecular Targets and Cancer Therapeutics Conference
19 October, 2017
TEL-AVIV, Israel / RALEIGH, NC, October 19, 2017 RedHill Biopharma Ltd. (NASDAQ: RDHL) (Tel-Aviv Stock Exchange: RDHL) (“RedHill” or the “Company”), a specialty biopharmaceutical company primarily focused on late clinical-stage development and commercialization of proprietary, orally-administered, small molecule drugs for gastrointestinal and inflammatory diseases and cancer, today announced a planned poster presentation relating to the active metabolite of MESUPRON, WX-UK1, at the 2017 AACR-NCI-EORTC Molecular Targets and Cancer Therapeutics Conference, on Sunday, October 29, 2017, from 12:30 - 4:00 PM, at the Pennsylvania Convention Center in Philadelphia, PA.
MESUPRON is a proprietary, first-in-class, orally-administered protease inhibitor, with several potential mechanisms of action to inhibit tumor invasion and metastasis. MESUPRON presents a new, non-cytotoxic approach to cancer therapy and potentially to additional inflammatory gastrointestinal diseases, such as diarrhea-predominant irritable bowel syndrome (IBS-D), pancreatitis and inflammatory bowel disease (IBD).
https://www.redhillbio.com/RedHill/Templates/showpage.asp?DB…
RedHill Biopharma Receives FDA Orphan Drug Designation for MESUPRON for Pancreatic Cancer
20 October, 2017
RedHill to benefit from various incentives to develop MESUPRON (upamostat) for the adjuvant treatment of pancreatic cancer, including a seven-year marketing exclusivity period for the indication, if approved
MESUPRON is a proprietary, first-in-class, orally-administered protease inhibitor, with several potential mechanisms of action to inhibit tumor invasion and metastasis
Pancreatic cancer is the third leading cause of cancer mortality in the U.S. and is characterized as a disease with a very high unmet medical need
The 2017 Worldwide sales of pancreatic cancer therapies are estimated to reach approximately $1.6 billion
Recently identified high-affinity molecular targets suggest additional applications in inflammatory gastrointestinal diseases
TEL-AVIV, Israel / RALEIGH, NC, October 20, 2017 RedHill Biopharma Ltd. (NASDAQ: RDHL) (Tel-Aviv Stock Exchange: RDHL) (“RedHill” or the “Company”), a specialty biopharmaceutical company primarily focused on late clinical-stage development and commercialization of proprietary, orally-administered, small molecule drugs for gastrointestinal and inflammatory diseases and cancer, today announced that the U.S. Food and Drug Administration (FDA) has granted MESUPRON (upamostat) Orphan Drug designation for the adjuvant treatment of pancreatic cancer.
The Orphan Drug designation allows RedHill to benefit from various development incentives to develop MESUPRON for this indication, including tax credits for qualified clinical testing, waiver of a prescription drug user fee (PDUFA fee) upon submission of a potential marketing application and, if approved, a seven-year marketing exclusivity period.
MESUPRON is a proprietary, first-in-class, orally-administered protease inhibitor, with several potential mechanisms of action to inhibit tumor invasion and metastasis. MESUPRON presents a new, non-cytotoxic approach to cancer therapy. MESUPRON has undergone several Phase I studies and two Phase II proof-of-concept studies.
RedHill recently announced the receipt of a Notice of Allowance from the United States Patent and Trademark Office (USPTO) for a new patent covering the use of MESUPRON and RedHill’s Phase II-stage investigational compound, YELIVA®, in combination with a known antibiotic, for hard-to-treat cancers.
https://www.redhillbio.com/RedHill/Templates/showpage.asp?DB…" target="_blank" rel="nofollow ugc noopener">https://www.redhillbio.com/RedHill/Templates/showpage.asp?DB…
[/https://www.redhillbio.com/RedHill/Templates/showpage.asp?DB…
RedHill Biopharma Receives FDA Orphan Drug Designation for MESUPRON for Pancreatic Cancer
20 October, 2017
RedHill to benefit from various incentives to develop MESUPRON (upamostat) for the adjuvant treatment of pancreatic cancer, including a seven-year marketing exclusivity period for the indication, if approved
MESUPRON is a proprietary, first-in-class, orally-administered protease inhibitor, with several potential mechanisms of action to inhibit tumor invasion and metastasis
Pancreatic cancer is the third leading cause of cancer mortality in the U.S. and is characterized as a disease with a very high unmet medical need
The 2017 Worldwide sales of pancreatic cancer therapies are estimated to reach approximately $1.6 billion
Recently identified high-affinity molecular targets suggest additional applications in inflammatory gastrointestinal diseases
TEL-AVIV, Israel / RALEIGH, NC, October 20, 2017 RedHill Biopharma Ltd. (NASDAQ: RDHL) (Tel-Aviv Stock Exchange: RDHL) (“RedHill” or the “Company”), a specialty biopharmaceutical company primarily focused on late clinical-stage development and commercialization of proprietary, orally-administered, small molecule drugs for gastrointestinal and inflammatory diseases and cancer, today announced that the U.S. Food and Drug Administration (FDA) has granted MESUPRON (upamostat) Orphan Drug designation for the adjuvant treatment of pancreatic cancer.
The Orphan Drug designation allows RedHill to benefit from various development incentives to develop MESUPRON for this indication, including tax credits for qualified clinical testing, waiver of a prescription drug user fee (PDUFA fee) upon submission of a potential marketing application and, if approved, a seven-year marketing exclusivity period.
MESUPRON is a proprietary, first-in-class, orally-administered protease inhibitor, with several potential mechanisms of action to inhibit tumor invasion and metastasis. MESUPRON presents a new, non-cytotoxic approach to cancer therapy. MESUPRON has undergone several Phase I studies and two Phase II proof-of-concept studies.
RedHill recently announced the receipt of a Notice of Allowance from the United States Patent and Trademark Office (USPTO) for a new patent covering the use of MESUPRON and RedHill’s Phase II-stage investigational compound, YELIVA®, in combination with a known antibiotic, for hard-to-treat cancers.
https://www.redhillbio.com/RedHill/Templates/showpage.asp?DB…" target="_blank" rel="nofollow ugc noopener">
RedHill Biopharma Announces Poster Presentation at the 2017 AACR-NCI-EORTC Molecular Targets and Cancer Therapeutics Conference
19 October, 2017
TEL-AVIV, Israel / RALEIGH, NC, October 19, 2017 RedHill Biopharma Ltd. (NASDAQ: RDHL) (Tel-Aviv Stock Exchange: RDHL) (“RedHill” or the “Company”), a specialty biopharmaceutical company primarily focused on late clinical-stage development and commercialization of proprietary, orally-administered, small molecule drugs for gastrointestinal and inflammatory diseases and cancer, today announced a planned poster presentation relating to the active metabolite of MESUPRON, WX-UK1, at the 2017 AACR-NCI-EORTC Molecular Targets and Cancer Therapeutics Conference, on Sunday, October 29, 2017, from 12:30 - 4:00 PM, at the Pennsylvania Convention Center in Philadelphia, PA.
MESUPRON is a proprietary, first-in-class, orally-administered protease inhibitor, with several potential mechanisms of action to inhibit tumor invasion and metastasis. MESUPRON presents a new, non-cytotoxic approach to cancer therapy and potentially to additional inflammatory gastrointestinal diseases, such as diarrhea-predominant irritable bowel syndrome (IBS-D), pancreatitis and inflammatory bowel disease (IBD).
https://www.redhillbio.com/RedHill/Templates/showpage.asp?DB…
RedHill Biopharma Receives FDA Orphan Drug Designation for MESUPRON for Pancreatic Cancer
20 October, 2017
RedHill to benefit from various incentives to develop MESUPRON (upamostat) for the adjuvant treatment of pancreatic cancer, including a seven-year marketing exclusivity period for the indication, if approved
MESUPRON is a proprietary, first-in-class, orally-administered protease inhibitor, with several potential mechanisms of action to inhibit tumor invasion and metastasis
Pancreatic cancer is the third leading cause of cancer mortality in the U.S. and is characterized as a disease with a very high unmet medical need
The 2017 Worldwide sales of pancreatic cancer therapies are estimated to reach approximately $1.6 billion
Recently identified high-affinity molecular targets suggest additional applications in inflammatory gastrointestinal diseases
TEL-AVIV, Israel / RALEIGH, NC, October 20, 2017 RedHill Biopharma Ltd. (NASDAQ: RDHL) (Tel-Aviv Stock Exchange: RDHL) (“RedHill” or the “Company”), a specialty biopharmaceutical company primarily focused on late clinical-stage development and commercialization of proprietary, orally-administered, small molecule drugs for gastrointestinal and inflammatory diseases and cancer, today announced that the U.S. Food and Drug Administration (FDA) has granted MESUPRON (upamostat) Orphan Drug designation for the adjuvant treatment of pancreatic cancer.
The Orphan Drug designation allows RedHill to benefit from various development incentives to develop MESUPRON for this indication, including tax credits for qualified clinical testing, waiver of a prescription drug user fee (PDUFA fee) upon submission of a potential marketing application and, if approved, a seven-year marketing exclusivity period.
MESUPRON is a proprietary, first-in-class, orally-administered protease inhibitor, with several potential mechanisms of action to inhibit tumor invasion and metastasis. MESUPRON presents a new, non-cytotoxic approach to cancer therapy. MESUPRON has undergone several Phase I studies and two Phase II proof-of-concept studies.
RedHill recently announced the receipt of a Notice of Allowance from the United States Patent and Trademark Office (USPTO) for a new patent covering the use of MESUPRON and RedHill’s Phase II-stage investigational compound, YELIVA®, in combination with a known antibiotic, for hard-to-treat cancers.
https://www.redhillbio.com/RedHill/Templates/showpage.asp?DB…
Meldungen zu Mesupron von Redhill
Im letzten Monat gab es mehrere Veröffentlichungen zu Mesupron von dem Partner Redhill.Webseite: https://www.redhillbio.com/RedHill/index.asp?DBID=1&LNGID=1
RedHill Biopharma Receives Notice of Allowance for a New U.S. Patent Covering its Combination Therapy for Hard-to-Treat Cancers
18 September, 2017
TEL-AVIV, Israel / RALEIGH, NC, September 18, 2017 RedHill Biopharma Ltd. (NASDAQ: RDHL) (Tel-Aviv Stock Exchange: RDHL) (“RedHill” or the “Company”), a specialty biopharmaceutical company primarily focused on late clinical-stage development and commercialization of proprietary, orally-administered, small molecule drugs for gastrointestinal and inflammatory diseases and cancer, today announced that it has received a Notice of Allowance from the United States Patent and Trademark Office (USPTO) for a new patent covering the use of two of RedHill’s Phase II-stage proprietary investigational compounds, YELIVA® and MESUPRON in combination with a known antibiotic.
https://www.redhillbio.com/RedHill/Templates/showpage.asp?DB…
[/https://www.redhillbio.com/RedHill/Templates/showpage.asp?DB…
RedHill Biopharma Receives FDA Orphan Drug Designation for MESUPRON for Pancreatic Cancer
20 October, 2017
RedHill to benefit from various incentives to develop MESUPRON (upamostat) for the adjuvant treatment of pancreatic cancer, including a seven-year marketing exclusivity period for the indication, if approved
MESUPRON is a proprietary, first-in-class, orally-administered protease inhibitor, with several potential mechanisms of action to inhibit tumor invasion and metastasis
Pancreatic cancer is the third leading cause of cancer mortality in the U.S. and is characterized as a disease with a very high unmet medical need
The 2017 Worldwide sales of pancreatic cancer therapies are estimated to reach approximately $1.6 billion
Recently identified high-affinity molecular targets suggest additional applications in inflammatory gastrointestinal diseases
TEL-AVIV, Israel / RALEIGH, NC, October 20, 2017 RedHill Biopharma Ltd. (NASDAQ: RDHL) (Tel-Aviv Stock Exchange: RDHL) (“RedHill” or the “Company”), a specialty biopharmaceutical company primarily focused on late clinical-stage development and commercialization of proprietary, orally-administered, small molecule drugs for gastrointestinal and inflammatory diseases and cancer, today announced that the U.S. Food and Drug Administration (FDA) has granted MESUPRON (upamostat) Orphan Drug designation for the adjuvant treatment of pancreatic cancer.
The Orphan Drug designation allows RedHill to benefit from various development incentives to develop MESUPRON for this indication, including tax credits for qualified clinical testing, waiver of a prescription drug user fee (PDUFA fee) upon submission of a potential marketing application and, if approved, a seven-year marketing exclusivity period.
MESUPRON is a proprietary, first-in-class, orally-administered protease inhibitor, with several potential mechanisms of action to inhibit tumor invasion and metastasis. MESUPRON presents a new, non-cytotoxic approach to cancer therapy. MESUPRON has undergone several Phase I studies and two Phase II proof-of-concept studies.
RedHill recently announced the receipt of a Notice of Allowance from the United States Patent and Trademark Office (USPTO) for a new patent covering the use of MESUPRON and RedHill’s Phase II-stage investigational compound, YELIVA®, in combination with a known antibiotic, for hard-to-treat cancers.
https://www.redhillbio.com/RedHill/Templates/showpage.asp?DB…" target="_blank" rel="nofollow ugc noopener">
RedHill Biopharma Announces Poster Presentation at the 2017 AACR-NCI-EORTC Molecular Targets and Cancer Therapeutics Conference
19 October, 2017
TEL-AVIV, Israel / RALEIGH, NC, October 19, 2017 RedHill Biopharma Ltd. (NASDAQ: RDHL) (Tel-Aviv Stock Exchange: RDHL) (“RedHill” or the “Company”), a specialty biopharmaceutical company primarily focused on late clinical-stage development and commercialization of proprietary, orally-administered, small molecule drugs for gastrointestinal and inflammatory diseases and cancer, today announced a planned poster presentation relating to the active metabolite of MESUPRON, WX-UK1, at the 2017 AACR-NCI-EORTC Molecular Targets and Cancer Therapeutics Conference, on Sunday, October 29, 2017, from 12:30 - 4:00 PM, at the Pennsylvania Convention Center in Philadelphia, PA.
MESUPRON is a proprietary, first-in-class, orally-administered protease inhibitor, with several potential mechanisms of action to inhibit tumor invasion and metastasis. MESUPRON presents a new, non-cytotoxic approach to cancer therapy and potentially to additional inflammatory gastrointestinal diseases, such as diarrhea-predominant irritable bowel syndrome (IBS-D), pancreatitis and inflammatory bowel disease (IBD).
https://www.redhillbio.com/RedHill/Templates/showpage.asp?DB…
RedHill Biopharma Receives FDA Orphan Drug Designation for MESUPRON for Pancreatic Cancer
20 October, 2017
RedHill to benefit from various incentives to develop MESUPRON (upamostat) for the adjuvant treatment of pancreatic cancer, including a seven-year marketing exclusivity period for the indication, if approved
MESUPRON is a proprietary, first-in-class, orally-administered protease inhibitor, with several potential mechanisms of action to inhibit tumor invasion and metastasis
Pancreatic cancer is the third leading cause of cancer mortality in the U.S. and is characterized as a disease with a very high unmet medical need
The 2017 Worldwide sales of pancreatic cancer therapies are estimated to reach approximately $1.6 billion
Recently identified high-affinity molecular targets suggest additional applications in inflammatory gastrointestinal diseases
TEL-AVIV, Israel / RALEIGH, NC, October 20, 2017 RedHill Biopharma Ltd. (NASDAQ: RDHL) (Tel-Aviv Stock Exchange: RDHL) (“RedHill” or the “Company”), a specialty biopharmaceutical company primarily focused on late clinical-stage development and commercialization of proprietary, orally-administered, small molecule drugs for gastrointestinal and inflammatory diseases and cancer, today announced that the U.S. Food and Drug Administration (FDA) has granted MESUPRON (upamostat) Orphan Drug designation for the adjuvant treatment of pancreatic cancer.
The Orphan Drug designation allows RedHill to benefit from various development incentives to develop MESUPRON for this indication, including tax credits for qualified clinical testing, waiver of a prescription drug user fee (PDUFA fee) upon submission of a potential marketing application and, if approved, a seven-year marketing exclusivity period.
MESUPRON is a proprietary, first-in-class, orally-administered protease inhibitor, with several potential mechanisms of action to inhibit tumor invasion and metastasis. MESUPRON presents a new, non-cytotoxic approach to cancer therapy. MESUPRON has undergone several Phase I studies and two Phase II proof-of-concept studies.
RedHill recently announced the receipt of a Notice of Allowance from the United States Patent and Trademark Office (USPTO) for a new patent covering the use of MESUPRON and RedHill’s Phase II-stage investigational compound, YELIVA®, in combination with a known antibiotic, for hard-to-treat cancers.
https://www.redhillbio.com/RedHill/Templates/showpage.asp?DB…" target="_blank" rel="nofollow ugc noopener">https://www.redhillbio.com/RedHill/Templates/showpage.asp?DB…
[/https://www.redhillbio.com/RedHill/Templates/showpage.asp?DB…
RedHill Biopharma Receives FDA Orphan Drug Designation for MESUPRON for Pancreatic Cancer
20 October, 2017
RedHill to benefit from various incentives to develop MESUPRON (upamostat) for the adjuvant treatment of pancreatic cancer, including a seven-year marketing exclusivity period for the indication, if approved
MESUPRON is a proprietary, first-in-class, orally-administered protease inhibitor, with several potential mechanisms of action to inhibit tumor invasion and metastasis
Pancreatic cancer is the third leading cause of cancer mortality in the U.S. and is characterized as a disease with a very high unmet medical need
The 2017 Worldwide sales of pancreatic cancer therapies are estimated to reach approximately $1.6 billion
Recently identified high-affinity molecular targets suggest additional applications in inflammatory gastrointestinal diseases
TEL-AVIV, Israel / RALEIGH, NC, October 20, 2017 RedHill Biopharma Ltd. (NASDAQ: RDHL) (Tel-Aviv Stock Exchange: RDHL) (“RedHill” or the “Company”), a specialty biopharmaceutical company primarily focused on late clinical-stage development and commercialization of proprietary, orally-administered, small molecule drugs for gastrointestinal and inflammatory diseases and cancer, today announced that the U.S. Food and Drug Administration (FDA) has granted MESUPRON (upamostat) Orphan Drug designation for the adjuvant treatment of pancreatic cancer.
The Orphan Drug designation allows RedHill to benefit from various development incentives to develop MESUPRON for this indication, including tax credits for qualified clinical testing, waiver of a prescription drug user fee (PDUFA fee) upon submission of a potential marketing application and, if approved, a seven-year marketing exclusivity period.
MESUPRON is a proprietary, first-in-class, orally-administered protease inhibitor, with several potential mechanisms of action to inhibit tumor invasion and metastasis. MESUPRON presents a new, non-cytotoxic approach to cancer therapy. MESUPRON has undergone several Phase I studies and two Phase II proof-of-concept studies.
RedHill recently announced the receipt of a Notice of Allowance from the United States Patent and Trademark Office (USPTO) for a new patent covering the use of MESUPRON and RedHill’s Phase II-stage investigational compound, YELIVA®, in combination with a known antibiotic, for hard-to-treat cancers.
https://www.redhillbio.com/RedHill/Templates/showpage.asp?DB…" target="_blank" rel="nofollow ugc noopener">
RedHill Biopharma Announces Poster Presentation at the 2017 AACR-NCI-EORTC Molecular Targets and Cancer Therapeutics Conference
19 October, 2017
TEL-AVIV, Israel / RALEIGH, NC, October 19, 2017 RedHill Biopharma Ltd. (NASDAQ: RDHL) (Tel-Aviv Stock Exchange: RDHL) (“RedHill” or the “Company”), a specialty biopharmaceutical company primarily focused on late clinical-stage development and commercialization of proprietary, orally-administered, small molecule drugs for gastrointestinal and inflammatory diseases and cancer, today announced a planned poster presentation relating to the active metabolite of MESUPRON, WX-UK1, at the 2017 AACR-NCI-EORTC Molecular Targets and Cancer Therapeutics Conference, on Sunday, October 29, 2017, from 12:30 - 4:00 PM, at the Pennsylvania Convention Center in Philadelphia, PA.
MESUPRON is a proprietary, first-in-class, orally-administered protease inhibitor, with several potential mechanisms of action to inhibit tumor invasion and metastasis. MESUPRON presents a new, non-cytotoxic approach to cancer therapy and potentially to additional inflammatory gastrointestinal diseases, such as diarrhea-predominant irritable bowel syndrome (IBS-D), pancreatitis and inflammatory bowel disease (IBD).
https://www.redhillbio.com/RedHill/Templates/showpage.asp?DB…
RedHill Biopharma Receives FDA Orphan Drug Designation for MESUPRON for Pancreatic Cancer
20 October, 2017
RedHill to benefit from various incentives to develop MESUPRON (upamostat) for the adjuvant treatment of pancreatic cancer, including a seven-year marketing exclusivity period for the indication, if approved
MESUPRON is a proprietary, first-in-class, orally-administered protease inhibitor, with several potential mechanisms of action to inhibit tumor invasion and metastasis
Pancreatic cancer is the third leading cause of cancer mortality in the U.S. and is characterized as a disease with a very high unmet medical need
The 2017 Worldwide sales of pancreatic cancer therapies are estimated to reach approximately $1.6 billion
Recently identified high-affinity molecular targets suggest additional applications in inflammatory gastrointestinal diseases
TEL-AVIV, Israel / RALEIGH, NC, October 20, 2017 RedHill Biopharma Ltd. (NASDAQ: RDHL) (Tel-Aviv Stock Exchange: RDHL) (“RedHill” or the “Company”), a specialty biopharmaceutical company primarily focused on late clinical-stage development and commercialization of proprietary, orally-administered, small molecule drugs for gastrointestinal and inflammatory diseases and cancer, today announced that the U.S. Food and Drug Administration (FDA) has granted MESUPRON (upamostat) Orphan Drug designation for the adjuvant treatment of pancreatic cancer.
The Orphan Drug designation allows RedHill to benefit from various development incentives to develop MESUPRON for this indication, including tax credits for qualified clinical testing, waiver of a prescription drug user fee (PDUFA fee) upon submission of a potential marketing application and, if approved, a seven-year marketing exclusivity period.
MESUPRON is a proprietary, first-in-class, orally-administered protease inhibitor, with several potential mechanisms of action to inhibit tumor invasion and metastasis. MESUPRON presents a new, non-cytotoxic approach to cancer therapy. MESUPRON has undergone several Phase I studies and two Phase II proof-of-concept studies.
RedHill recently announced the receipt of a Notice of Allowance from the United States Patent and Trademark Office (USPTO) for a new patent covering the use of MESUPRON and RedHill’s Phase II-stage investigational compound, YELIVA®, in combination with a known antibiotic, for hard-to-treat cancers.
https://www.redhillbio.com/RedHill/Templates/showpage.asp?DB…
Antwort auf Beitrag Nr.: 56.038.383 von BICYPAPA am 27.10.17 07:27:30Du hast einen neuen Thread aufgemacht. Dass zwei Foren parallel laufen ist vielleicht nicht so gut, verzettelt sich, vielleicht wäre es besser gewesen im alten Thread zu versuchen bei WO den Namen Wilex im Titel zu ersetzen mit Heidelberg Pharma.
Antwort auf Beitrag Nr.: 56.039.091 von Mogli3 am 27.10.17 08:51:36
http://www.ariva.de/forum/heidelberg-pharma-ag-551254
Für mich wäre es gar nicht so schlimm, da ich hier hauptsächlich Fakten zu Heidelberg Pharma einpflegen wollte.
Tut mir Leid, aber daran hab ich wirklich nicht gedacht. Doch einen Neustart eines Threads zu Heidelberg Pharma mit dem Namenswechsel bietet sich aber auch an.
Daran hab ich ...
Daran hab ich gar nicht gedacht. Ich wollte nur für Heidelberg Pharma einen Thread aufmachen, da ja jetzt alle Nachrichten hierunter reinlaufen. Ich habe auch bei ariva einen Thread aufgemacht um so die Informationen übergreifend zu posten.http://www.ariva.de/forum/heidelberg-pharma-ag-551254
Für mich wäre es gar nicht so schlimm, da ich hier hauptsächlich Fakten zu Heidelberg Pharma einpflegen wollte.
Tut mir Leid, aber daran hab ich wirklich nicht gedacht. Doch einen Neustart eines Threads zu Heidelberg Pharma mit dem Namenswechsel bietet sich aber auch an.
Antwort auf Beitrag Nr.: 56.040.453 von BICYPAPA am 27.10.17 11:06:46Bicypapa
Ich habe den alten Thread umtaufen lassen, heißt jetzt neu „Heidelberg Pharma buy“!! Vielleicht wäre es besser wenn du deinen neuen Thread wieder löschen lässt sonst müssen wir hier immer auf zwei Hochzeiten tanzen. WO und Ariva reicht ja schon.
Ich habe den alten Thread umtaufen lassen, heißt jetzt neu „Heidelberg Pharma buy“!! Vielleicht wäre es besser wenn du deinen neuen Thread wieder löschen lässt sonst müssen wir hier immer auf zwei Hochzeiten tanzen. WO und Ariva reicht ja schon.
Antwort auf Beitrag Nr.: 56.044.608 von Mogli3 am 27.10.17 18:14:40
Ich denke mal
Ich denke mal, wir kommen uns nicht in die Quere. Ich wollte diesen Thread sowieso hauptsächlich zur Faktensammlung nutzen. Die Diskussion kann ja dann im alten Thread weitergehen. War mir gar nicht bekannt, dass man Überschriften ändern kann. Prima Idee.
Antwort auf Beitrag Nr.: 56.045.349 von BICYPAPA am 27.10.17 19:35:10
Lee JE1, Kwon YJ1, Baek HS1, Ye DJ1, Cho E1, Choi HK1, Oh KS1, Chun YJ2.
Author information
https://www.ncbi.nlm.nih.gov/pubmed/28560500
Abstract
Urokinase-type plasminogen activator (uPA) has been validated as a predictive or prognostic biomarker protein, and mesupron is considered the first-in-class anticancer agent to inhibit uPA activity in human breast cancer. In the present study, we showed that the synergism between mesupron and auranofin, a thioredoxin reductase inhibitor, for inducing of apoptosis in MCF-7 human breast cancer cells. Our results demonstrated that mesupron and auranofin significantly lead to inhibition of the cancer cells proliferation; cell cycle arrest at the G1/S phase of the cell cycle, and apoptosis as indicated by caspase 3 activation, poly(ADP-ribose) polymerase cleavage, and annexin V staining. Isobologram analyses of MCF-7 cells showed a clear synergism between mesupron and auranofin. This combined treatment decreased the levels of mitochondrial anti-apoptotic factors, such as BCL-2, BCL-xL, and MCL-1 and caused nuclear translocation of apoptosis-inducing factor. Mitochondrial membrane potential (Δψ m ) was found to be strongly disrupted in combination-treated cells. In addition, combination treatment significantly enhanced the overproduction of reactive oxygen species, which was rescued by N-acetylcysteine treatment. The combination treatment suppressed phosphorylation of Akt, thus contributing to apoptosis. Taken together, our data suggest that the use of mesupron in combination with auranofin may be important in achieving high anticancer synergy.
Abstract Mesupron
Synergistic induction of apoptosis by combination treatment with mesupron and auranofin in human breast cancer cells.Lee JE1, Kwon YJ1, Baek HS1, Ye DJ1, Cho E1, Choi HK1, Oh KS1, Chun YJ2.
Author information
https://www.ncbi.nlm.nih.gov/pubmed/28560500
Abstract
Urokinase-type plasminogen activator (uPA) has been validated as a predictive or prognostic biomarker protein, and mesupron is considered the first-in-class anticancer agent to inhibit uPA activity in human breast cancer. In the present study, we showed that the synergism between mesupron and auranofin, a thioredoxin reductase inhibitor, for inducing of apoptosis in MCF-7 human breast cancer cells. Our results demonstrated that mesupron and auranofin significantly lead to inhibition of the cancer cells proliferation; cell cycle arrest at the G1/S phase of the cell cycle, and apoptosis as indicated by caspase 3 activation, poly(ADP-ribose) polymerase cleavage, and annexin V staining. Isobologram analyses of MCF-7 cells showed a clear synergism between mesupron and auranofin. This combined treatment decreased the levels of mitochondrial anti-apoptotic factors, such as BCL-2, BCL-xL, and MCL-1 and caused nuclear translocation of apoptosis-inducing factor. Mitochondrial membrane potential (Δψ m ) was found to be strongly disrupted in combination-treated cells. In addition, combination treatment significantly enhanced the overproduction of reactive oxygen species, which was rescued by N-acetylcysteine treatment. The combination treatment suppressed phosphorylation of Akt, thus contributing to apoptosis. Taken together, our data suggest that the use of mesupron in combination with auranofin may be important in achieving high anticancer synergy.
Antwort auf Beitrag Nr.: 56.051.292 von BICYPAPA am 29.10.17 09:00:36
Laufende und abgeschlossene Studien mit Iodine (124I) Girentuximab
Redectane Girentuximab Studien
https://clinicaltrials.gov/ct2/results?cond=&term=Girentuxim…Laufende und abgeschlossene Studien mit Iodine (124I) Girentuximab
Antwort auf Beitrag Nr.: 56.079.635 von BICYPAPA am 02.11.17 10:15:53
Ladenburg, 3. November 2017 - Der Vorstand der Heidelberg Pharma AG (ISIN DE000A11QVV0 / WKN A11QVV / WL6) hat heute mit Zustimmung des Aufsichtsrats eine Finanzierungsmaßnahme für die Weiterentwicklung ihrer ATAC-Entwicklungsprogramme beschlossen. Die Finanzierungsmaßnahme soll aus einer Kapitalerhöhung aus genehmigtem Kapital sowie aus der Ausgabe von Wandelschuldverschreibungen bestehen.
Geplant ist, das Grundkapital der Gesellschaft von 14.968.380,00 Euro um bis zu 7.484.190,00 Euro auf bis zu 22.452.570,00 Euro durch die Ausgabe von bis zu 7.484.190 neuen, auf den Inhaber lautenden Stückaktien mit einem anteiligen Betrag am Grundkapital von 1,00 Euro und mit voller Dividendenberechtigung ab dem 1. Dezember 2016, zu erhöhen. Darüber hinaus sollen bis zu 14.968.380 Wandelschuldverschreibungen im Nennbetrag von jeweils 1,00 Euro mit einem Gesamtnennbetrag von bis zu 14.968.380,00 Euro ausgegeben werden.
Die neuen Aktien und die Wandelschuldverschreibungen werden allen Aktionären zum Bezug angeboten. Etwaige nicht bezogene neue Aktien und Schuldverschreibungen werden im Rahmen von Privatplatzierungen an Investoren innerhalb und außerhalb Europas zum Erwerb angeboten. Die Bezugsfrist für die neuen Aktien und Schuldverschreibungen beginnt am 7. November 2017 um 0:00 Uhr (MEZ) und endet am 20. November 2017 um 24:00 Uhr (MEZ).
Die Hauptaktionärin dievini Hopp Biotech holding GmbH & Co. KG, Walldorf, (dievini) hat der Gesellschaft die grundsätzliche Bereitschaft signalisiert, sich jedenfalls in Höhe ihrer bisherigen Beteiligungsquote an der Finanzierungsmaßnahme bestehend aus Kapitalerhöhung und Wandelschuldverschreibung zu beteiligen. dievini ist unter der Prämisse einer angemessenen Preisfestsetzung grundsätzlich bereit, im Rahmen der Kapitalerhöhung und Wandelschuldverschreibung nicht bezogene Aktien und Schuldverschreibungen zu übernehmen.
Konditionen der Kapitalerhöhung
Die neuen Aktien sollen im Rahmen eines Bezugsrechtsangebots bestehenden Aktionären der Gesellschaft angeboten werden. Das Bezugsverhältnis ist mit 2:1 festgelegt, d.h. zwei alte Aktien berechtigen zum Bezug von einer neuen Aktie. Ein organisierter Bezugsrechtshandel findet nicht statt.
Der Bezugspreis der neuen Aktien wird voraussichtlich am 16. November 2017 auf der Basis des höheren der beiden nachfolgenden Beträge abzüglich eines möglichen vom Vorstand der Heidelberg Pharma AG mit Zustimmung des Aufsichtsrats festzulegenden Abschlags von bis zu 20 % ermittelt werden: (i) der ungewichtete Durchschnitt der Schlusspreise der bestehenden Aktien der Gesellschaft vom Beginn der Bezugsfrist am 7. November 2017 (einschließlich) bis zum Handelsschluss am 16. November 2017 oder (ii) der Schlusspreis der bestehenden Aktien der Gesellschaft am 16. November 2017. Der Bezugspreis wird im Wege einer Ad hoc-Mitteilung und auf der Internetseite der Gesellschaft (www.heidelberg-pharma.com) voraussichtlich am 16. November 2017 und im Bundesanzeiger voraussichtlich am 17. November 2017 veröffentlicht werden.
Die Kapitalerhöhung ist als gemischte Kapitalerhöhung gegen Bar- und/oder Sacheinlagen angelegt. Die Hauptaktionärin dievini kann für einen Teil der auf sie entfallenden Bezugsrechte neue Aktien gegen Leistung einer Sacheinlage beziehen. Die Sacheinlage besteht aus einem Rückzahlungsanspruch - einschließlich Zinsen vom 1. Januar 2017 bis zum 20. November 2017 - in Höhe von 3.928.933,33 Euro aus dem Darlehensvertrag vom 11. Oktober 2016 zwischen dievini und der Heidelberg Pharma AG.
Wandelschuldverschreibungen
Die Wandelschuldverschreibungen gewähren das Recht, die Schuldverschreibungen zum Wandlungsverhältnis in auf den Inhaber lautende Stammaktien (Stückaktien) der Gesellschaft mit einem auf eine Aktie entfallenden anteiligen Betrag des Grundkapitals der Gesellschaft von 1,00 Euro zu wandeln. Das Wandlungsrecht kann durch einen Anleihegläubiger ab dem 50. Tag nach dem Ausgabetag (voraussichtlich ab dem 11. Januar 2018) bis zum Endfälligkeitstag vorbehaltlich bestimmter Nichtausübungszeiträume ausgeübt werden. Die Gesellschaft kann am Ende der Laufzeit von zwei Jahren ab Ausgabetag die Wandlung der Schuldverschreibungen in Aktien der Gesellschaft verlangen. Die Pflichtwandlung erfolgt zum Wandlungspreis und jede Schuldverschreibung wird im Wandlungsverhältnis in auf den Inhaber lautende Stammaktien (Stückaktien) der Gesellschaft mit einem auf eine Aktie entfallenden anteiligen Betrag des Grundkapitals der Gesellschaft von 1,00 Euro gewandelt. Auf die Schuldverschreibungen werden keine Zinszahlungen geleistet (Null-Kupon).
Die Schuldverschreibungen werden den bestehenden Aktionären im Wege eines mittelbaren Bezugsrechts durch die Baader Bank AG, Unterschleißheim, angeboten. Der Bezugspreis je neuer Schuldverschreibung beträgt 1,00 Euro. Das Bezugsverhältnis ist mit 1:1 festgelegt. Das heißt, eine alte Aktie berechtigt zum Bezug von einer neuen Schuldverschreibung. Ein organisierter Bezugsrechtshandel findet nicht statt. Der Wandlungspreis je Aktie wird voraussichtlich am 16. November 2017 auf der Basis des höheren der beiden nachfolgenden Beträge abzüglich eines möglichen vom Vorstand der Heidelberg Pharma AG mit Zustimmung des Aufsichtsrats festzulegenden Abschlags von bis zu 20 % ermittelt werden: (i) der ungewichtete Durchschnitt der Schlusspreise der bestehenden Aktien der Gesellschaft vom Beginn der Bezugsfrist am 7. November 2017 (einschließlich) bis zum Handelsschluss am 16. November 2017 oder (ii) der Schlusspreis der bestehenden Aktien der Gesellschaft am 16. November 2017. Der Wandlungspreis wird im Wege einer Ad hoc-Mitteilung und auf der Internetseite der Gesellschaft (www.heidelberg-pharma.com) voraussichtlich am 16. November 2017 und im Bundesanzeiger voraussichtlich am 17. November 2017 veröffentlicht werden.
Verwendung der Emissionserlöse
Die Heidelberg Pharma AG beabsichtigt, den Emissionserlös aus der Finanzierungsmaßnahme insbesondere für die Weiterentwicklung ihrer ATAC-Technologie sowie für die präklinische und klinische Entwicklung des proprietären ATAC-Kandidaten HDP-101, einschließlich der Etablierung des GMP (Good Manufacturing Practice)-Herstellungsprozesses von Antikörper-Amanitin-Konjugaten (ATACs) zu verwenden. Rund 3,9 Mio. Euro des Emissionserlöses sollen zur Reduzierung der Finanzverbindlichkeiten durch die Einbringung der Darlehensforderung der Hauptaktionärin dievini im Wege der Sachkapitalerhöhung verwendet werden.
Kapitalmaßnahme geplant
Heidelberg Pharma AG plant Kapitalmaßnahme zur Finanzierung ihrer ATAC-EntwicklungsprogrammeLadenburg, 3. November 2017 - Der Vorstand der Heidelberg Pharma AG (ISIN DE000A11QVV0 / WKN A11QVV / WL6) hat heute mit Zustimmung des Aufsichtsrats eine Finanzierungsmaßnahme für die Weiterentwicklung ihrer ATAC-Entwicklungsprogramme beschlossen. Die Finanzierungsmaßnahme soll aus einer Kapitalerhöhung aus genehmigtem Kapital sowie aus der Ausgabe von Wandelschuldverschreibungen bestehen.
Geplant ist, das Grundkapital der Gesellschaft von 14.968.380,00 Euro um bis zu 7.484.190,00 Euro auf bis zu 22.452.570,00 Euro durch die Ausgabe von bis zu 7.484.190 neuen, auf den Inhaber lautenden Stückaktien mit einem anteiligen Betrag am Grundkapital von 1,00 Euro und mit voller Dividendenberechtigung ab dem 1. Dezember 2016, zu erhöhen. Darüber hinaus sollen bis zu 14.968.380 Wandelschuldverschreibungen im Nennbetrag von jeweils 1,00 Euro mit einem Gesamtnennbetrag von bis zu 14.968.380,00 Euro ausgegeben werden.
Die neuen Aktien und die Wandelschuldverschreibungen werden allen Aktionären zum Bezug angeboten. Etwaige nicht bezogene neue Aktien und Schuldverschreibungen werden im Rahmen von Privatplatzierungen an Investoren innerhalb und außerhalb Europas zum Erwerb angeboten. Die Bezugsfrist für die neuen Aktien und Schuldverschreibungen beginnt am 7. November 2017 um 0:00 Uhr (MEZ) und endet am 20. November 2017 um 24:00 Uhr (MEZ).
Die Hauptaktionärin dievini Hopp Biotech holding GmbH & Co. KG, Walldorf, (dievini) hat der Gesellschaft die grundsätzliche Bereitschaft signalisiert, sich jedenfalls in Höhe ihrer bisherigen Beteiligungsquote an der Finanzierungsmaßnahme bestehend aus Kapitalerhöhung und Wandelschuldverschreibung zu beteiligen. dievini ist unter der Prämisse einer angemessenen Preisfestsetzung grundsätzlich bereit, im Rahmen der Kapitalerhöhung und Wandelschuldverschreibung nicht bezogene Aktien und Schuldverschreibungen zu übernehmen.
Konditionen der Kapitalerhöhung
Die neuen Aktien sollen im Rahmen eines Bezugsrechtsangebots bestehenden Aktionären der Gesellschaft angeboten werden. Das Bezugsverhältnis ist mit 2:1 festgelegt, d.h. zwei alte Aktien berechtigen zum Bezug von einer neuen Aktie. Ein organisierter Bezugsrechtshandel findet nicht statt.
Der Bezugspreis der neuen Aktien wird voraussichtlich am 16. November 2017 auf der Basis des höheren der beiden nachfolgenden Beträge abzüglich eines möglichen vom Vorstand der Heidelberg Pharma AG mit Zustimmung des Aufsichtsrats festzulegenden Abschlags von bis zu 20 % ermittelt werden: (i) der ungewichtete Durchschnitt der Schlusspreise der bestehenden Aktien der Gesellschaft vom Beginn der Bezugsfrist am 7. November 2017 (einschließlich) bis zum Handelsschluss am 16. November 2017 oder (ii) der Schlusspreis der bestehenden Aktien der Gesellschaft am 16. November 2017. Der Bezugspreis wird im Wege einer Ad hoc-Mitteilung und auf der Internetseite der Gesellschaft (www.heidelberg-pharma.com) voraussichtlich am 16. November 2017 und im Bundesanzeiger voraussichtlich am 17. November 2017 veröffentlicht werden.
Die Kapitalerhöhung ist als gemischte Kapitalerhöhung gegen Bar- und/oder Sacheinlagen angelegt. Die Hauptaktionärin dievini kann für einen Teil der auf sie entfallenden Bezugsrechte neue Aktien gegen Leistung einer Sacheinlage beziehen. Die Sacheinlage besteht aus einem Rückzahlungsanspruch - einschließlich Zinsen vom 1. Januar 2017 bis zum 20. November 2017 - in Höhe von 3.928.933,33 Euro aus dem Darlehensvertrag vom 11. Oktober 2016 zwischen dievini und der Heidelberg Pharma AG.
Wandelschuldverschreibungen
Die Wandelschuldverschreibungen gewähren das Recht, die Schuldverschreibungen zum Wandlungsverhältnis in auf den Inhaber lautende Stammaktien (Stückaktien) der Gesellschaft mit einem auf eine Aktie entfallenden anteiligen Betrag des Grundkapitals der Gesellschaft von 1,00 Euro zu wandeln. Das Wandlungsrecht kann durch einen Anleihegläubiger ab dem 50. Tag nach dem Ausgabetag (voraussichtlich ab dem 11. Januar 2018) bis zum Endfälligkeitstag vorbehaltlich bestimmter Nichtausübungszeiträume ausgeübt werden. Die Gesellschaft kann am Ende der Laufzeit von zwei Jahren ab Ausgabetag die Wandlung der Schuldverschreibungen in Aktien der Gesellschaft verlangen. Die Pflichtwandlung erfolgt zum Wandlungspreis und jede Schuldverschreibung wird im Wandlungsverhältnis in auf den Inhaber lautende Stammaktien (Stückaktien) der Gesellschaft mit einem auf eine Aktie entfallenden anteiligen Betrag des Grundkapitals der Gesellschaft von 1,00 Euro gewandelt. Auf die Schuldverschreibungen werden keine Zinszahlungen geleistet (Null-Kupon).
Die Schuldverschreibungen werden den bestehenden Aktionären im Wege eines mittelbaren Bezugsrechts durch die Baader Bank AG, Unterschleißheim, angeboten. Der Bezugspreis je neuer Schuldverschreibung beträgt 1,00 Euro. Das Bezugsverhältnis ist mit 1:1 festgelegt. Das heißt, eine alte Aktie berechtigt zum Bezug von einer neuen Schuldverschreibung. Ein organisierter Bezugsrechtshandel findet nicht statt. Der Wandlungspreis je Aktie wird voraussichtlich am 16. November 2017 auf der Basis des höheren der beiden nachfolgenden Beträge abzüglich eines möglichen vom Vorstand der Heidelberg Pharma AG mit Zustimmung des Aufsichtsrats festzulegenden Abschlags von bis zu 20 % ermittelt werden: (i) der ungewichtete Durchschnitt der Schlusspreise der bestehenden Aktien der Gesellschaft vom Beginn der Bezugsfrist am 7. November 2017 (einschließlich) bis zum Handelsschluss am 16. November 2017 oder (ii) der Schlusspreis der bestehenden Aktien der Gesellschaft am 16. November 2017. Der Wandlungspreis wird im Wege einer Ad hoc-Mitteilung und auf der Internetseite der Gesellschaft (www.heidelberg-pharma.com) voraussichtlich am 16. November 2017 und im Bundesanzeiger voraussichtlich am 17. November 2017 veröffentlicht werden.
Verwendung der Emissionserlöse
Die Heidelberg Pharma AG beabsichtigt, den Emissionserlös aus der Finanzierungsmaßnahme insbesondere für die Weiterentwicklung ihrer ATAC-Technologie sowie für die präklinische und klinische Entwicklung des proprietären ATAC-Kandidaten HDP-101, einschließlich der Etablierung des GMP (Good Manufacturing Practice)-Herstellungsprozesses von Antikörper-Amanitin-Konjugaten (ATACs) zu verwenden. Rund 3,9 Mio. Euro des Emissionserlöses sollen zur Reduzierung der Finanzverbindlichkeiten durch die Einbringung der Darlehensforderung der Hauptaktionärin dievini im Wege der Sachkapitalerhöhung verwendet werden.
Antwort auf Beitrag Nr.: 56.093.453 von BICYPAPA am 03.11.17 16:04:18
Präsentation zur Maßnahme
Präsentation zur Maßnahme 3. November: http://heidelberg-pharma.com/files/2017-11-03_hd-pharma-pres…
Antwort auf Beitrag Nr.: 56.097.902 von BICYPAPA am 04.11.17 08:50:58
http://boersengefluester.de/heidelberg-pharma-entscheidende-…
Artikel und Hintergrund...
... zur Maßnahme.http://boersengefluester.de/heidelberg-pharma-entscheidende-…
Telix / Redectane
Heidelberg Pharma Partner Telix sichert sich die Finanzen zur Durchführung der Studien. Damit ist die finanzielle Voraussetzung geschaffen, die Redectane Studie zeitnah zu starten. Heidelberg Pharma hat Redectane zur weiteren Entwicklung an Telix auslizensiert.http://inpublic.globenewswire.com/releaseDetails.faces?rId=2…" target="_blank" rel="nofollow ugc noopener">
http://inpublic.globenewswire.com/releaseDetails.faces?rId=2…
http://www.telixpharma.com/telix-pharmaceuticals-limited-suc…
Antwort auf Beitrag Nr.: 56.143.610 von BICYPAPA am 09.11.17 15:37:38
https://clinicaltrials.gov/ct2/show/NCT01582204?term=wilex&r…
Nach Zahlungen von Milestones stehen dann auch "attraktive Umsatzbeteiligungen" an. Als Zeitdauer für die Studie wird von Telix etwa 2 Jahre angegeben. Ich habe mal eine Umsatzzahl von etwa 100 Millionen für Redectane gelesen, kann die Quelle aber nicht mehr finden. Somit hätte Heidelberg Pharma alleine durch Redectane eine enorm große Chance von etwa 25-30 Millionen $ in etwa 2 Jahren. Dies in Kürze mein Wissenstandstand. Bis zum Studienstart soll der Herstellungsprozess noch optimiert werden. Im 1 Q 2018 ist der Start geplant.
Redectane
Es läuft gerade noch eine Studie in Phase 3 durch das Memorial Sloan Kettering Cancer Center , die im April nächsten Jahres beendet sein soll.https://clinicaltrials.gov/ct2/show/NCT01582204?term=wilex&r…
Nach Zahlungen von Milestones stehen dann auch "attraktive Umsatzbeteiligungen" an. Als Zeitdauer für die Studie wird von Telix etwa 2 Jahre angegeben. Ich habe mal eine Umsatzzahl von etwa 100 Millionen für Redectane gelesen, kann die Quelle aber nicht mehr finden. Somit hätte Heidelberg Pharma alleine durch Redectane eine enorm große Chance von etwa 25-30 Millionen $ in etwa 2 Jahren. Dies in Kürze mein Wissenstandstand. Bis zum Studienstart soll der Herstellungsprozess noch optimiert werden. Im 1 Q 2018 ist der Start geplant.
Antwort auf Beitrag Nr.: 56.146.790 von BICYPAPA am 09.11.17 20:14:22
Heidelberg Pharma AG gibt Ergebnisse aus einer Forschungskooperation mit der Universität Heidelberg und dem DKFZ auf der ASH-Jahrestagung bekannt
- Wirksamkeit von ATACs in Multiplen Myelomzellen getestet - Erste vielversprechende Ergebnisse für HDP-101 liegen vor
- Forschungsergebnisse werden auf der Jahrestagung der ASH (American Society of Hematology) Anfang Dezember präsentiert
Ladenburg, 13. November 2017 - Die Heidelberg Pharma AG (ISIN DE000A11QVV0 / WKN A11QVV / WL6) gab heute bekannt, dass sie erste Ergebnisse einer Forschungskooperation mit der Universität Heidelberg und dem Deutschen Krebsforschungszentrum (DKFZ) unter der Leitung von PD Dr. Marc-Steffen Raab auf dem führenden Kongress für hämatologische Erkrankungen, dem 59. ASH Annual Meeting (American Society of Hematology), das vom 9.-12. Dezember 2017 in Atlanta, USA stattfindet, präsentieren wird.
Im Rahmen der Kooperation wurde die Wirksamkeit des Entwicklungskandidaten HDP-101 an Multiplen Myelomzellen aus Patienten getestet. HDP-101 setzt sich zusammen aus einem BCMA-Antikörper, einem Linker und dem Toxin Amanitin. BCMA (B-cell maturation antigen) ist ein Oberflächenprotein, das beim Multiplen Myelom selektiv exprimiert wird und an das der ausgewählte Antikörper spezifisch bindet. In der gemeinsam durchgeführten präklinischen Studie wurde HDP-101 an nicht-teilenden Krebszellen, die Multiplen Myelom-Patienten entnommen wurden, getestet. Bereits eine sehr niedrige Dosierung des Kandidaten zeigte eine starke zelltötende Wirkung, sogar in Krebszellen mit einer geringen Dichte an BCMA-Antigenen. In nicht-BCMA exprimierenden Kontrollzellen wurde keine Toxizität beobachtet. Damit wurde zum ersten Mal die Wirkung von Amanitin auf Krebszellen von humanen Patienten gezeigt.
Antikörper-Wirkstoff-Konjugate (ADCs - Antibody Drug Conjugates) mit Amanitin stellen in der Therapie des Multiplen Myeloms einen neuartigen therapeutischen Ansatz dar. Der biologische Wirkmechanismus des Toxins könnte Therapieresistenzen durchbrechen und die Prognose der Patienten verbessern. Der Start einer klinischen Studie mit HDP-101 ist für Ende 2018 geplant.
Prof. Dr. Andreas Pahl, Vorstand für Forschung und Entwicklung der Heidelberg Pharma AG, kommentierte: "Die gemeinsam mit der Universität Heidelberg und dem DKFZ durchgeführte präklinische Studie in der Indikation Multiples Myelom belegt die Wirkung unseres Kandidaten HDP-101 auf direkt aus den Patienten isolierten Tumorzellen. Dies liefert uns einen weiteren Beweis für die Wirksamkeit unseres ersten eigenen ATAC-Kandidaten HDP-101, der von großer Bedeutung für uns ist. Wir freuen uns sehr darüber, dass die Ergebnisse auf dem wichtigen ASH-Kongress präsentiert werden."
Präsentationsdetails: Präsentationsdetails:
Poster: 3070 Preclinical Evaluation of HDP-101, a Novel Anti-Bcma Antibody-Drug Conjugate, in Multiple Myeloma Session Name: 652. Myeloma: Pathophysiology and Pre-Clinical Studies,
excluding Therapy: Poster II Datum: Sonntag, 10. Dezember 2017 Zeit: 18:00 - 20:00 Uhr
Ergebnisse aus einer Forschungskooperation
http://www.finanznachrichten.de/nachrichten-2017-11/42224287…Heidelberg Pharma AG gibt Ergebnisse aus einer Forschungskooperation mit der Universität Heidelberg und dem DKFZ auf der ASH-Jahrestagung bekannt
- Wirksamkeit von ATACs in Multiplen Myelomzellen getestet - Erste vielversprechende Ergebnisse für HDP-101 liegen vor
- Forschungsergebnisse werden auf der Jahrestagung der ASH (American Society of Hematology) Anfang Dezember präsentiert
Ladenburg, 13. November 2017 - Die Heidelberg Pharma AG (ISIN DE000A11QVV0 / WKN A11QVV / WL6) gab heute bekannt, dass sie erste Ergebnisse einer Forschungskooperation mit der Universität Heidelberg und dem Deutschen Krebsforschungszentrum (DKFZ) unter der Leitung von PD Dr. Marc-Steffen Raab auf dem führenden Kongress für hämatologische Erkrankungen, dem 59. ASH Annual Meeting (American Society of Hematology), das vom 9.-12. Dezember 2017 in Atlanta, USA stattfindet, präsentieren wird.
Im Rahmen der Kooperation wurde die Wirksamkeit des Entwicklungskandidaten HDP-101 an Multiplen Myelomzellen aus Patienten getestet. HDP-101 setzt sich zusammen aus einem BCMA-Antikörper, einem Linker und dem Toxin Amanitin. BCMA (B-cell maturation antigen) ist ein Oberflächenprotein, das beim Multiplen Myelom selektiv exprimiert wird und an das der ausgewählte Antikörper spezifisch bindet. In der gemeinsam durchgeführten präklinischen Studie wurde HDP-101 an nicht-teilenden Krebszellen, die Multiplen Myelom-Patienten entnommen wurden, getestet. Bereits eine sehr niedrige Dosierung des Kandidaten zeigte eine starke zelltötende Wirkung, sogar in Krebszellen mit einer geringen Dichte an BCMA-Antigenen. In nicht-BCMA exprimierenden Kontrollzellen wurde keine Toxizität beobachtet. Damit wurde zum ersten Mal die Wirkung von Amanitin auf Krebszellen von humanen Patienten gezeigt.
Antikörper-Wirkstoff-Konjugate (ADCs - Antibody Drug Conjugates) mit Amanitin stellen in der Therapie des Multiplen Myeloms einen neuartigen therapeutischen Ansatz dar. Der biologische Wirkmechanismus des Toxins könnte Therapieresistenzen durchbrechen und die Prognose der Patienten verbessern. Der Start einer klinischen Studie mit HDP-101 ist für Ende 2018 geplant.
Prof. Dr. Andreas Pahl, Vorstand für Forschung und Entwicklung der Heidelberg Pharma AG, kommentierte: "Die gemeinsam mit der Universität Heidelberg und dem DKFZ durchgeführte präklinische Studie in der Indikation Multiples Myelom belegt die Wirkung unseres Kandidaten HDP-101 auf direkt aus den Patienten isolierten Tumorzellen. Dies liefert uns einen weiteren Beweis für die Wirksamkeit unseres ersten eigenen ATAC-Kandidaten HDP-101, der von großer Bedeutung für uns ist. Wir freuen uns sehr darüber, dass die Ergebnisse auf dem wichtigen ASH-Kongress präsentiert werden."
Präsentationsdetails: Präsentationsdetails:
Poster: 3070 Preclinical Evaluation of HDP-101, a Novel Anti-Bcma Antibody-Drug Conjugate, in Multiple Myeloma Session Name: 652. Myeloma: Pathophysiology and Pre-Clinical Studies,
excluding Therapy: Poster II Datum: Sonntag, 10. Dezember 2017 Zeit: 18:00 - 20:00 Uhr
Antwort auf Beitrag Nr.: 56.174.019 von BICYPAPA am 13.11.17 20:44:25
Ladenburg, 16. November 2017 - Der Vorstand der Heidelberg Pharma AG (ISIN DE000A11QVV0 / WKN A11QVV / WL6) hat heute mit Zustimmung des Aufsichtsrats den Bezugspreis für die geplante Ausgabe neuer Aktien in Höhe von 2,60 Euro je neuer Aktie und den Wandlungspreis der zur Begebung vorgesehenen Wandelschuldverschreibungen in Höhe von 2,60 Euro je Aktie festgelegt.
Der Bezugspreis je neuer Aktie und der Wandlungspreis je Aktie wurden mit der in der Ad-hoc-Mitteilung vom 3. November 2017 vorgegebenen Berechnungsmethode ermittelt. Der Bezugspreis und der Wandlungspreis entsprechen jeweils dem Schlusspreis der bestehenden Aktien der Gesellschaft im elektronischen Handelssystem XETRA der Frankfurter Wertpapierbörse am 16. November 2017 in Höhe von 2,859 Euro abzüglich eines heute festgelegten Abschlags von 9,1 %.
Die derzeit laufende Bezugsfrist für die neuen Aktien und die Schuldverschreibungen endet am 20. November 2017 um 24:00 Uhr (MEZ). Etwaige nicht bezogene neue Aktien und Schuldverschreibungen werden im Rahmen von Privatplatzierungen der Hauptaktionärin dievini Hopp Biotech holding GmbH & Co. KG, Walldorf, und institutionellen Investoren innerhalb und außerhalb Europas gegen Ende der Bezugsfrist zum Erwerb angeboten.
Zur Finanzierung ihrer ATAC-Entwicklungsprogramme plant Heidelberg Pharma, bis zu 7.484.190 neue Aktien gegen Bar- und/oder Sacheinlagen sowie bis zu 14.968.380 Wandelschuldverschreibungen im Nennbetrag von jeweils 1,00 Euro mit einem Gesamtnennbetrag von bis zu 14.968.380,00 Euro auszugeben. Weitere Informationen zur Kapitalmaßname sind der Ad-hoc-Mitteilung der Heidelberg Pharma AG vom 3. November 2017 zu entnehmen und können auch von der Unternehmenswebseite www.heidelberg-pharma.com abgerufen werden.
Bezugspreis für Maßnahme
Heidelberg Pharma AG gibt Bezugspreis für neue Aktien und Wandlungspreis für Wandelschuldverschreibungen aus laufender Kapitalmaßnahme bekanntLadenburg, 16. November 2017 - Der Vorstand der Heidelberg Pharma AG (ISIN DE000A11QVV0 / WKN A11QVV / WL6) hat heute mit Zustimmung des Aufsichtsrats den Bezugspreis für die geplante Ausgabe neuer Aktien in Höhe von 2,60 Euro je neuer Aktie und den Wandlungspreis der zur Begebung vorgesehenen Wandelschuldverschreibungen in Höhe von 2,60 Euro je Aktie festgelegt.
Der Bezugspreis je neuer Aktie und der Wandlungspreis je Aktie wurden mit der in der Ad-hoc-Mitteilung vom 3. November 2017 vorgegebenen Berechnungsmethode ermittelt. Der Bezugspreis und der Wandlungspreis entsprechen jeweils dem Schlusspreis der bestehenden Aktien der Gesellschaft im elektronischen Handelssystem XETRA der Frankfurter Wertpapierbörse am 16. November 2017 in Höhe von 2,859 Euro abzüglich eines heute festgelegten Abschlags von 9,1 %.
Die derzeit laufende Bezugsfrist für die neuen Aktien und die Schuldverschreibungen endet am 20. November 2017 um 24:00 Uhr (MEZ). Etwaige nicht bezogene neue Aktien und Schuldverschreibungen werden im Rahmen von Privatplatzierungen der Hauptaktionärin dievini Hopp Biotech holding GmbH & Co. KG, Walldorf, und institutionellen Investoren innerhalb und außerhalb Europas gegen Ende der Bezugsfrist zum Erwerb angeboten.
Zur Finanzierung ihrer ATAC-Entwicklungsprogramme plant Heidelberg Pharma, bis zu 7.484.190 neue Aktien gegen Bar- und/oder Sacheinlagen sowie bis zu 14.968.380 Wandelschuldverschreibungen im Nennbetrag von jeweils 1,00 Euro mit einem Gesamtnennbetrag von bis zu 14.968.380,00 Euro auszugeben. Weitere Informationen zur Kapitalmaßname sind der Ad-hoc-Mitteilung der Heidelberg Pharma AG vom 3. November 2017 zu entnehmen und können auch von der Unternehmenswebseite www.heidelberg-pharma.com abgerufen werden.
Antwort auf Beitrag Nr.: 56.174.019 von BICYPAPA am 13.11.17 20:44:25
Gesamter Artikel:
https://www.mskcc.org/blog/psma-new-target-prostate-cancer-t…
Summary
Prostate cancer cells have high levels of prostate-specific membrane antigen (PSMA), but researchers were unsure of its biological role. Now an MSK-led team has discovered that PSMA contributes to prostate cancer’s development. This offers a new target for drugs.
Highlights:
PSMA is a protein in prostate cells.
Researchers have found that it helps fuel prostate cancer.
This offers a new target for prostate cancer treatments.
Heidelberg Pharma hat bei dieser Indikation eben dieses PSMA im Ziel. Aktueller Artikel von gestern zu diesem Thema.
Heidelberg Pharma Pipeline:
http://heidelberg-pharma.com/de/forschung-entwicklung/ueberb…
Memorial Sloan Kettering Cancer Center
PSMA: A New Target for Prostate Cancer Treatment Gesamter Artikel:
https://www.mskcc.org/blog/psma-new-target-prostate-cancer-t…
Summary
Prostate cancer cells have high levels of prostate-specific membrane antigen (PSMA), but researchers were unsure of its biological role. Now an MSK-led team has discovered that PSMA contributes to prostate cancer’s development. This offers a new target for drugs.
Highlights:
PSMA is a protein in prostate cells.
Researchers have found that it helps fuel prostate cancer.
This offers a new target for prostate cancer treatments.
Heidelberg Pharma hat bei dieser Indikation eben dieses PSMA im Ziel. Aktueller Artikel von gestern zu diesem Thema.
Heidelberg Pharma Pipeline:
http://heidelberg-pharma.com/de/forschung-entwicklung/ueberb…
Antwort auf Beitrag Nr.: 56.204.202 von BICYPAPA am 16.11.17 22:39:56
Forschungsgruppen von MD Anderson und Heidelberg Pharma demonstrierten in präklinischen Studien die außergewöhnlich hohe Wirksamkeit von ATAC-Therapeutika in der Behandlung einer Darmkrebs-Subpopulation, die Veränderungen im Status des Tumorsuppressorgens TP53 aufweist. Dieses Gen hat die Aufgabe, die Tumorbildung in gesunden Zellen zu unterdrücken. Krebszellen verändern ihr Erbgut so, dass diese Schutzfunktion nicht mehr voll ausgeübt werden kann.
In der Forschungskooperation konnte gezeigt werden, dass diese Erbgutveränderung (sog. Hemizygotie) gleichzeitig zu einer deutlich höheren Wirksamkeit der ATACs führt, da in den Krebszellen das Gen des Zielmoleküls des Amanitins (POLR2A, RNA Polymerase II) ebenfalls durch diese Genveränderung verändert wird. Der hemizygote Genstatus von TP53 und POLR2A führt zur verringerten RNA Polymerase II mRNA- und Proteinspiegeln in Tumorzellen und dadurch zu einer signifikant höheren Sensitivität dieser Krebszellen gegenüber ATACs.
In präklinischen In-vitro- und In-vivo-Studien zeigten ATACs eine etwa zehnfach höhere Antitumoraktivität bei Tumoren mit hemizygotem POLR2A Status im Vergleich zu Tumoren mit homozygotem Status. Weitere Daten weisen darauf hin, dass solche genetischen Veränderungen auch bei anderen Tumorarten vorliegen.
Die auf Amanitin basierenden ATACs stellen somit eine vielversprechende therapeutische Strategie für Patienten dar, die an hochresistenten Tumorerkrankungen leiden. In der klinischen Anwendung könnte die Patientenselektion auf Basis des TP53 und POLR2A Genstatus das therapeutische Fenster erweitern und so eine hohe Wirksamkeit bei gleichzeitiger Verringerung der Nebenwirkungen ermöglichen. Nach Ansicht von Heidelberg Pharma wäre das der erste personalisierte Ansatz für ein ADC.
Prognostischer Biomarker p 53 / RNA Polymerase II
Prognostischer Biomarker p 53 / RNA Polymerase IIForschungsgruppen von MD Anderson und Heidelberg Pharma demonstrierten in präklinischen Studien die außergewöhnlich hohe Wirksamkeit von ATAC-Therapeutika in der Behandlung einer Darmkrebs-Subpopulation, die Veränderungen im Status des Tumorsuppressorgens TP53 aufweist. Dieses Gen hat die Aufgabe, die Tumorbildung in gesunden Zellen zu unterdrücken. Krebszellen verändern ihr Erbgut so, dass diese Schutzfunktion nicht mehr voll ausgeübt werden kann.
In der Forschungskooperation konnte gezeigt werden, dass diese Erbgutveränderung (sog. Hemizygotie) gleichzeitig zu einer deutlich höheren Wirksamkeit der ATACs führt, da in den Krebszellen das Gen des Zielmoleküls des Amanitins (POLR2A, RNA Polymerase II) ebenfalls durch diese Genveränderung verändert wird. Der hemizygote Genstatus von TP53 und POLR2A führt zur verringerten RNA Polymerase II mRNA- und Proteinspiegeln in Tumorzellen und dadurch zu einer signifikant höheren Sensitivität dieser Krebszellen gegenüber ATACs.
In präklinischen In-vitro- und In-vivo-Studien zeigten ATACs eine etwa zehnfach höhere Antitumoraktivität bei Tumoren mit hemizygotem POLR2A Status im Vergleich zu Tumoren mit homozygotem Status. Weitere Daten weisen darauf hin, dass solche genetischen Veränderungen auch bei anderen Tumorarten vorliegen.
Die auf Amanitin basierenden ATACs stellen somit eine vielversprechende therapeutische Strategie für Patienten dar, die an hochresistenten Tumorerkrankungen leiden. In der klinischen Anwendung könnte die Patientenselektion auf Basis des TP53 und POLR2A Genstatus das therapeutische Fenster erweitern und so eine hohe Wirksamkeit bei gleichzeitiger Verringerung der Nebenwirkungen ermöglichen. Nach Ansicht von Heidelberg Pharma wäre das der erste personalisierte Ansatz für ein ADC.
Antwort auf Beitrag Nr.: 56.262.725 von BICYPAPA am 24.11.17 07:19:49
TP53, a well-known tumor suppressor gene, is frequently inactivated by mutation or deletion in a majority of human tumors. A tremendous effort has been made to restore p53 activity in cancer therapies. However, no effective p53-based therapy has been successfully translated into clinical cancer treatment due to the complexity of p53 signaling. Therefore, identification of vulnerabilities conferred by TP53 deletion or mutation is a major challenge to target p53 aberrancy in human cancer. We demonstrate that genomic deletion of TP53 frequently encompasses neighboring essential genes, rendering cancer cells with hemizygous TP53 deletion vulnerable to further suppression of such genes. POLR2A is identified as such a gene that is always co-deleted with TP53 in human cancers. Hemizygous loss of TP53/POLR2A occurs in 53% of colorectal cancers (CRC), 62% of breast cancers, 75% of ovarian cancers, and 41% of pancreatic cancers. POLR2A encodes the largest and catalytic subunit of RNA polymerase II complex. It is specifically inhibited by ?-Amanitin, a cyclic 8-aa peptide toxin found in the death cap mushroom (Amanita phalloides). POLR2A expression levels are tightly correlated with its gene copy numbers in human colorectal cancer (CRC). Suppression of POLR2A selectively inhibits proliferation, survival and tumorigenic potential of CRC cells with hemizygous TP53 loss in a p53- independent manner. Previous clinical applications of ?-Amanitin have been limited due to its liver toxicity. Free ?-Amanitin causes apoptosis and necrosis of hepatocytes by interacting with the hepatocyte-specific transporting protein OATP1B3 (10). However, ?-Amanitin is no longer substrate for OATP1B3 when coupled to antibodies. Therefore, ?-Amanitin-based antibody drug conjugates (ADCs) are highly effective therapeutic agents with significantly reduced toxicity. Our study has shown that low doses of ?-Amanitin-conjugated anti- EpCAM (Epithelial Cell Adhesion Molecule) antibody lead to complete tumor regression in murine models of human CRC with hemizygous deletion of POLR2A. The preclinical studies in this application were recently published in Nature, which provide the foundation for future clinical trials. There is already discussion regarding the potential for initiation of a clinical trial based on our work. We propose that hemizygous deletion of TP53 in human cancers creates a therapeutic window between normal and cancer cells, and that PORL2A is a novel and druggable target in cancers with such genomic alterations.
Public Health Relevance
Hemizygous deletion of the tumor suppressor TP53 gene is a frequent genomic event in human cancers. As a gene essential for cell survival, the POLR2A gene is always co-deleted with TP53 in the cancer cell. In this proposal, we propose that hemizygous deletion of TP53 creates a therapeutic window between normal and cancer cells, and that PORL2A is a novel and druggable target in human cancers with such genomic alterations.
Abstract zu TP53
http://grantome.com/grant/NIH/R01-CA203737-01TP53, a well-known tumor suppressor gene, is frequently inactivated by mutation or deletion in a majority of human tumors. A tremendous effort has been made to restore p53 activity in cancer therapies. However, no effective p53-based therapy has been successfully translated into clinical cancer treatment due to the complexity of p53 signaling. Therefore, identification of vulnerabilities conferred by TP53 deletion or mutation is a major challenge to target p53 aberrancy in human cancer. We demonstrate that genomic deletion of TP53 frequently encompasses neighboring essential genes, rendering cancer cells with hemizygous TP53 deletion vulnerable to further suppression of such genes. POLR2A is identified as such a gene that is always co-deleted with TP53 in human cancers. Hemizygous loss of TP53/POLR2A occurs in 53% of colorectal cancers (CRC), 62% of breast cancers, 75% of ovarian cancers, and 41% of pancreatic cancers. POLR2A encodes the largest and catalytic subunit of RNA polymerase II complex. It is specifically inhibited by ?-Amanitin, a cyclic 8-aa peptide toxin found in the death cap mushroom (Amanita phalloides). POLR2A expression levels are tightly correlated with its gene copy numbers in human colorectal cancer (CRC). Suppression of POLR2A selectively inhibits proliferation, survival and tumorigenic potential of CRC cells with hemizygous TP53 loss in a p53- independent manner. Previous clinical applications of ?-Amanitin have been limited due to its liver toxicity. Free ?-Amanitin causes apoptosis and necrosis of hepatocytes by interacting with the hepatocyte-specific transporting protein OATP1B3 (10). However, ?-Amanitin is no longer substrate for OATP1B3 when coupled to antibodies. Therefore, ?-Amanitin-based antibody drug conjugates (ADCs) are highly effective therapeutic agents with significantly reduced toxicity. Our study has shown that low doses of ?-Amanitin-conjugated anti- EpCAM (Epithelial Cell Adhesion Molecule) antibody lead to complete tumor regression in murine models of human CRC with hemizygous deletion of POLR2A. The preclinical studies in this application were recently published in Nature, which provide the foundation for future clinical trials. There is already discussion regarding the potential for initiation of a clinical trial based on our work. We propose that hemizygous deletion of TP53 in human cancers creates a therapeutic window between normal and cancer cells, and that PORL2A is a novel and druggable target in cancers with such genomic alterations.
Public Health Relevance
Hemizygous deletion of the tumor suppressor TP53 gene is a frequent genomic event in human cancers. As a gene essential for cell survival, the POLR2A gene is always co-deleted with TP53 in the cancer cell. In this proposal, we propose that hemizygous deletion of TP53 creates a therapeutic window between normal and cancer cells, and that PORL2A is a novel and druggable target in human cancers with such genomic alterations.
Antwort auf Beitrag Nr.: 56.265.023 von BICYPAPA am 24.11.17 11:30:32
http://www.telixpharma.com/investors/asx-announcements/
Ein Schaubild zur Zeitplanung von Redectane füge ich an.
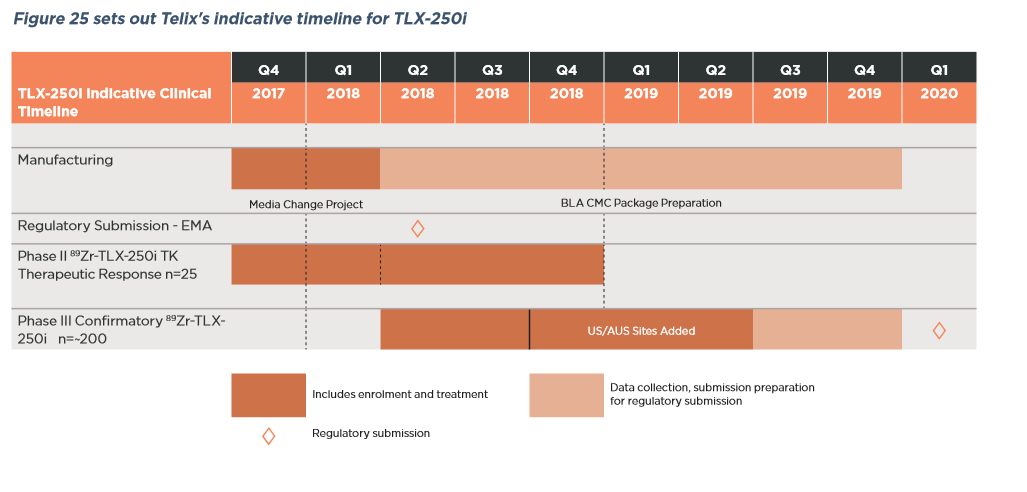
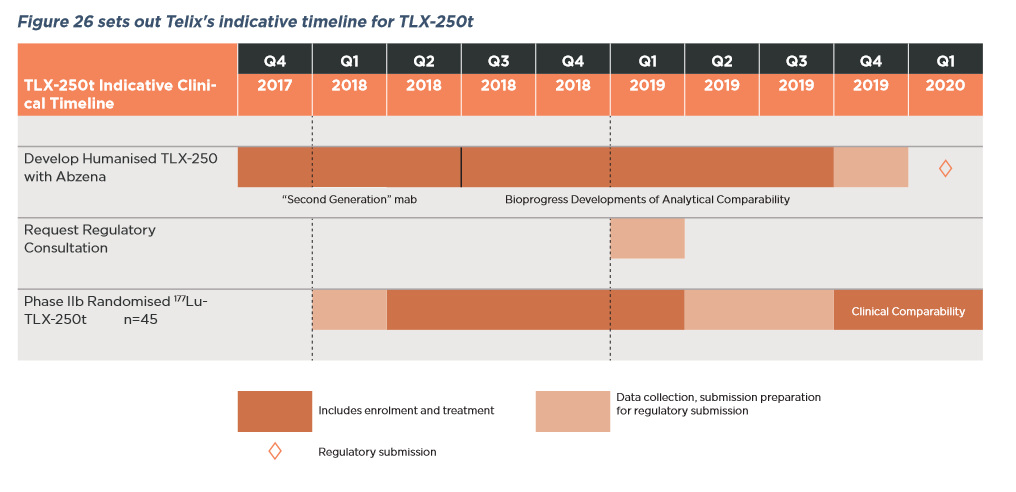
Redectane Studien
Habe mir gerade mal die Redectane Daten von Telix angeschaut. Erstmal liegt der Fokus auf die bildgebende Anwendung in der bekannten Anwendung Nierenzellkarzinom. Hierzu laufen parallel zwei Studien. Der Beginn der Hauptstudie ist für Ende Q1 2018 geplant. Ende der Rekrutierung soll etwa Ende Q2 2019 sein. Danach folgt die Auswertung und das übliche Prozedere bis zur Zulassung. Interessant ist die Diskussion zu einer Erweiterung der Anwendung in zusätzliche Anwendung. Somit wäre Redectane nicht auf die Ursprungsanwendung begrenzt. So können wir langfristig von einem beträchtlich höheren Peak sales von Redectane ausgehen. Die therapeutische Anwendung ist ebenfalls geplant und läuft parallel zu der bildgebenden Entwicklung. Fazit: Das Potential von Redectane wurde bis jetzt enorm unterschätzt. Die Auslizensierung an Telix birgt ein enormes zusätzliches Potential. Nähere Einzelheiten könnt ihr dem Prospekt von Telix entnehmen.http://www.telixpharma.com/investors/asx-announcements/
Ein Schaubild zur Zeitplanung von Redectane füge ich an.


Antwort auf Beitrag Nr.: 56.271.767 von BICYPAPA am 25.11.17 07:58:43
Melbourne (Australia) and Indianapolis, IN (USA) – 4th December 2017. Telix Pharmaceuticals Limited (ASX.TLX) (“Telix”, the “Company”), an Australian biopharmaceutical company focused on the development of diagnostic and therapeutic products based on targeted radiopharmaceuticals or “molecularly-targeted radiation” (MTR), has today announced the appointment of Dr. Bernard Lambert as President and Chief Operating Officer (COO) of Telix’s US subsidiary.
Telix’s US subsidiary – Telix Pharmaceuticals (US) Inc., a Delaware C-Corporation – was established in October 2017 as a wholly-owned international operating subsidiary of Telix Pharmaceuticals Limited. The purpose of the operating subsidiary is to support the Company’s US clinical and manufacturing activities, and to establish a commercial footprint in the United States.
Telix Co-Founder and CEO Dr. Christian Behrenbruch stated, “Bernard is an outstanding addition to the team and one of the most experienced radiopharmaceutical development executives in the United States. His extensive product development experience will be invaluable both with respect to the FDA, but also in support of Telix’s global collaborations more generally.”
Dr. Lambert’s responsibilities include managing Telix’s growing US manufacturing infrastructure, providing operational support for US-based clinical trials and establishing the team to support Telix’s near-term commercialization objectives in renal and prostate cancer imaging. Dr. Lambert was previously Vice President, CMC and Radiopharmaceutical Development at Zevacor Molecular and IBA Molecular, and led the manufacturing of 124I-girentuximab (the predecessor to Telix’s renal cancer imaging product) that was studied in the Phase III REDECT trial by Wilex AG. A radiochemist by training, Dr. Lambert received a Ph.D in chemistry from the University of Liège.
Dr. Lambert stated, “I am delighted to be joining Telix at such an exciting time in the growth of the business and it is a personal pleasure to be part of completing the commercialization of girentuximab-based imaging. Chris has built a world-class team with a strong track record in radiopharmaceutical development and I look forward to leading the US team.”
http://news.iguana2.com/macquaries/ASX/TLX/484025
Redectane-Telix
Telix Pharmaceuticals Appointed Dr Bernard Lambert as President of Telix Pharmaceuticals (US) Inc. Melbourne (Australia) and Indianapolis, IN (USA) – 4th December 2017. Telix Pharmaceuticals Limited (ASX.TLX) (“Telix”, the “Company”), an Australian biopharmaceutical company focused on the development of diagnostic and therapeutic products based on targeted radiopharmaceuticals or “molecularly-targeted radiation” (MTR), has today announced the appointment of Dr. Bernard Lambert as President and Chief Operating Officer (COO) of Telix’s US subsidiary.
Telix’s US subsidiary – Telix Pharmaceuticals (US) Inc., a Delaware C-Corporation – was established in October 2017 as a wholly-owned international operating subsidiary of Telix Pharmaceuticals Limited. The purpose of the operating subsidiary is to support the Company’s US clinical and manufacturing activities, and to establish a commercial footprint in the United States.
Telix Co-Founder and CEO Dr. Christian Behrenbruch stated, “Bernard is an outstanding addition to the team and one of the most experienced radiopharmaceutical development executives in the United States. His extensive product development experience will be invaluable both with respect to the FDA, but also in support of Telix’s global collaborations more generally.”
Dr. Lambert’s responsibilities include managing Telix’s growing US manufacturing infrastructure, providing operational support for US-based clinical trials and establishing the team to support Telix’s near-term commercialization objectives in renal and prostate cancer imaging. Dr. Lambert was previously Vice President, CMC and Radiopharmaceutical Development at Zevacor Molecular and IBA Molecular, and led the manufacturing of 124I-girentuximab (the predecessor to Telix’s renal cancer imaging product) that was studied in the Phase III REDECT trial by Wilex AG. A radiochemist by training, Dr. Lambert received a Ph.D in chemistry from the University of Liège.
Dr. Lambert stated, “I am delighted to be joining Telix at such an exciting time in the growth of the business and it is a personal pleasure to be part of completing the commercialization of girentuximab-based imaging. Chris has built a world-class team with a strong track record in radiopharmaceutical development and I look forward to leading the US team.”
http://news.iguana2.com/macquaries/ASX/TLX/484025
Antwort auf Beitrag Nr.: 56.353.853 von BICYPAPA am 04.12.17 07:47:01
Deshalb habe ich die NBI Werte bevorzugt. Zu den Motiven von Heidelberg Pharma. Heidelberg Pharma besteht hauptsächlich aus den drei folgenden Wirkstoffen oder Wirkstoffgruppen.
Das sind erst mal Mesupron, dem ich erst mal nicht so große Chancen einräume, da der Lizenznehmer im Augenblick finanziell nicht in der Lage ist die Entwicklung voranzutreiben.
Ein sehr aussichtsreicher Kandidat aus dem Wilex Erbe aber ist Redectane. Der Partner Telix aus Australien hat sich gerade die Gelder für die Bewältigung der Phase 3 gesichert. Ursprünglich war Redectane zur Bilddiagnostik beim Nierenzellkarzinom vorgesehen. Wilex gab den Peak sales in dieser Indikation von etwa 100 Millionen € an. Weiterhin soll Redectane zu therapeutischen Zwecken entwickelt werden. Außerdem wird eine Indikationserweiterung in weitere Anwendungen diskutiert.
Auch eine weitere Auslizensierung seitens Telix, dem Lizenzpartner von Heidelberg Pharma wird thematisiert. Der Studienstart in der therapeutischen Anwendung sowie für die bildgebende Anwendung ist laut Telix in ca 3-4 Monaten geplant. Die Dauer dürfte etwa 15 Monate bis zum Ende der Rekrutierung sein. Danach dann die Auswertung und das übliche Procedere bis zur Zulassung. Heidelberg Pharma erhält neben Milestones beträchtliche Umsatzbeteiligungen aus der Rectaneanwendung. In der ersten Indikation beim Nierenzelkazinom wären es mittelfristig ca 25-30% von etwa 100 Millionen Umsatz. Dazu dann in der Folge etwa 5% für die therapeutische Anwendung. Das Umsatzvolumen ist mir hier unbekannt. Langfristig soll aber noch eine Indikationserweiterung von Redectane gemacht werden, so dass "langfristig" von eine Verdreifachung des Umsatzes von Redectane möglich wäre. Im Erfolgsfall wären das für Heidelberg Pharma ca 30 Millionen €. Sehr langfristig wären bis zu 100 Millionen Umsatzbeteiligungen möglich, wenn in alle Indikationen erweitert wird. Dies kurz zu Redectane,
die wohl mit einer großen Wahrscheinlichkeit diesen Erfolg verbuchen können.
Jetzt zu der ATAC Pipeline. Das ist eigentlich das Hauptgebiet von Heidelberg Pharma. In Partnerschaften, aber auch in Eigenregie wird diese Pipeline entwickelt. Natürlich kann ich selber wenig zu den Erfolgsaussichten sagen. Doch gibt es einige Hinweise, dass dies klappen könnte. Erstmal die Partnerschaften mit MabVax, Nordic Nanovector und natürlich der Optionsdeal mit Takeda mit einem Volumen von über 300 Millionen €. Dann die Möglichkeit weiterer Partnerschaften. Eine erste Antwort darauf werden wir in ca 3 Jahren haben, wenn die Ergebnisse von HDP-101 vorliegen. Parallel dazu entwickelt man die restliche Pipeline weiter. Aber in diesen drei Jahren haben wir auch eine Optionsentscheidung von Takeda und im Erfolgsfall die Zulassung von Redectane. Diese Gesamtbetrachtung und die augenblickliche Finanzlage mit Geld für ca 3 Jahre ohne weitere Vertragsabschlüsse waren hauptsächlich meine Argumente für dieses Investment. Ich bin selber kein Fachmann, was medzinisches Fachwissen betrifft. Ich muß also andere Aussagen und Hinweise nehmen. z.Bsp, dass alle drei angesprochen Ziele von der eigenen Pipeline Heidelberg Pharma im Mittelpunkt der Diskussion stehen. Das ist meine Rangehensweise, um so meine Defizite im medizinischen Wissen abzumildern. Dies meine Sicht zu Heidelberg Pharma.
Meine Sicht
Ich beschäftige mich seit etwa 10 Jahren mit deutschen Biotechwerten und versuche hier durch Beobachtungen Erkenntnisse für mich zu gewinnen und entsprechend zu agieren. Die deutschen Biotechwerte haben in den ersten 9 Monaten ca 60% zugelegt und korrigieren nun heftig bis auf heute ca 40%. Meine Aufgabe besteht nun darin trotz der Korrektur die Favoriten herauszufiltern. Und dabei bot sich Heidelberg Pharma an. Ich selber bin vor ca 4 Wochen mit 4 Werten auf den NBI ausgewichen, da sie nach der Korrektur vor ca 2 Jahren in diesem Jahr "nur" bis heute ca 16% zugelegt haben. Hier sehe ich nicht ein so großes Korrekturpotential. Deshalb habe ich die NBI Werte bevorzugt. Zu den Motiven von Heidelberg Pharma. Heidelberg Pharma besteht hauptsächlich aus den drei folgenden Wirkstoffen oder Wirkstoffgruppen.
Das sind erst mal Mesupron, dem ich erst mal nicht so große Chancen einräume, da der Lizenznehmer im Augenblick finanziell nicht in der Lage ist die Entwicklung voranzutreiben.
Ein sehr aussichtsreicher Kandidat aus dem Wilex Erbe aber ist Redectane. Der Partner Telix aus Australien hat sich gerade die Gelder für die Bewältigung der Phase 3 gesichert. Ursprünglich war Redectane zur Bilddiagnostik beim Nierenzellkarzinom vorgesehen. Wilex gab den Peak sales in dieser Indikation von etwa 100 Millionen € an. Weiterhin soll Redectane zu therapeutischen Zwecken entwickelt werden. Außerdem wird eine Indikationserweiterung in weitere Anwendungen diskutiert.
Auch eine weitere Auslizensierung seitens Telix, dem Lizenzpartner von Heidelberg Pharma wird thematisiert. Der Studienstart in der therapeutischen Anwendung sowie für die bildgebende Anwendung ist laut Telix in ca 3-4 Monaten geplant. Die Dauer dürfte etwa 15 Monate bis zum Ende der Rekrutierung sein. Danach dann die Auswertung und das übliche Procedere bis zur Zulassung. Heidelberg Pharma erhält neben Milestones beträchtliche Umsatzbeteiligungen aus der Rectaneanwendung. In der ersten Indikation beim Nierenzelkazinom wären es mittelfristig ca 25-30% von etwa 100 Millionen Umsatz. Dazu dann in der Folge etwa 5% für die therapeutische Anwendung. Das Umsatzvolumen ist mir hier unbekannt. Langfristig soll aber noch eine Indikationserweiterung von Redectane gemacht werden, so dass "langfristig" von eine Verdreifachung des Umsatzes von Redectane möglich wäre. Im Erfolgsfall wären das für Heidelberg Pharma ca 30 Millionen €. Sehr langfristig wären bis zu 100 Millionen Umsatzbeteiligungen möglich, wenn in alle Indikationen erweitert wird. Dies kurz zu Redectane,
die wohl mit einer großen Wahrscheinlichkeit diesen Erfolg verbuchen können.
Jetzt zu der ATAC Pipeline. Das ist eigentlich das Hauptgebiet von Heidelberg Pharma. In Partnerschaften, aber auch in Eigenregie wird diese Pipeline entwickelt. Natürlich kann ich selber wenig zu den Erfolgsaussichten sagen. Doch gibt es einige Hinweise, dass dies klappen könnte. Erstmal die Partnerschaften mit MabVax, Nordic Nanovector und natürlich der Optionsdeal mit Takeda mit einem Volumen von über 300 Millionen €. Dann die Möglichkeit weiterer Partnerschaften. Eine erste Antwort darauf werden wir in ca 3 Jahren haben, wenn die Ergebnisse von HDP-101 vorliegen. Parallel dazu entwickelt man die restliche Pipeline weiter. Aber in diesen drei Jahren haben wir auch eine Optionsentscheidung von Takeda und im Erfolgsfall die Zulassung von Redectane. Diese Gesamtbetrachtung und die augenblickliche Finanzlage mit Geld für ca 3 Jahre ohne weitere Vertragsabschlüsse waren hauptsächlich meine Argumente für dieses Investment. Ich bin selber kein Fachmann, was medzinisches Fachwissen betrifft. Ich muß also andere Aussagen und Hinweise nehmen. z.Bsp, dass alle drei angesprochen Ziele von der eigenen Pipeline Heidelberg Pharma im Mittelpunkt der Diskussion stehen. Das ist meine Rangehensweise, um so meine Defizite im medizinischen Wissen abzumildern. Dies meine Sicht zu Heidelberg Pharma.
Antwort auf Beitrag Nr.: 56.382.316 von BICYPAPA am 06.12.17 21:08:13
Meldung:
news.iguana2.com/macquaries/ASX/TLX/484686
Telix Pharmaceuticals and JFE Announce Japanese Radiopharmaceutical Manufacturing Partnership
Melbourne (Australia) and Tokyo (Japan) – 13th December 2017. Telix Pharmaceuticals Limited (ASX.TLX) (“Telix”, the “Company”), an Australian biopharmaceutical company focused on the development of diagnostic and therapeutic products based on targeted radiopharmaceuticals or “molecularly-targeted radiation” (“MTR”), has today announced a manufacturing partnership with JFE Engineering Corporation (“JFE”). JFE is an engineering and manufacturing company with extensive expertise in the installation of cyclotron infrastructure and radiopharmaceutical manufacturing in Japan. JFE has recently installed a new IBA Cyclone® 18 MeV Cyclotron at its Yokohama (Kanagawa) facility and is preparing for beam activation and 89Zr (Zirconium) production in early 2018, representing the first commercial production in Japan. Importation of radioactive isotopes into Japan is typically very challenging and therefore the prospect of domestic production of new medical isotopes has generated significant clinical interest in novel imaging and therapeutic radiopharmaceuticals. Telix Co-Founder and CEO Christian Behrenbruch stated, “Telix has an extensive commitment to 89Zr isotope in our diagnostic imaging portfolio, particularly for TLX-250 imaging (89Zrgirentuximab), our lead program. Japan generally represents potentially the second largest market for our imaging products after the United States and this agreement with JFE paves the way to making our products available to Japanese cancer patients. JFE’s tremendous experience and operational capability is a real asset to our commercial plans in Japan.” The agreement is an exclusive agreement that initially focuses on technology transfer and feasibility assessment for producing TLX-250 for the Japanese market. The parties intend to work together to conduct initial pilot studies at several key Japanese nuclear medicine centres, as well as engage with the Pharmaceuticals and Medical Devices Agency (PMDA) in relation to obtaining advice on extending Telix’s clinical development activity in the US and Europe to include Japan. Shigeki Yamazaki, Director of JFE’s Medical Division stated, “We are very pleased to be working in partnership with Telix to develop a manufacturing and market access strategy for Japan. The unique geographical and regulatory requirements of the Japanese radiopharmaceutical industry means that centralized manufacturing of novel radiopharmaceutical products is a significant commercial opportunity that can deliver important benefit to patients.”
Redectane Erweiterung nach Japan
Neues von Telix und Redectane. Geografisch wird das Gebiet jetzt nach Japan ausgeweitet. Die Infrastruktur soll jetzt in Japan geschaffen werden.Meldung:
news.iguana2.com/macquaries/ASX/TLX/484686
Telix Pharmaceuticals and JFE Announce Japanese Radiopharmaceutical Manufacturing Partnership
Melbourne (Australia) and Tokyo (Japan) – 13th December 2017. Telix Pharmaceuticals Limited (ASX.TLX) (“Telix”, the “Company”), an Australian biopharmaceutical company focused on the development of diagnostic and therapeutic products based on targeted radiopharmaceuticals or “molecularly-targeted radiation” (“MTR”), has today announced a manufacturing partnership with JFE Engineering Corporation (“JFE”). JFE is an engineering and manufacturing company with extensive expertise in the installation of cyclotron infrastructure and radiopharmaceutical manufacturing in Japan. JFE has recently installed a new IBA Cyclone® 18 MeV Cyclotron at its Yokohama (Kanagawa) facility and is preparing for beam activation and 89Zr (Zirconium) production in early 2018, representing the first commercial production in Japan. Importation of radioactive isotopes into Japan is typically very challenging and therefore the prospect of domestic production of new medical isotopes has generated significant clinical interest in novel imaging and therapeutic radiopharmaceuticals. Telix Co-Founder and CEO Christian Behrenbruch stated, “Telix has an extensive commitment to 89Zr isotope in our diagnostic imaging portfolio, particularly for TLX-250 imaging (89Zrgirentuximab), our lead program. Japan generally represents potentially the second largest market for our imaging products after the United States and this agreement with JFE paves the way to making our products available to Japanese cancer patients. JFE’s tremendous experience and operational capability is a real asset to our commercial plans in Japan.” The agreement is an exclusive agreement that initially focuses on technology transfer and feasibility assessment for producing TLX-250 for the Japanese market. The parties intend to work together to conduct initial pilot studies at several key Japanese nuclear medicine centres, as well as engage with the Pharmaceuticals and Medical Devices Agency (PMDA) in relation to obtaining advice on extending Telix’s clinical development activity in the US and Europe to include Japan. Shigeki Yamazaki, Director of JFE’s Medical Division stated, “We are very pleased to be working in partnership with Telix to develop a manufacturing and market access strategy for Japan. The unique geographical and regulatory requirements of the Japanese radiopharmaceutical industry means that centralized manufacturing of novel radiopharmaceutical products is a significant commercial opportunity that can deliver important benefit to patients.”
Antwort auf Beitrag Nr.: 56.435.755 von BICYPAPA am 13.12.17 06:46:57
http://www.nordicnanovector.com/sites/default/files/ASH%20Co…
Nordic Nanovector
Heidelberg Pharmas Partner Nordic Nanovector präsentiert Daten von der ASH der BETALUTIN® LYMRIT 37-01 STUDY , die sehr gut ankommen. Mit Nordic Nanovector hat Heidelberg Pharma eine Entwicklungspartnerschaft.http://www.nordicnanovector.com/sites/default/files/ASH%20Co…
Antwort auf Beitrag Nr.: 56.435.755 von BICYPAPA am 13.12.17 06:46:57
Melbourne (Australia) and New York, NY (USA) – 14th December 2017. Telix Pharmaceuticals Limited (ASX.TLX) (“Telix”, the “Company”), an Australian biopharmaceutical company focused on the development of diagnostic and therapeutic products based on targeted radiopharmaceuticals or “molecularly-targeted radiation” (MTR), has today announced a collaboration with Memorial Sloan Kettering Cancer Center (MSK). Telix is developing 89Zr-girentuximab (TLX-250) for the purpose of imaging clear cell renal cell cancer (ccRCC) with Positron Emission Tomography (PET). Under the collaboration, MSK will use TLX-250 as a tool to better manage the therapeutic algorithm for patients with metastatic ccRCC by using imaging to assess early treatment response to standard care drugs (particularly sunitinib and pazopanib). The clinical objective is to use imaging as a precision medicine tool to rapidly determine an optimal therapeutic strategy for the patient. Telix Co-Founder and CEO Dr. Christian Behrenbruch stated, “We believe treatment-response imaging with TLX-250 can fundamentally change the way we cycle patients through tyrosine kinase inhibitors (TKI), mTOR inhibitors and VEGF-targeting drugs to more recently available options such as nivolumab. In doing so, it is hoped that we can do a better job of maximizing therapeutic response for patients with advanced disease.” Dr. Steven M. Larson, Director of the Center for Radioimmunotherapy and Theranostics (CRITT) of the Ludwig Center for Cancer Immunotherapy (LCCI) at MSK noted “The 124I-cG240 antibody, which was the fore-runner of the novel TLX-250 radio-antibody product, was tested in clinical trials which began more than a decade ago here at MSK, in order to meet the unmet need for better diagnosis and therapy planning for renal cancer. The development of 89Zr-girentuximab (TLX250), will bring this program full circle, toward a more nearly optimal PET-based imaging agent”. Dr. Neeta Pandit-Taskar, MSK nuclear medicine physician and Clinical Director, CRITT, added, “We are really excited to be working with Telix on this critically important program. Every day, we strive to find the best solution for how imaging can be used to measure patient response to therapy, since early assessment of treatment response is vitally important for our patients with metastatic kidney cancer.” As part of the collaboration, Telix will fund MSK’s implementation of a new radiochemistry process and will amend the existing study protocol for repeat dosing of 124I-girentuximab to take advantage of the superior sensitivity and specificity of using 89Zr (zirconium) chemistry. It is hoped that the improved 89Zr-radiochemistry will better detect changes in smaller lesions that are often challenging to image with iodine chemistry. Under the terms of the agreement, Telix will provide clinical-grade material to MSK and modest financial support for the radiochemistry upgrade. The agreement includes clinical data sharing.
Telix Redectane Cooperation
Telix Pharmaceuticals and Memorial Sloan Kettering Cancer Center Announce Renal Cancer Collaboration Melbourne (Australia) and New York, NY (USA) – 14th December 2017. Telix Pharmaceuticals Limited (ASX.TLX) (“Telix”, the “Company”), an Australian biopharmaceutical company focused on the development of diagnostic and therapeutic products based on targeted radiopharmaceuticals or “molecularly-targeted radiation” (MTR), has today announced a collaboration with Memorial Sloan Kettering Cancer Center (MSK). Telix is developing 89Zr-girentuximab (TLX-250) for the purpose of imaging clear cell renal cell cancer (ccRCC) with Positron Emission Tomography (PET). Under the collaboration, MSK will use TLX-250 as a tool to better manage the therapeutic algorithm for patients with metastatic ccRCC by using imaging to assess early treatment response to standard care drugs (particularly sunitinib and pazopanib). The clinical objective is to use imaging as a precision medicine tool to rapidly determine an optimal therapeutic strategy for the patient. Telix Co-Founder and CEO Dr. Christian Behrenbruch stated, “We believe treatment-response imaging with TLX-250 can fundamentally change the way we cycle patients through tyrosine kinase inhibitors (TKI), mTOR inhibitors and VEGF-targeting drugs to more recently available options such as nivolumab. In doing so, it is hoped that we can do a better job of maximizing therapeutic response for patients with advanced disease.” Dr. Steven M. Larson, Director of the Center for Radioimmunotherapy and Theranostics (CRITT) of the Ludwig Center for Cancer Immunotherapy (LCCI) at MSK noted “The 124I-cG240 antibody, which was the fore-runner of the novel TLX-250 radio-antibody product, was tested in clinical trials which began more than a decade ago here at MSK, in order to meet the unmet need for better diagnosis and therapy planning for renal cancer. The development of 89Zr-girentuximab (TLX250), will bring this program full circle, toward a more nearly optimal PET-based imaging agent”. Dr. Neeta Pandit-Taskar, MSK nuclear medicine physician and Clinical Director, CRITT, added, “We are really excited to be working with Telix on this critically important program. Every day, we strive to find the best solution for how imaging can be used to measure patient response to therapy, since early assessment of treatment response is vitally important for our patients with metastatic kidney cancer.” As part of the collaboration, Telix will fund MSK’s implementation of a new radiochemistry process and will amend the existing study protocol for repeat dosing of 124I-girentuximab to take advantage of the superior sensitivity and specificity of using 89Zr (zirconium) chemistry. It is hoped that the improved 89Zr-radiochemistry will better detect changes in smaller lesions that are often challenging to image with iodine chemistry. Under the terms of the agreement, Telix will provide clinical-grade material to MSK and modest financial support for the radiochemistry upgrade. The agreement includes clinical data sharing.
Antwort auf Beitrag Nr.: 56.443.321 von BICYPAPA am 14.12.17 00:16:55
https://clinicaltrials.gov/archive/NCT01762592/2017_12_21
Redectane Studie startet
Die Redectane Phase 3 Studie soll jetzt noch nach neuesten Angaben von Clinical Trials noch dieses Jahr starten. Die Dauer der Rekrutierung soll bis zum 1. Dezember nächsten Jahres gehen. Danach schließt dann die Auswertungsphase an.https://clinicaltrials.gov/archive/NCT01762592/2017_12_21
Antwort auf Beitrag Nr.: 56.541.526 von BICYPAPA am 25.12.17 09:37:35Wäre gut. Aber warum steht da Organisator: Wilex
Antwort auf Beitrag Nr.: 56.541.979 von Mogli3 am 25.12.17 13:06:15
https://clinicaltrials.gov/ct2/results?cond=&term=Girentuxim…
Ich kann aber nicht sagen inwieweit da die Zusammenhänge mit Telix sind. Laut Bericht arbeiten sie mit einigen UNI's und Instituten zusammen. So wie es aussieht sind sie aber jetzt mit der bildgebenden Studien in ca 12 Monaten mit der Rekrutierung durch. Es handelt sich hierbei immerhin um eine zulassungsrelevante Phase 3 Studie, bei der Heidelberg Pharma mit Milestones und attraktiven Umsatzbeteiligungen rechnen kann.
Weil die...
Weil Wilex damals die Phase 3 Studie angemeldet hat. Inzwischen hat aber Telix die Lizenz übernommen. Es laufen sowieso in Holland einige zusätzliche Studien mit Redectane. https://clinicaltrials.gov/ct2/results?cond=&term=Girentuxim…
Ich kann aber nicht sagen inwieweit da die Zusammenhänge mit Telix sind. Laut Bericht arbeiten sie mit einigen UNI's und Instituten zusammen. So wie es aussieht sind sie aber jetzt mit der bildgebenden Studien in ca 12 Monaten mit der Rekrutierung durch. Es handelt sich hierbei immerhin um eine zulassungsrelevante Phase 3 Studie, bei der Heidelberg Pharma mit Milestones und attraktiven Umsatzbeteiligungen rechnen kann.
Antwort auf Beitrag Nr.: 56.542.231 von BICYPAPA am 25.12.17 14:56:52
http://www.deraktionaer.de/aktie/biotech-aktie-heidelberg-ph…
Aktionär Interview mit Heidelberg Pharma
Biotech-Aktie Heidelberg Pharma startet durch: Großes Interview mit dem Vorstand Jan Schmidt-Brandhttp://www.deraktionaer.de/aktie/biotech-aktie-heidelberg-ph…
Antwort auf Beitrag Nr.: 56.573.863 von BICYPAPA am 30.12.17 13:21:28
Auch allen anderen konstruktiven Begleitern wie NewKid, Mogli, etc. Vielen Dank für Eure Beiträge in 2017! Es waren ja einige Unker und Kleingeister hier im HDP Board unterwegs, welche trotz unserer Mühe und warum auch immer die neue HDP Story nicht verstehen wollten / verstanden haben.
Das Jahr 2016/17 war die Transformation unserer alten Wilex in die zukunftsweisende Positionierung und Technologie der neuen HDP. Das Jahr 2018 wird m.E. das Fundament von HDP als innovativer beachtenswerter Player / Börsenwert mit einzigartiger Technologie im ADC Markt bilden (i.w. durch weitere Abschlüsse mit namenhaften Pharma-Adressen, Start der Klinik HDP-101, detaillierte Infos zum eigenen Biomarker, Zwischeninfo zum Fortschritt / Wirkung zum Takeda Deal und einer wirksamen Presse/IR). Parallel werden wir in 2018 zum Fortschritt der auslizensierten Produkte einiges Neues erfahren (mein Hoffnungsträger mit erheblichem finanziellem Potential: Redectane).
Das Interview im Aktionär gibt eine (nur ausschnittsweise) Vorahnung was hier mit HDP noch in den nächsten 3-5 Jahren möglich ist ... wenn sie solange überhaupt als eigenständiges Unternehmen auftreten werden.
Ich glaube wir werden noch viel Freude an unserem "alten" Baby haben
Auf ein gesundes und erfolgreiches Jahr 2018!
Ein guter Abschluss von 2017 und prima Ausblick auf 2018 ff
Vielen Dank für Deine umfassende Recherche und Dein steht's wachsames Auge auf alles was sich mit, für und um Heidelberg Pharma dreht! Ich habe alle Beiträge steht's sehr aufmerksam gelesen ... Bitte weiter so 
Auch allen anderen konstruktiven Begleitern wie NewKid, Mogli, etc. Vielen Dank für Eure Beiträge in 2017! Es waren ja einige Unker und Kleingeister hier im HDP Board unterwegs, welche trotz unserer Mühe und warum auch immer die neue HDP Story nicht verstehen wollten / verstanden haben.

Das Jahr 2016/17 war die Transformation unserer alten Wilex in die zukunftsweisende Positionierung und Technologie der neuen HDP. Das Jahr 2018 wird m.E. das Fundament von HDP als innovativer beachtenswerter Player / Börsenwert mit einzigartiger Technologie im ADC Markt bilden (i.w. durch weitere Abschlüsse mit namenhaften Pharma-Adressen, Start der Klinik HDP-101, detaillierte Infos zum eigenen Biomarker, Zwischeninfo zum Fortschritt / Wirkung zum Takeda Deal und einer wirksamen Presse/IR). Parallel werden wir in 2018 zum Fortschritt der auslizensierten Produkte einiges Neues erfahren (mein Hoffnungsträger mit erheblichem finanziellem Potential: Redectane).
Das Interview im Aktionär gibt eine (nur ausschnittsweise) Vorahnung was hier mit HDP noch in den nächsten 3-5 Jahren möglich ist ... wenn sie solange überhaupt als eigenständiges Unternehmen auftreten werden.

Ich glaube wir werden noch viel Freude an unserem "alten" Baby haben

Auf ein gesundes und erfolgreiches Jahr 2018!
Antwort auf Beitrag Nr.: 56.575.321 von behavior am 30.12.17 17:59:53Genau so wird es mit noch einiger Geduld kommen. Nach positvem Abschluss der Studie HDP-101 wird HDP stark übernahmegefährdet sein. Für einen anständigen Kurs haben wir ja dann Hopp! Ein gutes Neues und Gruss aus heute Lüderitz/ Namibia.
Antwort auf Beitrag Nr.: 56.573.863 von BICYPAPA am 30.12.17 13:21:28
http://files.shareholder.com/downloads/AMDA-1C0OBF/543735449…
Man ist auf der Suche nach der optimalen Indikation und Kombination mit anderen Wirkstoffen. Redhill ist wohl nicht mit sehr viel Geld gesegnet, so dass meine Hoffnung noch sehr gedämpft ist, zumal sie erst vor kurzem eine andere Studie vorgezogen haben. Einfach mal schauen wie sich die Sache mit Mesupron entwickelt.
Auch von LinkHealth, dem Mesupron Partner aus China hab ich nichts neues entdecken können.
Mesupron Redhill
In der Präsentation von Redhill taucht das auslizensierte Mesupron ( Upamostat ) wieder auf. http://files.shareholder.com/downloads/AMDA-1C0OBF/543735449…
Man ist auf der Suche nach der optimalen Indikation und Kombination mit anderen Wirkstoffen. Redhill ist wohl nicht mit sehr viel Geld gesegnet, so dass meine Hoffnung noch sehr gedämpft ist, zumal sie erst vor kurzem eine andere Studie vorgezogen haben. Einfach mal schauen wie sich die Sache mit Mesupron entwickelt.
Auch von LinkHealth, dem Mesupron Partner aus China hab ich nichts neues entdecken können.
Antwort auf Beitrag Nr.: 56.611.445 von BICYPAPA am 04.01.18 11:35:40
Since the inception of the partnership, activities have been centered on antibody-amanitin conjugates that are produced using controlled conjugation methods and possess high target-specific cytotoxic potency. The companies have successfully demonstrated the generation of ATACs using APC's proprietary protein modification technology.
"In a first step, we have succeeded in producing ADCs that are sufficiently cytotoxic to target-expressing cancer cell lines to proceed to the next level of in vivo testing. Results obtained from this collaboration will help us to increase the efficacy of our ATACs", commented Professor Andreas Pahl, CSO of Heidelberg Pharma.
"We are delighted that the partnership with Heidelberg Pharma has generated positive results and look forward to continuing our work together, to the benefit of both companies", commented Randal Chase, CEO of Advanced Proteome Therapeutics.
APC's technology aims at the coupling of a cytotoxic payload site-selectively to an antibody of interest without the necessity of genetically engineering such antibody. This may lead to more homogeneous products with certain additional advantages such as an increase in stability in the circulation, fewer side effects and facilitating further pre-clinical and clinical drug development.
About Advanced Proteome Therapeutics
Advanced Proteome Therapeutics Corporation (APC) (TSX VENTURE: APC) (FRANKFURT: 0E8) is developing a proprietary technology to directly target cancerous tumors and avoid destroying normal cells. This type of agent is capable of greater potency, higher specificity, and lower toxicity than other therapies that can also attack healthy cells. Advanced Proteome is working to streamline the process by which these agents are prepared, which to date, has been extremely cumbersome, limiting their potential. www.advancedproteome.com
Kooperationn mit Proteome Therapeutics Corporatio
Advanced Proteome Therapeutics Corporation (APC), a therapeutics discovery and development company, and Heidelberg Pharma announced today advances in their collaborative activities. The companies have agreed to test the combination of APC's proprietary site-selective protein modification technology and Heidelberg Pharma's proprietary ATAC technology in order to generate superior cancer therapeutics. Since the inception of the partnership, activities have been centered on antibody-amanitin conjugates that are produced using controlled conjugation methods and possess high target-specific cytotoxic potency. The companies have successfully demonstrated the generation of ATACs using APC's proprietary protein modification technology.
"In a first step, we have succeeded in producing ADCs that are sufficiently cytotoxic to target-expressing cancer cell lines to proceed to the next level of in vivo testing. Results obtained from this collaboration will help us to increase the efficacy of our ATACs", commented Professor Andreas Pahl, CSO of Heidelberg Pharma.
"We are delighted that the partnership with Heidelberg Pharma has generated positive results and look forward to continuing our work together, to the benefit of both companies", commented Randal Chase, CEO of Advanced Proteome Therapeutics.
APC's technology aims at the coupling of a cytotoxic payload site-selectively to an antibody of interest without the necessity of genetically engineering such antibody. This may lead to more homogeneous products with certain additional advantages such as an increase in stability in the circulation, fewer side effects and facilitating further pre-clinical and clinical drug development.
About Advanced Proteome Therapeutics
Advanced Proteome Therapeutics Corporation (APC) (TSX VENTURE: APC) (FRANKFURT: 0E8) is developing a proprietary technology to directly target cancerous tumors and avoid destroying normal cells. This type of agent is capable of greater potency, higher specificity, and lower toxicity than other therapies that can also attack healthy cells. Advanced Proteome is working to streamline the process by which these agents are prepared, which to date, has been extremely cumbersome, limiting their potential. www.advancedproteome.com
Antwort auf Beitrag Nr.: 56.650.358 von BICYPAPA am 08.01.18 14:38:19
Seit Beginn der Partnerschaft konzentrierten sich die Aktivitäten auf Antikörper-Amanitin-Konjugate, die unter Verwendung von kontrollierten Konjugationsverfahren hergestellt werden und eine hohe zielspezifische cytotoxische Potenz besitzen. Die Unternehmen haben die Generierung von ATACs mithilfe der proprietären Proteinmodifikationstechnologie von APC erfolgreich demonstriert.
"In einem ersten Schritt ist es uns gelungen, ADCs zu produzieren, die für Ziel-exprimierende Krebszelllinien ausreichend cytotoxisch sind, um zur nächsten Stufe der in vivo-Tests überzugehen. Die Ergebnisse dieser Zusammenarbeit werden uns helfen, die Wirksamkeit unserer ATACs zu erhöhen." , kommentiert Professor Andreas Pahl, CSO von Heidelberg Pharma.
"Wir freuen uns, dass die Partnerschaft mit Heidelberg Pharma zu positiven Ergebnissen geführt hat und wir freuen uns darauf, unsere Arbeit zum Wohle beider Unternehmen fortzusetzen", kommentierte Randal Chase, CEO von Advanced Proteome Therapeutics.
Die APC-Technologie zielt darauf ab, eine zytotoxische Nutzlast ortsselektiv an einen Antikörper von Interesse zu koppeln, ohne dass ein solcher Antikörper genetisch manipuliert werden muss. Dies kann zu homogeneren Produkten mit bestimmten zusätzlichen Vorteilen führen, wie z. B. einer Erhöhung der Kreislaufstabilität, weniger Nebenwirkungen und Erleichterung der weiteren präklinischen und klinischen Arzneimittelentwicklung.
Über Advanced Proteome Therapeutics
Die Advanced Proteome Therapeutics Corporation (APC) (TSX VENTURE: APC) (FRANKFURT: 0E8) entwickelt eine firmeneigene Technologie zur direkten Bekämpfung von Krebstumoren und zur Vermeidung der Zerstörung normaler Zellen. Diese Art von Mittel ist zu größerer Wirksamkeit, höherer Spezifität und geringerer Toxizität fähig als andere Therapien, die auch gesunde Zellen angreifen können. Advanced Proteome arbeitet daran, den Prozess zu beschleunigen, mit dem diese Wirkstoffe hergestellt werden, was bisher äußerst umständlich war und ihr Potenzial begrenzt hat. www.advancedproteome.com
Advanced Proteome Therapeutics
Die Advanced Proteome Therapeutics Corporation (APC), ein Unternehmen für die Entdeckung und Entwicklung von Therapeutika, und Heidelberg Pharma haben heute Fortschritte in ihrer Zusammenarbeit bekannt gegeben. Die Unternehmen haben zugestimmt, die Kombination von APCs proprietärer ortsselektiver Proteinmodifikationstechnologie und der proprietären ATAC-Technologie von Heidelberg Pharma zu testen, um überlegene Krebstherapeutika zu entwickeln.Seit Beginn der Partnerschaft konzentrierten sich die Aktivitäten auf Antikörper-Amanitin-Konjugate, die unter Verwendung von kontrollierten Konjugationsverfahren hergestellt werden und eine hohe zielspezifische cytotoxische Potenz besitzen. Die Unternehmen haben die Generierung von ATACs mithilfe der proprietären Proteinmodifikationstechnologie von APC erfolgreich demonstriert.
"In einem ersten Schritt ist es uns gelungen, ADCs zu produzieren, die für Ziel-exprimierende Krebszelllinien ausreichend cytotoxisch sind, um zur nächsten Stufe der in vivo-Tests überzugehen. Die Ergebnisse dieser Zusammenarbeit werden uns helfen, die Wirksamkeit unserer ATACs zu erhöhen." , kommentiert Professor Andreas Pahl, CSO von Heidelberg Pharma.
"Wir freuen uns, dass die Partnerschaft mit Heidelberg Pharma zu positiven Ergebnissen geführt hat und wir freuen uns darauf, unsere Arbeit zum Wohle beider Unternehmen fortzusetzen", kommentierte Randal Chase, CEO von Advanced Proteome Therapeutics.
Die APC-Technologie zielt darauf ab, eine zytotoxische Nutzlast ortsselektiv an einen Antikörper von Interesse zu koppeln, ohne dass ein solcher Antikörper genetisch manipuliert werden muss. Dies kann zu homogeneren Produkten mit bestimmten zusätzlichen Vorteilen führen, wie z. B. einer Erhöhung der Kreislaufstabilität, weniger Nebenwirkungen und Erleichterung der weiteren präklinischen und klinischen Arzneimittelentwicklung.
Über Advanced Proteome Therapeutics
Die Advanced Proteome Therapeutics Corporation (APC) (TSX VENTURE: APC) (FRANKFURT: 0E8) entwickelt eine firmeneigene Technologie zur direkten Bekämpfung von Krebstumoren und zur Vermeidung der Zerstörung normaler Zellen. Diese Art von Mittel ist zu größerer Wirksamkeit, höherer Spezifität und geringerer Toxizität fähig als andere Therapien, die auch gesunde Zellen angreifen können. Advanced Proteome arbeitet daran, den Prozess zu beschleunigen, mit dem diese Wirkstoffe hergestellt werden, was bisher äußerst umständlich war und ihr Potenzial begrenzt hat. www.advancedproteome.com
Antwort auf Beitrag Nr.: 56.650.568 von BICYPAPA am 08.01.18 14:56:52
Die deutsche Biotechgesellschaft Heidelberg Pharma (frühere Wilex) befindet sich weiter auf Kurs. Das Unternehmen konnte zuletzt Fortschritte aus der Zusammenarbeit mit Advanced Proteome Therapeutics (APC), ein Forschungs- und Entwicklungsunternehmen für Therapeutika, melden. Die Unternehmen testen die Kombination von APCs firmeneigener Technologie zur orts-spezifischen Proteinmodifikation und Heidelberg Pharmas proprietärer ATAC-Technologie, um Krebstherapeutika mit verbesserten Eigenschaften zu entwickeln.
Gesamter Artikel http://www.deraktionaer.de/aktie/heidelberg-pharma---der-neu…
Aktionär Artikel
Heidelberg Pharma – der neue deutsche Biotech-Star?Die deutsche Biotechgesellschaft Heidelberg Pharma (frühere Wilex) befindet sich weiter auf Kurs. Das Unternehmen konnte zuletzt Fortschritte aus der Zusammenarbeit mit Advanced Proteome Therapeutics (APC), ein Forschungs- und Entwicklungsunternehmen für Therapeutika, melden. Die Unternehmen testen die Kombination von APCs firmeneigener Technologie zur orts-spezifischen Proteinmodifikation und Heidelberg Pharmas proprietärer ATAC-Technologie, um Krebstherapeutika mit verbesserten Eigenschaften zu entwickeln.
Gesamter Artikel http://www.deraktionaer.de/aktie/heidelberg-pharma---der-neu…
Antwort auf Beitrag Nr.: 56.650.358 von BICYPAPA am 08.01.18 14:38:19
klar, die Nachricht ist positiv aber nicht vergleichbar mit einer Takeda Optionsausuebung. Nicht destotrotz, was erfahren wir im Detail und was bedeutet es ? Hier der wichtige Abschnitt aus der Meldung: "APCs Technologie ist auf die Kopplung eines zytotoxischen Wirkstoffes an einen orts-selektiven Antikörper gerichtet, jedoch ohne den Antikörper gentechnisch verändern zu müssen. Dieses Vorgehen könnte zu homogeneren Produkten mit weiteren Vorteilen wie einer verbesserten Stabilität der Zirkulation, geringeren Nebenwirkungen und erleichterter präklinischer und klinischer Entwicklung führen." Der erste Punkt ist enorm wichtig, weil damit alle Original Antikoerper zum ATAC aufwegertet werden koennen OHNE das Produkstionsverfahren zu veraendern und validieren zu muessen (kostet viel Zeit und viel Geld, eigentlich eine Huerde die die meisten Kandidaten von vornerein abschreckt) Und genau daran arbeiten HP und APC. Ein Beweis dazu ist in dem am 20. Dezember veroeffentlichten Quartalsberricht von APC zu finden. (Seite 13 und 14) Summary of R&D activities during the three months ended October 31, 2017 During the three months ended October 31, 2017, Advanced Proteome Therapeutics implemented its four cardinal objectives (italicized) of improving the stability of conjugates and their purity by forging strong bonds at select sites along the antibody surface; the same reactive handle could be linked to a site common to antibodies rendering the technology both versatile as well as potentially universal. Achievement of these objectives is expected to afford a considerable advantage in the marketplace for antibody-drug conjugates possessing demonstrable cancer cell killing activities. Activities during the three months ended October 31, 2017, were dominated by the preparation and testing of ADCs containing first generation linkers. It is customary to test ADCs in two formats: “noncleavable” linkers, and cleavable linkers. Cleavable linkers are designed chemically to trigger release of the drug or toxin inside the tumor cell, where it is required for efficacy. Such features are lacking in the “non-cleavable linker“, as the drug is “de-conjugated“ as a consequence of cellular processes that split the ADC into many pieces. Tests in the three month period ended July 31, 2017,, of a first generation Trastuzumab-amanitin conjugate with a non-cleavable linker, emerging from our partnership with Heidelberg Pharma, revealed both high affinity and potent cytotoxicity toward cancer cell lines. These encouraging results were followed up in the three months ended October 31, 2017,, with a Trastuzumab amanitin conjugate containing a cleavable linker, that was expected to display greater cytotoxicity (potency). Indeed, the latter showed much greater cytotoxicity toward the three lines of cancer cells tested, comparable to an ADC regarded as a gold standard in the field. HP hatte in den letzten 2 Jahren tolle pre-klinische Daten mit HER2 Amanitin Thiomabs praesentiert aber diese masgeschneiderte Konstrukten sind kommerziel nicht tragbar. Mit der APC Technologie sieht es jetzt ganz anders aus. Und zur Erinnerrung, Trastuzumab (Herceptin) wurde 1998 zugelassen, dass heisst, das HP unabhaengig von Roche und basierend auf einem Herceptin Biosimilar, schnell und kostenguenstig ein Konkurrenzprodukt zu TDM1 (=Roche HER2 ADC) entwickeln kann. Und dazu noch ein ungleich besseres Produkt !! Ich hatte die letzte Finanzierungsrunde nicht kommentiert, aber es muesste jedem aufgefallen sein, dass man von der Finanzierung am Tropf Abstand genommen hat. Es war die letzte Chance zum Schleuderpreis die Beteiligung zu maximieren, und die hat Hopp voll ausgenutzt. Rien ne va plus, les jeux sont faits.
Heidelberg Pharma "buy" | wallstreet-online.de - Vollständige Diskussion unter:
https://www.wallstreet-online.de/diskussion/1136347-neustebe…
Kopie von NewKidOntheBlock
Folgenden Beitrag kopiere ich aus dem Parallelboard. Es ereinfacht mir meine Recherche zu Heidelberg Pharma. Er ist so inhaltreich und wichtig für mich, so dass ich mir diese Kopie erlaube.klar, die Nachricht ist positiv aber nicht vergleichbar mit einer Takeda Optionsausuebung. Nicht destotrotz, was erfahren wir im Detail und was bedeutet es ? Hier der wichtige Abschnitt aus der Meldung: "APCs Technologie ist auf die Kopplung eines zytotoxischen Wirkstoffes an einen orts-selektiven Antikörper gerichtet, jedoch ohne den Antikörper gentechnisch verändern zu müssen. Dieses Vorgehen könnte zu homogeneren Produkten mit weiteren Vorteilen wie einer verbesserten Stabilität der Zirkulation, geringeren Nebenwirkungen und erleichterter präklinischer und klinischer Entwicklung führen." Der erste Punkt ist enorm wichtig, weil damit alle Original Antikoerper zum ATAC aufwegertet werden koennen OHNE das Produkstionsverfahren zu veraendern und validieren zu muessen (kostet viel Zeit und viel Geld, eigentlich eine Huerde die die meisten Kandidaten von vornerein abschreckt) Und genau daran arbeiten HP und APC. Ein Beweis dazu ist in dem am 20. Dezember veroeffentlichten Quartalsberricht von APC zu finden. (Seite 13 und 14) Summary of R&D activities during the three months ended October 31, 2017 During the three months ended October 31, 2017, Advanced Proteome Therapeutics implemented its four cardinal objectives (italicized) of improving the stability of conjugates and their purity by forging strong bonds at select sites along the antibody surface; the same reactive handle could be linked to a site common to antibodies rendering the technology both versatile as well as potentially universal. Achievement of these objectives is expected to afford a considerable advantage in the marketplace for antibody-drug conjugates possessing demonstrable cancer cell killing activities. Activities during the three months ended October 31, 2017, were dominated by the preparation and testing of ADCs containing first generation linkers. It is customary to test ADCs in two formats: “noncleavable” linkers, and cleavable linkers. Cleavable linkers are designed chemically to trigger release of the drug or toxin inside the tumor cell, where it is required for efficacy. Such features are lacking in the “non-cleavable linker“, as the drug is “de-conjugated“ as a consequence of cellular processes that split the ADC into many pieces. Tests in the three month period ended July 31, 2017,, of a first generation Trastuzumab-amanitin conjugate with a non-cleavable linker, emerging from our partnership with Heidelberg Pharma, revealed both high affinity and potent cytotoxicity toward cancer cell lines. These encouraging results were followed up in the three months ended October 31, 2017,, with a Trastuzumab amanitin conjugate containing a cleavable linker, that was expected to display greater cytotoxicity (potency). Indeed, the latter showed much greater cytotoxicity toward the three lines of cancer cells tested, comparable to an ADC regarded as a gold standard in the field. HP hatte in den letzten 2 Jahren tolle pre-klinische Daten mit HER2 Amanitin Thiomabs praesentiert aber diese masgeschneiderte Konstrukten sind kommerziel nicht tragbar. Mit der APC Technologie sieht es jetzt ganz anders aus. Und zur Erinnerrung, Trastuzumab (Herceptin) wurde 1998 zugelassen, dass heisst, das HP unabhaengig von Roche und basierend auf einem Herceptin Biosimilar, schnell und kostenguenstig ein Konkurrenzprodukt zu TDM1 (=Roche HER2 ADC) entwickeln kann. Und dazu noch ein ungleich besseres Produkt !! Ich hatte die letzte Finanzierungsrunde nicht kommentiert, aber es muesste jedem aufgefallen sein, dass man von der Finanzierung am Tropf Abstand genommen hat. Es war die letzte Chance zum Schleuderpreis die Beteiligung zu maximieren, und die hat Hopp voll ausgenutzt. Rien ne va plus, les jeux sont faits.
Heidelberg Pharma "buy" | wallstreet-online.de - Vollständige Diskussion unter:
https://www.wallstreet-online.de/diskussion/1136347-neustebe…
Antwort auf Beitrag Nr.: 56.681.516 von BICYPAPA am 11.01.18 08:11:11was ist dein Kursziel auf 12 monate gesehen
Antwort auf Beitrag Nr.: 56.704.847 von hahn0203 am 13.01.18 07:10:42
Dann haben wir evtl die Ergebnisse (Studienende)der Redectane Studie.
Dann die Optionsentscheidung von Takeda.
Dann noch neue Partnerschaften und oder Kooperationen.
Es sind ja in der ATAC Pipeline dann fast alles Blockbusterindikationen. Ich sehe Heidelberg Pharma in etwa so wie damals MorphoSys, nur mit dem Vorteil dass sie Redectane fortgeschritten in der Phase 3 haben und die Chance haben ohne weitere Kapitalmaßnahmen ihre Pipeline entwickeln können.
Das Potenzial von dem sie schöpfen können erscheint riesig groß. Die Kompetenz stimmt.
Es dauert bestimmt ein wenig. Sollten die Ergebnisse der Studien die Hoffnungen bestätigen werden sie langfristig auch im ähnlichen Bereich bewertet sein. Bei einem Jahr eine Vorhersage zu machen ist immer sehr schwierig, da man den Newsflow nicht genau vorhersagen kann. Ich bin da aber mit dem Aktionär überein. Es steht eine Neubewertung im mehrfachen Bereich wie die jetzige Bewertung an. Allein Redectane mit seinen Chancen und Entwicklungspotenzial rechtfertigt ja diese Bewertung. Dazu kommen dann alle weiteren Chancen der ATAC Pipeline mit bald unzähligen Blockbusterchancen. Vielleicht ist es noch ein Vorteil, dass sie so früh in der Entwicklung sind.
Sie sind ja gerade mal bei diesem Kurs mit ca 72 Millionen € bewertet. Mit ein wenig wird es dann ein mehrfaches sein. Langfristig sehe ich wie oben beschrieben im Erfolgsfall in etwa die gleichen Chancen wie bei MorphoSys, zudem Heidelberg Pharma mit ihrer einmaligen Behandlungsansatz in den Fokus der großen Pharmafirmen rücken dürften. Sagen wir mal so. Ich würde nicht ein Stück der Aktien abgeben.
Es kommt da auf die Ereignisse an.
Es kommt da ganz entscheidend auf die Nachrichten an.Dann haben wir evtl die Ergebnisse (Studienende)der Redectane Studie.
Dann die Optionsentscheidung von Takeda.
Dann noch neue Partnerschaften und oder Kooperationen.
Es sind ja in der ATAC Pipeline dann fast alles Blockbusterindikationen. Ich sehe Heidelberg Pharma in etwa so wie damals MorphoSys, nur mit dem Vorteil dass sie Redectane fortgeschritten in der Phase 3 haben und die Chance haben ohne weitere Kapitalmaßnahmen ihre Pipeline entwickeln können.
Das Potenzial von dem sie schöpfen können erscheint riesig groß. Die Kompetenz stimmt.
Es dauert bestimmt ein wenig. Sollten die Ergebnisse der Studien die Hoffnungen bestätigen werden sie langfristig auch im ähnlichen Bereich bewertet sein. Bei einem Jahr eine Vorhersage zu machen ist immer sehr schwierig, da man den Newsflow nicht genau vorhersagen kann. Ich bin da aber mit dem Aktionär überein. Es steht eine Neubewertung im mehrfachen Bereich wie die jetzige Bewertung an. Allein Redectane mit seinen Chancen und Entwicklungspotenzial rechtfertigt ja diese Bewertung. Dazu kommen dann alle weiteren Chancen der ATAC Pipeline mit bald unzähligen Blockbusterchancen. Vielleicht ist es noch ein Vorteil, dass sie so früh in der Entwicklung sind.
Sie sind ja gerade mal bei diesem Kurs mit ca 72 Millionen € bewertet. Mit ein wenig wird es dann ein mehrfaches sein. Langfristig sehe ich wie oben beschrieben im Erfolgsfall in etwa die gleichen Chancen wie bei MorphoSys, zudem Heidelberg Pharma mit ihrer einmaligen Behandlungsansatz in den Fokus der großen Pharmafirmen rücken dürften. Sagen wir mal so. Ich würde nicht ein Stück der Aktien abgeben.
Antwort auf Beitrag Nr.: 56.706.209 von BICYPAPA am 13.01.18 11:51:17danke, für das ausführliche Statement, dann werde ich wohl meine Posi noch ein bisschen aufstocken ...
Antwort auf Beitrag Nr.: 56.706.209 von BICYPAPA am 13.01.18 11:51:17
Hier die Meldung noch zur Gebietserweiterung nach Japan.
MELBOURNE, Australia and KYOTO Japan, Jan. 15, 2018 (GLOBE NEWSWIRE) -- Telix Pharmaceuticals Limited (ASX.TLX) (“Telix”, the “Company”), an Australian biopharmaceutical company focused on the development of diagnostic and therapeutic products based on targeted radiopharmaceuticals or “molecularly-targeted radiation” (MTR), has today announced the establishment Telix Pharmaceuticals (Japan) Ltd (“Telix Japan”) and appointment of the first two members of the Japanese leadership team.
Telix Japan is wholly-owned operating subsidiary of Telix Pharmaceuticals Limited. The purpose of the subsidiary is to support the Company’s Japanese clinical and radiopharmaceutical manufacturing activities and to establish a commercial footprint in the Japan, an important market for Telix’s products. To lead the Telix Japan activities, Dr. Shintaro Nishimura and Dr. Takeshi Oka have been appointed as President and Chief Operating Officer, and Chief Medical Officer (Japan), respectively.
Telix Co-Founder and CEO Dr. Christian Behrenbruch stated, “Japan is one of the most important prospective markets for Telix’s products and our activities in Japan covers a range of manufacturing and collaboration activities with leading Japanese clinical sites and biopharmaceutical companies. The Japanese radiopharmaceutical landscape is evolving rapidly, and we are pleased to have been able to hire two extremely high-caliber executives to lead our development and commercial activity.”
Dr. Nishimura stated, “Telix has an exciting commercial opportunity for its products in Japan and Dr. Oka and I are pleased to be leading the Company’s activities in the Japanese market. There is considerable interest in Telix’s oncology pipeline from our top nuclear medicine clinics and we hope to use this interest to obtain the additional data required to meet the marketing authorization requirements of the Pharmaceuticals and Medical Devices Agency (PMDA)1 to make Telix’s technology available to Japanese cancer patients.”
About Telix Pharmaceuticals Limited
Telix is an Australian biopharmaceutical company focused on the development of diagnostic and therapeutic products based on targeted radiopharmaceuticals or molecularly-targeted radiation (MTR). The Company is developing an advanced portfolio of oncology products that address significant unmet medical need in renal, prostate and brain (glioblastoma) cancer. Telix is listed on the Australian Securities Exchange (ASX:TLX).
Telix weitet nach Japan aus.
Vielleicht noch zu den Kurszielen. Deswegen ist es besonders schwer jetzt schon die Kursziele auf ca 12 Monate zu bestimmen. Alleine schon bei Redectane ist der Newsflow zeitmäßig nicht genau zu bestimmen. Er ist sehr positiv, aber wann sie genau eintreffen, das kann man nicht sagen. Es ist sehr gut möglich, das jetzt schon in einem Monat eine Indikationserweiterung und weitere Lizensierungen an Entwicklungspartner anstehen. Es kann aber auch erst in 18 Monaten sein. Die Studien laufen jetzt bald und eigentlich werden jetzt schon die Voraussetzungen für nach der Zulassung geschaffen. Telix geht davon aus, das die Zulassung gelingen wird. Und Heidelberg Pharma wird davon beträchlich profitieren, ohne einen weiteren Cent bei Redectane zu investieren. Wenn alles klappt ist schon Ende diesen Jahres die zulassungsrelevante Studie mit der Rekrutierung beendet. Vielleicht noch zu Redectane. Redectane ist ein Krankenhaus oder Facharztwirkstoff. Es muss kein anderes Produkt vom Markt verdrängen. Es wird zur Diagnostik dringend benötigt. Es wird damit auch innerhalb kürzester Zeit seine optimalen Verkaufszahlen erreichen. Hier die Meldung noch zur Gebietserweiterung nach Japan.
MELBOURNE, Australia and KYOTO Japan, Jan. 15, 2018 (GLOBE NEWSWIRE) -- Telix Pharmaceuticals Limited (ASX.TLX) (“Telix”, the “Company”), an Australian biopharmaceutical company focused on the development of diagnostic and therapeutic products based on targeted radiopharmaceuticals or “molecularly-targeted radiation” (MTR), has today announced the establishment Telix Pharmaceuticals (Japan) Ltd (“Telix Japan”) and appointment of the first two members of the Japanese leadership team.
Telix Japan is wholly-owned operating subsidiary of Telix Pharmaceuticals Limited. The purpose of the subsidiary is to support the Company’s Japanese clinical and radiopharmaceutical manufacturing activities and to establish a commercial footprint in the Japan, an important market for Telix’s products. To lead the Telix Japan activities, Dr. Shintaro Nishimura and Dr. Takeshi Oka have been appointed as President and Chief Operating Officer, and Chief Medical Officer (Japan), respectively.
Telix Co-Founder and CEO Dr. Christian Behrenbruch stated, “Japan is one of the most important prospective markets for Telix’s products and our activities in Japan covers a range of manufacturing and collaboration activities with leading Japanese clinical sites and biopharmaceutical companies. The Japanese radiopharmaceutical landscape is evolving rapidly, and we are pleased to have been able to hire two extremely high-caliber executives to lead our development and commercial activity.”
Dr. Nishimura stated, “Telix has an exciting commercial opportunity for its products in Japan and Dr. Oka and I are pleased to be leading the Company’s activities in the Japanese market. There is considerable interest in Telix’s oncology pipeline from our top nuclear medicine clinics and we hope to use this interest to obtain the additional data required to meet the marketing authorization requirements of the Pharmaceuticals and Medical Devices Agency (PMDA)1 to make Telix’s technology available to Japanese cancer patients.”
About Telix Pharmaceuticals Limited
Telix is an Australian biopharmaceutical company focused on the development of diagnostic and therapeutic products based on targeted radiopharmaceuticals or molecularly-targeted radiation (MTR). The Company is developing an advanced portfolio of oncology products that address significant unmet medical need in renal, prostate and brain (glioblastoma) cancer. Telix is listed on the Australian Securities Exchange (ASX:TLX).
Antwort auf Beitrag Nr.: 56.714.859 von BICYPAPA am 15.01.18 06:17:28
.. die Kursrakete wird ihren Weg in 2018 machen
Der heutige Kursverlauf zeigt auf, dass die nächste Zündung bevorsteht. Pharama und Biotechwerte werden die Renner in 2018 weltweit. Die Übernahmen der letzten Tage zeigen auf, was uns in 2018 bevorsteht.
Antwort auf Beitrag Nr.: 56.714.859 von BICYPAPA am 15.01.18 06:17:28
Despite the great promise of antibody-drug conjugates (ADC) with FDA approval of two ADCs, the blockbuster status of ADCs has been limited by a variety of constraints, not the least of which are heterogeneous mixtures of conjugated products which can negatively impact efficacy and limit therapeutic index. To meet these challenges, in 2017, APC aggressively demonstrated core principles of its antibody technology: (1) site-selective conjugation to improve product homogeneity; (2) surface attachment for chemically-stable conjugates to address the industry's product instability issues; (3) attachment of drug payloads to a conserved site mediated by what is arguably a "universal antibody connector", to which virtually any drug can be attached, streamlining the overall production process.
Whereas most companies in the ADC space utilize labor-intensive technology involving molecular biology and genetic engineering and need to customize their agents for each antigen target, ADC has standardized technology to rapidly facilitate discovery and development, which should position the Company to leapfrog beyond the competition.
These key accomplishments have been manifested in the context of APC's partnerships with (a) Heidelberg Pharma (HDP) involving amanitin, a unique toxin payload that APC has site-selectively linked to a target antibody of mutual interest (Marketwired-January 8, 2018), and (b) the Toronto Recombinant Antibody Centre (TRAC) at the University of Toronto (UT), from which APC has acquired an option to license validated antibody candidates, converted to ADCs by the Company, as potential treatments for cancer (Marketwired-October 19, 2016). In the creation of therapeutically-viable drug conjugates, conjugation (linker) technology plays a pivotal role in defining the properties of the ADC. Indeed, the recent demonstration of superior affinity and potency of an Advanced Proteome ADC, pitted against an industry gold standard in the killing of cancer cell lines, provides a compelling rationale for further development.
As we gather momentum and follow through with next steps in 2018, the Company is poised to obtain several key results from the testing of novel ADCs in animal studies. Technology transfer and scale-up of the conjugation technology by our contractual partners for animal testing of several therapeutically validated antibodies and their evaluation as potential ADC products have begun at the National Research Council of Canada (News releases-July18, 2017; November 20, 2017. These studies bear on the exercise of the aforementioned option). As well, scale-up and animal testing of antibody-amanitin conjugates and their evaluation as potential ADC products are in the offing. Conversations are ongoing with additional academic and commercial partners looking to utilize and evaluate our chemistry technology.
In 2017, it has been particularly gratifying for the Company to establish R&D operations physically in Canada, after being selected as a resident company at JLABS@Toronto. This initiative gives the Company the opportunity for significant partnering and financial incentives on the Canadian scene, which it has successfully attained and continues to vigorously pursue, while synergizing with continuing efforts in the Boston location.
Read more: http://www.digitaljournal.com/pr/3641503#ixzz55pnlSh4p
Meldung von Partner Advanced Proteome Therapeutics
Advanced Proteome Therapeutics Corporation ("APC" or the "Company") (TSX VENTURE: APC) (FRANKFURT: 0E8) announces that during the 2017 calendar year, it has witnessed very significant progress in APC's scientific program that has bolstered opportunities for achieving commercial success. APC realized critical milestones to enable the advancement of its technology to the next level of development, where it has created a high profile showcase for its conjugating technology and has markedly strengthened its competitive edge.Despite the great promise of antibody-drug conjugates (ADC) with FDA approval of two ADCs, the blockbuster status of ADCs has been limited by a variety of constraints, not the least of which are heterogeneous mixtures of conjugated products which can negatively impact efficacy and limit therapeutic index. To meet these challenges, in 2017, APC aggressively demonstrated core principles of its antibody technology: (1) site-selective conjugation to improve product homogeneity; (2) surface attachment for chemically-stable conjugates to address the industry's product instability issues; (3) attachment of drug payloads to a conserved site mediated by what is arguably a "universal antibody connector", to which virtually any drug can be attached, streamlining the overall production process.
Whereas most companies in the ADC space utilize labor-intensive technology involving molecular biology and genetic engineering and need to customize their agents for each antigen target, ADC has standardized technology to rapidly facilitate discovery and development, which should position the Company to leapfrog beyond the competition.
These key accomplishments have been manifested in the context of APC's partnerships with (a) Heidelberg Pharma (HDP) involving amanitin, a unique toxin payload that APC has site-selectively linked to a target antibody of mutual interest (Marketwired-January 8, 2018), and (b) the Toronto Recombinant Antibody Centre (TRAC) at the University of Toronto (UT), from which APC has acquired an option to license validated antibody candidates, converted to ADCs by the Company, as potential treatments for cancer (Marketwired-October 19, 2016). In the creation of therapeutically-viable drug conjugates, conjugation (linker) technology plays a pivotal role in defining the properties of the ADC. Indeed, the recent demonstration of superior affinity and potency of an Advanced Proteome ADC, pitted against an industry gold standard in the killing of cancer cell lines, provides a compelling rationale for further development.
As we gather momentum and follow through with next steps in 2018, the Company is poised to obtain several key results from the testing of novel ADCs in animal studies. Technology transfer and scale-up of the conjugation technology by our contractual partners for animal testing of several therapeutically validated antibodies and their evaluation as potential ADC products have begun at the National Research Council of Canada (News releases-July18, 2017; November 20, 2017. These studies bear on the exercise of the aforementioned option). As well, scale-up and animal testing of antibody-amanitin conjugates and their evaluation as potential ADC products are in the offing. Conversations are ongoing with additional academic and commercial partners looking to utilize and evaluate our chemistry technology.
In 2017, it has been particularly gratifying for the Company to establish R&D operations physically in Canada, after being selected as a resident company at JLABS@Toronto. This initiative gives the Company the opportunity for significant partnering and financial incentives on the Canadian scene, which it has successfully attained and continues to vigorously pursue, while synergizing with continuing efforts in the Boston location.
Read more: http://www.digitaljournal.com/pr/3641503#ixzz55pnlSh4p
Antwort auf Beitrag Nr.: 56.714.859 von BICYPAPA am 15.01.18 06:17:28
http://www.telixpharma.com/investors/asx-announcements/
Telix Redectane TLX250 Update
Telix veröffentlicht heute ein Update von Redectane TLX 250 zu seinem Programm. Ich bitte euch die Einzelheiten der Präsentation im folgenden link zu entnehmen. Redectane wurde von Heidelberg Pharma (Wilex) an Telix auslizensiert.http://www.telixpharma.com/investors/asx-announcements/
Heidelberg Pharma Update
HDP hat gestern ein Update ihrer Unternehmenspräsentation veröffentlicht. Hier der Link:http://heidelberg-pharma.com/files/20180208_HD-Pharma-Compan…
Am 22.03.2018 folgt dann morgens die Veröffentlichung vom Geschäftsbericht 2017 und gleichtägig am Nachmittag die Bilanz-Pressekonferenz und Analystenkonferenz 2018.
Interessant auch die hohe Anzahl an namenhaften Konferenzen und Kongressen an denen HDP alleine von heute an bis zum Juni 2018 plant teilzunehmen ... hier die Übersicht:
12th ODDO BHF GERMAN CONFERENCE, Frankfurt, 21 - 22 February 2018
4th Biologics & Biosimilars, Berlin, 05 - 06 March 2018
BIO-Europe Spring, Amsterdam, 12 - 14 March 2018
8th Annual World ADC Berlin, Berlin, 26 - 28 March 2018
6th Annual Antibodies & Antibody Drug Conjugates (ADCs) conference, London, 09 - 10 April 2018
AACR Annual Meeting 2018, Chicago, 14 – 18 April 2018
Deutsche Biotechnologietage, Berlin, 18 – 19 April 2018
14th Annual PEGS Boston, Boston, 30 April – 04 May 2018
CEO Conference 2018, Boston, 09 – 10 May 2018
Bio€quity Europe, Ghent, 14 - 16 May 2018
ASCO Annual Meeting, Chicago, 01 - 05 June 2018
Es bleibt spannend ...

Antwort auf Beitrag Nr.: 57.087.219 von behavior am 22.02.18 08:38:54
Ich habe mir die Präsentation mal angesehen. Kurz einige Bemerkungen:
Die Schätzung von Peak Sales für HDP-101 in Höhe von 1,8 Mrd. EUR ist unseriös.
Zum einen steht der klinische Nachweis aus, das Heidelbergs ADC-Technik am Menschen überhaupt funktioniert. Zum anderen herrscht um das Target BCMA ein dichtes Gedränge. Nur eine kleine Auswahl an Konkurrenzpräparaten, die BCMA adressieren und im Gegensatz zu HDP-101 bereits in der Klinik sind: AMG402, bb2121, bb21217, GSK2857916, SEA-BCMA, JNJ-6400795, PF-06863135 ... fast jeder große Player hat mindestens ein anti-BCMA-Präparat in der Pipeline. Vor diesem Hintergrund 1,8 Mrd. EUR Peak Sales für HDP-101 zu postulieren, disqualifiziert den Verantwortlichen der Präsentation.
Grundsätzlich macht es Sinn, sich bei der Target-Präselektion zunächst an CAR-T-Therapien zu orientieren. Amatoxin verzeiht keine Fehler, würde ein Target in nennenswertem Umfang von gesundem Gewebe exrimiert, gäbe es ein Unglück. Aus diesem Grund hätte man sich auch die Folie 11 schenken können, HER2 wird man mit ATACs in der Realität nie adressieren können.
In der Übersicht auf Folie 10 vermisse ich Toxine der neuen Generation.
Dass Leute wie Hopp die deutsche Biotech-Szene finanziell unterstützen, ist natürlich positiv. Insoweit wünsche ich Heidelberg Pharma viel Erfolg.
Zitat von behavior: HDP hat gestern ein Update ihrer Unternehmenspräsentation veröffentlicht. Hier der Link:
http://heidelberg-pharma.com/files/20180208_HD-Pharma-Compan…
Ich habe mir die Präsentation mal angesehen. Kurz einige Bemerkungen:
Die Schätzung von Peak Sales für HDP-101 in Höhe von 1,8 Mrd. EUR ist unseriös.
Zum einen steht der klinische Nachweis aus, das Heidelbergs ADC-Technik am Menschen überhaupt funktioniert. Zum anderen herrscht um das Target BCMA ein dichtes Gedränge. Nur eine kleine Auswahl an Konkurrenzpräparaten, die BCMA adressieren und im Gegensatz zu HDP-101 bereits in der Klinik sind: AMG402, bb2121, bb21217, GSK2857916, SEA-BCMA, JNJ-6400795, PF-06863135 ... fast jeder große Player hat mindestens ein anti-BCMA-Präparat in der Pipeline. Vor diesem Hintergrund 1,8 Mrd. EUR Peak Sales für HDP-101 zu postulieren, disqualifiziert den Verantwortlichen der Präsentation.
Grundsätzlich macht es Sinn, sich bei der Target-Präselektion zunächst an CAR-T-Therapien zu orientieren. Amatoxin verzeiht keine Fehler, würde ein Target in nennenswertem Umfang von gesundem Gewebe exrimiert, gäbe es ein Unglück. Aus diesem Grund hätte man sich auch die Folie 11 schenken können, HER2 wird man mit ATACs in der Realität nie adressieren können.
In der Übersicht auf Folie 10 vermisse ich Toxine der neuen Generation.
Dass Leute wie Hopp die deutsche Biotech-Szene finanziell unterstützen, ist natürlich positiv. Insoweit wünsche ich Heidelberg Pharma viel Erfolg.
Antwort auf Beitrag Nr.: 57.101.832 von Joschka Schröder am 23.02.18 13:48:14PS zu Folie 19 unten: Enmab entwickelt keine CAR-T-Therapeutika.
Antwort auf Beitrag Nr.: 57.101.856 von Joschka Schröder am 23.02.18 13:51:29
habe mich vertippt, muss natürlich Engmab heißen
Zitat von Joschka Schröder: PS zu Folie 19 unten: Enmab entwickelt keine CAR-T-Therapeutika.
habe mich vertippt, muss natürlich Engmab heißen
Antwort auf Beitrag Nr.: 57.101.877 von Joschka Schröder am 23.02.18 13:53:13Klingt ja ziemlich pessimistisch. Bin gespannt was Newkid dazu sagt, du hattest ja schon vor Monaten diesbezüglich mit ihm einen Disens. Das der klinische Nachweis fehlt müsste man ja nicht erwähnen, bei einem Kandidaten der noch nicht mal in Phase I steht ist das ja selbstredend. Ob Takeda im Sommer zugreift oder nicht wird die Richtung klären helfen. HDP-101 ist ja nur der Einstieg. Glaube kaum dass HDP so ins Blaue hinein dieses Ziel ausgesucht hat.
Antwort auf Beitrag Nr.: 57.105.417 von Mogli3 am 23.02.18 19:31:40Nein, so ist es nicht, BCMA macht als Target schon Sinn. Unseriös ist Peak Sales-Schätzung.
Antwort auf Beitrag Nr.: 57.106.566 von Joschka Schröder am 23.02.18 21:49:33Da gebe ich dir recht. Aber alle Firmen machen da immer für sie optimale Schätzungen am oberen Rand des theoretisch Möglichen unter optimalsten Bedingungen. Bis das überhaupt relevant wird dauert es noch Jahre und wie dann das Umfeld sein wird weiß ja keiner. Ich glaube bei HDP wissen die das schon. Warum meinst du jetzt doch dass sie den richtigen Weg gehen bei der Auswahl trotz der aufgezeigten Konkurrenzsituation?
Antwort auf Beitrag Nr.: 57.107.709 von Mogli3 am 24.02.18 04:44:22Amanitin lässt einem nicht viele Möglichkeiten. Insoweit ist nachvollziehbar, dass sie sich für BCMA als Target entschieden haben. Ob sich das wirtschaftlich rechnen wird, ist eine andere Frage.
Ein Investment in Heidelberg Pharma ist mit enormen Risiken behaftet. Für mich wäre das Chance-Risiko-Verhältnis jedenfalls nichts.
Ein Investment in Heidelberg Pharma ist mit enormen Risiken behaftet. Für mich wäre das Chance-Risiko-Verhältnis jedenfalls nichts.
Antwort auf Beitrag Nr.: 56.575.321 von behavior am 30.12.17 17:59:53Bitte nicht so hochnäsig (Absatz 2)! Diese Aussage beleidigt Joschka Schröder mit seinen aktuellen Beiträgen. Du blendest das enorme Risiko ja völlig aus. Möge dafür ja nur kein Geld fließen.
Antwort auf Beitrag Nr.: 57.108.582 von Joschka Schröder am 24.02.18 10:41:13Na ja, bei rund 90 Mio Marktbewertung scheint mir doch das Risiko nicht so bedeutend hoch. Biotech ist nun mal per sé risikobehaftet. Nimmt Takeda von den Dreien nur ein Zielmolekül sinkt das wirtschaftliche Risiko beträchtlich. Ich glaube bei der Auswahl des Targets bei HDP-101 geht es der Firma in erster Linie nicht um die Wirtschaftlichkeit bei einer allfälligen Zulassung in einigen Jahren sondern um die Demonstration dass ihre Technologie funktioniert. Geht diese Rechnung auf, dann wird eine Übernahme sehr wahrscheinlich und die Wirtschaftlichkeit von HDP-101 dann eher unwichtig. Auch sind die Chancen auf weitere Partnerschaften in den nächsten Monaten gegeben. Nicht zu vergessen die Entwicklung von Redectane bei Telix. Wäre en schönes Zubrot. Warum du bei der heutigen Börsenbewertung betreffend des Risikos so pessimistisch bist erschliesst sich mir nicht auf den ersten Blick. Aber ich bin hier nicht der Wissenschaftler, so wie du formulierst bist es eher du.
Noch einmal zu HDP-101: Da BCMA außerhalb der B-Zell-Linie von keinem gesunden Gewebe exprimiert wird, gehört es zu den wenigen Targets, die sich für eine Amanitin-Therapie anbieten.
Angesichts des erbarmungslosen Wirkmechanismus des Amanitins ist es besonders wichtig, dass der Linker außerhalb des beabsichtigten Wirkortes stabil bleibt. Andernfalls könnte es trotz (laut Unternehmenspräsentation) geringer Membranpermeabilität zu unschönen Nebenwirkungen durch freigesetztes Toxin kommen.
Zwangsläufige Nebenwirkungen auf die körpereigene Immuglobulinproduktion, die durch das Immunkonjugat verursacht werden, ließen sich hingegen durch vorübergehende IVIG-Substitution leicht beheben.
Unter der Voraussetzung, dass der Linker wie gewünscht funktioniert, würde ich die ADC-Gabe einer CAR-T-Therapie vorziehen, weil sie weit besser steuerbar ist.
Über Chance und Risiko der ATACs wird also insbesondere Heidelbergs Linker-Technologie entscheiden (dass die Partner geeignete Antikörper liefern, die eine ausreichende Bindung und gute Internalisierung des ADCs ermöglichen, setze ich voraus). Um mir ein besseres Bild machen zu können, werde ich heute Abend in den üblichen Patentdatenbanken nach Informationen zu Heidelbergs Linker-Technologie suchen, auf der Unternehmenshomepage habe ich zum Thema leider keine weiterführenden Informationen gefunden. Sollte ich auf der Unternehmenshomepage etwas übersehen haben sollte, wäre ich für einen Hinweis dankbar.
Angesichts des erbarmungslosen Wirkmechanismus des Amanitins ist es besonders wichtig, dass der Linker außerhalb des beabsichtigten Wirkortes stabil bleibt. Andernfalls könnte es trotz (laut Unternehmenspräsentation) geringer Membranpermeabilität zu unschönen Nebenwirkungen durch freigesetztes Toxin kommen.
Zwangsläufige Nebenwirkungen auf die körpereigene Immuglobulinproduktion, die durch das Immunkonjugat verursacht werden, ließen sich hingegen durch vorübergehende IVIG-Substitution leicht beheben.
Unter der Voraussetzung, dass der Linker wie gewünscht funktioniert, würde ich die ADC-Gabe einer CAR-T-Therapie vorziehen, weil sie weit besser steuerbar ist.
Über Chance und Risiko der ATACs wird also insbesondere Heidelbergs Linker-Technologie entscheiden (dass die Partner geeignete Antikörper liefern, die eine ausreichende Bindung und gute Internalisierung des ADCs ermöglichen, setze ich voraus). Um mir ein besseres Bild machen zu können, werde ich heute Abend in den üblichen Patentdatenbanken nach Informationen zu Heidelbergs Linker-Technologie suchen, auf der Unternehmenshomepage habe ich zum Thema leider keine weiterführenden Informationen gefunden. Sollte ich auf der Unternehmenshomepage etwas übersehen haben sollte, wäre ich für einen Hinweis dankbar.
Antwort auf Beitrag Nr.: 57.114.342 von Joschka Schröder am 25.02.18 15:59:02
Bei PSMA (Folie 17 der jüngsten Präsentation) sieht die Situation anders aus. PSMA wird in zahlreichen (gesunden) Geweben gebildet, so z.B. den proximalen Tubuli der Nieren, in Leber, Darm, Gehirn usw., als Target für ATACs ist PSMA deshalb meines Erachtens ungeeignet. Das PSMA-Projekt würde ich einstellen.
Zitat von Joschka Schröder: Noch einmal zu HDP-101: Da BCMA außerhalb der B-Zell-Linie von keinem gesunden Gewebe exprimiert wird, gehört es zu den wenigen Targets, die sich für eine Amanitin-Therapie anbieten.
Bei PSMA (Folie 17 der jüngsten Präsentation) sieht die Situation anders aus. PSMA wird in zahlreichen (gesunden) Geweben gebildet, so z.B. den proximalen Tubuli der Nieren, in Leber, Darm, Gehirn usw., als Target für ATACs ist PSMA deshalb meines Erachtens ungeeignet. Das PSMA-Projekt würde ich einstellen.
Personalie Telix
Odile Jaume to Lead Telix’s European Operations Melbourne (Australia) and Brussels (Belgium) – 1st of March, 2018. Telix Pharmaceuticals Limited (ASX:TLX) (“Telix”, the “Company”), an clinical-stage biopharmaceutical company focused on the development of diagnostic and therapeutic products based on targeted radiopharmaceuticals or “molecularly-targeted radiation” (MTR), has today announced the appointment of Ms. Odile Jaume as President and Chief Operating Officer (COO) of Telix’s European operations.
Telix has established several EU/UK entities as part of delivering the Company’s intellectual property management, clinical operations and manufacturing activities in Europe. Telix is currently executing a significant portfolio of clinical research activities in Europe to support key clinical trials for TLX-250 and TLX-101, as well as indication expansion for Telix’s pipeline.
Telix Co-Founder and CEO Dr. Christian Behrenbruch stated, “It’s my great pleasure to welcome Odile to the team, and for her to take charge of our European operations. Europe has a highly sophisticated nuclear medicine ecosystem that Odile knows very well, and we are pleased to have the benefit of her managerial and business development acumen.”
Based in Brussels, Ms. Jaume’s responsibilities include managing Telix’s collaborative and clinical relationships in Europe, overseeing the Company’s supply-chain and manufacturing platform, and providing business development support for several important pharmaceutical company collaborations. Prior to joining Telix, Ms. Jaume held a variety of senior product management, marketing and commercial roles at Molecubes, Siemens, CTI Molecular Imaging and IBA. Ms. Jaume’s qualifications include an M.Sc in material science from the Université Catholique de Louvain (UCL) and an MBA from the University of Chicago, Booth School of Business.
Ms. Jaume stated, “Over the past 12 months, Telix has undergone enormous activity growth in Europe, both in terms of clinical programs and academic partnerships to further build the future technology platform of the business. In a very short period, Telix has demonstrated they are a formidable player in the global nuclear medicine industry and I am pleased to be joining Chris and the team to lead the company’s European efforts.”
Antwort auf Beitrag Nr.: 57.153.192 von BICYPAPA am 01.03.18 07:58:30
Heidelberg Pharma schließt Lizenzvertrag mit Universität von Texas MD Anderson Cancer Center ab
- Heidelberg Pharma erwirbt exklusive Lizenz von der University of Texas System (MD Anderson) auf Patentrechte für die Diagnose und Behandlung ausgewählter Patientengruppen mit sogenannter RNA Polymerase II-Deletion, auf Basis von gemeinsam mit Heidelberg Pharma generierten Daten
- Präklinische Ergebnisse zeigen in vivo verbesserte Wirksamkeit von Amanitin und Heidelberg Pharmas Antikörper-Amanitin-Konjugaten (ATAC) auf aggressive Tumore mit TP53-Deletion
Ladenburg, 1. März 2018 - Die Heidelberg Pharma AG (FWB:WL6 ) gab heute den Abschluss eines Lizenzvertrags zwischen ihrer Tochtergesellschaft Heidelberg Pharma Research GmbH und der University of Texas System über Patentrechte in Verbindung mit der Diagnostik und Therapie von Patienten mit sogenannter RNA Polymerase II-Deletion bekannt. Gegenstand der Lizenz ist ein von der Universitätsleitung (Board of Regents) der University of Texas System eingereichter Patentantrag, der wichtige Aspekte einer möglichen personalisierten Behandlung von Patienten auf Grundlage der ATAC-Technologie von Heidelberg Pharma erfasst. Das Universitätssystem handelt für das US-Tumorzentrum MD Anderson Cancer Center (MD Anderson).
Heidelberg Pharma entwickelt eine neue Therapie für Krebserkrankungen auf Basis des Wirkstoffs Amanitin. Dieser hat aufgrund seines biologischen Wirkmechanismus (Hemmung der RNA Polymerase II) das Potenzial, besonders gut auf jene Tumoren mit aggressiven Verlaufsformen im Zusammenhang mit einer TP53-Deletion zu wirken. TP53 kodiert für ein Tumorsuppressorprotein und Tumore verlieren häufig eine Kopie des TP53-Gens, was zu einem unkontrollierten Wachstum der Tumorzellen führt. Da damit regelmäßig auch die RNA Polymerase II unterdrückt wird, sind die so veränderten Tumorzellen besonders empfindlich gegen Amanitin und Heidelberg Pharmas Antikörper-Amanitin-Konjugate (ATAC). Die TP53/RNA Polymerase II-Deletion gehört auch zur chromosomalen Deletion von 17p, die häufig in Tumorzellen beobachtet wird und in Verbindung mit aggressiven Tumoren mit schlechter Prognose steht.
Prof. Dr. Andreas Pahl, Vorstand für Forschung & Entwicklung der Heidelberg Pharma AG kommentiert: "Diese exklusive Lizenz erlaubt uns, die wichtigen Ergebnisse aus unserer Forschungsarbeit mit MD Anderson zu verwenden. Damit sind wir jetzt gut aufgestellt, die Entwicklung neuer Krebstherapien auf Basis unserer ATAC-Technologie voranzutreiben. Der nächste Schritt wird die Entwicklung eines Companion Diagnostics sein, um eine TP53/RNA Polymerase ll-Deletion in Patienten zu erkennen und zu quantifizieren. Wir glauben, dass dieser personalisierte Medizin-Ansatz uns zukünftig in die Lage versetzen wird, die Patienten zu identifizieren, die am meisten von der hohen Wirksamkeit der ATACs profitieren können."
Der Patentantrag geht auf die gemeinsam mit MD Anderson im April 2015 in NATURE veröffentlichten Forschungsergebnisse zurück. Heidelberg Pharma hatte aufgrund dieser Arbeiten die Option zur Lizenzierung der Ergebnisse erhalten. Diese Option wurde nun ausgeübt und bildet eine wichtige Grundlage, die einzigartigen Potenziale dieser Therapie zu evaluieren und klinisch zu erproben.
Finanzielle Details des Lizenzvertrags unterliegen der Vertraulichkeit, die Finanzierungsreichweite von Heidelberg Pharma wird dadurch nicht beeinflusst
Lizenzvertrag mit Universität von Texas
Heidelberg Pharma schließt Lizenzvertrag mit Universität von Texas MD Anderson Cancer Center ab
- Heidelberg Pharma erwirbt exklusive Lizenz von der University of Texas System (MD Anderson) auf Patentrechte für die Diagnose und Behandlung ausgewählter Patientengruppen mit sogenannter RNA Polymerase II-Deletion, auf Basis von gemeinsam mit Heidelberg Pharma generierten Daten
- Präklinische Ergebnisse zeigen in vivo verbesserte Wirksamkeit von Amanitin und Heidelberg Pharmas Antikörper-Amanitin-Konjugaten (ATAC) auf aggressive Tumore mit TP53-Deletion
Ladenburg, 1. März 2018 - Die Heidelberg Pharma AG (FWB:WL6 ) gab heute den Abschluss eines Lizenzvertrags zwischen ihrer Tochtergesellschaft Heidelberg Pharma Research GmbH und der University of Texas System über Patentrechte in Verbindung mit der Diagnostik und Therapie von Patienten mit sogenannter RNA Polymerase II-Deletion bekannt. Gegenstand der Lizenz ist ein von der Universitätsleitung (Board of Regents) der University of Texas System eingereichter Patentantrag, der wichtige Aspekte einer möglichen personalisierten Behandlung von Patienten auf Grundlage der ATAC-Technologie von Heidelberg Pharma erfasst. Das Universitätssystem handelt für das US-Tumorzentrum MD Anderson Cancer Center (MD Anderson).
Heidelberg Pharma entwickelt eine neue Therapie für Krebserkrankungen auf Basis des Wirkstoffs Amanitin. Dieser hat aufgrund seines biologischen Wirkmechanismus (Hemmung der RNA Polymerase II) das Potenzial, besonders gut auf jene Tumoren mit aggressiven Verlaufsformen im Zusammenhang mit einer TP53-Deletion zu wirken. TP53 kodiert für ein Tumorsuppressorprotein und Tumore verlieren häufig eine Kopie des TP53-Gens, was zu einem unkontrollierten Wachstum der Tumorzellen führt. Da damit regelmäßig auch die RNA Polymerase II unterdrückt wird, sind die so veränderten Tumorzellen besonders empfindlich gegen Amanitin und Heidelberg Pharmas Antikörper-Amanitin-Konjugate (ATAC). Die TP53/RNA Polymerase II-Deletion gehört auch zur chromosomalen Deletion von 17p, die häufig in Tumorzellen beobachtet wird und in Verbindung mit aggressiven Tumoren mit schlechter Prognose steht.
Prof. Dr. Andreas Pahl, Vorstand für Forschung & Entwicklung der Heidelberg Pharma AG kommentiert: "Diese exklusive Lizenz erlaubt uns, die wichtigen Ergebnisse aus unserer Forschungsarbeit mit MD Anderson zu verwenden. Damit sind wir jetzt gut aufgestellt, die Entwicklung neuer Krebstherapien auf Basis unserer ATAC-Technologie voranzutreiben. Der nächste Schritt wird die Entwicklung eines Companion Diagnostics sein, um eine TP53/RNA Polymerase ll-Deletion in Patienten zu erkennen und zu quantifizieren. Wir glauben, dass dieser personalisierte Medizin-Ansatz uns zukünftig in die Lage versetzen wird, die Patienten zu identifizieren, die am meisten von der hohen Wirksamkeit der ATACs profitieren können."
Der Patentantrag geht auf die gemeinsam mit MD Anderson im April 2015 in NATURE veröffentlichten Forschungsergebnisse zurück. Heidelberg Pharma hatte aufgrund dieser Arbeiten die Option zur Lizenzierung der Ergebnisse erhalten. Diese Option wurde nun ausgeübt und bildet eine wichtige Grundlage, die einzigartigen Potenziale dieser Therapie zu evaluieren und klinisch zu erproben.
Finanzielle Details des Lizenzvertrags unterliegen der Vertraulichkeit, die Finanzierungsreichweite von Heidelberg Pharma wird dadurch nicht beeinflusst
Antwort auf Beitrag Nr.: 57.154.041 von BICYPAPA am 01.03.18 09:09:11
TP53, a well-known tumor suppressor gene, is frequently inactivated by mutation or deletion in a majority of human tumors. A tremendous effort has been made to restore p53 activity in cancer therapies. However, no effective p53-based therapy has been successfully translated into clinical cancer treatment due to the complexity of p53 signaling. Therefore, identification of vulnerabilities conferred by TP53 deletion or mutation is a major challenge to target p53 aberrancy in human cancer. We demonstrate that genomic deletion of TP53 frequently encompasses neighboring essential genes, rendering cancer cells with hemizygous TP53 deletion vulnerable to further suppression of such genes. POLR2A is identified as such a gene that is always co-deleted with TP53 in human cancers. Hemizygous loss of TP53/POLR2A occurs in 53% of colorectal cancers (CRC), 62% of breast cancers, 75% of ovarian cancers, and 41% of pancreatic cancers. POLR2A encodes the largest and catalytic subunit of RNA polymerase II complex. It is specifically inhibited by ?-Amanitin, a cyclic 8-aa peptide toxin found in the death cap mushroom (Amanita phalloides). POLR2A expression levels are tightly correlated with its gene copy numbers in human colorectal cancer (CRC). Suppression of POLR2A selectively inhibits proliferation, survival and tumorigenic potential of CRC cells with hemizygous TP53 loss in a p53- independent manner. Previous clinical applications of ?-Amanitin have been limited due to its liver toxicity. Free ?-Amanitin causes apoptosis and necrosis of hepatocytes by interacting with the hepatocyte-specific transporting protein OATP1B3 (10). However, ?-Amanitin is no longer substrate for OATP1B3 when coupled to antibodies. Therefore, ?-Amanitin-based antibody drug conjugates (ADCs) are highly effective therapeutic agents with significantly reduced toxicity. Our study has shown that low doses of ?-Amanitin-conjugated anti- EpCAM (Epithelial Cell Adhesion Molecule) antibody lead to complete tumor regression in murine models of human CRC with hemizygous deletion of POLR2A. The preclinical studies in this application were recently published in Nature, which provide the foundation for future clinical trials. There is already discussion regarding the potential for initiation of a clinical trial based on our work. We propose that hemizygous deletion of TP53 in human cancers creates a therapeutic window between normal and cancer cells, and that PORL2A is a novel and druggable target in cancers with such genomic alterations.
Public Health Relevance
Hemizygous deletion of the tumor suppressor TP53 gene is a frequent genomic event in human cancers. As a gene essential for cell survival, the POLR2A gene is always co-deleted with TP53 in the cancer cell. In this proposal, we propose that hemizygous deletion of TP53 creates a therapeutic window between normal and cancer cells, and that PORL2A is a novel and druggable target in human cancers with such genomic alterations.
Hintergrundartikel
Hab ich schon mal gepostet. Doch aus aktuellem Anlass.TP53, a well-known tumor suppressor gene, is frequently inactivated by mutation or deletion in a majority of human tumors. A tremendous effort has been made to restore p53 activity in cancer therapies. However, no effective p53-based therapy has been successfully translated into clinical cancer treatment due to the complexity of p53 signaling. Therefore, identification of vulnerabilities conferred by TP53 deletion or mutation is a major challenge to target p53 aberrancy in human cancer. We demonstrate that genomic deletion of TP53 frequently encompasses neighboring essential genes, rendering cancer cells with hemizygous TP53 deletion vulnerable to further suppression of such genes. POLR2A is identified as such a gene that is always co-deleted with TP53 in human cancers. Hemizygous loss of TP53/POLR2A occurs in 53% of colorectal cancers (CRC), 62% of breast cancers, 75% of ovarian cancers, and 41% of pancreatic cancers. POLR2A encodes the largest and catalytic subunit of RNA polymerase II complex. It is specifically inhibited by ?-Amanitin, a cyclic 8-aa peptide toxin found in the death cap mushroom (Amanita phalloides). POLR2A expression levels are tightly correlated with its gene copy numbers in human colorectal cancer (CRC). Suppression of POLR2A selectively inhibits proliferation, survival and tumorigenic potential of CRC cells with hemizygous TP53 loss in a p53- independent manner. Previous clinical applications of ?-Amanitin have been limited due to its liver toxicity. Free ?-Amanitin causes apoptosis and necrosis of hepatocytes by interacting with the hepatocyte-specific transporting protein OATP1B3 (10). However, ?-Amanitin is no longer substrate for OATP1B3 when coupled to antibodies. Therefore, ?-Amanitin-based antibody drug conjugates (ADCs) are highly effective therapeutic agents with significantly reduced toxicity. Our study has shown that low doses of ?-Amanitin-conjugated anti- EpCAM (Epithelial Cell Adhesion Molecule) antibody lead to complete tumor regression in murine models of human CRC with hemizygous deletion of POLR2A. The preclinical studies in this application were recently published in Nature, which provide the foundation for future clinical trials. There is already discussion regarding the potential for initiation of a clinical trial based on our work. We propose that hemizygous deletion of TP53 in human cancers creates a therapeutic window between normal and cancer cells, and that PORL2A is a novel and druggable target in cancers with such genomic alterations.
Public Health Relevance
Hemizygous deletion of the tumor suppressor TP53 gene is a frequent genomic event in human cancers. As a gene essential for cell survival, the POLR2A gene is always co-deleted with TP53 in the cancer cell. In this proposal, we propose that hemizygous deletion of TP53 creates a therapeutic window between normal and cancer cells, and that PORL2A is a novel and druggable target in human cancers with such genomic alterations.
Hintergrundartikel
Hab ich schon mal gepostet. Doch aus aktuellem Anlass.
kannst du das auch erklären was es bedeuted oder hast du das nur reingestellt nach dem Motto `ich weiss was´?
Hab ich schon mal gepostet. Doch aus aktuellem Anlass.
kannst du das auch erklären was es bedeuted oder hast du das nur reingestellt nach dem Motto `ich weiss was´?
Antwort auf Beitrag Nr.: 57.167.763 von infomi am 02.03.18 09:54:50
Ich sammle Artikel und Meldungen zu Heidelberg Pharma und stelle sie hier ins Board.
Ich freue mich dabei über jeden der sich produktiv an einer Diskussion beteiligt.
Ich bin kein
Ich bin kein Fachmann. Doch soweit ich das erkennen konnte, ergeben beide Postings einen Zusammenhang. Solltest du eine Erklärung haben und dich produktiv an der Diskussion beteiligen möchtest, wäre ich dir recht dankbar. Ich sammle Artikel und Meldungen zu Heidelberg Pharma und stelle sie hier ins Board.
Ich freue mich dabei über jeden der sich produktiv an einer Diskussion beteiligt.
Antwort auf Beitrag Nr.: 57.167.763 von infomi am 02.03.18 09:54:50
Ich bin kein Fachmann und sammle sämtliche Meldungen zu deutschen Biotechwerten und hier im Thread speziell zu Heidelberg Pharma. Ich poste durchaus Beiträge, die aufgrund meines Wissensstandes als Nichtwissenschaftler möglich ist. Ich habe dies in Beitrag Nr 21 gemacht und dort auch erwähnt. Mir geht es darum alle relevanten Meldungen zu Heidelberg Pharma schnellstmöglich zur Hand zu haben. Deshalb habe ich diesen Thread eröffnet. Ich freue mich dabei über jeden, der sich hierbei beteiligt und mit Fachbeiträgen und oder Diskussion dazu beiträgt.
Weiterhin sammle ich zu allen anderen deutschen börsennotierten seit etlichen Jahren Meldungen und mache dazu Statistiken. Ich versuche dabei parallele Verläufe zu erkennen und davon zu profitieren.
Hier der Thread zu den deutschen Biotechwerten im W-O Board.
https://www.wallstreet-online.de/diskussion/1223874-neustebe…
Dann parallel dazu die Meldungen im Ariva Board
http://www.ariva.de/forum/deutsche-biotechwerte-ab-2016-5327…
Was mich aber interessiert ist , was hast du eigentlich für einen Kenntnis-Wissenshintergrund und auf welcher Basis postest du deine Beiträge? Wie ist deine Qualifikation um solch eine Frage zu stellen, die ich als verdammt überheblich empfinde?
Wenn du Lust hast kannst du dich gerne in den Threads gerne beteiligen. Qualifizierte Beiträge sind stets willkommen. Die Grundlage hierfür ist aber in etwa den gleichen Wissensstand durch die Beiträge zu haben, die ich hier poste.
@ Infomi
Ich möchte doch noch mal kurz darauf antworten, da ich das Posten von Meldungen in deinen Beitrag doch als etwas abschätzig empfinde.Ich bin kein Fachmann und sammle sämtliche Meldungen zu deutschen Biotechwerten und hier im Thread speziell zu Heidelberg Pharma. Ich poste durchaus Beiträge, die aufgrund meines Wissensstandes als Nichtwissenschaftler möglich ist. Ich habe dies in Beitrag Nr 21 gemacht und dort auch erwähnt. Mir geht es darum alle relevanten Meldungen zu Heidelberg Pharma schnellstmöglich zur Hand zu haben. Deshalb habe ich diesen Thread eröffnet. Ich freue mich dabei über jeden, der sich hierbei beteiligt und mit Fachbeiträgen und oder Diskussion dazu beiträgt.
Weiterhin sammle ich zu allen anderen deutschen börsennotierten seit etlichen Jahren Meldungen und mache dazu Statistiken. Ich versuche dabei parallele Verläufe zu erkennen und davon zu profitieren.
Hier der Thread zu den deutschen Biotechwerten im W-O Board.
https://www.wallstreet-online.de/diskussion/1223874-neustebe…
Dann parallel dazu die Meldungen im Ariva Board
http://www.ariva.de/forum/deutsche-biotechwerte-ab-2016-5327…
Was mich aber interessiert ist , was hast du eigentlich für einen Kenntnis-Wissenshintergrund und auf welcher Basis postest du deine Beiträge? Wie ist deine Qualifikation um solch eine Frage zu stellen, die ich als verdammt überheblich empfinde?
Wenn du Lust hast kannst du dich gerne in den Threads gerne beteiligen. Qualifizierte Beiträge sind stets willkommen. Die Grundlage hierfür ist aber in etwa den gleichen Wissensstand durch die Beiträge zu haben, die ich hier poste.
Antwort auf Beitrag Nr.: 57.180.051 von BICYPAPA am 04.03.18 08:39:24
ich beteilige mich gerne - aber nur dann, wenn ich eine eigene Überlegung beitragen kann;
du hingegen, kannst kaum was beitragen, erweckst aber unentwegt den Eindruck, dass du ein Fachmann bist (oder sein möchtest)
Zitat von BICYPAPA: Ich möchte doch noch mal kurz darauf antworten, da ich das Posten von Meldungen in deinen Beitrag doch als etwas abschätzig empfinde.
Ich bin kein Fachmann und sammle sämtliche Meldungen zu deutschen Biotechwerten und hier im Thread speziell zu Heidelberg Pharma. Ich poste durchaus Beiträge, die aufgrund meines Wissensstandes als Nichtwissenschaftler möglich ist. Ich habe dies in Beitrag Nr 21 gemacht und dort auch erwähnt. Mir geht es darum alle relevanten Meldungen zu Heidelberg Pharma schnellstmöglich zur Hand zu haben. Deshalb habe ich diesen Thread eröffnet. Ich freue mich dabei über jeden, der sich hierbei beteiligt und mit Fachbeiträgen und oder Diskussion dazu beiträgt.
Weiterhin sammle ich zu allen anderen deutschen börsennotierten seit etlichen Jahren Meldungen und mache dazu Statistiken. Ich versuche dabei parallele Verläufe zu erkennen und davon zu profitieren.
Hier der Thread zu den deutschen Biotechwerten im W-O Board.
https://www.wallstreet-online.de/diskussion/1223874-neustebe…
Dann parallel dazu die Meldungen im Ariva Board
http://www.ariva.de/forum/deutsche-biotechwerte-ab-2016-5327…
Was mich aber interessiert ist , was hast du eigentlich für einen Kenntnis-Wissenshintergrund und auf welcher Basis postest du deine Beiträge? Wie ist deine Qualifikation um solch eine Frage zu stellen, die ich als verdammt überheblich empfinde?
Wenn du Lust hast kannst du dich gerne in den Threads gerne beteiligen. Qualifizierte Beiträge sind stets willkommen. Die Grundlage hierfür ist aber in etwa den gleichen Wissensstand durch die Beiträge zu haben, die ich hier poste.
ich beteilige mich gerne - aber nur dann, wenn ich eine eigene Überlegung beitragen kann;
du hingegen, kannst kaum was beitragen, erweckst aber unentwegt den Eindruck, dass du ein Fachmann bist (oder sein möchtest)
Antwort auf Beitrag Nr.: 57.181.155 von infomi am 04.03.18 12:06:35
Nochmals. Ich sammle Fakten und Meldungen zu deutschen Biotechwerten und wenn ich was sagen möchte, dann tue ich das und das dann eben mit meinem Wissensstand. Nicht mehr und nicht weniger. Ich tue dies auch bei anderen Werten. Keine Ahnung warum du solch eine Erwartungshaltung in meine Person hast. Welche Qualifikation soll denn deiner Meinung nach hier im Board haben, um hier im Board zu posten zu dürfen. Wir sind hier im Aktienboard und nicht an einer Hochschule.
Von dir hab ich übrigens außer Kritik noch nicht einen einzigen sinnvollen Beitrag zu den entsprechenden Aktien gesehen. Und wenn dir meine Person nicht gefällt, dann ignoriere mich doch einfach und das Problem ist geregelt. Habe immer noch keine Ausführungen zu deiner Person oder Kompetenz gelesen. Und nochwas. Ich bin dir in keinster Weise irgendeine Rechenschaft schuldig, zumal du damit ja mentale Probleme hast und nur du mir eine Kompetenz unterstellst, die ich niemals vorgegaukelt habe.
Wenn du
Wenn du Wahrnehmungsprobleme hast, ist das dein Problem. Ich führe alle meine Depots und Threads für die deutschen Biotechwerte transparent und führe auch die Depots für alle sichtbar. Dort kannst du meine Fähigkeiten nachverfolgen. Du magst mit meiner Person Schwierigkeiten haben. Doch seit wann ist eine Faktensammlung etwas kritikwürdiges. Im Gegenteil ich habe öfters darauf hingewiesen, dass ich kein Fachmann bin. Es ist dein Wahrnehmungsproblem.Nochmals. Ich sammle Fakten und Meldungen zu deutschen Biotechwerten und wenn ich was sagen möchte, dann tue ich das und das dann eben mit meinem Wissensstand. Nicht mehr und nicht weniger. Ich tue dies auch bei anderen Werten. Keine Ahnung warum du solch eine Erwartungshaltung in meine Person hast. Welche Qualifikation soll denn deiner Meinung nach hier im Board haben, um hier im Board zu posten zu dürfen. Wir sind hier im Aktienboard und nicht an einer Hochschule.
Von dir hab ich übrigens außer Kritik noch nicht einen einzigen sinnvollen Beitrag zu den entsprechenden Aktien gesehen. Und wenn dir meine Person nicht gefällt, dann ignoriere mich doch einfach und das Problem ist geregelt. Habe immer noch keine Ausführungen zu deiner Person oder Kompetenz gelesen. Und nochwas. Ich bin dir in keinster Weise irgendeine Rechenschaft schuldig, zumal du damit ja mentale Probleme hast und nur du mir eine Kompetenz unterstellst, die ich niemals vorgegaukelt habe.
Antwort auf Beitrag Nr.: 57.181.464 von BICYPAPA am 04.03.18 12:49:56Bicypapa, lass dich nicht vollquasseln.
Ich finde deine und andere Posts dieser Art sehr hilfreich, sich ein Bild über hp zu machen.
Mir scheint gar, als würde man versuchen, diesen Informationsaustausch unterbinden zu wollen und mäkelt deshalb daran herum.
Keine Ahnung, was eine „eigene Meinungsäußerung“ an besserer informationsqualität haben sollte.
Mach einfach weiter wie gewohnt.
Danke, auch an andere hier, die sich die Mühe machen, solche Informationen im Netz ausfindig zu machen und hier mit anderen zu teilen.
Ich finde deine und andere Posts dieser Art sehr hilfreich, sich ein Bild über hp zu machen.
Mir scheint gar, als würde man versuchen, diesen Informationsaustausch unterbinden zu wollen und mäkelt deshalb daran herum.
Keine Ahnung, was eine „eigene Meinungsäußerung“ an besserer informationsqualität haben sollte.
Mach einfach weiter wie gewohnt.
Danke, auch an andere hier, die sich die Mühe machen, solche Informationen im Netz ausfindig zu machen und hier mit anderen zu teilen.
Antwort auf Beitrag Nr.: 57.182.065 von TheBoss_Springsteen am 04.03.18 14:46:08
Ladenburg, 5. März 2018 - Die Heidelberg Pharma AG (FWB:WL6), ein biotechnologisches Unternehmen, das neue Möglichkeiten in der Krebstherapie erforscht, und Magenta Therapeutics Inc., ein Biotechnologieunternehmen, das die Therapiemöglichkeiten im Bereich der Knochenmarkstransplantation für die Patienten verbessern und erweitern möchte, gaben heute den Abschluss einer exklusiven Forschungsvereinbarung für mehrere Zielmoleküle bekannt. Heidelberg Pharma Research GmbH unterzeichnete die Vereinbarung, bei der aus Magentas Stammzellplattform generierte proprietäre Antikörper für bis zu vier exklusive Zielmoleküle genutzt werden sollen, um mit Heidelberg Pharmas proprietärer ATAC-Technologie neue ATACs ("Antibody-Targeted-Amanitin-Conjugates") herzustellen.
Im Rahmen der exklusiven Forschungsvereinbarung für mehrere Zielmoleküle wird Magenta Zugang zu Heidelberg Pharmas Amanitin-Linker-Plattformtechnologie gewährt. Magenta erhält dabei die Option für die exklusive Lizenzierung der weltweiten Entwicklungs- und Vermarktungsrechte bestimmter Zielmoleküle und der daraus entstehenden Produktkandidaten.
Heidelberg Pharma erhält bei Vertragsunterzeichnung Zahlungen für Technologiezugang und Exklusivität sowie Zahlungen für zu erbringende Forschungsleistungen. Im Rahmen einer exklusiven Lizenzvereinbarung würde Heidelberg Pharma zusätzlich erfolgsabhängige Zahlungen für klinische Entwicklungs-, regulatorische und umsatzabhängige Meilensteine von insgesamt bis zu 334 Mio. USD erhalten, wenn Magenta die Optionen für alle Zielmoleküle ausüben würde und alle Meilensteine erreicht würden.
Informationen und Erläuterungen des Emittenten zu dieser Mitteilung:
Über Knochenmarkstransplantation Gesunde Knochenmark-Stammzellen und die von ihnen produzierten Blutzellen sind wichtig für das Leben. Es gibt aber einige Erkrankungen, die das Knochenmark beeinträchtigen, sodass dessen Funktionsfähigkeit gestört wird. Um das kranke Knochenmark durch gesunde Knochenmark-Stammzellen zu ersetzen, wird eine Knochenmarkstransplantation durchgeführt. Sie kann das Leben von Patienten mit Blutkrebs und genetischen Erkrankungen retten und ist eine mögliche Behandlung für Patienten mit schweren therapieresistenten Autoimmunerkrankungen. Allerdings können angesichts des hohen Risikos, toxischer Nebenwirkungen und der Komplexität des Eingriffs derzeit viele Patienten nicht davon profitieren. Diese benötigen ein Konditionierungsprogramm.
Heidelberg Pharma und Magenta Therapeutics
Heidelberg Pharma und Magenta Therapeutics unterzeichnen exklusive Forschungsvereinbarung für mehrere Zielmoleküle zur Entwicklung von Antikörper-Wirkstoff-KonjugatenLadenburg, 5. März 2018 - Die Heidelberg Pharma AG (FWB:WL6), ein biotechnologisches Unternehmen, das neue Möglichkeiten in der Krebstherapie erforscht, und Magenta Therapeutics Inc., ein Biotechnologieunternehmen, das die Therapiemöglichkeiten im Bereich der Knochenmarkstransplantation für die Patienten verbessern und erweitern möchte, gaben heute den Abschluss einer exklusiven Forschungsvereinbarung für mehrere Zielmoleküle bekannt. Heidelberg Pharma Research GmbH unterzeichnete die Vereinbarung, bei der aus Magentas Stammzellplattform generierte proprietäre Antikörper für bis zu vier exklusive Zielmoleküle genutzt werden sollen, um mit Heidelberg Pharmas proprietärer ATAC-Technologie neue ATACs ("Antibody-Targeted-Amanitin-Conjugates") herzustellen.
Im Rahmen der exklusiven Forschungsvereinbarung für mehrere Zielmoleküle wird Magenta Zugang zu Heidelberg Pharmas Amanitin-Linker-Plattformtechnologie gewährt. Magenta erhält dabei die Option für die exklusive Lizenzierung der weltweiten Entwicklungs- und Vermarktungsrechte bestimmter Zielmoleküle und der daraus entstehenden Produktkandidaten.
Heidelberg Pharma erhält bei Vertragsunterzeichnung Zahlungen für Technologiezugang und Exklusivität sowie Zahlungen für zu erbringende Forschungsleistungen. Im Rahmen einer exklusiven Lizenzvereinbarung würde Heidelberg Pharma zusätzlich erfolgsabhängige Zahlungen für klinische Entwicklungs-, regulatorische und umsatzabhängige Meilensteine von insgesamt bis zu 334 Mio. USD erhalten, wenn Magenta die Optionen für alle Zielmoleküle ausüben würde und alle Meilensteine erreicht würden.
Informationen und Erläuterungen des Emittenten zu dieser Mitteilung:
Über Knochenmarkstransplantation Gesunde Knochenmark-Stammzellen und die von ihnen produzierten Blutzellen sind wichtig für das Leben. Es gibt aber einige Erkrankungen, die das Knochenmark beeinträchtigen, sodass dessen Funktionsfähigkeit gestört wird. Um das kranke Knochenmark durch gesunde Knochenmark-Stammzellen zu ersetzen, wird eine Knochenmarkstransplantation durchgeführt. Sie kann das Leben von Patienten mit Blutkrebs und genetischen Erkrankungen retten und ist eine mögliche Behandlung für Patienten mit schweren therapieresistenten Autoimmunerkrankungen. Allerdings können angesichts des hohen Risikos, toxischer Nebenwirkungen und der Komplexität des Eingriffs derzeit viele Patienten nicht davon profitieren. Diese benötigen ein Konditionierungsprogramm.
Ich bin dann gespannt wann die Biotech-Investorengemeinde merkt dass hier ein Juwel heranwächst. Eine Kursentwicklung wie bei. 4SC ist überfällig.
Antwort auf Beitrag Nr.: 57.192.970 von Mogli3 am 05.03.18 20:15:37
Mit dem Grossaktionär Herrn Hopp und Familie haben wir einen phantastischen Grossaktionär, der weiss warum er sich hier an der Aktie vor kurzem beteiligt hat.
...gestrige Nachricht hervorragend..
Die gestrige Nachricht zweigt mir auf, in welche Dimensionen Heidelberg Pharma in der Zukunft gehen wird. Wenn man berücksichtigt, dass die Marktkapitalisierung aktuell nur bei ca. 71,40 Mio. EUR liegt und erfolgsabhängige Zahlungen, bei Erfolg, in Höhe von 334 Mio. USD angekündigt werden, dann kann ich Deinen Kurs-Optimismus voll unterstreichen. Da ist der Kursanstieg von 4sc (vervierfachung in den letzten 52 Wochen) ein sehr gutes Omen für Hedelberg Pharma. Hier muss man nur Geduld haben und kein Stück abgegeben.Mit dem Grossaktionär Herrn Hopp und Familie haben wir einen phantastischen Grossaktionär, der weiss warum er sich hier an der Aktie vor kurzem beteiligt hat.
Antwort auf Beitrag Nr.: 57.199.744 von HKroll am 06.03.18 14:22:11Meldungen wie diese veröffentlichen viele Forschungsunternehmen, das sind alles Angaben für den Fall des maximalen Erfolges. Die Wahrscheinlichkeit hierfür ist statisch betrachtet aber sehr gering.
Herr Hopp ist an dem Konstrukt Wilex/HP schon ein paar Jährchen beteiligt. Und die Tatsache, dass ein wohlklingender Name beteiligt ist, ist leider kein Erfolgsgarant, wie man hier nachlesen kann:
http://www.manager-magazin.de/magazin/artikel/biotech-dietma…
Von daher ist für Euphorie nicht unbedingt Anlass gegeben ...
Herr Hopp ist an dem Konstrukt Wilex/HP schon ein paar Jährchen beteiligt. Und die Tatsache, dass ein wohlklingender Name beteiligt ist, ist leider kein Erfolgsgarant, wie man hier nachlesen kann:
http://www.manager-magazin.de/magazin/artikel/biotech-dietma…
Von daher ist für Euphorie nicht unbedingt Anlass gegeben ...
Antwort auf Beitrag Nr.: 57.255.511 von watchingtheflood am 12.03.18 18:40:50
Ich kenne den Investor Hopp von SAP und allen Sportvereinen, die er im Rhein-Main Gebiet seit Jahren erfolgreich begleitet. Natürlich helfen bzw. unterstüztzen seine Kinder ihn bei seinen großartigen Aufgaben.
Da in der Biotechbranche viel Bewegung ist, müssen wir immer wieder auch mit nicht so tollen Nachrichten rechnen. Bisher sind die Nachrichten bei Heidelberg Pharma positiv, die uns einiges für die Zuzkunft erwarten lassen. Ich bin für das junge Unternehmen deshalb optimistisch gestimmt.
Warten wir ab. Ich finde es sehr gut, dass auch kritische Beiträge im Forum gesendet werden.
Deshalb nochmals, vielen Dank.
Dankeschön
Vielen Dank für Deinen wichtigen Beitrag und die Daten aus dem Manager Magazin.Ich kenne den Investor Hopp von SAP und allen Sportvereinen, die er im Rhein-Main Gebiet seit Jahren erfolgreich begleitet. Natürlich helfen bzw. unterstüztzen seine Kinder ihn bei seinen großartigen Aufgaben.
Da in der Biotechbranche viel Bewegung ist, müssen wir immer wieder auch mit nicht so tollen Nachrichten rechnen. Bisher sind die Nachrichten bei Heidelberg Pharma positiv, die uns einiges für die Zuzkunft erwarten lassen. Ich bin für das junge Unternehmen deshalb optimistisch gestimmt.
Warten wir ab. Ich finde es sehr gut, dass auch kritische Beiträge im Forum gesendet werden.
Deshalb nochmals, vielen Dank.
Antwort auf Beitrag Nr.: 57.255.511 von watchingtheflood am 12.03.18 18:40:50Allgemein gesagt kommt nur jeder 10. Produktekandidat im. Biotechbereich am Schluss auf den Markt, die anderen 9 Kandidaten muss man auf Null abschreiben. Das weiß auch Hopp und sollte jeder wissen der in Biotech investiert. Bis zum Markteinztitt kostet Biotech nur Geld. Bei den beiden Lizenzvereinbarungen von HDP liegt das Risiko bei den Lizenznehmern, der Gewinn bei HDP liegt zwischen derzeit praktisch Null und dem angegebenen Wert also jeweils ca 300 Mio.
Zu Hopp. Der Artikel blendet leider einiges aus. Die Beteiligung Cosmo ist zur Zeit ca 110 Mio wert, ca 8 mal höher als Hopp bezahlt hat. Bei Wilex sind nach wie vor 2 Kandidaten auslizensiert. Viele Kandidaten von Hopp sind erst am Anfang oder in der Mitte angelangt, ein Produktezyklus dauert in der Regel 10-15 Jahre bis zum Markt. Per heute kann man über die Investments von Hopp noch kein Urteil fällen. Halte den Artikel MM für tendenziös.
Zu Hopp. Der Artikel blendet leider einiges aus. Die Beteiligung Cosmo ist zur Zeit ca 110 Mio wert, ca 8 mal höher als Hopp bezahlt hat. Bei Wilex sind nach wie vor 2 Kandidaten auslizensiert. Viele Kandidaten von Hopp sind erst am Anfang oder in der Mitte angelangt, ein Produktezyklus dauert in der Regel 10-15 Jahre bis zum Markt. Per heute kann man über die Investments von Hopp noch kein Urteil fällen. Halte den Artikel MM für tendenziös.
Antwort auf Beitrag Nr.: 57.114.342 von Joschka Schröder am 25.02.18 15:59:02BCMA ist ein super target und ADC ist caeteris paribus besser als CAR-T
voellig inverstanden
zu deinen weiteren Fragen:
Top slides zum Thema Linker/site specific conjugation
http://worldadc-usa.com/wp-content/uploads/sites/99/2016/10/…
http://worldadc-usa.com/wp-content/uploads/sites/99/2016/10/…
HP Patent
WO 2012/119787 A1
weiter zu dem Thema, gute reviews (open source)
https://www.ncbi.nlm.nih.gov/pubmed/24423619
Site-specific antibody drug conjugates for cancer therapy, Panowski 2014
und
www.mdpi.com/2227-9059/5/4/64/pdf
Site-Specific Antibody Conjugation for ADC and Beyond, Zhou 2017
und schliesslich die Genentech Publikation zu THIOMAB in Nature 2008
voellig inverstanden
zu deinen weiteren Fragen:
Top slides zum Thema Linker/site specific conjugation
http://worldadc-usa.com/wp-content/uploads/sites/99/2016/10/…
http://worldadc-usa.com/wp-content/uploads/sites/99/2016/10/…
HP Patent
WO 2012/119787 A1
weiter zu dem Thema, gute reviews (open source)
https://www.ncbi.nlm.nih.gov/pubmed/24423619
Site-specific antibody drug conjugates for cancer therapy, Panowski 2014
und
www.mdpi.com/2227-9059/5/4/64/pdf
Site-Specific Antibody Conjugation for ADC and Beyond, Zhou 2017
und schliesslich die Genentech Publikation zu THIOMAB in Nature 2008
Antwort auf Beitrag Nr.: 57.189.595 von BICYPAPA am 05.03.18 15:20:03
[Melbourne (Australia) and Nijmegen (Netherlands) – 15 February 2018. Telix Pharmaceuticals Limited (ASX.TLX) (“Telix”, the “Company”), a clinical-stage biopharmaceutical company focused on the development of diagnostic and therapeutic products based on targeted radiopharmaceuticals or “molecularly-targeted radiation” (MTR), has today announced a clinical collaboration with Radboud University Medical Center (“Radboudumc”).
Telix is developing 89Zr-girentuximab (TLX-250) for the purpose of imaging clear cell renal cell cancer (ccRCC) with Positron Emission Tomography (PET). Radboudumc and Telix will collaborate on several clinical projects in relation to TLX-250, including leading the pre-Phase III bridging/dosimetry study for TLX-250, participating as a key adviser for the Phase III study, as well as the IMPACT-RCC study (NCT02228954) to better understand how molecular imaging can be used to measure therapeutic treatment response in metastatic kidney cancer.
Telix Co-Founder and CMO Dr. Andreas Kluge stated, “Radboudumc has been a clinical leader in the use of 89Zr-Girentuximab (TLX-250) in the clinic and their patient experience underpins much of the confidence we have in the imaging agent, particularly the change in isotope to a radiometal for superior image quality, sensitivity and patient convenience. We have worked closely with Radboudumc as part of activating our clinical activity for TLX-250 in Europe.”
Professor Peter Mulders, Chairman of the Department of Urology at Radboudumc noted, “We are pleased to be working with Telix to progress this very important technology from a clinical perspective. This international collaboration lays the foundation for the completion of product development of 89Zr-Girentuximab and we are delighted to be part of bringing this technology to renal cancer patients in the Netherlands and beyond.”
As part of the collaboration, Telix will fund a clinical fellowship position at the Department of Radiology and Nuclear Medicine of the Radboudumc to oversee the various activities around the collaboration. The Radboudumc Technology Center imaging facility will also be a key partner, with its cutting-edge technology and expertise for pre-clinical and clinical imaging.
Telix Redectane Cooperation
Telix Pharmaceuticals and Radboud University Medical Centre Conclude Clinical Collaboration Agreement [Melbourne (Australia) and Nijmegen (Netherlands) – 15 February 2018. Telix Pharmaceuticals Limited (ASX.TLX) (“Telix”, the “Company”), a clinical-stage biopharmaceutical company focused on the development of diagnostic and therapeutic products based on targeted radiopharmaceuticals or “molecularly-targeted radiation” (MTR), has today announced a clinical collaboration with Radboud University Medical Center (“Radboudumc”).
Telix is developing 89Zr-girentuximab (TLX-250) for the purpose of imaging clear cell renal cell cancer (ccRCC) with Positron Emission Tomography (PET). Radboudumc and Telix will collaborate on several clinical projects in relation to TLX-250, including leading the pre-Phase III bridging/dosimetry study for TLX-250, participating as a key adviser for the Phase III study, as well as the IMPACT-RCC study (NCT02228954) to better understand how molecular imaging can be used to measure therapeutic treatment response in metastatic kidney cancer.
Telix Co-Founder and CMO Dr. Andreas Kluge stated, “Radboudumc has been a clinical leader in the use of 89Zr-Girentuximab (TLX-250) in the clinic and their patient experience underpins much of the confidence we have in the imaging agent, particularly the change in isotope to a radiometal for superior image quality, sensitivity and patient convenience. We have worked closely with Radboudumc as part of activating our clinical activity for TLX-250 in Europe.”
Professor Peter Mulders, Chairman of the Department of Urology at Radboudumc noted, “We are pleased to be working with Telix to progress this very important technology from a clinical perspective. This international collaboration lays the foundation for the completion of product development of 89Zr-Girentuximab and we are delighted to be part of bringing this technology to renal cancer patients in the Netherlands and beyond.”
As part of the collaboration, Telix will fund a clinical fellowship position at the Department of Radiology and Nuclear Medicine of the Radboudumc to oversee the various activities around the collaboration. The Radboudumc Technology Center imaging facility will also be a key partner, with its cutting-edge technology and expertise for pre-clinical and clinical imaging.
Antwort auf Beitrag Nr.: 57.282.883 von BICYPAPA am 14.03.18 23:59:42
http://www.telixpharma.com/investors/asx-announcements/
Telix Brief zur Jahreshaptversammlung
Hier der link zur Telix Jahreshauptversammlung. Ich bitte euch weitere Einzelheiten zu Redectane (TLX-250) dem link zu entnehmen.http://www.telixpharma.com/investors/asx-announcements/
Antwort auf Beitrag Nr.: 57.283.276 von BICYPAPA am 15.03.18 06:16:16
Gesamter Artikel:
https://www.biospectrumasia.com/influencers/34/10466/cancer-…
Australia’s Telix Pharmaceuticals is developing an advanced portfolio of radiopharmaceuticals products that address significant unmet medical need in renal, prostate and brain (glioblastoma) cancer. Recently Telix announced the establishment its Japanese subsidiary and the appointment of the first two members of the Japanese leadership team. Speaking to BioSpectrum Asia Magazine, Dr Shintaro Nishimura, President and Chief Operating Officer of Telix Japan, elaborated on APAC’s oncology market as well as opportunities and challenges in the Japanese market for radiopharmaceutical products.
Redectane TLX-250 in Japan
'Cancer is an increasingly important health issue in the APAC region’Gesamter Artikel:
https://www.biospectrumasia.com/influencers/34/10466/cancer-…
Australia’s Telix Pharmaceuticals is developing an advanced portfolio of radiopharmaceuticals products that address significant unmet medical need in renal, prostate and brain (glioblastoma) cancer. Recently Telix announced the establishment its Japanese subsidiary and the appointment of the first two members of the Japanese leadership team. Speaking to BioSpectrum Asia Magazine, Dr Shintaro Nishimura, President and Chief Operating Officer of Telix Japan, elaborated on APAC’s oncology market as well as opportunities and challenges in the Japanese market for radiopharmaceutical products.
Antwort auf Beitrag Nr.: 57.314.966 von BICYPAPA am 19.03.18 06:12:56
Globally, the radiopharmaceutical medicine market is expected to reach USD 13.8 billion by 2024, according to a new report by Grand View Research. The market is driven by increasing number of cancer cases and rising awareness about nuclear medicine. Radiopharmaceuticals are pharmaceutical formulations comprising radioactive isotopes that are used in diagnosis and therapeutics. They contain a radioactive substance that is used in the treatment of cancer and cardiac and neurological disorders. The conventional chemotherapy methods are being replaced by more convenient therapeutic radiopharmaceuticals for oncology and cancer treatment, which opens up new avenues in the radiopharmaceuticals market. The convenience of the treatment with minimally invasive techniques attracts more patients towards radiopharmaceuticals mode of treatment as compared to chemotherapy.
Nuclear medicine also helps detect the presence of disease in its earliest stages and is one of the most favorable drivers of the market, as public awareness about chronic diseases is increasing. Increasing diagnostic nuclear medicine procedures is supporting the growth of the market and experts indicate that use of radiopharmaceuticals in diagnosis is growing at over 10% per year throughout the world.
The past decade has seen a mammoth rise in cancer cases and other lifestyle disorders in APAC and thus, this regions is expected to register fastest growth in nuclear medicine space in comparison to other global countries. Research reports elaborate that nuclear medicine practice in Japan is in high demand with a significant increase in cancer cases in recent years. Furthermore, China and India are boosting the growth of the Asia Pacific nuclear medicine market with increasing demand for treatment and diagnosis of Alzheimer’s and Parkinson’s disease.
With many unique advantages, radiopharmaceuticals offer clear potential for players in emerging Asian countries as there is a need to broaden healthcare coverage and address unmet medical needs. Realizing the market potential, recently several Asian companies have been increasing their focus on radiopharmaceuticals.
Entering the Japanese market, Telix Pharmaceuticals , an Australian biopharmaceutical company focused on the development of radio pharmaceutical diagnostic and therapeutic interventions recently announced the establishment Telix Pharmaceuticals (Japan) (“Telix Japan”) and the appointment of the first two members of the Japanese leadership team.
Telix Japan is wholly-owned operating subsidiary of Telix Pharmaceuticals Limited. The purpose of the subsidiary is to support the Company’s Japanese clinical and radiopharmaceutical manufacturing activities and to establish a commercial footprint in the Japan, an important market for Telix’s products. Telix is developing an advanced portfolio of oncology products that address significant unmet medical need in renal, prostate and brain (glioblastoma) cancer.
Recently Telix Pharmaceuticals also inked a manufacturing deal with JFE Engineering Corporation in order to develop and make Telix’s products available to Japanese cancer patients.
To lead the Telix Japan activities, Dr. Shintaro Nishimura and Dr. Takeshi Oka have been appointed as President and Chief Operating Officer, and Chief Medical Officer (Japan), respectively.
Speaking to BioSpectrum Asia Magazine, Dr Shintaro Nishimura, President and Chief Operating Officer of Telix Japan, elaborated on APAC’s oncology market as well as opportunities and challenges in the Japanese market for radiopharmaceutical products.
Why was Japan chosen as a destination for expansion?
Telix chose Japan as a destination for expansion because it is potentially a significant market for Telix’s products.
Historically, Japan has been slow to adopt advanced nuclear medicine due to restrictions on importing nuclear material, however, recent healthcare policy developments in the country has recognized the cost-effectiveness of molecularly-targeted radiation (MTR) technology. As such, there is significant momentum to develop domestic capacity to address the oncology needs of Japan’s rapidly ageing patient population.
In light of these macro factors, there is significant commercial opportunity for Telix in Japan, and considerable interest in our oncology pipeline from leading nuclear medicine clinics. As such, the company established a Japanese subsidiary in January 2018, and we hope to use this high level of clinical engagement to obtain the additional data required to support product approval in Japan in the future.
What according to you are the major opportunities and challenges for Telix products in the Japanese market?
Japan is the prospectively the second largest market for Telix’s products after the United States due to its growing cancer patient population. However, one obstacle faced by radiopharmaceutical companies is the difficulty of importing radioactive isotopes into the country. As such, there is significant clinical interest in the prospect of domestic production of new medical isotopes and, consequently, novel imaging and therapeutic radiopharmaceutical products, especially in oncology.
To address this issue, we were pleased to announce that Telix signed a manufacturing partnership with JFE Engineering Corporation (JFE), an engineering and manufacturing company with extensive expertise in radiopharmaceutical manufacturing, in December 2017. This partnership will see the production of 89Zr (Zirconium) in mid-2018 - the first commercial production of this isotope in Japan. The Zirconium isotope is critical to Telix’s diagnostic imaging portfolio - particularly for TLX-250, our lead program for imaging for renal cancer.
Please throw some light on Telix's further expansion plans
The company’s growth strategy involves commercial collaboration and partnering with leading radiation oncology and pharmaceutical companies that have an active interest in Telix and the radiation oncology space generally. Clinical and academic collaborations are also important; hence our recent announcement with Memorial Sloan Kettering Cancer Centre, one of the world’s leading cancer hospitals. We are also selectively expanding our portfolio through selective acquisitions or additional partnerships, while also investigating indication expansion opportunities for assets within our existing portfolio.
Please give us an overview of Telix's product pipeline
Telix is an Australian biopharmaceutical company focused on the development of diagnostic and therapeutic products based on targeted radiopharmaceuticals or molecularly-targeted radiation (MTR). The Company is developing an advanced portfolio of oncology products that address significant unmet medical need in renal, prostate and brain (glioblastoma) cancer. The company is listed on the Australian Securities Exchange as “TLX”.
The company’s portfolio of clinical programs include:
TLX-250: for the diagnosis and treatment of renal (kidney) cancer, which is the Company’s lead program and currently in Phase III and Phase II
TLX-591: for the treatment of prostate cancer, currently in Phase II
TLX-101: for the treatment of brain (glioblastoma) cancer, currently in Phase I
How is the APAC market for oncology products?
Cancer is an increasingly important health issue in the APAC region given the ageing population and changes to lifestyles associated with growing economic development and epidemiologic transition, and this is especially the case in Japan. Japan needs cost-effective therapeutic tools and radiopharmaceuticals have a very favorable cost-benefit equation. Generally speaking the global pharmaceutical industry has recognized the growth opportunity for both diagnostic and therapeutic medicine in Asia’s healthcare market. Asia remains price-sensitive but the market is also under-served. In particular, for Telix’s lead program TLX-250, the region is estimated to have the fastest growth rate for the kidney cancer drugs market – over 6% - due to the increasing patient base and growing disease awareness. Prostate cancer is also on the rise and part of our clinical activities in Japan is better understanding the differences in prostate cancer biology between “western” and Japanese men.
In general, Asian countries have lower rates of kidney cancer compared to North American and European countries, but Japan shows higher incidences of the disease – and most other cancers – than other Asian countries.
Artikel Redectane
Dr Shintaro Nishimura, President and Chief Operating Officer of Telix JapanGlobally, the radiopharmaceutical medicine market is expected to reach USD 13.8 billion by 2024, according to a new report by Grand View Research. The market is driven by increasing number of cancer cases and rising awareness about nuclear medicine. Radiopharmaceuticals are pharmaceutical formulations comprising radioactive isotopes that are used in diagnosis and therapeutics. They contain a radioactive substance that is used in the treatment of cancer and cardiac and neurological disorders. The conventional chemotherapy methods are being replaced by more convenient therapeutic radiopharmaceuticals for oncology and cancer treatment, which opens up new avenues in the radiopharmaceuticals market. The convenience of the treatment with minimally invasive techniques attracts more patients towards radiopharmaceuticals mode of treatment as compared to chemotherapy.
Nuclear medicine also helps detect the presence of disease in its earliest stages and is one of the most favorable drivers of the market, as public awareness about chronic diseases is increasing. Increasing diagnostic nuclear medicine procedures is supporting the growth of the market and experts indicate that use of radiopharmaceuticals in diagnosis is growing at over 10% per year throughout the world.
The past decade has seen a mammoth rise in cancer cases and other lifestyle disorders in APAC and thus, this regions is expected to register fastest growth in nuclear medicine space in comparison to other global countries. Research reports elaborate that nuclear medicine practice in Japan is in high demand with a significant increase in cancer cases in recent years. Furthermore, China and India are boosting the growth of the Asia Pacific nuclear medicine market with increasing demand for treatment and diagnosis of Alzheimer’s and Parkinson’s disease.
With many unique advantages, radiopharmaceuticals offer clear potential for players in emerging Asian countries as there is a need to broaden healthcare coverage and address unmet medical needs. Realizing the market potential, recently several Asian companies have been increasing their focus on radiopharmaceuticals.
Entering the Japanese market, Telix Pharmaceuticals , an Australian biopharmaceutical company focused on the development of radio pharmaceutical diagnostic and therapeutic interventions recently announced the establishment Telix Pharmaceuticals (Japan) (“Telix Japan”) and the appointment of the first two members of the Japanese leadership team.
Telix Japan is wholly-owned operating subsidiary of Telix Pharmaceuticals Limited. The purpose of the subsidiary is to support the Company’s Japanese clinical and radiopharmaceutical manufacturing activities and to establish a commercial footprint in the Japan, an important market for Telix’s products. Telix is developing an advanced portfolio of oncology products that address significant unmet medical need in renal, prostate and brain (glioblastoma) cancer.
Recently Telix Pharmaceuticals also inked a manufacturing deal with JFE Engineering Corporation in order to develop and make Telix’s products available to Japanese cancer patients.
To lead the Telix Japan activities, Dr. Shintaro Nishimura and Dr. Takeshi Oka have been appointed as President and Chief Operating Officer, and Chief Medical Officer (Japan), respectively.
Speaking to BioSpectrum Asia Magazine, Dr Shintaro Nishimura, President and Chief Operating Officer of Telix Japan, elaborated on APAC’s oncology market as well as opportunities and challenges in the Japanese market for radiopharmaceutical products.
Why was Japan chosen as a destination for expansion?
Telix chose Japan as a destination for expansion because it is potentially a significant market for Telix’s products.
Historically, Japan has been slow to adopt advanced nuclear medicine due to restrictions on importing nuclear material, however, recent healthcare policy developments in the country has recognized the cost-effectiveness of molecularly-targeted radiation (MTR) technology. As such, there is significant momentum to develop domestic capacity to address the oncology needs of Japan’s rapidly ageing patient population.
In light of these macro factors, there is significant commercial opportunity for Telix in Japan, and considerable interest in our oncology pipeline from leading nuclear medicine clinics. As such, the company established a Japanese subsidiary in January 2018, and we hope to use this high level of clinical engagement to obtain the additional data required to support product approval in Japan in the future.
What according to you are the major opportunities and challenges for Telix products in the Japanese market?
Japan is the prospectively the second largest market for Telix’s products after the United States due to its growing cancer patient population. However, one obstacle faced by radiopharmaceutical companies is the difficulty of importing radioactive isotopes into the country. As such, there is significant clinical interest in the prospect of domestic production of new medical isotopes and, consequently, novel imaging and therapeutic radiopharmaceutical products, especially in oncology.
To address this issue, we were pleased to announce that Telix signed a manufacturing partnership with JFE Engineering Corporation (JFE), an engineering and manufacturing company with extensive expertise in radiopharmaceutical manufacturing, in December 2017. This partnership will see the production of 89Zr (Zirconium) in mid-2018 - the first commercial production of this isotope in Japan. The Zirconium isotope is critical to Telix’s diagnostic imaging portfolio - particularly for TLX-250, our lead program for imaging for renal cancer.
Please throw some light on Telix's further expansion plans
The company’s growth strategy involves commercial collaboration and partnering with leading radiation oncology and pharmaceutical companies that have an active interest in Telix and the radiation oncology space generally. Clinical and academic collaborations are also important; hence our recent announcement with Memorial Sloan Kettering Cancer Centre, one of the world’s leading cancer hospitals. We are also selectively expanding our portfolio through selective acquisitions or additional partnerships, while also investigating indication expansion opportunities for assets within our existing portfolio.
Please give us an overview of Telix's product pipeline
Telix is an Australian biopharmaceutical company focused on the development of diagnostic and therapeutic products based on targeted radiopharmaceuticals or molecularly-targeted radiation (MTR). The Company is developing an advanced portfolio of oncology products that address significant unmet medical need in renal, prostate and brain (glioblastoma) cancer. The company is listed on the Australian Securities Exchange as “TLX”.
The company’s portfolio of clinical programs include:
TLX-250: for the diagnosis and treatment of renal (kidney) cancer, which is the Company’s lead program and currently in Phase III and Phase II
TLX-591: for the treatment of prostate cancer, currently in Phase II
TLX-101: for the treatment of brain (glioblastoma) cancer, currently in Phase I
How is the APAC market for oncology products?
Cancer is an increasingly important health issue in the APAC region given the ageing population and changes to lifestyles associated with growing economic development and epidemiologic transition, and this is especially the case in Japan. Japan needs cost-effective therapeutic tools and radiopharmaceuticals have a very favorable cost-benefit equation. Generally speaking the global pharmaceutical industry has recognized the growth opportunity for both diagnostic and therapeutic medicine in Asia’s healthcare market. Asia remains price-sensitive but the market is also under-served. In particular, for Telix’s lead program TLX-250, the region is estimated to have the fastest growth rate for the kidney cancer drugs market – over 6% - due to the increasing patient base and growing disease awareness. Prostate cancer is also on the rise and part of our clinical activities in Japan is better understanding the differences in prostate cancer biology between “western” and Japanese men.
In general, Asian countries have lower rates of kidney cancer compared to North American and European countries, but Japan shows higher incidences of the disease – and most other cancers – than other Asian countries.
Antwort auf Beitrag Nr.: 57.314.975 von BICYPAPA am 19.03.18 06:18:08
19 March, 2018
Data from non-clinical studies indicated that WX-UK1, the active metabolite of RHB-107 (formerly MESUPRON), is a potent and specific inhibitor of five human serine proteases, suggesting new potential therapeutic applications in oncology and inflammatory digestive diseases
TEL-AVIV, Israel / RALEIGH, NC, March 19, 2018 RedHill Biopharma Ltd. (NASDAQ: RDHL) (Tel-Aviv Stock Exchange: RDHL) (“RedHill” or the “Company”), a specialty biopharmaceutical company primarily focused on late clinical-stage development and commercialization of proprietary drugs for gastrointestinal diseases and cancer, today announced the presentation of a poster at the American Association for Cancer Research (AACR) 2018 Annual Meeting. The abstract (number 4200) will be presented by Mark L. Levitt, MD, Ph.D., Medical Director, Oncology at RedHill, on Tuesday, April 17, 2018 from 1:00 PM to 5:00 PM CDT, at McCormick Place, Chicago, IL.
The abstract1 presentation, entitled ‘New potential therapeutic applications of WX-UK1, as a specific and potent inhibitor of human trypsin-like proteases’, describes data from non-clinical studies concluding that WX-UK1, the active metabolite of RHB-107 (formerly MESUPRON) (INN: upamostat), is a potent and specific inhibitor of five human serine proteases (trypsin-3, trypsin-2, trypsin-1, matriptase-1 and trypsin-6). Several of these serine proteases are associated with cancer progression and metastasis. The non-clinical studies suggest new potential therapeutic applications of WX-UK1 in oncology and inflammatory gastrointestinal diseases. The abstract was authored by scientists from the Department of Molecular Biology and Genetics of Aarhus University in collaboration with RedHill2.
RHB-107 is a proprietary, first-in-class, orally-administered potent serine protease inhibitor, presenting a new non-cytotoxic approach to cancer therapy, as well as other indications of high unmet need, such as inflammatory digestive diseases and inflammatory lung diseases. RHB-107 has undergone several Phase I studies and two Phase II proof-of-concept studies in cancer patients.
With the recent identification of several serine proteases as high-affinity molecular targets, RedHill is evaluating utilization of RHB-107 in both cancer and inflammatory digestive diseases.
About RHB-107 (upamostat):
RHB-107 (formerly MESUPRON) (INN: upamostat) is a proprietary, first-in-class, orally-administered potent inhibitor of several serine proteases targeting cancer and inflammatory gastrointestinal diseases. Protease inhibitors have been shown to play key roles in tumor invasion and the metastasis process. High levels of certain proteases are associated with poor prognosis in various solid tumor cancers, such as pancreatic, gastric, breast and prostate cancers. RHB-107 was previously granted FDA Orphan Drug designation for the treatment of pancreatic cancer. RHB-107 presents a new non-cytotoxic approach to cancer therapy with several potential mechanisms of action to inhibit tumor invasion and metastasis. RHB-107 has undergone several Phase I studies and two Phase II proof-of-concept studies. The first Phase II study was in locally-advanced, non-metastatic pancreatic cancer and the second study in metastatic breast cancer in combination with first-line chemotherapeutic agents. RedHill was granted a new patent from the United States Patent and Trademark Office (USPTO) directed to a combination of RHB-107, YELIVA®, RedHill’s two Phase II-stage investigational compounds, and a known antibiotic. RedHill acquired the exclusive worldwide rights to RHB-107, excluding China, Hong Kong, Taiwan and Macao, from Germany’s Heidelberg Pharmaceuticals (formerly WILEX AG) for all indications.
Redhill Mesupron
RedHill Announces Poster Presentation on New Potential Therapeutic Applications of RHB-107 at the AACR 2018 Annual Meeting19 March, 2018
Data from non-clinical studies indicated that WX-UK1, the active metabolite of RHB-107 (formerly MESUPRON), is a potent and specific inhibitor of five human serine proteases, suggesting new potential therapeutic applications in oncology and inflammatory digestive diseases
TEL-AVIV, Israel / RALEIGH, NC, March 19, 2018 RedHill Biopharma Ltd. (NASDAQ: RDHL) (Tel-Aviv Stock Exchange: RDHL) (“RedHill” or the “Company”), a specialty biopharmaceutical company primarily focused on late clinical-stage development and commercialization of proprietary drugs for gastrointestinal diseases and cancer, today announced the presentation of a poster at the American Association for Cancer Research (AACR) 2018 Annual Meeting. The abstract (number 4200) will be presented by Mark L. Levitt, MD, Ph.D., Medical Director, Oncology at RedHill, on Tuesday, April 17, 2018 from 1:00 PM to 5:00 PM CDT, at McCormick Place, Chicago, IL.
The abstract1 presentation, entitled ‘New potential therapeutic applications of WX-UK1, as a specific and potent inhibitor of human trypsin-like proteases’, describes data from non-clinical studies concluding that WX-UK1, the active metabolite of RHB-107 (formerly MESUPRON) (INN: upamostat), is a potent and specific inhibitor of five human serine proteases (trypsin-3, trypsin-2, trypsin-1, matriptase-1 and trypsin-6). Several of these serine proteases are associated with cancer progression and metastasis. The non-clinical studies suggest new potential therapeutic applications of WX-UK1 in oncology and inflammatory gastrointestinal diseases. The abstract was authored by scientists from the Department of Molecular Biology and Genetics of Aarhus University in collaboration with RedHill2.
RHB-107 is a proprietary, first-in-class, orally-administered potent serine protease inhibitor, presenting a new non-cytotoxic approach to cancer therapy, as well as other indications of high unmet need, such as inflammatory digestive diseases and inflammatory lung diseases. RHB-107 has undergone several Phase I studies and two Phase II proof-of-concept studies in cancer patients.
With the recent identification of several serine proteases as high-affinity molecular targets, RedHill is evaluating utilization of RHB-107 in both cancer and inflammatory digestive diseases.
About RHB-107 (upamostat):
RHB-107 (formerly MESUPRON) (INN: upamostat) is a proprietary, first-in-class, orally-administered potent inhibitor of several serine proteases targeting cancer and inflammatory gastrointestinal diseases. Protease inhibitors have been shown to play key roles in tumor invasion and the metastasis process. High levels of certain proteases are associated with poor prognosis in various solid tumor cancers, such as pancreatic, gastric, breast and prostate cancers. RHB-107 was previously granted FDA Orphan Drug designation for the treatment of pancreatic cancer. RHB-107 presents a new non-cytotoxic approach to cancer therapy with several potential mechanisms of action to inhibit tumor invasion and metastasis. RHB-107 has undergone several Phase I studies and two Phase II proof-of-concept studies. The first Phase II study was in locally-advanced, non-metastatic pancreatic cancer and the second study in metastatic breast cancer in combination with first-line chemotherapeutic agents. RedHill was granted a new patent from the United States Patent and Trademark Office (USPTO) directed to a combination of RHB-107, YELIVA®, RedHill’s two Phase II-stage investigational compounds, and a known antibiotic. RedHill acquired the exclusive worldwide rights to RHB-107, excluding China, Hong Kong, Taiwan and Macao, from Germany’s Heidelberg Pharmaceuticals (formerly WILEX AG) for all indications.
Antwort auf Beitrag Nr.: 57.276.559 von NewKidOnTheBlog am 14.03.18 15:18:53Vielen Dank für die Links. Einige Arbeiten sind mir bereits bekannt, die restliche Literatur werde ich gelegentlich durchlesen. Hinsichtlich der Patentsituation, mit der ich mich noch nicht näher beschäftigt habe, fällt auf, dass zahlreiche Unternehmen Amatoxin-ADC´s zum Patent angemeldet haben (u.a. Novartis, Sorrento Therapeutics und Agensys). Da Du offensichtlich aus dem HDP-Umfeld stammst, könntest Du dazu evt. etwas Erhellendes schreiben. Wilex/HDP ist bekanntlich schon deutlich länger als ein Jahrzehnt mit Amatoxin-Themen befaßt ist, so dass vorstellbar ist, dass keine Schutzrechte mehr für Amatoxin als therapeutisches Toxin existieren.
Antwort auf Beitrag Nr.: 57.323.363 von Joschka Schröder am 19.03.18 20:10:48
http://heidelberg-pharma.com/wp-content/uploads/2011/02/2017…
Zur Patentsituation
Zur Patensituation habe ich auf der Heidelberg Pharma Webseite folgenden link gefunden. Vielleicht hilft das schon ein wenig weiter.http://heidelberg-pharma.com/wp-content/uploads/2011/02/2017…
Antwort auf Beitrag Nr.: 57.323.696 von BICYPAPA am 19.03.18 20:42:10Vielen Dank. Die Aussage "Einige noch anhängige Patentfamilien schützen Amanitin-Derivate und chemische
Bausteine, die für die chemische Synthese von ATACs notwendig sind" ist leider sehr allgemein gehalten. Da ich aktuell keine Zeit habe, sämtliche Patente, auch die der anderen Unternehmen, durchzulesen, kann NewKidOnTheBlog die Geschichte vielleicht etwas verkürzen. Andernfalls müßte man mal bei HDP nachfragen ... oder in den sauren Apfel beißen und doch noch alle Patentschriften selber durchlesen, wenn wieder mehr Zeit ist.
Bausteine, die für die chemische Synthese von ATACs notwendig sind" ist leider sehr allgemein gehalten. Da ich aktuell keine Zeit habe, sämtliche Patente, auch die der anderen Unternehmen, durchzulesen, kann NewKidOnTheBlog die Geschichte vielleicht etwas verkürzen. Andernfalls müßte man mal bei HDP nachfragen ... oder in den sauren Apfel beißen und doch noch alle Patentschriften selber durchlesen, wenn wieder mehr Zeit ist.
Antwort auf Beitrag Nr.: 57.323.696 von BICYPAPA am 19.03.18 20:42:10
Heidelberg Pharma veröffentlicht Finanzzahlen für das Geschäftsjahr 2017 und berichtet über den Geschäftsverlauf
- Finanzzahlen mit positiver Umsatzentwicklung im Rahmen der Planung
- Kapitalmaßnahmen 2017 sichern Finanzierung bis 2020
- Abschluss eines weltweiten Lizenzvertrags für Phase III-Kandidat REDECTANE(R) mit Telix
- ATAC-Technologie: Abschluss exklusiver Forschungsvereinbarungen mit Takeda und Magenta
- Vorbereitung von HDP-101 für die klinische Entwicklung in der Indikation Multiples Myelom läuft planmäßig
- Telefonkonferenz am 22. März 2018 um 13:00 Uhr MEZ
Finanzzahlen 2017
http://www.finanznachrichten.de/nachrichten-2018-03/43329990…Heidelberg Pharma veröffentlicht Finanzzahlen für das Geschäftsjahr 2017 und berichtet über den Geschäftsverlauf
- Finanzzahlen mit positiver Umsatzentwicklung im Rahmen der Planung
- Kapitalmaßnahmen 2017 sichern Finanzierung bis 2020
- Abschluss eines weltweiten Lizenzvertrags für Phase III-Kandidat REDECTANE(R) mit Telix
- ATAC-Technologie: Abschluss exklusiver Forschungsvereinbarungen mit Takeda und Magenta
- Vorbereitung von HDP-101 für die klinische Entwicklung in der Indikation Multiples Myelom läuft planmäßig
- Telefonkonferenz am 22. März 2018 um 13:00 Uhr MEZ
Hat jemand an der Telefonkonferenz von heute Mittag teilgenommen oder mitgehört? Wenn ja, würde etwas erzählt was so nicht im Geschäftsbericht steht oder ganz neu ist? Termin der Takeda-Entscheidung über die Moleküle zB??
Antwort auf Beitrag Nr.: 57.356.441 von Mogli3 am 22.03.18 15:45:57
habe gerade gesehen, daß der Mitschnitt der gestrigen Telko online ist und mir diese angehört.
Hier der Link: http://heidelberg-pharma.com/de/presse-investoren/kalender-u…
Damit Du es dir abkürzen kannst ... bis zur ca. 34 Minute wird die Päsenatation erläutert, dann folgen die Fragen.
Ausserdem wurde im Börsenradio gestern auch noch ein Interview veröffentlicht.
Hier auch der Link dazu: https://www.brn-ag.de/33786
Es läuft ....
Beste Grüße & schönes WE
Mitschnitt Telko ist Online
Hi Mogli3,habe gerade gesehen, daß der Mitschnitt der gestrigen Telko online ist und mir diese angehört.
Hier der Link: http://heidelberg-pharma.com/de/presse-investoren/kalender-u…
Damit Du es dir abkürzen kannst ... bis zur ca. 34 Minute wird die Päsenatation erläutert, dann folgen die Fragen.
Ausserdem wurde im Börsenradio gestern auch noch ein Interview veröffentlicht.
Hier auch der Link dazu: https://www.brn-ag.de/33786
Es läuft ....

Beste Grüße & schönes WE
Antwort auf Beitrag Nr.: 57.369.674 von behavior am 23.03.18 15:03:05Besten Dan
Börsenradio habe ich gehört, Telko dann nachher.
Börsenradio habe ich gehört, Telko dann nachher.
!
Dieser Beitrag wurde vom System automatisch gesperrt. Bei Fragen wenden Sie sich bitte an feedback@wallstreet-online.de
Antwort auf Beitrag Nr.: 57.369.674 von behavior am 23.03.18 15:03:05
http://www.ariva.de/forum/heidelberg-pharma-ag-551254
Aus irgendwelchen Gründen
Aus irgendwelchen Gründen wird der link zu dem Original Interview von W-O gesperrt. Es war nur der link mit einer Überschrift. Es ist ein Exclusiv Interview zur jetzigen Situation. Vielleicht geht es ja zu diesem link im anderen Board. Näheres könnt ihr dann dort entnehmen.http://www.ariva.de/forum/heidelberg-pharma-ag-551254
Antwort auf Beitrag Nr.: 57.388.712 von BICYPAPA am 26.03.18 16:23:00
http://www.finanznachrichten.de/nachrichten-2018-03/43395965…
Empfehlung HP
Neue Empfehlung von HP mit Kursziel 5,02€http://www.finanznachrichten.de/nachrichten-2018-03/43395965…
Antwort auf Beitrag Nr.: 57.420.467 von BICYPAPA am 29.03.18 10:44:42
Das war ein nettes Ostergeschenk.....
ATAC`s zeigen Potential – Zielkurs steigt
Vielen Dank für den Hinweis. Ich habe mir die 12- seitige Analyse durchgelesen und muss Dir gratulieren für den Optimismus. Hier können wir uns in der Zukunft auf interessante Kurssteigerungen freuen. Das war ein nettes Ostergeschenk.....
Antwort auf Beitrag Nr.: 57.423.557 von HKroll am 29.03.18 14:42:03
Heidelberg Pharma präsentiert proprietäre ATAC-Technologieplattform auf zwei wissenschaftlichen Konferenzen
Konferenz Präsentationen
http://www.ariva.de/news/heidelberg-pharma-praesentiert-prop…Heidelberg Pharma präsentiert proprietäre ATAC-Technologieplattform auf zwei wissenschaftlichen Konferenzen
Antwort auf Beitrag Nr.: 57.495.827 von BICYPAPA am 09.04.18 09:19:54
Somit erhalten wir in dieser Woche wieder ein paar wichtige Meldungen. Am Donnerstag erhalten wir dazu noch die Quartalszahlen in 2018.
Grüße und weiterhin positive Zahlen und Aussichten für unseren kleinen Wert!!!
Dankeschön!!
Vielen Dank für Deine wichtige Information.Somit erhalten wir in dieser Woche wieder ein paar wichtige Meldungen. Am Donnerstag erhalten wir dazu noch die Quartalszahlen in 2018.
Grüße und weiterhin positive Zahlen und Aussichten für unseren kleinen Wert!!!
Antwort auf Beitrag Nr.: 57.495.827 von BICYPAPA am 09.04.18 09:19:54
Quartalszahlen Q1
http://www.ariva.de/news/heidelberg-pharma-ag-zwischenmittei…
Antwort auf Beitrag Nr.: 57.523.694 von BICYPAPA am 12.04.18 08:40:06
http://www.telixpharma.com/investors/asx-announcements/
Telix Update Redectane
Europa Redectane startet bald. USA Start von Redectane wahrscheinlich später gegen Ende des Jahres.http://www.telixpharma.com/investors/asx-announcements/
Antwort auf Beitrag Nr.: 57.578.583 von BICYPAPA am 19.04.18 07:03:19
TLX 250
For our lead program, TLX-250 imaging in renal cancer, we were able to file our first IMPD or clinical trial “application” to EMA before Christmas and we are awaiting the first patients into the Phase III bridging study as I speak. The Phase III program itself is in the final stages of clinical protocol development, site selection and manufacturing and we expect this to be launched by mid-year. We will start in Europe but will add US and potentially Australian sites later in the year. The associated therapy program will move ahead in a similar time frame and we are currently preparing to manufacture the material for the therapy studies.
Antwort auf Beitrag Nr.: 57.181.155 von infomi am 04.03.18 12:06:35Der aktuelle Kursverlauf zeigt, wer hier Fachmann ist. Vergiß die anderen.
Antwort auf Beitrag Nr.: 57.108.582 von Joschka Schröder am 24.02.18 10:41:13
Volltreffer
Zitat von Joschka Schröder: Amanitin lässt einem nicht viele Möglichkeiten. Insoweit ist nachvollziehbar, dass sie sich für BCMA als Target entschieden haben. Ob sich das wirtschaftlich rechnen wird, ist eine andere Frage.
Ein Investment in Heidelberg Pharma ist mit enormen Risiken behaftet. Für mich wäre das Chance-Risiko-Verhältnis jedenfalls nichts.
Antwort auf Beitrag Nr.: 57.604.491 von j-schroeder-fan am 23.04.18 10:02:46So negativ, wie von Dir offenbar verstanden, sehe ich die Sache nicht.
Natürlich ist HDP ein Risiko-Investment und es bleibt z.B. abzuwarten, ob der Linker wie gewünscht funktioniert, wie dicht die Patentsituation ist (z.B. haben Novartis und ein anderes Unternehmen eigene Patente auf Amatoxin-ADCs angemeldet) usw ... den Grundgedanken, Antikörper gegen ganz spezielle (!) Targets wie BCMA oder CD19 mit Amanitin-Toxinen zu konjugieren, halte ich aber für gut und aussichtsreich (bei PSMA machen ATACs dagegen meines Erachtens wenig Sinn). Deshalb verfolge ich auch interessiert die weitere Unternehmensentwicklung.
Natürlich ist HDP ein Risiko-Investment und es bleibt z.B. abzuwarten, ob der Linker wie gewünscht funktioniert, wie dicht die Patentsituation ist (z.B. haben Novartis und ein anderes Unternehmen eigene Patente auf Amatoxin-ADCs angemeldet) usw ... den Grundgedanken, Antikörper gegen ganz spezielle (!) Targets wie BCMA oder CD19 mit Amanitin-Toxinen zu konjugieren, halte ich aber für gut und aussichtsreich (bei PSMA machen ATACs dagegen meines Erachtens wenig Sinn). Deshalb verfolge ich auch interessiert die weitere Unternehmensentwicklung.
DGAP-DD: Heidelberg Pharma AG deutsch
24.04.2018 - 13:39 | Quelle: DGAP | Lesedauer etwa 2 min. | Text vorlesen
facebook google+ twitter
Meldung und öffentliche Bekanntgabe der Geschäfte von Personen, die Führungsaufgaben wahrnehmen, sowie in enger Beziehung zu ihnen stehenden Personen
24.04.2018 / 13:38
Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
1. Angaben zu den Personen, die Führungsaufgaben wahrnehmen, sowie zu den in enger Beziehung zu ihnen stehenden Personen
a) Name
Titel: Prof. Dr.
Vorname: Andreas
Nachname(n): Pahl
2. Grund der Meldung
a) Position / Status
Position: Vorstand
b) Erstmeldung
3. Angaben zum Emittenten, zum Teilnehmer am Markt für Emissionszertifikate, zur Versteigerungsplattform, zum Versteigerer oder zur Auktionsaufsicht
a) Name
Heidelberg Pharma AG
b) LEI
391200E09XYBYITR1W32
4. Angaben zum Geschäft/zu den Geschäften
a) Beschreibung des Finanzinstruments, Art des Instruments, Kennung
Art: Aktie
ISIN: DE000A11QVV0
b) Art des Geschäfts
Annahme der Gewährung von 100.600 Aktienoptionen im Rahmen des Aktienoptionsprogramms 2017 für Mitarbeiter und Vorstandsmitglieder der Heidelberg Pharma AG. Die Ausübbarkeit der Aktienoptionen hängt u.a. von dem Ablauf der vierjährigen Wartefrist, dem Eintritt eines Erfolgsziels sowie der Zahlung des Ausübungspreises ab. Der Ausübungspreis der jeweiligen Aktienoption entspricht dem Durchschnittskurs der Heidelberg Pharma Aktie der letzten 10 Börsenhandelstage vor dem Ausgabetag.
Geschäft i.R. eines Mitarbeiterbeteiligungsprogramms
c) Preis(e) und Volumen
Preis(e) Volumen
0,0 EUR 0,0 EUR
d) Aggregierte Informationen
Preis Aggregiertes Volumen
0,0 EUR 0,0 EUR
e) Datum des Geschäfts
2018-04-23; UTC+2
f) Ort des Geschäfts
Außerhalb eines Handelsplatzes
24.04.2018 Die DGAP Distributionsservices umfassen gesetzliche Meldepflichten, Corporate News/Finanznachrichten und Pressemitteilungen.
Medienarchiv unter http://www.dgap.de
Sprache: Deutsch
Unternehmen: Heidelberg Pharma AG
Schriesheimer Str. 101
68526 Ladenburg
Deutschland
Internet: www.heidelberg-pharma.com
Ende der Mitteilung DGAP News-Service
42027 24.04.2018
24.04.2018 - 13:39 | Quelle: DGAP | Lesedauer etwa 2 min. | Text vorlesen
facebook google+ twitter
Meldung und öffentliche Bekanntgabe der Geschäfte von Personen, die Führungsaufgaben wahrnehmen, sowie in enger Beziehung zu ihnen stehenden Personen
24.04.2018 / 13:38
Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
1. Angaben zu den Personen, die Führungsaufgaben wahrnehmen, sowie zu den in enger Beziehung zu ihnen stehenden Personen
a) Name
Titel: Prof. Dr.
Vorname: Andreas
Nachname(n): Pahl
2. Grund der Meldung
a) Position / Status
Position: Vorstand
b) Erstmeldung
3. Angaben zum Emittenten, zum Teilnehmer am Markt für Emissionszertifikate, zur Versteigerungsplattform, zum Versteigerer oder zur Auktionsaufsicht
a) Name
Heidelberg Pharma AG
b) LEI
391200E09XYBYITR1W32
4. Angaben zum Geschäft/zu den Geschäften
a) Beschreibung des Finanzinstruments, Art des Instruments, Kennung
Art: Aktie
ISIN: DE000A11QVV0
b) Art des Geschäfts
Annahme der Gewährung von 100.600 Aktienoptionen im Rahmen des Aktienoptionsprogramms 2017 für Mitarbeiter und Vorstandsmitglieder der Heidelberg Pharma AG. Die Ausübbarkeit der Aktienoptionen hängt u.a. von dem Ablauf der vierjährigen Wartefrist, dem Eintritt eines Erfolgsziels sowie der Zahlung des Ausübungspreises ab. Der Ausübungspreis der jeweiligen Aktienoption entspricht dem Durchschnittskurs der Heidelberg Pharma Aktie der letzten 10 Börsenhandelstage vor dem Ausgabetag.
Geschäft i.R. eines Mitarbeiterbeteiligungsprogramms
c) Preis(e) und Volumen
Preis(e) Volumen
0,0 EUR 0,0 EUR
d) Aggregierte Informationen
Preis Aggregiertes Volumen
0,0 EUR 0,0 EUR
e) Datum des Geschäfts
2018-04-23; UTC+2
f) Ort des Geschäfts
Außerhalb eines Handelsplatzes
24.04.2018 Die DGAP Distributionsservices umfassen gesetzliche Meldepflichten, Corporate News/Finanznachrichten und Pressemitteilungen.
Medienarchiv unter http://www.dgap.de
Sprache: Deutsch
Unternehmen: Heidelberg Pharma AG
Schriesheimer Str. 101
68526 Ladenburg
Deutschland
Internet: www.heidelberg-pharma.com
Ende der Mitteilung DGAP News-Service
42027 24.04.2018
DGAP-DD: Heidelberg Pharma AG deutsch
24.04.2018 - 13:35 | Quelle: DGAP | Lesedauer etwa 2 min. | Text vorlesen
facebook google+ twitter
Meldung und öffentliche Bekanntgabe der Geschäfte von Personen, die Führungsaufgaben wahrnehmen, sowie in enger Beziehung zu ihnen stehenden Personen
24.04.2018 / 13:34
Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
1. Angaben zu den Personen, die Führungsaufgaben wahrnehmen, sowie zu den in enger Beziehung zu ihnen stehenden Personen
a) Name
Titel: Dr.
Vorname: Jan
Nachname(n): Schmidt-Brand
2. Grund der Meldung
a) Position / Status
Position: Vorstand
b) Erstmeldung
3. Angaben zum Emittenten, zum Teilnehmer am Markt für Emissionszertifikate, zur Versteigerungsplattform, zum Versteigerer oder zur Auktionsaufsicht
a) Name
Heidelberg Pharma AG
b) LEI
391200E09XYBYITR1W32
4. Angaben zum Geschäft/zu den Geschäften
a) Beschreibung des Finanzinstruments, Art des Instruments, Kennung
Art: Aktie
ISIN: DE000A11QVV0
b) Art des Geschäfts
Annahme der Gewährung von 100.600 Aktienoptionen im Rahmen des Aktienoptionsprogramms 2017 für Mitarbeiter und Vorstandsmitglieder der Heidelberg Pharma AG. Die Ausübbarkeit der Aktienoptionen hängt u.a. von dem Ablauf der vierjährigen Wartefrist, dem Eintritt eines Erfolgsziels sowie der Zahlung des Ausübungspreises ab. Der Ausübungspreis der jeweiligen Aktienoption entspricht dem Durchschnittskurs der Heidelberg Pharma Aktie der letzten 10 Börsenhandelstage vor dem Ausgabetag.
Geschäft i.R. eines Mitarbeiterbeteiligungsprogramms
c) Preis(e) und Volumen
Preis(e) Volumen
0,0 EUR 0,0 EUR
d) Aggregierte Informationen
Preis Aggregiertes Volumen
0 EUR 0,0000 EUR
e) Datum des Geschäfts
2018-04-23; UTC+2
f) Ort des Geschäfts
Außerhalb eines Handelsplatzes
24.04.2018 Die DGAP Distributionsservices umfassen gesetzliche Meldepflichten, Corporate News/Finanznachrichten und Pressemitteilungen.
Medienarchiv unter http://www.dgap.de
Sprache: Deutsch
Unternehmen: Heidelberg Pharma AG
Schriesheimer Str. 101
68526 Ladenburg
Deutschland
Internet: www.heidelberg-pharma.com
Ende der Mitteilung DGAP News-Service
42023 24.04.2018
24.04.2018 - 13:35 | Quelle: DGAP | Lesedauer etwa 2 min. | Text vorlesen
facebook google+ twitter
Meldung und öffentliche Bekanntgabe der Geschäfte von Personen, die Führungsaufgaben wahrnehmen, sowie in enger Beziehung zu ihnen stehenden Personen
24.04.2018 / 13:34
Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
1. Angaben zu den Personen, die Führungsaufgaben wahrnehmen, sowie zu den in enger Beziehung zu ihnen stehenden Personen
a) Name
Titel: Dr.
Vorname: Jan
Nachname(n): Schmidt-Brand
2. Grund der Meldung
a) Position / Status
Position: Vorstand
b) Erstmeldung
3. Angaben zum Emittenten, zum Teilnehmer am Markt für Emissionszertifikate, zur Versteigerungsplattform, zum Versteigerer oder zur Auktionsaufsicht
a) Name
Heidelberg Pharma AG
b) LEI
391200E09XYBYITR1W32
4. Angaben zum Geschäft/zu den Geschäften
a) Beschreibung des Finanzinstruments, Art des Instruments, Kennung
Art: Aktie
ISIN: DE000A11QVV0
b) Art des Geschäfts
Annahme der Gewährung von 100.600 Aktienoptionen im Rahmen des Aktienoptionsprogramms 2017 für Mitarbeiter und Vorstandsmitglieder der Heidelberg Pharma AG. Die Ausübbarkeit der Aktienoptionen hängt u.a. von dem Ablauf der vierjährigen Wartefrist, dem Eintritt eines Erfolgsziels sowie der Zahlung des Ausübungspreises ab. Der Ausübungspreis der jeweiligen Aktienoption entspricht dem Durchschnittskurs der Heidelberg Pharma Aktie der letzten 10 Börsenhandelstage vor dem Ausgabetag.
Geschäft i.R. eines Mitarbeiterbeteiligungsprogramms
c) Preis(e) und Volumen
Preis(e) Volumen
0,0 EUR 0,0 EUR
d) Aggregierte Informationen
Preis Aggregiertes Volumen
0 EUR 0,0000 EUR
e) Datum des Geschäfts
2018-04-23; UTC+2
f) Ort des Geschäfts
Außerhalb eines Handelsplatzes
24.04.2018 Die DGAP Distributionsservices umfassen gesetzliche Meldepflichten, Corporate News/Finanznachrichten und Pressemitteilungen.
Medienarchiv unter http://www.dgap.de
Sprache: Deutsch
Unternehmen: Heidelberg Pharma AG
Schriesheimer Str. 101
68526 Ladenburg
Deutschland
Internet: www.heidelberg-pharma.com
Ende der Mitteilung DGAP News-Service
42023 24.04.2018
Antwort auf Beitrag Nr.: 57.369.674 von behavior am 23.03.18 15:03:05
Ja, es läuft. Rückwärts!
Zitat von behavior: Hi Mogli3,
habe gerade gesehen, daß der Mitschnitt der gestrigen Telko online ist und mir diese angehört.
Hier der Link: http://heidelberg-pharma.com/de/presse-investoren/kalender-u…
Damit Du es dir abkürzen kannst ... bis zur ca. 34 Minute wird die Päsenatation erläutert, dann folgen die Fragen.
Ausserdem wurde im Börsenradio gestern auch noch ein Interview veröffentlicht.
Hier auch der Link dazu: https://www.brn-ag.de/33786
Es läuft ....
Beste Grüße & schönes WE
Antwort auf Beitrag Nr.: 57.192.970 von Mogli3 am 05.03.18 20:15:37
Die Investorengemeinde hat was gemerkt und verkauft. Leider ist es kein Juwel!
Zitat von Mogli3: Ich bin dann gespannt wann die Biotech-Investorengemeinde merkt dass hier ein Juwel heranwächst. Eine Kursentwicklung wie bei. 4SC ist überfällig.
Antwort auf Beitrag Nr.: 57.623.922 von j-schroeder-fan am 25.04.18 12:22:33Wer bei Biotech keine Geduld hat ist sowieso fehl am Platz. Umsätze sehr gering, Kurse werden zur Zeit bis zur nächsten positiven Meldung nur von Daytradern gemacht, Aktien werden hin und her geschoben. Wer sich in Biotech auskennt dem sind solche Kursverläufe bestens gekannt. Nur keine Sorge!
Hochverehrte Daytrader,
dafür, dass Ihr bei dem Chart vom 14. März diesen Jahres (3,49) bis heute (um die 2,70) verdient habt, zolle ich Euch meinen größten Respekt. Man lernt nie aus.
dafür, dass Ihr bei dem Chart vom 14. März diesen Jahres (3,49) bis heute (um die 2,70) verdient habt, zolle ich Euch meinen größten Respekt. Man lernt nie aus.
Antwort auf Beitrag Nr.: 57.624.108 von Mogli3 am 25.04.18 12:43:29
Es ist immer schwer den optimalen Kaufpunkt zu erwischen. Besonders dann, wenn man dann noch sehr überzeugt ist. Ich versuch dann immer ein wenig auf den Chart zu schauen . HP legt gerade eine Rutschbahn hin. Da würde ich im Chartbild eine Bodenbildung abwarten. Es sind auch enorme Stückzahlen für HP die geworfen werden.
BICIPAPA stimme ich eher zu
Zitat vom 23.04.:Es ist immer schwer den optimalen Kaufpunkt zu erwischen. Besonders dann, wenn man dann noch sehr überzeugt ist. Ich versuch dann immer ein wenig auf den Chart zu schauen . HP legt gerade eine Rutschbahn hin. Da würde ich im Chartbild eine Bodenbildung abwarten. Es sind auch enorme Stückzahlen für HP die geworfen werden.
Antwort auf Beitrag Nr.: 56.575.321 von behavior am 30.12.17 17:59:53
Zitat von behavior: Vielen Dank für Deine umfassende Recherche und Dein steht's wachsames Auge auf alles was sich mit, für und um Heidelberg Pharma dreht! Ich habe alle Beiträge steht's sehr aufmerksam gelesen ... Bitte weiter so
Auch allen anderen konstruktiven Begleitern wie NewKid, Mogli, etc. Vielen Dank für Eure Beiträge in 2017! Es waren ja einige Unker und Kleingeister hier im HDP Board unterwegs, welche trotz unserer Mühe und warum auch immer die neue HDP Story nicht verstehen wollten / verstanden haben.
Das Jahr 2016/17 war die Transformation unserer alten Wilex in die zukunftsweisende Positionierung und Technologie der neuen HDP. Das Jahr 2018 wird m.E. das Fundament von HDP als innovativer beachtenswerter Player / Börsenwert mit einzigartiger Technologie im ADC Markt bilden (i.w. durch weitere Abschlüsse mit namenhaften Pharma-Adressen, Start der Klinik HDP-101, detaillierte Infos zum eigenen Biomarker, Zwischeninfo zum Fortschritt / Wirkung zum Takeda Deal und einer wirksamen Presse/IR). Parallel werden wir in 2018 zum Fortschritt der auslizensierten Produkte einiges Neues erfahren (mein Hoffnungsträger mit erheblichem finanziellem Potential: Redectane).
Das Interview im Aktionär gibt eine (nur ausschnittsweise) Vorahnung was hier mit HDP noch in den nächsten 3-5 Jahren möglich ist ... wenn sie solange überhaupt als eigenständiges Unternehmen auftreten werden.
Ich glaube wir werden noch viel Freude an unserem "alten" Baby haben
Auf ein gesundes und erfolgreiches Jahr 2018!
Antwort auf Beitrag Nr.: 57.637.848 von j-schroeder-fan am 26.04.18 18:28:02
Unker und Kleingeister
liegen manchmal richtig! Hochmut kommt vor dem Fall von HDP fast auf den letzten Bezugspreis!
Antwort auf Beitrag Nr.: 57.637.911 von j-schroeder-fan am 26.04.18 18:32:26Hast du auch einen konstruktiven Beitrag zu bieten? Als JS-Fan solltest du dich ja eigentlich vom Auf und Ab bei Biotech- Aktien auskennen und was den Kurs bewegt.
Antwort auf Beitrag Nr.: 57.638.370 von Mogli3 am 26.04.18 19:16:13
Wir lieben unsere HDP-Aktien bis in den Tod ?
Konstruktiv ist für mich, auf die falschen Aussagen von "Sekten"-Pushern hinzuweisen. Ist der "Sektenführer" aus dem Dschungelbuch angesäuert ob des Auseinandernehmens seiner "Sektenmitglieder"? Ich kenne kein Forum, wo soviel Lobhudelei auf einen müffenden Haufen zusammenkommt. Eine Null zu viel?
Zitat mogli 5.2.18:"Warte in Johannesburg auf den Flieger, habe also Zeit zu m schreiben. Mit den 75% kann jetzt Hopp so gut wie alles bestimmen. Konnte er aber praktisch auch mit 70%!! Ich rechne nicht damit dass er ein Übernahmeangebot macht, hätte er doch schon längst gekonnt. UCB und Gerber haben zusammen wahrscheinlich über 5% und viele der restlichen 20% werden aufgrund der sehr guten Aussichten nicht verkaufen auch zu zB 8-10€ nicht. Er würde also so schnell nicht über die 95% kommen. Hopp‘ Anteil ist ja nur so hoch weil er immer den Rest aus den KE hat nehmen müssen! Für mich sind die 75% von Hopp eine Versicherung dass kein Großer ein tiefes Übernahmeangebot machen kann denn Hopp verkauft nicht unter 20-30€! Die 3 von jetzt waren ja mal 12€ vor dem Splitt und Hopp hat auch Aktien erworben die höher als 12€ liegen. Kapitelmassnahmen sind in den nächsten 2 Jahren nicht nötig. Ich bin fast sicher Hopp wartet die Forschungen jetzt einfach ab und wartet wie wir auf ein sehr hohes Übernahmeangebot."
20 bis 30 Euro! Warten in Johannesburg! Man könnte es auch großmäulig nennen. Das habe ich in den Foren bei Paion Molo oder Epi nicht erlebt. Klingt eins zu eins nach K.A.
Nur einer staunt bei 2,60 (in etwa jetziger Kurs)
Zitat mogli30:"Es ist schon erstaunlich Wieviele ihre frisch erworbenen Titel ( zu 2.60) so schnell auf den Markt werfen. Die Firma ist jetzt doch mindestens zwei Jahre durch finanziert und die vor Tagen gemeldeten Ergebnisse vielversprechend. Die Aktien wurden aber ohne Probleme aufgesogen, allerdings zu einem gedrückten Preis, selber schuld!! Nehme an dass vom Kongress in Atlanta ( 9.-12.12) wieder eine PM erfolgt und der Kurs wieder deutlich über 3 Euro steigt."
Die waren alle cleverer als die HDP-"Sekte"!
Antwort auf Beitrag Nr.: 57.639.450 von j-schroeder-fan am 26.04.18 20:38:14Schön das du weg warst ja-Fan...
Antwort auf Beitrag Nr.: 57.639.450 von j-schroeder-fan am 26.04.18 20:38:14Das Zitat ist vom 22.11.2017. Die genannten 3 Euro sind inzwischen ein Witz.
Ach ja: Konstruktiv an meinen Hinweisen ist die von mir gewollte Abschreckung, die Aktie NUR auf Grund der "Sekten"Mitglieder zu kaufen.
Ach ja: Konstruktiv an meinen Hinweisen ist die von mir gewollte Abschreckung, die Aktie NUR auf Grund der "Sekten"Mitglieder zu kaufen.
Antwort auf Beitrag Nr.: 57.639.507 von Diabolo2018 am 26.04.18 20:43:48Klar, keiner der die Lobhudelei in Frage stellt. Ihr versündigt Euch an den schlichten Lesern.
Antwort auf Beitrag Nr.: 57.639.549 von j-schroeder-fan am 26.04.18 20:47:06Beschreib mal bitte deine weiteren Symptome...evtl. kann man Dir noch helfen...
Antwort auf Beitrag Nr.: 57.639.549 von j-schroeder-fan am 26.04.18 20:47:06Sei mir nicht bös, aber als besonders konstruktiv empfinde ich Deine Beiträge nicht. Sinn des Forums sollte doch eigentlich sein, sachbezogen über Unternehmen zu diskutieren.
Antwort auf Beitrag Nr.: 57.639.531 von j-schroeder-fan am 26.04.18 20:45:31
Die von dir gewollte Abschreckung - interessant.
Übrigens, die Namensanlehnung an einen anderen Forumsteilnehmer gab es hier schon mal - na klingelt es - ist nich nicht lange her, der hat immer auf newkid geschimpft.. aber inhaltlich was verwertbares hat der nicht gebracht.
Zur Info: da istjemand mit 75% beteiligt undead mit Absicht, und so wie ich das sehe, um gewisse Dinge komplett zu unterbinden oder allein zu entscheiden - alles im positiven Sinne - unddas gefällt jemand anderem nicht.
Ab auf Ignore mit den xyz- Fans hier und gut ist.
Zitat von j-schroeder-fan: Das Zitat ist vom 22.11.2017. Die genannten 3 Euro sind inzwischen ein Witz.
Ach ja: Konstruktiv an meinen Hinweisen ist die von mir gewollte Abschreckung, die Aktie NUR auf Grund der "Sekten"Mitglieder zu kaufen.
Die von dir gewollte Abschreckung - interessant.
Übrigens, die Namensanlehnung an einen anderen Forumsteilnehmer gab es hier schon mal - na klingelt es - ist nich nicht lange her, der hat immer auf newkid geschimpft.. aber inhaltlich was verwertbares hat der nicht gebracht.
Zur Info: da istjemand mit 75% beteiligt undead mit Absicht, und so wie ich das sehe, um gewisse Dinge komplett zu unterbinden oder allein zu entscheiden - alles im positiven Sinne - unddas gefällt jemand anderem nicht.
Ab auf Ignore mit den xyz- Fans hier und gut ist.
!
Dieser Beitrag wurde von CommunityAssistance moderiert. Grund: themenfremder InhaltZur Erinnerung - selbst da lag der Kurs höher als heute
Wilex: Verluste steigen, Aktie nach Gewinnwarnung schwachExklusive News per Mail:
Ich habe die Informationen zum Datenschutz zur Kenntnis genommen.
Wir geben ihre Mailadresse nicht weiter! Sie können den Newsletter jederzeit abbestellen.
Nachricht vom 10.10.2017 10.10.2017 (www.4investors.de) - Die Wilex Aktie leidet am Dienstagvormittag unter einer Gewinnwarnung, die das Biotechunternehmen gestern Abend veröffentlicht hat (siehe Link unten). Aktuell notiert der Aktienkurs der Süddeutschen im XETRA-Handel der Frankfurter Börse bei 2,80 Euro mit 5,28 Prozent im Minus. Neben der Gewinnwarnung für 2017 hat Wilex zudem Zahlen für die ersten neun Monate des laufenden Jahres vorgelegt.
Den Umsatz hat das Unternehmen von 1,10 Millionen Euro auf 1,39 Millionen Euro gesteigert. Gestiegene betriebliche Aufwendungen sowie höhere Forschungs- und Entwicklungskosten haben allerdings den operativen Neunmonatsverlust bei Wilex von 4,11 Millionen Euro auf 7,62 Millionen Euro anschwellen lassen. Unter dem Strich meldet der Konzern je Wilex Aktie ein Minus von 0,55 Euro nach zuvor 0,35 Euro. Wilex beziffert die liquiden Mittel per Quartalsende auf 4,5 Millionen Euro. „Unberücksichtigt der Finanzierungskomponente aus den Kapitalerhöhungen 2017 und 2016 hatte WILEX in den ersten neun Monaten somit einen durchschnittlichen monatlichen Finanzmittelabfluss von 0,56 Millionen Euro (Vorjahr: 0,51 Mio. Euro) zu verzeichnen”, so das Unternehmen weiter.
Antwort auf Beitrag Nr.: 57.642.102 von j-schroeder-fan am 27.04.18 08:15:25
Und was ist nicht in ordnung am kurs von heute - hast du nicht verstanden, dass man hier biotech-Forschung betreibt die geld kostet und die - AUSSCHLUSSLICH bei positiven ergebnissen dieser forschung - erst später geld und Kurssteigerungen bringen?
Da scheint mir eine FALSCHE Erwartungshaltung Grund des Schreibens zu sein. Es gibt im Moment gar keinen grund, warum der Kurs steigen sollte. Den gibt es aber wenn einer der Optionen aus den lizenzdeals - lese diese mal - tatsächlich umgesetzt wird (wenn, das bleibt abzuwarten).
Zitat von j-schroeder-fan: Wilex: Verluste steigen, Aktie nach Gewinnwarnung schwach
Exklusive News per Mail:
Ich habe die Informationen zum Datenschutz zur Kenntnis genommen.
Wir geben ihre Mailadresse nicht weiter! Sie können den Newsletter jederzeit abbestellen.
Nachricht vom 10.10.2017 10.10.2017 (www.4investors.de) - Die Wilex Aktie leidet am Dienstagvormittag unter einer Gewinnwarnung, die das Biotechunternehmen gestern Abend veröffentlicht hat (siehe Link unten). Aktuell notiert der Aktienkurs der Süddeutschen im XETRA-Handel der Frankfurter Börse bei 2,80 Euro mit 5,28 Prozent im Minus. Neben der Gewinnwarnung für 2017 hat Wilex zudem Zahlen für die ersten neun Monate des laufenden Jahres vorgelegt.
Den Umsatz hat das Unternehmen von 1,10 Millionen Euro auf 1,39 Millionen Euro gesteigert. Gestiegene betriebliche Aufwendungen sowie höhere Forschungs- und Entwicklungskosten haben allerdings den operativen Neunmonatsverlust bei Wilex von 4,11 Millionen Euro auf 7,62 Millionen Euro anschwellen lassen. Unter dem Strich meldet der Konzern je Wilex Aktie ein Minus von 0,55 Euro nach zuvor 0,35 Euro. Wilex beziffert die liquiden Mittel per Quartalsende auf 4,5 Millionen Euro. „Unberücksichtigt der Finanzierungskomponente aus den Kapitalerhöhungen 2017 und 2016 hatte WILEX in den ersten neun Monaten somit einen durchschnittlichen monatlichen Finanzmittelabfluss von 0,56 Millionen Euro (Vorjahr: 0,51 Mio. Euro) zu verzeichnen”, so das Unternehmen weiter.
Und was ist nicht in ordnung am kurs von heute - hast du nicht verstanden, dass man hier biotech-Forschung betreibt die geld kostet und die - AUSSCHLUSSLICH bei positiven ergebnissen dieser forschung - erst später geld und Kurssteigerungen bringen?
Da scheint mir eine FALSCHE Erwartungshaltung Grund des Schreibens zu sein. Es gibt im Moment gar keinen grund, warum der Kurs steigen sollte. Den gibt es aber wenn einer der Optionen aus den lizenzdeals - lese diese mal - tatsächlich umgesetzt wird (wenn, das bleibt abzuwarten).
Interessanter Artikel aus dem Tagesspiegel vom 16.04. (mit Hinweis auf Hopp):
In Deutschland werde das Potential der Branche nicht genutzt, heißt es in einer Studie von Ernst&Young. Experten fordern mehr Unterstützung von der Bundesregierung. ROLF OBERTREISEine Laborassistentin der Berliner Biotech-Firma Noxxon Pharma AG bei der Arbeit.
Eine Laborassistentin der Berliner Biotech-Firma Noxxon Pharma AG bei der Arbeit.FOTO: KAI-UWE HEINRICH
Rekorde beim Umsatz, bei der Beschäftigung und bei der Finanzierung - und trotzdem hinkt die deutsche Biotechnologie-Branche im Vergleich zu anderen Länder in Europa hinterher. Der Abstand zu den USA hat sich in den letzten 20 Jahren sogar noch vergrößert. „Das ist erschütternd. Der große Sprung der Branche in Deutschland nach vorne bleibt aus“, sagte Siegfried Bialojan, Experte vom Life Science Center der Unternehmensberatung Ernst&Young.
Am Montag legte er zusammen mit Peter Heinrich, Chef des Branchenverbandes BIO Deutschland, in Frankfurt den jüngsten Biotechnologie-Report vor. In Deutschland werde das Potential der Branche und der Wissenschaft bei weitem nicht genutzt. Von der neuen Bundesregierung fordern die beiden Experten deutlich mehr Unterstützung, etwa eine breiter aufgestellte Forschungsförderung.
Enttäuschung trotz neuem Rekord
Auf den ersten Blick sehen die Zahlen der Branche für das vergangene Jahr gut aus. Der Umsatz der rund 650 deutschen Biotech-Firmen mit ihren 25.900 Beschäftigten (plus 12 Prozent) kletterte um acht Prozent auf den neuen Rekordwert von vier Milliarden Euro. Die Finanzierung stieg sogar um mehr als ein Drittel auf den Höchstwert von 627 Millionen Euro. Der größte Teil entfiel mit 340 Millionen aber auf Kapitalerhöhungen. Dagegen wagte nur eine einzige deutsche Biotech-Firma den Sprung an die Börse und dies an der US-Technologie-Börse Nasdaq - das Jenaer Unternehmen InflaRx erlöste rund 86 Millionen Euro.
Trotzdem ist man in der Branche über die Entwicklung enttäuscht. Die Zahl neuer Biotechfirmen steigt nur langsam. Generell waren die Wachstumsraten in den vergangenen Jahren höher. Zum anderen schrumpfte das Risiko-Kapital für junge Biotech-Start-Up-Unternehmen von 213 auf 201 Millionen Euro. Auch die Investitionen in Forschung und Entwicklung gingen um drei Prozent auf 1,2 Milliarden Euro zurück.
Ganz anders sieht es nach Angaben von Bialojan in anderen Ländern Europas aus. In Frankreich machten Risikokapital-Geber für die Biotechs im vergangenen Jahr 250 Millionen Euro locker, ein Plus von 85 Prozent. In Großbritannien waren es 672 und in der Schweiz 450 Millionen Euro. Und in Europa gab es insgesamt 27 Börsengänge von Biotech-Firmen. Die Kluft zu den USA wächst weiter: Dort wurden im vergangenen Jahr 2,56 Milliarden Dollar neu für Biotech-Firmen bereitgestellt. 29 Firmen gingen an die Börse.
Die meisten Neugründungen in Berlin und Potsdam
Wenn in Deutschland in Biotechfirmen investiert wird, kommt das Geld meist von ausländischen Fonds und Investoren. Von deutscher Seite aktiv waren dem Report zufolge im vergangenen Jahr unter anderem dievini Hopp BioTech (des SAP-Gründers Dietmar Hopp), Boehringer Ingelheim und Evotec. Die meisten Neugründungen von Biotechfirmen gab es 2016 und 2017 mit sechs in Berlin/Potsdam und in München (zusammen mit Planegg, Starnberg und Martinsried). In Baden-Württemberg waren es fünf, in Ostdeutschland dagegen nur drei.
Lebensmittel
Deutsche Biotech-Firma fahndet in China nach falschen Cornflakes
Damit die Frühstücksflocken als Cornflakes bezeichnet werden können, müssen sie aus Mais hergestellt werden.
Reinhart Bünger
Bialojan und Heinrich zufolge bedarf es eines gemeinsamen Engagements von Politik und Gesellschaft, um die Branche endlich richtig nach vorne zu bringen. „Wir brauchen einen Ruck“. Es gehe um Innovationen getragen von Forschung, Unternehmergeist und Kapitalverfügbarkeit. Die beiden Experten setzen dabei auf die neue Bundesregierung. Immerhin hat sich der neue Wirtschaftsminister Peter Altmaier (CDU) zum nächsten Branchentreffen angesagt.
Mehr lesen? Jetzt E-Paper gratis testen!
zur Startseite
AUTOR
Rolf Obertreis
Folgen Sie dem Autoren auf Twitter
Meistgelesen
Die Eisbären Berlin in der...
Petri Vehanen beendet die KarriereDas war das letzte Spiel. Mit 40 Jahren beendet Petri Vehanen seine Karriere.
Deniz Yücel
"Ich hätte mir eine Wortmeldung aus der Wirtschaft...Deniz Yücel während eines frühen Auftritts bei "Maybrit Illner" im Jahr 2016.
Antisemitismus-Debatte im...
Berliner FDP-Abgeordneter tritt als...Der Abgeordnete Marcel Luthe (FDP) spricht bei der Sitzung des Berliner Abgeordnetenhauses.
Wohnungsnot in der Hauptstadt
Berlins Wohnungsbau kommt nicht voranEs wird gebaut in Berlin, aber nicht genug.
1
Artikel drucken
Per Mail versenden
Präsentation
https://www.dgap.de/dgap/News/corporate/heidelberg-pharma-he…Heidelberg Pharma präsentiert auf anstehenden Konferenzen und Investorenveranstaltungen
Ladenburg, 30. April 2018 - Die Heidelberg Pharma AG (FWB: WL6) gab heute bekannt, dass sie an anstehenden Konferenzen und Investorenveranstaltungen teilnehmen und das Unternehmen sowie seine proprietäre ATAC-Technologie präsentieren wird. Das Management von Heidelberg Pharma steht bei diesen Veranstaltungen für Einzelgespräche zur Verfügung.
14th Annual PEGS: The Essential Protein Engineering Summit
Datum: 30. April - 4. Mai 2018
Veranstaltungsort: Seaport World Trade Center, Boston, USA
Prof. Andreas Pahl, Vorstand für Forschung und Entwicklung von Heidelberg Pharma, wird am Mittwoch, 2. Mai 2018 um 09:10 Uhr EDT (15:10 Uhr MESZ) folgenden Vortrag präsentieren:
Antibody Targeted Amanitin Conjugates (ATACs) - Expanding the ADC landscape with a new payload targeting RNA Polymerase II
Non Deal Roadshow USA
7. - 8. Mai 2018: New York
9. - 10. Mai 2018: Boston
BioEquity Europe 2018
Datum: 14. - 16. Mai 2018
Veranstaltungsort: Het Pand Konferenzzentrum, Ghent, Belgien
Dr. Jan Schmidt-Brand, Sprecher des Vorstands und Finanzvorstand von Heidelberg Pharma, wird am Dienstag, 15. Mai 2018 um 18.00 Uhr MESZ eine Unternehmenspräsentation halten.
Hinweis auf einen Artikel von KÖNNERN zu Hopp & Co. oder Glaube niemals blutigen Laien
manager magazinURL: http://www.manager-magazin.de/magazin/artikel/biotech-dietma…
zuletzt aktualisiert: 08. November 2017, 17:29 Uhr
Heft 8/2017: Booking.com die Suchtmaschine
Artikel drucken | Fenster schließen
Dietmar Hopp
Hopp und Ex? Das Biotech-Cluster des SAP-Mitgründers
Von Eva Müller und Martin Noé
Dietmar Hopp hat sich verrechnet. Anders als geplant, produziert seine Milliardeninvestition seit mehr als zehn Jahren nur Hoffnungswerte.
Antwort auf Beitrag Nr.: 57.670.803 von j-schroeder-fan am 01.05.18 17:49:29
Wie gut, das das die Entwicklung der Produckte nicht beeinträchtigt was.
Und wozu diese Werbung für einen halbe Jahr alten, verpufften Artikel?
Gibt man dir Geld fürs bewerben solcher Dinge hier, völlig ohne Bezug zum Aktienunternehmen?
Du must diese Fragen nicht beantworten, die Absichten sind ja deutlich - so hat’s der andere Namensnachäffer übrigens auch gemacht, hat dich verraten.
Zitat von j-schroeder-fan: manager magazin
URL: http://www.manager-magazin.de/magazin/artikel/biotech-dietma…
zuletzt aktualisiert: 08. November 2017, 17:29 Uhr
Heft 8/2017: Booking.com die Suchtmaschine
Artikel drucken | Fenster schließen
Dietmar Hopp
Hopp und Ex? Das Biotech-Cluster des SAP-Mitgründers
Von Eva Müller und Martin Noé
Dietmar Hopp hat sich verrechnet. Anders als geplant, produziert seine Milliardeninvestition seit mehr als zehn Jahren nur Hoffnungswerte.
Wie gut, das das die Entwicklung der Produckte nicht beeinträchtigt was.
Und wozu diese Werbung für einen halbe Jahr alten, verpufften Artikel?
Gibt man dir Geld fürs bewerben solcher Dinge hier, völlig ohne Bezug zum Aktienunternehmen?
Du must diese Fragen nicht beantworten, die Absichten sind ja deutlich - so hat’s der andere Namensnachäffer übrigens auch gemacht, hat dich verraten.

!
Dieser Beitrag wurde von CommunityAssistance moderiert. Grund: Provokation
Antwort auf Beitrag Nr.: 57.673.884 von j-schroeder-fan am 02.05.18 08:18:11
Dietmar Hopp verliert Millionen mit Biotech-InvestmentSAP-Mitbegründer Dietmar Hopp verliert Teile seines Vermögens. Mit 69 Prozent war der Hoffenheim-Mäzen am Biotechunternehmen Agennix beiteiligt, das erst 2009 die Nachfolge von GPC Biotech antrat. Ende des Monats wird die Firma liquidiert. Viele Gläubiger gehen dann voraussichtlich leer aus.
Das Hopp-Vorbild (wer kräht da veraltet?)
Agennix löst sich aufDietmar Hopp verliert Millionen mit Biotech-InvestmentSAP-Mitbegründer Dietmar Hopp verliert Teile seines Vermögens. Mit 69 Prozent war der Hoffenheim-Mäzen am Biotechunternehmen Agennix beiteiligt, das erst 2009 die Nachfolge von GPC Biotech antrat. Ende des Monats wird die Firma liquidiert. Viele Gläubiger gehen dann voraussichtlich leer aus.
!
Dieser Beitrag wurde von CommunityAssistance moderiert. Grund: bitte im entsprechendem Forum posten!
Dieser Beitrag wurde von CommunityAssistance moderiert. Grund: Bleiben Sie bitte sachlich.
Antwort auf Beitrag Nr.: 57.672.309 von TheBoss_Springsteen am 01.05.18 21:20:24Blende diesen Typen einfach aus. Ausser Müll schreibt er ja nichts. Hat sonst nicht zu tun den ganzen Tag, Aktien wird er sich kaum leisten können.
Antwort auf Beitrag Nr.: 57.673.884 von j-schroeder-fan am 02.05.18 08:18:11
Na, na, na, was zahlt man so einem wie dir fürs Schreiben hier?
Inhaltliches hast du zur Diskussion nicht beizubringen, es geht wohl ausschliesslich darum hier die Leute zu belabern, aber wer bezahlt dich dafür?
Komm, mir kannste es ruhig sagen, ich verrats auch nicht weiter.
Zitat von j-schroeder-fan: Tust Du oder bist Du so .... liebes Bösschen? ? Es geht im Artikel um Hopps fast 100-prozentige Fehlgriffe, sprich um sein Versagen. Geht lieber zur Volkshochschule, als hier intelligente Menschen zu belästigen.
Na, na, na, was zahlt man so einem wie dir fürs Schreiben hier?
Inhaltliches hast du zur Diskussion nicht beizubringen, es geht wohl ausschliesslich darum hier die Leute zu belabern, aber wer bezahlt dich dafür?
Komm, mir kannste es ruhig sagen, ich verrats auch nicht weiter.
Antwort auf Beitrag Nr.: 57.676.965 von Mogli3 am 02.05.18 13:40:52Ja vielen Dank, ich glaube den nimmt hier eh niemand für voll.
Mal was zum Thema:
Ich bin hier nicht mehr voll im Thema, was die zeitlichen Abläufe angeht. Gibt es zu den Optionsverträgen mit Takeda etc. eine zeitliche Erwartung, wann mit der Ausübung der Option oder dem Eingang entsprechender Forschungsergebnisse gerechnet werden kann.
ich meine du hattes bezüglich Takeda mal was von "sommer" geschrieben, fand aber keinen Bezug zu irgendwelchen zeitlichen Abläufen.
Danke.
Mal was zum Thema:
Ich bin hier nicht mehr voll im Thema, was die zeitlichen Abläufe angeht. Gibt es zu den Optionsverträgen mit Takeda etc. eine zeitliche Erwartung, wann mit der Ausübung der Option oder dem Eingang entsprechender Forschungsergebnisse gerechnet werden kann.
ich meine du hattes bezüglich Takeda mal was von "sommer" geschrieben, fand aber keinen Bezug zu irgendwelchen zeitlichen Abläufen.
Danke.
!
Dieser Beitrag wurde von CommunityAssistance moderiert. Grund: ProvokationMogli3 schrieb am 05.03.18 20:15:37 Beitrag Nr. 65 ( 57.192.970 )
"Ich bin dann gespannt wann die Biotech-Investorengemeinde merkt dass hier ein Juwel heranwächst. Eine Kursentwicklung wie bei. 4SC ist überfällig."Die Investorengemeinde folgt dem Dschungelmann nicht und eine gleiche Kursentwicklung wie bei 4SC weckt Erinnerungen an "Warten auf Godot".
!
Dieser Beitrag wurde von CloudMOD moderiert. Grund: Inhalt aus fremden Forum, zudem ohne Quellenangabe
Antwort auf Beitrag Nr.: 57.677.697 von j-schroeder-fan am 02.05.18 15:19:53
Als Foren-Clown bist du aber gar nicht witzig, von wegen großes Kino. Dafür zahlt man dir Geld?
Vielleicht übst du nochn bischen vorm Spiegel. Ist aber ermutigend zu sehen, dass sich Leute hier richtig viel Zeit nehmen das Forum vollzumüllen - das zeigt besonderes Interesse.
Zitat von j-schroeder-fan: Niedlich, die verblendeten Getroffenen lecken sich bei dem aktuellen Ramschkurs (in ihren Augen ist die Aktie ja ein unentdecktes Juwel = der aus dem Dschungelbuch) gegenseitig ihre Wunden. Grosses aber leider billiges Kino.
Als Foren-Clown bist du aber gar nicht witzig, von wegen großes Kino. Dafür zahlt man dir Geld?
Vielleicht übst du nochn bischen vorm Spiegel. Ist aber ermutigend zu sehen, dass sich Leute hier richtig viel Zeit nehmen das Forum vollzumüllen - das zeigt besonderes Interesse.
Klinken putzen gehen:
30.04.18 DGAP-News: Heidelberg Pharma AG: Heidelberg Pharma präsentiert auf anstehenden Konferenzen und Investorenveranstaltungen
Traurig, wenn dies in Zeiten von sog. Pharma-Scouts, die schon bei leichtem Verdacht einer Innovation der Konkurrenz diese selbst ermitteln, nötig ist. Und wenn damit Investoren, die so etwas doch in der Regel von ihren hoch bezahlten Spezialisten und nicht auf "Kaffeefahrten" erfahren, mit ein paar Postern gewonnen werden sollen.
Viel Werbung in dieser Branche macht doch wohl nur der, der es nötig hat um zu überleben. Und willige Pseudo-Fachleute in Foren ziehen wegen ihres Egos mit. Diese üblichen Verdächtigen waren beim Ende von Agennix sang und klanglos in der angemessenen Bedeutungslosigkeit verschwunden, nachdem sie vorher grölend das Lied ihres Herrn getrötet hatten. Beim Mologen-Forum wiederholt sich das zur Zeit.
Antwort auf Beitrag Nr.: 57.682.815 von j-schroeder-fan am 03.05.18 08:21:37...auf solche "Fans" würde man gerne verzichten!
Was liegt Dir auf der Seele, wieso arbeitest Du Dich so unentwegt an HDP und Hopp ab?
Was liegt Dir auf der Seele, wieso arbeitest Du Dich so unentwegt an HDP und Hopp ab?
!
Dieser Beitrag wurde von CommunityAssistance moderiert. Grund: auf eigenen Wunsch des Users
Bravo. Ich liebe Hooligans. Habe damals für 50 Cent verkaufen müssen.
Antwort auf Beitrag Nr.: 57.369.674 von behavior am 23.03.18 15:03:05
Antwort auf Beitrag Nr.: 42.450.283 von EGEM am 07.12.11 15:02:45
Danke EGEM!
Ich sehe die heutige Entwicklung allerdings nur als wichtige aber kleine Zwischenetappe zu ganz anderen Kurszielen. Wie oft von mir geschrieben und begründet sehe ich im nächsten Jahr die Schließung des langjährigen Gap`s bis zum Emmissionskurs, was etwa einem Kursziel von 12,50 bis 15,00 EUR bedeutet. Wilex ist dann immer "nur noch" mit einer Marktkapitalisierung von 250-300 Mio. EUR bewertet, was in Bezug auf Umsatzbewertungen aus nachhaltigen Meldungen zun der akt. Produktpipline, den beteiligten Gesellschaften oder Teilverkäufen/Übernahmen m.E. mehr als angemessen ist. Ende 2013 sehe ich dann eine erneute Verdopplung auf 20-25 EUR möglich, was insbesondere aufgrund der dann anstehenden Zulassungen/Marktrollout, weiterer Auslizensierungen und Umsatzbeteiligungen m.E. durchaus realistisch ist.
Nicht vergessen, es sind nur ca. 30 % Streubesitz an Aktien im Umlauf welche bei enger Abstimmung der festen Stakeholder ALLES MÖGLICH macht
Und zu den Umsätzen heute im Vergleich zu TecDax-Werten ... für mich ist es durchaus realistisch, daß Wilex 2012/2013 auch als Aufnahmekandidat für den TecDax gehandelt wird!
Noch eines ... auch die Fonds interessieren sich wieder mehr für Wilex und sind dabei bereits wieder aufzustocken. Im Vergleich zu meiner letzten Auswertung hat insbesondere der LAM kräftig zugelegt. Vielleicht merkens ja jetzt endlich auch noch andere von den so tollen Fondsmanagern und greifen zu bzw. erhöhen Ihre Position ...
A1CU8A LAM-EURO-SMALL CAPS-UNIVERSAL 1,54%
630843 POSTBANK DYNAMIK VISION 0,87%
973020 JB EF GERMAN VALUE-EUR B 0,30%
921837 JB EF GERMAN VALUE-EUR C 0,30%
973019 JB EF GERMAN VALUE-EUR A 0,30%
986841 SANTANDER DEUTSCHE AKTIEN B 0,30%
921869 DKB PHARMA FONDS AL 0,08%
541954 DKB PHARMA FONDS TNL 0,08%
979771 DEUTSCHE POSTBANK EUROPAFONDS PLUS 0,03%
Beste Grüße und auf weitere Erfolge!
ZitatAntwort4
1 1 Antwort?
Zusammenfassung:
- 20-30 EUR Ende 2013 möglich
- realistisch, daß WILEX 2012/2013 als Aufnahmekandidat für den TecDax gehandelt wird
Und heute (Kurs um die 2,70 EUR) wie damals trommelt er für diese Aktie und sieht eine rosige Zukunft. Wer solche Pseudo-Fachleute hier unterstützt und ohne Kritik duldet, mach sich ebenfalls unglaubwürdig.
Wenn hier Geldzahlungen an Foristen angedeutet werden - warum bei diesem noch nicht? Jahrelange WILEX/HDP-PR - die nur vom Kursverlauf ständig widerlegt wird.
Werte, nicht kommentierende Mitleser: Seit gewarnt und glaubt keine hier geschriebenen angeblichen Erfolgsaussichten dieses Users. Er hat sich mit solch einem Schmarren selbst unglaugwürdig gemacht. Kauft vor allen Dingen diese Aktie NICHT NUR wegen seiner hier verbreiteten Phantasien.
Dieser Text entlarvt behavior als schlichten oder aber gar vorsätzlichen Märchenerzähler:
behavior schrieb am 07.12.11 15:51:19 Beitrag Nr. 4.657 ( 42.450.597 )Antwort auf Beitrag Nr.: 42.450.283 von EGEM am 07.12.11 15:02:45
Danke EGEM!
Ich sehe die heutige Entwicklung allerdings nur als wichtige aber kleine Zwischenetappe zu ganz anderen Kurszielen. Wie oft von mir geschrieben und begründet sehe ich im nächsten Jahr die Schließung des langjährigen Gap`s bis zum Emmissionskurs, was etwa einem Kursziel von 12,50 bis 15,00 EUR bedeutet. Wilex ist dann immer "nur noch" mit einer Marktkapitalisierung von 250-300 Mio. EUR bewertet, was in Bezug auf Umsatzbewertungen aus nachhaltigen Meldungen zun der akt. Produktpipline, den beteiligten Gesellschaften oder Teilverkäufen/Übernahmen m.E. mehr als angemessen ist. Ende 2013 sehe ich dann eine erneute Verdopplung auf 20-25 EUR möglich, was insbesondere aufgrund der dann anstehenden Zulassungen/Marktrollout, weiterer Auslizensierungen und Umsatzbeteiligungen m.E. durchaus realistisch ist.

Nicht vergessen, es sind nur ca. 30 % Streubesitz an Aktien im Umlauf welche bei enger Abstimmung der festen Stakeholder ALLES MÖGLICH macht

Und zu den Umsätzen heute im Vergleich zu TecDax-Werten ... für mich ist es durchaus realistisch, daß Wilex 2012/2013 auch als Aufnahmekandidat für den TecDax gehandelt wird!

Noch eines ... auch die Fonds interessieren sich wieder mehr für Wilex und sind dabei bereits wieder aufzustocken. Im Vergleich zu meiner letzten Auswertung hat insbesondere der LAM kräftig zugelegt. Vielleicht merkens ja jetzt endlich auch noch andere von den so tollen Fondsmanagern und greifen zu bzw. erhöhen Ihre Position ...

A1CU8A LAM-EURO-SMALL CAPS-UNIVERSAL 1,54%
630843 POSTBANK DYNAMIK VISION 0,87%
973020 JB EF GERMAN VALUE-EUR B 0,30%
921837 JB EF GERMAN VALUE-EUR C 0,30%
973019 JB EF GERMAN VALUE-EUR A 0,30%
986841 SANTANDER DEUTSCHE AKTIEN B 0,30%
921869 DKB PHARMA FONDS AL 0,08%
541954 DKB PHARMA FONDS TNL 0,08%
979771 DEUTSCHE POSTBANK EUROPAFONDS PLUS 0,03%
Beste Grüße und auf weitere Erfolge!
ZitatAntwort4
1 1 Antwort?
Zusammenfassung:
- 20-30 EUR Ende 2013 möglich
- realistisch, daß WILEX 2012/2013 als Aufnahmekandidat für den TecDax gehandelt wird
Und heute (Kurs um die 2,70 EUR) wie damals trommelt er für diese Aktie und sieht eine rosige Zukunft. Wer solche Pseudo-Fachleute hier unterstützt und ohne Kritik duldet, mach sich ebenfalls unglaubwürdig.
Wenn hier Geldzahlungen an Foristen angedeutet werden - warum bei diesem noch nicht? Jahrelange WILEX/HDP-PR - die nur vom Kursverlauf ständig widerlegt wird.
Werte, nicht kommentierende Mitleser: Seit gewarnt und glaubt keine hier geschriebenen angeblichen Erfolgsaussichten dieses Users. Er hat sich mit solch einem Schmarren selbst unglaugwürdig gemacht. Kauft vor allen Dingen diese Aktie NICHT NUR wegen seiner hier verbreiteten Phantasien.
Antwort auf Beitrag Nr.: 57.684.315 von katja_sorglos am 03.05.18 10:48:54
Ich liebe Tropfsteinhöhlen.
Und dort besonders die Stalaktiten. Sie haben mit dem HDP-Kurs das Wachsen nach unten gemeinsam!
Antwort auf Beitrag Nr.: 57.688.827 von j-schroeder-fan am 03.05.18 18:50:01
Möge damals niemand auf diesen Schmarren hin eine der beiden Aktien zu den hohen Kursen gekauft haben!
Zu meinem Beitrag mit Agennix
behavior schrieb am 22.09.11 18:16:38 Beitrag Nr. 4.057 ( 42.123.153 )Mal so (nochmals) zum nachdenken ... vielleicht läuft ja bald doch auch was zusammen mit Agennix. Ohne für mich ersichtlichem Grund steigt der Kurs und die Umsätze sind für diesen marktengen Wert erstaunlich angestiegen. Im Forum ruht auch still der See ... wird hier was Großes vorbereitet? Hier mal der Xetra-Chart von einer Woche mit den Umsätzen ... 
Möge damals niemand auf diesen Schmarren hin eine der beiden Aktien zu den hohen Kursen gekauft haben!
Antwort auf Beitrag Nr.: 57.624.108 von Mogli3 am 25.04.18 12:43:29
Zu der Zeit war mogli3 auch schon dabei.
Daytrader
behavior schrieb am 10.08.11 22:56:52 Beitrag Nr. 3.885 ( 41.934.066 )In einem marktengen Papier wie Wilex macht man doch keine Daytrades!Zu der Zeit war mogli3 auch schon dabei.
Märchenerzähler II
Mogli3 schrieb am 10.01.12 12:01:24 Beitrag Nr. 4.815 ( 42.572.840 )Wer da ein Haar in der Suppe findet ist selber schuld. Für mich handelt das Management von Wilex sehr vorausschauend. Die Gewinne werden eh nicht jetzt und in den nächsten 4 bis 5 Monaten gemacht sondern ab 2013. Es ist doch völlig wurscht ob der Kurs derzeit bei 3 oder 4 Euro stehtMogli3 schrieb am 13.01.12 16:31:37 Beitrag Nr. 4.860 ( 42.591.264 )Ich brauch ja keine, hab ja genug davon. War mir bei Biotechs noch nie so sicher wie bei Wilex.
Mogli3 schrieb am 13.01.12 18:20:11 Beitrag Nr. 4.862 ( 42.592.090Relativ am sichersten hat auch noch ein Risiko in sich. Redactane ist praktisch durch, nur eine Frage der Zeit ( schätze noch 5% Risiko), bei Rencarex schätze ich das Risiko noch bei 20%. Und das bei einem Preis von 3.50 Euro. Verstehe die Leute nicht so richtig mit ihrer Risikoaversion. Müssen wohl viele Enttäuschungen erlebt haben bei Biotechs. Und Hopp kann ja auch nicht immer falsch liegen. Mit irgendeiner Bude muss er ja mal Gewinne machen und das wird Wilex sein.
Zusammenfassung:
- Gewinne bei WILEX ab 2013
- nie so sicher wie bei WILEX
- Risiko bei REDACTANE: 5%
- Risiko bei RENCAREX: 20%
Wie sind die Aussagen heute nach diesen "Voraussagen" zu werten?
Antwort auf Beitrag Nr.: 57.689.577 von j-schroeder-fan am 03.05.18 20:11:46
Avatar0 Bewertung:
Mogli3 schrieb am 15.08.12 15:23:49 Beitrag Nr. 6.051 ( 43.496.349 )Nachtrag: und ( Mologen) hat bereits eine höhere Börsenkapitalisierung als Wilex.KeinGeldmehr: gemessen an der Markteinschätzung von Mologen müsste Wilex heute schon auf 10 Euro stehen. 4 Euro sind ein schlechter Witz. Hätten wir noch "Neuer Markt-Zeiten" wäre Wilex jetzt schon auf 20!! Der heutige Wilex-Kurs ist einfach der schlechten Gesamtmarktsituation geschuldet.
Mogli3 schrieb am 13.09.12 16:30:20 Beitrag Nr. 6.197 ( 43.600.998 )Ich nahm nur 50% weil ich gemessen an meinem Gesamtportfolio schon viel zu viele Wilexaktien habe, schon unvernünftig viel wenn man bedenkt dass Biotechs Hochrisikoaktien sind und nicht weil ich nicht überzeugt wäre. Das bin ich absolut und sehe den nächsten 6-12 Monaten beruhigt entgegen. Wenn Wilex auch noch scheitern sollte kann man fast den ganzen deutschen Biotechladen schliessen. Immer kann ja Hopp auch nicht falsch liegen!
Zusammenfassung:
- RENCAREX zugelassen
- Kursphantasien wie gehabt
- Hochrisikoaktien (Hinweis fehlt heute immer)
- Spekulation wie gehabt
Stammtische liegen dagegen häufiger richtig. Warum beweihräuchert Ihr Euch nur alle immer gegenseitig? Hoffentlich gibt es da keine Verbindung zum HDP-Management, geschweige denn mit Bezahlung (glaube ich nicht, weil die Beiträge dafür doch zu übertrieben sind).
Glaubwürdigkeit first!
Mogli3 schrieb am 20.01.12 16:33:14 Beitrag Nr. 4.895 ( 42.624.062 )Also wenn es in Europa was zu vermarkten gibt, ist Rencarex ja zugelassen und dann mit sehr grosser Wahrscheinlichkeit auch in den USA. Und dann ist der Kapitalbedarf vorläufig gedeckt durch die Zahlungen von Prometheus.Avatar0 Bewertung:
Mogli3 schrieb am 15.08.12 15:23:49 Beitrag Nr. 6.051 ( 43.496.349 )Nachtrag: und ( Mologen) hat bereits eine höhere Börsenkapitalisierung als Wilex.KeinGeldmehr: gemessen an der Markteinschätzung von Mologen müsste Wilex heute schon auf 10 Euro stehen. 4 Euro sind ein schlechter Witz. Hätten wir noch "Neuer Markt-Zeiten" wäre Wilex jetzt schon auf 20!! Der heutige Wilex-Kurs ist einfach der schlechten Gesamtmarktsituation geschuldet.
Mogli3 schrieb am 13.09.12 16:30:20 Beitrag Nr. 6.197 ( 43.600.998 )Ich nahm nur 50% weil ich gemessen an meinem Gesamtportfolio schon viel zu viele Wilexaktien habe, schon unvernünftig viel wenn man bedenkt dass Biotechs Hochrisikoaktien sind und nicht weil ich nicht überzeugt wäre. Das bin ich absolut und sehe den nächsten 6-12 Monaten beruhigt entgegen. Wenn Wilex auch noch scheitern sollte kann man fast den ganzen deutschen Biotechladen schliessen. Immer kann ja Hopp auch nicht falsch liegen!
Zusammenfassung:
- RENCAREX zugelassen
- Kursphantasien wie gehabt
- Hochrisikoaktien (Hinweis fehlt heute immer)
- Spekulation wie gehabt
Stammtische liegen dagegen häufiger richtig. Warum beweihräuchert Ihr Euch nur alle immer gegenseitig? Hoffentlich gibt es da keine Verbindung zum HDP-Management, geschweige denn mit Bezahlung (glaube ich nicht, weil die Beiträge dafür doch zu übertrieben sind).
Antwort auf Beitrag Nr.: 57.684.102 von j-schroeder-fan am 03.05.18 10:30:42
Jetzt mal ehrlich, wie kann man das Plakat, dass ausschließlich die Funktion von Dietmar Hopp bei der TSG Hoffenheim betrifft und dies kritisiert mit seinem Engagement im Biotechbereich in Verbindung bringen! Das ist genauso falsch wie sein soziales Engagement mit der Funktion bei der TSG zu verbinden. Aber die Häufigkeit Deiner Posts hat Dich eideutig vom kritischen Schreiber zum Threadtroll werden lassen. Und ich werde den Troll nur einmal füttern, versprochen
Zitat von j-schroeder-fan: "Ein Plakat der Borussen-Fans gegen Hoffenheim-Mäzen Dietmar Hopp hat am Rande des 3:1-Auswärtssieges der Gladbacher bei 1899 Hoffenheim für Missstimmung gesorgt."
Das mache ich mir nicht zu eigen - aber bessere Plakate zur Investorengewinnung finde ich - wie auch Kaffeefahrten - peinlich. Und zwar Veranstalter UND Publikum.
...Psst: Familie und Fans kann man sich nicht aussuchen...
Jetzt mal ehrlich, wie kann man das Plakat, dass ausschließlich die Funktion von Dietmar Hopp bei der TSG Hoffenheim betrifft und dies kritisiert mit seinem Engagement im Biotechbereich in Verbindung bringen! Das ist genauso falsch wie sein soziales Engagement mit der Funktion bei der TSG zu verbinden. Aber die Häufigkeit Deiner Posts hat Dich eideutig vom kritischen Schreiber zum Threadtroll werden lassen. Und ich werde den Troll nur einmal füttern, versprochen

Dienstag, 26 Juni 2018 11:00 Ordentliche Hauptversammlung 2018 (Quelle Hompage HDP)
Die Einladung hat bis zur 21. KW (also nach Pfingsten) zu erfolgen. Der Kursverfall könnte mit einem überraschenden Tagesordnungspunkt zusammenhängen (fairplay:reine Spekulation). Aber ebenso kann der Kurs bis dahin "gepflegt" werden. !
Dieser Beitrag wurde von CommunityAssistance moderiert. Grund: Provokation
Antwort auf Beitrag Nr.: 57.692.835 von fohlenpelzig am 04.05.18 09:39:11
Na sicher, es geht ja auch nicht ums kritisieren - hp Arbeit in der Forschung und das was dort herauskommt ist erst in der Zukunft interessant -, nen es geht nur darum die Leute hier kirre zu machen.
So wie das aufgezogen wird, so mit eifrigem Herraussuchen uralter Beiträge und diese stetigen Beleidigungen und Herabsetzungen, scheint das professionell betrieben zu werden mit ganz bestimmten Zielen von ganz bestimmten Interessengruppen.
Das hat analog der vor- Account „behaverie“ getan, nun ist es j-Schroeder-Fan.
Konsequent Ab auf Ignore damit, Informationen kann man dem nicht entnehmen, dann braucht man das auch gar nicht erst lesen. Awe nicht keiner liest, werden die Beiträge und der Aufwand eben umsonst bezahlt..
Übrigens: die Entwicklung von hp ist gänzlich unabhängig solcher Versuche, Einfluss auf die Diskussionsteilnehmer zu nehmen.
Zitat von fohlenpelzig:Zitat von j-schroeder-fan: "Ein Plakat der Borussen-Fans gegen Hoffenheim-Mäzen Dietmar Hopp hat am Rande des 3:1-Auswärtssieges der Gladbacher bei 1899 Hoffenheim für Missstimmung gesorgt."
Das mache ich mir nicht zu eigen - aber bessere Plakate zur Investorengewinnung finde ich - wie auch Kaffeefahrten - peinlich. Und zwar Veranstalter UND Publikum.
...Psst: Familie und Fans kann man sich nicht aussuchen...
Jetzt mal ehrlich, wie kann man das Plakat, dass ausschließlich die Funktion von Dietmar Hopp bei der TSG Hoffenheim betrifft und dies kritisiert mit seinem Engagement im Biotechbereich in Verbindung bringen! Das ist genauso falsch wie sein soziales Engagement mit der Funktion bei der TSG zu verbinden. Aber die Häufigkeit Deiner Posts hat Dich eideutig vom kritischen Schreiber zum Threadtroll werden lassen. Und ich werde den Troll nur einmal füttern, versprochen
Na sicher, es geht ja auch nicht ums kritisieren - hp Arbeit in der Forschung und das was dort herauskommt ist erst in der Zukunft interessant -, nen es geht nur darum die Leute hier kirre zu machen.
So wie das aufgezogen wird, so mit eifrigem Herraussuchen uralter Beiträge und diese stetigen Beleidigungen und Herabsetzungen, scheint das professionell betrieben zu werden mit ganz bestimmten Zielen von ganz bestimmten Interessengruppen.
Das hat analog der vor- Account „behaverie“ getan, nun ist es j-Schroeder-Fan.
Konsequent Ab auf Ignore damit, Informationen kann man dem nicht entnehmen, dann braucht man das auch gar nicht erst lesen. Awe nicht keiner liest, werden die Beiträge und der Aufwand eben umsonst bezahlt..
Übrigens: die Entwicklung von hp ist gänzlich unabhängig solcher Versuche, Einfluss auf die Diskussionsteilnehmer zu nehmen.
Antwort auf Beitrag Nr.: 57.693.243 von TheBoss_Springsteen am 04.05.18 10:18:53
Zitat ist umgehend zu löschen
Ich untersage nach erfolgter Löschung durch w:o die widerrechtliche Verwendung.
Antwort auf Beitrag Nr.: 57.689.577 von j-schroeder-fan am 03.05.18 20:11:46js-Fan oder vor dem Februar 2018 wahrscheinlich " behavarie" oder??!
Ja es ist richtig, ich hatte mit ca. 80% mit einem positiven Ausgang der Phase III Zulassungsstudie zu Rencarex gerechnet, wie übrigens viele andere Investoren auch. Warum? Die Studie war für 3 Jahre geplant, hat aber 5 Jahre gedauert bis der letzte eingeschlossene Patient verstorben war. Naheliegend war deswegen dass das Überleben durch das Medikament deutlich höher war als angenommen. Auch waren die Phase II Studien ja erfolgreich abgeschlossen. Bei Biotech muss man eben bis zum Schluss mit allem rechnen, ist immer eine Abwägung der Wahrscheinlichkeiten. Im Durchschnitt scheitern noch ca 50% aller zulassungsrelevanten Phase III Studien. Im Nachhinein stellte sich heraus, dass das Studiendesign völlig fasch gewählt wurde, übrigens in Absprache mit der FDA. Man hat die völlig falsche Patientengruppe festgelegt.
Von der alten Wilex sind aber noch die beiden Kandidaten Redectane und Mesupron offen und auslizensiert, Ausgang ungewiss, bei Redectane besteht eine gute Chance auf Erfolg und relativ hohe Lizenzzahlungen. Hier hatte ja schon Wilex eine Phase III erfolgreich abgeschlossen.
HDP hat übrigens nichts mit der alten Wilex zu tun, ausser dass sie Hopp mit Wilex verheiratet hat. Die Aktie Wilex wurde damals zu 6 Euro verrechnet und das vor dem Split, was heute also 24 Euro bedeuten würde. Für die alten Wilex-Aktionäre aus heutiger Sicht also ein sehr gutes Geschäft
Was mich von dir interessieren würde ist deine Motivation hier zu schreiben. Aktien von HDP besitzt du ja mit Sicherheit nicht. Verfolgst du ein Ziel, ist es Zeitvertreib oder willst du allgemein Biotechanleger bekehren??
Du kannst mir ja ein Boardmail schicken wenn du die Fragen nicht hier im Forum beantworten willst.
Ja es ist richtig, ich hatte mit ca. 80% mit einem positiven Ausgang der Phase III Zulassungsstudie zu Rencarex gerechnet, wie übrigens viele andere Investoren auch. Warum? Die Studie war für 3 Jahre geplant, hat aber 5 Jahre gedauert bis der letzte eingeschlossene Patient verstorben war. Naheliegend war deswegen dass das Überleben durch das Medikament deutlich höher war als angenommen. Auch waren die Phase II Studien ja erfolgreich abgeschlossen. Bei Biotech muss man eben bis zum Schluss mit allem rechnen, ist immer eine Abwägung der Wahrscheinlichkeiten. Im Durchschnitt scheitern noch ca 50% aller zulassungsrelevanten Phase III Studien. Im Nachhinein stellte sich heraus, dass das Studiendesign völlig fasch gewählt wurde, übrigens in Absprache mit der FDA. Man hat die völlig falsche Patientengruppe festgelegt.
Von der alten Wilex sind aber noch die beiden Kandidaten Redectane und Mesupron offen und auslizensiert, Ausgang ungewiss, bei Redectane besteht eine gute Chance auf Erfolg und relativ hohe Lizenzzahlungen. Hier hatte ja schon Wilex eine Phase III erfolgreich abgeschlossen.
HDP hat übrigens nichts mit der alten Wilex zu tun, ausser dass sie Hopp mit Wilex verheiratet hat. Die Aktie Wilex wurde damals zu 6 Euro verrechnet und das vor dem Split, was heute also 24 Euro bedeuten würde. Für die alten Wilex-Aktionäre aus heutiger Sicht also ein sehr gutes Geschäft
Was mich von dir interessieren würde ist deine Motivation hier zu schreiben. Aktien von HDP besitzt du ja mit Sicherheit nicht. Verfolgst du ein Ziel, ist es Zeitvertreib oder willst du allgemein Biotechanleger bekehren??
Du kannst mir ja ein Boardmail schicken wenn du die Fragen nicht hier im Forum beantworten willst.
Antwort auf Beitrag Nr.: 57.695.232 von Mogli3 am 04.05.18 13:55:01
Aktiviert:
Die Beiträge dieses Nutzers werden ab sofort ausgeblendet. !
Dieser Beitrag wurde von CloudMOD moderiert. Grund: bitte das Threadthema beachten, unterlassen Sie doch bitte Beschäftigungen mit anderen Usern!
Dieser Beitrag wurde von CommunitySupport moderiert. Grund: Beleidigung
Antwort auf Beitrag Nr.: 57.695.970 von Joschka Schröder am 04.05.18 15:10:29Ja schade. aber erstens gehen diese Typen irgendwann wieder und zweitens gibt es noch den anderen Thread zu HDP. Zur Zeit scheint mir eh nur warten angesagt. Höchstens ein neuer Vertrag liegt an. Zu Takeda und Magenta erwarte ich vor Ende Jahr keine News und der eigene Kandidat ist auch erst in 2019/20 interessant für Neuigkeiten.
Antwort auf Beitrag Nr.: 57.696.078 von Mogli3 am 04.05.18 15:22:46
Bei Interesse bitte ich euch auf diesen Thread auszuweichen und wichtige Informationen dort ebenfalls zu posten.
Leider ist WO selber nicht in der Lage gegen diese Leute aktiv zu handeln. Sie haben ebenfalls den Paion Thread mit ihrem Müll zugepostet. Ich hoffe bei Ariva können wir einigermaßen ungehindert kommunizieren.
Ariva Thread:http://www.ariva.de/forum/heidelberg-pharma-ag-551254
Thread zu Heidelberg Pharma
Leider habe ich hier keinen Einfluss auf die Leute, die hier nur trollen wollen und den ganzen Thread zerstören. Mir ist aber das Verhalten dieser Trolle bekannt. Deswegen habe ich im Ariva Board einen fast identischen Thread laufen. Dort kann ich diese Trolle sperren. Bei Interesse bitte ich euch auf diesen Thread auszuweichen und wichtige Informationen dort ebenfalls zu posten.
Leider ist WO selber nicht in der Lage gegen diese Leute aktiv zu handeln. Sie haben ebenfalls den Paion Thread mit ihrem Müll zugepostet. Ich hoffe bei Ariva können wir einigermaßen ungehindert kommunizieren.
Ariva Thread:http://www.ariva.de/forum/heidelberg-pharma-ag-551254
!
Dieser Beitrag wurde von CommunityAssistance moderiert. Grund: themenfremder Inhalt
Antwort auf Beitrag Nr.: 57.696.204 von BICYPAPA am 04.05.18 15:32:30Danke für den Tipp.....;-)
Antwort auf Beitrag Nr.: 57.696.204 von BICYPAPA am 04.05.18 15:32:30Eigentlich muss man ja nur die entsprechenden Beiträge nicht lesen und ignorieren. So ist behaverie gegangen. Ich habe es eben heute zum letzten Mal mit ein m sachlichen Beitrag versucht.
!
Dieser Beitrag wurde von CommunityAssistance moderiert. Grund: Bleiben Sie bitte sachlich.
TheBoss_Springsteen schrieb am 27.04.18 08:42:08 Beitrag Nr. 116 ( 57.642.528 )
Und was ist nicht in ordnung am kurs von heute - hast du nicht verstanden, dass man hier biotech-Forschung betreibt die geld kostet und die - AUSSCHLUSSLICH bei positiven ergebnissen dieser forschung - erst später geld und Kurssteigerungen bringen?
Richtig. Aber unsere Märchenerzähler beherzigen dies nicht und machen schlichten Lesern aktuell Kurshoffnungen ohne Ende. Einfach mal nachlesen.
Und das es eine Hochrisikoaktie ist und damit auch der Totalverlust möglich ist, wird ständig rhetorisch umschifft.
Und was ist nicht in ordnung am kurs von heute - hast du nicht verstanden, dass man hier biotech-Forschung betreibt die geld kostet und die - AUSSCHLUSSLICH bei positiven ergebnissen dieser forschung - erst später geld und Kurssteigerungen bringen?
Richtig. Aber unsere Märchenerzähler beherzigen dies nicht und machen schlichten Lesern aktuell Kurshoffnungen ohne Ende. Einfach mal nachlesen.
Und das es eine Hochrisikoaktie ist und damit auch der Totalverlust möglich ist, wird ständig rhetorisch umschifft.
Antwort auf Beitrag Nr.: 57.707.014 von j-schroeder-fan am 07.05.18 10:06:22
"Ich bin dann gespannt wann die Biotech-Investorengemeinde merkt dass hier ein Juwel heranwächst. Eine Kursentwicklung wie bei. 4SC ist überfällig."
Überfällig ist nach Deiner Aussage nichts bei HDP
Dazu folgendes Beispiel:
Mogli3 schrieb am 05.03.18 20:15:37 Beitrag Nr. 65 ( 57.192.970 )"Ich bin dann gespannt wann die Biotech-Investorengemeinde merkt dass hier ein Juwel heranwächst. Eine Kursentwicklung wie bei. 4SC ist überfällig."
Überfällig ist nach Deiner Aussage nichts bei HDP
!
Dieser Beitrag wurde von CommunitySupport moderiert. Grund: Beitrag gelöscht - Provokation anderer User ohne Themenbezug!
Dieser Beitrag wurde von MadMod moderiert. Grund: themenfremder InhaltFür Gläubige meiner Kritiker: Keine Panik, alles Daytrader heute beim Kursverfall!
Mogli3 schrieb am 25.04.18 12:43:29 Beitrag Nr. 99 ( 57.624.108 )"Kurse werden zur Zeit bis zur nächsten positiven Meldung nur von Daytradern gemacht"
HDP ist für den European Mediscience Award nominiert worden in der Kategorie "BEST TECHNOLOGY AWARD".
http://www.mediscience-event.co.uk/awards/shortlist/
http://www.mediscience-event.co.uk/awards/shortlist/
!
Dieser Beitrag wurde von FairMOD moderiert. Grund: Spam, Werbung!
Dieser Beitrag wurde von CloudMOD moderiert. Grund: Korrespondierendes Posting wurde entfernt!
Dieser Beitrag wurde von MadMod moderiert. Grund: themenfremd - Beschäftigung mit anderen Usern!
Dieser Beitrag wurde von MadMod moderiert. Grund: themenfremd - Beschäftigung mit anderen Usern!
Dieser Beitrag wurde von MadMod moderiert. Grund: themenfremder Inhalt!
Dieser Beitrag wurde von CloudMOD moderiert. Grund: Postings von Doppel-IDsAktueller Kursverfall nach dieser Veranstaltung in Boston:
DGAP-NewsHeidelberg Pharma AG: Heidelberg Pharma präsentiert auf anstehenden Konferenzen und Investorenveranstaltungen
Nachrichtenquelle: EQS Group AG | 30.04.2018, 11:32 | 182 | 0 | 0
DGAP-News: Heidelberg Pharma AG / Schlagwort(e): Konferenz
Heidelberg Pharma AG: Heidelberg Pharma präsentiert auf anstehenden Konferenzen und Investorenveranstaltungen
30.04.2018 / 11:32
Für den Inhalt der Mitteilung ist der Emittent verantwortlich.
PRESSEMITTEILUNG
Heidelberg Pharma präsentiert auf anstehenden Konferenzen und Investorenveranstaltungen
Ladenburg, 30. April 2018 - Die Heidelberg Pharma AG (FWB: WL6) gab heute bekannt, dass sie an anstehenden Konferenzen und Investorenveranstaltungen teilnehmen und das Unternehmen sowie seine proprietäre ATAC-Technologie präsentieren wird. Das Management von Heidelberg Pharma steht bei diesen Veranstaltungen für Einzelgespräche zur Verfügung.
14th Annual PEGS: The Essential Protein Engineering Summit
Datum: 30. April - 4. Mai 2018
Veranstaltungsort: Seaport World Trade Center, Boston, USA
Prof. Andreas Pahl, Vorstand für Forschung und Entwicklung von Heidelberg Pharma, wird am Mittwoch, 2. Mai 2018 um 09:10 Uhr EDT (15:10 Uhr MESZ) folgenden Vortrag präsentieren:
Antibody Targeted Amanitin Conjugates (ATACs) - Expanding the ADC landscape with a new payload targeting RNA Polymerase II
!
Dieser Beitrag wurde von CloudMOD moderiert. Grund: Postings von Doppel-IDs!
Dieser Beitrag wurde von CloudMOD moderiert. Grund: Postings von Doppel-IDs
Mein Fan hat sich offenbar eine neue ID zugelegt:
Über wilex_sell
Registriert seit:07.05.2018
Da es in diesem Thread ganz offensichtlich nicht um sachbezogene Diskussionen geht, verrabschiede ich mich aus der Veranstaltung. Was HDP betrifft, so habe ich mir noch kein abschließendes Urteil gebildet. Im Hinblick auf einige, wenige Targets wie BCMA oder CD19 finde ich die ATAC-Technologie durchaus interessant. Für andere Targets wie CD37 oder PSMA halte ich den Einsatz eines RNA Polymerasehemmers hingegen für eher ungeeignet. Zu klären wäre noch, ob das Patent WO2017210288 der Sorrento Therapeutics mit der HDP-Patentfamilie kollidiert. Sollte der von HDP verwendete Linker zuverlässig funktionieren, könnte sich ein Investment auf Basis des gegenwärtigen Börsenkurses (ca. 2,70 EUR) rechnen. Besser beurteilen lassen wird sich die Sachlage Ende 2019, wenn vermutlich erste klinische Ergebnisse des HDP-101 vorliegen. Ich behalte die Aktie auf der Watchlist.
Über wilex_sell
Registriert seit:07.05.2018
Da es in diesem Thread ganz offensichtlich nicht um sachbezogene Diskussionen geht, verrabschiede ich mich aus der Veranstaltung. Was HDP betrifft, so habe ich mir noch kein abschließendes Urteil gebildet. Im Hinblick auf einige, wenige Targets wie BCMA oder CD19 finde ich die ATAC-Technologie durchaus interessant. Für andere Targets wie CD37 oder PSMA halte ich den Einsatz eines RNA Polymerasehemmers hingegen für eher ungeeignet. Zu klären wäre noch, ob das Patent WO2017210288 der Sorrento Therapeutics mit der HDP-Patentfamilie kollidiert. Sollte der von HDP verwendete Linker zuverlässig funktionieren, könnte sich ein Investment auf Basis des gegenwärtigen Börsenkurses (ca. 2,70 EUR) rechnen. Besser beurteilen lassen wird sich die Sachlage Ende 2019, wenn vermutlich erste klinische Ergebnisse des HDP-101 vorliegen. Ich behalte die Aktie auf der Watchlist.
!
Dieser Beitrag wurde von CloudMOD moderiert. Grund: Postings von Doppel-IDs
Antwort auf Beitrag Nr.: 57.714.469 von wilex_sell am 08.05.18 08:20:48Ihre sinnlosen Kommentare sind wirklich eine Zumutung.
Takeda übernimmt Shire. Beide zusammen bringen an der Börse zusammen rund 100 Mia $ auf die Waage. Ich hoffe nur dass dabei der Vertrag mit HDP nicht vergessen geht. In aller Regel haben die Zwei zunächst mal mit sich selbst zu tun, Japan und Irland klingt nicht grad nach ähnlicher Philosophie. Oder vielleicht kann die Ebene unter der Konzernspitze auch vor sich her arbeiten wie bisher.
!
Dieser Beitrag wurde von CloudMOD moderiert. Grund: ohne nachvollziehbare Quellenangabe, ggf überarbeitet neu einstellen
Antwort auf Beitrag Nr.: 57.696.204 von BICYPAPA am 04.05.18 15:32:30
http://heidelberg-pharma.com/files/20180322_HDP_GB_2017_D.pd…
Geschäftsbericht 2017
Der Geschäftsbericht 2017 ist veröffentlicht und online.http://heidelberg-pharma.com/files/20180322_HDP_GB_2017_D.pd…
Antwort auf Beitrag Nr.: 57.749.008 von BICYPAPA am 13.05.18 13:47:40
Quelle Telix Webseite :http://www.telixpharma.com/telix-pharmaceuticals-selects-goo…
Telix Pharmaceuticals Selects Goodwin Biotechnology as Manufacturing Scale‐up Partner
May, 2018 – Melbourne, Australia and Plantation, Florida ‐ Telix Pharmaceuticals Limited (Telix) (ASX:TLX), a clinicalstage biopharmaceutical company focused on the development of diagnostic and therapeutic products based on targeted radiopharmaceuticals or “molecularly‐targeted radiation” (MTR), has selected Goodwin Biotechnology, Inc. (Goodwin) to optimize the process for cGMP manufacturing of its renal cancer imaging antibody drug conjugate TLX250.The product will be used in Telix’s Phase III clinical study for the diagnostic imaging and staging of patients with clear cell renal cancer, and post‐approval commercialization.
Goodwin Biotechnology, Inc. is a US‐based, uniquely qualified and flexible full GMP Contract Development and Manufacturing Organization (CDMO) that offers a fully integrated Single Source Solutionu2122 from cell line development, process development, scale‐up, cGMP contract manufacturing, and aseptic Fill/Finish of mammalian cell‐culture derived monoclonal antibodies, recombinant proteins, vaccines, and Antibody Drug Conjugates (ADCs) for early‐ and late‐stage clinical trials.
CEO Dr. Christian Behrenbruch stated, “The radiopharmaceutical landscape has historically suffered from a lack of effective late‐stage product development. Vendor selection is important to product development and as such we have selected Goodwin Biotechnology for manufacturing scale‐up because of their track‐record in antibody conjugation, including radiopharmaceuticals.”
“It was clear from the start that the Telix team is an experienced group of biopharma clinicians and executives, with a passion for radiation biology and oncology’” said Karl Pinto, Chief Executive Officer at Goodwin Biotechnology. “We share their belief that the time for this technology has arrived and we are impressed by the pipeline development strategy.” “Goodwin’s experience with radioimmunoconjugates makes us an excellent partner to move forward with Telix’s lead program in renal cancer,” noted Muctarr Sesay, PhD, Chief Scientific Officer and Vice President of Bioconjugation at Goodwin Biotechnology. “We’re confident that we can optimize a robust process and scale it up to cost‐effectively supply sufficient amounts of the Girentuximab Conjugate for radiolabeling in order to meet the demand for the confirmatory Phase III trial and beyond.”
Telix Meldung
Hatte unten den link vergessen. Es ging um Redectane, das von Heidelberg Pharma an Telix auslizensiert wurde.Quelle Telix Webseite :http://www.telixpharma.com/telix-pharmaceuticals-selects-goo…
Telix Pharmaceuticals Selects Goodwin Biotechnology as Manufacturing Scale‐up Partner
May, 2018 – Melbourne, Australia and Plantation, Florida ‐ Telix Pharmaceuticals Limited (Telix) (ASX:TLX), a clinicalstage biopharmaceutical company focused on the development of diagnostic and therapeutic products based on targeted radiopharmaceuticals or “molecularly‐targeted radiation” (MTR), has selected Goodwin Biotechnology, Inc. (Goodwin) to optimize the process for cGMP manufacturing of its renal cancer imaging antibody drug conjugate TLX250.The product will be used in Telix’s Phase III clinical study for the diagnostic imaging and staging of patients with clear cell renal cancer, and post‐approval commercialization.
Goodwin Biotechnology, Inc. is a US‐based, uniquely qualified and flexible full GMP Contract Development and Manufacturing Organization (CDMO) that offers a fully integrated Single Source Solutionu2122 from cell line development, process development, scale‐up, cGMP contract manufacturing, and aseptic Fill/Finish of mammalian cell‐culture derived monoclonal antibodies, recombinant proteins, vaccines, and Antibody Drug Conjugates (ADCs) for early‐ and late‐stage clinical trials.
CEO Dr. Christian Behrenbruch stated, “The radiopharmaceutical landscape has historically suffered from a lack of effective late‐stage product development. Vendor selection is important to product development and as such we have selected Goodwin Biotechnology for manufacturing scale‐up because of their track‐record in antibody conjugation, including radiopharmaceuticals.”
“It was clear from the start that the Telix team is an experienced group of biopharma clinicians and executives, with a passion for radiation biology and oncology’” said Karl Pinto, Chief Executive Officer at Goodwin Biotechnology. “We share their belief that the time for this technology has arrived and we are impressed by the pipeline development strategy.” “Goodwin’s experience with radioimmunoconjugates makes us an excellent partner to move forward with Telix’s lead program in renal cancer,” noted Muctarr Sesay, PhD, Chief Scientific Officer and Vice President of Bioconjugation at Goodwin Biotechnology. “We’re confident that we can optimize a robust process and scale it up to cost‐effectively supply sufficient amounts of the Girentuximab Conjugate for radiolabeling in order to meet the demand for the confirmatory Phase III trial and beyond.”
!
Dieser Beitrag wurde von CloudMOD moderiert. Grund: Postings von Doppel-IDs
Mein Gott, schon wieder eine neue ID von (zuletzt) wilex_sell bzw. j-schroeder-fan ...
!
Dieser Beitrag wurde von CloudMOD moderiert. Grund: Postings von Doppel-IDs!
Dieser Beitrag wurde von CloudMOD moderiert. !
Dieser Beitrag wurde von MODelfin moderiert. Grund: Bezug zum Threadthema/Wert nicht deutlichEinstieg oder isch over?
Der offensichtlich nach unten bei 2,70 gestützte Kurs läßt beides wahrscheinlich erscheinen. Gibt es Ratschläge der geballten HDP-Intelligenzia? "Sell in May and go away?"
Bin weiter unentschlossen und warte auf schlaue Beiträge. Etwas verunsichert hat mich dies:Mogli3 schrieb am 05.03.18 20:15:37 Beitrag Nr. 65 ( 57.192.970 )
"Eine Kursentwicklung wie bei. 4SC ist überfällig."
Am 05.03. lag der Kurs bei 8,39, heute bei 4,73.
Ist das bei Heidelberg Pharma auch möglich?
Tolle Nachrichten für HDP - Magenta Therapeutics plant IPO an der NASDAQ
Magenta plant an die Nasdaq zu gehen ... Zur Erinnerung: HDP hat Magenta im März 2018 als Partner gewonnen  Magenta will bis zu 4 ATACs mit HDP testen und hat eine Option von HDP bekommen, diese zu lizenzieren und bis zum Markt zu entwickeln. HDP würde dann zusätzlich erfolgsabhängige Zahlungen für klinische Entwicklungs-, regulatorische und umsatzabhängige Meilensteine von insgesamt bis zu 334 Millionen Dollar erhalten ...
Magenta will bis zu 4 ATACs mit HDP testen und hat eine Option von HDP bekommen, diese zu lizenzieren und bis zum Markt zu entwickeln. HDP würde dann zusätzlich erfolgsabhängige Zahlungen für klinische Entwicklungs-, regulatorische und umsatzabhängige Meilensteine von insgesamt bis zu 334 Millionen Dollar erhalten ...  (siehe Meldung HDP vom 05.03.2018)
(siehe Meldung HDP vom 05.03.2018)Mit dem IPO hätte Magenta dann definitiv genug Geld in der Tasche für schwere Zahlungen an HDP und unsere (noch kleine) HDP ist paralel mit in den Schlagzeilen zum IPO und den weiteren Ergebnissen aus der o.g. Vereinbarung in den US / Nasdaq Ticker

 Jetzt heisst es Gas geben liebe HDP´ler und das Movement nutzen!!! Vielleicht könnt ihr ja schon am WE auf der ASCO Euch zusammen mit dem Magenta Management mit stolzer Brust zeigen und für weiteren Umsetzungsschwung der o.g. millionenschweren Vereinbarung sorgen und somit auch die ATAC-HDP-Story noch populärer machen
Jetzt heisst es Gas geben liebe HDP´ler und das Movement nutzen!!! Vielleicht könnt ihr ja schon am WE auf der ASCO Euch zusammen mit dem Magenta Management mit stolzer Brust zeigen und für weiteren Umsetzungsschwung der o.g. millionenschweren Vereinbarung sorgen und somit auch die ATAC-HDP-Story noch populärer machen 

https://www.biospace.com/article/magenta-therapeutics-sets-s…
Magenta Therapeutics Sets Sights on $100 Million IPO To Advance Bone Marrow Transplant Programs
Weeks after securing $52 million in a Series C financing, Magenta Therapeutics is eying the raising of $100 million in an initial public offering two years after it was launched by Third Rock Ventures and Atlas Venture with $48.5 million in Series A financing.
Cambridge, Mass.-based Magenta said it intends to use the funds from the IPO to advance its portfolio of bone marrow transplant medications. Bone marrow transplant is often used to treat certain types of blood cancers and genetic diseases. Magenta’s approach to address some of the issues with traditional marrow transplants is to use antibodies that recognize stem cells linked to drugs that can then selectively remove stem cells and diseased cells. The approach by Magenta is believed to have fewer side effects and toxicity.
In its S-1 filing with the U.S. Securities and Exchange Commission, the company said it intends to use the funding to specifically advance the development of two clinical assets, MGTA-456 and MGTA-145. With the finances gained from going public, Magenta said it would be able to support the development programs with investments in manufacturing and potential commercialization. Magenta said it will also use some of the money to initiate asset studies in other indications, such as sickle cell disease and blood cancers.
The Phase II MGTA-456 is the company’s most advanced asset. Magenta in-licensed MGTA-456 last year from Novartis. MGTA- 456 is a first-in-class allogeneic stem cell therapy consisting of a single umbilical cord blood unit expanded with an aryl hydrocarbon receptor (AHR) antagonist. Magenta believes MGTA-456 has the potential to treat patients with higher cell doses than otherwise possible and to have access to better HLA-matched cord blood units. In April the company dosed the first patient in the Phase II MGTA-456 trial. The patient has an undisclosed inherited metabolic disorder, the company said at the time.
Magenta’s MGTA-145 is being developed in order to help physicians have an easier time in harvesting a greater number of blood stem cells, which are known as hematopoietic stem cells or HSCs, from patients and donors to improve patient outcomes.
While Magenta said in its filing that it’s primarily focused on advancing its internal assets, the company noted that it could use some of the proceeds from the IPO to “in-license, acquire or invest in new businesses, technology or assets.” Magenta said it has no deals on the table but does “evaluate such opportunities” periodically.
Funds from an IPO will also likely be used to advance assets in its developmental deal with Germany’s Heidelberg Pharma GmbH. In March the two companies forged a multi-target research deal to improve curative bone marrow transplantation. Under terms of that deal, the companies will use Magenta’s stem cell platform and proprietary antibodies with Heidelberg’s proprietary ATAC (Antibody Targeted Amanitin Conjugates) platform to focus on up to four targets.
As Magenta looks to the IPO, the company closed out the first quarter with $41.5 million. The April financing round of $52.3 million gives the company just under $95 million in available cash.
https://endpts.com/magenta-therapeutics-unveils-plans-to-rai…
Magenta Therapeutics unveils plans to raise $100M in IPO weeks after a crossover round
Just weeks after bagging $52 million from venture capitalists in a crossover round, Cambridge, MA darling Magenta Therapeutics has declared intentions to list on the Nasdaq in an IPO angling at $100 million.
According to a statement filed with the SEC, the cash will be used to push forward Magenta’s most advanced clinical program: a cell therapy called MGTA- 456. The drug, currently in Phase II trials, is being tested in patients with inherited metabolic disorders. Magenta says new IPO money would push the treatment through a pivotal trial, pay for some commercialization activities, and also fund research into additional indications for the therapy, such as sickle cell disease and blood cancers.
Beyond that, Magenta might use the new funds to back MGTA-145, a novel stem cell mobilization product candidate.
Magenta, with its lofty goals of improving stem cell transplantation, has been making a splash in the big Cambridge/Boston hub, previously gathering something like $150 million in venture cash from some marquee investors that include GV – the venture group formerly known as Google Ventures – and in-licensing a mid-stage drug that Novartis thinks highly of for enhancing cord blood stem cells as a treatment.
Third Rock has the biggest chunk of equity, with 29% of the stock, while Atlas has 17% and GV weighs in at 12%.
CEO Jason Gardner, a GSK vet who joined the exodus into the booming biotech field, has a 3.7% stake in the company.
In March, Magenta teamed up with German biotech Heidelberg Pharma on a bone marrow R&D pact that included $334 million in potential milestone payments. And in February, Magenta recruited Big Pharma R&D exec John Davis, formerly of Pfizer, to serve as the company’s new chief medical officer.
Magenta plans to list on the Nasdaq under the stock symbol $MGTA.


Antwort auf Beitrag Nr.: 57.854.640 von behavior am 29.05.18 11:02:53
Eine Faustregel besagt, dass sich der inhaltliche Wert eines Postings umgekehrt proportional zur Anzahl der darin verwendeter Smilies verhält.
Bitte sei mir nicht bös, aber was Du Dir da hymnisch zusammendichtest, ist schlichtweg Nonsens. Die ASCO ist ein wissenschaftlicher Kongress, dort werden Fakten präsentiert, mit inhaltsleerem Marktgeschrei kommt man da nicht weiter. Entscheidend wird die Validierung der ATAC-Technologie sein und dazu sind zunächst Ergebnisse der bevorstehenden HDP-101-Studie von Bedeutung.
Zitat von behavior: Mit dem IPO hätte Magenta dann definitiv genug Geld in der Tasche für schwere Zahlungen an HDP und unsere (noch kleine) HDP ist paralel mit in den Schlagzeilen zum IPO und den weiteren Ergebnissen aus der o.g. Vereinbarung in den US / Nasdaq TickerJetzt heisst es Gas geben liebe HDP´ler und das Movement nutzen!!! Vielleicht könnt ihr ja schon am WE auf der ASCO Euch zusammen mit dem Magenta Management mit stolzer Brust zeigen und für weiteren Umsetzungsschwung der o.g. millionenschweren Vereinbarung sorgen und somit auch die ATAC-HDP-Story noch populärer machen

Eine Faustregel besagt, dass sich der inhaltliche Wert eines Postings umgekehrt proportional zur Anzahl der darin verwendeter Smilies verhält.
Bitte sei mir nicht bös, aber was Du Dir da hymnisch zusammendichtest, ist schlichtweg Nonsens. Die ASCO ist ein wissenschaftlicher Kongress, dort werden Fakten präsentiert, mit inhaltsleerem Marktgeschrei kommt man da nicht weiter. Entscheidend wird die Validierung der ATAC-Technologie sein und dazu sind zunächst Ergebnisse der bevorstehenden HDP-101-Studie von Bedeutung.
Antwort auf Beitrag Nr.: 57.855.777 von Joschka Schröder am 29.05.18 12:53:21Insgesamt gebe ich dir da recht. Aber an Kongressen wie der Asco trifft sich auch die ganze Branche und es finden zahlreiche Meetings und auch Vertragsverhandlungen statt. Und wichtig für HDP ist nicht nur der eigene Kandidat 101 sondern auch was die Vertragspartner wie Mangenta oder Takeda mit den Molekülen anstellen. Wobei Takeda zur Zeit vielleicht mit Shire andere Sorgen hat als HDP.
!
Dieser Beitrag wurde von CloudMOD moderiert. Grund: ANB-widrige Anmeldung
Antwort auf Beitrag Nr.: 57.855.777 von Joschka Schröder am 29.05.18 12:53:21@ Joschka, okay Dein Hinweis und was /wie es wirklich ab dem 01.06.18 auf der ASCO ablaufen wird werden uns letztendlich nur die Beteiligten berichten können. 
Ich bin wahrscheinlich nicht so ein rationaler Typ wie evtl. Du. Für mich gehören Emotionen (z.B. in Form von Smilies) zur Einwertung einer Meldung dazu. Hier spielt meine Mannschaft (HDP!) und da gehe ich auch erkennbar als Fan ins Stadion … mit Trikot, Kappe, emotionalen Erwartungen etc. und Jubel bei einem Tor für meine Mannschaft. Es nur zur Kenntnis zu nehmen und abzuhaken, wenn man z.B. 1:0 gewonnen hat und anschl. mit bspw. risikogewichteter Wahrscheinlichkeitsanalyse im stillen Kämmerlein zu errechnen welcher Tabellenplatz am Ende der Saison rausspringen würde ist nicht mein Ding. Das würde ich aber auch niemandem übel nehmen, der eher dafür der Typ ist. Jedem so wie es ihm Spaß macht und er seine Meinung vertreten will.
Was hältst Du von der IPO Meldung und den Auswirkungen für die weitere Partnerschaft von Magenta und HDP?

Ich bin wahrscheinlich nicht so ein rationaler Typ wie evtl. Du. Für mich gehören Emotionen (z.B. in Form von Smilies) zur Einwertung einer Meldung dazu. Hier spielt meine Mannschaft (HDP!) und da gehe ich auch erkennbar als Fan ins Stadion … mit Trikot, Kappe, emotionalen Erwartungen etc. und Jubel bei einem Tor für meine Mannschaft. Es nur zur Kenntnis zu nehmen und abzuhaken, wenn man z.B. 1:0 gewonnen hat und anschl. mit bspw. risikogewichteter Wahrscheinlichkeitsanalyse im stillen Kämmerlein zu errechnen welcher Tabellenplatz am Ende der Saison rausspringen würde ist nicht mein Ding. Das würde ich aber auch niemandem übel nehmen, der eher dafür der Typ ist. Jedem so wie es ihm Spaß macht und er seine Meinung vertreten will.
Was hältst Du von der IPO Meldung und den Auswirkungen für die weitere Partnerschaft von Magenta und HDP?
Antwort auf Beitrag Nr.: 57.856.524 von behavior am 29.05.18 14:09:12Mit dem IPO müssen sie sich sputen, die Zeiten werden ungemütlicher. Natürlich ist es positiv, wenn Kooperationspartner ausreichend Geld haben, um ihre Projekte zu verfolgen.
Ladenhüter aus Ladenburg
Ick gloob meen Schwein pfeift, du dumme Aktie. Kannst doch nich och wie wir nach Süden schippern. Hast schon mal wat von Pennystock jehört? Jeht janz schnelle, gloob ma nur.
Antwort auf Beitrag Nr.: 57.856.524 von behavior am 29.05.18 14:09:12
- Exklusive ATAC-Forschungskooperation mit Magenta eröffnet neue Bereiche in der Onkologie und anderen Indikationen
- Lizenzvertrag auf Patent mit Universität von Texas MD Anderson Cancer Center für potenziellen Biomarker abgeschlossen
- Beratungen mit dem Paul-Ehrlich-Institut und der FDA erfolgreich
- Finanzzahlen im Rahmen der Planung mit deutlichem Umsatzanstieg
- Öffentliche Telefonkonferenz am 12. Juli 2018 um 15:00 Uhr MESZ
https://www.dgap.de/dgap/News/corporate/heidelberg-pharma-be…
Halbjahresbericht
Heidelberg Pharma berichtet über das erste Halbjahr- Exklusive ATAC-Forschungskooperation mit Magenta eröffnet neue Bereiche in der Onkologie und anderen Indikationen
- Lizenzvertrag auf Patent mit Universität von Texas MD Anderson Cancer Center für potenziellen Biomarker abgeschlossen
- Beratungen mit dem Paul-Ehrlich-Institut und der FDA erfolgreich
- Finanzzahlen im Rahmen der Planung mit deutlichem Umsatzanstieg
- Öffentliche Telefonkonferenz am 12. Juli 2018 um 15:00 Uhr MESZ
https://www.dgap.de/dgap/News/corporate/heidelberg-pharma-be…
Magenta - Lotterie / Zu Risiken lesen Sie den Halbjahres-Finanzbericht von HDP (Kurslooser)
"...bis zu 334 Mio. USD erhalten, WENN Magenta die Optionen für ALLE Zielmoleküle ausübt UND ALLE Meilensteine erreicht WÜRDEN."
Antwort auf Beitrag Nr.: 58.193.144 von BICYPAPA am 12.07.18 07:19:17Telix Pharmaceuticals Limited (ASX.TLX) (“Telix”, the “Company”), an Australian biopharmaceutical company focused on the development of diagnostic and therapeutic products based on targeted radiopharmaceuticals or “molecularlytargeted radiation” (“MTR”) is pleased to announce that the Company has filed to initiate a Phase III trial in Europe for 89Zr-DFO-girentuximab (TLX250) for the imaging of renal (kidney) cancer with Positron Emission Tomography (PET).
Quelle und gesamter Text:
http://www.telixpharma.com/investors/asx-announcements/
Ich glaube, dieser Start löst eine Milestonezahlung an Heidelberg Pharma aus. Wir werden dann sowieso bald eine Meldung von Heidelberg Pharma bekommen
Quelle und gesamter Text:
http://www.telixpharma.com/investors/asx-announcements/
Ich glaube, dieser Start löst eine Milestonezahlung an Heidelberg Pharma aus. Wir werden dann sowieso bald eine Meldung von Heidelberg Pharma bekommen
Der Kursverlauf zeigt die völlige Unerheblichkeit der o.g. Meldung. Auf Magenta (s.o.) kommt es an.
Antwort auf Beitrag Nr.: 58.512.870 von BICYPAPA am 23.08.18 01:54:34
Historie
Wurden Sie nicht auf w:o "Märchenerzähler" genannt?
Antwort auf Beitrag Nr.: 58.515.219 von versuchsprimat am 23.08.18 11:00:29
Sorry!
Das war mogli3!
Antwort auf Beitrag Nr.: 58.515.159 von versuchsprimat am 23.08.18 10:54:46
Sollte das Anwendungsgebiet erweitert werden, dürfte sich langfristig das addressierte Volumen noch verdoppeln. Und du meinst das hat keine Bedeutung. Nur weil die meisten Aktionäre diese Nachricht noch nicht sofort interpretieren können, heißt das nicht, dass hier ein riesiges Potential für Telix und Heidelberg Pharma schlummert. Deine Bemerkung zeigt ja nur, dass du es selber nicht einschätzen kannst. Ich habe Heidelberg Pharma nicht nur im Trading Depot sondern auch seit heute in meinem Langfristdepot.
Wir sprechen da
Wir sprechen da mittelfristig von einem Umsatzvolumen von ca 100 Millionen € und Milestones bis zu 30% Umsatzbeteiligung für Heidelberg Pharma.Sollte das Anwendungsgebiet erweitert werden, dürfte sich langfristig das addressierte Volumen noch verdoppeln. Und du meinst das hat keine Bedeutung. Nur weil die meisten Aktionäre diese Nachricht noch nicht sofort interpretieren können, heißt das nicht, dass hier ein riesiges Potential für Telix und Heidelberg Pharma schlummert. Deine Bemerkung zeigt ja nur, dass du es selber nicht einschätzen kannst. Ich habe Heidelberg Pharma nicht nur im Trading Depot sondern auch seit heute in meinem Langfristdepot.
Antwort auf Beitrag Nr.: 58.515.288 von BICYPAPA am 23.08.18 11:07:15
"Die meisten Aktionäre sind dumm"
Interessante Sichtweise, weise Hoheit. Am Markt hat immer der Kurs recht.
Antwort auf Beitrag Nr.: 58.515.393 von versuchsprimat am 23.08.18 11:19:06
P.S.
Gilt die überhebliche Aussage auch für die institutionellen Anleger, die bekanntlich mit grossen Stückzahlen den Kurs bestimmen?
Antwort auf Beitrag Nr.: 58.515.423 von versuchsprimat am 23.08.18 11:22:16
Ja, die Antwort
Ja, die Antwort gilt für alle. Wenn sie die Fähigkeit nicht besitzen den Sachverhalt einer Firma richtig zu analysieren dann können sie es halt nicht. Das gilt gleichermaßen für Kleinanleger wie für die institutionellen Anleger. Zumal die Faktenlage hier bei 89Zr-DFO-girentuximab seit langem klar und eindeutig war. Sie haben es dann nicht berücksichtigt. Dann war es eben schlecht. Doch es ist deren Problem. Als Kleinanleger lebt man von der falschen Einschätzung anderer Anleger. Dabei ist es unerheblich ob es institutionellen Anleger (es sind auch Menschen mit Fehlern) oder Kleinanleger sind.
Antwort auf Beitrag Nr.: 58.515.516 von BICYPAPA am 23.08.18 11:30:11
Auf der HV beschlossene Kapitalerhöhung
Die wäre nach Ihren Aussagen dann wohl überflüssig. Abwarten und Kurs verfolgen. Dann erst wird der Sieger gekürt.
Antwort auf Beitrag Nr.: 58.515.549 von versuchsprimat am 23.08.18 11:33:10
Sollte Takeda oder Magenta eine Optionszusage machen, wären solche Maßnahmen überhaupt nicht nötig. Außerdem "drohen" ja jetzt wohl bald die Milestones von Telix und wenn es regelkonform zugeht wohl auch Umsatzbeteiligungen. Die Maßnahme wäre dann gar nicht mehr nötig. Selbst wenn man zur Überbrückung noch eine kleine Maßnahme bräuchte, wäre das nun auch kein Beinbruch. Sie sind im Biotechbereich üblich. Bis dahin stehen ja dann noch die beiden Optionsentscheidungen an. Selbst nur mit Girentuximab alleine könnte Heidelberg Pharma jetzt bei 30% Umsatzbeteiligung profitabel sein. Aber dafür ist Heidelberg Pharma nicht da.
Auf der Hauptversammlung
Auf der Hauptversammlung wurde gar keine Kapitalerhöhung beschlossen. Es wurde nur die Möglichkeit geschaffen, falls überhaupt erforderlich, solch eine Kapitalmaßnahme durchzuführen. Das sind Vorratsbeschlüsse, wie sie bei fast allen Unternehmen gerade im Biotechbereich üblich sind.Sollte Takeda oder Magenta eine Optionszusage machen, wären solche Maßnahmen überhaupt nicht nötig. Außerdem "drohen" ja jetzt wohl bald die Milestones von Telix und wenn es regelkonform zugeht wohl auch Umsatzbeteiligungen. Die Maßnahme wäre dann gar nicht mehr nötig. Selbst wenn man zur Überbrückung noch eine kleine Maßnahme bräuchte, wäre das nun auch kein Beinbruch. Sie sind im Biotechbereich üblich. Bis dahin stehen ja dann noch die beiden Optionsentscheidungen an. Selbst nur mit Girentuximab alleine könnte Heidelberg Pharma jetzt bei 30% Umsatzbeteiligung profitabel sein. Aber dafür ist Heidelberg Pharma nicht da.
!
Dieser Beitrag wurde von MadMod moderiert. Grund: unnötige Provokation
Antwort auf Beitrag Nr.: 58.512.870 von BICYPAPA am 23.08.18 01:54:34
Telix Pharmaceuticals, University of Melbourne and Peter Mac to Collaborate on Colorectal Cancer
Melbourne (Australia) – 24 August 2018. Telix Pharmaceuticals Limited (ASX.TLX) (“Telix”, the “Company”) has today announced a research collaboration with the University of Melbourne to investigate the use of targeted radiopharmaceuticals or “molecularly-targeted radiation” (MTR) to provide improved treatments for colorectal cancer patients. The collaboration will be led by Associate Professor Frederic Hollande (University of Melbourne Centre for Cancer Research) and Professor Alexander Heriot (Peter MacCallum Cancer Centre). The research program will explore the role of a tumour associated antigen, carbonic anhydrase IX (CAIX), in metastatic colorectal cancer. CAIX could be used as a potential pathway for new and more targeted diagnostic and therapeutic applications of Telix’s TLX250 (Girentuximab) program, currently under devleopment for renal cancer. As with many cancers1, high expression of CAIX in colorectal cancer tumours is a prognostic indicator for poor outcomes for patients treated with the currently available therapies2. Telix’s Director of Research and Development, Dr. Michael Wheatcroft, stated, “As part of our ongoing R&D strategy, we are committed to exploring potentially new indications for our programs. TLX250 imaging and therapy has potential in colorectal cancer where conventional radiation oncology strategies can be more limited, particularly for highly invasive disease. Using PET to more accurately stage patients and then deliver molecularly-targeted radiation to very sensitive tissues could prove to be a better option for patients than external beam radiation.” Professor Heriot noted: “Around 25 percent of colorectal cancer patients initially present with metastatic disease, and another 25 percent will develop subsequent metastases after being originally treated for a local stage of the disease. Unfortunately, over 80 percent of patients presenting with metastatic disease have unresectable metastases and systemic chemotherapy remains insufficiently effective to treat these patients, resulting in a very poor survival outlook. There is therefore a pressing need for alternative approaches to better target and treat these metastatic tumours.” Associate Professor Hollande added: “This pilot research project will more precisely explore CAIX expression in patients with metastatic colorectal cancer by correlating immunohistochemistry and RNA profiles of surgical resection specimens. This will enable us to understand how CAIX expression changes as a function of tumour growth, including through the study of organoids grown in the lab from actual patient metastasis samples.”
Neues Anwendungsgebiet für TLX250
Ich hatte es gestern schon mal kurz angesprochen. Man erschließt jetzt neue lukrative Anwendungsgebiete für Girentuximab. . Damit dürfte sich langfristig das Potential für Heidelberg Pharma verdoppeln. Girentuximab ist von Heidelberg Pharma an Telix auslizensiert. Während sie für das Hauptanwendungsgebiet beim Nierenkrebs bei einem geschätzten Umsatzvolumen von 100 Millionen € über 30% erhalten, beleuft sich die Umsatzbeteiligung bei allen zusätzlichen Indikationen bei einem viel höheren Umsatzvolumen in mehreren neuen Anwendungsgebieten etwa auf 5 % Beteiligung für Heidelberg Pharma. Damit werden langfristig die Einkünfte aber mehr als verdoppelt.Telix Pharmaceuticals, University of Melbourne and Peter Mac to Collaborate on Colorectal Cancer
Melbourne (Australia) – 24 August 2018. Telix Pharmaceuticals Limited (ASX.TLX) (“Telix”, the “Company”) has today announced a research collaboration with the University of Melbourne to investigate the use of targeted radiopharmaceuticals or “molecularly-targeted radiation” (MTR) to provide improved treatments for colorectal cancer patients. The collaboration will be led by Associate Professor Frederic Hollande (University of Melbourne Centre for Cancer Research) and Professor Alexander Heriot (Peter MacCallum Cancer Centre). The research program will explore the role of a tumour associated antigen, carbonic anhydrase IX (CAIX), in metastatic colorectal cancer. CAIX could be used as a potential pathway for new and more targeted diagnostic and therapeutic applications of Telix’s TLX250 (Girentuximab) program, currently under devleopment for renal cancer. As with many cancers1, high expression of CAIX in colorectal cancer tumours is a prognostic indicator for poor outcomes for patients treated with the currently available therapies2. Telix’s Director of Research and Development, Dr. Michael Wheatcroft, stated, “As part of our ongoing R&D strategy, we are committed to exploring potentially new indications for our programs. TLX250 imaging and therapy has potential in colorectal cancer where conventional radiation oncology strategies can be more limited, particularly for highly invasive disease. Using PET to more accurately stage patients and then deliver molecularly-targeted radiation to very sensitive tissues could prove to be a better option for patients than external beam radiation.” Professor Heriot noted: “Around 25 percent of colorectal cancer patients initially present with metastatic disease, and another 25 percent will develop subsequent metastases after being originally treated for a local stage of the disease. Unfortunately, over 80 percent of patients presenting with metastatic disease have unresectable metastases and systemic chemotherapy remains insufficiently effective to treat these patients, resulting in a very poor survival outlook. There is therefore a pressing need for alternative approaches to better target and treat these metastatic tumours.” Associate Professor Hollande added: “This pilot research project will more precisely explore CAIX expression in patients with metastatic colorectal cancer by correlating immunohistochemistry and RNA profiles of surgical resection specimens. This will enable us to understand how CAIX expression changes as a function of tumour growth, including through the study of organoids grown in the lab from actual patient metastasis samples.”
Telix Analyse Girentuximab
Es gibt gerade eine aktuelle Präsentation mit aktuellen Zahlen zu Girentuximab. TLX-250.Folgende Eckdaten werden genannt:
Globaler Umsatz für die Bilddiagnostik etwa 70 Millionen € . Heidelberg Pharma erhält hiervon einen Betrag vom Netto Umsatz von ca 30%. Die Phase 3 soll nächstes Jahr beendet sein und dann das übliche Procedere bis zur Zulassung
Für die therapeutische Anwendung wird ein globaler Umsatz von etwa 450 Millionen € genannt. Telix erhält wahrscheinlich eine Umsatzbeteiligung von 5%. Es ist eine Vermutung da seitens Heidelberg Pharma eine einstellige Nettoumsatzbeteiligung genannt wird.
Zusätzlich zu diesen Anwendung sind noch Indikationserweiterungen in der Planung, wie wir oben der Meldung entnehmen können. Vom Umsatz her könnte das noch mal eine Verdoppelung der diagnostischen Zahlen bedeuten.
Weitere Einzelheiten hierzu findet ihr in der aktuellen Analyse.
https://www.edisoninvestmentresearch.com/research/report/tel…
Antwort auf Beitrag Nr.: 58.573.133 von BICYPAPA am 30.08.18 16:38:43
Ich möchte kurz nach dem Affimed Deal mit Roche ein kleines DBI Update machen und den ersten Kandidaten aus der Liste vorstellen. Es ist Heidelberg Pharma, die ich schon mal vor einem Jahr vorgestellt habe. Doch sie kommen jetzt mit mehreren Projekten in die heiße Phase und deshalb noch mal ein persönliches Update zu Heidelberg Pharma.
Doch erst mal zu dem DBI Update. Der Sieger im letzten Monat heißt Affimed, die mit einem riesigen Deal Einen sehr schönen Verlauf zeigen noch Evotec, Medigene und Magforce im letzten Monat.
Qiagen, Biofrontera, Paion, Pieris und Nanorepro mit positiven Vorzeichen und einem günstigen Umfeld für Biotechwerte.
für die Schlagzeilen sorgten. Auch Mologen meldet eine Verhandlung über eine Auslizensierung. Doch hier ist die Nachrichtenlage um Mologen sehr unklar. Personalien werden offen im Board diskutiert und eine Entscheidungsfindung ist für Außenstehende unmöglich. Deshalb ist hier erst mal sehr große Vorsicht angesagt.
Die Biotechwerte werden wieder sehr gemocht und der NBI Nasdaq Biotechindex verzeichnet diese Jahr mittlerweile eine Performance von 14,4%. Der DBI verzeichnet jetzt auch eine Performance von ca. 12,5 %. Doch nur 10 Werte, allen voran Affimed von 28 deutschen Biotechwerte sind dafür nennenswert verantwortlich. Ca. 20 Werte notieren im negativen Bereich.
Mein DBI Depot konnte wieder signifikant zulegen und verzeichnet jetzt eine Performance von knapp 32% und belegt etwa Rang 40 von 1540 Spielteilnehmern. Das Langfristdepot auch weiter im Aufwärtstrend mit jetzt einer Performance von ca 65%. Allerdings wurde das Depot am 12.11. letzten Jahres gestartet.
Eine Einzelaufstellung mache ich dann nächstes mal wieder, da ich heute ein Update zu Heidelberg Pharma schreiben wollte.
Heidelberg Pharma:
Eine aktuelle Präsentation könnt ihr dem folgendem link entnehmen.
http://heidelberg-pharma.com/files/201807_HD-Pharma-Company-…
Ein Wert, der schon lange in meinem Depot ist und eigentlich durch Unauffälligkeit sich etwas versteckte. Manchmal haben es diese Werte in sich. Deshalb kurz eine Vorstellung und ein Update.
Man kann Heidelberg Pharma grob in vier Teilbereiche eingliedern.
1. Das Wilex Erbe mit Redectane und Mesupron.
2. Die eigene ATAC Pipeline
3. Die ATAC Technologie Partner
4. Die Kooperationtspartnerschaften
1. Das Wilex Erbe mit Redectane und Mesupron.
Zu diesem Erbe gehören die beiden Wirkstoffe Mesupron und Redectane.
Mesupron ist an Link Health in China und Redhill für ROW in Israel auslizensiert. Es sollte schon länger eine Phase 1/2 gestartet werden. Doch Redhill setzt im Augenblick durch die Kassenlage ihre Prioriitäten in ihrer Pipeline anders und so ist dieser Wirkstoff wohl im Augenblick nicht so interessant für sie. Wir sollten diesem Wirkstoff jetzt nicht so viel Bedeutung zumessen.
Redectane ist an den Spezialisten Telix in Australien auslizensiert. Der Name diesse Wirkstoffes taucht auch in verschiedenen Benennungen auf TLX-250 ist die Telix Bezeichnung. Girentuximab der Wirkstoffname von Wilex. In verschiedenen Anwendungen je nach diagnostischer oder therapeutischer Anwendung sind auch noch anderen Namen gebräuchlich.
Und Redectane könnte schon in kurzer Zeit ein Goldesel für Heidelberg Pharma werden. In den letzten Tagen hat Telix in Europa den Antrag für die Durchführung einer Phase 3 Studie gestellt. Es läuft noch eine weitere kleine Phase 3 Studie, die aber in einigen Tagen beendet sein dürfte. Warum jetzt ein Goldesel. Heidelberg Pharma hat für diesen Wirkstoff enorm günstige Konditionen ausgehandelt.
In Kürze dürfte die Phase 3 Studie für die bilddiagnostische Anwendung starten. Die Märkte in USA und ROW sollten dann bald folgen. Nach einer aktuellen Studie soll der Umsatz für die diagnostische Anwendung bei etwa 70 Millionen € liegen. Heidelberg Pharma erhält neben den Milestones noch eine Umsatzbeteiligung von 30%
Ebenfalls ist TLX-250 Redectane für die therapeutische Anwendung geeignet. Hier wird das Umsatzvolumen auf über 450 Millionen € geschätzt. Die Umsatzbeteiligung liegt für Heidelberg Pharma bei ca 5%. Es soll hier bald eine Phase 2 starten. Vorbereitende Studien laufen bereits in Holland Vom Volumen dürfte die Beteiligung für Heidelberg Pharma etwa gleich hoch sein wie in der diagnostischen Anwendung.
Telix geht zur Zeit Kooperationen mit TLX-250 in anderen Indikationen ein. Aus Berichten eignen sich mehrere Arten von Krebs für diesen Kandidaten. Auch hier würden Heidelberg Pharma dann langfristig für jede Indikationserweiterung 5% an Umsatzbeteiligung zustehen. Das Volumen dürfte dann geschätzt langfristig noch mal über 1 Milliarden € liegen. Das zur Langfristperspektive von Redectane.
Die Finanzierung und Vermarktung kostet dabei Heidelberg Pharma nichts mehr, da Telix und die Partner alle Kosten übernehmen.
Dies in Kürze zu Redectane.
2.Die ATAC Pipeline
Das sind die eigenen Wirkstoffe, die Heidelberg Pharma in der Entwicklung hat. Der Fokus liegt im Augenblick auf HDP-101 in der Anwendung beim Multiplen Myelom. Es wurden schon Gespräche mit den zuständigen Behörden geführt und der Sprung in die klinische Entwicklung steht kurz bevor. Das Umsatzvolumen für diese Indikation wird von Heidelberg Pharma wird für diese Indikation bei etwa 1,8 Milliarden Doller angegeben. Doch man sollte einfach mal abwarten wie die weitere Planung mit diesem Wirkstoff ist und welche Vermarktungsmodelle dann gewählt werden. Doch mit dem Übergang in die klinische Entwicklung steht für Heidelberg Pharma ein wichtiger Meilenstein an.
Weitere Entwicklungen werden vorangetrieben, befinden sich aber noch in sehr frühen Entwicklungsstadien.
3. Die ATAC Technologie Partner
In den letzten 15 Monaten konnte Heidelberg Pharma zwei große Entwicklungsvereinbarungen mit Takeda und Magenta Therapeutics eingehen. Man vereinbarte ein Optionsmodell, an deren Ende dann die Entscheidung der Partner steht. Sollten die Partner die Option eigehen werden dann folgende Vereinbarungen gültig.
Takeda:
Man arbeitet an drei Wirkstoffen, deren Ziel nicht veröffentlicht ist. Bei einer positiven Entscheidung werden dann bis zur kompletten Entwicklung dann ca 330 Millione $ fällig. Die Entwicklung übernimmt der Partner. Bei Vermarktung gibt es dann noch einmal Umsatzbeteiligungen.
Magenta Therapeutics:
Mit einer ganz neuen revolutionären Anwendung bei der Knochenmarkstransplation. Mit dem Wirkstoff, der zusammen entwickelt wird sollen dann noch vorhandene Krebszellen eliminiert werden und so ein patientenschonendes Verfahren möglich sein. Auf der letzten hauptversammlung wurde dieses Verfahren besonders herausgestellt. Die finanziellen Kondidatione bei 4 Wirkstoffen. Bei Optionsentscheidungen für die Wirkstoffe dann 330 Millionen Milestones an Heidelberg Pharma und bei Erfolg anschließende Umsatzbeteiligung.
4. Die Kooperationtspartnerschaften
Es gibt einige Kooperationspartnerschaften, die ich nicht mehr so weit ausführen möchte.
1. Es besteht eine Koperation mit Advanced Proteom Therapeutics
2. Es besteht eine Partnerschaft mit Nordic Nanovector mit denen gemeinsam ein Wirkstoff erarbeitet werden soll.
3. Ebenfalls vor einigen Monaten wurde eine vertrauliche Lizenzvereinbarung mit der Universität von Texas und dem MD Anderson Cancer Center abgeschlossen. Es geht hier um den interssanten Ansatz die Aminitin Anwendung in eine personlisierte Medizin zu überführen. Grundlage hierfür sind die TP53/RNA Forschungen.
Mit so einer breiten Palette an erfolgversrechenden Anwendungen gibt es nicht viele Werte in Deutschland. Als größter Investor zeichnet Dievini Hopp verantwortlich, die mittlerweile etwa 75% an dieser Firma besitzt. Der Start in die Phase 1 mit HDP-101. Dann noch weitere Partnerschaften mit dem erfolgversprechenden Wirkstoff Aminitin Und letztendlich die Optionsentscheidungen der Partner Takeda und Magenta dürften für weitere Kursimpulse sorgen. Einen Deal wie bei Affimed mit Roche halte ich gerade bei Heidelberg Pharma jederzeit bei diesen Erfolgsaussichten für möglich.. Kursbelastend sind noch einige Wandler die seit Anfang des Jahres bei etwa 2,60€ jederzeit gewandelt werden können. Kussicherheit bringt Hopp Dievini, die ihr Investment wohl nicht verkommen lassen. Meine Einschätzung. Enorme mittel bis langfristige Chancen allein schon durch Redectane bei biotechüblichem Risiko.
Update zu Heidelberg Pharma
Update zum 1.9.18 BICYPAPAIch möchte kurz nach dem Affimed Deal mit Roche ein kleines DBI Update machen und den ersten Kandidaten aus der Liste vorstellen. Es ist Heidelberg Pharma, die ich schon mal vor einem Jahr vorgestellt habe. Doch sie kommen jetzt mit mehreren Projekten in die heiße Phase und deshalb noch mal ein persönliches Update zu Heidelberg Pharma.
Doch erst mal zu dem DBI Update. Der Sieger im letzten Monat heißt Affimed, die mit einem riesigen Deal Einen sehr schönen Verlauf zeigen noch Evotec, Medigene und Magforce im letzten Monat.
Qiagen, Biofrontera, Paion, Pieris und Nanorepro mit positiven Vorzeichen und einem günstigen Umfeld für Biotechwerte.
für die Schlagzeilen sorgten. Auch Mologen meldet eine Verhandlung über eine Auslizensierung. Doch hier ist die Nachrichtenlage um Mologen sehr unklar. Personalien werden offen im Board diskutiert und eine Entscheidungsfindung ist für Außenstehende unmöglich. Deshalb ist hier erst mal sehr große Vorsicht angesagt.
Die Biotechwerte werden wieder sehr gemocht und der NBI Nasdaq Biotechindex verzeichnet diese Jahr mittlerweile eine Performance von 14,4%. Der DBI verzeichnet jetzt auch eine Performance von ca. 12,5 %. Doch nur 10 Werte, allen voran Affimed von 28 deutschen Biotechwerte sind dafür nennenswert verantwortlich. Ca. 20 Werte notieren im negativen Bereich.
Mein DBI Depot konnte wieder signifikant zulegen und verzeichnet jetzt eine Performance von knapp 32% und belegt etwa Rang 40 von 1540 Spielteilnehmern. Das Langfristdepot auch weiter im Aufwärtstrend mit jetzt einer Performance von ca 65%. Allerdings wurde das Depot am 12.11. letzten Jahres gestartet.
Eine Einzelaufstellung mache ich dann nächstes mal wieder, da ich heute ein Update zu Heidelberg Pharma schreiben wollte.
Heidelberg Pharma:
Eine aktuelle Präsentation könnt ihr dem folgendem link entnehmen.
http://heidelberg-pharma.com/files/201807_HD-Pharma-Company-…
Ein Wert, der schon lange in meinem Depot ist und eigentlich durch Unauffälligkeit sich etwas versteckte. Manchmal haben es diese Werte in sich. Deshalb kurz eine Vorstellung und ein Update.
Man kann Heidelberg Pharma grob in vier Teilbereiche eingliedern.
1. Das Wilex Erbe mit Redectane und Mesupron.
2. Die eigene ATAC Pipeline
3. Die ATAC Technologie Partner
4. Die Kooperationtspartnerschaften
1. Das Wilex Erbe mit Redectane und Mesupron.
Zu diesem Erbe gehören die beiden Wirkstoffe Mesupron und Redectane.
Mesupron ist an Link Health in China und Redhill für ROW in Israel auslizensiert. Es sollte schon länger eine Phase 1/2 gestartet werden. Doch Redhill setzt im Augenblick durch die Kassenlage ihre Prioriitäten in ihrer Pipeline anders und so ist dieser Wirkstoff wohl im Augenblick nicht so interessant für sie. Wir sollten diesem Wirkstoff jetzt nicht so viel Bedeutung zumessen.
Redectane ist an den Spezialisten Telix in Australien auslizensiert. Der Name diesse Wirkstoffes taucht auch in verschiedenen Benennungen auf TLX-250 ist die Telix Bezeichnung. Girentuximab der Wirkstoffname von Wilex. In verschiedenen Anwendungen je nach diagnostischer oder therapeutischer Anwendung sind auch noch anderen Namen gebräuchlich.
Und Redectane könnte schon in kurzer Zeit ein Goldesel für Heidelberg Pharma werden. In den letzten Tagen hat Telix in Europa den Antrag für die Durchführung einer Phase 3 Studie gestellt. Es läuft noch eine weitere kleine Phase 3 Studie, die aber in einigen Tagen beendet sein dürfte. Warum jetzt ein Goldesel. Heidelberg Pharma hat für diesen Wirkstoff enorm günstige Konditionen ausgehandelt.
In Kürze dürfte die Phase 3 Studie für die bilddiagnostische Anwendung starten. Die Märkte in USA und ROW sollten dann bald folgen. Nach einer aktuellen Studie soll der Umsatz für die diagnostische Anwendung bei etwa 70 Millionen € liegen. Heidelberg Pharma erhält neben den Milestones noch eine Umsatzbeteiligung von 30%
Ebenfalls ist TLX-250 Redectane für die therapeutische Anwendung geeignet. Hier wird das Umsatzvolumen auf über 450 Millionen € geschätzt. Die Umsatzbeteiligung liegt für Heidelberg Pharma bei ca 5%. Es soll hier bald eine Phase 2 starten. Vorbereitende Studien laufen bereits in Holland Vom Volumen dürfte die Beteiligung für Heidelberg Pharma etwa gleich hoch sein wie in der diagnostischen Anwendung.
Telix geht zur Zeit Kooperationen mit TLX-250 in anderen Indikationen ein. Aus Berichten eignen sich mehrere Arten von Krebs für diesen Kandidaten. Auch hier würden Heidelberg Pharma dann langfristig für jede Indikationserweiterung 5% an Umsatzbeteiligung zustehen. Das Volumen dürfte dann geschätzt langfristig noch mal über 1 Milliarden € liegen. Das zur Langfristperspektive von Redectane.
Die Finanzierung und Vermarktung kostet dabei Heidelberg Pharma nichts mehr, da Telix und die Partner alle Kosten übernehmen.
Dies in Kürze zu Redectane.
2.Die ATAC Pipeline
Das sind die eigenen Wirkstoffe, die Heidelberg Pharma in der Entwicklung hat. Der Fokus liegt im Augenblick auf HDP-101 in der Anwendung beim Multiplen Myelom. Es wurden schon Gespräche mit den zuständigen Behörden geführt und der Sprung in die klinische Entwicklung steht kurz bevor. Das Umsatzvolumen für diese Indikation wird von Heidelberg Pharma wird für diese Indikation bei etwa 1,8 Milliarden Doller angegeben. Doch man sollte einfach mal abwarten wie die weitere Planung mit diesem Wirkstoff ist und welche Vermarktungsmodelle dann gewählt werden. Doch mit dem Übergang in die klinische Entwicklung steht für Heidelberg Pharma ein wichtiger Meilenstein an.
Weitere Entwicklungen werden vorangetrieben, befinden sich aber noch in sehr frühen Entwicklungsstadien.
3. Die ATAC Technologie Partner
In den letzten 15 Monaten konnte Heidelberg Pharma zwei große Entwicklungsvereinbarungen mit Takeda und Magenta Therapeutics eingehen. Man vereinbarte ein Optionsmodell, an deren Ende dann die Entscheidung der Partner steht. Sollten die Partner die Option eigehen werden dann folgende Vereinbarungen gültig.
Takeda:
Man arbeitet an drei Wirkstoffen, deren Ziel nicht veröffentlicht ist. Bei einer positiven Entscheidung werden dann bis zur kompletten Entwicklung dann ca 330 Millione $ fällig. Die Entwicklung übernimmt der Partner. Bei Vermarktung gibt es dann noch einmal Umsatzbeteiligungen.
Magenta Therapeutics:
Mit einer ganz neuen revolutionären Anwendung bei der Knochenmarkstransplation. Mit dem Wirkstoff, der zusammen entwickelt wird sollen dann noch vorhandene Krebszellen eliminiert werden und so ein patientenschonendes Verfahren möglich sein. Auf der letzten hauptversammlung wurde dieses Verfahren besonders herausgestellt. Die finanziellen Kondidatione bei 4 Wirkstoffen. Bei Optionsentscheidungen für die Wirkstoffe dann 330 Millionen Milestones an Heidelberg Pharma und bei Erfolg anschließende Umsatzbeteiligung.
4. Die Kooperationtspartnerschaften
Es gibt einige Kooperationspartnerschaften, die ich nicht mehr so weit ausführen möchte.
1. Es besteht eine Koperation mit Advanced Proteom Therapeutics
2. Es besteht eine Partnerschaft mit Nordic Nanovector mit denen gemeinsam ein Wirkstoff erarbeitet werden soll.
3. Ebenfalls vor einigen Monaten wurde eine vertrauliche Lizenzvereinbarung mit der Universität von Texas und dem MD Anderson Cancer Center abgeschlossen. Es geht hier um den interssanten Ansatz die Aminitin Anwendung in eine personlisierte Medizin zu überführen. Grundlage hierfür sind die TP53/RNA Forschungen.
Mit so einer breiten Palette an erfolgversrechenden Anwendungen gibt es nicht viele Werte in Deutschland. Als größter Investor zeichnet Dievini Hopp verantwortlich, die mittlerweile etwa 75% an dieser Firma besitzt. Der Start in die Phase 1 mit HDP-101. Dann noch weitere Partnerschaften mit dem erfolgversprechenden Wirkstoff Aminitin Und letztendlich die Optionsentscheidungen der Partner Takeda und Magenta dürften für weitere Kursimpulse sorgen. Einen Deal wie bei Affimed mit Roche halte ich gerade bei Heidelberg Pharma jederzeit bei diesen Erfolgsaussichten für möglich.. Kursbelastend sind noch einige Wandler die seit Anfang des Jahres bei etwa 2,60€ jederzeit gewandelt werden können. Kussicherheit bringt Hopp Dievini, die ihr Investment wohl nicht verkommen lassen. Meine Einschätzung. Enorme mittel bis langfristige Chancen allein schon durch Redectane bei biotechüblichem Risiko.
Antwort auf Beitrag Nr.: 58.589.918 von BICYPAPA am 01.09.18 11:32:40
Wenn ich das noch richtig in Erinnerung habe, hat Redectane doch damals in der Phase III bei der Sensitivität nicht den vorgegebenen p-Value erreicht.
Worauf lässt sich denn die Annahme stützen, dass es diesmal besser läuft?
Redectane
Wenn ich das noch richtig in Erinnerung habe, hat Redectane doch damals in der Phase III bei der Sensitivität nicht den vorgegebenen p-Value erreicht.
Worauf lässt sich denn die Annahme stützen, dass es diesmal besser läuft?
Antwort auf Beitrag Nr.: 58.590.035 von Bilanzgewinn am 01.09.18 11:49:42
https://www.edisoninvestmentresearch.com/research/report/tel…" target="_blank" rel="nofollow ugc noopener">https://www.edisoninvestmentresearch.com/research/report/tel…
Recherchen bitte auch von der Telix Webseite. Da gibt's Einzelheiten in den Berichten mit Bildern.
http://www.telixpharma.com/
Eine kleine Kopie eines Ausschnittes aus der Analyse von Edison mit dem Hinweis auf ein anderes Isotop

Die Grundlagen gibts
Die Begründung gibt's aus folgender Analyse.https://www.edisoninvestmentresearch.com/research/report/tel…" target="_blank" rel="nofollow ugc noopener">https://www.edisoninvestmentresearch.com/research/report/tel…
Recherchen bitte auch von der Telix Webseite. Da gibt's Einzelheiten in den Berichten mit Bildern.
http://www.telixpharma.com/
Eine kleine Kopie eines Ausschnittes aus der Analyse von Edison mit dem Hinweis auf ein anderes Isotop

Antwort auf Beitrag Nr.: 58.590.134 von BICYPAPA am 01.09.18 12:09:07
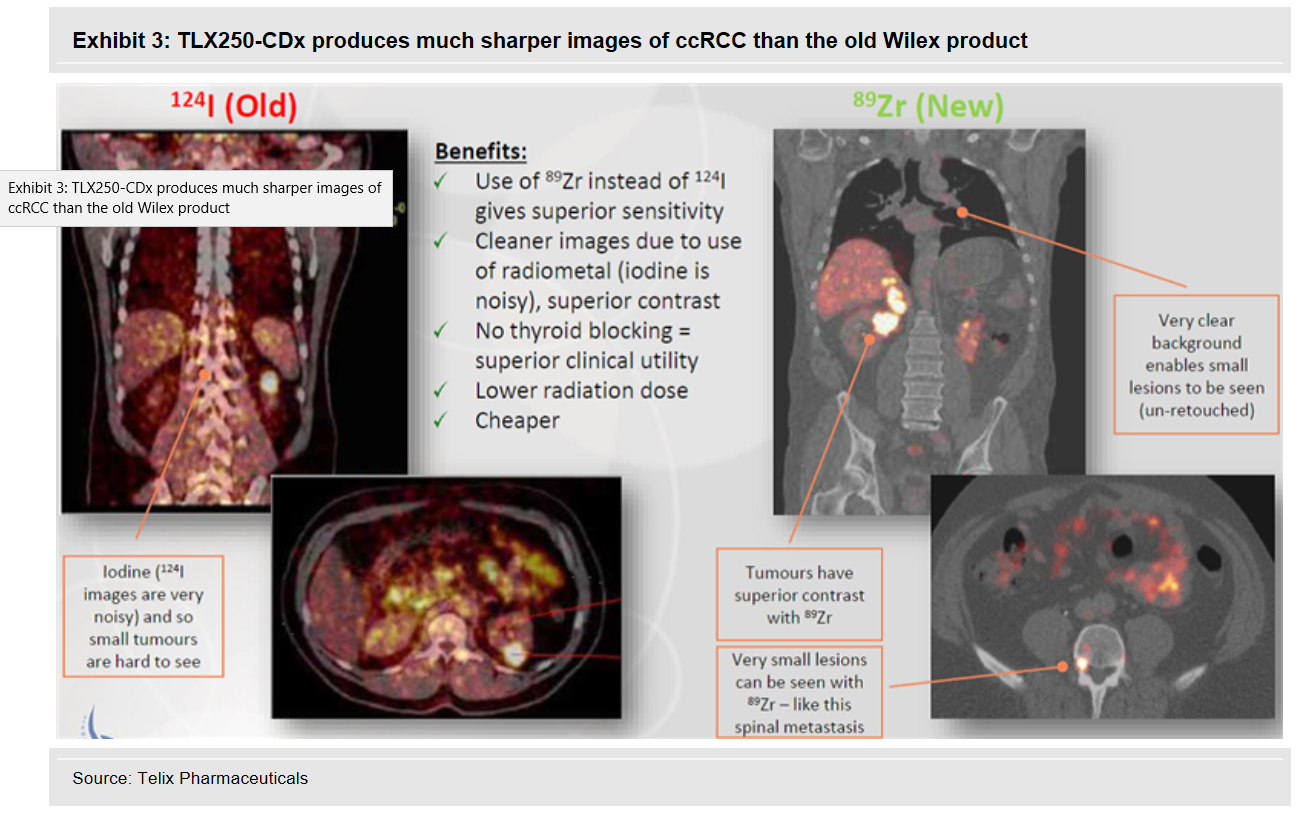
Ergänzung aus der Analyse
Hab hier aus der Analyse das entscheidende Bild kopiert.
Antwort auf Beitrag Nr.: 58.589.918 von BICYPAPA am 01.09.18 11:32:40
Ich hoffe ihr könnt mir ferzeihen.
Entschuldigt bitte die vielen Fehler
Ich bitte euch die vielen Fehler in dem Update zu entschuldigen. Aus irgendwelchen Gründen ist eine unkorrigierte Fassung durchgerutscht. Vom Sinn her sind die Ausführungen verständlich. Deshalb lasse ich den Beitrag mal so stehen. Ist nur ein wenig peinlich, wenn man sich so viel Mühe macht und man schickt dann die unkorregierte Fassung ab.Ich hoffe ihr könnt mir ferzeihen.

Korrigierte Fassung und Update.
In meinem letzten Beitrag waren doch zu viele Fehler drin. Deshalb korrigiere und ergänze ich meine Ausführung zu Heidelberg Pharma.Heidelberg Pharma:
Eine aktuelle Präsentation von Heidelberg Pharma könnt ihr dem folgendem link entnehmen.
http://heidelberg-pharma.com/files/201807_HD-Pharma-Company-…
Eine Version von der Hauptversammlung in Deutsch.
http://heidelberg-pharma.com/files/20180626_HV-Prsentation-2…
Ein Wert, der schon lange in meinem Depot ist und eigentlich durch Unauffälligkeit sich etwas versteckte. Manchmal haben es diese Werte in sich. Deshalb kurz eine Vorstellung und ein Update zu Heidelberg Pharma.
Man kann Heidelberg Pharma grob in vier Teilbereiche eingliedern.
1. Das Wilex Erbe mit Redectane und Mesupron.
2. Die eigene ATAC Pipeline mit Amatinin Wirkstoffen
3. Die ATAC Technologie Partner
4. Die Kooperationtspartnerschaften
1. Das Wilex Erbe mit Redectane und Mesupron.
Zu diesem Erbe gehören die beiden Wirkstoffe Mesupron und Redectane.
Mesupron ist ein Krebswirkstoff und ist an Link Health in China und Redhill für ROW in Israel auslizensiert. Es sollte schon länger eine Phase 1/2 gestartet werden. Doch Redhill setzt im Augenblick durch die Kassenlage ihre Prioriitäten in ihrer Pipeline anders und so ist dieser Wirkstoff wohl im Augenblick nicht so interessant für sie. Wir sollten diesem Wirkstoff jetzt nicht so viel Bedeutung zumessen. Bei Aktivitäten der Lizenznehmer wird Mesupron dann auch wieder in den Fokus rücken.
Redectane, ursprünglich ein Diagnostikum in der Entwicklung von Wilex bei Nierenkrebs ist an den Spezialisten Telix in Australien auslizensiert. Der Name diesse Wirkstoffes taucht auch in verschiedenen Benennungen auf TLX-250 ist die Telix Bezeichnung. Girentuximab der Wirkstoffname von Wilex. In verschiedenen Anwendungen je nach diagnostischer oder therapeutischer Anwendung sind auch noch anderen Namen gebräuchlich.
Und Redectane könnte schon in kurzer Zeit ein Goldesel für Heidelberg Pharma werden. In den letzten Tagen hat Telix in Europa den Antrag für die Durchführung einer Phase 3 Studie in EU gestellt. Es läuft noch eine weitere kleine vorbereitende Phase 3 Studie in Holland, die aber in einigen Tagen beendet sein dürfte.
Warum jetzt ein Goldesel. Heidelberg Pharma hat für diesen Wirkstoff enorm günstige Konditionen ausgehandelt. In Kürze dürfte die Phase 3 Studie nach dem Antrag von Telix für die bilddiagnostische Anwendung starten. Die Märkte in USA und ROW sollten dann bald folgen. Nach einer aktuellen Studie soll der Umsatz für die diagnostische Anwendung bei etwa 70 Millionen € liegen. Heidelberg Pharma erhält neben den Milestones noch eine Umsatzbeteiligung von 30%.
Ebenfalls ist TLX-250 Redectane für die therapeutische Anwendung geeignet. Hier wird das Umsatzvolumen auf über 450 Millionen € geschätzt. Die Umsatzbeteiligung liegt für Heidelberg Pharma bei ca 5%. Es soll hier bald mehrere Phase 2 Studien starten. Vorbereitende Studien laufen bereits in Holland Vom Gesamtumsatz dürfte die Beteiligung für Heidelberg Pharma etwa gleich hoch sein wie in der diagnostischen Anwendung.
Telix geht zur Zeit Kooperationen mit TLX-250 in anderen Indikationen ein. Aus Berichten laut Telix eignen sich mehrere Arten von Krebs für diesen Wirkstoffkandidaten. Auch hier würden Heidelberg Pharma dann langfristig für jede Indikationserweiterung 5% an Umsatzbeteiligung zustehen. Das Gesamtumsatzvolumen dürfte dann geschätzt langfristig noch mal weit über 1 Milliarden € liegen.
Das zur Langfristperspektive von Redectane. Die Finanzierung und Vermarktung kostet dabei Heidelberg Pharma nichts mehr, da Telix und die Partner alle Kosten übernehmen.
Wilex selber hatte damals bei der Zulassung große Schwierigkeiten Redectane als Diagnostikum wegen der Sensitivität zugelassen zu bekommen. Doch Telix hat dieses Präparat geändert und die Isotopen ausgetauscht. Die Verbesserung sind jetzt im folgendem Schaubild sichtbar und die Sensitivität Probleme mit Redectane scheinen gelöst.

2. Die eigene ATAC Pipeline mit Amatinin Wirkstoffen.
Das sind die eigenen Amanitin Wirkstoffe, die Heidelberg Pharma in der Entwicklung hat. Amanitin ist das Gift des Knollenblätterpilzes und soll nun bei der Bekämpfung von Krebs helfen. Dabei soll dieser Wirkstoff die Fähigkeit haben Resistenzen zu durchbrechen. Weiterhin sollen dann auch ruhende und sich teilende Krebszellen von diesem Krebswirkstoff eliminiert
Der Fokus liegt im Augenblick auf HDP-101 in der Anwendung beim Multiplen Myelom. Es wurden schon Gespräche mit den zuständigen Behörden geführt und der Sprung in die klinische Entwicklung steht kurz bevor. Das Umsatzvolumen für diese Indikation wird von Heidelberg Pharma wird für diese Indikation bei etwa 1,8 Milliarden Doller angegeben. Doch man sollte einfach mal abwarten wie die weitere Planung mit diesem Wirkstoff ist und welche Vermarktungsmodelle dann gewählt werden. Doch mit dem Übergang in die klinische Entwicklung steht für Heidelberg Pharma ein wichtiger Meilenstein an.
Weitere Wirkstoffe werden vorangetrieben, befinden sich aber noch in sehr frühen Entwicklungsstadien.
3. Die ATAC Technologie Partner
In den letzten 15 Monaten konnte Heidelberg Pharma zwei große Entwicklungsvereinbarungen mit Takeda und Magenta Therapeutics eingehen. Man vereinbarte ein Optionsmodell, an deren Ende dann die Entscheidung der Partner steht. Sollten die Partner die Option eigehen werden dann folgende Vereinbarungen gültig.
Takeda:
Man arbeitet an drei Wirkstoffen, deren Ziel aus verständlichen Geheimhaltungsgründen nicht veröffentlicht ist. Bei einer positiven Entscheidung werden dann bis zur kompletten Entwicklung dann ca 330 Millione $ fällig. Die Entwicklung übernimmt der Partner. Bei Vermarktung gibt es dann noch einmal Umsatzbeteiligungen.
Magenta Therapeutics:
Mit einer ganz neuen revolutionären Anwendung bei der Knochenmarktransplation. Mit dem Wirkstoff, der zusammen entwickelt wird sollen dann noch vorhandene Krebszellen eliminiert werden und so ein patientenschonendes Verfahren möglich sein. Auf der letzten Hauptversammlung wurde dieses Verfahren besonders herausgestellt. Die finanziellen Konditionen bei bis zu 4 Wirkstoffen. Bei postiver Optionsentscheidungen für die Wirkstoffe dann 330 Millionen Milestones an Heidelberg Pharma und bei Erfolg anschließende Umsatzbeteiligung.
4. Die Kooperationtspartnerschaften
Es gibt einige Kooperationspartnerschaften, die ich nicht mehr so weit ausführen und nur kurz erwähnen möchte.
1. Es besteht eine Kooperation mit Advanced Proteom Therapeutics
2. Es besteht eine Partnerschaft mit Nordic Nanovector mit denen gemeinsam ein Wirkstoff erarbeitet werden soll. Man hat sich erst kürzlich getroffen und die weitere Zusammenarbeit über einen Wirkstoffkandidaten diskutiert
3. Ebenfalls vor einigen Monaten wurde eine vertrauliche Lizenzvereinbarung mit der Universität von Texas und dem MD Anderson Cancer Center abgeschlossen. Es geht hier um den interessanten Ansatz die Amanitin Anwendung in eine personalisierte Medizin zu überführen. Grundlage hierfür sind die TP53/RNA Forschungen.
Meine Beurteilung:
So einer breiten Palette an erfolgversprechenden Anwendungen gibt es nicht viele Werte in Deutschland. Als größter Investor zeichnet Dievini Hopp verantwortlich, die mittlerweile etwa 75% an dieser Firma besitzen. Dann der baldige Start in die Phase 1 mit HDP-101 mit einem Amanitin Wirkstoff. Zusätzlich noch zukünftige weitere Partnerschaften mit dem erfolgversprechenden Wirkstoff Amanitin. Und letztendlich die Optionsentscheidungen der Partner Takeda und Magenta dürften für weitere Kursimpulse sorgen. Erfolgspotential bieten dann noch langfristig noch die Kooperationen, die jetzt noch gar nicht abschätzbar sind.
Als Absicherung dann noch die riesigen Erfolgsaussichten mit dem Wirkstoff Redectane/TLX-250, der sich nun bald in Phase 3 befindet. Ohne weitere Investition wird Heidelberg Pharma in etwa 2 Jahre erste Umsatzbeteilgungen generieren. Mittel bis Langfristig dürften dann die Einnahmen nur für Redectane bei über 50 Millionen € liegen. Wie oben angesprochen dies alles ohne weitere Investition und Vertriebskosten. Da es sich um ein Facharzt präperat zur Diagnose handelt, dürfte auch die Marktdurchdringung innerhalb kürzester Zeit geschehen
Einen Deal wie bei Affimed mit Roche halte ich gerade bei Heidelberg Pharma jederzeit bei diesen Erfolgsaussichten für möglich. Kursbelastend sind noch einige Wandler die seit Anfang des Jahres bei etwa 2,60€ jederzeit gewandelt werden können. Kurssicherheit bringt Hopp Dievini, die ihr Investment wohl nicht verkommen lassen. Bei Bedarf standen sie Heidelberg Pharma immer mit Finanzen, auch kurzfristig zur Seite. Sollte eine Überbrückung bis zu den ersten Redectane Umsatzbeteiligungen nötig sein rechne ich auch weiterhin mit der Unterstützung von Dievini Hopp. Neue Partnerschaften und Optionsentscheidungen könnten die Finanzsituation innerhalb kürzester Zeit sehr positiv verändern. Finanziell ist man mit der jetzigen planbaren Entwicklung im Augenblick bis in das Jahr 2020 gesichert.
Das kurz meine (BICYPAPA) Einschätzung zu Heidelberg Pharma in der korrigierten Version vom 2.9.2018
Viele offensichtlich unbedeutende Meldungen
Denn der Markt zeigt Flagge: sinkende Kurse!
Antwort auf Beitrag Nr.: 58.599.237 von versuchsprimat am 03.09.18 10:00:58....aber der Markt handelt nicht logisch und vernünftig, - oft, - aber nicht immer!
Antwort auf Beitrag Nr.: 58.593.794 von BICYPAPA am 02.09.18 09:43:17
In einem anderen Board wurde die Befürchtung geäußert, dass Magenta die Zusammenarbeit wieder beenden könnte. Natürlich sind Takeda und Magenta Therapeutics Optionsmodelle an denen sich diese Firmen an bestimmten Punkten für oder gegen einen Wirkstoff entscheiden müssen. Doch bis jetzt sind bei Magenta die Befürchtungen fehl am Platz. Gerade die Aminitin Variante steht im Mittelpunkt dieser neuen Anwendungsmethode bei der Vorbereitung der Knochenmarktransplantation.
Näheres hierzu von Heidelberg Pharma könnt ihr gut von der Präsentation der Hauptversammlung entnehmen. Sie ist in Deutsch geschrieben.
http://heidelberg-pharma.com/files/20180626_HV-Prsentation-2…
Die Sichtweise und die Wichtigkeit für Magenta ist klar in deren Webseite dkumentiert. Es lohnt sich da mal reinzuschauen worum es da eigentlich geht.
https://www.magentatx.com/

Es werden Befürchtungen geäußert, dass Magenta ebenso die Zusammenarbeit wie vor etwa 3 Jahren Roche mit Heidelberg Pharma aufkündigen könnte. Doch genau das Gegenteil ist der Fall. Innerhalb kürzester Zeit sind sie schon mit zwei Wirkstoffen MGTA-C100 und MGTA-C200 in die vorklinische Phase vorgedrungen. Sie legen dabei ein enormes Tempo vor. Mit MGTA-C300 sind sie noch in der Recherchephase. Über den vierten Kandidaten ist mir bis jetzt nichts bekannt.
Also mit dem großen Hoffnungsträger Redectane in Phase 3. Dann mit dem eigenen Wirkstoff HDP-101 deuten sich jetzt direkt zwei weitere Kandidaten aus der Magenta Kooperation für die klinische Entwicklung an. Natürlich ist bei Biotechwerten alles mit Risiko verbunden. Doch hier sieht es mir allerdings nicht nach einer Aufkündigung der Zusammenarbeit an.
Im Gegenteil. Ich rechne da eher mit neuen Kooperationen und Partnerschaften für Heidelberg Pharma.
Natürlich sind Biotechwerte immer riskobehaftet. Doch mit Redctane, die alleine Heidelberg Pharma schon zu einem lohnenden Investment machen, kommen ja noch die Eigenentwicklungen und die der Partnerschaften dazu. Aber durch Redectane ist das Risiko enorm abgemindert.
Ergänzung zu Magenta
In einem anderen Board wurde die Befürchtung geäußert, dass Magenta die Zusammenarbeit wieder beenden könnte. Natürlich sind Takeda und Magenta Therapeutics Optionsmodelle an denen sich diese Firmen an bestimmten Punkten für oder gegen einen Wirkstoff entscheiden müssen. Doch bis jetzt sind bei Magenta die Befürchtungen fehl am Platz. Gerade die Aminitin Variante steht im Mittelpunkt dieser neuen Anwendungsmethode bei der Vorbereitung der Knochenmarktransplantation.
Näheres hierzu von Heidelberg Pharma könnt ihr gut von der Präsentation der Hauptversammlung entnehmen. Sie ist in Deutsch geschrieben.
http://heidelberg-pharma.com/files/20180626_HV-Prsentation-2…
Die Sichtweise und die Wichtigkeit für Magenta ist klar in deren Webseite dkumentiert. Es lohnt sich da mal reinzuschauen worum es da eigentlich geht.
https://www.magentatx.com/

Es werden Befürchtungen geäußert, dass Magenta ebenso die Zusammenarbeit wie vor etwa 3 Jahren Roche mit Heidelberg Pharma aufkündigen könnte. Doch genau das Gegenteil ist der Fall. Innerhalb kürzester Zeit sind sie schon mit zwei Wirkstoffen MGTA-C100 und MGTA-C200 in die vorklinische Phase vorgedrungen. Sie legen dabei ein enormes Tempo vor. Mit MGTA-C300 sind sie noch in der Recherchephase. Über den vierten Kandidaten ist mir bis jetzt nichts bekannt.
Also mit dem großen Hoffnungsträger Redectane in Phase 3. Dann mit dem eigenen Wirkstoff HDP-101 deuten sich jetzt direkt zwei weitere Kandidaten aus der Magenta Kooperation für die klinische Entwicklung an. Natürlich ist bei Biotechwerten alles mit Risiko verbunden. Doch hier sieht es mir allerdings nicht nach einer Aufkündigung der Zusammenarbeit an.
Im Gegenteil. Ich rechne da eher mit neuen Kooperationen und Partnerschaften für Heidelberg Pharma.
Natürlich sind Biotechwerte immer riskobehaftet. Doch mit Redctane, die alleine Heidelberg Pharma schon zu einem lohnenden Investment machen, kommen ja noch die Eigenentwicklungen und die der Partnerschaften dazu. Aber durch Redectane ist das Risiko enorm abgemindert.
Antwort auf Beitrag Nr.: 58.606.593 von BICYPAPA am 04.09.18 07:48:49Vielen Dank BICYPAPA für die super Beiträge, da steckt viel interessante Information drin.
Antwort auf Beitrag Nr.: 58.606.593 von BICYPAPA am 04.09.18 07:48:49
Habe mir die Internetseite von Magenta angesehen und folgenden Auszug i.R. der Patient Preparation daraus kopiert:
"Before a transplant, patients are conditioned to remove existing stem cells in the bone marrow and diseased cells, and to prevent rejection of the incoming stem cells. This process currently uses highly toxic agents originally developed to treat cancer, and procedures such as radiation that kill cells in a non-specific manner. The toxic nature of these treatments prevents many patients from getting a transplant.
Magenta scientists have shown that antibodies that recognize stem cells linked to drugs can be used to safely and selectively remove stem cells and diseased cells.
The improved safety of these targeted conditioning agents may extend the use of curative bone marrow transplant to patients who cannot tolerate current conditioning methods and in patients where bone marrow transplant is currently thought to be too dangerous."
Insb. die von mir fett markierten Stellen lassen m.E. direkt auf den ATAC-Ansatz von Heidelberg Pharma hindeuten.
Wenn es demnächst auch so kommt, frage ich mich aus Sicht von Magenta aber schon, ob ich eher die bis zu 334 Mio. USD aus der Vereinbarung mit Heidelberg Pharma einplane oder doch Heidelberg Pharma eher zu einer eigenen Tochter machen wollen würde! Magenta hat immerhin durch das erst im Juni 2018 erfolgte IPO eine dick gefüllte Kassenlage! Heidelberg Pharma könnte dann den gesamten Prozess der Patient Preparation für Magenta abdecken. Die anderen Wertetreiber von Heidelberg Pharma wie Redectane, HDP 101, etc. wären dann on top und würden die Refi der Übernahme schnell sicherstellen!
@ BICYPAPA, hast Du dazu auch eine Meinung?
Prima Beiträge - Danke BICYPAPA
https://www.magentatx.com/programs/Habe mir die Internetseite von Magenta angesehen und folgenden Auszug i.R. der Patient Preparation daraus kopiert:
"Before a transplant, patients are conditioned to remove existing stem cells in the bone marrow and diseased cells, and to prevent rejection of the incoming stem cells. This process currently uses highly toxic agents originally developed to treat cancer, and procedures such as radiation that kill cells in a non-specific manner. The toxic nature of these treatments prevents many patients from getting a transplant.
Magenta scientists have shown that antibodies that recognize stem cells linked to drugs can be used to safely and selectively remove stem cells and diseased cells.
The improved safety of these targeted conditioning agents may extend the use of curative bone marrow transplant to patients who cannot tolerate current conditioning methods and in patients where bone marrow transplant is currently thought to be too dangerous."
Insb. die von mir fett markierten Stellen lassen m.E. direkt auf den ATAC-Ansatz von Heidelberg Pharma hindeuten.
Wenn es demnächst auch so kommt, frage ich mich aus Sicht von Magenta aber schon, ob ich eher die bis zu 334 Mio. USD aus der Vereinbarung mit Heidelberg Pharma einplane oder doch Heidelberg Pharma eher zu einer eigenen Tochter machen wollen würde! Magenta hat immerhin durch das erst im Juni 2018 erfolgte IPO eine dick gefüllte Kassenlage! Heidelberg Pharma könnte dann den gesamten Prozess der Patient Preparation für Magenta abdecken. Die anderen Wertetreiber von Heidelberg Pharma wie Redectane, HDP 101, etc. wären dann on top und würden die Refi der Übernahme schnell sicherstellen!

@ BICYPAPA, hast Du dazu auch eine Meinung?
Antwort auf Beitrag Nr.: 58.606.593 von BICYPAPA am 04.09.18 07:48:49Besten Dank für die wertvollen Beiträge. An der HV wurde mir schon gesagt dass Magenta ein hohes Tempo vorlege. Wenn dem alles so ist dann müsste bald einmal eine Meldung Magenta betreffend kommen. Die 334 Mio würden ja nicht auf einen Schlag fällig sondern würden sich über mehrere Jahre erstrecken- immer unter der Voraussetzung erfolgreicher Forschung. Eine Übernahme seitens Magenta würde Hopp auf alle Fälle verhindern. Ich glaube nicht dass er HDP viel unter einer Milliarde verkaufen würde, dazu hat er HDP/Wilex zu lange durchgefüttert.
MAGENTA Euphorie - Zur Zeit nur ein Traum
Die Meldung vom 05.03.2018 über die Forschungsvereinbarung von HDP und Magenta endet mit folgendem Warnhinweis:"Angesichts dieser Unwägbarkeiten, werden mögliche Investoren und Partner davor gewarnt, übermäßiges Vertrauen auf solche zukunftsgerichteten Aussagen zu stützen."
Also nur schlichte Träumer oder beruflich profitierende Trader blenden dies systematisch aus!
Antwort auf Beitrag Nr.: 58.618.365 von versuchsprimat am 05.09.18 09:02:12Oh je, oh je. Dieser Zusatz steht aus rechtlichen Gründen praktisch unter jeder Meldung die zukunfsgerichtet ist. Wenn du zwischen Risiken und Chancen nicht unterscheiden kannst bist du selber schuld. Hier ist man noch in der preklinischen Phase, die Risiken sind also besonders hoch, aber somit sich die Chancen. Du scheint dich hier mit deinem Risikoprofil ins Biotechforum verirrt zum haben. Bundesanleihen oder Sparschwein wären für dich das Richtige.
Schau, schaut, wer sich bei "schlicht" oder "beruflich" angesprochen fühlt
Freud hätte seine helle Freude daran, wie schnell einige Menschen sich outen."Hände weg von HDP" gilt für Anleger, die sich im Ernstfall keinen Totalverlust leisten können oder wollen. Nur berufliche Trader bringen fast immer ihre Schäfchen ins Trockene! Kein Normalanleger sollte sie füttern.
Antwort auf Beitrag Nr.: 58.618.566 von Mogli3 am 05.09.18 09:23:57
Der Gesetzgeber schützt damit gutgläubige Anleger vor zwielichtigen Gauklern und geldwütigen Spekulanten. Ihm sei Dank für diese soziale Regelung!
War die Information über Magenta auf der HV nur eine private Aussage unter 4 Augen?
Nur keine abfällige Aussage über unseren Rechtsstaat!
"Dieser Zusatz steht aus rechtlichen Gründen praktisch unter jeder Meldung die zukunfsgerichtet ist."Der Gesetzgeber schützt damit gutgläubige Anleger vor zwielichtigen Gauklern und geldwütigen Spekulanten. Ihm sei Dank für diese soziale Regelung!
War die Information über Magenta auf der HV nur eine private Aussage unter 4 Augen?
Antwort auf Beitrag Nr.: 58.606.593 von BICYPAPA am 04.09.18 07:48:49Vielen Dank für dein Update und deine weiteren Ausführungen. Sowas bringt in ein Forum richtig gute Qualität. Danke auch an mogli3 und behavior. Freue mich über weiter Informationen.
Antwort auf Beitrag Nr.: 58.606.593 von BICYPAPA am 04.09.18 07:48:49
Proceeding from cytotoxicity studies to the next phase of testing in animals necessitates scaling up processes by a significant factor that often requires outsourcing to other companies at considerable cost and down time. APC can now report that it has achieved a breakthrough in processing development candidates for scale up that will allow the Company to independently supply its partners with material.
The new modified protocol has enabled APC to progress collaborative programs as with Heidelberg Pharma (HDP) (Marketwired – January 08, 2018) by producing scaled-up amounts of antibody-drug conjugates with our proprietary, time-dependent, site-selective linking process. The Company can now handle the additional capacity necessary for animal testing, without resort to outsourcing and provide the requisite amounts of material at modest cost.
Allen Krantz, Chief Scientific Officer of APC, stated that “Our progress in reducing the volumes that required specialized equipment for purifying ADCs will facilitate technology transfer to our partners. The promising cytotoxicity studies that we announced in January provided the impetus for successfully scaling up our conjugative processes to accept a far larger scope of material necessary for the testing of potency and toxicity on animal subjects, which we are proud to have achieved in-house. For example, this technological advance has allowed us to efficiently produce samples for the HDP collaboration, which has now entered the animal phase of testing.”
Advanced Proteome Therapeutics Update
Advanced Proteome Therapeutics Corporation (“APC” or the “Company”) (TSXV: APC) (FSE: 0E8), is pleased to report continuing progress on its efforts to develop superior antibody drug conjugates (ADCs).Proceeding from cytotoxicity studies to the next phase of testing in animals necessitates scaling up processes by a significant factor that often requires outsourcing to other companies at considerable cost and down time. APC can now report that it has achieved a breakthrough in processing development candidates for scale up that will allow the Company to independently supply its partners with material.
The new modified protocol has enabled APC to progress collaborative programs as with Heidelberg Pharma (HDP) (Marketwired – January 08, 2018) by producing scaled-up amounts of antibody-drug conjugates with our proprietary, time-dependent, site-selective linking process. The Company can now handle the additional capacity necessary for animal testing, without resort to outsourcing and provide the requisite amounts of material at modest cost.
Allen Krantz, Chief Scientific Officer of APC, stated that “Our progress in reducing the volumes that required specialized equipment for purifying ADCs will facilitate technology transfer to our partners. The promising cytotoxicity studies that we announced in January provided the impetus for successfully scaling up our conjugative processes to accept a far larger scope of material necessary for the testing of potency and toxicity on animal subjects, which we are proud to have achieved in-house. For example, this technological advance has allowed us to efficiently produce samples for the HDP collaboration, which has now entered the animal phase of testing.”
Antwort auf Beitrag Nr.: 58.648.134 von BICYPAPA am 08.09.18 07:22:49
Quellenangabe: https://www.advancedproteome.com/2018/06/27/advanced-proteom…
Webseite:https://www.advancedproteome.com/
Quelle und Webseite
Hatte die Quellenangabe zu dem Update vergessen.Quellenangabe: https://www.advancedproteome.com/2018/06/27/advanced-proteom…
Webseite:https://www.advancedproteome.com/
Antwort auf Beitrag Nr.: 58.648.506 von BICYPAPA am 08.09.18 09:13:57
Hab noch eine Meldung aus Japan zu TLX-250 Redectane zur Partnerschaft von TLX-250 in Japan entdeckt.
MELBOURNE, Australia and KYOTO, Japan and TOKYO, Aug. 16, 2018 (GLOBE NEWSWIRE) -- Telix Pharmaceuticals Limited (ASX.TLX) ("Telix", the "Company"), a clinical-stage biopharmaceutical company focused on the development of diagnostic and therapeutic products based on targeted radiopharmaceuticals or "molecularly-targeted radiation" (MTR), and Nihon Medi-Physics Co., Ltd. ("NMP"), a leading manufacturer and supplier of radiopharmaceuticals and related products in Japan, have today announced that they have entered into a memorandum of understanding (MOU) for a commercial partnership in renal cancer imaging for the Japanese market.
The agreement between Telix and NMP is focused on Telix's TLX250 imaging program for renal cancer with Positron Emission Tomography (PET). Under the terms of the agreement, Telix and NMP will work together to establish a commercial partnership for TLX250 in Japan, with the objective of appointing NMP as an exclusive partner for the product in Japan. NMP will also support Telix in the near-term goal of including Japanese patients in Telix's global Phase III development program for TLX250.
Telix Pharmaceuticals Japan President, Dr. Shintaro Nishimura, stated, "NMP is a leading company in the Japanese radiopharmaceutical landscape with a strong track record of stable supply of PET imaging agents. As we develop our Japanese regulatory strategy for TLX250, we are pleased to have the experience and guidance of NMP."
NMP President, Mr. Hisashi Shimoda noted, "The technologies in which diagnostics and therapeutics are integrated will become increasingly important to the personalized medicine strategy for cancer treatment. TLX250 has the potential to become one of the best PET products in this field. Our goal is to identify and enrich our portfolio by new products and technologies that meet unmet medical need. It is our pleasure to collaborate with Telix to deliver new renal imaging capabilities to Japanese patients."
Telix on trading halt
Bin mal gespannt, was dahinter steckt.Hab noch eine Meldung aus Japan zu TLX-250 Redectane zur Partnerschaft von TLX-250 in Japan entdeckt.
MELBOURNE, Australia and KYOTO, Japan and TOKYO, Aug. 16, 2018 (GLOBE NEWSWIRE) -- Telix Pharmaceuticals Limited (ASX.TLX) ("Telix", the "Company"), a clinical-stage biopharmaceutical company focused on the development of diagnostic and therapeutic products based on targeted radiopharmaceuticals or "molecularly-targeted radiation" (MTR), and Nihon Medi-Physics Co., Ltd. ("NMP"), a leading manufacturer and supplier of radiopharmaceuticals and related products in Japan, have today announced that they have entered into a memorandum of understanding (MOU) for a commercial partnership in renal cancer imaging for the Japanese market.
The agreement between Telix and NMP is focused on Telix's TLX250 imaging program for renal cancer with Positron Emission Tomography (PET). Under the terms of the agreement, Telix and NMP will work together to establish a commercial partnership for TLX250 in Japan, with the objective of appointing NMP as an exclusive partner for the product in Japan. NMP will also support Telix in the near-term goal of including Japanese patients in Telix's global Phase III development program for TLX250.
Telix Pharmaceuticals Japan President, Dr. Shintaro Nishimura, stated, "NMP is a leading company in the Japanese radiopharmaceutical landscape with a strong track record of stable supply of PET imaging agents. As we develop our Japanese regulatory strategy for TLX250, we are pleased to have the experience and guidance of NMP."
NMP President, Mr. Hisashi Shimoda noted, "The technologies in which diagnostics and therapeutics are integrated will become increasingly important to the personalized medicine strategy for cancer treatment. TLX250 has the potential to become one of the best PET products in this field. Our goal is to identify and enrich our portfolio by new products and technologies that meet unmet medical need. It is our pleasure to collaborate with Telix to deliver new renal imaging capabilities to Japanese patients."
Antwort auf Beitrag Nr.: 58.657.296 von BICYPAPA am 10.09.18 05:44:22
Telix’s TLX250 program is based on the use of an anti-carbonic anhydrase IX (CAIX) antibody (girentuximab), to deliver diagnostic (89Zr for PET imaging) and therapeutic (177Lu) radiation to patients with CAIX-positive tumours. A number of Phase I, II and III trials have successfully explored the utility of girentuximab-targeted radiation delivery for clear cell renal cell carcinoma (ccRCC) and Telix is preparing to commence a multi-centre Phase III imaging trial (89Zr-girentuximab), with a bridging study already in progress.
While CAIX has a long, well-known association with tumour aggressiveness, hypoxia and disease severity in ccRCC patients, it has also been identified as a cancer-specific marker in more than 20 different cancer types. A recent meta-analysis evaluated data from 24,523 patient samples over 147 independent, published studies and revealed statistically significant correlations between CAIX expression and patient endpoints including overall survival and progression-free survival1.
Quelle:https://globenewswire.com/news-release/2018/08/23/1556199/0/…
Indikationserweiterung Redectane TLX-250
About TLX250 (89Zr / 177Lu-Girentuximab)Telix’s TLX250 program is based on the use of an anti-carbonic anhydrase IX (CAIX) antibody (girentuximab), to deliver diagnostic (89Zr for PET imaging) and therapeutic (177Lu) radiation to patients with CAIX-positive tumours. A number of Phase I, II and III trials have successfully explored the utility of girentuximab-targeted radiation delivery for clear cell renal cell carcinoma (ccRCC) and Telix is preparing to commence a multi-centre Phase III imaging trial (89Zr-girentuximab), with a bridging study already in progress.
While CAIX has a long, well-known association with tumour aggressiveness, hypoxia and disease severity in ccRCC patients, it has also been identified as a cancer-specific marker in more than 20 different cancer types. A recent meta-analysis evaluated data from 24,523 patient samples over 147 independent, published studies and revealed statistically significant correlations between CAIX expression and patient endpoints including overall survival and progression-free survival1.
Quelle:https://globenewswire.com/news-release/2018/08/23/1556199/0/…
Dem Kurs scheint es leider (noch) nicht zu interessieren.
Vielleich, wenn von Magenta die ersten (Meilenstein-) Zahlungen fließen...
Dann müßte allerdings eine Neubewertung hier stattfinden. Wenn das dann ähnlich wie bei Affimed zuletzt passiert, hätte ich nichts dagegen. ;-)
Vielleich, wenn von Magenta die ersten (Meilenstein-) Zahlungen fließen...
Dann müßte allerdings eine Neubewertung hier stattfinden. Wenn das dann ähnlich wie bei Affimed zuletzt passiert, hätte ich nichts dagegen. ;-)
Antwort auf Beitrag Nr.: 58.648.134 von BICYPAPA am 08.09.18 07:22:49
Quelle: https://www.stockwatch.com/News/Item.aspx?bid=Z-C:APC-265765…
Ausschnitt Heidelberg Pharma:
Collaboration with Heidelberg Pharma
Antibody-drug conjugates (ADCs), targeted for cancer indications, have been actively pursued for two decades, but have suffered from stability problems and product heterogeneity. Nevertheless, even a highly heterogeneous first generation ADC has had clinical and commercial impact with sales near a billion USD per annum, highlighting the great opportunity for improved versions. The combination of Advanced Proteome Therapeutics's proprietary site-selective protein modification technology and Heidelberg Pharma's proprietary ATAC technology, featuring the mushroom toxin amanitin, has yielded novel antibody-amanitin conjugates of high purity and chemical stability. Controlled conjugation methods have led to conjugates that possess high target-specific cytotoxic potency against three cancer cell lines. An antibody-amanitin conjugate has been scaled up for testing in animal tumor models, which has proceeded beyond the 4th quarter (ended July 31st). Initial results from these studies are still being tabulated, but nearing completion, and will be reported on as soon as the analysis of data is completed, within the next few weeks.
Advanced Proteome
Quelle: https://www.stockwatch.com/News/Item.aspx?bid=Z-C:APC-265765…
Ausschnitt Heidelberg Pharma:
Collaboration with Heidelberg Pharma
Antibody-drug conjugates (ADCs), targeted for cancer indications, have been actively pursued for two decades, but have suffered from stability problems and product heterogeneity. Nevertheless, even a highly heterogeneous first generation ADC has had clinical and commercial impact with sales near a billion USD per annum, highlighting the great opportunity for improved versions. The combination of Advanced Proteome Therapeutics's proprietary site-selective protein modification technology and Heidelberg Pharma's proprietary ATAC technology, featuring the mushroom toxin amanitin, has yielded novel antibody-amanitin conjugates of high purity and chemical stability. Controlled conjugation methods have led to conjugates that possess high target-specific cytotoxic potency against three cancer cell lines. An antibody-amanitin conjugate has been scaled up for testing in animal tumor models, which has proceeded beyond the 4th quarter (ended July 31st). Initial results from these studies are still being tabulated, but nearing completion, and will be reported on as soon as the analysis of data is completed, within the next few weeks.
Antwort auf Beitrag Nr.: 58.657.368 von BICYPAPA am 10.09.18 06:30:51
https://www.ncbi.nlm.nih.gov/pubmed/29730017
Positron Emission Tomography/Computed Tomography with 89Zr-girentuximab Can Aid in Diagnostic Dilemmas of Clear Cell Renal Cell Carcinoma Suspicion.
Hekman MCH1, Rijpkema M2, Aarntzen EH2, Mulder SF3, Langenhuijsen JF4, Oosterwijk E4, Boerman OC2, Oyen WJG5, Mulders PFA4.
Author information
Abstract
Based on the high expression of carbonic anhydrase IX (CAIX) in 95% of clear cell renal cell carcinoma (ccRCC), the anti-CAIX monoclonal antibody girentuximab can be used for the detection of ccRCC. This clinical study explores the value of 89Zr-labeled girentuximab positron emission tomography/computed tomography (PET/CT) imaging in diagnostic challenges regarding ccRCC. PET/CT imaging was performed 4 or 5 d after injection of 89Zr-girentuximab in patients with a primary renal mass (n=16) or a history of ccRCC (n=14). Scans were used for decision making (surgery/active surveillance) in case of indistinct renal masses. All resected PET-positive primary lesions proved to be ccRCC, while no lesion progression was seen in PET-negative masses. In patients suspected of recurrent/metastatic ccRCC, PET/CT with 89Zr-girentuximab was useful to confirm or exclude ccRCC, evaluate the extent of the disease, and differentiate from other cancers. In this group, 89Zr-girentuximab PET/CT resulted in a major change in clinical management in five patients (36%), while in three patients (21%) repeat biopsies could be avoided. We conclude that 89Zr-girentuximab PET/CT is a valuable diagnostic tool that can guide clinical decision making in case of diagnostic dilemmas concerning ccRCC suspicion.
PATIENT SUMMARY:
Positron emission tomography/computed tomography imaging with 89Zr-girentuximab can be a valuable diagnostic tool to identify clear cell renal cell carcinoma.
TLX-250 Redectane- Girentuximab
Hier einen brandneues Abstract zu dem Stellenwert dieses Diagnostikum TLX-250- Redctane, das Heidelberg Pharma an Telix auslizensiert hat.https://www.ncbi.nlm.nih.gov/pubmed/29730017
Positron Emission Tomography/Computed Tomography with 89Zr-girentuximab Can Aid in Diagnostic Dilemmas of Clear Cell Renal Cell Carcinoma Suspicion.
Hekman MCH1, Rijpkema M2, Aarntzen EH2, Mulder SF3, Langenhuijsen JF4, Oosterwijk E4, Boerman OC2, Oyen WJG5, Mulders PFA4.
Author information
Abstract
Based on the high expression of carbonic anhydrase IX (CAIX) in 95% of clear cell renal cell carcinoma (ccRCC), the anti-CAIX monoclonal antibody girentuximab can be used for the detection of ccRCC. This clinical study explores the value of 89Zr-labeled girentuximab positron emission tomography/computed tomography (PET/CT) imaging in diagnostic challenges regarding ccRCC. PET/CT imaging was performed 4 or 5 d after injection of 89Zr-girentuximab in patients with a primary renal mass (n=16) or a history of ccRCC (n=14). Scans were used for decision making (surgery/active surveillance) in case of indistinct renal masses. All resected PET-positive primary lesions proved to be ccRCC, while no lesion progression was seen in PET-negative masses. In patients suspected of recurrent/metastatic ccRCC, PET/CT with 89Zr-girentuximab was useful to confirm or exclude ccRCC, evaluate the extent of the disease, and differentiate from other cancers. In this group, 89Zr-girentuximab PET/CT resulted in a major change in clinical management in five patients (36%), while in three patients (21%) repeat biopsies could be avoided. We conclude that 89Zr-girentuximab PET/CT is a valuable diagnostic tool that can guide clinical decision making in case of diagnostic dilemmas concerning ccRCC suspicion.
PATIENT SUMMARY:
Positron emission tomography/computed tomography imaging with 89Zr-girentuximab can be a valuable diagnostic tool to identify clear cell renal cell carcinoma.
Antwort auf Beitrag Nr.: 58.674.591 von BICYPAPA am 11.09.18 21:14:42Mal eine Frage am Rande an Dich: was hältst Du von Sernova?
Wahrlich ein Juwel (Mogli3)
Neues 52 Wochentief. Pressglas ist sogar noch mehr wert.
Antwort auf Beitrag Nr.: 58.671.612 von BICYPAPA am 11.09.18 16:21:07
Erste Ergebnisse
VANCOUVER, British Columbia, Oct. 09, 2018 (GLOBE NEWSWIRE) -- Advanced Proteome Therapeutics Corporation (“APC” or the “Company”) (TSXV: APC) (FSE: 0E8), is pleased to report favorable results in initial animal studies. Antibody–drug conjugates (ADCs) are an emerging class of therapeutic agents with the potential to revolutionize current treatment strategies and regimens. The combination of APC's proprietary site-selective protein modification technology and Heidelberg Pharma's proprietary ATAC technology, featuring the mushroom toxin amanitin, has led to conjugates that possess high target-specific cytotoxic potency against several cancer cell lines. The lead conjugate has proceeded to the next level of testing in vivo. The company is pleased to announce that analysis of the first set of a series of ongoing experiments indicate that the lead antibody-amanitin conjugate has exhibited pronounced efficacy in the subcutaneous human breast carcinoma tumor model in female nude mice, the initial subject of testing. These encouraging results will be reported on more fully, along with the present round of studies, when they are completed in a few weeks. Allen Krantz, CSO of APC, commented “it is worthwhile pointing out at this juncture, that this first in vivo study utilizing APC’s linker technology represents a milestone: a clear demonstration of the viability of the technology involving a specific linker-toxin combination of antibody-drug conjugates directed toward reducing tumor burden in animal models of cancer.”
Antwort auf Beitrag Nr.: 58.906.947 von BICYPAPA am 09.10.18 15:48:50Könnte das der dritte Partnerschaftsvertrag werden?
Antwort auf Beitrag Nr.: 58.906.947 von BICYPAPA am 09.10.18 15:48:50APC ist eine sehr kleine Firma! Marktwert zur Zeit ca. 7 Mio$.
Antwort auf Beitrag Nr.: 58.907.130 von Mogli3 am 09.10.18 16:01:40
Sie haben doch
Sie haben doch bereits eine Partnerschaft mit HP. Inwieweit das ausgebaut werden kann und wie die weitere Zusammenarbeit aussieht kann ich nichts zu sagen. In einem tollen Artikel wurden aber im Board schon mal die Vorteile der Zusammenarbeit beschrieben.
Antwort auf Beitrag Nr.: 58.907.556 von BICYPAPA am 09.10.18 16:37:40
GenesisCare and Telix Enter into Strategic Collaboration Agreement to Accelerate Patient Access to New Treatments
Melbourne and Sydney (Australia) – 10 October 2018. Telix Pharmaceuticals Limited (ASX.TLX) (“Telix”, the “Company”), a clinical-stage biopharmaceutical company focused on the development of diagnostic and therapeutic products based on targeted radiopharmaceuticals or “molecularlytargeted radiation” (MTR), today announced that it has entered into a strategic collaboration agreement with GenesisCare Pty Ltd (“GenesisCare”), the largest private provider of oncology services in Australia and Europe.
The agreement covers three major collaboration areas. Firstly, GenesisCare and Telix have established a preferred clinical provider relationship for running radiation oncology studies in Australia for the inclusion of patients into Telix’s global multi-centre trials in neuro-oncology and urologic oncology. Secondly, GenesisCare and Telix will partner to deliver compassionate use access to Telix’s glioblastoma therapy program across its extensive patient network. Finally, Telix and GenesisCare will jointly explore the commercial potential of Telix’s products in China.
Telix CEO Christian Behrenbruch stated, “GenesisCare is a unique organisation that has both patient access and geographic reach in radiation oncology. The kind of products that Telix is developing are a natural fit for the GenesisCare clinical network, both in terms of trials to support product development but also eventual product roll-out.”
GenesisCare CEO Dan Collins commented, “We see strategic collaborations with companies like Telix as a way to advance clinical trials and make proven new treatments available more quickly – ultimately to improve life outcomes for patients. Healthcare access for all is also very important to us, and the compassionate-use program as part of this agreement will be life-changing for the patients involved. We look forward to a long partnership with Telix.”
Telix Partnerschaft
Telix schreitet mit der Zusammenarbeit und Kooperation voran. Nach Japan und USA nun auch Australien, Europa und China. Ein riesiger Markt.GenesisCare and Telix Enter into Strategic Collaboration Agreement to Accelerate Patient Access to New Treatments
Melbourne and Sydney (Australia) – 10 October 2018. Telix Pharmaceuticals Limited (ASX.TLX) (“Telix”, the “Company”), a clinical-stage biopharmaceutical company focused on the development of diagnostic and therapeutic products based on targeted radiopharmaceuticals or “molecularlytargeted radiation” (MTR), today announced that it has entered into a strategic collaboration agreement with GenesisCare Pty Ltd (“GenesisCare”), the largest private provider of oncology services in Australia and Europe.
The agreement covers three major collaboration areas. Firstly, GenesisCare and Telix have established a preferred clinical provider relationship for running radiation oncology studies in Australia for the inclusion of patients into Telix’s global multi-centre trials in neuro-oncology and urologic oncology. Secondly, GenesisCare and Telix will partner to deliver compassionate use access to Telix’s glioblastoma therapy program across its extensive patient network. Finally, Telix and GenesisCare will jointly explore the commercial potential of Telix’s products in China.
Telix CEO Christian Behrenbruch stated, “GenesisCare is a unique organisation that has both patient access and geographic reach in radiation oncology. The kind of products that Telix is developing are a natural fit for the GenesisCare clinical network, both in terms of trials to support product development but also eventual product roll-out.”
GenesisCare CEO Dan Collins commented, “We see strategic collaborations with companies like Telix as a way to advance clinical trials and make proven new treatments available more quickly – ultimately to improve life outcomes for patients. Healthcare access for all is also very important to us, and the compassionate-use program as part of this agreement will be life-changing for the patients involved. We look forward to a long partnership with Telix.”
Antwort auf Beitrag Nr.: 58.911.696 von BICYPAPA am 10.10.18 04:44:22
Beschreibung: Intraoperative tumor localization and resection can be enhanced using intraoperative fluorescence imaging and radiodetection. Labetuzumab specifically recognizes CEA which is is expressed on > 95% of colorectal cancers.. Therefore Indium-111-DOTA-labetuzumab-IRDye800CW is a perfect dual-labeled antibody for dual-modality image-guided surgery in peritoneal carcinomatosis of colorectal cancer.
The aim of this study is to assess the feasibility and safety of intraoperative dual-modality imaging with Indium-111-DOTA-girentuximab-IRDye800CW in renal cell carcinoma patients.
Quelle:https://clinicaltrials.gov/ct2/show/NCT03699332?term=girentu…
Der Faktor der Häufigkeit wäre aber um ca 4 fach größer wie beim Nierenkrebs Und beim Diagnostikum bei Nierenkrebs liegt die Schätzung bei etwa 70 Millionen €.
Redectane TLX-250 Girentuximab
Es läuft jetzt noch eine zusätzliche Studie mit einem Kombidiagnostikum bei Darmkrebs. Das ist der Telix Wirkstoff. Was super ist, damit haben wir eine Erweiterung in die Indikation Darmkrebs. Sie wird durch die Spezialisten von der Radboud University aus Holland durchgeführt. Die Patentrechte von Girentuximab hält HP, die an Telix auslizenziert haben. Sollte es klappen wären bei einem Diagnostikum von Telix 30% Umsatzbeteiligung an HP fällig. Die Studie läuft aber gut 2,5 Jahre. Allerdings ist das eine kombinierte Ph1/2 Studie.Beschreibung: Intraoperative tumor localization and resection can be enhanced using intraoperative fluorescence imaging and radiodetection. Labetuzumab specifically recognizes CEA which is is expressed on > 95% of colorectal cancers.. Therefore Indium-111-DOTA-labetuzumab-IRDye800CW is a perfect dual-labeled antibody for dual-modality image-guided surgery in peritoneal carcinomatosis of colorectal cancer.
The aim of this study is to assess the feasibility and safety of intraoperative dual-modality imaging with Indium-111-DOTA-girentuximab-IRDye800CW in renal cell carcinoma patients.
Quelle:https://clinicaltrials.gov/ct2/show/NCT03699332?term=girentu…
Der Faktor der Häufigkeit wäre aber um ca 4 fach größer wie beim Nierenkrebs Und beim Diagnostikum bei Nierenkrebs liegt die Schätzung bei etwa 70 Millionen €.
Antwort auf Beitrag Nr.: 58.912.374 von BICYPAPA am 10.10.18 08:25:38
Eligible patients with peritoneal carcinomatosis of colorectal origin scheduled for CRS + HIPEC will receive dual-labeled labetuzumab 6-7 days before surgery. At day 4 or 5 a SPECT/CT of the abdomen and thorax will be obtained. Cytoreductive surgery at day 7 will be extended with the use of a near-infrared fluorescence camera and a gamma probe.
The aim of this study is to assess the feasibility and safety of intraoperative dual-modality imaging with Indium-111-DOTA-labetuzumab-IRDye800CW in peritoneal carcinomatosis of colorectal cancer.
Ergänzung zur Studienbeschreibung
In oncologic surgery complete tumor resection is important for treatment outcome and patient survival. When performing cytoreductive surgery (CRS) for peritoneal carcinomatosis of colorectal origin it can sometimes be difficult to distinguish tumor deposits from adhesions and scar tissue. Intraoperative tumor localization and resection can be enhanced using intraoperative imaging techniques (e.g. targeted radioguided or fluorescence guided surgery). A powerful synergy can be achieved by combining radiotracers (e.g. Indium-111) and optical tracers (e.g. IRDye 800CW) conjugated to an antibody against a tumor-associated antigen. Labetuzumab specifically recognises CEA which is expressed on > 95% of all colorectal cancers. Therefore Indium-111-DOTA-labetuzumab-IRDye800CW is a perfect dual-labeled antibody for dual-modality image-guided surgery in peritoneal carcinomatosis of colorectal origin. The concept has been shown in preclinical studies with mice and the investigators will translate this to the clinic.Eligible patients with peritoneal carcinomatosis of colorectal origin scheduled for CRS + HIPEC will receive dual-labeled labetuzumab 6-7 days before surgery. At day 4 or 5 a SPECT/CT of the abdomen and thorax will be obtained. Cytoreductive surgery at day 7 will be extended with the use of a near-infrared fluorescence camera and a gamma probe.
The aim of this study is to assess the feasibility and safety of intraoperative dual-modality imaging with Indium-111-DOTA-labetuzumab-IRDye800CW in peritoneal carcinomatosis of colorectal cancer.
Heidelberg Pharma AG: Zwischenmitteilung für die ersten neun Monate 2018
https://www.finanznachrichten.de/nachrichten-2018-10/4498115…
Antwort auf Beitrag Nr.: 58.924.806 von onkelen am 11.10.18 07:50:05
Die Heidelberg Pharma AG (FWB: WL6) gab heute bekannt, dass ihr Partner Magenta Therapeutics (NASDAQ: MGTA), Cambridge, MA, USA, die Option für die Weiterentwicklung eines Zielmoleküls ausübt und nun die Entwicklung eines darauf basierenden Antikörper-Amanitin-Konjugats im Rahmen einer exklusiven Lizenzierung fortsetzt. Beide Unternehmen haben im März 2018 eine exklusive Forschungsvereinbarung für mehrere Zielmoleküle abgeschlossen, im Rahmen derer Magenta Zugang zu Heidelberg Pharmas Amanitin-Linker-Plattformtechnologie bekommen hat. Aus Magentas Stammzellplattform generierte proprietäre Antikörper für bis zu vier exklusive Zielmoleküle wurden genutzt, um mit Heidelberg Pharmas proprietärer ATAC-Technologie neue ATACs ("Antibody-Targeted-Amanitin-Conjugates") herzustellen. Magenta hat uns heute, am 11. Oktober, ihre Erklärung über die Ausübung der Option für die exklusive Lizenzierung der weltweiten Entwicklungs- und Vermarktungsrechte eines Zielmoleküls und der daraus entstehenden Produktkandidaten zukommen lassen. Heidelberg Pharma erhält dafür eine Meilensteinzahlung, über deren Höhe Vertraulichkeit vereinbart wurde. Darüber hinaus hat Heidelberg Pharma Anspruch auf erfolgsabhängige Zahlungen für klinische Entwicklungs-, regulatorische und umsatzabhängige Meilensteine.
Heidelberg Pharma "buy" | wallstreet-online.de - Vollständige Diskussion unter:
https://www.wallstreet-online.de/diskussion/1136347-neustebe…
Magenta übt Option aus
Partner Magenta Therapeutics übt Option für die Weiterentwicklung eines Zielmoleküls als Antikörper-Amanitin-Konjugat aus Ladenburg, 11. Oktober 2018 - Die Heidelberg Pharma AG (FWB: WL6) gab heute bekannt, dass ihr Partner Magenta Therapeutics (NASDAQ: MGTA), Cambridge, MA, USA, die Option für die Weiterentwicklung eines Zielmoleküls ausübt und nun die Entwicklung eines darauf basierenden Antikörper-Amanitin-Konjugats im Rahmen einer exklusiven Lizenzierung fortsetzt. Beide Unternehmen haben im März 2018 eine exklusive Forschungsvereinbarung für mehrere Zielmoleküle abgeschlossen, im Rahmen derer Magenta Zugang zu Heidelberg Pharmas Amanitin-Linker-Plattformtechnologie bekommen hat. Aus Magentas Stammzellplattform generierte proprietäre Antikörper für bis zu vier exklusive Zielmoleküle wurden genutzt, um mit Heidelberg Pharmas proprietärer ATAC-Technologie neue ATACs ("Antibody-Targeted-Amanitin-Conjugates") herzustellen. Magenta hat uns heute, am 11. Oktober, ihre Erklärung über die Ausübung der Option für die exklusive Lizenzierung der weltweiten Entwicklungs- und Vermarktungsrechte eines Zielmoleküls und der daraus entstehenden Produktkandidaten zukommen lassen. Heidelberg Pharma erhält dafür eine Meilensteinzahlung, über deren Höhe Vertraulichkeit vereinbart wurde. Darüber hinaus hat Heidelberg Pharma Anspruch auf erfolgsabhängige Zahlungen für klinische Entwicklungs-, regulatorische und umsatzabhängige Meilensteine.
Heidelberg Pharma "buy" | wallstreet-online.de - Vollständige Diskussion unter:
https://www.wallstreet-online.de/diskussion/1136347-neustebe…
Das ist doch eine super Meldung auf die wir gewartet haben. Ein Kurs von 3 ist schon unterirdisch angesichts des Potentials, dann abrutschen auf 2 und.... Trotz dieser Meldung bewegt sich kaum was . Bin mal gespant wann die Börsengemeinde das mal merkt.
Teilerfolg für Heidelberg Pharma
https://transkript.de/news/teilerfolg-fuer-heidelberg-pharma…
...Meilensteinzahlunhen bis 332(!) Mio. Euro...1/4 davon ist in greifbarer Näher gerückt...
Und der Kurs dümpelt bei 2 Euro herum. Ich bin mal gespannt, wann hier eine Neubewertung stattfindet...
Und der Kurs dümpelt bei 2 Euro herum. Ich bin mal gespannt, wann hier eine Neubewertung stattfindet...
Antwort auf Beitrag Nr.: 58.928.970 von BICYPAPA am 11.10.18 12:40:24
HP beschreibt im letzten Jahresbericht als einer der größten Gefahren für Biotechwerte die laufende Finanzierungen und die Gefahren die daraus entstehen. Dies kann jeder Biotechinvestor wohl bestätigen, der die Finanzierungen dieser Werte verfolgt. Doch kein Wert hat das Geld für etwa 10 Jahre Entwicklung auf dem Konto und so sind solche Maßnahmen in der Regel sehr kursbelastend und nervig für die Anleger aber unverzichtbar für die Biotechunternehmen.
Warum ich dies jetzt schreibe liegt einfach daran, das HP mit großer Wahrscheinlichkeit nun keine weiteren Finanzierungsrunden mehr nötig hat und aus eigener Kraft die Entwicklung der eigenen Projekte und die der Partner aus laufenden Einnahmen generieren kann..
Betrachten wir mal kurz die Finanzen und die jetzige Entwicklung bei HP. Ich arbeite hier jetzt manchmal mit Schätzungen, die sich aber an den bekannten und sehr wahrscheinlichen Zahlen orientieren. Sie sollen auch nur einen groben Überblick liefern Und die Möglichkeiten von HP aufzeigen.
In der Kasse befinden sich nach dem gestrigen Bericht zu Quartalsende etwa 22 Millionen Euro. Wenn man sich für die Ausgaben am oberen Ende mit etwa 1,1 Millionen € monatlichen Ausgaben orientiert dürfte man dann ziemlich richtig liegen. Zusätzlich wird man Einnahmen von etwa 5 Millionen € jährlich verzeichnen können. Da es sowieso nur um grobe Schätzungen handelt hätten wir ohne jede Optionszusage in etwa Finanzen von etwa 27-30 Millionen € zur Verfügung. Die Reichweite wäre bei einem jährlichen Kapitalverbrauch von ca 15 Millionen € etwa 18 Monate.
Nun kommt aber die Optionszusage von Magenta und die Milestones von Telix zu Redectane bei positiver Entwicklung hinzu. Auch wenn keine Zahlen genannt werden, so kennen wir sehr wohl die Höhe der Gesamtsumme. Magenta möchte an vier Wirkstoffen mit HP zusammenarbeiten Die Höhe des Gesamtpaketes beträgt etwa 334 Millionen € . Damit werden etwa 83 Millionen $ für HP freigesetzt. Rechnet man in etwa 8 Jahre für die Entwicklung eines Wirkstoffes kämen wir in etwa auf einen Betrag von 10 Millionen $ jährlich, der an HP gezahlt wird. Dies ist der augenblickliche Stand. Doch Magenta arbeitet im Augenblick mit 3 Amanitin Wirkstoffen von HP.

Magenta legt ein großes Tempo bei der Entwicklung vor, so dass ich schon im nächsten Jahr mit der zweiten Optionszusage rechne.
Die Zusammenarbeit mit Takeda soll laut letztem Quartalsbericht ebenfalls sehr erfolgreich verlaufen. Auch hier können wir im Laufe des nächsten Jahres mit der Optionsentscheidung rechnen. Das Volumen allerdings nur für 3 Wirkstoffe die entwickelt werden sollen beträgt hier auch 330 Millionen $
Wenn im Laufe der Zeit alle Optionen der Partner gezogen werden, haben wir in den nächsten 8-10 Jahren jährliche Einnahmen von etwa 60-70 Millionen $ für HP zu verbuchen. Damit könnte die eigene Pipeline weier entwickelt werden und so günstige Umsatzbeteiligungen zu erreichen.
Doch HP besteht nicht nur aus der Amanitin Forschung. Mittlerweile hat Telix die Entwicklung von Redectane TLX-250 weit vorangetrieben und es wird wohl bald die Phase 3 in der diagnostischen Anwendung starten. In der Folge dann noch mehrere Phase 2 Studien für die therapeutische Anwendung. Sollte es einigermaßen geregelt ablaufen so könnte Telix und HP Pharma die ersten Einnahmen für Redectane in 2021 verbuchen. Es liegen zwei Schätzungen vor von 70-100 Millionen Jahresvolumen für die diagnostische Anwendung. Telix hat jetzt schon in alle wichtige Gebiete der Welt Partnerschaften für den Vertrieb und die Entwicklung abgeschlossen. Es ist ein Diagnostikum, dass durch seine Vorteile unverzichtbar für die Patienten ist Das heißt, das die Marktdurchdringung innerhalb kürzester Zeit geschehen dürfte. Die Zulassung erfolgt demnach etwa 2021. Die Umsatzbeteiligung für HP beträgt etwa 30% von 70 Millionen $ Ab 2021 kann auch bei Redectane in der Bilddiagnostik mit Einnahmen von etwa 20 Millionen $ gerechnet werden. Die Entwicklung der therapeutischen Anwendung läuft parallel dazu und die möglichen Einnahmen haben bei einer Umsatzbeteiligung von 5% in der Gesamthöhe auch etwa 20 Millionen $. Dies aber erst ab ca. 2023.
Ganz unberücksichtigt lasse ich jetzt erstmal die Chancen die durch die eigene Pipeline ergeben. Man sollte dies machen wenn die ersten Ergebnisse etwa in 2021 für HDP-101 vorliegen. Durch die Optionsentscheidung hat sich Lage für HP entscheiden geändert. Es wird mit großer Wahrscheinlichkeit keine weiteren Verwässerungen durch Maßnahmen mehr geben. Die jetzigen Einnahmen von HP mit der Optionsentscheidung und Redectane reichen aus um die Finanzierung zu sichern. Jede zusätzliche Optionszusage von Takeda oder Magenta würde die Einnahmen um etwa 10 Millionen $ jährlich erhöhen. Von Telix würde langfristig zusätzlich zu den 20 Millionen $ für die Bilddiagnostik noch mal 20 Millionen $ für die Therapeutik und nochmal der gleiche Betrag sehr langfristig für Indikationserweiterungen von Redectane. Mittelfristig kann HP sehr wahrscheinlich demnach Einnahmen von etwa 100 Millionen $ aus den Optionen von Magenta und Redectane verbuchen. Langfristig kämen dann im optimalen noch die Einnahmen aus eigener Entwicklung und die Weiterentwicklung und Indikationserweiterung von Redectane hinzu.
Das ist meine augenblickliche Einschätzung zu den Finanzen und der Entwicklung von HP. HP ist bei einem Kurs von etwa 2€ und einem Kassenstand von etwa 22 Millionen € mit etwa 56 Millionen € an der Börse bewertet. Organisatorisch und finanziell hat HP die Weichen gestellt, dass wir hier bald mit einem sehr positiven Verlauf rechnen können.
Update nach Magenta Option
Ein Freund im Board hatte mich gebeten ein kleines Update zu Heidelberg Pharma (HP) nach der Magenta Optionszusage zu schreiben. Ich werde das gerne machen, da sich die Lage für HP nun gravierend geändert hat.HP beschreibt im letzten Jahresbericht als einer der größten Gefahren für Biotechwerte die laufende Finanzierungen und die Gefahren die daraus entstehen. Dies kann jeder Biotechinvestor wohl bestätigen, der die Finanzierungen dieser Werte verfolgt. Doch kein Wert hat das Geld für etwa 10 Jahre Entwicklung auf dem Konto und so sind solche Maßnahmen in der Regel sehr kursbelastend und nervig für die Anleger aber unverzichtbar für die Biotechunternehmen.
Warum ich dies jetzt schreibe liegt einfach daran, das HP mit großer Wahrscheinlichkeit nun keine weiteren Finanzierungsrunden mehr nötig hat und aus eigener Kraft die Entwicklung der eigenen Projekte und die der Partner aus laufenden Einnahmen generieren kann..
Betrachten wir mal kurz die Finanzen und die jetzige Entwicklung bei HP. Ich arbeite hier jetzt manchmal mit Schätzungen, die sich aber an den bekannten und sehr wahrscheinlichen Zahlen orientieren. Sie sollen auch nur einen groben Überblick liefern Und die Möglichkeiten von HP aufzeigen.
In der Kasse befinden sich nach dem gestrigen Bericht zu Quartalsende etwa 22 Millionen Euro. Wenn man sich für die Ausgaben am oberen Ende mit etwa 1,1 Millionen € monatlichen Ausgaben orientiert dürfte man dann ziemlich richtig liegen. Zusätzlich wird man Einnahmen von etwa 5 Millionen € jährlich verzeichnen können. Da es sowieso nur um grobe Schätzungen handelt hätten wir ohne jede Optionszusage in etwa Finanzen von etwa 27-30 Millionen € zur Verfügung. Die Reichweite wäre bei einem jährlichen Kapitalverbrauch von ca 15 Millionen € etwa 18 Monate.
Nun kommt aber die Optionszusage von Magenta und die Milestones von Telix zu Redectane bei positiver Entwicklung hinzu. Auch wenn keine Zahlen genannt werden, so kennen wir sehr wohl die Höhe der Gesamtsumme. Magenta möchte an vier Wirkstoffen mit HP zusammenarbeiten Die Höhe des Gesamtpaketes beträgt etwa 334 Millionen € . Damit werden etwa 83 Millionen $ für HP freigesetzt. Rechnet man in etwa 8 Jahre für die Entwicklung eines Wirkstoffes kämen wir in etwa auf einen Betrag von 10 Millionen $ jährlich, der an HP gezahlt wird. Dies ist der augenblickliche Stand. Doch Magenta arbeitet im Augenblick mit 3 Amanitin Wirkstoffen von HP.

Magenta legt ein großes Tempo bei der Entwicklung vor, so dass ich schon im nächsten Jahr mit der zweiten Optionszusage rechne.
Die Zusammenarbeit mit Takeda soll laut letztem Quartalsbericht ebenfalls sehr erfolgreich verlaufen. Auch hier können wir im Laufe des nächsten Jahres mit der Optionsentscheidung rechnen. Das Volumen allerdings nur für 3 Wirkstoffe die entwickelt werden sollen beträgt hier auch 330 Millionen $
Wenn im Laufe der Zeit alle Optionen der Partner gezogen werden, haben wir in den nächsten 8-10 Jahren jährliche Einnahmen von etwa 60-70 Millionen $ für HP zu verbuchen. Damit könnte die eigene Pipeline weier entwickelt werden und so günstige Umsatzbeteiligungen zu erreichen.
Doch HP besteht nicht nur aus der Amanitin Forschung. Mittlerweile hat Telix die Entwicklung von Redectane TLX-250 weit vorangetrieben und es wird wohl bald die Phase 3 in der diagnostischen Anwendung starten. In der Folge dann noch mehrere Phase 2 Studien für die therapeutische Anwendung. Sollte es einigermaßen geregelt ablaufen so könnte Telix und HP Pharma die ersten Einnahmen für Redectane in 2021 verbuchen. Es liegen zwei Schätzungen vor von 70-100 Millionen Jahresvolumen für die diagnostische Anwendung. Telix hat jetzt schon in alle wichtige Gebiete der Welt Partnerschaften für den Vertrieb und die Entwicklung abgeschlossen. Es ist ein Diagnostikum, dass durch seine Vorteile unverzichtbar für die Patienten ist Das heißt, das die Marktdurchdringung innerhalb kürzester Zeit geschehen dürfte. Die Zulassung erfolgt demnach etwa 2021. Die Umsatzbeteiligung für HP beträgt etwa 30% von 70 Millionen $ Ab 2021 kann auch bei Redectane in der Bilddiagnostik mit Einnahmen von etwa 20 Millionen $ gerechnet werden. Die Entwicklung der therapeutischen Anwendung läuft parallel dazu und die möglichen Einnahmen haben bei einer Umsatzbeteiligung von 5% in der Gesamthöhe auch etwa 20 Millionen $. Dies aber erst ab ca. 2023.
Ganz unberücksichtigt lasse ich jetzt erstmal die Chancen die durch die eigene Pipeline ergeben. Man sollte dies machen wenn die ersten Ergebnisse etwa in 2021 für HDP-101 vorliegen. Durch die Optionsentscheidung hat sich Lage für HP entscheiden geändert. Es wird mit großer Wahrscheinlichkeit keine weiteren Verwässerungen durch Maßnahmen mehr geben. Die jetzigen Einnahmen von HP mit der Optionsentscheidung und Redectane reichen aus um die Finanzierung zu sichern. Jede zusätzliche Optionszusage von Takeda oder Magenta würde die Einnahmen um etwa 10 Millionen $ jährlich erhöhen. Von Telix würde langfristig zusätzlich zu den 20 Millionen $ für die Bilddiagnostik noch mal 20 Millionen $ für die Therapeutik und nochmal der gleiche Betrag sehr langfristig für Indikationserweiterungen von Redectane. Mittelfristig kann HP sehr wahrscheinlich demnach Einnahmen von etwa 100 Millionen $ aus den Optionen von Magenta und Redectane verbuchen. Langfristig kämen dann im optimalen noch die Einnahmen aus eigener Entwicklung und die Weiterentwicklung und Indikationserweiterung von Redectane hinzu.
Das ist meine augenblickliche Einschätzung zu den Finanzen und der Entwicklung von HP. HP ist bei einem Kurs von etwa 2€ und einem Kassenstand von etwa 22 Millionen € mit etwa 56 Millionen € an der Börse bewertet. Organisatorisch und finanziell hat HP die Weichen gestellt, dass wir hier bald mit einem sehr positiven Verlauf rechnen können.
Antwort auf Beitrag Nr.: 58.938.459 von BICYPAPA am 12.10.18 07:31:14Perfekter Beitrag, Danke
Antwort auf Beitrag Nr.: 58.938.459 von BICYPAPA am 12.10.18 07:31:14Besten Dank. Sehr gute Zusammenfassung der Finanz-Lage. Bin gespannt wann das die Biotech- Börsengemeinde merkt was hier entsteht. In den USA kotiert läge der Kurs jetzt schon zweistellig. Eine Frage, wie kommst du auf die langen Zeiträume? Braucht Magenta 8 Jahre bis zu einer Zulassung der Fda? Takeda testet jetzt schon ein Jahr, denkst du die entscheiden sich eher früher als später in 2019? Takeda wäre natürlich eine ganz andere Reputation für HDP. Bin gespannt auf Telix weil dort wahrscheinlich dir Finanzierung von HDP am schnellsten erfolgen wird. Ich bin vorbereitet , habe nochmal aufgestockt auf über sechsstellig. Allerdings auch Risiko und schon 6 Jahre dabei und nach Redectane trotzdem dabei geblieben und immer nach gekauft. Wird sich auszahlen.
Antwort auf Beitrag Nr.: 58.939.590 von Mogli3 am 12.10.18 09:28:47
Natürlich kann die nächste Optionsentscheidung auch früher kommen. Doch das ist jetzt nicht mehr so wichtig. Die Finanzierung steht jetzt etwa bis Ende 2020. Ob die nächste Entscheidung jetzt noch diese Jahr kommt oder Mitte nächsten Jahres ist nicht mehr so wichtig. Natürlich ist Planungssicherheit immer gut. Doch man ist bis ca Ende 2020 durchfinanziert und danach greifen ja dann auch Redectane und evtl die neuen Entscheidungen. Man weiß ja auch nicht genau wann die Milestones genau fließen. Das wird eher unregelmäßig sein. Aber im Schnitt über die gesamte Wirkstoffentwicklung macht das etwa 10 Millionen $ pro Jahr und je positiver Optionsentscheidung. Man hat ja jetzt Geld bis etwa Ende 2020 in der Kasse und dann ist es nicht mehr so wichtig wann die nächste Entscheidung fällt.
Nächstes Jahr steht sowieso ab 3Q die Redectane Studie Ergebnisse im Fokus. Dann die eigene Entwicklung von HDP-101. Und dann stehen noch einige Optionsentscheidungen an. Ich glaube wir können dann mit einem guten Newsflow rechnen.
Es sind nur Richtwerte
Es sind nur Richtwerte, die ich da angegeben hab. 8 Jahre für die klinische Entwicklung ist ein realistischer Wert, wenn man den Zulassungsprozess mit einrechnet. Es kann auch ein Jahr weniger oder mehr werden. Es kommt da auch ein wenig auf die FDA an, ob man in einen beschleunigtes Verfahren kommt. Aber 8 Jahre ist wohl ein realistischer Mittelwert. Natürlich kann die nächste Optionsentscheidung auch früher kommen. Doch das ist jetzt nicht mehr so wichtig. Die Finanzierung steht jetzt etwa bis Ende 2020. Ob die nächste Entscheidung jetzt noch diese Jahr kommt oder Mitte nächsten Jahres ist nicht mehr so wichtig. Natürlich ist Planungssicherheit immer gut. Doch man ist bis ca Ende 2020 durchfinanziert und danach greifen ja dann auch Redectane und evtl die neuen Entscheidungen. Man weiß ja auch nicht genau wann die Milestones genau fließen. Das wird eher unregelmäßig sein. Aber im Schnitt über die gesamte Wirkstoffentwicklung macht das etwa 10 Millionen $ pro Jahr und je positiver Optionsentscheidung. Man hat ja jetzt Geld bis etwa Ende 2020 in der Kasse und dann ist es nicht mehr so wichtig wann die nächste Entscheidung fällt.
Nächstes Jahr steht sowieso ab 3Q die Redectane Studie Ergebnisse im Fokus. Dann die eigene Entwicklung von HDP-101. Und dann stehen noch einige Optionsentscheidungen an. Ich glaube wir können dann mit einem guten Newsflow rechnen.
Antwort auf Beitrag Nr.: 58.940.055 von BICYPAPA am 12.10.18 10:11:13Denke ich auch. Die Frage ist ob Magenta was die Forschung jetzt mit dem Molekül anbetrifft ganz am Anfang ist oder ob sie mit dem jetzigen Wissen schon mitten drin sind.
Antwort auf Beitrag Nr.: 58.939.590 von Mogli3 am 12.10.18 09:28:47
"Ich bin dann gespannt wann die Biotech-Investorengemeinde merkt dass hier ein Juwel heranwächst." (Mogli3 05.03.)
Die deutsche Investorengemeinde ist nicht so dumm, wie einige interessierte beruflichen Trader es erwarten. Die merkt durchaus was (in einem anderen Forum war von "Pferdefuss" die Rede) und hält sich fern. Nur wer hier bezahlte oder unbezahlte Werbung für die Aktie macht, hat tatsächlich keine Ahnung oder verschweigt dies. Zwei Forenmitglieder sind da ehrlicher: einer eher halbherzig, der andere letztens brutal ehrlich und schweigt seitdem.
Warten auf Godot
Peinlich, peinlich. Die alte Leier schon seit über 7 Monaten:"Ich bin dann gespannt wann die Biotech-Investorengemeinde merkt dass hier ein Juwel heranwächst." (Mogli3 05.03.)
Die deutsche Investorengemeinde ist nicht so dumm, wie einige interessierte beruflichen Trader es erwarten. Die merkt durchaus was (in einem anderen Forum war von "Pferdefuss" die Rede) und hält sich fern. Nur wer hier bezahlte oder unbezahlte Werbung für die Aktie macht, hat tatsächlich keine Ahnung oder verschweigt dies. Zwei Forenmitglieder sind da ehrlicher: einer eher halbherzig, der andere letztens brutal ehrlich und schweigt seitdem.
Ein Zitat von "Der Aktionär" gepostet von behavior am 23.08.:
"Der Wert eignet sich bestens als langfristige hochspekulative Depotbeimischung."http://www.deraktionaer.de/aktie/biotech-geheimtipp-heidelbe…
Antwort auf Beitrag Nr.: 58.941.678 von versuchsprimat am 12.10.18 12:35:12Du hast es anscheinend immer noch nicht gemerkt dass wir uns hier bei Biotechaktien befinden. Die sind grundsätzlich spekulativ und mit kleineren oder grösseren Risiken behaftet. Wenn ich HDP einschätze dann tue ich es nur innerhalb der Bandbreite der Biotechaktien und innerhalb Biotech ist HDP auf diesem Kurniveau eine tatsächlich eine vielversprechende Perle. Du solltest dich lieber mit Bundesanleihen beschäftigen, die zahlen ca 0.5% Zins aber dafür krisenfest.
Zum Zeitfaktor. Ich denke nicht dass wir hier 8 Jahre warten müssen. Sollten die Phase I oder II sowohl bei den Partnerschaften als auch bei den eigenen Kandidaten erfolgreich sei dann werden die Übernahmeangebote kommen, da bin ich mir ziemlich sicher. Die Frage ist zu welchem Kurs Hopp dann verkaufen wird. Man bedenke, die damalige Wilex hat HDP zu einem Wilex-Verrechnungskurs von damals 6 Euro erworben vor dem Split 1:4, d.h. 6 Euro wären heute 24 Euro. Hopp hat sehr viele KE zu damals 4-5 Euro ( heute 16-20) übernommen. Ich kann mir schlicht nicht vorstellen- vorausgesetzt die Phase I und II sind wirklich erfolgreich- dass Hopp dann für unter 30-35 Euro verkaufen würde ( oder ca. 1 Mia). Bicypapa hat weiter oben beschrieben, dass die Finanzen durch Partner inkl. Telix praktisch gesichert sind auch ohne KE, dann würde die Aktienzahl bei rund 28 Mio. bleiben. Das wäre natürlich Best Case, ob das so kommt wird man sehen, bei Biotech läuft es nie gradlinig.
Antwort auf Beitrag Nr.: 58.941.528 von versuchsprimat am 12.10.18 12:22:07
Und genau diese Biotechaktie (!)
schrumpft besonders schnell vor sich hin. Andere könne da nicht mithalten. Vom Höchstkurs nach der Kapitalerhöhung 50 Prozent im minus. Nochmal so viel minus: Its a Pennystock!
Antwort auf Beitrag Nr.: 58.942.404 von versuchsprimat am 12.10.18 13:37:58
Was sind ihre Beweggründe die Aktie runter zu schreiben und Leute im Board runter zu machen?
Ich bin selbst in Heidelberg Pharma investiert, kein Fachmann aber wenn ich eins nicht mag, dann sind das Menschen die in diesem Blog nichts produktives Beitragen, außer Sie haben nur ein Interesse: "Um jeden Preis den Wert der Aktie herunter zu schreiben, Angst verbreiten, den Kurs zu drücken um billig selbst zu sammeln!" Aber welche Motivation für ihr gehaltloses "Geschreibsel" wirklich verantwortlich ist, wissen nur Sie selbst! Wenn Sie von Heidelberg Pharma nicht überzeugt sind, dann verlassen Sie doch diesen Blog und lassen die Menschen in Ruhe die hier investiert sind. Ihr Verhalten ist Beleidigend und nicht hinnehmbar! Aber wenn man(n)/frau sich mit dem Pseudonym "Versuchsprimat" anmeldet sagt das ja schon viel über ihre Sozialisation aus! Tschö mit Ö

Angstmacher und Downpusher! Warum?
@versuchsprimatWas sind ihre Beweggründe die Aktie runter zu schreiben und Leute im Board runter zu machen?
Ich bin selbst in Heidelberg Pharma investiert, kein Fachmann aber wenn ich eins nicht mag, dann sind das Menschen die in diesem Blog nichts produktives Beitragen, außer Sie haben nur ein Interesse: "Um jeden Preis den Wert der Aktie herunter zu schreiben, Angst verbreiten, den Kurs zu drücken um billig selbst zu sammeln!" Aber welche Motivation für ihr gehaltloses "Geschreibsel" wirklich verantwortlich ist, wissen nur Sie selbst! Wenn Sie von Heidelberg Pharma nicht überzeugt sind, dann verlassen Sie doch diesen Blog und lassen die Menschen in Ruhe die hier investiert sind. Ihr Verhalten ist Beleidigend und nicht hinnehmbar! Aber wenn man(n)/frau sich mit dem Pseudonym "Versuchsprimat" anmeldet sagt das ja schon viel über ihre Sozialisation aus! Tschö mit Ö


Antwort auf Beitrag Nr.: 58.951.716 von SK-Mover am 13.10.18 18:55:55
Armer bemitleidenswerter
Angstbeisser! Aber selbst schuld, einer Versageraktie zu besitzen. !
Dieser Beitrag wurde von FairMOD moderiert. Grund: Beleidigung
Antwort auf Beitrag Nr.: 58.938.459 von BICYPAPA am 12.10.18 07:31:14
Interim Analysis of 89Zr-TLX250-CDx Bridging Study (“ZIR-DOSE”) Demonstrates Significantly Improved Patient Dosimetry Melbourne (Australia) 15 October 2018. Telix Pharmaceuticals Limited (ASX.TLX) (“Telix”, the “Company”), a clinical-stage biopharmaceutical company focused on the development of diagnostic and therapeutic products based on targeted radiopharmaceuticals or “molecularly-targeted radiation” (MTR), today announced that it has completed an interim analysis of the ZIR-DOSE dosimetry bridging study, conducted as part of Phase III readiness for 89Zr-TLX250-CDx imaging in metastatic renal (kidney) cancer. The ZIR-DOSE study is a 10 patient Pk / multi-time point imaging study designed to compare the whole-body dosimetry of 89Zr-girentuximab (TLX250-CDx) with historical dosimetry data for 124I-girentuximab (Wilex AG / Heidelberg Pharma). As part of the commercial development of TLX250-CDx, Telix elected to change the isotope from 124I to 89Zr in order to lower patient dose, enhance image contrast, lower cost of goods and improve clinical workflow by eliminating the need for thyroid blocking. The ZIR-DOSE study achieves both a mass dose comparison between 5mg and 10mg injected dose, as well as full body dosimetry. An interim analysis was conducted by ABX CRO (Dresden, Germany) on the first 5 patients, covering both 5 and 10mg mass dose. The key findings are: • A 10mg mass dose was confirmed as superior with a 50% reduction of liver dose and 25% less intestinal dose, compared with 5mg. • The absorbed dose from 37 MBq (1mCi) of 89Zr-girentuximab is 18 mSv/mCi, approximately 25% less than that of 124I-girentuximab (24 mSv/mCi) – validating that the change of isotope results in a meaningfully lower patient radiation dose. • The dosimetry observed for 89Zr-girentuximab (TLX250-CDx) is well within legislated radiation safety limits in any regulatory jurisdiction. Telix CEO Dr. Christian Behrenbruch stated, “This interim data enables us to proceed with first patients in our global multi-centre Phase III trial for TLX250-CDx with the confidence that we have the dosing and dosimetry right, with much improved image quality compared with iodinated girentuximab. Although this is a small study in terms of number of subjects, radiation dosimetry studies are especially demanding on patients and we are grateful to those who have volunteered to participate in the clinical trial, as well as our excellent clinical collaborators at Radboud University Medical Centre (RUMC) in the Netherlands.”
Super Ergebnis der TLX250 Studie
Die TLX250 Bridging Studie ist fertig und sie liefert ein optimales Ergebnis. Interim Analysis of 89Zr-TLX250-CDx Bridging Study (“ZIR-DOSE”) Demonstrates Significantly Improved Patient Dosimetry Melbourne (Australia) 15 October 2018. Telix Pharmaceuticals Limited (ASX.TLX) (“Telix”, the “Company”), a clinical-stage biopharmaceutical company focused on the development of diagnostic and therapeutic products based on targeted radiopharmaceuticals or “molecularly-targeted radiation” (MTR), today announced that it has completed an interim analysis of the ZIR-DOSE dosimetry bridging study, conducted as part of Phase III readiness for 89Zr-TLX250-CDx imaging in metastatic renal (kidney) cancer. The ZIR-DOSE study is a 10 patient Pk / multi-time point imaging study designed to compare the whole-body dosimetry of 89Zr-girentuximab (TLX250-CDx) with historical dosimetry data for 124I-girentuximab (Wilex AG / Heidelberg Pharma). As part of the commercial development of TLX250-CDx, Telix elected to change the isotope from 124I to 89Zr in order to lower patient dose, enhance image contrast, lower cost of goods and improve clinical workflow by eliminating the need for thyroid blocking. The ZIR-DOSE study achieves both a mass dose comparison between 5mg and 10mg injected dose, as well as full body dosimetry. An interim analysis was conducted by ABX CRO (Dresden, Germany) on the first 5 patients, covering both 5 and 10mg mass dose. The key findings are: • A 10mg mass dose was confirmed as superior with a 50% reduction of liver dose and 25% less intestinal dose, compared with 5mg. • The absorbed dose from 37 MBq (1mCi) of 89Zr-girentuximab is 18 mSv/mCi, approximately 25% less than that of 124I-girentuximab (24 mSv/mCi) – validating that the change of isotope results in a meaningfully lower patient radiation dose. • The dosimetry observed for 89Zr-girentuximab (TLX250-CDx) is well within legislated radiation safety limits in any regulatory jurisdiction. Telix CEO Dr. Christian Behrenbruch stated, “This interim data enables us to proceed with first patients in our global multi-centre Phase III trial for TLX250-CDx with the confidence that we have the dosing and dosimetry right, with much improved image quality compared with iodinated girentuximab. Although this is a small study in terms of number of subjects, radiation dosimetry studies are especially demanding on patients and we are grateful to those who have volunteered to participate in the clinical trial, as well as our excellent clinical collaborators at Radboud University Medical Centre (RUMC) in the Netherlands.”
Antwort auf Beitrag Nr.: 58.957.701 von BICYPAPA am 15.10.18 06:23:18
Telix Pharmaceuticals Limited (ASX.TLX) (“Telix”, the “Company”), a clinical-stage biopharmaceutical company focused on the development of diagnostic and therapeutic products based on targeted radiopharmaceuticals or “molecularly-targeted radiation” (MTR), today announced an extension to its master service agreement (MSA) with Cyclotek (Aust) Pty Ltd (“Cyclotek”) to include 89Zr-girentuximab (TLX250-CDx) for imaging patients with clear cell renal cell cancer (ccRCC) using Positron Emission Tomography (PET).
Telix has selected Cyclotek to manufacture and supply Australian clinical trial sites as well as serve as a part of Telix’s global production network as a backup site for the Company’s global multi-centre Phase III clinical trial. This extension of the MSA leverages Cyclotek’s extensive expertise in production scale-up of novel PET tracers and its leadership position in the Australian and New Zealand radiopharmaceutical manufacturing landscape. In addition to supporting clinical trials, the manufacturing partnership paves the way for the provision of TLX250-CDx to the regional market.
Telix CEO Dr Christian Behrenbruch stated, “The extension of our agreement with Cyclotek delivers another important component in Telix’s network for supply of TLX250 for our clinical trials and also creates a platform for commercialization of the product in the future. We value our partnership with Cyclotek for their experience in GMP manufacturing and their demonstrated ability to deliver highquality product as an integrated part of international trials.”
Cyclotek Clinical Director Dr Rob Ware commented, “We are delighted to expand our relationship with Telix to assist with their objective of including several excellent Australian clinical trial sites in their roadmap to establish the clinical effectiveness of 89Zr-girentuximab for the imaging of metastatic kidney cancer. This development aligns with our core belief in the potential of molecularly targeted radiation (MTR) to improve healthcare outcomes for cancer patients, both diagnostically and therapeutically.”
Telix Partnerschaft mit Cyclotec
Telix and Cyclotek Enter into Manufacturing Partnership for Kidney Cancer Imaging Melbourne (Australia) – 15 October 2018. Telix Pharmaceuticals Limited (ASX.TLX) (“Telix”, the “Company”), a clinical-stage biopharmaceutical company focused on the development of diagnostic and therapeutic products based on targeted radiopharmaceuticals or “molecularly-targeted radiation” (MTR), today announced an extension to its master service agreement (MSA) with Cyclotek (Aust) Pty Ltd (“Cyclotek”) to include 89Zr-girentuximab (TLX250-CDx) for imaging patients with clear cell renal cell cancer (ccRCC) using Positron Emission Tomography (PET).
Telix has selected Cyclotek to manufacture and supply Australian clinical trial sites as well as serve as a part of Telix’s global production network as a backup site for the Company’s global multi-centre Phase III clinical trial. This extension of the MSA leverages Cyclotek’s extensive expertise in production scale-up of novel PET tracers and its leadership position in the Australian and New Zealand radiopharmaceutical manufacturing landscape. In addition to supporting clinical trials, the manufacturing partnership paves the way for the provision of TLX250-CDx to the regional market.
Telix CEO Dr Christian Behrenbruch stated, “The extension of our agreement with Cyclotek delivers another important component in Telix’s network for supply of TLX250 for our clinical trials and also creates a platform for commercialization of the product in the future. We value our partnership with Cyclotek for their experience in GMP manufacturing and their demonstrated ability to deliver highquality product as an integrated part of international trials.”
Cyclotek Clinical Director Dr Rob Ware commented, “We are delighted to expand our relationship with Telix to assist with their objective of including several excellent Australian clinical trial sites in their roadmap to establish the clinical effectiveness of 89Zr-girentuximab for the imaging of metastatic kidney cancer. This development aligns with our core belief in the potential of molecularly targeted radiation (MTR) to improve healthcare outcomes for cancer patients, both diagnostically and therapeutically.”
Antwort auf Beitrag Nr.: 58.957.701 von BICYPAPA am 15.10.18 06:23:18
Eckdaten HP erhält ca 30% für die Bilddiagnostik von ca 70 Millionen$ bei Zulassung und zusätzliche Milestones von etwas über 3 Millionen Euro. Ab 2021 könnten sie damit nach der Zulassung nur für die Bilddiagnostik mit etwa 20 Millionen$ rechnen.
Mit der Therapeutik plant Telix Phase 2b Studien und wenn alles klappt wäre hier mit Zulassungen etwa 2023 zu rechen. Die Umsatzbeteilgung beträgt hier für HP etwa 5% von ca gut 400 Millionen $ Also noch mal etwa 20 Millionen $.
Es sind noch Indikationserweiteung seitens Telix mit TLX250 geplant. Doch das wäre sehr langfristig und ist alles noch in Anfangsplanungen
Die Einzelheiten könnt ihr der folgenden prima Analyse entnehmen.
https://www.ariva.de/news/edison-investment-research-limited…
Nach der Bridging TX250 Redectane Studie
Hier mal eine prima Analyse zu der Telix Pipeline und den Stellenwert von Redectane für Heidelberg und Telix.Eckdaten HP erhält ca 30% für die Bilddiagnostik von ca 70 Millionen$ bei Zulassung und zusätzliche Milestones von etwas über 3 Millionen Euro. Ab 2021 könnten sie damit nach der Zulassung nur für die Bilddiagnostik mit etwa 20 Millionen$ rechnen.
Mit der Therapeutik plant Telix Phase 2b Studien und wenn alles klappt wäre hier mit Zulassungen etwa 2023 zu rechen. Die Umsatzbeteilgung beträgt hier für HP etwa 5% von ca gut 400 Millionen $ Also noch mal etwa 20 Millionen $.
Es sind noch Indikationserweiteung seitens Telix mit TLX250 geplant. Doch das wäre sehr langfristig und ist alles noch in Anfangsplanungen
Die Einzelheiten könnt ihr der folgenden prima Analyse entnehmen.
https://www.ariva.de/news/edison-investment-research-limited…
Gute News sind unbedeutend, wenn Anleger die Aktie nicht mal mit spitzen Fingern anfassen
Nur der Kurs zählt. Und der liegt gerade mal doppelt so hoch wie ein Pennystock.
Mit minimalen Umsätzen ein schönes Plus von ca. 9%.
Ich lehne mich mal aus dem Fenster uns behaupte, das war es endgültig mit Kursen unter 2 Euro, falls der Markt nicht noch mehr korrigiert. Und über kurz oder lang werden die sehr guten News der letzten Wochen eingepreist. Vielleicht auch mal ‚ne Empfehlung in einem Börsenblättchen und der Kurs läuft wieder Richtung 3 Euro (und mehr 😉)...
Ich lehne mich mal aus dem Fenster uns behaupte, das war es endgültig mit Kursen unter 2 Euro, falls der Markt nicht noch mehr korrigiert. Und über kurz oder lang werden die sehr guten News der letzten Wochen eingepreist. Vielleicht auch mal ‚ne Empfehlung in einem Börsenblättchen und der Kurs läuft wieder Richtung 3 Euro (und mehr 😉)...
Antwort auf Beitrag Nr.: 58.957.842 von BICYPAPA am 15.10.18 07:32:34
Melbourne (Australia) and Nijmegen (the Netherlands) – 17 October 2018. Telix Pharmaceuticals Limited (ASX.TLX) (“Telix”, the “Company”), a clinical-stage biopharmaceutical company focused on the development of diagnostic and therapeutic products based on targeted radiopharmaceuticals or “molecularly-targeted radiation” (MTR), today announced that it has concluded a GMP manufacturing agreement with Radboud Translational Medicine B.V. (“RTM”).
Telix has been working with RTM under a technology transfer and research agreement for the past six months, during which time RTM and Telix have completed process development and production optimization. The parties are now completing validation runs with the objective of providing patient doses for European trial sites by approximately end-October 2018. Additionally, RTM will serve as a backup production site to Telix’s partner production sites in North America (Isologic) and Australia (Cyclotek).
Telix EU President Odile Jaume stated, “RTM has been a core part of taking the 89Zr-girentuximab process development out of Radboud University Medical Centre (RUMC) and industrializing the radiochemistry for Telix’s Phase III study. The RTM facility is state-of-the-art, backed by a very capable team and we are pleased to be working with them for our clinical trials and eventual commercial production of the product.”
RTM General Manager, Dr Lars Perk commented, “RUMC was a pioneer in the use of girentuximab for imaging and therapy and so it has been a pleasure to work with our university colleagues to bring this very promising technology out of academia and into a commercial production environment. As RTM continues to build its production capabilities, we welcome the opportunity to partner with innovative companies like Telix to bring new radiopharmaceuticals to market.”
Telix Redectane
Telix Selects RTM to Manufacture Kidney Imaging Program in Europe Melbourne (Australia) and Nijmegen (the Netherlands) – 17 October 2018. Telix Pharmaceuticals Limited (ASX.TLX) (“Telix”, the “Company”), a clinical-stage biopharmaceutical company focused on the development of diagnostic and therapeutic products based on targeted radiopharmaceuticals or “molecularly-targeted radiation” (MTR), today announced that it has concluded a GMP manufacturing agreement with Radboud Translational Medicine B.V. (“RTM”).
Telix has been working with RTM under a technology transfer and research agreement for the past six months, during which time RTM and Telix have completed process development and production optimization. The parties are now completing validation runs with the objective of providing patient doses for European trial sites by approximately end-October 2018. Additionally, RTM will serve as a backup production site to Telix’s partner production sites in North America (Isologic) and Australia (Cyclotek).
Telix EU President Odile Jaume stated, “RTM has been a core part of taking the 89Zr-girentuximab process development out of Radboud University Medical Centre (RUMC) and industrializing the radiochemistry for Telix’s Phase III study. The RTM facility is state-of-the-art, backed by a very capable team and we are pleased to be working with them for our clinical trials and eventual commercial production of the product.”
RTM General Manager, Dr Lars Perk commented, “RUMC was a pioneer in the use of girentuximab for imaging and therapy and so it has been a pleasure to work with our university colleagues to bring this very promising technology out of academia and into a commercial production environment. As RTM continues to build its production capabilities, we welcome the opportunity to partner with innovative companies like Telix to bring new radiopharmaceuticals to market.”
Kursanstieg bei minimalen Umsätzen (gestern, bisher heute)
Alte Hasen wissen, dass dies so gut wie immer nur eine rein technische Erholung ist. Zum "Schwur" kommt es deshalb noch in den nächsten Tagen. Nach der Halbierung (50 Prozent minus) bedarf es immerhin 100 Prozent plus, um den alten Kurs zu erreichen.
Antwort auf Beitrag Nr.: 58.978.911 von versuchsprimat am 17.10.18 09:39:45
Nah mein geliebter Downpusher und Angstbeißer, schwimmen dir die guten Einsteigerkurse davon.
Eine andere Erklärung gibt es ja nicht für deine offensichtliche bauernschlaue Downpusherei.
Aber jeder wie er mag
Nah, Angst nicht mehr billig in Heidelberg Pharma rein zu kommen um nach zu kaufen...!
@versuchsprimatNah mein geliebter Downpusher und Angstbeißer, schwimmen dir die guten Einsteigerkurse davon.
Eine andere Erklärung gibt es ja nicht für deine offensichtliche bauernschlaue Downpusherei.
Aber jeder wie er mag

Oder zu Höchstkursen von 2011 bei 20 Euro eingestiegen...?!
Da hilft nur nachkaufen & EK senken, Versuchsprimat! 🙈😉
Da hilft nur nachkaufen & EK senken, Versuchsprimat! 🙈😉
Antwort auf Beitrag Nr.: 58.977.369 von BICYPAPA am 17.10.18 05:15:12
Heidelberg Pharma is a drug development company, which provides pre-clinical drug discovery and development services for the development of anti-cancer and anti-inflammatory drugs to pharmaceutical and biotechnology industries.
https://www.proactiveinvestors.com/companies/stocktube/10893…
Präsentation at the Bio Investor Forum
Heidelberg Pharma AG (ETR:WL6) CEO Jan Schmidt-Brand spoke with Christine Corrado at the Bio Investor Forum in San Francisco.Heidelberg Pharma is a drug development company, which provides pre-clinical drug discovery and development services for the development of anti-cancer and anti-inflammatory drugs to pharmaceutical and biotechnology industries.
https://www.proactiveinvestors.com/companies/stocktube/10893…
Das Abwarten der Anleger
Schmidt-Brand am 26.03. im Interview 4Investors:Wir haben unsere Investor Relations-Arbeit wieder intensiviert und halten den Kontakt zu internationalen institutionellen Investoren, die an den Fortschritten unserer Technologie interessiert sind. Wir wissen, dass es viel Arbeit und Geduld bedarf, um gerade in den USA langfristige Investoren zu gewinnen. Aber wir sind sehr optimistisch, dass wir mit guten klinischen Daten unserer innovativen Technologie neue Investoren an Bord holen können.
Antwort auf Beitrag Nr.: 58.987.908 von BICYPAPA am 18.10.18 04:56:44
Heidelberg Pharma: GMP-Produktion von Krebswirkstoff etabliert - Aktienanalyse
http://www.aktiencheck.de/exklusiv/Artikel-Heidelberg_Pharma…
Empfehlung
Heidelberg Pharma: GMP-Produktion von Krebswirkstoff etabliert - Aktienanalyse
http://www.aktiencheck.de/exklusiv/Artikel-Heidelberg_Pharma…
Antwort auf Beitrag Nr.: 58.957.842 von BICYPAPA am 15.10.18 07:32:34
Preclinical validation of 111In-girentuximab-F(ab')2 as a tracer to image hypoxia related marker CAIX expression in head and neck cancer xenografts.
Huizing FJ1, Hoeben BAW2, Franssen G3, Lok J2, Heskamp S3, Oosterwijk E4, Boerman OC3, Bussink J2.
Author information
Abstract
BACKGROUND AND PURPOSE:
Hypoxia is a major cause of radio- and chemoresistance. Carbonic anhydrase IX (CAIX) is an endogenous hypoxia-related marker and an important prognostic marker. Assessment of CAIX expression may allow patient selection for hypoxia or CAIX-targeted treatment. The radioactive tracer 111In-girentuximab-F(ab')2 targets CAIX and can be used for SPECT imaging. Aim of this study was to validate and optimize 111In-girentuximab-F(ab')2 for imaging of CAIX expression in head and neck tumor xenografts.
MATERIAL AND METHODS:
Affinity and internalization kinetics of 111In-girentuximab-F(ab')2 were determined in vitro using CAIX-expressing SK-RC-52 cells. Tumor targeting characteristics were determined in athymic mice with six different head and neck squamous cell carcinoma (SCCNij) xenografts. Tracer uptake was measured by ex vivo radioactivity counting. Intratumoral distribution of tracer uptake was measured using autoradiography and CAIX expression was determined immunohistochemically.
RESULTS:
26% of the tracer was internalized into the SK-RC-52 cells within 24h. The half maximal inhibitory concentration (IC50) was 0.69±0.08nM. In biodistribution studies SCCNij153 tumors showed the highest tracer uptake: 4.1±0.8ID/g at 24h p.i. Immunohistochemical and autoradiographic analyses of the xenografts showed a distinct spatial correlation between localization of the tracer and CAIX expression.
CONCLUSION:
111In-girentuximab-F(ab')2 has a high affinity for CAIX. In vivo tumor uptake correlated strongly with CAIX expression in different head and neck xenografts. These results suggest that 111In-girentuximab-F(ab')2 is a promising tracer for imaging of hypoxia-related CAIX expression.
Redectane-Girentuximab_TLX250
Sehr wahrscheinlich wird die Ph3 Studie von Telix nun bald starten. Doch neben der Veröffentlichung von Telix TLX250 evtl bei Darmkrebsformen zu nutzen gibt es nun auch Hinweise Girentuximab noch in weiteren Indikationen anwenden zu können. Ich poste mal das Abstract hierzu. Das ist wahrscheinlich noch sehr langfristig. Doch es soll auch nur die Möglichkeiten von Girentuximab aufzeigen.Preclinical validation of 111In-girentuximab-F(ab')2 as a tracer to image hypoxia related marker CAIX expression in head and neck cancer xenografts.
Huizing FJ1, Hoeben BAW2, Franssen G3, Lok J2, Heskamp S3, Oosterwijk E4, Boerman OC3, Bussink J2.
Author information
Abstract
BACKGROUND AND PURPOSE:
Hypoxia is a major cause of radio- and chemoresistance. Carbonic anhydrase IX (CAIX) is an endogenous hypoxia-related marker and an important prognostic marker. Assessment of CAIX expression may allow patient selection for hypoxia or CAIX-targeted treatment. The radioactive tracer 111In-girentuximab-F(ab')2 targets CAIX and can be used for SPECT imaging. Aim of this study was to validate and optimize 111In-girentuximab-F(ab')2 for imaging of CAIX expression in head and neck tumor xenografts.
MATERIAL AND METHODS:
Affinity and internalization kinetics of 111In-girentuximab-F(ab')2 were determined in vitro using CAIX-expressing SK-RC-52 cells. Tumor targeting characteristics were determined in athymic mice with six different head and neck squamous cell carcinoma (SCCNij) xenografts. Tracer uptake was measured by ex vivo radioactivity counting. Intratumoral distribution of tracer uptake was measured using autoradiography and CAIX expression was determined immunohistochemically.
RESULTS:
26% of the tracer was internalized into the SK-RC-52 cells within 24h. The half maximal inhibitory concentration (IC50) was 0.69±0.08nM. In biodistribution studies SCCNij153 tumors showed the highest tracer uptake: 4.1±0.8ID/g at 24h p.i. Immunohistochemical and autoradiographic analyses of the xenografts showed a distinct spatial correlation between localization of the tracer and CAIX expression.
CONCLUSION:
111In-girentuximab-F(ab')2 has a high affinity for CAIX. In vivo tumor uptake correlated strongly with CAIX expression in different head and neck xenografts. These results suggest that 111In-girentuximab-F(ab')2 is a promising tracer for imaging of hypoxia-related CAIX expression.
Empfehlung EQUI-Reports, Analyst Thomas J. Schießle
Die Crux am Ende:"Offenlegung von möglichen Interessenskonflikten:
Mögliche Interessenkonflikte können Sie auf der Seite des Erstellers/ der Quelle der Analyse einsehen"
Empfehlung EQUI-Reports, Analyst Thomas J. Schießle
Die Crux am Ende:"Offenlegung von möglichen Interessenskonflikten:
Mögliche Interessenskonflikte können Sie auf der Seite des Erstellers/ derQuelle der Analyse einsehen."
Antwort auf Beitrag Nr.: 59.009.826 von BICYPAPA am 20.10.18 10:34:11
(Australia) – 23 October 2018. Telix Pharmaceuticals Limited (ASX:TLX) (“Telix”, the “Company”), a clinical-stage biopharmaceutical company focused on the development of diagnostic and therapeutic products based on targeted radiopharmaceuticals or “molecularlytargeted radiation” (“MTR”) has today announced that the Company is preparing to commence recruitment for its ZIRCON Phase III trial for imaging of clear cell renal cell cancer (ccRCC) with 89Zr-girentuximab (TLX250).
Concurrent with ongoing submissions to regulatory authorities and clinical sites in Europe, Telix has successfully completed a Clinical Trial Notification (CTN) submission to the Therapeutic Goods Administration (TGA) and has now received its first Human Research Ethics Committee (HREC) approval in Australia. The Company is planning to recruit patients at a total of four clinical sites in Australia.
Telix CEO Dr. Christian Behrenbruch stated, “As an Australian-headquartered company, it’s very pleasing to be able to start to recruit patients in our own backyard while we finalize the regulatory documentation in the various international jurisdictions. Our EU submissions are progressing well with several key review milestones in November that should enable us to bring further international sites online before end-year. In all the countries we plan to run the ZIRCON study, there has been a high level of clinician enagement and we expect this trial to recruit well.”
About the ZIRCON Study
ZIRCON (“Zirconium Imaging in Renal Cancer Oncology, EudraCT 2018-002773-21) is a global multi-centre Phase III study with at least 15 sites in Europe, Australia and the United States, subject to regulator approval in the various jurisdictions. ZIRCON is a prospective imaging trial in approximately 250 renal cancer patients undergoing kidney surgery, and will determine the sensitivity and specificity of TLX250-CDx PET imaging to detect clear cell renal cell cancer (ccRCC) in comparison with histologic “ground truth” determined from surgical resection specimens.
About TLX250
TLX250 (girentuximab) is being developed by Telix Pharmaceuticals both as a therapeutic drug (177Lu-girentuximab, in Phase II) and a diagnostic PET imaging agent, denoted as TLX250-CDx (“Companion Diagnostic”). TLX250 is an antibody-based platform that targets carbonic anhydrase IX (CAIX), a cell surface target that is over-expressed in several serious cancers, including renal, lung, colorectal and esophageal cancer. High CAIX tumour expression is generally correlated with poor prognosis. Telix has prioritized the development of TLX250 for metastatic renal cell cancer (RCC), particularly the clear cell variant (ccRCC), which almost ubiquitously over-expresses CAIX.
About the Renal Cancer Imaging Market
The opportunity for advanced renal cancer imaging techniques consists of several distinct clinical needs, ranging from patients that have had an incidental finding in the kidney, to diagnosed patients undergoing staging (or re-staging) and for treatment response assessment.
Kidney cancer patients are commonly mis-staged as metastases may be very small and do not typically image well using conventional techniques. Between the US and EU5 there are about 120,000 new diagnoses a year (Globocan), where more precise diagnostic imaging tools would significantly impact patient care. In the US alone the prevalence of clear cell renal cell cancer (ccRCC) is approxiately 450,000 patients (SEER), a large proportion of which would benefit from better imaging for staging and treatment response.
Start Phase 3 Redectane TLX250
Telix Commences ZIRCON Phase III Renal Cancer Imaging Trial Melbourne (Australia) – 23 October 2018. Telix Pharmaceuticals Limited (ASX:TLX) (“Telix”, the “Company”), a clinical-stage biopharmaceutical company focused on the development of diagnostic and therapeutic products based on targeted radiopharmaceuticals or “molecularlytargeted radiation” (“MTR”) has today announced that the Company is preparing to commence recruitment for its ZIRCON Phase III trial for imaging of clear cell renal cell cancer (ccRCC) with 89Zr-girentuximab (TLX250).
Concurrent with ongoing submissions to regulatory authorities and clinical sites in Europe, Telix has successfully completed a Clinical Trial Notification (CTN) submission to the Therapeutic Goods Administration (TGA) and has now received its first Human Research Ethics Committee (HREC) approval in Australia. The Company is planning to recruit patients at a total of four clinical sites in Australia.
Telix CEO Dr. Christian Behrenbruch stated, “As an Australian-headquartered company, it’s very pleasing to be able to start to recruit patients in our own backyard while we finalize the regulatory documentation in the various international jurisdictions. Our EU submissions are progressing well with several key review milestones in November that should enable us to bring further international sites online before end-year. In all the countries we plan to run the ZIRCON study, there has been a high level of clinician enagement and we expect this trial to recruit well.”
About the ZIRCON Study
ZIRCON (“Zirconium Imaging in Renal Cancer Oncology, EudraCT 2018-002773-21) is a global multi-centre Phase III study with at least 15 sites in Europe, Australia and the United States, subject to regulator approval in the various jurisdictions. ZIRCON is a prospective imaging trial in approximately 250 renal cancer patients undergoing kidney surgery, and will determine the sensitivity and specificity of TLX250-CDx PET imaging to detect clear cell renal cell cancer (ccRCC) in comparison with histologic “ground truth” determined from surgical resection specimens.
About TLX250
TLX250 (girentuximab) is being developed by Telix Pharmaceuticals both as a therapeutic drug (177Lu-girentuximab, in Phase II) and a diagnostic PET imaging agent, denoted as TLX250-CDx (“Companion Diagnostic”). TLX250 is an antibody-based platform that targets carbonic anhydrase IX (CAIX), a cell surface target that is over-expressed in several serious cancers, including renal, lung, colorectal and esophageal cancer. High CAIX tumour expression is generally correlated with poor prognosis. Telix has prioritized the development of TLX250 for metastatic renal cell cancer (RCC), particularly the clear cell variant (ccRCC), which almost ubiquitously over-expresses CAIX.
About the Renal Cancer Imaging Market
The opportunity for advanced renal cancer imaging techniques consists of several distinct clinical needs, ranging from patients that have had an incidental finding in the kidney, to diagnosed patients undergoing staging (or re-staging) and for treatment response assessment.
Kidney cancer patients are commonly mis-staged as metastases may be very small and do not typically image well using conventional techniques. Between the US and EU5 there are about 120,000 new diagnoses a year (Globocan), where more precise diagnostic imaging tools would significantly impact patient care. In the US alone the prevalence of clear cell renal cell cancer (ccRCC) is approxiately 450,000 patients (SEER), a large proportion of which would benefit from better imaging for staging and treatment response.
Antwort auf Beitrag Nr.: 58.978.911 von versuchsprimat am 17.10.18 09:39:45
Der Beweis
Die Kursentwicklung der letzten Tage beweist, dass es tatsächlich nur eine technische Erholung gab.
Dann nenne mir doch bitte mal Aktien, die sich derzeit dem schlechten Marktumfeld entziehen können?!
Bist ab sofort auf Ignore. Heute schon der 3. hier 🙄
Kann ich auch leider gar nicht lesen, welche Aktien das sein sollen, also bemühe dich 🐒 erst gar nicht 😄
Bist ab sofort auf Ignore. Heute schon der 3. hier 🙄
Kann ich auch leider gar nicht lesen, welche Aktien das sein sollen, also bemühe dich 🐒 erst gar nicht 😄
Subsumieren lernen
Speziell die HDP-Aktie zeichnet sich dadurch aus, dass sie sich beim Kurs und den durchaus vielen positiven Meldungen reziprok verhält: je mehr vielversprechende Meldungen, desto tiefer der Kurs. Einigen Mitgliedern hier, deren Beiträge panische Verlustangst verrät, eine Empfehlung von Mogli3 vom 12.10.:
"Du solltest dich lieber mit Bundesanleihen beschäftigen, die zahlen ca 0.5% Zins aber dafür krisenfest."
Die Mär vom schlechten Marktumfeld
Nehmen wir den 15. Januar diesen Jahres:DAX 13.200 - Kurs HDP 3,90
Heute:
Dax 11.300 - Kurs 2,05
Während der DAX nur 14,4 Prozent verloren hat, liegt der Verlust von HDP bei 47,4 Prozent.
Man sollte, auch wenn man bei diesen Zahlen verständlicherweise in Panik verfällt, andere nicht versuchen, für dumm zu verkaufen.
Antwort auf Beitrag Nr.: 59.025.448 von BICYPAPA am 23.10.18 05:59:52
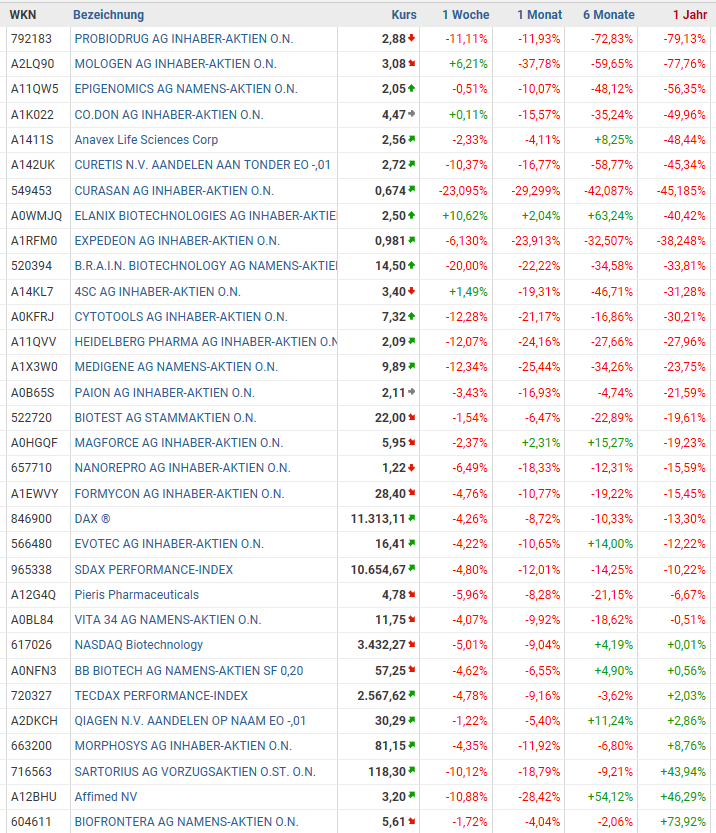
Wenn vergleichen, dann auch richtig
Es macht wenig Sinn HP mit den DAX Werten zu vergleichen. Man sollte dies sinnigerweise mit den deutschen Biotechwerten machen, die an der Börse notiert sind. Ich hab hier mal eine Statistik auf Jahresbasis. HP darin total unauffällig und eher im allgemeinen Biotechtrend. Die DBI Deutsche Biotechindex haben übrigens vom Top Anfang des Jahres bis heute etwa 27% abgegeben. Und etwa genau da befindet sich auch HP. Dies ist ein sinnvoller Vergleich. Die HP und eure Werte könnt ihr ja der Statistik entnehmen. 
Es war nur einem unaufmerksamen, panischem Forenmitglied geschuldet
Ein hilfreicher Beitrag für Stoxtrayder. Wir heben das Niveau.
Antwort auf Beitrag Nr.: 59.038.873 von BICYPAPA am 24.10.18 10:08:00
Noch mal kurz eine Darstellung im Chart des DBI.
Hier kurz der Verlauf der deutschen Biotechwerte seit Jahresanfang 2016 mit dem enormen Anstieg. Im Januar2018 wurde der Jahreshöchststand erreicht. Seit dem Zeitpunkt gibt der DBI nahezu 30% von seiner Performance ab. Nach dem Ausverkauf vorgestern beim NBI Nasdaq Biotechindex steigt die Chance, dass wir auch beim DBI Deutschen Biotechindex einen Boden ausbilden können. Dies kurz zur allgemeinen Lage der deutschen Biotechwerte. Wie oben beschrieben der Verlust vom Top nahezu 30%. Seit Jahresanfang beträgt der Verlust ca 13%.
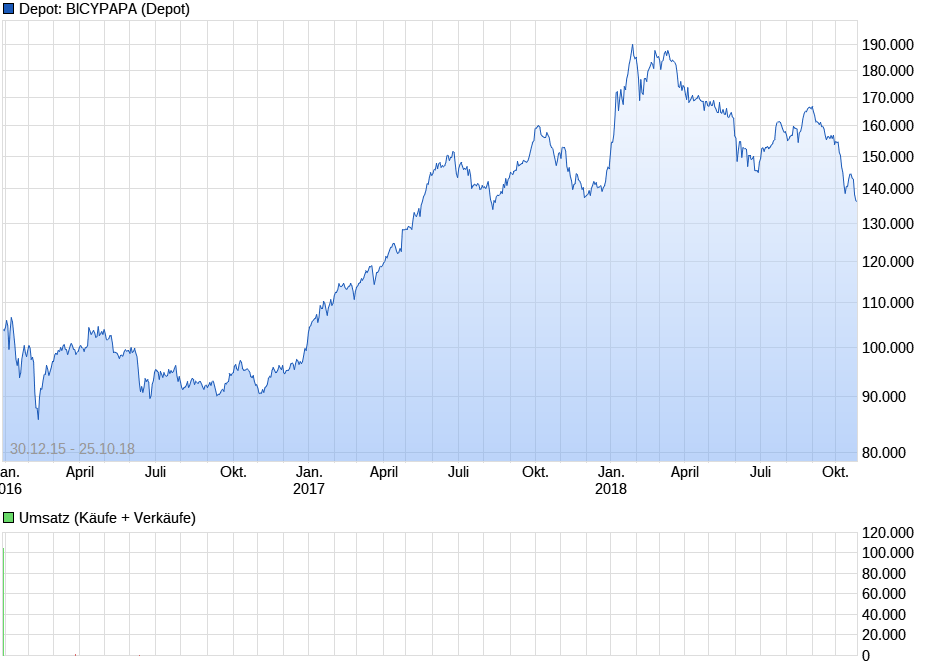
Situation von HP
Ich hab mal die Situation der deutschen Biotechwerte im Chart dargestellt. Dabei sieht man ganz deutlich, dass sich HP weitestgehend am Verlauf des DBI orientiert. Wahrscheinlich sind es Fachfonds die ihre Positionen bei den DBI werten abbauen und HP bleibt davon auch nicht verschont.Noch mal kurz eine Darstellung im Chart des DBI.
Hier kurz der Verlauf der deutschen Biotechwerte seit Jahresanfang 2016 mit dem enormen Anstieg. Im Januar2018 wurde der Jahreshöchststand erreicht. Seit dem Zeitpunkt gibt der DBI nahezu 30% von seiner Performance ab. Nach dem Ausverkauf vorgestern beim NBI Nasdaq Biotechindex steigt die Chance, dass wir auch beim DBI Deutschen Biotechindex einen Boden ausbilden können. Dies kurz zur allgemeinen Lage der deutschen Biotechwerte. Wie oben beschrieben der Verlust vom Top nahezu 30%. Seit Jahresanfang beträgt der Verlust ca 13%.

!
Dieser Beitrag wurde von CloudMOD moderiert. Grund: Löschung auf Wunsch des Users
Antwort auf Beitrag Nr.: 59.061.238 von versuchsprimat am 26.10.18 08:22:15
Und was ist jetzt
Und was ist jetzt dein Problem? Biotechwerte schwanken nun mal überproportional. Das gilt für beide Richtungen. Im Augenblick sind nun mal alleBiotechwerte vom Allgemeintrend bestimmt und nicht von den fundamentalen Gesichtspunkten. Genau das sollte man bei seinen Anlageentscheidungen berücksichtigen und die aussichtsreichsten Werte aussuchen. Und HP gehört dann von den deutschen Biotechwerten einfach dazu. Es kommt auf die zukünftige Entwicklung an. Die wird in der folgenden Monaten an der Börse bewertet werden. Eine Vergangenheitsbetrachtung kann zwar sehr sinnvoll sein um Trends zu beurteilen. Doch entscheidend ist doch wohl was in Zukunft passiert. !
Dieser Beitrag wurde von FairMOD moderiert. Grund: persönlicher Angriff!
Dieser Beitrag wurde von FairMOD moderiert. Grund: auf eigenen Wunsch des Users
Antwort auf Beitrag Nr.: 59.061.778 von versuchsprimat am 26.10.18 09:14:08Nein, nein Versuchsprimat!
Kein seriöser institutioneller Anleger würde solch eine diskreditierende Feststellung wie Sie sie getroffen haben, treffen! Das müssen SIE schon selbst verantworten!
Hier im Thread geht es um HP und somit um Onkologie, Antikörper-Wirkstoff-Konjugate, der Nutzung des biologischen Wirkmechanismus von Amanitin und der Partner/Kooperationen von HP. Dazu können sie gerne sachliche Beiträge liefern oder Meinungen konstruktiv diskutieren! Wenn Sie aber Beiträge zur "Immune Checkpoint Therapy" schreiben oder kommentieren wollen, dann müssen sie eher andere Foren (wie z.B. bei Mologen) im Auge behalten. Wenn Sie allerdings Verunglimpfungen, Beleidigungen oder jegliche Arten von abwertenden Beiträgen zu HP oder Usern formulieren oder irgendwie öffentlich verbreiten, dann werden diese Konsequenzen haben. Bitte nehmen sie das zur Kenntnis!
Kein seriöser institutioneller Anleger würde solch eine diskreditierende Feststellung wie Sie sie getroffen haben, treffen! Das müssen SIE schon selbst verantworten!
Hier im Thread geht es um HP und somit um Onkologie, Antikörper-Wirkstoff-Konjugate, der Nutzung des biologischen Wirkmechanismus von Amanitin und der Partner/Kooperationen von HP. Dazu können sie gerne sachliche Beiträge liefern oder Meinungen konstruktiv diskutieren! Wenn Sie aber Beiträge zur "Immune Checkpoint Therapy" schreiben oder kommentieren wollen, dann müssen sie eher andere Foren (wie z.B. bei Mologen) im Auge behalten. Wenn Sie allerdings Verunglimpfungen, Beleidigungen oder jegliche Arten von abwertenden Beiträgen zu HP oder Usern formulieren oder irgendwie öffentlich verbreiten, dann werden diese Konsequenzen haben. Bitte nehmen sie das zur Kenntnis!
!
Dieser Beitrag wurde von MadMod moderiert. Grund: auf eigenen Wunsch des UsersZur Einordnung des User behavior eine Zusammenstellung eines ehemaligen Mitglieds:
Dieser Text entlarvt behavior als schlichten oder aber gar vorsätzlichen Märchenerzähler:behavior schrieb am 07.12.11 15:51:19 Beitrag Nr. 4.657 ( 42.450.597 )
Antwort auf Beitrag Nr.: 42.450.283 von EGEM am 07.12.11 15:02:45
Danke EGEM!
Ich sehe die heutige Entwicklung allerdings nur als wichtige aber kleine Zwischenetappe zu ganz anderen Kurszielen. Wie oft von mir geschrieben und begründet sehe ich im nächsten Jahr die Schließung des langjährigen Gap`s bis zum Emmissionskurs, was etwa einem Kursziel von 12,50 bis 15,00 EUR bedeutet. Wilex ist dann immer "nur noch" mit einer Marktkapitalisierung von 250-300 Mio. EUR bewertet, was in Bezug auf Umsatzbewertungen aus nachhaltigen Meldungen zun der akt. Produktpipline, den beteiligten Gesellschaften oder Teilverkäufen/Übernahmen m.E. mehr als angemessen ist. Ende 2013 sehe ich dann eine erneute Verdopplung auf 20-25 EUR möglich, was insbesondere aufgrund der dann anstehenden Zulassungen/Marktrollout, weiterer Auslizensierungen und Umsatzbeteiligungen m.E. durchaus realistisch ist.

Nicht vergessen, es sind nur ca. 30 % Streubesitz an Aktien im Umlauf welche bei enger Abstimmung der festen Stakeholder ALLES MÖGLICH macht

Und zu den Umsätzen heute im Vergleich zu TecDax-Werten ... für mich ist es durchaus realistisch, daß Wilex 2012/2013 auch als Aufnahmekandidat für den TecDax gehandelt wird!

Noch eines ... auch die Fonds interessieren sich wieder mehr für Wilex und sind dabei bereits wieder aufzustocken. Im Vergleich zu meiner letzten Auswertung hat insbesondere der LAM kräftig zugelegt. Vielleicht merkens ja jetzt endlich auch noch andere von den so tollen Fondsmanagern und greifen zu bzw. erhöhen Ihre Position ...

A1CU8A LAM-EURO-SMALL CAPS-UNIVERSAL 1,54%
630843 POSTBANK DYNAMIK VISION 0,87%
973020 JB EF GERMAN VALUE-EUR B 0,30%
921837 JB EF GERMAN VALUE-EUR C 0,30%
973019 JB EF GERMAN VALUE-EUR A 0,30%
986841 SANTANDER DEUTSCHE AKTIEN B 0,30%
921869 DKB PHARMA FONDS AL 0,08%
541954 DKB PHARMA FONDS TNL 0,08%
979771 DEUTSCHE POSTBANK EUROPAFONDS PLUS 0,03%
Beste Grüße und auf weitere Erfolge!
ZitatAntwort4
1 1 Antwort?
Zusammenfassung:
- 20-30 EUR Ende 2013 möglich
- realistisch, daß WILEX 2012/2013 als Aufnahmekandidat für den TecDax gehandelt wird
Und heute (Kurs um die 2,70 EUR) wie damals trommelt er für diese Aktie und sieht eine rosige Zukunft. Wer solche Pseudo-Fachleute hier unterstützt und ohne Kritik duldet, mach sich ebenfalls unglaubwürdig.
Wenn hier Geldzahlungen an Foristen angedeutet werden - warum bei diesem noch nicht? Jahrelange WILEX/HDP-PR - die nur vom Kursverlauf ständig widerlegt wird.
Werte, nicht kommentierende Mitleser: Seit gewarnt und glaubt keine hier geschriebenen angeblichen Erfolgsaussichten dieses Users. Er hat sich mit solch einem Schmarren selbst unglaugwürdig gemacht. Kauft vor allen Dingen diese Aktie NICHT NUR wegen seiner hier verbreiteten Phantasien.
Dieser Vergleich ist fundiert und gehört genau hier hin:
Den Menschen wird zudem wesentlich mehr die Immuntherapie gegen Krebs, der sogenannten "Immune Checkpoint Therapy"
der diesjährigen Nobelpreisträger Allison und Honjo einmal helfen! Jeder Fortschritt dort wird sinkende Kurse bei Unternehmen wir HDP zur Folge haben, die ausschließlich von Hoffnungen und Erwartungen zur Zeit überleben.
Man hat ja langsam den Eindruck, bezahlte PR-Leute wüten hier herum.
Antwort auf Beitrag Nr.: 59.062.543 von versuchsprimat am 26.10.18 10:15:02Da siehst du mal was eine sachliche Meinung ist und wie eine ordentliche Recherche aussieht. Gutes Beispiel! Leider ist der Beitrag aus dem Jahr 2011 von der damals guten alten Wilex, welche u.a. Rencarex in einer PH3 hatte und gute Aussichten auf eine Zulassung mit Umsatz-Milliardenpotenzial bestand. Selbst Big Pharma hatte damals für ein Lizenzabkommen mit Wilex vorab einen zweistelligen Millionenbetrag gezahlt.
HEUTE haben wir aber keine Wilex mehr. Wir haben jetzt HP mit dem Focus auf Antikörper-Wirkstoff-Konjugate, der Nutzung des biologischen Wirkmechanismus von Amanitin, vielversprechenden Partnern/Kooperationen … etc.
Ich stehe zu meinem damaligen Beitrag und zur damaligen Einschätzung, auch wenn ich damals falsch lag. Heute sind wir 7 Jahre weiter … mit einer ganz neuen Storyline, Strategie, Business Case und vielversprechenden Ergebnissen und Verträgen (Telix/Redectane, Tekeda, Magenta, HDP-101, MD Anderson, etc.) von HP.
@ Versuchsprimat denk mal darüber nach, ob Du deine Glaubwürdigkeit wirklich erreichst indem Du Beiträge aus dem Jahr 2011 von einer Wilex mit der Einschätzung einer heutigen HP im Jahr 2018 vergleichst?
Ich weiss sehr wohl wovon ich rede, wenn ich Beiträge zu Wilex oder HP schreibe … den ich beschäftige mich schon seit 2010 als nachweislich angemeldeter User hier im Thread mit dem Wert. Du bist erst seit Juni 2018 hier angemeldet und erlaubst dir große Töne. Was hast Du all die Jahre vorher gemacht und warum kommst erst jetzt als „Bildungsbürger“ zu HP um die Ecke? Schreib doch mal was wirklich sachlich Überzeugendes zu HP!
HEUTE haben wir aber keine Wilex mehr. Wir haben jetzt HP mit dem Focus auf Antikörper-Wirkstoff-Konjugate, der Nutzung des biologischen Wirkmechanismus von Amanitin, vielversprechenden Partnern/Kooperationen … etc.
Ich stehe zu meinem damaligen Beitrag und zur damaligen Einschätzung, auch wenn ich damals falsch lag. Heute sind wir 7 Jahre weiter … mit einer ganz neuen Storyline, Strategie, Business Case und vielversprechenden Ergebnissen und Verträgen (Telix/Redectane, Tekeda, Magenta, HDP-101, MD Anderson, etc.) von HP.
@ Versuchsprimat denk mal darüber nach, ob Du deine Glaubwürdigkeit wirklich erreichst indem Du Beiträge aus dem Jahr 2011 von einer Wilex mit der Einschätzung einer heutigen HP im Jahr 2018 vergleichst?
Ich weiss sehr wohl wovon ich rede, wenn ich Beiträge zu Wilex oder HP schreibe … den ich beschäftige mich schon seit 2010 als nachweislich angemeldeter User hier im Thread mit dem Wert. Du bist erst seit Juni 2018 hier angemeldet und erlaubst dir große Töne. Was hast Du all die Jahre vorher gemacht und warum kommst erst jetzt als „Bildungsbürger“ zu HP um die Ecke? Schreib doch mal was wirklich sachlich Überzeugendes zu HP!
Gebe die 100% recht. Habe es aber inzwischen aufgegeben mich mit dem Herrn auseinander zu setzen, ist verlorene Zeit. Der setzt sich gar nicht mit der Materie auseinander sondern schreibt einfach seinen Senf herum, heute hier , morgen dort!
Antwort auf Beitrag Nr.: 59.063.500 von Mogli3 am 26.10.18 11:29:30"Gebe D I E 100 Prozent recht"
Warum so aufgeregt? Und wo bitte steht "Herr"?
Da Sie laut eigener Aussage eine sechsstellige Zahl HDP-Aktien halten, ist die Nervosität bei den jetzigen Kursen und meinen sich erfüllenden Prognosen durchaus verständlich. Sind Sie hier privat oder beruflich unterwegs?
Warum so aufgeregt? Und wo bitte steht "Herr"?
Da Sie laut eigener Aussage eine sechsstellige Zahl HDP-Aktien halten, ist die Nervosität bei den jetzigen Kursen und meinen sich erfüllenden Prognosen durchaus verständlich. Sind Sie hier privat oder beruflich unterwegs?
Sag ich doch...ab auf ignore mit ihm und gut ist.
Verbitterter Aktionär, gekündigter Hausmeisterjob bei HP...wer weiß das schon, was seine Intentionen hier sind?!
Don’t feed the troll!
Verbitterter Aktionär, gekündigter Hausmeisterjob bei HP...wer weiß das schon, was seine Intentionen hier sind?!
Don’t feed the troll!
!
Dieser Beitrag wurde von FairMOD moderiert. Grund: auf eigenen Wunsch des Users
Antwort auf Beitrag Nr.: 59.061.583 von BICYPAPA am 26.10.18 08:53:20
Gesperrt bei Ariva?
Was war da los?
Antwort auf Beitrag Nr.: 59.063.062 von behavior am 26.10.18 10:57:27
behavior am 23.08. - letzter Satz entscheidend
"Der Aktionär" sieht gerade per Meldung auch HDP als Biotech-Geheimtipp und kommte wie folgt zur abschließenden Einschätzung: "... Noch befindet sich Heidelberg Pharma in einer sehr frühen Phase der Entwicklung, der Ansatz sowie die bereits geschlossenen Kooperation sind aber äußerst vielversprechend. Gelingt dem Unternehmen ein entscheidender Fortschritt, dürfte die Aktie wie schon viele andere deutsche Biotechs, nach oben durchstarten. Der Wert eignet sich bestens als langfristige hochspekulative Depotbeimischung."
Antwort auf Beitrag Nr.: 59.063.773 von versuchsprimat am 26.10.18 11:50:29Erzähl doch mal was du so für Aktien hast. Ich halte HDP für Kurse in 3-4 Jahren. Was dazwischen passiert ist mir relativ wurscht. Und bis dahin lebt es sich ganz prächtig. Wie ist das bei dir?
Neuen Hausmeisterjob suchen & davon Gewinner-Aktien (BVB, Linde, Adidas etc.) kaufen! 😂😂
Sorry, für Off-Topic, der mußte sein 😋😉
Sorry, für Off-Topic, der mußte sein 😋😉
Antwort auf Beitrag Nr.: 59.060.965 von BICYPAPA am 26.10.18 07:16:56
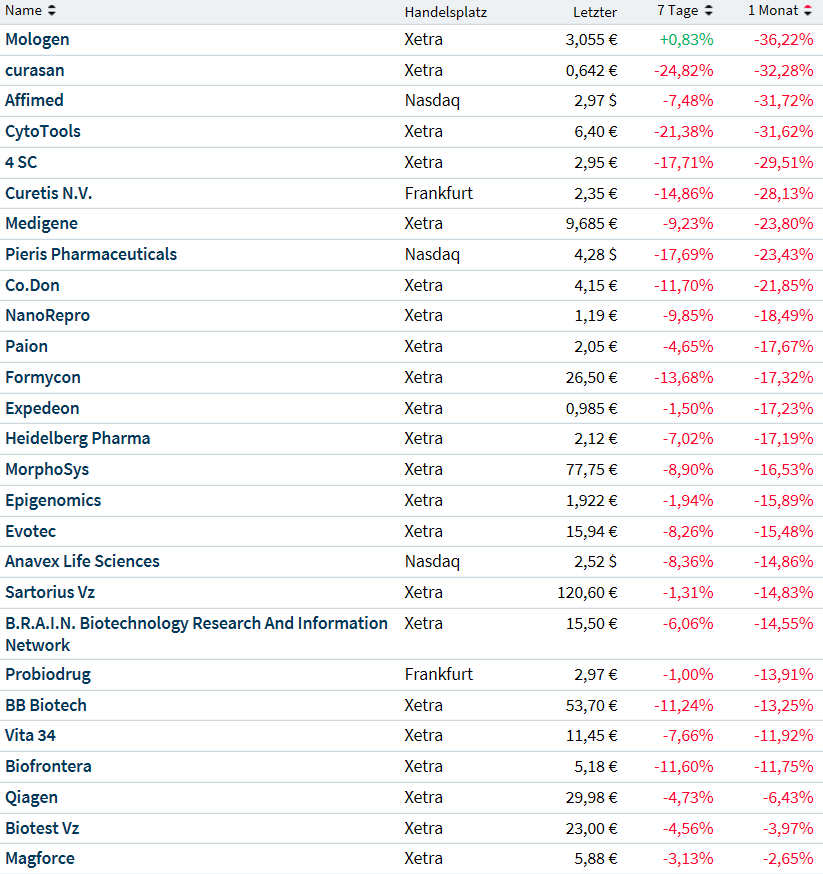
Aus aktuellem Anlass
Hier die Performance im letzten Monat der börsennotierten deutschen Biotechwerte gelistet nach ihrer Reihenfolge. Es gibt keinen einzigen Wert mit grünen Vorzeichen. 
Antwort auf Beitrag Nr.: 59.038.585 von versuchsprimat am 24.10.18 09:46:08
Bitte auch aufmerksam sein, wie durch geschickte Statistiken mit beliebigen Zeiträumen getrickst werden kann (rechtlicher Hinweis:allgemein, nicht personenbezogen).
HDP der Blinde unter den Einäugigen
Diese Performance mit minus 50 Prozent ist ein Zeichen für totale Schwäche, was die Beurteilung von Investoren angeht!Bitte auch aufmerksam sein, wie durch geschickte Statistiken mit beliebigen Zeiträumen getrickst werden kann (rechtlicher Hinweis:allgemein, nicht personenbezogen).
!
Dieser Beitrag wurde von CloudMOD moderiert. Grund: bitte das Threadthema beachten, bleiben Sie bitte sachlich
Antwort auf Beitrag Nr.: 59.072.035 von versuchsprimat am 27.10.18 10:25:43
(Winston Churchill - angeblich wohl fälschlicherweise)
Intention (zweiter Absatz)
Traue keiner Statistik, die du nicht selbst gefälscht hast.(Winston Churchill - angeblich wohl fälschlicherweise)
!
Dieser Beitrag wurde von MagicMOD moderiert. Grund: Spam, Werbung!
Dieser Beitrag wurde von CloudMOD moderiert. Grund: themenfremder InhaltWehe wehe wenn ich auf das (Kurs-) Ende sehe
Tradegate 20.34 Uhr: 9.000 Stück zu 2,06 bis 2,04. Es scheint morgen spannend zu werden. Bad News?Es sei an ein abgemeldetes Mitglied erinnert:
Joschka Schröder schrieb am 24.02.18 10:41:13:
Ein Investment in Heidelberg Pharma ist mit enormen Risiken behaftet. Für mich wäre das Chance-Risiko-Verhältnis jedenfalls nichts.
Unglücksrabe?:
Mogli3 schrieb am 12.10.18 09:28:47 Beitrag Nr. 248 ( 58.939.590 )
habe nochmal aufgestockt auf über sechsstellig
@Mogli3: wird bei diesen 50-Prozent-über-Pennystock-Kursen weiter aufgestockt?
!
Dieser Beitrag wurde von MadMod moderiert. Grund: Postings von Doppel-IDs
Antwort auf Beitrag Nr.: 59.071.747 von BICYPAPA am 27.10.18 09:18:41
Preclinical validation of 111In-girentuximab-F(ab')2 as a tracer to image hypoxia related marker CAIX expression in head and neck cancer xenografts.
Huizing FJ1, Hoeben BAW2, Franssen G3, Lok J2, Heskamp S3, Oosterwijk E4, Boerman OC3, Bussink J2.
Author information
Abstract
BACKGROUND AND PURPOSE:
Hypoxia is a major cause of radio- and chemoresistance. Carbonic anhydrase IX (CAIX) is an endogenous hypoxia-related marker and an important prognostic marker. Assessment of CAIX expression may allow patient selection for hypoxia or CAIX-targeted treatment. The radioactive tracer 111In-girentuximab-F(ab')2 targets CAIX and can be used for SPECT imaging. Aim of this study was to validate and optimize 111In-girentuximab-F(ab')2 for imaging of CAIX expression in head and neck tumor xenografts.
MATERIAL AND METHODS:
Affinity and internalization kinetics of 111In-girentuximab-F(ab')2 were determined in vitro using CAIX-expressing SK-RC-52 cells. Tumor targeting characteristics were determined in athymic mice with six different head and neck squamous cell carcinoma (SCCNij) xenografts. Tracer uptake was measured by ex vivo radioactivity counting. Intratumoral distribution of tracer uptake was measured using autoradiography and CAIX expression was determined immunohistochemically.
RESULTS:
26% of the tracer was internalized into the SK-RC-52 cells within 24h. The half maximal inhibitory concentration (IC50) was 0.69±0.08nM. In biodistribution studies SCCNij153 tumors showed the highest tracer uptake: 4.1±0.8ID/g at 24h p.i. Immunohistochemical and autoradiographic analyses of the xenografts showed a distinct spatial correlation between localization of the tracer and CAIX expression.
CONCLUSION:
111In-girentuximab-F(ab')2 has a high affinity for CAIX. In vivo tumor uptake correlated strongly with CAIX expression in different head and neck xenografts. These results suggest that 111In-girentuximab-F(ab')2 is a promising tracer for imaging of hypoxia-related CAIX expression.
Abstract zu Girentuximab
Abstract zu Girentuximab zur möglichen Indikationserweiterung, das von HP an Telix auslizensiert wurde.Preclinical validation of 111In-girentuximab-F(ab')2 as a tracer to image hypoxia related marker CAIX expression in head and neck cancer xenografts.
Huizing FJ1, Hoeben BAW2, Franssen G3, Lok J2, Heskamp S3, Oosterwijk E4, Boerman OC3, Bussink J2.
Author information
Abstract
BACKGROUND AND PURPOSE:
Hypoxia is a major cause of radio- and chemoresistance. Carbonic anhydrase IX (CAIX) is an endogenous hypoxia-related marker and an important prognostic marker. Assessment of CAIX expression may allow patient selection for hypoxia or CAIX-targeted treatment. The radioactive tracer 111In-girentuximab-F(ab')2 targets CAIX and can be used for SPECT imaging. Aim of this study was to validate and optimize 111In-girentuximab-F(ab')2 for imaging of CAIX expression in head and neck tumor xenografts.
MATERIAL AND METHODS:
Affinity and internalization kinetics of 111In-girentuximab-F(ab')2 were determined in vitro using CAIX-expressing SK-RC-52 cells. Tumor targeting characteristics were determined in athymic mice with six different head and neck squamous cell carcinoma (SCCNij) xenografts. Tracer uptake was measured by ex vivo radioactivity counting. Intratumoral distribution of tracer uptake was measured using autoradiography and CAIX expression was determined immunohistochemically.
RESULTS:
26% of the tracer was internalized into the SK-RC-52 cells within 24h. The half maximal inhibitory concentration (IC50) was 0.69±0.08nM. In biodistribution studies SCCNij153 tumors showed the highest tracer uptake: 4.1±0.8ID/g at 24h p.i. Immunohistochemical and autoradiographic analyses of the xenografts showed a distinct spatial correlation between localization of the tracer and CAIX expression.
CONCLUSION:
111In-girentuximab-F(ab')2 has a high affinity for CAIX. In vivo tumor uptake correlated strongly with CAIX expression in different head and neck xenografts. These results suggest that 111In-girentuximab-F(ab')2 is a promising tracer for imaging of hypoxia-related CAIX expression.
Antwort auf Beitrag Nr.: 59.096.138 von BICYPAPA am 30.10.18 17:04:59
https://www.edisoninvestmentresearch.com/research/report/tel…
Telix is preparing to commence recruitment in the ZIRCON Phase III trial for imaging clear cell renal cell carcinoma (ccRCC) with TLX250-CDx (89ZR-girentuximab), having completed the necessary preparations, including receiving regulatory and ethics approval to commence recruitment at the first of four planned sites in Australia. The first sites in Europe are expected to come on line before the end of the year.
The Phase III study is planned to recruit approximately 250 cancer patients undergoing surgery to remove suspicious kidney masses in at least 15 sites in Europe, Australia and the US. Management expects the Phase III study to complete by Q319. The study will determine the sensitivity and specificity of TLX250-CDx PET imaging to detect ccRCC in comparison with histology examination of tissue samples collected during surgery.
In recent weeks, Telix has appointed Netherlands-based Radboud Translational Medicine to manufacture TLX250-CDx for clinical trials (and eventual commercial production) in Europe. It has selected Cyclotek to manufacture and supply Australian clinical trial sites, as well as to act as a back-up production site for the global multi-centre Phase III trial.
It has reported the results of an interim analysis of the first five subjects in the 10-patient dosimetry bridging study (ZIR-dose), which confirmed that the TLX250-CDx product that contained 10mg of the girentuximab targeting antibody was superior to the 5mg product, with a 50% lower dose of radiation absorbed by the liver and a 25% lower dose in the lower intestinal dose. Eight of the target of 10 subjects have been recruited and the study is expected to complete before the end of the year.
A comparison with historical dosimetry data showed that the change of isotope from 124I to 89Zr has reduced the dose of radiation absorbed by the patient by approximately 25%. This suggests that in addition to improving image quality, the change in isotope may also have improved patient safety.
The interim analysis has given Telix confidence that it has identified the right dosing and dosimetry for TLX250-CDX, enabling it to proceed with dosing the first patients in the ZIRCON Phase III study.
We expect the primary application of TLX250-CDX to be to help distinguish between ccRCC (the most serious form of kidney cancer) and other renal masses as part of the initial diagnostic work-up. Kidney cancer is the eighth most common cancer, and is expected to account for 65,340 new cases and 14,970 deaths in the US in 2018.2 Globocan predicts that in 2020 there will be 423,000 new cases and 184,000 deaths from kidney cancer worldwide.
We estimate that the addressable market for TLX250-CDX is equivalent to 50% of new kidney cancer cases each year, with half of use being for initial diagnosis and the balance being for applications such as detecting metastatic disease, screening patients for suitability for MTR therapy and monitoring response to therapy with targeted agents.
Telix Redectane TLX250 Update
ZIRCON Phase III at the starting linehttps://www.edisoninvestmentresearch.com/research/report/tel…
Telix is preparing to commence recruitment in the ZIRCON Phase III trial for imaging clear cell renal cell carcinoma (ccRCC) with TLX250-CDx (89ZR-girentuximab), having completed the necessary preparations, including receiving regulatory and ethics approval to commence recruitment at the first of four planned sites in Australia. The first sites in Europe are expected to come on line before the end of the year.
The Phase III study is planned to recruit approximately 250 cancer patients undergoing surgery to remove suspicious kidney masses in at least 15 sites in Europe, Australia and the US. Management expects the Phase III study to complete by Q319. The study will determine the sensitivity and specificity of TLX250-CDx PET imaging to detect ccRCC in comparison with histology examination of tissue samples collected during surgery.
In recent weeks, Telix has appointed Netherlands-based Radboud Translational Medicine to manufacture TLX250-CDx for clinical trials (and eventual commercial production) in Europe. It has selected Cyclotek to manufacture and supply Australian clinical trial sites, as well as to act as a back-up production site for the global multi-centre Phase III trial.
It has reported the results of an interim analysis of the first five subjects in the 10-patient dosimetry bridging study (ZIR-dose), which confirmed that the TLX250-CDx product that contained 10mg of the girentuximab targeting antibody was superior to the 5mg product, with a 50% lower dose of radiation absorbed by the liver and a 25% lower dose in the lower intestinal dose. Eight of the target of 10 subjects have been recruited and the study is expected to complete before the end of the year.
A comparison with historical dosimetry data showed that the change of isotope from 124I to 89Zr has reduced the dose of radiation absorbed by the patient by approximately 25%. This suggests that in addition to improving image quality, the change in isotope may also have improved patient safety.
The interim analysis has given Telix confidence that it has identified the right dosing and dosimetry for TLX250-CDX, enabling it to proceed with dosing the first patients in the ZIRCON Phase III study.
We expect the primary application of TLX250-CDX to be to help distinguish between ccRCC (the most serious form of kidney cancer) and other renal masses as part of the initial diagnostic work-up. Kidney cancer is the eighth most common cancer, and is expected to account for 65,340 new cases and 14,970 deaths in the US in 2018.2 Globocan predicts that in 2020 there will be 423,000 new cases and 184,000 deaths from kidney cancer worldwide.
We estimate that the addressable market for TLX250-CDX is equivalent to 50% of new kidney cancer cases each year, with half of use being for initial diagnosis and the balance being for applications such as detecting metastatic disease, screening patients for suitability for MTR therapy and monitoring response to therapy with targeted agents.
Antwort auf Beitrag Nr.: 59.101.823 von BICYPAPA am 31.10.18 10:12:39
Quelle: https://www.edisoninvestmentresearch.com/research/report/tel…
Therapeutische Anwendung:
Three Phase II checkpoint inhibitor combo studies planned. Targeting US/Australia IND filings Q418
TLX250 ccRCC therapeutic
Telix is also developing TLX250, a MTR therapeutic targeting ccRCC. TLX250 is based on a modified and improved version of the mAb girentuximab (cG250) labelled with the isotope 177Lu. 177Lu is an ideal isotope for therapeutic MTR applications because it emits beta particles that travel only a short distance in tissue and are absorbed within the tumour, killing cancer cells. It has a comparatively short half-life of 6.64 days.
Wilex has completed two clinical studies of 177Lu-cG250 in patients with metastatic ccRCC. The two studies provided encouraging evidence of efficacy, with 78% and 68% of patients achieving responses of stable disease or better in the three months after the first course of treatment in the Phase I and Phase II studies, respectively. One of the 14 patients in the Phase II study achieved a partial response. While the treatment was generally well tolerated, a high proportion of subjects experienced myelosuppression (low levels of white blood cell production in the bone marrow). We expect the company to seek to optimise the dosing regimen (both amount and interval) in future studies to in order to reduce the incidence of this side effect. The company’s experience with MTR therapies in prostate cancer will help inform the programme to optimise the dosing regimen.
Better treatments are needed for metastatic ccRCC
While many patients who are diagnosed with early-stage RCC can be cured by surgical treatment, better treatments are needed for metastatic disease, where the five-year survival rate is only 12%.
Checkpoint inhibitors and targeted therapies (antiangiogenic therapies and mTOR inhibitors) are the mainstays of systemic treatment for unresectable and metastatic ccRCC, rather than cytotoxic chemotherapy. According to clinical guidelines, the preferred first-line therapies are the targeted therapies pazopanib and sunitinib; ipilimumab + nivolumab combination (FDA approved April 2018) is a preferred first-line therapy for intermediate and low risk patients, but not for high-risk patients9.
Preferred second-line therapies are cabozantinib (TKI including VEGFR) and the anti-PD1 immune checkpoint inhibitor (ICI) nivolumab, which was approved by the FDA for patients with advanced RCC in November 2015.
Potential for TLX250/ICI combo to improve response rates
Therapies such as ICI that enhance immune responses have had remarkable success in treating a range of cancers, however, typically less than a third of patients respond when these drugs are used as single agents (monotherapy). For example, the response to second-line treatment of mRCC with nivolumab was 22%10.
Combining ICI with chemotherapy has been an effective way to improve response rates compared to ICI monotherapy in a number of cancer types. For example, in newly diagnosed metastatic lung cancer the response rate to the Keytruda/chemo combo in the KEYNOTE-189 study was 49.4%11, which is substantially higher than the 27.3% ORR to Keytruda monotherapy reported in the separate KEYNOTE-042 study. The synergistic benefit of ICI/chemo combos is believed to be due to the cellular debris from tumour cells killed by the chemotherapy triggering an immune response (sometimes referred to as immunogenic cancer cell death or turning immunologically cold tumours hot), with the ICI then able to strengthen this immune response.
With chemotherapy not recommended in ccRCC, there is potential for MTR to play a similar role in killing tumour cells and releasing tumour antigens to stimulate an immune response. Combining MTR with ICI would be expected to improve ORR.
The ability of radiation therapy to have immune stimulatory effects is evidenced by the well-established phenomenon of so-called abscopal responses to radiation, where tumours away from the site of radiation also respond to treatment due to an immune response triggered by the therapy12.
Phase II trials for TLX250 planned for 2019
Telix is formulating plans for three Phase II studies of TLX250 in combination with ICIs, one of which is likely to be a pharma-sponsored study. The three studies are expected to involve ~60 subjects in total. It plans to submit two INDs in relation to these studies in US/Australia in Q418. The manufacture of clinical grade material for these studies is expected to be completed by the end of August.
By the end of 2019 the company expects these studies to have produced sufficient information to identify an appropriate strategy for the Phase III development of TLX250. A key goal of the planned Phase II studies is to demonstrate that there are synergistic benefits from combining TLX250 with ICI therapy.
Umsatzschätzungen therapeutische Anwendung. HP Umsatzbeteiligung 5%.
Global peak sales of US$470m. For the US assumes 65,300 kidney cancer cases/yr, 20% eligible for treatment, 20% penetration; for the EU assumes 93,000 cases/yr, 20% eligible, 16% penetration; pricing US$70k per patient, 30% discount in Europe; launch 2024 - biologicals market exclusivity to 2036 in US, 2034 in Europe; assume receives 12% net royalty.
R&D cost: A$4m for two small company funded Phase II studies, then out-license.
Therapeutische Anwendung TLX-250
Nach dem Update zur diagnostischen Anwendung hier nun der aktuelle Stand zur therapeutischen Anwendung:Quelle: https://www.edisoninvestmentresearch.com/research/report/tel…
Therapeutische Anwendung:
Three Phase II checkpoint inhibitor combo studies planned. Targeting US/Australia IND filings Q418
TLX250 ccRCC therapeutic
Telix is also developing TLX250, a MTR therapeutic targeting ccRCC. TLX250 is based on a modified and improved version of the mAb girentuximab (cG250) labelled with the isotope 177Lu. 177Lu is an ideal isotope for therapeutic MTR applications because it emits beta particles that travel only a short distance in tissue and are absorbed within the tumour, killing cancer cells. It has a comparatively short half-life of 6.64 days.
Wilex has completed two clinical studies of 177Lu-cG250 in patients with metastatic ccRCC. The two studies provided encouraging evidence of efficacy, with 78% and 68% of patients achieving responses of stable disease or better in the three months after the first course of treatment in the Phase I and Phase II studies, respectively. One of the 14 patients in the Phase II study achieved a partial response. While the treatment was generally well tolerated, a high proportion of subjects experienced myelosuppression (low levels of white blood cell production in the bone marrow). We expect the company to seek to optimise the dosing regimen (both amount and interval) in future studies to in order to reduce the incidence of this side effect. The company’s experience with MTR therapies in prostate cancer will help inform the programme to optimise the dosing regimen.
Better treatments are needed for metastatic ccRCC
While many patients who are diagnosed with early-stage RCC can be cured by surgical treatment, better treatments are needed for metastatic disease, where the five-year survival rate is only 12%.
Checkpoint inhibitors and targeted therapies (antiangiogenic therapies and mTOR inhibitors) are the mainstays of systemic treatment for unresectable and metastatic ccRCC, rather than cytotoxic chemotherapy. According to clinical guidelines, the preferred first-line therapies are the targeted therapies pazopanib and sunitinib; ipilimumab + nivolumab combination (FDA approved April 2018) is a preferred first-line therapy for intermediate and low risk patients, but not for high-risk patients9.
Preferred second-line therapies are cabozantinib (TKI including VEGFR) and the anti-PD1 immune checkpoint inhibitor (ICI) nivolumab, which was approved by the FDA for patients with advanced RCC in November 2015.
Potential for TLX250/ICI combo to improve response rates
Therapies such as ICI that enhance immune responses have had remarkable success in treating a range of cancers, however, typically less than a third of patients respond when these drugs are used as single agents (monotherapy). For example, the response to second-line treatment of mRCC with nivolumab was 22%10.
Combining ICI with chemotherapy has been an effective way to improve response rates compared to ICI monotherapy in a number of cancer types. For example, in newly diagnosed metastatic lung cancer the response rate to the Keytruda/chemo combo in the KEYNOTE-189 study was 49.4%11, which is substantially higher than the 27.3% ORR to Keytruda monotherapy reported in the separate KEYNOTE-042 study. The synergistic benefit of ICI/chemo combos is believed to be due to the cellular debris from tumour cells killed by the chemotherapy triggering an immune response (sometimes referred to as immunogenic cancer cell death or turning immunologically cold tumours hot), with the ICI then able to strengthen this immune response.
With chemotherapy not recommended in ccRCC, there is potential for MTR to play a similar role in killing tumour cells and releasing tumour antigens to stimulate an immune response. Combining MTR with ICI would be expected to improve ORR.
The ability of radiation therapy to have immune stimulatory effects is evidenced by the well-established phenomenon of so-called abscopal responses to radiation, where tumours away from the site of radiation also respond to treatment due to an immune response triggered by the therapy12.
Phase II trials for TLX250 planned for 2019
Telix is formulating plans for three Phase II studies of TLX250 in combination with ICIs, one of which is likely to be a pharma-sponsored study. The three studies are expected to involve ~60 subjects in total. It plans to submit two INDs in relation to these studies in US/Australia in Q418. The manufacture of clinical grade material for these studies is expected to be completed by the end of August.
By the end of 2019 the company expects these studies to have produced sufficient information to identify an appropriate strategy for the Phase III development of TLX250. A key goal of the planned Phase II studies is to demonstrate that there are synergistic benefits from combining TLX250 with ICI therapy.
Umsatzschätzungen therapeutische Anwendung. HP Umsatzbeteiligung 5%.
Global peak sales of US$470m. For the US assumes 65,300 kidney cancer cases/yr, 20% eligible for treatment, 20% penetration; for the EU assumes 93,000 cases/yr, 20% eligible, 16% penetration; pricing US$70k per patient, 30% discount in Europe; launch 2024 - biologicals market exclusivity to 2036 in US, 2034 in Europe; assume receives 12% net royalty.
R&D cost: A$4m for two small company funded Phase II studies, then out-license.
Antwort auf Beitrag Nr.: 59.110.025 von BICYPAPA am 01.11.18 05:54:23
Magenta Therapeutics Announces Acceptance of Nine Abstracts Covering Clinical and Preclinical Data at ASH, Representing Progress across the Portfolio of Conditioning, Stem Cell Mobilization and Expansion Programs
Magenta Therapeutics (NASDAQ: MGTA), a clinical-stage biotechnology company developing novel medicines to bring the curative power of bone marrow transplant to more patients, today announced that the Company will present clinical data and preclinical research at the 60th annual meeting of the American Society of Hematology (ASH), taking place December 1st through 4th in San Diego, Calif. Preliminary data in these abstracts became available on the ASH conference website at 9:00 a.m. ET today. The Company also provided an update today on its ongoing Phase 2 study of MGTA-456 in inherited metabolic disorders, including recent data from the study.
Conditioning Programs
CD117-Amanitin Antibody Drug Conjugates Effectively Deplete Human and Non-Human Primate HSCs: Proof of Concept as a Targeted Strategy for Conditioning Patients for Bone Marrow Transplant, Abstract #3314
Presenter: Brad Pearse, Ph.D., Magenta Therapeutics
Session Name: 701. Experimental Transplantation: Basic Biology, Pre-Clinical Models: Poster II
Session Date: Sunday, December 2, 2018
Session Time: 6:00 PM - 8:00 PM
Room: San Diego Convention Center, Hall GH
Targeting CD45 with an Amanitin Antibody-Drug Conjugate Effectively Depletes Human HSCs and Immune Cells for Transplant Conditioning, Abstract #4526
Presenter: Rahul Palchaudhuri, Ph.D., Magenta Therapeutics
Session Name: 701. Experimental Transplantation: Basic Biology, Pre-Clinical Models: Poster III
Session Date: Monday, December 3, 2018
Session Time: 6:00 PM - 8:00 PM
Room: San Diego Convention Center, Hall GH
Single Doses of Antibody Drug Conjugates (ADCs) Targeted to CD117 or CD45 Have Potent In Vivo Anti-Leukemia Activity and Survival Benefit in Patient Derived AML Models, Abstract #3316
Presenter: Jennifer Proctor, Magenta Therapeutics
Session Name: 701. Experimental Transplantation: Basic Biology, Pre-Clinical Models: Poster II
Session Date: Sunday, December 2, 2018
Session Time: 6:00 PM - 8:00 PM
Room: San Diego Convention Center, Hall GH
Antibody Drug Conjugates Targeted to CD45 or CD117 Enable Allogeneic Hematopoietic Stem Cell Transplantation in Animal Models, Abstract #3324
Presenter: Rahul Palchaudhuri, Ph.D., Magenta Therapeutics
Session Name: 701. Experimental Transplantation: Basic Biology, Pre-Clinical Models: Poster II
Date: Sunday, December 2, 2018
Presentation Time: 6:00 PM - 8:00 PM
Location: San Diego Convention Center, Hall GH
Magenta Präsentationen
Magenta Präsentationen zu C100 und C200.Magenta Therapeutics Announces Acceptance of Nine Abstracts Covering Clinical and Preclinical Data at ASH, Representing Progress across the Portfolio of Conditioning, Stem Cell Mobilization and Expansion Programs
Magenta Therapeutics (NASDAQ: MGTA), a clinical-stage biotechnology company developing novel medicines to bring the curative power of bone marrow transplant to more patients, today announced that the Company will present clinical data and preclinical research at the 60th annual meeting of the American Society of Hematology (ASH), taking place December 1st through 4th in San Diego, Calif. Preliminary data in these abstracts became available on the ASH conference website at 9:00 a.m. ET today. The Company also provided an update today on its ongoing Phase 2 study of MGTA-456 in inherited metabolic disorders, including recent data from the study.
Conditioning Programs
CD117-Amanitin Antibody Drug Conjugates Effectively Deplete Human and Non-Human Primate HSCs: Proof of Concept as a Targeted Strategy for Conditioning Patients for Bone Marrow Transplant, Abstract #3314
Presenter: Brad Pearse, Ph.D., Magenta Therapeutics
Session Name: 701. Experimental Transplantation: Basic Biology, Pre-Clinical Models: Poster II
Session Date: Sunday, December 2, 2018
Session Time: 6:00 PM - 8:00 PM
Room: San Diego Convention Center, Hall GH
Targeting CD45 with an Amanitin Antibody-Drug Conjugate Effectively Depletes Human HSCs and Immune Cells for Transplant Conditioning, Abstract #4526
Presenter: Rahul Palchaudhuri, Ph.D., Magenta Therapeutics
Session Name: 701. Experimental Transplantation: Basic Biology, Pre-Clinical Models: Poster III
Session Date: Monday, December 3, 2018
Session Time: 6:00 PM - 8:00 PM
Room: San Diego Convention Center, Hall GH
Single Doses of Antibody Drug Conjugates (ADCs) Targeted to CD117 or CD45 Have Potent In Vivo Anti-Leukemia Activity and Survival Benefit in Patient Derived AML Models, Abstract #3316
Presenter: Jennifer Proctor, Magenta Therapeutics
Session Name: 701. Experimental Transplantation: Basic Biology, Pre-Clinical Models: Poster II
Session Date: Sunday, December 2, 2018
Session Time: 6:00 PM - 8:00 PM
Room: San Diego Convention Center, Hall GH
Antibody Drug Conjugates Targeted to CD45 or CD117 Enable Allogeneic Hematopoietic Stem Cell Transplantation in Animal Models, Abstract #3324
Presenter: Rahul Palchaudhuri, Ph.D., Magenta Therapeutics
Session Name: 701. Experimental Transplantation: Basic Biology, Pre-Clinical Models: Poster II
Date: Sunday, December 2, 2018
Presentation Time: 6:00 PM - 8:00 PM
Location: San Diego Convention Center, Hall GH
Antwort auf Beitrag Nr.: 59.118.752 von BICYPAPA am 01.11.18 21:58:18
DGAP-News: Heidelberg Pharma AG / Schlagwort(e): Konferenz
02.11.2018 / 07:00
Für den Inhalt der Mitteilung ist der Emittent / Herausgeber verantwortlich.
PRESSEMITTEILUNG
Heidelberg Pharma kündigt Präsentationen von verschiedenen Forschungsergebnissen zur ATAC-Technologie auf der ASH-Jahrestagung 2018 an
- Partner MD Anderson Cancer Center wird in einem Vortrag präklinische Daten mit HDP-101 zur wirksamen 17p Deletion im Multiplen Myelom präsentieren
- Partner Magenta wird Daten zum Einsatz von Antikörper-Amanitin-Konjugaten (ATACs) bei der Vorbehandlung von Patienten mit Knochenmarktransplantationen vorstellen
Ladenburg, 2. November 2018 - Die Heidelberg Pharma AG (FWB: WL6) gab heute bekannt, dass ihre Kooperationspartner MD Anderson Cancer Center, Houston, TX, USA, sowie Magenta Therapeutics, Cambridge, MA, USA, präklinische Daten auf dem führenden Kongress für hämatologische Erkrankungen, der 60. Jahrestagung der American Society of Hematology (ASH) präsentieren werden. Die Tagung findet vom 1. bis 4. Dezember 2018 in San Diego, USA, statt.
Prof. Andreas Pahl, CSO der Heidelberg Pharma AG, kommentierte: "Wir sind hocherfreut, dass unser Forschungspartner MD Anderson Cancer Center präklinische Daten zu unserem Produktkandidaten HDP-101 in einem Vortrag präsentieren wird. Die Wissenschaftler des MD Anderson konnten jetzt nachweisen, dass das Amanitin-Konjugat HDP-101 Tumorzellen aus Patienten mit Multiplem Myelom mit 17p-Deletion besonders gut und effizient bekämpfen kann. Wir sind auch stolz, dass unser Lizenzpartner Magenta Daten mit unserer ATAC-Technologie auf dieser wichtigen Konferenz vorstellen wird."
Vortrag von MD Anderson: HDP-101, a Novel B-Cell Maturation Antigen (BCMA)-Targeted Antibody Conjugated to α-Amanitin, Is Active Against Myeloma with Preferential Efficacy Against Pre-Clinical Models of Deletion 17p
Abstract #593
Name der Session: 652. Myeloma: Pathophysiology and Pre-Clinical Studies, excluding Therapy: Development of Novel Immunotherapeutic Approaches in Multiple Myeloma
Vortragender: Dr. Ram Kumar Singh, Department of Lymphoma/Myeloma, MD Anderson Cancer Center
Datum: Montag, 3. Dezember 2018
Zeit: 7:00 Uhr - 8:30 Uhr PST (16:00 Uhr - 17:30 CET)
Präsentationszeit: 8:00 Uhr PST (17:00 Uhr CET)
Raum: San Diego Convention Center, Ballroom 20D
Frühere in Nature publizierte Studien mit Darmkrebszellen zeigten, dass Amanitin das Potenzial hat, besonders gut auf Tumoren mit aggressiven Verlaufsformen im Zusammenhang mit einer 17p-Deletion zu wirken. Mit "17p" bezeichnet man einen Abschnitt des Chromosoms, dessen DNA u. a. das Tumorsuppressorgen TP53, als auch das Gen für RNA-Polymerase II enthält. Tumore haben häufig eine verminderte TP53-Funktion, um die natürliche Tumorabwehr der Zellen zu schwächen. Da durch die 17p-Deletion auch die Menge an RNA-Polymerase II vermindert wird, sind solche Tumorzellen besonders empfindlich gegen Amanitin.
Posterpräsentationen von Magenta
Magenta Therapeutics wird präklinische Daten vorstellen, die in verschiedenen Studien zur Verbesserung der Therapiemöglichkeiten im Bereich der Knochenmarktransplantation gewonnen wurden. Die getesteten ADCs bestehen aus einem Antikörper von Magenta und der ATAC-Technologie von Heidelberg Pharma und wurden präklinisch auf ihre Eignung zur Konditionierung von Patienten für die Transplantation von Knochenmarkszellen getestet.
CD117-Amanitin Antibody Drug Conjugates Effectively Deplete Human and Non-Human Primate HSCs: Proof of Concept as a Targeted Strategy for Conditioning Patients for Bone Marrow Transplant
Abstract #3314
Name der Session: 701. Experimental Transplantation: Basic Biology, Pre-Clinical Models: Poster II
Vortragender: Dr. Brad Pearse, Magenta Therapeutics
Datum: Sonntag, 2. Dezember 2018
Zeit: 18:00 Uhr - 20:00 Uhr PST (3:00 Uhr - 5:00 Uhr CET, 3. Dezember 2018)
Raum: San Diego Convention Center, Hall GH
Single Doses of Antibody Drug Conjugates (ADCs) Targeted to CD117 or CD45 Have Potent In Vivo Anti-Leukemia Activity and Survival Benefit in Patient Derived AML Models
Abstract #3316
Name der Session: 701. Experimental Transplantation: Basic Biology, Pre-Clinical Models: Poster II
Vortragende: Jennifer Proctor, Magenta Therapeutics
Datum: Sonntag, 2. Dezember 2018
Zeit: 18:00 Uhr - 20:00 Uhr PST (3:00 Uhr - 5:00 Uhr CET, 3. Dezember 2018)
Raum: San Diego Convention Center, Hall GH
Targeting CD45 with an Amanitin Antibody-Drug Conjugate Effectively Depletes Human HSCs and Immune Cells for Transplant Conditioning
Abstract #4526
Name der Session: 701. Experimental Transplantation: Basic Biology, Pre-Clinical Models: Poster III
Vortragender: Dr. Rahul Palchaudhuri, Magenta Therapeutics
Datum: Montag, 3. Dezember 2018
Zeit: 18:00 Uhr - 20:00 Uhr PST (3:00 Uhr - 5:00 Uhr CET, 3. Dezember 2018)
Raum: San Diego Convention Center, Hall GH
Präsentationen HP
Heidelberg Pharma kündigt Präsentationen von verschiedenen Forschungsergebnissen zur ATAC-Technologie auf der ASH-Jahrestagung 2018 anPharma AG: DGAP-News: Heidelberg Pharma AG / Schlagwort(e): Konferenz
02.11.2018 / 07:00
Für den Inhalt der Mitteilung ist der Emittent / Herausgeber verantwortlich.
PRESSEMITTEILUNG
Heidelberg Pharma kündigt Präsentationen von verschiedenen Forschungsergebnissen zur ATAC-Technologie auf der ASH-Jahrestagung 2018 an
- Partner MD Anderson Cancer Center wird in einem Vortrag präklinische Daten mit HDP-101 zur wirksamen 17p Deletion im Multiplen Myelom präsentieren
- Partner Magenta wird Daten zum Einsatz von Antikörper-Amanitin-Konjugaten (ATACs) bei der Vorbehandlung von Patienten mit Knochenmarktransplantationen vorstellen
Ladenburg, 2. November 2018 - Die Heidelberg Pharma AG (FWB: WL6) gab heute bekannt, dass ihre Kooperationspartner MD Anderson Cancer Center, Houston, TX, USA, sowie Magenta Therapeutics, Cambridge, MA, USA, präklinische Daten auf dem führenden Kongress für hämatologische Erkrankungen, der 60. Jahrestagung der American Society of Hematology (ASH) präsentieren werden. Die Tagung findet vom 1. bis 4. Dezember 2018 in San Diego, USA, statt.
Prof. Andreas Pahl, CSO der Heidelberg Pharma AG, kommentierte: "Wir sind hocherfreut, dass unser Forschungspartner MD Anderson Cancer Center präklinische Daten zu unserem Produktkandidaten HDP-101 in einem Vortrag präsentieren wird. Die Wissenschaftler des MD Anderson konnten jetzt nachweisen, dass das Amanitin-Konjugat HDP-101 Tumorzellen aus Patienten mit Multiplem Myelom mit 17p-Deletion besonders gut und effizient bekämpfen kann. Wir sind auch stolz, dass unser Lizenzpartner Magenta Daten mit unserer ATAC-Technologie auf dieser wichtigen Konferenz vorstellen wird."
Vortrag von MD Anderson: HDP-101, a Novel B-Cell Maturation Antigen (BCMA)-Targeted Antibody Conjugated to α-Amanitin, Is Active Against Myeloma with Preferential Efficacy Against Pre-Clinical Models of Deletion 17p
Abstract #593
Name der Session: 652. Myeloma: Pathophysiology and Pre-Clinical Studies, excluding Therapy: Development of Novel Immunotherapeutic Approaches in Multiple Myeloma
Vortragender: Dr. Ram Kumar Singh, Department of Lymphoma/Myeloma, MD Anderson Cancer Center
Datum: Montag, 3. Dezember 2018
Zeit: 7:00 Uhr - 8:30 Uhr PST (16:00 Uhr - 17:30 CET)
Präsentationszeit: 8:00 Uhr PST (17:00 Uhr CET)
Raum: San Diego Convention Center, Ballroom 20D
Frühere in Nature publizierte Studien mit Darmkrebszellen zeigten, dass Amanitin das Potenzial hat, besonders gut auf Tumoren mit aggressiven Verlaufsformen im Zusammenhang mit einer 17p-Deletion zu wirken. Mit "17p" bezeichnet man einen Abschnitt des Chromosoms, dessen DNA u. a. das Tumorsuppressorgen TP53, als auch das Gen für RNA-Polymerase II enthält. Tumore haben häufig eine verminderte TP53-Funktion, um die natürliche Tumorabwehr der Zellen zu schwächen. Da durch die 17p-Deletion auch die Menge an RNA-Polymerase II vermindert wird, sind solche Tumorzellen besonders empfindlich gegen Amanitin.
Posterpräsentationen von Magenta
Magenta Therapeutics wird präklinische Daten vorstellen, die in verschiedenen Studien zur Verbesserung der Therapiemöglichkeiten im Bereich der Knochenmarktransplantation gewonnen wurden. Die getesteten ADCs bestehen aus einem Antikörper von Magenta und der ATAC-Technologie von Heidelberg Pharma und wurden präklinisch auf ihre Eignung zur Konditionierung von Patienten für die Transplantation von Knochenmarkszellen getestet.
CD117-Amanitin Antibody Drug Conjugates Effectively Deplete Human and Non-Human Primate HSCs: Proof of Concept as a Targeted Strategy for Conditioning Patients for Bone Marrow Transplant
Abstract #3314
Name der Session: 701. Experimental Transplantation: Basic Biology, Pre-Clinical Models: Poster II
Vortragender: Dr. Brad Pearse, Magenta Therapeutics
Datum: Sonntag, 2. Dezember 2018
Zeit: 18:00 Uhr - 20:00 Uhr PST (3:00 Uhr - 5:00 Uhr CET, 3. Dezember 2018)
Raum: San Diego Convention Center, Hall GH
Single Doses of Antibody Drug Conjugates (ADCs) Targeted to CD117 or CD45 Have Potent In Vivo Anti-Leukemia Activity and Survival Benefit in Patient Derived AML Models
Abstract #3316
Name der Session: 701. Experimental Transplantation: Basic Biology, Pre-Clinical Models: Poster II
Vortragende: Jennifer Proctor, Magenta Therapeutics
Datum: Sonntag, 2. Dezember 2018
Zeit: 18:00 Uhr - 20:00 Uhr PST (3:00 Uhr - 5:00 Uhr CET, 3. Dezember 2018)
Raum: San Diego Convention Center, Hall GH
Targeting CD45 with an Amanitin Antibody-Drug Conjugate Effectively Depletes Human HSCs and Immune Cells for Transplant Conditioning
Abstract #4526
Name der Session: 701. Experimental Transplantation: Basic Biology, Pre-Clinical Models: Poster III
Vortragender: Dr. Rahul Palchaudhuri, Magenta Therapeutics
Datum: Montag, 3. Dezember 2018
Zeit: 18:00 Uhr - 20:00 Uhr PST (3:00 Uhr - 5:00 Uhr CET, 3. Dezember 2018)
Raum: San Diego Convention Center, Hall GH
Endlich mal die passende Reaktion (auf die News). Wenn ich mir im Vergleich Dt. Biotechs (Morphosys, Evotec z.B.) anschaue, ist hier einiges an Aufholpotential vorhanden...
Hier haben wir noch ganz viel Zeit bei ganz viel Phantasie. Neben 4SC ist HP eines der aussichtsreichsten Bio-Buden, beide jeweils mit einem Ankeraktionär
Antwort auf Beitrag Nr.: 59.119.865 von BICYPAPA am 02.11.18 07:16:01
Hier dürfte in Zukunft ein reger Newsflow zu erwarten sein. Die Neuigkeiten bitte dem aktuellen link der Webseite entnehmen, da ich nicht direkt verlinken kann.
http://www.telixpharma.com/investors/asx-announcements/
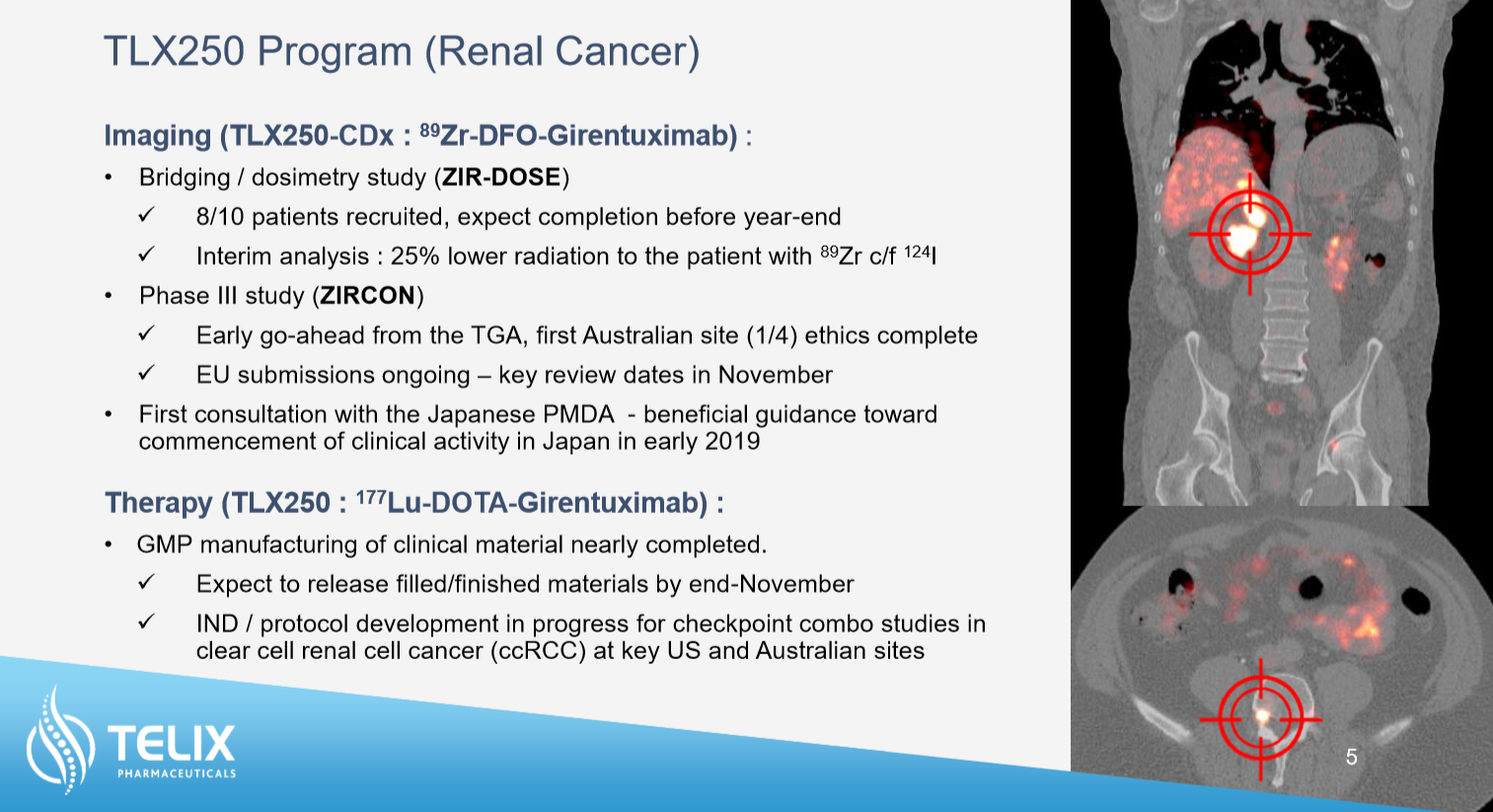 " target="_blank" rel="nofollow ugc noopener">Telix hat seinen Quartalsbericht veröffentlicht. Hier kurz das Update zu Redectane-TLX250
" target="_blank" rel="nofollow ugc noopener">Telix hat seinen Quartalsbericht veröffentlicht. Hier kurz das Update zu Redectane-TLX250
Hier dürfte in Zukunft ein reger Newsflow zu erwarten sein. Die Neuigkeiten bitte dem aktuellen link der Webseite entnehmen, da ich nicht direkt verlinken kann.
http://www.telixpharma.com/investors/asx-announcements/

Update Redectane-TLX250
Telix hat seinen Quartalsbericht veröffentlicht. Hier kurz das Update zu Redectane-TLX250Hier dürfte in Zukunft ein reger Newsflow zu erwarten sein. Die Neuigkeiten bitte dem aktuellen link der Webseite entnehmen, da ich nicht direkt verlinken kann.
http://www.telixpharma.com/investors/asx-announcements/
 " target="_blank" rel="nofollow ugc noopener">Telix hat seinen Quartalsbericht veröffentlicht. Hier kurz das Update zu Redectane-TLX250
" target="_blank" rel="nofollow ugc noopener">Telix hat seinen Quartalsbericht veröffentlicht. Hier kurz das Update zu Redectane-TLX250Hier dürfte in Zukunft ein reger Newsflow zu erwarten sein. Die Neuigkeiten bitte dem aktuellen link der Webseite entnehmen, da ich nicht direkt verlinken kann.
http://www.telixpharma.com/investors/asx-announcements/

Antwort auf Beitrag Nr.: 59.164.206 von BICYPAPA am 08.11.18 07:32:41
Continued to Strengthen Robust Intellectual Property Position: Magenta’s first U.S. patent, directed to dosage regimens of mobilization therapy MGTA-145 and plerixafor, was issued in August 2018. The Company’s second U.S. patent was issued for the C200 conditioning program in October 2018, with claims directed to methods of treatment using an anti-CD117-amatoxin antibody-drug conjugate (ADC). For the C100 targeted patient preparation program, an Australian patent application was allowed with claims directed to methods of treatment using an anti-CD45-amatoxin ADC.
Magenta Quartalsbericht
Demnach hat Magenta nun schon zwei Patente für den C100 und C200 Kandidaten bekommen. Ich kann mir gut vorstellen, das es mit der zweiten Optionsbestätigung nicht mehr so lange dauert. Vielleicht zur Präsentation in San Diego. Es ist reine Spekulation. Mal sehen.Continued to Strengthen Robust Intellectual Property Position: Magenta’s first U.S. patent, directed to dosage regimens of mobilization therapy MGTA-145 and plerixafor, was issued in August 2018. The Company’s second U.S. patent was issued for the C200 conditioning program in October 2018, with claims directed to methods of treatment using an anti-CD117-amatoxin antibody-drug conjugate (ADC). For the C100 targeted patient preparation program, an Australian patent application was allowed with claims directed to methods of treatment using an anti-CD45-amatoxin ADC.
Antwort auf Beitrag Nr.: 59.169.102 von BICYPAPA am 08.11.18 15:04:51
3314 CD117-Amanitin Antibody Drug Conjugates Effectively Deplete Human and Non-Human Primate HSCs: Proof of Concept As a Targeted Strategy for Conditioning Patients for Bone Marrow Transplant
https://ash.confex.com/ash/2018/webprogram/Paper114881.html
3316 Single Doses of Antibody Drug Conjugates (ADCs) Targeted to CD117 or CD45 Have Potent In Vivo Anti-Leukemia Activity and Survival Benefit in Patient Derived AML Models
https://ash.confex.com/ash/2018/webprogram/Paper112726.html
4526 Targeting CD45 with an Amanitin Antibody-Drug Conjugate Effectively Depletes Human HSCs and Immune Cells for Transplant Conditioning
https://ash.confex.com/ash/2018/webprogram/Paper117167.html
MD Anderson:
593 HDP101, a Novel B-Cell Maturation Antigen (BCMA)-Targeted Antibody Conjugated to α-Amanitin, Is Active Against Myeloma with Preferential Efficacy Against Pre-Clinical Models of Deletion 17p
https://ash.confex.com/ash/2018/webprogram/Paper118412.html
Abstracte zur ASH Konferenz in San Diego
Magenta Therapeutics:3314 CD117-Amanitin Antibody Drug Conjugates Effectively Deplete Human and Non-Human Primate HSCs: Proof of Concept As a Targeted Strategy for Conditioning Patients for Bone Marrow Transplant
https://ash.confex.com/ash/2018/webprogram/Paper114881.html
3316 Single Doses of Antibody Drug Conjugates (ADCs) Targeted to CD117 or CD45 Have Potent In Vivo Anti-Leukemia Activity and Survival Benefit in Patient Derived AML Models
https://ash.confex.com/ash/2018/webprogram/Paper112726.html
4526 Targeting CD45 with an Amanitin Antibody-Drug Conjugate Effectively Depletes Human HSCs and Immune Cells for Transplant Conditioning
https://ash.confex.com/ash/2018/webprogram/Paper117167.html
MD Anderson:
593 HDP101, a Novel B-Cell Maturation Antigen (BCMA)-Targeted Antibody Conjugated to α-Amanitin, Is Active Against Myeloma with Preferential Efficacy Against Pre-Clinical Models of Deletion 17p
https://ash.confex.com/ash/2018/webprogram/Paper118412.html
Advanced Proteome Therapeutics Reports Positive Results and Advances Collaboration with Heidelberg Pharma
VANCOUVER, British Columbia , Nov. 14, 2018 (GLOBE NEWSWIRE) -- Advanced Proteome Therapeutics Corporation (“APC” or the “Company”) (TSXV: APC) (FSE: 0E8), is pleased to announce very positive results from animal studies in collaboration with Heidelberg Pharma.
Antibody–drug conjugates (ADCs) are an emerging class of therapeutic agents with the potential to revolutionize current treatment strategies and regimens to fight cancer. The combination of APC's proprietary site-selective protein modification technology and Heidelberg Pharma's proprietary ATAC technology, featuring the mushroom toxin amanitin, has led to conjugates that possess high target-specific anti-cancer potency established in several human cancer cell types.
The Company is pleased to announce that the lead ADC has now impressively demonstrated complete tumor regression at a single low dose in two challenging mouse models of human cancer (JIMT-1, NCI-N87) over extended observation periods with clear superiority over benchmark molecules used as positive controls. The potency and efficacy exhibited by the ADC is profound and the studies are still ongoing, as the improved condition of the test animals permitted a longer-term evaluation than originally contemplated.
Dr. Allen Krantz, CSO and Founder of APC commented “These exciting results have exceeded our high expectations. APC’s ability to rapidly generate superior antibody-drug conjugates without having to perform labor-intensive engineering of the antibody to enable the point of selective attachment of the drug, represents a game changing advantage for our Company in the field of ADCs. Our site selective approach of linking drugs to a favored and universally present site in therapeutically-important antibodies is a powerful and efficient way of producing homogeneous cancer killing ADCs with excellent biophysical properties. The validation of our technology now opens the door to advanced state-of-the-art therapeutic approaches, which are in progress, and for which we have recently filed key patents.”
APC and Heidelberg Pharma have agreed to extend their collaboration in two important ways. Heidelberg Pharma are in the process of negotiating terms for APC’s linker technology to be included in the amanitin tool box available to pharma partners developing new ADCs. Also, Heidelberg Pharma and APC will continue to identify and test ADC drug candidates that best exploit the combined strengths of both our technologies.
Dr. Andreas Pahl, CSO of Heidelberg Pharma, said “APC’s linker technology, which does not require any modification of the natural framework of an antibody prior to its conversion into a drug, can significantly streamline development of a new generation of ADCs from existing, well proven antibodies.”
Bill Dickie, President and CEO of APC added “We are pleased to extend our collaboration with Heidelberg Pharma’s innovative technology and outstanding team, as we work together to advance the field of ADCs and build value for our companies.”
VANCOUVER, British Columbia , Nov. 14, 2018 (GLOBE NEWSWIRE) -- Advanced Proteome Therapeutics Corporation (“APC” or the “Company”) (TSXV: APC) (FSE: 0E8), is pleased to announce very positive results from animal studies in collaboration with Heidelberg Pharma.
Antibody–drug conjugates (ADCs) are an emerging class of therapeutic agents with the potential to revolutionize current treatment strategies and regimens to fight cancer. The combination of APC's proprietary site-selective protein modification technology and Heidelberg Pharma's proprietary ATAC technology, featuring the mushroom toxin amanitin, has led to conjugates that possess high target-specific anti-cancer potency established in several human cancer cell types.
The Company is pleased to announce that the lead ADC has now impressively demonstrated complete tumor regression at a single low dose in two challenging mouse models of human cancer (JIMT-1, NCI-N87) over extended observation periods with clear superiority over benchmark molecules used as positive controls. The potency and efficacy exhibited by the ADC is profound and the studies are still ongoing, as the improved condition of the test animals permitted a longer-term evaluation than originally contemplated.
Dr. Allen Krantz, CSO and Founder of APC commented “These exciting results have exceeded our high expectations. APC’s ability to rapidly generate superior antibody-drug conjugates without having to perform labor-intensive engineering of the antibody to enable the point of selective attachment of the drug, represents a game changing advantage for our Company in the field of ADCs. Our site selective approach of linking drugs to a favored and universally present site in therapeutically-important antibodies is a powerful and efficient way of producing homogeneous cancer killing ADCs with excellent biophysical properties. The validation of our technology now opens the door to advanced state-of-the-art therapeutic approaches, which are in progress, and for which we have recently filed key patents.”
APC and Heidelberg Pharma have agreed to extend their collaboration in two important ways. Heidelberg Pharma are in the process of negotiating terms for APC’s linker technology to be included in the amanitin tool box available to pharma partners developing new ADCs. Also, Heidelberg Pharma and APC will continue to identify and test ADC drug candidates that best exploit the combined strengths of both our technologies.
Dr. Andreas Pahl, CSO of Heidelberg Pharma, said “APC’s linker technology, which does not require any modification of the natural framework of an antibody prior to its conversion into a drug, can significantly streamline development of a new generation of ADCs from existing, well proven antibodies.”
Bill Dickie, President and CEO of APC added “We are pleased to extend our collaboration with Heidelberg Pharma’s innovative technology and outstanding team, as we work together to advance the field of ADCs and build value for our companies.”
Danke für’s Reinstellen der Meldung 👍
Kurs heute 2,63 Euro. Man hat heute auch wieder schön gesehen, wenige Stück stehen im Verkauf. Wenn dann mal eine etwas größere Order reinkommt, gehts gut nach oben. 👌
Kurs dieses Jahr noch 3 Euro!? Falls die Märkte nicht (nochmals) einbrechen...
Kurs heute 2,63 Euro. Man hat heute auch wieder schön gesehen, wenige Stück stehen im Verkauf. Wenn dann mal eine etwas größere Order reinkommt, gehts gut nach oben. 👌
Kurs dieses Jahr noch 3 Euro!? Falls die Märkte nicht (nochmals) einbrechen...
Ist einer meiner Jahres-Favoriten im thread von 'Kleiner Chef'
Antwort auf Beitrag Nr.: 59.176.188 von BICYPAPA am 09.11.18 10:10:47
Demnach wäre dies dann der vierte Kandidat mit dem internen Namen G100 aus der Magenta Pipeline, der auf den CD 137 Rezeptor adressiert ist.
Der dritte Kandidat ist dann einer der zur Vorbereitungsgruppe der Transplantationen gehört aber dessen Adresse zur Behandlung noch nicht veröffentlicht ist. Doch aus dem australischen Patent ist bekannt, dass hier fünf verschiedene Ziele angegeben sind.
Somit hätten wir dann alle vier Kandidaten aus der Optionsliste identifiziert.
Magenta Therapeutics 4. Kandidat
Magenta Therapeutics hat jetzt ein Patent angemeldet, bei dem der CD 137 adressiert wird und dies mit einem Amanitin Wirkstoff. Nach meinem laienhaften Verständnis handelt es sich hier aber um ein Patent, das die Komplikationen nach den Transplantationen behandelt.Demnach wäre dies dann der vierte Kandidat mit dem internen Namen G100 aus der Magenta Pipeline, der auf den CD 137 Rezeptor adressiert ist.
Der dritte Kandidat ist dann einer der zur Vorbereitungsgruppe der Transplantationen gehört aber dessen Adresse zur Behandlung noch nicht veröffentlicht ist. Doch aus dem australischen Patent ist bekannt, dass hier fünf verschiedene Ziele angegeben sind.
Somit hätten wir dann alle vier Kandidaten aus der Optionsliste identifiziert.
Antwort auf Beitrag Nr.: 59.245.675 von BICYPAPA am 19.11.18 08:13:57Besten Dank. Jetzt ist nur noch die Frage wann HDP das veröffentlicht. Das könnte dem Kurs ziemlichen Auftrieb geben.
Antwort auf Beitrag Nr.: 59.247.742 von Mogli3 am 19.11.18 12:15:12
Ich denke mal
Ich denke mal, dass Magenta Therapeutics hierzu die Meldehoheit hat. Manchmal dürfen die Partner laut Vertrag gar nicht melden. Es war auch purer Zufall bei meiner Recherche, das ich diese Patenterteilung an Magenta entdeckt habe.
Antwort auf Beitrag Nr.: 59.248.093 von BICYPAPA am 19.11.18 12:46:31Ja Magenta hat die Hoheit bei inhaltlichen Fragen. Aber der entgültige Bezug der andern 3 Moleküle bedingt ja einer vertraglichen Lösung die Meilensteinzahlungen auslöst. Das müsste ja dann HDP melden- wie beim ersten Molekül auch. Oder nicht?
Antwort auf Beitrag Nr.: 59.248.156 von Mogli3 am 19.11.18 12:53:27
Ich kenn die
Ich kenn die Vereinbarungen zwischen HP und Magenta leider nicht. Vielleicht wartet man auch einfach eine besondere Gelegenheit für die Meldung ab. Ich kann es nicht sagen.
https://www.edisoninvestmentresearch.com/?ACT=18&ID=22675&LA…
Das Deutsches Eigenkapitalforum findet am 26-28 Nov. in Frankfurt statt.
Edison ist da Sponsor und hat gestern ein Update zu HDP geschrieben.
Nichts Weltbewegendes für uns …
https://www.eigenkapitalforum.com/#/de/
Das Deutsches Eigenkapitalforum findet am 26-28 Nov. in Frankfurt statt.
Edison ist da Sponsor und hat gestern ein Update zu HDP geschrieben.
Nichts Weltbewegendes für uns …
https://www.eigenkapitalforum.com/#/de/
Antwort auf Beitrag Nr.: 59.258.728 von Lidenbrock am 20.11.18 14:49:08
"Analyse" von Edison
Danke für die Bewertung und Einschätzung von Edisoninvestment. Es ist immer schwer so Frühphasenfirmen irgendwie bei der Bewertung gerecht zu werden. Doch dieses Kursziel scheint mir doch irgendwie gewürfelt. Außerdem sind die Zahlen falsch. Die Option pro Wirkstoff von Takeda ist etwa 110 Millionen wert und nicht 83,5 Millionen. Das sind die Zahlen von Magenta. Auf Grundlage solch einer schlechten Analyse sollte man keine Kursziele vergeben. Sie sind eigentlich für eine gute Analysearbeit bekannt. Doch bei Heidelberg werden Zahlen vertauscht. Aufgrund dieser falschen Zahlen wird ein Kursziel vergeben. Das hätte man sich besser sparen können. Schlampige Arbeit ohne jeglichen Wert, da die Zukunftsperspektive sich keineswegs im Kursziel widerspiegelt.
3-Euro-Marke in greifbarer Nähe 🙌
Seit dem Tief knapp 50% kann sich sehen lassen...
Alles andere wie ‘ne Neubewertung nach den News der letzten Monate ist hier längst fällig 😏
Seit dem Tief knapp 50% kann sich sehen lassen...
Alles andere wie ‘ne Neubewertung nach den News der letzten Monate ist hier längst fällig 😏
Antwort auf Beitrag Nr.: 59.258.797 von BICYPAPA am 20.11.18 14:55:45
Folgendes Abstract gibt diesen Hinweis, der kürzlich veröffentlicht. So kommt nach Redectane, die jetzt in Phase 3 in Europa starten vielleicht auch noch Rencarex vielleicht wieder ins Gespräch.
Is there a role for adjuvant therapy after surgery in "high risk for recurrence" kidney cancer? An update on current concepts.
Sharma T1, Tajzler C1, Kapoor A1.
Author information
Abstract
Background:
Although surgical resection remains the standard of care for localized kidney cancers, a significant proportion of patients experience systemic recurrence after surgery and hence might benefit from effective adjuvant therapy. So far, several treatment options have been evaluated in adjuvant clinical trials, but only a few have provided promising results. Nevertheless, with the recent development of targeted therapy and immunomodulatory therapy, a series of clinical trials are in progress to evaluate the potential of those novel agents in the adjuvant setting. In this paper, we provide a narrative review of the progress in this field, and we summarize the results from recent adjuvant trials that have been completed.
Methods:
A literature search was conducted. The primary search strategy at the medline, Cochrane reviews, and http://ClinicalTrials.gov/databases included the keywords "adjuvant therapy," "renal cell carcinoma," and "targeted therapy or/and immunotherapy."
Conclusions:
Data from the s-trac study indicated that, in the "highest risk for recurrence" patient population, disease-free survival was increased with the use of adjuvant sunitinib compared with placebo. The assure trial showed no benefit for adjuvant sunitinib or sorafenib in the "intermediate- to high-risk" patient population. The ariser (adjuvant girentuximab) and protect (adjuvant pazopanib) trials indicated no survival benefit, but subgroup analyses in both trials recommended further investigation. The inconsistency in some of the current results can be attributed to a variety of factors pertaining to the lack of standardization across the trials. Nevertheless, patients in the "high risk of recurrence" category after surgery for their disease would benefit from a discussion about the potential benefits of adjuvant treatment and enrolment in ongoing adjuvant trials.
Jetzt kommt wieder Rencarex ins Gespräch
War damals für Wilex und alle Aktionäre ein schmerzhaftes Erlebnis. So wird Rencarex wieder in der Anwendung in Subgruppen diskutiert. Rencarex befindet sich noch im Portfolio von HP und steht zur Auslizensierung bereit. Folgendes Abstract gibt diesen Hinweis, der kürzlich veröffentlicht. So kommt nach Redectane, die jetzt in Phase 3 in Europa starten vielleicht auch noch Rencarex vielleicht wieder ins Gespräch.
Is there a role for adjuvant therapy after surgery in "high risk for recurrence" kidney cancer? An update on current concepts.
Sharma T1, Tajzler C1, Kapoor A1.
Author information
Abstract
Background:
Although surgical resection remains the standard of care for localized kidney cancers, a significant proportion of patients experience systemic recurrence after surgery and hence might benefit from effective adjuvant therapy. So far, several treatment options have been evaluated in adjuvant clinical trials, but only a few have provided promising results. Nevertheless, with the recent development of targeted therapy and immunomodulatory therapy, a series of clinical trials are in progress to evaluate the potential of those novel agents in the adjuvant setting. In this paper, we provide a narrative review of the progress in this field, and we summarize the results from recent adjuvant trials that have been completed.
Methods:
A literature search was conducted. The primary search strategy at the medline, Cochrane reviews, and http://ClinicalTrials.gov/databases included the keywords "adjuvant therapy," "renal cell carcinoma," and "targeted therapy or/and immunotherapy."
Conclusions:
Data from the s-trac study indicated that, in the "highest risk for recurrence" patient population, disease-free survival was increased with the use of adjuvant sunitinib compared with placebo. The assure trial showed no benefit for adjuvant sunitinib or sorafenib in the "intermediate- to high-risk" patient population. The ariser (adjuvant girentuximab) and protect (adjuvant pazopanib) trials indicated no survival benefit, but subgroup analyses in both trials recommended further investigation. The inconsistency in some of the current results can be attributed to a variety of factors pertaining to the lack of standardization across the trials. Nevertheless, patients in the "high risk of recurrence" category after surgery for their disease would benefit from a discussion about the potential benefits of adjuvant treatment and enrolment in ongoing adjuvant trials.
Antwort auf Beitrag Nr.: 59.293.191 von BICYPAPA am 25.11.18 12:30:23
Abgehoben wird explizit auf die Vorteile von Amanitin als Wirkstoff.
Wichtig neben der guten Wirksamkeit sei, dass es nicht mutagen wirke.
In Kombination mit der ATAC-Technoligie, bei der der Wirkstoff durch Antikörper sozusagen in´s Ziel gebracht wird, sei dieser Ansatz sehr vielversprechend.
Sehr positiv sei die gute Wirksamkeit auch unabhängig von der Zellteilungsrate.
In einem Interview mit Dr. Schmidt-Brand wird erwähnt, dass im 2. Quartal 2019 der Antrag für den Start einer klinischen Studie gestellt werde, sodass in der 2. Jahreshälfte mit ersten Patienten gerechnet werden kann.
Im Dezember wird die letzte präklinische Studie zur Toxizität gestartet, welche voraussichtlich nach 3 Monaten abgeschlossen werden kann.
Sie dient zur Ermittlung der geeigneten Dosis, für die klinische Prüfung beim Menschen.
Eingegangen wird auch auf die Partnerschaft mit Magenta Pharmaceuticals, welche sehr positiv verläuft.
Ziel von Magenta ist es, die Therapie bei Leukämie drastisch zu verändern.
Man will weg von der üblichen Behandlung, bei der vor einer Knochenmarkstransplantation das komplette Knochenmark des Patienten zerstört werden muss, hin zu einer selektiveren Therapieform.
Durch die Nutzung der ADC´s erhofft man sich die Möglichkeit einer gezielteren Therapie, bei der nur die erkrankten Zellen zerstört werden.
Auch hier könnte Amanitin einen deutlichen Vorteil bieten.
Anfang Dezember (1.-4. Dez.) wird Magenta drei Poster zu Amanitin-Daten beim Jahresmeeting der ASH (Am. Society of Hematology) in San Diego präsentieren.
Fazit:
Der Aktionär sieht das Interesse von neuen Investoren, sobald Heidelberg Pharma mit HDP-101 in die klinische Prüfung geht.
Das langfristige Potential sei enorm.
Aktuelles Kursziel 4,50€, empfohlener Stopp 1,70€
Aktionär Empfehlung
Der Aktionär schreibt in einem recht ausführlichen Artikel zu HDP sehr positiv.Abgehoben wird explizit auf die Vorteile von Amanitin als Wirkstoff.
Wichtig neben der guten Wirksamkeit sei, dass es nicht mutagen wirke.
In Kombination mit der ATAC-Technoligie, bei der der Wirkstoff durch Antikörper sozusagen in´s Ziel gebracht wird, sei dieser Ansatz sehr vielversprechend.
Sehr positiv sei die gute Wirksamkeit auch unabhängig von der Zellteilungsrate.
In einem Interview mit Dr. Schmidt-Brand wird erwähnt, dass im 2. Quartal 2019 der Antrag für den Start einer klinischen Studie gestellt werde, sodass in der 2. Jahreshälfte mit ersten Patienten gerechnet werden kann.
Im Dezember wird die letzte präklinische Studie zur Toxizität gestartet, welche voraussichtlich nach 3 Monaten abgeschlossen werden kann.
Sie dient zur Ermittlung der geeigneten Dosis, für die klinische Prüfung beim Menschen.
Eingegangen wird auch auf die Partnerschaft mit Magenta Pharmaceuticals, welche sehr positiv verläuft.
Ziel von Magenta ist es, die Therapie bei Leukämie drastisch zu verändern.
Man will weg von der üblichen Behandlung, bei der vor einer Knochenmarkstransplantation das komplette Knochenmark des Patienten zerstört werden muss, hin zu einer selektiveren Therapieform.
Durch die Nutzung der ADC´s erhofft man sich die Möglichkeit einer gezielteren Therapie, bei der nur die erkrankten Zellen zerstört werden.
Auch hier könnte Amanitin einen deutlichen Vorteil bieten.
Anfang Dezember (1.-4. Dez.) wird Magenta drei Poster zu Amanitin-Daten beim Jahresmeeting der ASH (Am. Society of Hematology) in San Diego präsentieren.
Fazit:
Der Aktionär sieht das Interesse von neuen Investoren, sobald Heidelberg Pharma mit HDP-101 in die klinische Prüfung geht.
Das langfristige Potential sei enorm.
Aktuelles Kursziel 4,50€, empfohlener Stopp 1,70€
Antwort auf Beitrag Nr.: 59.293.254 von BICYPAPA am 25.11.18 12:39:14Hot Stock der Woche auf 3 Seiten, wahrscheinlich der Grund für den Kursanstieg Ende Woche. Hört sich alles super an. Als Fazit am Schluss des Artikels wird auch von einem zusätzlichen Vertragspartner geschrieben der demnächst kommen könnte. Warte zunächst mal auf eine Meldung wegen den zusätzlichen Molekülen Magenta. Mit Kursen unter 3 wird bald einmal Schluss sein.
Unternehmenspräsentation von HP auf dem DEF in FFM
Heute um 14:00 Uhr ist der Vorstand von Heidelberg Pharma mit einem Vortrag auf dem Dt. Eigenkapitalforum in FFM vertreten und stellt wohl auch den aktuellsten Stand ihrer Ergebnisse und weiteren Massnahmen / Ausblick vor. Ich gehe davon aus, das anschliessend auch die neue vorgestellte Unternehmenspräsentation auf der HP Webseite veröffentlicht wird. Wenn aber jemand vor Ort ist, wäre es super, wenn er/sie hier seine Eindrücke und wesentliche News schildern würde.
https://www.eigenkapitalforum.com/#/de/
Sehe das mit dem Schmierblatt des Aktio... immer nicht so gerne, aber bisschen Werbung kann ja nicht/nie schaden. 😉
Bin gespannt auf die weitere News in der nächsten Zeit. Wie gesagt, für mich neben Evotec, Biofrontera, Formycon & Paion langfristig (Haltedauer 5-10 Jahre) die Favoriten im dt. Biotech-Bereich. Mit Abstrichen evtl. noch Epi, abhängin von der CMS-Entscheidung demnächst. So, jetzt aber genug Off-Topic 😉
Bin gespannt auf die weitere News in der nächsten Zeit. Wie gesagt, für mich neben Evotec, Biofrontera, Formycon & Paion langfristig (Haltedauer 5-10 Jahre) die Favoriten im dt. Biotech-Bereich. Mit Abstrichen evtl. noch Epi, abhängin von der CMS-Entscheidung demnächst. So, jetzt aber genug Off-Topic 😉
Präsentation Magenta
Magenta Therapeutics to Host Webcast of Investor and Analyst Event During ASHNovember 26, 2018 at 8:30 AM EST
CAMBRIDGE, Mass.--(BUSINESS WIRE)--Nov. 26, 2018-- Magenta Therapeutics (NASDAQ: MGTA), a clinical-stage biotechnology company developing novel medicines to bring the curative power of bone marrow transplant to more patients, today announced that it will host a live webcast of an investor and analyst event at 8:30 p.m. PST (11:30 p.m. EST) on Sunday, December 2, 2018, during the American Society of Hematology (ASH) Annual Meeting.
To access the webcast, please visit the “Events & Presentations” page within the Investors & Media section of the Magenta Therapeutics website at https://investor.magentatx.com/events-and-presentations. Replays of the webcast will be available on the Magenta Therapeutics website for 90 days following the event.
Antwort auf Beitrag Nr.: 59.315.252 von Lidenbrock am 28.11.18 10:58:10
Telix News zu Indikationserweiterung
Melbourne (Australia), Kyoto and Tokyo (Japan) – 29th November 2018. Telix Pharmaceuticals Limited (ASX.TLX) (“Telix”, the “Company”), a clinical-stage biopharmaceutical company focused on the development of diagnostic and therapeutic products based on targeted radiopharmaceuticals or “molecularly-targeted radiation” (MTR), and Nihon Medi-Physics Co., Ltd. (“NMP”), a leading manufacturer and supplier of radiopharmaceuticals and related products in Japan, have today announced that they have signed a collaboration agreement to jointly evaluate the feasibility of 225Ac-labeled (actinium) antibodies for the treatment of clear-cell renal cell cancer (ccRCC). In order to materialize “Theranostics (a concept of integrating therapeutics and diagnostics), NMP is actively developing alpha-emitting radionuclide (such as 225Ac)-based therapeutic pipeline, following the decision to build a new R&D site to produce radionuclides including 225Ac. In comparison to other types of radionuclides, alpha-emitters have relatively higher energy to damage cancer cells and shorter energy deposit range to minimize damages to the peripheral normal cells. Therefore, 225Ac, an alpha-emitting nuclide, is expected to have significant clinical potential for the treatment of cancer via nuclear medicine techniques. The parties will collaborate to apply NMP’s novel linker chemistry to Telix’s anti-CAIX antibodies and jointly conduct proofof-concept studies. Telix Pharmaceuticals Japan President, Dr. Shintaro Nishimura stated, “Part of the attractiveness of this collaboration with NMP is that Telix’s 89Zr-girentuximab (TLX205) PET imaging tracer also targets CAIX, and can therefore select patients for therapy. Through this important collaboration with NMP, we hope make “theranostics” a reality in Japan.” NMP President, Mr. Hisashi Shimoda noted, “NMP views “theranostic” radiopharmaceuticals as a growth driver for our business. This collaboration with Telix, who is extensively developing products in the oncology field, is expected to impact positively on our business strategy. NMP has long-standing experience and skills in the manufacture and supply of radiopharmaceuticals, and Telix’s product portfolio, combined with our expertise, will together contribute greatly to moving closer toward the real “Theranostics.”
Antwort auf Beitrag Nr.: 59.322.041 von BICYPAPA am 28.11.18 23:44:15
Patients undergoing bone marrow transplant or stem cell gene therapy are first prepared, or conditioned, with non-specific, genotoxic chemotherapy alone or in combination with total body irradiation. This conditioning process is associated with significant toxicity, including development of cancers, infertility, organ toxicities, or even death. As a result, many patients do not consider undergoing a bone marrow transplant or gene therapy. Magenta is developing a portfolio of targeted antibody drug conjugates (ADCs), including non-genotoxic agents, that selectively remove the specific cells to enable a successful transplant or gene therapy procedure.
“This year’s five ASH data presentations from our portfolio of targeted conditioning programs give further insight into our progress in addressing one of the major challenges of the transplant and gene therapy process: the genotoxic conditioning that leaves patients infertile and puts them at risk for malignancies and organ toxicity,” said Michael Cooke, Ph.D., chief scientific officer, Magenta Therapeutics. “Our most advanced targeted conditioning program, C200, is focused on ADCs directed at CD117, a target expressed on stem cells and many types of leukemia cells. Preclinical data at ASH this year show potent and selective depletion of human and non-human primate stem cells with our non-genotoxic CD117 ADC conjugated to amanitin. In addition, both this ADC and our CD45-targeted ADC from our C100 program demonstrated the additional benefit of anti-leukemia activity and survival advantage in patient-derived leukemia models. Based on these promising data, we are finalizing the CD117 and CD45 ADCs, and we expect to select a lead for development for the CD117 program to launch IND-enabling studies in 2019.”
Ergebnisse Magenta ASH Konferenz
Magenta Therapeutics (NASDAQ:MGTA), a clinical-stage biotechnology company developing novel medicines to bring the curative power of bone marrow transplant to more patients, today announced that the Company presented preclinical research on its targeted conditioning programs at the 60th annual meeting of the American Society of Hematology (ASH). Patients undergoing bone marrow transplant or stem cell gene therapy are first prepared, or conditioned, with non-specific, genotoxic chemotherapy alone or in combination with total body irradiation. This conditioning process is associated with significant toxicity, including development of cancers, infertility, organ toxicities, or even death. As a result, many patients do not consider undergoing a bone marrow transplant or gene therapy. Magenta is developing a portfolio of targeted antibody drug conjugates (ADCs), including non-genotoxic agents, that selectively remove the specific cells to enable a successful transplant or gene therapy procedure.
“This year’s five ASH data presentations from our portfolio of targeted conditioning programs give further insight into our progress in addressing one of the major challenges of the transplant and gene therapy process: the genotoxic conditioning that leaves patients infertile and puts them at risk for malignancies and organ toxicity,” said Michael Cooke, Ph.D., chief scientific officer, Magenta Therapeutics. “Our most advanced targeted conditioning program, C200, is focused on ADCs directed at CD117, a target expressed on stem cells and many types of leukemia cells. Preclinical data at ASH this year show potent and selective depletion of human and non-human primate stem cells with our non-genotoxic CD117 ADC conjugated to amanitin. In addition, both this ADC and our CD45-targeted ADC from our C100 program demonstrated the additional benefit of anti-leukemia activity and survival advantage in patient-derived leukemia models. Based on these promising data, we are finalizing the CD117 and CD45 ADCs, and we expect to select a lead for development for the CD117 program to launch IND-enabling studies in 2019.”
Antwort auf Beitrag Nr.: 59.346.914 von BICYPAPA am 03.12.18 04:01:33
Key results, presented by Brad Pearse, Ph.D., Magenta Therapeutics:
An anti-CD117 ADC conjugated with amanitin potently depleted human and non-human primate hematopoietic stem cells and progenitors in vivo.
An anti-CD117 amanitin ADC with engineered fast half-life showed potent stem cell depletion and rapid clearance, providing appropriate pharmacokinetics for patient preparation for bone marrow transplant.
The ADCs were well tolerated at the efficacious doses.
Potent and selective depletion of stem cells with rapid clearance of the ADC could provide a significant improvement over current approaches to patient preparation with an acceptable safety profile prior to BMT for malignancies, autoimmune diseases and gene therapies, broadening patient access to these potentially curative therapies.
Magenta will next finalize the linker-toxin construct and select a lead for development in 2018, then begin IND-enabling studies in 2019.
CD117
CD117-Amanitin Antibody Drug Conjugates Effectively Deplete Human and Non-Human Primate HSCs: Proof of Concept as a Targeted Strategy for Conditioning Patients for Bone Marrow Transplant, Abstract #3314Key results, presented by Brad Pearse, Ph.D., Magenta Therapeutics:
An anti-CD117 ADC conjugated with amanitin potently depleted human and non-human primate hematopoietic stem cells and progenitors in vivo.
An anti-CD117 amanitin ADC with engineered fast half-life showed potent stem cell depletion and rapid clearance, providing appropriate pharmacokinetics for patient preparation for bone marrow transplant.
The ADCs were well tolerated at the efficacious doses.
Potent and selective depletion of stem cells with rapid clearance of the ADC could provide a significant improvement over current approaches to patient preparation with an acceptable safety profile prior to BMT for malignancies, autoimmune diseases and gene therapies, broadening patient access to these potentially curative therapies.
Magenta will next finalize the linker-toxin construct and select a lead for development in 2018, then begin IND-enabling studies in 2019.
Antwort auf Beitrag Nr.: 59.346.920 von BICYPAPA am 03.12.18 04:04:17
Key results, presented by Jennifer Proctor, Magenta Therapeutics:
CD117 is expressed on human hematopoietic stem and progenitor cells and on leukemia cells in 80% of patients with acute myeloid leukemia (AML) and in 65% of patients with myelodysplastic syndromes (MDS); CD45 is expressed on all lympho-hematopoietic cells and in nearly all blood cancers, other than multiple myeloma.
Both the anti-CD117 amanitin ADC (C200 program) and the anti-CD45 amanitin ADC (C100 program) showed potent killing of human hematopoietic stem cells and human leukemia cell lines expressing these targets in vitro.
A single dose of either ADC showed potent in vivo anti-leukemia activity in mice bearing established human leukemia cell lines.
Both ADCs also significantly improved the survival of mice engrafted with human leukemia cells from AML patients, including leukemias that were resistant to multiple lines of therapy including previous allogeneic bone marrow transplant.
Magenta Therapeutics’ C200 and C100 programs are designed with the dual intent of selectively eliminating the necessary cells to enable a successful transplant and reducing disease burden in patients with active disease or in patients who are at high risk of disease relapse.
Magenta will next finalize the linker-toxin constructs, select anti-CD117 and anti-CD45 leads for development and continue to progress ADC-based conditioning approaches targeting CD45 and CD117 toward clinical development.
CD45 und CD117
Single Doses of Antibody Drug Conjugates (ADCs) Targeted to CD117 or CD45 Have Potent In Vivo Anti-Leukemia Activity and Survival Benefit in Patient-Derived AML Models, Abstract #3316Key results, presented by Jennifer Proctor, Magenta Therapeutics:
CD117 is expressed on human hematopoietic stem and progenitor cells and on leukemia cells in 80% of patients with acute myeloid leukemia (AML) and in 65% of patients with myelodysplastic syndromes (MDS); CD45 is expressed on all lympho-hematopoietic cells and in nearly all blood cancers, other than multiple myeloma.
Both the anti-CD117 amanitin ADC (C200 program) and the anti-CD45 amanitin ADC (C100 program) showed potent killing of human hematopoietic stem cells and human leukemia cell lines expressing these targets in vitro.
A single dose of either ADC showed potent in vivo anti-leukemia activity in mice bearing established human leukemia cell lines.
Both ADCs also significantly improved the survival of mice engrafted with human leukemia cells from AML patients, including leukemias that were resistant to multiple lines of therapy including previous allogeneic bone marrow transplant.
Magenta Therapeutics’ C200 and C100 programs are designed with the dual intent of selectively eliminating the necessary cells to enable a successful transplant and reducing disease burden in patients with active disease or in patients who are at high risk of disease relapse.
Magenta will next finalize the linker-toxin constructs, select anti-CD117 and anti-CD45 leads for development and continue to progress ADC-based conditioning approaches targeting CD45 and CD117 toward clinical development.
Antwort auf Beitrag Nr.: 59.346.923 von BICYPAPA am 03.12.18 04:06:43
Key results, presented by Sharon Hyzy, M.S., Magenta Therapeutics:
ADCs targeted to mouse CD45 or mouse CD117 have been shown to effectively condition immunocompetent mice for autologous bone marrow transplant.
To investigate the utility of these murine-specific tool ADCs conjugated to saporin to enable allogenic transplant, Magenta assessed these ADCs as single agents or in combination with immunosuppressive agents to facilitate transplant in a murine allogeneic transplant model.
Both anti-CD45 and anti-CD117 saporin ADCs, when combined with additional immunosuppressants, enabled successful minor mismatch whole bone marrow transplants in mouse models.
Conditioning with the anti-CD45 saporin ADC plus post-transplant cyclophosphamide to prevent graft vs. host disease enabled successful engraftment across minor histocompatibility antigens.
The ADCs were more effective than an unconjugated anti-CD45 antibody, pre-transplant cyclophosphamide, or sublethal irradiation in combination with post-transplant cyclophosphamide.
Magenta will next investigate other linker-toxins as well as ADC-based conditioning in various allogeneic mouse models.
Weitere CD45 und CD117
Antibody Drug Conjugates Targeted to CD45 or CD117 Enable Allogeneic Hematopoietic Stem Cell Transplantation in Animal Models, Abstract #3324Key results, presented by Sharon Hyzy, M.S., Magenta Therapeutics:
ADCs targeted to mouse CD45 or mouse CD117 have been shown to effectively condition immunocompetent mice for autologous bone marrow transplant.
To investigate the utility of these murine-specific tool ADCs conjugated to saporin to enable allogenic transplant, Magenta assessed these ADCs as single agents or in combination with immunosuppressive agents to facilitate transplant in a murine allogeneic transplant model.
Both anti-CD45 and anti-CD117 saporin ADCs, when combined with additional immunosuppressants, enabled successful minor mismatch whole bone marrow transplants in mouse models.
Conditioning with the anti-CD45 saporin ADC plus post-transplant cyclophosphamide to prevent graft vs. host disease enabled successful engraftment across minor histocompatibility antigens.
The ADCs were more effective than an unconjugated anti-CD45 antibody, pre-transplant cyclophosphamide, or sublethal irradiation in combination with post-transplant cyclophosphamide.
Magenta will next investigate other linker-toxins as well as ADC-based conditioning in various allogeneic mouse models.
Antwort auf Beitrag Nr.: 59.346.926 von BICYPAPA am 03.12.18 04:09:20
Key results will be presented by Rahul Palchaudhuri, Ph.D., Magenta Therapeutics, on Monday, December 3, 2018.
A human/primate cross-reactive anti-CD45 amanitin ADC potently depletes human hematopoietic stem cells and immune cells in culture.
The anti-CD45 ADC achieved efficient depletion of immune cells in the periphery and hematopoietic stem cells in the bone marrow of humanized mice.
Simultaneous depletion of immune and hematopoietic stem cells using an anti-CD45 ADC may enable safer conditioning for allogeneic transplant and enable immune-reset in autoimmune disease transplantation.
Magenta plans to optimize the anti-CD45 ADC and select a development candidate in 2019, with IND-enabling studies to begin in 2020.
CD45 HP Magenta ASH Abstract
Targeting CD45 with an Amanitin Antibody-Drug Conjugate Effectively Depletes Human HSCs and Immune Cells for Transplant Conditioning, Abstract #4526Key results will be presented by Rahul Palchaudhuri, Ph.D., Magenta Therapeutics, on Monday, December 3, 2018.
A human/primate cross-reactive anti-CD45 amanitin ADC potently depletes human hematopoietic stem cells and immune cells in culture.
The anti-CD45 ADC achieved efficient depletion of immune cells in the periphery and hematopoietic stem cells in the bone marrow of humanized mice.
Simultaneous depletion of immune and hematopoietic stem cells using an anti-CD45 ADC may enable safer conditioning for allogeneic transplant and enable immune-reset in autoimmune disease transplantation.
Magenta plans to optimize the anti-CD45 ADC and select a development candidate in 2019, with IND-enabling studies to begin in 2020.
Antwort auf Beitrag Nr.: 59.346.950 von BICYPAPA am 03.12.18 04:58:19Liege ich richtig wenn ich sage dass Magenta damit zwei Moleküle von HDP definitiv lizenziert hat? Für 1 Molekül gab es ja schon eine PM, für das zweite Molekül müsste dann noch gemeldet werden.
Antwort auf Beitrag Nr.: 59.348.087 von Mogli3 am 03.12.18 09:29:10
Ich sehe es auch so
CD45 und CD117 von Magenta werden wohl bald nach Optimierung klinisch sein. HDP101 von HP nächstes Jahr wahrscheinlich auch. Redectane Bilddiagnostik in Phase3 und Redectane Therapie in drei Phase 2 Studien. Das ist das klinische Programm wahrscheinlich im nächsten Jahr von HP und deren Partner.
Sehr schön! 👌
Wie gesagt, eine Neubewertung wird über kurz oder lang hier kommen. 😏
Was ist euer Kursziel hier für 2019 und darüber hinaus? Ich prognostiziere 5 Euro für nächstes Jahr & 15 Euro innerhalb der nächsten 2-3 Jahre. 😋
Wie gesagt, eine Neubewertung wird über kurz oder lang hier kommen. 😏
Was ist euer Kursziel hier für 2019 und darüber hinaus? Ich prognostiziere 5 Euro für nächstes Jahr & 15 Euro innerhalb der nächsten 2-3 Jahre. 😋
Antwort auf Beitrag Nr.: 59.348.819 von Stoxtrayder am 03.12.18 10:49:36
Es wäre schön
Es wäre schön ein wenig zu erklären auf welcher Grundlage zu deinem Kursziel kommst. Es ist durchaus möglich. Nur durch welche Fakten ist dein Kursziel in etwa 3 Jahren begründet. Was sind die Hauptfaktoren für dich. Erst dann macht es ja auch Sinn alternative Kursziele zu benennen, die evtl auf eine andere Argumentation und Faktenlage sich berufen
Antwort auf Beitrag Nr.: 59.346.950 von BICYPAPA am 03.12.18 04:58:19
HDP101, a Novel B-Cell Maturation Antigen (BCMA)-Targeted Antibody Conjugated to α-Amanitin, Is Active Against Myeloma with Preferential Efficacy Against Pre-Clinical Models of Deletion 17p
Program: Oral and Poster Abstracts
Type: Oral
Session: 652. Myeloma: Pathophysiology and Pre-Clinical Studies, excluding Therapy: Development of Novel Immunotherapeutic Approaches in Multiple Myeloma
Hematology Disease Topics & Pathways:
antibodies, Diseases, Biological, multiple myeloma, apoptosis, bioengineering, Therapies, Animal models, Biological Processes, Technology and Procedures, Plasma Cell Disorders, Xenograft models, Study Population, Lymphoid Malignancies, Clinically relevant, gene editing, Myeloid Malignancies, flow cytometry, molecular testing, signal transduction
Monday, December 3, 2018: 8:00 AM
Ballroom 20D (San Diego Convention Center)
Ram Kumar Singh, PhD1,2*, Richard J. Jones, Ph.D.2*, Samuel Hong, Ph.D.2*, Fazal Shirazi, PhD2*, Hua Wang, Ph.D.2*, Isere Kuiatse, Ph.D.2*, Andreas Pahl3* and Robert Z. Orlowski, MD, PhD4,5
1Department of Lymphoma and Myeloma, The University of Texas MD Anderson Cancer Center, HOUSTON, TX
2Department of Lymphoma and Myeloma, The University of Texas MD Anderson Cancer Center, Houston, TX
3Heidelberg Pharma AG, Munich, Germany
4The University of Texas M.D. Anderson Cancer Center, Houston, TX
5Department of Lymphoma and Myeloma, MD Anderson Cancer Center, Houston, TX
Background:
Deletion (del) of 17p involving the p53 tumor suppressor (TP53) remains an adverse prognostic factor in multiple myeloma (MM) despite the use of novel agents as well as high-dose chemotherapy with autologous stem cell rescue. Genomic TP53 deletion can cause haploinsufficiency of nearby genes, such as RNA polymerase II subunit A (POLR2A), which ia also located on 17p13.1. We therefore hypothesized that del 17p could reduce POLR2A expression and enhance sensitivity to a-Amanitin, a potent and specific inhibitor of POLR2A and RNA polymerase III.
Methods:
Pre-clinical studies were performed using HDP101, a monoclonal antibody-drug conjugate (ADC) targeting BCMA linked to a-Amanitin, along with unconjugated BCMA antibody, a-Amanitin, and a non-targeting control ADC in myeloma cell line models. The latter included H929, MM1.S, and MOLP-8 TP53 wild-type (WT) lines and isogenic cells in which TP53 had been knocked out (KO) using CRISPR/Cas9 genome editing techniques. To further model del 17p and POLR2A haploinsufficiency, POLR2A expression was knocked down using shRNAs.
Results:
Analysis of the Multiple Myeloma Research Foundation CoMMpassSM database revealed that del 17p13 by SeqFISH was associated with a significant reduction in POLR2A expression by RNASeq (26.05431 fragments per kilobase of transcript per million mapped reads (FPKM) with WT vs. 19.2983 FPKM with del 17p13; p<0.0001). Also, patients within the lower quartile of POLR2A expression, which included those with and without del 17p, had an inferior overall survival (p<0.0011) and a trend towards a worse progression-free survival, suggesting that low POLR2A levels by themselves are an adverse feature. The POLR2A inhibiting anti-BCMA/a-Amanitin conjugate HDP101 induced a time- and dose-dependent reduction in myeloma cell viability post 96-hours of drug exposure starting at concentrations as low as in the picomolar range. This reduction with HDP101 was much greater than that seen with controls, which included a-Amanitin alone, the anti-BCMA antibody without a-Amanitin, or an anti-digoxigenin antibody conjugated to a-Amanitin. When myeloma cells were co-cultured with HS-5 human marrow stromal cells, only a-Amanitin and, to a much greater extent, HDP101 induced a loss of cell viability in myeloma cells, while the stromal cells were spared by HDP101. Loss of cell viability due to HDP101 was associated with induction of apoptosis as judged by the appearance of an increased population of cells that had a sub-G0/G1 DNA content, and that stained positively with Annexin V. Moreover, HDP101 treatment caused the appearance of cleaved fragments of Caspase 9 and 3, and loss of the mitochondrial trans-membrane potential. H929, MM1.S, and MOLP-8 TP53 KO cells were more sensitive to both HDP101 and, less potently to a-Amanitin than were their isogenic TP53 WT parental cells. As H929 cells expressed high levels of BCMA regardless of TP53 or POLR2A status, these were further examined for their sensitivity to HDP101. Notably, the preferential impact upon TP53 KO cells was associated with increased expression of Activating transcription factors -4 and -6, suggesting enhanced induction of endoplasmic reticulum stress, and at least two arms of the unfolded protein response. Interestingly, shRNA-mediated knockdown (KD) of POLR2A expression alone was sufficient to increase baseline levels of apoptosis in both H929 TP53 WT and KO cells, with a greater impact in the latter, supporting the promise of this target. Importantly, KD of POLR2A expression to further model del 17p was also associated with enhanced sensitivity to HDP101 in both the TP53 WT and KO cells compared to the control treatments. Evaluation of HDP101 in primary samples and with in vivo models is underway, and will be presented at the Annual Meeting. These studies were supported by a Leukemia & Lymphoma Society Specialized Center of Research (SCOR-12206-17).
Conclusions:
Our preliminary data support the possibility that del 17p myeloma may have a therapeutic vulnerability to the POLR2A inhibitor a-Amanitin through loss of TP53, and that this sensitivity is further enhanced by decreased POLR2A expression, which is common among del 17p patients. Moreover, they suggest that HDP101 is a novel potent and specific therapeutic that could show enhanced activity in the clinic especially against high-risk multiple myeloma, where effective therapies are still needed to improve patient outcomes.
Disclosures: Pahl: Heidelberg Pharma AG: Employment. Orlowski: BioTheryX, Inc: Consultancy, Membership on an entity's Board of Directors or advisory committees; Genentech: Consultancy; Bristol Myers Squibb: Consultancy; Janssen Pharmaceuticals: Consultancy, Membership on an entity's Board of Directors or advisory committees; Celgene: Consultancy, Membership on an entity's Board of Directors or advisory committees; Millenium Pharmaceuticals: Consultancy, Research Funding; Amgen: Consultancy, Membership on an entity's Board of Directors or advisory committees, Research Funding; Poseida: Research Funding.
MD Anderson HDP101
593 HDP101, a Novel B-Cell Maturation Antigen (BCMA)-Targeted Antibody Conjugated to α-Amanitin, Is Active Against Myeloma with Preferential Efficacy Against Pre-Clinical Models of Deletion 17p
Program: Oral and Poster Abstracts
Type: Oral
Session: 652. Myeloma: Pathophysiology and Pre-Clinical Studies, excluding Therapy: Development of Novel Immunotherapeutic Approaches in Multiple Myeloma
Hematology Disease Topics & Pathways:
antibodies, Diseases, Biological, multiple myeloma, apoptosis, bioengineering, Therapies, Animal models, Biological Processes, Technology and Procedures, Plasma Cell Disorders, Xenograft models, Study Population, Lymphoid Malignancies, Clinically relevant, gene editing, Myeloid Malignancies, flow cytometry, molecular testing, signal transduction
Monday, December 3, 2018: 8:00 AM
Ballroom 20D (San Diego Convention Center)
Ram Kumar Singh, PhD1,2*, Richard J. Jones, Ph.D.2*, Samuel Hong, Ph.D.2*, Fazal Shirazi, PhD2*, Hua Wang, Ph.D.2*, Isere Kuiatse, Ph.D.2*, Andreas Pahl3* and Robert Z. Orlowski, MD, PhD4,5
1Department of Lymphoma and Myeloma, The University of Texas MD Anderson Cancer Center, HOUSTON, TX
2Department of Lymphoma and Myeloma, The University of Texas MD Anderson Cancer Center, Houston, TX
3Heidelberg Pharma AG, Munich, Germany
4The University of Texas M.D. Anderson Cancer Center, Houston, TX
5Department of Lymphoma and Myeloma, MD Anderson Cancer Center, Houston, TX
Background:
Deletion (del) of 17p involving the p53 tumor suppressor (TP53) remains an adverse prognostic factor in multiple myeloma (MM) despite the use of novel agents as well as high-dose chemotherapy with autologous stem cell rescue. Genomic TP53 deletion can cause haploinsufficiency of nearby genes, such as RNA polymerase II subunit A (POLR2A), which ia also located on 17p13.1. We therefore hypothesized that del 17p could reduce POLR2A expression and enhance sensitivity to a-Amanitin, a potent and specific inhibitor of POLR2A and RNA polymerase III.
Methods:
Pre-clinical studies were performed using HDP101, a monoclonal antibody-drug conjugate (ADC) targeting BCMA linked to a-Amanitin, along with unconjugated BCMA antibody, a-Amanitin, and a non-targeting control ADC in myeloma cell line models. The latter included H929, MM1.S, and MOLP-8 TP53 wild-type (WT) lines and isogenic cells in which TP53 had been knocked out (KO) using CRISPR/Cas9 genome editing techniques. To further model del 17p and POLR2A haploinsufficiency, POLR2A expression was knocked down using shRNAs.
Results:
Analysis of the Multiple Myeloma Research Foundation CoMMpassSM database revealed that del 17p13 by SeqFISH was associated with a significant reduction in POLR2A expression by RNASeq (26.05431 fragments per kilobase of transcript per million mapped reads (FPKM) with WT vs. 19.2983 FPKM with del 17p13; p<0.0001). Also, patients within the lower quartile of POLR2A expression, which included those with and without del 17p, had an inferior overall survival (p<0.0011) and a trend towards a worse progression-free survival, suggesting that low POLR2A levels by themselves are an adverse feature. The POLR2A inhibiting anti-BCMA/a-Amanitin conjugate HDP101 induced a time- and dose-dependent reduction in myeloma cell viability post 96-hours of drug exposure starting at concentrations as low as in the picomolar range. This reduction with HDP101 was much greater than that seen with controls, which included a-Amanitin alone, the anti-BCMA antibody without a-Amanitin, or an anti-digoxigenin antibody conjugated to a-Amanitin. When myeloma cells were co-cultured with HS-5 human marrow stromal cells, only a-Amanitin and, to a much greater extent, HDP101 induced a loss of cell viability in myeloma cells, while the stromal cells were spared by HDP101. Loss of cell viability due to HDP101 was associated with induction of apoptosis as judged by the appearance of an increased population of cells that had a sub-G0/G1 DNA content, and that stained positively with Annexin V. Moreover, HDP101 treatment caused the appearance of cleaved fragments of Caspase 9 and 3, and loss of the mitochondrial trans-membrane potential. H929, MM1.S, and MOLP-8 TP53 KO cells were more sensitive to both HDP101 and, less potently to a-Amanitin than were their isogenic TP53 WT parental cells. As H929 cells expressed high levels of BCMA regardless of TP53 or POLR2A status, these were further examined for their sensitivity to HDP101. Notably, the preferential impact upon TP53 KO cells was associated with increased expression of Activating transcription factors -4 and -6, suggesting enhanced induction of endoplasmic reticulum stress, and at least two arms of the unfolded protein response. Interestingly, shRNA-mediated knockdown (KD) of POLR2A expression alone was sufficient to increase baseline levels of apoptosis in both H929 TP53 WT and KO cells, with a greater impact in the latter, supporting the promise of this target. Importantly, KD of POLR2A expression to further model del 17p was also associated with enhanced sensitivity to HDP101 in both the TP53 WT and KO cells compared to the control treatments. Evaluation of HDP101 in primary samples and with in vivo models is underway, and will be presented at the Annual Meeting. These studies were supported by a Leukemia & Lymphoma Society Specialized Center of Research (SCOR-12206-17).
Conclusions:
Our preliminary data support the possibility that del 17p myeloma may have a therapeutic vulnerability to the POLR2A inhibitor a-Amanitin through loss of TP53, and that this sensitivity is further enhanced by decreased POLR2A expression, which is common among del 17p patients. Moreover, they suggest that HDP101 is a novel potent and specific therapeutic that could show enhanced activity in the clinic especially against high-risk multiple myeloma, where effective therapies are still needed to improve patient outcomes.
Disclosures: Pahl: Heidelberg Pharma AG: Employment. Orlowski: BioTheryX, Inc: Consultancy, Membership on an entity's Board of Directors or advisory committees; Genentech: Consultancy; Bristol Myers Squibb: Consultancy; Janssen Pharmaceuticals: Consultancy, Membership on an entity's Board of Directors or advisory committees; Celgene: Consultancy, Membership on an entity's Board of Directors or advisory committees; Millenium Pharmaceuticals: Consultancy, Research Funding; Amgen: Consultancy, Membership on an entity's Board of Directors or advisory committees, Research Funding; Poseida: Research Funding.
Wie ich auf mein Kursziel komme:
- für mich ist die niedrige Marktkapitalisierung ausschlaggebend. Annähernd 80 Mio. Euro ist doch ein Witz. Faire Bewertung ist für mich mind. das Doppelte.
- man sieht, daß das Geschäftsmodell aufgeht. Durch die Auslizenzierungen werden die nächsten Jahre kontinuierlich Einnahmen generiert.
- extremer Low-Floater, Hopp besitzt 75%. Wenn hier mal größere Nachfrage reinkommt, kann es gut nach oben knallen.
- charttechnische Gesichtspunkte 😉
- für mich ist die niedrige Marktkapitalisierung ausschlaggebend. Annähernd 80 Mio. Euro ist doch ein Witz. Faire Bewertung ist für mich mind. das Doppelte.
- man sieht, daß das Geschäftsmodell aufgeht. Durch die Auslizenzierungen werden die nächsten Jahre kontinuierlich Einnahmen generiert.
- extremer Low-Floater, Hopp besitzt 75%. Wenn hier mal größere Nachfrage reinkommt, kann es gut nach oben knallen.
- charttechnische Gesichtspunkte 😉
Nochmals zur Charttechnik:
Bin darin kein Experte, aber wenn ich den Chart von Heidelberg Pharma mit dem von Evotec & Biofrontera vergleiche, kann man da schon gewisse Parallelen erkennen...
Wäre natürlich das Tüpfelchen auf dem ‘i’, wenn Heidelberg Pharma den beiden o.g. fundamental in der Entwicklung folgt... 😏
Bin darin kein Experte, aber wenn ich den Chart von Heidelberg Pharma mit dem von Evotec & Biofrontera vergleiche, kann man da schon gewisse Parallelen erkennen...
Wäre natürlich das Tüpfelchen auf dem ‘i’, wenn Heidelberg Pharma den beiden o.g. fundamental in der Entwicklung folgt... 😏
Antwort auf Beitrag Nr.: 59.354.012 von Stoxtrayder am 03.12.18 21:00:29
Machen wir doch mal solch eine Projektion auf etwa drei Jahre und dann die weitere Aussicht. Wir gehen mal davon aus, dass HP nicht in irgendeiner Form übernommen und veräußert wird.
Fangen wir mal mit den Projektionen an. HP hat im Augenblick zwei Technologiepartner. Takeda und Magenta. Eine weitere große wurdein einem Artikel angekündigt. Wahrscheinlich werden wir dann im Laufe der nächsten Jahre noch mit ein oder zwei weiteren rechnen können.
Ich denke mal, dass die Zahlungen an HP jetzt langsam mit dem weiteren Erfolg steigen werden. Nehmen wir hierfür für alle Partner Optionsmodelle an. Wir hätten dann in drei jahren etwa vier oder fünf Technologiepartner mit etwa 15-17 Wirkstoffkandidaten. Im Schnitt dürfte der Optionspreis pro Wirkstoff wohl signifikant höher wie etwa 100 Millionen $ liegen. Für die Wirkstoffentwicklung der Partner würden dann in steigender Höhe allein die Optionsbeträge schon bei etwa 2 Milliarden $ liegen, wenn alle Optionen gezogen werden. Danach kämen dann bei fertiger Entwicklung etwa 5% Umsatzbeteiligung über die Laufzeit des Wirkstoffes.
Magenta geht nächstes Jahr schon mit CD117 in die Klinik, also die Phase1. Kurz darauf folgt schon CD45. In drei Jahren dürften wohl von der gesamten Pipeline 4-5 Wirkstoffe in der Phase1/2 sein. 5-6 in der vorklinischen Phase und 5-6 in der Forschungsphase. Dies zurSituation der Technologiepartner.
Dann aus der alten Pipeline von Wilex Redectane evtl Mesupron und Rencarex. Mesupron und Rencarex lassen wir mal weg, da sie im Augenblick bei den Partnern keine Priorität haben bzw nicht auslizensiert sind. Bleibt also der Hoffnungsträger Redectane, das an Telix auslizensiert ist. Sie sind hier schon in Australien in der diagnostischen Anwendung in der Phase 3. In Europa wird die Studie wohl in wenigen Tagen oder Wochen folgen. In der Phase 2 folgen drei Studien für die therapeutische Anwendung auch in den nächsten Wochen. Schon etwa Q3/Q4 sind diese Studien beendet und nach der Auswertung in der diagnostischen Anwendung steht hier der Zulassungsprozess an. In der therapeutischen Anwendung werden dann direkt danach die finalen Studien geplant. Telix treibt diese Studien mit enormen Tempo an. Indikationserweiterung und neue Anwendungsmethoden mit Girentuximab werden erprobt. Die Zulassung hier in der diagnostischen Anwendung etwa 2021. In der therapeutischen Anwendung etwa 2 Jahre später. Allein mit Redectane winken HP über die gesamte Laufzeit Einnahmen von etwa 200-250 Millionen €. Und das ohne Indikationserweiterung und neue Anwendungsgebiete. Der Betrag könnte sich bei positiver Entwicklung über die nächsten 10 Jahre noch einmal auf etwa 400 Millionen € verdoppeln. Das zu Redectane.
Dann zu HDP 101
Die technologische Entwicklung scheint nun abgeschlossen und es werden im Dezember Tierversuche gestartet um die optimale Dosis für die Phase 1 zu bestimmen Schon etwa ende 19 befinden wir uns hier in der Phase 1/2. Wenn du die letzte Präsentation zu TP53 und das Abstract von MD Anderson gelesen hast, sieht man das hier ein ganz heißes Eisne im Feuer ist, dass schon in etwa 4-5 Jahren zur Zulassung führen kann. Die Daten scheinen sehr überzeugend zu sein so dass man hier Hoffnung auf eine verkürzte Zulassung hat. Wahrscheinlich werden diese Projekte dann auslizensiert. Dann aber auch mit entsprechenden Anfangszahlungen und Umsatzbeteiligungen. Ich mag die Höhe noch gar nicht schätzen. Doch dürfte man auch hier bei über 1 Milliarde $ liegen bei etwa 15-20% Umsatzbeteiligung. Weitere Kandidaten werden entwickelt, stehen aber noch nicht im Fokus.
Dann noch die Entwicklungspartnerschaften mit Nordic Nanovector und Mabvax, bei denen anteilig entwickelt wird. Dann schauen wir uns doch noch mal in der Zusammenfassung in gut drei Jahren an.
4 Phase 1/2, 5-6 vorklinisch, 5-6 in der Forschung in den Entwicklungspartnerschaften
Eigene Pipeline Phase 2b bei beiden Projekten mit HDP101 evtl auslizensiert.
Redectane Diagnostic schon zugelassen. Redectane Therapeutische Anwendung in der Endphase 3.
Dies ist jetzt natürlich das günstigste Szenario. Wahrscheinlich werden auch Rückschläge kommen. Nicht alle Optionen werden gezogen werden. Und wenn du von der Bewertung sprichst bei diesen Werten, dann dürfte diese bei HP bei sehr weit über 1 Milliarde $ liegen. Also Kursen bei über 30Euro. Kann sein, dass es was später kommt, da einige Projekte verzögert sind. Doch das ist in etwa meine Prognose aufgrund der Einschätzung, die ich oben geschrieben habe.
Ich würde einen anderen Ansatz wählen.
Wenn ich in etwa ein Kursziel in drei Jahren benennen möchte, muss ich auch eine Projektion in etwa drei Jahren machen. Vielleicht dann noch die wahrscheinlichsten Szenarien beschreiben. Der Chart folgt dann auch in der Regel der fundamentalen Entwicklung.Machen wir doch mal solch eine Projektion auf etwa drei Jahre und dann die weitere Aussicht. Wir gehen mal davon aus, dass HP nicht in irgendeiner Form übernommen und veräußert wird.
Fangen wir mal mit den Projektionen an. HP hat im Augenblick zwei Technologiepartner. Takeda und Magenta. Eine weitere große wurdein einem Artikel angekündigt. Wahrscheinlich werden wir dann im Laufe der nächsten Jahre noch mit ein oder zwei weiteren rechnen können.
Ich denke mal, dass die Zahlungen an HP jetzt langsam mit dem weiteren Erfolg steigen werden. Nehmen wir hierfür für alle Partner Optionsmodelle an. Wir hätten dann in drei jahren etwa vier oder fünf Technologiepartner mit etwa 15-17 Wirkstoffkandidaten. Im Schnitt dürfte der Optionspreis pro Wirkstoff wohl signifikant höher wie etwa 100 Millionen $ liegen. Für die Wirkstoffentwicklung der Partner würden dann in steigender Höhe allein die Optionsbeträge schon bei etwa 2 Milliarden $ liegen, wenn alle Optionen gezogen werden. Danach kämen dann bei fertiger Entwicklung etwa 5% Umsatzbeteiligung über die Laufzeit des Wirkstoffes.
Magenta geht nächstes Jahr schon mit CD117 in die Klinik, also die Phase1. Kurz darauf folgt schon CD45. In drei Jahren dürften wohl von der gesamten Pipeline 4-5 Wirkstoffe in der Phase1/2 sein. 5-6 in der vorklinischen Phase und 5-6 in der Forschungsphase. Dies zurSituation der Technologiepartner.
Dann aus der alten Pipeline von Wilex Redectane evtl Mesupron und Rencarex. Mesupron und Rencarex lassen wir mal weg, da sie im Augenblick bei den Partnern keine Priorität haben bzw nicht auslizensiert sind. Bleibt also der Hoffnungsträger Redectane, das an Telix auslizensiert ist. Sie sind hier schon in Australien in der diagnostischen Anwendung in der Phase 3. In Europa wird die Studie wohl in wenigen Tagen oder Wochen folgen. In der Phase 2 folgen drei Studien für die therapeutische Anwendung auch in den nächsten Wochen. Schon etwa Q3/Q4 sind diese Studien beendet und nach der Auswertung in der diagnostischen Anwendung steht hier der Zulassungsprozess an. In der therapeutischen Anwendung werden dann direkt danach die finalen Studien geplant. Telix treibt diese Studien mit enormen Tempo an. Indikationserweiterung und neue Anwendungsmethoden mit Girentuximab werden erprobt. Die Zulassung hier in der diagnostischen Anwendung etwa 2021. In der therapeutischen Anwendung etwa 2 Jahre später. Allein mit Redectane winken HP über die gesamte Laufzeit Einnahmen von etwa 200-250 Millionen €. Und das ohne Indikationserweiterung und neue Anwendungsgebiete. Der Betrag könnte sich bei positiver Entwicklung über die nächsten 10 Jahre noch einmal auf etwa 400 Millionen € verdoppeln. Das zu Redectane.
Dann zu HDP 101
Die technologische Entwicklung scheint nun abgeschlossen und es werden im Dezember Tierversuche gestartet um die optimale Dosis für die Phase 1 zu bestimmen Schon etwa ende 19 befinden wir uns hier in der Phase 1/2. Wenn du die letzte Präsentation zu TP53 und das Abstract von MD Anderson gelesen hast, sieht man das hier ein ganz heißes Eisne im Feuer ist, dass schon in etwa 4-5 Jahren zur Zulassung führen kann. Die Daten scheinen sehr überzeugend zu sein so dass man hier Hoffnung auf eine verkürzte Zulassung hat. Wahrscheinlich werden diese Projekte dann auslizensiert. Dann aber auch mit entsprechenden Anfangszahlungen und Umsatzbeteiligungen. Ich mag die Höhe noch gar nicht schätzen. Doch dürfte man auch hier bei über 1 Milliarde $ liegen bei etwa 15-20% Umsatzbeteiligung. Weitere Kandidaten werden entwickelt, stehen aber noch nicht im Fokus.
Dann noch die Entwicklungspartnerschaften mit Nordic Nanovector und Mabvax, bei denen anteilig entwickelt wird. Dann schauen wir uns doch noch mal in der Zusammenfassung in gut drei Jahren an.
4 Phase 1/2, 5-6 vorklinisch, 5-6 in der Forschung in den Entwicklungspartnerschaften
Eigene Pipeline Phase 2b bei beiden Projekten mit HDP101 evtl auslizensiert.
Redectane Diagnostic schon zugelassen. Redectane Therapeutische Anwendung in der Endphase 3.
Dies ist jetzt natürlich das günstigste Szenario. Wahrscheinlich werden auch Rückschläge kommen. Nicht alle Optionen werden gezogen werden. Und wenn du von der Bewertung sprichst bei diesen Werten, dann dürfte diese bei HP bei sehr weit über 1 Milliarde $ liegen. Also Kursen bei über 30Euro. Kann sein, dass es was später kommt, da einige Projekte verzögert sind. Doch das ist in etwa meine Prognose aufgrund der Einschätzung, die ich oben geschrieben habe.
Antwort auf Beitrag Nr.: 59.354.450 von BICYPAPA am 03.12.18 22:06:49Kann dem nur zustimmen. Wir könnten sogar ohne weitere KE auskommen da ja nur HDP 101 zusätzlich zum laufenden Betrieb kostet, alles andere wird von den Partnern bezahlt, also nur Einnahmen für HDP. Natürlich weiß ich die Staffelung der Meilensteinzahlungen nicht, aber wenn tatsächlich ab 2019 ca 4 Partner zusammenkommen dann könnten diese Zahlungen für den laufenden Betrieb ausreichen. Und ab 2921 kämen dann Zahlungen von Telix dazu.
Topp Analyse Bycipapa 👌
Da bin ich ja mit meinem langfristigen Kursziel von 15 Euro ja noch eher konservativ 😉
30 Euro wäre ja aus heutiger Sicht ein lupenreiner Tenbagger, warum nicht mal die ‘Cohones’ haben und so’n Kursziel raushauen...?! 😎
Da bin ich ja mit meinem langfristigen Kursziel von 15 Euro ja noch eher konservativ 😉
30 Euro wäre ja aus heutiger Sicht ein lupenreiner Tenbagger, warum nicht mal die ‘Cohones’ haben und so’n Kursziel raushauen...?! 😎
Antwort auf Beitrag Nr.: 59.354.867 von Mogli3 am 03.12.18 23:18:03
Ich würde weitere Maßnahmen
Ich würde evtl. kleinere Maßnahmen in der jetzigen Situation noch nicht ganz ausschließen, weil sich ein Partner oder Anleger an HP beteiligen möchte. Die größeren Zahlungen an HP stehen wahrscheinlich an den markanten Punkten der Entwicklung an. Zur Überbrückung könnten vielleicht noch kleinere Maßnahmen nötig sein. Aber mit größeren Verwässerungen rechne ich auch nicht mehr, da ab 21 Zahlungen von Telix und Optionszahlungen der Technologiepartner anstehen. Vielleicht noch Beteiligungen oder kleinere Überbrückungen. Das wäre meine Einschätzung zu den Finanzen. Ich wollte hier aber erst auch mal die Prognose für das nächste Jahre abwarten, um eine bessere Einschätzung abzugeben. Es ist auch sehr gut möglich, dass man jetzt gar keine Maßnahme mehr braucht.
Antwort auf Beitrag Nr.: 59.355.485 von BICYPAPA am 04.12.18 07:19:42Das Ganze hängt natürlich vom Tempo der Partner ab. Bei Magenta ja, kleine Firma muss liefern, ist auf Erfolg angewiesen. Telix auch. Takeda jetzt mit Shire weiß ich nicht, bis jetzt langsamer als eine Schnecke. Kleine Biotechfirmen als Partner sind da offenbar besser für HDP. Denke auch dass die noch ergänzende Investoren suchen, das Management zumindest, Hopp weiß ich nicht. Der wüsste aber einverstanden sein wenn es eine Kapitaleinlage ohne Bezugsrecht geben soll.
Antwort auf Beitrag Nr.: 59.354.450 von BICYPAPA am 03.12.18 22:06:49
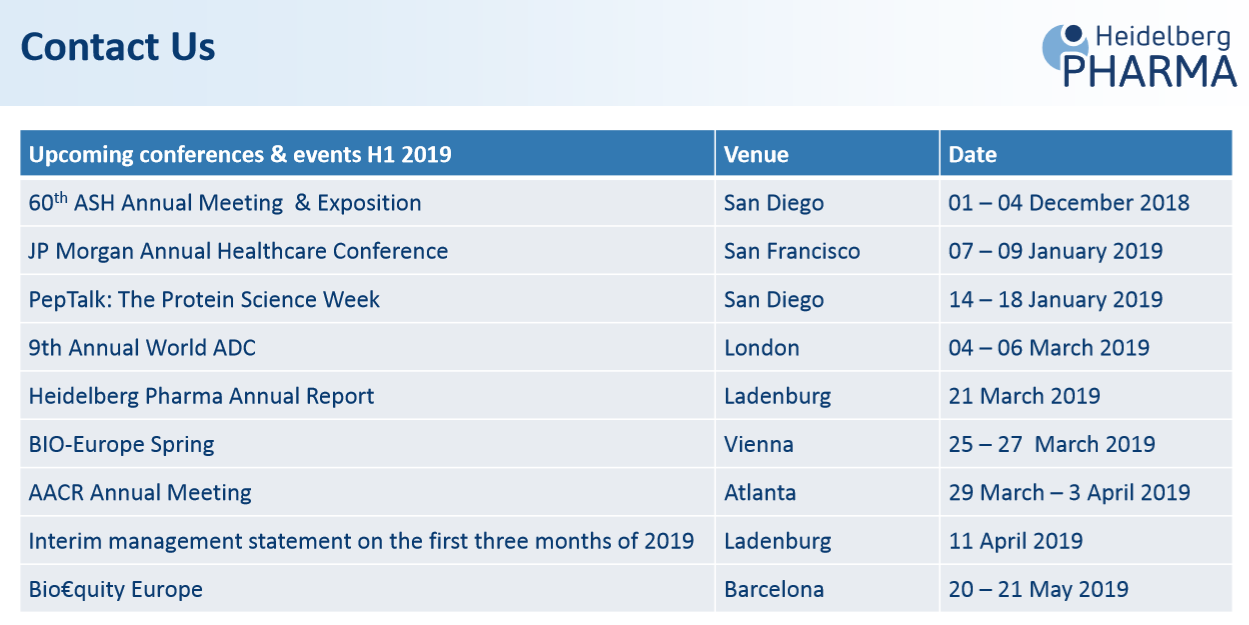
Konferenzkalender
Hier der aktuelle Konferenzkalender in den nächsten Monaten. Es stehen wieder jede Menge Termine an.
Antwort auf Beitrag Nr.: 59.401.911 von BICYPAPA am 10.12.18 07:59:36
Interview mit CEO
https://www.edisoninvestmentresearch.com/edison-tv/clip/exec…
Antwort auf Beitrag Nr.: 59.401.911 von BICYPAPA am 10.12.18 07:59:36
Mit C100 (CD45) folgt man in der Planung mit etwa einem Jahr Verzögerung.
Präsentation und Quelle zu dem Magenta Programm:
https://investor.magentatx.com/static-files/96c5cae5-2a9c-42…
Abstracts zu CD117 und CD45:
https://investor.magentatx.com/static-files/247aaa20-be4d-4d…
https://investor.magentatx.com/static-files/c3f48cb6-2010-4e…" target="_blank" rel="nofollow ugc noopener">
https://investor.magentatx.com/static-files/c3f48cb6-2010-4e…
https://investor.magentatx.com/static-files/b03d483c-5828-47…
Das Schaubild gibt die zeitliche Planung für C100 und C200 wieder.
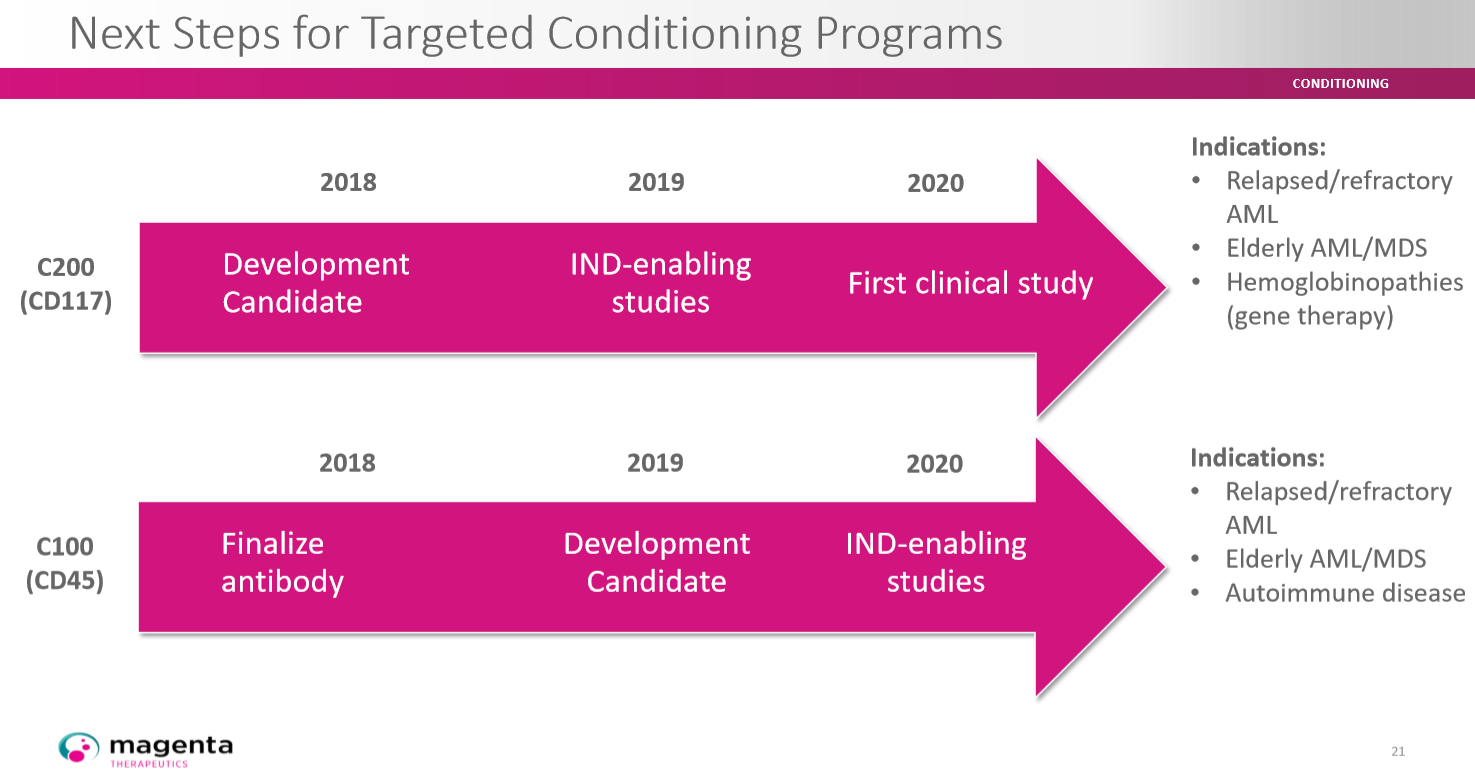
Magenta Update
Nach der ASH Konferenz gibt Magenta nun das weitere Programm zur Konditionierung bekannt. Mit C200 (CD 117)beabsichtigt man schon nach den vorbereiteten Studien 2020 in die klinische Phase zu gehen.Mit C100 (CD45) folgt man in der Planung mit etwa einem Jahr Verzögerung.
Präsentation und Quelle zu dem Magenta Programm:
https://investor.magentatx.com/static-files/96c5cae5-2a9c-42…
Abstracts zu CD117 und CD45:
https://investor.magentatx.com/static-files/247aaa20-be4d-4d…
https://investor.magentatx.com/static-files/c3f48cb6-2010-4e…" target="_blank" rel="nofollow ugc noopener">
https://investor.magentatx.com/static-files/c3f48cb6-2010-4e…
https://investor.magentatx.com/static-files/b03d483c-5828-47…
Das Schaubild gibt die zeitliche Planung für C100 und C200 wieder.

Antwort auf Beitrag Nr.: 59.444.265 von BICYPAPA am 15.12.18 07:00:04
http://www.deraktionaer.de/aktie/biotech-geheimtipp-heidelbe…
Aktionär Artikel
Sehr guter Artikel, der den Magenta Aspekt ausarbeitet. Wäre schön, wenn man auch mal Telix mit Redectane und HDP101 von HP entsprechend würdigen könnte. Ausgesprochener guter Hintergrund zu Magenta.http://www.deraktionaer.de/aktie/biotech-geheimtipp-heidelbe…
Antwort auf Beitrag Nr.: 59.444.265 von BICYPAPA am 15.12.18 07:00:04
Quantitative imaging of the hypoxia-related marker CAIX in head and neck squamous cell carcinoma xenograft models.
Huizing FJ, Hoeben BA, Franssen GM, Boerman OC, Heskamp S, Bussink J.
Abstract
Introduction Tumor hypoxia plays a major role in radio- and chemotherapy resistance in solid tumors. Carbonic AnhydraseIX (CAIX) is an endogenous hypoxia-related protein, which is associated with poor patient outcome. The quantitative assessment of CAIX expression of tumors may steer cancer treatment by predicting therapy response or patient selection for anti-hypoxia or CAIX-targeted treatment. Recently, the SPECT tracer [111In]In-DTPA-girentuximab-F(ab')2 was developed and validated for targeting CAIX. The aim of this study was to optimize quantitative microSPECT/CT of CAIX expression in vivo in head and neck tumor models. Methods Athymic mice with subcutaneous SCCNij153 and SCCNij202 head and neck squamous cell carcinoma xenografts were injected with [111In]In-DTPA-girentuximab-F(ab')2. First the protein dose, timing and image acquisition settings were optimized. Tracer uptake was determined by quantitative SPECT, ex vivo radioactivity counting, and by autoradiography of tumor sections. The same tumor sections were immunohistochemically stained for CAIX expression and hypoxia. Results Highest tumor-normal-tissue contrast was obtained at 24 hours after injection of the tracer. A protein dose of 10 µg resulted in the highest tumor-to-muscle ratio at 24 hours p.i. Ex vivo biodistribution studies showed a tumor uptake of 3.0 ± 0.6 %ID/g, and a tumor-to-muscle ratio of 8.7 ± 1.4 (SCCNij153). Quantitative analysis of the SPECT images enabled us to distinguish CAIX antigen blocked from non-blocked tumors, fractions positive for CAIX expression: 0.22 ± 0.02 versus 0.08 ± 0.01 (p < 0.01). Immunohistochemical, autoradiographic, and microSPECT/CT analyses showed a distinct intratumoral spatial correlation between localization of the radiotracer and CAIX expression. Conclusion Here we demonstrate that [111In]In-DTPA-girentuximab-F(ab')2 specifically targets CAIX-expressing cells in head and neck cancer xenografts. SPECT imaging with indium labeled girentuximab-F(ab')2 allows quantitative assessment of the fraction of CAIX positive tissue in head and neck cancer xenografts. These results indicate that [111In]In-DTPA-girentuximab-F(ab')2 is a promising tracer to image hypoxia-related CAIX expression
Abstract Girentuximab-Redectane
Hier nach diesem Abstract bietet sich eine weitere Indikationserweiterung für Redectane und Telix an. Für jede diagnostische Anwendung würde HP die hohe Beteiligung also ca 30% als Umsatzbeteiligung erhalten. Quantitative imaging of the hypoxia-related marker CAIX in head and neck squamous cell carcinoma xenograft models.
Huizing FJ, Hoeben BA, Franssen GM, Boerman OC, Heskamp S, Bussink J.
Abstract
Introduction Tumor hypoxia plays a major role in radio- and chemotherapy resistance in solid tumors. Carbonic AnhydraseIX (CAIX) is an endogenous hypoxia-related protein, which is associated with poor patient outcome. The quantitative assessment of CAIX expression of tumors may steer cancer treatment by predicting therapy response or patient selection for anti-hypoxia or CAIX-targeted treatment. Recently, the SPECT tracer [111In]In-DTPA-girentuximab-F(ab')2 was developed and validated for targeting CAIX. The aim of this study was to optimize quantitative microSPECT/CT of CAIX expression in vivo in head and neck tumor models. Methods Athymic mice with subcutaneous SCCNij153 and SCCNij202 head and neck squamous cell carcinoma xenografts were injected with [111In]In-DTPA-girentuximab-F(ab')2. First the protein dose, timing and image acquisition settings were optimized. Tracer uptake was determined by quantitative SPECT, ex vivo radioactivity counting, and by autoradiography of tumor sections. The same tumor sections were immunohistochemically stained for CAIX expression and hypoxia. Results Highest tumor-normal-tissue contrast was obtained at 24 hours after injection of the tracer. A protein dose of 10 µg resulted in the highest tumor-to-muscle ratio at 24 hours p.i. Ex vivo biodistribution studies showed a tumor uptake of 3.0 ± 0.6 %ID/g, and a tumor-to-muscle ratio of 8.7 ± 1.4 (SCCNij153). Quantitative analysis of the SPECT images enabled us to distinguish CAIX antigen blocked from non-blocked tumors, fractions positive for CAIX expression: 0.22 ± 0.02 versus 0.08 ± 0.01 (p < 0.01). Immunohistochemical, autoradiographic, and microSPECT/CT analyses showed a distinct intratumoral spatial correlation between localization of the radiotracer and CAIX expression. Conclusion Here we demonstrate that [111In]In-DTPA-girentuximab-F(ab')2 specifically targets CAIX-expressing cells in head and neck cancer xenografts. SPECT imaging with indium labeled girentuximab-F(ab')2 allows quantitative assessment of the fraction of CAIX positive tissue in head and neck cancer xenografts. These results indicate that [111In]In-DTPA-girentuximab-F(ab')2 is a promising tracer to image hypoxia-related CAIX expression
Antwort auf Beitrag Nr.: 59.450.709 von BICYPAPA am 17.12.18 07:25:17
Quelle: http://www.telixpharma.com/investors/asx-announcements/
Title: ZIR-DOSE Clinical Study Completes Enrolment
Synopsis:
The ZIR-DOSE trial is a small 10 patient study that was run as part of the Company’s development of TLX250-CDx. A previous version of the product used 124I (iodine) as the imaging isotope. Iodine is a challenging isotope to work with, is generally expensive to produce and requires additional clinical preparation of the patient (thyroid blocking). Telix elected to replace 124I with new chemistry supporting the use of 89Zr (zirconium). Zirconium easier to use, produces superior quality images and imparts less dose to the patient. The ZIR-DOSE study was run to accurately quantify these improvements and involves administering the product to a small number of patients that are imaged at multiple time-points over the course of a week.
Key points for investors:
• The ZIR-DOSE study further de-risks ongoing product development by accurately measuring the radiation dose to patients from this imaging procedure
• The ZIR-DOSE trial has validated that the dosimetry of TLX250-CDx is within prescribed radiation limits in the product’s intended commercial jurisdictions
• The ZIR-DOSE trial bridges previous iodine-based imaging experience in kidney cancer to Telix’s improved zirconium-based product, confirming significantly improved image quality and radiation characteristics
• The ZIR-DOSE trial confirms the optimal mass dose (injected quantity of imaging agent) for Telix’s ZIRCON multi-centre Phase III trial of TLX250-CDx for the imaging of kidney cancer
ZIR-DOSE Clinical Study Completes Enrolment
Melbourne (Australia), Brussels (Belgium) – 19th December 2018. Telix Pharmaceuticals Limited (ASX.TLX) (“Telix”, the “Company”), a clinical-stage biopharmaceutical company focused on the development of diagnostic and therapeutic products based on targeted radiopharmaceuticals or “molecularly-targeted radiation” (MTR) has today announced that the last patient has been imaged in the ZIR-DOSE bridging study conducted at Radboud University Medical Centre (RUMC) in the Netherlands.
The ZIR-DOSE study is a 10 patient multi-time point imaging study designed to compare the whole-body dosimetry of 89Zr-girentuximab (TLX250-CDx for the imaging of kidney cancer) with historical dosimetry data for 124I-girentuximab (Wilex AG / Heidelberg Pharma). Telix elected to change the isotope from 124I to 89Zr in order to reduce patient dose, enhance image contrast, lower cost of goods and improve clinical workflow by eliminating the need for thyroid blocking. The ZIR-DOSE study achieves both a mass dose comparison between 5mg and 10mg injected dose, as well as full body dosimetry.
Telix has previously reported (ASX release : 15/10/18) that interim analysis of the ZIR-DOSE study indicated a 25% reduction in dose through the change of isotope from 124I to 89Zr, as well as significantly lower liver dose (at 10mg) and superior image quality. The interim analysis has been used to inform the design of the ZIRCON Phase III study and has been incorporated into recent regulatory submissions.
The final analysis of the ZIR-DOSE study will be complete by approximately end-Q1 ’19 but is not expected to differ in outcome from the interim results. Telix co-founder and CEO, Dr. Christian Behrenbruch stated, “The ZIR-DOSE study is a very demanding study for patients because of the number of visits required and the extensive amount of imaging time required to measure dosimetry. The commitment of study participants to contribute to a better way of staging and managing kidney cancer is truly commendable and we are grateful to our partners at RUMC for their efforts in recruiting this trial in a timely fashion.”
Telix Update Japan ..
Telix veröffentlicht heute ein Update mit Redectane zum Stand in Japan und die Bridging Studie beendet die Rekrutierung.Quelle: http://www.telixpharma.com/investors/asx-announcements/
Title: ZIR-DOSE Clinical Study Completes Enrolment
Synopsis:
The ZIR-DOSE trial is a small 10 patient study that was run as part of the Company’s development of TLX250-CDx. A previous version of the product used 124I (iodine) as the imaging isotope. Iodine is a challenging isotope to work with, is generally expensive to produce and requires additional clinical preparation of the patient (thyroid blocking). Telix elected to replace 124I with new chemistry supporting the use of 89Zr (zirconium). Zirconium easier to use, produces superior quality images and imparts less dose to the patient. The ZIR-DOSE study was run to accurately quantify these improvements and involves administering the product to a small number of patients that are imaged at multiple time-points over the course of a week.
Key points for investors:
• The ZIR-DOSE study further de-risks ongoing product development by accurately measuring the radiation dose to patients from this imaging procedure
• The ZIR-DOSE trial has validated that the dosimetry of TLX250-CDx is within prescribed radiation limits in the product’s intended commercial jurisdictions
• The ZIR-DOSE trial bridges previous iodine-based imaging experience in kidney cancer to Telix’s improved zirconium-based product, confirming significantly improved image quality and radiation characteristics
• The ZIR-DOSE trial confirms the optimal mass dose (injected quantity of imaging agent) for Telix’s ZIRCON multi-centre Phase III trial of TLX250-CDx for the imaging of kidney cancer
ZIR-DOSE Clinical Study Completes Enrolment
Melbourne (Australia), Brussels (Belgium) – 19th December 2018. Telix Pharmaceuticals Limited (ASX.TLX) (“Telix”, the “Company”), a clinical-stage biopharmaceutical company focused on the development of diagnostic and therapeutic products based on targeted radiopharmaceuticals or “molecularly-targeted radiation” (MTR) has today announced that the last patient has been imaged in the ZIR-DOSE bridging study conducted at Radboud University Medical Centre (RUMC) in the Netherlands.
The ZIR-DOSE study is a 10 patient multi-time point imaging study designed to compare the whole-body dosimetry of 89Zr-girentuximab (TLX250-CDx for the imaging of kidney cancer) with historical dosimetry data for 124I-girentuximab (Wilex AG / Heidelberg Pharma). Telix elected to change the isotope from 124I to 89Zr in order to reduce patient dose, enhance image contrast, lower cost of goods and improve clinical workflow by eliminating the need for thyroid blocking. The ZIR-DOSE study achieves both a mass dose comparison between 5mg and 10mg injected dose, as well as full body dosimetry.
Telix has previously reported (ASX release : 15/10/18) that interim analysis of the ZIR-DOSE study indicated a 25% reduction in dose through the change of isotope from 124I to 89Zr, as well as significantly lower liver dose (at 10mg) and superior image quality. The interim analysis has been used to inform the design of the ZIRCON Phase III study and has been incorporated into recent regulatory submissions.
The final analysis of the ZIR-DOSE study will be complete by approximately end-Q1 ’19 but is not expected to differ in outcome from the interim results. Telix co-founder and CEO, Dr. Christian Behrenbruch stated, “The ZIR-DOSE study is a very demanding study for patients because of the number of visits required and the extensive amount of imaging time required to measure dosimetry. The commitment of study participants to contribute to a better way of staging and managing kidney cancer is truly commendable and we are grateful to our partners at RUMC for their efforts in recruiting this trial in a timely fashion.”
Antwort auf Beitrag Nr.: 59.467.074 von BICYPAPA am 19.12.18 06:55:29
Renal Cancer Imaging Program
– Japanese Regulatory
Progress Update Melbourne (Australia), Kyoto (Japan)
– 19th December 2018.
Telix Pharmaceuticals Limited (ASX.TLX) (“Telix”, the “Company”), a clinical-stage biopharmaceutical company focused on the development of diagnostic and therapeutic products based on targeted radiopharmaceuticals or “molecularly-targeted radiation” (MTR) has today announced that it has completed first and second stage consultations with the Japanese Pharmaceuticals and Medical Devices Agency (PMDA) and has been granted permission to submit a final stage application by the 11th January 2019 for a Phase I/II study of 89Zr-girentuximab (TLX250-CDx) in Japan.
The objective of the study is to validate the existing US and EU experience of imaging kidney cancer with girentuximab (anti-CAIX antibody) in Japanese patients. The study, as proposed, will build on the EU experience with TLX250-CDx, particularly the ZIR-DOSE study (EudraCT 2017-004769-2). The trial, which is expected to commence in Q2 2019 (subject to regulator approval), will use product manufactured in Japan by Telix’s partner JFE Engineering and will bridge to the global ZIRCON Phase III study (EudraCT 2018-002773-21).
Telix Pharmaceuticals Japan President, Dr. Shintaro Nishimura stated, “Over the past 6 months, Telix has made considerable progress with TLX250-CDx in Japan and our preliminary engagement with the PMDA has been very helpful in terms of developing a roadmap for this product in Japan. The imaging of CAIX in Japanese patients has potential utility in a wide variety of cancers, including renal cancer, and we are pleased with the progress in both manufacturing and regulator engagement.”
Girentuximab Japan
Vielleicht hier noch interessant. Hier wird der Einsatz von Girentuximab-TLX250-Redectane bei einer Vielzahl von Krebsarten angesprochen. Es ist sehr gut möglich das wir hier bald mit Indikationserweiterungen rechnen können. Demnach wären dann auch für diese Indikationserweiterungen im diagnostischen Bereich Umsatzbeteiligungen in Höhe von etwa 30% an HP fällig. Es dürfte zwar noch etwas dauern. Doch es dürfte die Einnahmen für HP mit Redectane wohl langfristig mehr als verdoppeln. Das Gute an der ganzen Sache. Diese Entwicklung wird von Telix und deren Partnern übernommen und kostet HP keinen Cent mehr.Renal Cancer Imaging Program
– Japanese Regulatory
Progress Update Melbourne (Australia), Kyoto (Japan)
– 19th December 2018.
Telix Pharmaceuticals Limited (ASX.TLX) (“Telix”, the “Company”), a clinical-stage biopharmaceutical company focused on the development of diagnostic and therapeutic products based on targeted radiopharmaceuticals or “molecularly-targeted radiation” (MTR) has today announced that it has completed first and second stage consultations with the Japanese Pharmaceuticals and Medical Devices Agency (PMDA) and has been granted permission to submit a final stage application by the 11th January 2019 for a Phase I/II study of 89Zr-girentuximab (TLX250-CDx) in Japan.
The objective of the study is to validate the existing US and EU experience of imaging kidney cancer with girentuximab (anti-CAIX antibody) in Japanese patients. The study, as proposed, will build on the EU experience with TLX250-CDx, particularly the ZIR-DOSE study (EudraCT 2017-004769-2). The trial, which is expected to commence in Q2 2019 (subject to regulator approval), will use product manufactured in Japan by Telix’s partner JFE Engineering and will bridge to the global ZIRCON Phase III study (EudraCT 2018-002773-21).
Telix Pharmaceuticals Japan President, Dr. Shintaro Nishimura stated, “Over the past 6 months, Telix has made considerable progress with TLX250-CDx in Japan and our preliminary engagement with the PMDA has been very helpful in terms of developing a roadmap for this product in Japan. The imaging of CAIX in Japanese patients has potential utility in a wide variety of cancers, including renal cancer, and we are pleased with the progress in both manufacturing and regulator engagement.”
Antwort auf Beitrag Nr.: 59.467.176 von BICYPAPA am 19.12.18 07:31:08
Li Y1,2,3, Liu Y2,3,4, Xu H1,2,3, Jiang G3, Van der Jeught K2,3, Fang Y2,3, Zhou Z3, Zhang L2,3, Frieden M3, Wang L3, Luo Z5, Radovich M4,6, Schneider BP7, Deng Y8, Liu Y3, Huang K7, He B9, Wang J10, He X11,12, Zhang X13,14, Ji G15, Lu X16,17,18.
Author information
Abstract
Heterozygous deletion of chromosome 17p (17p) is one of the most frequent genomic events in human cancers. Beyond the tumor suppressor TP53, the POLR2A gene encoding the catalytic subunit of RNA polymerase II (RNAP2) is also included in a ~20-megabase deletion region of 17p in 63% of metastatic castration-resistant prostate cancer (CRPC). Using a focused CRISPR-Cas9 screen, we discovered that heterozygous loss of 17p confers a selective dependence of CRPC cells on the ubiquitin E3 ligase Ring-Box 1 (RBX1). RBX1 activates POLR2A by the K63-linked ubiquitination and thus elevates the RNAP2-mediated mRNA synthesis. Combined inhibition of RNAP2 and RBX1 profoundly suppress the growth of CRPC in a synergistic manner, which potentiates the therapeutic effectivity of the RNAP2 inhibitor, α-amanitin-based antibody drug conjugate (ADC). Given the limited therapeutic options for CRPC, our findings identify RBX1 as a potentially therapeutic target for treating human CRPC harboring heterozygous deletion of 17p.
Abstract Hintergrund TP53 17p
Heterozygous deletion of chromosome 17p renders prostate cancer vulnerable to inhibition of RNA polymerase II.Li Y1,2,3, Liu Y2,3,4, Xu H1,2,3, Jiang G3, Van der Jeught K2,3, Fang Y2,3, Zhou Z3, Zhang L2,3, Frieden M3, Wang L3, Luo Z5, Radovich M4,6, Schneider BP7, Deng Y8, Liu Y3, Huang K7, He B9, Wang J10, He X11,12, Zhang X13,14, Ji G15, Lu X16,17,18.
Author information
Abstract
Heterozygous deletion of chromosome 17p (17p) is one of the most frequent genomic events in human cancers. Beyond the tumor suppressor TP53, the POLR2A gene encoding the catalytic subunit of RNA polymerase II (RNAP2) is also included in a ~20-megabase deletion region of 17p in 63% of metastatic castration-resistant prostate cancer (CRPC). Using a focused CRISPR-Cas9 screen, we discovered that heterozygous loss of 17p confers a selective dependence of CRPC cells on the ubiquitin E3 ligase Ring-Box 1 (RBX1). RBX1 activates POLR2A by the K63-linked ubiquitination and thus elevates the RNAP2-mediated mRNA synthesis. Combined inhibition of RNAP2 and RBX1 profoundly suppress the growth of CRPC in a synergistic manner, which potentiates the therapeutic effectivity of the RNAP2 inhibitor, α-amanitin-based antibody drug conjugate (ADC). Given the limited therapeutic options for CRPC, our findings identify RBX1 as a potentially therapeutic target for treating human CRPC harboring heterozygous deletion of 17p.
Antwort auf Beitrag Nr.: 59.486.406 von BICYPAPA am 21.12.18 07:31:08
Quelle und gesamter Artikel
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6197287/
Antwort auf Beitrag Nr.: 59.486.406 von BICYPAPA am 21.12.18 07:31:08
http://www.deraktionaer.de/aktie/biotech-geheimtipp---heidel…
Aktionär Interview
Biotech-Geheimtipp – Heidelberg-Pharma-Vorstand im Interview: „Studienstart im 2. Halbjahr 2019“http://www.deraktionaer.de/aktie/biotech-geheimtipp---heidel…
Antwort auf Beitrag Nr.: 59.499.510 von BICYPAPA am 23.12.18 10:55:04
https://investor.magentatx.com/static-files/b960beb0-adca-4e…
https://investor.magentatx.com/financial-information/sec-fil…
Magenta Update Präsentation
Ein neues Update von Magenta zu einer Konferenz zur 37th Annual J.P. Morgan Healthcare Conference in San Francisco on January 9, 2019 at 9:30 a.m. PSThttps://investor.magentatx.com/static-files/b960beb0-adca-4e…
https://investor.magentatx.com/financial-information/sec-fil…
Antwort auf Beitrag Nr.: 59.574.728 von BICYPAPA am 07.01.19 14:04:50
Redectane Therapeutisch TLX-250 Phase 2 Q419 Rekrutierung beendet. Daten werden ausgelesen. Umsatzschätzung ca 400-500 Millionen $. Beteiligung HP 5%.
Redectane TLX-250 Diagnostik Phase 3 Q419 Rekrutierung beendet, Daten werden ausgelesen.
Umsatzschätzung 250 Millionen $ Beteiligung HP 30%. Hierzu wird noch vermerkt, das im Augenblick zu diesem Verfahren keine Alternative besteht. Bisher gingen wir von einem Umsatz von ca 70 Millionen $ aus. In der jetzigen Präsentation wird der Jahresumsatz auf ca. 250 Millionen $ geschätzt. Damit müssen wir auch die Beteiligung für HP anpassen. Gingen wir bei der Diagnostik immer von einer Umsatzbeteilgung von ca 20 Millionen $ für HP aus wird sie nach dieser Präsentation bei etwa 75 Millionen $ liegen. Die Studie wird wahrscheinlich dieses Jahr beendet und das Zulassungsverfahren dürfte schon nächstes Jahr gelingen können. Somit kann HP ab ca 2021 mit Einnahmen mit sukzessiven Steigerungen bis zu ca 75 Millionen $ nur mit Redectane TLX-250 aus der Diagnostik geben. Das ist eine riesige Nachricht, zumal hierzu keine andere Alternativen bestehen.
Telix Update
Es gab gestern ein Telix Update. Hier die wichtigsten Eckdaten zu RedectaneRedectane Therapeutisch TLX-250 Phase 2 Q419 Rekrutierung beendet. Daten werden ausgelesen. Umsatzschätzung ca 400-500 Millionen $. Beteiligung HP 5%.
Redectane TLX-250 Diagnostik Phase 3 Q419 Rekrutierung beendet, Daten werden ausgelesen.
Umsatzschätzung 250 Millionen $ Beteiligung HP 30%. Hierzu wird noch vermerkt, das im Augenblick zu diesem Verfahren keine Alternative besteht. Bisher gingen wir von einem Umsatz von ca 70 Millionen $ aus. In der jetzigen Präsentation wird der Jahresumsatz auf ca. 250 Millionen $ geschätzt. Damit müssen wir auch die Beteiligung für HP anpassen. Gingen wir bei der Diagnostik immer von einer Umsatzbeteilgung von ca 20 Millionen $ für HP aus wird sie nach dieser Präsentation bei etwa 75 Millionen $ liegen. Die Studie wird wahrscheinlich dieses Jahr beendet und das Zulassungsverfahren dürfte schon nächstes Jahr gelingen können. Somit kann HP ab ca 2021 mit Einnahmen mit sukzessiven Steigerungen bis zu ca 75 Millionen $ nur mit Redectane TLX-250 aus der Diagnostik geben. Das ist eine riesige Nachricht, zumal hierzu keine andere Alternativen bestehen.
Danke für die Infos 👍
Eine Frage der Zeit, bis hier eine Neubewertung stattfindet. Erinnert mich irgendwie an Evotec, als der Kurs jahrelang zw. 2-4 Euro verharrte, um dann irgendwann auszubrechen...
Eine Frage der Zeit, bis hier eine Neubewertung stattfindet. Erinnert mich irgendwie an Evotec, als der Kurs jahrelang zw. 2-4 Euro verharrte, um dann irgendwann auszubrechen...
Antwort auf Beitrag Nr.: 59.580.227 von BICYPAPA am 08.01.19 07:35:24
Redectane-TLX250 oder auch Girentuximab benannt ist von Heidelberg Pharma an Telix auslizensiert.
Es kann in zwei Bereichen der Diagnostik oder auch therapeutisch eingesetzt werden.
In der therapeutischen Anwendung befindet man sich in der Phase 2 und das Ende der Rekrutierung wird etwa Q4 19 erwartet. Sollte die Entwicklung normal verlaufen folgt eine Phase 3 Studie und der Zulassungsprozess. Telix rechnet hier mit Einnahmen von ca 400-500 Millionen$. Erste Einnahmen dürften wir in der herapeutischen Anwendung etwa ab 2023 erwarten. Die Beteiligung für HP beträgt ca 5%.
In der Diagnostik befindet man sich in Phase 3 und das Ende der Rekrutierung wird etwa Q4 19 erwartet. Danach folgt die Auswertung und der Zulassungsprozess. Bitte entnehmt die Einzelheiten der aktuellen Januar Präsentation.
http://www.telixpharma.com/investors/asx-announcements/
Es ist gestern gar nicht so richtig zur Kenntnis genommen worden. Doch die Umsatzschätzung für die diagnostische Anwendung wird auf etwa 250 Millionen $ geschätzt. Dazu kommt dann zusätzlich der gleiche Betrag langfristig wird zusätzliche Indikationen. Die Beteiligung für HP beträgt hier ca 30%. Und man befindet sich nun schon in der Phase 3 . Erste Einnahmen bis zu ca 75 Millionen $ dürften etwa ab 2021 erwartbar sein. Langfristig kommt dann noch der gleiche Betrag für zusätzliche Indikationen dazu, da HP für alle diagnostischen Anwendungen mit Redectane mit etwa 30% beteiligt ist. Zur besseren Visualisierung der Fakten poste ich mal ein Schaubild von Telix dazu. Dies beschreibt jetzt nur die Chancen die HP mit Redectane hat. Mittelfristig können wir hier mit Einnahmen bis zu 100 Millionen € rechnen . Langfristig dürfte eine Verdoppelung dieser Umsatzbeteiligungen möglich sein. Dies noch mal zu Telix und Redectane-TLX250-Girentuximab.
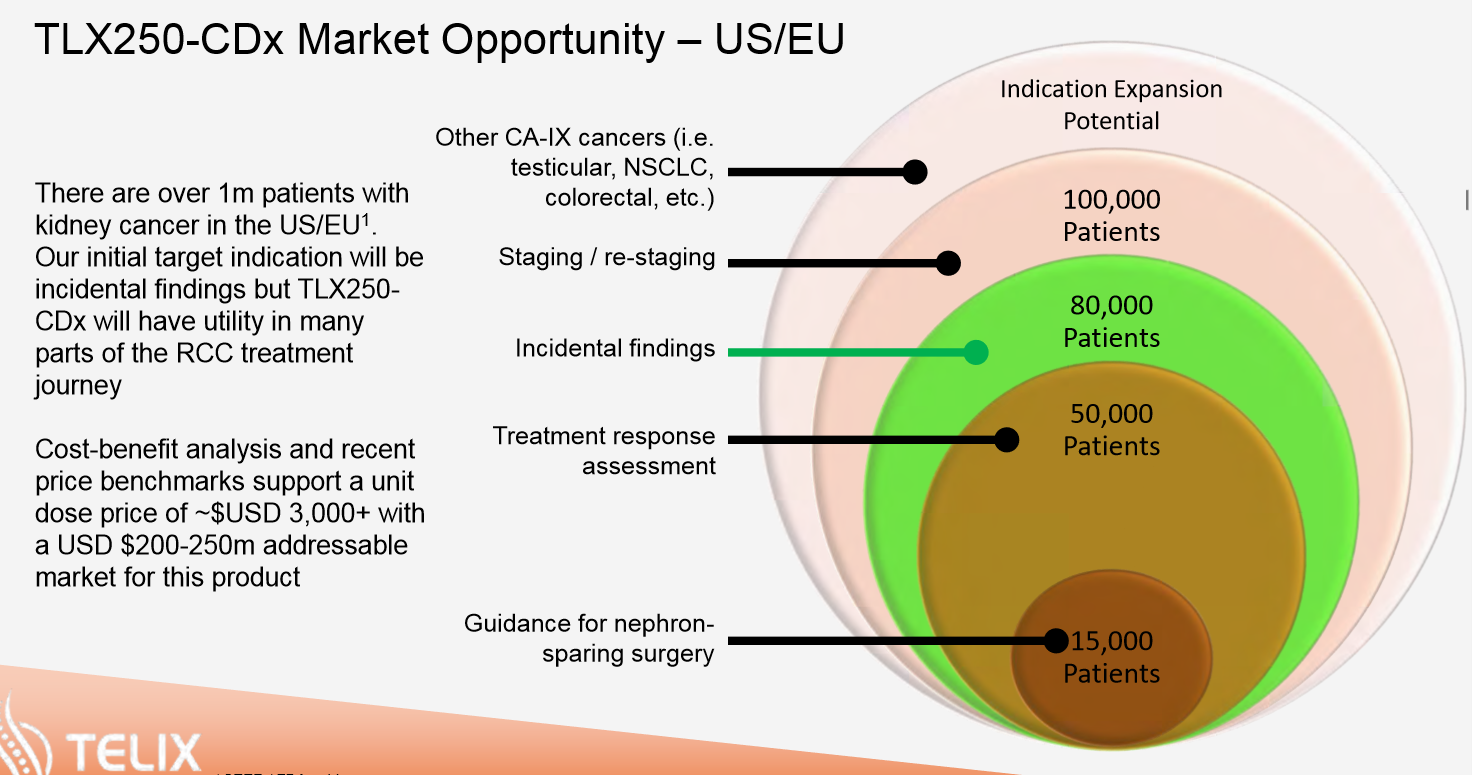
Telix Detailprogramm Januar
Telix macht noch mal eine ganz aktuelle Programmbeschreibung. Es stimmt schon sehr optimistisch, wenn die Prognosen so eintreffen wie in den Schaubildern angekündigt. Ich bitte euch die Präsentation bei Telix anzuschauen. Um sie hier zu posten, dazu ist sie zu umfangreich. Doch zwei drei Sätze und ein wichtiges Bild mit der Prognose möchte ich doch noch posten.Redectane-TLX250 oder auch Girentuximab benannt ist von Heidelberg Pharma an Telix auslizensiert.
Es kann in zwei Bereichen der Diagnostik oder auch therapeutisch eingesetzt werden.
In der therapeutischen Anwendung befindet man sich in der Phase 2 und das Ende der Rekrutierung wird etwa Q4 19 erwartet. Sollte die Entwicklung normal verlaufen folgt eine Phase 3 Studie und der Zulassungsprozess. Telix rechnet hier mit Einnahmen von ca 400-500 Millionen$. Erste Einnahmen dürften wir in der herapeutischen Anwendung etwa ab 2023 erwarten. Die Beteiligung für HP beträgt ca 5%.
In der Diagnostik befindet man sich in Phase 3 und das Ende der Rekrutierung wird etwa Q4 19 erwartet. Danach folgt die Auswertung und der Zulassungsprozess. Bitte entnehmt die Einzelheiten der aktuellen Januar Präsentation.
http://www.telixpharma.com/investors/asx-announcements/
Es ist gestern gar nicht so richtig zur Kenntnis genommen worden. Doch die Umsatzschätzung für die diagnostische Anwendung wird auf etwa 250 Millionen $ geschätzt. Dazu kommt dann zusätzlich der gleiche Betrag langfristig wird zusätzliche Indikationen. Die Beteiligung für HP beträgt hier ca 30%. Und man befindet sich nun schon in der Phase 3 . Erste Einnahmen bis zu ca 75 Millionen $ dürften etwa ab 2021 erwartbar sein. Langfristig kommt dann noch der gleiche Betrag für zusätzliche Indikationen dazu, da HP für alle diagnostischen Anwendungen mit Redectane mit etwa 30% beteiligt ist. Zur besseren Visualisierung der Fakten poste ich mal ein Schaubild von Telix dazu. Dies beschreibt jetzt nur die Chancen die HP mit Redectane hat. Mittelfristig können wir hier mit Einnahmen bis zu 100 Millionen € rechnen . Langfristig dürfte eine Verdoppelung dieser Umsatzbeteiligungen möglich sein. Dies noch mal zu Telix und Redectane-TLX250-Girentuximab.

Antwort auf Beitrag Nr.: 59.589.491 von BICYPAPA am 09.01.19 08:21:24
AMANITINKONJUGATE
The invention relates to a conjugate comprising (a) an amatoxin comprising (i) an amino acid 4 with a 6'-deoxy position; and (ii) an amino acid 8 with an S-deoxy position; (b) a target-binding moiety; and (c) optionally a linker linking said amatoxin and said target-binding moiety. The invention furthermore relates to a pharmaceutical composition comprising such conjugate.
https://patentscope.wipo.int/search/de/result.jsf
Patentveröffentlichung in Europa
AMANITINKONJUGATE
The invention relates to a conjugate comprising (a) an amatoxin comprising (i) an amino acid 4 with a 6'-deoxy position; and (ii) an amino acid 8 with an S-deoxy position; (b) a target-binding moiety; and (c) optionally a linker linking said amatoxin and said target-binding moiety. The invention furthermore relates to a pharmaceutical composition comprising such conjugate.
https://patentscope.wipo.int/search/de/result.jsf
Heidelberg Pharma AG: Vorabbekanntmachung über die Veröffentlichung von Finanzberichten gemäß § 114, 115, 117 WpHG
Heidelberg Pharma AG / Vorabbekanntmachung über die Veröffentlichung von
Rechnungslegungsberichten
21.01.2019 / 11:41
Vorabbekanntmachung über die Veröffentlichung von Finanzberichten gemäß §
114, 115, 117 WpHG übermittelt durch DGAP - ein Service der EQS Group AG.
Für den Inhalt der Mitteilung ist der Emittent / Herausgeber
verantwortlich.
Hiermit gibt die Heidelberg Pharma AG bekannt, dass folgende Finanzberichte
veröffentlicht werden:
Bericht: Jahresfinanzbericht
Veröffentlichungsdatum / Deutsch: 21.03.2019
Veröffentlichungsdatum / Englisch: 21.03.2019
Heidelberg Pharma AG / Vorabbekanntmachung über die Veröffentlichung von
Rechnungslegungsberichten
21.01.2019 / 11:41
Vorabbekanntmachung über die Veröffentlichung von Finanzberichten gemäß §
114, 115, 117 WpHG übermittelt durch DGAP - ein Service der EQS Group AG.
Für den Inhalt der Mitteilung ist der Emittent / Herausgeber
verantwortlich.
Hiermit gibt die Heidelberg Pharma AG bekannt, dass folgende Finanzberichte
veröffentlicht werden:
Bericht: Jahresfinanzbericht
Veröffentlichungsdatum / Deutsch: 21.03.2019
Veröffentlichungsdatum / Englisch: 21.03.2019
Antwort auf Beitrag Nr.: 59.675.877 von Ahwas am 21.01.19 12:26:19
Heidelberg Pharma erhält Meilensteinzahlung vom Partner Link Health
Ladenburg, 22. Januar 2019 - Die Heidelberg Pharma AG (FWB: WL6) gab heute bekannt, dass sie von ihrem Kooperationspartner Link Health Co., Guangzhou, China, eine Meilensteinzahlung erhalten hat. Hintergrund ist die Genehmigung der chinesischen Behörde für Lebensmittel- und Arzneimittelsicherheit (National Medical Product Administration - NMPA) für die Durchführung von klinischen Studien mit dem Produktkandidaten MESUPRON(R).
Die Genehmigung erfolgte nach den neuen Regularien der NMPA, welche eine Nutzung der Sicherheitsdaten aus den früheren Studien mit MESUPRON(R) zulassen und damit unmittelbar die Durchführung einer Phase II-Studie möglich machen können. Aufgrund der neuen regulatorischen Situation muss dazu aber eine Überarbeitung des klinischen Studienprotokolls durch Link Health erfolgen. Diese ist in den kommenden Monaten geplant.
Informationen über MESUPRON(R) und das uPA-Programm
Der uPA-Inhibitor MESUPRON(R) (INN: Upamostat) hemmt das Urokinase Plasminogen Aktivator (uPA)-System. 2014 wurden die Rechte zur Entwicklung und Kommerzialisierung von MESUPRON(R) an Link Health Co., Guangzhou, China, für die Region China, Hong Kong, Taiwan und Macao auslizenziert. Grundlage dafür waren Daten aus zwei Phase IIa-Studien in den Indikationen lokal-fortgeschrittener Bauchspeicheldrüsenkrebs (2010) und metastasierter Brustkrebs (2012), die Sicherheit und Aktivität des Medikamentenkandidaten in Kombination mit Chemotherapeutika gezeigt haben. Das Wirkprinzip des MESUPRON(R) könnte einen neuen Behandlungsansatz durch spezifische Blockierung der Metastasierung bei soliden Tumoren bilden.
Meilensteinzahlung für Mesupron
Mesupron hatten wir schon fast ganz aus den Augen verloren. Eine weitere positive Nachricht jetzt auch mit Mesupron. Heidelberg Pharma erhält Meilensteinzahlung vom Partner Link Health
Ladenburg, 22. Januar 2019 - Die Heidelberg Pharma AG (FWB: WL6) gab heute bekannt, dass sie von ihrem Kooperationspartner Link Health Co., Guangzhou, China, eine Meilensteinzahlung erhalten hat. Hintergrund ist die Genehmigung der chinesischen Behörde für Lebensmittel- und Arzneimittelsicherheit (National Medical Product Administration - NMPA) für die Durchführung von klinischen Studien mit dem Produktkandidaten MESUPRON(R).
Die Genehmigung erfolgte nach den neuen Regularien der NMPA, welche eine Nutzung der Sicherheitsdaten aus den früheren Studien mit MESUPRON(R) zulassen und damit unmittelbar die Durchführung einer Phase II-Studie möglich machen können. Aufgrund der neuen regulatorischen Situation muss dazu aber eine Überarbeitung des klinischen Studienprotokolls durch Link Health erfolgen. Diese ist in den kommenden Monaten geplant.
Informationen über MESUPRON(R) und das uPA-Programm
Der uPA-Inhibitor MESUPRON(R) (INN: Upamostat) hemmt das Urokinase Plasminogen Aktivator (uPA)-System. 2014 wurden die Rechte zur Entwicklung und Kommerzialisierung von MESUPRON(R) an Link Health Co., Guangzhou, China, für die Region China, Hong Kong, Taiwan und Macao auslizenziert. Grundlage dafür waren Daten aus zwei Phase IIa-Studien in den Indikationen lokal-fortgeschrittener Bauchspeicheldrüsenkrebs (2010) und metastasierter Brustkrebs (2012), die Sicherheit und Aktivität des Medikamentenkandidaten in Kombination mit Chemotherapeutika gezeigt haben. Das Wirkprinzip des MESUPRON(R) könnte einen neuen Behandlungsansatz durch spezifische Blockierung der Metastasierung bei soliden Tumoren bilden.
eidelberg Pharma AG: Heidelberg Pharma erhält Meilensteinzahlung vom Partner Link Health
DGAP-News: Heidelberg Pharma AG / Schlagwort(e): Kooperation
22.01.2019 / 07:02
Für den Inhalt der Mitteilung ist der Emittent / Herausgeber verantwortlich.
PRESSEMELDUNG
Heidelberg Pharma erhält Meilensteinzahlung vom Partner Link Health
Ladenburg, 22. Januar 2019 - Die Heidelberg Pharma AG (FWB: WL6) gab heute bekannt, dass sie von ihrem Kooperationspartner Link Health Co., Guangzhou, China, eine Meilensteinzahlung erhalten hat. Hintergrund ist die Genehmigung der chinesischen Behörde für Lebensmittel- und Arzneimittelsicherheit (National Medical Product Administration - NMPA) für die Durchführung von klinischen Studien mit dem Produktkandidaten MESUPRON(R).
Die Genehmigung erfolgte nach den neuen Regularien der NMPA, welche eine Nutzung der Sicherheitsdaten aus den früheren Studien mit MESUPRON(R) zulassen und damit unmittelbar die Durchführung einer Phase II-Studie möglich machen können. Aufgrund der neuen regulatorischen Situation muss dazu aber eine Überarbeitung des klinischen Studienprotokolls durch Link Health erfolgen. Diese ist in den kommenden Monaten geplant.
Informationen über MESUPRON(R) und das uPA-Programm
Der uPA-Inhibitor MESUPRON(R) (INN: Upamostat) hemmt das Urokinase Plasminogen Aktivator (uPA)-System. 2014 wurden die Rechte zur Entwicklung und Kommerzialisierung von MESUPRON(R) an Link Health Co., Guangzhou, China, für die Region China, Hong Kong, Taiwan und Macao auslizenziert. Grundlage dafür waren Daten aus zwei Phase IIa-Studien in den Indikationen lokal-fortgeschrittener Bauchspeicheldrüsenkrebs (2010) und metastasierter Brustkrebs (2012), die Sicherheit und Aktivität des Medikamentenkandidaten in Kombination mit Chemotherapeutika gezeigt haben. Das Wirkprinzip des MESUPRON(R) könnte einen neuen Behandlungsansatz durch spezifische Blockierung der Metastasierung bei soliden Tumoren bilden.
Über Heidelberg Pharma
Die Heidelberg Pharma AG ist ein biopharmazeutisches Unternehmen mit Sitz in Ladenburg. Heidelberg Pharma ist auf Onkologie spezialisiert und das erste Unternehmen, das den Wirkstoff Amanitin für die Verwendung bei Krebstherapien einsetzt und entwickelt. Dafür verwendet das Unternehmen seine innovative ATAC-Technologie (Antibody Targeted Amanitin Conjugates) und nutzt den biologischen Wirkmechanismus des Toxins als neues therapeutisches Prinzip. Diese proprietäre Technologieplattform wird für die Entwicklung eigener therapeutischer Antikörper-Amanitin-Konjugate sowie im Rahmen von Kooperationen mit externen Partnern eingesetzt, um eine Vielzahl von ATAC-Kandidaten zu erzeugen. Der am weitesten fortgeschrittene eigene Produktkandidat HDP-101 ist ein BCMA-ATAC für die Indikation Multiples Myelom.
Die Heidelberg Pharma AG hat die klinischen Produktkandidaten MESUPRON(R) und REDECTANE(R) zur Weiterentwicklung und Kommerzialisierung verpartnert. Das Unternehmen ist an der Frankfurter Wertpapierbörse notiert: ISIN DE000A11QVV0 / WKN A11QVV / Symbol WL6. Weitere Informationen finden Sie unter http://www.heidelberg-pharma.com/.
Über Link Health Group
Link Health ist ein führendes chinesisches Pharmaunternehmen mit Sitz in Südchina, das sich auf die Entwicklung innovativer Medikamente mit hohem medizinischen Bedarf konzentriert.
Link Health hat ein hochprofessionelles Team mit vielfältiger Expertise in den Bereichen Arzneimittelentwicklung, medizinische Angelegenheiten und Zulassungsfragen zusammengestellt. Link Health verfügt über ein tiefes Verständnis des chinesischen Marktes, ein günstiges regulatorisches Umfeld und ein starkes Netzwerk mit globalen biopharmazeutischen Unternehmen und ist gut positioniert, um innovative Medikamente effizient auf den Markt zu bringen. Mehr Informationen unter: http://www.healthinlink.com.
Kontakt
Heidelberg Pharma AG
Sylvia Wimmer
Tel.: +49 89 41 31 38-29
E-Mail: investors[at]hdpharma.com
Schriesheimer Str. 101, 68526 Ladenburg IR/PR-Unterstützung
MC Services AG
Katja Arnold (CIRO)
Managing Director & Partner
Tel.: +49 89 210 228-40
E-Mail: katja.arnold[at]mc-services.eu
DGAP-News: Heidelberg Pharma AG / Schlagwort(e): Kooperation
22.01.2019 / 07:02
Für den Inhalt der Mitteilung ist der Emittent / Herausgeber verantwortlich.
PRESSEMELDUNG
Heidelberg Pharma erhält Meilensteinzahlung vom Partner Link Health
Ladenburg, 22. Januar 2019 - Die Heidelberg Pharma AG (FWB: WL6) gab heute bekannt, dass sie von ihrem Kooperationspartner Link Health Co., Guangzhou, China, eine Meilensteinzahlung erhalten hat. Hintergrund ist die Genehmigung der chinesischen Behörde für Lebensmittel- und Arzneimittelsicherheit (National Medical Product Administration - NMPA) für die Durchführung von klinischen Studien mit dem Produktkandidaten MESUPRON(R).
Die Genehmigung erfolgte nach den neuen Regularien der NMPA, welche eine Nutzung der Sicherheitsdaten aus den früheren Studien mit MESUPRON(R) zulassen und damit unmittelbar die Durchführung einer Phase II-Studie möglich machen können. Aufgrund der neuen regulatorischen Situation muss dazu aber eine Überarbeitung des klinischen Studienprotokolls durch Link Health erfolgen. Diese ist in den kommenden Monaten geplant.
Informationen über MESUPRON(R) und das uPA-Programm
Der uPA-Inhibitor MESUPRON(R) (INN: Upamostat) hemmt das Urokinase Plasminogen Aktivator (uPA)-System. 2014 wurden die Rechte zur Entwicklung und Kommerzialisierung von MESUPRON(R) an Link Health Co., Guangzhou, China, für die Region China, Hong Kong, Taiwan und Macao auslizenziert. Grundlage dafür waren Daten aus zwei Phase IIa-Studien in den Indikationen lokal-fortgeschrittener Bauchspeicheldrüsenkrebs (2010) und metastasierter Brustkrebs (2012), die Sicherheit und Aktivität des Medikamentenkandidaten in Kombination mit Chemotherapeutika gezeigt haben. Das Wirkprinzip des MESUPRON(R) könnte einen neuen Behandlungsansatz durch spezifische Blockierung der Metastasierung bei soliden Tumoren bilden.
Über Heidelberg Pharma
Die Heidelberg Pharma AG ist ein biopharmazeutisches Unternehmen mit Sitz in Ladenburg. Heidelberg Pharma ist auf Onkologie spezialisiert und das erste Unternehmen, das den Wirkstoff Amanitin für die Verwendung bei Krebstherapien einsetzt und entwickelt. Dafür verwendet das Unternehmen seine innovative ATAC-Technologie (Antibody Targeted Amanitin Conjugates) und nutzt den biologischen Wirkmechanismus des Toxins als neues therapeutisches Prinzip. Diese proprietäre Technologieplattform wird für die Entwicklung eigener therapeutischer Antikörper-Amanitin-Konjugate sowie im Rahmen von Kooperationen mit externen Partnern eingesetzt, um eine Vielzahl von ATAC-Kandidaten zu erzeugen. Der am weitesten fortgeschrittene eigene Produktkandidat HDP-101 ist ein BCMA-ATAC für die Indikation Multiples Myelom.
Die Heidelberg Pharma AG hat die klinischen Produktkandidaten MESUPRON(R) und REDECTANE(R) zur Weiterentwicklung und Kommerzialisierung verpartnert. Das Unternehmen ist an der Frankfurter Wertpapierbörse notiert: ISIN DE000A11QVV0 / WKN A11QVV / Symbol WL6. Weitere Informationen finden Sie unter http://www.heidelberg-pharma.com/.
Über Link Health Group
Link Health ist ein führendes chinesisches Pharmaunternehmen mit Sitz in Südchina, das sich auf die Entwicklung innovativer Medikamente mit hohem medizinischen Bedarf konzentriert.
Link Health hat ein hochprofessionelles Team mit vielfältiger Expertise in den Bereichen Arzneimittelentwicklung, medizinische Angelegenheiten und Zulassungsfragen zusammengestellt. Link Health verfügt über ein tiefes Verständnis des chinesischen Marktes, ein günstiges regulatorisches Umfeld und ein starkes Netzwerk mit globalen biopharmazeutischen Unternehmen und ist gut positioniert, um innovative Medikamente effizient auf den Markt zu bringen. Mehr Informationen unter: http://www.healthinlink.com.
Kontakt
Heidelberg Pharma AG
Sylvia Wimmer
Tel.: +49 89 41 31 38-29
E-Mail: investors[at]hdpharma.com
Schriesheimer Str. 101, 68526 Ladenburg IR/PR-Unterstützung
MC Services AG
Katja Arnold (CIRO)
Managing Director & Partner
Tel.: +49 89 210 228-40
E-Mail: katja.arnold[at]mc-services.eu
Antwort auf Beitrag Nr.: 59.680.635 von BICYPAPA am 22.01.19 07:21:18
Mesupron ist in China an Link Health auslizensiert.
http://heidelberg-pharma.com/wp-content/uploads/2014/03/2014…" target="_blank" rel="nofollow ugc noopener">http://heidelberg-pharma.com/wp-content/uploads/2014/03/2014…
Für die Entwicklung sind 7 Millionen Euro an Milestones vereinbart. Die Umsatzbeteiligung beträgt einen mittleren einstelligen Prozentbereich, der nach Umsätzen gestaffelt ist.
Für alle restlichen Gebiete ist Redhill der Lizenznehmer für Mesupron. Die Gestaltung ist hier anders wie bei Link Heath. Es wurde eine enorm hohe Umsatzbeteiligung von etwa 15- 30% vereinbart.
http://heidelberg-pharma.com/wp-content/uploads/2014/06/2014…
Vereinbarungen zu Mesupron
Nach der positiven Meldung zu Mesupron Möchte ich doch kurz die wichtigsten Eckdaten zusammen fassen. Nach der Meldung gestern werde ich Mesupron nun auch mehr Aufmerksamkeit schenken.Mesupron ist in China an Link Health auslizensiert.
http://heidelberg-pharma.com/wp-content/uploads/2014/03/2014…" target="_blank" rel="nofollow ugc noopener">http://heidelberg-pharma.com/wp-content/uploads/2014/03/2014…
Für die Entwicklung sind 7 Millionen Euro an Milestones vereinbart. Die Umsatzbeteiligung beträgt einen mittleren einstelligen Prozentbereich, der nach Umsätzen gestaffelt ist.
Für alle restlichen Gebiete ist Redhill der Lizenznehmer für Mesupron. Die Gestaltung ist hier anders wie bei Link Heath. Es wurde eine enorm hohe Umsatzbeteiligung von etwa 15- 30% vereinbart.
http://heidelberg-pharma.com/wp-content/uploads/2014/06/2014…
Antwort auf Beitrag Nr.: 59.689.761 von BICYPAPA am 23.01.19 07:14:11
The Company held cash reserves of $25.668 million at the end of December. Cash outflows relating to operating expenses were $8.503 million, with total spend on direct R&D activities of $5.123 million. Cash outflows from investing activities at $3.672 million include $3.219 million as the cash element of the upfront consideration for the acquisition of Belgium-based Advanced Nuclear Medicine Ingredients (ANMI) SA, which completed on 24 December 2018. Significant activities during the quarter included:
• Scale-up of manufacturing of the 68Ga-PSMA illumetTM cold kit in preparation for US product launch (as an investigational product)
• Conclusion of a distribution agreement with Cardinal Health for the pharmacy preparation and distribution of the 68Ga-PSMA cold kit developed by ANMI SA and commercialised for the US market by Telix USA
• Entering into a strategic collaboration with GenesisCare Pty Ltd in relation to radiation oncology studies as part of Telix’s global multi-centre trials in neuro-oncology and urologic oncology
• Extension of a service agreement with Cyclotek (Aust) Pty Ltd to include TLX250-CDx for imaging patients with clear cell renal cell cancer (ccRCC) using PET
• Completion of the ZIR-DOSE dosimetry bridging study (renal cancer imaging with TLX250-CDx), which demonstrated that the Company’s change of isotope resulted in a meaningfully lower patient radiation dose
• Commencement of the ZIRCON Phase III study in Europe and Australia for TLX250CDx (renal cancer)
• Collaboration with Nihon Medi-Physics Co, a leading manufacturer and supplier of radiopharmaceuticals in Japan, for the feasibility of 225Ac-labeled (actinium) antibodies for the treatment of clear-cell renal cell cancer (ccRCC)
• Completion of first and second stage consultations with the Japanese Pharmaceuticals and Medical Devices Agency (PMDA) for a Phase I/II study of 89Zr-girentuximab (TLX250-CDx) in Japan
• Decision to progress TLX591 to Phase III as the result of data analysis of huJ591 data following the completion of the acquisition of Atlab (September ’18)
• The appointment of Nannette Rich, an experienced executive with a track record of product launch in the nuclear medicine field, as Vice President of Sales & Marketing focussed on the development of Telix’s commercial sales footprint in the US
• Sales of illumetTM (prostate imaging kit) commenced in December 2018
TLX-250 Telix Update
31st January 2019. Telix Pharmaceuticals Limited (ASX:TLX) (“Telix”, the “Company”), a clinical-stage biopharmaceutical company focused on the development of diagnostic and therapeutic products based on targeted radiopharmaceuticals or “molecularlytargeted radiation” (“MTR”), today releases its Appendix 4C for the December 2018 quarter.The Company held cash reserves of $25.668 million at the end of December. Cash outflows relating to operating expenses were $8.503 million, with total spend on direct R&D activities of $5.123 million. Cash outflows from investing activities at $3.672 million include $3.219 million as the cash element of the upfront consideration for the acquisition of Belgium-based Advanced Nuclear Medicine Ingredients (ANMI) SA, which completed on 24 December 2018. Significant activities during the quarter included:
• Scale-up of manufacturing of the 68Ga-PSMA illumetTM cold kit in preparation for US product launch (as an investigational product)
• Conclusion of a distribution agreement with Cardinal Health for the pharmacy preparation and distribution of the 68Ga-PSMA cold kit developed by ANMI SA and commercialised for the US market by Telix USA
• Entering into a strategic collaboration with GenesisCare Pty Ltd in relation to radiation oncology studies as part of Telix’s global multi-centre trials in neuro-oncology and urologic oncology
• Extension of a service agreement with Cyclotek (Aust) Pty Ltd to include TLX250-CDx for imaging patients with clear cell renal cell cancer (ccRCC) using PET
• Completion of the ZIR-DOSE dosimetry bridging study (renal cancer imaging with TLX250-CDx), which demonstrated that the Company’s change of isotope resulted in a meaningfully lower patient radiation dose
• Commencement of the ZIRCON Phase III study in Europe and Australia for TLX250CDx (renal cancer)
• Collaboration with Nihon Medi-Physics Co, a leading manufacturer and supplier of radiopharmaceuticals in Japan, for the feasibility of 225Ac-labeled (actinium) antibodies for the treatment of clear-cell renal cell cancer (ccRCC)
• Completion of first and second stage consultations with the Japanese Pharmaceuticals and Medical Devices Agency (PMDA) for a Phase I/II study of 89Zr-girentuximab (TLX250-CDx) in Japan
• Decision to progress TLX591 to Phase III as the result of data analysis of huJ591 data following the completion of the acquisition of Atlab (September ’18)
• The appointment of Nannette Rich, an experienced executive with a track record of product launch in the nuclear medicine field, as Vice President of Sales & Marketing focussed on the development of Telix’s commercial sales footprint in the US
• Sales of illumetTM (prostate imaging kit) commenced in December 2018
Antwort auf Beitrag Nr.: 59.763.369 von BICYPAPA am 01.02.19 07:15:11
Abstract: https://www.ncbi.nlm.nih.gov/pubmed/30703342
Near-comprehensive resequencing of cancer-associated genes in surgically resected metastatic liver tumors of gastric cancer.
Ikari N1, Serizawa A2, Mitani S3, Yamamoto M2, Furukawa T4.
Author information
Abstract
Liver metastasis is a major cause of death in patients with gastric cancer. We evaluated molecular alterations in clinically resected liver metastases of gastric cancer to identify candidate biomarkers and therapeutic targets. Seventy-four patients, including 37 with liver metastasis that underwent gastrectomy and hepatectomy for gastric cancer and 37 without liver metastasis that underwent gastrectomy for gastric cancer, were studied. Next-generation resequencing was performed for 412 cancer-associated genes in metastatic and/or primary tumors from 30 patients and somatic mutations in TP53, LRP1B, PIK3CA, ADAMTS20, PAX7, FN1, FOXO3, WRN, PTEN, ETV4, and RNF213 were found in metastatic tumors. TP53 mutations were studied by Sanger sequencing in remaining patients; the number of patients with TP53 mutations in metastatic tumors was significantly higher among those with liver metastasis (86.5%, 32/37) versus those without liver metastasis (40.5%; 15/37) (P < 0.0001). TP53 mutations in metastatic liver tumors and corresponding primary tumors were identical in 96.9% (31/32), including some patients with heterogeneous primary tumor components. Immunohistochemical analyses showed aberrant p53 expression in tumors with TP53 mutations. In silico functional evaluations indicated functional loss of missense-mutated TP53. Thus, p53 pathway may facilitate the development of biomarkers and therapeutic approaches to treat gastric cancer metastases to the liver.
Prognostischer Biomarker p 53
HP arbeitet zur Zeit an einem prognostischen Biomarker um die Patientgruppe mit p 53 Merkmalen zu erfassen. Hierzu werden in Abstracts immer mehr Anwendungsgebiete angesprochen. Es scheint ein Arbeitsfeld mit einem sehr beträchlichen Umfang und damit auch Potential für HP und seiner Amanitin Behandlungsmöglichkeit zu sein. Abstract: https://www.ncbi.nlm.nih.gov/pubmed/30703342
Near-comprehensive resequencing of cancer-associated genes in surgically resected metastatic liver tumors of gastric cancer.
Ikari N1, Serizawa A2, Mitani S3, Yamamoto M2, Furukawa T4.
Author information
Abstract
Liver metastasis is a major cause of death in patients with gastric cancer. We evaluated molecular alterations in clinically resected liver metastases of gastric cancer to identify candidate biomarkers and therapeutic targets. Seventy-four patients, including 37 with liver metastasis that underwent gastrectomy and hepatectomy for gastric cancer and 37 without liver metastasis that underwent gastrectomy for gastric cancer, were studied. Next-generation resequencing was performed for 412 cancer-associated genes in metastatic and/or primary tumors from 30 patients and somatic mutations in TP53, LRP1B, PIK3CA, ADAMTS20, PAX7, FN1, FOXO3, WRN, PTEN, ETV4, and RNF213 were found in metastatic tumors. TP53 mutations were studied by Sanger sequencing in remaining patients; the number of patients with TP53 mutations in metastatic tumors was significantly higher among those with liver metastasis (86.5%, 32/37) versus those without liver metastasis (40.5%; 15/37) (P < 0.0001). TP53 mutations in metastatic liver tumors and corresponding primary tumors were identical in 96.9% (31/32), including some patients with heterogeneous primary tumor components. Immunohistochemical analyses showed aberrant p53 expression in tumors with TP53 mutations. In silico functional evaluations indicated functional loss of missense-mutated TP53. Thus, p53 pathway may facilitate the development of biomarkers and therapeutic approaches to treat gastric cancer metastases to the liver.
Antwort auf Beitrag Nr.: 59.766.342 von BICYPAPA am 01.02.19 12:23:50
https://www.nature.com/articles/s41467-018-08201-x.epdf?shar…
Magenta Artikel
Ausführlicher Magenta Artikel brandneu zum CD117 ADChttps://www.nature.com/articles/s41467-018-08201-x.epdf?shar…
Antwort auf Beitrag Nr.: 59.809.719 von BICYPAPA am 06.02.19 22:12:38
Als Suchbegriff bitte Magenta Therapeutics angeben.
https://patentscope.wipo.int/search/de/search.jsf
Patentanmeldungen Magenta
Weitere Patentanmeldungen durch Magenta Therapeutics, die CD117 und unter Anderem CD45 adressieren. Somit scheint es nun doch sehr wahrscheinlich, dass in nächster Zeit Magenta von seiner Zweiten Option Gebrauch machen wird. Aus den eigenen Pipelinebezeichnungen sind das die Wirkstoffe C200 und C100.Als Suchbegriff bitte Magenta Therapeutics angeben.
https://patentscope.wipo.int/search/de/search.jsf
Verhältnismäßig hohe Umsätze heute. Gelingt nun endlich der Ausbruch über die 3-Euro-Marke...? 🙄
Antwort auf Beitrag Nr.: 59.857.678 von BICYPAPA am 12.02.19 22:03:24
Eine ganze Seite wird Heidelberg Pharma mit den wichtigsten Aspekten gewidmet. Wenn man die Empfehlung so liest meint man, man könnte Heidelberg Pharma 4 oder mehr Seiten widmen, um nur die wichtigsten Aspekte anzusprechen. So vielseitig ist mittlerweile die Pipeline mit erfolgversprechenden Wirkstoffen in Eigenregie aber auch schon an mehrere Partner auslizensiert geworden.
Deshalb empfehle ich allen Lesern hier im Board nach den Fakten ein wenig zu stöbern. Es wird sich bestimmt lohnen. Es ist eine gelungene Vorstellung, der ich aber bedeutend mehr Platz geboten hätte.
Damit erklärt sich auch der Anstieg von Gestern und die gestiegenen Umsätze. €uro ist eine Monatszeitung und wurde erst heute ausgeliefert. Deshalb rechne ich mit einer längeren Phase, an der HP im Fokus steht.
€uro Empfehlung für Heidelberg Pharma
Heute wir in der Monatausgabe von €uro Heidelberg Pharma von Börsenfux Jörg Lang empfohlen. Das Kursziel wird mit 5€ angegeben.Eine ganze Seite wird Heidelberg Pharma mit den wichtigsten Aspekten gewidmet. Wenn man die Empfehlung so liest meint man, man könnte Heidelberg Pharma 4 oder mehr Seiten widmen, um nur die wichtigsten Aspekte anzusprechen. So vielseitig ist mittlerweile die Pipeline mit erfolgversprechenden Wirkstoffen in Eigenregie aber auch schon an mehrere Partner auslizensiert geworden.
Deshalb empfehle ich allen Lesern hier im Board nach den Fakten ein wenig zu stöbern. Es wird sich bestimmt lohnen. Es ist eine gelungene Vorstellung, der ich aber bedeutend mehr Platz geboten hätte.
Damit erklärt sich auch der Anstieg von Gestern und die gestiegenen Umsätze. €uro ist eine Monatszeitung und wurde erst heute ausgeliefert. Deshalb rechne ich mit einer längeren Phase, an der HP im Fokus steht.
Antwort auf Beitrag Nr.: 59.931.623 von BICYPAPA am 21.02.19 13:36:43
https://clinicaltrials.gov/ct2/show/NCT03849118?term=telix&r…
TLX-250 Studie
Die Telix TLX250 Studie ist nun offiziell bei Clinical Trials in den USA gelistet. Damit dürfte sie offiziell genehmigt sein. Nache meinem Kenntnisstand löst dies eine Milestonezahlung an HP aus. Ich kann wohl nicht sagen ob diese Studie auch gleichzeitig für Europa gilt. Wir werden es rausfinden.https://clinicaltrials.gov/ct2/show/NCT03849118?term=telix&r…
Antwort auf Beitrag Nr.: 59.935.622 von BICYPAPA am 21.02.19 18:58:00.....grade solche news wie diese haben mich dazu bewogen hier mit einzusteigen . danke bicypapa für deine unendliche mühe uns hiermit bestens zu versorgen , um uns immer auf dem entsprechendem level halten zu können . kleinere bio-tech-schmieden benötigen dringlichst positive news um die anleger bei laune zu halten und dafür sehe ich die H PH für das jahr 2019 bestens geeignet um in absehbarer zeit bei der FDA vorstellig zu werden......allen viel glück.....
Antwort auf Beitrag Nr.: 59.939.833 von herthafan am 22.02.19 10:08:37Hallo Hertha, auch hier. Schließe mich dem Lob für Bicypapa an. Obwohl ich eigentlich ziemlich euphorisch bin bei HDP wird das mit der FDA noch etwas dauern bis es da etwas zuzulassen gibt. Les mal den Bericht im €uro Heft 3/19 oder das letzte Interview vom CEO Schmidt-Brand. Dann bist du im Bild.
Das passt hier sehr gut zusammen,Magenta steigt ebenfalls wie HDH seit Jahresbeginn an ...denke mal das wir hier 2019 noch viel Freude haben .
Beste Grüße
KS
Beste Grüße
KS
Antwort auf Beitrag Nr.: 59.939.833 von herthafan am 22.02.19 10:08:37
Ich habe meine Informationen noch mal durchgearbeitet und versuche mich gerade an einer neuen Fassung.
Sie ist sehr umfangreich und wird deshalb wahrscheinlich in 4 Teilen im Abstand von zwei drei Tagen veröffentlicht. Der erste Teil wird wohl jetzt Dienstag erscheinen. In großen Teilen ist die Analyse schon fertig. Doch für einige Detailfragen muss ich noch etwas recherchieren und noch ein wenig formulieren.
Ich wollte euch schon mal ein wenig auf die Folter spannen und mache deshalb jetzt schon mal diese Ankündigung
Heidelberg Pharma Analyse
Vor einigen Tagen gabe es einen sehr guten Artikel in der Zeitschrift €uro. Es gab eigentlich nichts zu kritisieren. Mein Einwand ging aber dahin, dass Heidelberg Pharma mit all seinen Projekten jetzt mindestens vier Seiten verdient hätte. Und genau das mache ich gerade. Deshalb möchte ich schon mal meine neue Analyse ankündigen. Ich habe meine Informationen noch mal durchgearbeitet und versuche mich gerade an einer neuen Fassung.
Sie ist sehr umfangreich und wird deshalb wahrscheinlich in 4 Teilen im Abstand von zwei drei Tagen veröffentlicht. Der erste Teil wird wohl jetzt Dienstag erscheinen. In großen Teilen ist die Analyse schon fertig. Doch für einige Detailfragen muss ich noch etwas recherchieren und noch ein wenig formulieren.
Ich wollte euch schon mal ein wenig auf die Folter spannen und mache deshalb jetzt schon mal diese Ankündigung
Antwort auf Beitrag Nr.: 59.984.413 von BICYPAPA am 28.02.19 10:52:47Super. Bin gespannt. Besten Dank im Voraus.
Antwort auf Beitrag Nr.: 59.984.413 von BICYPAPA am 28.02.19 10:52:47......noch einmal tausend mal sei dank gesagt für deine mühen . zahlt sich mit bestimmtheit irgendwann aus , wenn nicht in 2019 dann eben im nächsten jahr , und wie schon des öfteren gesagt.......was ist schon ein jahr , besonders an der börse....!!!!!
Antwort auf Beitrag Nr.: 59.987.695 von herthafan am 28.02.19 16:26:40
Guten Morgen,
schließe mich deinem Dank an BICYPAPA sehr gerne an
@BICYPAPA: aber dein Kursziel auf 12/18 Monatssicht kannst Du doch schon einmal preisgeben, oder?
Beste Brüße
up
Zitat von herthafan: ......noch einmal tausend mal sei dank gesagt für deine mühen . zahlt sich mit bestimmtheit irgendwann aus , wenn nicht in 2019 dann eben im nächsten jahr , und wie schon des öfteren gesagt.......was ist schon ein jahr , besonders an der börse....!!!!!
Guten Morgen,
schließe mich deinem Dank an BICYPAPA sehr gerne an

@BICYPAPA: aber dein Kursziel auf 12/18 Monatssicht kannst Du doch schon einmal preisgeben, oder?

Beste Brüße
up
Antwort auf Beitrag Nr.: 59.992.648 von upanddown1 am 01.03.19 08:04:36
Prognosen sind.
Prognosen sind immer schwer. Besonders wenn sie in der Zukunft liegen. Ich werde auch eine kleine Einschätzung zu meinem langfristigen Kursziel machen. Das ist Bestandteil meiner Analyse.
Magenta Therapeutics (HDP's Kunde) rockt! +14.57% gestern, +263% YTD.
Antwort auf Beitrag Nr.: 60.003.022 von Lidenbrock am 02.03.19 09:18:33Ja, aber wegen einer erfolgreichen Studie mit einem Kandidaten der nichts mit den HDP- Molekülen zu tun hat.
Antwort auf Beitrag Nr.: 60.003.490 von Mogli3 am 02.03.19 11:07:02würde nicht unbedingt so sehen...
am 25.2 hat MGTA Daten zum Lead Program MGTA-456 (HDP ist nicht dabei)
https://investor.magentatx.com/news-releases/news-release-de…
UND Daten zum C100 und C200 Programs (mit HDP)
https://investor.magentatx.com/news-releases/news-release-de…
am 25.2 hat MGTA Daten zum Lead Program MGTA-456 (HDP ist nicht dabei)
https://investor.magentatx.com/news-releases/news-release-de…
UND Daten zum C100 und C200 Programs (mit HDP)
https://investor.magentatx.com/news-releases/news-release-de…
publiziert.
Antwort auf Beitrag Nr.: 60.003.946 von Lidenbrock am 02.03.19 12:17:27Ja ich weiß schon. Der Kurs ist ja in den letzten 8 Monaten tief gefallen und hat wieder angezogen. Einen richtigen Schub gab es dann mit den Daten zu 456.
Antwort auf Beitrag Nr.: 59.984.413 von BICYPAPA am 28.02.19 10:52:47
1. Was ist ATAC-ADC Amanitin
2. Die eigene Pipeline mit dem Hauptentwicklungskandidaten HDP-101
3. Der TP53 Biomarker und Zusammenarbeit mit dem MD Anderson Cancer Center
ATAC-ADC-Amanitin:
Heidelberg Pharma entwickelt das Gift des Knollenblätterpilzes Amanitin zu einem toxischen Wirkstoff gegen Krebszellen. Als Börsianer ist man ja immer auf der Suche nach Alleinstellungsmerkmalen einer Firma, die dann letztendlich den Erfolg dieser Firma ausmachen. Herkömmliche Krebswirkstoffe bekämpfen in der Regel die sich schnell teilenden Zellen und versuchen so das Fortschreiten der Krankheit zu verhindern. Mit dem ATAC Ansatz Antibody Targeted Amanitin Conjugates scheint Heidelberg Pharma dieses Alleinstellungsmerkmal gelungen. Während nach einer gewissen Zeit bei den anderen Behandlungsansätzen die Metastasierung und Wiedererkrankung weiter fortschreitet, bekämpft Amanitin auch die ruhenden Krebszellen, die bei der Wiedererkrankung eine große Rolle spielen können. Amanitin bekämpft also die ruhenden und die sich teilenden Krebszellen. Es besitzt demnach die Fähigkeit Resistenzen zu durchbrechen. Bisher konnte HP in vivo und in vitro diese Eigenschaften mit großem Erfolg unter Beweis stellen.
Ich möchte gar nicht so sehr ins wissenschaftliche gehen, doch möchte ich kurz diesen ADC Wirkstoff erklären. Es gibt einen Antikörper bei dem mit einem Linker der Amanitinwirkstoff verbunden ist. Dieser ADC Antikörper mit dem Amanitin wandert zu der Krebszelle, die er anhand gewisser Merkmale erkennt. Er schleust sich in die Zelle ein und lädt den Giftstoff Amanitin in dieser Zelle ab, die dann durch den besonderen Wirkmechanismus die Krebszelle zerstört. Und dies wie oben erwähnt soll dies bei sich teilenden aber auch bei den ruhenden Krebszellen geschehen. Und das ist das besondere Alleinstellungsmerkmal bei den ATAC Wirkstoffen.
Eigene Pipeline mit dem Hauptentwicklungskandidaten ATAC HDP-101:
ATAC-ADC-Pipeline:
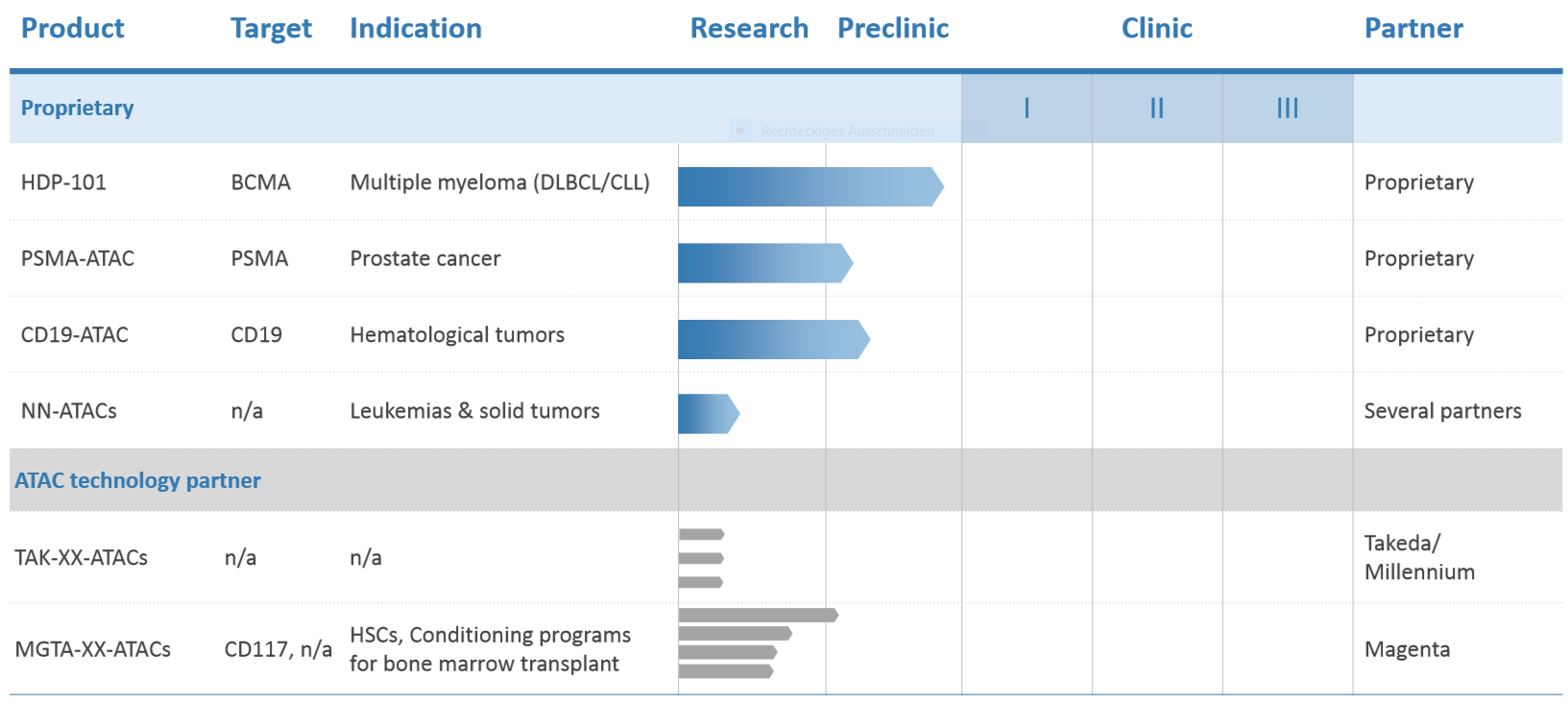
Heidelberg Pharma entwickelt in Eigenregie die Pipeline, wie sie oben im Schaubild angegeben ist. Hauptkandidat dabei ist aber HDP-101, die auch am weitesten in der Entwicklung sind.
HDP-101 soll beim Multiplem Myelom zur Behandlung eingesetzt werden. Das Multiple Myelom ist ein bösartiger Tumor im Knochenmark mit über 70.000 tödlichen Verläufen jährlich.
Nach der Implementierung der Anlage zur industriellen Produktion von Amanitin, hat HP im Dezember toxische Tierstudien gestartet. Die Ergebnisse dürften demnach bald vorliegen. Sie bilden die Basis für die Zulassung der klinischen Studien in Europa aber auch in den USA. Vorbereitende Gespräche mit den Zulassungsbehörden wurden schon geführt. Nach Studienstart dürften wir etwa gut in einem Jahr die ersten Ergebnisse erwarten. Nach meinem jetzigen Kenntnisstand sollte diese als 1b/2a konzipierte Studie noch Ende diesen Jahres starten können.
Vielleicht noch einige Worte zur Konkurrenz. Auf diesem Gebiet tummeln sich etwa 10 Entwickler um diesen tödlichen Tumor zu bekämpfen Viele befinden sich schon in frühen klinischen Phasen. Es wundert nicht, da es sich um eine Indikation handelt, die Einnahmen jenseits der Milliardengrenze verspricht. Was hier so positiv für HP aussieht ist das Alleinstellungsmerkmal, das ich am Anfang genannt habe. Nämlich die Bekämpfung von ruhenden und sich schnell teilenden Zellen. Dies könnte sich noch als riesiger Vorteil erweisen. Natürlich muss dieser Nachweis noch in diesen klinischen Studien erbracht werden.
Mit den zuständigen Zulassungsbehörden wurden die erforderlichen Gespräche aufgenommen und Heidelberg Pharma plant in Q4 diesen Jahres diese klinische Studie zu starten.
Weiterhin hat Heidelberg Pharma die Versuchsreihen mit dem PSMA ATAC gegen Prostatakrebs und mit dem CD19-ATAC gegen verschiedene hämatologische Tumore vorangetrieben. Priorität in der Entwicklung hat allerdings der Kandidat HDP-101
Eine Besonderheit scheint noch folgender Aspekt zu sein Die Wirksamkeit von Amanitin beim Multiplen Myelom, die das Merkmal "17p Deletion: Loss of TP53/POL2RA on chromosome 17" aufweisen. In einer vielbeachteten Präsentation wurde dieser Vortrag auf einer Fachkonferenz durch das University of Texas MD Anderson Cancer Center gehalten. Demnach weist Amanitin gegen diese Patientengruppe eine 10 mal höhere Wirksamkeit auf.
Hierfür entwickelt HP auch einen Biomarker, um diese Patientengruppen zu bestimmen. Diesem TP53 Biomarker werde ich gleich noch ein gesondertes Kapitel widmen.
Zusammenarbeit mit Universität von Texas MD Anderson Cancer Center :
Neben den bekannten Kooperationen arbeitet Heidelberg Pharma noch weltweit mit vielen wichtigen Instituten zusammen. Eine der wichtigsten Partner ist hier wohl das MD Anderson Cancer Center. Diese Zusammenarbeit gipfelt im März letzten Jahres in einer Lizenznahme der Patentrechte für die Diagnose und Behandlung ausgewählter Patientengruppen mit sogenannter RNA Polymerase II-Deletion, auf Basis von gemeinsam mit Heidelberg Pharma generierten Daten. Worum es hier geht wird im nächsten Abschnitt beschrieben.
Prognostischer Biomarker p 53 / RNA Polymerase II:
Forschungsgruppen von MD Anderson und Heidelberg Pharma demonstrierten in präklinischen Studien die außergewöhnlich hohe Wirksamkeit von ATAC-Therapeutika in der Behandlung einer Darmkrebs-Subpopulation, die Veränderungen im Status des Tumorsuppressorgens TP53 aufweist. Dieses Gen hat die Aufgabe, die Tumorbildung in gesunden Zellen zu unterdrücken. Krebszellen verändern ihr Erbgut so, dass diese Schutzfunktion nicht mehr voll ausgeübt werden kann.
In der Forschungskooperation konnte gezeigt werden, dass diese Erbgutveränderung (sog. Hemizygotie) gleichzeitig zu einer deutlich höheren Wirksamkeit der ATACs führt, da in den Krebszellen das Gen des Zielmoleküls des Amanitins (POLR2A, RNA Polymerase II) ebenfalls durch diese Genveränderung verändert wird. Der hemizygote Genstatus von TP53 und POLR2A führt zur verringerten RNA Polymerase II mRNA- und Proteinspiegeln in Tumorzellen und dadurch zu einer signifikant höheren Sensitivität dieser Krebszellen gegenüber ATACs.
In präklinischen In-vitro- und In-vivo-Studien zeigten ATACs eine etwa zehnfach höhere Antitumoraktivität bei Tumoren mit hemizygotem POLR2A Status im Vergleich zu Tumoren mit homozygotem Status. Weitere Daten weisen darauf hin, dass solche genetischen Veränderungen auch bei anderen Tumorarten vorliegen.
Die auf Amanitin basierenden ATACs stellen somit eine vielversprechende therapeutische Strategie für Patienten dar, die an hochresistenten Tumorerkrankungen leiden. In der klinischen Anwendung könnte die Patientenselektion auf Basis des TP53 und POLR2A Genstatus das therapeutische Fenster erweitern und so eine hohe Wirksamkeit bei gleichzeitiger Verringerung der Nebenwirkungen ermöglichen. Nach Ansicht von Heidelberg Pharma wäre das der erste personalisierte Ansatz für ein ADC.
Entwicklung eines Biomarkers für ATACS der TP53 Deletion:
Aufgrund dieser Erkenntnisse die oben beschrieben sind, entwickelt Heidelberg Pharma nun einen Biomarker, um eben diese Patientengruppen zu erfassen. Es vergeht kaum eine Woche, dass hier zu diesem Thema nicht eine Veröffentlichungen in den Fachorganen verbreitet wird. Das Betätigungsfeld für diese Gruppe der Krebserkrankten scheint riesig groß. Für diese Patientengruppen gibt es eine ganz schlechte Prognose. Und in dieses Betätigungsfeld stößt jetzt Heidelberg Pharma mit seiner chancenreichen ATAC Technologie.
Auf der ASH Tagung Ende letzten Jahres wird ein vielbeachteter Vortrag durch das MD Anderson Cancer Center gehalten. "HDP101, a Novel B-Cell Maturation Antigen (BCMA)-Targeted Antibody Conjugated to α-Amanitin, Is Active Against Myeloma with Preferential Efficacy Against Pre-Clinical Models of Deletion 17p"
Gesamter Abstract mit Hintergrund unter folgendem link:
https://ash.confex.com/ash/2018/webprogram/Paper118412.html
Ich muss jetzt noch mal ein wenig ausholen. Normalerweise dauert die Entwicklung eines Medikamentes zwischen 8 und 10 Jahre. Wenn man die vorklinische Phase dazurechnet noch erheblich länger.
Ich habe jetzt beschrieben, dass Heidelberg Pharma mit dem diagnostischen Biomarker und seiner gezeigten Überlegenheit mit den ATAC Wirkstoffen eine riesige Chance für diese Patientengruppe darstellt. Heidelberg Pharma verspricht sich für diese Entwicklung gleich einen Sonderstatus in mehreren Bereichen. Eine "Breakthrough" Therapie für besonders erfolgversprechende neue innovative Medikamente. Und einen "Fast Track" Status für seltene Erkrankungen. Das würde die Entwicklungszeit dieser Kandidaten enorm verkürzen. Rechnet man bei einer normalen Entwicklung etwa mit 10 Jahren, sind bei diesen Verfahren etwa 4-6 Jahre eine realistische Größe.
Veröffentlichung Teil 2:
In Teil 2 werden die Kooperation und weiteren Partnerschaften näher besprochen. Hier schon mal das Inhaltsverzeichnis.
1. ATAC Partnerschaft mit Takeda
2. ATAC Partnerschaft mit Magenta Therapeutics
3. Zusammenarbeit mit Mabvax, Nordic Nanovector und Advanced Proteome Therapeutics
Die Veröffentlichung wird sehr wahrscheinlich am Donnerstag den 7.3. sein.
BICYPAPA Analyse Heidelberg Pharma Teil 1
Dieses ist der erste Teil einer vierteiligen Analyse zu Heidelberg Pharma. Folgende Punkte werden in dem ersten Teil behandelt.1. Was ist ATAC-ADC Amanitin
2. Die eigene Pipeline mit dem Hauptentwicklungskandidaten HDP-101
3. Der TP53 Biomarker und Zusammenarbeit mit dem MD Anderson Cancer Center
ATAC-ADC-Amanitin:
Heidelberg Pharma entwickelt das Gift des Knollenblätterpilzes Amanitin zu einem toxischen Wirkstoff gegen Krebszellen. Als Börsianer ist man ja immer auf der Suche nach Alleinstellungsmerkmalen einer Firma, die dann letztendlich den Erfolg dieser Firma ausmachen. Herkömmliche Krebswirkstoffe bekämpfen in der Regel die sich schnell teilenden Zellen und versuchen so das Fortschreiten der Krankheit zu verhindern. Mit dem ATAC Ansatz Antibody Targeted Amanitin Conjugates scheint Heidelberg Pharma dieses Alleinstellungsmerkmal gelungen. Während nach einer gewissen Zeit bei den anderen Behandlungsansätzen die Metastasierung und Wiedererkrankung weiter fortschreitet, bekämpft Amanitin auch die ruhenden Krebszellen, die bei der Wiedererkrankung eine große Rolle spielen können. Amanitin bekämpft also die ruhenden und die sich teilenden Krebszellen. Es besitzt demnach die Fähigkeit Resistenzen zu durchbrechen. Bisher konnte HP in vivo und in vitro diese Eigenschaften mit großem Erfolg unter Beweis stellen.
Ich möchte gar nicht so sehr ins wissenschaftliche gehen, doch möchte ich kurz diesen ADC Wirkstoff erklären. Es gibt einen Antikörper bei dem mit einem Linker der Amanitinwirkstoff verbunden ist. Dieser ADC Antikörper mit dem Amanitin wandert zu der Krebszelle, die er anhand gewisser Merkmale erkennt. Er schleust sich in die Zelle ein und lädt den Giftstoff Amanitin in dieser Zelle ab, die dann durch den besonderen Wirkmechanismus die Krebszelle zerstört. Und dies wie oben erwähnt soll dies bei sich teilenden aber auch bei den ruhenden Krebszellen geschehen. Und das ist das besondere Alleinstellungsmerkmal bei den ATAC Wirkstoffen.
Eigene Pipeline mit dem Hauptentwicklungskandidaten ATAC HDP-101:
ATAC-ADC-Pipeline:

Heidelberg Pharma entwickelt in Eigenregie die Pipeline, wie sie oben im Schaubild angegeben ist. Hauptkandidat dabei ist aber HDP-101, die auch am weitesten in der Entwicklung sind.
HDP-101 soll beim Multiplem Myelom zur Behandlung eingesetzt werden. Das Multiple Myelom ist ein bösartiger Tumor im Knochenmark mit über 70.000 tödlichen Verläufen jährlich.
Nach der Implementierung der Anlage zur industriellen Produktion von Amanitin, hat HP im Dezember toxische Tierstudien gestartet. Die Ergebnisse dürften demnach bald vorliegen. Sie bilden die Basis für die Zulassung der klinischen Studien in Europa aber auch in den USA. Vorbereitende Gespräche mit den Zulassungsbehörden wurden schon geführt. Nach Studienstart dürften wir etwa gut in einem Jahr die ersten Ergebnisse erwarten. Nach meinem jetzigen Kenntnisstand sollte diese als 1b/2a konzipierte Studie noch Ende diesen Jahres starten können.
Vielleicht noch einige Worte zur Konkurrenz. Auf diesem Gebiet tummeln sich etwa 10 Entwickler um diesen tödlichen Tumor zu bekämpfen Viele befinden sich schon in frühen klinischen Phasen. Es wundert nicht, da es sich um eine Indikation handelt, die Einnahmen jenseits der Milliardengrenze verspricht. Was hier so positiv für HP aussieht ist das Alleinstellungsmerkmal, das ich am Anfang genannt habe. Nämlich die Bekämpfung von ruhenden und sich schnell teilenden Zellen. Dies könnte sich noch als riesiger Vorteil erweisen. Natürlich muss dieser Nachweis noch in diesen klinischen Studien erbracht werden.
Mit den zuständigen Zulassungsbehörden wurden die erforderlichen Gespräche aufgenommen und Heidelberg Pharma plant in Q4 diesen Jahres diese klinische Studie zu starten.
Weiterhin hat Heidelberg Pharma die Versuchsreihen mit dem PSMA ATAC gegen Prostatakrebs und mit dem CD19-ATAC gegen verschiedene hämatologische Tumore vorangetrieben. Priorität in der Entwicklung hat allerdings der Kandidat HDP-101
Eine Besonderheit scheint noch folgender Aspekt zu sein Die Wirksamkeit von Amanitin beim Multiplen Myelom, die das Merkmal "17p Deletion: Loss of TP53/POL2RA on chromosome 17" aufweisen. In einer vielbeachteten Präsentation wurde dieser Vortrag auf einer Fachkonferenz durch das University of Texas MD Anderson Cancer Center gehalten. Demnach weist Amanitin gegen diese Patientengruppe eine 10 mal höhere Wirksamkeit auf.
Hierfür entwickelt HP auch einen Biomarker, um diese Patientengruppen zu bestimmen. Diesem TP53 Biomarker werde ich gleich noch ein gesondertes Kapitel widmen.
Zusammenarbeit mit Universität von Texas MD Anderson Cancer Center :
Neben den bekannten Kooperationen arbeitet Heidelberg Pharma noch weltweit mit vielen wichtigen Instituten zusammen. Eine der wichtigsten Partner ist hier wohl das MD Anderson Cancer Center. Diese Zusammenarbeit gipfelt im März letzten Jahres in einer Lizenznahme der Patentrechte für die Diagnose und Behandlung ausgewählter Patientengruppen mit sogenannter RNA Polymerase II-Deletion, auf Basis von gemeinsam mit Heidelberg Pharma generierten Daten. Worum es hier geht wird im nächsten Abschnitt beschrieben.
Prognostischer Biomarker p 53 / RNA Polymerase II:
Forschungsgruppen von MD Anderson und Heidelberg Pharma demonstrierten in präklinischen Studien die außergewöhnlich hohe Wirksamkeit von ATAC-Therapeutika in der Behandlung einer Darmkrebs-Subpopulation, die Veränderungen im Status des Tumorsuppressorgens TP53 aufweist. Dieses Gen hat die Aufgabe, die Tumorbildung in gesunden Zellen zu unterdrücken. Krebszellen verändern ihr Erbgut so, dass diese Schutzfunktion nicht mehr voll ausgeübt werden kann.
In der Forschungskooperation konnte gezeigt werden, dass diese Erbgutveränderung (sog. Hemizygotie) gleichzeitig zu einer deutlich höheren Wirksamkeit der ATACs führt, da in den Krebszellen das Gen des Zielmoleküls des Amanitins (POLR2A, RNA Polymerase II) ebenfalls durch diese Genveränderung verändert wird. Der hemizygote Genstatus von TP53 und POLR2A führt zur verringerten RNA Polymerase II mRNA- und Proteinspiegeln in Tumorzellen und dadurch zu einer signifikant höheren Sensitivität dieser Krebszellen gegenüber ATACs.
In präklinischen In-vitro- und In-vivo-Studien zeigten ATACs eine etwa zehnfach höhere Antitumoraktivität bei Tumoren mit hemizygotem POLR2A Status im Vergleich zu Tumoren mit homozygotem Status. Weitere Daten weisen darauf hin, dass solche genetischen Veränderungen auch bei anderen Tumorarten vorliegen.
Die auf Amanitin basierenden ATACs stellen somit eine vielversprechende therapeutische Strategie für Patienten dar, die an hochresistenten Tumorerkrankungen leiden. In der klinischen Anwendung könnte die Patientenselektion auf Basis des TP53 und POLR2A Genstatus das therapeutische Fenster erweitern und so eine hohe Wirksamkeit bei gleichzeitiger Verringerung der Nebenwirkungen ermöglichen. Nach Ansicht von Heidelberg Pharma wäre das der erste personalisierte Ansatz für ein ADC.
Entwicklung eines Biomarkers für ATACS der TP53 Deletion:
Aufgrund dieser Erkenntnisse die oben beschrieben sind, entwickelt Heidelberg Pharma nun einen Biomarker, um eben diese Patientengruppen zu erfassen. Es vergeht kaum eine Woche, dass hier zu diesem Thema nicht eine Veröffentlichungen in den Fachorganen verbreitet wird. Das Betätigungsfeld für diese Gruppe der Krebserkrankten scheint riesig groß. Für diese Patientengruppen gibt es eine ganz schlechte Prognose. Und in dieses Betätigungsfeld stößt jetzt Heidelberg Pharma mit seiner chancenreichen ATAC Technologie.
Auf der ASH Tagung Ende letzten Jahres wird ein vielbeachteter Vortrag durch das MD Anderson Cancer Center gehalten. "HDP101, a Novel B-Cell Maturation Antigen (BCMA)-Targeted Antibody Conjugated to α-Amanitin, Is Active Against Myeloma with Preferential Efficacy Against Pre-Clinical Models of Deletion 17p"
Gesamter Abstract mit Hintergrund unter folgendem link:
https://ash.confex.com/ash/2018/webprogram/Paper118412.html
Ich muss jetzt noch mal ein wenig ausholen. Normalerweise dauert die Entwicklung eines Medikamentes zwischen 8 und 10 Jahre. Wenn man die vorklinische Phase dazurechnet noch erheblich länger.
Ich habe jetzt beschrieben, dass Heidelberg Pharma mit dem diagnostischen Biomarker und seiner gezeigten Überlegenheit mit den ATAC Wirkstoffen eine riesige Chance für diese Patientengruppe darstellt. Heidelberg Pharma verspricht sich für diese Entwicklung gleich einen Sonderstatus in mehreren Bereichen. Eine "Breakthrough" Therapie für besonders erfolgversprechende neue innovative Medikamente. Und einen "Fast Track" Status für seltene Erkrankungen. Das würde die Entwicklungszeit dieser Kandidaten enorm verkürzen. Rechnet man bei einer normalen Entwicklung etwa mit 10 Jahren, sind bei diesen Verfahren etwa 4-6 Jahre eine realistische Größe.
Veröffentlichung Teil 2:
In Teil 2 werden die Kooperation und weiteren Partnerschaften näher besprochen. Hier schon mal das Inhaltsverzeichnis.
1. ATAC Partnerschaft mit Takeda
2. ATAC Partnerschaft mit Magenta Therapeutics
3. Zusammenarbeit mit Mabvax, Nordic Nanovector und Advanced Proteome Therapeutics
Die Veröffentlichung wird sehr wahrscheinlich am Donnerstag den 7.3. sein.
Antwort auf Beitrag Nr.: 60.019.874 von BICYPAPA am 05.03.19 04:33:43
Inhaltsverzeichnis:
1. ATAC Partnerschaft mit Takeda
2. ATAC Partnerschaft mit Magenta Therapeutics
3. Zusammenarbeit mit Mabvax, Nordic Nanovector und Advanced Proteome Therapeutics
ATAC Partnerschaft mit Takeda:
Im Juni 2017 schließt Heidelberg Pharma eine erste ATAC Partnerschaft ab. Der Partner ist die Weltfirma Takeda. Die Vereinbarung sieht die Erforschung von 3 Kandidaten Antikörper-Wirkstoff-Konjugaten (Antibody Drug Conjugates – ADCs) mit dem Wirkstoff Amanitin vor.
Es wird ein Optionsmodell gewählt, bei der bei einer Bestätigung pro Entwicklungskandidat eine Zahlung von 113 Millionen USD fällig sind. Nach einer eventuellen positiven Entwicklung sind dann Umsatzbeteiligungen vorgesehen.
Das sind die offiziellen Verlautbarungen zu diesem Abkommen. Hier ist sonst alles sehr geheimnisvoll. Es dringt kein Hinweis nach außen. Weder von Takeda noch von Heidelberg Pharma dringen weitere Einzelheiten an die Öffentlichkeit. Takeda hat aus strategischen Gründen vor einigen Wochen die Firma Shire übernommen, um weitere Synergien zu heben. Deshalb befinden sie sich jetzt in einer Umstrukturierungsphase. Geschäftsfelder müssen neu geordnet und bewertet werden.
Seit dem Abschluss der Vereinbarung mit HP sind nun etwa 18 Monate vergangen. Ich rechne damit, dass hier bald die Entscheidungsprozesse zu einem Wirkstoff anstehen. Dieser Zeitrahmen wurde damals in einem Interview angedeutet. Doch bei Takeda wird zur Zeit, wie oben angedeutet viel umstrukturiert und organisiert. Nach dieser Phase rechne ich dann auch mit einer Entscheidung zu mindestens einer Option.
ATAC Partnerschaft Magenta Therapeutics:
Im März 2018 folgt die zweite große Partnerschaft für die ATAC Technologie. Es handelt sich um Magenta Therapeutics. Diesmal werden bis zu 4 Zielmoleküle als Vorgabe genannt. Die Gesamtsumme für die Bearbeitung der 4 Wirkstoffe beträgt 334 Millionen USD. Bei erfolgreicher Zulassung werden dann noch Umsatzbeteiligungen fällig. Pro Kandidat beträgt die Gebühr 83,5 Millionen USD. Auch hier wird das Optionsmodell gewählt.
Bereits im Oktober 2018 bestätigt Magenta die erste Option.
Magenta Therapeutics ist eine junge Firma, die angetreten die Behandlung von Knochenmarktransplantationen zu revolutionieren. Was geschieht bis jetzt. Die erkrankten Zellen im Knochenmark werden durch eine Chemotherapie zerstört, wobei auch das gesamte Knochenmark weitestgehend zerstört wird. Dieses Verfahren ist sehr belastend für die Patienten und kommt wohl auch nicht für alle Patienten in Frage.
Und genau hierfür bietet sich nun die ATAC Technologie mit ihren ADC Wirkstoffen an. Nämlich ganz gezielt nur die erkrankten Krebszellen zu zerstören. Je nach Erkrankung werden dabei verschiedene Rezeptoren angesprochen. Diese Verfahren nennt man die Vorbereitung für die Transplantation, bei der dann wieder gesunde Zellen eingepflanzt werden. Für die Vorbereitung der Transplantation hat Magenta 3 verschiedene Kandidaten, die je nach Erkrankung zur Anwendung kommen sollen. Es handelt sich um die Wirkstoffe mit der eigenen Bezeichnung C100, C200, und C300. Es wird bei jedem dieser Wirkstoffe ein besonderes Merkmal adressiert.
Für den C200 Wirkstoff hat Magenta bereits die Option ausgeübt. Magenta legt bei der Bearbeitung ihrer Aufgaben ein enormes Tempo vor, dass man hier schon im nächsten Jahr den Übergang in die klinische Phase erwartet. Etwas zeitversetzt sollen dann die anderen Kandidaten folgen.
In neueren Präsentationen von Magenta Therapeutics wird bereits über die weitere Entwicklung von C100 gesprochen. Somit ist es dann nur eine Frage der Zeit, bis hier die nächste Option gezogen wird.
Zur Detailanalyse empfehlen sich dann diese beiden Präsentationen von Magenta zu C100 und C200.
Präsentation zu C100
https://investor.magentatx.com/static-files/14e4aa29-0cef-48…
Präsentation zu C200
https://investor.magentatx.com/static-files/65df0b83-b7c7-43…
Der vierte Kandidat sollte eigentlich geheim sein. Doch es ist gut möglich, dass es sich hier um den Kandidaten G100 handeln könnte. Die Vermutung nährt sich durch eine Patentveröffentlichung bei der bei diesem Kandidaten eine Amanitinbesetzung des Antikörpers in Frage kommen kann. Außerdem Handelt sich nach Magenta Aussagen um einen ADC Kandidaten. Es ist aber jetzt aber noch nicht so wichtig. In Jahresfrist werden wir ja sowieso nähere Einzelheiten hierzu erfahren, da sich alle Projekte sowieso in der Bearbeitung befinden.
Schaubild Magenta Entwicklung C100 und C200:
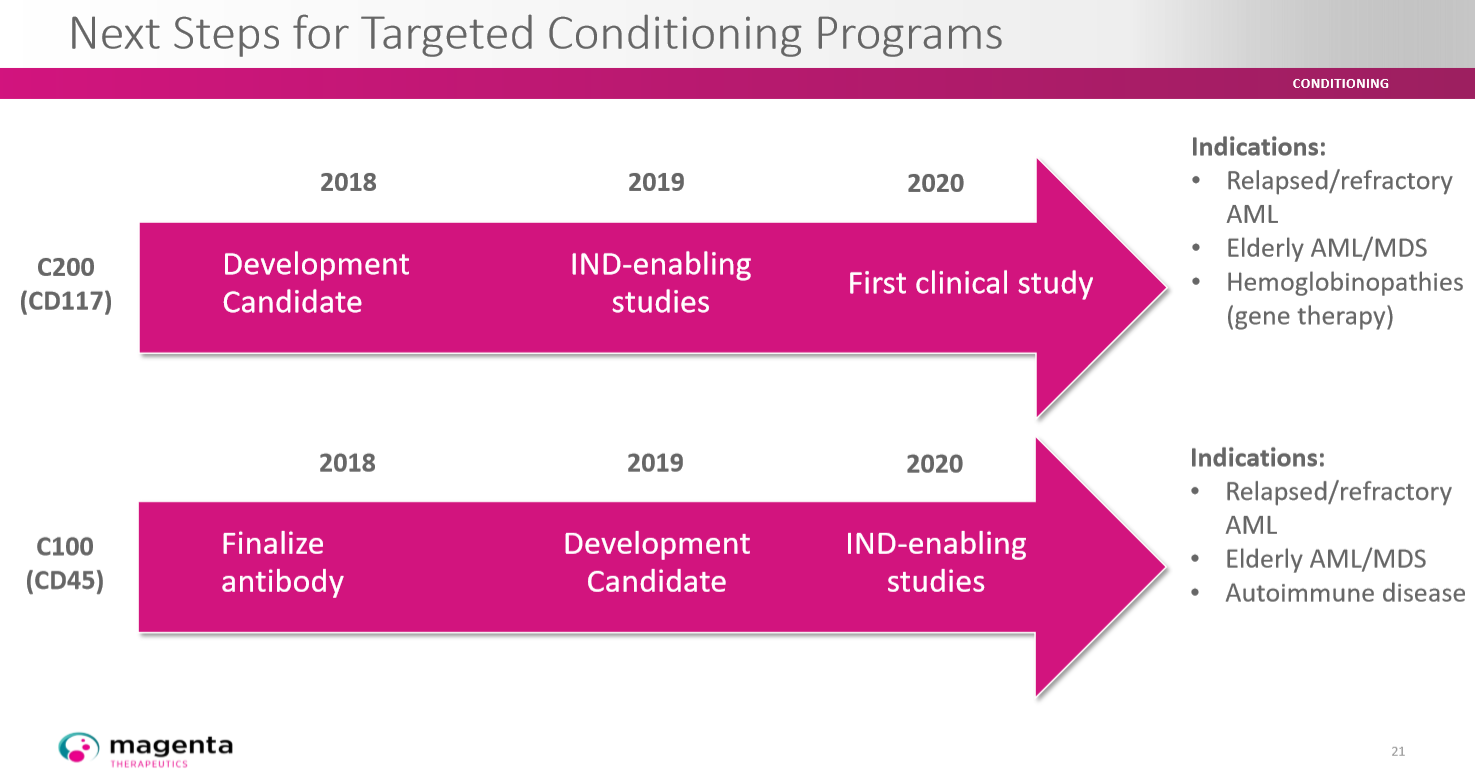
Der Eintritt in die klinische Erprobung des ersten Kandidaten soll demnach schon nächstes Jahr stattfinden. In der Folge dann die weiteren Kandidaten, falls sie sich als tauglich erweisen.
Ich kann bei dieser Präsentation die Thematik nur oberflächlich ansprechen. Fachinformationen zu diesem Thema könnt ihr aber dem folgenden link entnehmen. Diese Präsentation aus einer Nature Veröffentlichung beschreibt Sinn und Zweck und Chancen des Kandidaten C200. Absolut lesenswert für alle, die sich mit dem Thema Knochenmarktransplantation mit dem Magenta Verfahren beschäftigen.
https://www.nature.com/articles/s41467-018-08201-x.epdf?shar…
Kooperationen und Zusammenarbeit:
1. Mabvax und Nordic Nanovector
2. Advanced Proteome Therapeutics
Zusammenarbeit mit Mabvax und Nordic Nanovector:
In den letzten Jahren ist Heidelberg Pharma zwei Kooperationen mit den Firmen Mabvax und Nordic Nanovector eingegangen. Dabei sollten die Ausgaben und Entwicklung partnerschaftlich geteilt werden. Leider liegen hierzu keine neuen Meldungen vor. Beide Firmen beschäftigen sich im Augenblick mehr mit strukturellen Fragen. Die Kooperation werden zwar in der eigenen Pipeline als vorklinische Wirkstoffe aufgeführt. Doch es bewegt sich nicht so viel. So ist zu mindesten mein Eindruck. Man sollte hier einfach den Erfolg der beiden Firmen und ihre Bemühung abwarten, um die eigenen Probleme zu lösen. Sollten Aktivitäten erkennbar werden, werde ich hier dann mit einem Update reagieren. Ansonsten warte ich hier auf weitere Meldung zum Status von Heidelberg Pharma.
Zusammenarbeit mit Advanced Proteome Therapeutics:
Seit einiger Zeit gibt es eine Zusammenarbeit mit dieser Firma, um einige Wirkstoffe zu optimieren. Leider ist am Jahresende der CEO dieser Firma gestorben und erst vor wenigen Tagen hat der Sohn die Geschäfte übernommen. Hier warte ich einfach die Informationen von HP zum Sachverhalt ab. Von Zeit zu Zeit veröffentlicht Advanced Proteome Therapeutics enorm positive Ergebnisse von den Wirkstoffen. Doch bis zur Klärung der Sachlage mit dem neuen CEO warte ich mit weiteren Aussagen ab, bis HP dies mit Meldungen bestätigt.
Ich möchte jetzt schon mal den dritten Teil ankündigen. Er behandelt die Wirkstoffe, die Heidelberg Pharma im eigenen Portfolio hat und teilweise auslizensiert sind.
1. RENCAREX
2. MESUPRON
3. REDECTANE-TLX-250-Girentuximab
Das Datum der Veröffentlichung wird wahrscheinlich am Montag den 11. 3. sein.
BICYPAPA Analyse Heidelberg Pharma Teil 2
Teil 2 dieser Analyse beschäftigt sich mit den jetzigen Kooperationen und Partnerschaften von Heidelberg PharmaInhaltsverzeichnis:
1. ATAC Partnerschaft mit Takeda
2. ATAC Partnerschaft mit Magenta Therapeutics
3. Zusammenarbeit mit Mabvax, Nordic Nanovector und Advanced Proteome Therapeutics
ATAC Partnerschaft mit Takeda:
Im Juni 2017 schließt Heidelberg Pharma eine erste ATAC Partnerschaft ab. Der Partner ist die Weltfirma Takeda. Die Vereinbarung sieht die Erforschung von 3 Kandidaten Antikörper-Wirkstoff-Konjugaten (Antibody Drug Conjugates – ADCs) mit dem Wirkstoff Amanitin vor.
Es wird ein Optionsmodell gewählt, bei der bei einer Bestätigung pro Entwicklungskandidat eine Zahlung von 113 Millionen USD fällig sind. Nach einer eventuellen positiven Entwicklung sind dann Umsatzbeteiligungen vorgesehen.
Das sind die offiziellen Verlautbarungen zu diesem Abkommen. Hier ist sonst alles sehr geheimnisvoll. Es dringt kein Hinweis nach außen. Weder von Takeda noch von Heidelberg Pharma dringen weitere Einzelheiten an die Öffentlichkeit. Takeda hat aus strategischen Gründen vor einigen Wochen die Firma Shire übernommen, um weitere Synergien zu heben. Deshalb befinden sie sich jetzt in einer Umstrukturierungsphase. Geschäftsfelder müssen neu geordnet und bewertet werden.
Seit dem Abschluss der Vereinbarung mit HP sind nun etwa 18 Monate vergangen. Ich rechne damit, dass hier bald die Entscheidungsprozesse zu einem Wirkstoff anstehen. Dieser Zeitrahmen wurde damals in einem Interview angedeutet. Doch bei Takeda wird zur Zeit, wie oben angedeutet viel umstrukturiert und organisiert. Nach dieser Phase rechne ich dann auch mit einer Entscheidung zu mindestens einer Option.
ATAC Partnerschaft Magenta Therapeutics:
Im März 2018 folgt die zweite große Partnerschaft für die ATAC Technologie. Es handelt sich um Magenta Therapeutics. Diesmal werden bis zu 4 Zielmoleküle als Vorgabe genannt. Die Gesamtsumme für die Bearbeitung der 4 Wirkstoffe beträgt 334 Millionen USD. Bei erfolgreicher Zulassung werden dann noch Umsatzbeteiligungen fällig. Pro Kandidat beträgt die Gebühr 83,5 Millionen USD. Auch hier wird das Optionsmodell gewählt.
Bereits im Oktober 2018 bestätigt Magenta die erste Option.
Magenta Therapeutics ist eine junge Firma, die angetreten die Behandlung von Knochenmarktransplantationen zu revolutionieren. Was geschieht bis jetzt. Die erkrankten Zellen im Knochenmark werden durch eine Chemotherapie zerstört, wobei auch das gesamte Knochenmark weitestgehend zerstört wird. Dieses Verfahren ist sehr belastend für die Patienten und kommt wohl auch nicht für alle Patienten in Frage.
Und genau hierfür bietet sich nun die ATAC Technologie mit ihren ADC Wirkstoffen an. Nämlich ganz gezielt nur die erkrankten Krebszellen zu zerstören. Je nach Erkrankung werden dabei verschiedene Rezeptoren angesprochen. Diese Verfahren nennt man die Vorbereitung für die Transplantation, bei der dann wieder gesunde Zellen eingepflanzt werden. Für die Vorbereitung der Transplantation hat Magenta 3 verschiedene Kandidaten, die je nach Erkrankung zur Anwendung kommen sollen. Es handelt sich um die Wirkstoffe mit der eigenen Bezeichnung C100, C200, und C300. Es wird bei jedem dieser Wirkstoffe ein besonderes Merkmal adressiert.
Für den C200 Wirkstoff hat Magenta bereits die Option ausgeübt. Magenta legt bei der Bearbeitung ihrer Aufgaben ein enormes Tempo vor, dass man hier schon im nächsten Jahr den Übergang in die klinische Phase erwartet. Etwas zeitversetzt sollen dann die anderen Kandidaten folgen.
In neueren Präsentationen von Magenta Therapeutics wird bereits über die weitere Entwicklung von C100 gesprochen. Somit ist es dann nur eine Frage der Zeit, bis hier die nächste Option gezogen wird.
Zur Detailanalyse empfehlen sich dann diese beiden Präsentationen von Magenta zu C100 und C200.
Präsentation zu C100
https://investor.magentatx.com/static-files/14e4aa29-0cef-48…
Präsentation zu C200
https://investor.magentatx.com/static-files/65df0b83-b7c7-43…
Der vierte Kandidat sollte eigentlich geheim sein. Doch es ist gut möglich, dass es sich hier um den Kandidaten G100 handeln könnte. Die Vermutung nährt sich durch eine Patentveröffentlichung bei der bei diesem Kandidaten eine Amanitinbesetzung des Antikörpers in Frage kommen kann. Außerdem Handelt sich nach Magenta Aussagen um einen ADC Kandidaten. Es ist aber jetzt aber noch nicht so wichtig. In Jahresfrist werden wir ja sowieso nähere Einzelheiten hierzu erfahren, da sich alle Projekte sowieso in der Bearbeitung befinden.
Schaubild Magenta Entwicklung C100 und C200:

Der Eintritt in die klinische Erprobung des ersten Kandidaten soll demnach schon nächstes Jahr stattfinden. In der Folge dann die weiteren Kandidaten, falls sie sich als tauglich erweisen.
Ich kann bei dieser Präsentation die Thematik nur oberflächlich ansprechen. Fachinformationen zu diesem Thema könnt ihr aber dem folgenden link entnehmen. Diese Präsentation aus einer Nature Veröffentlichung beschreibt Sinn und Zweck und Chancen des Kandidaten C200. Absolut lesenswert für alle, die sich mit dem Thema Knochenmarktransplantation mit dem Magenta Verfahren beschäftigen.
https://www.nature.com/articles/s41467-018-08201-x.epdf?shar…
Kooperationen und Zusammenarbeit:
1. Mabvax und Nordic Nanovector
2. Advanced Proteome Therapeutics
Zusammenarbeit mit Mabvax und Nordic Nanovector:
In den letzten Jahren ist Heidelberg Pharma zwei Kooperationen mit den Firmen Mabvax und Nordic Nanovector eingegangen. Dabei sollten die Ausgaben und Entwicklung partnerschaftlich geteilt werden. Leider liegen hierzu keine neuen Meldungen vor. Beide Firmen beschäftigen sich im Augenblick mehr mit strukturellen Fragen. Die Kooperation werden zwar in der eigenen Pipeline als vorklinische Wirkstoffe aufgeführt. Doch es bewegt sich nicht so viel. So ist zu mindesten mein Eindruck. Man sollte hier einfach den Erfolg der beiden Firmen und ihre Bemühung abwarten, um die eigenen Probleme zu lösen. Sollten Aktivitäten erkennbar werden, werde ich hier dann mit einem Update reagieren. Ansonsten warte ich hier auf weitere Meldung zum Status von Heidelberg Pharma.
Zusammenarbeit mit Advanced Proteome Therapeutics:
Seit einiger Zeit gibt es eine Zusammenarbeit mit dieser Firma, um einige Wirkstoffe zu optimieren. Leider ist am Jahresende der CEO dieser Firma gestorben und erst vor wenigen Tagen hat der Sohn die Geschäfte übernommen. Hier warte ich einfach die Informationen von HP zum Sachverhalt ab. Von Zeit zu Zeit veröffentlicht Advanced Proteome Therapeutics enorm positive Ergebnisse von den Wirkstoffen. Doch bis zur Klärung der Sachlage mit dem neuen CEO warte ich mit weiteren Aussagen ab, bis HP dies mit Meldungen bestätigt.
Ich möchte jetzt schon mal den dritten Teil ankündigen. Er behandelt die Wirkstoffe, die Heidelberg Pharma im eigenen Portfolio hat und teilweise auslizensiert sind.
1. RENCAREX
2. MESUPRON
3. REDECTANE-TLX-250-Girentuximab
Das Datum der Veröffentlichung wird wahrscheinlich am Montag den 11. 3. sein.
bic vielen dank f.d. infos -klasse...!! scheint aber alles noch viel zukunftsmusik zu sein, bis konkret etwas vorhanden ist...
Antwort auf Beitrag Nr.: 60.062.777 von JohnAsh am 10.03.19 14:44:40
Dass es so lange dauert, das haben alle vergleichbaren Biotechwerte. Dann dürfte man nie Biotechwerte kaufen. Die dauern nämlich immer lange. Ich hatte es aber auch im 1. Teil geschrieben. Ich versuch darauf im letzten Teil der Analyse auch eine Antwort in einem gewissen Zeitrahmen ein vernünftiges Kursziel zu benennen.
Ja sicher..
Du hast Recht damit, dass es sehr lange dauert. Darum geht's meiner Meinung nach aber gar nicht. Das beantwortet nicht die Frage was in der Zwischenzeit passiert. Nimm dir mal als Beispiel MorphoSys. Die sind ja auch nicht am letzten Tag der Entwicklung von 10 auf 100 gesprungen. Da hat sich ja was getan in der Entwicklung der Pipeline und der Wirkstoffe in den letzten 10 Jahren. In dieser Zeit hat sich eine gewisse Reife und Entwicklung der Pipeline manifestiert. Dies gilt es zu antizipieren. Die Chancen und die Möglichkeiten, die in einem Wert stecken zu erfassen. Darauf kommt es an. Wie hoch ist Heidelberg Pharma jetzt bewertet und was traue ich ihnen mit der Pipeline in den nächsten 4 oder 6 Jahren zu. Darum geht's. Und wie bewerte ich das dann in der Zukunft. Darum sollte man sich bemühen, dies vorausschauend zu bewerten. Dass es so lange dauert, das haben alle vergleichbaren Biotechwerte. Dann dürfte man nie Biotechwerte kaufen. Die dauern nämlich immer lange. Ich hatte es aber auch im 1. Teil geschrieben. Ich versuch darauf im letzten Teil der Analyse auch eine Antwort in einem gewissen Zeitrahmen ein vernünftiges Kursziel zu benennen.
Antwort auf Beitrag Nr.: 60.062.976 von BICYPAPA am 10.03.19 15:41:24Exakt. Biotech ist vereinfacht ausgedrückt immer Zukunft. Ist es nämlich keine Zukunft mehr dann sind sie entweder Pleite oder von einem Großen der Branche übernommen. Kleinere und mittlere Biotechfirmen sind nicht anders als die Forschungsbank von Big Pharma.
yoo, so schauts aus....💪
Und wenn hier Big Pharma zuschlagen sollte, wird’s jedoch bei der Aktionärsstruktur nicht billig werden, da Dietmar Hopp 75% aller Anteile hält und sicherlich für den ‘handelsüblichen Aufschlag von 100-200%’ verkaufen wird...
Btw: Vielen Dank nochmals an dieser Stelle, BICYPAPA für deine ausführliche Analyse! 👍
Btw: Vielen Dank nochmals an dieser Stelle, BICYPAPA für deine ausführliche Analyse! 👍
*sicherlich nicht 😉
Antwort auf Beitrag Nr.: 60.038.132 von BICYPAPA am 07.03.19 04:41:23
In diesem dritten Teil beschreibe ich die Wirkstoffe, die HP noch aus Wilex Zeiten in seinem Portfolio hat. Teilweise hat HP diese Wirkstoffe schon auslizensiert. Hauptsächlich habe ich für die Recherche die Homepages von Telix und Heidelberg Pharma genutzt. Dort gibt es sehr ausführliche Beschreibungen zu diesen Wirkstoffen und ich empfehle die Recherche dort bei Interesse fortzuführen.
Heidelberg Pharma:
https://heidelberg-pharma.com/de/forschung-entwicklung/weite…
Telix Homapage:
www.telixpharma.com/
Inhaltsverzeichnis des dritten Teils der Heidelberg Pharma Beschreibung:
1. RENCAREX
2. MESUPRON
3. REDECTANE-TLX-250-Girentuximab
RENCAREX:
RENCAREX ist der Wirkstoff, den Wilex vor einigen Jahren bei Behandlung des Nierenzellkarzinoms getestet hat. Leider haben sich in dieser Versuchsanordnung die Hoffnungen nicht erfüllt. Es konnte gegenüber Placebo kein Vorteil bestätigt werden. Dieser Kandidat steht zur Zeit von HP zur Auslizensierung bereit. Es wurde ein Abstract zu der Studie veröffentlich die bei bestimmten Patientengruppen sehr wohl einen Vorteil erkennen lässt. Dies zu dem Wirkstoff RENCAREX
MESUPRON:
MESUPRON (INN: Upamostat) ist ein Krebswirkstoff, der von Wilex bei Bauchspeicheldrüsenkrebs und Brustkrebs in einer 2a Studie getestet wurde. Das Wirkprinzip des MESUPRON®könnte einen neuen Behandlungsansatz durch spezifische Blockierung der Metastasierung bei soliden Tumoren bilden.
Mittlerweile wurde MESUPRON an LinkHealth und Redhill auslizensiert.
MESUPRON ist in Hong Kong, Taiwan und Macao an Link Health auslizensiert. Im Januar 2019 zahlte Link Health für eine behördliche Genehmigung der chinesischen Behörden eine Meilensteinzahlung an HP.
Für die Entwicklung sind 7 Millionen Euro an Milestones vereinbart. Die Umsatzbeteiligung beträgt einen mittleren einstelligen Prozentbereich, der nach Umsätzen gestaffelt ist.
Für alle anderen Gebiete in der Welt wurde MESUPRON an die israelische Firma Redhill auslizensiert. Es wurde eine enorm hohe Umsatzbeteiligung von etwa 15- 30% vereinbart. Im Oktober 2017 gewährt die amerikanische Zulassungsbehörde FDA den Orphan Drug-Status für MESUPRON für die Behandlung von Bauchspeicheldrüsenkrebs. Bei Redhill sind allerdings keine großen Aktivitäten bezüglich MESUPRON erkennbar, da sie ihre Prioritäten aufgrund der finanziellen Situation anders gesetzt haben.
Redectane-Girentuximab-TLX250:
GIRENTUXIMAB ist ein Antikörper, der zusätzlich mit einem radioaktiven Teil bestückt wurde. Wilex benutze damals dafür Iodine (124I) . Dieser Wirkstoff sammelte sich in dem Krebsgewebe des Nierenkrebses an und konnte dann mithilfe von diagnostischen Geräten sichtbar gemacht werden. Bei der Sensitivität verpasste Wilex damals knapp den erforderlichen Wert. REDECTANE wurde im Januar 2017 an den australischen Spezialisten Telix auslizensiert. Dieser Spezialist optimierte nun den Antikörper mit einem neuen radioaktiven Teil 89 Zirconium zu 89Zr-girentuximab.
Schaubild ZR89 Girentuximab Vergleich Wilex-Telix:
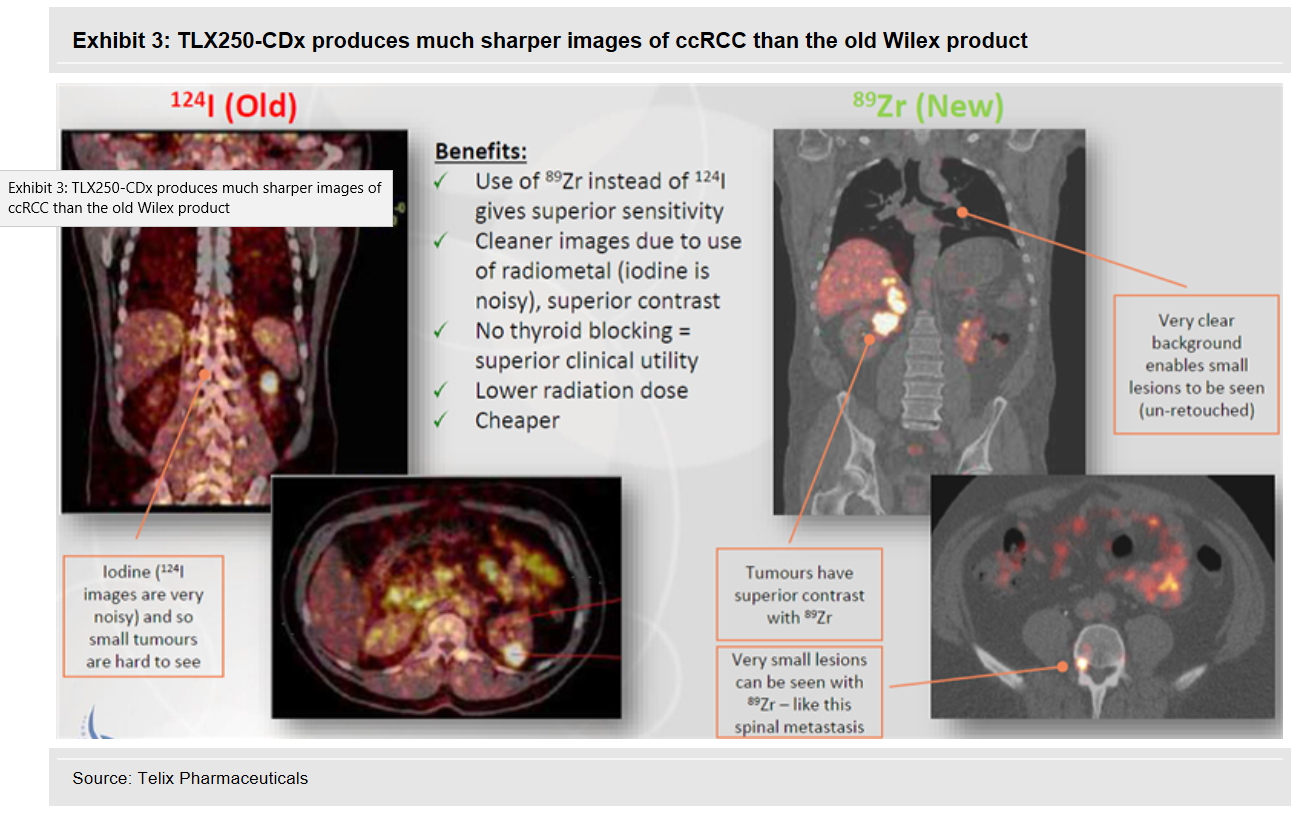
Eine kleine Bridging Studie zur Bestätigung der Verbesserung wurde von Telix durchgeführt. Nachdem diese Studie eben diese erhofften Merkmale eindrucksvoll unter Beweis stellte, startet nun weltweit in verschieden Kontinenten hintereinander die Phase 3 Studie. Die ersten Ergebnisse aus diesen Studien erwartet Telix etwa ab Q4 2019 beginnend mit Australien, dem dann die anderen Zulassungsbereiche der Reihe nachfolgen.
REDECTANE ist ein Wirkstoff aus der WILEX Pipeline und kann in zwei Bereichen der Diagnostik aber auch therapeutisch eingesetzt werden. Bei der Therapeutik ist der Antikörper Girentuximab etwas anders aufgebaut je nachdem welche Zielvorgaben man erfüllen möchte. Nach der angesprochenen Optimierung des Wirkstoffes durch Telix befindet sich REDECTANE in der aktiven Phase 3 in der Bilddiagnostik für die klinische Entwicklung.
In der therapeutischen Anwendung befindet man sich bald in der Phase 2 und das Ende der Rekrutierung der Phase 2 wird etwa Q4 19 erwartet. Geplant sind hier drei Studien mit verschiedenen Wirkstoffen. Die TLX250-Therapie (177Lu-Girentuximab) hat bei Patienten mit fortgeschrittenem metastasierendem ccRCC ohne weitere Behandlungsmöglichkeiten ein progressionsfreies Überleben von etwa 10 Monaten gezeigt. TLX250 wird im Jahr 2019 in Kombination mit einer Immuntherapie mit weiteren Studien beginnen. Sollte die Entwicklung von (177Lu-Girentuximab) normal und positiv verlaufen folgt eine Phase 3 Studie und der Zulassungsprozess. Telix rechnet hier mit Einnahmen von ca. 400-500 Millionen$, falls es in dieser Anwendung zu einer Zulassung kommt. Erste Einnahmen dürften wir in der therapeutischen Anwendung etwa ab 2023 erwarten.
In Japan wird ein ganz neues Verfahren der Theranostic Anwendung in Zusammenarbeit mit Nihon Medi-Physics mit Beteiligung von REDECTANE erprobt. Eine Ausdehnung auf andere Gebiete ist demnach bei einem positivem Verlauf sehr wahrscheinlich. Die Umsatzbeteiligung für HP beträgt in der therapeutischen Anwendung ca. 5%. In der diagnostischen Anwendung beträgt dieser Anteil immer 30%.
Was sind Theranostics?
Zur Bekämpfung von Krebszellen werden manchmal Radionukliden eingesetzt. Als Radionuklid oder radioaktives Nuklid bezeichnet man ein Nuklid (eine Atomsorte), wenn es instabil und damit radioaktiv ist. Bestimmte Antikörper, die die Krebszelle erkennen, werden dann mit solch einem radioaktiven strahlenden Teil besetzt. Der Antikörper wandert zur Krebszelle und die Strahlung des radioaktiven Teils zerstört dann die Krebszelle. Theranostics von Telix sind mit 225 Ac besetzt und dies ist ein Alpha-Emitter. Im Vergleich zu anderen Arten von Radionukliden haben Alpha-Emitter eine relativ höhere Energie, um Krebszellen zu schädigen und einen kürzeren Strahlungsbereich, um Schäden an den peripheren normalen Zellen zu minimieren. Daher wird erwartet, dass 225Ac, ein alpha-emittierendes Nuklid, ein erhebliches klinisches Potenzial für die Behandlung von Krebs mittels nuklearmedizinischer Techniken aufweist. Die Parteien werden zusammenarbeiten, um die neuartige Linker-Chemie von Nihon Medi-Physics Co., Ltd. auf die Anti-CAIX-Antikörper von Telix anzuwenden und gemeinsam Proof-of-Concept-Studien durchzuführen.
In der Bilddiagnostik befindet man sich wie oben schon angesprochen nun in Phase 3 und das Ende der Rekrutierung in Europa und Australien wird etwa Q4 19 erwartet. Danach folgt die Auswertung und der Zulassungsprozess.
Bild Umsatzprognose Telix:
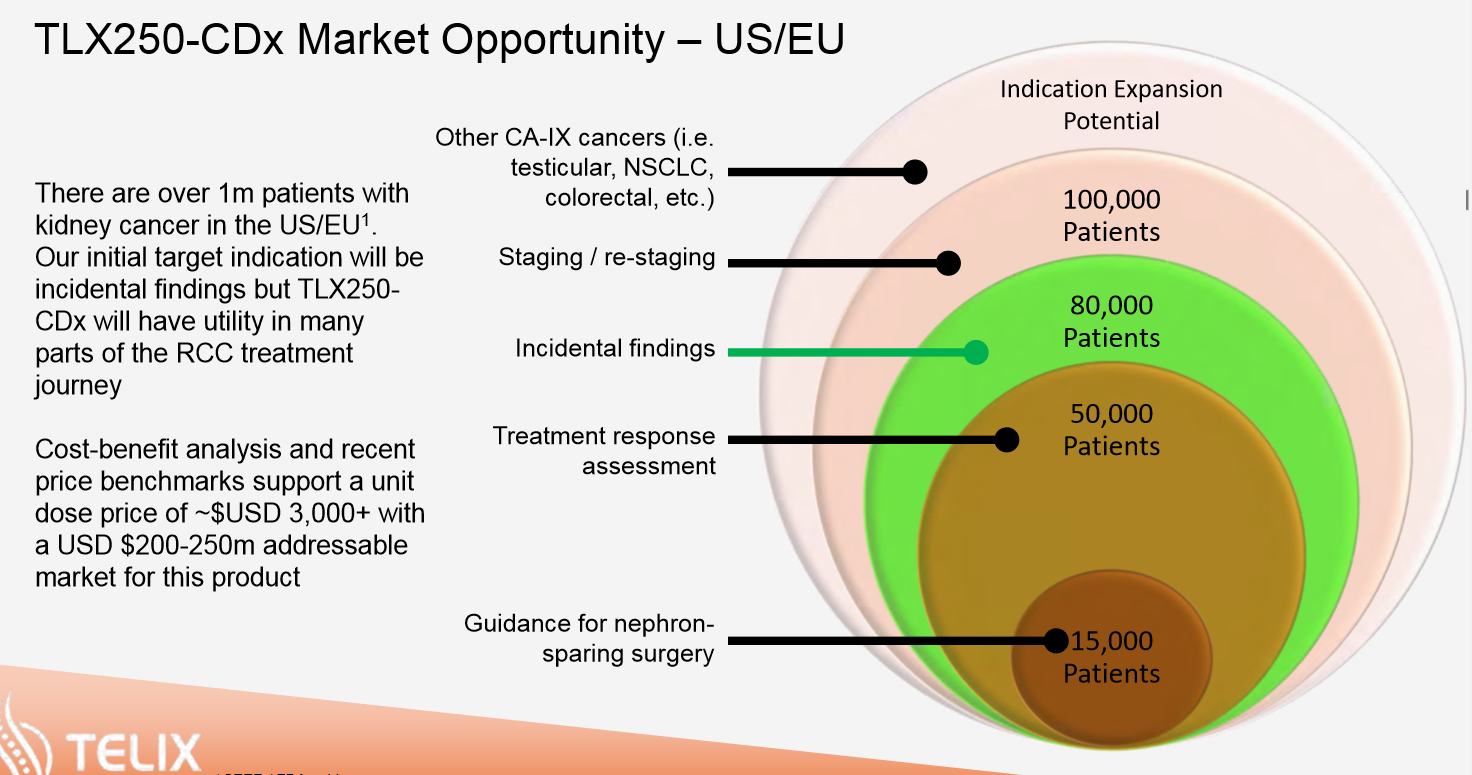
Die Umsatzschätzung für die diagnostische Anwendung wird mit etwa 250 Millionen USD angegeben.
Neben der Anwendung bei Nierenkrebs sind nun auch neue Anwendungsgebiete verschiedener Krebsarten in der Diskussion.
Es besteht eine realistische Chance, dass dann zusätzlich noch mal der gleiche Betrag langfristig für die Indikationserweiterung dazu kommen. Die sehr hohe Umsatzbeteiligung für HP beträgt hier 30% vom Nettoerlös. Und man befindet sich ja jetzt schon in der Phase 3 .
Erste Einnahmen bis zu ca. 75 Millionen USD dürften etwa ab 2021/22 nach der Zulassung erwartbar sein. Dies dürfte ein längerer Rollout der Gebiete werden, da die Beendigung und damit die Ergebnisse der Studien nacheinander erfolgen. Nach Australien und Japan folgt nun Europa und dann die USA.
Langfristig dürfte eine Verdoppelung dieser Umsatzbeteiligungen möglich sein, da laufend weitere Anwendungsgebiete und neue Verfahren diskutiert und durchgeführt werden. Dies kurz zu Telix und REDECTANE-TLX250-Girentuximab.
Ankündigung zu Teil 4 der Analyse:
Teil 4 ist nun der Bewertungsteil. Hier werde ich dann auch meine Kursziele benennen. Dieser vierte Teil behandelt folgende Themen.
1. Besondere Merkmale der Firma
2. Bewertung der Technologiepartnerschaften
3. Bewertung der Wirkstoffe RENCAREX MESUPRON und REDECTANE
4. Bewertung der eigenen Kandidaten insbesondere HDP-101.
5. Einschätzung der Kursziele
6. Finanzen.
7. Sonstiges
Es ist geplant diesen Teil am Mittwoch den 13.3. zu veröffentlichen.
BICYPAPA Analyse Heidelberg Pharma Teil 3
Dritter Teil der Heidelberg Pharma Analyse:In diesem dritten Teil beschreibe ich die Wirkstoffe, die HP noch aus Wilex Zeiten in seinem Portfolio hat. Teilweise hat HP diese Wirkstoffe schon auslizensiert. Hauptsächlich habe ich für die Recherche die Homepages von Telix und Heidelberg Pharma genutzt. Dort gibt es sehr ausführliche Beschreibungen zu diesen Wirkstoffen und ich empfehle die Recherche dort bei Interesse fortzuführen.
Heidelberg Pharma:
https://heidelberg-pharma.com/de/forschung-entwicklung/weite…
Telix Homapage:
www.telixpharma.com/
Inhaltsverzeichnis des dritten Teils der Heidelberg Pharma Beschreibung:
1. RENCAREX
2. MESUPRON
3. REDECTANE-TLX-250-Girentuximab
RENCAREX:
RENCAREX ist der Wirkstoff, den Wilex vor einigen Jahren bei Behandlung des Nierenzellkarzinoms getestet hat. Leider haben sich in dieser Versuchsanordnung die Hoffnungen nicht erfüllt. Es konnte gegenüber Placebo kein Vorteil bestätigt werden. Dieser Kandidat steht zur Zeit von HP zur Auslizensierung bereit. Es wurde ein Abstract zu der Studie veröffentlich die bei bestimmten Patientengruppen sehr wohl einen Vorteil erkennen lässt. Dies zu dem Wirkstoff RENCAREX
MESUPRON:
MESUPRON (INN: Upamostat) ist ein Krebswirkstoff, der von Wilex bei Bauchspeicheldrüsenkrebs und Brustkrebs in einer 2a Studie getestet wurde. Das Wirkprinzip des MESUPRON®könnte einen neuen Behandlungsansatz durch spezifische Blockierung der Metastasierung bei soliden Tumoren bilden.
Mittlerweile wurde MESUPRON an LinkHealth und Redhill auslizensiert.
MESUPRON ist in Hong Kong, Taiwan und Macao an Link Health auslizensiert. Im Januar 2019 zahlte Link Health für eine behördliche Genehmigung der chinesischen Behörden eine Meilensteinzahlung an HP.
Für die Entwicklung sind 7 Millionen Euro an Milestones vereinbart. Die Umsatzbeteiligung beträgt einen mittleren einstelligen Prozentbereich, der nach Umsätzen gestaffelt ist.
Für alle anderen Gebiete in der Welt wurde MESUPRON an die israelische Firma Redhill auslizensiert. Es wurde eine enorm hohe Umsatzbeteiligung von etwa 15- 30% vereinbart. Im Oktober 2017 gewährt die amerikanische Zulassungsbehörde FDA den Orphan Drug-Status für MESUPRON für die Behandlung von Bauchspeicheldrüsenkrebs. Bei Redhill sind allerdings keine großen Aktivitäten bezüglich MESUPRON erkennbar, da sie ihre Prioritäten aufgrund der finanziellen Situation anders gesetzt haben.
Redectane-Girentuximab-TLX250:
GIRENTUXIMAB ist ein Antikörper, der zusätzlich mit einem radioaktiven Teil bestückt wurde. Wilex benutze damals dafür Iodine (124I) . Dieser Wirkstoff sammelte sich in dem Krebsgewebe des Nierenkrebses an und konnte dann mithilfe von diagnostischen Geräten sichtbar gemacht werden. Bei der Sensitivität verpasste Wilex damals knapp den erforderlichen Wert. REDECTANE wurde im Januar 2017 an den australischen Spezialisten Telix auslizensiert. Dieser Spezialist optimierte nun den Antikörper mit einem neuen radioaktiven Teil 89 Zirconium zu 89Zr-girentuximab.
Schaubild ZR89 Girentuximab Vergleich Wilex-Telix:

Eine kleine Bridging Studie zur Bestätigung der Verbesserung wurde von Telix durchgeführt. Nachdem diese Studie eben diese erhofften Merkmale eindrucksvoll unter Beweis stellte, startet nun weltweit in verschieden Kontinenten hintereinander die Phase 3 Studie. Die ersten Ergebnisse aus diesen Studien erwartet Telix etwa ab Q4 2019 beginnend mit Australien, dem dann die anderen Zulassungsbereiche der Reihe nachfolgen.
REDECTANE ist ein Wirkstoff aus der WILEX Pipeline und kann in zwei Bereichen der Diagnostik aber auch therapeutisch eingesetzt werden. Bei der Therapeutik ist der Antikörper Girentuximab etwas anders aufgebaut je nachdem welche Zielvorgaben man erfüllen möchte. Nach der angesprochenen Optimierung des Wirkstoffes durch Telix befindet sich REDECTANE in der aktiven Phase 3 in der Bilddiagnostik für die klinische Entwicklung.
In der therapeutischen Anwendung befindet man sich bald in der Phase 2 und das Ende der Rekrutierung der Phase 2 wird etwa Q4 19 erwartet. Geplant sind hier drei Studien mit verschiedenen Wirkstoffen. Die TLX250-Therapie (177Lu-Girentuximab) hat bei Patienten mit fortgeschrittenem metastasierendem ccRCC ohne weitere Behandlungsmöglichkeiten ein progressionsfreies Überleben von etwa 10 Monaten gezeigt. TLX250 wird im Jahr 2019 in Kombination mit einer Immuntherapie mit weiteren Studien beginnen. Sollte die Entwicklung von (177Lu-Girentuximab) normal und positiv verlaufen folgt eine Phase 3 Studie und der Zulassungsprozess. Telix rechnet hier mit Einnahmen von ca. 400-500 Millionen$, falls es in dieser Anwendung zu einer Zulassung kommt. Erste Einnahmen dürften wir in der therapeutischen Anwendung etwa ab 2023 erwarten.
In Japan wird ein ganz neues Verfahren der Theranostic Anwendung in Zusammenarbeit mit Nihon Medi-Physics mit Beteiligung von REDECTANE erprobt. Eine Ausdehnung auf andere Gebiete ist demnach bei einem positivem Verlauf sehr wahrscheinlich. Die Umsatzbeteiligung für HP beträgt in der therapeutischen Anwendung ca. 5%. In der diagnostischen Anwendung beträgt dieser Anteil immer 30%.
Was sind Theranostics?
Zur Bekämpfung von Krebszellen werden manchmal Radionukliden eingesetzt. Als Radionuklid oder radioaktives Nuklid bezeichnet man ein Nuklid (eine Atomsorte), wenn es instabil und damit radioaktiv ist. Bestimmte Antikörper, die die Krebszelle erkennen, werden dann mit solch einem radioaktiven strahlenden Teil besetzt. Der Antikörper wandert zur Krebszelle und die Strahlung des radioaktiven Teils zerstört dann die Krebszelle. Theranostics von Telix sind mit 225 Ac besetzt und dies ist ein Alpha-Emitter. Im Vergleich zu anderen Arten von Radionukliden haben Alpha-Emitter eine relativ höhere Energie, um Krebszellen zu schädigen und einen kürzeren Strahlungsbereich, um Schäden an den peripheren normalen Zellen zu minimieren. Daher wird erwartet, dass 225Ac, ein alpha-emittierendes Nuklid, ein erhebliches klinisches Potenzial für die Behandlung von Krebs mittels nuklearmedizinischer Techniken aufweist. Die Parteien werden zusammenarbeiten, um die neuartige Linker-Chemie von Nihon Medi-Physics Co., Ltd. auf die Anti-CAIX-Antikörper von Telix anzuwenden und gemeinsam Proof-of-Concept-Studien durchzuführen.
In der Bilddiagnostik befindet man sich wie oben schon angesprochen nun in Phase 3 und das Ende der Rekrutierung in Europa und Australien wird etwa Q4 19 erwartet. Danach folgt die Auswertung und der Zulassungsprozess.
Bild Umsatzprognose Telix:

Die Umsatzschätzung für die diagnostische Anwendung wird mit etwa 250 Millionen USD angegeben.
Neben der Anwendung bei Nierenkrebs sind nun auch neue Anwendungsgebiete verschiedener Krebsarten in der Diskussion.
Es besteht eine realistische Chance, dass dann zusätzlich noch mal der gleiche Betrag langfristig für die Indikationserweiterung dazu kommen. Die sehr hohe Umsatzbeteiligung für HP beträgt hier 30% vom Nettoerlös. Und man befindet sich ja jetzt schon in der Phase 3 .
Erste Einnahmen bis zu ca. 75 Millionen USD dürften etwa ab 2021/22 nach der Zulassung erwartbar sein. Dies dürfte ein längerer Rollout der Gebiete werden, da die Beendigung und damit die Ergebnisse der Studien nacheinander erfolgen. Nach Australien und Japan folgt nun Europa und dann die USA.
Langfristig dürfte eine Verdoppelung dieser Umsatzbeteiligungen möglich sein, da laufend weitere Anwendungsgebiete und neue Verfahren diskutiert und durchgeführt werden. Dies kurz zu Telix und REDECTANE-TLX250-Girentuximab.
Ankündigung zu Teil 4 der Analyse:
Teil 4 ist nun der Bewertungsteil. Hier werde ich dann auch meine Kursziele benennen. Dieser vierte Teil behandelt folgende Themen.
1. Besondere Merkmale der Firma
2. Bewertung der Technologiepartnerschaften
3. Bewertung der Wirkstoffe RENCAREX MESUPRON und REDECTANE
4. Bewertung der eigenen Kandidaten insbesondere HDP-101.
5. Einschätzung der Kursziele
6. Finanzen.
7. Sonstiges
Es ist geplant diesen Teil am Mittwoch den 13.3. zu veröffentlichen.
Antwort auf Beitrag Nr.: 60.065.043 von BICYPAPA am 11.03.19 01:41:03
dich hier im Forum zu haben, kann ich einfach nur als Glücksfall bezeichnen. Das könntest du auch an ein Analystenhaus verkaufen, wirklich spitzenklasse. ..wobei Analysten es nicht annähernd so fundiert erklären würden.
Ich freue mich auf den letzten Teil und versuche noch ein paar Stücke einzusammeln...
Alles Gute für Dich
Viele Grüße
upanddown1
VIELEN DANK
Hallo BICIPAPA,dich hier im Forum zu haben, kann ich einfach nur als Glücksfall bezeichnen. Das könntest du auch an ein Analystenhaus verkaufen, wirklich spitzenklasse. ..wobei Analysten es nicht annähernd so fundiert erklären würden.
Ich freue mich auf den letzten Teil und versuche noch ein paar Stücke einzusammeln...

Alles Gute für Dich
Viele Grüße
upanddown1
Antwort auf Beitrag Nr.: 60.065.271 von upanddown1 am 11.03.19 07:03:11Jetzt hab ich auch noch Deinen Namen falsch geschrieben:
BICYPAPA natürlich, soviel Zeit muss sein..
😊
up
BICYPAPA natürlich, soviel Zeit muss sein..
😊
up
so gab mir auch mal be startposi zugelegt, da ich davon ausgehe, dassvhier viel musik drin sein kann. bicypapa-vielen dank f.d. überragende arbeit...
Antwort auf Beitrag Nr.: 60.065.043 von BICYPAPA am 11.03.19 01:41:03
In diesem vierten Teil mache ich jetzt eine Bewertung aller Geschäftsfelder von Heidelberg Pharma. Ich versuche dabei ein begründetes mittelfristiges und langfristiges Kursziel herzuleiten.
Dieser vierte Teil hat folgende Inhaltsangabe:
1. Besondere Merkmale der Firma.
2. Bewertung der Technologiepartnerschaften.
3. Bewertung der Wirkstoffe RENCAREX MESUPRON und REDECTANE.
4. Bewertung der eigenen Kandidaten insbesondere HDP-101.
5. Einschätzung der Kursziele.
6. Finanzen.
7. Sonstiges.
Besondere Merkmale der Firma und Einleitung:
Wir haben jetzt viel erfahren, was Heidelberg Pharma so alles macht und welche Projekte aktuell sind. Nun kommen wir zu dem Punkt, das man dies ein wenig einordnen sollte und die Chancen und Risiken gegeneinander abwägt und ein realistisches Kursziel zu dem Wert bestimmt.
Da ist es sehr hilfreich, wenn man Werte in der Entwicklung vergleicht, die ähnliche Verläufe hatten. In Deutschland bieten sich zwei solche Werte an. Das wären meiner Meinung nach MorphoSys und Evotec, die um die Jahrtausendwende an die Börse gegangen sind. Ähnlich sehe ich die Gegebenheiten von HP in der Entwicklung der Pipeline in den Frühphasen dieser beiden Vergleichswerte. Dem möchte ich jetzt Heidelberg Pharma entgegenstellen. Mittlerweile sind diese beiden Vergleichswerte mit etwa 3 Milliarden an der Börse bewertet. Heidelberg Pharma wird selbst nach dem Anstieg der letzten Tage bei einem Kurs um die 3€ gerade mal mit ca. 85 Millionen € an der Börse bewertet. Wenn sie auch in großen Bereichen noch viel früher in der Entwicklung sind wie jetzt Evotec oder MorphoSys, haben sie die Besonderheit, dass sie mit dem Produkt REDECTANE schon in der Phase 3 sind. Später dazu mehr. Meine Aufgabe liegt nun darin all die Faktoren aufzuzählen, die die Bewertung bestimmen. Dazu möchte ich mal eine Projektion machen wie es bei normaler Entwicklung bei HP in drei vier Jahren aussieht. Dies in etwa sollte sich dann in den Kurszielen niederschlagen.
Kompetenz und Technologievorsprung:
Die Einzigartigkeit von Heidelberg Pharma ist wohl die große Fachkompetenz in Sachen Amanitin Forschung. Wahrscheinlich sind sie die Einzigen auf der Welt, die den Wirkstoff Amanitin im industriellen Maßstab herstellen können und eine Produktion garantieren können, die allen Ansprüchen gerecht wird. Gerecht wird für die Forschung, aber auch später für die Produktion. Im Augenblick ist dies ein Alleinstellungsmerkmal, das keine andere Firma weltweit zu bieten hat.
Zur Bewertung der Technologiepartner:
Takeda:
Ich möchte noch vorausschicken, dass ich jetzt manchmal mit Schätzungen arbeite, die sich doch in einem Rahmen bewegen die international üblich sind. In drei vier Jahren hat Takeda wohl etwa zwei Projekte in der klinischen Entwicklung. Pro Kandidat werden etwa 110 Million USD an Optionsgebühr aktiviert, die sehr wahrscheinlich an den üblichen Punkten gezahlt werden. Ein dritter Kandidat befindet sich demnach noch in der Erforschung und bei Zulassung des Wirkstoffes werden etwa 5% Umsatzbeteiligung fällig. Es ist davon auszugehen, dass sich Takeda wohl Ziele ausgesucht hat, die mindestens im Milliardenbereich liegen werden. Dies kurz zum Technologiepartner Takeda, wie ich ihn im Augenblick einschätze. Auch wenn alles hierzu doch geheim ist. Für mich ist das so in etwa das wahrscheinlichste Szenario.
Magenta:
Magenta hat schon eine Option bestätigt die etwa 83 Millionen für die Entwicklung für HP aktivieren. Unklar ist nur der Zeitpunkt wann welche Gelder fließen. Zwei weitere Projekte sind bekanntermaßen in der Entwicklung und es ist gut möglich, dass auf Jahresfrist noch ein oder zwei weitere Optionen bestätigt werden. In drei vier Jahren kann es schon gut möglich sein, dass sich ein Kandidat auf dem Weg zur Phase 3 ist und zwei andere Kandidaten in der Klinischen Phase 2. Demnach sind dann die Gelder für 3 Optionen aktiviert. Eine vierte Option steht im Raume. Auch hier sind die Umsatzbeteiligungen für alle Wirkstoffe von etwa 5% sehr wahrscheinlich. Die Umsätze der Wirkstoffe werden um die Milliardengrenze geschätzt.
Neue Kandidaten:
Es wurde immer wieder geäußert, dass neue Partner Interesse an der ATAC Technologie zeigen. In drei vier Jahren rechne ich mit etwa vier weiteren Partnern. Damit wird die jetzige Pipeline der Partner mit 7 Entwicklungskandidaten auf etwa 18-20 Entwicklungskandidaten ausgebaut.
Demnach hätte HP dann etwa 20 Kandidaten mit je etwa 100 Millionen USD möglichen Optionsgebühr pro Wirkstoff in der Pipeline. Das bedeutet, dass im erfolgreichsten Fall mehr als 2 Milliarden USD im Laufe der nächsten Jahre von den Partnern an HP aktiviert werden können. Bei erfolgreicher Zulassung werden später dann noch Zahlungen zusätzlich von etwa 20 möglichen Kandidaten mit etwa 5% Umsatzbeteiligung fällig. Die Umsätze der Wirkstoffe dürften sich auch in einem sehr hohen Niveau bewegen. Wir sind jetzt noch sehr früh in der Entwicklung, doch ich wage eine Projektion auf etwa 3-4 Jahre die für mich dann sehr plausibel ist. Dies kurz zu den ATAC Partnerschaften und ein sehr wahrscheinliches Szenario.
RENCAREX:
Auch wenn RENCAREX zur Auslizensierung noch durch HP angeboten wird, billige ich RENCAREX nicht mehr so eine große Bedeutung zu. Auch wenn laut Abstract in Subgruppen ein Vorteil zu sehen ist, gibt es bald durch Telix und zusätzlich langfristig mit den Theranostics in der therapeutischen Anwendung Alternativen die die Gesamtgruppe positiv behandeln können. Natürlich muss auch das noch in weiteren Studien bestätigt werden. Deshalb werte ich RENCAREX im Augenblick nicht als so bedeutungsvoll ein.
MESUPRON:
Für mich sehr schwer einzuschätzen. LinkHealth will die klinische Entwicklung fortführen. Redhill ist bei MESUPRON wohl in einer Abwartestellung und sondiert gerade ein optimales Anwendungsgebiet. Wir müssen abwarten, welche Indikation von diesen Partnern gewählt werden und dann die erforderliche Bewertung der Chancen durchführen. MESUPRON wird dann wahrscheinlich bei Interesse der Lizenznehmer LinkHealth und Redhill als 2b Studie weitergeführt. Ich schätze MESUPRON als chancenreichen Kandidaten ein. Eine Bewertung wird bei entsprechender Sachlage durchgeführt. Weiter möchte ich mich hier noch nicht aus dem Fenster lehnen.
REDECTANE-TLX250
Ein sehr heißer Kandidat mit riesigen Chancen. Riesige Chancen bei der Zulassung. Aber auch riesige Chancen bei den Umsätzen. Zu TLX250 gibt es keine Behandlungsalternative in der Diagnostik von Nierenzellkarzinom und so wird es sich wohl innerhalb kürzester Zeit durchsetzen. In der Diagnositk erhält HP eine Nettoumsatzbeteiligung von 30%. Der Markt für diese Anwendung wird im Augenblick auf 250 Millionen USD geschätzt. Ab Ende diesen Jahres laufen dann sukzessive die Ergebnisse aus den einzelnen Zulassungsgebieten ein, bis dann alle abgearbeitet sind. Nach der Auswertung kommt der Zulassungsprozess und ab etwa Mitte 2021 können wir bei erfolgter Zulassung mit den ersten Umsatzbeteiligungen für HP rechnen. Allein in diesem Anwendungsgebiet beträgt dann die Beteiligung für Heidelberg Pharma etwa 50 Millionen USD , wenn dann der gesamte Markt abgedeckt ist. Dies dürfte ab 2021 mit Australien und Japan beginnend dann etwa knapp zwei Jahre dauern.
Bis etwa 2023 erhofft man sich dann auch für die therapeutische Anwendung das Ende der Studien. Die Beteiligung für HP beträgt etwa 5% von geschätzten 400 Millionen USD Umsatz für die therapeutische Anwendung.
Doch damit noch nicht genug. Es werden neue Indikationen diskutiert und neue Anwendungsverfahren durch die Theranostics die ebenfalls diesen Wirkstoff von HP beinhalten sollen. Damit wäre dann sehr langfristig noch mal eine Verdoppelung dieser Umsatzbeteiligung denkbar. Im positivsten Fall wären demnach jährliche Umsatzbeteiligungen von geschätzt etwa 150-200 Millionen USD möglich, wenn Telix und deren Partner alle Indikationen und Möglichkeiten abgearbeitet hat.
Und das ganze kostet Heidelberg Pharma dann keinen Pfennig mehr. Die gesamten Entwicklungskosten und der Vertrieb wird durch Telix und deren Partner übernommen. Selbst wenn alle Amanitin Projekte von Heidelberg Pharma scheitern würden (was ich nicht annehme) so wären doch nach dem vorliegenden Faktenstand die etwa 150 Millionen USD langfristig an Einnahmen durch TLX250 ziemlich sicher. REDECTANE-TLX250 ist für mich die Versicherung für HP und deren Aktionäre.
HDP-101:
HDP-101 ist ja das eigene Produkt aus dem Amanitin Wirkstoff in Verbindung mit einem einlizenzierten BCMA-Antikörper, der zur Behandlung beim Multiplen Myelom eingesetzt werden soll.
HDP-101 kommt geplant Q4/19 in die erste klinische Verprobung am Menschen. Die Chancen für HDP-101 rechne ich aufgrund der bisherigen ausgezeichneten präklinischen Daten als sehr hoch ein. Für mich sind zwei Szenarien bei einem weiteren positiven Verlauf denkbar. Die Ergebnisse bestätigen die vorklinischen Testungen und HDP-101 wird im Szenario eins ziemlich zügig an einen Partner für 12-15% Umsatzbeteiligung auslizensiert.
Szenario zwei beschreibt die Durchführung der Phase 2b in Eigenregie, um dadurch eine weitere Wertsteigerung zu erreichen. Es ist denkbar, dass bis zum Ende der Phase 1b/ 2a Heidelberg Pharma genug Einnahmen aus den ATAC-Optionszusagen, neuen Partnerverträgen, Milestones und Umsatzbeteiligungen von REDECTANE zur Verfügung hat, um diese Aufgabe einer 2b Studie eigenständig zu bewältigen. Bei diesem Szenario sind dann bei einer späteren Auslizensierung Umsatzbeteiligungen von über 20% denkbar.
Die Milestonezahlungen dürften dann auch bedeutend höher sein.
Die Gesamtumsätze in der Indikation Mutliples Myelom werden jenseits der Milliardengrenze liegen.
Die ersten Ergebnisse der ersten klinischen Studie werden nach den jetzigen Planungen etwa Ende 2020 vorliegen. Nach den Ergebnissen der ersten Studie rechne ich für HDP-101 für eine Beschleunigung der Zulassungsbehörden durch Anerkennung eines Sonderstatus "Breakthrough Therapie", wenn die im Anderson Abstract zum Multiplen Myelom beschriebenen Erfolge im Menschen bestätigt werden können.
In drei vier Jahren -das ist die Zielvorgabe- dürfte die Testung der 2b Studie ob jetzt mit oder ohne Partner abgeschlossen sein. Dann befindet man sich etwa in Phase 3 (sehr wahrscheinlich mit Partner) oder plant diese gerade.
Zusatzplus bei dieser Indikation und HDP-101. Durch den TP53 Biomarker ist eine Gruppe von Patienten zu definieren, bei der andere Behandlung schlecht oder überhaupt nicht greifen. Amanitin Wirkstoffe, insbesondere HDP-101 scheint für diese vorher definierte Gruppe eine Möglichkeit zu sein um diese tödliche Erkrankung erfolgreich behandeln zu können.
Die anderen eigenen Wirkstoffe in der HP Pipeline möchte ich jetzt noch nicht bewerten, bis sie sich in einem weiter fortgeschrittenem Status befinden und der Wert dann auch ersichtlicher wird.
TP53 Biomarker:
In ca. 2 Jahren dürfte der TP53 Biomarker durch Heidelberg Pharma fertiggestellt sein. Zur Zeit wird an einem Prototypen gearbeitet. Er dürfte noch unschätzbare Dienste für HP leisten. Nämlich die Definition von Gruppen von Krebserkrankten, die genau auf die AMANITIN Wirkstoffe besonders gut ansprechen und für die es bis jetzt kaum Behandlungsalternativen gibt. Wahrscheinlich wird er schon beim Multiplem Myelom bei HDP-101 eine große Rolle spielen. Doch diese Gruppen mit dem TP53 Merkmal gibt es bei vielen anderen Krebserkrankungen auch. Durch diesen Test erschließt man sich eine große Anzahl von Anwendungsgebieten für die AMANITIN Wirkstoffe. Und dieser Test bedeutet für viele Patienten eine große Hoffnung, da es erstmals durch Heidelberg Pharma mit Amanitin Wirkstoffen eine Behandlungsmöglichkeit für sie gibt.
Damit erhält HP eine enorme Wertsteigerung, da sie die Gruppen die sie behandeln möchten schon vorher definieren können. Allein schon durch die oben beschriebenen Vorteile hat dieser Test einen enormen Wert. Die finanzielle Dimension muss ich noch ein wenig recherchieren, inwieweit der Test nach Fertigstellung zur finanziellen Wertsteigerung beiträgt. Er wird mit großer Wahrscheinlichkeit nicht kostenlos angeboten werden. Bei Vorliegen der Informationen werde hierzu dann noch mal ein Update machen.
Kursziele bei Heidelberg Pharma:
Ich habe diese Analyse vorher in drei Kapitel eingeteilt, die die Wirkstoffe und Partner in separate Untergruppen einteilt. Jeder einzelne dieser Bereiche würde ausreichen um bei einer gewissen Reife eine Bewertung jenseits der Milliardengrenze zu begründen. Noch hat Heidelberg Pharma diese Reife aber noch nicht. Doch man ist auf einem sehr guten Weg dies zu bewerkstelligen. Ich wurde nach meinem Kursziel gefragt und versuche jetzt eine Antwort. HP wird zur Zeit etwa mit Kursen um die 3€ mit ca. 85 Millionen bewertet. Die Chancen für weitere Wertsteigerungen sind enorm, wie man den vorausgegangen Beschreibungen entnehmen kann.
Kurz- bis mittelfristiges Kursziel:
Ich möchte bei meinem mittelfristigen Kursziel den Zeitkorridor von etwa 24-30 Monate vorgeben. Die Fakten, die dann wahrscheinlich eingetreten sind:
-HDP101 hat erfolgreich die Phase 1b/2a abgeschlossen.
-Der TP53 Biomarker ist fertiggestellt
-HP hat jetzt 4 Kooperationspartner zu den ATAC Wirkstoffen mit etwa 13 Optionen.
-Davon sind etwa 5 Optionen bestätigt.
-Etwa 3 davon befinden sich in der klinischen Entwicklung.
-HP hat etwa 40- 50 Millionen Einnahmen jährlich aus ATAC-Optionszusagen und Umsatzbeteiligungen.
-Telix hat die Zulassung in den ersten Ländern zur Bilddiagnostik erreicht und beginnt mit der Vermarktung.
-In der Therapeutik befindet sich Telix in Phase 3.
-Die ersten Umsatzbeteiligungen von Telix beginnen zu fließen.
-Eventuell Einnahmen aus HDP-101, falls schon frühphasig auslizensiert wird.
Wenn das Szenario so in etwa eintritt rechne ich bei einer normalen Börsenlage mit einer Bewertung von etwa 400-500 Millionen € in dem vorgegebenen Zeitrahmen.
Langfristiges Kursziel:
Bei dem langfristigen Kursziel würde ich gerne einen Zeitkorridor von etwa 4-5 Jahren machen. Das Szenario möchte ich wie folgt beschreiben:
-HDP hat die Phase 2b von HDP erfolgreich abgeschlossen und hat den Sonderstatus "Breakthrough Therapie".
-Der Partner führt die Phase 3 Studie mit HDP101 durch.
-Zusätzliche Anwendungsgebiete und Indikationen werden durch HP bearbeitet.
-HP hat jetzt etwa 6 ATAC Kooperationspartner mit etwa 20 Optionen.
- Davon sind etwa 10 Optionen bestätigt.
-Etwa 8 Wirkstoffe befinden sich davon in der klinischen Entwicklung.
-Magenta befindet sich mit C200 schon in einer sehr späten Phase der Entwicklung.
-Zwei weitere Kandidaten von Magenta sind in der klinischen Phase.
-Telix meldet die Zulassung in der therapeutischen Anwendung und beginnt Vermarktung.
-Für die Diagnostik sind von Telix jetzt weltweit alle Gebiete erschlossen.
-Weitere Anwendungsgebiete für REDECTANE TLX250 werden erarbeitet.
-Die Einnahmen aus ATAC-Optionszusagen und Umsatzbeteiligungen von TLX250 und Einnahmen zu HDP101 aus Milestones betragen mittlerweile zwischen 100 und 120 Millionen € jährlich.
Daher lautet mein Kursziel bei einer normalen Börsenlage etwa 2,5-3 Milliarden € Börsenbewertung in etwa 4 - 5 Jahren. Das wäre in etwa die gleiche Bewertung, die zur Zeit MorphoSys oder Evotec zugebilligt wird.
Das ist natürlich ein sehr positives Szenario, das ich gezeichnet habe. Es wird nicht alles gelingen. Nicht jede Option wird bestätigt werden. Es wird bestimmt auch nicht jede Option bis zum Ende der Entwicklung bestehen. Vielleicht gibt es aber auch noch andere positive Überraschungen. Jeder mag selber seine Risikoabschläge von diesen Kurszielen machen, die so ziemlich das optimalste Szenario beschreiben. Ich selber aber orientiere mich daran und korrigiere sie dann, wenn neue Fakten eine neue Bewertung erfordern.
Finanzen und Sonstiges:
Die finanziellen Mittel betrugen zum Ende des Geschäftsjahres 2018, das im November endete, etwa 20 Millionen € (geschätzt). Der Geldverbrauch wird auf höchstem Niveau etwa 1,4 Millionen € pro Monat betragen.
In letzter Zeit wurden noch Milestones von LinkHealth und Magenta gezahlt sowie von Telix werden wohl noch Milestones zum Studienstart in Europa erwartet. Würde man keine weiteren Einnahmen in diesem Jahr verbuchen können, würde dies bedeuten, dass man Geldmittel noch bis etwa März 2020 bei Ausgaben bei diesem sehr hohen Niveau hätte.
Folgende Einnahmen sind im Ausblick des Jahres 2019 wahrscheinlich erwartbar :
-Einnahmen aus der 1. Optionsbestätigung von Magenta zur Antragstellung und zur Zulassung der ersten klinischen Phase von C200 .
- Eine zweite Optionszusage von Magenta (für C100) wird für sehr wahrscheinlich gehalten und dann werden auch entsprechende Zahlungen fällig.
-Eine erste Optionszusage von Takeda mit entsprechenden Zahlungen liegt im Bereich des Möglichen.
-Aus den normalen Geschäftstätigkeiten erwarte ich Einnahmen etwa um die 4-5 Millionen Euro in 2019.
-Weiterhin wurden Andeutungen zu möglichen neuen ATAC Partnerschaften gemacht. Auch hier könnte man erste neue Anfangszahlungen verbuchen.
- Sollte Link Health eine Phase 2 Studie mit MESUPRON schon in diesem Jahr in China starten können, wären auch hier wahrscheinlich weitere Milestonezahlungen fällig.
All diese Möglichkeiten verlängern die finanzielle Reichweite von HP. Ob dies ausreicht um jetzt schon die volle Finanzierung aus eigener Kraft zu sichern werden wir evtl. auf der HP Bilanz-/Investorenkonferenz zum 21. März erfahren. Hier gibt es dann bestimmt weitere Einzelheiten zu diesem Thema.
HP bemüht sich um neue Investoren. Wie das gelingen wird, ist letztendlich von Dietmar Hopp bzw. dessen Söhnen oder Verwalter abhängig. Sie besitzen akt. etwa 75% der Aktien von Heidelberg Pharma in ihren Depots . Vielleicht braucht man noch mal eine kleine Maßnahme oder Zwischenfinanzierung durch Hopp, bis dann die erforderlichen Gelder für HP aus dem eigenen operativem Cash Flow generiert werden um die Geschäftstätigkeit eigenständig nachhaltig zu sichern, ohne das weitere Kapitalmaßnahmen benötigt werden.
Datum der Analyse: 11.3.2019
Letzter Kurs bei Analyse: 3,26 €
Anzahl Aktien ca. 28,13 Millionen
Kapitalisierung an der Börse: ca. 91,7 Millionen €
Anteil Dietmar Hopp ca. 75 %
Anteil UCB ca. 4%
Freefloat ca. 20%
Bilanz-/Analystenkonferenz: 21.3.2019
Hauptversammlung: 21.5.2019
Anhang:
Für meine Recherchen habe ich hauptsächlich die Webseiten der Firmen und bekannte Webseiten für medizinische und wissenschaftliche Informationen genutzt. Alle Informationen sind öffentlich und für jeden einsehbar. Ich empfehle auch bei eingehenden Recherchen diese Webseiten zu nutzen, da es dort noch sehr viele Informationen gibt, die selbst in dieser sehr umfangreichen Analyse noch nicht enthalten sind.
Homepage Heidelberg Pharma: https://heidelberg-pharma.com/de/
Homepage Magenta Therapeutics: www.magentatx.com/
Homepage Telix Pharmaceuticals: www.telixpharma.com/
Ich möchte betonen, das dies meine Sicht zum Zeitpunkt der Erstellung der Analyse ist. Neue Erkenntnisse und Fakten werden natürlich meine Einschätzung ändern können. Ich habe diese Analyse mit aller Sorgfalt gemacht. Es ist meine (BICYPAPA)ganz private Sicht und ich habe bei Erstellung der Analyse keinerlei Kontakt zu Heidelberg Pharma gehabt.
Ich beschäftige mich schon sehr lange mit deutschen Biotechwerten und schreibe ab und zu bei aussichtsreichen Werten eine Analyse. Da ich Heidelberg Pharma im Augenblick für den aussichtsreichsten deutschen Biotechwert halte, habe ich zu diesem Wert jetzt diese Analyse geschrieben. Ich möchte aber noch ausdrücklich betonen, dass jeder selbst für sein Handeln verantwortlich ist.
So, das war meine doch sehr umfangreiche Analyse zu Heidelberg Pharma und ich bedanke mich für eure Aufmerksamkeit. In einigen Threads werde ich am Freitag eine Gesamtausgabe posten, falls es die Speicher zulassen.
BICYPAPA Analyse Heidelberg Pharma Teil 4
Vierter Teil der Heidelberg Pharma Analyse:In diesem vierten Teil mache ich jetzt eine Bewertung aller Geschäftsfelder von Heidelberg Pharma. Ich versuche dabei ein begründetes mittelfristiges und langfristiges Kursziel herzuleiten.
Dieser vierte Teil hat folgende Inhaltsangabe:
1. Besondere Merkmale der Firma.
2. Bewertung der Technologiepartnerschaften.
3. Bewertung der Wirkstoffe RENCAREX MESUPRON und REDECTANE.
4. Bewertung der eigenen Kandidaten insbesondere HDP-101.
5. Einschätzung der Kursziele.
6. Finanzen.
7. Sonstiges.
Besondere Merkmale der Firma und Einleitung:
Wir haben jetzt viel erfahren, was Heidelberg Pharma so alles macht und welche Projekte aktuell sind. Nun kommen wir zu dem Punkt, das man dies ein wenig einordnen sollte und die Chancen und Risiken gegeneinander abwägt und ein realistisches Kursziel zu dem Wert bestimmt.
Da ist es sehr hilfreich, wenn man Werte in der Entwicklung vergleicht, die ähnliche Verläufe hatten. In Deutschland bieten sich zwei solche Werte an. Das wären meiner Meinung nach MorphoSys und Evotec, die um die Jahrtausendwende an die Börse gegangen sind. Ähnlich sehe ich die Gegebenheiten von HP in der Entwicklung der Pipeline in den Frühphasen dieser beiden Vergleichswerte. Dem möchte ich jetzt Heidelberg Pharma entgegenstellen. Mittlerweile sind diese beiden Vergleichswerte mit etwa 3 Milliarden an der Börse bewertet. Heidelberg Pharma wird selbst nach dem Anstieg der letzten Tage bei einem Kurs um die 3€ gerade mal mit ca. 85 Millionen € an der Börse bewertet. Wenn sie auch in großen Bereichen noch viel früher in der Entwicklung sind wie jetzt Evotec oder MorphoSys, haben sie die Besonderheit, dass sie mit dem Produkt REDECTANE schon in der Phase 3 sind. Später dazu mehr. Meine Aufgabe liegt nun darin all die Faktoren aufzuzählen, die die Bewertung bestimmen. Dazu möchte ich mal eine Projektion machen wie es bei normaler Entwicklung bei HP in drei vier Jahren aussieht. Dies in etwa sollte sich dann in den Kurszielen niederschlagen.
Kompetenz und Technologievorsprung:
Die Einzigartigkeit von Heidelberg Pharma ist wohl die große Fachkompetenz in Sachen Amanitin Forschung. Wahrscheinlich sind sie die Einzigen auf der Welt, die den Wirkstoff Amanitin im industriellen Maßstab herstellen können und eine Produktion garantieren können, die allen Ansprüchen gerecht wird. Gerecht wird für die Forschung, aber auch später für die Produktion. Im Augenblick ist dies ein Alleinstellungsmerkmal, das keine andere Firma weltweit zu bieten hat.
Zur Bewertung der Technologiepartner:
Takeda:
Ich möchte noch vorausschicken, dass ich jetzt manchmal mit Schätzungen arbeite, die sich doch in einem Rahmen bewegen die international üblich sind. In drei vier Jahren hat Takeda wohl etwa zwei Projekte in der klinischen Entwicklung. Pro Kandidat werden etwa 110 Million USD an Optionsgebühr aktiviert, die sehr wahrscheinlich an den üblichen Punkten gezahlt werden. Ein dritter Kandidat befindet sich demnach noch in der Erforschung und bei Zulassung des Wirkstoffes werden etwa 5% Umsatzbeteiligung fällig. Es ist davon auszugehen, dass sich Takeda wohl Ziele ausgesucht hat, die mindestens im Milliardenbereich liegen werden. Dies kurz zum Technologiepartner Takeda, wie ich ihn im Augenblick einschätze. Auch wenn alles hierzu doch geheim ist. Für mich ist das so in etwa das wahrscheinlichste Szenario.
Magenta:
Magenta hat schon eine Option bestätigt die etwa 83 Millionen für die Entwicklung für HP aktivieren. Unklar ist nur der Zeitpunkt wann welche Gelder fließen. Zwei weitere Projekte sind bekanntermaßen in der Entwicklung und es ist gut möglich, dass auf Jahresfrist noch ein oder zwei weitere Optionen bestätigt werden. In drei vier Jahren kann es schon gut möglich sein, dass sich ein Kandidat auf dem Weg zur Phase 3 ist und zwei andere Kandidaten in der Klinischen Phase 2. Demnach sind dann die Gelder für 3 Optionen aktiviert. Eine vierte Option steht im Raume. Auch hier sind die Umsatzbeteiligungen für alle Wirkstoffe von etwa 5% sehr wahrscheinlich. Die Umsätze der Wirkstoffe werden um die Milliardengrenze geschätzt.
Neue Kandidaten:
Es wurde immer wieder geäußert, dass neue Partner Interesse an der ATAC Technologie zeigen. In drei vier Jahren rechne ich mit etwa vier weiteren Partnern. Damit wird die jetzige Pipeline der Partner mit 7 Entwicklungskandidaten auf etwa 18-20 Entwicklungskandidaten ausgebaut.
Demnach hätte HP dann etwa 20 Kandidaten mit je etwa 100 Millionen USD möglichen Optionsgebühr pro Wirkstoff in der Pipeline. Das bedeutet, dass im erfolgreichsten Fall mehr als 2 Milliarden USD im Laufe der nächsten Jahre von den Partnern an HP aktiviert werden können. Bei erfolgreicher Zulassung werden später dann noch Zahlungen zusätzlich von etwa 20 möglichen Kandidaten mit etwa 5% Umsatzbeteiligung fällig. Die Umsätze der Wirkstoffe dürften sich auch in einem sehr hohen Niveau bewegen. Wir sind jetzt noch sehr früh in der Entwicklung, doch ich wage eine Projektion auf etwa 3-4 Jahre die für mich dann sehr plausibel ist. Dies kurz zu den ATAC Partnerschaften und ein sehr wahrscheinliches Szenario.
RENCAREX:
Auch wenn RENCAREX zur Auslizensierung noch durch HP angeboten wird, billige ich RENCAREX nicht mehr so eine große Bedeutung zu. Auch wenn laut Abstract in Subgruppen ein Vorteil zu sehen ist, gibt es bald durch Telix und zusätzlich langfristig mit den Theranostics in der therapeutischen Anwendung Alternativen die die Gesamtgruppe positiv behandeln können. Natürlich muss auch das noch in weiteren Studien bestätigt werden. Deshalb werte ich RENCAREX im Augenblick nicht als so bedeutungsvoll ein.
MESUPRON:
Für mich sehr schwer einzuschätzen. LinkHealth will die klinische Entwicklung fortführen. Redhill ist bei MESUPRON wohl in einer Abwartestellung und sondiert gerade ein optimales Anwendungsgebiet. Wir müssen abwarten, welche Indikation von diesen Partnern gewählt werden und dann die erforderliche Bewertung der Chancen durchführen. MESUPRON wird dann wahrscheinlich bei Interesse der Lizenznehmer LinkHealth und Redhill als 2b Studie weitergeführt. Ich schätze MESUPRON als chancenreichen Kandidaten ein. Eine Bewertung wird bei entsprechender Sachlage durchgeführt. Weiter möchte ich mich hier noch nicht aus dem Fenster lehnen.
REDECTANE-TLX250
Ein sehr heißer Kandidat mit riesigen Chancen. Riesige Chancen bei der Zulassung. Aber auch riesige Chancen bei den Umsätzen. Zu TLX250 gibt es keine Behandlungsalternative in der Diagnostik von Nierenzellkarzinom und so wird es sich wohl innerhalb kürzester Zeit durchsetzen. In der Diagnositk erhält HP eine Nettoumsatzbeteiligung von 30%. Der Markt für diese Anwendung wird im Augenblick auf 250 Millionen USD geschätzt. Ab Ende diesen Jahres laufen dann sukzessive die Ergebnisse aus den einzelnen Zulassungsgebieten ein, bis dann alle abgearbeitet sind. Nach der Auswertung kommt der Zulassungsprozess und ab etwa Mitte 2021 können wir bei erfolgter Zulassung mit den ersten Umsatzbeteiligungen für HP rechnen. Allein in diesem Anwendungsgebiet beträgt dann die Beteiligung für Heidelberg Pharma etwa 50 Millionen USD , wenn dann der gesamte Markt abgedeckt ist. Dies dürfte ab 2021 mit Australien und Japan beginnend dann etwa knapp zwei Jahre dauern.
Bis etwa 2023 erhofft man sich dann auch für die therapeutische Anwendung das Ende der Studien. Die Beteiligung für HP beträgt etwa 5% von geschätzten 400 Millionen USD Umsatz für die therapeutische Anwendung.
Doch damit noch nicht genug. Es werden neue Indikationen diskutiert und neue Anwendungsverfahren durch die Theranostics die ebenfalls diesen Wirkstoff von HP beinhalten sollen. Damit wäre dann sehr langfristig noch mal eine Verdoppelung dieser Umsatzbeteiligung denkbar. Im positivsten Fall wären demnach jährliche Umsatzbeteiligungen von geschätzt etwa 150-200 Millionen USD möglich, wenn Telix und deren Partner alle Indikationen und Möglichkeiten abgearbeitet hat.
Und das ganze kostet Heidelberg Pharma dann keinen Pfennig mehr. Die gesamten Entwicklungskosten und der Vertrieb wird durch Telix und deren Partner übernommen. Selbst wenn alle Amanitin Projekte von Heidelberg Pharma scheitern würden (was ich nicht annehme) so wären doch nach dem vorliegenden Faktenstand die etwa 150 Millionen USD langfristig an Einnahmen durch TLX250 ziemlich sicher. REDECTANE-TLX250 ist für mich die Versicherung für HP und deren Aktionäre.
HDP-101:
HDP-101 ist ja das eigene Produkt aus dem Amanitin Wirkstoff in Verbindung mit einem einlizenzierten BCMA-Antikörper, der zur Behandlung beim Multiplen Myelom eingesetzt werden soll.
HDP-101 kommt geplant Q4/19 in die erste klinische Verprobung am Menschen. Die Chancen für HDP-101 rechne ich aufgrund der bisherigen ausgezeichneten präklinischen Daten als sehr hoch ein. Für mich sind zwei Szenarien bei einem weiteren positiven Verlauf denkbar. Die Ergebnisse bestätigen die vorklinischen Testungen und HDP-101 wird im Szenario eins ziemlich zügig an einen Partner für 12-15% Umsatzbeteiligung auslizensiert.
Szenario zwei beschreibt die Durchführung der Phase 2b in Eigenregie, um dadurch eine weitere Wertsteigerung zu erreichen. Es ist denkbar, dass bis zum Ende der Phase 1b/ 2a Heidelberg Pharma genug Einnahmen aus den ATAC-Optionszusagen, neuen Partnerverträgen, Milestones und Umsatzbeteiligungen von REDECTANE zur Verfügung hat, um diese Aufgabe einer 2b Studie eigenständig zu bewältigen. Bei diesem Szenario sind dann bei einer späteren Auslizensierung Umsatzbeteiligungen von über 20% denkbar.
Die Milestonezahlungen dürften dann auch bedeutend höher sein.
Die Gesamtumsätze in der Indikation Mutliples Myelom werden jenseits der Milliardengrenze liegen.
Die ersten Ergebnisse der ersten klinischen Studie werden nach den jetzigen Planungen etwa Ende 2020 vorliegen. Nach den Ergebnissen der ersten Studie rechne ich für HDP-101 für eine Beschleunigung der Zulassungsbehörden durch Anerkennung eines Sonderstatus "Breakthrough Therapie", wenn die im Anderson Abstract zum Multiplen Myelom beschriebenen Erfolge im Menschen bestätigt werden können.
In drei vier Jahren -das ist die Zielvorgabe- dürfte die Testung der 2b Studie ob jetzt mit oder ohne Partner abgeschlossen sein. Dann befindet man sich etwa in Phase 3 (sehr wahrscheinlich mit Partner) oder plant diese gerade.
Zusatzplus bei dieser Indikation und HDP-101. Durch den TP53 Biomarker ist eine Gruppe von Patienten zu definieren, bei der andere Behandlung schlecht oder überhaupt nicht greifen. Amanitin Wirkstoffe, insbesondere HDP-101 scheint für diese vorher definierte Gruppe eine Möglichkeit zu sein um diese tödliche Erkrankung erfolgreich behandeln zu können.
Die anderen eigenen Wirkstoffe in der HP Pipeline möchte ich jetzt noch nicht bewerten, bis sie sich in einem weiter fortgeschrittenem Status befinden und der Wert dann auch ersichtlicher wird.
TP53 Biomarker:
In ca. 2 Jahren dürfte der TP53 Biomarker durch Heidelberg Pharma fertiggestellt sein. Zur Zeit wird an einem Prototypen gearbeitet. Er dürfte noch unschätzbare Dienste für HP leisten. Nämlich die Definition von Gruppen von Krebserkrankten, die genau auf die AMANITIN Wirkstoffe besonders gut ansprechen und für die es bis jetzt kaum Behandlungsalternativen gibt. Wahrscheinlich wird er schon beim Multiplem Myelom bei HDP-101 eine große Rolle spielen. Doch diese Gruppen mit dem TP53 Merkmal gibt es bei vielen anderen Krebserkrankungen auch. Durch diesen Test erschließt man sich eine große Anzahl von Anwendungsgebieten für die AMANITIN Wirkstoffe. Und dieser Test bedeutet für viele Patienten eine große Hoffnung, da es erstmals durch Heidelberg Pharma mit Amanitin Wirkstoffen eine Behandlungsmöglichkeit für sie gibt.
Damit erhält HP eine enorme Wertsteigerung, da sie die Gruppen die sie behandeln möchten schon vorher definieren können. Allein schon durch die oben beschriebenen Vorteile hat dieser Test einen enormen Wert. Die finanzielle Dimension muss ich noch ein wenig recherchieren, inwieweit der Test nach Fertigstellung zur finanziellen Wertsteigerung beiträgt. Er wird mit großer Wahrscheinlichkeit nicht kostenlos angeboten werden. Bei Vorliegen der Informationen werde hierzu dann noch mal ein Update machen.
Kursziele bei Heidelberg Pharma:
Ich habe diese Analyse vorher in drei Kapitel eingeteilt, die die Wirkstoffe und Partner in separate Untergruppen einteilt. Jeder einzelne dieser Bereiche würde ausreichen um bei einer gewissen Reife eine Bewertung jenseits der Milliardengrenze zu begründen. Noch hat Heidelberg Pharma diese Reife aber noch nicht. Doch man ist auf einem sehr guten Weg dies zu bewerkstelligen. Ich wurde nach meinem Kursziel gefragt und versuche jetzt eine Antwort. HP wird zur Zeit etwa mit Kursen um die 3€ mit ca. 85 Millionen bewertet. Die Chancen für weitere Wertsteigerungen sind enorm, wie man den vorausgegangen Beschreibungen entnehmen kann.
Kurz- bis mittelfristiges Kursziel:
Ich möchte bei meinem mittelfristigen Kursziel den Zeitkorridor von etwa 24-30 Monate vorgeben. Die Fakten, die dann wahrscheinlich eingetreten sind:
-HDP101 hat erfolgreich die Phase 1b/2a abgeschlossen.
-Der TP53 Biomarker ist fertiggestellt
-HP hat jetzt 4 Kooperationspartner zu den ATAC Wirkstoffen mit etwa 13 Optionen.
-Davon sind etwa 5 Optionen bestätigt.
-Etwa 3 davon befinden sich in der klinischen Entwicklung.
-HP hat etwa 40- 50 Millionen Einnahmen jährlich aus ATAC-Optionszusagen und Umsatzbeteiligungen.
-Telix hat die Zulassung in den ersten Ländern zur Bilddiagnostik erreicht und beginnt mit der Vermarktung.
-In der Therapeutik befindet sich Telix in Phase 3.
-Die ersten Umsatzbeteiligungen von Telix beginnen zu fließen.
-Eventuell Einnahmen aus HDP-101, falls schon frühphasig auslizensiert wird.
Wenn das Szenario so in etwa eintritt rechne ich bei einer normalen Börsenlage mit einer Bewertung von etwa 400-500 Millionen € in dem vorgegebenen Zeitrahmen.
Langfristiges Kursziel:
Bei dem langfristigen Kursziel würde ich gerne einen Zeitkorridor von etwa 4-5 Jahren machen. Das Szenario möchte ich wie folgt beschreiben:
-HDP hat die Phase 2b von HDP erfolgreich abgeschlossen und hat den Sonderstatus "Breakthrough Therapie".
-Der Partner führt die Phase 3 Studie mit HDP101 durch.
-Zusätzliche Anwendungsgebiete und Indikationen werden durch HP bearbeitet.
-HP hat jetzt etwa 6 ATAC Kooperationspartner mit etwa 20 Optionen.
- Davon sind etwa 10 Optionen bestätigt.
-Etwa 8 Wirkstoffe befinden sich davon in der klinischen Entwicklung.
-Magenta befindet sich mit C200 schon in einer sehr späten Phase der Entwicklung.
-Zwei weitere Kandidaten von Magenta sind in der klinischen Phase.
-Telix meldet die Zulassung in der therapeutischen Anwendung und beginnt Vermarktung.
-Für die Diagnostik sind von Telix jetzt weltweit alle Gebiete erschlossen.
-Weitere Anwendungsgebiete für REDECTANE TLX250 werden erarbeitet.
-Die Einnahmen aus ATAC-Optionszusagen und Umsatzbeteiligungen von TLX250 und Einnahmen zu HDP101 aus Milestones betragen mittlerweile zwischen 100 und 120 Millionen € jährlich.
Daher lautet mein Kursziel bei einer normalen Börsenlage etwa 2,5-3 Milliarden € Börsenbewertung in etwa 4 - 5 Jahren. Das wäre in etwa die gleiche Bewertung, die zur Zeit MorphoSys oder Evotec zugebilligt wird.
Das ist natürlich ein sehr positives Szenario, das ich gezeichnet habe. Es wird nicht alles gelingen. Nicht jede Option wird bestätigt werden. Es wird bestimmt auch nicht jede Option bis zum Ende der Entwicklung bestehen. Vielleicht gibt es aber auch noch andere positive Überraschungen. Jeder mag selber seine Risikoabschläge von diesen Kurszielen machen, die so ziemlich das optimalste Szenario beschreiben. Ich selber aber orientiere mich daran und korrigiere sie dann, wenn neue Fakten eine neue Bewertung erfordern.
Finanzen und Sonstiges:
Die finanziellen Mittel betrugen zum Ende des Geschäftsjahres 2018, das im November endete, etwa 20 Millionen € (geschätzt). Der Geldverbrauch wird auf höchstem Niveau etwa 1,4 Millionen € pro Monat betragen.
In letzter Zeit wurden noch Milestones von LinkHealth und Magenta gezahlt sowie von Telix werden wohl noch Milestones zum Studienstart in Europa erwartet. Würde man keine weiteren Einnahmen in diesem Jahr verbuchen können, würde dies bedeuten, dass man Geldmittel noch bis etwa März 2020 bei Ausgaben bei diesem sehr hohen Niveau hätte.
Folgende Einnahmen sind im Ausblick des Jahres 2019 wahrscheinlich erwartbar :
-Einnahmen aus der 1. Optionsbestätigung von Magenta zur Antragstellung und zur Zulassung der ersten klinischen Phase von C200 .
- Eine zweite Optionszusage von Magenta (für C100) wird für sehr wahrscheinlich gehalten und dann werden auch entsprechende Zahlungen fällig.
-Eine erste Optionszusage von Takeda mit entsprechenden Zahlungen liegt im Bereich des Möglichen.
-Aus den normalen Geschäftstätigkeiten erwarte ich Einnahmen etwa um die 4-5 Millionen Euro in 2019.
-Weiterhin wurden Andeutungen zu möglichen neuen ATAC Partnerschaften gemacht. Auch hier könnte man erste neue Anfangszahlungen verbuchen.
- Sollte Link Health eine Phase 2 Studie mit MESUPRON schon in diesem Jahr in China starten können, wären auch hier wahrscheinlich weitere Milestonezahlungen fällig.
All diese Möglichkeiten verlängern die finanzielle Reichweite von HP. Ob dies ausreicht um jetzt schon die volle Finanzierung aus eigener Kraft zu sichern werden wir evtl. auf der HP Bilanz-/Investorenkonferenz zum 21. März erfahren. Hier gibt es dann bestimmt weitere Einzelheiten zu diesem Thema.
HP bemüht sich um neue Investoren. Wie das gelingen wird, ist letztendlich von Dietmar Hopp bzw. dessen Söhnen oder Verwalter abhängig. Sie besitzen akt. etwa 75% der Aktien von Heidelberg Pharma in ihren Depots . Vielleicht braucht man noch mal eine kleine Maßnahme oder Zwischenfinanzierung durch Hopp, bis dann die erforderlichen Gelder für HP aus dem eigenen operativem Cash Flow generiert werden um die Geschäftstätigkeit eigenständig nachhaltig zu sichern, ohne das weitere Kapitalmaßnahmen benötigt werden.
Datum der Analyse: 11.3.2019
Letzter Kurs bei Analyse: 3,26 €
Anzahl Aktien ca. 28,13 Millionen
Kapitalisierung an der Börse: ca. 91,7 Millionen €
Anteil Dietmar Hopp ca. 75 %
Anteil UCB ca. 4%
Freefloat ca. 20%
Bilanz-/Analystenkonferenz: 21.3.2019
Hauptversammlung: 21.5.2019
Anhang:
Für meine Recherchen habe ich hauptsächlich die Webseiten der Firmen und bekannte Webseiten für medizinische und wissenschaftliche Informationen genutzt. Alle Informationen sind öffentlich und für jeden einsehbar. Ich empfehle auch bei eingehenden Recherchen diese Webseiten zu nutzen, da es dort noch sehr viele Informationen gibt, die selbst in dieser sehr umfangreichen Analyse noch nicht enthalten sind.
Homepage Heidelberg Pharma: https://heidelberg-pharma.com/de/
Homepage Magenta Therapeutics: www.magentatx.com/
Homepage Telix Pharmaceuticals: www.telixpharma.com/
Ich möchte betonen, das dies meine Sicht zum Zeitpunkt der Erstellung der Analyse ist. Neue Erkenntnisse und Fakten werden natürlich meine Einschätzung ändern können. Ich habe diese Analyse mit aller Sorgfalt gemacht. Es ist meine (BICYPAPA)ganz private Sicht und ich habe bei Erstellung der Analyse keinerlei Kontakt zu Heidelberg Pharma gehabt.
Ich beschäftige mich schon sehr lange mit deutschen Biotechwerten und schreibe ab und zu bei aussichtsreichen Werten eine Analyse. Da ich Heidelberg Pharma im Augenblick für den aussichtsreichsten deutschen Biotechwert halte, habe ich zu diesem Wert jetzt diese Analyse geschrieben. Ich möchte aber noch ausdrücklich betonen, dass jeder selbst für sein Handeln verantwortlich ist.
So, das war meine doch sehr umfangreiche Analyse zu Heidelberg Pharma und ich bedanke mich für eure Aufmerksamkeit. In einigen Threads werde ich am Freitag eine Gesamtausgabe posten, falls es die Speicher zulassen.
Antwort auf Beitrag Nr.: 60.084.522 von BICYPAPA am 13.03.19 00:11:30Besten Dank für deine sehr umfangreiche Darstellung der Situation bei HDP. Vielleicht sieht man sich an der HV in Heidelberg.
Antwort auf Beitrag Nr.: 60.084.522 von BICYPAPA am 13.03.19 00:11:30Vielen Dank für die ausführliche Analyse.
Antwort auf Beitrag Nr.: 60.085.227 von Mogli3 am 13.03.19 07:44:28Unglaublich gut. Vielen Dank auch von meiner Seite.
mfg
mfg
Antwort auf Beitrag Nr.: 60.085.569 von skipper2004 am 13.03.19 08:18:31
Besonders Firmen, die nur einen oder wenige Kandidaten in der Pipeline haben können davon betroffen sein. Es ist an allen Punkten der Entwicklung ein großer Verlust möglich. Gerade Anfängern möchte ich vor diesen enormen Gefahren warnen.
Es besteht erst mal das allgemeine Risiko das einfach durch Korrekturphasen der Börsen der Kurs an Wert verliert, wie das Ende letzten Jahres passiert ist. Es gibt keine Garantie auf Gewinne an der Börse. Man hat eine Chance auf Gewinne. Mehr nicht. Punkt.
Es besteht immer ein Risiko in der Entwicklung, wie kürzlich erst Affimed schmerzlich erfahren musste. Ein Todesfall in einer Studie sorgte für enorme Verluste. Diese Gefahr droht praktisch allen Entwicklern.
Dann die Gefahr durch Wirkungslosigkeit. Es werden die Studien ja gerade gemacht um eine Wirkung nachzuweisen. Wie Paion vor einigen Jahren leidvoll mit Desmoteplase erfahren musste. Dieses Risiko sollte sich der Anleger immer bewusst sein. Der Anleger geht das Risiko an der Börse ein. Es ist nicht die Schuld der Firma oder der Geschäftsleitung. Es ist das allgemeine Biotechrisiko, das auch das Scheitern einer Studie beinhaltet. Auch Wilex jetzt Heidelberg Pharma oder Sygnis vor einigen Jahren können ein Lied davon singen. Manchmal sind enorme Verluste möglich. Das sollte jedem Anleger bewusst sein. Es ist nicht die "Schuld" der Firma. Es ist das Risiko des Anlegers. Die Firma testet nur, ob ein Wirkstoff dann am Patienten auch wirkt.
Es bestehen Gefahren in der Entwicklung, wie Cytotools schmerzlich erfahren musste. Auch hier Verluste bis zu 80% an einem Tag. Der Lohnhersteller des Wirkstoffes hat nach Firmenaussage eine falsche viel zu niedrige Dosierung hergestellt. Ein Scheitern der Phase 3 Studie war die Folge. Cytotools, die Aktionäre und der Kurs leiden heute noch unter der Folgewirkung.
Eine weitere Gefahr lauert dann noch im Zulassungsprozess. Es ist ähnlich wie vor Gericht. die Zulassungsbehörden sollen vor Gefahren schützen . Doch auch manchmal gibt es hier auch wie Epigenomics erfahren musste dubiose Entscheidung gegen einen Wirkstoff, die eine Zulassung jahrelang verhindern und enorme Kosten für die Firmen bedeuten. Auch hier sind enorme Verluste und neue Maßnahmen für die Firmen möglich.
Dann Verzögerungen bei der Entwicklung der Wirkstoffe, die bei Biotechwerten eher an der Tagesordnung sind. Oftmals sind es auch weitere Anfragen der Zulassungsbehörden, die einen Studienstart verzögern.
Ich habe jetzt nur einige Risiken aufgeführt um die Gefahren aufzuzeigen. All dies kann zu enormen Kursverlusten führen kann. Dann kann noch die Kapitalbeschaffung den Kurs für längere Zeit unter Druck setzen. Kaum ein Entwickler hat für 8 bis 10 Jahre Entwicklung das Geld in der Schublade rumliegen. Kapitalmaßnahmen sind zwar nervig wegen der Kursverluste für den Anleger aber unverzichtbar für die Firma um die Wirkstoffe dann auch zu entwickeln. Man sollte stets die Finanzlage einer Firma im Auge haben, wenn unerklärliche Kursverläufe auftauchen
All diese Gefahren drohen neben den üblichen Marktkorrekturen dem Biotechanleger. Deshalb ist immer größte Vorsicht angesagt. Dafür können im Erfolgsfall große Gewinne möglich sein.
Dies sind aus meiner Sicht die größten Gefahrenpunkte und man sollte auch überlegen an gewissen kritischen Punkten bei einer Firma nicht investiert zu sein.
Es sind jetzt meine Erfahrungen von den ich erzählen möchte. Ich selber habe bestimmt 6-7 große Verluste in meiner über 23 jährigen Börsenzeit hinnehmen müssen. Dies muss dann in anderen Phasen durch andere Werte wieder ausgeglichen werden. Jedes Risiko kann man nicht vermeiden, wenn plötzliche Ereignisse auftauchen. Doch man kann einigen Risken aus dem Weg gehen.
Doch trotzdem gibt es einige Werte, die trotz eines hohen Risikos aber auch enorme Chancen bieten. Und solch ein Wert ist meiner Meinung nach Heidelberg Pharma, den ich euch in den letzten Tagen
Risiko bei Biotechwerten
Ich möchte hier erst einmal auf die Gefahren bei Biotechwerten hinweisen. Etliche Werte haben in der Vergangenheit enorme Verluste hinnehmen müssen.Besonders Firmen, die nur einen oder wenige Kandidaten in der Pipeline haben können davon betroffen sein. Es ist an allen Punkten der Entwicklung ein großer Verlust möglich. Gerade Anfängern möchte ich vor diesen enormen Gefahren warnen.
Es besteht erst mal das allgemeine Risiko das einfach durch Korrekturphasen der Börsen der Kurs an Wert verliert, wie das Ende letzten Jahres passiert ist. Es gibt keine Garantie auf Gewinne an der Börse. Man hat eine Chance auf Gewinne. Mehr nicht. Punkt.
Es besteht immer ein Risiko in der Entwicklung, wie kürzlich erst Affimed schmerzlich erfahren musste. Ein Todesfall in einer Studie sorgte für enorme Verluste. Diese Gefahr droht praktisch allen Entwicklern.
Dann die Gefahr durch Wirkungslosigkeit. Es werden die Studien ja gerade gemacht um eine Wirkung nachzuweisen. Wie Paion vor einigen Jahren leidvoll mit Desmoteplase erfahren musste. Dieses Risiko sollte sich der Anleger immer bewusst sein. Der Anleger geht das Risiko an der Börse ein. Es ist nicht die Schuld der Firma oder der Geschäftsleitung. Es ist das allgemeine Biotechrisiko, das auch das Scheitern einer Studie beinhaltet. Auch Wilex jetzt Heidelberg Pharma oder Sygnis vor einigen Jahren können ein Lied davon singen. Manchmal sind enorme Verluste möglich. Das sollte jedem Anleger bewusst sein. Es ist nicht die "Schuld" der Firma. Es ist das Risiko des Anlegers. Die Firma testet nur, ob ein Wirkstoff dann am Patienten auch wirkt.
Es bestehen Gefahren in der Entwicklung, wie Cytotools schmerzlich erfahren musste. Auch hier Verluste bis zu 80% an einem Tag. Der Lohnhersteller des Wirkstoffes hat nach Firmenaussage eine falsche viel zu niedrige Dosierung hergestellt. Ein Scheitern der Phase 3 Studie war die Folge. Cytotools, die Aktionäre und der Kurs leiden heute noch unter der Folgewirkung.
Eine weitere Gefahr lauert dann noch im Zulassungsprozess. Es ist ähnlich wie vor Gericht. die Zulassungsbehörden sollen vor Gefahren schützen . Doch auch manchmal gibt es hier auch wie Epigenomics erfahren musste dubiose Entscheidung gegen einen Wirkstoff, die eine Zulassung jahrelang verhindern und enorme Kosten für die Firmen bedeuten. Auch hier sind enorme Verluste und neue Maßnahmen für die Firmen möglich.
Dann Verzögerungen bei der Entwicklung der Wirkstoffe, die bei Biotechwerten eher an der Tagesordnung sind. Oftmals sind es auch weitere Anfragen der Zulassungsbehörden, die einen Studienstart verzögern.
Ich habe jetzt nur einige Risiken aufgeführt um die Gefahren aufzuzeigen. All dies kann zu enormen Kursverlusten führen kann. Dann kann noch die Kapitalbeschaffung den Kurs für längere Zeit unter Druck setzen. Kaum ein Entwickler hat für 8 bis 10 Jahre Entwicklung das Geld in der Schublade rumliegen. Kapitalmaßnahmen sind zwar nervig wegen der Kursverluste für den Anleger aber unverzichtbar für die Firma um die Wirkstoffe dann auch zu entwickeln. Man sollte stets die Finanzlage einer Firma im Auge haben, wenn unerklärliche Kursverläufe auftauchen
All diese Gefahren drohen neben den üblichen Marktkorrekturen dem Biotechanleger. Deshalb ist immer größte Vorsicht angesagt. Dafür können im Erfolgsfall große Gewinne möglich sein.
Dies sind aus meiner Sicht die größten Gefahrenpunkte und man sollte auch überlegen an gewissen kritischen Punkten bei einer Firma nicht investiert zu sein.
Es sind jetzt meine Erfahrungen von den ich erzählen möchte. Ich selber habe bestimmt 6-7 große Verluste in meiner über 23 jährigen Börsenzeit hinnehmen müssen. Dies muss dann in anderen Phasen durch andere Werte wieder ausgeglichen werden. Jedes Risiko kann man nicht vermeiden, wenn plötzliche Ereignisse auftauchen. Doch man kann einigen Risken aus dem Weg gehen.
Doch trotzdem gibt es einige Werte, die trotz eines hohen Risikos aber auch enorme Chancen bieten. Und solch ein Wert ist meiner Meinung nach Heidelberg Pharma, den ich euch in den letzten Tagen
Antwort auf Beitrag Nr.: 60.104.389 von BICYPAPA am 14.03.19 20:57:30Vielen Dank BICYPAPA,
alles was du schreibst, ist mir bekannt. Und ein Greenhorn bin ich beleibe auch nicht . Mir sind die Risiken bei Aktien wohl bewusst und bei BIOTECHS im besonderen. Was mich aber nicht abhält, einen Teil meines Engagements in BIOS zu tätigen. In vernünftigen Maßen, wie ich denke.
. Mir sind die Risiken bei Aktien wohl bewusst und bei BIOTECHS im besonderen. Was mich aber nicht abhält, einen Teil meines Engagements in BIOS zu tätigen. In vernünftigen Maßen, wie ich denke.
Bin in EVOTEC, CLINUVEL, AMARIN, AEQUUS, AETERNA und BIOFRONTERA und eben in HP investiert.
Mal sehen, wie es in 3 - 5 Jahren ( mein Anlagehorizont) aussieht.
mfg
skipper
alles was du schreibst, ist mir bekannt. Und ein Greenhorn bin ich beleibe auch nicht
 . Mir sind die Risiken bei Aktien wohl bewusst und bei BIOTECHS im besonderen. Was mich aber nicht abhält, einen Teil meines Engagements in BIOS zu tätigen. In vernünftigen Maßen, wie ich denke.
. Mir sind die Risiken bei Aktien wohl bewusst und bei BIOTECHS im besonderen. Was mich aber nicht abhält, einen Teil meines Engagements in BIOS zu tätigen. In vernünftigen Maßen, wie ich denke.Bin in EVOTEC, CLINUVEL, AMARIN, AEQUUS, AETERNA und BIOFRONTERA und eben in HP investiert.
Mal sehen, wie es in 3 - 5 Jahren ( mein Anlagehorizont) aussieht.
mfg
skipper
Antwort auf Beitrag Nr.: 60.084.522 von BICYPAPA am 13.03.19 00:11:30
Vielen Dank auch noch mal für die positiven Kommentare, Anmerkungen und Nachfragen an mich. Erst dies ermöglicht es mir meine Analysen noch besser zu machen.
Liebe Grüße
BICYPAPA
Gesamtausgabe Heidelberg Pharma
Ich habe ja jetzt alle 4 Teile gepostet. Ich wollte heute eigentlich noch mal eine Gesamtausgabe machen. Doch ich werde das ein wenig verschieben. Nächste Woche am 21.3. gibt es den Geschäftsbericht und die Analystenkonferenz von HP. Einige kleinere Änderungen möchte ich auch noch machen, um einige Punkte noch besser zu verdeutlichen. Dann möchte ich die Analyse nach den Präsentationen noch einmal überarbeiten. Und immer daran denken, die erste Präsentation ist immer der schlechteste, eben weil es der erste Versuch war. Nach dem Update mach ich dann die überarbeitete Gesamtausgabe.Vielen Dank auch noch mal für die positiven Kommentare, Anmerkungen und Nachfragen an mich. Erst dies ermöglicht es mir meine Analysen noch besser zu machen.
Liebe Grüße
BICYPAPA
Antwort auf Beitrag Nr.: 60.106.225 von BICYPAPA am 15.03.19 07:34:24
https://langfristanleger.net/gastbeitrag-analyse-heidelberg-…
HP Analyse in neuer Präsentation
Mit ein wenig Stolz freue ich mich meine Heidelberg Pharma Analyse in einer neuen Aufmachung präsentieren zu dürfen. Herzlichen Dank dafür.https://langfristanleger.net/gastbeitrag-analyse-heidelberg-…
Antwort auf Beitrag Nr.: 60.113.785 von BICYPAPA am 15.03.19 18:16:32
Recent Business Highlights:
Updated preclinical data for C100 conditioning program showed potent depletion of hematopoietic stem cells and immune cells: At the Transplant and Cellular Therapy (TCT) meeting in February 2019, Magenta presented data from its C100 targeted conditioning program, showing potent stem and immune cell depletion with an anti-CD45 amanitin antibody-drug conjugate (ADC) that was well tolerated at efficacious doses in non-human primates. The Company expects to declare a development candidate for this program in 2019 and intends to develop C100 in both autoimmune diseases and blood cancers.
Declared development candidate in C200 targeted conditioning program and presented preclinical data: At the end of 2018, Magenta declared a development candidate in its C200 targeted conditioning program, which is designed to deplete stem cells in the bone marrow. The Company presented data at the TCT meeting in February 2019 on the development candidate, an anti-CD117 amanitin ADC, showing that it potently and selectively depleted hematopoietic stem cells in non-human primates while preserving the immune system. The ADC was well tolerated at the efficacious doses. Magenta has begun investigational new drug (IND)-enabling studies with this ADC and plans to develop it as a conditioning agent for stem cell gene therapy, in patients with genetic disorders such as sickle cell disease, where current conditioning regimens are toxic.
Bericht von Magenta
Magenta hat eben seinen Bericht veröffentlicht. Hier der Auszug, die auch Heidelberg Pharma betreffen zu C100 und C200.Recent Business Highlights:
Updated preclinical data for C100 conditioning program showed potent depletion of hematopoietic stem cells and immune cells: At the Transplant and Cellular Therapy (TCT) meeting in February 2019, Magenta presented data from its C100 targeted conditioning program, showing potent stem and immune cell depletion with an anti-CD45 amanitin antibody-drug conjugate (ADC) that was well tolerated at efficacious doses in non-human primates. The Company expects to declare a development candidate for this program in 2019 and intends to develop C100 in both autoimmune diseases and blood cancers.
Declared development candidate in C200 targeted conditioning program and presented preclinical data: At the end of 2018, Magenta declared a development candidate in its C200 targeted conditioning program, which is designed to deplete stem cells in the bone marrow. The Company presented data at the TCT meeting in February 2019 on the development candidate, an anti-CD117 amanitin ADC, showing that it potently and selectively depleted hematopoietic stem cells in non-human primates while preserving the immune system. The ADC was well tolerated at the efficacious doses. Magenta has begun investigational new drug (IND)-enabling studies with this ADC and plans to develop it as a conditioning agent for stem cell gene therapy, in patients with genetic disorders such as sickle cell disease, where current conditioning regimens are toxic.
Antwort auf Beitrag Nr.: 60.139.602 von BICYPAPA am 19.03.19 13:55:49
Mal sehen ob HP am Donnerstag darauf eingeht.
Sehr interessant bei C100
Sehr interessant auch die Entwicklung von C100. Nun wird auch geplant C100 sowohl bei Autoimmunkrankheiten als auch bei Blutkrebs zu entwickeln.Mal sehen ob HP am Donnerstag darauf eingeht.
Antwort auf Beitrag Nr.: 60.139.602 von BICYPAPA am 19.03.19 13:55:49Research, Development Option and License Agreement with Heidelberg Pharma Research GmbH
In March 2018, we entered into an exclusive research, development option and license agreement with Heidelberg Pharma Research GmbH, or Heidelberg Pharma. We refer to this agreement as the Heidelberg Agreement. Heidelberg Pharma has developed a proprietary antibody targeted amanitin conjugates platform. This collaboration enables our research and development efforts across several targeted conditioning programs through the combination of our proprietary antibodies and Heidelberg Pharma’s antibody targeted amanitin conjugates platform.
Under the terms of the Heidelberg Agreement, Heidelberg Pharma has granted to us a worldwide, non-exclusive research license for a one-year period with respect to certain targets set forth in an agreed-to research plan. We have the option to extend such license for up to an additional three years. In December 2018, we exercised this option to extend such license for one year. We also have an option to obtain an exclusive target-specific research license, which would expire two years after the exercise of such option. We have exercised this option for two initial targets with signature of the Heidelberg Agreement. In addition, we will have an option to obtain a target-specific exclusive license for global development and commercialization rights to each of the product candidates resulting from the research collaboration. We may obtain such exclusive target-specific rights to up to four targets. In October 2018, we exercised one of the target-specific development options. We are required to use commercially reasonable efforts to perform our research activities under the Heidelberg Agreement and, if we exercise our right to obtain a development and commercialization license, we are required to use commercially reasonable efforts to pursue development and commercialization of a product directed to the applicable target.
Under the terms of the Heidelberg Agreement, we granted Heidelberg Pharma a worldwide, non-exclusive license under all of our patents and know-how, and any improvements of the foregoing developed under the Heidelberg Agreement, that are reasonably necessary or useful for Heidelberg Pharma to perform its research activities under the Heidelberg Agreement. In addition, we grant Heidelberg Pharma a worldwide, royalty-free, non-exclusive license under all joint improvements developed under the Heidelberg Agreement for non-clinical research purposes only.
Payment terms to Heidelberg Pharma include an upfront technology access fee, research exclusivity fees with respect to the two initial targets, and payments for research support. Heidelberg Pharma is entitled to additional fees of between $50,000 and $1.1 million in the aggregate if we extend the initial research license or if we exercise our research exclusivity options with respect to additional targets. Upon our exercise of an option for an exclusive development and commercialization license, with respect to a target, we are required to make a low single digit million-dollar payment to Heidelberg Pharma for each exercised option. In addition, on a per target basis, we may be required to pay development, regulatory and commercial milestones totaling up to approximately $83.5 million per target. We will pay Heidelberg Pharma mid-single digit royalties on a country-by-countryand product-by-product basis, on worldwide net product sales of licensed products. Royalties are payable on a licensed product-by-licensed product and country-by-country basis until the later of (i) expiration of the last valid claim of a licensed patent right that covers the use, import, offering for sale, or sale of such licensed product in such country, and (ii) ten years following the first commercial sale of such licensed product in such country. We have the option to buy-down royalties at certain points during the development path of each product.
Heidelberg Pharma will own all improvements solely related to the intellectual property rights Heidelberg Pharma licensed to us under the Heidelberg Agreement. We will own all improvements solely related to the intellectual property rights that we licensed to Heidelberg Pharma and all other intellectual property rights developed under the Heidelberg Agreement for which ownership is not otherwise allocated.
Heidelberg Pharma controls the filing, prosecution, maintenance and enforcement of the intellectual property that it licenses to us under the Heidelberg Agreement. We have the right to enforce such licensed intellectual property against infringement if the infringement is competitive with our licensed products and Heidelberg Pharma does not pursue enforcement. We control the filing, prosecution, maintenance and enforcement of the intellectual property we license to Heidelberg Pharma under the HeidelbergAgreement.
The term of the Heidelberg Agreement will continue until the last to expire royalty term unless terminated earlier by either party. Each party has the right to terminate the Heidelberg Pharma Agreement due to the other party’s uncured material breach or insolvency on a product-by-product or target-by-target basis. We have the right to terminate the Heidelberg Agreement for convenience in its entirety or on a product-by-product, target-by-target or country-by-country basis upon 60 days’ prior written notice to Heidelberg Pharma if terminating before the first commercial sale of a product in a country or upon six months’ prior written notice to Heidelberg Pharma if terminating after the first commercial sale of any product directed to such target in such country.
Upon termination of the Heidelberg Agreement in its entirety or with respect to a product or target, all applicable licenses granted to us will terminate immediately.
In March 2018, we entered into an exclusive research, development option and license agreement with Heidelberg Pharma Research GmbH, or Heidelberg Pharma. We refer to this agreement as the Heidelberg Agreement. Heidelberg Pharma has developed a proprietary antibody targeted amanitin conjugates platform. This collaboration enables our research and development efforts across several targeted conditioning programs through the combination of our proprietary antibodies and Heidelberg Pharma’s antibody targeted amanitin conjugates platform.
Under the terms of the Heidelberg Agreement, Heidelberg Pharma has granted to us a worldwide, non-exclusive research license for a one-year period with respect to certain targets set forth in an agreed-to research plan. We have the option to extend such license for up to an additional three years. In December 2018, we exercised this option to extend such license for one year. We also have an option to obtain an exclusive target-specific research license, which would expire two years after the exercise of such option. We have exercised this option for two initial targets with signature of the Heidelberg Agreement. In addition, we will have an option to obtain a target-specific exclusive license for global development and commercialization rights to each of the product candidates resulting from the research collaboration. We may obtain such exclusive target-specific rights to up to four targets. In October 2018, we exercised one of the target-specific development options. We are required to use commercially reasonable efforts to perform our research activities under the Heidelberg Agreement and, if we exercise our right to obtain a development and commercialization license, we are required to use commercially reasonable efforts to pursue development and commercialization of a product directed to the applicable target.
Under the terms of the Heidelberg Agreement, we granted Heidelberg Pharma a worldwide, non-exclusive license under all of our patents and know-how, and any improvements of the foregoing developed under the Heidelberg Agreement, that are reasonably necessary or useful for Heidelberg Pharma to perform its research activities under the Heidelberg Agreement. In addition, we grant Heidelberg Pharma a worldwide, royalty-free, non-exclusive license under all joint improvements developed under the Heidelberg Agreement for non-clinical research purposes only.
Payment terms to Heidelberg Pharma include an upfront technology access fee, research exclusivity fees with respect to the two initial targets, and payments for research support. Heidelberg Pharma is entitled to additional fees of between $50,000 and $1.1 million in the aggregate if we extend the initial research license or if we exercise our research exclusivity options with respect to additional targets. Upon our exercise of an option for an exclusive development and commercialization license, with respect to a target, we are required to make a low single digit million-dollar payment to Heidelberg Pharma for each exercised option. In addition, on a per target basis, we may be required to pay development, regulatory and commercial milestones totaling up to approximately $83.5 million per target. We will pay Heidelberg Pharma mid-single digit royalties on a country-by-countryand product-by-product basis, on worldwide net product sales of licensed products. Royalties are payable on a licensed product-by-licensed product and country-by-country basis until the later of (i) expiration of the last valid claim of a licensed patent right that covers the use, import, offering for sale, or sale of such licensed product in such country, and (ii) ten years following the first commercial sale of such licensed product in such country. We have the option to buy-down royalties at certain points during the development path of each product.
Heidelberg Pharma will own all improvements solely related to the intellectual property rights Heidelberg Pharma licensed to us under the Heidelberg Agreement. We will own all improvements solely related to the intellectual property rights that we licensed to Heidelberg Pharma and all other intellectual property rights developed under the Heidelberg Agreement for which ownership is not otherwise allocated.
Heidelberg Pharma controls the filing, prosecution, maintenance and enforcement of the intellectual property that it licenses to us under the Heidelberg Agreement. We have the right to enforce such licensed intellectual property against infringement if the infringement is competitive with our licensed products and Heidelberg Pharma does not pursue enforcement. We control the filing, prosecution, maintenance and enforcement of the intellectual property we license to Heidelberg Pharma under the HeidelbergAgreement.
The term of the Heidelberg Agreement will continue until the last to expire royalty term unless terminated earlier by either party. Each party has the right to terminate the Heidelberg Pharma Agreement due to the other party’s uncured material breach or insolvency on a product-by-product or target-by-target basis. We have the right to terminate the Heidelberg Agreement for convenience in its entirety or on a product-by-product, target-by-target or country-by-country basis upon 60 days’ prior written notice to Heidelberg Pharma if terminating before the first commercial sale of a product in a country or upon six months’ prior written notice to Heidelberg Pharma if terminating after the first commercial sale of any product directed to such target in such country.
Upon termination of the Heidelberg Agreement in its entirety or with respect to a product or target, all applicable licenses granted to us will terminate immediately.
Antwort auf Beitrag Nr.: 60.141.309 von Lidenbrock am 19.03.19 16:26:01Ist dieses Papier öffentlich? Was bedeutet das jetzt genau?
Besten Dank
Besten Dank
Antwort auf Beitrag Nr.: 60.143.721 von Mogli3 am 19.03.19 19:57:58Es sind Extrakte aus Magenta 2018 annual report (heute publiziert) . Verträgliche Details zum Verbindung HDP-MGTA sind da zu lesen.
https://www.streetinsider.com/SEC+Filings/Form++10-K+++++++M…
https://www.streetinsider.com/SEC+Filings/Form++10-K+++++++M…
ich sage mal GUTEN Tag Hier.
Antwort auf Beitrag Nr.: 60.139.602 von BICYPAPA am 19.03.19 13:55:49
Over the past (approximately) nine months, Telix has been manufacturing cGMP (Current Good Manufacturing Practice) grade material for the production of TLX250. cGMP material is required to be able to conduct clinical trials in humans. The completion of manufacturing and release of the material is the final major step before being able to commence further clinical trials in kidney cancer patients. Telix expects to be able to start clinical trials in the US mid-2019, subject to receiving permission from the Food and Drug Administration (FDA).
Key points for investors:
• Manufacturing of an antibody conjugate is a technically challenging process. Telix has been able to complete the manufacturing process within budget although approximately 3-4 additional months were required to validate certain analytical methods involved in the process.
• Telix intends to study TLX250 in patients with metastatic kidney cancer. TLX250 will be studied in combination with immunotherapy (“checkpoint inhibitors”) as this is now the current standard of care in second-line kidney cancer therapy.
• Telix expects to launch at least two distinct clinical studies involving TLX250 at leading US cancer hospitals in the next few months. Clinical protocols are being finalized and regulatory submission paperwork is in progress.
cGMP Manufacturing of TLX250 (Renal Cancer Therapy) Complete Melbourne (Australia), Indianapolis (USA) – 20th March 2019.
Telix Pharmaceuticals Limited (ASX.TLX) (“Telix”, the “Company”), a clinical-stage biopharmaceutical company focused on the development of diagnostic and therapeutic products based on targeted radiopharmaceuticals or “molecularly-targeted radiation” (MTR) has today announced that manufacturing of material suitable for clinical trials has been completed for TLX250.
The manufacturing of TLX250, including fill/finish, was conducted under Current Good Manufacturing Practice (cGMP) by suitable contract manufacturing vendors in the United States. In addition, the Company has now developed the radiolabeling process for conjugating the therapeutic radionuclide 177Lu (lutetium) to TLX250 and will commence technology transfer to clinical sites later this month. Sufficient quantities of material have been produced to enable the Company to complete clinical development up to Phase III.
Telix Pharmaceuticals USA President and COO, Dr. Bernard Lambert said, “We have now developed and implemented the processes for GMP manufacturing and radiolabeling for TLX250. The analytical methods and manufacturing records are suitable for conducing further clinical studies at key US cancer centers and we are very excited to be able to formally commence therapeutic studies in clear cell renal cell patients in the near future, subject to FDA approval.”
Update TLX-250 Telix Therapeutic
Synopsis:Over the past (approximately) nine months, Telix has been manufacturing cGMP (Current Good Manufacturing Practice) grade material for the production of TLX250. cGMP material is required to be able to conduct clinical trials in humans. The completion of manufacturing and release of the material is the final major step before being able to commence further clinical trials in kidney cancer patients. Telix expects to be able to start clinical trials in the US mid-2019, subject to receiving permission from the Food and Drug Administration (FDA).
Key points for investors:
• Manufacturing of an antibody conjugate is a technically challenging process. Telix has been able to complete the manufacturing process within budget although approximately 3-4 additional months were required to validate certain analytical methods involved in the process.
• Telix intends to study TLX250 in patients with metastatic kidney cancer. TLX250 will be studied in combination with immunotherapy (“checkpoint inhibitors”) as this is now the current standard of care in second-line kidney cancer therapy.
• Telix expects to launch at least two distinct clinical studies involving TLX250 at leading US cancer hospitals in the next few months. Clinical protocols are being finalized and regulatory submission paperwork is in progress.
cGMP Manufacturing of TLX250 (Renal Cancer Therapy) Complete Melbourne (Australia), Indianapolis (USA) – 20th March 2019.
Telix Pharmaceuticals Limited (ASX.TLX) (“Telix”, the “Company”), a clinical-stage biopharmaceutical company focused on the development of diagnostic and therapeutic products based on targeted radiopharmaceuticals or “molecularly-targeted radiation” (MTR) has today announced that manufacturing of material suitable for clinical trials has been completed for TLX250.
The manufacturing of TLX250, including fill/finish, was conducted under Current Good Manufacturing Practice (cGMP) by suitable contract manufacturing vendors in the United States. In addition, the Company has now developed the radiolabeling process for conjugating the therapeutic radionuclide 177Lu (lutetium) to TLX250 and will commence technology transfer to clinical sites later this month. Sufficient quantities of material have been produced to enable the Company to complete clinical development up to Phase III.
Telix Pharmaceuticals USA President and COO, Dr. Bernard Lambert said, “We have now developed and implemented the processes for GMP manufacturing and radiolabeling for TLX250. The analytical methods and manufacturing records are suitable for conducing further clinical studies at key US cancer centers and we are very excited to be able to formally commence therapeutic studies in clear cell renal cell patients in the near future, subject to FDA approval.”
Antwort auf Beitrag Nr.: 60.113.785 von BICYPAPA am 15.03.19 18:16:32
https://langfristanleger.net/gastbeitrag-analyse-der-heidelb…
Präsentation von HP Teil 2
Hier nun der zweite Teil der Analyse von HP in neuer Aufmachung.https://langfristanleger.net/gastbeitrag-analyse-der-heidelb…
Antwort auf Beitrag Nr.: 60.154.389 von BICYPAPA am 20.03.19 19:35:00
- Wesentliche Meilensteine der GMP-Herstellung von HDP-101 erreicht
- Vorbereitung der klinischen Studie mit HDP-101 vorangetrieben
- Lizenzpartnerschaften zur Entwicklung von Antikörper-Amanitin-Konjugaten mit Magenta und Takeda machen Fortschritte
- Phase III-Studie von Kooperationspartner Telix beantragt und gestartet
- Deutliches Umsatzwachstum gegenüber Vorjahr
- Telefonkonferenz am 21. März 2019 um 15:00 Uhr MEZ
Ladenburg, 21. März 2019 - Die Heidelberg Pharma AG (FWB: WL6) veröffentlichte heute die Finanzzahlen und den Geschäftsbericht für das Geschäftsjahr 2018 (1. Dezember 2017 - 30. November 2018) sowie den Ausblick für 2019.
"Der Verlauf des Geschäftsjahres 2018 war sehr erfolgreich. Die wirtschaftliche Lage hat sich positiv im Rahmen der Planung entwickelt und die Umsätze haben sich nahezu verdoppelt. Der Jahresverlust fällt etwas geringer aus als prognostiziert, weil sich insbesondere F&E-Aufwendungen ins Jahr 2019 verschoben haben. Unser Geschäft mit der ATAC-Technologie hat sich gut entwickelt. Neben einer Reihe von Forschungskooperationen haben wir eine weitere Lizenzpartnerschaft abgeschlossen und die erste Option für eines der Zielmoleküle wurde im Herbst ausgeübt. Wir freuen uns sehr, dass unsere Partnerprojekte Fortschritte machen und bereits erste positive Daten auf wissenschaftlichen Konferenzen präsentiert wurden", kommentierte Dr. Jan Schmidt-Brand, Sprecher des Vorstands und Vorstand für Finanzen der Heidelberg Pharma AG.
"Für unseren eigenen Entwicklungskandidaten HDP-101 waren besonders die erzielten Fortschritte beim Aufbau der GMP-Herstellung wichtig. Parallel dazu haben wir die Vorbereitungen für die klinische Entwicklung von HDP-101 vorangetrieben und konnten renommierte klinische Zentren für unser klinisches Entwicklungsprogramm im Multiplen Myelom gewinnen. Der nunmehr konkretisierte Zeitplan für die Herstellung des Studienmaterials erlaubt die Abstimmungen mit der FDA und dem Paul-Ehrlich-Institut im vierten Quartal 2019. Die Erteilung der Genehmigung für die geplante Phase I-Studie ist Anfang des kommenden Jahres zu erwarten."
Wichtige Ereignisse im Geschäftsjahr 2018 und operativer Ausblick
- Aufbau der GMP-Herstellung von HDP-101: Es ist Heidelberg Pharma gelungen, den Technologietransfer für die Herstellung des Amanitins und der anderen Grundbausteine aus den eigenen Labors in eine industrielle Anlage erfolgreich abzuschließen. Nach Kenntnis von Heidelberg Pharma ist dies weltweit die erste und bislang einzige industrielle Quelle für chemisch hergestelltes Amanitin. Der Technologietransfer in den Industriemaßstab war ein wichtiger Meilenstein, sowohl für die Materialversorgung der eigenen als auch für die Partnerprojekte. Anschließend wurde bei den Produktionspartnern die erste, vollständig auf einem synthetischen Amanitin und dem bereits zuvor hergestellten BCMA-Antikörper beruhende, technische Charge des Entwicklungskandidaten HDP-101 hergestellt. Das Material aus dieser Herstellung wird derzeit für die abschließenden Toxizitätsstudien nach Good Laboratory Practice (GLP) zur Vorbereitung der klinischen Studien verwendet. Die Komplexität der Synthese stellte Heidelberg Pharma und seine Partner vor unterschiedliche Herausforderungen, die mit zusätzlichen Arbeitsschritten gemeistert werden konnten. Der Herstellungsprozess ist nun etabliert, wenngleich mit einer Verzögerung zum ursprünglichen Zeitplan.
- Vorbereitung der klinischen Studie mit HDP-101: Parallel wurde an der Konzeption des klinischen Entwicklungsprogramms für HDP-101 gearbeitet. Bei der Vorstellung dieses neuen therapeutischen Ansatzes bei den Zulassungsbehörden Paul-Ehrlich-Institut in Deutschland und FDA in den USA im Rahmen von wissenschaftlichen Beratungen wurde das präklinische Programm abgestimmt und das Potenzial des Amanitins zur Krebsbehandlung erläutert. Der proprietäre ATAC-Kandidat HDP-101 soll erstmals in Patienten in der Indikation Multiples Myelom getestet werden. Die klinische Entwicklungsstrategie sieht vor, die Anträge für die Phase Ia (Dosiseskalation) und Phase Ib (Dosisexpansion) zeitgleich in USA und in Deutschland einzureichen. Der nunmehr konkretisierte Zeitplan für die Herstellung des Studienmaterials erlaubt die Abstimmungen mit der FDA und dem Paul-Ehrlich-Institut im vierten Quartal 2019. Die Erteilung der Genehmigung für die geplante Phase I-Studie ist Anfang des kommenden Jahres zu erwarten. Die Rekrutierung der Patienten soll dann entsprechend der Aktivierung der klinischen Zentren erfolgen.
- Lizenzpartnerschaften zur Entwicklung von ATACs mit Magenta und Takeda: Heidelberg Pharma hat exklusive Forschungsvereinbarungen für mehrere Zielmoleküle mit Magenta Therapeutics, Cambridge, MA, USA, (März 2018) und Takeda Oncology, Cambridge, MA, USA, (Juni 2017) abgeschlossen. Den Partnern wird Zugang zu Heidelberg Pharmas ATAC-Plattformtechnologie zur Anwendung auf ihre Antikörper gewährt, und sie haben die Option für die exklusive Lizenzierung der weltweiten Entwicklungs- und Vermarktungsrechte aller Produktkandidaten, die jeweils aus der Zusammenarbeit hervorgehen. Takeda hat die Option auf bis zu drei, Magenta auf bis zu vier Zielstrukturen.
Magenta hat im Oktober 2018 die Option für die Weiterentwicklung eines Zielmoleküls ausgeübt und wird die Entwicklung eines darauf basierenden ATACs im Rahmen einer exklusiven Lizenzierung fortsetzen. Darüber hinaus hat der Partner erste Arbeiten mit CD45- und CD117-Antikörpern veröffentlicht. Die getesteten ATACs wurden präklinisch auf ihre Eignung zur sogenannten Konditionierung (Vorbereitung) von Patienten für die Transplantation von Knochenmarkszellen getestet und zeigten sehr gute Daten.
Auch die Zusammenarbeit mit Takeda läuft vertragsgemäß, aber es wurden bisher noch keine Daten veröffentlicht.
- Kooperationspartner Telix hat Antrag auf Zulassung einer Phase III-Studie eingereicht: Telix Pharmaceuticals Limited, Melbourne, Australien, der Kooperationspartner für den Diagnostikumkandidaten REDECTANE(R), hat 2018 einen Antrag auf Durchführung einer Phase III-Studie mit 89Zr-DFO-girentuximab (TLX250) zur bildgebenden Diagnostik von Nierenkrebs mittels Positronen-Emissions-Tomographie (PET) eingereicht. Die Studie wird derzeit als globale multizentrische Phase III-Studie an Standorten in Europa und Australien durchgeführt und soll ca. 250 Nierenkrebspatienten einschließen, die sich einer Nierenoperation unterziehen. Studienzentren sollen vorbehaltlich der behördlichen Genehmigungen auch in den USA und Kanada im Laufe des Jahres 2019 geöffnet werden. Die Studie soll die Sensitivität und Spezifität der TLX250-PET-Bildgebung zum Nachweis des klarzelligen Nierenzellkarzinoms (ccRCC) im Vergleich zu histologischen Referenzdaten aus chirurgischen Resektionsproben bestimmen.
- Rechtsstreit mit Siemens beigelegt: Die Heidelberg Pharma AG hat sich mit Siemens Corporation, Iselin, NJ, USA, auf eine Zahlung von 500 TUSD einschließlich der Prozesskosten und Zinsen zur abschließenden Erledigung des Rechtsstreites um eine Mietgarantie für Nuclea Biotechnologies geeinigt. Dem Vergleich ging ein Urteil auf Zahlung von 549 TUSD zu Lasten von Heidelberg Pharma voraus. Die Verpflichtung war weitestgehend durch die zuvor gebildete Rückstellung abgedeckt.
- Jahrestagung der American Society of Hematology (ASH): Im Dezember 2018 wurden verschiedene Abstracts auf der 60. Jahrestagung der American Society of Hematology (ASH) in San Diego veröffentlicht. Der Lizenzpartner Magenta präsentierte mehrere Poster mit sehr guten präklinischen Daten zu seinen zwei ATAC-Projekten (CD45- und CD117-Antikörper) aus der Zusammenarbeit mit Heidelberg Pharma. Für HDP-101 wurden Daten aus der Kollaboration mit dem US-amerikanischen Krebsforschungszentrum MD Anderson im Rahmen einer Präsentation vorgestellt. Diese Daten zeigen, dass ATACs das Potenzial haben, auch beim Multiplen Myelom präferenziell auf Tumorzellen mit aggressiven Verlaufsformen im Zusammenhang mit einer 17p-Deletion zu wirken.
Wichtige Ereignisse nach Ende der Berichtsperiode
- IND-Genehmigung und Meilensteinzahlung vom Partner Link Health: Im Januar 2019 hat Heidelberg Pharma bekanntgegeben, dass der von Link Health gestellte IND-Antrag zur Durchführung von klinischen Studien mit MESUPRON(R) genehmigt worden ist. Aufgrund von Änderungen für Studienregularien der chinesischen Zulassungsbehörde besteht jetzt die Chance, dass auf Grundlage der früheren Daten aus USA und Europa unmittelbar eine Phase II-Studie begonnen werden kann. Mit der grundsätzlichen Genehmigung der Studie wurde eine Meilensteinzahlung an Heidelberg Pharma fällig. In diesem Zusammenhang wurden 421 TEuro ertragswirksam vereinnahmt.
Finanzkennzahlen des Geschäftsjahres 2018 für den Heidelberg Pharma-Konzern
Das Geschäftsjahr 2018 bezieht sich auf den Zeitraum vom 1. Dezember 2017 bis zum 30. November 2018. Der Heidelberg Pharma-Konzern umfasst die Gesellschaften Heidelberg Pharma AG und Heidelberg Pharma Research GmbH.
Der Heidelberg Pharma-Konzern hat im Geschäftsjahr 2018 einen Anstieg der Umsatzerlöse um 93 % auf 3,7 Mio. Euro (Vorjahr: 1,9 Mio. Euro) realisiert, die im Wesentlichen von der Heidelberg Pharma Research GmbH (3,5 Mio. Euro) erwirtschaftet wurden. Davon wiederum stammen 2,6 Mio. Euro aus der ATAC-Technologie und 0,9 Mio. Euro aus dem Servicegeschäft. Die Umsätze der Muttergesellschaft (0,2 Mio. Euro) wurden im Zuge der Auslizenzierung von REDECTANE(R) erzielt.
Die sonstigen Erträge lagen mit 0,7 Mio. Euro über dem Vorjahresniveau (0,6 Mio. Euro). Sie sind beeinflusst durch Fördermittel der öffentlichen Hand auf bundesdeutscher und europäischer Ebene, welche Projekte der Heidelberg Pharma Research GmbH in Höhe von 0,1 Mio. Euro (Vorjahr: 0,2 Mio. Euro) unterstützen. Weiter konnten Erträge aus der Auflösung nicht in Anspruch genommener abgegrenzter Verbindlichkeiten und Rückstellungen in Höhe von 0,2 Mio. Euro (Vorjahr: 0,3 Mio. Euro) verbucht werden, welche im Wesentlichen Verjährungen anheimfielen. Aus der Weiterberechnung von Patentkosten im Kontext von Auslizenzierungen wurden von der Muttergesellschaft erstmals 0,2 Mio. Euro erzielt. Weitere Sachverhalte schlugen insgesamt mit 0,2 Mio. Euro Ertrag zu Buche (Vorjahr: 0,1 Mio. Euro).
Die betrieblichen Aufwendungen einschließlich der Abschreibungen sind 2018 plangemäß auf 16,0 Mio. Euro (Vorjahr: 13,2 Mio. Euro) gestiegen. Die Forschungs- und Entwicklungskosten in Höhe von 10,7 Mio. Euro stiegen im Vergleich zum Vorjahr (9,3 Mio. Euro) aufgrund der Ausweitung der kostenintensiven externen GMP-Produktion plangemäß an. Diese Kategorie stellte mit 67 % der betrieblichen Aufwendungen weiterhin den größten Kostenblock dar. Die Herstellungskosten haben sich auf 2,2 Mio. Euro (Vorjahr 1,0 Mio. Euro) erhöht und entsprechen 14 % der betrieblichen Aufwendungen. Die Verwaltungskosten betrugen 2,9 Mio. Euro, lagen damit über dem Vorjahresniveau (2,7 Mio. Euro) und entsprechen 18 % der betrieblichen Aufwendungen.
Die sonstigen Aufwendungen für Aktivitäten im Bereich Geschäftsentwicklung, Vermarktung und kommerzielle Marktversorgung betrugen unverändert zum Vorjahr 0,2 Mio. Euro, 1 % der betrieblichen Aufwendungen.
Der Heidelberg Pharma-Konzern hat im Geschäftsjahr 2018 ein Ergebnis vor Steuern von -11,7 Mio. Euro (Vorjahr: -11,0 Mio. Euro) ausgewiesen. Der Jahresfehlbetrag betrug ebenfalls 11,7 Mio. Euro (Vorjahr: 11,0 Mio. Euro). Das unverwässerte Ergebnis je Aktie verbesserte sich trotz des ausgeweiteten Verlustes aufgrund der 2018 höheren durchschnittlich ausgegebenen Aktienanzahl von -0,76 Euro im Vorjahr auf -0,41 Euro.
Zum Geschäftsjahresende wurde mit 31,2 Mio. Euro eine um 10,3 Mio. Euro niedrigere Bilanzsumme ausgewiesen als im Vorjahr (41,5 Mio. Euro), was im Wesentlichen aus der aufwandsinduzierten Abnahme des Zahlungsmittelbestandes und dem korrespondierenden Rückgang des Eigenkapitals resultiert.
Heidelberg Pharma verfügte am Ende des Geschäftsjahres über liquide Mittel in Höhe von 19,4 Mio. Euro (30. November 2017: 30,4 Mio. Euro). Der plangemäße Rückgang resultiert aus dem Liquiditätsabfluss infolge der operativen Geschäftstätigkeit. Der monatliche Barmittelverbrauch erhöhte sich auf 0,9 Mio. Euro (Vorjahr: 0,7 Mio. Euro). Das Konzern-Eigenkapital betrug 25,9 Mio. Euro (30. November 2017: 37,0 Mio. Euro). Das entspricht einer Eigenkapitalquote von 83,0 % (30. November 2017: 89,2 %).
Finanzausblick 2019 und Strategie
Der Heidelberg Pharma-Konzern rechnet für das Geschäftsjahr 2019 mit Umsätzen und sonstigen Erträgen zwischen insgesamt 5,0 Mio. Euro und 7,0 Mio. Euro (2018: 4,4 Mio. Euro). Die betrieblichen Aufwendungen werden sich nach der derzeitigen Planung in einem Korridor von 14,0 Mio. Euro bis 18,0 Mio. Euro bewegen (2018: 16,0 Mio. Euro). Für 2019 wird ein Betriebsergebnis (EBIT) zwischen -8,0 Mio. Euro und -12,0 Mio. Euro prognostiziert (2018:
-11,7 Mio. Euro).
Für 2019 rechnet Heidelberg Pharma mit einem Finanzmittelbedarf von 10,0 Mio. Euro bis 14,0 Mio. Euro. Der monatliche Barmittelverbrauch dürfte sich zwischen 0,9 Mio. Euro und 1,2 Mio. Euro pro Monat bewegen.
In dieser Planung sind weitere potenzielle Zahlungsmittelzuflüsse aus neuen Lizenzierungsaktivitäten bei Heidelberg Pharma Research berücksichtigt. Der Konzern ist auf Basis der aktuellen Planung bis Mitte 2020 finanziert.
Im Mittelpunkt der Strategie von Heidelberg Pharma steht die Entwicklung und Vermarktung der proprietären ATAC-Technologie. Kernelemente sind dabei der Ausbau der eigenen Projektpipeline, die Anbahnung von Forschungs-/Optionsverträgen und deren Erweiterung auf langfristige Lizenzvereinbarungen sowie die Verbreiterung der Technologiebasis
Jahresabschluss
Heidelberg Pharma veröffentlicht Finanzzahlen für das Geschäftsjahr 2018 und berichtet über den Geschäftsverlauf- Wesentliche Meilensteine der GMP-Herstellung von HDP-101 erreicht
- Vorbereitung der klinischen Studie mit HDP-101 vorangetrieben
- Lizenzpartnerschaften zur Entwicklung von Antikörper-Amanitin-Konjugaten mit Magenta und Takeda machen Fortschritte
- Phase III-Studie von Kooperationspartner Telix beantragt und gestartet
- Deutliches Umsatzwachstum gegenüber Vorjahr
- Telefonkonferenz am 21. März 2019 um 15:00 Uhr MEZ
Ladenburg, 21. März 2019 - Die Heidelberg Pharma AG (FWB: WL6) veröffentlichte heute die Finanzzahlen und den Geschäftsbericht für das Geschäftsjahr 2018 (1. Dezember 2017 - 30. November 2018) sowie den Ausblick für 2019.
"Der Verlauf des Geschäftsjahres 2018 war sehr erfolgreich. Die wirtschaftliche Lage hat sich positiv im Rahmen der Planung entwickelt und die Umsätze haben sich nahezu verdoppelt. Der Jahresverlust fällt etwas geringer aus als prognostiziert, weil sich insbesondere F&E-Aufwendungen ins Jahr 2019 verschoben haben. Unser Geschäft mit der ATAC-Technologie hat sich gut entwickelt. Neben einer Reihe von Forschungskooperationen haben wir eine weitere Lizenzpartnerschaft abgeschlossen und die erste Option für eines der Zielmoleküle wurde im Herbst ausgeübt. Wir freuen uns sehr, dass unsere Partnerprojekte Fortschritte machen und bereits erste positive Daten auf wissenschaftlichen Konferenzen präsentiert wurden", kommentierte Dr. Jan Schmidt-Brand, Sprecher des Vorstands und Vorstand für Finanzen der Heidelberg Pharma AG.
"Für unseren eigenen Entwicklungskandidaten HDP-101 waren besonders die erzielten Fortschritte beim Aufbau der GMP-Herstellung wichtig. Parallel dazu haben wir die Vorbereitungen für die klinische Entwicklung von HDP-101 vorangetrieben und konnten renommierte klinische Zentren für unser klinisches Entwicklungsprogramm im Multiplen Myelom gewinnen. Der nunmehr konkretisierte Zeitplan für die Herstellung des Studienmaterials erlaubt die Abstimmungen mit der FDA und dem Paul-Ehrlich-Institut im vierten Quartal 2019. Die Erteilung der Genehmigung für die geplante Phase I-Studie ist Anfang des kommenden Jahres zu erwarten."
Wichtige Ereignisse im Geschäftsjahr 2018 und operativer Ausblick
- Aufbau der GMP-Herstellung von HDP-101: Es ist Heidelberg Pharma gelungen, den Technologietransfer für die Herstellung des Amanitins und der anderen Grundbausteine aus den eigenen Labors in eine industrielle Anlage erfolgreich abzuschließen. Nach Kenntnis von Heidelberg Pharma ist dies weltweit die erste und bislang einzige industrielle Quelle für chemisch hergestelltes Amanitin. Der Technologietransfer in den Industriemaßstab war ein wichtiger Meilenstein, sowohl für die Materialversorgung der eigenen als auch für die Partnerprojekte. Anschließend wurde bei den Produktionspartnern die erste, vollständig auf einem synthetischen Amanitin und dem bereits zuvor hergestellten BCMA-Antikörper beruhende, technische Charge des Entwicklungskandidaten HDP-101 hergestellt. Das Material aus dieser Herstellung wird derzeit für die abschließenden Toxizitätsstudien nach Good Laboratory Practice (GLP) zur Vorbereitung der klinischen Studien verwendet. Die Komplexität der Synthese stellte Heidelberg Pharma und seine Partner vor unterschiedliche Herausforderungen, die mit zusätzlichen Arbeitsschritten gemeistert werden konnten. Der Herstellungsprozess ist nun etabliert, wenngleich mit einer Verzögerung zum ursprünglichen Zeitplan.
- Vorbereitung der klinischen Studie mit HDP-101: Parallel wurde an der Konzeption des klinischen Entwicklungsprogramms für HDP-101 gearbeitet. Bei der Vorstellung dieses neuen therapeutischen Ansatzes bei den Zulassungsbehörden Paul-Ehrlich-Institut in Deutschland und FDA in den USA im Rahmen von wissenschaftlichen Beratungen wurde das präklinische Programm abgestimmt und das Potenzial des Amanitins zur Krebsbehandlung erläutert. Der proprietäre ATAC-Kandidat HDP-101 soll erstmals in Patienten in der Indikation Multiples Myelom getestet werden. Die klinische Entwicklungsstrategie sieht vor, die Anträge für die Phase Ia (Dosiseskalation) und Phase Ib (Dosisexpansion) zeitgleich in USA und in Deutschland einzureichen. Der nunmehr konkretisierte Zeitplan für die Herstellung des Studienmaterials erlaubt die Abstimmungen mit der FDA und dem Paul-Ehrlich-Institut im vierten Quartal 2019. Die Erteilung der Genehmigung für die geplante Phase I-Studie ist Anfang des kommenden Jahres zu erwarten. Die Rekrutierung der Patienten soll dann entsprechend der Aktivierung der klinischen Zentren erfolgen.
- Lizenzpartnerschaften zur Entwicklung von ATACs mit Magenta und Takeda: Heidelberg Pharma hat exklusive Forschungsvereinbarungen für mehrere Zielmoleküle mit Magenta Therapeutics, Cambridge, MA, USA, (März 2018) und Takeda Oncology, Cambridge, MA, USA, (Juni 2017) abgeschlossen. Den Partnern wird Zugang zu Heidelberg Pharmas ATAC-Plattformtechnologie zur Anwendung auf ihre Antikörper gewährt, und sie haben die Option für die exklusive Lizenzierung der weltweiten Entwicklungs- und Vermarktungsrechte aller Produktkandidaten, die jeweils aus der Zusammenarbeit hervorgehen. Takeda hat die Option auf bis zu drei, Magenta auf bis zu vier Zielstrukturen.
Magenta hat im Oktober 2018 die Option für die Weiterentwicklung eines Zielmoleküls ausgeübt und wird die Entwicklung eines darauf basierenden ATACs im Rahmen einer exklusiven Lizenzierung fortsetzen. Darüber hinaus hat der Partner erste Arbeiten mit CD45- und CD117-Antikörpern veröffentlicht. Die getesteten ATACs wurden präklinisch auf ihre Eignung zur sogenannten Konditionierung (Vorbereitung) von Patienten für die Transplantation von Knochenmarkszellen getestet und zeigten sehr gute Daten.
Auch die Zusammenarbeit mit Takeda läuft vertragsgemäß, aber es wurden bisher noch keine Daten veröffentlicht.
- Kooperationspartner Telix hat Antrag auf Zulassung einer Phase III-Studie eingereicht: Telix Pharmaceuticals Limited, Melbourne, Australien, der Kooperationspartner für den Diagnostikumkandidaten REDECTANE(R), hat 2018 einen Antrag auf Durchführung einer Phase III-Studie mit 89Zr-DFO-girentuximab (TLX250) zur bildgebenden Diagnostik von Nierenkrebs mittels Positronen-Emissions-Tomographie (PET) eingereicht. Die Studie wird derzeit als globale multizentrische Phase III-Studie an Standorten in Europa und Australien durchgeführt und soll ca. 250 Nierenkrebspatienten einschließen, die sich einer Nierenoperation unterziehen. Studienzentren sollen vorbehaltlich der behördlichen Genehmigungen auch in den USA und Kanada im Laufe des Jahres 2019 geöffnet werden. Die Studie soll die Sensitivität und Spezifität der TLX250-PET-Bildgebung zum Nachweis des klarzelligen Nierenzellkarzinoms (ccRCC) im Vergleich zu histologischen Referenzdaten aus chirurgischen Resektionsproben bestimmen.
- Rechtsstreit mit Siemens beigelegt: Die Heidelberg Pharma AG hat sich mit Siemens Corporation, Iselin, NJ, USA, auf eine Zahlung von 500 TUSD einschließlich der Prozesskosten und Zinsen zur abschließenden Erledigung des Rechtsstreites um eine Mietgarantie für Nuclea Biotechnologies geeinigt. Dem Vergleich ging ein Urteil auf Zahlung von 549 TUSD zu Lasten von Heidelberg Pharma voraus. Die Verpflichtung war weitestgehend durch die zuvor gebildete Rückstellung abgedeckt.
- Jahrestagung der American Society of Hematology (ASH): Im Dezember 2018 wurden verschiedene Abstracts auf der 60. Jahrestagung der American Society of Hematology (ASH) in San Diego veröffentlicht. Der Lizenzpartner Magenta präsentierte mehrere Poster mit sehr guten präklinischen Daten zu seinen zwei ATAC-Projekten (CD45- und CD117-Antikörper) aus der Zusammenarbeit mit Heidelberg Pharma. Für HDP-101 wurden Daten aus der Kollaboration mit dem US-amerikanischen Krebsforschungszentrum MD Anderson im Rahmen einer Präsentation vorgestellt. Diese Daten zeigen, dass ATACs das Potenzial haben, auch beim Multiplen Myelom präferenziell auf Tumorzellen mit aggressiven Verlaufsformen im Zusammenhang mit einer 17p-Deletion zu wirken.
Wichtige Ereignisse nach Ende der Berichtsperiode
- IND-Genehmigung und Meilensteinzahlung vom Partner Link Health: Im Januar 2019 hat Heidelberg Pharma bekanntgegeben, dass der von Link Health gestellte IND-Antrag zur Durchführung von klinischen Studien mit MESUPRON(R) genehmigt worden ist. Aufgrund von Änderungen für Studienregularien der chinesischen Zulassungsbehörde besteht jetzt die Chance, dass auf Grundlage der früheren Daten aus USA und Europa unmittelbar eine Phase II-Studie begonnen werden kann. Mit der grundsätzlichen Genehmigung der Studie wurde eine Meilensteinzahlung an Heidelberg Pharma fällig. In diesem Zusammenhang wurden 421 TEuro ertragswirksam vereinnahmt.
Finanzkennzahlen des Geschäftsjahres 2018 für den Heidelberg Pharma-Konzern
Das Geschäftsjahr 2018 bezieht sich auf den Zeitraum vom 1. Dezember 2017 bis zum 30. November 2018. Der Heidelberg Pharma-Konzern umfasst die Gesellschaften Heidelberg Pharma AG und Heidelberg Pharma Research GmbH.
Der Heidelberg Pharma-Konzern hat im Geschäftsjahr 2018 einen Anstieg der Umsatzerlöse um 93 % auf 3,7 Mio. Euro (Vorjahr: 1,9 Mio. Euro) realisiert, die im Wesentlichen von der Heidelberg Pharma Research GmbH (3,5 Mio. Euro) erwirtschaftet wurden. Davon wiederum stammen 2,6 Mio. Euro aus der ATAC-Technologie und 0,9 Mio. Euro aus dem Servicegeschäft. Die Umsätze der Muttergesellschaft (0,2 Mio. Euro) wurden im Zuge der Auslizenzierung von REDECTANE(R) erzielt.
Die sonstigen Erträge lagen mit 0,7 Mio. Euro über dem Vorjahresniveau (0,6 Mio. Euro). Sie sind beeinflusst durch Fördermittel der öffentlichen Hand auf bundesdeutscher und europäischer Ebene, welche Projekte der Heidelberg Pharma Research GmbH in Höhe von 0,1 Mio. Euro (Vorjahr: 0,2 Mio. Euro) unterstützen. Weiter konnten Erträge aus der Auflösung nicht in Anspruch genommener abgegrenzter Verbindlichkeiten und Rückstellungen in Höhe von 0,2 Mio. Euro (Vorjahr: 0,3 Mio. Euro) verbucht werden, welche im Wesentlichen Verjährungen anheimfielen. Aus der Weiterberechnung von Patentkosten im Kontext von Auslizenzierungen wurden von der Muttergesellschaft erstmals 0,2 Mio. Euro erzielt. Weitere Sachverhalte schlugen insgesamt mit 0,2 Mio. Euro Ertrag zu Buche (Vorjahr: 0,1 Mio. Euro).
Die betrieblichen Aufwendungen einschließlich der Abschreibungen sind 2018 plangemäß auf 16,0 Mio. Euro (Vorjahr: 13,2 Mio. Euro) gestiegen. Die Forschungs- und Entwicklungskosten in Höhe von 10,7 Mio. Euro stiegen im Vergleich zum Vorjahr (9,3 Mio. Euro) aufgrund der Ausweitung der kostenintensiven externen GMP-Produktion plangemäß an. Diese Kategorie stellte mit 67 % der betrieblichen Aufwendungen weiterhin den größten Kostenblock dar. Die Herstellungskosten haben sich auf 2,2 Mio. Euro (Vorjahr 1,0 Mio. Euro) erhöht und entsprechen 14 % der betrieblichen Aufwendungen. Die Verwaltungskosten betrugen 2,9 Mio. Euro, lagen damit über dem Vorjahresniveau (2,7 Mio. Euro) und entsprechen 18 % der betrieblichen Aufwendungen.
Die sonstigen Aufwendungen für Aktivitäten im Bereich Geschäftsentwicklung, Vermarktung und kommerzielle Marktversorgung betrugen unverändert zum Vorjahr 0,2 Mio. Euro, 1 % der betrieblichen Aufwendungen.
Der Heidelberg Pharma-Konzern hat im Geschäftsjahr 2018 ein Ergebnis vor Steuern von -11,7 Mio. Euro (Vorjahr: -11,0 Mio. Euro) ausgewiesen. Der Jahresfehlbetrag betrug ebenfalls 11,7 Mio. Euro (Vorjahr: 11,0 Mio. Euro). Das unverwässerte Ergebnis je Aktie verbesserte sich trotz des ausgeweiteten Verlustes aufgrund der 2018 höheren durchschnittlich ausgegebenen Aktienanzahl von -0,76 Euro im Vorjahr auf -0,41 Euro.
Zum Geschäftsjahresende wurde mit 31,2 Mio. Euro eine um 10,3 Mio. Euro niedrigere Bilanzsumme ausgewiesen als im Vorjahr (41,5 Mio. Euro), was im Wesentlichen aus der aufwandsinduzierten Abnahme des Zahlungsmittelbestandes und dem korrespondierenden Rückgang des Eigenkapitals resultiert.
Heidelberg Pharma verfügte am Ende des Geschäftsjahres über liquide Mittel in Höhe von 19,4 Mio. Euro (30. November 2017: 30,4 Mio. Euro). Der plangemäße Rückgang resultiert aus dem Liquiditätsabfluss infolge der operativen Geschäftstätigkeit. Der monatliche Barmittelverbrauch erhöhte sich auf 0,9 Mio. Euro (Vorjahr: 0,7 Mio. Euro). Das Konzern-Eigenkapital betrug 25,9 Mio. Euro (30. November 2017: 37,0 Mio. Euro). Das entspricht einer Eigenkapitalquote von 83,0 % (30. November 2017: 89,2 %).
Finanzausblick 2019 und Strategie
Der Heidelberg Pharma-Konzern rechnet für das Geschäftsjahr 2019 mit Umsätzen und sonstigen Erträgen zwischen insgesamt 5,0 Mio. Euro und 7,0 Mio. Euro (2018: 4,4 Mio. Euro). Die betrieblichen Aufwendungen werden sich nach der derzeitigen Planung in einem Korridor von 14,0 Mio. Euro bis 18,0 Mio. Euro bewegen (2018: 16,0 Mio. Euro). Für 2019 wird ein Betriebsergebnis (EBIT) zwischen -8,0 Mio. Euro und -12,0 Mio. Euro prognostiziert (2018:
-11,7 Mio. Euro).
Für 2019 rechnet Heidelberg Pharma mit einem Finanzmittelbedarf von 10,0 Mio. Euro bis 14,0 Mio. Euro. Der monatliche Barmittelverbrauch dürfte sich zwischen 0,9 Mio. Euro und 1,2 Mio. Euro pro Monat bewegen.
In dieser Planung sind weitere potenzielle Zahlungsmittelzuflüsse aus neuen Lizenzierungsaktivitäten bei Heidelberg Pharma Research berücksichtigt. Der Konzern ist auf Basis der aktuellen Planung bis Mitte 2020 finanziert.
Im Mittelpunkt der Strategie von Heidelberg Pharma steht die Entwicklung und Vermarktung der proprietären ATAC-Technologie. Kernelemente sind dabei der Ausbau der eigenen Projektpipeline, die Anbahnung von Forschungs-/Optionsverträgen und deren Erweiterung auf langfristige Lizenzvereinbarungen sowie die Verbreiterung der Technologiebasis
Antwort auf Beitrag Nr.: 60.156.912 von BICYPAPA am 21.03.19 07:17:52Jahresverlust, Verschiebung, Herausforderungen, Verzögerung, Barmmittelverbrauch von einer Mio. EUR pro Monat
Antwort auf Beitrag Nr.: 60.157.632 von Golazo am 21.03.19 08:41:47Klingt alles ziemlich übel...
Antwort auf Beitrag Nr.: 60.157.638 von Golazo am 21.03.19 08:43:32
Hast du dich schon mal mit HDP beschäftig?
Sieht nicht so aus....
Zitat von Golazo: Klingt alles ziemlich übel...
Hast du dich schon mal mit HDP beschäftig?
Sieht nicht so aus....
Antwort auf Beitrag Nr.: 60.157.638 von Golazo am 21.03.19 08:43:32Total 5 Beiträge in zwei Jahren dieser Top-Qualität!! Super! Bravo! Auf deine Einblicke wurde hier sehnlichst gewartet.
Antwort auf Beitrag Nr.: 60.157.947 von Mogli3 am 21.03.19 09:04:30Vielen Dank für den netten Empfang! Was sagst Ihr denn inhaltlich zu den Punkten?
Antwort auf Beitrag Nr.: 60.156.912 von BICYPAPA am 21.03.19 07:17:52
Update Magenta.
Gestern hat auch Magenta seinen Jahresbericht veröffentlicht. Dazu möchte ich zu den ATAC Kandidaten ein kleines Update machen.
C100:
Gleich vier Kandidaten sind für die klinische Entwicklung schon im Jahr 2020 vorgesehen. Darunter auch in der Indikation Multiple Sclerose. Allein in der Indikation Multiple Sclerose gibt es alleine in Europa und USA etwa 1 Million betroffene Patienten.
Das erste Konditionierungsprogramm in dem Magenta Portfolio ist C100, unter dem Magenta ADCs entwickelt, die spezifisch die Wirts-HSCs und Immunzellen abbauen. Im Rahmen des C100-Programms ist CD45 das Hauptziel, ein wichtiges Zelloberflächenmolekül, das im gesamten hämatopoetischen und Immunsystem verbreitet ist. Magenta plant, C100 für Patienten mit Autoimmunkrankheiten wie Multiple Sklerose und Sklerodermie sowie Patienten mit Leukämie und Lymphomen zu entwickeln. Magenta plant, im Jahr 2019 einen Entwicklungskandidaten in unserem C100-Programm zu deklarieren und dann in die Erprobung eines neuen Arzneimittels (IND) zu wechseln, um Studien für 2020 zu ermöglichen.
C200:
Auch der Kandidat C200 soll gleich in mehreren Indikation für die klinische Entwicklung geplant sein.
Das am weitesten fortgeschrittene Konditionierungsprogramm C200 wurde entwickelt, um gezielt HSCs und krankheitsverursachende Zellen abzubauen. Der führende ADC-Produktkandidat zielt auf CD117, auch bekannt als c-Kit, das in HSCs und Leukämiezellen stark exprimiert wird. Dies macht es zu einem idealen Ziel für die Konditionierung bei einer Vielzahl von Krankheiten. Dies schließt Blutkrebs sowie Hämoglobinopathien wie Sichelzellkrankheit und Beta-Thalassämie ein, mit potenzieller Anwendbarkeit sowohl bei der Stammzelltransplantation als auch bei der Stammzell-Gentherapie. Magenta hat einen Entwicklungskandidaten in dem C200-Programm erklärt und ist zu IND-fähigen Studien übergegangen. Magenta plant, das IND für dieses Programm im Jahr 2020 einzureichen.
C300:
Das dritte ADC-basiertes Konditionierungsprogramm C300 zielt auf T-Zellen, eine Art Immunzelle. T-Zell-Depletion wird derzeit mit hochtoxischen, unspezifischen Medikamenten durchgeführt, die zu Immunschwäche, Infektionen und anderen Komplikationen einschließlich sekundärer Autoimmunreaktionen führen können. Magenta verfolgt Ziele, die auf den Oberflächen von T-Zellen ausgedrückt werden, mit dem Ziel, vor der CAR-T-Therapie bei Blutkrebs, der Verhinderung der Stammzellabstoßung vor der allogenen Stammzellentransplantation oder der Erreichung von Tumorzellen eine sichere und optimierte zielgerichtete Konditionierungsmethode durch T-Zell-Depletion anzubieten Immunsystem vor autologer Stammzelltransplantation bei Patienten mit Autoimmunerkrankungen zurückgesetzt.
Erstes Magenta Update
Nach der Präsentation möchte ich gerne ein kleines ATAC Partner Magenta Update machen.Update Magenta.
Gestern hat auch Magenta seinen Jahresbericht veröffentlicht. Dazu möchte ich zu den ATAC Kandidaten ein kleines Update machen.
C100:
Gleich vier Kandidaten sind für die klinische Entwicklung schon im Jahr 2020 vorgesehen. Darunter auch in der Indikation Multiple Sclerose. Allein in der Indikation Multiple Sclerose gibt es alleine in Europa und USA etwa 1 Million betroffene Patienten.
Das erste Konditionierungsprogramm in dem Magenta Portfolio ist C100, unter dem Magenta ADCs entwickelt, die spezifisch die Wirts-HSCs und Immunzellen abbauen. Im Rahmen des C100-Programms ist CD45 das Hauptziel, ein wichtiges Zelloberflächenmolekül, das im gesamten hämatopoetischen und Immunsystem verbreitet ist. Magenta plant, C100 für Patienten mit Autoimmunkrankheiten wie Multiple Sklerose und Sklerodermie sowie Patienten mit Leukämie und Lymphomen zu entwickeln. Magenta plant, im Jahr 2019 einen Entwicklungskandidaten in unserem C100-Programm zu deklarieren und dann in die Erprobung eines neuen Arzneimittels (IND) zu wechseln, um Studien für 2020 zu ermöglichen.
C200:
Auch der Kandidat C200 soll gleich in mehreren Indikation für die klinische Entwicklung geplant sein.
Das am weitesten fortgeschrittene Konditionierungsprogramm C200 wurde entwickelt, um gezielt HSCs und krankheitsverursachende Zellen abzubauen. Der führende ADC-Produktkandidat zielt auf CD117, auch bekannt als c-Kit, das in HSCs und Leukämiezellen stark exprimiert wird. Dies macht es zu einem idealen Ziel für die Konditionierung bei einer Vielzahl von Krankheiten. Dies schließt Blutkrebs sowie Hämoglobinopathien wie Sichelzellkrankheit und Beta-Thalassämie ein, mit potenzieller Anwendbarkeit sowohl bei der Stammzelltransplantation als auch bei der Stammzell-Gentherapie. Magenta hat einen Entwicklungskandidaten in dem C200-Programm erklärt und ist zu IND-fähigen Studien übergegangen. Magenta plant, das IND für dieses Programm im Jahr 2020 einzureichen.
C300:
Das dritte ADC-basiertes Konditionierungsprogramm C300 zielt auf T-Zellen, eine Art Immunzelle. T-Zell-Depletion wird derzeit mit hochtoxischen, unspezifischen Medikamenten durchgeführt, die zu Immunschwäche, Infektionen und anderen Komplikationen einschließlich sekundärer Autoimmunreaktionen führen können. Magenta verfolgt Ziele, die auf den Oberflächen von T-Zellen ausgedrückt werden, mit dem Ziel, vor der CAR-T-Therapie bei Blutkrebs, der Verhinderung der Stammzellabstoßung vor der allogenen Stammzellentransplantation oder der Erreichung von Tumorzellen eine sichere und optimierte zielgerichtete Konditionierungsmethode durch T-Zell-Depletion anzubieten Immunsystem vor autologer Stammzelltransplantation bei Patienten mit Autoimmunerkrankungen zurückgesetzt.
Antwort auf Beitrag Nr.: 60.158.055 von Golazo am 21.03.19 09:09:45Überraschungen sehe ich nicht.
Ein Satz zu Takeda (klingt ok):
"Auch die Zusammenarbeit mit Takeda läuft vertragsgemäß, aber es wurden bisher noch keine Daten veröffentlicht."
Newsflow erwarte ich eher in H2 2019
Ein Satz zu Takeda (klingt ok):
"Auch die Zusammenarbeit mit Takeda läuft vertragsgemäß, aber es wurden bisher noch keine Daten veröffentlicht."
Newsflow erwarte ich eher in H2 2019
Antwort auf Beitrag Nr.: 60.158.436 von Lidenbrock am 21.03.19 09:34:59Prof. Pahl war kürzlich eine Woche in Japan bei Takeda und ziemlich zufrieden mit den Fortschritten. Nur soviel dazu.
Antwort auf Beitrag Nr.: 60.158.055 von Golazo am 21.03.19 09:09:45Wie man in den Wald hinein ruft kommt es eben zurück. Bisher habe wie hier noch nie was von dir gehört. Du hättest also vielleicht fragen können wie hier im Forum die heutige PM und der Geschäftsbericht interpretiert werden. Die dargestellte Situation entspricht genau dem was der aktuelle Wissensstand vorher schon war. Les doch bitte die vierteilige Analyse des Users Bicypapa der letzen zwei Wochen dann bist du bestens im Bild. Und ganz generell, Biotechfirmen sind im Prinzip Forschungsinstitute die viel Geld verbrauchen und kaum Einnahmen haben und deswegen von Zeit zu Zeit Kapitalerhöhungen durchführen müssen.
Der Geschäftsbericht 2018 fördert im Prinzip nichts Neues zu Tage für Diejenigen die sich schon länger mit HDP beschäftigen. Neu ist hingegen die ausführliche Darstellung der Zusammenarbeit mit Magenta- natürlich nur für diejenigen die sich nicht vorher auf der Magenta Website schlau gemacht haben, aber HDP äußert sich zum ersten Mal ausführlich dazu. Das zweite ist die Äußerung zu weiteren Partnerschaften. Der Vorstand erwartet diese in einem Geschäftsbericht und nicht nur zwischen den Zeilen. Ein Vorstand kann und darf das nur so schreiben wenn erfolgsversprechende Verhandlungen im Gang sind. Zu erwarten sind deswegen in absehbarer Zeit News zu einer oder sogar zwei weiteren Optionsziehungen von Magenta und mindestens ein weiterer Abschluss mit einem neuen Partner.
Antwort auf Beitrag Nr.: 60.159.948 von Mogli3 am 21.03.19 11:39:54
Äußerst positiv aber die Partner. Magenta versucht wohl C100 und C200 gleich in mehreren Indikationen auf den Markt zu bringen. Die Breite der Pipeline ist bei Magenta die positive Überraschung. Neben einigen "kleineren" Indikationen dann aber auch Multiple Sclerose mit über 1 Million Betroffene Patienten allein in USA und Europa. Das wurde bisher so in dieser Dimension nicht antizipiert. Soweit ich das richtig im Kopf habe wurde hier mit Magenta eine mittlere einstellige Umsatzbeteiligung vereinbart also ca 5% in einer Multimilliarden Indikation. Das sind dann keine kleinen Kleckerbeträge mehr für HP. Vielleicht gibt es hier ja auch beschleunigte Zulassungsbedingungen, wenn sie so erfolgreich werden sollten wie es die vorklinischen Daten andeuten.
Bei Telix hat sich auch noch was getan in der therapeutischen Anwendung von TLX-250, doch da mach ich mein Update etwas später.
Für mich gibt..
Für mich gibt es auch keine größeren Überraschungen von dem Jahresbericht. Irgendwie war ja den Interessenten ja schon fast alles bekannt.Äußerst positiv aber die Partner. Magenta versucht wohl C100 und C200 gleich in mehreren Indikationen auf den Markt zu bringen. Die Breite der Pipeline ist bei Magenta die positive Überraschung. Neben einigen "kleineren" Indikationen dann aber auch Multiple Sclerose mit über 1 Million Betroffene Patienten allein in USA und Europa. Das wurde bisher so in dieser Dimension nicht antizipiert. Soweit ich das richtig im Kopf habe wurde hier mit Magenta eine mittlere einstellige Umsatzbeteiligung vereinbart also ca 5% in einer Multimilliarden Indikation. Das sind dann keine kleinen Kleckerbeträge mehr für HP. Vielleicht gibt es hier ja auch beschleunigte Zulassungsbedingungen, wenn sie so erfolgreich werden sollten wie es die vorklinischen Daten andeuten.
Bei Telix hat sich auch noch was getan in der therapeutischen Anwendung von TLX-250, doch da mach ich mein Update etwas später.
Antwort auf Beitrag Nr.: 60.160.566 von BICYPAPA am 21.03.19 12:50:55Anscheinend müssen wir nur auf unsern Hintern sitzen und zuschauen wie allmählich der Kurs steigt!!
Antwort auf Beitrag Nr.: 60.160.701 von Mogli3 am 21.03.19 13:01:59Mag sein, die Frage ist nur wie lange,
ich denke doch dass die Aussage von BICYPAPA :
"Kurz- bis mittelfristiges Kursziel: Ich möchte bei meinem mittelfristigen Kursziel den Zeitkorridor von etwa 24-30 Monate vorgeben.
-HP hat etwa 40- 50 Millionen Einnahmen jährlich aus ATAC-Optionszusagen und Umsatzbeteiligungen. "
ein wenig zu optimistisch vom Zeitrahmen her ist.
HP scheibt ja selbst im Geschäftsbericht:
"Heidelberg Pharma geht in den nächsten Jahren davon aus, dass die Aufwendungen die Erträge übersteigen
werden."
ich denke doch dass die Aussage von BICYPAPA :
"Kurz- bis mittelfristiges Kursziel: Ich möchte bei meinem mittelfristigen Kursziel den Zeitkorridor von etwa 24-30 Monate vorgeben.
-HP hat etwa 40- 50 Millionen Einnahmen jährlich aus ATAC-Optionszusagen und Umsatzbeteiligungen. "
ein wenig zu optimistisch vom Zeitrahmen her ist.
HP scheibt ja selbst im Geschäftsbericht:
"Heidelberg Pharma geht in den nächsten Jahren davon aus, dass die Aufwendungen die Erträge übersteigen
werden."
Antwort auf Beitrag Nr.: 60.160.839 von Steines am 21.03.19 13:17:34Dazu müsste Bicypapa Stellung nehmen. 30 Monate von jetzt an wäre Herbst 2021. Bis dahin rechnet er mit Umsatzbeteiligungen von Telix ( 30% bei TK 250) und Meilensteinzahlungen von Magenta und Takeda sowie von 2-3 weiteren Partnern. Selbst wenn das nur 20-30 Mio Einnahmen sind wird der Kurs bis dahin deutlich anziehen zumal die Phase I a/b bei HDP 101 fertig und hoffentlich erfolgreich ist.
Antwort auf Beitrag Nr.: 60.160.839 von Steines am 21.03.19 13:17:34
Leider kenn ich die Vertragsbedingungen nicht.
Ja das ist richtig
Ich habe bis zu diesem Zeitpunkt etwa mit 4-5 Optionszusagen gerechnet. Dabei habe ich die Gesamtsumme auf etwa 10 Jahre Entwicklungszeit verteilt. Pro Option ist das etwa eine Gesamtsumme von etwa 100 Millionen USD Bei einer gleichmäßigen Verteilung kämen da ungefähr 40-50 Millionen USD rechnerisch pro Jahr zustande. Kann sein, dass bei einem Start einer Phase 2 oder Phase 3 bedeutend mehr bezahlt werden, als in den vorherigen Abschnitten. Dann fällt dieser Betrag halt in den Folgejahren an. Es ist nur rechnerisch ein theoretischer Wert über ca 10 jahre verteilt. Mir hat natürlich keiner verraten, wann welche Summen fällig wird. Darum habe ich auch geschrieben, dass dieser Betrag aktiviert wird. Wann die Gelder genau fließen ist mir unbekannt. Doch über 10 Jahre verteilt wären das etwa die 40-50 Millionen USD. Dazu käme dann in 30 Monaten die Umsatzbeteiligungen aus den ersten TLX-250 Gebieten und evtl ein HDP 101 Deal. Wenn die Summe in 2,5 Jahren noch nicht gezahlt wird, wird dann am kürzeren Ende ein viel höherer Betrag fällig. Die Gesamtsumme pro Option steht ja fest.Leider kenn ich die Vertragsbedingungen nicht.
Antwort auf Beitrag Nr.: 60.161.067 von BICYPAPA am 21.03.19 13:39:29Also ich nehm das auch wenn es erst 2022/23 so kommt. Unter Optionen ziehen versteht du nicht Anzahl Partner!! Vertrag Magenta sind 4 und Takeda 3 Optionen, zusammen also bereits 7. Also wenn die in 2021 mehrheitlich noch nicht gezogen sind dann werden sie wohl kaum noch gezogen. Was ich nicht ganz genau weiß, ab welchen Zeitpunkt der Entwicklung muss eine Option definitiv gezogen werden wenn der Partner weiter forschen will.
Antwort auf Beitrag Nr.: 60.161.253 von Mogli3 am 21.03.19 13:55:04
Takeda hat schon drei Optionsmöglichkeiten.
Magenta hat vier Optionsmöglichkeiten, wovon eine bestätigt wurde.
In ca. 30 Monaten rechne ich mit etwa 4-5 bestätigten Optionen. Den Betrag verteile ich dann gleichmäßig über 10 Jahre. So habe ich meine Umsatzschätzung gemacht. Nur HP hat den Vorteil, die wissen an welchen Punkten und in welcher Höhe die Gelder fließen. Ich muss spekulieren. Sie können rechnen. Doch am Ende haben wir dann die gleiche Höhe.
Ja richtig
Ich rechne pro Option. Die Optionsgebühr ist im Augenblick gemittelt bei etwa 100. Millionen USD. Wahrscheinlich wird sie in Zukunft durch den Erfolg weiter steigen. Ich gehe aber bei meiner Berechnung weiterhin von 100 Millionen USD gleichmäßig verteilt auf etwa 10 Jahre aus. Das ist in etwa die Zeit, die ein Medikament bis zur Zulassung braucht.Takeda hat schon drei Optionsmöglichkeiten.
Magenta hat vier Optionsmöglichkeiten, wovon eine bestätigt wurde.
In ca. 30 Monaten rechne ich mit etwa 4-5 bestätigten Optionen. Den Betrag verteile ich dann gleichmäßig über 10 Jahre. So habe ich meine Umsatzschätzung gemacht. Nur HP hat den Vorteil, die wissen an welchen Punkten und in welcher Höhe die Gelder fließen. Ich muss spekulieren. Sie können rechnen. Doch am Ende haben wir dann die gleiche Höhe.
Antwort auf Beitrag Nr.: 60.161.388 von BICYPAPA am 21.03.19 14:06:35Ja genau. Meine Frage war noch nach dem Zeitpunkt ab wann sie eine Option ziehen müssen um weiter forschen zu können. Vor diesem Zeitpunkt können sie ja noch alles abblasen. Ich denke es könnte spätestens dann sein wenn der Partner in die klinische Phase eintritt?? Magenta hat allerdings ihre Option vorher gezogen, vielleicht auch nur um mal einen Fuß drin zu haben.
Antwort auf Beitrag Nr.: 60.162.318 von Mogli3 am 21.03.19 15:23:37Zu dem Zeitpunkt ist mir leider nichts bekannt. Da kann ich nichts zu sagen. Sie werden sich wohl die Zeit nehmen, die sie für ihre Entscheidungsfindung brauchen. Warum sollen sie da eine Deadline nehmen. Irgendwann liegen die Fakten, die man dafür braucht auf dem Tisch und dann ist es ja nur sinnvoll sich zu entscheiden. Die Fakten sind da wohl maßgeblich wie die Entscheidung ausfällt. Eine zeitliche Linie macht wenig Sinn
Antwort auf Beitrag Nr.: 60.162.606 von BICYPAPA am 21.03.19 15:45:14Für HDP und den Aktienkurs natürlich schon. Beim ziehen der Option ist doch eine Zahlung fällig. Im Extremfall könnte man ja warten bis eine zulassungsrelevante Phase III positiv beendet wurde und man dann einen Zulassungsantrag stellt. Deine Annahme ist ja, am Schluss sind 100 Mio fällig egal wann gezahlt wird. Das stimmt so zwar, aber ein Bekenntnis zum Produkt hilft ja auch dem Kurs. Magenta hätte ja dann nicht die erste Option ziehen müssen. Aber vielleicht liege ich da auch falsch.
Antwort auf Beitrag Nr.: 60.162.921 von Mogli3 am 21.03.19 16:06:37
Üblich..
Üblich sind doch solche Zahlungen an markanten Punkten. Also bei Antragstellungen, Studienstarts in den einzelnen Phasen und Einreichung der Zulassungsdossiers und bei Zulassung. Gegen Ende werden die Zahlungen natürlich auch höher. Nur kenn ich die Abmachungen leider nicht. Ich denke mal, dass HP da nicht so weit vertraglich von üblichen Verträgen abgewichen ist. So ein Geschäft läuft ja auf Gegenseitigkeit. Man will sich ja nicht den Partner über den Tisch ziehen. Das macht in solch einer Partnerschaft keinen Sinn.
Ja das mit dem gegenseitigen Umgang ist klar. Für mich gibt es 2 grundsätzliche Phasen des Vertrages. Phase 1 ist, man probt mit dem Molekül. Fällt das positiv aus dann zieht man die Option und durchläuft die einzelnen Forschungsphasen möglichst bis zur Zulassung. Fällt das Proben mit dem Molekül negativ aus dann lässt man es. Die Frage für mich ist nur wann ist Phase 1 beendet und man muss sich entscheiden ob man zieht oder nicht.
Antwort auf Beitrag Nr.: 60.163.284 von Mogli3 am 21.03.19 16:46:15Ich denke mal die Option wird gezogen sobald die klinische Erprobung vorbereitet wird oder geplant ist. Ohne Option gibt es keine klinische Entwicklung. Eine Option wird dann aktiv, wenn vertraglich vereinbarte Zahlungen für HP fällig sind. Die Firma muss sich ja irgendwann entscheiden, ob sie in die Klinik will. Das ist dann auch der Zeitpunkt. Wann genau an welchem Punkt die Zahlungen fällig sind und die Höhe entzieht sich meiner Kenntnis. Das verstehe ich unter dem Sinn einer Option. Falls die Phase 1 dann widererwartend schlechte Ergebnisse liefert, wird sie nicht mehr weiter verfolgt und die Optionszusage erlischt, weil sie nicht mehr aktiv ist. Es erfolgen dann ja keine Zahlungen mehr. So habe ich die Option bisher verstanden. Sollten die Ergebnisse positiv ausfallen wird die Option bis zum Ende ausgeübt, bis dann die komplette Optionsgebühr im positiven Sinne für HP gezahlt ist. Danach wird dann je nach Abmachung eine Umsatzbeteiligung von dem zugelassenen Wirkstoff in abgemachter Höhe fällig.
Antwort auf Beitrag Nr.: 60.163.443 von BICYPAPA am 21.03.19 17:03:42Denke auch dass es so abläuft.
Interview auf BRN AG mit CEO Dr. Jan Schmidt-Brand
https://www.brn-ag.de/35468-Heidelberg-Pharma-Krebsforschung…
Antwort auf Beitrag Nr.: 60.161.388 von BICYPAPA am 21.03.19 14:06:35
HP erwartet laut Geschäftsbericht dann auch bei den Optionen und evtl. Auslizensierungen die signifikanten Lizenzerträge ab ca. 2021, die dann auch in den Folgejahren bestehen bleiben sollen. Wie vermutet fallen dann die größeren Zahlungen in der klinischen Erprobung und dann wohl auch bei der Auslizensierung von HDP-101 an, falls dies zu diesem Zeitpunkt schon möglich ist.
Kann sein, dass ich mit meiner Schätzung ab etwa 2022 mit etwa 40-50 Millionen Euro an Einnahmen vielleicht noch zu hoch liege, doch dann wird das dann in den Folgequartalen irgendwann mit höheren Zahlungen realisiert werden. Das wird dann nur ins Folgejahr mit dann noch höheren Einnahmen verschoben, da am Ende dann einfach höhere Zahlungen aus den Verträgen anfallen.
Ab 2021 wird aber sehr wahrscheinlich die Finanzierung von HP aus eigener Kraft erreicht. Dann stehen ja auch die ersten Umsatzbeteiligungen von TLX-250 an. Wie die kleine Lücke noch geschlossen wird, kann ich jetzt noch nicht sagen. Vielleicht gibt Hopp Dievini den nötigen Übergangskredit, da ja auch bei HP durch die Erträge gesichert sind.Vielleicht gibt es auch einen Wandler. Vielleicht gibt es auch eine Beteiligung eines neuen Partners, falls Hopp Dievini zustimmen. Es gibt zu viele Optionen, falls Hopp da zustimmt.
Was man wohl jetzt sagen kann, dass man schon jetzt für einen Biotechwert sehr nah dran ist an der Profitabilität. Ab 2021 wird laut Geschäftsbericht damit gerechnet.
Finanzierung
Ich habe gerade das Interview angehört und mir den Jahresbericht noch mal durchgelesen. Demnach generiert HP ihre Einnahmen aus Optionszahlungen, Milestones und Produktverkäufen des Amanitin an die Partner, die die Lizenznehmer für ihre Forschung brauchen. Die Anlage wurde nach gmp wurde ja gerade erst fertiggestellt. Das heißt, man beginnt da bei den Verkäufen gerade erst und bei zunehmenden Partnerschaften wird dieser Posten auch signifikant ansteigen. Die Optionszahlungen liefern wahrscheinlich erst bei Übergang in die Klinik signifikante Einnahmen. Deshalb sind die Einnahmen in diesem und im nächsten Jahr noch nicht im profitablen Bereich.HP erwartet laut Geschäftsbericht dann auch bei den Optionen und evtl. Auslizensierungen die signifikanten Lizenzerträge ab ca. 2021, die dann auch in den Folgejahren bestehen bleiben sollen. Wie vermutet fallen dann die größeren Zahlungen in der klinischen Erprobung und dann wohl auch bei der Auslizensierung von HDP-101 an, falls dies zu diesem Zeitpunkt schon möglich ist.
Kann sein, dass ich mit meiner Schätzung ab etwa 2022 mit etwa 40-50 Millionen Euro an Einnahmen vielleicht noch zu hoch liege, doch dann wird das dann in den Folgequartalen irgendwann mit höheren Zahlungen realisiert werden. Das wird dann nur ins Folgejahr mit dann noch höheren Einnahmen verschoben, da am Ende dann einfach höhere Zahlungen aus den Verträgen anfallen.
Ab 2021 wird aber sehr wahrscheinlich die Finanzierung von HP aus eigener Kraft erreicht. Dann stehen ja auch die ersten Umsatzbeteiligungen von TLX-250 an. Wie die kleine Lücke noch geschlossen wird, kann ich jetzt noch nicht sagen. Vielleicht gibt Hopp Dievini den nötigen Übergangskredit, da ja auch bei HP durch die Erträge gesichert sind.Vielleicht gibt es auch einen Wandler. Vielleicht gibt es auch eine Beteiligung eines neuen Partners, falls Hopp Dievini zustimmen. Es gibt zu viele Optionen, falls Hopp da zustimmt.
Was man wohl jetzt sagen kann, dass man schon jetzt für einen Biotechwert sehr nah dran ist an der Profitabilität. Ab 2021 wird laut Geschäftsbericht damit gerechnet.
Antwort auf Beitrag Nr.: 60.154.389 von BICYPAPA am 20.03.19 19:35:00
https://langfristanleger.net/__trashed/aktien/
Präsentation von HP Teil 3
Nun der dritte Teil meiner HP Analyse in neuer Aufmachung. Nach den Quartalszahlen Anfang April werde ich noch mal ein umfängliches Update machen und dann eine neue Gesamtausgabe präsentieren. Bei Magenta und Telix hat sich ja wieder einiges getan. Hier der dritte Teil der Analyse:https://langfristanleger.net/__trashed/aktien/
Takeda heute mit einem weiteren Deal im Bereich ADC:
https://www.businesswire.com/news/home/20190321005823/en/Leg…
Kann gut oder schlecht sein für Heidelberg. Evtl. kann man die Technologien kombinieren.
https://www.businesswire.com/news/home/20190321005823/en/Leg…
Kann gut oder schlecht sein für Heidelberg. Evtl. kann man die Technologien kombinieren.
Antwort auf Beitrag Nr.: 60.168.420 von kmastra am 22.03.19 09:05:15
Bei Mersana ist übrigens der mit Takeda ausgesuchte und bearbeitete Wirkstoff wieder eingestellt worden. Ich denke mal, sie schauen einfach mal was geht und welche Chancen bestehen.
Sie sind bei mehreren Firmen..
Takeda sichert sich da viele Gebiete und sind bei mehreren erfolgversprechenden Firmen engagiert. Auch bei Mersana haben sie solch einen Deal gemacht. Sie wollen nun mal schauen, was LegoChem für sie an Chancen bietet. Ich glaube nicht, dass dies irgendwie gut oder schlecht ist. Sie stecken sich bei allen erfolgversprechenden Firmen ihre Gebiete ab. Auch HP ist nur eine Alternative für sie. Ebenso wie mersana oder LegoChem.Bei Mersana ist übrigens der mit Takeda ausgesuchte und bearbeitete Wirkstoff wieder eingestellt worden. Ich denke mal, sie schauen einfach mal was geht und welche Chancen bestehen.
Antwort auf Beitrag Nr.: 60.168.561 von BICYPAPA am 22.03.19 09:15:39Ich präzisiere: Kann gut schlecht oder egal sein. Evtl. kann man ja z.B. Linker und Payload von Heidelberger kombinieren. Reine Spekulation natürlich!
Antwort auf Beitrag Nr.: 60.167.247 von BICYPAPA am 22.03.19 05:49:42
Den Text hab ich mal durch einen Übersetzer geschickt. So haben wir auch eine deutsche Fassung. Bei Telix tut sich im Augenblick sehr viel mit dem auslizensierten Redectane. Ich komm kaum noch nach die Meldungen alle zu posten. Und bei all dem ist Heidelberg Pharma bei der Diagnose mit 30% und in der Therapeutik mit etwa 5% beteiligt. Und all dies ohne noch einen einzigen Euro investieren. Für die Entwicklung und Vermarktung sind alleine die Lizenzpartner zuständig.
Synopsis: VisAct® is an imaging agent (a “contrast agent”) used with Positron Emission Tomography (PET). VisAct® images the location of activated (killer) T-cells and can be essentially used to take a “snapshot” of how the immune system is responding to therapy. This is a potentially invaluable tool because we increasingly combine different anti-cancer drugs with immunotherapies, however determining how to best time / cycle between different drugs is challenging and often ad-hoc. By being able to image – quantitatively – immune cells trafficking to the tumour, we can optimize the delivery of combination treatments.
Key points for investors:
• MTR drugs are highly immunogenic. Irradiating a tumour causes immune cells to migrate to the cancer. Unleashing the potency of immune cells through combining targeted radiation with immuno-oncology drugs (for example, ‘checkpoint inhibitors’) is a potentially very potent strategy for treating metastatic cancer.
• Telix’s TLX250 therapeutic (177Lu-girentuximab) for the treatment of clear cell renal cell (kidney) cancer has demonstrated potent anti-tumour effect, as well as evidence of immune system involvement. In order to optimize the combination of TLX250 with immuno-oncology drugs, Telix intends to use VisAct® to image immune response and determine when best to cycle between therapies.
• Cyclotek, Telix’s manufacturing partner in Australia/New Zealand, is an experienced manufacturer of PET tracers for clinical use. VisAct® is available from Cyclotek as an investigational imaging agent.
• There is considerable international interest in the use of VisAct® and there are currently multiple collaborative clinical trials running (NCT03684655, NCT03142204, NCT03129061, NCT03007719) demonstrating the potential of this technology in immuno-oncology.
Telix and Cyclotek Complete Manufacturing of VisAct® ImmunoPET Tracer Melbourne (Australia) – 21st March 2019. Telix Pharmaceuticals Limited (ASX.TLX) (“Telix”, the “Company”), a clinical-stage biopharmaceutical company focused on the development of diagnostic and therapeutic products based on targeted radiopharmaceuticals or “molecularlytargeted radiation” (MTR) is pleased to announce that in conjunction with Cyclotek (Aust) Pty Ltd., a leading radiopharmaceutical contract manufacturing organisation (CMO), it has completed the manufacturing 18F-AraG (VisAct®) to a standard suitable for clinical use.
Telix obtained a research license and limited commercial rights for VisAct® from CellSight Technologies, Inc. in September 2017. Telix and Cyclotek have collaborated to establish a commercial-scale manufacturing process for VisAct® for use in Telix clinical trials as well as to enable access pharmaceutical companies and clinicians interested in using the product for research purposes. VisAct® is a novel positron emission tomography (PET) imaging tracer that enables quantitative images of the immune system to be captured using standard hospital imaging equipment. With the rise in importance of immuno-oncology, VisAct® is a potentially invaluable tool in the understanding of how to optimise the delivery of cancer immunotherapy”.
Telix Pharmaceuticals co-founder and CEO, Dr. Christian Behrenbruch stated, “We were keen to take a license to VisAct® because of our kidney cancer and glioblastoma (brain cancer) therapy programs. A vitally important part of the treatment response mechanism of targeted radiation relates to the mobilization of the immune system. In particular, Telix’s TLX250 program will be further developed as a combination therapy with ‘checkpoint inhibitor’ drugs such as Bristol-Myers Squibb’s Opdivo® (anti-PD-1 antibody) so we need to know when the immune system is properly “primed” to give the best combined treatment effect.”
Zusammenfassung:
VisAct® ist ein Bildgebungsmittel (ein "Kontrastmittel"), das bei der Positron-Emissions-Tomographie (PET) verwendet wird. VisAct® bildet die Position der aktivierten (Killer) T-Zellen ab und kann im Wesentlichen dazu verwendet werden, einen „Schnappschuss“ davon zu erstellen, wie das Immunsystem auf die Therapie reagiert. Dies ist ein potenziell unschätzbares Instrument, da wir zunehmend verschiedene Krebsmedikamente mit Immuntherapien kombinieren. Die Bestimmung der besten Zeit / Zykluszeit zwischen verschiedenen Medikamenten ist jedoch herausfordernd und oft ad hoc. Durch die Möglichkeit, Immunzellen zum Tumor quantitativ abzubilden, können wir die Bereitstellung von Kombinationsbehandlungen optimieren.
Eckpunkte für Investoren:
• MTR-Medikamente sind stark immunogen. Durch Bestrahlung eines Tumors wandern Immunzellen zum Krebs. Die Freisetzung der Potenz von Immunzellen durch Kombination gezielter Bestrahlung mit Medikamenten der Immunonkologie (z. B. „Checkpoint-Inhibitoren“) ist eine potenziell sehr wirksame Strategie zur Behandlung von metastatischem Krebs.
• Das TLX250-Therapeutikum von Telix (177Lu-girentuximab) zur Behandlung von Nierenzellkarzinomen (Nierenzellkarzinomen) hat einen starken Tumoreffekt sowie Hinweise auf eine Beteiligung des Immunsystems gezeigt. Um die Kombination von TLX250 mit Medikamenten für die Immunonkologie zu optimieren, beabsichtigt Telix, VisAct® zur Abbildung der Immunantwort zu verwenden und zu bestimmen, wann zwischen den Therapien am besten ein Zyklus durchgeführt werden kann.
• Cyclotek, der Produktionspartner von Telix in Australien / Neuseeland, ist ein erfahrener Hersteller von PET-Tracern für den klinischen Einsatz. VisAct® ist von Cyclotek als Bildgebungsmittel für die Forschung erhältlich.
• Es besteht ein internationales Interesse an der Verwendung von VisAct®. Derzeit laufen mehrere klinische Gemeinschaftsprojekte (NCT03684655, NCT03142204, NCT03129061, NCT03007719), die das Potenzial dieser Technologie in der Immunonkologie demonstrieren.
Telix und Cyclotek schließen Produktion von VisAct® ImmunoPET Tracer Melbourne (Australien) - 21. März 2019 ab. Telix Pharmaceuticals Limited (ASX.TLX) ("Telix", das "Unternehmen"), ein biopharmazeutisches Unternehmen im klinischen Stadium, das sich auf die Entwicklung von Diagnostika konzentriert und therapeutische Produkte auf der Basis gezielter Radiopharmaka oder „Molecularly-Targeted Radiation“ (MTR) freut sich bekannt zu geben, dass sie zusammen mit Cyclotek (Aust) Pty Ltd., einer führenden Organisation für radiopharmazeutische Auftragsfertigung (CMO), die Fertigung des 18F-AraG ( VisAct®) auf einen für den klinischen Einsatz geeigneten Standard. Telix erhielt im September 2017 von CellSight Technologies, Inc. eine Forschungslizenz und eingeschränkte kommerzielle Rechte für VisAct®. Telix und Cyclotek haben zusammengearbeitet, um ein kommerzielles Herstellungsverfahren für VisAct® für die Verwendung in klinischen Telix-Studien sowie für den Zugang zu etablieren Pharmaunternehmen und Kliniker, die das Produkt zu Forschungszwecken einsetzen möchten
. VisAct® ist ein neuartiger Imaging-Tracer für die Positronen-Emissions-Tomographie (PET), der die Erfassung quantitativer Bilder des Immunsystems mit Standard-Imaging-Geräten für Krankenhäuser ermöglicht. Mit der zunehmenden Bedeutung der Immunonkologie ist VisAct® ein potenziell unschätzbares Instrument, um zu verstehen, wie die Bereitstellung von Krebsimmuntherapien optimiert werden kann. “ Dr. Christian Behrenbruch, Mitbegründer und CEO von Telix Pharmaceuticals, erklärte: „Wir wollten unbedingt eine Lizenz für VisAct® erwerben, da wir Nierenkrebs- und Glioblastomtherapieprogramme (Gehirnkrebs) nutzen. Ein lebenswichtiger Teil des Behandlungsmechanismus der gezielten Bestrahlung bezieht sich auf die Mobilisierung des Immunsystems. Insbesondere wird das TLX250-Programm von Telix als Kombinationstherapie mit "Checkpoint-Inhibitor" -Drogen wie Opdivo® (Anti-PD-1-Antikörper) von Bristol-Myers Squibb weiterentwickelt. Daher müssen wir wissen, wann das Immunsystem richtig "angeregt" ist. um den besten kombinierten Behandlungseffekt zu erzielen. “
In Echtzeit das Immunsystem beobachten.
Ich hatte gestern noch eine Meldung von Telix die die Anwendung in der Therapeutik von Telix mit dem auslizensierten Redectane oder Girentuximab betrifft. Auch hier spielt Girentuximab wieder eine entscheidende Rolle. Ich hatte den text wegen des Geschäftsberichtes noch so lange zurückgestellt.Den Text hab ich mal durch einen Übersetzer geschickt. So haben wir auch eine deutsche Fassung. Bei Telix tut sich im Augenblick sehr viel mit dem auslizensierten Redectane. Ich komm kaum noch nach die Meldungen alle zu posten. Und bei all dem ist Heidelberg Pharma bei der Diagnose mit 30% und in der Therapeutik mit etwa 5% beteiligt. Und all dies ohne noch einen einzigen Euro investieren. Für die Entwicklung und Vermarktung sind alleine die Lizenzpartner zuständig.
Synopsis: VisAct® is an imaging agent (a “contrast agent”) used with Positron Emission Tomography (PET). VisAct® images the location of activated (killer) T-cells and can be essentially used to take a “snapshot” of how the immune system is responding to therapy. This is a potentially invaluable tool because we increasingly combine different anti-cancer drugs with immunotherapies, however determining how to best time / cycle between different drugs is challenging and often ad-hoc. By being able to image – quantitatively – immune cells trafficking to the tumour, we can optimize the delivery of combination treatments.
Key points for investors:
• MTR drugs are highly immunogenic. Irradiating a tumour causes immune cells to migrate to the cancer. Unleashing the potency of immune cells through combining targeted radiation with immuno-oncology drugs (for example, ‘checkpoint inhibitors’) is a potentially very potent strategy for treating metastatic cancer.
• Telix’s TLX250 therapeutic (177Lu-girentuximab) for the treatment of clear cell renal cell (kidney) cancer has demonstrated potent anti-tumour effect, as well as evidence of immune system involvement. In order to optimize the combination of TLX250 with immuno-oncology drugs, Telix intends to use VisAct® to image immune response and determine when best to cycle between therapies.
• Cyclotek, Telix’s manufacturing partner in Australia/New Zealand, is an experienced manufacturer of PET tracers for clinical use. VisAct® is available from Cyclotek as an investigational imaging agent.
• There is considerable international interest in the use of VisAct® and there are currently multiple collaborative clinical trials running (NCT03684655, NCT03142204, NCT03129061, NCT03007719) demonstrating the potential of this technology in immuno-oncology.
Telix and Cyclotek Complete Manufacturing of VisAct® ImmunoPET Tracer Melbourne (Australia) – 21st March 2019. Telix Pharmaceuticals Limited (ASX.TLX) (“Telix”, the “Company”), a clinical-stage biopharmaceutical company focused on the development of diagnostic and therapeutic products based on targeted radiopharmaceuticals or “molecularlytargeted radiation” (MTR) is pleased to announce that in conjunction with Cyclotek (Aust) Pty Ltd., a leading radiopharmaceutical contract manufacturing organisation (CMO), it has completed the manufacturing 18F-AraG (VisAct®) to a standard suitable for clinical use.
Telix obtained a research license and limited commercial rights for VisAct® from CellSight Technologies, Inc. in September 2017. Telix and Cyclotek have collaborated to establish a commercial-scale manufacturing process for VisAct® for use in Telix clinical trials as well as to enable access pharmaceutical companies and clinicians interested in using the product for research purposes. VisAct® is a novel positron emission tomography (PET) imaging tracer that enables quantitative images of the immune system to be captured using standard hospital imaging equipment. With the rise in importance of immuno-oncology, VisAct® is a potentially invaluable tool in the understanding of how to optimise the delivery of cancer immunotherapy”.
Telix Pharmaceuticals co-founder and CEO, Dr. Christian Behrenbruch stated, “We were keen to take a license to VisAct® because of our kidney cancer and glioblastoma (brain cancer) therapy programs. A vitally important part of the treatment response mechanism of targeted radiation relates to the mobilization of the immune system. In particular, Telix’s TLX250 program will be further developed as a combination therapy with ‘checkpoint inhibitor’ drugs such as Bristol-Myers Squibb’s Opdivo® (anti-PD-1 antibody) so we need to know when the immune system is properly “primed” to give the best combined treatment effect.”
Zusammenfassung:
VisAct® ist ein Bildgebungsmittel (ein "Kontrastmittel"), das bei der Positron-Emissions-Tomographie (PET) verwendet wird. VisAct® bildet die Position der aktivierten (Killer) T-Zellen ab und kann im Wesentlichen dazu verwendet werden, einen „Schnappschuss“ davon zu erstellen, wie das Immunsystem auf die Therapie reagiert. Dies ist ein potenziell unschätzbares Instrument, da wir zunehmend verschiedene Krebsmedikamente mit Immuntherapien kombinieren. Die Bestimmung der besten Zeit / Zykluszeit zwischen verschiedenen Medikamenten ist jedoch herausfordernd und oft ad hoc. Durch die Möglichkeit, Immunzellen zum Tumor quantitativ abzubilden, können wir die Bereitstellung von Kombinationsbehandlungen optimieren.
Eckpunkte für Investoren:
• MTR-Medikamente sind stark immunogen. Durch Bestrahlung eines Tumors wandern Immunzellen zum Krebs. Die Freisetzung der Potenz von Immunzellen durch Kombination gezielter Bestrahlung mit Medikamenten der Immunonkologie (z. B. „Checkpoint-Inhibitoren“) ist eine potenziell sehr wirksame Strategie zur Behandlung von metastatischem Krebs.
• Das TLX250-Therapeutikum von Telix (177Lu-girentuximab) zur Behandlung von Nierenzellkarzinomen (Nierenzellkarzinomen) hat einen starken Tumoreffekt sowie Hinweise auf eine Beteiligung des Immunsystems gezeigt. Um die Kombination von TLX250 mit Medikamenten für die Immunonkologie zu optimieren, beabsichtigt Telix, VisAct® zur Abbildung der Immunantwort zu verwenden und zu bestimmen, wann zwischen den Therapien am besten ein Zyklus durchgeführt werden kann.
• Cyclotek, der Produktionspartner von Telix in Australien / Neuseeland, ist ein erfahrener Hersteller von PET-Tracern für den klinischen Einsatz. VisAct® ist von Cyclotek als Bildgebungsmittel für die Forschung erhältlich.
• Es besteht ein internationales Interesse an der Verwendung von VisAct®. Derzeit laufen mehrere klinische Gemeinschaftsprojekte (NCT03684655, NCT03142204, NCT03129061, NCT03007719), die das Potenzial dieser Technologie in der Immunonkologie demonstrieren.
Telix und Cyclotek schließen Produktion von VisAct® ImmunoPET Tracer Melbourne (Australien) - 21. März 2019 ab. Telix Pharmaceuticals Limited (ASX.TLX) ("Telix", das "Unternehmen"), ein biopharmazeutisches Unternehmen im klinischen Stadium, das sich auf die Entwicklung von Diagnostika konzentriert und therapeutische Produkte auf der Basis gezielter Radiopharmaka oder „Molecularly-Targeted Radiation“ (MTR) freut sich bekannt zu geben, dass sie zusammen mit Cyclotek (Aust) Pty Ltd., einer führenden Organisation für radiopharmazeutische Auftragsfertigung (CMO), die Fertigung des 18F-AraG ( VisAct®) auf einen für den klinischen Einsatz geeigneten Standard. Telix erhielt im September 2017 von CellSight Technologies, Inc. eine Forschungslizenz und eingeschränkte kommerzielle Rechte für VisAct®. Telix und Cyclotek haben zusammengearbeitet, um ein kommerzielles Herstellungsverfahren für VisAct® für die Verwendung in klinischen Telix-Studien sowie für den Zugang zu etablieren Pharmaunternehmen und Kliniker, die das Produkt zu Forschungszwecken einsetzen möchten
. VisAct® ist ein neuartiger Imaging-Tracer für die Positronen-Emissions-Tomographie (PET), der die Erfassung quantitativer Bilder des Immunsystems mit Standard-Imaging-Geräten für Krankenhäuser ermöglicht. Mit der zunehmenden Bedeutung der Immunonkologie ist VisAct® ein potenziell unschätzbares Instrument, um zu verstehen, wie die Bereitstellung von Krebsimmuntherapien optimiert werden kann. “ Dr. Christian Behrenbruch, Mitbegründer und CEO von Telix Pharmaceuticals, erklärte: „Wir wollten unbedingt eine Lizenz für VisAct® erwerben, da wir Nierenkrebs- und Glioblastomtherapieprogramme (Gehirnkrebs) nutzen. Ein lebenswichtiger Teil des Behandlungsmechanismus der gezielten Bestrahlung bezieht sich auf die Mobilisierung des Immunsystems. Insbesondere wird das TLX250-Programm von Telix als Kombinationstherapie mit "Checkpoint-Inhibitor" -Drogen wie Opdivo® (Anti-PD-1-Antikörper) von Bristol-Myers Squibb weiterentwickelt. Daher müssen wir wissen, wann das Immunsystem richtig "angeregt" ist. um den besten kombinierten Behandlungseffekt zu erzielen. “
Antwort auf Beitrag Nr.: 60.170.460 von BICYPAPA am 22.03.19 11:51:56BICYPAPA,
Mal EIne Frage.
Das ist in Keiner Weise negativ wertend,
Einem Ein "Schlechtes Geschmäckle anhängend" gemeint.
Das sind schon sehr Ausführliche Arbeiten.
Machst Du Das kommerziell ??
Gruss
Mal EIne Frage.
Das ist in Keiner Weise negativ wertend,
Einem Ein "Schlechtes Geschmäckle anhängend" gemeint.
Das sind schon sehr Ausführliche Arbeiten.
Machst Du Das kommerziell ??
Gruss
Antwort auf Beitrag Nr.: 60.167.247 von BICYPAPA am 22.03.19 05:49:42
Ist damit explizit der Cashflow gemeint oder nur der Gewinn?
Problem bei Biotecs ist ja, dass sie gerade dann wenn sie erfolgreich werden sollten (was wir bei H.Pharma ja hoffen) besonders stark investieren müssen, erst recht falls sie die Eigenpipeline vorantreiben wollen, die ja aktuell noch in einem sehr frühen Stadium ist. Wenn sie also erfolgreich in die nächst höhere Entwicklungsphase kommen sollten, wie wollen sie dann eigentlich finanzieren? Hat man dazu was gesagt? Dass Hopp das bezahlt, kann ich mir schwer vorstellen. Man müsste also aus der Partnerpipeline hohe Milestones bekommen, aber ist das ab Mitte/Ende 2020 realistisch, wo ja laut gestrigen Vorstandsaussagen etwa das aktuelle vorhandene Geld ausgeht.
Nicht falsch verstehen! Ich bin ja mit einem ersten Betrag seit einigen Monaten investiert, weil ich die Pipeline in der Breite interessant finde. Aber gerade deshalb dürfte ja enormen Investitionsbedarf bestehen, den HP vermutlich nicht durch eigene Mittel wird finanzieren können. Entweder man holt sich also Partner ins Boot und die Eigenpipe geht eher in die Partnerpipe über. Oder man muss mit Kapitalerhöhungen oder bis zu einem gewissen Maß mit Fremdkapital arbeiten, wobei ich letzteres nicht empfehlen würde bei einem Biotec, jedenfalls nur in sehr begrenztem Maß.
Zitat von BICYPAPA: Ich habe gerade das Interview angehört und mir den Jahresbericht noch mal durchgelesen. Demnach generiert HP ihre Einnahmen aus Optionszahlungen, Milestones und Produktverkäufen des Amanitin an die Partner, die die Lizenznehmer für ihre Forschung brauchen. Die Anlage wurde nach gmp wurde ja gerade erst fertiggestellt. Das heißt, man beginnt da bei den Verkäufen gerade erst und bei zunehmenden Partnerschaften wird dieser Posten auch signifikant ansteigen. Die Optionszahlungen liefern wahrscheinlich erst bei Übergang in die Klinik signifikante Einnahmen. Deshalb sind die Einnahmen in diesem und im nächsten Jahr noch nicht im profitablen Bereich.
HP erwartet laut Geschäftsbericht dann auch bei den Optionen und evtl. Auslizensierungen die signifikanten Lizenzerträge ab ca. 2021, die dann auch in den Folgejahren bestehen bleiben sollen. Wie vermutet fallen dann die größeren Zahlungen in der klinischen Erprobung und dann wohl auch bei der Auslizensierung von HDP-101 an, falls dies zu diesem Zeitpunkt schon möglich ist.
Kann sein, dass ich mit meiner Schätzung ab etwa 2022 mit etwa 40-50 Millionen Euro an Einnahmen vielleicht noch zu hoch liege, doch dann wird das dann in den Folgequartalen irgendwann mit höheren Zahlungen realisiert werden. Das wird dann nur ins Folgejahr mit dann noch höheren Einnahmen verschoben, da am Ende dann einfach höhere Zahlungen aus den Verträgen anfallen.
Ab 2021 wird aber sehr wahrscheinlich die Finanzierung von HP aus eigener Kraft erreicht. Dann stehen ja auch die ersten Umsatzbeteiligungen von TLX-250 an. Wie die kleine Lücke noch geschlossen wird, kann ich jetzt noch nicht sagen. Vielleicht gibt Hopp Dievini den nötigen Übergangskredit, da ja auch bei HP durch die Erträge gesichert sind.Vielleicht gibt es auch einen Wandler. Vielleicht gibt es auch eine Beteiligung eines neuen Partners, falls Hopp Dievini zustimmen. Es gibt zu viele Optionen, falls Hopp da zustimmt.
Was man wohl jetzt sagen kann, dass man schon jetzt für einen Biotechwert sehr nah dran ist an der Profitabilität. Ab 2021 wird laut Geschäftsbericht damit gerechnet.
Ist damit explizit der Cashflow gemeint oder nur der Gewinn?
Problem bei Biotecs ist ja, dass sie gerade dann wenn sie erfolgreich werden sollten (was wir bei H.Pharma ja hoffen) besonders stark investieren müssen, erst recht falls sie die Eigenpipeline vorantreiben wollen, die ja aktuell noch in einem sehr frühen Stadium ist. Wenn sie also erfolgreich in die nächst höhere Entwicklungsphase kommen sollten, wie wollen sie dann eigentlich finanzieren? Hat man dazu was gesagt? Dass Hopp das bezahlt, kann ich mir schwer vorstellen. Man müsste also aus der Partnerpipeline hohe Milestones bekommen, aber ist das ab Mitte/Ende 2020 realistisch, wo ja laut gestrigen Vorstandsaussagen etwa das aktuelle vorhandene Geld ausgeht.
Nicht falsch verstehen! Ich bin ja mit einem ersten Betrag seit einigen Monaten investiert, weil ich die Pipeline in der Breite interessant finde. Aber gerade deshalb dürfte ja enormen Investitionsbedarf bestehen, den HP vermutlich nicht durch eigene Mittel wird finanzieren können. Entweder man holt sich also Partner ins Boot und die Eigenpipe geht eher in die Partnerpipe über. Oder man muss mit Kapitalerhöhungen oder bis zu einem gewissen Maß mit Fremdkapital arbeiten, wobei ich letzteres nicht empfehlen würde bei einem Biotec, jedenfalls nur in sehr begrenztem Maß.
Antwort auf Beitrag Nr.: 60.173.154 von Popeye82 am 22.03.19 15:56:28
Ich habe nur eine lange Erfahrung und beschwere mich oft über ganz schlimme Analysen zu diesen Biotechwerten. Deshalb mache ich meine Analysen selber und stelle sie dann manchmal auch ins Board. HP ist aber nun sehr ausführlich geworden, weil ich da auch auf mein älteres Material und eine große Sammlung zurückgreifen konnte. Ich mach es auch aus Spaß und natürlich weil der Kurs steigen soll, weil ich selbstverständlich auch Aktien von HP habe. Ich versuche mich dabei trotzdem immer an den Fakten zu halten ohne dabei diese Werte ungerechtfertigt zu pushen. Meine Analysen sind deshalb auch für alle überprüfbar und ich stelle mich der Kritik, wenn es dann Fragen dazu gibt. Manchmal korrigier ich auch dazu meine Meinung. Ich finde es aber auch nicht schlimm bei mir Korrekturen vorzunehmen. Die Analyse spiegelt halt auch nur meinen Kenntnisstand zum Zeitpunkt der Erstellung dar.
Zu HP die Analyse hat jetzt fast 4 Wochen bis zur Fertigstellung gebraucht, bis ich alle Fakten recherchiert hat und sie dann auch formuliert habe. So oft mach ich das in dem Umfang nicht.
Nein, das mache
Nein das mache ich nicht kommerziell. Ich beschäftige mich seit etwa 15 Jahren mit deutschen Biotechwerten. Und wenn eine Aktie für mich interessant ist, dann schreibe ich dazu schon mal eine Analyse. Du brauchst nur meine Threads verfolgen, da siehst du meine Ambitionen. Früher habe ich viel zu Paion, MorphoSys, Formycon aber auch Epigenomics und Cytotools geschriebe. Damals hab ich noch unter dem Namen Gurke geschrieben. Heute melde ich mich zu fast allen deutschen Biotechwerten im Privatboard bei Ariva, aber auch hier allgemein zu den deutschen Biotechwerten. Ich mache das hauptsächlich nur, weil ich HP im Augenblick für den besten deutschen Biotechwert halte. Schreiben tue ich aber auch zu den anderen. Nur sind einige Threads Trollverseucht. Da poste ich halt nicht mehr.Ich habe nur eine lange Erfahrung und beschwere mich oft über ganz schlimme Analysen zu diesen Biotechwerten. Deshalb mache ich meine Analysen selber und stelle sie dann manchmal auch ins Board. HP ist aber nun sehr ausführlich geworden, weil ich da auch auf mein älteres Material und eine große Sammlung zurückgreifen konnte. Ich mach es auch aus Spaß und natürlich weil der Kurs steigen soll, weil ich selbstverständlich auch Aktien von HP habe. Ich versuche mich dabei trotzdem immer an den Fakten zu halten ohne dabei diese Werte ungerechtfertigt zu pushen. Meine Analysen sind deshalb auch für alle überprüfbar und ich stelle mich der Kritik, wenn es dann Fragen dazu gibt. Manchmal korrigier ich auch dazu meine Meinung. Ich finde es aber auch nicht schlimm bei mir Korrekturen vorzunehmen. Die Analyse spiegelt halt auch nur meinen Kenntnisstand zum Zeitpunkt der Erstellung dar.
Zu HP die Analyse hat jetzt fast 4 Wochen bis zur Fertigstellung gebraucht, bis ich alle Fakten recherchiert hat und sie dann auch formuliert habe. So oft mach ich das in dem Umfang nicht.
Antwort auf Beitrag Nr.: 60.173.580 von katjuscha-research am 22.03.19 16:32:03
• Signifikante Lizenzerträge ab dem Jahr 2021 mit nachhaltig positiven Cashflows in den Folgejahren
Für mich scheint das auch logisch da wahrscheinlich auch die Partner Magenta in die Klinik gehen und somit weitere Milestones fällig werden. Dann stehen Milestones und Umsatzbeteiligungen zu TLX-250 an und HDP101 dürfte evftl. seinen proof of Concept gezeigt haben und wäre damit zur Lizensierung interessant. All dies dürfte für die Umsätze in 2021 eine große Rolle spielen.
Geld hätten sie ja nach Bericht sowieso noch bis Mitte 20. In 2020 stehen dann auch noch weitere Einnahmen an. Es wäre somit wenn nichts an Einnahmen dazu kommt mit einer kleineren Maßnahme durch Hopp zu rechnen. Wie die aussieht kann ich nicht sagen. Vielleicht ein Darlehen. Vielleicht ein Wandler.
Hallo Katjuscha
Ich zitiere aus dem Geschäftsbericht Seite 68• Signifikante Lizenzerträge ab dem Jahr 2021 mit nachhaltig positiven Cashflows in den Folgejahren
Für mich scheint das auch logisch da wahrscheinlich auch die Partner Magenta in die Klinik gehen und somit weitere Milestones fällig werden. Dann stehen Milestones und Umsatzbeteiligungen zu TLX-250 an und HDP101 dürfte evftl. seinen proof of Concept gezeigt haben und wäre damit zur Lizensierung interessant. All dies dürfte für die Umsätze in 2021 eine große Rolle spielen.
Geld hätten sie ja nach Bericht sowieso noch bis Mitte 20. In 2020 stehen dann auch noch weitere Einnahmen an. Es wäre somit wenn nichts an Einnahmen dazu kommt mit einer kleineren Maßnahme durch Hopp zu rechnen. Wie die aussieht kann ich nicht sagen. Vielleicht ein Darlehen. Vielleicht ein Wandler.
Antwort auf Beitrag Nr.: 60.173.634 von BICYPAPA am 22.03.19 16:36:26Danke für Die Vielen Informationen.
Du scheinst Mir Eine sehr gute Einstellung zu haben.
Was, Meiner Erfahrung, Lichtjahre von "selbstverständlich" entfernt liegt.
"4 Wochen für gebraucht".
Du kannst auf Jeden Fall von ausgehen dass ich verstehe Was Das heisst.
Eine "Halb Off topic" Frage vielleicht.
Bist Du, auch, bei/für nicht Deutsche Bio/MedTechnologiefirmen Eine Person,
Die man bei Fragen vielleicht mal ansprechen kann ??
Ist noch zu früh zu sagen, aber ich kann Mir, bis Jetzt, gut vorstellen dass ich Es vielleicht auch mal mit Deinem Wert versuche.
Das würde, Wenn, aber wohl zu Einem PROJEKT werden, falls Wer versteht Was Das bedeutet.
Du sicherlich.
Gruss
Du scheinst Mir Eine sehr gute Einstellung zu haben.
Was, Meiner Erfahrung, Lichtjahre von "selbstverständlich" entfernt liegt.
"4 Wochen für gebraucht".
Du kannst auf Jeden Fall von ausgehen dass ich verstehe Was Das heisst.
Eine "Halb Off topic" Frage vielleicht.
Bist Du, auch, bei/für nicht Deutsche Bio/MedTechnologiefirmen Eine Person,
Die man bei Fragen vielleicht mal ansprechen kann ??
Ist noch zu früh zu sagen, aber ich kann Mir, bis Jetzt, gut vorstellen dass ich Es vielleicht auch mal mit Deinem Wert versuche.
Das würde, Wenn, aber wohl zu Einem PROJEKT werden, falls Wer versteht Was Das bedeutet.
Du sicherlich.
Gruss
Antwort auf Beitrag Nr.: 60.173.580 von katjuscha-research am 22.03.19 16:32:03Also Aminitiin verkaufen Sie vorläufig kaum bei den kleinen Patientenzahlen. Und da sie noch nicht in der Klinik sind ist der Markt Jahre entfernt. Einnahmen sind Meilensteinzahlungen aus den Forschungsphasen sowie ab 2021 sehr wahrscheinlich umsatzbeteiligungen bei Telix, die aber realistisch schnell im zweistelligen Bereich liegen können. HDP seit längerem neue Investoren, Knackpunkt sind die 75% von Hopp die abschrecken. Also entweder finden Sie den oder in einem Jahr gibt es eine KE mit rund 15-20 Mio € Umfang.
Mit einem Darlehen wird Hopp diesmal kaum einspringen. Ist der Newsflow wie erhofft reichen für eine KE auch 3-4 Mio neue Aktien. Gut wäre wenn diese ein neuer Investor mit einer Privatplatzierung übernimmt.
Antwort auf Beitrag Nr.: 60.174.444 von Mogli3 am 22.03.19 17:53:16
Wär das nichts..
Wär das nichts für dich?
Antwort auf Beitrag Nr.: 60.174.564 von BICYPAPA am 22.03.19 18:04:46Wenn du mir das Kleingeld ausleihst.....
Auf der Website ist unter Präsentationen seit Kurzem der Mitschnitt der gestrigen TK aufgeschaltet. Die ersten 30 min ist lediglich die Kommentierung der Slides, dann ca 20 min Frage und Antworten. Sagen auch was zu Takeda und weiteren Partnern. Anscheinend proben mehrere Firmen mit den Molekülen aber noch keine steht kurzzeitig vor dem Abschluss, könnte aber jederzeit sein. Takeda ist einfach langsam weil sie groß sind und HDP nie eine von vielen Möglichkeiten ist.
Auf der Website ist unter Präsentationen seit Kurzem der Mitschnitt der gestrigen TK aufgeschaltet. Die ersten 30 min ist lediglich die Kommentierung der Slides, dann ca 20 min Frage und Antworten. Sagen auch was zu Takeda und weiteren Partnern. Anscheinend proben mehrere Firmen mit den Molekülen aber noch keine steht kurzzeitig vor dem Abschluss, könnte aber jederzeit sein. Takeda ist einfach langsam weil sie groß sind und HDP nie eine von vielen Möglichkeiten ist.
Antwort auf Beitrag Nr.: 60.170.460 von BICYPAPA am 22.03.19 11:51:56
Ich warte jetzt aber erst mal den Fortschritt bis April zu den Quartalszahlen der betreffenden Firmen ab, damit sich diese Arbeit auch lohnt.
Analyse HP 4. Teil
https://langfristanleger.net/gastbeitrag-analyse-der-heidelb…
Präsentation von HP Teil 4
Hier noch die Präsentation des 4. Teils der Analyse. Nach den Quartalsberichten werde ich meine Analyse noch mal überarbeiten und auf den neuesten Stand bringen. Im Kern war die erste Analyse doch in fast allen Punkten sehr zutreffend und so muß ich nur kleinere Änderungen und Ergänzungen vornehmen. Ich warte jetzt aber erst mal den Fortschritt bis April zu den Quartalszahlen der betreffenden Firmen ab, damit sich diese Arbeit auch lohnt.
Analyse HP 4. Teil
https://langfristanleger.net/gastbeitrag-analyse-der-heidelb…
super und vielen, vieken dank bicpapa..
Conf Call 21.03
Jan Schmidt-Brand:
...
Starting with HDP-101, we expect to complete several key activities during the year that will be needed to initiate the first-in-humans trial with this ATAC.
....
In the meantime, a more specific timeline for the manufacturing of the trial material has been determined which should enable the company to discuss details of the trial with the FDA and the Paul-Ehrlich-Institut in the fourth quarter of 2019. Approval of the planned Phase I trial is expected early next year.
....
Ursprünglich waren wir bei Q4 2018, dann H2 2109 und jetzt Q1 2020?
Vielleicht ein Grund für -9% heute ?
Jan Schmidt-Brand:
...
Starting with HDP-101, we expect to complete several key activities during the year that will be needed to initiate the first-in-humans trial with this ATAC.
....
In the meantime, a more specific timeline for the manufacturing of the trial material has been determined which should enable the company to discuss details of the trial with the FDA and the Paul-Ehrlich-Institut in the fourth quarter of 2019. Approval of the planned Phase I trial is expected early next year.
....
Ursprünglich waren wir bei Q4 2018, dann H2 2109 und jetzt Q1 2020?
Vielleicht ein Grund für -9% heute ?
Antwort auf Beitrag Nr.: 60.188.111 von Lidenbrock am 25.03.19 13:03:44
Ich sehe es eher als Gewinnmitnahme nach dem doch steilen Anstieg und stop los fishing unterhalb der 3€ Marke.
Telix läuft gut.
Magenta läuft gut.
HDP-101 eigentlich wie erwartet leicht verzögert.
Fundamental gibt es für mich keine erkennbaren Gründe jetzt zu verkaufen. So sind die Gründe halt einfach im strategischen Bereich zu suchen.
Die Verzögerung
Die Verzögerung von HDP-101 war doch irgendwie abzusehen, da die Produktionsanlage zur Herstellung von GMP Amanitin sich ja auch um etwa ein Quartal verzögert hat. Dementsprechend verschieben sich ja auch alle anderen davon abhängige Arbeiten ebenfalls um diesen Zeitfaktor. Ich sehe es eher als Gewinnmitnahme nach dem doch steilen Anstieg und stop los fishing unterhalb der 3€ Marke.
Telix läuft gut.
Magenta läuft gut.
HDP-101 eigentlich wie erwartet leicht verzögert.
Fundamental gibt es für mich keine erkennbaren Gründe jetzt zu verkaufen. So sind die Gründe halt einfach im strategischen Bereich zu suchen.
Antwort auf Beitrag Nr.: 60.188.111 von Lidenbrock am 25.03.19 13:03:44Auf der HV im Mai ist Gelegenheit genau nachzufragen. Bis dahin müsste der Zeitplan feststehen. Aber wir sind bei Biotech. Ich habe noch nie erlebt dass geplante Termine eingehalten werden.
DGAP-News: Heidelberg Pharma präsentiert proprietäre ATAC-Technologieplattform auf der AACR-Jahrestagung 2019 (deutsch)
27.03.2019 / 07:12
Für den Inhalt der Mitteilung ist der Emittent / Herausgeber verantwortlich.
PRESSEMITTEILUNG
Heidelberg Pharma präsentiert proprietäre ATAC-Technologieplattform auf der
AACR-Jahrestagung 2019
Ladenburg, 27. März 2019 - Die Heidelberg Pharma AG (FWB: WL6) gab heute
bekannt, dass sie präklinische Ergebnisse zur Anwendung ihrer proprietären
ATAC-Technologieplattform bei dreifach negativem Brustkrebs auf der
Jahrestagung der American Association for Cancer Research (AACR) 2019
präsentieren wird.
AACR Annual Meeting 2019
Datum: 29. März - 3. April
Veranstaltungsort: Georgia World Congress Center, Atlanta, USA
Präsentationsdetails:
Preclinical evaluation of anti-HER2 Antibody Targeted Amanitin Conjugates
(ATACs) on HER2low breast cancer with chromosome 17p deletion
Abstract Nummer: 237, Section 9
Vortragender: Dr. Christian Breunig
Datum: 31. März 2019, 13:00 - 17:00 Uhr EDT
Heidelberg Pharma wird im Rahmen einer Posterpräsentation präklinische Daten
zu einem ATAC präsentieren, das gegen das Brustkrebs-Antigen HER2 gerichtet
ist. Die Daten zeigen, dass das ATAC das Potenzial hat, auch gegen Tumore
mit niedriger HER2-Expression, wie bei dreifach negativem Brustkrebs, und
präferenziell auf Tumorzellen mit aggressiven Verlaufsformen im Zusammenhang
mit einer 17p-Deletion zu wirken.
...
https://www.finanznachrichten.de/nachrichten-2019-03/4630673…
27.03.2019 / 07:12
Für den Inhalt der Mitteilung ist der Emittent / Herausgeber verantwortlich.
PRESSEMITTEILUNG
Heidelberg Pharma präsentiert proprietäre ATAC-Technologieplattform auf der
AACR-Jahrestagung 2019
Ladenburg, 27. März 2019 - Die Heidelberg Pharma AG (FWB: WL6) gab heute
bekannt, dass sie präklinische Ergebnisse zur Anwendung ihrer proprietären
ATAC-Technologieplattform bei dreifach negativem Brustkrebs auf der
Jahrestagung der American Association for Cancer Research (AACR) 2019
präsentieren wird.
AACR Annual Meeting 2019
Datum: 29. März - 3. April
Veranstaltungsort: Georgia World Congress Center, Atlanta, USA
Präsentationsdetails:
Preclinical evaluation of anti-HER2 Antibody Targeted Amanitin Conjugates
(ATACs) on HER2low breast cancer with chromosome 17p deletion
Abstract Nummer: 237, Section 9
Vortragender: Dr. Christian Breunig
Datum: 31. März 2019, 13:00 - 17:00 Uhr EDT
Heidelberg Pharma wird im Rahmen einer Posterpräsentation präklinische Daten
zu einem ATAC präsentieren, das gegen das Brustkrebs-Antigen HER2 gerichtet
ist. Die Daten zeigen, dass das ATAC das Potenzial hat, auch gegen Tumore
mit niedriger HER2-Expression, wie bei dreifach negativem Brustkrebs, und
präferenziell auf Tumorzellen mit aggressiven Verlaufsformen im Zusammenhang
mit einer 17p-Deletion zu wirken.
...
https://www.finanznachrichten.de/nachrichten-2019-03/4630673…
Antwort auf Beitrag Nr.: 60.204.357 von HK12 am 27.03.19 07:18:33
Das ist ein sehr wertvoller Abstract nach der Behandlungsmöglichkeit beim Multiplem Myelom. Damit dürfte sich die ATAC Pipeline auf die gesamte Breite der Krebserkrankungen ausdehnen können.
Das ist prima
Krebserkrankungen mit diesem " chromosome 17p deletion" Merkmal gibt es auch bei vielen anderen Krebsarten auch. Ich hatte es auch in der Analyse auch geschrieben. Normalerweise gibt es für diese Patienten kaum oder gar keine Behandlungsmöglichkeiten. Heidelberg Pharma mit seiner ATAC Technologie scheint nun eine Möglichkeit zu sein, für diese Gruppe eine Behandlungsmöglichkeit zu bieten. Das ist ein sehr wertvoller Abstract nach der Behandlungsmöglichkeit beim Multiplem Myelom. Damit dürfte sich die ATAC Pipeline auf die gesamte Breite der Krebserkrankungen ausdehnen können.
Biotech-Geheimtipp Heidelberg Pharma gewinnt 4% - was ist da los?
...
https://www.deraktionaer.de/aktie/biotech-geheimtipp-heidelb…
...
https://www.deraktionaer.de/aktie/biotech-geheimtipp-heidelb…
Antwort auf Beitrag Nr.: 60.181.476 von BICYPAPA am 24.03.19 08:49:01
Vielen Dank für Deine Tollen Analysen.
Ich habe hier bereits eine kleinere Position eröffnet und überlege aufzustocken.
Dass die Chancen sehr groß sind hast Du sehr gut ausgearbeitet.
Ich erhoffe mir, dass die Risiken überschaubar sind, da man mehrere Eisen im Feuer hat.
Aber Du bist hier der Experte.
Meine konkrete Frage an Dich:
Wieviel % Deines Vermögens / Aktienvermögens hast Du in Heidelberg Pharma investiert?
Mich interessiert ob HP bei Dir eher unter Depotbeimischung läuft oder ob Du Dir bei Dieser Sache relativ sicher bist.
Gruß,
Johannes
Heidelberg Pharma - Wie stark bist Du hier investiert?
Hallo BICYPAPA,Vielen Dank für Deine Tollen Analysen.
Ich habe hier bereits eine kleinere Position eröffnet und überlege aufzustocken.
Dass die Chancen sehr groß sind hast Du sehr gut ausgearbeitet.
Ich erhoffe mir, dass die Risiken überschaubar sind, da man mehrere Eisen im Feuer hat.
Aber Du bist hier der Experte.
Meine konkrete Frage an Dich:
Wieviel % Deines Vermögens / Aktienvermögens hast Du in Heidelberg Pharma investiert?
Mich interessiert ob HP bei Dir eher unter Depotbeimischung läuft oder ob Du Dir bei Dieser Sache relativ sicher bist.
Gruß,
Johannes
Antwort auf Beitrag Nr.: 60.212.603 von JohannesWild am 27.03.19 19:53:54
Es bringt dir nichts, wenn ich dir genau meine Quote mitteile. Es ist kein Kriterium für andere. Man sollte sich nach der Faktenlage und nach seinem persönlichen Erfahrungswerten richten. Ich halte HP für den aussichtsreichsten deutschen Biotechwert. Ich hab es ja in der Analyse geschrieben. Und ich hab auch die Risiken erwähnt. Im Groben richte ich mich danach. Doch man darf sich nie zu sicher sein. Ich hab ja auch geschrieben, dass es mich in meiner Laufbahn 6 oder 7 mal schlimm erwischt hat. Ich rate dir die Analyse und auch die Risiken noch mal genau zu lesen und danach zu entscheiden. Meine eigene Quote spielt dafür keine Rolle.
Ich habe meist
Ich habe meist 4-5 Werte im Depot, wovon ich schon mal ein oder zwei etwas übergewichte oder manchmal auch reduziere. Das hängt bei mir von der aktuellen Lage ab und wie risikoreich ich sie einschätze. Es variiert also im Laufe der Zeit.Es bringt dir nichts, wenn ich dir genau meine Quote mitteile. Es ist kein Kriterium für andere. Man sollte sich nach der Faktenlage und nach seinem persönlichen Erfahrungswerten richten. Ich halte HP für den aussichtsreichsten deutschen Biotechwert. Ich hab es ja in der Analyse geschrieben. Und ich hab auch die Risiken erwähnt. Im Groben richte ich mich danach. Doch man darf sich nie zu sicher sein. Ich hab ja auch geschrieben, dass es mich in meiner Laufbahn 6 oder 7 mal schlimm erwischt hat. Ich rate dir die Analyse und auch die Risiken noch mal genau zu lesen und danach zu entscheiden. Meine eigene Quote spielt dafür keine Rolle.
Hey  Wie ausgiebig habt ihr so recherchiert, dass HP der einzige Konzern ist, der auch ruhunde Zellen angreift und nicht nur die Zellteilung von Krebszellen verhindert?
Wie ausgiebig habt ihr so recherchiert, dass HP der einzige Konzern ist, der auch ruhunde Zellen angreift und nicht nur die Zellteilung von Krebszellen verhindert?
 Wie ausgiebig habt ihr so recherchiert, dass HP der einzige Konzern ist, der auch ruhunde Zellen angreift und nicht nur die Zellteilung von Krebszellen verhindert?
Wie ausgiebig habt ihr so recherchiert, dass HP der einzige Konzern ist, der auch ruhunde Zellen angreift und nicht nur die Zellteilung von Krebszellen verhindert?
Antwort auf Beitrag Nr.: 60.219.608 von kostaszaf am 28.03.19 15:07:01
Wenn du eine Quelle
Wenn du eine Quelle hast von einer Firma, die bei der Krebsbekämpfung auch die ruhenden Zellen angreift, dann nenne sie bitte. Ich bin für jede Information dankbar. Die Quelle für die Information ist von Heidelberg Pharma selber. Es reichen zwei Klicks zur Webseite nach HP um dies zu recherchieren.
Obwohl ich davon ausgehe, dass HP sich mittelfristig sehr positiv entwickeln wird - es gibt einige Produkte in der Pipeline - muss jeder der hier investiert sich bewußt sein, dass es sich um einen sehr marktengen Titel handelt, der auch einer relativ hohen Volatilität unterliegt.
Chancen sind sicher vorhanden - es gibt aber auch erhebliche Risiken.
Man sollte hier nur investieren, wenn man bereit ist, sein Kapital auch einige Jahre ohne Dividende anzulegen.
Chancen sind sicher vorhanden - es gibt aber auch erhebliche Risiken.
Man sollte hier nur investieren, wenn man bereit ist, sein Kapital auch einige Jahre ohne Dividende anzulegen.
Antwort auf Beitrag Nr.: 60.219.653 von BICYPAPA am 28.03.19 15:12:30
https://patentscope.wipo.int/search/de/result.jsf
Als Suchbegriff Heidelberg Pharma eingeben. Das Patent wurde gestern veröffentlicht.
PSMA-TARGETING AMANITIN CONJUGATES
FIELD OF THE INVENTION
[001 ] The invention relates to a PSMA-targeting conjugate comprising (a) an amatoxin; (b) a small molecule PSMA-targeting moiety; and (c) optionally a linker linking said amatoxin and said small molecule PSMA-targeting moiety. The invention furthermore relates to said conjugate further comprising a half-life extension moiety. The invention furthermore relates to a pharmaceutical composition comprising such conjugate.
Patenterteilung Amanitin mit PSMA Ziel
Dies betrifft das PSMA Ziel, das HP gegen Prostatkrebs entwickelt.https://patentscope.wipo.int/search/de/result.jsf
Als Suchbegriff Heidelberg Pharma eingeben. Das Patent wurde gestern veröffentlicht.
PSMA-TARGETING AMANITIN CONJUGATES
FIELD OF THE INVENTION
[001 ] The invention relates to a PSMA-targeting conjugate comprising (a) an amatoxin; (b) a small molecule PSMA-targeting moiety; and (c) optionally a linker linking said amatoxin and said small molecule PSMA-targeting moiety. The invention furthermore relates to said conjugate further comprising a half-life extension moiety. The invention furthermore relates to a pharmaceutical composition comprising such conjugate.
Antwort auf Beitrag Nr.: 60.204.357 von HK12 am 27.03.19 07:18:33
https://heidelberg-pharma.com/files/AACR_2019_237.pdf
Die Präsentation ist online
Preclinical evaluation of anti-HER2 Antibody Targeted Amanitin Conjugates (ATACs) on HER2low breast cancer with chromosome 17p deletionhttps://heidelberg-pharma.com/files/AACR_2019_237.pdf
Hausgemachtes bei HP und einige interessante Entwicklungen im Wettbewerbsumfeld sind ein guter Anlass sich wieder mal zu Wort zu melden.
Meine Grundeinstellung zu HP ist unverändert positiv, genauer gesagt EXTREM POSITIV, das heist aber noch lange nicht, dass man mit rosaroten Brillen durch das Leben spaziert. Damit meine ich an erster Stelle, der Entwicklungsplan von HDP-101, sprich der Zeitpunkt der Behandlung des ersten Patienten.
Aus der Meldung vom 21/3/19
"In the meantime, a more specific timeline for the manufacturing of the trial material has been determined, which should enable the Company to discuss details of the trial with the FDA and the Paul-Ehrlich-Institut in the fourth quarter of 2019. Approval of the planned Phase I trial is expected early next year ".
Zum Vergleich, November 2018 Praesentation (Seite 29 von 31): "Clinical Trial Application Q2/2019, First patient in Q4/2019".
Und wenn ich noch weiter zurueckspule, genau ein Jahr zurueck auf der BPK 2018, konnte man lesen "1st program to enter the clinic by the end of 2018" (Uberschrift S 24). Die komplette Zeitachse war auf Seite 14 zu finden.
Ich fasse also zusammen: im letzten Jahr hat HP in Schueben den Entwickungsplan von HDP-101 um 1 Jahr nach hinten verschoben. Das ist Fakt und das ist schlecht.
Einen positiven Punkt der 21/3 Meldung entnehme ich aber schon: "applications for the Phase Ia (dose escalation) and Phase Ib (dose expansion) will be submitted simultaneously in the USA and Germany". Das ist schon sehr unüblich und kann einen (kleinen) Teil der Verschiebung erklären. Erstens kann es sein, dass die FDA sich bereit erklärt, eine kürzere Dosiseskalation als der PEI zu erlauben. Sie hat da viel mehr Erfahrung mit ADCs. Eine höhere Einstiegdosis heisst eine bessere Chance gleich Wirksamkeit zu zeigen, statt sich mit sub-therapeutischen Dosen monatelang durchzuquälen. Zweitens könnte man mit einem adaptiven Design einen Schritt in Richtung zulassungrelevante Studie nehmen. Klingt forsch aber die Kombo Amanitin + Biomarker hat das Zeug CART in den Schatten zu stellen. Und drittens ist eine offene IND bei der FDA fuer viele US Investoren das Eintrittsticket um überhaupt mitspielen zu dürfen.
Was gibt es sonst noch negatives zu berichten ? Zu berichten nichts, aber zu warnen schon einiges. Mein größtes Problem ist zur Zeit dass HP sich gar nicht auf die nächste Phase seiner Entwicklung vorbereitet hat, die Organisation ist die gleiche die Wilex bei der Übernahme 2011 vorgefunden hat. Der Übergang von der Preklinik zur Klinik ist ein aufregender Meilenstein, ist aber auch mit Risiko behaftet. Ich kenne zu viele Biotech Buden die die Kurve nicht gekriegt haben !
Ich nenne mal 3 Punkte: 1) Der Vorstand besteht aus CEO/CFO und CSO, 2) der Aufsichtsrat ist suboptimal (vorsichtig ausgedrückt) 3) kein naturwissenschaftlicher Beirat (scientific advisory board)
Im Detail
1) Vorstand.
JSB und AP haben beide hervorragende Leistung gebracht, aber eine Firma mit einem 2 Man Vorstand wird bei Pharma, Bankern und US Investoren nicht richtig ernst genommen. Ob intern (immerhin 60 VZBs) oder extern, es müssen neue Vorstandpositionen besetzt werden. CEO/CFO müssen getrennt werden, aber noch wichtiger ist die Berufung eines CMO Chief Medical Officers. Wer verantwortet Manufacturing ? Wer verantwortet Business Development ? Ich kann verstehen dass die Zeichen lange auf "Kostenminimierung" standen, vor allem nach dem Ausstieg von Roche im Sommer 2015, aber jetzt sind andere Prioritäten angesagt.
2) Aufsichtsrat.
Ich will niemanden zu nahe treten, ich rate aber jedem den Aufsichtsrat von HP und den von Magenta gegenüber zu stellen und sich genau die Profile der einzelnen Mitglieder durchzulesen. So viel zu diesem Punkt ...
Wettbewerb
Alles geht in die Richtung von HP !
Mersana: steht vor einem Scherbenhaufen. Die beim 2017 IPO hochgelobte Dolaflexin Platform hat bis jetzt nichts ihres Versprechens gehalten. Ehemaliger lead XMT1522 (HER2 ADC) ist gestorben. Nicht US Rechte sind von Takeda zurückgegeben worden und Mersana selbst hat das Programm eingestellt. Der neue lead in ph1 ist XMT1536 (target ist NaPi2b).
IPO war bei 15, letzte Finanzierung im März hat fast USD 100m eingebracht, aber bei 4 ! Marktkapitalisierung immerhin bei USD 230m.
Immunomedics: Mitte Januar kam von der FDA eine Ablehnung (CRL) zum Zulassungantrag von sacituzumab govitecan in TNBC (anti Trop-2 ADC). Der Grund lag bei dem Herstellungsverfahren des Präparats. Eine willkommene Erinnerung, dass HP mit dem über-vorsichtigen Vorankommen in der Herstellung vielleicht nicht ganz falsch liegt :-)
Dann kam Ende März der Hammer (USD 1.35Mrd upfront, 3.8Mrd milestones und und und), der Deal zwischen AstraZeneca und Daiichi-Sankyo, und weil es so schön ist, hab ich einfach mal den Kommentar von Bryan Garnier reinkopiert. Ich glaube, dass HP, und wir, mit dem voriger Woche auf der AACR vorgestellten HER2 ATAC selbst viel Freude haben werden :-)
(BG Kommentar zum DS-AZ Deal, 29/3/19)
AstraZeneca gets access to an interesting asset
Daiichi-Sankyo (DS) and AstraZeneca (AZ) have signed an agreement under which they will cooperate on the joint development and commercialization of an antibodydrug conjugate called trastuzumab deruxtecan, whose construct is quite similar to Kadcyla (trastuzumab emtansine) i.e. whereby trastuzumab acts not only as an antibody but also as a carrier to bring a chemotherapeutic agent to the tumour site. Daiichi-Sankyo has so far developed the drug in various HER2-positive cancers, of course starting with breast cancer where incidence is the greatest. Some quite impressive results have been made public in 2017 and 2018: in very heavily pretreated patients with HER2-positive advanced or metastatic breast cancer (BC), already treated at least by Herceptin and Perjeta and for most with Kadcyla too, trastuzumab deruxtecan showed DCR of about 95%, ORR of 56% and a median PFS of 10.3 months in the HER2-positive cohort of those having received Kadcyla. The drug has received BTD by the FDA for the specific setting of HER2+ advanced BC patients after Herceptin, Perjeta and Kadcyla where there are very few options.
A rich deal funded by an equity placement
AZ will pay DS USD1.35bn upfront, 50% immediately and 50% 12 months later. Further contingent payments include USD3.8bn of regulatory and development milestones and USD1.75bn of sales-related milestones. From now on, costs and profits will be equally shared although DS will book US and some European sales and AZ sales in rest of the world, except Japan where the first will keep exclusive rights. Surprisingly because it is quite uncommon, AZ will fund the transaction through an equity placement of approximately USD3.5bn, more than half of whose proceeds will be used specifically for it. The terms will be disclosed during the day. An easy reference to assess how big the drug can be is to take Kadcyla, whose sales reached close to USD1bn in 2018. However, it is still growing and with KATHERINE data should come close to USD2bn at peak. The plan with DS and AZ is to develop trastuzumab deruxtecan is various tumour types, including breast, but also in gastric cancer (where Herceptin works but Kadcyla is not), in NSCLC and in CRC (where HER-2 positivity is much less frequent but where a topoisomerase-1 inhibitor makes sense). The strategy does not seem to target direct competition against Roche, but to expand use of HER-2 targeting agents well beyond their existing presence. In breast only, epidemiology data suggest that patients going 3L-4L represent more than half of those eligible for Herceptin in 1L. We would like to see more data outside breast cancer (maybe in combination with durvalumab?) before including
sales in our model but BC and gastric cancer can be sufficient to make the drug a blockbuster in our view
Biomarker
17p deletion öffnet definitiv einen schnelleren Weg zur ersten Zulassung. In den meisten Fällen wird man auch ohne diese Einschränkung zugelassen werden, da die Wirksamkeit von Amanitin wirklich "off the chart" ist, aber das wird von Indikation zu Indikation unterschiedlich sein. Wie relevant dieser Biomarker unmittelbar ist zeigt das Beispiel Venetoclax von Abbvie. Der BCL2 Inhibitor wurde Ende 2018 zugelassen und soll es 2019 allein in CLL auf USD 725m Umsatz bringen.
Wie geht es weiter ?
HP ist bis Mitte 2010 finanziert, es ist aber klar, dass vorher eine weitere Finanzierung statt finden muss. Und da die first in man Tox Daten der eigenen ph1 bis dahin noch nicht vorhanden sein werden, ist ziemlich klar, dass man im Divini Hopp Revier "not amused" ist ! Ich bin es übrigens auch nicht ! Ich erinnere daran, dass DH die Beteiligung nach und nach zu Diskountpreisen aufgestockt hat und zuletzt in einem Poker inspirierten Move "All In" gegangen ist. Mit 75% ist es aber das Ende der Fahnenstange, mehr als diese Marke zu verteidigen ist nicht drin ohne die BaFin auf den Plan zu rufen. Es gibt Möglichkeiten ohne Verwässerung an Geld zu kommen, zum Beispiel über Darlehen der EIB. Die sind aber mit strikten Bedingungen verbunden und haben gute 6 Monate Vorlauf. Ich schätze die Chancen von HP als sehr positiv ein: die Mittel sind eindeutig F&E gebunden, die Firma hat Substanz (66 Mitarbeiter) und eine wertvolle Technologiefuehrerschaft (Amanitin Payload Platform). Man könnte auch saemtliche Rechte der Altprodukte verkaufen (Telix, Redhill etc...). Keine Ahnung wieviel damit zu versilbern ist, aber definitv genug für unsere Zwecke. Eine weitere Option wäre eine 10% Direktplazierung (also ohne BZR). Ich kann mir gut vorstellen, dass DH nichts dagegen auszusetzen hätte, wenn der Kurs etwas höher waere. Wie hoch lass ich mal dahingestellt. Man koennte zum Beispiel die Magenta Aktionaere gezielt ansprechen. Ich bin mir 100% sicher, dass die am liebsten HP komplett übernehmen möchten und sich mit 10% nicht zufrieden geben würden. Das wäre ein guter Anfang. Option 2 könnte sein ein Darlehen von DH, das bei erfolgreichem Nasdaq Listing fällig wird. OK, nicht das Traumszenario aus Sicht des Hauptaktionärs aber auch nicht von der Hand zu weisen. Aber da gibt's noch eine andere Option, und ganz ehrlich, mein Lieblingsszenario. Bitte anschnallen. Magenta und HP fusionieren. Diese Option ist eine WIN/WIN/WIN/WIN/WIN Situation wie ich sie nie erlebt habe. WIN 1= Magenta Management. Die sind auf die Knochenmarktransplantation (BMT) 100% fokussiert und haben mit Krebs nichts am Hut, ABER, doof sind die auch nicht, die wissen ganz genau, dass die HP IP 95% des langfristigen Wertes der Magenta ausmacht. WIN 2= Magenta Aktionäre. Für die ist es ein "no brainer", auf einer Linie mit dem Magenta Management. WIN 3= HP Management. Behält die Krebs Kompetenz, Integration in einem Nasdaq notierten Unternehmen, kein Kopfzerbrechen über Finanzierung mehr, Freischwimmen von einem allmächtigen Grossinvestor, intaktes Kursentwicklungspotential. WIN 4= DiviniHopp Niedrigerer Anteil an einem Nasdaq notierten Unternehmen ohne Einschränkung des Gesamtpotentials, flexibleres Aussteigen möglich. WIN 5= wir, die übrigen Akionäre von HP. Ich rede jetzt zwar nur für mich, aber die Tatsache, dass ich mir die Mühe gebe diese Szenarien durchzuspielen, lassen hoffentlich kein Zweifel offen, was ich davon halte. Lieber gestern als morgen heisst meine Devise.
Ich spiele mal mein Wunschszenario durch. 1) Magenta übernimmt 100% der HP Anteile in Form eines Aktientausches. Magenta ist zZ mit USD 500m bewertet, und bietet USD 250m fuer HP, also 2/3 Magenta, 1/3 HP. 2) Magenta finanziert die Übernahme mit neuen Aktien nach Zustimmung der bestehenden Aktionäre. 3) Magenta D (alt HP) und Magenta US treiben ihr ursprüngliches Geschäft voran, sprich Onkologie und Knochenmarkttransplatation. 4) nach Erreichen von näher zudefinieren klinischen Meilensteilen wird das Onkologie Geschäft (alt HP) an die Nasdaq separat eingeführt.
Die Rechtfertigung einer Fusion ist also glasklar, die einzige Frage ist wie soll die ursprüngliche relative Bewertung ausfallen. Ich glaube aber, dass ich mit meinem 1/3 vs 2/3 nicht weit von einer fairen relativen Bewertung liege. DiviniHopp hat natürlich das letzte Wort in diesem Spielchen, wenn aber eine Stand alone Strategie verfolgt wird, muss einiges passieren (siehe oben: Finanzmittel, Kompetenzen und Kontrollgremien). HeidelbergPharma ist eine Once in a Lifetime Chance. Ich bin mir nicht sicher, dass sich viele davon bewusst sind.
Ein letztes Wort zum dem SMDC Patent. (small molecule drug conjugate). Wurde von niemanden aufgenommen ist aber eine große Sache, super, super, super spannend ! Ich werde (vielleicht) später was dazu schreiben. PSMA ist ein erstes tolles target, nicht nur in der Indikation Prostatakrebs (mehr oder weniger alle soliden Krebsindikationen außer Hirntumore). Die Möglichkeit von großmolekülaren Vektoren (monoklonale Antikoerper) Abstand zu nehmen bringt erheblich Vorteile in Puncto Kosten, Entwicklungszeit und Wirksamkeit (bessere Penetration).
Meine Grundeinstellung zu HP ist unverändert positiv, genauer gesagt EXTREM POSITIV, das heist aber noch lange nicht, dass man mit rosaroten Brillen durch das Leben spaziert. Damit meine ich an erster Stelle, der Entwicklungsplan von HDP-101, sprich der Zeitpunkt der Behandlung des ersten Patienten.
Aus der Meldung vom 21/3/19
"In the meantime, a more specific timeline for the manufacturing of the trial material has been determined, which should enable the Company to discuss details of the trial with the FDA and the Paul-Ehrlich-Institut in the fourth quarter of 2019. Approval of the planned Phase I trial is expected early next year ".
Zum Vergleich, November 2018 Praesentation (Seite 29 von 31): "Clinical Trial Application Q2/2019, First patient in Q4/2019".
Und wenn ich noch weiter zurueckspule, genau ein Jahr zurueck auf der BPK 2018, konnte man lesen "1st program to enter the clinic by the end of 2018" (Uberschrift S 24). Die komplette Zeitachse war auf Seite 14 zu finden.
Ich fasse also zusammen: im letzten Jahr hat HP in Schueben den Entwickungsplan von HDP-101 um 1 Jahr nach hinten verschoben. Das ist Fakt und das ist schlecht.
Einen positiven Punkt der 21/3 Meldung entnehme ich aber schon: "applications for the Phase Ia (dose escalation) and Phase Ib (dose expansion) will be submitted simultaneously in the USA and Germany". Das ist schon sehr unüblich und kann einen (kleinen) Teil der Verschiebung erklären. Erstens kann es sein, dass die FDA sich bereit erklärt, eine kürzere Dosiseskalation als der PEI zu erlauben. Sie hat da viel mehr Erfahrung mit ADCs. Eine höhere Einstiegdosis heisst eine bessere Chance gleich Wirksamkeit zu zeigen, statt sich mit sub-therapeutischen Dosen monatelang durchzuquälen. Zweitens könnte man mit einem adaptiven Design einen Schritt in Richtung zulassungrelevante Studie nehmen. Klingt forsch aber die Kombo Amanitin + Biomarker hat das Zeug CART in den Schatten zu stellen. Und drittens ist eine offene IND bei der FDA fuer viele US Investoren das Eintrittsticket um überhaupt mitspielen zu dürfen.
Was gibt es sonst noch negatives zu berichten ? Zu berichten nichts, aber zu warnen schon einiges. Mein größtes Problem ist zur Zeit dass HP sich gar nicht auf die nächste Phase seiner Entwicklung vorbereitet hat, die Organisation ist die gleiche die Wilex bei der Übernahme 2011 vorgefunden hat. Der Übergang von der Preklinik zur Klinik ist ein aufregender Meilenstein, ist aber auch mit Risiko behaftet. Ich kenne zu viele Biotech Buden die die Kurve nicht gekriegt haben !
Ich nenne mal 3 Punkte: 1) Der Vorstand besteht aus CEO/CFO und CSO, 2) der Aufsichtsrat ist suboptimal (vorsichtig ausgedrückt) 3) kein naturwissenschaftlicher Beirat (scientific advisory board)
Im Detail
1) Vorstand.
JSB und AP haben beide hervorragende Leistung gebracht, aber eine Firma mit einem 2 Man Vorstand wird bei Pharma, Bankern und US Investoren nicht richtig ernst genommen. Ob intern (immerhin 60 VZBs) oder extern, es müssen neue Vorstandpositionen besetzt werden. CEO/CFO müssen getrennt werden, aber noch wichtiger ist die Berufung eines CMO Chief Medical Officers. Wer verantwortet Manufacturing ? Wer verantwortet Business Development ? Ich kann verstehen dass die Zeichen lange auf "Kostenminimierung" standen, vor allem nach dem Ausstieg von Roche im Sommer 2015, aber jetzt sind andere Prioritäten angesagt.
2) Aufsichtsrat.
Ich will niemanden zu nahe treten, ich rate aber jedem den Aufsichtsrat von HP und den von Magenta gegenüber zu stellen und sich genau die Profile der einzelnen Mitglieder durchzulesen. So viel zu diesem Punkt ...
Wettbewerb
Alles geht in die Richtung von HP !
Mersana: steht vor einem Scherbenhaufen. Die beim 2017 IPO hochgelobte Dolaflexin Platform hat bis jetzt nichts ihres Versprechens gehalten. Ehemaliger lead XMT1522 (HER2 ADC) ist gestorben. Nicht US Rechte sind von Takeda zurückgegeben worden und Mersana selbst hat das Programm eingestellt. Der neue lead in ph1 ist XMT1536 (target ist NaPi2b).
IPO war bei 15, letzte Finanzierung im März hat fast USD 100m eingebracht, aber bei 4 ! Marktkapitalisierung immerhin bei USD 230m.
Immunomedics: Mitte Januar kam von der FDA eine Ablehnung (CRL) zum Zulassungantrag von sacituzumab govitecan in TNBC (anti Trop-2 ADC). Der Grund lag bei dem Herstellungsverfahren des Präparats. Eine willkommene Erinnerung, dass HP mit dem über-vorsichtigen Vorankommen in der Herstellung vielleicht nicht ganz falsch liegt :-)
Dann kam Ende März der Hammer (USD 1.35Mrd upfront, 3.8Mrd milestones und und und), der Deal zwischen AstraZeneca und Daiichi-Sankyo, und weil es so schön ist, hab ich einfach mal den Kommentar von Bryan Garnier reinkopiert. Ich glaube, dass HP, und wir, mit dem voriger Woche auf der AACR vorgestellten HER2 ATAC selbst viel Freude haben werden :-)
(BG Kommentar zum DS-AZ Deal, 29/3/19)
AstraZeneca gets access to an interesting asset
Daiichi-Sankyo (DS) and AstraZeneca (AZ) have signed an agreement under which they will cooperate on the joint development and commercialization of an antibodydrug conjugate called trastuzumab deruxtecan, whose construct is quite similar to Kadcyla (trastuzumab emtansine) i.e. whereby trastuzumab acts not only as an antibody but also as a carrier to bring a chemotherapeutic agent to the tumour site. Daiichi-Sankyo has so far developed the drug in various HER2-positive cancers, of course starting with breast cancer where incidence is the greatest. Some quite impressive results have been made public in 2017 and 2018: in very heavily pretreated patients with HER2-positive advanced or metastatic breast cancer (BC), already treated at least by Herceptin and Perjeta and for most with Kadcyla too, trastuzumab deruxtecan showed DCR of about 95%, ORR of 56% and a median PFS of 10.3 months in the HER2-positive cohort of those having received Kadcyla. The drug has received BTD by the FDA for the specific setting of HER2+ advanced BC patients after Herceptin, Perjeta and Kadcyla where there are very few options.
A rich deal funded by an equity placement
AZ will pay DS USD1.35bn upfront, 50% immediately and 50% 12 months later. Further contingent payments include USD3.8bn of regulatory and development milestones and USD1.75bn of sales-related milestones. From now on, costs and profits will be equally shared although DS will book US and some European sales and AZ sales in rest of the world, except Japan where the first will keep exclusive rights. Surprisingly because it is quite uncommon, AZ will fund the transaction through an equity placement of approximately USD3.5bn, more than half of whose proceeds will be used specifically for it. The terms will be disclosed during the day. An easy reference to assess how big the drug can be is to take Kadcyla, whose sales reached close to USD1bn in 2018. However, it is still growing and with KATHERINE data should come close to USD2bn at peak. The plan with DS and AZ is to develop trastuzumab deruxtecan is various tumour types, including breast, but also in gastric cancer (where Herceptin works but Kadcyla is not), in NSCLC and in CRC (where HER-2 positivity is much less frequent but where a topoisomerase-1 inhibitor makes sense). The strategy does not seem to target direct competition against Roche, but to expand use of HER-2 targeting agents well beyond their existing presence. In breast only, epidemiology data suggest that patients going 3L-4L represent more than half of those eligible for Herceptin in 1L. We would like to see more data outside breast cancer (maybe in combination with durvalumab?) before including
sales in our model but BC and gastric cancer can be sufficient to make the drug a blockbuster in our view
Biomarker
17p deletion öffnet definitiv einen schnelleren Weg zur ersten Zulassung. In den meisten Fällen wird man auch ohne diese Einschränkung zugelassen werden, da die Wirksamkeit von Amanitin wirklich "off the chart" ist, aber das wird von Indikation zu Indikation unterschiedlich sein. Wie relevant dieser Biomarker unmittelbar ist zeigt das Beispiel Venetoclax von Abbvie. Der BCL2 Inhibitor wurde Ende 2018 zugelassen und soll es 2019 allein in CLL auf USD 725m Umsatz bringen.
Wie geht es weiter ?
HP ist bis Mitte 2010 finanziert, es ist aber klar, dass vorher eine weitere Finanzierung statt finden muss. Und da die first in man Tox Daten der eigenen ph1 bis dahin noch nicht vorhanden sein werden, ist ziemlich klar, dass man im Divini Hopp Revier "not amused" ist ! Ich bin es übrigens auch nicht ! Ich erinnere daran, dass DH die Beteiligung nach und nach zu Diskountpreisen aufgestockt hat und zuletzt in einem Poker inspirierten Move "All In" gegangen ist. Mit 75% ist es aber das Ende der Fahnenstange, mehr als diese Marke zu verteidigen ist nicht drin ohne die BaFin auf den Plan zu rufen. Es gibt Möglichkeiten ohne Verwässerung an Geld zu kommen, zum Beispiel über Darlehen der EIB. Die sind aber mit strikten Bedingungen verbunden und haben gute 6 Monate Vorlauf. Ich schätze die Chancen von HP als sehr positiv ein: die Mittel sind eindeutig F&E gebunden, die Firma hat Substanz (66 Mitarbeiter) und eine wertvolle Technologiefuehrerschaft (Amanitin Payload Platform). Man könnte auch saemtliche Rechte der Altprodukte verkaufen (Telix, Redhill etc...). Keine Ahnung wieviel damit zu versilbern ist, aber definitv genug für unsere Zwecke. Eine weitere Option wäre eine 10% Direktplazierung (also ohne BZR). Ich kann mir gut vorstellen, dass DH nichts dagegen auszusetzen hätte, wenn der Kurs etwas höher waere. Wie hoch lass ich mal dahingestellt. Man koennte zum Beispiel die Magenta Aktionaere gezielt ansprechen. Ich bin mir 100% sicher, dass die am liebsten HP komplett übernehmen möchten und sich mit 10% nicht zufrieden geben würden. Das wäre ein guter Anfang. Option 2 könnte sein ein Darlehen von DH, das bei erfolgreichem Nasdaq Listing fällig wird. OK, nicht das Traumszenario aus Sicht des Hauptaktionärs aber auch nicht von der Hand zu weisen. Aber da gibt's noch eine andere Option, und ganz ehrlich, mein Lieblingsszenario. Bitte anschnallen. Magenta und HP fusionieren. Diese Option ist eine WIN/WIN/WIN/WIN/WIN Situation wie ich sie nie erlebt habe. WIN 1= Magenta Management. Die sind auf die Knochenmarktransplantation (BMT) 100% fokussiert und haben mit Krebs nichts am Hut, ABER, doof sind die auch nicht, die wissen ganz genau, dass die HP IP 95% des langfristigen Wertes der Magenta ausmacht. WIN 2= Magenta Aktionäre. Für die ist es ein "no brainer", auf einer Linie mit dem Magenta Management. WIN 3= HP Management. Behält die Krebs Kompetenz, Integration in einem Nasdaq notierten Unternehmen, kein Kopfzerbrechen über Finanzierung mehr, Freischwimmen von einem allmächtigen Grossinvestor, intaktes Kursentwicklungspotential. WIN 4= DiviniHopp Niedrigerer Anteil an einem Nasdaq notierten Unternehmen ohne Einschränkung des Gesamtpotentials, flexibleres Aussteigen möglich. WIN 5= wir, die übrigen Akionäre von HP. Ich rede jetzt zwar nur für mich, aber die Tatsache, dass ich mir die Mühe gebe diese Szenarien durchzuspielen, lassen hoffentlich kein Zweifel offen, was ich davon halte. Lieber gestern als morgen heisst meine Devise.
Ich spiele mal mein Wunschszenario durch. 1) Magenta übernimmt 100% der HP Anteile in Form eines Aktientausches. Magenta ist zZ mit USD 500m bewertet, und bietet USD 250m fuer HP, also 2/3 Magenta, 1/3 HP. 2) Magenta finanziert die Übernahme mit neuen Aktien nach Zustimmung der bestehenden Aktionäre. 3) Magenta D (alt HP) und Magenta US treiben ihr ursprüngliches Geschäft voran, sprich Onkologie und Knochenmarkttransplatation. 4) nach Erreichen von näher zudefinieren klinischen Meilensteilen wird das Onkologie Geschäft (alt HP) an die Nasdaq separat eingeführt.
Die Rechtfertigung einer Fusion ist also glasklar, die einzige Frage ist wie soll die ursprüngliche relative Bewertung ausfallen. Ich glaube aber, dass ich mit meinem 1/3 vs 2/3 nicht weit von einer fairen relativen Bewertung liege. DiviniHopp hat natürlich das letzte Wort in diesem Spielchen, wenn aber eine Stand alone Strategie verfolgt wird, muss einiges passieren (siehe oben: Finanzmittel, Kompetenzen und Kontrollgremien). HeidelbergPharma ist eine Once in a Lifetime Chance. Ich bin mir nicht sicher, dass sich viele davon bewusst sind.
Ein letztes Wort zum dem SMDC Patent. (small molecule drug conjugate). Wurde von niemanden aufgenommen ist aber eine große Sache, super, super, super spannend ! Ich werde (vielleicht) später was dazu schreiben. PSMA ist ein erstes tolles target, nicht nur in der Indikation Prostatakrebs (mehr oder weniger alle soliden Krebsindikationen außer Hirntumore). Die Möglichkeit von großmolekülaren Vektoren (monoklonale Antikoerper) Abstand zu nehmen bringt erheblich Vorteile in Puncto Kosten, Entwicklungszeit und Wirksamkeit (bessere Penetration).
Antwort auf Beitrag Nr.: 60.305.032 von NewKidOnTheBlog am 08.04.19 15:55:52Zum wissenschaftlichen Teil deines Beitrages ist nichts zu sagen außer das „ äußerst positiv „ zu unterstreichen. Die Verzögerung bei 101 ist mittelfristig gesehen nicht allzu schlimm außer vielleicht dass das angedachte finanzielle Geschäftsmodell dadurch etwas ins Wanken kommt. Ich denke nämlich dass man bei HDP glaubte ohne weitere KE durchzukommen und zwar durch Meilensteinzahlungen Magenta und Takeda und ev. eines zusätzlichen Partners. Dazu zählen ab ca. 2021 die Umsatzbeteiligung Telix/ Redectane, immerhin liegt die bei 30%!! Das sind schnell einmal zweistellige Millionenbeträge im Erfolgsfall. Ich denke auch dass der Vorstand gerne eine Privatplatzierung sehen würde um die 75% von DH etwas herunter zu drücken. Der Aktientausch mit Magenta wäre so wie du es beschreibst für die HDP-Aktionäre angesichts der Zukunftsaussichten eher ein schlechtes Geschäft. Für mich ist DH eher ein Garant dass HDP nicht unter Wert verkauft wird. Verläuft 101 in der ersten Phase positiv dann sehe ich eher eine Milliardenbewertung bei HDP so ab 2022/23. Du nimmst ja auch fest an dass Magenta mit den HFP-Molekülen erfolgreich ist was ziemlich hohe Zahlungen auslöst.
Antwort auf Beitrag Nr.: 60.306.016 von Mogli3 am 08.04.19 17:37:52Setzt halt aber immer den Erfolgsfall voraus.
Und bei Biotecs sind letztlich 85% der News zum erreichen der nächsten Entwicklungsphase rein statistisch negativ. Und HP steht da erst ganz am Anfang, wenn auch mit einer vergleichsweise breiten Pipeline.
Bleibt ne spekulative aber sicherlich chancenreiche Aktie, aber hier werden (naturgemäß) hauptsächlich die Chancen erwähnt. Da muss man manchmal aufpassen, nicht zu weit nach vorn zu schauen. Ist immer so ein bißchen die psychologische Falle, in die man da reinlaufen kann.
Ich rechne vorsichtshalber mit einer KE im nächsten Jahr. Dann werd ich nicht negativ überrascht.
Und bei Biotecs sind letztlich 85% der News zum erreichen der nächsten Entwicklungsphase rein statistisch negativ. Und HP steht da erst ganz am Anfang, wenn auch mit einer vergleichsweise breiten Pipeline.
Bleibt ne spekulative aber sicherlich chancenreiche Aktie, aber hier werden (naturgemäß) hauptsächlich die Chancen erwähnt. Da muss man manchmal aufpassen, nicht zu weit nach vorn zu schauen. Ist immer so ein bißchen die psychologische Falle, in die man da reinlaufen kann.
Ich rechne vorsichtshalber mit einer KE im nächsten Jahr. Dann werd ich nicht negativ überrascht.
Antwort auf Beitrag Nr.: 60.306.901 von katjuscha-research am 08.04.19 19:07:39Biotech in der preklinischen Phase ist immer großes Risiko. Das mit Telix ist aber Phase 3 Zulassungsstudie und Redectane war da schon damit erfolgreich. Hier müsste schon viel schief gehen. Geld brauchen sie auf alle Fälle in 2020/21. aber es gibt ja da verschiedene Wege.
Antwort auf Beitrag Nr.: 60.305.032 von NewKidOnTheBlog am 08.04.19 15:55:52Danke NKOTB, ein wirklich interessanter und fundierter Beitrag von Dir!!!
Sehr spannend fand ich die Idee und Darstellung der Argumente/Vorteile einer Fusion zw. Magenta und HP. Auch das HP bei weiterer Eigenständigkeit eine umfassende Transformation in der internen Aufbau-/Ablauforganisation, bei den Organen und Gremien benötigt, ist eine nicht abzuweisende gut nachvollziehbare Feststellung. Alle Argumente sowie der Druck auf Magenta als noch relativ kleines Nasdaq notiertes Unternehmen eine stark wachstumsgetriebene Storyline vorzuweisen, sprechen für sich! Auch mit einer von dir als Szenario akt. Merger-Bewertung iHv 250 Mio. USD für HP könnte ich mit der Perspektive für eine adäquate Beteiligung an einem durchaus potenten Nasdaq-Unternehmen wie Magenta (incl. HP) leben!
Ein paar Fragen dazu:
1) Ich hoffe sehr deine Fusionsannahme beruht nicht nur auf dem Prinzip Hoffnung und einer passiven diskreten Zurückhaltung!?! Ich hoffe, du hast diese Gedankengänge bereits aktiv beim Management / AR beider Unternehmen platziert oder planst dieses nachhaltig zu tun? Solch ein Prozess ist ja nach meiner Erfahrung sehr umfangreich, wird durch externe Berater begleitet und bedarf letztendlich einer Due-Diligence-Prüfung. Wenn wir hier noch bei der Idee / am Anfang stehen, dann wird es mE schwer, dir dein Wunschszenario von eher gestern als morgen zu erfüllen.
2) Was meinst Du bedeutet das für die Zusammenarbeit mit den anderen Partner von HP (insb. Takeda und noch nicht offiziell benannten (größeren) MTA´s). Könnte das zu einer Konkurrenzsituation führen, weil evtl. auch diese anderen Partner ein Interesse an HP (Fusion oder Beteiligung) hätten und könnte evtl. ein Bieterwettbewerb für HP ausgelöst werden, wenn HP / Hopp sich grundsätzlich offen für solche Modelle zeigen würde?
Mich würden auch sehr deine avisierten erläuternden Ausführungen zum neuen SMDC Patent von HP interessieren. Danke vielmals vorab!
Sehr spannend fand ich die Idee und Darstellung der Argumente/Vorteile einer Fusion zw. Magenta und HP. Auch das HP bei weiterer Eigenständigkeit eine umfassende Transformation in der internen Aufbau-/Ablauforganisation, bei den Organen und Gremien benötigt, ist eine nicht abzuweisende gut nachvollziehbare Feststellung. Alle Argumente sowie der Druck auf Magenta als noch relativ kleines Nasdaq notiertes Unternehmen eine stark wachstumsgetriebene Storyline vorzuweisen, sprechen für sich! Auch mit einer von dir als Szenario akt. Merger-Bewertung iHv 250 Mio. USD für HP könnte ich mit der Perspektive für eine adäquate Beteiligung an einem durchaus potenten Nasdaq-Unternehmen wie Magenta (incl. HP) leben!
Ein paar Fragen dazu:
1) Ich hoffe sehr deine Fusionsannahme beruht nicht nur auf dem Prinzip Hoffnung und einer passiven diskreten Zurückhaltung!?! Ich hoffe, du hast diese Gedankengänge bereits aktiv beim Management / AR beider Unternehmen platziert oder planst dieses nachhaltig zu tun? Solch ein Prozess ist ja nach meiner Erfahrung sehr umfangreich, wird durch externe Berater begleitet und bedarf letztendlich einer Due-Diligence-Prüfung. Wenn wir hier noch bei der Idee / am Anfang stehen, dann wird es mE schwer, dir dein Wunschszenario von eher gestern als morgen zu erfüllen.
2) Was meinst Du bedeutet das für die Zusammenarbeit mit den anderen Partner von HP (insb. Takeda und noch nicht offiziell benannten (größeren) MTA´s). Könnte das zu einer Konkurrenzsituation führen, weil evtl. auch diese anderen Partner ein Interesse an HP (Fusion oder Beteiligung) hätten und könnte evtl. ein Bieterwettbewerb für HP ausgelöst werden, wenn HP / Hopp sich grundsätzlich offen für solche Modelle zeigen würde?
Mich würden auch sehr deine avisierten erläuternden Ausführungen zum neuen SMDC Patent von HP interessieren. Danke vielmals vorab!
Antwort auf Beitrag Nr.: 60.310.150 von behavior am 09.04.19 08:56:37Ich staune schon dass du HDP für 250 Mio $ hergeben würdest- NewKid ist ja äusserst positiv eingestellt zur weiteren Entwicklung von HDP. Er hat vor einiger Zeit auch schon von einem Milliardenunternehmen gesprochen. Ich sehe hier deswegen ein Widerspruch in seiner Argumentation. Und ich denke dass HDP- vorausgesetzt die Phase Ia+b wird erfolgreich- in 3-4 Jahren auch ein Milliardenunternehmen wird. Ich denke, dass zusätzliche finanzielle Mittel von ca 20-30 Mio ausreichen und ab ca. 2022/23 den break-even zu erreichen ( Partnerschaften Takeda, Magenta, + 2 weitere Partner, sowie Umsatzeinnahmen von Telix). Ist Magenta wirklich so erfolgreich wie NewKid annimmt, dann finanzieren die HDP auch so ohne Fusion. Und ist Magenta nicht so erfolgreich wie NewKid erwartet, dann wäre eine Fusion ein Flop für HDP. Das Geschäftsmodell von HDP ist in diesem Punkt eben ziemlich genial. Floppt der Partner, dann gibt es lediglich keine Einnahmen für HDP, der Partner trägt das ganze Risiko mit all den Folgeerscheinungen. Zu bedenken ist auch dass Biotechfirmen in den USA mindestens 3-4 mal höher bewertet werden an der Börse als in Deutschland dies wegen der besonderen Risikoaversion die hierzulande herrscht.
Antwort auf Beitrag Nr.: 60.311.521 von Mogli3 am 09.04.19 11:13:37Mogli, Danke für die Hinweise. Ich will das „Warum“ aus meiner Sicht etwas detaillierter erläutern …
Meine zentrale Frage ist doch, wie die wahrscheinlich weitere positive und sehr dynamische operativ geschäftliche Entwicklung von HP am besten wertetreibend ausgestaltet, gefördert und umfassend sichergestellt werden kann. Mit welchen Stellschrauben kann ich also das Business nachhaltig skalierbar deutlich ausweiten, die Kosten im Griff haben, das operationale Risiko minimal halten, kompetente Mitarbeiter/ Führungskräfte / Steuerungsorgane halten/neu gewinnen, gute Margen / Gewinne erzielen und meine deutlich zunehmende Kunden- / Vertragspartnerbasis umfassend von meinen Leistungen begeistern sowie eine weitere erfolgreiche Kundenakquisition / Vertrieb betreiben und somit den Wert des Unternehmens nachhaltig für die Stakeholder deutlich erhöhen.
Das sind alles komplexe Fragestellungen und können für ein Unternehmen existenzielle Auswirkungen haben. Natürlich könnte man das alles aus eigener Kraft stemmen und mit viel Ausdauer versuchen die Transformation zu schaffen. Oder aber ich suche mir einen / mehrere starke Partner an meiner Seite, welche das Know-How, Budget, Umsetzungsstärke und Kompetenz bereits an Bord haben sowie ihre Mannschaft / Organisation bereits auf großes Wachstum getrimmt haben. Zu solch einem möglichen Fusions-/Beteiligungspartner für HP zähle ich (NewKid folgend) Magenta.
Jetzt zur Bewertung von 250 Mio USD. Das entspräche ca. der 2,5 fachen heutigen Börsenbewertung von HP … also einem akt. Kursniveau von ca. 8 EUR. Ich sehe diese Bewertung zum jetzigen Zeitpunkt Anfang 2019 und im Verhältnis des Anteils iHv 1/3 an der zukünftigen fusionierten neuen Magenta (incl. HP). Es ist ja keine Barkomponente (welche ich tatsächlich nicht akzeptieren würde!), sondern es handelt sich um einen Aktientausch in neue Magenta Aktien zu diesem Verhältnis. Das HP mit seiner Pipeline und den Partrnern zukünftig grosse Chancen hat, ein Milliardenunternehmen zu werden, spreche ich gar nicht ab. Ich halte es sogar für sehr wahrscheinlich das es so kommt. Dafür muss aber HP wachsen können, die Strukturen geschaffen werden, … etc. (siehe oben). Davon sieht man aktuell zu wenig bei HP und alles läuft sehr langsam .... somit gebe ich NewKid an seiner Kritik dazu Recht. Der Preis, daß HP dann unter dem Mantel von Magenta wirken und wachsen kann ist die Chance / das Risiko der weiteren positiven Entwicklung von Magenta insgesamt. HP wird aber als bspw. deutsche Tochter von Magenta m.E. seine Ziele viel früher und umfassender erreichen können, weil sie den nicht geschäftlichen Ballast größtenteils los sind und einen kompetenten Partner mit breitem Netzwerk und anerkannter Erfahrung aus den USA haben. Außerdem wäre HP als Bestandteil von Magenta an der Nasdaq gelistet und somit ist der Newsflow / die Entwicklungen viel mehr im Fokus größerer und liquider Investoren / Fonds. Somit sehe ich HP dann u.a. schneller bei der klinischen Entwicklung in den USA, schnellere Erfolge beim Vertrieb der ATAC-Plattform und somit auch schneller in Richtung der Bewertung von einer Milliarde und mehr werden. Auch kann ich NewKids Gedanken zu einem separaten Listing von „Magenta Onkologie“ (alt HP) in ein paar Jahren an der Nasdaq dann gut nachvollziehen. Somit sehe ich hierbei auch ein enormes Kurspotential nach der Fusion mit HP im Kurs der neuen mit HP fusionierten Magenta. Also letztendlich im Wertzuwachs unserer Beteiligung aus dem o.g. Aktientausch!
Natürlich sind hier noch vertiefte Analysen und abschließend eine Due-Diligence-Prüfung erforderlich. In grober Abwägung Chance / Risiko ist für mich aber das Szenario HP in 2019 asap mit einem starkem geschäftlichen Beteiligungs-/Fusionspartner wie Magenta zu verschmelzen geschäftsbeschleunigend, risikoärmer und werttreibender. Ausserdem könnten die jetzigen HP Aktionäre zukünftig direkt einerseits vom geschäftlichen Erfolg der bisherigen HP und andererseits von der positiven Entwicklung der alten Magenta im Aktienkurs der fusionierten Magenta/HP profitieren. Das könnte sich als zusätzlicher deutlicher Hebel (oder auch natürlich Risiko) darstellen.
Letztendlich ist es aber eine Ansichtssache … somit kann ich auch alle Argumente von Dir verstehen. Außerdem ist Hopp mit seinen gut 75% Beteiligung der entscheidende Part und ich bin gespannt wie er sich dazu in den kommenden Monaten positionieren wird, denn eine Entscheidung wird er treffen müssen.
Meine zentrale Frage ist doch, wie die wahrscheinlich weitere positive und sehr dynamische operativ geschäftliche Entwicklung von HP am besten wertetreibend ausgestaltet, gefördert und umfassend sichergestellt werden kann. Mit welchen Stellschrauben kann ich also das Business nachhaltig skalierbar deutlich ausweiten, die Kosten im Griff haben, das operationale Risiko minimal halten, kompetente Mitarbeiter/ Führungskräfte / Steuerungsorgane halten/neu gewinnen, gute Margen / Gewinne erzielen und meine deutlich zunehmende Kunden- / Vertragspartnerbasis umfassend von meinen Leistungen begeistern sowie eine weitere erfolgreiche Kundenakquisition / Vertrieb betreiben und somit den Wert des Unternehmens nachhaltig für die Stakeholder deutlich erhöhen.
Das sind alles komplexe Fragestellungen und können für ein Unternehmen existenzielle Auswirkungen haben. Natürlich könnte man das alles aus eigener Kraft stemmen und mit viel Ausdauer versuchen die Transformation zu schaffen. Oder aber ich suche mir einen / mehrere starke Partner an meiner Seite, welche das Know-How, Budget, Umsetzungsstärke und Kompetenz bereits an Bord haben sowie ihre Mannschaft / Organisation bereits auf großes Wachstum getrimmt haben. Zu solch einem möglichen Fusions-/Beteiligungspartner für HP zähle ich (NewKid folgend) Magenta.
Jetzt zur Bewertung von 250 Mio USD. Das entspräche ca. der 2,5 fachen heutigen Börsenbewertung von HP … also einem akt. Kursniveau von ca. 8 EUR. Ich sehe diese Bewertung zum jetzigen Zeitpunkt Anfang 2019 und im Verhältnis des Anteils iHv 1/3 an der zukünftigen fusionierten neuen Magenta (incl. HP). Es ist ja keine Barkomponente (welche ich tatsächlich nicht akzeptieren würde!), sondern es handelt sich um einen Aktientausch in neue Magenta Aktien zu diesem Verhältnis. Das HP mit seiner Pipeline und den Partrnern zukünftig grosse Chancen hat, ein Milliardenunternehmen zu werden, spreche ich gar nicht ab. Ich halte es sogar für sehr wahrscheinlich das es so kommt. Dafür muss aber HP wachsen können, die Strukturen geschaffen werden, … etc. (siehe oben). Davon sieht man aktuell zu wenig bei HP und alles läuft sehr langsam .... somit gebe ich NewKid an seiner Kritik dazu Recht. Der Preis, daß HP dann unter dem Mantel von Magenta wirken und wachsen kann ist die Chance / das Risiko der weiteren positiven Entwicklung von Magenta insgesamt. HP wird aber als bspw. deutsche Tochter von Magenta m.E. seine Ziele viel früher und umfassender erreichen können, weil sie den nicht geschäftlichen Ballast größtenteils los sind und einen kompetenten Partner mit breitem Netzwerk und anerkannter Erfahrung aus den USA haben. Außerdem wäre HP als Bestandteil von Magenta an der Nasdaq gelistet und somit ist der Newsflow / die Entwicklungen viel mehr im Fokus größerer und liquider Investoren / Fonds. Somit sehe ich HP dann u.a. schneller bei der klinischen Entwicklung in den USA, schnellere Erfolge beim Vertrieb der ATAC-Plattform und somit auch schneller in Richtung der Bewertung von einer Milliarde und mehr werden. Auch kann ich NewKids Gedanken zu einem separaten Listing von „Magenta Onkologie“ (alt HP) in ein paar Jahren an der Nasdaq dann gut nachvollziehen. Somit sehe ich hierbei auch ein enormes Kurspotential nach der Fusion mit HP im Kurs der neuen mit HP fusionierten Magenta. Also letztendlich im Wertzuwachs unserer Beteiligung aus dem o.g. Aktientausch!
Natürlich sind hier noch vertiefte Analysen und abschließend eine Due-Diligence-Prüfung erforderlich. In grober Abwägung Chance / Risiko ist für mich aber das Szenario HP in 2019 asap mit einem starkem geschäftlichen Beteiligungs-/Fusionspartner wie Magenta zu verschmelzen geschäftsbeschleunigend, risikoärmer und werttreibender. Ausserdem könnten die jetzigen HP Aktionäre zukünftig direkt einerseits vom geschäftlichen Erfolg der bisherigen HP und andererseits von der positiven Entwicklung der alten Magenta im Aktienkurs der fusionierten Magenta/HP profitieren. Das könnte sich als zusätzlicher deutlicher Hebel (oder auch natürlich Risiko) darstellen.
Letztendlich ist es aber eine Ansichtssache … somit kann ich auch alle Argumente von Dir verstehen. Außerdem ist Hopp mit seinen gut 75% Beteiligung der entscheidende Part und ich bin gespannt wie er sich dazu in den kommenden Monaten positionieren wird, denn eine Entscheidung wird er treffen müssen.
Antwort auf Beitrag Nr.: 60.313.225 von behavior am 09.04.19 14:53:11
Die Ersparnis für Magenta. Etwa 330 Millionen USD Milestonezahlungen die ja jetzt überwiegend in der klinischen Phase fällig wären. Weiterhin etwa 5% Umsatzbeteiligungen von allen entwickelten Kandidaten. Es sind unter diesen Kandidaten mehrere Blockbuster dabei und wenn Multiple Sklerose gelingt wären es die 5 % von etlichen Milliarden USD. Im Erfolgsfall geht diese Umsatzbeteiligung in den Bereich von mehreren hundert Millionen USD jährlich für HP. Doch das liegt in ferner Zukunft.
Dann die Kandidaten aus der eigenen HP Pipeline mit langfristig enormen Gewinnchancen im Milliardenbereich.
Doch schon Ende diesen Jahres werden die ersten Rekrutierungen der Phase 3 mit Redectane durch Telix beendet. Schon ab nächstem Jahr fließen dann sukzessive Milestones und Umsatzbeteiligungen von etwa 400- 500 Millionen USD über die Lebenszeit von Redectane als Gegenleistung ab Ende 2020 in die Kassen von Magenta zurück. Ab hier etwa rechnet Telix mit den ersten Zulassungen. So in etwa sähe die Rechnung für Magenta oder einen anderen Übernehmer aus. Allein Redectane von Telix würde den Kaufpreis schon alleine doppelt wieder durch Umsatzbeteiligungen einspielen.
Wenn ich Magenta wäre
Wenn ich Magenta oder ein anderer Interessent wäre, würde ich es auch machen und zwar ziemlich bald. Nehmen wir mal einen Kaufpreis um die 250 Millionen USD an.Die Ersparnis für Magenta. Etwa 330 Millionen USD Milestonezahlungen die ja jetzt überwiegend in der klinischen Phase fällig wären. Weiterhin etwa 5% Umsatzbeteiligungen von allen entwickelten Kandidaten. Es sind unter diesen Kandidaten mehrere Blockbuster dabei und wenn Multiple Sklerose gelingt wären es die 5 % von etlichen Milliarden USD. Im Erfolgsfall geht diese Umsatzbeteiligung in den Bereich von mehreren hundert Millionen USD jährlich für HP. Doch das liegt in ferner Zukunft.
Dann die Kandidaten aus der eigenen HP Pipeline mit langfristig enormen Gewinnchancen im Milliardenbereich.
Doch schon Ende diesen Jahres werden die ersten Rekrutierungen der Phase 3 mit Redectane durch Telix beendet. Schon ab nächstem Jahr fließen dann sukzessive Milestones und Umsatzbeteiligungen von etwa 400- 500 Millionen USD über die Lebenszeit von Redectane als Gegenleistung ab Ende 2020 in die Kassen von Magenta zurück. Ab hier etwa rechnet Telix mit den ersten Zulassungen. So in etwa sähe die Rechnung für Magenta oder einen anderen Übernehmer aus. Allein Redectane von Telix würde den Kaufpreis schon alleine doppelt wieder durch Umsatzbeteiligungen einspielen.
Antwort auf Beitrag Nr.: 60.313.225 von behavior am 09.04.19 14:53:11Also ich finde das nicht nur eine Ansichtssache. Ihr macht eine eklatante Fehlüberlegung, das hat Bicypapa oben geschrieben. Magenta ist ja nur ein Partner von HDP. Auf Seite 94 des GB 2018 sind aus der Schweiz für MTA ( Material Transfer) 1.0 Mio Euro verbucht. Das heisst ein dritter Partner ist schon an Bord, ev. Roche oder Novartis und andere kommen noch dazu. Hat Magenta Erfolg zahlen die alleine mindestens die über 300 Mio, abgesehen von all den anderen. Und hat Magenta keinen Erfolg dann haben die das Risiko und nicht HDP. HDP bleiben dann noch all die anderen Partner und die eigenen Kandidaten. HDP würde da ein ziemlich mieses Geschäft machen. Bisher war ja eine riesige Organisation nicht nötig und hätte nur gekostet. All die Partnerprojekte laufen ja nur bei den Partnern und binden bei HDP gar nichts. Ich kann mir nicht vorstellen dass Hopp die 10 Jahre durchfüttert und dann einer doch relativ kleinen Biotechfirma aus den USA ( trotz 500 Mio Börsenbewertung) das Geschäft überlässt. Ein Listing an der Nasdaq ist auch ohne Magenta möglich. Ich denke schon dass HDP einmal übernommen wird, aber dann sicher nicht für 250 Mio!! Roche und Novartis zahlen regelmässig 3-4 Mia für ähnlich gelagerte Fälle wie es HDP in 3-4 Jahren sein wird.
Ergänzen muss man natürlich dass das Ganze auch negativ ausgehen kann wenn die HDP -Technologie nicht funktioniert. Man ist ja immer noch in der preklinischen Phase, kann noch alles schief gehen und übrig bleibt das alte Wilex Portfolio. Dann ist aber auch der Magenta-Teil gescheitert und nützt nichts.
Antwort auf Beitrag Nr.: 60.314.122 von Mogli3 am 09.04.19 16:16:22ja, es gibt da jemanden in der Schweiz der mit Amanitin experimentiert (genauer gesagt mit dem synthetischen Amanitin), und das im grossen Still: EUR1m ist fast 50% mehr als Takeda und Magenta ausgegeben haben. Und da wir nicht wissen ob der Betrag ueber 12 Monate angefallen ist oder 6 oder gar 3, ist es klar dass man es eilig hat und ernst meint ! Roche ist klar der Hauptverdaechtige (Geschichte und aktueller Portfolio Fokus) aber auch Novartis, Idorsia und weitere Spieler aus der 2. und 3. Reihe kommen in Frage. Eins muss man aber bedenken, MTA fuehrt nicht unbedingt zum einer Lizenzvereinbarung. Man kann es auch dabei lassen. Vielversprechend aber keine Garantie das was kommt. Sicher ist nur, dass Magenta sehr bald die 2. Lizenz offiziel machen wird.
Der Grund warum ich mich nochmal zu Wort melde ist einfach die Teilnehmer (den Kreis der Skeptiker/Kritiker) mit einer einfachen Frage zu konfrontieren: Was ist euch lieber: Roche uerbernimmt die HP in bar fuer EUR 300m oder HP fusionert mit Magenta wie von mir gestern beschrieben (mit Aktien im Verhaltnis 1/3 und 2/3) ?
Der Grund warum ich mich nochmal zu Wort melde ist einfach die Teilnehmer (den Kreis der Skeptiker/Kritiker) mit einer einfachen Frage zu konfrontieren: Was ist euch lieber: Roche uerbernimmt die HP in bar fuer EUR 300m oder HP fusionert mit Magenta wie von mir gestern beschrieben (mit Aktien im Verhaltnis 1/3 und 2/3) ?
Antwort auf Beitrag Nr.: 60.314.896 von NewKidOnTheBlog am 09.04.19 17:34:17
Andere Frage. Würde Dievini Hopp für ein Angebot von 300 Millionen € verkaufen. Doch wirklich nicht bei den Aussichten. Dafür ist man kein Biotechinvestor.
Wenn sie die
Wenn Magenta die zweite Lizenz bestätigen, dann können sie auch den Entwicklungskandidaten für C100 benennen. Das ist prima. Mit C100 wollten sie auch die Indikation Multiple Sklerose angehen. Das ist dann sehr flott gegangen. Damit sind sie in der Benennung des Kandidaten etwa gut 1 Quartal schneller wie ursprünglich kommuniziert.Andere Frage. Würde Dievini Hopp für ein Angebot von 300 Millionen € verkaufen. Doch wirklich nicht bei den Aussichten. Dafür ist man kein Biotechinvestor.
Antwort auf Beitrag Nr.: 60.314.896 von NewKidOnTheBlog am 09.04.19 17:34:17Nichts von beidem. Die 75% von Hopp sind eben Fluch und Segen zugleich. Allerdings Fluch nur dann wenn Hopp die anderen 25% auch noch will. Glaube ich aber nicht weil dann hätte er es schon längst getan. Segen ist dass Hopp auf die genannten 300 Mio von Roche nicht angewiesen wäre. Der kann auch noch 3 Jahre warten und dann 1 Mia nehmen.
Heidelberg Pharma AG: Zwischenmitteilung für die ersten drei Monate 2019
https://www.finanznachrichten.de/nachrichten-2019-04/4643632…
Heidelberg Pharma AG: Zwischenmitteilung für die ersten drei Monate 2019
DGAP-News: Heidelberg Pharma AG / Schlagwort(e): Quartalsergebnis
11.04.2019 / 07:13
Für den Inhalt der Mitteilung ist der Emittent / Herausgeber verantwortlich.
Heidelberg Pharma AG: Zwischenmitteilung für die ersten drei Monate 2019
- Partner Link Health erhält Genehmigung zur Durchführung klinischer Studien mit MESUPRON(R) in China
- Posterpräsentation auf der AACR-Jahrestagung 2019
- Finanzzahlen haben sich im Rahmen der Planung entwickelt
Ladenburg, 11. April 2019 - Die Heidelberg Pharma AG (FWB: WL6) berichtete heute über die ersten drei Monate des Geschäftsjahres 2019 (1. Dezember 2018 - 28. Februar 2019) und die Finanzzahlen des Konzerns.
Wichtige operative Fortschritte
- IND-Genehmigung und Meilensteinzahlung vom Partner Link Health: Im Januar 2019 hat Heidelberg Pharma bekanntgegeben, dass der IND-Antrag für eine Phase I- bzw. II-Studie mit MESUPRON(R) Ende 2018 genehmigt wurde. Details zu den geplanten Studien liegen noch nicht vor, da die chinesische Zulassungsbehörde die Studienregularien geändert hat und aufgrund dessen der klinische Entwicklungsplan für MESUPRON(R) von Link Health angepasst werden kann. Es besteht jetzt die Chance, dass auf Grundlage der früheren Daten aus USA und Europa unmittelbar eine Phase II-Studie begonnen werden kann. Mit der grundsätzlichen Genehmigung der Studie wurde eine Meilensteinzahlung an Heidelberg Pharma fällig. In diesem Zusammenhang wurden 421 TEuro ertragswirksam vereinnahmt.
- Amanitin-Herstellung nach Good Manufacturing Practice: Auf Basis der etablierten GMP-Herstellung für die von Heidelberg Pharma für seine Antikörper-Amanitin-Konjugate (ATACs) verwendeten Amanitin-Linker ist Heidelberg Pharma in der Lage, Lizenzpartner künftig nicht nur im Labormaßstab zu beliefern, sondern auch die Versorgung in GMP-Qualität anzubieten. Die konzeptionelle Abstimmung hierzu mit unserem GMP-Hersteller Carbogen und unserem Partner Magenta konnte in den vergangenen Wochen weitgehend abgeschlossen werden.
Ereignisse nach Ende der Berichtsperiode
- Posterpräsentation auf der AACR-Jahrestagung 2019: Heidelberg Pharma präsentierte im März auf der Jahrestagung der American Association of Cancer Research (AACR) in Atlanta ein Poster über präklinische Daten zu einem ATAC, das gegen das Brustkrebs-Antigen HER2 gerichtet ist. Diese Daten aus einer experimentellen Fallstudie zeigen, dass das HER2-ATAC das Potenzial hat, auch gegen Tumore mit niedriger HER2-Expression, wie bei dreifach negativem Brustkrebs (TNBC), und präferenziell auf Tumorzellen mit aggressiven Verlaufsformen im Zusammenhang mit einer 17p-Deletion zu wirken.
Ertrags-, Finanz- und Vermögenslage
Der Heidelberg Pharma-Konzern, zum Bilanzstichtag bestehend aus der Heidelberg Pharma AG und der Tochtergesellschaft Heidelberg Pharma Research GmbH, berichtet konsolidierte Zahlen. Die im Folgenden bezeichnete Berichtsperiode bezieht sich auf den Zeitraum vom 1. Dezember 2018 bis zum 28. Februar 2019 (Q1 2019).
Der Konzern erwirtschaftete in den ersten drei Monaten des Geschäftsjahres 2019 Umsatzerlöse und Erträge von insgesamt 1,3 Mio. Euro (Vorjahr: 0,7 Mio. Euro). Darin enthalten sind deutlich gestiegene Umsatzerlöse in Höhe von 1,1 Mio. Euro (Vorjahr: 0,6 Mio. Euro), welche sich auf die ATAC-Technologie (0,4 Mio. Euro), das Servicegeschäft (0,3 Mio. Euro) und die Auslizenzierung von MESUPRON(R) (0,4 Mio. Euro) verteilen.
Die sonstigen Erträge lagen mit 0,2 Mio. Euro über dem Niveau des Vorjahres (0,1 Mio. Euro) und setzen sich im Wesentlichen aus der Weiterberechnung von Patentkosten und aus der Auflösung nicht in Anspruch genommener abgegrenzter Verbindlichkeiten und Rückstellungen zusammen.
Sämtliche Betriebliche Aufwendungen, einschließlich der Abschreibungen, betrugen in der Berichtsperiode 4,4 Mio. Euro (Vorjahr: 3,1 Mio. Euro). Die Herstellungskosten beliefen sich auf 0,7 Mio. Euro (Vorjahr: 0,4 Mio. Euro) und betreffen die unmittelbar mit dem Umsatz verbundenen Kosten. Die Forschungs- und Entwicklungskosten in Höhe von 3,0 Mio. Euro stiegen um 0,9 Mio. Euro im Vergleich zur Vorjahresperiode (2,1 Mio. Euro), da bei der Heidelberg Pharma Research GmbH die Kosten für die Vorbereitung der externen Good Manufacturing Practice (GMP)-Produktion planmäßig ausgeweitet wurden. Diese Aufwandsart stellte mit 67 % der betrieblichen Aufwendungen wie geplant den weitaus größten Kostenblock dar. Die Verwaltungskosten stiegen im Dreimonatszeitraum 2019 auf 0,7 Mio. Euro im Vergleich zur Vorjahresperiode (0,6 Mio. Euro). Darin enthalten sind u.a. die Kosten für die Holdingaktivitäten und die Börsennotierung. Die Sonstigen Aufwendungen für Aktivitäten im Bereich Geschäftsentwicklung, Vermarktung und kommerzielle Marktversorgung, welche hauptsächlich Personal-, Reise- und Beratungskosten umfassen, betrugen in der aktuellen Berichtsperiode 0,03 Mio. Euro (Vorjahr: 0,03 Mio. Euro).
Der Heidelberg Pharma-Konzern hat den Periodenfehlbetrag für die ersten drei Monate des Geschäftsjahres mit 3,1 Mio. Euro im Vergleich zum Vorjahr (2,4 Mio. Euro) plangemäß ausgeweitet. Das unverwässerte Ergebnis je Aktie auf Basis der gewichteten durchschnittlichen Anzahl innerhalb der Berichtsperiode ausgegebener Aktien verschlechterte sich aufgrund des höheren Verlustes von -0,09 Euro im Vorjahr auf -0,11 Euro im abgelaufenen Quartal.
Die Bilanzsumme zum 28. Februar 2019 betrug 28,3 Mio. Euro und lag infolge des geringeren Zahlungsmittelbestands unter dem Wert des Vergleichsstichtags 30. November 2018 (31,2 Mio. Euro). Das Eigenkapital lag mit 22,9 Mio. Euro ebenfalls unterhalb des Werts zum Geschäftsjahresende 2018 (25,9 Mio. Euro). Das entspricht einer Eigenkapitalquote von 80,9 % (30. November 2018: 83,0 %). Durch im ersten Geschäftsquartal 2019 erfolgte Ausübungen von Wandelschuldverschreibungen (Pflichtwandelanleihen) entstanden weitere 10.552 neue Stückaktien, die das Grundkapital der Heidelberg Pharma AG von 28.133.308 Euro auf 28.143.860 Euro, eingeteilt in 28.143.860 auf den Inhaber lautende Stückaktien erhöhten.
Im Berichtszeitraum wurden keine Kapitalmaßnahmen durchgeführt.
Die liquiden Mittel beliefen sich zum Ende des Geschäftsquartals auf 16,1 Mio. Euro (30. November 2018: 19,4 Mio. Euro). Heidelberg Pharma hatte im ersten Viertel des Geschäftsjahres somit einen durchschnittlichen Finanzmittelabfluss von 1,12 Mio. Euro (Vorjahr: 1,08 Mio. Euro) pro Monat zu verzeichnen.
Finanzausblick 2019
Die am 21. März 2019 abgegebene Prognose für das laufende Geschäftsjahr für den Heidelberg Pharma-Konzern wird bestätigt. Es werden für das Geschäftsjahr 2019 Umsätze und sonstige Erträge zwischen insgesamt 5,0 Mio. Euro und 7,0 Mio. Euro (2018: 4,4 Mio. Euro) erwartet. In dieser Planung sind potenzielle Zahlungsmittelzuflüsse aus neuen Lizenzierungsaktivitäten enthalten. Die betrieblichen Aufwendungen werden sich nach der derzeitigen Planung in einem Korridor von 14,0 Mio. Euro bis 18,0 Mio. Euro bewegen und entsprechen damit etwa dem Niveau des Berichtsjahres (2018: 16,0 Mio. Euro). Für 2019 wird ein Betriebsergebnis (EBIT) zwischen -8,0 Mio. Euro und -12,0 Mio. Euro erwartet (2018: -11,7 Mio. Euro).
Für 2019 rechnet Heidelberg Pharma mit einem Finanzmittelbedarf von 10,0 Mio. Euro bis 14,0 Mio. Euro. Der monatliche Barmittelverbrauch dürfte sich zwischen 0,9 Mio. Euro und 1,2 Mio. Euro pro Monat bewegen. Auf Basis der aktuellen Planung ist die Finanzierung des Unternehmens bis Mitte 2020 gesichert.
Heidelberg Pharma wird keine Telefonkonferenz zu dieser Zwischenmitteilung anbieten. Das vollständige Zahlenwerk zum Zwischenabschluss steht unter http://www.heidelberg-pharma.com/ "Presse & Investoren > Mitteilungen und Berichte > Finanzberichte > Zwischenmitteilung für die ersten drei Monate 2019" zur Verfügung.
Kennzahlen für den Heidelberg Pharma-Konzern (ungeprüft)
In Tsd. Euro Q1 20191
Tsd. Euro Q1 20181
Tsd. Euro
Ergebnis
Umsatzerlöse 1.071 592
Sonstige Erträge 245 124
Betriebliche Aufwendungen (4.400) (3.130)
davon Forschungs- und Entwicklungskosten (2.969) (2.075)
Betriebsergebnis (3.084) (2.414)
Ergebnis vor Steuern (3.084) (2.414)
Periodenergebnis (3.084) (2.414)
Ergebnis je Aktie in Euro (unverwässert) (0,09) (0,11)
Bilanz zum Periodenende
Bilanzsumme 28.326 38.064
Liquide Mittel 16.069 27.151
Eigenkapital 22.916 34.641
Eigenkapitalquote 2 in % 80,9 91,0
Kapitalflussrechnung
Operativer Cashflow (2.957) (3.087)
Cashflow aus der Investitionstätigkeit (412) (154)
Cashflow aus der Finanzierungstätigkeit 0 0
Mitarbeiter (Anzahl)
Mitarbeiter am Ende der Periode 3 66 60
Vollzeitstellen am Ende der Periode 3 60 54
1 Der Berichtszeitraum beginnt am 1. Dezember und endet am 28. Februar.
2 Eigenkapital / Bilanzsumme
3 Inklusive Mitglieder des Vorstands
Durch die Rundung der exakten Zahlen können sich Differenzen ergeben.
Kontakt
Heidelberg Pharma AG
Corporate Communications
Sylvia Wimmer
Tel.: +49 89 41 31 38-29
E-Mail: investors[at]hdpharma.com
Schriesheimer Str. 101, 68526 Ladenburg IR/PR-Unterstützung
MC Services AG
Katja Arnold (CIRO)
Managing Director & Partner
Tel.: +49 89 210 228-40
Mobil: +49 160 9360 3022
E-Mail: katja.arnold[at]mc-services.eu
Über Heidelberg Pharma
Die Heidelberg Pharma AG ist ein biopharmazeutisches Unternehmen mit Sitz in Ladenburg. Heidelberg Pharma ist auf Onkologie spezialisiert und das erste Unternehmen, das den Wirkstoff Amanitin für die Verwendung bei Krebstherapien einsetzt und entwickelt. Dafür verwendet das Unternehmen seine innovative ATAC-Technologie (Antibody Targeted Amanitin Conjugates) und nutzt den biologischen Wirkmechanismus des Toxins als neues therapeutisches Prinzip. Diese proprietäre Technologieplattform wird für die Entwicklung eigener therapeutischer Antikörper-Wirkstoff-Konjugate sowie im Rahmen von Kooperationen mit externen Partnern eingesetzt, um eine Vielzahl von ATAC-Kandidaten zu erzeugen. Der am weitesten fortgeschrittene eigene Produktkandidat HDP-101 ist ein BCMA-ATAC für die Indikation Multiples Myelom.
Die klinischen Produktkandidaten MESUPRON(R) und REDECTANE(R) wurden zur Weiterentwicklung und Kommerzialisierung verpartnert. RENCAREX(R) steht zur Auslizenzierung und weiteren Entwicklung zur Verfügung. Die Heidelberg Pharma AG ist an der Frankfurter Wertpapierbörse notiert: ISIN DE000A11QVV0 / WKN A11QVV / Symbol WL6. Weitere Informationen finden Sie unter www.heidelberg-pharma.com.
Dieser Text enthält bestimmte zukunftsgerichtete Aussagen, die sich auf den Geschäftsbereich der Gesellschaft beziehen und die sich durch den Gebrauch von zukunftsgerichteter Terminologie wie etwa "schätzt", "glaubt", "erwartet", "könnte", "wird", "sollte", "zukünftig", "möglich" oder ähnliche Ausdrücke oder durch eine allgemeine Darstellung der Strategie, der Pläne und der Absichten der Gesellschaft auszeichnen. Solche zukunftsgerichteten Aussagen umfassen bekannte und unbekannte Risiken, Ungewissheiten und andere Faktoren, die bewirken könnten, dass sich die tatsächlichen Ergebnisse des Geschäftsbetriebs, die Finanzlage, die Ertragslage, die Errungenschaften oder auch die Ergebnisse des Sektors erheblich von jeglichen zukünftigen Ergebnissen, Erträgen oder Errungenschaften unterscheiden, die in solchen zukunftsgerichteten Aussagen ausgedrückt oder vorausgesetzt werden. Angesichts dieser Unwägbarkeiten werden mögliche Investoren und Partner davor gewarnt, übermäßiges Vertrauen in solche zukunftsgerichteten Aussagen zu setzen. Wir übernehmen keine Verpflichtung, solche zukunftsgerichteten Aussagen zu aktualisieren, um zukünftiges Geschehen oder Entwicklungen widerzuspiegeln.
11.04.2019 Veröffentlichung einer Corporate News/Finanznachricht, übermittelt durch DGAP - ein Service der EQS Group AG.
Für den Inhalt der Mitteilung ist der Emittent / Herausgeber verantwortlich.
Die DGAP Distributionsservices umfassen gesetzliche Meldepflichten, Corporate News/Finanznachrichten und Pressemitteilungen.
Medienarchiv unter http://www.dgap.de
DGAP-News: Heidelberg Pharma AG / Schlagwort(e): Quartalsergebnis
11.04.2019 / 07:13
Für den Inhalt der Mitteilung ist der Emittent / Herausgeber verantwortlich.
Heidelberg Pharma AG: Zwischenmitteilung für die ersten drei Monate 2019
- Partner Link Health erhält Genehmigung zur Durchführung klinischer Studien mit MESUPRON(R) in China
- Posterpräsentation auf der AACR-Jahrestagung 2019
- Finanzzahlen haben sich im Rahmen der Planung entwickelt
Ladenburg, 11. April 2019 - Die Heidelberg Pharma AG (FWB: WL6) berichtete heute über die ersten drei Monate des Geschäftsjahres 2019 (1. Dezember 2018 - 28. Februar 2019) und die Finanzzahlen des Konzerns.
Wichtige operative Fortschritte
- IND-Genehmigung und Meilensteinzahlung vom Partner Link Health: Im Januar 2019 hat Heidelberg Pharma bekanntgegeben, dass der IND-Antrag für eine Phase I- bzw. II-Studie mit MESUPRON(R) Ende 2018 genehmigt wurde. Details zu den geplanten Studien liegen noch nicht vor, da die chinesische Zulassungsbehörde die Studienregularien geändert hat und aufgrund dessen der klinische Entwicklungsplan für MESUPRON(R) von Link Health angepasst werden kann. Es besteht jetzt die Chance, dass auf Grundlage der früheren Daten aus USA und Europa unmittelbar eine Phase II-Studie begonnen werden kann. Mit der grundsätzlichen Genehmigung der Studie wurde eine Meilensteinzahlung an Heidelberg Pharma fällig. In diesem Zusammenhang wurden 421 TEuro ertragswirksam vereinnahmt.
- Amanitin-Herstellung nach Good Manufacturing Practice: Auf Basis der etablierten GMP-Herstellung für die von Heidelberg Pharma für seine Antikörper-Amanitin-Konjugate (ATACs) verwendeten Amanitin-Linker ist Heidelberg Pharma in der Lage, Lizenzpartner künftig nicht nur im Labormaßstab zu beliefern, sondern auch die Versorgung in GMP-Qualität anzubieten. Die konzeptionelle Abstimmung hierzu mit unserem GMP-Hersteller Carbogen und unserem Partner Magenta konnte in den vergangenen Wochen weitgehend abgeschlossen werden.
Ereignisse nach Ende der Berichtsperiode
- Posterpräsentation auf der AACR-Jahrestagung 2019: Heidelberg Pharma präsentierte im März auf der Jahrestagung der American Association of Cancer Research (AACR) in Atlanta ein Poster über präklinische Daten zu einem ATAC, das gegen das Brustkrebs-Antigen HER2 gerichtet ist. Diese Daten aus einer experimentellen Fallstudie zeigen, dass das HER2-ATAC das Potenzial hat, auch gegen Tumore mit niedriger HER2-Expression, wie bei dreifach negativem Brustkrebs (TNBC), und präferenziell auf Tumorzellen mit aggressiven Verlaufsformen im Zusammenhang mit einer 17p-Deletion zu wirken.
Ertrags-, Finanz- und Vermögenslage
Der Heidelberg Pharma-Konzern, zum Bilanzstichtag bestehend aus der Heidelberg Pharma AG und der Tochtergesellschaft Heidelberg Pharma Research GmbH, berichtet konsolidierte Zahlen. Die im Folgenden bezeichnete Berichtsperiode bezieht sich auf den Zeitraum vom 1. Dezember 2018 bis zum 28. Februar 2019 (Q1 2019).
Der Konzern erwirtschaftete in den ersten drei Monaten des Geschäftsjahres 2019 Umsatzerlöse und Erträge von insgesamt 1,3 Mio. Euro (Vorjahr: 0,7 Mio. Euro). Darin enthalten sind deutlich gestiegene Umsatzerlöse in Höhe von 1,1 Mio. Euro (Vorjahr: 0,6 Mio. Euro), welche sich auf die ATAC-Technologie (0,4 Mio. Euro), das Servicegeschäft (0,3 Mio. Euro) und die Auslizenzierung von MESUPRON(R) (0,4 Mio. Euro) verteilen.
Die sonstigen Erträge lagen mit 0,2 Mio. Euro über dem Niveau des Vorjahres (0,1 Mio. Euro) und setzen sich im Wesentlichen aus der Weiterberechnung von Patentkosten und aus der Auflösung nicht in Anspruch genommener abgegrenzter Verbindlichkeiten und Rückstellungen zusammen.
Sämtliche Betriebliche Aufwendungen, einschließlich der Abschreibungen, betrugen in der Berichtsperiode 4,4 Mio. Euro (Vorjahr: 3,1 Mio. Euro). Die Herstellungskosten beliefen sich auf 0,7 Mio. Euro (Vorjahr: 0,4 Mio. Euro) und betreffen die unmittelbar mit dem Umsatz verbundenen Kosten. Die Forschungs- und Entwicklungskosten in Höhe von 3,0 Mio. Euro stiegen um 0,9 Mio. Euro im Vergleich zur Vorjahresperiode (2,1 Mio. Euro), da bei der Heidelberg Pharma Research GmbH die Kosten für die Vorbereitung der externen Good Manufacturing Practice (GMP)-Produktion planmäßig ausgeweitet wurden. Diese Aufwandsart stellte mit 67 % der betrieblichen Aufwendungen wie geplant den weitaus größten Kostenblock dar. Die Verwaltungskosten stiegen im Dreimonatszeitraum 2019 auf 0,7 Mio. Euro im Vergleich zur Vorjahresperiode (0,6 Mio. Euro). Darin enthalten sind u.a. die Kosten für die Holdingaktivitäten und die Börsennotierung. Die Sonstigen Aufwendungen für Aktivitäten im Bereich Geschäftsentwicklung, Vermarktung und kommerzielle Marktversorgung, welche hauptsächlich Personal-, Reise- und Beratungskosten umfassen, betrugen in der aktuellen Berichtsperiode 0,03 Mio. Euro (Vorjahr: 0,03 Mio. Euro).
Der Heidelberg Pharma-Konzern hat den Periodenfehlbetrag für die ersten drei Monate des Geschäftsjahres mit 3,1 Mio. Euro im Vergleich zum Vorjahr (2,4 Mio. Euro) plangemäß ausgeweitet. Das unverwässerte Ergebnis je Aktie auf Basis der gewichteten durchschnittlichen Anzahl innerhalb der Berichtsperiode ausgegebener Aktien verschlechterte sich aufgrund des höheren Verlustes von -0,09 Euro im Vorjahr auf -0,11 Euro im abgelaufenen Quartal.
Die Bilanzsumme zum 28. Februar 2019 betrug 28,3 Mio. Euro und lag infolge des geringeren Zahlungsmittelbestands unter dem Wert des Vergleichsstichtags 30. November 2018 (31,2 Mio. Euro). Das Eigenkapital lag mit 22,9 Mio. Euro ebenfalls unterhalb des Werts zum Geschäftsjahresende 2018 (25,9 Mio. Euro). Das entspricht einer Eigenkapitalquote von 80,9 % (30. November 2018: 83,0 %). Durch im ersten Geschäftsquartal 2019 erfolgte Ausübungen von Wandelschuldverschreibungen (Pflichtwandelanleihen) entstanden weitere 10.552 neue Stückaktien, die das Grundkapital der Heidelberg Pharma AG von 28.133.308 Euro auf 28.143.860 Euro, eingeteilt in 28.143.860 auf den Inhaber lautende Stückaktien erhöhten.
Im Berichtszeitraum wurden keine Kapitalmaßnahmen durchgeführt.
Die liquiden Mittel beliefen sich zum Ende des Geschäftsquartals auf 16,1 Mio. Euro (30. November 2018: 19,4 Mio. Euro). Heidelberg Pharma hatte im ersten Viertel des Geschäftsjahres somit einen durchschnittlichen Finanzmittelabfluss von 1,12 Mio. Euro (Vorjahr: 1,08 Mio. Euro) pro Monat zu verzeichnen.
Finanzausblick 2019
Die am 21. März 2019 abgegebene Prognose für das laufende Geschäftsjahr für den Heidelberg Pharma-Konzern wird bestätigt. Es werden für das Geschäftsjahr 2019 Umsätze und sonstige Erträge zwischen insgesamt 5,0 Mio. Euro und 7,0 Mio. Euro (2018: 4,4 Mio. Euro) erwartet. In dieser Planung sind potenzielle Zahlungsmittelzuflüsse aus neuen Lizenzierungsaktivitäten enthalten. Die betrieblichen Aufwendungen werden sich nach der derzeitigen Planung in einem Korridor von 14,0 Mio. Euro bis 18,0 Mio. Euro bewegen und entsprechen damit etwa dem Niveau des Berichtsjahres (2018: 16,0 Mio. Euro). Für 2019 wird ein Betriebsergebnis (EBIT) zwischen -8,0 Mio. Euro und -12,0 Mio. Euro erwartet (2018: -11,7 Mio. Euro).
Für 2019 rechnet Heidelberg Pharma mit einem Finanzmittelbedarf von 10,0 Mio. Euro bis 14,0 Mio. Euro. Der monatliche Barmittelverbrauch dürfte sich zwischen 0,9 Mio. Euro und 1,2 Mio. Euro pro Monat bewegen. Auf Basis der aktuellen Planung ist die Finanzierung des Unternehmens bis Mitte 2020 gesichert.
Heidelberg Pharma wird keine Telefonkonferenz zu dieser Zwischenmitteilung anbieten. Das vollständige Zahlenwerk zum Zwischenabschluss steht unter http://www.heidelberg-pharma.com/ "Presse & Investoren > Mitteilungen und Berichte > Finanzberichte > Zwischenmitteilung für die ersten drei Monate 2019" zur Verfügung.
Kennzahlen für den Heidelberg Pharma-Konzern (ungeprüft)
In Tsd. Euro Q1 20191
Tsd. Euro Q1 20181
Tsd. Euro
Ergebnis
Umsatzerlöse 1.071 592
Sonstige Erträge 245 124
Betriebliche Aufwendungen (4.400) (3.130)
davon Forschungs- und Entwicklungskosten (2.969) (2.075)
Betriebsergebnis (3.084) (2.414)
Ergebnis vor Steuern (3.084) (2.414)
Periodenergebnis (3.084) (2.414)
Ergebnis je Aktie in Euro (unverwässert) (0,09) (0,11)
Bilanz zum Periodenende
Bilanzsumme 28.326 38.064
Liquide Mittel 16.069 27.151
Eigenkapital 22.916 34.641
Eigenkapitalquote 2 in % 80,9 91,0
Kapitalflussrechnung
Operativer Cashflow (2.957) (3.087)
Cashflow aus der Investitionstätigkeit (412) (154)
Cashflow aus der Finanzierungstätigkeit 0 0
Mitarbeiter (Anzahl)
Mitarbeiter am Ende der Periode 3 66 60
Vollzeitstellen am Ende der Periode 3 60 54
1 Der Berichtszeitraum beginnt am 1. Dezember und endet am 28. Februar.
2 Eigenkapital / Bilanzsumme
3 Inklusive Mitglieder des Vorstands
Durch die Rundung der exakten Zahlen können sich Differenzen ergeben.
Kontakt
Heidelberg Pharma AG
Corporate Communications
Sylvia Wimmer
Tel.: +49 89 41 31 38-29
E-Mail: investors[at]hdpharma.com
Schriesheimer Str. 101, 68526 Ladenburg IR/PR-Unterstützung
MC Services AG
Katja Arnold (CIRO)
Managing Director & Partner
Tel.: +49 89 210 228-40
Mobil: +49 160 9360 3022
E-Mail: katja.arnold[at]mc-services.eu
Über Heidelberg Pharma
Die Heidelberg Pharma AG ist ein biopharmazeutisches Unternehmen mit Sitz in Ladenburg. Heidelberg Pharma ist auf Onkologie spezialisiert und das erste Unternehmen, das den Wirkstoff Amanitin für die Verwendung bei Krebstherapien einsetzt und entwickelt. Dafür verwendet das Unternehmen seine innovative ATAC-Technologie (Antibody Targeted Amanitin Conjugates) und nutzt den biologischen Wirkmechanismus des Toxins als neues therapeutisches Prinzip. Diese proprietäre Technologieplattform wird für die Entwicklung eigener therapeutischer Antikörper-Wirkstoff-Konjugate sowie im Rahmen von Kooperationen mit externen Partnern eingesetzt, um eine Vielzahl von ATAC-Kandidaten zu erzeugen. Der am weitesten fortgeschrittene eigene Produktkandidat HDP-101 ist ein BCMA-ATAC für die Indikation Multiples Myelom.
Die klinischen Produktkandidaten MESUPRON(R) und REDECTANE(R) wurden zur Weiterentwicklung und Kommerzialisierung verpartnert. RENCAREX(R) steht zur Auslizenzierung und weiteren Entwicklung zur Verfügung. Die Heidelberg Pharma AG ist an der Frankfurter Wertpapierbörse notiert: ISIN DE000A11QVV0 / WKN A11QVV / Symbol WL6. Weitere Informationen finden Sie unter www.heidelberg-pharma.com.
Dieser Text enthält bestimmte zukunftsgerichtete Aussagen, die sich auf den Geschäftsbereich der Gesellschaft beziehen und die sich durch den Gebrauch von zukunftsgerichteter Terminologie wie etwa "schätzt", "glaubt", "erwartet", "könnte", "wird", "sollte", "zukünftig", "möglich" oder ähnliche Ausdrücke oder durch eine allgemeine Darstellung der Strategie, der Pläne und der Absichten der Gesellschaft auszeichnen. Solche zukunftsgerichteten Aussagen umfassen bekannte und unbekannte Risiken, Ungewissheiten und andere Faktoren, die bewirken könnten, dass sich die tatsächlichen Ergebnisse des Geschäftsbetriebs, die Finanzlage, die Ertragslage, die Errungenschaften oder auch die Ergebnisse des Sektors erheblich von jeglichen zukünftigen Ergebnissen, Erträgen oder Errungenschaften unterscheiden, die in solchen zukunftsgerichteten Aussagen ausgedrückt oder vorausgesetzt werden. Angesichts dieser Unwägbarkeiten werden mögliche Investoren und Partner davor gewarnt, übermäßiges Vertrauen in solche zukunftsgerichteten Aussagen zu setzen. Wir übernehmen keine Verpflichtung, solche zukunftsgerichteten Aussagen zu aktualisieren, um zukünftiges Geschehen oder Entwicklungen widerzuspiegeln.
11.04.2019 Veröffentlichung einer Corporate News/Finanznachricht, übermittelt durch DGAP - ein Service der EQS Group AG.
Für den Inhalt der Mitteilung ist der Emittent / Herausgeber verantwortlich.
Die DGAP Distributionsservices umfassen gesetzliche Meldepflichten, Corporate News/Finanznachrichten und Pressemitteilungen.
Medienarchiv unter http://www.dgap.de
Analyse und Arbeitspapier Heidelberg Pharma
Analyse und Arbeitspapier Heidelberg PharmaDie 1997, damals von einem Team von Ärzten und Krebsforschern unter dem Namen WILEX Biotechnology GmbH, gegründete Heidelberg Pharma AG ist ein auf Onkologie spezialisiertes biopharmazeutisches Unternehmen mit Sitz in Ladenburg. Dabei konzentriert man sich speziell auf die ADC (genauer gesagt Antibody-targeted Amanitin-Konjugate, “ATACs”) Werkstoffentwicklung die neue Möglichkeiten in der Behandlung von Tumoren ermöglichen soll.
Was ist ATAC-ADC-Amanitin ?
Die Heidelberg Pharma AG entwickelt das Gift des Knollenblätterpilzes Amanitin zu einem toxischen Wirkstoff gegen Krebszellen. Als Börsianer ist man ja immer auf der Suche nach Alleinstellungsmerkmalen einer Firma, die dann letztendlich den Erfolg dieser Firma ausmachen. Herkömmliche Krebswirkstoffe bekämpfen in der Regel die sich schnell teilenden Zellen und versuchen so das Fortschreiten der Krankheit zu verhindern. Mit dem ATAC Ansatz Antibody Targeted Amanitin Conjugates scheint Heidelberg Pharma dieses Alleinstellungsmerkmal gelungen.
Während nach einer gewissen Zeit bei den anderen Behandlungsansätzen die Metastasierung und Wiedererkrankung weiter fortschreitet, bekämpft Amanitin auch die ruhenden Krebszellen, die bei der Wiedererkrankung eine große Rolle spielen können. Amanitin soll somit auch gegen die ruhenden und sich teilenden Krebszellen wirken. Es besitzt demnach die Fähigkeit Resistenzen zu durchbrechen. Bisher konnte HP in vivo und in vitro diese Eigenschaften mit großem Erfolg unter Beweis stellen. An dieser Stelle möchte ich kurz den ADC Wirkstoff erklären. Hierzu muss man wissen, dass es einen Antikörper gibt bei dem mit einem Linker der Amanitinwirkstoff verbunden ist. Dieser ADC Antikörper in Kombination mit dem Amanitin wandert zu der Krebszelle, die er anhand gewisser Merkmale erkennt. Er schleust sich ferner in die Zelle ein und lädt den Giftstoff Amanitin dabei in dieser Zelle ab, die dann durch den besonderen Wirkmechanismus die Krebszelle zerstört. Die soll, wie eingangs erwähnt, auch bei sich teilenden aber auch bei ruhenden Krebszellen geschehen. Damit erklärt sich das besondere Alleinstellungsmerkmal bei den ATAC Wirkstoffen.
2. Eigene Pipeline mit dem Hauptentwicklungskandidaten ATAC HDP-101:
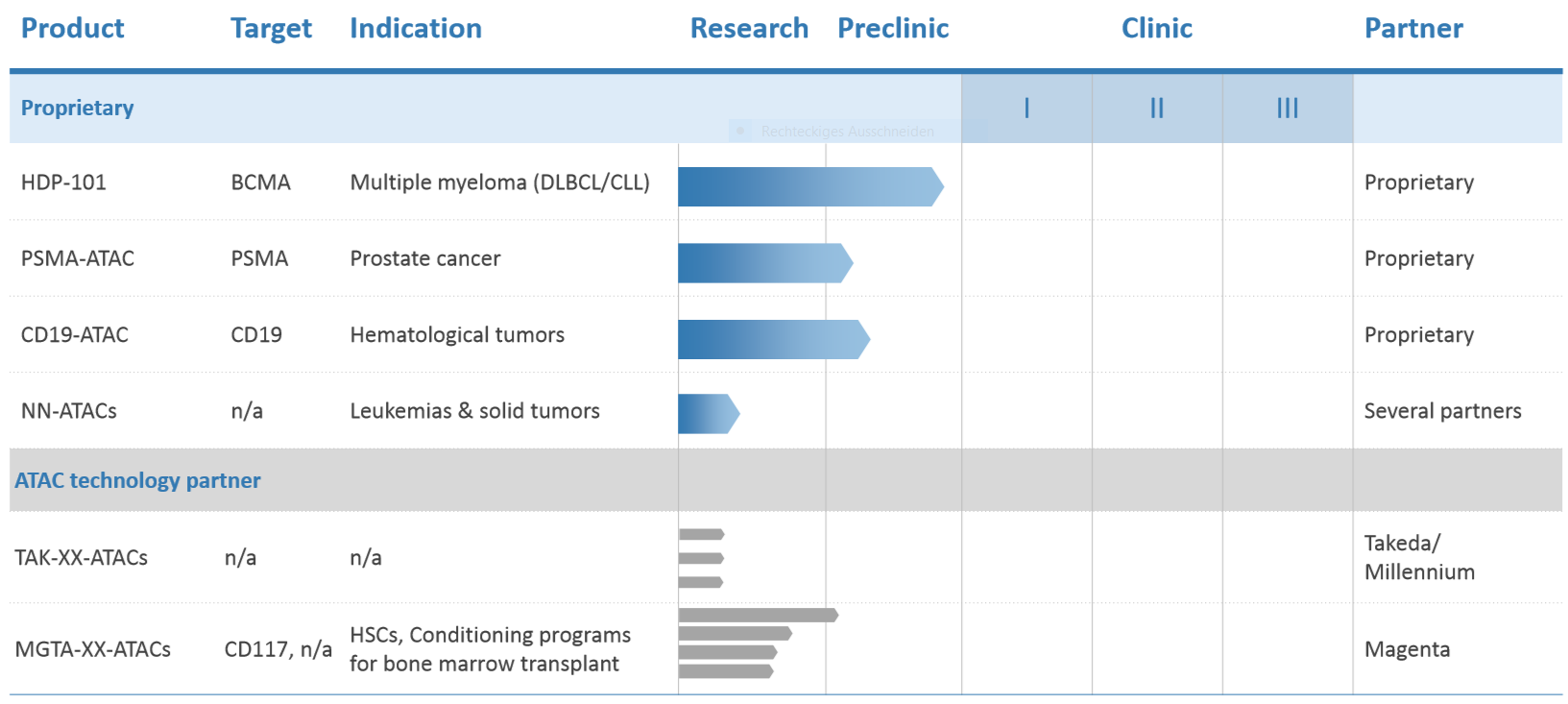
ATAC-ADC-Pipeline, Präsentation zum Eigenkapitalforum: heidelberg-pharma.com/files/...any-presentation_EKF-final.pdf am 28. November 2018
Heidelberg Pharma entwickelt in Eigenregie die Pipeline, wie sie oben im Schaubild angegeben ist. Hauptkandidat dabei ist aber HDP-101, die auch am weitesten in der Entwicklung sind. HDP-101 soll beim Multiplem Myelom zur Behandlung eingesetzt werden. Das Multiple Myelom ist ein bösartiger Tumor im Knochenmark mit über 70.000 tödlichen Verläufen jährlich. Nach der Implementierung der Anlage zur industriellen Produktion von Amanitin, hat HP im Dezember toxische Tierstudien gestartet. Die Ergebnisse dürften demnach bald vorliegen. Sie bilden die Basis für die Zulassung der klinischen Studien in Europa aber auch in den USA. Vorbereitende Gespräche mit den Zulassungsbehörden wurden schon geführt. Nach Studienstart dürften wir etwa gut in einem Jahr die ersten Ergebnisse erwarten. Nach meinem jetzigen Kenntnisstand sollte diese als 1a/1b konzipierte Studie Anfang nächsten Jahres starten können. Vielleicht noch einige Worte zur Konkurrenz. Auf diesem Gebiet tummeln sich etwa 10 Entwickler um diesen tödlichen Tumor zu bekämpfen Viele befinden sich schon in frühen klinischen Phasen.
Der hart umkämpfte Markt wundert dabei nicht, da es sich um eine Indikation handelt, die Einnahmen jenseits der Milliardengrenze verspricht. Was hier so positiv für HP aussieht ist das Alleinstellungsmerkmal, das ich am Anfang genannt habe. Nämlich die Bekämpfung von ruhenden und sich schnell teilenden Zellen. Dies könnte sich noch als riesiger Vorteil erweisen. Natürlich muss dieser Nachweis noch in diesen klinischen Studien erbracht werden. Mit den zuständigen Zulassungsbehörden wurden die erforderlichen Gespräche aufgenommen und Heidelberg Pharma plant Anfang nächsten Jahres diese klinische Studie zu starten. Weiterhin hat Heidelberg Pharma die Versuchsreihen mit dem PSMA ATAC gegen Prostatakrebs und mit dem CD19-ATAC gegen verschiedene hämatologische Tumore vorangetrieben. Priorität in der Entwicklung hat allerdings der Kandidat HDP-101.
Eine Besonderheit scheint noch folgender Aspekt zu sein: die Wirksamkeit von Amanitin beim Multiplen Myelom, die das Merkmal “17p Deletion: Loss of TP53/POL2RA on chromosome 17” aufweisen. In einer vielbeachteten Präsentation wurde dieser Vortrag auf einer Fachkonferenz durch das University of Texas MD Anderson Cancer Center gehalten. Demnach weist Amanitin gegen diese Patientengruppe eine 10 mal höhere Wirksamkeit auf. Hierfür entwickelt HP auch einen Biomarker, um diese Patientengruppen zu bestimmen. Diesem TP53 Biomarker werde ich gleich noch ein gesondertes Kapitel widmen.
Bestätigt wurde diese Besonderheit durch ein neues Abstract, diesmal in der Indikation einer bestimmten Form des Brustkrebs. Dazu wurde folgende Veröffentlichung und Präsentation von HP gemacht. Diese Besonderheit gibt es bei vielen Krebsarten und es scheint so, dass HP hier einen Wirkstoff an der Hand hat diese besonders aggressive und tödliche Form zu behandeln.
Posterpräsentation auf der AACR-Jahrestagung 2019: Heidelberg Pharma präsentierte im März auf der Jahrestagung der American Association of Cancer Research (AACR) in Atlanta ein Poster über präklinische Daten zu einem ATAC, das gegen das Brustkrebs-Antigen HER2 gerichtet ist. Diese Daten aus einer experimentellen Fallstudie zeigen, dass das HER2-ATAC das Potenzial hat, auch gegen Tumore mit niedriger HER2-Expression, wie bei dreifach negativem Brustkrebs (TNBC), und präferenziell auf Tumorzellen mit aggressiven Verlaufsformen im Zusammenhang mit einer 17p-Deletion zu wirken.
Poster:
heidelberg-pharma.com/files/AACR_2019_237.pdf
Zusammenarbeit mit Universität von Texas MD Anderson Cancer Center und Prognostischer Biomarker p 53 / RNA Polymerase: II:
Neben den bekannten Kooperationen arbeitet Heidelberg Pharma noch weltweit mit vielen wichtigen Instituten zusammen. Eine der wichtigsten Partner ist hier wohl das MD Anderson Cancer Center. Diese Zusammenarbeit gipfelt im März letzten Jahres in einer Lizenznahme der Patentrechte für die Diagnose und Behandlung ausgewählter Patientengruppen mit sogenannter RNA Polymerase II-Deletion, auf Basis von gemeinsam mit Heidelberg Pharma generierten Daten. Worum es hier geht wird im nächsten Abschnitt beschrieben.
Forschungsgruppen von MD Anderson und Heidelberg Pharma demonstrierten in präklinischen Studien die außergewöhnlich hohe Wirksamkeit von ATAC-Therapeutika in der Behandlung einer Darmkrebs-Subpopulation, die Veränderungen im Status des Tumorsuppressorgens TP53 aufweist. Dieses Gen hat die Aufgabe, die Tumorbildung in gesunden Zellen zu unterdrücken. Krebszellen verändern ihr Erbgut so, dass diese Schutzfunktion nicht mehr voll ausgeübt werden kann. In der Forschungskooperation konnte gezeigt werden, dass diese Erbgutveränderung (sog. Hemizygotie) gleichzeitig zu einer deutlich höheren Wirksamkeit der ATACs führt, da in den Krebszellen das Gen des Zielmoleküls des Amanitins (POLR2A, RNA Polymerase II) ebenfalls durch diese Genveränderung verändert wird.
Der hemizygote Genstatus von TP53 und POLR2A führt zur verringerten RNA Polymerase II mRNA- und Proteinspiegeln in Tumorzellen und dadurch zu einer signifikant höheren Sensitivität dieser Krebszellen gegenüber ATACs (1). In präklinischen In-vitro- und In-vivo-Studien zeigten ATACs eine etwa zehnfach höhere Antitumoraktivität bei Tumoren mit hemizygotem POLR2A Status im Vergleich zu Tumoren mit homozygotem Status. Weitere Daten weisen darauf hin, dass solche genetischen Veränderungen auch bei anderen Tumorarten vorliegen. Die auf Amanitin basierenden ATACs stellen somit eine vielversprechende therapeutische Strategie für Patienten dar, die an hochresistenten Tumorerkrankungen leiden. In der klinischen Anwendung könnte die Patientenselektion auf Basis des TP53 und POLR2A Genstatus das therapeutische Fenster erweitern und so eine hohe Wirksamkeit bei gleichzeitiger Verringerung der Nebenwirkungen ermöglichen. Nach Ansicht von Heidelberg Pharma wäre das der erste personalisierte Ansatz für ein ADC.
Entwicklung eines Biomarkers für ATACS der TP53 Deletion:
Aufgrund dieser Erkenntnisse die oben beschrieben sind, entwickelt Heidelberg Pharma nun einen Biomarker, um eben diese Patientengruppen zu erfassen. Es vergeht kaum eine Woche, dass hier zu diesem Thema nicht eine Veröffentlichungen in den Fachorganen verbreitet wird. Das Betätigungsfeld für diese Gruppe der Krebserkrankten scheint riesig. Für diese Patientengruppen gibt es eine ganz schlechte Prognose. Und in dieses Betätigungsfeld stößt jetzt Heidelberg Pharma mit seiner chancenreichen ATAC Technologie. Auf der ASH Tagung Ende letzten Jahres wird ein vielbeachteter Vortrag durch das MD Anderson Cancer Center gehalten mit dem Titel: “HDP101, a Novel B-Cell Maturation Antigen (BCMA)-Targeted Antibody Conjugated to α-Amanitin, Is Active Against Myeloma with Preferential Efficacy Against Pre-Clinical Models of Deletion 17p”. Den gesamten Abstract mit Hintergrund findet ihr unter folgendem Link.
http://www.bloodjournal.org/content/132/Suppl_1/593?sso-chec…
Wie ich oben schon beschrieben habe, eröffnet sich diese Möglichkeit bei vielen anderen Krebsarten auch. Die neuerliche Abstract präsentation bei Brustkrebs ist nur ein weiteres Anwendungsgebiet
An dieser Stelle muss ich noch mal ein wenig ausholen. Normalerweise dauert die Entwicklung eines Medikamentes zwischen 8 und 10 Jahre. Wenn man die vorklinische Phase dazurechnet noch erheblich länger. Ich habe jetzt beschrieben, dass Heidelberg Pharma mit dem diagnostischen Biomarker und seiner gezeigten Überlegenheit mit den ATAC Wirkstoffen eine riesige Chance für diese Patientengruppe darstellt. Heidelberg Pharma verspricht sich für diese Entwicklung gleich einen Sonderstatus in mehreren Bereichen. Eine “Breakthrough” Therapie für besonders erfolgversprechende neue innovative Medikamente. Und einen “Fast Track” Status für seltene Erkrankungen. Das würde die Entwicklungszeit dieser Kandidaten enorm verkürzen. Rechnet man bei einer normalen Entwicklung etwa mit 10 Jahren, sind bei diesen Verfahren etwa 4-6 Jahre eine realistische Größe.
ATAC Partnerschaft mit Takeda
ATAC Partnerschaft mit Magenta Therapeutics
ATAC Partnerschaft mit Takeda:
Im Juni 2017 schließt Heidelberg Pharma eine erste ATAC Partnerschaft ab. Der Partner ist die Weltfirma Takeda. Die Vereinbarung sieht die Erforschung von 3 Kandidaten Antikörper-Wirkstoff-Konjugaten (Antibody Drug Conjugates – ADCs) mit dem Wirkstoff Amanitin vor. Es wurde ein Optionsmodell gewählt, bei der bei einer Bestätigung pro Entwicklungskandidat eine Zahlung von bis zu 113 Millionen USD fällig wird, die über die Gesamtdauer der Entwicklung an vorher vereinbarten Punkten gezahlt wird. Nach einer eventuellen positiven Entwicklung sind Umsatzbeteiligungen vorgesehen.
Das sind die offiziellen Verlautbarungen zu diesem Abkommen. Die restlichen Rahmenbedingungen erscheinen wenig durchschaubar, so dringen so gut wie keine Hinweis nach außen. Weder von Takeda noch von Heidelberg Pharma wurden weitere Einzelheiten in der Öffentlichkeit lanciert. Takeda hingegen hat aus strategischen Gründen vor einigen Monaten die Firma Shire übernommen, um damit weitere Synergien zu heben. Aus diesen Gründen befindet man sich derzeit in einer Umstrukturierungsphase. Geschäftsfelder müssen neu geordnet und bewertet werden.
Seit dem Abschluss der Vereinbarung mit HP sind nun etwa knapp 2 Jahre vergangen. Ich rechne damit, dass hier bald die Entscheidungsprozesse zu einem Wirkstoff anstehen. Dieser Zeitrahmen wurde in einem Interview angedeutet. Nach den abgeschlossenen Umstrukturierungen bei Takeda gehe ich dann auch von einer Entscheidung zu mindestens einer Option aus.
ATAC Partnerschaft Magenta Therapeutics:
Im März 2018 folgte die zweite große Partnerschaft für die ATAC Technologie. Es handelt sich dabei um Magenta Therapeutics. Diesmal werden bis zu 4 Zielmoleküle als Vorgabe genannt. Die Gesamtsumme für die Bearbeitung der 4 Wirkstoffe beträgt 334 Millionen USD. Bei erfolgreicher Zulassung werden dann noch Umsatzbeteiligungen fällig. Pro Kandidat beträgt die Gebühr 83,5 Millionen USD. Auch hier wird das Optionsmodell gewählt bei der die vereinbarte Summe über die Gesamtdauer der Entwicklung an vorher vereinbarten Punkten gezahlt wird. Bereits im Oktober 2018 bestätigt Magenta die erste Option.
Magenta Therapeutics ist eine junge Firma, die angetreten ist die Behandlung von Knochenmarktransplantationen zu revolutionieren. Aber wie verläuft die Behandlung bisher? Aktuell werden die erkrankten Zellen im Knochenmark durch eine Chemotherapie zerstört, wobei dabei auch das gesamte Knochenmark weitestgehend zerstört wird. Dieses Verfahren ist sehr belastend und sogar manchmal tödlich für die Patienten und kommt wohl auch nicht für alle Patienten in Frage.
Und genau hierfür bietet sich nun die ATAC Technologie mit ihren ADC Wirkstoffen an. Diese haben zum Ziel, ganz gezielt nur die erkrankten Krebszellen zu zerstören. Je nach Erkrankung werden dabei verschiedene Rezeptoren angesprochen. Diese Verfahren nennt man die Vorbereitung für die Transplantation, bei der dann wieder gesunde Zellen eingepflanzt werden. Für die Vorbereitung eben dieser Transplantation hat Magenta 3 verschiedene Kandidaten, die je nach Erkrankung zur Anwendung kommen sollen. Es handelt sich dabei um die Wirkstoffe mit der eigenen Bezeichnung C100, C200, und C300. Bei jedem dieser Wirkstoffe wird dabei ein besonderes Merkmal adressiert.
Für den C200 Wirkstoff hat Magenta bereits die Option ausgeübt. Dabei legt die Firma bei der Bearbeitung ihrer Aufgaben ein enormes Tempo vor, sodass man schon im nächsten Jahr den Übergang in die klinische Phase erwartet. Etwas zeitversetzt sollen dann die anderen Kandidaten folgen.
In neueren Präsentationen von Magenta Therapeutics wird bereits über die weitere Entwicklung von C100 gesprochen. Somit ist es dann nur eine Frage der Zeit, bis hier die nächste Option gezogen wird.
Zur Detailanalyse empfehlen sich die Präsentationen von Magenta zu
C100
https://investor.magentatx.com/static-files/14e4aa29-0cef-48…
C200.
https://investor.magentatx.com/static-files/65df0b83-b7c7-43…
Der vierte Kandidat sollte eigentlich geheim sein. Doch es ist gut möglich, dass es sich hier um den Kandidaten G100 handeln könnte. Die Vermutung nährt sich durch eine Patentveröffentlichung, bei der bei diesem Kandidaten eine Amanitinbesetzung des Antikörpers in Frage kommen kann. Außerdem handelt es sich dabei nach Magenta Aussagen um einen ADC Kandidaten. Nähere Einzelheiten sind wohl in Jahressicht hierzu zu erfahren, da sich alle Projekte sowieso in der Bearbeitung befinden.
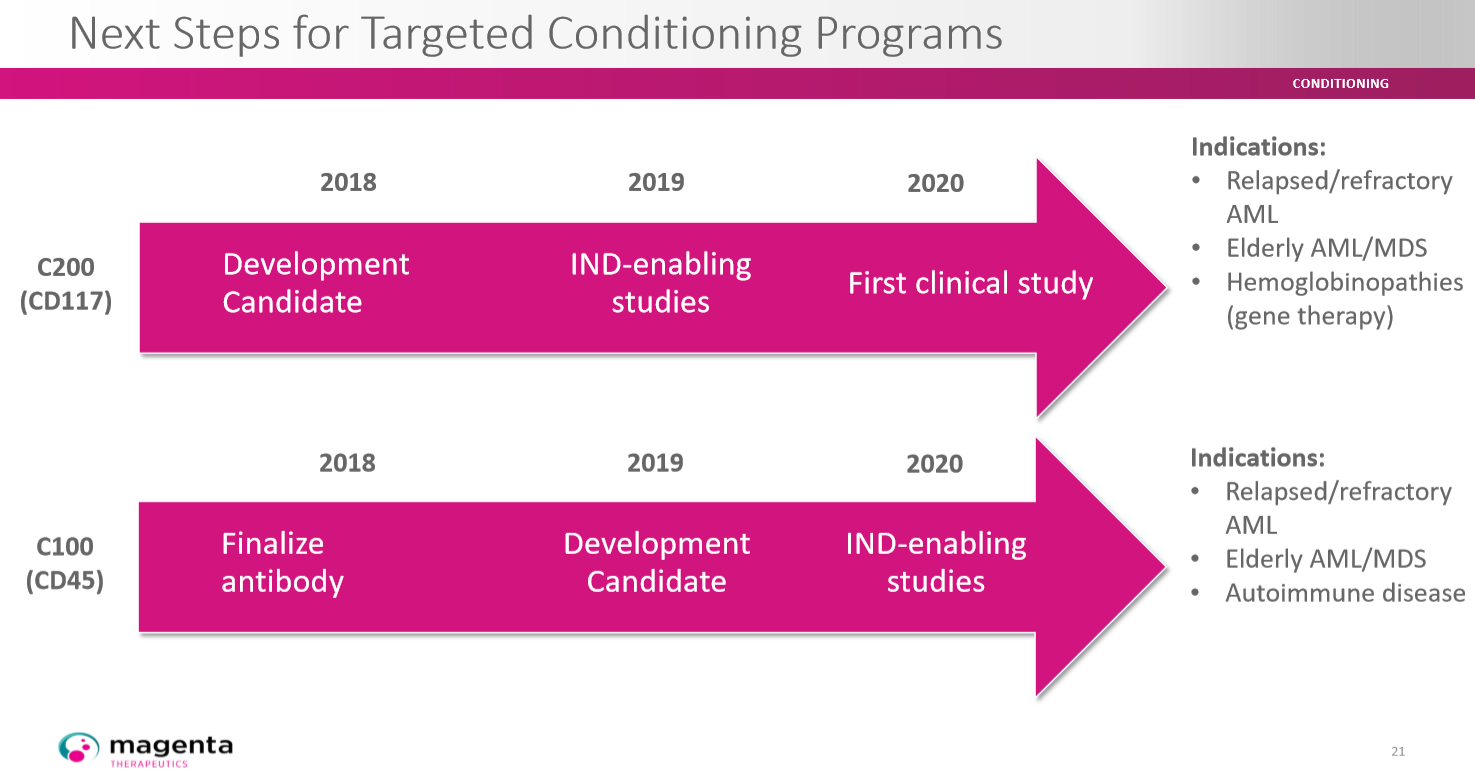
Der Eintritt in die klinische Erprobung des ersten Kandidaten soll demnach schon nächstes Jahr stattfinden. Anschließend sollen die restlichen Kandidaten folgen, falls sie sich diese als tauglich erweisen.
C100:
Gleich vier Kandidaten sind für die klinische Entwicklung schon im Jahr 2020 vorgesehen. Darunter auch in der Indikation Multiple Sklerose. Allein in der Indikation Multiple Sklerose gibt es alleine in Europa und USA etwa 1 Million betroffene Patienten.
Das erste Konditionierungsprogramm in dem Magenta Portfolio ist C100, unter dem Magenta ADCs entwickelt, die spezifisch die Wirts-HSCs und Immunzellen abbauen. Im Rahmen des C100-Programms ist CD45 das Hauptziel, ein wichtiges Zelloberflächenmolekül, das im gesamten hämatopoetischen und Immunsystem verbreitet ist. Magenta plant, C100 für Patienten mit Autoimmunkrankheiten wie Multiple Sklerose und Sklerodermie sowie Patienten mit Leukämie und Lymphomen zu entwickeln. Magenta plant, im Jahr 2019 einen Entwicklungskandidaten in unserem C100-Programm zu deklarieren und dann in die Erprobung eines neuen Arzneimittels (IND) zu wechseln, um Studien für 2020 zu ermöglichen.
C200:
Auch der Kandidat C200 soll gleich in mehreren Indikation für die klinische Entwicklung geplant sein.
Das am weitesten fortgeschrittene Konditionierungsprogramm C200 wurde entwickelt, um gezielt HSCs und krankheitsverursachende Zellen abzubauen. Der führende ADC-Produktkandidat zielt auf CD117, auch bekannt als c-Kit, das in HSCs und Leukämiezellen stark exprimiert wird. Dies macht es zu einem idealen Ziel für die Konditionierung bei einer Vielzahl von Krankheiten. Dies schließt Blutkrebs sowie Hämoglobinopathien wie Sichelzellkrankheit und Beta-Thalassämie ein, mit potenzieller Anwendbarkeit sowohl bei der Stammzelltransplantation als auch bei der Stammzell-Gentherapie. Magenta hat einen Entwicklungskandidaten in dem C200-Programm erklärt und ist zu IND-fähigen Studien übergegangen. Magenta plant, das IND für dieses Programm im Jahr 2020 einzureichen.
C300:
Das dritte ADC-basiertes Konditionierungsprogramm C300 zielt auf T-Zellen, eine Art Immunzelle. T-Zell-Depletion wird derzeit mit hochtoxischen, unspezifischen Medikamenten durchgeführt, die zu Immunschwäche, Infektionen und anderen Komplikationen einschließlich sekundärer Autoimmunreaktionen führen können. Magenta verfolgt Ziele, die auf den Oberflächen von T-Zellen markiert werden, mit dem Ziel, vor der CAR-T-Therapie bei Blutkrebs, der Verhinderung der Stammzellabstoßung vor der allogenen Stammzellentransplantation oder der Erreichung von Tumorzellen eine sichere und optimierte zielgerichtete Konditionierungsmethode durch T-Zell-Depletion anzubieten.
Magenta versucht wohl C100 und C200 gleich in mehreren Indikationen auf den Markt zu bringen. Die Breite der Pipeline ist bei Magenta die positive Überraschung. Neben einigen “kleineren” Indikationen dann aber auch Multiple Sklerose mit über 1 Million Betroffene Patienten allein in USA und Europa. Das wurde bisher so in dieser Dimension nicht antizipiert. Soweit ich das richtig im Kopf habe wurde hier mit Magenta eine mittlere einstellige Umsatzbeteiligung vereinbart also ca. 5% in einer Multimilliarden Indikation. Das sind dann keine kleinen Kleckerbeträge mehr für HP. Vielleicht gibt es hier ja auch beschleunigte Zulassungsbedingungen, wenn sie so erfolgreich werden sollten wie es die vorklinischen Daten andeuten.
Ich kann bei dieser Präsentation die Thematik nur oberflächlich ansprechen. Fachinformationen zu diesem Thema könnt ihr aber dem folgenden Link entnehmen.
https://www.nature.com/articles/s41467-018-08201-x.epdf?shar…
Diese Präsentation aus einer Nature Veröffentlichung beschreibt Sinn und Zweck und Chancen des Kandidaten C200. Absolut lesenswert für alle, die sich mit dem Thema Knochenmarktransplantation mit dem Magenta Verfahren beschäftigen.
RENCAREX
MESUPRON
REDECTANE-TLX-250-Girentuximab
RENCAREX:
RENCAREX ist der Wirkstoff, den Wilex vor einigen Jahren bei Behandlung des Nierenzellkarzinoms getestet hat. Leider haben sich in dieser Versuchsanordnung die Hoffnungen nicht erfüllt. Es konnte gegenüber dem Placebo kein Vorteil bestätigt werden. Dieser Kandidat steht zur Zeit von HP zur Auslizensierung bereit. Es wurde ein Abstract zu der Studie veröffentlich die bei bestimmten Patientengruppen sehr wohl einen Vorteil erkennen lässt. Dieser Kandidat wurde produktionstechnisch optimiert und eine aktuelle Auslizensierung wird gerade geprüft.
MESUPRON (INN: Upamostat)
MESUPRON (INN: Upamostat) ist ein Krebswirkstoff, der von Wilex bei Bauchspeicheldrüsenkrebs und Brustkrebs in einer 2a Studie getestet wurde. Das Wirkprinzip des MESUPRON könnte einen neuen Behandlungsansatz durch spezifische Blockierung der Metastasierung bei soliden Tumoren bilden. Mittlerweile wurde MESUPRON an LinkHealth und Redhill auslizensiert.
MESUPRON ist in China, Hong Kong, Taiwan und Macao an Link Health auslizensiert. Im Januar 2019 bezahlte Link Health für eine behördliche Genehmigung der chinesischen Behörden eine Meilensteinzahlung von 421000 € an HP. Für die Entwicklung sind 7 Millionen Euro an Milestones vereinbart. Die Umsatzbeteiligung beträgt einen mittleren einstelligen Prozentbereich, der nach Umsätzen gestaffelt ist. Es ist noch unklar in welcher Phase und in welcher Indikation in China weiter verfahren wird. Denkbar ist auch eine Einordnung nach den vorliegenden daten in eine Phase 2 Studie.
Für alle anderen Gebiete der Welt wurde MESUPRON an die israelische Firma Redhill auslizensiert. Es wurde eine hohe Umsatzbeteiligung von etwa 15- 30% vereinbart. Im Oktober 2017 gewährte die amerikanische Zulassungsbehörde FDA den Orphan Drug-Status für MESUPRON für die Behandlung von Bauchspeicheldrüsenkrebs. Bei Redhill sind keine großen Aktivitäten bezüglich MESUPRON erkennbar, da die Firma aufgrund der finanziellen Situation derzeit andere Priorititäten setzt.
Redectane-Girentuximab-TLX250:
GIRENTUXIMAB ist ein Antikörper, der zusätzlich mit einem radioaktiven Teil bestückt wurde. Wilex nutzte dafür Iodine (124I). Dieser Wirkstoff sammelte sich im Krebsgewebe des Nierenkrebses an und konnte mithilfe von diagnostischen Geräten sichtbar gemacht werden. Bei der Sensitivität verpasste Wilex damals knapp den erforderlichen Wert. REDECTANE wurde im Januar 2017 an den australischen Spezialisten Telix auslizensiert. Dieser Spezialist optimiert nun den Antikörper mit einem neuen radioaktiven Teil 89 Zirconium zu 89Zr-girentuximab.
(Schaubild ZR89 Girentuximab Vergleich Wilex-Telix

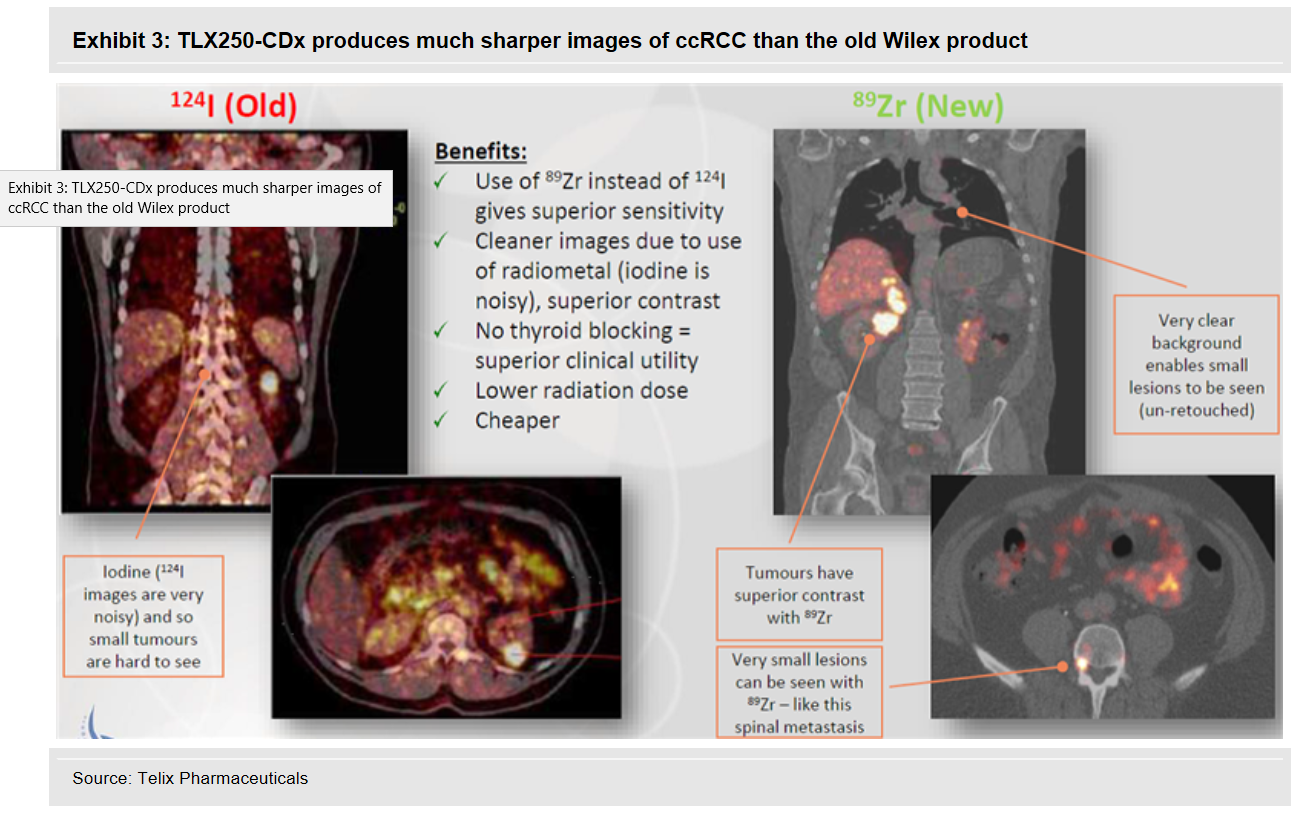
Quelle: www.telixpharma.com/ “ASX Announcements” Präsentation: “Detailed Program Update – January 2019
Eine kleinere Bridging Studie zur Bestätigung der Verbesserung wurde von Telix durchgeführt. Nachdem diese Studie eben diese erhofften Merkmale eindrucksvoll unter Beweis stellte, startet nun weltweit in verschieden Kontinenten hintereinander die Phase 3. Die ersten Ergebnisse aus diesen Studien erwartet Telix etwa ab Q4 2019 beginnend mit Australien, dem dann die anderen Zulassungsbereiche der Reihe nach folgen. REDECTANE ist ein Wirkstoff aus der WILEX Pipeline und kann in zwei Bereichen der Diagnostik aber auch therapeutisch eingesetzt werden. Bei der Therapeutik ist der Antikörper Girentuximab etwas anders aufgebaut je nachdem welche Zielvorgaben man erfüllen möchte.
Nach der angesprochenen Optimierung des Wirkstoffes durch Telix befindet sich REDECTANE in der aktiven Phase 3 der Bilddiagnostik für die klinische Entwicklung. In der therapeutischen Anwendung befindet man sich bald in der Phase 2 und das Ende der Rekrutierung der Phase 2 wird etwa Q4 19 erwartet. Geplant sind hier zwei Studien STARLITE 1 und STARLITE 2 mit verschiedenen Wirkstoffen. Die TLX250-Therapie (177Lu-Girentuximab) hat bei Patienten mit fortgeschrittenem metastasierendem ccRCC ohne weitere Behandlungsmöglichkeiten ein progressionsfreies Überleben von etwa 10 Monaten gezeigt. TLX250 wird im Jahr 2019 in Kombination mit einer Immuntherapie mit weiteren Studien beginnen. Sollte die Entwicklung von (177Lu-Girentuximab) normal und positiv verlaufen folgt eine Phase 3 Studie und der Zulassungsprozess.
Telix rechnet hier mit Einnahmen von ca. 400-500 Millionen USD, falls es in dieser Anwendung zu einer Zulassung kommt. Erste Einnahmen dürften wir in der therapeutischen Anwendung etwa ab 2023 erwarten.
In Japan wird ein ganz neues Verfahren der Theranostic Anwendung in Zusammenarbeit mit Nihon Medi-Physics mit Beteiligung von REDECTANE erprobt. Eine Ausdehnung auf andere Gebiete ist demnach bei einem positivem Verlauf sehr wahrscheinlich. Die Umsatzbeteiligung für HP beträgt in der therapeutischen Anwendung ca. 5%. In der diagnostischen Anwendung beträgt dieser Anteil immer 30%.
Was sind Theranostics?
Theranostics sind neue Technologien die Diagnose und Therapie miteinander verbinden, dabei werden die Wirkstoffe dementsprechend konzipiert. Telix mit seinem Partner in Japan geht dabei folgenden Weg:
Zur Bekämpfung von Krebszellen möchte man Radionukliden einsetzen. Bestimmte Antikörper, die die Krebszelle erkennen, werden dann mit solch einem radioaktiven strahlenden Teil besetzt. Als Radionuklid oder radioaktives Nuklid bezeichnet man ein Nuklid (eine Atomsorte), wenn es instabil und damit radioaktiv ist. Der Antikörper wandert zur Krebszelle und die Strahlung des radioaktiven Teils zerstört dann die Krebszelle. Theranostics von Telix sind mit 225 Ac besetzt und dies ist ein Alpha-Emitter.
Im Vergleich zu anderen Arten von Radionukliden haben Alpha-Emitter eine relativ höhere Energie, um Krebszellen zu schädigen und einen kürzeren Strahlungsbereich, um Schäden an den peripheren normalen Zellen zu minimieren. Daher wird erwartet, dass 225Ac, ein alpha-emittierendes Nuklid, ein erhebliches klinisches Potenzial für die Behandlung von Krebs mittels nuklearmedizinischer Techniken aufweist. Die Parteien werden zusammenarbeiten, um die neuartige Linker-Chemie von Nihon Medi-Physics Co., Ltd. auf die Anti-CAIX-Antikörper von Telix anzuwenden und gemeinsam Proof-of-Concept-Studien durchzuführen.
In der Bilddiagnostik befindet man sich wie oben schon angesprochen nun in Phase 3 und das Ende der Rekrutierung in Europa und Australien wird etwa Q4 19 erwartet. Danach folgt die Auswertung und der Zulassungsprozess.
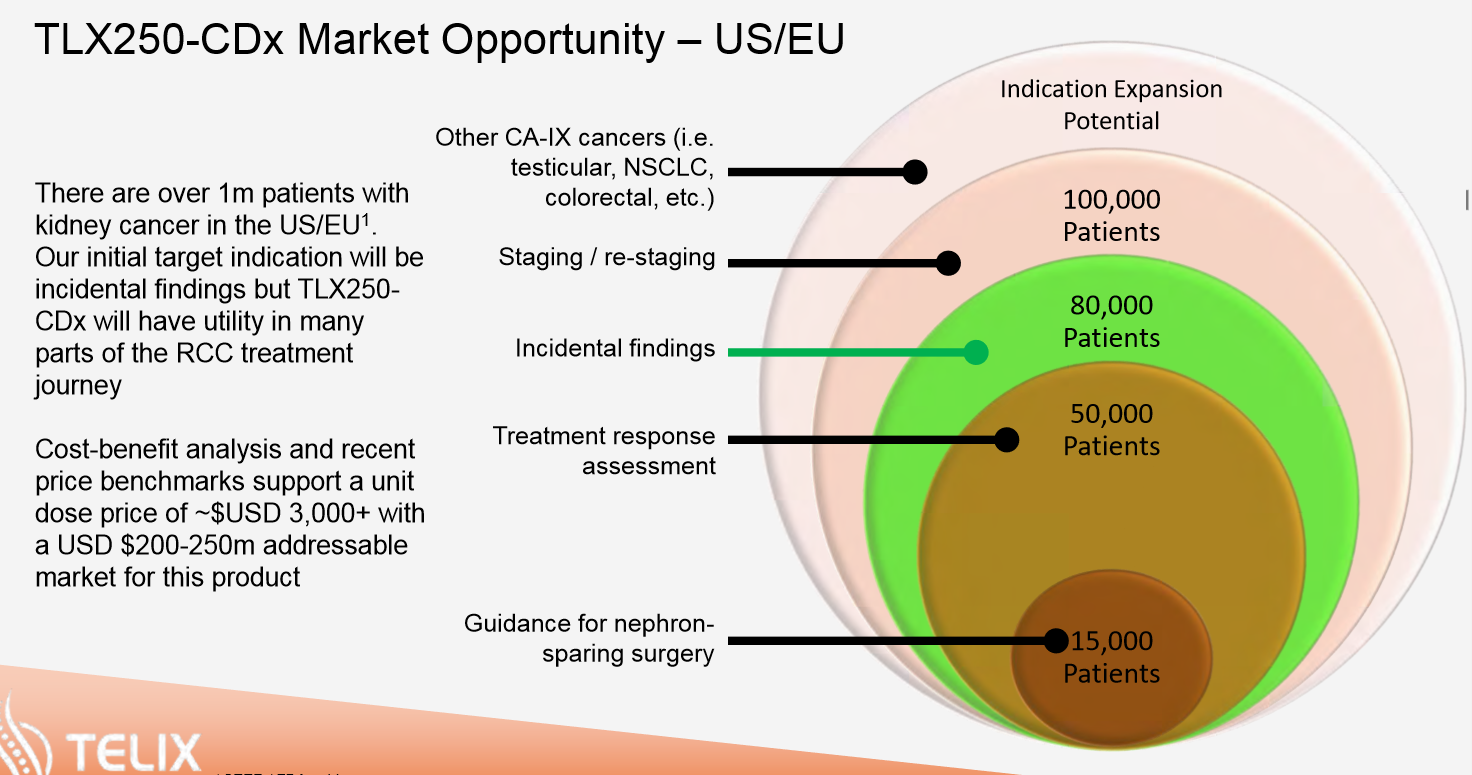
Quelle: www.telixpharma.com/ “ASX Announcements” Präsentation: “Detailed Program Update – January 2019
Die Umsatzschätzung für die diagnostische Anwendung wird mit etwa 250 Millionen USD angegeben. Neben der Anwendung bei Nierenkrebs sind nun auch neue Anwendungsgebiete verschiedener Krebsarten wie Hodenkrebs in der Diskussion bzw. in der vorklinischen Erprobung. Es besteht eine realistische Chance, dass dann zusätzlich noch mal der gleiche Betrag langfristig für die Indikationserweiterung dazu kommen. Die sehr hohe Umsatzbeteiligung für HP beträgt hier 30% vom Nettoerlös. Und man befindet sich schon in der Phase 3. Das Rekrutierungsende wird in einigen Ländern schon Ende 2019 erwartet, dem dann sukzessive die anderen Gebiete folgen werden. Erste Einnahmen bis zu ca. 75 Millionen USD dürften etwa ab 2021/22 nach der Zulassung erwartbar sein. Dies dürfte ein längerer Rollout der Gebiete werden, da die Beendigung und damit die Ergebnisse der Studien nacheinander erfolgen. Nach Australien und Japan folgt nun Europa und dann die USA. Langfristig dürfte eine Verdoppelung dieser Umsatzbeteiligungen möglich sein, da laufend weitere Anwendungsgebiete und neue Verfahren diskutiert und durchgeführt werden.
1. Besondere Merkmale der Firma und Einleitung:
Durch die oben aufgeführten Beiträge konntet ihr erfahren, was Heidelberg Pharma alles macht und welche Projekte aktuell laufen. Nun kommen wir zu dem Punkt, dass man dies ein wenig einordnen sollte und die Chancen und Risiken gegeneinander abwägt und ein realistisches Kursziel zu dem Wert bestimmt.
Da ist es sehr hilfreich, wenn man Werte in der Entwicklung vergleicht, die ähnliche Verläufe hatten. In Deutschland bieten sich zwei solcher Werte an. Das wären meiner Meinung nach MorphoSys und Evotec, die um die Jahrtausendwende an die Börse gegangen sind. Ähnlich sehe ich die Gegebenheiten von HP in der Entwicklung der Pipeline in den Frühphasen dieser beiden Vergleichswerte. Dem möchte ich jetzt Heidelberg Pharma gegenüberstellen. Mittlerweile sind diese beiden Vergleichswerte mit etwa 3 Milliarden an der Börse bewertet.
Heidelberg Pharma wird selbst nach dem Anstieg der letzten Wochen bei einem Kurs um die 3€ gerade mal mit ca. 85-90 Millionen € an der Börse bewertet. Wenn sie auch in großen Bereichen noch viel früher in der Entwicklung sind wie jetzt Evotec oder MorphoSys, haben sie die Besonderheit, dass sie mit dem Produkt REDECTANE schon in der Phase 3 sind. Meine Aufgabe liegt nun darin all die Faktoren aufzuzählen, die die Bewertung bestimmen. Dazu verwende ich eine Projektion wie es bei voraussichtlicher Entwicklung bei HP in drei vier Jahren aussehen könnte. Die Entwicklung sollte sich dann in den Kurszielen niederschlagen.
2. Kompetenz und Technologievorsprung:
Die Einzigartigkeit von Heidelberg Pharma ist wohl die große Fachkompetenz in Sachen Amanitin Forschung. Wahrscheinlich sind sie die Einzigen auf der Welt, die den Wirkstoff Amanitin im industriellen Maßstab in GMP Qualität herstellen können und eine Produktion garantieren können, die allen Ansprüchen (Forschung und Produktion) gerecht wird. Im Augenblick ist dies ein Alleinstellungsmerkmal, das keine andere Firma weltweit zu bieten hat.
Zur Bewertung der Technologiepartner:
Takeda:
Ich möchte noch vorausschicken, dass ich an dieser Stelle teilweise mit Schätzungen oder persönlichen Spekulationen arbeite, die sich doch in einem Rahmen bewegen die international üblich sind. In drei vier Jahren hat Takeda wohl etwa zwei Projekte in der klinischen Entwicklung. Pro Kandidat werden etwa 110 Million USD an Optionsgebühr aktiviert, die sehr wahrscheinlich an den üblichen Punkten gezahlt werden. Ein dritter Kandidat befindet sich demnach noch in der Erforschung und bei Zulassung des Wirkstoffes werden etwa 5% Umsatzbeteiligung fällig. Es ist davon auszugehen, dass sich Takeda wohl Ziele ausgesucht hat, die mindestens im Milliardenbereich liegen werden. Für mich ist dies, in etwa, das wahrscheinlichste Szenario.
Magenta:
Magenta hat schon eine Option bestätigt die etwa 83 Millionen für die Entwicklung für HP aktivieren. Unklar ist nur der Zeitpunkt wann welche Gelder fließen. Zwei weitere Projekte sind bekanntermaßen in der Entwicklung und es ist gut möglich, dass auf Jahresfrist noch ein oder zwei weitere Optionen bestätigt werden. In drei, vier Jahren kann es gut möglich sein, dass sich ein Kandidat auf dem Weg zur Phase 3 ist und sich zwei andere Kandidaten in der Klinischen Phase 2 befinden. Demnach sind dann die Gelder für 3 Optionen aktiviert. Eine vierte Option steht im Raume. Auch hier sind die Umsatzbeteiligungen für alle Wirkstoffe von etwa 5% sehr wahrscheinlich. Die Umsätze der Wirkstoffe werden um die Milliardengrenze geschätzt. Im Augenblick kommt die Bestätigung einer zweiten Option immer wieder ins Gespräch. Allein diese beiden Optionsbestätigungen decken eine Vielzahl von Indikationen ab, davon auch wie bei Multiple Sklerose, die vom Umsatz her mehrere Milliarden für Magenta und damit auch entsprechende Umsatzbeteiligungen und Milestones bedeuten können
Neue Kandidaten:
Es wurde immer wieder geäußert, dass neue Partner Interesse an der ATAC Technologie zeigen. In drei bis vier Jahren rechne ich persönlich mit etwa vier weiteren Partnern. Damit wird die jetzige Pipeline der Partner mit 7 Entwicklungskandidaten auf etwa 18-20 Entwicklungskandidaten ausgebaut. Demnach hätte HP dann etwa 20 Kandidaten mit je etwa 100 Millionen USD möglichen Optionsgebühr pro Wirkstoff in der Pipeline. Das bedeutet, dass im erfolgreichsten Fall mehr als 2 Milliarden USD im Laufe der nächsten Jahre von den Partnern an HP aktiviert werden können. Bei erfolgreicher Zulassung werden später dann noch Zahlungen zusätzlich von etwa 20 möglichen Kandidaten mit etwa 5% Umsatzbeteiligung fällig. Die Umsätze der Wirkstoffe dürften sich auf einem sehr hohen Niveau bewegen. Wir sind jetzt noch sehr früh in der Entwicklung, doch ich wage eine Projektion auf etwa 3-4 Jahre die für mich plausibel erscheint. Im Augenblick testet eine Adresse aus der Schweiz mit sehr hohem Geldeinsatz diese Amanitin Wirkstoffe. Doch man befindet sich erst in der Testphase mit offenem Ausgang für eine Partnerschaft.
Bewertung der Wirkstoffe RENCAREX, MESUPRON und REDECTANE
RENCAREX:
Rencarex wurde von HP produktionstechnisch optimiert und eine Auslizensierung wird gerade geprüft. Weitere Angaben lassen sich zu diesem Zeitpunkt leider nicht machen
MESUPRON:
Für mich persönlich sehr schwer einzuschätzen. LinkHealth will die klinische Entwicklung fortführen. Es erfolgt gerade die behördliche Genehmigung und eine Meilensteinzahlung an HP. Wir müssen hier einfach mal die Indikation und die Einordnung abwarten um genauere Schätzungen zu machen
Redhill ist bei MESUPRON wohl in einer Abwartestellung und sondiert gerade ein optimales Anwendungsgebiet. Wir müssen abwarten, welche Indikation von diesen Partnern gewählt wird und dann die erforderliche Bewertung der Chancen durchführen. MESUPRON wird wahrscheinlich bei Interesse der Lizenznehmer LinkHealth und Redhill als 2b Studie weitergeführt. Ich schätze MESUPRON als chancenreichen Kandidaten ein.
REDECTANE-TLX250:
Ein sehr heißer Kandidat mit riesen Chancen bei der Zulassung. Aber auch riesen Chancen bei den Umsätzen. Zu TLX250 gibt es keine Behandlungsalternative in der Diagnostik von Nierenzellkarzinom und so wird es sich wohl innerhalb kürzester Zeit durchsetzen. In der Diagnositk erhält HP eine Nettoumsatzbeteiligung von 30%. Der Markt für diese Anwendung wird im Augenblick auf 250 Millionen USD geschätzt. Ab Ende diesen Jahres laufen dann sukzessive die Ergebnisse aus den einzelnen Zulassungsgebieten ein, bis dann alle abgearbeitet sind. Nach der Auswertung kommt der Zulassungsprozess und ab etwa Mitte 2021 können wir bei erfolgter Zulassung mit den ersten Umsatzbeteiligungen für HP rechnen. Allein in diesem Anwendungsgebiet beträgt dann die Beteiligung für Heidelberg Pharma etwa 50 Millionen USD, wenn dann der gesamte Markt abgedeckt ist. Dies dürfte ab 2021 mit Australien und Japan beginnend dann etwa knapp zwei Jahre dauern.
Bis etwa 2023 erhofft man sich dann auch für die therapeutische Anwendung das Ende der Studien. Der Studienstart der STARLITE 1 und STARLITE 2 Studien ist unter Vorbehalt einer behördlichen Genehmigung fürs nächste Quartal vorgesehen.
Die Beteiligung für HP beträgt etwa 5% von geschätzten 400 Millionen USD Umsatz für die therapeutische Anwendung. Doch damit noch nicht genug. Es werden neue Indikationen diskutiert und neue Anwendungsverfahren durch die Theranostics, die ebenfalls den Wirkstoff von HP beinhalten sollen. In der Indikation Hodenkrebs befindet man sich aber schon in der vorklinischen Phase. Damit und mit den zusätzlichen Indikationen wäre dann sehr langfristig noch mal eine Verdoppelung der Umsatzbeteiligung denkbar. Im Best Case wären demnach jährliche Umsatzbeteiligungen von geschätzt etwa 150-200 Millionen USD möglich, wenn Telix und deren Partner alle Indikationen und Möglichkeiten abgearbeitet hat.
Und das ganze kostet Heidelberg Pharma dann keinen Pfennig mehr. Die gesamten Entwicklungskosten und der Vertrieb wird durch Telix und deren Partner übernommen. Selbst wenn alle Amanitin Projekte von Heidelberg Pharma scheitern würden (was ich nicht annehme) so wären doch nach dem vorliegenden Faktenstand etwa 150 Millionen USD langfristig an Einnahmen durch TLX250 sehr wahrscheinlich REDECTANE-TLX250 ist für mich persönlich die Versicherung für HP und deren Aktionäre.
Bewertung der eigenen Kandidaten insbesondere HDP-101
HDP-101:
HDP-101 ist das eigene Produkt aus dem Amanitin Wirkstoff in Verbindung mit einem einlizenzierten BCMA-Antikörper, der zur Behandlung beim Multiplen Myelom eingesetzt werden soll. HDP-101 kommt geplant Anfang 2020 in die erste klinische Verprobung am Menschen. Die Chancen für HDP-101 rechne ich aufgrund der bisherigen ausgezeichneten präklinischen Daten als sehr hoch ein. Für mich sind zwei Szenarien bei einem weiteren positiven Verlauf denkbar. Die Ergebnisse bestätigen die vorklinischen Testungen und HDP-101 wird im Szenario eins ziemlich zügig an einen Partner für 12-15% Umsatzbeteiligung auslizensiert. Szenario zwei beschreibt die Durchführung der Phase 2b in Eigenregie, um dadurch eine weitere Wertsteigerung zu erreichen. Es ist denkbar, dass bis zum Ende der Phase 1b/ 2a Heidelberg Pharma genug Einnahmen aus den ATAC-Optionszusagen, neuen Partnerverträgen, Milestones und Umsatzbeteiligungen von REDECTANE zur Verfügung hat, um diese Aufgabe einer 2b Studie eigenständig zu bewältigen. Bei diesem Szenario sind dann bei einer späteren Auslizensierung Umsatzbeteiligungen von über 20% denkbar. Die Milestonezahlungen dürften dann auch bedeutend höher sein. Die Gesamtumsätze in der Indikation Mutliples Myelom werden jenseits der Milliardengrenze liegen. Die ersten Ergebnisse der ersten klinischen Studie werden nach den jetzigen Planungen etwa Anfang 2021 vorliegen. Nach den Ergebnissen der ersten Studie rechne ich für HDP-101 für eine Beschleunigung der Zulassungsbehörden durch Anerkennung eines Sonderstatus “Breakthrough Therapie”, wenn die im Anderson Abstract zum Multiplen Myelom beschriebenen Erfolge im Menschen bestätigt werden können.
In drei vier Jahren -das ist etwa die Zeitzielvorgabe- dürfte die Testung der Phase 2 Studie ob jetzt mit oder ohne Partner abgeschlossen sein. Dann befindet man sich etwa in Phase 3 (sehr wahrscheinlich mit Partner) oder plant diese gerade. Zusatzplus bei dieser Indikation und HDP-101. Durch den TP53 Biomarker ist eine Gruppe von Patienten zu definieren, bei der andere Behandlung schlecht oder überhaupt nicht greifen. Amanitin Wirkstoffe, insbesondere HDP-101 scheint für diese vorher definierte Gruppe eine Möglichkeit zu sein um diese tödliche Erkrankung erfolgreich behandeln zu können. Die anderen eigenen Wirkstoffe in der HP Pipeline möchte ich jetzt noch nicht bewerten, bis sie sich in einem weiter fortgeschrittenem Status befinden und der Wert dann auch ersichtlicher wird.
TP53 Biomarker:
Im Augenblick wird mit einem Partner der TP53 Biomarker entwickelt. Er dürfte noch unschätzbare Dienste für HP leisten. Nämlich die Definition von Gruppen von Krebserkrankten, die genau auf die AMANITIN Wirkstoffe besonders gut ansprechen und für die es bis jetzt kaum Behandlungsalternativen gibt. Wahrscheinlich wird er schon beim Multiplem Myelom bei HDP-101 eine große Rolle spielen. Doch diese Gruppen mit dem TP53 Merkmal gibt es bei vielen anderen Krebserkrankungen auch. Durch diesen Test erschließt man sich eine große Anzahl von Anwendungsgebieten für die AMANITIN Wirkstoffe. Und dieser Test bedeutet für viele Patienten eine große Hoffnung, da es erstmals durch Heidelberg Pharma mit Amanitin Wirkstoffen eine Behandlungsmöglichkeit für sie gibt. Damit erhält HP eine enorme Wertsteigerung, da sie die Gruppen die sie behandeln möchten schon vorher definieren können. Allein schon durch die oben beschriebenen Vorteile hat dieser Test einen enormen Wert. Die finanzielle Dimension muss ich noch ein wenig recherchieren, inwieweit der Test nach Fertigstellung zur finanziellen Wertsteigerung beiträgt. Er wird mit großer Wahrscheinlichkeit nicht kostenlos angeboten werden. Bei Vorliegen der Informationen werde hierzu dann noch mal ein Update machen.
Kursziele bei Heidelberg Pharma:
Ich habe diese Analyse vorher in drei Kapitel eingeteilt, die die Wirkstoffe und Partner in separate Untergruppen einteilt. Jeder einzelne dieser Bereiche würde ausreichen um bei einer gewissen Reife eine Bewertung jenseits der Milliardengrenze zu begründen. Noch hat Heidelberg Pharma diese Reife aber noch nicht. Doch man ist auf einem sehr guten Weg dies zu bewerkstelligen. HP wird zur Zeit etwa mit Kursen um die 3€ mit ca. 85 Millionen bewertet. Die Chancen für weitere Wertsteigerungen sind enorm, wie man den vorausgegangen Beschreibungen entnehmen kann.
Mein kurz- bis mittelfristiges Kursziel:
Ich möchte bei meinem mittelfristigen Kursziel den Zeitkorridor von etwa 24-30 Monate vorgeben. Die Fakten, die dann wahrscheinlich eingetreten sind:
-HDP101 hat erfolgreich die Phase 1a/1b abgeschlossen.
-Der TP53 Biomarker ist fertiggestellt
-HP hat jetzt 4 Kooperationspartner zu den ATAC Wirkstoffen mit etwa 13 Optionen.
-Davon sind etwa 5 Optionen bestätigt.
-Etwa 3 davon befinden sich in der klinischen Entwicklung.
-HP hat etwa 30- 40Millionen Einnahmen jährlich aus ATAC-Optionszusagen und Umsatzbeteiligungen.
-Telix hat die Zulassung in den ersten Ländern zur Bilddiagnostik erreicht und beginnt mit der Vermarktung.
-In der Therapeutik befindet sich Telix in Phase 3.
-Die ersten Umsatzbeteiligungen von Telix sind fällig.
-Eventuell Einnahmen aus HDP-101, falls schon frühphasig auslizensiert wird.
Wenn das Szenario so in etwa eintritt rechne ich persönlich bei einer normalen Börsenlage mit einer Bewertung von etwa 400-500 Millionen € in dem vorgegebenen Zeitrahmen.
Mein langfristiges Kursziel
Bei dem langfristigen Kursziel gehe ich von einem Zeitkorridor von etwa 4-5 Jahren aus. Das Szenario möchte ich wie folgt beschreiben:
-HDP hat die Phase 2b von HDP erfolgreich abgeschlossen und hat den Sonderstatus “Breakthrough Therapie”.
-Zusätzliche Indikationen mit dem p53 Merkmal werden durch HP bearbeitet.
-Der Partner führt die Phase 3 Studie mit HDP101 durch.
-Zusätzliche Anwendungsgebiete und Indikationen werden durch HP bearbeitet.
-HP hat jetzt etwa 6 ATAC Kooperationspartner mit etwa 20 Optionen. – Davon sind etwa 10 Optionen bestätigt.
-Etwa 8 Wirkstoffe befinden sich davon in der klinischen Entwicklung.
-Magenta befindet sich mit C200 schon in einer sehr späten Phase der Entwicklung.
-Zwei weitere Kandidaten von Magenta sind in der klinischen Phase.
-Telix meldet die Zulassung in der therapeutischen Anwendung und beginnt Vermarktung.
-Für die Diagnostik sind von Telix jetzt weltweit alle Gebiete erschlossen.
-Weitere Anwendungsgebiete für REDECTANE TLX250 werden erarbeitet.
-Die Einnahmen aus ATAC-Optionszusagen und Umsatzbeteiligungen von TLX250 und Einnahmen zu HDP101 aus Milestones betragen mittlerweile zwischen 80 und 100 Millionen € jährlich.
Daher lautet mein persönliches Kursziel bei einer normalen Börsenlage etwa 2,5-3 Milliarden € Börsenbewertung in etwa 4 – 5 Jahren. Das wäre in etwa die gleiche Bewertung, die zur Zeit MorphoSys oder Evotec zugebilligt wird. Das ist natürlich ein sehr positives Szenario, das ich gezeichnet habe. Es wird nicht alles gelingen. Nicht jede Option wird bestätigt werden. Es wird bestimmt auch nicht jede Option bis zum Ende der Entwicklung bestehen. Vielleicht gibt es aber auch noch andere positive Überraschungen. Jeder mag selber seine Risikoabschläge von diesen Kurszielen machen, die so ziemlich das optimalste Szenario beschreiben. Ich selber aber orientiere mich daran und korrigiere sie dann, wenn neue Fakten eine neue Bewertung erfordern.
Finanzen und Sonstiges:
Die finanziellen Mittel betrugen laut Quartalsbericht zum Ende des ersten Geschäftsquartals 2019, etwa 16,1 Millionen € . Auf dem jetzigen Niveau würde das Geld bis etwa Mitte 2020 reichen
Folgende Einnahmen sind im Ausblick des Jahres 2019 erwartbar :
Einnahmen aus der 1. Optionsbestätigung von Magenta zur Antragstellung und zur Zulassung der ersten klinischen Phase von C200 .
Eine zweite Optionszusage von Magenta (für C100) wird für sehr wahrscheinlich gehalten und entsprechende Zahlungen würden fällig.
Eine erste Optionszusage von Takeda mit entsprechenden Zahlungen liegt im Bereich des Möglichen.
Aus den normalen Geschäftstätigkeiten erwarte ich Einnahmen etwa um die 5-7 Millionen Euro in 2019.
Weiterhin wurden Andeutungen zu möglichen neuen ATAC Partnerschaften gemacht. Auch hier könnte man erste neue Anfangszahlungen verbuchen.
Sollte Link Health eine Phase 2 Studie mit MESUPRON schon in diesem Jahr in China starten können, wären auch hier wahrscheinlich weitere Milestonezahlungen fällig.
All diese Möglichkeiten verlängern die finanzielle Reichweite von HP. . HP bemüht sich um neue Investoren. Wie das gelingen wird, ist letztendlich von Dietmar Hopp bzw. dessen Söhnen oder Verwalter abhängig. Sie besitzen akt. etwa 75% der Aktien von Heidelberg Pharma. Vielleicht braucht man noch mal eine kleine Maßnahme oder Zwischenfinanzierung durch Hopp, bis dann die erforderlichen Gelder für HP aus dem eigenen operativem Cash Flow generiert werden um die Geschäftstätigkeit eigenständig nachhaltig zu sichern, ohne das weitere Kapitalmaßnahmen benötigt werden.
Patenrechtliche Absicherung.
Heidelberg Pharma hat alle Wirkstoffe bis ins Jahr 2039 hinein patenrechtlich abgesichert. Ein ganz neues Patent, das erst in den letzten Tagen veröffentlicht wurde sorgt nach Meinung von Fachleuten für großes Aufsehen. Es handelt sich dabei um das folgende Patent
PSMA-TARGETING AMANITIN CONJUGATES FIELD OF THE INVENTION
[001 ] The invention relates to a PSMA-targeting conjugate comprising (a) an amatoxin; (b) a small molecule PSMA-targeting moiety; and (c) optionally a linker linking said amatoxin and said small molecule PSMA-targeting moiety. The invention furthermore relates to said conjugate further comprising a half-life extension moiety. The invention furthermore relates to a pharmaceutical composition comprising such conjugate.
Kommentar:
Es ist aber eine große Sache, super, super, super spannend ! Ich werde (vielleicht) später was dazu schreiben. PSMA ist ein erstes tolles target, nicht nur in der Indikation Prostatakrebs (mehr oder weniger alle soliden Krebsindikationen außer Hirntumore). Die Möglichkeit von großmolekülaren Vektoren (monoklonale Antikoerper) Abstand zu nehmen bringt erheblich Vorteile in Puncto Kosten, Entwicklungszeit und Wirksamkeit (bessere Penetration).
Ich möchte noch betonen, dass ich diese Analyse als Arbeitspapier betrachte, die ich gerne als Diskussionsgrundlage zur Verfügung stelle. Es ist nicht verwunderlich, dass bei diesen enormen Aussichten Spekulationen um Übernahmen oder Kooperationen diskutiert werden. Ich freue mich über weitere produktive Beiträge zu Heidelberg Pharma und bedanke mich für eure Aufmerksamkeit. Sollte mir irgendwo ein Fehler unterlaufen sein, würde ich mich über einen kleinen Hinweis freuen.
Datum der Analyse: 11.4.2019
Letzter Kurs bei Analyse: 3,12 €
Anzahl Aktien ca. 28,13 Millionen
Kapitalisierung an der Börse: ca. 88 Millionen €
Anteil Dietmar Hopp ca. 75 %
Anteil UCB ca. 4%
Freefloat ca. 20%
Hauptversammlung: 21.5.2019
Anhang:
Für meine Recherchen habe ich hauptsächlich die Webseiten der Firmen und bekannte Webseiten für medizinische und wissenschaftliche Informationen genutzt. Alle Informationen sind öffentlich und für jeden einsehbar. Ich empfehle auch bei eingehenden Recherchen diese Webseiten zu nutzen, da es dort noch sehr viele Informationen gibt, die selbst in dieser sehr umfangreichen Analyse noch nicht enthalten sind.
Quellen:
https://investor.magentatx.com/static-files/14e4aa29-0cef-48…
https://investor.magentatx.com/static-files/65df0b83-b7c7-43…
https://www.nature.com/articles/s41467-018-08201-x.epdf?shared_access_token=96H7W3_EaYMUIORoN_nKMdRgN0jAjWel9jnR3ZoT…
https://heidelberg-pharma.com/de/presse-investoren/aktieninf…
https://heidelberg-pharma.com/de/unternehmen/ueberblick
https://heidelberg-pharma.com/de/
https://telixpharma.com/
https://magentatx.com/
http://heidelberg-pharma.com/wp-content/uploads/2014/03/2014…
https://www.ncbi.nlm.nih.gov/pubmed/30703342
https://www.nature.com/articles/s41467-018-08201-x.epdf?shar…
https://patentscope.wipo.int/search/de/search.jsf
https://clinicaltrials.gov/ct2/show/NCT03849118?term=telix&r…
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6197287/
https://investor.magentatx.com/static-files/b960beb0-adca-4e…
https://investor.magentatx.com/financial-information/sec-fil…
https://patentscope.wipo.int/search/de/result.jsf
https://heidelberg-pharma.com/de/forschung-entwicklung/ueber…
Antwort auf Beitrag Nr.: 60.331.174 von BICYPAPA am 11.04.19 13:23:09Super. Herzlichen Dank
Ich hatte angekündigt, mich zum Thema PSMA zu melden. Daraus wird zunächst nichts, ich hab etwas noch aufregenderes gefunden. Nicht in der HP pipeline, sondern in der Magenta pipeline.
Von den 4 targets sind bereits CD117 (C200) und CD45 (C100) bekannt. Beide werden für die Knochenmarktransplantation Vorbehandlung (pre-conditioning) eingesetzt.
Ich weiss jetzt welcher der 3. Kandidat sein wird: CD137 (G100 laut Magenta pipeline) in der Indikation GvHD (Transplantat gegen Wirt Reaktion), also in der Nachbehandlung von allogenen Knochenmarktransplantationen.
Grundlage für meine Behauptung ist das am 14/3/19 veroeffentlichten Magenta Patent.
Compositions and methods for the deletion of CD137+ cells
https://patentimages.storage.googleapis.com/0c/76/2a/5c4f123…" target="_blank" rel="nofollow ugc noopener">https://patentimages.storage.googleapis.com/0c/76/2a/5c4f123…
Magenta hat alles daran gesetzt dieses Target solange wie möglich geheim zu halten, und das aus gutem Grund meiner Meinung nach. (Provisional filing 20/1/17, dann 7/12/17, und 19/1/18 und schließlich offizielles und öffentlich zugängliches filing erst am 21/11/18, also vor 4 Monaten).
Warum diese Geheimtuerei ? CD137 ist auch unter dem Namen 4-1BB oder TNFRSF9 bekannt, und das ist zZ ein sehr sehr heißes target in Immuno-onkologie. Man erhofft sich von 4-1BB das Anwendungspektrum von PD1/PDL1 zu erweitern. ABER, und das ist ein riesiges ABER, alle Ansätzte zielen es darauf ab, den Effekt von 4-1BB zu maximieren. 4-1BB ist ein so genannter AGONISTISCHER Co-Rezeptor auf aktivierten T-Zellen. Auf diesen Knopf zu drücken ist vergleichbar mit dem oft zitierten Bleifuss: von 100 auf 200 in 5s ! Wie kann es also sein, dass ausgerechnet das Gaspedal für die gefährlichsten aller transplantierten Zellen, die alloreaktiven T Zellen, als Bremse dienen kann ? Ich musste mich selbst kneifen bevor ich es kapierte. Die Lösung des Rätsels ist wie folgt: es findet ein Wettlauf statt, ein Wettlauf zwischen dem agonistischen Effekt des CD137 Antikoerpers (GvHD wird angeheizt !) und dem antagonistischen Effekt des Amanitin Payloads (aktivierte T-Zelle wird von innen "gesprengt", GvHD wird aufgehalten). Und Amanitin gewinnt den Wettlauf ! Der Ansatz ist echt verrückt, aber genial !
OK, funktionert diese geniale Idee ? JA, und zwar liefert das Patent die Antwort auf die 3 wichtigen Fragen:
1) alle CD137 aktivierten T Zellen werden ausgelöscht (Seite 4)
2) nicht aktivierten T Zellen werden nicht ausgelöscht (Seite 5)
3) Anwachsen (engraftment) des Transplants wird nicht verhindert (Seite 7)
BINGO
CD137 ist ein seit langem bekanntes Molekül (1989), dessen Biologie aber immer noch unbeantwortete Aspekte aufweist. Die mit Abstand höchste Expression ist auf aktivierten CD8+ T Zellen, aber CD137 ist auch auf allen anderen Lymphozyten exprimiert, sowie auf epithelial-Zellen. 2005 ging Urelumab (BMS) in eine ph1 klinische Studie. Schwere Lebertoxizität hat die Entwicklung zum Stillstand gebracht, bis Jahre später die Kombination mit anderen mAbs und mit stark reduzierten Dosen einen deutlich effektiveren ADCC Effekt zeigte. Pfizer fährt mit Utomilumab einen vergleichbaren Ansatz. Alle andere Players aber setzen auf bi-spezifizität (FStar CD127+PDL1, Pieris CD137+HER2, Alligator CD137+5T4 und noch einige mehr) um den Wirkmechanismus auf die aktivierten CD8+ T Zellen zu begrenzen.
Selbst wenn ich mich wiederhole, mit einem CD137 ADC ist Magenta ein Geniestreich gelungen (zumindest vom Konzept her ...). Alle anderen Ansätze bei der Behandlung von GvHD setzen entweder eine Vorlaufzeit in der Behandlung voraus (wie zum Beispiel Kiadis oder MolMed) oder sind nicht spezifisch (Immunhemmer). Ich bin mir sicher, dass das Programm G100 in den kommenden Monaten einen Sprung in der nach aussen getragenden Pipeline von Magenta machen wird.
Von den 4 targets sind bereits CD117 (C200) und CD45 (C100) bekannt. Beide werden für die Knochenmarktransplantation Vorbehandlung (pre-conditioning) eingesetzt.
Ich weiss jetzt welcher der 3. Kandidat sein wird: CD137 (G100 laut Magenta pipeline) in der Indikation GvHD (Transplantat gegen Wirt Reaktion), also in der Nachbehandlung von allogenen Knochenmarktransplantationen.
Grundlage für meine Behauptung ist das am 14/3/19 veroeffentlichten Magenta Patent.
Compositions and methods for the deletion of CD137+ cells
https://patentimages.storage.googleapis.com/0c/76/2a/5c4f123…" target="_blank" rel="nofollow ugc noopener">https://patentimages.storage.googleapis.com/0c/76/2a/5c4f123…
Magenta hat alles daran gesetzt dieses Target solange wie möglich geheim zu halten, und das aus gutem Grund meiner Meinung nach. (Provisional filing 20/1/17, dann 7/12/17, und 19/1/18 und schließlich offizielles und öffentlich zugängliches filing erst am 21/11/18, also vor 4 Monaten).
Warum diese Geheimtuerei ? CD137 ist auch unter dem Namen 4-1BB oder TNFRSF9 bekannt, und das ist zZ ein sehr sehr heißes target in Immuno-onkologie. Man erhofft sich von 4-1BB das Anwendungspektrum von PD1/PDL1 zu erweitern. ABER, und das ist ein riesiges ABER, alle Ansätzte zielen es darauf ab, den Effekt von 4-1BB zu maximieren. 4-1BB ist ein so genannter AGONISTISCHER Co-Rezeptor auf aktivierten T-Zellen. Auf diesen Knopf zu drücken ist vergleichbar mit dem oft zitierten Bleifuss: von 100 auf 200 in 5s ! Wie kann es also sein, dass ausgerechnet das Gaspedal für die gefährlichsten aller transplantierten Zellen, die alloreaktiven T Zellen, als Bremse dienen kann ? Ich musste mich selbst kneifen bevor ich es kapierte. Die Lösung des Rätsels ist wie folgt: es findet ein Wettlauf statt, ein Wettlauf zwischen dem agonistischen Effekt des CD137 Antikoerpers (GvHD wird angeheizt !) und dem antagonistischen Effekt des Amanitin Payloads (aktivierte T-Zelle wird von innen "gesprengt", GvHD wird aufgehalten). Und Amanitin gewinnt den Wettlauf ! Der Ansatz ist echt verrückt, aber genial !
OK, funktionert diese geniale Idee ? JA, und zwar liefert das Patent die Antwort auf die 3 wichtigen Fragen:
1) alle CD137 aktivierten T Zellen werden ausgelöscht (Seite 4)
2) nicht aktivierten T Zellen werden nicht ausgelöscht (Seite 5)
3) Anwachsen (engraftment) des Transplants wird nicht verhindert (Seite 7)
BINGO
CD137 ist ein seit langem bekanntes Molekül (1989), dessen Biologie aber immer noch unbeantwortete Aspekte aufweist. Die mit Abstand höchste Expression ist auf aktivierten CD8+ T Zellen, aber CD137 ist auch auf allen anderen Lymphozyten exprimiert, sowie auf epithelial-Zellen. 2005 ging Urelumab (BMS) in eine ph1 klinische Studie. Schwere Lebertoxizität hat die Entwicklung zum Stillstand gebracht, bis Jahre später die Kombination mit anderen mAbs und mit stark reduzierten Dosen einen deutlich effektiveren ADCC Effekt zeigte. Pfizer fährt mit Utomilumab einen vergleichbaren Ansatz. Alle andere Players aber setzen auf bi-spezifizität (FStar CD127+PDL1, Pieris CD137+HER2, Alligator CD137+5T4 und noch einige mehr) um den Wirkmechanismus auf die aktivierten CD8+ T Zellen zu begrenzen.
Selbst wenn ich mich wiederhole, mit einem CD137 ADC ist Magenta ein Geniestreich gelungen (zumindest vom Konzept her ...). Alle anderen Ansätze bei der Behandlung von GvHD setzen entweder eine Vorlaufzeit in der Behandlung voraus (wie zum Beispiel Kiadis oder MolMed) oder sind nicht spezifisch (Immunhemmer). Ich bin mir sicher, dass das Programm G100 in den kommenden Monaten einen Sprung in der nach aussen getragenden Pipeline von Magenta machen wird.
Respekt nkontb für das Fachwissen, welches du uns anschaulich hier darstellst! 🙂👍
Klingt ja fast so, als ob ein Invest in Magenta lukrativer sein könnte wie in Heidelberg Pharma...?! 😉
Klingt ja fast so, als ob ein Invest in Magenta lukrativer sein könnte wie in Heidelberg Pharma...?! 😉
Antwort auf Beitrag Nr.: 60.361.180 von NewKidOnTheBlog am 15.04.19 19:28:07Wenn nur die Hälfte von dem jetzt Angedachten realisiert wird dann werden wir in den nächsten Jahren noch viel Freude haben.
Woher kommt nur der Verkaufsdruck?
Irgendwie komisch. Seitdem ihr hier und in anderen Foren so gute Recherchearbeit macht bzw. diese mit der Öffentlichkeit teilt, geht es im Kurs trotzdem nicht voran, sondern es kommen immer mal wieder größere Verkaufsorders zwischen 3,2 und 3,5 € in den Markt. Kurs ging es sogar wieder unter 3 €.
Während viele andere Nebenwerte derzeit ganz ohne solch wertvolle Beiträge wie eure stark steigen, geht hier irgendwie gar nichts. Kann natürlich charttechnische Gründe haben, weil der ganze Bereich bei 3,4-3,7 € eine starke Widerstandszone ist. Dadurch wird ständig knapp darunter verkauft. Aber bei dem Potenzial, dass sich durch eure Arbeit rumgesprochen hat, hätte ich damit gerechnet, dass der Kurs anzieht.
Okay, in weiten Teilen geben eure Postings die Chancen des Investments wieder, was auch völlig in Ordnung ist, auch wenn Biotecs die üblichen großen Risiken haben, was quantitativ Fehlschläge betrifft. Vielleicht sehen manche Anleger das CRV nicht so gut wie ihr und bleiben vorsichtig. Dennoch merkwürdig, dass sich der Kurs nicht rührt, sondern weitestgehend zwischen 2,8 und 3,4 € verharrt, mit innerer Range 3,1-3,3 €.
Irgendwie komisch. Seitdem ihr hier und in anderen Foren so gute Recherchearbeit macht bzw. diese mit der Öffentlichkeit teilt, geht es im Kurs trotzdem nicht voran, sondern es kommen immer mal wieder größere Verkaufsorders zwischen 3,2 und 3,5 € in den Markt. Kurs ging es sogar wieder unter 3 €.
Während viele andere Nebenwerte derzeit ganz ohne solch wertvolle Beiträge wie eure stark steigen, geht hier irgendwie gar nichts. Kann natürlich charttechnische Gründe haben, weil der ganze Bereich bei 3,4-3,7 € eine starke Widerstandszone ist. Dadurch wird ständig knapp darunter verkauft. Aber bei dem Potenzial, dass sich durch eure Arbeit rumgesprochen hat, hätte ich damit gerechnet, dass der Kurs anzieht.
Okay, in weiten Teilen geben eure Postings die Chancen des Investments wieder, was auch völlig in Ordnung ist, auch wenn Biotecs die üblichen großen Risiken haben, was quantitativ Fehlschläge betrifft. Vielleicht sehen manche Anleger das CRV nicht so gut wie ihr und bleiben vorsichtig. Dennoch merkwürdig, dass sich der Kurs nicht rührt, sondern weitestgehend zwischen 2,8 und 3,4 € verharrt, mit innerer Range 3,1-3,3 €.
Antwort auf Beitrag Nr.: 60.385.819 von katjuscha-research am 18.04.19 16:53:56Ich kann dir nur Recht geben. Eigentlich seit Monaten werden meist 5000 Päckchen in den Markt gegeben und der Kurs bei etwa 3,20 € festgenagelt. Vielleicht sehen wir den Grund, falls bald eine neue Beteiligung in irgendeiner Form oder eine Maßnahme kommt. Man sieht solch ein Kursverhalten öfters bei solchen Maßnahmen. Es ist nur ein Erklärungsversuch von mir. Bei diesen erfolgversprechenden Aussichten kann ich auch nichts besseres anbieten. Die Aussichten sind ja prima.
Es gibt ja viele Spekulationen mit Magenta, Takeda oder dem Schweizer Kandidaten oder auch sonstige Maßnahmen durch neue Beteilgungen. Und da will man den Kurs einfach in der Spur halten.
Es gibt ja viele Spekulationen mit Magenta, Takeda oder dem Schweizer Kandidaten oder auch sonstige Maßnahmen durch neue Beteilgungen. Und da will man den Kurs einfach in der Spur halten.
Für einen Ausbruch über das derzeitige Kursniveau braucht es eine neue positive Nachricht wie der Bezug von Molekül 2 und 3 durch Magenta oder ein neuer Lizenzvertrag mit einem neuen Partner zB mit der Schweizer Firma oder der. Euch von Molekülen durch Takeda. Dann sehen wir die 4 vor dem Komma.
Antwort auf Beitrag Nr.: 60.361.600 von Mogli3 am 15.04.19 20:10:49Es gibt keinen Druck, weder nach oben noch nach unten. Erst wenn HP in die Klinik geht wird was passieren. Oder wenn Tatsächlich ein neuer deal kommt. Die Reaktion wird aber kurzfristig sein. Um wirklich nach oben zu gehen brauchen wir klinische Daten oder Geld. Geld wird erst fließen wenn magenta die erste phase 1 startet, das passiert nicht so schnell. Die Marktkapitalisierung liegt bei knapp 90m, das ist schon beachtlich, wenn man bedenkt, dass man noch gar nicht in der Klinik ist. In 5 Jahren wird man in dem Rückspiegel auf die Marktkapitalisierung von MorphoSys und Evotec kucken, aber noch sind wir nicht soweit.
Antwort auf Beitrag Nr.: 60.392.008 von NewKidOnTheBlog am 19.04.19 22:41:45
Telix hat mit TLX-250 (Redectane) schon einen Kandidaten von HP in Phase 3, bei dem in etwa 6 Monaten in den ersten Ländern die Rekrutierung der Phase 3 beendet wird. Ich hab das in der Analyse geschrieben. Schon Ende nächsten Jahres werden hier die Zulassungen und Milestones und Umsatzbeteiligungen für die ersten Länder erwartet. Und das alles kostet HP keinen Pfennig mehr. Ich hab die Aussichten in der Analyse beschrieben. ich möchte sie hier jetzt nicht wiederholen. Genau das ändert die Sachlage bei den Kurszielen doch enorm. Man kann nicht nur die ATAC Technologie mit allen Möglichkeiten betrachten. In der Bridging Studie wurde die Überlegenheit gegenüber der damaligen Wilex Studie eindrucksvoll unter Beweis gestellt. Und ab Ende nächste Jahres winken hier ab nächsten Jahr beginnend erste Einnahmen in beträchtlicher Millionenhöhe, die langfristig sehr wahrscheinlich noch ausgebaut werden können. wenn ich das mal betrachte, dann ist HP an der Börse doch gar nicht mal so teuer. Dann müsste ich HP dann auch mit einem Wert vergleichen, bei dem langfristig Einnahmen von etwa 100 Millionen € doch sehr wahrscheinlich sind, ohne weitere Ausgaben zu haben weil sie die Partner übernehmen.
Und dann kann man all die Perspektiven der ATAC Pipeline und die Möglichkeiten der Partner mit einrechnen. Auch Magenta plant ebenso wie HP den Studienstart im nächsten Jahr, wahrscheinlich schon mit zwei Kandidaten. HP Anfang nächsten Jahres. Und plötzlich erscheint mir Heidelberg Pharma unheimlich niedrig bewertet. Selbst bei einer Verdoppelung käme ich nicht auf die Idee zu behaupten, HP wäre zu teuer. Sie spiegeln dann gerade mal die Möglichkeiten wieder, die nur alleine in Redectane schlummern. Die enormen Möglichkeiten von der ATAC Pipeline sind dann noch nicht mal annähernd berücksichtigt. Ich muss doch jetzt bei meiner Kurszielbestimmung die Perspektiven in ca. 3 Jahren berücksichtigen. An der Börse wird doch die Zukunft bewertet. So, das kurz meine Stellungnahme zum augenblicklichen Kurs.
Heidelberg Pharma
Heidelberg Pharma ist aber nicht so eindimensional. Würde ich jetzt nur die eigene ATAC Pipeline und die Partnerschaften mit Takeda und Magenta betrachten, dann würde ich dir voll zustimmen. Dann käme ich zu einem ähnlichen Urteil. Aber alleine damit wäre es mittel bis langfristig einer der erfolgversprechendsten deutschen Biotechkandidaten. Telix hat mit TLX-250 (Redectane) schon einen Kandidaten von HP in Phase 3, bei dem in etwa 6 Monaten in den ersten Ländern die Rekrutierung der Phase 3 beendet wird. Ich hab das in der Analyse geschrieben. Schon Ende nächsten Jahres werden hier die Zulassungen und Milestones und Umsatzbeteiligungen für die ersten Länder erwartet. Und das alles kostet HP keinen Pfennig mehr. Ich hab die Aussichten in der Analyse beschrieben. ich möchte sie hier jetzt nicht wiederholen. Genau das ändert die Sachlage bei den Kurszielen doch enorm. Man kann nicht nur die ATAC Technologie mit allen Möglichkeiten betrachten. In der Bridging Studie wurde die Überlegenheit gegenüber der damaligen Wilex Studie eindrucksvoll unter Beweis gestellt. Und ab Ende nächste Jahres winken hier ab nächsten Jahr beginnend erste Einnahmen in beträchtlicher Millionenhöhe, die langfristig sehr wahrscheinlich noch ausgebaut werden können. wenn ich das mal betrachte, dann ist HP an der Börse doch gar nicht mal so teuer. Dann müsste ich HP dann auch mit einem Wert vergleichen, bei dem langfristig Einnahmen von etwa 100 Millionen € doch sehr wahrscheinlich sind, ohne weitere Ausgaben zu haben weil sie die Partner übernehmen.
Und dann kann man all die Perspektiven der ATAC Pipeline und die Möglichkeiten der Partner mit einrechnen. Auch Magenta plant ebenso wie HP den Studienstart im nächsten Jahr, wahrscheinlich schon mit zwei Kandidaten. HP Anfang nächsten Jahres. Und plötzlich erscheint mir Heidelberg Pharma unheimlich niedrig bewertet. Selbst bei einer Verdoppelung käme ich nicht auf die Idee zu behaupten, HP wäre zu teuer. Sie spiegeln dann gerade mal die Möglichkeiten wieder, die nur alleine in Redectane schlummern. Die enormen Möglichkeiten von der ATAC Pipeline sind dann noch nicht mal annähernd berücksichtigt. Ich muss doch jetzt bei meiner Kurszielbestimmung die Perspektiven in ca. 3 Jahren berücksichtigen. An der Börse wird doch die Zukunft bewertet. So, das kurz meine Stellungnahme zum augenblicklichen Kurs.
Beitrag zu dieser Diskussion schreiben
Investoren beobachten auch:
| Wertpapier | Perf. % |
|---|---|
| +0,47 | |
| -0,15 | |
| -0,28 | |
| 0,00 | |
| +2,36 | |
| -4,31 | |
| -0,52 | |
| +1,09 | |
| +0,18 | |
| 0,00 |
Meistdiskutiert
| Wertpapier | Beiträge | |
|---|---|---|
| 200 | ||
| 184 | ||
| 132 | ||
| 70 | ||
| 29 | ||
| 29 | ||
| 29 | ||
| 26 | ||
| 26 | ||
| 26 |
07:21 Uhr · EQS Group AG · Heidelberg Pharma |
07:21 Uhr · EQS Group AG · Heidelberg Pharma |
17.04.24 · EQS Group AG · Heidelberg Pharma |
05.04.24 · EQS Group AG · Heidelberg Pharma |
27.03.24 · EQS Group AG · Heidelberg Pharma |
27.03.24 · wO Chartvergleich · Super Micro Computer |





















