+++ Trevena +++ Revolution in der Schmerztherapie? - 500 Beiträge pro Seite (Seite 2)
eröffnet am 04.01.18 20:37:22 von
neuester Beitrag 03.02.24 08:02:54 von
neuester Beitrag 03.02.24 08:02:54 von
Beiträge: 2.375
ID: 1.270.862
ID: 1.270.862
Aufrufe heute: 3
Gesamt: 280.092
Gesamt: 280.092
Aktive User: 0
ISIN: US89532E2081 · WKN: A3DWN1 · Symbol: TRVN
0,3477
USD
-5,00 %
-0,0183 USD
Letzter Kurs 16:16:03 Nasdaq
Werte aus der Branche Biotechnologie
| Wertpapier | Kurs | Perf. % |
|---|---|---|
| 3.000,00 | +74.900,00 | |
| 0,9300 | +54,46 | |
| 1,6500 | +34,69 | |
| 2,4700 | +33,51 | |
| 3,4600 | +17,69 |
| Wertpapier | Kurs | Perf. % |
|---|---|---|
| 0,6205 | -11,36 | |
| 1,2600 | -11,89 | |
| 0,9980 | -14,52 | |
| 0,8501 | -17,47 | |
| 5,0550 | -22,71 |
Antwort auf Beitrag Nr.: 58.934.715 von stegonatus am 11.10.18 19:42:18
in den USA ist still stand, ich habe in NasdaqGS Real Time Price.
Zitat von stegonatus: Handel läuft anscheinend wieder!!
in den USA ist still stand, ich habe in NasdaqGS Real Time Price.
Stimmung auf StockTwits kippt etwas!
Antwort auf Beitrag Nr.: 58.935.135 von fypet am 11.10.18 20:13:23Dürfte aber bald starten
Antwort auf Beitrag Nr.: 58.935.150 von PESCADOS am 11.10.18 20:14:14Ich kippe auch bald wenn das noch lange dauert

Antwort auf Beitrag Nr.: 58.935.114 von Aktapot am 11.10.18 20:12:40
Den besten Krimi denn ich in letzter zeit gesehen habe.
Zitat von Aktapot: Ich kipp gleich von den Socken. Obwohl sollte lieber keine Hoffnung machen dann ist die Enttäuschung nicht so hoch.
Den besten Krimi denn ich in letzter zeit gesehen habe.
Antwort auf Beitrag Nr.: 58.935.228 von fypet am 11.10.18 20:20:26Aber Krimis gehen doch meistens gut aus

Cyberhexe, bitte gib einen Tip ab! Es wird sicher ganz knapp..
Antwort auf Beitrag Nr.: 58.935.252 von PESCADOS am 11.10.18 20:24:04
8 No 7 jes

Zitat von PESCADOS: Cyberhexe, bitte gib einen Tip ab! Es wird sicher ganz knapp..
8 No 7 jes

Antwort auf Beitrag Nr.: 58.935.294 von Schaeffi am 11.10.18 20:26:53Tippe auf umgekehrt. Knappes Jaaaaaaaa

Antwort auf Beitrag Nr.: 58.935.348 von stegonatus am 11.10.18 20:28:55Aber die sollen sich beeilen. Habe nicht mehr genug Alkohol zum Beruhigen da.

Antwort auf Beitrag Nr.: 58.935.348 von stegonatus am 11.10.18 20:28:55Mit Trump hat auch keiner gerechnet also....

Antwort auf Beitrag Nr.: 58.935.348 von stegonatus am 11.10.18 20:28:55Da ich nicht bei 2,90€ verkauft habe gehe ich davon aus das no dabei rauskommen wird, da ja Blödheit generell bestraft wird 😡
Antwort auf Beitrag Nr.: 58.935.375 von flipflap am 11.10.18 20:30:37Es wird wahrscheinlich wirklich knapp.
— BioWorld Today (@BioWorld) 11 October 2018
$ TRVN plädiert für den neuen #opioid Olinvo bei adcom: Überbehandlung sollte nicht als Vorteil gesehen werden. Ich sollte auf die Hinlänglichkeit von #PainRelief achten - nicht auf die Größenordnung.
$ TRVN plädiert für den neuen #opioid Olinvo bei adcom: Überbehandlung sollte nicht als Vorteil gesehen werden. Ich sollte auf die Hinlänglichkeit von #PainRelief achten - nicht auf die Größenordnung.
...ich wollte im vorhinein schon anmerken wie der kurs sich verhalten sollte nach einem knappen ergebnis wie z B: 8:7 oder ev. 7:8.....also im prinzip wäre dabei sogar noch alles möglich , also zumindesten bis zum 2. 11.18
Antwort auf Beitrag Nr.: 58.935.387 von Aktapot am 11.10.18 20:31:51Oh je. Vielleicht bekommst du ja noch mehr als 2,90

Antwort auf Beitrag Nr.: 58.935.387 von Aktapot am 11.10.18 20:31:51habe auch nicht verkauft und ärgere mich jetzt richtig......nach den Kurssturz hänge ich richtig im minus...egal
Antwort auf Beitrag Nr.: 58.935.393 von stegonatus am 11.10.18 20:32:13Egal wie aber bitte nicht mehr zu lange...mein Bier ist gleich alle

Aus und vorbei
Aus die Maus
Heute könnte WO hier Eintritt verlangen

Antwort auf Beitrag Nr.: 58.935.252 von PESCADOS am 11.10.18 20:24:04
..bin ganz deiner Meinung! Es dürfte sehr knapp zugehen - wahrscheinlich werden von den Nein-Sagern zusätzliche Daten zur Atmungsdepression gewünscht.
Zitat von PESCADOS: Cyberhexe, bitte gib einen Tip ab! Es wird sicher ganz knapp..
..bin ganz deiner Meinung! Es dürfte sehr knapp zugehen - wahrscheinlich werden von den Nein-Sagern zusätzliche Daten zur Atmungsdepression gewünscht.
...es könnte es aber auch noch zu " nachbesserungsvorschläge " kommen , die von der fda angefordert werden . wäre allerdings nicht so selten in dieser branche....
Antwort auf Beitrag Nr.: 58.935.387 von Aktapot am 11.10.18 20:31:51
Das nächste mal muss du verkaufen, ich noch darauf hingewiesen in 9 Tage 119% sind zu viel.
Zitat von Aktapot: Da ich nicht bei 2,90€ verkauft habe gehe ich davon aus das no dabei rauskommen wird, da ja Blödheit generell bestraft wird 😡
Das nächste mal muss du verkaufen, ich noch darauf hingewiesen in 9 Tage 119% sind zu viel.
Antwort auf Beitrag Nr.: 58.935.492 von fypet am 11.10.18 20:38:45Da hast du recht. Bei der nächsten aktie lieber nicht gierig sein wie bei mir der fall bei Trevena war. Muss noch viel lernen.
Bekomme auch langsam eine Atemdepression. Und zwar ganz ohne das Zeug. Heisst also nichts.

Jedenfalls wird der Kurs bald von der Leine gelassen. Nur die Richtung ist noch unklar.
Boah. Bier ist jetzt alle, Nägel alle abgekaut und sämtliche Haare ausgerissen

Antwort auf Beitrag Nr.: 58.935.639 von stegonatus am 11.10.18 20:46:35Warte bekommst meine Fussnägel
Antwort auf Beitrag Nr.: 58.935.525 von Aktapot am 11.10.18 20:41:26
Ich jeden tag studiere den chart, bei travena gab es zu viele offene gaps, das ist schon sehr gefährlich.
hier ein einfaches Chart-Tool
https://www.marketscreener.com/TREVENA-INC-14934954/?type_re…
Zitat von Aktapot: Da hast du recht. Bei der nächsten aktie lieber nicht gierig sein wie bei mir der fall bei Trevena war. Muss noch viel lernen.
Ich jeden tag studiere den chart, bei travena gab es zu viele offene gaps, das ist schon sehr gefährlich.
hier ein einfaches Chart-Tool
https://www.marketscreener.com/TREVENA-INC-14934954/?type_re…
Antwort auf Beitrag Nr.: 58.935.675 von fypet am 11.10.18 20:48:39Den Chart kannst Du jetzt vergessen
Antwort auf Beitrag Nr.: 58.935.474 von Cyberhexe am 11.10.18 20:37:17AC-Mitglieder sprechen eine Phase 4-Studie an. Das wäre super, da hierbei eine bedingte Zulassung gewährt würde.
....alkohol wäre da , mehr als zur genüge, dann pos abstimmung und dann nichts wie rein ins wochenende......ein wunderschöner traum wäre das.....
Antwort auf Beitrag Nr.: 58.935.723 von Cyberhexe am 11.10.18 20:51:01das heisst die Phase 4 würde im Rahmen einer bedingten Zulassung erfolgen?
Antwort auf Beitrag Nr.: 58.935.747 von stegonatus am 11.10.18 20:53:02Dann würder der Kurs aber wahrscheinlich erst einmal nachgeben 

Antwort auf Beitrag Nr.: 58.935.747 von stegonatus am 11.10.18 20:53:02...würde ich meinen. Aber das wird nicht heute entschieden. Bin gespannt, ob bei den Begründungen eine ph4 ein Thema ist.
Antwort auf Beitrag Nr.: 58.935.795 von stegonatus am 11.10.18 20:54:48Sehe ich nicht so
Antwort auf Beitrag Nr.: 58.935.675 von fypet am 11.10.18 20:48:39Danke für den Tip und link.
Antwort auf Beitrag Nr.: 58.935.825 von Cyberhexe am 11.10.18 20:56:54Also gehst von ablehnung aus
Hab ich in der Zusammenfassung gerade richtig verstanden „relatively safe“ und „no more dangerous than morphine“? Das wäre gut.
Interessiert lese ich mit....hab ja letzten Freitag meine +65% gesichert,alles verkauft.
Antwort auf Beitrag Nr.: 58.935.840 von Gibbasherkeinechance am 11.10.18 20:57:27Ich denke wenn es hier kein eindeutig positives Votum gibt, geht der Kurs erst einmal nach unten.
Antwort auf Beitrag Nr.: 58.935.879 von jensebeen1979 am 11.10.18 20:59:58Gut gemacht!!

Vielleicht wird heute gar nicht mehr gehandelt!?
Antwort auf Beitrag Nr.: 58.935.885 von stegonatus am 11.10.18 21:00:29
....meistens fängt sich der kurs nach derartigen abstimmungen aber schnell wieder , zumindestens bis zum 2.11. ...die hoffnung stirbt zuletzt.....!!!!!
Zitat von stegonatus: Ich denke wenn es hier kein eindeutig positives Votum gibt, geht der Kurs erst einmal nach unten.
....meistens fängt sich der kurs nach derartigen abstimmungen aber schnell wieder , zumindestens bis zum 2.11. ...die hoffnung stirbt zuletzt.....!!!!!
Antwort auf Beitrag Nr.: 58.935.978 von herthafan am 11.10.18 21:05:18Stimmt. Man müsste nur den Tiefstkurs erwischen

Handel soll wohl bis zum 1.11 ausgesetzt bleiben
Antwort auf Beitrag Nr.: 58.936.065 von Gibbasherkeinechance am 11.10.18 21:11:50
AHA....wo gelesen ??
Zitat von Gibbasherkeinechance: Handel soll wohl bis zum 1.11 ausgesetzt bleiben
AHA....wo gelesen ??
Antwort auf Beitrag Nr.: 58.936.065 von Gibbasherkeinechance am 11.10.18 21:11:50
...kaum zu glauben , wenn an 2.11. das endspiel beginnt......so noch nie erlebt in 18 jahren börse.
Zitat von Gibbasherkeinechance: Handel soll wohl bis zum 1.11 ausgesetzt bleiben
...kaum zu glauben , wenn an 2.11. das endspiel beginnt......so noch nie erlebt in 18 jahren börse.
Antwort auf Beitrag Nr.: 58.936.065 von Gibbasherkeinechance am 11.10.18 21:11:50blablabla link?
Antwort auf Beitrag Nr.: 58.936.065 von Gibbasherkeinechance am 11.10.18 21:11:50So ein Quatsch

bleibt spannend...….hab leider kein gutes Gefühl....
LG Printi
LG Printi
Hat Claudia Roth im Bundestag so gefordert 





Antwort auf Beitrag Nr.: 58.936.227 von Gibbasherkeinechance am 11.10.18 21:20:27

Zitat von Gibbasherkeinechance: Hat Claudia Roth im Bundestag so gefordert

Antwort auf Beitrag Nr.: 58.936.281 von bernie55 am 11.10.18 21:25:24So nämlich
...wenn das die hexe sehen würde . auweia....
7 yes 8 no
Antwort auf Beitrag Nr.: 58.936.281 von bernie55 am 11.10.18 21:25:24
ist sie auch in Trevena Aktien investiert
Zitat von bernie55:Zitat von Gibbasherkeinechance: Hat Claudia Roth im Bundestag so gefordert
ist sie auch in Trevena Aktien investiert
7 yes 8 no
Antwort auf Beitrag Nr.: 58.936.281 von bernie55 am 11.10.18 21:25:24die Zusammenfassung des AC-Vorsitzenden Zacharoff hinsichtlich Arzneimittelsicherheit fällt gar nicht so schlecht aus - die Hoffnung steigt wieder:


FDA ADCOMM VOTE: Do you recommend approval of the proposed dose of #oliceridine for the proposed indication of the management of moderate- to-severe acute pain in adults for whom an intravenous opioid is warranted. If not, what data are needed?
7-Yes
8-No
0-Abstain
$TRVN
https://twitter.com/FDAadcomm/status/1050469194951786496
7-Yes
8-No
0-Abstain
$TRVN
https://twitter.com/FDAadcomm/status/1050469194951786496
....76 millionen shares sind am zittern....!!!!!
Antwort auf Beitrag Nr.: 58.936.410 von bernie55 am 11.10.18 21:33:25das hatten wir mindestens andersrum erhofft - aber warten wir die Begründungen der NEINsager ab!
Wobei 8:7 oder 7:8 ist für die FDA eh nicht entscheidend!
Wobei 8:7 oder 7:8 ist für die FDA eh nicht entscheidend!
Das wars hab ich euch doch gestagt.Es geht nur ums Geld.
Absturz auch 0,20.
Absturz auch 0,20.
...noch ist doch nichts verloren , knapp aber weiter hoffen bis zum 2.11. ist jetzt angesagt...
Antwort auf Beitrag Nr.: 58.936.470 von Cyberhexe am 11.10.18 21:36:09Hieß es nicht in einem Artikel das die FDA generell dem Urteil immer übernimmt oder verwechsle ich etwas?
Antwort auf Beitrag Nr.: 58.936.485 von Blaucuranda am 11.10.18 21:36:36das wär doch was dann kauf ich 500.000St

Antwort auf Beitrag Nr.: 58.936.470 von Cyberhexe am 11.10.18 21:36:09...das ist gar nicht so schlecht: möglicherweise ist da Spielraum für eine ph4...bin gespannt welche zusätzliche Info die Neinsager einfordern.
Ich glaube zudem nicht, dass der Kurs gross nachgibt!
Ich glaube zudem nicht, dass der Kurs gross nachgibt!
Antwort auf Beitrag Nr.: 58.936.530 von herthafan am 11.10.18 21:39:37Ich denke an den Kursen bis 02.11. Wird man sehen ob die Leute noch Hoffnung haben. Rechne mit sinkenden Kursen bis dahin.
Antwort auf Beitrag Nr.: 58.936.533 von Aktapot am 11.10.18 21:39:38
Die FDA ist in keiner Weise an dieses Ergebnis gebunden.
bei Provenge bspw. war das Abstimmungsergebnis 17:0 und 13:4 für Zulassung und die FDA hat einen CRL verschickt (Complete Response Letter).
Zitat von Aktapot: Hieß es nicht in einem Artikel das die FDA generell dem Urteil immer übernimmt oder verwechsle ich etwas?
Die FDA ist in keiner Weise an dieses Ergebnis gebunden.
bei Provenge bspw. war das Abstimmungsergebnis 17:0 und 13:4 für Zulassung und die FDA hat einen CRL verschickt (Complete Response Letter).
Antwort auf Beitrag Nr.: 58.936.548 von Cyberhexe am 11.10.18 21:40:00Der Kurs gibt bei solchen Entscheidungen immer nach. 

Antwort auf Beitrag Nr.: 58.936.548 von Cyberhexe am 11.10.18 21:40:00
...haben schon gan z andere mitmachen müssen....
Zitat von Cyberhexe: ...das ist gar nicht so schlecht: möglicherweise ist da Spielraum für eine ph4...bin gespannt welche zusätzliche Info die Neinsager einfordern.
Ich glaube zudem nicht, dass der Kurs gross nachgibt!
...haben schon gan z andere mitmachen müssen....
Antwort auf Beitrag Nr.: 58.936.596 von stegonatus am 11.10.18 21:42:05will da einer günstig zusteigen?

Uff...bin ich froh über meine Entscheidung letzten Freitag!!
Einige der No Voter sagten sie seien auch "nahe an einem Ja gewesen".
Ich glaube ein Approval/Ph 4 ist durchaus im Bereich des Möglichen...wobei mir ein 9:6 lieber gewesen wäre, wenn 2 Wackelkandidaten mit Yes gestimmt hätten;(
Ich glaube ein Approval/Ph 4 ist durchaus im Bereich des Möglichen...wobei mir ein 9:6 lieber gewesen wäre, wenn 2 Wackelkandidaten mit Yes gestimmt hätten;(
Antwort auf Beitrag Nr.: 58.936.650 von printguru am 11.10.18 21:45:37Ach. Meinst Du das beeinflusst den Kurs?

...eine ph 4 wäre ja noch hoffnungsfroh ggü. einer totalen ablehnung
Antwort auf Beitrag Nr.: 58.936.548 von Cyberhexe am 11.10.18 21:40:00Wurde denn eine ph4 Studie verlangt?
Das glaube auch das der Kurs nicht weiter fällt, moderat ausgedrückt vom 6 Monatigem Durchschnittskurs 1.45 - 0.95 hat er schon 50% nachgegeben.
verdammt warum musste ich richtig liegen mit 8:7
die ganze Aufregung für diesen Bullsh*t
Von solchen Biotechklitschen hab ich erst mal genug.
na dann Gute Nacht
S.
die ganze Aufregung für diesen Bullsh*t
Von solchen Biotechklitschen hab ich erst mal genug.
na dann Gute Nacht
S.
Mit dieser Entscheidung ist leider Trevena Geschichte!
Schätze mal .50Cent morgen zur Eröffnung
Schätze mal .50Cent morgen zur Eröffnung
Ja leider nicht gut....
Gute Nacht
LG Printi
Gute Nacht
LG Printi
Ist doch noch Hoffnung da....weiterentwickeln und nochmal einreichen.
Minuskurse sind morgen Kaufkurse, da es hier sicher weitergeht.
Googleübersetzung von Reuters
Wir haben einfach nicht genügend Sicherheitsdaten, um zu sagen, dass wir den Menschen nicht versehentlich Schaden zufügen werden ", sagte Mary Ellen McCann, Mitglied des Gremiums und Dozentin der Anesthesia Harvard Medical School.
"Wenn diese Droge in einem weiteren halben Jahr oder einem Jahr mit besseren, mehr Daten aufgezogen wird, würde ich mich sehr freuen, mit Ja zu stimmen."
Die Entscheidung kommt zwei Tage nach der Beurteilung der FDA-Mitarbeiter, dass die Gesamtbewertung der missbrauchsrelevanten Daten darauf hindeutet, dass die Behandlung ein Missbrauchs- und Überdosierungspotential hat und zu einer ähnlichen körperlichen Abhängigkeit wie bei anderen Behandlungen führen könnte.
Die FDA wird bis zum 2. November über das Schicksal des Medikaments Oliceridin entscheiden. Der Regulator ist nicht verpflichtet, sich an die Empfehlungen des Gremiums zu halten, tut dies aber in der Regel.
Oliceridin gehört zu der gleichen Klasse von Opioiden wie üblicherweise verschriebene Schmerzmittel wie Morphin und Fentanyl.
Der Handel mit Aktien der Gesellschaft wurde eingestellt.
Minuskurse sind morgen Kaufkurse, da es hier sicher weitergeht.
Googleübersetzung von Reuters
Wir haben einfach nicht genügend Sicherheitsdaten, um zu sagen, dass wir den Menschen nicht versehentlich Schaden zufügen werden ", sagte Mary Ellen McCann, Mitglied des Gremiums und Dozentin der Anesthesia Harvard Medical School.
"Wenn diese Droge in einem weiteren halben Jahr oder einem Jahr mit besseren, mehr Daten aufgezogen wird, würde ich mich sehr freuen, mit Ja zu stimmen."
Die Entscheidung kommt zwei Tage nach der Beurteilung der FDA-Mitarbeiter, dass die Gesamtbewertung der missbrauchsrelevanten Daten darauf hindeutet, dass die Behandlung ein Missbrauchs- und Überdosierungspotential hat und zu einer ähnlichen körperlichen Abhängigkeit wie bei anderen Behandlungen führen könnte.
Die FDA wird bis zum 2. November über das Schicksal des Medikaments Oliceridin entscheiden. Der Regulator ist nicht verpflichtet, sich an die Empfehlungen des Gremiums zu halten, tut dies aber in der Regel.
Oliceridin gehört zu der gleichen Klasse von Opioiden wie üblicherweise verschriebene Schmerzmittel wie Morphin und Fentanyl.
Der Handel mit Aktien der Gesellschaft wurde eingestellt.
Antwort auf Beitrag Nr.: 58.936.587 von Cyberhexe am 11.10.18 21:41:47Wie sieht deine Einschätzung jetzt nach diesem Ergebnis aus...... und wird es für Trevena noch eine Chance für die zulassung geben???
Antwort auf Beitrag Nr.: 58.936.890 von PESCADOS am 11.10.18 22:02:56Also wer jetzt die Aktien für 50 US Cent wegwirft, dem ist nicht zu helfen
Dann werd ich wohl nochmal zukaufen müssen und auf 30k erhöhen
Die letzten Worte der FDA Panelleitung waren jetzt nicht so entschieden!

Dann werd ich wohl nochmal zukaufen müssen und auf 30k erhöhen

Die letzten Worte der FDA Panelleitung waren jetzt nicht so entschieden!
.....noch bleibt abzuwarten über die einschätzungen der analysten einschließlich des CEO und anderen profis hier im forum einschließlich cyberhexe u.a.
Das einzig Positive mann kann vor dem Amis Verkaufen😀
"...i am not sure you made our job any easier, but I think that you gave us a lot to think about..."
Dies waren die Abschlussworte der FDA AC!
Man spricht von 3-4 no votes, welche auch sehr nahe am yes waren...dies wird von der FDA auch so registriert worden sein...ich glaube an eine bedingte Zulassung mit weiteren Daten/ Studien im Rahmen einer P4...ich werde kein Stück verkaufen
Dies waren die Abschlussworte der FDA AC!
Man spricht von 3-4 no votes, welche auch sehr nahe am yes waren...dies wird von der FDA auch so registriert worden sein...ich glaube an eine bedingte Zulassung mit weiteren Daten/ Studien im Rahmen einer P4...ich werde kein Stück verkaufen

Da gibts nix mehr zum abwarten!
Sorry GAME OVER!!!
FDA schließt sich bekanntermaßen zu 90 Prozent an!
Sämtliche Analysten haben den Mist zwischen 5-15 Dollar empfohlen! Was soll ich jetzt wieder mit diesen Schwätzern anfangen?
Sorry GAME OVER!!!
FDA schließt sich bekanntermaßen zu 90 Prozent an!
Sämtliche Analysten haben den Mist zwischen 5-15 Dollar empfohlen! Was soll ich jetzt wieder mit diesen Schwätzern anfangen?
...was da ewas von REUTERS zu hören und was ist los bei L&S um 22.22h ....?????
Vielleicht will mir jemand seine wertlosen Aktien morgen verkaufen...für sagen wir 10 Cent, dann seid ihr nach Game Over den Schrott los und müsst euch nicht mehr ärgern

Antwort auf Beitrag Nr.: 58.937.427 von Gustl24 am 11.10.18 22:50:13Für 10Cent kannst du dir noch im Oktober die Shares an der Börse kaufen!
Das war der Todesstoß, die Firma kann ohne Zulassung sofort Konkurs anmelden sonst wäre es eine klassische Insolvenz-Verschleppung!
Das war der Todesstoß, die Firma kann ohne Zulassung sofort Konkurs anmelden sonst wäre es eine klassische Insolvenz-Verschleppung!
Pescados weisst du überhaupt, was du schreibst? Weisst du, wieviel,Geld sie in der Kasse haben ?
Das Produkt ist nicht krachend gescheitert, sondern hat mit Nachbesserungen bessere Perspektiven als vorher.
Das Produkt ist nicht krachend gescheitert, sondern hat mit Nachbesserungen bessere Perspektiven als vorher.
Die haben bis jetzt noch nie ein Geld verdient! Was in Forschung, Vertrieb, Marketing und Personal aufgeht, dass frisst die paar Kröten bald weg!
Voting ganz knapp verloren, der Kurs kommt trotzdem Nachbörslich nicht unter die Räder
Leichtes Minus von 10% und Tendenz steigend
Cash pro Share 0,89 usd
Denke morgen steht sie höher als heute
Weiteres Meeting mit FDA terminiert.. noch ist alles offen.
Leichtes Minus von 10% und Tendenz steigend
Cash pro Share 0,89 usd
Denke morgen steht sie höher als heute
Weiteres Meeting mit FDA terminiert.. noch ist alles offen.
Antwort auf Beitrag Nr.: 58.937.874 von File083 am 11.10.18 23:58:42Woher hast du die Information her das weitere meetings stattfinden werden?
Es entbehrt nicht einer gewissen Ironie, dass am Ende Argumente wie „Leute könnten meinen es wäre sicherer als Morphin und deshalb ist das Missbrauchsrisiko höher“ zu dem negativen Abstimmungsergebnis geführt haben.
Zukünftig sollte man vor dem Panel also alles so Darstellen als sei es brandgefährlich. Obwohl, dann stimmen sie auch mit nein, oder? Wie bei den Hexen früher...
Naja, es war nur Spiel- und Lehrgeld. Ich lass es erstmal liegen bis PDUFA im November und dann sehen wir weiter.
Zukünftig sollte man vor dem Panel also alles so Darstellen als sei es brandgefährlich. Obwohl, dann stimmen sie auch mit nein, oder? Wie bei den Hexen früher...
Naja, es war nur Spiel- und Lehrgeld. Ich lass es erstmal liegen bis PDUFA im November und dann sehen wir weiter.
Jetzt bring ich noch die alte Leier der Übernahme ins Spiel ...:
...:
Die neue CEO Ms. Bourdow hat 20 Jahre für Merck gearbeitet, war dann Vice President of Marketing bei Cubist Pharma- Cubist Pharma wurde dann wenig später von Merck aufgekauft...
Die MK von Trevena ist geradezu lächerlich...undundund ...nun genug der Spekulationen, aber hier ist noch viel möglich, auch wenn mir ein 9:6 Yes gestern lieber gewesen wäre!
 ...:
...:Die neue CEO Ms. Bourdow hat 20 Jahre für Merck gearbeitet, war dann Vice President of Marketing bei Cubist Pharma- Cubist Pharma wurde dann wenig später von Merck aufgekauft...
Die MK von Trevena ist geradezu lächerlich...undundund ...nun genug der Spekulationen, aber hier ist noch viel möglich, auch wenn mir ein 9:6 Yes gestern lieber gewesen wäre!
Au ja! Bayer hat auch eine schwache Pipeline und hierfür hätten Sie schon noch genug Geld.
Trevena Class Action Klage
NEW YORK , October 11, 2018 / PRNewswire / - Bernstein Liebhard LLP, eine auf nationaler Ebene anerkannte Anwaltskanzlei, gibt bekannt, dass eine Klage wegen Wertpapierklagen im Namen derjenigen, die die Wertpapiere von Trevena, Inc. gekauft oder erworben haben, eingereicht wurde. ("Trevena" oder das "Unternehmen") (NASDAQ: TRVN) zwischen dem 2. Mai 2016 und dem 8. Oktober 2018 , beide Daten einschließlich (der "Klassenzeitraum"). Die Klage zielt darauf ab, die Investitionsverluste der Trevena-Aktionäre wieder einzubringen.Bernstein Liebhard LLP. (PRNewsFoto/Bernstein Liebhard LLP) (PRNewsfoto/Bernstein Liebhard LLP)
Wenn Sie Trevena-Wertpapiere gekauft haben und / oder Ihre Rechte und Optionen besprechen möchten, besuchen Sie bitte die Trevena Aktionärsklassen-Klage oder kontaktieren Sie Daniel Sadeh gebührenfrei unter (877) 779-1414 oder dsadeh@bernlieb.com .
Laut der Klage verleitete Trevena seine Aktionäre zu der Annahme, dass das Treffen der "End-of-Phase 2" am 28. April 2016 mit der amerikanischen Gesundheitsbehörde FDA ("Food and Drug Administration") weit erfolgreicher war als es tatsächlich war. Das Unternehmen veröffentlichte am 2. Mai 2016 eine Pressemitteilung mit dem Titel "Trevena kündigt erfolgreichen Abschluss der Phase-2-Sitzung mit der FDA an und skizziert das Phase-3-Programm für Oliceridin" und gab bekannt, dass es "allgemeine Zustimmung" erreicht habe. mit der FDA zu Schlüsselelementen seines Phase-3-Programms für Oliceridin (TRV130) und war mit dem Ergebnis seiner Gespräche mit der FDA "sehr zufrieden".
In der Tat, am 9. Oktober 2018 , Minuten von der FDA-Sitzung am 28. April 2016 mit Trevena wurden veröffentlicht und zeigten, dass die FDA:
"stimmte der vorgeschlagenen Dosierung in den Phase-3-Studien nicht zu";
"stimmte dem vorgeschlagenen primären Endpunkt nicht zu"; und
"stimmte nicht mit der vorgeschlagenen Nichtunterlegenheit (NI) für den Vergleich von Morphin mit Oliceridin überein."
Nach diesen Nachrichten fiel die Trevena-Aktie in den nächsten zwei Handelstagen um 2,04 US-Dollar oder über 68 Prozent und schloss am 10. Oktober 2018 bei 0,947 US-Dollar, was den Anlegern schadete.
Wenn Sie als Hauptkläger auftreten möchten, müssen Sie das Gericht spätestens am 10. Dezember 2018 abordnen. Ein Hauptkläger ist eine repräsentative Partei, die im Namen anderer Klassenmitglieder den Prozess leitet. Ihre Fähigkeit, sich an einer Wiederherstellung zu beteiligen, erfordert nicht, dass Sie als Hauptkläger dienen. Wenn Sie nichts unternehmen, können Sie ein abwesendes Mitglied bleiben.
Wenn Sie Trevena-Wertpapiere gekauft haben und / oder Ihre Rechte und Optionen besprechen möchten, besuchen Sie bitte https://www.bernlieb.com/cases/trevena-inc-trvn-lawsuit-clas… / oder kontaktieren Sie Daniel Sadeh gebührenfrei unter (877) 779-1414 oder dsadeh@bernlieb.com .
Seit 1993 hat Bernstein Liebhard LLP für seine Kunden über 3,5 Milliarden Dollar zurückgewonnen . Neben der Vertretung von Privatanlegern wurde die Kanzlei von einigen der größten öffentlichen und privaten Pensionsfonds des Landes beaufsichtigt, um ihre Vermögenswerte zu überwachen und Rechtsstreitigkeiten in ihrem Namen zu verfolgen. Aufgrund des Erfolgs von Hunderten von Klagen und Sammelklagen wurde die Kanzlei 13 Mal in die "Hotelliste der Kläger" aufgenommen und zehn Jahre in The Legal 500 geführt .
Anwalt Werbung. © 2018 Bernstein Liebhard LLP. Die für diese Werbung verantwortliche Anwaltskanzlei ist Bernstein Liebhard LLP, 10 East 40. Straße, New York, New York 10016, (212) 779-1414. Der Anwalt, der für diese Werbung im Bundesstaat Connecticut verantwortlich ist, ist Michael S. Bigin. Frühere Ergebnisse garantieren oder prognostizieren kein ähnliches Ergebnis in Bezug auf zukünftige Angelegenheiten.
Kontaktinformation
Daniel Sadeh
Bernstein Liebhard LLP
http://www.bernlieb.com
(877) 779-1414
dsadeh@bernlieb.com
Original-Content zum Download von Multimedia anzeigen: http://www.prnewswire.com/news-releases/trevena-class-action… -been-eingereicht-gegen-trevena-inc - trvn-300729966.html
QUELLE Bernstein Liebhard LLP
Der Anschlag ist völlig überzogen... später stehen wir wieder bei 0,9... Kursziel war ein 1 Dollar beim scheidern des gestrigen Votums...das wurde ja schon davor erreicht.. Wichtig ist die Entscheidung in 2 Wochen.
Keine Chance auf Zulassung.Hab euch doch gesagt nur
Kohle macherei.Leider.mfg
Kohle macherei.Leider.mfg
Antwort auf Beitrag Nr.: 58.938.723 von onkelen am 12.10.18 08:13:01Kann die scheisse nicht mehr lesen wurde schon 30x mitgeteilt.........was soll das bitte schön??????
Ja, Ja.....jetzt wird geklagt....lach!!!!!! Ich denke Trevena läßt sich nicht die Butter vom Brot nehmen und sooooo niederschmetternd war die Abstimmung und die Argumentation nun mal auch nicht.
Die werden dran arbeiten und vielleicht noch eine Phase 4 überdenken, den Kapitalgeber wird es schon noch geben...würde ich drauf wetten.
Ja, Ja.....jetzt wird geklagt....lach!!!!!! Ich denke Trevena läßt sich nicht die Butter vom Brot nehmen und sooooo niederschmetternd war die Abstimmung und die Argumentation nun mal auch nicht.
Die werden dran arbeiten und vielleicht noch eine Phase 4 überdenken, den Kapitalgeber wird es schon noch geben...würde ich drauf wetten.
Antwort auf Beitrag Nr.: 58.938.783 von bernstein789 am 12.10.18 08:20:28Und um das vorweg zunehmen ich bin hier mit einen fünfstelligen Betrag drinnen und bin richtig im minus aber deswegen gleich rumzujaulen und alles schlecht reden....das geht nicht. Jeder weiß für sich das man mit den Pharmabuden Geld verdienen aber auch verlieren kann. Sonst würde die Börse ja nur eine Richtung gehen....so ein Quatsch.
Antwort auf Beitrag Nr.: 58.938.783 von bernstein789 am 12.10.18 08:20:28Bei den Klagen gibt es genau einen Gewinner: den Anwalt. Zahlenbeispiel:
Er sucht 1000 Kläger, die glauben, 10.000$ verloren zu haben. Dann schließt er einen Vergleich bei dem jedem 1.000$ zugesprochen werden, von denen er dann 800$ behält. Macht -1.000.000$ für das Unternehmen, +800.000$ für den Anwalt mit wenig Aufwand und +200$ für den Kläger, der sich wundert, wieso er keine 10.000$ bekommt, wo er doch recht hatte.
Er sucht 1000 Kläger, die glauben, 10.000$ verloren zu haben. Dann schließt er einen Vergleich bei dem jedem 1.000$ zugesprochen werden, von denen er dann 800$ behält. Macht -1.000.000$ für das Unternehmen, +800.000$ für den Anwalt mit wenig Aufwand und +200$ für den Kläger, der sich wundert, wieso er keine 10.000$ bekommt, wo er doch recht hatte.
Antwort auf Beitrag Nr.: 58.938.915 von deRendite am 12.10.18 08:31:27So sieht es aus......korrekt!!!!
Antwort auf Beitrag Nr.: 58.938.849 von bernstein789 am 12.10.18 08:26:43
Genau. Und deshalb teilt man das Geld auf mehrere auf. Wenn einer fliegt, passt das am Ende.
Zitat von bernstein789: Jeder weiß für sich das man mit den Pharmabuden Geld verdienen aber auch verlieren kann.
Genau. Und deshalb teilt man das Geld auf mehrere auf. Wenn einer fliegt, passt das am Ende.
Antwort auf Beitrag Nr.: 58.938.915 von deRendite am 12.10.18 08:31:27
Ihr habt wohl alle nicht "Erin Brokovic" gesehen?
 80% halte ich für völlig überzogen, aber einen hohen %-Satz schon. Was passiert, wenn der Anwalt verliert?
80% halte ich für völlig überzogen, aber einen hohen %-Satz schon. Was passiert, wenn der Anwalt verliert? 

Zitat von deRendite: Bei den Klagen gibt es genau einen Gewinner: den Anwalt. Zahlenbeispiel:
Er sucht 1000 Kläger, die glauben, 10.000$ verloren zu haben. Dann schließt er einen Vergleich bei dem jedem 1.000$ zugesprochen werden, von denen er dann 800$ behält. Macht -1.000.000$ für das Unternehmen, +800.000$ für den Anwalt mit wenig Aufwand und +200$ für den Kläger, der sich wundert, wieso er keine 10.000$ bekommt, wo er doch recht hatte.
Ihr habt wohl alle nicht "Erin Brokovic" gesehen?

 80% halte ich für völlig überzogen, aber einen hohen %-Satz schon. Was passiert, wenn der Anwalt verliert?
80% halte ich für völlig überzogen, aber einen hohen %-Satz schon. Was passiert, wenn der Anwalt verliert? 

Antwort auf Beitrag Nr.: 58.938.942 von deRendite am 12.10.18 08:33:27Das kannst du aber vielen nicht klar machen.....hier sind auch viele Taschengeldzocker dabei die meinen direkt mal eben 300% machen zu können. Die Realität sieht anders aus!!!
Antwort auf Beitrag Nr.: 58.937.244 von Gustl24 am 11.10.18 22:33:26
...wie bereits erwähnt, ist die FDA in keiner Weise an das Votum gebunden. Im Falle von Provenge, dem ersten Vaccin in der therapeutischen Onkologie, genügte ein 17:0 bzw. 13:4 beim AC nicht, um eine Zulassung zu erhalten. Im gestrigen AC, bzw. bei den Briefing Documents auch, gab es mehrfach Konfusion...sogar bei den Angestellten der Arzneimittelbehörde, so dass ein solches Abstimmungsergebnis (7:8 oder 8:7) für die FDA nicht wirklich von entscheidender Bedeutung sein kann. Vielmehr werden Pro und Contra auf den Tisch kommen, um dann ein abschliessendes Urteil zu fällen. Ein nahezu einstimmiges Urteil der Expertenrunde ist für die Entscheidungsfindung der FDA sicherlich von Vorteil, jedoch dem zitierten Bsp. (Provenge) folgend, nicht unbedingt zwingend. Wie der Vorsitzende des AC (Kevin Zacharoff) abschliessend festgestellt hat, erleichtert dieses Abstimmungsergebnis die Entscheidungsfindung nicht wesentlich und doch wurden Argumente getauscht, die bei dieser Berücksichtigung finden werden. Wichtig für das weitere Vorgehen wäre, schnellstmöglich das Protokoll des AC zu bekommen. Ayber das dauert, wenn mich meine Erinnerung nicht im Stich lässt, ungefähr 4 Wochen - das reicht nicht vor PDUFA.
Das Abstimmungsergebnis kommt in Teilen zumindest nicht überraschend. Wie bereits im Vorfeld vermutet, war davon auszugehen, dass ein Biostatistiker seine Zustimmung verweigert (weil zB Atemdepression nicht stat signifikant nachgewiesen wurde), die Anästhesisten diese Tendenz der verminderten Atemdepression jedoch wohlwollend zur Kenntnis nehmen. Übelkeit und Kotzeritis ist ebenso für den Anästhesisten, der mit dem Patienten "arbeitet", von grösserer Bedeutung als für den Hepatologen, für den wahrscheinlich das Signal der Lebertox von grösserer Bedeutung ist.
Wie weiter?
Nachdem sich meine Erwartungen (50/50) im Abstimmungsergebnis (7:8) wiederfinden, bin ich noch unschlüssig, wie ich mit meinen 15.000 Aktien umgehen soll. Bei einem 9:6 wäre der Kurs sicherlich gestiegen und man hätte mit einem Teilverkauf die Position absichern können.
Nun werde ich bemüht sein, das Abstimmungsverhalten mit Begründung der AC-Mitglieder ausfindig zu machen (auch ohne FDA-Protokoll). Falls die Praktiker aus der Anästhesie sich mehrheitlich für Zulassung ausgesprochen haben, wird dies meine Entscheidung beeinflussen.
Zitat von Gustl24: "...i am not sure you made our job any easier, but I think that you gave us a lot to think about..."
Dies waren die Abschlussworte der FDA AC!
Man spricht von 3-4 no votes, welche auch sehr nahe am yes waren...dies wird von der FDA auch so registriert worden sein...ich glaube an eine bedingte Zulassung mit weiteren Daten/ Studien im Rahmen einer P4...ich werde kein Stück verkaufen
...wie bereits erwähnt, ist die FDA in keiner Weise an das Votum gebunden. Im Falle von Provenge, dem ersten Vaccin in der therapeutischen Onkologie, genügte ein 17:0 bzw. 13:4 beim AC nicht, um eine Zulassung zu erhalten. Im gestrigen AC, bzw. bei den Briefing Documents auch, gab es mehrfach Konfusion...sogar bei den Angestellten der Arzneimittelbehörde, so dass ein solches Abstimmungsergebnis (7:8 oder 8:7) für die FDA nicht wirklich von entscheidender Bedeutung sein kann. Vielmehr werden Pro und Contra auf den Tisch kommen, um dann ein abschliessendes Urteil zu fällen. Ein nahezu einstimmiges Urteil der Expertenrunde ist für die Entscheidungsfindung der FDA sicherlich von Vorteil, jedoch dem zitierten Bsp. (Provenge) folgend, nicht unbedingt zwingend. Wie der Vorsitzende des AC (Kevin Zacharoff) abschliessend festgestellt hat, erleichtert dieses Abstimmungsergebnis die Entscheidungsfindung nicht wesentlich und doch wurden Argumente getauscht, die bei dieser Berücksichtigung finden werden. Wichtig für das weitere Vorgehen wäre, schnellstmöglich das Protokoll des AC zu bekommen. Ayber das dauert, wenn mich meine Erinnerung nicht im Stich lässt, ungefähr 4 Wochen - das reicht nicht vor PDUFA.
Das Abstimmungsergebnis kommt in Teilen zumindest nicht überraschend. Wie bereits im Vorfeld vermutet, war davon auszugehen, dass ein Biostatistiker seine Zustimmung verweigert (weil zB Atemdepression nicht stat signifikant nachgewiesen wurde), die Anästhesisten diese Tendenz der verminderten Atemdepression jedoch wohlwollend zur Kenntnis nehmen. Übelkeit und Kotzeritis ist ebenso für den Anästhesisten, der mit dem Patienten "arbeitet", von grösserer Bedeutung als für den Hepatologen, für den wahrscheinlich das Signal der Lebertox von grösserer Bedeutung ist.
Wie weiter?
Nachdem sich meine Erwartungen (50/50) im Abstimmungsergebnis (7:8) wiederfinden, bin ich noch unschlüssig, wie ich mit meinen 15.000 Aktien umgehen soll. Bei einem 9:6 wäre der Kurs sicherlich gestiegen und man hätte mit einem Teilverkauf die Position absichern können.
Nun werde ich bemüht sein, das Abstimmungsverhalten mit Begründung der AC-Mitglieder ausfindig zu machen (auch ohne FDA-Protokoll). Falls die Praktiker aus der Anästhesie sich mehrheitlich für Zulassung ausgesprochen haben, wird dies meine Entscheidung beeinflussen.
Antwort auf Beitrag Nr.: 58.938.987 von Cyberhexe am 12.10.18 08:39:26Guten Morgen.......deine Meinung ist mir wichtig, ich verfolge ganze Zeit deine ausführlichen Darstellungen und wenn hier einer Ahnung hat dann bist du das......Punkt
bin auch mal rein mit ner kleinen posi bei 57 allerdings nur als zock. begründung..wenn die hexe recht behält und es hintenrum noch um nachbesserungen geht und die dann passen, könnte das ganze doch noch positiv enden und darauf zock ich mal.
falls nicht siehts mau aus.die anderen 2 befinden sich erst in phase 1.....und das kann dauern!!!
falls nicht siehts mau aus.die anderen 2 befinden sich erst in phase 1.....und das kann dauern!!!
Antwort auf Beitrag Nr.: 58.938.987 von Cyberhexe am 12.10.18 08:39:26Ich werde meine Anteile erst einmal halten wobei ich die Situation nicht so gut einschätzen kann wie du. Daher orientiere ich mich auch auf deine Informationen. Natürlich ist jeder für seine Investition selber verantwortlich.
An dieser stelle möchteich nochmal danke sagen. Mit deinen Beiträgen gestern hast du es ganz schön spannend gemacht
An dieser stelle möchteich nochmal danke sagen. Mit deinen Beiträgen gestern hast du es ganz schön spannend gemacht

...also es hätte ehrlich gesagt noch schlimmer werden können und bin jetzt nur noch gespannt auf den 1.11. wobei es da für mich 3 verschiedene varianten geben sollte 1. ABLEHNUNG 2. ZULASSUNG MIT ERHEBLICHEN EINSCHRÄNKUNGEN 3. EHRENRUNDE ( PH4 )
Antwort auf Beitrag Nr.: 58.939.464 von Aktapot am 12.10.18 09:15:46Trevena würde doch gestern nachbörslich gehandelt 3,3 mio Stücke
Low war 0,56 high war 0,9496
geschlossen 0,7875
wobei die lows die ersten fünf kurse waren
danach ist sie nur noch gestiegen
oder hab ich da was falsch gelesen ?
Low war 0,56 high war 0,9496
geschlossen 0,7875
wobei die lows die ersten fünf kurse waren
danach ist sie nur noch gestiegen
oder hab ich da was falsch gelesen ?
.....wobei ich meine 5.000shares natürlich halten werde.....aber n m M.
Vor und nachbörslich wird immer übertrieben dass liegt am Volumen,
bei Tradegate und Co. ist es noch krasser.
Die Chancen für eine Zulassung sind immer noch intakt, 49% zu 51%.
AC Pro und Contra von gestern ist nichts weiteres als eine Risiko-Analyse.
deRendite schrieb: Bei den Klagen gibt es genau einen Gewinner: den Anwalt,
wie Geier stürzen sie sich auf solche Gelegenheiten.
Wenn Trevena doch noch die Zulassung bekommt dann liegt ein dreistelliger % Anstieg bevor.
Das Spiel wird zum Casino,
schönes Wochenende
bei Tradegate und Co. ist es noch krasser.
Die Chancen für eine Zulassung sind immer noch intakt, 49% zu 51%.
AC Pro und Contra von gestern ist nichts weiteres als eine Risiko-Analyse.
deRendite schrieb: Bei den Klagen gibt es genau einen Gewinner: den Anwalt,
wie Geier stürzen sie sich auf solche Gelegenheiten.
Wenn Trevena doch noch die Zulassung bekommt dann liegt ein dreistelliger % Anstieg bevor.
Das Spiel wird zum Casino,
schönes Wochenende
Ich bin in Trevena auch mit einer kleinen Posi investiert und habe mir mit Interesse gestern zum ersten Mal einen Webcast einer solchen "Expertengruppe" angeschaut. Ich bin kein Fachmann im Biotech-Bereich, aber letztendlich - mit gesunden Menschenverstand und Erfahrung bzgl. Meetings in anderen Bereichen - finde ich es schockierend, wie unvorbereitet / inkompetent einige der Kommissions-Mitglieder wirkten und mit welch teils nebensächlich oder fadenscheinig wirkenden Argumenten dort einige der Mitglieder mit nein votiert haben, obwohl sie die Wirksamkeit und den Nutzen des Medikamentes grundsätzlich gar nicht in Frage gestellt haben. Wie kann es sein, dass auf diese teils stümperhaft wirkende Weise über jahrelange Arbeit und Entwicklungskosten sowie das Schicksal einer seriösen Firma entschieden wird? Natürlich hat am Ende die FDA noch das letzte Wort, aber trotzdem hat dieses Votum ja einen Einfluss. Hoffen wir, dass die Entscheidungsträger der FDA gestern genau aufgepasst haben und gesehen haben, dass auch der Großteil der Nein-Stimmen im übergeorndeten Sinne - abgesehen von Detail-Aspekten und Zusatzinformationen, die diese Leute erörtert haben - eigentlich auch ein Ja waren. Konsequenterweise müsste die FDA, sofern die Nachforderungswünsche bzgl. Safety-aspekten und Patientengruppen gerechtfertigt sind, auf Nachuntersuchungen im Rahmen einer Phase 4 entscheiden, jedoch nicht das Approval verweigern. Ich wünsche dem Unternehmen Trevena und auch uns Investierten eine gerechte Entscheidung.
Antwort auf Beitrag Nr.: 58.942.002 von Profit2015 am 12.10.18 13:02:48Weil auch in den USA die Drogenkartelle bis in den entscheidenden Gremien ihre schmutzigen Finger drinnen haben!
Niemals würden sie dulden, dass das Geschäft weniger wird...Ungebildete und stümperhaft vorbereitete können auch mit NO stimmen. Das es genügt, hat man ja gestern gesehen.
Darum wird Oli niemals in Trump´s Reich zugelassen werden...! Klingt abenteuerlich, aber alles nachzulesen in den einschlägigen Foren der USA,
Ich persönlich könnte mir das gut vorstellen, erfahren werden wir es vermutlich nie!
Niemals würden sie dulden, dass das Geschäft weniger wird...Ungebildete und stümperhaft vorbereitete können auch mit NO stimmen. Das es genügt, hat man ja gestern gesehen.
Darum wird Oli niemals in Trump´s Reich zugelassen werden...! Klingt abenteuerlich, aber alles nachzulesen in den einschlägigen Foren der USA,
Ich persönlich könnte mir das gut vorstellen, erfahren werden wir es vermutlich nie!
Antwort auf Beitrag Nr.: 58.942.002 von Profit2015 am 12.10.18 13:02:48
...nun ja, man sollte berücksichtigen, dass die FDA in keiner Weise an die EMPFEHLUNG der Experten gebunden ist. Ohne wirklich Einblick in das Innere der Arzneimittelbehörde zu haben, würde ich dennoch vermuten, dass die Aussagen der wenig bis gar nicht vorbereiteten Mitglieder des AC und deren Argumente die letztendliche Entscheidung der FDA überhaupt nicht beeinflussen. Es gibt jedoch immer intensive Diskussionen und Risiko/Nutzenabwägungen, die mit Fakten und Argumenten unterlegt sind, die sehr wohl bei der Entscheidungsfindung berücksichtigt werden. Dies ist auch der Sinn der Einberufung einer solchen Expertenrunde.
Welche Daten könnten denn noch erforderlich sein?
Ich denke, dass mit der ATHENA-Studie die Diversität der Zielgruppe genügend untersucht wurde:
The Company has completed enrollment of patients in the ATHENA study to support its planned NDA submission. In the study, 772 patients were administered OLINVO to manage pain associated with a wide range of procedures and diagnoses. The most frequent procedures were orthopedic, gynecologic, colorectal, general, and plastic surgeries. Patients at risk of opioid-related adverse events were common, including patients over 65 years old and obese patients.
Die verzögerte ventrikuläre Repolarisation bzw. die Beantwortung der Fragen der FDA hiezu ist jedoch noch nicht vollständig abgeschlossen. In den Briefing Documents ist hierzu auf Seite 88 folgendes nachzulesen:

Möglicherweise sehe ich da einen kleinen Hoffnugsstreifen, der die FDA veranlassen könnte, die PDUFA um 3 Monate zu verschieben, um den Abschluss dieser Ermittlungen abzuwarten. Das wäre SUPI!
Zitat von Profit2015: Ich bin in Trevena auch mit einer kleinen Posi investiert und habe mir mit Interesse gestern zum ersten Mal einen Webcast einer solchen "Expertengruppe" angeschaut. Ich bin kein Fachmann im Biotech-Bereich, aber letztendlich - mit gesunden Menschenverstand und Erfahrung bzgl. Meetings in anderen Bereichen - finde ich es schockierend, wie unvorbereitet / inkompetent einige der Kommissions-Mitglieder wirkten und mit welch teils nebensächlich oder fadenscheinig wirkenden Argumenten dort einige der Mitglieder mit nein votiert haben, obwohl sie die Wirksamkeit und den Nutzen des Medikamentes grundsätzlich gar nicht in Frage gestellt haben. Wie kann es sein, dass auf diese teils stümperhaft wirkende Weise über jahrelange Arbeit und Entwicklungskosten sowie das Schicksal einer seriösen Firma entschieden wird? Natürlich hat am Ende die FDA noch das letzte Wort, aber trotzdem hat dieses Votum ja einen Einfluss. Hoffen wir, dass die Entscheidungsträger der FDA gestern genau aufgepasst haben und gesehen haben, dass auch der Großteil der Nein-Stimmen im übergeorndeten Sinne - abgesehen von Detail-Aspekten und Zusatzinformationen, die diese Leute erörtert haben - eigentlich auch ein Ja waren. Konsequenterweise müsste die FDA, sofern die Nachforderungswünsche bzgl. Safety-aspekten und Patientengruppen gerechtfertigt sind, auf Nachuntersuchungen im Rahmen einer Phase 4 entscheiden, jedoch nicht das Approval verweigern. Ich wünsche dem Unternehmen Trevena und auch uns Investierten eine gerechte Entscheidung.
...nun ja, man sollte berücksichtigen, dass die FDA in keiner Weise an die EMPFEHLUNG der Experten gebunden ist. Ohne wirklich Einblick in das Innere der Arzneimittelbehörde zu haben, würde ich dennoch vermuten, dass die Aussagen der wenig bis gar nicht vorbereiteten Mitglieder des AC und deren Argumente die letztendliche Entscheidung der FDA überhaupt nicht beeinflussen. Es gibt jedoch immer intensive Diskussionen und Risiko/Nutzenabwägungen, die mit Fakten und Argumenten unterlegt sind, die sehr wohl bei der Entscheidungsfindung berücksichtigt werden. Dies ist auch der Sinn der Einberufung einer solchen Expertenrunde.
Welche Daten könnten denn noch erforderlich sein?
Ich denke, dass mit der ATHENA-Studie die Diversität der Zielgruppe genügend untersucht wurde:
The Company has completed enrollment of patients in the ATHENA study to support its planned NDA submission. In the study, 772 patients were administered OLINVO to manage pain associated with a wide range of procedures and diagnoses. The most frequent procedures were orthopedic, gynecologic, colorectal, general, and plastic surgeries. Patients at risk of opioid-related adverse events were common, including patients over 65 years old and obese patients.
Die verzögerte ventrikuläre Repolarisation bzw. die Beantwortung der Fragen der FDA hiezu ist jedoch noch nicht vollständig abgeschlossen. In den Briefing Documents ist hierzu auf Seite 88 folgendes nachzulesen:

Möglicherweise sehe ich da einen kleinen Hoffnugsstreifen, der die FDA veranlassen könnte, die PDUFA um 3 Monate zu verschieben, um den Abschluss dieser Ermittlungen abzuwarten. Das wäre SUPI!
Antwort auf Beitrag Nr.: 58.942.077 von PESCADOS am 12.10.18 13:11:49
...ich glaube nicht an solche Verschwörungstheorien! Die Aussagen der schlecht vorbereiteten bzw. inkompetenten Mitglieder der Expertenrunde werden bei der Entscheidungsfindung schlussendlich einfach unberücksichtigt bleiben.
Vielmehr sollte man sich an den Briefings der FDA hinsichtlich Arzneimittelsicherheit orientieren:

- Das Signal der Lebertox sollte durch die Abklärung der externen Experten gelöst sein und war auch nie ein besonderer Knackpunkt während des AC
- die verzögerte ventrikuläre Repolarisation ist noch in Abklärung und ein Berichtsentwurf ist bereits bei der FDA eingegangen
- die Atmungsdepression ist tendenziell günstiger als bei Morphin. Wäre dieser Nachweis mit statistischer Signifikanz gelungen, würde man die Zulassung sicherlich nicht mehr in Frage stellen; Sollte die FDA diesen Nachweis verlangen, dann wird sie einen CRL (Complete Response Letter) verschicken (also eine Nichtzulassung). Das wäre der schlechteste Fall, denn eine zusätzliche Studie dauert und ist teuer. Natürlich dauert diese nicht so lange wie bspw. eine onkologische Studie, in welcher das Ergebnis (Survival) erst nach einer längeren Beobachtungszeit festzustellen ist, dennoch würde eine solche Studie eine mögliche Zulassung um schätzungsweise 2 Jahre verzögern
- bleibt noch die Möglichkeit einer bedingten Zulassung, also einer Studie nach Marktzulassung (Postmarketing Study oder ph4-Studie) - das wäre wohl das BEST CASE SZENARIO!
Zitat von PESCADOS: Weil auch in den USA die Drogenkartelle bis in den entscheidenden Gremien ihre schmutzigen Finger drinnen haben!
Niemals würden sie dulden, dass das Geschäft weniger wird...Ungebildete und stümperhaft vorbereitete können auch mit NO stimmen. Das es genügt, hat man ja gestern gesehen.
Darum wird Oli niemals in Trump´s Reich zugelassen werden...! Klingt abenteuerlich, aber alles nachzulesen in den einschlägigen Foren der USA,
Ich persönlich könnte mir das gut vorstellen, erfahren werden wir es vermutlich nie!
...ich glaube nicht an solche Verschwörungstheorien! Die Aussagen der schlecht vorbereiteten bzw. inkompetenten Mitglieder der Expertenrunde werden bei der Entscheidungsfindung schlussendlich einfach unberücksichtigt bleiben.
Vielmehr sollte man sich an den Briefings der FDA hinsichtlich Arzneimittelsicherheit orientieren:

- Das Signal der Lebertox sollte durch die Abklärung der externen Experten gelöst sein und war auch nie ein besonderer Knackpunkt während des AC
- die verzögerte ventrikuläre Repolarisation ist noch in Abklärung und ein Berichtsentwurf ist bereits bei der FDA eingegangen
- die Atmungsdepression ist tendenziell günstiger als bei Morphin. Wäre dieser Nachweis mit statistischer Signifikanz gelungen, würde man die Zulassung sicherlich nicht mehr in Frage stellen; Sollte die FDA diesen Nachweis verlangen, dann wird sie einen CRL (Complete Response Letter) verschicken (also eine Nichtzulassung). Das wäre der schlechteste Fall, denn eine zusätzliche Studie dauert und ist teuer. Natürlich dauert diese nicht so lange wie bspw. eine onkologische Studie, in welcher das Ergebnis (Survival) erst nach einer längeren Beobachtungszeit festzustellen ist, dennoch würde eine solche Studie eine mögliche Zulassung um schätzungsweise 2 Jahre verzögern
- bleibt noch die Möglichkeit einer bedingten Zulassung, also einer Studie nach Marktzulassung (Postmarketing Study oder ph4-Studie) - das wäre wohl das BEST CASE SZENARIO!
Antwort auf Beitrag Nr.: 58.942.977 von Cyberhexe am 12.10.18 14:25:40Mir fehlt bis dato ein aussagekräftiges Statement vom betroffenen Unternehmen für all seine Shareholder !
Wie siehst du das weitere Asiengeschäft Cyberhexe?
Da gibts doch schon Verträge!
Wie siehst du das weitere Asiengeschäft Cyberhexe?
Da gibts doch schon Verträge!
Antwort auf Beitrag Nr.: 58.942.977 von Cyberhexe am 12.10.18 14:25:40wow:
ATHENA Open Label Safety Study of OLINVO
• Postoperative nausea and vomiting in patients receiving parenteral opioids occurs in 44-72% of patients and costs $1,600-$8,900 per event across specialties.
• Postoperative respiratory compromise occurs in 3-17% of patients and costs $4,600-$20,000 per event across specialties.
ATHENA Open Label Safety Study of OLINVO
• Postoperative nausea and vomiting in patients receiving parenteral opioids occurs in 44-72% of patients and costs $1,600-$8,900 per event across specialties.
• Postoperative respiratory compromise occurs in 3-17% of patients and costs $4,600-$20,000 per event across specialties.
Unter https://www.mckinsey.com/~/media/McKinsey/dotcom/client_serv… gibt es eine Studie zu ACs und den letzlichen Approvals.
Interessant ist z.B. Seite 3. Wenn ich dort das mittlere Diagramm ansehe, dann sagt das, dass in 68% der betrachteten 63 Fälle ein klares "Yes" im AC rauskam und in 19% der Fälle ein klares "No". Das sind nach Adam Riese zufällig genau 43 und 12 Fälle, also genau so viele, wie Fälle in denen laut dem ersten Diagramm die FDA dem AC in der Entscheidung gefolgt ist. Angenommen, in allen diesen klaren Fällen ist die FDA dem AC gefolgt (ich weiß, das stimmt nicht ganz, aber meistens schon), dann würde das bedeuten, dass in ALLEN 8 Fällen, in denen das AC nur eine knappe Mehrheit für oder gegen die Zulassung hatte, die FDA am Ende anders entschieden hat, als die knappe Mehrheit empfohlen hat! Nochmal: Ich weiß, das gilt nur, wenn nicht klare "Yes" oder "No" Empfehlungen der ACs überstimmt wurden, was in der Vergangenheit auch passiert ist, aber eben nur sehr selten. Es gibt jedenfalls etwas Hoffnung!
Interessant ist z.B. Seite 3. Wenn ich dort das mittlere Diagramm ansehe, dann sagt das, dass in 68% der betrachteten 63 Fälle ein klares "Yes" im AC rauskam und in 19% der Fälle ein klares "No". Das sind nach Adam Riese zufällig genau 43 und 12 Fälle, also genau so viele, wie Fälle in denen laut dem ersten Diagramm die FDA dem AC in der Entscheidung gefolgt ist. Angenommen, in allen diesen klaren Fällen ist die FDA dem AC gefolgt (ich weiß, das stimmt nicht ganz, aber meistens schon), dann würde das bedeuten, dass in ALLEN 8 Fällen, in denen das AC nur eine knappe Mehrheit für oder gegen die Zulassung hatte, die FDA am Ende anders entschieden hat, als die knappe Mehrheit empfohlen hat! Nochmal: Ich weiß, das gilt nur, wenn nicht klare "Yes" oder "No" Empfehlungen der ACs überstimmt wurden, was in der Vergangenheit auch passiert ist, aber eben nur sehr selten. Es gibt jedenfalls etwas Hoffnung!
.....protektionismus , zynismus , fetternwirtschaft , mauschelei und heuchelei sind eben die mütter der FDA......von koruption ganz zu schweigen........tut mir leid , aber bekannt auf der ganzen welt....!!!!!
Antwort auf Beitrag Nr.: 58.944.081 von herthafan am 12.10.18 16:07:47 fetternwirtschaft
Ich kenne nur Vetternwirtschaft obwohl fett dann sicher auch auf die gevetterten zutreffen dürfte
obwohl fett dann sicher auch auf die gevetterten zutreffen dürfte

Ich kenne nur Vetternwirtschaft
 obwohl fett dann sicher auch auf die gevetterten zutreffen dürfte
obwohl fett dann sicher auch auf die gevetterten zutreffen dürfte
hab meinen Durchschnitt auf ein Wert herunter gedrückt, den der Kurs
die nächsten Tage/Wochen vor der FDA Entscheidung nochmal erreichen könnte.
min 1USD bis 1,20 sollten möglich sein, vermute ich.
dann raus mit einem blauen Auge und gut iss.
So iss mal mein Plan
die nächsten Tage/Wochen vor der FDA Entscheidung nochmal erreichen könnte.
min 1USD bis 1,20 sollten möglich sein, vermute ich.
dann raus mit einem blauen Auge und gut iss.
So iss mal mein Plan

Antwort auf Beitrag Nr.: 58.944.081 von herthafan am 12.10.18 16:07:47Ich kenne solche Entscheidungen aus eigener Erfahrung, arbeitete 18 Jahre für
ein Implantat Hersteller. Risiko-Analysen mit Behörden-Teilnehmer sind nicht immer Objektiv,
sie zeigen ihre Macht und ihre persönliche unwiderrufliche Einstellung.
TRVN wird in den nächsten Tagen um dem Market Cap von $65Mio. dahin tümpeln.
ein Implantat Hersteller. Risiko-Analysen mit Behörden-Teilnehmer sind nicht immer Objektiv,
sie zeigen ihre Macht und ihre persönliche unwiderrufliche Einstellung.
TRVN wird in den nächsten Tagen um dem Market Cap von $65Mio. dahin tümpeln.
News Story
Search Company
10/12/2018 04:01:00 PM
Trevena to Present Phase 3, Open-Label Safety Study of Oliceridine at the American Society of Anesthesiologists Annual Meeting
By GlobeNewswire
CHESTERBROOK, Pa., Oct. 12, 2018 (GLOBE NEWSWIRE) -- Trevena, Inc. (NASDAQ:TRVN) today announced a poster presentation at ANESTHESIOLOGY® 2018, the national conference for the American Society of Anesthesiologists (ASA), taking place in San Francisco, CA, from October 13 - 17, 2018.
The poster presentation highlights data from a large, open-label safety study evaluating oliceridine under conditions intended to emulate real-world practice in hospital patients with moderate to severe acute pain requiring intravenous (IV) opioids across a broad spectrum of surgical and medical conditions.
"There are significant challenges with conventional IV opioids in striking the balance between finding effective pain relief and minimizing treatment-limiting side effects," said Harold S. Minkowitz, M.D., Associate Director, Clinical Research, Division of Anesthesiology and Perioperative Medicine, The University of Texas MD Anderson Cancer Centre. "There have been very few new analgesic options in decades. The data from this study suggests that oliceridine, if approved, may be an important new treatment option in lieu of conventional IV opioids."
Poster presentation: Sunday, October 14th
e-poster presentation (A2174): Athena: A Phase 3, Open-label Safety Study of Oliceridine for the Treatment of Moderate-to-severe Acute Pain. Scheduled to be presented on Sunday, October 14th from 10:00 - 10:30 am on Monitor #02 in the Convention Center room, North, Hall D, Area A, at the Moscone Center.
In the ATHENA open-label safety study, oliceridine was administered to 768 patients with moderate to severe acute pain caused by medical conditions or surgery across 41 sites in the United States. The trial included substantial representation of patients at elevated risk for opioid-related adverse events (ORAEs), with 32% of patients over 65 years old, and more than 50% with body mass index (BMI) over 30 kg/m2. Results of the trial showed that the safety profile of oliceridine, in a broader patient group, is like that demonstrated in the controlled Phase 2 and 3 studies of oliceridine.
About Oliceridine
Oliceridine is a G-protein biased mu-opioid receptor (MOR) ligand in development for the management of moderate to severe acute pain in hospitals or other controlled clinical settings and where intravenous (IV) therapy is warranted. It is a new chemical entity with a novel mechanism of action that enables more selective targeting of newly discovered pathways with the potential for fewer side effects. Oliceridine is an investigational product and has not been approved by the FDA or any other regulatory agency. If approved, the Company has requested that oliceridine be classified as a Schedule II controlled substance.
About Trevena
Trevena, Inc. is a biopharmaceutical company focused on the development and commercialization of new and innovative treatment options for patients in pain. The Company has discovered three novel and differentiated drug candidates using its proprietary platform, including intravenous (IV) oliceridine, for the management of moderate to severe acute pain in hospitals, TRV250 for the treatment of acute migraine, and TRV734 for pain and/or management of opioid dependence. In its preclinical programs, Trevena is evaluating a set of novel S1P modulators that may offer a new, non-narcotic approach to managing chronic pain.
Cautionary note on forward looking statements
Any statements in this press release about future expectations, plans and prospects for the Company, including statements about the Company's strategy, future operations, clinical development of its therapeutic candidates, plans for potential future product candidates and other statements containing the words "anticipate," "believe," "estimate," "expect," "intend," "may," "plan," "predict," "project," "suggest," "target," "potential," "will," "would," "could," "should," "continue," and similar expressions, constitute forward-looking statements within the meaning of The Private Securities Litigation Reform Act of 1995. Actual results may differ materially from those indicated by such forward-looking statements as a result of various important factors, including: the status, timing, costs, results and interpretation of the Company's clinical trials or any future trials, including whether the data from the ATHENA open-label safety study suggest that oliceridine, if approved, may be an important new treatment option in lieu of conventional opioids; the uncertainties inherent in conducting clinical trials; interpretations of regulatory interactions and expectations for regulatory submissions and approvals; availability of funding sufficient for the Company's foreseeable and unforeseeable operating expenses and capital expenditure requirements; uncertainties related to the Company's intellectual property; other matters that could affect the availability or commercial potential of the Company's therapeutic candidates; and other factors discussed in the Risk Factors set forth in the Company's Annual Report on Form 10-K and Quarterly Reports on Form 10-Q filed with the Securities and Exchange Commission (SEC) and in other filings the Company makes with the SEC from time to time. In addition, the forward-looking statements included in this press release represent the Company's views only as of the date hereof. The Company anticipates that subsequent events and developments may cause the Company's views to change. However, while the Company may elect to update these forward-looking statements at some point in the future, it specifically disclaims any obligation to do so, except as may be required by law.
Contacts
Trevena, Inc.
Investors:
Jonathan Violin, Ph.D.
Senior Vice President, Scientific Affairs & Investor Relations Officer
610-354-8840 x231
jviolin@trevena.com
or
Media:
Public Relations
PR@trevena.com
Source: Trevena Inc.
Quotes From This Article
TRVN$0.8779 0.0691 7.3%
Trevena, Inc.
Home
News
Quotes
Settings
Search Company
10/12/2018 04:01:00 PM
Trevena to Present Phase 3, Open-Label Safety Study of Oliceridine at the American Society of Anesthesiologists Annual Meeting
By GlobeNewswire
CHESTERBROOK, Pa., Oct. 12, 2018 (GLOBE NEWSWIRE) -- Trevena, Inc. (NASDAQ:TRVN) today announced a poster presentation at ANESTHESIOLOGY® 2018, the national conference for the American Society of Anesthesiologists (ASA), taking place in San Francisco, CA, from October 13 - 17, 2018.
The poster presentation highlights data from a large, open-label safety study evaluating oliceridine under conditions intended to emulate real-world practice in hospital patients with moderate to severe acute pain requiring intravenous (IV) opioids across a broad spectrum of surgical and medical conditions.
"There are significant challenges with conventional IV opioids in striking the balance between finding effective pain relief and minimizing treatment-limiting side effects," said Harold S. Minkowitz, M.D., Associate Director, Clinical Research, Division of Anesthesiology and Perioperative Medicine, The University of Texas MD Anderson Cancer Centre. "There have been very few new analgesic options in decades. The data from this study suggests that oliceridine, if approved, may be an important new treatment option in lieu of conventional IV opioids."
Poster presentation: Sunday, October 14th
e-poster presentation (A2174): Athena: A Phase 3, Open-label Safety Study of Oliceridine for the Treatment of Moderate-to-severe Acute Pain. Scheduled to be presented on Sunday, October 14th from 10:00 - 10:30 am on Monitor #02 in the Convention Center room, North, Hall D, Area A, at the Moscone Center.
In the ATHENA open-label safety study, oliceridine was administered to 768 patients with moderate to severe acute pain caused by medical conditions or surgery across 41 sites in the United States. The trial included substantial representation of patients at elevated risk for opioid-related adverse events (ORAEs), with 32% of patients over 65 years old, and more than 50% with body mass index (BMI) over 30 kg/m2. Results of the trial showed that the safety profile of oliceridine, in a broader patient group, is like that demonstrated in the controlled Phase 2 and 3 studies of oliceridine.
About Oliceridine
Oliceridine is a G-protein biased mu-opioid receptor (MOR) ligand in development for the management of moderate to severe acute pain in hospitals or other controlled clinical settings and where intravenous (IV) therapy is warranted. It is a new chemical entity with a novel mechanism of action that enables more selective targeting of newly discovered pathways with the potential for fewer side effects. Oliceridine is an investigational product and has not been approved by the FDA or any other regulatory agency. If approved, the Company has requested that oliceridine be classified as a Schedule II controlled substance.
About Trevena
Trevena, Inc. is a biopharmaceutical company focused on the development and commercialization of new and innovative treatment options for patients in pain. The Company has discovered three novel and differentiated drug candidates using its proprietary platform, including intravenous (IV) oliceridine, for the management of moderate to severe acute pain in hospitals, TRV250 for the treatment of acute migraine, and TRV734 for pain and/or management of opioid dependence. In its preclinical programs, Trevena is evaluating a set of novel S1P modulators that may offer a new, non-narcotic approach to managing chronic pain.
Cautionary note on forward looking statements
Any statements in this press release about future expectations, plans and prospects for the Company, including statements about the Company's strategy, future operations, clinical development of its therapeutic candidates, plans for potential future product candidates and other statements containing the words "anticipate," "believe," "estimate," "expect," "intend," "may," "plan," "predict," "project," "suggest," "target," "potential," "will," "would," "could," "should," "continue," and similar expressions, constitute forward-looking statements within the meaning of The Private Securities Litigation Reform Act of 1995. Actual results may differ materially from those indicated by such forward-looking statements as a result of various important factors, including: the status, timing, costs, results and interpretation of the Company's clinical trials or any future trials, including whether the data from the ATHENA open-label safety study suggest that oliceridine, if approved, may be an important new treatment option in lieu of conventional opioids; the uncertainties inherent in conducting clinical trials; interpretations of regulatory interactions and expectations for regulatory submissions and approvals; availability of funding sufficient for the Company's foreseeable and unforeseeable operating expenses and capital expenditure requirements; uncertainties related to the Company's intellectual property; other matters that could affect the availability or commercial potential of the Company's therapeutic candidates; and other factors discussed in the Risk Factors set forth in the Company's Annual Report on Form 10-K and Quarterly Reports on Form 10-Q filed with the Securities and Exchange Commission (SEC) and in other filings the Company makes with the SEC from time to time. In addition, the forward-looking statements included in this press release represent the Company's views only as of the date hereof. The Company anticipates that subsequent events and developments may cause the Company's views to change. However, while the Company may elect to update these forward-looking statements at some point in the future, it specifically disclaims any obligation to do so, except as may be required by law.
Contacts
Trevena, Inc.
Investors:
Jonathan Violin, Ph.D.
Senior Vice President, Scientific Affairs & Investor Relations Officer
610-354-8840 x231
jviolin@trevena.com
or
Media:
Public Relations
PR@trevena.com
Source: Trevena Inc.
Quotes From This Article
TRVN$0.8779 0.0691 7.3%
Trevena, Inc.
Home
News
Quotes
Settings
Antwort auf Beitrag Nr.: 58.947.759 von PESCADOS am 12.10.18 22:06:37Cyberhexe, nicht schlecht,oder?😙
Antwort auf Beitrag Nr.: 58.947.759 von PESCADOS am 12.10.18 22:06:37
Die geben nicht locker

Zitat von PESCADOS: News Story
Search Company
10/12/2018 04:01:00 PM
Trevena to Present Phase 3, Open-Label Safety Study of Oliceridine at the American Society of Anesthesiologists Annual Meeting
By GlobeNewswire
CHESTERBROOK, Pa., Oct. 12, 2018 (GLOBE NEWSWIRE) -- Trevena, Inc. (NASDAQ:TRVN) today announced a poster presentation at ANESTHESIOLOGY® 2018, the national conference for the American Society of Anesthesiologists (ASA), taking place in San Francisco, CA, from October 13 - 17, 2018.
The poster presentation highlights data from a large, open-label safety study evaluating oliceridine under conditions intended to emulate real-world practice in hospital patients with moderate to severe acute pain requiring intravenous (IV) opioids across a broad spectrum of surgical and medical conditions.
"There are significant challenges with conventional IV opioids in striking the balance between finding effective pain relief and minimizing treatment-limiting side effects," said Harold S. Minkowitz, M.D., Associate Director, Clinical Research, Division of Anesthesiology and Perioperative Medicine, The University of Texas MD Anderson Cancer Centre. "There have been very few new analgesic options in decades. The data from this study suggests that oliceridine, if approved, may be an important new treatment option in lieu of conventional IV opioids."
Poster presentation: Sunday, October 14th
e-poster presentation (A2174): Athena: A Phase 3, Open-label Safety Study of Oliceridine for the Treatment of Moderate-to-severe Acute Pain. Scheduled to be presented on Sunday, October 14th from 10:00 - 10:30 am on Monitor #02 in the Convention Center room, North, Hall D, Area A, at the Moscone Center.
In the ATHENA open-label safety study, oliceridine was administered to 768 patients with moderate to severe acute pain caused by medical conditions or surgery across 41 sites in the United States. The trial included substantial representation of patients at elevated risk for opioid-related adverse events (ORAEs), with 32% of patients over 65 years old, and more than 50% with body mass index (BMI) over 30 kg/m2. Results of the trial showed that the safety profile of oliceridine, in a broader patient group, is like that demonstrated in the controlled Phase 2 and 3 studies of oliceridine.
About Oliceridine
Oliceridine is a G-protein biased mu-opioid receptor (MOR) ligand in development for the management of moderate to severe acute pain in hospitals or other controlled clinical settings and where intravenous (IV) therapy is warranted. It is a new chemical entity with a novel mechanism of action that enables more selective targeting of newly discovered pathways with the potential for fewer side effects. Oliceridine is an investigational product and has not been approved by the FDA or any other regulatory agency. If approved, the Company has requested that oliceridine be classified as a Schedule II controlled substance.
About Trevena
Trevena, Inc. is a biopharmaceutical company focused on the development and commercialization of new and innovative treatment options for patients in pain. The Company has discovered three novel and differentiated drug candidates using its proprietary platform, including intravenous (IV) oliceridine, for the management of moderate to severe acute pain in hospitals, TRV250 for the treatment of acute migraine, and TRV734 for pain and/or management of opioid dependence. In its preclinical programs, Trevena is evaluating a set of novel S1P modulators that may offer a new, non-narcotic approach to managing chronic pain.
Cautionary note on forward looking statements
Any statements in this press release about future expectations, plans and prospects for the Company, including statements about the Company's strategy, future operations, clinical development of its therapeutic candidates, plans for potential future product candidates and other statements containing the words "anticipate," "believe," "estimate," "expect," "intend," "may," "plan," "predict," "project," "suggest," "target," "potential," "will," "would," "could," "should," "continue," and similar expressions, constitute forward-looking statements within the meaning of The Private Securities Litigation Reform Act of 1995. Actual results may differ materially from those indicated by such forward-looking statements as a result of various important factors, including: the status, timing, costs, results and interpretation of the Company's clinical trials or any future trials, including whether the data from the ATHENA open-label safety study suggest that oliceridine, if approved, may be an important new treatment option in lieu of conventional opioids; the uncertainties inherent in conducting clinical trials; interpretations of regulatory interactions and expectations for regulatory submissions and approvals; availability of funding sufficient for the Company's foreseeable and unforeseeable operating expenses and capital expenditure requirements; uncertainties related to the Company's intellectual property; other matters that could affect the availability or commercial potential of the Company's therapeutic candidates; and other factors discussed in the Risk Factors set forth in the Company's Annual Report on Form 10-K and Quarterly Reports on Form 10-Q filed with the Securities and Exchange Commission (SEC) and in other filings the Company makes with the SEC from time to time. In addition, the forward-looking statements included in this press release represent the Company's views only as of the date hereof. The Company anticipates that subsequent events and developments may cause the Company's views to change. However, while the Company may elect to update these forward-looking statements at some point in the future, it specifically disclaims any obligation to do so, except as may be required by law.
Contacts
Trevena, Inc.
Investors:
Jonathan Violin, Ph.D.
Senior Vice President, Scientific Affairs & Investor Relations Officer
610-354-8840 x231
jviolin@trevena.com
or
Media:
Public Relations
PR@trevena.com
Source: Trevena Inc.
Quotes From This Article
TRVN$0.8779 0.0691 7.3%
Trevena, Inc.
Home
News
Quotes
Settings
Die geben nicht locker


Nachbörslich nähern wir uns wieder der 1Dollar-Marke nach den News 😆
Antwort auf Beitrag Nr.: 58.947.915 von PESCADOS am 12.10.18 22:20:35Diese präsentation dürfte kein Einfluß haben auf die fda Entscheidung.
Steht wo? 🙄
Antwort auf Beitrag Nr.: 58.947.915 von PESCADOS am 12.10.18 22:20:35
falls du ...
...die Kursentwicklung von TRVN meinst: ja, nicht schlecht!
...das Poster zu Athena auf dem Jahrestreffen der amerik. Gesellschaft der Anästhesisten meinst: das ist immer von Vorteil, wenn man sich bei der Fachärzteschaft zeigt - allerdings gibts hierbei sicherlich keine neuen Informationen.
...das AC zu sufentanil sublingual (brand: DSUVIA) von Acelrx Pharmaceuticals gemeint hast: wurde mit 10:3 vom AC zur Zulassung empfohlen. Ich habe mich in diese Briefings nur oberflächlich eingearbeitet und deswegen im Vorfeld nur 500 Aktien erworben. Wenn ich überflüssige Zeit habe, werde ich die Unterschiede (Abstimmungsverhalten beim AC, Wirkung und Nebenwirkung der beiden Schmerzmittel) intensiver betrachten. Auf den ersten Blick fand ich Oliceridine spannender, weil die überwiegende Schar der Experten diesem Wirkstoff keine Chance auf Zulassung gegeben hat und ich heute noch der Meinung bin, dass sogar kurzfristig noch vieles möglich ist. Wobei das beste Ergebnis, das ich erwarte, ist eine 3-monatige Verlängerung der PDUFA, um die verzögerte ventrikuläre Repolarisation bzw. die Fragen der FDA hiezu, vollständig zu beantworten. Ein Entwurf der Abklärung wurde der FDA bereits Ende August übermittelt.
Zitat von PESCADOS: Cyberhexe, nicht schlecht,oder?😙
falls du ...
...die Kursentwicklung von TRVN meinst: ja, nicht schlecht!
...das Poster zu Athena auf dem Jahrestreffen der amerik. Gesellschaft der Anästhesisten meinst: das ist immer von Vorteil, wenn man sich bei der Fachärzteschaft zeigt - allerdings gibts hierbei sicherlich keine neuen Informationen.
...das AC zu sufentanil sublingual (brand: DSUVIA) von Acelrx Pharmaceuticals gemeint hast: wurde mit 10:3 vom AC zur Zulassung empfohlen. Ich habe mich in diese Briefings nur oberflächlich eingearbeitet und deswegen im Vorfeld nur 500 Aktien erworben. Wenn ich überflüssige Zeit habe, werde ich die Unterschiede (Abstimmungsverhalten beim AC, Wirkung und Nebenwirkung der beiden Schmerzmittel) intensiver betrachten. Auf den ersten Blick fand ich Oliceridine spannender, weil die überwiegende Schar der Experten diesem Wirkstoff keine Chance auf Zulassung gegeben hat und ich heute noch der Meinung bin, dass sogar kurzfristig noch vieles möglich ist. Wobei das beste Ergebnis, das ich erwarte, ist eine 3-monatige Verlängerung der PDUFA, um die verzögerte ventrikuläre Repolarisation bzw. die Fragen der FDA hiezu, vollständig zu beantworten. Ein Entwurf der Abklärung wurde der FDA bereits Ende August übermittelt.
Antwort auf Beitrag Nr.: 58.944.387 von curacanne am 12.10.18 16:32:01...sorry . auch von meinen fetten vettern......bis zum 2. 11. sehen wir mit hoher wahrscheinlichkeit auch wieder kurse über der 1,-$-marke , in erwartung eines vielleicht eingefädelten deals zwecks zulassung zwischen trevena und der fda......
Weiß jemand ob die Institutionen ihre Anteile verkauft bzw. Ob die ganzen Fonds ihre Anteile an Trevena verkauft haben?
...es müsser von seiten des unternehmens weitere unterlagen eingereicht werden , um die bedenken der FDA zu widerlegen....!!!!!!
Antwort auf Beitrag Nr.: 58.961.916 von herthafan am 15.10.18 15:21:53hab mir gerade noch welche gekauft zu 0,9$ und hoffe dass bis zum 02/11 der Kurs einmal nach obenausschlgt bis max 1,2$ könnten drinnen sein.
LG Printi
LG Printi
Antwort auf Beitrag Nr.: 58.962.132 von printguru am 15.10.18 15:45:24,,,so oder so ähnlich waren/sind meine einschätzungen ebenso.....genau wie bei anderen bio-techs , die bei der fda kurz vor der türe stehen sollten......wie auch immer...!!!!
Neues Kursziel 15 Dollar‼️
Trevena (TRVN) Price Target Raised to $15.00
Posted by Stephan Byrd on Oct 15th, 2018 // No Comments
inShare
Trevena Inc logoTrevena (NASDAQ:TRVN) had its target price increased by JMP Securities from $4.00 to $15.00 in a research report report published on Friday morning, The Fly reports. The firm currently has an outperform rating on the biopharmaceutical company’s stock.
TRVN has been the subject of a number of other research reports. Zacks Investment Research raised Trevena from a hold rating to a buy rating and set a $1.75 price target for the company in a report on Friday, August 17th. Jefferies Financial Group cut Trevena from a buy rating to a hold rating and reduced their price target for the stock from $10.00 to $1.00 in a report on Wednesday, October 10th. Needham & Company LLC cut Trevena from a buy rating to a hold rating in a report on Friday. Finally, HC Wainwright reaffirmed a buy rating and issued a $7.00 price target on shares of Trevena in a report on Monday, August 13th. Four equities research analysts have rated the stock with a hold rating and five have issued a buy rating to the company’s stock. Trevena presently has an average rating of Buy and a consensus target price of $5.66.
Get Trevena alerts:
Shares of TRVN opened at $0.88 on Friday. Trevena has a 52 week low of $0.76 and a 52 week high of $3.58. The company has a current ratio of 3.40, a quick ratio of 3.40 and a debt-to-equity ratio of 0.28. The stock has a market capitalization of $161.29 million, a PE ratio of -0.73 and a beta of -0.38.
Trevena (NASDAQ:TRVN) last issued its earnings results on Thursday, August 2nd. The biopharmaceutical company reported ($0.13) EPS for the quarter, hitting analysts’ consensus estimates of ($0.13). The company had revenue of $2.50 million during the quarter, compared to analysts’ expectations of $5.50 million. On average, research analysts predict that Trevena will post -0.61 EPS for the current fiscal year.
Hedge funds and other institutional investors have recently added to or reduced their stakes in the stock. JPMorgan Chase & Co. raised its holdings in Trevena by 635.7% in the 1st quarter. JPMorgan Chase & Co. now owns 89,228 shares of the biopharmaceutical company’s stock worth $146,000 after purchasing an additional 77,100 shares during the period. LMR Partners LLP acquired a new position in Trevena in the 2nd quarter worth about $207,000. Schwab Charles Investment Management Inc. raised its holdings in Trevena by 55.0% in the 1st quarter. Schwab Charles Investment Management Inc. now owns 144,362 shares of the biopharmaceutical company’s stock worth $237,000 after purchasing an additional 51,200 shares during the period. Paloma Partners Management Co acquired a new position in shares of Trevena during the second quarter valued at approximately $411,000. Finally, GSA Capital Partners LLP raised its holdings in shares of Trevena by 186.2% during the second quarter. GSA Capital Partners LLP now owns 351,847 shares of the biopharmaceutical company’s stock valued at $507,000 after acquiring an additional 228,900 shares during the last quarter. 43.08% of the stock is owned by institutional investors.
Trevena (TRVN) Price Target Raised to $15.00
Posted by Stephan Byrd on Oct 15th, 2018 // No Comments
inShare
Trevena Inc logoTrevena (NASDAQ:TRVN) had its target price increased by JMP Securities from $4.00 to $15.00 in a research report report published on Friday morning, The Fly reports. The firm currently has an outperform rating on the biopharmaceutical company’s stock.
TRVN has been the subject of a number of other research reports. Zacks Investment Research raised Trevena from a hold rating to a buy rating and set a $1.75 price target for the company in a report on Friday, August 17th. Jefferies Financial Group cut Trevena from a buy rating to a hold rating and reduced their price target for the stock from $10.00 to $1.00 in a report on Wednesday, October 10th. Needham & Company LLC cut Trevena from a buy rating to a hold rating in a report on Friday. Finally, HC Wainwright reaffirmed a buy rating and issued a $7.00 price target on shares of Trevena in a report on Monday, August 13th. Four equities research analysts have rated the stock with a hold rating and five have issued a buy rating to the company’s stock. Trevena presently has an average rating of Buy and a consensus target price of $5.66.
Get Trevena alerts:
Shares of TRVN opened at $0.88 on Friday. Trevena has a 52 week low of $0.76 and a 52 week high of $3.58. The company has a current ratio of 3.40, a quick ratio of 3.40 and a debt-to-equity ratio of 0.28. The stock has a market capitalization of $161.29 million, a PE ratio of -0.73 and a beta of -0.38.
Trevena (NASDAQ:TRVN) last issued its earnings results on Thursday, August 2nd. The biopharmaceutical company reported ($0.13) EPS for the quarter, hitting analysts’ consensus estimates of ($0.13). The company had revenue of $2.50 million during the quarter, compared to analysts’ expectations of $5.50 million. On average, research analysts predict that Trevena will post -0.61 EPS for the current fiscal year.
Hedge funds and other institutional investors have recently added to or reduced their stakes in the stock. JPMorgan Chase & Co. raised its holdings in Trevena by 635.7% in the 1st quarter. JPMorgan Chase & Co. now owns 89,228 shares of the biopharmaceutical company’s stock worth $146,000 after purchasing an additional 77,100 shares during the period. LMR Partners LLP acquired a new position in Trevena in the 2nd quarter worth about $207,000. Schwab Charles Investment Management Inc. raised its holdings in Trevena by 55.0% in the 1st quarter. Schwab Charles Investment Management Inc. now owns 144,362 shares of the biopharmaceutical company’s stock worth $237,000 after purchasing an additional 51,200 shares during the period. Paloma Partners Management Co acquired a new position in shares of Trevena during the second quarter valued at approximately $411,000. Finally, GSA Capital Partners LLP raised its holdings in shares of Trevena by 186.2% during the second quarter. GSA Capital Partners LLP now owns 351,847 shares of the biopharmaceutical company’s stock valued at $507,000 after acquiring an additional 228,900 shares during the last quarter. 43.08% of the stock is owned by institutional investors.
Gepostet von Stephan Byrd am 15. Oktober 2018
aber uralt um monate zurück
hatte ich schon vor langer zeit gepostet
JMP-Analyst Jason Butler kommentierte: "Für die NDA wurde immer eine AdComm erwartet, und wir halten das Timing für übereinstimmend mit den Erwartungen. Wir erwarten auf dem Meeting eine Diskussion über das angemessene Gleichgewicht zwischen der Gewährleistung der medizinischen Schmerzbehandlung bei gleichzeitiger Vermeidung Da Oliceridin in einem kontrollierten Verfahren eingesetzt wird und es keine belastbaren Daten gibt, die die Verwendung von Opioiden im Krankenhaus mit dem Risiko eines Missbrauchs in der Gemeinschaft unterstützen, glauben wir, dass Patienten, deren Schmerzen bei der Entlassung gut kontrolliert werden, weniger sind Wir glauben, dass das Gremium die Zulassung befürworten wird, und wir sind weiterhin der Ansicht, dass die Phase-II / 3-Studien für Oliceridin bestätigen, dass es sich um ein neuartiges, differenziertes Opioid mit einer günstigeren Atemwegs- und GI-Sicherheit handelt . "
Als solches wiederholt Butler ein Buy-Rating für TRVN mit einem Kursziel von 15 US-Dollar (das höchste an der Wall Street), was einen enormen Kursanstieg von über 800% seit dem Schlusskurs vom Dienstag bedeutet. (Um Butlers Erfolgsbilanz zu sehen, klicken Sie hier )
aber uralt um monate zurück
hatte ich schon vor langer zeit gepostet
JMP-Analyst Jason Butler kommentierte: "Für die NDA wurde immer eine AdComm erwartet, und wir halten das Timing für übereinstimmend mit den Erwartungen. Wir erwarten auf dem Meeting eine Diskussion über das angemessene Gleichgewicht zwischen der Gewährleistung der medizinischen Schmerzbehandlung bei gleichzeitiger Vermeidung Da Oliceridin in einem kontrollierten Verfahren eingesetzt wird und es keine belastbaren Daten gibt, die die Verwendung von Opioiden im Krankenhaus mit dem Risiko eines Missbrauchs in der Gemeinschaft unterstützen, glauben wir, dass Patienten, deren Schmerzen bei der Entlassung gut kontrolliert werden, weniger sind Wir glauben, dass das Gremium die Zulassung befürworten wird, und wir sind weiterhin der Ansicht, dass die Phase-II / 3-Studien für Oliceridin bestätigen, dass es sich um ein neuartiges, differenziertes Opioid mit einer günstigeren Atemwegs- und GI-Sicherheit handelt . "
Als solches wiederholt Butler ein Buy-Rating für TRVN mit einem Kursziel von 15 US-Dollar (das höchste an der Wall Street), was einen enormen Kursanstieg von über 800% seit dem Schlusskurs vom Dienstag bedeutet. (Um Butlers Erfolgsbilanz zu sehen, klicken Sie hier )

Antwort auf Beitrag Nr.: 58.962.861 von onkelen am 15.10.18 17:01:55Sehr sportlich 😁
So ein Quatsch hier....jetzt wird die Aktie sowas von runtergeprügelt .....jetzt kommt demnächst die Insolvenz und vielleicht der Sasse noch.....lach. Achtung-----alles muß raus-----die Aktie ist nichts mehr wert-----Morgen Insolvenz----- unter 0,05€-----der ganze Laden brennt.
Antwort auf Beitrag Nr.: 58.962.861 von onkelen am 15.10.18 17:01:55Diese Kursziele gelten aber auch NUR bei Genehmigung der FDA für Oli‼️
Sonst sieht's finster aus...
Sonst sieht's finster aus...
Bis ende der Woche ist Trevena wieder über 1$. das Teil wird bis zum 2.11. noch hochgezogen.
Die Marktcap. liegt gerade mal bei 53 Mill.
Die Marktcap. liegt gerade mal bei 53 Mill.
Das ist wirklich Unsinn Trevena müsste bei einem Scheitern die Insolvenz anmelden.
TRVN bietet auch die Chance auf enorme Kursgewinne wenn es doch noch klappen würde
ansonsten wird ein neuer Termin angesetzt um das Risiko zu widerlegen.
TRVN bietet auch die Chance auf enorme Kursgewinne wenn es doch noch klappen würde
ansonsten wird ein neuer Termin angesetzt um das Risiko zu widerlegen.
Rein gefühlsmäßig ist da der Ofen endgültig aus! Bei der dünnen Eigenkapitaldecke ist der baldige Einbruch vorprogrammiert! Werde auf alle Fälle meine Shares noch diese Woche verkaufen bevor es ganz aus ist!
War mir eine teure Lehre!
War mir eine teure Lehre!
...es könnte aber auch gewisse auflagen seitens der FDA geben , mit erneuter studie bzw . vorstelligkeit.....
HC Wainwright Trims Trevena $TRVN Target Price to $3.00 http://zpr.io/6Cuqf
07:47 - 15 oct. 2018
Von $7,00 auf $3,00, ist immer noch höher wie Zurzeit $0,8997
07:47 - 15 oct. 2018
Von $7,00 auf $3,00, ist immer noch höher wie Zurzeit $0,8997
Antwort auf Beitrag Nr.: 58.969.872 von PESCADOS am 16.10.18 12:21:07Verkauf du mal......immer die Heulerei wenn die die Sache mal anders ausgeht, wenn das Geld weh tut was man investiert sollte man(n) der Börse fern bleiben. Und bei Trevena gehen noch lange nicht die Lichter aus.....
Antwort auf Beitrag Nr.: 58.972.929 von bernstein789 am 16.10.18 16:52:06
Man muss realistisch bleiben TRVN gibt es noch über 2020.... das finanzielle erfolgreichere
Produkt TRV250 Migrane Phase I muss ebenfalls berücksichtigt werden.
Bei Oliceridine haben sie konkurrenz durch ACRX bekommen,
Spekulanten haben leider ein Kurzzeitgedächtnis.
Zitat von bernstein789: Verkauf du mal......immer die Heulerei wenn die die Sache mal anders ausgeht, wenn das Geld weh tut was man investiert sollte man(n) der Börse fern bleiben. Und bei Trevena gehen noch lange nicht die Lichter aus.....
Man muss realistisch bleiben TRVN gibt es noch über 2020.... das finanzielle erfolgreichere
Produkt TRV250 Migrane Phase I muss ebenfalls berücksichtigt werden.
Bei Oliceridine haben sie konkurrenz durch ACRX bekommen,
Spekulanten haben leider ein Kurzzeitgedächtnis.
Antwort auf Beitrag Nr.: 58.911.069 von Cyberhexe am 09.10.18 22:40:08
...anbei das Abstimmungsverhalten der AC-Mitglieder:
Ja: 7
- Basavana Goudra (AADPAC), Prof. Anesthesiology............................................................[nicht teigenommen]
- Gregory Terman (Temp.), Prof. Anesthesiology + Pain Medicine.......................................[Dsuvia: ja]
- John Alexander (Temp.), Prof. of Medicine / Cardiology....................................................[nicht teigenommen]
- Joseph O'Brien (Temp.), Patient Representive ..............................................................[Dsuvia: ja]
- Kevin Zacharoff/Chair (AADPAC), Faculty & Clinical Instructor, Pain & Medical Ethics ......[Dsuvia: ja]
- Majorie Philips (Temp.), Pharmacy Coordinator.......................................................... [Dsuvia: ja]
- Ronald Litman (AADPAC), Prof. Anesthesiology & Pediatrics......................................... [Dsuvia: ja]
Nein:8
- Abigail Shoben (AADPAC), Prof. of Biostatistics .........................................[Dsuvia: ja]
- Alan Kaye (Temp.), Prof. Anesthesiology........................................................... [Dsuvia: ja]
- Jennifer Higgins (Temp.), Director of Research & Development Disabilities ..............[Dsuvia: ja]
- Lonnie Zeltzer (AADPAC), Director Pediatric pain & Palliative Care .......................[Dsuvia: ja]
- Mary McCann (AADPAC), Prof. Anesthesiology ...................................................[nicht teigenommen]
- Michael Fischer (Temp.), Assoc. Prof. of Medicine/Epidemiology.......................... [Dsuvia: nein]
- Steven Solga (Temp.), Assoc. Prof. of Clinical Medicine/Transplant Hepatology.......... [nicht teigenommen]
- Terry Warholak (Temp.), Prof. of Academic Affairs ............................................[Dsuvia: ja]
Das Abstimmungsverhalten des Statistikers bzw. - in war vorherzusagen. Ich hatte jedoch gehofft, dass die Anästhesisten unisono für eine Zulassung gestimmt haben. Dem ist leider nicht so!
In Klammern das Abstimmungsverhalten beim AC zu Dsuvia am 12.10.
ausserdem am Dsuvia-AC teilgenommen haben:
Steven Meisel [Dsuvia: nein]
Jacqueline Willac... [Dsuvia: nein]
Zitat von Cyberhexe: ...wenn eine Expertenrunde von der FDA einberufen wird, dann ist der Ausgang einer Zulassungsentscheidung durch Unsicherheiten geprägt. Durch die tendenziell konservative Darstellung der FDA, die jede mögliche "Ungereimtheit" aufdeckt und zur Diskussion stellt, erscheinen die Wirkstoffkandidaten tendenziell weniger zulassungsfähig. So auch bei Oliceridine .
Die auf den ersten Blick verheerende Analyse wird beim näheren Betrachten, vor allem auch der Unterlagen des "Sponsors", doch meistens etwas freundlicher.
Ich sehe dennoch Chancen auf ein "wohlwollendes" Abstimmungsergebnis der Experten, wobei der Ausgang absolut offen erscheint - fast sicher bin ich mir beim Abstimmungsverhalten des Statistikers, der wohl aufgrund der Ratio (--> geringerer Nutzen/ähnliches NW-Profil --> die Atemwegssicherheit hat keine statitische Signifikanz, für den Statistiker demzufolge nicht gegeben) gegen eine Zulassung votieren wird. Hingegen ist die Tendenz (wenn auich nicht stat signifikant) eindeutig und somit für den Anästhesisten von Bedeutung --> ich hoffe, dass diese zustimmen werden.
...anbei das Abstimmungsverhalten der AC-Mitglieder:
Ja: 7
- Basavana Goudra (AADPAC), Prof. Anesthesiology............................................................[nicht teigenommen]
- Gregory Terman (Temp.), Prof. Anesthesiology + Pain Medicine.......................................[Dsuvia: ja]
- John Alexander (Temp.), Prof. of Medicine / Cardiology....................................................[nicht teigenommen]
- Joseph O'Brien (Temp.), Patient Representive ..............................................................[Dsuvia: ja]
- Kevin Zacharoff/Chair (AADPAC), Faculty & Clinical Instructor, Pain & Medical Ethics ......[Dsuvia: ja]
- Majorie Philips (Temp.), Pharmacy Coordinator.......................................................... [Dsuvia: ja]
- Ronald Litman (AADPAC), Prof. Anesthesiology & Pediatrics......................................... [Dsuvia: ja]
Nein:8
- Abigail Shoben (AADPAC), Prof. of Biostatistics .........................................[Dsuvia: ja]
- Alan Kaye (Temp.), Prof. Anesthesiology........................................................... [Dsuvia: ja]
- Jennifer Higgins (Temp.), Director of Research & Development Disabilities ..............[Dsuvia: ja]
- Lonnie Zeltzer (AADPAC), Director Pediatric pain & Palliative Care .......................[Dsuvia: ja]
- Mary McCann (AADPAC), Prof. Anesthesiology ...................................................[nicht teigenommen]
- Michael Fischer (Temp.), Assoc. Prof. of Medicine/Epidemiology.......................... [Dsuvia: nein]
- Steven Solga (Temp.), Assoc. Prof. of Clinical Medicine/Transplant Hepatology.......... [nicht teigenommen]
- Terry Warholak (Temp.), Prof. of Academic Affairs ............................................[Dsuvia: ja]
Das Abstimmungsverhalten des Statistikers bzw. - in war vorherzusagen. Ich hatte jedoch gehofft, dass die Anästhesisten unisono für eine Zulassung gestimmt haben. Dem ist leider nicht so!
In Klammern das Abstimmungsverhalten beim AC zu Dsuvia am 12.10.
ausserdem am Dsuvia-AC teilgenommen haben:
Steven Meisel [Dsuvia: nein]
Jacqueline Willac... [Dsuvia: nein]
Antwort auf Beitrag Nr.: 58.973.295 von fypet am 16.10.18 17:22:30Da gebe ich dir völlig recht.....ich finde es immer nur schlimm wenn Leute dann nur noch negativ in die Zukunft schauen und sich mit dem Unternehmen nicht weiter auseinandersetzen. Manche Leute sind reine Spekulanten und wollen von heute auf morgen das dicke Geld machen aber so funktioniert die Börse nicht. Bei manchen Investment muß mal halt ein längeren Atem haben um Geld zu verdienen.....und ich denke wenn man sich den Kursverlauf von Trevena anschaut konnte man schon recht viel Geld verdienen. Der Punkt ist eben den richtigen Ausstieg hinzubekommen.
Bald sehen wir wieder $1 und wenn es weiter positiv aufwärts geht, sehen wir $1,4
das war die Bodenbildung (Seitwärtsbewegung) von Juni bis September.
das war die Bodenbildung (Seitwärtsbewegung) von Juni bis September.
Antwort auf Beitrag Nr.: 58.973.328 von Cyberhexe am 16.10.18 17:25:08Naja, den Damen im Panel war es dann wohl zu wackelig...da muss dann schon alles 1000% abgesichert sein...ich werde mit 12k Stücke durch den 2.11. gehen...the Game isn't over yet

na also..läuft doch :-)
Antwort auf Beitrag Nr.: 58.975.914 von sneakee am 16.10.18 21:12:11
Genau! Nachbörslich schon wieder >1 USD an der Nasdaq!
Zitat von sneakee: na also..läuft doch :-)
Genau! Nachbörslich schon wieder >1 USD an der Nasdaq!
Antwort auf Beitrag Nr.: 58.976.415 von deRendite am 16.10.18 22:02:28Sehe gerade, das war ja sogar schon im regulären Handel. Noch besser.
Interessanterweise traut man dem Braten bei AcelRX wohl auch noch nicht so ganz. Die sind wieder unter 4 USD gefallen. Bei Trevena wäre es jetzt wenigstens eine Überraschung, wenn die Zulassung doch kommt. Da ist noch nicht viel eingepreist.
Interessanterweise traut man dem Braten bei AcelRX wohl auch noch nicht so ganz. Die sind wieder unter 4 USD gefallen. Bei Trevena wäre es jetzt wenigstens eine Überraschung, wenn die Zulassung doch kommt. Da ist noch nicht viel eingepreist.
Antwort auf Beitrag Nr.: 58.938.981 von bernstein789 am 12.10.18 08:39:03
Guten abend,Bernstein789,
In Trevena Aktie habe ich heute einen Blick darauf geworen, und gerade eben festehstellt das ich mit all den Internationalen wertungen 0.840-0.889euro sehr zufreiden bin.
Auf weitere gute zusammenarbeit!
Mfg
GM
Zitat von bernstein789: Das kannst du aber vielen nicht klar machen.....hier sind auch viele Taschengeldzocker dabei die meinen direkt mal eben 300% machen zu können. Die Realität sieht anders aus!!!
Guten abend,Bernstein789,
In Trevena Aktie habe ich heute einen Blick darauf geworen, und gerade eben festehstellt das ich mit all den Internationalen wertungen 0.840-0.889euro sehr zufreiden bin.
Auf weitere gute zusammenarbeit!
Mfg
GM
sieht nicht schlecht aus würd ich sagen....
LG Printi
LG Printi
Antwort auf Beitrag Nr.: 58.973.328 von Cyberhexe am 16.10.18 17:25:08
Wie sind die Aussichten hinsichtlich der anstehenden Zulassungsentscheidung? Folgende Szenarien sind möglich:
1.) mit einer bedigungslosen Zulassung ist überhaupt nicht zu rechnen. Deren Wahrscheinlichkeit dürfte gegen 0 gehen.
2.) eine bedingte Zulassung in Verbindung mit einer ph4-Studie (postmarket drug safety surveillance) ist wohl das bestmögliche Szenario; obschon ich mir diese Variante nebst der nächsten Variante für meine 15.000 Aktien wünsche, halte ich die Wahrscheinlichkeit für eher gering (wenn ich schätzen müsste, vierlleicht 10%)
3.) Da die Beurteilung bereits eingereichter Daten zur QT-Verlängerung (verzögerte Repolarisation beim Herzschlag) noch aussteht, könnte die FDA den Zeitpunkt für die Entscheidung (PDUFA) um 3 Monate verschieben, also auf 2.2.2019 (20%)
4.) in Anbetracht der Datenlage und des Abstimmungsvervhalten der AC-Mitglieder ist die Wahrscheinlichkeit eines CRL (Complete Response Letter) gross (70%). In diesem Fall wird darauf zu achten sein, welche zusätzlichen Daten von der Behörde verlangt werden. Der schlechteste Fall wäre, wenn eine komplette zusätzliche ph3-Studie verlangt wird, welche einerseits lange dauert und andererseits mit den vorhandenen Ressourcen kaum zu finanzieren ist. Weniger dramatisch wäre das Einfordern einer nicht-klinischen Studie. Die Wahrscheinlichkeit der beiden Fälle würde ich auf 50/50 schätzen, so dass das "Worst case scenario" mit einer persönlichen Wahrscheinlichkeit von ca. 35% erwartet wird.
In Anbetracht der Wahrscheinlichkeit und des Potenzials bei Nichteintreten des schlechtesten Falles (65%) werde ich sehr wahrscheinlich mit 2/3 der 15.000 Aktien die Zulassungsentscheidung am 2.11.2018 abwarten.
5.000 Aktien sind bereits mit einer Verkaufsorder vermerkt ($1.19)
Zitat von Cyberhexe:Zitat von Cyberhexe: ...wenn eine Expertenrunde von der FDA einberufen wird, dann ist der Ausgang einer Zulassungsentscheidung durch Unsicherheiten geprägt. Durch die tendenziell konservative Darstellung der FDA, die jede mögliche "Ungereimtheit" aufdeckt und zur Diskussion stellt, erscheinen die Wirkstoffkandidaten tendenziell weniger zulassungsfähig. So auch bei Oliceridine .
Die auf den ersten Blick verheerende Analyse wird beim näheren Betrachten, vor allem auch der Unterlagen des "Sponsors", doch meistens etwas freundlicher.
Ich sehe dennoch Chancen auf ein "wohlwollendes" Abstimmungsergebnis der Experten, wobei der Ausgang absolut offen erscheint - fast sicher bin ich mir beim Abstimmungsverhalten des Statistikers, der wohl aufgrund der Ratio (--> geringerer Nutzen/ähnliches NW-Profil --> die Atemwegssicherheit hat keine statitische Signifikanz, für den Statistiker demzufolge nicht gegeben) gegen eine Zulassung votieren wird. Hingegen ist die Tendenz (wenn auich nicht stat signifikant) eindeutig und somit für den Anästhesisten von Bedeutung --> ich hoffe, dass diese zustimmen werden.
...anbei das Abstimmungsverhalten der AC-Mitglieder:
Ja: 7
- Basavana Goudra (AADPAC), Prof. Anesthesiology............................................................[nicht teigenommen]
- Gregory Terman (Temp.), Prof. Anesthesiology + Pain Medicine.......................................[Dsuvia: ja]
- John Alexander (Temp.), Prof. of Medicine / Cardiology....................................................[nicht teigenommen]
- Joseph O'Brien (Temp.), Patient Representive ..............................................................[Dsuvia: ja]
- Kevin Zacharoff/Chair (AADPAC), Faculty & Clinical Instructor, Pain & Medical Ethics ......[Dsuvia: ja]
- Majorie Philips (Temp.), Pharmacy Coordinator.......................................................... [Dsuvia: ja]
- Ronald Litman (AADPAC), Prof. Anesthesiology & Pediatrics......................................... [Dsuvia: ja]
Nein:8
- Abigail Shoben (AADPAC), Prof. of Biostatistics .........................................[Dsuvia: ja]
- Alan Kaye (Temp.), Prof. Anesthesiology........................................................... [Dsuvia: ja]
- Jennifer Higgins (Temp.), Director of Research & Development Disabilities ..............[Dsuvia: ja]
- Lonnie Zeltzer (AADPAC), Director Pediatric pain & Palliative Care .......................[Dsuvia: ja]
- Mary McCann (AADPAC), Prof. Anesthesiology ...................................................[nicht teigenommen]
- Michael Fischer (Temp.), Assoc. Prof. of Medicine/Epidemiology.......................... [Dsuvia: nein]
- Steven Solga (Temp.), Assoc. Prof. of Clinical Medicine/Transplant Hepatology.......... [nicht teigenommen]
- Terry Warholak (Temp.), Prof. of Academic Affairs ............................................[Dsuvia: ja]
Das Abstimmungsverhalten des Statistikers bzw. - in war vorherzusagen. Ich hatte jedoch gehofft, dass die Anästhesisten unisono für eine Zulassung gestimmt haben. Dem ist leider nicht so!
In Klammern das Abstimmungsverhalten beim AC zu Dsuvia am 12.10.
ausserdem am Dsuvia-AC teilgenommen haben:
Steven Meisel [Dsuvia: nein]
Jacqueline Willac... [Dsuvia: nein]
Wie sind die Aussichten hinsichtlich der anstehenden Zulassungsentscheidung? Folgende Szenarien sind möglich:
1.) mit einer bedigungslosen Zulassung ist überhaupt nicht zu rechnen. Deren Wahrscheinlichkeit dürfte gegen 0 gehen.
2.) eine bedingte Zulassung in Verbindung mit einer ph4-Studie (postmarket drug safety surveillance) ist wohl das bestmögliche Szenario; obschon ich mir diese Variante nebst der nächsten Variante für meine 15.000 Aktien wünsche, halte ich die Wahrscheinlichkeit für eher gering (wenn ich schätzen müsste, vierlleicht 10%)
3.) Da die Beurteilung bereits eingereichter Daten zur QT-Verlängerung (verzögerte Repolarisation beim Herzschlag) noch aussteht, könnte die FDA den Zeitpunkt für die Entscheidung (PDUFA) um 3 Monate verschieben, also auf 2.2.2019 (20%)
4.) in Anbetracht der Datenlage und des Abstimmungsvervhalten der AC-Mitglieder ist die Wahrscheinlichkeit eines CRL (Complete Response Letter) gross (70%). In diesem Fall wird darauf zu achten sein, welche zusätzlichen Daten von der Behörde verlangt werden. Der schlechteste Fall wäre, wenn eine komplette zusätzliche ph3-Studie verlangt wird, welche einerseits lange dauert und andererseits mit den vorhandenen Ressourcen kaum zu finanzieren ist. Weniger dramatisch wäre das Einfordern einer nicht-klinischen Studie. Die Wahrscheinlichkeit der beiden Fälle würde ich auf 50/50 schätzen, so dass das "Worst case scenario" mit einer persönlichen Wahrscheinlichkeit von ca. 35% erwartet wird.
In Anbetracht der Wahrscheinlichkeit und des Potenzials bei Nichteintreten des schlechtesten Falles (65%) werde ich sehr wahrscheinlich mit 2/3 der 15.000 Aktien die Zulassungsentscheidung am 2.11.2018 abwarten.
5.000 Aktien sind bereits mit einer Verkaufsorder vermerkt ($1.19)
Ich vermute die Aktie wird bis 2.11. extrem volatil gehandelt...ich sehe durchaus kurz vor dem FDA Entscheid Kurse um $1,40 - $1,50 im Bereich des Möglichen.
Es sind in dieser Aktie zuviele Verückte und Taschengeldzocker am Start, da kauft man sich halt noch 5k Stücke Ende Oktober im "größten Casino der Welt".
Zu den Chancen: ich glaube es ist tatsächlich sehr sehr schwer einzuschätzen wie der Entscheid ausfällt, ein 7:8 Votum mit derart "wackeligen" No Votern, welche dies auch nach der Panel-Sitzung unmittelbar kommuniziert haben! , ist relativ selten...so war ja bereits in der Abschlussrede von einer schwierigen Aufgabe bzgl. des Zulassungsentscheids gesprochen worden.
Unter Betrachtung das die Medikation nur von Fachpersonal verabreicht wird würde ich die unwahrscheinlichen Parameter sogar höher einschätzen...Zulassung 15%, bedingte Zulassung/Post-Studie 25%, PDUFA Beginn 2019 35%...ein CRL mit umfangreichen Studien wäre natürlich sehr unschön, würde für mich aber nicht das absolute Aus bedeuten, da ich dann noch die Erwägung eines Verkaufs an Bigpharma nicht ausschließen würde ( die Verflechtung der neuen CEO und ihre Historie zwingen fast zu diesem Gedanken...)
Nichtsdestotrotz bleibt es spannend!
Es sind in dieser Aktie zuviele Verückte und Taschengeldzocker am Start, da kauft man sich halt noch 5k Stücke Ende Oktober im "größten Casino der Welt".
Zu den Chancen: ich glaube es ist tatsächlich sehr sehr schwer einzuschätzen wie der Entscheid ausfällt, ein 7:8 Votum mit derart "wackeligen" No Votern, welche dies auch nach der Panel-Sitzung unmittelbar kommuniziert haben! , ist relativ selten...so war ja bereits in der Abschlussrede von einer schwierigen Aufgabe bzgl. des Zulassungsentscheids gesprochen worden.
Unter Betrachtung das die Medikation nur von Fachpersonal verabreicht wird würde ich die unwahrscheinlichen Parameter sogar höher einschätzen...Zulassung 15%, bedingte Zulassung/Post-Studie 25%, PDUFA Beginn 2019 35%...ein CRL mit umfangreichen Studien wäre natürlich sehr unschön, würde für mich aber nicht das absolute Aus bedeuten, da ich dann noch die Erwägung eines Verkaufs an Bigpharma nicht ausschließen würde ( die Verflechtung der neuen CEO und ihre Historie zwingen fast zu diesem Gedanken...)

Nichtsdestotrotz bleibt es spannend!
Interessanterweise sieht die FDA selbst einen Engpass bei der Versorgung mit Morphin und Fentanyl:
https://www.accessdata.fda.gov/scripts/drugshortages/default…
Vielleicht hilft das ja bei der Zulassung...
https://www.accessdata.fda.gov/scripts/drugshortages/default…
Vielleicht hilft das ja bei der Zulassung...
Antwort auf Beitrag Nr.: 58.977.561 von printguru am 17.10.18 06:47:10
printguru,
Ziemlich große 14CT Kursprünge, allerdings hält Sie sich unter 1000euro Geldorder sehr prima!
Da kommt Do.Freitag noch mehr hinein!?
Trevena Aktie ist gigantisch "günstig" in diesen wertungen unter pari 1.00euro über die deutschen Börsen noch, "günstig"

 Ein " Schnäpchenpreis" in diesen engen Internationalen gesamt-Aktienmärkten.: Wird "Amerika" auf Rang NUMMER 1. bei mir auf der Watchlist sein.
Ein " Schnäpchenpreis" in diesen engen Internationalen gesamt-Aktienmärkten.: Wird "Amerika" auf Rang NUMMER 1. bei mir auf der Watchlist sein.
Muss das ja jeder selber wissen.
Mit freundlichen Grüßen
Geldmanager
Zitat von printguru: sieht nicht schlecht aus würd ich sagen....
LG Printi
printguru,
Ziemlich große 14CT Kursprünge, allerdings hält Sie sich unter 1000euro Geldorder sehr prima!
Da kommt Do.Freitag noch mehr hinein!?
Trevena Aktie ist gigantisch "günstig" in diesen wertungen unter pari 1.00euro über die deutschen Börsen noch, "günstig"


 Ein " Schnäpchenpreis" in diesen engen Internationalen gesamt-Aktienmärkten.: Wird "Amerika" auf Rang NUMMER 1. bei mir auf der Watchlist sein.
Ein " Schnäpchenpreis" in diesen engen Internationalen gesamt-Aktienmärkten.: Wird "Amerika" auf Rang NUMMER 1. bei mir auf der Watchlist sein.Muss das ja jeder selber wissen.
Mit freundlichen Grüßen
Geldmanager
Interessant: Optionen Verhältnis
Die Calls sind spekulativ beliebter.Nehmen wir an TRVN steigt auf $1,60 , Calls mit Basispreis 2,5 / 5,0 / 7,5
diese Kurse werden natürlich nicht erreicht aber haben je weiter vom
Basiswert entfernt einen grösseren Hebel.

Fazit: Ohne Zulassung wird TRVN abgestraft mit einem Market Cap von max. 50Mio
Kanada geht das Cannabis aus
Kanada geht das Cannabis ausNach der Legalisierung des Cannabisverkaufs in Kanada hat die grosse Nachfrage vereinzelt zu Lieferengpässen geführt. In den Provinzen Neufundland und Saskatchwean sowie im arktischen Territorium Nunavut wurde am Donnerstag von zu Ende gehenden Vorräten berichtet.
Kanada hat am Mittwoch den Gebrauch von Cannabis vollständig freigegeben (BLICK berichtete). Schon am zweiten Tag des offenen Verkaufs hat die riesige Nachfrage teilweise zu Lieferengpässen geführt. In den Provinzen Neufundland und Saskatchwean sowie im arktischen Territorium Nunavut wurde am Donnerstag von zu Ende gehenden Vorräten berichtet.
Das Cannabis-Portal der Regierung von Ontario warnte Online-Kunden vor Wartezeiten von bis zu fünf Tagen. Vor vielen Marihuana-Geschäften des Landes bildeten sich auch am zweiten Tag nach der Legalisierung lange Schlangen.
«Es war die Hölle, es war kalt»
Unter den Wartenden vor einem Geschäft in Montreal war auch der 30-jährige Alexandre, der am Mittwoch bereits vergebens angestanden hatte. Nach sieben Stunden Wartezeit sei er um 21.00 Uhr (Ortszeit) abgewiesen worden. Die Polizei löste die wartende Menschenmenge auf - ohne Zwischenfälle. «Es war die Hölle, es war kalt», sagte Alexandre. «Wir hatten aber trotzdem Spass», fügte er hinzu.
Den Kiffern in Kanada scheinen die Engpässen egal zu sein. Schon am Mittwoch, als der legale Cannabis-Verkauf um Mitternacht startete, standen über 100 Menschen in der Provinzhauptstadt St. John's trotz Kälte und Wind vor einem Marihuana-Geschäft. «Ich bin heute Nacht herausgekommen, um die erste Person in Kanada zu sein, die das erste legale Gramm Cannabis gekauft hat und um endlich das Ende des Verbots in Kanada zu sehen», sagte Ian Power, der zu den ersten Käufern gehörte.
Regierung überrascht vom Ansturm
Kanada hatte am Mittwoch als weltweit zweites Land nach Uruguay vollständig den Verkauf von Cannabis legalisiert. Kanadischen Staatsbürgern ab 18 Jahren - in manchen Bundesstaaten liegt die Altersgrenze bei 19 Jahren - ist es seitdem erlaubt, per Bestellung oder in autorisierten Geschäften ein Gramm Haschisch für etwa zehn kanadische Dollar zu kaufen. Der persönliche Besitz ist auf 30 Gramm beschränkt.
In Kanadas bevölkerungsreichster Provinz Ontario wurden in den ersten Stunden nach der Legalisierung am Mittwoch rund 38'000 Bestellungen im Wert von umgerechnet etwa 750'000 kanadischen Dollar entgegengenommen. Der Umfang gehe weit über die Erwartungen hinaus, erklärte die Regierung der Provinz Quebec, die 42'000 Bestellungen verzeichnete. (SDA/nim)
Publiziert am 19.10.2018 | Aktualisiert um 09:03 Uhr
https://www.blick.ch/news/alexandre-30-fror-sieben-stunden-l…
Antwort auf Beitrag Nr.: 59.001.933 von onkelen am 19.10.18 10:56:59falscher thread?
What Is The Future Prospect For Healthcare And Trevena Inc (NASDAQ:TRVN)? 18.10.2018
Trevena Inc (NASDAQ:TRVN), a US$81m small-cap, is a healthcare company operating in an industry, which continues to be affected by the sustained economic uncertainty and structural trends, such as an aging population, impacting the sector globally. Healthcare analysts are forecasting for the entire industry, a fairly unexciting growth rate of 4.6% in the upcoming year , and an enormous growth of 63% over the next couple of years. This rate is larger than the growth rate of the US stock market as a whole. Below, I will examine the sector growth prospects, and also determine whether Trevena is a laggard or leader relative to its healthcare sector peers.
vollständiger Artikel:
https://finance.yahoo.com/news/future-prospect-healthcare-tr…
Trevena Inc (NASDAQ:TRVN), a US$81m small-cap, is a healthcare company operating in an industry, which continues to be affected by the sustained economic uncertainty and structural trends, such as an aging population, impacting the sector globally. Healthcare analysts are forecasting for the entire industry, a fairly unexciting growth rate of 4.6% in the upcoming year , and an enormous growth of 63% over the next couple of years. This rate is larger than the growth rate of the US stock market as a whole. Below, I will examine the sector growth prospects, and also determine whether Trevena is a laggard or leader relative to its healthcare sector peers.
vollständiger Artikel:
https://finance.yahoo.com/news/future-prospect-healthcare-tr…
Was meint ihr Trevena Gurus sehen wir noch mal eine Kaufwelle bis November?
Was mich nervt diese SHAREHOLDER ALERT die sollen doch in Kartoffeln investieren da haben kein
grosses Risiko.
Was mich nervt diese SHAREHOLDER ALERT die sollen doch in Kartoffeln investieren da haben kein
grosses Risiko.
Antwort auf Beitrag Nr.: 59.005.434 von fypet am 19.10.18 16:32:01Schätze schon, dass kurz vor dem PDUFA date noch ein paar Zocker auftauchen. Nächste Woche wird es wohl noch ruhig bleiben.
Bei DSUVIA gibt es jetzt Gegenwind aus der Politik:
https://www.markey.senate.gov/news/press-releases/senator-ma…
Ob das für Trevena gut ist oder nicht, vermag ich nicht zu sagen. Zumindest könnten Tabletten leichter verschwinden, denke ich.
https://www.markey.senate.gov/news/press-releases/senator-ma…
Ob das für Trevena gut ist oder nicht, vermag ich nicht zu sagen. Zumindest könnten Tabletten leichter verschwinden, denke ich.
Zusammenfassung
Nach einer negativen Sitzung des Beratenden Ausschusses scheinen die Aktien von Trevena bereit zu sein, zum Nettoinventarwert gehandelt zu werden.
Die FDA hat klargestellt, dass sie nicht glauben, dass Oliceridin von Morphin unterschieden wird.
Die FDA hatte mehrere Probleme mit Endpunkten und Sicherheit, die die Zulassung zu einem Ereignis mit geringer Wahrscheinlichkeit machen.
Ich würde die Aktie vermeiden.
Aktien der Biotech Trevena ( TRVN ) sind unter 1 USD gefallen, da der Markt die negativen Auswirkungen einer sehr umstrittenen Überprüfung der Anästhesie und Analgesic Advisory Committee der FDA und acht bis sieben Stimmen gegen die Zulassung des führenden Medikamentenkandidaten des Unternehmens, Oliceridine, verdaut hat. Angesichts der feindseligen Haltung der FDA-Protokolle, der negativen Sicht auf die Sicherheit und der negativen Abstimmung über die Zulassung glaube ich, dass die Aktien von Trevena im Wesentlichen wertlos sind, da ich nicht glaube, dass Oliceridin genehmigt wird.
Ein negativer FDA-Ton weist auf eine schlechte Kenntnis der Agenturkommunikation und des Zulassungsprozesses hin
Einer der verheerendsten Teile des gesamten Beratungskomitee-Prozesses für Trevena war der negative Ton der FDA, der in allen Konferenzmaterialien verflochten war. Auf Seite sieben stellt die FDA sofort fest, dass sie mit dem sekundären Endpunkt von Trevena in Bezug auf die Atmungssicherheit nicht übereinstimmt:
"Die FDA stimmte dem vorgeschlagenen Endpunkt von Trevena aufgrund von Bedenken hinsichtlich ihrer klinischen Aussagekraft nicht zu."
Dies ist die FDA, die besagt, dass Ihr Atemdepressionsvorteil, ein sekundärer Endpunkt, aber das entscheidende Unterscheidungsmerkmal zu Morphin, nicht besonders aussagekräftig ist. Später in dem Dokument erweitert die FDA den Sicherheitsendpunkt und sagt:
"Es gibt jedoch keinen Präzedenzfall für die Verwendung dieses Endpunkts [RSE] in einer klinischen Studie, und die FDA war nicht der Meinung, dass dies ein klinisch interpretierbarer Endpunkt für die Bewertung eines potenziellen respiratorischen Anspruchs war. Während der Entwicklung teilte die FDA dem Antragsteller mit, dass ihre Definition von RSE nicht klar definiert war und weitgehend auf klinischem Verständnis beruhte. "
Es gibt schlechte Ideen, und es gibt ein Medikament bei der FDA mit einem Endpunkt, von dem die Agentur nicht überzeugt ist, dass es relevant ist.
Die Meinungsverschiedenheit läuft über die Sitzungen hinweg und, was noch wichtiger ist, es gibt keinen klaren Hinweis darauf, dass Trevena in der Lage war, die FDA davon zu überzeugen, sie bei Meinungsverschiedenheiten zu beeinflussen.
https://seekingalpha.com/article/4212766-trevena-toast
Nach einer negativen Sitzung des Beratenden Ausschusses scheinen die Aktien von Trevena bereit zu sein, zum Nettoinventarwert gehandelt zu werden.
Die FDA hat klargestellt, dass sie nicht glauben, dass Oliceridin von Morphin unterschieden wird.
Die FDA hatte mehrere Probleme mit Endpunkten und Sicherheit, die die Zulassung zu einem Ereignis mit geringer Wahrscheinlichkeit machen.
Ich würde die Aktie vermeiden.
Aktien der Biotech Trevena ( TRVN ) sind unter 1 USD gefallen, da der Markt die negativen Auswirkungen einer sehr umstrittenen Überprüfung der Anästhesie und Analgesic Advisory Committee der FDA und acht bis sieben Stimmen gegen die Zulassung des führenden Medikamentenkandidaten des Unternehmens, Oliceridine, verdaut hat. Angesichts der feindseligen Haltung der FDA-Protokolle, der negativen Sicht auf die Sicherheit und der negativen Abstimmung über die Zulassung glaube ich, dass die Aktien von Trevena im Wesentlichen wertlos sind, da ich nicht glaube, dass Oliceridin genehmigt wird.
Ein negativer FDA-Ton weist auf eine schlechte Kenntnis der Agenturkommunikation und des Zulassungsprozesses hin
Einer der verheerendsten Teile des gesamten Beratungskomitee-Prozesses für Trevena war der negative Ton der FDA, der in allen Konferenzmaterialien verflochten war. Auf Seite sieben stellt die FDA sofort fest, dass sie mit dem sekundären Endpunkt von Trevena in Bezug auf die Atmungssicherheit nicht übereinstimmt:
"Die FDA stimmte dem vorgeschlagenen Endpunkt von Trevena aufgrund von Bedenken hinsichtlich ihrer klinischen Aussagekraft nicht zu."
Dies ist die FDA, die besagt, dass Ihr Atemdepressionsvorteil, ein sekundärer Endpunkt, aber das entscheidende Unterscheidungsmerkmal zu Morphin, nicht besonders aussagekräftig ist. Später in dem Dokument erweitert die FDA den Sicherheitsendpunkt und sagt:
"Es gibt jedoch keinen Präzedenzfall für die Verwendung dieses Endpunkts [RSE] in einer klinischen Studie, und die FDA war nicht der Meinung, dass dies ein klinisch interpretierbarer Endpunkt für die Bewertung eines potenziellen respiratorischen Anspruchs war. Während der Entwicklung teilte die FDA dem Antragsteller mit, dass ihre Definition von RSE nicht klar definiert war und weitgehend auf klinischem Verständnis beruhte. "
Es gibt schlechte Ideen, und es gibt ein Medikament bei der FDA mit einem Endpunkt, von dem die Agentur nicht überzeugt ist, dass es relevant ist.
Die Meinungsverschiedenheit läuft über die Sitzungen hinweg und, was noch wichtiger ist, es gibt keinen klaren Hinweis darauf, dass Trevena in der Lage war, die FDA davon zu überzeugen, sie bei Meinungsverschiedenheiten zu beeinflussen.
https://seekingalpha.com/article/4212766-trevena-toast
Antwort auf Beitrag Nr.: 59.006.982 von deRendite am 19.10.18 19:28:24Danke für die positive Nachricht, ich habe TRVN beim hoch verkauft und bin wieder eingestiegen.
Ich verfolgte ACRX aber die Volatilität der Aktie hat mich nicht überzeugt (dass ist wie ein Frühwarnsystem), zum glück stornierte ich den Auftrag $3,65 vor ein paar Tagen .
Sehe ich als leihe ebenso, Oliceridine wird nur von den Aerzten kontrolliert verabreicht, wieso
dieser Theater an dem AdCom-Meeting.
Bemerkung:
Außerdem bleibt festzuhalten, dass Olicierdine zwar nicht effektiver als Morphin sein dürfte, aber zumindest bei gewissenen Risikopatienten seine Einsatzberechtigung hat.
ACRX war heute schon mal -14%....
und wenn es Happyend gibt TRVN dann steigt sie auf $7.
Schönes Wochenende wünsch ich Dir.
Ich verfolgte ACRX aber die Volatilität der Aktie hat mich nicht überzeugt (dass ist wie ein Frühwarnsystem), zum glück stornierte ich den Auftrag $3,65 vor ein paar Tagen .
Sehe ich als leihe ebenso, Oliceridine wird nur von den Aerzten kontrolliert verabreicht, wieso
dieser Theater an dem AdCom-Meeting.
Bemerkung:
Außerdem bleibt festzuhalten, dass Olicierdine zwar nicht effektiver als Morphin sein dürfte, aber zumindest bei gewissenen Risikopatienten seine Einsatzberechtigung hat.
ACRX war heute schon mal -14%....
und wenn es Happyend gibt TRVN dann steigt sie auf $7.
Schönes Wochenende wünsch ich Dir.
7$?
Wäre ja fast ein Tenbagger vom jetzigen Kurs ausgesehen...
Soll mir recht sein, bin mit paar Kröten nach dem Absturz bei 1,18 eingestiegen 😉
Wäre ja fast ein Tenbagger vom jetzigen Kurs ausgesehen...
Soll mir recht sein, bin mit paar Kröten nach dem Absturz bei 1,18 eingestiegen 😉
Antwort auf Beitrag Nr.: 59.008.227 von Stoxtrayder am 19.10.18 21:54:41Das wäre ein 7 Dollar Traum, aber die Realität spricht eher dagegen
Ich bin mit 1.07 wieder eingestiegen und frage mich zu welchen Kurs steige ich wieder aus.
Vor ein paar Tagen war der Boden bei 0.83 und jetzt bei 0.483 bei Ablehnung der Zulassung ein
realistische Bewertung für die nächsten Monate und dann könnte TRVN wieder steigen mit
neue positiven News.
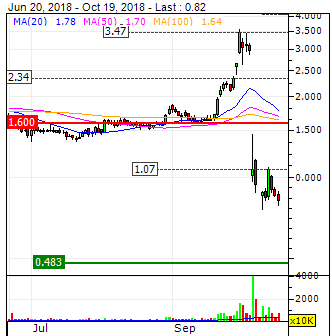
Ich bin mit 1.07 wieder eingestiegen und frage mich zu welchen Kurs steige ich wieder aus.
Vor ein paar Tagen war der Boden bei 0.83 und jetzt bei 0.483 bei Ablehnung der Zulassung ein
realistische Bewertung für die nächsten Monate und dann könnte TRVN wieder steigen mit
neue positiven News.

.....ob so oder so , die nächsten tage werden äusserst spannend werden , besonders der vorteig der entscheidung , also kommenden montag . zocker und andere "abenteuerer" steigen davor noch ein und hoffen nicht nur auf ein kleines wunder , sondern viel mehr auf die auflagen der FDA , die noch trevena auf den weg gegeben werden , um doch noch (wenn auch verspätet) zum erfolg zu kommen , medizinisch wie auch kommerziell gesehen ...n m M.
Antwort auf Beitrag Nr.: 59.015.635 von herthafan am 21.10.18 20:40:38Zurzeit pendelt TRVN zwischen 0.895- 0.91 gegen Handelsschluss könnte noch eine Kaufwelle starten.
Im Vergleich zu ACRX Market Cap 235Mio zu 65Mio liegt bei TRVN noch mehr Aufholbedarf.
Im Vergleich zu ACRX Market Cap 235Mio zu 65Mio liegt bei TRVN noch mehr Aufholbedarf.

Vor 7 Tagen hat sich das gleiche candle muster gebildet, ein Tag darauf +28% !!!

Der Kurs muss bis Handelsschluss über 0.90 - 0.94 schliessen.
Die FDA muss sich übrigens nicht zwangsläufig an das Datum des PDUFA Date halten. Eine Entscheidung kann auch vorher fallen (aber nicht später). Eine Zulassung ist wohl eher unwahrscheinlich aber nicht gänzlich ausgeschlossen. Viel Glück!
...keiner verkauft und das ist wohl eher als positiv zu bewerten , die zocker werden noch eingreifen ins geschehen und vielleicht auch noch die eine oder andere analyse , eventuell auch die der hexe !
Antwort auf Beitrag Nr.: 59.038.657 von herthafan am 24.10.18 09:51:26Ohne der heftigen Börsen-Korrektur von gestern wäre vielleicht TRVN schon Richtung $1 gelaufen.
Antwort auf Beitrag Nr.: 58.977.723 von Cyberhexe am 17.10.18 07:32:59
...meine Verkaufsorder konnte bisher nicht realisiert werden, so dass ich sehr wahrscheinlich am 2.11. 15.000 Aktien halten werde.
Weil das Potenzial für Missbrauch eines in Krankenhäusern verabreichten iv-Schmerzmittels doch eher überschaubar ist, halte ich die Zulassungschancen von Oli nicht wesentlich geringer als für das oral verabreichte Dsuvia (PDUFA 3.11.2018). Abstimmungsverhalten bei Dsuvia an dessen AC 10 zu 3 für Zulassung.
Zitat von Cyberhexe: Wie sind die Aussichten hinsichtlich der anstehenden Zulassungsentscheidung? Folgende Szenarien sind möglich:
1.) mit einer bedigungslosen Zulassung ist überhaupt nicht zu rechnen. Deren Wahrscheinlichkeit dürfte gegen 0 gehen.
2.) eine bedingte Zulassung in Verbindung mit einer ph4-Studie (postmarket drug safety surveillance) ist wohl das bestmögliche Szenario; obschon ich mir diese Variante nebst der nächsten Variante für meine 15.000 Aktien wünsche, halte ich die Wahrscheinlichkeit für eher gering (wenn ich schätzen müsste, vierlleicht 10%)
3.) Da die Beurteilung bereits eingereichter Daten zur QT-Verlängerung (verzögerte Repolarisation beim Herzschlag) noch aussteht, könnte die FDA den Zeitpunkt für die Entscheidung (PDUFA) um 3 Monate verschieben, also auf 2.2.2019 (20%)
4.) in Anbetracht der Datenlage und des Abstimmungsvervhalten der AC-Mitglieder ist die Wahrscheinlichkeit eines CRL (Complete Response Letter) gross (70%). In diesem Fall wird darauf zu achten sein, welche zusätzlichen Daten von der Behörde verlangt werden. Der schlechteste Fall wäre, wenn eine komplette zusätzliche ph3-Studie verlangt wird, welche einerseits lange dauert und andererseits mit den vorhandenen Ressourcen kaum zu finanzieren ist. Weniger dramatisch wäre das Einfordern einer nicht-klinischen Studie. Die Wahrscheinlichkeit der beiden Fälle würde ich auf 50/50 schätzen, so dass das "Worst case scenario" mit einer persönlichen Wahrscheinlichkeit von ca. 35% erwartet wird.
In Anbetracht der Wahrscheinlichkeit und des Potenzials bei Nichteintreten des schlechtesten Falles (65%) werde ich sehr wahrscheinlich mit 2/3 der 15.000 Aktien die Zulassungsentscheidung am 2.11.2018 abwarten.
5.000 Aktien sind bereits mit einer Verkaufsorder vermerkt ($1.19)
...meine Verkaufsorder konnte bisher nicht realisiert werden, so dass ich sehr wahrscheinlich am 2.11. 15.000 Aktien halten werde.
Weil das Potenzial für Missbrauch eines in Krankenhäusern verabreichten iv-Schmerzmittels doch eher überschaubar ist, halte ich die Zulassungschancen von Oli nicht wesentlich geringer als für das oral verabreichte Dsuvia (PDUFA 3.11.2018). Abstimmungsverhalten bei Dsuvia an dessen AC 10 zu 3 für Zulassung.
Antwort auf Beitrag Nr.: 59.045.584 von Cyberhexe am 24.10.18 18:55:51der Knackpunkt:
der Nachweis, dass Oli hinsichtlich Atmungsdepression vorteilhaft ist, wurde nicht mit statistischer Signifikanz erbracht:

der Nachweis, dass Oli hinsichtlich Atmungsdepression vorteilhaft ist, wurde nicht mit statistischer Signifikanz erbracht:

Antwort auf Beitrag Nr.: 59.045.995 von Cyberhexe am 24.10.18 19:31:00in Trevenas Präsentation sieht das schon wesentlich gefälliger aus:
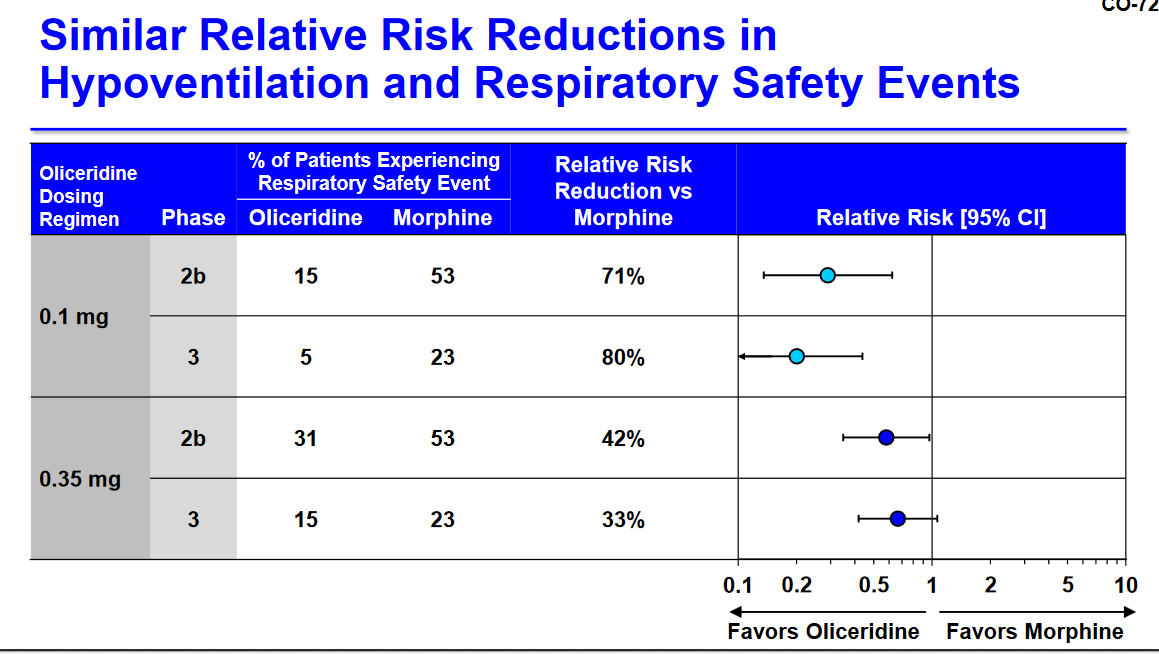

Antwort auf Beitrag Nr.: 59.046.046 von Cyberhexe am 24.10.18 19:37:00Leider gab es dazu noch immer kein Statement vom Management!
Antwort auf Beitrag Nr.: 59.046.148 von PESCADOS am 24.10.18 19:44:35
...das wäre total kontraproduktiv, vor einer derat wichtigen Entscheidung mit irgendwelchen Kommentaren an die Öffentlichkeit zu gehen. Auf dem AC wurde alles gesagt , was zu sagen ist. Nun ist der Ball bei der Arzneimittelbehörde.
...und unabhängig davon, welche Entscheidung am 2.11.veröffentlicht wird, ist festzustellen, das Trevena bzw. deren Referenten am AC einen hervorragenden job gemacht haben.

Zitat von PESCADOS: Leider gab es dazu noch immer kein Statement vom Management!
...das wäre total kontraproduktiv, vor einer derat wichtigen Entscheidung mit irgendwelchen Kommentaren an die Öffentlichkeit zu gehen. Auf dem AC wurde alles gesagt , was zu sagen ist. Nun ist der Ball bei der Arzneimittelbehörde.
...und unabhängig davon, welche Entscheidung am 2.11.veröffentlicht wird, ist festzustellen, das Trevena bzw. deren Referenten am AC einen hervorragenden job gemacht haben.

Antwort auf Beitrag Nr.: 59.047.780 von Cyberhexe am 24.10.18 22:05:19DIe Zahlen von Trevena zu den Risiken und Nebenwirkungen sehen gut aus, aber im AC wurde immer wieder bezweifelt, ob da nicht Äpfel mit Birnen verglichen wurden. Soll heißen, ob die Dosis die gleiche Wirksamkeit wie die zum Vergleich herangezogene Morphin-Dosis hatte. Darauf zielt ja auch der erste Punkt in der oben zitierten FDA Folie zu den 3001 und 3002 Studien ab. Die Vermutung einiger Panel-Mitglieder war, dass Oliceridin bei einer gleich wirkenden Dosis nicht mehr besser ist als Morphin. Es wurde aber fst einhellig (bis auf ein weibliches Panel-Mitglied) festgeatellt, dass Oliceridin in dem Punkt höchstwahrscheinlich nicht schlechter ist als Morphin. Deshalb hoffe ich dennoch auf Zulassung.
Antwort auf Beitrag Nr.: 59.049.142 von deRendite am 25.10.18 04:30:57
...ich kann deinen Beobachtungen voll und ganz zustimmen, dass die AC-Mitglieder äquivalenten Dosen ähnliche Nebenwirkungen beigemessen haben, obschon Trevena versucht hat, auf ein breiteres therapeutische Fenster hinzuweisen:
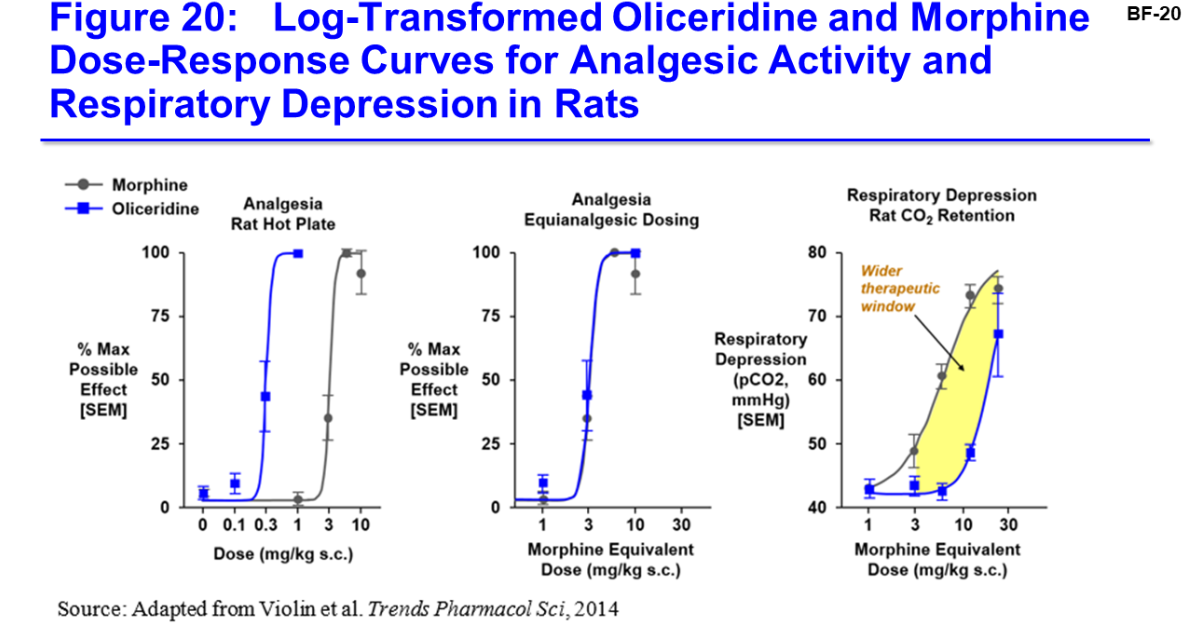
Zitat von deRendite: DIe Zahlen von Trevena zu den Risiken und Nebenwirkungen sehen gut aus, aber im AC wurde immer wieder bezweifelt, ob da nicht Äpfel mit Birnen verglichen wurden. Soll heißen, ob die Dosis die gleiche Wirksamkeit wie die zum Vergleich herangezogene Morphin-Dosis hatte. Darauf zielt ja auch der erste Punkt in der oben zitierten FDA Folie zu den 3001 und 3002 Studien ab. Die Vermutung einiger Panel-Mitglieder war, dass Oliceridin bei einer gleich wirkenden Dosis nicht mehr besser ist als Morphin. Es wurde aber fst einhellig (bis auf ein weibliches Panel-Mitglied) festgeatellt, dass Oliceridin in dem Punkt höchstwahrscheinlich nicht schlechter ist als Morphin. Deshalb hoffe ich dennoch auf Zulassung.
...ich kann deinen Beobachtungen voll und ganz zustimmen, dass die AC-Mitglieder äquivalenten Dosen ähnliche Nebenwirkungen beigemessen haben, obschon Trevena versucht hat, auf ein breiteres therapeutische Fenster hinzuweisen:

Antwort auf Beitrag Nr.: 59.049.316 von Cyberhexe am 25.10.18 07:13:47Genau. Und meine Hoffnung ist halt, dass die FDA das einsieht und eine P4 verlangt. Wenn sich die Sichtweise des Sponsors darin bestätigt, hätte man einen Schritt nach vorn gemacht, was die Arzneimittelsicherheit angeht. Wenn nicht, hätte man nichts verloren und vor allem die Entwicklung dieser neuen Produktklasse nicht abgewürgt. Dass Oli schlechter ist, ist auf Basis der vorliegenden Daten nicht zu erwarten.
Der größte Unterschied zu Morphin scheint mir in der schnelleren Wirkung zu liegen. Damit lässt sich im Grunde auch der Vorteil bei Übelkeit und Erbrechen erklären. Im KKH wird das ja mit einer Apparatur zur Selbstverabreichung gelöst. Der Patient kann sich per Knopfdruck selber eine kleine Dosis verabreichen. Danach ist das für eine Zeit (6 Minuten? genaue Zeit weiß ich aus dem Kopf nicht) gesperrt. Wenn es aber länger dauert bis der Patient die Wirkung spürt drückt er halt beim nächstmöglichen Zeitpunkt nochmal drauf. So kommt es bei Morphin wohl eher zu einer Überdosierung. TRVN hatte das in der Vergangenheit in den Präsentationen in einer graphischen Darstellung aufgezeigt.
Ich fänd es von daher schade, wenn Oliceridin nicht zugelassen würde. Der Unterschied zu Morphin ist sicher nicht groß aber doch vorhanden. Wenn es nicht klappt muss man die Schuld aber sicher bei TRVN suchen...
Ich fänd es von daher schade, wenn Oliceridin nicht zugelassen würde. Der Unterschied zu Morphin ist sicher nicht groß aber doch vorhanden. Wenn es nicht klappt muss man die Schuld aber sicher bei TRVN suchen...
Antwort auf Beitrag Nr.: 59.051.665 von kmastra am 25.10.18 10:58:13
Vermutlich. Im AdComm Meeting selbst waren sie excellent und haben sich keine Blöße gegeben. Es scheint aber, dass man im Vorfeld besser mit der FDA hätte kooperieren können um nicht mit einem so negativen Grund-Tenor in den Vorabunterlagen zu starten.
Zitat von kmastra: Wenn es nicht klappt muss man die Schuld aber sicher bei TRVN suchen...
Vermutlich. Im AdComm Meeting selbst waren sie excellent und haben sich keine Blöße gegeben. Es scheint aber, dass man im Vorfeld besser mit der FDA hätte kooperieren können um nicht mit einem so negativen Grund-Tenor in den Vorabunterlagen zu starten.
Danke an euch für eure gedanken...@hexe @ derendite und die anderen.
bin wenigstens nicht allein mit den sorgen und hoffen.
hier noch ein älterer positiv geschriebener korea artikel bzw. studie...
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5904350/
auf die sucht wird da allerdings nicht eingegangen...
bin wenigstens nicht allein mit den sorgen und hoffen.
hier noch ein älterer positiv geschriebener korea artikel bzw. studie...
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5904350/
auf die sucht wird da allerdings nicht eingegangen...
Antwort auf Beitrag Nr.: 59.049.316 von Cyberhexe am 25.10.18 07:13:47
wie ist denn derzeit die Stimmung in den US-Foren zu TRVN, auf was spekulieren die denn?
@Syperhexe
Hallo Cyperhexe,wie ist denn derzeit die Stimmung in den US-Foren zu TRVN, auf was spekulieren die denn?
Antwort auf Beitrag Nr.: 59.073.610 von clourac am 27.10.18 16:49:56Die Bullen machen sich mut, wohl auch, weil ein CRL (also eine Ablehnung auch schon vor PDUFA) hätte kommen können. Das finde ich persönlich einen etwas dünnen Strohhalm. Und die Bären? Die sind still. Ihnen war es wohl inzwischen zu langweilig und sie sind weitergezogen, weil sie das Ding schon seit dem AC für tot halten.
Nächste Woche wissen wir mehr. Vielleicht kommen ab Montag auch noch ein paar Zocker und kaufen sich ein.
Ich kann nur hoffen, dass Trevena die Zeit nach dem AC gut genutzt hat und mit der FDA kooperiert hat, ohne hochnäsig zu sein.
Nächste Woche wissen wir mehr. Vielleicht kommen ab Montag auch noch ein paar Zocker und kaufen sich ein.
Ich kann nur hoffen, dass Trevena die Zeit nach dem AC gut genutzt hat und mit der FDA kooperiert hat, ohne hochnäsig zu sein.
Antwort auf Beitrag Nr.: 59.073.610 von clourac am 27.10.18 16:49:56
...überwiegend skeptisch. Paradoxerweise wird die Opioidkrise mit bis zu 1000 Todesfällen pro Woche und die herbeigeschaffene Knappheit sowohl von Befürwortern als auch von Skeptikern als Argument für deren Haltung zitiert.
Ich glaube jedoch, dass die vorgebrachten Argumente (Pro: Knappheit an Opiaten verlangt nach neuen Medis - Contra: ein weiteres Medi wird die Krise verschärfen) keinen Einfluss auf die Entscheidung der Behörde haben. Diese wird das Risk/Benefit-Verhältnis von Oliceridine unabhängig von diesen vorgebrachten "Argumenten" abwägen und eine Entscheidung treffen.
Ich persönlich rechne mittlerweile mit einem CRL (Complete Response Letter), in welchem zusätzliche daten entweder zur Atmungsdepression oder aber zur QT-Verlängerung verlangt werden. Das wäre nicht das Ende!
Zitat von clourac: Hallo Cyperhexe,
wie ist denn derzeit die Stimmung in den US-Foren zu TRVN, auf was spekulieren die denn?
...überwiegend skeptisch. Paradoxerweise wird die Opioidkrise mit bis zu 1000 Todesfällen pro Woche und die herbeigeschaffene Knappheit sowohl von Befürwortern als auch von Skeptikern als Argument für deren Haltung zitiert.
Ich glaube jedoch, dass die vorgebrachten Argumente (Pro: Knappheit an Opiaten verlangt nach neuen Medis - Contra: ein weiteres Medi wird die Krise verschärfen) keinen Einfluss auf die Entscheidung der Behörde haben. Diese wird das Risk/Benefit-Verhältnis von Oliceridine unabhängig von diesen vorgebrachten "Argumenten" abwägen und eine Entscheidung treffen.
Ich persönlich rechne mittlerweile mit einem CRL (Complete Response Letter), in welchem zusätzliche daten entweder zur Atmungsdepression oder aber zur QT-Verlängerung verlangt werden. Das wäre nicht das Ende!
Antwort auf Beitrag Nr.: 59.080.859 von Cyberhexe am 29.10.18 08:48:25.....danke liebe hexe , d h. auch mit einer verlängerung (ehrenrunde) würde das ziel zu erreichen sein , allerdings müsste man dann wohl noch 4-6 monate in kauf nehmen müssen um noch zu einem positivem finale zu gelangen ......good luck.....
Antwort auf Beitrag Nr.: 59.081.105 von herthafan am 29.10.18 09:12:06
sorry, aber 4-6 Monate würden selbstverständlich nicht reichen.
Zitat von herthafan: .....danke liebe hexe , d h. auch mit einer verlängerung (ehrenrunde) würde das ziel zu erreichen sein , allerdings müsste man dann wohl noch 4-6 monate in kauf nehmen müssen um noch zu einem positivem finale zu gelangen ......good luck.....
sorry, aber 4-6 Monate würden selbstverständlich nicht reichen.
Sollte das stimmen, dann Gute Nacht Trevena!
Oct. 29, 2018 16:28 UTC
Robbins Arroyo LLP: Trevena, Inc. (TRVN) Misled Shareholders According to Another Class Action
SAN DIEGO & CHESTERBROOK, Pa.--(BUSINESS WIRE)-- Shareholder rights law firm Robbins Arroyo LLP announces that purchasers of Trevena, Inc. (NasdaqGS: TRVN) have filed a class action complaint against the company's officers and directors for alleged violations of the Securities Exchange Act of 1934 between May 2, 2016 and October 9, 2018. Trevena, a biopharmaceutical company, develops therapies based on breakthrough science to benefit patients and healthcare providers confronting serious medical conditions. Trevena's product candidate, known as oliceridine, is designed to treat pain intravenously.
View this information on the law firm's Shareholder Rights Blog: https://www.robbinsarroyo.com/trevena-inc-oct-2018/
Trevena Accused of Lying to Investors About Critical FDA Meeting for Over Two Years
According to the complaint, Trevena led shareholders to believe that the company's April 2016 End-of-Phase 2 meeting with the U.S. Food and Drug Administration ("FDA") was more successful than it actually was. Trevena stated that it had reached an agreement with the FDA on key elements of its Phase 3 program for oliceridine and that the company was "very pleased" with the outcome. However, on October 9, 2018, the FDA released meeting minutes from the April 2016 meeting revealing that the FDA did not agree with the proposed dosing in the Phase 3 studies, among other things. Then, on October 11, 2018, Trevena announced that the FDA denied its New Drug Application for oliceridine. Trevena's stock plummet on this news and now trades under $1.00.
Trevena Shareholders Have Legal Options
Concerned shareholders who would like more information about their rights and potential remedies can contact attorney Leonid Kandinov at (800) 350-6003, LKandinov@robbinsarroyo.com, or via the shareholder information form on the firm's website.
Robbins Arroyo LLP is a nationally recognized leader in shareholder rights law. The firm represents individual and institutional investors in shareholder derivative and securities class action lawsuits, and has helped its clients realize more than $1 billion of value for themselves and the companies in which they have invested. Sign up for our FREE portfolio monitoring service, Stock Watch.
Attorney Advertising. Past results do not guarantee a similar outcome.
View source version on businesswire.com: https://www.businesswire.com/news/home/20181029005582/en/
Contacts
Robbins Arroyo LLP
Leonid Kandinov
LKandinov@robbinsarroyo.com
(619) 525-3990 or Toll Free (800) 350-6003
www.robbinsarroyo.com
Oct. 29, 2018 16:28 UTC
Robbins Arroyo LLP: Trevena, Inc. (TRVN) Misled Shareholders According to Another Class Action
SAN DIEGO & CHESTERBROOK, Pa.--(BUSINESS WIRE)-- Shareholder rights law firm Robbins Arroyo LLP announces that purchasers of Trevena, Inc. (NasdaqGS: TRVN) have filed a class action complaint against the company's officers and directors for alleged violations of the Securities Exchange Act of 1934 between May 2, 2016 and October 9, 2018. Trevena, a biopharmaceutical company, develops therapies based on breakthrough science to benefit patients and healthcare providers confronting serious medical conditions. Trevena's product candidate, known as oliceridine, is designed to treat pain intravenously.
View this information on the law firm's Shareholder Rights Blog: https://www.robbinsarroyo.com/trevena-inc-oct-2018/
Trevena Accused of Lying to Investors About Critical FDA Meeting for Over Two Years
According to the complaint, Trevena led shareholders to believe that the company's April 2016 End-of-Phase 2 meeting with the U.S. Food and Drug Administration ("FDA") was more successful than it actually was. Trevena stated that it had reached an agreement with the FDA on key elements of its Phase 3 program for oliceridine and that the company was "very pleased" with the outcome. However, on October 9, 2018, the FDA released meeting minutes from the April 2016 meeting revealing that the FDA did not agree with the proposed dosing in the Phase 3 studies, among other things. Then, on October 11, 2018, Trevena announced that the FDA denied its New Drug Application for oliceridine. Trevena's stock plummet on this news and now trades under $1.00.
Trevena Shareholders Have Legal Options
Concerned shareholders who would like more information about their rights and potential remedies can contact attorney Leonid Kandinov at (800) 350-6003, LKandinov@robbinsarroyo.com, or via the shareholder information form on the firm's website.
Robbins Arroyo LLP is a nationally recognized leader in shareholder rights law. The firm represents individual and institutional investors in shareholder derivative and securities class action lawsuits, and has helped its clients realize more than $1 billion of value for themselves and the companies in which they have invested. Sign up for our FREE portfolio monitoring service, Stock Watch.
Attorney Advertising. Past results do not guarantee a similar outcome.
View source version on businesswire.com: https://www.businesswire.com/news/home/20181029005582/en/
Contacts
Robbins Arroyo LLP
Leonid Kandinov
LKandinov@robbinsarroyo.com
(619) 525-3990 or Toll Free (800) 350-6003
www.robbinsarroyo.com
Antwort auf Beitrag Nr.: 59.086.541 von PESCADOS am 29.10.18 18:33:53Warum sollte Robbins Arroyo schlimmer sein als die 10 Anwälte vorher oder die 10, die auch noch auf den Zug aufspringen werden? Das beunruhigt mich eher wenig.
Antwort auf Beitrag Nr.: 59.086.541 von PESCADOS am 29.10.18 18:33:53Jetz geht das wieder los......Sammelklagen gegen Trevena, Sammelklagen gegen Steinhoff, Sammelklagen gegen Gott und die Welt. Es gibt immer Aktionäre die sich benachteiligt fühlen und sich beklagen um zu klagen......Der einzigste der verdient...wenn überhaupt ist die Anwaltskanzlei.
Antwort auf Beitrag Nr.: 59.087.864 von bernstein789 am 29.10.18 20:31:02Ohhhh......und morgen geht das Gespenst der Insolvenz wieder um...lach!!!!!!
Antwort auf Beitrag Nr.: 58.926.912 von Cyberhexe am 11.10.18 10:08:44
Es gibt aber auch Anlass zur Hoffnung - zB die Begründung von John Alexander (temporäres, stimmberechtigtes Mitglied am AC --> siehe Pos.#7 im beigefügten historischen Beitrag) für sein Abstimmungsverhalten:

Zitat von Cyberhexe: ich hab gerade noch einmal die Teilnehmerliste des heutigen AC gesichtet und muss mich verbessern!!
Folgende Teilnehmer werden am AC teilnehmen - davon werden 15 Teilnehmer zur Abstimmung aufgefordert:
DESIGNATED FEDERAL OFFICER (Non-Voting)
Moon Hee V. Choi, PharmD
Division of Advisory Committee and Consultant Management
Office of Executive Programs, CDER, FDA
ANESTHETIC AND ANALGESIC DRUG PRODUCTS ADVISORY COMMITTEE MEMBERS
(Voting)
1.) Basavana G. Goudra, MD, FRCA, FCARSCI
Clinical Associate Professor of Anesthesiology and
Critical Care Medicine
Director of Endoscopy Anesthesia Services at the
Penn Presbyterian Medical Center
Perelman School of Medicine
Hospital of the University of Pennsylvania
Philadelphia, Pennsylvania
2.) Ronald S. Litman, DO, ML
Professor of Anesthesiology & Pediatrics
Perelman School of Medicine, Univ. of Pennsylvania
Attending Anesthesiologist
The Children’s Hospital of Philadelphia
Medical Director
Institute for Safe Medication Practices
Philadelphia, Pennsylvania
3.) Mary Ellen McCann, MD, MPH
Associate Professor of Anesthesia
Harvard Medical School
Senior Associate in Anesthesia
Boston Children’s Hospital
Boston, Massachusetts
4.) Abigail B. Shoben, PhD
Associate Professor, Division of Biostatistics
College of Public Health
The Ohio State University
Columbus, Ohio
5.) Kevin L. Zacharoff, MD, FACIP, FACPE, FAAP
(Acting Chairperson)
Faculty and Clinical Instructor
Pain and Medical Ethics
State University of New York, Stony Brook School
of Medicine, Stony Brook, New York
Ethics Committee Chair
St. Catherine of Siena Medical Center
Smithtown, New York
6.) Lonnie Zeltzer, MD
Director, Pediatric Pain and Palliative Care Program
Division of Pediatric Hematology-Oncology
Distinguished Professor of Pediatrics, Anesthesiology,
Psychiatry and Biobehavioral Sciences
David Geffen School of Medicine at UCLA
Los Angeles, California
ANESTHETIC AND ANALGESIC DRUG PRODUCTS ADVISORY COMMITTEE MEMBER (Non-Voting)
W. Joseph Herring, MD, PhD
(Industry Representative)
Associate Vice President , Clinical Neuroscience
Merck Research Laboratories
North Wales, Pennsylvania
TEMPORARY MEMBERS (Voting)
7.) John H. Alexander, MD, MHS
Professor of Medicine / Cardiology
Interim Director, Cardiac Diagnostic Unit
Director, Cardiovascular Research
Duke Clinical Research Institute
Duke Health
Durham, North Carolina
8.) Michael Fischer, MD, MS
Associate Professor of Medicine
Harvard Medical School
Associate Professor of Epidemiology
Harvard T.H. Chan School of Public Health
Division of Pharmacoepidemiology &
Pharmacoeconomics
Brigham & Women's Hospital
Boston, Massachusetts
9.) Jennifer Higgins, PhD
(Acting Consumer Representative)
Director of Research & Policy
Association of Developmental Disabilities
Providers
Framingham, Massachusetts
10.) Alan Kaye, MD, PhD
Professor, Program Director, and Chair
Department of Anesthesiology
Louisiana State University
New Orleans, Louisiana
11.) Joseph P. O'Brien, MBA
(Patient Representative)
President & Chief Executive Officer
National Scoliosis Foundation
Stoughton, Massachusetts
12.) Marjorie Shaw Phillips, MS, RPh, FASHP, CIP
Pharmacy Coordinator
Clinical Research and Education
AU Medical Center at Augusta University
Clinical Professor of Pharmacy Practice
University of Georgia College of Pharmacy
Augusta, Georgia
13.) Steven Solga, MD
Associate Professor of Clinical Medicine
Transplant Hepatology Program Director
Perelman School of Medicine
University of Pennsylvania
Philadelphia, Pennsylvania
14.) Gregory Terman, MD, PhD
Professor
Department of Anesthesiology and Pain Medicine
and the Graduate Program in Neuroscience
University of Washington
Seattle, Washington
15.) Terri L. Warholak, PhD, RPh, CPHQ, FAPhA
Professor and Assistant Dean
Academic Affairs and Assessment
College of Pharmacy
University of Arizona
Tucson, Arizona
FDA PARTICIPANTS (Non-Voting)
Mary Thanh Hai, MD
Acting Office Director
Office of Drug Evaluation II (ODE-II)
Office of New Drugs (OND), CDER, FDA
Sharon Hertz, MD
Director
Division of Anesthesia, Analgesia and Addiction
Products (DAAAP)
ODE-II, OND, CDER, FDA
Janet Maynard, MD, MHS
Clinical Team Leader
DAAAP, ODE-II, OND, CDER, FDA
Elizabeth Kilgore, MD, MS
Medical Officer
DAAAP, ODE-II, OND, CDER, FDA
David Petullo, PhD
Statistical Team Leader
Division of Biometrics II
Office of Biostatistics
Office of Translational Sciences, CDER, FDA
Es gibt aber auch Anlass zur Hoffnung - zB die Begründung von John Alexander (temporäres, stimmberechtigtes Mitglied am AC --> siehe Pos.#7 im beigefügten historischen Beitrag) für sein Abstimmungsverhalten:

Antwort auf Beitrag Nr.: 59.097.251 von Cyberhexe am 30.10.18 19:04:00
...oder aber die Begründung des Vorsitzenden des Oliceridine Advisory Committees vom 11.10.2018
Kevin Zacharoff:

5.) Kevin L. Zacharoff, MD, FACIP, FACPE, FAAP
(Acting Chairperson)
Faculty and Clinical Instructor
Pain and Medical Ethics
State University of New York, Stony Brook School
of Medicine, Stony Brook, New York
Ethics Committee Chair
St. Catherine of Siena Medical Center
Smithtown, New York
Zitat von Cyberhexe:Zitat von Cyberhexe: ich hab gerade noch einmal die Teilnehmerliste des heutigen AC gesichtet und muss mich verbessern!!
Folgende Teilnehmer werden am AC teilnehmen - davon werden 15 Teilnehmer zur Abstimmung aufgefordert:
DESIGNATED FEDERAL OFFICER (Non-Voting)
Moon Hee V. Choi, PharmD
Division of Advisory Committee and Consultant Management
Office of Executive Programs, CDER, FDA
ANESTHETIC AND ANALGESIC DRUG PRODUCTS ADVISORY COMMITTEE MEMBERS
(Voting)
1.) Basavana G. Goudra, MD, FRCA, FCARSCI
Clinical Associate Professor of Anesthesiology and
Critical Care Medicine
Director of Endoscopy Anesthesia Services at the
Penn Presbyterian Medical Center
Perelman School of Medicine
Hospital of the University of Pennsylvania
Philadelphia, Pennsylvania
2.) Ronald S. Litman, DO, ML
Professor of Anesthesiology & Pediatrics
Perelman School of Medicine, Univ. of Pennsylvania
Attending Anesthesiologist
The Children’s Hospital of Philadelphia
Medical Director
Institute for Safe Medication Practices
Philadelphia, Pennsylvania
3.) Mary Ellen McCann, MD, MPH
Associate Professor of Anesthesia
Harvard Medical School
Senior Associate in Anesthesia
Boston Children’s Hospital
Boston, Massachusetts
4.) Abigail B. Shoben, PhD
Associate Professor, Division of Biostatistics
College of Public Health
The Ohio State University
Columbus, Ohio
5.) Kevin L. Zacharoff, MD, FACIP, FACPE, FAAP
(Acting Chairperson)
Faculty and Clinical Instructor
Pain and Medical Ethics
State University of New York, Stony Brook School
of Medicine, Stony Brook, New York
Ethics Committee Chair
St. Catherine of Siena Medical Center
Smithtown, New York
6.) Lonnie Zeltzer, MD
Director, Pediatric Pain and Palliative Care Program
Division of Pediatric Hematology-Oncology
Distinguished Professor of Pediatrics, Anesthesiology,
Psychiatry and Biobehavioral Sciences
David Geffen School of Medicine at UCLA
Los Angeles, California
ANESTHETIC AND ANALGESIC DRUG PRODUCTS ADVISORY COMMITTEE MEMBER (Non-Voting)
W. Joseph Herring, MD, PhD
(Industry Representative)
Associate Vice President , Clinical Neuroscience
Merck Research Laboratories
North Wales, Pennsylvania
TEMPORARY MEMBERS (Voting)
7.) John H. Alexander, MD, MHS
Professor of Medicine / Cardiology
Interim Director, Cardiac Diagnostic Unit
Director, Cardiovascular Research
Duke Clinical Research Institute
Duke Health
Durham, North Carolina
8.) Michael Fischer, MD, MS
Associate Professor of Medicine
Harvard Medical School
Associate Professor of Epidemiology
Harvard T.H. Chan School of Public Health
Division of Pharmacoepidemiology &
Pharmacoeconomics
Brigham & Women's Hospital
Boston, Massachusetts
9.) Jennifer Higgins, PhD
(Acting Consumer Representative)
Director of Research & Policy
Association of Developmental Disabilities
Providers
Framingham, Massachusetts
10.) Alan Kaye, MD, PhD
Professor, Program Director, and Chair
Department of Anesthesiology
Louisiana State University
New Orleans, Louisiana
11.) Joseph P. O'Brien, MBA
(Patient Representative)
President & Chief Executive Officer
National Scoliosis Foundation
Stoughton, Massachusetts
12.) Marjorie Shaw Phillips, MS, RPh, FASHP, CIP
Pharmacy Coordinator
Clinical Research and Education
AU Medical Center at Augusta University
Clinical Professor of Pharmacy Practice
University of Georgia College of Pharmacy
Augusta, Georgia
13.) Steven Solga, MD
Associate Professor of Clinical Medicine
Transplant Hepatology Program Director
Perelman School of Medicine
University of Pennsylvania
Philadelphia, Pennsylvania
14.) Gregory Terman, MD, PhD
Professor
Department of Anesthesiology and Pain Medicine
and the Graduate Program in Neuroscience
University of Washington
Seattle, Washington
15.) Terri L. Warholak, PhD, RPh, CPHQ, FAPhA
Professor and Assistant Dean
Academic Affairs and Assessment
College of Pharmacy
University of Arizona
Tucson, Arizona
FDA PARTICIPANTS (Non-Voting)
Mary Thanh Hai, MD
Acting Office Director
Office of Drug Evaluation II (ODE-II)
Office of New Drugs (OND), CDER, FDA
Sharon Hertz, MD
Director
Division of Anesthesia, Analgesia and Addiction
Products (DAAAP)
ODE-II, OND, CDER, FDA
Janet Maynard, MD, MHS
Clinical Team Leader
DAAAP, ODE-II, OND, CDER, FDA
Elizabeth Kilgore, MD, MS
Medical Officer
DAAAP, ODE-II, OND, CDER, FDA
David Petullo, PhD
Statistical Team Leader
Division of Biometrics II
Office of Biostatistics
Office of Translational Sciences, CDER, FDA
Es gibt aber auch Anlass zur Hoffnung - zB die Begründung von John Alexander (temporäres, stimmberechtigtes Mitglied am AC --> siehe Pos.#7 im beigefügten historischen Beitrag) für sein Abstimmungsverhalten:
...oder aber die Begründung des Vorsitzenden des Oliceridine Advisory Committees vom 11.10.2018
Kevin Zacharoff:

5.) Kevin L. Zacharoff, MD, FACIP, FACPE, FAAP
(Acting Chairperson)
Faculty and Clinical Instructor
Pain and Medical Ethics
State University of New York, Stony Brook School
of Medicine, Stony Brook, New York
Ethics Committee Chair
St. Catherine of Siena Medical Center
Smithtown, New York
Antwort auf Beitrag Nr.: 59.097.326 von Cyberhexe am 30.10.18 19:10:13...und noch ein Aufsteller:
ANESTHETIC AND ANALGESIC DRUG PRODUCTS ADVISORY COMMITTEE MEMBERS (Voting)
1.) Basavana G. Goudra, MD, FRCA, FCARSCI
Clinical Associate Professor of Anesthesiology and Critical Care Medicine Director of Endoscopy Anesthesia Services at the Penn Presbyterian Medical Center Perelman School of Medicine Hospital of the University of Pennsylvania Philadelphia, Pennsylvania

ANESTHETIC AND ANALGESIC DRUG PRODUCTS ADVISORY COMMITTEE MEMBERS (Voting)
1.) Basavana G. Goudra, MD, FRCA, FCARSCI
Clinical Associate Professor of Anesthesiology and Critical Care Medicine Director of Endoscopy Anesthesia Services at the Penn Presbyterian Medical Center Perelman School of Medicine Hospital of the University of Pennsylvania Philadelphia, Pennsylvania

Antwort auf Beitrag Nr.: 59.097.404 von Cyberhexe am 30.10.18 19:19:24...ABER, um ausgewogen zu bleiben, natürlich auch jene Stimmen:
"I don't think both the dose regimens have a positive risk-benefit profile," said Terri Warholak, PhD, of the University of Arizona College of Pharmacy, though he called oliceridine an "innovative molecule" and noted that better pain-relief options are needed for patients who are allergic to opioids.
"I also worry about the perception of the decreased respiratory symptoms, [because] while it was compared to morphine several times, it wasn't compared in doses that were equivalent," said Warholak.
"I don't think both the dose regimens have a positive risk-benefit profile," said Terri Warholak, PhD, of the University of Arizona College of Pharmacy, though he called oliceridine an "innovative molecule" and noted that better pain-relief options are needed for patients who are allergic to opioids.
"I also worry about the perception of the decreased respiratory symptoms, [because] while it was compared to morphine several times, it wasn't compared in doses that were equivalent," said Warholak.
der Experte rund um Lebererkrankungen bzw. Transplantationen
13.) Steven Solga, MD
Associate Professor of Clinical Medicine
Transplant Hepatology Program Director
Perelman School of Medicine
University of Pennsylvania
Philadelphia, Pennsylvania
votierte ebenfalls mit Nein - und zwar einem klaren Nein-, jedoch nicht aufgrund des Signals bei den Leberwerten. Seine Begründung wurde mE auch durch die konfuse Darstellung der Daten durch die FDA beeinflusst.
Er begründete folgendermassen:

aber der Hinweis...
"unlike some others, I actually felt fairly firm with my no. "
--> im Gegensatz zu einigen anderen, fühlte ich mich eigentlich ziemlich fest mit meinem Nein.
..., dass die anderen Neinsager sich mit ihrem Votum nicht so sicher sind, hat doch auch einen positiven Aspekt. Oh, ist das spannend!
13.) Steven Solga, MD
Associate Professor of Clinical Medicine
Transplant Hepatology Program Director
Perelman School of Medicine
University of Pennsylvania
Philadelphia, Pennsylvania
votierte ebenfalls mit Nein - und zwar einem klaren Nein-, jedoch nicht aufgrund des Signals bei den Leberwerten. Seine Begründung wurde mE auch durch die konfuse Darstellung der Daten durch die FDA beeinflusst.
Er begründete folgendermassen:

aber der Hinweis...
"unlike some others, I actually felt fairly firm with my no. "
--> im Gegensatz zu einigen anderen, fühlte ich mich eigentlich ziemlich fest mit meinem Nein.
..., dass die anderen Neinsager sich mit ihrem Votum nicht so sicher sind, hat doch auch einen positiven Aspekt. Oh, ist das spannend!
Antwort auf Beitrag Nr.: 59.099.993 von Cyberhexe am 31.10.18 06:49:23Also wieder 50/50 Chancen Cyberhexe?
Antwort auf Beitrag Nr.: 59.100.890 von PESCADOS am 31.10.18 08:57:23
an meiner Einschätzung, die ich kurz nach dem AC veröffentlicht habe, hat sich nichts geändert: 30/70
Wie sind die Aussichten hinsichtlich der anstehenden Zulassungsentscheidung?
Folgende Szenarien sind möglich:
1.) mit einer bedigungslosen Zulassung ist überhaupt nicht zu rechnen. Deren Wahrscheinlichkeit dürfte gegen 0 gehen.
2.) eine bedingte Zulassung in Verbindung mit einer ph4-Studie (postmarket drug safety surveillance) ist wohl das bestmögliche Szenario; obschon ich mir diese Variante nebst der nächsten Variante für meine 15.000 Aktien wünsche, halte ich die Wahrscheinlichkeit für eher gering (wenn ich schätzen müsste, vierlleicht 10%)
3.) Da die Beurteilung bereits eingereichter Daten zur QT-Verlängerung (verzögerte Repolarisation beim Herzschlag) noch aussteht, könnte die FDA den Zeitpunkt für die Entscheidung (PDUFA) um 3 Monate verschieben, also auf 2.2.2019 (20%)
4.) in Anbetracht der Datenlage und des Abstimmungsvervhalten der AC-Mitglieder ist die Wahrscheinlichkeit eines CRL (Complete Response Letter) gross (70%). In diesem Fall wird darauf zu achten sein, welche zusätzlichen Daten von der Behörde verlangt werden. Der schlechteste Fall wäre, wenn eine komplette zusätzliche ph3-Studie verlangt wird, welche einerseits lange dauert und andererseits mit den vorhandenen Ressourcen kaum zu finanzieren ist. Weniger dramatisch wäre das Einfordern einer nicht-klinischen Studie. Die Wahrscheinlichkeit der beiden Fälle würde ich auf 50/50 schätzen, so dass das "Worst case scenario" mit einer persönlichen Wahrscheinlichkeit von ca. 35% erwartet wird. In Anbetracht der Wahrscheinlichkeit und des Potenzials bei Nichteintreten des schlechtesten Falles (65%) werde ich sehr wahrscheinlich mit 2/3 der 15.000 Aktien die Zulassungsentscheidung am 2.11.2018 abwarten.
Zitat von PESCADOS: Also wieder 50/50 Chancen Cyberhexe?
an meiner Einschätzung, die ich kurz nach dem AC veröffentlicht habe, hat sich nichts geändert: 30/70
Wie sind die Aussichten hinsichtlich der anstehenden Zulassungsentscheidung?
Folgende Szenarien sind möglich:
1.) mit einer bedigungslosen Zulassung ist überhaupt nicht zu rechnen. Deren Wahrscheinlichkeit dürfte gegen 0 gehen.
2.) eine bedingte Zulassung in Verbindung mit einer ph4-Studie (postmarket drug safety surveillance) ist wohl das bestmögliche Szenario; obschon ich mir diese Variante nebst der nächsten Variante für meine 15.000 Aktien wünsche, halte ich die Wahrscheinlichkeit für eher gering (wenn ich schätzen müsste, vierlleicht 10%)
3.) Da die Beurteilung bereits eingereichter Daten zur QT-Verlängerung (verzögerte Repolarisation beim Herzschlag) noch aussteht, könnte die FDA den Zeitpunkt für die Entscheidung (PDUFA) um 3 Monate verschieben, also auf 2.2.2019 (20%)
4.) in Anbetracht der Datenlage und des Abstimmungsvervhalten der AC-Mitglieder ist die Wahrscheinlichkeit eines CRL (Complete Response Letter) gross (70%). In diesem Fall wird darauf zu achten sein, welche zusätzlichen Daten von der Behörde verlangt werden. Der schlechteste Fall wäre, wenn eine komplette zusätzliche ph3-Studie verlangt wird, welche einerseits lange dauert und andererseits mit den vorhandenen Ressourcen kaum zu finanzieren ist. Weniger dramatisch wäre das Einfordern einer nicht-klinischen Studie. Die Wahrscheinlichkeit der beiden Fälle würde ich auf 50/50 schätzen, so dass das "Worst case scenario" mit einer persönlichen Wahrscheinlichkeit von ca. 35% erwartet wird. In Anbetracht der Wahrscheinlichkeit und des Potenzials bei Nichteintreten des schlechtesten Falles (65%) werde ich sehr wahrscheinlich mit 2/3 der 15.000 Aktien die Zulassungsentscheidung am 2.11.2018 abwarten.
So oder so, wie du die Lage einschätzt, wird es keine fetten Kursgewinne mehr geben. Ausser es geschieht ein völliges Wunder!
Antwort auf Beitrag Nr.: 59.103.611 von PESCADOS am 31.10.18 13:05:28
...falls einer der Fälle 1-3 eintritt, dann sind fette Kursgewinne sehr wohl möglich. Auch wenn ich die Wahrscheinlichkeit auf einen CRL grösser erachte, sind diese 3 Möglichkeiten (eigentlich nur 2 --> 1. Szenario halte ich für sehr unwahrscheinlich) der Grund, dass ich meine Aktien nicht verkaufe. Das Potenzial "nach unten" ist überschaubar, während in die andere Richtung einiges möglich erscheint.
Aber VORSICHT: ich habe meine Position bereits abgeschrieben, so dass ich die FDA-Entscheidung gelassen erwarte.
Zitat von PESCADOS: So oder so, wie du die Lage einschätzt, wird es keine fetten Kursgewinne mehr geben. Ausser es geschieht ein völliges Wunder!
...falls einer der Fälle 1-3 eintritt, dann sind fette Kursgewinne sehr wohl möglich. Auch wenn ich die Wahrscheinlichkeit auf einen CRL grösser erachte, sind diese 3 Möglichkeiten (eigentlich nur 2 --> 1. Szenario halte ich für sehr unwahrscheinlich) der Grund, dass ich meine Aktien nicht verkaufe. Das Potenzial "nach unten" ist überschaubar, während in die andere Richtung einiges möglich erscheint.
Aber VORSICHT: ich habe meine Position bereits abgeschrieben, so dass ich die FDA-Entscheidung gelassen erwarte.
Antwort auf Beitrag Nr.: 59.103.761 von Cyberhexe am 31.10.18 13:22:09Naja Cyberhexe, das Problem, dass die Punkte 1-3 eintreten schätzt du ja selbst nur mit 3O Prozent ein...
Außerdem dürfte bei Trevena bald ein finanzielles Problem am Horizont auftauchen, sollte sich das Ganze noch in unbestimmte Länge ziehen!
Außerdem dürfte bei Trevena bald ein finanzielles Problem am Horizont auftauchen, sollte sich das Ganze noch in unbestimmte Länge ziehen!
Zacks Equity Research
October 31, 2018
Anleger von Trevena, Inc. TRVN muss die Aktie aufgrund der jüngsten Veränderungen des Optionsmarkts genau beobachten. Dies liegt daran, dass der Call Call 2,50 $ am 16. November 2018 heute die höchste implizierte Volatilität aller Aktienoptionen hatte.
October 31, 2018
Anleger von Trevena, Inc. TRVN muss die Aktie aufgrund der jüngsten Veränderungen des Optionsmarkts genau beobachten. Dies liegt daran, dass der Call Call 2,50 $ am 16. November 2018 heute die höchste implizierte Volatilität aller Aktienoptionen hatte.
Sieht so aus, als wären zumindest ein paar Glücksritter unterwegs.
Und für alle Glücksritter hier im Board - einen kleinen Blick zur Seite zu ACRX...
Und was gibt es da zu sehen?
Trevena hat seinen FDA Termin am 2.11., ACRX am 3.11. (also am Sam. ...)...
...)...
Sind wie "Geschwister"...beides Painkiller aus der Klasse der Opioide...nur ACRX ein 10:3 Adcom Votum. Haben aber auch noch reichlich Gegenwind durch die Public Citizen Lobby...
 ...)...
...)...Sind wie "Geschwister"...beides Painkiller aus der Klasse der Opioide...nur ACRX ein 10:3 Adcom Votum. Haben aber auch noch reichlich Gegenwind durch die Public Citizen Lobby...
Antwort auf Beitrag Nr.: 59.045.584 von Cyberhexe am 24.10.18 18:55:51"...Weil das Potenzial für Missbrauch eines in Krankenhäusern verabreichten iv-Schmerzmittels doch eher überschaubar ist, halte ich die Zulassungschancen von Oli nicht wesentlich geringer als für das oral verabreichte Dsuvia (PDUFA 3.11.2018). Abstimmungsverhalten bei Dsuvia an dessen AC 10 zu 3 für Zulassung..."
Ich bin in beiden Werten investiert...durchaus mit Hoffnungen für Oli!
Ich kann mir aber weniger vorstellen, dass Dsuvia nicht die Zulassung bekommt- ein 10:3 Votum ist meines Wissens wohl noch sehr sehr selten negativ beschieden worden, das Ministerium of Defence hat ne Menge Geld reingesteckt und der Gegenwind des Politikers und Public Citizen (hab mir mal die Website angesehen...so what, dann kommt kein Opioid mehr auf den Markt ...) dürfte keinen großen Einfluss haben.
...) dürfte keinen großen Einfluss haben.
Die Kurschancen bei Oli sind natürlich in Prozenten ungleich höher bzgl. einer Vervielfachung, aber es muss halt auch morgen was kommen...
Ich bin in beiden Werten investiert...durchaus mit Hoffnungen für Oli!
Ich kann mir aber weniger vorstellen, dass Dsuvia nicht die Zulassung bekommt- ein 10:3 Votum ist meines Wissens wohl noch sehr sehr selten negativ beschieden worden, das Ministerium of Defence hat ne Menge Geld reingesteckt und der Gegenwind des Politikers und Public Citizen (hab mir mal die Website angesehen...so what, dann kommt kein Opioid mehr auf den Markt
 ...) dürfte keinen großen Einfluss haben.
...) dürfte keinen großen Einfluss haben.Die Kurschancen bei Oli sind natürlich in Prozenten ungleich höher bzgl. einer Vervielfachung, aber es muss halt auch morgen was kommen...
Trevena schiebt All-In mit Oliceridin
https://translate.google.com/translate?sl=en&tl=de&js=y&prev…https://seekingalpha.com/article/4216900-trevena-pushes-olic…
Ich könnte mich immer noch ärgern- mit 24k durch das Panel und wegen 1 Stimme !! einen Kurshüpfer verpasst, der meine ganzen "Oktoberverluste" in den Gewinn gezogen hätte. Tja hätte, alles was jetzt kommt ist Schmerzensgeld

Antwort auf Beitrag Nr.: 59.114.663 von onkelen am 01.11.18 15:07:45wow...onkelen....wenn das so kommen sollte...lege ich 10 purzelbäume hin.....morphin in die tonne...oli als neues mittel.....unternehmens marktwert weit über 1 milliarde. traum.
bald wisden wir mehr...oder in etlichen monaten.
bald wisden wir mehr...oder in etlichen monaten.
Antwort auf Beitrag Nr.: 59.114.663 von onkelen am 01.11.18 15:07:45Das klingt wirklich ganz passabel und aussichtsreich.
Ob die FDA das auch so sieht?
"Im Vergleich zu Morphium betrug die Zeit für die Rückkehr zur normalen Darmfunktion etwa 24 Stunden. Dies allein ist eine Einsparung von etwa 1200 US-Dollar pro Patient! Unter dem Strich ist es die Pflicht der FDA, Patienten, die etwas anderes benötigen, sichere und wirksame Alternativen anzubieten. Es gibt Millionen von Patienten, die gegen Morphium allergisch sind, Millionen mit Schlafapnoe, unzählige ältere Patienten und viele adipöse Patienten, bei denen das Risiko besteht, dass sie mit den derzeitigen Standards für IV-Opioide nachteilig wirken.
Sie sind die Patienten, die unbedingt etwas anderes haben wollen als das, was gegenwärtig existiert. Oliceridin hat sich im Vergleich zu anderen Medikamenten seiner Klasse als effizient und sicher erwiesen (siehe Abbildung 6) und verdient aus diesen Gründen eine FDA-Zulassung."
https://seekingalpha.com/article/4216900-trevena-pushes-olic…
Ob die FDA das auch so sieht?
"Im Vergleich zu Morphium betrug die Zeit für die Rückkehr zur normalen Darmfunktion etwa 24 Stunden. Dies allein ist eine Einsparung von etwa 1200 US-Dollar pro Patient! Unter dem Strich ist es die Pflicht der FDA, Patienten, die etwas anderes benötigen, sichere und wirksame Alternativen anzubieten. Es gibt Millionen von Patienten, die gegen Morphium allergisch sind, Millionen mit Schlafapnoe, unzählige ältere Patienten und viele adipöse Patienten, bei denen das Risiko besteht, dass sie mit den derzeitigen Standards für IV-Opioide nachteilig wirken.
Sie sind die Patienten, die unbedingt etwas anderes haben wollen als das, was gegenwärtig existiert. Oliceridin hat sich im Vergleich zu anderen Medikamenten seiner Klasse als effizient und sicher erwiesen (siehe Abbildung 6) und verdient aus diesen Gründen eine FDA-Zulassung."
https://seekingalpha.com/article/4216900-trevena-pushes-olic…
Antwort auf Beitrag Nr.: 59.120.000 von boersenkeks am 02.11.18 07:44:08
Die Begründung von L.Zeltzer für ihr "Nein" spiegelt das Abstimmungsverhalten von fast allen Nein-Sagern:

Zitat von boersenkeks: Das klingt wirklich ganz passabel und aussichtsreich.
Ob die FDA das auch so sieht?
"Im Vergleich zu Morphium betrug die Zeit für die Rückkehr zur normalen Darmfunktion etwa 24 Stunden. Dies allein ist eine Einsparung von etwa 1200 US-Dollar pro Patient! Unter dem Strich ist es die Pflicht der FDA, Patienten, die etwas anderes benötigen, sichere und wirksame Alternativen anzubieten. Es gibt Millionen von Patienten, die gegen Morphium allergisch sind, Millionen mit Schlafapnoe, unzählige ältere Patienten und viele adipöse Patienten, bei denen das Risiko besteht, dass sie mit den derzeitigen Standards für IV-Opioide nachteilig wirken.
Sie sind die Patienten, die unbedingt etwas anderes haben wollen als das, was gegenwärtig existiert. Oliceridin hat sich im Vergleich zu anderen Medikamenten seiner Klasse als effizient und sicher erwiesen (siehe Abbildung 6) und verdient aus diesen Gründen eine FDA-Zulassung."
https://seekingalpha.com/article/4216900-trevena-pushes-olic…
Die Begründung von L.Zeltzer für ihr "Nein" spiegelt das Abstimmungsverhalten von fast allen Nein-Sagern:

Antwort auf Beitrag Nr.: 59.120.948 von Cyberhexe am 02.11.18 09:36:18Unter Berücksichtigung aller Meinungen und knapper Votes scheint mir ein Phase 4 approval absolut realistisch
Wann ist heute mit einer Entscheidung zu rechnen?
Danke
Danke
Antwort auf Beitrag Nr.: 59.114.663 von onkelen am 01.11.18 15:07:45
auszug aus meinem posting
Trevena ist momentan eine Hot Button-Ausgabe für Bullen und Bären. Die Aktien fielen von einem 52-Wochen-Hoch von 3,578 USD auf knapp über dem 52-Wochen-Tief von 0,76 USD. Viele glauben, dass Trevena am PDUFA-Datum vom 2. November 2018 für seinen Spitzenkandidaten und Starspieler Oliceridine keinen Treffer hat. Das Unternehmen hatte am 11. Oktober ein Treffen mit dem Beratungsausschuss für Anästhetika und Schmerzmittel, bei dem das Gremium eng gegen die Zulassung von Oliceridin gestimmt hatte.
Zitat von onkelen: https://translate.google.com/translate?sl=en&tl=de&js=y&prev…
https://seekingalpha.com/article/4216900-trevena-pushes-olic…
auszug aus meinem posting
Trevena ist momentan eine Hot Button-Ausgabe für Bullen und Bären. Die Aktien fielen von einem 52-Wochen-Hoch von 3,578 USD auf knapp über dem 52-Wochen-Tief von 0,76 USD. Viele glauben, dass Trevena am PDUFA-Datum vom 2. November 2018 für seinen Spitzenkandidaten und Starspieler Oliceridine keinen Treffer hat. Das Unternehmen hatte am 11. Oktober ein Treffen mit dem Beratungsausschuss für Anästhetika und Schmerzmittel, bei dem das Gremium eng gegen die Zulassung von Oliceridin gestimmt hatte.
4. Trevena Inc. (TRVN)
Verliert 15,60%, um den Handel am Mittwoch bei 0,90 $ zu schließen.
Nachrichten: Keine Nachrichten
Letztes Ereignis:
Am 11. Oktober 2018 stimmte ein FDA-Gremium, das den Antrag des Unternehmens auf ein neues Arzneimittel für Oliceridin überprüfte, mit 8 Gegenstimmen und 7 Stimmen für seine Zulassung ab.
Das Unternehmen bittet um die Zulassung von Oliceridin für die Behandlung mittelschwerer bis schwerer akuter Schmerzen bei erwachsenen Patienten, für die ein intravenöses (IV) Opioid erforderlich ist. Die FDA ist nicht an die Empfehlungen des Beratenden Ausschusses gebunden, berücksichtigt jedoch ihren Rat bei ihrer Entscheidung, die für den 2. November 2018 vorgesehen ist.
https://www.nasdaq.com/article/fresenius-medical-trims-outlo…
Verliert 15,60%, um den Handel am Mittwoch bei 0,90 $ zu schließen.
Nachrichten: Keine Nachrichten
Letztes Ereignis:
Am 11. Oktober 2018 stimmte ein FDA-Gremium, das den Antrag des Unternehmens auf ein neues Arzneimittel für Oliceridin überprüfte, mit 8 Gegenstimmen und 7 Stimmen für seine Zulassung ab.
Das Unternehmen bittet um die Zulassung von Oliceridin für die Behandlung mittelschwerer bis schwerer akuter Schmerzen bei erwachsenen Patienten, für die ein intravenöses (IV) Opioid erforderlich ist. Die FDA ist nicht an die Empfehlungen des Beratenden Ausschusses gebunden, berücksichtigt jedoch ihren Rat bei ihrer Entscheidung, die für den 2. November 2018 vorgesehen ist.
https://www.nasdaq.com/article/fresenius-medical-trims-outlo…
Wer nicht allzu viel Geld einsetzen will sollte sich optionsschein suchen ein call könnte man mit wenig Geld mit großem Hebel viel verdienen und wenn nicht hat man wenig verloren
Also ich bin wieder im Plus :-)
weiß jemand, was in USA los ist ? zeitweise + 40%
Man hofft halt auf die Zulassung von Oliceridine heute. Wenn das klappt, kannst Du evtl auch 400% sehen. Wenn nicht aber gut und gerne auch -40% oder schlimmer. Die Spannung steigt.
Es gibt sicher auch Leute, die behaupten, da kaufen Insider. Ich persönlich glaube eher an Zocker.
Es gibt sicher auch Leute, die behaupten, da kaufen Insider. Ich persönlich glaube eher an Zocker.
Strohfeuer ist auch schon wieder vorbei.
Antwort auf Beitrag Nr.: 59.124.470 von deRendite am 02.11.18 15:01:45
Trevena, Inc. Echtzeit-Börsenkurse
$1.1687
+
0.1187
11.3%
Zitat von deRendite: Strohfeuer ist auch schon wieder vorbei.
Trevena, Inc. Echtzeit-Börsenkurse
$1.1687
+
0.1187
11.3%
In der Aktie sind lauter Irre und Zocker...wenn man in den US Boards liest glaubt man eher in einer Spielhallen in Las Vegas zu sein als an der Börse😉😂
Antwort auf Beitrag Nr.: 59.124.530 von Gustl24 am 02.11.18 15:07:20Was meinst du eigentlich Mit US Boards? Yahoo oder auch noch andere?
IHub, Stocktwits etcetc.
Antwort auf Beitrag Nr.: 58.977.723 von Cyberhexe am 17.10.18 07:32:59
...nun wurde die Verkaufsorder zu 1.19 doch noch ausgeführt - halte nun immer noch 10.000 Stück. Das genügt!
Zitat von Cyberhexe:Zitat von Cyberhexe: ...
...anbei das Abstimmungsverhalten der AC-Mitglieder:
Ja: 7
- Basavana Goudra (AADPAC), Prof. Anesthesiology............................................................[nicht teigenommen]
- Gregory Terman (Temp.), Prof. Anesthesiology + Pain Medicine.......................................[Dsuvia: ja]
- John Alexander (Temp.), Prof. of Medicine / Cardiology....................................................[nicht teigenommen]
- Joseph O'Brien (Temp.), Patient Representive ..............................................................[Dsuvia: ja]
- Kevin Zacharoff/Chair (AADPAC), Faculty & Clinical Instructor, Pain & Medical Ethics ......[Dsuvia: ja]
- Majorie Philips (Temp.), Pharmacy Coordinator.......................................................... [Dsuvia: ja]
- Ronald Litman (AADPAC), Prof. Anesthesiology & Pediatrics......................................... [Dsuvia: ja]
Nein:8
- Abigail Shoben (AADPAC), Prof. of Biostatistics .........................................[Dsuvia: ja]
- Alan Kaye (Temp.), Prof. Anesthesiology........................................................... [Dsuvia: ja]
- Jennifer Higgins (Temp.), Director of Research & Development Disabilities ..............[Dsuvia: ja]
- Lonnie Zeltzer (AADPAC), Director Pediatric pain & Palliative Care .......................[Dsuvia: ja]
- Mary McCann (AADPAC), Prof. Anesthesiology ...................................................[nicht teigenommen]
- Michael Fischer (Temp.), Assoc. Prof. of Medicine/Epidemiology.......................... [Dsuvia: nein]
- Steven Solga (Temp.), Assoc. Prof. of Clinical Medicine/Transplant Hepatology.......... [nicht teigenommen]
- Terry Warholak (Temp.), Prof. of Academic Affairs ............................................[Dsuvia: ja]
Das Abstimmungsverhalten des Statistikers bzw. - in war vorherzusagen. Ich hatte jedoch gehofft, dass die Anästhesisten unisono für eine Zulassung gestimmt haben. Dem ist leider nicht so!
In Klammern das Abstimmungsverhalten beim AC zu Dsuvia am 12.10.
ausserdem am Dsuvia-AC teilgenommen haben:
Steven Meisel [Dsuvia: nein]
Jacqueline Willac... [Dsuvia: nein]
Wie sind die Aussichten hinsichtlich der anstehenden Zulassungsentscheidung? Folgende Szenarien sind möglich:
1.) mit einer bedigungslosen Zulassung ist überhaupt nicht zu rechnen. Deren Wahrscheinlichkeit dürfte gegen 0 gehen.
2.) eine bedingte Zulassung in Verbindung mit einer ph4-Studie (postmarket drug safety surveillance) ist wohl das bestmögliche Szenario; obschon ich mir diese Variante nebst der nächsten Variante für meine 15.000 Aktien wünsche, halte ich die Wahrscheinlichkeit für eher gering (wenn ich schätzen müsste, vierlleicht 10%)
3.) Da die Beurteilung bereits eingereichter Daten zur QT-Verlängerung (verzögerte Repolarisation beim Herzschlag) noch aussteht, könnte die FDA den Zeitpunkt für die Entscheidung (PDUFA) um 3 Monate verschieben, also auf 2.2.2019 (20%)
4.) in Anbetracht der Datenlage und des Abstimmungsvervhalten der AC-Mitglieder ist die Wahrscheinlichkeit eines CRL (Complete Response Letter) gross (70%). In diesem Fall wird darauf zu achten sein, welche zusätzlichen Daten von der Behörde verlangt werden. Der schlechteste Fall wäre, wenn eine komplette zusätzliche ph3-Studie verlangt wird, welche einerseits lange dauert und andererseits mit den vorhandenen Ressourcen kaum zu finanzieren ist. Weniger dramatisch wäre das Einfordern einer nicht-klinischen Studie. Die Wahrscheinlichkeit der beiden Fälle würde ich auf 50/50 schätzen, so dass das "Worst case scenario" mit einer persönlichen Wahrscheinlichkeit von ca. 35% erwartet wird.
In Anbetracht der Wahrscheinlichkeit und des Potenzials bei Nichteintreten des schlechtesten Falles (65%) werde ich sehr wahrscheinlich mit 2/3 der 15.000 Aktien die Zulassungsentscheidung am 2.11.2018 abwarten.
5.000 Aktien sind bereits mit einer Verkaufsorder vermerkt ($1.19)
...nun wurde die Verkaufsorder zu 1.19 doch noch ausgeführt - halte nun immer noch 10.000 Stück. Das genügt!

TRVN ist nun vom Handel ausgesetzt dh demnächst dürfte die Entscheidung öffentlich werden!
Antwort auf Beitrag Nr.: 59.124.800 von Cyberhexe am 02.11.18 15:31:07
Zitat von Cyberhexe: TRVN ist nun vom Handel ausgesetzt dh demnächst dürfte die Entscheidung öffentlich werden!

Antwort auf Beitrag Nr.: 59.124.851 von Cyberhexe am 02.11.18 15:34:11Bei L&S kann ich kaufen
Antwort auf Beitrag Nr.: 59.124.866 von Mammut22 am 02.11.18 15:35:01Glaub ich nicht...Versuchs mal...
Antwort auf Beitrag Nr.: 59.124.941 von Gustl24 am 02.11.18 15:40:55Habe gerade für Spielgeld was gekauft
Sammelklagen gegen Trevena, Inc. (TRVN) und Hauptkläger. Frist: 10. Dezember 2018
NEW YORK, 02. November 2018 (GLOBE NEWSWIRE) - Anwaltwerbung - Bronstein, Gewirtz & Grossman, LLC informiert die Anleger darüber, dass eine Sammelklage eingereicht wurde Trevena, Inc. („Trevena“ oder das „Unternehmen“) ( NASDAQ: TRVN ) und einige ihrer leitenden Angestellten im Namen von Aktionären, die Trevena-Wertpapiere zwischen dem 2. Mai 2016 und dem 8. Oktober 2018 (einschließlich der "Klassenperiode") erworben haben. Diese Anleger werden aufgefordert, an diesem Fall teilzunehmen, indem sie die Website der Firma besuchen: www.bgandg.com/trvn .Mit dieser Sammelklage sollen Schadensersatzansprüche gegen die Beklagten wegen angeblicher Verstöße gegen die bundesstaatlichen Wertpapiergesetze nach dem Securities Exchange Act von 1934 geltend gemacht werden.
In der Beschwerde wird behauptet, dass die Angeklagten während des gesamten Klassenzeitraums die Aktionäre getäuscht hatten, zu glauben, dass das Ende-von-Phase-2-Treffen mit der US-amerikanischen FDA (Food and Drug Administration, "FDA") am 28. April 2016 erfolgreicher war als es tatsächlich war. Am 2. Mai 2016 veröffentlichte Trevena einen Bericht mit dem Titel „Trevena gibt erfolgreiches Ende-Phase-2-Treffen mit der FDA und Gliederung des Phase-3-Programms für Oliceridin bekannt“ und sagte, dass es mit der FDA „eine allgemeine Vereinbarung über die wichtigsten Elemente seiner Strategie getroffen hat Phase-3-Programm für Oliceridin (TRV130) und war mit den FDA-Diskussionen und dem Ergebnis „sehr zufrieden“. Am 9. Oktober 2018 wurden jedoch Informationen des Unternehmens und der Sitzung der FDA vom 28. April 2016 veröffentlicht, aus der hervorgeht, dass die FDA: (1) „der vorgeschlagenen Dosierung in den Phase-3-Studien nicht zustimmte“; (2) „stimmte dem vorgeschlagenen primären Endpunkt nicht zu“; und (3) „stimmte der vorgeschlagenen Marge für die Nichtunterlegenheit (NI) für den Vergleich von Morphin mit Oliceridin nicht zu.“ Nach dieser Meldung verlor die Trevena-Aktie in den nächsten zwei Handelstagen 2,04 USD pro Aktie oder über 68% 0,947 USD je Aktie am 10. Oktober 2018.
Eine Sammelklage wurde bereits eingereicht. Wenn Sie eine Kopie der Beschwerde prüfen möchten, besuchen Sie die Website der Firma: www.bgandg.com/trvn oder wenden Sie sich an Peretz Bronstein, Esq. oder sein Investor Relations Analyst, Yael Hurwitz von Bronstein, Gewirtz & Grossman, LLC, unter 212-697-6484. Wenn Sie in Trevena einen Verlust erlitten haben, haben Sie bis zum 10. Dezember 2018 die Möglichkeit, das Gericht als Hauptkläger zu bestellen. Ihre Fähigkeit, an einer Genesung teilzunehmen, erfordert nicht, dass Sie als Hauptkläger fungieren.
Bronstein, Gewirtz & Grossman, LLC ist eine Boutique für Rechtsstreitigkeiten. Unsere Hauptkompetenz ist die aggressive Verfolgung von Klagen im Namen unserer Kunden. Neben der Vertretung von Instituten und anderen Investor-Klägern in Sammelklagen im Bereich der Sammelklagen umfasst das Fachwissen des Unternehmens auch allgemeine Unternehmens- und Handelsrechtsstreitigkeiten sowie die Schlichtung von Wertpapieren. Anwalt Werbung. Frühere Ergebnisse garantieren keine ähnlichen Ergebnisse.
Kontakt:
Bronstein, Gewirtz & Grossman, LLC
Peretz Bronstein oder Yael Hurwitz
212-697-6484 | info@bgandg.com
https://finance.yahoo.com/news/shareholder-alert-bronstein-g…
Antwort auf Beitrag Nr.: 59.125.070 von onkelen am 02.11.18 15:59:27Poste hier jetzt nicht so eine Scheisse ........man wie oft sollen wir diesen Müll noch lesen.
Lass doch die Leute klagen......schlechte Verlierer!!!!!
Lass doch die Leute klagen......schlechte Verlierer!!!!!
Antwort auf Beitrag Nr.: 59.124.947 von Mammut22 am 02.11.18 15:41:44Nachdem die Aktien nun fast eine Stunde in meinem Depot waren, wurden sie mir nun ausgebucht und der Kauf storniert 😂 Geld komplett zurück erstattet
Antwort auf Beitrag Nr.: 59.125.397 von Mammut22 am 02.11.18 16:35:39Wer weiß, wofür das GUT oder NICHT GUT war 

Antwort auf Beitrag Nr.: 59.125.397 von Mammut22 am 02.11.18 16:35:39Sorry, dachte ich mir...halted ist halted, weiß der Praktikant bei L&S jetzt auch.
Also für einen CRL ist mir die Handelsausetzung jetzt bisserl lang...das könnte man auch unspektakulärer handhaben...but you Never know?
Antwort auf Beitrag Nr.: 59.125.070 von onkelen am 02.11.18 15:59:27 - Anwaltwerbung - mir alles klar!!!
Antwort auf Beitrag Nr.: 59.124.290 von deRendite am 02.11.18 14:47:57
deRente,
Seit gestern, habe ich einen Blick auf meine höheren WP-wertung 0.890euro geworfen!Heute keine ausführung, was ist los über pari 1.00euro Frankfurt!?
Mfg
GM
Zitat von deRendite: Also ich bin wieder im Plus :-)
deRente,
Seit gestern, habe ich einen Blick auf meine höheren WP-wertung 0.890euro geworfen!Heute keine ausführung, was ist los über pari 1.00euro Frankfurt!?
Mfg
GM
Ich habe meine letzte Position vor 2 Tagen verkauft,
heute wurde der Handel eingestellt um 10:26 AM USA time
weiss jemand warum ??? der FDA Entscheid ist ja erst morgen ?? oder nicht ?
heute wurde der Handel eingestellt um 10:26 AM USA time
weiss jemand warum ??? der FDA Entscheid ist ja erst morgen ?? oder nicht ?
Antwort auf Beitrag Nr.: 59.126.318 von fypet am 02.11.18 18:16:46
FDA Statement
Statement from FDA Commissioner Scott Gottlieb, M.D., on agency’s approval of Dsuvia and the FDA’s future consideration of new opioids
https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/u…
FDA Statement
Statement from FDA Commissioner Scott Gottlieb, M.D., on agency’s approval of Dsuvia and the FDA’s future consideration of new opioids
https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/u…
Antwort auf Beitrag Nr.: 59.126.516 von Cyberhexe am 02.11.18 18:40:17Page Not Found
Antwort auf Beitrag Nr.: 59.126.516 von Cyberhexe am 02.11.18 18:40:17revena Receives Complete Response Letter for Oliceridine from FDA
GlobeNewswire•November 2, 2018
Company to host conference call and webcast on November 5th
CHESTERBROOK, Pa., Nov. 02, 2018 (GLOBE NEWSWIRE) -- Trevena, Inc. (TRVN) today announced the Company has received a Complete Response Letter (CRL) from the U.S. Food and Drug Administration (FDA) regarding the New Drug Application (NDA) for oliceridine.
“While we are disappointed with FDA’s decision, we continue to believe in the strength of the data and the ultimate approvability of oliceridine,” said Carrie L. Bourdow, President and Chief Executive Officer. “We plan to schedule a follow-up meeting with FDA as soon as possible with the goal of bringing this important medicine to clinicians and hospital patients.”
GlobeNewswire•November 2, 2018
Company to host conference call and webcast on November 5th
CHESTERBROOK, Pa., Nov. 02, 2018 (GLOBE NEWSWIRE) -- Trevena, Inc. (TRVN) today announced the Company has received a Complete Response Letter (CRL) from the U.S. Food and Drug Administration (FDA) regarding the New Drug Application (NDA) for oliceridine.
“While we are disappointed with FDA’s decision, we continue to believe in the strength of the data and the ultimate approvability of oliceridine,” said Carrie L. Bourdow, President and Chief Executive Officer. “We plan to schedule a follow-up meeting with FDA as soon as possible with the goal of bringing this important medicine to clinicians and hospital patients.”
Antwort auf Beitrag Nr.: 59.126.567 von Cyberhexe am 02.11.18 18:47:44
Consistent with the discussion at the recent Advisory Committee meeting, FDA has requested additional clinical data on QT prolongation and indicated that the submitted safety database is not of adequate size for the proposed dosing. FDA also requested certain additional nonclinical data and validation reports.
...das dauert!
Consistent with the discussion at the recent Advisory Committee meeting, FDA has requested additional clinical data on QT prolongation and indicated that the submitted safety database is not of adequate size for the proposed dosing. FDA also requested certain additional nonclinical data and validation reports.
...das dauert!
Wie von dir vermutet Cyberhexe, CRL. Respekt 😏👍
Wann wird der Trading Halt aufgehoben & welche Kursreaktion erwartest du?
Danke 🙏
Wann wird der Trading Halt aufgehoben & welche Kursreaktion erwartest du?
Danke 🙏
O.k. Dsuvia ist durch, Oli in der Warteschleife...der Markt wird sicherlich überreagieren in den ersten Handelsminuten...wie will see.
Habe mal einen Kaufauftrag zu 0,35 Euro abgegeben.

Nicht approved
L&S kracht gerade auf -47,83 % runter
Antwort auf Beitrag Nr.: 59.126.855 von HH-ahoi2 am 02.11.18 19:11:42
so ein Mist- worst case
von welchem Zeitraum sprechen wir 1 -2 Jahre ?
Tja, wie man es macht ist es verkehrt. Also abschreiben und liegenlassen. Was soll‘s.
zum Glück 1/3 vorher verkauft und bei ACRX aufgesprungen
Hoffe die holen die Miesen von hier wieder rein.
mit dem Rest ?? - Bagholder
S.
Hoffe die holen die Miesen von hier wieder rein.
mit dem Rest ?? - Bagholder

S.
Für mich wars heute leider ein Nullevent...bisschen Plus mit ACRX, ein wenig im Hoch getradet mit TRVN, jetzt sogar im Tief hier noch ein bisschen nachgekauft...ich glaube sie werden einen Deal mit BigPharma machen und nicht ganz allein weitermachen (Merck??) bin sogar guter Dinge mit meiner Rest-Miniposi hier im Plus rauszukommen. Ich würde hier heute imho. nichts verkaufen...da kommen noch Möglichkeiten um die Ecke...

Antwort auf Beitrag Nr.: 59.127.110 von Gustl24 am 02.11.18 19:46:43Deswegen bin ich hier auch eingestiegen gerade. Mal schauen was hier noch geht, vllt muss man es dann paar Jahre liegen lassen bis hier wieder richtig was geht
Antwort auf Beitrag Nr.: 59.126.318 von fypet am 02.11.18 18:16:46
Gute Nacht! TRVN im freien Fall, bei 0.50 wird die Aktie wieder ein spekulative
interessantes Investment. Die Frage wie lange wird die Baisse anhalten? dass
geht sicher Monate bis Sicherheitsprofil durch klinische Daten die Forderung der FDA erfüllt.
(Die FDA forderte in ihrem vollständigen Antwortschreiben weitere klinische Daten an und wies darauf hin, dass die Sicherheitsdaten für die vorgeschlagene Dosierung nicht ausreichend waren.)
Zitat von fypet: Ich habe meine letzte Position vor 2 Tagen verkauft,
heute wurde der Handel eingestellt um 10:26 AM USA time
weiss jemand warum ??? der FDA Entscheid ist ja erst morgen ?? oder nicht ?
Gute Nacht! TRVN im freien Fall, bei 0.50 wird die Aktie wieder ein spekulative
interessantes Investment. Die Frage wie lange wird die Baisse anhalten? dass
geht sicher Monate bis Sicherheitsprofil durch klinische Daten die Forderung der FDA erfüllt.
(Die FDA forderte in ihrem vollständigen Antwortschreiben weitere klinische Daten an und wies darauf hin, dass die Sicherheitsdaten für die vorgeschlagene Dosierung nicht ausreichend waren.)
aus den Briefings der FDA (AC-Unterlagen):
In the Applicant’s Phase 3 studies, only limited ECG monitoring was obtained in patients (1,
24, and 48- hours post-loading dose for Study 3001 and 1 and 24 hours for Study 3002). Given
that the QTcF prolongation associated with oliceridine is delayed and oliceridine is
administered as needed with a wide range of doses up to a proposed maximum daily dose of
initially 100 mg and then decreased by the Applicant to 40 mg, the data from a single dose tQT
study (Table 2) and the limited ECG monitoring data obtained in Phase 3 do not appear to be
adequate to evaluate the QT effects of oliceridine.
...
During the review cycle, the Applicant was asked to provide the following information:
A) Provide a proposed mechanism for the delayed onset of the QTcF prolongation observed
with oliceridine. In addition, provide data to support this hypothesized mechanism.
B) Taking into consideration the proposed clinical dose (including the range and frequency of
dosing), provide additional data to adequately evaluate the QT effects of oliceridine, such as a
multiple dose tQT study.

... und nun scheint die Behörde trotzdem zusätzliche klinische Daten zur QT-Verlängerung einzufordern:
Consistent with the discussion at the recent Advisory Committee meeting, FDA has requested additional clinical data on QT prolongation and indicated that the submitted safety database is not of adequate size for the proposed dosing. FDA also requested certain additional nonclinical data and validation reports.
Ebenso scheinen nicht genügend Daten in angemessenem Umfang hinsichtlich Arzneimittelsicherheit vorhanden zu sein. Der zusätzliche Umfang dieser Daten wird entscheidend darüber bestimmen, wie lange eine erneute Antragstellung hinausgezögert wird. Der Vorteil gegenüber onkologoschen Studien besteht darin, dass die Daten unmittelbar während der Verabreichung erhoben werden und nicht wie zB bei der Überlebenszeitanalyse mit einer riesigen zeitlichen Verzögerung erfasst werden.
Mittlerweile wird das Unternehmen in Höhe der Cash-Reserven bewertet, so dass ich meine 10.000 Stück auf alle Fälle halten werde - im Gegenteil: ich habe ein Kauflimit von $0.59 eingegeben (10,000 Stück => entspricht dem Erlös von 5000 verkauften Aktien vor "Trading Halt").
In the Applicant’s Phase 3 studies, only limited ECG monitoring was obtained in patients (1,
24, and 48- hours post-loading dose for Study 3001 and 1 and 24 hours for Study 3002). Given
that the QTcF prolongation associated with oliceridine is delayed and oliceridine is
administered as needed with a wide range of doses up to a proposed maximum daily dose of
initially 100 mg and then decreased by the Applicant to 40 mg, the data from a single dose tQT
study (Table 2) and the limited ECG monitoring data obtained in Phase 3 do not appear to be
adequate to evaluate the QT effects of oliceridine.
...
During the review cycle, the Applicant was asked to provide the following information:
A) Provide a proposed mechanism for the delayed onset of the QTcF prolongation observed
with oliceridine. In addition, provide data to support this hypothesized mechanism.
B) Taking into consideration the proposed clinical dose (including the range and frequency of
dosing), provide additional data to adequately evaluate the QT effects of oliceridine, such as a
multiple dose tQT study.

... und nun scheint die Behörde trotzdem zusätzliche klinische Daten zur QT-Verlängerung einzufordern:
Consistent with the discussion at the recent Advisory Committee meeting, FDA has requested additional clinical data on QT prolongation and indicated that the submitted safety database is not of adequate size for the proposed dosing. FDA also requested certain additional nonclinical data and validation reports.
Ebenso scheinen nicht genügend Daten in angemessenem Umfang hinsichtlich Arzneimittelsicherheit vorhanden zu sein. Der zusätzliche Umfang dieser Daten wird entscheidend darüber bestimmen, wie lange eine erneute Antragstellung hinausgezögert wird. Der Vorteil gegenüber onkologoschen Studien besteht darin, dass die Daten unmittelbar während der Verabreichung erhoben werden und nicht wie zB bei der Überlebenszeitanalyse mit einer riesigen zeitlichen Verzögerung erfasst werden.
Mittlerweile wird das Unternehmen in Höhe der Cash-Reserven bewertet, so dass ich meine 10.000 Stück auf alle Fälle halten werde - im Gegenteil: ich habe ein Kauflimit von $0.59 eingegeben (10,000 Stück => entspricht dem Erlös von 5000 verkauften Aktien vor "Trading Halt").
Trevena könnt ihr jetzt ne weile vergessen da wird sie nicht mehr viel tun nach oben hin die wird ewig lang seitwärts laufen oder fallen schaut lieber mal zu oncosec medical rüber
Antwort auf Beitrag Nr.: 59.127.203 von sneakee am 02.11.18 19:55:52Na und, was sollen wir bei oncosec medical? Selbst wahrscheinlich reichlich eigekauft und der Kursverlauf ist nicht den Wünschen entsprechend, da müssen Andere gelockt werden! Vielleicht genau so loosig im Moment wie Trevena!!!
Antwort auf Beitrag Nr.: 59.127.290 von dollilolli am 02.11.18 20:05:39Bestimmt nicht. Und der Kurs wird drüben gemacht und nicht in Deutschland so dass ich das überhaupt nicht beeinflussen kann es stehen sehr guter Daten an guck einfach mal nach
Antwort auf Beitrag Nr.: 59.127.311 von sneakee am 02.11.18 20:09:26Die guten Daten standen bei Trevena auch an, bis vor paar Tagen! Allgemein---Die Aktienkurse können wir so und so nicht beeinflussen, hab ich auch nicht gesagt, das machen für uns die Institutionellen, und wenn die wollen, das Rohstoffe oder Technologiewerte etc. fallen, dann ändern wir heute, morgen und in einem Monat auch nichts dran. Aber nie vergessen...auch den Großen steht mitunter das Wasser bis zum Hals...das sagt dir nur keiner...und auch die müssen an der Börse irgendwie agieren und können nicht ewig zugucken und abwarten.
Aber Thema eigentlich jetzt verfehlt---noch mal zurück zum Thema---Die guten Daten standen bei Trevena auch an, bis vor paar Tagen, und wenn jemand eine Aktie empfiehlt, werden meist die Erwartungen nicht erfüllt und man muß etwas nachhelfen---nichts Persönliches
Aber Thema eigentlich jetzt verfehlt---noch mal zurück zum Thema---Die guten Daten standen bei Trevena auch an, bis vor paar Tagen, und wenn jemand eine Aktie empfiehlt, werden meist die Erwartungen nicht erfüllt und man muß etwas nachhelfen---nichts Persönliches
Antwort auf Beitrag Nr.: 59.127.434 von dollilolli am 02.11.18 20:28:01Na dann lass es dann brauchst du nicht zu kaufen
Antwort auf Beitrag Nr.: 59.101.151 von Cyberhexe am 31.10.18 09:22:08
Ich bin mir jetzt gar nicht soo sicher, ob der worst case eingetroffen ist.
Also klar ist, dass das wahrscheinlichste Szenario, nämlich Nr. 4 (--> CRL), eingetroffen ist. Da jedoch nicht klar ist, ob eine komplette neue Studie verlangt wird oder nur weitere klinische Daten zur QT-Verlängerung und anderen Nebenwirkungen, muss man die weiteren Info bzw. die angekündigte Pressekonferenz am kommenden Montag sowie das Treffen mit der FDA abwarten, nach welchem dann das weitere Vorgehen öffentlich sein sollte.
All jenen, die nun sehr enttäuscht sind, möchte ich in Erinnerung rufen, dass ein CRL gar nicht so selten ist und daraus oft auch neue Chancen entstehen können. Ich für meinen Teil habe eine Kauforder (10.000 Stück zu $0.59) platziert. Mein weiteres Verhalten zu TRVN wird von den Ergebnissen der Pressekonferenz und dem FDA-Treffen beeinflusst. Noch ist nicht aller Tage Abend! Die Kapitaldecke dürfte noch knapp 2 Jahre den Fortbestand sichern. Das müsste reichen, um Oli doch noch auf den Markt zu bringen.
Zitat von Cyberhexe: an meiner Einschätzung, die ich kurz nach dem AC veröffentlicht habe, hat sich nichts geändert: 30/70
Wie sind die Aussichten hinsichtlich der anstehenden Zulassungsentscheidung?
Folgende Szenarien sind möglich:
1.) mit einer bedigungslosen Zulassung ist überhaupt nicht zu rechnen. Deren Wahrscheinlichkeit dürfte gegen 0 gehen.
2.) eine bedingte Zulassung in Verbindung mit einer ph4-Studie (postmarket drug safety surveillance) ist wohl das bestmögliche Szenario; obschon ich mir diese Variante nebst der nächsten Variante für meine 15.000 Aktien wünsche, halte ich die Wahrscheinlichkeit für eher gering (wenn ich schätzen müsste, vierlleicht 10%)
3.) Da die Beurteilung bereits eingereichter Daten zur QT-Verlängerung (verzögerte Repolarisation beim Herzschlag) noch aussteht, könnte die FDA den Zeitpunkt für die Entscheidung (PDUFA) um 3 Monate verschieben, also auf 2.2.2019 (20%)
4.) in Anbetracht der Datenlage und des Abstimmungsvervhalten der AC-Mitglieder ist die Wahrscheinlichkeit eines CRL (Complete Response Letter) gross (70%). In diesem Fall wird darauf zu achten sein, welche zusätzlichen Daten von der Behörde verlangt werden. Der schlechteste Fall wäre, wenn eine komplette zusätzliche ph3-Studie verlangt wird, welche einerseits lange dauert und andererseits mit den vorhandenen Ressourcen kaum zu finanzieren ist. Weniger dramatisch wäre das Einfordern einer nicht-klinischen Studie. Die Wahrscheinlichkeit der beiden Fälle würde ich auf 50/50 schätzen, so dass das "Worst case scenario" mit einer persönlichen Wahrscheinlichkeit von ca. 35% erwartet wird. In Anbetracht der Wahrscheinlichkeit und des Potenzials bei Nichteintreten des schlechtesten Falles (65%) werde ich sehr wahrscheinlich mit 2/3 der 15.000 Aktien die Zulassungsentscheidung am 2.11.2018 abwarten.
Ich bin mir jetzt gar nicht soo sicher, ob der worst case eingetroffen ist.
Also klar ist, dass das wahrscheinlichste Szenario, nämlich Nr. 4 (--> CRL), eingetroffen ist. Da jedoch nicht klar ist, ob eine komplette neue Studie verlangt wird oder nur weitere klinische Daten zur QT-Verlängerung und anderen Nebenwirkungen, muss man die weiteren Info bzw. die angekündigte Pressekonferenz am kommenden Montag sowie das Treffen mit der FDA abwarten, nach welchem dann das weitere Vorgehen öffentlich sein sollte.
All jenen, die nun sehr enttäuscht sind, möchte ich in Erinnerung rufen, dass ein CRL gar nicht so selten ist und daraus oft auch neue Chancen entstehen können. Ich für meinen Teil habe eine Kauforder (10.000 Stück zu $0.59) platziert. Mein weiteres Verhalten zu TRVN wird von den Ergebnissen der Pressekonferenz und dem FDA-Treffen beeinflusst. Noch ist nicht aller Tage Abend! Die Kapitaldecke dürfte noch knapp 2 Jahre den Fortbestand sichern. Das müsste reichen, um Oli doch noch auf den Markt zu bringen.
Trevena erhält von der FDA einen vollständigen Antwortbrief für Oliceridin
Unternehmen, das am 5. November eine Telefonkonferenz und einen Webcast abhältCHESTERBROOK, Pennsylvania, 02. November 2018 (GLOBE NEWSWIRE) - Trevena, Inc. ( TRVN ) gab heute bekannt, dass das Unternehmen ein vollständiges Antwortschreiben (CRL) der US-amerikanischen Zulassungsbehörde FDA (Food and Drug Administration) bezüglich der neuen Droge erhalten hat Anwendung (NDA) für Oliceridin.
"Obwohl wir von der Entscheidung der FDA enttäuscht sind, glauben wir weiterhin an die Stärke der Daten und die endgültige Zulässigkeit von Oliceridin", sagte Carrie L. Bourdow, President und Chief Executive Officer. „Wir planen, so bald wie möglich ein Folgetreffen mit der FDA zu planen, mit dem Ziel, dieses wichtige Arzneimittel Ärzten und Krankenhauspatienten zuzuführen.“
In Übereinstimmung mit der Diskussion auf der letzten Sitzung des Beratenden Ausschusses hat die FDA zusätzliche klinische Daten zur Verlängerung des QT angefordert und angegeben, dass die vorgelegte Sicherheitsdatenbank für die vorgeschlagene Dosierung nicht ausreichend ist. Die FDA forderte auch bestimmte zusätzliche nichtklinische Daten und Validierungsberichte an.
"Die Entwicklung einer neuartigen chemischen Substanz ist komplex und wir glauben, dass die Daten, die wir zur Unterstützung von Oliceridin haben, die Pharmakologie von Therapien für akute Schmerztherapie verbessern", sagte Mark A. Demitrack, MD, SVP und Chief Medical Officer. "Die Diskussion auf der Sitzung des Beratenden Ausschusses hat uns ermutigt und wir freuen uns auf einen produktiven Dialog mit der FDA."
Eine Telefonkonferenz und ein Webcast finden am 5. November um 8:00 Uhr (ET) statt. Um an dem Anruf teilzunehmen, wählen Sie bitte die Nummer (855) 465-0180 (Konferenz-ID: 5489646).
Um an einem Live-Audio-Webcast des Anrufs teilzunehmen, besuchen Sie bitte den Abschnitt Investor Presentation der Website des Unternehmens (Konferenz-ID: 5489646). Nach Beendigung des Anrufs steht der Webcast 30 Tage lang zur Wiedergabe zur Verfügung.
Über Oliceridin
Oliceridin ist ein G-Protein-abhängiger mu-Opioid-Rezeptor (MOR) -Ligand, der sich in der Entwicklung befindet, für die Behandlung mäßiger bis schwerer akuter Schmerzen in Krankenhäusern oder anderen kontrollierten klinischen Umgebungen, in denen eine intravenöse (IV) -Therapie erforderlich ist. Es handelt sich um eine neue chemische Entität mit einem neuartigen Wirkungsmechanismus, der ein gezielteres Targeting neu entdeckter Pfade mit dem Potenzial für weniger Nebenwirkungen ermöglicht. Oliceridin ist ein Prüfprodukt und wurde weder von der FDA noch von einer anderen Aufsichtsbehörde zugelassen. Im Falle einer Zulassung hat das Unternehmen beantragt, dass Oliceridin als gemäß Schedule II kontrollierter Stoff eingestuft wird.
gestern wurde ein anderes Opioid-Schmerzmittel von AcelRx Pharmazugelassen
u.a.
Die FDA lehnte am Freitag die Zulassung eines weiteren Arzneimittels auf Opioid-Basis von Trevena Inc. ab, wobei unzureichende Sicherheitsdaten angeführt wurden.
"Wenn ich über diese spezielle Medikamentengenehmigung hinausblicke, denke ich, dass wir überlegen sollten, ob wir die Opioide für jeden Kandidaten mehr bewerten sollten", so Gottlieb (Grafik).
"Wir sollten uns überlegen, ob wir die Zulassungen besser abwägen könnten, um sicherzustellen, dass neue Opioide ausreichend besser sind als bestehende Drogen, um ihre Marktzugabe im Kontext der aktuellen Missbrauchskrise zu rechtfertigen", sagte er.
https://translate.google.com/#en/de/U.S.%20FDA%20approves%20…
u.a.
Die FDA lehnte am Freitag die Zulassung eines weiteren Arzneimittels auf Opioid-Basis von Trevena Inc. ab, wobei unzureichende Sicherheitsdaten angeführt wurden.
"Wenn ich über diese spezielle Medikamentengenehmigung hinausblicke, denke ich, dass wir überlegen sollten, ob wir die Opioide für jeden Kandidaten mehr bewerten sollten", so Gottlieb (Grafik).
"Wir sollten uns überlegen, ob wir die Zulassungen besser abwägen könnten, um sicherzustellen, dass neue Opioide ausreichend besser sind als bestehende Drogen, um ihre Marktzugabe im Kontext der aktuellen Missbrauchskrise zu rechtfertigen", sagte er.
https://translate.google.com/#en/de/U.S.%20FDA%20approves%20…
Antwort auf Beitrag Nr.: 59.127.593 von Cyberhexe am 02.11.18 20:52:49
Zitat von Cyberhexe:Zitat von Cyberhexe: Ich bin mir jetzt gar nicht soo sicher, ob der worst case eingetroffen ist.
Also klar ist, dass das wahrscheinlichste Szenario, nämlich Nr. 4 (--> CRL), eingetroffen ist. Da jedoch nicht klar ist, ob eine komplette neue Studie verlangt wird oder nur weitere klinische Daten zur QT-Verlängerung und anderen Nebenwirkungen, muss man die weiteren Info bzw. die angekündigte Pressekonferenz am kommenden Montag sowie das Treffen mit der FDA abwarten, nach welchem dann das weitere Vorgehen öffentlich sein sollte.
All jenen, die nun sehr enttäuscht sind, möchte ich in Erinnerung rufen, dass ein CRL gar nicht so selten ist und daraus oft auch neue Chancen entstehen können. Ich für meinen Teil habe eine Kauforder (10.000 Stück zu $0.59) platziert. Mein weiteres Verhalten zu TRVN wird von den Ergebnissen der Pressekonferenz und dem FDA-Treffen beeinflusst. Noch ist nicht aller Tage Abend! Die Kapitaldecke dürfte noch knapp 2 Jahre den Fortbestand sichern. Das müsste reichen, um Oli doch noch auf den Markt zu bringen.
Warum dem schlechten Geld noch Gutes hinterherwerfen, stellt sich mir die Frage.
Klar Chancen bestehen weiter hier, aber es gibt bessere meiner Meinung.
Warum nicht in ACRX / CHRS investieren ?? haben beide am Freitag ein OK von der FDA bekommen.
Das scheint mir persönlich momentan als der bessere Weg.
Noch zum TRVN Debakel:
War wieder eine Lehrstück in Sachen Biotech Invest für mich.
Auf dem US Board ST waren vor ADCOM alle seeeehr bullish , dort wurde schon über die Farben des Lambos diskutiert, welchen der ein oder andere sich bestellen würde , bei Zulassung.
Selbst nach dem ADCOM NO waren sie immer noch sehr bullish gewesen.
ACRX´s DSUVIA hatte den "Vorteil" schon mal einen CRL bekommen zu haben und
oral verabreicht zu werden. d.h. bei Unmöglichkeit einer IV Verabreichung zu punkten.
ausserdem hatte das US DOD sein Gewicht in die Waagschale geschmissen.
Die neue Soldaten Front Droge - 6-8x wirksamer als Fentanyl
Das DOD hatte schon 100.000 Einheiten bestellt.
Trotzdem war die Zulassung in US. recht umstritten.
Ich glaube, dass auch deshalb die FDA keine 2 umstrittenen "OpiumErsatzstoffe" an einem Tag zulassen konnte/mochte.
Gruss S.
TRVN wird noch unter $0.50 fallen, kein nachhaltiges Volumen und es wird noch Monate dauern
bis sie die angeforderten Studien abgeschlossen sind, schätzungsweise ein Market Cap von $35 Mio.
bis sie die angeforderten Studien abgeschlossen sind, schätzungsweise ein Market Cap von $35 Mio.
Antwort auf Beitrag Nr.: 59.133.637 von Schaeffi am 04.11.18 11:12:10
Zitat von Schaeffi:Zitat von Cyberhexe: ...
Warum dem schlechten Geld noch Gutes hinterherwerfen, stellt sich mir die Frage.
Klar Chancen bestehen weiter hier, aber es gibt bessere meiner Meinung.
Warum nicht in ACRX / CHRS investieren ?? haben beide am Freitag ein OK von der FDA bekommen.
Das scheint mir persönlich momentan als der bessere Weg.
Noch zum TRVN Debakel:
War wieder eine Lehrstück in Sachen Biotech Invest für mich.
Auf dem US Board ST waren vor ADCOM alle seeeehr bullish , dort wurde schon über die Farben des Lambos diskutiert, welchen der ein oder andere sich bestellen würde , bei Zulassung.
Selbst nach dem ADCOM NO waren sie immer noch sehr bullish gewesen.
ACRX´s DSUVIA hatte den "Vorteil" schon mal einen CRL bekommen zu haben und
oral verabreicht zu werden. d.h. bei Unmöglichkeit einer IV Verabreichung zu punkten.
ausserdem hatte das US DOD sein Gewicht in die Waagschale geschmissen.
Die neue Soldaten Front Droge - 6-8x wirksamer als Fentanyl
Das DOD hatte schon 100.000 Einheiten bestellt.
Trotzdem war die Zulassung in US. recht umstritten.
Ich glaube, dass auch deshalb die FDA keine 2 umstrittenen "OpiumErsatzstoffe" an einem Tag zulassen konnte/mochte.
Gruss S.
...ich habe am Freitag noch 5000 Stück zu $1.19 verkauft - dieses Kapital werde ich wieder in TRVN investieren, und zwar weil ich glaube, dass Oliceridine imer noch gute Zulassungschancen hat. Ich habe allerdings das Limit für den Kauf von 0.59$ auf 0.49$ nach unten korrigiert.
Antwort auf Beitrag Nr.: 59.140.578 von Cyberhexe am 05.11.18 16:04:10...ich habe am Freitag noch 5000 Stück zu $1.19 verkauft - dieses Kapital werde ich wieder in TRVN investieren, und zwar weil ich glaube, dass Oliceridine imer noch gute Zulassungschancen hat. Ich habe allerdings das Limit für den Kauf von 0.59$ auf 0.49$ nach unten korrigiert.
Antwort auf Beitrag Nr.: 59.140.587 von Cyberhexe am 05.11.18 16:05:25Wie lange wird es d.M. nach dauern bis die ganzen fehlenden Daten vorliegen und denkst du wirklich, dass die solange finanziell durch halten(können)?
Was kam denn bei der Telko heute heraus?keine interessanten News, wie es jetzt weitergeht?1
Nicht viel Belastbares. Klingt ganz optimistisch, aber das waren sie vor PDUFA und Adcom auch. Sie werden so bald wie möglich ein Treffen mut der FDa beantragen. Da wird dann innerhalb von 30 Tagen nach Antrag terminiert und findet nochmal später statt. Hängt von der Auslastung der FDA ab.
Man hofft, ohne neue Studie durchzukommen. Evtl mit dem Trick, die max Dosis auf 27 mg/d zu reduzieren (von 40). Dadurch „steigt“ in den vorliegenden studien die Nzahl der Patienten mit max Dosis oder darüber auf 350 wie von der FDA verlangt. Ansonstenwurdwn teilweise ja bereits Auswertungen nachgereicht, die noch nicht berücksichtigt wurden (hat Cyberheye ja schon erwähnt) und alles weitere soll mit einer Resubmission zusammen eingereicht werden.
Nicht ganz verstanden habe ich, wie sie aus der Qtc Verlängerung herauskommen wollen.
Soweit mein Eindruck von dem Call. Insgesamt wirkte es wie eine unangenehme Pflichtübung und ich frage mich, wieso man ds nicht einfach als Pressemeldung rausgegeben hat. Die Tonqualität war auch nicht optimal.
Man hofft, ohne neue Studie durchzukommen. Evtl mit dem Trick, die max Dosis auf 27 mg/d zu reduzieren (von 40). Dadurch „steigt“ in den vorliegenden studien die Nzahl der Patienten mit max Dosis oder darüber auf 350 wie von der FDA verlangt. Ansonstenwurdwn teilweise ja bereits Auswertungen nachgereicht, die noch nicht berücksichtigt wurden (hat Cyberheye ja schon erwähnt) und alles weitere soll mit einer Resubmission zusammen eingereicht werden.
Nicht ganz verstanden habe ich, wie sie aus der Qtc Verlängerung herauskommen wollen.
Soweit mein Eindruck von dem Call. Insgesamt wirkte es wie eine unangenehme Pflichtübung und ich frage mich, wieso man ds nicht einfach als Pressemeldung rausgegeben hat. Die Tonqualität war auch nicht optimal.
Ach ja: zur Finanzlage und den Auswirkungen will man sich am Donnerstag zusammen mit den Quartalszahlen äußern.
deRendite
danke für die Rückmedung/Info, dann wollen wir mal auf das beste hoffen, bin hier richtig fett im Minus
Extreme Kursabstrafung......finde ich komplett überzogen und das hat mit Börse nicht viel zu tun.
Was ist passiert........es gab keine Zulassung..und????? Das heißt noch lange nicht das es eine endgültige Entscheidung war sondern das gewisse Daten nachgeliefert werden müssen. Denken die Leute nicht mit und schmeißen Ihre Aktien nur weil es keine 1000% auf die Schnelle gab????
Meine Fresse......jetzt wird wieder alles schlecht geredet aber wehe wenn die Herde wieder los läuft
wenn wieder was positives folgt. Egal........scheiss drauf sollen sie doch den Kurs auf 0,20€ drücken für mich ein Zeichen das wenig Hirnmasse in den Köpfen der Verkäufer ist.
Was ist passiert........es gab keine Zulassung..und????? Das heißt noch lange nicht das es eine endgültige Entscheidung war sondern das gewisse Daten nachgeliefert werden müssen. Denken die Leute nicht mit und schmeißen Ihre Aktien nur weil es keine 1000% auf die Schnelle gab????
Meine Fresse......jetzt wird wieder alles schlecht geredet aber wehe wenn die Herde wieder los läuft
wenn wieder was positives folgt. Egal........scheiss drauf sollen sie doch den Kurs auf 0,20€ drücken für mich ein Zeichen das wenig Hirnmasse in den Köpfen der Verkäufer ist.
Tja... Mal sehen, was die Zahlen am Donnerstag bringen. Wenn ich den Q2-Bericht zugrunde lege, notiert die Aktie unterhalb des Umlaufvermögens. Habe aber keinen Überblick, wie die "burn rate" ist. Meilensteinzahlungen für Oliceridine fallen ja nun erstmal nicht an.
Bin schon schwer versucht, bei diesen Kursen auch nochmal nachzukaufen, aber eigentlich reichen mir meine 7k. Habe keine Lust, hier kleine Schwankungen zu handeln. Entweder das Ding fliegt doch noch irgendwann und dann profitiere ich auch mit meinem jetzigen Bestand ordentlich oder eben nicht, dann habe ich dem schlechten Geld zumindest kein gutes hinterhergeworfen.
Bin schon schwer versucht, bei diesen Kursen auch nochmal nachzukaufen, aber eigentlich reichen mir meine 7k. Habe keine Lust, hier kleine Schwankungen zu handeln. Entweder das Ding fliegt doch noch irgendwann und dann profitiere ich auch mit meinem jetzigen Bestand ordentlich oder eben nicht, dann habe ich dem schlechten Geld zumindest kein gutes hinterhergeworfen.
Die jetzige Nichtzulassung ist natürlich erstmal ein Rückschlag, war aber zu erwarten. Die Frage ist, ob man dies durch eine andere Kommunikation mit der FDA oder ein anderes Studiendesign während der klinischen Erprobung hätte vermeiden können. Von meinem Eindruck her würde ich das fast bejahen.
Zu den klinischen Aspekten gibt es erstmal keine Änderungen durch den CRL. Es gibt einen großen Bedarf zu einer Morphin-Alternative und Trevena hat diese im Portfolio. Oliceridin wirkt weniger atemdepressiv, ein großer Pluspunkt bei Intensivpatienten. Es macht nicht stärker bis weniger abhängig, bei der grassierenden Opiatabhängigkeit und der öffentlichen Wahrnehmung in den USA ebenfalls ein großer Pluspunkt. Bleiben erstmal die QT-Verlängerungen, mit möglichen lebensbedrohlichen Rhythmusstören (torsades de pointes). Als Anmerkung muss man dazu machen, dass ca. 3% der Medikamente diese Nebenwirkung haben, z.B. auch manche Antibiotika. Hier bleibt die Einschätzung der FDA zu weiteren Daten abzuwarten. Ich gehe weiter von einer Zulassung aus.
Zu den klinischen Aspekten gibt es erstmal keine Änderungen durch den CRL. Es gibt einen großen Bedarf zu einer Morphin-Alternative und Trevena hat diese im Portfolio. Oliceridin wirkt weniger atemdepressiv, ein großer Pluspunkt bei Intensivpatienten. Es macht nicht stärker bis weniger abhängig, bei der grassierenden Opiatabhängigkeit und der öffentlichen Wahrnehmung in den USA ebenfalls ein großer Pluspunkt. Bleiben erstmal die QT-Verlängerungen, mit möglichen lebensbedrohlichen Rhythmusstören (torsades de pointes). Als Anmerkung muss man dazu machen, dass ca. 3% der Medikamente diese Nebenwirkung haben, z.B. auch manche Antibiotika. Hier bleibt die Einschätzung der FDA zu weiteren Daten abzuwarten. Ich gehe weiter von einer Zulassung aus.
Hier noch weitere Durchhalteparolen auszugeben und spekulativ Geld nachzuschiessen ist schon der absolute Hammer.
Entweder geht die Firma ohnehin bald pleite oder sie wird binnen eines Monates, wenn der Kurs nicht über einen Dollar liegt von der Nasdaq bzw. Börse DEGELISTET !
Morgen kommen die erwarteten Horrorzahlen mit Bankrott-Ausblick und dann läuft der CountDown für die Reise ins Nirvana der Pharmaaktien.
Trevena ist nur mehr eine völlige, wertlose Schrottaktie. Das Management hat alles verbockt!
Game over! Rien a va plus!
Entweder geht die Firma ohnehin bald pleite oder sie wird binnen eines Monates, wenn der Kurs nicht über einen Dollar liegt von der Nasdaq bzw. Börse DEGELISTET !
Morgen kommen die erwarteten Horrorzahlen mit Bankrott-Ausblick und dann läuft der CountDown für die Reise ins Nirvana der Pharmaaktien.
Trevena ist nur mehr eine völlige, wertlose Schrottaktie. Das Management hat alles verbockt!
Game over! Rien a va plus!
Oder die manchen rs
Guckt euch mal argos therapeutics . Raus wer kann
!
Dieser Beitrag wurde von CommunityAssistance moderiert. Grund: Beschäftigung mit Usern - bitte kehren Sie zum Threadthema zurück.
Antwort auf Beitrag Nr.: 59.158.824 von PESCADOS am 07.11.18 15:02:08Vielleicht solltest Du Dich mal mit den verschiedenen Bedingungen der NASDAQ Notierungen und Grundsätzen der Aktienanlage vertraut machen. Dies ist ein Pennystock eines pharmazeutischen Unternehmens, also Hochrisikoklasse, und nur, weil Du Dein Taschengeld verzockt hast, heißt es ja nicht, dass andere hier noch ein sinnvolles Investment sehen. Diese Aktie ist nach meiner Einschätzung keineswegs erledigt, sondern könnte bei Bodenbildung sogar einen Einstieg lohnen. Aber jeder nach seiner Einschätzung....
SHAREHOLDER ALERT: Pomerantz Law Firm Reminds Shareholders with Losses on their Investment in Trevena, Inc. of Class Action Lawsuit and Upcoming Deadline - TRVN
New York (ots / PRNewswire) - Pomerantz LLP gibt bekannt, dass eine Sammelklage gegen Trevena Inc. ("Trevena oder das" Unternehmen ") (NASDAQ: TRVN) und einige seiner Offiziere eingereicht wurde. Die Klasse Diese Klage wurde beim United States District Court (Eastern District of Pennsylvania) eingereicht und ist unter der Nummer 18-cv-04426 indexiert. Sie handelt im Namen aller Personen und Organisationen, die keine Beklagten und ihre verbundenen Unternehmen sind und Trevena-Wertpapiere erworben oder anderweitig erworben haben zwischen dem 2. Mai 2016 und dem 9. Oktober 2018 , einschließlich beider Daten (die "Klassenperiode"), um Schadenersatzansprüche geltend zu machen, die durch Verstöße der Beklagten gegen die bundesstaatlichen Wertpapiergesetze verursacht wurden, und Abhilfemaßnahmen gemäß den Abschnitten 10 (b) und 20 (a ) des Securities Exchange Act von 1934 (das "Exchange Act") und der darin verkündeten Regel 10b -5 gegen die Gesellschaft und einige ihrer obersten Beamten.
Wenn Sie ein Aktionär sind, der Trevena-Wertpapiere zwischen dem 2. Mai 2016 und dem 9. Oktober 2018 erworben hat (beide Termine inklusive), haben Sie bis zum 10. Dezember 2018 die Möglichkeit, das Gericht zu ersuchen, Sie zum Hauptkläger der Klasse zu ernennen. Eine Kopie der Beschwerde ist unter www.pomerantzlaw.com erhältlich. Um diese Aktion zu besprechen, wenden Sie sich an Robert S. Willoughby unter rswilloughby@pomlaw.com oder 888.476.6529 (oder 888.4-POMLAW), gebührenfrei, Durchw. 9980. Diejenigen, die per E-Mail nachfragen, sollten ihre Postanschrift, ihre Telefonnummer und die Anzahl der erworbenen Aktien angeben.
[Hier klicken, um an dieser Klassenaktion teilzunehmen]
Trevena ist ein biopharmazeutisches Unternehmen, das innovative, auf bahnbrechenden wissenschaftlichen Erkenntnissen basierende Therapien entwickelt, die Patienten und Gesundheitsdienstleistern zugute kommen, die sich ernsthaften Erkrankungen stellen.
Das Unternehmen entwickelt derzeit OLINVO (Oliceridine) Injection, ein IV-Analgetikum der nächsten Generation für die Behandlung mittelschwerer bis schwerer akuter Schmerzen in Krankenhäusern und ähnlichen Einrichtungen, und wurde von der US-amerikanischen Food and Drug Administration (US-amerikanischen Food and Drug Administration) als Durchbruchstherapie ausgezeichnet ("FDA").
Nachdem das Unternehmen eine Phase-2-Studie mit OLINVO abgeschlossen hatte, gab es am 2. Mai 2016 eine Pressemitteilung heraus, in der es heißt: "[es] hat mit der FDA eine allgemeine Vereinbarung über die wichtigsten Elemente des Phase-3-Programms zur Unterstützung eines Antrags auf ein neues Arzneimittel ( NDA) für Oliceridin [.]
Während des gesamten Klassenzeitraums machten die Angeklagten wesentlich falsche und irreführende Aussagen bezüglich der Geschäfts-, Betriebs- und Compliance-Richtlinien des Unternehmens. Die Beklagten gaben insbesondere falsche und / oder irreführende Aussagen ab und / oder versäumten es, Folgendes zu offenbaren: (i) Die FDA hatte den Schlüsselelementen der Phase-3-Studie des Unternehmens für Oliceridin (TRV130) nicht zugestimmt. (ii) es unwahrscheinlich ist, dass die FDA Oliceridin (TRV130) auf der Grundlage der Phase-3-Studie des Unternehmens genehmigt; und (iii) Trevenas öffentliche Äußerungen waren daher zu allen relevanten Zeitpunkten im Wesentlichen falsch und irreführend.
Am 9. Oktober 2018 wurde bekannt, dass die FDA dem Unternehmen auf einer Sitzung im Jahr 2016 mitteilte, dass die FDA "nicht mit der vorgeschlagenen Dosierung in den Phase-3-Studien", dem vorgeschlagenen primären Endpunkt oder der "vorgeschlagenen Nichtunterlegenheit" einverstanden war (NI) -Marge zum Vergleich von Morphin mit Oliceridin. "
Im Anschluss an diese Nachricht fiel die Aktie von Trevena am 9. Oktober 2018 um mehr als 64% und schloss bei 1,07 USD je Aktie.
Am 11. Oktober 2018 gab das Unternehmen bekannt, dass die FDA ihren Antrag für neue Arzneimittel gegen Oliceridin abgelehnt hat.
Die Pomerantz-Kanzlei mit Büros in New York , Chicago , Los Angeles und Paris gilt als eine der führenden Kanzleien in den Bereichen Unternehmens-, Wertpapier- und Kartellrechtsstreitigkeiten. Die Firma Pomerantz wurde vom verstorbenen Abraham L. Pomerantz , bekannt als Dekan der Sammelklagen, gegründet und war Vorreiter im Bereich der Wertpapierklassen. Heute, mehr als 80 Jahre später, setzt die Firma Pomerantz ihre Tradition fort und kämpft für die Rechte der Betroffenen von Wertpapierbetrug, Verstöße gegen die Treuepflicht und für unternehmerisches Fehlverhalten. Die Kanzlei hat zahlreiche Schadensersatzleistungen in Höhe von mehreren Millionen US-Dollar für die Mitglieder der Klasse erhalten. Siehe www.pomerantzlaw.com
KONTAKT:
Robert S. Willoughby
Pomerantz LLP
rswilloughby@pomlaw.com
888-476-6529 ext. 9980
© 2018 PR Newswire
New York (ots / PRNewswire) - Pomerantz LLP gibt bekannt, dass eine Sammelklage gegen Trevena Inc. ("Trevena oder das" Unternehmen ") (NASDAQ: TRVN) und einige seiner Offiziere eingereicht wurde. Die Klasse Diese Klage wurde beim United States District Court (Eastern District of Pennsylvania) eingereicht und ist unter der Nummer 18-cv-04426 indexiert. Sie handelt im Namen aller Personen und Organisationen, die keine Beklagten und ihre verbundenen Unternehmen sind und Trevena-Wertpapiere erworben oder anderweitig erworben haben zwischen dem 2. Mai 2016 und dem 9. Oktober 2018 , einschließlich beider Daten (die "Klassenperiode"), um Schadenersatzansprüche geltend zu machen, die durch Verstöße der Beklagten gegen die bundesstaatlichen Wertpapiergesetze verursacht wurden, und Abhilfemaßnahmen gemäß den Abschnitten 10 (b) und 20 (a ) des Securities Exchange Act von 1934 (das "Exchange Act") und der darin verkündeten Regel 10b -5 gegen die Gesellschaft und einige ihrer obersten Beamten.
Wenn Sie ein Aktionär sind, der Trevena-Wertpapiere zwischen dem 2. Mai 2016 und dem 9. Oktober 2018 erworben hat (beide Termine inklusive), haben Sie bis zum 10. Dezember 2018 die Möglichkeit, das Gericht zu ersuchen, Sie zum Hauptkläger der Klasse zu ernennen. Eine Kopie der Beschwerde ist unter www.pomerantzlaw.com erhältlich. Um diese Aktion zu besprechen, wenden Sie sich an Robert S. Willoughby unter rswilloughby@pomlaw.com oder 888.476.6529 (oder 888.4-POMLAW), gebührenfrei, Durchw. 9980. Diejenigen, die per E-Mail nachfragen, sollten ihre Postanschrift, ihre Telefonnummer und die Anzahl der erworbenen Aktien angeben.
[Hier klicken, um an dieser Klassenaktion teilzunehmen]
Trevena ist ein biopharmazeutisches Unternehmen, das innovative, auf bahnbrechenden wissenschaftlichen Erkenntnissen basierende Therapien entwickelt, die Patienten und Gesundheitsdienstleistern zugute kommen, die sich ernsthaften Erkrankungen stellen.
Das Unternehmen entwickelt derzeit OLINVO (Oliceridine) Injection, ein IV-Analgetikum der nächsten Generation für die Behandlung mittelschwerer bis schwerer akuter Schmerzen in Krankenhäusern und ähnlichen Einrichtungen, und wurde von der US-amerikanischen Food and Drug Administration (US-amerikanischen Food and Drug Administration) als Durchbruchstherapie ausgezeichnet ("FDA").
Nachdem das Unternehmen eine Phase-2-Studie mit OLINVO abgeschlossen hatte, gab es am 2. Mai 2016 eine Pressemitteilung heraus, in der es heißt: "[es] hat mit der FDA eine allgemeine Vereinbarung über die wichtigsten Elemente des Phase-3-Programms zur Unterstützung eines Antrags auf ein neues Arzneimittel ( NDA) für Oliceridin [.]
Während des gesamten Klassenzeitraums machten die Angeklagten wesentlich falsche und irreführende Aussagen bezüglich der Geschäfts-, Betriebs- und Compliance-Richtlinien des Unternehmens. Die Beklagten gaben insbesondere falsche und / oder irreführende Aussagen ab und / oder versäumten es, Folgendes zu offenbaren: (i) Die FDA hatte den Schlüsselelementen der Phase-3-Studie des Unternehmens für Oliceridin (TRV130) nicht zugestimmt. (ii) es unwahrscheinlich ist, dass die FDA Oliceridin (TRV130) auf der Grundlage der Phase-3-Studie des Unternehmens genehmigt; und (iii) Trevenas öffentliche Äußerungen waren daher zu allen relevanten Zeitpunkten im Wesentlichen falsch und irreführend.
Am 9. Oktober 2018 wurde bekannt, dass die FDA dem Unternehmen auf einer Sitzung im Jahr 2016 mitteilte, dass die FDA "nicht mit der vorgeschlagenen Dosierung in den Phase-3-Studien", dem vorgeschlagenen primären Endpunkt oder der "vorgeschlagenen Nichtunterlegenheit" einverstanden war (NI) -Marge zum Vergleich von Morphin mit Oliceridin. "
Im Anschluss an diese Nachricht fiel die Aktie von Trevena am 9. Oktober 2018 um mehr als 64% und schloss bei 1,07 USD je Aktie.
Am 11. Oktober 2018 gab das Unternehmen bekannt, dass die FDA ihren Antrag für neue Arzneimittel gegen Oliceridin abgelehnt hat.
Die Pomerantz-Kanzlei mit Büros in New York , Chicago , Los Angeles und Paris gilt als eine der führenden Kanzleien in den Bereichen Unternehmens-, Wertpapier- und Kartellrechtsstreitigkeiten. Die Firma Pomerantz wurde vom verstorbenen Abraham L. Pomerantz , bekannt als Dekan der Sammelklagen, gegründet und war Vorreiter im Bereich der Wertpapierklassen. Heute, mehr als 80 Jahre später, setzt die Firma Pomerantz ihre Tradition fort und kämpft für die Rechte der Betroffenen von Wertpapierbetrug, Verstöße gegen die Treuepflicht und für unternehmerisches Fehlverhalten. Die Kanzlei hat zahlreiche Schadensersatzleistungen in Höhe von mehreren Millionen US-Dollar für die Mitglieder der Klasse erhalten. Siehe www.pomerantzlaw.com
KONTAKT:
Robert S. Willoughby
Pomerantz LLP
rswilloughby@pomlaw.com
888-476-6529 ext. 9980
© 2018 PR Newswire
Antwort auf Beitrag Nr.: 59.163.996 von onkelen am 08.11.18 06:31:42Ich verstehe das ganze Geschrei hier nicht......natürlich wird bei Der FDA mal ein Medikament nicht beim erstenmal zugelassen aber das heißt nocht lange nicht das es eine endgültige Entscheidung ist. Man sollte die Dinge mal etwas nüchterner sehen und abwarten was im Detail alles an Daten noch verlangt wird und erst dann aber auch nur dann kann man sehen ob bei Ttrevena irgendwann die lichter ausgehen. Zum jetzigen Zeitpunkt glaube ich nicht an das Ende von Trevena und der zulassung von Olinvo.....
Trevena beats by $0.08, beats on revenue
Revenue of $3M beats by $1M.
https://seekingalpha.com/news/3407279-trevena-beats-0_08-bea…
Trevena Reports Third Quarter 2018 Financial Results and Announces Workforce Restructuring
$70.0 Million of Cash, Cash Equivalents and Marketable Securities as of September 30.
The Company expects this amount, together with interest thereon, to be sufficient to fund operating expenses and capital expenditure requirements into the second quarter of 2020.
https://seekingalpha.com/pr/17327013-trevena-reports-third-q…
Revenue of $3M beats by $1M.
https://seekingalpha.com/news/3407279-trevena-beats-0_08-bea…
Trevena Reports Third Quarter 2018 Financial Results and Announces Workforce Restructuring
$70.0 Million of Cash, Cash Equivalents and Marketable Securities as of September 30.
The Company expects this amount, together with interest thereon, to be sufficient to fund operating expenses and capital expenditure requirements into the second quarter of 2020.
https://seekingalpha.com/pr/17327013-trevena-reports-third-q…
Antwort auf Beitrag Nr.: 59.168.280 von boersenkeks am 08.11.18 13:40:17Also 1/3 Personal-Abbau, um Kosten zu reduzieren und fokussiert an den CRL-Anforderungen zu arbeiten. Es bleiben die Schlüsselpersonen aus klinischen Studien, Produktion und Regulatory Affairs und die sollen mit externen Experten an der Oliceridin Zulassung weiterarbeiten.
Die anderen Produktkandidaten werden auf Pause gesetzt. Das heißt, es wird kein eigenes Kapital ausgegeben, um die Entwicklung voranzutreiben. Oliceridin hat absolute Priorität.
Mit den reduzierten Kosten will man bis Q2 2020 durchhalten. Das kann sich aber ändern, wenn sich in den Gesprächen mit der FDA herausstellt, dass Oliceridin doch noch mehr Aufwand erfordert als derzeit gedacht.
Die anderen Produktkandidaten werden auf Pause gesetzt. Das heißt, es wird kein eigenes Kapital ausgegeben, um die Entwicklung voranzutreiben. Oliceridin hat absolute Priorität.
Mit den reduzierten Kosten will man bis Q2 2020 durchhalten. Das kann sich aber ändern, wenn sich in den Gesprächen mit der FDA herausstellt, dass Oliceridin doch noch mehr Aufwand erfordert als derzeit gedacht.
Antwort auf Beitrag Nr.: 59.168.592 von deRendite am 08.11.18 14:16:38Das waren de meiner Meinung nach wichtigsten Infos aus dem Q3 conference call soeben.
Antwort auf Beitrag Nr.: 59.140.578 von Cyberhexe am 05.11.18 16:04:10Hallo,
kann mir jemand sagen, wie lange Trevena brauchen wuerde die fehlenden Daten zu ergaenzen?
Wird es noch ein Gespraech zwischen der FDA und Trevena geben?
kann mir jemand sagen, wie lange Trevena brauchen wuerde die fehlenden Daten zu ergaenzen?
Wird es noch ein Gespraech zwischen der FDA und Trevena geben?
Antwort auf Beitrag Nr.: 59.183.754 von Aktapot am 09.11.18 23:16:30
Da werden voraussichtlich einige Monate vergehen.
Zitat von Aktapot: Hallo,
kann mir jemand sagen, wie lange Trevena brauchen wuerde die fehlenden Daten zu ergaenzen?
Wird es noch ein Gespraech zwischen der FDA und Trevena geben?
Da werden voraussichtlich einige Monate vergehen.
Antwort auf Beitrag Nr.: 59.198.347 von fypet am 12.11.18 18:02:10Bei dem heiklen Thema ind Produkt glaube ich an länger als 1 Jahr.
....ich denke mal ebenso , also mindestens 12 monate und eventuell noch ein" paar tage" länger. mehrere orders unter 0,50 eurocent bereits eingegeben , einsammeln und dann abwarten , zumindestens bis zum nächsten bescheid der FDA .....(was ist schon ein jahr)......good luck......
Wenn es ein Jahr gehen wird bis zum nächsten bescheid der FDA
dann kann sich jeder selber Vorstellen wohin die Aktie geht.
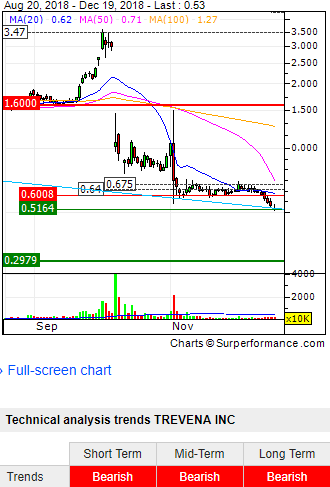
dann kann sich jeder selber Vorstellen wohin die Aktie geht.

Antwort auf Beitrag Nr.: 59.480.487 von fypet am 20.12.18 15:41:38Wo soll sie denn noch hingehen......gegen null?????? Das ding ist doch schon fast am tiefsten Punkt seit bestehen der Aktie......lach.
....ohne FDA geht hier leider garnichts......siehe andere bio-tech-werte wie z B. paion und andere , geschweide sogar mit , wie epi und andere die noch am herum dümpeln sind . vielleicht hilft eines tages wieder die cyberhexe etwas weiter mit ihrem fachwissen , aber zaubern kann sie leider auch nicht mehr . ansonsten schöne weihnachten für alle leid geplagten und im nächsten jahr sprechen wir uns hoffentlich etwas positiver gestimmt erneut wieder.
....ist da etwa ein split in sicht um die aktie wieder etwas attraktiver zu gestalten , so schreibt man zumindestens bei ariva.......allen guten rutsch ins neue jahr mit besseren vorzeichen für unsere bio-tech-schmiede trevena.
Seit dem Tief 0.38 hat sie wieder recht zugelegt, über 50%, fundamental sehe ich
nichts da hinter, Zocker, ein Split oder eine Kapitalerhöhung könnte es auch sein.
Bis zur FDA Entscheidung wird es noch lange dauern und dann sind wieder viele offene Fragen
Beantworten, roll out, vermarktung usw. ???
nichts da hinter, Zocker, ein Split oder eine Kapitalerhöhung könnte es auch sein.
Bis zur FDA Entscheidung wird es noch lange dauern und dann sind wieder viele offene Fragen
Beantworten, roll out, vermarktung usw. ???
Trevena-Rating (TRVN) erhöht, 16. Januar 2019
Trevena-Rating (TRVN) erhöht,Gepostet von Samantha Guadardo am 16. Januar 2019
Zacks Investment Research hat die Aktien von Trevena (NASDAQ: TRVN) in einer am Samstagmorgen veröffentlichten Research Note von einem Halten-Rating auf ein Kauf-Rating hochgestuft. Das Unternehmen hat derzeit ein Kursziel von 0,75 US-Dollar für die Aktie des biopharmazeutischen Unternehmens.
Zacks zufolge ist Trevena, Inc. ein biopharmazeutisches Unternehmen. Es konzentriert sich auf die Entdeckung und Entwicklung von Therapeutika für G-Protein-gekoppelte Rezeptoren. Die Produktpipeline des Unternehmens umfasst TRV027, TRV130, TRV734 und Delta-opioidabhängige Liganden, die sich in verschiedenen klinischen Phasen befinden. Trevena, Inc. hat seinen Sitz in King of Prussia, Pennsylvania. “
Erhalten Sie Trevena-Benachrichtigungen:
Mehrere andere Maklerfirmen haben sich auch zu TRVN geäußert. Jefferies Financial Group senkte Trevena von einem Kauf-Rating auf ein Halten-Rating und senkte das Kursziel für das Unternehmen von 10 USD auf 1,00 USD in einem Bericht am Mittwoch, dem 10. Oktober. JMP Securities erhöhte sein Kursziel für Trevena von 4,00 USD auf 15,00 USD und bewertete das Unternehmen am Freitag, dem 12. Oktober, mit einem Outperformance-Rating. Needham & Company LLC hat Trevena am Freitag, dem 12. Oktober, in einem Bericht von einer Kaufbewertung auf eine Haltebewertung gesenkt. Schließlich senkte HC Wainwright das Preisziel für Trevena von 7,00 $ auf 3,00 $ und legte dem Unternehmen am Freitag, dem 12. Oktober, eine Kaufbewertung fest. Fünf Aktienanalysten haben die Aktie mit einem Halten-Rating bewertet, und drei haben dem Unternehmen ein Kauf-Rating zugewiesen. Trevena hat derzeit eine durchschnittliche Bewertung von Hold und ein Konsenszielkurs von 5,42 USD.
Die Aktien von TRVN wurden am Freitag bei 0,51 USD eröffnet. Trevena hat ein 12-Monats-Tief von 0,38 USD und ein 12-Monats-Hoch von 3,58 USD. Das Unternehmen hat eine schnelle Ratio von 4,30, eine aktuelle Ratio von 4,30 und eine Verschuldungsquote von 0,16. Das Unternehmen verfügt über eine Marktkapitalisierung von 48,57 Millionen US-Dollar, einen PE-Wert von -0,42 und ein Beta von 0,98.
Trevena (NASDAQ: TRVN) hat zuletzt am Donnerstag, den 8. November, die Quartalsergebnisse veröffentlicht. Das biopharmazeutische Unternehmen verzeichnete (0,06 USD) für das Quartal und übertraf die Konsensschätzung von (0,13 USD) um 0,07 USD. Das Unternehmen erzielte im Quartal einen Umsatz von 3,00 Mio. USD, verglichen mit den Erwartungen der Analysten von 3,00 Mio. USD. Analysten prognostizieren, dass Trevena im laufenden Jahr einen Gewinn von -0,55 je Aktie erzielen wird.
Eine Reihe von Hedgefonds hat kürzlich ihre Aktienbestände geändert. Die Vanguard Group Inc. erhöhte ihre Beteiligung an Trevena im 3. Quartal um 29,2%. Vanguard Group Inc. besitzt nun 2.618.634 Aktien des biopharmazeutischen Unternehmens im Wert von 5.552.000 US-Dollar, nachdem im letzten Quartal weitere 592.152 Aktien erworben worden waren. Die Vanguard Group Inc. erhöhte ihre Beteiligung an Trevena im 3. Quartal um 29,2%. Vanguard Group Inc. besitzt nun 2.618.634 Aktien des biopharmazeutischen Unternehmens im Wert von 5.552.000 USD, nachdem im letzten Quartal weitere 592.152 Aktien erworben wurden. Renaissance Technologies LLC erhöhte ihre Beteiligung an Trevena im 3. Quartal um 67,2%. Renaissance Technologies LLC besitzt nun 872.300 Aktien des biopharmazeutischen Unternehmens im Wert von 1.849.000 USD, nachdem im letzten Quartal weitere 350.600 Aktien erworben worden waren. JPMorgan Chase & Co. erhöhte seine Beteiligung an Trevena im 3. Quartal um 17,5%. JPMorgan Chase & Co. besitzt jetzt 541.099 Aktien des biopharmazeutischen Unternehmens im Wert von 1.147.000 USD, nachdem im letzten Quartal weitere 80.437 Aktien erworben worden waren. Schließlich erhöhte BlackRock Inc. seine Beteiligung an Trevena im 3. Quartal um 151,4%. BlackRock Inc. besitzt nun 1.873.311 Aktien des biopharmazeutischen Unternehmens im Wert von 3.971.000 US-Dollar, nachdem im letzten Quartal weitere 1.128.041 Aktien erworben worden waren. Institutionelle Investoren halten 39,10% der Aktien des Unternehmens.
Über Trevena
Trevena, Inc., ein biopharmazeutisches Unternehmen, entwickelt Therapien, die auf bahnbrechenden wissenschaftlichen Erkenntnissen basieren, um Patienten und Gesundheitsdienstleistern zu helfen, die sich ernsthaften medizinischen Erkrankungen stellen. Zu den Produktkandidaten zählt die OLINVO-Injektion, ein G-Protein-vorgespannter Ligand des µ-Opioid-Rezeptors, der die klinischen Phase-III-Studien zur Behandlung mittelschwerer bis schwerer akuter Schmerzen abgeschlossen hat, wobei die intravenöse Verabreichung bevorzugt wird; TRV250, ein G-Protein-vorgespannter Ligand gegen den d-Rezeptor, der sich in der klinischen Phase I-Studie zur Behandlung von Migräne befindet; und TRV734, ein G-Protein-vorgespannter Ligand mit kleinem Molekül des µ-Opioid-Rezeptors, der die klinische Studie der Phase I zur Behandlung von mittelschwer bis schweren akuten und chronischen Schmerzen sowie TRV027 zur Behandlung von akutem Herzversagen abgeschlossen hat.
Antwort auf Beitrag Nr.: 59.664.779 von onkelen am 18.01.19 18:36:43quelle
https://weekherald.com/2019/01/16/trevena-trvn-rating-increa…
https://weekherald.com/2019/01/16/trevena-trvn-rating-increa…
Trevena wieder zum Leben zu erwecken?
25. Januar 2019 15:18 Uhr ET |Zusammenfassung
Die FDA erteilt Trevena am 02.11.18 eine CRL.
Die Analyse der CRL zeigt, dass die Zulassung kurz bevorsteht.
Die Zusammenfassung der Telefonkonferenz weist darauf hin, dass Trevena weiß, was zu tun ist, um eine Genehmigung zu erhalten, ohne mehr Kapital aufzubringen und die Aktie zu verwässern.
Die Zusammenfassung der Verdienste über das Ergebnis zeigt viele positive Ergebnisse für das Unternehmen.
Wie geht es weiter mit Trevena? FDA-Protokolle werden im ersten Quartal veröffentlicht.
TREVENA VOLLSTÄNDIGER ANTWORTBRIEF:
Anfang dieses Monats habe ich in meinem Artikel "Trevena drängt All-In mit Oliceridin" festgestellt, dass Trevena die FDA-Zulassung verdient hatte, da die FDA vor dem Treffen des Beratenden Ausschusses ein Dokument mit Befunden veröffentlichte, das mit Fehlern behaftet war, die Trevena in einem unfairen negativen Licht zeigten . In dem Briefing-Dokument gab die FDA an, dass bei Trevenas Oliceridin leichte oder mäßige Sicherheitsprobleme aufgetreten sind. Nachdem die Aktie um 65% gefallen war, veröffentlichte die FDA ein weiteres Dokument, das sich selbst korrigierte. In diesem "Erratum" stellte die FDA fest, dass Trevena in der Tat ein ähnliches Sicherheitsprofil wie das Placebo hatte , was bedeutet, dass keine wesentlichen Sicherheitsbedenken bestehen. Ich erklärte auch, dass es keinen Wettbewerb in Bezug auf die Wirksamkeit gab.
Trevena hat in Phase-3-Studien nachgewiesen, dass Oliceridin eine ähnliche analgetische Wirksamkeit wie Morphine aufweist. Anthony Senagore, MD, Professor für Chirurgie an der Western Michigan University, HomerStryker School of Medicine, teilte mit, dass die Schmerzbehandlung nach einer kolorektalen Operation einen Bereich darstellt, der noch nicht gedeckt ist. Selbst nach einer umfassenden Anwendung der multimodalen Analgesie sind zahlreiche Patienten für die Schmerzbehandlung immer noch auf IV-Morphin angewiesen. Infolgedessen leiden sie unter opioidbedingten nachteiligen Wirkungen. Senagore glaubt, dass Oliceridin das Potenzial hat, herkömmliche IV-Opioide zu ersetzen. - Siehe hier mehr
Es wurde vereinbart, dass sowohl die Sicherheit als auch die Wirksamkeit nachgewiesen wurden, und dennoch erhielt Trevena eine CRL. Warum?
Freitag, 2. November 2018 erhielt Trevena von der FDA ein vollständiges Antwortschreiben für ihr Hauptprodukt Oliceridin.
In Übereinstimmung mit der Diskussion auf der letzten Sitzung des Beratenden Ausschusses hat die FDA zusätzliche klinische Daten zur Verlängerung des QT angefordert und angegeben, dass die vorgelegte Sicherheitsdatenbank für die vorgeschlagene Dosierung nicht ausreichend ist. Die FDA forderte auch bestimmte zusätzliche nichtklinische Daten und Validierungsberichte an. Siehe CRL-Pressemitteilung
https://seekingalpha.com/article/4235691-fda-minutes-bring-t…
Antwort auf Beitrag Nr.: 59.716.461 von onkelen am 26.01.19 10:48:08Na das liest sich doch sehr gut. Ich denke da werde ich die nächsten 1-2 Wochen nochmal aufstocken.
Viel Erfolg allen Investierten!
Viel Erfolg allen Investierten!
Hier könnte sich nach dem Artilel von Seeking Alpha (FDA Minutes To Bring Trevena Back To Life?)
ein Einstieg wieder lohnen.
ein Einstieg wieder lohnen.
Antwort auf Beitrag Nr.: 59.144.709 von deRendite am 06.11.18 05:51:36so ist es gekommen :-)
Es besteht also durchaus noch Hoffnung
FDA has agreed that the Company’s current safety database will support labeling at a maximum daily dose of 27 mg.
FDA also has agreed that the Company can conduct a study in healthy volunteers to collect the requested QT interval data and that the study should include placebo- and positive-control arms. The Company intends to submit a detailed protocol and analysis plan to FDA shortly and, following receipt of FDA feedback, anticipates initiating this study in the first half of this year. The Company is not required to provide any additional efficacy data to resubmit the oliceridine NDA.
“We are encouraged by the productive discussion with FDA, which we believe has provided a path to resubmit the oliceridine NDA,” said Carrie L. Bourdow, President and Chief Executive Officer. “We remain committed to our mission of ensuring access to safe and effective treatment options for hospital patients who require an IV opioid to manage their moderate to severe acute pain.”
Es besteht also durchaus noch Hoffnung
FDA has agreed that the Company’s current safety database will support labeling at a maximum daily dose of 27 mg.
FDA also has agreed that the Company can conduct a study in healthy volunteers to collect the requested QT interval data and that the study should include placebo- and positive-control arms. The Company intends to submit a detailed protocol and analysis plan to FDA shortly and, following receipt of FDA feedback, anticipates initiating this study in the first half of this year. The Company is not required to provide any additional efficacy data to resubmit the oliceridine NDA.
“We are encouraged by the productive discussion with FDA, which we believe has provided a path to resubmit the oliceridine NDA,” said Carrie L. Bourdow, President and Chief Executive Officer. “We remain committed to our mission of ensuring access to safe and effective treatment options for hospital patients who require an IV opioid to manage their moderate to severe acute pain.”
Antwort auf Beitrag Nr.: 59.727.081 von rodi60 am 28.01.19 14:07:55Trevena, Inc. (NASDAQ: TRVN ) gab heute bekannt, dass das offizielle Typ-A-Sitzungsprotokoll der US-amerikanischen Food and Drug Administration (FDA) bezüglich des vollständigen Antwortschreibens (CRL) für den Oliceridin New Drug Application (NDA) erhalten wurde.
Die FDA hat zugestimmt, dass die aktuelle Sicherheitsdatenbank des Unternehmens die Kennzeichnung mit einer maximalen Tagesdosis von 27 mg unterstützen wird.
Die FDA hat außerdem vereinbart, dass das Unternehmen eine Studie mit gesunden Freiwilligen durchführen kann, um die angeforderten QT-Intervalldaten zu sammeln, und dass die Studie Placebo- und Positivkontrollarme umfassen sollte. Das Unternehmen beabsichtigt, der FDA in Kürze ein detailliertes Protokoll und einen Analyseplan vorzulegen. Nach Erhalt des Feedbacks der FDA wird der Beginn dieser Studie im ersten Halbjahr dieses Jahres erwartet. Das Unternehmen muss keine zusätzlichen Daten zur Wirksamkeit vorlegen, um die Oliceridin-NDA erneut einzubringen.
"Wir sind ermutigt durch die produktive Diskussion mit der FDA, von der wir glauben, dass sie einen Weg zur Wiederaufnahme der Olizeridin-NDA gefunden hat", sagte Carrie L. Bourdow, President und Chief Executive Officer. "Wir bleiben unserer Mission verpflichtet, sicherzustellen, dass Krankenhauspatienten, die ein IV-Opioid benötigen, um mit ihren mittelschweren bis schweren akuten Schmerzen umgehen zu können, sichere und wirksame Behandlungsmöglichkeiten zur Verfügung stehen."
Im Hinblick auf andere Punkte in der CRL hat die FDA angegeben, dass das Unternehmen unterstützende nichtklinische Daten in Bezug auf die Charakterisierung des 9662-Metaboliten und die verbleibenden Produktvalidierungsberichte enthalten sollte, wenn die NDA für Oliceridin erneut eingereicht wird.
Das Unternehmen kündigte außerdem an, dass es zum 31. Dezember 2018 liquide Mittel und marktgängige Wertpapiere in Höhe von rund 61,5 Millionen US Dollarar erwarten wird, die nach Ansicht des Unternehmens ausreichen werden, um die Betriebsausgaben und den Investitionsbedarf im zweiten Quartal 2020 zu finanzieren Im März 2019 erwartet das Unternehmen die Veröffentlichung der vollständigen Finanzergebnisse für das vierte Quartal und das vollständige Geschäftsjahr zum 31. Dezember 2018.
Telefonkonferenz und Webcast Eine Telefonkonferenz und ein Webcast werden am 28. Januar 2019 um 8:30 Uhr (ET) abgehalten. Um an dem Anruf teilzunehmen, wählen Sie bitte die Nummer (855) 465-0180 (Konferenz-ID: 3882155).
Um an einem Live-Audio-Webcast des Anrufs teilzunehmen, besuchen Sie bitte den Abschnitt "Investorenpräsentation" auf der Website des Unternehmens. Nach Beendigung des Anrufs steht der Webcast 30 Tage lang zur Wiedergabe zur Verfügung.
https://www.streetinsider.com/Corporate+News/Trevena+%28TRVN…
Die FDA hat zugestimmt, dass die aktuelle Sicherheitsdatenbank des Unternehmens die Kennzeichnung mit einer maximalen Tagesdosis von 27 mg unterstützen wird.
Die FDA hat außerdem vereinbart, dass das Unternehmen eine Studie mit gesunden Freiwilligen durchführen kann, um die angeforderten QT-Intervalldaten zu sammeln, und dass die Studie Placebo- und Positivkontrollarme umfassen sollte. Das Unternehmen beabsichtigt, der FDA in Kürze ein detailliertes Protokoll und einen Analyseplan vorzulegen. Nach Erhalt des Feedbacks der FDA wird der Beginn dieser Studie im ersten Halbjahr dieses Jahres erwartet. Das Unternehmen muss keine zusätzlichen Daten zur Wirksamkeit vorlegen, um die Oliceridin-NDA erneut einzubringen.
"Wir sind ermutigt durch die produktive Diskussion mit der FDA, von der wir glauben, dass sie einen Weg zur Wiederaufnahme der Olizeridin-NDA gefunden hat", sagte Carrie L. Bourdow, President und Chief Executive Officer. "Wir bleiben unserer Mission verpflichtet, sicherzustellen, dass Krankenhauspatienten, die ein IV-Opioid benötigen, um mit ihren mittelschweren bis schweren akuten Schmerzen umgehen zu können, sichere und wirksame Behandlungsmöglichkeiten zur Verfügung stehen."
Im Hinblick auf andere Punkte in der CRL hat die FDA angegeben, dass das Unternehmen unterstützende nichtklinische Daten in Bezug auf die Charakterisierung des 9662-Metaboliten und die verbleibenden Produktvalidierungsberichte enthalten sollte, wenn die NDA für Oliceridin erneut eingereicht wird.
Das Unternehmen kündigte außerdem an, dass es zum 31. Dezember 2018 liquide Mittel und marktgängige Wertpapiere in Höhe von rund 61,5 Millionen US Dollarar erwarten wird, die nach Ansicht des Unternehmens ausreichen werden, um die Betriebsausgaben und den Investitionsbedarf im zweiten Quartal 2020 zu finanzieren Im März 2019 erwartet das Unternehmen die Veröffentlichung der vollständigen Finanzergebnisse für das vierte Quartal und das vollständige Geschäftsjahr zum 31. Dezember 2018.
Telefonkonferenz und Webcast Eine Telefonkonferenz und ein Webcast werden am 28. Januar 2019 um 8:30 Uhr (ET) abgehalten. Um an dem Anruf teilzunehmen, wählen Sie bitte die Nummer (855) 465-0180 (Konferenz-ID: 3882155).
Um an einem Live-Audio-Webcast des Anrufs teilzunehmen, besuchen Sie bitte den Abschnitt "Investorenpräsentation" auf der Website des Unternehmens. Nach Beendigung des Anrufs steht der Webcast 30 Tage lang zur Wiedergabe zur Verfügung.
https://www.streetinsider.com/Corporate+News/Trevena+%28TRVN…
TRVN Hot Sheet
Price: $0.69 +27.78%
Overall Analyst Rating:
BUY (Up Up)
EPS Growth %: +77.8%
Price: $0.69 +27.78%
Overall Analyst Rating:
BUY (Up Up)
EPS Growth %: +77.8%
Trevena 29% Vormarket auf dem Oliceradin-CRL-Auflösungspfad
28. Januar 2019 8:22 Uhr ET | Von: Mamta Mayani , SA News Editor
Trevena (NASDAQ: TRVN ) hat von der FDA ein offizielles Typ-A-Sitzungsprotokoll bezüglich des Complete Response Letter (CRL) erhalten, das es im November 2018 für Oliceridin erhalten hatte.
Die Agentur ist an Bord, dass die derzeitige Sicherheitsdatenbank die Kennzeichnung mit einer maximalen Tagesdosis von 27 mg unterstützen wird und dass sie bei gesunden Freiwilligen eine Studie durchführen kann, um die angeforderten QT-Intervalldaten zu sammeln. Es ist geplant, die Studie in H1 einzuleiten.
Um andere Punkte in der CRL zu behandeln, gab die FDA an, dass das Unternehmen nichtklinische Daten in Bezug auf die Charakterisierung des Metaboliten 9662 und die verbleibenden Produktvalidierungsberichte enthalten sollte, wenn es seinen Marketingantrag erneut einreicht.
Es sind keine zusätzlichen Daten zur Wirksamkeit erforderlich, um eine Rücklegung zu unterstützen.
Das Management sagt, dass sein aktuelles schnelles Guthaben von ~ 61,5 Mio. USD ausreichen sollte, um Vorgänge in Q2 2020 zu finanzieren.
Eine Telefonkonferenz beginnt um 8:30 Uhr ET.
Der Aktienanteil ist um 29% gestiegen.
https://seekingalpha.com/news/3426355-trevena-29-percent-pre…
28. Januar 2019 8:22 Uhr ET | Von: Mamta Mayani , SA News Editor
Trevena (NASDAQ: TRVN ) hat von der FDA ein offizielles Typ-A-Sitzungsprotokoll bezüglich des Complete Response Letter (CRL) erhalten, das es im November 2018 für Oliceridin erhalten hatte.
Die Agentur ist an Bord, dass die derzeitige Sicherheitsdatenbank die Kennzeichnung mit einer maximalen Tagesdosis von 27 mg unterstützen wird und dass sie bei gesunden Freiwilligen eine Studie durchführen kann, um die angeforderten QT-Intervalldaten zu sammeln. Es ist geplant, die Studie in H1 einzuleiten.
Um andere Punkte in der CRL zu behandeln, gab die FDA an, dass das Unternehmen nichtklinische Daten in Bezug auf die Charakterisierung des Metaboliten 9662 und die verbleibenden Produktvalidierungsberichte enthalten sollte, wenn es seinen Marketingantrag erneut einreicht.
Es sind keine zusätzlichen Daten zur Wirksamkeit erforderlich, um eine Rücklegung zu unterstützen.
Das Management sagt, dass sein aktuelles schnelles Guthaben von ~ 61,5 Mio. USD ausreichen sollte, um Vorgänge in Q2 2020 zu finanzieren.
Eine Telefonkonferenz beginnt um 8:30 Uhr ET.
Der Aktienanteil ist um 29% gestiegen.
https://seekingalpha.com/news/3426355-trevena-29-percent-pre…
Trevena, Inc. Echtzeit-Börsenkurse
$0.8989
*
0.3579
+66.16%
*Realtime - Zum 1/28/2019 12:55:24 PM
$0.8989
*
0.3579
+66.16%
*Realtime - Zum 1/28/2019 12:55:24 PM
Gestern nun also mit knapp +120% auf 1,19 $ in den Feierabend. Bin gespannt, wie es heute weitergeht. Vor dem letzten Mega-Anstieg im Vorfeld des Zulassungsantrags bewegte sich der Kurs im Bereich 1,30 - 1.70$. Dann kam der Run auf rund 3,40$. Im Grunde stehen wir von der Ausgangslage wieder am Anfang, als wir im Bereich 1,30 - 1,70 $ unterwegs waren. Die Aussichten scheinen aber wohl ein klein wenig besser, dass es jetzt klappen könnte. Also sollten zumindest die 1,30$ erst einmal drin sein. Was denkt ihr, von welchem Wert aus wir die nächste FDA Entscheidung betrachten?
Cyberhexe hier noch mit an Board? Seine Meinung würde mich brennend interessieren...
Hab damals nach FDA-Emtscheidung auch ein paar Anteile zu 1,29 gekauft in der Hoffnung, der CRL würde doch dazuführen, daß doch noch die Zulassung kommt...
Am 5.11. schrieb er, daß er mit Limit 0,49$ einsteigen würde. Müsste ja im Dezember gegriffen haben. Wenn dem so ist/war, Respekt 👍
Hab damals nach FDA-Emtscheidung auch ein paar Anteile zu 1,29 gekauft in der Hoffnung, der CRL würde doch dazuführen, daß doch noch die Zulassung kommt...
Am 5.11. schrieb er, daß er mit Limit 0,49$ einsteigen würde. Müsste ja im Dezember gegriffen haben. Wenn dem so ist/war, Respekt 👍
Ich bin seit November mit einer Miniposition dabei und freue mich seit gestern über das Kleinvieh ;-)
Antwort auf Beitrag Nr.: 59.140.587 von Cyberhexe am 05.11.18 16:05:25
Ist tatsächlich so eingetroffen wie "erhofft"!
Hab heute die Hälfte wieder verkauft - der Rest wird (risikolos) gehalten. Mal schauen was noch kommt.
Zitat von Cyberhexe: ...ich habe am Freitag noch 5000 Stück zu $1.19 verkauft - dieses Kapital werde ich wieder in TRVN investieren, und zwar weil ich glaube, dass Oliceridine imer noch gute Zulassungschancen hat. Ich habe allerdings das Limit für den Kauf von 0.59$ auf 0.49$ nach unten korrigiert.
Ist tatsächlich so eingetroffen wie "erhofft"!
Hab heute die Hälfte wieder verkauft - der Rest wird (risikolos) gehalten. Mal schauen was noch kommt.
Ok, also du könntest dir schon die Zulassung vorstellen (da du die Hälfte noch hälst)?!
Antwort auf Beitrag Nr.: 59.737.185 von Stoxtrayder am 29.01.19 16:15:01
...ich hatte immer mit einem CRL gerechnet - das knappe Abstimmungsergebnis beim AC verbunden mit der ambivalenten Entscheidung vieler Nein-Sager war dennoch ein Hoffnungsstreifen. Und zudem hat Oliceridine einige Vorteile gegenüber anderen Schmerzmittel, die schlussendlich doch noch in einer Zulassung enden sollten. Aus meiner Sicht ist die Zulassungschance > 50%.
mein Kommentar vom 31.10.18
4.) in Anbetracht der Datenlage und des Abstimmungsvervhalten der AC-Mitglieder ist die Wahrscheinlichkeit eines CRL (Complete Response Letter) gross (70%). In diesem Fall wird darauf zu achten sein, welche zusätzlichen Daten von der Behörde verlangt werden. Der schlechteste Fall wäre, wenn eine komplette zusätzliche ph3-Studie verlangt wird, welche einerseits lange dauert und andererseits mit den vorhandenen Ressourcen kaum zu finanzieren ist. Weniger dramatisch wäre das Einfordern einer nicht-klinischen Studie
Zitat von Stoxtrayder: Ok, also du könntest dir schon die Zulassung vorstellen (da du die Hälfte noch hälst)?!
...ich hatte immer mit einem CRL gerechnet - das knappe Abstimmungsergebnis beim AC verbunden mit der ambivalenten Entscheidung vieler Nein-Sager war dennoch ein Hoffnungsstreifen. Und zudem hat Oliceridine einige Vorteile gegenüber anderen Schmerzmittel, die schlussendlich doch noch in einer Zulassung enden sollten. Aus meiner Sicht ist die Zulassungschance > 50%.
mein Kommentar vom 31.10.18
4.) in Anbetracht der Datenlage und des Abstimmungsvervhalten der AC-Mitglieder ist die Wahrscheinlichkeit eines CRL (Complete Response Letter) gross (70%). In diesem Fall wird darauf zu achten sein, welche zusätzlichen Daten von der Behörde verlangt werden. Der schlechteste Fall wäre, wenn eine komplette zusätzliche ph3-Studie verlangt wird, welche einerseits lange dauert und andererseits mit den vorhandenen Ressourcen kaum zu finanzieren ist. Weniger dramatisch wäre das Einfordern einer nicht-klinischen Studie
Nicht immer....erst nach der gescheiterten Zulassung. Du hattest doch kurz vorher nochmal ordentlich investiert,im Glaube der Zulassung. Kompensierst jetzt das grosse Minus. Ich war drin,ging raus 2 Tage vor dem Entscheid mit +75%.Passt.
Zulassungschance grösser als bei 50%.....wie weise.
Hier wird sich groß und günstig eingedeckt.Bin gespannt
was kommt.
was kommt.
......also ich halte nur noch 5.000shares und kaufe ggf. noch nach , aber es wird noch dauern bis hin zum finale und bis dahin werden einige nicht-geduldige noch aussteigen, um zu günstigen kursen noch einsteigen zu können ....aber n m M.
Trevena, Inc. (TRVN) (das „Unternehmen“) gab heute bekannt, dass es mit zwei institutionellen Anlegern, die auf das Gesundheitswesen ausgerichtet sind, Wertpapierkaufvereinbarungen getroffen hat, wonach Trevena sich bereit erklärte, den Käufern insgesamt 10.000.000 Stammaktien zu verkaufen einen Ausgabepreis von 1,00 USD pro Aktie in einem registrierten Direktem Angebot für einen Bruttoerlös von 10,0 Mio. USD vor Abzug der Gebühren für die Platzierungsstelle und von Trevena zu zahlenden Angebotskosten. Das Angebot wird voraussichtlich am oder um den 1. Februar 2019 geschlossen, vorbehaltlich der üblichen Abschlussbedingungen.
H.C. Wainwright & Co. fungiert als exklusiver Platzierungsagent für das Angebot.
Trevena beabsichtigt, den Nettoerlös aus dem Angebot in erster Linie für die Entwicklung seines Hauptproduktkandidaten Oliceridin und für andere allgemeine Unternehmenszwecke zu verwenden.
Die oben beschriebenen Stammaktien werden von Trevena gemäß einer zuvor eingereichten und von der Securities and Exchange Commission ("SEC") am 29. Juni 2018 für wirksam erklärten Anmeldung zur Eintragung im Regal (Aktenzeichen 333-225685) angeboten. Das Angebot der Stammaktien wird nur mittels eines Prospektnachtrags vorgenommen, der Bestandteil der Registrierungserklärung ist. Ein abschließender Prospektnachtrag und ein begleitender Prospekt in Bezug auf das Angebot werden bei der SEC eingereicht. Sofern verfügbar, können elektronische Kopien der Endprospektergänzung und des begleitenden Prospekts zu diesem Angebot von H.C. Wainwright & Co., LLC, 430 Park Avenue, New York, NY 10022, per E-Mail an placements@hcwco.com oder telefonisch unter (646) 975-6996 oder über die Website der SEC unter www.sec.gov.
H.C. Wainwright & Co. fungiert als exklusiver Platzierungsagent für das Angebot.
Trevena beabsichtigt, den Nettoerlös aus dem Angebot in erster Linie für die Entwicklung seines Hauptproduktkandidaten Oliceridin und für andere allgemeine Unternehmenszwecke zu verwenden.
Die oben beschriebenen Stammaktien werden von Trevena gemäß einer zuvor eingereichten und von der Securities and Exchange Commission ("SEC") am 29. Juni 2018 für wirksam erklärten Anmeldung zur Eintragung im Regal (Aktenzeichen 333-225685) angeboten. Das Angebot der Stammaktien wird nur mittels eines Prospektnachtrags vorgenommen, der Bestandteil der Registrierungserklärung ist. Ein abschließender Prospektnachtrag und ein begleitender Prospekt in Bezug auf das Angebot werden bei der SEC eingereicht. Sofern verfügbar, können elektronische Kopien der Endprospektergänzung und des begleitenden Prospekts zu diesem Angebot von H.C. Wainwright & Co., LLC, 430 Park Avenue, New York, NY 10022, per E-Mail an placements@hcwco.com oder telefonisch unter (646) 975-6996 oder über die Website der SEC unter www.sec.gov.
Das erklärt auch den Kurseinbruch trotz des positiven Anstiegs. Allerdings gehen 10 Mio. Aktien. Da hätte ich schon mit höheren Summen gerechnet.
Und das die beiden großen Einsteigen finde ich persönlich eine deutliche Bereicherung und Sicherheit.
Und das die beiden großen Einsteigen finde ich persönlich eine deutliche Bereicherung und Sicherheit.
Hallo zusammen.
Ich bin gestern rein mit einer recht großen Position, und zwar long.
Was mir auffiel beim Studium des Vorstands:
Es scheint ziemlich viele Verbindungen Richtung Merck zu geben.
Was meint ihr dazu, ist ein Buyout denkbar noch vor FDA Zulassung?
Grüße
Ich bin gestern rein mit einer recht großen Position, und zwar long.
Was mir auffiel beim Studium des Vorstands:
Es scheint ziemlich viele Verbindungen Richtung Merck zu geben.
Was meint ihr dazu, ist ein Buyout denkbar noch vor FDA Zulassung?
Grüße
Antwort auf Beitrag Nr.: 59.744.964 von Geldverbrennung am 30.01.19 13:49:58Kommt vorbörslich nicht so gut an:
https://www.cnbc.com/quotes/?symbol=trvn&qsearchterm=trvn
Gruß aaahhh
https://www.cnbc.com/quotes/?symbol=trvn&qsearchterm=trvn
Gruß aaahhh
Antwort auf Beitrag Nr.: 58.894.065 von PESCADOS am 08.10.18 13:12:08
@jense...nun ja, teilweise hatte ich heftig Prügel einzustecken für die von mir geäusserten Bedenken! Vielleicht haben dich ja diese zur Umkehr veranlasst?
by the way...eine Zulassungschance > 50% ist doch schon was! Die Dezimalstellen hierzu überlasse ich jedoch anderen.
Zitat von PESCADOS: Cyberhexe verkriech dich in dein Hexenhaus und bashe hier nicht saublöd herum! Die Genehmigung ist zu 99,9 Prozent durch!
@jense...nun ja, teilweise hatte ich heftig Prügel einzustecken für die von mir geäusserten Bedenken! Vielleicht haben dich ja diese zur Umkehr veranlasst?

by the way...eine Zulassungschance > 50% ist doch schon was! Die Dezimalstellen hierzu überlasse ich jedoch anderen.
Wann kann man frühestens mit einer Zulassung rechnen?
Danke!
Danke!
Antwort auf Beitrag Nr.: 59.745.768 von Stoxtrayder am 30.01.19 15:17:43....meistens mehrere und damit viele monate , es kommt immer auf die launen!!!!! der FDA-leuten darauf an wie sie sich entscheiden und damit wegweisend sein könnten und das kann dauern. ich kenne das von anderen bio-tech-schmieden , gedult ist angesagt und man muss lange warten bis zu einer finalen entscheidung , wie auch immer , bin aber über 50% positiv gestimmt.!!! good luck.....
Antwort auf Beitrag Nr.: 59.754.831 von herthafan am 31.01.19 11:25:34
sorry wenn ich widerspreche, aber mit Launen der FDA-Leute hat ein Arzneimittel-Zulassungsprozess sehr wenig zu tun; solche Verschwörungstheorien sind so häufig wie lächerlich und werden meistens immer dann bemüht, wenn Zulassungsentscheide nicht im Sinne von Aktionären gefällt werden.
Zitat von herthafan: ....meistens mehrere und damit viele monate , es kommt immer auf die launen!!!!! der FDA-leuten darauf an wie sie sich entscheiden und damit wegweisend sein könnten und das kann dauern. ich kenne das von anderen bio-tech-schmieden , gedult ist angesagt und man muss lange warten bis zu einer finalen entscheidung , wie auch immer , bin aber über 50% positiv gestimmt.!!! good luck.....
sorry wenn ich widerspreche, aber mit Launen der FDA-Leute hat ein Arzneimittel-Zulassungsprozess sehr wenig zu tun; solche Verschwörungstheorien sind so häufig wie lächerlich und werden meistens immer dann bemüht, wenn Zulassungsentscheide nicht im Sinne von Aktionären gefällt werden.
Antwort auf Beitrag Nr.: 59.763.162 von Cyberhexe am 01.02.19 04:04:33.....werte hexe , da habe ich aber leider schon andere merkwürdige entscheidungen seitens der FDA mit erleben müssen trotzdem viel glück mit unserem investment bis hin zum nächsten date der beiden parteien....
Vorsicht vor Wachstumspotenzial für Trevena, Inc. (TRVN)
Der Schlusskurs von Trevena, Inc. (NASDAQ: TRVN), der am 31. Januar 2019 notiert wurde, betrug 1,07 USD. Der Rückgang von -4,46% wäre für einen Anleger möglicherweise verlockend gewesen, zu diesem Zeitpunkt zu verkaufen. Dies würde sich jedoch als kurzfristiger Fehler erweisen, da Sell-Side-Analysten der Meinung sind, dass den Aktionären noch ein Gewinn von fast 273,83% bevorsteht. Die Aktie verzeichnete seit Anfang 2019 einen allgemeinen Aufwärtstrend von 148,84%. Analysten schätzten 4 $ als höchstes Kursziel, um höhere Gewinne zu erzielen. Das durchschnittliche Kursziel für 12 Monate, das sie von der Aktie erwarten, beträgt 2,38 US-Dollar. Dieses mittlere Kursziel entspricht einem Plus von 122,43% gegenüber seinem vorherigen Schlusskurs. Das von ihnen präsentierte durchschnittliche Kursziel betrug 2,38 US-Dollar für die nächsten 12 Monate, was ein Plus von 122,43% gegenüber dem aktuellen Niveau bedeutet. Einige Analysten haben ein niedrigstes Kursziel für die Aktie von 0,75 USD, was einen Wertzuwachs von -29,91% bedeuten würde.Eine neue Zusammenfassung des heutigen Tages stellt fest, dass die TRVN-Aktie in den letzten 12 Monaten rund -38,51% ihres Wertes eingebüßt hat, was darauf hindeutet, dass mehr Anleger in diesem Zeitraum Besorgnis ausgedrückt haben. Wenn wir uns generell der Straße zuwenden, überwiegen die Positiven immer noch die Negativen, da Trevena, Inc. (TRVN) eine neutrale (2,5) Analystenkonsensbewertung hat. In der aktuellen Zeit hat die Aktie 2 Kauf- und 2 Haltewerte. Die Aktie verzeichnete am 3. Oktober ihr 52-Wochen-Hoch von 3,58 USD und am 24. Dezember ihr 52-Wochen-Tief von 0,38 USD. Derzeit notiert die Aktie 0,4 USD über ihrem gleitenden Durchschnitt des YTD von 0,67 USD.
Trevena, Inc. (NASDAQ: TRVN) wird derzeit bei 0X gehandelt, um zu entscheiden, ob sich das Warten (und das Geld) lohnt. Der Gewinn pro Aktie liegt nach 12 Monaten. Dies entspricht einem Abschlag gegenüber dem 33.71X des Sektors und liegt unter dem 69.63X seiner Branche. Die beliebteste Methode zur Bewertung einer Aktie besteht in der Untersuchung der historischen Kurs-Gewinn-Relation (P / E) anhand der berichteten Erträge der letzten 12 Monate. Die EPS-Nummer dieser Aktie in den letzten vier Quartalen des Gewinns lag bei -0,57 $. Das P / E-Verhältnis ist so beliebt, weil es einfach, effektiv und tautologisch ist, weil es von jedem verwendet wird.
Die 14-tägige absolute ATR (Average True Range) am Donnerstag, 31. Januar 2019, zeigt, dass sich der Preis im Durchschnitt um 0,12 $ bewegt. Die durchschnittliche tägliche Volatilität der letzten Woche beträgt 28,55%. Die geringe Volatilität ist gut für die Aktie und bedeutet, dass wir ruhige und zuversichtliche Anleger haben. Wenn Sie das aktuelle Volumen von Trevena, Inc. (TRVN) überprüfen, werden Sie feststellen, dass sich das Volumen auf 4,07 Millionen Aktien gegenüber einem durchschnittlichen Tagesvolumen von 3,2 Millionen Aktien geändert hat.
Wenn Sie sich das Tages-Diagramm für TRVN anschauen, werden Sie feststellen, dass die Aktie in diesem Zeitraum -26,71% verloren hat und 179,88% von ihrem jüngsten Tief entfernt ist. Die Performance der letzten fünf Tage für die Aktie bleibt mit 100,75% positiv, stieg jedoch um 65,87% gegenüber dem gleitenden Durchschnitt von drei Wochen. Im Vergleich zu SMA mit 50 Tagen ist der Aktienkurs von Trevena, Inc. jetzt um 78,07% gestiegen. Es schloss auch -20,32% höher als 200 Tage SMA. Dies wird oft als die letzte Verteidigungslinie angesehen, um langfristige Trends zu finden, die sonst als gebrochen gelten und / oder in einem Bärenmarkt auftreten. Der Tages-Chart der Aktie zeigt deutlicher den Preisverfall, als er am Donnerstag mit einer 1-Monats-Performance von 148,84% schloss.
https://rnsdaily.com/2019/02/01/beware-of-growth-potential-f…
Der Trevena-Direktor hat gerade 100.000 Aktien geholt
Leon O Moulder, ein Direktor von Trevena, hat kürzlich 100.000 Aktien des Unternehmens erworben. Die Käufe erfolgten am 1. Februar 2019 für 1,02 US-Dollar je Aktie. Moulder besitzt nun 150.000 Aktien des Unternehmens. Kehlmaschine arbeitet von Miromar Lakes, FL. Einige zusätzliche Informationen wurden wie folgt bereitgestellt:Der in Spalte 4 angegebene Preis ist ein gewichteter Durchschnittspreis. Diese Aktien wurden in mehreren Transaktionen zu Preisen zwischen 1,0196 und 1,02 USD gekauft. Der Meldepflichtige verpflichtet sich, der Emittentin, einem Wertpapierinhaber der Emittentin oder den Mitarbeitern der Securities and Exchange Commission auf Anfrage vollständige Informationen über die Anzahl der zu jedem einzelnen Preis erworbenen Anteile innerhalb der in dieser Fußnote festgelegten Bandbreite zur Verfügung zu stellen zu diesem Formular 4.
http://www.conferencecalltranscripts.org/4/summary/?id=57257…
Insider-Handelstätigkeit von Trevena
Geschichte des Insiderhandels für Trevena Inc. (NASDAQ: TRVN)Am 2/5/2014 kaufte der Großaktionär Laboratories Holdings L Forest 428.571 mit einem durchschnittlichen Aktienkurs von 7,00 USD je Aktie und einer Gesamttransaktion von 2.999.999 USD.
Am 29.09.2014 verkaufte Rosamond Deegan, SVP, 44 Aktien mit einem durchschnittlichen Aktienkurs von 7,00 USD je Aktie und einer Gesamttransaktion von 308,00 USD.
Am 09.12.2014 kaufte Leon O Moulder Jr, Director, 30.200 Aktien mit einem durchschnittlichen Aktienkurs von 3,96 USD je Aktie und einer Gesamttransaktion von 119.592,00 USD.
Am 12.10.2014 kaufte Roberto Cuca, CFO, 25.000 Aktien mit einem durchschnittlichen Aktienkurs von 4,00 USD je Aktie und einer Gesamttransaktion von 100.000 USD.
Am 10.12.2014 kaufte Michael W Lark, VP, 5.000 Aktien mit einem durchschnittlichen Aktienkurs von 4,00 USD je Aktie und einer Gesamttransaktion von 20.000 USD.
Am 10.12.2014 kaufte Michael R Dougherty, Director, 7.000 Aktien mit einem durchschnittlichen Aktienkurs von 4,00 USD pro Aktie und einer Gesamttransaktion von 28.000 USD.
Am 10.12.2014 kaufte Maxine Gowen, CEO, 8.000 Aktien mit einem durchschnittlichen Aktienkurs von 4,00 USD je Aktie und einer Gesamttransaktion in Höhe von 32.000 USD.
Analysten-Bewertungsverlauf für Trevena Inc. (NASDAQ: TRVN)
Am 11.03.2017 FBR & Co Set-Preisziel der Bewertung Kaufen Sie mit einem Kursziel von 8,00 $
Am 17.04.2017 hat Aegis zum wiederholten Male Kaufen Sie mit einem Kursziel von 14,00 $ gekauft
Am 5/6/2017 Roth Capital Set Price Bewertungsziel Kaufen Sie mit einem Kursziel von 9,00 $
Am 16.10.2017 stufte Barclays die Rating-Kategorie Übergewicht auf Gleichgewicht mit einem Kursziel von 15,00 USD bis 2,50 USD herab
Am 03.05.2014 Oppenheimer Set Price Bewertungsziel Kaufen Sie mit einem Kursziel von 5,00 $
Am 07.05.2014 Cowen wiederholte Rating Kaufen Sie mit einem Kursziel von 10,00 $
Am 10.10.2014 hat die Jefferies Financial Group das Rating Buy to Hold mit einem Kursziel von 10,00 bis 1,00 USD herabgestuft
Letzte Handelsaktivität für Trevena Inc. (NASDAQ: TRVN)
Die Aktien von Trevena Inc. beendeten die vorangegangene Handelssitzung bei 1,08, +0,070 (6,93%), wobei 1,03 Aktien gehandelt wurden.
https://marketexclusive.com/trevena-inc-nasdaqtrvn-insider-t…
Macht heute weiter Boden gut... 👍
Carrie L Bourdow, nächster Insider Deal 50.000 zu 1.02$ http://investors.trevena.com/static-files/25f3e5cf-c2d9-4f5f…
Trevena präsentiert sich auf der 21. BIO CEO & Investor Conference
http://globenewswire.com/news-release/2019/02/05/1711104/0/e…
Antwort auf Beitrag Nr.: 59.800.998 von onkelen am 06.02.19 05:10:32
Trevena präsentiert sich auf der 21. BIO CEO & Investor Conference
Date: Tuesday, February 12, 2019
Time: 9:15 a.m. EST
Location: Hudson/Empire meeting rooms, New York Marriott Marquis, New York, NY
Trevena präsentiert sich auf der 21. BIO CEO & Investor Conference
Zitat von onkelen: http://globenewswire.com/news-release/2019/02/05/1711104/0/e…
Date: Tuesday, February 12, 2019
Time: 9:15 a.m. EST
Location: Hudson/Empire meeting rooms, New York Marriott Marquis, New York, NY
10 Mio Aktien gestern gehandelt; + 20%. Wer weiß, was hier los ist ?
Ich denke die Insider-Deals der letzten Zeit geben Vertrauen....
Vorbörslich schon wieder bei 1,60$.
In US-Foren spekulieren viele auf einen Buy-Out...
Vorbörslich schon wieder bei 1,60$.
In US-Foren spekulieren viele auf einen Buy-Out...
Wahnsinn, wie sich der Markt hier kaum bewegt und eigentlich nur bis 15:30 Uhr wartet
Am 11. Februar 2019 erhielt Trevena, Inc. (das „Unternehmen“) eine Mitteilung von der Abteilung Listing Qualifications (das „Personal“) des Nasdaq Stock Market, in der bestätigt wurde, dass der Schlusskurs des Unternehmens für die letzten 10 aufeinander folgenden Geschäftstage lag Die Stammaktien entsprechen mindestens dem Mindestpreis von 1,00 USD pro Aktie für die fortgesetzte Notierung, wie in der Nasdaq-Auflistungsregel 5450 (a) (1) dargelegt. Dementsprechend hat der Stab festgestellt, dass die Gesellschaft die Einhaltung der Nasdaq-Auflistungsregel 5450 (a) (1) wiedererlangt hat, und hat der Gesellschaft mitgeteilt, dass diese Angelegenheit nun abgeschlossen ist
https://www.sec.gov/Archives/edgar/data/1429560/000110465919…
https://www.sec.gov/Archives/edgar/data/1429560/000110465919…
Am 11. Februar 2019 erhielt Trevena, Inc. (das „Unternehmen“) eine Mitteilung von der Abteilung Listing Qualifications (das „Personal“) des Nasdaq Stock Market, in der bestätigt wurde, dass der Schlusskurs des Unternehmens für die letzten 10 aufeinander folgenden Geschäftstage lag Die Stammaktien entsprechen mindestens dem Mindestpreis von 1,00 USD pro Aktie für die fortgesetzte Notierung, wie in der Nasdaq-Auflistungsregel 5450 (a) (1) dargelegt. Dementsprechend hat der Stab festgestellt, dass die Gesellschaft die Einhaltung der Nasdaq-Auflistungsregel 5450 (a) (1) wiedererlangt hat, und hat der Gesellschaft mitgeteilt, dass diese Angelegenheit nun abgeschlossen ist
https://www.sec.gov/Archives/edgar/data/1429560/000110465919…
https://www.sec.gov/Archives/edgar/data/1429560/000110465919…
Hab ich was verpasst? 😱
Vorbörslich schon knappe 10% im Plus.
Mir soll‘s recht sein... 👌
Vorbörslich schon knappe 10% im Plus.
Mir soll‘s recht sein... 👌
2019 sollte für TRVN ein gutes Jahr sein, aber wie geht es weiter?
6. Februar 2019 von Zion Miller Einführung
Trevena Inc. (Nasdaq: TRVN ) stieg am 28. Januar um 119% von 0,5 USD auf 1,19 USD. Der Katalysator sind positive aufsichtsrechtliche Aktualisierungen aus dem FDA- Meeting vom Typ A-Meeting .
Kurz gesagt war die FDA der Meinung, dass die Sicherheitsdatenbank von TRVN eine maximale Markierungsdosis von 27 mg ausreichend unterstützte . Darüber hinaus sind keine Wirksamkeitsstudien mehr erforderlich. Das TRVN kann seine NDA (New Drug Application) erneut absenden, nachdem eine Studie zur Erfassung von QT-Intervalldaten ( dh wie sich die Medikamente auf den Herzrhythmus auswirken ) geplant sind, die für die erste Hälfte des Jahres 2019 geplant ist.
Zwei wichtige Punkte sind: 1) Die QT-Intervallstudie dauert nur 24 Stunden und 2) Sie kann an gesunden Freiwilligen durchgeführt werden. Die Konsequenz ist, dass TRVN möglicherweise noch in diesem Jahr seine NDA erneut einreichen und bereits Ende 2019 oder Anfang 2020 eine andere PDUFA erhalten könnte. Die FDA forderte auch, dass nicht-klinische Daten zu Oliceridins 9662-Metaboliten- und Produktvalidierungsberichten bei der NDA eingereicht wurden. Die 9662-Metabolitendaten können in einer einzigen nichtklinischen Spezies erzeugt werden, die den Prozess beschleunigt. Die pharmakokinetische Arbeit ist bereits im Gange.
Screenshot 2019-02-04 um 3.18.07 PM.png
Quelle: StockTwits
Die Typ-A-Sitzung folgte einem vollständigen Antwortschreiben (CRL), das von der FDA als Antwort auf eine NDA eingereicht wurde, die im Jahr 2018 für Oliceridin eingereicht wurde. Die jüngsten Nachrichten gaben den Anlegern Anlass, da TRVN ihre NDA viel früher als erwartet erneut einreichen kann. Darüber hinaus können sich Anleger darauf verlassen, dass TRVN im zweiten Quartal 2020 ausreichende Finanzmittel vorsieht.
Die 52-wöchige Preisaktion für TRVN zeigt ein Hoch von 3,58 USD und ein Tief von 0,38 USD. Es scheint, dass viele Bullen in der Nähe des oberen Endes vor der CRL vom November 2018 gefangen sind. Dies war zweifellos ein Faktor dafür, dass sich die Aktie nicht nachbildete, wie man es nach einem Lauf von 119% erwartet hätte. Am 30.01.19 verkündete das Unternehmen ein direktes Angebot von 10 Millionen Stammaktien , wodurch das Risiko einer solchen Aktion auch in diesem Jahr reduziert wird.
Über TRVN
Überarbeitete Anlegerpräsentation des TRVN
TRVN ist ein Biotech-Unternehmen im klinischen Stadium mit Hauptsitz in Chesterbrook, Pennsylvania. Sie konzentrieren sich hauptsächlich auf die Entdeckung und Entwicklung von G-Protein-gekoppelten Inhibitoren . Das Leitmolekül der Firma Oliceridin ist ein G-Protein-abhängiger Mu-Opioid-Rezeptor, der zur Behandlung mäßiger bis starker Schmerzen in kontrollierten Umgebungen wie Krankenhäusern entwickelt wird. Wenn die Zulassung vorliegt, hat das Unternehmen erklärt, dass es sich bei Oliceridin um ein Schedule 2-Medikament handelt . Drogen in dieser Klasse haben ein hohes Missbrauchspotential und können zu schweren psychischen Schäden oder körperlicher Abhängigkeit führen . Ein regulatorischer Vorteil wurde jedoch im Februar 2016 erzielt, als TRVN den Durchbruchsstatus (BTD) erhielt. Und die kommerzielle Betonung des beabsichtigten Einsatzes in einer stationären Umgebung verringert das Missbrauchsrisiko.
Sie können sich an unseren vorherigen Artikel über TRVN erinnern. In diesem Zusammenhang argumentierten wir, dass das Unternehmen in Erwartung des PDUFA-Datums nach oben tendieren würde. Unser Umzug bestand darin, die Aktie zu schwingen und vor der Entscheidung auszusteigen. Leider haben einige Anleger nicht denselben Ansatz gewählt. In diesem Artikel werden die Auswirkungen des Typ-A-Meetings für TRVN im Jahr 2019, Langzeitaussichten und die Fitness von TRVN in einer wettbewerbsorientierten Landschaft erörtert.
Kurzfristige Analyse von TRVN
Nach dem FDA-Treffen mit Typ A beschleunigten Insider-Käufe den Kurs noch weiter und erreichten am 5. Februar einen Höchststand von 1,40 USD. Der jüngste Kauf von Insidern erfolgte am 02/01/2019 durch den Präsidenten und den CEO. Dabei wurden 50.000 Aktien zu 1,02 USD aufgestockt . Mitregisseur Maxine Gowen kaufte ebenfalls 50.000 Aktien zu 1,02, während TRVN-Vorstandsvorsitzender Leon Moulder 100.000 Aktien zum gleichen Preis kaufte .
In einem technischen Hinweis sollten Anleger auf potenziell voraussagende Indikatoren wie den derzeit bei 74.27 ansässigen RSI achten . Ein RSI von 80 oder mehr wird allgemein als überkauftes Gebiet akzeptiert. Trotzdem sollte sich die Kursentwicklung des Aktienkurses für den Rest des Jahres nach oben entwickeln, sofern keine weiteren Zulassungshindernisse mehr auftreten.
TRVN sollte in Kürze ein Testdesign fertiggestellt haben und in den Händen der FDA stehen. Sobald sie grünes Licht erhalten, können sie mit einer relativ kurzen Studie (24 Stunden) QT-Intervalldaten von gesunden Freiwilligen erfassen. Die FDA stimmte der stündlichen Erhebung von Datenpunkten zu. Das Ergebnis sollte positiv und ohne negative klinische Abweichungen im Vergleich zum Placebo-Arm sein. Dieser Begriff wird durch Daten aus QT-Intervalldaten in Phase-3-Versuchen untermauert, wie sie während der Telefonkonferenz am 28. Januar festgehalten wurden. Von dort aus kann TRVN die angeforderten Daten und Informationen zusammenstellen und deren NDA erneut einreichen. In Anbetracht dessen, dass die von der FDA zur Unterstützung einer NDA verlangte FDA eine hohe Wahrscheinlichkeit der Zulassung für Oliceridin nahe legt, vorausgesetzt, die Daten des QT-Intervalls sind zufriedenstellend.
Die Anleger waren vor dem CRL für November ( gestützt auf geringes Verkaufsvolumen zu aktuellen Preisen ) in ihren Positionen gefangen und hatten Spekulationen über bevorstehende wichtige Ereignisse, Insider-Käufe und den Abschluss der jüngsten Emissionspunkte für einen Bullenlauf von 2019. Vor diesem Hintergrund ist es für Investoren wichtig, sich mit Unternehmen wie VSTM zu beschäftigen, die vor allem bis zu ihrem PDUFA-Datum profitierten. Nach der Zulassung für ihre Hauptdroge Copiktra brach die Aktie ein, obwohl sie von Insiderkäufen unterstützt wurde. Auffallend ist, dass TRVN einen ausgeprägten Wettbewerb bei der Behandlung von moderaten bis akuten Schmerzen hat.
Langfristiger Ausblick
Wenn Oliceridin bis 2020 zugelassen ist, muss TRVN für eine kommerzielle Markteinführung irgendwie Kapital beschaffen. Dies setzt voraus, dass sie mit ihrem Konkurrenten AcelRx Pharmaceuticals nachziehen und dies alleine tun. Die Finanzierung kann in Form eines öffentlichen Angebots, einer Fremdfinanzierung, der Ausgabe von Optionsscheinen oder Wandelanleihen oder einer Partnerschaft erfolgen. Letzteres ist sicherlich eine gute Möglichkeit angesichts der Nachfrage des Marktes nach verbesserten IV-Opioid-Optionen, die das Interesse großer Pharmakonzerne wecken würden. Neben Oliceridin besitzt TRVN in den früheren Entwicklungsphasen einige faszinierende Moleküle, die auch die Bedürfnisse der unterversorgten Schmerzbehandlung erfüllen.
In den USA werden jedes Jahr 610 Millionen Kopfschmerzen behandelt . Im Jahr 2014 waren dies 440 Millionen Menschen mit akuten episodischen Migräne und 170 Millionen Menschen mit chronischen Migräne . Laut TRVN reagierten 20% bis 30% dieser Menschen entweder nicht oder vertrugen die branchenübliche Triptan-Klasse für Schmerzmedikamente nicht . TRV250 ist ein kleines Molekül in Phase 1 der Entwicklung als verbesserte Behandlungsoption. Es aktiviert Delta-Rezeptoren, die sich als wirksame Angriffspunkte für die Behandlung von Migräne erwiesen haben und im Vergleich zu anderen Opioiden wie Oxycodon und Morphin ein viel geringeres Suchtrisiko aufweisen. Darüber hinaus legen präklinische Daten nahe, dass das Medikament auch zur Behandlung der Parkinson-Krankheit von Nutzen sein kann .
Akute und chronische Schmerztherapie ist seit langem ein medizinischer Bedarf. Die Dichotomie besteht darin, dass schwache Analgetika (z. B. Schmerzmittel) die Bedürfnisse der Patienten nicht ausreichend erfüllen, dass stärkere Analgetika jedoch ein höheres Risiko für Missbrauch, Abhängigkeit, Atemdepression und generell ungünstige Sicherheitsprofile haben. TRV734 ist eine weitere in der Entwicklung befindliche Phase-1-Verbindung als sicherere, aber gleichermaßen wirksame Alternative zu klassischen Opioiden. Im Gegensatz zu den meisten Opioiden zielt TRV734 auf den μ-Opioid-Rezeptor mit minimaler Rekrutierung von β-Arrestin-Proteinen, die mit Atemdepression, Verstopfung und analgetischer Toleranz einhergehen .
Marktlandschaft
Laut einem Research-Bericht von MarketWatch wird der Markt für Schmerzbehandlungstherapeutika bis 2024 84 Milliarden US-Dollar erreichen, mit einem CAGR von über 3,5% . Das Oliceridin von TRVN ist angesichts seiner hohen Spezifität und nachgewiesenen Wirksamkeit sicherlich ein Wettbewerber, um einen Teil davon zu gewinnen. BTD für Oliceridin wurde aufgrund vorläufiger klinischer Daten gewährt, die im Vergleich zu den verfügbaren Therapien eine überlegene klinische Verbesserung des Schmerzmanagements zeigten . Es wäre jedoch nachlässig, andere Pharmaunternehmen, die dieselbe Indikation verfolgen, sowie den politischen und sozialen Fokus auf die wachsende Opioid-Epidemie in den Vereinigten Staaten zu ignorieren.
Im November 2018 erhielt AcelRx Pharmaceuticals (Nasdaq: ACRX ) die Zulassung der FDA für sein Opioid-Medikament DSUVIA zur Behandlung von mittelschweren bis starken Schmerzen . Im Juni 2018 wurde sein Gegenstück DZUVEO in der Europäischen Union genehmigt . Der Wirkstoff in der Medikation ist ein starkes Opioid namens Sufentanil und kann intravenös (IV) oder oral verabreicht werden. Ein Vorteil von Sufentanil ist, dass es keine aktiven Metaboliten gibt. Daher ist ACRX im Vermarktungsprozess führend und hat keine Bedenken in Bezug auf Metaboliten wie 9662. Letztendlich kann sich letzteres jedoch als unbedeutend erweisen und letztendlich die bevorzugte Behandlung durchsetzen.
Einhundertdreißig Menschen sterben jeden Tag an Opioid-Überdosierungen . Ein Beitrag zu dieser Statistik sind synthetische Opioide, die missbraucht werden. Im Jahr 2017 waren 1,7 Millionen Menschen von Drogenmissbrauchsstörungen im Zusammenhang mit verschreibungspflichtigen Opioidmedikamenten betroffen . Ein Vorteil für Oliceridin ist, dass es nur für den stationären Gebrauch bestimmt ist (Ablenkung ist immer ein Risiko). Die Zielanwendung sind Umstände, unter denen die intravenöse Anwendung der oralen Anwendung (dh nach einer Operation oder wenn die Patienten nicht schlucken können) bevorzugt wird. In dieser Abteilung scheint es, als hätte TRVN ACRX geschlagen, da IV Sufentanil eine relativ kurze Wirkdauer hat . Daher die Entwicklung von oral verabreichtem DSUVIA.
Finanzanalyse
Wie bereits erwähnt, hat TRVN hinsichtlich des finanziellen Ausblicks ein gesteigertes Vertrauen gezeigt. Das dritte Quartal 2018 bot den Anlegern verbesserte Einblicke in ihre finanzielle Position. Bei einer kürzlich durchgeführten Telefonkonferenz wurde das Unternehmen mit folgenden Angaben zitiert: "Sie erwartet, dass Barmittel, Zahlungsmitteläquivalente und marktfähige Wertpapiere zum 31. Dezember 2018 bei rund 61,5 Millionen USD liegen werden." Ausreichend, um das zweite Quartal 2020 zu finanzieren. Es wurde zu diesem Zeitpunkt auch bekannt gegeben, dass das Unternehmen die Anleger im vierten Quartal und im Gesamtjahr bis zum 31. Dezember 2018 im März aktualisieren wird.
Ein Rückblick auf das jüngste 10-Jahresquartal von TRVN zeigt, dass ein Schlag um 0,08 US-Dollar zu einem Gewinn von -0,06 US-Dollar führt (Einnahmen von 3 Mio. US-Dollar übertreffen die Schätzungen um 1 Mio. US-Dollar). Wie Sie sehen, hat TRVN eine Erhöhung des Gesamtvermögens realisiert. Dies ist im Wesentlichen auf einen Anstieg der Zahlungsmittel und Zahlungsmitteläquivalente zurückzuführen. Darüber hinaus verzeichnete TRVN einen Rückgang sowohl der kurzfristigen als auch der gesamten Verbindlichkeiten. Dies ist im Wesentlichen auf den Rückgang der Darlehensverbindlichkeiten zurückzuführen. Die Ergebnisse dieser Faktoren führen zu einer Erhöhung des Eigenkapitals der Aktionäre. Aus der Bilanz heraus wird ein Rückgang des Betriebsverlusts beobachtet (-15.413 GJ17 und -4.258 GJ18). Zusammen mit anderen Faktoren führte dies zu einem Nettoverlust, der den Anteilseignern zuzurechnen war (4.483). Dies ist eine beträchtliche Veränderung gegenüber dem Geschäftsjahr von 17 (Vorjahr: 15.999). Der gewichtete Durchschnitt ausstehender Stammaktien, unverwässert und verwässert, erhöhte sich von 60.113.327 im Jahr 2017 auf 77.445.675 im Jahr 2018.
TRVN hatte eine Handvoll bullischer Anmerkungen, die sich im 10. Quartal widerspiegelten. Dies wird sich jedoch letztlich auf den Aktienkurs unwesentlich auswirken. Die Auswirkungen auf den Aktienkurs werden von den oben diskutierten wesentlichen Ereignissen bestimmt. Die Finanzzahlen von TRVN scheinen vorerst solide zu sein, da ein Angebot unwahrscheinlich erscheint, nachdem dies kürzlich geschehen war. Bedenken, die entstehen, sind mit den inhärenten Kosten der Vermarktung von Oliceridin verbunden. Wird TRVN bei einer Zulassung die finanzielle Kapazität haben, Oliceridin ordnungsgemäß zu vermarkten und zu positionieren, um im Wettbewerb zu Marktanteilen erfolgreich zu sein?
Risikoabschätzung
Das relevanteste Risiko, jetzt zu wissen, ist das Ergebnis der QT-Intervallstudie. Wenn der Oliceridin-Behandlungsarm keine klinisch signifikanten Unterschiede im Vergleich zum Placebo-Arm aufweist, kann TRVN nicht mit einer NDA-Anmeldung fortfahren. Eine Folge dieses Ergebnisses kann eine Neubewertung der maximal angegebenen Tagesdosis sein. Dies würde wahrscheinlich eine weitere klinische Studie beinhalten, die darauf abzielt, die Dosis zu bestimmen. 9662 Metabolitendaten müssen ebenfalls zur Zufriedenheit der FDA sein. Wenn einer dieser Datensätze ins Stocken gerät, wäre die Aussicht auf eine erneute Vorlage von NDA im Jahr 2019 düster. Folglich würden die Barreserven wahrscheinlich nicht ausreichen, um TRVN zu überstehen, bis ihre NDA erneut eingereicht werden könnte. Vielleicht nicht einmal bis zum zweiten Quartal 2020
Ein anderes Szenario könnte sein, dass die zur Unterstützung der NDA bereitgestellten Daten aufgrund unvorhergesehener Faktoren immer noch zu einer CRL führen würden. Dies würde wahrscheinlich auch mehr klinische Studien und mehr Geld zur Finanzierung von Operationen bedeuten.
Fazit
Die MS ist im Hinblick auf die Preisentwicklung von TRVN im Jahr 2019 optimistisch. Die Einleitung und der Abschluss der QT-Intervallstudie sollten eine positive Reaktion des Marktes hervorrufen. Wenn dies zeitnah geschieht und eine NDA in der zweiten Jahreshälfte 2019 erneut eingereicht wird, könnte dies noch weitere positive Auswirkungen haben. Unter idealen Umständen würde Oliceridin bis Anfang 2020, möglicherweise sogar Ende 2019, zur Vermarktung zugelassen. Wenn diese Abfolge von Ereignissen ablaufen würde, würde eine konservative Bewertung zwischen 4 und 6 USD je Aktie liegen. Wie wir wissen, verlaufen die Dinge in der Gesundheitsbranche jedoch nicht immer wie geplant, und die oben diskutierten inhärenten Risiken sollten in Betracht gezogen werden.
Im Falle einer Genehmigung in dem von uns festgelegten Zeitrahmen wird mit einem Ausverkauf oder Rückzug gerechnet, der der Reaktion der Märkte auf die Zustimmung von DSUVIA durch ACRX entspricht. Sobald das Produkt genehmigt ist, muss es sich durch Umsatz und wiederkehrendes Umsatzwachstum bewähren. TRVN wird auch Kapital benötigen, um Oliceridin zu starten und die laufenden Entwicklungsaktivitäten für TRV250 und TRV734 fortzusetzen. .
Abgesehen von Oliceridin verfügen TRV250 und TRV734 über ein hohes Potenzial, um in den Markt für akute und chronische Schmerzbehandlung einzudringen. Basierend auf vorläufigen klinischen Daten zeigen beide günstige pharmakokinetische Eigenschaften und Sicherheitsprofile im Vergleich zu Standardbehandlungsoptionen, ohne die Wirksamkeit zu beeinträchtigen. In Anbetracht dessen ist bei einer Zulassung von Oliceridin die Aussicht auf eine Partnerschaft oder ein Buyout eine echte Möglichkeit. Unter den gegenwärtigen Bedingungen bewerten wir TRVN als spekulativen Kauf mit einem 12-Monats-Kursziel von 5 USD.
MS Money Money wurde für das Schreiben dieses Artikels nicht entschädigt und hat keine Verbindung zu einem der genannten Unternehmen.
Haftungsausschluss
MS Money Moves und der Chief Operating Officer, ein Wissenschaftler und Einzelinvestor, sowie seine verbundenen Unternehmen sind keine eingetragenen Finanzberater. Unsere Beiträge sollten als Informationsmaterial dienen, um Sie bei der Durchführung von Due Diligence-Untersuchungen zu unterstützen. Posts und Artikel sind keine Richtlinien oder Empfehlungen, um in Sicherheiten zu investieren. Wir behalten uns das Recht vor, Sicherheiten ohne Benachrichtigung zu kaufen oder zu verkaufen, sofern dies nicht gesetzlich vorgeschrieben ist. Wir sind nicht für das Handeln unserer Partner verantwortlich. Anlagethemen können sich aufgrund der unterschiedlichen Natur des Wertpapiermarktes ändern. Aus diesem Grund besteht ein großes Risiko bei der Anlage in Aktien und Optionen, was zu Kapitalverlusten führen kann. Darüber hinaus ist die Performance in der Vergangenheit durch MS Money Moves oder eine andere Sicherheit kein Indikator für die zukünftige Performance. Jeder sollte seine eigene Forschung und Due Diligence durchführen, bevor er eine Investitionsentscheidung trifft. Wir empfehlen Ihnen, sich bezüglich Investitionsmaßnahmen an einen Finanzberater zu wenden.
Der Biotech-Sektor ist besonders volatil. Die Aktienkurse können aufgrund materieller oder immaterieller Entwicklungen erheblich schwanken. Wir empfehlen allen, sich mit den klinischen Prüfprozessen, der einschlägigen Terminologie, den FDA / SEC-Vorschriften und -Verordnungen und den allgemeinen Prozessen der Entwicklung / Zulassung von Arzneimitteln und Therapien vertraut zu machen. Führen Sie vor einer Investition immer eine unabhängige Sicherheitsprüfung durch.
Druckversion, PDF & E-Mail
https://msmoneymoves.com/2019/02/06/trvn-whats-happened-late…
Habe gerade nochmal nachgekauft. Für mich hellt sich das Bild auf und ich denke die Entwicklung wird sich noch beschleunigen auf die Zulassung hin.
...lt. ausführlichem bericht des users onkelen dauert ja die weitere forschung bis hin zur NDA doch noch einige zeit und läuft in etwa fifty/fifty hinaus . hoffentlich geht es dieses mal positiver aus , ich möchte garantiert kein erneutes debakel erleben wie in 2018 . vielleicht haben wir schon ende 19 bzw. 2020 alles in trockenen tüchern wie man an der börse zu pflegen sagt......good luck.....
Antwort auf Beitrag Nr.: 59.912.840 von herthafan am 19.02.19 19:13:15Bei $1,75 (05.02.2019) gab es wieder eine ausgezeichnete Verkaufschance.
TRVN könnte nochmals unter 1$ fallen weil noch viel Zeit vergeht.
Trevena ist beliebt unter den Zockern darum auch diese heftigen Ausschläge.
TRVN könnte nochmals unter 1$ fallen weil noch viel Zeit vergeht.
Trevena ist beliebt unter den Zockern darum auch diese heftigen Ausschläge.
Antwort auf Beitrag Nr.: 59.988.739 von fypet am 28.02.19 18:25:10....und genauso ist es auch wohl , wollte es nicht nur so schreiben wg. anfeindungen , bashversuchen usw. dauert wohl noch etwas länger und die gedult besitzen die meisten unter uns nun einmal nicht so wie gewünscht an de börse . habe nochmals eine order bei ,-90 eurocent eingestellt . man wird sehen , trotzdem allen weiterhin viel glück...!!!!
Abgang von Direktoren oder bestimmten Offizieren; Wahl der Direktoren; Ernennung bestimmter Offiziere; Ausgleichsvereinbarungen für bestimmte Amtsträger.
Am 27. Februar 2019 genehmigte der Verwaltungsrat (i) einen Bar-Incentive-Preis für das Geschäftsjahr 2018 im Rahmen des Incentive-Compensation-Plans („ICP“) von Trevena, Inc., der an Carrie L. Bourdow, den Präsidenten und Chief Executive Officer, gerichtet wird (der „CEO“) des Unternehmens und (ii) die ICP-Cash-Incentive-Awards für das Geschäftsjahr 2018 ratifiziert, die vom Compensation Committee des Verwaltungsrats für die Senior-Vizepräsidenten des Unternehmens genehmigt wurden. Die einzelnen ICP-Auszeichnungen, die im Jahr 2018 erworben wurden, werden Mitte März 2019 wie folgt ausgezahlt: Carrie L. Bourdow, $ 146.719; Mark A. Demitrack, MD, 103.950 US-Dollar; John P. Hamill, 22.171 $; John M. Limongelli, 99.712 US-Dollar; und Robert Yoder $ 65.100.
https://translate.google.com/translate?sl=en&tl=de&u=https%3…
Am 27. Februar 2019 genehmigte der Verwaltungsrat (i) einen Bar-Incentive-Preis für das Geschäftsjahr 2018 im Rahmen des Incentive-Compensation-Plans („ICP“) von Trevena, Inc., der an Carrie L. Bourdow, den Präsidenten und Chief Executive Officer, gerichtet wird (der „CEO“) des Unternehmens und (ii) die ICP-Cash-Incentive-Awards für das Geschäftsjahr 2018 ratifiziert, die vom Compensation Committee des Verwaltungsrats für die Senior-Vizepräsidenten des Unternehmens genehmigt wurden. Die einzelnen ICP-Auszeichnungen, die im Jahr 2018 erworben wurden, werden Mitte März 2019 wie folgt ausgezahlt: Carrie L. Bourdow, $ 146.719; Mark A. Demitrack, MD, 103.950 US-Dollar; John P. Hamill, 22.171 $; John M. Limongelli, 99.712 US-Dollar; und Robert Yoder $ 65.100.
https://translate.google.com/translate?sl=en&tl=de&u=https%3…
Gab es hier ein RS?
Was ist denn jetzt los? After market schmiert die Aktie von 1,50$ auf unter 1,20 ab?
Antwort auf Beitrag Nr.: 60.046.976 von boersenkeks am 07.03.19 22:16:50FDA hat wohl mitgeteilt, dass sie den Breakthrough Therapy Status für Oliceridine auf der aktuellen Datenlage nicht mehr für gerechtfertigt hält. Denke daher kommt der Kurssturz.
Aber mit diesen Sprüngen muss man bei den kleinen Biotechs immer in beide Richtungen rechnen. Es bleibt eine Wette auf ein großes Ereignis und wenn das positiv ist, sind die Hopser vorher irrelevant.
Aber mit diesen Sprüngen muss man bei den kleinen Biotechs immer in beide Richtungen rechnen. Es bleibt eine Wette auf ein großes Ereignis und wenn das positiv ist, sind die Hopser vorher irrelevant.
Aufgrund der vorläufigen Beweise aus klinischen Phase-2-Studien von Trevena (dem „Unternehmen“) zu Oliceridin erteilte die US-amerikanische Food and Drug Administration („FDA“) im Februar 2016 die Bezeichnung „Durchbruchstherapie“ an Oliceridin für die Behandlung mittelschwerer bis schwerer akuter Schmerzen . Die FDA hat die Bezeichnung "Durchbruchstherapie" für neue Therapien vergeben, die zur Behandlung schwerer oder lebensbedrohlicher Zustände gedacht sind und für die klinische Beweise vorliegen, dass das Medikament möglicherweise eine deutliche Verbesserung der verfügbaren Therapien gegenüber den verfügbaren Therapien aufweist. Falls gewährt, überprüft die FDA regelmäßig die Bezeichnung Durchbruchstherapie für einen Produktkandidaten, um sicherzustellen, dass weitere klinische Nachweise diese Bezeichnung weiterhin unterstützen. Im März 2019 teilte die FDA Trevena auf der Grundlage der Überprüfung der Daten aus den Phase-3-Studien des Unternehmens zu Oliceridin mit, dass diese Daten unter den untersuchten Bedingungen nicht ausreichten, um die Fortführung der zuvor von der FDA erteilten Durchbruchstherapiebestimmung zu untermauern.
Wie Ende Januar 2019 angekündigt, erhielt das Unternehmen das Protokoll der Sitzung vom Typ A von der FDA, in dem die im Antwortschreiben der FDA (der „CRL“) genannten Punkte behandelt wurden, die sich auf die Anwendung des neuen Medikaments Oliceridin bezogen. In diesem Protokoll einigte sich die FDA darauf, dass die derzeitige Sicherheitsdatenbank des Unternehmens die Kennzeichnung mit einer maximalen Tagesdosis von 27 mg unterstützen wird, und gab an, dass das Unternehmen eine Studie an gesunden Freiwilligen durchführen kann, um die in der CRL geforderten zusätzlichen QT-Intervalldaten zu erheben. Vor kurzem legte das Unternehmen der FDA ein detailliertes Protokoll und einen Analyseplan für diese Studie vor. Das Unternehmen geht weiterhin davon aus, dass es diese Studie im ersten Halbjahr 2019 initiieren wird, nachdem es von der FDA Feedback erhalten hat. Das Unternehmen geht nicht davon aus, dass das Fehlen einer Durchbruchstherapiebestimmung den Zeitpunkt der FDA-Prüfung der Anwendung des neuen Medikaments Oliceridin nach einer erneuten Einnahme beeinflussen wird.
http://secfilings.nasdaq.com/filingFrameset.asp?FilingID=132…
Wie Ende Januar 2019 angekündigt, erhielt das Unternehmen das Protokoll der Sitzung vom Typ A von der FDA, in dem die im Antwortschreiben der FDA (der „CRL“) genannten Punkte behandelt wurden, die sich auf die Anwendung des neuen Medikaments Oliceridin bezogen. In diesem Protokoll einigte sich die FDA darauf, dass die derzeitige Sicherheitsdatenbank des Unternehmens die Kennzeichnung mit einer maximalen Tagesdosis von 27 mg unterstützen wird, und gab an, dass das Unternehmen eine Studie an gesunden Freiwilligen durchführen kann, um die in der CRL geforderten zusätzlichen QT-Intervalldaten zu erheben. Vor kurzem legte das Unternehmen der FDA ein detailliertes Protokoll und einen Analyseplan für diese Studie vor. Das Unternehmen geht weiterhin davon aus, dass es diese Studie im ersten Halbjahr 2019 initiieren wird, nachdem es von der FDA Feedback erhalten hat. Das Unternehmen geht nicht davon aus, dass das Fehlen einer Durchbruchstherapiebestimmung den Zeitpunkt der FDA-Prüfung der Anwendung des neuen Medikaments Oliceridin nach einer erneuten Einnahme beeinflussen wird.
http://secfilings.nasdaq.com/filingFrameset.asp?FilingID=132…
Antwort auf Beitrag Nr.: 60.047.879 von onkelen am 08.03.19 06:30:04Wie soll man da jetzt bewerten......kann es sein das durch die Entscheidung der FDA das man den Wirkstoff Oliceridin nicht mehr als Durchbruchstherapie sieht und somit eine Zulassung des Wirkstoffes als normales Schmerzmedikament als wahrscheinlicher erachten kann.
Weil ansonsten klingt das Schreiben von der FDA ja recht positiv und es wurden keine größeren Studien mehr gefordert.
Weil ansonsten klingt das Schreiben von der FDA ja recht positiv und es wurden keine größeren Studien mehr gefordert.
Antwort auf Beitrag Nr.: 60.049.397 von bernstein789 am 08.03.19 09:32:07Vor kurzem legte das Unternehmen der FDA ein detailliertes Protokoll und einen Analyseplan für diese Studie vor. Das Unternehmen geht weiterhin davon aus, dass es diese Studie im ersten Halbjahr 2019 initiieren(den Anstoß zu etwas geben) in die Wege leiten wird, nachdem es von der FDA Feedback erhalten hat.
Antwort auf Beitrag Nr.: 60.049.553 von onkelen am 08.03.19 09:48:01Warum dann dieser 15% Kursabschlag.......im Prinzip hat sich doch dadurch nichts relevant geändert oder sind die Anleger nur besonders nervös....grins
...wenn wir pech haben sollten , dauert das prozedere leider etwas länger . die FDA sieht wohl keine dringlichkeit mehr vorhanden und beschränkt sich mehr auf andere details , wie auch immer . meine meinung dazu......bei ca. 1,- euro nachkaufen , liegen lassen und warten auf news seitens der FDA und dann hoffen auf juli/august 19 zwecks einbringung erneuter unterlagen zur abstimmung im amilang . aber n m M.
Trevena, Inc. (NASDAQ: TRVN ) gab heute die Veröffentlichung der Ergebnisse von APOLLO-1
https://translate.google.com/translate?sl=en&tl=de&u=https%3…
13. März 2019 07:00 Uhr ET Quelle: Trevena Inc.
- Das Unternehmen gibt die Vorlage eines Protokolls und eines Analyseplans für gesunde Freiwillige von Oliceridin bei der FDA bekannt -
- Erfolgreiches Fundraising erweitert Cash Runway in das 3. Quartal 2020 -
Unternehmen, das heute, 13. März 2019, um 8:00 Uhr (ET) Telefonkonferenz abhält
CHESTERBROOK, Pennsylvania, 13. März 2019 (GLOBE NEWSWIRE) - Trevena, Inc. (NASDAQ: TRVN), ein biopharmazeutisches Unternehmen, das sich auf die Entwicklung und Vermarktung innovativer Behandlungsoptionen konzentriert, die auf Erkrankungen des zentralen Nervensystems abzielen oder diese behandeln CNS, gab heute seine Finanzergebnisse für das vierte Quartal und das vollständige Geschäftsjahr zum 31. Dezember 2018 bekannt und gab einen Überblick über die operativen Highlights der Jahre 2018 und 2019.
"Nach unserem erfolgreichen Typ-A-Treffen mit der FDA haben wir das Oliceridin-Programm weiterhin rasch vorangetrieben", sagte Carrie L. Bourdow, President und Chief Executive Officer. „Wir haben das Protokoll für die zuvor angekündigte Studie zur gesunden Freiwilligenstudie von Oliceridin vorgelegt und gehen davon aus, dass diese Studie im ersten Halbjahr 2019 beginnen wird. Darüber hinaus haben wir mit unseren frühen Pipeline-Assets bedeutende Meilensteine erreicht und werden voraussichtlich im Jahr 2019 fortfahren die Entwicklung dieser Vermögenswerte zur Schaffung eines langfristigen Wertes der Aktionäre. “
2018 und die jüngsten Highlights des Unternehmens:
Klarheit auf dem Weg nach vorne zur Adress-CRL. Im Januar 2019 gab das Unternehmen den Erhalt des Typ-A-Sitzungsprotokolls von der FDA in Bezug auf das vollständige Antwortschreiben für Oliceridin (CRL) bekannt. Die FDA stimmte darin überein, dass die derzeitige Sicherheitsdatenbank des Unternehmens die Kennzeichnung mit einer maximalen Tagesdosis von 27 mg unterstützen wird, und gab an, dass das Unternehmen eine Studie an gesunden Freiwilligen durchführen kann, um die zusätzlichen QT-Intervalldaten zu erheben, die im Rahmen der CRL angefordert werden. Das Unternehmen hat der FDA ein detailliertes Protokoll und einen Analyseplan für diese Studie vorgelegt und erwartet, dass die Studie im ersten Halbjahr 2019 beginnen wird, nachdem die FDA ihr Feedback erhalten hat.
Ankündigung der Veröffentlichung von APOLLO 1 Phase 3 für Oliceridin. Das Unternehmen gab die Veröffentlichung der Ergebnisse der Phase 3 in The Journal of Pain Research über die Auswirkungen von Oliceridin gegenüber IV-Morphin für die Behandlung mittelschwerer bis schwerer akuter Schmerzen nach der Bunionektomie bekannt.
Erfolgreiche Kapitalerhöhung abgeschlossen. Im Januar 2019 schloss das Unternehmen ein registriertes direktes Angebot von Stammaktien in Höhe von 10 Millionen US-Dollar ab, das einen Nettoerlös von 9,2 Millionen US-Dollar einbrachte und es dem Unternehmen ermöglichte, seinen Cash-Runway in das dritte Quartal 2020 auszudehnen.
Weitere Fortschritte bei den Pipeline-Assets. 2018 schloss das Unternehmen eine Phase-1-Studie mit TRV250 ab, einem potenziellen neuen Wirkmechanismus zur Behandlung akuter Migräne, und begann eine Partnerschaft mit dem National Institute on Drug Abuse (NIDA) für TRV734 bei der Behandlung von Opioid-Nutzungsstörungen. In seinem S1P-Rezeptorprogramm gibt das Unternehmen heute die Identifizierung eines Spitzenkandidaten für dieses Programm bekannt, der als TRV045 bezeichnet wird. Dieser Kandidat verspricht einen neuen Wirkmechanismus für eine neuartige, nichtopioide Behandlung chronischer Schmerzen und anderer ZNS-Erkrankungen.
Stärkung des Verwaltungsrats. Mit Wirkung zum 1. Oktober 2018 wurde Scott Braunstein, M. D., in den Verwaltungsrat berufen und bringt mehr als 25 Jahre Branchenerfahrung in den Trevena-Vorstand ein.
Zwei Ex-US-Lizenzvereinbarungen wurden abgeschlossen. Im zweiten Quartal 2018 schloss das Unternehmen mit PharmBio Korea Inc. in Südkorea und in China mit Jiangsu Nhwa Pharmaceutical Co. Ltd. exklusive Lizenzverträge für die Entwicklung und Vermarktung von Oliceridin.
Finanzergebnisse für das vierte Quartal und das gesamte Jahr 2018
Für das vierte Quartal 2018 meldete das Unternehmen einen auf Stammaktionäre entfallenden Nettoverlust von 8,0 Mio. USD oder 0,10 USD je Aktie, verglichen mit 14,7 Mio. USD oder 0,24 USD pro Aktie für das vierte Quartal 2017. Für das am 31. Dezember endende Geschäftsjahr Im Jahr 2018 betrug der auf Stammaktionäre entfallende Nettoverlust 30,8 Mio. USD oder 0,42 USD je Aktie, verglichen mit 71,9 Mio. USD oder 1,21 USD je Aktie für das am 31. Dezember 2017 endende Geschäftsjahr. Dieser Rückgang ist im Wesentlichen auf die im Jahr 2018 erfassten Umsatzerlöse aus der Zusammenarbeit zurückzuführen mit den Lizenzvereinbarungen für Oliceridin verbunden sind und die Forschungs- und Entwicklungskosten erheblich senken sollen.
Die liquiden Mittel und Wertpapiere des Umlaufvermögens beliefen sich zum 31. Dezember 2018 auf 61,5 Millionen US-Dollar. Am 29. Januar 2018 schloss das Unternehmen ein registriertes direktes Angebot von 10,0 Millionen Stammaktien ab, das dem Unternehmen einen Nettoerlös von etwa 9,2 Millionen US-Dollar einbrachte. Die Gesellschaft geht davon aus, dass ihre liquiden Mittel und marktfähigen Wertpapiere zum 31. Dezember 2018 zusammen mit ihren Zinsen und der Nettoerlös von rund 9,2 Mio. USD aus dem registrierten Direktemissionsangebot ausreichen, um die Betriebskosten und die Kapitalausgaben der Gesellschaft zu finanzieren Anforderungen in das dritte Quartal 2020.
https://www.globenewswire.com/news-release/2019/03/13/175237…
- Das Unternehmen gibt die Vorlage eines Protokolls und eines Analyseplans für gesunde Freiwillige von Oliceridin bei der FDA bekannt -
- Erfolgreiches Fundraising erweitert Cash Runway in das 3. Quartal 2020 -
Unternehmen, das heute, 13. März 2019, um 8:00 Uhr (ET) Telefonkonferenz abhält
CHESTERBROOK, Pennsylvania, 13. März 2019 (GLOBE NEWSWIRE) - Trevena, Inc. (NASDAQ: TRVN), ein biopharmazeutisches Unternehmen, das sich auf die Entwicklung und Vermarktung innovativer Behandlungsoptionen konzentriert, die auf Erkrankungen des zentralen Nervensystems abzielen oder diese behandeln CNS, gab heute seine Finanzergebnisse für das vierte Quartal und das vollständige Geschäftsjahr zum 31. Dezember 2018 bekannt und gab einen Überblick über die operativen Highlights der Jahre 2018 und 2019.
"Nach unserem erfolgreichen Typ-A-Treffen mit der FDA haben wir das Oliceridin-Programm weiterhin rasch vorangetrieben", sagte Carrie L. Bourdow, President und Chief Executive Officer. „Wir haben das Protokoll für die zuvor angekündigte Studie zur gesunden Freiwilligenstudie von Oliceridin vorgelegt und gehen davon aus, dass diese Studie im ersten Halbjahr 2019 beginnen wird. Darüber hinaus haben wir mit unseren frühen Pipeline-Assets bedeutende Meilensteine erreicht und werden voraussichtlich im Jahr 2019 fortfahren die Entwicklung dieser Vermögenswerte zur Schaffung eines langfristigen Wertes der Aktionäre. “
2018 und die jüngsten Highlights des Unternehmens:
Klarheit auf dem Weg nach vorne zur Adress-CRL. Im Januar 2019 gab das Unternehmen den Erhalt des Typ-A-Sitzungsprotokolls von der FDA in Bezug auf das vollständige Antwortschreiben für Oliceridin (CRL) bekannt. Die FDA stimmte darin überein, dass die derzeitige Sicherheitsdatenbank des Unternehmens die Kennzeichnung mit einer maximalen Tagesdosis von 27 mg unterstützen wird, und gab an, dass das Unternehmen eine Studie an gesunden Freiwilligen durchführen kann, um die zusätzlichen QT-Intervalldaten zu erheben, die im Rahmen der CRL angefordert werden. Das Unternehmen hat der FDA ein detailliertes Protokoll und einen Analyseplan für diese Studie vorgelegt und erwartet, dass die Studie im ersten Halbjahr 2019 beginnen wird, nachdem die FDA ihr Feedback erhalten hat.
Ankündigung der Veröffentlichung von APOLLO 1 Phase 3 für Oliceridin. Das Unternehmen gab die Veröffentlichung der Ergebnisse der Phase 3 in The Journal of Pain Research über die Auswirkungen von Oliceridin gegenüber IV-Morphin für die Behandlung mittelschwerer bis schwerer akuter Schmerzen nach der Bunionektomie bekannt.
Erfolgreiche Kapitalerhöhung abgeschlossen. Im Januar 2019 schloss das Unternehmen ein registriertes direktes Angebot von Stammaktien in Höhe von 10 Millionen US-Dollar ab, das einen Nettoerlös von 9,2 Millionen US-Dollar einbrachte und es dem Unternehmen ermöglichte, seinen Cash-Runway in das dritte Quartal 2020 auszudehnen.
Weitere Fortschritte bei den Pipeline-Assets. 2018 schloss das Unternehmen eine Phase-1-Studie mit TRV250 ab, einem potenziellen neuen Wirkmechanismus zur Behandlung akuter Migräne, und begann eine Partnerschaft mit dem National Institute on Drug Abuse (NIDA) für TRV734 bei der Behandlung von Opioid-Nutzungsstörungen. In seinem S1P-Rezeptorprogramm gibt das Unternehmen heute die Identifizierung eines Spitzenkandidaten für dieses Programm bekannt, der als TRV045 bezeichnet wird. Dieser Kandidat verspricht einen neuen Wirkmechanismus für eine neuartige, nichtopioide Behandlung chronischer Schmerzen und anderer ZNS-Erkrankungen.
Stärkung des Verwaltungsrats. Mit Wirkung zum 1. Oktober 2018 wurde Scott Braunstein, M. D., in den Verwaltungsrat berufen und bringt mehr als 25 Jahre Branchenerfahrung in den Trevena-Vorstand ein.
Zwei Ex-US-Lizenzvereinbarungen wurden abgeschlossen. Im zweiten Quartal 2018 schloss das Unternehmen mit PharmBio Korea Inc. in Südkorea und in China mit Jiangsu Nhwa Pharmaceutical Co. Ltd. exklusive Lizenzverträge für die Entwicklung und Vermarktung von Oliceridin.
Finanzergebnisse für das vierte Quartal und das gesamte Jahr 2018
Für das vierte Quartal 2018 meldete das Unternehmen einen auf Stammaktionäre entfallenden Nettoverlust von 8,0 Mio. USD oder 0,10 USD je Aktie, verglichen mit 14,7 Mio. USD oder 0,24 USD pro Aktie für das vierte Quartal 2017. Für das am 31. Dezember endende Geschäftsjahr Im Jahr 2018 betrug der auf Stammaktionäre entfallende Nettoverlust 30,8 Mio. USD oder 0,42 USD je Aktie, verglichen mit 71,9 Mio. USD oder 1,21 USD je Aktie für das am 31. Dezember 2017 endende Geschäftsjahr. Dieser Rückgang ist im Wesentlichen auf die im Jahr 2018 erfassten Umsatzerlöse aus der Zusammenarbeit zurückzuführen mit den Lizenzvereinbarungen für Oliceridin verbunden sind und die Forschungs- und Entwicklungskosten erheblich senken sollen.
Die liquiden Mittel und Wertpapiere des Umlaufvermögens beliefen sich zum 31. Dezember 2018 auf 61,5 Millionen US-Dollar. Am 29. Januar 2018 schloss das Unternehmen ein registriertes direktes Angebot von 10,0 Millionen Stammaktien ab, das dem Unternehmen einen Nettoerlös von etwa 9,2 Millionen US-Dollar einbrachte. Die Gesellschaft geht davon aus, dass ihre liquiden Mittel und marktfähigen Wertpapiere zum 31. Dezember 2018 zusammen mit ihren Zinsen und der Nettoerlös von rund 9,2 Mio. USD aus dem registrierten Direktemissionsangebot ausreichen, um die Betriebskosten und die Kapitalausgaben der Gesellschaft zu finanzieren Anforderungen in das dritte Quartal 2020.
https://www.globenewswire.com/news-release/2019/03/13/175237…
Der CEO von Trevana sagt, dass das Biopharma sein Oliceridin-Schmerzmittelprogramm "schnell" vorantreibt
10:36 13. März 2019
Erfolgreiches Fundraising erweitert seine Cash-Runway bis ins dritte Quartal 2020
Schmerztherapie
Trevena ist ein biopharmazeutisches Unternehmen, das sich auf die Entwicklung und Vermarktung von Behandlungen für Schmerzpatienten konzentriert.
Carrie L Bourdow, CEO von Trevena Inc. ( NASDAQ: TRVN ), sagte am Mittwoch, dass das Unternehmen sein Oliceridin-Schmerzmittelprogramm rasch vorantreibt und das Protokoll für die zuvor angekündigte Studie von Oliceridin zur gesunden Freiwilligen bei der Food and Drug Administration eingereicht hat.
Biopharma führt die Studie an gesunden Freiwilligen durch, um die angeforderten QT-Intervalldaten für Oliceridin zu sammeln.
Das Oliceridin, unter dem Markennamen Olinvo, arbeitet anders als herkömmliche Opioide, sagt das Unternehmen. Es verwendet einen anderen Weg, um Schmerzen zu lindern, ohne Nebenwirkungen der Atemwege und des Magen-Darm-Trakts zu verursachen, die andere Schmerzmittel einschränken.
READ: Trevena-Aktien steigen nach guten FDA-Nachrichten über Schmerzmittel
Ende Januar einigte sich die FDA darauf, dass ihre Sicherheitsdatenbank die Kennzeichnung ihres Schmerzmittels Oliceridin mit einer maximalen Tagesdosis von 27 mg unterstützen wird.
Das in Chesterbrook, Pennsylvania, ansässige Unternehmen hat der FDA nach Erhalt der Rückmeldungen der Regulierungsbehörden ein detailliertes Protokoll und einen Analyseplan vorgelegt. Nach dem Erhalt von Rückmeldungen von der FDA soll in der ersten Hälfte dieses Jahres eine Studie gestartet werden.
"Nach unserem erfolgreichen Typ-A-Meeting mit der FDA haben wir das Oliceridin-Programm weiterhin rasch vorangebracht", sagte Bourdow in einer Erklärung. "Wir haben das Protokoll für die zuvor angekündigte Studie zur gesunden Freiwilligenstudie von Oliceridin vorgelegt und erwarten, dass diese Studie im ersten Halbjahr 2019 beginnen wird."
Finanzielle Aussichten
Ende Dezember 2018 verfügte das Unternehmen über liquide Mittel in Höhe von 61,5 Millionen US-Dollar, was ausreicht, um seine Betriebsausgaben und Investitionen bis in das dritte Quartal 2020 zu finanzieren, so das Management des Unternehmens.
Im Januar beschaffte das Unternehmen 9,2 Millionen USD durch ein direktes Aktienangebot, mit dem das Unternehmen seine Cash Runway bis in das dritte Quartal 2020 ausweiten konnte.
Für das vierte Quartal 2018 meldete das Unternehmen einen Nettoverlust von 8 Mio. USD oder 0,10 USD je Aktie, verglichen mit einem Verlust von 14,7 Mio. USD oder 0,24 USD pro Aktie im vierten Quartal 2017.
Für 2018 betrug der Nettoverlust 30,8 Millionen US-Dollar oder 0,42 US-Dollar pro Aktie, verglichen mit 71,9 Millionen US-Dollar oder 1,21 US-Dollar pro Aktie für das am 31. Dezember 2017 endende Geschäftsjahr.
"Dieser Rückgang ist vor allem darauf zurückzuführen, dass im Jahr 2018 Einnahmen aus der Zusammenarbeit im Zusammenhang mit den Lizenzvereinbarungen für Oliceridin erzielt wurden und die Forschungs- und Entwicklungskosten erheblich gesenkt wurden", sagte das Unternehmen.
Die Trevena-Aktie verlor kürzlich am Morgen um 2,7% auf 1,43 USD.
Beschäftigte Pipeline
Trevena ist ein biopharmazeutisches Unternehmen, das sich auf die Entwicklung und Vermarktung von Behandlungen für Schmerzpatienten konzentriert. Zu den Medikamentenkandidaten des Unternehmens gehören auch TRV250 zur Behandlung akuter Migräne und TRV734 für Schmerzen und die Behandlung der Opioidabhängigkeit.
„Neben Oliceridin haben wir mit unseren Anlagen in der Anfangsphase der Pipeline bedeutende Meilensteine erreicht und erwarten, dass die Entwicklung dieser Vermögenswerte im Jahr 2019 fortgesetzt wird, um einen langfristigen Wert für die Aktionäre zu schaffen“, sagte Bourdow.
2018 schloss das Unternehmen eine Phase-1-Studie für TRV250 ab, eine potenzielle neue Methode zur Behandlung akuter Migräne. Es ging auch eine Partnerschaft mit dem Nationalen Institut für Drogenmissbrauch (NIDA) für TRV734 bei der Behandlung von Opioid-Nutzungsstörungen ein.
In seinem S1P-Rezeptorprogramm gab das Unternehmen am Mittwoch bekannt, dass es einen als TRV045 bezeichneten Spitzenkandidaten identifiziert hat. Dieser Kandidat verspricht eine nichtopioide Behandlung chronischer Schmerzen und anderer Erkrankungen des zentralen Nervensystems.
Kontaktieren Sie Uttara Choudhury unter uttara@proactiveinvestors.com
Folgen Sie ihr auf Twitter : @UttaraProactive
10:36 13. März 2019
Erfolgreiches Fundraising erweitert seine Cash-Runway bis ins dritte Quartal 2020
Schmerztherapie
Trevena ist ein biopharmazeutisches Unternehmen, das sich auf die Entwicklung und Vermarktung von Behandlungen für Schmerzpatienten konzentriert.
Carrie L Bourdow, CEO von Trevena Inc. ( NASDAQ: TRVN ), sagte am Mittwoch, dass das Unternehmen sein Oliceridin-Schmerzmittelprogramm rasch vorantreibt und das Protokoll für die zuvor angekündigte Studie von Oliceridin zur gesunden Freiwilligen bei der Food and Drug Administration eingereicht hat.
Biopharma führt die Studie an gesunden Freiwilligen durch, um die angeforderten QT-Intervalldaten für Oliceridin zu sammeln.
Das Oliceridin, unter dem Markennamen Olinvo, arbeitet anders als herkömmliche Opioide, sagt das Unternehmen. Es verwendet einen anderen Weg, um Schmerzen zu lindern, ohne Nebenwirkungen der Atemwege und des Magen-Darm-Trakts zu verursachen, die andere Schmerzmittel einschränken.
READ: Trevena-Aktien steigen nach guten FDA-Nachrichten über Schmerzmittel
Ende Januar einigte sich die FDA darauf, dass ihre Sicherheitsdatenbank die Kennzeichnung ihres Schmerzmittels Oliceridin mit einer maximalen Tagesdosis von 27 mg unterstützen wird.
Das in Chesterbrook, Pennsylvania, ansässige Unternehmen hat der FDA nach Erhalt der Rückmeldungen der Regulierungsbehörden ein detailliertes Protokoll und einen Analyseplan vorgelegt. Nach dem Erhalt von Rückmeldungen von der FDA soll in der ersten Hälfte dieses Jahres eine Studie gestartet werden.
"Nach unserem erfolgreichen Typ-A-Meeting mit der FDA haben wir das Oliceridin-Programm weiterhin rasch vorangebracht", sagte Bourdow in einer Erklärung. "Wir haben das Protokoll für die zuvor angekündigte Studie zur gesunden Freiwilligenstudie von Oliceridin vorgelegt und erwarten, dass diese Studie im ersten Halbjahr 2019 beginnen wird."
Finanzielle Aussichten
Ende Dezember 2018 verfügte das Unternehmen über liquide Mittel in Höhe von 61,5 Millionen US-Dollar, was ausreicht, um seine Betriebsausgaben und Investitionen bis in das dritte Quartal 2020 zu finanzieren, so das Management des Unternehmens.
Im Januar beschaffte das Unternehmen 9,2 Millionen USD durch ein direktes Aktienangebot, mit dem das Unternehmen seine Cash Runway bis in das dritte Quartal 2020 ausweiten konnte.
Für das vierte Quartal 2018 meldete das Unternehmen einen Nettoverlust von 8 Mio. USD oder 0,10 USD je Aktie, verglichen mit einem Verlust von 14,7 Mio. USD oder 0,24 USD pro Aktie im vierten Quartal 2017.
Für 2018 betrug der Nettoverlust 30,8 Millionen US-Dollar oder 0,42 US-Dollar pro Aktie, verglichen mit 71,9 Millionen US-Dollar oder 1,21 US-Dollar pro Aktie für das am 31. Dezember 2017 endende Geschäftsjahr.
"Dieser Rückgang ist vor allem darauf zurückzuführen, dass im Jahr 2018 Einnahmen aus der Zusammenarbeit im Zusammenhang mit den Lizenzvereinbarungen für Oliceridin erzielt wurden und die Forschungs- und Entwicklungskosten erheblich gesenkt wurden", sagte das Unternehmen.
Die Trevena-Aktie verlor kürzlich am Morgen um 2,7% auf 1,43 USD.
Beschäftigte Pipeline
Trevena ist ein biopharmazeutisches Unternehmen, das sich auf die Entwicklung und Vermarktung von Behandlungen für Schmerzpatienten konzentriert. Zu den Medikamentenkandidaten des Unternehmens gehören auch TRV250 zur Behandlung akuter Migräne und TRV734 für Schmerzen und die Behandlung der Opioidabhängigkeit.
„Neben Oliceridin haben wir mit unseren Anlagen in der Anfangsphase der Pipeline bedeutende Meilensteine erreicht und erwarten, dass die Entwicklung dieser Vermögenswerte im Jahr 2019 fortgesetzt wird, um einen langfristigen Wert für die Aktionäre zu schaffen“, sagte Bourdow.
2018 schloss das Unternehmen eine Phase-1-Studie für TRV250 ab, eine potenzielle neue Methode zur Behandlung akuter Migräne. Es ging auch eine Partnerschaft mit dem Nationalen Institut für Drogenmissbrauch (NIDA) für TRV734 bei der Behandlung von Opioid-Nutzungsstörungen ein.
In seinem S1P-Rezeptorprogramm gab das Unternehmen am Mittwoch bekannt, dass es einen als TRV045 bezeichneten Spitzenkandidaten identifiziert hat. Dieser Kandidat verspricht eine nichtopioide Behandlung chronischer Schmerzen und anderer Erkrankungen des zentralen Nervensystems.
Kontaktieren Sie Uttara Choudhury unter uttara@proactiveinvestors.com
Folgen Sie ihr auf Twitter : @UttaraProactive
Trevena, Inc. (TRVN) Aktie: Ist diese Biotech-Aktie Ihre Aufmerksamkeit wert?
https://iwatchmarkets.com/2019/03/15/trevena-inc-trvn-stock-…https://translate.google.com/translate?sl=en&tl=de&u=https%3…
Trevena sagt, es habe einen "klaren Weg", um die Anwendung für experimentelle Schmerzmedizin erneut einzureichen
https://www.bizjournals.com/philadelphia/news/2019/03/15/tre…
https://translate.googleusercontent.com/translate_c?depth=1&…
https://www.bizjournals.com/philadelphia/news/2019/03/15/tre…
https://translate.googleusercontent.com/translate_c?depth=1&…
Antwort auf Beitrag Nr.: 60.117.022 von onkelen am 16.03.19 07:48:29....danke für die fundamentale und konstruktive analyse , schön und gut zu verstehen aber die dringlichkeit bzw. priorität ist wohl erst einmal wieder raus aus diesem wert . habe heute ein wenig nachgelegt und meine hoffnungen konzentrieren sich mehr auf das nächste jahr d.h also forschung ca 6 monate und und prüfung der FDA ebenfalls weitere 6 monate . leider wird sich das prozedere wohl derart verzögern und hoffentlich entscheidet dann die jury der fda wesentlich anders , als noch im november d.l.jahres . geduld sei hier besonders angesagt und daher wünsche ich allen investierten viel glück .
Antwort auf Beitrag Nr.: 60.117.022 von onkelen am 16.03.19 07:48:29Guter Lauf die letzten Tage! Mal schauen wie weit sie noch zulegt.
Gruß aaahhh
Gruß aaahhh
Trevena bringt Investoren Klarheit
Trevena bringt Investoren Klarheit22. März 2019 17:52 Uhr ET |Zusammenfassung der Telefonkonferenz am 13.03.19 und unabhängiger Telefonkonferenz zwischen NJ Biotech Expert / Mark Demitrack / Bob Yoder.
Das Studienprotokoll wurde der FDA für QT-Intervalldaten für Oliceridin vorgelegt. Die Studien sollen bis Ende des zweiten Quartals 2019 beginnen.
Der Durchbruchstherapiestatus ist nicht länger erforderlich, um die Zulassung von Oliceridin voranzutreiben.
Barmittel und marktfähige Wertpapiere in Höhe von 61,5 Mio. US-Dollar, ausreichend für das 3. Quartal 2020 und 10 Mio. US-Dollar direktes Angebot am 30.01.2014.
Es sind keine zusätzlichen Sicherheitsdaten erforderlich, um die Zulassung von Oliceridin mit einer maximalen Tagesdosis von 27 mg zu unterstützen.
FDA-Minuten bringen TRVN wieder zum Leben
In meinem letzten Artikel FDA-Minuten, um Trevena wieder ins Leben zu rufen , habe ich darüber diskutiert, wie die Veröffentlichung des Protokolls vom FDA-Meeting Trevena (NASDAQ: TRVN ) möglicherweise erneut in die Öffentlichkeit bringen könnte, um als nächster Kandidat in Frage zu kommen FDA-Zulassung und Empfänger potenzieller M & A-Aktivitäten. Die Aktie bewegte sich schnell aus dem Bereich von 0,50 $ in den Bereich von 1,50 $. Der Grund dafür war, dass die FDA zustimmte, dass die derzeitige Sicherheitsdatenbank des Unternehmens die Kennzeichnung mit einer maximalen Tagesdosis von 27 mg unterstützen wird. - Trevena gibt den Erhalt eines Typ A-Sitzungsprotokolls bekannt ...
NJ Biotech Expert hatte das Glück, eine persönliche Telefonkonferenz mit keinem anderen als dem Chief Business Officer Robert Yoder und dem Chief Medical Officer Dr. Mark Demitrack zu führen. Wir hatten am Freitag, 15.03.19, um 12:30 Uhr einen Anruf angesetzt, bei dem ich spezifische Fragen aus der Investorengemeinschaft (StockTwits) aufnahm und aufschrieb, um zu klären, um noch verbleibende Fragen zu klären, die während des Vorfalls nicht beantwortet wurden die Telefonkonferenz zu den Einnahmen am 13.03.19. Sie stimmten zu, die Fragen so gut wie möglich zu beantworten.
Dr. Mark Demitrack wurde im Mai letzten Jahres zum Chief Medical Officer ernannt, und Bob Yoder wurde kürzlich zum Chief Business Officer befördert. Mark hat über 20 Jahre in der Industrie verbracht und hat eine Reihe von Erfolgen bei der Durchführung zahlreicher ZNS-Programme für die klinische Entwicklung und Zulassung hinter sich.
Bob ist Mitte des vergangenen Jahres zu Trevena gekommen und verfügt über mehr als 30 Jahre Branchenerfahrung, führende globale Geschäftsentwicklung und kaufmännische Funktionen in einer Reihe von therapeutischen Bereichen, einschließlich der Akutversorgung. Sowohl Mark als auch Bob waren maßgeblich daran beteiligt, das Unternehmen an diesen kritischen Punkt zu bringen.
https://translate.google.com/translate?sl=en&tl=de&u=https%3…
https://seekingalpha.com/article/4250597-trevena-brings-clar…
Trevena (TRVN) zur Erzielung des ersten Quartals: Was erwartet die Aktie?
Zacks Equity Research, 24. April 2019
GILD TRVN INCY ADRO
Handelt ab 1 $
Vollständigen Artikel ausblenden
Der Fokus der Investoren liegt auf den Bemühungen von Trevena, Inc. (TRVN - Free Report), die Entwicklung der Schmerztherapie Oliceridin-Injektion zu unterstützen, wenn das Unternehmen die Ergebnisse des ersten Quartals 2019 meldet.
Trevenas Leistung in den letzten vier Quartalen war bisher ermutigend, da die Erträge des Unternehmens die Erwartungen dreimal übertrafen und nur einmal die Marke verfehlten. Die durchschnittliche positive Überraschung über die letzten vier Quartale beträgt 3,38%. Im letzten Quartal hatte Trevena eine negative Gewinnüberraschung von 66,67% erzielt.
Die Aktien von Trevena sind im bisherigen Jahresverlauf um 239,5% gestiegen und übertrafen den Anstieg der Branche um 2,2%.
Mal sehen, wie sich die Dinge für die kommenden Quartalsergebnisse gestalten.
Zu berücksichtigende Faktoren
Trevenas Top-Line besteht hauptsächlich aus Lizenz- und Kollaborationserlösen im Zusammenhang mit den Lizenzvereinbarungen für Oliceridin. Das Unternehmen hat fleißig an der Entwicklung seines Schmerztherapie-Kandidaten Oliceridin-Injektion gearbeitet.
Oliceridin ist ein auf Opioiden basierendes Analgetikum, das intravenös verabreicht wird, und auch ein G-Protein-vorgespannter Ligand des mu-Rezeptors, der zur Behandlung mittelschwerer bis schwerer akuter Schmerzen entwickelt wird.
Im Januar dieses Jahres kündigte Trevena den Erhalt des Typ-A-Sitzungsprotokolls von der FDA in Bezug auf das vollständige Antwortschreiben für Oliceridin (CRL) an, das im letzten November veröffentlicht wurde. Anschließend stimmte die Aufsichtsbehörde der aktuellen Sicherheitsdatenbank zu und wird die Kennzeichnung mit einer maximalen Tagesdosis von 27 mg unterstützen. Nach dieser Rückmeldung reichte Trevena der FDA ein detailliertes Protokoll und einen Analyseplan ein. In der ersten Hälfte des Jahres 2019 soll eine Studie initiiert werden, und die OlDA-NDA soll erneut verabreicht werden.
Wir erwarten, dass das Management während des bevorstehenden Investorenaufrufs ein Update zu diesem Thema bereitstellt.
Inzwischen entwickelt Trevena auch zwei G-Protein-abhängige Ligandenkandidaten - TRV250 als nicht narkotische Substanz bei Migräne und eine Partnerschaft mit dem National Institute for Drug Abuse (NIDA) für TRV734 - zur Behandlung mittelschwerer bis schwerer akuter und chronischer Schmerzen. Beide Kandidaten befinden sich in einer frühen Entwicklungsphase.
Im vierten Quartal 2018 stellte Trevena seinen Kandidaten TRV045 vor - einen neuartigen S1P-Modulator -, der für die nichtopioidale Behandlung chronischer Schmerzen evaluiert wird. Das Unternehmen plant, noch in diesem Jahr einen Prüfungsantrag für ein neues Arzneimittel einzureichen.
Wir erwarten, dass sich der Fokus der Anleger auf den Pipeline-Fortschritt des Unternehmens während der bevorstehenden Gewinnaufforderung konzentriert.
Einkommensgeflüster
Unser bewährtes Modell zeigt nicht abschließend, dass Trevena in diesem Berichtszyklus voraussichtlich die Gewinne übertreffen wird. Dies ist darauf zurückzuführen, dass die Aktie sowohl ein positives Earnings-ESP als auch einen Zacks-Rang 1 (Starker Kauf), 2 (Kauf) oder 3 (Halten) aufweisen muss, um dies zu erreichen. Dies ist jedoch hier nicht der Fall, wie Sie unten sehen werden.
Ergebnis-ESP: Trevena hat ein Ergebnis-ESP von 0,00%. Dies liegt daran, dass die genaueste Schätzung und die Zacks-Konsensschätzung mit einem Verlust von jeweils 9 Cent verbunden sind. Sie können die besten Aktien ermitteln, die Sie kaufen oder verkaufen können, bevor sie mit unserem Earnings-ESP-Filter gemeldet werden.
Zacks-Rang: Trevena verfügt über einen Zacks-Rang von 1, wodurch die Vorhersagekraft von ESP erhöht wird. Ein 0,00% ESP in der Kombination macht der Aktie in dieser Gewinnsaison jedoch eine Überraschungsprognose schwierig.
Wir weisen darauf hin, dass Sell-Rated-Aktien (Nr. 4 oder 5) nicht in die Gewinnmitteilung eingehen, insbesondere wenn das Unternehmen negative Schätzungskorrekturen sieht.
https://www.zacks.com/stock/news/398878/trevena-trvn-to-post…
Zacks Equity Research, 24. April 2019
GILD TRVN INCY ADRO
Handelt ab 1 $
Vollständigen Artikel ausblenden
Der Fokus der Investoren liegt auf den Bemühungen von Trevena, Inc. (TRVN - Free Report), die Entwicklung der Schmerztherapie Oliceridin-Injektion zu unterstützen, wenn das Unternehmen die Ergebnisse des ersten Quartals 2019 meldet.
Trevenas Leistung in den letzten vier Quartalen war bisher ermutigend, da die Erträge des Unternehmens die Erwartungen dreimal übertrafen und nur einmal die Marke verfehlten. Die durchschnittliche positive Überraschung über die letzten vier Quartale beträgt 3,38%. Im letzten Quartal hatte Trevena eine negative Gewinnüberraschung von 66,67% erzielt.
Die Aktien von Trevena sind im bisherigen Jahresverlauf um 239,5% gestiegen und übertrafen den Anstieg der Branche um 2,2%.
Mal sehen, wie sich die Dinge für die kommenden Quartalsergebnisse gestalten.
Zu berücksichtigende Faktoren
Trevenas Top-Line besteht hauptsächlich aus Lizenz- und Kollaborationserlösen im Zusammenhang mit den Lizenzvereinbarungen für Oliceridin. Das Unternehmen hat fleißig an der Entwicklung seines Schmerztherapie-Kandidaten Oliceridin-Injektion gearbeitet.
Oliceridin ist ein auf Opioiden basierendes Analgetikum, das intravenös verabreicht wird, und auch ein G-Protein-vorgespannter Ligand des mu-Rezeptors, der zur Behandlung mittelschwerer bis schwerer akuter Schmerzen entwickelt wird.
Im Januar dieses Jahres kündigte Trevena den Erhalt des Typ-A-Sitzungsprotokolls von der FDA in Bezug auf das vollständige Antwortschreiben für Oliceridin (CRL) an, das im letzten November veröffentlicht wurde. Anschließend stimmte die Aufsichtsbehörde der aktuellen Sicherheitsdatenbank zu und wird die Kennzeichnung mit einer maximalen Tagesdosis von 27 mg unterstützen. Nach dieser Rückmeldung reichte Trevena der FDA ein detailliertes Protokoll und einen Analyseplan ein. In der ersten Hälfte des Jahres 2019 soll eine Studie initiiert werden, und die OlDA-NDA soll erneut verabreicht werden.
Wir erwarten, dass das Management während des bevorstehenden Investorenaufrufs ein Update zu diesem Thema bereitstellt.
Inzwischen entwickelt Trevena auch zwei G-Protein-abhängige Ligandenkandidaten - TRV250 als nicht narkotische Substanz bei Migräne und eine Partnerschaft mit dem National Institute for Drug Abuse (NIDA) für TRV734 - zur Behandlung mittelschwerer bis schwerer akuter und chronischer Schmerzen. Beide Kandidaten befinden sich in einer frühen Entwicklungsphase.
Im vierten Quartal 2018 stellte Trevena seinen Kandidaten TRV045 vor - einen neuartigen S1P-Modulator -, der für die nichtopioidale Behandlung chronischer Schmerzen evaluiert wird. Das Unternehmen plant, noch in diesem Jahr einen Prüfungsantrag für ein neues Arzneimittel einzureichen.
Wir erwarten, dass sich der Fokus der Anleger auf den Pipeline-Fortschritt des Unternehmens während der bevorstehenden Gewinnaufforderung konzentriert.
Einkommensgeflüster
Unser bewährtes Modell zeigt nicht abschließend, dass Trevena in diesem Berichtszyklus voraussichtlich die Gewinne übertreffen wird. Dies ist darauf zurückzuführen, dass die Aktie sowohl ein positives Earnings-ESP als auch einen Zacks-Rang 1 (Starker Kauf), 2 (Kauf) oder 3 (Halten) aufweisen muss, um dies zu erreichen. Dies ist jedoch hier nicht der Fall, wie Sie unten sehen werden.
Ergebnis-ESP: Trevena hat ein Ergebnis-ESP von 0,00%. Dies liegt daran, dass die genaueste Schätzung und die Zacks-Konsensschätzung mit einem Verlust von jeweils 9 Cent verbunden sind. Sie können die besten Aktien ermitteln, die Sie kaufen oder verkaufen können, bevor sie mit unserem Earnings-ESP-Filter gemeldet werden.
Zacks-Rang: Trevena verfügt über einen Zacks-Rang von 1, wodurch die Vorhersagekraft von ESP erhöht wird. Ein 0,00% ESP in der Kombination macht der Aktie in dieser Gewinnsaison jedoch eine Überraschungsprognose schwierig.
Wir weisen darauf hin, dass Sell-Rated-Aktien (Nr. 4 oder 5) nicht in die Gewinnmitteilung eingehen, insbesondere wenn das Unternehmen negative Schätzungskorrekturen sieht.
https://www.zacks.com/stock/news/398878/trevena-trvn-to-post…
....also mal ganz kurz bitte um klarstellung . ich bin seit 19 jahren an der börse und allesamt auf loong eingestellt. wäre meine rechnung wirklich richtig so , wenn man derartig rechnen sollte ......beginn der studie 2.halbjahr 19 ....dauer etwa 6-9 monate bei positiver entwickelung antrag an die FDA dauer ebenfalls ca. 6-9 monate ......also eventuelle zulassung seitens der ami-behörde so ca. herbst 2020 ....????? das dauert aber noch seine zeit und wenn ich mich gravierend irren sollte bitte ich höflich um berichtigung , denn die kurse werden eh woanders gestellt . danke im voraus und grüsse an alle aus berlin.
Trevena gibt Ergebnisse des ersten Quartals 2019 bekannt
Trevena gibt Ergebnisse des ersten Quartals 2019 bekannt- Das Unternehmen gibt den Erhalt von Rückmeldungen der FDA zum Untersuchungsprotokoll und Analyseplan für gesunde Freiwillige für Oliceridin bekannt -
- Studie soll Ende Juni beginnen -
Firma, die die Telefonkonferenz am Montag, den 13. Mai 2019 um 8:00 Uhr ET abhält
CHESTERBROOK, PA, 10. Mai 2019 - Trevena, Inc. (Nasdaq: TRVN) , ein biopharmazeutisches Unternehmen, das sich auf die Entwicklung und Vermarktung neuartiger Arzneimittel für Patienten mit Erkrankungen des Zentralnervensystems (ZNS) konzentriert, gab heute den Eingang von Kommentaren des US-amerikanischen Zentralnervensystems bekannt US-amerikanische Arzneimittelbehörde FDA (Food and Drug Administration) zu dem vorgeschlagenen Protokoll für gesunde freiwillige Studien und den Finanzergebnissen für das am 31. März 2019 endende Quartal.
"Wir sind sehr zufrieden mit dem Feedback der FDA, das uns die notwendigen Informationen liefert, um die gesunde Freiwilligenstudie bis Ende Juni voranzutreiben", sagte Carrie Bourdow, President und Chief Executive Officer. "Dies ist ein entscheidender Schritt auf dem Weg zur Wiedervorlage des neuen Medikamentenantrags für Oliceridin. Ich bin stolz auf unser Team, das sich intensiv auf diese wichtige bevorstehende Arbeit vorbereitet hat."
Erstes Quartal und aktuelle Unternehmenshighlights:
· Erhaltenes Feedback von der FDA zu wichtigen Designelementen für die Studie mit gesunden Freiwilligen . Die FDA hat bestätigt, dass die Studie an gesunden Freiwilligen über einen Zeitraum von 24 Stunden durchgeführt werden kann. Die Studie wird an einer einzigen Stelle als Drei-Perioden-Crossover-Design durchgeführt, das Oliceridin, Placebo und Moxifloxacin als Positivkontrolle umfasst.
Das Unternehmen plant, Daten zu ca. 60 Teilnehmern einzureichen. Unter dieser Studienpopulation erhalten mindestens 20 Teilnehmer eine kumulative Dosis von 27 mg Oliceridin, der vorgeschlagenen maximalen Tagesdosis, während des 24-Stunden-Studienzeitraums.
Die Studie wird voraussichtlich Ende Juni beginnen. Das Unternehmen wird weitere Einzelheiten zu einer Telefonkonferenz bekannt geben, die für Montag, den 13. Mai, um 8:00 Uhr Eastern Time angesetzt ist .
· Erfolgreiche Kapitalerhöhung abgeschlossen. Im Januar schloss das Unternehmen ein direktes Angebot von Stammaktien im Wert von 10 Millionen US-Dollar ab, mit dem ein Nettoerlös von 9,2 Millionen US-Dollar erzielt wurde.
Finanzergebnisse für das erste Quartal 2019
Für das erste Quartal 2019 wies das Unternehmen einen den Stammaktionären zurechenbaren Nettoverlust von 5,2 Mio. USD oder 0,06 USD pro Aktie nach 9,0 Mio. USD oder 0,14 USD pro Aktie im ersten Quartal 2018 aus. Dieser Rückgang ist hauptsächlich auf einen geringeren Wert zurückzuführen personalbezogene Kosten im Zusammenhang mit der Umstrukturierung und Reduzierung des Personalbestands im Jahr 2018 sowie geringere Forschungs- und Entwicklungskosten.
Die liquiden Mittel und Wertpapiere des Umlaufvermögens beliefen sich zum 31. März 2019 auf 60,1 Mio. USD. Das Unternehmen ist der Ansicht, dass die liquiden Mittel und Wertpapiere des Umlaufvermögens zum 31. März 2019 zusammen mit den Zinsen ausreichen, um die Betriebskosten des Unternehmens zu finanzieren und Investitionsanforderungen in das dritte Quartal 2020.
Telefonkonferenz und Webcast-Informationen
Das Unternehmen wird am Montag, den 13. Mai, um 8:00 Uhr Eastern Time, eine Telefonkonferenz und einen Webcast mit der Investment-Community abhalten. Darin werden Ausführungen von Carrie Bourdow, President und CEO, und Mark Demitrack, SVP und Chief Medical Officer, zu sehen sein.
Live-Anruf:
Gebührenfrei: (855) 465-0180
International: (484) 756-4313
Webcast:
investors.trevena.com
Wiederholung:
Gebührenfrei: (855) 859-2056
International: (404) 537-3406
Konferenz-ID: 7698684
(Verfügbar ca. eine Stunde nach Abschluss des Live
Anruf bis 23.59 Uhr ET am 22. Mai 2019)
https://www.sec.gov/Archives/edgar/data/1429560/000110465919…
https://www.sec.gov/Archives/edgar/data/1429560/000110465919…
us forum...
Hoffentlich sehen wir morgen mehr als 2,00 US-Dollar und mehr als 3,57 US-Dollar nach den Nachrichten über erfolgreiche QT-Studien und Wiedervorlagen im nächsten Monat.
Hoffentlich sehen wir morgen mehr als 2,00 US-Dollar und mehr als 3,57 US-Dollar nach den Nachrichten über erfolgreiche QT-Studien und Wiedervorlagen im nächsten Monat.
us forum...
Ich habe die Telefonkonferenz und das Fazit einfach genossen - das Unternehmen und Oli sowie der Pipeline-Fortschritt sind solide. Das Management klingt solide, zuversichtlich und ihre Stimmen sind mit ihrer Arbeit, ihrem Fortschritt und ihrem Plan für die Zukunft zufrieden. Was auch immer heute mit dem Aktienkurs passiert (auch wenn er sinkt), ist kein Spiegelbild eines schlechten Unternehmens - nur ungeduldige "Investoren". Jede Schwäche dieser Aktie ist eine definitive Kaufgelegenheit.
Ich habe die Telefonkonferenz und das Fazit einfach genossen - das Unternehmen und Oli sowie der Pipeline-Fortschritt sind solide. Das Management klingt solide, zuversichtlich und ihre Stimmen sind mit ihrer Arbeit, ihrem Fortschritt und ihrem Plan für die Zukunft zufrieden. Was auch immer heute mit dem Aktienkurs passiert (auch wenn er sinkt), ist kein Spiegelbild eines schlechten Unternehmens - nur ungeduldige "Investoren". Jede Schwäche dieser Aktie ist eine definitive Kaufgelegenheit.
Trevena, Inc. (NASDAQ:TRVN) Q1 2019 Results Earnings Conference Call May 13, 2019 8:00 AM ET
https://seekingalpha.com/article/4263510-trevena-inc-trvn-ce…
Antwort auf Beitrag Nr.: 60.554.376 von onkelen am 13.05.19 14:25:11
Ich denke es wird erstmal wieder unter 1€ gehen, es ist noch zuviel Zeit bis zu den nächsten Ergebnissen. Erst danach wird es wieder interessant
Zitat von onkelen: us forum...
Ich habe die Telefonkonferenz und das Fazit einfach genossen - das Unternehmen und Oli sowie der Pipeline-Fortschritt sind solide. Das Management klingt solide, zuversichtlich und ihre Stimmen sind mit ihrer Arbeit, ihrem Fortschritt und ihrem Plan für die Zukunft zufrieden. Was auch immer heute mit dem Aktienkurs passiert (auch wenn er sinkt), ist kein Spiegelbild eines schlechten Unternehmens - nur ungeduldige "Investoren". Jede Schwäche dieser Aktie ist eine definitive Kaufgelegenheit.
Ich denke es wird erstmal wieder unter 1€ gehen, es ist noch zuviel Zeit bis zu den nächsten Ergebnissen. Erst danach wird es wieder interessant
Antwort auf Beitrag Nr.: 60.552.078 von onkelen am 13.05.19 09:57:15
.....iaus den letzten news war eigentlich zu verstehen , dass die studie für das schmerzmittel erst im 1. halbjahr 2019 beginnen sollte . daher für mich die verfrühte positive einstellung verständnislos , wie bereits schon einmal von mir vor kurzem beanstandet, oder habe ich irgend etwas verkehrt verstanden...???
Zitat von onkelen: us forum...
Hoffentlich sehen wir morgen mehr als 2,00 US-Dollar und mehr als 3,57 US-Dollar nach den Nachrichten über erfolgreiche QT-Studien und Wiedervorlagen im nächsten Monat.
.....iaus den letzten news war eigentlich zu verstehen , dass die studie für das schmerzmittel erst im 1. halbjahr 2019 beginnen sollte . daher für mich die verfrühte positive einstellung verständnislos , wie bereits schon einmal von mir vor kurzem beanstandet, oder habe ich irgend etwas verkehrt verstanden...???
Trevena, Inc. (NASDAQ:TRVN) Q1 2019 Ergebnis Ergebnis Telefonkonferenz 13. Mai 2019 8:00 Uhr ET ET
Unternehmensbeteiligte
Bob Yoder - Chief Business Officer (Geschäftsführer)
Carrie Bourdow - Präsidentin und CEO
Mark Demitrack - Chief Medical Officer (Leitender Arzt)
Teilnehmer der Telefonkonferenz
Douglas Tsao - H.C. Wainwright (Wainwright)
Bediener
Guten Tag, meine Damen und Herren, und willkommen zu Trevenas Telefonkonferenz zum ersten Quartal 2019. Zu diesem Zeitpunkt befinden sich alle Teilnehmer in einem reinen Hörmodus. Später werden wir eine Frage-und-Antwort-Veranstaltung durchführen, und zu diesem Zeitpunkt werden Anweisungen folgen. [Bedienungsanleitung]. Zur Erinnerung: Dieser Anruf wird aufgezeichnet.
Ich möchte Ihnen nun Ihren Gastgeber für die heutige Konferenz, Bob Yoder, Chief Business Officer, vorstellen. Bitte machen Sie weiter.
Bob Yoder
Vielen Dank und willkommen, ihr alle. Danke, dass du dich uns heute Morgen beim Anruf angeschlossen hast. Heute sind Carrie Bourdow, unsere Präsidentin und CEO, Mark Demitrack, unser Chief Medical Officer, und John Hamill, unser Vice President of Finance, bei mir.
Bevor wir beginnen, möchten wir die Teilnehmer darüber informieren, dass wir zu diesem Aufruf zukunftsgerichtete Aussagen machen werden, die gemäß der Safe Harbor-Bestimmung des Private Securities Litigation Reform Act von 1995 gemacht werden. Sie werden darauf hingewiesen, dass solche zukunftsgerichteten Aussagen mit Risiken und Unsicherheiten verbunden sind, einschließlich der Risiken, die von Zeit zu Zeit in den regelmäßigen Berichten des Unternehmens an die Securities and Exchange Commission aufgeführt sind, und wir übernehmen keine Verpflichtung, diese Aussagen über den heutigen Tag hinaus zu aktualisieren.
Während der heutigen Telefonkonferenz werden Carrie und Mark das Feedback, das wir kürzlich von der FDA zu einer gesunden freiwilligen Studie für Oliceridin erhalten haben, überprüfen, ein Update über die Zeitpläne für Studien geben, unsere Pläne für den Rest unserer Pipeline skizzieren und einen kurzen Überblick über unsere Finanzen geben. Wir werden dann die Leitung für Fragen öffnen.
Ich werde nun den Anruf an Carrie weiterleiten.
Carrie Bourdow
Danke, Bob. Guten Morgen zusammen. Vielen Dank, dass Sie sich uns heute angeschlossen haben. Wir freuen uns über das Feedback der FDA zu unserem Protokoll und Statistikplan für die Oliceridin-Studie für gesunde Probanden. Und wie Sie in der Pressemitteilung gesehen haben, freue ich mich über das Feedback der Agentur, da es Schlüsselelemente des Studiendesigns bestätigt und wir nun mit Zuversicht die Vorbereitung auf die Studieninitiierung vorantreiben können.
Zu Beginn des Jahres habe ich einen Plan aufgestellt, um Oliceridin für eine mögliche Zulassung zu positionieren, die Pipeline voranzutreiben und Wert für die Aktionäre zu schaffen. Das Team hat in kurzer Zeit viel Arbeit geleistet. Und wir haben jetzt einen klaren Weg für die Wiedereinreichung der NDA für Oliceridin. Mit dem vorliegenden FDA-Feedback sind wir auch in der Lage, gut fundierte Entscheidungen über Investitionen in den Rest der Pipeline zu treffen. Unser Hauptaugenmerk liegt auf Oliceridin, aber wir treffen bei allen unseren Pipeline-Vermögenswerten die richtigen Entscheidungen, um wichtige zukünftige Meilensteine zu erreichen.
Lassen Sie mich nun den Anruf an Mark weiterleiten, der über die Oliceridin-Studie und unsere Pipeline-Arbeit informieren wird.
Mark Demitrack
Danke, Carrie, und guten Morgen, zusammen. Um Carries Bemerkungen zu widerlegen, sind wir sehr erfreut, jetzt über alle Informationen zu verfügen, die wir benötigen, um die Initiierung der gesunden Freiwilligenstudie für Mark Demitrack voranzutreiben. Wie ich bereits in einem früheren Aufruf erwähnt habe, ist das Hauptziel dieser Studie, die von der FDA angeforderten zusätzlichen QT-Intervalldaten zu sammeln. Wir haben ein detailliertes Studienprotokoll und einen statistischen Analyseplan weniger als einen Monat nach Erhalt des Typ-A-Meeting-Protokolls vorgelegt und während der gesamten Überprüfung einen produktiven Dialog mit der Agentur geführt.
Bereits im März diskutierte ich die wichtigsten Studienmerkmale, die von der FDA als akzeptabel bezeichnet wurden. Insbesondere, dass die Studie an gesunden Probanden über einen Zeitraum von 24 Stunden durchgeführt werden könnte und sowohl das Placebo als auch einen positiven Kontrollarm umfassen sollte. Lassen Sie mich mir etwas Zeit, um das allgemeine Studiendesign zu trainieren. In einem typischen dreiperiodigen Crossover-Design durchläuft jedes Subjekt jede Phase der Frequenzweiche. Die Phasen sind in der Reihenfolge über die gesamte Probandenpopulation randomisiert, wobei eine kurze dazwischenliegende Beobachtungszeit zwischen den Phasen besteht.
Das Feedback der Agentur und unseres Protokolls bestätigt unsere vorgeschlagene Studienpopulation und Dosierungsdauer. Darüber hinaus planen wir, die Studie an einem einzigen Standort als dreitägiges Crossover-Design mit Oliceridin, Placebo und Moxifloxacin als Positivkontrolle durchzuführen. Und wir haben einen Vertrag mit einer etablierten Auftragsforschungsorganisation abgeschlossen, mit der wir bei früheren gesunden Freiwilligenstudien mit Oliceridin zusammengearbeitet haben.
Das Feedback der Agentur zu unserem Analyseplan hat es uns auch ermöglicht, den notwendigen Gesamtstichprobenumfang für eine korrekte statistische Aussagekraft der Studie zu ermitteln. Wir planen, Daten von etwa 60 Teilnehmern einzureichen, wobei mindestens 20 dieser Teilnehmer eine Gesamtdosis von 27 Milligramm Oliceridin, der vorgeschlagenen maximalen Tagesdosis, erhalten. Wir freuen uns, dass wir mit der FDA eine Einigung über diese kritischen Studienelemente erzielt haben.
Insbesondere die Fähigkeit, dies bei einer gesunden Freiwilligenpopulation und dem gesamten Sam zu tun.
Insbesondere die Fähigkeit, dies bei einer gesunden Freiwilligenpopulation durchzuführen, und der erforderliche Stichprobenumfang insgesamt geben uns die Gewissheit, dass die Studie in relativ kurzer Zeit und kostengünstig abgeschlossen werden kann.
In den letzten Monaten hat das Team aktiv an der Vorbereitung der logistischen Details der Studie gearbeitet, während wir auf das Feedback der FDA warteten. Als Ergebnis dieser Bemühungen glauben wir, dass wir bereit und gut positioniert sind, diese Studie so schnell wie möglich, spätestens Ende Juni, zu starten. Unter der Annahme, dass diese zeitnahen Studien beginnen, gehen wir davon aus, dass wir im vierten Quartal dieses Jahres Umsatzdaten veröffentlichen werden.
Wie Carrie bereits erwähnte, blicken wir auch auf das zweite Halbjahr dieses Jahres, wenn wir über unsere Pläne nachdenken, unsere Pipeline voranzubringen und unsere Präsenz im ZNS-Raum auszubauen. Mit einem klaren Weg nach vorne bei Oliceridin sehen wir uns nun gut positioniert, um unsere Entwicklungssubstanzen voranzutreiben. Deshalb möchte ich mir ein paar Minuten Zeit nehmen, um die nächsten Schritte zu skizzieren, die wir für unsere drei Pipeline-Vermögenswerte planen.
Wir planen, eine Proof-of-Mechanismusstudie für TRV250, unseren neuartigen Delta-Rezeptor-Agonisten, der auf die potenzielle Behandlung akuter Migräne abzielt, irgendwann in der zweiten Hälfte dieses Jahres zu initiieren. Wir glauben, dass dies einen fokussierten und kosteneffektiven Ansatz für uns bieten wird, um das Zielengagement anhand eines validierten Biomarker-Modells zu bestimmen.
Ich möchte betonen, dass es sich hierbei nicht um eine große tagebuchbasierte Phase-2-Studie handelt, die Sie vielleicht mit Migränemedikamenten sehen können. Stattdessen würde dies die Verwendung eines Erwachsenen-Migräne-Modells mit tatsächlichen Migräneanfälligen als Studienteilnehmer nutzen.
Mit diesem neuartigen verzerrten Wirkmechanismus glauben wir, dass TRV250 ein großes Potenzial hat, der erste Delta-Rezeptor-Modulator zu sein, der diese Phase der klinischen Prüfung erreicht, ein bemerkenswerter Meilenstein für die Medikamentenentwicklung dieses pharmakologischen Ziels.
Unsere Zusammenarbeit mit der Intramural Research Group am National Institute on Drug Abuse oder NIDA bleibt aktiv, da sie TRV734, unseren oral verfügbaren neuen Rezeptor-Agonisten, der unserer Meinung nach eine vielversprechende Option für Patienten darstellt, die sich einer oralen Erhaltungstherapie wegen einer Opioidkonsumstörung unterziehen. Wir sind stolz darauf, diesen dringenden Bedarf durch diese wichtige Partnerschaft mit NIDA zu decken.
Schließlich planen wir, nach unserem jüngsten Erfolg bei der Identifizierung von TRV045 als Hauptkandidat in unserem S1P-Teamrezeptorprogramm, zusätzliche in vivo-Pharmakologie-Studien und andere Arbeiten zu initiieren, die notwendig sind, um unsere IND-Aktivitäten in diesem Jahr voranzutreiben.
Wir freuen uns sehr, diesen neuen Wirkmechanismus weiter zu erforschen, der unserer Meinung nach eine einzigartige Gelegenheit bietet, die Vorteile der direkten Ausrichtung des S1P-Rezeptors auf das zentrale Nervensystem zu nutzen. Wir glauben, dass TRV045 für eine ganz andere Reihe von klinischen Indikationen entwickelt werden könnte. Zum Beispiel als nicht-opioidbasierte Behandlungsoption bei chronischen Schmerzen. Letztendlich streben wir an, dieses Asset zu IND zu entwickeln, entweder durch einen potenziellen Partner oder durch uns selbst.
Ich möchte nun den Anruf an Carrie für einige abschließende Bemerkungen zurückverweisen.
Carrie Bourdow
Danke, Mark. Lassen Sie mich unsere Pläne zusammenfassen. Unsere Priorität bleibt Oliceridin. Mit dem Feedback der FDA werden wir die Studie spätestens Ende Juni starten, mit der Erwartung, dass wir im vierten Quartal dieses Jahres über Top-Line-Daten verfügen werden. Wir bleiben auch auf Kurs, um die beiden anderen nichtklinischen Punkte abzuschließen, um die uns die FDA bittet. Infolgedessen glauben wir, dass wir einen klaren Weg zu einer erfolgreichen Wiedereinreichung der NDA für Oliceridin haben.
Ebenfalls in der zweiten Hälfte dieses Jahres werden wir mit den Arbeiten beginnen, die Mark an den anderen Pipeline-Vermögenswerten erwähnt hat.
Lassen Sie mich damit mit einem kurzen Überblick über unsere Finanzen schließen. Wie wir in unserer Gewinnmitteilung vom Freitag bekannt gaben, verfügten wir zum 31. März über liquide Mittel und handelbare Wertpapiere in Höhe von 60,1 Mio. US-Dollar, von denen wir glauben, dass sie unsere Geschäftstätigkeit bis ins dritte Quartal 2020 finanzieren werden. Wichtig ist, dass diese Cash Runway unsere Einschätzung der Kosten für die gesunde Freiwilligenstudie und der erwarteten Kosten für die Entwicklungsarbeit, die wir mit den Pipeline-Vermögenswerten initiieren möchten, beinhaltet.
Ich möchte nun den Call for Questions eröffnen. Operator?
Frage-und-Antwort-Sitzung
Bediener
[Bedienungsanleitung]. Unsere erste Frage kommt aus der Linie von Jason Butler mit JMP Securities. Deine Leitung ist jetzt offen.
Nicht identifizierter Analyst
Hi, hier ist[Grant] für Jason, und danke, dass du unsere Frage beantwortet hast. Also, eine kurze Frage vielleicht können Sie auf die gesunde Freiwilligenstudie antworten. Also Daten im vierten Quartal, ist es möglich, dass Sie die NDA noch in diesem Jahr erneut eingereicht haben? Planst du das erste Quartal nächsten Jahres? Und dann auch auf der Studie, was ist die maximale Dosis, die der Patient in einer einzigen Verabreichung während der Studie erhält?
Carrie Bourdow
Ich werde mich mit dem Zeitplan für die Einreichung befassen. Guten Morgen, [Grant] vielen Dank für Ihre Frage. Also werden wir uns auf den Weg machen.
Ich werde mich mit dem Zeitplan für die Einreichung befassen. Guten Morgen, [Grant] vielen Dank für Ihre Frage. Also werden wir die Studie in Gang bringen und dann werden wir wiederkommen und alle über den Zeitplan für die Wiedervorlage informieren. Also im Moment, was wir sind - wie Sie wissen, melden sich diese Studien ziemlich schnell an, aber wir wollen wirklich anfangen. Und dann werde ich zurückkommen und über den Zeitplan für die Wiedervorlage informieren. Willst du den.... beantworten?
Mark Demitrack
Sicher. So gut, dass Sie auch die Frage nach der maximalen Einzeldosis gestellt haben, die ein Patient in der Studie erhalten würde. Und das Paradigma der Studiendosierung ist so konzipiert, dass es den Ansichten der Labels folgt, die wir im Entwurf des Labels für die FDA vorgeschlagen haben. Und unter diesen Umständen beträgt die maximale Einzeldosis 3 Milligramm Oliceridin. Über die 24 Stunden hinweg eine Gesamtdosis von 27 Milligramm, was wiederum die maximale Tagesdosis ist.
Nicht identifizierter Analyst
Und dann für TRV250, werden Sie diesen Nachweis der Mechanikstudie in der zweiten Hälfte beginnen. Sollten wir davon in der ersten Hälfte des 20. bis 2020 Daten erwarten? Kannst du uns einen Eindruck davon vermitteln?
Mark Demitrack
Sicherlich werden die Daten im Jahr 2020 vorliegen. Wir sind an dieser Stelle einfach nicht in der Lage, eine klare Aussage über den Endpunkt der Studie zu machen. Ich gehe davon aus, dass wir in den kommenden Monaten viel mehr Klarheit über den Zeitplan der Meilensteine für dieses Projekt haben werden.
Nicht identifizierter Analyst
Es tut mir so leid, dass ich auf Oliceridin zurückkomme. Aber ihr seid Partner in China und Korea, habt ihr Jungs schon einen Eindruck von den Zeitplänen für diese Programme? Und was denkt ihr über andere Geografien nach, wie, was denkt ihr jetzt über Europa? Danke.
Carrie Bourdow
Ja. Also haben wir -- ja, wir haben eine Partnerschaft mit Nhwa in China und PharmBio in Südkorea. Und wir sind mit ihnen zusammen, wir führen produktive Gespräche, wir haben einen gemeinsamen Entwicklungsausschuss, aber noch keine wirklichen Updates über den Zeitplan. Das liegt wirklich an ihnen, die mit ihren Regulierungsbehörden zusammenarbeiten. Und wir prüfen aktiv weitere Ex-US-Partnerschaften, aber noch ist nichts veraltet.
Bediener
Unsere nächste Frage kommt aus der Linie von Douglas Tsao mit H.C. Wainwright. Deine Leitung ist jetzt offen.
Douglas Tsao
Nur Bob, wenn Sie etwas mehr Farbe in Bezug auf die Endpunkte für die Proof-of-Mechanismus-Studie liefern könnten? Und dann ist meine zweite Frage der S1P-Modulator. Nur neugierig, ist diese Arbeit, die Sie vorhersehen, genau mit dem IND Enabling zu machen, oder ist das nur, um eine Art mehr Beweis für die Konzept-Tierarbeit zu sein?
Carrie Bourdow
Mark?
Mark Demitrack
Sicher. Ja. Es ist Mark Demitrack. Die TRV250-Endpunkte, die wir in der Vergangenheit diskutiert haben, habe ich in meinen Bemerkungen nicht offiziell erwähnt, dass wir ein validiertes Modell entwickelt haben, das eine Nitroglycerin-Herausforderung als evozierte Migräneintervention verwendet. Die Endpunkte, da dies bei echten Migränepatienten geschieht, sind also die Lösung eines evozierten Kopfschmerzes. Dieses Modell wurde validiert, um zu zeigen, dass der späte Kopfschmerz bei Migräneanfällen für unsere praktischen Zwecke genauso ist wie eine spontan auftretende Migräne im Leben. Wir würden also nach einer Lösung der Kopfschmerzen als Endpunkt in dieser Studie suchen.
Sie hatten auch nach 045 gefragt, der S1P-Mischung. Und diese Arbeit, die ich skizziert habe, wie ich bereits erwähnte, ist IND-aktivierende Arbeit. So haben wir Ende des Jahres einen Hauptkandidaten in diesem Programm angekündigt, das ist das Molekül 045. Und wir sind im Prozess und in den frühen Phasen des Weges entlang der IND ermöglicht Arbeit, um die Einreichung der IND. Ich bin heute nicht in der Lage, Ihnen ein genaues Datum zu nennen, da es offensichtlich sehr früh in der Entwicklung des Programms ist. Aber während es fortschreitet, werden wir ein wenig mehr Klarheit darüber bekommen, wann wir erwarten, dass uns der Zeitpunkt der tatsächlichen IND zur Verfügung steht.
Douglas Tsao
Okay, großartig. Und dann schätze ich, vielleicht eine Folgefrage für Carrie, ich meine, du hast offensichtlich eine Menge Programme, die in den Anfangsphasen laufen. Ist es, haben Sie begonnen, über eine Art Sequenzierung und Priorisierung einer dieser Verbindungen nachzudenken, sicherlich in Bezug auf eine Art des Denkens über die Art der Finanzierung der Entwicklungsarbeit?
Carrie Bourdow
Ja, große Frage. Wie wir bereits sagten, ist unsere Priorität offensichtlich Oliceridin. Und wenn wir uns die Pipeline-Vermögenswerte ansehen, wenn wir uns die Markteinschätzungen ansehen, wenn wir potenzielle Interessen anderer Partner betrachten, wenn wir noch nicht unsere zweite Art von Fokus erklärt haben, dann sind TRV250, 734 offensichtlich weiter fortgeschritten, aber das S1P-Modulatorprogramm ist ein wirklich spannendes Programm. Bleiben Sie also dran für weitere Diskussionen rund um die Pipeline im kommenden Call.
Bediener
Ich danke dir. Wir haben zur Zeit keine weiteren Fragen in der Warteschlange. Ich möchte nun den Anruf an Carrie Bourdow für weitere Bemerkungen zurückverweisen.
Carrie Bourdow
Ich danke dir. Ich danke Ihnen allen für Ihre Fragen. Wir werden im Laufe des Jahres weiterhin Updates mit Ihnen teilen. Es ist eine aufregende Zeit in Trevena. Wie Sie gehört haben, leisten wir wichtige Arbeit, und wir setzen uns weiterhin dafür ein, neuartige Medikamente für Patienten zu entwickeln, die von ZNS-Bedingungen betroffen sind. Ich danke euch allen
Bediener
Meine Damen und Herren, vielen Dank für Ihre Teilnahme an der heutigen Konferenz. Damit endet das heutige Programm. Sie können alle die Verbindung trennen. Ich wünsche euch allen einen schönen Tag.
Übersetzt mit www.DeepL.com/Translator
https://seekingalpha.com/article/4263510-trevena-inc-trvn-ce…
Unternehmensbeteiligte
Bob Yoder - Chief Business Officer (Geschäftsführer)
Carrie Bourdow - Präsidentin und CEO
Mark Demitrack - Chief Medical Officer (Leitender Arzt)
Teilnehmer der Telefonkonferenz
Douglas Tsao - H.C. Wainwright (Wainwright)
Bediener
Guten Tag, meine Damen und Herren, und willkommen zu Trevenas Telefonkonferenz zum ersten Quartal 2019. Zu diesem Zeitpunkt befinden sich alle Teilnehmer in einem reinen Hörmodus. Später werden wir eine Frage-und-Antwort-Veranstaltung durchführen, und zu diesem Zeitpunkt werden Anweisungen folgen. [Bedienungsanleitung]. Zur Erinnerung: Dieser Anruf wird aufgezeichnet.
Ich möchte Ihnen nun Ihren Gastgeber für die heutige Konferenz, Bob Yoder, Chief Business Officer, vorstellen. Bitte machen Sie weiter.
Bob Yoder
Vielen Dank und willkommen, ihr alle. Danke, dass du dich uns heute Morgen beim Anruf angeschlossen hast. Heute sind Carrie Bourdow, unsere Präsidentin und CEO, Mark Demitrack, unser Chief Medical Officer, und John Hamill, unser Vice President of Finance, bei mir.
Bevor wir beginnen, möchten wir die Teilnehmer darüber informieren, dass wir zu diesem Aufruf zukunftsgerichtete Aussagen machen werden, die gemäß der Safe Harbor-Bestimmung des Private Securities Litigation Reform Act von 1995 gemacht werden. Sie werden darauf hingewiesen, dass solche zukunftsgerichteten Aussagen mit Risiken und Unsicherheiten verbunden sind, einschließlich der Risiken, die von Zeit zu Zeit in den regelmäßigen Berichten des Unternehmens an die Securities and Exchange Commission aufgeführt sind, und wir übernehmen keine Verpflichtung, diese Aussagen über den heutigen Tag hinaus zu aktualisieren.
Während der heutigen Telefonkonferenz werden Carrie und Mark das Feedback, das wir kürzlich von der FDA zu einer gesunden freiwilligen Studie für Oliceridin erhalten haben, überprüfen, ein Update über die Zeitpläne für Studien geben, unsere Pläne für den Rest unserer Pipeline skizzieren und einen kurzen Überblick über unsere Finanzen geben. Wir werden dann die Leitung für Fragen öffnen.
Ich werde nun den Anruf an Carrie weiterleiten.
Carrie Bourdow
Danke, Bob. Guten Morgen zusammen. Vielen Dank, dass Sie sich uns heute angeschlossen haben. Wir freuen uns über das Feedback der FDA zu unserem Protokoll und Statistikplan für die Oliceridin-Studie für gesunde Probanden. Und wie Sie in der Pressemitteilung gesehen haben, freue ich mich über das Feedback der Agentur, da es Schlüsselelemente des Studiendesigns bestätigt und wir nun mit Zuversicht die Vorbereitung auf die Studieninitiierung vorantreiben können.
Zu Beginn des Jahres habe ich einen Plan aufgestellt, um Oliceridin für eine mögliche Zulassung zu positionieren, die Pipeline voranzutreiben und Wert für die Aktionäre zu schaffen. Das Team hat in kurzer Zeit viel Arbeit geleistet. Und wir haben jetzt einen klaren Weg für die Wiedereinreichung der NDA für Oliceridin. Mit dem vorliegenden FDA-Feedback sind wir auch in der Lage, gut fundierte Entscheidungen über Investitionen in den Rest der Pipeline zu treffen. Unser Hauptaugenmerk liegt auf Oliceridin, aber wir treffen bei allen unseren Pipeline-Vermögenswerten die richtigen Entscheidungen, um wichtige zukünftige Meilensteine zu erreichen.
Lassen Sie mich nun den Anruf an Mark weiterleiten, der über die Oliceridin-Studie und unsere Pipeline-Arbeit informieren wird.
Mark Demitrack
Danke, Carrie, und guten Morgen, zusammen. Um Carries Bemerkungen zu widerlegen, sind wir sehr erfreut, jetzt über alle Informationen zu verfügen, die wir benötigen, um die Initiierung der gesunden Freiwilligenstudie für Mark Demitrack voranzutreiben. Wie ich bereits in einem früheren Aufruf erwähnt habe, ist das Hauptziel dieser Studie, die von der FDA angeforderten zusätzlichen QT-Intervalldaten zu sammeln. Wir haben ein detailliertes Studienprotokoll und einen statistischen Analyseplan weniger als einen Monat nach Erhalt des Typ-A-Meeting-Protokolls vorgelegt und während der gesamten Überprüfung einen produktiven Dialog mit der Agentur geführt.
Bereits im März diskutierte ich die wichtigsten Studienmerkmale, die von der FDA als akzeptabel bezeichnet wurden. Insbesondere, dass die Studie an gesunden Probanden über einen Zeitraum von 24 Stunden durchgeführt werden könnte und sowohl das Placebo als auch einen positiven Kontrollarm umfassen sollte. Lassen Sie mich mir etwas Zeit, um das allgemeine Studiendesign zu trainieren. In einem typischen dreiperiodigen Crossover-Design durchläuft jedes Subjekt jede Phase der Frequenzweiche. Die Phasen sind in der Reihenfolge über die gesamte Probandenpopulation randomisiert, wobei eine kurze dazwischenliegende Beobachtungszeit zwischen den Phasen besteht.
Das Feedback der Agentur und unseres Protokolls bestätigt unsere vorgeschlagene Studienpopulation und Dosierungsdauer. Darüber hinaus planen wir, die Studie an einem einzigen Standort als dreitägiges Crossover-Design mit Oliceridin, Placebo und Moxifloxacin als Positivkontrolle durchzuführen. Und wir haben einen Vertrag mit einer etablierten Auftragsforschungsorganisation abgeschlossen, mit der wir bei früheren gesunden Freiwilligenstudien mit Oliceridin zusammengearbeitet haben.
Das Feedback der Agentur zu unserem Analyseplan hat es uns auch ermöglicht, den notwendigen Gesamtstichprobenumfang für eine korrekte statistische Aussagekraft der Studie zu ermitteln. Wir planen, Daten von etwa 60 Teilnehmern einzureichen, wobei mindestens 20 dieser Teilnehmer eine Gesamtdosis von 27 Milligramm Oliceridin, der vorgeschlagenen maximalen Tagesdosis, erhalten. Wir freuen uns, dass wir mit der FDA eine Einigung über diese kritischen Studienelemente erzielt haben.
Insbesondere die Fähigkeit, dies bei einer gesunden Freiwilligenpopulation und dem gesamten Sam zu tun.
Insbesondere die Fähigkeit, dies bei einer gesunden Freiwilligenpopulation durchzuführen, und der erforderliche Stichprobenumfang insgesamt geben uns die Gewissheit, dass die Studie in relativ kurzer Zeit und kostengünstig abgeschlossen werden kann.
In den letzten Monaten hat das Team aktiv an der Vorbereitung der logistischen Details der Studie gearbeitet, während wir auf das Feedback der FDA warteten. Als Ergebnis dieser Bemühungen glauben wir, dass wir bereit und gut positioniert sind, diese Studie so schnell wie möglich, spätestens Ende Juni, zu starten. Unter der Annahme, dass diese zeitnahen Studien beginnen, gehen wir davon aus, dass wir im vierten Quartal dieses Jahres Umsatzdaten veröffentlichen werden.
Wie Carrie bereits erwähnte, blicken wir auch auf das zweite Halbjahr dieses Jahres, wenn wir über unsere Pläne nachdenken, unsere Pipeline voranzubringen und unsere Präsenz im ZNS-Raum auszubauen. Mit einem klaren Weg nach vorne bei Oliceridin sehen wir uns nun gut positioniert, um unsere Entwicklungssubstanzen voranzutreiben. Deshalb möchte ich mir ein paar Minuten Zeit nehmen, um die nächsten Schritte zu skizzieren, die wir für unsere drei Pipeline-Vermögenswerte planen.
Wir planen, eine Proof-of-Mechanismusstudie für TRV250, unseren neuartigen Delta-Rezeptor-Agonisten, der auf die potenzielle Behandlung akuter Migräne abzielt, irgendwann in der zweiten Hälfte dieses Jahres zu initiieren. Wir glauben, dass dies einen fokussierten und kosteneffektiven Ansatz für uns bieten wird, um das Zielengagement anhand eines validierten Biomarker-Modells zu bestimmen.
Ich möchte betonen, dass es sich hierbei nicht um eine große tagebuchbasierte Phase-2-Studie handelt, die Sie vielleicht mit Migränemedikamenten sehen können. Stattdessen würde dies die Verwendung eines Erwachsenen-Migräne-Modells mit tatsächlichen Migräneanfälligen als Studienteilnehmer nutzen.
Mit diesem neuartigen verzerrten Wirkmechanismus glauben wir, dass TRV250 ein großes Potenzial hat, der erste Delta-Rezeptor-Modulator zu sein, der diese Phase der klinischen Prüfung erreicht, ein bemerkenswerter Meilenstein für die Medikamentenentwicklung dieses pharmakologischen Ziels.
Unsere Zusammenarbeit mit der Intramural Research Group am National Institute on Drug Abuse oder NIDA bleibt aktiv, da sie TRV734, unseren oral verfügbaren neuen Rezeptor-Agonisten, der unserer Meinung nach eine vielversprechende Option für Patienten darstellt, die sich einer oralen Erhaltungstherapie wegen einer Opioidkonsumstörung unterziehen. Wir sind stolz darauf, diesen dringenden Bedarf durch diese wichtige Partnerschaft mit NIDA zu decken.
Schließlich planen wir, nach unserem jüngsten Erfolg bei der Identifizierung von TRV045 als Hauptkandidat in unserem S1P-Teamrezeptorprogramm, zusätzliche in vivo-Pharmakologie-Studien und andere Arbeiten zu initiieren, die notwendig sind, um unsere IND-Aktivitäten in diesem Jahr voranzutreiben.
Wir freuen uns sehr, diesen neuen Wirkmechanismus weiter zu erforschen, der unserer Meinung nach eine einzigartige Gelegenheit bietet, die Vorteile der direkten Ausrichtung des S1P-Rezeptors auf das zentrale Nervensystem zu nutzen. Wir glauben, dass TRV045 für eine ganz andere Reihe von klinischen Indikationen entwickelt werden könnte. Zum Beispiel als nicht-opioidbasierte Behandlungsoption bei chronischen Schmerzen. Letztendlich streben wir an, dieses Asset zu IND zu entwickeln, entweder durch einen potenziellen Partner oder durch uns selbst.
Ich möchte nun den Anruf an Carrie für einige abschließende Bemerkungen zurückverweisen.
Carrie Bourdow
Danke, Mark. Lassen Sie mich unsere Pläne zusammenfassen. Unsere Priorität bleibt Oliceridin. Mit dem Feedback der FDA werden wir die Studie spätestens Ende Juni starten, mit der Erwartung, dass wir im vierten Quartal dieses Jahres über Top-Line-Daten verfügen werden. Wir bleiben auch auf Kurs, um die beiden anderen nichtklinischen Punkte abzuschließen, um die uns die FDA bittet. Infolgedessen glauben wir, dass wir einen klaren Weg zu einer erfolgreichen Wiedereinreichung der NDA für Oliceridin haben.
Ebenfalls in der zweiten Hälfte dieses Jahres werden wir mit den Arbeiten beginnen, die Mark an den anderen Pipeline-Vermögenswerten erwähnt hat.
Lassen Sie mich damit mit einem kurzen Überblick über unsere Finanzen schließen. Wie wir in unserer Gewinnmitteilung vom Freitag bekannt gaben, verfügten wir zum 31. März über liquide Mittel und handelbare Wertpapiere in Höhe von 60,1 Mio. US-Dollar, von denen wir glauben, dass sie unsere Geschäftstätigkeit bis ins dritte Quartal 2020 finanzieren werden. Wichtig ist, dass diese Cash Runway unsere Einschätzung der Kosten für die gesunde Freiwilligenstudie und der erwarteten Kosten für die Entwicklungsarbeit, die wir mit den Pipeline-Vermögenswerten initiieren möchten, beinhaltet.
Ich möchte nun den Call for Questions eröffnen. Operator?
Frage-und-Antwort-Sitzung
Bediener
[Bedienungsanleitung]. Unsere erste Frage kommt aus der Linie von Jason Butler mit JMP Securities. Deine Leitung ist jetzt offen.
Nicht identifizierter Analyst
Hi, hier ist[Grant] für Jason, und danke, dass du unsere Frage beantwortet hast. Also, eine kurze Frage vielleicht können Sie auf die gesunde Freiwilligenstudie antworten. Also Daten im vierten Quartal, ist es möglich, dass Sie die NDA noch in diesem Jahr erneut eingereicht haben? Planst du das erste Quartal nächsten Jahres? Und dann auch auf der Studie, was ist die maximale Dosis, die der Patient in einer einzigen Verabreichung während der Studie erhält?
Carrie Bourdow
Ich werde mich mit dem Zeitplan für die Einreichung befassen. Guten Morgen, [Grant] vielen Dank für Ihre Frage. Also werden wir uns auf den Weg machen.
Ich werde mich mit dem Zeitplan für die Einreichung befassen. Guten Morgen, [Grant] vielen Dank für Ihre Frage. Also werden wir die Studie in Gang bringen und dann werden wir wiederkommen und alle über den Zeitplan für die Wiedervorlage informieren. Also im Moment, was wir sind - wie Sie wissen, melden sich diese Studien ziemlich schnell an, aber wir wollen wirklich anfangen. Und dann werde ich zurückkommen und über den Zeitplan für die Wiedervorlage informieren. Willst du den.... beantworten?
Mark Demitrack
Sicher. So gut, dass Sie auch die Frage nach der maximalen Einzeldosis gestellt haben, die ein Patient in der Studie erhalten würde. Und das Paradigma der Studiendosierung ist so konzipiert, dass es den Ansichten der Labels folgt, die wir im Entwurf des Labels für die FDA vorgeschlagen haben. Und unter diesen Umständen beträgt die maximale Einzeldosis 3 Milligramm Oliceridin. Über die 24 Stunden hinweg eine Gesamtdosis von 27 Milligramm, was wiederum die maximale Tagesdosis ist.
Nicht identifizierter Analyst
Und dann für TRV250, werden Sie diesen Nachweis der Mechanikstudie in der zweiten Hälfte beginnen. Sollten wir davon in der ersten Hälfte des 20. bis 2020 Daten erwarten? Kannst du uns einen Eindruck davon vermitteln?
Mark Demitrack
Sicherlich werden die Daten im Jahr 2020 vorliegen. Wir sind an dieser Stelle einfach nicht in der Lage, eine klare Aussage über den Endpunkt der Studie zu machen. Ich gehe davon aus, dass wir in den kommenden Monaten viel mehr Klarheit über den Zeitplan der Meilensteine für dieses Projekt haben werden.
Nicht identifizierter Analyst
Es tut mir so leid, dass ich auf Oliceridin zurückkomme. Aber ihr seid Partner in China und Korea, habt ihr Jungs schon einen Eindruck von den Zeitplänen für diese Programme? Und was denkt ihr über andere Geografien nach, wie, was denkt ihr jetzt über Europa? Danke.
Carrie Bourdow
Ja. Also haben wir -- ja, wir haben eine Partnerschaft mit Nhwa in China und PharmBio in Südkorea. Und wir sind mit ihnen zusammen, wir führen produktive Gespräche, wir haben einen gemeinsamen Entwicklungsausschuss, aber noch keine wirklichen Updates über den Zeitplan. Das liegt wirklich an ihnen, die mit ihren Regulierungsbehörden zusammenarbeiten. Und wir prüfen aktiv weitere Ex-US-Partnerschaften, aber noch ist nichts veraltet.
Bediener
Unsere nächste Frage kommt aus der Linie von Douglas Tsao mit H.C. Wainwright. Deine Leitung ist jetzt offen.
Douglas Tsao
Nur Bob, wenn Sie etwas mehr Farbe in Bezug auf die Endpunkte für die Proof-of-Mechanismus-Studie liefern könnten? Und dann ist meine zweite Frage der S1P-Modulator. Nur neugierig, ist diese Arbeit, die Sie vorhersehen, genau mit dem IND Enabling zu machen, oder ist das nur, um eine Art mehr Beweis für die Konzept-Tierarbeit zu sein?
Carrie Bourdow
Mark?
Mark Demitrack
Sicher. Ja. Es ist Mark Demitrack. Die TRV250-Endpunkte, die wir in der Vergangenheit diskutiert haben, habe ich in meinen Bemerkungen nicht offiziell erwähnt, dass wir ein validiertes Modell entwickelt haben, das eine Nitroglycerin-Herausforderung als evozierte Migräneintervention verwendet. Die Endpunkte, da dies bei echten Migränepatienten geschieht, sind also die Lösung eines evozierten Kopfschmerzes. Dieses Modell wurde validiert, um zu zeigen, dass der späte Kopfschmerz bei Migräneanfällen für unsere praktischen Zwecke genauso ist wie eine spontan auftretende Migräne im Leben. Wir würden also nach einer Lösung der Kopfschmerzen als Endpunkt in dieser Studie suchen.
Sie hatten auch nach 045 gefragt, der S1P-Mischung. Und diese Arbeit, die ich skizziert habe, wie ich bereits erwähnte, ist IND-aktivierende Arbeit. So haben wir Ende des Jahres einen Hauptkandidaten in diesem Programm angekündigt, das ist das Molekül 045. Und wir sind im Prozess und in den frühen Phasen des Weges entlang der IND ermöglicht Arbeit, um die Einreichung der IND. Ich bin heute nicht in der Lage, Ihnen ein genaues Datum zu nennen, da es offensichtlich sehr früh in der Entwicklung des Programms ist. Aber während es fortschreitet, werden wir ein wenig mehr Klarheit darüber bekommen, wann wir erwarten, dass uns der Zeitpunkt der tatsächlichen IND zur Verfügung steht.
Douglas Tsao
Okay, großartig. Und dann schätze ich, vielleicht eine Folgefrage für Carrie, ich meine, du hast offensichtlich eine Menge Programme, die in den Anfangsphasen laufen. Ist es, haben Sie begonnen, über eine Art Sequenzierung und Priorisierung einer dieser Verbindungen nachzudenken, sicherlich in Bezug auf eine Art des Denkens über die Art der Finanzierung der Entwicklungsarbeit?
Carrie Bourdow
Ja, große Frage. Wie wir bereits sagten, ist unsere Priorität offensichtlich Oliceridin. Und wenn wir uns die Pipeline-Vermögenswerte ansehen, wenn wir uns die Markteinschätzungen ansehen, wenn wir potenzielle Interessen anderer Partner betrachten, wenn wir noch nicht unsere zweite Art von Fokus erklärt haben, dann sind TRV250, 734 offensichtlich weiter fortgeschritten, aber das S1P-Modulatorprogramm ist ein wirklich spannendes Programm. Bleiben Sie also dran für weitere Diskussionen rund um die Pipeline im kommenden Call.
Bediener
Ich danke dir. Wir haben zur Zeit keine weiteren Fragen in der Warteschlange. Ich möchte nun den Anruf an Carrie Bourdow für weitere Bemerkungen zurückverweisen.
Carrie Bourdow
Ich danke dir. Ich danke Ihnen allen für Ihre Fragen. Wir werden im Laufe des Jahres weiterhin Updates mit Ihnen teilen. Es ist eine aufregende Zeit in Trevena. Wie Sie gehört haben, leisten wir wichtige Arbeit, und wir setzen uns weiterhin dafür ein, neuartige Medikamente für Patienten zu entwickeln, die von ZNS-Bedingungen betroffen sind. Ich danke euch allen
Bediener
Meine Damen und Herren, vielen Dank für Ihre Teilnahme an der heutigen Konferenz. Damit endet das heutige Programm. Sie können alle die Verbindung trennen. Ich wünsche euch allen einen schönen Tag.
Übersetzt mit www.DeepL.com/Translator
https://seekingalpha.com/article/4263510-trevena-inc-trvn-ce…
Analyst Ratings Summary
https://seekingalpha.com/symbol/TRVN/ratings/sell-side-ratin…
.....noch einmal eine frage in die runde bitte....nachdem ich ende letzter woche noch einmal aufgestockt habe und die nachbesserungs-studie für oliceridin erst bis zum 2.Q 2019 beginnen sollte , bis wann müsste man damit rechnen , bie diese phase beendet sein sollte und zum wiederholtem male bei der FDA eingereicht werden könnnte . DANKE....
Vergleich von DelMar Pharmaceuticals Inc. (DMPI) und Trevena Inc. (NASDAQ: TRVN)
ZusammenfassungTrevena Inc. schlägt 6 der 10 Faktoren DelMar Pharmaceuticals Inc.
DelMar Pharmaceuticals, Inc., ein Arzneimittelentwicklungsunternehmen im klinischen Stadium, konzentriert sich auf die Entwicklung und Vermarktung von Krebstherapien zur Behandlung von Krebspatienten, die auf eine moderne Therapie nicht angesprochen haben. Der Produktkandidat umfasst VAL-083, ein niedermolekulares Chemotherapeutikum, das die Phase I / II-Studie abgeschlossen hat, um die Sicherheit, Verträglichkeit, Pharmakokinetik und Antikrebsaktivität bei Patienten mit Glioblastoma multiforme, einer Form von Hirntumor, zu bewerten. Das Unternehmen unterhält eine strategische Zusammenarbeit mit Guangxi Wuzhou Pharmaceutical Company für die Herstellung und den Verkauf von VAL-083 in China. Kooperationsvereinbarung mit dem MD Anderson Cancer Center der University of Texas; und Kooperationsvereinbarung mit Accurexa Inc. zur Entwicklung einer neuartigen Formulierung für die lokale Verabreichung einer Kombinationschemotherapie zur Behandlung von Hirntumor und anderen soliden Tumoren. DelMar Pharmaceuticals, Inc. wurde 2009 gegründet und hat seinen Hauptsitz in Vancouver, Kanada.
Trevena, Inc., ein biopharmazeutisches Unternehmen, entwickelt verschiedene Therapien, die auf bahnbrechenden wissenschaftlichen Erkenntnissen beruhen und Patienten und Gesundheitsdienstleistern zugute kommen, die unter schwerwiegenden Erkrankungen leiden. Zu den Produktkandidaten zählen die Oliceridin-Injektion, ein selektiver Modulator des µ-Rezeptor-G-Proteinwegs, der sich in klinischen Phase-III-Studien zur Behandlung mittelschwerer bis schwerer akuter Schmerzen befindet, bei denen die intravenöse Verabreichung bevorzugt wird. TRV250, ein mit G-Protein vorgespannter Ligand, der auf den d-Rezeptor abzielt, der sich in der präklinischen Entwicklung für die Behandlung von Migräne befindet; und TRV734, ein mit einem kleinen Molekül G-Protein vorgespannter Ligand am mu-Rezeptor, der sich in klinischen Phase-I-Studien zur Behandlung mittelschwerer bis schwerer akuter und chronischer Schmerzen befindet, sowie TRV027 zur Behandlung akuter Herzinsuffizienz. Trevena, Inc. wurde 2007 gegründet und hat seinen Hauptsitz in King of Prussia, Pennsylvania.
https://nbonews.com/comparing-of-delmar-pharmaceuticals-inc-…
....jetzt wird wohl doch noch schneller als erwartet die 1,- euro-marke getestet und vielleicht sogar noch weit darunter . (siehe heute in frankf.) zum nachkaufen eigentlich nicht schlecht , fragt sich nur wann und zu welchem kurs , aber n m M. denn die kurse werden eh in übersee gestellt...!!!!
...mit frankf. meinte ich lediglich den heutigen geldkurs von 0,75 euro .....
Antwort auf Beitrag Nr.: 60.652.919 von herthafan am 24.05.19 16:54:55
Bei 50 Cent würde ich hier wieder einsteigen.
Zitat von herthafan: ...mit frankf. meinte ich lediglich den heutigen geldkurs von 0,75 euro .....
Bei 50 Cent würde ich hier wieder einsteigen.
Antwort auf Beitrag Nr.: 60.659.175 von Mammut22 am 25.05.19 14:24:55....erstaunlicher abwärtstrend zu verzeichnen , ist wohl doch noch der anschlussstudie zu verschulden die ja bekannter weise erst im juni 19 beginner sollte und hoffentlich noch in diesem jahr erfolgreich beendet werden könnte....hoffentlich.....
Investorenpräsentationen
20. Juni 2019 13:30 Uhr EDTJMP Securities Life Sciences Konferenz
5. Juni 2019 15:45 EDT
2019 BIO International Convention
https://investors.trevena.com/events-and-presentations/event…
....habe in der letzten woche noch einmal schön aufgestockt , mittelwert nun 1,25 euro . der käufer von gestern mit seinen 10.000 shares muss sich aber der storry von trev. sehr , sehr sicher gewesen sein , ansonsten ist wohl diese größenordnung in der jetzigen situation schon sehr ungewöhnlich . die zusatzstudie beginnt wohl noch in diesem monat , zumindestens nach den letzten infos von trevena.....na dann mal viel erfolg.....
Antwort auf Beitrag Nr.: 60.552.078 von onkelen am 13.05.19 09:57:15
....müsste ja dann demnächst mal etwas dazu kommen nach all de warterei . hoffe das nach der studie die FDA endlich zum positivem entscheid kommen sollte . auf dem bestem wege sollte man ja , lt. statement vom trevena , schon sein . hört sich alles ziemlich an zum positivem , hoffentlich bemerken es die amis ebenso schnell , denn da werden schließlich die kurse gestellt.....good lucky ihr amis....
Zitat von onkelen: us forum...
Hoffentlich sehen wir morgen mehr als 2,00 US-Dollar und mehr als 3,57 US-Dollar nach den Nachrichten über erfolgreiche QT-Studien und Wiedervorlagen im nächsten Monat.
....müsste ja dann demnächst mal etwas dazu kommen nach all de warterei . hoffe das nach der studie die FDA endlich zum positivem entscheid kommen sollte . auf dem bestem wege sollte man ja , lt. statement vom trevena , schon sein . hört sich alles ziemlich an zum positivem , hoffentlich bemerken es die amis ebenso schnell , denn da werden schließlich die kurse gestellt.....good lucky ihr amis....
Das Unternehmen ist weiterhin auf dem richtigen Weg, Daten für die Topline zu melden
CHESTERBROOK, Pa., 20. Juni 2019 (GLOBE NEWSWIRE) - Trevena, Inc. (Nasdaq: TRVN) („Trevena“ oder das „Unternehmen“), ein biopharmazeutisches Unternehmen, das sich auf die Entwicklung und Vermarktung neuartiger Arzneimittel für Patienten mit konzentriert Wie heute bekannt wurde, hat das Unternehmen die freiwillige QT-Intervallstudie für Oliceridin, den führenden Wirkstoffkandidaten des Unternehmens zur Behandlung mittelschwerer bis schwerer akuter Schmerzen, gestartet. Das Unternehmen ist nach wie vor auf dem Weg, im vierten Quartal 2019 Daten für die Topline zu melden, und geht derzeit davon aus, dass es den neuen Arzneimittelantrag (New Drug Application, NDA) für Oliceridin so früh wie möglich im ersten Quartal 2020 erneut einreichen wird."Nachdem wir Mitte Mai von der FDA ein Feedback zu unserem vorgeschlagenen Protokoll für gesunde Freiwilligenstudien und einem statistischen Analyseplan erhalten hatten, stellte das Team die Details schnell fertig, um einen rechtzeitigen Beginn der Studie zu gewährleisten", sagte Carrie Bourdow, President und CEO. "Ich möchte das Team für die beachtliche Arbeit loben, die es geleistet hat, um sicherzustellen, dass wir diesen wichtigen Meilenstein rechtzeitig erreicht haben, und wir freuen uns darauf, die wichtigen Arbeiten für eine erfolgreiche Wiedervorlage der NDA für Oliceridin abzuschließen."
Primäres Ziel der Studie ist es, die zusätzlichen QT-Intervalldaten zu sammeln, die von der US-amerikanischen Food and Drug Administration (FDA) für die erneute Einreichung der NDA für Oliceridin angefordert wurden. Die Studie wird an gesunden Freiwilligen an einem einzigen Standort als dreistufiges Crossover-Design durchgeführt. Jeder Proband wird nach dem Zufallsprinzip über alle drei Untersuchungszeiträume hinweg sequenziert: Oliceridin, Placebo und Moxifloxacin als Positivkontrolle. Zwischen den einzelnen Perioden tritt ein kurzes, behandlungsfreies Auswaschen auf. Elektrokardiogramme für alle Probanden werden während der gesamten Studie strengstens erstellt. Das Unternehmen plant, Daten zu ungefähr 60 gesunden Freiwilligen einzureichen. In dieser Studienpopulation erhalten mindestens 20 Probanden eine kumulative Dosis von 27 mg, die vorgeschlagene maximale Tagesdosis von Oliceridin.
http://www.globenewswire.com/news-release/2019/06/20/1871738…
Trevena + 6% Premarket als Oliceridin-Studie beginnt
20. Juni 2019 08:19 ET | Über: Trevena, Inc. (TRVN) | Von: Mamta Mayani , SA NachrichtenredakteurTrevena (NASDAQ: TRVN ) hat die QT-Intervallstudie für gesunde Probanden für Oliceridin, einen Wirkstoffkandidaten zur Behandlung von mittelschweren bis schweren akuten Schmerzen, gestartet.
Das Unternehmen geht davon aus, dass im vierten Quartal Daten vorliegen und im ersten Quartal 2020 erneut die NDA (New Drug Application) für Oliceridin eingereicht werden.
Das primäre Ziel der Studie ist die Erfassung der zusätzlichen QT-Intervalldaten, die von der FDA für die erneute Einreichung der NDA für Oliceridin angefordert wurden. Die Studie wird an gesunden Freiwilligen an einem einzigen Standort als dreistufiges Crossover-Design durchgeführt.
Trevena plant, Daten zu rd. 60 Freiwillige.
Aktien sind um 6% vor dem Börsengang gestiegen.
https://seekingalpha.com/news/3472628-trevena-plus-6-percent…
Trevena gibt die Einleitung einer Studie für gesunde Freiwillige für Oliceridin bekannt
Das Unternehmen ist weiterhin auf dem richtigen Weg, um im vierten Quartal 2019 Daten für die Topline zu melden6/20/19
Trevena, Inc. (Nasdaq: TRVN) („Trevena“ oder das „Unternehmen“), ein biopharmazeutisches Unternehmen, das sich auf die Entwicklung und Vermarktung neuartiger Arzneimittel für Patienten mit Erkrankungen des Zentralnervensystems konzentriert, gab heute bekannt, dass es den gesunden freiwilligen QT initiiert hat Intervallstudie zu Oliceridin, dem führenden Wirkstoffkandidaten des Unternehmens zur Behandlung von mittelschweren bis schweren akuten Schmerzen. Das Unternehmen ist nach wie vor auf dem Weg, im vierten Quartal 2019 Daten für die Topline zu melden, und geht derzeit davon aus, dass es den neuen Arzneimittelantrag (New Drug Application, NDA) für Oliceridin so früh wie möglich im ersten Quartal 2020 erneut einreichen wird.
"Nachdem wir Mitte Mai von der FDA ein Feedback zu unserem vorgeschlagenen Protokoll für gesunde Freiwilligenstudien und einem statistischen Analyseplan erhalten hatten, stellte das Team die Details schnell fertig, um einen rechtzeitigen Beginn der Studie zu gewährleisten", sagte Carrie Bourdow, President und CEO. "Ich möchte das Team für die beachtliche Arbeit loben, die es geleistet hat, um sicherzustellen, dass wir diesen wichtigen Meilenstein rechtzeitig erreicht haben, und wir freuen uns darauf, die wichtigen Arbeiten für eine erfolgreiche Wiedervorlage der NDA für Oliceridin abzuschließen."
Primäres Ziel der Studie ist es, die zusätzlichen QT-Intervalldaten zu sammeln, die von der US-amerikanischen Food and Drug Administration (FDA) für die erneute Einreichung der NDA für Oliceridin angefordert wurden. Die Studie wird an gesunden Freiwilligen an einem einzigen Standort als dreistufiges Crossover-Design durchgeführt. Jeder Proband wird nach dem Zufallsprinzip über alle drei Untersuchungszeiträume hinweg sequenziert: Oliceridin, Placebo und Moxifloxacin als Positivkontrolle. Zwischen den einzelnen Perioden tritt ein kurzes, behandlungsfreies Auswaschen auf. Elektrokardiogramme für alle Probanden werden während der gesamten Studie strengstens erstellt. Das Unternehmen plant, Daten zu ungefähr 60 gesunden Freiwilligen einzureichen. In dieser Studienpopulation erhalten mindestens 20 Probanden eine kumulative Dosis von 27 mg, die vorgeschlagene maximale Tagesdosis von Oliceridin.
https://www.trevena.com/news-details.php?id=226
Antwort auf Beitrag Nr.: 60.857.266 von onkelen am 21.06.19 06:59:10....also vollkommen richtig so, wie bereits beschrieben , vollkommen im vorprogrammiertem trend . was mich etwas verwundert ist die tatsache , dass der kurs nachläßt , anstatt positiv auf den weiteren weg zu reagieren . kommt zeit , kommt rat , kommt fda so wie z,B, gestern bei palatin . glückwunsch und blicke in die zukunft jetzt für trevena , denn ihre zeit kommt auch noch , in ca. 6 monaten spekulieren wir bestimmt auch schon über zulassungspläne seitens der FDA.....bereits jetzt schon mal viel glück.....
Antwort auf Beitrag Nr.: 60.867.034 von herthafan am 22.06.19 11:52:55Studienergebnisse sind positiv!
Der primäre Endpunkt der Studie wurde erreicht: Der Anteil der Patienten, die auf die Behandlung ansprachen, war in allen Behandlungsregimen mit Oliceridin statistisch signifikant höher als bei Placebo.
• Die Ergebnisse zeigten, dass die Analgesie mit Oliceridin schnell einsetzte und dass der Anteil der Patienten, die auf die Behandlung ansprachen, in den beiden höheren Oliceridin-Dosierungsschemata ähnlich war wie bei Patienten, die Morphin erhielten.
https://ih.advfn.com/stock-market/NASDAQ/trevena-inc-TRVN/s…
Gruß aaahhh
Der primäre Endpunkt der Studie wurde erreicht: Der Anteil der Patienten, die auf die Behandlung ansprachen, war in allen Behandlungsregimen mit Oliceridin statistisch signifikant höher als bei Placebo.
• Die Ergebnisse zeigten, dass die Analgesie mit Oliceridin schnell einsetzte und dass der Anteil der Patienten, die auf die Behandlung ansprachen, in den beiden höheren Oliceridin-Dosierungsschemata ähnlich war wie bei Patienten, die Morphin erhielten.
https://ih.advfn.com/stock-market/NASDAQ/trevena-inc-TRVN/s…
Gruß aaahhh
Antwort auf Beitrag Nr.: 60.876.891 von aaahhh am 24.06.19 13:52:44Das hört sich doch alles sehr gut an.
Studienzusammenfassung und Hauptergebnisse:
In APOLLO-2, einer randomisierten, doppelblinden, placebokontrollierten und aktiv kontrollierten Phase-3-Studie, wurden 401 Patienten nach Abdominoplastik 24 Stunden lang entweder Oliceridin, Morphin oder Placebo intravenös (iv) verabreicht.
Es gab drei Dosierungsschemata für Oliceridin (0,1 mg, 0,35 mg und 0,5 mg) und eines für Morphin (1 mg), die jeweils vom Patienten selbst verabreicht wurden, um die Schmerzen zu kontrollieren.
Der primäre Endpunkt der Studie wurde erreicht: Der Anteil der Patienten, die auf die Behandlung ansprachen, war in allen Behandlungsplänen mit Oliceridin statistisch signifikant höher als bei Placebo.
Die Ergebnisse zeigten, dass die Analgesie mit Oliceridin schnell einsetzte und der Anteil der Therapieantworter in den beiden höheren Oliceridin-Dosierungsschemata ähnlich war wie bei Patienten, die Morphin erhielten.
Die in der Studie am häufigsten berichteten unerwünschten Ereignisse waren Übelkeit, Erbrechen, Schläfrigkeit und Kopfschmerzen.
Der Anteil der Patienten mit einem respiratorischen Sicherheitsereignis war in allen Oliceridin-Behandlungsgruppen im Vergleich zu Morphin geringer, obwohl dieser Unterschied keine statistische Signifikanz erreichte.
Die Daten zur Wirksamkeit, Sicherheit und Verträglichkeit dieser Studie stimmen mit den Daten überein, die in früheren veröffentlichten klinischen Studien zu intravenös verabreichtem Oliceridin ermittelt wurden, und legen nahe, dass Oliceridin eine wichtige neue therapeutische Alternative für die Behandlung von Patienten mit mittelschweren bis schweren akuten Schmerzen bei intravenös verabreichten Patienten darstellt Opioid ist gerechtfertigt.
Studienzusammenfassung und Hauptergebnisse:
In APOLLO-2, einer randomisierten, doppelblinden, placebokontrollierten und aktiv kontrollierten Phase-3-Studie, wurden 401 Patienten nach Abdominoplastik 24 Stunden lang entweder Oliceridin, Morphin oder Placebo intravenös (iv) verabreicht.
Es gab drei Dosierungsschemata für Oliceridin (0,1 mg, 0,35 mg und 0,5 mg) und eines für Morphin (1 mg), die jeweils vom Patienten selbst verabreicht wurden, um die Schmerzen zu kontrollieren.
Der primäre Endpunkt der Studie wurde erreicht: Der Anteil der Patienten, die auf die Behandlung ansprachen, war in allen Behandlungsplänen mit Oliceridin statistisch signifikant höher als bei Placebo.
Die Ergebnisse zeigten, dass die Analgesie mit Oliceridin schnell einsetzte und der Anteil der Therapieantworter in den beiden höheren Oliceridin-Dosierungsschemata ähnlich war wie bei Patienten, die Morphin erhielten.
Die in der Studie am häufigsten berichteten unerwünschten Ereignisse waren Übelkeit, Erbrechen, Schläfrigkeit und Kopfschmerzen.
Der Anteil der Patienten mit einem respiratorischen Sicherheitsereignis war in allen Oliceridin-Behandlungsgruppen im Vergleich zu Morphin geringer, obwohl dieser Unterschied keine statistische Signifikanz erreichte.
Die Daten zur Wirksamkeit, Sicherheit und Verträglichkeit dieser Studie stimmen mit den Daten überein, die in früheren veröffentlichten klinischen Studien zu intravenös verabreichtem Oliceridin ermittelt wurden, und legen nahe, dass Oliceridin eine wichtige neue therapeutische Alternative für die Behandlung von Patienten mit mittelschweren bis schweren akuten Schmerzen bei intravenös verabreichten Patienten darstellt Opioid ist gerechtfertigt.
Antwort auf Beitrag Nr.: 60.883.221 von Carola11 am 25.06.19 08:59:24https://doi.org/10.1111/papr.12801 verfügbar ." target="_blank" rel="nofollow ugc noopener">Die Veröffentlichung: „APOLLO-2: Eine randomisierte, placebokontrollierte Phase-III-Studie zur Untersuchung von Oliceridin (TRV130), einem G-Protein-abhängigen Liganden am µ-Opioid-Rezeptor, zur Behandlung von mittelschweren bis schweren akuten Schmerzen nach Abdominoplastik“, Der Hauptautor, Dr. Neil Singla, CEO von Lotus Clinical Research, ist online unter https://doi.org/10.1111/papr.12801 verfügbar .
Quelle: Finanznachrichten.de vom 24.6.2019
Quelle: Finanznachrichten.de vom 24.6.2019
Antwort auf Beitrag Nr.: 60.884.217 von Carola11 am 25.06.19 11:00:09www.trevena.com/trevena-pipeline.php





Hallo Carola,
Welches Kursziel siehst du bis zum Zulassungsentscheid bzw. nach evtl. erfolgter Zulassung von Oliciredine?
Danke 🙏
Welches Kursziel siehst du bis zum Zulassungsentscheid bzw. nach evtl. erfolgter Zulassung von Oliciredine?
Danke 🙏
Antwort auf Beitrag Nr.: 60.888.327 von Stoxtrayder am 25.06.19 17:52:02Da Oliceridin eine wichtige neue therapeutische Alternative für die Behandlung von Patienten mit mittelschweren bis schweren akuten Schmerzen bei intravenös verabreichten Patienten darstellt.
Ich würde sagen, wenn ich in meine Glaskugel schaue, das der Kurs nun wieder Richtung Norden
geht und es stetig bis zur NDA - Entscheidung bis auf 3-4 $ gehen kann. Nach der Zulassung wären
Kurse so um die 12 $ bis ? ?? nach oben offen. Es ist für mich schwierig eine Prognose abzugeben.
Wie seht ihr das? Denn es hängt ja noch von vielen anderen Faktoren ab.
Ich würde sagen, wenn ich in meine Glaskugel schaue, das der Kurs nun wieder Richtung Norden
geht und es stetig bis zur NDA - Entscheidung bis auf 3-4 $ gehen kann. Nach der Zulassung wären
Kurse so um die 12 $ bis ? ?? nach oben offen. Es ist für mich schwierig eine Prognose abzugeben.
Wie seht ihr das? Denn es hängt ja noch von vielen anderen Faktoren ab.

Ok, werde wohl auch mal wieder ein paar Anteile demnächst erwerben. Gehe auch mit deiner Meinung einher, daß der Markt für Oliciderin auf jeden Fall sehr groß ist...
Hatte letztes Jahr Ende Oktober beim Absturz für 1,20$ gekauft und in März mit knapp 30% Plus verkauft.
Wie lange hat Trevena noch Cash bzw. reicht dieser bis zur evtl. kommenden Zulassung?
PS: Wieviel Prozent Depotanteil macht Sirona & Trevena bei dir aus, wenn ich fragen darf? 😉
Hatte letztes Jahr Ende Oktober beim Absturz für 1,20$ gekauft und in März mit knapp 30% Plus verkauft.
Wie lange hat Trevena noch Cash bzw. reicht dieser bis zur evtl. kommenden Zulassung?
PS: Wieviel Prozent Depotanteil macht Sirona & Trevena bei dir aus, wenn ich fragen darf? 😉
60 Mio. $ noch in der Kasse 👍
Warum hat der Kurs von der Meldung am 24.6. nicht mehr proftieren können deiner Meinung nach, Carola?
Warum hat der Kurs von der Meldung am 24.6. nicht mehr proftieren können deiner Meinung nach, Carola?
Antwort auf Beitrag Nr.: 60.889.662 von Stoxtrayder am 25.06.19 20:19:04Trevena ist einfach nicht so bekannt, wie Sirona. Das sieht man bei W schon an den Postings.
schon an den Postings.
Sirona Seiten (1381) Trevena (91). Aber das kann sich ja alles noch ändern.
Wenn man den Markt für Schmerzpatienten analysiert, glaube ich das er weit größer ist, als der Markt für Vitiligopatienten (Clinuvel) die jetzt z.Zt. so um die 22 Euro steht.
Marketingarbeit ist für die Unternehmen das A & O. Clinuvel hat den Fürsprecher Florian Homm, der, wie er sagt, selbst keine Aktien davon hält. Dennoch stieg die Aktie von 3 Euro auf ca. 22 Euro.
Die Hompages von Trevena ist auf dem neusten Stand und es läuft bei dem Unternehmen alles planmäßig. Der Boden ist gefunden und es geht wieder gen Norden.
Vielleicht kann Ahhhhhhhhhh mich hier noch ergänzen oder seine Sicht der Dinge ausführen.
 schon an den Postings.
schon an den Postings.Sirona Seiten (1381) Trevena (91). Aber das kann sich ja alles noch ändern.
Wenn man den Markt für Schmerzpatienten analysiert, glaube ich das er weit größer ist, als der Markt für Vitiligopatienten (Clinuvel) die jetzt z.Zt. so um die 22 Euro steht.
Marketingarbeit ist für die Unternehmen das A & O. Clinuvel hat den Fürsprecher Florian Homm, der, wie er sagt, selbst keine Aktien davon hält. Dennoch stieg die Aktie von 3 Euro auf ca. 22 Euro.
Die Hompages von Trevena ist auf dem neusten Stand und es läuft bei dem Unternehmen alles planmäßig. Der Boden ist gefunden und es geht wieder gen Norden.
Vielleicht kann Ahhhhhhhhhh mich hier noch ergänzen oder seine Sicht der Dinge ausführen.
Antwort auf Beitrag Nr.: 60.890.757 von Carola11 am 25.06.19 22:34:35Habe bezüglich im Vergleich mit Sirona noch etwas Entscheidendes vergessen.
Sirona braucht keine FDA-Zulassung, da der Hautaufheller als Kosmetik gewertet wird
und ein Deal mit den Chinesen schon so gut wie unterschrieben ist.
Trevena Phase 3 ist bestanden und Trevena wird die Zulassung meistern.
Dann sehen wir hier auch weit aus höhere Kurse Sie stand ja schon einmal bei 12 Euro
Sie stand ja schon einmal bei 12 Euro
und da war die Forschung/Entwicklung noch nicht so weit wie jetzt.
Sirona braucht keine FDA-Zulassung, da der Hautaufheller als Kosmetik gewertet wird
und ein Deal mit den Chinesen schon so gut wie unterschrieben ist.
Trevena Phase 3 ist bestanden und Trevena wird die Zulassung meistern.

Dann sehen wir hier auch weit aus höhere Kurse
 Sie stand ja schon einmal bei 12 Euro
Sie stand ja schon einmal bei 12 Euround da war die Forschung/Entwicklung noch nicht so weit wie jetzt.

Antwort auf Beitrag Nr.: 60.890.982 von Carola11 am 25.06.19 23:11:39Habe ich heute in einem Forum gefunden: Sprüche von Warren Buffet
“Seien Sie ängstlich, wenn die Welt gierig ist und seien Sie gierig, wenn die Welt ängstlich ist.”
“Wenn ein Unternehmen gut läuft, wird die Aktie letztendlich folgen.”
“Die Frage, wie man reich wird, ist leicht zu beantworten. Kaufe einen Dollar, aber bezahle nicht mehr als 50 Cent dafür.”
“Konzentrieren Sie Ihre Investments. Wenn Sie über einen Harem mit vierzig Frauen verfügen, lernen Sie keine richtig kennen.”
“Die meisten Leute interessieren sich für Aktien, wenn alle es tun. Die beste Zeit ist aber, wenn sich niemand für Aktien interessiert.”
“Investiere nur in eine Aktie, deren Geschäft du auch verstehst.”
“Man sollte nur in Firmen investieren, die auch ein absoluter Vollidiot leiten kann, denn eines Tages wird genau das passieren!”
“Es ist bei weitem besser, ein herausragendes Unternehmen zu einem anständigen Preis zu kaufen, als ein anständiges Unternehmen zu einem herausragenden Preis.”
“Eine Aktie, die man nicht 10 Jahre zu halten bereit ist, darf man auch nicht 10 Minuten besitzen.”
“Der erfolgreiche Investor hat sehr viel Geduld, er kauft weit unter dem fairen Wert und verkauft weit über dem fairen Wert.”
“Reich wird, wer in Unternehmen investiert, die weniger kosten, als sie wert sind.”
“Zeit ist der Freund von wunderbaren Unternehmen und der Feind von mittelmäßigen Unternehmen.” “Wenn jemand gute Aktien hat, wäre er verrückt, wenn er nur wegen eines Kursrückschlags verkaufen würde. Ich suche Unternehmen, die ich verstehe und von deren Zukunftsaussichten überzeugt bin.” “Kaufe nie eine Aktie, wenn du nicht damit leben kannst, dass sich der Kurs halbiert.”
“Seien Sie ängstlich, wenn die Welt gierig ist und seien Sie gierig, wenn die Welt ängstlich ist.”
“Wenn ein Unternehmen gut läuft, wird die Aktie letztendlich folgen.”
“Die Frage, wie man reich wird, ist leicht zu beantworten. Kaufe einen Dollar, aber bezahle nicht mehr als 50 Cent dafür.”
“Konzentrieren Sie Ihre Investments. Wenn Sie über einen Harem mit vierzig Frauen verfügen, lernen Sie keine richtig kennen.”
“Die meisten Leute interessieren sich für Aktien, wenn alle es tun. Die beste Zeit ist aber, wenn sich niemand für Aktien interessiert.”
“Investiere nur in eine Aktie, deren Geschäft du auch verstehst.”
“Man sollte nur in Firmen investieren, die auch ein absoluter Vollidiot leiten kann, denn eines Tages wird genau das passieren!”
“Es ist bei weitem besser, ein herausragendes Unternehmen zu einem anständigen Preis zu kaufen, als ein anständiges Unternehmen zu einem herausragenden Preis.”
“Eine Aktie, die man nicht 10 Jahre zu halten bereit ist, darf man auch nicht 10 Minuten besitzen.”
“Der erfolgreiche Investor hat sehr viel Geduld, er kauft weit unter dem fairen Wert und verkauft weit über dem fairen Wert.”
“Reich wird, wer in Unternehmen investiert, die weniger kosten, als sie wert sind.”
“Zeit ist der Freund von wunderbaren Unternehmen und der Feind von mittelmäßigen Unternehmen.” “Wenn jemand gute Aktien hat, wäre er verrückt, wenn er nur wegen eines Kursrückschlags verkaufen würde. Ich suche Unternehmen, die ich verstehe und von deren Zukunftsaussichten überzeugt bin.” “Kaufe nie eine Aktie, wenn du nicht damit leben kannst, dass sich der Kurs halbiert.”
Trevena ernennt Barry Shin zum Finanzvorstand
Email Druck freundlich Aktie27. Juni 2019 07:00 ET | Quelle: Trevena Inc.
CHESTERBROOK, Pa., 27. Juni 2019 (GLOBE NEWSWIRE) - Trevena, Inc. (Nasdaq: TRVN), ein biopharmazeutisches Unternehmen, das sich auf die Entwicklung und Vermarktung neuartiger Arzneimittel für Patienten mit Erkrankungen des Zentralnervensystems (ZNS) konzentriert, gab heute bekannt die Ernennung von Barry Shin zum Chief Financial Officer. Herr Shin verfügt über mehr als 17 Jahre Erfahrung im Investment Banking und in der Unternehmensberatung mit Schwerpunkt im Bereich Biopharmazeutika.
"Wir freuen uns sehr, dass Barry an diesem aufregenden Punkt unseres Fortschritts zum Trevena-Team stößt", sagte Carrie Bourdow. „Wir haben mehrere wichtige Meilensteine in naher Zukunft in Sicht, darunter den Erhalt von Top-Line-Daten aus unserer laufenden QT-Studie für gesunde Freiwillige für Oliceridin im vierten Quartal dieses Jahres, gefolgt von einer erneuten Einreichung der NDA. Barrys strategische und finanzielle Erfahrung wird von unschätzbarem Wert sein, wenn wir Oliceridin und unser innovatives Portfolio an CNS-Assets weiterentwickeln. “
"Ich freue mich sehr, dem hervorragenden Führungsteam von Trevena beizutreten", sagte Barry Shin. "Ich freue mich darauf, Teil des Unternehmenswachstums zu sein, da es Patienten in Not wichtige neue Therapiemöglichkeiten bietet, angefangen bei Oliceridin."
Herr Shin verfügt bei Trevena über umfangreiche Erfahrung in der Beratung biopharmazeutischer Unternehmen bei Fusionen und Übernahmen sowie bei Finanzierungstransaktionen. Zuvor war er Geschäftsführer der Healthcare Investment Banking Group bei Mizuho Securities. Vor seinem Wechsel zu Mizuho Securities war er von 2012 bis 2017 Geschäftsführer der Healthcare Investment Banking Group von Guggenheim Securities. Von 2005 bis 2012 war er in Positionen mit zunehmender Verantwortung in der Healthcare Investment Banking Group von Piper Jaffray tätig. Von 2001 bis 2005 beriet er Gesundheits- und Technologieunternehmen bei Finanzierungs- und M & A-Transaktionen als Unternehmensanwalt. Herr Shin erhielt einen B.Sc. und gemeinsamer JD / MBA von der University of Toronto.
https://translate.google.de/translate?sl=en&tl=de&u=http%3A%…
Trevena, Inc. (TRVN) FORMULAR 10-Q | Vierteljährlicher Bericht
https://translate.google.com/translate?sl=en&tl=de&u=https%3… Mehr potenzielle FDA-Opioidverzögerungen nach Nektar
Trevena arbeitet an einem Opioid-Medikament namens Oliceridin. Derzeit wird das Medikament an gesunden Probanden einer Sicherheitsstudie unterzogen, um sicherzustellen, dass es die QT-Verlängerung nicht negativ beeinflusst. Dies ist die Zeit, die das Herz benötigt, um sich zwischen den Herzschlägen wieder aufzuladen. Die Daten sollten bis zum vierten Quartal dieses Jahres vorliegen. Eine erneute Einreichung wird für 2020 erwartet. Trevena hat bereits ein vollständiges Antwortschreiben der FDA zum Thema QT-Verlängerung erhalten, könnte jedoch auf andere Probleme stoßen. Da Oliceridin nur im klinischen Umfeld verabreicht wird und daher weniger Missbrauch ausgesetzt ist, kann eine Verzögerung durch die FDA vermieden werden, obwohl die Behörde in dieser Situation möglicherweise eine Entscheidung trifft.https://translate.google.com/translate?sl=en&tl=de&u=https%3…
https://seekingalpha.com/article/4281403-potential-fda-opioi…
Trevena, Telefonkonferenz zum Ergebnis des zweiten Quartals 2019, 7. August 2019, 8:00 Uhr
UnternehmensteilnehmerRobert Yoder - Vizepräsident und Chief Business Officer
Carrie Bourdow - Präsidentin und Geschäftsführerin
Mark Demitrack - Chief Medical Officer
Barry Shin - Finanzvorstand
Teilnehmer der Telefonkonferenz
Jason Butler - JMP Securities
Douglas Tsao - H.C. Wainwright & Co.
Operator
Guten Tag, meine Damen und Herren, und herzlich willkommen bei der Telefonkonferenz zum Ergebnis von Trevena Inc., 2. Quartal 2019. Zu diesem Zeitpunkt befinden sich alle Teilnehmer im Listen-Only-Modus. Später werden wir eine Frage-und-Antwort-Sitzung durchführen und Anweisungen folgen zu diesem Zeitpunkt. [Bedienungsanleitung] Zur Erinnerung, diese Telefonkonferenz wird aufgezeichnet.
Ich möchte jetzt Ihren Gastgeber für die heutige Konferenz vorstellen, Herrn Bob Yoder, Chief Business Officer. Mr. Yoder, Sie können anfangen.
Robert Yoder
Vielen Dank und willkommen an alle. Vielen Dank, dass Sie heute Morgen zu uns gekommen sind. Bei mir sind heute Carrie Bourdow, unsere Präsidentin und CEO; Mark Demitrack, unser Chief Medical Officer; und Barry Shin, unser Finanzvorstand.
Bevor wir beginnen, möchten wir die Teilnehmer darüber informieren, dass wir zu dieser Aufforderung zukunftsgerichtete Aussagen machen werden, die gemäß der Safe-Harbor-Bestimmung des Private Securities Litigation Reform Act von 1995 getroffen werden Aussagen beinhalten Risiken und Ungewissheiten, einschließlich der Risiken, die von Zeit zu Zeit in den bei der Securities and Exchange Commission eingereichten regelmäßigen Berichten des Unternehmens aufgeführt werden. Wir übernehmen keine Verpflichtung, diese Aussagen über den heutigen Tag hinaus zu aktualisieren.
Während des heutigen Anrufs wird Carrie unsere jüngsten Unternehmenshighlights zusammenfassen und die Fortschritte, die wir in unserer Pipeline erzielt haben, überprüfen. Mark wird ein Update zur freiwilligen QT-Studie für Oliceridin bereitstellen und unsere Pläne für den Proof-of-Concept detaillierter skizzieren Studie für TRV250. Barry wird dann unsere Finanzergebnisse prüfen und einige Zeit auf Fragen warten.
Ich rufe jetzt Carrie an.
Carrie Bourdow
Danke, Bob. Guten Morgen allerseits. Vielen Dank, dass Sie heute zu uns gekommen sind. Im zweiten Quartal haben wir erhebliche Fortschritte bei unserem Plan zur erneuten Einreichung des NDA für Oliceridin erzielt. Dank der harten Arbeit des Teams. Wir konnten die Studie für gesunde Freiwillige pünktlich einleiten und sind bisher ermutigt, sich für eine Studie anzumelden. Über die Hälfte aller Probanden hat mit der Dosierung begonnen, und mehr als 20 Probanden haben bereits die maximale Tagesdosis von 27 Milligramm Oliceridin erhalten, eine der FDA-Anforderungen der CRL.
Wir gehen davon aus, dass die Daten für das vierte Quartal auf dem neuesten Stand sind und dass auch alle anderen Aktivitäten auf dem richtigen Weg sind, um die NDA-Wiedervorlage so früh wie möglich im ersten Quartal 2020 zu unterstützen. Wir haben die klinischen Versuchsdaten für Oliceridin weiter veröffentlicht und entwickeln eine Reihe robuster Vergleichsstudien. überprüfte Beweise, um unsere zukünftige Kommerzialisierung zu unterstützen. In der Fachzeitschrift Pain Practice wurde kürzlich das zweite unserer zentralen Ergebnisse der Phase III veröffentlicht, in denen die Wirksamkeit, Sicherheit und Verträglichkeit von Oliceridin bei Patienten mit mittelschweren bis schweren akuten Schmerzen nach einer Weichteiloperation hervorgehoben wird.
Ich freue mich auch, Ihnen mitteilen zu können, dass alle von uns eingereichten Abstracts für Oliceridin zur Präsentation auf der Tagung der American Society of Anaesthesiologists im Oktober 2019 angenommen wurden. Dies ist das weltweit größte Treffen von Anästhesisten. Wir freuen uns, dass diese wichtige Gruppe von Angehörigen der Gesundheitsberufe Interesse daran hat, mehr über Oliceridin zu erfahren. Auch in unserer Pipeline haben wir Fortschritte erzielt. Wir haben heute Morgen bekannt gegeben, dass wir das Studienprotokoll für akute Migräne für TRV250 weiterentwickelt haben und erwarten, im nächsten Quartal mit dieser Proof-of-Concept-Studie zu beginnen.
TRV250 ist ein weiterer neuer und differenzierter Wirkungsmechanismus, der am Delta-Rezeptor auftritt. Delta-Rezeptoren befinden sich im Gehirn und spielen eine wichtige Rolle bei der Regulation von Schmerz, Angst und Stimmung. Migräneschmerzen sind nach wie vor ein großer Markt mit über 600 Millionen Migränen, die jährlich in den USA behandelt werden. Wir glauben, dass für TRV250 eine beträchtliche Marktchance besteht, und wir freuen uns darauf, das Potenzial dieses Wirkstoffs nicht nur für Migräne, sondern auch im ZNS-Bereich weiter auszuloten breit.
Das Nationale Institut für Drogenmissbrauch (NIDA) hat TRV734 weiterhin als potenzielle Erhaltungstherapie für opioidinduzierte Störungen weiterentwickelt. NIDA wird eine Proof-of-Concept-Studie für Patienten vollständig finanzieren und plant, diese Studie noch in diesem Jahr zu beginnen.
Und schließlich haben wir mit den nicht-klinischen CMC-Aktivitäten begonnen, um eine zukünftige IND-Einreichung für TRV045, unseren neuartigen S1P-Rezeptormodulator, zu unterstützen. TRV045 könnte ein neuer Mechanismus für die nicht-opioide Behandlung chronischer Schmerzen sein, einschließlich chemisch induzierter peripherer Neuropathie. Wichtig ist, dass unsere aktuelle Cash Runway das Auslesen der Oliceridin-Topline-Daten, die NDA-Wiedervorlage und die Pipeline-Arbeit, die ich gerade skizziert habe, unterstützt.
Als letzten Höhepunkt des Quartals haben wir unser Führungsteam um ein wichtiges Mitglied erweitert. Barry Shin ist Trevena als Chief Financial Officer beigetreten und verfügt über mehr als 17 Jahre strategische und finanzielle Erfahrung mit Schwerpunkt auf dem biopharmazeutischen Sektor. Ich bin begeistert, Barry an Bord zu haben. Seine Führungsqualitäten und sein Fachwissen werden von unschätzbarem Wert sein, wenn wir uns auf den geschäftigen Rest des Jahres und den weiteren Aufschwung für das nächste Jahr vorbereiten.
Lassen Sie mich den Anruf an Mark weiterleiten, um weitere Informationen zu unseren jüngsten Erfolgen mit Oliceridin und TRV250 zu erhalten. Kennzeichen?
Mark Demitrack
Danke Carrie, und guten Morgen allerseits. Um den aktuellen Stand unseres Oliceridin-Programms zu rekapitulieren, haben wir Ende Juni erfolgreich die freiwillige QT-Intervallstudie für Oliceridin gestartet. Wir führen diese Studie an einem einzigen Standort als dreistufiges Crossover-Design durch. Jeder Proband durchläuft alle drei Untersuchungsperioden und erhält Oliceridin, Placebo und die Moxifloxacin-Positivkontrolle in einer zufälligen Reihenfolge mit einem kurzen Auswaschintervall zwischen den einzelnen Behandlungen.
Insgesamt dauert die Gesamtstudienzeit für jedes Fach etwa 20 Tage. Wir planen, Daten zu ungefähr 60 gesunden Probanden einzureichen, von denen mindestens 20 eine kumulative Dosis von 27 Milligramm Oliceridin erhalten, die vorgeschlagene maximale Tagesdosis.
Wie Carrie sagte, freue ich mich zu berichten, dass bis heute über die Hälfte unserer angestrebten Gesamtstudienpopulation mit der Dosierung begonnen hat. Von den Probanden, die die Dosierung abgeschlossen haben, erhielten mehr als 20 eine kumulative Dosis von 27 Milligramm Oliceridin, was der von der FDA vorgeschriebenen Mindestanzahl von Probanden entspricht, die auf dieser Ebene exponiert wurden.
Basierend auf diesen Fortschritten und der Registrierung gehen wir davon aus, dass diese Studie im nächsten Quartal planmäßig zum Auslesen der Topline-Daten verläuft. Mit unserem TRV250-Programm, unserem neuartigen Delta-Rezeptor-Agonisten, der auf die potenzielle Behandlung von akuter Migräne abzielt, haben wir ebenfalls bedeutende Fortschritte erzielt. Wir haben ein Protokoll für eine Proof-of-Concept-Studie zur akuten Migräne entwickelt.
Ich werde ein paar Minuten damit verbringen, einige der wichtigsten Designelemente der Studie zu skizzieren. Dies wird eine doppelblinde, placebokontrollierte klinische Studie sein, die auf einem Nitroglycerin-Provokations-Migräne-Modell aufbaut, einem gut validierten Ansatz für die Untersuchung von Migräne-Kopfschmerzen, der in der wissenschaftlichen Literatur in den letzten Jahren evaluiert wurde.
Es ist bekannt, dass Migränepatienten besonders anfällig dafür sind, nach einer Nitroglycerin-Exposition anhaltende Kopfschmerzen zu entwickeln, die alle klinischen Merkmale einer spontan auftretenden Migräne aufweisen. Dies macht es zu einem sehr attraktiven klinischen Modell, potenzielle Behandlungsinterventionen wie TRV250 zu untersuchen.
Das Hauptziel dieser Studie ist es, die Zielbindung am Delta-Rezeptor zu bestimmen. Dies wird anhand der Fähigkeit von TRV250 gemessen, die Anzahl der Probanden zu verringern, bei denen anhaltende Nitroglycerin-induzierte Kopfschmerzen auftreten. Wir planen, ungefähr 120 Migränepatienten an einem einzigen Standort zu immatrikulieren.
Alle Probanden werden randomisiert, bevor sie eine kontinuierliche Nitroglycerininfusion erhalten, gefolgt von der Verabreichung einer 20-Milligramm-Subkutandosis von TRV250 oder Placebo zu einem festgelegten Zeitpunkt. Danach werden sie für 24 Stunden in einem Krankenhaus überwacht. Wir gehen davon aus, dass wir im nächsten Quartal mit dieser Studie beginnen können, und ich freue mich darauf, diesen neuen Wirkungsmechanismus bei Migräne-Patienten zu untersuchen, ein wichtiger Meilenstein für die klinische Entwicklung dieses aufregenden Programms.
Ich übergebe jetzt den Anruf an Barry, um unsere Finanzdaten für das zweite Quartal zu überprüfen.
Barry Shin
Danke, Mark, und danke, Carrie für die Einführung. Es ist toll, heute morgen hier zu sein. Ich freue mich sehr, an diesem kritischen Wendepunkt zu Trevena zu kommen. Wir haben Klarheit über den regulatorischen Weg, unsere gesunde freiwillige Studie für Oliceridin ist in vollem Gange und wir machen solide wirtschaftliche Fortschritte bei unseren Pipeline-Kandidaten. Das Führungsteam hat hervorragende Arbeit geleistet, um die CRL schnell und effizient zu bearbeiten. Ich freue mich darauf, die Bemühungen zu unterstützen, die NDA erneut einzureichen und unsere anderen Pipeline-Assets voranzutreiben.
Nun zu den Zahlen. Wir haben die wichtigsten Finanzkennzahlen heute in unserer Pressemitteilung und dem vollständigen Jahresabschluss in unserem Formular 10-Q veröffentlicht. Im Moment werde ich die Überschriften zusammenfassen. Für das zweite Quartal 2019 wiesen wir einen Nettoverlust für Stammaktionäre von ca. 4,7 Mio. USD oder 0,05 USD pro Aktie aus, verglichen mit ca. 9,3 Mio. USD oder 0,13 USD pro Aktie für das zweite Quartal 2018.
Dieser Rückgang des Nettoverlusts und des Nettoverlusts je Aktie war hauptsächlich auf einen Rückgang der Ausgaben infolge der Umstrukturierung und des Rückgangs des Personalbestands im Jahr 2018 und der damit verbundenen Kosteneinsparungsinitiativen zurückzuführen. Wir gehen davon aus, dass die Ausgaben in der zweiten Jahreshälfte 2019 planmäßig steigen werden, was hauptsächlich auf die gesunde freiwillige Untersuchung von Oliceridin zurückzuführen ist, die wir im Juni dieses Jahres begonnen haben.
Die liquiden Mittel und Wertpapiere des Umlaufvermögens betrugen zum 30. Juni 2019 54 Mio. USD. Unsere Prognose bleibt unverändert und wir erwarten diesen Betrag weiterhin zusammen mit Zinserträgen. Wir werden unsere Betriebskosten, den Schuldendienst und die Investitionsausgaben für mindestens 12 Monate bis zum dritten Quartal 2020 finanzieren.
Dieser Zeitraum deckt wichtige Meilensteine ab, einschließlich des Abschlusses einer freiwilligen Studie für die Aufnahme von Oliceridin in die Proof-of-Concept-Studie für TRV250 im vierten Quartal dieses Jahres. Die IND-Aktivitäten für TRV045 haben bereits begonnen und die NDA für Oliceridin wurde erneut eingereicht im ersten Quartal 2020.
Wir werden jetzt den Aufruf zur Beantwortung von Fragen eröffnen, woraufhin Carrie einige abschließende Bemerkungen machen wird. Josh?
Frage-und-Antwort-Sitzung
Operator
Vielen Dank. [Bedienungsanleitung] Unsere erste Frage kommt von Jason Butler mit JMP Securities. Sie können mit Ihrer Frage fortfahren.
Jason Butler
Hallo. Vielen Dank für die Beantwortung der Fragen. Nur die erste zu Oliceridin, können Sie uns vielleicht einen Rahmen geben, was Sie zum Beispiel aus der QT-Studie sowie aus den wichtigsten Schlussfolgerungen zu erwarten haben? Werden Sie im Durchschnitt quantitative Informationen zu QT-Intervallen oder zu Patienten, die die Schwellenwerte für Ausreißer überschreiten, bereitstellen? Vielen Dank.
Carrie Bourdow
Toll. Guten Morgen, Jason. Kennzeichen?
Mark Demitrack
Wenn wir Topline-Daten melden, Jason, werden wir genau das melden. Wir werden uns die placebokorrigierte Änderung der QT-Intervallrate gegenüber der Grundlinie ansehen, also das sogenannte QTc-Intervall.
Und dann werden wir auch den Anteil der Ausreißer an standardmäßigen kategorialen Schwellenwerten für das Ausmaß der Änderung gegenüber der Basislinie sowie die absolute Länge des korrigierten QT-Intervalls selbst angeben.
Jason Butler
Toll. Sehr hilfreich. Und können Sie uns auf TRV250 etwas mehr Hintergrundwissen über die Nitroglycerin-Induktion geben? Wie viele Patienten würden Sie nach einer NTG-Induktion mit Kopfschmerzen erwarten? Wie lange dauert es, bis Kopfschmerzen auftreten? Und wenn Sie sich dann einen Behandlungseffekt für 250 ansehen, wie definieren Sie, ob ein Patient einen bekommt - wie definieren Sie die Reduzierung von Kopfschmerzen? Ist das eine kategorische? Ja Nein. Haben Sie Kopfschmerzen oder überschreiten Sie eine bestimmte Schwelle oder verwenden Sie eine Skala? Vielen Dank.
Mark Demitrack
Sicher. Dieses Modell wird also mit einer 20-minütigen intravenösen Infusion von Nitroglycerin durchgeführt. Und dieser Ansatz und das Dosierungsparadigma, das verwendet wurde, sind in der Literatur über ein paar Jahrzehnte der Forschung dieses Modells gut etabliert.
Außerdem haben wir mit der Forschungsstelle, mit der wir arbeiten, die Leistung dieses Modells an dieser Stelle in einer frühen Studie bei Migränepatienten tatsächlich validiert. Wir wissen also viel über die Leistungsparameter. Typischerweise tritt während der Infusion ein kurzer vaskulärer Kopfschmerz auf. Für einen gesunden Menschen wäre das das Ende. Dann ist die Infusion abgeschlossen und es gibt keine Folgen davon.
Bei einer Migränepatientin traten bei praktisch allen Migränepatienten nicht nur diese unmittelbaren vaskulären Kopfschmerzen auf, sondern über mehrere Stunden, in der Regel in den nächsten sechs bis acht Stunden, treten Kopfschmerzen auf, die alle klinischen Merkmale einer spontan auftretenden Migräne aufweisen. Und es ist wirklich sehr, sehr charakteristisch für Migränepatienten dieses Muster von Kopfschmerzen.
Unser Ergebnis wird anhand von Bewertungsskalen, Standardbewertungsskalen, die zur Bewertung der Intensität von Kopfschmerzen verwendet werden, und anhand von kategorialen Schnittpunkten ermittelt, ob Kopfschmerzen vorhanden sind oder nicht. Wir werden offensichtlich mehrere sekundäre Ergebnismaße haben, die wir uns mit verschiedenen anderen Schwellenwerten und Dauern und dergleichen befassen. Aber das ist im Allgemeinen der Ansatz, den wir mit dieser Studie verfolgen.
Jason Butler
OK großartig. Vielen Dank für die Beantwortung der Fragen.
Operator
Vielen Dank. Und unsere nächste Frage kommt von Douglas Tsao mit H.C. Wainwright. Sie können mit Ihrer Frage fortfahren.
Douglas Tsao
Hallo, guten Morgen. Danke für die Fragen. Nur in Bezug auf - für Oliceridin in Bezug auf den Abschluss der Studie. Wenn dies abgeschlossen ist, muss noch etwas in Bezug auf die erneute Einreichung getan werden, oder ist es nur eine einfache Zusammenstellung dieser Daten? Ist der letzte Schritt zum Nachfüllen?
Carrie Bourdow
Ja. Guten Morgen oder guten Nachmittag, Doug. Ich bin mir nicht ganz sicher, wo du bist, also werde ich ...
Douglas Tsao
Guten Morgen.
Carrie Bourdow
Okay. Guten Morgen. Sie werden sich vielleicht daran erinnern, dass der andere Bereich, den wir zum Abschluss bringen müssen, die PK-Arbeit ist, die wir zur Charakterisierung der Metaboliten durchführen müssen. Dies erfolgt vor Abschluss der QT-Studie. Das wird also auch Teil der Einreichung sein.
Und dann waren die beiden anderen Fragen wirklich - die andere Frage, die in die Einreichung der Validierungsberichte einbezogen wird, die wir bereits ausgefüllt haben. Und jetzt ist es wirklich eher eine Büroangelegenheit, die wir im Datenpaket bereitstellen müssen. Wir sollten also auf dem besten Weg sein, sobald die Studie abgeschlossen ist und wir sie so früh wie möglich im ersten Quartal des nächsten Jahres erneut einreichen können.
Douglas Tsao
Okay. Und wie lange dauert es nach der Registrierung eines Patienten, bis er die drei Übergangszeiträume durchlaufen hat?
Carrie Bourdow
Es sind ungefähr 20 Tage. Mark, richtig?
Mark Demitrack
Recht. Es sind ungefähr 20 Tage ab dem Tag, an dem sie eintreten, bis zu dem Tag, an dem sie die letzte Periode abgeschlossen haben.
Douglas Tsao
OK großartig. Vielen Dank.
Carrie Bourdow
Vielen Dank.
Operator
Vielen Dank. Und ich zeige derzeit keine weiteren Fragen. Ich möchte den Anruf jetzt an Carrie Bourdow, CEO, zurücksenden, um weitere Anmerkungen zu machen.
Carrie Bourdow
Toll. Vielen Dank. Vielen Dank für Ihre Fragen. Wie Sie heute gehört haben, haben wir wichtige Aufgaben vor uns und freuen uns darauf, Ihnen in der geschäftigen zweiten Jahreshälfte 2019 Aktualisierungen mitzuteilen. Wir konzentrieren uns weiterhin auf die Weiterentwicklung von Oliceridin in Richtung einer erfolgreichen Wiedervorlage. Die wichtigsten Daten aus der Studie mit gesunden Freiwilligen werden im nächsten Quartal erwartet, und wir werden die NDA so früh wie möglich im ersten Quartal des nächsten Jahres erneut einreichen.
Wir treiben auch unsere CNS-Pipeline weiter voran und planen, unser gesamtes Vermögen in den nächsten sechs Monaten auf wichtige Entwicklungsmeilensteine zu lenken. Wir sind auf dem besten Weg, die Proof-of-Concept-Studie zur akuten Migräne für TRV250 auch im nächsten Quartal zu initiieren, und wir unterstützen unsere Partner bei NIDA bei der Fertigstellung der Vorbereitungen für die Proof-of-Concept-Studie TRV734 bis zum Jahresende Die IND-Enabling-Arbeiten für TRV045 haben bereits begonnen. Zusammenfassend bleibt festzuhalten, dass wir diszipliniert, optimistisch und entschlossen sind, neue Arzneimittel für Patienten mit ZNS-Erkrankungen zu entwickeln.
Vielen Dank. Vielen Dank, dass Sie heute zu uns gekommen sind.
Operator
Vielen Dank. Sehr geehrte Damen und Herren, vielen Dank für Ihre Teilnahme an der heutigen Konferenz. Damit ist das heutige Programm beendet, und Sie können alle die Verbindung trennen. Jeder hat einen wunderschönen Tag.
https://seekingalpha.com/article/4282606-trevena-inc-trvn-ce…
Mal gespannt, wann der Kurs hier ‘nen Boden findet...
Daher weiterhin bei mir nur auf der Watchlist.
Daher weiterhin bei mir nur auf der Watchlist.
Trevena Advances NDA Resubmission Activities for Oliceridine
GlobeNewswire•August 28, 2019
— Completed enrollment in healthy volunteer QT study, topline data expected in Q4 2019 —
— Completed characterization of inactive metabolite —
— Remains on track to resubmit NDA in Q1 2020 —
CHESTERBROOK, Pa., Aug. 28, 2019 (GLOBE NEWSWIRE) -- Trevena, Inc. (TRVN), a biopharmaceutical company focused on the development and commercialization of novel medicines for patients with Central Nervous System (CNS) conditions, today provided an update on the activities to support resubmission of the New Drug Application (NDA) for oliceridine.
The Company has completed enrollment for the ongoing healthy volunteer QT study and remains on track to support topline data readout in the fourth quarter of 2019.
In addition, the Company has completed the necessary nonclinical work to further characterize the 9662 inactive metabolite. As agreed to with FDA, the Company has generated reproducible pharmacokinetic data using validated bioanalytical methods that demonstrate acceptable levels of exposure to the metabolite in nonclinical species.
Lastly, the Company has finished the outstanding drug product validation reports identified in the Complete Response Letter (CRL), which will be included in the NDA resubmission package.
“We continue to make steady progress on all fronts to gather the information needed to resubmit the NDA for oliceridine,” said Carrie Bourdow, President and Chief Executive Officer. “I am pleased that we have finished the work to address three of the four items outlined in the CRL. Once we receive topline data for the healthy volunteer QT study, which we are on schedule to report next quarter, we look forward to resubmitting the NDA as early as possible in the first quarter of next year.”
https://finance.yahoo.com/news/trevena-advances-nda-resubmis…
GlobeNewswire•August 28, 2019
— Completed enrollment in healthy volunteer QT study, topline data expected in Q4 2019 —
— Completed characterization of inactive metabolite —
— Remains on track to resubmit NDA in Q1 2020 —
CHESTERBROOK, Pa., Aug. 28, 2019 (GLOBE NEWSWIRE) -- Trevena, Inc. (TRVN), a biopharmaceutical company focused on the development and commercialization of novel medicines for patients with Central Nervous System (CNS) conditions, today provided an update on the activities to support resubmission of the New Drug Application (NDA) for oliceridine.
The Company has completed enrollment for the ongoing healthy volunteer QT study and remains on track to support topline data readout in the fourth quarter of 2019.
In addition, the Company has completed the necessary nonclinical work to further characterize the 9662 inactive metabolite. As agreed to with FDA, the Company has generated reproducible pharmacokinetic data using validated bioanalytical methods that demonstrate acceptable levels of exposure to the metabolite in nonclinical species.
Lastly, the Company has finished the outstanding drug product validation reports identified in the Complete Response Letter (CRL), which will be included in the NDA resubmission package.
“We continue to make steady progress on all fronts to gather the information needed to resubmit the NDA for oliceridine,” said Carrie Bourdow, President and Chief Executive Officer. “I am pleased that we have finished the work to address three of the four items outlined in the CRL. Once we receive topline data for the healthy volunteer QT study, which we are on schedule to report next quarter, we look forward to resubmitting the NDA as early as possible in the first quarter of next year.”
https://finance.yahoo.com/news/trevena-advances-nda-resubmis…
Trevena auf dem richtigen Weg, Oliceridin-NDA bis zum 1. Quartal einzureichen
Aktualisierung der Aktivitäten zur erneuten Einreichung von Oliceridin NDA, Trevena Inc
TRVN
Das Unternehmen hat die Registrierung für die laufende QT-Studie für gesunde Freiwillige abgeschlossen und bleibt auf dem richtigen Weg, um das Auslesen von Top-Line-Daten im vierten Quartal zu unterstützen. Das Unternehmen gab außerdem bekannt, die erforderlichen nichtklinischen Arbeiten zur weiteren Charakterisierung des inaktiven Metaboliten 9662 abgeschlossen zu haben und die in der CRL angegebenen ausstehenden Validierungsberichte für Arzneimittel abgeschlossen zu haben.
Trevena wurde im November 2018 eine CRL verliehen. Das Unternehmen hofft, die NDA bereits im ersten Quartal 2020 wieder einreichen zu können.
Die Aktie legte im außerbörslichen Handel um 2,56% auf 83 Cent zu.
https://www.benzinga.com/general/biotech/19/08/14347501/the-…
Aktualisierung der Aktivitäten zur erneuten Einreichung von Oliceridin NDA, Trevena Inc
TRVN
Das Unternehmen hat die Registrierung für die laufende QT-Studie für gesunde Freiwillige abgeschlossen und bleibt auf dem richtigen Weg, um das Auslesen von Top-Line-Daten im vierten Quartal zu unterstützen. Das Unternehmen gab außerdem bekannt, die erforderlichen nichtklinischen Arbeiten zur weiteren Charakterisierung des inaktiven Metaboliten 9662 abgeschlossen zu haben und die in der CRL angegebenen ausstehenden Validierungsberichte für Arzneimittel abgeschlossen zu haben.
Trevena wurde im November 2018 eine CRL verliehen. Das Unternehmen hofft, die NDA bereits im ersten Quartal 2020 wieder einreichen zu können.
Die Aktie legte im außerbörslichen Handel um 2,56% auf 83 Cent zu.
https://www.benzinga.com/general/biotech/19/08/14347501/the-…
....wäre das nun von vorteil für uns als aktionäre oder besser nicht....??? käme da noch ein aufschlag drauf , a la übernahme-angebot von x-prozent....???.....oder will man uns nur noch los werden , bevor eine eventuelle zulassung kommen sollte....????....fragen über fragen.....!!!!
Antwort auf Beitrag Nr.: 61.432.658 von onkelen am 07.09.19 09:08:19
In accordance with Nasdaq Marketplace Rule 5810(c)(3)(A), the Company has been provided a period of 180 calendar days, or until March 2, 2020, to regain compliance with Nasdaq Listing Rule 5450(a)(1).
To regain compliance with the minimum bid price requirement, the closing bid price of the Company’s common stock must be at least $1.00 per share for a minimum of ten consecutive business days during this 180-day period.
Zitat von onkelen: https://translate.google.de/translate?hl=de&tab=TT&sl=en&tl=…
https://www.sec.gov/Archives/edgar/data/1429560/000110465919…
In accordance with Nasdaq Marketplace Rule 5810(c)(3)(A), the Company has been provided a period of 180 calendar days, or until March 2, 2020, to regain compliance with Nasdaq Listing Rule 5450(a)(1).
To regain compliance with the minimum bid price requirement, the closing bid price of the Company’s common stock must be at least $1.00 per share for a minimum of ten consecutive business days during this 180-day period.
Was Analysten über Trevena, Inc. denken
Was Analysten über Trevena, Inc. denkenObwohl es nie eine kluge Idee ist, den Gedanken von Analysten blind zu folgen, ist es eine gute Idee, ihre Gedanken zu berücksichtigen, um Ihre eigenen Gedanken zu validieren, bevor Sie eine Investitionsentscheidung im Bereich Biotechnologie treffen. Hier sind die jüngsten Schritte, die wir von Analysten in Bezug auf TRVN gesehen haben.
Verschwenden Sie keine Zeit! Finden Sie mit Trade Ideas in wenigen Minuten erfolgreiche Trades !
31.-19. Mai Wieder aufgenommen HC Wainwright Kaufen
Nov-05-18 Downgrade HC Wainwright Kaufen → Neutral
12.-18. Oktober Downgrade Needham Kaufen → Halten
10.-18. Oktober Downgrade Jefferies Kaufen → Halten
Nov-08-17 Bekräftigt Needham Kaufen $ 9 → $ 7
https://iwatchmarkets.com/2019/09/08/trevena-inc-trvn-stock-…
Kann Oliceridin (TRV130), ein idealer neuer µ-Rezeptor-G-Protein-Pathway-selektiver (µ-GPS) Modulator, Analgesie ohne opioidbedingte Nebenwirkungen liefern?
https://translate.google.com/translate?sl=en&tl=de&u=https%3…
ASA Anesthesiologists Conference Orlando 19th-23rd October 2019.
October 19, 2019, 1:00 PM
BOC05. Improved Safety of Opioid Analgesic Oliceridine Compared to Morphine Assessed by Utility Function Analysis
October 20, 2019, 1:00 PM
A2228. Low Incidence of Opioid-induced Respiratory Depression Observed with Oliceridine Regardless of Age or Body Mass
October 20, 2019, 1:00 PM
A2232. Lower Incidence of Postoperative Opioid-induced Respiratory Depression with Oliceridine Compared to Morphine: A Retrospective Analysis
October 21, 2019, 9:30 AM
A3069. Oliceridine (TRV130) Demonstrates Less Opioid-induced Respiratory Depression than Morphine (M) as Measured by the Average Cumulative Duration of Dosing Interruption in Patients Being Treated for Acute Post-surgical Pain
https://www.abstractsonline.com/pp8/#!/6832/presentations/Tr…
October 19, 2019, 1:00 PM
BOC05. Improved Safety of Opioid Analgesic Oliceridine Compared to Morphine Assessed by Utility Function Analysis
October 20, 2019, 1:00 PM
A2228. Low Incidence of Opioid-induced Respiratory Depression Observed with Oliceridine Regardless of Age or Body Mass
October 20, 2019, 1:00 PM
A2232. Lower Incidence of Postoperative Opioid-induced Respiratory Depression with Oliceridine Compared to Morphine: A Retrospective Analysis
October 21, 2019, 9:30 AM
A3069. Oliceridine (TRV130) Demonstrates Less Opioid-induced Respiratory Depression than Morphine (M) as Measured by the Average Cumulative Duration of Dosing Interruption in Patients Being Treated for Acute Post-surgical Pain
https://www.abstractsonline.com/pp8/#!/6832/presentations/Tr…
Opioddiskussion in den USA ... ein Argument für?? Trevenas Produkt ?!?
Antwort auf Beitrag Nr.: 61.732.591 von mabu1970 am 21.10.19 09:15:29
unbedingt!
Zitat von mabu1970: Opioddiskussion in den USA ... ein Argument für?? Trevenas Produkt ?!?
unbedingt!
Antwort auf Beitrag Nr.: 61.733.299 von Cyberhexe am 21.10.19 10:19:52Warum?
Oliceridine ist auch ein Opiod.
Zudem wird es in einem anderen Setting eingesetzt. Die Opiodkrise hat doch nichts mit der post-operativen Gabe zu tun, sondern damit, dass man in den USA nach Zahn-Ops, bei Rückenschmerzen etc. Opiode (für zu Hause) verschrieben hat.
Oliceridine ist auch ein Opiod.
Zudem wird es in einem anderen Setting eingesetzt. Die Opiodkrise hat doch nichts mit der post-operativen Gabe zu tun, sondern damit, dass man in den USA nach Zahn-Ops, bei Rückenschmerzen etc. Opiode (für zu Hause) verschrieben hat.
Antwort auf Beitrag Nr.: 61.733.641 von kmastra am 21.10.19 11:03:09Oliceridine ist zwar ein Opioid unterscheidet sich jedoch in dessen Wirkungsweise dadurch, dass eine Interaktion mit β-Arrestin unterbleibt und deswegen der Rezeptor nicht internalisiert wird. Dies wiederum soll die für herkömmliche Opioide typischen Nebenwirkungen wie Atemdepression oder Verstopfung verringern. Ausserdem soll die Toleranz bei wiederholter oder chronischer Einnahme über einen bestimmten Zeitraum geringer sein. Bei gewöhnlichen Opioiden führt diese Toleranz dazu, dass über die Zeit grössere Dosen für den zu erzielenden Zweck erforderlich sind und somit tendenziell den medikamentenmissbrauch fördert.
Trevena kündigt Präsentationen auf der Jahrestagung 2019 der American Society of Anaesthesiologists an
https://translate.google.de/translate?sl=en&tl=de&u=https%3A…
Antwort auf Beitrag Nr.: 61.734.280 von Cyberhexe am 21.10.19 12:31:25Ich bleibe da skeptisch - sei mir nicht böse 
Ein Opiat, das ein wenig weniger schnell abhängig macht (was noch zu beweisen wäre, oder?), ist immer noch ein Opiat und im Zusammenhang mit der gegenwärtigen Diskussion eher Teil des Problems als Teil der Lösung.
Ansonsten forscht man momentan ja wie verrückt an neuen Wirkmechanismen. Auch TRVN hat da einen Kandidaten - allerdings erst präklinisch!

Ein Opiat, das ein wenig weniger schnell abhängig macht (was noch zu beweisen wäre, oder?), ist immer noch ein Opiat und im Zusammenhang mit der gegenwärtigen Diskussion eher Teil des Problems als Teil der Lösung.
Ansonsten forscht man momentan ja wie verrückt an neuen Wirkmechanismen. Auch TRVN hat da einen Kandidaten - allerdings erst präklinisch!
Antwort auf Beitrag Nr.: 61.738.864 von kmastra am 21.10.19 21:50:19
wieso sollte ich dir böse sein?
Der Diskurs ist gerade beim Wertpapiergeschäft von grösster Bedeutung.
Allerdings, das will ich schon betonen, bin auch ich immer wieder skeptisch und hinterfrage meine getroffenen Entscheidungen ständig. Bei TRVN bin ich an der Seitenlinie und beobachte das Geschehen, zumal ich kaum noch über "dry powder" verfüge. Ich hatte jedoch auf den Zusammenhang mit der Opioid-Krise in den US Stellung bezogen bzw. auf die Frage, ob TRVN davon betroffen sei, ...
"Opioddiskussion in den USA ... ein Argument für?? Trevenas Produkt ?!?"
…meine Meinung geäussert --> "unbedingt"
Und da bin ich mir ziemlich sicher, dass ein Analgetikum dieser Wirkstoffklasse (Opioide) gegenüber anderen Präparaten im Vorteil ist, wenn die klassischen Nebenwirkungen wie zB die Atemdepression (die sehr wahrscheinlich für viele Todesfälle verantwortlich ist) verringert sind. Ausserdem ist die Toleranz bei Oliceridine den bisherigen Opioiden überlegen, da eine Gewöhnung und die damit verbundene Dosiserhöhung weitaus geringer ausgeprägt ist. Selbstverständlich bleibt dieser Wirkstoff ein Opioid, aber, und darin besteht der potenzielle Erfolg dieser Verbindung, mit einem wesentlich günstigeren Profil an NW. Denn die Nachfrage nach Schmerzmittel ist ungebrochen und dürfte in Anbetracht der ins Alter kommenden Babyboomer weiter zunehmen.
Zitat von kmastra: Ich bleibe da skeptisch - sei mir nicht böse
Ein Opiat, das ein wenig weniger schnell abhängig macht (was noch zu beweisen wäre, oder?), ist immer noch ein Opiat und im Zusammenhang mit der gegenwärtigen Diskussion eher Teil des Problems als Teil der Lösung.
Ansonsten forscht man momentan ja wie verrückt an neuen Wirkmechanismen. Auch TRVN hat da einen Kandidaten - allerdings erst präklinisch!
wieso sollte ich dir böse sein?

Der Diskurs ist gerade beim Wertpapiergeschäft von grösster Bedeutung.
Allerdings, das will ich schon betonen, bin auch ich immer wieder skeptisch und hinterfrage meine getroffenen Entscheidungen ständig. Bei TRVN bin ich an der Seitenlinie und beobachte das Geschehen, zumal ich kaum noch über "dry powder" verfüge. Ich hatte jedoch auf den Zusammenhang mit der Opioid-Krise in den US Stellung bezogen bzw. auf die Frage, ob TRVN davon betroffen sei, ...
"Opioddiskussion in den USA ... ein Argument für?? Trevenas Produkt ?!?"
…meine Meinung geäussert --> "unbedingt"
Und da bin ich mir ziemlich sicher, dass ein Analgetikum dieser Wirkstoffklasse (Opioide) gegenüber anderen Präparaten im Vorteil ist, wenn die klassischen Nebenwirkungen wie zB die Atemdepression (die sehr wahrscheinlich für viele Todesfälle verantwortlich ist) verringert sind. Ausserdem ist die Toleranz bei Oliceridine den bisherigen Opioiden überlegen, da eine Gewöhnung und die damit verbundene Dosiserhöhung weitaus geringer ausgeprägt ist. Selbstverständlich bleibt dieser Wirkstoff ein Opioid, aber, und darin besteht der potenzielle Erfolg dieser Verbindung, mit einem wesentlich günstigeren Profil an NW. Denn die Nachfrage nach Schmerzmittel ist ungebrochen und dürfte in Anbetracht der ins Alter kommenden Babyboomer weiter zunehmen.
Antwort auf Beitrag Nr.: 61.739.479 von Cyberhexe am 21.10.19 23:41:28Sehr schön! Ist eher als Floskel gemeint gewesen. Ich denke eigentlich auch, dass unterschiedliche Meinungen einen weiterbringen!
In dem speziellen Fall kommen wir aber wohl nicht auf einen Nenner. Die Opiodkrise ist im Grunde ja auch ein Thema für sich. Ist aber auch nicht so wichtig, weil wir beide nicht mehr investiert sind.
Grundsätzlich ist der Bereich Schmerzreduktion ohne Opiate natürlich aber sehr interessant. Das könnte in den nächsten Jahren noch ein ganz großes Thema werden. Ist es natürlich jetzt schon....
In dem speziellen Fall kommen wir aber wohl nicht auf einen Nenner. Die Opiodkrise ist im Grunde ja auch ein Thema für sich. Ist aber auch nicht so wichtig, weil wir beide nicht mehr investiert sind.
Grundsätzlich ist der Bereich Schmerzreduktion ohne Opiate natürlich aber sehr interessant. Das könnte in den nächsten Jahren noch ein ganz großes Thema werden. Ist es natürlich jetzt schon....
Das Unternehmen erwartet, die NDA für Oliceridin im ersten Quartal 2020 erneut einzureichen
Trevena gibt die Ergebnisse des dritten Quartals 2019 und die wichtigsten Daten aus einer mehrdosierten, gesunden freiwilligen QT-Studie bekanntDas Unternehmen erwartet, die NDA für Oliceridin im ersten Quartal 2020 erneut einzureichen
Proof-of-Concept-Studie zu akuter Migräne für TRV250 eingeleitet
Firma, die um 8:30 EST eine Telefonkonferenz abhält
CHESTERBROOK, PA, 4. November 2019 (GLOBE NEWSWIRE) - Trevena, Inc. (Nasdaq: TRVN) , ein biopharmazeutisches Unternehmen, das sich heute auf die Entwicklung und Vermarktung neuartiger Arzneimittel für Patienten mit Erkrankungen des Zentralnervensystems (ZNS) konzentriert gab die Ergebnisse der Multi-Dose-QT-Studie für IV-Oliceridin bekannt, berichtete über die Finanzergebnisse für das am 30. September 2019 endende dritte Quartal und gab einen Überblick über die jüngsten operativen Highlights.
„Wir glauben, dass die Informationen aus der Mehrfachdosis-QT-Studie die von der FDA gestellten Fragen gründlich beantworten. Die Ergebnisse zeigen keinen Hinweis auf eine akkumulierende Wirkung von Oliceridin auf das QT-Intervall, wenn die empfohlene Tageshöchstdosis von 27 mg über 24 Stunden wiederholt verabreicht wird “, sagte Dr. Mark Demitrack, SVP und Chief Medical Officer. "Diese Daten bieten neben den in der ursprünglichen NDA übermittelten kardialen Sicherheitsdaten eine umfassende Einschätzung der Sicherheit und Verträglichkeit von Oliceridin und ermöglichen es uns, die Pläne für eine erneute NDA-Einreichung im ersten Quartal des nächsten Jahres voranzutreiben."
Aktuelle Unternehmenshighlights:
Abgeschlossene Mehrfachdosis-QT-Studie für Oliceridin. Im QT-Intervall wurde keine Akkumulation von Effekten beobachtet. Ein kleiner vorübergehender Effekt, der mit dem in der QT-Einzeldosisstudie beobachteten übereinstimmt, begann sich nach 12 Stunden aufzulösen und war am Ende des 24-stündigen Untersuchungszeitraums trotz wiederholter Dosierung von Oliceridin nicht vorhanden.
Oliceridin wurde gut vertragen, wobei 59 Probanden die maximale Tagesdosis von 27 mg erhielten. Es gab keine schwerwiegenden unerwünschten Ereignisse.
Zusätzlich zu diesen Daten gab das Unternehmen zuvor bekannt, dass es die Arbeiten abgeschlossen hat, um die anderen von der FDA in ihrem vollständigen Antwortschreiben (CRL) für Oliceridin angeforderten Punkte zu behandeln. Das Unternehmen erwartet, die NDA für Oliceridin im ersten Quartal 2020 erneut einzureichen.
Initiierte TRV250-Proof-of-Concept-Studie zur akuten Migräne . Dies ist eine doppelblinde, placebokontrollierte Einzeldosisstudie mit einem Ziel für die Aufnahme von ungefähr 120 Migränepatienten in ein validiertes Nitroglycerin (NTG) -Provokationsmigränemodell. Die Patienten werden randomisiert, bevor sie eine kontinuierliche NTG-Infusion erhalten, gefolgt von der Verabreichung einer subkutanen Dosis von 20 mg TRV250 oder Placebo.
Das Hauptziel der Studie ist es, die Zielbindung zu bestimmen, die als Reduktion von anhaltenden NTG-induzierten Kopfschmerzen gemessen wird. In dieser Studie wird auch die allgemeine Sicherheit von TRV250 und seine Fähigkeit zur Verringerung der symptomatischen Angst bewertet. Das Unternehmen geht davon aus, dass im zweiten Halbjahr 2020 Daten aus dieser Studie veröffentlicht werden.
„Mit Abschluss der Mehrfachdosis-QT-Studie haben wir alle erforderlichen Aktivitäten abgeschlossen, um die Fragen der FDA in der CRL für Oliceridin zu beantworten. Wir bleiben auf dem richtigen Weg, um die NDA für Oliceridin im ersten Quartal nächsten Jahres erneut einzureichen “, sagte Carrie Bourdow, President und Chief Executive Officer. "Ich freue mich auch sehr, dass wir unsere Pipeline mit der Einleitung der Proof-of-Concept-Studie zur akuten Migräne für TRV250 weiter vorantreiben."
Finanzergebnisse für das dritte Quartal 2019
Für das dritte Quartal 2019 wies das Unternehmen einen den Stammaktionären zurechenbaren Nettoverlust von 8,6 Mio. USD oder 0,09 USD pro Aktie nach 4,5 Mio. USD oder 0,06 USD pro Aktie im dritten Quartal 2018 aus. Dieser Anstieg ist hauptsächlich auf einen Anstieg zurückzuführen Forschungs- und Entwicklungskosten im Zusammenhang mit unserer QT-Studie für gesunde Freiwillige.
Die liquiden Mittel und Wertpapiere des Umlaufvermögens betrugen zum 30. September 2019 44,7 Mio. USD. Das Unternehmen ist der Ansicht, dass die liquiden Mittel und Wertpapiere des Umlaufvermögens zum 30. September 2019 zusammen mit den Zinsen ausreichen, um den Geschäftsbetrieb des Unternehmens zu finanzieren Ausgaben-, Schuldendienst- und Investitionsanforderungen bis zum dritten Quartal 2020.
Telefonkonferenz und Webcast-Informationen
Das Unternehmen wird am 4. November 2019 um 8.30 Uhr Eastern Time eine Telefonkonferenz und einen Webcast mit der Investment-Community abhalten, in dem sich Carrie Bourdow, President und Chief Executive Officer, Barry Shin, SVP und Chief Financial Officer, sowie Mark Demitrack äußern , SVP und Chief Medical Officer.
Live-Anruf: Gebührenfrei: (855) 465-0180
International: (484) 756-4313
Webcast:
investors.trevena.com
Wiederholung:
Gebührenfrei: (855) 859-2056
International: (404) 537-3406
Konferenz-ID: 5249124
(Verfügbar ca. eine Stunde nach Abschluss des Live-Anrufs bis zum 11. November 2019, 23:59 Uhr MEZ.)
https://www.globenewswire.com/news-release/2019/11/04/194012…
Antwort auf Beitrag Nr.: 61.831.017 von onkelen am 04.11.19 13:44:55

Hm, warum wurde die Aktie gestern dann so arg abgestraft? 🧐
Trevena präsentiert sich auf der Gesundheitskonferenz Stifel 2019
https://www.globenewswire.com/news-release/2019/11/18/194901… Trevena gibt Veröffentlichung der Ergebnisse der Phase-3-Sicherheitsstudie „Real World“ für Oliceridin im Journal of Pain Research bekannt
auszug....„Die Ergebnisse dieser Studie zeigen, dass Oliceridin bei einer Vielzahl von chirurgischen und medizinischen Erkrankungen mit akuten Schmerzen im Allgemeinen sicher und gut verträglich war. Darüber hinaus zeigte Oliceridin in der untersuchten Patientenpopulation eine konsistente Leistung, einschließlich älterer und fettleibiger Patienten, bei denen ein höheres Risiko für die Entwicklung opioidbedingter Nebenwirkungen besteht “, sagte Dr. Bergese. "Diese Ergebnisse legen nahe, dass Oliceridin eine potenzielle neue Behandlungsoption für die Behandlung mittelschwerer bis schwerer akuter Schmerzen darstellt, bei denen eine intravenöse Opioidtherapie erforderlich ist."
https://translate.google.com/translate?sl=en&tl=de&u=https%3…
Trevena + 12% bei positiven Oliceridin-Daten
Trevena + 12% bei positiven Oliceridin-Daten20. November 2019, 8:25 Uhr ET | Über: Trevena, Inc. (TRVN) | Von: Mamta Mayani , SA Nachrichtenredakteur
Trevena (NASDAQ: TRVN ) gibt Ergebnisse der offenen Phase-3-Sicherheitsstudie (ATHENA) für IV-Oliceridin im Journal of Pain Research bekannt .
Die Ergebnisse unterstreichen die Sicherheit und Verträglichkeit von Oliceridin bei der Behandlung mittelschwerer bis schwerer akuter Schmerzen in einer Vielzahl von chirurgischen / medizinischen Situationen und Patientengruppen.
768 Patienten wurden in die Studie aufgenommen. Die Ergebnisse zeigen, dass Oliceridin im Allgemeinen sicher und gut verträglich war.
Darüber hinaus zeigte Oliceridin eine konsistente Wirkung in der Patientenpopulation, einschließlich älterer und fettleibiger Patienten, bei denen ein höheres Risiko für die Entwicklung opioidbedingter Nebenwirkungen besteht.
Diese Ergebnisse legen nahe, dass Oliceridin eine potenzielle neue Behandlungsoption darstellt, bei der eine intravenöse Opioidtherapie erforderlich ist.
Die Aktien sind um 12% vor dem Börsengang gestiegen.
Trevena berichtet über Ergebnisse spezieller Populationsstudien für Oliceridin
Trevena berichtet über Ergebnisse spezieller Populationsstudien für Oliceridin20. November 2019, 08:37 Uhr ET | Über: Trevena, Inc. (TRVN) | Von: Mamta Mayani , SA Nachrichtenredakteur
Trevena (NASDAQ: TRVN ) gibt die Veröffentlichung von Ergebnissen aus zwei Phase-1-Studien zur Pharmakokinetik (PK) von IV-Oliceridin bekannt.
In der ersten Studie wurden die PK, die Sicherheit und die Verträglichkeit von Oliceridin bei 17 Patienten mit Nierenerkrankungen im Endstadium untersucht.
In der zweiten Phase-1-Studie wurden die PK, die Sicherheit und die Verträglichkeit von Oliceridin bei 34 Probanden mit leichter, mittelschwerer und schwerer Leberfunktionsstörung untersucht.
Die Ergebnisse zeigen, dass bei Patienten mit eingeschränkter Nierenfunktion oder bei Patienten mit leichter / mäßiger Leberfunktionsstörung keine Dosisanpassungen erforderlich sind.
Die Aktien sind um 12% vor dem Börsengang gestiegen.
Trevena: Lass dich nicht auf dieses Ding ein
https://translate.google.com/translate?sl=en&tl=de&u=https%3…
https://seekingalpha.com/article/4310250-trevena-dont-get-ho…
Kauf analyse seekingalpha aerticle
Ich habe den szenariobasierten gewichteten durchschnittlichen Gewinn je Aktie mit einem KGV von 8 bis 12 berechnet und eine Kaufspanne für Trevena-Aktien von etwa 0,21 bis 0,46 ermittelt. Nach meinen Berechnungen liegt das Unternehmen außerhalb meiner Kaufspanne, und angesichts des Risikoprofils des Unternehmens scheint die Belohnung etwas begrenzt zu sein. Ich gebe Trevena vorerst weiter, werde es aber auf meiner Beobachtungsliste behalten, falls die Aktie weiter fällt.
Kauf analyse seekingalpha aerticle
Ich habe den szenariobasierten gewichteten durchschnittlichen Gewinn je Aktie mit einem KGV von 8 bis 12 berechnet und eine Kaufspanne für Trevena-Aktien von etwa 0,21 bis 0,46 ermittelt. Nach meinen Berechnungen liegt das Unternehmen außerhalb meiner Kaufspanne, und angesichts des Risikoprofils des Unternehmens scheint die Belohnung etwas begrenzt zu sein. Ich gebe Trevena vorerst weiter, werde es aber auf meiner Beobachtungsliste behalten, falls die Aktie weiter fällt.
Antwort auf Beitrag Nr.: 62.076.311 von fypet am 04.12.19 12:40:13Die Analyse des Schreiberling war ja ganz nett und auch seine Einschätzung bezüglich der Werthaltigkeit der Aktie scheint weit weg von der Realität zu sein. Ich denke die Zulassung wird kommen und gerade wegen der Opiat Krise in den USA ist man für neue Wirkstoffe offen. Der Wirkstoff hat Vorteile die man nicht von der Hand weisen kann....... Es wird bald mit dem Kurs nach oben gehen und die Prognosen des Herausgebers 0,26-0,40 werden ein Wunschdenken bleiben.
Unbegreiflich manche Einschätzungen...
Unbegreiflich manche Einschätzungen...
Trevena präsentiert auf der Jahrestagung 2019 Daten der Phase 1 zu TRV250 für akute Migräne
https://translate.google.com/translate?sl=en&tl=de&u=https%3…
Antwort auf Beitrag Nr.: 62.142.620 von onkelen am 12.12.19 14:01:57
AUSZUG:
"Wir freuen uns, TRV250 als potenzielle neue Therapieoption für Migränepatienten zu verfolgen, von denen viele Schwierigkeiten haben, mit den derzeit verfügbaren Optionen Abhilfe zu schaffen",
"Die positiven Daten aus dieser Phase-1-Studie haben unsere kürzlich eingeleitete Proof-of-Concept-Studie untermauert, deren Daten für die zweite Hälfte des nächsten Jahres erwartet werden."
Dr. Mark A. Demitrack, Senior Vice President und Chief Medical Officer von Trevena, Inc.
Zitat von onkelen: https://translate.google.com/translate?sl=en&tl=de&u=https%3…
AUSZUG:
"Wir freuen uns, TRV250 als potenzielle neue Therapieoption für Migränepatienten zu verfolgen, von denen viele Schwierigkeiten haben, mit den derzeit verfügbaren Optionen Abhilfe zu schaffen",
"Die positiven Daten aus dieser Phase-1-Studie haben unsere kürzlich eingeleitete Proof-of-Concept-Studie untermauert, deren Daten für die zweite Hälfte des nächsten Jahres erwartet werden."
Dr. Mark A. Demitrack, Senior Vice President und Chief Medical Officer von Trevena, Inc.
Antwort auf Beitrag Nr.: 62.143.895 von bernie55 am 12.12.19 15:57:01bin heute vorsichtig eingestiegen:

Antwort auf Beitrag Nr.: 62.147.186 von Cyberhexe am 12.12.19 21:49:13Bin auch dabei ... 69,38 Cent gerade 5k in Stuttgart... schönen vierten Advent
seit gestern bin auch dabei .
Gestern Abende 34500 zu 0,66€ gekauft heute nochmal 15500 geordert wobei bis jetzt 4291 bedient wurden . Viel Glück
Glück Auf
Gestern Abende 34500 zu 0,66€ gekauft heute nochmal 15500 geordert wobei bis jetzt 4291 bedient wurden . Viel Glück
Glück Auf
Wie seht ihr die Gefahr des Zurückkommens auf rd 50$ Cent !?!??
Antwort auf Beitrag Nr.: 62.151.350 von mabu1970 am 13.12.19 12:13:17tja wenn ich Hellseher wäre ,wäre ich schon Reich. Es kann alles passieren . Kann sein das es wieder Richtung 0,50 geht kann aber auch ganz schnell Richtung 1,50 gehen .
Nun habe ich restliche Aktien bekommen habe nun 50.000 stck . Shit drauf Glück Auf
Nun habe ich restliche Aktien bekommen habe nun 50.000 stck . Shit drauf Glück Auf
Antwort auf Beitrag Nr.: 62.152.421 von Bosporus74 am 13.12.19 14:07:20
auf welchem börsenplatz hast du sie bekommen und was hast du dafür gezahlt?
Zitat von Bosporus74: tja wenn ich Hellseher wäre ,wäre ich schon Reich. Es kann alles passieren . Kann sein das es wieder Richtung 0,50 geht kann aber auch ganz schnell Richtung 1,50 gehen .
Nun habe ich restliche Aktien bekommen habe nun 50.000 stck . Shit drauf Glück Auf
auf welchem börsenplatz hast du sie bekommen und was hast du dafür gezahlt?
Antwort auf Beitrag Nr.: 62.153.879 von onkelen am 13.12.19 16:17:07Hi
34500 stck Gestern zu 0,665€ über Lang und Schwarz heute 15500 über Tradegate zu 0,69 und 0,70 wegen Teilausführung.
Bosporus
Shit drauf Glück Auf
34500 stck Gestern zu 0,665€ über Lang und Schwarz heute 15500 über Tradegate zu 0,69 und 0,70 wegen Teilausführung.
Bosporus
Shit drauf Glück Auf


Antwort auf Beitrag Nr.: 62.154.020 von Bosporus74 am 13.12.19 16:29:00ich wünsch dir viel glück damit

Antwort auf Beitrag Nr.: 62.154.020 von Bosporus74 am 13.12.19 16:29:00
ich habe ebenfalls weitere Order platziert, allerdings zu tieferen Kursen; ab $0,65 abwärts insgesamt 45.000 Stück. Bin mal gespannt, ob diese noch ausgeführt werden.
Wie immer Bernie: Time will tell!
Zitat von Bosporus74:
ich habe ebenfalls weitere Order platziert, allerdings zu tieferen Kursen; ab $0,65 abwärts insgesamt 45.000 Stück. Bin mal gespannt, ob diese noch ausgeführt werden.
Wie immer Bernie: Time will tell!

Antwort auf Beitrag Nr.: 62.154.395 von onkelen am 13.12.19 16:57:31Danke allen viel Glück .
Habe Stopp bei 0,58€ mal schauen. Habe letzte Woche mit Kauf Puma Bio gut Gewinn gemacht .
Shit drauf Glück Auf
Habe Stopp bei 0,58€ mal schauen. Habe letzte Woche mit Kauf Puma Bio gut Gewinn gemacht .
Shit drauf Glück Auf
Trevena gibt den Beginn einer Proof-of-Concept-Studie für TRV734 zur potenziellen Behandlung von Opioidkonsumstörungen bekannt
https://translate.google.com/translate?sl=en&tl=de&u=https%3…
Antwort auf Beitrag Nr.: 62.222.381 von onkelen am 23.12.19 17:18:07hab heute auf 30'000 Teile TRVN aufgestockt.
Good luck!
Good luck!
.... es freut mich , dass sich die cyberhexe wieder im forum meldet.... bei der letzten Trevena Ralley hat sie tollen Input geliefert!
Wenn Sie kauft, ist es für mich ein gutes Vorzeichen!
... “clovis oder Trevena , jetzt musst du dich entscheiden“
Wenn Sie kauft, ist es für mich ein gutes Vorzeichen!
... “clovis oder Trevena , jetzt musst du dich entscheiden“
Antwort auf Beitrag Nr.: 62.246.348 von donph am 30.12.19 07:16:56
...hab heute noch einmal aufgestockt: bin jetzt bei 42'000 Aktien. Weitere Abstauberlimits sind platziert.
Zitat von donph: .... es freut mich , dass sich die cyberhexe wieder im forum meldet.... bei der letzten Trevena Ralley hat sie tollen Input geliefert!
Wenn Sie kauft, ist es für mich ein gutes Vorzeichen!
... “clovis oder Trevena , jetzt musst du dich entscheiden“
...hab heute noch einmal aufgestockt: bin jetzt bei 42'000 Aktien. Weitere Abstauberlimits sind platziert.

Antwort auf Beitrag Nr.: 62.263.934 von fypet am 02.01.20 14:43:44gerade noch einmal aufgestockt auf 100k
Antwort auf Beitrag Nr.: 62.277.971 von Cyberhexe am 03.01.20 21:19:12.... steht die positive Entscheidung der FDA kurz bevor?
Mit welchen kursen rechnet die cyberhexe nach dem Okay der FDA?
Mit welchen kursen rechnet die cyberhexe nach dem Okay der FDA?
Antwort auf Beitrag Nr.: 62.277.971 von Cyberhexe am 03.01.20 21:19:12Das short interest war eine reine INFO ob es zutrifft steht in den Sternen!
Bei $0.865 ist ein bekannter Widerstand der war schon im Oktober 18 aktuell,
ich rechne mit Kursen von $3.5 entspricht eine MK von $250Mio.
Habe noch keine Aktien ins Depot gelegt, wann erwarten Sie die FDA Entscheidung?
Bei $0.865 ist ein bekannter Widerstand der war schon im Oktober 18 aktuell,
ich rechne mit Kursen von $3.5 entspricht eine MK von $250Mio.
Habe noch keine Aktien ins Depot gelegt, wann erwarten Sie die FDA Entscheidung?
Antwort auf Beitrag Nr.: 62.277.971 von Cyberhexe am 03.01.20 21:19:12
...ich habe noch einmal die FDA Briefing Documents zum AC im Oktober 2018 studiert. In diesen wird bemängelt, dass eine dosisabhängige Verlängerung der QTc-Phase im EKG beobachtet wurde, und zwar:
3mg --> 7 ms
6mg --> 12 ms
Die Behörde kam hinsichtlich QTc in den Briefing Documents zur Schlussfolgerung, dass die eingereichten Daten nicht ausreichend sind, um die QT-Effekte von Oliceridin für das vorgeschlagene maximale Dosierungsschema vorherzusagen.
In den "Type A meeting minutes" vom 28.1.2019 gibt TRVN bekannt, dass die Arzneimittelbehörde (FDA) eine weitere Studie mit gesunden Freiwilligen verlangt, in welcher QTc-Daten bei Mehrfachdosierung zu erfassen sind.
Am 4.11.2019 hat Trevena den Abschluss dieser QT-Mehrfachdosis-Studie bekanntgegeben und zwar mit folgendem Ergebnis:
- keine Akkumulation der QWirkung im QT-Intervall
- es gibt einen kleinen vörübergehenden Effekt, der mit dem in der QT-Einzeldosis-Studie übereinstimmt
- dieser Effekt beginnt sich nach 12h aufzulösen und war am Ende der 24-stündigen Studienperiode trotz wiederholter Oli.-Dosierung nicht vorhanden
- Oli, wurde gut vertragen und es gab keine ernsthaften unerwünschten Ereignisse
Ich denke, dass die von der Behörde beim AC im Oktober 2018 geäusserten Bedenken hinsichtlich Kardiotox bzw. QT-Verlängerung ausgeräumt wurden. Damit dürfte der Weg frei sein für eine Zulassung von Oli. --> Ich werde deswegen weitere Anteile ins Depot legen.
Zitat von Cyberhexe: gerade noch einmal aufgestockt auf 100k
...ich habe noch einmal die FDA Briefing Documents zum AC im Oktober 2018 studiert. In diesen wird bemängelt, dass eine dosisabhängige Verlängerung der QTc-Phase im EKG beobachtet wurde, und zwar:
3mg --> 7 ms
6mg --> 12 ms
Die Behörde kam hinsichtlich QTc in den Briefing Documents zur Schlussfolgerung, dass die eingereichten Daten nicht ausreichend sind, um die QT-Effekte von Oliceridin für das vorgeschlagene maximale Dosierungsschema vorherzusagen.
In den "Type A meeting minutes" vom 28.1.2019 gibt TRVN bekannt, dass die Arzneimittelbehörde (FDA) eine weitere Studie mit gesunden Freiwilligen verlangt, in welcher QTc-Daten bei Mehrfachdosierung zu erfassen sind.
Am 4.11.2019 hat Trevena den Abschluss dieser QT-Mehrfachdosis-Studie bekanntgegeben und zwar mit folgendem Ergebnis:
- keine Akkumulation der QWirkung im QT-Intervall
- es gibt einen kleinen vörübergehenden Effekt, der mit dem in der QT-Einzeldosis-Studie übereinstimmt
- dieser Effekt beginnt sich nach 12h aufzulösen und war am Ende der 24-stündigen Studienperiode trotz wiederholter Oli.-Dosierung nicht vorhanden
- Oli, wurde gut vertragen und es gab keine ernsthaften unerwünschten Ereignisse
Ich denke, dass die von der Behörde beim AC im Oktober 2018 geäusserten Bedenken hinsichtlich Kardiotox bzw. QT-Verlängerung ausgeräumt wurden. Damit dürfte der Weg frei sein für eine Zulassung von Oli. --> Ich werde deswegen weitere Anteile ins Depot legen.
Antwort auf Beitrag Nr.: 62.279.669 von donph am 04.01.20 09:34:35
Die Wiedereinreichng der Zulassungsunterlagen wurde von Tevena auf das 1.Quartal 2020 angekündigt. Ich denke, dass die Bearbeitungszeit auf 6 Monate begrenzt ist, da es sich um eine "Resubmission" handelt. Zulassungsentscheidung demzufolge im 3.Quartal 2020.
Die zu erwartenden Kurse? Oh, ich hab meine Glaskugel verlegt 🤔
Nach Einreichung der Unterlagen bzw. nach Annahme des eingereichten Dossiers (60 Tage nach Einreichung der Zulassungsunterlagen erfolgt eine Bekanntgabe hinsichtlich formaler Vollständigkeit) erwarte ich Kurse um die $1.50. Bei einer Zulassung sollten Kurse um 3$ möglich sein!
Zitat von donph: .... steht die positive Entscheidung der FDA kurz bevor?
Mit welchen kursen rechnet die cyberhexe nach dem Okay der FDA?
Die Wiedereinreichng der Zulassungsunterlagen wurde von Tevena auf das 1.Quartal 2020 angekündigt. Ich denke, dass die Bearbeitungszeit auf 6 Monate begrenzt ist, da es sich um eine "Resubmission" handelt. Zulassungsentscheidung demzufolge im 3.Quartal 2020.
Die zu erwartenden Kurse? Oh, ich hab meine Glaskugel verlegt 🤔
Nach Einreichung der Unterlagen bzw. nach Annahme des eingereichten Dossiers (60 Tage nach Einreichung der Zulassungsunterlagen erfolgt eine Bekanntgabe hinsichtlich formaler Vollständigkeit) erwarte ich Kurse um die $1.50. Bei einer Zulassung sollten Kurse um 3$ möglich sein!
Antwort auf Beitrag Nr.: 62.281.067 von Cyberhexe am 04.01.20 13:41:13Hi hexe
nun hast du mehr wie ich. Bin noch bei 50.000 stck. 🤑Aber wenn Zulassung kommt und so wie ich die Amis kenne werden wir Kurse um die 7,00 $ ganz locker sehen .
Schippe drauf Glück Auf
nun hast du mehr wie ich. Bin noch bei 50.000 stck. 🤑Aber wenn Zulassung kommt und so wie ich die Amis kenne werden wir Kurse um die 7,00 $ ganz locker sehen .
Schippe drauf Glück Auf
Antwort auf Beitrag Nr.: 62.282.723 von Bosporus74 am 04.01.20 19:25:58... hat der porsche vom bosporus 74 dann das wunschkennzeichen trevena1?😂
Da bekomme ich fast ein schlechtes gewissen, dass ich noch an der seitenlinie warte...
Aufgrund der der opiod krise der amis erwarte ich mir eine strenge prüfung durch die fda bzw habe ich noch meine bedenken... der ceo von trevena hat bei $1,02 gekauft!
Cyberhexe vielen Dank für deine beantwortung meiner frage!
Da bekomme ich fast ein schlechtes gewissen, dass ich noch an der seitenlinie warte...
Aufgrund der der opiod krise der amis erwarte ich mir eine strenge prüfung durch die fda bzw habe ich noch meine bedenken... der ceo von trevena hat bei $1,02 gekauft!
Cyberhexe vielen Dank für deine beantwortung meiner frage!
Antwort auf Beitrag Nr.: 62.282.855 von donph am 04.01.20 19:58:06Die 2016 erteilte "breakthrough designation" für Oliceridine wurde im März 2019 von der FDA wegen unzureichneder Daten für diese Kennzeichnung wieder aberkannt. Dies dürfte jedoch den Zeitrahmen für die Zulassungsentscheidung von Oli nicht tangieren, da es sich hierbei um eine Wiedereinreichung der Zulassungsunterlagen handelt und somit die Bearbeitungszeit, ungeachtet einer BTD, auf 6 Monate festgelegt werden sollte.
Time will tell!
Time will tell!
Antwort auf Beitrag Nr.: 62.281.067 von Cyberhexe am 04.01.20 13:41:13Halte die Einschätzung von 3 $ für eher konservativ.
Wir hatten in 2019 bereits Kurse im Bereich von 3,50 $.
Sollten sie eine Genehmigung erhalten, wie geht es dann weiter?
Eigene Vermarktung dürfte ohne safte KE nicht laufen.
Wir hatten in 2019 bereits Kurse im Bereich von 3,50 $.
Sollten sie eine Genehmigung erhalten, wie geht es dann weiter?
Eigene Vermarktung dürfte ohne safte KE nicht laufen.
Antwort auf Beitrag Nr.: 62.281.067 von Cyberhexe am 04.01.20 13:41:13Die potentielle Zulassung von Oliceridin (als Injektion) wäre erst der erste Schritt. Sollte die Zulassung erfolgen, kommt sicher auch eine Zulassung für die perorale Applikation (Tablette/Kapsel) hinzu. Das würde einen imensen Impact im US-Arzneimittelmarkt machen.
Der politische Druck, etwas gegen die 'Opioid-Krise' zu tun ist enorm.
Der politische Druck, etwas gegen die 'Opioid-Krise' zu tun ist enorm.
"Wir machen in allen Bereichen stetige Fortschritte, um die Informationen zu sammeln, die für die erneute Einreichung der NDA für Oliceridin erforderlich sind", sagte Carrie Bourdow, President und Chief Executive Officer. „Ich freue mich, dass wir die Arbeit an drei der vier in der CRL aufgeführten Punkte abgeschlossen haben. Sobald wir Top-Line-Daten für die QT-Studie für gesunde Freiwillige erhalten, über die wir voraussichtlich im nächsten Quartal Bericht erstatten, werden wir die NDA voraussichtlich so früh wie möglich im ersten Quartal des nächsten Jahres erneut einreichen. “
tja bin mal gesapannt
Schippe drauf Glück Auf
tja bin mal gesapannt
Schippe drauf Glück Auf
... bosporus74 für deinen letzten post! War für mich eine wichtige Information!
Wenn vorher keine übernahme kommt, können wir bis 2021 mit anderen titeln geld verdienen...😂
Wenn vorher keine übernahme kommt, können wir bis 2021 mit anderen titeln geld verdienen...😂
die Unternehmenspräsentation wurde aktualisiert:
https://d1io3yog0oux5.cloudfront.net/_9a5b3f6942e7dadc825709…
Mit dem positiven Ergebnis der QTc-Studie wurde mAn die grösste Hürde des CRL (Complete Response Letter) "übersprungen":
Da alle anderen "Aufgaben" des CRL ebenfalls erledigt wurden, sehe ich keinen Grund, Oliceridine die Zulassung zu verweigern. Wenn beim letzten AC das Ergebnis noch 7:8 negativ ausgefallen ist, wäre die Entscheidung bei einem weiteren AC eindeutig positiv - jedoch glaube ich nicht, dass die FDA ein 2. AC einberufen wird.
https://d1io3yog0oux5.cloudfront.net/_9a5b3f6942e7dadc825709…
Mit dem positiven Ergebnis der QTc-Studie wurde mAn die grösste Hürde des CRL (Complete Response Letter) "übersprungen":

Da alle anderen "Aufgaben" des CRL ebenfalls erledigt wurden, sehe ich keinen Grund, Oliceridine die Zulassung zu verweigern. Wenn beim letzten AC das Ergebnis noch 7:8 negativ ausgefallen ist, wäre die Entscheidung bei einem weiteren AC eindeutig positiv - jedoch glaube ich nicht, dass die FDA ein 2. AC einberufen wird.
Hallo habe ich das richtig verstanden der fda entscheid wird im 3. Quatal fallen?
Trevena Inc (NASDAQ: TRVN) verzeichnet starken Rückgang der Short Interest
Trevena Inc (NASDAQ: TRVN) verzeichnet starken Rückgang der Short InterestGepostet von Lars Charter am 13. Januar 2020
Trevena logoTrevena Inc (NASDAQ: TRVN) war das Ziel eines starken Rückgangs des Short-Interesses im Dezember. Am 13. Dezember gab es Short-Zinsen in Höhe von 4.420.000 Aktien, ein Rückgang von 14,2% gegenüber dem 28. November in Höhe von 5.150.000 Aktien. Etwa 5,3% der Aktien des Unternehmens sind Leerverkäufe. Bezogen auf ein durchschnittliches Tagesvolumen von 512.800 Aktien beträgt das Days-to-Cover-Verhältnis derzeit 8,6 Tage.
Mehrere große Investoren haben kürzlich TRVN-Aktien gekauft und verkauft. Clear Creek Financial Management LLC hat im 2. Quartal eine neue Beteiligung an Trevena im Wert von 75.000 USD erworben. Jane Street Group LLC hat im zweiten Quartal eine neue Beteiligung an Trevena im Wert von 51.000 USD erworben. D. E. Shaw & Co. Inc. erwarb im zweiten Quartal eine neue Beteiligung an Trevena im Wert von 39.000 USD. Morgan Stanley erhöhte seine Beteiligung an Trevena im zweiten Quartal um 2.651,1%. Morgan Stanley besitzt jetzt 530.436 Aktien des biopharmazeutischen Unternehmens im Wert von 546.000 USD, nachdem im Berichtszeitraum weitere 511.155 Aktien erworben wurden. Schließlich hat die Vanguard Group Inc. ihre Beteiligung an Trevena im zweiten Quartal um 11,5% aufgestockt. Vanguard Group Inc. besitzt nun 3.915.315 Aktien des biopharmazeutischen Unternehmens im Wert von 4.032.000 USD, nachdem im Berichtszeitraum weitere 403.060 Aktien erworben wurden. Hedgefonds und andere institutionelle Anleger halten 20,42% der Aktien des Unternehmens.
Erhalten Sie Trevena-Benachrichtigungen:
Die TRVN-Aktie notierte am Montag zur Mittagszeit mit einem Minus von 0,01 USD und erreichte 0,85 USD. Die Aktie hatte ein Handelsvolumen von 13.417 Aktien gegenüber einem durchschnittlichen Volumen von 550.849 Aktien. Das Unternehmen hat eine Verschuldungsquote von 0,23, eine aktuelle Quote von 3,31 und eine schnelle Quote von 3,31. Das Unternehmen hat einen gleitenden 50-Tage-Durchschnitt von 0,76 USD und einen gleitenden 200-Tage-Durchschnitt von 0,88 USD. Das Unternehmen hat eine Marktkapitalisierung von 79,63 Mio. USD, ein Preis-Leistungs-Verhältnis von -2,02 und ein Beta von 2,61. Trevena hat ein 52-Wochen-Tief von 0,49 USD und ein 52-Wochen-Hoch von 2,00 USD.
Trevena (NASDAQ: TRVN) veröffentlichte zuletzt seine Quartalsergebnisse am Montag, dem 4. November. Das biopharmazeutische Unternehmen meldete für das Quartal einen Gewinn je Aktie (EPS) von 0,09 US-Dollar, wobei die Schätzungen der Analysten zu einem Konsens von 0,08 US-Dollar um 0,01 US-Dollar fehlten. Analysten gehen davon aus, dass Trevena im laufenden Jahr ein Ergebnis je Aktie von -0,28 erzielen wird.
Mehrere Research-Analysten haben sich zur TRVN-Aktie geäußert. HC Wainwright wiederholte sein Kaufrating und gab in einem Bericht am Dienstag, dem 5. November, ein Kursziel von 3,50 USD für Trevena-Aktien heraus. Zacks Investment Research hat am Mittwoch, dem 18. Dezember, die Aktien von Trevena in einem Research-Bericht von einem "Sell" -Rating auf ein "Hold" -Rating heraufgestuft. Schließlich hat ValuEngine in einem Bericht am Dienstag, dem 3. Dezember, die Aktien von Trevena von einem "Verkaufs" -Rating auf ein "Halten" -Rating heraufgestuft.
Über Trevena
Trevena, Inc, ein biopharmazeutisches Unternehmen, konzentriert sich auf die Entwicklung und Vermarktung von Behandlungsoptionen, die auf Erkrankungen abzielen und diese behandeln, die das zentrale Nervensystem betreffen. Zu den Produktkandidaten zählen Oliceridin-Injektionen, ein G-Protein-abhängiger Mu-Opioid-Rezeptor (MOR) -Ligand, der klinische Phase-III-Studien zur Behandlung mittelschwerer bis schwerer akuter Schmerzen abgeschlossen hat, bei denen eine intravenöse Verabreichung erforderlich ist. TRV250, ein G-Protein-abhängiger Delta-Opioid-Rezeptor-Ligand, der sich in einer klinischen Phase-I-Studie zur Behandlung von akuter Migräne befindet; TRV734, ein niedermolekularer G-Protein-Bias-Ligand des MOR, der die klinische Phase-I-Studie zur Behandlung mittelschwerer bis schwerer akuter und chronischer Schmerzen abgeschlossen hat; TRV027 zur Behandlung von akuter Herzinsuffizienz; und TRV045, ein neuartiger S1P-Modulator zur Behandlung chronischer Schmerzen.
https://rivertonroll.com/news/2020/01/13/trevena-inc-nasdaqt…
Antwort auf Beitrag Nr.: 62.366.144 von Investini66 am 14.01.20 08:15:39Sie haben die Wiedereinreichung für Q1 angekündigt (ursprünglich mal "as early as possible in Q1") und wenn das so kommt, gehe ich von einer 6-monatigen PDUFA Frist aus, so dass in Q3 die Zulassung erfolgen kann. Ich sehe derzeit keinen Grund, weshalb das nicht klappen sollte.
Da der Cash-Bestand ebenfalls nur bis Q3 reicht, ist allerdings fraglich, wie die weitere Finanzierung aussieht. Entweder, man verpartnert sich oder man nutzt einen der positiven Milestones für eine Kapitalerhöhung. Für wahrscheinlicher halte ich letzteres.
Da der Cash-Bestand ebenfalls nur bis Q3 reicht, ist allerdings fraglich, wie die weitere Finanzierung aussieht. Entweder, man verpartnert sich oder man nutzt einen der positiven Milestones für eine Kapitalerhöhung. Für wahrscheinlicher halte ich letzteres.
Antwort auf Beitrag Nr.: 62.368.298 von opportoni am 14.01.20 11:01:27Diese Entscheidung müsste den TRVN-Kurs beflügeln: AC einstimmig gegen Zulassung von oxycodegol!
Ich kann mich nicht an ein derartig eindeutig negatives Ergebnis eines AC erinnern: 27:0 gegen die Zulassung von NKTR-181 (oxycodegol), einem Schmerzmittel (NCE), welches als erstes vollständiges Mu-Opioid-Agonistenmolekül eine wirksame Schmerzlinderung bewirken soll, ohne die für Opioide übliche Euphorie auszulösen, die bei Standardopioiden zu Missbrauch und Sucht führen kann.
(Reuters) - Independent advisers to the U.S. Food and Drug Administration on Tuesday unanimously voted against Nektar Therapeutics' opioid painkiller for adults with chronic low back pain for whom currently available therapies have been inadequate.
The panel voted 27-0 against approval of the oral pill, NKTR-181, raising concerns over its potential misuse or abuse.
By reducing the rate at which the drug enters the brain, Nektar said it aims to relieve pain without triggering the euphoric effect of opioids that could lead to abuse and addiction.
Die möglichen negativen Auswirkungen auf die Leberwerte dürften ein grosses Hindernis für die Zulassung sein:
Hepatic Safety Summary
The nonclinical program did not reveal any risks related to the hepatobiliary system. However,
during development, some subjects developed asymptomatic elevations in LFTs, predominantly
transaminase elevations, and precautions were added to the study protocols including criteria for
discontinuation of study drug based on LFT abnormalities. A total of 17 patients, all of whom
were on oxycodegol, were discontinued for LFT abnormalities. The vast majority of the events
occurred within one month of study drug initiation in both Phase 3 studies, during the initial
open-label dosing phase of the efficacy studies or on open-label studies when all patients were
being dosed with active drug. Review of the individual cases indicates that the LFT elevations
were transient and rapidly reversible with discontinuation of drug. However, medical review of
the individual cases suggests a causal relationship to oxycodegol in that most cases are not
confounded. No case met all criteria for Hy’s Law except one patient diagnosed with acute
hepatitis B. There was one case (Subject ) with signs or symptoms attributable to LFT
elevations as the patient experienced right upper quadrant pain with elevations in her LFTs. A
different patient nearly met biochemical criteria for Hy’s law (AST>3xULN, bilirubin
1.85xULN) with no symptoms.
Ich kann mich nicht an ein derartig eindeutig negatives Ergebnis eines AC erinnern: 27:0 gegen die Zulassung von NKTR-181 (oxycodegol), einem Schmerzmittel (NCE), welches als erstes vollständiges Mu-Opioid-Agonistenmolekül eine wirksame Schmerzlinderung bewirken soll, ohne die für Opioide übliche Euphorie auszulösen, die bei Standardopioiden zu Missbrauch und Sucht führen kann.
(Reuters) - Independent advisers to the U.S. Food and Drug Administration on Tuesday unanimously voted against Nektar Therapeutics' opioid painkiller for adults with chronic low back pain for whom currently available therapies have been inadequate.
The panel voted 27-0 against approval of the oral pill, NKTR-181, raising concerns over its potential misuse or abuse.
By reducing the rate at which the drug enters the brain, Nektar said it aims to relieve pain without triggering the euphoric effect of opioids that could lead to abuse and addiction.
Die möglichen negativen Auswirkungen auf die Leberwerte dürften ein grosses Hindernis für die Zulassung sein:
Hepatic Safety Summary
The nonclinical program did not reveal any risks related to the hepatobiliary system. However,
during development, some subjects developed asymptomatic elevations in LFTs, predominantly
transaminase elevations, and precautions were added to the study protocols including criteria for
discontinuation of study drug based on LFT abnormalities. A total of 17 patients, all of whom
were on oxycodegol, were discontinued for LFT abnormalities. The vast majority of the events
occurred within one month of study drug initiation in both Phase 3 studies, during the initial
open-label dosing phase of the efficacy studies or on open-label studies when all patients were
being dosed with active drug. Review of the individual cases indicates that the LFT elevations
were transient and rapidly reversible with discontinuation of drug. However, medical review of
the individual cases suggests a causal relationship to oxycodegol in that most cases are not
confounded. No case met all criteria for Hy’s Law except one patient diagnosed with acute
hepatitis B. There was one case (Subject ) with signs or symptoms attributable to LFT
elevations as the patient experienced right upper quadrant pain with elevations in her LFTs. A
different patient nearly met biochemical criteria for Hy’s law (AST>3xULN, bilirubin
1.85xULN) with no symptoms.
... The panel voted 27-0 against approval of the oral pill, NKTR-181, raising concerns over its potential misuse or abuse.
🤔🤔🤔
...es dürften einige leute mit einem anderen ergebnis gerechnet haben, wenn man sich den kursverlauf der letzten tage bei nektar ansieht!
... wenigstens bleibt es spannend😉
🤔🤔🤔
...es dürften einige leute mit einem anderen ergebnis gerechnet haben, wenn man sich den kursverlauf der letzten tage bei nektar ansieht!
... wenigstens bleibt es spannend😉
Antwort auf Beitrag Nr.: 62.377.904 von donph am 15.01.20 07:52:43
Der Wirkstoff Oxycodegol (ehemals NKTR-181) wird nicht weiter entwickelt! Das hätte ich so vor dem AC nicht erwartet. Für Trevena bedeutet dies auf der Wettbewerbsseite eine Erleichterung!
SAN FRANCISCO, Jan. 14, 2020 /PRNewswire/ -- Nektar Therapeutics (NASDAQ: NKTR) issued a statement today following a meeting of the Food and Drug Administration's (FDA's) Anesthetic and Analgesic Drug Products Advisory Committee (AADPAC) and Drug Safety and Risk Management Advisory Committee (DSaRM) to discuss the New Drug Application (NDA) for oxycodegol (formerly NKTR-181) where the Committees did not recommend approval of oxycodegol.
The Company is disappointed in the Committees' vote regarding oxycodegol and believes it is also disappointing for patients suffering from chronic pain and the physicians that treat those patients who are currently relying on existing opioid therapies. The Company created oxycodegol specifically to both help these patients and physicians and address the opioid abuse epidemic. For the development of oxycodegol, the Company used well-established efficacy, safety and human abuse potential study designs that have led to many prior FDA approvals of opioid medications. The development program for oxycodegol included over 2,000 patients and volunteers.
As a result of today's vote at the meeting, the Company has decided to withdraw the NDA for oxycodegol and to make no further investment into the program.
Zitat von donph: ... The panel voted 27-0 against approval of the oral pill, NKTR-181, raising concerns over its potential misuse or abuse.
🤔🤔🤔
...es dürften einige leute mit einem anderen ergebnis gerechnet haben, wenn man sich den kursverlauf der letzten tage bei nektar ansieht!
... wenigstens bleibt es spannend😉
Der Wirkstoff Oxycodegol (ehemals NKTR-181) wird nicht weiter entwickelt! Das hätte ich so vor dem AC nicht erwartet. Für Trevena bedeutet dies auf der Wettbewerbsseite eine Erleichterung!
SAN FRANCISCO, Jan. 14, 2020 /PRNewswire/ -- Nektar Therapeutics (NASDAQ: NKTR) issued a statement today following a meeting of the Food and Drug Administration's (FDA's) Anesthetic and Analgesic Drug Products Advisory Committee (AADPAC) and Drug Safety and Risk Management Advisory Committee (DSaRM) to discuss the New Drug Application (NDA) for oxycodegol (formerly NKTR-181) where the Committees did not recommend approval of oxycodegol.
The Company is disappointed in the Committees' vote regarding oxycodegol and believes it is also disappointing for patients suffering from chronic pain and the physicians that treat those patients who are currently relying on existing opioid therapies. The Company created oxycodegol specifically to both help these patients and physicians and address the opioid abuse epidemic. For the development of oxycodegol, the Company used well-established efficacy, safety and human abuse potential study designs that have led to many prior FDA approvals of opioid medications. The development program for oxycodegol included over 2,000 patients and volunteers.
As a result of today's vote at the meeting, the Company has decided to withdraw the NDA for oxycodegol and to make no further investment into the program.
Antwort auf Beitrag Nr.: 62.378.384 von Cyberhexe am 15.01.20 08:47:10das Potenzial von Oliceridine ist riesig - in der vorgestern aktualisierten Unternehmenpräsentation wird für Oliceridine 1 bis 1.5 Milliarden $ angegeben.
Schon nur 10% davon würden ein Vielfaches des jetzigen Börsenwert (ca. 80m$) rechtfertigen.
Ich habe weiter aufgestockt.

Schon nur 10% davon würden ein Vielfaches des jetzigen Börsenwert (ca. 80m$) rechtfertigen.
Ich habe weiter aufgestockt.

Der Kurs derzeit ist sicherlich deutlich zu gering. Aber ich glaube, man wird den high risk Patienten - Bereich abdecken - ca. 200 - 250 Mio. - schätze 200 - 250 Peak Sales. Dürfte aber bei einer m.E. sicheren Zulassung reichen, den Kurs locker in den Bereich von 3 - 3,50 $ zu bringen. Die Frage ist, wieviel man für die Vertreibung noch braucht. Da muss sicherlich ein Partner her.
INNOVATING FOR PATIENTS
https://d1io3yog0oux5.cloudfront.net/_9a5b3f6942e7dadc825709…
Antwort auf Beitrag Nr.: 62.383.406 von onkelen am 15.01.20 15:54:48
...alle im Rahmen des CRL geäusserten Mängel/Einwände/Fragen wurden addressiert und können beantwortet werden, insbesondere die in der Klinik gesichtete Verlängerung der QT-Phase beim Herzschlag müsste mit der "Freiwilligen-Studie" (--> multi-dose QT study for IV oliceridine) zur vollsten Zufriedenheit der FDA beantwortet sein.

“We believe the information provided from the multi-dose QT study thoroughly addresses the questions FDA posed to us. The results show no evidence of an accumulating effect of oliceridine on the QT interval, when administered in repeated doses to the 27 mg proposed maximum daily dose over 24 hours,” said Mark Demitrack, M.D., SVP and Chief Medical Officer. “These data, alongside the cardiac safety data submitted in the original NDA, provide a comprehensive assessment of the safety and tolerability of oliceridine, and will allow us to move ahead with plans for NDA resubmission in the first quarter of next year.”
Recent Corporate Highlights:
Completed multi-dose QT study for oliceridine. No accumulation of effect was observed on the QT interval. A small, transient effect, consistent with that observed in the single-dose QT study, began dissipating after 12 hours and was absent at the end of the 24-hour study period despite repeated dosing of oliceridine.
...alle im Rahmen des CRL geäusserten Mängel/Einwände/Fragen wurden addressiert und können beantwortet werden, insbesondere die in der Klinik gesichtete Verlängerung der QT-Phase beim Herzschlag müsste mit der "Freiwilligen-Studie" (--> multi-dose QT study for IV oliceridine) zur vollsten Zufriedenheit der FDA beantwortet sein.

“We believe the information provided from the multi-dose QT study thoroughly addresses the questions FDA posed to us. The results show no evidence of an accumulating effect of oliceridine on the QT interval, when administered in repeated doses to the 27 mg proposed maximum daily dose over 24 hours,” said Mark Demitrack, M.D., SVP and Chief Medical Officer. “These data, alongside the cardiac safety data submitted in the original NDA, provide a comprehensive assessment of the safety and tolerability of oliceridine, and will allow us to move ahead with plans for NDA resubmission in the first quarter of next year.”
Recent Corporate Highlights:
Completed multi-dose QT study for oliceridine. No accumulation of effect was observed on the QT interval. A small, transient effect, consistent with that observed in the single-dose QT study, began dissipating after 12 hours and was absent at the end of the 24-hour study period despite repeated dosing of oliceridine.
Antwort auf Beitrag Nr.: 62.382.860 von Cyberhexe am 15.01.20 15:07:56hi hexe wieviele hast du denn nun . Bin immer noch bei 50.000 stck. Werde vielleicht die tage 10.000 dazu kaufen
Und das nächste Opioid im Adcom gescheitert: Intellipharmaceuticals Oxycodone ER mit 2:24 abgelehnt. War auch schon der zweite Anlauf glaube ich.
Zum Glück hat Oliceridin aufgrund der IV Darreichung im Krankenhaus nur ein geringes Missbrauchspotenzial.
https://seekingalpha.com/news/3532217-fda-ad-com-thumbs-down…
Zum Glück hat Oliceridin aufgrund der IV Darreichung im Krankenhaus nur ein geringes Missbrauchspotenzial.
https://seekingalpha.com/news/3532217-fda-ad-com-thumbs-down…
Hallo bin vor einigen Wochen nun ebenfalls hier mit 15k Aktien eingestiegen und wollte mich nun auch mal kurz zu Wort melden.
Klingt ja derzeit alles wie "läuft" nach Plan usw. das Potential ist langfristig groß die Wirkung im Vergleich mit anderen Produkten überzeugt auch und würde die Situation für Patienten definitiv verbessern usw.
Also alles gute Nachrichten. Wie begründet sich dann das doch seeehr überschaubare Volumen bei der Aktie ?
Wird wegen der generellen Opioidkrise eine Zulassung derzeit von den meisten Anlegern noch als eher unwahrscheinlich angesehen auch wenn das Unternehmen in vielen relevanten offenen Fragen nun ausreichend validierte Antworten liefern kann ?
Was ist eure Vermutung ?
Ich denke auch dass eine Anwendung nach Zulassung erst mal sehr fokussiert sein wird und zunächst noch nicht den in deren Präsentation großen Markt adressieren wird. Aber auch das würde ja eine Vervielfachung des Kurses hier rechtfertigen also warum diese Zurückhaltung... was meint Ihr ?
Klingt ja derzeit alles wie "läuft" nach Plan usw. das Potential ist langfristig groß die Wirkung im Vergleich mit anderen Produkten überzeugt auch und würde die Situation für Patienten definitiv verbessern usw.
Also alles gute Nachrichten. Wie begründet sich dann das doch seeehr überschaubare Volumen bei der Aktie ?
Wird wegen der generellen Opioidkrise eine Zulassung derzeit von den meisten Anlegern noch als eher unwahrscheinlich angesehen auch wenn das Unternehmen in vielen relevanten offenen Fragen nun ausreichend validierte Antworten liefern kann ?
Was ist eure Vermutung ?
Ich denke auch dass eine Anwendung nach Zulassung erst mal sehr fokussiert sein wird und zunächst noch nicht den in deren Präsentation großen Markt adressieren wird. Aber auch das würde ja eine Vervielfachung des Kurses hier rechtfertigen also warum diese Zurückhaltung... was meint Ihr ?
Antwort auf Beitrag Nr.: 62.391.842 von flyingbeef am 16.01.20 11:32:39Ich denke, da kommt einiges zusammen. Die Opioid-Krise ist das eine.
Manch einem geht es mit der Wiedereinreichung des NDA nicht schnell genug und zuletzt klang es nach einer leichten Verzögerung, weil das "as early as possible" weggefallen ist. Diese trifft wiederum auf eine schwache Finanzierung und damit die Gefahr der Verwässerung.
Rein technisch droht durch den niedrigen Aktienkurs die Gefahr, das Nasdaq Listing zu verlieren und die Beteiligung institutioneller Investoren ist mit 20% sehr niedrig.
Dann ist es zwar ein Schmerzmittel mit neuem Wirkmechanismus, aber die deshalb erhofften Vorteile in Bezug auf Nebenwirkungen und Suchtpotenzial sind dann doch nicht so groß ausgefallen wie anfangs angenommen. Das führt bei einigen zu der Sorge, dass Ärzte weiterhin das nutzen, was sie kennen und was mutmaßlich auch zu einem niedrigeren Preis verfügbar ist.
Dagegen spricht, dass gerade die Ärzte im Adcom sich eher für die Zulassung ausgesprochen haben, um überhaupt eine Alternative zu haben und auch, weil sie es als einen ersten Schritt auf dem Weg zu wirklich deutlich besseren Schmerzmitteln ansehen.
Last but not least, ist die IV Darreichung in kontrollierter Umgebung zwar vorteilhaft für die Zulassung, begrenzt aber hinterher das Marktpotenzial.
PDUFA date wird voraussichtlich in Q3 sein und bis dahin erwarte ich steigende Kurse.
Manch einem geht es mit der Wiedereinreichung des NDA nicht schnell genug und zuletzt klang es nach einer leichten Verzögerung, weil das "as early as possible" weggefallen ist. Diese trifft wiederum auf eine schwache Finanzierung und damit die Gefahr der Verwässerung.
Rein technisch droht durch den niedrigen Aktienkurs die Gefahr, das Nasdaq Listing zu verlieren und die Beteiligung institutioneller Investoren ist mit 20% sehr niedrig.
Dann ist es zwar ein Schmerzmittel mit neuem Wirkmechanismus, aber die deshalb erhofften Vorteile in Bezug auf Nebenwirkungen und Suchtpotenzial sind dann doch nicht so groß ausgefallen wie anfangs angenommen. Das führt bei einigen zu der Sorge, dass Ärzte weiterhin das nutzen, was sie kennen und was mutmaßlich auch zu einem niedrigeren Preis verfügbar ist.
Dagegen spricht, dass gerade die Ärzte im Adcom sich eher für die Zulassung ausgesprochen haben, um überhaupt eine Alternative zu haben und auch, weil sie es als einen ersten Schritt auf dem Weg zu wirklich deutlich besseren Schmerzmitteln ansehen.
Last but not least, ist die IV Darreichung in kontrollierter Umgebung zwar vorteilhaft für die Zulassung, begrenzt aber hinterher das Marktpotenzial.
PDUFA date wird voraussichtlich in Q3 sein und bis dahin erwarte ich steigende Kurse.
Antwort auf Beitrag Nr.: 62.392.826 von opportoni am 16.01.20 13:00:05...nun, aus meiner Sicht bleiben da einige Eigenschaften unberücksichtigt, die für den Markterfolg eines Medikamentes von zentraler Bedeutung sind.
Grundsätzlich bleibt Oli ein Opiat, das bei intravenöser Anwendung nur im Krankenhausbetrieb angewendet wird und somit vom Missbrauch her wenig Oberfläche bietet. Allerdings sind einige Begleiterscheinungen (Atemdepression, Verdauungsproblem --> Verstopfung etc.) unter Oliceridine günstiger als bei den bisher bekannten Opiaten. Deswegen werden sehr wahrscheinlich Patienten, die einer Risikogruppe angehören, mit Oli behandelt, obwohl dieses verglichen mit konventionellen Opiaten teurer sein wird --> durch das geringere Risiko für "kostspielige" Nebenwirkungen jedoch dennoch günstiger! Der gesunde Betrachter würde vielleicht meinen, dass eine Verdauungsstörung wie zB eine Verstopfung doch nichts ungewöhnliches ist. In postoperativem Zustand kann eine solche Störung jedoch ein ernste und kostspielige Angelegenheit werden, in seltenen Fällen sogar mit fatalem Ende.
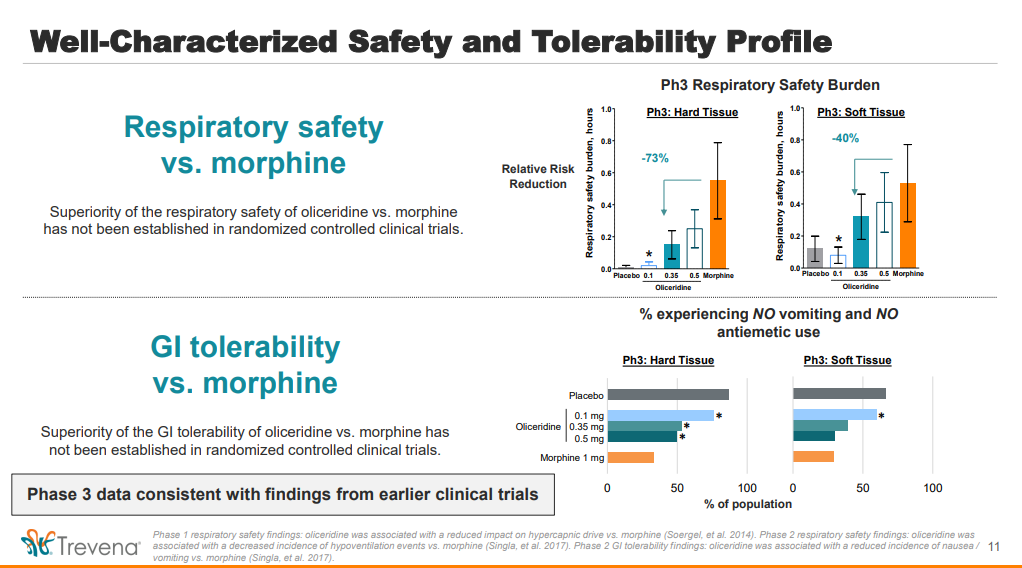
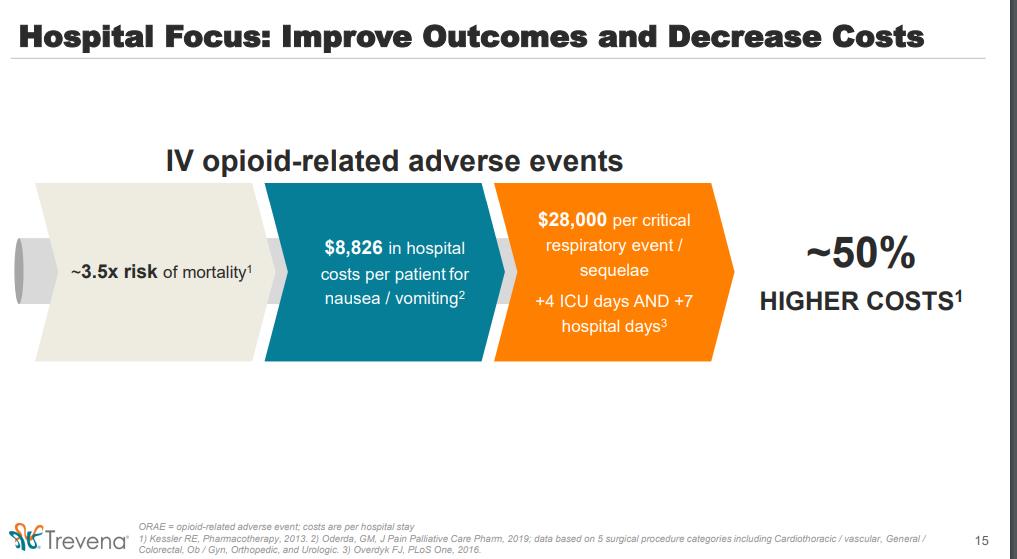
Grundsätzlich bleibt Oli ein Opiat, das bei intravenöser Anwendung nur im Krankenhausbetrieb angewendet wird und somit vom Missbrauch her wenig Oberfläche bietet. Allerdings sind einige Begleiterscheinungen (Atemdepression, Verdauungsproblem --> Verstopfung etc.) unter Oliceridine günstiger als bei den bisher bekannten Opiaten. Deswegen werden sehr wahrscheinlich Patienten, die einer Risikogruppe angehören, mit Oli behandelt, obwohl dieses verglichen mit konventionellen Opiaten teurer sein wird --> durch das geringere Risiko für "kostspielige" Nebenwirkungen jedoch dennoch günstiger! Der gesunde Betrachter würde vielleicht meinen, dass eine Verdauungsstörung wie zB eine Verstopfung doch nichts ungewöhnliches ist. In postoperativem Zustand kann eine solche Störung jedoch ein ernste und kostspielige Angelegenheit werden, in seltenen Fällen sogar mit fatalem Ende.


@ opportoni @cyberhexe
Danke für eure Sichtweisen ist sehr hilfreich das aktuell aus unterschiedlichen Gesichtspunkte zu betrachten.
Was ich so aus den "alten" Pressemitteilungen herausfiltern konnte ist in Summe eigentlich relativ einhellig egal aus welcher Perspektive dazu etwas geschrieben wurde dass dieses neue Medikament sehr wohl "erwünscht" ist und auch seine Chance bekommen soll, sollte die Firma Ihre Ergebnisse noch weiter verfeinern und untermauern. Dies haben Sie aus meiner Sicht sehr wohl die letzten Monate getan und sind dazu nun in der Lage. Denke auch das hier bewusst etwas auf Zeit gespielt werden sollte so das sich die Opiat"-aufregung" etwas bis zum neuen Verfahren legt.
Abseits dessen wie "durchschlagend" nun sag ich mal der Vorteil bei Nebenwirkungen und Suchtpotential ist, konnten Sie aber auch nachweisen das bei geringerer Dosierung wesentlich schneller z.B. Schmerzreduktion usw. erreicht werden kann was ich durchaus auch als sehr gutes Argument erachten würde, Personen die schonmal seehr intensive Schmerzen erleiden mussten können sicher sagen, alles was schneller hilft ist in solchen Situationen sehr willkommen und das sehen Ärzte sicher auch so.
Ich sehe auch durch eben diese eingeschränktere Zulassung eigentlich erst mal eher Vorteile und somit Medikamentenmissbrauchsprobleme usw. damit nahezu ausgeklammert was in aktueller Situation und Sichtweise auf Opiate allgemein nur von Vorteil sein kann und die richtige Strategie ist.
Das dadurch erst mal nicht ein sehr grosser Markt adressiert wird aber dennoch eine gute Einkommensquelle mit verlässlicher Basis geschafft werden kann sehe ich ebenfalls als Pluspunkt an, Hintergrund ist man bleibt auf dem Boden, man hat andere Wirkstoffe in der Pipeline die Firma setzt ja bewusst auf Weiterentwicklung(en) und kann diese dann stabil finanzieren uuund last but not least der Markt ist auch für eine kleinere Firma "realistisch" eher bedienbar mit Partnern als dass es hier unbedingt einen Big Pharma Deal benötigten würde damit das Business Model überhaupt funktioniert.
Fazit:
- Realistische Planung
- Wirklich realistische Zulassungschance
- Realistische Umsetzungsmöglichkeit
- Sehr gute Zukunftsaussichten für die Firma sich zu stabilisieren und später dann bei anderen Zulassungen Ihr Umsatzpotential wesentlich darüber hinaus auszubauen
= Erster Wertzuwachs der Aktie fast garantiert denke die 3 bis 3,5 Dollar Ziele sind da auch gerechtfertigt
= Stabiles Wachstum über lange Sicht möglich
= für langfristige Investments sollte das alles im Umkehrschluss sehr gut geparktes Geld sein d.h. dass werden die institutionellen Anleger auch dann gutieren und nach Zulassung und spätestens ersten Marktverfolgen im großen Umfang dazukommen... (daher macht mir aktuell die geringe Quote auch keine grosse Sorgen)
Für mich absolut gutes Investment mit sehr guten stabilen Aussichten ist jetzt nicht die extreme Kursrakete erst mal (obwohl man das nie sagen kann ob ein Hype passieren würde) aber Risiko sehe ich als gut begrenzt an und Gewinn fast sicher man muss nur etwas warten können.
Danke für eure Sichtweisen ist sehr hilfreich das aktuell aus unterschiedlichen Gesichtspunkte zu betrachten.
Was ich so aus den "alten" Pressemitteilungen herausfiltern konnte ist in Summe eigentlich relativ einhellig egal aus welcher Perspektive dazu etwas geschrieben wurde dass dieses neue Medikament sehr wohl "erwünscht" ist und auch seine Chance bekommen soll, sollte die Firma Ihre Ergebnisse noch weiter verfeinern und untermauern. Dies haben Sie aus meiner Sicht sehr wohl die letzten Monate getan und sind dazu nun in der Lage. Denke auch das hier bewusst etwas auf Zeit gespielt werden sollte so das sich die Opiat"-aufregung" etwas bis zum neuen Verfahren legt.
Abseits dessen wie "durchschlagend" nun sag ich mal der Vorteil bei Nebenwirkungen und Suchtpotential ist, konnten Sie aber auch nachweisen das bei geringerer Dosierung wesentlich schneller z.B. Schmerzreduktion usw. erreicht werden kann was ich durchaus auch als sehr gutes Argument erachten würde, Personen die schonmal seehr intensive Schmerzen erleiden mussten können sicher sagen, alles was schneller hilft ist in solchen Situationen sehr willkommen und das sehen Ärzte sicher auch so.
Ich sehe auch durch eben diese eingeschränktere Zulassung eigentlich erst mal eher Vorteile und somit Medikamentenmissbrauchsprobleme usw. damit nahezu ausgeklammert was in aktueller Situation und Sichtweise auf Opiate allgemein nur von Vorteil sein kann und die richtige Strategie ist.
Das dadurch erst mal nicht ein sehr grosser Markt adressiert wird aber dennoch eine gute Einkommensquelle mit verlässlicher Basis geschafft werden kann sehe ich ebenfalls als Pluspunkt an, Hintergrund ist man bleibt auf dem Boden, man hat andere Wirkstoffe in der Pipeline die Firma setzt ja bewusst auf Weiterentwicklung(en) und kann diese dann stabil finanzieren uuund last but not least der Markt ist auch für eine kleinere Firma "realistisch" eher bedienbar mit Partnern als dass es hier unbedingt einen Big Pharma Deal benötigten würde damit das Business Model überhaupt funktioniert.
Fazit:
- Realistische Planung
- Wirklich realistische Zulassungschance
- Realistische Umsetzungsmöglichkeit
- Sehr gute Zukunftsaussichten für die Firma sich zu stabilisieren und später dann bei anderen Zulassungen Ihr Umsatzpotential wesentlich darüber hinaus auszubauen
= Erster Wertzuwachs der Aktie fast garantiert denke die 3 bis 3,5 Dollar Ziele sind da auch gerechtfertigt
= Stabiles Wachstum über lange Sicht möglich
= für langfristige Investments sollte das alles im Umkehrschluss sehr gut geparktes Geld sein d.h. dass werden die institutionellen Anleger auch dann gutieren und nach Zulassung und spätestens ersten Marktverfolgen im großen Umfang dazukommen... (daher macht mir aktuell die geringe Quote auch keine grosse Sorgen)
Für mich absolut gutes Investment mit sehr guten stabilen Aussichten ist jetzt nicht die extreme Kursrakete erst mal (obwohl man das nie sagen kann ob ein Hype passieren würde) aber Risiko sehe ich als gut begrenzt an und Gewinn fast sicher man muss nur etwas warten können.
Antwort auf Beitrag Nr.: 62.406.029 von flyingbeef am 17.01.20 13:16:35Dann sind wir uns doch alle einig :-)
Ich wollte Oliceridin auch nicht schlecht reden (bin ja selbst investiert), aber du hattest ja gezielt nach den Punkten gefragt, die evtl. zu der niedrigen Bewertung am Markt beitragen.
Ich hoffe und gehe eigentlich davon aus, dass wir kein weiteres Adcom benötigen. Wenn doch, stellt das sicher nochmal ein Risiko dar. Schon 2018 wurden einerseits die geringeren Nebenwirkungen hinterfragt (Stichwort: waren die Dosen von Morphin und Oliceridin wirkungsgleich?) und andererseits kritisiert, dass geringere Nebenwirkungen die Wahrscheinlichkeit von Missbrauch erhöhen. Fast wie ein Hexenprozess. Wenn sie nun partout keine Opiate mehr zulassen wollen, können sie also immer einen Strick drehen. Möglicherweise befürchten sie inzwischen sogar, die Ärzte könnten sich das Zeug selbst spritzen.
Dieses Risiko sollte einem Anleger bewusst sein, aber ich schätze es als eher gering ein, weil ich grundsätzlich (wie Cyberhexe auch) der FDA vertraue, dass sie korrekt und gründlich arbeitet.
Ich wollte Oliceridin auch nicht schlecht reden (bin ja selbst investiert), aber du hattest ja gezielt nach den Punkten gefragt, die evtl. zu der niedrigen Bewertung am Markt beitragen.
Ich hoffe und gehe eigentlich davon aus, dass wir kein weiteres Adcom benötigen. Wenn doch, stellt das sicher nochmal ein Risiko dar. Schon 2018 wurden einerseits die geringeren Nebenwirkungen hinterfragt (Stichwort: waren die Dosen von Morphin und Oliceridin wirkungsgleich?) und andererseits kritisiert, dass geringere Nebenwirkungen die Wahrscheinlichkeit von Missbrauch erhöhen. Fast wie ein Hexenprozess. Wenn sie nun partout keine Opiate mehr zulassen wollen, können sie also immer einen Strick drehen. Möglicherweise befürchten sie inzwischen sogar, die Ärzte könnten sich das Zeug selbst spritzen.
Dieses Risiko sollte einem Anleger bewusst sein, aber ich schätze es als eher gering ein, weil ich grundsätzlich (wie Cyberhexe auch) der FDA vertraue, dass sie korrekt und gründlich arbeitet.
Nach Erhalt des CRL im November 2018 gab es Ende Januar 2019 ein Treffen mit der FDA, bei welchem die weiteren Schritte zur Evaluierung von zusätzlich benötigten Daten festgelegt wurden.
CHESTERBROOK, Pa., Jan. 28, 2019 (GLOBE NEWSWIRE) -- Trevena, Inc. (TRVN) today announced the receipt of the official Type A meeting minutes from the U.S. Food and Drug Administration (FDA) regarding the Complete Response Letter (CRL) received for the oliceridine New Drug Application (NDA).
FDA has agreed that the Company’s current safety database will support labeling at a maximum daily dose of 27 mg.
FDA also has agreed that the Company can conduct a study in healthy volunteers to collect the requested QT interval data and that the study should include placebo- and positive-control arms. The Company intends to submit a detailed protocol and analysis plan to FDA shortly and, following receipt of FDA feedback, anticipates initiating this study in the first half of this year. The Company is not required to provide any additional efficacy data to resubmit the oliceridine NDA.
“We are encouraged by the productive discussion with FDA, which we believe has provided a path to resubmit the oliceridine NDA,” said Carrie L. Bourdow, President and Chief Executive Officer. “We remain committed to our mission of ensuring access to safe and effective treatment options for hospital patients who require an IV opioid to manage their moderate to severe acute pain.”
To address other items in the CRL, FDA has indicated that the Company should include supporting nonclinical data related to the characterization of the 9662 metabolite and the remaining product validation reports when the oliceridine NDA is resubmitted.
Die wichtigste Konsequenz war die Initialisierung der QTc-Studie bei gesunden Freiwilligen gegenüber Plazebo. Das Ergebnis dieser Studie wurde mit Pressemitteilung vom 4.11.2019 der Öffentlichkeit mitgeteilt:
Recent Corporate Highlights:
Completed multi-dose QT study for oliceridine. No accumulation of effect was observed on the QT interval. A small, transient effect, consistent with that observed in the single-dose QT study, began dissipating after 12 hours and was absent at the end of the 24-hour study period despite repeated dosing of oliceridine.
Oliceridine was well tolerated, with 59 subjects receiving the 27 mg maximum daily dose. There were no serious adverse events.
Und weil alle im CRL (Complete Response Letter) aufgeführten Mängel erfüllt wurden und sich daraus (QTc-Studie) keine Risiken ableiten, müssten nun alle Voraussetzungen des SPA (Special Protocol Assessment) erfüllt sein, so dass die FDA keine andere Wahl hat, als Oliceridine die Zulassung zu erteilen. Deswegen wäre auch die Einberufung eines weiteren AC (Advisory Committee) eine Riesenüberraschung. Je mehr ich in die Unterlagen "reingehe" umso überzeugter bin ich, dass Oli zugelassen wird.
TIME WILL TELL!
ch
CHESTERBROOK, Pa., Jan. 28, 2019 (GLOBE NEWSWIRE) -- Trevena, Inc. (TRVN) today announced the receipt of the official Type A meeting minutes from the U.S. Food and Drug Administration (FDA) regarding the Complete Response Letter (CRL) received for the oliceridine New Drug Application (NDA).
FDA has agreed that the Company’s current safety database will support labeling at a maximum daily dose of 27 mg.
FDA also has agreed that the Company can conduct a study in healthy volunteers to collect the requested QT interval data and that the study should include placebo- and positive-control arms. The Company intends to submit a detailed protocol and analysis plan to FDA shortly and, following receipt of FDA feedback, anticipates initiating this study in the first half of this year. The Company is not required to provide any additional efficacy data to resubmit the oliceridine NDA.
“We are encouraged by the productive discussion with FDA, which we believe has provided a path to resubmit the oliceridine NDA,” said Carrie L. Bourdow, President and Chief Executive Officer. “We remain committed to our mission of ensuring access to safe and effective treatment options for hospital patients who require an IV opioid to manage their moderate to severe acute pain.”
To address other items in the CRL, FDA has indicated that the Company should include supporting nonclinical data related to the characterization of the 9662 metabolite and the remaining product validation reports when the oliceridine NDA is resubmitted.
Die wichtigste Konsequenz war die Initialisierung der QTc-Studie bei gesunden Freiwilligen gegenüber Plazebo. Das Ergebnis dieser Studie wurde mit Pressemitteilung vom 4.11.2019 der Öffentlichkeit mitgeteilt:
Recent Corporate Highlights:
Completed multi-dose QT study for oliceridine. No accumulation of effect was observed on the QT interval. A small, transient effect, consistent with that observed in the single-dose QT study, began dissipating after 12 hours and was absent at the end of the 24-hour study period despite repeated dosing of oliceridine.
Oliceridine was well tolerated, with 59 subjects receiving the 27 mg maximum daily dose. There were no serious adverse events.

Und weil alle im CRL (Complete Response Letter) aufgeführten Mängel erfüllt wurden und sich daraus (QTc-Studie) keine Risiken ableiten, müssten nun alle Voraussetzungen des SPA (Special Protocol Assessment) erfüllt sein, so dass die FDA keine andere Wahl hat, als Oliceridine die Zulassung zu erteilen. Deswegen wäre auch die Einberufung eines weiteren AC (Advisory Committee) eine Riesenüberraschung. Je mehr ich in die Unterlagen "reingehe" umso überzeugter bin ich, dass Oli zugelassen wird.
TIME WILL TELL!
ch
Wegen dem Thema Adcom tauscht man sich auf Stockwits auch recht "aktiv" aus.
Viele denken es wird keine geben.
Es gibt aber auch Stimmen die darauf wetten dass es wieder ein Adcom geben wird/muss.
Jedoch auch dijenigen die das sagen sind davon überzeugt das Trevena diesmal auch bei einem Adcom sehr gute Chancen hat die Überwiegende und wichtige Mehrheit zu überzeugen und ordnen daher solch ein Verfahren nicht als Gefahr ein.
Begründung warum es nochmals trotz CRL Erfüllung ein Adcom geben muss ist die politische Brisanz die das Thema Opioide inne hat. Daher schätzen einige dass es sozusagen diesen zusätzlichen "Baustein" benötigt, um dem Medikament später auch genügend Rückendwind zu geben so dass Kritiker so wenig Angriffsfläche wie möglich haben und man öffentlich behaupten kann man hatte alle Register bei der Zulassung gezogen und wirklich seehr verantwortungsvoll geprüft. So meine Interpretation aus dem ganzen.
Fazit:
Adcom wäre aus Sicht derer die damit rechnen kein Hals und Beinbruch und wenn es angekündigt werden sollte könnte man das auch als zusätzliche Starthilfe einordnen. Das Risiko dass sowas mit sich bringt ist dann wohl auch gewollt da es dieser "Absegnung" Bedarf um in aktueller Situation so einen Wirkstoff mit ausreichend Marktakzeptanz auszustatten. Es nützt ja nichts das zuzulassen und später traut sich keiner es richtig einzusetzen weil zu viele das ganze leicht angreifen und anzweifeln können.
Daher auch wenn es dazu kommt würde ich nicht in Panik verfallen und das sogar als notwendigen Baustein betrachten.
Viele denken es wird keine geben.
Es gibt aber auch Stimmen die darauf wetten dass es wieder ein Adcom geben wird/muss.
Jedoch auch dijenigen die das sagen sind davon überzeugt das Trevena diesmal auch bei einem Adcom sehr gute Chancen hat die Überwiegende und wichtige Mehrheit zu überzeugen und ordnen daher solch ein Verfahren nicht als Gefahr ein.
Begründung warum es nochmals trotz CRL Erfüllung ein Adcom geben muss ist die politische Brisanz die das Thema Opioide inne hat. Daher schätzen einige dass es sozusagen diesen zusätzlichen "Baustein" benötigt, um dem Medikament später auch genügend Rückendwind zu geben so dass Kritiker so wenig Angriffsfläche wie möglich haben und man öffentlich behaupten kann man hatte alle Register bei der Zulassung gezogen und wirklich seehr verantwortungsvoll geprüft. So meine Interpretation aus dem ganzen.
Fazit:
Adcom wäre aus Sicht derer die damit rechnen kein Hals und Beinbruch und wenn es angekündigt werden sollte könnte man das auch als zusätzliche Starthilfe einordnen. Das Risiko dass sowas mit sich bringt ist dann wohl auch gewollt da es dieser "Absegnung" Bedarf um in aktueller Situation so einen Wirkstoff mit ausreichend Marktakzeptanz auszustatten. Es nützt ja nichts das zuzulassen und später traut sich keiner es richtig einzusetzen weil zu viele das ganze leicht angreifen und anzweifeln können.
Daher auch wenn es dazu kommt würde ich nicht in Panik verfallen und das sogar als notwendigen Baustein betrachten.
Antwort auf Beitrag Nr.: 62.412.374 von flyingbeef am 17.01.20 22:44:21beim letzten AC wurden Wirkung/Nutzen/Missbrauch schon intensiv diskutiert; diesbezüglich wurden keine weiteren Aktivitäten innerhalb des CRL eingefordert wurden, sondern lediglich diverse Abklärungen bei Nebenwirkungen und Metaboliten. Weil die innerhalb des CRL zitierten offenen Fragen nun eindeutig geklärt sind bzw. die Bedenken hinsichtlich Kardiotox ausgeräumt wurden, macht es aus meiner Sicht wenig Sinn eine Expertenrunde noch einmal einzuberufen, um über diese neuen Erkenntnisse zu diskutieren. Und ob eine Wiederholung der Diskussion hinsichtlich Missbrauch und Suchpotenzial einen zusätzlichen Erkenntnisgewinn zu leisten vermag, möchte ich doch sehr bezweifeln. Deswegen bin ich mir ziemlich sicher, dass kein weiteres AC zu Oli einberufen wird.

druck unterm Deckel
nächste Widerstände 1,06 $ 1,22 $
Nach Erhalt des CRL im November 2018 gab es Ende Januar 2019 ein Treffen mit der FDA, bei welchem die weiteren Schritte zur Evaluierung von zusätzlich benötigten Daten festgelegt wurden. In den "Minutes" des "Type A meeting" wurde am Jan. 28, 2019 bekanntgegeben:
- FDA has agreed that the Company’s current safety database will support labeling at a maximum daily dose of 27 mg.
- FDA also has agreed that the Company can conduct a study in healthy volunteers to collect the requested QT interval data and that the study should include placebo- and positive-control arms.
- The Company is not required to provide any additional efficacy data to resubmit the oliceridine NDA.
Vor allem die Bekanntgabe, dass hinsichtlich Wirksamkeit keine weiteren Daten erforderlich sind, hat den Aktienkurs innerhalb einer Woche auf über $1.50 verdreifacht.
Nun, da TRVN kurz davor steht, den Zulassungsantrag nach Klärung der im CRL aufgeworfenen Fragen erneut einzureichen, müsste der Kurs doch annähernd das Niveau nach dem Type A Treffen mit der FDA erreichen. Deswegen sollten kurzfristig 1 1/2 USD möglich sein.
TIME WILL TELL!
159k
- FDA has agreed that the Company’s current safety database will support labeling at a maximum daily dose of 27 mg.
- FDA also has agreed that the Company can conduct a study in healthy volunteers to collect the requested QT interval data and that the study should include placebo- and positive-control arms.
- The Company is not required to provide any additional efficacy data to resubmit the oliceridine NDA.
Vor allem die Bekanntgabe, dass hinsichtlich Wirksamkeit keine weiteren Daten erforderlich sind, hat den Aktienkurs innerhalb einer Woche auf über $1.50 verdreifacht.
Nun, da TRVN kurz davor steht, den Zulassungsantrag nach Klärung der im CRL aufgeworfenen Fragen erneut einzureichen, müsste der Kurs doch annähernd das Niveau nach dem Type A Treffen mit der FDA erreichen. Deswegen sollten kurzfristig 1 1/2 USD möglich sein.
TIME WILL TELL!
159k
Antwort auf Beitrag Nr.: 62.483.619 von Cyberhexe am 25.01.20 08:16:29hi
immer noch 50.000 stck
Shippe drauf Glück Auf
immer noch 50.000 stck
Shippe drauf Glück Auf
Hier noch einmal im Überblick die angestrebten Ziele für das Jahr 2020


Antwort auf Beitrag Nr.: 62.509.070 von bernie55 am 28.01.20 14:52:01heute wurde noch ein Abstauberlimut bei 0,88$ bedient - hätte ich nicht gedacht!
Bin gespannt, wann die 1€-Marke nachhaltig geknackt wird?
gruss ch
164k
Bin gespannt, wann die 1€-Marke nachhaltig geknackt wird?
gruss ch
164k
Antwort auf Beitrag Nr.: 62.513.006 von Cyberhexe am 28.01.20 20:05:16
Zur Erinnerung:
Um die Einhaltung der Nasdaq-Listungsregel 5450(a)(1) wieder zu erreichen, muss bis zum 2.März 2020 der Aktienkurs von TRVN an mindestens zehn aufeinanderfolgenden Geschäftstagen über 1,00 USD abschließen.
Ansonsten erfolgt das Delisting von der Nasdaq.
Grüße
bernie55
https://www.sec.gov/Archives/edgar/data/1429560/000110465919…
Zitat von Cyberhexe: heute wurde noch ein Abstauberlimut bei 0,88$ bedient - hätte ich nicht gedacht!
Bin gespannt, wann die 1€- 1,00 USD - Marke ........nachhaltig geknackt wird?
gruss ch
164k
Zur Erinnerung:
Um die Einhaltung der Nasdaq-Listungsregel 5450(a)(1) wieder zu erreichen, muss bis zum 2.März 2020 der Aktienkurs von TRVN an mindestens zehn aufeinanderfolgenden Geschäftstagen über 1,00 USD abschließen.
Ansonsten erfolgt das Delisting von der Nasdaq.
Grüße
bernie55

https://www.sec.gov/Archives/edgar/data/1429560/000110465919…
Beitrag zu dieser Diskussion schreiben
Investoren beobachten auch:
| Wertpapier | Perf. % |
|---|---|
| +0,39 | |
| -0,07 | |
| 0,00 | |
| -0,51 | |
| -30,00 | |
| -0,67 | |
| +0,91 | |
| +0,84 | |
| +2,44 | |
| +0,88 |
Meistdiskutiert
| Wertpapier | Beiträge | |
|---|---|---|
| 202 | ||
| 98 | ||
| 89 | ||
| 71 | ||
| 64 | ||
| 57 | ||
| 38 | ||
| 37 | ||
| 35 | ||
| 31 |





















