Morphosys – fachliche Überlegungen zur Entwicklungspipeline - 500 Beiträge pro Seite
eröffnet am 19.07.13 21:27:33 von
neuester Beitrag 06.05.20 22:40:51 von
neuester Beitrag 06.05.20 22:40:51 von
Beiträge: 772
ID: 1.183.993
ID: 1.183.993
Aufrufe heute: 0
Gesamt: 149.358
Gesamt: 149.358
Aktive User: 0
ISIN: DE0006632003 · WKN: 663200
67,68
EUR
-0,07 %
-0,05 EUR
Letzter Kurs 22:46:08 Lang & Schwarz
Neuigkeiten
| Morphosys Aktien jetzt im kostenlosen Demokonto handeln!Anzeige |
05:10 Uhr · kapitalerhoehungen.de |
15.04.24 · Felix Haupt Anzeige |
11.04.24 · dpa-AFX |
Werte aus der Branche Biotechnologie
| Wertpapier | Kurs | Perf. % |
|---|---|---|
| 3.000,00 | +74.900,00 | |
| 0,9300 | +54,46 | |
| 3,1000 | +39,01 | |
| 2,4700 | +33,51 | |
| 2,7200 | +30,14 |
| Wertpapier | Kurs | Perf. % |
|---|---|---|
| 2,2600 | -19,29 | |
| 1,4300 | -24,34 | |
| 1,4700 | -27,76 | |
| 2,2000 | -31,25 | |
| 1,3135 | -50,94 |
Dieser Thread soll sich, wie die Überschrift bereits impliziert, ausschließlich mit der Entwicklungspipeline der Morphosys AG sowie in diesem Zusammenhang relevanten Konkurrenzentwicklungen anderer Unternehmen befassen. Im Vordergrund sollen dabei medizinisch-wissenschaftliche Aspekte stehen, daraus abgeleitet aber auch Bewertungsfragen einzelner Projekte.
Inhalt dieses Threads sollen ausdrücklich nicht sein:
- Aktienkursdiskussionen
- Charttechnik
- Diskussionen über das Führungspersonal der Gesellschaft
- unfundierte Spekulationen jeglicher Art
- persönliche Anlagestrategien und Aktiendispositionen
- Austausch anderer persönlicher Befindlichkeiten
Ich werde die Moderatoren bitten, themenfremde Beiträge jeglicher Art zu löschen.
Von meiner Seite aus werde ich versuchen, gelegentlich einige Entwicklungspräparate zu beleuchten, die noch nicht im Fokus der Öffentlichkeit stehen. So hat Morphosys beispielsweise Antikörper u.a. gegen folgende Targets entwickelt:
ALK1
C-FMS
IL-17C (gemeinsam mit Galapagos)
Timp-1 (gemeinsam mit Bayer)
GCR (gemeinsam mit Boehringer Ingelheim)
a5ss 1 integrin (gemeinsam mit Bayer)
EphB4 (gemeinsam mit Bayer)
ED-B-fibronectin (gemeinsam mit Bayer) usw. usw.
Dazu kommen noch diverse Präparate, die gemeinsam mit/für Novartis entwickelt worden sind, sowie verschiedene Kombinationsbehandlungen, die Morphosys für aussichtsreich hält (z.B. MOR208 plus Purin-Analog, MOR103 plus anti-CD20 usw.).
Etwas detaillierter weiterverfolgen sollten wir auch das Thema Morbus Alzheimer, weil ein künftiger Erfolg/Mißerfolg des Antikörpers Gantenerumab von enormer wirtschaftlicher Bedeutung (nicht nur für Morphosys, sondern für den gesamten Pharmastandort Basel) sein dürfte.
Inhalt der Diskussion sollen natürlich auch alle anderen Präparate sein, die bereits offiziell in der Morphosys-Pipeline ausgewiesen sind.
Schon jetzt muss ich jedoch um Nachsicht bitten, dass ich aus Zeitgründen nur in unregelmäßigen Abständen Beiträge schreiben werde.
Über eine rege Diskussionsteilnahme würde ich mich freuen.
Inhalt dieses Threads sollen ausdrücklich nicht sein:
- Aktienkursdiskussionen
- Charttechnik
- Diskussionen über das Führungspersonal der Gesellschaft
- unfundierte Spekulationen jeglicher Art
- persönliche Anlagestrategien und Aktiendispositionen
- Austausch anderer persönlicher Befindlichkeiten
Ich werde die Moderatoren bitten, themenfremde Beiträge jeglicher Art zu löschen.
Von meiner Seite aus werde ich versuchen, gelegentlich einige Entwicklungspräparate zu beleuchten, die noch nicht im Fokus der Öffentlichkeit stehen. So hat Morphosys beispielsweise Antikörper u.a. gegen folgende Targets entwickelt:
ALK1
C-FMS
IL-17C (gemeinsam mit Galapagos)
Timp-1 (gemeinsam mit Bayer)
GCR (gemeinsam mit Boehringer Ingelheim)
a5ss 1 integrin (gemeinsam mit Bayer)
EphB4 (gemeinsam mit Bayer)
ED-B-fibronectin (gemeinsam mit Bayer) usw. usw.
Dazu kommen noch diverse Präparate, die gemeinsam mit/für Novartis entwickelt worden sind, sowie verschiedene Kombinationsbehandlungen, die Morphosys für aussichtsreich hält (z.B. MOR208 plus Purin-Analog, MOR103 plus anti-CD20 usw.).
Etwas detaillierter weiterverfolgen sollten wir auch das Thema Morbus Alzheimer, weil ein künftiger Erfolg/Mißerfolg des Antikörpers Gantenerumab von enormer wirtschaftlicher Bedeutung (nicht nur für Morphosys, sondern für den gesamten Pharmastandort Basel) sein dürfte.
Inhalt der Diskussion sollen natürlich auch alle anderen Präparate sein, die bereits offiziell in der Morphosys-Pipeline ausgewiesen sind.
Schon jetzt muss ich jedoch um Nachsicht bitten, dass ich aus Zeitgründen nur in unregelmäßigen Abständen Beiträge schreiben werde.
Über eine rege Diskussionsteilnahme würde ich mich freuen.
Vor nunmehr 7 Jahren begann Morphosys eine Partnerschaft mit Daiichi Sankyo. Vor ca. 4 Jahren wurde diese auf Krankenhausinfektionen erweitert bzw. präzisiert. Wir sollten versuchen, hier etwas Licht ins Dunkel zu bringen, auch wenn das im japanischen Markt schwierig sein dürfte.
Auch die Partnerschaft zu GeneFrontier / Kaneka und Astellas sollten einer näheren Beleuchtung unterzogen werden. Hier ist trotz einer relativ langen Partnerschaft bislang nichts passiert.
Auch die Partnerschaft zu GeneFrontier / Kaneka und Astellas sollten einer näheren Beleuchtung unterzogen werden. Hier ist trotz einer relativ langen Partnerschaft bislang nichts passiert.
Sehr gute Idee, ich wünsche viel Erfolg!
Zu ALK1 und C-FMS, sind das MOR-eigene Projekte? Und wenn ja schon älter oder aktuell?
Zu ALK1 und C-FMS, sind das MOR-eigene Projekte? Und wenn ja schon älter oder aktuell?
Antwort auf Beitrag Nr.: 45.083.471 von yok am 20.07.13 12:04:36Beides sind aktuelle Entwicklungen.
Indikation ALK1: Tumorerkrankungen und Macula-Degeneration
Indikation C-FMS: Osteoarthritis und Schmerz
C-FMS wurde gemeinsam mit den Erfindern des MOR103 entwickelt.
Indikation ALK1: Tumorerkrankungen und Macula-Degeneration
Indikation C-FMS: Osteoarthritis und Schmerz
C-FMS wurde gemeinsam mit den Erfindern des MOR103 entwickelt.
In nächster Zeit sollten eigentlich Zwischenergebnisse zu MOR208 veröffentlicht werden.
Um das mögliche Potential des MOR208 abschätzen zu können, ist nach Veröffentlichung ein Vergleich mit Daten anderer anti CD19-MAKs angesagt.
Am weitesten fortgeschritten sind folgende Konkurrenzentwicklungen:
Blinatumomab von Amgen, bispezifisch, Phase 2
SAR3419 von Sanofi/IMGN, ADC, Phase 2
Medi-551 von Astra Zeneca/Medimmune, humanisiert, Phase 2
SGN-CD19A von Seattle Genetics, ADC, Phase 1
DI-B4 von Cancer Research UK/Merck KGaA, humanisiert, Phase 1
MDX1342 von Bristol-Myers Squibb, human, Phase 1
Zu SAR3419 sollen noch in diesem Jahr wichtige Studienergebnisse publiziert werden. Laut Aussagen der IMGN-Unternehemführung ist Sanofi hinsichtlich der Wirksamkeitsdaten sehr optimistisch.
MOR208 muss sich somit gegenüber einer Menge anderer Antikörper behaupten, die dasselbe Target ansteuern.
Dazu kommen noch diverse präklinische anti CD19-Antikörperentwicklungen, z.B. von Immunomedics oder auch - wie MOR208 FC-optimiert - einer französischen Firma. Auch Roche hat nunmehr über die Tochter Roche Glycart einen eigenen Kandidaten entwickelt.
Um das mögliche Potential des MOR208 abschätzen zu können, ist nach Veröffentlichung ein Vergleich mit Daten anderer anti CD19-MAKs angesagt.
Am weitesten fortgeschritten sind folgende Konkurrenzentwicklungen:
Blinatumomab von Amgen, bispezifisch, Phase 2
SAR3419 von Sanofi/IMGN, ADC, Phase 2
Medi-551 von Astra Zeneca/Medimmune, humanisiert, Phase 2
SGN-CD19A von Seattle Genetics, ADC, Phase 1
DI-B4 von Cancer Research UK/Merck KGaA, humanisiert, Phase 1
MDX1342 von Bristol-Myers Squibb, human, Phase 1
Zu SAR3419 sollen noch in diesem Jahr wichtige Studienergebnisse publiziert werden. Laut Aussagen der IMGN-Unternehemführung ist Sanofi hinsichtlich der Wirksamkeitsdaten sehr optimistisch.
MOR208 muss sich somit gegenüber einer Menge anderer Antikörper behaupten, die dasselbe Target ansteuern.
Dazu kommen noch diverse präklinische anti CD19-Antikörperentwicklungen, z.B. von Immunomedics oder auch - wie MOR208 FC-optimiert - einer französischen Firma. Auch Roche hat nunmehr über die Tochter Roche Glycart einen eigenen Kandidaten entwickelt.
Die Forscher scheinen den IVIG-Ansatz zur Heilung von Alzheimer noch nicht aufgegeben zu haben, bei Patienten die Träger des APOE-e4 Gens sind, wurde eine Reduzierung des amyloids beobachtet. Für eine Zulassung zur Behandlung der Patienten mit dem entsprechendem Gen sind diese Daten aber nicht ausreichend, so dass weitere klinische Studien nötig wären.
etwas ausführlicher hier nachlesbar
http://www.eurekalert.org/pub_releases/2013-07/wcmc-wcp07151…
etwas ausführlicher hier nachlesbar
http://www.eurekalert.org/pub_releases/2013-07/wcmc-wcp07151…
Antwort auf Beitrag Nr.: 45.083.997 von RCZ am 20.07.13 14:42:43Wenn man die Ergebnisse aller bisherigen IVIG-Studien, die in der Indikation Morbus Alzheimer durchgeführt worden sind, zusammenfaßt und sich gleichzeitig vor Augen führt, dass IVIG-Hersteller wie Baxter, Octapharma und Grifols quasi ohne konkrete pathophysiologische Vorstellungen zu Werke gehen, muss man zum Ergebnis kommen, dass der IVIG-Ansatz mit an Sicherheit grenzender Wahrscheinlichkeit nichts taugt. Irgendeine kleine Subgruppe, in der ein oder zwei Parameter (zufällig) auf die Therapie ansprechen, finden sich oft ... sind aber kein überzeugender Hinweis darauf, dass die Therapie tatsächlich wirkt.
Antwort auf Beitrag Nr.: 45.083.869 von Joschka Schröder am 20.07.13 13:58:44Um noch einmal auf MOR208 zurückzukommen.
Sollten die laufenden Studienergebnisse positiv ausfallen, dürfte Morphosys (bzw. ein künftiger Kooperationspartner) anschließend Kombinationsstudien durchführen, in denen MOR208 zusammen mit DNA-Alkylantien wie Bendamustin oder Purin-Analogen wie Flutarabin appliziert wird.
Für beide Kombinationsbehandlungen hat Morphosys Patente eingereicht, nachdem es der F&E-Abteilung gelungen war nachzuweisen, dass MOR208 und Bendamustin bzw. Flutarabin synergistisch wirken.
Die Patente beziehen sich auf jegliche Kombinationen aus anti CD19-Antikörpern und den genannten Substanzgruppen. Mein [hoffentlich] gesunder Menschenverstand meldet jedoch Zweifel an, ob Morphosys nur deshalb, weil man in eigenen in vitro- und in vivo-Versuchen (Mäusemodell) für MOR208 derartige Synergien nachgewiesen hat, anderen Konkurrenten etwaige Kombinationsbehandlungen mit eigenen Antikörperpräparaten und frei verfügbaren Medikamenten untersagen könnte.
Bevor solche Fragen jedoch relevant werden, müssen wir zunächst die Ergebnisse der laufenden klinischen Studien abwarten.
PS: Bei meinem MOR208-Vergleich ausgeklammert habe ich andersartige Therapieansätze, die ebenfalls das CD19-Antigen ansteuern. Dazu gehören beispielsweise T-Zellen mit einem anti-CD19 chimären Antigen-Rezeptor usw.. Dies würde aber zu weit führen. Es ist auch so kompliziert genug, halbwegs den Überblick zu bewahren.
Sollten die laufenden Studienergebnisse positiv ausfallen, dürfte Morphosys (bzw. ein künftiger Kooperationspartner) anschließend Kombinationsstudien durchführen, in denen MOR208 zusammen mit DNA-Alkylantien wie Bendamustin oder Purin-Analogen wie Flutarabin appliziert wird.
Für beide Kombinationsbehandlungen hat Morphosys Patente eingereicht, nachdem es der F&E-Abteilung gelungen war nachzuweisen, dass MOR208 und Bendamustin bzw. Flutarabin synergistisch wirken.
Die Patente beziehen sich auf jegliche Kombinationen aus anti CD19-Antikörpern und den genannten Substanzgruppen. Mein [hoffentlich] gesunder Menschenverstand meldet jedoch Zweifel an, ob Morphosys nur deshalb, weil man in eigenen in vitro- und in vivo-Versuchen (Mäusemodell) für MOR208 derartige Synergien nachgewiesen hat, anderen Konkurrenten etwaige Kombinationsbehandlungen mit eigenen Antikörperpräparaten und frei verfügbaren Medikamenten untersagen könnte.
Bevor solche Fragen jedoch relevant werden, müssen wir zunächst die Ergebnisse der laufenden klinischen Studien abwarten.
PS: Bei meinem MOR208-Vergleich ausgeklammert habe ich andersartige Therapieansätze, die ebenfalls das CD19-Antigen ansteuern. Dazu gehören beispielsweise T-Zellen mit einem anti-CD19 chimären Antigen-Rezeptor usw.. Dies würde aber zu weit führen. Es ist auch so kompliziert genug, halbwegs den Überblick zu bewahren.
Zitat von Milestones: Vor nunmehr 7 Jahren begann Morphosys eine Partnerschaft mit Daiichi Sankyo. Vor ca. 4 Jahren wurde diese auf Krankenhausinfektionen erweitert bzw. präzisiert. Wir sollten versuchen, hier etwas Licht ins Dunkel zu bringen, auch wenn das im japanischen Markt schwierig sein dürfte.
Die Kooperation hinsichtlich der Krankenhausinfektionen fand ich bei Bekanntgabe ebenfalls sehr interessant.
Im Geschäftsbericht 2011 - nach dann lediglich zwei Jahren - wurde jedoch von deren Beendigung gesprochen (Seite 57: "Die Zusammenarbeit der beiden Unternehmen [MOR und DS] auf dem Gebiet der Infektionskrankheiten wurde im Mai 2011 beendet."). Ich nehme an, dass hiermit die Krankenhausinfektionskooperation gemeint war. Wenn das stimmt, ist die Frage, ob hieraus in der relativ kurzen Zeit Projekte entstanden sein könnten, die DS weiterführt, oder ob die Zusammenarbeit aus welchen Gründen auch immer ohne konkrete Ergebnisse beendet wurde. DS gehörte in 2011 für das Gesamtjahr umsatztechnisch immerhin noch zu den Top-Drei-Partnern von MorphoSys, und das nur mit fünf Kooperationsmonaten.
Antwort auf Beitrag Nr.: 45.081.753 von Joschka Schröder am 19.07.13 21:27:33Finde ich sehr löblich, wenn du versuchst Licht in die doch weitgehend zumindest im halbdunkel liegenden Pipelineprojekte zu bringen.
Jede erzielte Transparenz, auch zu Konkurrenzentwicklungen, hilft bei der Gesamteinschätzung.
@BReal und Daiichi Sankyo (DS)
Zwar wurde die Kooperation beendet, aber es sollte noch laufende tantiemepflichtige Programme geben, denn DS wird noch als bestehende Partnerschaft auf der HP geführt:
http://www.morphosys.de/partnerschaften/partnered-discovery/…
Andere Partnerschaften sind nach Kooperationsbeendigung auch schon ganz erloschen, aber alle Partner dieser Liste sollten jeweils mindestens ein noch nicht gestopptes Projekt bedeuten.
Jede erzielte Transparenz, auch zu Konkurrenzentwicklungen, hilft bei der Gesamteinschätzung.
@BReal und Daiichi Sankyo (DS)
Zwar wurde die Kooperation beendet, aber es sollte noch laufende tantiemepflichtige Programme geben, denn DS wird noch als bestehende Partnerschaft auf der HP geführt:
http://www.morphosys.de/partnerschaften/partnered-discovery/…
Andere Partnerschaften sind nach Kooperationsbeendigung auch schon ganz erloschen, aber alle Partner dieser Liste sollten jeweils mindestens ein noch nicht gestopptes Projekt bedeuten.
Ja, es laufen ganz sicher noch einige Projekte bei DS mit MOR-AK; die Frage, die ich mir stellte, ist jedoch, ob es sich dabei auch um Projekte im Infektionsbereich handeln kann. Die Zusammenarbeit hat in diesem Bereich noch nicht einmal volle zwei Jahre gedauert (vielleicht reicht das ja auch für das Anschieben einiger Kandidaten, ich weiß es nicht), und wenn ich den Novartis-Deal richtig verstanden habe, hätte gar keine Notwendigkeit bestanden, auch die DS-Zusammenarbeit im Infektionsbereich so früh zu beenden.
Die Pressemitteilung zur Zusammenarbeit bei Infektionen klang damals relativ euphorisch:
"[...] Die Unternehmen werden gemeinschaftlich etablierte sowie neuartige Verfahren anwenden, um optimierte, vollständig humane therapeutische Antikörper gegen krankheitsrelevante Zielmoleküle zu entwickeln, die mit nosokomialen Infektionen in Verbindung stehen. Daiichi Sankyo verpflichtet sich darüber hinaus, die Entwicklung bestimmter, für Infektionskrankheiten spezifische Technologien bei MorphoSys zu finanzieren, die zur Identifikation der wirksamsten Antikörper-basierten Medikamente eingesetzt werden. [...]"
Kann dieses alles in <2 Jahren erfolgreich umgesetzt worden sein? Wenn ja: umso besser, ich hatte diese Kooperation nach der Stellungnahme im GB2011 jedenfalls persönlich abgeschrieben. Es kann natürlich gut sein, dass ich mich irre. MOR bleibt mit der Absynth-Kooperation ja definitiv weiterhin im Infektionsbereich tätig.
Die Pressemitteilung zur Zusammenarbeit bei Infektionen klang damals relativ euphorisch:
"[...] Die Unternehmen werden gemeinschaftlich etablierte sowie neuartige Verfahren anwenden, um optimierte, vollständig humane therapeutische Antikörper gegen krankheitsrelevante Zielmoleküle zu entwickeln, die mit nosokomialen Infektionen in Verbindung stehen. Daiichi Sankyo verpflichtet sich darüber hinaus, die Entwicklung bestimmter, für Infektionskrankheiten spezifische Technologien bei MorphoSys zu finanzieren, die zur Identifikation der wirksamsten Antikörper-basierten Medikamente eingesetzt werden. [...]"
Kann dieses alles in <2 Jahren erfolgreich umgesetzt worden sein? Wenn ja: umso besser, ich hatte diese Kooperation nach der Stellungnahme im GB2011 jedenfalls persönlich abgeschrieben. Es kann natürlich gut sein, dass ich mich irre. MOR bleibt mit der Absynth-Kooperation ja definitiv weiterhin im Infektionsbereich tätig.
Antwort auf Beitrag Nr.: 45.090.261 von BReal am 22.07.13 13:13:17nö, das mit Absynth hat sicher erledigt - info vom letzten (?) CC
es ist aber anderweitig noch etwas am laufen.
evtl. Contrafect?
es ist aber anderweitig noch etwas am laufen.
evtl. Contrafect?
BYM338
------
joschka, weißt du zufällig, warum Shire/Acceleron das ActRIIB protein ACE-031 eingestellt haben?
http://www.acceleronpharma.com/2013/05/acceleron-and-shire-c…" target="_blank" rel="nofollow ugc noopener">http://www.acceleronpharma.com/2013/05/acceleron-and-shire-c…
das klang ja vorher noch vielversprechend:
http://www.actionduchenne.org/duchennepedia/article/149/ace-…
nebenwirkungen??
wäre interessant zu wissen, ob novartis BYM338 in DMD auch testen will.
was dopingmissbrauch betrifft, wie muss ein pharma sich da absichern, bzw. kann sowas ein problem werden?
------
joschka, weißt du zufällig, warum Shire/Acceleron das ActRIIB protein ACE-031 eingestellt haben?
http://www.acceleronpharma.com/2013/05/acceleron-and-shire-c…" target="_blank" rel="nofollow ugc noopener">http://www.acceleronpharma.com/2013/05/acceleron-and-shire-c…
das klang ja vorher noch vielversprechend:
http://www.actionduchenne.org/duchennepedia/article/149/ace-…
nebenwirkungen??
wäre interessant zu wissen, ob novartis BYM338 in DMD auch testen will.
was dopingmissbrauch betrifft, wie muss ein pharma sich da absichern, bzw. kann sowas ein problem werden?
Antwort auf Beitrag Nr.: 45.093.817 von PathFinder2 am 22.07.13 22:46:30die Info stammt aus dem letzten Quartalsbericht (Q1 2013) -> Seite 5
In Hinblick auf Projekte in den vorklinischen Entwicklungsphasen hat MorphoSys die Entscheidung
getroffen, ein frühes Forschungsprogramm im Bereich der Infektionserkrankungen einzustellen. Das im
September 2010 in Kooperation mit dem britischen Biopharmazie-Unternehmen Absynth Biologics
gestartete Programm untersuchte verschiedene Antikörper gegen Erreger des Typs Staphylococcus
aureus.
http://www.morphosys.de/medien-investoren/finanzberichte
In Hinblick auf Projekte in den vorklinischen Entwicklungsphasen hat MorphoSys die Entscheidung
getroffen, ein frühes Forschungsprogramm im Bereich der Infektionserkrankungen einzustellen. Das im
September 2010 in Kooperation mit dem britischen Biopharmazie-Unternehmen Absynth Biologics
gestartete Programm untersuchte verschiedene Antikörper gegen Erreger des Typs Staphylococcus
aureus.
http://www.morphosys.de/medien-investoren/finanzberichte
Antwort auf Beitrag Nr.: 45.093.969 von PathFinder2 am 22.07.13 23:21:41Ich habe noch verschiedene Anfragen dazu laufen.
Offensichtlich ist das Projekt wegen unerwarteter Nebenwirkungen abgebrochen worden: Fest steht, dass die behandelten Jungen mit Duchenne Muskelatrophie unter der Therapie mit ACE-031 auffallend kleine Nasen (leider kein Witz), Zahnfleischbluten und erweiterte Blutgefäße in der Haut entwickelt haben. Darauf hin hat Acceleron zusätzliche präklinische Tests durchgeführt, die schließlich zu einem Projektabbruch geführt haben.
Erwähnenswert auch, dass zuvor schon Wyeth die Entwicklung seines Myostatin-Inhibitors (= neutralisierender Antikörper) MYO-029 eingestellt hatte, diesmal jedoch aus Gründen mangelnder Wirksamkeit (bestimmte Endpunkte nicht erreicht -> http://www.ncbi.nlm.nih.gov/pubmed/18335515). Nebenwirkungen an der Haut sind auch unter MYO-o29 aufgetreten.
All dies muss bzgl. BYM338 nichts bedeuten, dennoch kamen die Nebenwirkungen des Fusionsproteins ACE-031 unerwartet und machen nachdenklich.
Es wird einem immer wieder vor Augen geführt, dass Biotechnologie eine Risikobranche ist. Ich werde versuchen, weitere Informationen einzuholen.
Offensichtlich ist das Projekt wegen unerwarteter Nebenwirkungen abgebrochen worden: Fest steht, dass die behandelten Jungen mit Duchenne Muskelatrophie unter der Therapie mit ACE-031 auffallend kleine Nasen (leider kein Witz), Zahnfleischbluten und erweiterte Blutgefäße in der Haut entwickelt haben. Darauf hin hat Acceleron zusätzliche präklinische Tests durchgeführt, die schließlich zu einem Projektabbruch geführt haben.
Erwähnenswert auch, dass zuvor schon Wyeth die Entwicklung seines Myostatin-Inhibitors (= neutralisierender Antikörper) MYO-029 eingestellt hatte, diesmal jedoch aus Gründen mangelnder Wirksamkeit (bestimmte Endpunkte nicht erreicht -> http://www.ncbi.nlm.nih.gov/pubmed/18335515). Nebenwirkungen an der Haut sind auch unter MYO-o29 aufgetreten.
All dies muss bzgl. BYM338 nichts bedeuten, dennoch kamen die Nebenwirkungen des Fusionsproteins ACE-031 unerwartet und machen nachdenklich.
Es wird einem immer wieder vor Augen geführt, dass Biotechnologie eine Risikobranche ist. Ich werde versuchen, weitere Informationen einzuholen.
Antwort auf Beitrag Nr.: 45.095.905 von Joschka Schröder am 23.07.13 11:25:35PS: Interessant in diesem Zusammenhang, dass Novartis BYM338 nicht in der Indikation Morbus Duchenne testet.
Zitat von PathFinder2: was dopingmissbrauch betrifft, wie muss ein pharma sich da absichern, bzw. kann sowas ein problem werden?
Du meinst, doping ist grundsätzlich missbrauch und wie ein Pharma das verhindern kann?

Klar ist: Sollt BYM388 relativ Nebenwirkungsarm sehr massive Muskelzuwächse auslösen können, dann wird es seine Anhänger in der Szene finden. Sei es um nach Verletzungen und REHA schneller wieder Anschluss zu finden oder eben direkt als Doping-Mittel bei Gesunden.
Nur der enorme Preis wird den Einsatz bremsen.
Wenn nach Zulassung ein Arzt die MIttel verschreibt und abseits einsetzt, was soll ein Pharma da tun? Er macht zusätzlich Umsatz......
Sehr gute Idee, dieser Thread. Diese Art von Informationen sind im ganzen Hintergrundrauschen des großen Threads oft etwas untergegangen oder waren zumindest schwer zu finden. Ich muss zugeben, dass ich etwas überrascht bin von der Targetliste. Mir ist da einiges neu im Zusammenhang mit MOR. Kannst du zu den Projekten bzgl. ALK1 und c-fms noch was sagen? V.a. auch zur Quelle der Information und zum Enwicklungsstand? Timp 1 auf deiner Liste überrascht mich auch etwas. Vor vielen Jahren lief da was präklinisch mit Bayer, es gibt meine ich sogar eine Publikation, die bei Pubmed gelistet ist. Hatte das Projekt aber längst für tot gehalten.
Indirekte gute Nachricht für Medi-551, einen anti-CD19 Antikörper von AstraZeneca/Medimmune, der FC-optimiert ist, jedoch in einer anderen Form als MOR208 (Medi-551 = glycoengineered, MOR208 = amino acid engineered):
Heute wurden Ergebnisse des Roche-Präparats obinutuzumab (anti CD20) veröffentlicht, dessen FC-Teil in ähnlicher Form wie Medi-551 optimiert worden ist. Nachfolgend die Meldung:
Roche’s obinutuzumab (GA101) delayed disease progression longer than MabThera/Rituxan in people with one of the most common forms of blood cancer
• Phase III CLL11 study showed GA101 plus chlorambucil, a chemotherapy, was superior to MabThera/Rituxan plus chlorambucil in helping people with previously untreated chronic lymphocytic leukemia live longer without their disease worsening
• Final data from the CLL11 study will be submitted to the American Society of Hematology’s 55th Annual Meeting in December 2013
Roche (SIX: RO, ROG; OTCQX: RHHBY): Roche today announced positive results from the phase III CLL11 study. At a pre-planned interim analysis, an independent data monitoring committee determined that the study met its primary endpoint showing that GA101 plus chlorambucil helped people live significantly longer without their disease worsening (progression-free survival; PFS) compared to MabThera/Rituxan plus chlorambucil. The CLL11 study is being conducted in cooperation with the German CLL Study Group (GCLLSG). These final data were reached well ahead of the target completion date in 2014 as a result of the magnitude of difference seen between the two study arms. No new safety signals for GA101 or MabThera/Rituxan were identified in this analysis, and adverse events were similar to those observed in the first stage of the study which was previously reported earlier this year.
“The positive final results from the CLL11 study show the promise that GA101 could hold for people with CLL,” said Hal Barron, M.D., Roche’s Chief Medical Officer and Head, Global Product Development. "It is important to explore the potential of this medicine in other types of blood cancer, and our broad development program includes studies in aggressive and indolent lymphoma that compare GA101with MabThera/Rituxan."
GA101 is the first type II anti-CD20 medicine that is glycoengineered, which means specific sugar molecules in GA101 were modified to change its interaction with the body’s immune cells.
This modification creates a unique antibody that is designed to act as an immunotherapy, engaging the patient’s own immune system to help attack the cancerous cells; in addition, GA101 binds to CD20 with the aim of inducing direct cell death.
These data will be submitted for consideration to the 55th Annual Meeting of the American Society of Hematology (ASH) in New Orleans, which is taking place December 7-10, 2013.
Based on an earlier analysis (stage 1) of the CLL11 study, marketing applications for GA101 were submitted to regulatory authorities including the U.S. Food and Drug Administration (FDA) and European Medicines Agency (EMA) in April, 2013. Due to the significance of the positive trial results and the serious and life threatening nature of CLL, the FDA granted the GA101 application both Breakthrough Therapy Designation and Priority Review.
About obinutuzumab (GA101)
GA101 is the first investigational type II, glycoengineered medicine designed to attack cells that have a certain marker (CD20) on their surface. It attacks targeted cells both directly and together with the body’s immune system. GA101 is currently being investigated in a large clinical program, including multiple head-to-head phase III studies versus MabThera/Rituxan in indolent non-Hodgkin lymphoma (NHL) and diffuse large B-cell lymphoma (DLBCL).
In the U.S., GA101 is being developed and will be commercialized in collaboration with Biogen Idec.
About the CLL11 study
CLL11 is a phase III, multicenter, open-label, randomized three-arm study to investigate the efficacy and safety profile of either GA101 plus chlorambucil or MabThera/Rituxan plus chlorambucil compared to chlorambucil alone in 781 previously untreated people with CLL and co-existing medical conditions who are in need of therapy. The study included two stages of analysis.
• Stage 1 included 589 patients and evaluated GA101 plus chlorambucil to chlorambucil alone and MabThera/Rituxan plus chlorambucil to chlorambucil alone. Stage 1 results were reported earlier this year and showed that GA101 plus chlorambucil doubled the time people lived without their disease worsening 23.0 vs. 10.9 months compared to chlorambucil alone (HR=0.14 CI 0.09-0.21 p<0.0001).
• Stage 2 (announced today) enrolled an additional 192 patients to enable the final direct comparison of GA101 versus MabThera/Rituxan, both in combination with chlorambucil.
The primary endpoint of the study was PFS with secondary endpoints including overall response rate (ORR), overall survival (OS), disease-free survival (DFS), minimal residual disease (MRD) and safety profile.
About the German CLL Study Group (GCLLSG)
Founded in 1996 and headed by Dr. Michael Hallek, the GCLLSG has been running various phase III, phase II and phase I trials in CLL with the goal to provide optimal treatment to patients suffering from this disease. Among those were landmark trials like the CLL8 trial which led to the current standard of care in CLL. For many years, GCLLSG has been aiming to improve not just the treatment of younger and physically fit patients, but also that of elderly and less fit patients. These patients are generally underrepresented in clinical trials although they constitute the majority of CLL patients treated by doctors in daily practice. The German CLL Study Group is an independent non-profit research organization supported by the German Cancer Aid (Deutsche Krebshilfe).
Heute wurden Ergebnisse des Roche-Präparats obinutuzumab (anti CD20) veröffentlicht, dessen FC-Teil in ähnlicher Form wie Medi-551 optimiert worden ist. Nachfolgend die Meldung:
Roche’s obinutuzumab (GA101) delayed disease progression longer than MabThera/Rituxan in people with one of the most common forms of blood cancer
• Phase III CLL11 study showed GA101 plus chlorambucil, a chemotherapy, was superior to MabThera/Rituxan plus chlorambucil in helping people with previously untreated chronic lymphocytic leukemia live longer without their disease worsening
• Final data from the CLL11 study will be submitted to the American Society of Hematology’s 55th Annual Meeting in December 2013
Roche (SIX: RO, ROG; OTCQX: RHHBY): Roche today announced positive results from the phase III CLL11 study. At a pre-planned interim analysis, an independent data monitoring committee determined that the study met its primary endpoint showing that GA101 plus chlorambucil helped people live significantly longer without their disease worsening (progression-free survival; PFS) compared to MabThera/Rituxan plus chlorambucil. The CLL11 study is being conducted in cooperation with the German CLL Study Group (GCLLSG). These final data were reached well ahead of the target completion date in 2014 as a result of the magnitude of difference seen between the two study arms. No new safety signals for GA101 or MabThera/Rituxan were identified in this analysis, and adverse events were similar to those observed in the first stage of the study which was previously reported earlier this year.
“The positive final results from the CLL11 study show the promise that GA101 could hold for people with CLL,” said Hal Barron, M.D., Roche’s Chief Medical Officer and Head, Global Product Development. "It is important to explore the potential of this medicine in other types of blood cancer, and our broad development program includes studies in aggressive and indolent lymphoma that compare GA101with MabThera/Rituxan."
GA101 is the first type II anti-CD20 medicine that is glycoengineered, which means specific sugar molecules in GA101 were modified to change its interaction with the body’s immune cells.
This modification creates a unique antibody that is designed to act as an immunotherapy, engaging the patient’s own immune system to help attack the cancerous cells; in addition, GA101 binds to CD20 with the aim of inducing direct cell death.
These data will be submitted for consideration to the 55th Annual Meeting of the American Society of Hematology (ASH) in New Orleans, which is taking place December 7-10, 2013.
Based on an earlier analysis (stage 1) of the CLL11 study, marketing applications for GA101 were submitted to regulatory authorities including the U.S. Food and Drug Administration (FDA) and European Medicines Agency (EMA) in April, 2013. Due to the significance of the positive trial results and the serious and life threatening nature of CLL, the FDA granted the GA101 application both Breakthrough Therapy Designation and Priority Review.
About obinutuzumab (GA101)
GA101 is the first investigational type II, glycoengineered medicine designed to attack cells that have a certain marker (CD20) on their surface. It attacks targeted cells both directly and together with the body’s immune system. GA101 is currently being investigated in a large clinical program, including multiple head-to-head phase III studies versus MabThera/Rituxan in indolent non-Hodgkin lymphoma (NHL) and diffuse large B-cell lymphoma (DLBCL).
In the U.S., GA101 is being developed and will be commercialized in collaboration with Biogen Idec.
About the CLL11 study
CLL11 is a phase III, multicenter, open-label, randomized three-arm study to investigate the efficacy and safety profile of either GA101 plus chlorambucil or MabThera/Rituxan plus chlorambucil compared to chlorambucil alone in 781 previously untreated people with CLL and co-existing medical conditions who are in need of therapy. The study included two stages of analysis.
• Stage 1 included 589 patients and evaluated GA101 plus chlorambucil to chlorambucil alone and MabThera/Rituxan plus chlorambucil to chlorambucil alone. Stage 1 results were reported earlier this year and showed that GA101 plus chlorambucil doubled the time people lived without their disease worsening 23.0 vs. 10.9 months compared to chlorambucil alone (HR=0.14 CI 0.09-0.21 p<0.0001).
• Stage 2 (announced today) enrolled an additional 192 patients to enable the final direct comparison of GA101 versus MabThera/Rituxan, both in combination with chlorambucil.
The primary endpoint of the study was PFS with secondary endpoints including overall response rate (ORR), overall survival (OS), disease-free survival (DFS), minimal residual disease (MRD) and safety profile.
About the German CLL Study Group (GCLLSG)
Founded in 1996 and headed by Dr. Michael Hallek, the GCLLSG has been running various phase III, phase II and phase I trials in CLL with the goal to provide optimal treatment to patients suffering from this disease. Among those were landmark trials like the CLL8 trial which led to the current standard of care in CLL. For many years, GCLLSG has been aiming to improve not just the treatment of younger and physically fit patients, but also that of elderly and less fit patients. These patients are generally underrepresented in clinical trials although they constitute the majority of CLL patients treated by doctors in daily practice. The German CLL Study Group is an independent non-profit research organization supported by the German Cancer Aid (Deutsche Krebshilfe).
Antwort auf Beitrag Nr.: 45.103.053 von Joschka Schröder am 24.07.13 09:44:10Noch eine aus meiner Sicht wichtige Zusatzinformation:
obinutuzumab wurde mit Hilfe der GlycoMab-Plattform vom Biotech-Start-up Glycart (Zürch-Schlieren) entwickelt. Roche hatte Glycart im Jahr 2005 für ca. 235 Mio. Fr (Zahlenangabe stammt aus der FuW) übernommen.
In #2 hatte ich verschiedene anti CD19-Entwicklungsprojekte aufgelistet und erwähnt, dass auch Roche "nunmehr über die Tochter Roche Glycart einen eigenen Kandidaten entwickelt" habe. Ich habe mal kurz in betreffendem Patent nachgesehen: Die Entwicklung wurde mit Hilfe der GlycoMab-Plattform durchgeführt, mithin handelt es sich bei Roches neuem anti CD19-MAB um einen Antikörper, dessen FC-Teil demjenigen des obinituzumab gleicht.
Es wird immer augenscheinlicher, welcher enormen Konkurrenz MOR208 ausgesetzt sein wird ... mehreren FC-optimierten Antikörpern, einigen Immunkonjugaten usw. ... und alles Präparate erstklassiger Firmen. Für mich ziehe ich daraus die Schlussfolgerung, dass die Marktanteile künftiger Präparate mit zunehmender Konkurrenz immer kleiner werden wird. Viele Antikörper, die gegen bestimmte Targets gerichtet sind, werden sich hinsichtlich Wirkung und Nebenwirkung nicht viel geben. Pauschale Projekt-Bewertungszahlen, die sich auf zurückliegende Zeiten beziehen, in denen nur wenige Biotech-Präparate auf dem Markt waren, sind aus meiner Sicht deutlich überzogen und lange überholt. Künftig wird es nur noch in den seltesten Fällen Antikörperpräparate geben, die tatsächlich einen "Blockbuster"-Status erreichen. Jeder Vorstand mißt seinem eigenen Entwicklungsprojekt Blockbusterpotential zu ... diese Rechnung kann aber nicht aufgehen, wenn gleichzeitig 10 Präparate auf den Markt kommen, die mit sehr ähnlichem Wirkmechanismus dasselbe Target bearbeiten. Insoweit scheint mir angesichts der gegenwärtigen Biotech-Euphorie durchaus etwas Vorsicht angesagt.
obinutuzumab wurde mit Hilfe der GlycoMab-Plattform vom Biotech-Start-up Glycart (Zürch-Schlieren) entwickelt. Roche hatte Glycart im Jahr 2005 für ca. 235 Mio. Fr (Zahlenangabe stammt aus der FuW) übernommen.
In #2 hatte ich verschiedene anti CD19-Entwicklungsprojekte aufgelistet und erwähnt, dass auch Roche "nunmehr über die Tochter Roche Glycart einen eigenen Kandidaten entwickelt" habe. Ich habe mal kurz in betreffendem Patent nachgesehen: Die Entwicklung wurde mit Hilfe der GlycoMab-Plattform durchgeführt, mithin handelt es sich bei Roches neuem anti CD19-MAB um einen Antikörper, dessen FC-Teil demjenigen des obinituzumab gleicht.
Es wird immer augenscheinlicher, welcher enormen Konkurrenz MOR208 ausgesetzt sein wird ... mehreren FC-optimierten Antikörpern, einigen Immunkonjugaten usw. ... und alles Präparate erstklassiger Firmen. Für mich ziehe ich daraus die Schlussfolgerung, dass die Marktanteile künftiger Präparate mit zunehmender Konkurrenz immer kleiner werden wird. Viele Antikörper, die gegen bestimmte Targets gerichtet sind, werden sich hinsichtlich Wirkung und Nebenwirkung nicht viel geben. Pauschale Projekt-Bewertungszahlen, die sich auf zurückliegende Zeiten beziehen, in denen nur wenige Biotech-Präparate auf dem Markt waren, sind aus meiner Sicht deutlich überzogen und lange überholt. Künftig wird es nur noch in den seltesten Fällen Antikörperpräparate geben, die tatsächlich einen "Blockbuster"-Status erreichen. Jeder Vorstand mißt seinem eigenen Entwicklungsprojekt Blockbusterpotential zu ... diese Rechnung kann aber nicht aufgehen, wenn gleichzeitig 10 Präparate auf den Markt kommen, die mit sehr ähnlichem Wirkmechanismus dasselbe Target bearbeiten. Insoweit scheint mir angesichts der gegenwärtigen Biotech-Euphorie durchaus etwas Vorsicht angesagt.
Zitat von Joschka Schröder: ...
obinutuzumab wurde mit Hilfe der GlycoMab-Plattform vom Biotech-Start-up Glycart (Zürch-Schlieren) entwickelt. ...
In #2 hatte ich verschiedene anti CD19-Entwicklungsprojekte aufgelistet und erwähnt, dass auch Roche "nunmehr über die Tochter Roche Glycart einen eigenen Kandidaten entwickelt" habe. Ich habe mal kurz in betreffendem Patent nachgesehen: Die Entwicklung wurde mit Hilfe der GlycoMab-Plattform durchgeführt, mithin handelt es sich bei Roches neuem anti CD19-MAB um einen Antikörper, dessen FC-Teil demjenigen des obinituzumab gleicht.
....
Ist mir neu, dass Roche auch bei CD19 mABs mitmischt. Kannst du mal die Quelle verlinken?
Bislang war für mich nur ersichtlich, dass Roche weiterhin CD20 'treu bleibt' und es keine wirklichen Gründe gibt, jetzt mit CD19 mABs den eigenen CD20 Produkten Konkurenz zu machen. Die CD20 Antikörper verkaufen sich extrem gut und der Patentauslauf wurde gerade in aufwendigen klinschen Studien mit neuen, optimierten CD20 mAbs kompensiert.
Antwort auf Beitrag Nr.: 45.103.681 von rollingovermilestones am 24.07.13 10:58:49Details findest Du in Patent Nr. WO2011147834(A1) vom 1.12.2011
Zitat von Joschka Schröder: Details findest Du in Patent Nr. WO2011147834(A1) vom 1.12.2011
Vielen Dank!
Anbei noch ein link zu einem MOR208 / CD19 Artikel:
http://www.nature.com/leu/journal/v27/n7/full/leu2012373a.ht…
Vermutlich kennst du diesen bereits...
Ja, vielen Dank ... die CD19-Recherche habe ich mittlerweile nahezu abgeschlossen und warte nun auf die ASH-Daten im Dezember.
Vorher dürfte Morphosys noch (im groben) über MOR208 berichten. Daran, dass MOR208 wirken dürfte, habe ich wenig Zweifel. Wichtiger werden jedoch die Vergleichsdaten zu anderen anti-CD19-MABs sein, incl. den jeweiligen Nebenwirkungen (NW-Profil dürfte etwas ungünstiger sein als bei den anti-CD20-Präparaten).
Mittlerweile habe ich mich auch durch die wesentlichen Alzheimer-Publikationen gearbeitet und hatte in diesem Zusammenhang auch Kontakt mit Mitearbeitern der Roche F&E und verschiedenen Wissenschaftlern aus dem Universitätsbereich. Schon vorab: Es ist fast zum verzweifeln. Im Grunde genommen weiß man so gut wie nichts konkretes. Insbesondere die Amyloid-Hypothese scheint auf äußerst dünnen Beinchen zu stehen, obwohl sich ca. 95 % der Alzheimer-Forscher auf der Amyloid-Schiene bewegen (s. dazu auch Ballard/London gegenüber Bloomberg im Mai 2013 -> http://www.bloomberg.com/news/2013-05-21/novartis-ramping-up…).
Inzwischen würde ich die Chance, dass Gantenerumab einen wirklichen Benefit bringen wird, mit vielleicht 1:20 ansetzen. Details später.
PS: Je tiefer man in die Materie einsteigt, desto skeptischer wird man.
Vorher dürfte Morphosys noch (im groben) über MOR208 berichten. Daran, dass MOR208 wirken dürfte, habe ich wenig Zweifel. Wichtiger werden jedoch die Vergleichsdaten zu anderen anti-CD19-MABs sein, incl. den jeweiligen Nebenwirkungen (NW-Profil dürfte etwas ungünstiger sein als bei den anti-CD20-Präparaten).
Mittlerweile habe ich mich auch durch die wesentlichen Alzheimer-Publikationen gearbeitet und hatte in diesem Zusammenhang auch Kontakt mit Mitearbeitern der Roche F&E und verschiedenen Wissenschaftlern aus dem Universitätsbereich. Schon vorab: Es ist fast zum verzweifeln. Im Grunde genommen weiß man so gut wie nichts konkretes. Insbesondere die Amyloid-Hypothese scheint auf äußerst dünnen Beinchen zu stehen, obwohl sich ca. 95 % der Alzheimer-Forscher auf der Amyloid-Schiene bewegen (s. dazu auch Ballard/London gegenüber Bloomberg im Mai 2013 -> http://www.bloomberg.com/news/2013-05-21/novartis-ramping-up…).
Inzwischen würde ich die Chance, dass Gantenerumab einen wirklichen Benefit bringen wird, mit vielleicht 1:20 ansetzen. Details später.
PS: Je tiefer man in die Materie einsteigt, desto skeptischer wird man.
Zitat von Joschka Schröder: Details findest Du in Patent Nr. WO2011147834(A1) vom 1.12.2011
Roche bzw. Genentech taucht noch nicht bei den CD19-Studien auf; allerdings gibt es Konkurenz von einer Reihe anderer Gesellschaften.
Insofern gut, weil das target interessant scheint und zumindest Roche nicht unter den konkurierenden Firmen ist. Vielleicht ließe sich ein guter CD19 MAb an Roche verpartnern? Durch die CD20 Erfahrung könnte viel Studienerfahrung einfließen! Allerdings ist ein potenter Partner ohne interne CD20 Konkurenz sicherlich entschiedener beim entwickeln und launchen...
Ich hoffe Morphosys hat mit der Xencoreinlizensierung von MOR208 soviel Erfolg, wie mit der Verpartnerung von MOR103 und MOR202!
Zitat von Joschka Schröder: ... Es wird immer augenscheinlicher, welcher enormen Konkurrenz MOR208 ausgesetzt sein wird .... Pauschale Projekt-Bewertungszahlen, die sich auf zurückliegende Zeiten beziehen, in denen nur wenige Biotech-Präparate auf dem Markt waren, sind aus meiner Sicht deutlich überzogen und lange überholt. Künftig wird es nur noch in den seltesten Fällen Antikörperpräparate geben, die tatsächlich einen "Blockbuster"-Status erreichen. Jeder Vorstand mißt seinem eigenen Entwicklungsprojekt Blockbusterpotential zu ... diese Rechnung kann aber nicht aufgehen, wenn gleichzeitig 10 Präparate auf den Markt kommen, die mit sehr ähnlichem Wirkmechanismus dasselbe Target bearbeiten. Insoweit scheint mir angesichts der gegenwärtigen Biotech-Euphorie durchaus etwas Vorsicht angesagt.
Etwas gekürzt und ein paar Anmerkungen.
Nur weil aktuell etwa 10 Präparate gegen das gleiche target in Entwicklung sind, werden ja nicht 10 zugelassen. Niemand rechnet in den DCF-Abschätzungen mit 100% Zulassungswahrscheinlichkeit, sondern vielleicht mit 30%. Es geht also um ca. 3 Zulassungen.
Und damit steigt die Chance darauf, dass sich bei 1, 2 oder gar 3en dieser zugelassenen Bestperformer (für die Patienten) tatsächlich um einen Blockbuster handelt, wiederum enorm.
Ganz allgemein und nicht speziell auf MOR208 bezogen.
Und Entwicklungen skeptisch begleiten ist immer ok. Euphorie vernebelt die Blicke.
Antwort auf Beitrag Nr.: 45.104.369 von eck64 am 24.07.13 12:05:23Dein Einwand ist berechtigt. Meine Formulierung war etwas überspitzt und damit mißverständlich. Im Grunde wollte ich zum Ausdruck bringen, dass die Konkurrenz mittlerweile unglaublich groß ist und sich viele Antikörper auf den ersten Blick kaum noch wesentlich unterscheiden (z.B. ähnliche FC-Optimierung usw.). Per Saldo darf man gespannt sein, wie groß die Unterschiede im Wirkungs-/NW-Profil sein werden und wie viele Präparate es auf den Markt schaffen werden. Die Pionierzeiten, in denen einzelne Präparate wie z.B. Rituxan quasi ungestört den Markt aufrollen, dürften jedenfalls vorbei sein.
PS: Schön, Dich in diesem Thread zu sehen.
PS: Schön, Dich in diesem Thread zu sehen.
Zitat von Joschka Schröder:Zitat von rollingovermilestones: Vielleicht ließe sich ein guter CD19 MAb an Roche verpartnern?
Ausgeschlossen, die haben doch bereits den genannten, auf der GlycoMab-Plattform konstruierten FC-optimierten anti-CD19-MAB in der Eigenentwicklung.
Glaube nicht, dass, bei soviel Konkurenz, Roche eigenentwickelte CD19-mAbs in die klinische Entwicklung führt. Eher wird auf einen bereits fahrenden Zug aufgesprungen....
Aber nur falls es eine aussichtsreiche Reise wird.
Kommt die Prognoseanhebung noch bis zur HV, also die Genehmigung des MOR202-Deals?
Langsam wird es eng.
Ich würde auch gerne über die Entwicklung bei MOR103 und GSK hören.
Was für Studien geplant sind und wie es mit weiteren Indikationen (neben MS) aussieht.
Langsam wird es eng.
Ich würde auch gerne über die Entwicklung bei MOR103 und GSK hören.
Was für Studien geplant sind und wie es mit weiteren Indikationen (neben MS) aussieht.
Antwort auf Beitrag Nr.: 45.106.109 von rollingovermilestones am 24.07.13 15:35:50Ich habe eben noch einmal in die Patentdatenbank geschaut und gesehen, dass die Angaben zu Roches anti-CD19-MAB am 23.7.2013, also gestern, aktualisiert worden sind. Als Status ist nunmehr vermerkt: "Despatch of communication that the application is deemed to be withdrawn, reason: filing fee / search fee not paid in time".
Falls kein Versäumnis vorliegt, das nachträglich geheilt werden kann, hat Roche möglicherweise tatsächlich die weitere (klinische) Projektentwicklung kurzfristig aufgegeben. Das wäre wirklich eine Überraschung, deren Gründe zu erfahren interessant wäre.
Da in diesem Thread möglichst wenig spekuliert werden soll, sondern Fakten-basierte Argumentation gewünscht ist, habe ich bereits eine Anfrage laufen. Ich hoffe, noch heute Abend eine Antwort zu bekommen, die ich dann im genehmigten Umfang gerne weiterleite.
Kurz noch eine persönliche Anmerkung: Der Thread macht Freude ... sachbezogene, ruhige Diskussionen, Fragen, die ernst zu nehmen sind und dazu anregen, eigene Einstellungen zu hinterfragen. Mir gefällts. Allen, die sich in netter Form beteiligen, meinen besten Dank.
Falls kein Versäumnis vorliegt, das nachträglich geheilt werden kann, hat Roche möglicherweise tatsächlich die weitere (klinische) Projektentwicklung kurzfristig aufgegeben. Das wäre wirklich eine Überraschung, deren Gründe zu erfahren interessant wäre.
Da in diesem Thread möglichst wenig spekuliert werden soll, sondern Fakten-basierte Argumentation gewünscht ist, habe ich bereits eine Anfrage laufen. Ich hoffe, noch heute Abend eine Antwort zu bekommen, die ich dann im genehmigten Umfang gerne weiterleite.
Kurz noch eine persönliche Anmerkung: Der Thread macht Freude ... sachbezogene, ruhige Diskussionen, Fragen, die ernst zu nehmen sind und dazu anregen, eigene Einstellungen zu hinterfragen. Mir gefällts. Allen, die sich in netter Form beteiligen, meinen besten Dank.
Joschka, ich denke bei den MOR-targets - ich vermute sie beruhen auf patentanmeldungen? - muss man etwas vorsichtig sein. es wird sicher einiges davon nicht weiterverfolgt, was in den patenten oft erst mit großer verspätung ersichtlich wird.
z.b. ALK von MOR; bin mir nicht sicher ob es diesen noch gibt
interessant ist die liste aber allemal.
z.b. ALK von MOR; bin mir nicht sicher ob es diesen noch gibt
interessant ist die liste aber allemal.
zu MOR202
---------
Joschka, wie schätzt du das ein:
Genmab/J&J behauptet ja, dass Daratumumab mehr wirkmechanismen als die konkurrenz von MOR bzw. Sanofi aufweist. dies wurde angeblich auch durch direkten präklinischen vergleich mit den mitbewerbern durch Genmab (J&J) getestet!
man sieht die mechanismen von daratumab hier http://files.shareholder.com/downloads/JNJ/2609194274x0x6664… auf seite 237:
- induction of CDC
- modulation of enzymatic activation
- apoptosis after cross-linking
- induction of ADCC and ADCP
MOR konnte bisher folgende mechanismen in präklinischen studien nachweisen:
- induction of ADCC and ADCP
für mich stellt sich als laie die frage, wie "wichtig" die anderen wirkmechanismen sind.
und wie wahrscheinlich ist es, dass diese zusätzlichen wirkmechanismen zu einem schlechteren verträglichkeitsprofil verglichen mit MOR202 führen können, bzw. umgekehrt?
nachdem sehr viel wert bei MOR202 liegt, ist dies meiner meinung nach ein recht interessantes thema, und ich bin für fachkundige beiträge sehr dankbar!
---------
Joschka, wie schätzt du das ein:
Genmab/J&J behauptet ja, dass Daratumumab mehr wirkmechanismen als die konkurrenz von MOR bzw. Sanofi aufweist. dies wurde angeblich auch durch direkten präklinischen vergleich mit den mitbewerbern durch Genmab (J&J) getestet!
man sieht die mechanismen von daratumab hier http://files.shareholder.com/downloads/JNJ/2609194274x0x6664… auf seite 237:
- induction of CDC
- modulation of enzymatic activation
- apoptosis after cross-linking
- induction of ADCC and ADCP
MOR konnte bisher folgende mechanismen in präklinischen studien nachweisen:
- induction of ADCC and ADCP
für mich stellt sich als laie die frage, wie "wichtig" die anderen wirkmechanismen sind.
und wie wahrscheinlich ist es, dass diese zusätzlichen wirkmechanismen zu einem schlechteren verträglichkeitsprofil verglichen mit MOR202 führen können, bzw. umgekehrt?
nachdem sehr viel wert bei MOR202 liegt, ist dies meiner meinung nach ein recht interessantes thema, und ich bin für fachkundige beiträge sehr dankbar!
Antwort auf Beitrag Nr.: 45.137.545 von PathFinder2 am 29.07.13 22:08:57Hallo PF,
hab das in der Tendenz auch schon anders gelesen (natürlich sind diese präklinischen Daten allesamt noch nicht so sehr aussagekräftig, wenn man 202 und Dara vergleichen will, das ist uns ja allen klar):
Comparable preclinical data for MOR202 and daratumumab. MOR202 reduced MM-mediated bone lysis by up to 55% at 12 mg/ kg. Combination of MOR202 (3mg/kg) and lenalidomide (50mg/kg) or bortezomib (0.6mg/kg) completely abolished bone lysis, while lenalidomide or bortezomib alone inhibited bone lysis by 20% and 40%, respectively (Endell et al., ASCO 2011, #8078). In a preclinical study, daratumumab was shown to induce 39% lysis in CD38 positive MM cell lines at a concentration of 0.1ug/ml (Weers et al., J Immunol 2011, 186:1840-1848). In another study, combination of daratumumab + lenalidomide was shown to induce ~55% of cell lysis vs. ~40% for daratumumab and ~13% for lenalidomide (Van Der Veer et al., Haematologica 2011, 96:284-290). Although these are two different measurements, both compounds showed synergistic activity when combined with either lenalidomide or bortezomib. MOR202 combination therapy appears to be more impressive since it completely abolished bone lysis.
CD38 is a potential target for multiple hematologic cancers. CD38 is highly expressed on the surface of multiple myeloma cells and also expressed in diffused large B-Cell lymphoma, chronic lymphocytic leukemia, acute lymphoblastic leukemia, acute myeloid leukemia, follicular lymphoma and mantle cell lymphoma. Although the wide expression of CD38 had initially led to safety concerns about this mechanism, MEDACorp key opinion leaders have commented that daratumumab data have not revealed a safety signal.
hab das in der Tendenz auch schon anders gelesen (natürlich sind diese präklinischen Daten allesamt noch nicht so sehr aussagekräftig, wenn man 202 und Dara vergleichen will, das ist uns ja allen klar):
Comparable preclinical data for MOR202 and daratumumab. MOR202 reduced MM-mediated bone lysis by up to 55% at 12 mg/ kg. Combination of MOR202 (3mg/kg) and lenalidomide (50mg/kg) or bortezomib (0.6mg/kg) completely abolished bone lysis, while lenalidomide or bortezomib alone inhibited bone lysis by 20% and 40%, respectively (Endell et al., ASCO 2011, #8078). In a preclinical study, daratumumab was shown to induce 39% lysis in CD38 positive MM cell lines at a concentration of 0.1ug/ml (Weers et al., J Immunol 2011, 186:1840-1848). In another study, combination of daratumumab + lenalidomide was shown to induce ~55% of cell lysis vs. ~40% for daratumumab and ~13% for lenalidomide (Van Der Veer et al., Haematologica 2011, 96:284-290). Although these are two different measurements, both compounds showed synergistic activity when combined with either lenalidomide or bortezomib. MOR202 combination therapy appears to be more impressive since it completely abolished bone lysis.
CD38 is a potential target for multiple hematologic cancers. CD38 is highly expressed on the surface of multiple myeloma cells and also expressed in diffused large B-Cell lymphoma, chronic lymphocytic leukemia, acute lymphoblastic leukemia, acute myeloid leukemia, follicular lymphoma and mantle cell lymphoma. Although the wide expression of CD38 had initially led to safety concerns about this mechanism, MEDACorp key opinion leaders have commented that daratumumab data have not revealed a safety signal.
Zitat von SLGramann: MOR202 combination therapy appears to be more impressive since it completely abolished bone lysis.
Das dürfte auch ein Grund dafür sein, das Celgene sich die Rechte gesichert hat. Aber ob sich das bestätigt? Dafür müssen sie jetzt erstmals breiter angelegte Studien auflegen. Und erst deren Ergebnisse werden die Hoffnungen bestätigen oder verwerfen.
Mit MOR202 haben wir jetzt ein weiteres dickes Lotterielos in der Ziehung, zwar noch sehr frühe klinische Phase, aber eben doch aussichtsreich.
Hoffentlich ist Celgene auch interessiert an baldiger Präsentation von Studiendaten, z.B. auch um seine Investition zu begründen und die führende Rolle und Kompetenz in der Indikation.
Antwort auf Beitrag Nr.: 45.139.283 von eck64 am 30.07.13 09:42:47hallo SLgramann!
danke, nehme an das ist von da
http://oncology.healthace.com/062713/oncology_report_062713.…
es wäre natürlich traumhaft, wenn MOR202 an daratumumab herankäme oder sogar besser wäre. das wäre dann der große jackpot, und MOR sollte dann sofort alle eigenentwicklungen einstellen, weil sie so etwas sowieso nicht mehr schaffen
danke, nehme an das ist von da
http://oncology.healthace.com/062713/oncology_report_062713.…
es wäre natürlich traumhaft, wenn MOR202 an daratumumab herankäme oder sogar besser wäre. das wäre dann der große jackpot, und MOR sollte dann sofort alle eigenentwicklungen einstellen, weil sie so etwas sowieso nicht mehr schaffen

hallo joschka,
noch eine wirkmechanismusfrage:
http://www.fiercebiotechresearch.com/story/ucla-team-ids-ant…" target="_blank" rel="nofollow ugc noopener">
http://www.fiercebiotechresearch.com/story/ucla-team-ids-ant…
"The findings, published in the new open-access journal eLife, support growing evidence that oligomers--smaller assemblies of amyloid beta--and not the fibrils themselves, are the toxic agents responsible for Alzheimer's symptoms."
ich denke du warst es, der vor kurzem genauer bezüglich gantenerumab recherchiert hat - wie beurteilst du das oben falls es stimmt?
noch eine wirkmechanismusfrage:
http://www.fiercebiotechresearch.com/story/ucla-team-ids-ant…" target="_blank" rel="nofollow ugc noopener">
http://www.fiercebiotechresearch.com/story/ucla-team-ids-ant…
"The findings, published in the new open-access journal eLife, support growing evidence that oligomers--smaller assemblies of amyloid beta--and not the fibrils themselves, are the toxic agents responsible for Alzheimer's symptoms."
ich denke du warst es, der vor kurzem genauer bezüglich gantenerumab recherchiert hat - wie beurteilst du das oben falls es stimmt?
Antwort auf Beitrag Nr.: 45.145.863 von PathFinder2 am 30.07.13 21:23:00@PathFinder2
Wenn möglich, werde ich in den nächsten Tagen etwas detaillierter zu Gantenerumab Stellung beziehen. Schon jetzt nur so viel: Bei Roche sieht man die Dinge sehr realistisch. Den Nachweis, dass die Auflösung von Amyoid-Plaques auch einen therapeutischen Effekt hat, gibt es bislang nicht und die bisweilen widersprüchlichen Ergebnisse diverser Tierversuche lassen sich nicht auf den Menschen übertragen. Der Ausgang der gegenwärtigen Studie ist völlig ungewiß. Nach all meinen Recherchen würde ich die Wahrscheinlichkeit eines Erfolgs mittlerweile nicht höher als etwa 1:20 einschätzen. Die aus meiner Sicht fähigsten Wissenschaftler, mit denen ich in der Sache Kontakt hatte, halten die Amyloid-Hypothese für nicht zielführend.
Wenn möglich, werde ich in den nächsten Tagen etwas detaillierter zu Gantenerumab Stellung beziehen. Schon jetzt nur so viel: Bei Roche sieht man die Dinge sehr realistisch. Den Nachweis, dass die Auflösung von Amyoid-Plaques auch einen therapeutischen Effekt hat, gibt es bislang nicht und die bisweilen widersprüchlichen Ergebnisse diverser Tierversuche lassen sich nicht auf den Menschen übertragen. Der Ausgang der gegenwärtigen Studie ist völlig ungewiß. Nach all meinen Recherchen würde ich die Wahrscheinlichkeit eines Erfolgs mittlerweile nicht höher als etwa 1:20 einschätzen. Die aus meiner Sicht fähigsten Wissenschaftler, mit denen ich in der Sache Kontakt hatte, halten die Amyloid-Hypothese für nicht zielführend.
Zitat von PathFinder2: hallo joschka,
noch eine wirkmechanismusfrage:
http://www.fiercebiotechresearch.com/story/ucla-team-ids-ant…" target="_blank" rel="nofollow ugc noopener">
http://www.fiercebiotechresearch.com/story/ucla-team-ids-ant…
"The findings, published in the new open-access journal eLife, support growing evidence that oligomers--smaller assemblies of amyloid beta--and not the fibrils themselves, are the toxic agents responsible for Alzheimer's symptoms."
ich denke du warst es, der vor kurzem genauer bezüglich gantenerumab recherchiert hat - wie beurteilst du das oben falls es stimmt?
Das dürfte unumstritten sein und ist so auch in der gängigen Literatur nachzulesen. Auch für Verfechter der Amyloid-Theorie liegt hier ein möglicher Schwachpunkt des Gantenerumabs, das vorwiegend Plaques auflöst (laut Patent allerdings in einem gewissen Umfang auch Oligomere und Dimere zu spalten vermag ... dieser Effekt scheint jedoch schwächer ausgeprägt zu sein).
Antwort auf Beitrag Nr.: 45.139.177 von SLGramann am 30.07.13 09:30:39zu den Beiträgen 33 und 34:
Die präklinischen Studien lassen sich schwer vergleichen, da sie unter unterschiedlichen experimentellen Bedingungen durchgeführt worden sind. Dazu kommen dann noch Dosisfragen (die jeweils verwendeten Dosen werden kaum mit denjenigen identisch sein, die später bei der Humantherapie angewendet werden).
Zur Frage nach den unterschiedlichen Wirkmechanismen: Um diese Frage zu bentworten müßte man u.a. wissen, wie stark die jeweiligen Mechanismen zur Gesamtwirkung beitragen. Und da bislang noch nicht einmal ein Vergleich der Gesamtwirkung möglich ist, bin ich auch hier überfragt.
Die präklinischen Studien lassen sich schwer vergleichen, da sie unter unterschiedlichen experimentellen Bedingungen durchgeführt worden sind. Dazu kommen dann noch Dosisfragen (die jeweils verwendeten Dosen werden kaum mit denjenigen identisch sein, die später bei der Humantherapie angewendet werden).
Zur Frage nach den unterschiedlichen Wirkmechanismen: Um diese Frage zu bentworten müßte man u.a. wissen, wie stark die jeweiligen Mechanismen zur Gesamtwirkung beitragen. Und da bislang noch nicht einmal ein Vergleich der Gesamtwirkung möglich ist, bin ich auch hier überfragt.
Zitat von SLGramann: Comparable preclinical data for MOR202 and daratumumab. MOR202 reduced MM-mediated bone lysis by up to 55% at 12 mg/ kg. Combination of MOR202 (3mg/kg) and lenalidomide (50mg/kg) or bortezomib (0.6mg/kg) completely abolished bone lysis, while lenalidomide or bortezomib alone inhibited bone lysis by 20% and 40%, respectively (Endell et al., ASCO 2011, #8078). In a preclinical study, daratumumab was shown to induce 39% lysis in CD38 positive MM cell lines at a concentration of 0.1ug/ml (Weers et al., J Immunol 2011, 186:1840-1848). In another study, combination of daratumumab + lenalidomide was shown to induce ~55% of cell lysis vs. ~40% for daratumumab and ~13% for lenalidomide (Van Der Veer et al., Haematologica 2011, 96:284-290). Although these are two different measurements, both compounds showed synergistic activity when combined with either lenalidomide or bortezomib. MOR202 combination therapy appears to be more impressive since it completely abolished bone lysis.
CD38 is a potential target for multiple hematologic cancers. CD38 is highly expressed on the surface of multiple myeloma cells and also expressed in diffused large B-Cell lymphoma, chronic lymphocytic leukemia, acute lymphoblastic leukemia, acute myeloid leukemia, follicular lymphoma and mantle cell lymphoma. Although the wide expression of CD38 had initially led to safety concerns about this mechanism, MEDACorp key opinion leaders have commented that daratumumab data have not revealed a safety signal.
Dazu möchte ich noch anmerken, dass beispielsweise das Immunkonjugat BT-062 von Biotest/Immunogen in präklinischen Untersuchungen 100 % aller MM-Zellen gekillt hat (s. Ikeda et al. in Clin Cancer Res 2009, Juniausgabe). Dennoch waren die klinischen Studienergebnisse bislang eher ernüchternd. Die Sache ist mal wieder komplizierter als es zunächst ausschaut.
zu den anti CD19-MAK´s: Bzgl. SAR3419 (ADC von Sanofi/IMGN) bin ich trotz der sehr positiven Äußerungen des IMGN-Vorstands etwas skeptischer. Das Immunkonjugat beinhaltet den spaltbaren Disulfid-Linker SPDB, der neben gewissen Vorteilen (lokaler bystander-Effekt) auch nicht unerhebliche Nachteile im Sicherheitsprofil zeigt (höhere Dissoziationsraten im Plasma, Permeation des intrazellulär freigesetzten Toxins durch die Zellmembran mit anschließendem Wiedereintritt in den Blutkreislauf usw.). Die NW äußern sich, wie auch bei anderen SPDB-DM4-MABs u.a. in ophtalmologischen Problemen (Verschwommensehen). Man muss also abwarten, ob die von den toxikol. NW vorgegebene maximal tolerierte Dosis (nach Angaben Immunogens: 4,3 mg/kg) ausreichen wird, die erwünschte therapeutische Wirkung zu erzielen. Der nackte Antikörper selbst induziert nur eine geringe ADCC- und überhaupt keine CDC-Wirkung.
ADCC = antibody dependend cytotoxicity
CDC = complement dependent cytotoxicity
ADCC = antibody dependend cytotoxicity
CDC = complement dependent cytotoxicity
Antwort auf Beitrag Nr.: 45.179.077 von Joschka Schröder am 04.08.13 21:59:23Habe mir zwischenzeitlich neuere Präsentationen angesehen: Das NW-Problem hat man nun mit einem neuen Dosisregime offensichtlich in den Griff bekommen. In der Kohortenstudie nunmehr 6 von 21 Patienten mit objective response, darunter 3 mit CRu! Reversible Augenprobleme leichtesten Grades bei gerade noch einem Patienten.
Bin gespannt, was die P2-Studie erbracht hat. Mehr dazu gibts vermutlich im Winter bei der ASH-Tagung.
Bin gespannt, was die P2-Studie erbracht hat. Mehr dazu gibts vermutlich im Winter bei der ASH-Tagung.
Wer einmal sehen möchte, wie man ohne jegliche Fachkenntnis eine Medikamentenpipeline bewertet, sollte sich die aktuelle Morphosys-Studie der Deutschen Bank vom 5. August 2013 anschauen (Analysten: Gunnar Romer und Holger Blum). Es ist lustig (und traurig zugleich) zu sehen, wie Banken quasi aus dem hohlen Bauch und ohne ausreichende Branchenkenntnis einzelne Entwicklungspräparate bewerten. Dabei geht es nicht um Pauschalansätze, sondern um Detailbewertungen (künftige Umsätze, Erfolgswahrscheinlichkeiten) etc., die zumindest eine spezielle Kenntnis aktueller Konkurrenzentwicklungen voraussetzen. Und wie viele Antikörperpräparate, die ein und dasselbe Target ansteuern, sich gegenwärtig in Entwicklung befinden, wurde in diesem Thread exemplarisch für das CD19-Antigen gezeigt. Darüber hinaus gibt es zahlreiche weitere Präparate, die CD19 mit Hilfe anders gelagerter Therapieansätze adressieren. Und die anti CD19-Präparate müssen sich wiederum mit anti CD20-Antikörpern, Enzymhemmern u.v.a.m. herumschlagen. Und was für CD19 zutrifft, gilt im Wesentlichen auch für jedes andere Target.
Wer seinen Investmententscheidungen "Studien" wie diejenige der Deutschen Bank zugrunde legt, sollte alternativ einen Spielbankbesuch in Erwägung ziehen.
Wer seinen Investmententscheidungen "Studien" wie diejenige der Deutschen Bank zugrunde legt, sollte alternativ einen Spielbankbesuch in Erwägung ziehen.
Next-gen Alzheimer's drug targets brain enzyme -> http://www.fiercedrugdelivery.com/story/next-gen-alzheimers-…
Macht allerdings auch nur dann richtig Sinn, wenn sich die Amyloid-Theorie als zutreffend erweist.
Macht allerdings auch nur dann richtig Sinn, wenn sich die Amyloid-Theorie als zutreffend erweist.
Hier noch die etwas ausführlichere Mitteilung der EPFL -> http://actu.epfl.ch/news/new-drugs-to-find-the-right-target-…
Hinsichtlich des Wirkmechanismus ist der hier beschriebene Ansatz demjenigen des Gantenerumab deutlich überlegen. Was etwaige Nebenwirkungen betrifft, muss man mal abwarten.
Von Gantenerumab verspreche ich mir auf lange Sicht nicht sehr viel:
a) die Amyloidhypothese ist bislang unbelegt
b) wenn sie denn zutreffen sollte, wäre der Gantenerumab-Ansatz eine Methode, die erst gegen Ende des Geschehens eingreift. Da wären z.B. Verfahren wie das von der EPFL beschriebene deutlich eleganter, weil sie viel näher an der (vermuteten) Ursache ansetzen.
Zur Alzheimer-Problematik und diversen Therapieansätzen incl. Einschätzungen verschiedener Wissenschaftler möchte ich demnächst noch etwas schreiben. Momentan ist mir dies aus zeitlichen Gründen einfach nicht möglich.
Hinsichtlich des Wirkmechanismus ist der hier beschriebene Ansatz demjenigen des Gantenerumab deutlich überlegen. Was etwaige Nebenwirkungen betrifft, muss man mal abwarten.
Von Gantenerumab verspreche ich mir auf lange Sicht nicht sehr viel:
a) die Amyloidhypothese ist bislang unbelegt
b) wenn sie denn zutreffen sollte, wäre der Gantenerumab-Ansatz eine Methode, die erst gegen Ende des Geschehens eingreift. Da wären z.B. Verfahren wie das von der EPFL beschriebene deutlich eleganter, weil sie viel näher an der (vermuteten) Ursache ansetzen.
Zur Alzheimer-Problematik und diversen Therapieansätzen incl. Einschätzungen verschiedener Wissenschaftler möchte ich demnächst noch etwas schreiben. Momentan ist mir dies aus zeitlichen Gründen einfach nicht möglich.
Antwort auf Beitrag Nr.: 45.201.785 von Joschka Schröder am 07.08.13 19:56:13Der Gamma-Sekretase-Inhibitor von LLY ist 2010 mit Pauken und Trompeten durchgefallen (aus dem Wikipedia-Eintrag Semagacestat):
Phase III double-blind clinical trials started in March 2008 with the IDENTITY study (Interrupting Alzheimer's dementia by evaluating treatment of amyloid pathology), including 1500 patients from 22 countries. This study was intended to run until May 2011.[4] The successor trial with further 1500 patients, IDENTITY-2, started in September 2008.[5] The open-label trial IDENTITY-XT, which included patients who have completed one of the two studies, started in December 2009.[6] On 17 August 2010, it was announced that the phase III trials failed. Preliminary findings show that not only did semagacestat fail to slow disease progression, but that it was actually associated with “worsening of clinical measures of cognition and the ability to perform activities of daily living”. Furthermore, the incidence of skin cancer was significantly higher in the treatment group than the placebo group.[7]
Mein Eindruck ist, dass nur noch Beta-Secretase-Hemmer in der Industrie ernsthaft weiterverfolgt werden.
Phase III double-blind clinical trials started in March 2008 with the IDENTITY study (Interrupting Alzheimer's dementia by evaluating treatment of amyloid pathology), including 1500 patients from 22 countries. This study was intended to run until May 2011.[4] The successor trial with further 1500 patients, IDENTITY-2, started in September 2008.[5] The open-label trial IDENTITY-XT, which included patients who have completed one of the two studies, started in December 2009.[6] On 17 August 2010, it was announced that the phase III trials failed. Preliminary findings show that not only did semagacestat fail to slow disease progression, but that it was actually associated with “worsening of clinical measures of cognition and the ability to perform activities of daily living”. Furthermore, the incidence of skin cancer was significantly higher in the treatment group than the placebo group.[7]
Mein Eindruck ist, dass nur noch Beta-Secretase-Hemmer in der Industrie ernsthaft weiterverfolgt werden.
zu ACE-031 aus dem S-1 (auch Acceleron will an die börse):
"Recently, we discontinued the development of ACE-031, another of our clinical stage protein therapeutics that binds to ligands of the TGF-b superfamily. Clinical development of ACE-031 was put on clinical hold in 2011 due to preliminary safety observations in patients. After gathering further information from animal toxicology studies, we and our ACE-031 partner, Shire AG, determined that the risk-benefit profile of ACE-031 was not appropriate for the intended patient population, boys aged four and older with a genetic muscle wasting disease, and we discontinued development of this protein therapeutic candidate"
(der klinische stopp war von FDA veranlasst).
leider habe ich (noch) keine konkreteren angaben zu den safety issues in erfahrung bringen können. wäre evtl. in zusammenhang mit BYM338 interessant.
"Recently, we discontinued the development of ACE-031, another of our clinical stage protein therapeutics that binds to ligands of the TGF-b superfamily. Clinical development of ACE-031 was put on clinical hold in 2011 due to preliminary safety observations in patients. After gathering further information from animal toxicology studies, we and our ACE-031 partner, Shire AG, determined that the risk-benefit profile of ACE-031 was not appropriate for the intended patient population, boys aged four and older with a genetic muscle wasting disease, and we discontinued development of this protein therapeutic candidate"
(der klinische stopp war von FDA veranlasst).
leider habe ich (noch) keine konkreteren angaben zu den safety issues in erfahrung bringen können. wäre evtl. in zusammenhang mit BYM338 interessant.
siehe Beitrag 15:
Offensichtlich ist das Projekt wegen unerwarteter Nebenwirkungen abgebrochen worden: Fest steht, dass die behandelten Jungen mit Duchenne Muskelatrophie unter der Therapie mit ACE-031 auffallend kleine Nasen (leider kein Witz), Zahnfleischbluten und erweiterte Blutgefäße in der Haut entwickelt haben. Darauf hin hat Acceleron zusätzliche präklinische Tests durchgeführt, die schließlich zu einem Projektabbruch geführt haben.
Erwähnenswert auch, dass zuvor schon Wyeth die Entwicklung seines Myostatin-Inhibitors (= neutralisierender Antikörper) MYO-029 eingestellt hatte, diesmal jedoch aus Gründen mangelnder Wirksamkeit (bestimmte Endpunkte nicht erreicht -> http://www.ncbi.nlm.nih.gov/pubmed/18335515). Nebenwirkungen an der Haut sind auch unter MYO-o29 aufgetreten.
All dies muss bzgl. BYM338 nichts bedeuten, dennoch kamen die Nebenwirkungen des Fusionsproteins ACE-031 unerwartet und machen nachdenklich.
Offensichtlich ist das Projekt wegen unerwarteter Nebenwirkungen abgebrochen worden: Fest steht, dass die behandelten Jungen mit Duchenne Muskelatrophie unter der Therapie mit ACE-031 auffallend kleine Nasen (leider kein Witz), Zahnfleischbluten und erweiterte Blutgefäße in der Haut entwickelt haben. Darauf hin hat Acceleron zusätzliche präklinische Tests durchgeführt, die schließlich zu einem Projektabbruch geführt haben.
Erwähnenswert auch, dass zuvor schon Wyeth die Entwicklung seines Myostatin-Inhibitors (= neutralisierender Antikörper) MYO-029 eingestellt hatte, diesmal jedoch aus Gründen mangelnder Wirksamkeit (bestimmte Endpunkte nicht erreicht -> http://www.ncbi.nlm.nih.gov/pubmed/18335515). Nebenwirkungen an der Haut sind auch unter MYO-o29 aufgetreten.
All dies muss bzgl. BYM338 nichts bedeuten, dennoch kamen die Nebenwirkungen des Fusionsproteins ACE-031 unerwartet und machen nachdenklich.
Antwort auf Beitrag Nr.: 45.204.241 von Joschka Schröder am 08.08.13 08:58:53oh danke, das hatte ich überlesen
preisfrge ob dies klassenspezifisch oder nur ACE031-spezifisch ist
preisfrge ob dies klassenspezifisch oder nur ACE031-spezifisch ist
Eine Frage an die Experten:
Was wird eurer Meinung nach der erste Morphosys Wirkstoff sein, der zugelassen wird?
Von der aktuellen Pipeline http://www.morphosys.de/pipeline halte ich Guselkumab für sehr aussichtsreich die "Ziellinie" als erster zu kreuzen.
Das target verspricht in meinen Augen sehr hohe Umsätze in etlichen inflammatorischen Indikationen und ist wahrscheinlich MOR103 in der Anwendungsbreite überlegen (zumindest als Dauertherapie bei chronischen Entzündungen).
Ich bin sehr gespannt auf eure Einschätzungen und die Bewertung der Pipeline. Es ist sicherlich klar, dass keine zuverlässigen Vorhersagen möglich sind, aber eure Meinung interessiert mich trotzdessen!
Bildquelle: http://files.shareholder.com/downloads/JNJ/2609194274x0x6664…
Was wird eurer Meinung nach der erste Morphosys Wirkstoff sein, der zugelassen wird?
Von der aktuellen Pipeline http://www.morphosys.de/pipeline halte ich Guselkumab für sehr aussichtsreich die "Ziellinie" als erster zu kreuzen.
Das target verspricht in meinen Augen sehr hohe Umsätze in etlichen inflammatorischen Indikationen und ist wahrscheinlich MOR103 in der Anwendungsbreite überlegen (zumindest als Dauertherapie bei chronischen Entzündungen).
Ich bin sehr gespannt auf eure Einschätzungen und die Bewertung der Pipeline. Es ist sicherlich klar, dass keine zuverlässigen Vorhersagen möglich sind, aber eure Meinung interessiert mich trotzdessen!

Bildquelle: http://files.shareholder.com/downloads/JNJ/2609194274x0x6664…
edison rechnet mit 40% wahrscheinlichkeit für ganterumab-zulassung 
das ist ja noch euphorischer als die 30% von eck.
dafür rechnen sie mit peak-sales von nur 1,8 mrd. USD.
beides ziemlich daneben wie ich finde - aber unterm strich gleicht es sich wieder aus.

das ist ja noch euphorischer als die 30% von eck.
dafür rechnen sie mit peak-sales von nur 1,8 mrd. USD.
beides ziemlich daneben wie ich finde - aber unterm strich gleicht es sich wieder aus.
Zitat von PathFinder2: edison rechnet mit 40% wahrscheinlichkeit für ganterumab-zulassung
das ist ja noch euphorischer als die 30% von eck.
dafür rechnen sie mit peak-sales von nur 1,8 mrd. USD.
beides ziemlich daneben wie ich finde - aber unterm strich gleicht es sich wieder aus.
Jeder (andere) der sich öffentlich auf etwas festlegt ist halt daneben.
Schliesslich wird Gantenerumab eben zugelassen oder auch nicht.
Wenn du aber die Weisheit hast, nicht so daneben zu sein wie Edison oder ich, dann lass uns halt dran teilhaben? Und für die anderen Projekte auch?
Und dann mach nen Strich drunter, und tu alles kund.....
Danke.

Antwort auf Beitrag Nr.: 45.216.651 von eck64 am 09.08.13 13:32:31Das Postulat würde freilich im Ergebnis bedeuten, sich der Blöße öffentlichen Spekulierens auszusetzen. Das liegt nicht jedem. 

Antwort auf Beitrag Nr.: 45.207.667 von rollingovermilestones am 08.08.13 13:49:54Guselkumab muss sich zunächst im Unternehmenseigenen Wettbewerb gegen Ustekinumab durchsetzen (Ergebnisse der Vergleichsstudie sind für Mitte 2014 angekündigt).
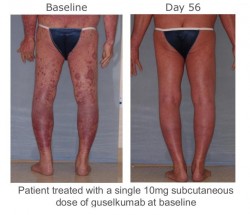
Zu den Bildern aus der J&J-Präsentation ist anzumerken, dass es sich um eine vergleichsweise unseriöse Darstellung handelt:
vor Therapie = Normalaufnahme
nach Therapie = Solarium/Photoshop
Schade, dass der Einfluss diverser Marketing-Abteilungen oft größer ist als derjenige der beteiligten Wissenschaftler.
Zu den Bildern aus der J&J-Präsentation ist anzumerken, dass es sich um eine vergleichsweise unseriöse Darstellung handelt:
vor Therapie = Normalaufnahme
nach Therapie = Solarium/Photoshop
Schade, dass der Einfluss diverser Marketing-Abteilungen oft größer ist als derjenige der beteiligten Wissenschaftler.
Antwort auf Beitrag Nr.: 45.216.945 von Joschka Schröder am 09.08.13 14:06:10Rollingovermilestones hat sicher recht, wenn er Guselkumab auch auf dem Schirm des potentiellen "HuCAL-Erstzulassungschamps".
Und natrürlich muss sich Guselkumab sowohl im firmeninternen als auch externen Wettbewerb durchsetzen.
Hier die Vergleichsstudie mit Ustekinumab, immerhin 274 Patienten, Rekrutierung bereits beendet, Auswertung bis Juni 2014:
http://clinicaltrials.gov/ct2/show/NCT01645280?term=cnto+195…
Aber hier geht es doch "nur" um Rheumatoide Arthritis?
Insofern könnte Guselkumab doch z.B. im internen Vergleich bei RA scheitern und trotzdem mit Psoriasis in die P3 gehen?
Jedenfalls könnte Guselkumab (CNTO1959) 2014 zur P3-Entscheidung anstehen.
Klar eine große Hürde, wenn nicht die größte, denn da muss die Firma richtig überzeugt von der Entwicklung sein. Ab da geht es richtig ins Geld.
Und natrürlich muss sich Guselkumab sowohl im firmeninternen als auch externen Wettbewerb durchsetzen.
Hier die Vergleichsstudie mit Ustekinumab, immerhin 274 Patienten, Rekrutierung bereits beendet, Auswertung bis Juni 2014:
http://clinicaltrials.gov/ct2/show/NCT01645280?term=cnto+195…
Aber hier geht es doch "nur" um Rheumatoide Arthritis?
Insofern könnte Guselkumab doch z.B. im internen Vergleich bei RA scheitern und trotzdem mit Psoriasis in die P3 gehen?
Jedenfalls könnte Guselkumab (CNTO1959) 2014 zur P3-Entscheidung anstehen.
Klar eine große Hürde, wenn nicht die größte, denn da muss die Firma richtig überzeugt von der Entwicklung sein. Ab da geht es richtig ins Geld.
Zitat von eck64: Aber hier geht es doch "nur" um Rheumatoide Arthritis?
Insofern könnte Guselkumab doch z.B. im internen Vergleich bei RA scheitern und trotzdem mit Psoriasis in die P3 gehen?
Das ist natürlich richtig. In der Indikation Psoriasis ist Guselkumab meines Wissens bislang ausschließlich gegen Adalimumab (Humira) getestet worden (Ergebnisse soll es im Frühjahr 2014 geben), was sogar dafür sprechen könnte, dass man in dieser Indikation Guselkumab nicht gegen Ustekimumab (Stelara) ins Rennen schicken möchte, sondern eine mögliche Parallelvermarktung im Auge hat.
Antwort auf Beitrag Nr.: 45.217.311 von Joschka Schröder am 09.08.13 14:40:31Da müßte man in der Tat gelegentlich mal bei J&J nachfragen, wie man sich dort die weitere Psoriasis-Strategie vorstellt. Ist doch noch eine spätere Vergleichsstudie zwischen Guselkumab und Ustekimumab geplant, wenn die laufenden Guselkumab-Studien zu positiven Ergebnissen führen sollten? Und für den Fall, dass keine Vergleichsstudie geplant ist und man Guselkumab in der Indikation Psoriasis parallel zu Ustekimumab auf dem Markt bringen möchte: Mit welcher pathophysiologischen Begründung soll in welchen Fällen der anti IL-23p19-MAB eingesetzt werden, wann der anti IL-12/IL-23-MAB?
Antwort auf Beitrag Nr.: 45.216.651 von eck64 am 09.08.13 13:32:31eck, hier nochmal mein posting zum nachdenken bezüglich alzheimerforschung:
= = = =
Antwort auf Beitrag Nr.: 45.140.317 von eck64 am 30.07.13 11:38:13eck, zu deinem kommentar „Ob 30% für eine P3 wirklich sehr optimistisch sind? Immerhin nur (knapp) die Hälfte der üblichen 60 bis 70%.“
vielleicht etwas zum nachdenken:
Seite 14
http://phrma.org/sites/default/files/pdf/alzheimersetbacksre…
(…)
In recent years we have seen a steady stream of drug candidates in development accompanied by a long series of unsuccessful outcomes. As research has intensified we have seen a higher average of potential medicines pulled out of development each year. The number of investigational drugs studied for the treatment of Alzheimer’s disease that fail to reach patients each year offers a simple metric of both the difficulty of the endeavor and the commitment of biopharmaceutical researchers to find better treatments for the disease. An examination of data from the Adis R&D Insight database shows that since 1998, 101 medicines in development have been become inactive and have not received regulatory approval. (See figure above.) Of those, 83 have been definitively discontinued. The “inactive” category includes investigational studies which are labeled by the database curators as “discontinued” (definitively halted), “suspended” (halted for the foreseeable future), or have “no development reported” (no evidence of continued research in the past 18-24 months). (Adis database editors report that the chance of reactivation of “inactive” projects is very small. See detailed note on methodology and definitions at the end of this report.)
Since 1998 three new medicines for Alzheimer’s were approved, resulting in a 34 to 1 ratio of “failures” to approvals (two other medicines were approved before this timeframe). It should not be concluded that these numbers imply that for every 34 setbacks one new approval will result, but it provides an indication of recent research outcomes. Since 2003, when the most recent Alzheimer’s medicine was approved, there have been 66 unsuccessful projects.
(…)
um ein paar namentlich zu nennen:
bapineuzumab
solanezumab (***wobei hier eine neue studie mit N = 2100 in MILD alzheimers disease aufgelegt wird – siehe http://clinicaltrials.gov/ct2/show/NCT01900665?term=solanezu…)
gammagard (IVIG)
AN-1792
dimebon
tramiprosate
rosiglitazone
semagacestat
tarenflurbil
die üblichen wahrscheinlichkeiten gelten weit nicht für den bereich alzheimer. das hat u.a. auch damit zum tun, dass quasi zum scheitern verurteilte projekte (vom gesichtspunkt der wirksamkeit) von vielen firmen, speziell auch den großen, dennoch um teures geld in PIII geführt werden, WEIL EIN GEWALTIGER JACKPOT WARTET falls es zufällig doch was wird.
was speziell den a-beta-ansatz betrifft: wurde schon von jemandem nachgewiesen, dass eine abeta-reduktion tatsächlich etwas bringt? mir ist da jetzt nichts konkretes bekannt. falls auch roche in der phase II nur nachgewiesen hat, dass man a-beta wie gewünscht reduziert, aber nicht mehr, dann führt man ein projekt in PIII, das noch keinen PoC geliefert hat. alleine das unterscheidet schon von anderen bereichen, wo man natürlich im regelfall in einer PII den PoC erbracht hat.
ob roche schon mehr als einen PoM (sprich nachweis, dass gantenerumab abeta entfernt) erreicht hat, weiß ich nicht, wüsste ich aber gerne ;-)
jedenfalls fühle ich mich mit 30% wahrscheinlichkeit nicht sonderlich wohl wenn man sich entwicklungen in dem bereich ansieht.
aber, wie hier schon öfters geschrieben, ein lotterieticket, dass es in sich hätte...
====
= = = =
Antwort auf Beitrag Nr.: 45.140.317 von eck64 am 30.07.13 11:38:13eck, zu deinem kommentar „Ob 30% für eine P3 wirklich sehr optimistisch sind? Immerhin nur (knapp) die Hälfte der üblichen 60 bis 70%.“
vielleicht etwas zum nachdenken:
Seite 14
http://phrma.org/sites/default/files/pdf/alzheimersetbacksre…
(…)
In recent years we have seen a steady stream of drug candidates in development accompanied by a long series of unsuccessful outcomes. As research has intensified we have seen a higher average of potential medicines pulled out of development each year. The number of investigational drugs studied for the treatment of Alzheimer’s disease that fail to reach patients each year offers a simple metric of both the difficulty of the endeavor and the commitment of biopharmaceutical researchers to find better treatments for the disease. An examination of data from the Adis R&D Insight database shows that since 1998, 101 medicines in development have been become inactive and have not received regulatory approval. (See figure above.) Of those, 83 have been definitively discontinued. The “inactive” category includes investigational studies which are labeled by the database curators as “discontinued” (definitively halted), “suspended” (halted for the foreseeable future), or have “no development reported” (no evidence of continued research in the past 18-24 months). (Adis database editors report that the chance of reactivation of “inactive” projects is very small. See detailed note on methodology and definitions at the end of this report.)
Since 1998 three new medicines for Alzheimer’s were approved, resulting in a 34 to 1 ratio of “failures” to approvals (two other medicines were approved before this timeframe). It should not be concluded that these numbers imply that for every 34 setbacks one new approval will result, but it provides an indication of recent research outcomes. Since 2003, when the most recent Alzheimer’s medicine was approved, there have been 66 unsuccessful projects.
(…)
um ein paar namentlich zu nennen:
bapineuzumab
solanezumab (***wobei hier eine neue studie mit N = 2100 in MILD alzheimers disease aufgelegt wird – siehe http://clinicaltrials.gov/ct2/show/NCT01900665?term=solanezu…)
gammagard (IVIG)
AN-1792
dimebon
tramiprosate
rosiglitazone
semagacestat
tarenflurbil
die üblichen wahrscheinlichkeiten gelten weit nicht für den bereich alzheimer. das hat u.a. auch damit zum tun, dass quasi zum scheitern verurteilte projekte (vom gesichtspunkt der wirksamkeit) von vielen firmen, speziell auch den großen, dennoch um teures geld in PIII geführt werden, WEIL EIN GEWALTIGER JACKPOT WARTET falls es zufällig doch was wird.
was speziell den a-beta-ansatz betrifft: wurde schon von jemandem nachgewiesen, dass eine abeta-reduktion tatsächlich etwas bringt? mir ist da jetzt nichts konkretes bekannt. falls auch roche in der phase II nur nachgewiesen hat, dass man a-beta wie gewünscht reduziert, aber nicht mehr, dann führt man ein projekt in PIII, das noch keinen PoC geliefert hat. alleine das unterscheidet schon von anderen bereichen, wo man natürlich im regelfall in einer PII den PoC erbracht hat.
ob roche schon mehr als einen PoM (sprich nachweis, dass gantenerumab abeta entfernt) erreicht hat, weiß ich nicht, wüsste ich aber gerne ;-)
jedenfalls fühle ich mich mit 30% wahrscheinlichkeit nicht sonderlich wohl wenn man sich entwicklungen in dem bereich ansieht.
aber, wie hier schon öfters geschrieben, ein lotterieticket, dass es in sich hätte...
====
Antwort auf Beitrag Nr.: 45.217.729 von PathFinder2 am 09.08.13 15:22:04was studiengröße betrifft, meint übrigens Edison das:
In June 2012 Roche expanded the trial with gantenerumab into a pivotal Phase III trial by increasing the number of patients in the trial from 360 to 770. This could be sufficient to support the filing of the product, although a further trial with c 1,000 patients is likely to be required.
(quelle Edison Investment Research)
In June 2012 Roche expanded the trial with gantenerumab into a pivotal Phase III trial by increasing the number of patients in the trial from 360 to 770. This could be sufficient to support the filing of the product, although a further trial with c 1,000 patients is likely to be required.
(quelle Edison Investment Research)
aber im endeffekt egal! wir sind alle der gleichen meinung, dass gantenerumab wahrscheinlich nicht zugelassen wird.
joschka geht von 5% aus, edison von 40%, du von 30%, ich leg mich zwischen dich und joschka ;-)
ich wünsche mir natürlich auch eine zulassung, für meine brieftasche und noch mehr für die alzheimerpatienten. aber, börse ist kein wunschkonzert, leider.
jedenfalls, wenn gante zugelassen wird hast du mehr recht als ich!
joschka geht von 5% aus, edison von 40%, du von 30%, ich leg mich zwischen dich und joschka ;-)
ich wünsche mir natürlich auch eine zulassung, für meine brieftasche und noch mehr für die alzheimerpatienten. aber, börse ist kein wunschkonzert, leider.
jedenfalls, wenn gante zugelassen wird hast du mehr recht als ich!

Zitat von PathFinder2: ob roche schon mehr als einen PoM (sprich nachweis, dass gantenerumab abeta entfernt) erreicht hat, weiß ich nicht, wüsste ich aber gerne
Die Antwort lautet definitiv: NEIN. Einen Wirksamkeitsnachweis gibt es nicht und die mit der Thematik befaßten Roche-Wissenschaftler weisen explizit darauf hin, dass man aus positiven kognitiven Effekten, die mit verschiedenen Präparaten bei transgenen Mäusen erzielt worden sind, nicht ableiten kann, dass auch bei Alzheimer-Patienten ähnliche Ergebnisse erzielt werden können. In Basel ist man da sehr ehrlich und realistisch.
Zitat von PathFinder2: aber im endeffekt egal! wir sind alle der gleichen meinung, dass gantenerumab wahrscheinlich nicht zugelassen wird.
joschka geht von 5% aus, edison von 40%, du von 30%, ich leg mich zwischen dich und joschka ;-)
ich wünsche mir natürlich auch eine zulassung, für meine brieftasche und noch mehr für die alzheimerpatienten. aber, börse ist kein wunschkonzert, leider.
jedenfalls, wenn gante zugelassen wird hast du mehr recht als ich!
Wenn du mich weiter so ärgerst, dann ändere ich das beim nächsten mal auf 10% oder 12% und 10 Milliarden peak. ;-)

Antwort auf Beitrag Nr.: 45.219.017 von eck64 am 09.08.13 17:10:36Mit diesen Zahlen wäre ich dann zum erstemal einverstanden. Wobei es sich hier um rein "gefühlte Wahrscheinlichkeit" handelt, da eine Eintreffwahrscheinlichkeit im Sinne echter Statistik bei n=1 Ereignissen keinerlei Sinn macht (das Ereignis tritt irgendwann einfach ein, oder es trifft eben nicht ein).
Weitere Konkurrenz für MOR208: Nach Sanofi/IMGN hat nun auch Seattle Genetics ein Immunkonjugat entwickelt, das CD19 adressiert. Das entsprechende Patent ist Ende des vergangenen Jahres veröffentlicht worden.
Die Entwicklung von Immunokonjugaten macht in diesem Fall Sinn, weil der anti CD19-CD19-Komplex ausgezeichnet internalisiert wird ... eine zwingende Voraussetzung für den Erfolg eines ADC.
Die aktuellen Entwicklungen in der Biotechnologie-Branche sind wirklich spannend. Immer mehr Unternehmen konkurrieren um identische Targets, gleichzeitig werden immer wieder neue Targets in den Entwicklungsprogrammen berücksichtigt.
Das ganze läuft auf eine zunehmend personalisierte Medizin hinaus ... Spitzenumsätze, die in der Vergangenheit mit Antikörpern erzielt worden sind, werden bald der Vergangenheit angehören. Dies nur als Hinweis für Investoren/Analysten, die künftige Spitzenumsätze abschätzen (bzw. überschätzen).
Die Entwicklung von Immunokonjugaten macht in diesem Fall Sinn, weil der anti CD19-CD19-Komplex ausgezeichnet internalisiert wird ... eine zwingende Voraussetzung für den Erfolg eines ADC.
Die aktuellen Entwicklungen in der Biotechnologie-Branche sind wirklich spannend. Immer mehr Unternehmen konkurrieren um identische Targets, gleichzeitig werden immer wieder neue Targets in den Entwicklungsprogrammen berücksichtigt.
Das ganze läuft auf eine zunehmend personalisierte Medizin hinaus ... Spitzenumsätze, die in der Vergangenheit mit Antikörpern erzielt worden sind, werden bald der Vergangenheit angehören. Dies nur als Hinweis für Investoren/Analysten, die künftige Spitzenumsätze abschätzen (bzw. überschätzen).
Zitat von Joschka Schröder: ...
Die aktuellen Entwicklungen in der Biotechnologie-Branche sind wirklich spannend. Immer mehr Unternehmen konkurrieren um identische Targets, gleichzeitig werden immer wieder neue Targets in den Entwicklungsprogrammen berücksichtigt.
Das ganze läuft auf eine zunehmend personalisierte Medizin hinaus ... Spitzenumsätze, die in der Vergangenheit mit Antikörpern erzielt worden sind, werden bald der Vergangenheit angehören. Dies nur als Hinweis für Investoren/Analysten, die künftige Spitzenumsätze abschätzen (bzw. überschätzen).
Es ist sicherlich ein Faktor dem Beachtung zu schenken ist.
Allerdings für "first in class" und "best in class", egal ob mAb, small molecule oder medical device etc. werden immer noch ordentliche Umsätze generiert werden.
Bei einigen targets in der MOR-Pipeline darf man in der Tat davon träumen, dass gute, neue, innovative Medikamente an den Markt kommen werden!! Das ist sicher, wie ein Amen in der Kirche!
Ich billige den targets, die den IL-17 pathway adressieren, vielversprechende Umsätze zu. Ein riesiger Markt, der viele Entzündungs- und Autoimmunerkrankungen lindern wird, -trotz und sicherlich gleichfalls nicht unerheblich- auf Kosten der bereits zugelassenen Medikamente in diesem Bereich. Die Forschung war dort in den letzten 15 Jahren sehr innovativ.
Bei den ganzen Krebsinnovationen bin ich z.B. um einiges weniger optimistisch und glaube, dass sich insbesondere dort Behandlungen etablieren werden, die als "personalisierte Medizin" gelten.
Natürlich wird es bei den Umsätzen zu Anpassungen kommen. Ich weiß nicht, wie Joschka das zahlenmäßig konkret meint, aber ich bin mir sehr sicher, dass dennoch auch in Zukunft sehr viele Präparate über eine Mrd. Umsatz erzielen, um mal eine Größenordnung zu nennen. Insgesamt wird es im Pharma-Bereich v.a. zu einer Verschiebung der Umsätze hin zu "biologicals" und "targeted medicine" kommen. Die Zeiten, wo man mit einem Cholesterinsenker 13 Mrd. Umsatz macht, sind vorbei. Gerade bei den "normalen" Medikamenten wie Antihypertensiva, Cholesterinsenker, PPI, Thrombozytenaggregationshemmer etc. Ist nicht mehr viel zu holen. Überall laufen die Patente aus, ich sehe auch kaum Innovationen, was man hat hat, ist eben auch hocheffektiv, zB in der kardiovaskulären Medizin.
Die Zukunft wird den o.g. Trends gehören, wenn man es kommerziell betrachtet, erst recht. Für das Gesamtsystem kann das auch zu deutlichen Kostensteigerungen führen. Wenn es eche Verbesserungen und Innovationen sind, wird man das in Kauf nehmen. Das formuliere ich mal ganz ohne Wertung.
Um es nochmal konkret zu sagen und Beispiele zu nennen: Wenn ein AK auf den Markt kommt, der besser ist als anti-TNF im RA Bereich, wird der zig Milliarden Umsatz erzielen, auch wenn viel Konkurrenz in der Pipeline ist. Wir haben ja alleine vier AK gegen obiges Target, zum Teil Multimilliardenblockbuster, zum Teil noch recht neu und auf dem Wege dorthin. Anderes Beispiel: Man möge sich anschauen, wie viele Medikamente im MS Bereich Blockbuster Status haben. In der Tumortherapie steht doch vieles noch am Anfang und wir warten auf große Durchbrüche. Avastin bringt selten mehr als ein paar Monate Lebensverlängerung, dafür werden Milliardenbeträge ausgegeben. Die Liste ließe sich endlos fortsetzen.
Fazit: Ich teile die Einschätzung, dass Spitzenumsätze (ich definiere mal als größer 1 Mrd) in Zukunft nur noch selten vorkommen werden, ganz und gar nicht.
Die Zukunft wird den o.g. Trends gehören, wenn man es kommerziell betrachtet, erst recht. Für das Gesamtsystem kann das auch zu deutlichen Kostensteigerungen führen. Wenn es eche Verbesserungen und Innovationen sind, wird man das in Kauf nehmen. Das formuliere ich mal ganz ohne Wertung.
Um es nochmal konkret zu sagen und Beispiele zu nennen: Wenn ein AK auf den Markt kommt, der besser ist als anti-TNF im RA Bereich, wird der zig Milliarden Umsatz erzielen, auch wenn viel Konkurrenz in der Pipeline ist. Wir haben ja alleine vier AK gegen obiges Target, zum Teil Multimilliardenblockbuster, zum Teil noch recht neu und auf dem Wege dorthin. Anderes Beispiel: Man möge sich anschauen, wie viele Medikamente im MS Bereich Blockbuster Status haben. In der Tumortherapie steht doch vieles noch am Anfang und wir warten auf große Durchbrüche. Avastin bringt selten mehr als ein paar Monate Lebensverlängerung, dafür werden Milliardenbeträge ausgegeben. Die Liste ließe sich endlos fortsetzen.
Fazit: Ich teile die Einschätzung, dass Spitzenumsätze (ich definiere mal als größer 1 Mrd) in Zukunft nur noch selten vorkommen werden, ganz und gar nicht.
Wieviel Hucal-mAbs sind eigentlich bislang in klinischen Studien gescheitert?
Ich erinnere den GPC-mAb, CNTO888; was noch? Sicherlich einige 'undisclosed projects'...
Hat jemand von euch ein paar Zahlen dazu oder erinnert sich besser als ich?
War eigentlich MOR201 und MOR101 sowie MOR102 jemals in einer klinischen Studie?
Es wäre sicherlich ganz nett, eine entsprechende Statistik zu führen.
Ich vermute, dass die Erfolgsraten bislang besser sind, als der historische Vergleich mit der Konkurenz.
Ich finde solche Betrachtungen nicht unwichtig, einfach um mal ein Gefühl für die aktuelle Pipeline zu bekommen!
Ich erinnere den GPC-mAb, CNTO888; was noch? Sicherlich einige 'undisclosed projects'...
Hat jemand von euch ein paar Zahlen dazu oder erinnert sich besser als ich?
War eigentlich MOR201 und MOR101 sowie MOR102 jemals in einer klinischen Studie?
Es wäre sicherlich ganz nett, eine entsprechende Statistik zu führen.
Ich vermute, dass die Erfolgsraten bislang besser sind, als der historische Vergleich mit der Konkurenz.
Ich finde solche Betrachtungen nicht unwichtig, einfach um mal ein Gefühl für die aktuelle Pipeline zu bekommen!
zu BYM338:
Ich habe mir noch einmal in Ruhe die Gründe angesehen, weshalb die Konkurrenzpräparate ACE031 (synthet. AcRIIb) und MYO-029 (wie BYM338 ein humaner neutralisierender Antikörper) überraschend gescheitert sind.
Im Fall des ACE031 war neben den bereits in einem früheren Beitrag erwähnten Gründen die Hauptursache für den Entwicklungsstop eine inakzeptable Suppression des Follikel-stimulierenden-Hormons (FSH). Wenn man sich die dem Activin rezeptor Typ IIb nachgeschalteten Regelkreise anschaut, scheint hier (-> FSH) auch eine wesentliche Hauptgefahr für unerwünschte Nebenwirkungen zu liegen. ActRIIb ist aber auch in andere physiologische Prozesse involviert wie z.B. die Angiogenese. Aus diesem Grund hat Roche/Genentech einen synthetischen ActRIIb entwickelt, der u.a. zur Tumorbehandlung (-> Anti-Angiogenese) eingesetzt werden soll.
Lange Rede, kurzer Sinn: Ist alles nicht ganz unkompliziert, an der Wirksamkeit des BYM338 habe ich keinen Zweifel, etwaige Nebenwirkungen bei längerer Anwendung könnten einem aber ggf. noch einen Strich durch die Rechnung machen.
Ich habe mir noch einmal in Ruhe die Gründe angesehen, weshalb die Konkurrenzpräparate ACE031 (synthet. AcRIIb) und MYO-029 (wie BYM338 ein humaner neutralisierender Antikörper) überraschend gescheitert sind.
Im Fall des ACE031 war neben den bereits in einem früheren Beitrag erwähnten Gründen die Hauptursache für den Entwicklungsstop eine inakzeptable Suppression des Follikel-stimulierenden-Hormons (FSH). Wenn man sich die dem Activin rezeptor Typ IIb nachgeschalteten Regelkreise anschaut, scheint hier (-> FSH) auch eine wesentliche Hauptgefahr für unerwünschte Nebenwirkungen zu liegen. ActRIIb ist aber auch in andere physiologische Prozesse involviert wie z.B. die Angiogenese. Aus diesem Grund hat Roche/Genentech einen synthetischen ActRIIb entwickelt, der u.a. zur Tumorbehandlung (-> Anti-Angiogenese) eingesetzt werden soll.
Lange Rede, kurzer Sinn: Ist alles nicht ganz unkompliziert, an der Wirksamkeit des BYM338 habe ich keinen Zweifel, etwaige Nebenwirkungen bei längerer Anwendung könnten einem aber ggf. noch einen Strich durch die Rechnung machen.
Zitat von rollingovermilestones: Wieviel Hucal-mAbs sind eigentlich bislang in klinischen Studien gescheitert?
Ich erinnere den GPC-mAb, CNTO888; was noch? Sicherlich einige 'undisclosed projects'...
Hat jemand von euch ein paar Zahlen dazu oder erinnert sich besser als ich?
War eigentlich MOR201 und MOR101 sowie MOR102 jemals in einer klinischen Studie?
Es wäre sicherlich ganz nett, eine entsprechende Statistik zu führen.
Ich vermute, dass die Erfolgsraten bislang besser sind, als der historische Vergleich mit der Konkurenz.
Ich finde solche Betrachtungen nicht unwichtig, einfach um mal ein Gefühl für die aktuelle Pipeline zu bekommen!
Bisher ist noch jedes undicloused Projekt der klinischen Pipeline discloused worden. Jedenfalls ist noch keines unbekannterweise abgebrochen worden.
Gescheitert in der Klinik sind
1D09C3 von GPC
CNTO888 von Centocor
BAY79-4620 von Bayer. Als Immunkonjugat gescheitert, aber der Antikörper an sich sei zurück in der Präklinik. Chance sicher gering.
Auf der Kippe scheint BHQ880 stehen.
Alles andere wurde vor Klinikstart aussortiert, bisher.
MOR201 und MOR101 sowie MOR102 waren nie in der Klinik. 2006, als Morphosys wieder in die eigene Entwicklung eingestiegen ist, wurde entschieden diese 3 Programme abzuservieren und MOR103 und MOR202 weiter zu entwickeln um sie in die Klinik zu bringen.
Schon im Vorgriff auf die erwarteten MOR208-Ergebnisse einige Vergleichsdaten des Konkurrenzpräparats Blinatumomab (bispez. Antikörper/Amgen):
Von insgesamt 36 Patienten mit relapsed/refractory B-precursor ALL erzielten 26 Patienten (72 %) eine CR/CRh, darunter 16 CR und 10 CRh (CR = complete Remission, CRh = CR with partial hematological recovery).
Per Saldo sind dies überragende Wirksamkeitsdaten, an denen sich MOR208 wird messen lassen müssen.
Weniger schön die Nebenwirkungen des Blinatumomab in Form von (reversiblen) ZNS-Affektionen und dem wiederholten Auftreten eines cytokin release syndroms (CRS), das jedoch unter Dexamethasongabe ebenfalls immer reversibel war.
Noch kurz zur Erinnerung die MOR208-Daten aus Phase 1: Von den 16 Patienten mit CLL und SLL hatten in der höchsten Dosisgruppe 4 Patienten eine PR (= partial remission) und 14 eine SD (= stable disease).
Von insgesamt 36 Patienten mit relapsed/refractory B-precursor ALL erzielten 26 Patienten (72 %) eine CR/CRh, darunter 16 CR und 10 CRh (CR = complete Remission, CRh = CR with partial hematological recovery).
Per Saldo sind dies überragende Wirksamkeitsdaten, an denen sich MOR208 wird messen lassen müssen.
Weniger schön die Nebenwirkungen des Blinatumomab in Form von (reversiblen) ZNS-Affektionen und dem wiederholten Auftreten eines cytokin release syndroms (CRS), das jedoch unter Dexamethasongabe ebenfalls immer reversibel war.
Noch kurz zur Erinnerung die MOR208-Daten aus Phase 1: Von den 16 Patienten mit CLL und SLL hatten in der höchsten Dosisgruppe 4 Patienten eine PR (= partial remission) und 14 eine SD (= stable disease).
Zitat von Joschka Schröder: Schon im Vorgriff auf die erwarteten MOR208-Ergebnisse einige Vergleichsdaten des Konkurrenzpräparats Blinatumomab (bispez. Antikörper/Amgen):
Von insgesamt 36 Patienten mit relapsed/refractory B-precursor ALL erzielten 26 Patienten (72 %) eine CR/CRh, darunter 16 CR und 10 CRh (CR = complete Remission, CRh = CR with partial hematological recovery).
Per Saldo sind dies überragende Wirksamkeitsdaten, an denen sich MOR208 wird messen lassen müssen.
Weniger schön die Nebenwirkungen des Blinatumomab in Form von (reversiblen) ZNS-Affektionen und dem wiederholten Auftreten eines cytokin release syndroms (CRS), das jedoch unter Dexamethasongabe ebenfalls immer reversibel war.
Noch kurz zur Erinnerung die MOR208-Daten aus Phase 1: Von den 16 Patienten mit CLL und SLL hatten in der höchsten Dosisgruppe 4 Patienten eine PR (= partial remission) und 14 eine SD (= stable disease).
Der Vorgriff ist aber sehr extrem. Die MOR208-Studie ist gerade erst frisch gestartet.
http://clinicaltrials.gov/ct2/show/NCT01685021?spons=morphos…
Study of Fc-Optimized Anti-CD19 Antibody (MOR00208) to Treat B-cell Acute Lymphoblastic Leukemia(B-ALL)
Estimated Enrollment: 30
Study Start Date: April 2013
Estimated Study Completion Date: October 2014
Estimated Primary Completion Date: July 2014 (Final data collection date for primary outcome measure)
Was ist eine SLL?
Daten von CLL und ALL in einen Topf zu werfen, ist gewagt, da vergleicht man Äpfel mit Birnen. Wenn es um die Verträglichkeit eines Medikamentes geht, kann man das vielleicht noch machen, bei den Anprechraten erscheint es wenig sinnvoll.
Daten von CLL und ALL in einen Topf zu werfen, ist gewagt, da vergleicht man Äpfel mit Birnen. Wenn es um die Verträglichkeit eines Medikamentes geht, kann man das vielleicht noch machen, bei den Anprechraten erscheint es wenig sinnvoll.
Zitat von deadflowers: Was ist eine SLL?
small lymphocytic lymphoma
Zitat von deadflowers: Daten von CLL und ALL in einen Topf zu werfen, ist gewagt, da vergleicht man Äpfel mit Birnen.
Falls Du mich meintest: Ich habe da nichts in einen Topf geworfen. Die Blinatumomab-ALL-Daten werden mit den MOR208-ALL-Daten verglichen werden.
Die CLL- und SLL-P1-Daten für MOR208 habe ich ausschließlich der Vollständigkeit halber - durch einen Absatz getrennt und als solche ausgewiesen - gepostet.
Zitat von eck64: Der Vorgriff ist aber sehr extrem. Die MOR208-Studie ist gerade erst frisch gestartet.
http://clinicaltrials.gov/ct2/show/NCT01685021?spons=morphos…
Study of Fc-Optimized Anti-CD19 Antibody (MOR00208) to Treat B-cell Acute Lymphoblastic Leukemia(B-ALL)
Estimated Enrollment: 30
Study Start Date: April 2013
Estimated Study Completion Date: October 2014
Estimated Primary Completion Date: July 2014 (Final data collection date for primary outcome measure)
Ich gehe davon aus, dass es bereits im Dezember bei der ASH-Tagung erste Zwischenergebnisse geben wird (open label study). Natürlich ist es bis dahin noch etwas hin ... ich wollte mit meinem Posting aber nicht bis Dezember warten, weil ich mich gerade etwas intensiver mit CD19 beschäftigt habe ... in den nächsten Wochen stehen dann wieder andere Themen im Vordergrund.
Antwort auf Beitrag Nr.: 45.259.373 von Joschka Schröder am 15.08.13 17:38:21Ok, die Daten von der CLL-Studie-Extension stehen auch noch aus.
Aber auf der ASH gleich noch eine Zwischenauswertung bzw. erste Trends? Das wäre ja toll.
Immerhin investiert Morphosys ja wirklich ordentlich in MOR208. Das könnte man dann deutlich besser nachvollziehen.
Aber auf der ASH gleich noch eine Zwischenauswertung bzw. erste Trends? Das wäre ja toll.
Immerhin investiert Morphosys ja wirklich ordentlich in MOR208. Das könnte man dann deutlich besser nachvollziehen.
Antwort auf Beitrag Nr.: 45.259.599 von eck64 am 15.08.13 18:02:38Die ALL-Daten für SAR3419 müßten auch bald kommen.
Wäre großartig, wenn wir zum Jahresende bereits vollständige P2-ALL-Daten für Blinatumomab (bereits existent) und SAR3419 (erwartet) sowie erste P2-ALL-Daten für MOR208 vorliegen hätten.
Von den anderen Hauptkonkurrenten (Medi-551, SGN-CD19A, Di-B4, MDX1342) müßte es bei der ASH-Tagung (für andere Indikationen) ebenfalls News aus verschiedenen klinischen Studien geben.
Es sollte dann zunehmend möglich sein, erste Überlegungen anzustellen, welches Präparat am aussichtsreichsten sein könnte.
Wäre großartig, wenn wir zum Jahresende bereits vollständige P2-ALL-Daten für Blinatumomab (bereits existent) und SAR3419 (erwartet) sowie erste P2-ALL-Daten für MOR208 vorliegen hätten.
Von den anderen Hauptkonkurrenten (Medi-551, SGN-CD19A, Di-B4, MDX1342) müßte es bei der ASH-Tagung (für andere Indikationen) ebenfalls News aus verschiedenen klinischen Studien geben.
Es sollte dann zunehmend möglich sein, erste Überlegungen anzustellen, welches Präparat am aussichtsreichsten sein könnte.
Zitat von Joschka Schröder:Zitat von deadflowers: Was ist eine SLL?
small lymphocytic lymphoma
OK, danke. Das small lymphotic lymphoma ist ja eine Unterform der CLL. Die Abkürzung war mir neu, sie ist bei uns nicht gebräuchlich.
Zitat von Joschka Schröder:Zitat von deadflowers: Was ist eine SLL?
Daten von CLL und ALL in einen Topf zu werfen, ist gewagt, da vergleicht man Äpfel mit Birnen.
Falls Du mich meintest: Ich habe da nichts in einen Topf geworfen. Die Blinatumomab-ALL-Daten werden mit den MOR208-ALL-Daten verglichen werden.
Die CLL- und SLL-P1-Daten für MOR208 habe ich ausschließlich der Vollständigkeit halber - durch einen Absatz getrennt und als solche ausgewiesen - gepostet.
Ich hab dich schon gemeint. Wenn du das nur der Vollständigkeit halber gepostet hast und das nicht vergleichend gemeint war, ist ja gut. Das war dann wohl ein Wahrnehmungsfehler meinerseits.

Zitat von Joschka Schröder: Weniger schön die Nebenwirkungen des Blinatumomab in Form von (reversiblen) ZNS-Affektionen und dem wiederholten Auftreten eines cytokin release syndroms (CRS), das jedoch unter Dexamethasongabe ebenfalls immer reversibel war.
Ich hatte zwischenzeitlich noch einmal Kontakt mit Agmen. Das Problem des zu Therapiebeginn beobachteten CRS (First-Dosis-Effekt) ist mittlerweile durch Dosisanpassung (Start mit niedrigere Dosis, nach einer Woche Erhöhung auf Zieldosis) gelöst. Eine alternative Präventionsmethode wäre, wie bereits erwähnt, eine Dexamethasongabe vor Therapiebeginn.
Von der etwas umständlichen Applikation abgesehen (Dauerinfusion), ist Blinatumomab somit auf Basis des derzeitigen Kenntnisstandes ein herausragendes Therapeutikum.
Zitat von Joschka Schröder: Von der etwas umständlichen Applikation abgesehen (Dauerinfusion), ist Blinatumomab somit auf Basis des derzeitigen Kenntnisstandes ein herausragendes Therapeutikum.
In der Tat ist ein großer Vorteil von MOR208, die viel kürzere Applikationszeit (1 h vs. 1 Monat).
Die Wirksamkeitserfolge von Blinatumomab sind ein großer Erfolg und wurden in den hämatologischen journals entsprechend gewürdigt. Nicht ohne Grund hat sich Amgen letztes Jahr Micromet einverleibt.
Der Vergleich der Wirksamkeit zu MOR208 ist im Augenblick schwierig. Die Datenlage ist noch dürftig. 12/16 partial response und 4/16 stable disease für MOR208 sind nicht so schlecht, weil ALLE Patienten schon Rituximab (CD20) vorbehandelt waren. Genau kann das nur eine Vergleichsstudie rausarbeiten.
Könnten deiner Meinung nach die Nebenwirkungen im ZNS mit dem Bite-Format zusammenhängen? Vielleicht ist die Passage der Blut-Hirn-Schranke einfacher?
Ich hoffe jedenfalls, dass die Einlizensierung von MOR208 eine gute Wahl war. Jedoch werden weitere Daten erst genauere Einschätzungen möglich machen. Man bräuchte dann auch einen Partner, der richtig Gas geben kann, um den Vorsprung zu Konkurenzprodukten zu verkürzen!
Es wird sich weisen, welch gut oder schlechtes Händchen sie bei MOR208 hatten....
@JoschkaSchröder,
hier geht es ja unter anderem auch um die Projekte die anstehen könnten für P3 bzw. als erste MOR-Technologie-basierte AKs zur Zulassung zu kommen.
Womöglich ist LFG316 in verschiedenen Augenerkrankungen nicht der Umsatzträchtigste AK in der Pipeline, aber womöglich kann es hier dank relativ kurzer Behandlungsdauer und relativ eindeutigen Erfolgs/Misserfolgskriterien auch sehr schnell gehen:
http://clinicaltrials.gov/ct2/results?term=LFG316&recr=&rslt…
Was hälst du von dem?
hier geht es ja unter anderem auch um die Projekte die anstehen könnten für P3 bzw. als erste MOR-Technologie-basierte AKs zur Zulassung zu kommen.
Womöglich ist LFG316 in verschiedenen Augenerkrankungen nicht der Umsatzträchtigste AK in der Pipeline, aber womöglich kann es hier dank relativ kurzer Behandlungsdauer und relativ eindeutigen Erfolgs/Misserfolgskriterien auch sehr schnell gehen:
http://clinicaltrials.gov/ct2/results?term=LFG316&recr=&rslt…
Was hälst du von dem?
ich denke wir hatten es schon, stell es aber zur sicherheit noch hier rein - betrifft BAY 94-9343 PI ergebnisse
http://www.abstractsonline.com/Plan/ViewAbstract.aspx?sKey=d…
http://www.abstractsonline.com/Plan/ViewAbstract.aspx?sKey=d…
Hallo JoschkaSchröder,
http://www.finanzen.net/nachricht/aktien/PRESS-RELEASE-Novar…
Wie es aussieht wäre nun wohl doch ein update der Einschätzung hinsichtlich Zulassungschance und Umsatzpotential von BYM338 bzw. bimagrumab angesagt. Immerhin hat die fda breaktrough status gegeben, orphan drug in Europa und USA schon länger.
Und neben sBIM stehen ja weitere P2-Indikationen an.
http://www.finanzen.net/nachricht/aktien/PRESS-RELEASE-Novar…
Wie es aussieht wäre nun wohl doch ein update der Einschätzung hinsichtlich Zulassungschance und Umsatzpotential von BYM338 bzw. bimagrumab angesagt. Immerhin hat die fda breaktrough status gegeben, orphan drug in Europa und USA schon länger.
Und neben sBIM stehen ja weitere P2-Indikationen an.
Antwort auf Beitrag Nr.: 45.284.527 von eck64 am 20.08.13 12:19:47Ja, ich habe es heute früh in einer Novartis-PR-Meldung gelesen. Sehr erfreulich, dass offensichtlich die unter ACE031 beobachteten Nebenwirkungen bei BYM338 nicht aufgetreten sind. Dazu muss man sagen, dass ACE031 kein monoklonaler AK ist, sondern ein synthetischer activin-Rezeptor, sich beide Therapieansätze mithin in nicht unwichtigen Details unterscheiden (MYO-029 von Wyeth wiederum ist wie BYM338 ein neutralisierender humaner AK, die Entwicklung ist jedoch mangels Wirkung eingestellt worden).
Lange Rede, kurzer Sinn: Nachdem die FDA die BYM338-Unterlagen gründlich durchleutet hat und zu einem positiven Urteil gekommen ist, würde ich die Zulassungswahrscheinlichkeit mit über 80 % beziffern.
Peak Sales für BYM338 abzuschätzen, ist schwierig. Angesichts dessen, dass Jimenez das Präparat wiederholt als Hoffnungsträger bezeichnet hat, dürften einige Mrd. USD aber schon realistisch sein.
Lange Rede, kurzer Sinn: Nachdem die FDA die BYM338-Unterlagen gründlich durchleutet hat und zu einem positiven Urteil gekommen ist, würde ich die Zulassungswahrscheinlichkeit mit über 80 % beziffern.
Peak Sales für BYM338 abzuschätzen, ist schwierig. Angesichts dessen, dass Jimenez das Präparat wiederholt als Hoffnungsträger bezeichnet hat, dürften einige Mrd. USD aber schon realistisch sein.
Antwort auf Beitrag Nr.: 45.284.951 von Joschka Schröder am 20.08.13 13:17:49Du kannst es dir ja denken:
Mir geht es um eine erste DCF-Bewertung für BYM338.
Ich dachte da daran die 65% Zulassungswahrscheinlichkeit für eine P3-Studie gleich auszuschöpfen. Deine 80% sind da schon eine offensice Hausnummer.
Ich nehme an dem dringenden und ungedeckten medizinischen Bedarf und der Vorprüfung durch fda geschuldet?
Ich habe das doch richtig erfasst: Für die P2 liegen positive Daten vor, können diese Nebenwirkungsarm bzw. -Verträglich mit einer größeren Zahl an Patienten bestätigt werden, dann gibts auch die Zulassung? Eben weil es sonst nichts gibt was hilft?
Zum Umsatz: Du leitest "mehrere Milliarden" aus dem Begriff Hoffnungsträger ab?
Bezieht sich das nicht primär auf die Hoffnung der Patienten, die sonst keine Therapieoption haben, denn die Patientenanzahl ist doch, zumindest auf sIBM bezogen, doch eher überschaubar?
Wobei eine Zulassung zu 80% mit Markteintritt ab 2016/17 und peak von mehreren Milliarden, ja jedermenschens Kursziel stark aufblasen würde.
Mir geht es um eine erste DCF-Bewertung für BYM338.
Ich dachte da daran die 65% Zulassungswahrscheinlichkeit für eine P3-Studie gleich auszuschöpfen. Deine 80% sind da schon eine offensice Hausnummer.
Ich nehme an dem dringenden und ungedeckten medizinischen Bedarf und der Vorprüfung durch fda geschuldet?
Ich habe das doch richtig erfasst: Für die P2 liegen positive Daten vor, können diese Nebenwirkungsarm bzw. -Verträglich mit einer größeren Zahl an Patienten bestätigt werden, dann gibts auch die Zulassung? Eben weil es sonst nichts gibt was hilft?
Zum Umsatz: Du leitest "mehrere Milliarden" aus dem Begriff Hoffnungsträger ab?
Bezieht sich das nicht primär auf die Hoffnung der Patienten, die sonst keine Therapieoption haben, denn die Patientenanzahl ist doch, zumindest auf sIBM bezogen, doch eher überschaubar?
Wobei eine Zulassung zu 80% mit Markteintritt ab 2016/17 und peak von mehreren Milliarden, ja jedermenschens Kursziel stark aufblasen würde.

Antwort auf Beitrag Nr.: 45.285.675 von eck64 am 20.08.13 14:55:52Mit 1,5 Mrd Euro Peak-Umsatz ab 2021 und 65% Zulassungswahrscheinlichkeit (2016) käme ich bereits auf 280 mio€. Damit wäre bimagrumab das aktuell teuerste Proejkt auf meiner DCF-Liste und alleine für 11 Euro Bewertung gut, bzw. ich sollte meine Faire Bewertung 9 Euro anheben. 

Da muss ich aber noch drüber schlafen.


Da muss ich aber noch drüber schlafen.
Ich hab das Gefühl, dass Adimab komplett davon zieht. Da scheint viel mehr Dynamik als bei Mor drin zu sein, was "early stage"-Projekte und Partnerschaften angeht. Was machen die besser?
August 20, 2013 | By Ryan McBride
Celgene has joined the ranks of the biotech company Adimab's collaborators, which now include several of the largest pharma and biotech companies in the world.
...
In July, Adimab announced that Biogen Idec ($BIIB) and GlaxoSmithKline ($GSK) had both paid sizable sums to gain licenses to Adimab's discovery technology for in-house use. Over the past four years, Adimab has built an impressive roster of collaborators and partners, including Merck ($MRK), Roche ($RHHBY) and its U.S. subsidiary Genentech, Novartis ($NVS), Eli Lilly ($LLY), Novo Nordisk ($NVO), Gilead ($GILD) and Kyowa Hakko Kirin.
Adimab has also achieved technical milestones in its work for Gilead, Lilly and Kyowa Hakko Kirin, the company said today.
http://www.fiercebiotech.com/story/adimab-adds-celgene-high-…
Interesse an einem IPO besteht nicht. Man hat auch so genug Geld:
http://blogs.wsj.com/venturecapital/2013/07/26/adimab-invest…
August 20, 2013 | By Ryan McBride
Celgene has joined the ranks of the biotech company Adimab's collaborators, which now include several of the largest pharma and biotech companies in the world.
...
In July, Adimab announced that Biogen Idec ($BIIB) and GlaxoSmithKline ($GSK) had both paid sizable sums to gain licenses to Adimab's discovery technology for in-house use. Over the past four years, Adimab has built an impressive roster of collaborators and partners, including Merck ($MRK), Roche ($RHHBY) and its U.S. subsidiary Genentech, Novartis ($NVS), Eli Lilly ($LLY), Novo Nordisk ($NVO), Gilead ($GILD) and Kyowa Hakko Kirin.
Adimab has also achieved technical milestones in its work for Gilead, Lilly and Kyowa Hakko Kirin, the company said today.
http://www.fiercebiotech.com/story/adimab-adds-celgene-high-…
Interesse an einem IPO besteht nicht. Man hat auch so genug Geld:
http://blogs.wsj.com/venturecapital/2013/07/26/adimab-invest…
Zitat von eck64: Zum Umsatz: Du leitest "mehrere Milliarden" aus dem Begriff Hoffnungsträger ab?
Bezieht sich das nicht primär auf die Hoffnung der Patienten, die sonst keine Therapieoption haben, denn die Patientenanzahl ist doch, zumindest auf sIBM bezogen, doch eher überschaubar?
Wenn Jimenez BYM338 sinngemäß als Hoffnungsträger bezeichnet, dann sicherlich nicht, weil er die Welt aus der Sicht des Patienten sieht. Novartis verspricht sich von BYM338 großen wirtschaftlichen Erfolg.
Lesenswert ist im übrigen die aktuelle Ausgabe der Annals of the Rheumatic Diseases. Dort werden verschiedene RA-Studien vorgestellt, die mit dem GM-CSF(alpha)-Antagonisten Mavrilimumab und dem anti-BAFF-Mab Tabalumab durchgeführt worden sind.
Die Enwicklung von Tabalumab in der Indikation RA ist mittlerweile eingestellt worden, so dass man auf dieses Präparat nicht näher eingehen muss (interessant dennoch zu sehen, zu welch unterschiedlichen Ergebnissen verschiedene P2-Studien geführt haben und wie diese - teilweise beschönend - interpretiert worden sind).
Hinsichtlich Mavrilimumab, dem MOR103-Konkurrenten, werden ausführliche Ergebnisse einer P2-Studie präsentiert, über die bereits weniger detailliert bei der ACR-Tagung 2011 berichtet worden ist.
Interessant ist, dass auch nach einer zwölfwöchigen Behandlungperiode keine Veränderungen der Serumkonzentrationen von SP-D und KL-6 (-> Biomarker für Alveoläre Proteinose und eine Reihe anderer Lungenaffektionen) gefunden worden sind. Nennenswerte Veränderungen der CO-Diffusionskapazität (soweit methodisch überhaupt valide erfassbar) waren in den höheren Dosisgruppen nicht häufiger als unter Placebo. Somit kann man mit recht hoher Wahrscheinlichkeit davon ausgehen, dass MOR103 zumindest einige Monate lang verabreicht werden kann, ohne dass pulmonale Komplikationen auftreten. Positiv für MOR103 außerdem, dass die ACR-Werte (insbesondere ACR50) unter Mavrilimumab nach der vierten Woche noch deutlich angestiegen sind. Na ja, anderes - d.h. wenn die Blockade des GM-CSF-Signalwegs nach vier Wochen keinen weiter ansteigenden Therapieeffekt gezeigt hätte - wäre für MOR103 auch extrem ungünstig gewesen, zumal die ACR50-Werte in der MOR103-Studie nach vier Wochen gerade einmal zwischen 4 % (Placebo und untere Dosisgruppe) und 23 (mittlere Dosisgruppe) lagen (hohe Dosisgruppe: 9 %). [Würden derartige Werte nach 8 oder 12 Wochen erreicht, wäre MOR103 schlichtweg nicht konkurrenzfähig.]
Per Saldo kann man aus den Mavrilimumab-Daten an Positivem für MOR103 ableiten, dass eine zwölfwöchige Gabe möglich war, ohne dass es zu einer pulmonalen Störung kam.
Ein besseres Urteil über MOR103 wird erst dann möglich sein, wenn Daten einer "richtigen" P2-Studie vorliegen. Der Start einer solchen Studie dürfte im Jahr 2014 erfolgen.
Es kann noch sehr viel besser werden mit MOR; ich bin optimistisch im Hinblick auf die Zukunft und die Pipeline!
Hier kommt ein sehr posiver Artikel in Bezug auf MOR103 (GSK), Guselkumab/CNTO1959 (Janssen), CNTO6785 (Janssen) und evtl. VAY736 (Novartis):
Gesundheitsökonomie
Arthritis: IQWiG lobt Biologics
27.08.2013 - Bei der Behandlung von Arthritis bieten Biopharmazeutika Vorteile. Zu diesem Urteil kommt das IQWiG, nachdem Studien neu ausgewertet wurden.
Lob von ungewohnter Seite für neun Biopharmazeutika, die als Zweitlinientherapie Erwachsenen mit rheumatoider Arthritis eingesetzt werden. Das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) hat jeder der Arzneien nun einen Nutzen bescheinigt. Damit adelt jene Organisation die Arthritis-Medikamente, die im Rahmen der frühen Nutzenbewertung schon einer ganze Reihe von Biotech-Wirkstoffen einen fehlenden Zusatznutzen bescheinigt hatte. Welches Medikament allerdings am besten wirkt bleibt ungeklärt. „Aussagekräftige Direktvergleiche, in denen die Biologika gemäß ihrer Zulassung eingesetzt wurden, und Langzeitdaten zum Nutzen und Schaden fehlen aber weiterhin – obwohl die neun Biologika zum Teil seit über zehn Jahren auf dem Markt sind“, monierte das IQWiG.
Insgesamt 35 Studien zu neun Arthritis-Arzneien, die 2010 zugelassen waren, nahmen die Experten vom IQWiG unter die Lupe: Abatacept, Adalimumab, Anakinra, Certolizumab pegol, Etanercept, Golimumab, Infliximab, Rituximab und Tocilizumab. Bei fünf Wirkstoffen (Abatacept, Adalimumab, Certolizumab pegol, Golimumab und Tocilizumab) ließen sich Belege für einen Nutzen bezüglich der Zielkriterien Remission, Symptome (z. B. Schmerzen, Schwellungen der Gelenke, Morgensteifigkeit), körperlicher Funktionsstatus und/oder Lebensqualität ableiten. Für die vier anderen Wirkstoffe (Anakinra, Etanercept, Infliximab und Rituximab) war der Nachweis der positiven Wirkung schwächer. Hier sprach das IQWiG von Hinweisen oder Anhaltspunkten für einen Nutzen. Bei drei Wirkstoffen (Adalimumab, Certolizumab pegol und Tocilizumab) zeigten sich jedoch auch mindestens Anhaltspunkte für Schäden durch unerwünschte Arzneimittelwirkungen.
Das IQWiG fordert nun, langfristige Direktvergleiche zwischen den Biopharmaka anzustellen. Denn: Aufgrund der positiven Effekte der Biotech-Arzneien seien placebokontrollierte Langzeitstudien „ethisch nicht vertretbar“.
http://www.transkript.de/nachrichten/politik/2013-03/arthrit…
Hier kommt ein sehr posiver Artikel in Bezug auf MOR103 (GSK), Guselkumab/CNTO1959 (Janssen), CNTO6785 (Janssen) und evtl. VAY736 (Novartis):
Gesundheitsökonomie
Arthritis: IQWiG lobt Biologics
27.08.2013 - Bei der Behandlung von Arthritis bieten Biopharmazeutika Vorteile. Zu diesem Urteil kommt das IQWiG, nachdem Studien neu ausgewertet wurden.
Lob von ungewohnter Seite für neun Biopharmazeutika, die als Zweitlinientherapie Erwachsenen mit rheumatoider Arthritis eingesetzt werden. Das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) hat jeder der Arzneien nun einen Nutzen bescheinigt. Damit adelt jene Organisation die Arthritis-Medikamente, die im Rahmen der frühen Nutzenbewertung schon einer ganze Reihe von Biotech-Wirkstoffen einen fehlenden Zusatznutzen bescheinigt hatte. Welches Medikament allerdings am besten wirkt bleibt ungeklärt. „Aussagekräftige Direktvergleiche, in denen die Biologika gemäß ihrer Zulassung eingesetzt wurden, und Langzeitdaten zum Nutzen und Schaden fehlen aber weiterhin – obwohl die neun Biologika zum Teil seit über zehn Jahren auf dem Markt sind“, monierte das IQWiG.
Insgesamt 35 Studien zu neun Arthritis-Arzneien, die 2010 zugelassen waren, nahmen die Experten vom IQWiG unter die Lupe: Abatacept, Adalimumab, Anakinra, Certolizumab pegol, Etanercept, Golimumab, Infliximab, Rituximab und Tocilizumab. Bei fünf Wirkstoffen (Abatacept, Adalimumab, Certolizumab pegol, Golimumab und Tocilizumab) ließen sich Belege für einen Nutzen bezüglich der Zielkriterien Remission, Symptome (z. B. Schmerzen, Schwellungen der Gelenke, Morgensteifigkeit), körperlicher Funktionsstatus und/oder Lebensqualität ableiten. Für die vier anderen Wirkstoffe (Anakinra, Etanercept, Infliximab und Rituximab) war der Nachweis der positiven Wirkung schwächer. Hier sprach das IQWiG von Hinweisen oder Anhaltspunkten für einen Nutzen. Bei drei Wirkstoffen (Adalimumab, Certolizumab pegol und Tocilizumab) zeigten sich jedoch auch mindestens Anhaltspunkte für Schäden durch unerwünschte Arzneimittelwirkungen.
Das IQWiG fordert nun, langfristige Direktvergleiche zwischen den Biopharmaka anzustellen. Denn: Aufgrund der positiven Effekte der Biotech-Arzneien seien placebokontrollierte Langzeitstudien „ethisch nicht vertretbar“.
http://www.transkript.de/nachrichten/politik/2013-03/arthrit…
Da ist sie, die Ankündigung einer P2-Start-Meldung demnächst:
http://www.clinicaltrials.gov/ct2/show/NCT01930175?term=vay&…
Study of Efficacy and Safety of VAY736 in Patients With Pemphigus Vulgaris
ClinicalTrials.gov Identifier:
NCT01930175
First received: August 23, 2013
Last updated: August 27, 2013
Last verified: August 2013
Estimated Enrollment: 30
Study Start Date: November 2013
Estimated Study Completion Date: February 2016
Estimated Primary Completion Date: February 2016 (Final data collection date for primary outcome measure)
xxxxxxxxxxxx
Zu VAY736 von Novartis hatte bisher niemand irgendwas gepostet.
Target unbekannt.
Diese Indikation sagt mir auch nichts, aber vielleicht gibt es ja auch mehrere?
Aber ich nehme an, da werden sich die Nebel lichten.

xxxxxxxxxxx
JoschkaSchröder,
kannst du da den Schleier lüften?
http://www.clinicaltrials.gov/ct2/show/NCT01930175?term=vay&…
Study of Efficacy and Safety of VAY736 in Patients With Pemphigus Vulgaris
ClinicalTrials.gov Identifier:
NCT01930175
First received: August 23, 2013
Last updated: August 27, 2013
Last verified: August 2013
Estimated Enrollment: 30
Study Start Date: November 2013
Estimated Study Completion Date: February 2016
Estimated Primary Completion Date: February 2016 (Final data collection date for primary outcome measure)
xxxxxxxxxxxx
Zu VAY736 von Novartis hatte bisher niemand irgendwas gepostet.
Target unbekannt.
Diese Indikation sagt mir auch nichts, aber vielleicht gibt es ja auch mehrere?
Aber ich nehme an, da werden sich die Nebel lichten.


xxxxxxxxxxx
JoschkaSchröder,
kannst du da den Schleier lüften?
Antwort auf Beitrag Nr.: 45.350.955 von eck64 am 29.08.13 17:09:43VAY736 bindet an den BAFF-Rezeptor (BAFF = "B-cell-activatin factor" oder auch "B lymphocyte stimulator"). Wirkmechanismus also via B-Zell-Schiene. Lesenswert in diesem Zusammenhang die Übersichtsarbeit "B-Cell-Directed Therapy for Inflammatory Skin Diseases" im Journal of Investigative Dermatology (2009) 129, 289–301.
Antwort auf Beitrag Nr.: 45.351.313 von Joschka Schröder am 29.08.13 17:50:08PS: Details zu VAY736 werden in Patent US2010021452(A1) beschrieben.
Antwort auf Beitrag Nr.: 45.351.313 von Joschka Schröder am 29.08.13 17:50:08Ah, danke. Stimmt ja. Hatte ich schon in meiner Tabelle stehen.
Beim unbenannten Augenheilprogramm habe ich kein target notiert....
Beim unbenannten Augenheilprogramm habe ich kein target notiert....
Heute in der "Finanz- und Wirtschaft":
Der Pharmakonzern Novartis geht mit dem privaten amerikanischen Biotechnologieunternehmen Regenerex ein exklusives weltweites Lizenzabkommen ein. Die Übereinkunft, zu der keine finanziellen Details kommuniziert worden sind, sieht auch eine exklusive Partnerschaft in der Forschung und Entwicklung vor. Regenerex verfügt über eine Plattform für die Verwendung von Stammzellen und hat damit unter anderem in der Nierentransplatation Erfahrungen gesammelt. Zwei – für Zelltherapien in der Hämatologie vorgesehene – Produkte, HSC835 und CTL019, befinden sich in Phase II der klinischen Erforschung.
CLT019 (CART19) ist ein weiteres Konkurrenzprodukt zu MOR208, Details hier -> http://www.novartisoncology.com/research-innovation/pipeline…
Der Pharmakonzern Novartis geht mit dem privaten amerikanischen Biotechnologieunternehmen Regenerex ein exklusives weltweites Lizenzabkommen ein. Die Übereinkunft, zu der keine finanziellen Details kommuniziert worden sind, sieht auch eine exklusive Partnerschaft in der Forschung und Entwicklung vor. Regenerex verfügt über eine Plattform für die Verwendung von Stammzellen und hat damit unter anderem in der Nierentransplatation Erfahrungen gesammelt. Zwei – für Zelltherapien in der Hämatologie vorgesehene – Produkte, HSC835 und CTL019, befinden sich in Phase II der klinischen Erforschung.
CLT019 (CART19) ist ein weiteres Konkurrenzprodukt zu MOR208, Details hier -> http://www.novartisoncology.com/research-innovation/pipeline…
Antwort auf Beitrag Nr.: 45.396.687 von Joschka Schröder am 06.09.13 10:33:18CAR-T ist laut einigen biotechexperten sehr aussichtsreich.
MOR208 wenig interessant dagegen.
MOR208 wenig interessant dagegen.
Zitat von PathFinder2: MOR208 wenig interessant dagegen.
Deine persönliche Meinung oder Meinung (welcher) Dritter?
Gestern ist übrigens in der Schweizer Sonntagszeitung ein interessanter Bericht über BYM338/Bimabgrumab erschienen (Bimagrumab von Bhima = Pendant zu Herkules in der indischen Sagenwelt). Dem Bericht zufolge plant die Welt-Doping-Agentur, bei der Entwicklung eines Screeningtests mit Novartis zusammenzuarbeiten. Eingesetzt werden soll BYM338 neben den bereits bekannten Indikationen u.a. auch bei Astronauten, Unfallopfern, Übergewichtigen und Diabetes II-Patienten (im Rahmen der Myostation-Blockade verbrennt der Körper mehr Fett -> Blutzucker und LDL sinken ... ein erwünschter (Neben-)Effekt).
Auch der 2004 im NEJM berichtete Fall eines vierjährigen Buben wird erwähnt. Der Knabe mit ausgeschaltetem Myostatin-Signalweg konnte mit zur Seite gestreckten Armen problemlos beidseits je drei Kilogramm schwere Hanteln tragen.
Antwort auf Beitrag Nr.: 45.408.749 von Joschka Schröder am 09.09.13 09:04:58Auch online komplett zu lesen:
Der link zu dem sehr interessanten Artikel:
http://www.sonntagszeitung.ch/wissen/artikel-detailseite/?ne…
Auszug:
Im August nun erhielt Novartis von der US-Arzneimittelbehörde FDA das Label «Durchbruch» für einen Wirkstoff namens Bimagrumab, nachdem erste Tests an 14 Patienten erfolgreich verlaufen waren. Das Label garantiert die Zulassungsprüfung im Schnellverfahren. Läuft alles planmässig, will Novartis diese 2016 beantragen.
Im Fokus hat der Pharmariese aber weitere Gebiete: Lungenkranke, Krebspatienten, schwache Senioren oder Patienten auf Intensivstationen, die beatmet werden. Allen gemeinsam ist, dass ihre Muskeln schwinden. Bei einem Viertel der Krebstodesfälle beispielsweise führt letztlich nicht der Tumor, sondern die damit verbundene Abmagerung zum Tod. Wird der Muskelabbau gebremst, verlängert sich allein dadurch die Überlebenszeit deutlich - zumindest bei Mäusen.
xxxxxxxxxxxxxxxxx
Jedenfalls sieht Novartis Chancen, dass die potentiellen Anwendungsgebiete weit streuen.
Sollte man tatsächlich auch noch vielen Krebspatienten zwar nicht kurativ helfen, aber doch ein paar Monate schenken können, dann wird endgültig klar, warum von einem Hoffnungsträger der Pipeline gesprochen wird.
Der link zu dem sehr interessanten Artikel:
http://www.sonntagszeitung.ch/wissen/artikel-detailseite/?ne…
Auszug:
Im August nun erhielt Novartis von der US-Arzneimittelbehörde FDA das Label «Durchbruch» für einen Wirkstoff namens Bimagrumab, nachdem erste Tests an 14 Patienten erfolgreich verlaufen waren. Das Label garantiert die Zulassungsprüfung im Schnellverfahren. Läuft alles planmässig, will Novartis diese 2016 beantragen.
Im Fokus hat der Pharmariese aber weitere Gebiete: Lungenkranke, Krebspatienten, schwache Senioren oder Patienten auf Intensivstationen, die beatmet werden. Allen gemeinsam ist, dass ihre Muskeln schwinden. Bei einem Viertel der Krebstodesfälle beispielsweise führt letztlich nicht der Tumor, sondern die damit verbundene Abmagerung zum Tod. Wird der Muskelabbau gebremst, verlängert sich allein dadurch die Überlebenszeit deutlich - zumindest bei Mäusen.
xxxxxxxxxxxxxxxxx
Jedenfalls sieht Novartis Chancen, dass die potentiellen Anwendungsgebiete weit streuen.
Sollte man tatsächlich auch noch vielen Krebspatienten zwar nicht kurativ helfen, aber doch ein paar Monate schenken können, dann wird endgültig klar, warum von einem Hoffnungsträger der Pipeline gesprochen wird.
Antwort auf Beitrag Nr.: 45.408.749 von Joschka Schröder am 09.09.13 09:04:58CART ist generell heiß.
was MOR208 betrifft, hier ist zb Ohad Hammer sehr kritisch, u.a. wegen wettbewerbssituation. aber vielleicht gewinnen wir ja in den nächsten 3 wochen bedeutende neue erkenntnisse nach vorliegen der dosiseskalationsdaten.
es wäre toll wenn Morphosys auch für MOR208 eine auslizenzierung schafft! (wobei dies wohl kaum vor vorliegen von PII daten angestrebt wird)
was MOR208 betrifft, hier ist zb Ohad Hammer sehr kritisch, u.a. wegen wettbewerbssituation. aber vielleicht gewinnen wir ja in den nächsten 3 wochen bedeutende neue erkenntnisse nach vorliegen der dosiseskalationsdaten.
es wäre toll wenn Morphosys auch für MOR208 eine auslizenzierung schafft! (wobei dies wohl kaum vor vorliegen von PII daten angestrebt wird)
Zitat von PathFinder2: CART ist generell heiß.
was MOR208 betrifft, hier ist zb Ohad Hammer sehr kritisch, u.a. wegen wettbewerbssituation. aber vielleicht gewinnen wir ja in den nächsten 3 wochen bedeutende neue erkenntnisse nach vorliegen der dosiseskalationsdaten.
es wäre toll wenn Morphosys auch für MOR208 eine auslizenzierung schafft! (wobei dies wohl kaum vor vorliegen von PII daten angestrebt wird)
Das sehe ich auch so. Nachdem die eigene Pipelineverantwortung durch Auslizenzierung von MOR103 und MOR202 erheblich ausgedünnt wurde hat man nun sowohl die Kapazität als auch den cash MOR208 eigenverantwortlich weiter voran zu treiben.
Man kann nur hoffen, dass das Projektcontrolling so weit intakt ist und bleibt, dass man keinen lahmen Gaul zu Tode reitet. Die Präsentation der Extension-Daten in naher Zukunft sollte Begründung für das Investitionsvolumen liefern und dann ist es auch ok.
Im Entwicklungs-Erfolgsfalle wird Morphosys auch für MOR208 in Europa Vermarktungsrechte behalten wollen. Meine Vermutung.
Im Zusammenhang mit MOR103 von Interesse (Abstract zur diesjährigen ACR-Konferenz):
Safety Of Mavrilimumab In Cynomolgus Monkeys: Relevance Of Nonclinical Findings In Lung To Human Safety
Abstract:
#2378
Presenter:
Ryan, Patricia C. PhD
Co-Authors:
Sleeman, Matthew A. PhD; Rebelatto, Marlon ; Wang, Bing PhD; Lu, Hong ; Wu, Chi-Yuan PhD; Wilkins, Dee ; Spitz, Susan ; Ranganna, Gopi ; Godwood, Alex MSc; Michaels, Alex MD; Saurigny, Didier MSc; Roskos, Lorin PhD; Close, David ; Towers, Heidi PhD; McKeever, Kathleen PhD; Dixit, Rakesh PhD
Date:
Tuesday, October 29, 2013
Presenter Available:
9:00 am - 11:00 am
Poster Available:
8:30 am - 4:00 pm
Location:
Exhibit Hall B2-C-D
Session Title:
Rheumatoid Arthritis Treatment - Small Molecules, Biologics and Gene Therapy III
Abstract Category:
Rheumatoid Arthritis - Small Molecules, Biologics and Gene Therapy
Type:
Poster
Description:
Background/Purpose: GM-CSF plays a central role in the pathogenesis of rheumatoid arthritis (RA) through the activation, differentiation, and survival of macrophages and neutrophils. Mavrilimumab (CAM-3001) is a human monoclonal antibody targeting the alpha subunit of GM-CSF receptor which MedImmune is developing as a novel treatment for RA. Because GM-CSF plays a role in the regulation of pulmonary surfactant homeostasis (Trapnell and Whitsett, Ann Rev Physiology, 2002:775-802), lung toxicity is a potential concern for biologics such as mavrilimumab which inhibit GM-CSF receptor signaling. As a result, additional attention was given to the potential impact of lung toxicity during the development of mavrilimumab.
Methods: Nonclinical safety of mavrilimumab was evaluated in several repeat dose studies in cynomolgus monkeys. Comprehensive toxicity parameters were assessed in each study, and treatment duration ranged from 4 to 26 weeks. All animal studies were performed under approved protocols at AAALAC-accredited labs. In the recently completed Ph2a clinical study EARTH (Burmester et al., ARD 2012 ) intensive respiratory monitoring included chest X-rays, forced expiratory volume (FEV1), forced vital capacity (FVC), diffusing capacity of the lung for carbon monoxide (DLCO) and dyspnea scores. Serum biomarkers of lung damage, surfactant protein D (SP-D) and Krebs von den Lungen-6 (KL-6) were measured using commercially available immunoassays (BioVendor, LLC; Candler, NC).
Results: Mavrilimumab has an acceptable safety profile in monkeys with no changes in any parameters other than microscopic findings in lung. In several studies, minimal accumulation of foamy alveolar macrophages was observed. This finding was reversible following a dose-free recovery period and was considered non-adverse. At very high dose levels (≥30 mg/kg), in a 26-week repeat IV dose study, the presence of lung foreign material, cholesterol clefts, and granulomatous inflammation was also observed in a few animals and was considered adverse. These dose and time related changes in lung were consistent with mavrilimumab inhibitory effects on lung macrophage function arising from exaggerated pharmacology. Overall, a clean no-observed-adverse-effect-level (NOAEL) without any effects in lung was established and provided adequate clinical safety margins. In EARTH, mavrilimumab demonstrated good clinical activity with no clinically significant or persistent changes in the lung function tests performed. Likewise, the serum biomarkers of lung damage, SP-D and KL-6, showed no clinically significant changes following mavrilimumab treatment.
Conclusion: These results suggest that suppressing macrophage activity by targeting GM-CSF receptor alpha may be a novel approach with an acceptable safety profile for the treatment of RA.
Safety Of Mavrilimumab In Cynomolgus Monkeys: Relevance Of Nonclinical Findings In Lung To Human Safety
Abstract:
#2378
Presenter:
Ryan, Patricia C. PhD
Co-Authors:
Sleeman, Matthew A. PhD; Rebelatto, Marlon ; Wang, Bing PhD; Lu, Hong ; Wu, Chi-Yuan PhD; Wilkins, Dee ; Spitz, Susan ; Ranganna, Gopi ; Godwood, Alex MSc; Michaels, Alex MD; Saurigny, Didier MSc; Roskos, Lorin PhD; Close, David ; Towers, Heidi PhD; McKeever, Kathleen PhD; Dixit, Rakesh PhD
Date:
Tuesday, October 29, 2013
Presenter Available:
9:00 am - 11:00 am
Poster Available:
8:30 am - 4:00 pm
Location:
Exhibit Hall B2-C-D
Session Title:
Rheumatoid Arthritis Treatment - Small Molecules, Biologics and Gene Therapy III
Abstract Category:
Rheumatoid Arthritis - Small Molecules, Biologics and Gene Therapy
Type:
Poster
Description:
Background/Purpose: GM-CSF plays a central role in the pathogenesis of rheumatoid arthritis (RA) through the activation, differentiation, and survival of macrophages and neutrophils. Mavrilimumab (CAM-3001) is a human monoclonal antibody targeting the alpha subunit of GM-CSF receptor which MedImmune is developing as a novel treatment for RA. Because GM-CSF plays a role in the regulation of pulmonary surfactant homeostasis (Trapnell and Whitsett, Ann Rev Physiology, 2002:775-802), lung toxicity is a potential concern for biologics such as mavrilimumab which inhibit GM-CSF receptor signaling. As a result, additional attention was given to the potential impact of lung toxicity during the development of mavrilimumab.
Methods: Nonclinical safety of mavrilimumab was evaluated in several repeat dose studies in cynomolgus monkeys. Comprehensive toxicity parameters were assessed in each study, and treatment duration ranged from 4 to 26 weeks. All animal studies were performed under approved protocols at AAALAC-accredited labs. In the recently completed Ph2a clinical study EARTH (Burmester et al., ARD 2012 ) intensive respiratory monitoring included chest X-rays, forced expiratory volume (FEV1), forced vital capacity (FVC), diffusing capacity of the lung for carbon monoxide (DLCO) and dyspnea scores. Serum biomarkers of lung damage, surfactant protein D (SP-D) and Krebs von den Lungen-6 (KL-6) were measured using commercially available immunoassays (BioVendor, LLC; Candler, NC).
Results: Mavrilimumab has an acceptable safety profile in monkeys with no changes in any parameters other than microscopic findings in lung. In several studies, minimal accumulation of foamy alveolar macrophages was observed. This finding was reversible following a dose-free recovery period and was considered non-adverse. At very high dose levels (≥30 mg/kg), in a 26-week repeat IV dose study, the presence of lung foreign material, cholesterol clefts, and granulomatous inflammation was also observed in a few animals and was considered adverse. These dose and time related changes in lung were consistent with mavrilimumab inhibitory effects on lung macrophage function arising from exaggerated pharmacology. Overall, a clean no-observed-adverse-effect-level (NOAEL) without any effects in lung was established and provided adequate clinical safety margins. In EARTH, mavrilimumab demonstrated good clinical activity with no clinically significant or persistent changes in the lung function tests performed. Likewise, the serum biomarkers of lung damage, SP-D and KL-6, showed no clinically significant changes following mavrilimumab treatment.
Conclusion: These results suggest that suppressing macrophage activity by targeting GM-CSF receptor alpha may be a novel approach with an acceptable safety profile for the treatment of RA.
Weil sich in einem anderen Morphosys-Thread zahlreiche Diskussionsteilnehmer gerade so verhalten, als seinen alle Entwicklungen der MOR-Pipeline geradezu konkurrenzlos und quasi schon auf dem Markt, mal wieder ein kleiner Blick über den Tellerrand: Amgen und AstraZeneca berichten heute über die neuesten klinischen Ergebnisse ihres anti IL-17-R-Antikörpers brodalumab -> http://www.medimmune.com/media/press-releases/2013/10/03/amg…
Weitere Neuigkeiten vom EADV-Kongress, die u.a. im Zusammenhang mit Janssens/Morphosys´ Guselkumab von Interesse sind -> http://www.pmlive.com/pharma_news/novartis_psoriasis_drug_se…
Zitat von Joschka Schröder: Weitere Neuigkeiten vom EADV-Kongress, die u.a. im Zusammenhang mit Janssens/Morphosys´ Guselkumab von Interesse sind -> http://www.pmlive.com/pharma_news/novartis_psoriasis_drug_se…
Wie weit hinkt denn CNTO 6785/IL17A von Janssen, secukinumab von NOV in der klinischen Entwicklung hinterher?
300mg sind ja eine ziemlich satte Menge; hätte ein mAb mit geringerer Dosis bei vergleichbarer Wirkung, für das selbe target Chancen, den Zeitvorsprung wettzumachen?
Hoffentlich ist die Formulierung oder Applikation von CNTO 6785 wenigstens überlegen!
Ich habe den ganzen Thread durchgeblättert u. diesen ziemlich kritischen zu Gantenerumab nicht gefunden.
Vllt. steht er auch im anderen Thread, deshalb nur der Link.
Roche’s gantenerumab could face similar fate as failed drug bapineuzumab in Alzheimer’s, experts say
http://www.ft.com/cms/s/2/2a16570a-e585-11e2-ad1a-00144feabd…
Vllt. steht er auch im anderen Thread, deshalb nur der Link.
Roche’s gantenerumab could face similar fate as failed drug bapineuzumab in Alzheimer’s, experts say
http://www.ft.com/cms/s/2/2a16570a-e585-11e2-ad1a-00144feabd…
Antwort auf Beitrag Nr.: 45.573.753 von evotecci am 05.10.13 14:47:47Von Gantenerumab verspreche ich mir wenig. Da gibt es deutlich aussichtsreichere therapeutische Ansätze, am besten dürfte dieser sein -> http://www.ncbi.nlm.nih.gov/pubmed/23604588
Anle138b blockiert eine pathologische Proteinaggregation (u.a. die Bildung toxischer Oligomere), ohne physiologische Prozesse zu beeinflussen. Bei M. Alzheimer verhindert es die Bildung sowohl von Beta-Amyloid-Plaques als auch von Neurofibrillenbündeln aus Tau-Protein.
Anle138b blockiert eine pathologische Proteinaggregation (u.a. die Bildung toxischer Oligomere), ohne physiologische Prozesse zu beeinflussen. Bei M. Alzheimer verhindert es die Bildung sowohl von Beta-Amyloid-Plaques als auch von Neurofibrillenbündeln aus Tau-Protein.
Antwort auf Beitrag Nr.: 45.574.247 von Joschka Schröder am 05.10.13 16:52:46PS: Einschränkend muss man natürlich ergänzen, dass sich Anle138b erst noch in Humanstudien bewähren muss.
Die finalen Daten der MOR208-Studie sind heute veröffentlich worden -> http://www.morphosys.de/pressrelease/morphosys-und-xencor-ge…
Ein Vergleich mit den Daten direkter (anti CD19-)Konkurrenzpräparaten wie Blinatumomab und SAR3419 ist schwer möglich, weil die Studien in unterschiedlichen Indikationen durchgeführt worden sind.
Ein Vergleich mit den Daten direkter (anti CD19-)Konkurrenzpräparaten wie Blinatumomab und SAR3419 ist schwer möglich, weil die Studien in unterschiedlichen Indikationen durchgeführt worden sind.
Antwort auf Beitrag Nr.: 45.578.689 von Joschka Schröder am 07.10.13 09:17:49Kannst du was zur "Gesamtansprechrate von 29,6% (gemäß der IWCLL-Kriterien von 2008) basierend auf der Gesamtzahl der behandelten Teilnehmer der Studie" sagen?
Man ist mit 8 Patienten in Verlängerung gegangen, wobei 4 von 8 nach 2 kompletten Zyklen noch nicht angesprochen hatten?
Nach den bis zu 4 weiteren Zyklen hatten aber alle angesprochen.
Allerding waren in der Hauptsudie schon wenigstens 22 von 27 "stable disease", aber das ohne ansprechen?
Vielleicht kannst du uns Laien das ein wenig erläutern, auch ohne 1:1 Vergleich zum Wettbewerb.
Und die künftige Therapieoption ist dann die Verbesserung einer bestehenden Therapie durch Kombination?
Man ist mit 8 Patienten in Verlängerung gegangen, wobei 4 von 8 nach 2 kompletten Zyklen noch nicht angesprochen hatten?

Nach den bis zu 4 weiteren Zyklen hatten aber alle angesprochen.
Allerding waren in der Hauptsudie schon wenigstens 22 von 27 "stable disease", aber das ohne ansprechen?
Vielleicht kannst du uns Laien das ein wenig erläutern, auch ohne 1:1 Vergleich zum Wettbewerb.
Und die künftige Therapieoption ist dann die Verbesserung einer bestehenden Therapie durch Kombination?
Die finale Studienergebnisse inklusive des erweiterten Behandlungsarms zeigten eine Gesamtansprechrate von 29,6% (gemäß der IWCLL-Kriterien von 2008) basierend auf der Gesamtzahl der behandelten Teilnehmer der Studie (n=27) - eine Steigerung gegenüber der bisher veröffentlichten Ansprechrate von 14,8%.
Sterigerung gegenüber dem besten Vergleichmedikament um 14,8%, also ca. 25,% auf 29,6 % Ansprechrate? Bei 27 auswertbaren Patienten.
"Naja" bis "es fehlen größere Patientenzahlen"
Sterigerung gegenüber dem besten Vergleichmedikament um 14,8%, also ca. 25,% auf 29,6 % Ansprechrate? Bei 27 auswertbaren Patienten.
"Naja" bis "es fehlen größere Patientenzahlen"
Antwort auf Beitrag Nr.: 45.578.857 von Ditjg am 07.10.13 09:41:56@Ditjg,
ich denke, das hast du falsch gelesen.
Die 14,8% sind nicht das beste Vergleichmedikament, sondern die Ansprechrate der ursprünglichen Studie mit den 27 sehr stark vorbehandelten Patienten.
Also genau 4 Patienten.
Man ging mit 8 Patienten in weitere Behandlungszyklen und erreichte dabei ein 10%iges "ansprechen".
Leider habe ich keine rechte Ahnung, was ansprechen bedeutet.
Krankheits-Stillstand, Verbesserung, Heilung. Damit fange ich persönlich mehr an. Und natürlich der Vergleich zu vorhandenen oder in Entwicklung befindlichen Therapien.
Aber eine gute Chance, in Kombination mit anderen Mitteln scheint ja durchaus gegeben zu sein.

ich denke, das hast du falsch gelesen.
Die 14,8% sind nicht das beste Vergleichmedikament, sondern die Ansprechrate der ursprünglichen Studie mit den 27 sehr stark vorbehandelten Patienten.
Also genau 4 Patienten.
Man ging mit 8 Patienten in weitere Behandlungszyklen und erreichte dabei ein 10%iges "ansprechen".
Leider habe ich keine rechte Ahnung, was ansprechen bedeutet.
Krankheits-Stillstand, Verbesserung, Heilung. Damit fange ich persönlich mehr an. Und natürlich der Vergleich zu vorhandenen oder in Entwicklung befindlichen Therapien.
Aber eine gute Chance, in Kombination mit anderen Mitteln scheint ja durchaus gegeben zu sein.


Auf Basis der heutigen Meldung lassen sich die Studienergebnisse leider nicht recht einschätzen. Dazu bedarf es detaillierterer Informationen, die es vermutlich in der angekündigten wissenschaftlichen Publikation geben wird.
Die Aussagen hinsichtlich der angedachten Kombi-Therapie stellen sich für mich erst einmal neutral - also nicht negativ - dar. Dass MOR208 in der Indikation CLL später allenfalls im Rahmen einer Kombinationsbehandlung eingesetzt werden dürfte, war nicht anders zu erwarten. Sieht man mal von der Option einer allogenen Stammzelltransplantation ab, ist die CLL bislang - auch mit Antikörper-basierten Kombinationsbehandlungen - nicht heilbar. Eine recht gute Übersicht über die Erkrankung findet sich hier -> http://www.dgho-onkopedia.de/de/onkopedia/leitlinien/cll.
Die Aussagen hinsichtlich der angedachten Kombi-Therapie stellen sich für mich erst einmal neutral - also nicht negativ - dar. Dass MOR208 in der Indikation CLL später allenfalls im Rahmen einer Kombinationsbehandlung eingesetzt werden dürfte, war nicht anders zu erwarten. Sieht man mal von der Option einer allogenen Stammzelltransplantation ab, ist die CLL bislang - auch mit Antikörper-basierten Kombinationsbehandlungen - nicht heilbar. Eine recht gute Übersicht über die Erkrankung findet sich hier -> http://www.dgho-onkopedia.de/de/onkopedia/leitlinien/cll.
Nachdem ich noch einmal alte Kongressunterlagen durchgesehen habe, muss ich meine Aussagen leider modifizieren. Auf dem AACR-Meeting 2013 wurden Ergebnisse präsentiert, die mit CART19 an CLL-Patienten erzielt worden sind -> http://www.abstractsonline.com/plan/ViewAbstract.aspx?mID=30…. Herausragende Ergebnisse, mit denen MOR208 ganz offensichtlich nicht ansatzweise mithalten kann.
Zitat von PathFinder2: CART ist generell heiß.
was MOR208 betrifft, hier ist zb Ohad Hammer sehr kritisch, u.a. wegen wettbewerbssituation. aber vielleicht gewinnen wir ja in den nächsten 3 wochen bedeutende neue erkenntnisse nach vorliegen der dosiseskalationsdaten.
es wäre toll wenn Morphosys auch für MOR208 eine auslizenzierung schafft! (wobei dies wohl kaum vor vorliegen von PII daten angestrebt wird)
Wenn man die CART19-Daten vom diesjährigen AACR-Meeting mit den aktuellen (rudimentären) MOR208-Daten vergleicht, dürften O.H. und Du mit Euren eher kritischen Einschätzungen richtig liegen. Die Vorstellung, in die weitere MOR208-Entwicklung könnten große zweistellige Millionenbeträge fließen (s. auch Begründung für die jüngste KP-Erhöhung) begeistert unter diesen Umständen natürlich nicht.
Betrifft BPS804: Es gibt einen interessanten neuen Ansatz zur Behandlung der Osteoporose via Plastin 3. Hier -> http://www.nejm.org/doi/full/10.1056/NEJMoa1308223#t=article die aktuelle Arbeit aus dem NEJM.
zu Gantenerumab:
Im Zusammenhang mit der Alzheimer-Diskussion (Amyloid-Theorie) erwähnenswert ... Medicaire lehnt Kostenübernahme für Lilly´s Amyvid ab -> http://www.fiercepharma.com/story/lilly-fails-persuade-medic…
Im Zusammenhang mit der Alzheimer-Diskussion (Amyloid-Theorie) erwähnenswert ... Medicaire lehnt Kostenübernahme für Lilly´s Amyvid ab -> http://www.fiercepharma.com/story/lilly-fails-persuade-medic…
Antwort auf Beitrag Nr.: 45.583.199 von Joschka Schröder am 07.10.13 19:50:36sorry, sollte natürlich "Medicare" heißen
Wie bereits diskutiert, scheint MOR208 in der Indikation CLL dem Konkurrenzpräparat CART19 hoffnungslos unterlegen. Ich weiß nicht, ob es klug ist, mit MOR208 eine Phase II-Studie in dieser Indikation zu beginnen. Falls man sich bei Morphosys für eine solche Studie entscheiden wird, dürfte MOR208 mit DNA-Alkylantien wie Bendamustin kombiniert werden. In präklinischen Studien hat man diesbezüglich synergistische Wirkungen beobachtet. Beschrieben wird dies u.a. in Patent WO2013024097 (A1).
Zitat von Joschka Schröder: Wie bereits diskutiert, scheint MOR208 in der Indikation CLL dem Konkurrenzpräparat CART19 hoffnungslos unterlegen. Ich weiß nicht, ob es klug ist, mit MOR208 eine Phase II-Studie in dieser Indikation zu beginnen. Falls man sich bei Morphosys für eine solche Studie entscheiden wird, dürfte MOR208 mit DNA-Alkylantien wie Bendamustin kombiniert werden. In präklinischen Studien hat man diesbezüglich synergistische Wirkungen beobachtet. Beschrieben wird dies u.a. in Patent WO2013024097 (A1).
Würdest du bitte vorrechnen, welche theoretisch höchstmögliche Ansprechrate basierend auf der Gesamtzahl der behandelten Teilnehmer Morphosys in der erweiterungsstudie erreichen konnte und welche Zahl sie gemeldet haben?
Die finale Studienergebnisse inklusive des erweiterten Behandlungsarms zeigten eine Gesamtansprechrate von 29,6% (gemäß der IWCLL-Kriterien von 2008) basierend auf der Gesamtzahl der behandelten Teilnehmer der Studie (n=27) - eine Steigerung gegenüber der bisher veröffentlichten Ansprechrate von 14,8%. Eine detaillierte Analyse der Studienergebnisse wird in einer wissenschaftlichen Fachpublikation veröffentlicht.
Warum gilt heute dieser Satz nicht mehr?
Auf Basis der heutigen Meldung lassen sich die Studienergebnisse leider nicht recht einschätzen. Dazu bedarf es detaillierterer Informationen, die es vermutlich in der angekündigten wissenschaftlichen Publikation geben wird.
Zitat von eck64:Zitat von Joschka Schröder: Wie bereits diskutiert, scheint MOR208 in der Indikation CLL dem Konkurrenzpräparat CART19 hoffnungslos unterlegen. Ich weiß nicht, ob es klug ist, mit MOR208 eine Phase II-Studie in dieser Indikation zu beginnen. Falls man sich bei Morphosys für eine solche Studie entscheiden wird, dürfte MOR208 mit DNA-Alkylantien wie Bendamustin kombiniert werden. In präklinischen Studien hat man diesbezüglich synergistische Wirkungen beobachtet. Beschrieben wird dies u.a. in Patent WO2013024097 (A1).
Würdest du bitte vorrechnen, welche theoretisch höchstmögliche Ansprechrate basierend auf der Gesamtzahl der behandelten Teilnehmer Morphosys in der erweiterungsstudie erreichen konnte und welche Zahl sie gemeldet haben?
Die finale Studienergebnisse inklusive des erweiterten Behandlungsarms zeigten eine Gesamtansprechrate von 29,6% (gemäß der IWCLL-Kriterien von 2008) basierend auf der Gesamtzahl der behandelten Teilnehmer der Studie (n=27) - eine Steigerung gegenüber der bisher veröffentlichten Ansprechrate von 14,8%. Eine detaillierte Analyse der Studienergebnisse wird in einer wissenschaftlichen Fachpublikation veröffentlicht.
Deine Frage habe ich bereits in Deinem Thread beantwortet. Kannst Du dort nachlesen.
Zitat von eck64: Warum gilt heute dieser Satz nicht mehr?
Auf Basis der heutigen Meldung lassen sich die Studienergebnisse leider nicht recht einschätzen. Dazu bedarf es detaillierterer Informationen, die es vermutlich in der angekündigten wissenschaftlichen Publikation geben wird.
Weil ich, als ich diesen Satz schrieb, dummerweise nicht die CART19-Ergebnisse nicht im Kopf hatte, sondern nur Ergebnisse aus Studien mit Mabs und ADCs wie Blinatumomab und SAR3419 (die wegen unterschiedlicher Indikation etc. nicht mit den aktuellen MOR208-Daten verglichen werden können).
Natürlich warte ich gespannt auf die wissenschaftliche Publikation der MOR208-Ergebnisse. Um eine Unterlegenheit gegenüber CART19 festzustellen (Ansprechrate 70 % mit PR und CR), bedarfes jedoch keiner weiteren Informationen.
Antwort auf Beitrag Nr.: 45.586.137 von Joschka Schröder am 08.10.13 10:53:56
Um mich mal hier einzumischen:
Bei lebensbedrohenden Erkrankungen (hier CLL/Blutkrebs) gilt: aus ethischen Gründen, darf ein Patient in einer Humanstudie nicht von einer wirksamen Behandlungsform ausgeschlossen werden, weil er ein experimentelles Therapeutikum bekommen soll.
Deshalb können nur Patienten mit Remissionen, bei denen keine zugelassenen Standarttherapien mehr wirken, in solche Studien aufgenommen werden.
Ziel dieser Studie (1/2a) war, erste Anzeichen von Wirksamkeit im Patienten nachzuweisen und zudem noch eine wirksame Dosis zu finden und Nebenwirkungen aufzuzeigen.
Bei festgestellter Wirksamkeit (Anzeichen dafür) kann im nächsten Schritt nachgewiesen werden, ob das immer noch experimentelle Therapeutikum ähnlich gut oder schlecht wirkt, wie eine zugelassene Standarttherapie. Anbieten würde sich hier (meiner Meinung nach) eine Kombinationsstudie Chemotherapeutikum mit mAb und als Vergleichs-mAbs kommen sicherlich Rituximab bzw. der Nachfolger Ocrelizumab in Frage. Das sind die beiden mAbs, die als Blockbuster in Standarttherapien eingesetzt werden.
Eine Ethikkommission wird entscheiden, ob und wie MOR208 sich messen darf.
Ein Vergleich mit anderen nicht zugelassenen Therapien ist nicht zielführend. Es gilt, der besten zugelassenen Behandlungsform Konkurrenz zu machen und dort einen Patientennutzen zu beweisen.
MOR wird sich sicherlich die Konkurrenzsituation ansehen, bevor man weiterentwickelt, sollte sich jedoch nicht von anderen unzugelassenen Therapien abschrecken lassen. Rituxan wäre der Vergleich…
Das wäre ungefähr so, dass ich bei einem Wettkampf nicht starte, nur weil ich glaube, dass der/die anderen ohnehin besser sind und ich keine Chance habe. Das Ergebnis ist das Resultat und nicht die Vermutung wer gewinnt.…und Rituxan war sicherlich bei allen Patienten in der Vorbehandlung dabei, also auch bei denen mit Ansprechrate.
Wie gesagt, dabei hat eine Ethikkommission ein gewichtiges Wort!
CART ist bislang ein experimenteller Ansatz mit interessanten Resultaten, allerdings mit starken Nebenwirkungen. Der cytokine release storm,der mich an den Fehlschlag bei Tegenero (TGN1412) erinnert, muss hier mit anderen Medikamenten unterdrückt werden.
30% Ansprechrate bei MOR208 sind erste Anzeichen von Wirksamkeit! Ohne Frage ist eine höhere Ansprechrate wünschenswert, aber es wurden nur stark vorbehandelte Patienten in dieser 1/2a Studie untersucht!
Um mich mal hier einzumischen:
Bei lebensbedrohenden Erkrankungen (hier CLL/Blutkrebs) gilt: aus ethischen Gründen, darf ein Patient in einer Humanstudie nicht von einer wirksamen Behandlungsform ausgeschlossen werden, weil er ein experimentelles Therapeutikum bekommen soll.
Deshalb können nur Patienten mit Remissionen, bei denen keine zugelassenen Standarttherapien mehr wirken, in solche Studien aufgenommen werden.
Ziel dieser Studie (1/2a) war, erste Anzeichen von Wirksamkeit im Patienten nachzuweisen und zudem noch eine wirksame Dosis zu finden und Nebenwirkungen aufzuzeigen.
Bei festgestellter Wirksamkeit (Anzeichen dafür) kann im nächsten Schritt nachgewiesen werden, ob das immer noch experimentelle Therapeutikum ähnlich gut oder schlecht wirkt, wie eine zugelassene Standarttherapie. Anbieten würde sich hier (meiner Meinung nach) eine Kombinationsstudie Chemotherapeutikum mit mAb und als Vergleichs-mAbs kommen sicherlich Rituximab bzw. der Nachfolger Ocrelizumab in Frage. Das sind die beiden mAbs, die als Blockbuster in Standarttherapien eingesetzt werden.
Eine Ethikkommission wird entscheiden, ob und wie MOR208 sich messen darf.
Ein Vergleich mit anderen nicht zugelassenen Therapien ist nicht zielführend. Es gilt, der besten zugelassenen Behandlungsform Konkurrenz zu machen und dort einen Patientennutzen zu beweisen.
MOR wird sich sicherlich die Konkurrenzsituation ansehen, bevor man weiterentwickelt, sollte sich jedoch nicht von anderen unzugelassenen Therapien abschrecken lassen. Rituxan wäre der Vergleich…
Das wäre ungefähr so, dass ich bei einem Wettkampf nicht starte, nur weil ich glaube, dass der/die anderen ohnehin besser sind und ich keine Chance habe. Das Ergebnis ist das Resultat und nicht die Vermutung wer gewinnt.…und Rituxan war sicherlich bei allen Patienten in der Vorbehandlung dabei, also auch bei denen mit Ansprechrate.
Wie gesagt, dabei hat eine Ethikkommission ein gewichtiges Wort!
CART ist bislang ein experimenteller Ansatz mit interessanten Resultaten, allerdings mit starken Nebenwirkungen. Der cytokine release storm,der mich an den Fehlschlag bei Tegenero (TGN1412) erinnert, muss hier mit anderen Medikamenten unterdrückt werden.
30% Ansprechrate bei MOR208 sind erste Anzeichen von Wirksamkeit! Ohne Frage ist eine höhere Ansprechrate wünschenswert, aber es wurden nur stark vorbehandelte Patienten in dieser 1/2a Studie untersucht!
Antwort auf Beitrag Nr.: 45.593.343 von rollingovermilestones am 09.10.13 10:41:32Ein CRS ist im übrigen auch bei Blinatumomab im Rahmen eines first dose Effekts beobachtet worden, ließ sich aber durch Reduktion der Tumorlast mittels Steroiden bzw. mit einer niedrigeren Anfangsdosis umgehen. In einem Fall wurde - wie bei CART19 - das CRS erfolgreich ein anti IL-6-R-Antikörper behandelt. Etwas kritischer dürften bei Blinatumomab die ZNS-Affektionen sein.
Zum Patientenkollektiv: Hier sehe ich auf den ersten Blick keine nennenswerten Unterschiede ... auch die CART19-Patienten waren zuvor "austherapiert"!
Deine Aussage, ein Vergleich mit anderen nicht zugelassenen Therapien sei nicht zielführend, teile ich nicht. Im Gegenteil: Bevor größere Investitionsentscheidungen getroffen werden, muss man in jedem Fall sorgfältig abwägen, welche Konkurrenzentwicklungen sich mit welchen Resultaten in der klinischen Entwicklung befinden. Ich bin davon überzeugt, dass man sich bei Morphosys die Konkurrenzdaten im Detail ansehen wird, bevor man weiteren Entscheidungen trifft.
Zum Patientenkollektiv: Hier sehe ich auf den ersten Blick keine nennenswerten Unterschiede ... auch die CART19-Patienten waren zuvor "austherapiert"!
Deine Aussage, ein Vergleich mit anderen nicht zugelassenen Therapien sei nicht zielführend, teile ich nicht. Im Gegenteil: Bevor größere Investitionsentscheidungen getroffen werden, muss man in jedem Fall sorgfältig abwägen, welche Konkurrenzentwicklungen sich mit welchen Resultaten in der klinischen Entwicklung befinden. Ich bin davon überzeugt, dass man sich bei Morphosys die Konkurrenzdaten im Detail ansehen wird, bevor man weiteren Entscheidungen trifft.
Zitat von Joschka Schröder: Ein CRS ist im übrigen auch bei Blinatumomab im Rahmen eines first dose Effekts beobachtet worden, ließ sich aber durch Reduktion der Tumorlast mittels Steroiden bzw. mit einer niedrigeren Anfangsdosis umgehen. In einem Fall wurde - wie bei CART19 - das CRS erfolgreich ein anti IL-6-R-Antikörper behandelt. Etwas kritischer dürften bei Blinatumomab die ZNS-Affektionen sein.
Zum Patientenkollektiv: Hier sehe ich auf den ersten Blick keine nennenswerten Unterschiede ... auch die CART19-Patienten waren zuvor "austherapiert"!
Deine Aussage, ein Vergleich mit anderen nicht zugelassenen Therapien sei nicht zielführend, teile ich nicht. Im Gegenteil: Bevor größere Investitionsentscheidungen getroffen werden, muss man in jedem Fall sorgfältig abwägen, welche Konkurrenzentwicklungen sich mit welchen Resultaten in der klinischen Entwicklung befinden. Ich bin davon überzeugt, dass man sich bei Morphosys die Konkurrenzdaten im Detail ansehen wird, bevor man weiteren Entscheidungen trifft.
Ich glaube, da meinen wir das gleiche:
"....MOR wird sich sicherlich die Konkurrenzsituation ansehen, bevor man weiterentwickelt, sollte sich jedoch nicht von anderen unzugelassenen Therapien abschrecken lassen. Rituxan wäre der Vergleich…"
Antwort auf Beitrag Nr.: 45.593.641 von rollingovermilestones am 09.10.13 11:20:49So ganz meinen wir wohl nicht das gleiche: Als Vergleichsmaßstab sollten meines Erachtens nicht nur bereits etablierte Therapien gelten, sondern auch klinische Entwicklungspräparate anderer Unternehmen.
Zitat von Joschka Schröder: So ganz meinen wir wohl nicht das gleiche: Als Vergleichsmaßstab sollten meines Erachtens nicht nur bereits etablierte Therapien gelten, sondern auch klinische Entwicklungspräparate anderer Unternehmen.
Das gehört sicherlich zur Konkurrenzsituation.
Eine Marktanlalyse ebenso.
Jedoch gibt es in der Regel Platz für mehrere Therapeutika im gleichen Markt und zwischen diesen sind zudem Synergien möglich.
Bei den Antikörpern gegen Entzündungen kann ich dir einen ganzen Strauß aufzählen, der unterschiedliche targets bedient. Zudem gibt es noch die ganzen "MeToo'S"...
Das ist dir natürlich auch bekannt....
Deshalb sollte auch alles was (verträglich) wirkt, entwickelt und zugelassen werden. Ob es sich rechnet, muss bei Kapitalunternehmen sicherlich eine Rolle spielen. Für den Patientennutzen ist es ohne Belang (hier wäre es ethisch besser, möglichst viele Präparate zur Auswahl zu haben).
Auf jeden Fall ist eine durchschlagene Therapie besser, als eine mit schlechterer Ansprechrate und höherem Risiko. 100% sind immer besser als 30%. Bloß wo gibt es solche Resultate? Die fallen nicht vom Himmel!
Das Entwicklungsrisiko ist immens. Jedoch gibt es immer wieder Zulassungserfolge bei zweifelhaften Nutzen. Anti-CD20 und anti-VEGF wirken auch nicht bei allen zugelassenen Diagnosen und werden trotzdem verschrieben. Evidence based medicine ist noch weit weg!
Ich habe Vertrauen, dass die Entscheidungsträger bei MOR das Risiko gegen den möglichen Ertrag abwägen.
Neues aus der Kooperation mit Heptares -> http://www.heptares.com/news/145/74/Heptares-Delivers-first-…
Antwort auf Beitrag Nr.: 45.601.031 von Joschka Schröder am 10.10.13 11:12:30
LJM716 wird wohl kein Blockbuster...
http://www.ncbi.nlm.nih.gov/pubmed/23928993
LJM716 wird wohl kein Blockbuster...
http://www.ncbi.nlm.nih.gov/pubmed/23928993
Antwort auf Beitrag Nr.: 45.601.329 von rollingovermilestones am 10.10.13 11:46:39
Hier noch Veröffentlichungen von Bayer, Roche und BI
Konjugat-mAb (BAY 79-4620)
http://www.ncbi.nlm.nih.gov/pubmed/22147747
Protease-Activated Receptor-2 (BI)
(ist nicht der IGF1/2 anti-Cancer mAb von BI)
http://www.ncbi.nlm.nih.gov/pubmed/22129678
Gantenerumab (Roche)
http://www.ncbi.nlm.nih.gov/pubmed/21955818
Hier noch Veröffentlichungen von Bayer, Roche und BI
Konjugat-mAb (BAY 79-4620)
http://www.ncbi.nlm.nih.gov/pubmed/22147747
Protease-Activated Receptor-2 (BI)
(ist nicht der IGF1/2 anti-Cancer mAb von BI)
http://www.ncbi.nlm.nih.gov/pubmed/22129678
Gantenerumab (Roche)
http://www.ncbi.nlm.nih.gov/pubmed/21955818
Am kommenden Dienstag bei der ANA-Tagung ist es so weit:
Treatment of Sporadic Inclusion Body Myositis with an Anti-Activin Receptor IIB Antibody
Anthony A. Amato, Kumaraswamy Sivakumar, Namita Goyal, William David, Richard J. Barohn, Mohammad Salajegheh, Didier Laurent, Jens Praestgaard, Estelle Trifilieff, Anne-Ulrike Trendelenburg,David J. Glass, Ronenn Roubenoff, Brian S. Tseng and Steven A. Greenberg. Boston, MA; Phoenix, AZ; Kansas City, KS and Cambridge, MA
Treatment of Sporadic Inclusion Body Myositis with an Anti-Activin Receptor IIB Antibody
Anthony A. Amato, Kumaraswamy Sivakumar, Namita Goyal, William David, Richard J. Barohn, Mohammad Salajegheh, Didier Laurent, Jens Praestgaard, Estelle Trifilieff, Anne-Ulrike Trendelenburg,David J. Glass, Ronenn Roubenoff, Brian S. Tseng and Steven A. Greenberg. Boston, MA; Phoenix, AZ; Kansas City, KS and Cambridge, MA
Zitat von rollingovermilestones: LJM716 wird wohl kein Blockbuster...
http://www.ncbi.nlm.nih.gov/pubmed/23928993
Deine Skepsis kann ich nicht recht nachvollziehen.
Ich habe die Arbeit durchgelesen und finde die Ergebnisse durchaus beeindruckend.
1. Die Kombi aus Trastuzumab (Herceptin) + LJM716 wirkt in vitro und in vivo besser als die Kombi aus Trastuzumab + Pertuzumab (Perjeta). Warum sollte LJM716 daher nicht größeres wirtschaftliches Potential besitzen als Pertuzumab?
2. Die Wirkung von Cetuximab (Erbitux) wird bei gleichzeitiger Gabe von LJM716 deutlich gesteigert. Auch hier sprechen die bisherigen Daten für eine spätere Kombibehandlung.
3. Der Wirkmechanismus läßt erwarten, dass LJM716 genauso synergistisch mit T-DM1 (Kadcyla) und - im Fall dessen erfolgreicher Entwicklung - IMGN289 kombiniert werden kann.
Fazit: Aus meiner Sicht handelt es sich bei LJM716 um eine äußerst vielversprechende Entwicklung.
Antwort auf Beitrag Nr.: 45.606.645 von Joschka Schröder am 10.10.13 21:29:21LJM716 ist weniger als Monotherapeutikum konzipiert, sondern soll in Kombination mit HER1- und HER2-Antagonisten zur Anwendung kommen. Dies beeinträchtigt jedoch nicht das wirtschaftliche Potential dieses Antikörpers ... im Gegenteil!
Noch zu LJM716: Einschränkend muss sollte man jedoch erwähnen, dass sich LJM716 gegen Konkurrenzpräparate wie RO5479599 (GlycoMab von Roche, ähnlich konstruiert wie obinutuzumab) behaupten muss. Zur Konkurrenzsituation gelegentlich mehr.
Newsflow(erwartungs)liste 2013
Stand 11.10.2013
Eigene Pipeline:
* MOR103: Partnervertrag mit GlaxoSmithKline, upfront 22,5, MS 423, Tantieme 2-stellig, 3.6.2013
MOR103: Namensgebung XXXumab durch GSK
MOR103: P1b-MS-Studie Abschluss
MOR103: P1b-MS-Studie Auswertung
MOR103: Studienanmeldung für P2b-Studie, Indikation RAMOR103: Weitere Indikationen in P1b/P2a
MOR103: Präklinische Informationen in weiteren Indikationen
* MOR202: Parntervertrag mit Celgene, upfront 70,8, KE 46,2, MS 628, Tantieme 2-stellig, 26.6.2013
* MOR202: MOR zu Celgene 1/3 zu 2/3 Entwicklungskosten, Option Europavermarktung zu 50%, 26.6.2013
* MOR202: Zustimmung der US-Kartellbehörden im Rahmen des Hart-Scott-Rodino Act, 10.8.2013
MOR202: forcierte Planung weiterer Studien mit Celgene
MOR202: MM-Studie: Zwischenstandsmeldungen zur Rekrutierung und zu den Studienarmen
MOR202: Einzelfallpräsentation/Zwischenergebnisse -> ASH
* MOR208: Start P2 in ALL, akute Lymphatischer B-Zell-Leukämie, 26.4.2013
* MOR208: Start P2 in NHL, Non-Hodgkin-Lymphom, 13.5.2013
* MOR208: Ergebnis erweiterte P2a: CLL/SLL: Verlängerung resultiert in höherer Ansprechrate, 7.10.2013
* MOR208: Optionen für P2-Kombinationsstudien in CLL werden untersucht, 7.10.2013
MOR208: Wissenschaftliche Veröffentlichung mit Details der CLL/SLL-Studie geplant
MORxxx: Statusänderungen, Indikationen und Zielmoleküle zu Projekten im vorklinischen Bereich
MORxxx: Weitere neue Projekte schaffen es von der Evaluierung zum offiziellen Projektstart
Co-Entwicklung Galapagos: Details zu Projekten
Co-Entwicklung Absynth: Details zu Projekten
Vereinbarungen über Co-Entwicklungen mit weiteren Partnern
Einlizenzierung/Übernahme von Projekten Dritter
Partnerpipeline:
* 1. IND 2013: Novartis mit Augenheilkundeprogramm, 2.5.2013
* 2. P1-Start 2013: Janssen, CNTO3157, Asthma, 17.9.2013
3. IND 2013: XXX
* 1. P2-Start 2013: Janssen, CNTO6785, rheumatoide Arthritis, 17.9.201
2. P2-Start 2013: XXX (VAY736)
3. P2-Start 2013: XXX
* 1. P3-Start 2013: Novartis, Bimagrumab/BYM338, sporadische Einschlusskörpermyositis, 2.10.2013
2. P3-Start 2013: XXX
Daten/Zwischenergebnisse diverser Partner zu diversen Programmen
Insbesondere Gantenerumab, BHQ880, CNTO888, BPS804, BYM338, LFG316 und CNTO1959
Weitere Projektbezeichnungen und Indikationen aus der klinischen Pipeline werden bekannt
Technologie und Partnerschaften
* Erstes Patent für neue Antikörperplattform Ylanthia in den USA, 8.2.2013
* Zusammenarbeit mit Heptares zur Entwicklung von tAKs gegen GPCR-Moleküle, 13.2.2013
* wissenschaftliche Veröffentlichung zur neuen Antikörper-Plattform Ylanthia, 10.5.2013
* Heptares erreicht 1. Meilenstein, Selektion des 1. GPCR-targets durch Morphosys, 10.10.2013
slonomics Partnerschaft(en)
arYla Partnerschaft(en)
Ylanthia Partnerschaft(en)
Innovationskapital
Forschungs- und Diagnostiksparte:
* MorphoSys vollzieht Verkauf von AbD Serotec an Bio-Rad für 53 mio€, 10.1.2013
* Morphosys gibt Sparte auf, zugunsten einer Focusierung aufs Kerngeschäft
Zahlen und Allgemeines:
* MOR gibt Ergebnisse für das Geschäftsjahr 2012 bekannt, 13.2.2013
* 2013E: Umsatz 48 bis 52. EBIT -18 bis -22, ohne MOR103-Deal 13.2.2013
* 2013E: Umsatz 68 bis 72. EBIT -2 bis +2, nach MOR103-Deal 3.6.2013
* MorphoSys beginnt mit Aktienrückkaufprogramm, 22.4.2013
* Q1 mit 16,9 (11,7) mio€ Umsatz, EBIT 2,5 (-0,7), 3.5.2013
* Wegen Upfront 70,8 mio durch celgene, zusätzliche F&E, Prognose unter Vorbehalt, 26.6.2013
* HJ 48,2 (24,4) mio€ Umsatz, EBIT 17,3 (-1,3), 31.7.2013
* Celgene erhält 797.150 Aktien für 46,2 mio€, Kurs 57,90€ (5% Premium), 3,4% Anteil, 10.8.2013
* 2. Prognoseanhebung 2013E: Umsatz 74 bis 78, EBIT +2 bis +6 mio, nach Celgene-Deal, 10.8.2013
* MorphoSys erlöst 84 mio€ aus Kapitalerhöhung, 1.514.066 Aktien zu 55,76€, 19.9.2013
Stimmrechtsmeldungen/Beteiligung
Entscheidung/Planungsbeginn Umzug, neuer Standort
Akquise
Legende:
Mit * ist schon passiert
Rot: Erst kürzlich erreicht
Grün: Von mir in naher Zukunft erwartet
Stand 11.10.2013
Eigene Pipeline:
* MOR103: Partnervertrag mit GlaxoSmithKline, upfront 22,5, MS 423, Tantieme 2-stellig, 3.6.2013
MOR103: Namensgebung XXXumab durch GSK
MOR103: P1b-MS-Studie Abschluss
MOR103: P1b-MS-Studie Auswertung
MOR103: Studienanmeldung für P2b-Studie, Indikation RAMOR103: Weitere Indikationen in P1b/P2a
MOR103: Präklinische Informationen in weiteren Indikationen
* MOR202: Parntervertrag mit Celgene, upfront 70,8, KE 46,2, MS 628, Tantieme 2-stellig, 26.6.2013
* MOR202: MOR zu Celgene 1/3 zu 2/3 Entwicklungskosten, Option Europavermarktung zu 50%, 26.6.2013
* MOR202: Zustimmung der US-Kartellbehörden im Rahmen des Hart-Scott-Rodino Act, 10.8.2013
MOR202: forcierte Planung weiterer Studien mit Celgene
MOR202: MM-Studie: Zwischenstandsmeldungen zur Rekrutierung und zu den Studienarmen
MOR202: Einzelfallpräsentation/Zwischenergebnisse -> ASH
* MOR208: Start P2 in ALL, akute Lymphatischer B-Zell-Leukämie, 26.4.2013
* MOR208: Start P2 in NHL, Non-Hodgkin-Lymphom, 13.5.2013
* MOR208: Ergebnis erweiterte P2a: CLL/SLL: Verlängerung resultiert in höherer Ansprechrate, 7.10.2013
* MOR208: Optionen für P2-Kombinationsstudien in CLL werden untersucht, 7.10.2013
MOR208: Wissenschaftliche Veröffentlichung mit Details der CLL/SLL-Studie geplant
MORxxx: Statusänderungen, Indikationen und Zielmoleküle zu Projekten im vorklinischen Bereich
MORxxx: Weitere neue Projekte schaffen es von der Evaluierung zum offiziellen Projektstart
Co-Entwicklung Galapagos: Details zu Projekten
Co-Entwicklung Absynth: Details zu Projekten
Vereinbarungen über Co-Entwicklungen mit weiteren Partnern
Einlizenzierung/Übernahme von Projekten Dritter
Partnerpipeline:
* 1. IND 2013: Novartis mit Augenheilkundeprogramm, 2.5.2013
* 2. P1-Start 2013: Janssen, CNTO3157, Asthma, 17.9.2013
3. IND 2013: XXX
* 1. P2-Start 2013: Janssen, CNTO6785, rheumatoide Arthritis, 17.9.201
2. P2-Start 2013: XXX (VAY736)
3. P2-Start 2013: XXX
* 1. P3-Start 2013: Novartis, Bimagrumab/BYM338, sporadische Einschlusskörpermyositis, 2.10.2013
2. P3-Start 2013: XXX
Daten/Zwischenergebnisse diverser Partner zu diversen Programmen
Insbesondere Gantenerumab, BHQ880, CNTO888, BPS804, BYM338, LFG316 und CNTO1959
Weitere Projektbezeichnungen und Indikationen aus der klinischen Pipeline werden bekannt
Technologie und Partnerschaften
* Erstes Patent für neue Antikörperplattform Ylanthia in den USA, 8.2.2013
* Zusammenarbeit mit Heptares zur Entwicklung von tAKs gegen GPCR-Moleküle, 13.2.2013
* wissenschaftliche Veröffentlichung zur neuen Antikörper-Plattform Ylanthia, 10.5.2013
* Heptares erreicht 1. Meilenstein, Selektion des 1. GPCR-targets durch Morphosys, 10.10.2013
slonomics Partnerschaft(en)
arYla Partnerschaft(en)
Ylanthia Partnerschaft(en)
Innovationskapital
Forschungs- und Diagnostiksparte:
* MorphoSys vollzieht Verkauf von AbD Serotec an Bio-Rad für 53 mio€, 10.1.2013
* Morphosys gibt Sparte auf, zugunsten einer Focusierung aufs Kerngeschäft
Zahlen und Allgemeines:
* MOR gibt Ergebnisse für das Geschäftsjahr 2012 bekannt, 13.2.2013
* 2013E: Umsatz 48 bis 52. EBIT -18 bis -22, ohne MOR103-Deal 13.2.2013
* 2013E: Umsatz 68 bis 72. EBIT -2 bis +2, nach MOR103-Deal 3.6.2013
* MorphoSys beginnt mit Aktienrückkaufprogramm, 22.4.2013
* Q1 mit 16,9 (11,7) mio€ Umsatz, EBIT 2,5 (-0,7), 3.5.2013
* Wegen Upfront 70,8 mio durch celgene, zusätzliche F&E, Prognose unter Vorbehalt, 26.6.2013
* HJ 48,2 (24,4) mio€ Umsatz, EBIT 17,3 (-1,3), 31.7.2013
* Celgene erhält 797.150 Aktien für 46,2 mio€, Kurs 57,90€ (5% Premium), 3,4% Anteil, 10.8.2013
* 2. Prognoseanhebung 2013E: Umsatz 74 bis 78, EBIT +2 bis +6 mio, nach Celgene-Deal, 10.8.2013
* MorphoSys erlöst 84 mio€ aus Kapitalerhöhung, 1.514.066 Aktien zu 55,76€, 19.9.2013
Stimmrechtsmeldungen/Beteiligung
Entscheidung/Planungsbeginn Umzug, neuer Standort
Akquise
Legende:
Mit * ist schon passiert
Rot: Erst kürzlich erreicht
Grün: Von mir in naher Zukunft erwartet
Antwort auf Beitrag Nr.: 45.593.995 von rollingovermilestones am 09.10.13 12:05:30
Hier ein paar Daten zu MOR208 die von Xencor offengelegt wurden:
XmAb5574/MOR208, a Cytotoxic B-cell Depleting Product Candidate for the Treatment of B-cell Cancers
Background and Market Opportunity
XmAb5574/MOR208 is a monoclonal antibody that targets CD19 and incorporates our Cytotoxic Fc Domain technology to kill malignant B cells. In contrast to XmAb5871, which uses our Immune Inhibitor Fc Domain, XmAb5574/MOR208 targets cancer cells where depletion is the goal in treating the disease.
B-cell cancers include lymphomas such as the non-Hodgkin Lymphomas (NHL) and leukemias such as chronic lymphocytic leukemia (CLL) and acute lymphoblastic leukemia (ALL). Collectively, lymphomas represent about five percent of all cancers diagnosed in the United States. NHL is the most prevalent of all lymphoproliferative diseases, with the National Cancer Institute estimating that over 69,000 new cases will be reported in the United States in 2013, and 85% of NHLs are classified as B-cell disorders. The Leukemia and Lymphoma Society estimates that over 16,000 new cases of CLL and over 6,000 new cases of ALL will be reported in 2013. CD19, the target of XmAb5871's Fv domain, is a B-cell surface protein that is highly expressed on the tumor cells in NHL and many leukemias, including ALL and CLL. We believe that targeting CD19 with XmAb5574/MOR208 offers potential advantages over the current standard of care for B-cell malignancies, which is treatment with Rituxan plus chemotherapy. Rituxan, an anti-CD20 antibody, plus chemotherapy has successfully treated many B-cell NHLs and some B-cell leukemias, demonstrating the utility of antibodies targeting B-cell diseases. Although the Rituxan-chemotherapy regimen has led to major improvements in response rates and progression-free survival, the majority of patients relapse and many lose responsiveness to Rituxan treatment.
Overview
XmAb5574/MOR208 is a monoclonal antibody that targets CD19 and incorporates our Cytotoxic Fc Domain technology for killing of malignant B cells. XmAb5574/MOR208 was discovered by us and is now being developed by MorphoSys, pursuant to a collaboration and license agreement that we entered into in June 2010. Under this agreement, we granted MorphoSys an exclusive worldwide license to XmAb5574/MOR208 for all indications. We were responsible for completing a Phase 1 clinical trial of XmAb5574/MOR208 in CLL, which was completed in January 2013. MorphoSys is solely responsible, at its own cost, for all other development and commercialization activities. MorphoSys commenced Phase 2 clinical trials in patients with B-ALL and NHL, in April and May 2013, respectively.
We humanized XmAb5574/MOR208 with our proprietary technology and applied our Cytotoxic Fc Domain to enhance binding to the human Fc receptors FcgRIIIa and FcgRIIa, thereby enhancing recruitment of natural killer (NK) cells and other FcgR-bearing effector cells. We applied further engineering to the CD19-binding Fv domain of XmAb5574/MOR208 to enhance its affinity over 10-fold for human CD19, and also increased its affinity for monkey CD19, enabling monkey toxicology and efficacy studies.
CD19 is an alternative target to CD20 that can be used in salvage regimens for patients failing Rituxan. Further, CD19 is expressed on the B cell surface earlier in development and persists longer through B-cell maturation. Therefore, XmAb5574/MOR208 may be able to target a broader spectrum of lymphoid malignancies, such as ALL or CLL, where Rituxan's efficacy may be limited. Finally, we believe that combination therapy of XmAb5574/MOR208 with immunomodulatory agents, such as lenalidomide, and/or new chemotherapy agents, offers the potential for superior efficacy to existing therapies.

◦ XmAb5574 recruits Natural Killer cells to malignant B cells to promote their destruction.
Clinical Development Summary
In preclinical studies, we demonstrated that XmAb5574/MOR208 had FcgR-dependent anti-tumor activity against multiple human B-cell lymphomas in vitro and strong anti-tumor effects in mouse lymphoma models. We also demonstrated favorable half-life and potent B-cell depletion in monkey models. Our completed Phase 1 multiple ascending dose clinical trial in patients with CLL demonstrated an acceptable safety profile and encouraging signs of anti-tumor activity.
• Phase 1 clinical trial
In January 2013, we completed a Phase 1 clinical trial of XmAb5574/MOR208 in patients with high-risk, heavily-pretreated CLL, in which the antibody showed encouraging signs of preliminary anti-tumor activity and an acceptable safety profile and was well tolerated. Dose levels from 0.3 to 12 mg/kg were tested. The trial protocol was amended to include a period of extended dosing for a total of eight patients at the 12 mg/kg dose to study the effect of longer duration of exposure on safety and response rate.
The primary endpoints for this clinical trial were safety, pharmacokinetics and immunogenicity. The secondary endpoints for this clinical trial included clinical responses assessed according to International Working Group on CLL (IWCLL) 2008 and 1996 Guidelines. Overall response rate by IWCLL 2008 criteria was 29.6% (eight partial responses in 27 evaluable patients). Using IWCLL 1996, response criteria resulted in a response rate of 66.7% (18 partial responses).
We expect regulatory approval of oncology therapies to require progression-free survival data or overall survival data.
During the Phase 1 clinical trial, the most common adverse events were mild to moderate infusion reactions which were experienced only with the first dose. Clinically-significant, treatment-related adverse events classified as Grade 3 or higher occurred in 5 out of 27 patients. One patient treated at the 1 mg/kg dose level experienced neutropenia (low white blood cells). Four patients at the 12 mg/kg dose level experienced one or more of neutropenia, febrile neutropenia (neutropenia with fever), thrombocytopenia (low platelets), elevated aspartate aminotransferase (liver enzyme level) or tumor lysis syndrome (metabolic toxicity linked to rapid destruction of tumor cells). Only one dose-limiting toxicity, neutropenia, was observed and this was in one of the 16 patients treated at the 12 mg/kg dose level. No maximum tolerated dose was reached in this clinical trial.
• Further Clinical Development
Based on the Phase 1 clinical trial results, MorphoSys decided to continue the development of XmAb5574/MOR208 and has initiated two Phase 2 clinical trials of XmAb5574/MOR208 in patients
with ALL and NHL, respectively.
The Phase 2 clinical trial in ALL began in April 2013 and is an open-label, multicenter, single-arm clinical trial designed to assess efficacy in patients suffering from relapsed or refractory B-ALL. Secondary outcome measures include response duration, safety and pharmacokinetics of XmAb5574/MOR208. In total, 30 patients are planned to be enrolled.
The Phase 2 clinical trial in NHL began in May 2013 and is an open-label, multicenter, single-arm clinical trial designed to assess the efficacy of XmAb5574/MOR208 in patients with relapsed or refractory NHL. Secondary outcome measures include response duration, safety and pharmacokinetics of XmAb5574/MOR208. A total of up to 120 patients are planned to be enrolled in four separate sub-indications (follicular lymphoma, MCL, diffuse large B-cell lymphoma, and other forms of NHL).
Additional clinical trials in other B-cell malignancies and in combination with chemotherapy are possible and will be conducted at the discretion of and under the control of MorphoSys.
Preclinical Development Summary
Our preclinical observations include:
• • Cytotoxicity against multiple lymphoma cell lines;
•
• • Cytotoxicity against malignant cells from ALL and MCL patients;
•
• • Inhibition of tumor growth in mouse xenograft models;
•
• • Rapid and sustained depletion of peripheral and tissue B cells in monkeys; and
•
• • Well tolerated at high doses in monkeys.
In preclinical in vitro studies, we tested XmAb5574/MOR208 for ADCC activity against a large number of lymphoma-derived tumor cell lines. In these studies, XmAb5574/MOR208 was shown to mediate strong NK-mediated killing against the CD19-positive tumor cell lines tested.
Similar tests were performed with tumor cells taken directly from patients with either ALL or mantle cell lymphoma (MCL). In these studies, XmAb5574/MOR208 demonstrated substantial ADCC activity against both types of lymphomas.
In all contexts examined, the control antibody, which is identical to XmAb5574/MOR208 except its Fc domain is an unmodified Fc domain (anti-CD19 IgG1), showed greatly reduced ADCC, in some cases with no detectable killing of tumor cells. This comparison highlights the impact of our Cytotoxic Fc Domain technology on the ability of anti-CD19 antibodies to recruit NK cells and attack tumor cells. In addition to NK-mediated killing, the presumed dominant mechanism of action, we also observed macrophage-mediated phagocytosis of tumor cells in vitro, and a direct anti-tumor effect (requiring no effector cells such as NK or macrophage) in which the antibody appears to slow the growth of some tumor lines.
We used mouse xenograft models to examine the in vivo activity of XmAb5574/MOR208 against subcutaneously implanted lymphoma cells. The antibody inhibits lymphoma growth in both prophylactic (tumor-prevention) models and established tumor models. Notably, anti-CD19 antibodies with unmodified Fc domains had diminished anti-tumor activity compared to XmAb5574/MOR208.
Although the precursor antibody does not react strongly with monkey CD19 or B cells, our affinity-enhanced Fv domain does react well with monkey B cells, and this enabled further POC and toxicology studies in cynomolgus monkeys. We performed an initial high-dose (10 mg/kg) study in monkeys and observed rapid depletion of peripheral B cells after a single dose of the antibody, ultimately reducing the B cells to less than five percent of their starting numbers. Significant B-cell reductions were also observed in the bone marrow, spleen and lymph nodes, notable because of Rituxan's relatively poor ability to impact tissue-resident B cells. The 10 mg/kg dose was well-tolerated by the monkeys, with no adverse effects.
In additional monkey studies, we compared the ability of different doses of XmAb5574/MOR208 to deplete monkey B cells and observed significant B-cell reductions at lower doses, 1 and 3 mg/kg. In a final study to demonstrate the impact of our Cytotoxic Fc Domain technology on in vivo tumor cell killing, we compared the ability of XmAb5574/MOR208 to an unmodified IgG1 control antibody (anti-CD19 IgG1) to deplete monkey B cells at a 3 mg/kg dose (figure below). The XmAb5574/MOR208-treated animals displayed a marked drop in peripheral B-cell counts. The unmodified control antibody anti-CD19 IgG1, on the other hand, did not noticeably affect B-cell counts and was indistinguishable from the effects of treatment with vehicle alone.

◦ A single dose of XmAb5574/MOR208 depletes peripheral B cells in cynomolgus monkeys. A control anti-CD19 antibody containing an unmodified IgG1 Fc domain and placebo, consisting of the buffer vehicle, have no effect on B cells.
XmAb5574/MOR208 is being developed for the treatment of blood-based cancers and uses our Cytotoxic Fc Domain. Our partner, MorphoSys AG (MorphoSys), is currently conducting two Phase 2 clinical trials of XmAb5574/MOR208 in patients with B-cell acute lymphoblastic leukemia (B-ALL) and non-Hodgkin lymphomas (NHL). According to the Leukemia and Lymphoma Society, over 60,000 Americans are diagnosed with these cancers each year. Rituxan, the leading antibody therapy for NHL, generated approximately $6.1 billion in worldwide oncology sales in 2012.
Hier ein paar Daten zu MOR208 die von Xencor offengelegt wurden:
XmAb5574/MOR208, a Cytotoxic B-cell Depleting Product Candidate for the Treatment of B-cell Cancers
Background and Market Opportunity
XmAb5574/MOR208 is a monoclonal antibody that targets CD19 and incorporates our Cytotoxic Fc Domain technology to kill malignant B cells. In contrast to XmAb5871, which uses our Immune Inhibitor Fc Domain, XmAb5574/MOR208 targets cancer cells where depletion is the goal in treating the disease.
B-cell cancers include lymphomas such as the non-Hodgkin Lymphomas (NHL) and leukemias such as chronic lymphocytic leukemia (CLL) and acute lymphoblastic leukemia (ALL). Collectively, lymphomas represent about five percent of all cancers diagnosed in the United States. NHL is the most prevalent of all lymphoproliferative diseases, with the National Cancer Institute estimating that over 69,000 new cases will be reported in the United States in 2013, and 85% of NHLs are classified as B-cell disorders. The Leukemia and Lymphoma Society estimates that over 16,000 new cases of CLL and over 6,000 new cases of ALL will be reported in 2013. CD19, the target of XmAb5871's Fv domain, is a B-cell surface protein that is highly expressed on the tumor cells in NHL and many leukemias, including ALL and CLL. We believe that targeting CD19 with XmAb5574/MOR208 offers potential advantages over the current standard of care for B-cell malignancies, which is treatment with Rituxan plus chemotherapy. Rituxan, an anti-CD20 antibody, plus chemotherapy has successfully treated many B-cell NHLs and some B-cell leukemias, demonstrating the utility of antibodies targeting B-cell diseases. Although the Rituxan-chemotherapy regimen has led to major improvements in response rates and progression-free survival, the majority of patients relapse and many lose responsiveness to Rituxan treatment.
Overview
XmAb5574/MOR208 is a monoclonal antibody that targets CD19 and incorporates our Cytotoxic Fc Domain technology for killing of malignant B cells. XmAb5574/MOR208 was discovered by us and is now being developed by MorphoSys, pursuant to a collaboration and license agreement that we entered into in June 2010. Under this agreement, we granted MorphoSys an exclusive worldwide license to XmAb5574/MOR208 for all indications. We were responsible for completing a Phase 1 clinical trial of XmAb5574/MOR208 in CLL, which was completed in January 2013. MorphoSys is solely responsible, at its own cost, for all other development and commercialization activities. MorphoSys commenced Phase 2 clinical trials in patients with B-ALL and NHL, in April and May 2013, respectively.
We humanized XmAb5574/MOR208 with our proprietary technology and applied our Cytotoxic Fc Domain to enhance binding to the human Fc receptors FcgRIIIa and FcgRIIa, thereby enhancing recruitment of natural killer (NK) cells and other FcgR-bearing effector cells. We applied further engineering to the CD19-binding Fv domain of XmAb5574/MOR208 to enhance its affinity over 10-fold for human CD19, and also increased its affinity for monkey CD19, enabling monkey toxicology and efficacy studies.
CD19 is an alternative target to CD20 that can be used in salvage regimens for patients failing Rituxan. Further, CD19 is expressed on the B cell surface earlier in development and persists longer through B-cell maturation. Therefore, XmAb5574/MOR208 may be able to target a broader spectrum of lymphoid malignancies, such as ALL or CLL, where Rituxan's efficacy may be limited. Finally, we believe that combination therapy of XmAb5574/MOR208 with immunomodulatory agents, such as lenalidomide, and/or new chemotherapy agents, offers the potential for superior efficacy to existing therapies.

◦ XmAb5574 recruits Natural Killer cells to malignant B cells to promote their destruction.
Clinical Development Summary
In preclinical studies, we demonstrated that XmAb5574/MOR208 had FcgR-dependent anti-tumor activity against multiple human B-cell lymphomas in vitro and strong anti-tumor effects in mouse lymphoma models. We also demonstrated favorable half-life and potent B-cell depletion in monkey models. Our completed Phase 1 multiple ascending dose clinical trial in patients with CLL demonstrated an acceptable safety profile and encouraging signs of anti-tumor activity.
• Phase 1 clinical trial
In January 2013, we completed a Phase 1 clinical trial of XmAb5574/MOR208 in patients with high-risk, heavily-pretreated CLL, in which the antibody showed encouraging signs of preliminary anti-tumor activity and an acceptable safety profile and was well tolerated. Dose levels from 0.3 to 12 mg/kg were tested. The trial protocol was amended to include a period of extended dosing for a total of eight patients at the 12 mg/kg dose to study the effect of longer duration of exposure on safety and response rate.
The primary endpoints for this clinical trial were safety, pharmacokinetics and immunogenicity. The secondary endpoints for this clinical trial included clinical responses assessed according to International Working Group on CLL (IWCLL) 2008 and 1996 Guidelines. Overall response rate by IWCLL 2008 criteria was 29.6% (eight partial responses in 27 evaluable patients). Using IWCLL 1996, response criteria resulted in a response rate of 66.7% (18 partial responses).
We expect regulatory approval of oncology therapies to require progression-free survival data or overall survival data.
During the Phase 1 clinical trial, the most common adverse events were mild to moderate infusion reactions which were experienced only with the first dose. Clinically-significant, treatment-related adverse events classified as Grade 3 or higher occurred in 5 out of 27 patients. One patient treated at the 1 mg/kg dose level experienced neutropenia (low white blood cells). Four patients at the 12 mg/kg dose level experienced one or more of neutropenia, febrile neutropenia (neutropenia with fever), thrombocytopenia (low platelets), elevated aspartate aminotransferase (liver enzyme level) or tumor lysis syndrome (metabolic toxicity linked to rapid destruction of tumor cells). Only one dose-limiting toxicity, neutropenia, was observed and this was in one of the 16 patients treated at the 12 mg/kg dose level. No maximum tolerated dose was reached in this clinical trial.
• Further Clinical Development
Based on the Phase 1 clinical trial results, MorphoSys decided to continue the development of XmAb5574/MOR208 and has initiated two Phase 2 clinical trials of XmAb5574/MOR208 in patients
with ALL and NHL, respectively.
The Phase 2 clinical trial in ALL began in April 2013 and is an open-label, multicenter, single-arm clinical trial designed to assess efficacy in patients suffering from relapsed or refractory B-ALL. Secondary outcome measures include response duration, safety and pharmacokinetics of XmAb5574/MOR208. In total, 30 patients are planned to be enrolled.
The Phase 2 clinical trial in NHL began in May 2013 and is an open-label, multicenter, single-arm clinical trial designed to assess the efficacy of XmAb5574/MOR208 in patients with relapsed or refractory NHL. Secondary outcome measures include response duration, safety and pharmacokinetics of XmAb5574/MOR208. A total of up to 120 patients are planned to be enrolled in four separate sub-indications (follicular lymphoma, MCL, diffuse large B-cell lymphoma, and other forms of NHL).
Additional clinical trials in other B-cell malignancies and in combination with chemotherapy are possible and will be conducted at the discretion of and under the control of MorphoSys.
Preclinical Development Summary
Our preclinical observations include:
• • Cytotoxicity against multiple lymphoma cell lines;
•
• • Cytotoxicity against malignant cells from ALL and MCL patients;
•
• • Inhibition of tumor growth in mouse xenograft models;
•
• • Rapid and sustained depletion of peripheral and tissue B cells in monkeys; and
•
• • Well tolerated at high doses in monkeys.
In preclinical in vitro studies, we tested XmAb5574/MOR208 for ADCC activity against a large number of lymphoma-derived tumor cell lines. In these studies, XmAb5574/MOR208 was shown to mediate strong NK-mediated killing against the CD19-positive tumor cell lines tested.
Similar tests were performed with tumor cells taken directly from patients with either ALL or mantle cell lymphoma (MCL). In these studies, XmAb5574/MOR208 demonstrated substantial ADCC activity against both types of lymphomas.
In all contexts examined, the control antibody, which is identical to XmAb5574/MOR208 except its Fc domain is an unmodified Fc domain (anti-CD19 IgG1), showed greatly reduced ADCC, in some cases with no detectable killing of tumor cells. This comparison highlights the impact of our Cytotoxic Fc Domain technology on the ability of anti-CD19 antibodies to recruit NK cells and attack tumor cells. In addition to NK-mediated killing, the presumed dominant mechanism of action, we also observed macrophage-mediated phagocytosis of tumor cells in vitro, and a direct anti-tumor effect (requiring no effector cells such as NK or macrophage) in which the antibody appears to slow the growth of some tumor lines.
We used mouse xenograft models to examine the in vivo activity of XmAb5574/MOR208 against subcutaneously implanted lymphoma cells. The antibody inhibits lymphoma growth in both prophylactic (tumor-prevention) models and established tumor models. Notably, anti-CD19 antibodies with unmodified Fc domains had diminished anti-tumor activity compared to XmAb5574/MOR208.
Although the precursor antibody does not react strongly with monkey CD19 or B cells, our affinity-enhanced Fv domain does react well with monkey B cells, and this enabled further POC and toxicology studies in cynomolgus monkeys. We performed an initial high-dose (10 mg/kg) study in monkeys and observed rapid depletion of peripheral B cells after a single dose of the antibody, ultimately reducing the B cells to less than five percent of their starting numbers. Significant B-cell reductions were also observed in the bone marrow, spleen and lymph nodes, notable because of Rituxan's relatively poor ability to impact tissue-resident B cells. The 10 mg/kg dose was well-tolerated by the monkeys, with no adverse effects.
In additional monkey studies, we compared the ability of different doses of XmAb5574/MOR208 to deplete monkey B cells and observed significant B-cell reductions at lower doses, 1 and 3 mg/kg. In a final study to demonstrate the impact of our Cytotoxic Fc Domain technology on in vivo tumor cell killing, we compared the ability of XmAb5574/MOR208 to an unmodified IgG1 control antibody (anti-CD19 IgG1) to deplete monkey B cells at a 3 mg/kg dose (figure below). The XmAb5574/MOR208-treated animals displayed a marked drop in peripheral B-cell counts. The unmodified control antibody anti-CD19 IgG1, on the other hand, did not noticeably affect B-cell counts and was indistinguishable from the effects of treatment with vehicle alone.

◦ A single dose of XmAb5574/MOR208 depletes peripheral B cells in cynomolgus monkeys. A control anti-CD19 antibody containing an unmodified IgG1 Fc domain and placebo, consisting of the buffer vehicle, have no effect on B cells.
XmAb5574/MOR208 is being developed for the treatment of blood-based cancers and uses our Cytotoxic Fc Domain. Our partner, MorphoSys AG (MorphoSys), is currently conducting two Phase 2 clinical trials of XmAb5574/MOR208 in patients with B-cell acute lymphoblastic leukemia (B-ALL) and non-Hodgkin lymphomas (NHL). According to the Leukemia and Lymphoma Society, over 60,000 Americans are diagnosed with these cancers each year. Rituxan, the leading antibody therapy for NHL, generated approximately $6.1 billion in worldwide oncology sales in 2012.

Antwort auf Beitrag Nr.: 45.615.635 von rollingovermilestones am 12.10.13 10:35:23
Hier ein paar mehr facts zu MOR208, als bislang veröffentlicht:
- mit acht Patienten wurde erweitert (aus der höchsten Dosisgruppe, der Rest kam nicht in Frage)
- 30% Response mit IWCLL 2008
- 67% Response mit IWCLL 1996: (18 PR !!!, 0 CR?, X SD?)
Also es passiert was, ob es reicht, werden wir sehen.
Zu beachten ist, dass die Entwicklung ohnehin vorsieht, MOR208 (ausschließlich?) in Kombinationstherapien anzuwenden. Das verbessert dann natürlich die Wirkung und damit auch Zulassungschancen!!
• Phase 1 clinical trial
In January 2013, we completed a Phase 1 clinical trial of XmAb5574/MOR208 in patients with high-risk, heavily-pretreated CLL, in which the antibody showed encouraging signs of preliminary anti-tumor activity and an acceptable safety profile and was well tolerated. Dose levels from 0.3 to 12 mg/kg were tested. The trial protocol was amended to include a period of extended dosing for a total of eight patients at the 12 mg/kg dose to study the effect of longer duration of exposure on safety and response rate.
The primary endpoints for this clinical trial were safety, pharmacokinetics and immunogenicity. The secondary endpoints for this clinical trial included clinical responses assessed according to International Working Group on CLL (IWCLL) 2008 and 1996 Guidelines. Overall response rate by IWCLL 2008 criteria was 29.6% (eight partial responses in 27 evaluable patients). Using IWCLL 1996, response criteria resulted in a response rate of 66.7% (18 partial responses).
We expect regulatory approval of oncology therapies to require progression-free survival data or overall survival data.
During the Phase 1 clinical trial, the most common adverse events were mild to moderate infusion reactions which were experienced only with the first dose. Clinically-significant, treatment-related adverse events classified as Grade 3 or higher occurred in 5 out of 27 patients. One patient treated at the 1 mg/kg dose level experienced neutropenia (low white blood cells). Four patients at the 12 mg/kg dose level experienced one or more of neutropenia, febrile neutropenia (neutropenia with fever), thrombocytopenia (low platelets), elevated aspartate aminotransferase (liver enzyme level) or tumor lysis syndrome (metabolic toxicity linked to rapid destruction of tumor cells). Only one dose-limiting toxicity, neutropenia, was observed and this was in one of the 16 patients treated at the 12 mg/kg dose level. No maximum tolerated dose was reached in this clinical trial.
• Further Clinical Development
Based on the Phase 1 clinical trial results, MorphoSys decided to continue the development of XmAb5574/MOR208 and has initiated two Phase 2 clinical trials of XmAb5574/MOR208 in patients
with ALL and NHL, respectively.
The Phase 2 clinical trial in ALL began in April 2013 and is an open-label, multicenter, single-arm clinical trial designed to assess efficacy in patients suffering from relapsed or refractory B-ALL. Secondary outcome measures include response duration, safety and pharmacokinetics of XmAb5574/MOR208. In total, 30 patients are planned to be enrolled.
The Phase 2 clinical trial in NHL began in May 2013 and is an open-label, multicenter, single-arm clinical trial designed to assess the efficacy of XmAb5574/MOR208 in patients with relapsed or refractory NHL. Secondary outcome measures include response duration, safety and pharmacokinetics of XmAb5574/MOR208. A total of up to 120 patients are planned to be enrolled in four separate sub-indications (follicular lymphoma, MCL, diffuse large B-cell lymphoma, and other forms of NHL).
Additional clinical trials in other B-cell malignancies and in combination with chemotherapy are possible and will be conducted at the discretion of and under the control of MorphoSys.
Hier ein paar mehr facts zu MOR208, als bislang veröffentlicht:
- mit acht Patienten wurde erweitert (aus der höchsten Dosisgruppe, der Rest kam nicht in Frage)
- 30% Response mit IWCLL 2008
- 67% Response mit IWCLL 1996: (18 PR !!!, 0 CR?, X SD?)
Also es passiert was, ob es reicht, werden wir sehen.
Zu beachten ist, dass die Entwicklung ohnehin vorsieht, MOR208 (ausschließlich?) in Kombinationstherapien anzuwenden. Das verbessert dann natürlich die Wirkung und damit auch Zulassungschancen!!
• Phase 1 clinical trial
In January 2013, we completed a Phase 1 clinical trial of XmAb5574/MOR208 in patients with high-risk, heavily-pretreated CLL, in which the antibody showed encouraging signs of preliminary anti-tumor activity and an acceptable safety profile and was well tolerated. Dose levels from 0.3 to 12 mg/kg were tested. The trial protocol was amended to include a period of extended dosing for a total of eight patients at the 12 mg/kg dose to study the effect of longer duration of exposure on safety and response rate.
The primary endpoints for this clinical trial were safety, pharmacokinetics and immunogenicity. The secondary endpoints for this clinical trial included clinical responses assessed according to International Working Group on CLL (IWCLL) 2008 and 1996 Guidelines. Overall response rate by IWCLL 2008 criteria was 29.6% (eight partial responses in 27 evaluable patients). Using IWCLL 1996, response criteria resulted in a response rate of 66.7% (18 partial responses).
We expect regulatory approval of oncology therapies to require progression-free survival data or overall survival data.
During the Phase 1 clinical trial, the most common adverse events were mild to moderate infusion reactions which were experienced only with the first dose. Clinically-significant, treatment-related adverse events classified as Grade 3 or higher occurred in 5 out of 27 patients. One patient treated at the 1 mg/kg dose level experienced neutropenia (low white blood cells). Four patients at the 12 mg/kg dose level experienced one or more of neutropenia, febrile neutropenia (neutropenia with fever), thrombocytopenia (low platelets), elevated aspartate aminotransferase (liver enzyme level) or tumor lysis syndrome (metabolic toxicity linked to rapid destruction of tumor cells). Only one dose-limiting toxicity, neutropenia, was observed and this was in one of the 16 patients treated at the 12 mg/kg dose level. No maximum tolerated dose was reached in this clinical trial.
• Further Clinical Development
Based on the Phase 1 clinical trial results, MorphoSys decided to continue the development of XmAb5574/MOR208 and has initiated two Phase 2 clinical trials of XmAb5574/MOR208 in patients
with ALL and NHL, respectively.
The Phase 2 clinical trial in ALL began in April 2013 and is an open-label, multicenter, single-arm clinical trial designed to assess efficacy in patients suffering from relapsed or refractory B-ALL. Secondary outcome measures include response duration, safety and pharmacokinetics of XmAb5574/MOR208. In total, 30 patients are planned to be enrolled.
The Phase 2 clinical trial in NHL began in May 2013 and is an open-label, multicenter, single-arm clinical trial designed to assess the efficacy of XmAb5574/MOR208 in patients with relapsed or refractory NHL. Secondary outcome measures include response duration, safety and pharmacokinetics of XmAb5574/MOR208. A total of up to 120 patients are planned to be enrolled in four separate sub-indications (follicular lymphoma, MCL, diffuse large B-cell lymphoma, and other forms of NHL).
Additional clinical trials in other B-cell malignancies and in combination with chemotherapy are possible and will be conducted at the discretion of and under the control of MorphoSys.
@rollingovermilestones
Ich weiß nicht, wie es anderen Lesern geht, aber mich macht der Wechsel von Farben, Fett- und Dünndruck ziemlich kirre. Wäre es nicht besser, sich auf die Farbe schwarz zu einigen und Sonderfarben nicht derart inflationär zu verwenden?
Zum Inhalt: Neu ist die Bestätigung der bereits geäußerten Vermutung, dass es während der Verlängerungsphase vier neue PR, jedoch keine CR gegeben hat. Die restlichen Daten waren bereits veröffentlicht.
Ich weiß nicht, wie es anderen Lesern geht, aber mich macht der Wechsel von Farben, Fett- und Dünndruck ziemlich kirre. Wäre es nicht besser, sich auf die Farbe schwarz zu einigen und Sonderfarben nicht derart inflationär zu verwenden?
Zum Inhalt: Neu ist die Bestätigung der bereits geäußerten Vermutung, dass es während der Verlängerungsphase vier neue PR, jedoch keine CR gegeben hat. Die restlichen Daten waren bereits veröffentlicht.
Wilex versucht seit Jahren, mit der Rencarex-Entwicklung weiter voranzukommen. Ich sehe für Rencarex keine große Zukunft, zumal sich mit BAY79-4620 (Bayer/Morphosys/Seattle Genetics) ein aussichtsreicheres Präparat gegen CAIX in der klinischen Entwicklung befindet -> http://mct.aacrjournals.org/content/11/2/340.full
BAY79-4620 wirkt über drei unterschiedliche Mechanismen:
1) antibody mediated cellular cytotoxicity (ADCC)
2) cytotoxic T-lymphocyte (CTL)response
3) Toxinwirkung
BAY79-4620 wirkt über drei unterschiedliche Mechanismen:
1) antibody mediated cellular cytotoxicity (ADCC)
2) cytotoxic T-lymphocyte (CTL)response
3) Toxinwirkung
Zitat von Joschka Schröder: @rollingovermilestones
Ich weiß nicht, wie es anderen Lesern geht, aber mich macht der Wechsel von Farben, Fett- und Dünndruck ziemlich kirre. Wäre es nicht besser, sich auf die Farbe schwarz zu einigen und Sonderfarben nicht derart inflationär zu verwenden?
Zum Inhalt: Neu ist die Bestätigung der bereits geäußerten Vermutung, dass es während der Verlängerungsphase vier neue PR, jedoch keine CR gegeben hat. Die restlichen Daten waren bereits veröffentlicht.



Du kannst dir gerne die Mühe machen es anders zu colorieren. Ich habe nichts dagegen!



Ich habe jedenfalls keine Zeit, es wunderschön zu unterlegen. Was hätte ich davon; ist schließlich kein paper?



Ich wollte nur mal SCHNELL ein paar Sachen kennzeichnen, ohne geschmacklich den Liebreiz der Leserschaft zu treffen.



Also nur zu, Verbesserungen sind immer willkommen.
:O:O:O
Antwort auf Beitrag Nr.: 45.615.887 von rollingovermilestones am 12.10.13 11:59:05Ein bewährte Faustregel lautet: Je bunter die Beiträge, je mehr Fettdruck und Unterstreichungen, je mehr Smilies ... desto unbrauchbarer die Beiträge.
Zitat von Joschka Schröder: @rollingovermilestones
...
Zum Inhalt: Neu ist die Bestätigung der bereits geäußerten Vermutung, dass es während der Verlängerungsphase vier neue PR, jedoch keine CR gegeben hat. Die restlichen Daten waren bereits veröffentlicht.
@Joschka: Dir möchte ich auf den Weg geben:
Wer lesen und rechnen kann, ist klar im Vorteil!
MOR Meldung vom 05.11.2012:
3/27 PR (nur Gruppe 6 9 12) (11%)
22/27 SD (81,5%)
2/27 Verschlechtert (7,5%)
Summe 27/27 (100%)
IWCLL 2008: 11%
IWCLL 1996: 42%
-Zusatzarm: 8 Patienten (aus Gruppe 12) wurden verlängert
-Kombinationsstudie geplant
MOR Meldung vom 07.10.2013:
Summe 27/27 (100%)
IWCLL 2008: 30% (+19% durch Erweiterung, also 30-11 ist bei mir 19% und nicht 14,8% wie vermeldet)
Veröffentlichung von Xencor:
8/27 PR (also 5 Patienten mehr durch Erweiterung) (29,5%)
IWCLL 2008: 29,5%
IWCLL 1996 (67%), 18/27 PR
Ich gehe davon aus, dass die 5 Patienten mit der Verbesserung aus der Gruppe mit SD kommen.
Deshalb ergibt sich zusammenfassend folgendes Ergebnis:
8/27 PR (nur Gruppe 6 9 12) (29,5%)
17/27 SD (63%)
2/27 Verschlechtert (7,5%)
Summe 27/27 (100%)
IWCLL 2008: 29,5%
IWCLL 1996 (67%), 18/27 PR
Durch die Erweiterung konnte die PR von 11% um 19% auf 29,5% gesteigert werden (Gesamtrate).
Betrachtet man hingegen nur die Steigerung der PR durch die Erweiterung ergibt sich ein Quotient: 8/3, also mehr als verdoppelt.
Bestenfalls könnte es sein, dass die 8 PR alle aus dem erweiterten Arm sind (3+5 PR). Das würde bedeuten, dass in der Verlängerungsgruppe 100% PR (8/8) wären.
Schlechtestenfalls, gab es deshalb eine Ansprechrate von 62,5% (5/8) PR in der Gruppe des erweiterten Arms. (Nur, falls die drei früheren PR nicht 'verlängert' wurden…).
D.h. die Verlängerung der Therapie führte zu einer Ansprechrate in dieser Subgruppe zwischen 62-100% PR.
Klar ist; fast man SD und PR zusammen hatten 25/27 (92,5%) mindestens ein „stable disease“.
Dies ist gar nicht so schlecht, im Hinblick darauf, dass
1) Patienten stark vorbehandelt wurden, dass
2) Dosierungen von 0,3 bis 12 mg/kg verabreicht wurden und vorallem weil
3) auf Kombinationstherapien abgezielt wird.
4) Die Depletionsrate der B-Zellen liegt bei ungefähr 95%.
Deshalb kann bei diesem stark proliferierenden Blutkrebstyp kein Wunder durch eine Monotherapie erwartet werden.



Nur meine Meinung!



Antwort auf Beitrag Nr.: 45.616.521 von rollingovermilestones am 12.10.13 15:38:32@rollingovermilestones
1. Du nervst.
2. Auf der ASH-Konferenz 2012 sind bereits - bis auf die vier Migrationen aus der SD- in die PR-Gruppe im Verlängerungsarm - sämtliche Ergebnisse im Detail publiziert worden. Die ASH-Ergebnisse sind Dir offensichtlich nicht bekannt. Es bleibt bei meiner Aussage in #139.
3. Ich möchte Dich bitten, diesen Thread nicht als Mülleimer für penetrante Beiträge zu nutzen, und wäre Dir dankbar, Deinen Unrat in einem anderen Thread zu entsorgen. Fachlich trägst Du nichts zur Diskussion bei.
4. Ich setze Dich jetzt auf meine Ignore List.
1. Du nervst.
2. Auf der ASH-Konferenz 2012 sind bereits - bis auf die vier Migrationen aus der SD- in die PR-Gruppe im Verlängerungsarm - sämtliche Ergebnisse im Detail publiziert worden. Die ASH-Ergebnisse sind Dir offensichtlich nicht bekannt. Es bleibt bei meiner Aussage in #139.
3. Ich möchte Dich bitten, diesen Thread nicht als Mülleimer für penetrante Beiträge zu nutzen, und wäre Dir dankbar, Deinen Unrat in einem anderen Thread zu entsorgen. Fachlich trägst Du nichts zur Diskussion bei.
4. Ich setze Dich jetzt auf meine Ignore List.
Zitat von Joschka Schröder: @rollingovermilestones
1. Du nervst.
2. Auf der ASH-Konferenz 2012 sind bereits - bis auf die vier Migrationen aus der SD- in die PR-Gruppe im Verlängerungsarm - sämtliche Ergebnisse im Detail publiziert worden. Die ASH-Ergebnisse sind Dir offensichtlich nicht bekannt. Es bleibt bei meiner Aussage in #139.
3. Ich möchte Dich bitten, diesen Thread nicht als Mülleimer für penetrante Beiträge zu nutzen, und wäre Dir dankbar, Deinen Unrat in einem anderen Thread zu entsorgen. Fachlich trägst Du nichts zur Diskussion bei.
4. Ich setze Dich jetzt auf meine Ignore List.
Was soll ich sagen??
Ich hab damit kein Problem!!
...und machs besser, du Macho!!



So, die Nachtschicht ist jetzt erledigt.
Hier mal ein paar Überlegungen zu MOR208 und der Vergleich zur Rituximab Studie von MD Anderson 2001:
Quelle: http://jco.ascopubs.org/content/19/8/2165.long
...Fifty patients with CLL (n = 40) or other mature B-cell lymphoid leukemias (n = 10) were treated with four weekly infusions of rituximab. The first dose was 375 mg/m2 for all patients; dose- escalation began with dose 2 but was held constant for each patient. Escalated doses were from 500 to 2,250 mg/m2...
...The overall response rate was 40%; all responses in patients with CLL were partial remissions. Response rates were 36% in CLL and 60% in other B-cell lymphoid leukemias....Anmerkung: hier noch nach IWCLL 1996 Kriterien!!
...Among patients with CLL, the response rate was 36%, and all responses were partial responses. Response criteria were those defined by the National Cancer Institute Working Group...
Anmerkung: hier publiziert: Cheson BD, Bennett JM, Grever M, et al: National Cancer Institute-Sponsored Working Group Guidelines for Chronic Lymphocytic Leukemia: Revised guidelines for diagnosis and treatment. Blood 87: 4990-4997, 1996
...All patients with CLL had received prior therapy. ...Anmerkung: vor Rituxan gab es keine CD20-mAbs, jedoch MOR208 Patienten waren zu 100% Rituxan vorbehandelt!
...The majority of the patients (80%) had advanced-stage disease...
...When the response rates at low doses (500 to 825 mg/m2), intermediate doses (1,000 to 1,500 mg/m2), and at the highest dose (2,250 mg/m2) were examined, there was a significant dose response, as listed in Table 5; the respective response rates were 23%, 44%, and 80% (P = .007). If the analysis is confined only to patients with CLL, the respective response rates are 22%, 43% and 75% (P = .03)...Anmerkung: Achtung, hier noch nach den alten IWCLL 1996 Kriterien!!
...An important aim of our study was to determine whether rituximab had any significant activity in the setting of CLL; clearly, a response rate of 40% was encouraging. However, the cost associated with administration of such high doses is prohibitive. Potential synergy between chemotherapeutic agents and rituximab may be achieved with standard doses of the antibody. The finding that rituximab has activity in CLL lays the groundwork for use of this agent in combination with chemotherapy...
Noch eine weitere interessante Quelle:
http://www.cancer.gov/cancertopics/druginfo/fda-rituximab
Meiner Ansicht nach kann MOR208 mit den Rituxan-Daten durchaus mithalten!
(siehe weiter unten)
Es wurden mit MOR208 nach IWCLL 1996 mit 18/27 PR (67%), (Quelle: Xencor, siehe unten) viel bessere Werte als mit Rituxan erreicht.
Selbst 29,5% nach IWCLL 2008 sind im Vergleich sehr gut. Vorallem, wenn man bedenkt, dass die Rituxan-Patienten damals NICHT mit einem B-Zell depletierenden mAb vorbehandelt waren, jedoch die MOR208 Patienten alle Rituxan vorbehandelt waren!
Außerdem, mehr als partielles Ansprechen gab es auch mit Rituxan nicht!
Zudem wird MOR208 NIE für eine Monotherapie in CLL zugelassen werden; in dieser Indikation geht es ausschließlich um Kombitherapien mit Chemotherapeutika!!
Hier mal ein paar Überlegungen zu MOR208 und der Vergleich zur Rituximab Studie von MD Anderson 2001:
Quelle: http://jco.ascopubs.org/content/19/8/2165.long
...Fifty patients with CLL (n = 40) or other mature B-cell lymphoid leukemias (n = 10) were treated with four weekly infusions of rituximab. The first dose was 375 mg/m2 for all patients; dose- escalation began with dose 2 but was held constant for each patient. Escalated doses were from 500 to 2,250 mg/m2...
...The overall response rate was 40%; all responses in patients with CLL were partial remissions. Response rates were 36% in CLL and 60% in other B-cell lymphoid leukemias....Anmerkung: hier noch nach IWCLL 1996 Kriterien!!
...Among patients with CLL, the response rate was 36%, and all responses were partial responses. Response criteria were those defined by the National Cancer Institute Working Group...
Anmerkung: hier publiziert: Cheson BD, Bennett JM, Grever M, et al: National Cancer Institute-Sponsored Working Group Guidelines for Chronic Lymphocytic Leukemia: Revised guidelines for diagnosis and treatment. Blood 87: 4990-4997, 1996
...All patients with CLL had received prior therapy. ...Anmerkung: vor Rituxan gab es keine CD20-mAbs, jedoch MOR208 Patienten waren zu 100% Rituxan vorbehandelt!
...The majority of the patients (80%) had advanced-stage disease...
...When the response rates at low doses (500 to 825 mg/m2), intermediate doses (1,000 to 1,500 mg/m2), and at the highest dose (2,250 mg/m2) were examined, there was a significant dose response, as listed in Table 5; the respective response rates were 23%, 44%, and 80% (P = .007). If the analysis is confined only to patients with CLL, the respective response rates are 22%, 43% and 75% (P = .03)...Anmerkung: Achtung, hier noch nach den alten IWCLL 1996 Kriterien!!
...An important aim of our study was to determine whether rituximab had any significant activity in the setting of CLL; clearly, a response rate of 40% was encouraging. However, the cost associated with administration of such high doses is prohibitive. Potential synergy between chemotherapeutic agents and rituximab may be achieved with standard doses of the antibody. The finding that rituximab has activity in CLL lays the groundwork for use of this agent in combination with chemotherapy...
Noch eine weitere interessante Quelle:
http://www.cancer.gov/cancertopics/druginfo/fda-rituximab
Meiner Ansicht nach kann MOR208 mit den Rituxan-Daten durchaus mithalten!
(siehe weiter unten)
Es wurden mit MOR208 nach IWCLL 1996 mit 18/27 PR (67%), (Quelle: Xencor, siehe unten) viel bessere Werte als mit Rituxan erreicht.
Selbst 29,5% nach IWCLL 2008 sind im Vergleich sehr gut. Vorallem, wenn man bedenkt, dass die Rituxan-Patienten damals NICHT mit einem B-Zell depletierenden mAb vorbehandelt waren, jedoch die MOR208 Patienten alle Rituxan vorbehandelt waren!
Außerdem, mehr als partielles Ansprechen gab es auch mit Rituxan nicht!
Zudem wird MOR208 NIE für eine Monotherapie in CLL zugelassen werden; in dieser Indikation geht es ausschließlich um Kombitherapien mit Chemotherapeutika!!
Zitat von rollingovermilestones: MOR Meldung vom 05.11.2012:
Quelle: http://www.morphosys.de/pressrelease/morphosys-und-xencor-pr…
3/27 PR (nur Gruppe 6 9 12) (11%)
22/27 SD (81,5%)
2/27 Verschlechtert (7,5%)
Summe 27/27 (100%)
IWCLL 2008: 11%
IWCLL 1996: 42%
-Zusatzarm: 8 Patienten (aus Gruppe 12) wurden verlängert
-Kombinationsstudie geplant
MOR Meldung vom 07.10.2013:
Quelle:
http://www.morphosys.de/pressrelease/morphosys-und-xencor-ge…
Summe 27/27 (100%)
IWCLL 2008: 30% (+19% durch Erweiterung, also 30-11 ist bei mir 19% und nicht 14,8% wie vermeldet)
Veröffentlichung von Xencor:
Quelle: http://www.sec.gov/Archives/edgar/data/1326732/0001047469130…
8/27 PR (also 5 Patienten mehr durch Erweiterung) (29,5%)
IWCLL 2008: 29,5%
IWCLL 1996 (67%), 18/27 PR
Ich gehe davon aus, dass die 5 Patienten mit der Verbesserung aus der Gruppe mit SD kommen.
Deshalb ergibt sich zusammenfassend folgendes Ergebnis:
8/27 PR (nur Gruppe 6 9 12) (29,5%)
17/27 SD (63%)
2/27 Verschlechtert (7,5%)
Summe 27/27 (100%)
IWCLL 2008: 29,5%
IWCLL 1996 (67%), 18/27 PR
Durch die Erweiterung konnte die PR von 11% um 19% auf 29,5% gesteigert werden (Gesamtrate).
Betrachtet man hingegen nur die Steigerung der PR durch die Erweiterung ergibt sich ein Quotient: 8/3, also mehr als verdoppelt.
Bestenfalls könnte es sein, dass die 8 PR alle aus dem erweiterten Arm sind (3+5 PR). Das würde bedeuten, dass in der Verlängerungsgruppe 100% PR (8/8) wären.
Schlechtestenfalls, gab es deshalb eine Ansprechrate von 62,5% (5/8) PR in der Gruppe des erweiterten Arms. (Nur, falls die drei früheren PR nicht 'verlängert' wurden…).
D.h. die Verlängerung der Therapie führte zu einer Ansprechrate in dieser Subgruppe zwischen 62-100% PR.
Addiert man SD und PR, dann hatten 25/27 (92,5%) mindestens ein „stable disease“.
Dies ist gar nicht so schlecht, im Hinblick darauf, dass
1) Patienten stark vorbehandelt wurden, dass
2) Dosierungen von 0,3 bis 12 mg/kg verabreicht wurden und vorallem weil
3) auf Kombinationstherapien abgezielt wird.
4) Die Depletionsrate der B-Zellen liegt bei ungefähr 95%.
Deshalb kann bei diesem stark proliferierenden Blutkrebstyp kein Wunder durch eine Monotherapie erwartet werden.
Antwort auf Beitrag Nr.: 45.617.915 von rollingovermilestones am 13.10.13 02:43:55Das Problem ist, dass sich bei CLL das gesamte Behandlungsschema ändern wird.
Wir bekommen Afutuzumab (GA101) dazu. Vor allem aber den BTK-Inhibitor Ibrutinib - eine ganz neue Welt.
Dann kommen die PI3k-Inhibitoren (Idelalisib von Gilead oder IPI145 von Infinity).
Später werden wohl auch die neuen CD38-mabs wie Daratumumab bei CLL getestet werden.
Ich messe MOR208 in der Indikation CLL bis auf weiteres keinen Wert zu. In den Zeiten von Ibrutinib liegt die Schwelle viel, viel höher als früher. Derzeitige Einschätzung für MOR208 bei CLL: Zu wenig, zu spät.
Wir bekommen Afutuzumab (GA101) dazu. Vor allem aber den BTK-Inhibitor Ibrutinib - eine ganz neue Welt.
Dann kommen die PI3k-Inhibitoren (Idelalisib von Gilead oder IPI145 von Infinity).
Später werden wohl auch die neuen CD38-mabs wie Daratumumab bei CLL getestet werden.
Ich messe MOR208 in der Indikation CLL bis auf weiteres keinen Wert zu. In den Zeiten von Ibrutinib liegt die Schwelle viel, viel höher als früher. Derzeitige Einschätzung für MOR208 bei CLL: Zu wenig, zu spät.
Antwort auf Beitrag Nr.: 45.617.951 von SLGramann am 13.10.13 06:37:56Dieser Artikel zum Thema CLL ist lesenswert:
http://pharmastrategyblog.com/2013/10/the-cll-landscape-is-r…
http://pharmastrategyblog.com/2013/10/the-cll-landscape-is-r…
Antwort auf Beitrag Nr.: 45.615.877 von Joschka Schröder am 12.10.13 11:57:09Mist, wie konnte ich das übersehen?
BAY79-4620: Präklinik hervorragend, erste P1 im Frühjahr 2013 abgeschlossen, zweite P1 aber laut Unternehmensangaben wegen toxikolog. NW beendet! Sogar in den clinicaltrials steht´s.
BAY79-4620: Präklinik hervorragend, erste P1 im Frühjahr 2013 abgeschlossen, zweite P1 aber laut Unternehmensangaben wegen toxikolog. NW beendet! Sogar in den clinicaltrials steht´s.
Antwort auf Beitrag Nr.: 45.621.379 von Joschka Schröder am 14.10.13 10:02:40Das hatte wir schon mal besprochen im Forum.
Morphosys hat das Projekt immunkonjugat-Projekt BAY79-4620 seinerzeit in die Präklinik zurückgestuft und von der Liste der klinischen Projekte gestrichen.
Laut Morphosys würde Bayer die Probleme allerdings beim Konjugat sehen und zugrundeliegende target und den Basis-HuCAL-AK weiterverfolgen.
Hatte das für mich so interpretiert: Bayer zahlt für Exclusivlizenz des targets und die Reservierung des HuCAL-AKs weiter seine Lizenzgebühren und prüft, ob, wie und was mit diesen noch anzufangen ist.
Weiterhin habe ich das seinerzeit eben als bestätigungendes Indiz für Moroneys These gewertet, dass bei voll humanen AKs, im Gegensatz zu anderen Protein-Bastel-Kombinationen, die Phase 1 kaum eine Hürde darstellt in Bezug auf das finden einer sicheren und verträglich verabreichbaren Dosis. Für Konjugate ergeben sich aber weitere Risiken, wobei man sich verbesserte Effektivität erhofft.....
Morphosys hat das Projekt immunkonjugat-Projekt BAY79-4620 seinerzeit in die Präklinik zurückgestuft und von der Liste der klinischen Projekte gestrichen.
Laut Morphosys würde Bayer die Probleme allerdings beim Konjugat sehen und zugrundeliegende target und den Basis-HuCAL-AK weiterverfolgen.
Hatte das für mich so interpretiert: Bayer zahlt für Exclusivlizenz des targets und die Reservierung des HuCAL-AKs weiter seine Lizenzgebühren und prüft, ob, wie und was mit diesen noch anzufangen ist.
Weiterhin habe ich das seinerzeit eben als bestätigungendes Indiz für Moroneys These gewertet, dass bei voll humanen AKs, im Gegensatz zu anderen Protein-Bastel-Kombinationen, die Phase 1 kaum eine Hürde darstellt in Bezug auf das finden einer sicheren und verträglich verabreichbaren Dosis. Für Konjugate ergeben sich aber weitere Risiken, wobei man sich verbesserte Effektivität erhofft.....
Antwort auf Beitrag Nr.: 45.621.661 von eck64 am 14.10.13 10:37:29Vielen Dank für den Hinweis.
Medimmune steigt mittels einer Firmenübernahme in die ADC-Technologie ein -> http://www.medimmune.com/media/press-releases/2013/10/15/ast…
Zitat von Joschka Schröder: Am kommenden Dienstag bei der ANA-Tagung ist es so weit:
Treatment of Sporadic Inclusion Body Myositis with an Anti-Activin Receptor IIB Antibody
Anthony A. Amato, Kumaraswamy Sivakumar, Namita Goyal, William David, Richard J. Barohn, Mohammad Salajegheh, Didier Laurent, Jens Praestgaard, Estelle Trifilieff, Anne-Ulrike Trendelenburg,David J. Glass, Ronenn Roubenoff, Brian S. Tseng and Steven A. Greenberg. Boston, MA; Phoenix, AZ; Kansas City, KS and Cambridge, MA
Etwas überraschend heißt es heute bei Novartis, es werde zu BYM338 keine PR-Mitteilung geben, weil die Angelegenheit zu unbedeutend sei.
Antwort auf Beitrag Nr.: 45.629.969 von Joschka Schröder am 15.10.13 13:41:53Aber den Vortrag gibt es schon, oder?!
Ich dachte das wäre schon am 14.10 gewesen?
Hast du nachgefragt bezüglich einer Meldung?
Hast du nachgefragt bezüglich einer Meldung?
zu #155 und #156
1) Ich habe bei Novartis nachgefragt.
2) In den Kongressunterlagen ist die Präsentation auf heute terminiert.
3) Eine Meldung dazu wird es nicht geben (siehe #154).
4) Abstracts o.ä. rückt Novartis grundsätzlich nicht heraus.
1) Ich habe bei Novartis nachgefragt.
2) In den Kongressunterlagen ist die Präsentation auf heute terminiert.
3) Eine Meldung dazu wird es nicht geben (siehe #154).
4) Abstracts o.ä. rückt Novartis grundsätzlich nicht heraus.
Für den Gantenerumab-Konkurrenzkandidaten Crenezumab wird Roche in Q4 2013 oder H1 2014 eine Zwischenauswertung vorlegen.
Zitat von SLGramann: Das Problem ist, dass sich bei CLL das gesamte Behandlungsschema ändern wird.
Wir bekommen Afutuzumab (GA101) dazu. Vor allem aber den BTK-Inhibitor Ibrutinib - eine ganz neue Welt.
Dann kommen die PI3k-Inhibitoren (Idelalisib von Gilead oder IPI145 von Infinity).
Später werden wohl auch die neuen CD38-mabs wie Daratumumab bei CLL getestet werden.
Ich messe MOR208 in der Indikation CLL bis auf weiteres keinen Wert zu. In den Zeiten von Ibrutinib liegt die Schwelle viel, viel höher als früher. Derzeitige Einschätzung für MOR208 bei CLL: Zu wenig, zu spät.
Ich habe mir gerade die jüngsten Phase-I-Studienergebnisse für den Bcl-2 inhibitor GDC-0199/ABT-199 (läuft bei Roche auch unter der Bezeichnung RG7601) in der Indikation CLL angesehen: 84 % overall response rate, darunter 18% complete responses!
Eindrucksvoll auch die GA101-Ergebnisse. Dazu werden weitere Details beim ASH-Kongress im Dezember vorgestellt. Bei Roche ist man extrem positiv gestimmt.
Angesichts der ausgezeichneten Konkurrenzdaten - aber auch im Hinblick auf die mit Xencor vereinbarten Finanzkonditionen und die laufenden Studienkosten - bereitet mir das MOR208-Projekt ein wenig Unbehagen.
Antwort auf Beitrag Nr.: 45.644.033 von Joschka Schröder am 17.10.13 11:43:40Die angeprochenen MOR208-Konditionen:
Sie liegen deutlich unterhalb der Preise, die für MOR103 und MOR202 im Raume stehen bei erfolgreicher Entwicklung, sind aber auch weit teurer, als Morphosys bei den Partnerprojekten erzielen kann, bei denen für targets ein neuer AK generiert wird.
Das korrelliert damit, das man MOR208 an der Schwelle zur P1 einlizenziert hat.
Ich habe auch geschluckt, als ich die Zahlen gelesen habe, aber so ist es eben, wenn man mal auf der anderen Seite vom Tisch sitzt. Die Konditionen sind also im Rahmen und werden ja auch nur mit Entwicklungsfortschritt fällig.
Insofern beschränkt sich mein Bauchweh auf die Chancen einer erfolgreichen Weiterentwicklung und die Wettbewerbssituation. Kann man hier wirklich Mehrwert generieren? Letztlich kann man nur hoffen, dass die Reißleine gezogen wird, wenn die Chancen zu schlecht stehen, aber hierzu habe ich den Einblick nicht und bin gespannt auf die Details der Extension-Studie und natürlich auch, was in den beiden laufenden P2-Studien herauskommen kann.
Sie liegen deutlich unterhalb der Preise, die für MOR103 und MOR202 im Raume stehen bei erfolgreicher Entwicklung, sind aber auch weit teurer, als Morphosys bei den Partnerprojekten erzielen kann, bei denen für targets ein neuer AK generiert wird.
Das korrelliert damit, das man MOR208 an der Schwelle zur P1 einlizenziert hat.
Ich habe auch geschluckt, als ich die Zahlen gelesen habe, aber so ist es eben, wenn man mal auf der anderen Seite vom Tisch sitzt. Die Konditionen sind also im Rahmen und werden ja auch nur mit Entwicklungsfortschritt fällig.
Insofern beschränkt sich mein Bauchweh auf die Chancen einer erfolgreichen Weiterentwicklung und die Wettbewerbssituation. Kann man hier wirklich Mehrwert generieren? Letztlich kann man nur hoffen, dass die Reißleine gezogen wird, wenn die Chancen zu schlecht stehen, aber hierzu habe ich den Einblick nicht und bin gespannt auf die Details der Extension-Studie und natürlich auch, was in den beiden laufenden P2-Studien herauskommen kann.
Im Zusammenhang mit MOR208 (Konkurrenzsituation usw.) lesenswert ist die Übersichtsarbeit "Therapeutic targeting of CD19 in hematological malignncies: past, present, future and beyond" von Katz und Herishanu, kürzlich erschienen in Leukemia & Lymphoma.
In einem kleinen Abschnitt wird dort auch auf längerfristige Behandlungsrisiken hingewiesen (z.B. Elimination regulatorischer B-Zellen mit konsekutiver Exacerbation von Entzündungen und T-Zell-vermittelten Autoimmunerkrankungen sowie Nephropathien).
Insgesamt eine recht gute Zusammenfassung der klinischen CD19-Forschung.
In einem kleinen Abschnitt wird dort auch auf längerfristige Behandlungsrisiken hingewiesen (z.B. Elimination regulatorischer B-Zellen mit konsekutiver Exacerbation von Entzündungen und T-Zell-vermittelten Autoimmunerkrankungen sowie Nephropathien).
Insgesamt eine recht gute Zusammenfassung der klinischen CD19-Forschung.
Ich habe mir noch einmal etwas detaillierter die präklinischen Daten zu MOR208 angesehen (u.a. in "CD19 targeting of chronic lymphocytic leukemia with a novel Fc-domain-engineered monoclonal antibody", blood 2010).
Das ADCC-vermittelte cytotoxische Potential scheint mir im Hinblick auf die Indikation CLL insgesamt einfach zu gering zu sein.
Da die gleichzeitige Gabe von Lenalidomide die ADCC-Wirkung offensichtlich verstärkt, könnte man sich allenfalls eine Kombibehandlung aus MOR208 und Lenalidomide vorstellen (in den Patenten WO2013024097 und WO2013024095 werden auch Kombinationen mit DNA-Alkylantien und Purin-Analogen vorgeschlagen). Angesichts der nicht zu unterschätzenden Konkurrenzsituation wäre es aus meiner Sicht jedoch sinnvoller, erst einmal die Ergebnisse der laufenden MOR208-Phase II-Studien sowie einiger Konkurrenzstudien (-> ASH2013) abzuwarten, bevor man zusätzliches Geld investiert.
Etwas problematisch ist, dass eine Auslizensierung von MOR208 angesichts des Xencor-Kontraktes wenig realistisch sein dürfte. Insoweit wird man vermutlich nach Abschluss der laufenden Studien eine "alles oder nichts"-Entscheidung treffen müssen.
Das ADCC-vermittelte cytotoxische Potential scheint mir im Hinblick auf die Indikation CLL insgesamt einfach zu gering zu sein.
Da die gleichzeitige Gabe von Lenalidomide die ADCC-Wirkung offensichtlich verstärkt, könnte man sich allenfalls eine Kombibehandlung aus MOR208 und Lenalidomide vorstellen (in den Patenten WO2013024097 und WO2013024095 werden auch Kombinationen mit DNA-Alkylantien und Purin-Analogen vorgeschlagen). Angesichts der nicht zu unterschätzenden Konkurrenzsituation wäre es aus meiner Sicht jedoch sinnvoller, erst einmal die Ergebnisse der laufenden MOR208-Phase II-Studien sowie einiger Konkurrenzstudien (-> ASH2013) abzuwarten, bevor man zusätzliches Geld investiert.
Etwas problematisch ist, dass eine Auslizensierung von MOR208 angesichts des Xencor-Kontraktes wenig realistisch sein dürfte. Insoweit wird man vermutlich nach Abschluss der laufenden Studien eine "alles oder nichts"-Entscheidung treffen müssen.
Hier eine erste Zusammenfassung der BYM338-Ergebnisse, die von Greenberg auf der ANA-Tagung am 14.10.2013 präsentiert worden sind:
Background: We found TGFb superfamily signaling through the activin type IIB receptor (ActRIIB) to be elevated in muscle of
patients with inclusion body myositis (sIBM) through assay of SMAD2/3 phosphorylation. We therefore conducted a randomized, placebo-controlled clinical trial of BYM338, a monoclonal antibody that blocks ActRIIB, in sIBM.
Methods: A single dose of BYM338 or placebo was administered to 14 randomized patients with sIBM. The primary outcome was the change in thigh muscle volume (TMV) by MRI at 8 weeks. Lean body mass (LBM), strength, and function were secondary outcomes. Twelve of the patients participated in a subsequent 16-week observation phase.
Results: Eight weeks after dosing, the BYM338-treated patients increased TMV (right leg + 6.5%, P=0.024; left leg +7.6%, P =
0.009) and LBM (+5.7%, P=0.014). BYM338-treated patients had improved 6 minute walking distance, which peaked at 16 weeks (+ 14.6%, P=0.008). There were no serious adverse events.
Conclusions: TGFb superfamily signaling, at least partially through ActRIIB, is implicated in the pathophysiology of sIBM.
Inhibition of ActRIIB increased muscle mass and function in this pilot trial, offering a potential novel treatment of sIBM.
Background: We found TGFb superfamily signaling through the activin type IIB receptor (ActRIIB) to be elevated in muscle of
patients with inclusion body myositis (sIBM) through assay of SMAD2/3 phosphorylation. We therefore conducted a randomized, placebo-controlled clinical trial of BYM338, a monoclonal antibody that blocks ActRIIB, in sIBM.
Methods: A single dose of BYM338 or placebo was administered to 14 randomized patients with sIBM. The primary outcome was the change in thigh muscle volume (TMV) by MRI at 8 weeks. Lean body mass (LBM), strength, and function were secondary outcomes. Twelve of the patients participated in a subsequent 16-week observation phase.
Results: Eight weeks after dosing, the BYM338-treated patients increased TMV (right leg + 6.5%, P=0.024; left leg +7.6%, P =
0.009) and LBM (+5.7%, P=0.014). BYM338-treated patients had improved 6 minute walking distance, which peaked at 16 weeks (+ 14.6%, P=0.008). There were no serious adverse events.
Conclusions: TGFb superfamily signaling, at least partially through ActRIIB, is implicated in the pathophysiology of sIBM.
Inhibition of ActRIIB increased muscle mass and function in this pilot trial, offering a potential novel treatment of sIBM.
Antwort auf Beitrag Nr.: 45.662.955 von Joschka Schröder am 21.10.13 10:46:46Leider ist es mir nicht gelungen, das Poster via E-Mail von den Autoren zu erhalten. S.Greenberg möchte die Präsentation nicht außerhalb des Meetings zirkulieren lassen. Novartis ist in dieser Hinsicht sehr restriktiv, außerdem soll das Ganze noch in einem Paper veröffentlicht werden (ich schätze aber nicht vor Q2 2014).
Unabhängig davon hat S.Greenberg am 19.10. bei einer Patientenveranstaltung über BYM338 berichtet, ohne dass dabei jedoch Neues zu erfahren gewesen wäre ->
http://www.ustream.tv/recorded/39989577
http://www.ustream.tv/recorded/39990811
Via Twitter konnte man die Veranstaltung ebenfalls verfolgen.
Hinsichtlich potentieller Nebenwirkungen muss man wohl die Herzfunktion im Auge behalten, insbesondere bei längerer Gabe (in Studie NCT01423110 ist BYM338 als Einmaldosis verabreicht worden). Bereits unter physiologischen Bedingungen wird in den Purkinje-Fasern (einem Teil des Erregungsleitungssystems des Herzens) Myostatin gebildet, im Tierversuch hat man zudem nach Myocardinfarkten eine verstärkte Myostatin-Expression beobachtet (s. auch Sharma et al.: Myostatin, a transforming growth factor-beta superfamily member, is expressed in heart muscle and is upregulated in cardiomyocytes after infarct. J Cell Physiol.
1999;180:1–9). Die Zusammenhänge scheinen aber noch nicht ganz klar und detaillierte Angaben zur Aktivin IIb-Rezeptordichte in verschiedenen Geweben suche ich noch.
Unabhängig davon hat S.Greenberg am 19.10. bei einer Patientenveranstaltung über BYM338 berichtet, ohne dass dabei jedoch Neues zu erfahren gewesen wäre ->
http://www.ustream.tv/recorded/39989577
http://www.ustream.tv/recorded/39990811
Via Twitter konnte man die Veranstaltung ebenfalls verfolgen.
Hinsichtlich potentieller Nebenwirkungen muss man wohl die Herzfunktion im Auge behalten, insbesondere bei längerer Gabe (in Studie NCT01423110 ist BYM338 als Einmaldosis verabreicht worden). Bereits unter physiologischen Bedingungen wird in den Purkinje-Fasern (einem Teil des Erregungsleitungssystems des Herzens) Myostatin gebildet, im Tierversuch hat man zudem nach Myocardinfarkten eine verstärkte Myostatin-Expression beobachtet (s. auch Sharma et al.: Myostatin, a transforming growth factor-beta superfamily member, is expressed in heart muscle and is upregulated in cardiomyocytes after infarct. J Cell Physiol.
1999;180:1–9). Die Zusammenhänge scheinen aber noch nicht ganz klar und detaillierte Angaben zur Aktivin IIb-Rezeptordichte in verschiedenen Geweben suche ich noch.
Exprimiert wird AR2B in multiplen Organen, so auch im Herzen (desweiteren u.a. auch in Hirn, Hoden und Ovar) ... eine Übersicht über die jeweilige Expressionsstärke und andere Details werde ich noch versuchen aufzutreiben.
Zitat von Joschka Schröder: Hier eine erste Zusammenfassung der BYM338-Ergebnisse, die von Greenberg auf der ANA-Tagung am 14.10.2013 präsentiert worden sind:
Background: We found TGFb superfamily signaling through the activin type IIB receptor (ActRIIB) to be elevated in muscle of
patients with inclusion body myositis (sIBM) through assay of SMAD2/3 phosphorylation. We therefore conducted a randomized, placebo-controlled clinical trial of BYM338, a monoclonal antibody that blocks ActRIIB, in sIBM.
Methods: A single dose of BYM338 or placebo was administered to 14 randomized patients with sIBM. The primary outcome was the change in thigh muscle volume (TMV) by MRI at 8 weeks. Lean body mass (LBM), strength, and function were secondary outcomes. Twelve of the patients participated in a subsequent 16-week observation phase.
Results: Eight weeks after dosing, the BYM338-treated patients increased TMV (right leg + 6.5%, P=0.024; left leg +7.6%, P =
0.009) and LBM (+5.7%, P=0.014). BYM338-treated patients had improved 6 minute walking distance, which peaked at 16 weeks (+ 14.6%, P=0.008). There were no serious adverse events.
Conclusions: TGFb superfamily signaling, at least partially through ActRIIB, is implicated in the pathophysiology of sIBM.
Inhibition of ActRIIB increased muscle mass and function in this pilot trial, offering a potential novel treatment of sIBM.
Als jemand, der regelmäßig ins Fitnessstudio geht, bin ich geradezu schockiert, welcht enormer Muskelzuwachs da aus Einmalgabe resultiert. Wobei ich die Berechnungsmethode/Definition für Muskelzuwachs nicht kenne.
Risiken, gerade fürs Herz, bedürfen sicher hoher Aufmerksamkeit, aber JoschkaSchröder, die (in kleiner Gruppe) erreichten Verbesserungen sind doch wirklich enorm, oder?
Antwort auf Beitrag Nr.: 45.669.759 von eck64 am 22.10.13 10:13:00Klar, der Muskelzuwachs ist enorm (gemessen als Volumenzunahme der Oberschenkelmuskulatur mittels Kernspin-Untersuchung), die präklinischen Daten waren, wenn ich mich recht erinnere, sogar noch besser.
Hinsichtlich etwaiger Nebenwirkungen muss man mal abwarten. Akne könnte auf ActR2B-Expression in Ovar/Testes etc. zurückzuführen sein und hinsichtlich möglicher kardialer Interaktionen/Komplikationen muss man mal abwarten. Hinsichtlich des Ausmaßes der ActR2B-Expression gibt es offensichtlich keine nennenswerten Unterschiede zwischen Herz- und Skeletmuskulatur. Habe gestern Abend noch gelesen, dass transgene Mäuse, deren ActR2B inaktiviert worden ist, nach der Geburt offensichtlich an Herzversagen sterben (s. auch Genes Dev 11:1812-1826, 1997).
Bald müßten im übrigen auch die Ergebnisse der Konkurrenzstudie mit LY2495655 (Lilly) publiziert werden. 2014 wird dann Pfizer mit seinem anti-Myostation-Antikörper PF-06252616 folgen.
Spannendes Target, großer Muskeleffekt, die entscheidende Frage wird die Verträglichkeit sein.
Hinsichtlich etwaiger Nebenwirkungen muss man mal abwarten. Akne könnte auf ActR2B-Expression in Ovar/Testes etc. zurückzuführen sein und hinsichtlich möglicher kardialer Interaktionen/Komplikationen muss man mal abwarten. Hinsichtlich des Ausmaßes der ActR2B-Expression gibt es offensichtlich keine nennenswerten Unterschiede zwischen Herz- und Skeletmuskulatur. Habe gestern Abend noch gelesen, dass transgene Mäuse, deren ActR2B inaktiviert worden ist, nach der Geburt offensichtlich an Herzversagen sterben (s. auch Genes Dev 11:1812-1826, 1997).
Bald müßten im übrigen auch die Ergebnisse der Konkurrenzstudie mit LY2495655 (Lilly) publiziert werden. 2014 wird dann Pfizer mit seinem anti-Myostation-Antikörper PF-06252616 folgen.
Spannendes Target, großer Muskeleffekt, die entscheidende Frage wird die Verträglichkeit sein.
Morphosys hat bekanntlich für Centocor den IL-17A-Antikörper CNTO6785 entwickelt.
Novartis besitzt mit Secukinumab eine Parallelentwicklung gegen dasselbe Target. Beim ACR-Meeting sind für die Indikation Rheumatoide Arthritis Secukinumab-Studiendaten präsentiert worden. Sehr schwach ... nach 12 Wochen kein signifikanter Unterschied bzgl. des ACR20-Kriteriums (primärer Endpunkt) zwischen Secukinumab und Placebo!
Novartis besitzt mit Secukinumab eine Parallelentwicklung gegen dasselbe Target. Beim ACR-Meeting sind für die Indikation Rheumatoide Arthritis Secukinumab-Studiendaten präsentiert worden. Sehr schwach ... nach 12 Wochen kein signifikanter Unterschied bzgl. des ACR20-Kriteriums (primärer Endpunkt) zwischen Secukinumab und Placebo!
Antwort auf Beitrag Nr.: 45.715.705 von Joschka Schröder am 29.10.13 15:03:32http://clinicaltrials.gov/ct2/show/NCT01966549?term=cnto6785…
A Study to Evaluate the Effectiveness and Safety of CNTO6785 in Patients With Moderate to Severe Chronic Obstructive Pulmonary Disease
Estimated Enrollment: 170
Study Start Date: October 2013
Estimated Study Completion Date: February 2015
xxxxxxxxxx
Immerhin starten die gerade eine ordentlich große P2-Studie mit CNTO6785 bei COPD.
Die kürzlich gestartete RA-Studie mit 250 Patienten, zeigt, dass sie es auch hier genauer wissen wollen:
http://clinicaltrials.gov/ct2/show/NCT01909427?term=cnto6785…
Dieses Programm wird wohl wenigstens bis 2015 weiter laufen, bevor Entscheidungen/Bewertungen anstehen.
A Study to Evaluate the Effectiveness and Safety of CNTO6785 in Patients With Moderate to Severe Chronic Obstructive Pulmonary Disease
Estimated Enrollment: 170
Study Start Date: October 2013
Estimated Study Completion Date: February 2015
xxxxxxxxxx
Immerhin starten die gerade eine ordentlich große P2-Studie mit CNTO6785 bei COPD.
Die kürzlich gestartete RA-Studie mit 250 Patienten, zeigt, dass sie es auch hier genauer wissen wollen:
http://clinicaltrials.gov/ct2/show/NCT01909427?term=cnto6785…
Dieses Programm wird wohl wenigstens bis 2015 weiter laufen, bevor Entscheidungen/Bewertungen anstehen.

Nicht so schön: Novartis hat eine Phase II-Studie mit BPS804 zurückgezogen -> http://clinicaltrials.gov/ct2/show/NCT01806610?term=BPS804&r…
Zitat von Joschka Schröder: Nicht so schön: Novartis hat eine Phase II-Studie mit BPS804 zurückgezogen -> http://clinicaltrials.gov/ct2/show/NCT01806610?term=BPS804&r…
Bischen seltsame Studie sowieso.
Im März für nur 10 Patienten vorgesehen, seither nie rekrutiert und nun abgeblasen.
Hast du nähere Infos zu dieser Studie?
Antwort auf Beitrag Nr.: 45.762.685 von eck64 am 05.11.13 10:58:51Nein, leider nicht.
Die Studie hatte wohl einen eher experimentellen Charakter. Möglicherweise haben die Ergebnisse dieser (Vorläufer-)Studie -> http://clinicaltrials.gov/ct2/show?term=BPS804&rank=3 die Erwartungen nicht erfüllt, so dass man von weiteren/ähnlichen Interventionen in den Phosphatstoffwechsel abgesehen hat.
Die Studie hatte wohl einen eher experimentellen Charakter. Möglicherweise haben die Ergebnisse dieser (Vorläufer-)Studie -> http://clinicaltrials.gov/ct2/show?term=BPS804&rank=3 die Erwartungen nicht erfüllt, so dass man von weiteren/ähnlichen Interventionen in den Phosphatstoffwechsel abgesehen hat.
Zu MOR208:
Bei der bevorstehenden ASH-Tagung werden u.a. Sanofi über SAR3419 und Seattle Genetics über SGN-CD19A (beides anti CD19-ADC´s) berichten.
Bei der bevorstehenden ASH-Tagung werden u.a. Sanofi über SAR3419 und Seattle Genetics über SGN-CD19A (beides anti CD19-ADC´s) berichten.
Konkurrenz zu MOR208 aus dem universitären Bereich. Interessant ist die Herunterreguation der CD19-Expression bei einigen Patienten während der Therapie (-> therapeutisch ungünstig). Dies ist ein Aspekt, den man auch bei MOR208 im Auge behalten muss.
From Bedside To Bench: Molecular Benchmarking Of An Fc‑Optimized CD19 Antibody Used In Treatment Of Relapsed and Refractory Pediatric B-Lineage Acute Lymphoblastic Leukemia
Program: Oral and Poster Abstracts
Session: 614. Acute Lymphoblastic Leukemia: Therapy, excluding Transplantation: Poster III
Monday, December 9, 2013: , 6:00 PM-8:00 PM
Hall E (Ernest N. Morial Convention Center)
Ursula J.E. Seidel1*, Ludger Grosse-Hovest, PhD2*, Patrick Schlegel, MD1*, Martin Hofmann3*, Friedhelm R. Schuster, MD4*, Kai-Erik Witte1*, Steffen Aulwurm, PhD3*, Rouwen Teltschik1*, Elwira Pyz, PhD3*, Hans-Georg Rammensee3,5*, Gundram Jung, MD2,5*, Rupert Handgretinger, Prof.1,5 and Peter Lang, MD6
1Department of General Paediatrics, Oncology/Haematology, University Children's Hospital, Tuebingen, Germany
2Department of Immunology, Eberhard Karls University, Tuebingen, Germany
3Interfaculty Institute for Cell Biology, Department of Immunology, Eberhard Karls University, Tuebingen, Germany
4Department of Pediatric Oncology, Hematology and Clinical Immunology, University Duesseldorf, Medical Faculty, Duesseldorf, Germany
5Partner Site Tuebingen, German Cancer Consortium (DKTK) and German Cancer Research Center (DKFZ), Tuebingen, Germany
6Department of Pediatric Oncology, University Children´s Hospital, Tuebingen, Germany
B-lineage acute lymphoblastic leukemia (ALL) is the most common childhood cancer. Although this disease can be curatively treated in 80% of patients by chemotherapy, prognosis for primary refractory or relapsed patients is very poor. Even after allogeneic stem cell transplantation (SCT), relapse rates are considerable and correlate significantly with persistent minimal residual disease (MRD) prior to or after SCT. Since a MRD constellation represents favorable effector-target ratios it is well suited for immunotherapy with therapeutic antibodies.
We developed and produced a third-generation CD19-specific monoclonal antibody (mAb) (4G7SDIE) in clinical-grade quality at a university-owned production unit. This high affinity Fc‑optimized chimerized CD19-specific mAb mediates enhanced antibody‑dependent cellular cytotoxicity (ADCC) by NK cells through its improved capability to recruit FcγRIIIa bearing effector cells. In this study, 4G7SDIE was applied within the scope of a compassionate use program in pediatric patients with relapsed or refractory B-lineage ALL and characterized in vitro and in vivo.
Firstly, it was confirmed that CD19 is commonly and stably expressed in pediatric B-lineage ALL by quantitative flow cytometry analysis of primary leukemic blasts (mean expression: 1.4x104 CD19 molecules/cell; range 4.5x103-2.4x104; n = 18). Hence CD19 is a well suited target for immunotherapy of pediatric B-lineage ALL. Half-saturating concentrations of 4G7SDIE on primary leukemic blasts and cell line NALM-16 were reached at EC50 = 85 ng/ml (± 29). Half-maximal target cell lysis was reached at EC50 = 25 ng/ml. Furthermore, lysis of primary B‑lineage ALL blasts by PBMC of 4 healthy donors could be significantly increased by 22% when adding 1 µg/ml 4G7SDIE to donor serum in 2 h‑cytotoxicity assays (n = 9; p = 0.03).
4G7SDIE was applied in 11 pediatric patients with relapsed or refractory B-lineage ALL in order to reduce or eradicate MRD and thus prevent relapse in these high-risk pre- and post-transplant patients. Especially, in a post-transplant context, with a high number of allogeneic NK effector cells available, use of an ADCC-mediating mAb shows potential. In 6/9 treated patients with detectable MRD, leukemic load was reduced by ≥ 1 log or pushed below detection limit (10-4) through immunotherapy with 4G7SDIE. Moreover, 2 further patients responded to 4G7SDIE treatment. However, they received additional therapy with tyrosine-kinase inhibitors. Five of the treated patients eventually relapsed, 5 other patients went into remission after 4G7SDIE application (range 27-597 days).
Concomitant in vitro 2 h-cytotoxicity assays with donor-derived PBMC of 2 treated patients showed that NK‑cell mediated lysis of autologous B‑lineage ALL blasts was increased by 33%, when adding 1 µg/ml 4G7SDIE or by 22% when adding autologous patient serum taken after antibody treatment (n = 8; p = 0.02). Serum half‑life of 4G7SDIE in the first treatment cycles ranged between 20 h and 43 h and after infusion of 20 mg/m2, saturating serum concentrations of ≥700 ng/ml were detectable for at least 13 days.
In a standardized model with MCF7‑CD19‑transfectants, expressing various CD19 levels on the cell surface, a correlation between increasing CD19 molecules/cell and increasing specific lysis by PBMC of healthy donors coincubated with 4G7SDIE was shown (spearman r = 0.88; p = 0.01). Strikingly, in 3 patients with residual disease detectable by flow cytometry, a down‑modulation of CD19 on leukemic blasts under 4G7SDIE therapy was observed. In one patient up-regulation of CD19 after discontinuation of 4G7SDIE treatment was observed. In vitro antigenic shift assays on primary leukemic blasts showed considerable but very heterogeneous shift of CD19 surface expression. These observations hint at in vivotumor escape mechanisms and furthermore indicate selective pressure exerted by immunotherapy with 4G7SDIE, underlining its therapeutic potential, but also delineating its limitations.
In conclusion, promising antileukemic effects have been observed in vitro and in vivo in this compassionate use program. However, potential CD19 down-modulation upon immunotherapy should be taken into account and may indicate the relevance of optimized treatment schedules and dosage as well as specific patient selection. We are currently setting up a clinical trial.
Disclosures: No relevant conflicts of interest to declare.
From Bedside To Bench: Molecular Benchmarking Of An Fc‑Optimized CD19 Antibody Used In Treatment Of Relapsed and Refractory Pediatric B-Lineage Acute Lymphoblastic Leukemia
Program: Oral and Poster Abstracts
Session: 614. Acute Lymphoblastic Leukemia: Therapy, excluding Transplantation: Poster III
Monday, December 9, 2013: , 6:00 PM-8:00 PM
Hall E (Ernest N. Morial Convention Center)
Ursula J.E. Seidel1*, Ludger Grosse-Hovest, PhD2*, Patrick Schlegel, MD1*, Martin Hofmann3*, Friedhelm R. Schuster, MD4*, Kai-Erik Witte1*, Steffen Aulwurm, PhD3*, Rouwen Teltschik1*, Elwira Pyz, PhD3*, Hans-Georg Rammensee3,5*, Gundram Jung, MD2,5*, Rupert Handgretinger, Prof.1,5 and Peter Lang, MD6
1Department of General Paediatrics, Oncology/Haematology, University Children's Hospital, Tuebingen, Germany
2Department of Immunology, Eberhard Karls University, Tuebingen, Germany
3Interfaculty Institute for Cell Biology, Department of Immunology, Eberhard Karls University, Tuebingen, Germany
4Department of Pediatric Oncology, Hematology and Clinical Immunology, University Duesseldorf, Medical Faculty, Duesseldorf, Germany
5Partner Site Tuebingen, German Cancer Consortium (DKTK) and German Cancer Research Center (DKFZ), Tuebingen, Germany
6Department of Pediatric Oncology, University Children´s Hospital, Tuebingen, Germany
B-lineage acute lymphoblastic leukemia (ALL) is the most common childhood cancer. Although this disease can be curatively treated in 80% of patients by chemotherapy, prognosis for primary refractory or relapsed patients is very poor. Even after allogeneic stem cell transplantation (SCT), relapse rates are considerable and correlate significantly with persistent minimal residual disease (MRD) prior to or after SCT. Since a MRD constellation represents favorable effector-target ratios it is well suited for immunotherapy with therapeutic antibodies.
We developed and produced a third-generation CD19-specific monoclonal antibody (mAb) (4G7SDIE) in clinical-grade quality at a university-owned production unit. This high affinity Fc‑optimized chimerized CD19-specific mAb mediates enhanced antibody‑dependent cellular cytotoxicity (ADCC) by NK cells through its improved capability to recruit FcγRIIIa bearing effector cells. In this study, 4G7SDIE was applied within the scope of a compassionate use program in pediatric patients with relapsed or refractory B-lineage ALL and characterized in vitro and in vivo.
Firstly, it was confirmed that CD19 is commonly and stably expressed in pediatric B-lineage ALL by quantitative flow cytometry analysis of primary leukemic blasts (mean expression: 1.4x104 CD19 molecules/cell; range 4.5x103-2.4x104; n = 18). Hence CD19 is a well suited target for immunotherapy of pediatric B-lineage ALL. Half-saturating concentrations of 4G7SDIE on primary leukemic blasts and cell line NALM-16 were reached at EC50 = 85 ng/ml (± 29). Half-maximal target cell lysis was reached at EC50 = 25 ng/ml. Furthermore, lysis of primary B‑lineage ALL blasts by PBMC of 4 healthy donors could be significantly increased by 22% when adding 1 µg/ml 4G7SDIE to donor serum in 2 h‑cytotoxicity assays (n = 9; p = 0.03).
4G7SDIE was applied in 11 pediatric patients with relapsed or refractory B-lineage ALL in order to reduce or eradicate MRD and thus prevent relapse in these high-risk pre- and post-transplant patients. Especially, in a post-transplant context, with a high number of allogeneic NK effector cells available, use of an ADCC-mediating mAb shows potential. In 6/9 treated patients with detectable MRD, leukemic load was reduced by ≥ 1 log or pushed below detection limit (10-4) through immunotherapy with 4G7SDIE. Moreover, 2 further patients responded to 4G7SDIE treatment. However, they received additional therapy with tyrosine-kinase inhibitors. Five of the treated patients eventually relapsed, 5 other patients went into remission after 4G7SDIE application (range 27-597 days).
Concomitant in vitro 2 h-cytotoxicity assays with donor-derived PBMC of 2 treated patients showed that NK‑cell mediated lysis of autologous B‑lineage ALL blasts was increased by 33%, when adding 1 µg/ml 4G7SDIE or by 22% when adding autologous patient serum taken after antibody treatment (n = 8; p = 0.02). Serum half‑life of 4G7SDIE in the first treatment cycles ranged between 20 h and 43 h and after infusion of 20 mg/m2, saturating serum concentrations of ≥700 ng/ml were detectable for at least 13 days.
In a standardized model with MCF7‑CD19‑transfectants, expressing various CD19 levels on the cell surface, a correlation between increasing CD19 molecules/cell and increasing specific lysis by PBMC of healthy donors coincubated with 4G7SDIE was shown (spearman r = 0.88; p = 0.01). Strikingly, in 3 patients with residual disease detectable by flow cytometry, a down‑modulation of CD19 on leukemic blasts under 4G7SDIE therapy was observed. In one patient up-regulation of CD19 after discontinuation of 4G7SDIE treatment was observed. In vitro antigenic shift assays on primary leukemic blasts showed considerable but very heterogeneous shift of CD19 surface expression. These observations hint at in vivotumor escape mechanisms and furthermore indicate selective pressure exerted by immunotherapy with 4G7SDIE, underlining its therapeutic potential, but also delineating its limitations.
In conclusion, promising antileukemic effects have been observed in vitro and in vivo in this compassionate use program. However, potential CD19 down-modulation upon immunotherapy should be taken into account and may indicate the relevance of optimized treatment schedules and dosage as well as specific patient selection. We are currently setting up a clinical trial.
Disclosures: No relevant conflicts of interest to declare.
Zur MOR208-Konkurrenzsituation (Indikation CLL, mehrfach vorbehandelte Patienten):
Der absolute Hammer sind die mit dem Bcl-2 Inhibitor ABT-199 (GDC-0199) in Monotherapie erzielten Studienergebnisse.
Overall Response Rate 84 %
complete responses 21 %
partial responses 63 %
Medi-555 erzielt in der Indikation CLL Ergebnisse, die in etwa mit den MOR208-Daten vergleichbar sind, vielleicht einen Hauch schwächer.
Ofatumumab (anti CD20) in Kombi mit Afuresertib:
42 % PR
58 % SD
Gute Ergebnisse auch des Syk Inhibitors GS9973 (vielfach vorbehandelte Patienten mit CLL, SLL, Details in Poster1634)
Fazit: Insbesondere gegen CART19 und ABT-199 wird es MOR208 sehr schwer haben. Die Strategie, MOR208 in Eigenregie weiterzuentwickeln, halte ich für äußerst riskant.
Der absolute Hammer sind die mit dem Bcl-2 Inhibitor ABT-199 (GDC-0199) in Monotherapie erzielten Studienergebnisse.
Overall Response Rate 84 %
complete responses 21 %
partial responses 63 %
Medi-555 erzielt in der Indikation CLL Ergebnisse, die in etwa mit den MOR208-Daten vergleichbar sind, vielleicht einen Hauch schwächer.
Ofatumumab (anti CD20) in Kombi mit Afuresertib:
42 % PR
58 % SD
Gute Ergebnisse auch des Syk Inhibitors GS9973 (vielfach vorbehandelte Patienten mit CLL, SLL, Details in Poster1634)
Fazit: Insbesondere gegen CART19 und ABT-199 wird es MOR208 sehr schwer haben. Die Strategie, MOR208 in Eigenregie weiterzuentwickeln, halte ich für äußerst riskant.
Zitat von Joschka Schröder: Der absolute Hammer sind die mit dem Bcl-2 Inhibitor ABT-199 (GDC-0199) in Monotherapie erzielten Studienergebnisse.
Overall Response Rate 84 %
complete responses 21 %
partial responses 63 %
Vorbildlich und eindrucksvoll, wie detailliert AbbVie und Roche ihr Präparat ABT-199 klinisch und präklinisch untersuchen. Bei der ASH-Tagung wimmelt es nur so vor ABT-199-Postern mit einer Vielzahl an Fragestellungen. Vermutlich handelt es sich bei ABT-199 um eine der besten Pharmaentwicklungen der vergangenen Jahre.
Daratumumab (HuMax™-CD38) zeigt in Kombitherapie mit Lenalidomide und Dexamethason gewisse Probleme hinsichtlich des NW-Profils (6 x Grad 3 oder mehr, davon 5 x Neutropenie und 1 x Thrombozythopenie ... und dies bei 6 Patienten).
Wirkung gut (bislang 50% CR/VGPR, 50 % PR), NW nicht ohne. Bin gespannt, ob bei MOR202 NW in vergleichbarem Ausmaß auftreten werden.
Wirkung gut (bislang 50% CR/VGPR, 50 % PR), NW nicht ohne. Bin gespannt, ob bei MOR202 NW in vergleichbarem Ausmaß auftreten werden.
Heute hat die FDA Ibrutinib, einen BTK-Inhibitor, zur Behandlung des Mantelzell-Lymphoms zugelassen -> http://www.multivu.com/mnr/62689-imbruvica-fda-approval-jans…
Ibrutinib ist im übrigen ein weiterer Konkurrent für MOR208.
In der Indikation relapsed or refractory CLL/SLL hat Ibrutinib Studienergebnisse erzielt, die deutlich besser sind als die kürzlich für MOR208 gemeldeten Daten (z.B. 67 % ORR, siehe z.B. ASH-Konferenz 2012).
Ibrutinib ist im übrigen ein weiterer Konkurrent für MOR208.
In der Indikation relapsed or refractory CLL/SLL hat Ibrutinib Studienergebnisse erzielt, die deutlich besser sind als die kürzlich für MOR208 gemeldeten Daten (z.B. 67 % ORR, siehe z.B. ASH-Konferenz 2012).
Zitat von Joschka Schröder: Heute hat die FDA Ibrutinib, einen BTK-Inhibitor, zur Behandlung des Mantelzell-Lymphoms zugelassen -> http://www.multivu.com/mnr/62689-imbruvica-fda-approval-jans…
Ibrutinib ist im übrigen ein weiterer Konkurrent für MOR208.
In der Indikation relapsed or refractory CLL/SLL hat Ibrutinib Studienergebnisse erzielt, die deutlich besser sind als die kürzlich für MOR208 gemeldeten Daten (z.B. 67 % ORR, siehe z.B. ASH-Konferenz 2012).
Hast du das Rumgeeier von Moroney gehört, rund um die demnächst geplante CLL-Studie mit MOR208? Das soll mit einem Small molecule in Kombi starten.
Könnte das Ibrutinib sein?
Moroney wollte nicht mal bestätigen, ob das gewählte Kombipräparat bereits zugelassen oder ebenfalls "nur" in Entwicklung sei.
Bis der derzeitigen Biotech-Blase ausreichend Luft entwichen ist, werde ich in diesem Thread bis auf Weiteres noch etwas kürzer treten, als dies auch so schon der Fall war.
Wieso ich die Bewertung der Biotech-Branche - inklusive Morphosys-Pipeline - in letzter Zeit zunehmend skeptisch gegenüberstehe, habe ich bereits an anderer Stelle begründet. Nachfolgend noch einmal eine Zusammenfassung:
In Analysten-Modellen werden gewöhnlich diversen Entwicklungspräparaten Peak Sales und Zulassungswahrscheinlichkeiten zugeordnet. Wenn man sich konkret Analystenschätzungen für verschiedene konkurrierende Entwicklungspräparate ansieht, fällt auf, dass die Summe der risikogewichteten Umsatzschätzungen das gesamte vorstellbare Marktpotential für die jeweiligen Krankheitsbilder mittlerweile weit übersteigt. Die Analystenschätzungen haben den Boden der Realität verlassen.
Morphosys ist in diesem Zusammenhang leider kein Ausnahmefall.
Ein kleines Beispiel: Edison schätzt für MOR208 Peak Sales in Höhe von 1,2 Mrd. USD bei einer Zulassungswahrscheinlichkeit von 30 %.
Schaut man sich ergänzend Analystenschätzungen für aussichtsreiche Konkurrenzpräparate an und berücksichtigt man evt. noch vielversprechende Entwicklungspräparate, die der Analystengemeinde offensichtlich unbekannt sind, so ergibt sich ein fiktives Marktvolumen, das mit der Realität nichts mehr zu tun hat. Falls sich jemand die Mühe machen möchte, dies für MOR208 zu überprüfen: Alleine gegen das Target CD19 werden derzeit eine Vielzahl von Medikamenten entwickelt, denen beeindruckende Peak Sales zugestanden werden (u.a. CLT019/CART19, Blinatumomab, SAR3419, Medi-551, SGN-CD19A, DI-B4, MDX1342).
Dazu kommen noch andere aussichtsreiche Präparate, die sich derzeit in der Präklinik befinden (u.a. von Intern. Drug Dev. Biotech und Glenmark), und – noch viel wichtiger – Therapieansätze, welche die gleichen Krankheitsbilder wie MOR208 über andere Targets ansteuern (Beispiele: Ibrutinib via BTK-Inhibition, ABT-199 via Bcl-2-Inhibition).
Dann gibt es noch eine Vielzahl bereits zu gelassenen Therapien (zuletzt Obinutuzumab), auf die ich an dieser Stelle aus Zeitgründen nicht näher eingehen kann.
Wenn man nun, wie Analysten dies tun, jedem dieser Medikamente mit vergleichsweise großer Erfolgswahrscheinlichkeit Peak Sales in Milliardenhöhe zugesteht, ergeben sich in Summe Phantasiebewertungen und eine Biotech-Blase.
In dieser Blase befinden wir uns gerade.
Auch Morphosys ist von dieser Entwicklung betroffen:
-> Zulassungswahrscheinlichkeit für MOR103 laut Deutscher Bank 49 % – natürlich gleich mit zwei Milliarden Peak Sales, obwohl gerade einmal eine rudimentäre Phase Ib-Studie abgeschlossen worden ist.
-> Gleich mal fast ein Viertel des MM-Marktes für MOR202, obwohl bislang keinerlei klinische Studienergebnisse vorliegen und es eine Vielzahl anderer aussichtsreicher Konkurrenzentwicklungen gibt.
Man könnte die Aufzählung fast beliebig fortsetzen.
Fazit: Von wenigen Ausnahmen abgesehen, sind Biotech-Unternehmen derzeit deutlich zu hoch bewertet, weil sich die Analystengemeinde Phantasiegebilde zurechtgezimmert hat.
Wieso ich die Bewertung der Biotech-Branche - inklusive Morphosys-Pipeline - in letzter Zeit zunehmend skeptisch gegenüberstehe, habe ich bereits an anderer Stelle begründet. Nachfolgend noch einmal eine Zusammenfassung:
In Analysten-Modellen werden gewöhnlich diversen Entwicklungspräparaten Peak Sales und Zulassungswahrscheinlichkeiten zugeordnet. Wenn man sich konkret Analystenschätzungen für verschiedene konkurrierende Entwicklungspräparate ansieht, fällt auf, dass die Summe der risikogewichteten Umsatzschätzungen das gesamte vorstellbare Marktpotential für die jeweiligen Krankheitsbilder mittlerweile weit übersteigt. Die Analystenschätzungen haben den Boden der Realität verlassen.
Morphosys ist in diesem Zusammenhang leider kein Ausnahmefall.
Ein kleines Beispiel: Edison schätzt für MOR208 Peak Sales in Höhe von 1,2 Mrd. USD bei einer Zulassungswahrscheinlichkeit von 30 %.
Schaut man sich ergänzend Analystenschätzungen für aussichtsreiche Konkurrenzpräparate an und berücksichtigt man evt. noch vielversprechende Entwicklungspräparate, die der Analystengemeinde offensichtlich unbekannt sind, so ergibt sich ein fiktives Marktvolumen, das mit der Realität nichts mehr zu tun hat. Falls sich jemand die Mühe machen möchte, dies für MOR208 zu überprüfen: Alleine gegen das Target CD19 werden derzeit eine Vielzahl von Medikamenten entwickelt, denen beeindruckende Peak Sales zugestanden werden (u.a. CLT019/CART19, Blinatumomab, SAR3419, Medi-551, SGN-CD19A, DI-B4, MDX1342).
Dazu kommen noch andere aussichtsreiche Präparate, die sich derzeit in der Präklinik befinden (u.a. von Intern. Drug Dev. Biotech und Glenmark), und – noch viel wichtiger – Therapieansätze, welche die gleichen Krankheitsbilder wie MOR208 über andere Targets ansteuern (Beispiele: Ibrutinib via BTK-Inhibition, ABT-199 via Bcl-2-Inhibition).
Dann gibt es noch eine Vielzahl bereits zu gelassenen Therapien (zuletzt Obinutuzumab), auf die ich an dieser Stelle aus Zeitgründen nicht näher eingehen kann.
Wenn man nun, wie Analysten dies tun, jedem dieser Medikamente mit vergleichsweise großer Erfolgswahrscheinlichkeit Peak Sales in Milliardenhöhe zugesteht, ergeben sich in Summe Phantasiebewertungen und eine Biotech-Blase.
In dieser Blase befinden wir uns gerade.
Auch Morphosys ist von dieser Entwicklung betroffen:
-> Zulassungswahrscheinlichkeit für MOR103 laut Deutscher Bank 49 % – natürlich gleich mit zwei Milliarden Peak Sales, obwohl gerade einmal eine rudimentäre Phase Ib-Studie abgeschlossen worden ist.
-> Gleich mal fast ein Viertel des MM-Marktes für MOR202, obwohl bislang keinerlei klinische Studienergebnisse vorliegen und es eine Vielzahl anderer aussichtsreicher Konkurrenzentwicklungen gibt.
Man könnte die Aufzählung fast beliebig fortsetzen.
Fazit: Von wenigen Ausnahmen abgesehen, sind Biotech-Unternehmen derzeit deutlich zu hoch bewertet, weil sich die Analystengemeinde Phantasiegebilde zurechtgezimmert hat.
so viel kürzer biste ja bisher noch nicht getreten...Mor wird das Geschäftsmodell wie bisher weiter erfolgreich ausbauen und sicherlich weitere Überraschungen bringen...außerdem ist Mor nach wie vor der volle Übernahmekanditat...und mit Schröder als Kontraindikator kann man ruhig auf weiter steigende Kurse setzen...
Antwort auf Beitrag Nr.: 45.880.566 von micjagger am 20.11.13 17:32:00Schade, dass nun auch in diesem Thread inhaltsleerer Mist abgeladen wird. Von gewissen Usern hat man noch nie auch nur einen halbwegs differenzierten Satz gelesen.
Antwort auf Beitrag Nr.: 45.827.590 von eck64 am 13.11.13 20:32:40
Hast du das Rumgeeier von Moroney gehört, rund um die demnächst geplante CLL-Studie mit MOR208? Das soll mit einem Small molecule in Kombi starten.
Könnte das Ibrutinib sein?
Moroney wollte nicht mal bestätigen, ob das gewählte Kombipräparat bereits zugelassen oder ebenfalls "nur" in Entwicklung sei.
oder Kyprolis?
oder etc....
Hast du das Rumgeeier von Moroney gehört, rund um die demnächst geplante CLL-Studie mit MOR208? Das soll mit einem Small molecule in Kombi starten.
Könnte das Ibrutinib sein?
Moroney wollte nicht mal bestätigen, ob das gewählte Kombipräparat bereits zugelassen oder ebenfalls "nur" in Entwicklung sei.
oder Kyprolis?
oder etc....
Zitat von Joschka Schröder: MOR103: Peak 0,4 Mrd., Zulassungswahrscheinlichkeit 20 %, Markteintritt 2020
Einen Auszug von drüben rübergeholt.
Du bist da extrem reserviert in der Einschätzung von MOR103. Sowohl was peak sales als auch Chance an sich betrifft.
Der GSK Einstand bezahlt für so eine schlechte Chance, von RA über MS bis hin zu allen anderen potentiellen Indikationen? Und dann über alle Indikationen hinweg nur 0,4 mio Peak?
Für mich passt das nicht zusammen.
Wenn Studienpläne zu RA kommen und die Daten zu MS draussen sind, vielleicht GSK sogar in weiteren Indikationen direkt P2a Studien startet, würdest du das dann überdenken?
Was könnte ein Anlass sein, deine Einschätzung zu überdenken?
Antwort auf Beitrag Nr.: 45.903.694 von eck64 am 23.11.13 17:31:19Na ja, bislang hat GSK 22,5 Mio. € für den Kauf von MOR103 investiert. Das ist ein überschaubarer Betrag.
Ich bin in meinen Annahmen konservativer als andere, weil ich jede Menge aussichtreicher Konkurrenzpräparate sehe. Und es ist nicht so, dass der Gesamtkuchen (= das gesamte zu verteilende Marktvolumen) beliebig wachsen könnte.
Letztlich wird vermutlich alles darauf hinauslaufen, dass im Rahmen der personalisierten und differenzierten Medizin einzelne Präparate in enger umschriebenen Situationen zum Einsatz kommen werden (MOR103 z.B., falls es das Nebenwirkungsprofil zuläßt, in schweren Krankheitsphasen bei Patienten, die beispielsweise nicht ausreichend auf IL-6-R(lösl.)-Antagonisten ansprechen).
Fazit: Der Kuchen wird also in viel kleinere Stücke zerteilt werden als dies derzeit noch der Fall ist - gerade bei entzündlichen (Auto-)Immunerkrankungen.
Ich bin in meinen Annahmen konservativer als andere, weil ich jede Menge aussichtreicher Konkurrenzpräparate sehe. Und es ist nicht so, dass der Gesamtkuchen (= das gesamte zu verteilende Marktvolumen) beliebig wachsen könnte.
Letztlich wird vermutlich alles darauf hinauslaufen, dass im Rahmen der personalisierten und differenzierten Medizin einzelne Präparate in enger umschriebenen Situationen zum Einsatz kommen werden (MOR103 z.B., falls es das Nebenwirkungsprofil zuläßt, in schweren Krankheitsphasen bei Patienten, die beispielsweise nicht ausreichend auf IL-6-R(lösl.)-Antagonisten ansprechen).
Fazit: Der Kuchen wird also in viel kleinere Stücke zerteilt werden als dies derzeit noch der Fall ist - gerade bei entzündlichen (Auto-)Immunerkrankungen.
Zitat von eck64:Zitat von Joschka Schröder: MOR103: Peak 0,4 Mrd., Zulassungswahrscheinlichkeit 20 %, Markteintritt 2020
Einen Auszug von drüben rübergeholt.
Du bist da extrem reserviert in der Einschätzung von MOR103. Sowohl was peak sales als auch Chance an sich betrifft.
Der GSK Einstand bezahlt für so eine schlechte Chance, von RA über MS bis hin zu allen anderen potentiellen Indikationen? Und dann über alle Indikationen hinweg nur 0,4 mio Peak?
Für mich passt das nicht zusammen.
Wenn Studienpläne zu RA kommen und die Daten zu MS draussen sind, vielleicht GSK sogar in weiteren Indikationen direkt P2a Studien startet, würdest du das dann überdenken?
Was könnte ein Anlass sein, deine Einschätzung zu überdenken?
Wenn ich mich mal ganz frech dazuschalten darf, ein paar kurze Fragen:
-warum wird GSK (laut JH) über 750 Mio. in MOR103 investieren und diesen mAb für verschiedene Therapien weiterentwickeln?
-lohnt sich das bei 400 Mio./Jahr noch wirklich, dieses Risiko einzugehen?
-ist es nicht weniger risikoreich gleich biosimilars in den Markt zu bringen?
-warum will die gute, alte, innovative Amgen jetzt auch diesen Markt adressieren?
-lohnt sich das bei der mAb-Schwämme überhaupt, die hier immer wieder ins Spiel gebracht wird?
-warum tummeln sich soviele Firmen im mAb-space und werden immer mehr?
-gibt es wirklich in Zukunft nur noch Krümmel aufzulesen?
-können die alle schlechter rechnen, als die ganzen Schlau-Männer aus diesem board?
--> Ja, es lohnt sich und wie!
Ich glaube, dass der Markt weiter wachsen wird. Es wird allerdings nicht alles über die klassische KV bezahlt werden. Wir werden eine Mehrklassenmedizin bekommen (es gibt sie ja bereits).
Sicherlich wird sich der Markt auch etwas zerklüften, aber er wird wachsen, er wird nie gesättigt sein. Gesundheit lässt sich nicht sättigen. Gesundheit ist kein iPhone. Wir werden von Gesundheit nie genug haben!
Einzelne Produkte werden sicherlich keine so großen Verkaufszahlen wie Humira z.Z. generieren. Jedoch für first in class und best in class werden immernoch ordentliche Beträge fließen.
Deshalb glaube ich tatsächlich an Investitionen in die Biotechnologie. Die Spreu wird sich vom Weizen trennen, aber das Fass hat keinen Boden. Wer geschickt und innovativ handelt, wird in diesem Markt nach wie vor riesig viel Geld verdienen, das ist ziemlich sicher!
10.000 mio. peak sales wie für Humira sind sicherlich eine Ausnahme, aber bis eine log-Stufe niedriger werden innovative Produkte Umsätze machen.
Antwort auf Beitrag Nr.: 45.904.168 von rollingovermilestones am 23.11.13 19:22:25rollingovermilestones, es gibt keinen Anlass zur Hektik.
1. Welche Gelder GSK tatsächlich in die Entwicklung des MOR103 stecken wird, hängt von weiteren Studienergebnissen ab, nicht von den Erwartungen/der Phantasie Dritter. Es ist ja nicht so, dass GSK intern bereits ein Entwicklungsbudget in Höhe von 750 Mio. für MOR103 abgenickt hätte.
2. 400 Mio. € entsprechen ca. 536 Mio. USD ... dies soll ein Umsatzvolumen sein, das die Entwicklung eines therapeutischen Antikörpers unrentabel macht?
3. Wer selber einmal persönlich mit der Entwicklung von Biotherapeutika näher befasst war, wird in seinen Prognosen zurückhaltender. Ich denke, in einer sachbezogenen Diskussion sollte dies eigentlich zu akzeptieren sein.
4. Von einer "Marktsättigung" war nie die Rede. Die finanziellen Ressourcen in den staatlichen und nichtstaatlichen Gesundheitssystemen sind jedoch limitiert. Unbegrenztes Wachstum gibt es nicht.
5. Die Erkenntnis, dass man "von Gesundheit nicht genug haben" kann, ist trivial, bei der Bewertung von Pharmaunternehmen aber nicht besonders hilfreich.
1. Welche Gelder GSK tatsächlich in die Entwicklung des MOR103 stecken wird, hängt von weiteren Studienergebnissen ab, nicht von den Erwartungen/der Phantasie Dritter. Es ist ja nicht so, dass GSK intern bereits ein Entwicklungsbudget in Höhe von 750 Mio. für MOR103 abgenickt hätte.
2. 400 Mio. € entsprechen ca. 536 Mio. USD ... dies soll ein Umsatzvolumen sein, das die Entwicklung eines therapeutischen Antikörpers unrentabel macht?
3. Wer selber einmal persönlich mit der Entwicklung von Biotherapeutika näher befasst war, wird in seinen Prognosen zurückhaltender. Ich denke, in einer sachbezogenen Diskussion sollte dies eigentlich zu akzeptieren sein.
4. Von einer "Marktsättigung" war nie die Rede. Die finanziellen Ressourcen in den staatlichen und nichtstaatlichen Gesundheitssystemen sind jedoch limitiert. Unbegrenztes Wachstum gibt es nicht.
5. Die Erkenntnis, dass man "von Gesundheit nicht genug haben" kann, ist trivial, bei der Bewertung von Pharmaunternehmen aber nicht besonders hilfreich.
Genau darum geht es, seinen market share zu adressieren.
Ich glaube, du unterschätzt mit deinen pessimistischen Annahmen den Markt gewaltig.
Diese ganzen peak sales forecasts sind sicherlich nett, aber irgendwie trotzdem Firlefanz.
Nehmen wir an 200 Mrd. werden mit mAbs pro Jahr umgesetzt (ist konservativ für die Zukunft).
Nehmen wir an ca. 500 mAbs sind in Entwicklungen, alle bekommen eine Zulassung.
Morphosys entwickelt 80 mAbs, dann entfallen 32 Mrd. auf diesen Teil. Fünf Prozent davon sind 1,6 Mrd.. Bei einem KGV von 20 sind wir wieder bei 32 Mrd.
Sagen wir, ich habe die 500 mAbs unterschätzt und es sind 2000 mAbs (Faktor vier) dann wären wir bei 8 Mrd.
Diese ’theoretische’ Betrachtung zeigt mir, wie attraktiv im Prinzip dieser Markt ist und wie gut Morphosys diesen (mit seinen Partnern) trotz allem adressiert. 80/500 bzw. 80/2000 sind doch Wahnsinn!
Es ist eher arrogant, dass Morphosys keine biosimilars entwickeln will (natürlich nicht allein, sondern auf dem Tantiemenmodel mit einem Partner).
Selbst bei 1% royalties wäre das ein Superanwendungfeld für Ylanthia. Sie können damit mAbs prima optimieren: Halbwertzeit, Löslichkeit, Temperaturstabilität, Expressionsstärke... usf..
Und noch was als Anmerkung:
Entscheidend ist, dass die Pipeline wächst und gedeiht und aus den bestimmt auch innovativen targets endlich zugelassene Medikamente werden.
Seit IPO wird damit hausiert und verspochen, dass mAbs nur 7-8 Jahre statt 10-12 Jahre bis zur Zulassung brauchen. Viele der Morphosys-Partner sind Schlafmützen! -nur leere Ankündigungen.
Ich mochte die target-Exklusivität nie. Sie verhindert Konkurrenz zwischen den Hucal-Anwendern.
Man hat sich damit abkochen lassen! Man ist am ausgestreckten Arm sicherlich nicht verhungert, jedoch richtig fett fressen war nicht.
Wer den Laden seit Anbeginn kennt, hat sicherlich noch im Ohr: Bayer bis zu 20 Programme, Pfizer, Schering, Schering-Plough, Merck, Astellas, Daiichi... 15 der Top 20 Pharmas waren Kunden und dafür sind heute 80 Programme zu wenig. Außer Janssen und Novartis und Roche mit einem Programm, fast nur enttäuschendes.
Der Lizenznehmer der am SCHNELLSTEN ein Hucal-mAb gegen ein bestimmtes target durch die klinische Entwicklung zieht, soll den Nutzen haben. Und nicht der Partner, der weniger aggressiv seine mAbs entwickelt, aber zu erst einen Vertrag abgeschlossen und damit targets blockiert hat.
Das ist bzw. war Morphosys Problem. Sie hatten nie einen Hebel –trotz klasse Technologie- ihre Kunden zu voran zu treiben. Inzwischen ist Hucal nicht mehr der Star und Ylanthia auch nicht.
Wie gesagt 1% für biosimilars mit Ylanthia würden riesige Märkte eröffnen, ohne viel in F&E stecken zu müssen!
Zum Glück hatte SM genug Geld, um eigene Ideen voranzubringen und sich damit unabhängig gemacht.
Ich glaube, du unterschätzt mit deinen pessimistischen Annahmen den Markt gewaltig.
Diese ganzen peak sales forecasts sind sicherlich nett, aber irgendwie trotzdem Firlefanz.
Nehmen wir an 200 Mrd. werden mit mAbs pro Jahr umgesetzt (ist konservativ für die Zukunft).
Nehmen wir an ca. 500 mAbs sind in Entwicklungen, alle bekommen eine Zulassung.
Morphosys entwickelt 80 mAbs, dann entfallen 32 Mrd. auf diesen Teil. Fünf Prozent davon sind 1,6 Mrd.. Bei einem KGV von 20 sind wir wieder bei 32 Mrd.
Sagen wir, ich habe die 500 mAbs unterschätzt und es sind 2000 mAbs (Faktor vier) dann wären wir bei 8 Mrd.
Diese ’theoretische’ Betrachtung zeigt mir, wie attraktiv im Prinzip dieser Markt ist und wie gut Morphosys diesen (mit seinen Partnern) trotz allem adressiert. 80/500 bzw. 80/2000 sind doch Wahnsinn!
Es ist eher arrogant, dass Morphosys keine biosimilars entwickeln will (natürlich nicht allein, sondern auf dem Tantiemenmodel mit einem Partner).
Selbst bei 1% royalties wäre das ein Superanwendungfeld für Ylanthia. Sie können damit mAbs prima optimieren: Halbwertzeit, Löslichkeit, Temperaturstabilität, Expressionsstärke... usf..
Und noch was als Anmerkung:
Entscheidend ist, dass die Pipeline wächst und gedeiht und aus den bestimmt auch innovativen targets endlich zugelassene Medikamente werden.
Seit IPO wird damit hausiert und verspochen, dass mAbs nur 7-8 Jahre statt 10-12 Jahre bis zur Zulassung brauchen. Viele der Morphosys-Partner sind Schlafmützen! -nur leere Ankündigungen.
Ich mochte die target-Exklusivität nie. Sie verhindert Konkurrenz zwischen den Hucal-Anwendern.
Man hat sich damit abkochen lassen! Man ist am ausgestreckten Arm sicherlich nicht verhungert, jedoch richtig fett fressen war nicht.
Wer den Laden seit Anbeginn kennt, hat sicherlich noch im Ohr: Bayer bis zu 20 Programme, Pfizer, Schering, Schering-Plough, Merck, Astellas, Daiichi... 15 der Top 20 Pharmas waren Kunden und dafür sind heute 80 Programme zu wenig. Außer Janssen und Novartis und Roche mit einem Programm, fast nur enttäuschendes.
Der Lizenznehmer der am SCHNELLSTEN ein Hucal-mAb gegen ein bestimmtes target durch die klinische Entwicklung zieht, soll den Nutzen haben. Und nicht der Partner, der weniger aggressiv seine mAbs entwickelt, aber zu erst einen Vertrag abgeschlossen und damit targets blockiert hat.
Das ist bzw. war Morphosys Problem. Sie hatten nie einen Hebel –trotz klasse Technologie- ihre Kunden zu voran zu treiben. Inzwischen ist Hucal nicht mehr der Star und Ylanthia auch nicht.
Wie gesagt 1% für biosimilars mit Ylanthia würden riesige Märkte eröffnen, ohne viel in F&E stecken zu müssen!
Zum Glück hatte SM genug Geld, um eigene Ideen voranzubringen und sich damit unabhängig gemacht.
Zitat von Joschka Schröder: rollingovermilestones, es gibt keinen Anlass zur Hektik.
1. Welche Gelder GSK tatsächlich in die Entwicklung des MOR103 stecken wird, hängt von weiteren Studienergebnissen ab, nicht von den Erwartungen/der Phantasie Dritter. Es ist ja nicht so, dass GSK intern bereits ein Entwicklungsbudget in Höhe von 750 Mio. für MOR103 abgenickt hätte.
2. 400 Mio. € entsprechen ca. 536 Mio. USD ... dies soll ein Umsatzvolumen sein, das die Entwicklung eines therapeutischen Antikörpers unrentabel macht?
3. Wer selber einmal persönlich mit der Entwicklung von Biotherapeutika näher befasst war, wird in seinen Prognosen zurückhaltender. Ich denke, in einer sachbezogenen Diskussion sollte dies eigentlich zu akzeptieren sein.
4. Von einer "Marktsättigung" war nie die Rede. Die finanziellen Ressourcen in den staatlichen und nichtstaatlichen Gesundheitssystemen sind jedoch limitiert. Unbegrenztes Wachstum gibt es nicht.
5. Die Erkenntnis, dass man "von Gesundheit nicht genug haben" kann, ist trivial, bei der Bewertung von Pharmaunternehmen aber nicht besonders hilfreich.
Antwort auf Beitrag Nr.: 45.904.694 von rollingovermilestones am 23.11.13 22:16:51@rollingovermilestones
Ich wäre dankbar, wenn die Diskussionen in einem anderen Thread fortgeführt werden könnten. Dieser Thread ist als Plattform für fachliche Diskussionen der Entwicklungspipeline gedacht. Es war schon ein Fehler, dass ich im Rahmen dieses Threads auf Deinen Beitrag #186 geantwortet habe.
Diskussionen allgemeiner Art sind in anderen Threads besser aufgehoben.
Um das Thema an dieser Stelle abzuschießen: Deine Annahmen
Nehmen wir an 200 Mrd. werden mit mAbs pro Jahr umgesetzt (ist konservativ für die Zukunft).
Nehmen wir an ca. 500 mAbs sind in Entwicklungen, alle bekommen eine Zulassung.
Morphosys entwickelt 80 mAbs, dann entfallen 32 Mrd. auf diesen Teil. Fünf Prozent davon sind 1,6 Mrd.. Bei einem KGV von 20 sind wir wieder bei 32 Mrd.
entbehren aus meiner Sicht jeglicher Realität. Ich bin gerne bereit, an anderer Stelle darüber weiter zu diskutieren, in diesem Thrad jedoch nicht (s.o.).
Ich wäre dankbar, wenn die Diskussionen in einem anderen Thread fortgeführt werden könnten. Dieser Thread ist als Plattform für fachliche Diskussionen der Entwicklungspipeline gedacht. Es war schon ein Fehler, dass ich im Rahmen dieses Threads auf Deinen Beitrag #186 geantwortet habe.
Diskussionen allgemeiner Art sind in anderen Threads besser aufgehoben.
Um das Thema an dieser Stelle abzuschießen: Deine Annahmen
Nehmen wir an 200 Mrd. werden mit mAbs pro Jahr umgesetzt (ist konservativ für die Zukunft).
Nehmen wir an ca. 500 mAbs sind in Entwicklungen, alle bekommen eine Zulassung.
Morphosys entwickelt 80 mAbs, dann entfallen 32 Mrd. auf diesen Teil. Fünf Prozent davon sind 1,6 Mrd.. Bei einem KGV von 20 sind wir wieder bei 32 Mrd.
entbehren aus meiner Sicht jeglicher Realität. Ich bin gerne bereit, an anderer Stelle darüber weiter zu diskutieren, in diesem Thrad jedoch nicht (s.o.).
Zitat von Joschka Schröder: @rollingovermilestones
Ich wäre dankbar, wenn die Diskussionen in einem anderen Thread fortgeführt werden könnten. Dieser Thread ist als Plattform für fachliche Diskussionen der Entwicklungspipeline gedacht. Es war schon ein Fehler, dass ich im Rahmen dieses Threads auf Deinen Beitrag #186 geantwortet habe.
Diskussionen allgemeiner Art sind in anderen Threads besser aufgehoben.
Nun, ich hatte mich leidlich in die Beiträge #184, 185 mit meinem #186 eingeklinkt, unter welcher Überschrift auch immer.
Der dortige ’fachliche’ Inhalt war vergleichbar mau.... Oder siehst du das anders?
In der Tat finde ich es löblich, einen thread auf fachliches zu beschränken und ich mag die Gedanken und Anregungen sehr, die dort vertauscht werden!
Ist zwar nichts 'fachliches' hat jedoch mit einem Konkurrenz-mAb zu tun. Ich hoffe, in Martinsried kommen 2014 auch CD38 milestones und Celgene/Morphosys geben Gas, um Anschluss zu halten....
Genmab Reaches First Milestone in Daratumumab Collaboration with Janssen & Improves 2013 Financial Guidance
Company Announcement
-- Genmab to receive USD 8 million milestone payment from Janssen -- Milestone triggered by clinical development progress -- 2013 financial guidance improved
Copenhagen, Denmark; November 26, 2013 - Genmab A/S (OMX: GEN) announced today it has reached the first milestone in its daratumumab collaboration with Janssen Biotech, Inc. ("Janssen"). The milestone was triggered by progress in the clinical development of daratumumab. Genmab will receive a USD 8 million milestone payment from Janssen in connection with this event.
"Since the inception of our agreement with Janssen, we have reported encouraging data from two clinical studies of daratumumab and have started one new study. We are pleased to reach the first milestone in this productive collaboration and look forward to making further progress with daratumumab," said Jan van de Winkel, Ph.D., Chief Executive Officer of Genmab.
Genmab Reaches First Milestone in Daratumumab Collaboration with Janssen & Improves 2013 Financial Guidance
Company Announcement
-- Genmab to receive USD 8 million milestone payment from Janssen -- Milestone triggered by clinical development progress -- 2013 financial guidance improved
Copenhagen, Denmark; November 26, 2013 - Genmab A/S (OMX: GEN) announced today it has reached the first milestone in its daratumumab collaboration with Janssen Biotech, Inc. ("Janssen"). The milestone was triggered by progress in the clinical development of daratumumab. Genmab will receive a USD 8 million milestone payment from Janssen in connection with this event.
"Since the inception of our agreement with Janssen, we have reported encouraging data from two clinical studies of daratumumab and have started one new study. We are pleased to reach the first milestone in this productive collaboration and look forward to making further progress with daratumumab," said Jan van de Winkel, Ph.D., Chief Executive Officer of Genmab.
Lesenswerte Publikation zu BYM338 in der Online-Ausgabe der Mol.Cell.Biol. am 2.12.2013 mit umfangreicher Präsentation präklinischer Ergebnisse.
Interessant u.a. die Therapie kortisoninduzierter Muskelschwäche durch BYM338. Ausgezeichneter Therapieeffekt. Diese Indikation könnte ggf. einen großen Zusatzmarkt erschließen.
Wichtig auch der Vergleich zwischen ActRIIB-Blockade (via BYM338) und Myostation-Blockade (Wirkmechanismus z.B. von Lillys LY2495655 und Pfizers PF-06252616), bei dem sich die ActRIIB-Blockade als deutlich wirksamer erweist (ca. doppelt so großer Muskelzuwachs). Bei Indikationen wie Tumorkachexie reicht die Myostatin-Blockade allein nicht aus, um einen therapeutischen Effekt zu erzielen.
Interessant u.a. die Therapie kortisoninduzierter Muskelschwäche durch BYM338. Ausgezeichneter Therapieeffekt. Diese Indikation könnte ggf. einen großen Zusatzmarkt erschließen.
Wichtig auch der Vergleich zwischen ActRIIB-Blockade (via BYM338) und Myostation-Blockade (Wirkmechanismus z.B. von Lillys LY2495655 und Pfizers PF-06252616), bei dem sich die ActRIIB-Blockade als deutlich wirksamer erweist (ca. doppelt so großer Muskelzuwachs). Bei Indikationen wie Tumorkachexie reicht die Myostatin-Blockade allein nicht aus, um einen therapeutischen Effekt zu erzielen.
Betrifft MOR202
ASH2013:
Die ersten Daratumumab-Kombi-Daten (LEN/DEX) sehen sehr gut aus. Kleines Patientenkollektiv, in den niedrigen Dosisgruppen, in denen bereits etwas länger behandelt worden ist, jedoch ausgezeichnete Wirkung (100 % ORR, fast alles CR und VGPR).
Heute kommen weitere Konkurrenzdaten (u.a. BT-062, SAR650984).
Im Anschluss an die ASH-Tagung werde ich vielleicht einen Vergleich ins Netz stellen. Wichtig immer dabei, die Einschlusskriterien zu beachten (Patientenauswahl, Vorbehandlungen, Resistenzen etc.).
ASH2013:
Die ersten Daratumumab-Kombi-Daten (LEN/DEX) sehen sehr gut aus. Kleines Patientenkollektiv, in den niedrigen Dosisgruppen, in denen bereits etwas länger behandelt worden ist, jedoch ausgezeichnete Wirkung (100 % ORR, fast alles CR und VGPR).
Heute kommen weitere Konkurrenzdaten (u.a. BT-062, SAR650984).
Im Anschluss an die ASH-Tagung werde ich vielleicht einen Vergleich ins Netz stellen. Wichtig immer dabei, die Einschlusskriterien zu beachten (Patientenauswahl, Vorbehandlungen, Resistenzen etc.).
Betrifft MOR208, das nun in einer Kombinationsstudie mit Lenalidomide in der Indikation CLL getestet werden soll:
Extrem harte Konkurrenz, das wird für MOR208 äußerst schwierig. Einige aussichtsreiche Konkurrenzpräparate werden hier -> http://www.bloomberg.com/news/2013-12-09/new-leukemia-drugs-… erwähnt.
Extrem harte Konkurrenz, das wird für MOR208 äußerst schwierig. Einige aussichtsreiche Konkurrenzpräparate werden hier -> http://www.bloomberg.com/news/2013-12-09/new-leukemia-drugs-… erwähnt.
MorphoSys gibt weitere klinische Studie für Krebsantikörper MOR208 bekannt
.
10.12.2013 / 07:30, CET
Phase-2-Studie in CLL erprobt MOR208 in Kombination mit Lenalidomid
Die MorphoSys AG (Frankfurt: MOR; Prime Standard Segment, TecDAX, OTC: MPSYY) gab heute bekannt, dass die Ohio State University (OSU), Abteilung für innere Medizin unter der Leitung von Prof. Dr. John Byrd, Director Division of Hematology, klinische Studie begonnen haben, um die Wirksamkeit und Verträglichkeit von MOR208 in Kombination mit dem Medikament Lenalidomid (Revlimid®) in Patienten mit chronischer lymphatischer Leukämie (CLL) zu untersuchen. Die Studie wurde durch die leitende Prüfärztin Dr. Jennifer Woyach, Assistenzprofessor für innere Medizin an der OSU, initiiert, und soll bis zu 20 bisher unbehandelte CLL-Patienten und bis zu 20 mit refraktärer/rezidivierter Verlaufsform einschließen. Die offene, mehrfach dosierte und doppelarmige Studie trägt den Titel "A Phase II Study of MOR00208 in Combination with Lenalidomide for Patients with Relapsed or Refractory Chronic Lymphocytic Leukemia (CLL) / Small Lymphocytic Lymphoma (SLL), Prolymphocytic Leukemia (PLL) or Patients with Untreated CLL/SLL/PLL". MorphoSys wird den Antikörperwirkstoff MOR208 für die Studie zur Verfügung stellen. Weitere Informationen zur Studie sind unter dem Suchbegriff MOR208 auf der Internetseite www.clinicaltrials.gov verfügbar.
"Wir sind sehr erfreut, dass sich Dr. Jennifer Woyach entschieden hat, diese Studie zu beginnen. Die erste Studie zu MOR208, bei der die Initiative von einem Prüfarzt ausgeht, belegt auch das wachsende Interesse an diesem innovativen Antikörperwirkstoff in der medizinischen Fachwelt. Es konnte in vorklinischen Modellen gezeigt werden, dass MOR208 synergistisch mit dem Immunmodulator Lenalidomid wirken kann. Im Gegensatz zu anderen möglichen Kombinationspartnern lässt Lenalidomid die durch den Fc-Rezeptor stimulierte Immunantwort der natürlichen Killerzellen unangetastet, insbesondere die Antikörper-vermittelte zelluläre Toxizität (ADCC). Damit könnte die Kombination die tumorhemmende Wirkung beider Wirkstoffe erhalten. Die Kombination kann CLL-Patienten mit begrenzten Behandlungsmöglichkeiten eine Chemotherapie-freie Alternative bieten", erklärte Dr. Arndt Schottelius, Entwicklungsvorstand der MorphoSys AG.
MOR208 ist ein humanisierter, monoklonaler Anti-CD19-Antikörper zur Behandlung maligner Erkrankungen der B-Zellen sowie Autoimmun-Erkrankungen. MOR208 wurde dahingehend optimiert, dass er eine deutlich gesteigerte Immunantwort mittels antikörperabhängiger zellulärer Zytotoxizität (ADCC) auslöst, wodurch ein Schlüsselmechanismus bei der Abtötung von Tumorzellen verbessert wurde und das Potenzial für eine höhere Wirksamkeit im Vergleich zu herkömmlichen Krebs-Antikörpern besteht.
Präklinische Studien der MorphoSys AG weisen darauf hin, dass Lenalidomid ein leistungsfähiger Kombinationspartner für den therapeutischen Antikörper MOR208 sein kann. Lenalidomid verstärkte in präklinischen Modellen die Immunantwort durch T-Zellen und natürliche Killerzellen. MOR208 in Kombination mit Lenalidomid hat eine stärkere zytotoxische Wirkung gezeigt als MOR208 alleine, was auf eine synergistische Wirkweise der beiden Substanzen hindeutet.
MOR208 zeigte in einer Phase-1/2a-Studie vielversprechende erste Anzeichen der Anti-Tumor-Wirksamkeit und ein akzeptables Sicherheits- und Verträglichkeitsprofil in intensiv vorbehandelten Hochrisiko-Patienten mit chronischer lymphatischer Leukämie (CLL) oder kleinzellig-lymphozytischem Lymphom (SLL). Die finalen Studienergebnisse zeigten eine Gesamtansprechrate von 29,6% (gemäß der IWCLL-Kriterien von 2008) basierend auf der Gesamtzahl der behandelten Teilnehmer der Studie (n=27). MorphoSys prüft den Wirkstoff derzeit in klinischen Phase-2-Studien in akuter lymphatischer B-Zell-Leukämie (B-ALL) und dem Non-Hodgkin-Lymphom.
...
.
10.12.2013 / 07:30, CET
Phase-2-Studie in CLL erprobt MOR208 in Kombination mit Lenalidomid
Die MorphoSys AG (Frankfurt: MOR; Prime Standard Segment, TecDAX, OTC: MPSYY) gab heute bekannt, dass die Ohio State University (OSU), Abteilung für innere Medizin unter der Leitung von Prof. Dr. John Byrd, Director Division of Hematology, klinische Studie begonnen haben, um die Wirksamkeit und Verträglichkeit von MOR208 in Kombination mit dem Medikament Lenalidomid (Revlimid®) in Patienten mit chronischer lymphatischer Leukämie (CLL) zu untersuchen. Die Studie wurde durch die leitende Prüfärztin Dr. Jennifer Woyach, Assistenzprofessor für innere Medizin an der OSU, initiiert, und soll bis zu 20 bisher unbehandelte CLL-Patienten und bis zu 20 mit refraktärer/rezidivierter Verlaufsform einschließen. Die offene, mehrfach dosierte und doppelarmige Studie trägt den Titel "A Phase II Study of MOR00208 in Combination with Lenalidomide for Patients with Relapsed or Refractory Chronic Lymphocytic Leukemia (CLL) / Small Lymphocytic Lymphoma (SLL), Prolymphocytic Leukemia (PLL) or Patients with Untreated CLL/SLL/PLL". MorphoSys wird den Antikörperwirkstoff MOR208 für die Studie zur Verfügung stellen. Weitere Informationen zur Studie sind unter dem Suchbegriff MOR208 auf der Internetseite www.clinicaltrials.gov verfügbar.
"Wir sind sehr erfreut, dass sich Dr. Jennifer Woyach entschieden hat, diese Studie zu beginnen. Die erste Studie zu MOR208, bei der die Initiative von einem Prüfarzt ausgeht, belegt auch das wachsende Interesse an diesem innovativen Antikörperwirkstoff in der medizinischen Fachwelt. Es konnte in vorklinischen Modellen gezeigt werden, dass MOR208 synergistisch mit dem Immunmodulator Lenalidomid wirken kann. Im Gegensatz zu anderen möglichen Kombinationspartnern lässt Lenalidomid die durch den Fc-Rezeptor stimulierte Immunantwort der natürlichen Killerzellen unangetastet, insbesondere die Antikörper-vermittelte zelluläre Toxizität (ADCC). Damit könnte die Kombination die tumorhemmende Wirkung beider Wirkstoffe erhalten. Die Kombination kann CLL-Patienten mit begrenzten Behandlungsmöglichkeiten eine Chemotherapie-freie Alternative bieten", erklärte Dr. Arndt Schottelius, Entwicklungsvorstand der MorphoSys AG.
MOR208 ist ein humanisierter, monoklonaler Anti-CD19-Antikörper zur Behandlung maligner Erkrankungen der B-Zellen sowie Autoimmun-Erkrankungen. MOR208 wurde dahingehend optimiert, dass er eine deutlich gesteigerte Immunantwort mittels antikörperabhängiger zellulärer Zytotoxizität (ADCC) auslöst, wodurch ein Schlüsselmechanismus bei der Abtötung von Tumorzellen verbessert wurde und das Potenzial für eine höhere Wirksamkeit im Vergleich zu herkömmlichen Krebs-Antikörpern besteht.
Präklinische Studien der MorphoSys AG weisen darauf hin, dass Lenalidomid ein leistungsfähiger Kombinationspartner für den therapeutischen Antikörper MOR208 sein kann. Lenalidomid verstärkte in präklinischen Modellen die Immunantwort durch T-Zellen und natürliche Killerzellen. MOR208 in Kombination mit Lenalidomid hat eine stärkere zytotoxische Wirkung gezeigt als MOR208 alleine, was auf eine synergistische Wirkweise der beiden Substanzen hindeutet.
MOR208 zeigte in einer Phase-1/2a-Studie vielversprechende erste Anzeichen der Anti-Tumor-Wirksamkeit und ein akzeptables Sicherheits- und Verträglichkeitsprofil in intensiv vorbehandelten Hochrisiko-Patienten mit chronischer lymphatischer Leukämie (CLL) oder kleinzellig-lymphozytischem Lymphom (SLL). Die finalen Studienergebnisse zeigten eine Gesamtansprechrate von 29,6% (gemäß der IWCLL-Kriterien von 2008) basierend auf der Gesamtzahl der behandelten Teilnehmer der Studie (n=27). MorphoSys prüft den Wirkstoff derzeit in klinischen Phase-2-Studien in akuter lymphatischer B-Zell-Leukämie (B-ALL) und dem Non-Hodgkin-Lymphom.
...
Konkurrenz für Gantenerumab:
(Reuters) - Merck & Co said it will advance its experimental Alzheimer's drug into late-stage trials among patients with mild to moderate disease, after an independent monitoring board reviewed its safety and recommended the trial continue to recruit patients.
The data monitoring committee gave its blessing to a far larger trial involving almost 2,000 patients after examining interim safety data from a mid-stage trial of 200 patients who had been treated with the medicine, called MK-8931, for at least three months, Merck said.
The medicine works by blocking an enzyme called BACE that is involved in the production of beta-amyloid, a protein that creates plaques in the brains of people with Alzheimer's disease.
BACE inhibition is considered the most promising new approach to slowing progression of Alzheimer's disease, after other efforts to directly block beta amyloid have failed or fallen short in trials conducted by Pfizer Inc, Eli Lilly and Co and other drugmakers.
Beide Ansätze betreffen die umstrittene Amyloid-Schiene, Gantenerumab zerlegt Amyloid-Plaques, MK-8931 soll bereits deren Bildung verhindern.
(Reuters) - Merck & Co said it will advance its experimental Alzheimer's drug into late-stage trials among patients with mild to moderate disease, after an independent monitoring board reviewed its safety and recommended the trial continue to recruit patients.
The data monitoring committee gave its blessing to a far larger trial involving almost 2,000 patients after examining interim safety data from a mid-stage trial of 200 patients who had been treated with the medicine, called MK-8931, for at least three months, Merck said.
The medicine works by blocking an enzyme called BACE that is involved in the production of beta-amyloid, a protein that creates plaques in the brains of people with Alzheimer's disease.
BACE inhibition is considered the most promising new approach to slowing progression of Alzheimer's disease, after other efforts to directly block beta amyloid have failed or fallen short in trials conducted by Pfizer Inc, Eli Lilly and Co and other drugmakers.
Beide Ansätze betreffen die umstrittene Amyloid-Schiene, Gantenerumab zerlegt Amyloid-Plaques, MK-8931 soll bereits deren Bildung verhindern.
Nebenwirkungen bei der anti CD20-Therapie mit ofatuzumab (Rote-Hand-Brief vom 16.12.13):
Der Hersteller informiert in einem Rote-Hand-Brief über Fälle von HBV-Infektionen und HBV-Reaktivierungen bei Patienten, die mit CD20-Antikörpern wie Ofatumumab behandelt wurden. Einige dieser Fälle führten zu einer fulminanten Hepatitis und Leberversagen, zum Teil mit tödlichem Ausgang.
Bei allen Patienten wird vor Behandlungsbeginn mit Ofatumumab ein HBV-Screening empfohlen. Patienten mit aktiver/bestehender Hepatitis-B-Erkrankung dürfen nicht mit Ofatumumab behandelt werden. Bei Patienten mit einer positiven HBV-Serologie soll ein Arzt mit Erfahrung in der Hepatitis-B-Behandlung zur Überwachung und Einleitung einer antiviralen Therapie zu Rate gezogen werden.
Bei Patienten mit einer HBV-Reaktivierung während der Behandlung (nach vermeintlich überwundener Hepatitis-B-Infektion) müssen Ofatumumab und jede gleichzeitig verabreichte Chemotherapie unverzüglich abgesetzt und geeignete Behandlungsmaßnahmen eingeleitet werden. Eine HBV-Reaktivierung ist definiert als ein plötzlicher Anstieg der HBV-Replikation, die sich in einem schnellen Anstieg der HBV-DNA-Serumspiegel oder im Nachweis von HBsAg bei Personen, die zuvor HBsAg-negativ und anti-HBc-positiv waren, zeigt.
Die zusätzlichen Sicherheitsinformationen werden in der Fachinformation aktualisiert.
Der Hersteller informiert in einem Rote-Hand-Brief über Fälle von HBV-Infektionen und HBV-Reaktivierungen bei Patienten, die mit CD20-Antikörpern wie Ofatumumab behandelt wurden. Einige dieser Fälle führten zu einer fulminanten Hepatitis und Leberversagen, zum Teil mit tödlichem Ausgang.
Bei allen Patienten wird vor Behandlungsbeginn mit Ofatumumab ein HBV-Screening empfohlen. Patienten mit aktiver/bestehender Hepatitis-B-Erkrankung dürfen nicht mit Ofatumumab behandelt werden. Bei Patienten mit einer positiven HBV-Serologie soll ein Arzt mit Erfahrung in der Hepatitis-B-Behandlung zur Überwachung und Einleitung einer antiviralen Therapie zu Rate gezogen werden.
Bei Patienten mit einer HBV-Reaktivierung während der Behandlung (nach vermeintlich überwundener Hepatitis-B-Infektion) müssen Ofatumumab und jede gleichzeitig verabreichte Chemotherapie unverzüglich abgesetzt und geeignete Behandlungsmaßnahmen eingeleitet werden. Eine HBV-Reaktivierung ist definiert als ein plötzlicher Anstieg der HBV-Replikation, die sich in einem schnellen Anstieg der HBV-DNA-Serumspiegel oder im Nachweis von HBsAg bei Personen, die zuvor HBsAg-negativ und anti-HBc-positiv waren, zeigt.
Die zusätzlichen Sicherheitsinformationen werden in der Fachinformation aktualisiert.
Antwort auf Beitrag Nr.: 46.062.794 von Joschka Schröder am 17.12.13 10:05:05Du erwartest ähnliche Risiken bei CD19 bzw. MOR208?
Antwort auf Beitrag Nr.: 46.063.278 von eck64 am 17.12.13 11:07:30Überraschend sind derartige NW bei CD20-Blockade eigentlich nicht. Gleiches trifft natürlich auch auf CD19 zu.
Ich hab´s einfach nur schnell zur Info ins Netz gestellt, der Erkenntnisgewinn hält sich im Rahmen.
Ich hab´s einfach nur schnell zur Info ins Netz gestellt, der Erkenntnisgewinn hält sich im Rahmen.
http://www.prnewswire.com/news-releases/kalobios-presents-cl…
Hallo JoschkaSchröder,
könntest du eine Einschätzung der Ergebnisse abgeben und damit auch die Chance ob und warum GSK das mit MOR103 auch versuchen sollte, bzw. nicht?
Danke vorab.
Amgen hat positive Romosozumab Phase 2 Daten veröffentlicht. Das target sclerostin ist ebenso von NOV/MOR unter BSP804 in klinischen Studien und somit von Interesse:
http://www.benzinga.com/pressreleases/14/01/n4187780/romosoz…" target="_blank" rel="nofollow ugc noopener">http://www.benzinga.com/pressreleases/14/01/n4187780/romosoz…
Allen ein gutes Neues!
Und auf ein neues Jahr mit neuen P3 Studien und Fortschritten bei der Eigenpipeline.
Auf meiner Wunschliste steht eine Erweiterung der Technologie in Richtung Peptid-Binder...
http://www.ncbi.nlm.nih.gov/pubmed/23914189
http://www.benzinga.com/pressreleases/14/01/n4187780/romosoz…" target="_blank" rel="nofollow ugc noopener">http://www.benzinga.com/pressreleases/14/01/n4187780/romosoz…
Allen ein gutes Neues!
Und auf ein neues Jahr mit neuen P3 Studien und Fortschritten bei der Eigenpipeline.
Auf meiner Wunschliste steht eine Erweiterung der Technologie in Richtung Peptid-Binder...
http://www.ncbi.nlm.nih.gov/pubmed/23914189
Zwei Literaturempfehlungen:
Profile of gantenerumab an its potential in the treatment of Alzheimer´s disease. Drug Design, Development and Therapy 2013:7 1359-1364.
Epigenetic suppression of neuroligin 1 underlies amyloid-induced memory deficiency. Nature Neuroscience, online publiziert am 19.1.2014
Profile of gantenerumab an its potential in the treatment of Alzheimer´s disease. Drug Design, Development and Therapy 2013:7 1359-1364.
Epigenetic suppression of neuroligin 1 underlies amyloid-induced memory deficiency. Nature Neuroscience, online publiziert am 19.1.2014
Zitat von Joschka Schröder: Zwei Literaturempfehlungen:
Profile of gantenerumab an its potential in the treatment of Alzheimer´s disease. Drug Design, Development and Therapy 2013:7 1359-1364.
Epigenetic suppression of neuroligin 1 underlies amyloid-induced memory deficiency. Nature Neuroscience, online publiziert am 19.1.2014
Danke!!
Vom zweiten Artikel wusste ich schon. Spricht ja für die amyloid Hypothese.
Was ist im ersten Artikel so zu lesen?
Nachdem im NEJM die Phase II-Ergebnisse des BPS804-Konkurrenzpräparats Romosumab veröffentlicht worden sind, gibt es nun auch im Deutschen Ärzteblatt eine allgemein verständliche Zusammenfassung -> http://www.aerzteblatt.de/nachrichten/57435/Romosozumab-Neue…
Wie erwartet wirkt Romosumab besser als alle bislang zugelassenen Medikamente, auch wenn die anabole Wirkung mit der Zeit leider deutlich nachläßt. Darauf deuteten bereits frühere Ergebnisse hin. Mit diesem Phänomen war ursprünglich (als der AK in die Klinik kam) eigentlich nicht zu rechnen.
Wie erwartet wirkt Romosumab besser als alle bislang zugelassenen Medikamente, auch wenn die anabole Wirkung mit der Zeit leider deutlich nachläßt. Darauf deuteten bereits frühere Ergebnisse hin. Mit diesem Phänomen war ursprünglich (als der AK in die Klinik kam) eigentlich nicht zu rechnen.
Details zur neuen Gantenerumab-Studie -> http://clinicaltrials.gov/ct2/show/NCT02051608?term=Cognitio…
Interessantes (auch wenn teilweise noch etwas unausgegoren) zu möglichen cardio-vasculären Nebenwirkungen von TNF-Antagonisten -> http://www.the-rheumatologist.org/details/article/5759251/Do…
(Von größerer Bedeutung dürften die cardio-protectiven, anti-entzündlichen Effekte der TNF-Antagonisten sein.)
(Von größerer Bedeutung dürften die cardio-protectiven, anti-entzündlichen Effekte der TNF-Antagonisten sein.)
Betrifft indirekt MOR103: Das nicht börsennotierte Biotech-Unternehmen Covagen (ansässig in Zürich-Schlieren) bringt nunmehr den Wirkstoff COVA322 in die Klinik. COVA322 ist ein bispezifisches Protein aus Humira (verliert 2016 den Patentschutz) und einem IL-17A-Antagonisten.
Für Alle, die sich näher mit der Konkurrenz zu MOR208 beschäftigen möchten ->
http://stm.sciencemag.org/content/6/224/224ra25
http://stm.sciencemag.org/content/6/224/224ra25
Die Targets von PF-05082566 (CD137) und BI-836845 (IGF-1) sind nunmehr auch offiziell bestätigt.
Zitat von Joschka Schröder: Die Targets von PF-05082566 (CD137) und BI-836845 (IGF-1) sind nunmehr auch offiziell bestätigt.
Vor allem sind diese Programme überhaupt offiziell von Morphosys als Partnerprogramme bestätigt mit Namen.
Die waren bisher auch noch unbekannt, bzw. nur inoffiziell zugeordnet.
Weiterhin fehlt das Bekenntnis bei 3 klinischen Novartis-Programmen:
In der P2 ist es BPS804 / sclerostin.
Und dann 2 P1 Programme, eines in Augenheilkunde, eines bei Entzündungen. Programmname und target gänzlich unbekannt.
Zitat von Joschka Schröder: Die Targets von PF-05082566 (CD137) und BI-836845 (IGF-1) sind nunmehr auch offiziell bestätigt.
Zu PF-05082566 gibt es gleich noch eine erfreuliche Neuigkeit: Merck wird seinen PD-1 Inhibitor MK-3475 zusammen mit PF-05082566 in klinischen Studien bei multiplen Tumorarten testen -> http://www.genengnews.com/gen-news-highlights/merck-raises-s…
Betrifft indirekt Gantenerumab:
In der aktuellen Ausgabe der Zeitschrift Cell ist eine interessante Arbeit erschienen, die - auf Basis der "tau-Theorie" - neue Ansätze zur Therapie des M. Alzheimer bietet -> http://www.cell.com/retrieve/pii/S0092867414000890
In der aktuellen Ausgabe der Zeitschrift Cell ist eine interessante Arbeit erschienen, die - auf Basis der "tau-Theorie" - neue Ansätze zur Therapie des M. Alzheimer bietet -> http://www.cell.com/retrieve/pii/S0092867414000890
Noch eine aktuelle Arbeit, die im Zusammenhang mit der tau-Theorie von Interesse ist -> http://jem.rupress.org/content/early/2014/02/11/jem.20131685
Novartis AG (NOVN)’s muscle-building drug bimagrumab may reach as much as $4 billion in peak sales, according to the medicine’s co-developer.
The forecast is for the use of the treatment, known as BYM338, in all indications, according to Simon Moroney, chief executive officer of MorphoSys AG (MOR), the company that developed the drug for Novartis. He spoke yesterday at an investor event in Munich.
Novartis has said it plans to ask regulators for permission to market the drug to treat sporadic inclusion body myositis, a rare disease characterized by weakening muscles, as early as in 2016. MorphoSys will receive mid-single-digit percentage royalties on sales of the drug, Moroney said. Novartis hasn’t given a revenue estimate for the drug, Anja von Treskow, a spokeswoman for Basel, Switzerland-based drugmaker said in an e-mail.
The drug is currently being tested to treat other illnesses, and the largest share of sales will probably be from ailments such as cachexia, the weight and muscle loss that’s often found in patients with illnesses such as cancer and chronic obstructive pulmonary disease, Moroney said. The forecast is the result of an external estimate MorphoSys commissioned, he also said.
The forecast is for the use of the treatment, known as BYM338, in all indications, according to Simon Moroney, chief executive officer of MorphoSys AG (MOR), the company that developed the drug for Novartis. He spoke yesterday at an investor event in Munich.
Novartis has said it plans to ask regulators for permission to market the drug to treat sporadic inclusion body myositis, a rare disease characterized by weakening muscles, as early as in 2016. MorphoSys will receive mid-single-digit percentage royalties on sales of the drug, Moroney said. Novartis hasn’t given a revenue estimate for the drug, Anja von Treskow, a spokeswoman for Basel, Switzerland-based drugmaker said in an e-mail.
The drug is currently being tested to treat other illnesses, and the largest share of sales will probably be from ailments such as cachexia, the weight and muscle loss that’s often found in patients with illnesses such as cancer and chronic obstructive pulmonary disease, Moroney said. The forecast is the result of an external estimate MorphoSys commissioned, he also said.
Aktuell wird eine umfassende Kooperation zwischen Biogen und Eisai in der Indikation Morbus Alzheimer gemeldet, u.a. mit E2609, einem BACE-Hemmer (Phase II), BAN2401, einem humanisierten MaB gegen lösliche, toxische Amyloid-Oligomere (Phase II), BIIB037, einem humanen MaB, vergleichbar in etwa Gantenerumab (Phase Ib) und einem anti tau-Mab (nicht näher benannt, in den einschlägigen Patentdatenbanken habe ich diesbezüglich noch nicht nachgesehen).
Zusammenfassung siehe auch hier -> http://www.bioportfolio.com/news/article/1841765/Eisai-and-B…
Zusammenfassung siehe auch hier -> http://www.bioportfolio.com/news/article/1841765/Eisai-and-B…
Bald müßten die BPS804-Ergebnisse (Osteoporose-Studie) vorliegen.
BPS804 wird sich mit anderen anti-Sclerostin-Antikörpern wie Romosozumab (Amgen) und blosozumab (Eli Lilly) messen müssen.
Über Amgens Rosozumab (derzeot Phase III) wurde bereits ausführlich berichtet. Zu blosozumab finden sich beispielsweise hier -> http://www.bone-abstracts.org/ba/0001/ba0001OC5.3.htm Daten aus einer abgeschlossenen Phase II-Studie.
BPS804 ist gegenüber den beiden anderen MABs zeitlich leider in Verzug. Rosozumab wird vermutlich einige Jahre früher zugelassen werden und damit als Platzhirsch agieren.
BPS804 wird sich mit anderen anti-Sclerostin-Antikörpern wie Romosozumab (Amgen) und blosozumab (Eli Lilly) messen müssen.
Über Amgens Rosozumab (derzeot Phase III) wurde bereits ausführlich berichtet. Zu blosozumab finden sich beispielsweise hier -> http://www.bone-abstracts.org/ba/0001/ba0001OC5.3.htm Daten aus einer abgeschlossenen Phase II-Studie.
BPS804 ist gegenüber den beiden anderen MABs zeitlich leider in Verzug. Rosozumab wird vermutlich einige Jahre früher zugelassen werden und damit als Platzhirsch agieren.
Antwort auf Beitrag Nr.: 46.544.453 von Joschka Schröder am 28.02.14 19:34:18Hier ein Bericht zu dem Thema #212
(biotechnologie.de, vom 03.03.14)
http://www.biotechnologie.de/BIO/Navigation/DE/root,did=1710…
(biotechnologie.de, vom 03.03.14)
http://www.biotechnologie.de/BIO/Navigation/DE/root,did=1710…
Lesenswert:
Sclerostin: how human mutations have helped reveal a new target for the treatment of osteoporosis. Erschienen in Drug Discovery Today, Vol 18, Nr. 13/14, 2013.
Ich glaube, die Übersichtsarbeit ist frei erhältlich.
Sclerostin: how human mutations have helped reveal a new target for the treatment of osteoporosis. Erschienen in Drug Discovery Today, Vol 18, Nr. 13/14, 2013.
Ich glaube, die Übersichtsarbeit ist frei erhältlich.
Zitat von Joschka Schröder: Lesenswert:
Sclerostin: how human mutations have helped reveal a new target for the treatment of osteoporosis. Erschienen in Drug Discovery Today, Vol 18, Nr. 13/14, 2013.
Ich glaube, die Übersichtsarbeit ist frei erhältlich.
Meinst du den hier:
http://csmres.co.uk/cs.public.upd/article-downloads/Sclerost…
Wie schätzt du aktuell die Chancen ein, das BPS804/sclerostin-mAB in die P3 kommt?
Bei Bimagrumab gibt es z.B. einen mab-Namen, eine ganze Varianten-Reihe an P2-Studien. Das erscheint weit dynamischer.
Antwort auf Beitrag Nr.: 46.573.607 von eck64 am 06.03.14 09:57:31Die Geheimnistuerei um BPS804 ist mir ein Rätsel.
Während für BYM338 (Bimabrumab) schon lange vor Abschluss der P2-Studie(n) eine Stellenausschreibung für die später geplante Markteinführung veröffentlicht worden ist, gibt es bzgl. BPS804 keinerlei Informationen.
Die präklinischen BPS804-Daten haben mir sehr gut gefallen. Bald müßten die Daten der Osteoporose-Studie vorliegen. Dann wird man hinsichtlich der weiteren Entwicklung klarer sehen.
Während für BYM338 (Bimabrumab) schon lange vor Abschluss der P2-Studie(n) eine Stellenausschreibung für die später geplante Markteinführung veröffentlicht worden ist, gibt es bzgl. BPS804 keinerlei Informationen.
Die präklinischen BPS804-Daten haben mir sehr gut gefallen. Bald müßten die Daten der Osteoporose-Studie vorliegen. Dann wird man hinsichtlich der weiteren Entwicklung klarer sehen.
http://www.firstwordpharma.com/node/1197550?tsid=28®ion_i…" target="_blank" rel="nofollow ugc noopener">http://www.firstwordpharma.com/node/1197550?tsid=28®ion_i…
....Guselkumab also appeared to be as good as or more effective than AbbVie's Humira (adalimumab) at four of the tested doses, ....
http://www.medpagetoday.com/Dermatology/Psoriasis/44889" target="_blank" rel="nofollow ugc noopener">http://www.medpagetoday.com/Dermatology/Psoriasis/44889
http://news.yahoo.com/experimental-j-j-psoriasis-drug-153000…" target="_blank" rel="nofollow ugc noopener">http://news.yahoo.com/experimental-j-j-psoriasis-drug-153000…
http://pakobserver.net/detailnews.asp?id=237262" target="_blank" rel="nofollow ugc noopener">http://pakobserver.net/detailnews.asp?id=237262
Der Entzündungsmarkt ist riesig, hat allerdings mit den ganzen TNF-Blockern gewaltig Konkurrenz...
Humira und Co. was abzugraben wird nicht leicht werden.
Aber bei aller Euphorie: das war zunächst Phase 2 und 'nur' in Psoriasis. Das Ziel Markteinführung ist längst noch nicht erreicht!
Ich bin wirklich sehr gespannt, ob Guselkumab noch bevor Bimagrumab zugelassen wird.
....Guselkumab also appeared to be as good as or more effective than AbbVie's Humira (adalimumab) at four of the tested doses, ....
http://www.medpagetoday.com/Dermatology/Psoriasis/44889" target="_blank" rel="nofollow ugc noopener">http://www.medpagetoday.com/Dermatology/Psoriasis/44889
http://news.yahoo.com/experimental-j-j-psoriasis-drug-153000…" target="_blank" rel="nofollow ugc noopener">http://news.yahoo.com/experimental-j-j-psoriasis-drug-153000…
http://pakobserver.net/detailnews.asp?id=237262" target="_blank" rel="nofollow ugc noopener">http://pakobserver.net/detailnews.asp?id=237262
Der Entzündungsmarkt ist riesig, hat allerdings mit den ganzen TNF-Blockern gewaltig Konkurrenz...
Humira und Co. was abzugraben wird nicht leicht werden.
Aber bei aller Euphorie: das war zunächst Phase 2 und 'nur' in Psoriasis. Das Ziel Markteinführung ist längst noch nicht erreicht!
Ich bin wirklich sehr gespannt, ob Guselkumab noch bevor Bimagrumab zugelassen wird.
Zitat von rollingovermilestones: Eine Frage an die Experten:
Was wird eurer Meinung nach der erste Morphosys Wirkstoff sein, der zugelassen wird?
Von der aktuellen Pipeline http://www.morphosys.de/pipeline halte ich Guselkumab für sehr aussichtsreich die "Ziellinie" als erster zu kreuzen.
Das target verspricht in meinen Augen sehr hohe Umsätze in etlichen inflammatorischen Indikationen und ist wahrscheinlich MOR103 in der Anwendungsbreite überlegen (zumindest als Dauertherapie bei chronischen Entzündungen).
Ich bin sehr gespannt auf eure Einschätzungen und die Bewertung der Pipeline. Es ist sicherlich klar, dass keine zuverlässigen Vorhersagen möglich sind, aber eure Meinung interessiert mich trotzdessen!
Bildquelle: http://files.shareholder.com/downloads/JNJ/2609194274x0x6664…
Antwort auf Beitrag Nr.: 46.686.789 von rollingovermilestones am 24.03.14 11:48:49Zumindest erscheint mir Laien Guselkumab bei Entzündungs-/Hautkrankheit wie Psoiasis weniger riskant, auch bei längerfristiger Behandlung.
Während eine Muskelwachstumsstimulierung durch Bimagrumab die Frage aufwirft, was z.B. mit dem Herz passiert, bzw. welche Museklpartien wie unterschiedlich betroffen sind.
Guselkumab muss man sicher auch auf der Rechnung haben.
Während eine Muskelwachstumsstimulierung durch Bimagrumab die Frage aufwirft, was z.B. mit dem Herz passiert, bzw. welche Museklpartien wie unterschiedlich betroffen sind.
Guselkumab muss man sicher auch auf der Rechnung haben.
Ich schau mir gerade den Psoriasis-Markt an. Alleine im Segement der monoklonalen Antikörper befinden sich zahlreiche Präparate in den klinischen Phasen II und III. Das wird nach etwaigen Zulassungen ein Hauen und Stechen geben:
Zugelassen ist bereits ustekimumab/stelara (anti IL-12/23, Johnson&Johnson).
aktuell in PIII:
secukinumab, anti IL-17A, Novartis
brodalumab, anti IL-17, Amgen
ixekizumab, anti IL-17, Elli Lilly
tildrakizumab, anti IL-23, Merck Inc.
aktuell in PII
guselkumab, anti IL-23p19,Johnson&Johnson/MOR
Tregalizumab/BT-061, anti CD4/CD25, Abbvie/Biotest
Zugelassen ist bereits ustekimumab/stelara (anti IL-12/23, Johnson&Johnson).
aktuell in PIII:
secukinumab, anti IL-17A, Novartis
brodalumab, anti IL-17, Amgen
ixekizumab, anti IL-17, Elli Lilly
tildrakizumab, anti IL-23, Merck Inc.
aktuell in PII
guselkumab, anti IL-23p19,Johnson&Johnson/MOR
Tregalizumab/BT-061, anti CD4/CD25, Abbvie/Biotest
In der Liste fehlt CNTO6785, target IL17a und ein HuCal-mAb, z.Z. für RA in P2.
Klar, der Entzündungsmarkt ist immens und bleibt sehr attraktiv.
Das zeigt jetzt selbst die gute alte amgen und entwickelt biosimilars im anti-TNF Feld.
In meinen Augen sollte MOR mit den superguten Optimierungsmöglichkeiten von ylanthia sich auch im biosimilar space tummeln. Mit Partner natürlich. Dosing (schedule) und Halbwertzeiten zu optimieren sind mit ylanthia sehr gut machbar und ein wichtiges Argument bei Ärzten für eine effektivere Patientenversorgung.
Aber das werden wir mit SM nicht erleben...
Er hat kein Interesse an biobetters; sondern einen Tunnelblick für first-in/best-in class. -Leider!
Klar, der Entzündungsmarkt ist immens und bleibt sehr attraktiv.
Das zeigt jetzt selbst die gute alte amgen und entwickelt biosimilars im anti-TNF Feld.
In meinen Augen sollte MOR mit den superguten Optimierungsmöglichkeiten von ylanthia sich auch im biosimilar space tummeln. Mit Partner natürlich. Dosing (schedule) und Halbwertzeiten zu optimieren sind mit ylanthia sehr gut machbar und ein wichtiges Argument bei Ärzten für eine effektivere Patientenversorgung.
Aber das werden wir mit SM nicht erleben...
Er hat kein Interesse an biobetters; sondern einen Tunnelblick für first-in/best-in class. -Leider!
Zitat von Joschka Schröder: Ich schau mir gerade den Psoriasis-Markt an. Alleine im Segement der monoklonalen Antikörper befinden sich zahlreiche Präparate in den klinischen Phasen II und III. Das wird nach etwaigen Zulassungen ein Hauen und Stechen geben:
Zugelassen ist bereits ustekimumab/stelara (anti IL-12/23, Johnson&Johnson).
aktuell in PIII:
secukinumab, anti IL-17A, Novartis
brodalumab, anti IL-17, Amgen
ixekizumab, anti IL-17, Elli Lilly
tildrakizumab, anti IL-23, Merck Inc.
aktuell in PII
guselkumab, anti IL-23p19,Johnson&Johnson/MOR
Tregalizumab/BT-061, anti CD4/CD25, Abbvie/Biotest
Zitat von Joschka Schröder:Zitat von rollingovermilestones: In der Liste fehlt CNTO6785, target IL17a und ein HuCal-mAb, z.Z. für RA in P2.
CNTO6784 wird nicht in der Indikation Psoriasis getestet und gehört somit auch nicht in die Übersicht.
Das habe ich nicht behauptet, sondern auf RA verwiesen; aber es ist leicht ableitbar, dass PSO auch eine mögliche Indikation für CNTO6784 werden wird. Der Markt ist nicht zu verachten.
Insofern hast du genau genommen Recht, dass CNTO6785 (noch) nicht in deine Liste gehört.
Ich halte es jedoch für äußerst abwegig, dass Janssen mit anti-IL17A nur RA im Blick hat. Oder?
Egal, es steht außer Frage, dass immer mehr biologics Entzündungen adressieren, es viele sinnvolle targets gibt, die wiederum von vielen in Konkurrenz stehenden Pharmas und Biotechs in den Markt gedrückt werden.
In 10 Jahren gibt es zu den gefühlt 10 anti-TNFs noch 20 weitere mAbs für andere targets in den gleichen Indikationen.
Der Markt ist jedoch 50-100 Mrd.$ groß, d.h. trotz vielleicht 30 Produkten hat jedes für sich im statistischen Mittel ein lockeres Blockbusterpotential....
Fragt sich nur wer's bezahlt!
Bislang kann ich keine Überlegenheit guselkumabs im Vergleich zu Konkurrenzpräparaten wie ixekizumab erkennen. Z.B. werden mit ixezizumab nach 12 Wochen die gleichen PASI 75-Werte erreicht wie mit guselkumab nach 16 Wochen.
Hinsichtlich etwaiger Peak Sales-Schätzungen erscheint Zurückhaltung angesagt.
Hinsichtlich etwaiger Peak Sales-Schätzungen erscheint Zurückhaltung angesagt.
In der April-Ausgabe der Nat Rev Rheumatol. ist ein neuer therapeutischer Ansatz via CSF-1 beschrieben ("Experimental arthritis: Antibody against CSF-1 receptor protects bone and cartilage"), der in die gleiche Richtung zielt wie MOR103.
Das ist wirklich interessant ! -> http://www.akdae.de/Arzneimittelsicherheit/Bekanntgaben/Arch…
(betrifft mittelbar u.a. Guselkumab und MOR103)
(betrifft mittelbar u.a. Guselkumab und MOR103)
Betrifft: Gantenerumab
Ich bin bekanntlich skeptisch, was den Amyloid-Ansatz betrifft. Es gibt jedoch indirekte Hinweise darauf, dass sich mit Gantenerumab möglicherweise doch eine therapeutische Wirkung erzielen lässt.
1. Die Wirksamkeitsdaten der Abby-Phase II-Studie mit Crenezumab (anti ABeta-Antikörper Roche/AC Immune) umfassen u.a. ADAS-cog und clinical dementia rating und sind intern bereits bekannt. Kongressvorstellung während der nächsten Monate.
2. Es war überraschend, dass Roche mit Gantenerumab eine zweite aufwendige Phase II-Studie (Marguerite-Studie, 1.000 Patienten, mild Alzheimer´s Disease) gestartet hat, ohne dass Wirksamkeitsdaten aus der Gantenerumab-SCarlet-Studie bekannt sind.
Eine mögliche Erklärung für 2. könnte darin bestehen, dass der Amyloid-Ansatz mit 1. validiert worden ist. Ich bin sehr gespannt.
Ich bin bekanntlich skeptisch, was den Amyloid-Ansatz betrifft. Es gibt jedoch indirekte Hinweise darauf, dass sich mit Gantenerumab möglicherweise doch eine therapeutische Wirkung erzielen lässt.
1. Die Wirksamkeitsdaten der Abby-Phase II-Studie mit Crenezumab (anti ABeta-Antikörper Roche/AC Immune) umfassen u.a. ADAS-cog und clinical dementia rating und sind intern bereits bekannt. Kongressvorstellung während der nächsten Monate.
2. Es war überraschend, dass Roche mit Gantenerumab eine zweite aufwendige Phase II-Studie (Marguerite-Studie, 1.000 Patienten, mild Alzheimer´s Disease) gestartet hat, ohne dass Wirksamkeitsdaten aus der Gantenerumab-SCarlet-Studie bekannt sind.
Eine mögliche Erklärung für 2. könnte darin bestehen, dass der Amyloid-Ansatz mit 1. validiert worden ist. Ich bin sehr gespannt.
Antwort auf Beitrag Nr.: 46.826.231 von Joschka Schröder am 15.04.14 11:52:35Ja, die "soft hints" und die scheinbare Überzeugung bei Roche erzeugen bei mir auch eine sehr gedämpft wohlige Erwartungshaltung. Vielleicht zieht das Lottoticket ja wirklich. 2016 wissen wir es.
Zitat von Joschka Schröder: ... Die Wirksamkeitsdaten der Abby-Phase II-Studie mit Crenezumab (anti ABeta-Antikörper Roche/AC Immune) umfassen u.a. ADAS-cog und clinical dementia rating und sind intern bereits bekannt. Kongressvorstellung während der nächsten Monate. ...
Schon mal dick anstreichen im Kalender: Die Phase II Ergebnisse von Crenezumab werden von Roche auf dem AAIC in Copenhagen July 12-17 vorgestellt.
Zitat von Joschka Schröder: Betrifft: Gantenerumab
Ich bin bekanntlich skeptisch, was den Amyloid-Ansatz betrifft. Es gibt jedoch indirekte Hinweise darauf, dass sich mit Gantenerumab möglicherweise doch eine therapeutische Wirkung erzielen lässt.
1. Die Wirksamkeitsdaten der Abby-Phase II-Studie mit Crenezumab (anti ABeta-Antikörper Roche/AC Immune) umfassen u.a. ADAS-cog und clinical dementia rating und sind intern bereits bekannt. Kongressvorstellung während der nächsten Monate.
2. Es war überraschend, dass Roche mit Gantenerumab eine zweite aufwendige Phase II-Studie (Marguerite-Studie, 1.000 Patienten, mild Alzheimer´s Disease) gestartet hat, ohne dass Wirksamkeitsdaten aus der Gantenerumab-SCarlet-Studie bekannt sind.
Eine mögliche Erklärung für 2. könnte darin bestehen, dass der Amyloid-Ansatz mit 1. validiert worden ist. Ich bin sehr gespannt.
Jedenfalls sind die Gantenerumab ergebnisse wohl immer noch blind, aber es dürfte bei den Frühphasenpatienten, im Gegensatz zu anderen Plaque-Abbau-Studien, keine Probleme gegeben haben mit Gehirnentzündungen.
Den Plaqueabbau hatte Gantenerumab ja bereits hinreichend statistisch signifikant sehr gut bewiesen. Man kann davon ausgehen, dass so auch überhaupt die Plaquebildung bei entsprechend disponierten Menschen verhindert werden kann.
Letztlich ist die primäre Frage: Nützt es auch was gegen Alzheimer, oder macht man "nur" erfolgreich an einem Syptom, also der Plaquebildung herum. Wobei allein diese zu verzögern und zu verhindern bereits ein gewisser Nutzen sein dürfte, z.B. für Kombination mit anderen Medikamenten.
Ich sehe es auch als sehr gutes Zeichen an, das Roche gleich noch eine 1000er Studie nachgelegt hat, mit einem etwas fortgeschritteneren Patientenpool. Hier lassen sich Studienteilnehmer mit weit weniger Aufwand finden.
Antwort auf Beitrag Nr.: 46.839.216 von Ville7 am 17.04.14 05:06:34Stimmt, für die Validierung des Amyloid-Ansatzes - und damit auch etwaiger Gantenerumab-Möglichkeiten - wird der genannte Termin sehr wichtig sein.
Betrifft indirekt MOR208:
Die neuesten Blinatumomab-Daten scheinen sehr gut auszusehen, Amgen hofft auf eine beschleunigte Zulassung -> http://www.fiercebiotech.com/story/amgen-beats-path-fda-look…
Die neuesten Blinatumomab-Daten scheinen sehr gut auszusehen, Amgen hofft auf eine beschleunigte Zulassung -> http://www.fiercebiotech.com/story/amgen-beats-path-fda-look…
hallo joschka,
hast du dir dieses paper mal zu gemüte geführt
http://onlinelibrary.wiley.com/doi/10.1002/jbmr.2059/pdf
was macht NOV mit BPS804??? schläft das projekt ein?
hast du dir dieses paper mal zu gemüte geführt
http://onlinelibrary.wiley.com/doi/10.1002/jbmr.2059/pdf
was macht NOV mit BPS804??? schläft das projekt ein?
Antwort auf Beitrag Nr.: 46.874.264 von PathFinder2 am 25.04.14 12:40:36Ja, hab ich gelesen.
Bei BPS804 warte ich auf die Ergebnisauswertung der Osteoporose-Studie und einen möglichen P3-Start. Aufgrund der bisherigen Geheimniskrämerei dürfte es dazu aber vermutlich keine größeren PR-Mitteilungen geben.
Betrifft Gantenerumab:
Ich tendiere ja eher zur Tau-Theorie. Auf diesem Sektor werden in der Branche nun zunehmend Aktivitäten entwickelt. Jüngste Meldung -> http://www.xconomy.com/san-francisco/2014/04/29/seeking-tau-…
Bei BPS804 warte ich auf die Ergebnisauswertung der Osteoporose-Studie und einen möglichen P3-Start. Aufgrund der bisherigen Geheimniskrämerei dürfte es dazu aber vermutlich keine größeren PR-Mitteilungen geben.
Betrifft Gantenerumab:
Ich tendiere ja eher zur Tau-Theorie. Auf diesem Sektor werden in der Branche nun zunehmend Aktivitäten entwickelt. Jüngste Meldung -> http://www.xconomy.com/san-francisco/2014/04/29/seeking-tau-…
Betrifft (indirekt) Guselkumab:
Covagen startet in der Indikation Psoriasis eine Phase Ib/IIa-Studie mit dem bispezifischen anti-TNF/anti-IL17A-FynomAb COVA322. Wenn ich mich recht erinnere, hatte ich das Präparat früher schon einmal erwähnt.
-> http://www.bioportfolio.com/news/article/1913491/Covagen-Ini…
Covagen startet in der Indikation Psoriasis eine Phase Ib/IIa-Studie mit dem bispezifischen anti-TNF/anti-IL17A-FynomAb COVA322. Wenn ich mich recht erinnere, hatte ich das Präparat früher schon einmal erwähnt.
-> http://www.bioportfolio.com/news/article/1913491/Covagen-Ini…
Betrifft Guselkumab:
Die anti-IL-17(A)-Antikörper secukinumab, brodalumab und ixekizumab führen in etwa zu übereinstimmenden Studienergebnissen. Am Wochenende wurden die aktuellen Phase III-Studienergebnisse zu brodalumab bekannt gegeben http://www.bioportfolio.com/news/article/1921529/Amgen-And-A…" target="_blank" rel="nofollow ugc noopener">http://www.bioportfolio.com/news/article/1921529/Amgen-And-A…
.
guselkumab hat in der X-Plore IIB-Studie ähnliche Ergebnisse erzielt, wobei die Studienkonzepte nicht ganz vergleichbar sind (z.B. wurde bei den anti IL-17-Antikörpern nach 12 Wochen ausgewertet, bei guselkumab nach 16 Wochen).
Die anti-IL-17(A)-Antikörper secukinumab, brodalumab und ixekizumab führen in etwa zu übereinstimmenden Studienergebnissen. Am Wochenende wurden die aktuellen Phase III-Studienergebnisse zu brodalumab bekannt gegeben http://www.bioportfolio.com/news/article/1921529/Amgen-And-A…" target="_blank" rel="nofollow ugc noopener">http://www.bioportfolio.com/news/article/1921529/Amgen-And-A…
.
guselkumab hat in der X-Plore IIB-Studie ähnliche Ergebnisse erzielt, wobei die Studienkonzepte nicht ganz vergleichbar sind (z.B. wurde bei den anti IL-17-Antikörpern nach 12 Wochen ausgewertet, bei guselkumab nach 16 Wochen).
Positiv für MOR103:
AstraZeneca setzt u.a. voll auf Mavralizumab (anti CM-CSF-R-Antikörper)
Quelle: aktuelle Management-Präsentation, zitiert von Reuters -> http://in.reuters.com/article/2014/05/12/us-astrazeneca-pfiz…
AstraZeneca setzt u.a. voll auf Mavralizumab (anti CM-CSF-R-Antikörper)
Quelle: aktuelle Management-Präsentation, zitiert von Reuters -> http://in.reuters.com/article/2014/05/12/us-astrazeneca-pfiz…
Antwort auf Beitrag Nr.: 46.966.716 von Joschka Schröder am 12.05.14 20:13:51Sorry, muss natürlich heißen Mavralimumab (ist human, nicht humanisiert)
Antwort auf Beitrag Nr.: 46.966.716 von Joschka Schröder am 12.05.14 20:13:51Hier noch die heutige Unternehmensmeldung, in der über die Ergebnisse der Mavrilimumab-Phase IIB-Studie berichtet wird -> http://www.astrazeneca.com/Media/Press-releases/Article/2014…
Angaben zu ACR50 und ACR70 fehlen leider, positiv ist, dass es auch nach 24-wöchiger Anwendung nicht zu erwähnenswerten pulmonalen NW gekommen ist. Dies ist die aus meiner Sicht wichtigste Botschaft.
Angaben zu ACR50 und ACR70 fehlen leider, positiv ist, dass es auch nach 24-wöchiger Anwendung nicht zu erwähnenswerten pulmonalen NW gekommen ist. Dies ist die aus meiner Sicht wichtigste Botschaft.
Was gibt ASCO zu den MOR202 Konkurrenten her?
(Posting von g3233 kopiert von Investorvillage):
daratumumab vs. SAR650984
Dose-dependent efficacy of daratumumab (DARA) as monotherapy in patients with relapsed or refractory multiple myeloma (RR MM)
http://abstracts.asco.org/144/AbstView_144_127438.html
Methods: Pts =18 yrs, RR to at least 2 prior lines of therapy, incl. IMiDs and proteasome inhibitors, and ineligible for ASCT were enrolled at 2 dose levels: A: 8mg/kg +/- pre-dose (10mg) wkly for the first 8 infusions.B: 16mg/kg without pre-dose with a 3-wk washout period between the first 2 doses followed by 7 wkly doses. Then all pts were dosed every 2nd wk for 16 wks followed by dosing every 4th wk until disease progression, toxicity or for max 24 mths.
Results: Data from 30 pts in the 8mg/kg cohort and 15 pts in the 16mg/kg cohort recruited into the GEN501 expansion part are presented. Median age was 58.2 (35.1-76.9) and 64.1 (50.5-75.0) years, prior treatment lines were 5 (3-11), and 4 (2-8) and time since diagnosis was 5.5 (2.1-15.2) and 7.1 (0.4-13.3) years, respectively.
ORR at 8 mg/kg (n=30): 7%
ORR at 16 mg/kg (n=13): 46%
Conclusions: DARA monotherapy in RR MM pts resulted in high single agent activity when administered at 16 mg/kg (46% ORR). The safety profile was manageable. Full response data will be presented at the meeting incl. bone marrow assessments.
http://clinicaltrials.gov/ct2/show/NCT00574288
http://clinicaltrials.gov/ct2/show/NCT02136134
http://clinicaltrials.gov/ct2/show/NCT02076009
Daratumumab has received Fast Track Designation and Breakthrough Therapy Designation from the US FDA for the treatment of patients with multiple myeloma who have received at least three prior lines of therapy including a proteasome inhibitor (PI) and an immunomodulatory agent (IMiD) or who are double refractory to a PI and IMiD. Breakthrough Therapy Designation is a program intended to expedite the development and review of drugs to treat serious or life-threatening diseases in cases where preliminary clinical evidence shows that the drug may provide substantial improvements over available therapy. Daratumumab has also received Orphan Drug Designation from the US FDA and the EMA for the treatment of multiple myeloma.
=============
A phase I trial of SAR650984, a CD38 monoclonal antibody, in relapsed or refractory multiple myeloma
http://abstracts.asco.org/144/AbstView_144_129808.html
Methods: SAR was given IV weekly (QW) or every 2 weeks (Q2W). Dose levels (DL) 0.3, 1, 3, 5, 10 and 20 mg/kg Q2W and 10 mg/kg QW using the classic 3+3 design were evaluated.
Results: 35 pts with RRMM were treated; median age 64 yrs (40-76); median lines of therapy were 6 (2-14), 34/35 received an IMiD and a proteasome inhibitor (57% had carfilzomib (C) and/or pomalidomide (P). MTD was not reached at any DL.
ORR at ALL DL (n=34): 24%
ORR at >= 10 mg/kg (n=18): 33%
Conclusions: The MTD of SAR was not reached. SAR demonstrates encouraging and durable single agent efficacy in heavily pretreated RRMM pts, including those with prior (C) and (P) and warrants further evaluation.
(Posting von g3233 kopiert von Investorvillage):
daratumumab vs. SAR650984
Dose-dependent efficacy of daratumumab (DARA) as monotherapy in patients with relapsed or refractory multiple myeloma (RR MM)
http://abstracts.asco.org/144/AbstView_144_127438.html
Methods: Pts =18 yrs, RR to at least 2 prior lines of therapy, incl. IMiDs and proteasome inhibitors, and ineligible for ASCT were enrolled at 2 dose levels: A: 8mg/kg +/- pre-dose (10mg) wkly for the first 8 infusions.B: 16mg/kg without pre-dose with a 3-wk washout period between the first 2 doses followed by 7 wkly doses. Then all pts were dosed every 2nd wk for 16 wks followed by dosing every 4th wk until disease progression, toxicity or for max 24 mths.
Results: Data from 30 pts in the 8mg/kg cohort and 15 pts in the 16mg/kg cohort recruited into the GEN501 expansion part are presented. Median age was 58.2 (35.1-76.9) and 64.1 (50.5-75.0) years, prior treatment lines were 5 (3-11), and 4 (2-8) and time since diagnosis was 5.5 (2.1-15.2) and 7.1 (0.4-13.3) years, respectively.
ORR at 8 mg/kg (n=30): 7%
ORR at 16 mg/kg (n=13): 46%
Conclusions: DARA monotherapy in RR MM pts resulted in high single agent activity when administered at 16 mg/kg (46% ORR). The safety profile was manageable. Full response data will be presented at the meeting incl. bone marrow assessments.
http://clinicaltrials.gov/ct2/show/NCT00574288
http://clinicaltrials.gov/ct2/show/NCT02136134
http://clinicaltrials.gov/ct2/show/NCT02076009
Daratumumab has received Fast Track Designation and Breakthrough Therapy Designation from the US FDA for the treatment of patients with multiple myeloma who have received at least three prior lines of therapy including a proteasome inhibitor (PI) and an immunomodulatory agent (IMiD) or who are double refractory to a PI and IMiD. Breakthrough Therapy Designation is a program intended to expedite the development and review of drugs to treat serious or life-threatening diseases in cases where preliminary clinical evidence shows that the drug may provide substantial improvements over available therapy. Daratumumab has also received Orphan Drug Designation from the US FDA and the EMA for the treatment of multiple myeloma.
=============
A phase I trial of SAR650984, a CD38 monoclonal antibody, in relapsed or refractory multiple myeloma
http://abstracts.asco.org/144/AbstView_144_129808.html
Methods: SAR was given IV weekly (QW) or every 2 weeks (Q2W). Dose levels (DL) 0.3, 1, 3, 5, 10 and 20 mg/kg Q2W and 10 mg/kg QW using the classic 3+3 design were evaluated.
Results: 35 pts with RRMM were treated; median age 64 yrs (40-76); median lines of therapy were 6 (2-14), 34/35 received an IMiD and a proteasome inhibitor (57% had carfilzomib (C) and/or pomalidomide (P). MTD was not reached at any DL.
ORR at ALL DL (n=34): 24%
ORR at >= 10 mg/kg (n=18): 33%
Conclusions: The MTD of SAR was not reached. SAR demonstrates encouraging and durable single agent efficacy in heavily pretreated RRMM pts, including those with prior (C) and (P) and warrants further evaluation.
Die Ergebnisse von OMP-59R5 (anti-Notch2/3; Kooperation OncoMed-Morphosys) sehen vielversprechend aus!
-> http://abstracts.asco.org/144/AbstView_144_134328.html
-> http://abstracts.asco.org/144/AbstView_144_134328.html
Die Kombitherapie aus Trastuzumab und JLM716 (anti HER3; Kooperation Novartis-Morphosys) scheint nicht viel zu bringen -> http://abstracts.asco.org/144/AbstView_144_125589.html
Wird chancenlos gegen Kadcyla-Monotherapie sein.
Wenn Kombinationstherapie, dann allenfalls aus Kadcyla + JLM716.
Wird chancenlos gegen Kadcyla-Monotherapie sein.
Wenn Kombinationstherapie, dann allenfalls aus Kadcyla + JLM716.
Die Daten zu BI-836845 und PF-05082566 reißen mich nicht gerade vom Hocker.
Die anti-CD19-ADC´s von Seattle Genetics und von Sanofi/IMGN haben hingegen gute Ergebnisse erzielt. Die Konkurrenz für MOR208 ist außergewöhnlich groß. Ob es seitens Morphosys sinnvoll ist, große Ressourcen in die Bearbeitung dieses Targets zu stecken?
Die anti-CD19-ADC´s von Seattle Genetics und von Sanofi/IMGN haben hingegen gute Ergebnisse erzielt. Die Konkurrenz für MOR208 ist außergewöhnlich groß. Ob es seitens Morphosys sinnvoll ist, große Ressourcen in die Bearbeitung dieses Targets zu stecken?
Antwort auf Beitrag Nr.: 46.987.578 von Joschka Schröder am 15.05.14 14:01:40Kannst du daraus wirklich schon etwas interpretieren? Und auf Basis welcher Informationen kommt deine Einschätzung?
Schließlich ist es eine Kombistudie mit zwei zusätzlichen Medikamenten. Die Responses scheinen mir nicht abhängig von der Dosis des AKs zu sein, da mit 5mg/kg die größte RR erreicht wurde und der Effekt der erreichten Partial Responses auch ausschließlich auf die Chemotherapien zurückzuführen sein könnte. Zudem ist die Samplesize winzig.
Schließlich ist es eine Kombistudie mit zwei zusätzlichen Medikamenten. Die Responses scheinen mir nicht abhängig von der Dosis des AKs zu sein, da mit 5mg/kg die größte RR erreicht wurde und der Effekt der erreichten Partial Responses auch ausschließlich auf die Chemotherapien zurückzuführen sein könnte. Zudem ist die Samplesize winzig.
Du hast recht, die Kollektive sind in der Tat sehr klein. In der 10 mg-Gruppe und der 5 mg-Gruppe jeweils 100 % PR. Warum die 5 mg-Gruppe am besten abgeschnitten haben soll, erschließt sich mir nicht so recht. Die Auswertung der höheren Dosisgruppen läuft noch. Vielversprechend ist, dass es bislang keine PD gegeben hat. Bei diesem Krankheitsbild ist dies ein Erfolg (wäre mit Chemo alleine kaum erreicht worden). Per Saldo ist es für ein belastbares Urteil natürlich zu früh. Da kann ich Dir nicht widersprechen.
Betrifft MOR208:
Ein weiteres anti-CD19 CAR T program, diesmal von Kite Pharma Inc.
-> http://www.sec.gov/Archives/edgar/data/1510580/0001193125142…
Ein weiteres anti-CD19 CAR T program, diesmal von Kite Pharma Inc.
-> http://www.sec.gov/Archives/edgar/data/1510580/0001193125142…
Betrifft MOR208:
CHMP recommends EU approval of Roche’s Gazyvaro™ for people with chronic lymphocytic leukemia
• In the pivotal phase III CLL11 study, treatment with Gazyvaro (obinutuzumab) plus chlorambucil has been shown to significantly reduce the risk of disease worsening or death by 86% and increase survival time for previously untreated CLL patients compared to those who received treatment with chlorambucil alone
• As compared to MabThera® plus chlorambucil, Gazyvaro plus chlorambucil significantly reduced the risk of disease worsening or death by 61%
Roche (SIX: RO, ROG; OTCQX: RHHBY) today announced that the EU Committee for Medicinal Products for Human Use (CHMP) recommended that the European Commission approve Gazyvaro in combination with chlorambucil for the treatment of adult patients with previously untreated chronic lymphocytic leukemia (CLL) who have comorbidities making them unsuitable for a certain type of chemotherapy (full-dose fludarabine). Gazyvaro is marketed as Gazyva in the U.S. and the rest of the world.
“We are delighted the CHMP has recognized the strength of the Gazyvaro data established in the CLL11 study,” said Sandra Horning, M.D., Roche’s Chief Medical Officer and Head, Global Product Development. “Typically, around half of patients diagnosed with CLL have comorbidities that make full-dose fludarabine based treatment unsuitable for them. We are pleased to be one step closer to making Gazyvaro available as a new foundation of treatment for their disease.”
The CHMP opinion is based primarily on data from the phase III CLL11 study that was conducted in close collaboration with the German CLL Study Group. The study showed that Gazyvaro plus chlorambucil met its primary endpoint by significantly lengthening the amount of time people lived without their disease worsening (progression free survival; PFS) compared to chlorambucil alone and compared to MabThera® (rituximab) plus chlorambucil while also increasing the depth of remissions as measured by Minimal Residual Disease (MRD). Gazyvaro plus chlorambucil also increased survival time for previously untreated CLL patients compared to those who received treatment with chlorambucil alone. Data from the study was recently published in the New England Journal of Medicine (i).
Roche expects a final decision from the European Commission in the coming months.
About Chronic Lymphocytic Leukemia
Chronic lymphocytic leukemia is the most common type of leukemia in the Western world. Each year, CLL is responsible for approximately 10,000 deaths across Europe (ii, iii)
About Gazyvaro
Gazyvaro, marketed as Gazyva in the U.S. and the rest of the world is a new monoclonal antibody designed to attach to CD20, a protein found only on B cells. It attacks targeted cells both directly and together with the body's immune system.
Gazyvaro was discovered by Roche Glycart AG, now known as Roche Innovation Center Zurich, a part of the company's Pharma Research and Early Development organization. In the U.S., Gazyva was approved in November 2013 in combination with chlorambucil for people with previously untreated chronic lymphocytic leukemia. Globally, Gazyvaro is also being investigated in a large clinical program, including multiple head-to-head phase III studies compared to MabThera/Rituxan in indolent non-Hodgkin lymphoma (NHL) and diffuse large B-cell lymphoma (DLBCL).
About the CLL11 study
CLL11 is a phase III, multicentre, open-label, randomised three-arm study conducted in close collaboration with the German CLL Study Group which is investigating the efficacy and safety profile of Gazyvaro plus chlorambucil, MabThera/Rituxan plus chlorambucil and chlorambucil alone in 781 previously untreated people with CLL and co-existing medical conditions who are in need of therapy. Stage 1 (n=589) compared Gazyvaro plus chlorambucil to chlorambucil alone and MabThera/Rituxan plus chlorambucil to chlorambucil alone. Stage 2 (n=663) compared Gazyvaro plus chlorambucil directly with MabThera/Rituxan plus chlorambucil.
The primary endpoint of the study was PFS with secondary endpoints including overall response rate (ORR), overall survival (OS), disease free survival (DFS), MRD and safety profile.
About Roche in hematology
For more than 20 years, Roche has been developing medicines that redefine treatment in hematology. Today, we’re investing more than ever in our effort to bring innovative treatment options to people with cancers of the blood.
In addition to MabThera and Gazyvaro, Roche’s pipeline of potential hematology medicines includes an anti-CD79b antibody drug conjugate (RG7596/polatuzumab vedotin), a small molecule antagonist of MDM2 (RG7112) and in collaboration with AbbVie, a small molecule BCL-2 inhibitor (RG7601/GDC-0199/ABT-199).
CHMP recommends EU approval of Roche’s Gazyvaro™ for people with chronic lymphocytic leukemia
• In the pivotal phase III CLL11 study, treatment with Gazyvaro (obinutuzumab) plus chlorambucil has been shown to significantly reduce the risk of disease worsening or death by 86% and increase survival time for previously untreated CLL patients compared to those who received treatment with chlorambucil alone
• As compared to MabThera® plus chlorambucil, Gazyvaro plus chlorambucil significantly reduced the risk of disease worsening or death by 61%
Roche (SIX: RO, ROG; OTCQX: RHHBY) today announced that the EU Committee for Medicinal Products for Human Use (CHMP) recommended that the European Commission approve Gazyvaro in combination with chlorambucil for the treatment of adult patients with previously untreated chronic lymphocytic leukemia (CLL) who have comorbidities making them unsuitable for a certain type of chemotherapy (full-dose fludarabine). Gazyvaro is marketed as Gazyva in the U.S. and the rest of the world.
“We are delighted the CHMP has recognized the strength of the Gazyvaro data established in the CLL11 study,” said Sandra Horning, M.D., Roche’s Chief Medical Officer and Head, Global Product Development. “Typically, around half of patients diagnosed with CLL have comorbidities that make full-dose fludarabine based treatment unsuitable for them. We are pleased to be one step closer to making Gazyvaro available as a new foundation of treatment for their disease.”
The CHMP opinion is based primarily on data from the phase III CLL11 study that was conducted in close collaboration with the German CLL Study Group. The study showed that Gazyvaro plus chlorambucil met its primary endpoint by significantly lengthening the amount of time people lived without their disease worsening (progression free survival; PFS) compared to chlorambucil alone and compared to MabThera® (rituximab) plus chlorambucil while also increasing the depth of remissions as measured by Minimal Residual Disease (MRD). Gazyvaro plus chlorambucil also increased survival time for previously untreated CLL patients compared to those who received treatment with chlorambucil alone. Data from the study was recently published in the New England Journal of Medicine (i).
Roche expects a final decision from the European Commission in the coming months.
About Chronic Lymphocytic Leukemia
Chronic lymphocytic leukemia is the most common type of leukemia in the Western world. Each year, CLL is responsible for approximately 10,000 deaths across Europe (ii, iii)
About Gazyvaro
Gazyvaro, marketed as Gazyva in the U.S. and the rest of the world is a new monoclonal antibody designed to attach to CD20, a protein found only on B cells. It attacks targeted cells both directly and together with the body's immune system.
Gazyvaro was discovered by Roche Glycart AG, now known as Roche Innovation Center Zurich, a part of the company's Pharma Research and Early Development organization. In the U.S., Gazyva was approved in November 2013 in combination with chlorambucil for people with previously untreated chronic lymphocytic leukemia. Globally, Gazyvaro is also being investigated in a large clinical program, including multiple head-to-head phase III studies compared to MabThera/Rituxan in indolent non-Hodgkin lymphoma (NHL) and diffuse large B-cell lymphoma (DLBCL).
About the CLL11 study
CLL11 is a phase III, multicentre, open-label, randomised three-arm study conducted in close collaboration with the German CLL Study Group which is investigating the efficacy and safety profile of Gazyvaro plus chlorambucil, MabThera/Rituxan plus chlorambucil and chlorambucil alone in 781 previously untreated people with CLL and co-existing medical conditions who are in need of therapy. Stage 1 (n=589) compared Gazyvaro plus chlorambucil to chlorambucil alone and MabThera/Rituxan plus chlorambucil to chlorambucil alone. Stage 2 (n=663) compared Gazyvaro plus chlorambucil directly with MabThera/Rituxan plus chlorambucil.
The primary endpoint of the study was PFS with secondary endpoints including overall response rate (ORR), overall survival (OS), disease free survival (DFS), MRD and safety profile.
About Roche in hematology
For more than 20 years, Roche has been developing medicines that redefine treatment in hematology. Today, we’re investing more than ever in our effort to bring innovative treatment options to people with cancers of the blood.
In addition to MabThera and Gazyvaro, Roche’s pipeline of potential hematology medicines includes an anti-CD79b antibody drug conjugate (RG7596/polatuzumab vedotin), a small molecule antagonist of MDM2 (RG7112) and in collaboration with AbbVie, a small molecule BCL-2 inhibitor (RG7601/GDC-0199/ABT-199).
nochmal (indirekt) zu MOR208:
Nach dem jüngsten Scheitern des anti CD20-Antikörpers ofatumumab in der ORCHARRD-Studie ist nachfolgendes Paper mit dem Titel "Complement deficiencies limit CD20 monoclonal antibody treatment efficacy in CLL" absolut lesenswert! -> http://www.nature.com/leu/journal/vaop/ncurrent/full/leu2014…
Nach dem jüngsten Scheitern des anti CD20-Antikörpers ofatumumab in der ORCHARRD-Studie ist nachfolgendes Paper mit dem Titel "Complement deficiencies limit CD20 monoclonal antibody treatment efficacy in CLL" absolut lesenswert! -> http://www.nature.com/leu/journal/vaop/ncurrent/full/leu2014…
@eck, für Deine Tabelle:
neue klinische Studie mit VAY736 in der Indikation "Sjögren´s Syndrom(e)"
-> http://clinicaltrials.gov/show/NCT02149420
neue klinische Studie mit VAY736 in der Indikation "Sjögren´s Syndrom(e)"
-> http://clinicaltrials.gov/show/NCT02149420
@eck, für Deine Tabelle:
noch eine neue P1-Studie mit BI 836845 in Japan -> http://clinicaltrials.gov/ct2/show/NCT02145741?term=BI+83684…
noch eine neue P1-Studie mit BI 836845 in Japan -> http://clinicaltrials.gov/ct2/show/NCT02145741?term=BI+83684…
Zur Konkurrenzsituation um MOR208:
SAR3419 (anti CD19-ADC von Sanofi/IMGN):
Die P2-Studie in der Indikation ALL ist wegen Erfolglosigkeit eingestellt worden -> http://www.clinicaltrials.gov/ct2/show?term=sar3419&rank=3
GDC-0199/ABT-199:
aktuelle Meldung von Roche
(SIX: RO, ROG; OTCQX: RHHBY) today presented positive interim results of a phase 1b study for its investigational BCL-2 inhibitor GDC-0199/ABT-199, which is being developed in collaboration with AbbVie, at the ASCO 2014 Annual Meeting. The data showed that GDC-0199/ABT-199 combined with MabThera/Rituxan (rituximab) achieved either a complete response or complete response with incomplete blood count recovery (CR/CRi) rate of 36% in patients with R/R CLL. Importantly, of the patients achieving CR, 75% were free of minimal residual disease (MRD).
At ASCO, additional data will be presented from the global clinical development program of GDC-0199/ABT-199. This includes updated data from the previously reported phase 1 study of GDC-0199/ABT-199 monotherapy in CLL and small lymphocytic lymphoma and new data from a phase 1 study in R/R diffuse large B-cell (DLBCL) and R/R follicular lymphoma (FL) which evaluates the use of higher dosing in these lymphoma settings.
Phase I study of ABT-199 (GDC-0199) in patients with relapsed/refractory (R/R) non-Hodgkin lymphoma (NHL): Responses observed in diffuse large B-cell (DLBCL) and follicular lymphoma (FL) at higher cohort doses. Poster Presentation, Friday May 30 during the Lymphoma and Plasma Cell Disorders session (Abstract #8522)
ABT-199 (GDC-0199) combined with rituximab (R) in patients (pts) with relapsed/refractory (R/R) chronic lymphocytic leukemia (CLL): Interim results of a phase 1b study. Poster Presentation, Saturday May 31 during the Leukemia, Myelodysplasia, and Transplantation session (Abstract #7013)
ABT-199 (GDC-0199) in relapsed/refractory (R/R) chronic lymphocytic leukemia (CLL) and small lymphocytic lymphoma (SLL): High complete-response rate and durable disease control. Poster Presentation, Saturday May 31 during the Leukemia, Myelodysplasia, and Transplantation session (Abstract #7015)
A phase 2 open-label study of the efficacy of ABT-199 (GDC-0199) in patients with relapsed or refractory (R/R) chronic lymphocytic leukemia (CLL) harboring 17p deletion. Poster Presentation, Monday June 2 during the Leukemia, Myelodysplasia, and Transplantation session (Abstract #TPS7121)
SAR3419 (anti CD19-ADC von Sanofi/IMGN):
Die P2-Studie in der Indikation ALL ist wegen Erfolglosigkeit eingestellt worden -> http://www.clinicaltrials.gov/ct2/show?term=sar3419&rank=3
GDC-0199/ABT-199:
aktuelle Meldung von Roche
(SIX: RO, ROG; OTCQX: RHHBY) today presented positive interim results of a phase 1b study for its investigational BCL-2 inhibitor GDC-0199/ABT-199, which is being developed in collaboration with AbbVie, at the ASCO 2014 Annual Meeting. The data showed that GDC-0199/ABT-199 combined with MabThera/Rituxan (rituximab) achieved either a complete response or complete response with incomplete blood count recovery (CR/CRi) rate of 36% in patients with R/R CLL. Importantly, of the patients achieving CR, 75% were free of minimal residual disease (MRD).
At ASCO, additional data will be presented from the global clinical development program of GDC-0199/ABT-199. This includes updated data from the previously reported phase 1 study of GDC-0199/ABT-199 monotherapy in CLL and small lymphocytic lymphoma and new data from a phase 1 study in R/R diffuse large B-cell (DLBCL) and R/R follicular lymphoma (FL) which evaluates the use of higher dosing in these lymphoma settings.
Phase I study of ABT-199 (GDC-0199) in patients with relapsed/refractory (R/R) non-Hodgkin lymphoma (NHL): Responses observed in diffuse large B-cell (DLBCL) and follicular lymphoma (FL) at higher cohort doses. Poster Presentation, Friday May 30 during the Lymphoma and Plasma Cell Disorders session (Abstract #8522)
ABT-199 (GDC-0199) combined with rituximab (R) in patients (pts) with relapsed/refractory (R/R) chronic lymphocytic leukemia (CLL): Interim results of a phase 1b study. Poster Presentation, Saturday May 31 during the Leukemia, Myelodysplasia, and Transplantation session (Abstract #7013)
ABT-199 (GDC-0199) in relapsed/refractory (R/R) chronic lymphocytic leukemia (CLL) and small lymphocytic lymphoma (SLL): High complete-response rate and durable disease control. Poster Presentation, Saturday May 31 during the Leukemia, Myelodysplasia, and Transplantation session (Abstract #7015)
A phase 2 open-label study of the efficacy of ABT-199 (GDC-0199) in patients with relapsed or refractory (R/R) chronic lymphocytic leukemia (CLL) harboring 17p deletion. Poster Presentation, Monday June 2 during the Leukemia, Myelodysplasia, and Transplantation session (Abstract #TPS7121)
Zitat von Joschka Schröder: nochmal (indirekt) zu MOR208:
Nach dem jüngsten Scheitern des anti CD20-Antikörpers ofatumumab in der ORCHARRD-Studie ist nachfolgendes Paper mit dem Titel "Complement deficiencies limit CD20 monoclonal antibody treatment efficacy in CLL" absolut lesenswert! -> http://www.nature.com/leu/journal/vaop/ncurrent/full/leu2014…
Mir ist nicht ganz klar, wieso die Überlegenheit von ibrutinib gegenüber ofatumumab bei der CLL-Therapie von den Nachrichtenagenturen derart gefeiert wird, nachdem ofatumumab doch gerade erst in der ORCHARRD-Studie gescheitert ist. Hier die Ergebnisse der RESONATE-Studie (Vergleich ibrutinib versus ofatumumab) -> http://www.nejm.org/doi/full/10.1056/NEJMoa1400376. Dass der Tyrosinkinase-Hemmer ibrutinib ein aussichtsreiches Medikament ist, soll damit natürlich nicht in Frage gestellt werden.
weiter zum Thema CD19, aktuelle Meldung von Seattle Genetics, ermutigende Ergebnisse in der Indikation NHL:
Interim analysis of a phase 1, open-label, dose-escalation study of SGN-CD19A in patients with relapsed or refractory B-lineage non-Hodgkin lymphoma (Abstract #8505, oral presentation Sunday, June 1st at 9:48 a.m. Central Time)
Data were reported from 37 patients with relapsed or refractory aggressive B-cell non-Hodgkin lymphoma (NHL), including 32 patients with diffuse large B-cell lymphoma (DLBCL), four patients with mantle cell lymphoma (MCL) and one patient with Grade 3 follicular lymphoma. The median age of patients was 65 years and the median number of prior systemic therapies was two, with 10 patients (27 percent) having received a prior autologous stem cell transplant. Among enrolled patients, eight percent were primary refractory, 54 percent were refractory to their last treatment and 38 percent had relapsed following a response to their last treatment.
The primary endpoints of the ongoing clinical trial are to estimate the maximum tolerated dose and to evaluate the safety of SGN-CD19A. In addition, the trial is evaluating antitumor activity, pharmacokinetics, progression-free survival and overall survival. In this dose-escalation study, patients receive a single dose of SGN-CD19A on an every 3-week basis. Key findings included:
No dose limiting toxicity was observed in the first cycle for any patients. Adverse events were observed in the 6 milligrams per kilogram (mg/kg) dosing regimen after the first cycle, therefore enrollment was discontinued. The 3, 4 and 5 mg/kg cohorts are being expanded, and the trial continues to enroll.
At the time of data analysis, of the 37 patients treated across all dose levels, the objective response rate observed was 30 percent (11 patients). Six patients (16 percent) achieved a complete remission, five (14 percent) achieved a partial remission, 13 (35 percent) had stable disease and 13 (35 percent) had progressive disease as best response. The clinical trial is ongoing with nine of the 37 patients (24 percent) remaining on treatment and new patients continuing to be enrolled.
The most common adverse events of any grade occurring in more than 30 percent of patients were blurred vision (51 percent), fatigue (38 percent), dry eye (35 percent), constipation (30 percent) and keratopathy (30 percent). Grade 3 or higher adverse events observed in two or more patients included blurred vision (six patients), keratopathy (three patients), low platelet count (three patients) and anemia (three patients).
Interim analysis of a phase 1, open-label, dose-escalation study of SGN-CD19A in patients with relapsed or refractory B-lineage non-Hodgkin lymphoma (Abstract #8505, oral presentation Sunday, June 1st at 9:48 a.m. Central Time)
Data were reported from 37 patients with relapsed or refractory aggressive B-cell non-Hodgkin lymphoma (NHL), including 32 patients with diffuse large B-cell lymphoma (DLBCL), four patients with mantle cell lymphoma (MCL) and one patient with Grade 3 follicular lymphoma. The median age of patients was 65 years and the median number of prior systemic therapies was two, with 10 patients (27 percent) having received a prior autologous stem cell transplant. Among enrolled patients, eight percent were primary refractory, 54 percent were refractory to their last treatment and 38 percent had relapsed following a response to their last treatment.
The primary endpoints of the ongoing clinical trial are to estimate the maximum tolerated dose and to evaluate the safety of SGN-CD19A. In addition, the trial is evaluating antitumor activity, pharmacokinetics, progression-free survival and overall survival. In this dose-escalation study, patients receive a single dose of SGN-CD19A on an every 3-week basis. Key findings included:
No dose limiting toxicity was observed in the first cycle for any patients. Adverse events were observed in the 6 milligrams per kilogram (mg/kg) dosing regimen after the first cycle, therefore enrollment was discontinued. The 3, 4 and 5 mg/kg cohorts are being expanded, and the trial continues to enroll.
At the time of data analysis, of the 37 patients treated across all dose levels, the objective response rate observed was 30 percent (11 patients). Six patients (16 percent) achieved a complete remission, five (14 percent) achieved a partial remission, 13 (35 percent) had stable disease and 13 (35 percent) had progressive disease as best response. The clinical trial is ongoing with nine of the 37 patients (24 percent) remaining on treatment and new patients continuing to be enrolled.
The most common adverse events of any grade occurring in more than 30 percent of patients were blurred vision (51 percent), fatigue (38 percent), dry eye (35 percent), constipation (30 percent) and keratopathy (30 percent). Grade 3 or higher adverse events observed in two or more patients included blurred vision (six patients), keratopathy (three patients), low platelet count (three patients) and anemia (three patients).
Antwort auf Beitrag Nr.: 47.082.238 von Joschka Schröder am 01.06.14 16:50:31Die mit SGN-CD19A erzielten Ergebnisse entsprechen in etwa denjenigen Ergebnissen, die in derselben Indikation mit dem Konkurrenzpräparat SAR3419 erzielt und auf der ASCO-Tagung von zwei Jahren präsentiert worden sind.
Das geht Schlag auf Schlag, nun meldet IMGN die neuesten Daten zu SAR3419. Sehen gut aus:
ImmunoGen, Inc. Announces Favorable STARLYTE Phase II Clinical Data with Sanofi's SAR3419 in Diffuse Large B-Cell Lymphoma
SAR3419 achieved objective responses well above the study threshold and was found to have a favorable safety profile.
Objective responses reported in patients whose disease had not responded to prior therapy.
Selected for Best of ASCO.
WALTHAM, Mass.--(BUSINESS WIRE)-- ImmunoGen, Inc. (NASDAQ: IMGN), a biotechnology company that develops novel anticancer therapeutics using its antibody-drug conjugate (ADC) technology, today announced the presentation of favorable clinical findings with SAR3419 (coltuximab ravtansine) from the STARLYTE Phase II trial in diffuse large B-cell lymphoma (DLBCL). SAR3419 is a CD19-targeting ADC developed by ImmunoGen and licensed to Sanofi as part of a broader collaboration between the companies. The study results were reported in an oral abstract session at the American Society of Clinical Oncology (ASCO) 50th Annual Meeting being held in Chicago, IL; they were also selected for Best of ASCO (abstract #8506).
In the data presented today, study investigators reported achievement of proof of concept, with 43.9% objective response rate (ORR) for the per protocol population (patients with relapsed or relapsed/refractory disease). The primary objective of the study was to assess whether single agent SAR3419 could achieve an ORR of at least 20% in this patient population using Cheson 2007 criteria. Additionally, objective responses were reported among the patients enrolled with primary refractory disease - cancer that had not responded to first-line treatment - with a 21.4% ORR.
"SAR3419 demonstrated promising activity against previously treated DLBCL, including disease that had not responded to first-line treatment," commented Daniel Junius, president and CEO of ImmunoGen. "We believe the unique profile of SAR3419 can make an important difference for patients with DLBCL, and potentially for other types of B-cell malignancies. These data also add to the growing body of favorable findings with ADCs using our technology."
The STARLYTE trial is evaluating the efficacy and safety of SAR3419 used as a single agent to treat relapsed or relapsed/refractory CD19-positive DLBCL. Patients received SAR3419 at 55 mg/m2 weekly for four weeks and then every other week until disease progression or discontinuation. Of the patients enrolled in the trial, 55 were evaluable for efficacy and 61 were evaluable for safety.
The 41 per protocol patients included 26 patients with relapsed but not refractory disease and 15 patients with disease refractory to their last treatment. Among these patients:
The ORR was 53.8% among the patients with relapsed disease, with 69.2% having stable disease or better. The 14 patients with objective responses included 5 patients with complete responses (CRs) and 9 patients with partial responses (PRs).
Among the 15 patients with disease refractory to the last treatment, the ORR was 26.7%, with 46.7% having stable disease or better. These included 1 CR and 3 PRs.
The 55 efficacy evaluable patients also included 14 individuals with primary refractory disease. Among these patients, the ORR was 21.4%, with 35.7% having stable disease or better. The objective responses reported included 1 CR as well as 2 PRs.
The investigators reported that SAR3419 was found to have a favorable safety profile, with few treatment-related grade 3/4 adverse events (AEs) or serious AEs reported. No grade 3 or 4 peripheral neuropathy or ocular events were observed; any ocular events were low grade (1 or 2), manageable and reversible. Moderate hematological toxicities were reported including anemia, thrombocytopenia and neutropenia.
ImmunoGen, Inc. Announces Favorable STARLYTE Phase II Clinical Data with Sanofi's SAR3419 in Diffuse Large B-Cell Lymphoma
SAR3419 achieved objective responses well above the study threshold and was found to have a favorable safety profile.
Objective responses reported in patients whose disease had not responded to prior therapy.
Selected for Best of ASCO.
WALTHAM, Mass.--(BUSINESS WIRE)-- ImmunoGen, Inc. (NASDAQ: IMGN), a biotechnology company that develops novel anticancer therapeutics using its antibody-drug conjugate (ADC) technology, today announced the presentation of favorable clinical findings with SAR3419 (coltuximab ravtansine) from the STARLYTE Phase II trial in diffuse large B-cell lymphoma (DLBCL). SAR3419 is a CD19-targeting ADC developed by ImmunoGen and licensed to Sanofi as part of a broader collaboration between the companies. The study results were reported in an oral abstract session at the American Society of Clinical Oncology (ASCO) 50th Annual Meeting being held in Chicago, IL; they were also selected for Best of ASCO (abstract #8506).
In the data presented today, study investigators reported achievement of proof of concept, with 43.9% objective response rate (ORR) for the per protocol population (patients with relapsed or relapsed/refractory disease). The primary objective of the study was to assess whether single agent SAR3419 could achieve an ORR of at least 20% in this patient population using Cheson 2007 criteria. Additionally, objective responses were reported among the patients enrolled with primary refractory disease - cancer that had not responded to first-line treatment - with a 21.4% ORR.
"SAR3419 demonstrated promising activity against previously treated DLBCL, including disease that had not responded to first-line treatment," commented Daniel Junius, president and CEO of ImmunoGen. "We believe the unique profile of SAR3419 can make an important difference for patients with DLBCL, and potentially for other types of B-cell malignancies. These data also add to the growing body of favorable findings with ADCs using our technology."
The STARLYTE trial is evaluating the efficacy and safety of SAR3419 used as a single agent to treat relapsed or relapsed/refractory CD19-positive DLBCL. Patients received SAR3419 at 55 mg/m2 weekly for four weeks and then every other week until disease progression or discontinuation. Of the patients enrolled in the trial, 55 were evaluable for efficacy and 61 were evaluable for safety.
The 41 per protocol patients included 26 patients with relapsed but not refractory disease and 15 patients with disease refractory to their last treatment. Among these patients:
The ORR was 53.8% among the patients with relapsed disease, with 69.2% having stable disease or better. The 14 patients with objective responses included 5 patients with complete responses (CRs) and 9 patients with partial responses (PRs).
Among the 15 patients with disease refractory to the last treatment, the ORR was 26.7%, with 46.7% having stable disease or better. These included 1 CR and 3 PRs.
The 55 efficacy evaluable patients also included 14 individuals with primary refractory disease. Among these patients, the ORR was 21.4%, with 35.7% having stable disease or better. The objective responses reported included 1 CR as well as 2 PRs.
The investigators reported that SAR3419 was found to have a favorable safety profile, with few treatment-related grade 3/4 adverse events (AEs) or serious AEs reported. No grade 3 or 4 peripheral neuropathy or ocular events were observed; any ocular events were low grade (1 or 2), manageable and reversible. Moderate hematological toxicities were reported including anemia, thrombocytopenia and neutropenia.
Antwort auf Beitrag Nr.: 47.082.340 von Joschka Schröder am 01.06.14 17:35:28Wenn man die Ergebnisse normalisiert, d.h. die Zusammensetzung der Patientenkollektive berücksichtigt (relapsed versus refractory), so scheint das Konkurrenzpräparat SGN-CD19A von Seattle Genetics jedoch besser abzuschneiden als SAR3419. Und beim SGN-CD19 wird noch nicht mit der optimalen Dosis gearbeiten (Dosisfindung läuft noch).
Zitat von Joschka Schröder: nochmal (indirekt) zu MOR208:
Nach dem jüngsten Scheitern des anti CD20-Antikörpers ofatumumab in der ORCHARRD-Studie ist nachfolgendes Paper mit dem Titel "Complement deficiencies limit CD20 monoclonal antibody treatment efficacy in CLL" absolut lesenswert! -> http://www.nature.com/leu/journal/vaop/ncurrent/full/leu2014…
In diesem Zusammenhang ist positiv, dass MOR208 via ADCC (-> natürliche Killerzellen) und nicht via CDC (-> Komplementvermittelt) wirkt!
Rationales Investieren im Biotech-Sektor wird immer schwieriger, weil so vieles in Bewegung ist. Gerade auch angesichts nachrückender Therapieansätze (z.B. Roche hat im Kontext Krebs-Immuntherapien Interessantes aus der Präklinik berichtet) und veränderter Studienkonzepte (ausgeprägte Phase I, danach gleich Phase II/III) läßt sich kaum mehr überblicken, mit welcher Wahrscheinlichkeit welches Medikament über welche Zeiträume Umsätze in welcher Höhe wird generieren können. Angesichts der zunehmenden Komplexizität überlege ich ernsthaft, mich an der Börse zunehmend aus dem Biotechbereich zurückzuziehen. Es gibt Sektoren, in denen sich mit deutlich geringerem Zeitaufwand bei übersichtlicherem Chance-Risiko-Verhältnis investieren läßt.
neue Bimagrumab-Studie (Indikation: nach Oberschenkelhalsfrakturen) -> http://clinicaltrials.gov/show/NCT02152761
Könnte man später am besten gleich mit BPS804 kombinieren.
Könnte man später am besten gleich mit BPS804 kombinieren.
Ist vielleicht im Zusammenhang mit Gantenerumab nicht unwichtig.
Bin gerade über einen Zeitungsbericht "gestolpert" über gute Studienergebenisse bei Alzheimer für die Affiris AG aus Wien.
Sind aber nicht Börsennotiert.
Der Wirkstoff "AD04" soll sehr gute Studienergebnisse gebracht haben bei 332
behandelten Patienten.
Wäre ja nicht schlecht wenn sich endlich bei diesen Krankheitsbild was tut bei den Medikamenten und nicht alles scheitert!
Bin gerade über einen Zeitungsbericht "gestolpert" über gute Studienergebenisse bei Alzheimer für die Affiris AG aus Wien.
Sind aber nicht Börsennotiert.
Der Wirkstoff "AD04" soll sehr gute Studienergebnisse gebracht haben bei 332
behandelten Patienten.
Wäre ja nicht schlecht wenn sich endlich bei diesen Krankheitsbild was tut bei den Medikamenten und nicht alles scheitert!
Antwort auf Beitrag Nr.: 47.112.194 von Trapos am 05.06.14 20:18:19Die überaus positive darstellung der Studiendaten durch Affiris ist in meinen Augen abolut unseriös!
Das eigentliche Studienmedikament AD02 (3 Arme, Placebo 1 Arm) ist bei der Studie gefloppt. AD04 war eigentlich das Placebo in der Studie u. war nie als Medikament gedacht.
Noch letzte Woche hat das Affiris Management einen sensationellen Durchbruch bei AD angekündigt u. dann kommen solche windigen Daten, bei der das Placebo ziemlich gut abschneidet u. Affiris jetzt auf einmal AD04 aus dem Ärmel zaubert.
Sind die Daten purer Zufall? Wie auch immer, ein Durchbruch ist es erst mal mitnichten.
Das eigentliche Studienmedikament AD02 (3 Arme, Placebo 1 Arm) ist bei der Studie gefloppt. AD04 war eigentlich das Placebo in der Studie u. war nie als Medikament gedacht.
Noch letzte Woche hat das Affiris Management einen sensationellen Durchbruch bei AD angekündigt u. dann kommen solche windigen Daten, bei der das Placebo ziemlich gut abschneidet u. Affiris jetzt auf einmal AD04 aus dem Ärmel zaubert.
Sind die Daten purer Zufall? Wie auch immer, ein Durchbruch ist es erst mal mitnichten.
Antwort auf Beitrag Nr.: 47.112.806 von evotecci am 05.06.14 21:58:41Danke, für die rasche Antwort.
Hat halt in den Medien besser geklungen als wahrscheinlich dahinter steckt.
Hat halt in den Medien besser geklungen als wahrscheinlich dahinter steckt.
Grundsätzlich ist jede F&E-Aktivität erfreulich. Merck Serono ist aus meiner Sicht jedoch kein Top-Partner in der Immun-Onkologie. Zudem sind andere Konzerne auf diesem Sektor schon deutlich weiter.
Zu den Konditionen der Vereinbarung kann man wenig sagen. Morphosys muss zunächst ins Risiko gehen. Bleibt zu hoffen, dass eine angemessene Kompensation des Risikos durch die Höhe etwaiger Meilensteinzahlungen und Royalties vorgesehen ist.
Der Deal läßt vermuten, dass die Zeit komfortabler Entwicklungsvereinbarungen Vergangenheit ist.
Schön wäre, wenn Morphosys eine Technik mit Alleinstellungsmerkmal entwickeln würde, mit der auch wieder attraktive Auslizensierungsabkommen möglich sind. Ich denke beispielsweise an Techniken, wie sie CytomX oder andere entwickelt haben.
Die MorphoSys AG (Frankfurt: MOR; Prime Standard Segment, TecDAX, OTC: MPSYY) und Merck haben heute bekannt gegeben, dass sie eine Vereinbarung unterzeichnet haben, nach der sie therapeutische Antikörper gegen Zielmoleküle der Klasse der Immun-Checkpoints identifizieren und entwickeln wollen.
Im Rahmen des Vertrags wollen MorphoSys und Merck Serono, die biopharmazeutische Sparte von Merck, gemeinsam Therapieformen entwickeln, die das Immunsystem dazu anregen sollen, Tumore anzugreifen. MorphoSys, ein führendes Unternehmen im Technologiebereich der vollständig menschlichen Antikörper, wird seine firmeneigene Antikörperphagenbibliothek Ylanthia® und weitere Technologie-Plattformen einsetzen, um Antikörper gegen die ausgewählten Zielmoleküle zu generieren. Merck Serono bringt ein breites Portfolio und die Expertise im Bereich der Immunonkologie und klinischer Entwicklung ein und wird die Projektverantwortung ab Phase 1 der klinischen Entwicklung komplett übernehmen.
"Merck Serono setzt auf Partnerschaften mit Unternehmen, die innovative Technologieplattformen besitzen. Dies ist ein integraler Bestandteil unserer Strategie, um unser bereits heute sehr vielfältiges Portfolio in der Immunonkologie zu erweitern", sagte Dr. Helen Sabzevari, Leiterin des Bereiches Immunonkologie bei Merck Serono. "Die Kombination unserer umfangreichen Erfahrung in der Immunonkologie mit MorphoSys' fortschrittlicher Antikörpertechnologie bietet uns die vielversprechende Möglichkeit, neue Therapieformen zu entwickeln, mit denen wir möglicherweise Krebspatienten helfen können."
"Therapeutische Wirkstoffe in der Immunonkologie können neue Wege in der Behandlung von Krebs aufzeigen. Wir sind sehr erfreut, mit Merck Serono auf diesem Gebiet zusammenzuarbeiten", sagte Dr. Simon Moroney, Vorstandsvorsitzender von MorphoSys. "Wir sind der Überzeugung, dass unsere Ylanthia-Technologie das Potenzial hat, klar differenzierte Antikörper gegen die für diese Kooperation ausgewählten Zielmoleküle zu gewinnen. Merck Serono ist mit seiner Erfahrung in der Immunonkologie und den Stärken bei Entwicklung und Kommerzialisierung therapeutischer Antikörper der ideale Partner für MorphoSys."
Mit Hilfe von Partnerschaften ist Merck Serono bestrebt, sein bestehendes Portfolio an Krebsimmuntherapien zu stärken, die sowohl als Monotherapien als auch in Kombinationen mit anderen Wirkstoffen eingesetzt werden können. Die von Merck Serono derzeit in klinischen Studien der Phasen 1 bis 3 für die Behandlung verschiedener Krebsformen untersuchten Ansätze in der Immunonkologie umfassen die Wirkstoffe Tecemotide, eine gegen MUC1 gerichtete antigenspezifische Krebsimmuntherapie, zwei Immunzytokine NHS-IL2 (MSB0010445) und NHS-IL12 (MSB0010360) sowie den monoklonalen anti-PD-L1-Antikörper MSB0010718C. Darüber hinaus hat Merck Serono, aufbauend auf den drei Innovationsclustern therapeutische Krebsimpfstoffe, Krebsstammzellen und Immuntoleranz, eine robuste präklinische Pipeline etabliert.
Im Rahmen der Entwicklungs- und Lizenzvereinbarung wird MorphoSys die Forschungs- und Entwicklungskosten der Kooperation mittragen, mit der Option, zu vordefinierten Zeitpunkten aus dem Vertrag auszutreten. MorphoSys wird Entwicklungs- und kommerzielle Meilensteinzahlungen sowie gestaffelte Tantiemen auf Produktverkäufe erhalten, die die Dauer der gemeinsamen Entwicklungsphase reflektieren werden. Merck Serono wird für die Kommerzialisierung der resultierenden Produkte alleine verantwortlich sein. Weitere finanzielle Einzelheiten wurden nicht bekannt gegeben.
Zu den Konditionen der Vereinbarung kann man wenig sagen. Morphosys muss zunächst ins Risiko gehen. Bleibt zu hoffen, dass eine angemessene Kompensation des Risikos durch die Höhe etwaiger Meilensteinzahlungen und Royalties vorgesehen ist.
Der Deal läßt vermuten, dass die Zeit komfortabler Entwicklungsvereinbarungen Vergangenheit ist.
Schön wäre, wenn Morphosys eine Technik mit Alleinstellungsmerkmal entwickeln würde, mit der auch wieder attraktive Auslizensierungsabkommen möglich sind. Ich denke beispielsweise an Techniken, wie sie CytomX oder andere entwickelt haben.
Die MorphoSys AG (Frankfurt: MOR; Prime Standard Segment, TecDAX, OTC: MPSYY) und Merck haben heute bekannt gegeben, dass sie eine Vereinbarung unterzeichnet haben, nach der sie therapeutische Antikörper gegen Zielmoleküle der Klasse der Immun-Checkpoints identifizieren und entwickeln wollen.
Im Rahmen des Vertrags wollen MorphoSys und Merck Serono, die biopharmazeutische Sparte von Merck, gemeinsam Therapieformen entwickeln, die das Immunsystem dazu anregen sollen, Tumore anzugreifen. MorphoSys, ein führendes Unternehmen im Technologiebereich der vollständig menschlichen Antikörper, wird seine firmeneigene Antikörperphagenbibliothek Ylanthia® und weitere Technologie-Plattformen einsetzen, um Antikörper gegen die ausgewählten Zielmoleküle zu generieren. Merck Serono bringt ein breites Portfolio und die Expertise im Bereich der Immunonkologie und klinischer Entwicklung ein und wird die Projektverantwortung ab Phase 1 der klinischen Entwicklung komplett übernehmen.
"Merck Serono setzt auf Partnerschaften mit Unternehmen, die innovative Technologieplattformen besitzen. Dies ist ein integraler Bestandteil unserer Strategie, um unser bereits heute sehr vielfältiges Portfolio in der Immunonkologie zu erweitern", sagte Dr. Helen Sabzevari, Leiterin des Bereiches Immunonkologie bei Merck Serono. "Die Kombination unserer umfangreichen Erfahrung in der Immunonkologie mit MorphoSys' fortschrittlicher Antikörpertechnologie bietet uns die vielversprechende Möglichkeit, neue Therapieformen zu entwickeln, mit denen wir möglicherweise Krebspatienten helfen können."
"Therapeutische Wirkstoffe in der Immunonkologie können neue Wege in der Behandlung von Krebs aufzeigen. Wir sind sehr erfreut, mit Merck Serono auf diesem Gebiet zusammenzuarbeiten", sagte Dr. Simon Moroney, Vorstandsvorsitzender von MorphoSys. "Wir sind der Überzeugung, dass unsere Ylanthia-Technologie das Potenzial hat, klar differenzierte Antikörper gegen die für diese Kooperation ausgewählten Zielmoleküle zu gewinnen. Merck Serono ist mit seiner Erfahrung in der Immunonkologie und den Stärken bei Entwicklung und Kommerzialisierung therapeutischer Antikörper der ideale Partner für MorphoSys."
Mit Hilfe von Partnerschaften ist Merck Serono bestrebt, sein bestehendes Portfolio an Krebsimmuntherapien zu stärken, die sowohl als Monotherapien als auch in Kombinationen mit anderen Wirkstoffen eingesetzt werden können. Die von Merck Serono derzeit in klinischen Studien der Phasen 1 bis 3 für die Behandlung verschiedener Krebsformen untersuchten Ansätze in der Immunonkologie umfassen die Wirkstoffe Tecemotide, eine gegen MUC1 gerichtete antigenspezifische Krebsimmuntherapie, zwei Immunzytokine NHS-IL2 (MSB0010445) und NHS-IL12 (MSB0010360) sowie den monoklonalen anti-PD-L1-Antikörper MSB0010718C. Darüber hinaus hat Merck Serono, aufbauend auf den drei Innovationsclustern therapeutische Krebsimpfstoffe, Krebsstammzellen und Immuntoleranz, eine robuste präklinische Pipeline etabliert.
Im Rahmen der Entwicklungs- und Lizenzvereinbarung wird MorphoSys die Forschungs- und Entwicklungskosten der Kooperation mittragen, mit der Option, zu vordefinierten Zeitpunkten aus dem Vertrag auszutreten. MorphoSys wird Entwicklungs- und kommerzielle Meilensteinzahlungen sowie gestaffelte Tantiemen auf Produktverkäufe erhalten, die die Dauer der gemeinsamen Entwicklungsphase reflektieren werden. Merck Serono wird für die Kommerzialisierung der resultierenden Produkte alleine verantwortlich sein. Weitere finanzielle Einzelheiten wurden nicht bekannt gegeben.
Antwort auf Beitrag Nr.: 47.141.516 von Joschka Schröder am 12.06.14 10:00:22Sehe ich auch so. Der Deal ist alles in allem erfreulich, aber er begeistert nicht.
Vor allem ist man mal wieder viel zu spät dran. Das PD(L)-1-Thema wird von anderen Playern beherrscht, die zeitlich Jahre voraus sind. Bei Roche, BMS und Merck (der amerikanischen) hat man inzwischen auch jede Menge Deals mit Biotechs abgeschlossen, die eventuelle Kombipräparate in der Mache haben (bspw. INCY und CLDX).
Mag aber sein, dass MorphoSys da noch eine Lücke finden wird. Die Frage, welche Kombinationen von Immuncheckpoint-Modulationen in welchen Indikationen möglich sind, wird die Forschung wohl in den nächsten 10 bis 20 Jahren beschäftigen.
Ein kleiner Überblick über die diesbezüglichen Trends auf der ASCO findet sich hier:
http://www.orf-blog.com/2-prominent-themes-at-asco-2014/
Allgemein gebe ich Dir recht, dass der Aufwand um einigermaßen im Stoff zu bleiben, ständig größer wird. Alles wird immer unübersichtlicher. Ich kann und will das immer weniger leisten und bin in Sachen Biotech zumindest gedanklich bereits auf dem Rückzug.
Vor allem ist man mal wieder viel zu spät dran. Das PD(L)-1-Thema wird von anderen Playern beherrscht, die zeitlich Jahre voraus sind. Bei Roche, BMS und Merck (der amerikanischen) hat man inzwischen auch jede Menge Deals mit Biotechs abgeschlossen, die eventuelle Kombipräparate in der Mache haben (bspw. INCY und CLDX).
Mag aber sein, dass MorphoSys da noch eine Lücke finden wird. Die Frage, welche Kombinationen von Immuncheckpoint-Modulationen in welchen Indikationen möglich sind, wird die Forschung wohl in den nächsten 10 bis 20 Jahren beschäftigen.
Ein kleiner Überblick über die diesbezüglichen Trends auf der ASCO findet sich hier:
http://www.orf-blog.com/2-prominent-themes-at-asco-2014/
Allgemein gebe ich Dir recht, dass der Aufwand um einigermaßen im Stoff zu bleiben, ständig größer wird. Alles wird immer unübersichtlicher. Ich kann und will das immer weniger leisten und bin in Sachen Biotech zumindest gedanklich bereits auf dem Rückzug.
Zitat von SLGramann: Allgemein gebe ich Dir recht, dass der Aufwand um einigermaßen im Stoff zu bleiben, ständig größer wird. Alles wird immer unübersichtlicher. Ich kann und will das immer weniger leisten und bin in Sachen Biotech zumindest gedanklich bereits auf dem Rückzug.
In den letzten Jahren ließ sich im Biotech-Sektor viel Geld verdienen. Diese Zeiten sind meines Erachtens vorbei. Zudem steht der Recherche-Aufwand in keinem Verhältnis mehr zum Chance-Risiko-Verhältnis. Ich befinde mich daher bereits mitten in der Sektorenrotation. Aus den Biotechs habe ich mich, von ein, zwei Ausnahmen abgesehen, bereits vollständig verabschiedet.
Darf man fragen, welchen Sektoren du dich stattdessen verstärkt zuwendest?
Der Mesothelin-mAb von Bayer hat jetzt einen Namen:
Anetumab-Ravtansine (HuCal-ADC).
Hier eine aktuelle Veröffentlichung dazu: http://www.ncbi.nlm.nih.gov/pubmed/24714131
Sieht ganz gut aus....
Anetumab-Ravtansine (HuCal-ADC).
Hier eine aktuelle Veröffentlichung dazu: http://www.ncbi.nlm.nih.gov/pubmed/24714131
Sieht ganz gut aus....
Antwort auf Beitrag Nr.: 47.153.062 von rollingovermilestones am 14.06.14 11:14:08Hallo rollingover, die Pfizer Studie ist in Phase1 auf 6 Jahre angelegt (erste Ergebnisse nach 5 Jahren). Ist das nicht doch ein wenig lang? Welche Gründe kann es dafür geben? Ist vielleicht die Rekrutierung schwierig?
Zitat von Ville7:Zitat von Joschka Schröder: ... Die Wirksamkeitsdaten der Abby-Phase II-Studie mit Crenezumab (anti ABeta-Antikörper Roche/AC Immune) umfassen u.a. ADAS-cog und clinical dementia rating und sind intern bereits bekannt. Kongressvorstellung während der nächsten Monate. ...
Schon mal dick anstreichen im Kalender: Die Phase II Ergebnisse von Crenezumab werden von Roche auf dem AAIC in Copenhagen July 12-17 vorgestellt.
Ergebnisse für Kurs und Richtung ?
Tödliche Infusionsreaktion bei Ofatumumab -> http://www.pharmazeutische-zeitung.de/index.php?id=52958
Zitat von Joschka Schröder: Tödliche Infusionsreaktion bei Ofatumumab -> http://www.pharmazeutische-zeitung.de/index.php?id=52958
grad gelesen:
Genmab A/S: GSK and Genmab Receive EU Authorization for Arzerra (ofatumumab) as First-Line Treatment for Chronic Lymphocytic Leukemia (CLL) in Combination with Chlorambucil or Bendamustine for Patients Ineligible for Fludarabine-based Therapy
Das ist sehr tragisch für diesen Patienten!
Aber
wenn ich den Artikel richitg verstanden habe, dann gehört das wohl mehr oder weniger zum bekannten und damit wohl auch aufgeklärten Rísiko der Patienten.
Ich hoffe, dass ich selbst von so einer Krankheit verschont bleibe. Würde es mich allerdings erwischen, dann könnte es gut möglich sein, dass ich mich trotz eines solchen Risikos so einer entsprechenden Behandlung unterziehen würde. Viele Möglichkeiten bleiben einem Menschen mit so einem Schicksal/Krankheit leider nicht....
Aber
wenn ich den Artikel richitg verstanden habe, dann gehört das wohl mehr oder weniger zum bekannten und damit wohl auch aufgeklärten Rísiko der Patienten.
Ich hoffe, dass ich selbst von so einer Krankheit verschont bleibe. Würde es mich allerdings erwischen, dann könnte es gut möglich sein, dass ich mich trotz eines solchen Risikos so einer entsprechenden Behandlung unterziehen würde. Viele Möglichkeiten bleiben einem Menschen mit so einem Schicksal/Krankheit leider nicht....
Irgendwann wird auch bei MOR202 die Kasse klingeln. Aber der Daratumumab Vorsprung ist immens!
Auf jeden Fall ein gutes Zeichen für CD38 und somit auch für MOR202!
Genmab A/S: Genmab Reaches USD 25 Million Milestone in Daratumumab Collaboration with Janssen
-- Genmab to receive USD 25 million milestone payment from Janssen -- Milestone triggered by progress in the Phase III study of daratumumab in combination with lenalidomide and dexamethasone in relapsed or refractory multiple myeloma
Copenhagen, Denmark; July 7, 2014 - Genmab A/S (OMX: GEN) announced today it has reached the third milestone in its daratumumab collaboration with Janssen Biotech, Inc. ("Janssen"). The USD 25 million milestone payment was triggered by progress in the ongoing Phase III study of daratumumab in combination with lenalidomide and dexamethasone versus lenalidomide and dexamethasone alone for the treatment of relapsed or refractory multiple myeloma.
"Since our partnership with Janssen began in October 2012, we have made very significant progress with the development of daratumumab, announcing five new clinical studies and reporting data from two ongoing studies in multiple myeloma. Today's milestone marks another important step, as patients are now receiving treatment in the first Phase III study of daratumumab in multiple myeloma," said Jan van de Winkel, Ph.D., Chief Executive Officer of Genmab.
The milestone payment is included in Genmab's 2014 financial guidance published on May 1, 2014.
About daratumumab Daratumumab is a human CD38 monoclonal antibody with broad-spectrum killing activity. Daratumumab is in clinical development for multiple myeloma (MM). Daratumumab targets the CD38 molecule which is highly expressed on the surface of multiple myeloma cells. Daratumumab may also have potential in other cancers on which CD38 is expressed, including diffuse large B-cell lymphoma, chronic lymphocytic leukemia, acute lymphoblastic leukemia, plasma cell leukemia, acute myeloid leukemia, follicular lymphoma and mantle cell lymphoma. Daratumumab has been granted Breakthrough Therapy Designation from the US FDA for the treatment of patients with multiple myeloma who have received at least three prior lines of therapy including a proteasome inhibitor (PI) and an immunomodulatory agent (IMiD) or who are double refractory to a PI and an IMiD. In August 2012, Genmab granted Janssen Biotech, Inc. an exclusive worldwide license to develop and commercialize daratumumab.
Etwas off topic, zudem aus einer Tageszeitung, aber dennoch durchaus lesenswert -> http://www.welt.de/gesundheit/article131040127/Aerzte-richte…
In einem aktuellen Artikel bei Nature Reviews Immunology (Juli 2014) ist der HuCal-Antikörper CNTO-6785 (Target IL17-A) schon in Phase 3 für RA.....
http://www.nature.com/nri/journal/v14/n7/fig_tab/nri3700_T2.…
Immerhin ist MOR im IL17 Bereich über CNTO-6785 vertreten, leider im Vergleich etwas hinten dran.
Jedoch sehe ich dort trotzdem sehr realistische Chancen für eine weitere Zulassung.
Ein gutes Target für zahlreiche anti-inflammatorische Therapien!
Leider exploriert Janssen das Target (noch?) sehr verhalten. Keine Ahnung warum!
http://www.nature.com/nri/journal/v14/n7/fig_tab/nri3700_T2.…

Immerhin ist MOR im IL17 Bereich über CNTO-6785 vertreten, leider im Vergleich etwas hinten dran.
Jedoch sehe ich dort trotzdem sehr realistische Chancen für eine weitere Zulassung.
Ein gutes Target für zahlreiche anti-inflammatorische Therapien!
Leider exploriert Janssen das Target (noch?) sehr verhalten. Keine Ahnung warum!
Zum aktuellen Deal (MOR209/ES414):
Ich finde das Target nicht uninteressant. Im Vergleich zu MOR208 (anti CD19) scheint hier die Konkurrenz auch (noch) überschaubar.
Am weitesten fortgeschritten (Phase II) ist das ADC von Progenics/SGEN, ohne dass bislang aufregende Studienergebnisse publiziert worden wären. Die ADC´s anderer Gesellschaften (EC1169, Ambryx PSMA-ADC, ADCT401) stecken allesamt noch im Discovery-Stadium.
Interessant sind auch die therapeutischen Ansätze zweier US-Unis (beide Phase I), die auf modifizierten T-Zellen (gegen PSMA) basieren. Die Rekrutierung in diesen Studien erfolgt allerdings im Schneckentempo, weil die Studien jeweils nur an einem Ort durchgeführt werden.
Fazit: Bei Zukäufen bin ich immer skeptisch. Im vorliegenden Fall könnte die Einlizensierung aber Sinn machen.
Ich finde das Target nicht uninteressant. Im Vergleich zu MOR208 (anti CD19) scheint hier die Konkurrenz auch (noch) überschaubar.
Am weitesten fortgeschritten (Phase II) ist das ADC von Progenics/SGEN, ohne dass bislang aufregende Studienergebnisse publiziert worden wären. Die ADC´s anderer Gesellschaften (EC1169, Ambryx PSMA-ADC, ADCT401) stecken allesamt noch im Discovery-Stadium.
Interessant sind auch die therapeutischen Ansätze zweier US-Unis (beide Phase I), die auf modifizierten T-Zellen (gegen PSMA) basieren. Die Rekrutierung in diesen Studien erfolgt allerdings im Schneckentempo, weil die Studien jeweils nur an einem Ort durchgeführt werden.
Fazit: Bei Zukäufen bin ich immer skeptisch. Im vorliegenden Fall könnte die Einlizensierung aber Sinn machen.
Kurze Anmerkung zum Emergent/MOR209-Deal:
In meinen Augen ist der Deal zu MOR209 mit Emergent Biosolutions relativ sorgfältig ausgewählt.
Ob die Konditionen 2/3 Finanzierung der klinischen Phasen und nur „20%“ Tantiemen im Hauptmarkt Nordamerika günstig sind, muss man sehen.
Nur als Beispielrechnung mit einer runden Zahl:
Bei Umsätzen von z.B. 1 Mrd. kämen dann 200 Mio. pro Jahr in die Kasse.
Dann würde es sich sicherlich rechnen.
Wunderlich ist jedoch, dass, wenn das Target vielversprechend ist, sich Morphosys einkaufen konnte. Warum?
Emergent Biosolutions hat bereits zugelassene Produkte und late-stage assets (in Ph3 und Ph2, zudem Anthrax-Therapie Kandidaten) und hätte es somit sicherlich finanziell ebenso allein verfolgen können (http://ebsi.com/sites/default/files/Emergent-Corporate_Fact_…
Gerade Ph1 und Ph2 sind ja vom Investitionsvolumen einigermaßen überschaubar...
Groß ist in jedem Fall der Markt, der nicht nur mCRPC umfassen sollte. Sondern ich halte es durchaus für möglich, dass mit diesem Target nicht nur die aggressiven Tumore behandelt werden können.
Vielmehr könnte in ganz frühen Stadien, welche (noch) nicht behandelt werden müssen, über solch eine Immuntherapie Prostatakrebs zurück gedrängt werden.
Die Nutzen der Vorsorgeuntersuchungen, vorallem das PSA-Screening, steht in einen schlechten Licht und führt häufig zu umstrittenen Operationen, Hormon-bzw. Chemotherapien bei älteren Männern.
Prostatakrebs ist i.R. wenig aggressiv und wächst nur langsam. Deshalb könnten viele Patienten bis zum Lebensende ohne die klassischen Therapieformen auskommen.
Insofern sehe ich, ausgehend von schwachen Nebenwirkungen, vorallem großes Potential in der ‚Prävention’ vor diesen umstrittenen Behandlungsformen: die Aktivierung von körpereigenen Immunzellen gegen kleine, langsam-wachsende, nicht-lebensbedrohende Tumorherde. Dieses könnte ein wahnsinnig großer Markt sein!
Ich bin in jedem Fall gespannt, auf das lange Ende.
In meinen Augen ist der Deal zu MOR209 mit Emergent Biosolutions relativ sorgfältig ausgewählt.
Ob die Konditionen 2/3 Finanzierung der klinischen Phasen und nur „20%“ Tantiemen im Hauptmarkt Nordamerika günstig sind, muss man sehen.
Nur als Beispielrechnung mit einer runden Zahl:
Bei Umsätzen von z.B. 1 Mrd. kämen dann 200 Mio. pro Jahr in die Kasse.
Dann würde es sich sicherlich rechnen.
Wunderlich ist jedoch, dass, wenn das Target vielversprechend ist, sich Morphosys einkaufen konnte. Warum?
Emergent Biosolutions hat bereits zugelassene Produkte und late-stage assets (in Ph3 und Ph2, zudem Anthrax-Therapie Kandidaten) und hätte es somit sicherlich finanziell ebenso allein verfolgen können (http://ebsi.com/sites/default/files/Emergent-Corporate_Fact_…
Gerade Ph1 und Ph2 sind ja vom Investitionsvolumen einigermaßen überschaubar...
Groß ist in jedem Fall der Markt, der nicht nur mCRPC umfassen sollte. Sondern ich halte es durchaus für möglich, dass mit diesem Target nicht nur die aggressiven Tumore behandelt werden können.
Vielmehr könnte in ganz frühen Stadien, welche (noch) nicht behandelt werden müssen, über solch eine Immuntherapie Prostatakrebs zurück gedrängt werden.
Die Nutzen der Vorsorgeuntersuchungen, vorallem das PSA-Screening, steht in einen schlechten Licht und führt häufig zu umstrittenen Operationen, Hormon-bzw. Chemotherapien bei älteren Männern.
Prostatakrebs ist i.R. wenig aggressiv und wächst nur langsam. Deshalb könnten viele Patienten bis zum Lebensende ohne die klassischen Therapieformen auskommen.
Insofern sehe ich, ausgehend von schwachen Nebenwirkungen, vorallem großes Potential in der ‚Prävention’ vor diesen umstrittenen Behandlungsformen: die Aktivierung von körpereigenen Immunzellen gegen kleine, langsam-wachsende, nicht-lebensbedrohende Tumorherde. Dieses könnte ein wahnsinnig großer Markt sein!
Ich bin in jedem Fall gespannt, auf das lange Ende.
Antwort auf Beitrag Nr.: 47.597.208 von rollingovermilestones am 24.08.14 22:22:49Das halte ich für eher unrealistisch. Da PSMA auch von gesundem Gewebe exprimiert wird (weshalb der entsprechende Test, wie von Dir bereits erwähnt, oft zu umstrittenen Ergebnissen führt), wird das Präparat wegen entsprechender Nebenwirkungen sicherlich nicht in leichteren Fällen eingesetzt werden. Die Indikation der geplanten P1-Studie trägt dem Rechnung.
Antwort auf Beitrag Nr.: 47.597.355 von Joschka Schröder am 24.08.14 23:14:24Ich nicht!
Die Expression ist sicherlich ein Argument, aber dem möchte ich entgegenhalten, dass die Expression in gesundem Gewebe sehr, sehr schwach ist. (Dies hatten auch SM oder AS im CC geäußert). Insofern ist es abhängig vom Nebenwirkungsprofil.
Wir werden sehen.
Ich könnte mir jedoch vorstellen, dass die Therapie sehr viel weniger Probleme macht als eine OP, eine Hormon- oder gar Chemotherapie.
Aber gut, das ist meine Meinung. Begonnen wird, insofern hast du Recht, erstmal mit mCRPC-Patienten.
Die Expression ist sicherlich ein Argument, aber dem möchte ich entgegenhalten, dass die Expression in gesundem Gewebe sehr, sehr schwach ist. (Dies hatten auch SM oder AS im CC geäußert). Insofern ist es abhängig vom Nebenwirkungsprofil.
Wir werden sehen.
Ich könnte mir jedoch vorstellen, dass die Therapie sehr viel weniger Probleme macht als eine OP, eine Hormon- oder gar Chemotherapie.
Aber gut, das ist meine Meinung. Begonnen wird, insofern hast du Recht, erstmal mit mCRPC-Patienten.
Eine traurige Nachricht für die Morphosys-Pipeline:
Die Entwicklung des anti-sclerostin-Antikörpers BPS804 wurde gestoppt.
Schade, besonders von diesem Präparat hatte ich mir eigentlich so viel erwartet.
Die Entwicklung des anti-sclerostin-Antikörpers BPS804 wurde gestoppt.
Schade, besonders von diesem Präparat hatte ich mir eigentlich so viel erwartet.
Antwort auf Beitrag Nr.: 47.624.151 von Joschka Schröder am 27.08.14 16:11:50
Wo
steht
denn
das?
Konnte es bislang im Netz nirgendwo finden.

Lediglich für 'chronic kidney disease' wurde die 4. Ph2 im letzten Jahr schon (vor dem Start) abgebrochen.
Zitat von Joschka Schröder: Eine traurige Nachricht für die Morphosys-Pipeline:
Die Entwicklung des anti-sclerostin-Antikörpers BPS804 wurde gestoppt.
Schade, besonders von diesem Präparat hatte ich mir eigentlich so viel erwartet.
Wo
steht
denn
das?
Konnte es bislang im Netz nirgendwo finden.

Lediglich für 'chronic kidney disease' wurde die 4. Ph2 im letzten Jahr schon (vor dem Start) abgebrochen.
Antwort auf Beitrag Nr.: 47.627.850 von rollingovermilestones am 27.08.14 21:53:02Keine Ahnung, ob das irgendwo im Netz steht. Vermutlich eher nicht, sonst hätte ich es wohl schon vorher gewußt. Ich habe leider erst heute davon erfahren. Die Entscheidung ist offensichtlich schon vor längerer Zeit getroffen worden.
Die präklinischen Daten - insbesondere die Kombination aus BPS804 und Novartis´Bisphosphonat Aclasta - sahen noch so aussichtreich aus!
Die präklinischen Daten - insbesondere die Kombination aus BPS804 und Novartis´Bisphosphonat Aclasta - sahen noch so aussichtreich aus!
Bei Morphosys stellt sich mir derzeit die Frage einer angemessenen Bewertung. Vorweg: Ich sehe mich kaum in der Lage, diese Frage vernünftig zu beantworten.
Tatsache ist, dass mit BPS804 nunmehr ein wesentlicher Hoffnungsträger wegfällt. Ich rechne weiterhin damit, dass auch das BHQ880-Projekt nicht mehr weitergeführt werden wird. Eine offizielle Entscheidung dazu ist mir zwar nicht bekannt, die klinischen Phase II-Studien sind jedoch schon lange abgeschlossen, neue Studien sind nicht mehr begonnen worden und in der Novartis-Pipeline taucht BHQ880 bei den Filings auch nach 2018 nicht auf.
Tja, was sind nun eigentlich die werthaltigen Hoffnungsträger, die eine Marktkapitalisierung von gegenwärtig über 1,8 Mrd. € begründen können?
1) Bimagrumab ist aus meiner Sicht der größte Hoffnungsträger, auch wenn es hinsichtlich etwaiger Nebenwirkungen bei Langzeitanwendung noch Ungewissheiten gibt.
2) Guselkumab scheint aussichtsreich, muss sich aber erst noch mit einer Masse bislang gleichwertiger Neuentwicklungen messen (u.a. ustekimumab, secukinumab, brodalumab, ixekizumab, tildrakizumab und tregalizumab).
3) MOR202, das in Konkurrenz zu anderen anti CD38-Antikörpern wie daratumumab und SAR650984 steht, außerdem zu Antikörpern/ADC´s, die andere Targets adressieren (z.B. Biotest´s anti CD138-Antikörper BT-062 oder Elotuzumab gegen CS1) und neue Präparate, die in völlig andere Signalwege eingreifen (z.B. HDAC6-Inhibitoren). Zu MOR202 liegen zudem noch keine Studiendaten vor.
4) MOR103: Ebenfalls große Konkurrenz durch andere Antikörper (z.B. anti-IL6(-R)), weiterhin durch ähnliche Präparate, die den GM-CSF-Weg blockieren (z.B. namilumab und mavrilimumab), wobei wesentliche Fragen wie etwaige NW bei Langzeitgabe noch offen sind. Die bislang publizierte MOR103-Studie war zu rudimentär, als dass daraus ein Marktpotential abgeleitet werden könnte.
5) MOR208: Aus meiner Sicht mit zu großer Konkurrenz. Kein Hoffnungsträger.
Man könnte die Liste beliebig fortsetzen.
Bleibt noch das "Lotterielos" Gantenerumab. Ohne dieses Los wäre die Aktie vermutlich deutlich zu teuer. Gantenerumab verleiht dem Investment allerdings einen sehr spekulativen Charakter.
Keine Ahnung, wie sich der Kurs in den nächsten Monaten entwickeln wird. Eine stärkere Konsolidierung würde mich angesichts der beschriebenen Umstände allerdings nicht überraschen.
Tatsache ist, dass mit BPS804 nunmehr ein wesentlicher Hoffnungsträger wegfällt. Ich rechne weiterhin damit, dass auch das BHQ880-Projekt nicht mehr weitergeführt werden wird. Eine offizielle Entscheidung dazu ist mir zwar nicht bekannt, die klinischen Phase II-Studien sind jedoch schon lange abgeschlossen, neue Studien sind nicht mehr begonnen worden und in der Novartis-Pipeline taucht BHQ880 bei den Filings auch nach 2018 nicht auf.
Tja, was sind nun eigentlich die werthaltigen Hoffnungsträger, die eine Marktkapitalisierung von gegenwärtig über 1,8 Mrd. € begründen können?
1) Bimagrumab ist aus meiner Sicht der größte Hoffnungsträger, auch wenn es hinsichtlich etwaiger Nebenwirkungen bei Langzeitanwendung noch Ungewissheiten gibt.
2) Guselkumab scheint aussichtsreich, muss sich aber erst noch mit einer Masse bislang gleichwertiger Neuentwicklungen messen (u.a. ustekimumab, secukinumab, brodalumab, ixekizumab, tildrakizumab und tregalizumab).
3) MOR202, das in Konkurrenz zu anderen anti CD38-Antikörpern wie daratumumab und SAR650984 steht, außerdem zu Antikörpern/ADC´s, die andere Targets adressieren (z.B. Biotest´s anti CD138-Antikörper BT-062 oder Elotuzumab gegen CS1) und neue Präparate, die in völlig andere Signalwege eingreifen (z.B. HDAC6-Inhibitoren). Zu MOR202 liegen zudem noch keine Studiendaten vor.
4) MOR103: Ebenfalls große Konkurrenz durch andere Antikörper (z.B. anti-IL6(-R)), weiterhin durch ähnliche Präparate, die den GM-CSF-Weg blockieren (z.B. namilumab und mavrilimumab), wobei wesentliche Fragen wie etwaige NW bei Langzeitgabe noch offen sind. Die bislang publizierte MOR103-Studie war zu rudimentär, als dass daraus ein Marktpotential abgeleitet werden könnte.
5) MOR208: Aus meiner Sicht mit zu großer Konkurrenz. Kein Hoffnungsträger.
Man könnte die Liste beliebig fortsetzen.
Bleibt noch das "Lotterielos" Gantenerumab. Ohne dieses Los wäre die Aktie vermutlich deutlich zu teuer. Gantenerumab verleiht dem Investment allerdings einen sehr spekulativen Charakter.
Keine Ahnung, wie sich der Kurs in den nächsten Monaten entwickeln wird. Eine stärkere Konsolidierung würde mich angesichts der beschriebenen Umstände allerdings nicht überraschen.
Antwort auf Beitrag Nr.: 47.646.138 von Joschka Schröder am 29.08.14 16:20:52Als P2-Partner-Projekte habe ich die Projekte BPS804 und BHQ880 in meinem Bewertungsmodell noch pauschal zu je 40 mio€ drin.
So lange Morphosys die noch in der Liste führt, streiche ich die auch nicht.
BHQ880 habe ich ja auch schon längers auf der Abschussliste und bei BPS804 war auch schon eine ganze Zeit kein Fortschritt erkennbar.
80 mio€ wären ca. 3 Euro im Kurs die auf dem Spiel stehen.
Und bezüglich der anderen Projekte wird man eben die Entwicklung abwarten müssen. Die pipeline ist zu breit um Morphosys als Lottolos zu sehen.
So lange Morphosys die noch in der Liste führt, streiche ich die auch nicht.
BHQ880 habe ich ja auch schon längers auf der Abschussliste und bei BPS804 war auch schon eine ganze Zeit kein Fortschritt erkennbar.
80 mio€ wären ca. 3 Euro im Kurs die auf dem Spiel stehen.
Und bezüglich der anderen Projekte wird man eben die Entwicklung abwarten müssen. Die pipeline ist zu breit um Morphosys als Lottolos zu sehen.
Antwort auf Beitrag Nr.: 47.646.612 von eck64 am 29.08.14 16:54:08Als Lottolos habe ich Morphosys auch nicht bezeichnet!
OT
hallo joschka,
ich denke du hast dich relativ intensiv mit IMGN befasst.
was spricht für und was gegen einen kauf?
sie waren jedenfalls schon mal wesentlich teurer als jetzt....
danke!
hallo joschka,
ich denke du hast dich relativ intensiv mit IMGN befasst.
was spricht für und was gegen einen kauf?
sie waren jedenfalls schon mal wesentlich teurer als jetzt....
danke!
Antwort auf Beitrag Nr.: 47.647.989 von PathFinder2 am 29.08.14 18:58:52Tut mir leid, aber das Thema IMGN ist zu komplex, um es in kurzer Zeit abzuhandeln. Vielleicht so viel: IMGN289 könnte was werden, bei allen anderen Eigenentwicklungen bin ich skeptisch.
Antwort auf Beitrag Nr.: 47.648.535 von Joschka Schröder am 29.08.14 20:08:22danke trotzdem
wie stark bist du investiert (prozentual)?
wie stark bist du investiert (prozentual)?
MOR103 report vom ACTRIMS/ECTRIMS Meeting
BOSTON -- A biologic drug targeting the granulocyte-macrophage colony stimulating factor (GM-CSF) was safe and showed hints of activity against brain lesions in multiple sclerosis (MS) patients in a phase I trial, researchers said here.
In patients receiving the highest dose of the monoclonal antibody drug, MOR103, declines in medians for both T1 hypointense and T2 lesion volumes on MRI were seen after 20 weeks in the double-blind, placebo-controlled study, reported Cris Constantinescu, MD, PhD, of the University of Nottingham in England, and colleagues.
Only one serious treatment-emergent adverse event was seen among the 25 patients receiving the investigational agent -- an exacerbation of MS in a member of the middle-dosage group.
The trial results point toward a clinical impact from years of research into the role of GM-CSF in MS and other autoimmune conditions, he suggested to attendees at the European Committee for Treatment and Research in Multiple Sclerosis annual meeting, held jointly this year with its North American counterpart.
As the name suggests, GM-CSF is a growth factor for important immune system components. Although neither granulocytes nor macrophages are directly involved in MS pathology, the extensive cross-talk between different classes of immune cells means that modulation of one type can lead to wide-ranging effects elsewhere in the immune system.
Constantinescu noted that previous studies in animals, especially rodents with experimental autoimmune encephalomyelitis (EAE), have suggested that targeting GM-CSF may downregulate some aspects of MS pathology.
For example, mice with their GM-CSF homolog gene knocked out are resistant to EAE, while animals overexpressing the growth factor show an exaggerated form of EAE, he said. Development of EAE also requires that T cells secrete GM-CSF. And, antibodies to GM-CSF administered to animals suppresses EAE.
The subject of the current study, MOR103, developed by the German firm MorphoSys AG, is a human monoclonal antibody directed against a GM-CSF epitope that prevents the protein from activating its receptor.
For the trial, 31 patients with relapsing-remitting (n=27) or secondary progressive MS (n=4) were recruited -- six assigned to placebo and the others divided among MOR103 doses of 0.5, 1, or 2 mg/kg, all given by intravenous infusion every 2 weeks for 10 weeks. Patients were then followed for an additional 10 weeks with MRI scans.
Mean disease duration was about 6 years (month?) in the placebo and low-dose cohorts, and more than 10 years (month?) in the middle- and high-dose groups. Mean scores on the Expanded Disability Status Scale were about 4 in all groups.
Treatment-emergent adverse events were common in the study, averaging about six per patient, but only a handful were rated as serious. There were no infusion reactions and those considered possibly or probably related to the study drug were most common with placebo and the lowest drug dose.
The only potentially treatment-related effect that was present in both higher-dose cohorts and not in the placebo group was elevation in C-reactive protein, which Constantinescu did not quantify.
On the sole efficacy outcome tracked in the study, change in median T1 hypointense and T2 lesion volumes, either no change or increases were seen in the placebo and low-dose cohorts. In the middle-dose group, a slight (0.1 mL) decrease in median T1 lesion volume occurred, along with a 0.2-mL increase in median T2 volume. The high-dose group, however, saw decreases of 0.3 mL in median T1 volume and 0.9 mL in median T2 volume.
Constantinescu also reported that numbers of new lesions were "low" in the high-dose group and that no relapses occurred, although the sample size and study duration were not sufficient for that to mean much.
Of greater short-term importance for the drug's future, no anti-drug antibodies were seen and levels of major cytokines, immunoglobulin subtypes, and T-cell and monocyte subtypes did not appear to be affected with treatment, which would be reassuring to MorphoSys.
The drug's pharmacokinetics also appeared to support the weekly dosing interval, with blood levels reaching a plateau after about 7 weeks of treatment.
Constantinescu said a phase II trial had now begun. The company has already conducted a phase Ib/IIa trial with the agent in rheumatoid arthritis, with favorable results reported earlier this year.
http://www.medpagetoday.com/MeetingCoverage/ECTRIMS/47649
BOSTON -- A biologic drug targeting the granulocyte-macrophage colony stimulating factor (GM-CSF) was safe and showed hints of activity against brain lesions in multiple sclerosis (MS) patients in a phase I trial, researchers said here.
In patients receiving the highest dose of the monoclonal antibody drug, MOR103, declines in medians for both T1 hypointense and T2 lesion volumes on MRI were seen after 20 weeks in the double-blind, placebo-controlled study, reported Cris Constantinescu, MD, PhD, of the University of Nottingham in England, and colleagues.
Only one serious treatment-emergent adverse event was seen among the 25 patients receiving the investigational agent -- an exacerbation of MS in a member of the middle-dosage group.
The trial results point toward a clinical impact from years of research into the role of GM-CSF in MS and other autoimmune conditions, he suggested to attendees at the European Committee for Treatment and Research in Multiple Sclerosis annual meeting, held jointly this year with its North American counterpart.
As the name suggests, GM-CSF is a growth factor for important immune system components. Although neither granulocytes nor macrophages are directly involved in MS pathology, the extensive cross-talk between different classes of immune cells means that modulation of one type can lead to wide-ranging effects elsewhere in the immune system.
Constantinescu noted that previous studies in animals, especially rodents with experimental autoimmune encephalomyelitis (EAE), have suggested that targeting GM-CSF may downregulate some aspects of MS pathology.
For example, mice with their GM-CSF homolog gene knocked out are resistant to EAE, while animals overexpressing the growth factor show an exaggerated form of EAE, he said. Development of EAE also requires that T cells secrete GM-CSF. And, antibodies to GM-CSF administered to animals suppresses EAE.
The subject of the current study, MOR103, developed by the German firm MorphoSys AG, is a human monoclonal antibody directed against a GM-CSF epitope that prevents the protein from activating its receptor.
For the trial, 31 patients with relapsing-remitting (n=27) or secondary progressive MS (n=4) were recruited -- six assigned to placebo and the others divided among MOR103 doses of 0.5, 1, or 2 mg/kg, all given by intravenous infusion every 2 weeks for 10 weeks. Patients were then followed for an additional 10 weeks with MRI scans.
Mean disease duration was about 6 years (month?) in the placebo and low-dose cohorts, and more than 10 years (month?) in the middle- and high-dose groups. Mean scores on the Expanded Disability Status Scale were about 4 in all groups.
Treatment-emergent adverse events were common in the study, averaging about six per patient, but only a handful were rated as serious. There were no infusion reactions and those considered possibly or probably related to the study drug were most common with placebo and the lowest drug dose.
The only potentially treatment-related effect that was present in both higher-dose cohorts and not in the placebo group was elevation in C-reactive protein, which Constantinescu did not quantify.
On the sole efficacy outcome tracked in the study, change in median T1 hypointense and T2 lesion volumes, either no change or increases were seen in the placebo and low-dose cohorts. In the middle-dose group, a slight (0.1 mL) decrease in median T1 lesion volume occurred, along with a 0.2-mL increase in median T2 volume. The high-dose group, however, saw decreases of 0.3 mL in median T1 volume and 0.9 mL in median T2 volume.
Constantinescu also reported that numbers of new lesions were "low" in the high-dose group and that no relapses occurred, although the sample size and study duration were not sufficient for that to mean much.
Of greater short-term importance for the drug's future, no anti-drug antibodies were seen and levels of major cytokines, immunoglobulin subtypes, and T-cell and monocyte subtypes did not appear to be affected with treatment, which would be reassuring to MorphoSys.
The drug's pharmacokinetics also appeared to support the weekly dosing interval, with blood levels reaching a plateau after about 7 weeks of treatment.
Constantinescu said a phase II trial had now begun. The company has already conducted a phase Ib/IIa trial with the agent in rheumatoid arthritis, with favorable results reported earlier this year.
http://www.medpagetoday.com/MeetingCoverage/ECTRIMS/47649
Antwort auf Beitrag Nr.: 47.847.815 von rollingovermilestones am 22.09.14 22:49:53hallo Joschka!
was hältst du von diesen MOR103 daten im MS?
danke
was hältst du von diesen MOR103 daten im MS?
danke
Antwort auf Beitrag Nr.: 46.566.527 von Joschka Schröder am 05.03.14 09:34:01Das kann Roche auch; bislang nur präklinisch:
( http://www.jneurosci.org/content/34/35/11621.full )
Combined Treatment with a BACE Inhibitor and Anti-Aβ Antibody Gantenerumab Enhances Amyloid Reduction in APPLondon Mice
( http://www.jneurosci.org/content/34/35/11621.full )
Combined Treatment with a BACE Inhibitor and Anti-Aβ Antibody Gantenerumab Enhances Amyloid Reduction in APPLondon Mice
Zitat von Joschka Schröder: Aktuell wird eine umfassende Kooperation zwischen Biogen und Eisai in der Indikation Morbus Alzheimer gemeldet, u.a. mit E2609, einem BACE-Hemmer (Phase II), BAN2401, einem humanisierten MaB gegen lösliche, toxische Amyloid-Oligomere (Phase II), BIIB037, einem humanen MaB, vergleichbar in etwa Gantenerumab (Phase Ib) und einem anti tau-Mab (nicht näher benannt, in den einschlägigen Patentdatenbanken habe ich diesbezüglich noch nicht nachgesehen).
Zusammenfassung siehe auch hier -> http://www.bioportfolio.com/news/article/1841765/Eisai-and-B…
Antwort auf Beitrag Nr.: 48.276.250 von rollingovermilestones am 10.11.14 17:31:54Noch ein weiteres paper aus jüngster Vergangenheit
http://informahealthcare.com/doi/abs/10.1586/14737175.2014.9…
...An ongoing secondary prevention trial of gantenerumab in presymptomatic subjects with genetic mutations for autosomal-dominant AD will verify the utility of anti-Aβ monoclonal antibodies as prevention therapy.
Die DIANE-Studie (estimated Study Completion Date: March 2017) wird zeigen, ob A-ß ein lohnendes target ist.
Ich bin grad verwundert, dass die prodomale Studie jetzt erst nach der milden Studie beendet ist Ende 2018.
War das schon immer so geplant?
http://informahealthcare.com/doi/abs/10.1586/14737175.2014.9…
...An ongoing secondary prevention trial of gantenerumab in presymptomatic subjects with genetic mutations for autosomal-dominant AD will verify the utility of anti-Aβ monoclonal antibodies as prevention therapy.
Die DIANE-Studie (estimated Study Completion Date: March 2017) wird zeigen, ob A-ß ein lohnendes target ist.
Ich bin grad verwundert, dass die prodomale Studie jetzt erst nach der milden Studie beendet ist Ende 2018.
War das schon immer so geplant?
Betrifft Guselkumab (wichtiger Quervergleich): Brodalumab (anti-IL17, Amgen) schlägt Stelara/Ustekinumab (anti-IL12-IL23, Johnson & Johnson) bei der Psoriasistherapie!
http://www.fiercebiotech.com/press-releases/amgen-and-astraz…
http://www.fiercebiotech.com/press-releases/amgen-and-astraz…
Antwort auf Beitrag Nr.: 48.303.961 von Joschka Schröder am 13.11.14 00:53:26Danke für deinen Post!
Na ja, der Unterschied ist jetzt nicht so klar, finde ich. Dosis und Intervall sind auch zu berücksichtigen!
Verglichen wurde:
Drug: 210 mg brodalumab
210 mg brodalumab administered SC
und
Drug: 140 mg brodalumab
140 mg brodalumab administered SC
mit
Drug: ustekinumab
45 mg or 90 mg ustekinumab administered SC per the labeled dosing regimen.
Für PASI75 war der Unterschied nicht sehr deutlich:
"69.2 percent of patients in the brodalumab 140 mg group, 69.3 percent of patients in the Stelara group ...achieved PASI 75"
Und in wie weit Guselkumab (IL23p19) schlechter oder besser oder gleich ist, muss sich noch zeigen. Hier stehen 100 mg mAb im Studienprotokoll. Das Intervall ist allerdings kürzer als für ustekinumab (8 vs. 12 Wochen).
Klar ist auf jeden Fall, dass die anti-IL17 bzw. anti-IL12/23 oder anti-IL23 gute Chancen haben, den anti-TNFalfa Therapien Umsätze abzunehmen.
Na ja, der Unterschied ist jetzt nicht so klar, finde ich. Dosis und Intervall sind auch zu berücksichtigen!
Verglichen wurde:
Drug: 210 mg brodalumab
210 mg brodalumab administered SC
und
Drug: 140 mg brodalumab
140 mg brodalumab administered SC
mit
Drug: ustekinumab
45 mg or 90 mg ustekinumab administered SC per the labeled dosing regimen.
Für PASI75 war der Unterschied nicht sehr deutlich:
"69.2 percent of patients in the brodalumab 140 mg group, 69.3 percent of patients in the Stelara group ...achieved PASI 75"
Und in wie weit Guselkumab (IL23p19) schlechter oder besser oder gleich ist, muss sich noch zeigen. Hier stehen 100 mg mAb im Studienprotokoll. Das Intervall ist allerdings kürzer als für ustekinumab (8 vs. 12 Wochen).
Klar ist auf jeden Fall, dass die anti-IL17 bzw. anti-IL12/23 oder anti-IL23 gute Chancen haben, den anti-TNFalfa Therapien Umsätze abzunehmen.
Zitat von Joschka Schröder: Betrifft Guselkumab (wichtiger Quervergleich): Brodalumab (anti-IL17, Amgen) schlägt Stelara/Ustekinumab (anti-IL12-IL23, Johnson & Johnson) bei der Psoriasistherapie!
http://www.fiercebiotech.com/press-releases/amgen-and-astraz…
Wenn schon, dann mußt Du zum Vergleich für brodalumab die höhere Dosisgruppe nehmen, das entspricht derjenigen Dosis, mit der das Medikament auf den Markt kommen soll.
In Sachen CD19 (und später ganz generell) ist seit einiger Zeit ja viel von CAR-T oder auch TCR die Rede. Zunächst bei Novartis, aber es gibt auch andere Player.
Hier mal eine Präsentation von Kite, die ich jedem ans Herz lege, der sich für Fortschritte in der Onkologie interessiert:
http://files.shareholder.com/downloads/AMDA-2V2XOY/363731175…
Bei aller immer angebrachten Skepsis und bei allen bereits zu Tage getretenen Problemen mit diesen Technologien, fällt es mir doch schwer, meine Begeisterung zu zügeln.
Hier mal eine Präsentation von Kite, die ich jedem ans Herz lege, der sich für Fortschritte in der Onkologie interessiert:
http://files.shareholder.com/downloads/AMDA-2V2XOY/363731175…
Bei aller immer angebrachten Skepsis und bei allen bereits zu Tage getretenen Problemen mit diesen Technologien, fällt es mir doch schwer, meine Begeisterung zu zügeln.
Antwort auf Beitrag Nr.: 45.785.450 von Joschka Schröder am 07.11.13 17:42:34Die CLL-Daten für MOR208 / ASH sind doch ganz vielversprechend, besonders im Hinblick auf geplante Kombi-Therapien, oder seht ihr das anders?
"27 pts were enrolled, ....
On the basis of physical exam and laboratory studies, 18 patients (66.7%) achieved a partial response (PR), and the remaining 9 patients (33.3%) achieved stable disease (SD). Adding CT criteria, 8 patients (29.6%) achieved a PR with an additional 16 patients (59.3%) achieving SD. Two patients had progressive disease by CT criteria. No patient dosed below 3 mg/kg had an objective response. Of the 16 pts treated at the maximum dose, 12 patients (75%) had a PR by physical exam criteria and 6 patients (37.5%) had a PR by CT criteria, with 2 of these pts achieving a PR during the maintenance phase. Median progression free survival (PFS) for all patients was 199 days (95% CI: 168-299 days). For patients on all dose levels who received 9 doses or less, PFS was 189 days, and for the 8 patients on the extended treatment cohort, PFS was 420 days (95% CI: 168 days-not reached)...."
(- https://ash.confex.com/ash/2014/webprogram/Paper71691.html -)
"27 pts were enrolled, ....
On the basis of physical exam and laboratory studies, 18 patients (66.7%) achieved a partial response (PR), and the remaining 9 patients (33.3%) achieved stable disease (SD). Adding CT criteria, 8 patients (29.6%) achieved a PR with an additional 16 patients (59.3%) achieving SD. Two patients had progressive disease by CT criteria. No patient dosed below 3 mg/kg had an objective response. Of the 16 pts treated at the maximum dose, 12 patients (75%) had a PR by physical exam criteria and 6 patients (37.5%) had a PR by CT criteria, with 2 of these pts achieving a PR during the maintenance phase. Median progression free survival (PFS) for all patients was 199 days (95% CI: 168-299 days). For patients on all dose levels who received 9 doses or less, PFS was 189 days, and for the 8 patients on the extended treatment cohort, PFS was 420 days (95% CI: 168 days-not reached)...."
(- https://ash.confex.com/ash/2014/webprogram/Paper71691.html -)
Zitat von Joschka Schröder: Zur MOR208-Konkurrenzsituation (Indikation CLL, mehrfach vorbehandelte Patienten):
Der absolute Hammer sind die mit dem Bcl-2 Inhibitor ABT-199 (GDC-0199) in Monotherapie erzielten Studienergebnisse.
Overall Response Rate 84 %
complete responses 21 %
partial responses 63 %
Medi-555 erzielt in der Indikation CLL Ergebnisse, die in etwa mit den MOR208-Daten vergleichbar sind, vielleicht einen Hauch schwächer.
Ofatumumab (anti CD20) in Kombi mit Afuresertib:
42 % PR
58 % SD
Gute Ergebnisse auch des Syk Inhibitors GS9973 (vielfach vorbehandelte Patienten mit CLL, SLL, Details in Poster1634)
Fazit: Insbesondere gegen CART19 und ABT-199 wird es MOR208 sehr schwer haben. Die Strategie, MOR208 in Eigenregie weiterzuentwickeln, halte ich für äußerst riskant.
Keine guten Nachrichten für Johnson&Johnson´s Stelara: Zuerst die Niederlage in der head-to-head-Vergleichsstudie mit Amgen´s IL-17-Antagonisten brodalumab, nun eine Warnung wegen unschöner Nebenwirkungen -> http://medpharmtext.blogspot.ch/2014/11/ustenkinumab-rote-ha…
Guselkumab muss zu deutlich besseren Therapieergebnissen als Stelara führen, andernfalls wäre das Marktpotential sehr limitiert.
Guselkumab muss zu deutlich besseren Therapieergebnissen als Stelara führen, andernfalls wäre das Marktpotential sehr limitiert.
MOR208-Konkurrenzpräparat Blinatumomab beschleunigt von der FDA zugelassen -> http://www.fda.gov/Drugs/InformationOnDrugs/ApprovedDrugs/uc…
Antwort auf Beitrag Nr.: 48.395.564 von Joschka Schröder am 24.11.14 10:01:31betrifft MOR202
Ausweitung des Indikationsspektrums der anti-CD38-Antikörper: Genmab startet mit Daratumumab eine p2-Studie in der Indikation NHL -> http://ir.genmab.com/releasedetail.cfm?ReleaseID=886083
Ausweitung des Indikationsspektrums der anti-CD38-Antikörper: Genmab startet mit Daratumumab eine p2-Studie in der Indikation NHL -> http://ir.genmab.com/releasedetail.cfm?ReleaseID=886083
zum Thema CD19-Target (hier: CART-19-Ansatz): http://www.novartis.com/newsroom/media-releases/en/2014/1877…
Antwort auf Beitrag Nr.: 48.508.670 von Joschka Schröder am 07.12.14 11:13:07etwas off topic
Zum Thema PD-1 sind aktuell im NEJM zwei interessante (frei zugängliche) Arbeiten erschienen (u.a. zur Hodgkin-Therapie mit Nivolumab), hier das Editorial -> http://www.nejm.org/doi/full/10.1056/NEJMe1413488#t=article
Zum Thema PD-1 sind aktuell im NEJM zwei interessante (frei zugängliche) Arbeiten erschienen (u.a. zur Hodgkin-Therapie mit Nivolumab), hier das Editorial -> http://www.nejm.org/doi/full/10.1056/NEJMe1413488#t=article
Was sagst Du zu den Mor208 Daten?
Antwort auf Beitrag Nr.: 48.496.667 von Joschka Schröder am 05.12.14 10:17:27
kann das sein, das der schon nach Phase 2 zugelassen wurde? Wenn ja, warum?
Zitat von Joschka Schröder: MOR208-Konkurrenzpräparat Blinatumomab beschleunigt von der FDA zugelassen -> http://www.fda.gov/Drugs/InformationOnDrugs/ApprovedDrugs/uc…
kann das sein, das der schon nach Phase 2 zugelassen wurde? Wenn ja, warum?
Bisher lagen die " Experten "in diesem Forum mit ihren Urteilen zu Studienergebnissen von Mor doch reichlich daneben.Auf Veröffentlichungen zu Ergebnissen,folgten prompt negative Expertisen.
Die beziehen ihre Informationen nur über das Netz. Kein Insiderwissen.
Diese user sind gute Kontraindikatoren - der Markt hat die bisherigen Studienerfolge anders interpretiert/ beurteilt.
Möge es so bleiben............
Die beziehen ihre Informationen nur über das Netz. Kein Insiderwissen.
Diese user sind gute Kontraindikatoren - der Markt hat die bisherigen Studienerfolge anders interpretiert/ beurteilt.
Möge es so bleiben............

Antwort auf Beitrag Nr.: 48.510.077 von aalerich am 07.12.14 17:19:401) Welches "Insiderwissen" benötigt man, um Studienergebnisse miteinander zu vergleichen?
2) Darüber, was richtig oder falsch ist, entscheidet nicht "der Markt".
2) Darüber, was richtig oder falsch ist, entscheidet nicht "der Markt".
Antwort auf Beitrag Nr.: 48.510.290 von Joschka Schröder am 07.12.14 18:20:02Die ASH-Poster (MOR208) sind online, hier gehts zum download
-> http://t.co/LPZmz8QTmx
-> http://t.co/pld0I7goRh
-> http://t.co/LPZmz8QTmx
-> http://t.co/pld0I7goRh
Antwort auf Beitrag Nr.: 48.512.813 von Joschka Schröder am 08.12.14 10:19:41Dein Eindruck und Interpretation?
Antwort auf Beitrag Nr.: 48.512.987 von eck64 am 08.12.14 10:39:58Erster Eindruck: gut, insbesondere auch die DoR-Daten, aalerich sollte also verkaufen.
Antwort auf Beitrag Nr.: 48.508.670 von Joschka Schröder am 07.12.14 11:13:07
Novartis CTL019 mit nahezu konkurrenzlosen Studienergebnissen -> http://www.fiercebiotech.com/story/novartis-adds-car-ts-lust…
Zitat von Joschka Schröder: zum Thema CD19-Target (hier: CART-19-Ansatz): http://www.novartis.com/newsroom/media-releases/en/2014/1877…
Novartis CTL019 mit nahezu konkurrenzlosen Studienergebnissen -> http://www.fiercebiotech.com/story/novartis-adds-car-ts-lust…
Antwort auf Beitrag Nr.: 48.518.123 von Joschka Schröder am 08.12.14 19:17:00Die CART-Studienergebnisse sind ohne Zweifel spektakulär. Allerdings sind die Risiken schon erheblich, und was im Langzeitverlauf mit diesen gentechnisch veränderten Zellen passiert, weiß man auch nicht. Wie lange es zu einer kompletten Depletion der B-Zellen kommt, weiß ich ehrlich gesagt nicht, gerade im Vergleich zu den CD 19/20-Antikörpern. Wenn das noch länger anhält, erhöht sich das Risiko nochmals, auch unter Rituximab sind sehr schwere Infektionen beschrieben worden (jc etc.). Ich bin gespannt, welchen Stellenwert das Verfahren bekommt, womöglich erstmal für therapierefraktäre Verläufe.
Antwort auf Beitrag Nr.: 48.519.980 von deadflowers am 08.12.14 22:22:51Wir beurteilen die Situation offensichtlich ähnlich. Ich habe gewisse Zweifel, ob CART-19 in der Erstlinientherapie Standard werden kann, ... es ist aber ein großartiges Gefühl, als ultima ratio eine derartige Waffe zur Verfügung zu haben.
Mit Details der Langzeittherapie habe ich mich noch nicht befasst. Vermutlich dürfte aber eine lebenslange Immunglobulin-Substitution erforderlich sein.
Mit Details der Langzeittherapie habe ich mich noch nicht befasst. Vermutlich dürfte aber eine lebenslange Immunglobulin-Substitution erforderlich sein.
Antwort auf Beitrag Nr.: 48.513.590 von Joschka Schröder am 08.12.14 11:37:12
Ich habe kurz einmal die aktuellen Studiendaten der Präparate MOR208 und Adcetris (anti-CD30, von Seattle Genetics) in der Indikation relapsed/refractory DLBCL miteinander verglichen. Anwendung jeweils in Monotherapie. In der Adcetris-Studie wird zwischen einer CD30-undectablen Patientengruppe und eine CD30-positiven Gruppe unterschieden. Die Patienten in allen Studien sind ähnlich vorbehandelt. Der Vergleichbarkeit halber werden in der Auswertung nur evaluierbare Patienten berücksichtigt.
MOR208 (n=25)
ORR 36 %
CR 8 %
PR 28 %
DoR 5,5 Monate
Adcetris in CD30-neg-Gruppe (n=42)
ORR 31 %
CR 10 %
PR 21 %
PFS 1,4 Monate
DoR 1,6 Monate
Adcetris in CD30-pos-Gruppe (n=48)
ORR 44 %
CR 17 %
PR 27 %
PFS 4,0 Monate
Schlussfolgerung: Bei CD30-positiven Patienten schneidet Adcetris etwas besser ab, in der CD30-negativen Gruppe sind die Responses in etwa gleichwertig, positiv dort aber die langdauernde Antwort des MOR208 (5,5 Monate versus 1,6 Monate!).
Zitat von Joschka Schröder: Erster Eindruck: gut, insbesondere auch die DoR-Daten, aalerich sollte also verkaufen.
Ich habe kurz einmal die aktuellen Studiendaten der Präparate MOR208 und Adcetris (anti-CD30, von Seattle Genetics) in der Indikation relapsed/refractory DLBCL miteinander verglichen. Anwendung jeweils in Monotherapie. In der Adcetris-Studie wird zwischen einer CD30-undectablen Patientengruppe und eine CD30-positiven Gruppe unterschieden. Die Patienten in allen Studien sind ähnlich vorbehandelt. Der Vergleichbarkeit halber werden in der Auswertung nur evaluierbare Patienten berücksichtigt.
MOR208 (n=25)
ORR 36 %
CR 8 %
PR 28 %
DoR 5,5 Monate
Adcetris in CD30-neg-Gruppe (n=42)
ORR 31 %
CR 10 %
PR 21 %
PFS 1,4 Monate
DoR 1,6 Monate
Adcetris in CD30-pos-Gruppe (n=48)
ORR 44 %
CR 17 %
PR 27 %
PFS 4,0 Monate
Schlussfolgerung: Bei CD30-positiven Patienten schneidet Adcetris etwas besser ab, in der CD30-negativen Gruppe sind die Responses in etwa gleichwertig, positiv dort aber die langdauernde Antwort des MOR208 (5,5 Monate versus 1,6 Monate!).
Antwort auf Beitrag Nr.: 48.520.058 von Joschka Schröder am 08.12.14 22:33:45Juno Therapeutics, die Pioniere der CAR-T-Technologie, gehen an die Börse:
http://www.genomicsvisions.com/WPnews/wordpress/?p=12565
http://www.genomicsvisions.com/WPnews/wordpress/?p=12565
Antwort auf Beitrag Nr.: 48.395.564 von Joschka Schröder am 24.11.14 10:01:31
Stelara ist in einer Vergleichsstudie auch Sekukinumab unterlegen -> http://www.stockhouse.com/news/press-releases/2014/12/12/hea…
Zitat von Joschka Schröder: Keine guten Nachrichten für Johnson&Johnson´s Stelara: Zuerst die Niederlage in der head-to-head-Vergleichsstudie mit Amgen´s IL-17-Antagonisten brodalumab, nun eine Warnung wegen unschöner Nebenwirkungen -> http://medpharmtext.blogspot.ch/2014/11/ustenkinumab-rote-ha…
Guselkumab muss zu deutlich besseren Therapieergebnissen als Stelara führen, andernfalls wäre das Marktpotential sehr limitiert.
Stelara ist in einer Vergleichsstudie auch Sekukinumab unterlegen -> http://www.stockhouse.com/news/press-releases/2014/12/12/hea…
Antwort auf Beitrag Nr.: 48.553.682 von Joschka Schröder am 12.12.14 09:36:42Bleibt zu hoffen, dass J&J mit dem zweiten Entzündungs-mAb den Anschluss bald finden. CNTO6785 adressiert das gleiche target (IL-17A) wie Sekukinumab und ist noch in Ph2. NOV ist einfach schneller.
Vermutlich hatte Centocor vor NOV das target bei MOR schon geblockt und zu wenig gepusht.
Immerhin gibt es mit CNTO6785 ein IL17A-Projekt bei MOR und auch Guselkumab sieht bislang in head to head-Vergleichen (mit Humira) ganz gut aus. Nur die Entschlossenheit von J&J könnte besser sein.....
Aber der Entzündungsmarkt wird allen neuen Ansätzen Platz geben. Selbst TNF-a Biosimilars scheinen sich noch zu lohnen!!
Ich glaube, dass J&J auch die ganze Palette der Indikationen und der targets adressieren wird. Der Markt ist einfach riesig und sehr profitabel.
Vermutlich hatte Centocor vor NOV das target bei MOR schon geblockt und zu wenig gepusht.
Immerhin gibt es mit CNTO6785 ein IL17A-Projekt bei MOR und auch Guselkumab sieht bislang in head to head-Vergleichen (mit Humira) ganz gut aus. Nur die Entschlossenheit von J&J könnte besser sein.....
Aber der Entzündungsmarkt wird allen neuen Ansätzen Platz geben. Selbst TNF-a Biosimilars scheinen sich noch zu lohnen!!
Ich glaube, dass J&J auch die ganze Palette der Indikationen und der targets adressieren wird. Der Markt ist einfach riesig und sehr profitabel.
Zitat von Joschka Schröder:Zitat von Joschka Schröder: Keine guten Nachrichten für Johnson&Johnson´s Stelara: Zuerst die Niederlage in der head-to-head-Vergleichsstudie mit Amgen´s IL-17-Antagonisten brodalumab, nun eine Warnung wegen unschöner Nebenwirkungen -> http://medpharmtext.blogspot.ch/2014/11/ustenkinumab-rote-ha…
Guselkumab muss zu deutlich besseren Therapieergebnissen als Stelara führen, andernfalls wäre das Marktpotential sehr limitiert.
Stelara ist in einer Vergleichsstudie auch Sekukinumab unterlegen -> http://www.stockhouse.com/news/press-releases/2014/12/12/hea…
Antwort auf Beitrag Nr.: 48.556.292 von rollingovermilestones am 12.12.14 13:14:01Amgen mischt auch mit im IL17 Space. 2015 werden einige Daten kommen. Ich schätze Guselkumab wird Anfang 2015 auf einer Konferenz Daten für RA Ph2 rausbringen...
www.streetinsider.com/Corporate+News/Amgen+%28AMGN%29%2C+As…
www.streetinsider.com/Corporate+News/Amgen+%28AMGN%29%2C+AstraZeneca+%28AZN%29+to+Present+Brodalumab+Phase+3+Results+at+Psoriasis%3A+From+Gene+to+Clinic+Congress/10090764.html
Bleibt zu hoffen, dass J&J mit dem zweiten Entzündungs-mAb den Anschluss bald finden. CNTO6785 adressiert das gleiche target (IL-17A) wie Sekukinumab und ist noch in Ph2. NOV ist einfach schneller.
Vermutlich hatte Centocor vor NOV das target bei MOR schon geblockt und zu wenig gepusht.
Immerhin gibt es mit CNTO6785 ein IL17A-Projekt bei MOR und auch Guselkumab sieht bislang in head to head-Vergleichen (mit Humira) ganz gut aus. Nur die Entschlossenheit von J&J könnte besser sein.....
Aber der Entzündungsmarkt wird allen neuen Ansätzen Platz geben. Selbst TNF-a Biosimilars scheinen sich noch zu lohnen!!
Ich glaube, dass J&J auch die ganze Palette der Indikationen und der targets adressieren wird. Der Markt ist einfach riesig und sehr profitabel.
www.streetinsider.com/Corporate+News/Amgen+%28AMGN%29%2C+AstraZeneca+%28AZN%29+to+Present+Brodalumab+Phase+3+Results+at+Psoriasis%3A+From+Gene+to+Clinic+Congress/10090764.html
www.streetinsider.com/Corporate+News/Amgen+%28AMGN%29%2C+As…
www.streetinsider.com/Corporate+News/Amgen+%28AMGN%29%2C+AstraZeneca+%28AZN%29+to+Present+Brodalumab+Phase+3+Results+at+Psoriasis%3A+From+Gene+to+Clinic+Congress/10090764.html
Bleibt zu hoffen, dass J&J mit dem zweiten Entzündungs-mAb den Anschluss bald finden. CNTO6785 adressiert das gleiche target (IL-17A) wie Sekukinumab und ist noch in Ph2. NOV ist einfach schneller.
Vermutlich hatte Centocor vor NOV das target bei MOR schon geblockt und zu wenig gepusht.
Immerhin gibt es mit CNTO6785 ein IL17A-Projekt bei MOR und auch Guselkumab sieht bislang in head to head-Vergleichen (mit Humira) ganz gut aus. Nur die Entschlossenheit von J&J könnte besser sein.....
Aber der Entzündungsmarkt wird allen neuen Ansätzen Platz geben. Selbst TNF-a Biosimilars scheinen sich noch zu lohnen!!
Ich glaube, dass J&J auch die ganze Palette der Indikationen und der targets adressieren wird. Der Markt ist einfach riesig und sehr profitabel.
Zitat von Joschka Schröder: ..." target="_blank" rel="nofollow ugc noopener">www.streetinsider.com/Corporate+News/Amgen+%28AMGN%29%2C+AstraZeneca+%28AZN%29+to+Present+Brodalumab+Phase+3+Results+at+Psoriasis%3A+From+Gene+to+Clinic+Congress/10090764.html/url]
Stelara ist in einer Vergleichsstudie auch Sekukinumab unterlegen -> http://www.stockhouse.com/news/press-releases/2014/12/12/hea…
www.streetinsider.com/Corporate+News/Amgen+%28AMGN%29%2C+AstraZeneca+%28AZN%29+to+Present+Brodalumab+Phase+3+Results+at+Psoriasis%3A+From+Gene+to+Clinic+Congress/10090764.html
Zitat von rollingovermilestones: Bleibt zu hoffen, dass J&J mit dem zweiten Entzündungs-mAb den Anschluss bald finden. CNTO6785 adressiert das gleiche target (IL-17A) wie Sekukinumab und ist noch in Ph2. NOV ist einfach schneller.
Vermutlich hatte Centocor vor NOV das target bei MOR schon geblockt und zu wenig gepusht.
Immerhin gibt es mit CNTO6785 ein IL17A-Projekt bei MOR und auch Guselkumab sieht bislang in head to head-Vergleichen (mit Humira) ganz gut aus. Nur die Entschlossenheit von J&J könnte besser sein.....
Aber der Entzündungsmarkt wird allen neuen Ansätzen Platz geben. Selbst TNF-a Biosimilars scheinen sich noch zu lohnen!!
Ich glaube, dass J&J auch die ganze Palette der Indikationen und der targets adressieren wird. Der Markt ist einfach riesig und sehr profitabel.
Zitat von Joschka Schröder: ...
Stelara ist in einer Vergleichsstudie auch Sekukinumab unterlegen -> http://www.stockhouse.com/news/press-releases/2014/12/12/hea…
Antwort auf Beitrag Nr.: 48.561.896 von rollingovermilestones am 12.12.14 22:45:48http://www.streetinsider.com/Corporate+News/Amgen+%28AMGN%29…
Antwort auf Beitrag Nr.: 45.574.247 von Joschka Schröder am 05.10.13 16:52:46
Schon vor 6 Jahren wurde im Parallelthread Skepsis gegenüber dem Amyloid-Ansatz formuliert. In diesem Thread wurden die Bedenken weiter verfeinert. Nachdem zuletzt einige überraschende Studienergebnisse (z.B. BII037), die allerdings nur rudimentär kommuniziert worden ist, noch einmal Hoffnung aufkeimen ließen, der Amyloid-Ansatz könne in frühesten Krankheitsstadien doch noch zu einem gewissen Erfolg führen (was für Gantenerumab ein großes Marktpotential bedeutet hätte), scheint die Sache nun geklärt zu sein. Der Neuroanatom Braak hatte recht.
Zitat von Joschka Schröder: Von Gantenerumab verspreche ich mir wenig. Da gibt es deutlich aussichtsreichere therapeutische Ansätze, am besten dürfte dieser sein -> http://www.ncbi.nlm.nih.gov/pubmed/23604588
Schon vor 6 Jahren wurde im Parallelthread Skepsis gegenüber dem Amyloid-Ansatz formuliert. In diesem Thread wurden die Bedenken weiter verfeinert. Nachdem zuletzt einige überraschende Studienergebnisse (z.B. BII037), die allerdings nur rudimentär kommuniziert worden ist, noch einmal Hoffnung aufkeimen ließen, der Amyloid-Ansatz könne in frühesten Krankheitsstadien doch noch zu einem gewissen Erfolg führen (was für Gantenerumab ein großes Marktpotential bedeutet hätte), scheint die Sache nun geklärt zu sein. Der Neuroanatom Braak hatte recht.
Ich habe mir zwischenzeitlich die in der Dezemberausgabe der Zeitschrift Neurology veröffentlichten Bimagrumab-Studienergebnisse durchgelesen (Indikation "sporadic inclusion body myositis").
Die Ergebnisse sind etwas enttäuschend. Aufgrund der kleinen Studiengruppen weichen wesentliche Basisdaten der Verumgruppe von denjenigen der Basisgruppe deutlich ab (z.B. mittleres Gewicht 95,1 kg versus 79,0 kg), was die Interpretation zusätzlich erschwert.
In der Zusammenfassung der Arbeit werden einzelne Daten präsentiert, die für Bimagrumab-Gruppe günstiger aussehen. Man könnte aber auch umgekehrt argumentieren.
Z.B. 6-Minuten-Gehdistanz nach 24 Wochen versus Ausgangswert:
unter Bimagrumab 386,2 m versus 359,7 m (+7,4 %)
unter Placebo 339,9 m versus 312,2 m (+8,9 %).
Oder quantitativer Muskeltest (rechter Quadrizeps):
unter Bimagrumab 93,37 N versus 92,27 N (+1,2 %)
unter Placebo 69,37 N versus 66,75 N (+3,9 %),
nur um zwei Beispiele zu nennen.
Je nachdem, welche Meßdaten man sich herauspickt, kommt man zu unterschiedlichen Ergebnissen. Per Saldo führt die Studie meines Erachtens zu keinem klaren Ergebnis.
Die Ergebnisse sind etwas enttäuschend. Aufgrund der kleinen Studiengruppen weichen wesentliche Basisdaten der Verumgruppe von denjenigen der Basisgruppe deutlich ab (z.B. mittleres Gewicht 95,1 kg versus 79,0 kg), was die Interpretation zusätzlich erschwert.
In der Zusammenfassung der Arbeit werden einzelne Daten präsentiert, die für Bimagrumab-Gruppe günstiger aussehen. Man könnte aber auch umgekehrt argumentieren.
Z.B. 6-Minuten-Gehdistanz nach 24 Wochen versus Ausgangswert:
unter Bimagrumab 386,2 m versus 359,7 m (+7,4 %)
unter Placebo 339,9 m versus 312,2 m (+8,9 %).
Oder quantitativer Muskeltest (rechter Quadrizeps):
unter Bimagrumab 93,37 N versus 92,27 N (+1,2 %)
unter Placebo 69,37 N versus 66,75 N (+3,9 %),
nur um zwei Beispiele zu nennen.
Je nachdem, welche Meßdaten man sich herauspickt, kommt man zu unterschiedlichen Ergebnissen. Per Saldo führt die Studie meines Erachtens zu keinem klaren Ergebnis.
Antwort auf Beitrag Nr.: 48.714.035 von Joschka Schröder am 07.01.15 11:19:32vllt. stehe ich auf der Leitung.
Aber ich verstehe das so, dass unter Verabreichung von Bimagrumab doch sehr erhebliche Verbesserungen zu erkennen sind. Sowohl die im Test zurückgelegten Meter als auch die Muskelzunahme sind doch ziemlich hoch im Vergleich zum Placebo.
Oder verstehe ich da etwas falsch?
Aber ich verstehe das so, dass unter Verabreichung von Bimagrumab doch sehr erhebliche Verbesserungen zu erkennen sind. Sowohl die im Test zurückgelegten Meter als auch die Muskelzunahme sind doch ziemlich hoch im Vergleich zum Placebo.
Oder verstehe ich da etwas falsch?

Antwort auf Beitrag Nr.: 48.715.322 von milchbubi am 07.01.15 13:29:33Nein, nur die Ausgangswerte in der Bimagrumab-Gruppe waren deutlich besser und dies ist ausschließlich der Zusammenstellung der Kollektive geschuldet. Die prozentuale Verbesserung infolge der Therapie/Scheintherapie war in den von mir genannten Beipielen unter Placebo-"Therapie" besser.
Antwort auf Beitrag Nr.: 48.715.415 von Joschka Schröder am 07.01.15 13:38:26
das hat man ja gleich gesehen. Die Frage ist, ob es auch andere Beispiele gibt, wo Bimagrumab besser abschneidet.
Zitat von Joschka Schröder: Nein, nur die Ausgangswerte in der Bimagrumab-Gruppe waren deutlich besser und dies ist ausschließlich der Zusammenstellung der Kollektive geschuldet. Die prozentuale Verbesserung infolge der Therapie/Scheintherapie war in den von mir genannten Beipielen unter Placebo-"Therapie" besser.
das hat man ja gleich gesehen. Die Frage ist, ob es auch andere Beispiele gibt, wo Bimagrumab besser abschneidet.
wenn ich das richtig verstehe, gab es nur 3 Placebopatienten und nur 2 wurden über 16 Wochen verfolgt. Da sind die prozentualen Angaben bei Placebo schon etwas fragwürdig.
Den ganzen Artikel kann man nur kaufen, tja das ist mir doch etwas teuer da.
Abstract
Objective: To study activin signaling and its blockade in sporadic inclusion body myositis (sIBM) through translational studies and a randomized controlled trial.
Methods: We measured transforming growth factor β signaling by SMAD2/3 phosphorylation in muscle biopsies of 50 patients with neuromuscular disease (17 with sIBM). We tested inhibition of activin receptors IIA and IIB (ActRII) in 14 patients with sIBM using one dose of bimagrumab (n = 11) or placebo (n = 3). The primary outcome was the change in right thigh muscle volume by MRI at 8 weeks. Lean body mass, strength, and function were secondary outcomes. Twelve of the patients (10 bimagrumab, 2 placebo) participated in a subsequent 16-week observation phase.
Results: Muscle SMAD2/3 phosphorylation was higher in sIBM than in other muscle diseases studied (p = 0.003). Eight weeks after dosing, the bimagrumab-treated patients increased thigh muscle volume (right leg +6.5% compared with placebo, p = 0.024; left leg +7.6%, p = 0.009) and lean body mass (+5.7% compared with placebo, p = 0.014). Subsequently, bimagrumab-treated patients had improved 6-minute walking distance, which peaked at 16 weeks (+14.6%, p = 0.008) compared with placebo. There were no serious adverse events; the main adverse events with bimagrumab were mild acne and transient involuntary muscle contractions.
Conclusions: Transforming growth factor β superfamily signaling, at least through ActRII, is implicated in the pathophysiology of sIBM. Inhibition of ActRII increased muscle mass and function in this pilot trial, offering a potential novel treatment of sIBM.
Classification of evidence: This study provides Class I evidence that for patients with inclusion body myositis, bimagrumab increases thigh muscle volume at 8 weeks.
Den ganzen Artikel kann man nur kaufen, tja das ist mir doch etwas teuer da.
Abstract
Objective: To study activin signaling and its blockade in sporadic inclusion body myositis (sIBM) through translational studies and a randomized controlled trial.
Methods: We measured transforming growth factor β signaling by SMAD2/3 phosphorylation in muscle biopsies of 50 patients with neuromuscular disease (17 with sIBM). We tested inhibition of activin receptors IIA and IIB (ActRII) in 14 patients with sIBM using one dose of bimagrumab (n = 11) or placebo (n = 3). The primary outcome was the change in right thigh muscle volume by MRI at 8 weeks. Lean body mass, strength, and function were secondary outcomes. Twelve of the patients (10 bimagrumab, 2 placebo) participated in a subsequent 16-week observation phase.
Results: Muscle SMAD2/3 phosphorylation was higher in sIBM than in other muscle diseases studied (p = 0.003). Eight weeks after dosing, the bimagrumab-treated patients increased thigh muscle volume (right leg +6.5% compared with placebo, p = 0.024; left leg +7.6%, p = 0.009) and lean body mass (+5.7% compared with placebo, p = 0.014). Subsequently, bimagrumab-treated patients had improved 6-minute walking distance, which peaked at 16 weeks (+14.6%, p = 0.008) compared with placebo. There were no serious adverse events; the main adverse events with bimagrumab were mild acne and transient involuntary muscle contractions.
Conclusions: Transforming growth factor β superfamily signaling, at least through ActRII, is implicated in the pathophysiology of sIBM. Inhibition of ActRII increased muscle mass and function in this pilot trial, offering a potential novel treatment of sIBM.
Classification of evidence: This study provides Class I evidence that for patients with inclusion body myositis, bimagrumab increases thigh muscle volume at 8 weeks.
Antwort auf Beitrag Nr.: 48.715.928 von riverstar_de am 07.01.15 14:21:56Die ganze Studie und deren Ergebnisse sind fragwürdig. Mini-Patientenkollektive, Placebogruppe mit anderen Startwerten als Verumgruppe, Ergebnis je nach Untersuchungszeitpunkt mal in Verumgruppe, mal bei den Placebos besser. Wenn man nur das Abstract liest, könnte man meinen, Bimagrumab hätte überzeugende Ergebnisse geliefert. Nach Durchsicht aller Daten wird jedoch kein eindeutiger Effekt sichtbar. Insoweit bin ich von der Studie schon enttäuscht, zumal Bimagrumab ein wesentlicher Hoffnungsträger in der Pipeline ist (der zweite Hoffnungsträger BPS804 ist ja leider aus unbekanntem Grund gescheitert).
Antwort auf Beitrag Nr.: 48.717.476 von Joschka Schröder am 07.01.15 16:28:48das widerspricht sich dann aber dann doch ganz ordentlich mit der gewährten break-through-designation, die ja nur bei aussichtsreichen klinischen daten gewährt wird.
Antwort auf Beitrag Nr.: 48.714.035 von Joschka Schröder am 07.01.15 11:19:32Und übrig blieb am Ende nur einer....
.... Guselkumab ....
Guselkumab jetzt mit vierter Ph3-Studie!!!
(Hoffen wir nicht, dass es so kommt. Jedoch ist sowohl bei Gantenerumab als auch Bimagrumab noch nichts endgültig. Aber beide Programme sind in meinen Augen viel riskanter was Zulassungschancen betrifft.)
Guselkumab jetzt in vierter Ph3-Studie:
(VOYAGE1):
Estimated Enrollment: 750
https://clinicaltrials.gov/ct2/show?term=guselkumab&rank=3
(VOYAGE2):
Estimated Enrollment: 1000
https://clinicaltrials.gov/ct2/show?term=guselkumab&rank=2
(NAVIGATE):
Estimated Enrollment: 800
https://clinicaltrials.gov/ct2/show?term=guselkumab&rank=5
(Neu):
Estimated Enrollment: 180
https://clinicaltrials.gov/ct2/show?term=guselkumab&rank=6
Sowie in Ph2 in Psoriatic Arthritis (PsA):
Estimated Enrollment: 150
https://clinicaltrials.gov/ct2/show?term=guselkumab&rank=4
.... Guselkumab ....
Guselkumab jetzt mit vierter Ph3-Studie!!!
(Hoffen wir nicht, dass es so kommt. Jedoch ist sowohl bei Gantenerumab als auch Bimagrumab noch nichts endgültig. Aber beide Programme sind in meinen Augen viel riskanter was Zulassungschancen betrifft.)
Guselkumab jetzt in vierter Ph3-Studie:
(VOYAGE1):
Estimated Enrollment: 750
https://clinicaltrials.gov/ct2/show?term=guselkumab&rank=3
(VOYAGE2):
Estimated Enrollment: 1000
https://clinicaltrials.gov/ct2/show?term=guselkumab&rank=2
(NAVIGATE):
Estimated Enrollment: 800
https://clinicaltrials.gov/ct2/show?term=guselkumab&rank=5
(Neu):
Estimated Enrollment: 180
https://clinicaltrials.gov/ct2/show?term=guselkumab&rank=6
Sowie in Ph2 in Psoriatic Arthritis (PsA):
Estimated Enrollment: 150
https://clinicaltrials.gov/ct2/show?term=guselkumab&rank=4
Zitat von Joschka Schröder: Ich habe mir zwischenzeitlich die in der Dezemberausgabe der Zeitschrift Neurology veröffentlichten Bimagrumab-Studienergebnisse durchgelesen (Indikation "sporadic inclusion body myositis").
Die Ergebnisse sind etwas enttäuschend. Aufgrund der kleinen Studiengruppen weichen wesentliche Basisdaten der Verumgruppe von denjenigen der Basisgruppe deutlich ab (z.B. mittleres Gewicht 95,1 kg versus 79,0 kg), was die Interpretation zusätzlich erschwert.
In der Zusammenfassung der Arbeit werden einzelne Daten präsentiert, die für Bimagrumab-Gruppe günstiger aussehen. Man könnte aber auch umgekehrt argumentieren.
Z.B. 6-Minuten-Gehdistanz nach 24 Wochen versus Ausgangswert:
unter Bimagrumab 386,2 m versus 359,7 m (+7,4 %)
unter Placebo 339,9 m versus 312,2 m (+8,9 %).
Oder quantitativer Muskeltest (rechter Quadrizeps):
unter Bimagrumab 93,37 N versus 92,27 N (+1,2 %)
unter Placebo 69,37 N versus 66,75 N (+3,9 %),
nur um zwei Beispiele zu nennen.
Je nachdem, welche Meßdaten man sich herauspickt, kommt man zu unterschiedlichen Ergebnissen. Per Saldo führt die Studie meines Erachtens zu keinem klaren Ergebnis.
Antwort auf Beitrag Nr.: 48.720.074 von PathFinder2 am 07.01.15 20:14:02@PathFinder2
Vermutlich hat Novartis der FDA zusätzlich eine Menge anderer Daten vorgelegt, die wir nicht kennen.
@rollingovermilestones
Gantenerumab ist für mich gestorben, bei Bimagrumab darf man m.E. weiterhin zuversichtlich sein, obwohl besagte Studiendaten schon etwas enttäuschend waren. Da hatte ich eindeutigere Daten erwartet.
Vermutlich hat Novartis der FDA zusätzlich eine Menge anderer Daten vorgelegt, die wir nicht kennen.
@rollingovermilestones
Gantenerumab ist für mich gestorben, bei Bimagrumab darf man m.E. weiterhin zuversichtlich sein, obwohl besagte Studiendaten schon etwas enttäuschend waren. Da hatte ich eindeutigere Daten erwartet.
vielleicht bin ich ja etwas blöd, aber hier sind nur 17 Patienten mit SIBM in der Gruppe, in der gesamten Phase 3 Studie sollen 240 Patienten untersucht werden. Die Phase 3 Studie startete in September 2013. Ich glaube das müssen eigentlich zwei verschiedene Dinge sein über die wir hier sprechen. Ich glaube kaum, das man jetzt im Dezember 2014 etwas veröffentlicht und etwas schreibt wie " in this pilot trial, offering a potential novel treatment of sIBM.".
????
????
Antwort auf Beitrag Nr.: 48.721.784 von riverstar_de am 08.01.15 00:47:02Das von Dir zitierte Abstract in #327 und die Einschätzung von JS in #323 beziehen sich auf die Ergebnisse der P2-Studie mit BYM338 in sIBM, in die nur 14 Patienten eingeschlossen waren (11 behandelt, 3 Placebo). Von der P3 gibt es noch keinerlei Ergebnisse.
P2-Protokoll: https://clinicaltrials.gov/ct2/show/NCT01423110
P3-Protokoll: https://clinicaltrials.gov/ct2/show/NCT01925209
P2-Protokoll: https://clinicaltrials.gov/ct2/show/NCT01423110
P3-Protokoll: https://clinicaltrials.gov/ct2/show/NCT01925209
Antwort auf Beitrag Nr.: 48.721.811 von Saaletaler am 08.01.15 01:13:28
genau darauf wollte ich hinaus, das es eben keine Ergebnisse der Phase 3 sind. Haben die aber ganz schön lange gebraucht für die Veröffentlichung.
Zitat von Saaletaler: Das von Dir zitierte Abstract in #327 und die Einschätzung von JS in #323 beziehen sich auf die Ergebnisse der P2-Studie mit BYM338 in sIBM, in die nur 14 Patienten eingeschlossen waren (11 behandelt, 3 Placebo). Von der P3 gibt es noch keinerlei Ergebnisse.
P2-Protokoll: https://clinicaltrials.gov/ct2/show/NCT01423110
P3-Protokoll: https://clinicaltrials.gov/ct2/show/NCT01925209
genau darauf wollte ich hinaus, das es eben keine Ergebnisse der Phase 3 sind. Haben die aber ganz schön lange gebraucht für die Veröffentlichung.
Antwort auf Beitrag Nr.: 45.877.232 von Joschka Schröder am 20.11.13 12:31:20
Ich glaube, die Überlegungen aus dem vergangenen März waren so blöd nicht, obwohl sich die Blase noch weiter aufgepumpt hat.
Auf Genmab´s-ASH-Präsentation (präklinische Vergleichsuntersuchung Daratumumab versus MOR202, bei der MOR202 deutlich schlechter abgeschnitten hat), hatte ich an anderer Stelle hingewiesen.
Wie stellt sich die Situation jetzt dar?
Alle Morphosys-Hoffnungsträger sind bislang gescheitert:
Gantenerumab = wirkungslos
BPS804 = eingestellt
MOR103 = seit Jahren keine Aktivitäten mehr
MOR202 = Celgene aus dem Programm ausgestiegen ... bestimmt nicht, weil die klinischen Zwischenergebnisse so hervorragend sind. Die präklinischen Resultate von Genmab´s ASH-Vergleichspräsentation scheinen sich auch in der Klinik zu bewahrheiten: MOR202 dürfte Daratumumab unterlegen sein, ansonsten hätte Celgene die Koopertation nicht beendet.
Tja, was bleibt nun noch?
Zwei einlizensierte Programme, hinter denen kein Morphosys-know how steht (MOR208, MOR209) und die in einer Indikation unterwegs sind, in denen es hervorragende Konkurrenzentwicklungen gibt.
Guselkumab, das sich mit fortgeschrittene Parallelentwicklungen auseinandersetzen muss, die das gleiche Target ansteuern (z.B. tildrakizumab), außerdem mit den IL-17-Antgonisten wie Secukinumab, die aussichtsreicher sein dürften.
Der einzige echte Hoffnungsträger ist aus meiner Sicht Bimagrumab, das Morphosys´ Marktkapitalisierung jedoch nicht ansatzweise schultern kann (die bisherigen klinischen Studienergebnisse waren zudem weit weniger überzeugend als die Präklinik).
Morphosys´Kursentwicklung der vergangenen 17 Jahre ist ein Lehrbeispiel dafür, wie fundamentale Entwicklungen und Börsenkurse - in alle Richtungen - auseinandergleiten können, wenn Investoren ihr Investment fundamental nicht überblicken, was in der Biotech-Branche eigentlich der Normalfall ist. Ich bin gespannt, wie´s weitergeht.
Zitat von Joschka Schröder: Bis der derzeitigen Biotech-Blase ausreichend Luft entwichen ist, werde ich in diesem Thread bis auf Weiteres noch etwas kürzer treten, als dies auch so schon der Fall war.
Wieso ich die Bewertung der Biotech-Branche - inklusive Morphosys-Pipeline - in letzter Zeit zunehmend skeptisch gegenüberstehe, habe ich bereits an anderer Stelle begründet. Nachfolgend noch einmal eine Zusammenfassung:
In Analysten-Modellen werden gewöhnlich diversen Entwicklungspräparaten Peak Sales und Zulassungswahrscheinlichkeiten zugeordnet. Wenn man sich konkret Analystenschätzungen für verschiedene konkurrierende Entwicklungspräparate ansieht, fällt auf, dass die Summe der risikogewichteten Umsatzschätzungen das gesamte vorstellbare Marktpotential für die jeweiligen Krankheitsbilder mittlerweile weit übersteigt. Die Analystenschätzungen haben den Boden der Realität verlassen.
Morphosys ist in diesem Zusammenhang leider kein Ausnahmefall.
Ein kleines Beispiel: Edison schätzt für MOR208 Peak Sales in Höhe von 1,2 Mrd. USD bei einer Zulassungswahrscheinlichkeit von 30 %.
Schaut man sich ergänzend Analystenschätzungen für aussichtsreiche Konkurrenzpräparate an und berücksichtigt man evt. noch vielversprechende Entwicklungspräparate, die der Analystengemeinde offensichtlich unbekannt sind, so ergibt sich ein fiktives Marktvolumen, das mit der Realität nichts mehr zu tun hat. Falls sich jemand die Mühe machen möchte, dies für MOR208 zu überprüfen: Alleine gegen das Target CD19 werden derzeit eine Vielzahl von Medikamenten entwickelt, denen beeindruckende Peak Sales zugestanden werden (u.a. CLT019/CART19, Blinatumomab, SAR3419, Medi-551, SGN-CD19A, DI-B4, MDX1342).
Dazu kommen noch andere aussichtsreiche Präparate, die sich derzeit in der Präklinik befinden (u.a. von Intern. Drug Dev. Biotech und Glenmark), und – noch viel wichtiger – Therapieansätze, welche die gleichen Krankheitsbilder wie MOR208 über andere Targets ansteuern (Beispiele: Ibrutinib via BTK-Inhibition, ABT-199 via Bcl-2-Inhibition).
Dann gibt es noch eine Vielzahl bereits zu gelassenen Therapien (zuletzt Obinutuzumab), auf die ich an dieser Stelle aus Zeitgründen nicht näher eingehen kann.
Wenn man nun, wie Analysten dies tun, jedem dieser Medikamente mit vergleichsweise großer Erfolgswahrscheinlichkeit Peak Sales in Milliardenhöhe zugesteht, ergeben sich in Summe Phantasiebewertungen und eine Biotech-Blase.
In dieser Blase befinden wir uns gerade.
Auch Morphosys ist von dieser Entwicklung betroffen:
-> Zulassungswahrscheinlichkeit für MOR103 laut Deutscher Bank 49 % – natürlich gleich mit zwei Milliarden Peak Sales, obwohl gerade einmal eine rudimentäre Phase Ib-Studie abgeschlossen worden ist.
-> Gleich mal fast ein Viertel des MM-Marktes für MOR202, obwohl bislang keinerlei klinische Studienergebnisse vorliegen und es eine Vielzahl anderer aussichtsreicher Konkurrenzentwicklungen gibt.
Man könnte die Aufzählung fast beliebig fortsetzen.
Fazit: Von wenigen Ausnahmen abgesehen, sind Biotech-Unternehmen derzeit deutlich zu hoch bewertet, weil sich die Analystengemeinde Phantasiegebilde zurechtgezimmert hat.
Ich glaube, die Überlegungen aus dem vergangenen März waren so blöd nicht, obwohl sich die Blase noch weiter aufgepumpt hat.
Auf Genmab´s-ASH-Präsentation (präklinische Vergleichsuntersuchung Daratumumab versus MOR202, bei der MOR202 deutlich schlechter abgeschnitten hat), hatte ich an anderer Stelle hingewiesen.
Wie stellt sich die Situation jetzt dar?
Alle Morphosys-Hoffnungsträger sind bislang gescheitert:
Gantenerumab = wirkungslos
BPS804 = eingestellt
MOR103 = seit Jahren keine Aktivitäten mehr
MOR202 = Celgene aus dem Programm ausgestiegen ... bestimmt nicht, weil die klinischen Zwischenergebnisse so hervorragend sind. Die präklinischen Resultate von Genmab´s ASH-Vergleichspräsentation scheinen sich auch in der Klinik zu bewahrheiten: MOR202 dürfte Daratumumab unterlegen sein, ansonsten hätte Celgene die Koopertation nicht beendet.
Tja, was bleibt nun noch?
Zwei einlizensierte Programme, hinter denen kein Morphosys-know how steht (MOR208, MOR209) und die in einer Indikation unterwegs sind, in denen es hervorragende Konkurrenzentwicklungen gibt.
Guselkumab, das sich mit fortgeschrittene Parallelentwicklungen auseinandersetzen muss, die das gleiche Target ansteuern (z.B. tildrakizumab), außerdem mit den IL-17-Antgonisten wie Secukinumab, die aussichtsreicher sein dürften.
Der einzige echte Hoffnungsträger ist aus meiner Sicht Bimagrumab, das Morphosys´ Marktkapitalisierung jedoch nicht ansatzweise schultern kann (die bisherigen klinischen Studienergebnisse waren zudem weit weniger überzeugend als die Präklinik).
Morphosys´Kursentwicklung der vergangenen 17 Jahre ist ein Lehrbeispiel dafür, wie fundamentale Entwicklungen und Börsenkurse - in alle Richtungen - auseinandergleiten können, wenn Investoren ihr Investment fundamental nicht überblicken, was in der Biotech-Branche eigentlich der Normalfall ist. Ich bin gespannt, wie´s weitergeht.
Antwort auf Beitrag Nr.: 49.433.048 von Joschka Schröder am 26.03.15 18:13:19Wenn man nun, wie Analysten dies tun, jedem dieser Medikamente mit vergleichsweise großer Erfolgswahrscheinlichkeit Peak Sales in Milliardenhöhe zugesteht, ergeben sich in Summe Phantasiebewertungen und eine Biotech-Blase.
In der Summe schon, aber es geht wohl keiner davon aus dass es alles schaffen.
Wenn da von Zulassungswahrscheinlichkeiten von 30 - 40 - 50 % ausgegangen wird, dann kann man gleichzeitig davon ausgehen dass sie es zu 50 - 60 -70 % nicht schaffen. Bleibt also nur einer oder 2 übrig sehen die Bewertungen doch schon realistischer aus.
In der Summe schon, aber es geht wohl keiner davon aus dass es alles schaffen.
Wenn da von Zulassungswahrscheinlichkeiten von 30 - 40 - 50 % ausgegangen wird, dann kann man gleichzeitig davon ausgehen dass sie es zu 50 - 60 -70 % nicht schaffen. Bleibt also nur einer oder 2 übrig sehen die Bewertungen doch schon realistischer aus.
Antwort auf Beitrag Nr.: 49.434.137 von wohinistmeinGeld am 26.03.15 20:17:32Die Pipelines sind - anders als vor zehn Jahren - prall gefüllt, es werden - absolut gesehen - viel mehr Präparate auf den Markt kommen (gleichzeitg natürlich auch viel mehr Projekte scheitern). Diejenigen Präparate, die Marktreife erlangen, werden sich im Normalfall mit deutlich kleineren Marktanteilen begnügen müssen. Die Analystengilde berücksichtigt dies gewöhnlich in ihren Schätzungen nicht. Stattdessen werden die Wunschvorstellungen irgendwelcher Unternehmensführungen nachgeplappert.
Antwort auf Beitrag Nr.: 49.435.166 von Joschka Schröder am 26.03.15 22:37:04BAY 94-9343 ... Neues von der Konkurrenz -> http://www.fiercebiotech.com/story/novartis-new-car-t-hopefu…
Guselkumab ... ebenfalls Neuigkeiten von der Konkurrenz -> http://www.fiercebiotech.com/story/lillys-psoriatic-arthriti…
Guselkumab ... ebenfalls Neuigkeiten von der Konkurrenz -> http://www.fiercebiotech.com/story/lillys-psoriatic-arthriti…
Antwort auf Beitrag Nr.: 49.435.166 von Joschka Schröder am 26.03.15 22:37:04Betrifft mittelbar MOR208: MEDIMMUNE AND JUNO THERAPEUTICS ANNOUNCE IMMUNO-ONCOLOGY CLINICAL TRIAL COLLABORATION -> https://www.medimmune.com/media/press-releases/2015/04/23/me…
Auch für Genmab und Morphosys interessant (einiges in der Meldung dürfte allerdings nicht ganz stimmen, Sanofis anti-CD38-Mab SAR650984 befindet sich bereits in der klinischen Testung und um diesen Antikörper dürfte es letztlich gehen)->
Heidelberg, 4. Mai 2015 | Pressemitteilung 2015/55
Universitätsklinikum Heidelberg und Sanofi gründen Forschungsallianz gegen Knochenmarkkrebs
Neuer Wirkstoff soll erkrankte Immunzellen im Knochenmark blockieren / Sanofi fördert gemeinsame Forschung mit 1,4 Millionen Euro / Multiples Myelom und Amyloidose im Fokus
Wissenschaftler des Universitätsklinikums Heidelberg und des Gesundheitsunternehmens Sanofi erforschen ab sofort gemeinsam molekulare Grundlagen der Amyloidose, einer seltenen Erkrankung des Knochenmarks, und des Multiplen Myeloms, einer Krebserkrankung des Knochenmarks. Ziel ist es, die Erkenntnisse in die Entwicklung eines neuen, ergänzenden Therapieansatzes einzubringen. Sanofi fördert das nun gestartete Kooperationsprojekt am Universitätsklinikum zunächst zwei Jahre mit insgesamt 1,4 Millionen Euro. Beide Teams werden in dieser Zeit untersuchen, wie sich ein spezielles Oberflächenprotein von Knochenmarkzellen, das so genannte CD38, auf Krankheitsverlauf und Prognose auswirkt. Im Fokus der Forscher steht außerdem, ob sich CD38 als Angriffsziel für ein künstlich hergestelltes Protein eignet, einen so genannten Antikörper, der ausschließlich an CD38 bindet. Ziel ist es, dank der gebündelten Expertise beider Partner den neuen Wirkstoff möglichst schnell für klinische Studien mit Patienten vorzubereiten. Projektpartner am Universitätsklinikum ist die Abteilung Hämatologie, Onkologie und Rheumatologie unter der Leitung von Professor Dr. Anthony D. Ho, in Zusammenarbeit mit dem Pathologischen Institut (Direktor: Professor Dr. Peter Schirmacher).
Beim Multiplen Myelom, an dem jährlich in Deutschland rund 5.800 Menschen neu erkranken, sind bestimmte Immunzellen im Knochenmark, die Plasmazellen, krankhaft verändert. Sie vermehren sich übermäßig, verdrängen mit der Zeit das gesunde Knochenmark und verursachen Knochenschäden. Bei der so genannten Leichtketten-Amyloidose geben veränderte Plasmazellen fehlerhaft geformte Eiweiße, die sogenannten Leichtketten, ins Blut ab. Diese können sich in spezieller Form (genannt Amyloid) in verschiedenen Organen ablagern und dort schwere Schäden verursachen. Bisher gibt es keine Verfahren, abgelagertes Amyloid wieder aus den Organen zu lösen. Die Produktion und Ablagerung weiteren Amyloids muss daher möglichst schnell gestoppt werden.
Derzeit verfügbare Therapien bringen meist keine Heilung
"Die Therapien bei Multiplem Myelom und Leichtketten-Amyloidose zielen darauf ab, die veränderten Plasmazellen abzutöten. Je gründlicher das gelingt, desto länger können wir die Erkrankung zurückdrängen", erklärt Professor Ho. "Eine Heilung erreichen wir mit den derzeit verfügbaren Medikamenten und Chemotherapien aber meist nicht." Gemeinsam mit den Kooperationspartnern von Sanofi arbeiten die Heidelberger Myelom- und Amyloidose-Experten nun an einem Behandlungsansatz, der die gängigen Therapien unterstützen und verbessern kann.
Die Wissenschaftler von Sanofi haben einen Antikörper entwickelt, ein Protein, wie es in ähnlicher Form auch vom Immunsystem des Körpers zur Abwehr von Krankheitserregern gebildet wird. Der künstlich hergestellte Antikörper bindet ausschließlich an das Protein CD38, das Plasmazellen im Knochenmark auf ihrer Oberfläche tragen, und blockiert so wichtige Zugangswege zur Zelle. Zwar trifft er dabei theoretisch auch gesunde Plasmazellen. Da diese allerdings bei den Patienten fast vollständig verloren gegangen sind, werden die Patienten durch die neue Behandlung voraussichtlich nicht zusätzlich beeinträchtigt. Langzeiterfahrungen gibt es aber noch nicht.
"Sanofi hat sich seit jeher stark auf dem Gebiet der Onkologie engagiert. Wir freuen uns, dass wir gemeinsam mit dem Universitätsklinikum Heidelberg die translationale Medizin auf diesem speziellen Feld der Krebsforschung voranbringen werden", sagte Jochen Maas, Geschäftsführer Forschung & Entwicklung bei Sanofi Deutschland. "Unsere Partnerschaft zieht Nutzen aus der speziellen Expertise der jeweiligen Organisation. So können wir innovative Ansätze schneller entwickeln und Patienten früher davon profitieren."
Vor Einsatz am Patienten müssen offene Fragen geklärt werden
Ziel der Wissenschaftler ist es nun, CD38 und seine Wechselwirkung mit dem künstlichen Antikörper weiter zu erforschen. Wichtige Fragen sind dabei unter anderem: Kann CD38 Auskunft über den weiteren individuellen Verlauf der Erkrankung geben? Bleibt die Menge an CD38 auf der Zelle im Verlauf der Erkrankung konstant, um eine ausreichende Angriffsfläche für den Antikörper zu bieten? Lässt die Menge an CD38 auf der Oberfläche der Plasmazelle Rückschlüsse auf die genetischen Veränderungen im Zellkern zu? Welche anderen Zellen tragen noch CD38 an ihrer Oberfläche? Wie stark werden diese durch die Therapie geschädigt? Welche Nebenwirkungen gehen damit einher? "Wenn sich unsere Erwartungen an den Antikörper erfüllen, steht uns bald ein zusätzlicher Behandlungsbaustein zur Verfügung, mit dem wir die gängigen Therapien sehr gezielt und daher schonend ergänzen können", sagt Ho. Darüber hinaus sei dann auch ein Einsatz bei bestimmten Leukämieformen denkbar.
Heidelberg, 4. Mai 2015 | Pressemitteilung 2015/55
Universitätsklinikum Heidelberg und Sanofi gründen Forschungsallianz gegen Knochenmarkkrebs
Neuer Wirkstoff soll erkrankte Immunzellen im Knochenmark blockieren / Sanofi fördert gemeinsame Forschung mit 1,4 Millionen Euro / Multiples Myelom und Amyloidose im Fokus
Wissenschaftler des Universitätsklinikums Heidelberg und des Gesundheitsunternehmens Sanofi erforschen ab sofort gemeinsam molekulare Grundlagen der Amyloidose, einer seltenen Erkrankung des Knochenmarks, und des Multiplen Myeloms, einer Krebserkrankung des Knochenmarks. Ziel ist es, die Erkenntnisse in die Entwicklung eines neuen, ergänzenden Therapieansatzes einzubringen. Sanofi fördert das nun gestartete Kooperationsprojekt am Universitätsklinikum zunächst zwei Jahre mit insgesamt 1,4 Millionen Euro. Beide Teams werden in dieser Zeit untersuchen, wie sich ein spezielles Oberflächenprotein von Knochenmarkzellen, das so genannte CD38, auf Krankheitsverlauf und Prognose auswirkt. Im Fokus der Forscher steht außerdem, ob sich CD38 als Angriffsziel für ein künstlich hergestelltes Protein eignet, einen so genannten Antikörper, der ausschließlich an CD38 bindet. Ziel ist es, dank der gebündelten Expertise beider Partner den neuen Wirkstoff möglichst schnell für klinische Studien mit Patienten vorzubereiten. Projektpartner am Universitätsklinikum ist die Abteilung Hämatologie, Onkologie und Rheumatologie unter der Leitung von Professor Dr. Anthony D. Ho, in Zusammenarbeit mit dem Pathologischen Institut (Direktor: Professor Dr. Peter Schirmacher).
Beim Multiplen Myelom, an dem jährlich in Deutschland rund 5.800 Menschen neu erkranken, sind bestimmte Immunzellen im Knochenmark, die Plasmazellen, krankhaft verändert. Sie vermehren sich übermäßig, verdrängen mit der Zeit das gesunde Knochenmark und verursachen Knochenschäden. Bei der so genannten Leichtketten-Amyloidose geben veränderte Plasmazellen fehlerhaft geformte Eiweiße, die sogenannten Leichtketten, ins Blut ab. Diese können sich in spezieller Form (genannt Amyloid) in verschiedenen Organen ablagern und dort schwere Schäden verursachen. Bisher gibt es keine Verfahren, abgelagertes Amyloid wieder aus den Organen zu lösen. Die Produktion und Ablagerung weiteren Amyloids muss daher möglichst schnell gestoppt werden.
Derzeit verfügbare Therapien bringen meist keine Heilung
"Die Therapien bei Multiplem Myelom und Leichtketten-Amyloidose zielen darauf ab, die veränderten Plasmazellen abzutöten. Je gründlicher das gelingt, desto länger können wir die Erkrankung zurückdrängen", erklärt Professor Ho. "Eine Heilung erreichen wir mit den derzeit verfügbaren Medikamenten und Chemotherapien aber meist nicht." Gemeinsam mit den Kooperationspartnern von Sanofi arbeiten die Heidelberger Myelom- und Amyloidose-Experten nun an einem Behandlungsansatz, der die gängigen Therapien unterstützen und verbessern kann.
Die Wissenschaftler von Sanofi haben einen Antikörper entwickelt, ein Protein, wie es in ähnlicher Form auch vom Immunsystem des Körpers zur Abwehr von Krankheitserregern gebildet wird. Der künstlich hergestellte Antikörper bindet ausschließlich an das Protein CD38, das Plasmazellen im Knochenmark auf ihrer Oberfläche tragen, und blockiert so wichtige Zugangswege zur Zelle. Zwar trifft er dabei theoretisch auch gesunde Plasmazellen. Da diese allerdings bei den Patienten fast vollständig verloren gegangen sind, werden die Patienten durch die neue Behandlung voraussichtlich nicht zusätzlich beeinträchtigt. Langzeiterfahrungen gibt es aber noch nicht.
"Sanofi hat sich seit jeher stark auf dem Gebiet der Onkologie engagiert. Wir freuen uns, dass wir gemeinsam mit dem Universitätsklinikum Heidelberg die translationale Medizin auf diesem speziellen Feld der Krebsforschung voranbringen werden", sagte Jochen Maas, Geschäftsführer Forschung & Entwicklung bei Sanofi Deutschland. "Unsere Partnerschaft zieht Nutzen aus der speziellen Expertise der jeweiligen Organisation. So können wir innovative Ansätze schneller entwickeln und Patienten früher davon profitieren."
Vor Einsatz am Patienten müssen offene Fragen geklärt werden
Ziel der Wissenschaftler ist es nun, CD38 und seine Wechselwirkung mit dem künstlichen Antikörper weiter zu erforschen. Wichtige Fragen sind dabei unter anderem: Kann CD38 Auskunft über den weiteren individuellen Verlauf der Erkrankung geben? Bleibt die Menge an CD38 auf der Zelle im Verlauf der Erkrankung konstant, um eine ausreichende Angriffsfläche für den Antikörper zu bieten? Lässt die Menge an CD38 auf der Oberfläche der Plasmazelle Rückschlüsse auf die genetischen Veränderungen im Zellkern zu? Welche anderen Zellen tragen noch CD38 an ihrer Oberfläche? Wie stark werden diese durch die Therapie geschädigt? Welche Nebenwirkungen gehen damit einher? "Wenn sich unsere Erwartungen an den Antikörper erfüllen, steht uns bald ein zusätzlicher Behandlungsbaustein zur Verfügung, mit dem wir die gängigen Therapien sehr gezielt und daher schonend ergänzen können", sagt Ho. Darüber hinaus sei dann auch ein Einsatz bei bestimmten Leukämieformen denkbar.
Hallo Joschka Schröder,
was hälst du von
"MorphoSys übernimmt Peptid-Therapeutika-Unternehmen Lanthio Pharma "?
was hälst du von
"MorphoSys übernimmt Peptid-Therapeutika-Unternehmen Lanthio Pharma "?
Antwort auf Beitrag Nr.: 49.738.722 von eck64 am 08.05.15 10:19:36Dazu kann ich leider nichts Konstruktives sagen. Mit Lanthio´s Technologie habe ich mich noch nicht beschäftigt.
ASCO-Abstracts-Schnelldursicht:
Zu MOR202 finden sich keine Wirkungsdaten, wird es wohl erst vor Ort geben.
LJM716: Das sieht nicht gut aus, unschöne Nebenwirkungen, zu allem Übel darüber hinaus bislang sehr dürftige Wirkung -> http://abstracts.asco.org/156/AbstView_156_145702.html
Zu MOR202 finden sich keine Wirkungsdaten, wird es wohl erst vor Ort geben.
LJM716: Das sieht nicht gut aus, unschöne Nebenwirkungen, zu allem Übel darüber hinaus bislang sehr dürftige Wirkung -> http://abstracts.asco.org/156/AbstView_156_145702.html
MOR208 (ASCO-Abstract):
Indikation DLBCL mit Wirkungsdaten (ORR 26 %), die denjenigen anderer Präparate unterlegen sind (Adcetris bei CD30+ 44 %, SAR3419 44 %, IMGN529 bereits in der Dosisfindung 40 %) usw. Positiv hingegen die mDoR (7,7 Monate).
Insgesamt dürften die ASCO-Abstracts bei nüchterner Betrachtung den Morphosys-Kurs kaum beflügeln.
Indikation DLBCL mit Wirkungsdaten (ORR 26 %), die denjenigen anderer Präparate unterlegen sind (Adcetris bei CD30+ 44 %, SAR3419 44 %, IMGN529 bereits in der Dosisfindung 40 %) usw. Positiv hingegen die mDoR (7,7 Monate).
Insgesamt dürften die ASCO-Abstracts bei nüchterner Betrachtung den Morphosys-Kurs kaum beflügeln.
Antwort auf Beitrag Nr.: 49.776.048 von Joschka Schröder am 14.05.15 00:18:35Wenig erfreulich bei MOR208 die vielen Nebenwirkungen der Grade 3 und mehr ("Grade ≥ 3 non-hematologic and hematologic treatment-emergent adverse events were recorded in 30/89 (34%) and 8/89 (9%) pts").
Noch zu MOR202: Erwähnenswert, weil ungewöhnlich, ist auch, dass ein Patient offensichtlich Antikörper gegen MOR202 gebildet hat, obwohl MOR202 ein humaner therapeutischer Antikörper ist.
Ich bin nun gespannt auf die Wirkungsdaten, die während der Postersession präsentiert werden sollen.
Insgesamt erkenne ich in den ASCO-Abstracts, was die Morphosys-Pipeline betrifft, wenig inspirierendes.
Ich bin nun gespannt auf die Wirkungsdaten, die während der Postersession präsentiert werden sollen.
Insgesamt erkenne ich in den ASCO-Abstracts, was die Morphosys-Pipeline betrifft, wenig inspirierendes.
Antwort auf Beitrag Nr.: 49.776.777 von Joschka Schröder am 14.05.15 09:15:37
wenn ich das richtig gelesen habe, aber nur vorübergehend.
Zitat von Joschka Schröder: Noch zu MOR202: Erwähnenswert, weil ungewöhnlich, ist auch, dass ein Patient offensichtlich Antikörper gegen MOR202 gebildet hat, obwohl MOR202 ein humaner therapeutischer Antikörper ist.
Ich bin nun gespannt auf die Wirkungsdaten, die während der Postersession präsentiert werden sollen.
Insgesamt erkenne ich in den ASCO-Abstracts, was die Morphosys-Pipeline betrifft, wenig inspirierendes.
wenn ich das richtig gelesen habe, aber nur vorübergehend.
Antwort auf Beitrag Nr.: 49.777.275 von riverstar_de am 14.05.15 10:14:39Ja, da muss man mal nachfragen. "Vorübergehende" Antikörperbildung gegen MOR202 wäre noch ungewöhnlicher.
Ich gehe gerade die Kursziele durch und entdeckte dabei das:
17.03.2015
Goldman senkt Ziel für Morphosys auf 75 Euro - 'Neutral'
NEW YORK (dpa-AFX Analyser) - Die US-Investmentbank Goldman Sachs hat das Kursziel für Morphosys von 76 auf 75 Euro gesenkt und die Einstufung auf "Neutral" belassen. Analyst Steve Chesney passte seine Bewertungsmodell in einer Studie vom Dienstag an die Ergebnisse des vierten Quartals an. Er geht beim Antikörper-Spezialisten nun von stärker abschmelzenden Barmitteln aus und rechnet bis 2016 mit höheren Forschungs- und Entwicklungskosten./ag/tav
Kann es denn echt sein dass die Forschungskosten bis 2016 steigen?
LG
17.03.2015
Goldman senkt Ziel für Morphosys auf 75 Euro - 'Neutral'
NEW YORK (dpa-AFX Analyser) - Die US-Investmentbank Goldman Sachs hat das Kursziel für Morphosys von 76 auf 75 Euro gesenkt und die Einstufung auf "Neutral" belassen. Analyst Steve Chesney passte seine Bewertungsmodell in einer Studie vom Dienstag an die Ergebnisse des vierten Quartals an. Er geht beim Antikörper-Spezialisten nun von stärker abschmelzenden Barmitteln aus und rechnet bis 2016 mit höheren Forschungs- und Entwicklungskosten./ag/tav
Kann es denn echt sein dass die Forschungskosten bis 2016 steigen?
LG
Antwort auf Beitrag Nr.: 49.780.563 von monstercat am 14.05.15 20:02:28Die F/E-Kosten müssten allein schon wg.MOR202 und Lanthio-Projekten steigen.
Das bedeutet natürlich sowohl Risiko als auch Chance
Das bedeutet natürlich sowohl Risiko als auch Chance
Antwort auf Beitrag Nr.: 49.776.048 von Joschka Schröder am 14.05.15 00:18:35
Vielleicht ist man ja unterlegen, aber 26 % ORR sind doch nicht Zoo schlecht, wenn ich mir gerade angucke, wie z. B. die Daten von IMMU-132 bewertet werden (dort ORR 26-32 % je nach Indikation). Also schaun mer mal. Vielleicht kann man ja doch etwas vom Kuchen abbekommen.
Zitat von Joschka Schröder: MOR208 (ASCO-Abstract):
Indikation DLBCL mit Wirkungsdaten (ORR 26 %), die denjenigen anderer Präparate unterlegen sind (Adcetris bei CD30+ 44 %, SAR3419 44 %, IMGN529 bereits in der Dosisfindung 40 %) usw. Positiv hingegen die mDoR (7,7 Monate).
Insgesamt dürften die ASCO-Abstracts bei nüchterner Betrachtung den Morphosys-Kurs kaum beflügeln.
Vielleicht ist man ja unterlegen, aber 26 % ORR sind doch nicht Zoo schlecht, wenn ich mir gerade angucke, wie z. B. die Daten von IMMU-132 bewertet werden (dort ORR 26-32 % je nach Indikation). Also schaun mer mal. Vielleicht kann man ja doch etwas vom Kuchen abbekommen.
Antwort auf Beitrag Nr.: 49.790.991 von riverstar_de am 16.05.15 20:05:12
Du vergleichst da Äpfel mit Birnen. IMMU-132 adressiert ganz andere Tumorarten.
Zielführend kann nur der Vergleich mit Konkurrenzpräparaten sein, die in denselben Indikationen eingesetzt werden (sollen) wie MOR208.
Zitat von riverstar_de:Zitat von Joschka Schröder: MOR208 (ASCO-Abstract):
Indikation DLBCL mit Wirkungsdaten (ORR 26 %), die denjenigen anderer Präparate unterlegen sind (Adcetris bei CD30+ 44 %, SAR3419 44 %, IMGN529 bereits in der Dosisfindung 40 %) usw. Positiv hingegen die mDoR (7,7 Monate).
Insgesamt dürften die ASCO-Abstracts bei nüchterner Betrachtung den Morphosys-Kurs kaum beflügeln.
Vielleicht ist man ja unterlegen, aber 26 % ORR sind doch nicht Zoo schlecht, wenn ich mir gerade angucke, wie z. B. die Daten von IMMU-132 bewertet werden (dort ORR 26-32 % je nach Indikation). Also schaun mer mal. Vielleicht kann man ja doch etwas vom Kuchen abbekommen.
Du vergleichst da Äpfel mit Birnen. IMMU-132 adressiert ganz andere Tumorarten.
Zielführend kann nur der Vergleich mit Konkurrenzpräparaten sein, die in denselben Indikationen eingesetzt werden (sollen) wie MOR208.
Antwort auf Beitrag Nr.: 49.791.021 von Joschka Schröder am 16.05.15 20:11:24
das ich Äpfel mit Birnen verglichen habe, war mir klar, dennoch ist es eben nicht klar, wie schlecht 26 % ORR nun wirklich sind
Zitat von Joschka Schröder:Zitat von riverstar_de: ...
Vielleicht ist man ja unterlegen, aber 26 % ORR sind doch nicht Zoo schlecht, wenn ich mir gerade angucke, wie z. B. die Daten von IMMU-132 bewertet werden (dort ORR 26-32 % je nach Indikation). Also schaun mer mal. Vielleicht kann man ja doch etwas vom Kuchen abbekommen.
Du vergleichst da Äpfel mit Birnen. IMMU-132 adressiert ganz andere Tumorarten.
Zielführend kann nur der Vergleich mit Konkurrenzpräparaten sein, die in denselben Indikationen eingesetzt werden (sollen) wie MOR208.
das ich Äpfel mit Birnen verglichen habe, war mir klar, dennoch ist es eben nicht klar, wie schlecht 26 % ORR nun wirklich sind
Antwort auf Beitrag Nr.: 49.791.021 von Joschka Schröder am 16.05.15 20:11:24
Entschuldigung, aber Du vergleichst ebenfalls Äpfel mit Birnen! Du beziehst dich zwar auf Produkte, die die gleichen Tumorarten adressieren (IMGN592), vergisst aber, dass bei der Studie auch der fortgeschrittene Krankheitsverlauf eine entscheidende Rolle spielt.
Moroney hat auf der HV betont, dass die behandelten Patienten ausnahmslos austherapiert waren!!! Sie hatten (soweit ich mich erinnere) mindestens 3 Vorbehandlungen, die nicht mehr wirkten und galten als nicht mehr behandelbar.
Allein die Einschlusskriterien bei den beiden Studien sind so unterschiedlich wie Tag und Nacht...
Zur besseren Einsicht habe ich die Kriterien aus clinicaltrials herauskopiert. Da kann sich jeder selbst ein Bild machen. Allein der ECOG Status spricht Bände, das Kriterium "Recovered or stabilized from prior Treatments" ebenfalls.
Hier die Kriterien von IMGN529

Und nun die Kriterien von MOR208 - ein kleiner Horrorkatalog...

Zitat von Joschka Schröder: Du vergleichst da Äpfel mit Birnen. IMMU-132 adressiert ganz andere Tumorarten.
Zielführend kann nur der Vergleich mit Konkurrenzpräparaten sein, die in denselben Indikationen eingesetzt werden (sollen) wie MOR208.
Entschuldigung, aber Du vergleichst ebenfalls Äpfel mit Birnen! Du beziehst dich zwar auf Produkte, die die gleichen Tumorarten adressieren (IMGN592), vergisst aber, dass bei der Studie auch der fortgeschrittene Krankheitsverlauf eine entscheidende Rolle spielt.
Moroney hat auf der HV betont, dass die behandelten Patienten ausnahmslos austherapiert waren!!! Sie hatten (soweit ich mich erinnere) mindestens 3 Vorbehandlungen, die nicht mehr wirkten und galten als nicht mehr behandelbar.
Allein die Einschlusskriterien bei den beiden Studien sind so unterschiedlich wie Tag und Nacht...
Zur besseren Einsicht habe ich die Kriterien aus clinicaltrials herauskopiert. Da kann sich jeder selbst ein Bild machen. Allein der ECOG Status spricht Bände, das Kriterium "Recovered or stabilized from prior Treatments" ebenfalls.
Hier die Kriterien von IMGN529

Und nun die Kriterien von MOR208 - ein kleiner Horrorkatalog...

Antwort auf Beitrag Nr.: 49.794.702 von Milestones am 17.05.15 22:55:49Wenn man nun bei ca. einem Viertel dieser todgeweihten Patienten noch ein Ansprechen der Therapie erreicht, ist das meiner Ansicht nach nicht schlecht. Schau'n wir mal, was die Konkurrenz bei derart zerstörten Körpern zu leisten im Stande ist, sprich wenn z.B. die Organfunktionen nicht mehr adäquat sind...
Ich muss Milestones da zustimmen. Da man nichts anderes hat, ist es natürlich irgendwie nachvollziehbar, dass man Ergebnisse unterschiedlicher Studien vergleicht und anhand dessen versucht, Erfolgsaussichten abzuschätzen. Man muss sich aber bewusst sein - und sollte auch den medizinischen Laien bzw. denjenigen der im Umgang mit Statistik ungeübt ist darauf aufmerksam machen - dass man sich damit auf einem Niveau befindet, das kaum über Kaffeesatzlesen hinausgeht. Einfach irgendwelche Prozentzahlen aus Studien mit zum Teil völlig unterschiedlichen Patientenkollektiven zu vergleichen, ist aus wissenschaftlicher Sicht natürlich vollkommen unhaltbar. Jeder Statistiker würde einem das um die Ohren hauen, selbst wenn die Kollektive ähnlich sind. Denn sie sind in unterschiedlichen Studien nie gleich, und es spielen einfach viele Variablen mit. Noch dazu reden wir meist über sehr kleine Patientenzahlen. Insofern frage ich mich schon manchmal, was eigentlich der Zweck solcher Einschätzungen ist und wer damit (des)informiert werden soll.
Antwort auf Beitrag Nr.: 49.794.702 von Milestones am 17.05.15 22:55:491. Die Patienten waren in sämtlichen Studien, die mit den von mir genannten Präparaten durchgeführt worden sind, weitgehend austherapiert.
2. Natürlich ist eine unmittelbare (!) Vergleichbarkeit nicht gegeben. Dies bedeutet aber nicht, dass sich Studienergebnisse nicht mit der/m gebotenen Sorgfalt/Vorbehalt vergleichen ließen.
3. Der von Dir gewählte Vergleich von Ergebnisdaten von Päparaten, die in völlig unterschiedlichen Indikationen eingesetzt werden, ist und bleibt hingegen völliger Nonsens.
2. Natürlich ist eine unmittelbare (!) Vergleichbarkeit nicht gegeben. Dies bedeutet aber nicht, dass sich Studienergebnisse nicht mit der/m gebotenen Sorgfalt/Vorbehalt vergleichen ließen.
3. Der von Dir gewählte Vergleich von Ergebnisdaten von Päparaten, die in völlig unterschiedlichen Indikationen eingesetzt werden, ist und bleibt hingegen völliger Nonsens.
Antwort auf Beitrag Nr.: 49.794.747 von deadflowers am 17.05.15 23:17:44
Derartige Unverschämtheiten solltest Du Dir künftig besser verkneifen.
Zitat von deadflowers: Insofern frage ich mich schon manchmal, was eigentlich der Zweck solcher Einschätzungen ist und wer damit (des)informiert werden soll.
Derartige Unverschämtheiten solltest Du Dir künftig besser verkneifen.
Antwort auf Beitrag Nr.: 49.794.900 von Joschka Schröder am 18.05.15 01:02:03
Das wäre mir neu... Ich habe keinerlei derartige Vergleiche angestellt!
Und ich bleibe bei meiner Meinung, dass die Einschlusskriterien bei der MOR 208 Studie deutlich ungünstiger waren.
Zitat von Joschka Schröder: 3. Der von Dir gewählte Vergleich von Ergebnisdaten von Päparaten, die in völlig unterschiedlichen Indikationen eingesetzt werden, ist und bleibt hingegen völliger Nonsens.
Das wäre mir neu... Ich habe keinerlei derartige Vergleiche angestellt!
Und ich bleibe bei meiner Meinung, dass die Einschlusskriterien bei der MOR 208 Studie deutlich ungünstiger waren.
Antwort auf Beitrag Nr.: 49.794.906 von Joschka Schröder am 18.05.15 01:06:23Vorerst letzter Beitrag von mir zum Thema: Ich hab mich glaube ich lange genug mit klinischen Studien und medizinischer Statistik beschäftigt, dass ich mich von solchen Posts wie (49.776.048) nicht in irgendwelchen Kaufentscheidungen beeeinflussen lasse. Bei anderen Lesern bin ich mir da nicht so sicher. Wenn man in der Materie drin ist, lernt man relativ schnell, wie limitiert der Aussagewert vieler, v.a. kleiner Studien ist, und dass es oft wirklich auf Details ankommt, um sie richtig zu bewerten. Man lernt auch, wie die Pharmaindustrie arbeitet, und wie hier manipuliert wird (nämlich nicht durch irgendeine plumnpe Ergebnisfälschung, sondern durch die Interpretation der Ergebnisse). Man bastelt einen schönen mehrfarbigen Prospekt, lässt "Experten" zu Wort gekommen (die natürlich auf der eigenen Gehaltsliste stehen, sowas ist ja in Deutschland explizit erlaubt!) und stellt die Ergebnisse im für sich günstigen Licht dar. Das funktioniert erstaunlich gut. Ich staune einfach immer wieder aufs Neue, mit welch hellseherischen Fähigkeiten hier weitreichende Schlüsse aus Abstracts (!) von Studien mit einer handvoll Patienten gezogen werden, in denen noch dazu Wirksamkeit meist gar nicht der primäre Endpunkt ist. Insofern finde ich die Frage legitim und keineswegs unverschämt, ob da nicht auch Interessen dahinter stecken könnten. Wenn dem nicht so ist, umso besser, ich möchte es ausdrücklich niemandem unterstellen.
Antwort auf Beitrag Nr.: 49.795.056 von Milestones am 18.05.15 07:16:50
Stimmt, das warst nicht Du, sondern riverstar in Beitrag 351 ("Vielleicht ist man ja unterlegen, aber 26 % ORR sind doch nicht Zoo schlecht, wenn ich mir gerade angucke, wie z. B. die Daten von IMMU-132 bewertet werden (dort ORR 26-32 % je nach Indikation). Also schaun mer mal. Vielleicht kann man ja doch etwas vom Kuchen abbekommen.")
Tatsache ist, dass entscheidendes Aufnahmekriterium, was die Ausprägung der Erkrankung betrifft, in der MOR208-Studie ein Performance Status gemäß Eastern Cooperative Oncology Group (EOCG) kleiner 3 war. In der IMGN-Studie ist ein EOCG kleiner oder gleich 2 vorgegeben. Worin liegt der Unterschied?
In der MOR208-Studienbeschreibung finden sich zwar zahlreiche Zusatzangaben, dies bedeutet aber nicht, dass sich die Patientenkollektive dadurch nennenswert unterscheiden. Lies Dir einfach die entsprechenden Kongresspublikationen durch.
Zitat von Milestones:Zitat von Joschka Schröder: 3. Der von Dir gewählte Vergleich von Ergebnisdaten von Päparaten, die in völlig unterschiedlichen Indikationen eingesetzt werden, ist und bleibt hingegen völliger Nonsens.
Das wäre mir neu... Ich habe keinerlei derartige Vergleiche angestellt!
Stimmt, das warst nicht Du, sondern riverstar in Beitrag 351 ("Vielleicht ist man ja unterlegen, aber 26 % ORR sind doch nicht Zoo schlecht, wenn ich mir gerade angucke, wie z. B. die Daten von IMMU-132 bewertet werden (dort ORR 26-32 % je nach Indikation). Also schaun mer mal. Vielleicht kann man ja doch etwas vom Kuchen abbekommen.")
Zitat von Milestones: Und ich bleibe bei meiner Meinung, dass die Einschlusskriterien bei der MOR 208 Studie deutlich ungünstiger waren.
Tatsache ist, dass entscheidendes Aufnahmekriterium, was die Ausprägung der Erkrankung betrifft, in der MOR208-Studie ein Performance Status gemäß Eastern Cooperative Oncology Group (EOCG) kleiner 3 war. In der IMGN-Studie ist ein EOCG kleiner oder gleich 2 vorgegeben. Worin liegt der Unterschied?
In der MOR208-Studienbeschreibung finden sich zwar zahlreiche Zusatzangaben, dies bedeutet aber nicht, dass sich die Patientenkollektive dadurch nennenswert unterscheiden. Lies Dir einfach die entsprechenden Kongresspublikationen durch.
Antwort auf Beitrag Nr.: 49.795.602 von deadflowers am 18.05.15 08:55:56
ich wollte sicher keinen zum Kauf bewegen - ich habe quasi nur mal laut gedacht und zum Glück einiges an Feedback bekommen.
Zitat von deadflowers: Vorerst letzter Beitrag von mir zum Thema: Ich hab mich glaube ich lange genug mit klinischen Studien und medizinischer Statistik beschäftigt, dass ich mich von solchen Posts wie (49.776.048) nicht in irgendwelchen Kaufentscheidungen beeeinflussen lasse. Bei anderen Lesern bin ich mir da nicht so sicher. Wenn man in der Materie drin ist, lernt man relativ schnell, wie limitiert der Aussagewert vieler, v.a. kleiner Studien ist, und dass es oft wirklich auf Details ankommt, um sie richtig zu bewerten. Man lernt auch, wie die Pharmaindustrie arbeitet, und wie hier manipuliert wird (nämlich nicht durch irgendeine plumnpe Ergebnisfälschung, sondern durch die Interpretation der Ergebnisse). Man bastelt einen schönen mehrfarbigen Prospekt, lässt "Experten" zu Wort gekommen (die natürlich auf der eigenen Gehaltsliste stehen, sowas ist ja in Deutschland explizit erlaubt!) und stellt die Ergebnisse im für sich günstigen Licht dar. Das funktioniert erstaunlich gut. Ich staune einfach immer wieder aufs Neue, mit welch hellseherischen Fähigkeiten hier weitreichende Schlüsse aus Abstracts (!) von Studien mit einer handvoll Patienten gezogen werden, in denen noch dazu Wirksamkeit meist gar nicht der primäre Endpunkt ist. Insofern finde ich die Frage legitim und keineswegs unverschämt, ob da nicht auch Interessen dahinter stecken könnten. Wenn dem nicht so ist, umso besser, ich möchte es ausdrücklich niemandem unterstellen.
ich wollte sicher keinen zum Kauf bewegen - ich habe quasi nur mal laut gedacht und zum Glück einiges an Feedback bekommen.
Ich schliesse mich den Meinung von Milestones an. Ich habe selbst meine Skepsis geäußert bezüglich MOR208 im ASCO Abstract. Dabei, aheb ich nicht wirklich im Detail geachtet welche Patienten Gruppe Therapiert wurde. das war ein klarer Fehler von mir. Es stimmt schon, wann Mann Menchen behandelt die praktisch im endstadium sind kriteren ganz anders erwartungen von Primärtumor therapie. Wann es bei 25 % leben für ein Jahr oder mehr verlängert ist das nicht wenig. So gesehen sieht MOR208 erstmal ganz gut aus.
Ind dem sinne kann Mann theoretisch gleichen Typ von Preparaten rein Theoretisch vergleichen selbst wenn die verschiedene Tumoren ansprechen. Mann vergleicht nicht biologie und Mechanismum sondern einfach Patient outcome.
Ind dem sinne kann Mann theoretisch gleichen Typ von Preparaten rein Theoretisch vergleichen selbst wenn die verschiedene Tumoren ansprechen. Mann vergleicht nicht biologie und Mechanismum sondern einfach Patient outcome.
Unterschied ist in der gruppe 2,1 bis 2,9... Und wann das die Mehrheit gewesen ist dann ist das schon ziemlich unterschiedlich. Unter anderem ich sehe das ECOG performance status sehr wage ist und kann vieles bedeuten deswegen sind genaue angaben über vergangenen Therapien sehr wichtig.
http://www.npcrc.org/files/news/ECOG_performance_status.pdf
http://www.npcrc.org/files/news/ECOG_performance_status.pdf
Antwort auf Beitrag Nr.: 49.795.602 von deadflowers am 18.05.15 08:55:56Dass in der Pharmabranche oft nicht ganz sauber gearbeitet wird, ist unbestritten. Ebenso unbestritten ist, dass Quervergleiche zwischen unterschiedlichen Studien immer mit einer gewissen Vorsicht zu genießen sind. Dennoch sind derartige Quervergleiche insbesondere in der Onkologie notwendig und werden entsprechend auch von Zulassungsbehörden und Organisationen wie der FDA durchgeführt.
Eine orientierender Quervergleich zwischen Präparaten, die dieselbe Indikation adressieren und an ähnlichen Patientenkollektiven durchgeführt worden sind, machen somit sehr wohl Sinn.
Deine Unterstellungen der gezielten Desinformation (und Manipulation) in Beitrag 356 sind inakzeptabel und empörend. Auch wenn Deine Richtigstellung in Beitrag 360 einiges relativiert hat, habe ich jedenfalls keine Lust mehr, Informationen zu Morphosys-Präparaten, die ich mit einigem Zeitwand nach bestem Wissen und Gewissen zusammengestellt habe und die ich für nützlich halte, mit anderen Usern zu teilen. Das Morphosys-Publikum behagt mir nicht. Obwohl es doch eigentlich Sinn des Forums sein sollte, Dinge in Frage zu stellen und kritisch zu diskutieren, sind derartige Beiträge hier offensichtlich nicht erwünscht. Diesem Wunsch werde ich künftig gerne nachkommen. Spart eine Menge Zeit.
Eine orientierender Quervergleich zwischen Präparaten, die dieselbe Indikation adressieren und an ähnlichen Patientenkollektiven durchgeführt worden sind, machen somit sehr wohl Sinn.
Deine Unterstellungen der gezielten Desinformation (und Manipulation) in Beitrag 356 sind inakzeptabel und empörend. Auch wenn Deine Richtigstellung in Beitrag 360 einiges relativiert hat, habe ich jedenfalls keine Lust mehr, Informationen zu Morphosys-Präparaten, die ich mit einigem Zeitwand nach bestem Wissen und Gewissen zusammengestellt habe und die ich für nützlich halte, mit anderen Usern zu teilen. Das Morphosys-Publikum behagt mir nicht. Obwohl es doch eigentlich Sinn des Forums sein sollte, Dinge in Frage zu stellen und kritisch zu diskutieren, sind derartige Beiträge hier offensichtlich nicht erwünscht. Diesem Wunsch werde ich künftig gerne nachkommen. Spart eine Menge Zeit.
Antwort auf Beitrag Nr.: 49.797.516 von Joschka Schröder am 18.05.15 12:42:55
Ah Joschka bitte nicht... Ich schreibe zwar erst seit kurzem, lese ich aber schon länger und natürlich dient forum kritischen auseinandersetzungen. Und wan die Meinungen unterschiedlich sind ist das auch gut. Immerhin weisst keiner von uns wie es weiter geht, und alles ist Bewertungsache.
Ich wurde Verschwörungtheorien garnicht komentieren. aber ich finde schon das es gerade wichtig sind das Leute die Fachliches wissen haben deren input geben so wie die es sehen. Ich hoffe jetzt beleidige ich nicht die andere gruppe von "laien". Aber ich finde grade dieses forum prima weil es anderes ist als typische Analysten " es geht hoch , es geht runter geqatche."
bitte bitte weiter posten. Ich bin mir sicher das viele andere users auch so sehen
Ah Joschka bitte nicht... Ich schreibe zwar erst seit kurzem, lese ich aber schon länger und natürlich dient forum kritischen auseinandersetzungen. Und wan die Meinungen unterschiedlich sind ist das auch gut. Immerhin weisst keiner von uns wie es weiter geht, und alles ist Bewertungsache.
Ich wurde Verschwörungtheorien garnicht komentieren. aber ich finde schon das es gerade wichtig sind das Leute die Fachliches wissen haben deren input geben so wie die es sehen. Ich hoffe jetzt beleidige ich nicht die andere gruppe von "laien". Aber ich finde grade dieses forum prima weil es anderes ist als typische Analysten " es geht hoch , es geht runter geqatche."
bitte bitte weiter posten. Ich bin mir sicher das viele andere users auch so sehen

Antwort auf Beitrag Nr.: 49.797.252 von Maslacak am 18.05.15 12:10:54
Das ist natürlich Quatsch. Es gibt keine halben oder zehntel Punkte beim ECOG-Status, das Einschlusskriterium kleiner/gleich 2 oder kleiner 3 ist identisch.
Zitat von Maslacak: Unterschied ist in der gruppe 2,1 bis 2,9... Und wann das die Mehrheit gewesen ist dann ist das schon ziemlich unterschiedlich. Unter anderem ich sehe das ECOG performance status sehr wage ist und kann vieles bedeuten deswegen sind genaue angaben über vergangenen Therapien sehr wichtig.
http://www.npcrc.org/files/news/ECOG_performance_status.pdf
Das ist natürlich Quatsch. Es gibt keine halben oder zehntel Punkte beim ECOG-Status, das Einschlusskriterium kleiner/gleich 2 oder kleiner 3 ist identisch.
Antwort auf Beitrag Nr.: 49.797.516 von Joschka Schröder am 18.05.15 12:42:55
Wenn du meine beiden Posts mal in Ruhe liest, wirst du feststellen, dass ich dir das nicht unterstellt habe. Wenn das so angekommen ist, möchte ich klarstellen, dass das so nicht gemeint war. Ich hab nur meine Verwunderung über m.E. vorschnelle Urteile mit der definitiv fehlenden notwendigen Relativierung zum Ausdruck gebracht. Die Motive dafür sind mir nicht bekannt, vielleicht ist es einfach eine unterschiedliche Herangehensweise.
Dass die FDA Quervergleich anstellt, mag schon sein. Klar ist aber auch, dass die Zulassungsbehörden wahre Datenberge fordern, das geht zum Teil in die hundertausenden Seiten. Da urteilt sicher niemand auf der Basis eines dreizeiligen Abstracts. Der Punkt ist doch einfach: Studienergebnisse können selbst bei identischen Einschlusskriterien unterscheidlich ausfallen, da gibt es genügend Beispiele. Dass es schon bei der Rekrutierung zum ersten Selektionsbias kommt ist doch nicht zu bestreiten. Die daraus häufig resultierende geringe externe Validität von RCTs wird ja oft genug kritisiert. Man müsste sich schon die Mühe machen, die tatsächlichen Patientenkollektive im Detail zu vergleichen. Und das ist nur der erste Bias.
Zitat von Joschka Schröder: Deine Unterstellungen der gezielten Desinformation (und Manipulation) in Beitrag 356 sind inakzeptabel und empörend.
Wenn du meine beiden Posts mal in Ruhe liest, wirst du feststellen, dass ich dir das nicht unterstellt habe. Wenn das so angekommen ist, möchte ich klarstellen, dass das so nicht gemeint war. Ich hab nur meine Verwunderung über m.E. vorschnelle Urteile mit der definitiv fehlenden notwendigen Relativierung zum Ausdruck gebracht. Die Motive dafür sind mir nicht bekannt, vielleicht ist es einfach eine unterschiedliche Herangehensweise.
Zitat von Joschka Schröder: Dennoch sind derartige Quervergleiche insbesondere in der Onkologie notwendig und werden entsprechend auch von Zulassungsbehörden und Organisationen wie der FDA durchgeführt.
Eine orientierender Quervergleich zwischen Präparaten, die dieselbe Indikation adressieren und an ähnlichen Patientenkollektiven durchgeführt worden sind, machen somit sehr wohl Sinn.
Dass die FDA Quervergleich anstellt, mag schon sein. Klar ist aber auch, dass die Zulassungsbehörden wahre Datenberge fordern, das geht zum Teil in die hundertausenden Seiten. Da urteilt sicher niemand auf der Basis eines dreizeiligen Abstracts. Der Punkt ist doch einfach: Studienergebnisse können selbst bei identischen Einschlusskriterien unterscheidlich ausfallen, da gibt es genügend Beispiele. Dass es schon bei der Rekrutierung zum ersten Selektionsbias kommt ist doch nicht zu bestreiten. Die daraus häufig resultierende geringe externe Validität von RCTs wird ja oft genug kritisiert. Man müsste sich schon die Mühe machen, die tatsächlichen Patientenkollektive im Detail zu vergleichen. Und das ist nur der erste Bias.
Antwort auf Beitrag Nr.: 49.798.269 von deadflowers am 18.05.15 14:32:04Nun gut dann nicht Dann wurde ich als Naturwissenschaftlerin sagen ECOG bietet keine besonderes gute klassifikation. Ich meine wirklich:
Dann wurde ich als Naturwissenschaftlerin sagen ECOG bietet keine besonderes gute klassifikation. Ich meine wirklich:
2) Ambulatory and capable of all selfcare but unable to carry out any work
activities. Up and about more than 50% of waking hours
3)Capable of only limited selfcare, confined to bed or chair more than 50% of
waking hours
da ist so viel Raum zu Interpretationen mir fehlen die Worte. Ich weiss die mussen irgendwie vorgehen, aber wir kommen züruck zum gleichen Schluss: wichtig sind genaue Daten und Patient history. Um gruppe zu Beschreiben.
 Dann wurde ich als Naturwissenschaftlerin sagen ECOG bietet keine besonderes gute klassifikation. Ich meine wirklich:
Dann wurde ich als Naturwissenschaftlerin sagen ECOG bietet keine besonderes gute klassifikation. Ich meine wirklich:2) Ambulatory and capable of all selfcare but unable to carry out any work
activities. Up and about more than 50% of waking hours
3)Capable of only limited selfcare, confined to bed or chair more than 50% of
waking hours
da ist so viel Raum zu Interpretationen mir fehlen die Worte. Ich weiss die mussen irgendwie vorgehen, aber wir kommen züruck zum gleichen Schluss: wichtig sind genaue Daten und Patient history. Um gruppe zu Beschreiben.
Hi Leue,
Hab mal eine Frage: Laut meinen Infos endet die Phase III bei Bimagrumab heuer im Dezember. Novartis möchte Anfang 2016 die Zulassung beantragen. Wie lange dauert so eine Zulassung im normalen Verfahren, wie lange im abgekürzten Verfahren normalerweise? Und: Kann Novartis für Bimagrumab ein abgekürztes Verfahren (mit Aussicht auf Erfolg) beantragen?
Hab mal eine Frage: Laut meinen Infos endet die Phase III bei Bimagrumab heuer im Dezember. Novartis möchte Anfang 2016 die Zulassung beantragen. Wie lange dauert so eine Zulassung im normalen Verfahren, wie lange im abgekürzten Verfahren normalerweise? Und: Kann Novartis für Bimagrumab ein abgekürztes Verfahren (mit Aussicht auf Erfolg) beantragen?
"...I had my 8th infusion of the experimental drug BYM338 on Monday this week. ...
...It seems I’m doing ok, my hands and arms are definitely stronger. Pre-trial I could barely lift the TV remote control but I’ve progressed to curling a 1.5kg weight with my right arm and 1kg with my left...."
https://guineapigstale.wordpress.com/
...It seems I’m doing ok, my hands and arms are definitely stronger. Pre-trial I could barely lift the TV remote control but I’ve progressed to curling a 1.5kg weight with my right arm and 1kg with my left...."
https://guineapigstale.wordpress.com/
Antwort auf Beitrag Nr.: 49.797.516 von Joschka Schröder am 18.05.15 12:42:55Joschka deine kritischen Anmerkungen und sehr gut fundierten Beiträge sind überhaupt erst der Grund warum ich und viele andere diesen Thread überhaupt lesen. Ich bin selbst nicht mehr in MOR investiert und verfolge die Aktie nur aus der Ferne. Es wäre aber sehr schade, wenn wir keine Beiträge mehr von dir lesen würden. Ohne jetzt zu schleimen, aber solche gerade kritischen Beiträge machen doch erst WO aus.
Antwort auf Beitrag Nr.: 49.842.523 von RichyBerlin am 25.05.15 11:57:33Finde ich für mich sehr informativ. Ich habe mich immer schon gefragt, was es mit den Vergleichen des Gehtempos bzw. der zurückgelegten Distanz auf sich hat.
Der Artikel ist ja sehr aktuell. Es scheint für mich so, dass Novartis selbst eigentlich schon sicher davon ausgeht, dass in naher Zukunft (wie schon oft zu lesen war Ende 2015/Anfang 2016) die Zulassung beantragt wird. Ich gehe dann auch davon aus, dass es tatsächlich zur Zulassung kommt. Das freut mich für Morphosys und natürlich für alle Aktionäre, die schon so lange auf die erste Zulassung warten.
Der Artikel ist ja sehr aktuell. Es scheint für mich so, dass Novartis selbst eigentlich schon sicher davon ausgeht, dass in naher Zukunft (wie schon oft zu lesen war Ende 2015/Anfang 2016) die Zulassung beantragt wird. Ich gehe dann auch davon aus, dass es tatsächlich zur Zulassung kommt. Das freut mich für Morphosys und natürlich für alle Aktionäre, die schon so lange auf die erste Zulassung warten.
LBBW erhöht Kursziel für Morphosys von €70 auf €75 - "Kaufen"
(09:06) - Echtzeitrating/Jandaya
(09:06) - Echtzeitrating/Jandaya
Generelle (In-)Fragestellungen von IL-17 / IL-23 ?
Amgen's decision to hand back rights to brodalumab to AstraZeneca (AZ) on safety grounds has raised a question mark over the entire IL-17 inhibitor class.
http://www.pmlive.com/pharma_news/amgen_decision_on_brodalum…
nature:
http://www.nature.com/nrd/journal/v14/n1/fig_tab/nrd4518_T1.…
il-17 und il-23
http://www.rheumatologynetwork.com/psoriatic-arthritis/inter…
Amgen's decision to hand back rights to brodalumab to AstraZeneca (AZ) on safety grounds has raised a question mark over the entire IL-17 inhibitor class.
http://www.pmlive.com/pharma_news/amgen_decision_on_brodalum…
nature:
http://www.nature.com/nrd/journal/v14/n1/fig_tab/nrd4518_T1.…
il-17 und il-23
http://www.rheumatologynetwork.com/psoriatic-arthritis/inter…
Antwort auf Beitrag Nr.: 49.847.860 von RichyBerlin am 26.05.15 12:02:45Dazu ist ergänzend zu bemerken, dass Boehringer Ingelheim die klinische Studie mit seinem viel gepriesenen humanen anti-IL23p19-Antikörper BI655066 (steuert dasselbe Target an wie Guselkumab) für männliche Teilnehmer geschlossen hat. Es gab Nebenwirkungen im Fertilitätsbereich.
Mich wundert schon die ganze Zeit, dass der MOR-Kurs so stabil ist. Vermutlich hat der Kapitalmarkt die jüngsten Entwicklungen überhaupt nicht registriert.
Mich wundert schon die ganze Zeit, dass der MOR-Kurs so stabil ist. Vermutlich hat der Kapitalmarkt die jüngsten Entwicklungen überhaupt nicht registriert.
Antwort auf Beitrag Nr.: 49.847.860 von RichyBerlin am 26.05.15 12:02:45Die Angaben in der Nature-Übersicht sind teilweise nicht exakt: BI65066 ist nicht humanisiert, sondern (wie Guselkumab) voll human.
Antwort auf Beitrag Nr.: 49.848.055 von Joschka Schröder am 26.05.15 12:32:28
Für Guselkumab dürfte dies deutlich relevanter sein als es die brodalumab-Probleme sind. Die unter brodalumab beobachteten Nebenwirkungen dürften mit einiger Wahrscheinlichkeit nicht auf andere Mab´s der IL-17-Schiene (inkl. IL-23) übertragbar sein.
Zitat von Joschka Schröder: Dazu ist ergänzend zu bemerken, dass Boehringer Ingelheim die klinische Studie mit seinem viel gepriesenen humanen anti-IL23p19-Antikörper BI655066 (steuert dasselbe Target an wie Guselkumab) für männliche Teilnehmer geschlossen hat. Es gab Nebenwirkungen im Fertilitätsbereich.
Für Guselkumab dürfte dies deutlich relevanter sein als es die brodalumab-Probleme sind. Die unter brodalumab beobachteten Nebenwirkungen dürften mit einiger Wahrscheinlichkeit nicht auf andere Mab´s der IL-17-Schiene (inkl. IL-23) übertragbar sein.
Antwort auf Beitrag Nr.: 49.848.328 von Joschka Schröder am 26.05.15 13:06:30
Auf Seite 21 in dem Unternehmensbericht 2014 von Boehringer Ingelheim
http://www.boehringer-ingelheim.com/content/dam/internet/opu…
...
Die in der Entwicklung am weitesten fortgeschrittene Verbindung von Boehringer Ingelheim, die Substanz BI 655066, ist ein humanisierter Antikörper, der die IL-23-Signalkaskade blockiert. Folglich verhindert sie die Bindung und Signalweiterleitung über den IL-23-Rezeptor.
...
Zitat von Joschka Schröder: Die Angaben in der Nature-Übersicht sind teilweise nicht exakt: BI65066 ist nicht humanisiert, sondern (wie Guselkumab) voll human.
Auf Seite 21 in dem Unternehmensbericht 2014 von Boehringer Ingelheim
http://www.boehringer-ingelheim.com/content/dam/internet/opu…
...
Die in der Entwicklung am weitesten fortgeschrittene Verbindung von Boehringer Ingelheim, die Substanz BI 655066, ist ein humanisierter Antikörper, der die IL-23-Signalkaskade blockiert. Folglich verhindert sie die Bindung und Signalweiterleitung über den IL-23-Rezeptor.
...
Antwort auf Beitrag Nr.: 49.848.712 von -weitblick- am 26.05.15 14:12:46Aus der Originalpublikation in The Journal of Allergy and Clinical Immunology:
BI 655066 is a fully human IgG1 mAb specific for the IL-23 p19 subunit.
http://www.jacionline.org/article/S0091-6749%2815%2900108-6/…
Ich glaube eher wissenschaftlichen Originalpublikationen als Geschäftsberichten. Die widersprüchliche Darstellung ist aber zweifellos sehr ärgerlich. Muss mal im Patent nachschauen, was nun wirklich stimmt.
BI 655066 is a fully human IgG1 mAb specific for the IL-23 p19 subunit.
http://www.jacionline.org/article/S0091-6749%2815%2900108-6/…
Ich glaube eher wissenschaftlichen Originalpublikationen als Geschäftsberichten. Die widersprüchliche Darstellung ist aber zweifellos sehr ärgerlich. Muss mal im Patent nachschauen, was nun wirklich stimmt.
Antwort auf Beitrag Nr.: 49.847.860 von RichyBerlin am 26.05.15 12:02:45Meine Überschrift war wohl falsch. In Frage gestellt wird im Artikel eigentlich doch nur IL-17 !?  und z.B.Guselkumab als andere Option genannt
und z.B.Guselkumab als andere Option genannt
"..However, with several new antibodies coming through the pipeline for psoriasis and other inflammatory disorders, clinicians may be tempted to choose another option over an IL-17-targeting drug. Celgene's new oral therapy Otezla (apremilast) is one candidate, along with J&J's Stelara follow-up guselkumab and anti-IL-23 antibodies from Merck & Co/Sun Pharma and J&J/Morphosys.."
Deshalb können Joschkas Beiträge natürlich trotzdem zutreffen. Danke dafür!
Boehringer scheint noch ganz guter Dinge zu sein;
http://www.boehringer-ingelheim.com/news/news_releases/press…
 und z.B.Guselkumab als andere Option genannt
und z.B.Guselkumab als andere Option genannt"..However, with several new antibodies coming through the pipeline for psoriasis and other inflammatory disorders, clinicians may be tempted to choose another option over an IL-17-targeting drug. Celgene's new oral therapy Otezla (apremilast) is one candidate, along with J&J's Stelara follow-up guselkumab and anti-IL-23 antibodies from Merck & Co/Sun Pharma and J&J/Morphosys.."
Deshalb können Joschkas Beiträge natürlich trotzdem zutreffen. Danke dafür!
Boehringer scheint noch ganz guter Dinge zu sein;
http://www.boehringer-ingelheim.com/news/news_releases/press…
Antwort auf Beitrag Nr.: 49.848.865 von Joschka Schröder am 26.05.15 14:33:31Das Patent WO 2013165791 A1 könnte dafür sprechen, dass BI655066 tatsächlich humanisiert ist. Dann wären die Angaben in der zitierten Originalpublikation falsch ... hmmm, so etwas begegnet einem selten.
@RichyBerlin
Boehringer hat diesbezüglich auch in den ClinicalTrials (noch) nichts geändert. Ich weiß aber, dass in die aktuelle BI655066-Studie bis auf Weiteres keine männlichen Probanden mehr eingeschlossen werden.
@RichyBerlin
Boehringer hat diesbezüglich auch in den ClinicalTrials (noch) nichts geändert. Ich weiß aber, dass in die aktuelle BI655066-Studie bis auf Weiteres keine männlichen Probanden mehr eingeschlossen werden.
Antwort auf Beitrag Nr.: 49.849.111 von Joschka Schröder am 26.05.15 15:05:35Hier auch noch einmal aus dem EU Clinical Trials Register:
https://www.clinicaltrialsregister.eu/ctr-search/trial/2013-…
...
https://www.clinicaltrialsregister.eu/ctr-search/trial/2013-…
...
D.3.11.13.1 Other medicinal product type humanized IgG monoclonal antibody...
Antwort auf Beitrag Nr.: 49.848.055 von Joschka Schröder am 26.05.15 12:32:28
Weißt du (oder jemand anderes) eine Quelle, wo man Details dazu nachlesen kann? Ich höre ehrlich gesagt zum ersten Mal davon. Eine PM von BI gibt es dazu nicht, die rekrutierenden Studien auf Clinical Trials haben alle Männer dabei (last updated May 22).
https://clinicaltrials.gov/ct2/show/NCT02203851?term=BI+6550…
https://clinicaltrials.gov/ct2/show/NCT02031276?term=BI+6550…
Zitat von Joschka Schröder: Dazu ist ergänzend zu bemerken, dass Boehringer Ingelheim die klinische Studie mit seinem viel gepriesenen humanen anti-IL23p19-Antikörper BI655066 (steuert dasselbe Target an wie Guselkumab) für männliche Teilnehmer geschlossen hat. Es gab Nebenwirkungen im Fertilitätsbereich.
Weißt du (oder jemand anderes) eine Quelle, wo man Details dazu nachlesen kann? Ich höre ehrlich gesagt zum ersten Mal davon. Eine PM von BI gibt es dazu nicht, die rekrutierenden Studien auf Clinical Trials haben alle Männer dabei (last updated May 22).
https://clinicaltrials.gov/ct2/show/NCT02203851?term=BI+6550…
https://clinicaltrials.gov/ct2/show/NCT02031276?term=BI+6550…
Antwort auf Beitrag Nr.: 49.852.072 von deadflowers am 26.05.15 20:33:05Eine offizielle Publikation dazu ist mir leider nicht bekannt.
Hier ein neuer Beitrag zum Thema in dem nochmal genauer auf die Nebenwirkungen dieser IL-17-Medikation eingegangen wird (Selbsttötungsgedanken, Depressionen, Angstzustände).
Konkurrenzentwicklungen werden nicht in die Berichterstattung eingeschlossen, sondern als bislang vielversprechend hervorgehoben.
"..AstraZeneca would face some stiff competition if it decides to move forward solo on the drug. Novartis is already well in front with its IL-17 program for secukinumab, approved in January as Cosentyx. Eli Lilly ($LLY) has also been racking up positive late-stage studies for its IL-17-blocking ixekizumab, trailed by Merck's ($MRK) MK-3222 and Johnson & Johnson's ($JNJ) IL-23 inhibitor guselkumab.."
http://www.fiercebiotech.com/story/suicide-stunner-prompts-a…
Konkurrenzentwicklungen werden nicht in die Berichterstattung eingeschlossen, sondern als bislang vielversprechend hervorgehoben.
"..AstraZeneca would face some stiff competition if it decides to move forward solo on the drug. Novartis is already well in front with its IL-17 program for secukinumab, approved in January as Cosentyx. Eli Lilly ($LLY) has also been racking up positive late-stage studies for its IL-17-blocking ixekizumab, trailed by Merck's ($MRK) MK-3222 and Johnson & Johnson's ($JNJ) IL-23 inhibitor guselkumab.."
http://www.fiercebiotech.com/story/suicide-stunner-prompts-a…
Die studien über anti Il-17 Antikörpern sind zwar interessant aber haben mit Guselkumab wirklich garnichts zu tun. Ist zwar selbe indikation, aber wann Antikörpern zwei unterschiedliche Proteinen treffen, auswirkung ist ganz klar unterschiedlich.
Ich finde selbst beim gleichen Target können zwei Antikörper unterschiedlich sein. Protein ist zwar der Selbe, aber Epitop ( genuae stelle wo Antikörper bindet) ist Anders, deswegen sind so genanten "offside effects" oft andere. Und dennn gibt es immer, egal wie Spezifisch ein Antikörper ist. dazu kommen auch finessen: was ist eigentlich im detail das mechanismus (IL23 bindet nicht mehr an rezeptor- garnicht/ ein wenig/ unterbestimmten bedienungen etc). die daten gibt es vermutlich in preklinischen studien, aber es ist die Frage ob eigentlichen experimenten für verschiedenen Wirkstoffen wirklich unter selben experimentalen bedienungen gemacht wurden. Oft ist das nicht der Fall...
bis jetzt finde ich Guselkumab in der Klinik ganz ok. Es gab wann ich mich nicht irre ein Problämatischen fall von Herzinfarkt aber es wurde als "zufall" kategoriesiert. Ich hoffe alles läuft gut in Phase III.
Ich finde selbst beim gleichen Target können zwei Antikörper unterschiedlich sein. Protein ist zwar der Selbe, aber Epitop ( genuae stelle wo Antikörper bindet) ist Anders, deswegen sind so genanten "offside effects" oft andere. Und dennn gibt es immer, egal wie Spezifisch ein Antikörper ist. dazu kommen auch finessen: was ist eigentlich im detail das mechanismus (IL23 bindet nicht mehr an rezeptor- garnicht/ ein wenig/ unterbestimmten bedienungen etc). die daten gibt es vermutlich in preklinischen studien, aber es ist die Frage ob eigentlichen experimenten für verschiedenen Wirkstoffen wirklich unter selben experimentalen bedienungen gemacht wurden. Oft ist das nicht der Fall...
bis jetzt finde ich Guselkumab in der Klinik ganz ok. Es gab wann ich mich nicht irre ein Problämatischen fall von Herzinfarkt aber es wurde als "zufall" kategoriesiert. Ich hoffe alles läuft gut in Phase III.
Die MOR202-Wirksamkeitsdaten haben die Erwartungen deutlich verfehlt.
Wenn man sich vor Augen hält, dass das Patientenkollektiv zudem vergleichsweise schwach vorbehandelt war, kann man die Wirksamkeitsdaten nur als extrem schlecht bezeichnen. Was zeigt die unmittelbare Konkurrenz? Z.B. anti-CD38-Mab SAR650984 Monotherapie an Patienten, die im Mittel 6,5 Therapien hinter sich haben, also fast austherapiert sind: Im Gesamtkollektiv, also auch minimale Dosierung umfassend (MTD noch nicht erreicht), mit 10 % CR, 17 % PR und 7 % MR. MOR202 hingegen nur einmal VGRP, und das noch in einer DEX-Kombigruppe. Es ist ein Rätsel, wieso Morphosys MOR202 nicht verschrottet. Die Celgene-Entscheidung, aus dem MOR202-Projekt auszusteigen, ist jetzt gut verständlich. Die vorliegenden Daten sprechen eine eindeutige Sprache.
Wenn man sich vor Augen hält, dass das Patientenkollektiv zudem vergleichsweise schwach vorbehandelt war, kann man die Wirksamkeitsdaten nur als extrem schlecht bezeichnen. Was zeigt die unmittelbare Konkurrenz? Z.B. anti-CD38-Mab SAR650984 Monotherapie an Patienten, die im Mittel 6,5 Therapien hinter sich haben, also fast austherapiert sind: Im Gesamtkollektiv, also auch minimale Dosierung umfassend (MTD noch nicht erreicht), mit 10 % CR, 17 % PR und 7 % MR. MOR202 hingegen nur einmal VGRP, und das noch in einer DEX-Kombigruppe. Es ist ein Rätsel, wieso Morphosys MOR202 nicht verschrottet. Die Celgene-Entscheidung, aus dem MOR202-Projekt auszusteigen, ist jetzt gut verständlich. Die vorliegenden Daten sprechen eine eindeutige Sprache.
Tut mir leid aber ich lese und interpretiere das als Laie total anders. Da vertraue ich mehr den Leuten von Morphosys.
@Maslacak. Du bist doch auch vom Fach und Praktiker. Wie schätzt Du das ganze ein?
Die MorphoSys AG (Frankfurt: MOR; Prime Standard Segment, TecDAX; OTC: MPSYY) veröffentlichte heute vorläufige Daten zu Sicherheit und Wirksamkeit ihres firmeneigenen Wirkstoffkandidaten MOR202. Die Daten stammen aus einer klinischen Studie der Phase 1/2a in 42 intensiv vorbehandelten Patienten mit rezidiviertem/refraktärem multiplem Myelom. Bei MOR202 handelt es sich um einen vollständig menschlichen monoklonalen HuCAL-Antikörper gegen CD38, ein stark exprimiertes und validiertes Zielmolekül im multiplen Myelom. Die vorläufigen klinischen Daten, die heute auf der Jahrestagung 2015 der American Society of Clinical Oncology (ASCO) vorgestellt wurden, zeigen, dass MOR202 sicher und gut verträglich war. Als 2-stündige Infusion wies der Wirkstoff hinsichtlich der Infusionsverträglichkeit das beste Profil seiner Wirkstoffklasse auf: die Infusionsreaktionen bei Patienten, die MOR202 ohne Dexamethason erhielten, waren überwiegend leicht bis moderat und beschränkten sich zumeist auf die erste Infusion. Bei Patienten, die MOR202 in Kombination mit Dexamethason erhielten, wurden gar keine Infusionsreaktionen beobachtet. MOR202 zeigte vielversprechende erste Anzeichen klinischer Aktivität und bereits bei geringer Dosierung konnte bei einigen Patienten eine langanhaltende Tumorkontrolle beobachtet werden.
Die laufende unverblindete, multizentrische Phase 1/2a-Studie mit ansteigender Dosierung wird in mehreren Studienzentren in Deutschland und Österreich durchgeführt. Die Studie untersucht die Sicherheit und erste Hinweise auf Wirksamkeit von MOR202 als Monotherapie und in Kombination mit Pomalidomid und Lenalidomid plus Dexamethason in Patienten mit rezidiviertem/refraktärem multiplem Myelom. Primäre Endpunkte der Studie sind die Sicherheit und Verträglichkeit sowie die Bestimmung der empfohlenen Dosis von MOR202 als Einzelwirkstoff und in Kombination mit Immunmodulatoren (IMiDs). Als weitere Zielvorgaben werden die Pharmakokinetik und vorläufige Ergebnisse zur Wirksamkeit untersucht, basierend auf der Gesamtansprechrate, der Ansprechdauer und der progressionsfreien Überlebenszeit.
Die auf der heutigen ASCO-Jahrestagung präsentierten Daten zeigen, dass MOR202 sicher und gut verträglich war, und als 2-stündige Infusion verabreicht werden konnte. Infusionsbedingte Reaktionen traten bei 13 Patienten (37 %) auf, die MOR202 ohne Dexamethason erhielten, und beschränkten sich überwiegend auf die erste Infusion. Alle Infusionsreaktionen waren leicht oder mäßig (Grad 1/2), bis auf einen Patienten mit Grad 3. Bei Patienten, die zusätzlich Dexamethason erhielten, traten keinerlei Infusionsreaktionen auf. Die maximal verträgliche Dosis (MTD) wurde nicht erreicht. Das bislang beste Ansprechverhalten, ein sehr gutes teilweises Ansprechen (VGPR), wurde in der Kohorte erzielt, die MOR202 als wöchentliche 4,0 mg/kg-Dosis plus Dexamethason erhielt. Darüber hinaus wurde aus anderen Dosierungsgruppen, beginnend mit einer geringen Dosierung von zweiwöchentlich 1,5 mg/kg, ein Fall von minimalem Ansprechen (MR) berichtet und zehn Fälle, in denen sich die Krankheit stabilisierte (SD). Die vorläufigen pharmakokinetischen Daten deuten darauf hin, dass eine vollständige Sättigung des Zielmoleküls bei einer wöchentlichen Dosierung von 16 mg/kg erreicht werden könnte.
Die Studie wird derzeit fortgeführt und höhere Dosen von MOR202 in Kombination mit Dexamethason untersucht. Weitere Kohorten, in denen die Patienten MOR202 bis zu einer wöchentlichen Dosis von 16 mg/kg in Kombination mit den immunmodulatorischen Wirkstoffen Pomalidomid und Lenalidomid plus Dexamethason erhalten werden, starten in Kürze.
"MOR202 hat eine klinische Aktivität gezeigt, die bereits sehr vielversprechend ist. Das Sicherheits- und Verträglichkeitsprofil von MOR202 eröffnet für unseren Wirkstoff eindeutig die Möglichkeit, sich von anderen derzeit in der Entwicklung befindlichen Anti-CD38-Therapien abzuheben, insbesondere im Hinblick auf die Infusionsreaktionen", kommentierte Dr. Arndt Schottelius, Entwicklungsvorstand der MorphoSys AG. "Wir sind sehr zufrieden mit diesen ersten Eindrücken des klinischen Potenzials von MOR202. Die Daten werden im Verlauf der kommenden Monate noch an Aussagekraft gewinnen und wir werden auf den kommenden medizinischen Konferenzen Updates hierzu geben."
MorphoSys stellte heute außerdem vielversprechende präklinische Daten vor, die das synergistische Potenzial von MOR202 und Pomalidomid, einem etablierten Immunmodulatoren bei der Behandlung des rezidivierten/refraktären multiplen Myeloms, belegen.
Der Synergieeffekt lag dabei um das 1,2-fache bis 3,1-fache über dem theoretischen Effekt der Wirkstoffkombination. Dem Effekt lagen gleich mehrere Wirkmechanismen zugrunde: direkte Zytotoxizität, eine Hochregulierung von CD38 und die Aktivierung von Effektorzellen.
Dr. Schottelius fügte an: "Wir halten MOR202 für einen sehr attraktiven Kombinationspartner im Bereich des multiplen Myelom. Die heute präsentierten Daten untermauern die Überlegung, MOR202 mit Lenalidomid und Pomalidomid, zwei bewährten Wirkstoffen gegen das multiple Myelom, in den demnächst startenden Kohorten der Studie zu kombinieren.
@Maslacak. Du bist doch auch vom Fach und Praktiker. Wie schätzt Du das ganze ein?
Die MorphoSys AG (Frankfurt: MOR; Prime Standard Segment, TecDAX; OTC: MPSYY) veröffentlichte heute vorläufige Daten zu Sicherheit und Wirksamkeit ihres firmeneigenen Wirkstoffkandidaten MOR202. Die Daten stammen aus einer klinischen Studie der Phase 1/2a in 42 intensiv vorbehandelten Patienten mit rezidiviertem/refraktärem multiplem Myelom. Bei MOR202 handelt es sich um einen vollständig menschlichen monoklonalen HuCAL-Antikörper gegen CD38, ein stark exprimiertes und validiertes Zielmolekül im multiplen Myelom. Die vorläufigen klinischen Daten, die heute auf der Jahrestagung 2015 der American Society of Clinical Oncology (ASCO) vorgestellt wurden, zeigen, dass MOR202 sicher und gut verträglich war. Als 2-stündige Infusion wies der Wirkstoff hinsichtlich der Infusionsverträglichkeit das beste Profil seiner Wirkstoffklasse auf: die Infusionsreaktionen bei Patienten, die MOR202 ohne Dexamethason erhielten, waren überwiegend leicht bis moderat und beschränkten sich zumeist auf die erste Infusion. Bei Patienten, die MOR202 in Kombination mit Dexamethason erhielten, wurden gar keine Infusionsreaktionen beobachtet. MOR202 zeigte vielversprechende erste Anzeichen klinischer Aktivität und bereits bei geringer Dosierung konnte bei einigen Patienten eine langanhaltende Tumorkontrolle beobachtet werden.
Die laufende unverblindete, multizentrische Phase 1/2a-Studie mit ansteigender Dosierung wird in mehreren Studienzentren in Deutschland und Österreich durchgeführt. Die Studie untersucht die Sicherheit und erste Hinweise auf Wirksamkeit von MOR202 als Monotherapie und in Kombination mit Pomalidomid und Lenalidomid plus Dexamethason in Patienten mit rezidiviertem/refraktärem multiplem Myelom. Primäre Endpunkte der Studie sind die Sicherheit und Verträglichkeit sowie die Bestimmung der empfohlenen Dosis von MOR202 als Einzelwirkstoff und in Kombination mit Immunmodulatoren (IMiDs). Als weitere Zielvorgaben werden die Pharmakokinetik und vorläufige Ergebnisse zur Wirksamkeit untersucht, basierend auf der Gesamtansprechrate, der Ansprechdauer und der progressionsfreien Überlebenszeit.
Die auf der heutigen ASCO-Jahrestagung präsentierten Daten zeigen, dass MOR202 sicher und gut verträglich war, und als 2-stündige Infusion verabreicht werden konnte. Infusionsbedingte Reaktionen traten bei 13 Patienten (37 %) auf, die MOR202 ohne Dexamethason erhielten, und beschränkten sich überwiegend auf die erste Infusion. Alle Infusionsreaktionen waren leicht oder mäßig (Grad 1/2), bis auf einen Patienten mit Grad 3. Bei Patienten, die zusätzlich Dexamethason erhielten, traten keinerlei Infusionsreaktionen auf. Die maximal verträgliche Dosis (MTD) wurde nicht erreicht. Das bislang beste Ansprechverhalten, ein sehr gutes teilweises Ansprechen (VGPR), wurde in der Kohorte erzielt, die MOR202 als wöchentliche 4,0 mg/kg-Dosis plus Dexamethason erhielt. Darüber hinaus wurde aus anderen Dosierungsgruppen, beginnend mit einer geringen Dosierung von zweiwöchentlich 1,5 mg/kg, ein Fall von minimalem Ansprechen (MR) berichtet und zehn Fälle, in denen sich die Krankheit stabilisierte (SD). Die vorläufigen pharmakokinetischen Daten deuten darauf hin, dass eine vollständige Sättigung des Zielmoleküls bei einer wöchentlichen Dosierung von 16 mg/kg erreicht werden könnte.
Die Studie wird derzeit fortgeführt und höhere Dosen von MOR202 in Kombination mit Dexamethason untersucht. Weitere Kohorten, in denen die Patienten MOR202 bis zu einer wöchentlichen Dosis von 16 mg/kg in Kombination mit den immunmodulatorischen Wirkstoffen Pomalidomid und Lenalidomid plus Dexamethason erhalten werden, starten in Kürze.
"MOR202 hat eine klinische Aktivität gezeigt, die bereits sehr vielversprechend ist. Das Sicherheits- und Verträglichkeitsprofil von MOR202 eröffnet für unseren Wirkstoff eindeutig die Möglichkeit, sich von anderen derzeit in der Entwicklung befindlichen Anti-CD38-Therapien abzuheben, insbesondere im Hinblick auf die Infusionsreaktionen", kommentierte Dr. Arndt Schottelius, Entwicklungsvorstand der MorphoSys AG. "Wir sind sehr zufrieden mit diesen ersten Eindrücken des klinischen Potenzials von MOR202. Die Daten werden im Verlauf der kommenden Monate noch an Aussagekraft gewinnen und wir werden auf den kommenden medizinischen Konferenzen Updates hierzu geben."
MorphoSys stellte heute außerdem vielversprechende präklinische Daten vor, die das synergistische Potenzial von MOR202 und Pomalidomid, einem etablierten Immunmodulatoren bei der Behandlung des rezidivierten/refraktären multiplen Myeloms, belegen.
Der Synergieeffekt lag dabei um das 1,2-fache bis 3,1-fache über dem theoretischen Effekt der Wirkstoffkombination. Dem Effekt lagen gleich mehrere Wirkmechanismen zugrunde: direkte Zytotoxizität, eine Hochregulierung von CD38 und die Aktivierung von Effektorzellen.
Dr. Schottelius fügte an: "Wir halten MOR202 für einen sehr attraktiven Kombinationspartner im Bereich des multiplen Myelom. Die heute präsentierten Daten untermauern die Überlegung, MOR202 mit Lenalidomid und Pomalidomid, zwei bewährten Wirkstoffen gegen das multiple Myelom, in den demnächst startenden Kohorten der Studie zu kombinieren.
Antwort auf Beitrag Nr.: 49.884.055 von milchbubi am 31.05.15 16:34:04"Tut mir leid aber ich lese und interpretiere das als Laie total anders."
Vielleicht solltest Du es lassen, so etwas zu "interpretieren"?
So, wie ich die PM lese, wurden ca. 35 Patienten behandelt. Bis jetzt nur eine VGPR? Das ist die einzige OR aus 35 Patienten?
Klar wird noch hochdosiert, aber das klingt erst mal echt nach Asche.
Vielleicht solltest Du es lassen, so etwas zu "interpretieren"?
So, wie ich die PM lese, wurden ca. 35 Patienten behandelt. Bis jetzt nur eine VGPR? Das ist die einzige OR aus 35 Patienten?
Klar wird noch hochdosiert, aber das klingt erst mal echt nach Asche.
Antwort auf Beitrag Nr.: 49.884.097 von SLGramann am 31.05.15 16:42:02"So, wie ich die PM lese, wurden ca. 35 Patienten behandelt."
Sorry, 42 Patienten - steht ja drin. Ist ja noch mal schlechter dann...
Sorry, 42 Patienten - steht ja drin. Ist ja noch mal schlechter dann...
Antwort auf Beitrag Nr.: 49.884.106 von SLGramann am 31.05.15 16:44:07tut mir wirklich leid Chef Gramann, dass ich mir erlaubt habe, meinen Senf im Eliteforum der absoluten Fachleute abzulassen. Ich entschuldige mich aufrichtig Herr SL Gramann. Ich werde künftig die internen Bordregeln respektieren und mich beherrschen noch etwas zu schreiben. Tausendmal Sorry Chef Gramann.
Antwort auf Beitrag Nr.: 49.884.124 von milchbubi am 31.05.15 16:52:46"tut mir wirklich leid Chef Gramann"
Du kannst schreiben was immer Du möchtest und wo immer Du möchtest, das meinte ich nicht.
Was ich meinte war Deine Bemerkung, dass Du "lieber MorphoSys vertraust" womit Du eine üblicherweise blumig und positiv formulierte Pressemitteilung einfach 1:1 als Grundlage für Deine Entscheidungen akzeptierst.
Und wohlgemeint: DAS solltest Du wirklich lassen!
Du kannst schreiben was immer Du möchtest und wo immer Du möchtest, das meinte ich nicht.
Was ich meinte war Deine Bemerkung, dass Du "lieber MorphoSys vertraust" womit Du eine üblicherweise blumig und positiv formulierte Pressemitteilung einfach 1:1 als Grundlage für Deine Entscheidungen akzeptierst.
Und wohlgemeint: DAS solltest Du wirklich lassen!
Mir ist schon klar, dass eine Firma ihre Produkte in erster Linie im eigenen Interesse anpreist. Allerdings ist es hier für mich (als Nichtfachmann wohlgemerkt!!!) einfach so, dass ich den Worten der Wissenschaftler von Morphosys mehr vertraue als jetzt z.B. Dir oder Joschka. Von Joschka weiß ich, dass er durchaus Fachkenntnisse hat. Auch von dem ein oder anderen hier.
IM MOMENT ist es einfach so, dass ICH PERSÖNLICH (und ich rede nur für mich) noch mehr Vertrauen in deren Worte lege. Wir werden die Tage bzw. die kommenden Wochen sehen wie es der Markt interpretiert.
IM MOMENT ist es einfach so, dass ICH PERSÖNLICH (und ich rede nur für mich) noch mehr Vertrauen in deren Worte lege. Wir werden die Tage bzw. die kommenden Wochen sehen wie es der Markt interpretiert.
Hallo an alle Ich denke schon das die glaubwürdig sind , Morphosys leute meine ich... Ich finde auch nicht das die zu viel Spin zu Story geben. Natürlich ist das ganze schön verpackt aber die sind relativ offen. So wie die das gemacht haben, also MOR 202 alleine oder MOR + DEX in niedrigen Dosierung reicht deutlich nicht.
Ich denke schon das die glaubwürdig sind , Morphosys leute meine ich... Ich finde auch nicht das die zu viel Spin zu Story geben. Natürlich ist das ganze schön verpackt aber die sind relativ offen. So wie die das gemacht haben, also MOR 202 alleine oder MOR + DEX in niedrigen Dosierung reicht deutlich nicht.
Also die hoffen das gute Verträglichkeit den ermöglicht wahrscheinlich mit 16 mg/kg in Kombination mit lenalidomide und pomalidomide bessere Wirksamkeit zu erreichen. Warum die noch nicht MOR 202 beendet haben? Einfach, weil es sein kann das Kombination in der tat erfolgreich wird. Falls das nicht passiert MOR 202 wird in 2016. nicht weiter entwickelt, das bin ich mir sicher, die haben das auch deutlich angekündigt. Und von Prognosen wie die Ergebnisse ausfallen werden möchte ich gerne in Moment Abstand nehmen. Prozessen in Biologie und Medizin sind nicht linear. Sonst wäre Anzahl von Klinischen trials viel kleiner generell ( und prozentuell mehr erfolgreich).Sachen mussen einfach ausuprobiert werden....Und wir müssen uns gedulden.
 Ich denke schon das die glaubwürdig sind , Morphosys leute meine ich... Ich finde auch nicht das die zu viel Spin zu Story geben. Natürlich ist das ganze schön verpackt aber die sind relativ offen. So wie die das gemacht haben, also MOR 202 alleine oder MOR + DEX in niedrigen Dosierung reicht deutlich nicht.
Ich denke schon das die glaubwürdig sind , Morphosys leute meine ich... Ich finde auch nicht das die zu viel Spin zu Story geben. Natürlich ist das ganze schön verpackt aber die sind relativ offen. So wie die das gemacht haben, also MOR 202 alleine oder MOR + DEX in niedrigen Dosierung reicht deutlich nicht. Also die hoffen das gute Verträglichkeit den ermöglicht wahrscheinlich mit 16 mg/kg in Kombination mit lenalidomide und pomalidomide bessere Wirksamkeit zu erreichen. Warum die noch nicht MOR 202 beendet haben? Einfach, weil es sein kann das Kombination in der tat erfolgreich wird. Falls das nicht passiert MOR 202 wird in 2016. nicht weiter entwickelt, das bin ich mir sicher, die haben das auch deutlich angekündigt. Und von Prognosen wie die Ergebnisse ausfallen werden möchte ich gerne in Moment Abstand nehmen. Prozessen in Biologie und Medizin sind nicht linear. Sonst wäre Anzahl von Klinischen trials viel kleiner generell ( und prozentuell mehr erfolgreich).Sachen mussen einfach ausuprobiert werden....Und wir müssen uns gedulden.
Noch was dazu. Es ist klar warum Celgene das ganze nicht gereicht hat. Die sind im best case Szenario immernoch dabei wegen pomalidomide and lenalidomide ( am Umsatz direkt beteiligt). Parallel, sind die in super teueres PD-L1 Projekt mit Aztra zeneca eingegangen. Übrigens am Freitag bei ASCO nettes Beispiel wie Medizin auch von Mode und Trends lebt. Jetzt machen die alle plotzlich checkpoint inhibitoren ( PD-L1), aber neue daten von Bristol Mayers Squibb haben schön gezeigt das das ganze etwas komplizierter sein wird um krebs wirklich zu heilen ( es gab direkt -6% and der Börse). Ist aber der letze Schrei " checkpoint inhibitoren".
Zurück zu MOR 202- es mag sein das es nicht begeistert im Moment, aber besser marginale Wirksamkeit ( aber immerhin Wirksamkeit), als zum Beispiel LJM716 das ganz offensichtlich toxisch ist.

Zurück zu MOR 202- es mag sein das es nicht begeistert im Moment, aber besser marginale Wirksamkeit ( aber immerhin Wirksamkeit), als zum Beispiel LJM716 das ganz offensichtlich toxisch ist.
Die Daten sehen tatsächlich außerordentlich schwach aus. Der Text der Pressemeldung mutet in diesem Zuammenhang seltsam an. Es stellen sich zwei Fragen:
1. Liegt es möglicherweise daran, dass der AK biher noch unterdosiert ist?
2. Wenn nein, was ist der Grund, dass die Wirksamkeit deutlich schlechter ist als bei anderen CD38-AK?
Durch vollkommen schwachsinnige Entscheidungen ist die Unternehmensleitung bisher aber auch nicht aufgefallen. Insofern gehe ich davon aus, dass nach der nächsten Studie entweder deutlich bessere Ergebnisse vorliegen oder man das Projekt einstellt.
1. Liegt es möglicherweise daran, dass der AK biher noch unterdosiert ist?
2. Wenn nein, was ist der Grund, dass die Wirksamkeit deutlich schlechter ist als bei anderen CD38-AK?
Durch vollkommen schwachsinnige Entscheidungen ist die Unternehmensleitung bisher aber auch nicht aufgefallen. Insofern gehe ich davon aus, dass nach der nächsten Studie entweder deutlich bessere Ergebnisse vorliegen oder man das Projekt einstellt.
Antwort auf Beitrag Nr.: 49.884.331 von Maslacak am 31.05.15 18:10:04"wie Medizin auch von Mode und Trends lebt"
Es gibt Trends und Moden, vor allem in der PR von börsennotierten Biotechs, da hast Du vollkommen recht.
Ich weiß aber nicht, ob es schon jemals eine "Mode" gab, die so viel Berechtigung hatte, wie die im Bereich Immuntherapie und insbesondere beim Target PD(L)-1.
Es gibt Trends und Moden, vor allem in der PR von börsennotierten Biotechs, da hast Du vollkommen recht.
Ich weiß aber nicht, ob es schon jemals eine "Mode" gab, die so viel Berechtigung hatte, wie die im Bereich Immuntherapie und insbesondere beim Target PD(L)-1.
deadflowers zu punkt zwei:
Sorry aber die können das nicht wissen. Ich möchte Morphosys nicht verteidigen aber genau solche Sachen sind wahre Risiko bei Biotechs und Pharma. Ich habe das vor ein paar Tagen schon angesprochen in anderem Kontext. Aber nur weil zwei Antikörper gegen gleiche Target sind die sind nie Identisch. Oder gleichwertig. Und es ist meistens super schwierig in der Forschungsphase Klinisches Wirkung zu vorhersagen. Es kann sein das aus irgendeinen Grund MOR 202 schlechter ist als andere CD38 Antikörper. Anderes epitop, schlechter zugänglich in vivo, Probleme bei Pharmakokinetik, bioavailability, wer weiss. Aber das heisst nicht das bei MOR fachliche Fehlern passiert sind sondern einfach Pech gehabt. Es ist normal das viele Wirkstoffe in der Phase II ( Wirksamkeit) scheitern. Es ist Alltag.
Sorry aber die können das nicht wissen. Ich möchte Morphosys nicht verteidigen aber genau solche Sachen sind wahre Risiko bei Biotechs und Pharma. Ich habe das vor ein paar Tagen schon angesprochen in anderem Kontext. Aber nur weil zwei Antikörper gegen gleiche Target sind die sind nie Identisch. Oder gleichwertig. Und es ist meistens super schwierig in der Forschungsphase Klinisches Wirkung zu vorhersagen. Es kann sein das aus irgendeinen Grund MOR 202 schlechter ist als andere CD38 Antikörper. Anderes epitop, schlechter zugänglich in vivo, Probleme bei Pharmakokinetik, bioavailability, wer weiss. Aber das heisst nicht das bei MOR fachliche Fehlern passiert sind sondern einfach Pech gehabt. Es ist normal das viele Wirkstoffe in der Phase II ( Wirksamkeit) scheitern. Es ist Alltag.
Antwort auf Beitrag Nr.: 49.884.409 von SLGramann am 31.05.15 18:35:22Ich habe nicht gesagt das alles Blöd ist, scheckpoint inhibitoren sind auf Jedenfall Interessant aber ich erkenne noch nicht das wahres Durchbruch was Krebs Heilung angeht. Wirkliches Heilung. Vielleicht werden die PD-L1 inhibitoren in Kombination in Zukunft wichtige rolle spielen aber eine Lebensverlängerung von 12 Monaten ist für mich keine Revolution. vielleicht bin ich Biased als Zellbiologe und kein Immunobiologie aber ich denke schon das mann den weg finden muss um Krebs an sich spezifisch zu treffen ( bis jetzt noch nicht passiert). Immunotherapie wird nicht reichen. Deswegen finde ich mesothelin Ansätze gar-nicht schlecht. Oder NOTCH2/3 als targets...
Antwort auf Beitrag Nr.: 49.884.340 von deadflowers am 31.05.15 18:14:35
zu 2. Die Wirkmechanismen der Mabs unterscheiden sich in einigen Punkten. Bei der letzten ASH-Tagung wurde dies bereits von Genmab ausführlich in präklinischen Vergleichsstudien thematisiert. Wenn ich mich recht erinnere, weist MOR202 keine complement-dependent cytotoxicity (CDC) and apoptosis auf.
zu 1. Zur Ergänzung: Die zitierten SAR650984-Ergebnisse wurden an Kollektiven erzielt, denen zwischen 1 mg/kg und 20 mg/kg verabreicht worden sind.
Was die Qualität des Morphosys-Managements betrifft, stimme ich zu.
Ich kann mir nur vorstellen, dass man voll auf die Kombi-Studien setzt. Biotest´s anti-CD138-Mab BT-061 war in der Mono-Studie auch extrem schwach (Zwischenergebnis auf dem Antibody-Kongress in Genua 2012 gerade einmal 4 % ORR, die Endergebnisse der Studie 975 müßten eigentlich im kommenden Monat verffentlicht werden), hat dann aber in der Kombi mit Lenalidomide sehr gute Ergebnisse erzielt.
Da Celgene einen Großteil der laufenden Studienkosten deckt, macht es daher eigentlich schon Sinn, sicherheitshalber noch die Kombi-Therapien abzuwarten, bevor man eine endgültige Entscheidung trifft. Mein nachmittäglicher Vorschlag, MOR202 zu entsorgen, war somit etwas vorschnell.
Für die Aussage in der PR-Meldung "MOR202 hat eine klinische Aktivität gezeigt, die bereits sehr vielversprechend ist", ist bislang allerdings keine reale Basis zu erkennen.
Zitat von deadflowers: Die Daten sehen tatsächlich außerordentlich schwach aus. Der Text der Pressemeldung mutet in diesem Zuammenhang seltsam an. Es stellen sich zwei Fragen:
1. Liegt es möglicherweise daran, dass der AK biher noch unterdosiert ist?
2. Wenn nein, was ist der Grund, dass die Wirksamkeit deutlich schlechter ist als bei anderen CD38-AK?
Durch vollkommen schwachsinnige Entscheidungen ist die Unternehmensleitung bisher aber auch nicht aufgefallen. Insofern gehe ich davon aus, dass nach der nächsten Studie entweder deutlich bessere Ergebnisse vorliegen oder man das Projekt einstellt.
zu 2. Die Wirkmechanismen der Mabs unterscheiden sich in einigen Punkten. Bei der letzten ASH-Tagung wurde dies bereits von Genmab ausführlich in präklinischen Vergleichsstudien thematisiert. Wenn ich mich recht erinnere, weist MOR202 keine complement-dependent cytotoxicity (CDC) and apoptosis auf.
zu 1. Zur Ergänzung: Die zitierten SAR650984-Ergebnisse wurden an Kollektiven erzielt, denen zwischen 1 mg/kg und 20 mg/kg verabreicht worden sind.
Was die Qualität des Morphosys-Managements betrifft, stimme ich zu.
Ich kann mir nur vorstellen, dass man voll auf die Kombi-Studien setzt. Biotest´s anti-CD138-Mab BT-061 war in der Mono-Studie auch extrem schwach (Zwischenergebnis auf dem Antibody-Kongress in Genua 2012 gerade einmal 4 % ORR, die Endergebnisse der Studie 975 müßten eigentlich im kommenden Monat verffentlicht werden), hat dann aber in der Kombi mit Lenalidomide sehr gute Ergebnisse erzielt.
Da Celgene einen Großteil der laufenden Studienkosten deckt, macht es daher eigentlich schon Sinn, sicherheitshalber noch die Kombi-Therapien abzuwarten, bevor man eine endgültige Entscheidung trifft. Mein nachmittäglicher Vorschlag, MOR202 zu entsorgen, war somit etwas vorschnell.
Für die Aussage in der PR-Meldung "MOR202 hat eine klinische Aktivität gezeigt, die bereits sehr vielversprechend ist", ist bislang allerdings keine reale Basis zu erkennen.
Antwort auf Beitrag Nr.: 49.884.616 von Joschka Schröder am 31.05.15 19:47:28
Ich sehe gerade ... ich hab´s überhaupt nicht vorgeschlagen, sondern nur gedacht.
Zitat von Joschka Schröder: Mein nachmittäglicher Vorschlag, MOR202 zu entsorgen, war somit etwas vorschnell.
Ich sehe gerade ... ich hab´s überhaupt nicht vorgeschlagen, sondern nur gedacht.

Hi all,
es geht ja in diesem Forum um "fachliche Überlegungen" wie ich der Überschrift entnehmen kann. Daher lese ich als Wirtschaftswissenschaftler gerne ein bisschen mit hier
Daher auch ein Statement aus Wirtschaft Sicht: Die Börsen leben immer auch von der Phantasie zu zukünftigen Entwicklungen von Firmen. Morphosys hat mit den Ergebnissen die Phantasie geweckt und morgen werden wir die Aktie deutlich im Plus sehen ... Bei Lang & Schwarz waren wir schon wieder bei 70 € und insbesondere institutionelle Anleger werden morgen wieder zugreifen.
Nur ein Gedanke ... Geld verdienen macht ja auch Spass
es geht ja in diesem Forum um "fachliche Überlegungen" wie ich der Überschrift entnehmen kann. Daher lese ich als Wirtschaftswissenschaftler gerne ein bisschen mit hier

Daher auch ein Statement aus Wirtschaft Sicht: Die Börsen leben immer auch von der Phantasie zu zukünftigen Entwicklungen von Firmen. Morphosys hat mit den Ergebnissen die Phantasie geweckt und morgen werden wir die Aktie deutlich im Plus sehen ... Bei Lang & Schwarz waren wir schon wieder bei 70 € und insbesondere institutionelle Anleger werden morgen wieder zugreifen.
Nur ein Gedanke ... Geld verdienen macht ja auch Spass

Antwort auf Beitrag Nr.: 49.884.646 von Imperium1 am 31.05.15 19:55:06
Einen etwaiger Kursanstieg infolge der vorliegenden Ergebnisse würde eine totale Ahnungslosigkeit voraussetzen, die ich in diesem Ausmaß nicht vermuten würde.
Ich habe mir noch einmal die SAR650984-Präsentation vom letztjährigen ASCO-Kongress angesehen. SAR650984 wurde ohne DEX-Zugabe appliziert. Ohne DEX-Zugabe gab es bei MOR202 überhaupt keine klinische Antwort.
Zur (präklinischen) Synergie zwischen LEN/POM und MOR202: Als Ursache der Synergie wird eine Hochregulation der CD38-Expression durch LEN und POM vermutet. Von diesem Effekt profitieren jedoch auch die Konkurrenzantikörper SAR650984 und Daratumumab, die bislang so viel besser abgeschnitten haben als MOR202.
Man muss nun einmal die Ruhe die Ergebnisse der bevorstehenden Kombi-Studien abwarten. Am wahrscheinlichsten erscheint, dass sich an der bisherigen Unterlegenheit gegenüber den anderen CD38-Mabs nichts ändern wird. Die Celgene-Entscheidung, die Kooperation aufzukündigen, scheint jedenfalls gut begründet.
Zitat von Imperium1: Daher auch ein Statement aus Wirtschaft Sicht: Die Börsen leben immer auch von der Phantasie zu zukünftigen Entwicklungen von Firmen. Morphosys hat mit den Ergebnissen die Phantasie geweckt und morgen werden wir die Aktie deutlich im Plus sehen ... Bei Lang & Schwarz waren wir schon wieder bei 70 € und insbesondere institutionelle Anleger werden morgen wieder zugreifen.
Einen etwaiger Kursanstieg infolge der vorliegenden Ergebnisse würde eine totale Ahnungslosigkeit voraussetzen, die ich in diesem Ausmaß nicht vermuten würde.
Ich habe mir noch einmal die SAR650984-Präsentation vom letztjährigen ASCO-Kongress angesehen. SAR650984 wurde ohne DEX-Zugabe appliziert. Ohne DEX-Zugabe gab es bei MOR202 überhaupt keine klinische Antwort.
Zur (präklinischen) Synergie zwischen LEN/POM und MOR202: Als Ursache der Synergie wird eine Hochregulation der CD38-Expression durch LEN und POM vermutet. Von diesem Effekt profitieren jedoch auch die Konkurrenzantikörper SAR650984 und Daratumumab, die bislang so viel besser abgeschnitten haben als MOR202.
Man muss nun einmal die Ruhe die Ergebnisse der bevorstehenden Kombi-Studien abwarten. Am wahrscheinlichsten erscheint, dass sich an der bisherigen Unterlegenheit gegenüber den anderen CD38-Mabs nichts ändern wird. Die Celgene-Entscheidung, die Kooperation aufzukündigen, scheint jedenfalls gut begründet.
Antwort auf Beitrag Nr.: 49.884.424 von Maslacak am 31.05.15 18:39:06
ASH 2014:
3474 Direct in Vitro Comparison of Daratumumab with Surrogate Analogs of CD38 Antibodies MOR03087, SAR650984 and Ab79
Program: Oral and Poster Abstracts
Session: 653. Myeloma: Therapy, excluding Transplantation: Poster II
Sunday, December 7, 2014, 6:00 PM-8:00 PM
West Building, Level 1 (Moscone Center)
Jeroen Lammerts van Bueren, PhD1*, Danielle Jakobs1*, Niels Kaldenhoven1*, Marcel Roza1*, Sanne Hiddingh1*, Joyce Meesters1*, Marleen Voorhorst1*, Elke Gresnigt1*, Luus Wiegman1*, Antonio Ortiz Buijsse1*, Grietje Andringa1*, Marije B. Overdijk, PhD1*, Parul Doshi, PhD2*, Kate Sasser2*, Michel de Weers, PhD1* and Paul W.H.I. Parren, PhD3,4*
1Genmab, Utrecht, Netherlands
2Janssen Research & Development, Springhouse, PA
3Genmab BV, Utrecht, Netherlands
4Institute of Molecular Medicine/Department of Cancer and inflammation Research, University of Southern Denmark, Odense, Denmark
The CD38 molecule, with its high expression on Multiple Myeloma (MM), is considered a suitable target for antibody therapy of MM. We developed daratumumab (DARA), a human CD38 monoclonal antibody (mAb) with direct and Fc-mediated cell killing activity. DARA induces killing of tumor cells, mainly via complement-dependent cytotoxicity (CDC), antibody-dependent cell-mediated cytotoxicity (ADCC) (de Weers M. J Immunol 2011), and antibody-dependent cellular phagocytosis (ADCP) by macrophages (both murine and human). In addition, DARA induces apoptosis upon secondary cross-linking and modulates CD38 enzymatic function. DARA is currently in phase I, II and III clinical evaluation in patients with MM.
Besides DARA, several other anti-CD38 mAb are in development; SAR650894 (SAR; clone 38SB19; Sanofi-Aventis) for MM and other CD38+ hematological malignancies, MOR03087 (MOR; Morphosys) for relapsed/refractory MM and Ab79 (Millenium/Takeda) which is in preclinical development. Similar mechanisms of action (MoA) are described for these mAb; nevertheless direct comparison studies would be critical for differentiation among these antibodies. .
In this study, the efficacy of these anti-CD38 mAb was directly compared to DARA with respect to binding, apoptosis, CD38 ectoenzyme activity, and the induction of ADCC, ADCP and CDC. Surrogate antibodies of MOR, SAR and Ab79 were generated on the basis of protein sequences, as published in their corresponding patents families, and were attached to the backbone of DARA.
Binding to CD38 expressing Daudi tumor cells was assessed by flow cytomery. All CD38 antibodies showed similar EC50 (~0.1 µg/mL) and maximal binding, except MOR which showed a lower apparent affinity (~0.3 µg/mL). Previously, CD38 amino acid residues Q272 and S274 were reported as critical for DARA binding. ELISA analyses using CD38 point mutants revealed MOR, SAR and Ab79 not to be affected by mutation of these residues. All CD38 mAb were equally potent in inducing ADCC of Daudi cells (40-60% lysis, 0.02 µg/mL), in classic Cr51-release ADCC assay using human PBMC effector cells (E:T ratio 100:1). Important differences were observed with respect to induction of CDC. SAR was unable to induce CDC in Daudi cells at concentrations up to 30 µg/mL, while DARA induced more than 80% lysis at concentrations above 1 µg/mL. Ab79 and MOR induced CDC, yet maximum lysis was 50% and 20%, respectively.
Evaluation of Annexin V/propidium iodide (AnnV/PI) staining and activation of caspase-3 showed that only SAR induced AnnV/PI+ in Ramos cells (~40%) after 48 h exposure without Fc crosslinking, but did not activate caspase-3. In the presence of Fc crosslinking antibodies, all anti-CD38 mAb induced AnnV/PI+, caspase-3 mediated apoptosis.
In enzyme activity assays using purified CD38 protein, SAR inhibited generation of cGDPR (indicative of the combined CD38 cyclase activity generating fluorescent cGDPR and hydrolase activity converting cGDPR into GDPR)more effectively than DARA (~70% vs. ~20% inhibition at 30 µg/mL). Ab79 had a modest effect on CD38 enzyme activity (~10% inhibition). MOR did not affect CD38 enzyme activity at all.
The capacity to induce ADCP was only tested for DARA, MOR and Ab79 using mouse macrophages (mφ) as effector cells and Daudi target cells. mφ, isolated and matured from bone marrow cells, and calcein-AM labelled target cells (E:T ratio 1:1) were cultured in the presence of 0.0006-5 µg/mL antibody for 4 h. Non-phagocytosed target cells and mφ were collected and ADCP was evaluated by flow cytometry. All CD38 mAb induced mφ-mediated phagocytosis, as observed by a concentration dependent increase in the number of double positive mφ and killing of target cells. Ab79 was as effective as DARA (EC50 ~0.01 µg/mL) in ADCP induction, whereas MOR was less effective (EC50 0.04 µg/mL).
In summary, DARA and surrogate mAb of MOR, SAR and Ab79 showed similar binding to cells and induced similar amounts of ADCC. Differences between these mAb involved the ability to directly induce apoptosis, to inhibit the enzymatic activity of CD38 and to induce ADCP. The most striking difference was observed for the ability to induce CDC, the MoA which is currently believed the most important mechanism of MM cell killing in the clinic. DARA efficiently induced high levels of CDC at low concentrations, whereas the other CD38 mAb were unable or less capable to induce CDC.
Zitat von Maslacak: deadflowers zu punkt zwei:
Sorry aber die können das nicht wissen. Ich möchte Morphosys nicht verteidigen aber genau solche Sachen sind wahre Risiko bei Biotechs und Pharma. Ich habe das vor ein paar Tagen schon angesprochen in anderem Kontext. Aber nur weil zwei Antikörper gegen gleiche Target sind die sind nie Identisch. Oder gleichwertig. Und es ist meistens super schwierig in der Forschungsphase Klinisches Wirkung zu vorhersagen. Es kann sein das aus irgendeinen Grund MOR 202 schlechter ist als andere CD38 Antikörper. Anderes epitop, schlechter zugänglich in vivo, Probleme bei Pharmakokinetik, bioavailability, wer weiss. Aber das heisst nicht das bei MOR fachliche Fehlern passiert sind sondern einfach Pech gehabt. Es ist normal das viele Wirkstoffe in der Phase II ( Wirksamkeit) scheitern. Es ist Alltag.
ASH 2014:
3474 Direct in Vitro Comparison of Daratumumab with Surrogate Analogs of CD38 Antibodies MOR03087, SAR650984 and Ab79
Program: Oral and Poster Abstracts
Session: 653. Myeloma: Therapy, excluding Transplantation: Poster II
Sunday, December 7, 2014, 6:00 PM-8:00 PM
West Building, Level 1 (Moscone Center)
Jeroen Lammerts van Bueren, PhD1*, Danielle Jakobs1*, Niels Kaldenhoven1*, Marcel Roza1*, Sanne Hiddingh1*, Joyce Meesters1*, Marleen Voorhorst1*, Elke Gresnigt1*, Luus Wiegman1*, Antonio Ortiz Buijsse1*, Grietje Andringa1*, Marije B. Overdijk, PhD1*, Parul Doshi, PhD2*, Kate Sasser2*, Michel de Weers, PhD1* and Paul W.H.I. Parren, PhD3,4*
1Genmab, Utrecht, Netherlands
2Janssen Research & Development, Springhouse, PA
3Genmab BV, Utrecht, Netherlands
4Institute of Molecular Medicine/Department of Cancer and inflammation Research, University of Southern Denmark, Odense, Denmark
The CD38 molecule, with its high expression on Multiple Myeloma (MM), is considered a suitable target for antibody therapy of MM. We developed daratumumab (DARA), a human CD38 monoclonal antibody (mAb) with direct and Fc-mediated cell killing activity. DARA induces killing of tumor cells, mainly via complement-dependent cytotoxicity (CDC), antibody-dependent cell-mediated cytotoxicity (ADCC) (de Weers M. J Immunol 2011), and antibody-dependent cellular phagocytosis (ADCP) by macrophages (both murine and human). In addition, DARA induces apoptosis upon secondary cross-linking and modulates CD38 enzymatic function. DARA is currently in phase I, II and III clinical evaluation in patients with MM.
Besides DARA, several other anti-CD38 mAb are in development; SAR650894 (SAR; clone 38SB19; Sanofi-Aventis) for MM and other CD38+ hematological malignancies, MOR03087 (MOR; Morphosys) for relapsed/refractory MM and Ab79 (Millenium/Takeda) which is in preclinical development. Similar mechanisms of action (MoA) are described for these mAb; nevertheless direct comparison studies would be critical for differentiation among these antibodies. .
In this study, the efficacy of these anti-CD38 mAb was directly compared to DARA with respect to binding, apoptosis, CD38 ectoenzyme activity, and the induction of ADCC, ADCP and CDC. Surrogate antibodies of MOR, SAR and Ab79 were generated on the basis of protein sequences, as published in their corresponding patents families, and were attached to the backbone of DARA.
Binding to CD38 expressing Daudi tumor cells was assessed by flow cytomery. All CD38 antibodies showed similar EC50 (~0.1 µg/mL) and maximal binding, except MOR which showed a lower apparent affinity (~0.3 µg/mL). Previously, CD38 amino acid residues Q272 and S274 were reported as critical for DARA binding. ELISA analyses using CD38 point mutants revealed MOR, SAR and Ab79 not to be affected by mutation of these residues. All CD38 mAb were equally potent in inducing ADCC of Daudi cells (40-60% lysis, 0.02 µg/mL), in classic Cr51-release ADCC assay using human PBMC effector cells (E:T ratio 100:1). Important differences were observed with respect to induction of CDC. SAR was unable to induce CDC in Daudi cells at concentrations up to 30 µg/mL, while DARA induced more than 80% lysis at concentrations above 1 µg/mL. Ab79 and MOR induced CDC, yet maximum lysis was 50% and 20%, respectively.
Evaluation of Annexin V/propidium iodide (AnnV/PI) staining and activation of caspase-3 showed that only SAR induced AnnV/PI+ in Ramos cells (~40%) after 48 h exposure without Fc crosslinking, but did not activate caspase-3. In the presence of Fc crosslinking antibodies, all anti-CD38 mAb induced AnnV/PI+, caspase-3 mediated apoptosis.
In enzyme activity assays using purified CD38 protein, SAR inhibited generation of cGDPR (indicative of the combined CD38 cyclase activity generating fluorescent cGDPR and hydrolase activity converting cGDPR into GDPR)more effectively than DARA (~70% vs. ~20% inhibition at 30 µg/mL). Ab79 had a modest effect on CD38 enzyme activity (~10% inhibition). MOR did not affect CD38 enzyme activity at all.
The capacity to induce ADCP was only tested for DARA, MOR and Ab79 using mouse macrophages (mφ) as effector cells and Daudi target cells. mφ, isolated and matured from bone marrow cells, and calcein-AM labelled target cells (E:T ratio 1:1) were cultured in the presence of 0.0006-5 µg/mL antibody for 4 h. Non-phagocytosed target cells and mφ were collected and ADCP was evaluated by flow cytometry. All CD38 mAb induced mφ-mediated phagocytosis, as observed by a concentration dependent increase in the number of double positive mφ and killing of target cells. Ab79 was as effective as DARA (EC50 ~0.01 µg/mL) in ADCP induction, whereas MOR was less effective (EC50 0.04 µg/mL).
In summary, DARA and surrogate mAb of MOR, SAR and Ab79 showed similar binding to cells and induced similar amounts of ADCC. Differences between these mAb involved the ability to directly induce apoptosis, to inhibit the enzymatic activity of CD38 and to induce ADCP. The most striking difference was observed for the ability to induce CDC, the MoA which is currently believed the most important mechanism of MM cell killing in the clinic. DARA efficiently induced high levels of CDC at low concentrations, whereas the other CD38 mAb were unable or less capable to induce CDC.
Mir ist ganz klar das solche vergleich Studien gemacht werden, sind auch notwendig weil es keine bessere Tools gibt und irgendwo muss mann Anfangen, ich wollte nur deutlich machen das präklinik sehr Grosse Defiziten hat. Methodologisch gesehen. Wir können jetzt drei Tagen diskutieren ( irgendwann werden alle leute gelangweilt ) warum das so ist, was ich eigentlich sagen wollte: bis Wirksamkeit in echten Patienten getestet ist und gezeigt ist ist alles nur Spekulativ und mit Vorsicht zu geniessen.
Und was MOR aktienkurs angeht: MOR ist nicht nur 202, morgen gibt es Vortrag zum 208, ich nehme an auch presse mitteilung....
Und was MOR aktienkurs angeht: MOR ist nicht nur 202, morgen gibt es Vortrag zum 208, ich nehme an auch presse mitteilung....
Antwort auf Beitrag Nr.: 49.884.745 von Joschka Schröder am 31.05.15 20:17:59... ich würde das nicht so negativ sehen. Die Analysten werden sowas lieben:
http://www.stock-world.de/nachrichten/marktberichte/dpa-AFX-…
Morphosys legt positive Studiendaten zu Krebs-Antikörper MOR202 vor
MARTINSRIED - Das Biotechnologie-Unternehmen Morphosys hat zu seinem Krebs-Antikörper MOR202 positive Studienergebnisse vorgelegt. Der Antikörper habe in einem Test mit 42 Patienten erste Zeichen einer klinischen Wirkung gegen das Multiple Myelom gezeigt, teilte das Unternehmen am Sonntag zum Jahrestreffen der Amerikanischen Gesellschaft für klinische Onkologie (Asco) mit. Zudem werde er in wöchentlichen und zweiwöchentlichen Dosen gut vertragen. Die Entwicklung des Antikörpers führt Morphosys alleine fort, nachdem eine Zusammenarbeit mit dem Celgene im März überraschend beendet worden war./stw/
oder
http://de.investing.com/news/aktienmarkt-nachrichten/%C3%BCb…
Morgen gehts rauf
http://www.stock-world.de/nachrichten/marktberichte/dpa-AFX-…
Morphosys legt positive Studiendaten zu Krebs-Antikörper MOR202 vor
MARTINSRIED - Das Biotechnologie-Unternehmen Morphosys hat zu seinem Krebs-Antikörper MOR202 positive Studienergebnisse vorgelegt. Der Antikörper habe in einem Test mit 42 Patienten erste Zeichen einer klinischen Wirkung gegen das Multiple Myelom gezeigt, teilte das Unternehmen am Sonntag zum Jahrestreffen der Amerikanischen Gesellschaft für klinische Onkologie (Asco) mit. Zudem werde er in wöchentlichen und zweiwöchentlichen Dosen gut vertragen. Die Entwicklung des Antikörpers führt Morphosys alleine fort, nachdem eine Zusammenarbeit mit dem Celgene im März überraschend beendet worden war./stw/
oder
http://de.investing.com/news/aktienmarkt-nachrichten/%C3%BCb…
Morgen gehts rauf

Zum besseren Verständnis für Uninformierte wie mich:
Der MOR-AK wurde mit 1,5mg und 4mg dosiert und brachte hinsichtlich Response so gut wie nichts, der SAR-AK wiederum wurde mit 1mg bis 20mg dosiert und sah viel besser aus? So zumindest wurde es hier ohne weitere Detailinformationen geschrieben.
Das klingt jetzt erstmal so, als ob einige Personen 1,5 oder 4 Flaschen von Bier A getrunken haben und so gut wie niemand davon besoffen wurde, von Bier B wiederum durften andere Leute 1 bis 20 Flaschen trinken und es wurden einige schwere Alkoholvergiftungen konstatiert. Der Schluss daraus soll nun sein, dass mit dem Alkoholgehalt von Bier A etwas nicht stimmen kann.
Ich denke, dass dieser Schluss unbedarften Lesern wie mir ohne weitere Informationen bezüglich der Verteilung der RR innerhalb der SAR-Gruppen etwas voreilig erscheinen könnte.
Der MOR-AK wurde mit 1,5mg und 4mg dosiert und brachte hinsichtlich Response so gut wie nichts, der SAR-AK wiederum wurde mit 1mg bis 20mg dosiert und sah viel besser aus? So zumindest wurde es hier ohne weitere Detailinformationen geschrieben.
Das klingt jetzt erstmal so, als ob einige Personen 1,5 oder 4 Flaschen von Bier A getrunken haben und so gut wie niemand davon besoffen wurde, von Bier B wiederum durften andere Leute 1 bis 20 Flaschen trinken und es wurden einige schwere Alkoholvergiftungen konstatiert. Der Schluss daraus soll nun sein, dass mit dem Alkoholgehalt von Bier A etwas nicht stimmen kann.
Ich denke, dass dieser Schluss unbedarften Lesern wie mir ohne weitere Informationen bezüglich der Verteilung der RR innerhalb der SAR-Gruppen etwas voreilig erscheinen könnte.
Antwort auf Beitrag Nr.: 49.884.886 von Imperium1 am 31.05.15 20:55:04Die präsentierten Studiendaten zu MOR202 waren definitiv mies, die zitierten Meldungen beten nur die unerklärlich optimistisch formulierte Unternehmensmeldung wieder. Grundsätzlich muß man an der Börse aber mit Allem rechnen.
Antwort auf Beitrag Nr.: 49.885.108 von BReal am 31.05.15 22:09:07
Das stimmt nicht!
MOR202 Mono ohne DEX: 1,5 mg/kg bis 16 mg/kg alle 2 Wochen sowie 4 mg/kg wöchentlich -> null response
zum Vergleich:
SAR650984 Mono ohne DEX: 0,1 mg/kg bis 20 mg/kg alle 2 Wochen ->
CR 8 %, PR 17 %, MR 8 % (ASH 2013) und in Dosierungen zwischen 1 mg/kg und 20 mg/kg alle 2 Wochen -> CR 16 %, PR 16 %, MR 5 % (Asco 2014)
... und die SAR650984-Patienten waren deutlich stärker austherapiert!
MOR202 scheidet deutlich schlechter ab. Auch in Kombi mit DEX gibt es gerade mal 1 VGPR.
Zitat von BReal: Zum besseren Verständnis für Uninformierte wie mich:
Der MOR-AK wurde mit 1,5mg und 4mg dosiert und brachte hinsichtlich Response so gut wie nichts, der SAR-AK wiederum wurde mit 1mg bis 20mg dosiert und sah viel besser aus? So zumindest wurde es hier ohne weitere Detailinformationen geschrieben.
Das stimmt nicht!
MOR202 Mono ohne DEX: 1,5 mg/kg bis 16 mg/kg alle 2 Wochen sowie 4 mg/kg wöchentlich -> null response
zum Vergleich:
SAR650984 Mono ohne DEX: 0,1 mg/kg bis 20 mg/kg alle 2 Wochen ->
CR 8 %, PR 17 %, MR 8 % (ASH 2013) und in Dosierungen zwischen 1 mg/kg und 20 mg/kg alle 2 Wochen -> CR 16 %, PR 16 %, MR 5 % (Asco 2014)
... und die SAR650984-Patienten waren deutlich stärker austherapiert!
MOR202 scheidet deutlich schlechter ab. Auch in Kombi mit DEX gibt es gerade mal 1 VGPR.
Antwort auf Beitrag Nr.: 49.886.242 von Imperium1 am 01.06.15 08:50:56liebes Imperium1,
könntest Du bitte Deine Beiträge in eck´s allgemein gehaltenen Morphosys-Thread platzieren? Hier soll ausschließlich die Pipeline (incl. Bewertungsfragen) diskutiert werden.
Was den Kursverlauf betrifft, so haben heute früh tatsächlich ahnungslose Kleinanleger den Kurs bis 69,5 € in Frankfurt hochgekauft. Mittlerweile notiert die Aktie aber bei 64,4 € im Xetra-Handel ... ganz so naiv, wie Du denkst, sind die Institutionellen nun doch nicht. Dies soll´s nun aber gewesen sein, weitere Kursdiskussionen und Verlinkung zu minderwertigen Anlegerblättchen bitte in einem anderen Thread.
Vielen Dank!
könntest Du bitte Deine Beiträge in eck´s allgemein gehaltenen Morphosys-Thread platzieren? Hier soll ausschließlich die Pipeline (incl. Bewertungsfragen) diskutiert werden.
Was den Kursverlauf betrifft, so haben heute früh tatsächlich ahnungslose Kleinanleger den Kurs bis 69,5 € in Frankfurt hochgekauft. Mittlerweile notiert die Aktie aber bei 64,4 € im Xetra-Handel ... ganz so naiv, wie Du denkst, sind die Institutionellen nun doch nicht. Dies soll´s nun aber gewesen sein, weitere Kursdiskussionen und Verlinkung zu minderwertigen Anlegerblättchen bitte in einem anderen Thread.
Vielen Dank!
Daten als Erfolg zu verkaufen is wirklich irreführend. Die daten sind schwach, so wie die sind sind ganz klar schwach. Morphosys gibt as zu  r. Schottelius fügte an: "Wir halten MOR202 für einen sehr attraktiven Kombinationspartner im Bereich des multiplen Myelom.- Kann Mann auch lesen: Wir wissen das MOR202 als monotherapie aussichtslos ist...., was Joscka oben nett dargestellt hat.
r. Schottelius fügte an: "Wir halten MOR202 für einen sehr attraktiven Kombinationspartner im Bereich des multiplen Myelom.- Kann Mann auch lesen: Wir wissen das MOR202 als monotherapie aussichtslos ist...., was Joscka oben nett dargestellt hat.
Bleibt aber die hoffnung das Kombinationtherapie in der taat viel besser wird. Manchmal passiert so was. die presäntieren wider im Wien. Haben die vor wieder das gleiche zu sagen? Ich weiss nicht, Studien sind "open label" vielleicht wissen die dann schon etwas mehr ( raw data ) über grupe 16 mg+ DEX und deswegen optimistisch sind.
 r. Schottelius fügte an: "Wir halten MOR202 für einen sehr attraktiven Kombinationspartner im Bereich des multiplen Myelom.- Kann Mann auch lesen: Wir wissen das MOR202 als monotherapie aussichtslos ist...., was Joscka oben nett dargestellt hat.
r. Schottelius fügte an: "Wir halten MOR202 für einen sehr attraktiven Kombinationspartner im Bereich des multiplen Myelom.- Kann Mann auch lesen: Wir wissen das MOR202 als monotherapie aussichtslos ist...., was Joscka oben nett dargestellt hat.Bleibt aber die hoffnung das Kombinationtherapie in der taat viel besser wird. Manchmal passiert so was. die presäntieren wider im Wien. Haben die vor wieder das gleiche zu sagen? Ich weiss nicht, Studien sind "open label" vielleicht wissen die dann schon etwas mehr ( raw data ) über grupe 16 mg+ DEX und deswegen optimistisch sind.
Antwort auf Beitrag Nr.: 49.885.453 von Joschka Schröder am 01.06.15 00:07:38Vielen Dank für die Richtigstellung, Du hast offensichtlich recht.
Ob ein alleiniges Setzen auf Kombo oder das Sicherheits-/Wirksamkeitsprofil tatsächlich die weitere Arbeit an diesem Projekt rechtfertigt? Ich hoffe, man weiß, was man tut.
Ob ein alleiniges Setzen auf Kombo oder das Sicherheits-/Wirksamkeitsprofil tatsächlich die weitere Arbeit an diesem Projekt rechtfertigt? Ich hoffe, man weiß, was man tut.
In der MOR208-Präsentation gibt es im Vergleich zum bereits bekannten Abstract wenig Neues.
Angesichts dessen, dass 41 % der mit MOR208 behandelten Patienten Nebenwirkungen des Schweregrads 3 und mehr aufweisen, ist das Zitat in der heutigen Meldung ("Die dabei beobachtete gute Verträglichkeit des Wirkstoffs unterstützt unsere Absicht, ihn in Kombinationen mit anderen Therapieansätzen zu untersuchen", kommentierte Dr. Arndt Schottelius, Entwicklungsvorstand der MorphoSys AG) schwer nachvollziehbar.
Angesichts dessen, dass 41 % der mit MOR208 behandelten Patienten Nebenwirkungen des Schweregrads 3 und mehr aufweisen, ist das Zitat in der heutigen Meldung ("Die dabei beobachtete gute Verträglichkeit des Wirkstoffs unterstützt unsere Absicht, ihn in Kombinationen mit anderen Therapieansätzen zu untersuchen", kommentierte Dr. Arndt Schottelius, Entwicklungsvorstand der MorphoSys AG) schwer nachvollziehbar.
Im Zusammenhang mit CD19/MOR208 von Interesse (Meldung von gestern):
Novartis highlights CTL019 data showing its potential in the treatment of specific types of hard-to-treat non-Hodgkin lymphoma
Data show adult patients may achieve durable response rates, with 13 of 19 evaluable patients with relapsed/refractory non-Hodgkin lymphomas responding to therapy[1]
Recent milestones for Novartis CAR therapy program include initiation of global Phase II multi-center CTL019 study and activation of cell processing facility
Data also highlight preliminary safety and efficacy data for CTL019 in other indications
Basel, Switzerland, June 1, 2015 - Novartis is highlighting data from an ongoing Phase II clinical study of CTL019, an investigational chimeric antigen receptor (CAR) T cell therapy, that indicate its potential in the treatment of specific types of hard-to-treat non-Hodgkin lymphoma. Findings from the ongoing study conducted by the University of Pennsylvania's Perelman School of Medicine (Penn) in adults with relapsed or refractory (r/r) diffuse large B-cell lymphoma (DLBCL) and follicular lymphoma (FL) found an overall response rate (ORR) of 100% in patients with FL and 50% in patients with DLBCL[1]. Thirteen of 19 evaluable patients responded to the therapy. Eleven achieved a complete response (CR) and two experienced a partial response (PR) to treatment[1]. These results will be presented in an oral session at the 51st American Society of Clinical Oncology (ASCO) Annual Meeting on Monday, June 1 (Abstract #8516, June 1, 3:24 p.m. CDT)[1].
"The results from this ongoing study of CTL019 are encouraging, as we now have data through six months showing that patients may have achieved durable overall response rates," said lead investigator Stephen Schuster, M.D., associate professor, division of Hematology/Oncology at the University of Pennsylvania, Abramson Cancer Center. "These data support our ongoing efforts to determine the potential role of CTL019 in improving outcomes for patients with certain types of B-cell lymphomas."
Study results include 19 adult patients (12 with DLBCL and seven with FL) who were evaluable for response[1]. The study found that six patients with a PR to treatment at three months achieved a CR by six months[1]. Two patients with a PR experienced disease progression at 6 and 12 months after treatment[1]. Median patient follow-up is 274 days for the patients with DLBCL and 290 days for the patients with FL[1]. In the study, two patients developed cytokine release syndrome (CRS) of grade 3 or higher at peak T cell expansion[1].
"These new CTL019 findings are inspiring as we continue clinical research with our collaborators at the University of Pennsylvania, with the goal of altering the course of cancer care and treating areas of critical unmet need," said Usman Azam, Global Head, Cell & Gene Therapies Unit, Novartis Pharmaceuticals. "As Novartis initiates the Phase II multi-center global study of CTL019, this reinforces our commitment to furthering the new frontier of cell and gene therapies."
Additional CTL019 data being presented at ASCO include the preliminary safety and efficacy findings of a Phase I study investigating the use of CTL019 in the treatment of multiple myeloma (Abstract #8517, June 1, 3:36 p.m. CDT)[2]. This study adds to the growing body of data on CARTs and supports the advancement of the expanding pre-clinical and early clinical research pipeline at Novartis.
Novartis has initiated a Phase II multi-center global study of CTL019 in pediatric patients with r/r acute lymphoblastic leukemia (ALL). This study has opened in the United States, with the intention of expanding into other countries as soon as possible. Further, Novartis has begun to process patient cells at its cell processing facility in Morris Plains, N.J., and will utilize the facility in the Phase II multi-center global study. The facility is the first US Food and Drug Administration (FDA)-approved Good Manufacturing Practices quality site for a cell therapy.
Novartis and Penn have an exclusive global collaboration to research, develop and commercialize CAR T cell therapies for the investigational treatment of cancers. In July 2014, the FDA designated CTL019 as a Breakthrough Therapy for the treatment of pediatric and adult patients with r/r ALL under the Penn Investigational New Drug application (IND). Breakthrough Therapy designation is intended to expedite the development and review of drugs that treat serious or life-threatening conditions if the therapy has demonstrated substantial improvement over an available therapy on at least one clinically significant endpoint. Novartis holds the worldwide rights to CARs developed through the collaboration with Penn for all cancer indications, including the lead program, CTL019.
Novartis highlights CTL019 data showing its potential in the treatment of specific types of hard-to-treat non-Hodgkin lymphoma
Data show adult patients may achieve durable response rates, with 13 of 19 evaluable patients with relapsed/refractory non-Hodgkin lymphomas responding to therapy[1]
Recent milestones for Novartis CAR therapy program include initiation of global Phase II multi-center CTL019 study and activation of cell processing facility
Data also highlight preliminary safety and efficacy data for CTL019 in other indications
Basel, Switzerland, June 1, 2015 - Novartis is highlighting data from an ongoing Phase II clinical study of CTL019, an investigational chimeric antigen receptor (CAR) T cell therapy, that indicate its potential in the treatment of specific types of hard-to-treat non-Hodgkin lymphoma. Findings from the ongoing study conducted by the University of Pennsylvania's Perelman School of Medicine (Penn) in adults with relapsed or refractory (r/r) diffuse large B-cell lymphoma (DLBCL) and follicular lymphoma (FL) found an overall response rate (ORR) of 100% in patients with FL and 50% in patients with DLBCL[1]. Thirteen of 19 evaluable patients responded to the therapy. Eleven achieved a complete response (CR) and two experienced a partial response (PR) to treatment[1]. These results will be presented in an oral session at the 51st American Society of Clinical Oncology (ASCO) Annual Meeting on Monday, June 1 (Abstract #8516, June 1, 3:24 p.m. CDT)[1].
"The results from this ongoing study of CTL019 are encouraging, as we now have data through six months showing that patients may have achieved durable overall response rates," said lead investigator Stephen Schuster, M.D., associate professor, division of Hematology/Oncology at the University of Pennsylvania, Abramson Cancer Center. "These data support our ongoing efforts to determine the potential role of CTL019 in improving outcomes for patients with certain types of B-cell lymphomas."
Study results include 19 adult patients (12 with DLBCL and seven with FL) who were evaluable for response[1]. The study found that six patients with a PR to treatment at three months achieved a CR by six months[1]. Two patients with a PR experienced disease progression at 6 and 12 months after treatment[1]. Median patient follow-up is 274 days for the patients with DLBCL and 290 days for the patients with FL[1]. In the study, two patients developed cytokine release syndrome (CRS) of grade 3 or higher at peak T cell expansion[1].
"These new CTL019 findings are inspiring as we continue clinical research with our collaborators at the University of Pennsylvania, with the goal of altering the course of cancer care and treating areas of critical unmet need," said Usman Azam, Global Head, Cell & Gene Therapies Unit, Novartis Pharmaceuticals. "As Novartis initiates the Phase II multi-center global study of CTL019, this reinforces our commitment to furthering the new frontier of cell and gene therapies."
Additional CTL019 data being presented at ASCO include the preliminary safety and efficacy findings of a Phase I study investigating the use of CTL019 in the treatment of multiple myeloma (Abstract #8517, June 1, 3:36 p.m. CDT)[2]. This study adds to the growing body of data on CARTs and supports the advancement of the expanding pre-clinical and early clinical research pipeline at Novartis.
Novartis has initiated a Phase II multi-center global study of CTL019 in pediatric patients with r/r acute lymphoblastic leukemia (ALL). This study has opened in the United States, with the intention of expanding into other countries as soon as possible. Further, Novartis has begun to process patient cells at its cell processing facility in Morris Plains, N.J., and will utilize the facility in the Phase II multi-center global study. The facility is the first US Food and Drug Administration (FDA)-approved Good Manufacturing Practices quality site for a cell therapy.
Novartis and Penn have an exclusive global collaboration to research, develop and commercialize CAR T cell therapies for the investigational treatment of cancers. In July 2014, the FDA designated CTL019 as a Breakthrough Therapy for the treatment of pediatric and adult patients with r/r ALL under the Penn Investigational New Drug application (IND). Breakthrough Therapy designation is intended to expedite the development and review of drugs that treat serious or life-threatening conditions if the therapy has demonstrated substantial improvement over an available therapy on at least one clinically significant endpoint. Novartis holds the worldwide rights to CARs developed through the collaboration with Penn for all cancer indications, including the lead program, CTL019.
Und noch ein Blick über den Tellerrand:
SGEN kooperiert mit einem neuen Unternehmen namens Unum, die an sogenannten ACTR´s (oder gewissermaßen an dem ACTR).
Hier ein kurzer Artikel dazu, der das Prinzip relativ gut verständlich erläutert:
http://epvantage.com/Universal/View.aspx?type=Story&id=57917…
Natürlich... niemand weiß, ob da je was draus wird, aber das ist nicht der Punkt. Der Punkt ist vielmehr, dass es da draußen immer mehr ganz neue Ansätze und Technologien gibt und dass MorphoSys auf mich (ganz subjektive Laienmeinung) einfach sehr altbacken wirkt.
(Persönlich finde ich die grundsätzliche Idee hinter den ACTR extrem sexy!)
SGEN kooperiert mit einem neuen Unternehmen namens Unum, die an sogenannten ACTR´s (oder gewissermaßen an dem ACTR).
Hier ein kurzer Artikel dazu, der das Prinzip relativ gut verständlich erläutert:
http://epvantage.com/Universal/View.aspx?type=Story&id=57917…
Natürlich... niemand weiß, ob da je was draus wird, aber das ist nicht der Punkt. Der Punkt ist vielmehr, dass es da draußen immer mehr ganz neue Ansätze und Technologien gibt und dass MorphoSys auf mich (ganz subjektive Laienmeinung) einfach sehr altbacken wirkt.
(Persönlich finde ich die grundsätzliche Idee hinter den ACTR extrem sexy!)
Antwort auf Beitrag Nr.: 49.900.258 von Joschka Schröder am 02.06.15 22:54:36Ein Überblick, was im CD19-Bereich so abgeht (und das ist bestimmt nicht vollständig):


BPS804 überraschend reanimiert!
Basel, July 29, 2015 - Novartis announced today a swap of clinical assets for equity with Mereo BioPharma Group Ltd. The deal involves compounds in areas of unmet medical need including BPS-804, to improve bone density in brittle bone syndrome, an orphan disease; BCT-197 for acute exacerbations in COPD, and BGS-649 for obese men with hypogonadotrophic hypogonadism to normalize testosterone levels.
Under the terms of the agreement, Novartis will have an equity stake in Mereo and will share in the success of the development of these compounds, including a share on milestones and royalties on future commercial sales.
"We are pleased that through this deal with Mereo we have found a way to work together to bring these valued innovations to patients," said David Epstein, Head of Novartis Pharmaceuticals.
Mereo is a recently formed specialty biopharmaceutical company based in the UK who focuses on the acquisition and development of innovative medicines, particularly in rare and specialist disease areas, through the acquisition of validated, mid stage development programs.
In der heutigen F.A.Z. findet sich in "Natur und Wissenschaft" eine längere Diskussion über M.Alzheimer incl. Amyloid-These. Inhaltlich wenig Neues, aber dennoch lesenswert.
Basel, July 29, 2015 - Novartis announced today a swap of clinical assets for equity with Mereo BioPharma Group Ltd. The deal involves compounds in areas of unmet medical need including BPS-804, to improve bone density in brittle bone syndrome, an orphan disease; BCT-197 for acute exacerbations in COPD, and BGS-649 for obese men with hypogonadotrophic hypogonadism to normalize testosterone levels.
Under the terms of the agreement, Novartis will have an equity stake in Mereo and will share in the success of the development of these compounds, including a share on milestones and royalties on future commercial sales.
"We are pleased that through this deal with Mereo we have found a way to work together to bring these valued innovations to patients," said David Epstein, Head of Novartis Pharmaceuticals.
Mereo is a recently formed specialty biopharmaceutical company based in the UK who focuses on the acquisition and development of innovative medicines, particularly in rare and specialist disease areas, through the acquisition of validated, mid stage development programs.
In der heutigen F.A.Z. findet sich in "Natur und Wissenschaft" eine längere Diskussion über M.Alzheimer incl. Amyloid-These. Inhaltlich wenig Neues, aber dennoch lesenswert.
Antwort auf Beitrag Nr.: 50.287.455 von Joschka Schröder am 29.07.15 09:35:26wird nun auch wieder in der Pipeline geführt
http://www.morphosys.de/pipeline
verstehe nur nicht ganz warum sie den einst eingestampften AK weitergeben?
http://www.morphosys.de/pipeline
verstehe nur nicht ganz warum sie den einst eingestampften AK weitergeben?
Antwort auf Beitrag Nr.: 50.292.891 von schnappi am 29.07.15 18:40:53Kann mal jemand eine historische Pipeline von MOR reinstellen, in der BPS-804 aufgeführt war? Wann wurde das Programm aus der Pipeline entfernt?
Antwort auf Beitrag Nr.: 50.292.891 von schnappi am 29.07.15 18:40:53
Die Frage stelle ich mir auch. Wenn Novartis da kein Geld mehr reinstecken wollte, warum dann jemand anders?
Zitat von schnappi: wird nun auch wieder in der Pipeline geführt
http://www.morphosys.de/pipeline
verstehe nur nicht ganz warum sie den einst eingestampften AK weitergeben?
Die Frage stelle ich mir auch. Wenn Novartis da kein Geld mehr reinstecken wollte, warum dann jemand anders?
Antwort auf Beitrag Nr.: 50.293.638 von riverstar_de am 29.07.15 20:28:25Wenn ich mich recht erinnere, war nie ganz klar, aus welchen Gründen (wegen welcher Nebenwirkungen) die Entwicklung des Antikörpers von Novartis eingestellt worden ist.
Mereo möchte BPS804 der Meldung zufolge ausschließlich in der Indikation Osteogenesis imperfecta weiterentwickeln. Möglicherweise sind in dieser Indikation die beobachteten "Nachteile" weniger relevant als z.B. in marktbreiten Indikationen wie Osteoporose (= ursprüngliche Hauptindikation).
Mereo möchte BPS804 der Meldung zufolge ausschließlich in der Indikation Osteogenesis imperfecta weiterentwickeln. Möglicherweise sind in dieser Indikation die beobachteten "Nachteile" weniger relevant als z.B. in marktbreiten Indikationen wie Osteoporose (= ursprüngliche Hauptindikation).
Antwort auf Beitrag Nr.: 50.294.244 von Joschka Schröder am 29.07.15 22:07:35 ... und die Weiterentwicklung eines Medikamentenkandidaten für ein kommerziell limitiertes Indikationsgebiet lohnt sich nicht für ein Big Player wie Novartis. Mehr wird man erst sagen können, wenn irgendwann einmal Studiendaten publiziert werden sollten.
Danke, Joschka für die Info über BPS-804.
Welche "Nachteile" in den anderen Indikationen könnten das gewesen sein? Und wieso entwickelt die Konkurrenz ihre AKs in diesen Indikationen munter weiter?
Welche "Nachteile" in den anderen Indikationen könnten das gewesen sein? Und wieso entwickelt die Konkurrenz ihre AKs in diesen Indikationen munter weiter?
Handelt es sich bei "Filgotinib" um Mor106?
http://seekingalpha.com/news/2676205-galapagoss-filgotinib-s…
http://seekingalpha.com/news/2676205-galapagoss-filgotinib-s…
Antwort auf Beitrag Nr.: 50.316.738 von milchbubi am 02.08.15 22:36:30
nö, steht ja da: Galapagos
Zitat von milchbubi: Handelt es sich bei "Filgotinib" um Mor106?
http://seekingalpha.com/news/2676205-galapagoss-filgotinib-s…
nö, steht ja da: Galapagos
Sicher?
MOR106 ist doch ein Wirkstoff, der zusammen mit Galapagos entwickelt wird, dessen Wirkmechanismus nicht veröffentlicht wurde. Und es würde doch auch paasen.
28.07.2014 ..."MOR106 - Gemeinsames Entwicklungsprogramm mit Galapagos in Präklinik
Das Ziel der Zusammenarbeit zwischen MorphoSys und Galapagos ist die Erforschung und Entwicklung von Antikörpertherapien mit neuartigen Wirkmechanismen für Knochen- und Gelenkserkrankungen wie rheumatoider Arthritis, Osteoporose und Osteoarthritis. Das erste gemeinsame Entwicklungsprogramm ist kürzlich in die präklinische Phase eingetreten. Bei dem Programm mit dem Namen MOR106 handelt es sich um einen Antikörper, der MorphoSys' jüngster Antikörperbibliothek Ylanthia entstammt und gegen entzündliche Krankheiten entwickelt wird...
http://www.morphosys.com/node/6078
MOR106 ist doch ein Wirkstoff, der zusammen mit Galapagos entwickelt wird, dessen Wirkmechanismus nicht veröffentlicht wurde. Und es würde doch auch paasen.
28.07.2014 ..."MOR106 - Gemeinsames Entwicklungsprogramm mit Galapagos in Präklinik
Das Ziel der Zusammenarbeit zwischen MorphoSys und Galapagos ist die Erforschung und Entwicklung von Antikörpertherapien mit neuartigen Wirkmechanismen für Knochen- und Gelenkserkrankungen wie rheumatoider Arthritis, Osteoporose und Osteoarthritis. Das erste gemeinsame Entwicklungsprogramm ist kürzlich in die präklinische Phase eingetreten. Bei dem Programm mit dem Namen MOR106 handelt es sich um einen Antikörper, der MorphoSys' jüngster Antikörperbibliothek Ylanthia entstammt und gegen entzündliche Krankheiten entwickelt wird...
http://www.morphosys.com/node/6078
Antwort auf Beitrag Nr.: 50.317.080 von milchbubi am 03.08.15 05:44:29
ja, sicher, weil da steht: from a 594-subject Phase 2b clinical trial,
Zitat von milchbubi: Sicher?
MOR106 ist doch ein Wirkstoff, der zusammen mit Galapagos entwickelt wird, dessen Wirkmechanismus nicht veröffentlicht wurde. Und es würde doch auch paasen.
28.07.2014 ..."MOR106 - Gemeinsames Entwicklungsprogramm mit Galapagos in Präklinik
Das Ziel der Zusammenarbeit zwischen MorphoSys und Galapagos ist die Erforschung und Entwicklung von Antikörpertherapien mit neuartigen Wirkmechanismen für Knochen- und Gelenkserkrankungen wie rheumatoider Arthritis, Osteoporose und Osteoarthritis. Das erste gemeinsame Entwicklungsprogramm ist kürzlich in die präklinische Phase eingetreten. Bei dem Programm mit dem Namen MOR106 handelt es sich um einen Antikörper, der MorphoSys' jüngster Antikörperbibliothek Ylanthia entstammt und gegen entzündliche Krankheiten entwickelt wird...
http://www.morphosys.com/node/6078
ja, sicher, weil da steht: from a 594-subject Phase 2b clinical trial,
Antwort auf Beitrag Nr.: 50.316.738 von milchbubi am 02.08.15 22:36:30Bei filgotinib handelt es, wie es bereits der Name impliziert, nicht um einen Antikörper.
Antwort auf Beitrag Nr.: 50.297.085 von Ville7 am 30.07.15 10:49:44@Ville
Eine befriedigende Antwort, die über vage Spekulationen hinausgeht, habe ich derzeit leider auch nicht. Bisher hatte ich auch noch keine Gelegenheit, mit Osteologen zu sprechen, die sich schwerpunktmäßig mit der Entwicklung derartiger Substanzen beschäftigen.
Eine befriedigende Antwort, die über vage Spekulationen hinausgeht, habe ich derzeit leider auch nicht. Bisher hatte ich auch noch keine Gelegenheit, mit Osteologen zu sprechen, die sich schwerpunktmäßig mit der Entwicklung derartiger Substanzen beschäftigen.
Antwort auf Beitrag Nr.: 50.317.833 von Joschka Schröder am 03.08.15 09:28:53
Könntest Du Leuten, die nicht so genau wissen, wie sie Medikamentenbezeichnungen lesen müssen, ein paar kleine Hinweise geben? Du bist doch hier der "Spezialist"...
@ milchbubi: Medikamentengruppen erkennt man an deren Namensendungen wie z.B. "-mab" für monoclonal antibody. Man kann auch erkennen, ob dieser human oder murin bzw. humanisiert ist usw.
"-tinib" steht für "tyrosine kinase inhibitor" und das sind sog. small molecules, die in der Krebsbehandlung ebenfalls eine große Rolle spielen.
Zitat von Joschka Schröder: Bei filgotinib handelt es, wie es bereits der Name impliziert, nicht um einen Antikörper.
Könntest Du Leuten, die nicht so genau wissen, wie sie Medikamentenbezeichnungen lesen müssen, ein paar kleine Hinweise geben? Du bist doch hier der "Spezialist"...
@ milchbubi: Medikamentengruppen erkennt man an deren Namensendungen wie z.B. "-mab" für monoclonal antibody. Man kann auch erkennen, ob dieser human oder murin bzw. humanisiert ist usw.
"-tinib" steht für "tyrosine kinase inhibitor" und das sind sog. small molecules, die in der Krebsbehandlung ebenfalls eine große Rolle spielen.
Antwort auf Beitrag Nr.: 50.318.562 von Milestones am 03.08.15 11:00:53Danke für die Erläuterung! 

Amgen/UCB´s anti-sclerostin-Mab Romosozumab hat es geschafft ... schade, dass BPS804 in dieser wichtigen und lukrativen Indikation gescheitert ist.
Primary Endpoint Met in Study of Postmenopausal Women with Osteoporosis Transitioning From Bisphosphonate Treatment
BRUSSELS, BELGIUM and THOUSAND OAKS, Calif. (Sept. 01, 2015) – UCB (Euronext Brussels: UCB) and Amgen (NASDAQ:AMGN) today announced top-line results from the STRUCTURE trial (STudy evaluating effect of RomosozUmab Compared with Teriparatide in postmenopaUsal women with osteoporosis at high risk for fracture pReviously treated with bisphosphonatE therapy). The study (NCT01796301) met the primary endpoint, demonstrating a statistically significant difference in favor of romosozumab in the percent change of total hip bone mineral density (measured by DXA) through month 12.1
STRUCTURE was a Phase 3, multi-center, international, randomized, open-label, teriparatide-controlled study that evaluated the safety, tolerability and efficacy of romosozumab in women with postmenopausal osteoporosis. A total of 436 patients previously treated with bisphosphonate therapy received either subcutaneous romosozumab (210 mg monthly) or subcutaneous teriparatide (20 mcg daily) through to month 12.1
The overall subject incidence of adverse events was generally balanced between arms. Adverse events in patients treated with romosozumab were similar to those previously reported and no new safety signals were detected. Adverse events reported in the romosozumab arm in more than five percent of patients were nasopharyngitis, arthralgia, back pain, headache and fall.1 Further analysis of the STRUCTURE study results are ongoing and will be submitted to a future medical conference and for publication.
About Romosozumab
Romosozumab is an investigational bone-forming agent and is not approved by any regulatory authority for the treatment of osteoporosis. It is designed to work by inhibiting the protein sclerostin, thereby increasing bone formation and decreasing bone breakdown.2 Romosozumab is being studied for its potential to reduce the risk of fractures in an extensive global Phase 3 program. This program includes two large fracture trials comparing romosozumab to either placebo or active comparator in more than 10,000 postmenopausal women with osteoporosis. First results from the Phase 3 study FRAME are expected in H1 2016. Romosozumab is being co-developed by Amgen and UCB.
Primary Endpoint Met in Study of Postmenopausal Women with Osteoporosis Transitioning From Bisphosphonate Treatment
BRUSSELS, BELGIUM and THOUSAND OAKS, Calif. (Sept. 01, 2015) – UCB (Euronext Brussels: UCB) and Amgen (NASDAQ:AMGN) today announced top-line results from the STRUCTURE trial (STudy evaluating effect of RomosozUmab Compared with Teriparatide in postmenopaUsal women with osteoporosis at high risk for fracture pReviously treated with bisphosphonatE therapy). The study (NCT01796301) met the primary endpoint, demonstrating a statistically significant difference in favor of romosozumab in the percent change of total hip bone mineral density (measured by DXA) through month 12.1
STRUCTURE was a Phase 3, multi-center, international, randomized, open-label, teriparatide-controlled study that evaluated the safety, tolerability and efficacy of romosozumab in women with postmenopausal osteoporosis. A total of 436 patients previously treated with bisphosphonate therapy received either subcutaneous romosozumab (210 mg monthly) or subcutaneous teriparatide (20 mcg daily) through to month 12.1
The overall subject incidence of adverse events was generally balanced between arms. Adverse events in patients treated with romosozumab were similar to those previously reported and no new safety signals were detected. Adverse events reported in the romosozumab arm in more than five percent of patients were nasopharyngitis, arthralgia, back pain, headache and fall.1 Further analysis of the STRUCTURE study results are ongoing and will be submitted to a future medical conference and for publication.
About Romosozumab
Romosozumab is an investigational bone-forming agent and is not approved by any regulatory authority for the treatment of osteoporosis. It is designed to work by inhibiting the protein sclerostin, thereby increasing bone formation and decreasing bone breakdown.2 Romosozumab is being studied for its potential to reduce the risk of fractures in an extensive global Phase 3 program. This program includes two large fracture trials comparing romosozumab to either placebo or active comparator in more than 10,000 postmenopausal women with osteoporosis. First results from the Phase 3 study FRAME are expected in H1 2016. Romosozumab is being co-developed by Amgen and UCB.
Habe mir eben die heutige Präsentation angesehen. Vieles scheint zu einseitig und optimistisch dargestellt. Z.B. hat man MOR208 mit Medi-551 und einigen anti-CD20-Mabs verglichen. Kein Wort aber zu wesentlichen, konkurrierenden Neuentwicklungen wie Adcetris, SAR3419, IMGN529 usw. ...
Auch die rosarote Betrachtung des MOR202 ("First clinical data hint towards a balanced and potentially best-in-class safety/efficacy profile") ist nicht nachvollziehbar.
Und was soll´s, jetzt schon bei MOR209 von "Phase3 preparations" für 2018 zu sprechen, wo doch noch nicht einmal früheste klinische Daten vorliegen? Kein Wort im übrigen zur Konkurrenzsituation.
Keine Ahnung, was die heutige Veranstaltungen an wirklich neuen Informationen bringen sollte außer der Vermittlung des Sachverhalts, dass die F&E-Kosten in den nächsten Jahren deutlich steigen werden.
Auch die rosarote Betrachtung des MOR202 ("First clinical data hint towards a balanced and potentially best-in-class safety/efficacy profile") ist nicht nachvollziehbar.
Und was soll´s, jetzt schon bei MOR209 von "Phase3 preparations" für 2018 zu sprechen, wo doch noch nicht einmal früheste klinische Daten vorliegen? Kein Wort im übrigen zur Konkurrenzsituation.
Keine Ahnung, was die heutige Veranstaltungen an wirklich neuen Informationen bringen sollte außer der Vermittlung des Sachverhalts, dass die F&E-Kosten in den nächsten Jahren deutlich steigen werden.
Antwort auf Beitrag Nr.: 50.581.913 von Joschka Schröder am 08.09.15 19:01:25
Nicht zu vergessen: CART-19/CLT019 und insbesondere auch der Bcl2-Inhibitor ABT-199 von AbbVie und Roche!
Zitat von Joschka Schröder: Habe mir eben die heutige Präsentation angesehen. Vieles scheint zu einseitig und optimistisch dargestellt. Z.B. hat man MOR208 mit Medi-551 und einigen anti-CD20-Mabs verglichen. Kein Wort aber zu wesentlichen, konkurrierenden Neuentwicklungen wie Adcetris, SAR3419, IMGN529 usw. ...
Nicht zu vergessen: CART-19/CLT019 und insbesondere auch der Bcl2-Inhibitor ABT-199 von AbbVie und Roche!
Eine Bimagrumab-Zulassung in der Indikation "Sporadic Inclusion Body Myositis" dürfte noch länger auf sich warten lassen. Novartis hat nun noch eine zusätzliche Sicherheits- und Effizienzstudie eingeschoben, die bis Dezember 2017 laufen soll -> https://clinicaltrials.gov/show/NCT02573467
Antwort auf Beitrag Nr.: 50.821.563 von Joschka Schröder am 11.10.15 09:55:35"Patients who complete the core study and qualify for this extension study will enter Treatment Period 1, during which they will continue on the study drug which they were receiving in the core study (either one of the three BYM338 doses or placebo). Treatment Period 1 will continue until the dose of BYM338 with the best benefit-risk profile is determined and selected. The duration of Treatment Period 1 could be up to one year (but estimated to be between 6 and 8 months) and the total duration of Treatment Period 1 will depend upon the timing of selection of the dose for Treatment Period 2. Once the dose with the best benefit-risk profile is selected, all ongoing subjects (including those who have been receiving placebo) will enter Treatment Period 2 and will be switched to open-label treatment with BYM338 at the selected dose. Treatment Period 2 will continue until BYM338 is approved and commercially available in the country of the investigational site."
Für Ende Dezember 2017 wird mit der Datenauswertung (Final data collection date for primary outcome measure) gerechnet.
Noch zwei konkurrierende Studien/Therapieansätze:
Natalizumab (Tysabri) -> https://clinicaltrials.gov/ct2/show/NCT02483845?term=Inclusi…
Rapamycin -> https://clinicaltrials.gov/ct2/show/NCT02481453?term=Inclusi…
Für Ende Dezember 2017 wird mit der Datenauswertung (Final data collection date for primary outcome measure) gerechnet.
Noch zwei konkurrierende Studien/Therapieansätze:
Natalizumab (Tysabri) -> https://clinicaltrials.gov/ct2/show/NCT02483845?term=Inclusi…
Rapamycin -> https://clinicaltrials.gov/ct2/show/NCT02481453?term=Inclusi…
Betrifft Guselkumab:
Neueste Daten und ausfürliche Informationen zum Konkurrenzprodukt Cosentyx (secukinumab) von Novartis finden sich hier -> http://multimediacapsule.thomsonone.com/novartis/novartis-pr…
Neueste Daten und ausfürliche Informationen zum Konkurrenzprodukt Cosentyx (secukinumab) von Novartis finden sich hier -> http://multimediacapsule.thomsonone.com/novartis/novartis-pr…
Antwort auf Beitrag Nr.: 50.581.913 von Joschka Schröder am 08.09.15 19:01:25Wer hier seine Kohle anlegt ist selber schuld.
Morphosys hat noch nicht einmal seit Jahren mit adequaten Ergebnissen geglänzt.
Ständig werden die Erwartungen wieder eingestampft.
Verbrannte Kohle Morphosys
Mehr gibts nicht zu sagen.
Morphosys hat noch nicht einmal seit Jahren mit adequaten Ergebnissen geglänzt.
Ständig werden die Erwartungen wieder eingestampft.
Verbrannte Kohle Morphosys
Mehr gibts nicht zu sagen.
Antwort auf Beitrag Nr.: 50.827.575 von Fluglotse am 12.10.15 12:21:38und warum beobachtest und interessierst Du dich dann für Morphosys?
Wenn mich eine Aktie überhaupt rein gar nicht nie und nimmer interessiert, dann würde ich auch nichts drüber lesen oder suchen wollen. Geschweige denn in einem Forum.
Deine Ratschläge sind sicherlich gut gemeint und Du bist ganz ganz sicher auch nur ein sehr großherziger Mensch, der sich um das Geld und Wohlbefinden der Anderen sorgt.
Aber ich denke, Du solltest jedem selbst überlassen, ob er hier sein Geld investiert oder nicht!
Wenn mich eine Aktie überhaupt rein gar nicht nie und nimmer interessiert, dann würde ich auch nichts drüber lesen oder suchen wollen. Geschweige denn in einem Forum.
Deine Ratschläge sind sicherlich gut gemeint und Du bist ganz ganz sicher auch nur ein sehr großherziger Mensch, der sich um das Geld und Wohlbefinden der Anderen sorgt.
Aber ich denke, Du solltest jedem selbst überlassen, ob er hier sein Geld investiert oder nicht!
Antwort auf Beitrag Nr.: 50.830.494 von milchbubi am 12.10.15 17:32:31
Bís jetzt ist Morphosys noch alles schuldig geblieben. Wenn Guselkumab auch noch pfloppt, dann war es das erst einmal. Es nützt halt nichts die Statistik suf seiner Seite zu haben, nach dem Motto - es muss ja irgendwas die Zulassung bekommen.
Aber einen eigenen Vertrieb aufbauen wollen.
Die sind nicht mal in der Lage und gewillt die Zahlen von Joschka zu bestätigen, was die Einlizensierung von Xencor anbetrifft. Xencor wiederum gibt das gern öffenlich bekannn und informiert jeden deres wissen will. Moroney kommt mir immer mehr wie Frau Merkel vor - irgendwie ein bisschen Realitätsverlust, aber wir schaffen das.
Zitat von milchbubi: und warum beobachtest und interessierst Du dich dann für Morphosys?
Wenn mich eine Aktie überhaupt rein gar nicht nie und nimmer interessiert, dann würde ich auch nichts drüber lesen oder suchen wollen. Geschweige denn in einem Forum.
Deine Ratschläge sind sicherlich gut gemeint und Du bist ganz ganz sicher auch nur ein sehr großherziger Mensch, der sich um das Geld und Wohlbefinden der Anderen sorgt.
Aber ich denke, Du solltest jedem selbst überlassen, ob er hier sein Geld investiert oder nicht!
Bís jetzt ist Morphosys noch alles schuldig geblieben. Wenn Guselkumab auch noch pfloppt, dann war es das erst einmal. Es nützt halt nichts die Statistik suf seiner Seite zu haben, nach dem Motto - es muss ja irgendwas die Zulassung bekommen.
Aber einen eigenen Vertrieb aufbauen wollen.
Die sind nicht mal in der Lage und gewillt die Zahlen von Joschka zu bestätigen, was die Einlizensierung von Xencor anbetrifft. Xencor wiederum gibt das gern öffenlich bekannn und informiert jeden deres wissen will. Moroney kommt mir immer mehr wie Frau Merkel vor - irgendwie ein bisschen Realitätsverlust, aber wir schaffen das.
Antwort auf Beitrag Nr.: 50.831.595 von riverstar_de am 12.10.15 20:01:48ich glaube es ist hier im Forum auch etwas Frust von uns Anlegern mit im Spiel, da wir ungeduldig werden und manchmal anmaßend werden.
Ich glaube einfach, dass ein Unternehmen wie Morphosys schlichtweg nicht auf jede Anfrage eine Antwort geben wollen. Was jedoch nicht heißen muss, dass sie etwas zu verbergen haben. Sie werden ihre Gründe haben, nicht jede Anfrage zu beantworten.
Auch ich bin derzeit ungeduldig. Kommen jedoch gute News und steigt der Kurs, dann jubelt auch wieder jeder.
Ich glaube einfach, dass ein Unternehmen wie Morphosys schlichtweg nicht auf jede Anfrage eine Antwort geben wollen. Was jedoch nicht heißen muss, dass sie etwas zu verbergen haben. Sie werden ihre Gründe haben, nicht jede Anfrage zu beantworten.
Auch ich bin derzeit ungeduldig. Kommen jedoch gute News und steigt der Kurs, dann jubelt auch wieder jeder.
Antwort auf Beitrag Nr.: 50.830.494 von milchbubi am 12.10.15 17:32:31
Ich habe Morphosys schon getradet als Förtsch noch Dausend schrie.
Als sie vor einigen Jahren bei 10 Stand wieder.
Ich broabachte diese Firma nun über 15 Jahre....
Was ist denn bitte bis dato erfolgreich seitens Morphosys oder derer support auf dem Markt platziert worden ?
Nix....
Quantität in der Pipeline aber keinerlei Qualität ausserhalb der Pipeline...
Und so wird es weiter gehen...my 2 cents
Mim bissi Glück gibts n Übernahmeangebot irgendwann...
Zitat von milchbubi: und warum beobachtest und interessierst Du dich dann für Morphosys?
Wenn mich eine Aktie überhaupt rein gar nicht nie und nimmer interessiert, dann würde ich auch nichts drüber lesen oder suchen wollen. Geschweige denn in einem Forum.
Deine Ratschläge sind sicherlich gut gemeint und Du bist ganz ganz sicher auch nur ein sehr großherziger Mensch, der sich um das Geld und Wohlbefinden der Anderen sorgt.
Aber ich denke, Du solltest jedem selbst überlassen, ob er hier sein Geld investiert oder nicht!
Ich habe Morphosys schon getradet als Förtsch noch Dausend schrie.
Als sie vor einigen Jahren bei 10 Stand wieder.
Ich broabachte diese Firma nun über 15 Jahre....
Was ist denn bitte bis dato erfolgreich seitens Morphosys oder derer support auf dem Markt platziert worden ?
Nix....
Quantität in der Pipeline aber keinerlei Qualität ausserhalb der Pipeline...
Und so wird es weiter gehen...my 2 cents
Mim bissi Glück gibts n Übernahmeangebot irgendwann...
Antwort auf Beitrag Nr.: 50.831.595 von riverstar_de am 12.10.15 20:01:48was heißt: wenn jetzt Guselkumab auch noch floppt?
Wurde irgendwas abgeblasen? Wurden irgendwelche fixen Termine was die Zulassung eines Kanditaten betrifft genannt?
Hab ich was verpasst????
Wurde irgendwas abgeblasen? Wurden irgendwelche fixen Termine was die Zulassung eines Kanditaten betrifft genannt?
Hab ich was verpasst????
Antwort auf Beitrag Nr.: 50.832.045 von Fluglotse am 12.10.15 20:58:35na ja ich habe bei 6,99 gekauft und bin damit sehr zufrieden. Im Gegensatz zu Dir bin ich seitdem dabei geblieben.
Allerdings würde ich mich natürlich auch freuen, wenns jetzt endlich mal richtig einschlägt und ein Erfolg gemeldet wird.
Allerdings würde ich mich natürlich auch freuen, wenns jetzt endlich mal richtig einschlägt und ein Erfolg gemeldet wird.
Könntet Ihr Eure allgemeinen Diskussionen bitte in eck´s Thread weiterführen? In diesem Thread wollten wir uns - dem offiziellen Thema entsprechend - auf fachliche Überlegungen zur Entwicklungspipeline (eigene Präparate, Partnerpräparate, Konkurrenzentwicklungen, Bewertungsfragen) konzentrieren. Allgemeines Geblubber ohne Informationsgehalt bitte woanders abladen. Vielen Dank!
Morphosys
mir ist bekannt dass für die Markteinführung von Medikamenten ca. 10-16 J veranschlagt werden ... die m.E. von Banken und Finanzmedien seit IPO sehr hochgehandelte Morphosys gibt es aber schon seit ca 24 Jahren (Gründung 92), bisher hat es jedoch noch kein Wirkstoff in die Zulassung geschafft. Warum ? ich stelle ich mir als Laie die Frage ob deren Wirkstoff-Ansätze nicht grundsätzlich etwas überschätzt werden ?
Antwort auf Beitrag Nr.: 51.576.090 von SmartCap am 25.01.16 20:49:38Eine einfache Erklärung lautet: Zum Zeitpunkt der Unternehmensgründung gab es noch keinen Medikamentenkandidaten.
Es ist richtig, dass in den nächsten zwei Jahren ein, zwei Zulassungen erfolgen sollten. Aus dem Umstand, dass bisher kein mit Hilfe einer Morphosys-Bibliothek erzeugter Antikörper auf dem Markt ist, lassen sich jedoch keine Qualitätsmängel von HuCal etc. ableiten.
Es ist richtig, dass in den nächsten zwei Jahren ein, zwei Zulassungen erfolgen sollten. Aus dem Umstand, dass bisher kein mit Hilfe einer Morphosys-Bibliothek erzeugter Antikörper auf dem Markt ist, lassen sich jedoch keine Qualitätsmängel von HuCal etc. ableiten.
Antwort auf Beitrag Nr.: 51.576.489 von Joschka Schröder am 25.01.16 21:42:58besten Dank für Deine Einschätzung
sc
sc
Wenn man sich die Phase III-Ergebnisse des ursprünglichen BPS804-Konkurrenten Romosozumab im Detail ansieht, kann es trotz Erreichen des primären Studienendpunkts nur eine Reaktion geben: Enttäuschung! Keine Reduktion non-vertrabraler Frakturen, auch hier - wie schon bei Denosumab - Auftreten von Osteonekrosen usw. ... nach den präklinischen und den frühen klinischen Studienergebnissen hätte man deutlich bessere Resultate erwartet.
UCB And Amgen Announce Positive Topline Results From The Phase 3 Study Of Romosozumab in Postmenopausal Women With Osteoporosis
FRAME Study Met All Primary Endpoints by Reducing the Incidence of New Vertebral Fracture Through 12 and 24 Months
Brussels, Belgium, Thousand Oaks, Calif, 22 February 2016 – 07:00am (CET) -regulated information - UCB (Euronext Brussels: UCB) and Amgen (NASDAQ:AMGN) today announced top-line results from the Phase 3 placebo-controlled FRActure study in postmenopausal woMen with ostEoporosis (FRAME). These data showed FRAME met the co-primary endpoints by reducing the incidence of new vertebral fracture through months 12 and 24 in postmenopausal women with osteoporosis treated with romosozumab.
The study also met the secondary endpoint of reducing the incidence of clinical fractures (composite of vertebral and non-vertebral fractures) in postmenopausal women with osteoporosis through 12 months. However, the secondary endpoint of reducing the incidence of non-vertebral fractures through months 12 and 24 was not met.
“These data are encouraging and in meeting the co-primary endpoints of this study, romosozumab has shown to be effective in reducing the incidence of new vertebral fractures at months 12 and 24 and for clinical fractures as early as 12 months,” said Professor Dr. Iris Loew-Friedrich, Chief Medical Officer and Executive Vice President, UCB. “Deeper understanding of the results will help us sharpen the profile of romosozumab in postmenopausal women with osteoporosis."
Results from the FRAME study showed that women receiving subcutaneous injection of romosozumab monthly experienced a statistically significant 73 percent reduction in the relative risk of a vertebral (spine) fracture through 12 months compared to those receiving placebo. The effect size persisted after both groups were transitioned to denosumab through the second year of treatment. Specifically, through month 24, romosozumab followed by denosumab reduced the relative risk of new vertebral fractures by a statistically significant 75 percent compared to placebo followed by denosumab. Additionally, patients receiving romosozumab experienced a statistically significant 36 percent reduction in the relative risk of a clinical fracture through 12 months compared to those receiving placebo.
“A vertebral fracture due to osteoporosis can be a life-altering event and the risk of these kinds of fractures will be a growing burden as our society ages,” said Sean E. Harper, M.D., executive vice president of Research and Development at Amgen. “These data show that romosozumab reduced new vertebral fracture risk as soon as 12 months."
The percentage of patients with adverse events and serious adverse events in the 12-month double-blind period and 24-month study period were balanced overall between the treatment groups. In the initial 12-month treatment period, the most commonly reported adverse events in both arms (greater than 10 percent) were arthralgia, nasopharyngitis and back pain. Injection site reactions were reported in 5.2 percent of patients in the romosozumab treatment group and 2.9 percent in the placebo group during the 12-month period. Most injection site reactions were reported as mild in severity. Sub-studies evaluating hearing loss and worsening of knee osteoarthritis showed no difference between the treatment groups. There were two positively adjudicated events of osteonecrosis of the jaw in the romosozumab treatment group, one after completing romosozumab dosing and the other after completing romosozumab treatment and receiving the initial dose of denosumab. There was one positively adjudicated event of atypical femoral fracture after three months of romosozumab treatment.
FRAME is a Phase 3 multi-center, international, randomized, double-blind, placebo-controlled, parallel-group study to assess the efficacy and safety of romosozumab treatment in postmenopausal women with osteoporosis. The study evaluated 12 months of romosozumab treatment versus placebo followed by 12 months of open-label denosumab treatment for both arms. The purpose of this study was to determine if treatment with romosozumab is effective in reducing the risk of fracture in women with postmenopausal osteoporosis through months 12 and 24.
Further analysis of the Phase 3 FRAME study data is ongoing and will be submitted to a future medical conference and for publication. UCB and Amgen plan to discuss these results with global regulators in anticipation of a potential filing in 2016.
About Romosozumab
Romosozumab is an investigational bone-forming monoclonal antibody and is not approved by any regulatory authority for the treatment of osteoporosis. It is designed to work by inhibiting the protein sclerostin, and has a dual effect on bone, both increasing bone formation and decreasing bone resorption.1,2,3 Romosozumab is being studied for its potential to reduce the risk of fractures in an extensive global Phase 3 program. This program includes two large fracture trials comparing romosozumab to either placebo or active comparator in more than 10,000 postmenopausal women with osteoporosis. Amgen and UCB are co-developing romosozumab.
About the FRAME study
FRAME is a multi-center, international, randomized, double-blind, placebo-controlled, parallel-group study in postmenopausal women with osteoporosis, defined as low bone mineral density at the total hip or femoral neck. The study evaluated the effectiveness of romosozumab treatment, compared with placebo, in reducing the risk of new vertebral fractures through 12 months. The study also further evaluated if romosozumab treatment for 12 months followed by denosumab treatment for 12 months, compared with placebo followed by denosumab treatment, was effective in reducing the risk of new vertebral fractures through 24 months. In addition, clinical fracture (a composite endpoint of symptomatic vertebral and non-vertebral fractures) risk reduction, non-vertebral fracture (fractures outside of the spine, excluding sites that are not considered osteoporotic, fractures due to high trauma or pathologic fractures) risk reduction and other endpoints were assessed at 12 and 24 months.
7,180 patients were randomized 1:1 to receive either 210 mg romosozumab subcutaneous (SC) monthly (QM) or placebo SC QM for the 12-month double-blind study period. After the placebo-controlled study period, patients entered the open-label phase where all patients received 60 mg denosumab SC every six months (Q6M) for 12 months, while remaining blinded to initial treatment. An additional 12 month extension period of open-label 60 mg denosumab SC Q6M is currently ongoing.
UCB And Amgen Announce Positive Topline Results From The Phase 3 Study Of Romosozumab in Postmenopausal Women With Osteoporosis
FRAME Study Met All Primary Endpoints by Reducing the Incidence of New Vertebral Fracture Through 12 and 24 Months
Brussels, Belgium, Thousand Oaks, Calif, 22 February 2016 – 07:00am (CET) -regulated information - UCB (Euronext Brussels: UCB) and Amgen (NASDAQ:AMGN) today announced top-line results from the Phase 3 placebo-controlled FRActure study in postmenopausal woMen with ostEoporosis (FRAME). These data showed FRAME met the co-primary endpoints by reducing the incidence of new vertebral fracture through months 12 and 24 in postmenopausal women with osteoporosis treated with romosozumab.
The study also met the secondary endpoint of reducing the incidence of clinical fractures (composite of vertebral and non-vertebral fractures) in postmenopausal women with osteoporosis through 12 months. However, the secondary endpoint of reducing the incidence of non-vertebral fractures through months 12 and 24 was not met.
“These data are encouraging and in meeting the co-primary endpoints of this study, romosozumab has shown to be effective in reducing the incidence of new vertebral fractures at months 12 and 24 and for clinical fractures as early as 12 months,” said Professor Dr. Iris Loew-Friedrich, Chief Medical Officer and Executive Vice President, UCB. “Deeper understanding of the results will help us sharpen the profile of romosozumab in postmenopausal women with osteoporosis."
Results from the FRAME study showed that women receiving subcutaneous injection of romosozumab monthly experienced a statistically significant 73 percent reduction in the relative risk of a vertebral (spine) fracture through 12 months compared to those receiving placebo. The effect size persisted after both groups were transitioned to denosumab through the second year of treatment. Specifically, through month 24, romosozumab followed by denosumab reduced the relative risk of new vertebral fractures by a statistically significant 75 percent compared to placebo followed by denosumab. Additionally, patients receiving romosozumab experienced a statistically significant 36 percent reduction in the relative risk of a clinical fracture through 12 months compared to those receiving placebo.
“A vertebral fracture due to osteoporosis can be a life-altering event and the risk of these kinds of fractures will be a growing burden as our society ages,” said Sean E. Harper, M.D., executive vice president of Research and Development at Amgen. “These data show that romosozumab reduced new vertebral fracture risk as soon as 12 months."
The percentage of patients with adverse events and serious adverse events in the 12-month double-blind period and 24-month study period were balanced overall between the treatment groups. In the initial 12-month treatment period, the most commonly reported adverse events in both arms (greater than 10 percent) were arthralgia, nasopharyngitis and back pain. Injection site reactions were reported in 5.2 percent of patients in the romosozumab treatment group and 2.9 percent in the placebo group during the 12-month period. Most injection site reactions were reported as mild in severity. Sub-studies evaluating hearing loss and worsening of knee osteoarthritis showed no difference between the treatment groups. There were two positively adjudicated events of osteonecrosis of the jaw in the romosozumab treatment group, one after completing romosozumab dosing and the other after completing romosozumab treatment and receiving the initial dose of denosumab. There was one positively adjudicated event of atypical femoral fracture after three months of romosozumab treatment.
FRAME is a Phase 3 multi-center, international, randomized, double-blind, placebo-controlled, parallel-group study to assess the efficacy and safety of romosozumab treatment in postmenopausal women with osteoporosis. The study evaluated 12 months of romosozumab treatment versus placebo followed by 12 months of open-label denosumab treatment for both arms. The purpose of this study was to determine if treatment with romosozumab is effective in reducing the risk of fracture in women with postmenopausal osteoporosis through months 12 and 24.
Further analysis of the Phase 3 FRAME study data is ongoing and will be submitted to a future medical conference and for publication. UCB and Amgen plan to discuss these results with global regulators in anticipation of a potential filing in 2016.
About Romosozumab
Romosozumab is an investigational bone-forming monoclonal antibody and is not approved by any regulatory authority for the treatment of osteoporosis. It is designed to work by inhibiting the protein sclerostin, and has a dual effect on bone, both increasing bone formation and decreasing bone resorption.1,2,3 Romosozumab is being studied for its potential to reduce the risk of fractures in an extensive global Phase 3 program. This program includes two large fracture trials comparing romosozumab to either placebo or active comparator in more than 10,000 postmenopausal women with osteoporosis. Amgen and UCB are co-developing romosozumab.
About the FRAME study
FRAME is a multi-center, international, randomized, double-blind, placebo-controlled, parallel-group study in postmenopausal women with osteoporosis, defined as low bone mineral density at the total hip or femoral neck. The study evaluated the effectiveness of romosozumab treatment, compared with placebo, in reducing the risk of new vertebral fractures through 12 months. The study also further evaluated if romosozumab treatment for 12 months followed by denosumab treatment for 12 months, compared with placebo followed by denosumab treatment, was effective in reducing the risk of new vertebral fractures through 24 months. In addition, clinical fracture (a composite endpoint of symptomatic vertebral and non-vertebral fractures) risk reduction, non-vertebral fracture (fractures outside of the spine, excluding sites that are not considered osteoporotic, fractures due to high trauma or pathologic fractures) risk reduction and other endpoints were assessed at 12 and 24 months.
7,180 patients were randomized 1:1 to receive either 210 mg romosozumab subcutaneous (SC) monthly (QM) or placebo SC QM for the 12-month double-blind study period. After the placebo-controlled study period, patients entered the open-label phase where all patients received 60 mg denosumab SC every six months (Q6M) for 12 months, while remaining blinded to initial treatment. An additional 12 month extension period of open-label 60 mg denosumab SC Q6M is currently ongoing.
Hinsichtlich etwaiger Vermarktungschancen günstig für Morphosys (und Immunogen): AstraZeneca´s Tremelimumab (anti CTLA-4) ist einer Zulassungsrelevanten Phase IIb-Studie in der Indikation Mesotheliom gescheitert. IMGN und Morphosys sind bekanntlich via BAY94-9343 (anti Mesothelin-ADC) in dieser Indikation aktiv (derzeit Phase II) .
Die bisherigen Phase 1-Daten der MOR209-Studie waren offensichtlich eine große Enttäuschung. Die Studie soll jetzt mit anderem Dosisregime Mitte 2016 noch einmal gestartet werden.
Morphosys´ Unternehmenspolitik, Antikörper von Konkurrenzunternehmen einzulizensieren, wird bekanntlich nicht von allen Investoren goutiert. Oft heißt es, Morphosys müsse damit eine zeitliche Entwicklungslücke schließen. In diesem Zusammenhang stellt sich jedoch die Frage, warum dies denn unbedingt erforderlich sein soll. Alternativ könnten die nicht unerheblichen Finanzaufwendungen in weitere Eigenentwicklungen sowie in technisches Knowhow gesteckt werden ... von größeren technische Innovationen hat man aus dem Hause Morphosys ja leider schon länger nichts mehr gehört.
Um sich ein besseres Bild vom Chance-Risiko-Verhältnis diverser Einlizensierungen machen zu können, nachfolgend die Details der Vereinbarungen zu MOR208 und MOR209.
Zunächst die ursprünglichen Vereinbarungen zwischen Morphosys und Emergent Biosolutions bzgl. MOR209 aus dem Sommer 2014:
MOR zahlt 20 Mio. USD Upfront und bis zu 163 Mio. USD Milestones (davon 80 Mio. USD Entwicklungsmeilensteine und 83 Mio. Zulassungsmeilensteine).
Emergent übernimmt 36 % der Entwicklungskosten mit Cap i.H.v. 186 Mio. USD, MOR den Rest.
Emergent erhält Rechte für USA und Kanada und zahlt dort Royalties in Spanne mid-singe digit bis 20 %. MOR bekommt Rechte für den Rest der Wert und zahlt dort Tantiemen im low single-digit-Bereich an Emergent.
Nach Auswertung derP1-Dosiseskalations-Daten wurden die Vereinbarungen folgendermaßen geändert:
Meilensteine nunmehr 32,5 Mio. USD (Entwicklung) und 41,5 Mio. USD (Zulassung).
Entwicklungskosten-CAP für Emergent Biosolutions jetzt 460 Mio. USD.
Aufteilung der Entwicklungskosten im Jahr 2016: Emergent 75 %, MOR 25 %
Aufteilung der Entwicklungskosten im Jahr 207-18: Emergent 49 %, MOR 51 %
Aufteilung der Entwicklungskosten ab 2019: Emergent 34 %, MOR 66 % (wie ursprünglich).
Bislang hat Morphosys in MOR209 30,8 Mio. USD investiert.
Hier noch die Konditionen des MOR208-Deals mit Xencor (hatte ich bereits irgendwann gepostet):
3 Mio. USD Upfront, 62 Mio. USD klin. Milestones, 187 Mio. USD bei Zulassung, 50 Mio. USD bei Erreichen bestimmter Sales. Royalties hoch einstellig bis niedrig zweistellig mindestens 11 Jahre lang nach Erstzulassung auf Land-zu-Land-Basis.
Die Kenntnis dieser Informationen sind wichtig, um abschätzen zu können, wie erfolgreich ein Präparat sein muss, damit sich die Einlizensierung mit gutem Chance-Risiko-Verhältnis trägt. Wenn man sich dann noch detaillierter die jeweilige Markt-/Konkurrenzsituation ansieht, sind die Voraussetzungen für eine vernünftige Urteilsbildung gegeben.
Morphosys´ Unternehmenspolitik, Antikörper von Konkurrenzunternehmen einzulizensieren, wird bekanntlich nicht von allen Investoren goutiert. Oft heißt es, Morphosys müsse damit eine zeitliche Entwicklungslücke schließen. In diesem Zusammenhang stellt sich jedoch die Frage, warum dies denn unbedingt erforderlich sein soll. Alternativ könnten die nicht unerheblichen Finanzaufwendungen in weitere Eigenentwicklungen sowie in technisches Knowhow gesteckt werden ... von größeren technische Innovationen hat man aus dem Hause Morphosys ja leider schon länger nichts mehr gehört.
Um sich ein besseres Bild vom Chance-Risiko-Verhältnis diverser Einlizensierungen machen zu können, nachfolgend die Details der Vereinbarungen zu MOR208 und MOR209.
Zunächst die ursprünglichen Vereinbarungen zwischen Morphosys und Emergent Biosolutions bzgl. MOR209 aus dem Sommer 2014:
MOR zahlt 20 Mio. USD Upfront und bis zu 163 Mio. USD Milestones (davon 80 Mio. USD Entwicklungsmeilensteine und 83 Mio. Zulassungsmeilensteine).
Emergent übernimmt 36 % der Entwicklungskosten mit Cap i.H.v. 186 Mio. USD, MOR den Rest.
Emergent erhält Rechte für USA und Kanada und zahlt dort Royalties in Spanne mid-singe digit bis 20 %. MOR bekommt Rechte für den Rest der Wert und zahlt dort Tantiemen im low single-digit-Bereich an Emergent.
Nach Auswertung derP1-Dosiseskalations-Daten wurden die Vereinbarungen folgendermaßen geändert:
Meilensteine nunmehr 32,5 Mio. USD (Entwicklung) und 41,5 Mio. USD (Zulassung).
Entwicklungskosten-CAP für Emergent Biosolutions jetzt 460 Mio. USD.
Aufteilung der Entwicklungskosten im Jahr 2016: Emergent 75 %, MOR 25 %
Aufteilung der Entwicklungskosten im Jahr 207-18: Emergent 49 %, MOR 51 %
Aufteilung der Entwicklungskosten ab 2019: Emergent 34 %, MOR 66 % (wie ursprünglich).
Bislang hat Morphosys in MOR209 30,8 Mio. USD investiert.
Hier noch die Konditionen des MOR208-Deals mit Xencor (hatte ich bereits irgendwann gepostet):
3 Mio. USD Upfront, 62 Mio. USD klin. Milestones, 187 Mio. USD bei Zulassung, 50 Mio. USD bei Erreichen bestimmter Sales. Royalties hoch einstellig bis niedrig zweistellig mindestens 11 Jahre lang nach Erstzulassung auf Land-zu-Land-Basis.
Die Kenntnis dieser Informationen sind wichtig, um abschätzen zu können, wie erfolgreich ein Präparat sein muss, damit sich die Einlizensierung mit gutem Chance-Risiko-Verhältnis trägt. Wenn man sich dann noch detaillierter die jeweilige Markt-/Konkurrenzsituation ansieht, sind die Voraussetzungen für eine vernünftige Urteilsbildung gegeben.
Bei der geplanten Kombistudie MOR208 plus idelalisib im Auge zu behalten -> http://www.ema.europa.eu/ema/index.jsp?curl=pages/news_and_e…
Antwort auf Beitrag Nr.: 51.968.715 von Joschka Schröder am 13.03.16 12:07:15Vielleicht auch ein Grund warum die Studie schon lange auf Not yet recruiting ist?
Auch in diesem Forum wurde immer wieder die Frage gestellt, aus welchem Grund wohl Novartis die klinische Entwicklung des gemeinsam mit Morphosys konzipierten, eigentlich so aussichtsreichen anti-Sclerostin-Antikörpers BPS804 (-> hervorragende Präklinik, ebenso ausgezeichnete klinische Daten nach Einmal-Gabe) eingestellt hat.
Dieser Bericht könnte den Schlüssel zu einer Erklärung liefern -> https://www.deutsche-apotheker-zeitung.de/news/artikel/2016/…
Nun wird auch verständlich, wieso Mereo Biopharma BPS804 in der (nicht-entzündlichen!) Nischenindikation Osteogenesis imperfecta weiterentwickeln wird (in dieser Indikation hat BPS804 übrigens am 2.3.2016 den Orphan Drug status für die USA erhalten).
Des Weiteren wird es interessant sein zu sehen, wie sich unter diesen Umständen das - ehemalige - Konkurrenzprodukt Romosozumab (humanisierter anti-Sclerostin-Mab von Amgen/UCB/Celltech) langfristig in der Indikation Osteoporose bewähren wird.
Dieser Bericht könnte den Schlüssel zu einer Erklärung liefern -> https://www.deutsche-apotheker-zeitung.de/news/artikel/2016/…
Nun wird auch verständlich, wieso Mereo Biopharma BPS804 in der (nicht-entzündlichen!) Nischenindikation Osteogenesis imperfecta weiterentwickeln wird (in dieser Indikation hat BPS804 übrigens am 2.3.2016 den Orphan Drug status für die USA erhalten).
Des Weiteren wird es interessant sein zu sehen, wie sich unter diesen Umständen das - ehemalige - Konkurrenzprodukt Romosozumab (humanisierter anti-Sclerostin-Mab von Amgen/UCB/Celltech) langfristig in der Indikation Osteoporose bewähren wird.
Die angekündigte Kombinationsstudie MOR208 plus Idelalisib wird mit an Sicherheit grenzender Wahrscheinlichkeit nicht stattfinden können. Auf die Problematik der geplanten Kombistudie hatte ich an anderer Stelle des Forums schon hingewiesen ... jetzt ist es quasi offiziell -> http://www.fiercepharma.com/story/zydelig-dead-water-after-t…
Es gibt ein neues Präparat aus der Kooperation mit Novartis, ein Immunkonjugat, das an adherin-6C bindet. Der Antikörper des ADC wurde mittels HuCal generiert. Als Linker liefert Immunogen den sulfo-SPDB-Linker, der bereits mit Erfolg bei IMGN853 bzw. Mirvetuximab soravtansine eingesetzt wird (als Toxin wird ebenfalls DM4 verwendet). Das Immunkonjugat soll in den Indikationen Eierstockkrebs und Nierenkrebs eingesetzt werden. Der Eintritt in die klinische Studienphase dürfte 2016 erfolgen. Auf Basis des gegenwärtigen Kenntnisstandes ein interessantes und aussichtsreiches Projekt.
Antwort auf Beitrag Nr.: 52.032.512 von Joschka Schröder am 22.03.16 10:23:15Danke für die Info. Hattest du eine öffentliche Quelle dafür?
Konjugat scheint bei Mirvetuximab soravtansine, soliden Tumoren und passender Exprimierung des Targets zu funktionieren. Allerdings ist es noch zu früh das endgültig zu beurteilen.
Das Target sagt mir bisher gar nichts, hast du da etwas Einblick für uns?
Eine Gefahr ist auch, dass die Linkerkonstruktion zu (reversiblen) Nebenwirkungen führt (blurred vision) und wohl nur eine Dosierung im 3weekly oder 4weekly Schema möglich macht.
Konjugat scheint bei Mirvetuximab soravtansine, soliden Tumoren und passender Exprimierung des Targets zu funktionieren. Allerdings ist es noch zu früh das endgültig zu beurteilen.
Das Target sagt mir bisher gar nichts, hast du da etwas Einblick für uns?
Eine Gefahr ist auch, dass die Linkerkonstruktion zu (reversiblen) Nebenwirkungen führt (blurred vision) und wohl nur eine Dosierung im 3weekly oder 4weekly Schema möglich macht.
Antwort auf Beitrag Nr.: 52.039.889 von Ville7 am 23.03.16 06:24:27http://www.abstractsonline.com/Plan/ViewAbstract.aspx?sKey=a…
Dass es sich um einen HuCal-Antikörper handelt, ergibt sich aus dem dazugehörigen Patent. Entsprechenden Link kann ich auf Wunsch nachreichen.
Dass es sich um einen HuCal-Antikörper handelt, ergibt sich aus dem dazugehörigen Patent. Entsprechenden Link kann ich auf Wunsch nachreichen.
Ja klingt erstmal nicht schlecht, aber wie bei allem Krebs Projekten es ist besser abzuwarten auf richtige klinische Daten. Hacken ist, meine Meinung nach, in den PDX Modellen. An der Seite Grundsatz Diskussion über die aussage kraft von Xenografts , sagen wir mal die sind das beste was pre klinik anbietet und mussen gemacht werden. Aber "unselected" heisst immer noch die haben deren seits keine besondere Kriterien angewendet ( haben alle genommen die angewachsen sind) , aber die PDX sind schon eine sehr spezielle subgruppe. Von dem Tumor Material von Ovarialkarzinom Patientientinen für nur ein sehr kleines teil kann mann PDX model generieren. Effizienz ist extrem gering.
Und ovarialkarzinom is anderseits extrem Genetsich heterogen, etlicher Art von molekularen stratifizierung ist sehr schwer. Aber wer weiss, ich wurde mich jedenfalls freuen.....
Und ovarialkarzinom is anderseits extrem Genetsich heterogen, etlicher Art von molekularen stratifizierung ist sehr schwer. Aber wer weiss, ich wurde mich jedenfalls freuen.....
Antwort auf Beitrag Nr.: 52.040.579 von Joschka Schröder am 23.03.16 08:46:26Danke. Novartis hat von IMGN schon PCA062 mit Target P-cadherin in einer Phase 1.
"CDH6, also known as K-(kidney)-cadherin, is a member of the cadherin superfamily of calcium-dependent cell-cell adhesion molecules."
Scheint nicht derselbe AK zu sein. Novartis probiert da wohl einiges bezüglich cadherin aus. Klingt mir dann nach "entweder - oder", der bessere gewinnt.
"CDH6, also known as K-(kidney)-cadherin, is a member of the cadherin superfamily of calcium-dependent cell-cell adhesion molecules."
Scheint nicht derselbe AK zu sein. Novartis probiert da wohl einiges bezüglich cadherin aus. Klingt mir dann nach "entweder - oder", der bessere gewinnt.
Vom Annual Meeting of the American Association for Geriatric Psychiatry, das gerade in Washington stattgefunden hat:
"High-Dose Gantenerumab Shows Benefit in Faster-Progressing Alzheimer’s Disease: Presented at AAGP" -> http://www.firstwordpharma.com/node/1368452?tsid=28®ion_i…
"High-Dose Gantenerumab Shows Benefit in Faster-Progressing Alzheimer’s Disease: Presented at AAGP" -> http://www.firstwordpharma.com/node/1368452?tsid=28®ion_i…
Antwort auf Beitrag Nr.: 52.048.958 von Joschka Schröder am 23.03.16 23:54:29Interessant.
Beantwortet möglicherweise zwei Fragen:
1. wieso Roche mit Gantenerumab trotzdem weitermacht (in höherer Dosierung): weil sie Hinweise auf dosisabhängige Effekte sehen und weil der Antikörper bisher genauso sicher wie Placebo war
2. wieso a-beta doch funktionieren könnte: weil die (CSF) Tau's reduziert werden.
Beantwortet möglicherweise zwei Fragen:
1. wieso Roche mit Gantenerumab trotzdem weitermacht (in höherer Dosierung): weil sie Hinweise auf dosisabhängige Effekte sehen und weil der Antikörper bisher genauso sicher wie Placebo war
2. wieso a-beta doch funktionieren könnte: weil die (CSF) Tau's reduziert werden.
Antwort auf Beitrag Nr.: 52.039.889 von Ville7 am 23.03.16 06:24:27Joschka, weisst du wie die Dosierungen alt/neu sind für MOR209? Bei clinicaltrials wird 0.2 - 300 ug/kg angegeben... da die Studie zuletzt im May 2015 aktualisiert wurde, ist das wohl das alte Schema. Hast du irgendwo gelesen, wie sie jetzt dosieren werden?
Frage Bimagrumab
Zuerst mal vielen Dank bei Joschka für seine wirklich fundierten Beiträge:Da ich eine sehr interessante Info gefunden habe, möchte ich mal diese mit euch teilen, bzw. euch um eure Einschätzung dazu bitten: Sie stammt von James Berg, vom 07.03.2016 der beim Trail mitmacht:
The one year or more extension of BYM338 is currently in process. For six to eight months the dosages will remain as per the original trial. Thus, the 25% placebo will remain.
During the 6 to 8 month (short period) the following will be determined by Novartis; what is the optimum dosage of the drug and the possibility of an immunogenicity effect. At the conclusion of the short period, Novartis will submit to the FDA for approval and all trial participants will receive the drug on an "Open Label". The "Open Label" will continue until the drug is FDA approved.This approval process could take 8 months. We are guessing that the drug could be available in the first quarter of 2017.
The question: what is Immunogenicity? There are two kinds; wanted and unwanted. Novartis will be concerned with unwanted which is an "immune response by an organism against the monoclonal antibody" the drug in the BYM338 trial. This reaction leads to "production of anti-drug-antibodies inactivating the therapeutic effects of the treatment"(wikipedia). In other words, long term the drug may not work and Novartis want to determine if this is a possibility.
There are fewer than 240 people on the trial extension as some sites have dropped out and some patients.
http://tmacommunityforum.ning.com/forum/topics/bym338-extens…
Vielen Dank
prinzeugen22
Antwort auf Beitrag Nr.: 52.073.909 von prinzeugen22 am 29.03.16 12:17:50Dass Patienten gegen therapeutsche Antikörper eigene Antikörper bilden, kommt leider immer wieder vor. Bei manchen therapeutischen Mabs kommt eine derartige Immunreaktion äußerst selten vor (z.B. Omalizumab), bei anderen hingegen häufiger (z.B. Adalimumab). Bei Bigramumab sammelt man gerade Erfahrungen.
@yok: Zur aktuellen MOR209-Dosis kann ich leider nichts beitragen.
@yok: Zur aktuellen MOR209-Dosis kann ich leider nichts beitragen.
MOR106 dürfte ein anti-IL17C-Antikörper sein, beschrieben u.a. in Patent EP2768859.
Interleukin 17C stimuliert die Freisetzung von TNFalpha und Interleukin 1 durch/aus Monozyten.
Interleukin 17C stimuliert die Freisetzung von TNFalpha und Interleukin 1 durch/aus Monozyten.
Antwort auf Beitrag Nr.: 52.150.641 von Joschka Schröder am 08.04.16 18:07:50Hallo Joschka, vielen Dank für deine schnelle Recherche und Antwort.
Ehrlicherweise bin ich ziemlich enttäuscht für MOR106 ein IL-17C Target zu lesen. Das klingt mir recht unkreativ. Da hat man die angeblich so tolle Target-Discovery-Plattform von Galapagos benötigt um dann doch nur bei einer Variante von IL-17 zu landen? Sehe ich das etwas zu vereinfacht? Was hälst du von diesem Target? Tummelt sich in diesem Bereich nicht schon die halbe Pharmawelt?
Ehrlicherweise bin ich ziemlich enttäuscht für MOR106 ein IL-17C Target zu lesen. Das klingt mir recht unkreativ. Da hat man die angeblich so tolle Target-Discovery-Plattform von Galapagos benötigt um dann doch nur bei einer Variante von IL-17 zu landen? Sehe ich das etwas zu vereinfacht? Was hälst du von diesem Target? Tummelt sich in diesem Bereich nicht schon die halbe Pharmawelt?
Antwort auf Beitrag Nr.: 52.152.023 von Ville7 am 08.04.16 21:24:24Schwer zu sagen.
Von einer einfachen Variante des IL-17 würde ich eher nicht sprechen. Die Aminosäuresequenzen von IL-17C und IL-17A, das z.B. durch secukinumab/Cosentyx blockiert wird, stimmen z.B. nur zu 27 % überein und IL-17C bindet nicht bzw. nur mit geringer Affinität an den IL-17A-Rezeptor.
Zur Funktion: IL-17C stimuliert u.a. die Expression von GCSF und beta-defensin-2 in Keratozyten. Außerdem stimuliert IL-17C die Bildung von Il-17A. TNF and IL1B wiederum induzieren die IL-17C-Freisetzung aus Epithelzellen.
Letztlich bin ich aber überfragt, wenn es um die Beamtwortung der entscheidenden Frage geht, welchen konkreten therapeutischen Vorteil ein anti-IL-17C-Antikörper z.B. im Vergleich zu einem anti-IL-17A-Antikörper haben kann.
Tut mir leid, dass ich derzeit nicht mehr zu diesem Thema beitragen kann.
Von einer einfachen Variante des IL-17 würde ich eher nicht sprechen. Die Aminosäuresequenzen von IL-17C und IL-17A, das z.B. durch secukinumab/Cosentyx blockiert wird, stimmen z.B. nur zu 27 % überein und IL-17C bindet nicht bzw. nur mit geringer Affinität an den IL-17A-Rezeptor.
Zur Funktion: IL-17C stimuliert u.a. die Expression von GCSF und beta-defensin-2 in Keratozyten. Außerdem stimuliert IL-17C die Bildung von Il-17A. TNF and IL1B wiederum induzieren die IL-17C-Freisetzung aus Epithelzellen.
Letztlich bin ich aber überfragt, wenn es um die Beamtwortung der entscheidenden Frage geht, welchen konkreten therapeutischen Vorteil ein anti-IL-17C-Antikörper z.B. im Vergleich zu einem anti-IL-17A-Antikörper haben kann.
Tut mir leid, dass ich derzeit nicht mehr zu diesem Thema beitragen kann.
Off topic zu dem Thema Checkpoint-Inhibitoren: Heute hat BMS für Opdivo (Nivolumab) von der FDA eine Biologics License Application in der Indikation rezidivierendes Hodgkin-Lymphom erhalten. Die Checkpoint-Inhibitoren sind gegenwärtig bekanntlich DAS große Thema in der Onkologie. Wenn man sich die immunologischen Nebenwirkungen anschaut, kann einem allerdings schwindelig werden ... weiter unten deshalb der zweite Teil der heutigen Meldung, in dem diverse Warnhinweise enthalten sind.
Es ist leider wie gewohnt in der Medizin: Was besonders gut wirkt (wie z.B. bei den klassischen Pharmaka Kortison oder Morphium), hat gewöhnlich auch besonders häßliche Nebenwirkungen.
OPDIVO® (nivolumab) is indicated for the treatment of patients with advanced renal cell carcinoma (RCC) who have received prior anti-angiogenic therapy.
IMPORTANT SAFETY INFORMATION
WARNING: IMMUNE-MEDIATED ADVERSE REACTIONS
YERVOY can result in severe and fatal immune-mediated adverse reactions. These immune-mediated reactions may involve any organ system; however, the most common severe immune-mediated adverse reactions are enterocolitis, hepatitis, dermatitis (including toxic epidermal necrolysis), neuropathy, and endocrinopathy. The majority of these immune-mediated reactions initially manifested during treatment; however, a minority occurred weeks to months after discontinuation of YERVOY.
Assess patients for signs and symptoms of enterocolitis, dermatitis, neuropathy, and endocrinopathy and evaluate clinical chemistries including liver function tests (LFTs), adrenocorticotropic hormone (ACTH) level, and thyroid function tests at baseline and before each dose.
Permanently discontinue YERVOY and initiate systemic high-dose corticosteroid therapy for severe immune-mediated reactions.
Immune-Mediated Pneumonitis
Immune-mediated pneumonitis, including fatal cases, occurred with OPDIVO treatment. Across the clinical trial experience with solid tumors, fatal immune-mediated pneumonitis occurred with OPDIVO. In addition, in Checkmate 069, there were six patients who died without resolution of abnormal respiratory findings. Monitor patients for signs with radiographic imaging and symptoms of pneumonitis. Administer corticosteroids for Grade 2 or greater pneumonitis. Permanently discontinue for Grade 3 or 4 and withhold until resolution for Grade 2. In Checkmate 069 and 067, immune-mediated pneumonitis occurred in 6% (25/407) of patients receiving OPDIVO with YERVOY: Fatal (n=1), Grade 3 (n=6), Grade 2 (n=17), and Grade 1 (n=1). In Checkmate 037, 066, and 067, immune-mediated pneumonitis occurred in 1.8% (14/787) of patients receiving OPDIVO: Grade 3 (n=2) and Grade 2 (n=12). In Checkmate 057, immune-mediated pneumonitis, including interstitial lung disease, occurred in 3.4% (10/287) of patients: Grade 3 (n=5), Grade 2 (n=2), and Grade 1 (n=3). In Checkmate 025, pneumonitis, including interstitial lung disease, occurred in 5% (21/406) of patients receiving OPDIVO and 18% (73/397) of patients receiving everolimus. Immune-mediated pneumonitis occurred in 4.4% (18/406) of patients receiving OPDIVO: Grade 4 (n=1), Grade 3 (n=4), Grade 2 (n=12), and Grade 1 (n=1).
Immune-Mediated Colitis
Immune-mediated colitis can occur with OPDIVO treatment. Monitor patients for signs and symptoms of colitis. Administer corticosteroids for Grade 2 (of more than 5 days duration), 3, or 4 colitis. As a single agent, withhold OPDIVO for Grade 2 or 3 and permanently discontinue for Grade 4 or recurrent colitis upon restarting OPDIVO. When administered with YERVOY, withhold OPDIVO for Grade 2 and permanently discontinue for Grade 3 or 4 or recurrent colitis upon restarting OPDIVO. In Checkmate 069 and 067, diarrhea or colitis occurred in 56% (228/407) of patients receiving OPDIVO with YERVOY. Immune-mediated colitis occurred in 26% (107/407) of patients: Grade 4 (n=2), Grade 3 (n=60), Grade 2 (n=32), and Grade 1 (n=13). In Checkmate 037, 066, and 067, diarrhea or colitis occurred in 31% (242/787) of patients receiving OPDIVO. Immune-mediated colitis occurred in 4.1% (32/787) of patients: Grade 3 (n=20), Grade 2 (n=10), and Grade 1 (n=2). In Checkmate 057, diarrhea or colitis occurred in 17% (50/287) of patients receiving OPDIVO. Immune-mediated colitis occurred in 2.4% (7/287) of patients: Grade 3 (n=3), Grade 2 (n=2), and Grade 1 (n=2). In Checkmate 025, diarrhea or colitis occurred in 25% (100/406) of patients receiving OPDIVO and 32% (126/397) of patients receiving everolimus. Immune-mediated diarrhea or colitis occurred in 3.2% (13/406) of patients receiving OPDIVO: Grade 3 (n=5), Grade 2 (n=7), and Grade 1 (n=1).
In a separate Phase 3 study of YERVOY 3 mg/kg, severe, life-threatening, or fatal (diarrhea of ≥7 stools above baseline, fever, ileus, peritoneal signs; Grade 3-5) immune-mediated enterocolitis occurred in 34 (7%) patients. Across all YERVOY-treated patients in that study (n=511), 5 (1%) developed intestinal perforation, 4 (0.8%) died as a result of complications, and 26 (5%) were hospitalized for severe enterocolitis.
Immune-Mediated Hepatitis
Immune-mediated hepatitis can occur with OPDIVO treatment. Monitor patients for abnormal liver tests prior to and periodically during treatment. Administer corticosteroids for Grade 2 or greater transaminase elevations. Withhold for Grade 2 and permanently discontinue for Grade 3 or 4 immune-mediated hepatitis. In Checkmate 069 and 067, immune-mediated hepatitis occurred in 13% (51/407) of patients receiving OPDIVO with YERVOY: Grade 4 (n=8), Grade 3 (n=37), Grade 2 (n=5), and Grade 1 (n=1). In Checkmate 037, 066, and 067, immune-mediated hepatitis occurred in 2.3% (18/787) of patients receiving OPDIVO: Grade 4 (n=3), Grade 3 (n=11), and Grade 2 (n=4). In Checkmate 057, one patient (0.3%) developed immune-mediated hepatitis. In Checkmate 025, there was an increased incidence of liver test abnormalities compared to baseline in AST (33% vs 39%), alkaline phosphatase (32% vs 32%), ALT (22% vs 31%), and total bilirubin (9% vs 3.5%) in the OPDIVO and everolimus arms, respectively. Immune-mediated hepatitis requiring systemic immunosuppression occurred in 1.5% (6/406) of patients receiving OPDIVO: Grade 3 (n=5) and Grade 2 (n=1).
In a separate Phase 3 study of YERVOY 3 mg/kg, severe, life-threatening, or fatal hepatotoxicity (AST or ALT elevations >5x the ULN or total bilirubin elevations >3x the ULN; Grade 3-5) occurred in 8 (2%) patients, with fatal hepatic failure in 0.2% and hospitalization in 0.4%.
Immune-Mediated Dermatitis
In a separate Phase 3 study of YERVOY 3 mg/kg, severe, life-threatening, or fatal immune-mediated dermatitis (eg, Stevens-Johnson syndrome, toxic epidermal necrolysis, or rash complicated by full thickness dermal ulceration, or necrotic, bullous, or hemorrhagic manifestations; Grade 3-5) occurred in 13 (2.5%) patients. 1 (0.2%) patient died as a result of toxic epidermal necrolysis. 1 additional patient required hospitalization for severe dermatitis.
Immune-Mediated Neuropathies
In a separate Phase 3 study of YERVOY 3 mg/kg, 1 case of fatal Guillain-Barré syndrome and 1 case of severe (Grade 3) peripheral motor neuropathy were reported.
Immune-Mediated Endocrinopathies
Hypophysitis, adrenal insufficiency, thyroid disorders, and type 1 diabetes mellitus can occur with OPDIVO treatment. Monitor patients for signs and symptoms of hypophysitis, signs and symptoms of adrenal insufficiency during and after treatment, thyroid function prior to and periodically during treatment, and hyperglycemia. Administer corticosteroids for Grade 2 or greater hypophysitis. Withhold for Grade 2 or 3 and permanently discontinue for Grade 4 hypophysitis. Administer corticosteroids for Grade 3 or 4 adrenal insufficiency. Withhold for Grade 2 and permanently discontinue for Grade 3 or 4 adrenal insufficiency. Administer hormone-replacement therapy for hypothyroidism. Initiate medical management for control of hyperthyroidism. Administer insulin for type 1 diabetes. Withhold OPDIVO for Grade 3 and permanently discontinue for Grade 4 hyperglycemia.
In Checkmate 069 and 067, hypophysitis occurred in 9% (36/407) of patients receiving OPDIVO with YERVOY: Grade 3 (n=8), Grade 2 (n=25), and Grade 1 (n=3). In Checkmate 037, 066, and 067, hypophysitis occurred in 0.9% (7/787) of patients receiving OPDIVO: Grade 3 (n=2), Grade 2 (n=3), and Grade 1 (n=2). In Checkmate 025, hypophysitis occurred in 0.5% (2/406) of patients receiving OPDIVO: Grade 3 (n=1) and Grade 1 (n=1). In Checkmate 069 and 067, adrenal insufficiency occurred in 5% (21/407) of patients receiving OPDIVO with YERVOY: Grade 4 (n=1), Grade 3 (n=7), Grade 2 (n=11), and Grade 1 (n=2). In Checkmate 037, 066, and 067, adrenal insufficiency occurred in 1% (8/787) of patients receiving OPDIVO: Grade 3 (n=2), Grade 2 (n=5), and Grade 1 (n=1). In Checkmate 057, 0.3% (1/287) of OPDIVO-treated patients developed adrenal insufficiency. In Checkmate 025, adrenal insufficiency occurred in 2.0% (8/406) of patients receiving OPDIVO: Grade 3 (n=3), Grade 2 (n=4), and Grade 1 (n=1). In Checkmate 069 and 067, hypothyroidism or thyroiditis occurred in 22% (89/407) of patients receiving OPDIVO with YERVOY: Grade 3 (n=6), Grade 2 (n=47), and Grade 1 (n=36). Hyperthyroidism occurred in 8% (34/407) of patients: Grade 3 (n=4), Grade 2 (n=17), and Grade 1 (n=13). In Checkmate 037, 066, and 067, hypothyroidism or thyroiditis occurred in 9% (73/787) of patients receiving OPDIVO: Grade 3 (n=1), Grade 2 (n=37), Grade 1 (n=35). Hyperthyroidism occurred in 4.4% (35/787) of patients receiving OPDIVO: Grade 3 (n=1), Grade 2 (n=12), and Grade 1 (n=22). In Checkmate 057, Grade 1 or 2 hypothyroidism, including thyroiditis, occurred in 7% (20/287) and elevated thyroid stimulating hormone occurred in 17% of patients receiving OPDIVO. Grade 1 or 2 hyperthyroidism occurred in 1.4% (4/287) of patients. In Checkmate 025, thyroid disease occurred in 11% (43/406) of patients receiving OPDIVO, including one Grade 3 event, and in 3.0% (12/397) of patients receiving everolimus. Hypothyroidism/thyroiditis occurred in 8% (33/406) of patients receiving OPDIVO: Grade 3 (n=2), Grade 2 (n=17), and Grade 1 (n=14). Hyperthyroidism occurred in 2.5% (10/406) of patients receiving OPDIVO: Grade 2 (n=5) and Grade 1 (n=5). In Checkmate 069 and 067, diabetes mellitus or diabetic ketoacidosis occurred in 1.5% (6/407) of patients: Grade 4 (n=3), Grade 3 (n=1), Grade 2 (n=1), and Grade 1 (n=1). In Checkmate 037, 066, and 067, diabetes mellitus or diabetic ketoacidosis occurred in 0.8% (6/787) of patients receiving OPDIVO: Grade 3 (n=2), Grade 2 (n=3), and Grade 1 (n=1). In Checkmate 025, hyperglycemic adverse events occurred in 9% (37/406) patients. Diabetes mellitus or diabetic ketoacidosis occurred in 1.5% (6/406) of patients receiving OPDIVO: Grade 3 (n=3), Grade 2 (n=2), and Grade 1 (n=1).
In a separate Phase 3 study of YERVOY 3 mg/kg, severe to life-threatening immune-mediated endocrinopathies (requiring hospitalization, urgent medical intervention, or interfering with activities of daily living; Grade 3-4) occurred in 9 (1.8%) patients. All 9 patients had hypopituitarism, and some had additional concomitant endocrinopathies such as adrenal insufficiency, hypogonadism, and hypothyroidism. 6 of the 9 patients were hospitalized for severe endocrinopathies.
Immune-Mediated Nephritis and Renal Dysfunction
Immune-mediated nephritis can occur with OPDIVO treatment. Monitor patients for elevated serum creatinine prior to and periodically during treatment. For Grade 2 or 3 increased serum creatinine, withhold and administer corticosteroids; if worsening or no improvement occurs, permanently discontinue. Administer corticosteroids for Grade 4 serum creatinine elevation and permanently discontinue. In Checkmate 069 and 067, immune-mediated nephritis and renal dysfunction occurred in 2.2% (9/407) of patients: Grade 4 (n=4), Grade 3 (n=3), and Grade 2 (n=2). In Checkmate 037, 066, and 067, nephritis and renal dysfunction of any grade occurred in 5% (40/787) of patients receiving OPDIVO. Immune-mediated nephritis and renal dysfunction occurred in 0.8% (6/787) of patients: Grade 3 (n=4) and Grade 2 (n=2). In Checkmate 057, Grade 2 immune-mediated renal dysfunction occurred in 0.3% (1/287) of patients receiving OPDIVO. In Checkmate 025, renal injury occurred in 7% (27/406) of patients receiving OPDIVO and 3.0% (12/397) of patients receiving everolimus. Immune-mediated nephritis and renal dysfunction occurred in 3.2% (13/406) of patients receiving OPDIVO: Grade 5 (n=1), Grade 4 (n=1), Grade 3 (n=5), and Grade 2 (n=6).
Immune-Mediated Rash
Immune-mediated rash can occur with OPDIVO treatment. Severe rash (including rare cases of fatal toxic epidermal necrolysis) occurred in the clinical program of OPDIVO. Monitor patients for rash. Administer corticosteroids for Grade 3 or 4 rash. Withhold for Grade 3 and permanently discontinue for Grade 4. In Checkmate 069 and 067, immune-mediated rash occurred in 22.6% (92/407) of patients receiving OPDIVO with YERVOY: Grade 3 (n=15), Grade 2 (n=31), and Grade 1 (n=46). In Checkmate 037, 066, and 067, immune-mediated rash occurred in 9% (72/787) of patients receiving OPDIVO: Grade 3 (n=7), Grade 2 (n=15), and Grade 1 (n=50). In Checkmate 057, immune-mediated rash occurred in 6% (17/287) of patients receiving OPDIVO including four Grade 3 cases. In Checkmate 025, rash occurred in 28% (112/406) of patients receiving OPDIVO and 36% (143/397) of patients receiving everolimus. Immune-mediated rash, defined as a rash treated with systemic or topical corticosteroids, occurred in 7% (30/406) of patients receiving OPDIVO: Grade 3 (n=4), Grade 2 (n=7), and Grade 1 (n=19).
Immune-Mediated Encephalitis
Immune-mediated encephalitis can occur with OPDIVO treatment. Withhold OPDIVO in patients with new-onset moderate to severe neurologic signs or symptoms and evaluate to rule out other causes. If other etiologies are ruled out, administer corticosteroids and permanently discontinue OPDIVO for immune-mediated encephalitis. In Checkmate 067, encephalitis was identified in one patient (0.2%) receiving OPDIVO with YERVOY. In Checkmate 057, fatal limbic encephalitis occurred in one patient (0.3%) receiving OPDIVO.
Other Immune-Mediated Adverse Reactions
Based on the severity of adverse reaction, permanently discontinue or withhold treatment, administer high-dose corticosteroids, and, if appropriate, initiate hormone-replacement therapy. In < 1.0% of patients receiving OPDIVO, the following clinically significant, immune-mediated adverse reactions occurred: uveitis, pancreatitis, facial and abducens nerve paresis, demyelination, polymyalgia rheumatica, autoimmune neuropathy, Guillain-Barré syndrome, hypopituitarism, systemic inflammatory response syndrome, gastritis, duodenitis, and sarcoidosis. Across clinical trials of OPDIVO as a single agent administered at doses of 3 mg/kg and 10 mg/kg, additional clinically significant, immune-mediated adverse reactions were identified: motor dysfunction, vasculitis, and myasthenic syndrome.
Infusion Reactions
Severe infusion reactions have been reported in <1.0% of patients in clinical trials of OPDIVO. Discontinue OPDIVO in patients with Grade 3 or 4 infusion reactions. Interrupt or slow the rate of infusion in patients with Grade 1 or 2. In Checkmate 069 and 067, infusion- related reactions occurred in 2.5% (10/407) of patients receiving OPDIVO with YERVOY: Grade 2 (n=6) and Grade 1 (n=4). In Checkmate 037, 066, and 067, Grade 2 infusion related reactions occurred in 2.7% (21/787) of patients receiving OPDIVO: Grade 3 (n=2), Grade 2 (n=8), and Grade 1 (n=11). In Checkmate 057, Grade 2 infusion reactions requiring corticosteroids occurred in 1.0% (3/287) of patients receiving OPDIVO. In Checkmate 025, hypersensitivity/infusion-related reactions occurred in 6% (25/406) of patients receiving OPDIVO and 1.0% (4/397) of patients receiving everolimus.
Embryo-fetal Toxicity
Based on their mechanisms of action, OPDIVO and YERVOY can cause fetal harm when administered to a pregnant woman. Advise pregnant women of the potential risk to a fetus. Advise females of reproductive potential to use effective contraception during treatment with an OPDIVO- or YERVOY- containing regimen and for at least 5 months after the last dose of OPDIVO.
Lactation
It is not known whether OPDIVO or YERVOY is present in human milk. Because many drugs, including antibodies, are excreted in human milk and because of the potential for serious adverse reactions in nursing infants from an OPDIVO-containing regimen, advise women to discontinue breastfeeding during treatment. Advise women to discontinue nursing during treatment with YERVOY and for 3 months following the final dose.
Serious Adverse Reactions
In Checkmate 067, serious adverse reactions (73% and 37%), adverse reactions leading to permanent discontinuation (43% and 14%) or to dosing delays (55% and 28%), and Grade 3 or 4 adverse reactions (72% and 44%) all occurred more frequently in the OPDIVO plus YERVOY arm relative to the OPDIVO arm. The most frequent (≥10%) serious adverse reactions in the OPDIVO plus YERVOY arm and the OPDIVO arm, respectively, were diarrhea (13% and 2.6%), colitis (10% and 1.6%), and pyrexia (10% and 0.6%). In Checkmate 037, serious adverse reactions occurred in 41% of patients receiving OPDIVO. Grade 3 and 4 adverse reactions occurred in 42% of patients receiving OPDIVO. The most frequent Grade 3 and 4 adverse drug reactions reported in 2% to <5% of patients receiving OPDIVO were abdominal pain, hyponatremia, increased aspartate aminotransferase, and increased lipase. In Checkmate 066, serious adverse reactions occurred in 36% of patients receiving OPDIVO. Grade 3 and 4 adverse reactions occurred in 41% of patients receiving OPDIVO. The most frequent Grade 3 and 4 adverse reactions reported in ≥2% of patients receiving OPDIVO were gamma-glutamyltransferase increase (3.9%) and diarrhea (3.4%). In Checkmate 057, serious adverse reactions occurred in 47% of patients receiving OPDIVO. The most frequent serious adverse reactions reported in ≥2% of patients were pneumonia, pulmonary embolism, dyspnea, pleural effusion, and respiratory failure. In Checkmate 025, serious adverse reactions occurred in 47% of patients receiving OPDIVO. The most frequent serious adverse reactions reported in ≥2% of patients were acute kidney injury, pleural effusion, pneumonia, diarrhea, and hypercalcemia.
Common Adverse Reactions
In Checkmate 067, the most common (≥20%) adverse reactions in the OPDIVO plus YERVOY arm were fatigue (59%), rash (53%), diarrhea (52%), nausea (40%), pyrexia (37%), vomiting (28%), and dyspnea (20%). The most common (≥20%) adverse reactions in the OPDIVO arm were fatigue (53%), rash (40%), diarrhea (31%), and nausea (28%). In Checkmate 037, the most common adverse reaction (≥20%) reported with OPDIVO was rash (21%). In Checkmate 066, the most common adverse reactions (≥20%) reported with OPDIVO vs dacarbazine were fatigue (49% vs 39%), musculoskeletal pain (32% vs 25%), rash (28% vs 12%), and pruritus (23% vs 12%). In Checkmate 057, the most common adverse reactions (≥20%) reported with OPDIVO were fatigue (49%), musculoskeletal pain (36%), cough (30%), decreased appetite (29%), and constipation (23%). In Checkmate 025, the most common adverse reactions (≥20%) reported in patients receiving OPDIVO vs everolimus were asthenic conditions (56% vs 57%), cough (34% vs 38%), nausea (28% vs 29%), rash (28% vs 36%), dyspnea (27% vs 31%), diarrhea (25% vs 32%), constipation (23% vs 18%), decreased appetite (23% vs 30%), back pain (21% vs 16%), and arthralgia (20% vs 14%).
In a separate Phase 3 study of YERVOY 3 mg/kg, the most common adverse reactions (≥5%) in patients who received YERVOY at 3 mg/kg were fatigue (41%), diarrhea (32%), pruritus (31%), rash (29%), and colitis (8%).
Es ist leider wie gewohnt in der Medizin: Was besonders gut wirkt (wie z.B. bei den klassischen Pharmaka Kortison oder Morphium), hat gewöhnlich auch besonders häßliche Nebenwirkungen.
OPDIVO® (nivolumab) is indicated for the treatment of patients with advanced renal cell carcinoma (RCC) who have received prior anti-angiogenic therapy.
IMPORTANT SAFETY INFORMATION
WARNING: IMMUNE-MEDIATED ADVERSE REACTIONS
YERVOY can result in severe and fatal immune-mediated adverse reactions. These immune-mediated reactions may involve any organ system; however, the most common severe immune-mediated adverse reactions are enterocolitis, hepatitis, dermatitis (including toxic epidermal necrolysis), neuropathy, and endocrinopathy. The majority of these immune-mediated reactions initially manifested during treatment; however, a minority occurred weeks to months after discontinuation of YERVOY.
Assess patients for signs and symptoms of enterocolitis, dermatitis, neuropathy, and endocrinopathy and evaluate clinical chemistries including liver function tests (LFTs), adrenocorticotropic hormone (ACTH) level, and thyroid function tests at baseline and before each dose.
Permanently discontinue YERVOY and initiate systemic high-dose corticosteroid therapy for severe immune-mediated reactions.
Immune-Mediated Pneumonitis
Immune-mediated pneumonitis, including fatal cases, occurred with OPDIVO treatment. Across the clinical trial experience with solid tumors, fatal immune-mediated pneumonitis occurred with OPDIVO. In addition, in Checkmate 069, there were six patients who died without resolution of abnormal respiratory findings. Monitor patients for signs with radiographic imaging and symptoms of pneumonitis. Administer corticosteroids for Grade 2 or greater pneumonitis. Permanently discontinue for Grade 3 or 4 and withhold until resolution for Grade 2. In Checkmate 069 and 067, immune-mediated pneumonitis occurred in 6% (25/407) of patients receiving OPDIVO with YERVOY: Fatal (n=1), Grade 3 (n=6), Grade 2 (n=17), and Grade 1 (n=1). In Checkmate 037, 066, and 067, immune-mediated pneumonitis occurred in 1.8% (14/787) of patients receiving OPDIVO: Grade 3 (n=2) and Grade 2 (n=12). In Checkmate 057, immune-mediated pneumonitis, including interstitial lung disease, occurred in 3.4% (10/287) of patients: Grade 3 (n=5), Grade 2 (n=2), and Grade 1 (n=3). In Checkmate 025, pneumonitis, including interstitial lung disease, occurred in 5% (21/406) of patients receiving OPDIVO and 18% (73/397) of patients receiving everolimus. Immune-mediated pneumonitis occurred in 4.4% (18/406) of patients receiving OPDIVO: Grade 4 (n=1), Grade 3 (n=4), Grade 2 (n=12), and Grade 1 (n=1).
Immune-Mediated Colitis
Immune-mediated colitis can occur with OPDIVO treatment. Monitor patients for signs and symptoms of colitis. Administer corticosteroids for Grade 2 (of more than 5 days duration), 3, or 4 colitis. As a single agent, withhold OPDIVO for Grade 2 or 3 and permanently discontinue for Grade 4 or recurrent colitis upon restarting OPDIVO. When administered with YERVOY, withhold OPDIVO for Grade 2 and permanently discontinue for Grade 3 or 4 or recurrent colitis upon restarting OPDIVO. In Checkmate 069 and 067, diarrhea or colitis occurred in 56% (228/407) of patients receiving OPDIVO with YERVOY. Immune-mediated colitis occurred in 26% (107/407) of patients: Grade 4 (n=2), Grade 3 (n=60), Grade 2 (n=32), and Grade 1 (n=13). In Checkmate 037, 066, and 067, diarrhea or colitis occurred in 31% (242/787) of patients receiving OPDIVO. Immune-mediated colitis occurred in 4.1% (32/787) of patients: Grade 3 (n=20), Grade 2 (n=10), and Grade 1 (n=2). In Checkmate 057, diarrhea or colitis occurred in 17% (50/287) of patients receiving OPDIVO. Immune-mediated colitis occurred in 2.4% (7/287) of patients: Grade 3 (n=3), Grade 2 (n=2), and Grade 1 (n=2). In Checkmate 025, diarrhea or colitis occurred in 25% (100/406) of patients receiving OPDIVO and 32% (126/397) of patients receiving everolimus. Immune-mediated diarrhea or colitis occurred in 3.2% (13/406) of patients receiving OPDIVO: Grade 3 (n=5), Grade 2 (n=7), and Grade 1 (n=1).
In a separate Phase 3 study of YERVOY 3 mg/kg, severe, life-threatening, or fatal (diarrhea of ≥7 stools above baseline, fever, ileus, peritoneal signs; Grade 3-5) immune-mediated enterocolitis occurred in 34 (7%) patients. Across all YERVOY-treated patients in that study (n=511), 5 (1%) developed intestinal perforation, 4 (0.8%) died as a result of complications, and 26 (5%) were hospitalized for severe enterocolitis.
Immune-Mediated Hepatitis
Immune-mediated hepatitis can occur with OPDIVO treatment. Monitor patients for abnormal liver tests prior to and periodically during treatment. Administer corticosteroids for Grade 2 or greater transaminase elevations. Withhold for Grade 2 and permanently discontinue for Grade 3 or 4 immune-mediated hepatitis. In Checkmate 069 and 067, immune-mediated hepatitis occurred in 13% (51/407) of patients receiving OPDIVO with YERVOY: Grade 4 (n=8), Grade 3 (n=37), Grade 2 (n=5), and Grade 1 (n=1). In Checkmate 037, 066, and 067, immune-mediated hepatitis occurred in 2.3% (18/787) of patients receiving OPDIVO: Grade 4 (n=3), Grade 3 (n=11), and Grade 2 (n=4). In Checkmate 057, one patient (0.3%) developed immune-mediated hepatitis. In Checkmate 025, there was an increased incidence of liver test abnormalities compared to baseline in AST (33% vs 39%), alkaline phosphatase (32% vs 32%), ALT (22% vs 31%), and total bilirubin (9% vs 3.5%) in the OPDIVO and everolimus arms, respectively. Immune-mediated hepatitis requiring systemic immunosuppression occurred in 1.5% (6/406) of patients receiving OPDIVO: Grade 3 (n=5) and Grade 2 (n=1).
In a separate Phase 3 study of YERVOY 3 mg/kg, severe, life-threatening, or fatal hepatotoxicity (AST or ALT elevations >5x the ULN or total bilirubin elevations >3x the ULN; Grade 3-5) occurred in 8 (2%) patients, with fatal hepatic failure in 0.2% and hospitalization in 0.4%.
Immune-Mediated Dermatitis
In a separate Phase 3 study of YERVOY 3 mg/kg, severe, life-threatening, or fatal immune-mediated dermatitis (eg, Stevens-Johnson syndrome, toxic epidermal necrolysis, or rash complicated by full thickness dermal ulceration, or necrotic, bullous, or hemorrhagic manifestations; Grade 3-5) occurred in 13 (2.5%) patients. 1 (0.2%) patient died as a result of toxic epidermal necrolysis. 1 additional patient required hospitalization for severe dermatitis.
Immune-Mediated Neuropathies
In a separate Phase 3 study of YERVOY 3 mg/kg, 1 case of fatal Guillain-Barré syndrome and 1 case of severe (Grade 3) peripheral motor neuropathy were reported.
Immune-Mediated Endocrinopathies
Hypophysitis, adrenal insufficiency, thyroid disorders, and type 1 diabetes mellitus can occur with OPDIVO treatment. Monitor patients for signs and symptoms of hypophysitis, signs and symptoms of adrenal insufficiency during and after treatment, thyroid function prior to and periodically during treatment, and hyperglycemia. Administer corticosteroids for Grade 2 or greater hypophysitis. Withhold for Grade 2 or 3 and permanently discontinue for Grade 4 hypophysitis. Administer corticosteroids for Grade 3 or 4 adrenal insufficiency. Withhold for Grade 2 and permanently discontinue for Grade 3 or 4 adrenal insufficiency. Administer hormone-replacement therapy for hypothyroidism. Initiate medical management for control of hyperthyroidism. Administer insulin for type 1 diabetes. Withhold OPDIVO for Grade 3 and permanently discontinue for Grade 4 hyperglycemia.
In Checkmate 069 and 067, hypophysitis occurred in 9% (36/407) of patients receiving OPDIVO with YERVOY: Grade 3 (n=8), Grade 2 (n=25), and Grade 1 (n=3). In Checkmate 037, 066, and 067, hypophysitis occurred in 0.9% (7/787) of patients receiving OPDIVO: Grade 3 (n=2), Grade 2 (n=3), and Grade 1 (n=2). In Checkmate 025, hypophysitis occurred in 0.5% (2/406) of patients receiving OPDIVO: Grade 3 (n=1) and Grade 1 (n=1). In Checkmate 069 and 067, adrenal insufficiency occurred in 5% (21/407) of patients receiving OPDIVO with YERVOY: Grade 4 (n=1), Grade 3 (n=7), Grade 2 (n=11), and Grade 1 (n=2). In Checkmate 037, 066, and 067, adrenal insufficiency occurred in 1% (8/787) of patients receiving OPDIVO: Grade 3 (n=2), Grade 2 (n=5), and Grade 1 (n=1). In Checkmate 057, 0.3% (1/287) of OPDIVO-treated patients developed adrenal insufficiency. In Checkmate 025, adrenal insufficiency occurred in 2.0% (8/406) of patients receiving OPDIVO: Grade 3 (n=3), Grade 2 (n=4), and Grade 1 (n=1). In Checkmate 069 and 067, hypothyroidism or thyroiditis occurred in 22% (89/407) of patients receiving OPDIVO with YERVOY: Grade 3 (n=6), Grade 2 (n=47), and Grade 1 (n=36). Hyperthyroidism occurred in 8% (34/407) of patients: Grade 3 (n=4), Grade 2 (n=17), and Grade 1 (n=13). In Checkmate 037, 066, and 067, hypothyroidism or thyroiditis occurred in 9% (73/787) of patients receiving OPDIVO: Grade 3 (n=1), Grade 2 (n=37), Grade 1 (n=35). Hyperthyroidism occurred in 4.4% (35/787) of patients receiving OPDIVO: Grade 3 (n=1), Grade 2 (n=12), and Grade 1 (n=22). In Checkmate 057, Grade 1 or 2 hypothyroidism, including thyroiditis, occurred in 7% (20/287) and elevated thyroid stimulating hormone occurred in 17% of patients receiving OPDIVO. Grade 1 or 2 hyperthyroidism occurred in 1.4% (4/287) of patients. In Checkmate 025, thyroid disease occurred in 11% (43/406) of patients receiving OPDIVO, including one Grade 3 event, and in 3.0% (12/397) of patients receiving everolimus. Hypothyroidism/thyroiditis occurred in 8% (33/406) of patients receiving OPDIVO: Grade 3 (n=2), Grade 2 (n=17), and Grade 1 (n=14). Hyperthyroidism occurred in 2.5% (10/406) of patients receiving OPDIVO: Grade 2 (n=5) and Grade 1 (n=5). In Checkmate 069 and 067, diabetes mellitus or diabetic ketoacidosis occurred in 1.5% (6/407) of patients: Grade 4 (n=3), Grade 3 (n=1), Grade 2 (n=1), and Grade 1 (n=1). In Checkmate 037, 066, and 067, diabetes mellitus or diabetic ketoacidosis occurred in 0.8% (6/787) of patients receiving OPDIVO: Grade 3 (n=2), Grade 2 (n=3), and Grade 1 (n=1). In Checkmate 025, hyperglycemic adverse events occurred in 9% (37/406) patients. Diabetes mellitus or diabetic ketoacidosis occurred in 1.5% (6/406) of patients receiving OPDIVO: Grade 3 (n=3), Grade 2 (n=2), and Grade 1 (n=1).
In a separate Phase 3 study of YERVOY 3 mg/kg, severe to life-threatening immune-mediated endocrinopathies (requiring hospitalization, urgent medical intervention, or interfering with activities of daily living; Grade 3-4) occurred in 9 (1.8%) patients. All 9 patients had hypopituitarism, and some had additional concomitant endocrinopathies such as adrenal insufficiency, hypogonadism, and hypothyroidism. 6 of the 9 patients were hospitalized for severe endocrinopathies.
Immune-Mediated Nephritis and Renal Dysfunction
Immune-mediated nephritis can occur with OPDIVO treatment. Monitor patients for elevated serum creatinine prior to and periodically during treatment. For Grade 2 or 3 increased serum creatinine, withhold and administer corticosteroids; if worsening or no improvement occurs, permanently discontinue. Administer corticosteroids for Grade 4 serum creatinine elevation and permanently discontinue. In Checkmate 069 and 067, immune-mediated nephritis and renal dysfunction occurred in 2.2% (9/407) of patients: Grade 4 (n=4), Grade 3 (n=3), and Grade 2 (n=2). In Checkmate 037, 066, and 067, nephritis and renal dysfunction of any grade occurred in 5% (40/787) of patients receiving OPDIVO. Immune-mediated nephritis and renal dysfunction occurred in 0.8% (6/787) of patients: Grade 3 (n=4) and Grade 2 (n=2). In Checkmate 057, Grade 2 immune-mediated renal dysfunction occurred in 0.3% (1/287) of patients receiving OPDIVO. In Checkmate 025, renal injury occurred in 7% (27/406) of patients receiving OPDIVO and 3.0% (12/397) of patients receiving everolimus. Immune-mediated nephritis and renal dysfunction occurred in 3.2% (13/406) of patients receiving OPDIVO: Grade 5 (n=1), Grade 4 (n=1), Grade 3 (n=5), and Grade 2 (n=6).
Immune-Mediated Rash
Immune-mediated rash can occur with OPDIVO treatment. Severe rash (including rare cases of fatal toxic epidermal necrolysis) occurred in the clinical program of OPDIVO. Monitor patients for rash. Administer corticosteroids for Grade 3 or 4 rash. Withhold for Grade 3 and permanently discontinue for Grade 4. In Checkmate 069 and 067, immune-mediated rash occurred in 22.6% (92/407) of patients receiving OPDIVO with YERVOY: Grade 3 (n=15), Grade 2 (n=31), and Grade 1 (n=46). In Checkmate 037, 066, and 067, immune-mediated rash occurred in 9% (72/787) of patients receiving OPDIVO: Grade 3 (n=7), Grade 2 (n=15), and Grade 1 (n=50). In Checkmate 057, immune-mediated rash occurred in 6% (17/287) of patients receiving OPDIVO including four Grade 3 cases. In Checkmate 025, rash occurred in 28% (112/406) of patients receiving OPDIVO and 36% (143/397) of patients receiving everolimus. Immune-mediated rash, defined as a rash treated with systemic or topical corticosteroids, occurred in 7% (30/406) of patients receiving OPDIVO: Grade 3 (n=4), Grade 2 (n=7), and Grade 1 (n=19).
Immune-Mediated Encephalitis
Immune-mediated encephalitis can occur with OPDIVO treatment. Withhold OPDIVO in patients with new-onset moderate to severe neurologic signs or symptoms and evaluate to rule out other causes. If other etiologies are ruled out, administer corticosteroids and permanently discontinue OPDIVO for immune-mediated encephalitis. In Checkmate 067, encephalitis was identified in one patient (0.2%) receiving OPDIVO with YERVOY. In Checkmate 057, fatal limbic encephalitis occurred in one patient (0.3%) receiving OPDIVO.
Other Immune-Mediated Adverse Reactions
Based on the severity of adverse reaction, permanently discontinue or withhold treatment, administer high-dose corticosteroids, and, if appropriate, initiate hormone-replacement therapy. In < 1.0% of patients receiving OPDIVO, the following clinically significant, immune-mediated adverse reactions occurred: uveitis, pancreatitis, facial and abducens nerve paresis, demyelination, polymyalgia rheumatica, autoimmune neuropathy, Guillain-Barré syndrome, hypopituitarism, systemic inflammatory response syndrome, gastritis, duodenitis, and sarcoidosis. Across clinical trials of OPDIVO as a single agent administered at doses of 3 mg/kg and 10 mg/kg, additional clinically significant, immune-mediated adverse reactions were identified: motor dysfunction, vasculitis, and myasthenic syndrome.
Infusion Reactions
Severe infusion reactions have been reported in <1.0% of patients in clinical trials of OPDIVO. Discontinue OPDIVO in patients with Grade 3 or 4 infusion reactions. Interrupt or slow the rate of infusion in patients with Grade 1 or 2. In Checkmate 069 and 067, infusion- related reactions occurred in 2.5% (10/407) of patients receiving OPDIVO with YERVOY: Grade 2 (n=6) and Grade 1 (n=4). In Checkmate 037, 066, and 067, Grade 2 infusion related reactions occurred in 2.7% (21/787) of patients receiving OPDIVO: Grade 3 (n=2), Grade 2 (n=8), and Grade 1 (n=11). In Checkmate 057, Grade 2 infusion reactions requiring corticosteroids occurred in 1.0% (3/287) of patients receiving OPDIVO. In Checkmate 025, hypersensitivity/infusion-related reactions occurred in 6% (25/406) of patients receiving OPDIVO and 1.0% (4/397) of patients receiving everolimus.
Embryo-fetal Toxicity
Based on their mechanisms of action, OPDIVO and YERVOY can cause fetal harm when administered to a pregnant woman. Advise pregnant women of the potential risk to a fetus. Advise females of reproductive potential to use effective contraception during treatment with an OPDIVO- or YERVOY- containing regimen and for at least 5 months after the last dose of OPDIVO.
Lactation
It is not known whether OPDIVO or YERVOY is present in human milk. Because many drugs, including antibodies, are excreted in human milk and because of the potential for serious adverse reactions in nursing infants from an OPDIVO-containing regimen, advise women to discontinue breastfeeding during treatment. Advise women to discontinue nursing during treatment with YERVOY and for 3 months following the final dose.
Serious Adverse Reactions
In Checkmate 067, serious adverse reactions (73% and 37%), adverse reactions leading to permanent discontinuation (43% and 14%) or to dosing delays (55% and 28%), and Grade 3 or 4 adverse reactions (72% and 44%) all occurred more frequently in the OPDIVO plus YERVOY arm relative to the OPDIVO arm. The most frequent (≥10%) serious adverse reactions in the OPDIVO plus YERVOY arm and the OPDIVO arm, respectively, were diarrhea (13% and 2.6%), colitis (10% and 1.6%), and pyrexia (10% and 0.6%). In Checkmate 037, serious adverse reactions occurred in 41% of patients receiving OPDIVO. Grade 3 and 4 adverse reactions occurred in 42% of patients receiving OPDIVO. The most frequent Grade 3 and 4 adverse drug reactions reported in 2% to <5% of patients receiving OPDIVO were abdominal pain, hyponatremia, increased aspartate aminotransferase, and increased lipase. In Checkmate 066, serious adverse reactions occurred in 36% of patients receiving OPDIVO. Grade 3 and 4 adverse reactions occurred in 41% of patients receiving OPDIVO. The most frequent Grade 3 and 4 adverse reactions reported in ≥2% of patients receiving OPDIVO were gamma-glutamyltransferase increase (3.9%) and diarrhea (3.4%). In Checkmate 057, serious adverse reactions occurred in 47% of patients receiving OPDIVO. The most frequent serious adverse reactions reported in ≥2% of patients were pneumonia, pulmonary embolism, dyspnea, pleural effusion, and respiratory failure. In Checkmate 025, serious adverse reactions occurred in 47% of patients receiving OPDIVO. The most frequent serious adverse reactions reported in ≥2% of patients were acute kidney injury, pleural effusion, pneumonia, diarrhea, and hypercalcemia.
Common Adverse Reactions
In Checkmate 067, the most common (≥20%) adverse reactions in the OPDIVO plus YERVOY arm were fatigue (59%), rash (53%), diarrhea (52%), nausea (40%), pyrexia (37%), vomiting (28%), and dyspnea (20%). The most common (≥20%) adverse reactions in the OPDIVO arm were fatigue (53%), rash (40%), diarrhea (31%), and nausea (28%). In Checkmate 037, the most common adverse reaction (≥20%) reported with OPDIVO was rash (21%). In Checkmate 066, the most common adverse reactions (≥20%) reported with OPDIVO vs dacarbazine were fatigue (49% vs 39%), musculoskeletal pain (32% vs 25%), rash (28% vs 12%), and pruritus (23% vs 12%). In Checkmate 057, the most common adverse reactions (≥20%) reported with OPDIVO were fatigue (49%), musculoskeletal pain (36%), cough (30%), decreased appetite (29%), and constipation (23%). In Checkmate 025, the most common adverse reactions (≥20%) reported in patients receiving OPDIVO vs everolimus were asthenic conditions (56% vs 57%), cough (34% vs 38%), nausea (28% vs 29%), rash (28% vs 36%), dyspnea (27% vs 31%), diarrhea (25% vs 32%), constipation (23% vs 18%), decreased appetite (23% vs 30%), back pain (21% vs 16%), and arthralgia (20% vs 14%).
In a separate Phase 3 study of YERVOY 3 mg/kg, the most common adverse reactions (≥5%) in patients who received YERVOY at 3 mg/kg were fatigue (41%), diarrhea (32%), pruritus (31%), rash (29%), and colitis (8%).
Antwort auf Beitrag Nr.: 52.193.320 von Joschka Schröder am 14.04.16 23:47:26Der Vollständigkeit halber ein kleiner Nachtrag: Beim Kopieren der gestrigen Meldung habe ich versehentlich einen Teil der Indikationsübersicht "abgeschnitten". Nachfolgend deshalb die vollständige Übersicht, aus der klar wird, wieso in der Meldung auch Nebenwirkungen des Präparats YERVOY erwähnt werden ... OPDIVO und YERVOY werden in der Melanom-Therapie auch als Kombination verordnet.
OPDIVO® (nivolumab) as a single agent is indicated for the treatment of patients with BRAF V600 wild-type unresectable or metastatic melanoma.
OPDIVO® (nivolumab) as a single agent is indicated for the treatment of patients with BRAF V600 mutation-positive unresectable or metastatic melanoma. This indication is approved under accelerated approval based on progression-free survival. Continued approval for this indication may be contingent upon verification and description of clinical benefit in confirmatory trials.
OPDIVO® (nivolumab), in combination with YERVOY® (ipilimumab), is indicated for the treatment of patients with unresectable or metastatic melanoma. This indication is approved under accelerated approval based on progression-free survival. Continued approval for this indication may be contingent upon verification and description of clinical benefit in the confirmatory trials.
OPDIVO® (nivolumab) is indicated for the treatment of patients with metastatic non-small cell lung cancer (NSCLC) with progression on or after platinum-based chemotherapy. Patients with EGFR or ALK genomic tumor aberrations should have disease progression on FDA-approved therapy for these aberrations prior to receiving OPDIVO.
OPDIVO® (nivolumab) is indicated for the treatment of patients with advanced renal cell carcinoma (RCC) who have received prior anti-angiogenic therapy.
OPDIVO® (nivolumab) as a single agent is indicated for the treatment of patients with BRAF V600 wild-type unresectable or metastatic melanoma.
OPDIVO® (nivolumab) as a single agent is indicated for the treatment of patients with BRAF V600 mutation-positive unresectable or metastatic melanoma. This indication is approved under accelerated approval based on progression-free survival. Continued approval for this indication may be contingent upon verification and description of clinical benefit in confirmatory trials.
OPDIVO® (nivolumab), in combination with YERVOY® (ipilimumab), is indicated for the treatment of patients with unresectable or metastatic melanoma. This indication is approved under accelerated approval based on progression-free survival. Continued approval for this indication may be contingent upon verification and description of clinical benefit in the confirmatory trials.
OPDIVO® (nivolumab) is indicated for the treatment of patients with metastatic non-small cell lung cancer (NSCLC) with progression on or after platinum-based chemotherapy. Patients with EGFR or ALK genomic tumor aberrations should have disease progression on FDA-approved therapy for these aberrations prior to receiving OPDIVO.
OPDIVO® (nivolumab) is indicated for the treatment of patients with advanced renal cell carcinoma (RCC) who have received prior anti-angiogenic therapy.
Antwort auf Beitrag Nr.: 48.717.476 von Joschka Schröder am 07.01.15 16:28:48
Zur heutigen Meldung (Bimagrumab in der Indikation sIBM gescheitert): Hinsichtlich Bimagrumab gab es ja bereits einige Warnsignale (s. obiger Beitrag vom 07.01.15). Es ist es zum verzweifeln, dass immer wieder die Pipeline-Spitze abbricht.
Zitat von Joschka Schröder: Die ganze Studie und deren Ergebnisse sind fragwürdig. Mini-Patientenkollektive, Placebogruppe mit anderen Startwerten als Verumgruppe, Ergebnis je nach Untersuchungszeitpunkt mal in Verumgruppe, mal bei den Placebos besser. Wenn man nur das Abstract liest, könnte man meinen, Bimagrumab hätte überzeugende Ergebnisse geliefert. Nach Durchsicht aller Daten wird jedoch kein eindeutiger Effekt sichtbar. Insoweit bin ich von der Studie schon enttäuscht, zumal Bimagrumab ein wesentlicher Hoffnungsträger in der Pipeline ist (der zweite Hoffnungsträger BPS804 ist ja leider aus unbekanntem Grund gescheitert).
Zur heutigen Meldung (Bimagrumab in der Indikation sIBM gescheitert): Hinsichtlich Bimagrumab gab es ja bereits einige Warnsignale (s. obiger Beitrag vom 07.01.15). Es ist es zum verzweifeln, dass immer wieder die Pipeline-Spitze abbricht.
Angesichts der heutigen Meldung habe ich mir eben die Ergebnisse der Phase II-Studie NCT01433263 [Cachexia in Patients With Stage IV Non-small Cell Lung Cancer or Stage III/IV Adenocarcinoma of the Pancreas] angesehen. Auch dort kein Wirksamkeitsnachweis dür Bimagrumab (30 mg/kg i.v.).
Und in Studie NCT01669174 (Kachexie bei COPD-Patienten, 30 mg/kg i.v.): Muskelzuwachs, aber keine funktionelle Besserung.
Die unbefriedigenden Ergebnisse der beiden P2-Studien dürften der Grund dafür sein, dass man Bimagrumab in diesen Indikationen nicht in die Phase 3 gebracht hat.
Die unbefriedigenden Ergebnisse der beiden P2-Studien dürften der Grund dafür sein, dass man Bimagrumab in diesen Indikationen nicht in die Phase 3 gebracht hat.
In Joschkas Thread geht sowas weniger verloren - Oncomed Abstract-Titel zu ASCO:
Abstract #2516: Phase 1b Study of WNT Inhibitor Vantictumab (VAN, human monoclonal antibody) with Paclitaxel (P) in Patients (pts) with 1st- to 3rd-Line Metastatic HER2-Negative Breast Cancer (BC)
Abstract #8564: Updated results of Phase 1b study of tarextumab (TRXT, anti-Notch2/3) in combination with etoposide and platinum (EP) in patients (pts) with untreated extensive-stage small-cell lung cancer (ED-SCLC)
Abstract #2516: Phase 1b Study of WNT Inhibitor Vantictumab (VAN, human monoclonal antibody) with Paclitaxel (P) in Patients (pts) with 1st- to 3rd-Line Metastatic HER2-Negative Breast Cancer (BC)
Abstract #8564: Updated results of Phase 1b study of tarextumab (TRXT, anti-Notch2/3) in combination with etoposide and platinum (EP) in patients (pts) with untreated extensive-stage small-cell lung cancer (ED-SCLC)
Gestern hatte ich Gelegenheit, die Ergebnisse der drei klinischen Studien mit BHQ880 durchzusehen.
1) Indikation = "Multiples Myelom", Gabe zusammen mit Aclasta (= Bisphosponat von Novartis): geplant als Phase I/II-Studie. Abbruch nach Phase I, weil absehbar war, dass in Phase II nicht der primäre Endpunkt werden erreicht würde. Grund dafür war, dass zu wenige SRE´s (skeletal-related events) aufgetreten sind. Mithin scheint das Studienkonzept mangelhaft.
2) Indikation = bislang unbehandeltes "smoldering MM", open-label, singe-arm, Phase II. Ergebnis: 0 % ORR, Hinweis auf anabole Wirkung auf den Knochenstoffwechsel mittels Knochendichtemessung via quantitative Computertomographie, jedoch keine eindeutige Veränderung serologischer Parameter des Knochenstoffwechsels.
3) Indikation = unbehandeltes "MM + Niereninsuffizienz": Vorzeitiger Abbruch der Studie, weil sich die Standardtherapie zwischenzeitlich geändert hatte.
Die Studien 1 und 3 haben aufgrund konzeptioneller Mängel keinen nennenswerten Erkenntnisgewinn gebracht, in Studie 2 war m.E. die Hauptfragestellung (-> ORR) zweifelhaft. Hinsichtlich der wichtigen Frage des Knochenstoffwechsels ergab Studie 2 widersprüchliche Ergebnisse (Knochendichte versus Serologie).
Ob die untersuchten Indikationen für den Antikörper geeignet waren? Ich hatte und habe meine Zweifel. Fest dürfte wohl stehen, dass das Projekt BHQ880 nicht weiter verfolgt wird.
Meines Erachtens hätte man BHQ880 besser z.B. in Kombination mit Aclasta bei Osteoporose-Patienten testen sollen. Dies hat man vermutlich deshalb nicht gemacht, weil man BPS804 für aussichtsreicher hielt. Ok, im Grundsatz eigentlich verständlich, wenn man sich die präklinischen Daten anschaut. Nur hätte man BHQ880 dann nicht ersatzweise in mehr oder weniger aussichtlose Ersatzindikationen/-studien schicken sollen. Reine Geldverschwendung. Schade um die beteiligten Wissenschaftler, die viel Zeit in die Entwicklung des Antikörpers investiert haben.
1) Indikation = "Multiples Myelom", Gabe zusammen mit Aclasta (= Bisphosponat von Novartis): geplant als Phase I/II-Studie. Abbruch nach Phase I, weil absehbar war, dass in Phase II nicht der primäre Endpunkt werden erreicht würde. Grund dafür war, dass zu wenige SRE´s (skeletal-related events) aufgetreten sind. Mithin scheint das Studienkonzept mangelhaft.
2) Indikation = bislang unbehandeltes "smoldering MM", open-label, singe-arm, Phase II. Ergebnis: 0 % ORR, Hinweis auf anabole Wirkung auf den Knochenstoffwechsel mittels Knochendichtemessung via quantitative Computertomographie, jedoch keine eindeutige Veränderung serologischer Parameter des Knochenstoffwechsels.
3) Indikation = unbehandeltes "MM + Niereninsuffizienz": Vorzeitiger Abbruch der Studie, weil sich die Standardtherapie zwischenzeitlich geändert hatte.
Die Studien 1 und 3 haben aufgrund konzeptioneller Mängel keinen nennenswerten Erkenntnisgewinn gebracht, in Studie 2 war m.E. die Hauptfragestellung (-> ORR) zweifelhaft. Hinsichtlich der wichtigen Frage des Knochenstoffwechsels ergab Studie 2 widersprüchliche Ergebnisse (Knochendichte versus Serologie).
Ob die untersuchten Indikationen für den Antikörper geeignet waren? Ich hatte und habe meine Zweifel. Fest dürfte wohl stehen, dass das Projekt BHQ880 nicht weiter verfolgt wird.
Meines Erachtens hätte man BHQ880 besser z.B. in Kombination mit Aclasta bei Osteoporose-Patienten testen sollen. Dies hat man vermutlich deshalb nicht gemacht, weil man BPS804 für aussichtsreicher hielt. Ok, im Grundsatz eigentlich verständlich, wenn man sich die präklinischen Daten anschaut. Nur hätte man BHQ880 dann nicht ersatzweise in mehr oder weniger aussichtlose Ersatzindikationen/-studien schicken sollen. Reine Geldverschwendung. Schade um die beteiligten Wissenschaftler, die viel Zeit in die Entwicklung des Antikörpers investiert haben.
Antwort auf Beitrag Nr.: 52.253.452 von Ville7 am 22.04.16 12:02:02Auch relevant für Morphosys zu ASCO:
Abstract 2509
Phase I study of anti-mesothelin antibody drug conjugate anetumab ravtansine (AR).
Abstract 2509
Phase I study of anti-mesothelin antibody drug conjugate anetumab ravtansine (AR).
Antwort auf Beitrag Nr.: 52.285.480 von Ville7 am 27.04.16 09:42:48Abstract TPS8576
A pivotal randomized phase II study of anetumab ravtansine or vinorelbine in patients with advanced or metastatic pleural mesothelioma after progression on platinum/pemetrexed-based chemotherapy (NCT02610140
A pivotal randomized phase II study of anetumab ravtansine or vinorelbine in patients with advanced or metastatic pleural mesothelioma after progression on platinum/pemetrexed-based chemotherapy (NCT02610140
Bayer mit einem neuem Phase 2 Trial zu anetumab ravtansine:
https://clinicaltrials.gov/ct2/show/NCT02751918?term=bay94-9…
https://clinicaltrials.gov/ct2/show/NCT02751918?term=bay94-9…
ASCO: MOR202 und MOR208
Jun 06 Monday8:00 AM - 11:30 AM
Poster Session
Abstract 8012
MOR202 alone and in combination with pomalidomide or lenalidomide in relapsed or refractory multiple myeloma: Data from clinically relevant cohorts from a phase I/IIa study.
Poster Board: #277
Discussed at the Poster Discussion Session on Monday, June 6, 2016, 3:00 PM - 4:15 PM, at E354b
Marc S. Raab, MD, PhD - Presenter
Department of Medicine V, University Hospital Heidelberg
Abstract 7545
Subgroup analyses of diffuse large B-cell lymphoma (DLBCL) and indolent lymphoma cohorts from a phase IIa study of single-agent MOR208 in patients with relapsed or refractory non-Hodgkin’s lymphoma (R-R NHL).
Poster Board: #101
Wojciech Jurczak, MD PhD - Presenter
Malopolskie Medical Center
Abstract TPS7572
A phase II study of MOR208 plus idelalisib in patients with relapsed or refractory chronic lymphocytic leukemia (CLL) or small lymphocytic lymphoma (SLL) previously treated with a Bruton's tyrosine kinase inhibitor (MIRACLE).
Poster Board: #128a
Clemens-Martin Wendtner, MD - Presenter
Klinikum Schwabing, Department I of Medicine, Academic Teaching Hospital of University of Munich
Irgendwie blicke ich es nicht. Bimagrumab hat doch den primären Endpunkt der Studie nicht erreicht. Ich dachte, dass das Program in sIBM damit eingestellt wurde? Auf den Präsentationen und bei Morphosys selbst wird aber immer noch Studie 3 hinterlegt und das hier:
....BIMAGRUMAB-STUDIE: AKTUELLE INFOS
Hauptstudienziel nicht erreicht
Die MorphoSys AG hat in Abstimmung mit Novartis Pharmaceuticals am 20. April 2016 bekanntgegeben, dass die Substanz Bimagrumab in der sIBM-Studie (BYM338) nicht das erhoffte Ergebnis im Hinblick auf das Hauptstudienziel (primärer Studienendparameter) erbracht hat.
Als Haupstudienziel wurde im Studiendesign die Verbesserung der Gehstrecke in einem Zeitrahmen von sechs Minuten definiert - hier konnte kein signifikanter Unterschied zwischen Placebo und Bimagrubab festgestellt werden. Das bedeutet, es wurde im Hinblick auf diesen Parameter kein klarer Zusammenhang dafür gefunden, dass Bimagrumab besser wirkt als der Placebo.
Da aber bisher lediglich erste Auswertungen für diesen einzelnen Studienparameter vorliegen, lässt dieses vorläufige Ergebnis noch keine Rückschlüsse darauf zu, in wie weit weitere Studienziele erreicht werden können. Erst nach Abschluss der klinischen Studie und genauer Analyse aller relevanten Daten kann eine fundierte Aussage getroffen werden, ob und in welcher Weise Bimagrumab einen Einfluss auf den Verlauf von IBM hat. Mit dem abschließenden Ergebnis ist nicht vor September 2016 zu rechnen.
Erwähnenswert ist: Die Studie weist keine Sicherheitsprobleme auf, es traten keine schweren Nebenwirkungen auf, die Anlass zum Abbruch der Studie gegeben hätten. Alle weiteren Bimagrumab-Studien werden wie geplant fortgeführt.....
habe ich grad gefunden. Heißt das, dass doch noch mögliche Hoffnungen in das Projekt (bei sIBM) gesetzt werden und das letzte Wort hier doch noch nicht gesprochen wurde??
....BIMAGRUMAB-STUDIE: AKTUELLE INFOS
Hauptstudienziel nicht erreicht
Die MorphoSys AG hat in Abstimmung mit Novartis Pharmaceuticals am 20. April 2016 bekanntgegeben, dass die Substanz Bimagrumab in der sIBM-Studie (BYM338) nicht das erhoffte Ergebnis im Hinblick auf das Hauptstudienziel (primärer Studienendparameter) erbracht hat.
Als Haupstudienziel wurde im Studiendesign die Verbesserung der Gehstrecke in einem Zeitrahmen von sechs Minuten definiert - hier konnte kein signifikanter Unterschied zwischen Placebo und Bimagrubab festgestellt werden. Das bedeutet, es wurde im Hinblick auf diesen Parameter kein klarer Zusammenhang dafür gefunden, dass Bimagrumab besser wirkt als der Placebo.
Da aber bisher lediglich erste Auswertungen für diesen einzelnen Studienparameter vorliegen, lässt dieses vorläufige Ergebnis noch keine Rückschlüsse darauf zu, in wie weit weitere Studienziele erreicht werden können. Erst nach Abschluss der klinischen Studie und genauer Analyse aller relevanten Daten kann eine fundierte Aussage getroffen werden, ob und in welcher Weise Bimagrumab einen Einfluss auf den Verlauf von IBM hat. Mit dem abschließenden Ergebnis ist nicht vor September 2016 zu rechnen.
Erwähnenswert ist: Die Studie weist keine Sicherheitsprobleme auf, es traten keine schweren Nebenwirkungen auf, die Anlass zum Abbruch der Studie gegeben hätten. Alle weiteren Bimagrumab-Studien werden wie geplant fortgeführt.....
habe ich grad gefunden. Heißt das, dass doch noch mögliche Hoffnungen in das Projekt (bei sIBM) gesetzt werden und das letzte Wort hier doch noch nicht gesprochen wurde??

Antwort auf Beitrag Nr.: 52.397.568 von milchbubi am 12.05.16 22:31:42Bei bimagrumab wurde die Extension Studie (Phase 3) noch nicht gestoppt, da Novartis erst eine Entscheidung treffen muss. Ich bin alles andere als optimistisch. Weder für sBIM noch für das gesamte Projekt.
In den MOR-Abstracts (inkl. Partner-Abstracts) zum ASCO-Meeting findet sich nicht viel Verwertbares, einige versteckte Informationen sind aber schon interessant.
Dauer der Responses bei MOR208 in DLBCL mittlerweile 13,7 Monate, das ist ein sehr guter Wert.
Gut auch die bisherigen vantictumab-Phase Ib-Daten.
Ein fundierteres Urteil wird wohl erst nach dem Meeting möglich sein.
Dauer der Responses bei MOR208 in DLBCL mittlerweile 13,7 Monate, das ist ein sehr guter Wert.
Gut auch die bisherigen vantictumab-Phase Ib-Daten.
Ein fundierteres Urteil wird wohl erst nach dem Meeting möglich sein.
Nicht so schön sind die permanenten occulären Nebenwirkungen bei anetumab ravtansine, die bereits in der P1-Expansionskohorte zu einer weiteren Dosisreduktion geführt haben.
Zu den heutigen Präsentationen zu MOR202 und MOR208 beim ASCO-Meeting:
MOR202
Die Datenlage hat sich deutlich besser entwickelt als erwartet, wobei die "Monotherapie"-Daten (tatsächlich handelt es sich um eine MOR202-DEX-Kombibehandlung) letztlich irrelevant sind. Für die weitere klinische Entwicklung sind im Grunde genommen nur die 8 mg/kg und 12 mg/kg-MOR202/LEN(POM)/DEX-Ergebnisse von Bedeutung.
MOR202+POM/DEX (8 mg/kg): 50 % CR und 80 % CBR bei im Mittel 4 Vorbehandlungen ... wenn es dabei bleiben würde, müßte sich MOR202 hinter den anderen anti-CD38-Antikörpern und der übrigen Biotherapeutika-Konkurrenz nicht verstecken. Biotest´s anti-CD138-ADC z.B. hat in der POM/DEX-Kombi bislang noch überhaupt keine CR generiert (wobei die Anzahl der Vorbehandlungen in der BT-062-Studie noch unbekannt ist).
MOR202+LEN/DEX (8 mg/kg): ORR 75 % (aktuell 50 % VGPR und 25 % PR) bei im Median zwei Vorbehandlungen. In ähnlichen Größenordnungen bewegte sich Daratumumab in früheren Publikationen. Auch Sanofis anti-CD38-ADC SAR650984 erreichte ähnliche Werte (65 % ORR bei allerdings deutlich stärker austherapierten Patienten).
Auch wenn Quervergleiche immer mit Vorsicht zu genießen sind, allein schon, weil die jeweiligen Eingangskriterien (-> Patientenselektion) nicht identisch sind, so läßt sich doch sagen, dass Morphosys mit Fortschreiten der Studie immer mehr zu den Konkurrenzantikörpern aufgeschlossen hat. Auf Basis der aktuellen Datenlage sind keine nennenswerten Wirksamkeitsunterschiede zu erkennen. Alles natürlich unter Vorbehalt der sehr kleinen Kollektive.
Interessant und wichtig werden spätere Daten zur Dauer der klinischen Antworten sein. Morphosys verspricht sich diesbezüglich ja Vorteile wegen des geringeren Verbrauchs an Killerzellen.
Positiv ist bei MOR202 zudem die bessere Infusionsverträglichkeit.
Die MOR202-Präsentation ist eine positive Überraschung. Insbesondere mit dem kompletten Ansprechen auf die MOR202+POM/DEX-Therapie war angesichts der bisherigen Datenlage kaum zu rechnen.
MOR208
Hauptindikation ist ja die DLBCL. Hier waren die Ansprechraten des Gesamtkollektivs (inkl. der nicht evaluierbaren Patienten) ja bereits aus dem Abstract bekannt. Sie entsprechen in etwa den Ergebnissen, die mit Konkurrenzpräparaten wie Adcetris (anti-CD30), IMGN529 (anti-CD37) und SAR3419 (anti-CD19) erzielt werden können. Ein Highlight ist aber die Dauer der klinischen Antwort (DoR): 20 Monate sind absolut top. Im Abstract waren es noch 13,7 Monate und beim letzten ASCO-Meeting 7,7 Monate. Zum Vergleich: DoR Adcetris = 1,6 Monate!
Erfreulich auch die 40 %-Quote bzgl. des progressionsfreien Überlebens von 1 Jahr. Auch hier als Anhaltspunkt: Das mittlere PFS in der Adcetris-Studie betrug zuletzt 1,4 Monate im Gesamtkollektiv und 4 Monate bei den CD30-positiven Patienten.
FAZIT: Insgesamt hat Morphosys beim ASCO-Meeting unerwartet gute Daten präsentiert. Die paradoxe Kursreaktion ist nicht nachvollziehbar.
MOR202
Die Datenlage hat sich deutlich besser entwickelt als erwartet, wobei die "Monotherapie"-Daten (tatsächlich handelt es sich um eine MOR202-DEX-Kombibehandlung) letztlich irrelevant sind. Für die weitere klinische Entwicklung sind im Grunde genommen nur die 8 mg/kg und 12 mg/kg-MOR202/LEN(POM)/DEX-Ergebnisse von Bedeutung.
MOR202+POM/DEX (8 mg/kg): 50 % CR und 80 % CBR bei im Mittel 4 Vorbehandlungen ... wenn es dabei bleiben würde, müßte sich MOR202 hinter den anderen anti-CD38-Antikörpern und der übrigen Biotherapeutika-Konkurrenz nicht verstecken. Biotest´s anti-CD138-ADC z.B. hat in der POM/DEX-Kombi bislang noch überhaupt keine CR generiert (wobei die Anzahl der Vorbehandlungen in der BT-062-Studie noch unbekannt ist).
MOR202+LEN/DEX (8 mg/kg): ORR 75 % (aktuell 50 % VGPR und 25 % PR) bei im Median zwei Vorbehandlungen. In ähnlichen Größenordnungen bewegte sich Daratumumab in früheren Publikationen. Auch Sanofis anti-CD38-ADC SAR650984 erreichte ähnliche Werte (65 % ORR bei allerdings deutlich stärker austherapierten Patienten).
Auch wenn Quervergleiche immer mit Vorsicht zu genießen sind, allein schon, weil die jeweiligen Eingangskriterien (-> Patientenselektion) nicht identisch sind, so läßt sich doch sagen, dass Morphosys mit Fortschreiten der Studie immer mehr zu den Konkurrenzantikörpern aufgeschlossen hat. Auf Basis der aktuellen Datenlage sind keine nennenswerten Wirksamkeitsunterschiede zu erkennen. Alles natürlich unter Vorbehalt der sehr kleinen Kollektive.
Interessant und wichtig werden spätere Daten zur Dauer der klinischen Antworten sein. Morphosys verspricht sich diesbezüglich ja Vorteile wegen des geringeren Verbrauchs an Killerzellen.
Positiv ist bei MOR202 zudem die bessere Infusionsverträglichkeit.
Die MOR202-Präsentation ist eine positive Überraschung. Insbesondere mit dem kompletten Ansprechen auf die MOR202+POM/DEX-Therapie war angesichts der bisherigen Datenlage kaum zu rechnen.
MOR208
Hauptindikation ist ja die DLBCL. Hier waren die Ansprechraten des Gesamtkollektivs (inkl. der nicht evaluierbaren Patienten) ja bereits aus dem Abstract bekannt. Sie entsprechen in etwa den Ergebnissen, die mit Konkurrenzpräparaten wie Adcetris (anti-CD30), IMGN529 (anti-CD37) und SAR3419 (anti-CD19) erzielt werden können. Ein Highlight ist aber die Dauer der klinischen Antwort (DoR): 20 Monate sind absolut top. Im Abstract waren es noch 13,7 Monate und beim letzten ASCO-Meeting 7,7 Monate. Zum Vergleich: DoR Adcetris = 1,6 Monate!
Erfreulich auch die 40 %-Quote bzgl. des progressionsfreien Überlebens von 1 Jahr. Auch hier als Anhaltspunkt: Das mittlere PFS in der Adcetris-Studie betrug zuletzt 1,4 Monate im Gesamtkollektiv und 4 Monate bei den CD30-positiven Patienten.
FAZIT: Insgesamt hat Morphosys beim ASCO-Meeting unerwartet gute Daten präsentiert. Die paradoxe Kursreaktion ist nicht nachvollziehbar.
Antwort auf Beitrag Nr.: 52.555.256 von Joschka Schröder am 06.06.16 22:38:31Danke für deine Einschätzung, Joschka. MOR202 überzeugt mich immer noch nicht, hat einfach noch zu wenig Daten um die beobachteten Effekte fortschreiben zu können. Aber meine persönliche Hürde ist auch Recht hoch, das ist den hervorragenden Daten von Dara geschuldet.
Ich denke der relevante Grund, wieso der Kurs so abgetaucht ist, ist die klare Aussicht auf eine P3 in MOR202. Dr. Chatterjee, der die MOR202 Daten im Investorbriefing nach ASCO vorgestellt hat, meinte man solle doch eine P3 versuchen. Und zwar in Kombi mit POM, weil hier bei Dara noch keine Daten vorlägen. Man müsse sich dazu aber beeilen, da (sinngemäß) der Zug sonst abgefahren sei (zeitlich gegenüber Dara). Zudem sagt Schottelius, dass für die nächsten Schritte nicht unbedingt ein Partner erforderlich sei. Das klang etwas gedrängt und überstürzt für mich...
Das weckt dann wahrscheinlich auch nicht gerade die Zuversicht des Marktes. Ich hätte in der Wirksamkeit gerne zuerst die Aussicht, dass der AK gegenüber Dara mindestens gleichwertig ist
Ich denke der relevante Grund, wieso der Kurs so abgetaucht ist, ist die klare Aussicht auf eine P3 in MOR202. Dr. Chatterjee, der die MOR202 Daten im Investorbriefing nach ASCO vorgestellt hat, meinte man solle doch eine P3 versuchen. Und zwar in Kombi mit POM, weil hier bei Dara noch keine Daten vorlägen. Man müsse sich dazu aber beeilen, da (sinngemäß) der Zug sonst abgefahren sei (zeitlich gegenüber Dara). Zudem sagt Schottelius, dass für die nächsten Schritte nicht unbedingt ein Partner erforderlich sei. Das klang etwas gedrängt und überstürzt für mich...
Das weckt dann wahrscheinlich auch nicht gerade die Zuversicht des Marktes. Ich hätte in der Wirksamkeit gerne zuerst die Aussicht, dass der AK gegenüber Dara mindestens gleichwertig ist
Antwort auf Beitrag Nr.: 52.556.027 von Ville7 am 07.06.16 06:37:40
Das kann eigentlich insoweit nicht der Grund für den - aus meiner Sicht: paradoxen - Kurseinbruch sein, weil das Treffen erst nachbörslich stattgefunden hat. Während des Kurssturzes am gestrigen Vormittag deutscher Zeit war in den USA noch tiefe Nacht.
Die laufende Studie ist ja noch nicht fertig. Erst kommen noch die 16 mg/kg-Daten und - ganz wichtig - die Daten zur DoR. Hier erwartet Morphosys bekanntlich aufgrund der geringeren Depletion von Killerzellen ja Überlegenheit gegenüber Daratumumab. Danach wird man weitersehen.
Ich war auch immer gegenüber MOR202 skeptisch, muss aber zugeben, dass ich möglicherweise zu vorsichtig war. Jetzt das Projekt nicht einzustellen, ergäbe angesichts der aktuellen Datenlage keinen Sinn.
Bei dieser Gelegenheit noch etwas off topic: Frau Gutjahr-Löser toppt alle mir bekannten IR-Leute aus der Branche. Es ist immer wieder verblüffend, wie gut sie - auch über Konkurrenzentwicklungen und darüber hinaus gehende Themen - informiert ist. Ich hatte dies schon früher erwähnt, möchte das an dieser Stelle aber noch einmal wiederholen.
Zitat von Ville7: Ich denke der relevante Grund, wieso der Kurs so abgetaucht ist, ist die klare Aussicht auf eine P3 in MOR202. Dr. Chatterjee, der die MOR202 Daten im Investorbriefing nach ASCO vorgestellt hat, meinte man solle doch eine P3 versuchen. Und zwar in Kombi mit POM, weil hier bei Dara noch keine Daten vorlägen. Man müsse sich dazu aber beeilen, da (sinngemäß) der Zug sonst abgefahren sei (zeitlich gegenüber Dara). Zudem sagt Schottelius, dass für die nächsten Schritte nicht unbedingt ein Partner erforderlich sei. Das klang etwas gedrängt und überstürzt für mich...
Das weckt dann wahrscheinlich auch nicht gerade die Zuversicht des Marktes. Ich hätte in der Wirksamkeit gerne zuerst die Aussicht, dass der AK gegenüber Dara mindestens gleichwertig ist
Das kann eigentlich insoweit nicht der Grund für den - aus meiner Sicht: paradoxen - Kurseinbruch sein, weil das Treffen erst nachbörslich stattgefunden hat. Während des Kurssturzes am gestrigen Vormittag deutscher Zeit war in den USA noch tiefe Nacht.
Die laufende Studie ist ja noch nicht fertig. Erst kommen noch die 16 mg/kg-Daten und - ganz wichtig - die Daten zur DoR. Hier erwartet Morphosys bekanntlich aufgrund der geringeren Depletion von Killerzellen ja Überlegenheit gegenüber Daratumumab. Danach wird man weitersehen.
Ich war auch immer gegenüber MOR202 skeptisch, muss aber zugeben, dass ich möglicherweise zu vorsichtig war. Jetzt das Projekt nicht einzustellen, ergäbe angesichts der aktuellen Datenlage keinen Sinn.
Bei dieser Gelegenheit noch etwas off topic: Frau Gutjahr-Löser toppt alle mir bekannten IR-Leute aus der Branche. Es ist immer wieder verblüffend, wie gut sie - auch über Konkurrenzentwicklungen und darüber hinaus gehende Themen - informiert ist. Ich hatte dies schon früher erwähnt, möchte das an dieser Stelle aber noch einmal wiederholen.
Antwort auf Beitrag Nr.: 52.556.849 von Joschka Schröder am 07.06.16 08:45:08Ja der direkte Grund kann es nicht gewesen sein. Habe mich vielleicht auch falsch ausgedrückt. Die Daten zu MOR202 waren nun so gut, dass eine Phase3 in MOR202 vom Markt eingepreist wird. Das kann der Markt auch ohne die Aussagen, die das dann bestätigt haben, so gespielt haben.
Klar sind die Daten besser geworden. Aber meines Wissens ist auch die DoR bei Dara hervorragend. Trotz des Effektes, dass die CD38 Targetausprägungen mit der Antikörpergabe verschwinden (sich dann aber regenerieren), was bei MOR202 nicht der Fall sein soll.
Die Latte um Dara zu schlagen hängt eben sehr hoch, der Vorsprung ist gewaltig und einen Fuss in die Tür bekommt man nur, wenn MOR202 tatsächlich in bestimmten Bereichen klar überlegen ist - bei vergleichbarer Wirksamkeit. DoR oder infusionsbedingte Reaktionen. Und wenn man jetzt sehr zügig weiterentwickelt und dafür ne Menge Geld in die Hand nimmt. Also auch höheres Entwicklungsrisiko fährt.
Einstellen wäre für mich aktuell auch kein Thema. Aber ohne Partner in eine zweite P3 (neben MOr208) zu gehen sehe ich aus Sicht eines Investors als sehr hohes Risiko an und habe die Befürchtung, dass man nun massiv verwässern muss. Ich hoffe daher, dass sich für eine P3 noch ein neuer Partner finden lässt.
Hattest du längere Gespräche mit Frau Gutjahr-Löser oder wie kommst du zu der Einschätzung?
Klar sind die Daten besser geworden. Aber meines Wissens ist auch die DoR bei Dara hervorragend. Trotz des Effektes, dass die CD38 Targetausprägungen mit der Antikörpergabe verschwinden (sich dann aber regenerieren), was bei MOR202 nicht der Fall sein soll.
Die Latte um Dara zu schlagen hängt eben sehr hoch, der Vorsprung ist gewaltig und einen Fuss in die Tür bekommt man nur, wenn MOR202 tatsächlich in bestimmten Bereichen klar überlegen ist - bei vergleichbarer Wirksamkeit. DoR oder infusionsbedingte Reaktionen. Und wenn man jetzt sehr zügig weiterentwickelt und dafür ne Menge Geld in die Hand nimmt. Also auch höheres Entwicklungsrisiko fährt.
Einstellen wäre für mich aktuell auch kein Thema. Aber ohne Partner in eine zweite P3 (neben MOr208) zu gehen sehe ich aus Sicht eines Investors als sehr hohes Risiko an und habe die Befürchtung, dass man nun massiv verwässern muss. Ich hoffe daher, dass sich für eine P3 noch ein neuer Partner finden lässt.
Hattest du längere Gespräche mit Frau Gutjahr-Löser oder wie kommst du zu der Einschätzung?
Es ist klar das die sagen " die können es alleine" so lange die kein Partner finden für MOR202 weiterentwicklung. Es ist aber auch warscheinlich das die welches finden werden wann sich bei 16 mg/POM trend fortsetzt. Bei noch mal ~50 prozent "complete response" ( angenommen es passiert) wäre dumm abzubrechen. Klar sind das weietere Millionen die unsicher investiert werden müssen, aber anderseits ist beteiligung am zukunftlichen Profit auch höher. und dann reden wir niche mehr über 5-7%.... No pain, no gain.
Ich finde unterschied in Safety profil zwischen MOR202 und Dara echt klar. Natürlich muss vergleihbares wirksamkeit auch da sein..... Ich bin schon froh über die Daten auch wann blick auf kursentwicklung keine freude macht im Moment
Ich finde unterschied in Safety profil zwischen MOR202 und Dara echt klar. Natürlich muss vergleihbares wirksamkeit auch da sein..... Ich bin schon froh über die Daten auch wann blick auf kursentwicklung keine freude macht im Moment

mit ein Grund für den Kurseinbruch könnte die erneute Shortattacke von Adage capital gestern gewesen sein
Gut möglich aber, dad sie dieses mal falsch gewettet hsben, wenn die Investoren die Studienergebnisse anders bewerten!
Gut möglich aber, dad sie dieses mal falsch gewettet hsben, wenn die Investoren die Studienergebnisse anders bewerten!
Ohad Hammer auf Nachfrage wie er die Daten zu MOR208 und 202 @ASCO findet: "I don't find those data sets exciting."
Antwort auf Beitrag Nr.: 52.564.004 von Ville7 am 07.06.16 23:03:19
Ich habe in der Vergangenheit gelegentlich Kommentare von OH gelesen und fand sie eigentlich recht gut. In diesem Fall sind mir seine Ansichten jedoch unverständlich. Könnte es sein, dass er sich die Posterpräsentationen überhaupt nicht näher angesehen hat?
Nehmen wir MOR208. Die overall response rate beträgt im Kollektiv der evaluierbaren DLBCL-Patienten 36 %. Das ist gut und mit den Ergebnissen anderer Präparate vergleichbar, also tatsächlich nicht aufregend. ABER ... und darauf könntest Du OH einmal ansprechen, falls Ihr (wieder) miteinander korrespondieren solltet: Die mittlere Dauer des klinischen Ansprechens (DoR) beträgt bei MOR208 im Schnitt 13,7 Monate! Zum Vergleich: Das Hoffnungspräparat Venetoclax, ein gefeierter BCL2-Inhibitor aus einer AbbVie-Roche-Kooperation bringt es (bei geringeren Ansprechraten) gerade einmal auf 3,3 Monate und die Dauer der Responses nach Gabe des anti-CD30-ADC Adcetris endet (bei ähnlichen Ansprechraten wie MOR208) im Mittel bereits nach 1,6 Monaten. (Dass die mit MOR208 behandelten Patienten im Median 2 Vortherapien hinter sich hatten, während es bei Venetoclax 3 waren, kann man bei derart großen DoR-Differenzen vernachlässigen).
Welches Mittel würde man unter diesen Umständen einem Patienten am ehesten verordnen?
Ich gehe davon aus, dass OH diesen wichtigen Punkt einfach übersehen hat. Anders läßt sich seine Reaktion kaum erklären.
Bzgl. MOR202 sieht es ähnlich aus ... diejenigen Botschaften, die Anlass zur Freude geben, sind nur dann deutlich zu erkennen, wenn man das Poster aufmerksam betrachtet und sich speziell mit dem CD38-Target beschäftigt hat. Im Kongressband, d.h. in den Abstracts, finden sich in diesem Fall nicht die erforderlichen Informationen.
Zitat von Ville7: Ohad Hammer auf Nachfrage wie er die Daten zu MOR208 und 202 @ASCO findet: "I don't find those data sets exciting."
Ich habe in der Vergangenheit gelegentlich Kommentare von OH gelesen und fand sie eigentlich recht gut. In diesem Fall sind mir seine Ansichten jedoch unverständlich. Könnte es sein, dass er sich die Posterpräsentationen überhaupt nicht näher angesehen hat?
Nehmen wir MOR208. Die overall response rate beträgt im Kollektiv der evaluierbaren DLBCL-Patienten 36 %. Das ist gut und mit den Ergebnissen anderer Präparate vergleichbar, also tatsächlich nicht aufregend. ABER ... und darauf könntest Du OH einmal ansprechen, falls Ihr (wieder) miteinander korrespondieren solltet: Die mittlere Dauer des klinischen Ansprechens (DoR) beträgt bei MOR208 im Schnitt 13,7 Monate! Zum Vergleich: Das Hoffnungspräparat Venetoclax, ein gefeierter BCL2-Inhibitor aus einer AbbVie-Roche-Kooperation bringt es (bei geringeren Ansprechraten) gerade einmal auf 3,3 Monate und die Dauer der Responses nach Gabe des anti-CD30-ADC Adcetris endet (bei ähnlichen Ansprechraten wie MOR208) im Mittel bereits nach 1,6 Monaten. (Dass die mit MOR208 behandelten Patienten im Median 2 Vortherapien hinter sich hatten, während es bei Venetoclax 3 waren, kann man bei derart großen DoR-Differenzen vernachlässigen).
Welches Mittel würde man unter diesen Umständen einem Patienten am ehesten verordnen?
Ich gehe davon aus, dass OH diesen wichtigen Punkt einfach übersehen hat. Anders läßt sich seine Reaktion kaum erklären.
Bzgl. MOR202 sieht es ähnlich aus ... diejenigen Botschaften, die Anlass zur Freude geben, sind nur dann deutlich zu erkennen, wenn man das Poster aufmerksam betrachtet und sich speziell mit dem CD38-Target beschäftigt hat. Im Kongressband, d.h. in den Abstracts, finden sich in diesem Fall nicht die erforderlichen Informationen.
Antwort auf Beitrag Nr.: 52.564.250 von Joschka Schröder am 08.06.16 00:10:29Joschka, re MOR202:
Fragen: Ist es valide, wenn Morphosys seinen MOR202+Dex Trial zu Daratumumab ohne Dex vergleicht? Kann man beides als Monotherapie zählen, so wie Morphosys das macht? Erhöht Dex die Wirksamkeit des anti-CD38 Antikörpers nicht?
Vergleich von MOR202 8/16mg/kg+Dex gegenüber Dara 8/6mg/kg (SIRIUS Studie):
Dara: median 5 prior lines
Dara ORR: 29,2%
Dara mDoR: 7,4 Monate
MOR202: median 4 prior lines
MOR202 ORR (habe auch die unconfirmed PR gezählt): 3/12= 25% (mit Chance der weiteren Erhöhung, falls 1 unconfirmed MR oder 2 SD noch zu mindestens PR werden)
MOR202 mDoR: Wenn man von den 3 Responses diejenige Response nimmt, die die mittlere Dauer hat (Patient 12024) und vom Poster abliest, dann kommt man auf ca. 44 Wochen minus 8 Wochen (andauernd), gleichbedeutend mit mind. 8,3 Monate.
Sollte Dex keine Rolle spielen gibt es bisher in der Tat keine Hinweise, dass MOR202 in Monotherapie unterlegen ist. Natürlich ist Vorsicht geboten, da nur eine kleine Patientenzahl bei MOR202.
Fragen: Ist es valide, wenn Morphosys seinen MOR202+Dex Trial zu Daratumumab ohne Dex vergleicht? Kann man beides als Monotherapie zählen, so wie Morphosys das macht? Erhöht Dex die Wirksamkeit des anti-CD38 Antikörpers nicht?
Vergleich von MOR202 8/16mg/kg+Dex gegenüber Dara 8/6mg/kg (SIRIUS Studie):
Dara: median 5 prior lines
Dara ORR: 29,2%
Dara mDoR: 7,4 Monate
MOR202: median 4 prior lines
MOR202 ORR (habe auch die unconfirmed PR gezählt): 3/12= 25% (mit Chance der weiteren Erhöhung, falls 1 unconfirmed MR oder 2 SD noch zu mindestens PR werden)
MOR202 mDoR: Wenn man von den 3 Responses diejenige Response nimmt, die die mittlere Dauer hat (Patient 12024) und vom Poster abliest, dann kommt man auf ca. 44 Wochen minus 8 Wochen (andauernd), gleichbedeutend mit mind. 8,3 Monate.
Sollte Dex keine Rolle spielen gibt es bisher in der Tat keine Hinweise, dass MOR202 in Monotherapie unterlegen ist. Natürlich ist Vorsicht geboten, da nur eine kleine Patientenzahl bei MOR202.
Antwort auf Beitrag Nr.: 52.564.379 von Ville7 am 08.06.16 01:33:35Hier noch der Link zu den Dara-Daten der "SIRIUS" Studie:
http://www.jnj.com/news/all/Data-Show-Daratumumab-Achieved-a…
http://www.jnj.com/news/all/Data-Show-Daratumumab-Achieved-a…
Antwort auf Beitrag Nr.: 52.564.379 von Ville7 am 08.06.16 01:33:35https://en.wikipedia.org/wiki/Dexamethasone
"Dexamethasone is also used as a direct chemotherapeutic agent in certain haematological malignancies, especially in the treatment of multiple myeloma, in which dexamethasone is given alone or in combination with other chemotherapeutic drugs, including most commonly with thalidomide (Thal-dex), lenalidomide, bortezomib (Velcade, Vel-dex),[11] or a combination of doxorubicin (Adriamycin) and vincristine or bortezomib/lenalidomide/dexamethasone."
Wirksamkeiterhöhend? Ja oder Nein?
"Dexamethasone is also used as a direct chemotherapeutic agent in certain haematological malignancies, especially in the treatment of multiple myeloma, in which dexamethasone is given alone or in combination with other chemotherapeutic drugs, including most commonly with thalidomide (Thal-dex), lenalidomide, bortezomib (Velcade, Vel-dex),[11] or a combination of doxorubicin (Adriamycin) and vincristine or bortezomib/lenalidomide/dexamethasone."
Wirksamkeiterhöhend? Ja oder Nein?
Antwort auf Beitrag Nr.: 52.564.388 von Ville7 am 08.06.16 01:50:14Scheinbar ist Dex wirksamkeitserhöhend und selbst eine active drug gegen myeloma:
"Prednisone and dexamethasone are very active against myeloma with the advantages of oral administration and lack of myelotoxicity."
http://www.bloodjournal.org/content/116/13/2215?sso-checked=…
Sind Morphosys "Monotherapie"-Daten dann nicht geschummelt? Morphosys vergleicht ja seine MOR202+Dex Daten immer gegen Dara Mono (ohne Dex) u.a. bei der Goldman Sachs Healthcare Conference (https://cc.talkpoint.com/gold006/060716b_ae/?entity=35_8HFRC…) ab Minute 17:30 hier sagt Schottelius sie lägen bei 27% ORR und Dara im SIRIUS trial hatte 29% in Monotherapie. Das zu vergleichen ist dann ja nicht valide. Welcher Effekt ist Dex geschuldet und welcher dem MOR202 AK?
"Prednisone and dexamethasone are very active against myeloma with the advantages of oral administration and lack of myelotoxicity."
http://www.bloodjournal.org/content/116/13/2215?sso-checked=…
Sind Morphosys "Monotherapie"-Daten dann nicht geschummelt? Morphosys vergleicht ja seine MOR202+Dex Daten immer gegen Dara Mono (ohne Dex) u.a. bei der Goldman Sachs Healthcare Conference (https://cc.talkpoint.com/gold006/060716b_ae/?entity=35_8HFRC…) ab Minute 17:30 hier sagt Schottelius sie lägen bei 27% ORR und Dara im SIRIUS trial hatte 29% in Monotherapie. Das zu vergleichen ist dann ja nicht valide. Welcher Effekt ist Dex geschuldet und welcher dem MOR202 AK?
Beitrag zu dieser Diskussion schreiben
Zu dieser Diskussion können keine Beiträge mehr verfasst werden, da der letzte Beitrag vor mehr als zwei Jahren verfasst wurde und die Diskussion daraufhin archiviert wurde.
Bitte wenden Sie sich an feedback@wallstreet-online.de und erfragen Sie die Reaktivierung der Diskussion oder starten Sie eine neue Diskussion.
Investoren beobachten auch:
| Wertpapier | Perf. % |
|---|---|
| -1,92 | |
| -0,88 | |
| -2,92 | |
| +0,40 | |
| +1,19 | |
| +0,36 | |
| -0,84 | |
| +0,92 | |
| -0,74 | |
| -1,06 |
Meistdiskutiert
| Wertpapier | Beiträge | |
|---|---|---|
| 229 | ||
| 113 | ||
| 81 | ||
| 77 | ||
| 57 | ||
| 50 | ||
| 45 | ||
| 40 | ||
| 37 | ||
| 37 |
05:10 Uhr · kapitalerhoehungen.de · Morphosys |
11.04.24 · dpa-AFX · Morphosys |
11.04.24 · wO Newsflash · Morphosys |
11.04.24 · EQS Group AG · Morphosys |
10.04.24 · kapitalerhoehungen.de · Bayer |
02.04.24 · kapitalerhoehungen.de · Morphosys |
| Zeit | Titel |
|---|---|
| 15:27 Uhr | |
| 07.02.24 | |
| 06.02.24 | |
| 06.02.24 | |
| 16.01.24 | |
| 05.01.24 | |
| 11.12.23 |





















