INTROGEN prepares for boom - 500 Beiträge pro Seite
eröffnet am 18.01.04 17:26:27 von
neuester Beitrag 29.04.09 18:35:11 von
neuester Beitrag 29.04.09 18:35:11 von
Beiträge: 173
ID: 811.475
ID: 811.475
Aufrufe heute: 0
Gesamt: 13.758
Gesamt: 13.758
Aktive User: 0
ISIN: US46119F1075 · WKN: 936231
Neuigkeiten
| TitelBeiträge |
|---|
Werte aus der Branche Biotechnologie
| Wertpapier | Kurs | Perf. % |
|---|---|---|
| 1,2500 | +50,42 | |
| 1,0800 | +28,56 | |
| 2,1800 | +27,49 | |
| 1,9900 | +20,61 | |
| 10.777,50 | +19,75 |
| Wertpapier | Kurs | Perf. % |
|---|---|---|
| 46,60 | -15,27 | |
| 0,5701 | -16,77 | |
| 2,5100 | -17,43 | |
| 2,2001 | -20,57 | |
| 0,6339 | -33,97 |
Wer 2004 bei Biotech Investments in Bezug auf Performance ganz vorne mit dabei sein will, sollte sich den Artikel unter folgendem Link durchlesen !
http://www.bizjournals.com/austin/stories/2003/12/08/story2.…
Gruß und viel Erfolg,
chirint
http://www.bizjournals.com/austin/stories/2003/12/08/story2.…
Gruß und viel Erfolg,
chirint
Chirint,
bin auch dabei... halte INGN 2004 auch für sehr aussichtsreich. Allerdings ist Advexin noch nicht in trockenen Tüchern. Wann rechnest du mit den PhaseIII-Ergebnissen und mit der BLA?
http://www.google.de/search?q=cache:HGG_Jt18dQkJ:www.bioproc…
Interessant an einer Zulassung wäre nicht nur der Einsatz bei der aktuellen PhaseIII Indikation HNC, auch nicht der generelle Einsatz von Advexin, sondern dass es sich dann um die erste zugelassene Gentherapie der westlichen Welt handelt. Die anderen Vektoren von INGN müssten damit ebenfalls sehr viel höher bewertet werden, da die prinzipielle Wirksamkeit des Verfahrens bewiesen ist. (so wie man bei den Angiogenese-Hemmer auf Avastin geschaut hat)
was ist heute mit der HP los?
http://www.introgen.com
wurde sie von den Baptisten geentert?
Gibt es für dich noch weitere aussichtreiche Biotechs für 2004 (Blockbuster PhaseIII + niedrige Bewertung)? Was hälst du von GENR, PTIE oder GPC?
mfg ipollit
bin auch dabei... halte INGN 2004 auch für sehr aussichtsreich. Allerdings ist Advexin noch nicht in trockenen Tüchern. Wann rechnest du mit den PhaseIII-Ergebnissen und mit der BLA?
http://www.google.de/search?q=cache:HGG_Jt18dQkJ:www.bioproc…
Interessant an einer Zulassung wäre nicht nur der Einsatz bei der aktuellen PhaseIII Indikation HNC, auch nicht der generelle Einsatz von Advexin, sondern dass es sich dann um die erste zugelassene Gentherapie der westlichen Welt handelt. Die anderen Vektoren von INGN müssten damit ebenfalls sehr viel höher bewertet werden, da die prinzipielle Wirksamkeit des Verfahrens bewiesen ist. (so wie man bei den Angiogenese-Hemmer auf Avastin geschaut hat)
was ist heute mit der HP los?
http://www.introgen.com
wurde sie von den Baptisten geentert?

Gibt es für dich noch weitere aussichtreiche Biotechs für 2004 (Blockbuster PhaseIII + niedrige Bewertung)? Was hälst du von GENR, PTIE oder GPC?
mfg ipollit

Hallo ipollit
auf der letzten Pressekonferenz ließ das Management verlauten, dass Phase III Ergebnisse nicht vor einreichen der BLA veröffentlicht werden. Die BLA wiederum wird 2004 sektionsweise ("...on a rolling basis...") eingereicht, d.h. dies könnte sich schon bald ereignen. Bis jedoch die vollständigen Daten an die FDA weitergegeben können, werden meiner Meinung nach noch 6 Monate vergehen (Patienten-Rekrutierung bis Anfang 2004, follow up Untersuchungen ca. 6 Monate). Danach hat die FDA 6 Monate Zeit, um über die Zulassung von Advexin zu entscheiden. Damit erwarte ich für Mitte 2004 Phase III Ergebnisse und einen positiven Zulassungsbescheid für Advexin Ende 2004 o. Anfang 2005. An einer Zulassung zweifle ich keinen Moment lang (siehe Gendicine und China), auf Dauer kann sich die USA diesen Prestigeverlust auf diesem innovativen Sektor nicht leisten.
Gruß chirint
auf der letzten Pressekonferenz ließ das Management verlauten, dass Phase III Ergebnisse nicht vor einreichen der BLA veröffentlicht werden. Die BLA wiederum wird 2004 sektionsweise ("...on a rolling basis...") eingereicht, d.h. dies könnte sich schon bald ereignen. Bis jedoch die vollständigen Daten an die FDA weitergegeben können, werden meiner Meinung nach noch 6 Monate vergehen (Patienten-Rekrutierung bis Anfang 2004, follow up Untersuchungen ca. 6 Monate). Danach hat die FDA 6 Monate Zeit, um über die Zulassung von Advexin zu entscheiden. Damit erwarte ich für Mitte 2004 Phase III Ergebnisse und einen positiven Zulassungsbescheid für Advexin Ende 2004 o. Anfang 2005. An einer Zulassung zweifle ich keinen Moment lang (siehe Gendicine und China), auf Dauer kann sich die USA diesen Prestigeverlust auf diesem innovativen Sektor nicht leisten.
Gruß chirint
Moin zusammen,
hat eigentlich jemand eine Erklärung für den schleichenden Kursverfall der letzten 2 Wochen ??
kann keine News finden
Scheint sich zwar ein Boden zu bilden aber
Danke
Gruß Knolle
~braucht keine Chemie aufm Acker~
hat eigentlich jemand eine Erklärung für den schleichenden Kursverfall der letzten 2 Wochen ??
kann keine News finden

Scheint sich zwar ein Boden zu bilden aber

Danke
Gruß Knolle
~braucht keine Chemie aufm Acker~
Hallo,
es gibt zur Zeit keine News von Introgen.
Die Glücklichen, die im März bei 2$ eingestiegen waren, wollen jetzt Ihre Gewinne einstreichen. Zudem trennen sich wohl die Pechvögel von ihren fast 7 Mio. Stücken, die sie im September zu Kursen oberhalb 9,75$ eingekauft hatten.
Könnte sein, daß sich bald wieder gute Einstiegschancen bzw. Nachkaufgelegenheiten ergeben.
es gibt zur Zeit keine News von Introgen.
Die Glücklichen, die im März bei 2$ eingestiegen waren, wollen jetzt Ihre Gewinne einstreichen. Zudem trennen sich wohl die Pechvögel von ihren fast 7 Mio. Stücken, die sie im September zu Kursen oberhalb 9,75$ eingekauft hatten.
Könnte sein, daß sich bald wieder gute Einstiegschancen bzw. Nachkaufgelegenheiten ergeben.
Habe auf der Website von Roche folgende News zu p53 gefunden:
----------------------------------------------------------
Basel, 2. Februar 2004
Roche-Forscher entdecken Moleküle, die einen wichtigen Stoffwechselweg zur Tumorunterdrückung aktivieren
Forschern bei Roche ist es gelungen, neue Einblicke in den für Krebserkrankungen wichtigen Signalweg der Zelle zu gewinnen, bei dem das Tumorsuppressor-Gen p53 bzw. sein Genprodukt das P53 Protein, eine zentrale Rolle spielen. In einem in Science am 6. Februar publizierten Artikel und in Sciencexpress vom 2. Januar berichten sie über die Identifizierung eines Moleküls, das den p53 Signalweg aktiviert, indem es die Bindung des Hemmstoffes MDM2 an P53 verhindert. Krebsforscher interessieren sich schon seit Langem für den p53 Signalweg, doch hielten sie die Entwicklung eines niedermolekularen P53-MDM2-Bindungshemmers bislang für unmöglich. Eingriffe in die Wechselwirkung von Proteinen, stellen seit jeher eine Herausforderung für die Arzneimittelforschung dar. Die neuen Forschungsergebnisse belegen nun, dass dies möglich ist. Beim Tumorsuppressor-Gen p53 handelt es sich um einen hoch wirksamen Transkriptionsfaktor, der einen wichtigen Stoffwechselweg kontrolliert und in dieser Funktion die Zellen davor schützt zu entarten, d.h. zur Krebszelle zu werden. Daher ist das p53 Gen auch das am häufigsten inaktive Gen bei menschlichen Krebserkrankungen und somit ein wichtiges Zielmolekül in der Wirkstoffforschung. Bei rund 50% aller Tumoren des Menschen ist p53 nicht funktionsfähig und man geht davon aus, dass bei den restlichen Krebserkrankungen andere Mechanismen den Tumorsuppressor inaktivieren. Einer dieser Mechanismen ist die Überproduktion des natürlichen P53 Hemmstoffs MDM2. Lyubomir Vassilev, Forschungsleiter bei Roche und Hauptautor des Artikels, dazu: „Durch die Hemmung von MDM2 können wir P53 stabilisieren und aktivieren, wodurch es im Tumor zu einem Wachstumsstillstand und der Zerstörung der Zellen (Apoptose) kommt. Dieses Forschungsergebnis eröffnet möglicherweise neue Ansätze für die Krebstherapie und kann zur Entwicklung eines niedermolekularen Wirkstoffes führen, der oral verabreicht werden könnte.“ Zur Identifizierung des kleinen Moleküls – welches die P53-MDM2 Bindung verhindert, indem es an die P53 Andockstelle des MDM2 bindet - durchkämmten die Forscher bei Roche mit Hilfe des Hochleistungs-Screenings eine umfassende Bibliothek verschiedenartiger chemischer Substanzen und wurden dabei auf die Wirkstoffklasse der so genannten Nutline aufmerksam. Nutlin hemmt das Tumorwachstum bei Mäusen um 90%, ohne schädliche Nebenwirkungen hervorzurufen. Lyubomir Vassilev weiter: „Obschon MDM2-Antagonisten voraussichtlich bei Tumoren mit aussergewöhnlich hohem MDM2 Anteil die beste Wirkung entfalten, könnten auch viele jener Krebspatienten, die Träger eines normalen p53 Gens (p53-Wildtyps) sind, d.h. etwa 50% aller Patienten, von einer p53-aktivierenden Therapie profitieren.“David Heimbrook, Vizepräsident der Krebsforschung von Roche Nutley und Leiter des globalen therapeutischen Bereichs Onkologie von Roche, ergänzt: „Es sind zwar noch viele weitere Studien erforderlich, um das volle therapeutische Potenzial von Nutlin zu ermitteln, doch hat uns die vorliegende Forschungsarbeit nützliche Instrumente für das weitere Vorgehen zur Verfügung gestellt und unsere Kenntnisse im Bereich des p53-Signalwegs in mehrfacher Hinsicht erweitert.“
Über P53
Das P53-Protein und das dazugehörige Gen wurden 1979 entdeckt; seine Rolle als wichtiger Tumorsuppressor wurde jedoch erst in den frühen 1990er Jahren aufgeklärt. P53 nimmt eine zentrale Stellung in der Wachstums- und Teilungskontrolle von Zellen ein. Es kontrolliert die Reaktion von Zellen auf Stress – wozu auch die Schädigung der DNA zählt. P53 wird vor allem dann aktiv, wenn in der Zelle Erbgutschäden vorliegen, kann aber auch durch äussere Signale aktiviert werden. Bei Schädigung der Zelle unterbindet es den Zellzyklus, um eine DNA Reparatur zu ermöglichen oder gibt bei zu grosser Schädigung der Zellen den Befehl zum programmierten Zelltod (Apoptose). Auf diese Weise werden die Zellen vor der malignen Entartung geschützt. Bei dem für das P53-Protein codierenden Gen (p53) handelt es sich um das am häufigsten mutierte Gen bei menschlichen Krebserkrankungen. 50% aller Tumoren weisen Veränderungen des p53-Gens auf. Diese Zahl steigt bei gewissen Formen von Lungen- und Darmkrebs auf 60 bis 70% an.
Roche in der Onkologie
In den letzten fünf Jahren hat sich Roche zum weltweit führenden Anbieter von Krebstherapien, von Medikamenten für die unterstützende Behandlung sowie von Diagnostika entwickelt. Das Onkologiegeschäft umfasst mit Herceptin, MabThera und Xeloda gleich drei neuartige Präparate, die der Behandlung von Krebskrankheiten wie Brustkrebs, Non-Hodgkin-Lymphom und Dickdarmkrebs dienen und den Patienten einen Überlebensvorteil bieten. Weitere wichtige Medikamente auf diesem Gebiet sind: NeoRecormon (Anämie bei verschiedenen Krebserkrankungen), Bondronat (Verhütung skelettbezogener Ereignisse bei Brustkrebspatientinnen sowie bei Patienten mit Knochenmetastasen, tumorinduzierte Hyperkalzämie), Kytril (Übelkeit und Erbrechen infolge Chemo- oder Strahlentherapie) und Roferon-A (Leukämie, Kaposi-Sarkom, malignes Melanom, Nierenzellkarzinom). Roche erzielte in den ersten neun Monaten des Jahres 2003 Verkäufe von 4,5 Milliarden Schweizer Franken mit Krebsmedikamenten.Das Ziel der Krebsforschung bei Roche ist es, durch die Erforschung und Entwicklung neuartiger Therapien noch wirksamere Medikamente gegen Krebs zur Verfügung zu stellen. Im Zentrum der Forschung stehen die folgenden vier wichtigen Therapieansätze: Zytostatika, gezielt wirkende Medikamente auf molekularer Ebene, die Hemmung des Wachstums von Blutgefässen im Tumor sowie unterstützende Behandlungen für Krebspatienten. Dabei wird eine Vielzahl verschiedener Tumorarten untersucht, zu denen auch die fünf häufigsten und tödlichen Formen zählen: Lungenkrebs, Brustkrebs, Dickdarmkrebs, Prostatakrebs und das Lymphom.Roche entwickelt zudem neue Tests, welche die Behandlung von Krebspatienten künftig stark verbessern werden. Mit einem breiten Angebot an Tumormarkern für Prostata-, Dickdarm-, Leber-, Eierstock- und Brustkrebs, Krebserkrankungen des Magens, der Bauchspeicheldrüse und der Lunge sowie mit zahlreichen molekulardiagnostischen Krebstests wird Roche in der Onkologie auch weiterhin führend beim Anbot von Medikamenten und diagnostischen Produkten sein. Roche verfügt im Bereich Onkologie über vier Forschungsstandorte (zwei in den USA und je einem in Deutschland und Japan) sowie vier Hauptentwicklungsstandorte (zwei in den USA und je einem in Grossbritannien und der Schweiz).Über RocheRoche mit Hauptsitz in Basel, Schweiz, ist ein global führendes, auf Innovation fokussiertes Healthcare-Unternehmen mit den Schwerpunkten Pharma und Diagnostics. Roche ist weltweit die Nummer eins auf dem Diagnostikmarkt, der führende Anbieter von Krebsmedikamenten und nimmt in den Bereichen Virologie und Transplantation eine Spitzenposition ein. Mit Produkten und Dienstleistungen, die der Prävention, Diagnose und Behandlung von Krankheiten dienen, trägt das Unternehmen auf breiter Basis zur Verbesserung der Gesundheit und Lebensqualität von Menschen bei. Roche beschäftigt weltweit rund 65 000 Mitarbeitende in 150 Ländern. Das Unternehmen führt Allianzen sowie Forschungs- und Entwicklungskooperationen mit zahlreichen Partnern, hierzu gehören auch die Mehrheitsbeteiligungen an Genentech und Chugai.
Weitere Informationen
· Gene p53 - A Paradigm for Drug Discovery." The Pharmaceutical Journal. 2000; Volume 265, No 7116: p486 · www.roche.com/home/science/science-events/science-roundtablep.htm · www.gene.com/gene/index.jsp · www.sciencemag.org
----------------------------------------------------------
Basel, 2. Februar 2004
Roche-Forscher entdecken Moleküle, die einen wichtigen Stoffwechselweg zur Tumorunterdrückung aktivieren
Forschern bei Roche ist es gelungen, neue Einblicke in den für Krebserkrankungen wichtigen Signalweg der Zelle zu gewinnen, bei dem das Tumorsuppressor-Gen p53 bzw. sein Genprodukt das P53 Protein, eine zentrale Rolle spielen. In einem in Science am 6. Februar publizierten Artikel und in Sciencexpress vom 2. Januar berichten sie über die Identifizierung eines Moleküls, das den p53 Signalweg aktiviert, indem es die Bindung des Hemmstoffes MDM2 an P53 verhindert. Krebsforscher interessieren sich schon seit Langem für den p53 Signalweg, doch hielten sie die Entwicklung eines niedermolekularen P53-MDM2-Bindungshemmers bislang für unmöglich. Eingriffe in die Wechselwirkung von Proteinen, stellen seit jeher eine Herausforderung für die Arzneimittelforschung dar. Die neuen Forschungsergebnisse belegen nun, dass dies möglich ist. Beim Tumorsuppressor-Gen p53 handelt es sich um einen hoch wirksamen Transkriptionsfaktor, der einen wichtigen Stoffwechselweg kontrolliert und in dieser Funktion die Zellen davor schützt zu entarten, d.h. zur Krebszelle zu werden. Daher ist das p53 Gen auch das am häufigsten inaktive Gen bei menschlichen Krebserkrankungen und somit ein wichtiges Zielmolekül in der Wirkstoffforschung. Bei rund 50% aller Tumoren des Menschen ist p53 nicht funktionsfähig und man geht davon aus, dass bei den restlichen Krebserkrankungen andere Mechanismen den Tumorsuppressor inaktivieren. Einer dieser Mechanismen ist die Überproduktion des natürlichen P53 Hemmstoffs MDM2. Lyubomir Vassilev, Forschungsleiter bei Roche und Hauptautor des Artikels, dazu: „Durch die Hemmung von MDM2 können wir P53 stabilisieren und aktivieren, wodurch es im Tumor zu einem Wachstumsstillstand und der Zerstörung der Zellen (Apoptose) kommt. Dieses Forschungsergebnis eröffnet möglicherweise neue Ansätze für die Krebstherapie und kann zur Entwicklung eines niedermolekularen Wirkstoffes führen, der oral verabreicht werden könnte.“ Zur Identifizierung des kleinen Moleküls – welches die P53-MDM2 Bindung verhindert, indem es an die P53 Andockstelle des MDM2 bindet - durchkämmten die Forscher bei Roche mit Hilfe des Hochleistungs-Screenings eine umfassende Bibliothek verschiedenartiger chemischer Substanzen und wurden dabei auf die Wirkstoffklasse der so genannten Nutline aufmerksam. Nutlin hemmt das Tumorwachstum bei Mäusen um 90%, ohne schädliche Nebenwirkungen hervorzurufen. Lyubomir Vassilev weiter: „Obschon MDM2-Antagonisten voraussichtlich bei Tumoren mit aussergewöhnlich hohem MDM2 Anteil die beste Wirkung entfalten, könnten auch viele jener Krebspatienten, die Träger eines normalen p53 Gens (p53-Wildtyps) sind, d.h. etwa 50% aller Patienten, von einer p53-aktivierenden Therapie profitieren.“David Heimbrook, Vizepräsident der Krebsforschung von Roche Nutley und Leiter des globalen therapeutischen Bereichs Onkologie von Roche, ergänzt: „Es sind zwar noch viele weitere Studien erforderlich, um das volle therapeutische Potenzial von Nutlin zu ermitteln, doch hat uns die vorliegende Forschungsarbeit nützliche Instrumente für das weitere Vorgehen zur Verfügung gestellt und unsere Kenntnisse im Bereich des p53-Signalwegs in mehrfacher Hinsicht erweitert.“
Über P53
Das P53-Protein und das dazugehörige Gen wurden 1979 entdeckt; seine Rolle als wichtiger Tumorsuppressor wurde jedoch erst in den frühen 1990er Jahren aufgeklärt. P53 nimmt eine zentrale Stellung in der Wachstums- und Teilungskontrolle von Zellen ein. Es kontrolliert die Reaktion von Zellen auf Stress – wozu auch die Schädigung der DNA zählt. P53 wird vor allem dann aktiv, wenn in der Zelle Erbgutschäden vorliegen, kann aber auch durch äussere Signale aktiviert werden. Bei Schädigung der Zelle unterbindet es den Zellzyklus, um eine DNA Reparatur zu ermöglichen oder gibt bei zu grosser Schädigung der Zellen den Befehl zum programmierten Zelltod (Apoptose). Auf diese Weise werden die Zellen vor der malignen Entartung geschützt. Bei dem für das P53-Protein codierenden Gen (p53) handelt es sich um das am häufigsten mutierte Gen bei menschlichen Krebserkrankungen. 50% aller Tumoren weisen Veränderungen des p53-Gens auf. Diese Zahl steigt bei gewissen Formen von Lungen- und Darmkrebs auf 60 bis 70% an.
Roche in der Onkologie
In den letzten fünf Jahren hat sich Roche zum weltweit führenden Anbieter von Krebstherapien, von Medikamenten für die unterstützende Behandlung sowie von Diagnostika entwickelt. Das Onkologiegeschäft umfasst mit Herceptin, MabThera und Xeloda gleich drei neuartige Präparate, die der Behandlung von Krebskrankheiten wie Brustkrebs, Non-Hodgkin-Lymphom und Dickdarmkrebs dienen und den Patienten einen Überlebensvorteil bieten. Weitere wichtige Medikamente auf diesem Gebiet sind: NeoRecormon (Anämie bei verschiedenen Krebserkrankungen), Bondronat (Verhütung skelettbezogener Ereignisse bei Brustkrebspatientinnen sowie bei Patienten mit Knochenmetastasen, tumorinduzierte Hyperkalzämie), Kytril (Übelkeit und Erbrechen infolge Chemo- oder Strahlentherapie) und Roferon-A (Leukämie, Kaposi-Sarkom, malignes Melanom, Nierenzellkarzinom). Roche erzielte in den ersten neun Monaten des Jahres 2003 Verkäufe von 4,5 Milliarden Schweizer Franken mit Krebsmedikamenten.Das Ziel der Krebsforschung bei Roche ist es, durch die Erforschung und Entwicklung neuartiger Therapien noch wirksamere Medikamente gegen Krebs zur Verfügung zu stellen. Im Zentrum der Forschung stehen die folgenden vier wichtigen Therapieansätze: Zytostatika, gezielt wirkende Medikamente auf molekularer Ebene, die Hemmung des Wachstums von Blutgefässen im Tumor sowie unterstützende Behandlungen für Krebspatienten. Dabei wird eine Vielzahl verschiedener Tumorarten untersucht, zu denen auch die fünf häufigsten und tödlichen Formen zählen: Lungenkrebs, Brustkrebs, Dickdarmkrebs, Prostatakrebs und das Lymphom.Roche entwickelt zudem neue Tests, welche die Behandlung von Krebspatienten künftig stark verbessern werden. Mit einem breiten Angebot an Tumormarkern für Prostata-, Dickdarm-, Leber-, Eierstock- und Brustkrebs, Krebserkrankungen des Magens, der Bauchspeicheldrüse und der Lunge sowie mit zahlreichen molekulardiagnostischen Krebstests wird Roche in der Onkologie auch weiterhin führend beim Anbot von Medikamenten und diagnostischen Produkten sein. Roche verfügt im Bereich Onkologie über vier Forschungsstandorte (zwei in den USA und je einem in Deutschland und Japan) sowie vier Hauptentwicklungsstandorte (zwei in den USA und je einem in Grossbritannien und der Schweiz).Über RocheRoche mit Hauptsitz in Basel, Schweiz, ist ein global führendes, auf Innovation fokussiertes Healthcare-Unternehmen mit den Schwerpunkten Pharma und Diagnostics. Roche ist weltweit die Nummer eins auf dem Diagnostikmarkt, der führende Anbieter von Krebsmedikamenten und nimmt in den Bereichen Virologie und Transplantation eine Spitzenposition ein. Mit Produkten und Dienstleistungen, die der Prävention, Diagnose und Behandlung von Krankheiten dienen, trägt das Unternehmen auf breiter Basis zur Verbesserung der Gesundheit und Lebensqualität von Menschen bei. Roche beschäftigt weltweit rund 65 000 Mitarbeitende in 150 Ländern. Das Unternehmen führt Allianzen sowie Forschungs- und Entwicklungskooperationen mit zahlreichen Partnern, hierzu gehören auch die Mehrheitsbeteiligungen an Genentech und Chugai.
Weitere Informationen
· Gene p53 - A Paradigm for Drug Discovery." The Pharmaceutical Journal. 2000; Volume 265, No 7116: p486 · www.roche.com/home/science/science-events/science-roundtablep.htm · www.gene.com/gene/index.jsp · www.sciencemag.org
Hallo !
Finde ich gut, dass es hier doch ein paar Introgen Anhänger gibt. Abgesehen von der Firma interessiert mich die medizinsche Entwicklung auf diesem Gebiet sehr.
Kommende Woche rechne ich mit einer kurzfristig (wie meistens bisher) angekündigten Pressekonferrenz zum 4. Quartal 2003. Im Februar und März stehen weitere interessante Termine an (siehe homepage). Höhepunkt dürfte im Juni der ASCO Kongess sein. Um diesen Zeitraum dürfte meiner Meinung nach auch die Bekanntgabe des BLA-Antrages an die FDA fallen (nach Aussage von Introgen im ersten Halbjahr 2004). Nach Einreichen des Antrages hat die FDA 6 Monate Zeit (fast track status), über die Zulassung oder Ablehnung von Advexin zu entscheiden.
Der Kursverlauf in diesem Jahr zeigt eine gewisse Parallelität zu 2003. Im Februar wird nochmal versucht, die Kurse zu drücken, um günstig einzusteigen, danach geht´s bis Juni aufwärts.
Übrigens erhielt INGN letzte Woche ein wichtiges Patent bezüglich einer signifikant verbesserten Konservierungs- und Lagerungslösung für Adenoviren (die bei ADVEXIN als Genfähren für das p53 Gen fungieren). In Magel an Kenntissen auf dem innovativen Gebiet der Gentherape ist diese Meldung von der Finanzwelt noch (!) nicht entsprechend honoriert worden.
Grüsse und spannende Wochen und Monate,
chirint
Finde ich gut, dass es hier doch ein paar Introgen Anhänger gibt. Abgesehen von der Firma interessiert mich die medizinsche Entwicklung auf diesem Gebiet sehr.
Kommende Woche rechne ich mit einer kurzfristig (wie meistens bisher) angekündigten Pressekonferrenz zum 4. Quartal 2003. Im Februar und März stehen weitere interessante Termine an (siehe homepage). Höhepunkt dürfte im Juni der ASCO Kongess sein. Um diesen Zeitraum dürfte meiner Meinung nach auch die Bekanntgabe des BLA-Antrages an die FDA fallen (nach Aussage von Introgen im ersten Halbjahr 2004). Nach Einreichen des Antrages hat die FDA 6 Monate Zeit (fast track status), über die Zulassung oder Ablehnung von Advexin zu entscheiden.
Der Kursverlauf in diesem Jahr zeigt eine gewisse Parallelität zu 2003. Im Februar wird nochmal versucht, die Kurse zu drücken, um günstig einzusteigen, danach geht´s bis Juni aufwärts.
Übrigens erhielt INGN letzte Woche ein wichtiges Patent bezüglich einer signifikant verbesserten Konservierungs- und Lagerungslösung für Adenoviren (die bei ADVEXIN als Genfähren für das p53 Gen fungieren). In Magel an Kenntissen auf dem innovativen Gebiet der Gentherape ist diese Meldung von der Finanzwelt noch (!) nicht entsprechend honoriert worden.
Grüsse und spannende Wochen und Monate,
chirint
Introgen Therapeutics Presents Preclinical Data Supporting Utility of INGN 241 Combination Regimens for the Treatment of Lung and Breast Cancer
Tuesday February 17, 4:50 pm ET
Combination of INGN 241 and Genentech`s Herceptin Shows Promising Results In Breast Cancer Model
AUSTIN, Texas, Feb. 17 /PRNewswire-FirstCall/ -- Three abstracts evaluating the role of mda-7/IL-24, the active ingredient in Introgen Therapeutics` (Nasdaq: INGN - News) INGN 241, in models of lung and breast cancer were presented this weekend at the Society of University Surgeons 65th Annual Meeting. Introgen has completed a phase I/II clinical trial with INGN 241 and the data indicates that the therapy has demonstrated activity as a monotherapy in several cancer indications. Due to the multi-functional activity of mda-7/IL-24, which acts as a tumor suppressor, a potent inhibitor of angiogenesis and an immunostimulating cytokine, INGN 241 may have broad utility as a monotherapy or as a component of combination regimens in a variety of cancer indications.
ADVERTISEMENT
Abstract #42, "Combination therapy of Ad-mda7 and Herceptin increases apoptosis in Her-2/neu-overexpressing breast cancer" described preclinical studies of a promising combination therapy for breast cancer. INGN 241 and Herceptin® (trastuzumab) were evaluated as single agents and in combination. The data show that INGN 241 and Herceptin each reduced viability and tumor growth of HER2-positive cancer cell lines when used as monotherapy. INGN 241, but not Herceptin, demonstrated a similar growth inhibitory effect in HER2- negative cells. In HER2-positive cells, INGN 241 significantly enhanced the anti-tumor activity of Herceptin, resulting in increased growth inhibition. This appears to be the result of enhanced down-regulation, in the combination regimen, of specific proteins associated with a poor prognosis in patients with breast cancer. The complete data from this study are expected to be published in a peer-reviewed scientific publication later this year.
Two additional abstracts, "Adenoviral MDA-7 induces apoptosis in p53 resistant lung cancer cells through PKR induction" (Abstract #88) and "Histone deacetylase inhibition enhances Ad-mda-7 transgene expression and apoptosis induction in lung cancer cell lines" (Abstract #91) discussed studies evaluating two molecular pathways involved in INGN 241-induced cancer cell death. Data from Abstract #88 indicate that INGN 241 induces apoptosis (programmed cell death) through the activation of the PKR pathway, resulting in increased expression of key mediators of apoptosis. This study suggests that INGN 241 can overcome resistance to anti-cancer drugs by exploiting novel cancer-killing mechanisms. Data from Abstract #91 identify a novel approach to increasing anti-tumor activity in cancer cells treated with INGN 241. In these studies, the addition of an inhibitor of histone deacetylase four hours after treatment with INGN 241 resulted in increased amounts of MDA-7 protein and increased apoptosis in three different lung cancer cell lines. Histone deacetylase inhibitors include small chain fatty acids such as sodium butyrate and have shown promise as anti-cancer drug candidates. Complete data from the studies reported in Abstract #88 also are expected to be published later this year.
Sunil Chada, Ph.D., Introgen`s director of research and development, said, "A variety of preclinical studies of INGN 241 are providing important data that may enhance the clinical efficacy of this promising cancer therapy candidate. The addition of small molecules to INGN 241 regimens increases the rate of tumor cell killing and may allow us to achieve clinically meaningful effects at lower doses of INGN 241. Additionally, the promising results from the combination of INGN 241 and Herceptin highlight the broad utility of INGN 241 as a potential component of a variety of cancer regimens. We believe that these data will help to strengthen our clinical development program for INGN 241 and look forward to sharing the complete data set from these studies with our colleagues in the oncology community when they are published later this year."
The mda-7 gene was discovered by the laboratory of Dr. Paul B. Fisher, professor of clinical pathology and the Michael and Stella Chernow Urological Cancer Research Scientist in the Departments of Neurological Surgery, Pathology and Urology at Columbia University. Introgen holds an exclusive worldwide license to the mda-7 gene from the Corixa Corporation.
Introgen is a leader in the development and production of gene-based drugs for the treatment of cancer and other diseases. Introgen maintains integrated research, development, manufacturing, clinical and regulatory departments and operates a commercial-scale, CGMP manufacturing facility.
Certain statements in this press release that are not strictly historical may be "forward-looking" statements, which involve risks and uncertainties. Such forward-looking statements include, but are not limited to, those relating to Introgen`s future success with its clinical development program with INGN 241 for the treatment of cancer. There can be no assurance that Introgen will be able to commercially develop gene-based drugs, that necessary regulatory approvals will be obtained or that any clinical trials or studies undertaken will be successful or that the proposed treatments will prove to be safe and/or effective. The actual results may differ from those described in this press release due to risks and uncertainties that exist in Introgen`s operations and business environment, including, but without limitation, Introgen`s stage of product development and the limited experience in the development of gene-based drugs in general, Introgen`s dependence upon proprietary technology and current competition, history of operating losses and accumulated deficits, reliance on collaborative relationships, and uncertainties related to clinical trials, the safety and efficacy of Introgen`s product candidates, the ability to obtain the appropriate regulatory approvals, patent protection and market acceptance, as well as other risks detailed from time to time in Introgen`s filings with the Securities and Exchange Commission, including its annual report on Form 10-K filed on March 31, 2003 and its quarterly report on Form 10-Q filed on November 14, 2003, and its prospectus supplement filed with the SEC pursuant to Rule 424(b)(2) on November 26, 2003. Introgen undertakes no obligation to publicly release the results of any revisions to any forward-looking statements that reflect events or circumstances arising after the date hereof.
Tuesday February 17, 4:50 pm ET
Combination of INGN 241 and Genentech`s Herceptin Shows Promising Results In Breast Cancer Model
AUSTIN, Texas, Feb. 17 /PRNewswire-FirstCall/ -- Three abstracts evaluating the role of mda-7/IL-24, the active ingredient in Introgen Therapeutics` (Nasdaq: INGN - News) INGN 241, in models of lung and breast cancer were presented this weekend at the Society of University Surgeons 65th Annual Meeting. Introgen has completed a phase I/II clinical trial with INGN 241 and the data indicates that the therapy has demonstrated activity as a monotherapy in several cancer indications. Due to the multi-functional activity of mda-7/IL-24, which acts as a tumor suppressor, a potent inhibitor of angiogenesis and an immunostimulating cytokine, INGN 241 may have broad utility as a monotherapy or as a component of combination regimens in a variety of cancer indications.
ADVERTISEMENT
Abstract #42, "Combination therapy of Ad-mda7 and Herceptin increases apoptosis in Her-2/neu-overexpressing breast cancer" described preclinical studies of a promising combination therapy for breast cancer. INGN 241 and Herceptin® (trastuzumab) were evaluated as single agents and in combination. The data show that INGN 241 and Herceptin each reduced viability and tumor growth of HER2-positive cancer cell lines when used as monotherapy. INGN 241, but not Herceptin, demonstrated a similar growth inhibitory effect in HER2- negative cells. In HER2-positive cells, INGN 241 significantly enhanced the anti-tumor activity of Herceptin, resulting in increased growth inhibition. This appears to be the result of enhanced down-regulation, in the combination regimen, of specific proteins associated with a poor prognosis in patients with breast cancer. The complete data from this study are expected to be published in a peer-reviewed scientific publication later this year.
Two additional abstracts, "Adenoviral MDA-7 induces apoptosis in p53 resistant lung cancer cells through PKR induction" (Abstract #88) and "Histone deacetylase inhibition enhances Ad-mda-7 transgene expression and apoptosis induction in lung cancer cell lines" (Abstract #91) discussed studies evaluating two molecular pathways involved in INGN 241-induced cancer cell death. Data from Abstract #88 indicate that INGN 241 induces apoptosis (programmed cell death) through the activation of the PKR pathway, resulting in increased expression of key mediators of apoptosis. This study suggests that INGN 241 can overcome resistance to anti-cancer drugs by exploiting novel cancer-killing mechanisms. Data from Abstract #91 identify a novel approach to increasing anti-tumor activity in cancer cells treated with INGN 241. In these studies, the addition of an inhibitor of histone deacetylase four hours after treatment with INGN 241 resulted in increased amounts of MDA-7 protein and increased apoptosis in three different lung cancer cell lines. Histone deacetylase inhibitors include small chain fatty acids such as sodium butyrate and have shown promise as anti-cancer drug candidates. Complete data from the studies reported in Abstract #88 also are expected to be published later this year.
Sunil Chada, Ph.D., Introgen`s director of research and development, said, "A variety of preclinical studies of INGN 241 are providing important data that may enhance the clinical efficacy of this promising cancer therapy candidate. The addition of small molecules to INGN 241 regimens increases the rate of tumor cell killing and may allow us to achieve clinically meaningful effects at lower doses of INGN 241. Additionally, the promising results from the combination of INGN 241 and Herceptin highlight the broad utility of INGN 241 as a potential component of a variety of cancer regimens. We believe that these data will help to strengthen our clinical development program for INGN 241 and look forward to sharing the complete data set from these studies with our colleagues in the oncology community when they are published later this year."
The mda-7 gene was discovered by the laboratory of Dr. Paul B. Fisher, professor of clinical pathology and the Michael and Stella Chernow Urological Cancer Research Scientist in the Departments of Neurological Surgery, Pathology and Urology at Columbia University. Introgen holds an exclusive worldwide license to the mda-7 gene from the Corixa Corporation.
Introgen is a leader in the development and production of gene-based drugs for the treatment of cancer and other diseases. Introgen maintains integrated research, development, manufacturing, clinical and regulatory departments and operates a commercial-scale, CGMP manufacturing facility.
Certain statements in this press release that are not strictly historical may be "forward-looking" statements, which involve risks and uncertainties. Such forward-looking statements include, but are not limited to, those relating to Introgen`s future success with its clinical development program with INGN 241 for the treatment of cancer. There can be no assurance that Introgen will be able to commercially develop gene-based drugs, that necessary regulatory approvals will be obtained or that any clinical trials or studies undertaken will be successful or that the proposed treatments will prove to be safe and/or effective. The actual results may differ from those described in this press release due to risks and uncertainties that exist in Introgen`s operations and business environment, including, but without limitation, Introgen`s stage of product development and the limited experience in the development of gene-based drugs in general, Introgen`s dependence upon proprietary technology and current competition, history of operating losses and accumulated deficits, reliance on collaborative relationships, and uncertainties related to clinical trials, the safety and efficacy of Introgen`s product candidates, the ability to obtain the appropriate regulatory approvals, patent protection and market acceptance, as well as other risks detailed from time to time in Introgen`s filings with the Securities and Exchange Commission, including its annual report on Form 10-K filed on March 31, 2003 and its quarterly report on Form 10-Q filed on November 14, 2003, and its prospectus supplement filed with the SEC pursuant to Rule 424(b)(2) on November 26, 2003. Introgen undertakes no obligation to publicly release the results of any revisions to any forward-looking statements that reflect events or circumstances arising after the date hereof.
Introgen`s INGN 241 Continues to Demonstrate Broad Utility as a Novel Anti-Cancer Agent
Wednesday March 31, 8:04 am ET
Studies Show INGN 241 Can Effectively Induce Cancer Cell Death as a Single Agent and in Combination With Other Cancer Therapies
ORLANDO, Fla., March 31 /PRNewswire-FirstCall/ -- Introgen Therapeutics (Nasdaq: INGN - News) presented preclinical data at the 95th annual meeting of the American Association of Cancer Research (AACR) supporting the utility of MDA-7/IL-24, the active ingredient in INGN 241. Anti-tumor activity of INGN 241 was demonstrated in multiple cancer settings as a single agent and in combination with a variety of other therapeutic approaches. The data were reported during various sessions at AACR. The studies were conducted as part of an ongoing collaboration between researchers at Introgen and The University of Texas M. D. Anderson Cancer Center. INGN 241 is currently in Phase 1 and 2 trials in a variety of cancers.
ADVERTISEMENT
"These studies demonstrate that INGN 241 can effectively induce cancer cell death as a single agent and improves killing of tumor cells when combined with other cancer therapies," said Dr. Sunil Chada, Introgen`s director of research and development.
Importantly, these studies show that INGN 241 can be combined with standard treatments such as radiation, and with other novel therapeutic agents such as monoclonal antibodies or small molecule drugs to enhance tumor cell death. Additionally, the data show that the anti-cancer effects of INGN 241 are mediated through multiple molecular pathways. The ability of INGN 241 to cause cancer cell death through a variety of molecular pathways and in combination with multiple therapeutic modalities suggests that this innovative product candidate may have broad utility in treating a variety of cancers.
"The more we learn about mda-7 gene expression in a variety of cancer settings, the more excited we become about the potential utility of INGN 241 in the treatment of this devastating disease," stated Dr. Chada.
The abstracts, which are available at the American Association of Cancer Research website, www.aacr.org , include:
Abstract #568: Involvement of PERK in Human MDA-IL-24 Mediated Inhibition of Murine Tumor Cell Growth.
Abstract #584: MDA-7/IL 24 Mediated Killing of Human Ovarian Cells Involves the Fas/FasL signaling pathway.
Abstract #3778: Melanoma Differentiation Associated Gene-7 Protein Physically Associates With the Double-Stranded RNA Activated Protein Kinase PKR In Vitro.
Abstract #4891: Mda7-IL-24 in Combination with Sulindac Induces a Synergistic Therapeutic Effect in Human Lung Cancer Cells.
Abstract #4970: Ad-mda7 Activates the UPR Pathway in Lung Cancer Cells.
Abstract #5303: Recombinant Human MDA-7/IL-24 Protein Suppresses the Expression of Proteins Involved in DNA Repair and Inhibition of Apoptosis in Endothelial Cells.
About Introgen
Introgen is a leading developer of biopharmaceutical products designed to induce therapeutic protein expression using non-integrating gene agents for the treatment of cancer and other diseases. Introgen maintains integrated research, development, manufacturing, clinical and regulatory departments and operates a commercial-scale, CGMP manufacturing facility.
Certain statements in this press release that are not strictly historical may be "forward-looking" statements, which are based on current expectations and entail various risks and uncertainties. Such forward-looking statements include, but are not limited to, those relating to Introgen`s future success with its INGN 241 clinical development program for cancer and other diseases. There can be no assurance that Introgen will be able to commercially develop gene-based drugs, that necessary regulatory approvals will be obtained or that any clinical trials or studies undertaken will be successful or that the proposed treatments will prove to be safe and/or effective. The actual results may differ from those described in this press release due to risks and uncertainties that exist in Introgen`s operations and business environment, including, but without limitation, Introgen`s stage of product development and the limited experience in the development of gene-based drugs in general, Introgen`s dependence upon proprietary technology and current competition, history of operating losses and accumulated deficits, reliance on collaborative relationships, and uncertainties related to clinical trials, the safety and efficacy of Introgen`s product candidates, the ability to obtain the appropriate regulatory approvals, patent protection and market acceptance, as well as other risks detailed from time to time in Introgen`s filings with the Securities and Exchange Commission. Introgen undertakes no obligation to publicly release the results of any revisions to any forward-looking statements that reflect events or circumstances arising after the date hereof.
For more information on Introgen Therapeutics, or for a menu of archived press releases, please visit Introgen`s Website at: www.introgen.com .
Wednesday March 31, 8:04 am ET
Studies Show INGN 241 Can Effectively Induce Cancer Cell Death as a Single Agent and in Combination With Other Cancer Therapies
ORLANDO, Fla., March 31 /PRNewswire-FirstCall/ -- Introgen Therapeutics (Nasdaq: INGN - News) presented preclinical data at the 95th annual meeting of the American Association of Cancer Research (AACR) supporting the utility of MDA-7/IL-24, the active ingredient in INGN 241. Anti-tumor activity of INGN 241 was demonstrated in multiple cancer settings as a single agent and in combination with a variety of other therapeutic approaches. The data were reported during various sessions at AACR. The studies were conducted as part of an ongoing collaboration between researchers at Introgen and The University of Texas M. D. Anderson Cancer Center. INGN 241 is currently in Phase 1 and 2 trials in a variety of cancers.
ADVERTISEMENT
"These studies demonstrate that INGN 241 can effectively induce cancer cell death as a single agent and improves killing of tumor cells when combined with other cancer therapies," said Dr. Sunil Chada, Introgen`s director of research and development.
Importantly, these studies show that INGN 241 can be combined with standard treatments such as radiation, and with other novel therapeutic agents such as monoclonal antibodies or small molecule drugs to enhance tumor cell death. Additionally, the data show that the anti-cancer effects of INGN 241 are mediated through multiple molecular pathways. The ability of INGN 241 to cause cancer cell death through a variety of molecular pathways and in combination with multiple therapeutic modalities suggests that this innovative product candidate may have broad utility in treating a variety of cancers.
"The more we learn about mda-7 gene expression in a variety of cancer settings, the more excited we become about the potential utility of INGN 241 in the treatment of this devastating disease," stated Dr. Chada.
The abstracts, which are available at the American Association of Cancer Research website, www.aacr.org , include:
Abstract #568: Involvement of PERK in Human MDA-IL-24 Mediated Inhibition of Murine Tumor Cell Growth.
Abstract #584: MDA-7/IL 24 Mediated Killing of Human Ovarian Cells Involves the Fas/FasL signaling pathway.
Abstract #3778: Melanoma Differentiation Associated Gene-7 Protein Physically Associates With the Double-Stranded RNA Activated Protein Kinase PKR In Vitro.
Abstract #4891: Mda7-IL-24 in Combination with Sulindac Induces a Synergistic Therapeutic Effect in Human Lung Cancer Cells.
Abstract #4970: Ad-mda7 Activates the UPR Pathway in Lung Cancer Cells.
Abstract #5303: Recombinant Human MDA-7/IL-24 Protein Suppresses the Expression of Proteins Involved in DNA Repair and Inhibition of Apoptosis in Endothelial Cells.
About Introgen
Introgen is a leading developer of biopharmaceutical products designed to induce therapeutic protein expression using non-integrating gene agents for the treatment of cancer and other diseases. Introgen maintains integrated research, development, manufacturing, clinical and regulatory departments and operates a commercial-scale, CGMP manufacturing facility.
Certain statements in this press release that are not strictly historical may be "forward-looking" statements, which are based on current expectations and entail various risks and uncertainties. Such forward-looking statements include, but are not limited to, those relating to Introgen`s future success with its INGN 241 clinical development program for cancer and other diseases. There can be no assurance that Introgen will be able to commercially develop gene-based drugs, that necessary regulatory approvals will be obtained or that any clinical trials or studies undertaken will be successful or that the proposed treatments will prove to be safe and/or effective. The actual results may differ from those described in this press release due to risks and uncertainties that exist in Introgen`s operations and business environment, including, but without limitation, Introgen`s stage of product development and the limited experience in the development of gene-based drugs in general, Introgen`s dependence upon proprietary technology and current competition, history of operating losses and accumulated deficits, reliance on collaborative relationships, and uncertainties related to clinical trials, the safety and efficacy of Introgen`s product candidates, the ability to obtain the appropriate regulatory approvals, patent protection and market acceptance, as well as other risks detailed from time to time in Introgen`s filings with the Securities and Exchange Commission. Introgen undertakes no obligation to publicly release the results of any revisions to any forward-looking statements that reflect events or circumstances arising after the date hereof.
For more information on Introgen Therapeutics, or for a menu of archived press releases, please visit Introgen`s Website at: www.introgen.com .
Homepage-Update von Introgen:
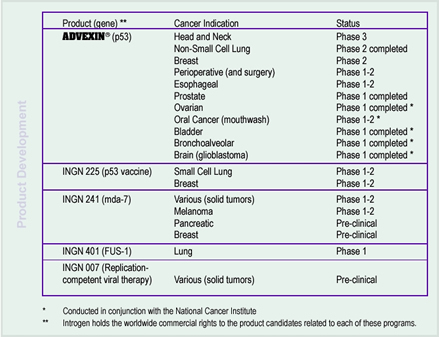
Laut INGN-Management soll BLA für Advexin (fast track status) im 1. Halbjahr 2004 eingereicht werden!
Grüsse, chirint

Laut INGN-Management soll BLA für Advexin (fast track status) im 1. Halbjahr 2004 eingereicht werden!
Grüsse, chirint
@chirint
Advexin ist, wenn ich das richtig verstanden habe ja nur lokal wirksam, oder? Ist damit der Einsatz stark limitiert? Ich hoffe mal, dass Advexin unabhängig vom Erfolg der Therapie zu einem Durchbruch für die Gentherapie wird... damit müßte Introgen insgesamt ja auch positiver gesehen werden.
Warum ist mda-7 vielversprechender als Advexin? Und wie sieht es mit FUS-1 und INGN007 aus?
Hast du von microcapfun das pdf erhalten? Wovon handelt es, dass er es nicht offentlich ins board stellt?
mfg ipollit
Advexin ist, wenn ich das richtig verstanden habe ja nur lokal wirksam, oder? Ist damit der Einsatz stark limitiert? Ich hoffe mal, dass Advexin unabhängig vom Erfolg der Therapie zu einem Durchbruch für die Gentherapie wird... damit müßte Introgen insgesamt ja auch positiver gesehen werden.
Warum ist mda-7 vielversprechender als Advexin? Und wie sieht es mit FUS-1 und INGN007 aus?
Hast du von microcapfun das pdf erhalten? Wovon handelt es, dass er es nicht offentlich ins board stellt?
mfg ipollit

chirint,
Introgen ist interessant, beschäftigst du dich aber auch mit anderen Biotechs? Hast du vielleicht einen weiteren interessanten Wert? ... ich bin immer auf der Suche.
mfg ipollit
Introgen ist interessant, beschäftigst du dich aber auch mit anderen Biotechs? Hast du vielleicht einen weiteren interessanten Wert? ... ich bin immer auf der Suche.
mfg ipollit

Hi ipollit,
außer INGN, war ich in ONCY, Onyx Pharm. und Elan aktiv, bin aber bei allen schon Ende letzten Jahres ausgestiegen (leider zu früh). Aktuell halte ich nur meine Position bei INGN und kaufe hier bei Rückschlägen nach. Ich denke 2004 dürfte ein gutes Jahr für INGN werden. Leider habe momentan nicht genug Zeit um mich intensiv mit anderen Werten auseinanderzusetzen. Generell halte ich derzeit Complementinhibitoren für interessant, muss aber noch weitere Literatur studieren (sofern ich Zeit habe wie gesagt).
Microcapfun hat mir einen Artikel uber Ad p53 Gentherapie und Advexin gemailt (Edelman et al., Curr Opin Mol Ther 2003). Den hatte ich schon zuvor gelesen, zwar ganz interessant aber nicht wirklich neue Aufschlüsse über den aktuellen Stand von Advexin (bezieht sich vielmehr auf die Phase II Studien T201 und T202, beinhaltet also nicht die neuen Daten von Aventis T207).
Nachteil von Advexin, wenn man es so nennen möchte, ist, dass es im Prinzip wohl nur lokal und nicht systemisch angewandt werden kann. Das stimmt aber nur zum Teil, INGN225 z.B. (dendritische Zellen, die mit Advexin gegen das p53 Protein aktiviert werden) scheinen eine systemische Wirkung zu zeigen (Phase I/II Studien bei invasivem Mamma-Ca und kleinzelligem Lungen-Ca derzeit am laufen).
Bezüglich mda-7 und INGN 007 nächstes mal mehr, sofern Interesse besteht.
Grüsse, chirint
außer INGN, war ich in ONCY, Onyx Pharm. und Elan aktiv, bin aber bei allen schon Ende letzten Jahres ausgestiegen (leider zu früh). Aktuell halte ich nur meine Position bei INGN und kaufe hier bei Rückschlägen nach. Ich denke 2004 dürfte ein gutes Jahr für INGN werden. Leider habe momentan nicht genug Zeit um mich intensiv mit anderen Werten auseinanderzusetzen. Generell halte ich derzeit Complementinhibitoren für interessant, muss aber noch weitere Literatur studieren (sofern ich Zeit habe wie gesagt).
Microcapfun hat mir einen Artikel uber Ad p53 Gentherapie und Advexin gemailt (Edelman et al., Curr Opin Mol Ther 2003). Den hatte ich schon zuvor gelesen, zwar ganz interessant aber nicht wirklich neue Aufschlüsse über den aktuellen Stand von Advexin (bezieht sich vielmehr auf die Phase II Studien T201 und T202, beinhaltet also nicht die neuen Daten von Aventis T207).
Nachteil von Advexin, wenn man es so nennen möchte, ist, dass es im Prinzip wohl nur lokal und nicht systemisch angewandt werden kann. Das stimmt aber nur zum Teil, INGN225 z.B. (dendritische Zellen, die mit Advexin gegen das p53 Protein aktiviert werden) scheinen eine systemische Wirkung zu zeigen (Phase I/II Studien bei invasivem Mamma-Ca und kleinzelligem Lungen-Ca derzeit am laufen).
Bezüglich mda-7 und INGN 007 nächstes mal mehr, sofern Interesse besteht.
Grüsse, chirint
chirint,
du scheinst dich ja wirklich bestens auszukennen, kommst du aus dem medizinischen Bereich?
Klar besteht Interesse bezüglich Informationen zu mda-7 und INGN 007... da fehlt mir noch eine Menge Wissen.
Hast du dir mal Gedanken zu einem möglichen Marktpotential von Advexin gemacht? "Advexin`s primary target now, head and neck cancer, has a peak sales opportunity as high as $500 million, according to the New York-based investment bank Rodman & Renshaw Inc. But Navdeep Jaikaria, the Rodman & Renshaw analyst who follows Introgen, says the overall market for Introgen`s gene-based drug easily could top $1 billion." ... ist das eine realistische Einschätzung oder vollkommend illusorisch?
Complementinhibitors... hab ich noch nichts von gehört: welche Unternehmen sind darin besonders aktiv? Bei der ersten Suche bin ich auf Alexion gestoßen...
Ich denke eine sehr entscheidende Größe für den Erfolg eines Unternehmens ist die Erfahrenheit und Kompetenz der führenden Köpfe... wie sieht es da bei Introgen aus? Arbeiten sie gut mit der FDA zusammen, oder gab es mal Probleme? Haben sie Erfahrung mit klinischen Studien und Zulassungsprozessen?
Investierst du wegen einer interessanten Technologie oder wegen einer zu niedrigen Bewertung in so Unternehmen wie Introgen? Hast du dich auch mit anderen Biotechs außer den von dir genannten beschäftigt, auch wenn du nicht investiert warst?
mfg ipollit
du scheinst dich ja wirklich bestens auszukennen, kommst du aus dem medizinischen Bereich?
Klar besteht Interesse bezüglich Informationen zu mda-7 und INGN 007... da fehlt mir noch eine Menge Wissen.
Hast du dir mal Gedanken zu einem möglichen Marktpotential von Advexin gemacht? "Advexin`s primary target now, head and neck cancer, has a peak sales opportunity as high as $500 million, according to the New York-based investment bank Rodman & Renshaw Inc. But Navdeep Jaikaria, the Rodman & Renshaw analyst who follows Introgen, says the overall market for Introgen`s gene-based drug easily could top $1 billion." ... ist das eine realistische Einschätzung oder vollkommend illusorisch?
Complementinhibitors... hab ich noch nichts von gehört: welche Unternehmen sind darin besonders aktiv? Bei der ersten Suche bin ich auf Alexion gestoßen...
Ich denke eine sehr entscheidende Größe für den Erfolg eines Unternehmens ist die Erfahrenheit und Kompetenz der führenden Köpfe... wie sieht es da bei Introgen aus? Arbeiten sie gut mit der FDA zusammen, oder gab es mal Probleme? Haben sie Erfahrung mit klinischen Studien und Zulassungsprozessen?
Investierst du wegen einer interessanten Technologie oder wegen einer zu niedrigen Bewertung in so Unternehmen wie Introgen? Hast du dich auch mit anderen Biotechs außer den von dir genannten beschäftigt, auch wenn du nicht investiert warst?
mfg ipollit

Hallo ipollit,
versuche Deine Fragen kurz zu beantworten.
$500 Millionen halte ich nach einer kurzen Anlaufphase für relativ realistisch. Fakt ist, wenn Advexin für den relativ kleinen Indikationsbereich refraktäre Plattenepithelkarzinome des Kopf- und Halsbereiches zugelassen wird, dürfte in kurzen Abständen mit weitern Zulassungen für andere Tumore zu rechnen sein. Für diese "ad on" Indikationen könnten u.U. schon aussagekräftige Phase II Studien für eine beschleunigte Zulassung sorgen (z.B. NSLC und Mamma-Ca Stadium III/IV).
Darüber hinaus haben nicht nur onkologisch ausgebildete Ärzte die Möglichkeit, Advexin "off-label" bei anderen Tumoren einzusetzen, auch wenn Advexin dafür noch nicht zugelassen wird. In der Literatur wird eine p53 Genmutation in über 50% aller humanen Tumore beschrieben. Außerdem konnte gezeigt werden, dass Advexin auch wirksam ist, wenn das p53 in den Tumorzellen nicht mutagen verändert ist.
Was das Management betrifft, hat Introgen mindestens 2 Mitarbeiter, die zuvor bei der FDA als leitende Angestellte tätig waren. Max Talbot war, soweit ich weis, Abteilungsleiter und zuvor für andere pharmazeutische Unternehmen tätig und hat federführend dazu beigetragen Medikamente auf den Markt zu bringen.
Ich investiere hauptsächlich aus wissenschaftlicher Sicht in diesen Wert, auch wenn die Gentechnik und speziell diese Vektortechnik noch in den "Kinderschuhen" steckt. Dennoch ist es spannend die Entwicklung auf dem Sektor zu verfolgen. Mittel- und langfristig, mit Entwicklung von Adenoviren der II. und III. Generation, Weiterentwicklung von AAV´s und anderer Viren (oder auch nicht-virale Vektoren) zur langfristigen Genexpression glaube ich persönlich, dass diese Technologie sehr aussichtsreich sein wird.
Gruß, chirint
versuche Deine Fragen kurz zu beantworten.
$500 Millionen halte ich nach einer kurzen Anlaufphase für relativ realistisch. Fakt ist, wenn Advexin für den relativ kleinen Indikationsbereich refraktäre Plattenepithelkarzinome des Kopf- und Halsbereiches zugelassen wird, dürfte in kurzen Abständen mit weitern Zulassungen für andere Tumore zu rechnen sein. Für diese "ad on" Indikationen könnten u.U. schon aussagekräftige Phase II Studien für eine beschleunigte Zulassung sorgen (z.B. NSLC und Mamma-Ca Stadium III/IV).
Darüber hinaus haben nicht nur onkologisch ausgebildete Ärzte die Möglichkeit, Advexin "off-label" bei anderen Tumoren einzusetzen, auch wenn Advexin dafür noch nicht zugelassen wird. In der Literatur wird eine p53 Genmutation in über 50% aller humanen Tumore beschrieben. Außerdem konnte gezeigt werden, dass Advexin auch wirksam ist, wenn das p53 in den Tumorzellen nicht mutagen verändert ist.
Was das Management betrifft, hat Introgen mindestens 2 Mitarbeiter, die zuvor bei der FDA als leitende Angestellte tätig waren. Max Talbot war, soweit ich weis, Abteilungsleiter und zuvor für andere pharmazeutische Unternehmen tätig und hat federführend dazu beigetragen Medikamente auf den Markt zu bringen.
Ich investiere hauptsächlich aus wissenschaftlicher Sicht in diesen Wert, auch wenn die Gentechnik und speziell diese Vektortechnik noch in den "Kinderschuhen" steckt. Dennoch ist es spannend die Entwicklung auf dem Sektor zu verfolgen. Mittel- und langfristig, mit Entwicklung von Adenoviren der II. und III. Generation, Weiterentwicklung von AAV´s und anderer Viren (oder auch nicht-virale Vektoren) zur langfristigen Genexpression glaube ich persönlich, dass diese Technologie sehr aussichtsreich sein wird.
Gruß, chirint
New Data Describe Tumor-Killing Activity of Introgen Therapeutics` Advexin Cancer Therapy
Thursday April 22, 11:02 am ET
AUSTIN, Texas, April 22 /PRNewswire-FirstCall/ -- Recent preclinical studies provide new insight into the molecular pathways by which p53, the active component of Introgen Therapeutics` (Nasdaq: INGN - News) Advexin therapy, kills tumor cells. These preclinical studies were undertaken in order to provide additional molecular data supporting the clinical benefit observed during the clinical development of Advexin, now in phase 3 trials for the treatment of head and neck cancer. The studies were conducted by Introgen`s collaborators at Okayama University in Japan and at The University of Texas M. D. Anderson Cancer Center and were published earlier this year in an issue of Molecular Cancer Therapeutics. Introgen has previously sponsored studies in Japan which include a phase 1-2 trial in non-small cell lung cancer and a phase 2 trial in esophageal cancer.
ADVERTISEMENT
These recently reported findings add substantially to our knowledge of the timing and expression levels of p53 and genes that are activated by p53 protein after the delivery of Advexin therapy. The p53 protein and gene functions as a tumor suppressor by arresting cell growth, inducing programmed cell death, causing cancer cells to differentiate, and inhibiting the growth of new blood vessels required to support tumor growth. Preclinical and early clinical studies with Advexin have shown that delivery of the p53 gene to cancer cells can provide therapeutic benefit by reducing tumor volume, halting tumor growth, and improving survival. The current study provides additional information regarding the specific pathways that mediate the observed therapeutic effects of Advexin.
Lou Zumstein, Ph.D., Introgen`s director of research said, "These studies provide additional evidence supporting Advexin`s ability to attack cancer cells through multiple molecular pathways. The additional information about the timing, duration and persistence of expression of p53 and genes activated by p53 following Advexin administration may help us to further optimize Advexin therapy. Additionally, quantifying the expression levels of genes that are activated by p53 protein may help to identify other candidates for gene-based cancer therapy."
Welcome, meislo2001 [Sign Out] Money Manager - My Yahoo! View - Customize
Financial News
Enter symbol(s) BasicPerformanceReal-time MktDetailedChartResearchOptionsOrder Book Symbol Lookup
Press Release Source: Introgen Therapeutics, Inc.
Southwest Oncology Group Initiates Phase 2 Clinical Trial Using Introgen`s Advexin(R) Cancer Therapy
Wednesday April 21, 10:01 am ET
AUSTIN, Texas and SAN ANTONIO, April 21 /PRNewswire-FirstCall/ -- The Southwest Oncology Group (SWOG), one of the largest U.S. cancer clinical trials cooperative groups supported by the National Cancer Institute, has initiated a new clinical trial using gene therapy for the treatment of Stage III or IV squamous cell carcinoma (SCC) of the oral cavity, or oropharynx, that is able to be removed surgically. The study is designed to assess the feasibility, efficacy and safety of administering Advexin® at the time of surgery for suppression of remaining tumor cells, followed by a combination of chemotherapy and radiation therapy. Advexin is a product of Introgen Therapeutics, Inc. (Nasdaq: INGN - News).
ADVERTISEMENT
"One of the problems with head and neck cancer is that 25-40% of patients will relapse after conventional therapy," states Dr. George Yoo, associate professor at Wayne State University and the Barbara Ann Karmanos Cancer Institute in Detroit and principal investigator for the study. "We hope that the administration of Advexin at the time of surgery will kill residual cancer cells and improve patients` ultimate outcome with no additional toxicity."
Squamous cell carcinomas are the most prevalent cancers of the oral cavity region, and it is estimated that 30,000 new cases of oral cavity cancer occur annually in the United States. Cancers of the oropharynx occur in approximately an additional 4,000 patients annually. Frequently, cancers in this region of the body recur after surgery, chemotherapy, and radiotherapy, and consequently new approaches to preventing recurrence are needed. Advexin may provide an alternative mechanism for controlling the residual disease with limited or no added toxicity, which may translate to less frequent recurrence, prolonged survival, or improvements in the quality of life.
Dr. Charles A. Coltman, Jr., Chairman of the Southwest Oncology Group said, "The Southwest Oncology Group is dedicated to understanding and successfully preventing and treating cancer. This study is another example of our continuing commitment to aggressively pursue new approaches of treatment and improve the lives of people with cancer."
The study will be conducted at 10 sites across the United States and will enroll approximately 60 patients. To find out if the study is being conducted in your area, contact the National Cancer Institute Cancer Information Service (CIS) at 1-800-4CANCER and reference Southwest Oncology Group Study S0011.
Introgen Therapeutics and the American Cancer Society Sponsor `Showdown Against Cancer`
Thursday April 15, 4:30 pm ET
Event With University of Texas Coaches to Benefit Families Dealing With Cancer
AUSTIN, Texas, April 15 /PRNewswire-FirstCall/ -- Introgen Therapeutics, Inc. (Nasdaq: INGN - News) announced today that it co-sponsored "The Showdown Against Cancer" with the American Cancer Society to raise funds for families dealing with cancer. These American Cancer Society-sponsored weekend retreats offer families support, education, and information needed to cope with a cancer diagnosis. It also provides recreation and connection with other families managing similar situations. For more information about this event please visit http://www.cancer.org/asp/coe/coe_global.asp . Introgen is a society member of the American Cancer Society.
At the special luncheon, which took place earlier today, head coaches from The University of Texas at Austin, including Mack Brown, Jody Conradt and Rick Barnes, spoke about their experiences with cancer. This event coincides with the beginning of head and neck cancer awareness week (April 19-24), a national event which raises awareness of and encourages screenings for the disease at area hospitals. Head and neck cancer affects 40,000 new patients in the U.S. annually. The midpoint of known survival time is six to twelve months for end-stage head and neck cancer patients who have failed conventional treatments such as surgery or chemotherapy and new therapies are needed for this disease.
Introgen has several anti-cancer therapies in development including Advexin for several types of cancer including head and neck, lung and breast. Introgen is also developing INGN 241 for melanoma, the most aggressive form of skin cancer.
Introgen Therapeutics Receives NCI Grant to Fund Phase 2 Study of INGN 241 in Malignant Melanoma
Tuesday April 13, 1:00 pm ET
AUSTIN, Texas, April 13 /PRNewswire-FirstCall/ -- Introgen Therapeutics, Inc. (Nasdaq: INGN - News) has received a Small Business Technology Transfer (STTR) grant from the National Cancer Institute to support a recently initiated Phase 2 clinical trial of INGN 241 in patients with malignant melanoma. The grant will provide over $1.8 million in funding and will support a Phase 2 trial designed to evaluate the efficacy and biologic activity of INGN 241 in this indication. The grant also covers costs associated with the performance of assays to measure induction of tumor cell death and anti-tumor immune system activation in patients with metastatic melanoma. The primary investigators on the grant are Elizabeth A. Grimm, Ph.D., Co-Director of the Melanoma Research Program and Professor, Department of Bioimmunotherapy at The University of Texas M.D. Anderson Cancer Center, and Sunil Chada, Ph.D., Introgen`s director of research and development.
ADVERTISEMENT
"This grant is a validation of the significant potential of INGN 241 as a novel treatment for malignant melanoma," said Dr. Chada. "Currently available treatment options for advanced disease are associated with serious side effects but have little impact on survival. Studies of INGN 241 in a variety of cancers indicate that this product candidate has favorable safety and tolerability profiles. Results from a previous clinical study testing INGN 241 in a variety of solid tumors, including malignant melanoma, have been very encouraging, with regression of multiple injected tumors. This grant will support continued development of INGN 241 in this indication, as melanoma is one with clear unmet medical need."
The grant will support a recently initiated Phase 2 trial, which is designed to enroll up to 25 patients with metastatic melanoma. The primary objective of this study is to determine if intratumoral injection of INGN 241 can exert regional and systemic biologic activity. Secondary objectives include toxicity, tumor response and induction of specific immunity against the patients` melanoma cells. The study is being conducted at The University of Texas M. D. Anderson Cancer Center.
"An important component of this grant is funding to evaluate induction of tumor cell death and stimulation of systemic anti-tumor immune system responses in patients with malignant melanoma following administration of INGN 241," said Dr. Grimm. "These studies may help to expand our knowledge of the molecular basis of malignant melanoma and also may enhance our understanding of some of the multiple anti-cancer activities of MDA-7/IL-24, the active component of INGN 241."
Introgen Therapeutics Advances INGN 241 Clinical Development Program for Metastatic Melanoma
Wednesday April 7, 2:00 pm ET
AUSTIN, Texas, April 7 /PRNewswire-FirstCall/ -- Introgen Therapeutics, Inc. (Nasdaq: INGN - News) today announced the initiation of a Phase 2 clinical trial of INGN 241 in patients with metastatic melanoma. Mda-7/IL-24, the active component of INGN 241, is a novel tumor suppressor gene that also exhibits tumor-selective apoptosis, immune-stimulating and angiogenesis inhibiting activities. INGN 241 has completed a Phase 1 clinical trial in a variety of cancers.
ADVERTISEMENT
"Clinical activity of INGN 241 in the treatment of melanoma has been demonstrated in a previous clinical study in which significant regression of multiple tumors was observed after treatment," said Sunil Chada, Introgen`s director of research and development. "The MDA-7/IL-24 protein has multiple anti-cancer activities, including tumor suppression, stimulation of the immune system and inhibition of the growth of new blood vessels necessary to support tumor growth. These activities may lead to regional and systemic anti-tumor effects. Previous results in patients with metastatic melanoma are very encouraging and suggest INGN 241 may have utility in this disease, which is difficult to treat."
The Phase 2 trial is designed to enroll up to 25 metastatic melanoma patients with at least three regional lesions. The primary objective of this study is to determine if intratumoral injection of INGN 241 can exert regional and systemic biologic activity. Secondary objectives include analysis of toxicity, tumor response and induction of specific immunity against the melanoma tumors. The study is being conducted at The University of Texas M. D. Anderson Cancer Center.
"We are very interested in evaluating the effect of INGN 241 on metastatic melanoma lesions," said Kevin Kim, M.D., Assistant Professor of Medicine in the Department of Melanoma Medical Oncology at The University of Texas M. D. Anderson Cancer Center and the trial`s principal investigator. "Currently available chemotherapy regimens for metastatic melanoma do not significantly improve median survival. The addition of biologics to these chemotherapy regimens results in only a five to 20 percent complete response rate. Moreover, many metastatic melanoma patients cannot tolerate the existing regimens. Metastatic melanoma patients have great, unmet medical need for therapies that are active against their disease and have favorable safety and tolerability profiles. This trial will help us assess the potential for INGN 241 as a new approach to treating malignant melanoma."
According to the American Cancer Society 55,100 new cases of melanoma will be diagnosed and 7,910 people will die of melanoma in 2004 in the United States alone.
Welcome, meislo2001 [Sign Out] Money Manager - My Yahoo! View - Customize
Financial News
Enter symbol(s) BasicPerformanceReal-time MktDetailedChartResearchOptionsOrder Book Symbol Lookup
Press Release Source: Introgen Therapeutics, Inc.
Introgen`s INGN 241 Enhances Anti-Tumor Effects of Herceptin(R) in Preclinical Studies
Wednesday March 31, 1:00 pm ET
ORLANDO, Fla., March 31 /PRNewswire-FirstCall/ -- Preclinical data presented at the 95th annual meeting of the American Association of Cancer Research (AACR) demonstrate that INGN 241 enhances the anti-tumor effects of Herceptin® (Trastuzumab) in HER2-positive breast cancer. INGN 241, a novel product candidate designed to deliver the MDA-7/IL-24 gene to tumor cells, is being developed by Introgen Therapeutics, Inc. (Nasdaq: INGN - News) and is in Phase 1 and Phase 2 clinical trials in a variety of cancers. The data were generated in an ongoing collaboration between researchers at Introgen and The University of Texas M. D. Anderson Cancer Center.
ADVERTISEMENT
Dr. Sunil Chada, Introgen`s director of research and development said, "These data demonstrate that enhanced cell killing of HER2-positive breast cancer cells can be achieved by combining INGN 241 with Herceptin. Tumor cells that overexpress HER2, a growth factor receptor that is the target of Herceptin, are more aggressive and difficult to treat than HER2-negative tumors. Herceptin has become an important treatment option for women with metastatic HER2-positive tumors, and INGN 241 appears to enhance Herceptin`s anti-tumor effects in a model of this aggressive form of cancer. These data demonstrate the potential for INGN 241 to improve the anti-tumor effects of approved cancer therapies."
Abstract #5135, "Combination therapy of Ad-mda7 and Herceptin inhibits tumor growth in nude mice and increases apoptosis in HER2/NEU overexpressing breast cancer cells," described several molecular markers involved in cancer cell killing by INGN 241 and Herceptin as single agents or in combination. Although both agents caused significant tumor growth inhibition in an animal model of breast cancer, the combination of the two resulted in significantly enhanced growth inhibition. Results of this study demonstrate that the combination of Herceptin and INGN 241 produced a greater anti-tumor effect by decreasing levels of Akt and p-akt in HER-2/neu over-expressing breast cancer cells. The Akt and p-akt proteins are associated with cell growth, migration and metastasis.
Abstract #4402, "Increased apoptosis in HER2/NEU over-expressing breast cancer cells by combination therapy of Ad-mda-7 and Herceptin," reported similar results from studies conducted in cultured tumor cells. Data from these studies show that INGN 241 and Herceptin each reduced viability and suppressed tumor growth of HER2-positive breast cancer cell lines when used as single agents. INGN 241, but not Herceptin, demonstrated a similar growth inhibitory effect in HER2-negative cells. In HER2-positive cells, INGN 241 significantly enhanced the anti-tumor activity of Herceptin, resulting in increased growth inhibition of cultured tumor cells.
Combined Analysis of Results From Three Multi-National Phase 2 Trials Reported
ORLANDO, Fla., March 30 /PRNewswire-FirstCall/ -- Introgen Therapeutics (Nasdaq: INGN - News) today reported combined safety and efficacy results based on three multi-center, multi-national Phase 2 clinical trials of Advexin® p53 gene therapy in 217 patients with recurrent, squamous cell carcinoma of the head and neck. These data were presented in a late breaking session at the 95th annual meeting of the American Association of Cancer Research taking place March 27-31, 2004 in Orlando, Florida.
ADVERTISEMENT
The objective overall response rate of Advexin monotherapy was 10 percent (complete and partial response with greater than 50 percent reduction in tumor size). Tumor growth control (stable disease or better) was achieved in 59 percent of all treated lesions. The primary objective of the trials was to assess tumor growth control and safety following Advexin monotherapy in patients with recurrent head and neck cancer. All patients had failed previous conventional treatment.
"The primary endpoint results from the three Phase 2 trials confirm our previously reported findings regarding the activity and safety of Advexin," stated Robert E. Sobol, M.D., Introgen`s senior vice president of medical and scientific affairs. "This multi-center, multi-national analysis is the first detailed report of the combined data from all of our Phase 2 trials in recurrent head and neck cancer. These results were collected from over 40 clinical sites in the U.S. and Europe. We are encouraged by the response and safety data and the consistency of the findings."
Secondary endpoints of the studies included assessments of patient survival. A difference was observed between patients treated with high doses and low doses of Advexin. Patients treated with higher doses had a statistically significant increase in median survival compared to patients treated with lower doses (243 vs. 119 days). Additionally, the overall median survival was longer in patients who were treated with Advexin followed by chemotherapy in each of the studies: Trial 202 (n=20) 330 days; Trial 201 (n=47) 260 days; Trial 207 (n=29) 246 days.
Advexin therapy was administered by intra-tumoral injections. Advexin treatment-related side effects were generally mild to moderate in nature and included transient injection site pain and fever. All patients had been previously treated with radiation therapy and 59 percent had previous chemotherapy. To date, clinical investigators in North America, Europe and Japan have treated over 500 patients with several thousand doses of Advexin therapy, establishing a large safety database.
"We will continue to monitor the survival data from these Phase 2 uncontrolled, non-randomized studies and will further analyze survival duration as part of our ongoing controlled and randomized Phase 3 clinical trials in recurrent head and neck cancer patients," added Dr. Sobol.
About Advexin
There are two multi-national, multi-site Phase 3 trials of Advexin therapy, currently underway in recurrent squamous cell cancer of the head and neck. Introgen has received FDA Fast Track designation for Advexin therapy and Advexin has been designated as an Orphan Drug for the treatment of head and neck cancer under the Orphan Drug Act.
Advexin has been evaluated in a variety of cancer types and in combination with several standard cancer therapies, including radiation and chemotherapy. Data from several published preclinical and clinical studies have demonstrated the ability of Advexin to safely enhance the anti-cancer effects of radiation and chemotherapy treatment.
Advexin supplies p53 protein in very high concentrations in cancer tissue and selectively kills cancer cells. p53 is a normal constituent of cells and is known as a tumor suppressor because it inhibits the growth of tumor cells. One of the major roles of this protein is to eliminate cancerous cells by recognizing when the cell has been damaged by mutations and stopping cell growth to initiate repair. If the cell is damaged beyond repair, p53 initiates the cell death pathway to prevent the cell from growing out of control
Thursday April 22, 11:02 am ET
AUSTIN, Texas, April 22 /PRNewswire-FirstCall/ -- Recent preclinical studies provide new insight into the molecular pathways by which p53, the active component of Introgen Therapeutics` (Nasdaq: INGN - News) Advexin therapy, kills tumor cells. These preclinical studies were undertaken in order to provide additional molecular data supporting the clinical benefit observed during the clinical development of Advexin, now in phase 3 trials for the treatment of head and neck cancer. The studies were conducted by Introgen`s collaborators at Okayama University in Japan and at The University of Texas M. D. Anderson Cancer Center and were published earlier this year in an issue of Molecular Cancer Therapeutics. Introgen has previously sponsored studies in Japan which include a phase 1-2 trial in non-small cell lung cancer and a phase 2 trial in esophageal cancer.
ADVERTISEMENT
These recently reported findings add substantially to our knowledge of the timing and expression levels of p53 and genes that are activated by p53 protein after the delivery of Advexin therapy. The p53 protein and gene functions as a tumor suppressor by arresting cell growth, inducing programmed cell death, causing cancer cells to differentiate, and inhibiting the growth of new blood vessels required to support tumor growth. Preclinical and early clinical studies with Advexin have shown that delivery of the p53 gene to cancer cells can provide therapeutic benefit by reducing tumor volume, halting tumor growth, and improving survival. The current study provides additional information regarding the specific pathways that mediate the observed therapeutic effects of Advexin.
Lou Zumstein, Ph.D., Introgen`s director of research said, "These studies provide additional evidence supporting Advexin`s ability to attack cancer cells through multiple molecular pathways. The additional information about the timing, duration and persistence of expression of p53 and genes activated by p53 following Advexin administration may help us to further optimize Advexin therapy. Additionally, quantifying the expression levels of genes that are activated by p53 protein may help to identify other candidates for gene-based cancer therapy."
Welcome, meislo2001 [Sign Out] Money Manager - My Yahoo! View - Customize
Financial News
Enter symbol(s) BasicPerformanceReal-time MktDetailedChartResearchOptionsOrder Book Symbol Lookup
Press Release Source: Introgen Therapeutics, Inc.
Southwest Oncology Group Initiates Phase 2 Clinical Trial Using Introgen`s Advexin(R) Cancer Therapy
Wednesday April 21, 10:01 am ET
AUSTIN, Texas and SAN ANTONIO, April 21 /PRNewswire-FirstCall/ -- The Southwest Oncology Group (SWOG), one of the largest U.S. cancer clinical trials cooperative groups supported by the National Cancer Institute, has initiated a new clinical trial using gene therapy for the treatment of Stage III or IV squamous cell carcinoma (SCC) of the oral cavity, or oropharynx, that is able to be removed surgically. The study is designed to assess the feasibility, efficacy and safety of administering Advexin® at the time of surgery for suppression of remaining tumor cells, followed by a combination of chemotherapy and radiation therapy. Advexin is a product of Introgen Therapeutics, Inc. (Nasdaq: INGN - News).
ADVERTISEMENT
"One of the problems with head and neck cancer is that 25-40% of patients will relapse after conventional therapy," states Dr. George Yoo, associate professor at Wayne State University and the Barbara Ann Karmanos Cancer Institute in Detroit and principal investigator for the study. "We hope that the administration of Advexin at the time of surgery will kill residual cancer cells and improve patients` ultimate outcome with no additional toxicity."
Squamous cell carcinomas are the most prevalent cancers of the oral cavity region, and it is estimated that 30,000 new cases of oral cavity cancer occur annually in the United States. Cancers of the oropharynx occur in approximately an additional 4,000 patients annually. Frequently, cancers in this region of the body recur after surgery, chemotherapy, and radiotherapy, and consequently new approaches to preventing recurrence are needed. Advexin may provide an alternative mechanism for controlling the residual disease with limited or no added toxicity, which may translate to less frequent recurrence, prolonged survival, or improvements in the quality of life.
Dr. Charles A. Coltman, Jr., Chairman of the Southwest Oncology Group said, "The Southwest Oncology Group is dedicated to understanding and successfully preventing and treating cancer. This study is another example of our continuing commitment to aggressively pursue new approaches of treatment and improve the lives of people with cancer."
The study will be conducted at 10 sites across the United States and will enroll approximately 60 patients. To find out if the study is being conducted in your area, contact the National Cancer Institute Cancer Information Service (CIS) at 1-800-4CANCER and reference Southwest Oncology Group Study S0011.
Introgen Therapeutics and the American Cancer Society Sponsor `Showdown Against Cancer`
Thursday April 15, 4:30 pm ET
Event With University of Texas Coaches to Benefit Families Dealing With Cancer
AUSTIN, Texas, April 15 /PRNewswire-FirstCall/ -- Introgen Therapeutics, Inc. (Nasdaq: INGN - News) announced today that it co-sponsored "The Showdown Against Cancer" with the American Cancer Society to raise funds for families dealing with cancer. These American Cancer Society-sponsored weekend retreats offer families support, education, and information needed to cope with a cancer diagnosis. It also provides recreation and connection with other families managing similar situations. For more information about this event please visit http://www.cancer.org/asp/coe/coe_global.asp . Introgen is a society member of the American Cancer Society.
At the special luncheon, which took place earlier today, head coaches from The University of Texas at Austin, including Mack Brown, Jody Conradt and Rick Barnes, spoke about their experiences with cancer. This event coincides with the beginning of head and neck cancer awareness week (April 19-24), a national event which raises awareness of and encourages screenings for the disease at area hospitals. Head and neck cancer affects 40,000 new patients in the U.S. annually. The midpoint of known survival time is six to twelve months for end-stage head and neck cancer patients who have failed conventional treatments such as surgery or chemotherapy and new therapies are needed for this disease.
Introgen has several anti-cancer therapies in development including Advexin for several types of cancer including head and neck, lung and breast. Introgen is also developing INGN 241 for melanoma, the most aggressive form of skin cancer.
Introgen Therapeutics Receives NCI Grant to Fund Phase 2 Study of INGN 241 in Malignant Melanoma
Tuesday April 13, 1:00 pm ET
AUSTIN, Texas, April 13 /PRNewswire-FirstCall/ -- Introgen Therapeutics, Inc. (Nasdaq: INGN - News) has received a Small Business Technology Transfer (STTR) grant from the National Cancer Institute to support a recently initiated Phase 2 clinical trial of INGN 241 in patients with malignant melanoma. The grant will provide over $1.8 million in funding and will support a Phase 2 trial designed to evaluate the efficacy and biologic activity of INGN 241 in this indication. The grant also covers costs associated with the performance of assays to measure induction of tumor cell death and anti-tumor immune system activation in patients with metastatic melanoma. The primary investigators on the grant are Elizabeth A. Grimm, Ph.D., Co-Director of the Melanoma Research Program and Professor, Department of Bioimmunotherapy at The University of Texas M.D. Anderson Cancer Center, and Sunil Chada, Ph.D., Introgen`s director of research and development.
ADVERTISEMENT
"This grant is a validation of the significant potential of INGN 241 as a novel treatment for malignant melanoma," said Dr. Chada. "Currently available treatment options for advanced disease are associated with serious side effects but have little impact on survival. Studies of INGN 241 in a variety of cancers indicate that this product candidate has favorable safety and tolerability profiles. Results from a previous clinical study testing INGN 241 in a variety of solid tumors, including malignant melanoma, have been very encouraging, with regression of multiple injected tumors. This grant will support continued development of INGN 241 in this indication, as melanoma is one with clear unmet medical need."
The grant will support a recently initiated Phase 2 trial, which is designed to enroll up to 25 patients with metastatic melanoma. The primary objective of this study is to determine if intratumoral injection of INGN 241 can exert regional and systemic biologic activity. Secondary objectives include toxicity, tumor response and induction of specific immunity against the patients` melanoma cells. The study is being conducted at The University of Texas M. D. Anderson Cancer Center.
"An important component of this grant is funding to evaluate induction of tumor cell death and stimulation of systemic anti-tumor immune system responses in patients with malignant melanoma following administration of INGN 241," said Dr. Grimm. "These studies may help to expand our knowledge of the molecular basis of malignant melanoma and also may enhance our understanding of some of the multiple anti-cancer activities of MDA-7/IL-24, the active component of INGN 241."
Introgen Therapeutics Advances INGN 241 Clinical Development Program for Metastatic Melanoma
Wednesday April 7, 2:00 pm ET
AUSTIN, Texas, April 7 /PRNewswire-FirstCall/ -- Introgen Therapeutics, Inc. (Nasdaq: INGN - News) today announced the initiation of a Phase 2 clinical trial of INGN 241 in patients with metastatic melanoma. Mda-7/IL-24, the active component of INGN 241, is a novel tumor suppressor gene that also exhibits tumor-selective apoptosis, immune-stimulating and angiogenesis inhibiting activities. INGN 241 has completed a Phase 1 clinical trial in a variety of cancers.
ADVERTISEMENT
"Clinical activity of INGN 241 in the treatment of melanoma has been demonstrated in a previous clinical study in which significant regression of multiple tumors was observed after treatment," said Sunil Chada, Introgen`s director of research and development. "The MDA-7/IL-24 protein has multiple anti-cancer activities, including tumor suppression, stimulation of the immune system and inhibition of the growth of new blood vessels necessary to support tumor growth. These activities may lead to regional and systemic anti-tumor effects. Previous results in patients with metastatic melanoma are very encouraging and suggest INGN 241 may have utility in this disease, which is difficult to treat."
The Phase 2 trial is designed to enroll up to 25 metastatic melanoma patients with at least three regional lesions. The primary objective of this study is to determine if intratumoral injection of INGN 241 can exert regional and systemic biologic activity. Secondary objectives include analysis of toxicity, tumor response and induction of specific immunity against the melanoma tumors. The study is being conducted at The University of Texas M. D. Anderson Cancer Center.
"We are very interested in evaluating the effect of INGN 241 on metastatic melanoma lesions," said Kevin Kim, M.D., Assistant Professor of Medicine in the Department of Melanoma Medical Oncology at The University of Texas M. D. Anderson Cancer Center and the trial`s principal investigator. "Currently available chemotherapy regimens for metastatic melanoma do not significantly improve median survival. The addition of biologics to these chemotherapy regimens results in only a five to 20 percent complete response rate. Moreover, many metastatic melanoma patients cannot tolerate the existing regimens. Metastatic melanoma patients have great, unmet medical need for therapies that are active against their disease and have favorable safety and tolerability profiles. This trial will help us assess the potential for INGN 241 as a new approach to treating malignant melanoma."
According to the American Cancer Society 55,100 new cases of melanoma will be diagnosed and 7,910 people will die of melanoma in 2004 in the United States alone.
Welcome, meislo2001 [Sign Out] Money Manager - My Yahoo! View - Customize
Financial News
Enter symbol(s) BasicPerformanceReal-time MktDetailedChartResearchOptionsOrder Book Symbol Lookup
Press Release Source: Introgen Therapeutics, Inc.
Introgen`s INGN 241 Enhances Anti-Tumor Effects of Herceptin(R) in Preclinical Studies
Wednesday March 31, 1:00 pm ET
ORLANDO, Fla., March 31 /PRNewswire-FirstCall/ -- Preclinical data presented at the 95th annual meeting of the American Association of Cancer Research (AACR) demonstrate that INGN 241 enhances the anti-tumor effects of Herceptin® (Trastuzumab) in HER2-positive breast cancer. INGN 241, a novel product candidate designed to deliver the MDA-7/IL-24 gene to tumor cells, is being developed by Introgen Therapeutics, Inc. (Nasdaq: INGN - News) and is in Phase 1 and Phase 2 clinical trials in a variety of cancers. The data were generated in an ongoing collaboration between researchers at Introgen and The University of Texas M. D. Anderson Cancer Center.
ADVERTISEMENT
Dr. Sunil Chada, Introgen`s director of research and development said, "These data demonstrate that enhanced cell killing of HER2-positive breast cancer cells can be achieved by combining INGN 241 with Herceptin. Tumor cells that overexpress HER2, a growth factor receptor that is the target of Herceptin, are more aggressive and difficult to treat than HER2-negative tumors. Herceptin has become an important treatment option for women with metastatic HER2-positive tumors, and INGN 241 appears to enhance Herceptin`s anti-tumor effects in a model of this aggressive form of cancer. These data demonstrate the potential for INGN 241 to improve the anti-tumor effects of approved cancer therapies."
Abstract #5135, "Combination therapy of Ad-mda7 and Herceptin inhibits tumor growth in nude mice and increases apoptosis in HER2/NEU overexpressing breast cancer cells," described several molecular markers involved in cancer cell killing by INGN 241 and Herceptin as single agents or in combination. Although both agents caused significant tumor growth inhibition in an animal model of breast cancer, the combination of the two resulted in significantly enhanced growth inhibition. Results of this study demonstrate that the combination of Herceptin and INGN 241 produced a greater anti-tumor effect by decreasing levels of Akt and p-akt in HER-2/neu over-expressing breast cancer cells. The Akt and p-akt proteins are associated with cell growth, migration and metastasis.
Abstract #4402, "Increased apoptosis in HER2/NEU over-expressing breast cancer cells by combination therapy of Ad-mda-7 and Herceptin," reported similar results from studies conducted in cultured tumor cells. Data from these studies show that INGN 241 and Herceptin each reduced viability and suppressed tumor growth of HER2-positive breast cancer cell lines when used as single agents. INGN 241, but not Herceptin, demonstrated a similar growth inhibitory effect in HER2-negative cells. In HER2-positive cells, INGN 241 significantly enhanced the anti-tumor activity of Herceptin, resulting in increased growth inhibition of cultured tumor cells.
Combined Analysis of Results From Three Multi-National Phase 2 Trials Reported
ORLANDO, Fla., March 30 /PRNewswire-FirstCall/ -- Introgen Therapeutics (Nasdaq: INGN - News) today reported combined safety and efficacy results based on three multi-center, multi-national Phase 2 clinical trials of Advexin® p53 gene therapy in 217 patients with recurrent, squamous cell carcinoma of the head and neck. These data were presented in a late breaking session at the 95th annual meeting of the American Association of Cancer Research taking place March 27-31, 2004 in Orlando, Florida.
ADVERTISEMENT
The objective overall response rate of Advexin monotherapy was 10 percent (complete and partial response with greater than 50 percent reduction in tumor size). Tumor growth control (stable disease or better) was achieved in 59 percent of all treated lesions. The primary objective of the trials was to assess tumor growth control and safety following Advexin monotherapy in patients with recurrent head and neck cancer. All patients had failed previous conventional treatment.
"The primary endpoint results from the three Phase 2 trials confirm our previously reported findings regarding the activity and safety of Advexin," stated Robert E. Sobol, M.D., Introgen`s senior vice president of medical and scientific affairs. "This multi-center, multi-national analysis is the first detailed report of the combined data from all of our Phase 2 trials in recurrent head and neck cancer. These results were collected from over 40 clinical sites in the U.S. and Europe. We are encouraged by the response and safety data and the consistency of the findings."
Secondary endpoints of the studies included assessments of patient survival. A difference was observed between patients treated with high doses and low doses of Advexin. Patients treated with higher doses had a statistically significant increase in median survival compared to patients treated with lower doses (243 vs. 119 days). Additionally, the overall median survival was longer in patients who were treated with Advexin followed by chemotherapy in each of the studies: Trial 202 (n=20) 330 days; Trial 201 (n=47) 260 days; Trial 207 (n=29) 246 days.
Advexin therapy was administered by intra-tumoral injections. Advexin treatment-related side effects were generally mild to moderate in nature and included transient injection site pain and fever. All patients had been previously treated with radiation therapy and 59 percent had previous chemotherapy. To date, clinical investigators in North America, Europe and Japan have treated over 500 patients with several thousand doses of Advexin therapy, establishing a large safety database.
"We will continue to monitor the survival data from these Phase 2 uncontrolled, non-randomized studies and will further analyze survival duration as part of our ongoing controlled and randomized Phase 3 clinical trials in recurrent head and neck cancer patients," added Dr. Sobol.
About Advexin
There are two multi-national, multi-site Phase 3 trials of Advexin therapy, currently underway in recurrent squamous cell cancer of the head and neck. Introgen has received FDA Fast Track designation for Advexin therapy and Advexin has been designated as an Orphan Drug for the treatment of head and neck cancer under the Orphan Drug Act.
Advexin has been evaluated in a variety of cancer types and in combination with several standard cancer therapies, including radiation and chemotherapy. Data from several published preclinical and clinical studies have demonstrated the ability of Advexin to safely enhance the anti-cancer effects of radiation and chemotherapy treatment.
Advexin supplies p53 protein in very high concentrations in cancer tissue and selectively kills cancer cells. p53 is a normal constituent of cells and is known as a tumor suppressor because it inhibits the growth of tumor cells. One of the major roles of this protein is to eliminate cancerous cells by recognizing when the cell has been damaged by mutations and stopping cell growth to initiate repair. If the cell is damaged beyond repair, p53 initiates the cell death pathway to prevent the cell from growing out of control
Source: University Of Texas M. D. Anderson Cancer Center
Date: 2004-05-07
Newly-described Route To Cancer Solves A Mystery In Lung Cancer
HOUSTON - Researchers at The University of Texas M. D. Anderson Cancer Center are describing an entirely new way by which cells can become cancerous. And they say their finding provides an answer to a mystery in lung and other cancers: why a potent tumor suppressor gene called FUS1 functions as it should, yet none of the protein it produces can be found anywhere in a cancer cell.
In the May issue of Cancer Research, Advances in Brief, the investigators report that protective proteins made by FUS1 are, in fact, normal, but that a critical modification that should take place after they are produced does not - and this renders the proteins inert.
Specifically, they found the defect is in a common cell process known as "myristoylation" that occurs when chains of fatty acids hook on to newly-minted proteins, which allows them to stick to the oily surface of the cell membrane.
In this case, the fatty acids don`t attach on to the FUS1 protein, for reasons that are not understood, and the non-functional proteins are quickly broken apart inside the cell. Without FUS1 protein, cells cannot self destruct if damaged, thus cancer development can proceed unchecked.
This is the first time that myristoylation has been fingered as a potential root cause of cancer, say the researchers.
"Most genetic mechanisms for causing cancer include mutations that make gene products overactive or inactive. That`s not the case here," says the study`s senior author, Lin Ji, Ph.D., assistant professor in the Department of Thoracic & Cardiovascular Surgery Research. "This is a novel mechanism, a completely new way of disabling a tumor suppressor protein."
Loss of functional FUS1 "is certainly one of the earliest changes that occurs in lung cancer, and it likely happens in other cancers, such as breast and kidney, where the gene is known to be a target for inactivation," says co-author Jack Roth, M.D. chair of the Department of Thoracic & Cardiovascular Surgery.
Roth says the study suggests two potential therapeutic strategies. One would be to "reactivate myristoylation in tumor cells to restore their normal function," he says. The other is gene therapy to flood the tumor with active FUS1 genes - a phase I clinical trial currently under way at M. D. Anderson Cancer Center.
In order to design corrective treatments, Roth, Ji, and a team of researchers have been working for years to piece together a picture of what happens to a cell in the earliest stages of lung cancer. For example, they found that the p53 tumor suppressor gene was missing or altered in most lung cancer cells and that the gene could be successfully replaced. Clinical trials of p53 gene therapy have been under way at M. D. Anderson since 1995.
Then, working with John Minna, M.D., and other investigators from the University of Texas Southwestern Medical Center, the investigators found that parts of chromosome 3p (a region known as 3p21.3) are often missing in lung cells at the very beginning of cancer development. "One of two inherited copies of this chromosomal region is missing and we speculate this is a fragile site that breaks easily in response to exposure to cancer causing agents," says Roth. "This is a very early change that we see in stage one cancer, and carcinoma in situ. We also see it in the lung cells of smokers who do not have cancer."
The researchers found that area contains a number of tumor suppressor genes including FUS1 that not only inhibited tumor growth and metastasis, but induced human lung cancer cell death.
Still, people who have lost one copy of their FUS1 gene at 3p21.3 have an active copy on their intact chromosome, but for reasons unknown as yet, the now-described defect in myristoylation occurs, rendering the proteins produced by the remaining FUS1 gene functionally inactive. "Inactivation of FUS1 appears to be a two-hit process, in which one good FUS1 gene is lost, and the other produces tumor suppressor protein that is disabled," says Ji.
The gene therapy trial underway at M. D. Anderson may offer a solution, says Roth. It uses bubbles of fat to encase millions of copies of FUS1 genes, which can be easily absorbed into tumor cells. So far, six patients with metastatic lung cancer have been treated.
Although replacement of the FUS1 gene in tumor cells does not specifically repair myristoylation defects, Roth says that experiments suggest "overexpressing the gene somehow seems to overcomes this problem."
Replacing the FUS1 gene therapeutically at the earliest time possible in patients missing one copy of the 3p21.3 region "may possibly prevent or delay the development of lung tumors," Ji says.
The study was funded primarily by grants from the National Cancer Institute and the National Institutes of Health. Other co-authors include John Minna, M.D., and Masashi Kondo, from UT Southwestern Medical Center, and from M. D. Anderson: Futoshi Uno, M.D., Ph.D., Jiichiro Sasaki M.D., Ph.D., Masahiko Nishizaki M.D., Ph.D., Giovanni Carboni M.D., Kai Xu, and Edward Atkinson, Ph.D.
Nebenbei bemerkt: ANTISOMA´s Absturz war abzusehen. Ansatz und Indikation waren aus meiner Sicht von Anfang an nicht erfolgversprechend. Der Gründe hierfür habe ich bereits vor knapp einem Jahr (ich glaube auf dem Antisoma thread ... mehrere 1000% usw.) dargelegt.
Gruss, chirint
Date: 2004-05-07
Newly-described Route To Cancer Solves A Mystery In Lung Cancer
HOUSTON - Researchers at The University of Texas M. D. Anderson Cancer Center are describing an entirely new way by which cells can become cancerous. And they say their finding provides an answer to a mystery in lung and other cancers: why a potent tumor suppressor gene called FUS1 functions as it should, yet none of the protein it produces can be found anywhere in a cancer cell.
In the May issue of Cancer Research, Advances in Brief, the investigators report that protective proteins made by FUS1 are, in fact, normal, but that a critical modification that should take place after they are produced does not - and this renders the proteins inert.
Specifically, they found the defect is in a common cell process known as "myristoylation" that occurs when chains of fatty acids hook on to newly-minted proteins, which allows them to stick to the oily surface of the cell membrane.
In this case, the fatty acids don`t attach on to the FUS1 protein, for reasons that are not understood, and the non-functional proteins are quickly broken apart inside the cell. Without FUS1 protein, cells cannot self destruct if damaged, thus cancer development can proceed unchecked.
This is the first time that myristoylation has been fingered as a potential root cause of cancer, say the researchers.
"Most genetic mechanisms for causing cancer include mutations that make gene products overactive or inactive. That`s not the case here," says the study`s senior author, Lin Ji, Ph.D., assistant professor in the Department of Thoracic & Cardiovascular Surgery Research. "This is a novel mechanism, a completely new way of disabling a tumor suppressor protein."
Loss of functional FUS1 "is certainly one of the earliest changes that occurs in lung cancer, and it likely happens in other cancers, such as breast and kidney, where the gene is known to be a target for inactivation," says co-author Jack Roth, M.D. chair of the Department of Thoracic & Cardiovascular Surgery.
Roth says the study suggests two potential therapeutic strategies. One would be to "reactivate myristoylation in tumor cells to restore their normal function," he says. The other is gene therapy to flood the tumor with active FUS1 genes - a phase I clinical trial currently under way at M. D. Anderson Cancer Center.
In order to design corrective treatments, Roth, Ji, and a team of researchers have been working for years to piece together a picture of what happens to a cell in the earliest stages of lung cancer. For example, they found that the p53 tumor suppressor gene was missing or altered in most lung cancer cells and that the gene could be successfully replaced. Clinical trials of p53 gene therapy have been under way at M. D. Anderson since 1995.
Then, working with John Minna, M.D., and other investigators from the University of Texas Southwestern Medical Center, the investigators found that parts of chromosome 3p (a region known as 3p21.3) are often missing in lung cells at the very beginning of cancer development. "One of two inherited copies of this chromosomal region is missing and we speculate this is a fragile site that breaks easily in response to exposure to cancer causing agents," says Roth. "This is a very early change that we see in stage one cancer, and carcinoma in situ. We also see it in the lung cells of smokers who do not have cancer."
The researchers found that area contains a number of tumor suppressor genes including FUS1 that not only inhibited tumor growth and metastasis, but induced human lung cancer cell death.
Still, people who have lost one copy of their FUS1 gene at 3p21.3 have an active copy on their intact chromosome, but for reasons unknown as yet, the now-described defect in myristoylation occurs, rendering the proteins produced by the remaining FUS1 gene functionally inactive. "Inactivation of FUS1 appears to be a two-hit process, in which one good FUS1 gene is lost, and the other produces tumor suppressor protein that is disabled," says Ji.
The gene therapy trial underway at M. D. Anderson may offer a solution, says Roth. It uses bubbles of fat to encase millions of copies of FUS1 genes, which can be easily absorbed into tumor cells. So far, six patients with metastatic lung cancer have been treated.
Although replacement of the FUS1 gene in tumor cells does not specifically repair myristoylation defects, Roth says that experiments suggest "overexpressing the gene somehow seems to overcomes this problem."
Replacing the FUS1 gene therapeutically at the earliest time possible in patients missing one copy of the 3p21.3 region "may possibly prevent or delay the development of lung tumors," Ji says.
The study was funded primarily by grants from the National Cancer Institute and the National Institutes of Health. Other co-authors include John Minna, M.D., and Masashi Kondo, from UT Southwestern Medical Center, and from M. D. Anderson: Futoshi Uno, M.D., Ph.D., Jiichiro Sasaki M.D., Ph.D., Masahiko Nishizaki M.D., Ph.D., Giovanni Carboni M.D., Kai Xu, and Edward Atkinson, Ph.D.
Nebenbei bemerkt: ANTISOMA´s Absturz war abzusehen. Ansatz und Indikation waren aus meiner Sicht von Anfang an nicht erfolgversprechend. Der Gründe hierfür habe ich bereits vor knapp einem Jahr (ich glaube auf dem Antisoma thread ... mehrere 1000% usw.) dargelegt.
Gruss, chirint
Am Markt finden die Titel von Introgen Therapeutics heute überdurchschnittliche Beachtung. Das Unternehmen hatte von vorklinischen Tests mit zwei genetische veränderten Viren berichtet, die Krebszellen angreifen und zerstören sollen. Die ersten Testreihen seien mit diesen beiden Virentypen sehr hoffnungsvoll ausgefallen. Introgen hat anteilige Verwertungsrechte an diesen Viren und verwandten Technologien von VirRx erworben.
AUSTIN, Texas, May 17 /PRNewswire-FirstCall/ -- Introgen Therapeutics, Inc. (Nasdaq: INGN - News) today announced the publication of preclinical data from studies of two oncolytic viruses that have potential as novel cancer therapies. Introgen has licensed rights to these oncolytic viruses and other related technologies from VirRx, Inc. The studies were conducted in the laboratory of William S.M. Wold, Ph.D., chairman of the Department of Microbiology and Immunology at the Saint Louis University School of Medicine and founder and chief executive officer of VirRx, and are published in the current issue of Cancer Research.
ADVERTISEMENT
INGN 007 (VRX-007) and VRX-009 are novel oncolytic adenoviruses that have been engineered to kill cancer cells via viral replication. These viruses can be engineered so that they are active in specific types of cancer cells. The data published today indicate that INGN 007 and VRX-009 efficiently killed cancer cells in culture. VRX-009, which has been designed to kill cells that carry a mutation common in many colon cancers, efficiently killed cultured colon cancer cells, but not lung cancer cells. INGN 007 effectively killed both types of cancer cells. In an animal model of colon cancer, injection of either INGN 007 or VRX-009 into tumors suppressed tumor growth more efficiently than a negative control (five-fold and ten-fold suppression, respectively). INGN 007 also completely suppressed tumor growth in a lung cancer model of disease.
Louis Zumstein, Ph.D., director of research at Introgen, said "These preclinical data are very promising, and support our belief that oncolytic adenoviruses have enormous potential as a new class of cancer therapies that may provide potent and selective killing of cancer cells. These data also illustrate the flexibility of engineered oncolytic adenoviruses to target selected tumor types with great specificity. Our expertise in developing adenoviral-based cancer therapies, including Advexin in Phase 3 trials and INGN 241 in Phase 2 trials, positions us to be the leader in tumor-specific oncolytic adenoviruses. We are conducting additional studies to support the continued development of our oncolytic adenovirus programs."
INGN 007 and VRX-009 are replicating adenovirus vectors that over-express ADP, an adenoviral protein that plays a key role in the release of viral particles from infected cells. This release kills the cell, and also yields a pool of new viral particles capable of infecting additional cells within the tumor. The ability to overexpress the ADP gene sets this technology apart from other existing oncolytic viruses and has been shown to provide a powerful antitumor effect. Introgen holds an exclusive license to this technology from VirRx.
"Oncolytic adenoviruses kill cancer cells through a mechanism that is completely different from chemotherapy or radiation," said Dr. Wold. "These viruses have the potential to treat many cancers that are resistant to currently available therapeutics. Additionally, it may be possible to use these viruses in combination with other therapies to create novel treatment regimens."
AUSTIN, Texas, May 17 /PRNewswire-FirstCall/ -- Introgen Therapeutics, Inc. (Nasdaq: INGN - News) today announced the publication of preclinical data from studies of two oncolytic viruses that have potential as novel cancer therapies. Introgen has licensed rights to these oncolytic viruses and other related technologies from VirRx, Inc. The studies were conducted in the laboratory of William S.M. Wold, Ph.D., chairman of the Department of Microbiology and Immunology at the Saint Louis University School of Medicine and founder and chief executive officer of VirRx, and are published in the current issue of Cancer Research.
ADVERTISEMENT
INGN 007 (VRX-007) and VRX-009 are novel oncolytic adenoviruses that have been engineered to kill cancer cells via viral replication. These viruses can be engineered so that they are active in specific types of cancer cells. The data published today indicate that INGN 007 and VRX-009 efficiently killed cancer cells in culture. VRX-009, which has been designed to kill cells that carry a mutation common in many colon cancers, efficiently killed cultured colon cancer cells, but not lung cancer cells. INGN 007 effectively killed both types of cancer cells. In an animal model of colon cancer, injection of either INGN 007 or VRX-009 into tumors suppressed tumor growth more efficiently than a negative control (five-fold and ten-fold suppression, respectively). INGN 007 also completely suppressed tumor growth in a lung cancer model of disease.
Louis Zumstein, Ph.D., director of research at Introgen, said "These preclinical data are very promising, and support our belief that oncolytic adenoviruses have enormous potential as a new class of cancer therapies that may provide potent and selective killing of cancer cells. These data also illustrate the flexibility of engineered oncolytic adenoviruses to target selected tumor types with great specificity. Our expertise in developing adenoviral-based cancer therapies, including Advexin in Phase 3 trials and INGN 241 in Phase 2 trials, positions us to be the leader in tumor-specific oncolytic adenoviruses. We are conducting additional studies to support the continued development of our oncolytic adenovirus programs."
INGN 007 and VRX-009 are replicating adenovirus vectors that over-express ADP, an adenoviral protein that plays a key role in the release of viral particles from infected cells. This release kills the cell, and also yields a pool of new viral particles capable of infecting additional cells within the tumor. The ability to overexpress the ADP gene sets this technology apart from other existing oncolytic viruses and has been shown to provide a powerful antitumor effect. Introgen holds an exclusive license to this technology from VirRx.
"Oncolytic adenoviruses kill cancer cells through a mechanism that is completely different from chemotherapy or radiation," said Dr. Wold. "These viruses have the potential to treat many cancers that are resistant to currently available therapeutics. Additionally, it may be possible to use these viruses in combination with other therapies to create novel treatment regimens."
zur Zeit läuft die ganze Biotech ja überhaupt nicht, wird mal langsam Zeit für ein paar gute Nachrichte.
Hi Leute
Introgen ist ja ganz schön zurück gekommen,gibts dafür n grund ?
Kann man da jetzt zuschlagen oder sollte man lieber erst abwarten ?
Danke
Grüsse
B.M.
Introgen ist ja ganz schön zurück gekommen,gibts dafür n grund ?
Kann man da jetzt zuschlagen oder sollte man lieber erst abwarten ?
Danke
Grüsse
B.M.
warum gestern +30%
wird INGN jetzt hier in D delistet? Was passiert dann mit den Aktien, die ich hier gekauft habe?
mfg ipollit
wird INGN jetzt hier in D delistet? Was passiert dann mit den Aktien, die ich hier gekauft habe?
mfg ipollit

ich hab auf ein anderes Pferd gesetzt...



Diese Meldung dürfte zum Vorteil von INGN sein:
Genentech slides on Avastin warnings
Company and FDA warn of link to heart attack and stroke
By Val Brickates Kennedy, CBS.MarketWatch.com
Last Update: 5:35 PM ET Aug. 13, 2004
BOSTON (CBS.MW) -- Genentech shares fell as much as 8 percent Friday after the company and the U.S. Food and Drug Administration said it had sent a letter to physicians, warning that use of the oncology drug Avastin could increase risk of such conditions as heart attack and stroke in cancer patients.
According to a spokeswoman for the South San Francisco, Calif.-based biotech company, the warning applies particularly to patients who have already experienced cardiovascular problems or are older than 65.
Shares of Genentech (DNA: news, chart, profile) closed down $2.88, or 6.11 percent, at $44.23 on Friday afternoon.
Avastin, derived from genetically engineered antibodies, is designed to thwart the formation of blood vessels that nourish cancer tumors. The drug was approved in February by the FDA to treat metastatic colorectal cancer.
The drug already carries two medical warnings. The first is that the drug may cause fatal hemorrhaging in patients with advanced lung cancer. The second is that it may interfere with the healing of wounds in the gastrointestinal tract.
Avastin was developed using licensed technology from antibody researcher Protein Design Labs (PDLI: news, chart, profile), which also receives sizable royalties on Avastin sales. Protein Design Labs closed down 69 cents, or 4.06 percent, at $16.31.
A spokesman for Protein Design Labs said the company was not involved in Friday`s action as it only supplies the technology used to produce the drug.
Genentech slides on Avastin warnings
Company and FDA warn of link to heart attack and stroke
By Val Brickates Kennedy, CBS.MarketWatch.com
Last Update: 5:35 PM ET Aug. 13, 2004
BOSTON (CBS.MW) -- Genentech shares fell as much as 8 percent Friday after the company and the U.S. Food and Drug Administration said it had sent a letter to physicians, warning that use of the oncology drug Avastin could increase risk of such conditions as heart attack and stroke in cancer patients.
According to a spokeswoman for the South San Francisco, Calif.-based biotech company, the warning applies particularly to patients who have already experienced cardiovascular problems or are older than 65.
Shares of Genentech (DNA: news, chart, profile) closed down $2.88, or 6.11 percent, at $44.23 on Friday afternoon.
Avastin, derived from genetically engineered antibodies, is designed to thwart the formation of blood vessels that nourish cancer tumors. The drug was approved in February by the FDA to treat metastatic colorectal cancer.
The drug already carries two medical warnings. The first is that the drug may cause fatal hemorrhaging in patients with advanced lung cancer. The second is that it may interfere with the healing of wounds in the gastrointestinal tract.
Avastin was developed using licensed technology from antibody researcher Protein Design Labs (PDLI: news, chart, profile), which also receives sizable royalties on Avastin sales. Protein Design Labs closed down 69 cents, or 4.06 percent, at $16.31.
A spokesman for Protein Design Labs said the company was not involved in Friday`s action as it only supplies the technology used to produce the drug.
@mini
zum Vorteil von INGN?
seit wann ist INGN ein Konkurrent von DNA? Seit wann Advexin die Konkurrenz von Avastin? Abgesehen davon, dass diese "News" laut mehrerer Kommentare ein alter Hut ist... Advexin könnte die erste Gentherapie sein und für die erste Indikation Kopf&Hals, dagegen ist Avastin der erste Angiogenese-Hemmer und richtet sich gegen Darmkrebs.
Ein gewisse Bedeutung könnte es vielleicht haben, dass Aventis/Medigene seine rAAV-Genfähre hingeschmissen hat... INGN benutzt einen Adenovirus
nn (), Thu, 24 Apr 2003
Trotz aller Rueckschlaege entwickelt sich die Gentherapie allmaehlich zu einem ernst zu nehmenden Markt. Fuer klinische Versuche werden Gentherapieprodukte bereits in groesserem Massstab hergestellt und werden voraussichtlich ab 2005 im Handel erscheinen. Bis 2010 soll ihr Jahresumsatz in Europa nach einer neuen Analyse der Unternehmensberatung Frost & Sullivan knapp 1,1 Milliarden US-Dollar erreichen.
Wissenschaftler und Pharmaindustrie warten gespannt auf die erfolgreiche Bestaetigung des Funktionsprinzips der Gentherapie. Advexin (adSCMV-p53)von Introgen fuer fortgeschrittene Tumorerkrankungen im Kopf- und Halsbereich und Generx (ad5-FGF4) von Schering fuer die koronare Herzkrankheit (KHK) (geplante Einfuehrung jeweils 2005) koennten diesen Nachweis in den Schluesselsegmenten Krebstherapie und Gefaesserkrankungen erbringen. Mit einer Neubewertung der Zukunftsaussichten duerfte dann die anfaengliche Begeisterung zurueckkehren, sodass mit einem Investitionsaufschwung in Forschung und Entwicklung zu rechnen ist.
Die ersten Umsaetze im Jahr 2005 werden wahrscheinlich zu gleichen Teilen mitTherapien fuer Krebs und Gefaesserkrankungen erzielt. Danach duerfte dank zusaetzlicher Produkte und aufgrund der grossen Patientenzahlen die Behandlung von Gefaesskrankheiten dominieren. Die Bedeutung der Krebstherapie soll wegen der geringeren Patientenzahlen bei den betreffenden Tumorarten dahinter zurueckbleiben. Wenn allerdings ab 2008 weitere Indikationen und Produkte hinzu kommen, koennten 2010 mit Krebsmedikamenten immerhin 28 Prozent des Gesamtumsatzes erwirtschaftet werden.
In 15 Jahren ein lohnendes Geschaeft Tatsaechlich beschraenkt sich die Gentherapie nicht mehr nur auf monogen bedingte Erkrankungen. Diese bieten zwar weiterhin die besten Erfolgsaussichten, duerften aber wegen der geringen Patientenzahlen trotz Zuwaechsen im Jahr 2006 kaum groessere Umsaetze bringen. «Wenn das Geschaeft mit Gentherapieanwendungen in zehn bis 1 5 Jahren richtig lohnend wird, dann eher in Verbindung mit verbreiteten chronischen und Infektionskrankheiten als mit seltenen Tumoren», so die Einschaetzung von Nicola Furley, Programme Manager bei Frost & Sullivan. Hinsichtlich Technologien und Krankheitstypen ist der Gentherapiemarkt extrem divers. «Die Atmosphaere ist zurzeit noch eher akademisch als wettbewerbsorientiert», meint Furley. «Mit der Markteinfuehrung der ersten Produkte wird sich der Wettbewerb allerdings erheblich verschaerfen.» Fuehrend bei der Entwicklung sind die Unternehmen Aventis, Novartis und Schering, die deshalb auch den zukuenftigen Markt dominieren duerften.
Aufklaerung statt Euphorie Von grosser Bedeutung bleibt die Aufklaerung von Aerzten und Aeffentlichkeit ueber Funktionsweise und Sicherheitsaspekte der Technologie. Euphemistische Produktbeschreibungen moegen zwar mittelfristig dem Aktienkurs nuetzen, dienen aber laut Frost & Sullivan langfristig kaum dazu, den Gentherapiemarkt insgesamt zu etablieren. Die Produktgeneration, die demnaechst klinisch geprueftwird, hat den Vorteil, dass das gewuenschte Gen auf eine bestimmte Position auf einem bestimmten Chromosom gelenkt werden kann. Die Vektoren sollen so veraendert werden, dass sie sich auf bestimmte Gewebetypen ausrichten lassen. Dadurch wuerden der Bedarf fuer die direkte (Mikro-)Injektion von DNA und deren unerwuenschte systemische Auswirkungen weiter reduziert.
Titel der Analyse Frost & Sullivan`s Analysis Of The European Gene Therapy Market (Report B 1 12)
***********
SILVIA VON DER WEIDEN (Die Welt, 04.02.2003
Einbau in das Erbgut von Empfaengerzellen sicherer gemacht - Anwendung der Methode gegen schwarzen Hautkrebs im Test
Martinsried - Bei der Gentherapie setzen viele Wissenschaftler auf Viren als Transportvehikel. 100 Mal kleiner als eine Bakterienzelle, bestehen Viren aus wenigen Genen, die in einer Huelle aus Eiweißmolekuelen stecken. Sie kennen nur eine Aufgabe: die Uebertragung ihrer Gene in fremde Zellen. Das macht Viren im Prinzip zu idealen Gen-Faehren. Doch bevor Viren als Werkzeug fuer die Gentherapie dienen koennen, muessen sie "ihrer krank machenden Eigenschaften beraubt" werden.
Genau da liegt das Problem, wie die beiden Faelle der vor kurzem an Leukaemie erkrankten Gentherapiepatienten aus Frankreich zeigen. Den an einer erblichen Immunschwaeche erkrankten Kindern waren heilende Gene mit Hilfe von gezaehmten Retroviren uebertragen worden. Allerdings integrieren Retroviren fremde Gene zufaellig. Werden sie an einer falschen Stelle eingefuegt, kann das Stoerungen und sogar Krebs ausloesen. Weil das Risiko moeglicherweise falsch eingeschaetzt wurde, liegen nun fast alle Studien, die Retroviren als Gentaxis nutzen, auf Eis.
Auch ein anderes Transportvehikel der Gentherapie, so genannte Adenoviren, wird von vielen Wissenschaftlern als zu riskant fuer den weiteren Einsatz eingeschaetzt. Diese verfuegen wie Retroviren ueber eine große Aufnahmekapazitaet fuer fremde Gene. Doch koennen auch entschaerfte Adenoviren noch eine starke Abwehrreaktion im Koerper ausloesen. Vor drei Jahren fuehrte das in den USA bei dem mit einer Gentherapie behandelten Patienten Jesse Gelsinger zum Tod.
Einen Ausweg aus dem Dilemma koennten Adeno-assoziierte Viren (AAV) bieten, die beim Menschen mit keiner Erkrankung verbunden sind. AAV bieten zwar nur wenig Platz fuer fremde Gene, bauen diese aber relativ sicher in das Erbgut der Empfaengerzelle ein. Bei der Vermehrung sind AAV auf Adenoviren als Helfer angewiesen. Fuer den gentherapeutischen Einsatz muessen AAV daher sicher von den Helferviren getrennt werden. Das Problem haben nun Forscher des in Martinsried bei Muenchen ansaessigen Biotechnologieunternehmen Medigene mit Hilfe einer neuartigen Filtertechnik geloest.
Das patentierte Verfahren nutzt Filtermembranen mit einstellbaren Nano-Poren, um die unterschiedlich großen Viren sicher voneinander zu trennen. Die Methode dient bereits zur Herstellung eines Impfstoffes, der schwarzen Hautkrebs noch in fortgeschrittenen Stadien heilen soll. Dabei werden den Patienten Tumorzellen entnommen, denen im Reagenzglas mit Hilfe von AAV die Gene fuer zwei immunstimulierende Eiweißstoffe uebertragen werden. Die so gekennzeichneten Krebszellen koennen vom menschlichen Abwehrsystem erkannt und bekaempft werden. Der Patient erhaelt die praeparierten Krebszellen zurueck, die dann aehnlich wie ein Impfstoff wirken.
Derzeit wird die Gentherapie in Kliniken in Frankreich, der Schweiz und den Niederlanden erprobt. "Die große Chance fuer die AAV-Technologie liegt darin, dass sie auch zur Behandlung weit verbreiteter Krankheiten wie Diabetes, Bluthochdruck oder Atherosklerose eingesetzt werden kann", sagt Medigene-Expertin Julia von Hummel.
Mit einem aehnlichen Ansatz gelang es US-Forschern vom Children`s Hospital in Philadelphia und der Stanford University, das Gen fuer den Gerinnungsfaktor IX zu uebertragen. Dieses Gen fehlt Bluterkranken. Von drei Patienten, die so behandelt wurden, erreichte einer einen ausreichend hohen Blutspiegel. Die anderen konnten voruebergehend auf das Spritzen des Gerinnungsfaktors verzichten.
VON SILVIA VON DER WEIDEN
*****************
China: Gendicine zur Behandlung von Krebserkrankungen zugelassen
Erstmals wurde einem auf Gentherapie basierenden Behandlungsverfahren von offiziellen Stellen die Genehmigung zum Einsatz erteilt. Laut Newscientist hat die chinesische Bundesbehörde zur Überwachung von Nahrungs- und Arzneimitteln (SFDA) Gendicine nach viel versprechenden Ergebnissen in klinischen Tests zur Behandlung von Krebserkrankungen zugelassen.
Die Ergebnisse der Studie sollen im nächsten Monat in einer nationalen chinesischen Fachzeitschrift veröffentlicht werden. Eine Übersetzung ins Englische ist angekündigt. Im Januar nächsten Jahres wird Gendicine von SiBiono GeneTech auf den Markt gebracht.
Die Behandlung besteht aus einem Adenovirus, der für das Einfügen des Gens p53 vorgesehen ist. Dieses Gen kodiert ein Protein, das den Zelltod bei unkontrolliertem Wachstum auslöst und verhindert so, dass sie kanzerös werden. SiBiono entschied das neue Verfahren bei Plattenepithelkarzinomen im Kopf- und Nackenbereich zu testen. p53 verfügt bei über 60 Prozent dieser Tumore über Mutationen. Es handelt sich dabei um eine Krebsform, die in China besonders verbreitet ist.
Am grössten klinischen Versuch nahmen 120 Patienten mit nasopharyngealem Krebs teil. Sie erhielten entweder nur eine Strahlenbehandlung oder eine Kombination von Gendicine und Strahlenbehandlung. Die p53 tragenden Viren wurden acht Wochen lang wöchentlich direkt in die Tumore injiziert. Die meisten Teilnehmer wurden anschliessend mehr als ein Jahr lang beobachtet. Bei 64 Prozent der Patienten führte Gendicine zu einer kompletten Regression der primären Tumore. Dieser Wert war drei Mal so hoch wie bei der Gruppe, die nur eine Bestrahlung erhalten hatte.
Der Chef des Unternehmens Zhaohui Peng hofft, dass das Virus auch bei anderen Krebsarten wirksam ist. Als einzige Nebenwirkung wurde bei rund einem Drittel der Patienten Fieber beobachtet. Nachdem das Virus nicht in das Genom von Zellen integriert wird, sei auch nicht mit Langzeitbeeinträchtigungen zu rechnen. Eine Dosis wird laut Peng 360 Dollar kosten und kann einfach durch jeden Arzt verabreicht werden.
***************

http://www.unifr.ch/nfp37/sibiono.html
mfg ipollit
zum Vorteil von INGN?

seit wann ist INGN ein Konkurrent von DNA? Seit wann Advexin die Konkurrenz von Avastin? Abgesehen davon, dass diese "News" laut mehrerer Kommentare ein alter Hut ist... Advexin könnte die erste Gentherapie sein und für die erste Indikation Kopf&Hals, dagegen ist Avastin der erste Angiogenese-Hemmer und richtet sich gegen Darmkrebs.
Ein gewisse Bedeutung könnte es vielleicht haben, dass Aventis/Medigene seine rAAV-Genfähre hingeschmissen hat... INGN benutzt einen Adenovirus
nn (), Thu, 24 Apr 2003
Trotz aller Rueckschlaege entwickelt sich die Gentherapie allmaehlich zu einem ernst zu nehmenden Markt. Fuer klinische Versuche werden Gentherapieprodukte bereits in groesserem Massstab hergestellt und werden voraussichtlich ab 2005 im Handel erscheinen. Bis 2010 soll ihr Jahresumsatz in Europa nach einer neuen Analyse der Unternehmensberatung Frost & Sullivan knapp 1,1 Milliarden US-Dollar erreichen.
Wissenschaftler und Pharmaindustrie warten gespannt auf die erfolgreiche Bestaetigung des Funktionsprinzips der Gentherapie. Advexin (adSCMV-p53)von Introgen fuer fortgeschrittene Tumorerkrankungen im Kopf- und Halsbereich und Generx (ad5-FGF4) von Schering fuer die koronare Herzkrankheit (KHK) (geplante Einfuehrung jeweils 2005) koennten diesen Nachweis in den Schluesselsegmenten Krebstherapie und Gefaesserkrankungen erbringen. Mit einer Neubewertung der Zukunftsaussichten duerfte dann die anfaengliche Begeisterung zurueckkehren, sodass mit einem Investitionsaufschwung in Forschung und Entwicklung zu rechnen ist.
Die ersten Umsaetze im Jahr 2005 werden wahrscheinlich zu gleichen Teilen mitTherapien fuer Krebs und Gefaesserkrankungen erzielt. Danach duerfte dank zusaetzlicher Produkte und aufgrund der grossen Patientenzahlen die Behandlung von Gefaesskrankheiten dominieren. Die Bedeutung der Krebstherapie soll wegen der geringeren Patientenzahlen bei den betreffenden Tumorarten dahinter zurueckbleiben. Wenn allerdings ab 2008 weitere Indikationen und Produkte hinzu kommen, koennten 2010 mit Krebsmedikamenten immerhin 28 Prozent des Gesamtumsatzes erwirtschaftet werden.
In 15 Jahren ein lohnendes Geschaeft Tatsaechlich beschraenkt sich die Gentherapie nicht mehr nur auf monogen bedingte Erkrankungen. Diese bieten zwar weiterhin die besten Erfolgsaussichten, duerften aber wegen der geringen Patientenzahlen trotz Zuwaechsen im Jahr 2006 kaum groessere Umsaetze bringen. «Wenn das Geschaeft mit Gentherapieanwendungen in zehn bis 1 5 Jahren richtig lohnend wird, dann eher in Verbindung mit verbreiteten chronischen und Infektionskrankheiten als mit seltenen Tumoren», so die Einschaetzung von Nicola Furley, Programme Manager bei Frost & Sullivan. Hinsichtlich Technologien und Krankheitstypen ist der Gentherapiemarkt extrem divers. «Die Atmosphaere ist zurzeit noch eher akademisch als wettbewerbsorientiert», meint Furley. «Mit der Markteinfuehrung der ersten Produkte wird sich der Wettbewerb allerdings erheblich verschaerfen.» Fuehrend bei der Entwicklung sind die Unternehmen Aventis, Novartis und Schering, die deshalb auch den zukuenftigen Markt dominieren duerften.
Aufklaerung statt Euphorie Von grosser Bedeutung bleibt die Aufklaerung von Aerzten und Aeffentlichkeit ueber Funktionsweise und Sicherheitsaspekte der Technologie. Euphemistische Produktbeschreibungen moegen zwar mittelfristig dem Aktienkurs nuetzen, dienen aber laut Frost & Sullivan langfristig kaum dazu, den Gentherapiemarkt insgesamt zu etablieren. Die Produktgeneration, die demnaechst klinisch geprueftwird, hat den Vorteil, dass das gewuenschte Gen auf eine bestimmte Position auf einem bestimmten Chromosom gelenkt werden kann. Die Vektoren sollen so veraendert werden, dass sie sich auf bestimmte Gewebetypen ausrichten lassen. Dadurch wuerden der Bedarf fuer die direkte (Mikro-)Injektion von DNA und deren unerwuenschte systemische Auswirkungen weiter reduziert.
Titel der Analyse Frost & Sullivan`s Analysis Of The European Gene Therapy Market (Report B 1 12)
***********
SILVIA VON DER WEIDEN (Die Welt, 04.02.2003
Einbau in das Erbgut von Empfaengerzellen sicherer gemacht - Anwendung der Methode gegen schwarzen Hautkrebs im Test
Martinsried - Bei der Gentherapie setzen viele Wissenschaftler auf Viren als Transportvehikel. 100 Mal kleiner als eine Bakterienzelle, bestehen Viren aus wenigen Genen, die in einer Huelle aus Eiweißmolekuelen stecken. Sie kennen nur eine Aufgabe: die Uebertragung ihrer Gene in fremde Zellen. Das macht Viren im Prinzip zu idealen Gen-Faehren. Doch bevor Viren als Werkzeug fuer die Gentherapie dienen koennen, muessen sie "ihrer krank machenden Eigenschaften beraubt" werden.
Genau da liegt das Problem, wie die beiden Faelle der vor kurzem an Leukaemie erkrankten Gentherapiepatienten aus Frankreich zeigen. Den an einer erblichen Immunschwaeche erkrankten Kindern waren heilende Gene mit Hilfe von gezaehmten Retroviren uebertragen worden. Allerdings integrieren Retroviren fremde Gene zufaellig. Werden sie an einer falschen Stelle eingefuegt, kann das Stoerungen und sogar Krebs ausloesen. Weil das Risiko moeglicherweise falsch eingeschaetzt wurde, liegen nun fast alle Studien, die Retroviren als Gentaxis nutzen, auf Eis.
Auch ein anderes Transportvehikel der Gentherapie, so genannte Adenoviren, wird von vielen Wissenschaftlern als zu riskant fuer den weiteren Einsatz eingeschaetzt. Diese verfuegen wie Retroviren ueber eine große Aufnahmekapazitaet fuer fremde Gene. Doch koennen auch entschaerfte Adenoviren noch eine starke Abwehrreaktion im Koerper ausloesen. Vor drei Jahren fuehrte das in den USA bei dem mit einer Gentherapie behandelten Patienten Jesse Gelsinger zum Tod.
Einen Ausweg aus dem Dilemma koennten Adeno-assoziierte Viren (AAV) bieten, die beim Menschen mit keiner Erkrankung verbunden sind. AAV bieten zwar nur wenig Platz fuer fremde Gene, bauen diese aber relativ sicher in das Erbgut der Empfaengerzelle ein. Bei der Vermehrung sind AAV auf Adenoviren als Helfer angewiesen. Fuer den gentherapeutischen Einsatz muessen AAV daher sicher von den Helferviren getrennt werden. Das Problem haben nun Forscher des in Martinsried bei Muenchen ansaessigen Biotechnologieunternehmen Medigene mit Hilfe einer neuartigen Filtertechnik geloest.
Das patentierte Verfahren nutzt Filtermembranen mit einstellbaren Nano-Poren, um die unterschiedlich großen Viren sicher voneinander zu trennen. Die Methode dient bereits zur Herstellung eines Impfstoffes, der schwarzen Hautkrebs noch in fortgeschrittenen Stadien heilen soll. Dabei werden den Patienten Tumorzellen entnommen, denen im Reagenzglas mit Hilfe von AAV die Gene fuer zwei immunstimulierende Eiweißstoffe uebertragen werden. Die so gekennzeichneten Krebszellen koennen vom menschlichen Abwehrsystem erkannt und bekaempft werden. Der Patient erhaelt die praeparierten Krebszellen zurueck, die dann aehnlich wie ein Impfstoff wirken.
Derzeit wird die Gentherapie in Kliniken in Frankreich, der Schweiz und den Niederlanden erprobt. "Die große Chance fuer die AAV-Technologie liegt darin, dass sie auch zur Behandlung weit verbreiteter Krankheiten wie Diabetes, Bluthochdruck oder Atherosklerose eingesetzt werden kann", sagt Medigene-Expertin Julia von Hummel.
Mit einem aehnlichen Ansatz gelang es US-Forschern vom Children`s Hospital in Philadelphia und der Stanford University, das Gen fuer den Gerinnungsfaktor IX zu uebertragen. Dieses Gen fehlt Bluterkranken. Von drei Patienten, die so behandelt wurden, erreichte einer einen ausreichend hohen Blutspiegel. Die anderen konnten voruebergehend auf das Spritzen des Gerinnungsfaktors verzichten.
VON SILVIA VON DER WEIDEN
*****************
China: Gendicine zur Behandlung von Krebserkrankungen zugelassen
Erstmals wurde einem auf Gentherapie basierenden Behandlungsverfahren von offiziellen Stellen die Genehmigung zum Einsatz erteilt. Laut Newscientist hat die chinesische Bundesbehörde zur Überwachung von Nahrungs- und Arzneimitteln (SFDA) Gendicine nach viel versprechenden Ergebnissen in klinischen Tests zur Behandlung von Krebserkrankungen zugelassen.
Die Ergebnisse der Studie sollen im nächsten Monat in einer nationalen chinesischen Fachzeitschrift veröffentlicht werden. Eine Übersetzung ins Englische ist angekündigt. Im Januar nächsten Jahres wird Gendicine von SiBiono GeneTech auf den Markt gebracht.
Die Behandlung besteht aus einem Adenovirus, der für das Einfügen des Gens p53 vorgesehen ist. Dieses Gen kodiert ein Protein, das den Zelltod bei unkontrolliertem Wachstum auslöst und verhindert so, dass sie kanzerös werden. SiBiono entschied das neue Verfahren bei Plattenepithelkarzinomen im Kopf- und Nackenbereich zu testen. p53 verfügt bei über 60 Prozent dieser Tumore über Mutationen. Es handelt sich dabei um eine Krebsform, die in China besonders verbreitet ist.
Am grössten klinischen Versuch nahmen 120 Patienten mit nasopharyngealem Krebs teil. Sie erhielten entweder nur eine Strahlenbehandlung oder eine Kombination von Gendicine und Strahlenbehandlung. Die p53 tragenden Viren wurden acht Wochen lang wöchentlich direkt in die Tumore injiziert. Die meisten Teilnehmer wurden anschliessend mehr als ein Jahr lang beobachtet. Bei 64 Prozent der Patienten führte Gendicine zu einer kompletten Regression der primären Tumore. Dieser Wert war drei Mal so hoch wie bei der Gruppe, die nur eine Bestrahlung erhalten hatte.
Der Chef des Unternehmens Zhaohui Peng hofft, dass das Virus auch bei anderen Krebsarten wirksam ist. Als einzige Nebenwirkung wurde bei rund einem Drittel der Patienten Fieber beobachtet. Nachdem das Virus nicht in das Genom von Zellen integriert wird, sei auch nicht mit Langzeitbeeinträchtigungen zu rechnen. Eine Dosis wird laut Peng 360 Dollar kosten und kann einfach durch jeden Arzt verabreicht werden.
***************

http://www.unifr.ch/nfp37/sibiono.html
mfg ipollit
HI,
Introgen hat am 21.07.04 bestätigt, dass bei Advexin
zur Brustkrebsbehandlung noch diese Jahr die Zulassung
bei der FDA beantragt wird. Bereits im letzten Jahr
wurde dafür der Fast-Track-Status von der FDA gewährt.
Und auch bei Kopf-und Halskrebs und bei Lungenkrebs
wurden überzeugende Ergebnisse erzielt.
Also: nicht verkaufen sondern zukaufen, besonders
an schwachen Tagen.
Die Aktie hat enormes Potential
Kursziel: 20$ oder auch mehr!
therman
Introgen hat am 21.07.04 bestätigt, dass bei Advexin
zur Brustkrebsbehandlung noch diese Jahr die Zulassung
bei der FDA beantragt wird. Bereits im letzten Jahr
wurde dafür der Fast-Track-Status von der FDA gewährt.
Und auch bei Kopf-und Halskrebs und bei Lungenkrebs
wurden überzeugende Ergebnisse erzielt.
Also: nicht verkaufen sondern zukaufen, besonders
an schwachen Tagen.
Die Aktie hat enormes Potential
Kursziel: 20$ oder auch mehr!
therman

ipollit,
meinen Hinweis wollte ich nicht unter medizinisch-wissenschaftlich Aspekten verstanden wissen, sondern als anlagestrategischen Hinweis.
Ich interpretiere die Meldung so, daß Avastin für die DNA einfach keine Zukunft mehr bietet, und wenn ich deren Anteilscheine hätte, würde ich diese umgehend abstoßen. Eine aussichtsreiche Alternative scheint mir INGN zu sein - so einfach ist das mit der Konkurrenz an der Börse! Im Übrigen bin ich seit einiger Zeit in INGN investiert und trage mich mit der Absicht, bald wieder nachzukaufen.
Für mögliche Interessenten ist der folgende Link sicher ganz aufschlußreich:
http://www.corporate-ir.net/ireye/ir_site.zhtml?ticker=ingn&…
MfG
meinen Hinweis wollte ich nicht unter medizinisch-wissenschaftlich Aspekten verstanden wissen, sondern als anlagestrategischen Hinweis.
Ich interpretiere die Meldung so, daß Avastin für die DNA einfach keine Zukunft mehr bietet, und wenn ich deren Anteilscheine hätte, würde ich diese umgehend abstoßen. Eine aussichtsreiche Alternative scheint mir INGN zu sein - so einfach ist das mit der Konkurrenz an der Börse! Im Übrigen bin ich seit einiger Zeit in INGN investiert und trage mich mit der Absicht, bald wieder nachzukaufen.
Für mögliche Interessenten ist der folgende Link sicher ganz aufschlußreich:
http://www.corporate-ir.net/ireye/ir_site.zhtml?ticker=ingn&…
MfG
minimoney,
du bist ja witzig: "daß Avastin für die DNA einfach keine Zukunft mehr bietet" ... Avastin ist ein Multi-Mrd-Blockbuster, von denen es nur sehr wenige gibt (z.B. im Onkologiebereich Taxotere oder Rituxan). Die peak-sales sollten einmal deutlich mehr als 2 Mrd USD erreichen... ich habe auch schon mal von bis zu 10 Mrd USD gelesen (was wahrscheinlich sehr übertrieben ist). Was meinst du, warum DNA infolge der Zulassung um etwa 30-40 Mrd USD mehr wert ist?
DNA und INGN spielen einfach nicht in der gleichen Liga... wenn mit Avastin wirklich etwas schief läuft, dann ist das kein Vorteil für INGN. Sie werden es in diesem Fall es sogar noch schwerer haben, ein Zulassung für Advexin zu erhalten und der Wind wird den Biotechs allgemein noch stärker ins Gesicht blasen...
Meines Wissens läuft Advexin unter Gentherapie... die Zulassungsdaten müssen absolut wasserdicht sein, sonst wird das nichts.
Ich bin übrigens auch schon seit längerem in INGN investiert...
mfg ipollit
du bist ja witzig: "daß Avastin für die DNA einfach keine Zukunft mehr bietet" ... Avastin ist ein Multi-Mrd-Blockbuster, von denen es nur sehr wenige gibt (z.B. im Onkologiebereich Taxotere oder Rituxan). Die peak-sales sollten einmal deutlich mehr als 2 Mrd USD erreichen... ich habe auch schon mal von bis zu 10 Mrd USD gelesen (was wahrscheinlich sehr übertrieben ist). Was meinst du, warum DNA infolge der Zulassung um etwa 30-40 Mrd USD mehr wert ist?
DNA und INGN spielen einfach nicht in der gleichen Liga... wenn mit Avastin wirklich etwas schief läuft, dann ist das kein Vorteil für INGN. Sie werden es in diesem Fall es sogar noch schwerer haben, ein Zulassung für Advexin zu erhalten und der Wind wird den Biotechs allgemein noch stärker ins Gesicht blasen...
Meines Wissens läuft Advexin unter Gentherapie... die Zulassungsdaten müssen absolut wasserdicht sein, sonst wird das nichts.
Ich bin übrigens auch schon seit längerem in INGN investiert...
mfg ipollit

Hallo,
hab auch schon die ganze Achterbahnfahrt von 3 auf 10 und wieder auf 3 auf 6 USD mitgemachtet und mich schon einige male in den A.. gebissen, doch die Meldungen der letzten Tage stimmen mich optimistisch.
und wieder auf 3 auf 6 USD mitgemachtet und mich schon einige male in den A.. gebissen, doch die Meldungen der letzten Tage stimmen mich optimistisch.
Barton Hutt wird einiges regeln und von der Entwicklungsseite her sind aussichtsreiche Produkte (außer
Advexin) in der Mache (bin kein Molekularbiologe - eher mit Endprodukten beschäftigt ), dazu eine gute Pressearbeit , also Kurs stetig nach Norden, oder wie seht ihr das?
), dazu eine gute Pressearbeit , also Kurs stetig nach Norden, oder wie seht ihr das?
Gruß
Knolle
hab auch schon die ganze Achterbahnfahrt von 3 auf 10
 und wieder auf 3 auf 6 USD mitgemachtet und mich schon einige male in den A.. gebissen, doch die Meldungen der letzten Tage stimmen mich optimistisch.
und wieder auf 3 auf 6 USD mitgemachtet und mich schon einige male in den A.. gebissen, doch die Meldungen der letzten Tage stimmen mich optimistisch.Barton Hutt wird einiges regeln und von der Entwicklungsseite her sind aussichtsreiche Produkte (außer
Advexin) in der Mache (bin kein Molekularbiologe - eher mit Endprodukten beschäftigt
 ), dazu eine gute Pressearbeit , also Kurs stetig nach Norden, oder wie seht ihr das?
), dazu eine gute Pressearbeit , also Kurs stetig nach Norden, oder wie seht ihr das?Gruß
Knolle
HI,
Strong buy für INGN
Introgen Therapeutics, Inc. (ticker: ingn, exchange: NASDAQ) News Release - 8/30/04
--------------------------------------------------------------------------------
Introgen`s Cancer Therapies Featured in Conquest Magazine; Also Profiles Two ADVEXIN(R) Patients Celebrating 5 Year Anniversary
AUSTIN, Texas, Aug. 30 /PRNewswire-FirstCall/ -- Introgen Therapeutics, Inc. (Nasdaq: INGN) today announced that its ADVEXIN program has been featured in Conquest magazine, the quarterly magazine published by The University of Texas M. D. Anderson Cancer Center. A feature article about M. D. Anderson`s pioneering research in gene therapy highlighted Introgen`s lead product ADVEXIN. Also profiled were two lung cancer patients who had previously failed conventional therapies and then received combination treatments with ADVEXIN therapy. These two patients recently celebrated their 5-year anniversary. Previously, M. D. Anderson profiled another lung cancer patient from the same ADVEXIN trial who also celebrated her 5 year survival after failing conventional treatments.
Subscribers to Conquest can read the article now and non-subscribers may view the complete article on-line at http://www.mdanderson.org/publications/conquest/ on or about September 3rd.
In addition to the ADVEXIN program, the article also discussed two other cancer therapies from Introgen that are currently being tested at M. D. Anderson. One is the phase 1 clinical development of INGN 401, Introgen`s systemically delivered nanoparticle tumor suppressor therapy. INGN 401 uses the FUS-1 gene, a gene frequently altered or missing in the development of many solid tumors. Encouraging preliminary data from this trial was discussed in Introgen`s recently held quarterly conference. The phase 1 trial is treating patients with refractory stage IV non-small-cell lung cancer patients who typically have limited survival of approximately six months. Five of six patients are still alive 11-15 months after treatment with INGN 401.
Also mentioned in the article is Introgen`s clinical trial testing ADVEXIN as an oral rinse, or mouthwash, for precancerous oral lesions. This trial uses "topical gene therapy to treat patients at risk of developing oral cancer."
About ADVEXIN
Introgen has received FDA Fast Track designation for ADVEXIN therapy and ADVEXIN has been designated as an Orphan Drug for the treatment of head and neck cancer under the Orphan Drug Act. There are two Phase 3 trials of ADVEXIN therapy currently underway in cancer of the head and neck and phase 2 trials have been completed in lung and breast cancer.
ADVEXIN supplies the tumor suppressor p53 protein in very high concentrations in cancer tissue to selectively kill cancer cells. p53 is a normal constituent of cells and is known as a tumor suppressor because it inhibits the growth of tumor cells. One of the major roles of this protein is to eliminate cancerous cells by recognizing when the cell has been damaged by mutations and stopping cell growth to initiate repair. If the cell is damaged beyond repair, p53 initiates the cell death pathway to prevent the cell from growing out of control.
Strong buy für INGN
Introgen Therapeutics, Inc. (ticker: ingn, exchange: NASDAQ) News Release - 8/30/04
--------------------------------------------------------------------------------
Introgen`s Cancer Therapies Featured in Conquest Magazine; Also Profiles Two ADVEXIN(R) Patients Celebrating 5 Year Anniversary
AUSTIN, Texas, Aug. 30 /PRNewswire-FirstCall/ -- Introgen Therapeutics, Inc. (Nasdaq: INGN) today announced that its ADVEXIN program has been featured in Conquest magazine, the quarterly magazine published by The University of Texas M. D. Anderson Cancer Center. A feature article about M. D. Anderson`s pioneering research in gene therapy highlighted Introgen`s lead product ADVEXIN. Also profiled were two lung cancer patients who had previously failed conventional therapies and then received combination treatments with ADVEXIN therapy. These two patients recently celebrated their 5-year anniversary. Previously, M. D. Anderson profiled another lung cancer patient from the same ADVEXIN trial who also celebrated her 5 year survival after failing conventional treatments.
Subscribers to Conquest can read the article now and non-subscribers may view the complete article on-line at http://www.mdanderson.org/publications/conquest/ on or about September 3rd.
In addition to the ADVEXIN program, the article also discussed two other cancer therapies from Introgen that are currently being tested at M. D. Anderson. One is the phase 1 clinical development of INGN 401, Introgen`s systemically delivered nanoparticle tumor suppressor therapy. INGN 401 uses the FUS-1 gene, a gene frequently altered or missing in the development of many solid tumors. Encouraging preliminary data from this trial was discussed in Introgen`s recently held quarterly conference. The phase 1 trial is treating patients with refractory stage IV non-small-cell lung cancer patients who typically have limited survival of approximately six months. Five of six patients are still alive 11-15 months after treatment with INGN 401.
Also mentioned in the article is Introgen`s clinical trial testing ADVEXIN as an oral rinse, or mouthwash, for precancerous oral lesions. This trial uses "topical gene therapy to treat patients at risk of developing oral cancer."
About ADVEXIN
Introgen has received FDA Fast Track designation for ADVEXIN therapy and ADVEXIN has been designated as an Orphan Drug for the treatment of head and neck cancer under the Orphan Drug Act. There are two Phase 3 trials of ADVEXIN therapy currently underway in cancer of the head and neck and phase 2 trials have been completed in lung and breast cancer.
ADVEXIN supplies the tumor suppressor p53 protein in very high concentrations in cancer tissue to selectively kill cancer cells. p53 is a normal constituent of cells and is known as a tumor suppressor because it inhibits the growth of tumor cells. One of the major roles of this protein is to eliminate cancerous cells by recognizing when the cell has been damaged by mutations and stopping cell growth to initiate repair. If the cell is damaged beyond repair, p53 initiates the cell death pathway to prevent the cell from growing out of control.
Introgen Therapeutics, Inc. (ticker: ingn, exchange: NASDAQ) News Release - 9/16/04
--------------------------------------------------------------------------------
Introgen`s INGN 241 Enhances the Effects of Radiotherapy in Lung Cancer Cells Without Impacting Normal Cells
-Publication in Oncogene Supports Utility of INGN 241 in Combination With
Other Cancer Therapies-
AUSTIN, Texas, Sept. 16 /PRNewswire-FirstCall/ -- Introgen Therapeutics, Inc. (Nasdaq: INGN) today announced the publication of preclinical data from studies of INGN 241 in combination with radiotherapy in lung cancer cells. The studies show that INGN 241 enhances the cell killing effects of radiation in cancer cells but not in normal lung cells. This effect appears to be mediated by suppressing the repair of radiation-induced DNA damage. The studies were conducted by researchers at The University of Texas M. D. Anderson Cancer Center in conjunction with Introgen scientists, and the results appear in the current issue of Oncogene.
"These data provide a direct molecular explanation for our previous observations that INGN 241 enhances the effects of radiotherapy in cancer cells," said Dr. Raymond E. Meyn, chair (Ad Interim) of the Department of Experimental Radiation Oncology at M. D. Anderson. "This study complements our recent publication in Molecular Therapy demonstrating that INGN 241 can kill lung tumors in animals by blocking angiogenesis (tumor blood supply). Thus, the combinations of direct killing of tumor cells by blocking DNA repair and starving tumors of nutrients by anti-angiogenesis may synergize to provide enhanced anti-cancer activity. The results of these studies validate the use of INGN 241 in combination with radiotherapy for the treatment of non-small cell lung cancer, and other cancers."
The studies reported today evaluated the impact of INGN 241 on a specific molecular pathway that is involved in repairing breaks in double-stranded DNA. These breaks are induced by radiation and are the primary mechanism through which radiotherapy kills cancer cells. The ability of cancer cells to repair these breaks may lead to resistance to radiotherapy. In these studies, the addition of INGN 241 to cultured lung cancer cells suppressed the expression of several genes involved in the repair pathway. This suppression was not observed in normal cells treated with INGN 241. Suppression of these genes in lung cancer cells resulted in decreased levels of DNA repair and enhanced cancer cell death after ionizing radiation. There was no significant reduction in DNA repair in normal cells treated with radiation and INGN 241.
"The ability of INGN 241 to elicit anti-cancer effects in cancer cells without impacting normal cells is one of the most exciting features of this product candidate," said Sunil Chada, Ph.D., Introgen`s director of Research and Development. "The major side effects associated with radiotherapy result from damage to normal cells and tissue. These new studies demonstrate that INGN 241 increases the cell killing effects of radiation in lung cancer cells, but not in normal lung cells. We hope that this will translate into improved tumor responses without an increase in side effects. Additionally, the addition of INGN 241 to radiotherapy may allow a therapeutic effect to be achieved at a lower dose of radiation, potentially reducing the treatment limiting side effects associated with radiotherapy."
Each year in the U.S. there are approximately 715,000 cancer patient treatments with radiation. Introgen has already conducted a number of clinical studies using its proprietary delivery systems to deliver gene drugs in combination with conventional therapies such as radiation.
--------------------------------------------------------------------------------
Introgen`s INGN 241 Enhances the Effects of Radiotherapy in Lung Cancer Cells Without Impacting Normal Cells
-Publication in Oncogene Supports Utility of INGN 241 in Combination With
Other Cancer Therapies-
AUSTIN, Texas, Sept. 16 /PRNewswire-FirstCall/ -- Introgen Therapeutics, Inc. (Nasdaq: INGN) today announced the publication of preclinical data from studies of INGN 241 in combination with radiotherapy in lung cancer cells. The studies show that INGN 241 enhances the cell killing effects of radiation in cancer cells but not in normal lung cells. This effect appears to be mediated by suppressing the repair of radiation-induced DNA damage. The studies were conducted by researchers at The University of Texas M. D. Anderson Cancer Center in conjunction with Introgen scientists, and the results appear in the current issue of Oncogene.
"These data provide a direct molecular explanation for our previous observations that INGN 241 enhances the effects of radiotherapy in cancer cells," said Dr. Raymond E. Meyn, chair (Ad Interim) of the Department of Experimental Radiation Oncology at M. D. Anderson. "This study complements our recent publication in Molecular Therapy demonstrating that INGN 241 can kill lung tumors in animals by blocking angiogenesis (tumor blood supply). Thus, the combinations of direct killing of tumor cells by blocking DNA repair and starving tumors of nutrients by anti-angiogenesis may synergize to provide enhanced anti-cancer activity. The results of these studies validate the use of INGN 241 in combination with radiotherapy for the treatment of non-small cell lung cancer, and other cancers."
The studies reported today evaluated the impact of INGN 241 on a specific molecular pathway that is involved in repairing breaks in double-stranded DNA. These breaks are induced by radiation and are the primary mechanism through which radiotherapy kills cancer cells. The ability of cancer cells to repair these breaks may lead to resistance to radiotherapy. In these studies, the addition of INGN 241 to cultured lung cancer cells suppressed the expression of several genes involved in the repair pathway. This suppression was not observed in normal cells treated with INGN 241. Suppression of these genes in lung cancer cells resulted in decreased levels of DNA repair and enhanced cancer cell death after ionizing radiation. There was no significant reduction in DNA repair in normal cells treated with radiation and INGN 241.
"The ability of INGN 241 to elicit anti-cancer effects in cancer cells without impacting normal cells is one of the most exciting features of this product candidate," said Sunil Chada, Ph.D., Introgen`s director of Research and Development. "The major side effects associated with radiotherapy result from damage to normal cells and tissue. These new studies demonstrate that INGN 241 increases the cell killing effects of radiation in lung cancer cells, but not in normal lung cells. We hope that this will translate into improved tumor responses without an increase in side effects. Additionally, the addition of INGN 241 to radiotherapy may allow a therapeutic effect to be achieved at a lower dose of radiation, potentially reducing the treatment limiting side effects associated with radiotherapy."
Each year in the U.S. there are approximately 715,000 cancer patient treatments with radiation. Introgen has already conducted a number of clinical studies using its proprietary delivery systems to deliver gene drugs in combination with conventional therapies such as radiation.
Hi,
zur Zeit bietet sich eine gute Einstiegs- oder
Nachkaufgelegenheit bei INGN.
Nicht vergessen:
Bei Advexin zur Brustkrebsbehandlung wird noch dieses Jahr
die Zulassung bei der FDA beantragt. Bereits im letzten
Jahr wurde dafür der Fast-Track-Status von der FDA gewährt.
Und auch bei Kopf-und Halskrebs und bei Lungenkrebs
wurden überzeugende Ergebnisse erzielt.
David G. Nance, Introgen`s CEO said:
Our programs are progressing and we look forward to achieving our goals of moving ADVEXIN and other product candidates to the market and to patients. We reiterate our guidance that we remain on track for the initiation of the ADVEXIN BLA submission this year. I believe Introgen`s prospects have never been more attractive.
therman
zur Zeit bietet sich eine gute Einstiegs- oder
Nachkaufgelegenheit bei INGN.
Nicht vergessen:
Bei Advexin zur Brustkrebsbehandlung wird noch dieses Jahr
die Zulassung bei der FDA beantragt. Bereits im letzten
Jahr wurde dafür der Fast-Track-Status von der FDA gewährt.
Und auch bei Kopf-und Halskrebs und bei Lungenkrebs
wurden überzeugende Ergebnisse erzielt.
David G. Nance, Introgen`s CEO said:
Our programs are progressing and we look forward to achieving our goals of moving ADVEXIN and other product candidates to the market and to patients. We reiterate our guidance that we remain on track for the initiation of the ADVEXIN BLA submission this year. I believe Introgen`s prospects have never been more attractive.
therman

Hi,
weiterhin gut Nachrichten bei INGN
Introgen Therapeutics, Inc. (ticker: ingn, exchange: NASDAQ) News Release - 10/20/04
--------------------------------------------------------------------------------
Introgen`s INGN 225 Therapy Demonstrates Powerful New Approach to Developing Therapeutic Cancer Vaccines
Results Presented at American Association of Cancer Research Symposium on Cancer Prevention
SEATTLE, Oct 20, 2004 /PRNewswire-FirstCall via COMTEX/ -- Introgen Therapeutics, Inc. (Nasdaq: INGN) today announced preclinical data demonstrating the promise of its INGN 225 therapy as a cancer vaccine. The data were presented yesterday at the Third Annual AACR International Conference on Frontiers in Cancer Prevention Research, being held in Seattle. INGN 225 is a therapeutic consisting of a cancer patient`s own immune cells treated with an adenovector carrying the human p53 gene, Ad-p53. INGN 225 is currently in Phase 1/2 trials in patients with small cell lung cancer and breast cancer. Introgen is also developing Ad-p53, or ADVEXIN(R), in phase 3 clinical trials for head and neck cancer, and for a variety of other cancers.
Previous studies have shown that p53 is a critical tumor suppressor gene, whose function is to prevent tumor formation. Mutations in p53 are required for tumor formation. These characteristics make p53 protein an ideal target for a cancer vaccine. In normal cells, p53 is found at very low levels and its expression is very tightly controlled. In cancer cells however, p53 fails to function normally and often accumulates to high levels. This high level of abnormal expression of p53 is used by the immune system to identify and destroy tumor cells following INGN 225 vaccination.
"We believe that these studies highlight the great potential of INGN 225 for the treatment of cancer, and we are equally excited by the prospect of using this technology to prevent cancer," said Sunil Chada, Ph.D., Introgen`s director of Research and Development. "The ability of INGN 225 to stimulate natural immunity and kill cancer cells is an important advance in the development of cancer vaccines. INGN 225 is a good example of how we can combine molecular therapies with the body`s own immune system to develop new cancer vaccine strategies."
The studies presented today were designed to assess the activity of p53-directed immunotherapy and specifically, the ability of p53-treated immune system cells, termed dendritic cells, to generate immunity against cancer cells that over-express p53. Mice were vaccinated with their own dendritic cells or with INGN 225. After 24 days, the mice were injected with a dose of cancer cells that previously has been shown to give rise to cancer in 100 percent of animals tested. In these studies, up to 85 percent of animals were protected from developing tumors. INGN 225 also was assessed for its effect on existing tumors and demonstrated a significant reduction in tumor growth compared with controls. Importantly, activation of the immune system to recognize high levels of p53 expressed in cancer cells did not result in any damage to normal tissue, indicating that this approach should have a very good safety profile.
"The ability to activate a patient`s immune system is a key advantage of using this type of therapeutic approach," said Dmitry Gabrilovich, M.D., Associate Professor of Oncology at the H. Lee Moffitt Cancer Center and principal investigator of the INGN 225 lung cancer clinical trial. "In these studies, combining the power of Ad-p53 with dendritic cell technology enabled us to generate potent immune responses and prevent tumor growth in animal models. These data validate the use of tumor suppressor antigens as therapeutic targets, and demonstrate that adenovectors provide an efficient method of stimulating dendritic cells so that they can generate a powerful anti-cancer immune response. We hope to ultimately be able to expand our ongoing therapeutic studies in patients into future prevention of this terrible disease."
weiterhin gut Nachrichten bei INGN
Introgen Therapeutics, Inc. (ticker: ingn, exchange: NASDAQ) News Release - 10/20/04
--------------------------------------------------------------------------------
Introgen`s INGN 225 Therapy Demonstrates Powerful New Approach to Developing Therapeutic Cancer Vaccines
Results Presented at American Association of Cancer Research Symposium on Cancer Prevention
SEATTLE, Oct 20, 2004 /PRNewswire-FirstCall via COMTEX/ -- Introgen Therapeutics, Inc. (Nasdaq: INGN) today announced preclinical data demonstrating the promise of its INGN 225 therapy as a cancer vaccine. The data were presented yesterday at the Third Annual AACR International Conference on Frontiers in Cancer Prevention Research, being held in Seattle. INGN 225 is a therapeutic consisting of a cancer patient`s own immune cells treated with an adenovector carrying the human p53 gene, Ad-p53. INGN 225 is currently in Phase 1/2 trials in patients with small cell lung cancer and breast cancer. Introgen is also developing Ad-p53, or ADVEXIN(R), in phase 3 clinical trials for head and neck cancer, and for a variety of other cancers.
Previous studies have shown that p53 is a critical tumor suppressor gene, whose function is to prevent tumor formation. Mutations in p53 are required for tumor formation. These characteristics make p53 protein an ideal target for a cancer vaccine. In normal cells, p53 is found at very low levels and its expression is very tightly controlled. In cancer cells however, p53 fails to function normally and often accumulates to high levels. This high level of abnormal expression of p53 is used by the immune system to identify and destroy tumor cells following INGN 225 vaccination.
"We believe that these studies highlight the great potential of INGN 225 for the treatment of cancer, and we are equally excited by the prospect of using this technology to prevent cancer," said Sunil Chada, Ph.D., Introgen`s director of Research and Development. "The ability of INGN 225 to stimulate natural immunity and kill cancer cells is an important advance in the development of cancer vaccines. INGN 225 is a good example of how we can combine molecular therapies with the body`s own immune system to develop new cancer vaccine strategies."
The studies presented today were designed to assess the activity of p53-directed immunotherapy and specifically, the ability of p53-treated immune system cells, termed dendritic cells, to generate immunity against cancer cells that over-express p53. Mice were vaccinated with their own dendritic cells or with INGN 225. After 24 days, the mice were injected with a dose of cancer cells that previously has been shown to give rise to cancer in 100 percent of animals tested. In these studies, up to 85 percent of animals were protected from developing tumors. INGN 225 also was assessed for its effect on existing tumors and demonstrated a significant reduction in tumor growth compared with controls. Importantly, activation of the immune system to recognize high levels of p53 expressed in cancer cells did not result in any damage to normal tissue, indicating that this approach should have a very good safety profile.
"The ability to activate a patient`s immune system is a key advantage of using this type of therapeutic approach," said Dmitry Gabrilovich, M.D., Associate Professor of Oncology at the H. Lee Moffitt Cancer Center and principal investigator of the INGN 225 lung cancer clinical trial. "In these studies, combining the power of Ad-p53 with dendritic cell technology enabled us to generate potent immune responses and prevent tumor growth in animal models. These data validate the use of tumor suppressor antigens as therapeutic targets, and demonstrate that adenovectors provide an efficient method of stimulating dendritic cells so that they can generate a powerful anti-cancer immune response. We hope to ultimately be able to expand our ongoing therapeutic studies in patients into future prevention of this terrible disease."
NEWS:
Introgen Therapeutics Adds 15th Adenoviral p53 Related Patent to Portfolio
Wednesday October 20, 1:00 pm ET
AUSTIN, Texas, Oct. 20 /PRNewswire-FirstCall/ -- Introgen Therapeutics, Inc. (Nasdaq: INGN - News) announced today that U.S. Patent No 6,805,858 has been awarded by the U.S. Patent and Trademark Office and covers several methods by which ADVEXIN®, Introgen`s leading anticancer therapy, is administered to cancer patients. The patent entitled "Methods for the Administration of Adenovirus p53" was issued to the Board of Regents of The University of Texas System and is exclusively licensed to Introgen. This patent is directed to various routes of administration of adenoviral p53, including virtually all of those routes currently being used for adenoviral delivery, such as direct administration to the tumor or to the body region where the tumor is located, as well as systemic, intravenous or intratracheal delivery.
ADVERTISEMENT
David L. Parker, Ph.D., J.D., Introgen`s vice president of Intellectual Property said, "This patent represents yet another important step in our ADVEXIN portfolio development, which has been to issue both broader and narrow patents covering all aspects of adenoviral compositions and clinical therapy. This patent focuses on the important routes and locales of adenoviral p53 administration, including regional, intravenous, direct tumoral injection and intratracheal administration. We believe that this patent separately covers virtually every route contemplated for adenoviral therapy."
Introgen`s ADVEXIN therapy uses the adenovirus delivery platform, a very important and frequently used tool in the fields of tumor suppressor therapy and vaccines. Unlike other viral delivery systems, adenoviruses do not mix with a patient`s DNA. Rather, they are genetically altered so that they are unable to replicate in humans and also have important properties that lend themselves readily to commercial scale manufacturing. With an excellent safety record, they have been used as vectors in many clinical studies to date. The adenovirus has been used for many years in the vaccine field, and more recently as a powerful tool to develop tumor suppressor therapies for a variety of diseases.
NEWS:
Introgen Therapeutics, Inc. to Present at the Rodman & Renshaw Techvest 6th Annual Healthcare Conference
Thursday October 21, 4:54 pm ET
Joins Over 200 Emerging Growth Biotech Companies at Annual Event
AUSTIN, Texas, Oct. 21 /PRNewswire-FirstCall/ -- Introgen Therapeutics (Nasdaq: INGN - News) today announced that it will present on Wednesday, October 27, at the Rodman & Renshaw Techvest 6th Annual Healthcare Conference taking place in New York on October 26-28, 2004. The conference is being held at The Waldorf-Astoria.
Introgen joins over 200 emerging growth biotechnology companies as they evolve from cutting-edge, innovative research vehicles to companies with life- enhancing product pipelines. The conference aims to provide investors -- both specialists and generalists -- with the opportunity to meet with corporate executives and experts from the scientific and medical communities.
The three-day conference will include company presentations, breakout sessions, Q&A, and one-on-one meetings with presenting companies.
Introgen Therapeutics Adds 15th Adenoviral p53 Related Patent to Portfolio
Wednesday October 20, 1:00 pm ET
AUSTIN, Texas, Oct. 20 /PRNewswire-FirstCall/ -- Introgen Therapeutics, Inc. (Nasdaq: INGN - News) announced today that U.S. Patent No 6,805,858 has been awarded by the U.S. Patent and Trademark Office and covers several methods by which ADVEXIN®, Introgen`s leading anticancer therapy, is administered to cancer patients. The patent entitled "Methods for the Administration of Adenovirus p53" was issued to the Board of Regents of The University of Texas System and is exclusively licensed to Introgen. This patent is directed to various routes of administration of adenoviral p53, including virtually all of those routes currently being used for adenoviral delivery, such as direct administration to the tumor or to the body region where the tumor is located, as well as systemic, intravenous or intratracheal delivery.
ADVERTISEMENT
David L. Parker, Ph.D., J.D., Introgen`s vice president of Intellectual Property said, "This patent represents yet another important step in our ADVEXIN portfolio development, which has been to issue both broader and narrow patents covering all aspects of adenoviral compositions and clinical therapy. This patent focuses on the important routes and locales of adenoviral p53 administration, including regional, intravenous, direct tumoral injection and intratracheal administration. We believe that this patent separately covers virtually every route contemplated for adenoviral therapy."
Introgen`s ADVEXIN therapy uses the adenovirus delivery platform, a very important and frequently used tool in the fields of tumor suppressor therapy and vaccines. Unlike other viral delivery systems, adenoviruses do not mix with a patient`s DNA. Rather, they are genetically altered so that they are unable to replicate in humans and also have important properties that lend themselves readily to commercial scale manufacturing. With an excellent safety record, they have been used as vectors in many clinical studies to date. The adenovirus has been used for many years in the vaccine field, and more recently as a powerful tool to develop tumor suppressor therapies for a variety of diseases.
NEWS:
Introgen Therapeutics, Inc. to Present at the Rodman & Renshaw Techvest 6th Annual Healthcare Conference
Thursday October 21, 4:54 pm ET
Joins Over 200 Emerging Growth Biotech Companies at Annual Event
AUSTIN, Texas, Oct. 21 /PRNewswire-FirstCall/ -- Introgen Therapeutics (Nasdaq: INGN - News) today announced that it will present on Wednesday, October 27, at the Rodman & Renshaw Techvest 6th Annual Healthcare Conference taking place in New York on October 26-28, 2004. The conference is being held at The Waldorf-Astoria.
Introgen joins over 200 emerging growth biotechnology companies as they evolve from cutting-edge, innovative research vehicles to companies with life- enhancing product pipelines. The conference aims to provide investors -- both specialists and generalists -- with the opportunity to meet with corporate executives and experts from the scientific and medical communities.
The three-day conference will include company presentations, breakout sessions, Q&A, and one-on-one meetings with presenting companies.
weitere gute News von
INGN
Study Identifies Unique Cancer Killing Activity of Introgen`s INGN 241 Therapy
AUSTIN, Texas, Oct. 27 /PRNewswire-FirstCall/ -- Introgen Therapeutics, Inc. (Nasdaq: INGN) today announced the publication of a study identifying a unique mechanism of action for INGN 241 contributing to its anti-tumor effects observed in clinical trials. The study, performed in melanoma, showed that INGN 241 is secreted during therapy resulting in the killing of injected target cancer cells as well as in neighboring cancer cells. This effect, called a `bystander effect` may serve as an amplification system to kill more cancer cells. Scientists at Introgen conducted the studies in collaboration with researchers at The University of Texas M. D. Anderson Cancer Center and The University of Texas Medical Branch.
The data are published in the online edition of Molecular Therapy and will appear in print in the December 2004 issue of the journal. INGN 241, Introgen`s cancer therapy that utilizes the mda-7 gene, is currently in phase 2 clinical studies to treat metastatic melanoma. A phase 1 clinical study to treat various solid tumors has been completed and demonstrated the ability of INGN 241 to induce partial or complete regression of injected tumors. Additional laboratory studies are ongoing in breast and pancreatic cancer.
INGN 241 produces MDA-7 protein both within injected target cells and causes MDA-7 secretion outside cells. This study demonstrates for the first time, that secreted MDA-7 protein can kill neighboring cancer cells. Furthermore, the studies identify a specific type of cell surface receptor, called the interleukin-20 receptor (IL-20R), as being essential to the anti- cancer effects of secreted MDA-7 in melanoma cells. Thus, entry of INGN 241 into one tumor cell can result in killing of multiple neighboring cancer cells.
"Our studies have shown that INGN 241 exhibits potent anti-cancer activity with every type of cancer cell we have tested. In addition to furthering our understanding of the multiple anti-cancer activities of MDA-7, these studies suggest that INGN 241 may have significant potential in treating metastatic melanoma, for which a phase 2 clinical study is ongoing," said Elizabeth A. Grimm, Co-Director of the Melanoma Research Program and Professor, Department of Experimental Therapeutics at M. D. Anderson Cancer Center, a co-author on the paper, and Introgen`s collaborator. "Patients with metastatic melanoma have few treatment options, and we are optimistic about the potential of new ways in which to treat this terrible disease."
INGN 241 uses Introgen`s proprietary adenovector technology to deliver the gene encoding the MDA-7 protein. The mda-7 gene was discovered by the laboratory of Dr. Paul B. Fisher, Professor of Clinical Pathology at Columbia University. Introgen holds an exclusive worldwide license for the gene from the Corixa Corporation.
INGN
Study Identifies Unique Cancer Killing Activity of Introgen`s INGN 241 Therapy
AUSTIN, Texas, Oct. 27 /PRNewswire-FirstCall/ -- Introgen Therapeutics, Inc. (Nasdaq: INGN) today announced the publication of a study identifying a unique mechanism of action for INGN 241 contributing to its anti-tumor effects observed in clinical trials. The study, performed in melanoma, showed that INGN 241 is secreted during therapy resulting in the killing of injected target cancer cells as well as in neighboring cancer cells. This effect, called a `bystander effect` may serve as an amplification system to kill more cancer cells. Scientists at Introgen conducted the studies in collaboration with researchers at The University of Texas M. D. Anderson Cancer Center and The University of Texas Medical Branch.
The data are published in the online edition of Molecular Therapy and will appear in print in the December 2004 issue of the journal. INGN 241, Introgen`s cancer therapy that utilizes the mda-7 gene, is currently in phase 2 clinical studies to treat metastatic melanoma. A phase 1 clinical study to treat various solid tumors has been completed and demonstrated the ability of INGN 241 to induce partial or complete regression of injected tumors. Additional laboratory studies are ongoing in breast and pancreatic cancer.
INGN 241 produces MDA-7 protein both within injected target cells and causes MDA-7 secretion outside cells. This study demonstrates for the first time, that secreted MDA-7 protein can kill neighboring cancer cells. Furthermore, the studies identify a specific type of cell surface receptor, called the interleukin-20 receptor (IL-20R), as being essential to the anti- cancer effects of secreted MDA-7 in melanoma cells. Thus, entry of INGN 241 into one tumor cell can result in killing of multiple neighboring cancer cells.
"Our studies have shown that INGN 241 exhibits potent anti-cancer activity with every type of cancer cell we have tested. In addition to furthering our understanding of the multiple anti-cancer activities of MDA-7, these studies suggest that INGN 241 may have significant potential in treating metastatic melanoma, for which a phase 2 clinical study is ongoing," said Elizabeth A. Grimm, Co-Director of the Melanoma Research Program and Professor, Department of Experimental Therapeutics at M. D. Anderson Cancer Center, a co-author on the paper, and Introgen`s collaborator. "Patients with metastatic melanoma have few treatment options, and we are optimistic about the potential of new ways in which to treat this terrible disease."
INGN 241 uses Introgen`s proprietary adenovector technology to deliver the gene encoding the MDA-7 protein. The mda-7 gene was discovered by the laboratory of Dr. Paul B. Fisher, Professor of Clinical Pathology at Columbia University. Introgen holds an exclusive worldwide license for the gene from the Corixa Corporation.
News
Introgen`s ADVEXIN Cancer Therapy in Combination With Chemotherapy Effective Against Head and Neck Cancer Cells
Monday November 8, 1:00 pm ET
AUSTIN, Texas, Nov. 8 /PRNewswire-FirstCall/ -- Introgen Therapeutics, Inc. (Nasdaq: INGN - News) today announced the publication of data from preclinical studies evaluating the impact of ADVEXIN in combination with chemotherapy (docetaxel) on head and neck cancer tumor cells. Data show that the combination resulted in potent tumor cell killing. Introgen researchers and collaborators at Wayne Sate University, the Karmanos Cancer Institute located in Detroit, Michigan and the University of California - Irvine conducted the studies and the data appear in the current issue of The Laryngoscope. ADVEXIN currently is in Phase 3 trials in patients with recurrent head and neck squamous cell carcinoma. The studies reported today were conducted to evaluate ADVEXIN`s utility in a number of treatment regimens, including single-agent therapy and as part of combination therapy with a variety of chemotherapeutic agents.
ADVERTISEMENT
George H. Yoo, M.D., Associate Professor in the Department of Otolaryngology-Head and Neck Surgery at Wayne State University and the lead author on the paper, commented, "Patients with head and neck cancer generally have poor outcomes. These patients need new treatment options that can provide improved outcomes and better quality of life during treatment. The results of these studies add to a growing body of data that support ADVEXIN`s potential in the treatment of head and neck cancer."
These studies show that the combination of ADVEXIN and docetaxel resulted in increased levels of programmed cell death in head and neck tumor cells. The combination of docetaxel and ADVEXIN increased the expression of p53, the active component of ADVEXIN, decreased the expression of several genes that drive cell growth and division, and increased the expression of genes that cause cancer cells to die, suggesting a likely mechanism for the increased programmed cell death which was observed. The results also suggest that docetaxel facilitates ADVEXIN`s entry into the cell.
"The studies published today highlight the potential of ADVEXIN as a stand-alone therapy and in combination with chemotherapy," said Robert E. Sobol, M.D., Introgen`s senior vice president, Medical and Scientific Affairs. "Recurrent head and neck cancer is difficult to treat, and patients with this disease represent a significant unmet medical need. ADVEXIN may provide a new approach to treating head and neck cancer as well as other cancers."
Introgen`s ADVEXIN Cancer Therapy in Combination With Chemotherapy Effective Against Head and Neck Cancer Cells
Monday November 8, 1:00 pm ET
AUSTIN, Texas, Nov. 8 /PRNewswire-FirstCall/ -- Introgen Therapeutics, Inc. (Nasdaq: INGN - News) today announced the publication of data from preclinical studies evaluating the impact of ADVEXIN in combination with chemotherapy (docetaxel) on head and neck cancer tumor cells. Data show that the combination resulted in potent tumor cell killing. Introgen researchers and collaborators at Wayne Sate University, the Karmanos Cancer Institute located in Detroit, Michigan and the University of California - Irvine conducted the studies and the data appear in the current issue of The Laryngoscope. ADVEXIN currently is in Phase 3 trials in patients with recurrent head and neck squamous cell carcinoma. The studies reported today were conducted to evaluate ADVEXIN`s utility in a number of treatment regimens, including single-agent therapy and as part of combination therapy with a variety of chemotherapeutic agents.
ADVERTISEMENT
George H. Yoo, M.D., Associate Professor in the Department of Otolaryngology-Head and Neck Surgery at Wayne State University and the lead author on the paper, commented, "Patients with head and neck cancer generally have poor outcomes. These patients need new treatment options that can provide improved outcomes and better quality of life during treatment. The results of these studies add to a growing body of data that support ADVEXIN`s potential in the treatment of head and neck cancer."
These studies show that the combination of ADVEXIN and docetaxel resulted in increased levels of programmed cell death in head and neck tumor cells. The combination of docetaxel and ADVEXIN increased the expression of p53, the active component of ADVEXIN, decreased the expression of several genes that drive cell growth and division, and increased the expression of genes that cause cancer cells to die, suggesting a likely mechanism for the increased programmed cell death which was observed. The results also suggest that docetaxel facilitates ADVEXIN`s entry into the cell.
"The studies published today highlight the potential of ADVEXIN as a stand-alone therapy and in combination with chemotherapy," said Robert E. Sobol, M.D., Introgen`s senior vice president, Medical and Scientific Affairs. "Recurrent head and neck cancer is difficult to treat, and patients with this disease represent a significant unmet medical need. ADVEXIN may provide a new approach to treating head and neck cancer as well as other cancers."
hallo,
ich würde ja nur zu gerne wissen, wer bei den Amis dauernd diese "Kurspflege" betreibt

Gruß
die gentechnikfreie Knolle
ich würde ja nur zu gerne wissen, wer bei den Amis dauernd diese "Kurspflege" betreibt


Gruß
die gentechnikfreie Knolle
eieieieieiei
heut sind aber einige stücke erstaunlich gut aufgenommen worden
bin echt gespannt wie`s weitergeht

7 odewr 8$??
schaumamal
heut sind aber einige stücke erstaunlich gut aufgenommen worden
bin echt gespannt wie`s weitergeht


7 odewr 8$??
schaumamal
Introgen Announces New Clinical Data for ADVEXIN and Submits Request to Food and Drug Administration for Initiation of Accelerated Approval Biologics License Application
AUSTIN, Texas, Dec. 23 /PRNewswire-FirstCall/ -- Introgen Therapeutics, Inc. (Nasdaq: INGN) today announced the findings of its recent analyses of Phase 2 clinical data for ADVEXIN(R) monotherapy in a subpopulation of recurrent, unresectable head and neck cancer (SCCHN) patients. ADVEXIN is Introgen`s investigational cancer therapy with two Phase 3 trials underway in recurrent SCCHN. In addition, Introgen announced that it has filed a Request with the U. S. Food and Drug Administration (FDA) to accept a "rolling Biologics License Application" (rolling BLA) for ADVEXIN. Introgen also plans to seek Accelerated Approval of ADVEXIN. The company has received FDA Fast Track designation for ADVEXIN therapy and ADVEXIN has been designated as an Orphan Drug for the treatment of head and neck cancer.
The data from Introgen`s phase 2 clinical trial treating patients with recurrent, unresectable SCCHN showed that tumor growth control, defined by confirmed complete responses, partial responses with greater than 50 percent tumor reduction, or stable disease, was observed in 41 percent of these patients. The confirmed objective response rate (complete responses and partial responses) was 15 percent. Patients achieving disease control also showed clinical benefit reflected by either lack of progression and/or improvement in disease related morbidity (performance score, weight loss and pain). Median survival of the sub-population was 13.5 months for the patients who achieved tumor growth control and 31.4 months for patients who achieved an objective response. This subpopulation of patients had certain defining prognostic, medical and biological characteristics that represent refined targeting of ADVEXIN treatment in advanced SCCHN. These findings, along with other data, are planned for presentation at an upcoming scientific meeting and for publication in a peer-reviewed medical journal.
"The sub-population analysis identifies the characteristics of patients most likely to respond to ADVEXIN with tumor growth control and extended survival," said Robert E. Sobol, M.D., senior vice president, Medical and Scientific Affairs at Introgen. "It is well known that spontaneous tumor remissions are rarely, if ever, observed in recurrent head and neck cancers. Consequently, we believe that these clinical responses were due to ADVEXIN therapy. We feel a responsibility to seek accelerated approval based upon these new analyses to make ADVEXIN available to patients with unmet medical needs as soon as possible."
Based on the analyses of these data, Introgen has decided to pursue Accelerated Approval for ADVEXIN. The company is requesting that the Accelerated Approval rolling BLA begin immediately, with the completion of the filing process before the end of next year.
FDA has established procedures that allow the Accelerated Approval of breakthrough drugs and biologics for life threatening diseases based upon surrogate endpoints that are reasonably likely to predict clinical benefit. Subpart E (21 CFR 601.41: comparable to Subpart H for drugs) permits the Accelerated Approval and sale of those drugs and biologics that meet unmet medical needs. Under these Accelerated Approval provisions, subsequent confirmatory clinical trials validating the surrogate endpoints are required.
A rolling BLA is the first regulatory step in the accelerated approval process. In conjunction with the Introgen Request for a rolling BLA, the company has submitted its first technical section for a pre-review evaluation by FDA. If granted by FDA, the rolling BLA will permit the sequential submission of the remaining technical sections for BLA review. The FDA uses rolling BLA expedited submission and review procedures for Fast Track products.
"We have based our accelerated regulatory submission strategy upon recent analyses of currently available ADVEXIN clinical data supporting efficacy in head and neck cancer patients," said Max W. Talbott, Ph.D., Introgen`s senior vice president of Worldwide Regulatory and Commercial Development. "From the perspective of patients with few options, we believe that it is advantageous to seek accelerated approval for ADVEXIN. Accordingly, Introgen`s plans for the Accelerated Approval of ADVEXIN make use of the provisions of 21 CFR 601.41 Subpart E of the biologics regulations. This approach also permits us to pursue a more traditional BLA review if FDA concludes that Accelerated Approval is not warranted."
Introgen recognizes that these regulatory requests are to be resolved at the sole discretion of FDA. Past experience has shown that some similar requests have been accepted while other similar requests have been rejected. Introgen believes that, after consideration of a number of factors, it has taken the responsible approach to endeavor to move ADVEXIN more quickly to the market so that patients may benefit.
About ADVEXIN
ADVEXIN induces the expression of the tumor suppressor p53 protein in very high concentrations in cancer tissue to selectively kill cancer cells. p53 is a normal constituent of cells and is known as a tumor suppressor because it inhibits the growth of tumor cells. One of the major roles of this protein is to eliminate cancerous cells by recognizing when the cell has been damaged by mutations and stopping cell growth to initiate repair. If the cell is damaged beyond repair, p53 initiates the cell death pathway to prevent the cell from growing out of control. ADVEXIN has been tested clinically as a monotherapy and as a combination therapy with chemotherapy, radiation therapy and surgery. In addition ADVEXIN is also being tested as an oral rinse or mouthwash for patients with oral pre-malignancies.
AUSTIN, Texas, Dec. 23 /PRNewswire-FirstCall/ -- Introgen Therapeutics, Inc. (Nasdaq: INGN) today announced the findings of its recent analyses of Phase 2 clinical data for ADVEXIN(R) monotherapy in a subpopulation of recurrent, unresectable head and neck cancer (SCCHN) patients. ADVEXIN is Introgen`s investigational cancer therapy with two Phase 3 trials underway in recurrent SCCHN. In addition, Introgen announced that it has filed a Request with the U. S. Food and Drug Administration (FDA) to accept a "rolling Biologics License Application" (rolling BLA) for ADVEXIN. Introgen also plans to seek Accelerated Approval of ADVEXIN. The company has received FDA Fast Track designation for ADVEXIN therapy and ADVEXIN has been designated as an Orphan Drug for the treatment of head and neck cancer.
The data from Introgen`s phase 2 clinical trial treating patients with recurrent, unresectable SCCHN showed that tumor growth control, defined by confirmed complete responses, partial responses with greater than 50 percent tumor reduction, or stable disease, was observed in 41 percent of these patients. The confirmed objective response rate (complete responses and partial responses) was 15 percent. Patients achieving disease control also showed clinical benefit reflected by either lack of progression and/or improvement in disease related morbidity (performance score, weight loss and pain). Median survival of the sub-population was 13.5 months for the patients who achieved tumor growth control and 31.4 months for patients who achieved an objective response. This subpopulation of patients had certain defining prognostic, medical and biological characteristics that represent refined targeting of ADVEXIN treatment in advanced SCCHN. These findings, along with other data, are planned for presentation at an upcoming scientific meeting and for publication in a peer-reviewed medical journal.
"The sub-population analysis identifies the characteristics of patients most likely to respond to ADVEXIN with tumor growth control and extended survival," said Robert E. Sobol, M.D., senior vice president, Medical and Scientific Affairs at Introgen. "It is well known that spontaneous tumor remissions are rarely, if ever, observed in recurrent head and neck cancers. Consequently, we believe that these clinical responses were due to ADVEXIN therapy. We feel a responsibility to seek accelerated approval based upon these new analyses to make ADVEXIN available to patients with unmet medical needs as soon as possible."
Based on the analyses of these data, Introgen has decided to pursue Accelerated Approval for ADVEXIN. The company is requesting that the Accelerated Approval rolling BLA begin immediately, with the completion of the filing process before the end of next year.
FDA has established procedures that allow the Accelerated Approval of breakthrough drugs and biologics for life threatening diseases based upon surrogate endpoints that are reasonably likely to predict clinical benefit. Subpart E (21 CFR 601.41: comparable to Subpart H for drugs) permits the Accelerated Approval and sale of those drugs and biologics that meet unmet medical needs. Under these Accelerated Approval provisions, subsequent confirmatory clinical trials validating the surrogate endpoints are required.
A rolling BLA is the first regulatory step in the accelerated approval process. In conjunction with the Introgen Request for a rolling BLA, the company has submitted its first technical section for a pre-review evaluation by FDA. If granted by FDA, the rolling BLA will permit the sequential submission of the remaining technical sections for BLA review. The FDA uses rolling BLA expedited submission and review procedures for Fast Track products.
"We have based our accelerated regulatory submission strategy upon recent analyses of currently available ADVEXIN clinical data supporting efficacy in head and neck cancer patients," said Max W. Talbott, Ph.D., Introgen`s senior vice president of Worldwide Regulatory and Commercial Development. "From the perspective of patients with few options, we believe that it is advantageous to seek accelerated approval for ADVEXIN. Accordingly, Introgen`s plans for the Accelerated Approval of ADVEXIN make use of the provisions of 21 CFR 601.41 Subpart E of the biologics regulations. This approach also permits us to pursue a more traditional BLA review if FDA concludes that Accelerated Approval is not warranted."
Introgen recognizes that these regulatory requests are to be resolved at the sole discretion of FDA. Past experience has shown that some similar requests have been accepted while other similar requests have been rejected. Introgen believes that, after consideration of a number of factors, it has taken the responsible approach to endeavor to move ADVEXIN more quickly to the market so that patients may benefit.
About ADVEXIN
ADVEXIN induces the expression of the tumor suppressor p53 protein in very high concentrations in cancer tissue to selectively kill cancer cells. p53 is a normal constituent of cells and is known as a tumor suppressor because it inhibits the growth of tumor cells. One of the major roles of this protein is to eliminate cancerous cells by recognizing when the cell has been damaged by mutations and stopping cell growth to initiate repair. If the cell is damaged beyond repair, p53 initiates the cell death pathway to prevent the cell from growing out of control. ADVEXIN has been tested clinically as a monotherapy and as a combination therapy with chemotherapy, radiation therapy and surgery. In addition ADVEXIN is also being tested as an oral rinse or mouthwash for patients with oral pre-malignancies.
INGN vorbörslich auf 9,80 US$.
Weiteres Potential der Aktie meiner Meinung nach
ca. 20$.
therman
Weiteres Potential der Aktie meiner Meinung nach
ca. 20$.
therman
Long-Term Introgen ADVEXIN Survivors Featured in TV Story; Lung Cancer Patients Celebrate 5 1/2 Years
AUSTIN, Texas, Dec. 23 /PRNewswire-FirstCall/ -- Introgen Therapeutics, Inc. (Nasdaq: INGN) today announced that two long-term survivors treated with ADVEXIN therapy were featured in a broadcast feature on KTRK-TV, Channel 13, which aired on December 22, 2004. KTRK-TV is a Houston-based station. The news story was an update, provided by The University of Texas M. D. Anderson Cancer Center, to a story that aired in August 2004 celebrating the patients` 5-year post treatment anniversaries.
The two patients being profiled -- lung cancer patients -- had previously failed conventional therapies and then received combination treatments with ADVEXIN therapy.
The broadcast can be viewed at http://abclocal.go.com/ktrk/ or by logging onto Introgen`s web site at http://www.introgen.com and visiting the Media Mentions page.
AUSTIN, Texas, Dec. 23 /PRNewswire-FirstCall/ -- Introgen Therapeutics, Inc. (Nasdaq: INGN) today announced that two long-term survivors treated with ADVEXIN therapy were featured in a broadcast feature on KTRK-TV, Channel 13, which aired on December 22, 2004. KTRK-TV is a Houston-based station. The news story was an update, provided by The University of Texas M. D. Anderson Cancer Center, to a story that aired in August 2004 celebrating the patients` 5-year post treatment anniversaries.
The two patients being profiled -- lung cancer patients -- had previously failed conventional therapies and then received combination treatments with ADVEXIN therapy.
The broadcast can be viewed at http://abclocal.go.com/ktrk/ or by logging onto Introgen`s web site at http://www.introgen.com and visiting the Media Mentions page.
Hallo,
so langsam sollte es doch mal wieder Richtung 9 $ gehen

Gruß
Knolle
so langsam sollte es doch mal wieder Richtung 9 $ gehen

Gruß
Knolle
kaum geschrieben , schon fällt die Acht

gab auch lange keine News mehr

gab auch lange keine News mehr
Auch die letzte Nachricht ist doch eigentlich recht vielversprechend:
Introgen Therapeutics, Inc. (ticker: ingn, exchange: NASDAQ Stock Exchange (.O)) News Release - 3/17/05
--------------------------------------------------------------------------------
Introgen`s INGN 241 Demonstrates Clinically Significant Activity in Patients With Advanced Cancer
AUSTIN, TX, Mar 17, 2005 (MARKET WIRE via COMTEX) -- Introgen Therapeutics, Inc. (NASDAQ: INGN) today reported the publication of data from a Phase 1 trial of INGN 241 in patients with solid tumors. These data demonstrate that direct injection of INGN 241 induced programmed cell death in 100 percent of the tumors treated, even in patients who had failed prior therapy with other anti-cancer drugs. Clinical responses were observed in 44 percent of the treated lesions, including complete and partial responses in two patients with melanoma. Patients treated with INGN 241 had increases in a subset of T-cells that help to destroy cancer cells, which is consistent with the role of MDA-7 protein as a member of the interleukin family of immune stimulating proteins. mda-7 is the active component of INGN 241. The results appear in two papers in an issue of Molecular Therapy.
"These data are very encouraging and provided the rationale for advancing INGN 241 to Phase 2 clinical development," said Robert E. Sobol, M.D., senior vice president, Medical and Scientific Affairs at Introgen. "The ability of INGN 241 to induce clinically relevant responses in patients with advanced cancer, while demonstrating a favorable safety profile, is very encouraging. One patient with advanced melanoma had a complete response in a treated tumor, and also demonstrated activity in untreated tumors. These data suggest that INGN 241 may have potential to treat primary tumors as well as cancer that has spread throughout the body."
The Phase 1 dose escalation study treated 22 patients with advanced solid tumors. All patients had previously been treated for cancer, and the majority had received surgery in addition to chemotherapy or radiation therapy. A total of 15 different tumor types were treated, including melanoma, breast, colorectal, non-small cell lung cancer and lymphoma. The data from these patients indicate that INGN 241 is well tolerated, and a maximum tolerated dose was not reached. Two of five patients treated at the highest dose showed objective clinical responses, including complete regression of one treated lesion in a patient with melanoma. Immune activation was noted in these patients along with molecular changes that mirrored preclinical studies.
"The clinical and molecular responses observed following treatment with INGN 241 are exciting and warrant additional evaluation," said Dr. Sobol. "MDA-7 protein has multiple anti-cancer effects, including inducing programmed cell death, stimulating an immune response to tumor cells and inhibiting the formation of new blood vessels needed to support tumor growth. These multiple activities may enable INGN 241 to provide clinical benefit to patients with a variety of tumor types and we continue to be excited about the potential of INGN 241 as a new approach to treating cancer."
INGN 241 uses Introgen`s proprietary adenovector technology to deliver the gene encoding the MDA-7 protein. The mda-7 gene was discovered by the laboratory of Dr. Paul B. Fisher, Professor of Clinical Pathology at Columbia University. Introgen holds an exclusive worldwide license for the gene from the Corixa Corporation.
Auch die am 14.03.2005 vorgelegten Quartalszahlen dürften wohl nicht so schlecht gewesen sein.
Weiß jemand, wann mit einer FDA-Entscheidung bzgl. einer Zulassung von Advexin zu rechnen ist?
Als Investierter bin ich gespannt, ob die Unterstützungszone, in der sich der Kurs jetzt bewegt, halten wird, bevor es die hoffentlich guten News gibt...
Stammzelle
Introgen Therapeutics, Inc. (ticker: ingn, exchange: NASDAQ Stock Exchange (.O)) News Release - 3/17/05
--------------------------------------------------------------------------------
Introgen`s INGN 241 Demonstrates Clinically Significant Activity in Patients With Advanced Cancer
AUSTIN, TX, Mar 17, 2005 (MARKET WIRE via COMTEX) -- Introgen Therapeutics, Inc. (NASDAQ: INGN) today reported the publication of data from a Phase 1 trial of INGN 241 in patients with solid tumors. These data demonstrate that direct injection of INGN 241 induced programmed cell death in 100 percent of the tumors treated, even in patients who had failed prior therapy with other anti-cancer drugs. Clinical responses were observed in 44 percent of the treated lesions, including complete and partial responses in two patients with melanoma. Patients treated with INGN 241 had increases in a subset of T-cells that help to destroy cancer cells, which is consistent with the role of MDA-7 protein as a member of the interleukin family of immune stimulating proteins. mda-7 is the active component of INGN 241. The results appear in two papers in an issue of Molecular Therapy.
"These data are very encouraging and provided the rationale for advancing INGN 241 to Phase 2 clinical development," said Robert E. Sobol, M.D., senior vice president, Medical and Scientific Affairs at Introgen. "The ability of INGN 241 to induce clinically relevant responses in patients with advanced cancer, while demonstrating a favorable safety profile, is very encouraging. One patient with advanced melanoma had a complete response in a treated tumor, and also demonstrated activity in untreated tumors. These data suggest that INGN 241 may have potential to treat primary tumors as well as cancer that has spread throughout the body."
The Phase 1 dose escalation study treated 22 patients with advanced solid tumors. All patients had previously been treated for cancer, and the majority had received surgery in addition to chemotherapy or radiation therapy. A total of 15 different tumor types were treated, including melanoma, breast, colorectal, non-small cell lung cancer and lymphoma. The data from these patients indicate that INGN 241 is well tolerated, and a maximum tolerated dose was not reached. Two of five patients treated at the highest dose showed objective clinical responses, including complete regression of one treated lesion in a patient with melanoma. Immune activation was noted in these patients along with molecular changes that mirrored preclinical studies.
"The clinical and molecular responses observed following treatment with INGN 241 are exciting and warrant additional evaluation," said Dr. Sobol. "MDA-7 protein has multiple anti-cancer effects, including inducing programmed cell death, stimulating an immune response to tumor cells and inhibiting the formation of new blood vessels needed to support tumor growth. These multiple activities may enable INGN 241 to provide clinical benefit to patients with a variety of tumor types and we continue to be excited about the potential of INGN 241 as a new approach to treating cancer."
INGN 241 uses Introgen`s proprietary adenovector technology to deliver the gene encoding the MDA-7 protein. The mda-7 gene was discovered by the laboratory of Dr. Paul B. Fisher, Professor of Clinical Pathology at Columbia University. Introgen holds an exclusive worldwide license for the gene from the Corixa Corporation.
Auch die am 14.03.2005 vorgelegten Quartalszahlen dürften wohl nicht so schlecht gewesen sein.
Weiß jemand, wann mit einer FDA-Entscheidung bzgl. einer Zulassung von Advexin zu rechnen ist?
Als Investierter bin ich gespannt, ob die Unterstützungszone, in der sich der Kurs jetzt bewegt, halten wird, bevor es die hoffentlich guten News gibt...

Stammzelle
Hallo Introgen-Freunde!!!
Kann mir mal jemand die außergewöhnlichen Kursanstiege in letzten Handelsstunden vom gestrigen und heutigen Tage erklären? Bin nicht so ganz neu an der Börse, habe so etwas aber noch nicht so oft gesehen und von Chartangelegenheiten ohnehin auch nicht sehr viel Ahnung... Gruß, STAMMZELLE.
Kann mir mal jemand die außergewöhnlichen Kursanstiege in letzten Handelsstunden vom gestrigen und heutigen Tage erklären? Bin nicht so ganz neu an der Börse, habe so etwas aber noch nicht so oft gesehen und von Chartangelegenheiten ohnehin auch nicht sehr viel Ahnung... Gruß, STAMMZELLE.

tja, schwer zu sagen,
die amis spekulieren auf short selling oder good news im anmarsch
jedenfalls wirds heute spannend

gruß knolle
die amis spekulieren auf short selling oder good news im anmarsch
jedenfalls wirds heute spannend


gruß knolle
Hallo INTROGENER, ich weiß derartige Übersetzungen über altavista sind nicht gerade beliebt. Mache es trotzdem, weil es insersondere um Termine/ Events geht, auf denen einer der absoluten Hoffnungsträger vorgestellt wird:
Einzigartige Eigenschaften von INGN 241 Introgens mögen neuer Annäherung zur Krebs-Therapie ermöglichen
Dienstag April 5, 3:30 P.M. UND
AUSTIN, TX -- (market WIRE) -- Apr 5, 2005 -- Introgen Therapeutics, Inc. (NasdaqNM:INGN - Nachrichten) heute stellt Daten bezüglich der mehrfachen krebsbekämpfenden Einheiten von INGN 241 bei der experimentellen Konferenz der Biologie 2005 dar, gefördert durch die Vereinigung der amerikanischen Gesellschaften für experimentelle Biologie (FASEB). Die Daten zeigen daß mda-7, der Wirkanteil von INGN 241, Taten als Tumorentstörer, ein immun-anregendes cytokine und ein anti-angiogenic Mittel. Forscher an der Introgen Therapeutik und ihre Mitarbeiter in der Abteilung der experimentellen Therapeutik in M.D. Anderson der Krebs-Mitte leiteten die Studien, die in der Darstellung gekennzeichnet wurden.
"Tumorentstörer, haben cytokines und anti-angiogenic Mittel einzeln bedeutendes Potential in der Behandlung des Krebses," gezeigt, sagte Sunil Chada, Ph.D. Introgens Teilnehmervizepräsidenten, klinische Forschung und Leitung Autor auf dem Auszug. "INGN 241 ist die erste krebsbekämpfende Droge in Untersuchung, das diese drei leistungsfähigen krebsbekämpfenden Tätigkeiten in ein einzelnes therapeutisches kombiniert. Cytokines wie IL-2, Interferon-Alpha und Avastin. (bevacizumab), ein anti-angiogenic Mittel, sind bereits für die Behandlung bestimmter Arten des Krebses genehmigt worden. Die mehrfachen krebsbekämpfenden Tätigkeiten von INGN 241 schlagen, daß es eine Romanannäherung zum Behandeln des Krebses zur Verfügung stellen könnte, ein vor, das enthält einige validierte therapeutische Annäherungen in eine einzelne Droge."
Introgen und seine akademischen Mitarbeiter haben einen robusten Körper des Wissens um die mehrfachen krebsbekämpfenden Tätigkeiten von INGN 241 erzeugt. Wie in der heutigen Darstellung hervorgehoben, verursacht Leitung von INGN 241 apoptosis (programmierten Zelle Tod) in den Krebszellen aber nicht in den normalen Zellen. Zusätzlich sensibilisiert INGN 241 Tumoren zu den herkömmlichen Drogen wie Chemotherapie- und Strahlentherapie und erhöht eine Vielzahl der immun-anregenden cytokines. Studien zeigen auch, daß INGN 241 angiogenesis, den Prozeß hemmt, durch den neue $blutgefässe gebildet werden. Angiogenesis wird angefordert, um das Wachstum der Tumoren über einer minimalen Größe hinaus zu stützen, und Hemmung dieses Prozesses ist als Annäherung an das Behandeln des Krebses validiert worden.
Robert E. Sobol, M.D., Introgens älterer Vizepräsident, medizinische und wissenschaftliche Angelegenheiten, stellte die Daten dar und kommentierte, "die molekularen Einheiten von INGN 241, das in dieser Darstellung gekennzeichnet wird, stellen das Grundprinzip für die vielversprechenden krebsbekämpfenden Effekte, die wir in preclinical gesehen haben zur Verfügung und teilen 1 und 2 klinische Versuche dieser Romanuntersuchungskrebstherapie ein. Wir werden über das Potential dieser erfinderischen, niedrigen Giftigkeitannäherung an das Behandeln des Krebses aufgeregt und fortfahren, die wissenschaftliche und klinische Entwicklung von INGN 241 für eine Vielzahl von Malignancies vorzurücken."
Daten von einigen preclinical Studien von INGN 241 werden an der amerikanischen Verbindung der jährlichen Sitzung der Krebsforschung (April 16-20, 2005) und an der amerikanischen Gesellschaft für jährliche Sitzung der Gen-Therapie dargestellt (Juni 1-5, 2005); klinische Daten werden an der amerikanischen Gesellschaft der jährlichen Sitzung der klinischen Onkologie dargestellt (Mai 13-17, 2005).
Das Gen mda-7 wurde durch das Labor von Dr. Paul B. Fisher, Professor der klinischen Pathologie und der Michael und der Stella Chernow urologische Krebsforschung-Wissenschaftler in den Abteilungen der neurologischen Chirurgie, der Pathologie und des Urology an der Kolumbien Universität entdeckt. Introgen hält eine exklusive weltweite Lizenz für alle Gentherapieanwendungen von Corixa Corporation.
Vielleicht bekommt der Kurs dadurch neuen Aufwind.
Stammzelle
Einzigartige Eigenschaften von INGN 241 Introgens mögen neuer Annäherung zur Krebs-Therapie ermöglichen
Dienstag April 5, 3:30 P.M. UND
AUSTIN, TX -- (market WIRE) -- Apr 5, 2005 -- Introgen Therapeutics, Inc. (NasdaqNM:INGN - Nachrichten) heute stellt Daten bezüglich der mehrfachen krebsbekämpfenden Einheiten von INGN 241 bei der experimentellen Konferenz der Biologie 2005 dar, gefördert durch die Vereinigung der amerikanischen Gesellschaften für experimentelle Biologie (FASEB). Die Daten zeigen daß mda-7, der Wirkanteil von INGN 241, Taten als Tumorentstörer, ein immun-anregendes cytokine und ein anti-angiogenic Mittel. Forscher an der Introgen Therapeutik und ihre Mitarbeiter in der Abteilung der experimentellen Therapeutik in M.D. Anderson der Krebs-Mitte leiteten die Studien, die in der Darstellung gekennzeichnet wurden.
"Tumorentstörer, haben cytokines und anti-angiogenic Mittel einzeln bedeutendes Potential in der Behandlung des Krebses," gezeigt, sagte Sunil Chada, Ph.D. Introgens Teilnehmervizepräsidenten, klinische Forschung und Leitung Autor auf dem Auszug. "INGN 241 ist die erste krebsbekämpfende Droge in Untersuchung, das diese drei leistungsfähigen krebsbekämpfenden Tätigkeiten in ein einzelnes therapeutisches kombiniert. Cytokines wie IL-2, Interferon-Alpha und Avastin. (bevacizumab), ein anti-angiogenic Mittel, sind bereits für die Behandlung bestimmter Arten des Krebses genehmigt worden. Die mehrfachen krebsbekämpfenden Tätigkeiten von INGN 241 schlagen, daß es eine Romanannäherung zum Behandeln des Krebses zur Verfügung stellen könnte, ein vor, das enthält einige validierte therapeutische Annäherungen in eine einzelne Droge."
Introgen und seine akademischen Mitarbeiter haben einen robusten Körper des Wissens um die mehrfachen krebsbekämpfenden Tätigkeiten von INGN 241 erzeugt. Wie in der heutigen Darstellung hervorgehoben, verursacht Leitung von INGN 241 apoptosis (programmierten Zelle Tod) in den Krebszellen aber nicht in den normalen Zellen. Zusätzlich sensibilisiert INGN 241 Tumoren zu den herkömmlichen Drogen wie Chemotherapie- und Strahlentherapie und erhöht eine Vielzahl der immun-anregenden cytokines. Studien zeigen auch, daß INGN 241 angiogenesis, den Prozeß hemmt, durch den neue $blutgefässe gebildet werden. Angiogenesis wird angefordert, um das Wachstum der Tumoren über einer minimalen Größe hinaus zu stützen, und Hemmung dieses Prozesses ist als Annäherung an das Behandeln des Krebses validiert worden.
Robert E. Sobol, M.D., Introgens älterer Vizepräsident, medizinische und wissenschaftliche Angelegenheiten, stellte die Daten dar und kommentierte, "die molekularen Einheiten von INGN 241, das in dieser Darstellung gekennzeichnet wird, stellen das Grundprinzip für die vielversprechenden krebsbekämpfenden Effekte, die wir in preclinical gesehen haben zur Verfügung und teilen 1 und 2 klinische Versuche dieser Romanuntersuchungskrebstherapie ein. Wir werden über das Potential dieser erfinderischen, niedrigen Giftigkeitannäherung an das Behandeln des Krebses aufgeregt und fortfahren, die wissenschaftliche und klinische Entwicklung von INGN 241 für eine Vielzahl von Malignancies vorzurücken."
Daten von einigen preclinical Studien von INGN 241 werden an der amerikanischen Verbindung der jährlichen Sitzung der Krebsforschung (April 16-20, 2005) und an der amerikanischen Gesellschaft für jährliche Sitzung der Gen-Therapie dargestellt (Juni 1-5, 2005); klinische Daten werden an der amerikanischen Gesellschaft der jährlichen Sitzung der klinischen Onkologie dargestellt (Mai 13-17, 2005).
Das Gen mda-7 wurde durch das Labor von Dr. Paul B. Fisher, Professor der klinischen Pathologie und der Michael und der Stella Chernow urologische Krebsforschung-Wissenschaftler in den Abteilungen der neurologischen Chirurgie, der Pathologie und des Urology an der Kolumbien Universität entdeckt. Introgen hält eine exklusive weltweite Lizenz für alle Gentherapieanwendungen von Corixa Corporation.
Vielleicht bekommt der Kurs dadurch neuen Aufwind.

Stammzelle
Hallo, hat jemand Ahnung,warum Rodman & Renshaw INGN von "Market Perform" auf "Market Underperform" herabgestuft hat? Konnte dazu nichts finden .
.
Gruß, Stammzelle!
 .
.Gruß, Stammzelle!


Introgen`s Tumor Suppressor INGN 241 Highlighted With Six Presentations at American Association of Cancer Research Annual Meeting INGN 241 Exhibits Multiple Cancer Fighting Properties: Tumor Growth Suppression, Cancer Vaccine and Anti-Angiogenic Prop
AUSTIN, Texas, April 18, 2005 /PRNewswire-FirstCall via COMTEX/ -- Introgen
Therapeutics, Inc. (Nasdaq: INGN) today announced the presentation of data from
multiple studies of the tumor suppressor INGN 241, documenting the Company`s
ongoing progress in evaluating the multiple anti-cancer activities of this novel
investigational therapy. INGN 241, adenoviral-mda-7, is currently being
evaluated in a Phase 2 clinical trial in patients with malignant melanoma. The
data, which will be presented this week in six separate presentations at the
American Association of Cancer Research 96th Annual Meeting (AACR) in Anaheim,
California, underscore the broad and growing potential of INGN 241 in a variety
of cancers. The presentations illustrate the activity of INGN 241 when used as a
monotherapy, as part of combination regimens, as an anti- angiogenic agent and
as an immunotherapy.
"As we advance the clinical development of INGN 241, we continue to evaluate its
multiple anti-cancer activities in a variety of preclinical models of cancer,"
said Sunil Chada, Ph.D., Introgen`s associate vice president, clinical research.
"The various abstracts presented at this conference demonstrate how targeted
molecular cancer therapies can address the disease process through a variety of
biologically and clinically relevant molecular pathways."
Abstract #3876 highlights a novel mechanism by which INGN 241 inhibits the
formation of new blood vessels (angiogenesis) needed to support tumor growth.
Previous studies have shown that INGN 241 inhibits the formation of blood
vessels supplying tumors by blocking production of the cells that cause the
development of the new blood vessels. The data presented at AACR demonstrate
that INGN 241 also inhibits the production of VEGF protein, a potent and
upstream inducer of angiogenesis, within lung cancer cells. INGN 241 thus
inhibits tumor angiogenesis, a key requirement for tumor growth through two
distinct mechanisms.
Current approaches to anti-angiogenic cancer therapies focus on inhibiting the
ability of blood vessel growth factors, such as VEGF, to bind to their receptors
on blood vessels, thus blocking production of new vessels. In addition to this
activity, INGN 241 appears to elicit anti-angiogenic effects much further
upstream in this process, by blocking production of VEGF protein.
Data from another series of studies (Abstract #5996) demonstrate that
administration of INGN 241 results in the development of systemic immune
responses against tumor cells and suggest that INGN 241 could be used as a novel
cancer vaccine. In preclinical studies, implantation of INGN 241- treated tumor
cells into mice resulted in a significant inhibition of tumor growth.
Significantly, mice that were immunized with INGN 241-treated cells showed
inhibition of tumor growth after a subsequent challenge with additional tumor
cells. The data suggest that administration of INGN 241 induces systemic
immunity that can inhibit tumor growth.
Dr. Chada continued, "We currently are conducting clinical studies of INGN 225,
a cancer vaccine that utilizes p53, the active component of ADVEXIN. Our data
suggest that a vaccine utilizing mda-7, the active component of INGN 241, may
also have therapeutic benefit. We continue to expand our understanding of the
immune stimulating, anti-angiogenic and growth inhibition activities of INGN 241
through ongoing preclinical studies such as those presented at this conference,
and at the FASEB conference earlier this month. Such studies provide us with
important data that help to drive the clinical development of INGN 241 toward
commercialization."
Other highlights of INGN 241 preclinical data presented at AACR include:
* Efficacy as a monotherapy in models of ovarian cancer (Abstract #5026)
* Efficacy in combination with novel investigational classes of
chemotherapy (Abstract #1349 and Abstract #2014)
* Mechanisms of anti-cancer activity in breast cancer (Abstract #3694)



Researchers at Introgen and The University of Texas M. D. Anderson Cancer Center
collaborated on the studies presented at the conference.
The mda-7 gene was discovered by the laboratory of Dr. Paul B. Fisher, professor
of clinical pathology and the Michael and Stella Chernow Urological Cancer
Research Scientist in the Departments of Neurological Surgery, Pathology and
Urology at Columbia University. Introgen holds an exclusive worldwide license
for all gene therapy applications from the Corixa Corporation.

Introgen holds a licensing agreement with M.D. Anderson to commercialize
products based on licensed technologies, and has the option to license future
technologies under sponsored research agreements. The University of Texas Board
of Regents own stock in Introgen. These arrangements are managed in accordance
with M.D. Anderson`s conflict of interest policies.

Introgen is a leading developer of biopharmaceutical products designed to induce
therapeutic protein expression using non-integrating gene agents for the
treatment of cancer and other diseases. Introgen maintains integrated research,
development, manufacturing, clinical and regulatory departments and operates a
commercial-scale, CGMP manufacturing facility.
Certain statements in this press release that are not strictly historical may be
"forward-looking" statements, which are based on current expectations and entail
various risks and uncertainties. Such forward-looking statements include, but
are not limited to those relating to INGN 241 and its development as a
monotherapy, as part of combination regimens, as an anti-angiogenic agent and as
an immunotherapy. There can be no assurance that Introgen will be able to
commercially develop gene-based drugs, that necessary regulatory approvals will
be obtained or that any clinical trials or studies undertaken will be successful
or that the proposed treatments will prove to be safe and/or effective. The
actual results may differ from those described in this press release due to
risks and uncertainties that exist in Introgen`s operations and business
environment, including, but not limited to, Introgen`s stage of product
development and the limited experience in the development of gene- based drugs
in general, Introgen`s dependence upon proprietary technology and the current
competitive environment, history of operating losses and accumulated deficits,
reliance on collaborative relationships, and uncertainties related to clinical
trials, the safety and efficacy of Introgen`s product candidates, the ability to
obtain the appropriate regulatory approvals, Introgen`s patent protection and
market acceptance, as well as other risks detailed from time to time in
Introgen`s filings with the Securities and Exchange Commission including its
annual report on Form 10-K filed with the Securities and Exchange Commission on
March 15, 2005 and its quarterly report on Form 10-Q filed with the Securities
and Exchange Commission on November 15, 2004. Introgen undertakes no obligation
to publicly release the results of any revisions to any forward-looking
statements that reflect events or circumstances arising after the date hereof.
Editor`s Note: For more information on Introgen Therapeutics, or for a menu of
archived press releases, please visit Introgen`s Website at:
http://www.introgen.com
Contact:
Introgen Therapeutics, Inc.
C. Channing Burke
(512) 708 9310 Ext. 322
Email: c.burke@introgen.com
SOURCE Introgen Therapeutics, Inc.
CONTACT: C. Channing Burke of Introgen Therapeutics, Inc., +1-512-708-9310, ext. 322, or
c.burke@introgen.com
URL: http://www.prnewswire.com
http://www.introgen.com

Tendenz seit Ende März + Ergebnisse diese Woche=
hoffentlich endlich mal 2stellige Kurse
Gruß
Knolle
Das verstehe Mal einer... Erst kommt letzte Woche eine Herabstufung von Rodman & Renshaw, jetzt in einer Ersteinschätzung ein "Strong Buy" von Adam Harkness. Bleibe investiert und bin auch Mal gespannt, wie der Kurs diese Woche verlaufen wird. Derzeit ja noch nix Dolles... Hab aber ein gutes Gefühl. Das hatte ich 2000 aber auch...
Viel Spaß weiterhin mit INGN. Sind in Deutschland wohl eh nur eine Hand voll INGN-Investoren, oder?
Gruß, Stammzelle.
Viel Spaß weiterhin mit INGN. Sind in Deutschland wohl eh nur eine Hand voll INGN-Investoren, oder?
Gruß, Stammzelle.

 sooo schlecht sind die Zahlen doch gar nicht , die müssen halt langsam mal Umsatz machen
sooo schlecht sind die Zahlen doch gar nicht , die müssen halt langsam mal Umsatz machenCONSOLIDATED BALANCE SHEET
MARCH 31, DECEMBER 31,
2005 2004
(Unaudited)
(Thousands)
CASH, CASH EQUIVALENTS AND SHORT-TERM INVESTMENTS 32,648 38,180
OTHER CURRENT ASSETS 690 659
PROPERTY AND EQUIPMENT, NET 6,974 7,277
GRANT RIGHTS ACQUIRED 1,345 1,582
OTHER ASSETS 353 359
TOTAL ASSETS $ 42,010 $ 48,057
ACCOUNTS PAYABLE, ACCRUALS AND OTHER CURRENT LIABILITIES $ 6,479 $ 6,858
NOTES PAYABLE, NET OF CURRENT PORTION 7,962 7,901
OTHER LONG TERM LIABILITIES 1,200 1,132
TOTAL LIABILITIES 15,641 15,891
TOTAL STOCKHOLDERS’ EQUITY 26,369 32,166
TOTAL LIABILITIES AND STOCKHOLDERS’ EQUITY $ 42,010 $ 48,057
Gruß
Knolle
Hallo,
bestimmt noch jemand da?....
das nenn ich wirklich mal ne gute Nachricht:
von der Homepage
Introgen Therapeutics, Inc. (ticker: ingn, exchange: NASDAQ Stock Exchange (.O)) News Release - 11/4/05
--------------------------------------------------------------------------------
Introgen Therapeutics, Inc. Announces Oral Health Alliance With Colgate-Palmolive Using Introgen`s Molecular Therapies
$20 Million Transaction Will Target Treatment and Prevention of Oral Cancer and Oral Premalignancies
AUSTIN, Texas, Nov. 4 /PRNewswire-FirstCall/ -- Introgen Therapeutics, Inc. (Nasdaq: INGN) today announced an alliance with Colgate-Palmolive Company (NYSE: CL) to develop and potentially market oral health care products. The terms of the alliance call for the development of specialized formulations of Introgen`s molecular therapies targeted at pre-cancerous conditions of the oral cavity and oral cancer. Colgate-Palmolive has today purchased $20 million of Introgen shares
 and has priority rights regarding products that may be developed by the alliance.
and has priority rights regarding products that may be developed by the alliance.
Research and development activities in the alliance will be conducted by Introgen and will focus on oral formulations of Introgen`s molecular therapeutics employing tumor suppressors such as p53, mda-7, and FUS1. Introgen academic collaborators are conducting a phase 1/2 clinical study using INGN 234, a mouthwash formulation delivering the p53 tumor suppressor for oral cancer prevention in patients diagnosed with leukoplakia, a pre-cancerous condition that can lead to oral cancer. Leukoplakia is usually diagnosed by dentists and, according to the journal Practical Periodontics and Aesthetic Dentistry, occurs in approximately 3 percent of the adult population.
of the adult population.
"We are enthusiastic about the opportunity to apply Introgen`s molecular agents to develop oral care products with Colgate-Palmolive," stated David G. Nance, Chief Executive Officer of Introgen. "We believe future commercial applications of therapeutic genes will include topical formulations such as those developed for oral use under the alliance with Colgate. The tissues lining the oral cavity may be particularly well suited and accessible targets for molecular therapies that can arrest abnormal cell growth without harming normal cells. We believe that repair of damaged cells and safe elimination of malignant or pre-malignant cells from the mouth could represent important therapies for dentists, oral health professionals and oncology specialists to prevent and treat oral diseases. We expect to investigate new formulations of oral rinses, gels or other topically applied products under the Colgate alliance."
 Excluded from the alliance with Colgate are Introgen`s current portfolio of cancer product candidates, i.e. ADVEXIN, INGN 241, INGN 225, and INGN 401.
Excluded from the alliance with Colgate are Introgen`s current portfolio of cancer product candidates, i.e. ADVEXIN, INGN 241, INGN 225, and INGN 401.
......
Gruß
Knolle
bestimmt noch jemand da?....
das nenn ich wirklich mal ne gute Nachricht:
von der Homepage
Introgen Therapeutics, Inc. (ticker: ingn, exchange: NASDAQ Stock Exchange (.O)) News Release - 11/4/05
--------------------------------------------------------------------------------
Introgen Therapeutics, Inc. Announces Oral Health Alliance With Colgate-Palmolive Using Introgen`s Molecular Therapies
$20 Million Transaction Will Target Treatment and Prevention of Oral Cancer and Oral Premalignancies
AUSTIN, Texas, Nov. 4 /PRNewswire-FirstCall/ -- Introgen Therapeutics, Inc. (Nasdaq: INGN) today announced an alliance with Colgate-Palmolive Company (NYSE: CL) to develop and potentially market oral health care products. The terms of the alliance call for the development of specialized formulations of Introgen`s molecular therapies targeted at pre-cancerous conditions of the oral cavity and oral cancer. Colgate-Palmolive has today purchased $20 million of Introgen shares

 and has priority rights regarding products that may be developed by the alliance.
and has priority rights regarding products that may be developed by the alliance.Research and development activities in the alliance will be conducted by Introgen and will focus on oral formulations of Introgen`s molecular therapeutics employing tumor suppressors such as p53, mda-7, and FUS1. Introgen academic collaborators are conducting a phase 1/2 clinical study using INGN 234, a mouthwash formulation delivering the p53 tumor suppressor for oral cancer prevention in patients diagnosed with leukoplakia, a pre-cancerous condition that can lead to oral cancer. Leukoplakia is usually diagnosed by dentists and, according to the journal Practical Periodontics and Aesthetic Dentistry, occurs in approximately 3 percent
 of the adult population.
of the adult population."We are enthusiastic about the opportunity to apply Introgen`s molecular agents to develop oral care products with Colgate-Palmolive," stated David G. Nance, Chief Executive Officer of Introgen. "We believe future commercial applications of therapeutic genes will include topical formulations such as those developed for oral use under the alliance with Colgate. The tissues lining the oral cavity may be particularly well suited and accessible targets for molecular therapies that can arrest abnormal cell growth without harming normal cells. We believe that repair of damaged cells and safe elimination of malignant or pre-malignant cells from the mouth could represent important therapies for dentists, oral health professionals and oncology specialists to prevent and treat oral diseases. We expect to investigate new formulations of oral rinses, gels or other topically applied products under the Colgate alliance."
 Excluded from the alliance with Colgate are Introgen`s current portfolio of cancer product candidates, i.e. ADVEXIN, INGN 241, INGN 225, and INGN 401.
Excluded from the alliance with Colgate are Introgen`s current portfolio of cancer product candidates, i.e. ADVEXIN, INGN 241, INGN 225, and INGN 401.
......
Gruß
Knolle

http://www.quote.com/qc/stocks/charts.aspx?symbols=NASDAQ:IN…
und auf weitere sonnige tage
mal schaun wie weit es diesmal geht
16 September 2005 Aventis Inc Sell 10,392* 5.52 to 5.52 $57,364
13 September 2005 Aventis Inc Sell 28,272* 5.75 to 5.75 $162,564
12 September 2005 Aventis Inc Sell 33,200* 5.81 to 5.81 $192,892
8 September 2005 Aventis Inc Sell 25,000* 5.75 to 5.75 $143,750
7 September 2005 Aventis Inc Sell 40,253* 5.82 to 5.82 $234,272
6 September 2005 Aventis Inc Sell 165,260* 5.97 to 5.97 $986,602
2 September 2005 Aventis Inc Sell 59,671* 5.9 to 6.01 $353,055

die werden sich auf jeden Fall in den Arsch beißen in den virtuellen
Gruß
Knolle
Merkwürdigerweise verkauft AVENTIS schon seit geraumer Zeit - auch die letzten Tage. Warum nur? Die haben natürlich auch noch mega-viel INGN-Shares. Dass sie sich in den A**** beißen, glaub ich irgendwie nicht...
Der Newsflow hat ja wieder zugenommen. So ist die Colgate-Kooperation ja sehr gut aufgenommen worden.
Jetzt müsste nur die Rakete ADVEXIN noch zünden. Denke, dass es im Januar 2006 soweit sein wird. Ist nur so ein Gefühl...
Dann wird INGN - so denke ich - nicht mehr zu halten sein!
Gruß, Stammzelle.

Der Newsflow hat ja wieder zugenommen. So ist die Colgate-Kooperation ja sehr gut aufgenommen worden.
Jetzt müsste nur die Rakete ADVEXIN noch zünden. Denke, dass es im Januar 2006 soweit sein wird. Ist nur so ein Gefühl...
Dann wird INGN - so denke ich - nicht mehr zu halten sein!

Gruß, Stammzelle.
Hi Introgener,
wollte Mal ein kleines Update reinstellen. Denke, dass 2006 die Entscheidung fallen wird...
PR Newswire
Introgen aktualisiert Zulassungsleitlinien für ADVEXIN-Therapie bei Kopf- und Halskrebs
AUSTIN, Texas, December 23 /PRNewswire/ --
- Zwischenanalyse der Daten aus klinischer Phase-3-Studie wird beschleunigt -
Introgen Therapeutics, Inc. (Nasdaq: INGN) gab heute bekannt, dass es bei der US-amerikanischen Lebensmittel- und Arzneimittelbehörde (Food and Drug Administration - FDA) um einen vorzeitigen Beginn der Zwischenanalyse der
Daten aus seiner randomisierten, kontrollierten klinischen Phase-3-Studie zu ADVEXIN angesucht hat. Introgen plant den Beginn der Sicherheitsanalyse seiner randomisierten, kontrollierten klinischen Phase-3-Studie zur Evaluierung
der ADVEXIN-Monotherapie für die Kontrolle von rezidivierendem Plattenepithelkarzinom des Kopfes und Halses (SCCHN - Squamous Cell Carcinoma of the Head and Neck). Die Analyse der Daten aus der Phase-3-Studie beginnt vor Eintreten der im Protokoll festgelegten Anzahl der Überlebensfälle.
Im Rahmen des laufenden Dialoges mit der FDA beabsichtigt das Unternehmen auch die Einreichung zusätzlicher Informationen hinsichtlich der Eigenschaften von Patienten, die mit grösster Wahrscheinlichkeit von einer
ADVEXIN-Therapie auf Basis des bekannten molekularen Wirkungsmechanismus des Arzneimittels profitieren, sowie weitere Analysen der Daten aus der klinischen Phase-2-Studie zum Einsatz von ADVEXIN bei Kopf- und Halskrebs.
Eine Korrelierung des Wirkstoffmechanismus mit der Krankheit und den Patienteneigenschaften ermöglicht die Auswahl geeigneter Endpunkte für die klinische Studie und bestimmt Zielpatientenpopulationen, die mit grösster
Wahrscheinlichkeit von der Behandlung profitieren.
Dr. Max Talbott, Senior Vice President für weltweite Vermarktung bei Introgen, dazu: "Die FDA brachte den Vorschlag, dass Introgen eine vorläufige
Wirksamkeitsanalyse der Daten aus der klinischen Phase-3-Studie zu Kopf- und Halskrebs in Erwägung ziehen solle. Wir entwickeln derzeit einen Plan für diese Analysen, der mit den FDA-Initiativen zur Beschleunigung von Arzneimittelzulassungen auf Basis der Bestimmung von
Zielpatientenpopulationen, die mit grösster Wahrscheinlichkeit von der Therapie profitieren, in Einklang steht. Wir haben wichtige Daten zum molekularen Wirkungsmechanismus von ADVEXIN, den Prognosefaktoren und
Krankheitseigenschaften zur Bestimmung der Patienten, die mit grösster Wahrscheinlichkeit von einer ADVEXIN-Behandlung profitieren, gesammelt. Wir planen eine Einreichung dieser Informationen sowie der Phase-3-Zwischenanalyse bei der FDA, um die Zulassungsanträge für ADVEXIN zu beschleunigen."
Die Informationen zur Korrelierung eines Wirkstoffmechanismus mit den Krankheitseigenschaften der Patienten entsprechen den Vorgaben für eine selektive Zulassung und der Critical-Path-Initiative der FDA zur
Beschleunigung von Arzneimittelgenehmigungen mittels Bestimmung der Zielpatientenpopulationen, die mit grösster Wahrscheinlichkeit von der Therapie profitieren. Das Protokoll der Phase-3-Studie verlangt ein unabhängiges Data Safety Monitoring Board (DSMB) zur Analyse der vorläufigen Zwischendaten sowie anschliessender Übermittlung der Ergebnisse an Introgen und die FDA.
Dr. Robert E. Sobol, Senior Vice President von Introgen für die Bereiche Medizin und Wissenschaft, dazu: "Wir haben uns angemessen für die Anzahl der vorgegebenen einzutretenden Überlebensfälle registriert. Wir sind der
Meinung, dass die Zwischenanalyse zur Beschleunigung der Zulassungsanträge für ADVEXIN sachgerecht ist. Es ist an der Zeit, der FDA Zwischendaten aus unseren Phase-3-Studien zur Ergänzung der bereits eingereichten Daten aus
der Phase-2-Studie zu übermitteln, welche die Sicherheit und selektive Antikrebswirkung von ADVEXIN belegen. Introgen treibt die Entwicklung selektiver molekularer Wirkstoff weiter voran. Diese Wirkstoffe sind
imstande, Krebs ohne die schweren Nebenwirkungen, die mit herkömmlichen Krebsbehandlungen einhergehen, zu kontrollieren."
Über ADVEXIN
Derzeit sind zwei multinationale, multizentrische Phase-3-Studien zur ADVEXIN-Therapie bei rezidivierendem Plattenepithelkarzinom des Kopfes und Halses im Laufen. Introgen wurde von der US-amerikanischen Lebensmittel- und
Arzneimittelbehörde (FDA) der "Fast-Track"-Status für die ADVEXIN-Therapie zugesprochen. Zudem erhielt ADVEXIN gemäss dem Orphan Drug Act den "Orphan Drug"-Status (Arzneimittel zur Behandlung sehr seltener Krankheiten) für die Behandlung von Kopf- und Halskrebs. Im Dezember 2004 startete Introgen das Zulassungsverfahren für ADVEXIN mit der Einreichung einer Anfrage für einen Lizenzantrag für ein biologisches Präparat bei der US-amerikanischen
Lebensmittel- und Arzneimittelbehörde.
ADVEXIN wurde für eine Reihe von Krebserkrankungen sowie in Kombination mit verschiedenen Standard-Krebstherapien wie Strahlen- oder Chemotherapie evaluiert. Daten aus mehreren veröffentlichten vorklinischen und klinischen
Studien belegen das Potenzial von ADVEXIN, die Antikrebswirkung von Strahlen- und Chemotherapie auf sichere Weise zu verstärken.
ADVEXIN versorgt Krebsgewebe mit dem p53-Protein in sehr hohen Konzentrationen und tötet Krebszellen selektiv ab. p53, als "Genomwächter" bezeichnet, ist ein normaler Zellbestandteil und als Tumorsuppressor bekannt, da es das Wachstum von Tumorzellen hemmt. Eine der Hauptfunktionen dieses Proteins ist die Eliminierung von Krebszellen, indem es erkennt, wann die Zelle durch Mutation beschädigt wird und hierauf das Zellwachstum stoppt, um die Zellreparatur einzuleiten. Ist die Zelle so stark beschädigt, dass sie nicht mehr repariert werden kann, so löst p53 den Zelltod aus, um ein unkontrolliertes Wachstum der Zelle zu verhindern.
Abwarten und Tee trinken...
Gruß, Stammzelle
wollte Mal ein kleines Update reinstellen. Denke, dass 2006 die Entscheidung fallen wird...
PR Newswire
Introgen aktualisiert Zulassungsleitlinien für ADVEXIN-Therapie bei Kopf- und Halskrebs
AUSTIN, Texas, December 23 /PRNewswire/ --
- Zwischenanalyse der Daten aus klinischer Phase-3-Studie wird beschleunigt -
Introgen Therapeutics, Inc. (Nasdaq: INGN) gab heute bekannt, dass es bei der US-amerikanischen Lebensmittel- und Arzneimittelbehörde (Food and Drug Administration - FDA) um einen vorzeitigen Beginn der Zwischenanalyse der
Daten aus seiner randomisierten, kontrollierten klinischen Phase-3-Studie zu ADVEXIN angesucht hat. Introgen plant den Beginn der Sicherheitsanalyse seiner randomisierten, kontrollierten klinischen Phase-3-Studie zur Evaluierung
der ADVEXIN-Monotherapie für die Kontrolle von rezidivierendem Plattenepithelkarzinom des Kopfes und Halses (SCCHN - Squamous Cell Carcinoma of the Head and Neck). Die Analyse der Daten aus der Phase-3-Studie beginnt vor Eintreten der im Protokoll festgelegten Anzahl der Überlebensfälle.
Im Rahmen des laufenden Dialoges mit der FDA beabsichtigt das Unternehmen auch die Einreichung zusätzlicher Informationen hinsichtlich der Eigenschaften von Patienten, die mit grösster Wahrscheinlichkeit von einer
ADVEXIN-Therapie auf Basis des bekannten molekularen Wirkungsmechanismus des Arzneimittels profitieren, sowie weitere Analysen der Daten aus der klinischen Phase-2-Studie zum Einsatz von ADVEXIN bei Kopf- und Halskrebs.
Eine Korrelierung des Wirkstoffmechanismus mit der Krankheit und den Patienteneigenschaften ermöglicht die Auswahl geeigneter Endpunkte für die klinische Studie und bestimmt Zielpatientenpopulationen, die mit grösster
Wahrscheinlichkeit von der Behandlung profitieren.
Dr. Max Talbott, Senior Vice President für weltweite Vermarktung bei Introgen, dazu: "Die FDA brachte den Vorschlag, dass Introgen eine vorläufige
Wirksamkeitsanalyse der Daten aus der klinischen Phase-3-Studie zu Kopf- und Halskrebs in Erwägung ziehen solle. Wir entwickeln derzeit einen Plan für diese Analysen, der mit den FDA-Initiativen zur Beschleunigung von Arzneimittelzulassungen auf Basis der Bestimmung von
Zielpatientenpopulationen, die mit grösster Wahrscheinlichkeit von der Therapie profitieren, in Einklang steht. Wir haben wichtige Daten zum molekularen Wirkungsmechanismus von ADVEXIN, den Prognosefaktoren und
Krankheitseigenschaften zur Bestimmung der Patienten, die mit grösster Wahrscheinlichkeit von einer ADVEXIN-Behandlung profitieren, gesammelt. Wir planen eine Einreichung dieser Informationen sowie der Phase-3-Zwischenanalyse bei der FDA, um die Zulassungsanträge für ADVEXIN zu beschleunigen."
Die Informationen zur Korrelierung eines Wirkstoffmechanismus mit den Krankheitseigenschaften der Patienten entsprechen den Vorgaben für eine selektive Zulassung und der Critical-Path-Initiative der FDA zur
Beschleunigung von Arzneimittelgenehmigungen mittels Bestimmung der Zielpatientenpopulationen, die mit grösster Wahrscheinlichkeit von der Therapie profitieren. Das Protokoll der Phase-3-Studie verlangt ein unabhängiges Data Safety Monitoring Board (DSMB) zur Analyse der vorläufigen Zwischendaten sowie anschliessender Übermittlung der Ergebnisse an Introgen und die FDA.
Dr. Robert E. Sobol, Senior Vice President von Introgen für die Bereiche Medizin und Wissenschaft, dazu: "Wir haben uns angemessen für die Anzahl der vorgegebenen einzutretenden Überlebensfälle registriert. Wir sind der
Meinung, dass die Zwischenanalyse zur Beschleunigung der Zulassungsanträge für ADVEXIN sachgerecht ist. Es ist an der Zeit, der FDA Zwischendaten aus unseren Phase-3-Studien zur Ergänzung der bereits eingereichten Daten aus
der Phase-2-Studie zu übermitteln, welche die Sicherheit und selektive Antikrebswirkung von ADVEXIN belegen. Introgen treibt die Entwicklung selektiver molekularer Wirkstoff weiter voran. Diese Wirkstoffe sind
imstande, Krebs ohne die schweren Nebenwirkungen, die mit herkömmlichen Krebsbehandlungen einhergehen, zu kontrollieren."
Über ADVEXIN
Derzeit sind zwei multinationale, multizentrische Phase-3-Studien zur ADVEXIN-Therapie bei rezidivierendem Plattenepithelkarzinom des Kopfes und Halses im Laufen. Introgen wurde von der US-amerikanischen Lebensmittel- und
Arzneimittelbehörde (FDA) der "Fast-Track"-Status für die ADVEXIN-Therapie zugesprochen. Zudem erhielt ADVEXIN gemäss dem Orphan Drug Act den "Orphan Drug"-Status (Arzneimittel zur Behandlung sehr seltener Krankheiten) für die Behandlung von Kopf- und Halskrebs. Im Dezember 2004 startete Introgen das Zulassungsverfahren für ADVEXIN mit der Einreichung einer Anfrage für einen Lizenzantrag für ein biologisches Präparat bei der US-amerikanischen
Lebensmittel- und Arzneimittelbehörde.
ADVEXIN wurde für eine Reihe von Krebserkrankungen sowie in Kombination mit verschiedenen Standard-Krebstherapien wie Strahlen- oder Chemotherapie evaluiert. Daten aus mehreren veröffentlichten vorklinischen und klinischen
Studien belegen das Potenzial von ADVEXIN, die Antikrebswirkung von Strahlen- und Chemotherapie auf sichere Weise zu verstärken.
ADVEXIN versorgt Krebsgewebe mit dem p53-Protein in sehr hohen Konzentrationen und tötet Krebszellen selektiv ab. p53, als "Genomwächter" bezeichnet, ist ein normaler Zellbestandteil und als Tumorsuppressor bekannt, da es das Wachstum von Tumorzellen hemmt. Eine der Hauptfunktionen dieses Proteins ist die Eliminierung von Krebszellen, indem es erkennt, wann die Zelle durch Mutation beschädigt wird und hierauf das Zellwachstum stoppt, um die Zellreparatur einzuleiten. Ist die Zelle so stark beschädigt, dass sie nicht mehr repariert werden kann, so löst p53 den Zelltod aus, um ein unkontrolliertes Wachstum der Zelle zu verhindern.
Abwarten und Tee trinken...
Gruß, Stammzelle
Hi, ist wirklich langweilig geblieben hier im Thread...
Hoffe, das ändert sich noch im Jahr 2006, wenn Advexin endlich DER Kurstreiber wird. Auch vom Unternehmen selbst kommt ja nix.
Da habe ich nochmal die von KNOLLE eingestellte News in Deutsch rausgesucht und sie hier für unsere nicht englisch-sprechenden Freunde - verstehe das selbst meistens auch nicht alles - eingestellt...
Introgen Therapeutics, Inc. geht Bündnis mit Colgate-Palmolive für Mundgesundheitspflege durch Nutzung von Introgens Molekulartherapien ein
AUSTIN, Texas, November 4 /PRNewswire/ --
- Transaktion in Höhe von 20 Millionen USD zur Behandlung und Prävention von Mundkrebs und oralen Prämalignitäten
Introgen Therapeutics, Inc. (Nasdaq: INGN) gab heute ein Bündnis mit der Colgate-Palmolive Company (NYSE: CL) für die Entwicklung und potenzielle Vermarktung von Mundgesundheitspflegeprodukten bekannt. Die Bedingungen des Bündnisses verlangen die Entwicklung spezieller Formeln der Molekulartherapien von Introgen gegen vor dem Krebs auftretende Erkrankungen der Mundhöhle und gegen Mundkrebs. Colgate-Palmolive erwarb heute Introgen-Aktien in Höhe von 20 Millionen USD und hat Vorzugsrechte für Produkte, die im Rahmen des Bündnisses entwickelt werden.
Die Forschungs- und Entwicklungsarbeiten des Bündnisses werden von Introgen geleitet und konzentrieren sich auf orale Formeln der Molekulartherapien von Introgen mit Hilfe von Tumorsuppressoren wie p53, mda-7 und FUS1. Von den wissenschaftlichen Mitarbeitern Introgens wird eine Studie der Phase 1/2 unter Verwendung der Mundspülungsformel INGN 234 durchgeführt, durch die der Tumorsuppressor p53 für orale Krebsprävention Patienten mit Leukoplakie (vor dem Krebs auftretende Erkrankung, die zu Mundkrebs führen kann) verabreicht wird. Leukoplakie wird normalerweise von Zahnärzten diagnostiziert und tritt laut der Fachzeitschrift Practical Periodontics and Aesthetic Dentistry bei etwa 3 % der Erwachsenenbevölkerung auf.
"Wir freuen uns sehr über die Anwendungsmöglichkeit für die Molekularwirkstoffe von Introgen zur Entwicklung von Mundpflegeprodukten mit Colgate-Palmolive," berichtete David G. Nance, Chief Executive Officer von Introgen. "Wir glauben, dass zukünftige kommerzielle Anwendungen therapeutischer Gene topische Formeln wie die für die orale Verwendung zusammen mit Colgate entwickelten Formeln mit einschliessen werden. Der Gewebebelag der Mundhöhle kann besonders gut geeignetes und zugängliches Ziel für Molekulartherapien sein, die anormales Zellwachstum ohne Schädigung normaler Zellen stoppen können. Wir sind der Ansicht, dass die Reparatur geschädigter Zellen und die sichere Eliminierung prämalignanter Zellen aus dem Mund wichtige Therapien für Zahnärzte, Mundgesundheitsexperten und Onkologiespezialisten zur Prävention und Behandlung oraler Erkrankungen sein können. Wir erwarten eine Untersuchung neuer Formeln von Mundspülungen, -gelen oder anderen örtlich angewendeten Produkten im Rahmen des Bündnisses mit Colgate."
Von dem Bündnis mit Colgate ausgeschlossen ist das aktuelle Portfolio an Krebsproduktkandidaten von Introgen, also ADVEXIN, INGN 241, INGN 225 und INGN 401.
Introgen Therapeutics, Inc. ist ein biopharmazeutisches Unternehmen mit Spezialisierung in der Erforschung, Entwicklung und Kommerzialisierung zielgerichteter Molekulartherapien zur Behandlung von Krebs und anderen Erkrankungen. Introgen entwickelt Molekulartherapien, Immuntherapien, Impfseren und Nanoteilchen-Tumorsuppressortherapien zur Behandlung eines breiten Spektrums an Krebserkrankungen und hyperproliferativer Störungen mit Hilfe von Tumorsuppressoren, Zytokinen, Proteinen und Genen. Introgen unterhält eigene Abteilungen für Forschung, Entwicklung, Fertigung sowie für klinische und regulatorische Aufgaben. Darüber hinaus betreibt das Unternehmen mehrere Fertigungsanlagen, darunter eine kommerziell ausgelegte cGMP-Fertigungsanlage. Weitere Information zu Introgen Therapeutics und ein Menü für das Archiv mit den Pressemitteilungen finden Sie auf der Website von Introgen unter: http://www.introgen.com
Bestimmte Aussagen in dieser Pressemitteilung, die sich nicht eindeutig auf vergangene Ereignisse beziehen, können auch Aussagen "vorausschauender" Natur sein, darunter etwa die Aussagen über den Erfolg des klinischen Entwicklungsprogramms von Introgen zur Behandlung von Krebs oder anderen Erkrankungen und die Entwicklung der Molekulartherapien gegen Mundkrebs und vor dem Krebs auftretende Erkrankungen der Mundhöhle durch Introgen Therapeutics, Inc. im Zusammenhang mit dem Bündnis mit Colgate-Palmolive. Die tatsächlichen Ergebnisse können sich von den in dieser Pressemitteilung beschriebenen Ergebnissen unterscheiden. Ausschlag gebend hierfür können Risiken und Unwägbarkeiten im Rahmen der Tätigkeiten und Geschäftsumgebung von Introgen sein; zu denken ist dabei unter anderem an das Stadium der Produktentwicklung bei Introgen und die begrenzte Erfahrung in der Entwicklung von gentechnisch erzeugten Arzneimitteln im Allgemeinen, seine Abhängigkeit von proprietärer Technologie und der gegenwärtigen Wettbewerbslage, an den Verlauf der operativen Verluste und aufgelaufenen Defizite, die Einbindung von Introgen in Kooperationsbeziehungen sowie Unwägbarkeiten in Verbindung mit klinischen Untersuchungen, Sicherheit und Wirksamkeit der Produktkandidaten von Introgen, dem Erhalt der entsprechenden regulatorischen Genehmigungen, Introgens Patentschutz und der Akzeptanz auf dem Markt, aber auch an andere Risiken, die von Zeit zu Zeit im Rahmen des Informationsaustausches zwischen Introgen und der Securities and Exchange Commission in den Dokumenten auf Formular 10-K und auf Formular 10-Q eingereichten Quartalsberichts. Introgen verpflichtet sich in keiner Weise zur öffentlichen Bekanntgabe von Ergebnissen aus der Überarbeitung eventuell gemachter, vorausschauender Aussagen zu Ereignissen oder Umständen, die sich nach dem Datum dieser Mitteilung ergeben können.
Klingt alles in allem doch sehr gut! Schaun wir Mal.
Mein Tipp zum INGN-Kurs am 31.12.2006: 15,77 EUR. Was meint ihr, falls ihr nicht gerade im Winterschlaf seid?
Stammzelle
Hoffe, das ändert sich noch im Jahr 2006, wenn Advexin endlich DER Kurstreiber wird. Auch vom Unternehmen selbst kommt ja nix.
Da habe ich nochmal die von KNOLLE eingestellte News in Deutsch rausgesucht und sie hier für unsere nicht englisch-sprechenden Freunde - verstehe das selbst meistens auch nicht alles - eingestellt...
Introgen Therapeutics, Inc. geht Bündnis mit Colgate-Palmolive für Mundgesundheitspflege durch Nutzung von Introgens Molekulartherapien ein
AUSTIN, Texas, November 4 /PRNewswire/ --
- Transaktion in Höhe von 20 Millionen USD zur Behandlung und Prävention von Mundkrebs und oralen Prämalignitäten
Introgen Therapeutics, Inc. (Nasdaq: INGN) gab heute ein Bündnis mit der Colgate-Palmolive Company (NYSE: CL) für die Entwicklung und potenzielle Vermarktung von Mundgesundheitspflegeprodukten bekannt. Die Bedingungen des Bündnisses verlangen die Entwicklung spezieller Formeln der Molekulartherapien von Introgen gegen vor dem Krebs auftretende Erkrankungen der Mundhöhle und gegen Mundkrebs. Colgate-Palmolive erwarb heute Introgen-Aktien in Höhe von 20 Millionen USD und hat Vorzugsrechte für Produkte, die im Rahmen des Bündnisses entwickelt werden.
Die Forschungs- und Entwicklungsarbeiten des Bündnisses werden von Introgen geleitet und konzentrieren sich auf orale Formeln der Molekulartherapien von Introgen mit Hilfe von Tumorsuppressoren wie p53, mda-7 und FUS1. Von den wissenschaftlichen Mitarbeitern Introgens wird eine Studie der Phase 1/2 unter Verwendung der Mundspülungsformel INGN 234 durchgeführt, durch die der Tumorsuppressor p53 für orale Krebsprävention Patienten mit Leukoplakie (vor dem Krebs auftretende Erkrankung, die zu Mundkrebs führen kann) verabreicht wird. Leukoplakie wird normalerweise von Zahnärzten diagnostiziert und tritt laut der Fachzeitschrift Practical Periodontics and Aesthetic Dentistry bei etwa 3 % der Erwachsenenbevölkerung auf.
"Wir freuen uns sehr über die Anwendungsmöglichkeit für die Molekularwirkstoffe von Introgen zur Entwicklung von Mundpflegeprodukten mit Colgate-Palmolive," berichtete David G. Nance, Chief Executive Officer von Introgen. "Wir glauben, dass zukünftige kommerzielle Anwendungen therapeutischer Gene topische Formeln wie die für die orale Verwendung zusammen mit Colgate entwickelten Formeln mit einschliessen werden. Der Gewebebelag der Mundhöhle kann besonders gut geeignetes und zugängliches Ziel für Molekulartherapien sein, die anormales Zellwachstum ohne Schädigung normaler Zellen stoppen können. Wir sind der Ansicht, dass die Reparatur geschädigter Zellen und die sichere Eliminierung prämalignanter Zellen aus dem Mund wichtige Therapien für Zahnärzte, Mundgesundheitsexperten und Onkologiespezialisten zur Prävention und Behandlung oraler Erkrankungen sein können. Wir erwarten eine Untersuchung neuer Formeln von Mundspülungen, -gelen oder anderen örtlich angewendeten Produkten im Rahmen des Bündnisses mit Colgate."
Von dem Bündnis mit Colgate ausgeschlossen ist das aktuelle Portfolio an Krebsproduktkandidaten von Introgen, also ADVEXIN, INGN 241, INGN 225 und INGN 401.
Introgen Therapeutics, Inc. ist ein biopharmazeutisches Unternehmen mit Spezialisierung in der Erforschung, Entwicklung und Kommerzialisierung zielgerichteter Molekulartherapien zur Behandlung von Krebs und anderen Erkrankungen. Introgen entwickelt Molekulartherapien, Immuntherapien, Impfseren und Nanoteilchen-Tumorsuppressortherapien zur Behandlung eines breiten Spektrums an Krebserkrankungen und hyperproliferativer Störungen mit Hilfe von Tumorsuppressoren, Zytokinen, Proteinen und Genen. Introgen unterhält eigene Abteilungen für Forschung, Entwicklung, Fertigung sowie für klinische und regulatorische Aufgaben. Darüber hinaus betreibt das Unternehmen mehrere Fertigungsanlagen, darunter eine kommerziell ausgelegte cGMP-Fertigungsanlage. Weitere Information zu Introgen Therapeutics und ein Menü für das Archiv mit den Pressemitteilungen finden Sie auf der Website von Introgen unter: http://www.introgen.com
Bestimmte Aussagen in dieser Pressemitteilung, die sich nicht eindeutig auf vergangene Ereignisse beziehen, können auch Aussagen "vorausschauender" Natur sein, darunter etwa die Aussagen über den Erfolg des klinischen Entwicklungsprogramms von Introgen zur Behandlung von Krebs oder anderen Erkrankungen und die Entwicklung der Molekulartherapien gegen Mundkrebs und vor dem Krebs auftretende Erkrankungen der Mundhöhle durch Introgen Therapeutics, Inc. im Zusammenhang mit dem Bündnis mit Colgate-Palmolive. Die tatsächlichen Ergebnisse können sich von den in dieser Pressemitteilung beschriebenen Ergebnissen unterscheiden. Ausschlag gebend hierfür können Risiken und Unwägbarkeiten im Rahmen der Tätigkeiten und Geschäftsumgebung von Introgen sein; zu denken ist dabei unter anderem an das Stadium der Produktentwicklung bei Introgen und die begrenzte Erfahrung in der Entwicklung von gentechnisch erzeugten Arzneimitteln im Allgemeinen, seine Abhängigkeit von proprietärer Technologie und der gegenwärtigen Wettbewerbslage, an den Verlauf der operativen Verluste und aufgelaufenen Defizite, die Einbindung von Introgen in Kooperationsbeziehungen sowie Unwägbarkeiten in Verbindung mit klinischen Untersuchungen, Sicherheit und Wirksamkeit der Produktkandidaten von Introgen, dem Erhalt der entsprechenden regulatorischen Genehmigungen, Introgens Patentschutz und der Akzeptanz auf dem Markt, aber auch an andere Risiken, die von Zeit zu Zeit im Rahmen des Informationsaustausches zwischen Introgen und der Securities and Exchange Commission in den Dokumenten auf Formular 10-K und auf Formular 10-Q eingereichten Quartalsberichts. Introgen verpflichtet sich in keiner Weise zur öffentlichen Bekanntgabe von Ergebnissen aus der Überarbeitung eventuell gemachter, vorausschauender Aussagen zu Ereignissen oder Umständen, die sich nach dem Datum dieser Mitteilung ergeben können.
Klingt alles in allem doch sehr gut! Schaun wir Mal.
Mein Tipp zum INGN-Kurs am 31.12.2006: 15,77 EUR. Was meint ihr, falls ihr nicht gerade im Winterschlaf seid?
Stammzelle
[posting]19.980.829 von Stammzelle am 31.01.06 20:08:47[/posting]Hi,
ich beobachte INGN sehr genau und warte auf ein Kaufsignal auf charttechnischer Basis.
therman
ich beobachte INGN sehr genau und warte auf ein Kaufsignal auf charttechnischer Basis.
therman
Jemand ne Ahnung, wieso INGN nicht richtig anzieht bei der Meldung? Der Ausbruch ist ja direkt wieder in sich zusammen gefallen!


[posting]20.313.367 von erbla am 21.02.06 19:45:38[/posting]Es sind sehr viele Shorties am Werk,
die den Kurs niedrig halten wollen.
Ein shortsqueeze ist nur eine Frage der Zeit.
Bin heute bei 5,80$ eingestiegen.
therman
die den Kurs niedrig halten wollen.
Ein shortsqueeze ist nur eine Frage der Zeit.
Bin heute bei 5,80$ eingestiegen.
therman
Naja, hab sie mit leichtem Verlust wieder liquidiert.
Introgen stellt Lungenkrebs Studie vor
Introgen Therapeutics hat heute die Ergebnisse einer Lungenkrebsstudie der klinischen Phase I/II bekannt gegeben. Demnach habe die Immunisierungstherapie mit dem Wirkstoff INGN 225 bei 62 Prozent der Patienten mit fortgeschrittenem Lungenkrebs objektiv angeschlagen. Bei einer zweiten Stufe der klassischen Chemotherapie liege diese Rate nur zwischen 5 und 25 Prozent. Auch die Kombination von INGN 225 mit Chemotherapie habe bessere Resultate erbracht, als erwartet worden war.
Introgen Therapeutics hat heute die Ergebnisse einer Lungenkrebsstudie der klinischen Phase I/II bekannt gegeben. Demnach habe die Immunisierungstherapie mit dem Wirkstoff INGN 225 bei 62 Prozent der Patienten mit fortgeschrittenem Lungenkrebs objektiv angeschlagen. Bei einer zweiten Stufe der klassischen Chemotherapie liege diese Rate nur zwischen 5 und 25 Prozent. Auch die Kombination von INGN 225 mit Chemotherapie habe bessere Resultate erbracht, als erwartet worden war.
Hi "Introgener",
habe die letzte News Mal durch den Altavista-Wolf geschoben...
Bleibt trotzdem noch Info genug übrig. Denke, dass weiterhin alles planmäßig in Bezug auf ADVEXIN verläuft.
Die News:
Neue FDA Tätigkeit Validiert ADVEXIN(R) Ausrichtung Strategie; Introgen angeregt von Approval von Erbitux(R) für Kopf-und Ansatz-Krebs
AUSTIN, Texas, März 3 /PRNewswire-FirstCall/ -- Introgen Therapeutik, (Nachrichten) Inc. sagte, daß heute es durch die neue VEREINIGTE STAATEN Nahrungsmittel-und Droge-Leitung (FDA) Tätigkeit angeregt wird, die eine neue Therapie für Patienten genehmigt, die unter Kopf- und Ansatzkrebs leiden. Dieses bestätigt die Zustimmung Annäherung, die von Introgen in seinem ADVEXIN(R) globalen Ausrichtung Programm genommen wird. Es gibt geschätzte 400.000 Patienten weltweit mit Kopf und Ansatzkrebs, der von jeder vorhandenen Behandlung des Verbesserung Überschusses profitieren könnte vorher, nähert sich.
Erbitux(R) (Centuximab) wird durch Bristol-Myers Squibb vermarktet und war für Gebrauch als Monotherapy bei rückläufigen Kopf- und Ansatzkrebspatienten auf der Grundlage von einen Phase 2 Versuch mit 103 Patienten anerkannt, die eine Ansprechgeschwindigkeit von 13 Prozent zeigen. Introgen wird durch diese FDA-Tätigkeit angeregt, weil ADVEXIN(R) gleiche oder verbesserte Tätigkeit Phase 2 in den Versuchen gezeigt hat, die 217 Patienten mit einbeziehen, in denen Ansprechgeschwindigkeiten von 10 Prozent bis 29 Prozent beobachtetes Abhängen nach dem Definieren der geduldigen Eigenschaften waren.
Dr. Max Talbott, Introgens älterer Vizepräsident von der weltweiten kommerziellen Entwicklung, die, "wir angegeben wird, werden durch die Zustimmung der FDA von Erbitux(R) für den rückläufigen Kopf- und Ansatzkrebs angeregt, der nach Phase 2 klinischen Probedaten gegründet wird, die durch Phase 2 ADVEXIN(R)s klinische Resultate in dieser Anzeige zusammengebracht oder überstiegen wird. Diese Zustimmung validiert die Ausrichtung Strategie für ADVEXIN(R), das den Gebrauch von Phase 2 Daten enthält. In den letzten Jahren hat die FDA mehr als Therapien eines Dutzend die neuen Krebses genehmigt, die nach einzelnen Armphase 2 Studien gegründet werden. Unsere Annäherung und klinisches Probedesign für ADVEXIN(R) Ausrichtung werden nicht durch diese Zustimmung geändert. Wir freuen, diese positive Entwicklung zu besprechen und das Zur Verfügung stellen eines Updates auf unserem regelnden Fortschritt während unseres upcoming vierteljährlichen Konferenzanrufs."
Dr. Robert E. Sobol, Introgens älterer Vizepräsident von den klinischen Angelegenheiten, die, "es fortgesetzt werden, ist wichtig, festzustellen, daß Erbitux(R) nicht heilende Therapie im rückläufigen Kopf- und Ansatzkrebs ist und daß ADVEXIN(R) bei neueren Stadium Patienten verwendet werden kann, die frühere Behandlung mit Erbitux(R) oder jeder möglicher anderen Therapie verlassen haben. Zusätzlich hat Introgen über die darstellenden Daten berichtet, synergistische Tätigkeit vom Kombinieren von von Erbitux(R) und von von ADVEXIN(R) und wir glauben, daß Patienten beide Therapien schließlich gegeben werden können ".
Zusätzlich zum Behandeln des rückläufigen Kopf- und Ansatzkrebses als Monotherapy, wurde Erbitux(R) auch im Verbindung mit Strahlung für die Ausgangsbehandlung von am Ort oder vorrückte regional Kopf- und Ansatzkrebs genehmigt, der nicht chirurgisch entfernt werden kann. Diese therapeutische Annäherung von Erbitux(R) im Verbindung mit Strahlung ist für eine andere geduldige Bevölkerung als ADVEXIN(R)s geplante Ausgangsausrichtung für die Behandlung des rückläufigen Kopf- und Ansatzkrebses. ADVEXIN(R) ist Introgens p53 gegründete krebsbekämpfende Therapie, für die Ausrichtung Tätigkeiten unterwegs sind.
Klinische Forscher mit der Erfahrung, die Kopf- und Ansatzkrebspatienten behandelt, berichteten während eines vorhergehenden Konferenzanrufs, der von der Firma gehalten wurde, daß ADVEXIN(R) Phase 2 Sicherheit und Wirksamkeitdaten im rückläufigen Kopf- und Ansatzkrebs oder überstiegenes Erbitux(R) zusammengepaßt haben, wo die zwei verglichen werden können.
Introgen berichtete vorher preclinical über erhöhte therapeutische Effekte der Daten Vertretung kombinierten ADVEXIN(R) und der Erbitux(R) Therapien in einem Tiermodell des menschlichen nicht-kleinen Zelle Lungenkrebses. In den Studien, ergab die Kombination ADVEXIN(R) und Erbitux(R) der Therapie eine 2 bis 6 Falte grössere Verringerung der Tumorgröße, die mit jedem Mittel verglichen wurde, das alleine benutzt wurde.
ADVEXIN(R) ist gut als Monotherapy und im Verbindung mit anderen Krebsbehandlungen in den zahlreichen klinischen Versuchen zugelassen worden. Erbitux(R) Leitung ist mit Nebenwirkungen der Infusion und anderen Komplikationen verbunden ge$$$WESEN, die streng, die die Schwierigkeit, die einschließen, atmet, Hautausschlag, niedriger Blutdruck und Herzangriff sein können, wie vom Förderer berichtet.
ADVEXIN(R) p53 Therapie ist eine gerichtete molekulare Therapie mit ausgedehnter Anwendbarkeit in einer breiten Strecke der Tumorarten und der klinischen Einstellungen, weil sie einen der grundlegendsten und allgemeinsten molekularen Defekte, die anormale Funktion entstör des Tumors p53 zielt, verbunden mit Krebseinführung, Weiterentwicklung und Behandlungwiderstand.
Über Introgen Therapeutik Inc..
Introgen Therapeutics, Inc. ist eine biopharmaceutical Firma, die auf die Entdeckung, die Entwicklung und die Kommerzialisierung der zugelassenen, gerichteten molekularen Therapien des Brunnens für die Behandlung des Krebses und anderer Krankheiten gerichtet wird. Introgen hat fünf klinische Stadium Produktanwärter und eine Anzahl von preclinical Programmen. Introgen wendet seine molekulare Therapeutik, Immunotherapies und Nanopartikel Tumorentstör- Behandlungen an, um eine breite Strecke der Krebse und der VorPre-malignancies zu adressieren. Introgen behält integrierte Forschung, Entwicklung, Herstellung, klinische und regelnde Abteilungen bei und läßt mehrfache Produktionsanlagen einschließlich eine kommerzielle Produktionsanlage der Skala GMP laufen.
Aussagen in dieser Freigabe, die nicht ausschließlich historisch sind, können Aussagen, einschließlich die in bezug auf Introgens zukünftigen Erfolg mit seinem ADVEXIN(R) klinischen Entwicklungsprogramm für Behandlung des Krebses und den Erfolg der Tätigkeiten Ausrichtung Introgens "Vorwärts-schauen", die mit ADVEXIN(R) verbunden sind. Die tatsächlichen Resultate können von denen sich unterscheiden, die in dieser Freigabe wegen der Gefahren und der Ungewißheiten, die, beschrieben werden in den Betrieben Introgens und im betrieblichen Umfeld, einschließlich Stadium Introgens der Produktentwicklung und die begrenzte Erfahrung in der Entwicklung der Gen-gegründeten Drogen im allgemeinen, Abhängigkeit nach eigener Technologie und das gegenwärtige konkurrierende Klima, Geschichte von Betriebsverlusten bestehen und ansammelten Defizit, Vertrauen auf gemeinschaftlichen Verhältnissen und die Ungewißheiten, die auf klinischen Versuchen, der Sicherheit und Wirksamkeit der Produktanwärter Introgens, die Fähigkeit, den passenden Genehmigungen durch die zuständige Aufsichtsbehörde, Patentschutz Introgens und Marktakzept, sowie andere Gefahren einzuholen bezogen werden, die genau geschildert werden von Zeit zu Zeit in den Archivierungen Introgens mit der Sicherheiten und Austausch-Kommission einschließlich sein Archivierungen auf Form 10-K und Form 10-Q. Introgen geht keine Verbindlichkeit ein, die Resultate aller möglicher Neuausgaben zu irgendwelchen Vorwärts-schauenden Aussagen öffentlich freizugeben, die die Fälle oder Umstände reflektieren, die hiervon nach dem Datum entstehen.
Anmerkung Des Herausgebers: Zu mehr Information über Introgen Therapeutik oder für ein Menü der archivierten Pressekommuniquã©s, besichtigen Sie bitte Web site Introgens an: http://www.introgen.com/ .
Kontakt: Introgen Therapeutics, Inc. C. Channing Burke (512) 708 9310 Ext.. email 322: c.burke@introgen.com
Bin optimistisch - STRONG BUY!!!!
Ich glaube nicht, dass die Aktie zu laufen beginnen wird, sobald Bush seine ablehnende Haltung gegenüber Gentherapie aufgeben wird. Halt er ja schon in Bezug auf die alternativen Energien getan.
Gruß, Stammzelle.
habe die letzte News Mal durch den Altavista-Wolf geschoben...
Bleibt trotzdem noch Info genug übrig. Denke, dass weiterhin alles planmäßig in Bezug auf ADVEXIN verläuft.
Die News:
Neue FDA Tätigkeit Validiert ADVEXIN(R) Ausrichtung Strategie; Introgen angeregt von Approval von Erbitux(R) für Kopf-und Ansatz-Krebs
AUSTIN, Texas, März 3 /PRNewswire-FirstCall/ -- Introgen Therapeutik, (Nachrichten) Inc. sagte, daß heute es durch die neue VEREINIGTE STAATEN Nahrungsmittel-und Droge-Leitung (FDA) Tätigkeit angeregt wird, die eine neue Therapie für Patienten genehmigt, die unter Kopf- und Ansatzkrebs leiden. Dieses bestätigt die Zustimmung Annäherung, die von Introgen in seinem ADVEXIN(R) globalen Ausrichtung Programm genommen wird. Es gibt geschätzte 400.000 Patienten weltweit mit Kopf und Ansatzkrebs, der von jeder vorhandenen Behandlung des Verbesserung Überschusses profitieren könnte vorher, nähert sich.
Erbitux(R) (Centuximab) wird durch Bristol-Myers Squibb vermarktet und war für Gebrauch als Monotherapy bei rückläufigen Kopf- und Ansatzkrebspatienten auf der Grundlage von einen Phase 2 Versuch mit 103 Patienten anerkannt, die eine Ansprechgeschwindigkeit von 13 Prozent zeigen. Introgen wird durch diese FDA-Tätigkeit angeregt, weil ADVEXIN(R) gleiche oder verbesserte Tätigkeit Phase 2 in den Versuchen gezeigt hat, die 217 Patienten mit einbeziehen, in denen Ansprechgeschwindigkeiten von 10 Prozent bis 29 Prozent beobachtetes Abhängen nach dem Definieren der geduldigen Eigenschaften waren.
Dr. Max Talbott, Introgens älterer Vizepräsident von der weltweiten kommerziellen Entwicklung, die, "wir angegeben wird, werden durch die Zustimmung der FDA von Erbitux(R) für den rückläufigen Kopf- und Ansatzkrebs angeregt, der nach Phase 2 klinischen Probedaten gegründet wird, die durch Phase 2 ADVEXIN(R)s klinische Resultate in dieser Anzeige zusammengebracht oder überstiegen wird. Diese Zustimmung validiert die Ausrichtung Strategie für ADVEXIN(R), das den Gebrauch von Phase 2 Daten enthält. In den letzten Jahren hat die FDA mehr als Therapien eines Dutzend die neuen Krebses genehmigt, die nach einzelnen Armphase 2 Studien gegründet werden. Unsere Annäherung und klinisches Probedesign für ADVEXIN(R) Ausrichtung werden nicht durch diese Zustimmung geändert. Wir freuen, diese positive Entwicklung zu besprechen und das Zur Verfügung stellen eines Updates auf unserem regelnden Fortschritt während unseres upcoming vierteljährlichen Konferenzanrufs."
Dr. Robert E. Sobol, Introgens älterer Vizepräsident von den klinischen Angelegenheiten, die, "es fortgesetzt werden, ist wichtig, festzustellen, daß Erbitux(R) nicht heilende Therapie im rückläufigen Kopf- und Ansatzkrebs ist und daß ADVEXIN(R) bei neueren Stadium Patienten verwendet werden kann, die frühere Behandlung mit Erbitux(R) oder jeder möglicher anderen Therapie verlassen haben. Zusätzlich hat Introgen über die darstellenden Daten berichtet, synergistische Tätigkeit vom Kombinieren von von Erbitux(R) und von von ADVEXIN(R) und wir glauben, daß Patienten beide Therapien schließlich gegeben werden können ".
Zusätzlich zum Behandeln des rückläufigen Kopf- und Ansatzkrebses als Monotherapy, wurde Erbitux(R) auch im Verbindung mit Strahlung für die Ausgangsbehandlung von am Ort oder vorrückte regional Kopf- und Ansatzkrebs genehmigt, der nicht chirurgisch entfernt werden kann. Diese therapeutische Annäherung von Erbitux(R) im Verbindung mit Strahlung ist für eine andere geduldige Bevölkerung als ADVEXIN(R)s geplante Ausgangsausrichtung für die Behandlung des rückläufigen Kopf- und Ansatzkrebses. ADVEXIN(R) ist Introgens p53 gegründete krebsbekämpfende Therapie, für die Ausrichtung Tätigkeiten unterwegs sind.
Klinische Forscher mit der Erfahrung, die Kopf- und Ansatzkrebspatienten behandelt, berichteten während eines vorhergehenden Konferenzanrufs, der von der Firma gehalten wurde, daß ADVEXIN(R) Phase 2 Sicherheit und Wirksamkeitdaten im rückläufigen Kopf- und Ansatzkrebs oder überstiegenes Erbitux(R) zusammengepaßt haben, wo die zwei verglichen werden können.
Introgen berichtete vorher preclinical über erhöhte therapeutische Effekte der Daten Vertretung kombinierten ADVEXIN(R) und der Erbitux(R) Therapien in einem Tiermodell des menschlichen nicht-kleinen Zelle Lungenkrebses. In den Studien, ergab die Kombination ADVEXIN(R) und Erbitux(R) der Therapie eine 2 bis 6 Falte grössere Verringerung der Tumorgröße, die mit jedem Mittel verglichen wurde, das alleine benutzt wurde.
ADVEXIN(R) ist gut als Monotherapy und im Verbindung mit anderen Krebsbehandlungen in den zahlreichen klinischen Versuchen zugelassen worden. Erbitux(R) Leitung ist mit Nebenwirkungen der Infusion und anderen Komplikationen verbunden ge$$$WESEN, die streng, die die Schwierigkeit, die einschließen, atmet, Hautausschlag, niedriger Blutdruck und Herzangriff sein können, wie vom Förderer berichtet.
ADVEXIN(R) p53 Therapie ist eine gerichtete molekulare Therapie mit ausgedehnter Anwendbarkeit in einer breiten Strecke der Tumorarten und der klinischen Einstellungen, weil sie einen der grundlegendsten und allgemeinsten molekularen Defekte, die anormale Funktion entstör des Tumors p53 zielt, verbunden mit Krebseinführung, Weiterentwicklung und Behandlungwiderstand.
Über Introgen Therapeutik Inc..
Introgen Therapeutics, Inc. ist eine biopharmaceutical Firma, die auf die Entdeckung, die Entwicklung und die Kommerzialisierung der zugelassenen, gerichteten molekularen Therapien des Brunnens für die Behandlung des Krebses und anderer Krankheiten gerichtet wird. Introgen hat fünf klinische Stadium Produktanwärter und eine Anzahl von preclinical Programmen. Introgen wendet seine molekulare Therapeutik, Immunotherapies und Nanopartikel Tumorentstör- Behandlungen an, um eine breite Strecke der Krebse und der VorPre-malignancies zu adressieren. Introgen behält integrierte Forschung, Entwicklung, Herstellung, klinische und regelnde Abteilungen bei und läßt mehrfache Produktionsanlagen einschließlich eine kommerzielle Produktionsanlage der Skala GMP laufen.
Aussagen in dieser Freigabe, die nicht ausschließlich historisch sind, können Aussagen, einschließlich die in bezug auf Introgens zukünftigen Erfolg mit seinem ADVEXIN(R) klinischen Entwicklungsprogramm für Behandlung des Krebses und den Erfolg der Tätigkeiten Ausrichtung Introgens "Vorwärts-schauen", die mit ADVEXIN(R) verbunden sind. Die tatsächlichen Resultate können von denen sich unterscheiden, die in dieser Freigabe wegen der Gefahren und der Ungewißheiten, die, beschrieben werden in den Betrieben Introgens und im betrieblichen Umfeld, einschließlich Stadium Introgens der Produktentwicklung und die begrenzte Erfahrung in der Entwicklung der Gen-gegründeten Drogen im allgemeinen, Abhängigkeit nach eigener Technologie und das gegenwärtige konkurrierende Klima, Geschichte von Betriebsverlusten bestehen und ansammelten Defizit, Vertrauen auf gemeinschaftlichen Verhältnissen und die Ungewißheiten, die auf klinischen Versuchen, der Sicherheit und Wirksamkeit der Produktanwärter Introgens, die Fähigkeit, den passenden Genehmigungen durch die zuständige Aufsichtsbehörde, Patentschutz Introgens und Marktakzept, sowie andere Gefahren einzuholen bezogen werden, die genau geschildert werden von Zeit zu Zeit in den Archivierungen Introgens mit der Sicherheiten und Austausch-Kommission einschließlich sein Archivierungen auf Form 10-K und Form 10-Q. Introgen geht keine Verbindlichkeit ein, die Resultate aller möglicher Neuausgaben zu irgendwelchen Vorwärts-schauenden Aussagen öffentlich freizugeben, die die Fälle oder Umstände reflektieren, die hiervon nach dem Datum entstehen.
Anmerkung Des Herausgebers: Zu mehr Information über Introgen Therapeutik oder für ein Menü der archivierten Pressekommuniquã©s, besichtigen Sie bitte Web site Introgens an: http://www.introgen.com/ .
Kontakt: Introgen Therapeutics, Inc. C. Channing Burke (512) 708 9310 Ext.. email 322: c.burke@introgen.com
Bin optimistisch - STRONG BUY!!!!
Ich glaube nicht, dass die Aktie zu laufen beginnen wird, sobald Bush seine ablehnende Haltung gegenüber Gentherapie aufgeben wird. Halt er ja schon in Bezug auf die alternativen Energien getan.

Gruß, Stammzelle.
Introgen weitet Quartalsverlust aus
Mittwoch 15. März 2006, 21:55 Uhr
Das Biotechnologie-Unternehmen Introgen Therapeutics Inc. (ISIN US46119F1075/ WKN 936231) hat seinen Verlust im abgelaufenen Quartal ausgeweitet, dabei aber die Erwartungen der Analysten übertroffen.
Wie der Konzern am Mittwoch bekannt gab, erzielte man im vierten Quartal einen Nettoverlust von 6,75 Mio. Dollar bzw. 19 Cents, nach einem Minus von 4,37 Mio. Dollar bzw. 16 Cents je Aktie. Der Umsatz brach von 1,22 Mio. Dollar im Vorjahr um 49 Prozent auf 624.000 Dollar ein. Analysten hatten im Vorfeld Umsätze in Höhe von 700.000 Dollar und einen Verlust von 23 Cents je Aktie erwartet.
finanzen.net
Mittwoch 15. März 2006, 21:55 Uhr
Das Biotechnologie-Unternehmen Introgen Therapeutics Inc. (ISIN US46119F1075/ WKN 936231) hat seinen Verlust im abgelaufenen Quartal ausgeweitet, dabei aber die Erwartungen der Analysten übertroffen.
Wie der Konzern am Mittwoch bekannt gab, erzielte man im vierten Quartal einen Nettoverlust von 6,75 Mio. Dollar bzw. 19 Cents, nach einem Minus von 4,37 Mio. Dollar bzw. 16 Cents je Aktie. Der Umsatz brach von 1,22 Mio. Dollar im Vorjahr um 49 Prozent auf 624.000 Dollar ein. Analysten hatten im Vorfeld Umsätze in Höhe von 700.000 Dollar und einen Verlust von 23 Cents je Aktie erwartet.
finanzen.net
es wurde ein höherer Verlust erwartet und die Aktie reagiert so? Seltsam. Sonstige Nachrichten sind doch auch nicht so schlecht.
Hi Introgener,
wieder Mal eine positive Nachricht:
03.04.2006 20:35
Introgen: Erfolg in früher Krebsstudie
Introgen Therapeutics (Nachrichten) hat heute vielversprechende Ergebnisse aus einer frühen Studie mit dem Krebs-Präparat „INGN 241“ vorgestellt. Demnach habe der Angionese-Hemmer in Kombination mit „Avastin“ das Tumorenwachstum bei Lungenkrebs deutlich stärker beeinträchtigt als INGN 241 oder Avastin alleine. Demnach lasse sich durch die Zusammenwirkung der beiden Präparate offenbar die krebs-hemmende Wirkung signifikant verbessern, ohne dass der Patient gleichzeitig höheren toxischen Belastungen ausgesetzt werde.
Angiogenese-Hemmer blockieren die Bildung von Bindegewebszellen und Blutgefäßen innerhalb eines Tumors und können ihn auf diese Weise im Idealfall aushungern. Avastin wurde von Genentech entwickelt.
Und wieder Mal springt der Kurs nach Bekanntgabe der Meldung kurz und heftig an - dann fehlen aber die Anschlusskäufer... Ist schon eine zähe Partie mit Introgen. Hoffentlich wird man eines nicht so fernen Tages für diese Ausdauer belohnt.
Gruß, Stammzelle.
wieder Mal eine positive Nachricht:

03.04.2006 20:35
Introgen: Erfolg in früher Krebsstudie
Introgen Therapeutics (Nachrichten) hat heute vielversprechende Ergebnisse aus einer frühen Studie mit dem Krebs-Präparat „INGN 241“ vorgestellt. Demnach habe der Angionese-Hemmer in Kombination mit „Avastin“ das Tumorenwachstum bei Lungenkrebs deutlich stärker beeinträchtigt als INGN 241 oder Avastin alleine. Demnach lasse sich durch die Zusammenwirkung der beiden Präparate offenbar die krebs-hemmende Wirkung signifikant verbessern, ohne dass der Patient gleichzeitig höheren toxischen Belastungen ausgesetzt werde.
Angiogenese-Hemmer blockieren die Bildung von Bindegewebszellen und Blutgefäßen innerhalb eines Tumors und können ihn auf diese Weise im Idealfall aushungern. Avastin wurde von Genentech entwickelt.
Und wieder Mal springt der Kurs nach Bekanntgabe der Meldung kurz und heftig an - dann fehlen aber die Anschlusskäufer... Ist schon eine zähe Partie mit Introgen. Hoffentlich wird man eines nicht so fernen Tages für diese Ausdauer belohnt.

Gruß, Stammzelle.
Und wieder positive - den Kurs aber scheinbar nicht interessierende Nachrichten:
04.04.2006 23:23
Introgen: Erfolg an der Krebs-Front
Introgen Therapeutics (Nachrichten) hat heute positive Neuigkeiten für sein Krebspräparat INGN 241 mitgeteilt.
So habe die Universität Texas festgestellt, dass der aktive Bestandteil des Präparats Krebszellen vernichten könne, die sich zuvor als Cisplatin-resistent erwiesen hatten. Cisplatin ist eines der gängigsten Chemotherapie-Präparate.
Die entsprechenden Tumorzellen hätten eine bestimmte Proteinveränderung erkennen lassen, die signifikant mit deren Widerstandsfähigkeit zusammenzuhängen scheine. INGN 241 habe sich gerade bei der Vernichtung dieser Krebszellen besonders bewährt. Die Versuche seien mit Eierstock- und Lungenkrebszellen durchgeführt worden.
Klingt ja auch weiterhin alles positiv. Warten wir also auf die bahnbrechenden News...
Gruß, Stammzelle.
04.04.2006 23:23
Introgen: Erfolg an der Krebs-Front
Introgen Therapeutics (Nachrichten) hat heute positive Neuigkeiten für sein Krebspräparat INGN 241 mitgeteilt.
So habe die Universität Texas festgestellt, dass der aktive Bestandteil des Präparats Krebszellen vernichten könne, die sich zuvor als Cisplatin-resistent erwiesen hatten. Cisplatin ist eines der gängigsten Chemotherapie-Präparate.
Die entsprechenden Tumorzellen hätten eine bestimmte Proteinveränderung erkennen lassen, die signifikant mit deren Widerstandsfähigkeit zusammenzuhängen scheine. INGN 241 habe sich gerade bei der Vernichtung dieser Krebszellen besonders bewährt. Die Versuche seien mit Eierstock- und Lungenkrebszellen durchgeführt worden.
Klingt ja auch weiterhin alles positiv. Warten wir also auf die bahnbrechenden News...
Gruß, Stammzelle.
Hi,
wie gehabt, gute News ... Der Kurs wird sich wohl aber erst signifikant gen Norden bewegen, wenn ADVEXIN die Zulassung erhält
... Der Kurs wird sich wohl aber erst signifikant gen Norden bewegen, wenn ADVEXIN die Zulassung erhält !
!
Introgen stellt ADVEXIN p53 Therapie für Krebspatienten mit Li-Fraumeni Syndrom zur Verfügung
Austin, Texas (ots/PRNewswire) -
- ADVEXIN für bestimmte Patienten auf "Compassionate Use"-Basis verfügbar
Die ADVEXIN p53 Therapie von Introgen Therapeutics (Nachrichten) (Nasdaq: INGN) ist erfolgreich zur Behandlung eines Krebspatienten mit Li-Fraumeni Syndrom auf "Compassionate Use"-Basis mit einem von der US-amerikanischen FDA (Food and Drug Administration) genehmigten Protokoll eingesetzt worden. Aufgrund dieses ermutigenden klinischen Ergebnisses wird Introgen die ADVEXIN p53 Therapie auf "Compassionate Use"-Basis geeigneten Patienten mit Li-Fraumeni Syndrom und gegen Standardbehandlung refraktären Tumoren nach geeigneten Protokollen und in entsprechenden Einrichtungen zur Verfügung stellen.
Informationen zum Li-Fraumeni Syndrom
Das Li-Fraumeni Syndrom (LFS) ist eine genetische Erbkrankheit, bei der das Risiko, bestimmte Krebsarten zu entwickeln stark erhöht ist und Tumoren typischerweise bereits im Jugendalter erstmals auftreten. Die meisten LFS-Familien weisen vererbte Mutationen des p53 Tumor Suppressor Gens auf. Die Behandlung von Li-Fraumeni Tumoren mit ADVEXIN p53 stellt eine gezielte Therapie des molekularen Defekts, der die Entstehung und Entwicklung der Krebstumoren verursacht, dar.
Dr. Robert E. Sobol, Senior Vice President of Clinical and Scientific Affairs bei Introgen, sagte: "Die Behandlung von Tumoren dieses Syndroms mit ADVEXIN ist der Inbegriff einer gezielten Therapie, weil die Ursache für diese Krebstumoren die anormale p53-Funktion ist, die durch die ADVEXIN Behandlung direkt angegangen wird".
Teilnahmevoraussetzungen
Die Teilnahmevoraussetzungen für dieses Programm sind über die gebührenfreie Hotline für klinische Studien von Introgen unter der Telefonnummer +1-866-631-4646 zu erfahren.
Informationen zu ADVEXIN
Bei der ADVEXIN p53 Therapie handelt es sich um eine gezielte molekulare Therapie, die bei einer breiten Reihe von Tumorarten und klinischen Situationen eingesetzt werden kann, weil sie direkt auf einen der grundlegenden und verbreitendsten molekularen Defekte, nämlich die anormale p53 Tumor Suppressor Funktion, zielt, die mit der Krebsentstehung, der Krebsentwicklung und der Behandlungsresistenz zusammenhängt.
ADVEXIN versorgt Krebsgewebe mit sehr hohen Konzentrationen des p53-Protein und tötet Krebszellen selektiv ab. p53 ist unter der Bezeichnung "Genomwächter" ein normaler Zellbestandteil und als Tumorsuppressor, der das Wachstum von Tumorzellen hemmt, bekannt. Eine der Hauptfunktionen dieses Proteins ist die Beseitigung von Krebszellen, indem es erkennt, wann die Zelle durch Mutation beschädigt wird und hierauf das Zellwachstum stoppt, um die Zellreparatur einzuleiten. Ist die Zelle so stark beschädigt, dass sie nicht mehr repariert werden kann, so löst p53 den Zelltod aus, um ein unkontrolliertes Wachstum der Zelle zu verhindern.
ADVEXIN wurde für eine Reihe von Krebserkrankungen sowie in Kombination mit verschiedenen Standard-Krebstherapien wie Strahlen- oder Chemotherapie evaluiert. Ergebnisse mehrerer veröffentlichter vorklinischer und klinischer Studien belegen die Aktivität von ADVEXIN als Monotherapie sowie die gefahrlose Unterstützung der Antikrebswirkung bei Strahlen- und Chemotherapie.
Informationen zu Introgen Therapeutics, Inc.
Introgen Therapeutics Inc. ist ein biopharmazeutisches Unternehmen dessen Schwerpunkt auf der Erforschung, Entwicklung und Vermarktung zielgerichteter Molekulartherapien zur Behandlung von Krebs und anderen Erkrankungen liegt. Introgen entwickelt Molekulartherapien, Immuntherapien, Impfstoffe und Nanopartikel-Tumorsuppressortherapien zur Behandlung einer Reihe von Krebserkrankungen mittels Tumorsuppressoren, Zytokinen und Genen. Introgen unterhält eigene Abteilungen für Forschung, Entwicklung und Produktion sowie für klinische und Zulassungs-Fragen. Darüber hinaus betreibt das Unternehmen mehrere Produktionsanlagen, u.a. eine kommerziell ausgelegte cGMP-Produktionsanlage.
Bei Aussagen in dieser Pressemitteilung, die sich nicht eindeutig auf historische Ereignisse beziehen, kann es sich um zukunftsorientierte Aussagen handeln. Zu diesen zukunftsorientierten Aussagen gehören unter anderem Aussagen über den künftigen Erfolg von Introgens klinischem Entwicklungsprogramm für ADVEXIN zur Behandlung von Krebspatienten mit Li-Fraumeni Syndrom. Die ADVEXIN p53 Therapie befindet sich z.Z. in der Untersuchungsphase und ist von der FDA nicht zugelassen. Die Gefahrlosigkeit und Wirksamkeit der ADVEXIN p53 Therapie zur Behandlung des LFS-Syndroms ist noch nicht durch klinische Studien belegt. Introgen behält sich das Recht vor, künftig nach eigenem Ermessen und ohne vorherige Ankündigung, die Teilnahmevoraussetzungen abzuändern bzw. die ADVEXIN p53 Therapie nicht mehr auf "Compassionate Use"-Basis zur Verfügung zu stellen. Es kann keine Garantie dafür geben, dass ein Patient die ADVEXIN p53 Therapie auf "Compassionate Use"-Basis erhält. Die tatsächlich eintretenden Ergebnisse können aufgrund von Risiken und Unwägbarkeiten im Rahmen des Geschäftsumfeldes von Introgen von den in dieser Pressemitteilung beschriebenen Ergebnissen abweichen. Dazu zählen unter anderem das Stadium der Produktentwicklung bei Introgen und die begrenzte Erfahrung in der Entwicklung von gentechnisch erzeugten Arzneimitteln im Allgemeinen, seine Abhängigkeit von eigener Technologie und der gegenwärtigen Wettbewerbslage, Geschichte der operativen Verluste und Bilanzverluste, die Einbindung von Introgen in Kooperationsbeziehungen sowie Unwägbarkeiten in Verbindung mit klinischen Studien, Sicherheit und Wirksamkeit der Produktkandidaten von Introgen, dem Erhalt der entsprechenden Zulassungsgenehmigungen, Patentschutz und Marktakzeptanz von Introgen sowie andere Risiken, die von Zeit zu Zeit in den Einreichungen von Introgen bei der US-amerikanischen Börsenaufsichtsbehörde (Securities and Exchange Commission) dargelegt werden, einschliesslich der Einreichungen auf Formular 10-K und Formular 10-Q. Introgen verpflichtet sich in keiner Weise zur öffentlichen Bekanntgabe von Ergebnissen aus der Überarbeitung allfälliger zukunftorientierter Aussagen aufgrund von Ereignissen oder Umständen, die sich nach dem Datum dieser Mitteilung ergeben können.
Redaktionelle Hinweise: Weitergehende Informationen zu Introgen Therapeutics sowie eine Auswahl früherer Pressemitteilungen stehen auf der Website von Introgen unter http://www.introgen.com zur Verfügung.
Ansprechpartner: Introgen Therapeutics, Inc. C. Channing Burke Tel.: +1-512-708-9310 App. 322 E-Mail: c.burke@introgen.com
Website: http://www.introgen.com
Originaltext: Introgen Therapeutics Inc. Digitale Pressemappe: http://presseportal.de/story.htx?firmaid=25349 Pressemappe via RSS : feed://presseportal.de/rss/pm_25349.rss2
Pressekontakt: C. Channing Burke von Introgen Therapeutics Inc., Tel.: +1-512-708-9310, App. 322, oder E-Mail: c.burke@introgen.com
Gruß, Stammzelle.
wie gehabt, gute News
 ... Der Kurs wird sich wohl aber erst signifikant gen Norden bewegen, wenn ADVEXIN die Zulassung erhält
... Der Kurs wird sich wohl aber erst signifikant gen Norden bewegen, wenn ADVEXIN die Zulassung erhält !
!Introgen stellt ADVEXIN p53 Therapie für Krebspatienten mit Li-Fraumeni Syndrom zur Verfügung
Austin, Texas (ots/PRNewswire) -
- ADVEXIN für bestimmte Patienten auf "Compassionate Use"-Basis verfügbar
Die ADVEXIN p53 Therapie von Introgen Therapeutics (Nachrichten) (Nasdaq: INGN) ist erfolgreich zur Behandlung eines Krebspatienten mit Li-Fraumeni Syndrom auf "Compassionate Use"-Basis mit einem von der US-amerikanischen FDA (Food and Drug Administration) genehmigten Protokoll eingesetzt worden. Aufgrund dieses ermutigenden klinischen Ergebnisses wird Introgen die ADVEXIN p53 Therapie auf "Compassionate Use"-Basis geeigneten Patienten mit Li-Fraumeni Syndrom und gegen Standardbehandlung refraktären Tumoren nach geeigneten Protokollen und in entsprechenden Einrichtungen zur Verfügung stellen.
Informationen zum Li-Fraumeni Syndrom
Das Li-Fraumeni Syndrom (LFS) ist eine genetische Erbkrankheit, bei der das Risiko, bestimmte Krebsarten zu entwickeln stark erhöht ist und Tumoren typischerweise bereits im Jugendalter erstmals auftreten. Die meisten LFS-Familien weisen vererbte Mutationen des p53 Tumor Suppressor Gens auf. Die Behandlung von Li-Fraumeni Tumoren mit ADVEXIN p53 stellt eine gezielte Therapie des molekularen Defekts, der die Entstehung und Entwicklung der Krebstumoren verursacht, dar.
Dr. Robert E. Sobol, Senior Vice President of Clinical and Scientific Affairs bei Introgen, sagte: "Die Behandlung von Tumoren dieses Syndroms mit ADVEXIN ist der Inbegriff einer gezielten Therapie, weil die Ursache für diese Krebstumoren die anormale p53-Funktion ist, die durch die ADVEXIN Behandlung direkt angegangen wird".
Teilnahmevoraussetzungen
Die Teilnahmevoraussetzungen für dieses Programm sind über die gebührenfreie Hotline für klinische Studien von Introgen unter der Telefonnummer +1-866-631-4646 zu erfahren.
Informationen zu ADVEXIN
Bei der ADVEXIN p53 Therapie handelt es sich um eine gezielte molekulare Therapie, die bei einer breiten Reihe von Tumorarten und klinischen Situationen eingesetzt werden kann, weil sie direkt auf einen der grundlegenden und verbreitendsten molekularen Defekte, nämlich die anormale p53 Tumor Suppressor Funktion, zielt, die mit der Krebsentstehung, der Krebsentwicklung und der Behandlungsresistenz zusammenhängt.
ADVEXIN versorgt Krebsgewebe mit sehr hohen Konzentrationen des p53-Protein und tötet Krebszellen selektiv ab. p53 ist unter der Bezeichnung "Genomwächter" ein normaler Zellbestandteil und als Tumorsuppressor, der das Wachstum von Tumorzellen hemmt, bekannt. Eine der Hauptfunktionen dieses Proteins ist die Beseitigung von Krebszellen, indem es erkennt, wann die Zelle durch Mutation beschädigt wird und hierauf das Zellwachstum stoppt, um die Zellreparatur einzuleiten. Ist die Zelle so stark beschädigt, dass sie nicht mehr repariert werden kann, so löst p53 den Zelltod aus, um ein unkontrolliertes Wachstum der Zelle zu verhindern.
ADVEXIN wurde für eine Reihe von Krebserkrankungen sowie in Kombination mit verschiedenen Standard-Krebstherapien wie Strahlen- oder Chemotherapie evaluiert. Ergebnisse mehrerer veröffentlichter vorklinischer und klinischer Studien belegen die Aktivität von ADVEXIN als Monotherapie sowie die gefahrlose Unterstützung der Antikrebswirkung bei Strahlen- und Chemotherapie.
Informationen zu Introgen Therapeutics, Inc.
Introgen Therapeutics Inc. ist ein biopharmazeutisches Unternehmen dessen Schwerpunkt auf der Erforschung, Entwicklung und Vermarktung zielgerichteter Molekulartherapien zur Behandlung von Krebs und anderen Erkrankungen liegt. Introgen entwickelt Molekulartherapien, Immuntherapien, Impfstoffe und Nanopartikel-Tumorsuppressortherapien zur Behandlung einer Reihe von Krebserkrankungen mittels Tumorsuppressoren, Zytokinen und Genen. Introgen unterhält eigene Abteilungen für Forschung, Entwicklung und Produktion sowie für klinische und Zulassungs-Fragen. Darüber hinaus betreibt das Unternehmen mehrere Produktionsanlagen, u.a. eine kommerziell ausgelegte cGMP-Produktionsanlage.
Bei Aussagen in dieser Pressemitteilung, die sich nicht eindeutig auf historische Ereignisse beziehen, kann es sich um zukunftsorientierte Aussagen handeln. Zu diesen zukunftsorientierten Aussagen gehören unter anderem Aussagen über den künftigen Erfolg von Introgens klinischem Entwicklungsprogramm für ADVEXIN zur Behandlung von Krebspatienten mit Li-Fraumeni Syndrom. Die ADVEXIN p53 Therapie befindet sich z.Z. in der Untersuchungsphase und ist von der FDA nicht zugelassen. Die Gefahrlosigkeit und Wirksamkeit der ADVEXIN p53 Therapie zur Behandlung des LFS-Syndroms ist noch nicht durch klinische Studien belegt. Introgen behält sich das Recht vor, künftig nach eigenem Ermessen und ohne vorherige Ankündigung, die Teilnahmevoraussetzungen abzuändern bzw. die ADVEXIN p53 Therapie nicht mehr auf "Compassionate Use"-Basis zur Verfügung zu stellen. Es kann keine Garantie dafür geben, dass ein Patient die ADVEXIN p53 Therapie auf "Compassionate Use"-Basis erhält. Die tatsächlich eintretenden Ergebnisse können aufgrund von Risiken und Unwägbarkeiten im Rahmen des Geschäftsumfeldes von Introgen von den in dieser Pressemitteilung beschriebenen Ergebnissen abweichen. Dazu zählen unter anderem das Stadium der Produktentwicklung bei Introgen und die begrenzte Erfahrung in der Entwicklung von gentechnisch erzeugten Arzneimitteln im Allgemeinen, seine Abhängigkeit von eigener Technologie und der gegenwärtigen Wettbewerbslage, Geschichte der operativen Verluste und Bilanzverluste, die Einbindung von Introgen in Kooperationsbeziehungen sowie Unwägbarkeiten in Verbindung mit klinischen Studien, Sicherheit und Wirksamkeit der Produktkandidaten von Introgen, dem Erhalt der entsprechenden Zulassungsgenehmigungen, Patentschutz und Marktakzeptanz von Introgen sowie andere Risiken, die von Zeit zu Zeit in den Einreichungen von Introgen bei der US-amerikanischen Börsenaufsichtsbehörde (Securities and Exchange Commission) dargelegt werden, einschliesslich der Einreichungen auf Formular 10-K und Formular 10-Q. Introgen verpflichtet sich in keiner Weise zur öffentlichen Bekanntgabe von Ergebnissen aus der Überarbeitung allfälliger zukunftorientierter Aussagen aufgrund von Ereignissen oder Umständen, die sich nach dem Datum dieser Mitteilung ergeben können.
Redaktionelle Hinweise: Weitergehende Informationen zu Introgen Therapeutics sowie eine Auswahl früherer Pressemitteilungen stehen auf der Website von Introgen unter http://www.introgen.com zur Verfügung.
Ansprechpartner: Introgen Therapeutics, Inc. C. Channing Burke Tel.: +1-512-708-9310 App. 322 E-Mail: c.burke@introgen.com
Website: http://www.introgen.com
Originaltext: Introgen Therapeutics Inc. Digitale Pressemappe: http://presseportal.de/story.htx?firmaid=25349 Pressemappe via RSS : feed://presseportal.de/rss/pm_25349.rss2
Pressekontakt: C. Channing Burke von Introgen Therapeutics Inc., Tel.: +1-512-708-9310, App. 322, oder E-Mail: c.burke@introgen.com
Gruß, Stammzelle.
Hi,
Grund für den derzeitgen Aufwärtstrend dürfte wohl das anstehende Conferenz-call am 18.07.2006 sein. Mal sehen, was für Infos es geben wird.

Panel of Experts to Review Importance of Introgen Therapeutics' Recently Reported ADVEXIN Data
AUSTIN, Texas, June 26 /PRNewswire-FirstCall/ -- Introgen Therapeutics, (Nachrichten) Inc. will conduct a conference call on July 18, 2006 at 3:30 p.m. ET to discuss data regarding Introgen's lead product ADVEXIN(R) presented at the annual meetings of the American Society of Gene Therapy (ASGT) and the American Society of Clinical Oncology (ASCO). A panel of clinical experts will discuss the importance of prognostic indicators of ADVEXIN efficacy associated with high response rates, locoregional disease control and increased survival identified in Introgen's Phase 2 trials in patients with head and neck cancer.
The call will include detailed discussions of the significance and clinical application of biomarkers predictive of ADVEXIN efficacy. The identification of prognostic indicators of ADVEXIN activity complies with initiatives of regulatory agencies to identify biomarkers that can predict the patient populations most likely to benefit from a specific cancer therapy.
In blinded analyses performed by an independent testing laboratory, a molecular biomarker was identified that predicted patients most likely to benefit from ADVEXIN cancer therapy. This biomarker also identifies patients who are less likely to respond to standard cancer treatment. The predictive biomarkers correlated with statistically significant increases in survival, tumor response and loco-regional disease control following ADVEXIN therapy in clinical trials. The predictive use of biomarkers coincides with Food and Drug Administration as well as with National Cancer Institute initiatives on the use of biomarkers in the development of breakthrough cancer therapies.
In addition, Introgen will discuss the successful use of ADVEXIN for Li- Fraumeni Syndrome cancer, an inherited form of malignancy characterized by the loss of p53 tumor suppressor protection.
The call will be hosted by David Nance, President and CEO, Robert E. Sobol, M.D., Introgen's senior vice president, Medical and Scientific Affairs, and Max W. Talbott, Ph.D., Introgen's senior vice president for Regulatory and Worldwide Commercial Development. They will be joined by several expert investigators from ADEVXIN clinical trials.
Conference Call Information Date / Time: July 18, 2006 at 3:30 p.m. ET Participant Dial-in numbers: (877) 616-4476 U.S. and Canada (706) 679-7372 International
This call is also being web cast and can be accessed at Introgen's web site at http://www.introgen.com/ . A web cast replay will be available for one week at http://www.introgen.com/ .
Lassen wir uns (hoffentlich positiv) überraschen.
Gruß, Stammzelle.
Grund für den derzeitgen Aufwärtstrend dürfte wohl das anstehende Conferenz-call am 18.07.2006 sein. Mal sehen, was für Infos es geben wird.

Panel of Experts to Review Importance of Introgen Therapeutics' Recently Reported ADVEXIN Data
AUSTIN, Texas, June 26 /PRNewswire-FirstCall/ -- Introgen Therapeutics, (Nachrichten) Inc. will conduct a conference call on July 18, 2006 at 3:30 p.m. ET to discuss data regarding Introgen's lead product ADVEXIN(R) presented at the annual meetings of the American Society of Gene Therapy (ASGT) and the American Society of Clinical Oncology (ASCO). A panel of clinical experts will discuss the importance of prognostic indicators of ADVEXIN efficacy associated with high response rates, locoregional disease control and increased survival identified in Introgen's Phase 2 trials in patients with head and neck cancer.
The call will include detailed discussions of the significance and clinical application of biomarkers predictive of ADVEXIN efficacy. The identification of prognostic indicators of ADVEXIN activity complies with initiatives of regulatory agencies to identify biomarkers that can predict the patient populations most likely to benefit from a specific cancer therapy.
In blinded analyses performed by an independent testing laboratory, a molecular biomarker was identified that predicted patients most likely to benefit from ADVEXIN cancer therapy. This biomarker also identifies patients who are less likely to respond to standard cancer treatment. The predictive biomarkers correlated with statistically significant increases in survival, tumor response and loco-regional disease control following ADVEXIN therapy in clinical trials. The predictive use of biomarkers coincides with Food and Drug Administration as well as with National Cancer Institute initiatives on the use of biomarkers in the development of breakthrough cancer therapies.
In addition, Introgen will discuss the successful use of ADVEXIN for Li- Fraumeni Syndrome cancer, an inherited form of malignancy characterized by the loss of p53 tumor suppressor protection.
The call will be hosted by David Nance, President and CEO, Robert E. Sobol, M.D., Introgen's senior vice president, Medical and Scientific Affairs, and Max W. Talbott, Ph.D., Introgen's senior vice president for Regulatory and Worldwide Commercial Development. They will be joined by several expert investigators from ADEVXIN clinical trials.
Conference Call Information Date / Time: July 18, 2006 at 3:30 p.m. ET Participant Dial-in numbers: (877) 616-4476 U.S. and Canada (706) 679-7372 International
This call is also being web cast and can be accessed at Introgen's web site at http://www.introgen.com/ . A web cast replay will be available for one week at http://www.introgen.com/ .
Lassen wir uns (hoffentlich positiv) überraschen.
Gruß, Stammzelle.
Hi,
ich denke Mal, dass sich nicht nur die Charttechnik in den letzten Wochen erheblich verbessert haben. Auch die letzten News sind meiner Ansicht nach nicht zu verachten. So die letzte:
15.09.2006 09:07
Molecular Biomarkers Predicting Efficacy of Introgen Therapeutics' ADVEXIN Cancer Therapy is Highlighted at Major Cancer Conference
CHICAGO, September 15 /PRNewswire/ --
- Agreement with FDA for Analyses Using Biomarkers Supports ADVEXIN Approval
News of Introgen Therapeutics, (Nachrichten) Inc.'s (Nasdaq: INGN) use of a molecular biomarker to predict the efficacy of its ADVEXIN cancer therapy was released yesterday by the American Association for Cancer Research (AACR). Introgen has reached agreement with the U.S. Food and Drug Administration (FDA) to incorporate the use of Introgen's p53 molecular biomarkers in the analysis of ADVEXIN clinical data used in support of FDA submissions for approval. Data were presented at the AACR International Conference on Molecular Diagnostics in Cancer Therapeutic Development in Chicago. The AACR news release is entitled, "Abnormal Overexpression of p53 is a Predictive Molecular Biomarker of Advexin Efficacy in Recurrent Squamous Cell Carcinoma of the Head and Neck" and can be found at: http://www.aacr.org/Default.aspx?p=1275&d=652 .
The data demonstrate that a simple test may be used to identify patients showing statistically significant increased survival and disease control following ADVEXIN therapy. Importantly, pre-treatment analysis could be used to identify patients who are most likely to respond to ADVEXIN and least likely to benefit from conventional cancer therapies. The same molecular biomarker may also be used to identify cancer patients lacking normal cancer suppression function.
Max Talbott, Introgen's senior vice president of Worldwide Commercial Development and Regulatory Affairs stated, "The use of Introgen's prognostic biomarkers for clinical data analysis is important in positioning ADVEXIN therapy for FDA approval and wide clinical application. We plan to use the biomarkers to analyze our Phase 3 patient data and are exploring the use of ADVEXIN as a potential therapy for any solid tumors in patients characterized by abnormal p53 protein levels. We are encouraged that our biomarkers may also be employed to identify patients that could avoid toxicities associated with conventional cancer treatments."
Bemerkenswert finde ich auch, dass Mal wieder ein Insider-Kauf getätigt wurde - endlich.
5-Sep-06 PARKER, DAVID L.
Senior Vice President 15,000 Direct Option Exercise at $0.519 per share. $7,785
Mal sehen, was die nächsten Monate so bringen .
.
Gruß, Stammzelle.
ich denke Mal, dass sich nicht nur die Charttechnik in den letzten Wochen erheblich verbessert haben. Auch die letzten News sind meiner Ansicht nach nicht zu verachten. So die letzte:
15.09.2006 09:07
Molecular Biomarkers Predicting Efficacy of Introgen Therapeutics' ADVEXIN Cancer Therapy is Highlighted at Major Cancer Conference
CHICAGO, September 15 /PRNewswire/ --
- Agreement with FDA for Analyses Using Biomarkers Supports ADVEXIN Approval
News of Introgen Therapeutics, (Nachrichten) Inc.'s (Nasdaq: INGN) use of a molecular biomarker to predict the efficacy of its ADVEXIN cancer therapy was released yesterday by the American Association for Cancer Research (AACR). Introgen has reached agreement with the U.S. Food and Drug Administration (FDA) to incorporate the use of Introgen's p53 molecular biomarkers in the analysis of ADVEXIN clinical data used in support of FDA submissions for approval. Data were presented at the AACR International Conference on Molecular Diagnostics in Cancer Therapeutic Development in Chicago. The AACR news release is entitled, "Abnormal Overexpression of p53 is a Predictive Molecular Biomarker of Advexin Efficacy in Recurrent Squamous Cell Carcinoma of the Head and Neck" and can be found at: http://www.aacr.org/Default.aspx?p=1275&d=652 .
The data demonstrate that a simple test may be used to identify patients showing statistically significant increased survival and disease control following ADVEXIN therapy. Importantly, pre-treatment analysis could be used to identify patients who are most likely to respond to ADVEXIN and least likely to benefit from conventional cancer therapies. The same molecular biomarker may also be used to identify cancer patients lacking normal cancer suppression function.
Max Talbott, Introgen's senior vice president of Worldwide Commercial Development and Regulatory Affairs stated, "The use of Introgen's prognostic biomarkers for clinical data analysis is important in positioning ADVEXIN therapy for FDA approval and wide clinical application. We plan to use the biomarkers to analyze our Phase 3 patient data and are exploring the use of ADVEXIN as a potential therapy for any solid tumors in patients characterized by abnormal p53 protein levels. We are encouraged that our biomarkers may also be employed to identify patients that could avoid toxicities associated with conventional cancer treatments."
Bemerkenswert finde ich auch, dass Mal wieder ein Insider-Kauf getätigt wurde - endlich.
5-Sep-06 PARKER, DAVID L.
Senior Vice President 15,000 Direct Option Exercise at $0.519 per share. $7,785
Mal sehen, was die nächsten Monate so bringen
 .
.Gruß, Stammzelle.
Hi,
ich kann nur sagen: HEUTE KAUFEN UND RUHIG WARTEN!!!! Bin eigentlich eher zurückhaltend, aber INGN wird für mich der Mega-Hammer. INGN241 in Kombination mit Avastin = TUMORKILLER Nr. 1!
Das musste Mal raus...
Introgen's INGN 241 Works Synergistically With Avastin(R) to Cut Blood Supply to Cancers
BOSTON, Sept 19, 2006 /PRNewswire-FirstCall via COMTEX News Network/ --
Introgen Therapeutics, Inc. (Nasdaq: INGN) reported data from preclinical studies in which mda-7, the active component of INGN 241, in combination with Avastin(R) (Bevacizumab), produced a complete and synergistic therapeutic effect in models of lung cancer. INGN 241 and Avastin each inhibit the development of blood vessels in tumors, called angiogenesis, through distinct mechanisms, and the combination of the two agents significantly increases antitumor activity compared to the activity of either agent used alone. Researchers at Introgen and The University of Texas M. D. Anderson Cancer Center conducted the study. Dr. Rajagopal Ramesh, Associate Professor, Department of Thoracic and Cardiovascular Medicine at M. D. Anderson Cancer Center was principal investigator of the study and presented the data today at the 4th Annual Angiogenesis and Vascular Targeting conference held in Boston.
"These results are very encouraging because they suggest that the anti- cancer activity of targeted, anti-angiogenic agents can be enhanced without increasing toxicity," said Sunil Chada, Ph.D., associate vice president, Clinical Research and Development, at Introgen. "The data presented today, and our robust body of clinical data demonstrating the favorable safety and tolerability profiles of INGN 241 suggests that this investigational cancer therapy may be combined with Avastin to make a more potent weapon in the fight against cancer."
Tumor angiogenesis -- the formation of new blood vessels within a tumor -- is essential to support the growth of tumors beyond a minimum size. Avastin is a therapeutic antibody designed to inhibit angiogenesis by binding to and inhibiting the activity of vascular endothelial growth factor (VEGF), a key mediator of angiogenesis. Although inhibiting VEGF activity with Avastin reduces tumor angiogenesis and growth, it does not eradicate tumors. MDA-7 also has been shown to have potent anti-angiogenic activity, and works via a different mechanism than Avastin. The reported study was designed to evaluate the combination of INGN 241 and Avastin on tumor angiogenesis, growth and survival.
Dr. Chada continued, "INGN 241 functions to block angiogenesis by inhibiting expression of VEGF -- a critical protein in tumor angiogenesis. In contrast, Avastin blocks binding of VEGF to its receptor. Thus combining these two agents with distinct anti-angiogenic mechanisms provides enhanced anti-tumor effects and completely eradicates tumors in mice, resulting in dramatic improvement in survival."
About INGN 241
INGN 241 is being tested in a Phase 2 clinical trial for patients suffering from advanced melanoma and in a Phase 3 clinical trial in combination with radiation therapy in solid tumors. The mda-7 gene was discovered by the laboratory of Dr. Paul B. Fisher, professor of clinical pathology at Columbia University. Introgen holds an exclusive worldwide sublicense to the Columbia University rights for all gene therapy applications from GlaxoSmithKline.
ich kann nur sagen: HEUTE KAUFEN UND RUHIG WARTEN!!!! Bin eigentlich eher zurückhaltend, aber INGN wird für mich der Mega-Hammer. INGN241 in Kombination mit Avastin = TUMORKILLER Nr. 1!
Das musste Mal raus...

Introgen's INGN 241 Works Synergistically With Avastin(R) to Cut Blood Supply to Cancers
BOSTON, Sept 19, 2006 /PRNewswire-FirstCall via COMTEX News Network/ --
Introgen Therapeutics, Inc. (Nasdaq: INGN) reported data from preclinical studies in which mda-7, the active component of INGN 241, in combination with Avastin(R) (Bevacizumab), produced a complete and synergistic therapeutic effect in models of lung cancer. INGN 241 and Avastin each inhibit the development of blood vessels in tumors, called angiogenesis, through distinct mechanisms, and the combination of the two agents significantly increases antitumor activity compared to the activity of either agent used alone. Researchers at Introgen and The University of Texas M. D. Anderson Cancer Center conducted the study. Dr. Rajagopal Ramesh, Associate Professor, Department of Thoracic and Cardiovascular Medicine at M. D. Anderson Cancer Center was principal investigator of the study and presented the data today at the 4th Annual Angiogenesis and Vascular Targeting conference held in Boston.
"These results are very encouraging because they suggest that the anti- cancer activity of targeted, anti-angiogenic agents can be enhanced without increasing toxicity," said Sunil Chada, Ph.D., associate vice president, Clinical Research and Development, at Introgen. "The data presented today, and our robust body of clinical data demonstrating the favorable safety and tolerability profiles of INGN 241 suggests that this investigational cancer therapy may be combined with Avastin to make a more potent weapon in the fight against cancer."
Tumor angiogenesis -- the formation of new blood vessels within a tumor -- is essential to support the growth of tumors beyond a minimum size. Avastin is a therapeutic antibody designed to inhibit angiogenesis by binding to and inhibiting the activity of vascular endothelial growth factor (VEGF), a key mediator of angiogenesis. Although inhibiting VEGF activity with Avastin reduces tumor angiogenesis and growth, it does not eradicate tumors. MDA-7 also has been shown to have potent anti-angiogenic activity, and works via a different mechanism than Avastin. The reported study was designed to evaluate the combination of INGN 241 and Avastin on tumor angiogenesis, growth and survival.
Dr. Chada continued, "INGN 241 functions to block angiogenesis by inhibiting expression of VEGF -- a critical protein in tumor angiogenesis. In contrast, Avastin blocks binding of VEGF to its receptor. Thus combining these two agents with distinct anti-angiogenic mechanisms provides enhanced anti-tumor effects and completely eradicates tumors in mice, resulting in dramatic improvement in survival."
About INGN 241
INGN 241 is being tested in a Phase 2 clinical trial for patients suffering from advanced melanoma and in a Phase 3 clinical trial in combination with radiation therapy in solid tumors. The mda-7 gene was discovered by the laboratory of Dr. Paul B. Fisher, professor of clinical pathology at Columbia University. Introgen holds an exclusive worldwide sublicense to the Columbia University rights for all gene therapy applications from GlaxoSmithKline.
Wow,
besonders der dieser Satz gefällt mir:
Thus combining these two agents with distinct anti-angiogenic mechanisms provides enhanced anti-tumor effects and completely eradicates tumors in mice, resulting in dramatic improvement in survival.
Der Turmor wird komplett abgetötet!!!
Ich weiß, es ist alles noch Zukunftsmusik, aber der Newsflow der jüngsten Zeit ist echt vielversprechend.
Endlich merkt man, dass es vorangeht. Werde auf alle Fälle in der nächsten Zeit noch Mal nachlegen. Wer ist denn sonst noch investiert?? Was ist mit chirint, knollebauer und therman?
Wie sehr ihr die jüngste Entwicklung?
Gruß, Stammzelle.
besonders der dieser Satz gefällt mir:
Thus combining these two agents with distinct anti-angiogenic mechanisms provides enhanced anti-tumor effects and completely eradicates tumors in mice, resulting in dramatic improvement in survival.

Der Turmor wird komplett abgetötet!!!
Ich weiß, es ist alles noch Zukunftsmusik, aber der Newsflow der jüngsten Zeit ist echt vielversprechend.

Endlich merkt man, dass es vorangeht. Werde auf alle Fälle in der nächsten Zeit noch Mal nachlegen. Wer ist denn sonst noch investiert?? Was ist mit chirint, knollebauer und therman?
Wie sehr ihr die jüngste Entwicklung?
Gruß, Stammzelle.
Antwort auf Beitrag Nr.: 24.049.168 von Stammzelle am 19.09.06 20:33:41
moin,
keine Sorge ich bleib dabei - hoffe, dass heute die letzte Chance ist günstig reinzukommen , endlich mal ne Meldung für die Germans
Gruß
Knolle

moin,
keine Sorge ich bleib dabei - hoffe, dass heute die letzte Chance ist günstig reinzukommen , endlich mal ne Meldung für die Germans

Gruß
Knolle
Hi,
wie immer sehr ruhig hier im Thread. Auch die jüngste Kursentwicklung ist ja eher langweilig. Es scheint sich derzeit ein Boden im Bereich von 4,4 USD aus zu bilden. Immerhin...
Bin jetzt schon seit knapp drei Jahren in INGN investiert. Man braucht wohl noch ein wenig Ausdauer. Allerdings muss man zugeben, dass die Pipeline, die man auf der überarbeiteten Homepage schön nachvollziehen kann, in den letzten Jahren schön fortgeschritten ist. Meiner Ansicht nach sieht alles recht hoffnungsvoll aus. Insbesondere dann, wenn Bush sich endlich bewegt und die Gentherapie endlich auch fördert.
Als ich damals in INGN eingestiegen bin, hieß es immer, ob es nicht besser sei, in Onyx Pharmaceuticals ein zu steigen. Beide hatten einen Wirkstoff gegen Krebs im Hals- und Nackenansatz im fortgeschrittenen Versuchsstadium. Onyx wurde damals aber die bessere Pipeline attestiert.
Rückblickend muss man feststellen, dass man mit Onyx zwischenzeitlich sehr viel Geld hätte verdienen können. Allerdings hätte man anschließend auch wieder sehr viel verlieren können, wenn man sich die Berg- und Talfahrt des Kursverlauf einmal vor Augen hält.
Denke, dass bald beide pari sein werden...
Denke, dass sich auch die Pipeline von INGN zwischenzeitlich wirklich sehen lassen kann.
Allen Investierten ein erfolgreiches Jahr 2007!!!
Gruß, Stammzelle.
wie immer sehr ruhig hier im Thread. Auch die jüngste Kursentwicklung ist ja eher langweilig. Es scheint sich derzeit ein Boden im Bereich von 4,4 USD aus zu bilden. Immerhin...
Bin jetzt schon seit knapp drei Jahren in INGN investiert. Man braucht wohl noch ein wenig Ausdauer. Allerdings muss man zugeben, dass die Pipeline, die man auf der überarbeiteten Homepage schön nachvollziehen kann, in den letzten Jahren schön fortgeschritten ist. Meiner Ansicht nach sieht alles recht hoffnungsvoll aus. Insbesondere dann, wenn Bush sich endlich bewegt und die Gentherapie endlich auch fördert.
Als ich damals in INGN eingestiegen bin, hieß es immer, ob es nicht besser sei, in Onyx Pharmaceuticals ein zu steigen. Beide hatten einen Wirkstoff gegen Krebs im Hals- und Nackenansatz im fortgeschrittenen Versuchsstadium. Onyx wurde damals aber die bessere Pipeline attestiert.
Rückblickend muss man feststellen, dass man mit Onyx zwischenzeitlich sehr viel Geld hätte verdienen können. Allerdings hätte man anschließend auch wieder sehr viel verlieren können, wenn man sich die Berg- und Talfahrt des Kursverlauf einmal vor Augen hält.
Denke, dass bald beide pari sein werden...
Denke, dass sich auch die Pipeline von INGN zwischenzeitlich wirklich sehen lassen kann.
Allen Investierten ein erfolgreiches Jahr 2007!!!

Gruß, Stammzelle.
Hi,
hat jemand Infos, was hinter dem kapitalen Kursplus von 10,95 % vom vergangenen Freitag steht? Das Plus entstand unter ungewöhnlich hohem Volumen.
Kann mich nicht erinnern, dass 1.100.818 Shares gehandelt wurden, ohne dass eine News herausgegeben wurde.
Vielleicht stehen ja endlich einmal bahnrechende News an...?!
Gruß, Stammzelle.
hat jemand Infos, was hinter dem kapitalen Kursplus von 10,95 % vom vergangenen Freitag steht? Das Plus entstand unter ungewöhnlich hohem Volumen.
Kann mich nicht erinnern, dass 1.100.818 Shares gehandelt wurden, ohne dass eine News herausgegeben wurde.
Vielleicht stehen ja endlich einmal bahnrechende News an...?!

Gruß, Stammzelle.
Hi,
wieder einmal eine sehr Erfolg versprechende Nachricht, die INGN da heute veröffentlicht hat. Man hat über präklinische Tests von INGN241 in Kombination mit Avastin von Roche berichtet.
Die Studie habe gezeigt, dass die Kombination von INGN 241 und von Avastin sehr wirkungsvoll ist.
Die Resultate zeigen an, dass Tumore vollständig innerhalb der ersten vier Wochen der Behandlung zurückgegangen und dass kein neues Wachstum nach Beendigung der Therapie beobachtet worden sei.
Wenn ich alles richtig verstanden habe, hemmen sowohl INGN241 als auch Avastin sogenannte VEGF ("vascular endothelial Growth Factor")
Der vaskuläre endotheliale Wachstumsfaktor ist ein Polypeptid. Es stimuliert das Einsprießen von Blutgefäßen. Neben der normalen physiologischen Funktion ist VEGF auch ein Botenstoff in der Vaskularisation maligner Prozesse.
Avastin als immerhin schon zugelassenes Medikament (therapeutischer Antikörper) hemmt die Bildung von Blutgefäßen (Angiogenesis), indem
es diese Gefäße zuschnürt und die Aktivität der VEGF damit hemmt. Dadurch werden die Tumore aber nicht ausgerottet.
INGN241 scheint an sich auch ein Hemmer für die VEGF zu sein. Dabei wird Angiogenesis blockiert, indem es die Produktion von VEGF hemmt.
Die Studie habe ergeben, dass die Kombination von INGN 241 und Avastin eine komplette Tumorhemmung und -rückbildung ergibt.
Für mich sind die sogenannten Medikamenten-Cocktails ohnehin eine DER zukunftsweisenden Richtungen. Es könnte sich mit diesen sich offenbar sehr gut ergänzenden anti-antiogenic-Therapien ein Mega-Blockbuster entwickeln.
Nach Bekanntwerden dieser Ergenisse schnellte der INGN-Kurs innerhalb kürzester Zeit von knapp über 5,- USD auf 6,25 USD. Sehr viele Shares wechselten die Besitzer.
Denke, dass wir mit ein wenig Geduld noch sehr, sehr viel Freude mit INGN haben werden. Werde in naher Zukunft noch einmal aufstocken.
Gruß, Stammzelle.
wieder einmal eine sehr Erfolg versprechende Nachricht, die INGN da heute veröffentlicht hat. Man hat über präklinische Tests von INGN241 in Kombination mit Avastin von Roche berichtet.

Die Studie habe gezeigt, dass die Kombination von INGN 241 und von Avastin sehr wirkungsvoll ist.
Die Resultate zeigen an, dass Tumore vollständig innerhalb der ersten vier Wochen der Behandlung zurückgegangen und dass kein neues Wachstum nach Beendigung der Therapie beobachtet worden sei.
Wenn ich alles richtig verstanden habe, hemmen sowohl INGN241 als auch Avastin sogenannte VEGF ("vascular endothelial Growth Factor")
Der vaskuläre endotheliale Wachstumsfaktor ist ein Polypeptid. Es stimuliert das Einsprießen von Blutgefäßen. Neben der normalen physiologischen Funktion ist VEGF auch ein Botenstoff in der Vaskularisation maligner Prozesse.
Avastin als immerhin schon zugelassenes Medikament (therapeutischer Antikörper) hemmt die Bildung von Blutgefäßen (Angiogenesis), indem
es diese Gefäße zuschnürt und die Aktivität der VEGF damit hemmt. Dadurch werden die Tumore aber nicht ausgerottet.
INGN241 scheint an sich auch ein Hemmer für die VEGF zu sein. Dabei wird Angiogenesis blockiert, indem es die Produktion von VEGF hemmt.
Die Studie habe ergeben, dass die Kombination von INGN 241 und Avastin eine komplette Tumorhemmung und -rückbildung ergibt.
Für mich sind die sogenannten Medikamenten-Cocktails ohnehin eine DER zukunftsweisenden Richtungen. Es könnte sich mit diesen sich offenbar sehr gut ergänzenden anti-antiogenic-Therapien ein Mega-Blockbuster entwickeln.

Nach Bekanntwerden dieser Ergenisse schnellte der INGN-Kurs innerhalb kürzester Zeit von knapp über 5,- USD auf 6,25 USD. Sehr viele Shares wechselten die Besitzer.
Denke, dass wir mit ein wenig Geduld noch sehr, sehr viel Freude mit INGN haben werden. Werde in naher Zukunft noch einmal aufstocken.

Gruß, Stammzelle.
Antwort auf Beitrag Nr.: 27.160.634 von Stammzelle am 24.01.07 21:04:54Hallo Zelle,
habe 2 Werte im Depot , wo ich garnichtmehr hingucke, weil die kommen auf jeden Fall - ingn mit Käufen zw. 7 und 5 $ ,bis zur Rente ohne Stress
alles Gute
Knolle

habe 2 Werte im Depot , wo ich garnichtmehr hingucke, weil die kommen auf jeden Fall - ingn mit Käufen zw. 7 und 5 $ ,bis zur Rente ohne Stress

alles Gute
Knolle
Antwort auf Beitrag Nr.: 27.176.633 von Knollebauer am 25.01.07 13:51:04Hi Knolle,
super, dass du noch investiert bist. Schön, dass du Mal den in letzter Zeit erfreulichen Chart eingestellt hast.
Mir geht es bei INGN ähnlich wie dir. Bin mir ganz sicher, dass die Rakete zünden wird. Braucht noch gar nicht so weit sein. Für meinen Geschmack bin ich noch ein wenig unterinvestiert und möchte noch Mal nachlegen!
INGN ist allerdings der einzige Wert, bei dem ich so ruhig warten kann. Die anderen sind noch riskanter und lassen mich schön des Öfteren in mein Depot schauen.
Welcher Wert in deinem Depot lässt dich denn noch ruhig schlafen?
Gruß, Stammzelle.
super, dass du noch investiert bist. Schön, dass du Mal den in letzter Zeit erfreulichen Chart eingestellt hast.
Mir geht es bei INGN ähnlich wie dir. Bin mir ganz sicher, dass die Rakete zünden wird. Braucht noch gar nicht so weit sein. Für meinen Geschmack bin ich noch ein wenig unterinvestiert und möchte noch Mal nachlegen!

INGN ist allerdings der einzige Wert, bei dem ich so ruhig warten kann. Die anderen sind noch riskanter und lassen mich schön des Öfteren in mein Depot schauen.
Welcher Wert in deinem Depot lässt dich denn noch ruhig schlafen?
Gruß, Stammzelle.
Neue Untersuchungsergebnisse: http://biz.yahoo.com/bw/070129/20070129005138.html?.v=1
Introgen's INGN 225 Molecular Cancer Vaccine Demonstrates Promising Results in Phase 2 Trial
Monday January 29, 9:30 am ET
AUSTIN, Texas--(BUSINESS WIRE)--Approximately half of patients with advanced small cell lung cancer responded to Introgen Therapeutics, Inc.'s (NASDAQ:INGN - News) INGN 225 molecular cancer vaccine in combination with subsequent chemotherapy. The encouraging Phase 2 clinical data were presented over the weekend by Introgen's collaborator Dr. Scott Antonia of the H. Lee Moffitt Cancer Center & Research Institute. Patients in the study achieved a 52 percent objective tumor response rate and 41 percent of patients were still alive one year after receiving the immunotherapy. Historically, tumor responses to second-line chemotherapy are between 6 and 30 percent and most patients survive for less than 6 months. The data imply that INGN 225 immunotherapy can sensitize cancer cells to the effects of chemotherapy restoring its effectiveness. INGN 225 is a cancer vaccine containing the p53 gene. p53 is called the "Guardian of the Genome," and is known to help restore normal cellular function and to promote apoptosis, or programmed cell death in abnormal cells such as cancer cells, allowing tumors to die when treated with chemotherapy.
Dr. Antonia, associate professor in the Department of Interdisciplinary Oncology and Molecular Medicine, reported the data during the Fourth Biennial Meeting of Molecular Targets in Cancer Therapy in Clearwater Beach, Florida. An interim analysis of the phase 2 clinical trial was previously published in the medical journal Clinical Cancer Research.
"Data from Introgen's study in lung cancer patients, as well as other published studies, supports the novel approach of using a combination of immunotherapy and chemotherapy to treat cancer patients," said Dr. Dmitry Gabrilovich, also of H. Lee Moffitt Cancer Center & Research Institute, organizer of the conference and co-principal investigator of the clinical trial. "INGN 225 sensitized tumors to the effects of platinum and taxane chemotherapies. Of particular interest, some patients who previously failed platinum chemotherapy responded to platinum re-treatment. These findings have important implications for improving the efficacy of these widely utilized cancer chemotherapies."
INGN 225 is an immunotherapy (vaccine) that utilizes an adenovector to deliver the p53 gene to a patient's immune cells, stimulating an anti-tumor immune response. Induction of p53-specific immune responses were observed following INGN 225 therapy and were found to correlate with increased tumor responses to the administered chemotherapy.
Gruß Cyberhai
Introgen's INGN 225 Molecular Cancer Vaccine Demonstrates Promising Results in Phase 2 Trial
Monday January 29, 9:30 am ET
AUSTIN, Texas--(BUSINESS WIRE)--Approximately half of patients with advanced small cell lung cancer responded to Introgen Therapeutics, Inc.'s (NASDAQ:INGN - News) INGN 225 molecular cancer vaccine in combination with subsequent chemotherapy. The encouraging Phase 2 clinical data were presented over the weekend by Introgen's collaborator Dr. Scott Antonia of the H. Lee Moffitt Cancer Center & Research Institute. Patients in the study achieved a 52 percent objective tumor response rate and 41 percent of patients were still alive one year after receiving the immunotherapy. Historically, tumor responses to second-line chemotherapy are between 6 and 30 percent and most patients survive for less than 6 months. The data imply that INGN 225 immunotherapy can sensitize cancer cells to the effects of chemotherapy restoring its effectiveness. INGN 225 is a cancer vaccine containing the p53 gene. p53 is called the "Guardian of the Genome," and is known to help restore normal cellular function and to promote apoptosis, or programmed cell death in abnormal cells such as cancer cells, allowing tumors to die when treated with chemotherapy.
Dr. Antonia, associate professor in the Department of Interdisciplinary Oncology and Molecular Medicine, reported the data during the Fourth Biennial Meeting of Molecular Targets in Cancer Therapy in Clearwater Beach, Florida. An interim analysis of the phase 2 clinical trial was previously published in the medical journal Clinical Cancer Research.
"Data from Introgen's study in lung cancer patients, as well as other published studies, supports the novel approach of using a combination of immunotherapy and chemotherapy to treat cancer patients," said Dr. Dmitry Gabrilovich, also of H. Lee Moffitt Cancer Center & Research Institute, organizer of the conference and co-principal investigator of the clinical trial. "INGN 225 sensitized tumors to the effects of platinum and taxane chemotherapies. Of particular interest, some patients who previously failed platinum chemotherapy responded to platinum re-treatment. These findings have important implications for improving the efficacy of these widely utilized cancer chemotherapies."
INGN 225 is an immunotherapy (vaccine) that utilizes an adenovector to deliver the p53 gene to a patient's immune cells, stimulating an anti-tumor immune response. Induction of p53-specific immune responses were observed following INGN 225 therapy and were found to correlate with increased tumor responses to the administered chemotherapy.
Gruß Cyberhai
Antwort auf Beitrag Nr.: 27.178.142 von Stammzelle am 25.01.07 15:09:14Moin Zelle,
schöner Tag gestern - bei uns Frühling
- bei uns Frühling
deine Frage könnt ich ja mit Marius beantworten: die dt. Bank, denn die zahlt aus in bar
 aber wer gestern wieder ackermann gesehen hat .....ich könnt k..... hauptsache die bilanzen stimmen
aber wer gestern wieder ackermann gesehen hat .....ich könnt k..... hauptsache die bilanzen stimmen 

aber mal ernsthaft der andere "Rentenwert" - ganz andere Baustelle und nicht nur weil ich 2 Trecker mit dem Namen auf der Haube habe :
na, klingelt's ?
deutz
weiterhin alles Gute
Gruß
Knolle
schöner Tag gestern
 - bei uns Frühling
- bei uns Frühlingdeine Frage könnt ich ja mit Marius beantworten: die dt. Bank, denn die zahlt aus in bar

 aber wer gestern wieder ackermann gesehen hat .....ich könnt k..... hauptsache die bilanzen stimmen
aber wer gestern wieder ackermann gesehen hat .....ich könnt k..... hauptsache die bilanzen stimmen 

aber mal ernsthaft der andere "Rentenwert" - ganz andere Baustelle und nicht nur weil ich 2 Trecker mit dem Namen auf der Haube habe :
na, klingelt's ?
deutz
weiterhin alles Gute
Gruß
Knolle
Hi,
gibt es eigentlich einen plausiblen Grund für den doch nicht geringen Kursverlust?
Negative News oder auch Insiderverkäufe sind ja nicht zu registrieren gewesen.
Bei 2,50 € kaufe ich vielleicht noch mal nach...
Gruß, Stammzelle.
gibt es eigentlich einen plausiblen Grund für den doch nicht geringen Kursverlust?
Negative News oder auch Insiderverkäufe sind ja nicht zu registrieren gewesen.
Bei 2,50 € kaufe ich vielleicht noch mal nach...
Gruß, Stammzelle.
Antwort auf Beitrag Nr.: 28.331.741 von Stammzelle am 16.03.07 17:51:35Hallo Stammzelle,
vielleicht können die Insider gar nicht verkaufen, weil die Aktien an ein bestimmtes Optionsprogramm gebunden sind. Jedenfalls will keiner zukaufen bzw. nur dann, wenn es die Aktien billig über Optionen gibt...
Aventis hat seit Sept. 06 keine Aktien mehr verkauft, obwohl die noch ca. 3,7 Stück haben: http://biz.yahoo.com/t/37/7028.html.
Der Kursverfall ist sicherlich darauf zurückzuführen, dass die Investoren es langsam leid sind, von Jahr zu Jahr bezüglich dem Wirkstoff Advexin vertröstet zu werden. Dies beschreibt z.B. ziemlich gut folgender Bericht: http://www.thestreet.com/_yahoo/newsanalysis/biotech/1034295…
Ich bin ehrlich gesagt auch ziemlich enttäuscht und hatte bereits mit dem Gedanken gespielt, einen Teil zu verkaufen. Ich bleibe jedoch vorerst noch voll investiert.
Gruß Cyberhai
vielleicht können die Insider gar nicht verkaufen, weil die Aktien an ein bestimmtes Optionsprogramm gebunden sind. Jedenfalls will keiner zukaufen bzw. nur dann, wenn es die Aktien billig über Optionen gibt...
Aventis hat seit Sept. 06 keine Aktien mehr verkauft, obwohl die noch ca. 3,7 Stück haben: http://biz.yahoo.com/t/37/7028.html.
Der Kursverfall ist sicherlich darauf zurückzuführen, dass die Investoren es langsam leid sind, von Jahr zu Jahr bezüglich dem Wirkstoff Advexin vertröstet zu werden. Dies beschreibt z.B. ziemlich gut folgender Bericht: http://www.thestreet.com/_yahoo/newsanalysis/biotech/1034295…
Ich bin ehrlich gesagt auch ziemlich enttäuscht und hatte bereits mit dem Gedanken gespielt, einen Teil zu verkaufen. Ich bleibe jedoch vorerst noch voll investiert.
Gruß Cyberhai
Guten Abend,
ich bin bei meinen Recherchen auf einen Artikel in der renommierten Zeitschrift TIME gestoßen, dem zufolge sich Introgen eines ähnlich wirkenden Konkurrenzproduktes aus China namens Gendicine (entwickelt von der Shenzhen SiBiono GeneTech Co.) erwehren muss. Der Autor mutmaßt, dass Introgen angesichts der beim Konkurrenten geringeren Entwicklungszeit und niedrigeren Kosten den Wettlauf verlieren wird.
Siehe http://www.time.com/time/magazine/article/0,9171,1549366-1,0… vom 23.10.2006, aber hier bisher noch nicht diskutiert.
Gibt es dazu Meinungen?
Gruß von Wilhelm Bartsch, Kunstmaler
ich bin bei meinen Recherchen auf einen Artikel in der renommierten Zeitschrift TIME gestoßen, dem zufolge sich Introgen eines ähnlich wirkenden Konkurrenzproduktes aus China namens Gendicine (entwickelt von der Shenzhen SiBiono GeneTech Co.) erwehren muss. Der Autor mutmaßt, dass Introgen angesichts der beim Konkurrenten geringeren Entwicklungszeit und niedrigeren Kosten den Wettlauf verlieren wird.
Siehe http://www.time.com/time/magazine/article/0,9171,1549366-1,0… vom 23.10.2006, aber hier bisher noch nicht diskutiert.
Gibt es dazu Meinungen?
Gruß von Wilhelm Bartsch, Kunstmaler
 Starker Anstieg!
Starker Anstieg!
Hi,
finde den jüngsten Kursanstieg bei verhältnismäßig hohen Umsätzen an der Nasdaq auch bemerkenswert.
Der Anstieg erfolgt, ohne dass offizielle News rausgekommen sind. Bin gespannt, wie die weitere Entwicklung aussehen wird.
Habe geträumt, dass INGN den Kursverlauf von Dendreon Corp. kopieren wird. Übrigens: Warum sollte das nicht irgendwann einmal der Fall sein?
INGN241 beispielsweise sorgt in Kombination anderer Medikationen - so z.B. das von Roche und Genentech entwickelte Avastin - ja schon für viel Fantasie (siehe mein Posting #74)!
Auch bin ich für Advexin immer noch positiv gestimmt. Natürlich ist es nicht gut, wenn die Investoren bzgl. dessen Zulassung immer wieder vertröstet werden.
Im Grunde hat Provenge von Dendreon die Zulassung völlig überraschend erhalten.
Möglicherweise will die FDA aber Patienten mit schweren Krebs-Erkrankungen den Zugang zu hoffnungsvollen Medikationen nicht durch eine (allzu) starre Zulassungspolitik im Wege stehen.
Meiner Ansicht nach steckt in INGN ähnliches Potential. Niemand würde kurzfristig mit einer Zulassung von Advexin rechnen. Wenn sie aber doch einmal plötzlich und unerwartet kommen sollte, sollte man sich eingedeckt haben.
Meiner Ansicht nach sollte man in jedem Fall ein paar Shares im Depot haben und einfach liegen lassen. Ist aber nur die persönliche Meinung eines völlig Außenstehenden!
Gruß, Stammzelle.
finde den jüngsten Kursanstieg bei verhältnismäßig hohen Umsätzen an der Nasdaq auch bemerkenswert.
Der Anstieg erfolgt, ohne dass offizielle News rausgekommen sind. Bin gespannt, wie die weitere Entwicklung aussehen wird.
Habe geträumt, dass INGN den Kursverlauf von Dendreon Corp. kopieren wird. Übrigens: Warum sollte das nicht irgendwann einmal der Fall sein?
INGN241 beispielsweise sorgt in Kombination anderer Medikationen - so z.B. das von Roche und Genentech entwickelte Avastin - ja schon für viel Fantasie (siehe mein Posting #74)!
Auch bin ich für Advexin immer noch positiv gestimmt. Natürlich ist es nicht gut, wenn die Investoren bzgl. dessen Zulassung immer wieder vertröstet werden.
Im Grunde hat Provenge von Dendreon die Zulassung völlig überraschend erhalten.
Möglicherweise will die FDA aber Patienten mit schweren Krebs-Erkrankungen den Zugang zu hoffnungsvollen Medikationen nicht durch eine (allzu) starre Zulassungspolitik im Wege stehen.
Meiner Ansicht nach steckt in INGN ähnliches Potential. Niemand würde kurzfristig mit einer Zulassung von Advexin rechnen. Wenn sie aber doch einmal plötzlich und unerwartet kommen sollte, sollte man sich eingedeckt haben.
Meiner Ansicht nach sollte man in jedem Fall ein paar Shares im Depot haben und einfach liegen lassen. Ist aber nur die persönliche Meinung eines völlig Außenstehenden!
Gruß, Stammzelle.
Antwort auf Beitrag Nr.: 28.615.438 von MalerWilhelmBartsch am 01.04.07 23:14:03Hallo!
Lt. Thread: Bahnbrechende News ! Erstes Gentherapeutikum zugelassen! hat Introgen die weltweiten Patente außer China.
@Stammzelle: Schöne Zusammenfassung, ich sehe die derzeitige Situation gleich
Gruß Cyberhai
Lt. Thread: Bahnbrechende News ! Erstes Gentherapeutikum zugelassen! hat Introgen die weltweiten Patente außer China.
@Stammzelle: Schöne Zusammenfassung, ich sehe die derzeitige Situation gleich

Gruß Cyberhai
Antwort auf Beitrag Nr.: 28.745.792 von Stammzelle am 10.04.07 20:02:35Provenge hat nicht die Zulassung erhalten, sondern wurde zum Zulassungsverfahren zugelassen. Das Ergebniss wird es vermutlich am 15.5 geben.
Antwort auf Beitrag Nr.: 28.752.377 von wohinistmeinGeld am 11.04.07 09:47:28Hi wohin...
hast natürlich recht.
Dennoch folgt die FDA der Empfehlung des Advisory-Komitees im Normalfall. Die Entscheidung dieses Komitees fiel doch recht überwältigend aus.
Auch wenn natürlich ein Restrisiko bleibt - die Wahrscheinlichkeit der endgültigen Zulassung würde ich schon als recht hoch bezeichnen.
Gruß, Stammzelle.
hast natürlich recht.
Dennoch folgt die FDA der Empfehlung des Advisory-Komitees im Normalfall. Die Entscheidung dieses Komitees fiel doch recht überwältigend aus.
Auch wenn natürlich ein Restrisiko bleibt - die Wahrscheinlichkeit der endgültigen Zulassung würde ich schon als recht hoch bezeichnen.
Gruß, Stammzelle.
Antwort auf Beitrag Nr.: 28.766.170 von Stammzelle am 11.04.07 22:19:39Das dachte ich auch mal. Ich war in Hana als mitten im Zulassungsverfahren, 2 Monate vorm Termin, die Hiobsbotschaft von Abbruch des Zulassungsverfahren kam

Antwort auf Beitrag Nr.: 28.766.889 von wohinistmeinGeld am 11.04.07 22:50:37Hi wohin...,
komischerweise trifft es immer wieder Empfehlungen aus Förtsch's Maganzin DER AKTIONÄR (YM Bio, Hana)...
Gruß, Stammzelle.
komischerweise trifft es immer wieder Empfehlungen aus Förtsch's Maganzin DER AKTIONÄR (YM Bio, Hana)...
Gruß, Stammzelle.
Antwort auf Beitrag Nr.: 28.783.618 von Stammzelle am 12.04.07 20:54:12ist da Introgen auch dabei? Ich schau da selten rein.
Hoffentlich geht das bei Dendreon nicht schief, sonst würden sicher alle Krebsaktien mit runter gezogen. Ich habe vor ca. 1 Monat aufgestockt, aber ich muß zugeben, daß ich dieses Tief zum Kauf erwischt habe ist reiner Zufall, ich hatte viel Geld von meiner Flucht aus Hana übrig und habe das auf verschiedene Werte verteilt.
Ich hatte noch Dendreon im Auge, da war ich vor ein paar JAhren schon mal drin, aber es fällt mir schwer in eine Aktie zurück zu gehen aus der ich wegen negativer Nachrichten mal raus bin.
In nächster Zeit kommen einige Cancer-meetings, wenn da noch ein paar gute Sachen dabei sind könnte der Anstieg weiter gehen, außerdem sind die Krebsaktien lange genug underperformt. Das Abkommen mit NCI hilft auch noch ein wenig nach.

Hoffentlich geht das bei Dendreon nicht schief, sonst würden sicher alle Krebsaktien mit runter gezogen. Ich habe vor ca. 1 Monat aufgestockt, aber ich muß zugeben, daß ich dieses Tief zum Kauf erwischt habe ist reiner Zufall, ich hatte viel Geld von meiner Flucht aus Hana übrig und habe das auf verschiedene Werte verteilt.

Ich hatte noch Dendreon im Auge, da war ich vor ein paar JAhren schon mal drin, aber es fällt mir schwer in eine Aktie zurück zu gehen aus der ich wegen negativer Nachrichten mal raus bin.

In nächster Zeit kommen einige Cancer-meetings, wenn da noch ein paar gute Sachen dabei sind könnte der Anstieg weiter gehen, außerdem sind die Krebsaktien lange genug underperformt. Das Abkommen mit NCI hilft auch noch ein wenig nach.
AP
Introgen Cites Positive Study Results
Tuesday April 17, 5:23 pm ET
Introgen Therapeutics Cites Positive Early Study Data on Lung Cancer Trial for FUS1
AUSTIN, Texas (AP) -- Biopharmaceutical company Introgen Therapeutics Inc. said Tuesday it saw positive results from an early-stage study of its cancer treatment candidate FUS1.
The Phase I clinical trial, involving 13 people, showed the treatment had no significant side effects and showed a median survival time of 14.6 months in late-stage lung cancer patients. That compares with a 7-month median survival rate for patients receiving second-line therapy.
The clinical trial is continuing and no maximum tolerated dose has been determined.
Shares of Introgen rose 24 cents, or 4.7 percent, to $5.40 in after-hours trading after rising 28 cents, or 5.7 percent, to close at $5.16 on the Nasdaq Stock Market.
Introgen Cites Positive Study Results
Tuesday April 17, 5:23 pm ET
Introgen Therapeutics Cites Positive Early Study Data on Lung Cancer Trial for FUS1
AUSTIN, Texas (AP) -- Biopharmaceutical company Introgen Therapeutics Inc. said Tuesday it saw positive results from an early-stage study of its cancer treatment candidate FUS1.
The Phase I clinical trial, involving 13 people, showed the treatment had no significant side effects and showed a median survival time of 14.6 months in late-stage lung cancer patients. That compares with a 7-month median survival rate for patients receiving second-line therapy.
The clinical trial is continuing and no maximum tolerated dose has been determined.
Shares of Introgen rose 24 cents, or 4.7 percent, to $5.40 in after-hours trading after rising 28 cents, or 5.7 percent, to close at $5.16 on the Nasdaq Stock Market.
das Elend hier kann man auch nicht mehr mit ansehen, zum Glück hatte ich hier nur ein kleines Taschengeld investiert

Introgen and Clinical Collaborators to Report New Results with Advanced-Stage Cancer Therapies at Upcoming Medical Meetings
Updated Phase 2 Tumor Response and Survival Data with ADVEXIN(R), INGN 225 and INGN 241 to Be Presented at ASCO and ASGT
AUSTIN, Texas--(BUSINESS WIRE)--May 29, 2007--Introgen Therapeutics, Inc. (NASDAQ:INGN) and the Company's clinical collaborators will report updated Phase 2 clinical trial results for its lead cancer therapy product candidates at the upcoming annual meetings of The American Society of Clinical Oncology (ASCO) in Chicago and the American Society of Gene Therapy (ASGT) in Seattle.
"We have a stronger than ever, advancing pipeline of first-in-class cancer therapies generating exciting data that could change the way cancer is treated and fulfill the promise of molecularly targeted cancer therapy," said Robert E. Sobol, M.D., senior vice president of Medical and Scientific Affairs at Introgen. "We have multiple Phase 3 programs either underway or planned with the goal of bringing these therapies to market to provide new treatments for widely underserved patient populations that are effective, generally well tolerated and can be easily combined and act synergistically with standard therapies by or before the end of this decade."
ASCO
-- Final results of a phase II trial of patients with extensive
stage small cell lung cancer (ES-SCLC) immunized with wild
type -p53 transduced dendritic cells after first-line
chemotherapy, Abstract #3012: Poster presentation on Sun.,
June 3, from 2:00 - 6:00 p.m. in room S102a at McCormick
Place, by lead author Alberto Chiappori, M.D., H. Lee Moffitt
Cancer Center and Research Institute.
-- Tumor response criteria and biomarkers associated with
increased survival following adenoviral p53 gene therapy
(ADVEXIN) in patients with recurrent squamous cell carcinoma
of the head and neck, Abstract #6057: Poster presentation on
Mon., June 4, from 1:00 - 5:00 p.m. at McCormick Place by lead
author John Nemunaitis, M.D., Mary Crowley Medical Research
Center and poster presentation by Robert Sobol, M.D., Introgen
Therapeutics, Inc.
ASGT
-- Role of the Immune System in Replicating Adenovirus Using a
Permissive Immune Competent Syrian Hamster Model, William
Wold, Ph.D., St. Louis University School of Medicine:
Presentation on Thurs., May 31, from 9:30 - 11:30 a.m. at
Washington State Convention Center during symposium titled
"Cancer: Hot Topics in Cancer Gene Therapy"
-- MDA-7 (INGN-241) Kills Chemoresistant Cancer Cells and
Restores Chemosensitivity to Cisplatin, Abstract #197:
Presentation during "Cancer: Apoptosis and Suicide" poster
session on Thurs., May 31, from 5:00 - 8:00 p.m. at Washington
State Convention Center by Rajagopal Ramesh, Ph.D., M. D.
Anderson Cancer Center
-- Effect of Pre-existing Anti-Adenovirus Immunity and Anti-Tumor
Immunity on the Efficacy of Adenovirus Vectors in
Immunocompetent Syrian Hamster Model, Abstract #668:
Presentation during "Immune Responses to Adenoviral Vectors"
poster session on Fri, June 1, from 5:15- 8:15 p.m. in Hall
4AB at Washington State Convention Center by Debanjan Dhar,
St. Louis University School of Medicine
-- Anticancer Activity of Oncolytic Adenovirus Vector Armed with
IFN-alpha and ADP is Enhanced by Pharmacologically-Controlled
Expression of TRAIL, Abstract #588: Presentation during
"Cancer Immunotherapy II" poster session on Fri., June 1, 2007
from 5:15 - 8:15 p.m. in Hall 4AB at Washington State
Convention Center by Elena V. Shashkova, VirRx, Inc.
-- Clinical Experience with the mda-7/IL-24 Tumor Suppressor,
Abstract # 380: Presentation during "Tumor Suppressor and
Targeted Gene Therapy" poster session and oral presentation on
Friday, June 1, 2007 at 8:45 a.m. at the Washington State
Convention Center by Sunil Chada, Ph.D., Introgen
Therapeutics, Inc.
About Introgen Therapeutics, Inc.
Introgen Therapeutics, Inc. is a biopharmaceutical company focused on the discovery, development and commercialization of targeted molecular therapies for the treatment of cancer and other diseases. Introgen is developing molecular therapeutics, immunotherapies, vaccines and nano-particle tumor suppressor therapies to treat a wide range of cancers using tumor suppressors, cytokines and genes. Introgen maintains integrated research, development, manufacturing, clinical and regulatory departments and operates multiple manufacturing facilities including a commercial scale cGMP manufacturing facility.
Statements in this release that are not strictly historical may be "forward-looking" statements, including those relating to Introgen's future success with its ADVEXIN, INGN 241, and INGN 007 clinical development programs. The actual results may differ from those described in this release due to risks and uncertainties that exist in Introgen's operations and business environment, including Introgen's stage of product development and the limited experience in the development of gene-based drugs in general, dependence upon proprietary technology and the current competitive environment, history of operating losses and accumulated deficits, reliance on collaborative relationships, and uncertainties related to clinical trials, the safety and efficacy of Introgen's product candidates, the ability to obtain the appropriate regulatory approvals, Introgen's patent protection and market acceptance, as well as other risks detailed from time to time in Introgen's filings with the Securities and Exchange Commission including its filings on Form 10-K and Form 10-Q. Introgen undertakes no obligation to publicly release the results of any revisions to any forward-looking statements that reflect events or circumstances arising after the date hereof.
Editor's Note: For more information on Introgen Therapeutics, or for a menu of archived press releases, please visit Introgen's Website at: www.introgen.com.
CONTACT:
Introgen Therapeutics, Inc., Austin
C. Channing Burke, 512-708-9310, ext. 322
c.burke@introgen.com
SOURCE:
Introgen Therapeutics, Inc.
News Releases
Media Contacts
Events
Information Request
E-mail Alerts
About Introgen | Clinical Trials | Contract Services | Investor Relations | PR / News | Technologies Powered by Dot Command Center, Inc.
© Copyright 2006. Introgen Therapeutics, Inc. All rights reserved. | Terms of Use | Privacy Policy Site Map | Contact Us
Updated Phase 2 Tumor Response and Survival Data with ADVEXIN(R), INGN 225 and INGN 241 to Be Presented at ASCO and ASGT
AUSTIN, Texas--(BUSINESS WIRE)--May 29, 2007--Introgen Therapeutics, Inc. (NASDAQ:INGN) and the Company's clinical collaborators will report updated Phase 2 clinical trial results for its lead cancer therapy product candidates at the upcoming annual meetings of The American Society of Clinical Oncology (ASCO) in Chicago and the American Society of Gene Therapy (ASGT) in Seattle.
"We have a stronger than ever, advancing pipeline of first-in-class cancer therapies generating exciting data that could change the way cancer is treated and fulfill the promise of molecularly targeted cancer therapy," said Robert E. Sobol, M.D., senior vice president of Medical and Scientific Affairs at Introgen. "We have multiple Phase 3 programs either underway or planned with the goal of bringing these therapies to market to provide new treatments for widely underserved patient populations that are effective, generally well tolerated and can be easily combined and act synergistically with standard therapies by or before the end of this decade."
ASCO
-- Final results of a phase II trial of patients with extensive
stage small cell lung cancer (ES-SCLC) immunized with wild
type -p53 transduced dendritic cells after first-line
chemotherapy, Abstract #3012: Poster presentation on Sun.,
June 3, from 2:00 - 6:00 p.m. in room S102a at McCormick
Place, by lead author Alberto Chiappori, M.D., H. Lee Moffitt
Cancer Center and Research Institute.
-- Tumor response criteria and biomarkers associated with
increased survival following adenoviral p53 gene therapy
(ADVEXIN) in patients with recurrent squamous cell carcinoma
of the head and neck, Abstract #6057: Poster presentation on
Mon., June 4, from 1:00 - 5:00 p.m. at McCormick Place by lead
author John Nemunaitis, M.D., Mary Crowley Medical Research
Center and poster presentation by Robert Sobol, M.D., Introgen
Therapeutics, Inc.
ASGT
-- Role of the Immune System in Replicating Adenovirus Using a
Permissive Immune Competent Syrian Hamster Model, William
Wold, Ph.D., St. Louis University School of Medicine:
Presentation on Thurs., May 31, from 9:30 - 11:30 a.m. at
Washington State Convention Center during symposium titled
"Cancer: Hot Topics in Cancer Gene Therapy"
-- MDA-7 (INGN-241) Kills Chemoresistant Cancer Cells and
Restores Chemosensitivity to Cisplatin, Abstract #197:
Presentation during "Cancer: Apoptosis and Suicide" poster
session on Thurs., May 31, from 5:00 - 8:00 p.m. at Washington
State Convention Center by Rajagopal Ramesh, Ph.D., M. D.
Anderson Cancer Center
-- Effect of Pre-existing Anti-Adenovirus Immunity and Anti-Tumor
Immunity on the Efficacy of Adenovirus Vectors in
Immunocompetent Syrian Hamster Model, Abstract #668:
Presentation during "Immune Responses to Adenoviral Vectors"
poster session on Fri, June 1, from 5:15- 8:15 p.m. in Hall
4AB at Washington State Convention Center by Debanjan Dhar,
St. Louis University School of Medicine
-- Anticancer Activity of Oncolytic Adenovirus Vector Armed with
IFN-alpha and ADP is Enhanced by Pharmacologically-Controlled
Expression of TRAIL, Abstract #588: Presentation during
"Cancer Immunotherapy II" poster session on Fri., June 1, 2007
from 5:15 - 8:15 p.m. in Hall 4AB at Washington State
Convention Center by Elena V. Shashkova, VirRx, Inc.
-- Clinical Experience with the mda-7/IL-24 Tumor Suppressor,
Abstract # 380: Presentation during "Tumor Suppressor and
Targeted Gene Therapy" poster session and oral presentation on
Friday, June 1, 2007 at 8:45 a.m. at the Washington State
Convention Center by Sunil Chada, Ph.D., Introgen
Therapeutics, Inc.
About Introgen Therapeutics, Inc.
Introgen Therapeutics, Inc. is a biopharmaceutical company focused on the discovery, development and commercialization of targeted molecular therapies for the treatment of cancer and other diseases. Introgen is developing molecular therapeutics, immunotherapies, vaccines and nano-particle tumor suppressor therapies to treat a wide range of cancers using tumor suppressors, cytokines and genes. Introgen maintains integrated research, development, manufacturing, clinical and regulatory departments and operates multiple manufacturing facilities including a commercial scale cGMP manufacturing facility.
Statements in this release that are not strictly historical may be "forward-looking" statements, including those relating to Introgen's future success with its ADVEXIN, INGN 241, and INGN 007 clinical development programs. The actual results may differ from those described in this release due to risks and uncertainties that exist in Introgen's operations and business environment, including Introgen's stage of product development and the limited experience in the development of gene-based drugs in general, dependence upon proprietary technology and the current competitive environment, history of operating losses and accumulated deficits, reliance on collaborative relationships, and uncertainties related to clinical trials, the safety and efficacy of Introgen's product candidates, the ability to obtain the appropriate regulatory approvals, Introgen's patent protection and market acceptance, as well as other risks detailed from time to time in Introgen's filings with the Securities and Exchange Commission including its filings on Form 10-K and Form 10-Q. Introgen undertakes no obligation to publicly release the results of any revisions to any forward-looking statements that reflect events or circumstances arising after the date hereof.
Editor's Note: For more information on Introgen Therapeutics, or for a menu of archived press releases, please visit Introgen's Website at: www.introgen.com.
CONTACT:
Introgen Therapeutics, Inc., Austin
C. Channing Burke, 512-708-9310, ext. 322
c.burke@introgen.com
SOURCE:
Introgen Therapeutics, Inc.
News Releases
Media Contacts
Events
Information Request
E-mail Alerts
About Introgen | Clinical Trials | Contract Services | Investor Relations | PR / News | Technologies Powered by Dot Command Center, Inc.
© Copyright 2006. Introgen Therapeutics, Inc. All rights reserved. | Terms of Use | Privacy Policy Site Map | Contact Us
Nachricht vom 30.05.2007 | 13:33 mal gelesen 30.05.07 13:33
Introgen´s ADVEXIN Demonstrates Clinical Benefit in Inherited Cancer
--------------------------------------------------------------------------------
16.04.07 13:29
Introgen Therapeutics Receives European Certification of its U.S. ADVEXIN(R) Production Facility
--------------------------------------------------------------------------------
Introgen´s ADVEXIN Demonstrates Clinical Benefit in Inherited Cancer
Introgen Therapeutics, Inc. (NASDAQ:INGN ) announced today the publication of data describing the dramatic clinical benefit of its lead product ADVEXIN in a patient with a rare inherited form of cancer known as Li-Fraumeni Syndrome (LFS), a genetic disorder characterized by inherited mutations in the p53 tumor suppressor gene. This is the first reported treatment of Li-Fraumeni tumors with a therapy targeted to the underlying molecular cause of the disorder. These cancers are due to inherited abnormalities of p53 function which is directly addressed by ADVEXIN treatment. In addition, the results of the study evaluated biomarkers which confirmed the molecular mechanism of activity of ADVEXIN. These biomarkers will guide ADVEXIN therapy of other cancers with p53 abnormalities, which is one of the most common molecular defects found in virtually all types of cancer.
The patient was treated as part of a study at the Mary Crowley Medical Research Center in Dallas, TX and the importance of the findings were underscored by publication this week in the Spotlight on Clinical Response editorial highlights section of the current issue of Molecular Cancer Therapeutics, a journal of the American Association for Cancer Research.
ADVEXIN treatment of a tumor in an LFS patient led to improvement of tumor-related symptoms and resulted in a complete response as determined by positron emission tomography (PET) scans. In addition, molecular biomarker studies using tumor biopsies before treatment detected abnormal levels of p53 protein predictive of ADVEXIN efficacy. Tumor biopsies analyzed after therapy identified restoration of p53 tumor suppressor function including suppression of tumor growth and induction of tumor cell death validating ADVEXIN´s mechanisms of action.
"This case study showcases and provides proof of the principle for the therapeutic application of targeted ADVEXIN therapy in tumors with p53 abnormalities that are among the most common and fundamental molecular defects in cancer," said Neil Senzer, M.D., Scientific Director, Mary Crowley Medical Research Center, and lead author of the article. "ADVEXIN´s mechanism of action is targeted to restoring p53 tumor suppressor function that is abnormal in Li-Fraumeni tumors and in many other types of cancer."
ADVEXIN is being developed for European markets by Gendux AB, a subsidiary of Introgen Therapeutics, Inc. The European Medicines Agency (EMEA) has designated, and the European Union has confirmed, ADVEXIN p53 therapy as an Orphan Drug for the treatment of LFS. A Letter of Intent to the EMEA regarding Marketing Authorization Application for the approval of ADVEXIN to treat LFS was filed under the Exceptional Circumstances Approval procedures in the EU.
Collaborators on this publication included clinicians from Mary Crowley Medical Research Center, Sammons Cancer Center, Baylor University Medical Center, The Royal Marsden Hospital NHS Foundation Trust, Imperial College London Hammersmith Campus, and the Institute of Cancer Research in the United Kingdom.
About Li-Fraumeni Syndrome
Approximately 400 families are affected by LFS annually. The majority of LFS families contain mutations in the p53 tumor suppressor gene. Affected individuals often develop multiple primary tumors, which typically occur at a young age. Conventional therapy of patients with the Li-Fraumeni Syndrome is frequently unsuccessful due to the occurrence of multiple malignancies that share a common p53 genetic defect fundamental to cancer progression and the development of treatment resistance. Defects in p53-mediated cell death pathways cause these tumors to develop resistance to standard therapy, resulting in early death. Additionally, because affected individuals lack p53-mediated DNA repair function, treatment with DNA damaging agents such as radiation and some types of chemotherapy can induce genetic changes that give rise to additional tumors.
About ADVEXIN
ADVEXIN p53 therapy is a targeted molecular therapy with broad applicability in a wide range of tumor types and clinical settings because it targets one of the most fundamental and common molecular defects, abnormal p53 tumor suppressor function, associated with cancer initiation, progression and treatment resistance. Prognostic biomarkers can identify patients most likely to respond to ADVEXIN. ADVEXIN has demonstrated clinical activity in a number of solid tumor types in multiple phase 1, 2 and 3 clinical trials conducted worldwide.
About Introgen Therapeutics, Inc.
Introgen Therapeutics, Inc. is a biopharmaceutical company focused on the discovery, development and commercialization of targeted molecular therapies for the treatment of cancer and other diseases. Introgen is developing molecular therapeutics, immunotherapies, vaccines and nano-particle therapies to treat a wide range of cancers using tumor suppressors and cytokines. Introgen maintains integrated research, development, manufacturing, clinical and regulatory departments and operates multiple manufacturing facilities including a commercial scale cGMP manufacturing facility.
Statements in this release that are not strictly historical may be "forward-looking" statements, including those relating to Introgen´s future success with its ADVEXIN clinical development program for the treatment of patients with Li-Fraumeni Syndrome. The actual results may differ from those described in this release due to risks and uncertainties that exist in Introgen´s operations and business environment, including Introgen´s stage of product development and the limited experience in the development of gene-based drugs in general, dependence upon proprietary technology and the current competitive environment, history of operating losses and accumulated deficits, reliance on collaborative relationships, and uncertainties related to clinical trials, the safety and efficacy of Introgen´s product candidates, the ability to obtain the appropriate regulatory approvals, Introgen´s patent protection and market acceptance, as well as other risks detailed from time to time in Introgen´s filings with the Securities and Exchange Commission including its filings on Form 10-K and Form 10-Q. Introgen undertakes no obligation to publicly release the results of any revisions to any forward-looking statements that reflect events or circumstances arising after the date hereof.
Editor´s Note: For more information on Introgen Therapeutics, or for a menu of archived press releases, please visit Introgen´s Website at: www.introgen.com.
© Business Wire
© Business Wire
Disclaimer wallstreet:online bietet Redakteuren, Agenturen und Unternehmen die Möglichkeit, Kommentare, Analysen und Nachrichten auf www.wallstreet-online.de zu veröffentlichen. Für diese Inhalte übernimmt die wallstreet:online AG weder Haftung noch Gewähr. Dies gilt insbesondere für unvollständige oder falsch wiedergegebene Meldungen, falsche Kursangaben und redaktionelle Versehen. Die Artikel stellen weder Kauf- bzw. Verkaufsempfehlungen dar, noch sind sie als Zusicherung etwaiger Kursentwicklungen zu verstehen. Die Artikel sind ausschließlich für die Leser von www.wallstreet-online.de und den Abonnenten des zugehörigen e-mail Verteilers bestimmt. Die Verbreitung oder Wiedergabe in Auszügen oder als Ganzes ist grundsätzlich nicht gestattet und bedarf der Zustimmung des jeweiligen Autors. Beachten Sie auch unsere Nutzungsbestimmungen und AGBs.
Introgen´s ADVEXIN Demonstrates Clinical Benefit in Inherited Cancer
--------------------------------------------------------------------------------
16.04.07 13:29
Introgen Therapeutics Receives European Certification of its U.S. ADVEXIN(R) Production Facility
--------------------------------------------------------------------------------
Introgen´s ADVEXIN Demonstrates Clinical Benefit in Inherited Cancer
Introgen Therapeutics, Inc. (NASDAQ:INGN ) announced today the publication of data describing the dramatic clinical benefit of its lead product ADVEXIN in a patient with a rare inherited form of cancer known as Li-Fraumeni Syndrome (LFS), a genetic disorder characterized by inherited mutations in the p53 tumor suppressor gene. This is the first reported treatment of Li-Fraumeni tumors with a therapy targeted to the underlying molecular cause of the disorder. These cancers are due to inherited abnormalities of p53 function which is directly addressed by ADVEXIN treatment. In addition, the results of the study evaluated biomarkers which confirmed the molecular mechanism of activity of ADVEXIN. These biomarkers will guide ADVEXIN therapy of other cancers with p53 abnormalities, which is one of the most common molecular defects found in virtually all types of cancer.
The patient was treated as part of a study at the Mary Crowley Medical Research Center in Dallas, TX and the importance of the findings were underscored by publication this week in the Spotlight on Clinical Response editorial highlights section of the current issue of Molecular Cancer Therapeutics, a journal of the American Association for Cancer Research.
ADVEXIN treatment of a tumor in an LFS patient led to improvement of tumor-related symptoms and resulted in a complete response as determined by positron emission tomography (PET) scans. In addition, molecular biomarker studies using tumor biopsies before treatment detected abnormal levels of p53 protein predictive of ADVEXIN efficacy. Tumor biopsies analyzed after therapy identified restoration of p53 tumor suppressor function including suppression of tumor growth and induction of tumor cell death validating ADVEXIN´s mechanisms of action.
"This case study showcases and provides proof of the principle for the therapeutic application of targeted ADVEXIN therapy in tumors with p53 abnormalities that are among the most common and fundamental molecular defects in cancer," said Neil Senzer, M.D., Scientific Director, Mary Crowley Medical Research Center, and lead author of the article. "ADVEXIN´s mechanism of action is targeted to restoring p53 tumor suppressor function that is abnormal in Li-Fraumeni tumors and in many other types of cancer."
ADVEXIN is being developed for European markets by Gendux AB, a subsidiary of Introgen Therapeutics, Inc. The European Medicines Agency (EMEA) has designated, and the European Union has confirmed, ADVEXIN p53 therapy as an Orphan Drug for the treatment of LFS. A Letter of Intent to the EMEA regarding Marketing Authorization Application for the approval of ADVEXIN to treat LFS was filed under the Exceptional Circumstances Approval procedures in the EU.
Collaborators on this publication included clinicians from Mary Crowley Medical Research Center, Sammons Cancer Center, Baylor University Medical Center, The Royal Marsden Hospital NHS Foundation Trust, Imperial College London Hammersmith Campus, and the Institute of Cancer Research in the United Kingdom.
About Li-Fraumeni Syndrome
Approximately 400 families are affected by LFS annually. The majority of LFS families contain mutations in the p53 tumor suppressor gene. Affected individuals often develop multiple primary tumors, which typically occur at a young age. Conventional therapy of patients with the Li-Fraumeni Syndrome is frequently unsuccessful due to the occurrence of multiple malignancies that share a common p53 genetic defect fundamental to cancer progression and the development of treatment resistance. Defects in p53-mediated cell death pathways cause these tumors to develop resistance to standard therapy, resulting in early death. Additionally, because affected individuals lack p53-mediated DNA repair function, treatment with DNA damaging agents such as radiation and some types of chemotherapy can induce genetic changes that give rise to additional tumors.
About ADVEXIN
ADVEXIN p53 therapy is a targeted molecular therapy with broad applicability in a wide range of tumor types and clinical settings because it targets one of the most fundamental and common molecular defects, abnormal p53 tumor suppressor function, associated with cancer initiation, progression and treatment resistance. Prognostic biomarkers can identify patients most likely to respond to ADVEXIN. ADVEXIN has demonstrated clinical activity in a number of solid tumor types in multiple phase 1, 2 and 3 clinical trials conducted worldwide.
About Introgen Therapeutics, Inc.
Introgen Therapeutics, Inc. is a biopharmaceutical company focused on the discovery, development and commercialization of targeted molecular therapies for the treatment of cancer and other diseases. Introgen is developing molecular therapeutics, immunotherapies, vaccines and nano-particle therapies to treat a wide range of cancers using tumor suppressors and cytokines. Introgen maintains integrated research, development, manufacturing, clinical and regulatory departments and operates multiple manufacturing facilities including a commercial scale cGMP manufacturing facility.
Statements in this release that are not strictly historical may be "forward-looking" statements, including those relating to Introgen´s future success with its ADVEXIN clinical development program for the treatment of patients with Li-Fraumeni Syndrome. The actual results may differ from those described in this release due to risks and uncertainties that exist in Introgen´s operations and business environment, including Introgen´s stage of product development and the limited experience in the development of gene-based drugs in general, dependence upon proprietary technology and the current competitive environment, history of operating losses and accumulated deficits, reliance on collaborative relationships, and uncertainties related to clinical trials, the safety and efficacy of Introgen´s product candidates, the ability to obtain the appropriate regulatory approvals, Introgen´s patent protection and market acceptance, as well as other risks detailed from time to time in Introgen´s filings with the Securities and Exchange Commission including its filings on Form 10-K and Form 10-Q. Introgen undertakes no obligation to publicly release the results of any revisions to any forward-looking statements that reflect events or circumstances arising after the date hereof.
Editor´s Note: For more information on Introgen Therapeutics, or for a menu of archived press releases, please visit Introgen´s Website at: www.introgen.com.
© Business Wire
© Business Wire
Disclaimer wallstreet:online bietet Redakteuren, Agenturen und Unternehmen die Möglichkeit, Kommentare, Analysen und Nachrichten auf www.wallstreet-online.de zu veröffentlichen. Für diese Inhalte übernimmt die wallstreet:online AG weder Haftung noch Gewähr. Dies gilt insbesondere für unvollständige oder falsch wiedergegebene Meldungen, falsche Kursangaben und redaktionelle Versehen. Die Artikel stellen weder Kauf- bzw. Verkaufsempfehlungen dar, noch sind sie als Zusicherung etwaiger Kursentwicklungen zu verstehen. Die Artikel sind ausschließlich für die Leser von www.wallstreet-online.de und den Abonnenten des zugehörigen e-mail Verteilers bestimmt. Die Verbreitung oder Wiedergabe in Auszügen oder als Ganzes ist grundsätzlich nicht gestattet und bedarf der Zustimmung des jeweiligen Autors. Beachten Sie auch unsere Nutzungsbestimmungen und AGBs.
Gibt schon wieder eine gute Nachricht, solangsam galube ich doch das könnte mal was werden.
Introgen Reports Promising Phase 1/2 Clinical Results With INGN 241 in Patients With Advanced Solid Tumors
Friday June 1, 9:00 am ET
SEATTLE--(BUSINESS WIRE)--Introgen Therapeutics, Inc. (NASDAQ:INGN - News) reported promising Phase 1/2 clinical data with INGN 241, the Company's novel investigational mda-7/IL-24 tumor suppressor agent, in patients with advanced solid tumors.
ADVERTISEMENT
The data (Abstract #380), which were presented today at the annual meeting of the American Society of Gene Therapy, showed that in this 22-patient trial, INGN 241 induced killing in all treated tumors, including in those patients who failed prior therapy with other anti-cancer agents. INGN 241 was well tolerated, and a maximum tolerated dose was not reached. Tumor growth control was observed in 44 percent of treated tumors. Two of five patients treated at the highest dose showed objective responses (greater than 50 percent reduction in tumor size). Increases in the number of immune cells known to mediate anti-tumor effects were also observed in all patients, consistent with the immune-stimulating activity of INGN 241.
Although INGN 241 was administered directly to tumors, evidence of distant biologic activity was observed, suggesting that this therapy may have utility in treating primary tumors as well as metastatic disease. INGN 241 treatment in combination with radiotherapy is being evaluated in an ongoing Phase 3 trial in solid tumors, including patients with head and neck cancer.
"These data are particularly encouraging because they demonstrate INGN 241 has clinical activity even in patients who have failed previous therapies," said Sunil Chada, Ph.D., associate vice president, Clinical Research and Development at Introgen.
INGN 241 Shown to Restore Platinum Sensitivity in Preclinical Studies
Data from preclinical studies of INGN 241 also were presented (Abstract #197) that evaluated the ability of INGN 241 to restore cisplatin sensitivity to ovarian cancer cells that are cisplatin-resistant. The results showed that INGN 241 effectively kills cisplatin-resistant cells when used as monotherapy, and restores cisplatin sensitivity. Cisplatin is one of the most commonly utilized treatments for lung, breast and colon cancers. However, development of cisplatin resistance is a common event and the ability of INGN 241 to kill these resistant tumors and restore cisplatin efficacy has important clinical implications. Previous INGN 241 preclinical studies have indicated similar synergies with other chemotherapies and with radiation treatment.
Dr. Chada added, "These preclinical data demonstrate that INGN 241 can restore sensitivity to cisplatin, a widely used chemotherapy drug that frequently gives rise to resistance. Our findings support applications of INGN 241 in combination with standard chemotherapy and radiation regimens and we are planning future clinical trials based on these results."
Introgen Reports Promising Phase 1/2 Clinical Results With INGN 241 in Patients With Advanced Solid Tumors
Friday June 1, 9:00 am ET
SEATTLE--(BUSINESS WIRE)--Introgen Therapeutics, Inc. (NASDAQ:INGN - News) reported promising Phase 1/2 clinical data with INGN 241, the Company's novel investigational mda-7/IL-24 tumor suppressor agent, in patients with advanced solid tumors.
ADVERTISEMENT
The data (Abstract #380), which were presented today at the annual meeting of the American Society of Gene Therapy, showed that in this 22-patient trial, INGN 241 induced killing in all treated tumors, including in those patients who failed prior therapy with other anti-cancer agents. INGN 241 was well tolerated, and a maximum tolerated dose was not reached. Tumor growth control was observed in 44 percent of treated tumors. Two of five patients treated at the highest dose showed objective responses (greater than 50 percent reduction in tumor size). Increases in the number of immune cells known to mediate anti-tumor effects were also observed in all patients, consistent with the immune-stimulating activity of INGN 241.
Although INGN 241 was administered directly to tumors, evidence of distant biologic activity was observed, suggesting that this therapy may have utility in treating primary tumors as well as metastatic disease. INGN 241 treatment in combination with radiotherapy is being evaluated in an ongoing Phase 3 trial in solid tumors, including patients with head and neck cancer.
"These data are particularly encouraging because they demonstrate INGN 241 has clinical activity even in patients who have failed previous therapies," said Sunil Chada, Ph.D., associate vice president, Clinical Research and Development at Introgen.
INGN 241 Shown to Restore Platinum Sensitivity in Preclinical Studies
Data from preclinical studies of INGN 241 also were presented (Abstract #197) that evaluated the ability of INGN 241 to restore cisplatin sensitivity to ovarian cancer cells that are cisplatin-resistant. The results showed that INGN 241 effectively kills cisplatin-resistant cells when used as monotherapy, and restores cisplatin sensitivity. Cisplatin is one of the most commonly utilized treatments for lung, breast and colon cancers. However, development of cisplatin resistance is a common event and the ability of INGN 241 to kill these resistant tumors and restore cisplatin efficacy has important clinical implications. Previous INGN 241 preclinical studies have indicated similar synergies with other chemotherapies and with radiation treatment.
Dr. Chada added, "These preclinical data demonstrate that INGN 241 can restore sensitivity to cisplatin, a widely used chemotherapy drug that frequently gives rise to resistance. Our findings support applications of INGN 241 in combination with standard chemotherapy and radiation regimens and we are planning future clinical trials based on these results."
Antwort auf Beitrag Nr.: 29.574.992 von wohinistmeinGeld am 01.06.07 15:39:21Hi wohin,
guter Hoffnung bin ich schon, seitdem ich INGN kenne. Im Grunde haben sie von den News her noch nie enttäuscht.
Das Thema Gentherapie ist nur in den U.S.A. ein ganz heißes Eisen. Meiner Ansicht liegt darin die große UNBEKANNTE.
Was mich jetzt langsam fasziniert, ist die Tatsache, dass der Wert auch hierzulande langsam entdeckt und regelmäßig an den Börsen gehandelt wird. Das war jahrelang nicht der Fall.
Denke, dass man langsam auch mal wieder die News in deutscher Sprache herausgeben sollte - so wie es früher schon war.
Denke, dass INGN in den nächsten Jahren plötzlich abgehen wird wie ein ZÄPFCHEN - und zwar nach oben!!!
Gruß, Stammzelle.
guter Hoffnung bin ich schon, seitdem ich INGN kenne. Im Grunde haben sie von den News her noch nie enttäuscht.
Das Thema Gentherapie ist nur in den U.S.A. ein ganz heißes Eisen. Meiner Ansicht liegt darin die große UNBEKANNTE.
Was mich jetzt langsam fasziniert, ist die Tatsache, dass der Wert auch hierzulande langsam entdeckt und regelmäßig an den Börsen gehandelt wird. Das war jahrelang nicht der Fall.
Denke, dass man langsam auch mal wieder die News in deutscher Sprache herausgeben sollte - so wie es früher schon war.
Denke, dass INGN in den nächsten Jahren plötzlich abgehen wird wie ein ZÄPFCHEN - und zwar nach oben!!!
Gruß, Stammzelle.
Antwort auf Beitrag Nr.: 29.580.122 von Stammzelle am 01.06.07 20:10:19ich bin schon vor ca. 6 Jahren durch GBI darauf aufmerksam geworden und ziemlich stark eingekauft.
Allerdings ist es dann mal zu viel gefallen und ich habe bis auf eine kleine Position verkauft und den Rest als ich 2003 dann plötzlich 300% im Plus war.
Ich bin dann ab 2005 wieder eingestiegen, aber zwischendurch hatte ich mal die Hoffnung aufgegeben daß das noch was wird. Seit März habe ich aufgestockt, nachdem die Nachrichten doch langsam wieder kommen und ganz gut aussehen. Ich bin jetzt verkraftbar im Minus und ich denke das Tief ist vorerst erreicht nachdem endlich mal wieder gute Meldungen kommen.
Die Biotech allgemein ist lange genug schlecht gelaufen, das dürfte endlich mal drehen, ich noch ein paar andere.
In den USA gab es ja schon mal Todesfälle nach Gentherapie, wobei , soviel ich weiß, nicht der direkte Zusammenhang nachgewiesen werden konnt. Aber eine Zitterpartie würde ein Zulassungsverfahren geben mit riesen Kursschwankungen. Dendreon macht es vor.
Allerdings ist es dann mal zu viel gefallen und ich habe bis auf eine kleine Position verkauft und den Rest als ich 2003 dann plötzlich 300% im Plus war.
Ich bin dann ab 2005 wieder eingestiegen, aber zwischendurch hatte ich mal die Hoffnung aufgegeben daß das noch was wird. Seit März habe ich aufgestockt, nachdem die Nachrichten doch langsam wieder kommen und ganz gut aussehen. Ich bin jetzt verkraftbar im Minus und ich denke das Tief ist vorerst erreicht nachdem endlich mal wieder gute Meldungen kommen.
Die Biotech allgemein ist lange genug schlecht gelaufen, das dürfte endlich mal drehen, ich noch ein paar andere.

In den USA gab es ja schon mal Todesfälle nach Gentherapie, wobei , soviel ich weiß, nicht der direkte Zusammenhang nachgewiesen werden konnt. Aber eine Zitterpartie würde ein Zulassungsverfahren geben mit riesen Kursschwankungen. Dendreon macht es vor.
Was ist eigentlich mit Advexin passiert? Das wurde doch Ende 2004 oder Anfang 2005 zum Zulassungsverfahren eingereicht. Außerdem hat es den Fast Track Status bekommen was ja eigentlich heißt, daß es innerhalb 6 Monate eine Entscheidung der FDA gibt. Jetzt sind es schon 2 Jahre, gab es da mal Probleme zwischendurch?
Antwort auf Beitrag Nr.: 29.583.196 von wohinistmeinGeld am 01.06.07 23:00:36Tja, woistdeinGeldhin,
das ist so eine Sache. Lies dir mal folgenden Artikel durch, auf den cyberhai schon in seinem Posting #80 hingewiesen hat:
http://www.thestreet.com/_yahoo/newsanalysis/biotech/1034295…
Beschreibt diese Situation eigentlich recht gut.
Allerdings habe ich Advexin längst nicht abgeschrieben.
Gruß, Stammzelle.
das ist so eine Sache. Lies dir mal folgenden Artikel durch, auf den cyberhai schon in seinem Posting #80 hingewiesen hat:
http://www.thestreet.com/_yahoo/newsanalysis/biotech/1034295…
Beschreibt diese Situation eigentlich recht gut.
Allerdings habe ich Advexin längst nicht abgeschrieben.
Gruß, Stammzelle.
Antwort auf Beitrag Nr.: 29.583.382 von Stammzelle am 01.06.07 23:36:47das ist halt ein Problem der Biotech, erst muß die Wirkung erzielt werden, dann muß man sehen ob es was hilft und dann noch die Wirkung und Nebenwirkungen auf lange Sicht.
Spätfolgen können auch erst nach vielen Jahren auftreten, wobei mir persönlich das jetzt ziemlich egal wäre wenn ich an Krebs sterben würde und ich könnte mit einem Medikament die Lebenszeit deutlich verlängern und sterbe dann an den Nebenwirkungen.
Aber wegen der Gefahr späterer Klagen können die natürlich kein Risiko eingehen.
Bei Hana das Problem mit Zensana während dem Zulassungsverfahren oder Helix mit der Interferon Creme, die eigentlich auch schon vor 3 Jahren in die Zulassung gehen sollte. Also nichts besonderes be Biotechs, nur wäre manchmal hilfreich wenn man den Grund der Verzögerungen wüßte. Bei Hana wurde das klar dargestellt.
Spätfolgen können auch erst nach vielen Jahren auftreten, wobei mir persönlich das jetzt ziemlich egal wäre wenn ich an Krebs sterben würde und ich könnte mit einem Medikament die Lebenszeit deutlich verlängern und sterbe dann an den Nebenwirkungen.
Aber wegen der Gefahr späterer Klagen können die natürlich kein Risiko eingehen.
Bei Hana das Problem mit Zensana während dem Zulassungsverfahren oder Helix mit der Interferon Creme, die eigentlich auch schon vor 3 Jahren in die Zulassung gehen sollte. Also nichts besonderes be Biotechs, nur wäre manchmal hilfreich wenn man den Grund der Verzögerungen wüßte. Bei Hana wurde das klar dargestellt.
Antwort auf Beitrag Nr.: 29.586.226 von wohinistmeinGeld am 02.06.07 12:56:09Hi wohin...,
mache das gleiche Drama schon seit Jahren mit Nuvo Research und deren Medikamentenanwärter Pennsaid durch. Da wurde man allerdings auch Monate im Unklaren gelassen.
Bei Hana handelt es ja wieder um so einen Wert, den Förtsch getrieben hat. Wollte dort auch Mal einsteigen. Genauso bei YM Biosciences...
Wie sieht es aktuell eigentlich bei Hana aus? Gibt es noch Chancen auf eine Marktzulassung von Zensana?
Gruß, Stammzelle.
mache das gleiche Drama schon seit Jahren mit Nuvo Research und deren Medikamentenanwärter Pennsaid durch. Da wurde man allerdings auch Monate im Unklaren gelassen.
Bei Hana handelt es ja wieder um so einen Wert, den Förtsch getrieben hat. Wollte dort auch Mal einsteigen. Genauso bei YM Biosciences...
Wie sieht es aktuell eigentlich bei Hana aus? Gibt es noch Chancen auf eine Marktzulassung von Zensana?
Gruß, Stammzelle.
Hi,
meiner Ansicht nach wieder eine sehr positive News, die gerade aktuell raus ist.
Introgen Reports Updated Phase 2 ADVEXIN(R) Data Correlating Improved Survival, Tumor Responses and Predictive p53 Biomarker
6/4/2007
Abnormal p53 Predicts Increased Tumor Responses and Survival
CHICAGO, Jun 04, 2007 (BUSINESS WIRE) --
Introgen Therapeutics, Inc. (NASDAQ: INGN) and the Company\'s clinical collaborators today reported updated Phase 2 data demonstrating a significant correlation between abnormal p53, tumor responses and increased survival following ADVEXIN(R) therapy in patients with recurrent squamous cell carcinoma of the head and neck. The data (Abstract #6057) were presented today at the annual meeting of the American Society of Clinical Oncology in Chicago.
Tumor responses were assessed in 112 patients with recurrent head and neck cancer who received ADVEXIN. Overall, the percentages of patients with tumor responses defined by reductions in bi-dimensional tumor area on CT scan of 50 percent, 25 percent, 10 percent or stable disease for more than 2 treatment cycles were 6 percent, 7 percent, 12 percent and 22 percent, respectively. Median survival for these responder populations were 41, 17, 15 and 10 months, respectively. There was a statistically significant increase in median survival for each of the responder populations compared to the 6 month median survival of the non-responders (p less than 0.0016).
\"The 41 month median duration of survival for the patients with a 50 percent or greater reduction in tumor size is very impressive and significantly greater than the six month median survival of non-responders that is typical for patients with recurrent tumors,\" said John Nemunaitis, M.D., Medical Director, Mary Crowley Medical Research Center. \"Our findings are also consistent with a growing body of data that even smaller reductions in tumor size are clinically meaningful and are associated with increased survival.\"
The presentation also included data demonstrating that the predictive abnormal p53 biomarker was associated with a statistically significant increase in tumor responses to ADVEXIN therapy. A reduction in tumor size was observed in 40 percent of patients with the abnormal p53 biomarker compared to none (0 percent) of the patients with p53 normal tumors. In addition, tumor growth control lasting for a minimum of two treatment cycles was observed in 75 percent of patients with abnormal p53 tumors compared to 27 percent of patients with a normal p53 biomarker. Both the increased reduction in tumor size and tumor growth control associated with the abnormal p53 biomarker were statistically significant (p = 0.02). In addition, the abnormal p53 was a predictive biomarker for increased survival following ADVEXIN treatment. Median survival of patients with abnormal p53 was 11.6 months, compared with only 3.5 months for patients with normal p53 (p = 0.0007). These biomarker analyses were conducted with pre-treatment samples from 28 patients on a completely blinded basis by an independent laboratory that was not aware of the clinical results of the study. The association of tumor responses, increased survival and the abnormal p53 biomarker could not be accounted for by other known prognostic factors.
\"These findings indicate important relationships between increased tumor responses and survival and the predictive abnormal p53 biomarker that is the target of ADVEXIN treatment,\" added Dr. Nemunaitis. \"We now have the ability to match patients with a treatment that may improve their survival, and if borne out in the ongoing Phase 3 clinical trials now undergoing analyses, could fulfill the promise of molecularly targeted cancer therapies.\"
Biomarkers are tests or measurements that predict response to treatment. Molecular biomarkers include measurements of genetic markers or molecular pathways while clinical biomarkers refer to clinical history or clinical measurements. Introgen\'s molecular biomarkers include the identification of aberrant p53 function by a routine assay performed by pathology laboratories worldwide detecting abnormally elevated levels of p53 protein in tumor tissues. Introgen believes that application of molecular and clinical biomarkers can predict the patients who are most likely to respond to ADVEXIN treatment.
About ADVEXIN
ADVEXIN p53 therapy is a targeted molecular therapy with broad applicability in a wide range of tumor types and clinical settings because it targets one of the most fundamental and common molecular defects, abnormal p53 tumor suppressor function, associated with cancer initiation, progression and treatment resistance. ADVEXIN has demonstrated increased survival and tumor growth control in recurrent head and neck cancer patients. ADVEXIN has demonstrated clinical activity in a number of solid tumor types in multiple phase 1, 2 and 3 clinical trials conducted worldwide.
Introgen\'s clinical collaborators included John Nemunaitis, M.D., Medical Director, Mary Crowley Medical Research Center, Gary Clayman, M.D., Department of Otolayngology, M.D. Anderson Cancer Center, Carol Bier-Laning, M.D., Clinical Assistant Professor, Loyola University Medical Center, Heikki Minn, M.D., Ph.D., Department of Oncology and Radiotherapy, Turku University Hospital, D. Van Echo, M.D., Director, HarborView Cancer Center, George Yoo, M.D., Vice-Chair, Department of Otolaryngology-Head and Neck Surgery and Oncology, Wayne State University, Kerstin Menander, PhD, M.D., Introgen\'s vice president of Clinical Development and W. Jarrard Goodwin M.D., Director, University of Miami Hospital & Sylvester Comprehensive Cancer Clinics.
Bin gespannt, wie die Amis diese Meldung aufnehmen. Langfristig ist es auf jeden Fall bedeutend und gut.
Gruß, Stammzelle.
meiner Ansicht nach wieder eine sehr positive News, die gerade aktuell raus ist.
Introgen Reports Updated Phase 2 ADVEXIN(R) Data Correlating Improved Survival, Tumor Responses and Predictive p53 Biomarker
6/4/2007
Abnormal p53 Predicts Increased Tumor Responses and Survival
CHICAGO, Jun 04, 2007 (BUSINESS WIRE) --
Introgen Therapeutics, Inc. (NASDAQ: INGN) and the Company\'s clinical collaborators today reported updated Phase 2 data demonstrating a significant correlation between abnormal p53, tumor responses and increased survival following ADVEXIN(R) therapy in patients with recurrent squamous cell carcinoma of the head and neck. The data (Abstract #6057) were presented today at the annual meeting of the American Society of Clinical Oncology in Chicago.
Tumor responses were assessed in 112 patients with recurrent head and neck cancer who received ADVEXIN. Overall, the percentages of patients with tumor responses defined by reductions in bi-dimensional tumor area on CT scan of 50 percent, 25 percent, 10 percent or stable disease for more than 2 treatment cycles were 6 percent, 7 percent, 12 percent and 22 percent, respectively. Median survival for these responder populations were 41, 17, 15 and 10 months, respectively. There was a statistically significant increase in median survival for each of the responder populations compared to the 6 month median survival of the non-responders (p less than 0.0016).
\"The 41 month median duration of survival for the patients with a 50 percent or greater reduction in tumor size is very impressive and significantly greater than the six month median survival of non-responders that is typical for patients with recurrent tumors,\" said John Nemunaitis, M.D., Medical Director, Mary Crowley Medical Research Center. \"Our findings are also consistent with a growing body of data that even smaller reductions in tumor size are clinically meaningful and are associated with increased survival.\"
The presentation also included data demonstrating that the predictive abnormal p53 biomarker was associated with a statistically significant increase in tumor responses to ADVEXIN therapy. A reduction in tumor size was observed in 40 percent of patients with the abnormal p53 biomarker compared to none (0 percent) of the patients with p53 normal tumors. In addition, tumor growth control lasting for a minimum of two treatment cycles was observed in 75 percent of patients with abnormal p53 tumors compared to 27 percent of patients with a normal p53 biomarker. Both the increased reduction in tumor size and tumor growth control associated with the abnormal p53 biomarker were statistically significant (p = 0.02). In addition, the abnormal p53 was a predictive biomarker for increased survival following ADVEXIN treatment. Median survival of patients with abnormal p53 was 11.6 months, compared with only 3.5 months for patients with normal p53 (p = 0.0007). These biomarker analyses were conducted with pre-treatment samples from 28 patients on a completely blinded basis by an independent laboratory that was not aware of the clinical results of the study. The association of tumor responses, increased survival and the abnormal p53 biomarker could not be accounted for by other known prognostic factors.
\"These findings indicate important relationships between increased tumor responses and survival and the predictive abnormal p53 biomarker that is the target of ADVEXIN treatment,\" added Dr. Nemunaitis. \"We now have the ability to match patients with a treatment that may improve their survival, and if borne out in the ongoing Phase 3 clinical trials now undergoing analyses, could fulfill the promise of molecularly targeted cancer therapies.\"
Biomarkers are tests or measurements that predict response to treatment. Molecular biomarkers include measurements of genetic markers or molecular pathways while clinical biomarkers refer to clinical history or clinical measurements. Introgen\'s molecular biomarkers include the identification of aberrant p53 function by a routine assay performed by pathology laboratories worldwide detecting abnormally elevated levels of p53 protein in tumor tissues. Introgen believes that application of molecular and clinical biomarkers can predict the patients who are most likely to respond to ADVEXIN treatment.
About ADVEXIN
ADVEXIN p53 therapy is a targeted molecular therapy with broad applicability in a wide range of tumor types and clinical settings because it targets one of the most fundamental and common molecular defects, abnormal p53 tumor suppressor function, associated with cancer initiation, progression and treatment resistance. ADVEXIN has demonstrated increased survival and tumor growth control in recurrent head and neck cancer patients. ADVEXIN has demonstrated clinical activity in a number of solid tumor types in multiple phase 1, 2 and 3 clinical trials conducted worldwide.
Introgen\'s clinical collaborators included John Nemunaitis, M.D., Medical Director, Mary Crowley Medical Research Center, Gary Clayman, M.D., Department of Otolayngology, M.D. Anderson Cancer Center, Carol Bier-Laning, M.D., Clinical Assistant Professor, Loyola University Medical Center, Heikki Minn, M.D., Ph.D., Department of Oncology and Radiotherapy, Turku University Hospital, D. Van Echo, M.D., Director, HarborView Cancer Center, George Yoo, M.D., Vice-Chair, Department of Otolaryngology-Head and Neck Surgery and Oncology, Wayne State University, Kerstin Menander, PhD, M.D., Introgen\'s vice president of Clinical Development and W. Jarrard Goodwin M.D., Director, University of Miami Hospital & Sylvester Comprehensive Cancer Clinics.
Bin gespannt, wie die Amis diese Meldung aufnehmen. Langfristig ist es auf jeden Fall bedeutend und gut.
Gruß, Stammzelle.
Antwort auf Beitrag Nr.: 29.635.850 von Stammzelle am 04.06.07 20:33:19 Gerade raus, dann werde ich doch sogleich mal einen Blick auf den Realtime-Kurs werfen: 4,59 USD um 14:39:37 Uhr
Gerade raus, dann werde ich doch sogleich mal einen Blick auf den Realtime-Kurs werfen: 4,59 USD um 14:39:37 Uhr
 Gerade raus, dann werde ich doch sogleich mal einen Blick auf den Realtime-Kurs werfen: 4,59 USD um 14:39:37 Uhr
Gerade raus, dann werde ich doch sogleich mal einen Blick auf den Realtime-Kurs werfen: 4,59 USD um 14:39:37 Uhr
Antwort auf Beitrag Nr.: 29.635.850 von Stammzelle am 04.06.07 20:33:19 Nach weiteren 12 Minuten keine Veränderung und im Orderbuch noch Luft nach unten. Also ein Non-Event.
Nach weiteren 12 Minuten keine Veränderung und im Orderbuch noch Luft nach unten. Also ein Non-Event.
 Nach weiteren 12 Minuten keine Veränderung und im Orderbuch noch Luft nach unten. Also ein Non-Event.
Nach weiteren 12 Minuten keine Veränderung und im Orderbuch noch Luft nach unten. Also ein Non-Event.
Antwort auf Beitrag Nr.: 29.609.641 von Stammzelle am 03.06.07 14:50:35Die letzten News sind zwar jetzt nicht die Renner die Grund für Euphorie geben könnten, es sind einfach nur Updates, aber es läuft zumindest mal in die richtige Richtung, keine schlechten Nachrichten. Es könnte eigentlich mal einen leichten Aufwärtstrend geben der wenigstens paralell zum Biotech Index verläuft, allerdings ist die MK bei 140 Mio und das ist natürlich auch etwas viel für einen Laden der noch nichts am Markt hat und keinerlei Einnahmen.
Da ist noch Platz nach unten wenn es mal etwas schlechtes zu melden gibt. Wenn ich es richtig in Erinnerung habe ist noch Kohle für ca. 20 Monate vorhanden. Irgendwie zweifle ich daran, daß das reichen wird bis eine Zulassung da ist.
Bei Hana glaube ich nicht mehr so richtig dran, daß die überhaupt was zustande bringen, neues zu Zensana gibts noch nicht und sonst läuft auch gar nichts nach Plan.
Da ist noch Platz nach unten wenn es mal etwas schlechtes zu melden gibt. Wenn ich es richtig in Erinnerung habe ist noch Kohle für ca. 20 Monate vorhanden. Irgendwie zweifle ich daran, daß das reichen wird bis eine Zulassung da ist.
Bei Hana glaube ich nicht mehr so richtig dran, daß die überhaupt was zustande bringen, neues zu Zensana gibts noch nicht und sonst läuft auch gar nichts nach Plan.
Antwort auf Beitrag Nr.: 29.667.177 von wohinistmeinGeld am 06.06.07 15:24:13die pipe ist doch gut,bei bios wird die zukunft gehandelt.und wenn die kohle nicht reicht macht man eine ke oder holt einen partner ins boot.mit diesen problemen haben die meisten bios zu kämpfen.wird schon werden.bist du investiert??
asics
asics
Antwort auf Beitrag Nr.: 29.668.064 von asics01 am 06.06.07 16:20:28ja,- #96
die Zeiten wo Biotechs so hoch bewertet wurden sind seit 2000 vorbei, aber ich meine auch, daß bei dieser Pipline wenigstens der Index zu schlagen sein dürfte.
ich glaube ich werde mal demnächst ein wenig aufstocken.
die Zeiten wo Biotechs so hoch bewertet wurden sind seit 2000 vorbei, aber ich meine auch, daß bei dieser Pipline wenigstens der Index zu schlagen sein dürfte.
ich glaube ich werde mal demnächst ein wenig aufstocken.
Introgen ist heute mal wieder mit -4,5% mein miesester Wert im Depot.

Antwort auf Beitrag Nr.: 29.670.279 von wohinistmeinGeld am 06.06.07 18:33:04geht mir auch so
Antwort auf Beitrag Nr.: 29.672.372 von asics01 am 06.06.07 20:24:12Introgen habe ich bisher nur auf der Watchlist und da wird die Aktie momentan auch noch bleiben. Aber tröstet Euch - DUERR hat in meinem Depot heute noch schlechter abgeschnitten. 

wenn der markt in die knie geht,sind die bios immer vorne weg.



Antwort auf Beitrag Nr.: 29.673.564 von asics01 am 06.06.07 21:33:49und wenn der Markt hoch geht sind sie hinten dran, die sind einfach nicht mehr in.
5 Mio Aktien Short, May 15, 2007
Short Interest........Avg Daily Share Volume.....Days to Cover
5,067,512 ................337,056 ...........................15.03
Die sind natürlich nicht so besonders wild auf steigende Kurse.
5 Mio Aktien Short, May 15, 2007
Short Interest........Avg Daily Share Volume.....Days to Cover
5,067,512 ................337,056 ...........................15.03
Die sind natürlich nicht so besonders wild auf steigende Kurse.
was soll denn das jetzt, haben die Konkurs angemeldet? Schon wieder 5% Minus.

ich muß besoffen sein, ich habe vorhin noch ein paar dazu gekauft.
Wäre jetzt am besten wenn mein Computer den Geist aufgibt damit ich das Elend nicht mit ansehen muß.
Wäre jetzt am besten wenn mein Computer den Geist aufgibt damit ich das Elend nicht mit ansehen muß.

Antwort auf Beitrag Nr.: 29.695.028 von wohinistmeinGeld am 07.06.07 22:32:09ich habe gestern abend in usa auch noch einmal zugekauft,ich glaube das es heute eine erholung geben wird.dein nickname ist gut ich sollte mich wohl wohinistmeinGeld2 nennen.

alles wird gut(hoffen wir mal)
asics


alles wird gut(hoffen wir mal)
asics
wenigstens die neu gekauften sind noch nicht im Minus

Antwort auf Beitrag Nr.: 29.707.292 von wohinistmeinGeld am 08.06.07 16:49:53ich bin ja noch nicht so lange investiert bei mir hält sich das ganze noch in grenzen,die erste position habe ich bei 3,14€ gekauft
und gestern 3,92$ in usa.wenn ich alles in einem jahr mit +10% steuerfrei verkaufen kann ist das doch ok,wenns mehr wird auch nicht schlecht.
und gestern 3,92$ in usa.wenn ich alles in einem jahr mit +10% steuerfrei verkaufen kann ist das doch ok,wenns mehr wird auch nicht schlecht.
die 5 miesen von gestern haben wir wieder zurück erobert



Vertrauenserweckend sieht hier der Chart aber nicht aus. 



es ist einfach nur noch zum k..... 
Gibt es überhaupt noch Biotechs die nicht im Minus sind?
Vielleicht liegt es an dem Bericht der in Finanztreff über die Zulassungsverfahren kam. Der Markt scheint zu glauben, daß es überhaupt keine neuen Medikamente mehr gibt.
http://www.finanztreff.de/ftreff/news--a.sektion.topthemen.r…

Gibt es überhaupt noch Biotechs die nicht im Minus sind?
Vielleicht liegt es an dem Bericht der in Finanztreff über die Zulassungsverfahren kam. Der Markt scheint zu glauben, daß es überhaupt keine neuen Medikamente mehr gibt.
http://www.finanztreff.de/ftreff/news--a.sektion.topthemen.r…
Antwort auf Beitrag Nr.: 30.156.143 von wohinistmeinGeld am 22.06.07 21:28:25ich kann dir nachfühlen,bios sind nichts für schwache nerven.mich beutelt es auch gerade gewaltig.
Antwort auf Beitrag Nr.: 30.156.143 von wohinistmeinGeld am 22.06.07 21:28:25
Gibt es überhaupt noch Biotechs die nicht im Minus sind?
In der Liga, in der Introgen spielt, ist Genitope vorzuziehen. Die haben das Tief schon hinter sich, haben eine etwas bescheidenere Informationspolitik und sind in der Branche nicht so umstritten, weil sie ihre zeitlichen Vorgaben besser einhalten.
Gibt es überhaupt noch Biotechs die nicht im Minus sind?
In der Liga, in der Introgen spielt, ist Genitope vorzuziehen. Die haben das Tief schon hinter sich, haben eine etwas bescheidenere Informationspolitik und sind in der Branche nicht so umstritten, weil sie ihre zeitlichen Vorgaben besser einhalten.
Antwort auf Beitrag Nr.: 30.272.677 von zeitreisen am 24.06.07 15:24:18das ist doch auch so eine Bude.
2004 hieß es Zulassung für Anfang 2006, jetzt heißt es Ende 2007 Ende der Phase 3 und Zulassung 2009.
Im Herbst 2006 hatte GBI ins Musterdepot aufgenommen, für mich wäre das eher Grund zum Aussteigen.
2004 hieß es Zulassung für Anfang 2006, jetzt heißt es Ende 2007 Ende der Phase 3 und Zulassung 2009.
Im Herbst 2006 hatte GBI ins Musterdepot aufgenommen, für mich wäre das eher Grund zum Aussteigen.
ich bin mal gespannt,wie weit die noch runter gezogen werden.
Antwort auf Beitrag Nr.: 30.334.238 von asics01 am 26.06.07 20:49:54Ich denke, dies sind die ersten Anzeichen eines größeren Abwärtstrends.
Antwort auf Beitrag Nr.: 30.337.223 von zeitreisen am 26.06.07 23:03:04die bios haben ein eigenleben das ist ja das reizvolle an den bios.introgen wird seinen weg machen,und irgendwann wenn keiner damit rechnet fliegt dir das ding um die ohren.scheiss auf 5 oder 10% miese

asics


asics
Antwort auf Beitrag Nr.: 30.357.278 von asics01 am 27.06.07 21:26:00ungefähr so wie bei Migenix heute als sich Schering verabschiedet hat. -40%
Antwort auf Beitrag Nr.: 30.358.865 von wohinistmeinGeld am 27.06.07 22:34:10wer in bios investiert muß mit solchen sachen rechnen,aber anders rum kann es auch kommen.
Antwort auf Beitrag Nr.: 30.360.165 von asics01 am 28.06.07 06:01:36die Chance ist aber geringer, wo doch die meisten Biotechs irgendwann in der Versenkung verschwinden. Das einzige was mich in den Biotechs hält ist, daß wenn etwas an den Markt kommt, dann gehts richtig ab. Die Chance wird wohl so etwa einem 5er mit Lotto entsprechen.



Antwort auf Beitrag Nr.: 30.402.095 von wohinistmeinGeld am 29.06.07 23:47:39hey wohinistmeingeld
hab geduld kauf noch mal günstig nach, und schau in 1-2 jahren mal wieder nach dem kurs.zur zeit werden die bios alle runtergeprügelt wird schon werden.

hab geduld kauf noch mal günstig nach, und schau in 1-2 jahren mal wieder nach dem kurs.zur zeit werden die bios alle runtergeprügelt wird schon werden.


Antwort auf Beitrag Nr.: 30.405.460 von asics01 am 30.06.07 07:59:35

Nachkauf?! Warum denn das? Der Abwärtstrend ist doch ungebrochen und voll intakt und die Aktie ist noch nicht mal überverkauft. Leidenschaft für bestimmte Aktien sollte nicht zu überhasteten Anfängerfehlern führen.
Warum denn das? Der Abwärtstrend ist doch ungebrochen und voll intakt und die Aktie ist noch nicht mal überverkauft. Leidenschaft für bestimmte Aktien sollte nicht zu überhasteten Anfängerfehlern führen.

Gruß zeitreisen


Nachkauf?!
 Warum denn das? Der Abwärtstrend ist doch ungebrochen und voll intakt und die Aktie ist noch nicht mal überverkauft. Leidenschaft für bestimmte Aktien sollte nicht zu überhasteten Anfängerfehlern führen.
Warum denn das? Der Abwärtstrend ist doch ungebrochen und voll intakt und die Aktie ist noch nicht mal überverkauft. Leidenschaft für bestimmte Aktien sollte nicht zu überhasteten Anfängerfehlern führen.Gruß zeitreisen
Antwort auf Beitrag Nr.: 30.406.023 von zeitreisen am 30.06.07 10:08:22ich bin der meinung dass die bios ein eigenleben haben,und man da nicht soviel wert auf den chart legen sollte.
asics
asics
Antwort auf Beitrag Nr.: 30.405.460 von asics01 am 30.06.07 07:59:35trotzdem



Wahrscheinlich ist der Hauptgrund des Niedergangs der Biotechs in letzter Zeit schon wegen der neuen Zulassungsmethoden wie in dem Artikel # 119 beschrieben.



Wahrscheinlich ist der Hauptgrund des Niedergangs der Biotechs in letzter Zeit schon wegen der neuen Zulassungsmethoden wie in dem Artikel # 119 beschrieben.
Antwort auf Beitrag Nr.: 30.406.964 von wohinistmeinGeld am 30.06.07 13:31:54Ich sehe das Problem eher in dem in #98 und #80 genannten Artikel und dieser beschreibt ein generelles Problem, das Introgen zu Recht schwindendes Anlegervertrauen beschert hat. Hier nochmals der Link: http://www.thestreet.com/_yahoo/newsanalysis/biotech/1034295…
P.S.: bleiben nützt da auch nichts mehr. Besser verkaufen oder weiter
bleiben nützt da auch nichts mehr. Besser verkaufen oder weiter 


P.S.:
 bleiben nützt da auch nichts mehr. Besser verkaufen oder weiter
bleiben nützt da auch nichts mehr. Besser verkaufen oder weiter 


Introgen Receives Broad U.S. Patent for Improved Storage-Stable Formulations of its Adenoviral-Based Pharmaceuticals
Monday July 2, 1:30 pm ET
AUSTIN, Texas--(BUSINESS WIRE)--Introgen Therapeutics, Inc. (NASDAQ:INGN - News) announced today that a patent covering adenovirus compositions including its product ADVEXIN has been awarded by the by the U.S. Patent and Trademark Office. Patent number 7,235,391, titled Formulations of Adenovirus for Gene Therapy, relates to improved pharmaceutical formulations for the long-term storage of adenoviruses.
David L. Parker, Ph.D, J.D., Introgen's senior vice president of Intellectual Property said, "The issuance of this patent is significant for Introgen in that the development of adenoviral formulations with improved storage stability and ease of shipping and handling is a is sought-after goal by the adenovirus industry in general and Introgen specifically. The formulations covered by this patent achieve these important goals."
The technology covered under this patent was developed as the result of extensive testing and investigation by Introgen's viral formulations group, and is based on the finding that long term storage of adenovirus particles under reasonable storage and shipping conditions (for example, 4 degrees C.) could be achieved using relatively simple combination of components, such as glycerol and non-ionic detergents. Such formulations provide Introgen the capability to distribute its adenoviral drug candidates, such as its ADVEXIN p53 and INGN 241 mda-7 therapies, using simplified procedures, as well as ultimately providing pharmacies the ability to store such therapeutics for longer periods of time under more typical drug storage conditions.
Adenoviruses are clinically important viruses used in the delivery of therapeutic or diagnostic genes to cells, such as the delivery of tumor suppressor genes to cancer cells. Adenovirus has been used in hundreds of thousands of patients in government, industry and academia for vaccine and therapy programs. Adenoviruses can be genetically altered so that they are unable to replicate in humans and they do not mix with a patient's DNA. Adenoviruses have important properties that lend themselves readily to commercial scale manufacturing. Introgen's own adenoviral vector based therapies include ADVEXIN p53 therapy and INGN 241 mda-7 therapy. Moreover, there are currently hundreds of development programs around the world for adenoviral-based therapies, including oncolytics, gene and protein delivery for cancer, cardiovascular, ophthalmologic, siRNA, and numerous other direct therapies, as well as forming the basis for the next generation of vaccines. All of these technologies will benefit from the technology covered by this patent.
Gruß Cyberhai
Monday July 2, 1:30 pm ET
AUSTIN, Texas--(BUSINESS WIRE)--Introgen Therapeutics, Inc. (NASDAQ:INGN - News) announced today that a patent covering adenovirus compositions including its product ADVEXIN has been awarded by the by the U.S. Patent and Trademark Office. Patent number 7,235,391, titled Formulations of Adenovirus for Gene Therapy, relates to improved pharmaceutical formulations for the long-term storage of adenoviruses.
David L. Parker, Ph.D, J.D., Introgen's senior vice president of Intellectual Property said, "The issuance of this patent is significant for Introgen in that the development of adenoviral formulations with improved storage stability and ease of shipping and handling is a is sought-after goal by the adenovirus industry in general and Introgen specifically. The formulations covered by this patent achieve these important goals."
The technology covered under this patent was developed as the result of extensive testing and investigation by Introgen's viral formulations group, and is based on the finding that long term storage of adenovirus particles under reasonable storage and shipping conditions (for example, 4 degrees C.) could be achieved using relatively simple combination of components, such as glycerol and non-ionic detergents. Such formulations provide Introgen the capability to distribute its adenoviral drug candidates, such as its ADVEXIN p53 and INGN 241 mda-7 therapies, using simplified procedures, as well as ultimately providing pharmacies the ability to store such therapeutics for longer periods of time under more typical drug storage conditions.
Adenoviruses are clinically important viruses used in the delivery of therapeutic or diagnostic genes to cells, such as the delivery of tumor suppressor genes to cancer cells. Adenovirus has been used in hundreds of thousands of patients in government, industry and academia for vaccine and therapy programs. Adenoviruses can be genetically altered so that they are unable to replicate in humans and they do not mix with a patient's DNA. Adenoviruses have important properties that lend themselves readily to commercial scale manufacturing. Introgen's own adenoviral vector based therapies include ADVEXIN p53 therapy and INGN 241 mda-7 therapy. Moreover, there are currently hundreds of development programs around the world for adenoviral-based therapies, including oncolytics, gene and protein delivery for cancer, cardiovascular, ophthalmologic, siRNA, and numerous other direct therapies, as well as forming the basis for the next generation of vaccines. All of these technologies will benefit from the technology covered by this patent.
Gruß Cyberhai
Ist zwar nur die Zuteilung eines Patents und eine euphorische Stimmung zu erwarten wäre etwas unangebracht, aber ins Minus müßte es vor Schreck auch nicht gehen.
17/2007 1:47:43 PM Introgen Therapeutics, Inc. (INGN) on Tuesday revealed the receipt of a patent titled "Diminishing Viral Gene Expression by Promoter Replacement" from the U.S. Patent and Trademark Office for adenoviral vector development. The company also stated that, claims of patent would cover deletion of multiple viral genes within a vector.
Further, the patent covers adenoviral vector's use with pro-apoptotic genes, currently designed to induce cell death in the target cell, one of the desired outcomes in treating cancer.
Commenting on the receipt of patent, Introgen's senior vice president of Intellectual Property, David Parker, said, "This patent is a significant addition to Introgen's intellectual property portfolio in that it covers viral vectors with genetic modifications that will permit researchers to easily control the replication of such vectors by, for example, supplying an inducing factor, which can prevent unwanted vector replicatio

17/2007 1:47:43 PM Introgen Therapeutics, Inc. (INGN) on Tuesday revealed the receipt of a patent titled "Diminishing Viral Gene Expression by Promoter Replacement" from the U.S. Patent and Trademark Office for adenoviral vector development. The company also stated that, claims of patent would cover deletion of multiple viral genes within a vector.
Further, the patent covers adenoviral vector's use with pro-apoptotic genes, currently designed to induce cell death in the target cell, one of the desired outcomes in treating cancer.
Commenting on the receipt of patent, Introgen's senior vice president of Intellectual Property, David Parker, said, "This patent is a significant addition to Introgen's intellectual property portfolio in that it covers viral vectors with genetic modifications that will permit researchers to easily control the replication of such vectors by, for example, supplying an inducing factor, which can prevent unwanted vector replicatio
das sieht nicht gut aus,was gibt es neues dass die so abkacken???
asics
asics
werden die sturmreif geschossen,oder ist deren ADVEXIN doch nur heiße luft?
asics
asics
Hi Leute,
nach dem Conference-Call vom heutigen Tage geht es ja ganz schön aufwärts. Weiß jemand, was genau so tolles berichtet wurde?
Gruß, Stammzelle.
nach dem Conference-Call vom heutigen Tage geht es ja ganz schön aufwärts. Weiß jemand, was genau so tolles berichtet wurde?
Gruß, Stammzelle.
Hi, vielleicht hängt es ja auch mit folgender News von heute zusammen:
Introgen Therapeutics, Inc. to Present at Canaccord Adams' 27th Global Growth Conference
Tuesday August 7, 12:00 pm ET
AUSTIN, Texas--(BUSINESS WIRE)--Introgen Therapeutics, Inc. (NASDAQ:INGN - News) announced today that it will deliver a presentation at the 27th Annual Canaccord Adams Global Growth Conference in Boston. David G. Nance, president and CEO, is scheduled to present to leading institutional investment representatives on Thursday, August 9, 2007, at 11:00 a.m. ET, at the InterContinental Boston. Mr. Nance's presentation will be webcast live and will be available at www.introgen.com.
So wie ich im US-Board nachgelesen habe, ist es schon ungewöhnlich, dass Boss Nance diese Präsentation selber vornimmt. Vielleicht deutet dieses doch auf ein sehr wichtiges Event hin.
Canaccord Adams ist auch ein neues Analystenhaus für INGN.
Könnte mir vorstellen, dass auch neue Partner vorgestellt werden...
Schauen wir, was passieren wird. Vielleicht verfolge ich das Mal über die Homepage. Vielleicht reicht mein Englisch ja (glaube ich nicht), um das zu verstehen, was unser Boss zu sagen hat.
Gruß, Stammzelle.
Introgen Therapeutics, Inc. to Present at Canaccord Adams' 27th Global Growth Conference
Tuesday August 7, 12:00 pm ET
AUSTIN, Texas--(BUSINESS WIRE)--Introgen Therapeutics, Inc. (NASDAQ:INGN - News) announced today that it will deliver a presentation at the 27th Annual Canaccord Adams Global Growth Conference in Boston. David G. Nance, president and CEO, is scheduled to present to leading institutional investment representatives on Thursday, August 9, 2007, at 11:00 a.m. ET, at the InterContinental Boston. Mr. Nance's presentation will be webcast live and will be available at www.introgen.com.
So wie ich im US-Board nachgelesen habe, ist es schon ungewöhnlich, dass Boss Nance diese Präsentation selber vornimmt. Vielleicht deutet dieses doch auf ein sehr wichtiges Event hin.
Canaccord Adams ist auch ein neues Analystenhaus für INGN.
Könnte mir vorstellen, dass auch neue Partner vorgestellt werden...
Schauen wir, was passieren wird. Vielleicht verfolge ich das Mal über die Homepage. Vielleicht reicht mein Englisch ja (glaube ich nicht), um das zu verstehen, was unser Boss zu sagen hat.

Gruß, Stammzelle.
Antwort auf Beitrag Nr.: 31.069.455 von Stammzelle am 07.08.07 19:58:56wenn news kommen am donnerstag,aber wie halt immer, ein paar wissen da schon wieder mehr.kann auch eine falle sein, abwarten ist angesagt.viel glück den investierten.
asics
asics
Hi,
heute noch Mal - kurz vor dem morgigen Event - ein Kursplus von 5,33 % auf 4,15 USD.
Für mich allerdings mit 267336 gehandelten Shares nicht so doll. Dürften meiner Einschätzung nach viele Kleinanleger mit einer großen Erwartungshaltung aufgesprungen sein.
Schauen wir Mal, was unser Nance Morgen zu berichten hat.
Gruß, Stammzelle.
heute noch Mal - kurz vor dem morgigen Event - ein Kursplus von 5,33 % auf 4,15 USD.
Für mich allerdings mit 267336 gehandelten Shares nicht so doll. Dürften meiner Einschätzung nach viele Kleinanleger mit einer großen Erwartungshaltung aufgesprungen sein.
Schauen wir Mal, was unser Nance Morgen zu berichten hat.

Gruß, Stammzelle.
Introgen's p53 Immunotherapy Drug Candidate to Advance Into Second Phase 2 Clinical Trial in Small Cell Lung Cancer With National Cancer Institute
AUSTIN, Texas & TAMPA, Florida--(BUSINESS WIRE)--Sept. 6, 2007--Introgen Therapeutics, Inc. (NASDAQ:INGN) and Moffitt Cancer Center today announced plans to begin a phase 2 randomized, controlled study of INGN 225, Introgen's investigational immunotherapy product in patients with metastatic small-cell lung cancer (termed extensive stage SCLC).
INGN 225 is an immunotherapy using a patient's own cells to stimulate an anti-tumor immune response to fight cancer. The immunotherapeutic targets a molecular abnormality found in over half of all solid cancers.
The National Institutes of Health National Cancer Institute awarded a grant of approximately $1.3 million to fund this trial, which is expected to enroll as many as 80 patients starting early next year upon completion of the protocol with the NCI and U.S. Food and Drug Administration.
Results from a previous Phase 2 trial were presented today at the 12th World Conference on Lung Cancer, sponsored by the International Association for the Study of Lung Cancer, in Seoul, Korea showing a 45 percent response rate in patients with platinum-resistant small-cell lung cancer who received chemotherapy following INGN 225. Interim results from this study also were presented earlier this year at the annual meeting of the American Society of Clinical Oncology. The historical response rate is generally less than 15 percent in these patients. Among the 43 patients evaluable for survival following INGN 225 treatment, survival was also improved compared to historical controls.
"The data to date indicate that INGN 225 could be a promising treatment in terms of survival, response rate and tolerability in a disease with virtually no treatments after chemotherapy has failed," said Dr. Dmitry Gabrilovich, professor of Oncology at Moffitt Cancer Center. "We are looking forward to confirming these earlier findings in a randomized, controlled phase 2 study that, if successful, could be expanded to become a registration study since there is such an acute medical need for new treatments in patients with extensive stage small-cell lung cancer resistant to chemotherapy."
The controlled, randomized trial, which will be co-led by Dr. Scott Antonia, program leader, Immunology and medical director, Cellular Therapies Core, and Dr. Gabrilovich, is being designed to evaluate the efficacy and safety of INGN 225 in patients with extensive stage SCLC at multiple centers and will include a control arm.
About Small-Cell Lung Cancer
Lung cancer is the leading cause of cancer death for both men and women. More people die of lung cancer than colon, breast and prostate cancers combined. In 2007 there will be 213,380 new cases of lung cancer. About 15-20 percent of all lung cancers are small-cell lung cancer. Patients with extensive stage (metastatic) small-cell lung cancer have a dismal prognosis and most live less than 10 months. This cancer often starts in the bronchi near the center of the chest, although the cancer cells often multiply quickly to form tumors that spread widely through the body. This is important because it means the treatment must include drugs that kill the widespread disease. (Source: American Cancer Society)
About INGN 225
INGN 225 is an investigational immunotherapy that delivers the p53 tumor suppressor (Ad-p53) to a patient's immune cells, stimulating an anti-tumor immune response. Dendritic cells are collected from patient following the last dose of first-line chemotherapy, and treated in the laboratory with Ad-p53, to generate the INGN 225 immunotherapy.
About Moffitt Cancer Center
Located in Tampa, Florida, Moffitt Cancer Center (www.moffitt.org) is the only Florida-based cancer center with the NCI designation as a Comprehensive Cancer Center for its excellence in research and contributions to clinical trials, prevention and cancer control. Moffitt currently has 15 affiliates in Florida, one in Georgia and two in Puerto Rico. Additionally, Moffitt is a member of the National Comprehensive Cancer Network, a prestigious alliance of the country's leading cancer centers, and is listed in U.S. News & World Report as one of "America's Best Hospitals" for cancer and ear, nose and throat. Moffitt's sole mission is to contribute to the prevention and cure of cancer.
About Introgen Therapeutics, Inc.
Introgen Therapeutics, Inc. is a biopharmaceutical company focused on the development, manufacturing and commercialization of targeted tumor suppressors, a new class of therapies for the treatment of cancer. Introgen's technology delivers targeted molecular therapies that increase production of normal cancer-fighting proteins and cytokines. The Company is developing a proprietary pipeline of product candidates utilizing molecular biomarkers to identify patients most likely to benefit from its therapies which target central cancer-causing mechanisms. ADVEXIN(R), its lead product candidate, targets abnormal p53, a fundamental cancer defect present in over 50 percent of all tumors. Introgen is analyzing its phase 3 clinical trial data for recurrent head and neck cancer using ADVEXIN as a monotherapy. The Company plans to complete regulatory filings in both the United States and in Europe by the end of 2007. For more information about the Company, please visit www.introgen.com.
Forward-Looking Statements
Statements in this release that are not strictly historical may be "forward-looking" statements, including those relating to Introgen's future success with its INGN 225 clinical development program for the treatment of small-cell lung cancer. The actual results may differ from those described in this release due to risks and uncertainties that exist in Introgen's operations and business environment, including Introgen's stage of product development and the limited experience in the development of gene-based drugs in general, dependence upon proprietary technology and the current competitive environment, history of operating losses and accumulated deficits, reliance on collaborative relationships, and uncertainties related to clinical trials, the safety and efficacy of Introgen's product candidates, the ability to obtain the appropriate regulatory approvals, Introgen's patent protection and market acceptance, as well as other risks detailed from time to time in Introgen's filings with the Securities and Exchange Commission including its filings on Form 10-K and Form 10-Q. Introgen undertakes no obligation to publicly release the results of any revisions to any forward-looking statements that reflect events or circumstances arising after the date hereof.
Editor's Note: For more information on Introgen Therapeutics, or for a menu of archived press releases, please visit Introgen's Website at: www.introgen.com.
Editor's Note: The project is supported by Grant Number R01CA120282 from the National Cancer Institute.
MULTIMEDIA AVAILABLE:
http://www.businesswire.com/cgi-bin/mmg.cgi?eid=5485649
CONTACT:
Introgen Therapeutics, Inc., Austin
C. Channing Burke, 512-965-0907
c.burke@introgen.com
or
Moffitt Cancer Center
Michelle Foley, 813-745-1505
michelle.foley@moffitt.org
or
WeissComm Partners
Amy Martini, 212-301-7223
amartini@wcpglobal.com
SOURCE:
Introgen Therapeutics, Inc.
News Releases
Media Contacts
Events
Information Request
E-mail Alerts
About Introgen | Clinical Trials | Contract Services | Investor Relations | PR / News | Technologies Powered by Dot Command Center, Inc.
© Copyright 2006. Introgen Therapeutics, Inc. All rights reserved. | Terms of Use | Privacy Policy Site Map | Contact Us
AUSTIN, Texas & TAMPA, Florida--(BUSINESS WIRE)--Sept. 6, 2007--Introgen Therapeutics, Inc. (NASDAQ:INGN) and Moffitt Cancer Center today announced plans to begin a phase 2 randomized, controlled study of INGN 225, Introgen's investigational immunotherapy product in patients with metastatic small-cell lung cancer (termed extensive stage SCLC).
INGN 225 is an immunotherapy using a patient's own cells to stimulate an anti-tumor immune response to fight cancer. The immunotherapeutic targets a molecular abnormality found in over half of all solid cancers.
The National Institutes of Health National Cancer Institute awarded a grant of approximately $1.3 million to fund this trial, which is expected to enroll as many as 80 patients starting early next year upon completion of the protocol with the NCI and U.S. Food and Drug Administration.
Results from a previous Phase 2 trial were presented today at the 12th World Conference on Lung Cancer, sponsored by the International Association for the Study of Lung Cancer, in Seoul, Korea showing a 45 percent response rate in patients with platinum-resistant small-cell lung cancer who received chemotherapy following INGN 225. Interim results from this study also were presented earlier this year at the annual meeting of the American Society of Clinical Oncology. The historical response rate is generally less than 15 percent in these patients. Among the 43 patients evaluable for survival following INGN 225 treatment, survival was also improved compared to historical controls.
"The data to date indicate that INGN 225 could be a promising treatment in terms of survival, response rate and tolerability in a disease with virtually no treatments after chemotherapy has failed," said Dr. Dmitry Gabrilovich, professor of Oncology at Moffitt Cancer Center. "We are looking forward to confirming these earlier findings in a randomized, controlled phase 2 study that, if successful, could be expanded to become a registration study since there is such an acute medical need for new treatments in patients with extensive stage small-cell lung cancer resistant to chemotherapy."
The controlled, randomized trial, which will be co-led by Dr. Scott Antonia, program leader, Immunology and medical director, Cellular Therapies Core, and Dr. Gabrilovich, is being designed to evaluate the efficacy and safety of INGN 225 in patients with extensive stage SCLC at multiple centers and will include a control arm.
About Small-Cell Lung Cancer
Lung cancer is the leading cause of cancer death for both men and women. More people die of lung cancer than colon, breast and prostate cancers combined. In 2007 there will be 213,380 new cases of lung cancer. About 15-20 percent of all lung cancers are small-cell lung cancer. Patients with extensive stage (metastatic) small-cell lung cancer have a dismal prognosis and most live less than 10 months. This cancer often starts in the bronchi near the center of the chest, although the cancer cells often multiply quickly to form tumors that spread widely through the body. This is important because it means the treatment must include drugs that kill the widespread disease. (Source: American Cancer Society)
About INGN 225
INGN 225 is an investigational immunotherapy that delivers the p53 tumor suppressor (Ad-p53) to a patient's immune cells, stimulating an anti-tumor immune response. Dendritic cells are collected from patient following the last dose of first-line chemotherapy, and treated in the laboratory with Ad-p53, to generate the INGN 225 immunotherapy.
About Moffitt Cancer Center
Located in Tampa, Florida, Moffitt Cancer Center (www.moffitt.org) is the only Florida-based cancer center with the NCI designation as a Comprehensive Cancer Center for its excellence in research and contributions to clinical trials, prevention and cancer control. Moffitt currently has 15 affiliates in Florida, one in Georgia and two in Puerto Rico. Additionally, Moffitt is a member of the National Comprehensive Cancer Network, a prestigious alliance of the country's leading cancer centers, and is listed in U.S. News & World Report as one of "America's Best Hospitals" for cancer and ear, nose and throat. Moffitt's sole mission is to contribute to the prevention and cure of cancer.
About Introgen Therapeutics, Inc.
Introgen Therapeutics, Inc. is a biopharmaceutical company focused on the development, manufacturing and commercialization of targeted tumor suppressors, a new class of therapies for the treatment of cancer. Introgen's technology delivers targeted molecular therapies that increase production of normal cancer-fighting proteins and cytokines. The Company is developing a proprietary pipeline of product candidates utilizing molecular biomarkers to identify patients most likely to benefit from its therapies which target central cancer-causing mechanisms. ADVEXIN(R), its lead product candidate, targets abnormal p53, a fundamental cancer defect present in over 50 percent of all tumors. Introgen is analyzing its phase 3 clinical trial data for recurrent head and neck cancer using ADVEXIN as a monotherapy. The Company plans to complete regulatory filings in both the United States and in Europe by the end of 2007. For more information about the Company, please visit www.introgen.com.
Forward-Looking Statements
Statements in this release that are not strictly historical may be "forward-looking" statements, including those relating to Introgen's future success with its INGN 225 clinical development program for the treatment of small-cell lung cancer. The actual results may differ from those described in this release due to risks and uncertainties that exist in Introgen's operations and business environment, including Introgen's stage of product development and the limited experience in the development of gene-based drugs in general, dependence upon proprietary technology and the current competitive environment, history of operating losses and accumulated deficits, reliance on collaborative relationships, and uncertainties related to clinical trials, the safety and efficacy of Introgen's product candidates, the ability to obtain the appropriate regulatory approvals, Introgen's patent protection and market acceptance, as well as other risks detailed from time to time in Introgen's filings with the Securities and Exchange Commission including its filings on Form 10-K and Form 10-Q. Introgen undertakes no obligation to publicly release the results of any revisions to any forward-looking statements that reflect events or circumstances arising after the date hereof.
Editor's Note: For more information on Introgen Therapeutics, or for a menu of archived press releases, please visit Introgen's Website at: www.introgen.com.
Editor's Note: The project is supported by Grant Number R01CA120282 from the National Cancer Institute.
MULTIMEDIA AVAILABLE:
http://www.businesswire.com/cgi-bin/mmg.cgi?eid=5485649
CONTACT:
Introgen Therapeutics, Inc., Austin
C. Channing Burke, 512-965-0907
c.burke@introgen.com
or
Moffitt Cancer Center
Michelle Foley, 813-745-1505
michelle.foley@moffitt.org
or
WeissComm Partners
Amy Martini, 212-301-7223
amartini@wcpglobal.com
SOURCE:
Introgen Therapeutics, Inc.
News Releases
Media Contacts
Events
Information Request
E-mail Alerts
About Introgen | Clinical Trials | Contract Services | Investor Relations | PR / News | Technologies Powered by Dot Command Center, Inc.
© Copyright 2006. Introgen Therapeutics, Inc. All rights reserved. | Terms of Use | Privacy Policy Site Map | Contact Us
Introgen Presents Biomarker Data Demonstrating Abnormal p53 Predicts ADVEXIN Efficacy in Head and Neck, Lung, Prostate and Li-Fraumeni Cancers
Introgen Therapeutics, Inc. (NASDAQ:INGN ) today reported the results of new data analysis from multiple Phase 2 clinical studies showing a statistically significant correlation between the abnormal p53 biomarker and tumor response after treatment with ADVEXIN in patients with head and neck, lung, prostate and Li-Fraumeni Syndrome cancers. These data were presented at the Mary Crowley Medical Research Center Conference on Cancer Gene Therapy in Dallas.
The Company will utilize these biomarker findings for its ongoing analyses of its randomized Phase 3 trial comparing ADVEXIN therapy to methotrexate for the treatment of recurrent head and neck cancer. Prior to the initiation of the Phase 3 analyses, the Company gained consent from the U.S. Food and Drug Administration to amend the ADVEXIN Investigational New Drug Application and Statistical Analysis Plan to include analyses of patient populations identified by the abnormal p53 biomarker. These prospective analyses and evaluations will be included in the ADVEXIN U.S. and international regulatory submissions.
"These findings provide important support for our regulatory filings," said Max W. Talbott, Ph.D., Introgen´s senior vice president of Worldwide Commercial Development and Regulatory Affairs. "They provide further justification for incorporating p53 biomarker analyses in our regulatory submissions for recurrent head and neck cancer in the United States and will advance our European Union application for ADVEXIN in Li-Fraumeni Syndrome, an inherited cancer disorder characterized by the development of multiple tumor types with abnormal p53."
In 54 late-stage cancer patient samples evaluated from the Company´s Phase 2 studies, tumor response after ADVEXIN monotherapy was observed in 35 percent of patients with the abnormal p53 biomarker and all tumor responses occurred in the abnormal p53 biomarker group (p = 0.0013). The majority of these patients had recurrent disease after receiving standard therapies.
Introgen has previously reported study results demonstrating a statistically significant correlation between the abnormal p53 biomarker and increased survival after ADVEXIN therapy in head and neck cancer patients.
"The results presented today confirm and extend previous biomarker data correlating the abnormal p53 biomarker with increased tumor responses following ADVEXIN treatment and support its use as a biomarker to predict ADVEXIN efficacy," said John Nemunaitis, M.D., a principal investigator of the studies and executive director of the Mary Crowley Medical Research Center. "Importantly, the data from multiple tumor types indicate an absolute correlation of tumor response and abnormal p53 as 100 percent of the responding tumors had the abnormal p53 biomarker."
About ADVEXIN
ADVEXIN p53 therapy is a targeted molecular therapy with broad applicability in a wide range of tumor types and clinical settings because it targets one of the most fundamental and common molecular defects, abnormal p53 tumor suppressor function, associated with cancer initiation, progression and treatment resistance. Introgen believes that ADVEXIN has demonstrated increased survival and tumor growth control in recurrent head and neck cancer patients. In addition, ADVEXIN has demonstrated clinical activity in a number of solid tumor types in multiple phase 1, 2 and 3 clinical trials conducted worldwide. Introgen´s first clinical trial was initiated in 1995 and approximately 30 clinical trials have been conducted to date in more than ten different oncology indications. Neither ADVEXIN nor any of Introgen´s other adenovirus products have ever been put on clinical hold by FDA or other regulators due to safety concerns or for any other reason.
About Introgen Therapeutics, Inc.
Introgen Therapeutics, Inc. is a biopharmaceutical company focused on the development, manufacturing and commercialization of targeted tumor suppressors, a new class of therapies for the treatment of cancer. Introgen´s technology delivers targeted molecular therapies that increase production of normal cancer-fighting proteins and cytokines. The Company is developing a proprietary pipeline of product candidates utilizing molecular biomarkers to identify patients most likely to benefit from its therapies which target central cancer-causing mechanisms. ADVEXIN(R), its lead product candidate, targets abnormal p53, a fundamental cancer defect present in over 50 percent of all tumors. Introgen is analyzing its phase 3 clinical trial for recurrent head and neck cancer using ADVEXIN as a monotherapy. The Company plans to complete regulatory filings in both the United States and in Europe by the end of 2007.
Statements in this release that are not strictly historical may be "forward-looking" statements, including those relating to Introgen´s future success with its ADVEXIN clinical development program for treatment of cancer. The actual results may differ from those described in this release due to risks and uncertainties that exist in Introgen´s operations and business environment, including Introgen´s stage of product development and the limited experience in the development of gene-based drugs in general, dependence upon proprietary technology and the current competitive environment, history of operating losses and accumulated deficits, reliance on collaborative relationships, and uncertainties related to clinical trials, the safety and efficacy of Introgen´s product candidates, the ability to obtain the appropriate regulatory approvals, Introgen´s patent protection and market acceptance, as well as other risks detailed from time to time in Introgen´s filings with the Securities and Exchange Commission including its filings on Form 10-K and Form 10-Q. Introgen undertakes no obligation to publicly release the results of any revisions to any forward-looking statements that reflect events or circumstances arising after the date hereof.
Editor´s Note: For more information on Introgen Therapeutics, or for a menu of archived press releases, please visit Introgen´s Website at: www.introgen.com.
© Business Wire
© Business Wire
Introgen Therapeutics, Inc. (NASDAQ:INGN ) today reported the results of new data analysis from multiple Phase 2 clinical studies showing a statistically significant correlation between the abnormal p53 biomarker and tumor response after treatment with ADVEXIN in patients with head and neck, lung, prostate and Li-Fraumeni Syndrome cancers. These data were presented at the Mary Crowley Medical Research Center Conference on Cancer Gene Therapy in Dallas.
The Company will utilize these biomarker findings for its ongoing analyses of its randomized Phase 3 trial comparing ADVEXIN therapy to methotrexate for the treatment of recurrent head and neck cancer. Prior to the initiation of the Phase 3 analyses, the Company gained consent from the U.S. Food and Drug Administration to amend the ADVEXIN Investigational New Drug Application and Statistical Analysis Plan to include analyses of patient populations identified by the abnormal p53 biomarker. These prospective analyses and evaluations will be included in the ADVEXIN U.S. and international regulatory submissions.
"These findings provide important support for our regulatory filings," said Max W. Talbott, Ph.D., Introgen´s senior vice president of Worldwide Commercial Development and Regulatory Affairs. "They provide further justification for incorporating p53 biomarker analyses in our regulatory submissions for recurrent head and neck cancer in the United States and will advance our European Union application for ADVEXIN in Li-Fraumeni Syndrome, an inherited cancer disorder characterized by the development of multiple tumor types with abnormal p53."
In 54 late-stage cancer patient samples evaluated from the Company´s Phase 2 studies, tumor response after ADVEXIN monotherapy was observed in 35 percent of patients with the abnormal p53 biomarker and all tumor responses occurred in the abnormal p53 biomarker group (p = 0.0013). The majority of these patients had recurrent disease after receiving standard therapies.
Introgen has previously reported study results demonstrating a statistically significant correlation between the abnormal p53 biomarker and increased survival after ADVEXIN therapy in head and neck cancer patients.
"The results presented today confirm and extend previous biomarker data correlating the abnormal p53 biomarker with increased tumor responses following ADVEXIN treatment and support its use as a biomarker to predict ADVEXIN efficacy," said John Nemunaitis, M.D., a principal investigator of the studies and executive director of the Mary Crowley Medical Research Center. "Importantly, the data from multiple tumor types indicate an absolute correlation of tumor response and abnormal p53 as 100 percent of the responding tumors had the abnormal p53 biomarker."
About ADVEXIN
ADVEXIN p53 therapy is a targeted molecular therapy with broad applicability in a wide range of tumor types and clinical settings because it targets one of the most fundamental and common molecular defects, abnormal p53 tumor suppressor function, associated with cancer initiation, progression and treatment resistance. Introgen believes that ADVEXIN has demonstrated increased survival and tumor growth control in recurrent head and neck cancer patients. In addition, ADVEXIN has demonstrated clinical activity in a number of solid tumor types in multiple phase 1, 2 and 3 clinical trials conducted worldwide. Introgen´s first clinical trial was initiated in 1995 and approximately 30 clinical trials have been conducted to date in more than ten different oncology indications. Neither ADVEXIN nor any of Introgen´s other adenovirus products have ever been put on clinical hold by FDA or other regulators due to safety concerns or for any other reason.
About Introgen Therapeutics, Inc.
Introgen Therapeutics, Inc. is a biopharmaceutical company focused on the development, manufacturing and commercialization of targeted tumor suppressors, a new class of therapies for the treatment of cancer. Introgen´s technology delivers targeted molecular therapies that increase production of normal cancer-fighting proteins and cytokines. The Company is developing a proprietary pipeline of product candidates utilizing molecular biomarkers to identify patients most likely to benefit from its therapies which target central cancer-causing mechanisms. ADVEXIN(R), its lead product candidate, targets abnormal p53, a fundamental cancer defect present in over 50 percent of all tumors. Introgen is analyzing its phase 3 clinical trial for recurrent head and neck cancer using ADVEXIN as a monotherapy. The Company plans to complete regulatory filings in both the United States and in Europe by the end of 2007.
Statements in this release that are not strictly historical may be "forward-looking" statements, including those relating to Introgen´s future success with its ADVEXIN clinical development program for treatment of cancer. The actual results may differ from those described in this release due to risks and uncertainties that exist in Introgen´s operations and business environment, including Introgen´s stage of product development and the limited experience in the development of gene-based drugs in general, dependence upon proprietary technology and the current competitive environment, history of operating losses and accumulated deficits, reliance on collaborative relationships, and uncertainties related to clinical trials, the safety and efficacy of Introgen´s product candidates, the ability to obtain the appropriate regulatory approvals, Introgen´s patent protection and market acceptance, as well as other risks detailed from time to time in Introgen´s filings with the Securities and Exchange Commission including its filings on Form 10-K and Form 10-Q. Introgen undertakes no obligation to publicly release the results of any revisions to any forward-looking statements that reflect events or circumstances arising after the date hereof.
Editor´s Note: For more information on Introgen Therapeutics, or for a menu of archived press releases, please visit Introgen´s Website at: www.introgen.com.
© Business Wire
© Business Wire
Introgen Announces Publication of Research Showing Promising Activity of INGN 241 Combined with Velcade(R) in Ovarian Cancer
AUSTIN, Texas, Oct 02, 2007 (BUSINESS WIRE) -- Introgen Therapeutics, Inc. (NASDAQ:INGN) announced today the publication of data from a preclinical study demonstrating the combination of INGN 241, Introgen's mda-7/IL-24 cancer product candidate, and Velcade(R) (Bortezemib) resulted in increased tumor cell killing in human ovarian cancer cells. The results from the study appeared in an advanced on-line article in Cancer Gene Therapy and provide a new molecularly targeted approach to specifically destroy cancer cells. The research was performed in the laboratory of Dr. Rajagopal Ramesh, associate professor in the Department of Thoracic and Cardiovascular Surgery at M.D. Anderson Cancer Center.
"This study shows that prolonging expression and function of tumor suppressor therapies, such as INGN 241, results in increased destruction of cancer cells," said Dr. Ramesh. "Having discovered a fundamental facet of MDA-7 regulation advances the goal of being able to defeat ways that cancer cells survive, enabling us to outsmart them."
Study Results
Researchers identified the degradation pathway for the MDA-7 tumor suppressor protein that is the active component of INGN 241. They showed that co-administration of INGN 241 and Velcade, a known protein degradation inhibitor, further elevated MDA-7 protein levels and caused a significant increase in killing of ovarian cancer cells. Velcade is also known to prolong expression of other tumor suppressor proteins such as p53.
Late last year, Introgen announced the worldwide, exclusive license to a family of patent applications, one of which covers the combination of Introgen's tumor suppressor product candidates and proteasome inhibitors, which can increase therapeutic functionality, such as Velcade(R) (Bortezemib).
About INGN 241
INGN 241 utilizes the mda-7/IL-24 tumor suppressor and targets several key pathways that impact the development, growth and metastasis of cancer cells. INGN 241 has been shown to have potent anti-angiogenic activity and works by inhibiting the production of a key blood vessel growth protein termed vascular endothelial growth factor. INGN 241 is being tested in a Phase 2 clinical trial for patients suffering from advanced melanoma and in a Phase 3 clinical trial in combination with radiation therapy in solid tumors. Mda-7 was discovered in the laboratory of Dr. Paul B. Fisher, professor of clinical pathology at Columbia University. Introgen holds an exclusive worldwide sublicense to the Columbia University rights for all gene therapy applications from GlaxoSmithKline.
About Introgen Therapeutics, Inc.
Introgen Therapeutics, Inc. is a biopharmaceutical company focused on the development, manufacturing and commercialization of targeted tumor suppressors, a new class of therapies for the treatment of cancer. Introgen's technology delivers targeted molecular therapies that increase production of normal cancer-fighting proteins and cytokines. The Company is developing a proprietary pipeline of product candidates utilizing molecular biomarkers to identify patients most likely to benefit from its therapies which target central cancer-causing mechanisms. ADVEXIN(R), its lead product candidate, targets abnormal p53, a fundamental cancer defect present in over 50 percent of all tumors. Introgen is analyzing its phase 3 clinical trial for recurrent head and neck cancer using ADVEXIN as a monotherapy. The Company plans to complete regulatory filings in both the United States and in Europe by the end of 2007.
Forward-Looking Statements
Statements in this release that are not strictly historical may be "forward-looking" statements, including those relating to Introgen's future success with its INGN 241 clinical development program for treatment of cancer. The actual results may differ from those described in this release due to risks and uncertainties that exist in Introgen's operations and business environment, including Introgen's stage of product development and the limited experience in the development of gene-based drugs in general, dependence upon proprietary technology and the current competitive environment, history of operating losses and accumulated deficits, reliance on collaborative relationships, and uncertainties related to clinical trials, the safety and efficacy of Introgen's product candidates, the ability to obtain the appropriate regulatory approvals, Introgen's patent protection and market acceptance, as well as other risks detailed from time to time in Introgen's filings with the Securities and Exchange Commission including its filings on Form 10-K and Form 10-Q. Introgen undertakes no obligation to publicly release the results of any revisions to any forward-looking statements that reflect events or circumstances arising after the date hereof.
Editor's Note: For more information on Introgen Therapeutics, or for a menu of archived press releases, please visit Introgen's Website at: www.introgen.com.
SOURCE:
Introgen Therapeutics, Inc.
Introgen Therapeutics, Inc.
C. Channing Burke, 512-708-9310, Ext. 322
c.burke@introgen.com
News Releases
Media Contacts
Events
Information Request
E-mail Alerts
About Introgen | Clinical Trials | Contract Services | Investor Relations | PR / News | Technologies Powered by Dot Command Center, Inc.
© Copyright 2006. Introgen Therapeutics, Inc. All rights reserved. | Terms of Use | Privacy Policy
AUSTIN, Texas, Oct 02, 2007 (BUSINESS WIRE) -- Introgen Therapeutics, Inc. (NASDAQ:INGN) announced today the publication of data from a preclinical study demonstrating the combination of INGN 241, Introgen's mda-7/IL-24 cancer product candidate, and Velcade(R) (Bortezemib) resulted in increased tumor cell killing in human ovarian cancer cells. The results from the study appeared in an advanced on-line article in Cancer Gene Therapy and provide a new molecularly targeted approach to specifically destroy cancer cells. The research was performed in the laboratory of Dr. Rajagopal Ramesh, associate professor in the Department of Thoracic and Cardiovascular Surgery at M.D. Anderson Cancer Center.
"This study shows that prolonging expression and function of tumor suppressor therapies, such as INGN 241, results in increased destruction of cancer cells," said Dr. Ramesh. "Having discovered a fundamental facet of MDA-7 regulation advances the goal of being able to defeat ways that cancer cells survive, enabling us to outsmart them."
Study Results
Researchers identified the degradation pathway for the MDA-7 tumor suppressor protein that is the active component of INGN 241. They showed that co-administration of INGN 241 and Velcade, a known protein degradation inhibitor, further elevated MDA-7 protein levels and caused a significant increase in killing of ovarian cancer cells. Velcade is also known to prolong expression of other tumor suppressor proteins such as p53.
Late last year, Introgen announced the worldwide, exclusive license to a family of patent applications, one of which covers the combination of Introgen's tumor suppressor product candidates and proteasome inhibitors, which can increase therapeutic functionality, such as Velcade(R) (Bortezemib).
About INGN 241
INGN 241 utilizes the mda-7/IL-24 tumor suppressor and targets several key pathways that impact the development, growth and metastasis of cancer cells. INGN 241 has been shown to have potent anti-angiogenic activity and works by inhibiting the production of a key blood vessel growth protein termed vascular endothelial growth factor. INGN 241 is being tested in a Phase 2 clinical trial for patients suffering from advanced melanoma and in a Phase 3 clinical trial in combination with radiation therapy in solid tumors. Mda-7 was discovered in the laboratory of Dr. Paul B. Fisher, professor of clinical pathology at Columbia University. Introgen holds an exclusive worldwide sublicense to the Columbia University rights for all gene therapy applications from GlaxoSmithKline.
About Introgen Therapeutics, Inc.
Introgen Therapeutics, Inc. is a biopharmaceutical company focused on the development, manufacturing and commercialization of targeted tumor suppressors, a new class of therapies for the treatment of cancer. Introgen's technology delivers targeted molecular therapies that increase production of normal cancer-fighting proteins and cytokines. The Company is developing a proprietary pipeline of product candidates utilizing molecular biomarkers to identify patients most likely to benefit from its therapies which target central cancer-causing mechanisms. ADVEXIN(R), its lead product candidate, targets abnormal p53, a fundamental cancer defect present in over 50 percent of all tumors. Introgen is analyzing its phase 3 clinical trial for recurrent head and neck cancer using ADVEXIN as a monotherapy. The Company plans to complete regulatory filings in both the United States and in Europe by the end of 2007.
Forward-Looking Statements
Statements in this release that are not strictly historical may be "forward-looking" statements, including those relating to Introgen's future success with its INGN 241 clinical development program for treatment of cancer. The actual results may differ from those described in this release due to risks and uncertainties that exist in Introgen's operations and business environment, including Introgen's stage of product development and the limited experience in the development of gene-based drugs in general, dependence upon proprietary technology and the current competitive environment, history of operating losses and accumulated deficits, reliance on collaborative relationships, and uncertainties related to clinical trials, the safety and efficacy of Introgen's product candidates, the ability to obtain the appropriate regulatory approvals, Introgen's patent protection and market acceptance, as well as other risks detailed from time to time in Introgen's filings with the Securities and Exchange Commission including its filings on Form 10-K and Form 10-Q. Introgen undertakes no obligation to publicly release the results of any revisions to any forward-looking statements that reflect events or circumstances arising after the date hereof.
Editor's Note: For more information on Introgen Therapeutics, or for a menu of archived press releases, please visit Introgen's Website at: www.introgen.com.
SOURCE:
Introgen Therapeutics, Inc.
Introgen Therapeutics, Inc.
C. Channing Burke, 512-708-9310, Ext. 322
c.burke@introgen.com
News Releases
Media Contacts
Events
Information Request
E-mail Alerts
About Introgen | Clinical Trials | Contract Services | Investor Relations | PR / News | Technologies Powered by Dot Command Center, Inc.
© Copyright 2006. Introgen Therapeutics, Inc. All rights reserved. | Terms of Use | Privacy Policy
Introgen Therapeutics Highlights Summary ADVEXIN Data at the Third International Workshop on Mutant p53 and the Symposium on Li-Fraumeni Syndrome
LYON, France--(BUSINESS WIRE)--Nov. 15, 2007--Introgen Therapeutics, Inc. (NASDAQ:INGN) today reported summary data from clinical studies of its lead product, ADVEXIN(R). These data confirm and extend previous biomarker data correlating the abnormal p53 biomarker with increased tumor responses following ADVEXIN treatment and support its use as a biomarker to predict ADVEXIN efficacy. Additionally, data are being presented demonstrating clinical benefit of ADVEXIN in a patient with a rare inherited form of cancer known as Li-Fraumeni Syndrome (LFS), a genetic disorder characterized by inherited mutations in the p53 tumor suppressor gene. These data have been the subject of previous presentations at scientific and medical conferences.
These data are being presented at the 3rd International Workshop on Mutant p53 and the Symposium on Li-Fraumeni Syndrome in Lyon, France, organized by the International Agency for Research on Cancer and the European community. The conference focuses on the biological role of mutant p53 and its clinical impact, bringing together an international community of scientists and clinicians to discuss state-of-the-art approaches to cancers in which p53 plays a role.
LFS is a cancer syndrome characterized by the inheritance of an abnormal p53 tumor suppressor. There are no approved therapies to specifically treat LFS. Normal p53, known as the "Guardian of the Genome," suppresses cancer and tumor formation. Without p53 tumor suppression, LFS patients often develop spontaneous and widespread tumors at an early age. Frequently, multiple members of the same family suffer from this genetic disorder.
Earlier this week, Introgen and its subsidiary, Gendux Molecular Limited, announced that a Marketing Authorization Application (MAA) was submitted to the European Medicines Agency for ADVEXIN, Introgen's targeted p53 tumor suppressor therapy for the treatment of Li-Fraumeni Syndrome cancers.
About Introgen Therapeutics, Inc.
Introgen Therapeutics, Inc. is a biopharmaceutical company focused on the development, manufacturing and commercialization of targeted tumor suppressors, a new class of therapies for the treatment of cancer. Introgen's technology delivers targeted molecular therapies that increase production of normal cancer-fighting proteins and cytokines. The Company is developing a proprietary pipeline of product candidates utilizing molecular biomarkers to identify patients most likely to benefit from its therapies which target central cancer-causing mechanisms. ADVEXIN(R), its lead product candidate, targets abnormal p53, a fundamental cancer defect present in over 50 percent of all tumors. Introgen is analyzing its phase 3 clinical trial for recurrent head and neck cancer using ADVEXIN as a monotherapy. The Company plans to complete regulatory filings in both the United States and in Europe by the end of 2007.
Statements in this release that are not strictly historical may be "forward-looking" statements, including those relating to Introgen's future success with its ADVEXIN clinical development program for treatment of cancer and Li-Fraumeni syndrome cancers. The actual results may differ from those described in this release due to risks and uncertainties that exist in Introgen's operations and business environment, including Introgen's stage of product development and the limited experience in the development of gene-based drugs in general, dependence upon proprietary technology and the current competitive environment, history of operating losses and accumulated deficits, reliance on collaborative relationships, and uncertainties related to clinical trials, the safety and efficacy of Introgen's product candidates, the ability to obtain the appropriate regulatory approvals, Introgen's patent protection and market acceptance, as well as other risks detailed from time to time in Introgen's filings with the Securities and Exchange Commission including its filings on Form 10-K and Form 10-Q. Introgen undertakes no obligation to publicly release the results of any revisions to any forward-looking statements that reflect events or circumstances arising after the date hereof.
Editor's Note: For more information on Introgen Therapeutics, or for a menu of archived press releases, please visit Introgen's Website at: www.introgen.com.
CONTACT:
Introgen Therapeutics, Inc.
C. Channing Burke, 512-708-9310 Ext. 322
c.burke@introgen.com
or
WeissComm Partners
E. Blair Schoeb, 760-365-1857
bschoeb@wcpglobal.com
SOURCE:
Introgen Therapeutics, Inc.
News Releases
Media Contacts
Events
Information Request
E-mail Alerts
About Introgen | Clinical Trials | Contract Services | Investor Relations | PR / News | Technologies Powered by Dot Command Center, Inc.
© Copyright 2006. Introgen Therapeutics, Inc. All rights reserved. | Terms of Use | Privacy Policy Site Map | Contact Us
LYON, France--(BUSINESS WIRE)--Nov. 15, 2007--Introgen Therapeutics, Inc. (NASDAQ:INGN) today reported summary data from clinical studies of its lead product, ADVEXIN(R). These data confirm and extend previous biomarker data correlating the abnormal p53 biomarker with increased tumor responses following ADVEXIN treatment and support its use as a biomarker to predict ADVEXIN efficacy. Additionally, data are being presented demonstrating clinical benefit of ADVEXIN in a patient with a rare inherited form of cancer known as Li-Fraumeni Syndrome (LFS), a genetic disorder characterized by inherited mutations in the p53 tumor suppressor gene. These data have been the subject of previous presentations at scientific and medical conferences.
These data are being presented at the 3rd International Workshop on Mutant p53 and the Symposium on Li-Fraumeni Syndrome in Lyon, France, organized by the International Agency for Research on Cancer and the European community. The conference focuses on the biological role of mutant p53 and its clinical impact, bringing together an international community of scientists and clinicians to discuss state-of-the-art approaches to cancers in which p53 plays a role.
LFS is a cancer syndrome characterized by the inheritance of an abnormal p53 tumor suppressor. There are no approved therapies to specifically treat LFS. Normal p53, known as the "Guardian of the Genome," suppresses cancer and tumor formation. Without p53 tumor suppression, LFS patients often develop spontaneous and widespread tumors at an early age. Frequently, multiple members of the same family suffer from this genetic disorder.
Earlier this week, Introgen and its subsidiary, Gendux Molecular Limited, announced that a Marketing Authorization Application (MAA) was submitted to the European Medicines Agency for ADVEXIN, Introgen's targeted p53 tumor suppressor therapy for the treatment of Li-Fraumeni Syndrome cancers.
About Introgen Therapeutics, Inc.
Introgen Therapeutics, Inc. is a biopharmaceutical company focused on the development, manufacturing and commercialization of targeted tumor suppressors, a new class of therapies for the treatment of cancer. Introgen's technology delivers targeted molecular therapies that increase production of normal cancer-fighting proteins and cytokines. The Company is developing a proprietary pipeline of product candidates utilizing molecular biomarkers to identify patients most likely to benefit from its therapies which target central cancer-causing mechanisms. ADVEXIN(R), its lead product candidate, targets abnormal p53, a fundamental cancer defect present in over 50 percent of all tumors. Introgen is analyzing its phase 3 clinical trial for recurrent head and neck cancer using ADVEXIN as a monotherapy. The Company plans to complete regulatory filings in both the United States and in Europe by the end of 2007.
Statements in this release that are not strictly historical may be "forward-looking" statements, including those relating to Introgen's future success with its ADVEXIN clinical development program for treatment of cancer and Li-Fraumeni syndrome cancers. The actual results may differ from those described in this release due to risks and uncertainties that exist in Introgen's operations and business environment, including Introgen's stage of product development and the limited experience in the development of gene-based drugs in general, dependence upon proprietary technology and the current competitive environment, history of operating losses and accumulated deficits, reliance on collaborative relationships, and uncertainties related to clinical trials, the safety and efficacy of Introgen's product candidates, the ability to obtain the appropriate regulatory approvals, Introgen's patent protection and market acceptance, as well as other risks detailed from time to time in Introgen's filings with the Securities and Exchange Commission including its filings on Form 10-K and Form 10-Q. Introgen undertakes no obligation to publicly release the results of any revisions to any forward-looking statements that reflect events or circumstances arising after the date hereof.
Editor's Note: For more information on Introgen Therapeutics, or for a menu of archived press releases, please visit Introgen's Website at: www.introgen.com.
CONTACT:
Introgen Therapeutics, Inc.
C. Channing Burke, 512-708-9310 Ext. 322
c.burke@introgen.com
or
WeissComm Partners
E. Blair Schoeb, 760-365-1857
bschoeb@wcpglobal.com
SOURCE:
Introgen Therapeutics, Inc.
News Releases
Media Contacts
Events
Information Request
E-mail Alerts
About Introgen | Clinical Trials | Contract Services | Investor Relations | PR / News | Technologies Powered by Dot Command Center, Inc.
© Copyright 2006. Introgen Therapeutics, Inc. All rights reserved. | Terms of Use | Privacy Policy Site Map | Contact Us
na endlich gehts mal wieder richtig runter, es kann doch nicht dauernd ungestraft über dem Allzeittief rumturnen.

Antwort auf Beitrag Nr.: 32.461.902 von wohinistmeinGeld am 17.11.07 01:29:01bios sind zur zeit out,da wird mächtig luft abgelassen obwohl die bios die ganze hausse nicht mitgemacht haben.mich kotzt das ganze auch mächtig an,aber was solls augen zu und durch.obwohl es noch richtig weh tun kann,denn nach unten ist noch luft genug
 :
:

 :
:
na geht doch auch andersrum





Antwort auf Beitrag Nr.: 32.543.202 von asics01 am 23.11.07 19:08:27solange es nur immer solche Eintagsfliegen sind ists ein schwacher Trost.

Hi,
langsam wird es spannend
Introgen´s ADVEXIN Advances as Marketing Authorization Application is Accepted for Review in Europe
Introgen Therapeutics, Inc. (NASDAQ:INGN ) and its subsidiary, Gendux Molecular Limited ("Gendux"), announced today the advancement of a Marketing Authorization Application ("MAA") for ADVEXIN. The MAA, the submission of which was recently announced, has now been accepted for technical review by the European medicines regulatory authority (the "EMEA") for the treatment of inherited Li-Fraumeni Syndrome ("LFS") cancers. This acceptance indicates that all administrative issues have been addressed and that the formal technical evaluation of the Application will be conducted under the EMEA´s Exceptional Circumstances Approval rules. If approved, ADVEXIN would be the world´s first treatment specific for an inherited cancer syndrome. ADVEXIN is targeted to reverse one of the most common cancer genetic defects that is inherited in Li-Fraumeni patients and found in the majority of non-inherited cancers.
The acceptance of the MAA for ADVEXIN will initiate the regulatory review of the Application´s preclinical, manufacturing and clinical data by EMEA. Exceptional Circumstances Approval rules available in Europe are being utilized by Gendux to expedite review of potential breakthrough therapies. The review will be based on clinical efficacy and safety results from the use of ADVEXIN in LFS and in a wide variety of non-inherited cancers with abnormal p53 tumor suppression that is the target of ADVEXIN treatment. Abnormal p53 is inherited in LFS and is also the most commonly identified defective gene in all solid cancers whether inherited or acquired. Patients´ tumors can be checked to determine if they have the p53 abnormality targeted by ADVEXIN using widely available tests.
Dr. Max Talbott, senior vice president of Worldwide Regulatory Affairs, said, "The ADVEXIN application is a historic submission, and could represent a truly personalized cancer therapy approach. We are encouraged by the EMEA´s acceptance of our Application under the Exceptional Circumstances Approval provisions and now look forward to working with the European regulatory authorities during the technical review process."
About ADVEXIN
ADVEXIN p53 therapy is a targeted molecular therapy with broad applicability in a wide range of tumor types and clinical settings because it targets one of the most fundamental and common molecular defects, abnormal p53 tumor suppressor function, associated with cancer initiation, progression and treatment resistance. ADVEXIN has demonstrated tumor growth control in recurrent head and neck cancer, lung cancer, breast cancer, esophageal, prostate and other cancer indications. ADVEXIN has demonstrated clinical activity in a number of solid tumor types in multiple phase 1, 2 and 3 clinical trials conducted worldwide.
About Li-Fraumeni Syndrome
LFS is a cancer syndrome characterized by the inheritance of an abnormal p53 tumor suppressor. Normal p53, known as the Guardian of the Genome, suppresses cancer and tumor formation. Without p53 tumor suppression, cancer patients can lose the ability to naturally combat cancer. Without a normally functioning p53 defense, LFS cancer patients often develop spontaneous and widespread tumors at an early age. Frequently, multiple members of the same family suffer from this genetic disorder and currently there are no approved therapies to specifically treat LFS.
About Introgen Therapeutics, Inc.
Introgen (NASDAQ:INGN) is a biopharmaceutical company focused on the development, manufacturing and commercialization of targeted tumor suppressors, a new class of therapies for the treatment of cancer. Introgen´s technology delivers targeted molecular therapies that increase production of normal cancer-fighting proteins and cytokines. Introgen is developing a proprietary pipeline of product candidates utilizing molecular biomarkers to identify patients most likely to benefit from its therapies which target central cancer-causing mechanisms. For more information on Introgen Therapeutics, or for a menu of archived press releases, please visit Introgen´s Website at: www.introgen.com.
About Gendux Molecular Limited
Gendux Molecular Limited is a non-resident Irish company based in Dublin, Ireland. The Company is focused on the commercialization of targeted molecular therapies to be applied with molecular diagnostic tools to introduce personalized medical products in European and other markets. Gendux is a subsidiary of Introgen Therapeutics, Inc. For more information on Gendux, or for a menu of archived press releases, please visit Gendux´s Website at: www.gendux.ie.
Forward-Looking Statements
Statements in this release that are not strictly historical may be "forward-looking" statements, including those relating to Introgen´s future success with its ADVEXIN clinical development program for treatment of LFS cancers, the approval of ADVEXIN for LFS in European markets, and the acceptance of Gendux Molecular Limited´s Marketing Authorization Application. The actual results may differ from those described in this release due to risks and uncertainties that exist in Introgen´s operations and business environment, including Introgen´s stage of product development and the limited experience in the development of gene-based drugs in general, dependence upon proprietary technology and the current competitive environment, history of operating losses and accumulated deficits, reliance on collaborative relationships, and uncertainties related to clinical trials, the safety and efficacy of Introgen´s product candidates, the ability to obtain the appropriate regulatory approvals, Introgen´s patent protection and market acceptance, as well as other risks detailed from time to time in Introgen´s filings with the Securities and Exchange Commission including its filings on Form 10-K and Form 10-Q. Introgen undertakes no obligation to publicly release the results of any revisions to any forward-looking statements that reflect events or circumstances arising after the date hereof.
© Business Wire
Weiß gar nicht, warum ihr euch so aufregt. Jedem der in INGN investiert, weiß um die Problematik von Gentechnik - gerade in den U.S.A.
Kursschwächen muss man einfach aussitzen. Es ist doch sowieso ein Hopp- oder Topp-Spiel mit extrem ungewissem Ausgang. Das ist aber nicht nur bei INGN so (siehe GPC).
50 % im Minus kann ruckizucki auch in +200 % münden.
Allen Investierten viel Erfolg!!!
Gruß, Stammzelle.
langsam wird es spannend

Introgen´s ADVEXIN Advances as Marketing Authorization Application is Accepted for Review in Europe
Introgen Therapeutics, Inc. (NASDAQ:INGN ) and its subsidiary, Gendux Molecular Limited ("Gendux"), announced today the advancement of a Marketing Authorization Application ("MAA") for ADVEXIN. The MAA, the submission of which was recently announced, has now been accepted for technical review by the European medicines regulatory authority (the "EMEA") for the treatment of inherited Li-Fraumeni Syndrome ("LFS") cancers. This acceptance indicates that all administrative issues have been addressed and that the formal technical evaluation of the Application will be conducted under the EMEA´s Exceptional Circumstances Approval rules. If approved, ADVEXIN would be the world´s first treatment specific for an inherited cancer syndrome. ADVEXIN is targeted to reverse one of the most common cancer genetic defects that is inherited in Li-Fraumeni patients and found in the majority of non-inherited cancers.
The acceptance of the MAA for ADVEXIN will initiate the regulatory review of the Application´s preclinical, manufacturing and clinical data by EMEA. Exceptional Circumstances Approval rules available in Europe are being utilized by Gendux to expedite review of potential breakthrough therapies. The review will be based on clinical efficacy and safety results from the use of ADVEXIN in LFS and in a wide variety of non-inherited cancers with abnormal p53 tumor suppression that is the target of ADVEXIN treatment. Abnormal p53 is inherited in LFS and is also the most commonly identified defective gene in all solid cancers whether inherited or acquired. Patients´ tumors can be checked to determine if they have the p53 abnormality targeted by ADVEXIN using widely available tests.
Dr. Max Talbott, senior vice president of Worldwide Regulatory Affairs, said, "The ADVEXIN application is a historic submission, and could represent a truly personalized cancer therapy approach. We are encouraged by the EMEA´s acceptance of our Application under the Exceptional Circumstances Approval provisions and now look forward to working with the European regulatory authorities during the technical review process."
About ADVEXIN
ADVEXIN p53 therapy is a targeted molecular therapy with broad applicability in a wide range of tumor types and clinical settings because it targets one of the most fundamental and common molecular defects, abnormal p53 tumor suppressor function, associated with cancer initiation, progression and treatment resistance. ADVEXIN has demonstrated tumor growth control in recurrent head and neck cancer, lung cancer, breast cancer, esophageal, prostate and other cancer indications. ADVEXIN has demonstrated clinical activity in a number of solid tumor types in multiple phase 1, 2 and 3 clinical trials conducted worldwide.
About Li-Fraumeni Syndrome
LFS is a cancer syndrome characterized by the inheritance of an abnormal p53 tumor suppressor. Normal p53, known as the Guardian of the Genome, suppresses cancer and tumor formation. Without p53 tumor suppression, cancer patients can lose the ability to naturally combat cancer. Without a normally functioning p53 defense, LFS cancer patients often develop spontaneous and widespread tumors at an early age. Frequently, multiple members of the same family suffer from this genetic disorder and currently there are no approved therapies to specifically treat LFS.
About Introgen Therapeutics, Inc.
Introgen (NASDAQ:INGN) is a biopharmaceutical company focused on the development, manufacturing and commercialization of targeted tumor suppressors, a new class of therapies for the treatment of cancer. Introgen´s technology delivers targeted molecular therapies that increase production of normal cancer-fighting proteins and cytokines. Introgen is developing a proprietary pipeline of product candidates utilizing molecular biomarkers to identify patients most likely to benefit from its therapies which target central cancer-causing mechanisms. For more information on Introgen Therapeutics, or for a menu of archived press releases, please visit Introgen´s Website at: www.introgen.com.
About Gendux Molecular Limited
Gendux Molecular Limited is a non-resident Irish company based in Dublin, Ireland. The Company is focused on the commercialization of targeted molecular therapies to be applied with molecular diagnostic tools to introduce personalized medical products in European and other markets. Gendux is a subsidiary of Introgen Therapeutics, Inc. For more information on Gendux, or for a menu of archived press releases, please visit Gendux´s Website at: www.gendux.ie.
Forward-Looking Statements
Statements in this release that are not strictly historical may be "forward-looking" statements, including those relating to Introgen´s future success with its ADVEXIN clinical development program for treatment of LFS cancers, the approval of ADVEXIN for LFS in European markets, and the acceptance of Gendux Molecular Limited´s Marketing Authorization Application. The actual results may differ from those described in this release due to risks and uncertainties that exist in Introgen´s operations and business environment, including Introgen´s stage of product development and the limited experience in the development of gene-based drugs in general, dependence upon proprietary technology and the current competitive environment, history of operating losses and accumulated deficits, reliance on collaborative relationships, and uncertainties related to clinical trials, the safety and efficacy of Introgen´s product candidates, the ability to obtain the appropriate regulatory approvals, Introgen´s patent protection and market acceptance, as well as other risks detailed from time to time in Introgen´s filings with the Securities and Exchange Commission including its filings on Form 10-K and Form 10-Q. Introgen undertakes no obligation to publicly release the results of any revisions to any forward-looking statements that reflect events or circumstances arising after the date hereof.
© Business Wire
Weiß gar nicht, warum ihr euch so aufregt. Jedem der in INGN investiert, weiß um die Problematik von Gentechnik - gerade in den U.S.A.
Kursschwächen muss man einfach aussitzen. Es ist doch sowieso ein Hopp- oder Topp-Spiel mit extrem ungewissem Ausgang. Das ist aber nicht nur bei INGN so (siehe GPC).
50 % im Minus kann ruckizucki auch in +200 % münden.
Allen Investierten viel Erfolg!!!
Gruß, Stammzelle.
Introgen für perspektivisch Denkende
Endingen (aktiencheck.de AG) - Die Experten von "Global Biotech Investing" halten die Aktie von Introgen (ISIN US46119F1075/ WKN 936231) für perspektivisch denkende Anleger für interessant.
Die Biotechgesellschaft habe in der vergangenen Woche bei der EMEA den Zulassungsantrag für Advexin bei Li-Fraumeni Syndrom-Krebsarten (LFS) eingereicht. Weitere Anträge in Europa und in den USA für den Einsatz von Advexin bei Kopf- und Halskrebs sollten folgen.
Werfe man einen Blick auf den Chart des Titels, so werde deutlich, dass der Markt nach dem Desaster der Vormonate nicht an einen Erfolg glaube. Doch was würde passieren, wenn der Antrag doch erfolgreich wäre, würden die Experten fragen.
Die Experten von "Global Biotech Investing" halten die Aktie von Introgen für perspektivisch denkende Anleger für interessant. (Ausgabe 23 vom 03.12.2007) (03.12.2007/ac/a/a)
Analyse-Datum: 03.12.2007
Endingen (aktiencheck.de AG) - Die Experten von "Global Biotech Investing" halten die Aktie von Introgen (ISIN US46119F1075/ WKN 936231) für perspektivisch denkende Anleger für interessant.
Die Biotechgesellschaft habe in der vergangenen Woche bei der EMEA den Zulassungsantrag für Advexin bei Li-Fraumeni Syndrom-Krebsarten (LFS) eingereicht. Weitere Anträge in Europa und in den USA für den Einsatz von Advexin bei Kopf- und Halskrebs sollten folgen.
Werfe man einen Blick auf den Chart des Titels, so werde deutlich, dass der Markt nach dem Desaster der Vormonate nicht an einen Erfolg glaube. Doch was würde passieren, wenn der Antrag doch erfolgreich wäre, würden die Experten fragen.
Die Experten von "Global Biotech Investing" halten die Aktie von Introgen für perspektivisch denkende Anleger für interessant. (Ausgabe 23 vom 03.12.2007) (03.12.2007/ac/a/a)
Analyse-Datum: 03.12.2007
und wieso rauscht die heute so in den keller???

File BLA and MAA for ADVEXIN in Advanced Head and Neck Cancer in First Half of 2008
AUSTIN, Texas, Dec 20, 2007 (BUSINESS WIRE) -- Introgen Therapeutics, Inc. (NASDAQ:INGN) announced today that upon the recommendation of its external regulatory and clinical advisors, the Company will include additional patient tissue samples from its Phase 3 trials for p53 biomarker analyses to predict ADVEXIN efficacy to strengthen its U.S. and European regulatory filings. This recommendation was made by the advisors without knowledge of Introgen's Phase 3 clinical trial results.
The Company expects to announce top-line Phase 3 data and submit its Biologics Licensing Application (BLA) and Marketing Authorization Application (MAA) for ADVEXIN for head and neck cancer in the first half of 2008. The Company's MAA for ADVEXIN for the potential treatment of Li-Fraumeni Syndrome, a genetically inherited cancer, was accepted for filing by the European Medicines Agency (EMEA) last month under the EMEA's Exceptional Circumstances rules.
The additional tissue samples, which were previously unavailable, can now be collected upon appropriate consent and, in some cases, Institutional Review Board (IRB) approvals. The Company expects to capture an additional 20 percent or more of biomarker data through this effort, which its advisors believe will substantially strengthen the clinical data portion of its regulatory filings.
"The Company feels that evaluation of all available data is critical to supporting the strongest possible regulatory application for ADVEXIN as a new treatment for patients with advanced head and neck cancer," said Max W. Talbott, Introgen's senior vice president of Regulatory Affairs.
Abnormality of the p53 tumor suppressor is one of the most common and fundamental molecular defects in cancer and the target of ADVEXIN p53 therapy. Introgen has previously reported data from its earlier trials in head and neck, lung, prostate and Li-Fraumeni demonstrating statistically significant correlations between p53 biomarkers, tumor response or increased survival following treatment with ADVEXIN. The efficacy evaluation of the Phase 3 study will incorporate molecular biomarker analyses that assess p53 abnormalities and p53 protein levels in patients' pre-treatment tumor samples.
About ADVEXIN
ADVEXIN is a targeted molecular therapy with the potential to be broadly applicable across a wide range of tumor types and clinical settings because it targets one of the most fundamental and common molecular defects, abnormal or blocked p53 tumor suppressor function, associated with cancer initiation, progression and treatment resistance. ADVEXIN has demonstrated increased survival and tumor growth control in recurrent head and neck cancer.
About Introgen Therapeutics, Inc.
Introgen Therapeutics, Inc. is a biopharmaceutical company focused on the development, manufacturing and commercialization of targeted tumor suppressors, a new class of therapies for the treatment of cancer. Introgen's technology delivers targeted molecular therapies that increase production of normal cancer-fighting proteins and cytokines. The Company is developing a proprietary pipeline of product candidates utilizing molecular biomarkers to identify patients most likely to benefit from its therapies which target central cancer-causing mechanisms.
Statements in this release that are not strictly historical may be "forward-looking" statements, including those relating to Introgen's future success with its ADVEXIN clinical development program for treatment of cancer, its success in obtaining and analyzing additional tissue samples from patients treated with ADVEXIN, and its success in making regulatory filings in the U.S. and Europe in the first half of 2008. Only the FDA and EMEA can determine whether ADVEXIN can be marketed in the United States and Europe. The actual results may differ from those described in this release due to risks and uncertainties that exist in Introgen's operations and business environment, including Introgen's stage of product development and the limited experience in the development of gene-based drugs in general, dependence upon proprietary technology and the current competitive environment, history of operating losses and accumulated deficits, reliance on collaborative relationships, and uncertainties related to clinical trials, the safety and efficacy of Introgen's product candidates, the ability to obtain the appropriate regulatory approvals, Introgen's patent protection and market acceptance, as well as other risks detailed from time to time in Introgen's filings with the Securities and Exchange Commission including its filings on Form 10-K and Form 10-Q. Introgen undertakes no obligation to publicly release the results of any revisions to any forward-looking statements that reflect events or circumstances arising after the date hereof.
Editor's Note: For more information on Introgen Therapeutics, or for a menu of archived press releases, please visit Introgen's Website at: www.introgen.com.
SOURCE:
Introgen Therapeutics, Inc.
Introgen Therapeutics, Inc.
C. Channing Burke, 512-708-9310 Ext. 322
c.burke@introgen.com
News Releases
Media Contacts
Events
Information Request
E-mail Alerts
About Introgen | Clinical Trials | Contract Services | Investor Relations | PR / News | Technologies Powered by Dot Command Center, Inc.
© Copyright 2006. Introgen Therapeutics, Inc. All rights reserved. | Terms of Use | Privacy Policy Site Map | Contact Us


File BLA and MAA for ADVEXIN in Advanced Head and Neck Cancer in First Half of 2008
AUSTIN, Texas, Dec 20, 2007 (BUSINESS WIRE) -- Introgen Therapeutics, Inc. (NASDAQ:INGN) announced today that upon the recommendation of its external regulatory and clinical advisors, the Company will include additional patient tissue samples from its Phase 3 trials for p53 biomarker analyses to predict ADVEXIN efficacy to strengthen its U.S. and European regulatory filings. This recommendation was made by the advisors without knowledge of Introgen's Phase 3 clinical trial results.
The Company expects to announce top-line Phase 3 data and submit its Biologics Licensing Application (BLA) and Marketing Authorization Application (MAA) for ADVEXIN for head and neck cancer in the first half of 2008. The Company's MAA for ADVEXIN for the potential treatment of Li-Fraumeni Syndrome, a genetically inherited cancer, was accepted for filing by the European Medicines Agency (EMEA) last month under the EMEA's Exceptional Circumstances rules.
The additional tissue samples, which were previously unavailable, can now be collected upon appropriate consent and, in some cases, Institutional Review Board (IRB) approvals. The Company expects to capture an additional 20 percent or more of biomarker data through this effort, which its advisors believe will substantially strengthen the clinical data portion of its regulatory filings.
"The Company feels that evaluation of all available data is critical to supporting the strongest possible regulatory application for ADVEXIN as a new treatment for patients with advanced head and neck cancer," said Max W. Talbott, Introgen's senior vice president of Regulatory Affairs.
Abnormality of the p53 tumor suppressor is one of the most common and fundamental molecular defects in cancer and the target of ADVEXIN p53 therapy. Introgen has previously reported data from its earlier trials in head and neck, lung, prostate and Li-Fraumeni demonstrating statistically significant correlations between p53 biomarkers, tumor response or increased survival following treatment with ADVEXIN. The efficacy evaluation of the Phase 3 study will incorporate molecular biomarker analyses that assess p53 abnormalities and p53 protein levels in patients' pre-treatment tumor samples.
About ADVEXIN
ADVEXIN is a targeted molecular therapy with the potential to be broadly applicable across a wide range of tumor types and clinical settings because it targets one of the most fundamental and common molecular defects, abnormal or blocked p53 tumor suppressor function, associated with cancer initiation, progression and treatment resistance. ADVEXIN has demonstrated increased survival and tumor growth control in recurrent head and neck cancer.
About Introgen Therapeutics, Inc.
Introgen Therapeutics, Inc. is a biopharmaceutical company focused on the development, manufacturing and commercialization of targeted tumor suppressors, a new class of therapies for the treatment of cancer. Introgen's technology delivers targeted molecular therapies that increase production of normal cancer-fighting proteins and cytokines. The Company is developing a proprietary pipeline of product candidates utilizing molecular biomarkers to identify patients most likely to benefit from its therapies which target central cancer-causing mechanisms.
Statements in this release that are not strictly historical may be "forward-looking" statements, including those relating to Introgen's future success with its ADVEXIN clinical development program for treatment of cancer, its success in obtaining and analyzing additional tissue samples from patients treated with ADVEXIN, and its success in making regulatory filings in the U.S. and Europe in the first half of 2008. Only the FDA and EMEA can determine whether ADVEXIN can be marketed in the United States and Europe. The actual results may differ from those described in this release due to risks and uncertainties that exist in Introgen's operations and business environment, including Introgen's stage of product development and the limited experience in the development of gene-based drugs in general, dependence upon proprietary technology and the current competitive environment, history of operating losses and accumulated deficits, reliance on collaborative relationships, and uncertainties related to clinical trials, the safety and efficacy of Introgen's product candidates, the ability to obtain the appropriate regulatory approvals, Introgen's patent protection and market acceptance, as well as other risks detailed from time to time in Introgen's filings with the Securities and Exchange Commission including its filings on Form 10-K and Form 10-Q. Introgen undertakes no obligation to publicly release the results of any revisions to any forward-looking statements that reflect events or circumstances arising after the date hereof.
Editor's Note: For more information on Introgen Therapeutics, or for a menu of archived press releases, please visit Introgen's Website at: www.introgen.com.
SOURCE:
Introgen Therapeutics, Inc.
Introgen Therapeutics, Inc.
C. Channing Burke, 512-708-9310 Ext. 322
c.burke@introgen.com
News Releases
Media Contacts
Events
Information Request
E-mail Alerts
About Introgen | Clinical Trials | Contract Services | Investor Relations | PR / News | Technologies Powered by Dot Command Center, Inc.
© Copyright 2006. Introgen Therapeutics, Inc. All rights reserved. | Terms of Use | Privacy Policy Site Map | Contact Us
Antwort auf Beitrag Nr.: 32.828.160 von asics01 am 20.12.07 16:40:40hier die überschrift komplett
Introgen Plans to Expand Biomarker Database in Phase 3 Trials and File BLA and MAA for ADVEXIN in Advanced Head and Neck Cancer in First Half of 2008
Introgen Plans to Expand Biomarker Database in Phase 3 Trials and File BLA and MAA for ADVEXIN in Advanced Head and Neck Cancer in First Half of 2008
bis jetzt habe ich noch keinen Haken an der Sache gefunden
Muß mir das später nochmal genau ansehen.

Muß mir das später nochmal genau ansehen.
Antwort auf Beitrag Nr.: 32.828.916 von wohinistmeinGeld am 20.12.07 17:34:33wo liegt der hund begraben 



Antwort auf Beitrag Nr.: 32.842.192 von asics01 am 21.12.07 19:01:34Ich bin mir nicht sicher, mein englisch ist nicht weltbewegend.
Es sollen wohl von wem auch immer zusätzliche Tests vorgeschlagen, empfohlen oder vorgeschrieben werden.
Das ist erst mal schlecht, aber anderseits gibt es durch diese zusätzlichen Tests wieder mehr Daten.
ich weiß jetzt nicht ob der ursprüngliche Termin für die Phase 3 sich dadurch verzögert, aber das war, wenn ich mich recht erinnere doch sowieso erst im Frühjahr vorgesehen, also wenn das jetzt 2-3 Monate länger dauert ist das doch kein Grund für den Kurssturz. Die Erfolgsausichten werden dadurch eher verbessert.
Vielleicht findet sich ja mal jemand der besser übersetzen kann.
Es sollen wohl von wem auch immer zusätzliche Tests vorgeschlagen, empfohlen oder vorgeschrieben werden.
Das ist erst mal schlecht, aber anderseits gibt es durch diese zusätzlichen Tests wieder mehr Daten.
ich weiß jetzt nicht ob der ursprüngliche Termin für die Phase 3 sich dadurch verzögert, aber das war, wenn ich mich recht erinnere doch sowieso erst im Frühjahr vorgesehen, also wenn das jetzt 2-3 Monate länger dauert ist das doch kein Grund für den Kurssturz. Die Erfolgsausichten werden dadurch eher verbessert.
Vielleicht findet sich ja mal jemand der besser übersetzen kann.
also, ich habe nochmal rumgesucht, es war erst im November noch bekanntgegeben worden, daß man im Plan wäre, und der hätte schon für Ende dieses Jahr die Vorlage bei FDA und EMA vorgesehen.
So wird der Kurssturz also klar.
Also eine weitere Verschiebung und aufkommender Verdacht, daß es hier alles andere als gut Läuft. Es ist halt eine von vielen Biotech-Klitschen die nur dazu gut sind Geld an der Börse einzusammeln und irgendwann in der Versenkung zu verschwinden.
Ich habe mit Helix nochmal die selbe Bude. Die Leute könnten miteinander verwandt sein. Das Hauptgeschäft nach dem Aktienverkauf scheint verzögern zu sein.
Ich habe nicht verkauft und werde es jetzt auch nicht tun. Ich hoffe auf einen ähnlichen Verlauf wie bei Dendreon, irgendwann eine gute Nachricht, eine Explosion um 300-500% und dann den Mist nichts wie weg bevor es wieder vorbei ist.
So wird der Kurssturz also klar.
Also eine weitere Verschiebung und aufkommender Verdacht, daß es hier alles andere als gut Läuft. Es ist halt eine von vielen Biotech-Klitschen die nur dazu gut sind Geld an der Börse einzusammeln und irgendwann in der Versenkung zu verschwinden.
Ich habe mit Helix nochmal die selbe Bude. Die Leute könnten miteinander verwandt sein. Das Hauptgeschäft nach dem Aktienverkauf scheint verzögern zu sein.

Ich habe nicht verkauft und werde es jetzt auch nicht tun. Ich hoffe auf einen ähnlichen Verlauf wie bei Dendreon, irgendwann eine gute Nachricht, eine Explosion um 300-500% und dann den Mist nichts wie weg bevor es wieder vorbei ist.
Antwort auf Beitrag Nr.: 32.845.987 von wohinistmeinGeld am 22.12.07 01:03:38Endingen (aktiencheck.de AG) - Die Experten von "Global Biotech Investing" halten die Aktie von Introgen (ISIN US46119F1075/ WKN 936231) für perspektivisch denkende Anleger für interessant.
Die Biotechgesellschaft habe in der vergangenen Woche bei der EMEA den Zulassungsantrag für Advexin bei Li-Fraumeni Syndrom-Krebsarten (LFS) eingereicht. Weitere Anträge in Europa und in den USA für den Einsatz von Advexin bei Kopf- und Halskrebs sollten folgen.
Werfe man einen Blick auf den Chart des Titels, so werde deutlich, dass der Markt nach dem Desaster der Vormonate nicht an einen Erfolg glaube. Doch was würde passieren, wenn der Antrag doch erfolgreich wäre, würden die Experten fragen.
Die Experten von "Global Biotech Investing" halten die Aktie von Introgen für perspektivisch denkende Anleger für interessant. (Ausgabe 23 vom 03.12.2007) (03.12.2007/ac/a/a)
Analyse-Datum: 03.12.2007
Die Biotechgesellschaft habe in der vergangenen Woche bei der EMEA den Zulassungsantrag für Advexin bei Li-Fraumeni Syndrom-Krebsarten (LFS) eingereicht. Weitere Anträge in Europa und in den USA für den Einsatz von Advexin bei Kopf- und Halskrebs sollten folgen.
Werfe man einen Blick auf den Chart des Titels, so werde deutlich, dass der Markt nach dem Desaster der Vormonate nicht an einen Erfolg glaube. Doch was würde passieren, wenn der Antrag doch erfolgreich wäre, würden die Experten fragen.
Die Experten von "Global Biotech Investing" halten die Aktie von Introgen für perspektivisch denkende Anleger für interessant. (Ausgabe 23 vom 03.12.2007) (03.12.2007/ac/a/a)
Analyse-Datum: 03.12.2007
Antwort auf Beitrag Nr.: 32.847.009 von asics01 am 22.12.07 12:58:12das hast du erst vor 2 Wochen rein gestellt und ist schon veraltet.
Jetzt sind erst mal (wieder) Verzögerungen angesagt weil zusätzliche Daten gebraucht werden.
Das ist ähnlich wie bei Helix, die ihren vor 3 Jahren angekündigten Zulassungsantrag bis heute nicht geschaft haben, oder Hana, die während dem Zulassungsverfahren zurückgezogen haben weil sie merkten dass das Zeug nichts taugt.
Ich traue der Sache nicht und befürchte, Advexin ist ein großer Schwindel mit manipulierten Daten.
Der Absturz ist berechtigt und ob sie sich nochmal erholt bezweifle ich.
Jetzt sind erst mal (wieder) Verzögerungen angesagt weil zusätzliche Daten gebraucht werden.
Das ist ähnlich wie bei Helix, die ihren vor 3 Jahren angekündigten Zulassungsantrag bis heute nicht geschaft haben, oder Hana, die während dem Zulassungsverfahren zurückgezogen haben weil sie merkten dass das Zeug nichts taugt.
Ich traue der Sache nicht und befürchte, Advexin ist ein großer Schwindel mit manipulierten Daten.
Der Absturz ist berechtigt und ob sie sich nochmal erholt bezweifle ich.
Antwort auf Beitrag Nr.: 32.847.330 von wohinistmeinGeld am 22.12.07 14:40:17mit bios kann man eigentlich nur verlieren,man sollte nur noch bios shorten.
meinst du das advexin eine luftnummer ist???
was fehlen für daten ??wie lange brauchen die um die fehlenden daten nachzureichen??fragen über fragen.
meinst du das advexin eine luftnummer ist???
was fehlen für daten ??wie lange brauchen die um die fehlenden daten nachzureichen??fragen über fragen.
Antwort auf Beitrag Nr.: 32.851.504 von asics01 am 23.12.07 09:40:06Ich glaube nicht, daß Advexin eine Luftnummer ist, sondern die ganze Firma.
Der Rest steht in der News die du selbst eingestellt hast.
Der Rest steht in der News die du selbst eingestellt hast.
!
Dieser Beitrag wurde moderiert.
Hi,
möchte nur mal etwas posten, das den Niedergang des einstigen Hoffnungsträgers in Sachen Gentherapie von einst krönt:
Introgen Receives Nasdaq Notice Regarding Minimum Market Value of Listed Securities
AUSTIN, Texas, Aug 01, 2008 (BUSINESS WIRE) --
Introgen Therapeutics, Inc. (NASDAQ:INGN), a developer of targeted molecular therapies for cancer, today announced that on July 30, 2008, it received a letter from The Nasdaq Stock Market ("Nasdaq") indicating that it does not comply with the minimum $50,000,000 market value of listed securities nor the alternative requirement of a minimum $50,000,000 in total assets and total revenue required for continued listing on The Nasdaq Global Market set forth in Marketplace Rules 4450(b)(1)(A) and 4450(b)(1)(B), respectively. This notification has no effect on the listing of the company's common stock at this time.
In accordance with Nasdaq Marketplace Rules, Introgen will have until August 29, 2008, to regain compliance with the minimum market value requirement. During this period, compliance will be regained if the market value of Introgen's listed securities is at least $50,000,000 for a minimum of 10 consecutive business days, which period may be extended at Nasdaq's discretion. If Introgen has not demonstrated compliance with the Marketplace Rules by August 29, 2008, Nasdaq will provide the company with written notice that its securities will be delisted. At that time, Introgen may appeal Nasdaq's determination to delist the company's common stock.
Alternatively, the company may apply to transfer its common stock to The Nasdaq Capital Market. Though no assurance can be made that its shares will be accepted for listing on that exchange, Introgen believes that it currently satisfies all the criteria for listing on The Nasdaq Capital Market. The Company will explore all options available to it to address the current listing issue.
About Introgen
Introgen Therapeutics, Inc. is a biopharmaceutical company focused on the discovery, development and commercialization of targeted molecular therapies for the treatment of cancer and other diseases. Introgen is developing molecular therapeutics, immunotherapies, vaccines and nano-particle tumor suppressor therapies to treat a wide range of cancers using tumor suppressors, cytokines and genes. Introgen maintains integrated research, development, manufacturing, clinical and regulatory departments and operates multiple manufacturing facilities including a commercial scale cGMP manufacturing facility.
SOURCE: Introgen Therapeutics, Inc.
Introgen Therapeutics, Inc., Austin Channing Burke, 512-708-9310, ext. 322 c.burke@introgen.com or Vida Communication Stephanie Diaz, 415-675-7400 (investors) sdiaz@vidacommunication.com or Tim Brons, 415-675-7400 (media) tbrons@vidacommunication.com
Copyright Business Wire 2008
Es sieht wirklich gaaaaanz traurig aus, wenn nicht bald die Reißleine gezogen werden kann!!! Aber wie?
Gruß,
Stammzelle.
möchte nur mal etwas posten, das den Niedergang des einstigen Hoffnungsträgers in Sachen Gentherapie von einst krönt:
Introgen Receives Nasdaq Notice Regarding Minimum Market Value of Listed Securities
AUSTIN, Texas, Aug 01, 2008 (BUSINESS WIRE) --
Introgen Therapeutics, Inc. (NASDAQ:INGN), a developer of targeted molecular therapies for cancer, today announced that on July 30, 2008, it received a letter from The Nasdaq Stock Market ("Nasdaq") indicating that it does not comply with the minimum $50,000,000 market value of listed securities nor the alternative requirement of a minimum $50,000,000 in total assets and total revenue required for continued listing on The Nasdaq Global Market set forth in Marketplace Rules 4450(b)(1)(A) and 4450(b)(1)(B), respectively. This notification has no effect on the listing of the company's common stock at this time.
In accordance with Nasdaq Marketplace Rules, Introgen will have until August 29, 2008, to regain compliance with the minimum market value requirement. During this period, compliance will be regained if the market value of Introgen's listed securities is at least $50,000,000 for a minimum of 10 consecutive business days, which period may be extended at Nasdaq's discretion. If Introgen has not demonstrated compliance with the Marketplace Rules by August 29, 2008, Nasdaq will provide the company with written notice that its securities will be delisted. At that time, Introgen may appeal Nasdaq's determination to delist the company's common stock.
Alternatively, the company may apply to transfer its common stock to The Nasdaq Capital Market. Though no assurance can be made that its shares will be accepted for listing on that exchange, Introgen believes that it currently satisfies all the criteria for listing on The Nasdaq Capital Market. The Company will explore all options available to it to address the current listing issue.
About Introgen
Introgen Therapeutics, Inc. is a biopharmaceutical company focused on the discovery, development and commercialization of targeted molecular therapies for the treatment of cancer and other diseases. Introgen is developing molecular therapeutics, immunotherapies, vaccines and nano-particle tumor suppressor therapies to treat a wide range of cancers using tumor suppressors, cytokines and genes. Introgen maintains integrated research, development, manufacturing, clinical and regulatory departments and operates multiple manufacturing facilities including a commercial scale cGMP manufacturing facility.
SOURCE: Introgen Therapeutics, Inc.
Introgen Therapeutics, Inc., Austin Channing Burke, 512-708-9310, ext. 322 c.burke@introgen.com or Vida Communication Stephanie Diaz, 415-675-7400 (investors) sdiaz@vidacommunication.com or Tim Brons, 415-675-7400 (media) tbrons@vidacommunication.com
Copyright Business Wire 2008
Es sieht wirklich gaaaaanz traurig aus, wenn nicht bald die Reißleine gezogen werden kann!!! Aber wie?

Gruß,
Stammzelle.
Antwort auf Beitrag Nr.: 34.646.888 von Stammzelle am 04.08.08 22:47:52Ich hätte nicht gedacht, dass sich tatsächlich noch einer um diesen Pleitekandidaten kümmert.
Die waren übrigens nicht
der einstigen Hoffnungsträgers in Sachen Gentherapie
sondern
einer der vielen einstigen Hoffnungsträgers in Sachen Gentherapie
und genauso wie viele der anderen Luftnummern waren sind die es eben auch, damit muß man in der Biotech rechnen wo früher oder später 90% der Firmen verschwinden.
Deshalb sollte man sich nicht in eine Aktie verlieben und alles hinnehmen, egal wieviel Mist die bauen, sonder verkaufen sobald was nicht nach Plan läuft.
Die waren übrigens nicht
der einstigen Hoffnungsträgers in Sachen Gentherapie
sondern
einer der vielen einstigen Hoffnungsträgers in Sachen Gentherapie
und genauso wie viele der anderen Luftnummern waren sind die es eben auch, damit muß man in der Biotech rechnen wo früher oder später 90% der Firmen verschwinden.
Deshalb sollte man sich nicht in eine Aktie verlieben und alles hinnehmen, egal wieviel Mist die bauen, sonder verkaufen sobald was nicht nach Plan läuft.
jetzt hat das Elend dann bald ein Ende. Der $ ist wohl endgültig weg und der Rauswurf aus der Nasdaq wird dann auch dem letzten Träumer die Augen öffnen.
und da hats es schon
-------------------
05.09.2008 22:32
Introgen Receives Staff Determination Letter from Nasdaq Global Market
Introgen Therapeutics, (News) Inc. (NASDAQ:INGN), a developer of targeted molecular therapies for cancer, today announced that on September 4, 2008, it received a letter from The Nasdaq Stock Market (News) ("Nasdaq") indicating that it had not regained compliance with Marketplace Rule 4450(b)(1)(A), requiring a minimum $50 million market value of listed securities for continued inclusion on The Nasdaq Global Market. Introgen intends to request a hearing before the Nasdaq Listing Qualifications Panel (the ”Panel“). The company expects the hearing to take place within four to eight weeks, and the Company's shares will continue to be listed on The Nasdaq Global Market pending the outcome of the appeal. Alternatively, Introgen may apply to have its listing transferred to The Nasdaq Capital Market, provided that it satisfies the requirements for continued listing on that market at the time of transfer.
APPEAL PROCESS
Pursuant to The Nasdaq Marketplace Rules, the Panel has discretion to grant an exception not to exceed 180 days from September 4, 2008, the date of receipt of the Staff delisting notification, allowing the Company to implement and adhere to a plan of compliance. There can be no assurance that the Panel will grant the company's request for continued listing on The Nasdaq Global Market. In the event of an unfavorable determination by the Panel, the Company would alternatively apply to have its common stock transferred to The Nasdaq Capital Market, as long as it satisfies the requirements for continued inclusion set forth in the Marketplace Rules. There can be no assurance that the Company's shares will be approved for listing on The Nasdaq Capital Market.
BACKGROUND
As announced on August 1, 2008, Introgen received a letter from Nasdaq indicating that it was not in compliance with the minimum $50 million market value of listed securities nor the alternative requirement of a minimum $50 million in total assets and total revenue required for continued listing on The Nasdaq Global Market set forth in Marketplace Rules 4450(b)(1)(A) and 4450(b)(1)(B), respectively. In accordance with the Nasdaq Marketplace Rule 4450(e)(4), the company was provided a period of 30 calendar days to regain compliance with the Marketplace Rule.
http://www.finanznachrichten.de/nachrichten-2008-09/artikel-…" target="_blank" rel="nofollow ugc noopener">http://www.finanznachrichten.de/nachrichten-2008-09/artikel-…
------------------
Wird Zeit dass die dahin geschoben wo sie hin gehören, zu den anderen Luftnummern bei den Pink Sheets.
Eine MK von 50 Mio sind mindestens 49,9 Mio zuviel, und damit dürfte klar sein, dass sie die auch nicht mehr erreichen.
-------------------
05.09.2008 22:32
Introgen Receives Staff Determination Letter from Nasdaq Global Market
Introgen Therapeutics, (News) Inc. (NASDAQ:INGN), a developer of targeted molecular therapies for cancer, today announced that on September 4, 2008, it received a letter from The Nasdaq Stock Market (News) ("Nasdaq") indicating that it had not regained compliance with Marketplace Rule 4450(b)(1)(A), requiring a minimum $50 million market value of listed securities for continued inclusion on The Nasdaq Global Market. Introgen intends to request a hearing before the Nasdaq Listing Qualifications Panel (the ”Panel“). The company expects the hearing to take place within four to eight weeks, and the Company's shares will continue to be listed on The Nasdaq Global Market pending the outcome of the appeal. Alternatively, Introgen may apply to have its listing transferred to The Nasdaq Capital Market, provided that it satisfies the requirements for continued listing on that market at the time of transfer.
APPEAL PROCESS
Pursuant to The Nasdaq Marketplace Rules, the Panel has discretion to grant an exception not to exceed 180 days from September 4, 2008, the date of receipt of the Staff delisting notification, allowing the Company to implement and adhere to a plan of compliance. There can be no assurance that the Panel will grant the company's request for continued listing on The Nasdaq Global Market. In the event of an unfavorable determination by the Panel, the Company would alternatively apply to have its common stock transferred to The Nasdaq Capital Market, as long as it satisfies the requirements for continued inclusion set forth in the Marketplace Rules. There can be no assurance that the Company's shares will be approved for listing on The Nasdaq Capital Market.
BACKGROUND
As announced on August 1, 2008, Introgen received a letter from Nasdaq indicating that it was not in compliance with the minimum $50 million market value of listed securities nor the alternative requirement of a minimum $50 million in total assets and total revenue required for continued listing on The Nasdaq Global Market set forth in Marketplace Rules 4450(b)(1)(A) and 4450(b)(1)(B), respectively. In accordance with the Nasdaq Marketplace Rule 4450(e)(4), the company was provided a period of 30 calendar days to regain compliance with the Marketplace Rule.
http://www.finanznachrichten.de/nachrichten-2008-09/artikel-…" target="_blank" rel="nofollow ugc noopener">http://www.finanznachrichten.de/nachrichten-2008-09/artikel-…
------------------
Wird Zeit dass die dahin geschoben wo sie hin gehören, zu den anderen Luftnummern bei den Pink Sheets.
Eine MK von 50 Mio sind mindestens 49,9 Mio zuviel, und damit dürfte klar sein, dass sie die auch nicht mehr erreichen.
Die Luftnummer zuckt ja noch, ich dachte die wären inzwischen verschwunden, aber es geht ja in riesen Schritten auf eine 0 nach Komma zu
Ob die News noch irgendwie interessant ist glaub ich ja nicht, aber lesen kann auch nicht schaden.
Introgen Therapeutics Reports Third Quarter 2008 Financial Results
Introgen Therapeutics, (News) Inc. (NASDAQ:INGN), a developer of targeted molecular therapies for cancer, today announced financial results for the quarter and nine months ended September 30, 2008, and highlighted recent corporate developments.
Recent Developments:
Introgen announced additional positive data from its Phase III clinical trial of ADVEXIN® (p53 tumor suppressor therapy) for recurrent, refractory head and neck cancer. Findings showed that ADVEXIN demonstrated a statistically significant increased survival benefit compared to methotrexate in the prospectively defined p53 biomarker population, and a statistically significant increase in tumor response compared to methotrexate in the p53 biomarker population.
The company's Marketing Authorization Application (MAA) for ADVEXIN was accepted for review by the European Medicines Agency (EMEA).
The United States Food and Drug Administration (FDA) informed the company that the Biologics License Application (BLA) submitted by Introgen for the marketing approval of ADVEXIN in the United States was not sufficiently complete. The company intends to appeal this decision and is in discussions with the FDA regarding the appeal.
Also during the third quarter, Introgen initiated a restructuring of the company, including reducing staff, to conserve and redirect financial resources toward several priority objectives including:
Prosecution of the MAA for ADVEXIN in Europe.
Working with the FDA to determine an appropriate clinical development path for ADVEXIN in the U.S.
Contract production and manufacturing of biologics.
As a further step toward enhancing shareholder value, subsequent to the quarter end Introgen engaged Torreya Partners as its strategic advisor for the purpose of exploring a range of strategic opportunities for both the company and its programs. Strategic alternatives the company may pursue could include, but are not limited to, the sale of company assets, partnering or other collaboration agreements, a merger, or other strategic transactions.
The Company accepted the resignation of James W. Albrecht, Jr., as Chief Financial Officer and from all positions that he held with Introgen and its subsidiaries, effective as of November 14, 2008. Mr. Albrecht resigned to pursue new opportunities and not because of any disagreement with management as to our accounting practices or policies for which he was responsible.
”We are continuing operational expense reductions and exploring a range of strategic options with the intent of leveraging the company's key programs and manufacturing assets. These efforts are designed to enhance value for our shareholders,“ stated David G. Nance, president and CEO of Introgen. ”Concurrently, we are committed to ADVEXIN, which if approved by the EMEA, has the potential to become an important cancer therapy in Europe. We are also working with the FDA to determine the best potential registration path for ADVEXIN in the U.S.“
Third Quarter 2008 Financial Results
During the quarter, the company's cash, cash equivalents and short-term investments decreased $4.7 million as a result of the use of those resources to conduct its business, which is consistent with the anticipated decrease in the amount of these resources consumed compared to the previous quarter ended June 30, 2008. Introgen's cash, cash equivalents and short-term investments were $6.3 million at September 30, 2008.
Revenue was $331,000 for the quarter ended September 30, 2008, compared to revenue of $139,000 for the quarter ended September 30, 2007. Operating expense was $6.5 million for the quarter ended September 30, 2008, compared to operating expense of $8.1 million for the quarter ended September 30, 2007, which includes a $1.1 million expense in each period related to share-based compensation. Operating expense for the third quarter declined primarily as a result of the completion of activities associated with the ADVEXIN regulatory filings in both the U.S. and Europe during the second quarter of 2008 and ongoing programs to reduce our operating expenses.
The company's net loss was $6.0 million, or $0.14 per share, for the quarter ended September 30, 2008. These results compare to a net loss of $7.5 million, or $0.17 per share, for the comparable quarter ended September 30, 2007.
Nine Months Financial Results
Revenue was $638,000 for the nine months ended September 30, 2008, compared to revenue of $543,000 for the nine months ended September 30, 2007. Operating expense was $20.3 million for the nine months ended September 30, 2008, compared to operating expenses of $22.8 million for the nine months ended September 30, 2007, which includes $3.3 million and $3.9 million, respectively, of expense related to share-based compensation.
The company's net loss was $14.7 million, or $0.33 per share, for the nine months ended September 30, 2008. These results compare to a net loss of $20.9 million, or $0.48 per share, for the nine months ended September 30, 2007.
About ADVEXIN
ADVEXIN p53 therapy is a targeted molecular therapy with broad applicability in a wide range of tumor types and clinical settings because it targets one of the most fundamental and common molecular defects, abnormal p53 tumor suppressor function, associated with cancer initiation, progression and treatment resistance. ADVEXIN has demonstrated increased survival and tumor growth control in recurrent head and neck cancer patients. ADVEXIN has demonstrated clinical activity in a number of solid tumor types in multiple Phase 1, 2 and 3 clinical trials conducted worldwide. ADVEXIN is considered an 'Orphan Drug' in the U.S. for the treatment of recurrent, refractory head and neck cancer, which, if approved, entitles the drug to extended market exclusivity for the approved indication. ADVEXIN is a registered trademark describing p53 therapy, developed by Introgen under exclusive worldwide licenses from The University of Texas M.D. Anderson Cancer Center.
http://www.finanznachrichten.de/nachrichten-2008-11/12339346…

Ob die News noch irgendwie interessant ist glaub ich ja nicht, aber lesen kann auch nicht schaden.
Introgen Therapeutics Reports Third Quarter 2008 Financial Results
Introgen Therapeutics, (News) Inc. (NASDAQ:INGN), a developer of targeted molecular therapies for cancer, today announced financial results for the quarter and nine months ended September 30, 2008, and highlighted recent corporate developments.
Recent Developments:
Introgen announced additional positive data from its Phase III clinical trial of ADVEXIN® (p53 tumor suppressor therapy) for recurrent, refractory head and neck cancer. Findings showed that ADVEXIN demonstrated a statistically significant increased survival benefit compared to methotrexate in the prospectively defined p53 biomarker population, and a statistically significant increase in tumor response compared to methotrexate in the p53 biomarker population.
The company's Marketing Authorization Application (MAA) for ADVEXIN was accepted for review by the European Medicines Agency (EMEA).
The United States Food and Drug Administration (FDA) informed the company that the Biologics License Application (BLA) submitted by Introgen for the marketing approval of ADVEXIN in the United States was not sufficiently complete. The company intends to appeal this decision and is in discussions with the FDA regarding the appeal.
Also during the third quarter, Introgen initiated a restructuring of the company, including reducing staff, to conserve and redirect financial resources toward several priority objectives including:
Prosecution of the MAA for ADVEXIN in Europe.
Working with the FDA to determine an appropriate clinical development path for ADVEXIN in the U.S.
Contract production and manufacturing of biologics.
As a further step toward enhancing shareholder value, subsequent to the quarter end Introgen engaged Torreya Partners as its strategic advisor for the purpose of exploring a range of strategic opportunities for both the company and its programs. Strategic alternatives the company may pursue could include, but are not limited to, the sale of company assets, partnering or other collaboration agreements, a merger, or other strategic transactions.
The Company accepted the resignation of James W. Albrecht, Jr., as Chief Financial Officer and from all positions that he held with Introgen and its subsidiaries, effective as of November 14, 2008. Mr. Albrecht resigned to pursue new opportunities and not because of any disagreement with management as to our accounting practices or policies for which he was responsible.
”We are continuing operational expense reductions and exploring a range of strategic options with the intent of leveraging the company's key programs and manufacturing assets. These efforts are designed to enhance value for our shareholders,“ stated David G. Nance, president and CEO of Introgen. ”Concurrently, we are committed to ADVEXIN, which if approved by the EMEA, has the potential to become an important cancer therapy in Europe. We are also working with the FDA to determine the best potential registration path for ADVEXIN in the U.S.“
Third Quarter 2008 Financial Results
During the quarter, the company's cash, cash equivalents and short-term investments decreased $4.7 million as a result of the use of those resources to conduct its business, which is consistent with the anticipated decrease in the amount of these resources consumed compared to the previous quarter ended June 30, 2008. Introgen's cash, cash equivalents and short-term investments were $6.3 million at September 30, 2008.
Revenue was $331,000 for the quarter ended September 30, 2008, compared to revenue of $139,000 for the quarter ended September 30, 2007. Operating expense was $6.5 million for the quarter ended September 30, 2008, compared to operating expense of $8.1 million for the quarter ended September 30, 2007, which includes a $1.1 million expense in each period related to share-based compensation. Operating expense for the third quarter declined primarily as a result of the completion of activities associated with the ADVEXIN regulatory filings in both the U.S. and Europe during the second quarter of 2008 and ongoing programs to reduce our operating expenses.
The company's net loss was $6.0 million, or $0.14 per share, for the quarter ended September 30, 2008. These results compare to a net loss of $7.5 million, or $0.17 per share, for the comparable quarter ended September 30, 2007.
Nine Months Financial Results
Revenue was $638,000 for the nine months ended September 30, 2008, compared to revenue of $543,000 for the nine months ended September 30, 2007. Operating expense was $20.3 million for the nine months ended September 30, 2008, compared to operating expenses of $22.8 million for the nine months ended September 30, 2007, which includes $3.3 million and $3.9 million, respectively, of expense related to share-based compensation.
The company's net loss was $14.7 million, or $0.33 per share, for the nine months ended September 30, 2008. These results compare to a net loss of $20.9 million, or $0.48 per share, for the nine months ended September 30, 2007.
About ADVEXIN
ADVEXIN p53 therapy is a targeted molecular therapy with broad applicability in a wide range of tumor types and clinical settings because it targets one of the most fundamental and common molecular defects, abnormal p53 tumor suppressor function, associated with cancer initiation, progression and treatment resistance. ADVEXIN has demonstrated increased survival and tumor growth control in recurrent head and neck cancer patients. ADVEXIN has demonstrated clinical activity in a number of solid tumor types in multiple Phase 1, 2 and 3 clinical trials conducted worldwide. ADVEXIN is considered an 'Orphan Drug' in the U.S. for the treatment of recurrent, refractory head and neck cancer, which, if approved, entitles the drug to extended market exclusivity for the approved indication. ADVEXIN is a registered trademark describing p53 therapy, developed by Introgen under exclusive worldwide licenses from The University of Texas M.D. Anderson Cancer Center.
http://www.finanznachrichten.de/nachrichten-2008-11/12339346…
Antwort auf Beitrag Nr.: 35.997.394 von wohinistmeinGeld am 18.11.08 22:44:01der 1. Schritt zum Abschied von der Nasdaq ist getan, Luftnummern haben hier auch nichts verloren.
Introgen Therapeutics Inc. is getting knocked from the Nasdaq Global Market to the Nasdaq Capital Market.
The Austin-based biopharmaceutical company has been out of compliance with Nasdaq rules and is facing delisting by Nasdaq altogether.
The company’s shares will continue to be listed on the Nasdaq Capital Market if Introgen can demonstrate compliance with all listing requirements of the market by March 3, 2009.
Introgen (Nasdaq: INGN) has received two delisting notifications from the Nasdaq, the last of which was on Sept. 29. Nasdaq rules require that a company’s shares must close above $1 for 30 consecutive days and companies must maintain a minimum market value of $50 million or total assets and revenue of $50 million. Introgen has not been in compliance with either of those rules.
In early September, Introgen was dealt a significant blow when the U.S. Food and Drug Administration declined to accept the company’s application to market its head and neck cancer drug Advexin. Introgen has spent more than a decade developing Advexin.
Shares of Introgen were trading around 21 cents on Wednesday, up a bit from Tuesday’s closing price. The stock has traded in the range of 20 cents to $4.62 in the last year.
Introgen Therapeutics Inc. is getting knocked from the Nasdaq Global Market to the Nasdaq Capital Market.
The Austin-based biopharmaceutical company has been out of compliance with Nasdaq rules and is facing delisting by Nasdaq altogether.
The company’s shares will continue to be listed on the Nasdaq Capital Market if Introgen can demonstrate compliance with all listing requirements of the market by March 3, 2009.
Introgen (Nasdaq: INGN) has received two delisting notifications from the Nasdaq, the last of which was on Sept. 29. Nasdaq rules require that a company’s shares must close above $1 for 30 consecutive days and companies must maintain a minimum market value of $50 million or total assets and revenue of $50 million. Introgen has not been in compliance with either of those rules.
In early September, Introgen was dealt a significant blow when the U.S. Food and Drug Administration declined to accept the company’s application to market its head and neck cancer drug Advexin. Introgen has spent more than a decade developing Advexin.
Shares of Introgen were trading around 21 cents on Wednesday, up a bit from Tuesday’s closing price. The stock has traded in the range of 20 cents to $4.62 in the last year.
Es geht Schritt für Schritt dem Ende entgegen.
---------------------
As of 12:00 AM ET 11/26/08Introgen Therapeutics, a biopharmaceutical company, has reduced its staff from approximately 45 to 15 employees, as part of its restructuring operations. In conjunction with the reorganization, David Nance resigned his position as president and CEO of the company.
David Enloe, Jr, formerly Introgen's senior vice president of operations, has been named president and CEO of the company, succeeding Mr Nance, who will continue in his role as chairman of the board.
As a result of the restructuring, Introgen's non-manufacturing operations will be significantly reduced and will principally support the Advexin regulatory programs in the US and Europe.
In addition to David Nance, Max Talbott, senior vice president of clinical affairs, Robert Sobol, senior vice president of medical and scientific affairs, and David Parker, senior vice president of intellectual property have resigned their positions as officers of Introgen as a further step to preserve financial resources. However, to best support program continuity, these former officers, as well as other senior regulatory and medical staff, will continue to be available to the company through consulting or other arrangements.
-------------------
Wenn man bedenkt dass die seit 10 JAhren nichts als Luft produziert haben sind die restlichen 15 Leute immer noch viel zu viel, um Geld vom Konto abzuheben reicht eigentlich einer. Und noch einen braucht man natürlich wenn man eine Briefkastenfirma hat die was auf sich hält, es muß ja noch jemand den Briefkasten leeren, sowas macht man als Chef nicht selbst


---------------------
As of 12:00 AM ET 11/26/08Introgen Therapeutics, a biopharmaceutical company, has reduced its staff from approximately 45 to 15 employees, as part of its restructuring operations. In conjunction with the reorganization, David Nance resigned his position as president and CEO of the company.
David Enloe, Jr, formerly Introgen's senior vice president of operations, has been named president and CEO of the company, succeeding Mr Nance, who will continue in his role as chairman of the board.
As a result of the restructuring, Introgen's non-manufacturing operations will be significantly reduced and will principally support the Advexin regulatory programs in the US and Europe.
In addition to David Nance, Max Talbott, senior vice president of clinical affairs, Robert Sobol, senior vice president of medical and scientific affairs, and David Parker, senior vice president of intellectual property have resigned their positions as officers of Introgen as a further step to preserve financial resources. However, to best support program continuity, these former officers, as well as other senior regulatory and medical staff, will continue to be available to the company through consulting or other arrangements.
-------------------
Wenn man bedenkt dass die seit 10 JAhren nichts als Luft produziert haben sind die restlichen 15 Leute immer noch viel zu viel, um Geld vom Konto abzuheben reicht eigentlich einer. Und noch einen braucht man natürlich wenn man eine Briefkastenfirma hat die was auf sich hält, es muß ja noch jemand den Briefkasten leeren, sowas macht man als Chef nicht selbst



So, das wars, leider hatte ich recht als ich meinte es wird nie etwas von dieser Bude am Markt geben. Jetzt gehen sie den den vieler Biotechs vor ihnen und den auch noch weitere gehen werden.
Introgen files for bankruptcy, sees exit in 2009
NEW YORK, Dec 3 (Reuters) - Introgen Therapeutics Inc (News) filed for bankruptcy protection on Wednesday, after a U.S. regulatory setback earlier this year harmed the prospects for a speedy approval of its experimental cancer drug, Advexin.
The company said it expects to reorganize and emerge from bankruptcy protection in 2009.
In a Chapter 11 bankruptcy petition filed with the U.S. bankruptcy court for the Western District of Texas, the company listed assets of $9.1 million and debts of $12.9 million.
Last month, the company's chief executive resigned as did its chief financial officer, and it said it had hired a financial advisor to help it explore strategic opportunities.
Introgen said last week it wanted to focus on near-term revenue from its manufacturing and service business and cut its staff to 15 employees from about 45 employees.
The company said in a statement on Wednesday that it was 'optimistic' about its contract manufacturing business, but that it would continue to explore strategic alternatives for its therapeutic business portfolio.
(Reporting by Emily Chasan) Keywords: INTROGEN/BANKRUPTCY
(emily.chasan@thomsonreuters.com; +1 646 223 6114; Reuters Messaging: emily.chasan.reuters.com@reuters.net)
COPYRIGHT
Copyright Thomson Reuters 2008. All rights reserved.
The copying, republication or redistribution of Reuters News Content, including by framing or similar means, is expressly prohibited without the prior written consent of Thomson Reuters.
Introgen files for bankruptcy, sees exit in 2009
NEW YORK, Dec 3 (Reuters) - Introgen Therapeutics Inc (News) filed for bankruptcy protection on Wednesday, after a U.S. regulatory setback earlier this year harmed the prospects for a speedy approval of its experimental cancer drug, Advexin.
The company said it expects to reorganize and emerge from bankruptcy protection in 2009.
In a Chapter 11 bankruptcy petition filed with the U.S. bankruptcy court for the Western District of Texas, the company listed assets of $9.1 million and debts of $12.9 million.
Last month, the company's chief executive resigned as did its chief financial officer, and it said it had hired a financial advisor to help it explore strategic opportunities.
Introgen said last week it wanted to focus on near-term revenue from its manufacturing and service business and cut its staff to 15 employees from about 45 employees.
The company said in a statement on Wednesday that it was 'optimistic' about its contract manufacturing business, but that it would continue to explore strategic alternatives for its therapeutic business portfolio.
(Reporting by Emily Chasan) Keywords: INTROGEN/BANKRUPTCY
(emily.chasan@thomsonreuters.com; +1 646 223 6114; Reuters Messaging: emily.chasan.reuters.com@reuters.net)
COPYRIGHT
Copyright Thomson Reuters 2008. All rights reserved.
The copying, republication or redistribution of Reuters News Content, including by framing or similar means, is expressly prohibited without the prior written consent of Thomson Reuters.
Hi,
beobachtet noch jemand INGN?
Warum ging es in den U.S.A. in den letzten Tagen mit dem Kurs so rasend bergauf?
Habe die Leichen noch immer im Depot.
Weiß jemand, was mit den ganzen Lizenzen und den Forschungsreihen passiert? So war doch die Entwicklung des Medikaments gegen den schwarzen Hautkrebs recht vielversprechend.
Gruß, Stammzelle.
beobachtet noch jemand INGN?
Warum ging es in den U.S.A. in den letzten Tagen mit dem Kurs so rasend bergauf?

Habe die Leichen noch immer im Depot.
Weiß jemand, was mit den ganzen Lizenzen und den Forschungsreihen passiert? So war doch die Entwicklung des Medikaments gegen den schwarzen Hautkrebs recht vielversprechend.
Gruß, Stammzelle.
Antwort auf Beitrag Nr.: 37.019.165 von Stammzelle am 22.04.09 17:06:47wie kann der Kurs einer Aktie rauf gehen die gar nicht mehr existiert, hast du da geträumt?
Beitrag zu dieser Diskussion schreiben
Zu dieser Diskussion können keine Beiträge mehr verfasst werden, da der letzte Beitrag vor mehr als zwei Jahren verfasst wurde und die Diskussion daraufhin archiviert wurde.
Bitte wenden Sie sich an feedback@wallstreet-online.de und erfragen Sie die Reaktivierung der Diskussion oder starten Sie eine neue Diskussion.
Investoren beobachten auch:
| Wertpapier | Perf. % |
|---|---|
| +0,17 | |
| -0,77 | |
| -1,03 | |
| -0,26 | |
| -1,15 | |
| +0,07 | |
| -1,77 | |
| +0,08 | |
| +0,97 | |
| +0,37 |
Meistdiskutiert
| Wertpapier | Beiträge | |
|---|---|---|
| 98 | ||
| 56 | ||
| 56 | ||
| 49 | ||
| 48 | ||
| 45 | ||
| 44 | ||
| 34 | ||
| 29 | ||
| 29 |





















