Immunogen: T-DM1 ein zukünftiger Blockbuster - 500 Beiträge pro Seite
eröffnet am 27.04.10 08:24:07 von
neuester Beitrag 25.12.16 17:22:10 von
neuester Beitrag 25.12.16 17:22:10 von
Beiträge: 606
ID: 1.157.409
ID: 1.157.409
Aufrufe heute: 0
Gesamt: 62.502
Gesamt: 62.502
Aktive User: 0
ISIN: US45253H1014 · WKN: 878613 · Symbol: IMGN
31,25
USD
+0,03 %
+0,01 USD
Letzter Kurs 10.02.24 NYSE
Neuigkeiten
01.02.24 · Business Wire (engl.) |
03.01.24 · Business Wire (engl.) |
10.12.23 · Business Wire (engl.) |
05.12.23 · Business Wire (engl.) |
05.12.23 · Business Wire (engl.) |
Werte aus der Branche Biotechnologie
| Wertpapier | Kurs | Perf. % |
|---|---|---|
| 1,9000 | +59,66 | |
| 0,5922 | +44,44 | |
| 7,3500 | +43,84 | |
| 11,690 | +40,84 | |
| 0,7000 | +36,69 |
| Wertpapier | Kurs | Perf. % |
|---|---|---|
| 10,110 | -13,44 | |
| 8,2200 | -13,47 | |
| 7,6100 | -17,20 | |
| 1,6100 | -18,27 | |
| 2,1200 | -21,77 |
Roche wird wohl demnächst für T-DM1 zur Drittlinienbehandlung bei metastatischem Brustkrebs einen Zulassungsantrag bei der FDA einreichen. T-DM1 (Trastuzumab-DM1-Konjugat) ist eine "intelligente" Weiterentwicklung des monoklonalen Roche-Antikörpers Trastuzumab (Herceptin), mit welchem die Basler derzeit einen Jahresumsatz von über 5 Milliarden CHF (2009: 5,266 Milliarden CHF) generieren. T-DM1 verbindet den Antikörper über eine Brücke (Linker) mit einem hochtoxischen Zytostatika (Maytansin). Der Vorteil des Antikörper-Arznei-Konjugates ist der kombinierte Wirkmechanismus sowohl des Antikörpers als auch des Zytostatikas. Der Antikörper bindet an die HER2-Rezeptoren der Brustkrebszellen und wird in die Krebszelle internalisiert. Das gebundene Toxin (DM1 oder Maytansin) wird erst in der Zelle freigesetzt und entfaltet dann seine hochgiftige, den Zelltod verursachende Wirkung. In einer Phase-2-Studie konnte eine viel versprechende Wirksamkeit bei einer sehr geringen Toxizität nachgewiesen werden, so dass Roche möglicherweise eine Zulassung 3rd line aufgrund dieser Daten bei der FDA beantragen wird. Mittelfristig könnte Roche mit T-DM1 die Anwendung von Trastuzumab vollständig ersetzen, und somit die Auswirkungen des auslaufenden Patentschutz von Trastuzumab (2014?) auf ein Minimum beschränken. Da Immunogen mit 6% an den Umsätzen beteiligt sein wird, ergeben sich alleine für diesen Wirkstoff glänzende Aussichten.
Antwort auf Beitrag Nr.: 39.405.656 von Cyberhexe am 27.04.10 08:24:07Roche rechnet damit, mit T-DM1 die Anwedndung von Herceptin vollständig zu ersetzen und dies zudem zu einem höheren Preis. Die prognostizierten Umsätze für T-DM1 erscheinen vor diesem Hintergrund sehr konservativ, da Roche im abgelaufenen Geschäftsjahr mit Herceptin mehr als 5 Milliarden CHF umgesetzt hat.
Aus der Seeking-Alfa Mitschrift der Pressekonferenz von Immunogen zur Veröffentlichung des Quartalsergebnisses:
At the same time, they note that T-DM1 offers the benefit of being chemotherapy sparing, which certainly has an impact on the toxicity profile of the compound but also potentially benefits the overall cost of delivery. And as noted earlier, Roche did mention peak sales of T-DM1 as being between 2 billion and 5 billion Swiss Francs.
Allein diese Lizenzgebühren werden Immunogen zu einem profitablen Unternehmen machen.
Aus der Seeking-Alfa Mitschrift der Pressekonferenz von Immunogen zur Veröffentlichung des Quartalsergebnisses:
At the same time, they note that T-DM1 offers the benefit of being chemotherapy sparing, which certainly has an impact on the toxicity profile of the compound but also potentially benefits the overall cost of delivery. And as noted earlier, Roche did mention peak sales of T-DM1 as being between 2 billion and 5 billion Swiss Francs.
Allein diese Lizenzgebühren werden Immunogen zu einem profitablen Unternehmen machen.
Es ist wahrscheinlich, das NMS das Potenzial zum Blockbuster hat. Langfristig 2015, ist hier ein neuer "Teenbagger" durchaus möglich. Vom heutigen Kursniveau aus gesehen.
Antwort auf Beitrag Nr.: 39.450.806 von Cyberhexe am 04.05.10 11:30:17Seeeehr interessant dazu das Rochestatement:
"I am very pleased that, after discussions with the FDA, we are now planning to submit a US marketing application for our innovative breast cancer treatment T-DM1 this year, based on strong phase II data in women who have not responded to prior treatments."
Kannst du illustrieren, welchen Zeitrahmen bei einer "marketing application" seitens Roche in 2010 man in etwa für eine Marktzulassung von T-DM1 erwarten kann?!
Wie wahrscheinlich ist in diesem Zusammenhang, dass die FDA weitere Studien verlangt?!
"I am very pleased that, after discussions with the FDA, we are now planning to submit a US marketing application for our innovative breast cancer treatment T-DM1 this year, based on strong phase II data in women who have not responded to prior treatments."
Kannst du illustrieren, welchen Zeitrahmen bei einer "marketing application" seitens Roche in 2010 man in etwa für eine Marktzulassung von T-DM1 erwarten kann?!
Wie wahrscheinlich ist in diesem Zusammenhang, dass die FDA weitere Studien verlangt?!
Antwort auf Beitrag Nr.: 39.550.075 von Gulliver am 19.05.10 19:33:46
Ich denke, dass für die 3rd-line keine weiteren Studien verlangt werden (das ist sicher mit der FDA so abgestimmt) und dass die Wahrscheinlichkeit einer Zulassung ziemlich hoch ist. Ich würde auch von einer schnellen Entscheidung ausgehen und meine Vermutung ist, dass die Zulassung in einem Jahr um diese Zeit schon Geschichte ist.
(Zur ASCO sollen übrigens P II-Daten für eine second-line-Kombitherapie kommen. Bin gespannt.)
sorry, fürs Reinquatschen.
Ich denke, dass für die 3rd-line keine weiteren Studien verlangt werden (das ist sicher mit der FDA so abgestimmt) und dass die Wahrscheinlichkeit einer Zulassung ziemlich hoch ist. Ich würde auch von einer schnellen Entscheidung ausgehen und meine Vermutung ist, dass die Zulassung in einem Jahr um diese Zeit schon Geschichte ist.
(Zur ASCO sollen übrigens P II-Daten für eine second-line-Kombitherapie kommen. Bin gespannt.)
sorry, fürs Reinquatschen.
Antwort auf Beitrag Nr.: 39.559.188 von SLGramann am 20.05.10 20:24:55Wieso "sorry fürs reinquatschen" - ich bin froh über jeden qualifizierten Meinungsaustausch - auch wenn man nicht immer einer Meinung sein muss! 
Stehe hier noch ganz am Anfang meiner Due Diligence, aber ich schätze Cyberhexe sehr und bin dadurch auf den Wert aufmerksam geworden...
Prinzipiell habe ich persönlich mehrmals die Erfahrung gemacht, dass die FDA in ihrer Reaktion auf Anträge absolut unberechenbar reagiert.
Deshalb setze ich persönlich das Risiko einer Ablehnung oder Forderung nach weiteren Studien als relativ hoch an, mag Roche noch so positiv gestimmt sein.
Man denke einfach mal an den ersten DNDN-Zulassungsantrag für Provenge in 2007 zurück. Da hatten selbst die Experten überwältigend für eine Zulassung gestimmt...!
Mein Szenario (bitte auch gerne um Contrapositionen):
Kommt es zu einer Zulassung, ist der Wert auf 36 Monatssicht mit einem Tenbaggerpotential ausgestattet. Kommt es zu einer Ablehnung, droht eine Kurshalbierung bis Kursdrittelung.
Umsätze von 300 Millionen $ für IMGN können wohl laut Cyberhexes Rechnung durch T-DM1 als Nachfolger von Herceptin ab 2014 erreicht werden.
Mit dem Blockbusterpotential wird dann auch gerne mal ein Price/Sales-Ratio von 10 durch den Markt zugestanden.
Da ich die Chancen auf eine Zulassung 50:50 einschätze, macht eine 5%-Position des Portfolios hier imho schon Sinn!
Bedauernswert ist, dass momentan keine langlaufenden Optionen auf IMGN angeboten werden.
Bei DNDN hatte ich im März 2009 bei Kursen von 3$ eine Call-Option mit Laufzeit Januar 2011 und Basis 30$ gekauft.
Während der Kurs um den Faktor 1.500 gestiegen ist, ist die Option um den Faktor 4.000% gestiegen (habe leider viel zu früh verkauft, aber inähnlichen Relationen Option zu Aktie).
Da es aus meiner Sicht unwesentlich ist, ob sich der Investitionseinsatz bei 5% der Depotsumme halbiert oder wertlos verfällt (im Falle einer Option), würde ich aufgrund des höheren Kurshebels immer eine Option der Aktie vorziehen. Ein vernünftiges Pricing vorausgesetzt.
Aber die längsten Optionen bei IMGN laufen momentan nur bis Oktober 2010 und sind damit gegenüber der Aktie uninteressant!
Gibt es eine Schätzung über das Marktpotential von T-DM1 als Drittlinienbehandlung?

Stehe hier noch ganz am Anfang meiner Due Diligence, aber ich schätze Cyberhexe sehr und bin dadurch auf den Wert aufmerksam geworden...
Prinzipiell habe ich persönlich mehrmals die Erfahrung gemacht, dass die FDA in ihrer Reaktion auf Anträge absolut unberechenbar reagiert.

Deshalb setze ich persönlich das Risiko einer Ablehnung oder Forderung nach weiteren Studien als relativ hoch an, mag Roche noch so positiv gestimmt sein.
Man denke einfach mal an den ersten DNDN-Zulassungsantrag für Provenge in 2007 zurück. Da hatten selbst die Experten überwältigend für eine Zulassung gestimmt...!
Mein Szenario (bitte auch gerne um Contrapositionen):
Kommt es zu einer Zulassung, ist der Wert auf 36 Monatssicht mit einem Tenbaggerpotential ausgestattet. Kommt es zu einer Ablehnung, droht eine Kurshalbierung bis Kursdrittelung.
Umsätze von 300 Millionen $ für IMGN können wohl laut Cyberhexes Rechnung durch T-DM1 als Nachfolger von Herceptin ab 2014 erreicht werden.
Mit dem Blockbusterpotential wird dann auch gerne mal ein Price/Sales-Ratio von 10 durch den Markt zugestanden.
Da ich die Chancen auf eine Zulassung 50:50 einschätze, macht eine 5%-Position des Portfolios hier imho schon Sinn!
Bedauernswert ist, dass momentan keine langlaufenden Optionen auf IMGN angeboten werden.
Bei DNDN hatte ich im März 2009 bei Kursen von 3$ eine Call-Option mit Laufzeit Januar 2011 und Basis 30$ gekauft.
Während der Kurs um den Faktor 1.500 gestiegen ist, ist die Option um den Faktor 4.000% gestiegen (habe leider viel zu früh verkauft, aber inähnlichen Relationen Option zu Aktie).
Da es aus meiner Sicht unwesentlich ist, ob sich der Investitionseinsatz bei 5% der Depotsumme halbiert oder wertlos verfällt (im Falle einer Option), würde ich aufgrund des höheren Kurshebels immer eine Option der Aktie vorziehen. Ein vernünftiges Pricing vorausgesetzt.
Aber die längsten Optionen bei IMGN laufen momentan nur bis Oktober 2010 und sind damit gegenüber der Aktie uninteressant!
Gibt es eine Schätzung über das Marktpotential von T-DM1 als Drittlinienbehandlung?

Antwort auf Beitrag Nr.: 39.560.605 von Gulliver am 20.05.10 23:05:48
Also, third-line ist umsatzseitig nicht attraktiv - trotz möglichen off-label-Einsatzes.
Ob für second und first-line (auch) überzeugende Ergebnisse kommen, wird die Zukunft zeigen (obwohl die Chancen sicher gut sind).
300 Mio. an royalties dürfte aber in jedem Fall sehr weit entfernte Zukunftsmusik sein.
"In summary, Immunogen should start to generate commercial revenues already in 2011. The royalty stream will probably start at a low level of ~$2M next year and can go up to $8M in 2012. FDA approval and perhaps even filing will probably trigger a milestone payment of more than $10M. From 2013 onwards, royalties could climb substantially if T-DM1 is approved for 2nd line patients."
hier steht alles wesentliche:
http://www.hammerstockblog.com/immunogen-%E2%80%93-another-s…
Also, third-line ist umsatzseitig nicht attraktiv - trotz möglichen off-label-Einsatzes.
Ob für second und first-line (auch) überzeugende Ergebnisse kommen, wird die Zukunft zeigen (obwohl die Chancen sicher gut sind).
300 Mio. an royalties dürfte aber in jedem Fall sehr weit entfernte Zukunftsmusik sein.
"In summary, Immunogen should start to generate commercial revenues already in 2011. The royalty stream will probably start at a low level of ~$2M next year and can go up to $8M in 2012. FDA approval and perhaps even filing will probably trigger a milestone payment of more than $10M. From 2013 onwards, royalties could climb substantially if T-DM1 is approved for 2nd line patients."
hier steht alles wesentliche:
http://www.hammerstockblog.com/immunogen-%E2%80%93-another-s…
Antwort auf Beitrag Nr.: 39.561.080 von SLGramann am 21.05.10 05:43:06sehr informativer Artikel - vielen Dank. Werde die Seite mal bookmarken.
Da habe ich das mittelfristig erreichbare Umsatzpotential wohl eindeutig zu hoch angesetzt, die Frage ist welche Bewertung der Markt der Aktie aufgrund des "Potentials" zutraut, wenn die FDA für Drittlinienbehandlung eine Zulassung erteilt und paralle erfolgreiche Phase-2 Ergebnisse in Halbjahr 2 kommen für first-line und secondline-treatments..
Da habe ich das mittelfristig erreichbare Umsatzpotential wohl eindeutig zu hoch angesetzt, die Frage ist welche Bewertung der Markt der Aktie aufgrund des "Potentials" zutraut, wenn die FDA für Drittlinienbehandlung eine Zulassung erteilt und paralle erfolgreiche Phase-2 Ergebnisse in Halbjahr 2 kommen für first-line und secondline-treatments..

Antwort auf Beitrag Nr.: 39.561.080 von SLGramann am 21.05.10 05:43:06...der Umsatz von Herceptin ist mittlerweile > 5 Milliarden CHF/a und innerhalb Roche rechnet man damit, dass T-DM1 den Antikörper nach Ablauf des Patentschutzes (2014) vollständig ersetzen wird und zwar 1LmBC, 2LmBC (Zweitlinienbehandlung metastaischer Brustkrebs), eBC (early breast cancer) sowie auch in adjuvanter Anwendung und dies bei einem wahrscheinlich höheren Preis als für die bisherige Antikörpertherapie. Dies könnte dennoch zu einer möglichen Entlastung der KK beitragen, da der ADC (Antikörper-Arznei-Verbindung von Antibody Drug Conjugate) möglicherweise die konventionelle Chemotherapie überflüssig machen könnte.
Positiv ist die Tatsache, dass bei TDM1 bisher keine dosisabhängige Cardiotoxizität beobachtet wurde bzw. keine anderen neuen Signale auf Nebenwirkungen.
Natürlich ist es noch ein weiter Weg bis das Umsatzziel von Roche mit TDM1 realisiert wird, jedoch, und dies spricht für ein Investment in IMGN, hat Roche in der Vergangenheit ganz ganz selten derartige Prognosen nicht eingehalten. Und 6% von 5 Milliarden/a sind nun einmal 300 Mio/a.
Positiv ist die Tatsache, dass bei TDM1 bisher keine dosisabhängige Cardiotoxizität beobachtet wurde bzw. keine anderen neuen Signale auf Nebenwirkungen.
Natürlich ist es noch ein weiter Weg bis das Umsatzziel von Roche mit TDM1 realisiert wird, jedoch, und dies spricht für ein Investment in IMGN, hat Roche in der Vergangenheit ganz ganz selten derartige Prognosen nicht eingehalten. Und 6% von 5 Milliarden/a sind nun einmal 300 Mio/a.
Antwort auf Beitrag Nr.: 39.563.574 von Cyberhexe am 21.05.10 12:54:50
Ich stimme Dir weitestgehend zu. Nur würde ich die 5 Mrd. Dollar Umsatz nicht schon für 2014 oder 2015 erwarten.
Aber IMGN ist ja auch nicht nur T-DM1, auch wenn das natürlich für die nächste Zeit der entscheidende Werttreiber ist. Ihre Plattform ist einfach sehr spannend und wer im ADC-Bereich dabei sein will, der sollte sich m.E. nicht nur auf SGEN beschränken, die irgendwie immer als "heißer" gehandelt werden. Dementsprechend bin ich seit über einem Jahr (auch) in IMGN investiert.
Dennoch: Noch fehlen entscheidende Testdaten in der second und first-line-Behandlung und nur dort sind relevante Umsätze möglich. Wenn ich es jetzt richtig erinnere, soll in diesem Sommer übrigens eine P III für die first-line-Therapie beginnen.
Insgesamt finde ich bei IMGN das Chance/Risiko-Profil überdurchschnittlich ansprechend!
Ich stimme Dir weitestgehend zu. Nur würde ich die 5 Mrd. Dollar Umsatz nicht schon für 2014 oder 2015 erwarten.
Aber IMGN ist ja auch nicht nur T-DM1, auch wenn das natürlich für die nächste Zeit der entscheidende Werttreiber ist. Ihre Plattform ist einfach sehr spannend und wer im ADC-Bereich dabei sein will, der sollte sich m.E. nicht nur auf SGEN beschränken, die irgendwie immer als "heißer" gehandelt werden. Dementsprechend bin ich seit über einem Jahr (auch) in IMGN investiert.
Dennoch: Noch fehlen entscheidende Testdaten in der second und first-line-Behandlung und nur dort sind relevante Umsätze möglich. Wenn ich es jetzt richtig erinnere, soll in diesem Sommer übrigens eine P III für die first-line-Therapie beginnen.
Insgesamt finde ich bei IMGN das Chance/Risiko-Profil überdurchschnittlich ansprechend!
Antwort auf Beitrag Nr.: 39.563.574 von Cyberhexe am 21.05.10 12:54:50http://www.roche.com/investors/ir_agenda.htm?tab=2
interessante Road show von Roche
New York, USA, May 11, 2010
Bank of America-Merrill Lynch, Global Healthcare Conference
--> p.6
T-DM1 patient population
3L US: 4,400 EU: 3,750
4L US: 3,200 EU: 1,700
T-DM1 in advanced breast cancer
Single-agent, phase II data in patients
pre-treated with Herceptin, lapatinib and
chemotherapy
After successful discussion with FDA:
To be filed 2010
Die Zielgruppe für 3LmBC von TDM1 umfasst ca. 12.000 potenzielle Patienten. Bei erwarteten Kosten von nahezu 100.000 USD/Therapie ist das Umsatzpotenzial bereits bei der Drittlineienbehandlung beachtlich.
interessante Road show von Roche
New York, USA, May 11, 2010
Bank of America-Merrill Lynch, Global Healthcare Conference
--> p.6
T-DM1 patient population
3L US: 4,400 EU: 3,750
4L US: 3,200 EU: 1,700
T-DM1 in advanced breast cancer
Single-agent, phase II data in patients
pre-treated with Herceptin, lapatinib and
chemotherapy
After successful discussion with FDA:
To be filed 2010
Die Zielgruppe für 3LmBC von TDM1 umfasst ca. 12.000 potenzielle Patienten. Bei erwarteten Kosten von nahezu 100.000 USD/Therapie ist das Umsatzpotenzial bereits bei der Drittlineienbehandlung beachtlich.
Antwort auf Beitrag Nr.: 39.563.968 von Cyberhexe am 21.05.10 13:39:47nächste Woche dürfte T-DM1 zur Zulassung eingereicht werden. Dann dürfte der Kurs zweistellig schliessen.
nicht unbedingt die Meldung, auf die wir gerade warten, aber immerhin...
ImmunoGen, Inc. Earns Milestone with Start of SAR650984 Clinical Trial
- Novel Antibody Therapy for Multiple Hematological Malignancies Enters Clinic -
WALTHAM, Mass., Jun 24, 2010 (BUSINESS WIRE) --ImmunoGen, Inc. (Nasdaq: IMGN), a biotechnology company that develops targeted antibody-based anticancer products, today announced that sanofi-aventis has initiated a Phase I clinical trial with SAR650984, an investigational antibody that targets cancer cells expressing the CD38 protein antigen. This event triggers a $1 million milestone payment to ImmunoGen.
Developed under a research collaboration between ImmunoGen and sanofi-aventis, SAR650984 is being evaluated as a potential treatment for a number of hematological (blood) tumors, including acute and chronic lymphocytic leukemia, acute and chronic myeloid leukemia, multiple myeloma and non-Hodgkin's lymphoma.
In preclinical testing, SAR650984 has been found to be an effective anticancer agent.Of particular note, it has been found to have potent antibody-dependent cell-mediated cytotoxicity (ADCC), complement-dependent cytotoxicity (CDC), and apoptotic activity (achievement of programmed cell death).1
John Lambert, PhD, Executive Vice President and Chief Scientific Officer, commented, "ImmunoGen has extensive capabilities in the development and evaluation of antibodies - both for use as anticancer agents on their own as 'naked antibodies', like SAR650984, and as part of TAP compounds. SAR650984 killed cancer cells through three different mechanisms - ADCC, CDC, and apoptosis - in our preclinical models. We believe this compound may provide unique benefits in the treatment of a number of hematological malignancies."
SAR650984 is being evaluated in a Phase I, dose-escalation trial to establish its maximum tolerated dose and dose-limiting toxicities. Patients with certain types of relapsed/refractory CD38+ hematological malignancies are eligible for enrollment, including B-cell non-Hodgkin's lymphoma, multiple myeloma, acute myeloid leukemia, acute lymphoblastic leukemia, and chronic lymphocytic leukemia.
ImmunoGen, Inc. Earns Milestone with Start of SAR650984 Clinical Trial
- Novel Antibody Therapy for Multiple Hematological Malignancies Enters Clinic -
WALTHAM, Mass., Jun 24, 2010 (BUSINESS WIRE) --ImmunoGen, Inc. (Nasdaq: IMGN), a biotechnology company that develops targeted antibody-based anticancer products, today announced that sanofi-aventis has initiated a Phase I clinical trial with SAR650984, an investigational antibody that targets cancer cells expressing the CD38 protein antigen. This event triggers a $1 million milestone payment to ImmunoGen.
Developed under a research collaboration between ImmunoGen and sanofi-aventis, SAR650984 is being evaluated as a potential treatment for a number of hematological (blood) tumors, including acute and chronic lymphocytic leukemia, acute and chronic myeloid leukemia, multiple myeloma and non-Hodgkin's lymphoma.
In preclinical testing, SAR650984 has been found to be an effective anticancer agent.Of particular note, it has been found to have potent antibody-dependent cell-mediated cytotoxicity (ADCC), complement-dependent cytotoxicity (CDC), and apoptotic activity (achievement of programmed cell death).1
John Lambert, PhD, Executive Vice President and Chief Scientific Officer, commented, "ImmunoGen has extensive capabilities in the development and evaluation of antibodies - both for use as anticancer agents on their own as 'naked antibodies', like SAR650984, and as part of TAP compounds. SAR650984 killed cancer cells through three different mechanisms - ADCC, CDC, and apoptosis - in our preclinical models. We believe this compound may provide unique benefits in the treatment of a number of hematological malignancies."
SAR650984 is being evaluated in a Phase I, dose-escalation trial to establish its maximum tolerated dose and dose-limiting toxicities. Patients with certain types of relapsed/refractory CD38+ hematological malignancies are eligible for enrollment, including B-cell non-Hodgkin's lymphoma, multiple myeloma, acute myeloid leukemia, acute lymphoblastic leukemia, and chronic lymphocytic leukemia.
Sehr schöner Artikel zu T-DM1 und ADCs im Allgemeinen:
Genentech’s Souped-Up Herceptin: The Odyssey Toward a More Powerful Breast Cancer Drug
Luke Timmerman 6/14/10
Scientists have been dreaming for decades about drugs that go after cancer cells like heat-seeking missiles. The idea is to destroy the enemy and spare other cells from the collateral damage that so many cancer drugs cause. Now after more than 10 years of sustained effort by one of largest teams ever assembled at Genentech, and some gut-wrenching ups and downs, that vision is on the verge of turning into reality.
This story began when Genentech, the South San Francisco biotech pioneer now owned by Roche, made history back in September 1998. That’s when it got the green light from the FDA to sell a genetically engineered antibody designed to seek out a mutated protein found on malignant cells in about one-fourth of women with breast cancer. The drug, trastuzumab (marketed as Herceptin), has been proven over the years to work even better than Genentech first imagined it would in women with early stages of cancer. The therapy is now one of the biggest selling biotech products in history, generating more than $5 billion in annual worldwide sales.
Yet from the moment of the FDA’s approval, a small group of scientists in-house were thinking even bigger. They suspected that their engineered antibody, even though it could hit a specific target on cells, would fail to land a real knockout punch against tumors. The scientists had shown that drugs of trastuzumab’s generation could interrupt signals cancer cells need to grow, and they later realized that the drugs could also sometimes provoke an immune system reaction against the tumor. But they weren’t a cure.
So scientists at Genentech, including Mark Sliwkowski, wondered if a targeted antibody would work even better if they could attach potent little toxins to it, making it into a “smart bomb” or an “empowered antibody.” Nobody has turned this concept into a commercial success after 30 years of trying, but Genentech and its partner in Waltham, MA, ImmunoGen (NASDAQ: IMGN), are betting they have finally been able to pull off this daunting scientific trick.
Evidence to support the claim arrived last December at the San Antonio Breast Cancer Symposium. A next-generation form of Herceptin, jointly developed by Genentech and ImmunoGen, called T-DM1, partially or completely shrank tumors in about one-third of 110 patients who were extremely sick, whose cancer was still worsening after they had endured an average of seven prior rounds of therapy. The most common severe adverse event was a depletion of blood platelet cells, which was found in 5.5 percent of patients, researchers said. The balance of safety and effectiveness was so convincing that Genentech plans to seek FDA approval before the end of this year to start selling T-DM1 in the U.S.
Important as it may be for breast cancer patients, the finding has re-energized the once moribund field of antibody-drug combinations, often called “antibody drug conjugates.” Genentech is so bullish on the concept that it now has 50 such drug candidates moving through its internal R&D pipeline, following the lead of T-DM1. This idea of “bombing” the tumor, once written off as a pipe dream by most people inside Genentech and academic research, has morphed into one of the company’s top strategies for fighting cancer, according to Sliwkowski, a longtime champion of the concept.
“We take this far more seriously than we did previously,” Sliwkowski says. “We are investing a lot of money and resources into this. That should answer your question.”
One of Genentech’s collaborators on antibody-drug conjugates, Seattle Genetics, says T-DM1 and another drug it is developing for Hodgkin’s disease called SGN-35, are at the forefront of a new wave of cancer therapy. “These are both exciting programs that have the potential to help thousands of cancer patients,” says Seattle Genetics CEO Clay Siegall. “I believe they represent only the beginning of what is possible with empowered antibody-based therapies.”
The FDA approval of Herceptin was pivotal, but T-DM1 began its journey inside Genentech as far back as late 1997, Sliwkowski says. Genentech in those days wasn’t really a cancer drug company. It was better known for its work in cardiovascular disease and with genetically engineered growth hormones. It had just gotten its first taste of success in cancer with rituximab (Rituxan), a hit drug for lymphoma.
Scientists at Genentech got fired up about another first-generation antibody for cancer, the original Herceptin, when the pivotal Phase III results arrived in late 1997 that proved the drug was likely good enough to win FDA approval. The thought of creating a more potent second-generation drug was floated internally, but didn’t get much traction right away, Sliwkowski says. That’s because the company was so preoccupied with getting its original Herceptin application filed with the FDA, passing muster at an expert advisory panel meeting, and lining up proper diagnostics to make sure the drug got to the right patients.
“We were a pretty lean and mean team, and didn’t have a lot of extra time to think about second generation drugs and all that kind of stuff,” Sliwkowski says.
Sliwkowski, who joined the company in 1991 and did a lot of work on the original Herceptin, started thinking more seriously about a more potent form of the drug the day after FDA approval in September 1998. “Not that the date means anything to me,” he joked.
There was enormous skepticism inside the company, and outside, at the time. Many researchers had tried to create this kind of “magic bullet,” virtually from the moment the Nobel Prize-winning team of Georges Kohler and Cesar Milstein created the first targeted antibodies in 1975. All subsequent efforts to make antibody drugs loaded with toxins had failed. Often, it was because nobody knew how to properly link a toxin to the antibody. The toxin would often break off in the bloodstream before it ever got to the tumor, making the drug less potent and possibly more toxic than it should have been than if it got to the target and was properly metabolized. “There was a lot of baggage,” Sliwkowski says.
Still, Genentech was in the mood to think big. It had proven its critics wrong about Herceptin. Scientists were skeptical about whether that treatment, like most antibodies before it, would provoke a human immune system reaction against the antibody itself that would render the product useless. Others wondered whether the target it was aimed at (the HER2 protein) was truly more abundant on cancer cells than healthy ones. Overcoming those doubts made a few people within Genentech think they could solve the problems again with antibody-drug conjugates, Sliwkowski says.
“The pendulum of interest in oncology within Genentech swung in a new direction. We were this oncology company now. We were serious.” Sliwkowski says.
They needed to be. The scientists at Genentech figured there were four major variables that needed to be resolved if an antibody-drug combination were ever to work.
First, they needed to aim the antibody at a truly valid target that is involved in an important cancer cell process, is found abundantly in an accessible place on the surface of cancer cells, and has minimal presence on healthy cells. Few targets like this exist in the human body, but Genentech had shown this to be the case for HER2, the target of Herceptin. “We knew HER2 was special, and as validated a target as you could get. We said if we can’t get it to work on HER2, then it ain’t going to work,” Sliwkowski says.
Then came the antibody itself. The good news was that because Genentech had an FDA-approved antibody for breast cancer cells, the manufacturing wing was churning out vats of it by the kilogram, not the usual micrograms that basic researchers need to scrape by with. That meant the scientists had more than enough raw material to run every experiment they could possibly think up, Sliwkowski says. It may sound trivial, he says, but projects in academic labs or small companies often stall because they only have enough resources to produce very small quantities of a drug, forcing them to do pretty limited experiments. Since they had lots of bulk drug, and it easy to link the antibody to all different types of toxins, the scientists went at it, Sliwkowski says. They had the luxury to think systematically, to try hundreds of combinations of antibodies and toxins in the petri dish, review the data, and tinker with one variable at a time until they got what they wanted.
“I didn’t think people were assessing the full potential of these things. I really wanted to turn the crank. And we did,” Sliwkowski says.
The third key variable was with the linker system that was meant to attach the antibody to the toxin. This is the part where Genentech leaned on the expertise of its partners at ImmunoGen, and later, at Seattle Genetics. Getting a linker that was stable in the bloodstream, and get the toxin exactly where it was supposed to go inside the cell, was the key challenge.
The fourth major variable, Sliwkowski says, was figuring out how to deal with the toxin. These molecules, because they are being directed to tumors in small doses, need to be super-potent, i.e. more than 1,000-fold more potent cell-killers than the usual chemotherapy drugs, which circulate throughout a cancer patient’s body. Nobody knew when Genentech first got going on this project whether the antibody, a relatively huge Y-shaped protein in molecular terms, should be loaded with one, two, five, 10 or 20 different toxins to get the ideal tumor-killing punch. They really didn’t where those toxins should be strategically placed on the antibody backbone, or what kind of difference that might make.
But having confidence in the cell target, and the antibody itself, helped scientists narrow down their options from the start. Even so, most of their preconceptions were wrong, Sliwkowski says. Some people thought that if loading more toxins on the antibody would give it more punch. Actually there was a sweet spot in the middle that was most effective. Others, Sliwkowski included, thought that maybe the Herceptin antibody wasn’t really the best vessel because it was so big and bulky, and that an antibody fragment might be a more efficient vehicle for delivering toxin to tumor. Wrong again.
“We did those experiments with fragment. The efficacy was fantastic. Toxicity was horrible,” Sliwkowski says. “It was jaw dropping. You’d injected the rats, and the guys would call you up the next morning, saying ‘they’re all dead.”
Despite the setbacks, Genentech’s senior managers gave this program some vital support early on. When Sliwkowski came asking for significant resources, one key supporter was Richard Scheller, now the executive vice president of research and early development.
Scheller’s role was important, because he had authority to do something pretty unusual in development, Sliwkowski says. Most basic scientists at an early stage of research wouldn’t bother to think about things like enlisting the help of toxicologists, the people who help assess whether a drug is being properly absorbed and metabolized in the body or whether it’s going to be too toxic. People with that skill are often busy working on drugs in later stages of development. But many drugs that look good in a petri dish stumble later in animals or people when they prove to be too toxic. In this case, Scheller made sure Sliwkowski and his colleagues got important early help from their peers in toxicology.
So Sliwkowski felt he had the resources he needed to help screen out the duds early on, and improve the odds of success.
Even with all that support, the worst was yet to come. By 2002, Genentech had taken its lead antibody-drug conjugate into its first clinical trial. At the time, it used what is known as a disulfide linker. This was thought to have the nifty ability to remain stable in the blood, but selectively release its toxic cargo once confronted by certain enzymes in cancer cells. It looked great on the whiteboard, and it showed a clear affect on cancer cells in the lab. But when this candidate with the disulfide linker entered animal testing, it flopped. “We really tripped up on safety,” Sliwkowski says. [[Correction: 1:25 pm, 6/16/10: An earlier version said the drug and disulfide linker failed in a clinical trial.]]
Though the researchers had poured three years and a lot of resources into the first conjugate, it was time to start over. Genentech started to run its usual battery of tests, altering one variable at a time to see how it changed the results, in cancer cells and healthy cells in the lab.
Fast forward three more years, to Valentine’s Day, 2005. Sliwkowski says that’s the day senior management gave the green light for the R&D teams to do the last experiments they needed to seek FDA clearance to begin a new round of clinical trials. This time, they used a “thioether” linker from ImmunoGen. The big difference with this new linker, scientists learned, was that it instead of releasing the cell-killing agent, it formed a covalent bond between the antibody and the toxin that couldn’t be broken.
Using that new linker meant that the whole antibody-drug package could get internalized into the cell, trafficked to the place where it encountered certain enzymes, and then be degraded, the same way enzymes in your stomach break down the steak you ate for dinner. Through this degradation process, a huge antibody is ultimately broken down into amino acid building blocks, still clinging to the potent toxin, which can then do its anti-tumor thing.
By April 2006, the scientists had raced through their preparations to get what was now T-DM1 ready to enter its very first clinical trial. One year later, Genentech’s senior brass started raving about how the company was seeing anti-tumor activity from T-DM1 in this original study of 18 patients, even in some cases at the tiniest doses that were just intended to assess safety, not effectiveness. When I was a reporter at Bloomberg, Ian Krop, a researcher at the Dana-Farber Cancer Institute, told me, “We’re about as excited about this one as we can get this early in the game.” More details emerged a couple months later at the biggest annual cancer meeting of the year, the American Society of Clinical Oncology.
The scientists were still a little nervous, and a little scared of what might happen, given how they’d been rudely surprised by the failure of the earlier souped-up version of Herceptin, Sliwkowski says. He says it was a sobering moment, to realize that actual patients were gutsy enough to take an experimental drug like this, with so many potential risks that could have emerged.
But those days are now past, Sliwkowski says. Even though scientists expect most of their creations to fail, they now expect T-DM1 to succeed.
“This thing works, and it works pretty well. We expect as we move it up the ladder into earlier and earlier breast cancer, it’s going to work even better,” Sliwkowski says.
That’s not to say this program is risk-free. Genentech is planning to seek FDA approval this year based on a relatively thin body of evidence, from a clinical trial that didn’t have a control group. It’s possible the FDA could convene an expert advisory committee to debate whether to wait for data from more rigorous clinical trials.
T-DM1 also takes twice as long to manufacture as a regular version of Herceptin, and is more complicated to piece together from various contract manufacturers around the world, says spokeswoman Krysta Pellegrino. If the drug is approved for sale, and lives up to its billing in early-stage breast cancer, then Genentech will need to invest more in commercial-scale manufacturing.
And what about those 50 other antibody-drug conjugates at earlier stages of R&D? Will they benefit from the lessons learned through the T-DM1 experience, and truly usher in a new paradigm for cancer treatment? Genentech can’t say that for sure. Each target is different, and so is the way the cell internalizes the antibody-drug conjugate, Sliwkowski says. All the usual questions about the right target, right antibody, right linker, and right number and positioning for the toxins all still apply.
Still, this is a technology that could become a reusable “platform,” for the discovery of multiple products, not just a one-hit wonder or a “me-too” incremental advance. Before I left the Genentech South San Francisco campus last week, I had to ask Sliwkowski how much confidence he has in the 50 other drug candidates, and whether they will represent a new wave of cancer treatment.
“I certainly hope so,” Sliwkowski says. “But you’ll have to hold onto that pipeline chart and come back and see us in 10 years.”
Luke Timmerman is the National Biotechnology Editor for Xconomy, and the Editor of Xconomy Seattle. You can e-mail him at ltimmerman@xconomy.com, or follow him on Twitter at twitter.com/ldtimmerman.
http://www.xconomy.com/san-francisco/2010/06/14/genentechs-s…
Genentech’s Souped-Up Herceptin: The Odyssey Toward a More Powerful Breast Cancer Drug
Luke Timmerman 6/14/10
Scientists have been dreaming for decades about drugs that go after cancer cells like heat-seeking missiles. The idea is to destroy the enemy and spare other cells from the collateral damage that so many cancer drugs cause. Now after more than 10 years of sustained effort by one of largest teams ever assembled at Genentech, and some gut-wrenching ups and downs, that vision is on the verge of turning into reality.
This story began when Genentech, the South San Francisco biotech pioneer now owned by Roche, made history back in September 1998. That’s when it got the green light from the FDA to sell a genetically engineered antibody designed to seek out a mutated protein found on malignant cells in about one-fourth of women with breast cancer. The drug, trastuzumab (marketed as Herceptin), has been proven over the years to work even better than Genentech first imagined it would in women with early stages of cancer. The therapy is now one of the biggest selling biotech products in history, generating more than $5 billion in annual worldwide sales.
Yet from the moment of the FDA’s approval, a small group of scientists in-house were thinking even bigger. They suspected that their engineered antibody, even though it could hit a specific target on cells, would fail to land a real knockout punch against tumors. The scientists had shown that drugs of trastuzumab’s generation could interrupt signals cancer cells need to grow, and they later realized that the drugs could also sometimes provoke an immune system reaction against the tumor. But they weren’t a cure.
So scientists at Genentech, including Mark Sliwkowski, wondered if a targeted antibody would work even better if they could attach potent little toxins to it, making it into a “smart bomb” or an “empowered antibody.” Nobody has turned this concept into a commercial success after 30 years of trying, but Genentech and its partner in Waltham, MA, ImmunoGen (NASDAQ: IMGN), are betting they have finally been able to pull off this daunting scientific trick.
Evidence to support the claim arrived last December at the San Antonio Breast Cancer Symposium. A next-generation form of Herceptin, jointly developed by Genentech and ImmunoGen, called T-DM1, partially or completely shrank tumors in about one-third of 110 patients who were extremely sick, whose cancer was still worsening after they had endured an average of seven prior rounds of therapy. The most common severe adverse event was a depletion of blood platelet cells, which was found in 5.5 percent of patients, researchers said. The balance of safety and effectiveness was so convincing that Genentech plans to seek FDA approval before the end of this year to start selling T-DM1 in the U.S.
Important as it may be for breast cancer patients, the finding has re-energized the once moribund field of antibody-drug combinations, often called “antibody drug conjugates.” Genentech is so bullish on the concept that it now has 50 such drug candidates moving through its internal R&D pipeline, following the lead of T-DM1. This idea of “bombing” the tumor, once written off as a pipe dream by most people inside Genentech and academic research, has morphed into one of the company’s top strategies for fighting cancer, according to Sliwkowski, a longtime champion of the concept.
“We take this far more seriously than we did previously,” Sliwkowski says. “We are investing a lot of money and resources into this. That should answer your question.”
One of Genentech’s collaborators on antibody-drug conjugates, Seattle Genetics, says T-DM1 and another drug it is developing for Hodgkin’s disease called SGN-35, are at the forefront of a new wave of cancer therapy. “These are both exciting programs that have the potential to help thousands of cancer patients,” says Seattle Genetics CEO Clay Siegall. “I believe they represent only the beginning of what is possible with empowered antibody-based therapies.”
The FDA approval of Herceptin was pivotal, but T-DM1 began its journey inside Genentech as far back as late 1997, Sliwkowski says. Genentech in those days wasn’t really a cancer drug company. It was better known for its work in cardiovascular disease and with genetically engineered growth hormones. It had just gotten its first taste of success in cancer with rituximab (Rituxan), a hit drug for lymphoma.
Scientists at Genentech got fired up about another first-generation antibody for cancer, the original Herceptin, when the pivotal Phase III results arrived in late 1997 that proved the drug was likely good enough to win FDA approval. The thought of creating a more potent second-generation drug was floated internally, but didn’t get much traction right away, Sliwkowski says. That’s because the company was so preoccupied with getting its original Herceptin application filed with the FDA, passing muster at an expert advisory panel meeting, and lining up proper diagnostics to make sure the drug got to the right patients.
“We were a pretty lean and mean team, and didn’t have a lot of extra time to think about second generation drugs and all that kind of stuff,” Sliwkowski says.
Sliwkowski, who joined the company in 1991 and did a lot of work on the original Herceptin, started thinking more seriously about a more potent form of the drug the day after FDA approval in September 1998. “Not that the date means anything to me,” he joked.
There was enormous skepticism inside the company, and outside, at the time. Many researchers had tried to create this kind of “magic bullet,” virtually from the moment the Nobel Prize-winning team of Georges Kohler and Cesar Milstein created the first targeted antibodies in 1975. All subsequent efforts to make antibody drugs loaded with toxins had failed. Often, it was because nobody knew how to properly link a toxin to the antibody. The toxin would often break off in the bloodstream before it ever got to the tumor, making the drug less potent and possibly more toxic than it should have been than if it got to the target and was properly metabolized. “There was a lot of baggage,” Sliwkowski says.
Still, Genentech was in the mood to think big. It had proven its critics wrong about Herceptin. Scientists were skeptical about whether that treatment, like most antibodies before it, would provoke a human immune system reaction against the antibody itself that would render the product useless. Others wondered whether the target it was aimed at (the HER2 protein) was truly more abundant on cancer cells than healthy ones. Overcoming those doubts made a few people within Genentech think they could solve the problems again with antibody-drug conjugates, Sliwkowski says.
“The pendulum of interest in oncology within Genentech swung in a new direction. We were this oncology company now. We were serious.” Sliwkowski says.
They needed to be. The scientists at Genentech figured there were four major variables that needed to be resolved if an antibody-drug combination were ever to work.
First, they needed to aim the antibody at a truly valid target that is involved in an important cancer cell process, is found abundantly in an accessible place on the surface of cancer cells, and has minimal presence on healthy cells. Few targets like this exist in the human body, but Genentech had shown this to be the case for HER2, the target of Herceptin. “We knew HER2 was special, and as validated a target as you could get. We said if we can’t get it to work on HER2, then it ain’t going to work,” Sliwkowski says.
Then came the antibody itself. The good news was that because Genentech had an FDA-approved antibody for breast cancer cells, the manufacturing wing was churning out vats of it by the kilogram, not the usual micrograms that basic researchers need to scrape by with. That meant the scientists had more than enough raw material to run every experiment they could possibly think up, Sliwkowski says. It may sound trivial, he says, but projects in academic labs or small companies often stall because they only have enough resources to produce very small quantities of a drug, forcing them to do pretty limited experiments. Since they had lots of bulk drug, and it easy to link the antibody to all different types of toxins, the scientists went at it, Sliwkowski says. They had the luxury to think systematically, to try hundreds of combinations of antibodies and toxins in the petri dish, review the data, and tinker with one variable at a time until they got what they wanted.
“I didn’t think people were assessing the full potential of these things. I really wanted to turn the crank. And we did,” Sliwkowski says.
The third key variable was with the linker system that was meant to attach the antibody to the toxin. This is the part where Genentech leaned on the expertise of its partners at ImmunoGen, and later, at Seattle Genetics. Getting a linker that was stable in the bloodstream, and get the toxin exactly where it was supposed to go inside the cell, was the key challenge.
The fourth major variable, Sliwkowski says, was figuring out how to deal with the toxin. These molecules, because they are being directed to tumors in small doses, need to be super-potent, i.e. more than 1,000-fold more potent cell-killers than the usual chemotherapy drugs, which circulate throughout a cancer patient’s body. Nobody knew when Genentech first got going on this project whether the antibody, a relatively huge Y-shaped protein in molecular terms, should be loaded with one, two, five, 10 or 20 different toxins to get the ideal tumor-killing punch. They really didn’t where those toxins should be strategically placed on the antibody backbone, or what kind of difference that might make.
But having confidence in the cell target, and the antibody itself, helped scientists narrow down their options from the start. Even so, most of their preconceptions were wrong, Sliwkowski says. Some people thought that if loading more toxins on the antibody would give it more punch. Actually there was a sweet spot in the middle that was most effective. Others, Sliwkowski included, thought that maybe the Herceptin antibody wasn’t really the best vessel because it was so big and bulky, and that an antibody fragment might be a more efficient vehicle for delivering toxin to tumor. Wrong again.
“We did those experiments with fragment. The efficacy was fantastic. Toxicity was horrible,” Sliwkowski says. “It was jaw dropping. You’d injected the rats, and the guys would call you up the next morning, saying ‘they’re all dead.”
Despite the setbacks, Genentech’s senior managers gave this program some vital support early on. When Sliwkowski came asking for significant resources, one key supporter was Richard Scheller, now the executive vice president of research and early development.
Scheller’s role was important, because he had authority to do something pretty unusual in development, Sliwkowski says. Most basic scientists at an early stage of research wouldn’t bother to think about things like enlisting the help of toxicologists, the people who help assess whether a drug is being properly absorbed and metabolized in the body or whether it’s going to be too toxic. People with that skill are often busy working on drugs in later stages of development. But many drugs that look good in a petri dish stumble later in animals or people when they prove to be too toxic. In this case, Scheller made sure Sliwkowski and his colleagues got important early help from their peers in toxicology.
So Sliwkowski felt he had the resources he needed to help screen out the duds early on, and improve the odds of success.
Even with all that support, the worst was yet to come. By 2002, Genentech had taken its lead antibody-drug conjugate into its first clinical trial. At the time, it used what is known as a disulfide linker. This was thought to have the nifty ability to remain stable in the blood, but selectively release its toxic cargo once confronted by certain enzymes in cancer cells. It looked great on the whiteboard, and it showed a clear affect on cancer cells in the lab. But when this candidate with the disulfide linker entered animal testing, it flopped. “We really tripped up on safety,” Sliwkowski says. [[Correction: 1:25 pm, 6/16/10: An earlier version said the drug and disulfide linker failed in a clinical trial.]]
Though the researchers had poured three years and a lot of resources into the first conjugate, it was time to start over. Genentech started to run its usual battery of tests, altering one variable at a time to see how it changed the results, in cancer cells and healthy cells in the lab.
Fast forward three more years, to Valentine’s Day, 2005. Sliwkowski says that’s the day senior management gave the green light for the R&D teams to do the last experiments they needed to seek FDA clearance to begin a new round of clinical trials. This time, they used a “thioether” linker from ImmunoGen. The big difference with this new linker, scientists learned, was that it instead of releasing the cell-killing agent, it formed a covalent bond between the antibody and the toxin that couldn’t be broken.
Using that new linker meant that the whole antibody-drug package could get internalized into the cell, trafficked to the place where it encountered certain enzymes, and then be degraded, the same way enzymes in your stomach break down the steak you ate for dinner. Through this degradation process, a huge antibody is ultimately broken down into amino acid building blocks, still clinging to the potent toxin, which can then do its anti-tumor thing.
By April 2006, the scientists had raced through their preparations to get what was now T-DM1 ready to enter its very first clinical trial. One year later, Genentech’s senior brass started raving about how the company was seeing anti-tumor activity from T-DM1 in this original study of 18 patients, even in some cases at the tiniest doses that were just intended to assess safety, not effectiveness. When I was a reporter at Bloomberg, Ian Krop, a researcher at the Dana-Farber Cancer Institute, told me, “We’re about as excited about this one as we can get this early in the game.” More details emerged a couple months later at the biggest annual cancer meeting of the year, the American Society of Clinical Oncology.
The scientists were still a little nervous, and a little scared of what might happen, given how they’d been rudely surprised by the failure of the earlier souped-up version of Herceptin, Sliwkowski says. He says it was a sobering moment, to realize that actual patients were gutsy enough to take an experimental drug like this, with so many potential risks that could have emerged.
But those days are now past, Sliwkowski says. Even though scientists expect most of their creations to fail, they now expect T-DM1 to succeed.
“This thing works, and it works pretty well. We expect as we move it up the ladder into earlier and earlier breast cancer, it’s going to work even better,” Sliwkowski says.
That’s not to say this program is risk-free. Genentech is planning to seek FDA approval this year based on a relatively thin body of evidence, from a clinical trial that didn’t have a control group. It’s possible the FDA could convene an expert advisory committee to debate whether to wait for data from more rigorous clinical trials.
T-DM1 also takes twice as long to manufacture as a regular version of Herceptin, and is more complicated to piece together from various contract manufacturers around the world, says spokeswoman Krysta Pellegrino. If the drug is approved for sale, and lives up to its billing in early-stage breast cancer, then Genentech will need to invest more in commercial-scale manufacturing.
And what about those 50 other antibody-drug conjugates at earlier stages of R&D? Will they benefit from the lessons learned through the T-DM1 experience, and truly usher in a new paradigm for cancer treatment? Genentech can’t say that for sure. Each target is different, and so is the way the cell internalizes the antibody-drug conjugate, Sliwkowski says. All the usual questions about the right target, right antibody, right linker, and right number and positioning for the toxins all still apply.
Still, this is a technology that could become a reusable “platform,” for the discovery of multiple products, not just a one-hit wonder or a “me-too” incremental advance. Before I left the Genentech South San Francisco campus last week, I had to ask Sliwkowski how much confidence he has in the 50 other drug candidates, and whether they will represent a new wave of cancer treatment.
“I certainly hope so,” Sliwkowski says. “But you’ll have to hold onto that pipeline chart and come back and see us in 10 years.”
Luke Timmerman is the National Biotechnology Editor for Xconomy, and the Editor of Xconomy Seattle. You can e-mail him at ltimmerman@xconomy.com, or follow him on Twitter at twitter.com/ldtimmerman.
http://www.xconomy.com/san-francisco/2010/06/14/genentechs-s…
Man möchte fast ausrufen: Na endlich!
July 7, 2010 — 7:59am ET | By John Carroll
Wowed by stellar mid-stage data, Roche has filed a BLA for trastuzumab-DM1, or T-DM1, seeking approval to market the pioneering conjugated monoclonal antibody to women with treatment-resistant HER2 positive breast cancer. For Roche, T-DM1 represents a potential mega-blockbuster capable of eventually rivaling Herceptin in the market for cancer drugs. And the filing marks a major milestone for the investigators at Genentech and Immunogen who successfully combined a monoclonal antibody with a toxic chemotherapy to single out cancer cells for termination--sparing healthy cells.
"Conjugated monoclonal antibodies [such as T-DM1] are viewed by thought leaders in oncology as one of the next area of significant innovation for the treatment of cancer," Andrew Weiss of Bank Vontobel tells the Wall Street Journal.
If granted an accelerated review, Roche could gain marketing clearance in as little as six months to begin treating advanced breast cancer cases. In the meantime, Roche is pursuing an ambitious slate of late-stage trials to build T-DM1 into a major franchise drug. In Phase II, the drug shrank the tumors in one-third of women who had received on average seven prior medicines for advanced HER2-positive breast cancer--making T-DM1 a last line of defense, according to a statement. That argument will help Roche make a compelling case for approval on the basis of mid-stage data.
"While we've made great strides in treating HER2-positive breast cancer, there is a group of people whose breast cancer will come back after many treatments, leaving them with very limited options," says Hal Barron, Roche's chief medical officer. "Data from studies have shown that T-DM1 shrank tumors in these people, so we are excited to have submitted this application to the FDA in hopes offering a potential new medicine to people with this type of breast cancer."
- here's the press release
- here's the story from the Wall Street Journal
July 7, 2010 — 7:59am ET | By John Carroll
Wowed by stellar mid-stage data, Roche has filed a BLA for trastuzumab-DM1, or T-DM1, seeking approval to market the pioneering conjugated monoclonal antibody to women with treatment-resistant HER2 positive breast cancer. For Roche, T-DM1 represents a potential mega-blockbuster capable of eventually rivaling Herceptin in the market for cancer drugs. And the filing marks a major milestone for the investigators at Genentech and Immunogen who successfully combined a monoclonal antibody with a toxic chemotherapy to single out cancer cells for termination--sparing healthy cells.
"Conjugated monoclonal antibodies [such as T-DM1] are viewed by thought leaders in oncology as one of the next area of significant innovation for the treatment of cancer," Andrew Weiss of Bank Vontobel tells the Wall Street Journal.
If granted an accelerated review, Roche could gain marketing clearance in as little as six months to begin treating advanced breast cancer cases. In the meantime, Roche is pursuing an ambitious slate of late-stage trials to build T-DM1 into a major franchise drug. In Phase II, the drug shrank the tumors in one-third of women who had received on average seven prior medicines for advanced HER2-positive breast cancer--making T-DM1 a last line of defense, according to a statement. That argument will help Roche make a compelling case for approval on the basis of mid-stage data.
"While we've made great strides in treating HER2-positive breast cancer, there is a group of people whose breast cancer will come back after many treatments, leaving them with very limited options," says Hal Barron, Roche's chief medical officer. "Data from studies have shown that T-DM1 shrank tumors in these people, so we are excited to have submitted this application to the FDA in hopes offering a potential new medicine to people with this type of breast cancer."
- here's the press release
- here's the story from the Wall Street Journal

Erste Ergebnisse von TDM4450g werden auf dem diesjährigen ESMO-Kongress "European Society for Medical Oncology" (in Mailand vom 8.-12.10.2010) erwartet --> http://www.esmo.org/events/milan-2010-congress.html.
Sollten die ph2-Daten bei der Erstlinienbehandlung vom metastatischem Brustkrebs nicht schlechter sein als bei der konventionellen Chemo/Antikörpertherapie, dann dürfte die Immunogen-Aktie zulegen. Sollten die Daten jedoch besser sein als bei der Erstlinienbehandlung mit Trastuzumab und Docetaxel, dann sind Kurse über 20 USD nicht unrealistisch.
http://www.mh-hannover.de/studien/protocols/254.html
ID Studie
TDM4450g
EudraCT-Nummer
2008-002819-40
Clinicaltrials.gov Identifier
NCT00679341
Beschreibung
Randomisierte, multizentrische, internationale, zweiarmige, klinische open-Label-Studie der Phase II, die die Wirksamkeit und Sicherheit von T-DM1 im Vergleich zu der Kombination von Trastuzumab und Docetaxel bei Patientinnen mit HER2-positivem metastatischem Brustkrebs untersuchen soll, die zuvor keine Chemotherapie gegen Metastasierung erhalten haben.
http://www.clinicaltrials.gov/ct2/show/NCT00679341?term=TDM4…
Sollten die ph2-Daten bei der Erstlinienbehandlung vom metastatischem Brustkrebs nicht schlechter sein als bei der konventionellen Chemo/Antikörpertherapie, dann dürfte die Immunogen-Aktie zulegen. Sollten die Daten jedoch besser sein als bei der Erstlinienbehandlung mit Trastuzumab und Docetaxel, dann sind Kurse über 20 USD nicht unrealistisch.
http://www.mh-hannover.de/studien/protocols/254.html
ID Studie
TDM4450g
EudraCT-Nummer
2008-002819-40
Clinicaltrials.gov Identifier
NCT00679341
Beschreibung
Randomisierte, multizentrische, internationale, zweiarmige, klinische open-Label-Studie der Phase II, die die Wirksamkeit und Sicherheit von T-DM1 im Vergleich zu der Kombination von Trastuzumab und Docetaxel bei Patientinnen mit HER2-positivem metastatischem Brustkrebs untersuchen soll, die zuvor keine Chemotherapie gegen Metastasierung erhalten haben.
http://www.clinicaltrials.gov/ct2/show/NCT00679341?term=TDM4…
nun auch US:
August 18, 2010 12:45 PM Eastern Daylight Time
ImmunoGen, Inc. Announces Orphan Drug Designation Granted to Lorvotuzumab Mertansine for Treatment of Small-Cell Lung Cancer
WALTHAM, Mass.--(BUSINESS WIRE)--ImmunoGen, Inc. (Nasdaq: IMGN), a biotechnology company that develops antibody-based targeted anticancer products, today announced that the US Food and Drug Administration (FDA) has granted orphan drug designation to its lorvotuzumab mertansine (formerly IMGN901) product candidate when used for the treatment of small-cell lung cancer (SCLC). Through a separate process, ImmunoGen has received a positive opinion for lorvotuzumab mertansine as an orphan medicinal product for the treatment of SCLC from the European Medicines Agency (EMA) Committee for Orphan Medicinal Products (COMP) and is awaiting final designation from the European Commission. The compound previously was granted orphan drug designation for the treatment of Merkel cell carcinoma in both the US and European Union (EU).
“Lorvotuzumab mertansine has shown encouraging initial activity and tolerability when used as a single agent to treat relapsed SCLC, a very difficult cancer,” commented Daniel Junius, President and CEO. “We believe this product candidate has the potential to make a real difference for patients with SCLC, and we’re planning to start a trial later this year that assesses the compound, used together with standard care, for first-line treatment of this cancer.”
In the US, the Orphan Drug Act is intended to encourage companies to develop therapies for the treatment of diseases that affect fewer than 200,000 people in this country. Orphan drug designation provides ImmunoGen with seven years of market exclusivity that begins once lorvotuzumab mertansine receives FDA marketing approval for the treatment of SCLC. It also provides certain financial incentives that can help support the development of the compound for this indication.
Similarly, in the EU, orphan medicinal product designation is intended to encourage companies to develop therapies for life-threatening or chronically debilitating conditions that affect no more than five in 10,000 people in the EU. Orphan medicinal product designation provides ImmunoGen with ten years of market exclusivity that begins once lorvotuzumab mertansine receives European approval for SCLC. It also enables access to certain financial incentives as well as to protocol assistance.
About Lorvotuzumab Mertansine
Lorvotuzumab mertansine is an investigational agent designed to kill cancer cells that express CD56, a protein. It consists of a CD56-binding antibody, lorvotuzumab, with a potent cancer-cell killing agent, DM1, attached using an engineered linker. The compound utilizes ImmunoGen’s Targeted Antibody Payload (TAP) technology and is wholly owned by the Company.
CD56 is expressed on SCLC, Merkel cell carcinoma, ovarian cancer, carcinoid and other solid tumors of neuroendocrine origin, and lorvotuzumab mertansine is in early clinical testing for the treatment of SCLC, Merkel cell carcinoma and ovarian cancer. CD56 also is expressed on multiple myeloma and certain other hematological malignancies. The compound is in early clinical testing for the treatment of CD56+ multiple myeloma, both when used as a single agent and as part of a combination regimen.
August 18, 2010 12:45 PM Eastern Daylight Time
ImmunoGen, Inc. Announces Orphan Drug Designation Granted to Lorvotuzumab Mertansine for Treatment of Small-Cell Lung Cancer
WALTHAM, Mass.--(BUSINESS WIRE)--ImmunoGen, Inc. (Nasdaq: IMGN), a biotechnology company that develops antibody-based targeted anticancer products, today announced that the US Food and Drug Administration (FDA) has granted orphan drug designation to its lorvotuzumab mertansine (formerly IMGN901) product candidate when used for the treatment of small-cell lung cancer (SCLC). Through a separate process, ImmunoGen has received a positive opinion for lorvotuzumab mertansine as an orphan medicinal product for the treatment of SCLC from the European Medicines Agency (EMA) Committee for Orphan Medicinal Products (COMP) and is awaiting final designation from the European Commission. The compound previously was granted orphan drug designation for the treatment of Merkel cell carcinoma in both the US and European Union (EU).
“Lorvotuzumab mertansine has shown encouraging initial activity and tolerability when used as a single agent to treat relapsed SCLC, a very difficult cancer,” commented Daniel Junius, President and CEO. “We believe this product candidate has the potential to make a real difference for patients with SCLC, and we’re planning to start a trial later this year that assesses the compound, used together with standard care, for first-line treatment of this cancer.”
In the US, the Orphan Drug Act is intended to encourage companies to develop therapies for the treatment of diseases that affect fewer than 200,000 people in this country. Orphan drug designation provides ImmunoGen with seven years of market exclusivity that begins once lorvotuzumab mertansine receives FDA marketing approval for the treatment of SCLC. It also provides certain financial incentives that can help support the development of the compound for this indication.
Similarly, in the EU, orphan medicinal product designation is intended to encourage companies to develop therapies for life-threatening or chronically debilitating conditions that affect no more than five in 10,000 people in the EU. Orphan medicinal product designation provides ImmunoGen with ten years of market exclusivity that begins once lorvotuzumab mertansine receives European approval for SCLC. It also enables access to certain financial incentives as well as to protocol assistance.
About Lorvotuzumab Mertansine
Lorvotuzumab mertansine is an investigational agent designed to kill cancer cells that express CD56, a protein. It consists of a CD56-binding antibody, lorvotuzumab, with a potent cancer-cell killing agent, DM1, attached using an engineered linker. The compound utilizes ImmunoGen’s Targeted Antibody Payload (TAP) technology and is wholly owned by the Company.
CD56 is expressed on SCLC, Merkel cell carcinoma, ovarian cancer, carcinoid and other solid tumors of neuroendocrine origin, and lorvotuzumab mertansine is in early clinical testing for the treatment of SCLC, Merkel cell carcinoma and ovarian cancer. CD56 also is expressed on multiple myeloma and certain other hematological malignancies. The compound is in early clinical testing for the treatment of CD56+ multiple myeloma, both when used as a single agent and as part of a combination regimen.
Wirklich enttäuschend! Ich war davon ausgegangen, dass man das im Vorfeld ausreichend abgestimmt hat. Statt dessen holt man sich jetzt so eine Klatsche. 
Roche, Genentech hit with refuse-to-file letter
August 27, 2010 — 7:02am ET | By Maureen Martino
The FDA has handed Roche and Genentech a refuse-to-file letter for the developers' BLA for trastuzumab-DM1. The drug attaches ImmunoGen DM1 cancer-cell killing agent to Genentech's HER2-targeting antibody, trastuzumab. Roche submitted the BLA in July following a successful Phase II study in which the drug shrank tumors by one-third in women with late-stage breast cancer. The company had hoped to gain accelerated approval of the drug.
The FDA says the T-DM1 trials did not meet the agency's standards for accelerated approval because all available treatment choices approved for metastatic breast cancer, regardless of HER2 status, had not been exhausted in the study population, according to a statement. Genentech says it will continue an ongoing Phase III trial of the drug and hopes to submit a BLA in mid-2012.
"It goes without saying that we're disappointed by this decision of the FDA," said Immunogen CEO Daniel Junius in a conference call this morning. But he added that the BLA rejection "appears to be a technical issue, not a fundamental one." Immunogen was slated to receive a milestone payment upon the FDA acceptance of the Genentech BLA. Junius noted that, despite the fact that his company won't realize that payment in 2010 as planned, Immunogen has no plans at this time to cut its burn rate.

Roche, Genentech hit with refuse-to-file letter
August 27, 2010 — 7:02am ET | By Maureen Martino
The FDA has handed Roche and Genentech a refuse-to-file letter for the developers' BLA for trastuzumab-DM1. The drug attaches ImmunoGen DM1 cancer-cell killing agent to Genentech's HER2-targeting antibody, trastuzumab. Roche submitted the BLA in July following a successful Phase II study in which the drug shrank tumors by one-third in women with late-stage breast cancer. The company had hoped to gain accelerated approval of the drug.
The FDA says the T-DM1 trials did not meet the agency's standards for accelerated approval because all available treatment choices approved for metastatic breast cancer, regardless of HER2 status, had not been exhausted in the study population, according to a statement. Genentech says it will continue an ongoing Phase III trial of the drug and hopes to submit a BLA in mid-2012.
"It goes without saying that we're disappointed by this decision of the FDA," said Immunogen CEO Daniel Junius in a conference call this morning. But he added that the BLA rejection "appears to be a technical issue, not a fundamental one." Immunogen was slated to receive a milestone payment upon the FDA acceptance of the Genentech BLA. Junius noted that, despite the fact that his company won't realize that payment in 2010 as planned, Immunogen has no plans at this time to cut its burn rate.
Meinung Pharma Strategy Blog:
FDA rejects the Roche Immunogen T-DM1 accelerated approval filing
Interesting news arrived in my email box this morning:
"Roche (SIX: RO, ROG; OTCQX: RHHBY) today announced that the U.S. Food and Drug Administration (FDA) issued a Refuse to File letter for accelerated approval for the company’s trastuzumab-DM1 (T-DM1) Biologics License Application (BLA). As planned Roche will continue with its ongoing Phase III EMILIA registration study. Roche will continue to work with the FDA and expects a global regulatory submission of T-DM1 mid 2012.
The BLA submitted in July 2010 requested accelerated approval for T-DM1 based on the results of a single-arm Phase II study, which showed T-DM1 shrank tumors in one-third of women with advanced HER2 positive breast cancer, who had received on average seven prior medicines, including two HER2 targeted agents."
There was a lot of excitement around the initial phase II results (one third of the women experienced tumour shrinkage, for example). Yet, to much surprise, the application was rejected:
"In their review of the BLA, FDA stated the T-DM1 trials did not meet the standard for accelerated approval because all available treatment choices approved for metastatic breast cancer, regardless of HER2 status, had not been exhausted in the study population."
At first reading of the press release, my thoughts centred around:
1. How could the FDA possibly reject such an application?
2. Was an SPA agreed up front?
The first question is easy to be indignant about, but what criteria were used for the trial and what does the data actually show?
Looking at the available clinical trials for T-DM1, this one looks most likely as 100 patients were required and the inclusion criteria stated:
* HER2-positive disease
* Metastatic breast cancer
* Disease progression on the last chemotherapy regimen received in the metastatic setting
* Prior treatment with an anthracycline, trastuzumab, a taxane, lapatinib, and capecitabine in the neoadjuvant, adjuvant, locally advanced, or metastatic setting and prior treatment with at least two lines of therapy (a line of therapy can be a combination of two agents or single-agent chemotherapy) in the metastatic setting
* At least two lines of anti-HER2 therapy must have been given in the metastatic setting as monotherapy or combined with chemotherapy or hormonal therapy. The HER2-targeted agent can include trastuzumab, lapatinib, or an investigational agent with HER2-inhibitory activity.
There are only two approved treatments for HER2-positive breast cancer, trastuzumab and lapatinib, plus others in clinical trials, eg pertuzumab, which was also allowed as one of the prior therapies. All patients appear to have been refractory to at least two of these drugs, most likely trastuzumab and lapatinib.
The prior chemotherapies included anthracyclines, taxanes and capecitabine, which is quite heavy pre-treatment and includes all of the considered standards of care for several lines of therapy. Indeed, the results of the trial presented at the San Antonio Breast Cancer Symposium last December showed that the average number of prior treatments in the metastatic setting was 7.
The others that could be used in the treatment of breast cancer include nab-paclitaxel (Abraxane), which I'm assuming would be covered in the taxane group and ixabepilone (Ixempra), an epothilone approved in by the FDA for metastatic breast cancer following progression on a taxane and anthracyclines, with or without capecitabine.
Ixabepilone is not a taxane or an anthracycline and therefore technically not covered in the inclusion criteria as a prior therapy, although some of the women would likely have received it, but not all. It is, however, a taxane-like compound in that it targets the microtubules, as described in the PI:
"Ixabepilone is a semi-synthetic analog of epothilone B. Ixabepilone binds directly to B-tubulin subunits on microtubules, leading to suppression of microtubule dynamics. Ixabepilone suppresses the dynamic instability of aB-II and aB-III microtubules."
If that was the criteria for rejecting the trial as not truly refractory in a very heavily pre-treated setting, I would be surprised. It's a bit of a technicality and nit-picking. Ixabepilone is not a commonly preferred treatment at all and BMS reported very low sales in 2009. Most US physicians appear to prefer the well established taxanes such as paclitaxel, docetaxel and nab-paclitaxel rather than a synthetic taxane-like agent and probably consider it as a last resort. It is used as a standalone therapy in the refractory/salvage setting.
However, we're talking about a potential indication for a targeted agent that inhibits HER2 dimerization not a chemotherapy, so I would have thought that most of the important bases were covered by including the most common chemotherapies, trastuzumab and lapatinib in the inclusion criteria.
With regards to the latter question, Twitter chat this morning suggested that no, an SPA wasn't formally agreed upon, but Roche held discussions with the FDA that led them to file for accelerated approval. Thanks to Adam Feuerstein of The Street for being the first to answer that question.
My general opinion is that if you have an agreed Special Protocol Assessment (SPA) and meet the defined targets, it's much easier to move forward and gain approval. If you don't, things may turn into a crapshoot and it can go either way. And that seems to be what has happened here.
The other factor that comes into play in this discussion is the ongoing discussion of the accelerated approval for Avastin in metastatic breast cancer and the overwhelming negative ODAC opinion last month. That will not have helped, although one would like to think it shouldn't influence any decision making at the FDA. We would probably be naive to think otherwise given the full protocol included PFS rather than OS as the endpoint.
To be fair, Roche appear to be addressing this issue, in their announcement this morning:
"Roche will amend the Phase III randomized EMILIA study in order to rigorously evaluate overall survival in addition to progression-free survival and will submit data from EMILIA to support a global regulatory submission in mid 2012."
Overall, I think it's a disappointing decision by the FDA given the heavily pre-treated population and lack of options for women who are refractory to both trastuzumab and lapatinib. Chemotherapy has not been shown to be particularly effective in HER2 disease, and by then the women generally have a poor prognosis. When you look again at the SABCS data, you find an objective response rate (ORR) of approximately 30% and a clinical benefit rate of around 40%, which is quite startling in a heavily pre-treated group.
Meanwhile, for now we'll have to wait another two years to see what the survival data looks like. That's a rather long time for women who have failed Herceptin and Tykerb to wait for a drug that appears to have significant activity.
{UPDATE: I posted this analysis in a hurry, uncaffeinated, and in a rush to head out to a meeting. Of course, one remembers later that SPA's apply to phase III not phase II trials, so a formal agreement wouldn't apply here. Thanks also to the two people who gently reminded me of this. Usually though, there are some discussions with FDA around the trial design for accelerated review. Essentially, in layman terms, it means patients are refractory to existing treatments for the disease concerned. Note that Roche, in their press release defined it as, "Consideration by the FDA for accelerated approval requires recognition of a defined patient population of unmet need (a life-threatening disease with limited treatment choices)." It looks like the FDA are applying it more strictly to ALL therapies, although the number of women who might have taken ixabepilone AND be HER2-positive will likely be miniscule. I would still maintain that refractory to all available HER2 therapies and most chemotherapies apply for the majority in this case.}
Posted by MaverickNY on August 27, 2010 at 10:30 AM
http://www.pharmastrategyblog.com/2010/08/fda-rejects-the-ro…
Hammer will sich demnächst auch dazu äußern.
Bin derzeit der Auffassung, dass wir es hier tatsächlich "nur" mit einer Verzögerung aufgrund eines unzureichenden Trialdesigns und/oder einer härteren Linie der FDA zu tun haben.
Ich habe meine IMGN-Position daher gestern verdoppelt.
FDA rejects the Roche Immunogen T-DM1 accelerated approval filing
Interesting news arrived in my email box this morning:
"Roche (SIX: RO, ROG; OTCQX: RHHBY) today announced that the U.S. Food and Drug Administration (FDA) issued a Refuse to File letter for accelerated approval for the company’s trastuzumab-DM1 (T-DM1) Biologics License Application (BLA). As planned Roche will continue with its ongoing Phase III EMILIA registration study. Roche will continue to work with the FDA and expects a global regulatory submission of T-DM1 mid 2012.
The BLA submitted in July 2010 requested accelerated approval for T-DM1 based on the results of a single-arm Phase II study, which showed T-DM1 shrank tumors in one-third of women with advanced HER2 positive breast cancer, who had received on average seven prior medicines, including two HER2 targeted agents."
There was a lot of excitement around the initial phase II results (one third of the women experienced tumour shrinkage, for example). Yet, to much surprise, the application was rejected:
"In their review of the BLA, FDA stated the T-DM1 trials did not meet the standard for accelerated approval because all available treatment choices approved for metastatic breast cancer, regardless of HER2 status, had not been exhausted in the study population."
At first reading of the press release, my thoughts centred around:
1. How could the FDA possibly reject such an application?
2. Was an SPA agreed up front?
The first question is easy to be indignant about, but what criteria were used for the trial and what does the data actually show?
Looking at the available clinical trials for T-DM1, this one looks most likely as 100 patients were required and the inclusion criteria stated:
* HER2-positive disease
* Metastatic breast cancer
* Disease progression on the last chemotherapy regimen received in the metastatic setting
* Prior treatment with an anthracycline, trastuzumab, a taxane, lapatinib, and capecitabine in the neoadjuvant, adjuvant, locally advanced, or metastatic setting and prior treatment with at least two lines of therapy (a line of therapy can be a combination of two agents or single-agent chemotherapy) in the metastatic setting
* At least two lines of anti-HER2 therapy must have been given in the metastatic setting as monotherapy or combined with chemotherapy or hormonal therapy. The HER2-targeted agent can include trastuzumab, lapatinib, or an investigational agent with HER2-inhibitory activity.
There are only two approved treatments for HER2-positive breast cancer, trastuzumab and lapatinib, plus others in clinical trials, eg pertuzumab, which was also allowed as one of the prior therapies. All patients appear to have been refractory to at least two of these drugs, most likely trastuzumab and lapatinib.
The prior chemotherapies included anthracyclines, taxanes and capecitabine, which is quite heavy pre-treatment and includes all of the considered standards of care for several lines of therapy. Indeed, the results of the trial presented at the San Antonio Breast Cancer Symposium last December showed that the average number of prior treatments in the metastatic setting was 7.
The others that could be used in the treatment of breast cancer include nab-paclitaxel (Abraxane), which I'm assuming would be covered in the taxane group and ixabepilone (Ixempra), an epothilone approved in by the FDA for metastatic breast cancer following progression on a taxane and anthracyclines, with or without capecitabine.
Ixabepilone is not a taxane or an anthracycline and therefore technically not covered in the inclusion criteria as a prior therapy, although some of the women would likely have received it, but not all. It is, however, a taxane-like compound in that it targets the microtubules, as described in the PI:
"Ixabepilone is a semi-synthetic analog of epothilone B. Ixabepilone binds directly to B-tubulin subunits on microtubules, leading to suppression of microtubule dynamics. Ixabepilone suppresses the dynamic instability of aB-II and aB-III microtubules."
If that was the criteria for rejecting the trial as not truly refractory in a very heavily pre-treated setting, I would be surprised. It's a bit of a technicality and nit-picking. Ixabepilone is not a commonly preferred treatment at all and BMS reported very low sales in 2009. Most US physicians appear to prefer the well established taxanes such as paclitaxel, docetaxel and nab-paclitaxel rather than a synthetic taxane-like agent and probably consider it as a last resort. It is used as a standalone therapy in the refractory/salvage setting.
However, we're talking about a potential indication for a targeted agent that inhibits HER2 dimerization not a chemotherapy, so I would have thought that most of the important bases were covered by including the most common chemotherapies, trastuzumab and lapatinib in the inclusion criteria.
With regards to the latter question, Twitter chat this morning suggested that no, an SPA wasn't formally agreed upon, but Roche held discussions with the FDA that led them to file for accelerated approval. Thanks to Adam Feuerstein of The Street for being the first to answer that question.
My general opinion is that if you have an agreed Special Protocol Assessment (SPA) and meet the defined targets, it's much easier to move forward and gain approval. If you don't, things may turn into a crapshoot and it can go either way. And that seems to be what has happened here.
The other factor that comes into play in this discussion is the ongoing discussion of the accelerated approval for Avastin in metastatic breast cancer and the overwhelming negative ODAC opinion last month. That will not have helped, although one would like to think it shouldn't influence any decision making at the FDA. We would probably be naive to think otherwise given the full protocol included PFS rather than OS as the endpoint.
To be fair, Roche appear to be addressing this issue, in their announcement this morning:
"Roche will amend the Phase III randomized EMILIA study in order to rigorously evaluate overall survival in addition to progression-free survival and will submit data from EMILIA to support a global regulatory submission in mid 2012."
Overall, I think it's a disappointing decision by the FDA given the heavily pre-treated population and lack of options for women who are refractory to both trastuzumab and lapatinib. Chemotherapy has not been shown to be particularly effective in HER2 disease, and by then the women generally have a poor prognosis. When you look again at the SABCS data, you find an objective response rate (ORR) of approximately 30% and a clinical benefit rate of around 40%, which is quite startling in a heavily pre-treated group.
Meanwhile, for now we'll have to wait another two years to see what the survival data looks like. That's a rather long time for women who have failed Herceptin and Tykerb to wait for a drug that appears to have significant activity.
{UPDATE: I posted this analysis in a hurry, uncaffeinated, and in a rush to head out to a meeting. Of course, one remembers later that SPA's apply to phase III not phase II trials, so a formal agreement wouldn't apply here. Thanks also to the two people who gently reminded me of this. Usually though, there are some discussions with FDA around the trial design for accelerated review. Essentially, in layman terms, it means patients are refractory to existing treatments for the disease concerned. Note that Roche, in their press release defined it as, "Consideration by the FDA for accelerated approval requires recognition of a defined patient population of unmet need (a life-threatening disease with limited treatment choices)." It looks like the FDA are applying it more strictly to ALL therapies, although the number of women who might have taken ixabepilone AND be HER2-positive will likely be miniscule. I would still maintain that refractory to all available HER2 therapies and most chemotherapies apply for the majority in this case.}
Posted by MaverickNY on August 27, 2010 at 10:30 AM
http://www.pharmastrategyblog.com/2010/08/fda-rejects-the-ro…
Hammer will sich demnächst auch dazu äußern.
Bin derzeit der Auffassung, dass wir es hier tatsächlich "nur" mit einer Verzögerung aufgrund eines unzureichenden Trialdesigns und/oder einer härteren Linie der FDA zu tun haben.
Ich habe meine IMGN-Position daher gestern verdoppelt.
Antwort auf Beitrag Nr.: 40.060.850 von SLGramann am 28.08.10 11:13:26Ich halte die FDA-Entscheidung unter ethischen Gesichtspunkten für zweifelhaft. Entscheidend für die eher spitzfindige Entscheidung waren aus meiner Sicht eher finanzpolitische Aspekte.
Für 2011 und 2012 werden infolge der Entscheidung kleinere Umsätze wegfallen. Am Zeitgang für die wirklich Umsatzrelevanten Indikationen (Erst- und Zweitlinientherapie usw.) hat sich nichts geändert!
Ich habe gestern lange mit den Roche-Verantwortlichen telefoniert. Dort ist man unverändert davon überzeugt, mit dem Immunkonjugat in einigen Jahren Umsätze in Milliardenhöhe zu erwirtschaften.
Der gestrige Kursverfall war eine ausgezeichnete Möglichkeit, IMGN-Aktien zu erwerben. Ich habe dies jedenfalls in größerem Stil getan. Sollte der Kurs in den nächsten Tagen weiter schwächeln, werde ich zukaufen. Zu einem späteren Zeitpunkt, wenn sich die Marktteilnehmer wieder abgeregt haben, werde ich die Position auf einen angemessenen Depotanteil reduzieren.
Für 2011 und 2012 werden infolge der Entscheidung kleinere Umsätze wegfallen. Am Zeitgang für die wirklich Umsatzrelevanten Indikationen (Erst- und Zweitlinientherapie usw.) hat sich nichts geändert!
Ich habe gestern lange mit den Roche-Verantwortlichen telefoniert. Dort ist man unverändert davon überzeugt, mit dem Immunkonjugat in einigen Jahren Umsätze in Milliardenhöhe zu erwirtschaften.
Der gestrige Kursverfall war eine ausgezeichnete Möglichkeit, IMGN-Aktien zu erwerben. Ich habe dies jedenfalls in größerem Stil getan. Sollte der Kurs in den nächsten Tagen weiter schwächeln, werde ich zukaufen. Zu einem späteren Zeitpunkt, wenn sich die Marktteilnehmer wieder abgeregt haben, werde ich die Position auf einen angemessenen Depotanteil reduzieren.
Antwort auf Beitrag Nr.: 40.060.850 von SLGramann am 28.08.10 11:13:26SLGramann,
manche Entscheidungen der FDA sind nur schwer nachzuvollziehen.
Ich denke, hier ist oft auch Politik mit im Spiel.
Ich bin ziemlich stark in Celldex investiert, die ja mit CDX-011 einen vergleichbaren Impfstoff für fortgeschrittenen Brustkrebs entwickeln.
Daher habe ich Immunogen die letzten Monate sehr genau beobachtet.
Da ich die Kursreaktion aufgrund der nicht gewährten beschleunigten Zulassung für übertrieben fand, habe ich mir am Freitag einige Stücke IMNG ins Depot gelegt.
Leider müssen wir jetzt bis 2012 warten, aber ich denke, das Geld ist gut angelegt.
Mich würde deine Meinung zu CDX-011 von Celldex interessieren.
Das Trialdesign der Phase II von CDX-011 finde ich besser als das von T-DM1.
Hier der Link dazu:
http://clinicaltrials.gov/ct2/show/NCT01156753?term=cdx-011&…
Entscheidend ist wohl folgendes:
In contrast, the CDX-011 study will only include patients which have exhausted all available therapeutical options:
"2.Locally advanced or metastatic breast cancer.
3.Previous treatment with at least two but no more than five prior chemotherapy treatments for progressive, recurrent or metastatic breast cancer.
4.Unless not a candidate for these agents, prior therapies must have included a taxane, an anthracycline, capecitabine and ixabepilone, as well as trastuzumab and lapatinib for patients whose tumors are positive for the human epidermal growth factor receptor 2 (HER2). (Patients who received incomplete courses of therapy with these agents due to intolerance will be eligible.)"
Außerdem ist die Patientenanzahl bei CDX-011 mit 120 im Vergleich zu T-DM1 mit ca. 50 mehr als doppelt so groß.
Bin gespannt, ob Celldex, vorausgestzt die Phase II bringt positive Ergebnisse hervor, ebenfalls einen Antrag auf accelerated approval stellen wird und um die FDA dem zustimmt.
Wenn ja, könnten beide Impfstoff in etwa zur selben Zeit auf den Markt kommen.
Wie ist deine Meinung dazu?
Gruß wachholder
manche Entscheidungen der FDA sind nur schwer nachzuvollziehen.
Ich denke, hier ist oft auch Politik mit im Spiel.
Ich bin ziemlich stark in Celldex investiert, die ja mit CDX-011 einen vergleichbaren Impfstoff für fortgeschrittenen Brustkrebs entwickeln.
Daher habe ich Immunogen die letzten Monate sehr genau beobachtet.
Da ich die Kursreaktion aufgrund der nicht gewährten beschleunigten Zulassung für übertrieben fand, habe ich mir am Freitag einige Stücke IMNG ins Depot gelegt.
Leider müssen wir jetzt bis 2012 warten, aber ich denke, das Geld ist gut angelegt.
Mich würde deine Meinung zu CDX-011 von Celldex interessieren.
Das Trialdesign der Phase II von CDX-011 finde ich besser als das von T-DM1.
Hier der Link dazu:
http://clinicaltrials.gov/ct2/show/NCT01156753?term=cdx-011&…
Entscheidend ist wohl folgendes:
In contrast, the CDX-011 study will only include patients which have exhausted all available therapeutical options:
"2.Locally advanced or metastatic breast cancer.
3.Previous treatment with at least two but no more than five prior chemotherapy treatments for progressive, recurrent or metastatic breast cancer.
4.Unless not a candidate for these agents, prior therapies must have included a taxane, an anthracycline, capecitabine and ixabepilone, as well as trastuzumab and lapatinib for patients whose tumors are positive for the human epidermal growth factor receptor 2 (HER2). (Patients who received incomplete courses of therapy with these agents due to intolerance will be eligible.)"
Außerdem ist die Patientenanzahl bei CDX-011 mit 120 im Vergleich zu T-DM1 mit ca. 50 mehr als doppelt so groß.
Bin gespannt, ob Celldex, vorausgestzt die Phase II bringt positive Ergebnisse hervor, ebenfalls einen Antrag auf accelerated approval stellen wird und um die FDA dem zustimmt.
Wenn ja, könnten beide Impfstoff in etwa zur selben Zeit auf den Markt kommen.
Wie ist deine Meinung dazu?
Gruß wachholder
Antwort auf Beitrag Nr.: 40.063.297 von wachholder am 29.08.10 15:06:23"Impfstoff" ???
Antwort auf Beitrag Nr.: 40.063.297 von wachholder am 29.08.10 15:06:23
Hallo wachholder,
für mich ist es leider nicht möglich, bei solchen Fragen zu einem eigenständigen Urteil zu kommen, weil mir dafür die Fachkompetenz fehlt. Ich versuche daher, mich an mir verständlichen Fakten zu orientieren (behördlichen Entscheidungen, Kooperationsvereinbarungen usw.) und/oder Meinungsquellen zu erschließen, denen ich Kompetenz zubillige und denen ich in gewissem Maß vertraue.
Das von Dir genannte Projekt kenne ich aus diesem - inzwischen recht alt gewordenem - Artikel aus einer solchen aus meiner Sicht kompetenten und vertrauenswürdigen Quelle:
http://www.hammerstockblog.com/spicing-up-the-biotech-portfo…
Das war natürlich vor der Übernahme von Curagen durch Celldex.
Dass kürzlich die von Dir verlinkte P II angelaufen ist, finde ich sehr erfreulich. Meine Einschätzung als Laie reicht aber nur so weit, zu sagen, dass wir dann zum ersten Mal eine recht umfassende Datenbasis zu diesem ADC haben werden. Ob das schon in Richtung Zulassung gehen könnte, kann ich aber nicht beurteilen.
Hallo wachholder,
für mich ist es leider nicht möglich, bei solchen Fragen zu einem eigenständigen Urteil zu kommen, weil mir dafür die Fachkompetenz fehlt. Ich versuche daher, mich an mir verständlichen Fakten zu orientieren (behördlichen Entscheidungen, Kooperationsvereinbarungen usw.) und/oder Meinungsquellen zu erschließen, denen ich Kompetenz zubillige und denen ich in gewissem Maß vertraue.
Das von Dir genannte Projekt kenne ich aus diesem - inzwischen recht alt gewordenem - Artikel aus einer solchen aus meiner Sicht kompetenten und vertrauenswürdigen Quelle:
http://www.hammerstockblog.com/spicing-up-the-biotech-portfo…
Das war natürlich vor der Übernahme von Curagen durch Celldex.
Dass kürzlich die von Dir verlinkte P II angelaufen ist, finde ich sehr erfreulich. Meine Einschätzung als Laie reicht aber nur so weit, zu sagen, dass wir dann zum ersten Mal eine recht umfassende Datenbasis zu diesem ADC haben werden. Ob das schon in Richtung Zulassung gehen könnte, kann ich aber nicht beurteilen.
Antwort auf Beitrag Nr.: 40.063.420 von SLGramann am 29.08.10 16:26:19Hallo SLGramann,
danke, faire Antwort.
Obwohl ich auch sehr viel über Krebsimpfstoffe und die ADC-Technologie lese, das Thema hat soviele Facetten und daher ist es für einen Laien sehr schwer, sich ein Urteil zu bilden.
Auch ich versuche mich daher an verständlichen Fakten zu orientieren.
SeattleGenetics (SGEN) meldet bald Ergebnisse zu SGN-35, ein antibody drug conjungate mit dem linker MMAE. Genau diese Technologie wird auch von Celldex eingesetzt.
Die Ergebnisse von SGEN werden daher für Immunogen und Celldex Weisungscharakter haben.
Es empfiehlt sich daher, SeattleGenetics in den kommenden Wochen genau zu beobachten.
Gruß
wachholder
danke, faire Antwort.
Obwohl ich auch sehr viel über Krebsimpfstoffe und die ADC-Technologie lese, das Thema hat soviele Facetten und daher ist es für einen Laien sehr schwer, sich ein Urteil zu bilden.
Auch ich versuche mich daher an verständlichen Fakten zu orientieren.
SeattleGenetics (SGEN) meldet bald Ergebnisse zu SGN-35, ein antibody drug conjungate mit dem linker MMAE. Genau diese Technologie wird auch von Celldex eingesetzt.
Die Ergebnisse von SGEN werden daher für Immunogen und Celldex Weisungscharakter haben.
Es empfiehlt sich daher, SeattleGenetics in den kommenden Wochen genau zu beobachten.
Gruß
wachholder
Antwort auf Beitrag Nr.: 40.061.744 von Joschka Schröder am 28.08.10 17:54:06Hallo Joschka !
Falls Roche mit dem Immunkonjugat in einigen Jahren Milliardenumsätze generieren kann, was springt ´dabei Immunogen raus ?
Wie sind die Verträge konzipiert ?
Welches Kursziel wäre dann nach deinen Erfahrungen gerechtfertigt ?
Viele Grüße
rootsofcanada
Falls Roche mit dem Immunkonjugat in einigen Jahren Milliardenumsätze generieren kann, was springt ´dabei Immunogen raus ?
Wie sind die Verträge konzipiert ?
Welches Kursziel wäre dann nach deinen Erfahrungen gerechtfertigt ?
Viele Grüße
rootsofcanada
Hier noch ein Statement von Prohost, das an Deutlichkeit nichts zu wünschen übrig lässt.
Insbesondere werden hier noch mal die schon von JoschkaSchröder hervorgehobenen ethischen Bedenken gegen die FDA-Entscheidung betont.
Two lethal viruses plague general investors. The euphoria virus infects investors when the market stages sustained rallies. This virus makes investors buy and buy until the balloon becomes overstretched and eventually bursts. The fear virus causes hysteria in susceptible investors when their stocks go south and rush them to sell at ridiculously low prices. The fear virus also provokes vulnerable investors to immediately dispose of their stocks at the hint of unfavorable news, whether or not the negative news is indicative of weakness in the firms’ fundamentals. Healthy, rational investors usually take advantage to accumulate the battered stocks of firms with strong fundamentals at the new bargain price that results from sell-offs by the fearful.
A case in point
IMMUNOGEN (IMGN)
The recent news announcing Genentech’s receipt of a “Refuse to File (RTF)” letter from the FDA for the accelerated approval of the Biologic License Application (BLA) for trastuzumab-DM1 (T-DM1) has caused a sell-off in Immunogenic, the owner of the technology and partner on the drug with Roche. According to the FDA letter, the refusal to give the early approval was because “the trials had not yet exhausted all available drugs approved for metastatic breast cancer, regardless of HER2 status!
The question is: Is the sell-off a fair market reaction to the news? Our answer is definitely no. Nothing in the news was related to the drug, its safety, efficacy, or its breakthrough nature. The FDA did not discuss the drug’s approvability and has not rejected it. The agency’s letter constituted a refusal only of an attempt to get the drug early on the market for the hopeless category of patients with tumor recurrence. Genentech made this decision based on the results of a single-arm Phase 2 study, which showed T-DM1 shrank tumors in one-third of women with advanced HER2-positive breast cancer who had received on average seven prior medicines, including two HER2-targeted medicines. The results convinced Genentech that TDM-1 works in recurrent HER2 breast cancer that resisted its blockbuster drug Herceptin and, evidently, the other non-specific treatments.
WOW, said a physician who was hearing the news. She developed HER2 breast cancer herself and tested positive for BRCA, which means she has inherited the breast cancer gene. As a matter of fact, her 28 years old daughter tested also positive for the gene. She has not developed metastasis or any other tumor recurrence, but she is concerned. Commenting on the FDA letter explanation to its decision, the physician/patent said, “trying to figure out what the FDA meant by exhausting all available treatment choices approved for metastatic breast cancer, the question that keeps crossing my mind is: Haven’t those patients received prior Herceptin (trastuzumab), capecitabine, anthracycline, taxane and lapatinib. How much more drugs must they receive? You know what? The drugs would be exhausted when Genentech uses them all, but definitely the patients who would receive them will.” We asked the doctor/patient whether there are existing data on these drugs that were not used in T-DM1 trials, her answer was, “Of course the data exist and have been published, yet, why do we need them? Oncologists know that most non-specific treatments have not helped most HER2 breast cancer even in its early stages, let alone their recurrences. I wonder why should we withdraw the big hope that HER2 metastatic patients hanged on since they heard about TDM-1 results – hope that has tremendously increased since these patients learned about the filing for early approval of the promising drug. Most these patients might not be around on the delayed day of the approval.”
Herceptin is the first approved HER2 targeted drug. It has improved by far the bad prognosis of HER2 breast cancer. But the drug has failed to work on around 50% of the cancer recurrence following a successful initial treatment. These patients are the candidate forT-DM1, which has demonstrated efficacy on them.
Trastuzumab-DM1 (T-DM1), in global development by Roche under a collaboration agreement with ImmunoGen. consists of DM1 cell-killing agent attached to the HER2-binding antibody trastuzumab (Herceptin) using ImmunoGen’s linker and methods of attachment. The drug is being developed for all stages of HER2+ metastatic breast cancer (MBC). T-DM1 has demonstrated the capability of walking the extra step towards killing the recurrent resistant cancer cells that Herceptin and other drugs failed to kill. The FDA decision has not affected Genentech’s confidence in the drug and will continue the EMILIA study, which compares T-DM1 to lapatinib in combination with capecitabine in people with advanced HER2-positive breast cancer whose disease has worsened after receiving initial treatment. ImmunoGen expressed disappointment that there will be a delay in the opportunity for T-DM1 to be approved for desperate patients and will continue to focus on the development of its robust and expanding pipeline as well as advancing its technology through new partnerships.
The whole story of the FDA letter revolves around fulfillment conditions for metastatic approval and
Currently:
Enrollment is on track in the Phase 3 trial (EMILIA) evaluating T-DM1 for 2nd-line** use with 580-patient randomized trial that began in February 2009 and compares T-DM1 – used as a single agent – to lapatinib) plus capecitabine.
A Phase 3 trial (MARIANNE) for 1st-line trial on route.
Waiting for October to hear the interim data of the phase 2 trial evaluating T-DM1 for first line treatment. The trial has completed patient enrollment. The data will be reported at the European Society of Medical Oncology (ESMO) meeting being held Oct. 8-12, 2010 in Milan, Italy. This trial compares T-DM1, given as a single agent, to Herceptin (trastuzumab) plus Taxotere (docetaxel).
Genentech has disclosed that trials to evaluate T-DM1 for early stage HER2+ breast cancer (adjuvant use) are being considered.
Data from earlier-stage phase 1 and phase 2 clinical trials have been reported and Information on these and other T-DM1 clinical trials can be found at ClinicalTrials.gov.
The firm’s pipeline comprises: T-DM1 (see above). Lorvotuzumab, for non-small-cell-lung cancer, Merkel cell and ovarian cancers, SAR3419, for non-hogkin’s lymphoma, IMGN 388, for solid tumors. BIIB015, for solid tumors. BT-062, for multiple myeloma, SAR650984, for lquid tumors, in addition to other investigational drugs in earlier stages.
Final note:
We ask those who caused the sell-off in IMGN: Are all these activities and results worth nothing compared to the refusal to accept earlier approval of the drug? The FDA has a job to do. We too have a job to do. Let the agency do its job and let the firms discuss the decision with the agency; it is their job too. Our job, though, is to assess the value of the firm’s drug and pipeline.
We believe the T-DM1 is formidable. We believe that ImmunoGen’s technology is impressive and so is the firm’s product pipeline based on its technology. We like the firm and believe it is way undervalued as traded.
Insbesondere werden hier noch mal die schon von JoschkaSchröder hervorgehobenen ethischen Bedenken gegen die FDA-Entscheidung betont.
Two lethal viruses plague general investors. The euphoria virus infects investors when the market stages sustained rallies. This virus makes investors buy and buy until the balloon becomes overstretched and eventually bursts. The fear virus causes hysteria in susceptible investors when their stocks go south and rush them to sell at ridiculously low prices. The fear virus also provokes vulnerable investors to immediately dispose of their stocks at the hint of unfavorable news, whether or not the negative news is indicative of weakness in the firms’ fundamentals. Healthy, rational investors usually take advantage to accumulate the battered stocks of firms with strong fundamentals at the new bargain price that results from sell-offs by the fearful.
A case in point
IMMUNOGEN (IMGN)
The recent news announcing Genentech’s receipt of a “Refuse to File (RTF)” letter from the FDA for the accelerated approval of the Biologic License Application (BLA) for trastuzumab-DM1 (T-DM1) has caused a sell-off in Immunogenic, the owner of the technology and partner on the drug with Roche. According to the FDA letter, the refusal to give the early approval was because “the trials had not yet exhausted all available drugs approved for metastatic breast cancer, regardless of HER2 status!
The question is: Is the sell-off a fair market reaction to the news? Our answer is definitely no. Nothing in the news was related to the drug, its safety, efficacy, or its breakthrough nature. The FDA did not discuss the drug’s approvability and has not rejected it. The agency’s letter constituted a refusal only of an attempt to get the drug early on the market for the hopeless category of patients with tumor recurrence. Genentech made this decision based on the results of a single-arm Phase 2 study, which showed T-DM1 shrank tumors in one-third of women with advanced HER2-positive breast cancer who had received on average seven prior medicines, including two HER2-targeted medicines. The results convinced Genentech that TDM-1 works in recurrent HER2 breast cancer that resisted its blockbuster drug Herceptin and, evidently, the other non-specific treatments.
WOW, said a physician who was hearing the news. She developed HER2 breast cancer herself and tested positive for BRCA, which means she has inherited the breast cancer gene. As a matter of fact, her 28 years old daughter tested also positive for the gene. She has not developed metastasis or any other tumor recurrence, but she is concerned. Commenting on the FDA letter explanation to its decision, the physician/patent said, “trying to figure out what the FDA meant by exhausting all available treatment choices approved for metastatic breast cancer, the question that keeps crossing my mind is: Haven’t those patients received prior Herceptin (trastuzumab), capecitabine, anthracycline, taxane and lapatinib. How much more drugs must they receive? You know what? The drugs would be exhausted when Genentech uses them all, but definitely the patients who would receive them will.” We asked the doctor/patient whether there are existing data on these drugs that were not used in T-DM1 trials, her answer was, “Of course the data exist and have been published, yet, why do we need them? Oncologists know that most non-specific treatments have not helped most HER2 breast cancer even in its early stages, let alone their recurrences. I wonder why should we withdraw the big hope that HER2 metastatic patients hanged on since they heard about TDM-1 results – hope that has tremendously increased since these patients learned about the filing for early approval of the promising drug. Most these patients might not be around on the delayed day of the approval.”
Herceptin is the first approved HER2 targeted drug. It has improved by far the bad prognosis of HER2 breast cancer. But the drug has failed to work on around 50% of the cancer recurrence following a successful initial treatment. These patients are the candidate forT-DM1, which has demonstrated efficacy on them.
Trastuzumab-DM1 (T-DM1), in global development by Roche under a collaboration agreement with ImmunoGen. consists of DM1 cell-killing agent attached to the HER2-binding antibody trastuzumab (Herceptin) using ImmunoGen’s linker and methods of attachment. The drug is being developed for all stages of HER2+ metastatic breast cancer (MBC). T-DM1 has demonstrated the capability of walking the extra step towards killing the recurrent resistant cancer cells that Herceptin and other drugs failed to kill. The FDA decision has not affected Genentech’s confidence in the drug and will continue the EMILIA study, which compares T-DM1 to lapatinib in combination with capecitabine in people with advanced HER2-positive breast cancer whose disease has worsened after receiving initial treatment. ImmunoGen expressed disappointment that there will be a delay in the opportunity for T-DM1 to be approved for desperate patients and will continue to focus on the development of its robust and expanding pipeline as well as advancing its technology through new partnerships.
The whole story of the FDA letter revolves around fulfillment conditions for metastatic approval and
Currently:
Enrollment is on track in the Phase 3 trial (EMILIA) evaluating T-DM1 for 2nd-line** use with 580-patient randomized trial that began in February 2009 and compares T-DM1 – used as a single agent – to lapatinib) plus capecitabine.
A Phase 3 trial (MARIANNE) for 1st-line trial on route.
Waiting for October to hear the interim data of the phase 2 trial evaluating T-DM1 for first line treatment. The trial has completed patient enrollment. The data will be reported at the European Society of Medical Oncology (ESMO) meeting being held Oct. 8-12, 2010 in Milan, Italy. This trial compares T-DM1, given as a single agent, to Herceptin (trastuzumab) plus Taxotere (docetaxel).
Genentech has disclosed that trials to evaluate T-DM1 for early stage HER2+ breast cancer (adjuvant use) are being considered.
Data from earlier-stage phase 1 and phase 2 clinical trials have been reported and Information on these and other T-DM1 clinical trials can be found at ClinicalTrials.gov.
The firm’s pipeline comprises: T-DM1 (see above). Lorvotuzumab, for non-small-cell-lung cancer, Merkel cell and ovarian cancers, SAR3419, for non-hogkin’s lymphoma, IMGN 388, for solid tumors. BIIB015, for solid tumors. BT-062, for multiple myeloma, SAR650984, for lquid tumors, in addition to other investigational drugs in earlier stages.
Final note:
We ask those who caused the sell-off in IMGN: Are all these activities and results worth nothing compared to the refusal to accept earlier approval of the drug? The FDA has a job to do. We too have a job to do. Let the agency do its job and let the firms discuss the decision with the agency; it is their job too. Our job, though, is to assess the value of the firm’s drug and pipeline.
We believe the T-DM1 is formidable. We believe that ImmunoGen’s technology is impressive and so is the firm’s product pipeline based on its technology. We like the firm and believe it is way undervalued as traded.
Ohad Hammer hat den ersten Teil seiner Stellungnahme präsentiert. Wie immer, gewinnt man bei ihm die tiefsten Einsichten!
http://www.hammerstockblog.com/immunogen-what-really-happene…
Last week, Roche announced that the FDA was unwilling to accept T-DM1’s accelerated approval filing for breast cancer, sending Immunogen’s (IMGN) shares tumbling almost 40%. The filing was based on impressive results from a single arm phase II trial in 3rd line HER2 breast cancer. Typically, gaining regulatory approval requires a large, randomized phase III study but in cases of highly unmet need where patients are bereft of effective treatment options, the FDA may consider approval in a limited patient population.
Surprisingly, it turns out that the FDA was unwilling to even consider approval for T-DM1 based on the phase II. T-DM1’s data set is one of the most impressive ever generated in late stage breast cancer, which is why the market (myself included) was confident T-DM1 would win FDA approval. The reason for the FDA’s response as appears in the official press release was that “all available treatment choices approved for metastatic breast cancer, regardless of HER2 status, had not been exhausted in the study population”. In other words, T-DM1 did not qualify for accelerated approval based on the phase II results. This got people scratching their heads as no further details were provided by the FDA, Roche or Immunogen.
Regardless of the reasons for the rejection (to be discussed below), it is important to note that it had nothing to do with the clinical data, which remains promising. The next attempt to get T-DM1 approved will be based on a large randomized phase III trial (the EMILIA study) in mid 2012. This is a major setback for T-DM1 and Immunogen, which is eligible for a 4-5% royalty rate, but it has no real impact on T-DM1’s long term potential.
Defining available treatment options
The FDA’s statement that not all available treatment options had been exhausted probably refers to a chemotherapy regimen, as the patients in the trial had progressed on both Herceptin and Tykerb, which are HER2 targeted therapies. According to the data presented last December, patients in the phase II trial had prior therapy with a median of 7 agents, including Herceptin and Tykerb. All but one of the patients had been treated with the three most commonly used chemo drugs (or classes of drugs): An anthracycline, a taxane, and Xeloda. So what were then the additional treatment options the FDA was referring to?
There are many chemo drugs that can be used in breast cancer, some have been approved for decades, however, patients rarely receive all of them. Therefore, it is unrealistic to expect every patient to receive every drug that was ever approved. If I had to guess, the single drug the FDA wanted to see as a prior therapy was BMS’s (BMY) Ixempra, which is (to my knowledge) the only drug that is specifically approved in breast cancer patients who relapse after Xeloda.
Ixempra was approved in 2007 for Xeloda-pretreated patients as a single agent. Intriguingly, its approval was very similar to that pursued by Roche for T-DM1. The filing was based on a single arm phase II study in 126 patients who had previously been treated with an anthracycline, a taxane, and Xeloda. The response rate in 113 response-evaluable patients was 12.4% and the median progression free survival (PFS) was 3.1 months. Of note, BMS pursued approval of Ixempra in combination with Xeloda for an earlier treatment line in the same filing, which probably increased chances of approval.
If the FDA had Ixempra in mind when it decided to issue the “refuse to file” response, this makes the decision even more puzzling. T-DM1 led to a response rate of 32.7% and preliminary PFS of 7.3 months (final PFS should be higher as this figure represents the first 50 patients who experienced disease progression). Although T-DM1 and Ixempra have been evaluated in different trials in non-overlapping patient populations (only 7% of patients in the Ixempra study were HER2 positive), T-DM1 looks much more effective than Ixempra in HER2 breast cancer patients. T-DM1 also seems to have a better safety profile, which could be an issue for heavily pretreated patients who are often frail and more sensitive to side effects.
The FDA’s dilemma
The FDA probably faced a dilemma: On the one hand there was a highly efficacious and safe drug in a well defined patient population. On the other hand were objective criteria that had to be met in order to receive tentative accelerated approval. Technically, the patients in the T-DM1 study were not last line patients because they were eligible for single agent Ixempra. Nevertheless, Ixempra’s efficacy seems limited, which may explain the drug’s modest sales (~$110M per year) and the fact that it was not approved in Europe.
As the gatekeeper of healthcare in the US, the FDA must be very protective and prevent ineffective or unsafe drugs from reaching the market. This time, it seems the FDA chose (or had to) follow the rules rather than bend them by not giving T-DM1 an opportunity to be evaluated by an expert panel. Unfortunately, by sticking to the formal rules, the agency lost sight of the patients’ best interest, depriving them of access to an excellent drug. Instead, patients are left with an ineffective, toxic drug they are not likely to receive anyway.
Putting investment aspects aside, the real challenge right now is getting T-DM1 to patients who need it as part of a compassionate use program. 3rd line patients are not eligible for the majority of ongoing clinical trials with T-DM1 and at the moment, there are only 9 sites across the US that offer the drug as part of an expanded access study, according to clinicaltrials.gov. It is the moral obligation of all parties involved to provide 3rd line patients with T-DM1 as an experimental drug.
Morgen folgt eine Fortsetzung.
http://www.hammerstockblog.com/immunogen-what-really-happene…
Last week, Roche announced that the FDA was unwilling to accept T-DM1’s accelerated approval filing for breast cancer, sending Immunogen’s (IMGN) shares tumbling almost 40%. The filing was based on impressive results from a single arm phase II trial in 3rd line HER2 breast cancer. Typically, gaining regulatory approval requires a large, randomized phase III study but in cases of highly unmet need where patients are bereft of effective treatment options, the FDA may consider approval in a limited patient population.
Surprisingly, it turns out that the FDA was unwilling to even consider approval for T-DM1 based on the phase II. T-DM1’s data set is one of the most impressive ever generated in late stage breast cancer, which is why the market (myself included) was confident T-DM1 would win FDA approval. The reason for the FDA’s response as appears in the official press release was that “all available treatment choices approved for metastatic breast cancer, regardless of HER2 status, had not been exhausted in the study population”. In other words, T-DM1 did not qualify for accelerated approval based on the phase II results. This got people scratching their heads as no further details were provided by the FDA, Roche or Immunogen.
Regardless of the reasons for the rejection (to be discussed below), it is important to note that it had nothing to do with the clinical data, which remains promising. The next attempt to get T-DM1 approved will be based on a large randomized phase III trial (the EMILIA study) in mid 2012. This is a major setback for T-DM1 and Immunogen, which is eligible for a 4-5% royalty rate, but it has no real impact on T-DM1’s long term potential.
Defining available treatment options
The FDA’s statement that not all available treatment options had been exhausted probably refers to a chemotherapy regimen, as the patients in the trial had progressed on both Herceptin and Tykerb, which are HER2 targeted therapies. According to the data presented last December, patients in the phase II trial had prior therapy with a median of 7 agents, including Herceptin and Tykerb. All but one of the patients had been treated with the three most commonly used chemo drugs (or classes of drugs): An anthracycline, a taxane, and Xeloda. So what were then the additional treatment options the FDA was referring to?
There are many chemo drugs that can be used in breast cancer, some have been approved for decades, however, patients rarely receive all of them. Therefore, it is unrealistic to expect every patient to receive every drug that was ever approved. If I had to guess, the single drug the FDA wanted to see as a prior therapy was BMS’s (BMY) Ixempra, which is (to my knowledge) the only drug that is specifically approved in breast cancer patients who relapse after Xeloda.
Ixempra was approved in 2007 for Xeloda-pretreated patients as a single agent. Intriguingly, its approval was very similar to that pursued by Roche for T-DM1. The filing was based on a single arm phase II study in 126 patients who had previously been treated with an anthracycline, a taxane, and Xeloda. The response rate in 113 response-evaluable patients was 12.4% and the median progression free survival (PFS) was 3.1 months. Of note, BMS pursued approval of Ixempra in combination with Xeloda for an earlier treatment line in the same filing, which probably increased chances of approval.
If the FDA had Ixempra in mind when it decided to issue the “refuse to file” response, this makes the decision even more puzzling. T-DM1 led to a response rate of 32.7% and preliminary PFS of 7.3 months (final PFS should be higher as this figure represents the first 50 patients who experienced disease progression). Although T-DM1 and Ixempra have been evaluated in different trials in non-overlapping patient populations (only 7% of patients in the Ixempra study were HER2 positive), T-DM1 looks much more effective than Ixempra in HER2 breast cancer patients. T-DM1 also seems to have a better safety profile, which could be an issue for heavily pretreated patients who are often frail and more sensitive to side effects.
The FDA’s dilemma
The FDA probably faced a dilemma: On the one hand there was a highly efficacious and safe drug in a well defined patient population. On the other hand were objective criteria that had to be met in order to receive tentative accelerated approval. Technically, the patients in the T-DM1 study were not last line patients because they were eligible for single agent Ixempra. Nevertheless, Ixempra’s efficacy seems limited, which may explain the drug’s modest sales (~$110M per year) and the fact that it was not approved in Europe.
As the gatekeeper of healthcare in the US, the FDA must be very protective and prevent ineffective or unsafe drugs from reaching the market. This time, it seems the FDA chose (or had to) follow the rules rather than bend them by not giving T-DM1 an opportunity to be evaluated by an expert panel. Unfortunately, by sticking to the formal rules, the agency lost sight of the patients’ best interest, depriving them of access to an excellent drug. Instead, patients are left with an ineffective, toxic drug they are not likely to receive anyway.
Putting investment aspects aside, the real challenge right now is getting T-DM1 to patients who need it as part of a compassionate use program. 3rd line patients are not eligible for the majority of ongoing clinical trials with T-DM1 and at the moment, there are only 9 sites across the US that offer the drug as part of an expanded access study, according to clinicaltrials.gov. It is the moral obligation of all parties involved to provide 3rd line patients with T-DM1 as an experimental drug.
Morgen folgt eine Fortsetzung.
hier nun Teil 2:
http://www.hammerstockblog.com/immunogen-beyond-the-t-dm1-de…
Immunogen beyond the T-DM1 delay
The FDA’s decision to reject Roche’s filing for accelerated approval of T-DM1’s had quite an impact on Immunogen’s (IMGN) stock. There is no doubt that T-DM1 represents the company’s most valuable, even if it is in the form of a mid single digit royalty rate, due to its blockbuster potential and impressive clinical activity. This justifies to some extent last week’s market reaction, as the next potential approval for T-DM1 will is anticipated in mid 2012. Nevertheless, T-DM1 is facing multiple potential value creation events in the coming year, including an important data set for T-DM1 next month. In addition, the company is involved in 6 clinical stage programs (#7 is expected to enter the clinic this month), some of which are expected to generate data in the coming months. Although none of these programs are nearly as exciting as T-DM1, some of them could become more attractive with time.
T-DM1 related events
It is important to note that the regulatory setback has nothing to do with T-DM1’s activity or Immunogen’s technology. T-DM1 is still a promising drug with impressive activity and a very good safety profile in heavily pretreated breast cancer patients. The next shot is in 2nd line approval where Roche is conducting a large double arm trial head to head vs. standard of care. In this case, the trial is probably well powered to support filing providing the data is positive. Naturally, large randomized controlled studies are always more challenging compared to single arm trials, but givenT-DM1’s clinical profile ,the drug has a decent shot to beat the control arm (Tykerb+Xeloda).
T-DM1’s potential market remains unchanged, with a blockbuster potential based on the $4.8B in sales Herceptin had last year. Herceptin’s sales will probably grow beyond $5B following the approval in HER2 positive gastric cancer. As I explained two years ago, T-DM1’s potential could be even larger than that currently served by Herceptin as there are several additional indications where a subset of patients express HER2. In these indications, Herceptin was not successful but since T-DM1 has a totally different mode of action, it could work where Herceptin failed, just like in Herceptin pretreated breast cancer.
The vast majority of Immunogen’s value is derived from T-DM1, which is in a broad and aggressive development program. The pivotal data in 2nd line patients will probably be available late next year. Until then, T-DM1 will have readouts from several early stage trials.
The most important of these readouts will occur next month at the ESMO meeting, where investigators will present a trial with T-DM1 in 1st line patients (not previously treated with Herceptin). This will not only be the first opportunity to evaluate T-DM1 in Herceptin naïve patients but also the first trial that compares T-DM1 with another treatment regimen (Herceptin+Taxotere). It will be important to see how T-DM1 performs in comparison to an established chemotherapy regimen, and based on Roche’s decision to initiate a phase III trial for T-DM1 in 1st line patients, there should be at least a comparable level of activity.
Other interesting trials involve combining T-DM1 with other agents. Preliminary results from one of the trials evaluating T-DM1 and pertuzumab were reported earlier this year. Although the safety profile of the combination was good, the efficacy seemed similar to that of single agent T-DM1 in prior trials. Interestingly, the 1st line pivotal trial includes a T-DM1+pertuzumab arm, so perhaps updated results from the phase I will be better. Another interesting study combines T-DM1 with GDC-0941, a PI3K inhibitor. This combination is interesting because preliminary signs show that over activation of the PI3K pathway renders tumors less sensitive to T-DM1 and other HER2 targeting drugs.
The rest of Immunogen’s pipeline
There are currently 6 agents in clinical development that are based on Immunogen’s technology. Based on the available data, none of them come close to T-DM1 in terms of clinical data and likelihood of approval. Of course, new data (good or bad) will change the inherent value of these compounds.
IMGN901 (anti CD56, wholly owned)
Results from 2 trials are expected this year. The first trial is an expansion of an ongoing phase I study in a rare type of cancer called Merkel Cell. This indication was chosen based on unusual anecdotal activity in Merkel Cell that was discussed here. As I wrote, this could be a very fast route to market and a meaningful value creation event but results to date are ambiguous. Updated data is expected at ESMO next month and will enable the company to decide whether or not to pursue development of IMGN901 in this niche indication.
The second trial is a phase I in multiple myeloma that will probably be reported at ASH in December. I reviewed earlier results from this trial here. The updated results will give a better sense of the agent’s clinical profile but the data is unlikely to justify pursuing IMGN901 as monotherapy in multiple myeloma. Immunogen has already initiated a combination trial with Revlimid, which is a common drug for this indication. Preliminary data from this trial will not be meaningful as it will be hard to associate activity with IMGN901 directly.
SAR3419 (anti CD19, Sanofi-Aventis)
Last year Sanofi (SNY) presented positive (but not overwhelming) results from a phase I of SAR3419 in lymphoma. At ASH this December, the company will present data from another phase I utilizing a more frequent dosing schedule (weekly administration). It appears that this regimen is more active than the prior regimen and Sanofi plans to use the weekly regimen in future phase II studies. This, however, resulted in a delay in the initiation of SAR3419’s phase II, which is now expected to begin in the summer of 2011. This is good news for Micromet (MITI), who is developing a competing antibody for the same target, as I discussed last year. Seattle Genetics (SGEN) is also expected to enter the clinic with its anti-CD19 ADC next year.
IMGN388 (anti alphav integrin, wholly owned)
This ADC was originally developed by J&J’s (JNJ) Centocor, who decided not to advance it into clinic trials. Immunogen saw this as an opportunity to bring a compound to the clinic very quickly and with minimal cost. There are several antibodies that target integrins in development, as well as two approved antibodies in non oncology indications. Although integrins have an established role in cancer associated functions such as invasion and motility, the value of anti-integrin antibodies in cancer is still unclear.
Alphav integrin is found in many solid tumors and tumor blood vessels, but it is also present on normal cells. This target is being pursued by Pfizer (PFE) and Centocor through naked antibodies. The Centocor antibody (CNTO-95) has been in clinical trials for 8 years and is currently in a phase I study where it is given together with Avastin. Results to date were unimpressive although there were some signs of clinical activity as a single agent.
IMGN388 is interesting because it is the first and only antibody drug conjugate targeting an integrin. The naked antibodies aim at disrupting the biologic activity and signaling of integrins and so far showed little promise. As an ADC, IMGN388 uses integrins for delivering a drug payload into cancer cells. On top of the activity issue, there were doubts about the safety profile of IMGN388 because integrins are expressed by certain normal cells as well.
3 months ago, Immunogen released first data from a phase I trial that showed the ADC is surprisingly safe. There were no responses, even though some of the patients’ tumors had high integrin expression. There were several cases of disease stabilization as well as what could be seen as a correlation of integrin expression and dose to clinical benefit, but numbers were too small to draw definitive conclusions. Immunogen will release an update from the trial in November. Expectations from this agent are low, so any clinical activity seen with IMGN388 will be a positive surprise.
BT062 (anti CD138, Biotest)
Biotest is developing BT062 for multiple myeloma. Results to date indicate certain degree of activity but similarly to IMGN901, this agent is not likely to be pursued as a single agent. Last month, Biotest announced its plans to start a trial evaluating more frequent administration.
BIIB015 (anti-CRIPTO, Biogen Idec)
This ADC entered phase I more than two years ago, however, no results were published, which is usually not a good sign. Expectations from this agent are low.
SAR650984 (Anti CD38, Sanofi Aventis)
This is a naked antibody for blood cancers which recently entered clinical testing. Genmab is developing its own CD38 antibody in multiple myeloma but has not reported anything from a study that is ongoing for almost 3 years. Morphosys has a preclinical program for CD38 as well.
SAR566658 (anti DS6, Sanofi Aventis)
SAR566658, which will probably enter clinical testing in a matter of weeks, is an ADC targeting DS6. DS6 a sugar side chain on MUC1, a well known cancer associated target. To date, all attempts to target MUC1 failed, and ADCs are not considered a good option for this target due to lack of specificity. SAR566658 targets a side chain on MUC1 that seems to be more differentially expressed. Immunogen already used this approach with IMGN242 which is an ADC against a MUC1 glycoform (CanAg), but its development was discontinued last year due to insufficient efficacy. In any case, meaningful data for SAR566658 is not expected in the near term future.
Business development activity
Immunogen is expected to announce new licensing agreements after a long drought of 2 years with no new deals (the last deal with Bayer announced in October 2008). This is surprising given the strong validation T-DM1 has provided to Immunogen’s technology. On the recent conference call, CEO Dan Junius addressed this discrepancy, explaining the company decided to be more selective in its deals due to the need to retain enough resources for internal development. In addition, it seems Immunogen is asking for terms that are substantially better than those of its current collaborations.
In contrast to Immunogen, Seattle Genetics has seen quite a lot of business activity, including three broad collaborations with GSK, Genentech and Agensys (part of Astellas) as well as a licensing deal for lead agent SGN-35 with Millenium (Takeda). The four deals brought Seattle Genetics over $100M in upfront payments.
Similarly to Immunogen, Seattle Genetics derives the vast majority of its valuation from a single drug, SGN-35, which is expected to be approved next year for Hodgkin’s Lymphoma. Results from a pivotal phase II trial are expected next month. This is also a single arm phase II but unlike the T-DM1 trial, it is conducted under a SPA (special protocol assessment), which minimizes the risk of last minute surprises from the FDA.
Seattle Genetics’ pipeline is expanding at a fast rate, including phase I initiations for 7 different ADCs in the past year or so. One of these agents is wholly owned by the company (SGN-75), two are being co-developed with Agensys(AGS-5ME, AGS- 16M8F) and four are being developed by partners. It seems that two of these programs have already been terminated: MEDI-547’s trial has been terminated prematurely probably due to toxicity. Another ADC that was developed by Genentech entered phase I in 2008 but there was no mentioning of this agent ever since.
In summary, both Immunogen and Seattle Genetics have one promising agent in development and an expanding pipeline of early stage ADCs to which little value can be ascribed at the moment. It is also likely that the majority of these agents will fail to reach the market, based on the high attrition rate in oncology. The good news is that positive data from any of these early stage programs will have a big impact on the company’s valuation. While it’s impossible to predict which programs become successful, the growing number of ADCs in the clinic make this a matter of “when” rather than “if”.
http://www.hammerstockblog.com/immunogen-beyond-the-t-dm1-de…
Immunogen beyond the T-DM1 delay
The FDA’s decision to reject Roche’s filing for accelerated approval of T-DM1’s had quite an impact on Immunogen’s (IMGN) stock. There is no doubt that T-DM1 represents the company’s most valuable, even if it is in the form of a mid single digit royalty rate, due to its blockbuster potential and impressive clinical activity. This justifies to some extent last week’s market reaction, as the next potential approval for T-DM1 will is anticipated in mid 2012. Nevertheless, T-DM1 is facing multiple potential value creation events in the coming year, including an important data set for T-DM1 next month. In addition, the company is involved in 6 clinical stage programs (#7 is expected to enter the clinic this month), some of which are expected to generate data in the coming months. Although none of these programs are nearly as exciting as T-DM1, some of them could become more attractive with time.
T-DM1 related events
It is important to note that the regulatory setback has nothing to do with T-DM1’s activity or Immunogen’s technology. T-DM1 is still a promising drug with impressive activity and a very good safety profile in heavily pretreated breast cancer patients. The next shot is in 2nd line approval where Roche is conducting a large double arm trial head to head vs. standard of care. In this case, the trial is probably well powered to support filing providing the data is positive. Naturally, large randomized controlled studies are always more challenging compared to single arm trials, but givenT-DM1’s clinical profile ,the drug has a decent shot to beat the control arm (Tykerb+Xeloda).
T-DM1’s potential market remains unchanged, with a blockbuster potential based on the $4.8B in sales Herceptin had last year. Herceptin’s sales will probably grow beyond $5B following the approval in HER2 positive gastric cancer. As I explained two years ago, T-DM1’s potential could be even larger than that currently served by Herceptin as there are several additional indications where a subset of patients express HER2. In these indications, Herceptin was not successful but since T-DM1 has a totally different mode of action, it could work where Herceptin failed, just like in Herceptin pretreated breast cancer.
The vast majority of Immunogen’s value is derived from T-DM1, which is in a broad and aggressive development program. The pivotal data in 2nd line patients will probably be available late next year. Until then, T-DM1 will have readouts from several early stage trials.
The most important of these readouts will occur next month at the ESMO meeting, where investigators will present a trial with T-DM1 in 1st line patients (not previously treated with Herceptin). This will not only be the first opportunity to evaluate T-DM1 in Herceptin naïve patients but also the first trial that compares T-DM1 with another treatment regimen (Herceptin+Taxotere). It will be important to see how T-DM1 performs in comparison to an established chemotherapy regimen, and based on Roche’s decision to initiate a phase III trial for T-DM1 in 1st line patients, there should be at least a comparable level of activity.
Other interesting trials involve combining T-DM1 with other agents. Preliminary results from one of the trials evaluating T-DM1 and pertuzumab were reported earlier this year. Although the safety profile of the combination was good, the efficacy seemed similar to that of single agent T-DM1 in prior trials. Interestingly, the 1st line pivotal trial includes a T-DM1+pertuzumab arm, so perhaps updated results from the phase I will be better. Another interesting study combines T-DM1 with GDC-0941, a PI3K inhibitor. This combination is interesting because preliminary signs show that over activation of the PI3K pathway renders tumors less sensitive to T-DM1 and other HER2 targeting drugs.
The rest of Immunogen’s pipeline
There are currently 6 agents in clinical development that are based on Immunogen’s technology. Based on the available data, none of them come close to T-DM1 in terms of clinical data and likelihood of approval. Of course, new data (good or bad) will change the inherent value of these compounds.
IMGN901 (anti CD56, wholly owned)
Results from 2 trials are expected this year. The first trial is an expansion of an ongoing phase I study in a rare type of cancer called Merkel Cell. This indication was chosen based on unusual anecdotal activity in Merkel Cell that was discussed here. As I wrote, this could be a very fast route to market and a meaningful value creation event but results to date are ambiguous. Updated data is expected at ESMO next month and will enable the company to decide whether or not to pursue development of IMGN901 in this niche indication.
The second trial is a phase I in multiple myeloma that will probably be reported at ASH in December. I reviewed earlier results from this trial here. The updated results will give a better sense of the agent’s clinical profile but the data is unlikely to justify pursuing IMGN901 as monotherapy in multiple myeloma. Immunogen has already initiated a combination trial with Revlimid, which is a common drug for this indication. Preliminary data from this trial will not be meaningful as it will be hard to associate activity with IMGN901 directly.
SAR3419 (anti CD19, Sanofi-Aventis)
Last year Sanofi (SNY) presented positive (but not overwhelming) results from a phase I of SAR3419 in lymphoma. At ASH this December, the company will present data from another phase I utilizing a more frequent dosing schedule (weekly administration). It appears that this regimen is more active than the prior regimen and Sanofi plans to use the weekly regimen in future phase II studies. This, however, resulted in a delay in the initiation of SAR3419’s phase II, which is now expected to begin in the summer of 2011. This is good news for Micromet (MITI), who is developing a competing antibody for the same target, as I discussed last year. Seattle Genetics (SGEN) is also expected to enter the clinic with its anti-CD19 ADC next year.
IMGN388 (anti alphav integrin, wholly owned)
This ADC was originally developed by J&J’s (JNJ) Centocor, who decided not to advance it into clinic trials. Immunogen saw this as an opportunity to bring a compound to the clinic very quickly and with minimal cost. There are several antibodies that target integrins in development, as well as two approved antibodies in non oncology indications. Although integrins have an established role in cancer associated functions such as invasion and motility, the value of anti-integrin antibodies in cancer is still unclear.
Alphav integrin is found in many solid tumors and tumor blood vessels, but it is also present on normal cells. This target is being pursued by Pfizer (PFE) and Centocor through naked antibodies. The Centocor antibody (CNTO-95) has been in clinical trials for 8 years and is currently in a phase I study where it is given together with Avastin. Results to date were unimpressive although there were some signs of clinical activity as a single agent.
IMGN388 is interesting because it is the first and only antibody drug conjugate targeting an integrin. The naked antibodies aim at disrupting the biologic activity and signaling of integrins and so far showed little promise. As an ADC, IMGN388 uses integrins for delivering a drug payload into cancer cells. On top of the activity issue, there were doubts about the safety profile of IMGN388 because integrins are expressed by certain normal cells as well.
3 months ago, Immunogen released first data from a phase I trial that showed the ADC is surprisingly safe. There were no responses, even though some of the patients’ tumors had high integrin expression. There were several cases of disease stabilization as well as what could be seen as a correlation of integrin expression and dose to clinical benefit, but numbers were too small to draw definitive conclusions. Immunogen will release an update from the trial in November. Expectations from this agent are low, so any clinical activity seen with IMGN388 will be a positive surprise.
BT062 (anti CD138, Biotest)
Biotest is developing BT062 for multiple myeloma. Results to date indicate certain degree of activity but similarly to IMGN901, this agent is not likely to be pursued as a single agent. Last month, Biotest announced its plans to start a trial evaluating more frequent administration.
BIIB015 (anti-CRIPTO, Biogen Idec)
This ADC entered phase I more than two years ago, however, no results were published, which is usually not a good sign. Expectations from this agent are low.
SAR650984 (Anti CD38, Sanofi Aventis)
This is a naked antibody for blood cancers which recently entered clinical testing. Genmab is developing its own CD38 antibody in multiple myeloma but has not reported anything from a study that is ongoing for almost 3 years. Morphosys has a preclinical program for CD38 as well.
SAR566658 (anti DS6, Sanofi Aventis)
SAR566658, which will probably enter clinical testing in a matter of weeks, is an ADC targeting DS6. DS6 a sugar side chain on MUC1, a well known cancer associated target. To date, all attempts to target MUC1 failed, and ADCs are not considered a good option for this target due to lack of specificity. SAR566658 targets a side chain on MUC1 that seems to be more differentially expressed. Immunogen already used this approach with IMGN242 which is an ADC against a MUC1 glycoform (CanAg), but its development was discontinued last year due to insufficient efficacy. In any case, meaningful data for SAR566658 is not expected in the near term future.
Business development activity
Immunogen is expected to announce new licensing agreements after a long drought of 2 years with no new deals (the last deal with Bayer announced in October 2008). This is surprising given the strong validation T-DM1 has provided to Immunogen’s technology. On the recent conference call, CEO Dan Junius addressed this discrepancy, explaining the company decided to be more selective in its deals due to the need to retain enough resources for internal development. In addition, it seems Immunogen is asking for terms that are substantially better than those of its current collaborations.
In contrast to Immunogen, Seattle Genetics has seen quite a lot of business activity, including three broad collaborations with GSK, Genentech and Agensys (part of Astellas) as well as a licensing deal for lead agent SGN-35 with Millenium (Takeda). The four deals brought Seattle Genetics over $100M in upfront payments.
Similarly to Immunogen, Seattle Genetics derives the vast majority of its valuation from a single drug, SGN-35, which is expected to be approved next year for Hodgkin’s Lymphoma. Results from a pivotal phase II trial are expected next month. This is also a single arm phase II but unlike the T-DM1 trial, it is conducted under a SPA (special protocol assessment), which minimizes the risk of last minute surprises from the FDA.
Seattle Genetics’ pipeline is expanding at a fast rate, including phase I initiations for 7 different ADCs in the past year or so. One of these agents is wholly owned by the company (SGN-75), two are being co-developed with Agensys(AGS-5ME, AGS- 16M8F) and four are being developed by partners. It seems that two of these programs have already been terminated: MEDI-547’s trial has been terminated prematurely probably due to toxicity. Another ADC that was developed by Genentech entered phase I in 2008 but there was no mentioning of this agent ever since.
In summary, both Immunogen and Seattle Genetics have one promising agent in development and an expanding pipeline of early stage ADCs to which little value can be ascribed at the moment. It is also likely that the majority of these agents will fail to reach the market, based on the high attrition rate in oncology. The good news is that positive data from any of these early stage programs will have a big impact on the company’s valuation. While it’s impossible to predict which programs become successful, the growing number of ADCs in the clinic make this a matter of “when” rather than “if”.
Antwort auf Beitrag Nr.: 40.089.861 von SLGramann am 02.09.10 16:22:40Es macht immer wieder Spaß, Ohad Hammers gescheiten Zusammenfassungen zu lesen.
Antwort auf Beitrag Nr.: 40.063.591 von wachholder am 29.08.10 17:53:37Hallo Wacholder;
monomethyl auristatin E (MMAE) ist eines der Toxine, die SGEN und auch Celldex einsetzen.
Die Linkertechnologie (weiss ich nur bei SGEN, habe mich nicht mit Celldex beschäftigt) ist eigenes IP von SGEN.
Der Linker ist extracellulär stabil und wird erst in der Zelle gespalten, sodass das Toxin in diesem Fall MMAE, die Zellteilung durch den Antikörper dirigiert stoppen und die Zelle in den Zelltod treiben soll.
SGENs Linker-Technologie soll theoretisch grosse Vorteile gegenüber den anderen Linkern aufweisen, dass muss sich aber erst in der Praxis zeigen.
http://en.wikipedia.org/wiki/Monomethyl_auristatin_E
daher ist CDX-011 auch kein Impfstoff sondern ein Antikörper Drug Conjugate (ADC) "CDX-011 consists of an antibody attached to a drug, monomethyl auristatin E (MMAE), that can kill cancer cells. The antibody delivers the drug to cancer cells by attaching to a protein called glycoprotein NMB (GPNMB) that is expressed on the cancer cell. The MMAE is then released inside of the cell, where it interferes with cell growth and may lead to cell death."
monomethyl auristatin E (MMAE) ist eines der Toxine, die SGEN und auch Celldex einsetzen.
Die Linkertechnologie (weiss ich nur bei SGEN, habe mich nicht mit Celldex beschäftigt) ist eigenes IP von SGEN.
Der Linker ist extracellulär stabil und wird erst in der Zelle gespalten, sodass das Toxin in diesem Fall MMAE, die Zellteilung durch den Antikörper dirigiert stoppen und die Zelle in den Zelltod treiben soll.
SGENs Linker-Technologie soll theoretisch grosse Vorteile gegenüber den anderen Linkern aufweisen, dass muss sich aber erst in der Praxis zeigen.
http://en.wikipedia.org/wiki/Monomethyl_auristatin_E
daher ist CDX-011 auch kein Impfstoff sondern ein Antikörper Drug Conjugate (ADC) "CDX-011 consists of an antibody attached to a drug, monomethyl auristatin E (MMAE), that can kill cancer cells. The antibody delivers the drug to cancer cells by attaching to a protein called glycoprotein NMB (GPNMB) that is expressed on the cancer cell. The MMAE is then released inside of the cell, where it interferes with cell growth and may lead to cell death."
Antwort auf Beitrag Nr.: 40.129.982 von Soederbaum am 10.09.10 04:57:31
SGENs Linker-Technologie soll theoretisch grosse Vorteile gegenüber den anderen Linkern aufweisen
Könntest Du das eventuell näher ausführen? Insbesondere im Vergleich zum IMGN? Es fällt jedenfalls auf, dass Genentech in der Vorklinik sehr viel mit SGEN macht, obschon eines der ersten und erfolgreichsten ADC-Projekte, nämlich T-DM1, auf IMGN-Technik beruht.
SGENs Linker-Technologie soll theoretisch grosse Vorteile gegenüber den anderen Linkern aufweisen
Könntest Du das eventuell näher ausführen? Insbesondere im Vergleich zum IMGN? Es fällt jedenfalls auf, dass Genentech in der Vorklinik sehr viel mit SGEN macht, obschon eines der ersten und erfolgreichsten ADC-Projekte, nämlich T-DM1, auf IMGN-Technik beruht.
Antwort auf Beitrag Nr.: 40.137.743 von SLGramann am 12.09.10 12:54:59Vor- und Nachteile der Linkertechnologien von Immunogen (T-DM1, Roche) und SeattleGenetics (CDX-011, Celldex) würden mich auch sehr interessieren.
Ende Oktober gibt es Konferenz, die sich ausscchließlich um ADC dreht.
Dort werden auch die aktuellen Updates zu T-DM1 und CDX-011 vorgestellt.
Vielleicht wissen wir danach mehr.
http://www.hansonwade.com/events/antibody-drug-conjugates/85…
Gruß
wachholder
Ende Oktober gibt es Konferenz, die sich ausscchließlich um ADC dreht.
Dort werden auch die aktuellen Updates zu T-DM1 und CDX-011 vorgestellt.
Vielleicht wissen wir danach mehr.
http://www.hansonwade.com/events/antibody-drug-conjugates/85…
Gruß
wachholder
Antwort auf Beitrag Nr.: 40.138.283 von wachholder am 12.09.10 18:49:01den Unterschied SGEN IMGN werde ich am Wochenende einmal ausarbeiten;
nur so vorab:
SGEN hat eine vielzahl von deals publiziert in denen die SGEN linker Technologie verpartnert wurde, die letzte vom 14.Sept 2010 mit Genmab.
damit hätten wir folgende Firmen, die sich auf die SGEN Technologie stuetzen
-Genmab
- Bayer
-Celldex Therapeutics
- Daiichi Sankyo
-Genentech
-GlaxoSmithKline
-MedImmune, a subsidiary of AstraZeneca
- Millennium (The Takeda Oncology Company)
-Progenics, as well as an ADC co-development agreement with Agensys, an affiliate of Astellas.
Genmab and Seattle Genetics Enter Into Antibody-Drug Conjugate Research Collaboration
Copenhagen, Denmark and Bothell, WA; September 14, 2010 – Genmab A/S (OMX: GEN) and Seattle Genetics, Inc. (Nasdaq: SGEN) announced today that the companies have entered into an antibody-drug conjugate (ADC) research collaboration agreement. Under the agreement, Genmab has rights to utilize Seattle Genetics’ ADC technology with its HuMax-TF antibody targeting the Tissue Factor antigen, which is expressed on numerous types of solid tumors. Seattle Genetics received an undisclosed upfront payment and has the right to exercise a co-development option for any resulting ADC products at the end of Phase I clinical development.
disclaimer
bin in SGEN und Imunnogen investiert; SGEN langzeit Potential, Immunogen, T-DM1 kann etwas werden auch wenn IMGN "nur ca. 5% royalties einfährt. ist aber nur meine persönliche Meinung und keine Kaufempfehlung, im Gegenteil VORSICHT bei Biotech sehr riskant) bei SGEN ist gerade Lintuzumab abgestürzt; das war schon fast erwartet worden, es handelt sich um einen reinen Antikörper KEIN ADC
(Ausserdem will ja nicht, dass die Dinger kurzfristig steigen, dann wird ja ein weiteres Investment meinerseits teurer... :-) )
nur so vorab:
SGEN hat eine vielzahl von deals publiziert in denen die SGEN linker Technologie verpartnert wurde, die letzte vom 14.Sept 2010 mit Genmab.
damit hätten wir folgende Firmen, die sich auf die SGEN Technologie stuetzen
-Genmab
- Bayer
-Celldex Therapeutics
- Daiichi Sankyo
-Genentech
-GlaxoSmithKline
-MedImmune, a subsidiary of AstraZeneca
- Millennium (The Takeda Oncology Company)
-Progenics, as well as an ADC co-development agreement with Agensys, an affiliate of Astellas.
Genmab and Seattle Genetics Enter Into Antibody-Drug Conjugate Research Collaboration
Copenhagen, Denmark and Bothell, WA; September 14, 2010 – Genmab A/S (OMX: GEN) and Seattle Genetics, Inc. (Nasdaq: SGEN) announced today that the companies have entered into an antibody-drug conjugate (ADC) research collaboration agreement. Under the agreement, Genmab has rights to utilize Seattle Genetics’ ADC technology with its HuMax-TF antibody targeting the Tissue Factor antigen, which is expressed on numerous types of solid tumors. Seattle Genetics received an undisclosed upfront payment and has the right to exercise a co-development option for any resulting ADC products at the end of Phase I clinical development.
disclaimer
bin in SGEN und Imunnogen investiert; SGEN langzeit Potential, Immunogen, T-DM1 kann etwas werden auch wenn IMGN "nur ca. 5% royalties einfährt. ist aber nur meine persönliche Meinung und keine Kaufempfehlung, im Gegenteil VORSICHT bei Biotech sehr riskant) bei SGEN ist gerade Lintuzumab abgestürzt; das war schon fast erwartet worden, es handelt sich um einen reinen Antikörper KEIN ADC
(Ausserdem will ja nicht, dass die Dinger kurzfristig steigen, dann wird ja ein weiteres Investment meinerseits teurer... :-) )
Antwort auf Beitrag Nr.: 40.152.144 von Soederbaum am 15.09.10 07:20:19
Super, das wird hier auf großes Interesse stoßen.
Der Hinweis zum Risiko ist berechtigt. Auf SGEN bezogen bedeutet das beispielsweise, dass es da innerhalb der nächsten 6 Wochen auch zu einem Desaster kommen könnte, falls die allgemein als positiv unterstellten Brentuximab-Daten doch enttäuschen sollten. Damit rechne ich zwar nicht, aber möglich ist so etwas immer. Ich würde dann mindestens von -50% ausgehen. Wer an die Technologie an sich glaubt, hat für solche Katastrophentage Cash beiseite gelegt und kauft nach. So wie kürzlich auch eine gute Kaufgelegenheit bei IMGN bestanden hat (und eigentlich immer noch besteht). Doch auch hier wird der Oktober aller Voraussicht nach eine dynamische Bewegung nach oben oder nach unten bringen (ESMO).
Super, das wird hier auf großes Interesse stoßen.
Der Hinweis zum Risiko ist berechtigt. Auf SGEN bezogen bedeutet das beispielsweise, dass es da innerhalb der nächsten 6 Wochen auch zu einem Desaster kommen könnte, falls die allgemein als positiv unterstellten Brentuximab-Daten doch enttäuschen sollten. Damit rechne ich zwar nicht, aber möglich ist so etwas immer. Ich würde dann mindestens von -50% ausgehen. Wer an die Technologie an sich glaubt, hat für solche Katastrophentage Cash beiseite gelegt und kauft nach. So wie kürzlich auch eine gute Kaufgelegenheit bei IMGN bestanden hat (und eigentlich immer noch besteht). Doch auch hier wird der Oktober aller Voraussicht nach eine dynamische Bewegung nach oben oder nach unten bringen (ESMO).
Antwort auf Beitrag Nr.: 40.152.719 von SLGramann am 15.09.10 09:38:54Stimme zu, Biotech ist immer sehr riskant, dafür ergeben sich aber auch die besten Renditemöglichkeiten.
SGN-35
Ich denke, die Chancen stehen hier 80:20, dass die Ergebnisse sehr gut sein werden.
Trotzdem dürfte das Potential der Aktie von SeattleGenetics nach oben begrenzt sein, da die Aktie meiner Meinung nach schon gut bewertet ist.
Die kürzlich abgeschlossenen Partnerschaften zeigen aber deutlich, dass viele namenhaften Unternehmen auf die Technologie von SeattleGenetics vertrauen.
Insgesamt dann langfristig weiteres Kurspotential.
Celldex
Habe den Rücksetzer letzte Woche genutzt, um nochmals nachzukaufen.
Die Aktie wurde im Vorfeld zur ASCO bis auf $9,50 hochgepusht und dann gnadenlos abverkauf. Nach dem Pfizerausstieg ging es nochmals deutlich runter bis auf knapp $3.
Aktueller Kurs $3,87.
Einen besseren Einstieg kann man wohl nicht erwischen.
Daher auch zahlreiche Insiderkäufe in den letzten Tagen.
Ich bleibe bei meiner Einschätzung, dass Pfizer bei CDX-110 nicht ausgestiegen ist, weil das Produkt schlecht ist, sondern weil CDX-110 nach der Akquisition von Wyeth einer notwendigen Konsolidierung zum Opfer gefallen ist.
Celldex wird die Phase 3 nun alleine durchführen oder zumindest für das internationale Geschäft einen Partner suchen und wie ich glaube auch finden.
Kurz zusammengefasst nochmals die Pipeline und Marktpotentiale (von mir geschätzt).
Produkt/Typ/Indikation/Phase/Marktpotential
CDX-110/Vaccine/Glioblastoma Multiforme, Brain Cancer/P2 finalized/200-300 Millionen
CDX-011/ADC/Advanced Breast Cancer/P2 started/400-500 Millionen
CDX-1307/Vaccine/Bladder Cancer/P2 started/500-700 Millionen
CDX-1401/Vaccine/Different Cancer/P1 finalized/??
In vorklinischen Phasen befinden sich noch weitere Produkte
CDX-1135
CDX-301
CDX-014
CDX-1127
Cash aktuell ca. 65 Mio. USD.
Eine Kapitalerhöhung wird zwar längerfristig notwendig sein, meiner Meinung nach wird diese aber erst in 2012 stattfinden, also genug Luft, um sich einen guten Zeitpunkt auszusuchen.
Ausstehende Aktien aktuell nur 30 Millionen.
Die Ergebnisse zu SGN-35 werden für Celldex sehr relevant sein, da Celldex bei CDX-011 die Linker-Technologie von Seattle einsetzt und das gleiche Toxin (MMAE) wie bei SGN-35 verwendet.
Gruß
wachholder
SGN-35
Ich denke, die Chancen stehen hier 80:20, dass die Ergebnisse sehr gut sein werden.
Trotzdem dürfte das Potential der Aktie von SeattleGenetics nach oben begrenzt sein, da die Aktie meiner Meinung nach schon gut bewertet ist.
Die kürzlich abgeschlossenen Partnerschaften zeigen aber deutlich, dass viele namenhaften Unternehmen auf die Technologie von SeattleGenetics vertrauen.
Insgesamt dann langfristig weiteres Kurspotential.
Celldex
Habe den Rücksetzer letzte Woche genutzt, um nochmals nachzukaufen.
Die Aktie wurde im Vorfeld zur ASCO bis auf $9,50 hochgepusht und dann gnadenlos abverkauf. Nach dem Pfizerausstieg ging es nochmals deutlich runter bis auf knapp $3.
Aktueller Kurs $3,87.
Einen besseren Einstieg kann man wohl nicht erwischen.
Daher auch zahlreiche Insiderkäufe in den letzten Tagen.
Ich bleibe bei meiner Einschätzung, dass Pfizer bei CDX-110 nicht ausgestiegen ist, weil das Produkt schlecht ist, sondern weil CDX-110 nach der Akquisition von Wyeth einer notwendigen Konsolidierung zum Opfer gefallen ist.
Celldex wird die Phase 3 nun alleine durchführen oder zumindest für das internationale Geschäft einen Partner suchen und wie ich glaube auch finden.
Kurz zusammengefasst nochmals die Pipeline und Marktpotentiale (von mir geschätzt).
Produkt/Typ/Indikation/Phase/Marktpotential
CDX-110/Vaccine/Glioblastoma Multiforme, Brain Cancer/P2 finalized/200-300 Millionen
CDX-011/ADC/Advanced Breast Cancer/P2 started/400-500 Millionen
CDX-1307/Vaccine/Bladder Cancer/P2 started/500-700 Millionen
CDX-1401/Vaccine/Different Cancer/P1 finalized/??
In vorklinischen Phasen befinden sich noch weitere Produkte
CDX-1135
CDX-301
CDX-014
CDX-1127
Cash aktuell ca. 65 Mio. USD.
Eine Kapitalerhöhung wird zwar längerfristig notwendig sein, meiner Meinung nach wird diese aber erst in 2012 stattfinden, also genug Luft, um sich einen guten Zeitpunkt auszusuchen.
Ausstehende Aktien aktuell nur 30 Millionen.
Die Ergebnisse zu SGN-35 werden für Celldex sehr relevant sein, da Celldex bei CDX-011 die Linker-Technologie von Seattle einsetzt und das gleiche Toxin (MMAE) wie bei SGN-35 verwendet.
Gruß
wachholder
Habe einen, wie ich meine, sehr interessanten Artikel über ADC's gefunden.
Die Autoren arbeiten bei SeattleGenetics.
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2726597/
wachholder
Die Autoren arbeiten bei SeattleGenetics.
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2726597/
wachholder
Angesichts
- der aussichtsreichen TAP-Technologie,
- der heterogenen Zusammensetzung des Aktionariats,
- des zusammengefalteten Kurs und
- der mit hoher Wahrscheinlichkeit zu erwartenden beträchtlichen Mittelzuflüsse aus der Roche-Kooperation (T-DM1)
ist Immunogen aus meiner Sicht ein Übernahmekandidat.
- der aussichtsreichen TAP-Technologie,
- der heterogenen Zusammensetzung des Aktionariats,
- des zusammengefalteten Kurs und
- der mit hoher Wahrscheinlichkeit zu erwartenden beträchtlichen Mittelzuflüsse aus der Roche-Kooperation (T-DM1)
ist Immunogen aus meiner Sicht ein Übernahmekandidat.
Wie verträgt sich das mit der Roche-Kooperation?
Antwort auf Beitrag Nr.: 40.170.095 von LeoF am 17.09.10 16:46:32Die Kooperation ist auf wenige Substanzen beschränkt. Insoweit gäbe es keine Probleme.
(Sobald ein durchschlagender Markterfolg des T-DM1 unmittelbar absehbar ist, wäre eine etwaige Übernahme ggf. auch für Roche interessant, da in diesem Fall jährliche Zahlungen in Höhe von ca. 100 Mio. USD bis 200 Mio. USD an Immunogen fällig würden. Es ist jedoch davon auszugehen, dass die IMGN-Aktie bis dahin auf einem anderen Kursniveau notieren wird.)
(Sobald ein durchschlagender Markterfolg des T-DM1 unmittelbar absehbar ist, wäre eine etwaige Übernahme ggf. auch für Roche interessant, da in diesem Fall jährliche Zahlungen in Höhe von ca. 100 Mio. USD bis 200 Mio. USD an Immunogen fällig würden. Es ist jedoch davon auszugehen, dass die IMGN-Aktie bis dahin auf einem anderen Kursniveau notieren wird.)
- Company Remains on Track for Achieving 12 Novel Anticancer Agents in Clinic by End of 2011 through ImmunoGen and Partner Programs -
WALTHAM, Mass., Sep 21, 2010 (BUSINESS WIRE) --
ImmunoGen, Inc. (Nasdaq: IMGN), a biotechnology company that develops targeted antibody-based anticancer products, today announced the start of clinical testing with SAR566658. Eight compounds are now in the clinic through ImmunoGen's product programs and those of its partners, consistent with Company expectations of as many as 12 such compounds being in the clinic by late 2011 and marked, sustained pipeline growth thereafter.
SAR566658 is a potential treatment for many ovarian, breast, cervical, lung and pancreatic cancers. It was developed under a research collaboration between the Company and sanofi-aventis. SAR566658 utilizes ImmunoGen's Targeted Antibody Payload (TAP) technology with the CA6-binding antibody, huDS6, created by East Carolina University and humanized with ImmunoGen's proprietary resurfacing technology. Sanofi-aventis has begun clinical evaluation of SAR566658, triggering a $1 million milestone payment to ImmunoGen.
"The development and advancement of this highly promising compound reflects the vision and successful collaboration of multiple parties," commented John Lambert, PhD, Executive Vice President and Chief Scientific Officer of ImmunoGen.
About the Research Collaboration between ImmunoGen and sanofi-aventis
In 2003, ImmunoGen and sanofi-aventis (then Aventis) entered into a five-year research collaboration to develop novel antibody-based anticancer drugs using ImmunoGen's antibody expertise. These included both therapeutic antibody compounds and TAP compounds, in which the antibody is conjugated to one of ImmunoGen's proprietary highly potent cancer-cell killing agents. Two TAP compounds, SAR3419 and SAR566658, and one therapeutic antibody compound, SAR650984, are now in clinical testing through this collaboration. For each compound developed in the collaboration, ImmunoGen is entitled to receive milestone payments plus royalties on the sales of any resulting product; ImmunoGen also has certain co-promotion rights. Sanofi-aventis is responsible for product development, clinical testing, manufacturing and marketing.
About ImmunoGen's Proprietary Technology
ImmunoGen has comprehensive capabilities to develop highly effective, well-tolerated antibody-based anticancer compounds. In addition to the Company's established antibody-development capabilities, ImmunoGen's proprietary resurfacing technology has been used to humanize numerous antibodies that have advanced into clinical testing.
The Company's TAP technology uses tumor-targeting antibodies to deliver one of ImmunoGen's highly potent cancer-cell killing agents (e.g., DM1, DM4) specifically to tumors. The Company's proprietary cancer-cell killing agents are many-fold more potent than standard chemotherapeutics and were developed by ImmunoGen scientists specifically for targeted delivery to tumors. ImmunoGen also has engineered linkage technology that keeps the cancer-cell killing agent attached to the antibody until it reaches the cancer cell and then controls the release of the agent inside the cell.
Seven TAP compounds are now in clinical testing: trastuzumab-DM1 (T-DM1), in global development by Roche; IMGN901 and IMGN388, in development by ImmunoGen; SAR3419 and SAR566658, in development by sanofi-aventis; and BIIB015 and BT-062, in development by Biogen Idec and Biotest, respectively. The Company expects 3 - 4 additional TAP compounds to enter clinical testing by the end of 2011. The therapeutic antibody compound, SAR650984, entered clinical testing earlier this year.
About ImmunoGen, Inc.
ImmunoGen, Inc. develops targeted anticancer therapeutics using its expertise in cancer biology, monoclonal antibodies and the creation and attachment of potent cell-killing agents. The Company's TAP technology uses antibodies to deliver one of ImmunoGen's proprietary cancer-cell killing agents specifically to tumor targets. In addition to the Company's product pipeline, compounds are in clinical testing through ImmunoGen's collaborations with Genentech (a member of the Roche Group), sanofi-aventis, Biogen Idec and Biotest. The most advanced TAP compound, T-DM1, is in Phase III testing. Other ImmunoGen collaborative partners include Bayer Schering HealthCare and Amgen. More information about ImmunoGen can be found at www.immunogen.com.
This press release includes forward-looking statements. For these statements, ImmunoGen claims the protection of the safe harbor for forward-looking statements provided by the Private Securities Litigation Reform Act of 1995. It should be noted that there are risks and uncertainties related to the advancement of new compounds into clinical evaluation, including uncertainties around preclinical study results, resource support, and regulatory review processes, as well as uncertainties around clinical trials conducted and their results.A review of these risks can be found in ImmunoGen's Annual Report on Form 10-K for the fiscal year ended June 30, 2010 and other reports filed with the Securities and Exchange Commission.
SOURCE: ImmunoGen, Inc.
For Investors:
ImmunoGen, Inc.
Carol Hausner, 781-895-0600
Executive Director, Investor Relations and Corporate Communications
info@immunogen.com
or
For Media:
The Yates Network
Adriana Jenkins, 617-744-1713
WALTHAM, Mass., Sep 21, 2010 (BUSINESS WIRE) --
ImmunoGen, Inc. (Nasdaq: IMGN), a biotechnology company that develops targeted antibody-based anticancer products, today announced the start of clinical testing with SAR566658. Eight compounds are now in the clinic through ImmunoGen's product programs and those of its partners, consistent with Company expectations of as many as 12 such compounds being in the clinic by late 2011 and marked, sustained pipeline growth thereafter.
SAR566658 is a potential treatment for many ovarian, breast, cervical, lung and pancreatic cancers. It was developed under a research collaboration between the Company and sanofi-aventis. SAR566658 utilizes ImmunoGen's Targeted Antibody Payload (TAP) technology with the CA6-binding antibody, huDS6, created by East Carolina University and humanized with ImmunoGen's proprietary resurfacing technology. Sanofi-aventis has begun clinical evaluation of SAR566658, triggering a $1 million milestone payment to ImmunoGen.
"The development and advancement of this highly promising compound reflects the vision and successful collaboration of multiple parties," commented John Lambert, PhD, Executive Vice President and Chief Scientific Officer of ImmunoGen.
About the Research Collaboration between ImmunoGen and sanofi-aventis
In 2003, ImmunoGen and sanofi-aventis (then Aventis) entered into a five-year research collaboration to develop novel antibody-based anticancer drugs using ImmunoGen's antibody expertise. These included both therapeutic antibody compounds and TAP compounds, in which the antibody is conjugated to one of ImmunoGen's proprietary highly potent cancer-cell killing agents. Two TAP compounds, SAR3419 and SAR566658, and one therapeutic antibody compound, SAR650984, are now in clinical testing through this collaboration. For each compound developed in the collaboration, ImmunoGen is entitled to receive milestone payments plus royalties on the sales of any resulting product; ImmunoGen also has certain co-promotion rights. Sanofi-aventis is responsible for product development, clinical testing, manufacturing and marketing.
About ImmunoGen's Proprietary Technology
ImmunoGen has comprehensive capabilities to develop highly effective, well-tolerated antibody-based anticancer compounds. In addition to the Company's established antibody-development capabilities, ImmunoGen's proprietary resurfacing technology has been used to humanize numerous antibodies that have advanced into clinical testing.
The Company's TAP technology uses tumor-targeting antibodies to deliver one of ImmunoGen's highly potent cancer-cell killing agents (e.g., DM1, DM4) specifically to tumors. The Company's proprietary cancer-cell killing agents are many-fold more potent than standard chemotherapeutics and were developed by ImmunoGen scientists specifically for targeted delivery to tumors. ImmunoGen also has engineered linkage technology that keeps the cancer-cell killing agent attached to the antibody until it reaches the cancer cell and then controls the release of the agent inside the cell.
Seven TAP compounds are now in clinical testing: trastuzumab-DM1 (T-DM1), in global development by Roche; IMGN901 and IMGN388, in development by ImmunoGen; SAR3419 and SAR566658, in development by sanofi-aventis; and BIIB015 and BT-062, in development by Biogen Idec and Biotest, respectively. The Company expects 3 - 4 additional TAP compounds to enter clinical testing by the end of 2011. The therapeutic antibody compound, SAR650984, entered clinical testing earlier this year.
About ImmunoGen, Inc.
ImmunoGen, Inc. develops targeted anticancer therapeutics using its expertise in cancer biology, monoclonal antibodies and the creation and attachment of potent cell-killing agents. The Company's TAP technology uses antibodies to deliver one of ImmunoGen's proprietary cancer-cell killing agents specifically to tumor targets. In addition to the Company's product pipeline, compounds are in clinical testing through ImmunoGen's collaborations with Genentech (a member of the Roche Group), sanofi-aventis, Biogen Idec and Biotest. The most advanced TAP compound, T-DM1, is in Phase III testing. Other ImmunoGen collaborative partners include Bayer Schering HealthCare and Amgen. More information about ImmunoGen can be found at www.immunogen.com.
This press release includes forward-looking statements. For these statements, ImmunoGen claims the protection of the safe harbor for forward-looking statements provided by the Private Securities Litigation Reform Act of 1995. It should be noted that there are risks and uncertainties related to the advancement of new compounds into clinical evaluation, including uncertainties around preclinical study results, resource support, and regulatory review processes, as well as uncertainties around clinical trials conducted and their results.A review of these risks can be found in ImmunoGen's Annual Report on Form 10-K for the fiscal year ended June 30, 2010 and other reports filed with the Securities and Exchange Commission.
SOURCE: ImmunoGen, Inc.
For Investors:
ImmunoGen, Inc.
Carol Hausner, 781-895-0600
Executive Director, Investor Relations and Corporate Communications
info@immunogen.com
or
For Media:
The Yates Network
Adriana Jenkins, 617-744-1713
Die Immunogen-Aktie befindet sich an einem wichtigen Punkt:

Sobald die 6 USD-Marke übersprungen wird, dürften die chartorientierten Anleger auf den Zug springen.
Für die Anhänger der "Fundamentalanalyse": Am 10./11.10. werden Roche/Immunogen wichtige Daten zu T-DM1 auf dem ESMO-Kongress präsentieren.
10.10.10 um 17 Uhr: T-DM1 bei Mamma-Ca, vorbehandelt mit Trastuzumab, Lapatinib und Chemotherapie
und ganz wichtig:
11.10.10 um 16 Uhr: T-DM1 als Erstlinientherapie versus Trastuzumab + Docetaxel.
Sollte T-DM1 besser abschneiden als die bisherige Standardtherapie (Trastuzumab + Docetacel), könnte das GAP (s. Chart) recht zügig geschlossen werden. Angesichts der üblichen Analystenschätzungen, in deren Rahmen die Wahrscheinlichkeit des T-DM1 als Erstlinientherapie nur mit geringen Wahrscheinlichkeiten eskomptiert wird, würde es mich nicht überraschen, wenn die Immunogen-Aktie im Fall positiver Studiendaten taggleich einen Satz um 20 % bis 30 % nach oben machen würde.
Mal sehen, ob/wie sich die Institutionen im Vorfeld des Kongresses positionieren werden.
Ich bleibe bullish und gehe davon aus, dass sich der im Anschluss an den - aus meiner Sicht völlig irrationalen - Kursverfall (Ende August) durchgeführte Positionsaufbau materiell voll auszahlen wird.
Sobald die 6 USD-Marke übersprungen wird, dürften die chartorientierten Anleger auf den Zug springen.
Für die Anhänger der "Fundamentalanalyse": Am 10./11.10. werden Roche/Immunogen wichtige Daten zu T-DM1 auf dem ESMO-Kongress präsentieren.
10.10.10 um 17 Uhr: T-DM1 bei Mamma-Ca, vorbehandelt mit Trastuzumab, Lapatinib und Chemotherapie
und ganz wichtig:
11.10.10 um 16 Uhr: T-DM1 als Erstlinientherapie versus Trastuzumab + Docetaxel.
Sollte T-DM1 besser abschneiden als die bisherige Standardtherapie (Trastuzumab + Docetacel), könnte das GAP (s. Chart) recht zügig geschlossen werden. Angesichts der üblichen Analystenschätzungen, in deren Rahmen die Wahrscheinlichkeit des T-DM1 als Erstlinientherapie nur mit geringen Wahrscheinlichkeiten eskomptiert wird, würde es mich nicht überraschen, wenn die Immunogen-Aktie im Fall positiver Studiendaten taggleich einen Satz um 20 % bis 30 % nach oben machen würde.
Mal sehen, ob/wie sich die Institutionen im Vorfeld des Kongresses positionieren werden.
Ich bleibe bullish und gehe davon aus, dass sich der im Anschluss an den - aus meiner Sicht völlig irrationalen - Kursverfall (Ende August) durchgeführte Positionsaufbau materiell voll auszahlen wird.
Antwort auf Beitrag Nr.: 40.228.246 von Joschka Schröder am 28.09.10 22:54:23Wie erwartet Kursausbruch nach Überwinden der 6 €-Marke (der Chart in #42 aktualisiert sich automatisch).
@Soederbaum
In #31 schriebst Du "SGENs Linker-Technologie soll theoretisch grosse Vorteile gegenüber den anderen Linkern aufweisen"
und in #34 kam die Ankündigung "den Unterschied SGEN IMGN werde ich am Wochenende einmal ausarbeiten".
Wie weit ist Dein Vergleich mittlerweile inzwischen gediehen?
Mir ist es bislang nicht gelungen, einen Vorteil der SGEN-Technologie gegenüber der TAP-Technologie Immunogens ausfindig zu machen. Insoweit bin ich auf Deinen Vergleich sehr gespannt.
@Soederbaum
In #31 schriebst Du "SGENs Linker-Technologie soll theoretisch grosse Vorteile gegenüber den anderen Linkern aufweisen"
und in #34 kam die Ankündigung "den Unterschied SGEN IMGN werde ich am Wochenende einmal ausarbeiten".
Wie weit ist Dein Vergleich mittlerweile inzwischen gediehen?
Mir ist es bislang nicht gelungen, einen Vorteil der SGEN-Technologie gegenüber der TAP-Technologie Immunogens ausfindig zu machen. Insoweit bin ich auf Deinen Vergleich sehr gespannt.
Noch zur TAP-Technologie:
Im Immunkonjugat T-DM1 (Roche/Immunogen) wird beispielsweise der Linker MCC verwendet, dessen Thioether-Brücke äußerst stabil ist (70fache molare Konzentrationsdifferenz zwischen T-DM1 und DM1) und erst intrazellulär lysosomal gespalten wird. Die Halbwertszeit des Immunkonjugats ähnelt dem natürlicher Immunglobuline. In Summe überzeugende Kennziffern.
Mir ist nicht bekannt, dass Linker anderer Biotech-Unternehmen (z.B. SGEN, Immunomedics) bessere Eigenschaften aufweisen würden. Und beim MCC handelt sich noch nicht einmal um einen besonders aktuellen Linker (in Biotest/Immunogens Immunkonjugat nBT062-SPDB-DM4 wird z.B. der Linker SPDB verwendet, der eine Disulfid-Brücke beinhaltet ... und in vivo zu einer noch größeren antitumorösen Aktivität des Konjugats führt).
Im Immunkonjugat T-DM1 (Roche/Immunogen) wird beispielsweise der Linker MCC verwendet, dessen Thioether-Brücke äußerst stabil ist (70fache molare Konzentrationsdifferenz zwischen T-DM1 und DM1) und erst intrazellulär lysosomal gespalten wird. Die Halbwertszeit des Immunkonjugats ähnelt dem natürlicher Immunglobuline. In Summe überzeugende Kennziffern.
Mir ist nicht bekannt, dass Linker anderer Biotech-Unternehmen (z.B. SGEN, Immunomedics) bessere Eigenschaften aufweisen würden. Und beim MCC handelt sich noch nicht einmal um einen besonders aktuellen Linker (in Biotest/Immunogens Immunkonjugat nBT062-SPDB-DM4 wird z.B. der Linker SPDB verwendet, der eine Disulfid-Brücke beinhaltet ... und in vivo zu einer noch größeren antitumorösen Aktivität des Konjugats führt).
Antwort auf Beitrag Nr.: 40.228.246 von Joschka Schröder am 28.09.10 22:54:23
Joschka, gerade hat Ohad Hammer sich ebenfalls und wiederholt hoffnungsvoll in Bezug auf die ESMO geäußert. Er weißt dabei auf ein interessantes Detail hin:
Immunogen’s T-DM1 gets presidential treatment
Immunogen (IMGN) is still trying to recuperate from the controversial rejection of T-DM1’s accelerated approval filing. The message Immunogen was trying to convey is that nothing has changed in terms of T-DM1’s long term potential. According to the company, the FDA’s problem was not with the drug’s stellar activity but the patient population enrolled on the trial. In just over a week from now, it could have the data to prove it.
Although the next potential filing is expected only in 2012 based on an ongoing phase III trial (EMILA study), T-DM1 will have two important data readouts at next month’s ESMO conference. The first is a phase II study where it is compared to chemotherapy+ Herceptin, the current standard of care for 1st line breast cancer patients. As I reviewed last month, expectations from this trial are high given Roche’s decision to start a pivotal trial based on a similar trial design.
Now investors have another reason for optimism: T-DM1’s 1st line data is included in the presidential symposium, to be held on October 11th. Organizers typically put the most interesting presentations in this kind of sessions, so it safe to assume the trial is not a total flop. Just to give a sense of the profile of this session, other presentations in the presidential symposium include Cougar’s phase III in prostate cancer and a phase III study of Avastin in ovarian cancer. Both studies have already been touted as successful. As a result, investors could expect T-DM1 to be safe and active as a 1st line treatment.
Another important readout is from the 3rd line phase II trial that served as the basis for the accelerated approval application which was declined by the FDA. Top line results were already presented last December, with an impressive response rate of 33%. At ESMO, the most important piece of data in the trial will be updated progression free survival (PFS) numbers. This will shed more light on T-DM1’s prospects in the ongoing 2nd line phase III trial. At the last update, median PFS was ~7.3 months but this figure excluded many patients who were deriving benefit from T-DM1 and still had not progressed at the time. Therefore, updated numbers could be better than 7.3 months.
In summary, the ESMO conference should prove once again that T-DM1 is highly active and that fundamentally, T-DM1’s prospects have not changed as a result of the recent rejection.
Another important readout for Immunogen will be updated results for IMGN901 in Merkel Cell (MCC), a niche indication but also a potential fast route to market. To date, results in MCC were intriguing but somewhat ambiguous (discussed here under ” Looking beyond T-DM1″). The market’s expectations for this agent are low, so any positive data will be a pleasant surprise.
http://www.hammerstockblog.com/immunogens-t-dm1-gets-preside…
Joschka, gerade hat Ohad Hammer sich ebenfalls und wiederholt hoffnungsvoll in Bezug auf die ESMO geäußert. Er weißt dabei auf ein interessantes Detail hin:
Immunogen’s T-DM1 gets presidential treatment
Immunogen (IMGN) is still trying to recuperate from the controversial rejection of T-DM1’s accelerated approval filing. The message Immunogen was trying to convey is that nothing has changed in terms of T-DM1’s long term potential. According to the company, the FDA’s problem was not with the drug’s stellar activity but the patient population enrolled on the trial. In just over a week from now, it could have the data to prove it.
Although the next potential filing is expected only in 2012 based on an ongoing phase III trial (EMILA study), T-DM1 will have two important data readouts at next month’s ESMO conference. The first is a phase II study where it is compared to chemotherapy+ Herceptin, the current standard of care for 1st line breast cancer patients. As I reviewed last month, expectations from this trial are high given Roche’s decision to start a pivotal trial based on a similar trial design.
Now investors have another reason for optimism: T-DM1’s 1st line data is included in the presidential symposium, to be held on October 11th. Organizers typically put the most interesting presentations in this kind of sessions, so it safe to assume the trial is not a total flop. Just to give a sense of the profile of this session, other presentations in the presidential symposium include Cougar’s phase III in prostate cancer and a phase III study of Avastin in ovarian cancer. Both studies have already been touted as successful. As a result, investors could expect T-DM1 to be safe and active as a 1st line treatment.
Another important readout is from the 3rd line phase II trial that served as the basis for the accelerated approval application which was declined by the FDA. Top line results were already presented last December, with an impressive response rate of 33%. At ESMO, the most important piece of data in the trial will be updated progression free survival (PFS) numbers. This will shed more light on T-DM1’s prospects in the ongoing 2nd line phase III trial. At the last update, median PFS was ~7.3 months but this figure excluded many patients who were deriving benefit from T-DM1 and still had not progressed at the time. Therefore, updated numbers could be better than 7.3 months.
In summary, the ESMO conference should prove once again that T-DM1 is highly active and that fundamentally, T-DM1’s prospects have not changed as a result of the recent rejection.
Another important readout for Immunogen will be updated results for IMGN901 in Merkel Cell (MCC), a niche indication but also a potential fast route to market. To date, results in MCC were intriguing but somewhat ambiguous (discussed here under ” Looking beyond T-DM1″). The market’s expectations for this agent are low, so any positive data will be a pleasant surprise.
http://www.hammerstockblog.com/immunogens-t-dm1-gets-preside…
Antwort auf Beitrag Nr.: 40.244.833 von Joschka Schröder am 30.09.10 23:04:16Linker Technologie bei Konjugatwirksoffen; Antikörper-, Polymer-, Cyclodextrin-, Vitamin-Konjugate.
Zusammenfassung;
IMG: Stabile Linker, die in der Zelle durch "Verdauung" des ADC das Toxin freisetzen
SGEN: Spaltbare Linker, die in der Zelle durch spezifische Enzymspaltung den Linker spalten.
Die Prinzipien für die Konjugation von Wirkstoffe mit allen „Targeting Agents“ sind vergleichbar, im Folgenden soll auf Antikörper-Drug-Konjuagte eingegangen werden.
Reine Antikörpern, die Oberflächenantigene von Tumorzellen adressieren sind für sich alleine in der Regel nicht sehr effektiv, daher sind Kombinationstherapien derzeit die Regel.
Die AntikörperDrugConjugate (ADC) sind ein relativ neues Therapiekonzept, welches die hohe Spezifität von Antikörpern und die hohe, meist cytotoxische oder cytostatische Aktivität (Toxine- oft Inhibitoren des Tubulin) von Wirkstoffen kombinieren sollen.
Cytotoxische Therapiekonzepte in der Onkologie haben den Nachteil oft schwerer systemischer Nebenwirkungen. Durch eine Bindung an z.B. einen Antikörper der für Oberflächen Antigene von Krebszell spezifisch ist, soll die Wirkung zielgerichtet gegen sich teilende, maligne Zellen erfolgen. Daher ist die Konzeption eines ADC darauf angelegt, dass Toxine möglichst nur Krebszellen erreichen und in den Zelltod treiben sollen. Die für die therapeutische Breite eines ADCs wichtigen Parameter, Antikörper, Linker und Toxin werden variiert, um die Indikations-spezifität zu erreichen.
Eine weitere der Herausforderung bei der Entwicklung von ADCs ist die sogenannte „Beladung“ des Antikörpers mit einer definierten Anzahl von Toxinen (hier spielt die Linker Technologie eine grosse Rolle). Problem hierbei ist eine gaußsche Verteilung (z.B. mittlere Beladung 3 Toxine) es gibt aber auch Vaianten 1,2,4 etc... eine grosse Herausforderung für die Produktentwicklung (2), das war eines der Probleme des Paclitaxel-Polymer-Konjugates von CTI).
Die feste Verbindung eines Antikörpers z.B. mit einem Toxin wird über einen sogenannten Linker ermöglicht. Ein Linker ist bildlich gesprochen eine Kette über die Antikörper und Wirkstoff verbunden sind. Der Linker muss mit dem einen Ende spezifisch am Antikörper anbeißen und am anderen Ende im nächsten Schritt das Toxin binden. Wären die Linker nicht „bispezifisch“ würden z.B. im ersten Schritt nur zwei Antikörper verbunden werden...
hier eine Aufstellung der derzeit klinischen Entwicklung befindlichen ADCs:
-Calicheamicin basiert (Pfizer, vormals Wyeth)
Gemtuzumab Ozogamicin, Mylotarg (anti-CD33) vom Markt genommen.
CMC-544 (anti-CD22)
-Maytansinoid basiert (ImmunoGen)
T-DM1 (anti HER 2, Genentech/Roche)
IMGN901 (anti-CD56)
IMGN388 (anti-integrin)
SAR3419 (anti-CD19, sanofi-aventis)
BIIB015 (anti-Cripto, Biogen Idec)
BT-062 (anti-CD138, Biotest)
•Auristatin based (Seattle Genetics)
SGN-35 (anti-CD30)
CR-011 (anti-GPNMB,Curagen)
PSMA ADC(anti-PSMA, Progenics)
MED 1547 (anti-EphA2, Astra Zenica/Medimmune)
MN-IC (anti-MN, Bayer)
SGN-75 (anti-CD70)
•Undisclosed cytotoxische Wirkstoffe (BMS/Medarex)
MDX1203 (anti-CD70)
•Weitere cytotoxische Agentien in der praeklinischen Entwicklung basierend auf:
Doxorubicin
Duocarmycin
Paclitaxel
Epohilones (Ixabepilone)
Tubulisines
wird erweitert..
Es gibt grob vereinfacht zwei Klassen von Linkern;
1. „Stabile Linker“ die lokal, meist intrazellulär metabolisiert werden.
Der metabilisch, d.H. im Blutkreislauf realtiv stabile Linker erlaubt ein „Targeting“ der Krebszelle durch das Andocken des Antikörpers an das für Krebszellen spezifische Oberflächenantigen. Nach Internalisierung des ADCs (hier bilden sich kleine Membran-Bläschen- Lysosomen-, die das ADC einschliessen und in die Zelle einschleusen) in der Zelle wird das ADC „verdaut“ = abgebaut und lokal das Toxin freigesetzt.
Die Wirkungsweise einer Reihe von IMG Linkern ist im AACR 2010 Poster Abstracts 4398 beschrieben. „Oxidatively stressed Ab-SMCC-DM1 conjugates can maintain their specific potency antigen-positive cells.“ (1)
Es wurde zudem gezeigt, dass ein nicht-reduzierbarer Linker zur verbesserten Effizenz und verminderter Toxizität des ADC im Vergleich zu ADCs mit reduzierbaren Linkern führt. (3) IMNG nennt es Targeted Antibody Payload= TAP-Technologie.
1.1 maleimide-derived thioether link (N-succinimidyl-4-(N-maleimidomethyl)- cyclohexane-1-carboxylate); next Generation DM1 Linker zusammen mit Genentec publiziert(3b.)
1.2.haloacetamide-derived thioether link
1.3 Ab-(CH2)3-Maytansinoid
1.4.Ab-mcc- Maytansinoid
TMAb-mcc-DM1 ist der Klinische Kandidat(3b.) im Vergleich zu 1.1. ein Schwefelatom weniger. Die hohe Spezifizität kombiniert mit hoher Aktivität zeigt sich in den bisherigen Brust Krebs Studien mit einer objektiven Response Rate von 44% bei einer Dosis von 3.6mg/kg.
2. Spaltbare Linker; die Linker haben eine „Sollbruchstelle“, die am Zielort einer Krebszelle gespalten werden und lokal den Wirkstoff/das Toxin freisetzen.
Unter diese Kategorie fallen u.a. die Seattle Genetics Linker.
Das Prinzip der spaltbaren Linkern beruht auf der Tatsache, dass die ADCs genau wie für 1. am Zielort am Oberflächen Antigen andocken, und dann in die Zelle aufgenommen werden; In den Lysosomen, die das ADC einschliessen ist der pH niedriger wie im gepufferten Blutserum zudem sind lytische, d.h. Protein-zersetzende Enzyme sind vorhanden und leiten die Spaltung bevorzugt am Linker ein. Als Konsequenz bricht die Bindung des ADC und setzt das Toxin frei.
2.1
Säurelabile Hydrazon Linker; die Spaltung verläuft pH abhängig und basiert auf der Theorie, dass der pH intracellulär höher ist und selektiv den Wirkstoff freisetzt.
2.2.
Disulfid Linker,
Eine Schwefel-Schwefel-Bindung im Linker wird innerhalb der Zelle oxidiert und das Toxin freigesetzt.
2.3
Peptid-Linker(4)Seattle Genetics Linke; der Bi-spezifische Linker besteht überwiegend aus Peptiden = Eiweiss-Bausteinen, die von verdauenden Enzymen erkannt und gespalten werden. SGEN bereichtet eine bis zu Faktor 10 höhere Stabilität im Serum gegenüber konventionellen Linkern (4)
Fortsetzung folgt; PATENTE
Bei aller Theorie, ADCs sind derzeit noch nicht der Rosettastein der Onkologie und das bisher einzige ADC am Markt, MylotargTM (Gemtuzumab Ozogamicin, anti-CD33) ist von Wyeth-Pfizer zurückgenommen worden.
T-DM1 und SGEN-35 haben in FRÜHEN Phasen erfolgversprechende Daten gezeigt, aber wie die Geschichte des Drug Developments gezeigt hat, kann es bei guten Ergebnissen schnell im Kurs raufgehen, aber auch genauso schnell wieder runter. Die weitere Entwicklung weiterer Workstoffe in allen Bereichen, Targeting Agent, Linker und Toxin ist meiner persönlichen Meinung nach erst am Anfang, (fast) alle Pharmaunternehmen sind in diesem Bereich unterwegs und wir werden sicher noch eine Reihe von M&As, Co-Development und Licensing Deals sehen. Es bleibt spannend, und ich frage mich, wann die Antikörper von Morphosys in dieses Therapiekonzept eingebunden werden.
DISCLAIMER; bin in SGEN (Technologieplattform, Anzahl der Co-Development Deals) und IMG (da ich denke, dass die Aktie zu weit heruntergepruegelt wurde)
investiert.
(1) www.immunogen.com/.../AACR%204-10%20poster%20of%20abst%204404.pdf
(2) Mark X. Sliwkowski et al., Engineered Thio-Trastuzumab-DM1 Conjugate with an Improved Therapeutic Index to Target Human Epidermal Growth Factor Receptor 2–Positive Breast CancerClin Cancer Res; 16(19); 4769–78. 2010 AACR.
(3)a. http://www.cancer.gov/drugdictionary/?CdrID=564399, b. Phillips GDL, Li GM, Dugger DL, et al. Targeting HER2-Positive Breast Cancer with Trastuzumab-DM1, an Antibody-Cytotoxic Drug Conjugate. Cancer Res 2008;68:9280–90.
(4) http://www.seagen.com/technology_adc_tech.shtml
Zusammenfassung;
IMG: Stabile Linker, die in der Zelle durch "Verdauung" des ADC das Toxin freisetzen
SGEN: Spaltbare Linker, die in der Zelle durch spezifische Enzymspaltung den Linker spalten.
Die Prinzipien für die Konjugation von Wirkstoffe mit allen „Targeting Agents“ sind vergleichbar, im Folgenden soll auf Antikörper-Drug-Konjuagte eingegangen werden.
Reine Antikörpern, die Oberflächenantigene von Tumorzellen adressieren sind für sich alleine in der Regel nicht sehr effektiv, daher sind Kombinationstherapien derzeit die Regel.
Die AntikörperDrugConjugate (ADC) sind ein relativ neues Therapiekonzept, welches die hohe Spezifität von Antikörpern und die hohe, meist cytotoxische oder cytostatische Aktivität (Toxine- oft Inhibitoren des Tubulin) von Wirkstoffen kombinieren sollen.
Cytotoxische Therapiekonzepte in der Onkologie haben den Nachteil oft schwerer systemischer Nebenwirkungen. Durch eine Bindung an z.B. einen Antikörper der für Oberflächen Antigene von Krebszell spezifisch ist, soll die Wirkung zielgerichtet gegen sich teilende, maligne Zellen erfolgen. Daher ist die Konzeption eines ADC darauf angelegt, dass Toxine möglichst nur Krebszellen erreichen und in den Zelltod treiben sollen. Die für die therapeutische Breite eines ADCs wichtigen Parameter, Antikörper, Linker und Toxin werden variiert, um die Indikations-spezifität zu erreichen.
Eine weitere der Herausforderung bei der Entwicklung von ADCs ist die sogenannte „Beladung“ des Antikörpers mit einer definierten Anzahl von Toxinen (hier spielt die Linker Technologie eine grosse Rolle). Problem hierbei ist eine gaußsche Verteilung (z.B. mittlere Beladung 3 Toxine) es gibt aber auch Vaianten 1,2,4 etc... eine grosse Herausforderung für die Produktentwicklung (2), das war eines der Probleme des Paclitaxel-Polymer-Konjugates von CTI).
Die feste Verbindung eines Antikörpers z.B. mit einem Toxin wird über einen sogenannten Linker ermöglicht. Ein Linker ist bildlich gesprochen eine Kette über die Antikörper und Wirkstoff verbunden sind. Der Linker muss mit dem einen Ende spezifisch am Antikörper anbeißen und am anderen Ende im nächsten Schritt das Toxin binden. Wären die Linker nicht „bispezifisch“ würden z.B. im ersten Schritt nur zwei Antikörper verbunden werden...
hier eine Aufstellung der derzeit klinischen Entwicklung befindlichen ADCs:
-Calicheamicin basiert (Pfizer, vormals Wyeth)
Gemtuzumab Ozogamicin, Mylotarg (anti-CD33) vom Markt genommen.
CMC-544 (anti-CD22)
-Maytansinoid basiert (ImmunoGen)
T-DM1 (anti HER 2, Genentech/Roche)
IMGN901 (anti-CD56)
IMGN388 (anti-integrin)
SAR3419 (anti-CD19, sanofi-aventis)
BIIB015 (anti-Cripto, Biogen Idec)
BT-062 (anti-CD138, Biotest)
•Auristatin based (Seattle Genetics)
SGN-35 (anti-CD30)
CR-011 (anti-GPNMB,Curagen)
PSMA ADC(anti-PSMA, Progenics)
MED 1547 (anti-EphA2, Astra Zenica/Medimmune)
MN-IC (anti-MN, Bayer)
SGN-75 (anti-CD70)
•Undisclosed cytotoxische Wirkstoffe (BMS/Medarex)
MDX1203 (anti-CD70)
•Weitere cytotoxische Agentien in der praeklinischen Entwicklung basierend auf:
Doxorubicin
Duocarmycin
Paclitaxel
Epohilones (Ixabepilone)
Tubulisines
wird erweitert..
Es gibt grob vereinfacht zwei Klassen von Linkern;
1. „Stabile Linker“ die lokal, meist intrazellulär metabolisiert werden.
Der metabilisch, d.H. im Blutkreislauf realtiv stabile Linker erlaubt ein „Targeting“ der Krebszelle durch das Andocken des Antikörpers an das für Krebszellen spezifische Oberflächenantigen. Nach Internalisierung des ADCs (hier bilden sich kleine Membran-Bläschen- Lysosomen-, die das ADC einschliessen und in die Zelle einschleusen) in der Zelle wird das ADC „verdaut“ = abgebaut und lokal das Toxin freigesetzt.
Die Wirkungsweise einer Reihe von IMG Linkern ist im AACR 2010 Poster Abstracts 4398 beschrieben. „Oxidatively stressed Ab-SMCC-DM1 conjugates can maintain their specific potency antigen-positive cells.“ (1)
Es wurde zudem gezeigt, dass ein nicht-reduzierbarer Linker zur verbesserten Effizenz und verminderter Toxizität des ADC im Vergleich zu ADCs mit reduzierbaren Linkern führt. (3) IMNG nennt es Targeted Antibody Payload= TAP-Technologie.
1.1 maleimide-derived thioether link (N-succinimidyl-4-(N-maleimidomethyl)- cyclohexane-1-carboxylate); next Generation DM1 Linker zusammen mit Genentec publiziert(3b.)
1.2.haloacetamide-derived thioether link
1.3 Ab-(CH2)3-Maytansinoid
1.4.Ab-mcc- Maytansinoid
TMAb-mcc-DM1 ist der Klinische Kandidat(3b.) im Vergleich zu 1.1. ein Schwefelatom weniger. Die hohe Spezifizität kombiniert mit hoher Aktivität zeigt sich in den bisherigen Brust Krebs Studien mit einer objektiven Response Rate von 44% bei einer Dosis von 3.6mg/kg.
2. Spaltbare Linker; die Linker haben eine „Sollbruchstelle“, die am Zielort einer Krebszelle gespalten werden und lokal den Wirkstoff/das Toxin freisetzen.
Unter diese Kategorie fallen u.a. die Seattle Genetics Linker.
Das Prinzip der spaltbaren Linkern beruht auf der Tatsache, dass die ADCs genau wie für 1. am Zielort am Oberflächen Antigen andocken, und dann in die Zelle aufgenommen werden; In den Lysosomen, die das ADC einschliessen ist der pH niedriger wie im gepufferten Blutserum zudem sind lytische, d.h. Protein-zersetzende Enzyme sind vorhanden und leiten die Spaltung bevorzugt am Linker ein. Als Konsequenz bricht die Bindung des ADC und setzt das Toxin frei.
2.1
Säurelabile Hydrazon Linker; die Spaltung verläuft pH abhängig und basiert auf der Theorie, dass der pH intracellulär höher ist und selektiv den Wirkstoff freisetzt.
2.2.
Disulfid Linker,
Eine Schwefel-Schwefel-Bindung im Linker wird innerhalb der Zelle oxidiert und das Toxin freigesetzt.
2.3
Peptid-Linker(4)Seattle Genetics Linke; der Bi-spezifische Linker besteht überwiegend aus Peptiden = Eiweiss-Bausteinen, die von verdauenden Enzymen erkannt und gespalten werden. SGEN bereichtet eine bis zu Faktor 10 höhere Stabilität im Serum gegenüber konventionellen Linkern (4)
Fortsetzung folgt; PATENTE
Bei aller Theorie, ADCs sind derzeit noch nicht der Rosettastein der Onkologie und das bisher einzige ADC am Markt, MylotargTM (Gemtuzumab Ozogamicin, anti-CD33) ist von Wyeth-Pfizer zurückgenommen worden.
T-DM1 und SGEN-35 haben in FRÜHEN Phasen erfolgversprechende Daten gezeigt, aber wie die Geschichte des Drug Developments gezeigt hat, kann es bei guten Ergebnissen schnell im Kurs raufgehen, aber auch genauso schnell wieder runter. Die weitere Entwicklung weiterer Workstoffe in allen Bereichen, Targeting Agent, Linker und Toxin ist meiner persönlichen Meinung nach erst am Anfang, (fast) alle Pharmaunternehmen sind in diesem Bereich unterwegs und wir werden sicher noch eine Reihe von M&As, Co-Development und Licensing Deals sehen. Es bleibt spannend, und ich frage mich, wann die Antikörper von Morphosys in dieses Therapiekonzept eingebunden werden.
DISCLAIMER; bin in SGEN (Technologieplattform, Anzahl der Co-Development Deals) und IMG (da ich denke, dass die Aktie zu weit heruntergepruegelt wurde)
investiert.
(1) www.immunogen.com/.../AACR%204-10%20poster%20of%20abst%204404.pdf
(2) Mark X. Sliwkowski et al., Engineered Thio-Trastuzumab-DM1 Conjugate with an Improved Therapeutic Index to Target Human Epidermal Growth Factor Receptor 2–Positive Breast CancerClin Cancer Res; 16(19); 4769–78. 2010 AACR.
(3)a. http://www.cancer.gov/drugdictionary/?CdrID=564399, b. Phillips GDL, Li GM, Dugger DL, et al. Targeting HER2-Positive Breast Cancer with Trastuzumab-DM1, an Antibody-Cytotoxic Drug Conjugate. Cancer Res 2008;68:9280–90.
(4) http://www.seagen.com/technology_adc_tech.shtml
Antwort auf Beitrag Nr.: 40.244.972 von Joschka Schröder am 30.09.10 23:38:58Hi Joschka,
T-DM1 ist nicht der Thioether sondern TMAb-mcc-DM1 (1), sehr frühe Daten von ThioTMAb-mcc-DM1 wurde gerade (1.10.2010) von der Genentec Crew mit einem auf die DM1 Dosis verbesserten therapeutischen Index publiziert: "An improved safety profile of >2-fold was observed in a short-term target-independent .... safety study... safety studies, thioTMAb-mpeo-DM1 was tolerated at higher antibody doses (up to 48 mg/kg or 6,000 μg DM1/m2) compared with the conventional ADC that had dose-limiting toxicity at 30 mg/kg (6,000 μg DM1/m2)". (2).
Dieses Paper wird auch darauf eingegangen, dass bei der Synthese von mcc versus T-mcc im Durchschnitt 3,3 DM1 pro Antikörper gebildet werden; die Analytik zeigt bei der Synthese (Achtung das finale Produkt schaut anders = aufgereiningt aus!!) ein Toxin pro Antikörper bis zu sieben Toxine pro Antikörper gebildet werden. Beim Thia-mcc sind es im Durchschnitt 1.8 mit einer Verteilung von 0 und 2 Toxinen pro Antikörper.
(1) Phillips GDL, Li GM, Dugger DL, et al. Targeting HER2-Positive Breast Cancer with Trastuzumab-DM1, an Antibody-Cytotoxic Drug Conjugate. Cancer Res 2008;68:9280–90.
(2) Mark X. Sliwkowski et al., Engineered Thio-Trastuzumab-DM1 Conjugate with an Improved Therapeutic Index to Target Human Epidermal Growth Factor Receptor 2–Positive Breast CancerClin Cancer Res; 16(19); 4769–78. 2010 AACR.
T-DM1 ist nicht der Thioether sondern TMAb-mcc-DM1 (1), sehr frühe Daten von ThioTMAb-mcc-DM1 wurde gerade (1.10.2010) von der Genentec Crew mit einem auf die DM1 Dosis verbesserten therapeutischen Index publiziert: "An improved safety profile of >2-fold was observed in a short-term target-independent .... safety study... safety studies, thioTMAb-mpeo-DM1 was tolerated at higher antibody doses (up to 48 mg/kg or 6,000 μg DM1/m2) compared with the conventional ADC that had dose-limiting toxicity at 30 mg/kg (6,000 μg DM1/m2)". (2).
Dieses Paper wird auch darauf eingegangen, dass bei der Synthese von mcc versus T-mcc im Durchschnitt 3,3 DM1 pro Antikörper gebildet werden; die Analytik zeigt bei der Synthese (Achtung das finale Produkt schaut anders = aufgereiningt aus!!) ein Toxin pro Antikörper bis zu sieben Toxine pro Antikörper gebildet werden. Beim Thia-mcc sind es im Durchschnitt 1.8 mit einer Verteilung von 0 und 2 Toxinen pro Antikörper.
(1) Phillips GDL, Li GM, Dugger DL, et al. Targeting HER2-Positive Breast Cancer with Trastuzumab-DM1, an Antibody-Cytotoxic Drug Conjugate. Cancer Res 2008;68:9280–90.
(2) Mark X. Sliwkowski et al., Engineered Thio-Trastuzumab-DM1 Conjugate with an Improved Therapeutic Index to Target Human Epidermal Growth Factor Receptor 2–Positive Breast CancerClin Cancer Res; 16(19); 4769–78. 2010 AACR.
Antwort auf Beitrag Nr.: 40.264.147 von Soederbaum am 05.10.10 10:13:27Hallo Soederbaum,
zunächst besten Dank für Deinen Beitrag, dessen Inhalt ich jedoch in Teilen nicht recht nachvollziehen kann.
"T-DM1 ist nicht der Thioether sondern TMAb-mcc-DM1 "
T-DM1 ist die gängige und offizielle Bezeichnung des von uns besprochenen Immunkonjugats, welches den Thioether-Linker [N-malemidomethyl]cyvlohexane-1-carboxylate (MCC) beeinhaltet.
Lange Rede, kurzer Sinn: "TMAb-MCC-DM1" ist nichts anderes als eine andere Bezeichnung für das in der klinischen Testung befindliche T-DM1!!!
(Ausführliche Details zum Thema finden sich in "Phase I Study of Trastuzumab-DM1, a HER2 Antibody-Drug Conjugate, Given every 3 Weeks to Patients With HER2-Positive Metastatic Breast Cancer", erschienen am 26.4.2010 im JOURNAL OF CLINICAL ONCOLOGY.)
"Dieses Paper wird auch darauf eingegangen, dass bei der Synthese von mcc versus T-mcc im Durchschnitt 3,3 DM1 pro Antikörper gebildet werden; die Analytik zeigt bei der Synthese (Achtung das finale Produkt schaut anders = aufgereiningt aus!!) ein Toxin pro Antikörper bis zu sieben Toxine pro Antikörper gebildet werden. Beim Thia-mcc sind es im Durchschnitt 1.8 mit einer Verteilung von 0 und 2 Toxinen pro Antikörper. "
Man muss es nicht komplizierter machen als es ist: Im fertigen Produkt T-DM1 sind mit der Fc-Region des Trastuzumab über den Linker im Mittel 3,5 DM1-Moleküle verbunden.
Fazit: Beitrag #47 trägt aus meiner Sicht eher zur Verwirrung bei.
Der tatsächliche Sachverhalt läßt sich ganz kurz zusammenfassen: In der klinischen Testung befindet sich eine genau definierte T-DM1-Variante, die den Thioether-Linker MCC beeinhaltet, über den mit jeder Fc-Region des T(rastuzumabs) 3,5 DM1-Moleküle verbunden sind.
zunächst besten Dank für Deinen Beitrag, dessen Inhalt ich jedoch in Teilen nicht recht nachvollziehen kann.
"T-DM1 ist nicht der Thioether sondern TMAb-mcc-DM1 "
T-DM1 ist die gängige und offizielle Bezeichnung des von uns besprochenen Immunkonjugats, welches den Thioether-Linker [N-malemidomethyl]cyvlohexane-1-carboxylate (MCC) beeinhaltet.
Lange Rede, kurzer Sinn: "TMAb-MCC-DM1" ist nichts anderes als eine andere Bezeichnung für das in der klinischen Testung befindliche T-DM1!!!
(Ausführliche Details zum Thema finden sich in "Phase I Study of Trastuzumab-DM1, a HER2 Antibody-Drug Conjugate, Given every 3 Weeks to Patients With HER2-Positive Metastatic Breast Cancer", erschienen am 26.4.2010 im JOURNAL OF CLINICAL ONCOLOGY.)
"Dieses Paper wird auch darauf eingegangen, dass bei der Synthese von mcc versus T-mcc im Durchschnitt 3,3 DM1 pro Antikörper gebildet werden; die Analytik zeigt bei der Synthese (Achtung das finale Produkt schaut anders = aufgereiningt aus!!) ein Toxin pro Antikörper bis zu sieben Toxine pro Antikörper gebildet werden. Beim Thia-mcc sind es im Durchschnitt 1.8 mit einer Verteilung von 0 und 2 Toxinen pro Antikörper. "
Man muss es nicht komplizierter machen als es ist: Im fertigen Produkt T-DM1 sind mit der Fc-Region des Trastuzumab über den Linker im Mittel 3,5 DM1-Moleküle verbunden.
Fazit: Beitrag #47 trägt aus meiner Sicht eher zur Verwirrung bei.
Der tatsächliche Sachverhalt läßt sich ganz kurz zusammenfassen: In der klinischen Testung befindet sich eine genau definierte T-DM1-Variante, die den Thioether-Linker MCC beeinhaltet, über den mit jeder Fc-Region des T(rastuzumabs) 3,5 DM1-Moleküle verbunden sind.
Antwort auf Beitrag Nr.: 40.263.323 von Soederbaum am 05.10.10 07:45:30Kurz noch einige Anmerkungen zu #46:
"Zusammenfassung;
IMG: Stabile Linker, die in der Zelle durch "Verdauung" des ADC das Toxin freisetzen
SGEN: Spaltbare Linker, die in der Zelle durch spezifische Enzymspaltung den Linker spalten."
Das, was Du als "Verdauung" bezeichnest, ist doch nichts anderes als eine lysosomale Spaltung durch hydrolytische Enzyme!!!
Auf Deine Übersicht verschiedener Linker möchte ich an dieser Stelle nicht näher eingehen, weil dies zu weit führen würde. Nur so viel: Die von Dir gewählte Klassifikation (z.B. Unterscheidung zwischen "stabile" Linker und Linker mit "Sollbruchstelle") ist für mich in weiten Teilen leider nicht nachvollziehbar.
Aber da es uns ja im Kern um den Vergleich zwischen Immunkonjugaten der Firmen IMGN und SEGN geht (SGEN hat übrigens außer Peptid-Linkern auch Linker im Programm, die auf Saccharidbasis (u.a. Fuctose) u.a. konzipiert sind, während IMGN ebenfalls eine ganze Palette unterschiedlicher Linker wie z.B. Thioether und Disulfide verwendet): Zu belegen war die Aussage "SGENs Linker-Technologie soll theoretisch grosse Vorteile gegenüber den anderen Linkern aufweisen".
Zur Untermauerung dieser These konnten Deine Postings aus meiner Sicht leider noch nichts beitragen. Ich würde mich auf eine Fortsetzung der Diskussion aber sehr freuen, wobei wir uns besser auf die wesentlichen Dinge beschränken und nicht unnötig verzetteln sollten.
"Zusammenfassung;
IMG: Stabile Linker, die in der Zelle durch "Verdauung" des ADC das Toxin freisetzen
SGEN: Spaltbare Linker, die in der Zelle durch spezifische Enzymspaltung den Linker spalten."
Das, was Du als "Verdauung" bezeichnest, ist doch nichts anderes als eine lysosomale Spaltung durch hydrolytische Enzyme!!!
Auf Deine Übersicht verschiedener Linker möchte ich an dieser Stelle nicht näher eingehen, weil dies zu weit führen würde. Nur so viel: Die von Dir gewählte Klassifikation (z.B. Unterscheidung zwischen "stabile" Linker und Linker mit "Sollbruchstelle") ist für mich in weiten Teilen leider nicht nachvollziehbar.
Aber da es uns ja im Kern um den Vergleich zwischen Immunkonjugaten der Firmen IMGN und SEGN geht (SGEN hat übrigens außer Peptid-Linkern auch Linker im Programm, die auf Saccharidbasis (u.a. Fuctose) u.a. konzipiert sind, während IMGN ebenfalls eine ganze Palette unterschiedlicher Linker wie z.B. Thioether und Disulfide verwendet): Zu belegen war die Aussage "SGENs Linker-Technologie soll theoretisch grosse Vorteile gegenüber den anderen Linkern aufweisen".
Zur Untermauerung dieser These konnten Deine Postings aus meiner Sicht leider noch nichts beitragen. Ich würde mich auf eine Fortsetzung der Diskussion aber sehr freuen, wobei wir uns besser auf die wesentlichen Dinge beschränken und nicht unnötig verzetteln sollten.
Antwort auf Beitrag Nr.: 40.264.779 von Joschka Schröder am 05.10.10 11:25:47Habe mich in #48 vertippt ... muss natürlich "cyclohexane" heißen.
Schöne Kursentwicklung bei IMGN. Aktuelle Notiz 6,47 USD, obwohl JPMorgan die Aktie kürzlich in einer Ersttudie nur als "neutral" eingestuft hat. Man kann aber davon ausgehen, dass die Kursziele wie so oft nachträglich angehoben werden. Spätestens am nächsten Montag erwarte ich im Zusammenhang mit der ESCO-Präsentation eine Anpassung der Analystenschätzungen.
Unverändert halte ich es für gut möglich, dass sich das Ende August geöffnete GAP bald schließen wird. In der nächsten Woche könnte die Aktie (gute Studiendaten für die Erstlinienbehandlung mit T-DM1 vorausgesetzt) die 8 USD-Marke durchbrechen.
Schöne Kursentwicklung bei IMGN. Aktuelle Notiz 6,47 USD, obwohl JPMorgan die Aktie kürzlich in einer Ersttudie nur als "neutral" eingestuft hat. Man kann aber davon ausgehen, dass die Kursziele wie so oft nachträglich angehoben werden. Spätestens am nächsten Montag erwarte ich im Zusammenhang mit der ESCO-Präsentation eine Anpassung der Analystenschätzungen.
Unverändert halte ich es für gut möglich, dass sich das Ende August geöffnete GAP bald schließen wird. In der nächsten Woche könnte die Aktie (gute Studiendaten für die Erstlinienbehandlung mit T-DM1 vorausgesetzt) die 8 USD-Marke durchbrechen.
Antwort auf Beitrag Nr.: 40.267.072 von Joschka Schröder am 05.10.10 16:22:28Sehr beruhigend, daß sich Fachwissen gelegentlich selbst an der Börse auszuzahlen scheint!
ImmunoGen's TDM-1 Looks Strong at ESMO
Adam Feuerstein
10/08/10 - 10:18 AM EDT
BOSTON (TheStreet) -- The "armed antibody" drug TDM-1 under development by Roche and ImmunoGen(IMGN) posted a higher response rate and lower toxicity than the blockbuster breast cancer drug Herceptin, according to results from the first head-to-head study of the two drugs to be presented at a European cancer meeting Monday.
The data from the TDM-1 phase II study in front-line breast cancer patients are early and very preliminary, but also encouraging because they suggest TDM-1 may be the next-generation successor to Herceptin that Roche has been looking for.
ImmunoGen, as Roche's partner on TDM-1, stands to profit as well if the drug is approved and successful.
In the phase II study, 137 women with HER2-positive metastatic breast cancer with no prior chemotherapy were randomly assigned to treatment with TDM-1 or Herceptin plus the chemotherapy drug Taxotere.
After six months of follow-up, the overall response rate for patients treated with TDM-1 was 48% compared to a 41% response rate for patients treated with Herceptin-Taxotere.
More striking was the difference in the rate of adverse events between the two drugs. The rate of "clinically relevant" adverse events (defined as Grade 3 or higher) was 37% in the TDM-1 arm compared to 75% in the Herceptin-Taxotere arm.
A full presentation of the T-DM1 study will be made Monday at the European Society of Medical Oncology (ESMO) annual meeting taking place in Milan.
Roche CEO Severin Schwan called the TDM-1 data "stunning" at a press event in Tokyo, according to a Reuters story Friday.
ImmunoGen shares were up 7% to $7.18 in early Friday trading.
T-DM1 is a so-called "armed antibody" that combines the targeted antibody drug Herceptin owned by Roche (already a potent cancer drug on its own) with a chemotherapy payload developed by ImmunoGen.
TDM-1 is designed to deliver a cancer-killing dose of chemotherapy directly inside tumors, sparring healthy cells from toxic side effects. This may explain the sharply lower toxicities observed in the front-line breast cancer study of TDM-1 compared to Herceptin-Taxotere.
For instance, the rates of hair loss and neutropenia (low white blood cell counts) in the Herceptin-Taxotere arm were 66% and 57%, respectively. By comparison, hair loss and neutropenia were reported in 1.5% and 7.5% of TDM-1 patients, respectively.
More patients treated with TDM-1 reported fever and nausea than those treated with Herceptin-Taxotere.
The TDM-1 data to be presented Monday are preliminary and may not hold up as the phase II study progresses. The study's primary endpoint is progression-free survival, which will determine whether TDM-1 can significantly delay the time before a patient's tumor starts to grow compared to Herceptin-Taxotere.
Roche, however, is not waiting for final results from this phase II study to push ahead with TDM-1 development in front-line metastatic breast cancer. A large, phase III study comparing TDM-1, Herceptin and another Roche drug, pertuzumab, has already been announced.
The TDM-1 data to be presented Monday may also help ease the sting felt in August when the U.S. Food and Drug Administration rejected Roche's effort to seek approval for T-DM1 based on results from a different phase II study involving patients with more advanced breast cancer.
Adam Feuerstein
10/08/10 - 10:18 AM EDT
BOSTON (TheStreet) -- The "armed antibody" drug TDM-1 under development by Roche and ImmunoGen(IMGN) posted a higher response rate and lower toxicity than the blockbuster breast cancer drug Herceptin, according to results from the first head-to-head study of the two drugs to be presented at a European cancer meeting Monday.
The data from the TDM-1 phase II study in front-line breast cancer patients are early and very preliminary, but also encouraging because they suggest TDM-1 may be the next-generation successor to Herceptin that Roche has been looking for.
ImmunoGen, as Roche's partner on TDM-1, stands to profit as well if the drug is approved and successful.
In the phase II study, 137 women with HER2-positive metastatic breast cancer with no prior chemotherapy were randomly assigned to treatment with TDM-1 or Herceptin plus the chemotherapy drug Taxotere.
After six months of follow-up, the overall response rate for patients treated with TDM-1 was 48% compared to a 41% response rate for patients treated with Herceptin-Taxotere.
More striking was the difference in the rate of adverse events between the two drugs. The rate of "clinically relevant" adverse events (defined as Grade 3 or higher) was 37% in the TDM-1 arm compared to 75% in the Herceptin-Taxotere arm.
A full presentation of the T-DM1 study will be made Monday at the European Society of Medical Oncology (ESMO) annual meeting taking place in Milan.
Roche CEO Severin Schwan called the TDM-1 data "stunning" at a press event in Tokyo, according to a Reuters story Friday.
ImmunoGen shares were up 7% to $7.18 in early Friday trading.
T-DM1 is a so-called "armed antibody" that combines the targeted antibody drug Herceptin owned by Roche (already a potent cancer drug on its own) with a chemotherapy payload developed by ImmunoGen.
TDM-1 is designed to deliver a cancer-killing dose of chemotherapy directly inside tumors, sparring healthy cells from toxic side effects. This may explain the sharply lower toxicities observed in the front-line breast cancer study of TDM-1 compared to Herceptin-Taxotere.
For instance, the rates of hair loss and neutropenia (low white blood cell counts) in the Herceptin-Taxotere arm were 66% and 57%, respectively. By comparison, hair loss and neutropenia were reported in 1.5% and 7.5% of TDM-1 patients, respectively.
More patients treated with TDM-1 reported fever and nausea than those treated with Herceptin-Taxotere.
The TDM-1 data to be presented Monday are preliminary and may not hold up as the phase II study progresses. The study's primary endpoint is progression-free survival, which will determine whether TDM-1 can significantly delay the time before a patient's tumor starts to grow compared to Herceptin-Taxotere.
Roche, however, is not waiting for final results from this phase II study to push ahead with TDM-1 development in front-line metastatic breast cancer. A large, phase III study comparing TDM-1, Herceptin and another Roche drug, pertuzumab, has already been announced.
The TDM-1 data to be presented Monday may also help ease the sting felt in August when the U.S. Food and Drug Administration rejected Roche's effort to seek approval for T-DM1 based on results from a different phase II study involving patients with more advanced breast cancer.
Antwort auf Beitrag Nr.: 40.290.729 von Joschka Schröder am 08.10.10 17:08:58Ganz wichtig sind die vergleichsweise geringen Nebenwirkungen des T-DM1. Bei der bisherigen Standardtherapie mit Trastuzumab + Chemo erhalten die Patientinnen beispielsweise wegen der starken Neutropenie nach jeder Anwendung eine Ampulle Pegfilgrastim (Neulasta), die mehrere tausend Euro kostet. Kann man sich bei Gabe des T-DM1 im Zweifelsfall alles schenken.
Auf Basis der aktuellen Datenlage rechne ich damit, dass T-DM1 in einigen Jahren jährliche Umsätze in Höhe von 5 Milliarden USD generieren wird. Davon würden an IMGN ca. 4-5% (200 bis 250 MIO. USD) Tantiemen fließen.
Zum Vergleich: Derzeit ist IMGN mit einem Unternehmenswert (EV) von 352 Mio. USD bewertet.
Auf Basis der aktuellen Datenlage rechne ich damit, dass T-DM1 in einigen Jahren jährliche Umsätze in Höhe von 5 Milliarden USD generieren wird. Davon würden an IMGN ca. 4-5% (200 bis 250 MIO. USD) Tantiemen fließen.
Zum Vergleich: Derzeit ist IMGN mit einem Unternehmenswert (EV) von 352 Mio. USD bewertet.
UPDATE 1-Roche's cancer drug T-DM1 shows promise in study
Fri Oct 8, 2010 10:41pm IST
* T-DM1 has fewer side-effects than standard care
* New drug seen as follow on to blockbuster Herceptin
(Adds details, background)
MILAN/ZURICH, Oct 8 (Reuters) - Roche Holding AG's (ROG.VX) experimental cancer drug T-DM1 is more effective than older therapies, with substantially fewer side-effects in breast cancer, giving the Swiss drugmaker's pipeline a much needed boost.
Researchers at this year's Congress of the European Society for Medical Oncology (ESMO) in Milan said T-DMI had shown encouraging activity as a first-line therapy in HER2-postive metastatic disease.
Roche, the world's largest maker of cancer drugs, has had a tough year so far as its drug development pipeline has been hit by a number of setbacks and top-selling Avastin has stumbled at a number of hurdles, knocking investor confidence in the group.
But the T-DM1 data is likely to go some way to restoring investors' faith in the group's pipeline as it shows the drug, viewed inside Roche as a key product, could still come to the market to improve established blockbuster Herceptin.
Researchers found an overall response rate of 48 percent in patients given T-DM1, compared with 41 percent in the Herceptin, or trastuzumab, plus docetaxel arm, researchers said in a statement.
"Importantly, the rates of clinically relevant adverse events were significantly lower in the T-DM1 arm compared to the rate in women given trastuzumab plus docetaxel," the researchers said.
T-DM1's image was tarnished in August when U.S. regulators rejected Roche's bid to gain marketing approval based only mid-stage Phase II trials.
T-DM1, which Roche developed with U.S. biotech group ImmunoGen (IMGN.O), is also the first of a new kind of "armed antibody" that can carry a cell-killing payload into cancer cells.
"We are encouraged by the results. The study demonstrated that T-DM1 has very good anti-tumour activity as well as much lower toxicity when evaluated side by side to the older 'standard'," Edith Perez, principal investigator of the study said in a statement issued on Friday.
ESMO released data on the drug early because an embargo was broken. (Reporting by Katie Reid; Editing by David Cowell)
Fri Oct 8, 2010 10:41pm IST
* T-DM1 has fewer side-effects than standard care
* New drug seen as follow on to blockbuster Herceptin
(Adds details, background)
MILAN/ZURICH, Oct 8 (Reuters) - Roche Holding AG's (ROG.VX) experimental cancer drug T-DM1 is more effective than older therapies, with substantially fewer side-effects in breast cancer, giving the Swiss drugmaker's pipeline a much needed boost.
Researchers at this year's Congress of the European Society for Medical Oncology (ESMO) in Milan said T-DMI had shown encouraging activity as a first-line therapy in HER2-postive metastatic disease.
Roche, the world's largest maker of cancer drugs, has had a tough year so far as its drug development pipeline has been hit by a number of setbacks and top-selling Avastin has stumbled at a number of hurdles, knocking investor confidence in the group.
But the T-DM1 data is likely to go some way to restoring investors' faith in the group's pipeline as it shows the drug, viewed inside Roche as a key product, could still come to the market to improve established blockbuster Herceptin.
Researchers found an overall response rate of 48 percent in patients given T-DM1, compared with 41 percent in the Herceptin, or trastuzumab, plus docetaxel arm, researchers said in a statement.
"Importantly, the rates of clinically relevant adverse events were significantly lower in the T-DM1 arm compared to the rate in women given trastuzumab plus docetaxel," the researchers said.
T-DM1's image was tarnished in August when U.S. regulators rejected Roche's bid to gain marketing approval based only mid-stage Phase II trials.
T-DM1, which Roche developed with U.S. biotech group ImmunoGen (IMGN.O), is also the first of a new kind of "armed antibody" that can carry a cell-killing payload into cancer cells.
"We are encouraged by the results. The study demonstrated that T-DM1 has very good anti-tumour activity as well as much lower toxicity when evaluated side by side to the older 'standard'," Edith Perez, principal investigator of the study said in a statement issued on Friday.
ESMO released data on the drug early because an embargo was broken. (Reporting by Katie Reid; Editing by David Cowell)
Jetzt gibt es auch ein offizielles Statement von Immunogen (noch nicht einmal in Ruhe Fußball kann schauen ...):
ImmunoGen, Inc. Announces Positive Interim Results in Randomized Clinical Trial Comparing Trastuzumab-DM1 vs. Standard First-Line Therapy for First-Line HER2+ Metastatic Breast Cancer
WALTHAM, Mass., Oct 08, 2010 (BUSINESS WIRE) --
ImmunoGen, Inc. (Nasdaq: IMGN), a biotechnology company that develops targeted antibody-based anticancer products, today announced the reporting of positive interim clinical data with trastuzumab-DM1 (T-DM1) for first-line treatment of HER2+ metastatic breast cancer in a press release issued by the European Society for Medical Oncology (ESMO). T-DM1 consists of ImmunoGen's DM1 cancer cell-killing agent attached to the HER2-targeting antibody, trastuzumab, developed by Genentech, a member of the Roche Group. The compound is in global development by Roche under a collaboration agreement between ImmunoGen and Genentech.
The ESMO press release reports on data to be presented on Monday, October 11 in its Presidential Symposium. These data are initial findings from a 137-patient randomized Phase II clinical trial comparing T-DM1 versus Herceptin(R) (trastuzumab) plus chemotherapy (docetaxel) for the treatment of HER2+ metastatic breast cancer that has not previously been treated with chemotherapy. Herceptin plus chemotherapy is current standard first-line therapy for this cancer.
The objective response rate for patients treated with T-DM1 was 47.8%, compared to 41.4% for patients treated with Herceptin plus chemotherapy, with a minimum of 5.9 months of patient follow-up. Longer follow-up is required for analysis of progression-free survival (PFS) - the primary endpoint of the study - and for final, mature objective response rate data. Final PFS data are expected to be available in 2Q 2011.
Of particular note, the incidence of more serious side effects (Grade 3 and higher) reported with T-DM1 was approximately half of that reported with trastuzumab plus docetaxel (37% vs. 75%, respectively), with no increased risk of cardiotoxicity. There were no new safety-signals reported with T-DM1 in this trial compared with earlier T-DM1 clinical studies.
The most common adverse events (all grades) in the Herceptin plus docetaxel arm of the study were alopecia (66.2% compared to 1.5% for the T-DM1 arm), neutropenia (57.4% vs. 7.5%) and diarrhea (45.6% vs. 10.4%). The most common adverse events in the T-DM1 arm of the study were nausea (47.8% vs. 39.7% for the Herceptin plus docetaxel arm), fatigue (46.3% vs. 46.2%) and temperature increase (35.8% vs. 20.6%).
This early analysis supports further investigation of T-DM1 for first-line treatment of HER2+ metastatic breast cancer. In July 2010, Roche initiated a Phase III trial, MARIANNE, to assess T-DM1 further for this use. MARIANNE compares both T-DM1 alone and T-DM1 used in combination with pertuzumab to Herceptin used in combination with a taxane in patients with advanced HER2+ breast cancer not previously treated for advanced disease.
About T-DM1
T-DM1 consists of ImmunoGen's DM1 cancer cell-killing agent attached using the Company's linker and methods of attachment to the HER2-targeting antibody, trastuzumab, developed by Genentech. T-DM1 is in Phase III testing for second-line and first-line treatment of HER2+ metastatic breast cancer (EMILIA and MARIANNE, respectively). A Phase II trial to evaluate the cardiac event rate and safety of T-DM1 in the neoadjuvant/adjuvant setting is scheduled to begin in 4Q2010.
About ImmunoGen's Targeted Antibody Payload (TAP) Technology
The Company's TAP technology uses tumor-targeting antibodies to deliver one of ImmunoGen's highly potent cancer-cell killing agents (e.g., DM1, DM4) specifically to tumors. The Company's proprietary cytotoxic agents are many-fold more potent than standard chemotherapeutics and were developed by ImmunoGen specifically for targeted delivery to tumors. The Company also has engineered linkage technology that keeps the cancer-cell killing agent attached to the antibody until it reaches the tumor cells and then controls the release of the agent inside the cell. Currently, seven TAP compounds are in clinical testing, with 3-4 more expected to enter the clinic in 2011.
About ImmunoGen, Inc.
ImmunoGen, Inc. develops targeted anticancer therapeutics using its expertise in cancer biology, monoclonal antibodies and the creation and attachment of potent cancer cell-killing agents. The Company's TAP technology uses engineered antibodies to deliver one of ImmunoGen's proprietary cancer-cell killing agents specifically to tumor targets. Product candidates are in development through the Company's own product programs and through ImmunoGen's collaborations with Amgen, Bayer Schering Pharma, Biogen Idec, Biotest, Genentech and sanofi-aventis. The most advanced compound using ImmunoGen's TAP technology, T-DM1, is in Phase III testing through the Company's collaboration with Genentech.
ImmunoGen, Inc. Announces Positive Interim Results in Randomized Clinical Trial Comparing Trastuzumab-DM1 vs. Standard First-Line Therapy for First-Line HER2+ Metastatic Breast Cancer
WALTHAM, Mass., Oct 08, 2010 (BUSINESS WIRE) --
ImmunoGen, Inc. (Nasdaq: IMGN), a biotechnology company that develops targeted antibody-based anticancer products, today announced the reporting of positive interim clinical data with trastuzumab-DM1 (T-DM1) for first-line treatment of HER2+ metastatic breast cancer in a press release issued by the European Society for Medical Oncology (ESMO). T-DM1 consists of ImmunoGen's DM1 cancer cell-killing agent attached to the HER2-targeting antibody, trastuzumab, developed by Genentech, a member of the Roche Group. The compound is in global development by Roche under a collaboration agreement between ImmunoGen and Genentech.
The ESMO press release reports on data to be presented on Monday, October 11 in its Presidential Symposium. These data are initial findings from a 137-patient randomized Phase II clinical trial comparing T-DM1 versus Herceptin(R) (trastuzumab) plus chemotherapy (docetaxel) for the treatment of HER2+ metastatic breast cancer that has not previously been treated with chemotherapy. Herceptin plus chemotherapy is current standard first-line therapy for this cancer.
The objective response rate for patients treated with T-DM1 was 47.8%, compared to 41.4% for patients treated with Herceptin plus chemotherapy, with a minimum of 5.9 months of patient follow-up. Longer follow-up is required for analysis of progression-free survival (PFS) - the primary endpoint of the study - and for final, mature objective response rate data. Final PFS data are expected to be available in 2Q 2011.
Of particular note, the incidence of more serious side effects (Grade 3 and higher) reported with T-DM1 was approximately half of that reported with trastuzumab plus docetaxel (37% vs. 75%, respectively), with no increased risk of cardiotoxicity. There were no new safety-signals reported with T-DM1 in this trial compared with earlier T-DM1 clinical studies.
The most common adverse events (all grades) in the Herceptin plus docetaxel arm of the study were alopecia (66.2% compared to 1.5% for the T-DM1 arm), neutropenia (57.4% vs. 7.5%) and diarrhea (45.6% vs. 10.4%). The most common adverse events in the T-DM1 arm of the study were nausea (47.8% vs. 39.7% for the Herceptin plus docetaxel arm), fatigue (46.3% vs. 46.2%) and temperature increase (35.8% vs. 20.6%).
This early analysis supports further investigation of T-DM1 for first-line treatment of HER2+ metastatic breast cancer. In July 2010, Roche initiated a Phase III trial, MARIANNE, to assess T-DM1 further for this use. MARIANNE compares both T-DM1 alone and T-DM1 used in combination with pertuzumab to Herceptin used in combination with a taxane in patients with advanced HER2+ breast cancer not previously treated for advanced disease.
About T-DM1
T-DM1 consists of ImmunoGen's DM1 cancer cell-killing agent attached using the Company's linker and methods of attachment to the HER2-targeting antibody, trastuzumab, developed by Genentech. T-DM1 is in Phase III testing for second-line and first-line treatment of HER2+ metastatic breast cancer (EMILIA and MARIANNE, respectively). A Phase II trial to evaluate the cardiac event rate and safety of T-DM1 in the neoadjuvant/adjuvant setting is scheduled to begin in 4Q2010.
About ImmunoGen's Targeted Antibody Payload (TAP) Technology
The Company's TAP technology uses tumor-targeting antibodies to deliver one of ImmunoGen's highly potent cancer-cell killing agents (e.g., DM1, DM4) specifically to tumors. The Company's proprietary cytotoxic agents are many-fold more potent than standard chemotherapeutics and were developed by ImmunoGen specifically for targeted delivery to tumors. The Company also has engineered linkage technology that keeps the cancer-cell killing agent attached to the antibody until it reaches the tumor cells and then controls the release of the agent inside the cell. Currently, seven TAP compounds are in clinical testing, with 3-4 more expected to enter the clinic in 2011.
About ImmunoGen, Inc.
ImmunoGen, Inc. develops targeted anticancer therapeutics using its expertise in cancer biology, monoclonal antibodies and the creation and attachment of potent cancer cell-killing agents. The Company's TAP technology uses engineered antibodies to deliver one of ImmunoGen's proprietary cancer-cell killing agents specifically to tumor targets. Product candidates are in development through the Company's own product programs and through ImmunoGen's collaborations with Amgen, Bayer Schering Pharma, Biogen Idec, Biotest, Genentech and sanofi-aventis. The most advanced compound using ImmunoGen's TAP technology, T-DM1, is in Phase III testing through the Company's collaboration with Genentech.
Die Reaktion des Marktes auf die offensichtlich vorzeitig bekanntgewordenen Daten ist erstaunlich verhalten. Sehr viel mehr konnte man wirklich nicht erwarten imho. T-DM1 scheint bei Erstbehandlung wirksamer zu sein, als Herceptin + Chemo und das bei einem signifikant günstigeren Nebenwirkungsprofil.
Wenn sich das bestätigen lässt und wenn die PFS-Daten auch überzeugen - und es spricht bisher alles dafür - dann wird T-DM1 eines Tages Herceptin weitgehend ersetzen.
Ich glaube, das Problem ist, dass T-DM1 aus Börsensicht noch recht weit vom Markt weg ist. Umsätze sind nun wohl erst 2013 zu erwarten, das ganz große Geschäft 2015 und später. Dennoch ist meiner Meinung nach Immunogen nur wegen T-DM1 eine Milliarde Dollar Wert, wenn sich die Daten in der Zukunft so bestätigen lassen.
In jedem Fall war es mit Stand heute richtig, die Kursdelle, die kürzlich aufgrund der fragwürdigen FDA-Entscheidung in Sachen third line entstanden war, für aggressives Nachkaufen zu nutzen!
Wenn sich das bestätigen lässt und wenn die PFS-Daten auch überzeugen - und es spricht bisher alles dafür - dann wird T-DM1 eines Tages Herceptin weitgehend ersetzen.
Ich glaube, das Problem ist, dass T-DM1 aus Börsensicht noch recht weit vom Markt weg ist. Umsätze sind nun wohl erst 2013 zu erwarten, das ganz große Geschäft 2015 und später. Dennoch ist meiner Meinung nach Immunogen nur wegen T-DM1 eine Milliarde Dollar Wert, wenn sich die Daten in der Zukunft so bestätigen lassen.
In jedem Fall war es mit Stand heute richtig, die Kursdelle, die kürzlich aufgrund der fragwürdigen FDA-Entscheidung in Sachen third line entstanden war, für aggressives Nachkaufen zu nutzen!
Antwort auf Beitrag Nr.: 40.292.394 von SLGramann am 08.10.10 21:20:18"dann wird T-DM1 eines Tages Herceptin weitgehend ersetzen"
T-DM1 wird dann wohl Herceptin+Chemo(+Neulasta+...) ersetzen, d.h. der T-DM1-Umsatz wird dann deutlich über dem heutigen Herceptin-Umsatz liegen.
Besonders erwähnenswert ist aus meiner Sicht, dass unter T-DM1 bislang in keiner (!) der Studien eine Zunahme kardialer Nebenwirkungen beobachtet worden ist.
"Die Reaktion des Marktes auf die offensichtlich vorzeitig bekanntgewordenen Daten ist erstaunlich verhalten."
Das sehe ich auch so. Als die Aktie im Laufe des heutigen Handels zwischenzeitlich von 7,25 USD auf 6,70 USD fiel, traute ich meinen Augen kaum.
Ich denke aber, dass die Analysten in der kommenden Woche ihre Schätzungen wieder nach oben korrigieren und neue Kursziele ausrufen werden (bei rationaler Betrachtung stellt sich die Situation für T-DM1 angesichts der neuen Datenlage derzeit noch aussichtsreicher dar als vor einigen Monaten, als die Aktie phasenweise über 10 USD notierte und die Kursziele teilweise doppelt so hoch lagen wie zuletzt). Die Aktie dürfte somit weiter steigen (vgl. Kursanstieg von Seattle Genetics von 11,8 USD auf aktuell 16,77 USD seit Ende September nach einer weit weniger beeindruckenden Meldung ... der SGEN-Kursanstieg erfolgte schrittweise bis zum heutigen Tage).
T-DM1 wird dann wohl Herceptin+Chemo(+Neulasta+...) ersetzen, d.h. der T-DM1-Umsatz wird dann deutlich über dem heutigen Herceptin-Umsatz liegen.
Besonders erwähnenswert ist aus meiner Sicht, dass unter T-DM1 bislang in keiner (!) der Studien eine Zunahme kardialer Nebenwirkungen beobachtet worden ist.
"Die Reaktion des Marktes auf die offensichtlich vorzeitig bekanntgewordenen Daten ist erstaunlich verhalten."
Das sehe ich auch so. Als die Aktie im Laufe des heutigen Handels zwischenzeitlich von 7,25 USD auf 6,70 USD fiel, traute ich meinen Augen kaum.
Ich denke aber, dass die Analysten in der kommenden Woche ihre Schätzungen wieder nach oben korrigieren und neue Kursziele ausrufen werden (bei rationaler Betrachtung stellt sich die Situation für T-DM1 angesichts der neuen Datenlage derzeit noch aussichtsreicher dar als vor einigen Monaten, als die Aktie phasenweise über 10 USD notierte und die Kursziele teilweise doppelt so hoch lagen wie zuletzt). Die Aktie dürfte somit weiter steigen (vgl. Kursanstieg von Seattle Genetics von 11,8 USD auf aktuell 16,77 USD seit Ende September nach einer weit weniger beeindruckenden Meldung ... der SGEN-Kursanstieg erfolgte schrittweise bis zum heutigen Tage).
Leider gibt es die früheren Spekulationsfristen nicht mehr.
Erstaunlich auch, daß es auf w.-o. kaum Interesse an Unternehmen und Aktie gibt. Durch die Zusammenarbeit mit Roche scheint mir hier doch manches schon etwas konkreter zu sein als anderswo.
Erstaunlich auch, daß es auf w.-o. kaum Interesse an Unternehmen und Aktie gibt. Durch die Zusammenarbeit mit Roche scheint mir hier doch manches schon etwas konkreter zu sein als anderswo.
Jetzt berichtet sogar die BILD-Zeitung (inhaltlich wie gewohnt fehlerhaft) über das "Wunder-Medikament" T-DM1 ...dann kann ja wirklich nichts mehr schief gehen ... Kursziel DAUSEND
Neues Krebs-Medikament verspricht Durchbruch Chemotherapie bald ohne Nebenwirkungen?
T-DM1 heißt die Hoffnung von Millionen Krebspatienten. Es ist der Name eines neuen Medikaments, das eine Chemotherapie verträglicher und wirksamer machen soll. Offenbar kann es Tumor-Zellen gezielt eliminieren!
Wissenschaftler der Pharma-Unternehmen Immunogen und Roche haben den Stoff entwickelt und bereits erfolgreich getestet, berichtet die britische Sonntagszeitung „Sunday Telegraph“.
T-DM1 wird zusammen mit den normalen Medikamenten zur Chemotherapie verabreicht . Der Wirkstoff unterstützt und steuert sie so, dass bösartige Krebszellen gezielt zerstört werden, gesunde aber verschont.
. Der Wirkstoff unterstützt und steuert sie so, dass bösartige Krebszellen gezielt zerstört werden, gesunde aber verschont.
So kommt es bei der Krebsbehandlung zu deutlich weniger Nebenwirkungen. Chemotherapien sind üblicherweise mit Übelkeit, Infekt-Anfälligkeit, Haarausfall und vielem mehr verbunden.
Das Wunder-Medikament wird am 11. Oktober auf einem Fach-Kongress in Mailand vorgestellt. Studienleiterin Dr. Edith Perez von der Mayo-Klinik Florida sagte der Zeitung: „Die Testergebnisse machen uns Mut. Die Studie hat gezeigt, dass T-DM1 eine sehr gute Anti-Krebs-Aktivität, aber eine geringe Toxizität hat.“
Bislang zeigte das Medikament bei Brustkrebs-Patientinnen Erfolge. Die Experten glauben aber, dass es gegen zahlreiche Krebsarten einsetzbar ist.
http://www.bild.de/BILD/ratgeber/gesund-fit/2010/10/10/durch…
Neues Krebs-Medikament verspricht Durchbruch Chemotherapie bald ohne Nebenwirkungen?
T-DM1 heißt die Hoffnung von Millionen Krebspatienten. Es ist der Name eines neuen Medikaments, das eine Chemotherapie verträglicher und wirksamer machen soll. Offenbar kann es Tumor-Zellen gezielt eliminieren!
Wissenschaftler der Pharma-Unternehmen Immunogen und Roche haben den Stoff entwickelt und bereits erfolgreich getestet, berichtet die britische Sonntagszeitung „Sunday Telegraph“.
T-DM1 wird zusammen mit den normalen Medikamenten zur Chemotherapie verabreicht
 . Der Wirkstoff unterstützt und steuert sie so, dass bösartige Krebszellen gezielt zerstört werden, gesunde aber verschont.
. Der Wirkstoff unterstützt und steuert sie so, dass bösartige Krebszellen gezielt zerstört werden, gesunde aber verschont.So kommt es bei der Krebsbehandlung zu deutlich weniger Nebenwirkungen. Chemotherapien sind üblicherweise mit Übelkeit, Infekt-Anfälligkeit, Haarausfall und vielem mehr verbunden.
Das Wunder-Medikament wird am 11. Oktober auf einem Fach-Kongress in Mailand vorgestellt. Studienleiterin Dr. Edith Perez von der Mayo-Klinik Florida sagte der Zeitung: „Die Testergebnisse machen uns Mut. Die Studie hat gezeigt, dass T-DM1 eine sehr gute Anti-Krebs-Aktivität, aber eine geringe Toxizität hat.“
Bislang zeigte das Medikament bei Brustkrebs-Patientinnen Erfolge. Die Experten glauben aber, dass es gegen zahlreiche Krebsarten einsetzbar ist.
http://www.bild.de/BILD/ratgeber/gesund-fit/2010/10/10/durch…
Novartis geht mit ImmunoGen Kooperation zur Entwicklung von Krebs-Antikörper ein
11.10.2010 10:07
Basel (awp) - Die Novartis AG und das US-Pharmaunternehmen ImmunoGen Inc sind bei der Entwicklung von Krebs-Antikörpern eine Kooperation eingegangen. Mithilfe von ImmunoGen-Technologien sollen sogenannte Antibody Drug Conjugates (ADC's) entwickelt werden, die eine deutlich höhere Wirksamkeit als traditionelle Chemotherapien aufweisen würden, schreibt ImmunoGen am Montag in einer Mitteilung.
Im Rahmen der Kooperation werde Novartis an ImmunoGen eine Upfront- respektive eine Vorauszahlung im Umfang von 45 Mio USD leisten. In der Folge sind beim Erreichen von definierten Zielsetzungen sogenannte Meilenstein-Zahlungen von 200 Mio USD je Ziel vorgesehen.
Die mit Novartis eingegangene Kooperation zeige auf, dass ADC-Behandlungen für grosse Pharmaunternehmen mit Ausrichtung auf Krebsmedikamente ein "must have" sind, so die Mitteilung. ImmunoGen unterhalte entsprechende Kooperationen mit Roche/Genentech, Sanofi Aventis und nun neu mit Novartis.
aus : Finanz und Wirtschaft, Details siehe Immunogen-Homepage
Hier der vollständige Text:
ImmunoGen, Inc. Announces Collaboration for Rights to Use ImmunoGen's TAP Technology
WALTHAM, Mass., Oct 11, 2010 (BUSINESS WIRE) --
ImmunoGen, Inc. (Nasdaq: IMGN) announced today that it has entered into a collaboration agreement with Novartis to discover and develop targeted anticancer therapeutics using antibodies to several antigen targets to be named by Novartis.
Under this agreement, Novartis will pay a $45 million upfront fee to ImmunoGen for exclusive rights to use the Company's Targeted Antibody Payload (TAP) technology with antibodies to the specified number of antigen targets. For each target that results in an anticancer therapeutic, ImmunoGen is entitled to receive milestone payments potentially totaling $200.5 million plus royalties on product sales, if any. The Company also is entitled to receive financial compensation for research and for any manufacturing done on behalf of Novartis. Novartis is responsible for the development, manufacturing, and marketing of any products resulting from this agreement.
"ImmunoGen has a valuable technology, and we're committed to developing our own pipeline of anticancer therapeutics," commented Daniel Junius, President and CEO of ImmunoGen. "Our partnerships provide funding support for our internal product programs and further development of our technology. We plan to continue to establish new collaborations on a selective basis."
About ImmunoGen's Targeted Antibody Payload (TAP) Technology
ImmunoGen developed its TAP technology to achieve more effective, better tolerated anticancer drugs. A TAP compound consists of a tumor-targeting manufactured antibody with one of ImmunoGen's proprietary, highly potent cancer-killing agents attached as a payload. The antibody serves to deliver the payload specifically to tumor cells, and the payload serves to kill these cells.
ImmunoGen's technology portfolio uniquely provides:
* A selection of highly potent cancer-killing payload agents;
* A selection of stable linkers for attachment of these agents to antibodies; and
* Means of attaching the payload to the antibody that retain the desired structural and functional properties of the antibody.
Seven TAP compounds are now in clinical testing through ImmunoGen's own product programs and those of its partners.
About ImmunoGen, Inc.
ImmunoGen, Inc. develops targeted anticancer therapeutics using the Company's expertise in tumor biology, monoclonal antibodies and potent cancer-cell killing agents. The Company's TAP technology uses monoclonal antibodies to deliver one of ImmunoGen's proprietary cancer-cell killing agents specifically to tumor cells. There are currently seven TAP compounds in the clinic, with a wealth of clinical data reported with the technology. ImmunoGen collaborative partners include Amgen, Bayer Schering Pharma, Biogen Idec, Biotest, Genentech (a member of the Roche Group), Novartis, and sanofi-aventis. The most advanced compound using ImmunoGen's TAP technology, T-DM1, is in Phase III testing through the Company's collaboration with Genentech. More information about ImmunoGen can be found at www.immunogen.com.
ImmunoGen, Inc. Announces Collaboration for Rights to Use ImmunoGen's TAP Technology
WALTHAM, Mass., Oct 11, 2010 (BUSINESS WIRE) --
ImmunoGen, Inc. (Nasdaq: IMGN) announced today that it has entered into a collaboration agreement with Novartis to discover and develop targeted anticancer therapeutics using antibodies to several antigen targets to be named by Novartis.
Under this agreement, Novartis will pay a $45 million upfront fee to ImmunoGen for exclusive rights to use the Company's Targeted Antibody Payload (TAP) technology with antibodies to the specified number of antigen targets. For each target that results in an anticancer therapeutic, ImmunoGen is entitled to receive milestone payments potentially totaling $200.5 million plus royalties on product sales, if any. The Company also is entitled to receive financial compensation for research and for any manufacturing done on behalf of Novartis. Novartis is responsible for the development, manufacturing, and marketing of any products resulting from this agreement.
"ImmunoGen has a valuable technology, and we're committed to developing our own pipeline of anticancer therapeutics," commented Daniel Junius, President and CEO of ImmunoGen. "Our partnerships provide funding support for our internal product programs and further development of our technology. We plan to continue to establish new collaborations on a selective basis."
About ImmunoGen's Targeted Antibody Payload (TAP) Technology
ImmunoGen developed its TAP technology to achieve more effective, better tolerated anticancer drugs. A TAP compound consists of a tumor-targeting manufactured antibody with one of ImmunoGen's proprietary, highly potent cancer-killing agents attached as a payload. The antibody serves to deliver the payload specifically to tumor cells, and the payload serves to kill these cells.
ImmunoGen's technology portfolio uniquely provides:
* A selection of highly potent cancer-killing payload agents;
* A selection of stable linkers for attachment of these agents to antibodies; and
* Means of attaching the payload to the antibody that retain the desired structural and functional properties of the antibody.
Seven TAP compounds are now in clinical testing through ImmunoGen's own product programs and those of its partners.
About ImmunoGen, Inc.
ImmunoGen, Inc. develops targeted anticancer therapeutics using the Company's expertise in tumor biology, monoclonal antibodies and potent cancer-cell killing agents. The Company's TAP technology uses monoclonal antibodies to deliver one of ImmunoGen's proprietary cancer-cell killing agents specifically to tumor cells. There are currently seven TAP compounds in the clinic, with a wealth of clinical data reported with the technology. ImmunoGen collaborative partners include Amgen, Bayer Schering Pharma, Biogen Idec, Biotest, Genentech (a member of the Roche Group), Novartis, and sanofi-aventis. The most advanced compound using ImmunoGen's TAP technology, T-DM1, is in Phase III testing through the Company's collaboration with Genentech. More information about ImmunoGen can be found at www.immunogen.com.
Antwort auf Beitrag Nr.: 40.297.614 von Joschka Schröder am 11.10.10 10:57:11
Also, zwei Dinge scheinen mir hier bemerkenswert: Erstens etwas Allgemeines: Der ADC-Zug kommt immer mehr ins Rollen. Die Partnerschaften, die IMGN und SGEN abschließen sind jetzt schon beeindruckend und werden voraussichtlich weiter zunehmen. Ganz ohne ADCs wird wohl in einigen Jahren kein großer Pharma mehr auskommen, wenn er im Onkologiebereich vorn dabei sein will.
Zweitens: Der konkrete Deal scheint mir phantastische Konditionen für IMGN zu beinhalten. Verstehe ich das richtig, dass den Milestones von 200 Mio. pro erfolgreichem Projekt faktisch keine eigenen Kosten bei IMGN entgegenstehen? Das wäre ein Ding!
(Die 45 Mio. upfront-Gebühr sind natürlich auch sehr angenehm und stärken die Cashposition, gerade nach dem verschobenen Start von T-DM1 ist das wichtig.)
Also, zwei Dinge scheinen mir hier bemerkenswert: Erstens etwas Allgemeines: Der ADC-Zug kommt immer mehr ins Rollen. Die Partnerschaften, die IMGN und SGEN abschließen sind jetzt schon beeindruckend und werden voraussichtlich weiter zunehmen. Ganz ohne ADCs wird wohl in einigen Jahren kein großer Pharma mehr auskommen, wenn er im Onkologiebereich vorn dabei sein will.
Zweitens: Der konkrete Deal scheint mir phantastische Konditionen für IMGN zu beinhalten. Verstehe ich das richtig, dass den Milestones von 200 Mio. pro erfolgreichem Projekt faktisch keine eigenen Kosten bei IMGN entgegenstehen? Das wäre ein Ding!
(Die 45 Mio. upfront-Gebühr sind natürlich auch sehr angenehm und stärken die Cashposition, gerade nach dem verschobenen Start von T-DM1 ist das wichtig.)
Antwort auf Beitrag Nr.: 40.297.860 von SLGramann am 11.10.10 11:39:21"Verstehe ich das richtig, dass den Milestones von 200 Mio. pro erfolgreichem Projekt faktisch keine eigenen Kosten bei IMGN entgegenstehen? "
So wurde es von allen Beteiligten kommuniziert! Dazu kommen dann noch im Erfolgsfall nach Markteintritt die üblichen Tantiemen.
So wurde es von allen Beteiligten kommuniziert! Dazu kommen dann noch im Erfolgsfall nach Markteintritt die üblichen Tantiemen.
Sehr gut, keine weitere KP-Maßnahmen bis 2013 erforderlich. Und dann wird vermutlich T-DM1 in der ersten Indikation zugelassen!
ImmunoGen, Inc. Announces Updated Guidance for 2011 Fiscal Year
WALTHAM, Mass., Oct 11, 2010 (BUSINESS WIRE) --
ImmunoGen, Inc. (Nasdaq: IMGN), a biotechnology company that develops targeted antibody-based anticancer products, today announced updated guidance for the Company's fiscal year ending June 30, 2011.
Net cash used in operations is expected to be between $0 and $4 million, with a net loss expected to total between $60 and $64 million. Cash and marketable securities at its fiscal year end of June 30, 2011 are expected to total between $106 and $110 million, which should be sufficient to fund operations through the Company's 2013 fiscal year.
ImmunoGen, Inc. Announces Updated Guidance for 2011 Fiscal Year
WALTHAM, Mass., Oct 11, 2010 (BUSINESS WIRE) --
ImmunoGen, Inc. (Nasdaq: IMGN), a biotechnology company that develops targeted antibody-based anticancer products, today announced updated guidance for the Company's fiscal year ending June 30, 2011.
Net cash used in operations is expected to be between $0 and $4 million, with a net loss expected to total between $60 and $64 million. Cash and marketable securities at its fiscal year end of June 30, 2011 are expected to total between $106 and $110 million, which should be sufficient to fund operations through the Company's 2013 fiscal year.
Herzlichen Glückwunsch, JoschkaSchröder, zu den letzten Nachrichten von ImmunoGen!!
Trotz des relativ starken Anstieges der letzten Tage erscheint mir die Aktie aufgrund der stark verbesserten Finanzlage immer noch attraktiv.
Viele Grüße!!
Trotz des relativ starken Anstieges der letzten Tage erscheint mir die Aktie aufgrund der stark verbesserten Finanzlage immer noch attraktiv.
Viele Grüße!!
Antwort auf Beitrag Nr.: 40.297.860 von SLGramann am 11.10.10 11:39:21Der Punkt "For each target that results in an anticancer therapeutic, ImmunoGen is entitled to receive milestone payments potentially totaling $200.5 million plus royalties on product sales, if any." der Immunogen-Mitteilung wurde zumindest bei J.S. Zitat aus Finanz und Wirtschaft #60 so übersetzt.
Bei der Höhe dachte ich sogleich, dass es evtl. keine Umsatzbeteiligungen mehr gibt.
Wenn man nach "payments" gedanklich einen Absatz einbaut, kann man das Ganze auch anders deuten, was m.e. Sinn macht, denn die Höhe wäre schon exorbitant. Dann würden die vereinbarte Anzahl ("several") von Targets zusammen diese Meilensteine bei Erfolg einbringen, denn Umsatzbeteiligungen gibt es weiterhin.
IMGN hatte durch die vorzeitige Zulassung von T-DM1 in der Nischenindikation wohl ungefähr die gleiche Summe (45 Mio USD) Einnahmen eingeplant. Beruhigend, dass auf diesem Weg so schnell und ohne verwässernde Kapitalerhöhung die fehlenden Einnahmen generiert werden konnten. Ob diese nun wirklich solange ausreichen, bis Geld aus Umsatzbeteiligungen die Finanzierung sicherstellt, kann ich nicht einschätzen.
Bei der Höhe dachte ich sogleich, dass es evtl. keine Umsatzbeteiligungen mehr gibt.
Wenn man nach "payments" gedanklich einen Absatz einbaut, kann man das Ganze auch anders deuten, was m.e. Sinn macht, denn die Höhe wäre schon exorbitant. Dann würden die vereinbarte Anzahl ("several") von Targets zusammen diese Meilensteine bei Erfolg einbringen, denn Umsatzbeteiligungen gibt es weiterhin.
IMGN hatte durch die vorzeitige Zulassung von T-DM1 in der Nischenindikation wohl ungefähr die gleiche Summe (45 Mio USD) Einnahmen eingeplant. Beruhigend, dass auf diesem Weg so schnell und ohne verwässernde Kapitalerhöhung die fehlenden Einnahmen generiert werden konnten. Ob diese nun wirklich solange ausreichen, bis Geld aus Umsatzbeteiligungen die Finanzierung sicherstellt, kann ich nicht einschätzen.
Heute fliegen einem die IMGN-Meldungen nur so um die Ohren. Besonders erfreulich die Ergebnisse zur MCC-Therapie (bislang äußerst schlechte Prognose, IMGN mit Orphan Drug-Status):
ImmunoGen, Inc. Announces Presentation of Encouraging Clinical Data for Lorvotuzumab Mertansine at ESMO Annual Meeting
WALTHAM, Mass., Oct 11, 2010 (BUSINESS WIRE) --
ImmunoGen, Inc. (Nasdaq: IMGN), a biopharmaceutical company that develops targeted anticancer therapeutics using its Targeted Antibody Payload (TAP) technology, today announced the presentation of encouraging clinical data for the Company's lorvotuzumab mertansine (IMGN901) targeted anticancer compound at the 35th European Society for Medical Oncology (ESMO) Conference being held in Milan, Italy, October 8-12, 2010.
Lorvotuzumab mertansine is designed to target and kill cancer cells that express CD56, a protein. This targeted anticancer compound is a potential treatment for Merkel cell carcinoma (MCC), small-cell lung cancer (SCLC), ovarian cancer, multiple myeloma, and other CD56+ tumors. It is wholly owned by ImmunoGen.
Clinical Data Reported
The data reported today are from an early-stage clinical trial evaluating lorvotuzumab mertansine in CD56+ solid tumors. During the dose-escalation phase of the trial, patients with any type of CD56+ solid tumor were eligible for enrollment. In the ongoing expansion phase of the trial, enrollment is limited to patients with MCC, SCLC, or ovarian cancer.
A total of 64 patients with CD56+ solid tumors had been enrolled at the time of data cut-off for presentation. Among these, 45 patients could be quantitatively assessed for changes in overall tumor burden. Thirteen (29%) of these 45 patients had a reduction in tumor volume ranging from 1.3 - 100%, and another 10 patients (22%) had no discernable increase in tumor burden.
Findings in Merkel Cell Carcinoma
Patients with Merkel cell carcinoma are being enrolled in the expansion phase of this trial as promising activity has been reported with lorvotuzumab mertansine for MCC, and the Company is assessing whether to initiate a pivotal trial with the compound for this use.
Metastatic MCC is a rare and aggressive neuroendocrine cancer of the skin. Among patients diagnosed with metastatic MCC, median survival is less than seven months. There are no approved therapies for metastatic MCC, and typically the disease progresses rapidly (within 1 to 2 months) on the therapies currently used.
Thirteen patients with metastatic MCC had been enrolled in the study at the time of data cut off. Five (38%) of these patients had notable clinical benefit:
* 1 patient had a complete response (CR) and has remained disease free for more than 5 years;
* 1 patient had a partial response (PR) that evolved to a CR, and has been disease free for at least 17 months; and
* 3 patients had clinically relevant stable disease for this patient population, remaining on lorvotuzumab mertansine for at least three months.
Findings in Small-Cell Lung Cancer
Twenty-six patients were enrolled with SCLC, which has commonalities with MCC in biological characteristics, clinical course and response to treatments. SCLC tumors generally respond to first-line treatment but then recur. Survival at that stage is usually less than 6 months.1
While all of the SCLC patients enrolled in this trial had cancer that had recurred following treatment with other therapies, three patients had clinically meaningful stable disease and another patient with refractory disease achieved an unconfirmed PR.
ImmunoGen plans to begin a study later this year to assess lorvotuzumab mertansine for first-line treatment of SCLC used in combination with standard care.
"These findings are encouraging in light of the prior treatments these patients have received and the stage of their disease at the time of study entry," commented James O'Leary, MD, Vice President and Chief Medical Officer. "We believe it's important to assess lorvotuzumab mertansine as part of a combination regimen, as cancer is typically treated with several agents with different mechanisms of action. The combination trial planned in SCLC and the one underway in multiple myeloma are expected to be particularly significant to determining the potential opportunity for this compound."
About the Clinical Trial Reported
The patients enrolled at the time of data cut-off for presentation consisted of 26 patients with SCLC, 16 with neuroendocrine tumors, 13 with MCC, and 9 patients with other types of CD56+ solid tumors. The first ovarian patient entered the study after that time.
In the expansion phase of the trial, lorvotuzumab mertansine is being administered at a dose of 60 mg/m²/day for three consecutive days every 21 days.
About Lorvotuzumab Mertansine
Lorvotuzumab mertansine, a TAP compound, consists of a CD56-binding antibody with ImmunoGen's potent cancer-cell killing agent, DM1, attached to it using one of the Company's engineered linkers.
Lorvotuzumab mertansine has been granted orphan drug designation for MCC in the US and Europe. It also has been granted orphan drug status for SCLC in the US and is in the process of receiving this designation in Europe.
About MCC, SCLC and Ovarian Cancer
MCC is an aggressive neuroendocrine cancer of the skin that typically occurs on the head/neck, most often in individuals of European ancestry. There are approximately 1,900 new cases of MCC diagnosed in the US each year, with the incidence considered to be increasing.2 An estimated 28,000 new cases of SCLC are expected to be diagnosed in the US in 2010, and 22,000 new cases of ovarian cancer.3, 4 Based on published literature and Company research, CD56 is expressed on virtually all cases of MCC and SCLC and on approximately 58% of ovarian cancer tumors.
About ImmunoGen, Inc.
ImmunoGen, Inc. develops targeted anticancer therapeutics using the Company's expertise in tumor biology, monoclonal antibodies and potent cancer-cell killing agents. The Company's TAP technology uses monoclonal antibodies to deliver one of ImmunoGen's proprietary cancer-cell killing agents specifically to tumor cells. There are currently seven TAP compounds in the clinic, with a wealth of clinical data reported with the technology. ImmunoGen collaborative partners include Amgen, Bayer Schering Pharma, Biogen Idec, Biotest, Genentech (a member of the Roche Group), Novartis, and sanofi-aventis. The most advanced compound using ImmunoGen's TAP technology, T-DM1, is in Phase III testing through the Company's collaboration with Genentech. More information about ImmunoGen can be found at www.immunogen.com.
Davies A, 2004.
2 Based on incidence data from Agelli M, 2003; Hodgson NC, 2006.
3 American Cancer Society, Cancer Facts & Figures, 2010.
4 American Cancer Society, Guide to small-cell lung cancer, 2010.
This press release includes forward-looking statements. For these statements, ImmunoGen claims the protection of the safe harbor for forward-looking statements provided by the Private Securities Litigation Reform Act of 1995. It should be noted that there are risks and uncertainties related to the development of lorvotuzumab mertansine, including uncertainties around the timing of clinical trials conducted and their results. A review of these risks can be found in ImmunoGen's Annual Report on Form 10-K for the fiscal year ended June 30, 2010 and other reports filed with the Securities and Exchange Commission.
SOURCE: ImmunoGen, Inc.
ImmunoGen, Inc. Announces Presentation of Encouraging Clinical Data for Lorvotuzumab Mertansine at ESMO Annual Meeting
WALTHAM, Mass., Oct 11, 2010 (BUSINESS WIRE) --
ImmunoGen, Inc. (Nasdaq: IMGN), a biopharmaceutical company that develops targeted anticancer therapeutics using its Targeted Antibody Payload (TAP) technology, today announced the presentation of encouraging clinical data for the Company's lorvotuzumab mertansine (IMGN901) targeted anticancer compound at the 35th European Society for Medical Oncology (ESMO) Conference being held in Milan, Italy, October 8-12, 2010.
Lorvotuzumab mertansine is designed to target and kill cancer cells that express CD56, a protein. This targeted anticancer compound is a potential treatment for Merkel cell carcinoma (MCC), small-cell lung cancer (SCLC), ovarian cancer, multiple myeloma, and other CD56+ tumors. It is wholly owned by ImmunoGen.
Clinical Data Reported
The data reported today are from an early-stage clinical trial evaluating lorvotuzumab mertansine in CD56+ solid tumors. During the dose-escalation phase of the trial, patients with any type of CD56+ solid tumor were eligible for enrollment. In the ongoing expansion phase of the trial, enrollment is limited to patients with MCC, SCLC, or ovarian cancer.
A total of 64 patients with CD56+ solid tumors had been enrolled at the time of data cut-off for presentation. Among these, 45 patients could be quantitatively assessed for changes in overall tumor burden. Thirteen (29%) of these 45 patients had a reduction in tumor volume ranging from 1.3 - 100%, and another 10 patients (22%) had no discernable increase in tumor burden.
Findings in Merkel Cell Carcinoma
Patients with Merkel cell carcinoma are being enrolled in the expansion phase of this trial as promising activity has been reported with lorvotuzumab mertansine for MCC, and the Company is assessing whether to initiate a pivotal trial with the compound for this use.
Metastatic MCC is a rare and aggressive neuroendocrine cancer of the skin. Among patients diagnosed with metastatic MCC, median survival is less than seven months. There are no approved therapies for metastatic MCC, and typically the disease progresses rapidly (within 1 to 2 months) on the therapies currently used.
Thirteen patients with metastatic MCC had been enrolled in the study at the time of data cut off. Five (38%) of these patients had notable clinical benefit:
* 1 patient had a complete response (CR) and has remained disease free for more than 5 years;
* 1 patient had a partial response (PR) that evolved to a CR, and has been disease free for at least 17 months; and
* 3 patients had clinically relevant stable disease for this patient population, remaining on lorvotuzumab mertansine for at least three months.
Findings in Small-Cell Lung Cancer
Twenty-six patients were enrolled with SCLC, which has commonalities with MCC in biological characteristics, clinical course and response to treatments. SCLC tumors generally respond to first-line treatment but then recur. Survival at that stage is usually less than 6 months.1
While all of the SCLC patients enrolled in this trial had cancer that had recurred following treatment with other therapies, three patients had clinically meaningful stable disease and another patient with refractory disease achieved an unconfirmed PR.
ImmunoGen plans to begin a study later this year to assess lorvotuzumab mertansine for first-line treatment of SCLC used in combination with standard care.
"These findings are encouraging in light of the prior treatments these patients have received and the stage of their disease at the time of study entry," commented James O'Leary, MD, Vice President and Chief Medical Officer. "We believe it's important to assess lorvotuzumab mertansine as part of a combination regimen, as cancer is typically treated with several agents with different mechanisms of action. The combination trial planned in SCLC and the one underway in multiple myeloma are expected to be particularly significant to determining the potential opportunity for this compound."
About the Clinical Trial Reported
The patients enrolled at the time of data cut-off for presentation consisted of 26 patients with SCLC, 16 with neuroendocrine tumors, 13 with MCC, and 9 patients with other types of CD56+ solid tumors. The first ovarian patient entered the study after that time.
In the expansion phase of the trial, lorvotuzumab mertansine is being administered at a dose of 60 mg/m²/day for three consecutive days every 21 days.
About Lorvotuzumab Mertansine
Lorvotuzumab mertansine, a TAP compound, consists of a CD56-binding antibody with ImmunoGen's potent cancer-cell killing agent, DM1, attached to it using one of the Company's engineered linkers.
Lorvotuzumab mertansine has been granted orphan drug designation for MCC in the US and Europe. It also has been granted orphan drug status for SCLC in the US and is in the process of receiving this designation in Europe.
About MCC, SCLC and Ovarian Cancer
MCC is an aggressive neuroendocrine cancer of the skin that typically occurs on the head/neck, most often in individuals of European ancestry. There are approximately 1,900 new cases of MCC diagnosed in the US each year, with the incidence considered to be increasing.2 An estimated 28,000 new cases of SCLC are expected to be diagnosed in the US in 2010, and 22,000 new cases of ovarian cancer.3, 4 Based on published literature and Company research, CD56 is expressed on virtually all cases of MCC and SCLC and on approximately 58% of ovarian cancer tumors.
About ImmunoGen, Inc.
ImmunoGen, Inc. develops targeted anticancer therapeutics using the Company's expertise in tumor biology, monoclonal antibodies and potent cancer-cell killing agents. The Company's TAP technology uses monoclonal antibodies to deliver one of ImmunoGen's proprietary cancer-cell killing agents specifically to tumor cells. There are currently seven TAP compounds in the clinic, with a wealth of clinical data reported with the technology. ImmunoGen collaborative partners include Amgen, Bayer Schering Pharma, Biogen Idec, Biotest, Genentech (a member of the Roche Group), Novartis, and sanofi-aventis. The most advanced compound using ImmunoGen's TAP technology, T-DM1, is in Phase III testing through the Company's collaboration with Genentech. More information about ImmunoGen can be found at www.immunogen.com.
Davies A, 2004.
2 Based on incidence data from Agelli M, 2003; Hodgson NC, 2006.
3 American Cancer Society, Cancer Facts & Figures, 2010.
4 American Cancer Society, Guide to small-cell lung cancer, 2010.
This press release includes forward-looking statements. For these statements, ImmunoGen claims the protection of the safe harbor for forward-looking statements provided by the Private Securities Litigation Reform Act of 1995. It should be noted that there are risks and uncertainties related to the development of lorvotuzumab mertansine, including uncertainties around the timing of clinical trials conducted and their results. A review of these risks can be found in ImmunoGen's Annual Report on Form 10-K for the fiscal year ended June 30, 2010 and other reports filed with the Securities and Exchange Commission.
SOURCE: ImmunoGen, Inc.
Ohad Hammer hat den Novartis-Deal und die T-DM1 eingeordnet:
Earlier today, both Immunogen (IMGN) and Exelixis (EXEL) announced two important partnership deals. As with any deal, both companies enjoy an injection of non-dilutive funds as well as a vote of confidence for the companies’ technologies. This time, however, it seems the deals, which could not have come in a better time, represent much more than that.
Immunogen announced a broad licensing deal with Novartis (NVS) which provides the pharma giant with rights to use Immunogen’s antibody drug conjugate (ADC) technology for an undisclosed number of targets. The numbers demonstrate the huge appreciation in the value of Immunogen’s technology compared to several years ago. The deal includes an upfront payment of $45M as well as $200M in milestone payments for every program Novartis chooses to develop. For the sake of comparison, current agreements with Genentech and Sanofi Aventis (SNY) entail milestone payments of in the $20-40 million range.
On top of being one of the world’s largest pharmaceutical companies, Novartis is establishing itself as an antibody powerhouse on the heels of its huge collaboration with Morphosys. The deal is significant for Immunogen not only because of the financial terms but also because it ends a two year drought. During those two years, Seattle Genetics (SGEN) announced multiple collaborations, which led many to conclude that the industry is leaning more towards Seattle Genetics’ ADC technology. Both Seattle Genetics’ and Immunogen’s technologies are now well validated following SGN-35’s and T-DM1’s stellar results in Hodgkin Lymphoma and breast cancer, respectively.
Today’s announcement is coming on the heels of data from the long anticipated trial for T-DM1 in 1st line breast cancer patients. Results were indeed “stunning”, as touted by Roche’s CEO last week. Not only was T-DM1 more effective than chemotherapy and Herceptin combined in terms of tumor shrinkage, it was also much safer and well tolerated. This is the first time T-DM1 is compared directly to an approved regimen and investors can hope the agent performs as well in an ongoing phase III trial vs. another chemo regimen in 2nd line patients.
It is important to note that the ESMO results are still early with more mature data expected next year. It will be interesting to see if there is a difference also in progression-free survival, which is the primary endpoint of an ongoing phase III study in 1st line patients. In other words, in order to get approved for 1st line breast cancer, T-DM1 will have to demonstrate at least comparable PFS.
Although it is too early to tell, it looks like T-DM1 stands a fair chance of beating chemo+Hercetin. Thanks to its excellent safety profile, T-DM1 should have an inherent advantage: In contrast to chemo drugs that are given for a limited number of cycles due to side effects, T-DM1 can theoretically be administered chronically until progression. This is exactly the concept behind antibody drug conjugates – potency of chemotherapy coupled with the safety profile of antibodies.
Earlier today, both Immunogen (IMGN) and Exelixis (EXEL) announced two important partnership deals. As with any deal, both companies enjoy an injection of non-dilutive funds as well as a vote of confidence for the companies’ technologies. This time, however, it seems the deals, which could not have come in a better time, represent much more than that.
Immunogen announced a broad licensing deal with Novartis (NVS) which provides the pharma giant with rights to use Immunogen’s antibody drug conjugate (ADC) technology for an undisclosed number of targets. The numbers demonstrate the huge appreciation in the value of Immunogen’s technology compared to several years ago. The deal includes an upfront payment of $45M as well as $200M in milestone payments for every program Novartis chooses to develop. For the sake of comparison, current agreements with Genentech and Sanofi Aventis (SNY) entail milestone payments of in the $20-40 million range.
On top of being one of the world’s largest pharmaceutical companies, Novartis is establishing itself as an antibody powerhouse on the heels of its huge collaboration with Morphosys. The deal is significant for Immunogen not only because of the financial terms but also because it ends a two year drought. During those two years, Seattle Genetics (SGEN) announced multiple collaborations, which led many to conclude that the industry is leaning more towards Seattle Genetics’ ADC technology. Both Seattle Genetics’ and Immunogen’s technologies are now well validated following SGN-35’s and T-DM1’s stellar results in Hodgkin Lymphoma and breast cancer, respectively.
Today’s announcement is coming on the heels of data from the long anticipated trial for T-DM1 in 1st line breast cancer patients. Results were indeed “stunning”, as touted by Roche’s CEO last week. Not only was T-DM1 more effective than chemotherapy and Herceptin combined in terms of tumor shrinkage, it was also much safer and well tolerated. This is the first time T-DM1 is compared directly to an approved regimen and investors can hope the agent performs as well in an ongoing phase III trial vs. another chemo regimen in 2nd line patients.
It is important to note that the ESMO results are still early with more mature data expected next year. It will be interesting to see if there is a difference also in progression-free survival, which is the primary endpoint of an ongoing phase III study in 1st line patients. In other words, in order to get approved for 1st line breast cancer, T-DM1 will have to demonstrate at least comparable PFS.
Although it is too early to tell, it looks like T-DM1 stands a fair chance of beating chemo+Hercetin. Thanks to its excellent safety profile, T-DM1 should have an inherent advantage: In contrast to chemo drugs that are given for a limited number of cycles due to side effects, T-DM1 can theoretically be administered chronically until progression. This is exactly the concept behind antibody drug conjugates – potency of chemotherapy coupled with the safety profile of antibodies.
Pre-Market 7,75 $ 

Marktreaktion eher etwas mager (hüben wie drüben).
Auch BILD-"Leser" sind derzeit offenbar nicht auf Aktien konditioniert.
Auch BILD-"Leser" sind derzeit offenbar nicht auf Aktien konditioniert.
Antwort auf Beitrag Nr.: 40.298.238 von Nase_weis_nix am 11.10.10 12:42:34Bzgl. Einordnung der Meilensteinzahlung habe ich mich definitiv getäuscht! Es kann pro Ziel bis zu 200.5 Mio USD an Meilensteinzahlungen geben. Das ist beeindruckend!
Die endgültige Bestätigung gab mir der Conference Call:
http://www.immunogen.com/wt/home/home -> Investor Information -> Audio Archives -> Oct.11, 2010 08:30 -> bei 06:19 min wird darauf hingewiesen.
Immunogen gibt ausserdem bekannt, dass die Struktur der Meilensteinzahlung nicht zur Veröffentlichung bestimmt ist. Ebeso ist uns die Höhe der Umsatzbeteiligung unbekannt. Evtl. fällt diese etwas niedriger aus. Von der Deal-Struktur ähnelt die Novartis-Partnerschaft der mit Genentech, nur sind die finanziellen Rahmenbedingungen lt. Immunogen besser.
Lt. Conference Call ist die Durchfinanzierung nicht mehr in Stein gemeißelt. Hier wird ausgesagt, daß die neuen Kooperationseinnahmen verwässernde Kapitalmaßnahmen zumindest abmildern. Es sind schliesslich Studien des Eigengewächses IMGN901 zu finanzieren.
Die endgültige Bestätigung gab mir der Conference Call:
http://www.immunogen.com/wt/home/home -> Investor Information -> Audio Archives -> Oct.11, 2010 08:30 -> bei 06:19 min wird darauf hingewiesen.
Immunogen gibt ausserdem bekannt, dass die Struktur der Meilensteinzahlung nicht zur Veröffentlichung bestimmt ist. Ebeso ist uns die Höhe der Umsatzbeteiligung unbekannt. Evtl. fällt diese etwas niedriger aus. Von der Deal-Struktur ähnelt die Novartis-Partnerschaft der mit Genentech, nur sind die finanziellen Rahmenbedingungen lt. Immunogen besser.
Lt. Conference Call ist die Durchfinanzierung nicht mehr in Stein gemeißelt. Hier wird ausgesagt, daß die neuen Kooperationseinnahmen verwässernde Kapitalmaßnahmen zumindest abmildern. Es sind schliesslich Studien des Eigengewächses IMGN901 zu finanzieren.
Antwort auf Beitrag Nr.: 40.302.482 von Nase_weis_nix am 12.10.10 07:19:56
Danke fürs Mithören und die Infos.
Du darfst die Meilensteine aber gern auch weiterhin als exorbitant bezeichnen. Denn das sind sie, wenn man bedenkt, dass bei Immunogen letztlich keine Kosten für diese Programme anfallen.
Denn das sind sie, wenn man bedenkt, dass bei Immunogen letztlich keine Kosten für diese Programme anfallen.
Man kann das meiner Meinung nach kaum anders deuten, als dass die ADC-Bauer derzeit an einem ganz langen Hebel sitzen.
@Leo, zur Marktreaktion: Ich glaube, die Börse hat mit allem ein Problem, was noch mehr als 1 Jahr in der Zukunft liegt. Bei T-DM1 wird der nächste Zulassungsantrag erst in 2012 erwartet und bis dahin gibt es umfangreiche neue Daten - also auch wieder eine gewisse Unsicherheit. Der Novartis-Vertrag wird - abgesehen von den sehr willkommenen 45 Mio. - erst in einigen Jahren erste Früchte tragen.
Zwar gehe ich davon aus, dass einige (die meisten?) der Antikörper bereits bei Novartis bereit stehen und nicht ganz neu designt werden, dennoch dürfte der Beginn zulassungsrelevanter Studien wohl eher noch mindestens 5 Jahre in der Zukunft liegen - und erst dann rollen vermutlich die großen Meilensteine.
Danke fürs Mithören und die Infos.
Du darfst die Meilensteine aber gern auch weiterhin als exorbitant bezeichnen.
 Denn das sind sie, wenn man bedenkt, dass bei Immunogen letztlich keine Kosten für diese Programme anfallen.
Denn das sind sie, wenn man bedenkt, dass bei Immunogen letztlich keine Kosten für diese Programme anfallen.Man kann das meiner Meinung nach kaum anders deuten, als dass die ADC-Bauer derzeit an einem ganz langen Hebel sitzen.
@Leo, zur Marktreaktion: Ich glaube, die Börse hat mit allem ein Problem, was noch mehr als 1 Jahr in der Zukunft liegt. Bei T-DM1 wird der nächste Zulassungsantrag erst in 2012 erwartet und bis dahin gibt es umfangreiche neue Daten - also auch wieder eine gewisse Unsicherheit. Der Novartis-Vertrag wird - abgesehen von den sehr willkommenen 45 Mio. - erst in einigen Jahren erste Früchte tragen.
Zwar gehe ich davon aus, dass einige (die meisten?) der Antikörper bereits bei Novartis bereit stehen und nicht ganz neu designt werden, dennoch dürfte der Beginn zulassungsrelevanter Studien wohl eher noch mindestens 5 Jahre in der Zukunft liegen - und erst dann rollen vermutlich die großen Meilensteine.
Die Missverständnisse im Hinblick auf die Höhe der Meilensteinzahlungen beruht auf einem Übersetzungsfehler der Nachrichtenagentur Dow Jones, die in Deutschland und in Österreich von allen Medien ungeprüft übernommen worden ist.
Heute früh wurde die Meldung entsprechend korrigiert:
KORREKTUR: Novartis und Immunogen kooperieren bei Krebs-Antikörpern
12.10.2010 - 07:17
(In der am Montag um 10.29 Uhr gesendeten Meldung "Novartis und Immunogen kooperieren bei Krebs-Antikörpern" muss es im 4. Satz des 1. Absatzes korrekt "Meilensteinzahlungen von bis zu 200 Mio USD je Entwicklungsprogramm" heißen. Damit wird klargestellt, dass nicht insgesamt sondern je Entwicklungsprogamm Meilensteinzahlung von bis zu 200 Mio USD fällig werden. Es folgt die korrigierte und ergänzte Fassung.)
Novartis und Immunogen kooperieren bei Krebs-Antikörpern
ZÜRICH (Dow Jones)--Die schweizerische Novartis AG hat einen Kooperationsvertrag mit dem US-Pharmaunternehmen Immunogen unterzeichnet. Gemeinsam wollen die beiden Pharmaunternehmen sogenannte Antibody Drug Conjugates zur Behandlung von Krebs entwickeln, wie Novartis und die Immunogen Inc am Montag mitteilten. Immunogen erhält nach eigenen Angaben von Novartis eine Vorauszahlung von 45 Mio USD für die Gewährung bestimmter Nutzungsrechte. Hinzu kommen Meilensteinzahlungen von bis zu 200 Mio USD je Entwicklungsprogramm sofern bestimmte Ziele erreicht werden. Zur Zahl der Entwicklungsprogramme äußerte sich Immunogen nicht.
Heute früh wurde die Meldung entsprechend korrigiert:
KORREKTUR: Novartis und Immunogen kooperieren bei Krebs-Antikörpern
12.10.2010 - 07:17
(In der am Montag um 10.29 Uhr gesendeten Meldung "Novartis und Immunogen kooperieren bei Krebs-Antikörpern" muss es im 4. Satz des 1. Absatzes korrekt "Meilensteinzahlungen von bis zu 200 Mio USD je Entwicklungsprogramm" heißen. Damit wird klargestellt, dass nicht insgesamt sondern je Entwicklungsprogamm Meilensteinzahlung von bis zu 200 Mio USD fällig werden. Es folgt die korrigierte und ergänzte Fassung.)
Novartis und Immunogen kooperieren bei Krebs-Antikörpern
ZÜRICH (Dow Jones)--Die schweizerische Novartis AG hat einen Kooperationsvertrag mit dem US-Pharmaunternehmen Immunogen unterzeichnet. Gemeinsam wollen die beiden Pharmaunternehmen sogenannte Antibody Drug Conjugates zur Behandlung von Krebs entwickeln, wie Novartis und die Immunogen Inc am Montag mitteilten. Immunogen erhält nach eigenen Angaben von Novartis eine Vorauszahlung von 45 Mio USD für die Gewährung bestimmter Nutzungsrechte. Hinzu kommen Meilensteinzahlungen von bis zu 200 Mio USD je Entwicklungsprogramm sofern bestimmte Ziele erreicht werden. Zur Zahl der Entwicklungsprogramme äußerte sich Immunogen nicht.
Antwort auf Beitrag Nr.: 40.302.527 von SLGramann am 12.10.10 07:43:45"zur Marktreaktion: (...)"
Ja, SLGramann, so ist es wohl. Aus spekulativer Sicht hätte (habe) ich mir aber für Mailand (Kongreß) + Basel (Novartis) Kurse von über 8, Richtung 9 USD erwartet (erhofft), ehe es wieder etwas bröckelt.
Ja, SLGramann, so ist es wohl. Aus spekulativer Sicht hätte (habe) ich mir aber für Mailand (Kongreß) + Basel (Novartis) Kurse von über 8, Richtung 9 USD erwartet (erhofft), ehe es wieder etwas bröckelt.
Wenn man sich die aktuellen US-Märkte ansieht, muß man wohl konstatieren, daß es eigentlich keinen Sinn mehr macht, in Biotechs zu investieren.
Die Kursentwicklung von Immunogen ist zumindest für einen Laien wie mich völlig frustierend. Ich hatte gehofft, hier einen kleineren Posten langfristig über eine größere kurzfristige Spekulation in einem optimalen Umfeld (Gesamtmarkt, attraktive Firmenbewertung, sehr starker, auch unerwarteter Newsflow) zu finanzieren. Diesen Plan sehe ich bereits fast als gescheitert an. Bitter, zumal das Geld zuletzt, selbst bei US-Wechselrichtercashburnern und winzigen dt. Mobilfunkserviceprovidern, auf der Straße lag.
Die Kursentwicklung von Immunogen ist zumindest für einen Laien wie mich völlig frustierend. Ich hatte gehofft, hier einen kleineren Posten langfristig über eine größere kurzfristige Spekulation in einem optimalen Umfeld (Gesamtmarkt, attraktive Firmenbewertung, sehr starker, auch unerwarteter Newsflow) zu finanzieren. Diesen Plan sehe ich bereits fast als gescheitert an. Bitter, zumal das Geld zuletzt, selbst bei US-Wechselrichtercashburnern und winzigen dt. Mobilfunkserviceprovidern, auf der Straße lag.
Antwort auf Beitrag Nr.: 40.308.971 von LeoF am 12.10.10 21:56:56Vielleicht hebt das ja Deine Stimmung:
http://www.fool.com/investing/high-growth/2010/10/12/this-dr…
Irgendwann merkt das auch der Markt.
http://www.fool.com/investing/high-growth/2010/10/12/this-dr…
Irgendwann merkt das auch der Markt.
Die Markttechnik ist aktuell etwas belastend (s. z.B. Put/Call-ratio http://www.marketintellisearch.com/articles/1060690.html). Nach dem Kursanstieg der letzten Tage realisieren viele Trader ihre kurzfristigen Gewinne.
Nach Bereinigung der Markttechnik sollten jedoch wieder Fundamentaldaten an Gewicht gewinnen ... und in dieser Hinsicht sieht die Unternehmensperspektive besser denn ja aus. Eigentlich müsste die Aktie deutlich höher notieren.
Nach Bereinigung der Markttechnik sollten jedoch wieder Fundamentaldaten an Gewicht gewinnen ... und in dieser Hinsicht sieht die Unternehmensperspektive besser denn ja aus. Eigentlich müsste die Aktie deutlich höher notieren.
Ich will den Thread nicht mit Klagen & Lamentieren eines wider jede Vernunft zu groß und riskant angegangenen Investments zumüllen, zumal jedem Leser anno 2010 sicher klar ist, daß sich Geld leider nirgendwo so schnell verflüchtigt wie hier und das Wörtchen "eigentlich" im Zusammenhang mit Biotechs eines der Allerallerteuersten überhaupt sein kann. An dem Völkchen der Trader (die sich in diesen Tagen vor Arbeit & Glück nicht retten können) liegt es wohl weniger als an dem offenbar auf lange Zeit in andere Gefilde abgewanderten Volksstamm der Investoren.
Interessant, gerade gesehen: Roche testet T-DM1 nun auch als adjuvante bzw. neoadjuvante Therapie in frühen Tumorstadien. Dies untermauert die Absicht, das Immunkonjugat auf längere Sicht bei sämtlichen HER2-positiven Brusttumoren einzusetzen (und damit Herceptin vollständig durch T-DM1 zu ersetzen).
http://www.clinicaltrials.gov/ct2/show/NCT01196052?term=Roch…
http://www.clinicaltrials.gov/ct2/show/NCT01196052?term=Roch…
Ich hatte heute die Möglichkeit, die ausführliche ESMO-Präsentation zu T-DM1 durchzusehen (insgesamt 42 Seiten). Nach der ersten Durchsicht bin ich insoweit etwas enttäuscht, als sich mir der Eindruck aufdrängt, dass über die Studienergebnisse in den Pressemitteilungen der Roche AG/Immunogen Inc. etwas zu einseitig (positiv) berichtet worden ist. Betrachtet man nämlich das gesamte Datenmaterial, so scheint es zum derzeitigen Zeitpunkt völlig offen, welcher therapeutische Ansatz (T-DM1 versus Trastuzumab + Docetaxel) bei HER2-positiven, metastasierendem Mamma-Ca tatsächlich der bessere ist.
Auch wenn ich Immunogen´s TAP-Technologie für sehr aussichtsreich halte, wird mich dies nicht hindern, morgen im Sinne einer ausgewogenen Argumentation einige kritische Anmerkungen zu den Studienergebnissen nachzureichen. Heute ist es schon zu spät.
Auch wenn ich Immunogen´s TAP-Technologie für sehr aussichtsreich halte, wird mich dies nicht hindern, morgen im Sinne einer ausgewogenen Argumentation einige kritische Anmerkungen zu den Studienergebnissen nachzureichen. Heute ist es schon zu spät.
Nachfolgend einige (kritische) Anmerkungen zur IMGN-Meldung vom 8.12.2010:
Die Aussage „The objective response rate for patients treated with T-DM1 was 47.8%, compared to 41.4% for patients treated with Herceptin plus chemotherapy” hätte man eigentlich dahingehend ergänzen müssen, dass die clinical benefit rate ( = "objective response" plus "maintained stable disease for at last 6 month") in der Kontrollgruppe mit 57,1 % leicht größer war als in der T-DM1-Gruppe (55,2 %). Entsprechend kam es unter T-DM1 häufiger zu einer Progression der Erkrankung (11,9 %) als in der Kontrollgruppe (5,7 %).
Nun handelt es sich bislang um ein recht übersichtliches Kollektiv, so dass sich in der Bewertung noch einiges verschieben kann. Zum jetzigen Zeitpunkt erscheinen beide Therapien hinsichtlich der Effektivität in etwa gleichwertig, ein alleiniger Hinweis auf die objective response ist mir jedoch zu einseitig (bzw. tendenziös).
Hinsichtlich der Nebenwirkungen heißt es in der IMGN-Meldung: „Of particular note, the incidence of more serious side effects (Grade 3 and higher) reported with T-DM1 was approximately half of that reported with trastuzumab plus docetaxel (37% vs. 75%, respectively), with no increased risk of cardiotoxicity. There were no new safety-signals reported with T-DM1 in this trial compared with earlier T-DM1 clinical studies”.
In diesem Zusammenhang hätte man meines Erachtens fairerweise darauf hinweisen müssen, dass ein Großteil der in der Kontrollgruppe beobachteten Nebenwirkungen der Schweregrade 3 und 4 Neutropenien (bei 52,9 % aller Patientinnen) waren, die sich gewöhnlich recht gut durch die routinemäßige Gabe eines G-CSF-Agonisten wie z.B. Pegfilgrastim vermeiden lassen (der Nachteil einer Pegfilgrastim-Gabe besteht insbesondere in deren hohen Kosten). Nicht erwähnt wurde in der Meldung darüber hinaus, dass unter T-DM1 gehäuft schwere Thrombopenien (Grad 3) und hepatische Dysfunktionen (ebenfalls Schweregrad 3) aufgetreten sind. Insgesamt war die Häufigkeit besonders schwerer Nebenwirkungen (Kriterien: lebensbedrohlich, eine Hospitalisierung erfordernd usw.) in der T-DM1-Gruppe mit 19,4 % nicht wesentlich geringer als in der Vergleichsgruppe (22,1 %).
Dass die Behandlung mit T-DM1, wie in der Meldung wieder explizit erwähnt, nur in 1,5 % der Fälle zu Haarausfall geführt hat (Kontrollgruppe: 66,2 %), ist ein positiver Nebeneffekt, für die Behandlungsstrategie aber nicht von Bedeutung ist.
Fazit: In der IMGN-Meldung finden sich zwar keine falschen Angaben, aus meiner Sicht ist sie jedoch zu einseitig formuliert. Die Aussage des Roche CEO (s. Reuters-Meldung vom 8.10.2010) „I think the T-DM1 results are stunning“ erscheinen mir bei Durchsicht des gesamten Datensatzes zum jetzigen Zeitpunkt verfrüht (wobei es natürlich immer auf den Blickwinkel ankommt, d.h. welche Erwartungen man mit einem neuen Medikament verbindet). Ich selbst halte T-DM1 nach wie vor für sehr aussichtsreich, ob sich T-DM1 als Erstlinientherapie durchsetzen wird, dürfte vor dem Hintergrund des umfangreicheren Datenmaterials jedoch noch völlig offen sein.
Im Hinblick auf die zweite beim ESMO-Meeting vorgestellte T-DM1-Studie nur kurz folgende Anmerkung: In der Studie mit dem Titel „A phase 2 study of the HER2 antibody-drug conjugate trastuzumab-DM1 (T-DM1) in patients (pts) with HER2-positive metastatic breast cancer (MBC) previously treated with trastuzumab, lapatinib, and chemotherapy“ wurden insgesamt 110 Patientinnen behandelt, von denen 95 Patientinnen in einer retrospektiven (im Roche-Forschungszentrum) zentral durchgeführten Untersuchung noch einmal hinsichtlich ihres HER2-Status überprüft worden sind. Überraschend für mich war, dass von diesen 95 Patientinnen offensichtlich nur 80 Patientinnen tatsächlich als HER2-positiv validiert werden konnten. Dies wirft die Frage auf, wie genau die üblichen Bestimmungen des HER2-Status überhaupt sind. Da kann man betroffenen Patientinnen nur wünschen, dass sie in einem qualifizierten Zentrum untersucht werden.
Interessant ist weiterhin, dass die Studienergebnisse in wesentlichen Punkten (response rates, clinical benefit rate) bei Auswertung durch einen „Investigator“ um bis zu 6,3 Prozentpunkten von denjenigen Ergebnissen abweichen, die durch eine „independent review facility“ erhobent worden sind. Dies führt einem mal wieder in Erinnerung, wie schwer es oft ist, tatsächlich valide (objektive) Daten zu erhalten.
Lobenswert ist, dass die Roche AG ihre Studiendaten auf Kongressen sehr transparent kommuniziert! Bei der gestrigen Analystenkonferenz hat man es sich jedoch – wie auch IMGN in der oben zitierten Meldung – zu leicht gemacht, indem man in einer Übersicht ausschließlich die für T-DM1 positiven Aspekte der jüngsten Studie präsentiert hat (objective response, Anzahl der Nebenwirkungen, selektives Auflisten der für die Kontrollgruppe spezifischen Nebenwirkungen wie Haarausfall, Neutropenie und Durchfall), ohne jedoch die für T-DM1 spezifischen Nebenwirkungen oder andere negative Aspekte zu erwähnen.
Insgesamt ist es immer wieder lehrreich, Publikationen in den Wirtschaftsmedien mit den ihnen zugrunde liegenden wissenschaftlichen Veröffentlichungen und Datensammlungen zu vergleichen und letztere besonders sorgfältig zu studieren. So lässt sich erkennen, dass oft leider nicht unbedingt mit der erhofften Objektivität berichtet wird und bereits bei der Studienauswertung gewisse Ermessensspielräume bestehen. Insoweit ist es bedauerlich, dass z.B. die Bundesregierung gegenwärtig weitgehend neutrale Institutionen wie das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (wissentlich) schwächt.
Die Aussage „The objective response rate for patients treated with T-DM1 was 47.8%, compared to 41.4% for patients treated with Herceptin plus chemotherapy” hätte man eigentlich dahingehend ergänzen müssen, dass die clinical benefit rate ( = "objective response" plus "maintained stable disease for at last 6 month") in der Kontrollgruppe mit 57,1 % leicht größer war als in der T-DM1-Gruppe (55,2 %). Entsprechend kam es unter T-DM1 häufiger zu einer Progression der Erkrankung (11,9 %) als in der Kontrollgruppe (5,7 %).
Nun handelt es sich bislang um ein recht übersichtliches Kollektiv, so dass sich in der Bewertung noch einiges verschieben kann. Zum jetzigen Zeitpunkt erscheinen beide Therapien hinsichtlich der Effektivität in etwa gleichwertig, ein alleiniger Hinweis auf die objective response ist mir jedoch zu einseitig (bzw. tendenziös).
Hinsichtlich der Nebenwirkungen heißt es in der IMGN-Meldung: „Of particular note, the incidence of more serious side effects (Grade 3 and higher) reported with T-DM1 was approximately half of that reported with trastuzumab plus docetaxel (37% vs. 75%, respectively), with no increased risk of cardiotoxicity. There were no new safety-signals reported with T-DM1 in this trial compared with earlier T-DM1 clinical studies”.
In diesem Zusammenhang hätte man meines Erachtens fairerweise darauf hinweisen müssen, dass ein Großteil der in der Kontrollgruppe beobachteten Nebenwirkungen der Schweregrade 3 und 4 Neutropenien (bei 52,9 % aller Patientinnen) waren, die sich gewöhnlich recht gut durch die routinemäßige Gabe eines G-CSF-Agonisten wie z.B. Pegfilgrastim vermeiden lassen (der Nachteil einer Pegfilgrastim-Gabe besteht insbesondere in deren hohen Kosten). Nicht erwähnt wurde in der Meldung darüber hinaus, dass unter T-DM1 gehäuft schwere Thrombopenien (Grad 3) und hepatische Dysfunktionen (ebenfalls Schweregrad 3) aufgetreten sind. Insgesamt war die Häufigkeit besonders schwerer Nebenwirkungen (Kriterien: lebensbedrohlich, eine Hospitalisierung erfordernd usw.) in der T-DM1-Gruppe mit 19,4 % nicht wesentlich geringer als in der Vergleichsgruppe (22,1 %).
Dass die Behandlung mit T-DM1, wie in der Meldung wieder explizit erwähnt, nur in 1,5 % der Fälle zu Haarausfall geführt hat (Kontrollgruppe: 66,2 %), ist ein positiver Nebeneffekt, für die Behandlungsstrategie aber nicht von Bedeutung ist.
Fazit: In der IMGN-Meldung finden sich zwar keine falschen Angaben, aus meiner Sicht ist sie jedoch zu einseitig formuliert. Die Aussage des Roche CEO (s. Reuters-Meldung vom 8.10.2010) „I think the T-DM1 results are stunning“ erscheinen mir bei Durchsicht des gesamten Datensatzes zum jetzigen Zeitpunkt verfrüht (wobei es natürlich immer auf den Blickwinkel ankommt, d.h. welche Erwartungen man mit einem neuen Medikament verbindet). Ich selbst halte T-DM1 nach wie vor für sehr aussichtsreich, ob sich T-DM1 als Erstlinientherapie durchsetzen wird, dürfte vor dem Hintergrund des umfangreicheren Datenmaterials jedoch noch völlig offen sein.
Im Hinblick auf die zweite beim ESMO-Meeting vorgestellte T-DM1-Studie nur kurz folgende Anmerkung: In der Studie mit dem Titel „A phase 2 study of the HER2 antibody-drug conjugate trastuzumab-DM1 (T-DM1) in patients (pts) with HER2-positive metastatic breast cancer (MBC) previously treated with trastuzumab, lapatinib, and chemotherapy“ wurden insgesamt 110 Patientinnen behandelt, von denen 95 Patientinnen in einer retrospektiven (im Roche-Forschungszentrum) zentral durchgeführten Untersuchung noch einmal hinsichtlich ihres HER2-Status überprüft worden sind. Überraschend für mich war, dass von diesen 95 Patientinnen offensichtlich nur 80 Patientinnen tatsächlich als HER2-positiv validiert werden konnten. Dies wirft die Frage auf, wie genau die üblichen Bestimmungen des HER2-Status überhaupt sind. Da kann man betroffenen Patientinnen nur wünschen, dass sie in einem qualifizierten Zentrum untersucht werden.
Interessant ist weiterhin, dass die Studienergebnisse in wesentlichen Punkten (response rates, clinical benefit rate) bei Auswertung durch einen „Investigator“ um bis zu 6,3 Prozentpunkten von denjenigen Ergebnissen abweichen, die durch eine „independent review facility“ erhobent worden sind. Dies führt einem mal wieder in Erinnerung, wie schwer es oft ist, tatsächlich valide (objektive) Daten zu erhalten.
Lobenswert ist, dass die Roche AG ihre Studiendaten auf Kongressen sehr transparent kommuniziert! Bei der gestrigen Analystenkonferenz hat man es sich jedoch – wie auch IMGN in der oben zitierten Meldung – zu leicht gemacht, indem man in einer Übersicht ausschließlich die für T-DM1 positiven Aspekte der jüngsten Studie präsentiert hat (objective response, Anzahl der Nebenwirkungen, selektives Auflisten der für die Kontrollgruppe spezifischen Nebenwirkungen wie Haarausfall, Neutropenie und Durchfall), ohne jedoch die für T-DM1 spezifischen Nebenwirkungen oder andere negative Aspekte zu erwähnen.
Insgesamt ist es immer wieder lehrreich, Publikationen in den Wirtschaftsmedien mit den ihnen zugrunde liegenden wissenschaftlichen Veröffentlichungen und Datensammlungen zu vergleichen und letztere besonders sorgfältig zu studieren. So lässt sich erkennen, dass oft leider nicht unbedingt mit der erhofften Objektivität berichtet wird und bereits bei der Studienauswertung gewisse Ermessensspielräume bestehen. Insoweit ist es bedauerlich, dass z.B. die Bundesregierung gegenwärtig weitgehend neutrale Institutionen wie das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (wissentlich) schwächt.
Vielen Dank für diese ausführlichen, sachlich-kritischen Anmerkungen. Das dämpft meine Begeisterung über Folie 66 der Präsentation etwas (downloadbar bei http://www.roche.com/investors/ir_agenda/q3-2009.htm), auf die Du vermutlich angespielt hast und die gestern noch zu einem schwunghaften Handel in den USA führte.
Angesichts der bisher sehr kleinen Testgruppen ist sowieso Vorsicht geboten. Auch Studienauswertung ist ein weites Feld.
Viele Grüße!!
Angesichts der bisher sehr kleinen Testgruppen ist sowieso Vorsicht geboten. Auch Studienauswertung ist ein weites Feld.
Viele Grüße!!
Antwort auf Beitrag Nr.: 40.329.159 von LeoF am 15.10.10 13:40:05Nein, ich meinte Seite 20 der gestrigen Präsentation, auf der die T-DM1 Ergebnisse (in geschönter Form) zusammengefasst worden sind.
Nur sehe ich gerade zu meiner größten Überraschung, dass die gestrige Präsentation (122 Seiten) durch eine neue Präsentation (129 Seiten) ersetzt worden ist, in der die von mir beanstandete Abbildung entfernt worden ist. Das gibt´s doch nicht! Muss mal in Ruhe schauen, was sonst noch Korrekturen durchgeführt worden ist.
Nur sehe ich gerade zu meiner größten Überraschung, dass die gestrige Präsentation (122 Seiten) durch eine neue Präsentation (129 Seiten) ersetzt worden ist, in der die von mir beanstandete Abbildung entfernt worden ist. Das gibt´s doch nicht! Muss mal in Ruhe schauen, was sonst noch Korrekturen durchgeführt worden ist.
Antwort auf Beitrag Nr.: 40.329.159 von LeoF am 15.10.10 13:40:05Ok, Fehler geklärt: Dein Link führte zur vorjährigen Q3-Präsentation!
Ich bezog mich u.a. auf S.20 der gestrigen Präsentation.
Ich bezog mich u.a. auf S.20 der gestrigen Präsentation.
@LeoF
Hier kannst Du die Unterlagen zur gestrigen Konferenz laden:
http://www.roche.com/investors/ir_agenda/q3-2010.htm
Hier kannst Du die Unterlagen zur gestrigen Konferenz laden:
http://www.roche.com/investors/ir_agenda/q3-2010.htm
Sorry, da ist mir in der Eile einiges durcheinandergeraten: auch ich meinte natürlich die Folie 20 (T-DM1 vs. Herceptin + docetaxel in Breast Cancer). Lag daran, daß ich mich mit meinen Ausdrucken und einem Word-Dokument mit den dazugehörigen links vertan habe.
Das GAP aus dem irrationalen Ausverkauf Ende August (Kursverfall bis zu Kursen unter 5 USD !!) hat sich nunmehr wie erwartet geschlossen.
Die letzte KP-Erhöhung wurde kurz vor dem Kurssturz zu einem Bezugskurs von 8 USD - also exakt auf dem derzeitigen Kursniveau - durchgeführt. Ich vermute, dass viele der Investoren, die zu 8 USD IMGN-Aktien gezeichnet und bis heute durchgehalten haben, nach dieser Tal- und Bergfahrt erleichtert sind, das Investment ohne Verluste beenden zu können (das wäre jedenfalls ein typischer Reflex institutioneller Anleger). Insoweit erwarte ich, dass der Kurs nun erst einmal im Bereich um 8 USD herumdümpeln wird, bis der Markt entsprechend bereinigt ist.
Der weitere Kursverlauf dürfte dann von neuen Studiendaten (z.B San Antonio Brust Cancer Symposium) beeinflusst werden.
Die letzte KP-Erhöhung wurde kurz vor dem Kurssturz zu einem Bezugskurs von 8 USD - also exakt auf dem derzeitigen Kursniveau - durchgeführt. Ich vermute, dass viele der Investoren, die zu 8 USD IMGN-Aktien gezeichnet und bis heute durchgehalten haben, nach dieser Tal- und Bergfahrt erleichtert sind, das Investment ohne Verluste beenden zu können (das wäre jedenfalls ein typischer Reflex institutioneller Anleger). Insoweit erwarte ich, dass der Kurs nun erst einmal im Bereich um 8 USD herumdümpeln wird, bis der Markt entsprechend bereinigt ist.
Der weitere Kursverlauf dürfte dann von neuen Studiendaten (z.B San Antonio Brust Cancer Symposium) beeinflusst werden.
Damit erweitert sich auch die Indikationsbreite und das Marktpotential von T-DM1:
Roche bekommt auch US-Zulassung für Herceptin bei Magenkrebs
21.10.2010 - 07:28
BASEL (Dow Jones)--Der schweizerische Pharmakonzern Roche hat von der US-Gesundheitsbehörde FDA die Zulassung für Herceptin bei Patienten mit metastasierenden HER2-positiven Magenkrebs bekommen. Die US-amerikanische Food and Drug Administration (FDA) hat nach einer Mitteilung der Schweizer vom Donnerstagmorgen Herceptin (Trastuzumab) in Kombination mit Chemotherapie bei metastasierendem, HER2-positivem Magenkrebs oder Krebs im Bereich des Übergangs von der Speiseröhre zum Magen bei Patienten zugelassen, deren fortgeschrittene Erkrankung zuvor noch nicht mit Medikamenten behandelt wurde.
Im Januar 2010 erteilte die Europäische Kommission bereits die Zulassung für Herceptin in Kombination mit einer Chemotherapie für die Anwendung bei Patienten mit HER2- positivem, metastasierendem Magenkrebs. Die US-Zulassung stützt sich laut Roche auf positive Resultate der Phase-III-Studie ToGA. Diese Studie habe gezeigt hat, dass Patienten, die mit Herceptin plus Chemotherapie behandelt wurden, länger lebten als die Patienten, die nur eine Chemotherapie erhielten.
Roche bekommt auch US-Zulassung für Herceptin bei Magenkrebs
21.10.2010 - 07:28
BASEL (Dow Jones)--Der schweizerische Pharmakonzern Roche hat von der US-Gesundheitsbehörde FDA die Zulassung für Herceptin bei Patienten mit metastasierenden HER2-positiven Magenkrebs bekommen. Die US-amerikanische Food and Drug Administration (FDA) hat nach einer Mitteilung der Schweizer vom Donnerstagmorgen Herceptin (Trastuzumab) in Kombination mit Chemotherapie bei metastasierendem, HER2-positivem Magenkrebs oder Krebs im Bereich des Übergangs von der Speiseröhre zum Magen bei Patienten zugelassen, deren fortgeschrittene Erkrankung zuvor noch nicht mit Medikamenten behandelt wurde.
Im Januar 2010 erteilte die Europäische Kommission bereits die Zulassung für Herceptin in Kombination mit einer Chemotherapie für die Anwendung bei Patienten mit HER2- positivem, metastasierendem Magenkrebs. Die US-Zulassung stützt sich laut Roche auf positive Resultate der Phase-III-Studie ToGA. Diese Studie habe gezeigt hat, dass Patienten, die mit Herceptin plus Chemotherapie behandelt wurden, länger lebten als die Patienten, die nur eine Chemotherapie erhielten.
IMGN dümpelt wie erwartet seit Tagen im Bereich von 8 USD vor sich hin. Die Bereinigung (Stichwort "KP-Maßnahme") läuft noch.
Die nächsten bedeutsamen Events:
4.-7.12.2010 ASH-Meeting
8.-12.12.2010 San Antonio Breast Cancer Symposium
Die nächsten bedeutsamen Events:
4.-7.12.2010 ASH-Meeting
8.-12.12.2010 San Antonio Breast Cancer Symposium
Ein etwas weniger bedeutsames Event findet nächste Woche in Boston statt:
http://www.adc-summit.com
http://www.adc-summit.com
Antwort auf Beitrag Nr.: 40.375.203 von EPPI25 am 22.10.10 16:55:39
Unter allgemein wissenschaftlichen Gesichtspunkten (Linker-Technologien, Optimieren von Immunkonjugaten, Grundlagenforschung etc.) ist der von Dir genannte Kongress sicherlich mit am interessantesten (auch wenn er den IMGN-Kurs vermutlich wohl eher nicht beeinflussen wird). Von meinen Favoriten ist dort auch Biotest durch den Leiter der präklinischen Biotherapeutika-Entwicklung vertreten (wird dort über den BT-062 referieren). Das Kongressprogramm ist auf den einschlägigen Internetseiten abrufbar.
Unter allgemein wissenschaftlichen Gesichtspunkten (Linker-Technologien, Optimieren von Immunkonjugaten, Grundlagenforschung etc.) ist der von Dir genannte Kongress sicherlich mit am interessantesten (auch wenn er den IMGN-Kurs vermutlich wohl eher nicht beeinflussen wird). Von meinen Favoriten ist dort auch Biotest durch den Leiter der präklinischen Biotherapeutika-Entwicklung vertreten (wird dort über den BT-062 referieren). Das Kongressprogramm ist auf den einschlägigen Internetseiten abrufbar.
Da der Conference Call gerade etwas langatmig ist, kurz eine Übersicht über die Immunogen-Pipeline (incl. Partnerprogrammen). Bis Ende 2011 sollen sich 12 Präparate in der klinischen Studienphase befinden.
Our Proprietary Product Candidates - Highlights
IMGN901 (lorvotuzumab mertansine) - in clinical testing for treatment of CD56+ solid tumors and multiple myeloma.
* Updated clinical data were presented at the ESMO annual meeting in October 2010, including encouraging results for the treatment of Merkel cell carcinoma (MCC). By the end of 2010, the Company expects to make a go/no go decision related to initiating a pivotal trial with IMGN901 in MCC. IMGN901 has been granted orphan drug status for MCC in the US and Europe.
* A Phase I/II trial to assess IMGN901 for 1st-line treatment of small-cell lung cancer (SCLC), used in combination with standard care, is on track to be initiated by late 2010. IMGN901 has been granted orphan drug status for SCLC in the US and Europe.
* The first clinical data for IMGN901 used in combination with Revlimid(R) (lenalidomide)/dexamethasone for the treatment of multiple myeloma (MM) are expected to be presented at ASH in December 2010. Updated clinical data with the compound used as monotherapy in MM also are expected to be presented at ASH.
IMGN388 - in clinical testing for treatment of solid tumors.
* Updated clinical findings from early-stage testing have been accepted for presentation at the EORTC-NCI-AACR meeting in November 2010.
IMGN529 - in preclinical development for types of liquid tumors.
* The Company expects to report the first preclinical data with IMGN529 in 1H2011.
* ImmunoGen expects to submit an IND for this TAP compound in mid-2011.
IMGN853 - in preclinical development for types of solid tumors.
* This TAP compound targets folate receptor 1 (FOLR1) and is a potential treatment for ovarian cancer and several other epithelial malignancies.
* Preclinical data related to targeting FOLR1 with TAP compounds will be presented at the EORTC-NCI-AACR meeting in November 2010.
* ImmunoGen expects to submit an IND for IMGN853 in 2012.
Partner Product Candidates - Highlights
Trastuzumab-DM1 (T-DM1) - in global development by Roche for treatment of HER2+ breast cancer (BC).
* Phase III trial, EMILIA, assessing T-DM1 for 2nd-line use in advanced HER2+ BC - study protocol is being revised to add overall survival as a co-primary endpoint and to increase the study size to 980 patients. Roche expects to apply for marketing approval of T-DM1 in the US and Europe with this study in mid-2012.
* Phase III trial, MARIANNE, assessing T-DM1 for 1st-line use in advanced HER2+ BC - study was initiated in July 2010.
* Phase II trial assessing T-DM1 for 1st-line use in advanced HER2+ BC - positive interim data were presented at ESMO in October 2010 with final data expected in 2Q2011.
* Phase Ib/II trial assessing T-DM1 used in combination with pertuzumab - Roche expects new data from this study to be reported at SABCS in December 2010.
* Phase II safety study assessing T-DM1 for adjuvant/neoadjuvant therapy - patient enrollment has begun.
SAR3419, SAR650984, and SAR566658 - in development by sanofi-aventis as a result of a previous research collaboration with ImmunoGen.
* Sanofi-aventis is planning to further expand its Phase I evaluation of SAR3419 with the intent of starting its Phase II program in 2H2011.
* SAR650984, a therapeutic antibody (non-TAP compound), advanced into clinical testing in June 2010 for the treatment of certain hematological malignancies.
* SAR566658 entered the clinic in September 2010 for the treatment of CA6+ solid tumors, which include ovarian, breast and lung cancers.
Other partner compounds
* BT-062 - in line with the development plan, Biotest is now evaluating a more frequent dosing schedule in a Phase I/IIa trial. Additional findings from its first Phase I study have been accepted for presentation at ASH in December 2010.
* BIIB015 - Biogen Idec expects this TAP compound to enter Phase II in 2H2011.
* ImmunoGen expects 2-3 additional TAP compounds to enter the clinic in 2011 through the Company's collaborative partners.
Our Proprietary Product Candidates - Highlights
IMGN901 (lorvotuzumab mertansine) - in clinical testing for treatment of CD56+ solid tumors and multiple myeloma.
* Updated clinical data were presented at the ESMO annual meeting in October 2010, including encouraging results for the treatment of Merkel cell carcinoma (MCC). By the end of 2010, the Company expects to make a go/no go decision related to initiating a pivotal trial with IMGN901 in MCC. IMGN901 has been granted orphan drug status for MCC in the US and Europe.
* A Phase I/II trial to assess IMGN901 for 1st-line treatment of small-cell lung cancer (SCLC), used in combination with standard care, is on track to be initiated by late 2010. IMGN901 has been granted orphan drug status for SCLC in the US and Europe.
* The first clinical data for IMGN901 used in combination with Revlimid(R) (lenalidomide)/dexamethasone for the treatment of multiple myeloma (MM) are expected to be presented at ASH in December 2010. Updated clinical data with the compound used as monotherapy in MM also are expected to be presented at ASH.
IMGN388 - in clinical testing for treatment of solid tumors.
* Updated clinical findings from early-stage testing have been accepted for presentation at the EORTC-NCI-AACR meeting in November 2010.
IMGN529 - in preclinical development for types of liquid tumors.
* The Company expects to report the first preclinical data with IMGN529 in 1H2011.
* ImmunoGen expects to submit an IND for this TAP compound in mid-2011.
IMGN853 - in preclinical development for types of solid tumors.
* This TAP compound targets folate receptor 1 (FOLR1) and is a potential treatment for ovarian cancer and several other epithelial malignancies.
* Preclinical data related to targeting FOLR1 with TAP compounds will be presented at the EORTC-NCI-AACR meeting in November 2010.
* ImmunoGen expects to submit an IND for IMGN853 in 2012.
Partner Product Candidates - Highlights
Trastuzumab-DM1 (T-DM1) - in global development by Roche for treatment of HER2+ breast cancer (BC).
* Phase III trial, EMILIA, assessing T-DM1 for 2nd-line use in advanced HER2+ BC - study protocol is being revised to add overall survival as a co-primary endpoint and to increase the study size to 980 patients. Roche expects to apply for marketing approval of T-DM1 in the US and Europe with this study in mid-2012.
* Phase III trial, MARIANNE, assessing T-DM1 for 1st-line use in advanced HER2+ BC - study was initiated in July 2010.
* Phase II trial assessing T-DM1 for 1st-line use in advanced HER2+ BC - positive interim data were presented at ESMO in October 2010 with final data expected in 2Q2011.
* Phase Ib/II trial assessing T-DM1 used in combination with pertuzumab - Roche expects new data from this study to be reported at SABCS in December 2010.
* Phase II safety study assessing T-DM1 for adjuvant/neoadjuvant therapy - patient enrollment has begun.
SAR3419, SAR650984, and SAR566658 - in development by sanofi-aventis as a result of a previous research collaboration with ImmunoGen.
* Sanofi-aventis is planning to further expand its Phase I evaluation of SAR3419 with the intent of starting its Phase II program in 2H2011.
* SAR650984, a therapeutic antibody (non-TAP compound), advanced into clinical testing in June 2010 for the treatment of certain hematological malignancies.
* SAR566658 entered the clinic in September 2010 for the treatment of CA6+ solid tumors, which include ovarian, breast and lung cancers.
Other partner compounds
* BT-062 - in line with the development plan, Biotest is now evaluating a more frequent dosing schedule in a Phase I/IIa trial. Additional findings from its first Phase I study have been accepted for presentation at ASH in December 2010.
* BIIB015 - Biogen Idec expects this TAP compound to enter Phase II in 2H2011.
* ImmunoGen expects 2-3 additional TAP compounds to enter the clinic in 2011 through the Company's collaborative partners.
So, nun hat IMGN offensichtlich die Seitwärtskonsolidierung verlassen, aktuell 8,45 USD (+ 5 %).
Antwort auf Beitrag Nr.: 40.328.774 von Joschka Schröder am 15.10.10 12:57:21
Hi JS,
mit Verspätung vielen Dank für die kritischen Anmerkungen zu den ESMO-Daten.
Das erinnert uns daran, diese Daten generell nicht zu überschätzen. Sie sind eben nur vorläufig.
Primäre Endpunkte sind PFS und in letzter Konsequenz OS. Zu beiden Zielpunkten gibt es noch überhaupt keine Daten.
Erst im April 2011 wird sich zeigen, ob T-DM1 ein verlängertes oder zumindest gleichwertiges PFS bieten kann.
Sollte dieser Endpunkt verfehlt werden (und das ist nach wie vor zumindest im Bereich des Möglichen), dann wars das zunächst mit T-DM1.
Der vorsichtige Investor wird daher seine Depotposition begrenzen.
So sehe ich das.
Viele Grüße
Hi JS,
mit Verspätung vielen Dank für die kritischen Anmerkungen zu den ESMO-Daten.
Das erinnert uns daran, diese Daten generell nicht zu überschätzen. Sie sind eben nur vorläufig.
Primäre Endpunkte sind PFS und in letzter Konsequenz OS. Zu beiden Zielpunkten gibt es noch überhaupt keine Daten.
Erst im April 2011 wird sich zeigen, ob T-DM1 ein verlängertes oder zumindest gleichwertiges PFS bieten kann.
Sollte dieser Endpunkt verfehlt werden (und das ist nach wie vor zumindest im Bereich des Möglichen), dann wars das zunächst mit T-DM1.
Der vorsichtige Investor wird daher seine Depotposition begrenzen.
So sehe ich das.
Viele Grüße
Anbei der conference-call in Schriftform, für alle "american slang" Geplagten wie mich
http://seekingalpha.com/article/233208-immunogen-ceo-discuss…
Frdl Grüsse,
StefanR
http://seekingalpha.com/article/233208-immunogen-ceo-discuss…
Frdl Grüsse,
StefanR
Ein aus meiner Sicht besonders erfreuliches Ergebnis des CC war, dass bis zum geplanten Markteintritt des T-DM1 keine Kapitalmaßnahmen mehr geplant sind, mithin kein Verwässerungseffekt zu befürchten.
"We expect to end the year on June 30, 2011 would between $106 million and $110 million in cash and marketable security. We believe this is sufficient to fund our operations well into the second half about 2013 fiscal year."
"We expect to end the year on June 30, 2011 would between $106 million and $110 million in cash and marketable security. We believe this is sufficient to fund our operations well into the second half about 2013 fiscal year."
Betrifft Poster 235/ 22.EORTC NCI Symposium
http://poster-submission.com/search/sresult/220
Antibody–maytansinoid conjugates (AMCs) targeting cancer cell-surface antigens are in clinical trials against several cancers. The AMCs in the clinic employ disulfide- or thioether-bonds to link cytotoxic maytansinoid molecules to the antibody. In pre-clinical models, disulfide-linked AMCs demonstrate superior in vivo activity compared to thioether-linked conjugates for several reasons including bystander killing. Cancer cells can be multi-drug resistant due to overexpression of drug efflux transporters such as MDR1. A goal of this study was to enhance the potency of disulfide-linked conjugates against multidrug-resistant cancer cells. Since MDR1 favors neutral substrates, we hypothesized that the incorporation of a negatively-charged sulfonate group in the disulfide linker would improve retention of the polar metabolite inside the cell and enhance conjugate potency to MDR1-expressing cells. We compared the cytotoxic potencies of disulfide-linked anti-EpCAM AMCs with a neutral linker (SPDB) and a negatively-charged linker (sulfo-SPDB) in several EpCAM-expressing cells with different levels of MDR1. The conjugates had similar cytotoxicities toward MDR1-negative cells, but the sulfo-SPDB conjugate was 10‐ to 30‐fold more potent than the SPDB conjugate toward MDR1-positive COLO 205MDR and HCT‐15 cells. An MDR1 inhibitor enhanced the cytotoxic potency of the SPDB conjugate to a level similar to that of the sulfo-SPDB conjugate. The sulfo-SPDB linker allowed preparation of AMCs with high numbers of maytansinoid molecules per antibody (6–8), which showed increased cytotoxic potency over conjugates with the usual level of payload (3–4) against the MDR1 cells. Importantly, the sulfo-SPDB conjugate demonstrated greater activity than the SPDB conjugate against multidrug-resistant HCT-15 tumors in SCID mice. The advantage of the sulfo-SPDB linker was further demonstrated for anti-CanAg antibody conjugates against COLO 205MDR cells, where the sulfo-SPDB linked conjugate was more active than the SPDB conjugate in arresting cells in the G2‐M phase. Similar bystander killing activities were observed for sulfo-SPDB and SPDB conjugates: both conjugates eradicated mixed-cell populations of antigen-positive and antigen-negative cells in culture. Thus, we have developed a new linker that improves the potency of the disulfide-linked conjugate to multidrug resistant cancer cells, while preserving the conjugate activity towards non-resistant cells.
Aus meiner Sicht interessant, wie die Linker-Technologie zunehmend effizienter entwickelt wird, so daß die Zytostatikaresistenz umgangen werden kann und gleichzeitig die Anzahl der maytansinoid-Moleküle pro Antikörper verdoppelt werden kann.
Je entwickelter die ADC-Technologie ist, desto schwieriger wird es für big pharma, TAP-Arzneimittel im eigenen Haus alleine zur Marktreife zu bringen.
Der Marktwert der kleinen Firmen Seagen, immunogen und celldex sollte dadurch steigen.
Frdl Grüsse, StefanR
http://poster-submission.com/search/sresult/220
Antibody–maytansinoid conjugates (AMCs) targeting cancer cell-surface antigens are in clinical trials against several cancers. The AMCs in the clinic employ disulfide- or thioether-bonds to link cytotoxic maytansinoid molecules to the antibody. In pre-clinical models, disulfide-linked AMCs demonstrate superior in vivo activity compared to thioether-linked conjugates for several reasons including bystander killing. Cancer cells can be multi-drug resistant due to overexpression of drug efflux transporters such as MDR1. A goal of this study was to enhance the potency of disulfide-linked conjugates against multidrug-resistant cancer cells. Since MDR1 favors neutral substrates, we hypothesized that the incorporation of a negatively-charged sulfonate group in the disulfide linker would improve retention of the polar metabolite inside the cell and enhance conjugate potency to MDR1-expressing cells. We compared the cytotoxic potencies of disulfide-linked anti-EpCAM AMCs with a neutral linker (SPDB) and a negatively-charged linker (sulfo-SPDB) in several EpCAM-expressing cells with different levels of MDR1. The conjugates had similar cytotoxicities toward MDR1-negative cells, but the sulfo-SPDB conjugate was 10‐ to 30‐fold more potent than the SPDB conjugate toward MDR1-positive COLO 205MDR and HCT‐15 cells. An MDR1 inhibitor enhanced the cytotoxic potency of the SPDB conjugate to a level similar to that of the sulfo-SPDB conjugate. The sulfo-SPDB linker allowed preparation of AMCs with high numbers of maytansinoid molecules per antibody (6–8), which showed increased cytotoxic potency over conjugates with the usual level of payload (3–4) against the MDR1 cells. Importantly, the sulfo-SPDB conjugate demonstrated greater activity than the SPDB conjugate against multidrug-resistant HCT-15 tumors in SCID mice. The advantage of the sulfo-SPDB linker was further demonstrated for anti-CanAg antibody conjugates against COLO 205MDR cells, where the sulfo-SPDB linked conjugate was more active than the SPDB conjugate in arresting cells in the G2‐M phase. Similar bystander killing activities were observed for sulfo-SPDB and SPDB conjugates: both conjugates eradicated mixed-cell populations of antigen-positive and antigen-negative cells in culture. Thus, we have developed a new linker that improves the potency of the disulfide-linked conjugate to multidrug resistant cancer cells, while preserving the conjugate activity towards non-resistant cells.
Aus meiner Sicht interessant, wie die Linker-Technologie zunehmend effizienter entwickelt wird, so daß die Zytostatikaresistenz umgangen werden kann und gleichzeitig die Anzahl der maytansinoid-Moleküle pro Antikörper verdoppelt werden kann.
Je entwickelter die ADC-Technologie ist, desto schwieriger wird es für big pharma, TAP-Arzneimittel im eigenen Haus alleine zur Marktreife zu bringen.
Der Marktwert der kleinen Firmen Seagen, immunogen und celldex sollte dadurch steigen.
Frdl Grüsse, StefanR
Betrifft Poster 235/ 22.EORTC NCI Symposium
http://poster-submission.com/search/sresult/220
Antibody–maytansinoid conjugates (AMCs) targeting cancer cell-surface antigens are in clinical trials against several cancers. The AMCs in the clinic employ disulfide- or thioether-bonds to link cytotoxic maytansinoid molecules to the antibody. In pre-clinical models, disulfide-linked AMCs demonstrate superior in vivo activity compared to thioether-linked conjugates for several reasons including bystander killing. Cancer cells can be multi-drug resistant due to overexpression of drug efflux transporters such as MDR1. A goal of this study was to enhance the potency of disulfide-linked conjugates against multidrug-resistant cancer cells. Since MDR1 favors neutral substrates, we hypothesized that the incorporation of a negatively-charged sulfonate group in the disulfide linker would improve retention of the polar metabolite inside the cell and enhance conjugate potency to MDR1-expressing cells. We compared the cytotoxic potencies of disulfide-linked anti-EpCAM AMCs with a neutral linker (SPDB) and a negatively-charged linker (sulfo-SPDB) in several EpCAM-expressing cells with different levels of MDR1. The conjugates had similar cytotoxicities toward MDR1-negative cells, but the sulfo-SPDB conjugate was 10‐ to 30‐fold more potent than the SPDB conjugate toward MDR1-positive COLO 205MDR and HCT‐15 cells. An MDR1 inhibitor enhanced the cytotoxic potency of the SPDB conjugate to a level similar to that of the sulfo-SPDB conjugate. The sulfo-SPDB linker allowed preparation of AMCs with high numbers of maytansinoid molecules per antibody (6–8), which showed increased cytotoxic potency over conjugates with the usual level of payload (3–4) against the MDR1 cells. Importantly, the sulfo-SPDB conjugate demonstrated greater activity than the SPDB conjugate against multidrug-resistant HCT-15 tumors in SCID mice. The advantage of the sulfo-SPDB linker was further demonstrated for anti-CanAg antibody conjugates against COLO 205MDR cells, where the sulfo-SPDB linked conjugate was more active than the SPDB conjugate in arresting cells in the G2‐M phase. Similar bystander killing activities were observed for sulfo-SPDB and SPDB conjugates: both conjugates eradicated mixed-cell populations of antigen-positive and antigen-negative cells in culture. Thus, we have developed a new linker that improves the potency of the disulfide-linked conjugate to multidrug resistant cancer cells, while preserving the conjugate activity towards non-resistant cells.
Aus meiner Sicht interessant, wie die Linker-Technologie zunehmend effizienter entwickelt wird, so daß die Zytostatikaresistenz umgangen werden kann und gleichzeitig die Anzahl der maytansinoid-Moleküle pro Antikörper verdoppelt werden kann.
Je entwickelter die ADC-Technologie ist, desto schwieriger wird es für big pharma, TAP-Arzneimittel im eigenen Haus alleine zur Marktreife zu bringen.
Der Marktwert der kleinen Firmen Seagen, immunogen und celldex sollte dadurch steigen.
Frdl Grüsse, StefanR
http://poster-submission.com/search/sresult/220
Antibody–maytansinoid conjugates (AMCs) targeting cancer cell-surface antigens are in clinical trials against several cancers. The AMCs in the clinic employ disulfide- or thioether-bonds to link cytotoxic maytansinoid molecules to the antibody. In pre-clinical models, disulfide-linked AMCs demonstrate superior in vivo activity compared to thioether-linked conjugates for several reasons including bystander killing. Cancer cells can be multi-drug resistant due to overexpression of drug efflux transporters such as MDR1. A goal of this study was to enhance the potency of disulfide-linked conjugates against multidrug-resistant cancer cells. Since MDR1 favors neutral substrates, we hypothesized that the incorporation of a negatively-charged sulfonate group in the disulfide linker would improve retention of the polar metabolite inside the cell and enhance conjugate potency to MDR1-expressing cells. We compared the cytotoxic potencies of disulfide-linked anti-EpCAM AMCs with a neutral linker (SPDB) and a negatively-charged linker (sulfo-SPDB) in several EpCAM-expressing cells with different levels of MDR1. The conjugates had similar cytotoxicities toward MDR1-negative cells, but the sulfo-SPDB conjugate was 10‐ to 30‐fold more potent than the SPDB conjugate toward MDR1-positive COLO 205MDR and HCT‐15 cells. An MDR1 inhibitor enhanced the cytotoxic potency of the SPDB conjugate to a level similar to that of the sulfo-SPDB conjugate. The sulfo-SPDB linker allowed preparation of AMCs with high numbers of maytansinoid molecules per antibody (6–8), which showed increased cytotoxic potency over conjugates with the usual level of payload (3–4) against the MDR1 cells. Importantly, the sulfo-SPDB conjugate demonstrated greater activity than the SPDB conjugate against multidrug-resistant HCT-15 tumors in SCID mice. The advantage of the sulfo-SPDB linker was further demonstrated for anti-CanAg antibody conjugates against COLO 205MDR cells, where the sulfo-SPDB linked conjugate was more active than the SPDB conjugate in arresting cells in the G2‐M phase. Similar bystander killing activities were observed for sulfo-SPDB and SPDB conjugates: both conjugates eradicated mixed-cell populations of antigen-positive and antigen-negative cells in culture. Thus, we have developed a new linker that improves the potency of the disulfide-linked conjugate to multidrug resistant cancer cells, while preserving the conjugate activity towards non-resistant cells.
Aus meiner Sicht interessant, wie die Linker-Technologie zunehmend effizienter entwickelt wird, so daß die Zytostatikaresistenz umgangen werden kann und gleichzeitig die Anzahl der maytansinoid-Moleküle pro Antikörper verdoppelt werden kann.
Je entwickelter die ADC-Technologie ist, desto schwieriger wird es für big pharma, TAP-Arzneimittel im eigenen Haus alleine zur Marktreife zu bringen.
Der Marktwert der kleinen Firmen Seagen, immunogen und celldex sollte dadurch steigen.
Frdl Grüsse, StefanR
"Der Marktwert der kleinen Firmen Seagen, immunogen und celldex sollte dadurch steigen."
Celldex hat meines Wissens (z.B. für das Immunkonjugat CDX-011) die Technologie der Seattle Genetics Inc lizensiert und dürfte keine eigene ADC-Technologie-Plattform besitzen.
(Die Unternehmenseigene APC-Technologie funktioniert anders. Aus meiner Sicht ist sie deutlich weniger zuverlässig und setzt zudem ein voll funktionsfähiges Immunsystem voraus. Ähnliches gilt für Mikromets BiTE-Plattform ).
Celldex hat meines Wissens (z.B. für das Immunkonjugat CDX-011) die Technologie der Seattle Genetics Inc lizensiert und dürfte keine eigene ADC-Technologie-Plattform besitzen.
(Die Unternehmenseigene APC-Technologie funktioniert anders. Aus meiner Sicht ist sie deutlich weniger zuverlässig und setzt zudem ein voll funktionsfähiges Immunsystem voraus. Ähnliches gilt für Mikromets BiTE-Plattform ).
Antwort auf Beitrag Nr.: 40.515.616 von StefanR am 12.11.10 22:44:29http://www.prnewswire.com/news-releases/immungenes-pipeline-…
Der Link sollte klappen.
Der Link sollte klappen.
Dein Link führt leider ins Niemandsland.
Antwort auf Beitrag Nr.: 40.515.627 von StefanR am 12.11.10 22:47:52Unsere Beiträge haben sich zeitlich überschnitten. Jetzt klappt´s!
ImmunoGen, Inc. Announces Initiation of Randomized Clinical Trial Evaluating IMGN901 for First-Line Treatment of Small-Cell Lung Cancer
WALTHAM, Mass., Nov 30, 2010 (BUSINESS WIRE) --
ImmunoGen, Inc. (Nasdaq: IMGN), a biotechnology company that develops antibody-based anticancer products using its Targeted Antibody Payload (TAP) technology, today announced the initiation of a randomized Phase I/II clinical trial to evaluate its proprietary product candidate, IMGN901 (lorvotuzumab mertansine), for first-line treatment of small-cell lung cancer (SCLC) in patients with extensive disease.
"We believe IMGN901 has the potential to be an important treatment for SCLC, particularly as part of a combination regimen," commented James O'Leary, MD, Vice President and Chief Medical Officer. "IMGN901 has been found to be well tolerated and to demonstrate evidence of activity when used as a single agent to treat this highly aggressive cancer. The tolerability profile of IMGN901 supports evaluating it in combination with other active agents, and - in preclinical testing - it has shown highly compelling activity used together with these same therapies."
This multi-national trial will evaluate IMGN901 used together with carboplatin plus etoposide (C/E) - standard care for first-line treatment of SCLC - versus C/E alone. In the dose-escalation Phase I portion of the trial, increasing doses of IMGN901 will be administered with C/E to establish the maximum tolerated dose of the study compound with C/E. In the Phase II portion, patients will be randomized to receive C/E plus IMGN901 (60 patients) or C/E alone (30 patients).
IMGN901 will be administered weekly for two weeks in a three-week cycle, and C/E will be dosed on the standard three-week schedule. Patients can receive up to six cycles of C/E, consistent with established usage, but those randomized to also receive IMGN901 will be allowed to remain on the study drug alone as long as they continue to benefit from it.
The primary endpoint of this trial is progression-free survival (PFS). Secondary endpoints include PFS at 6 months, overall survival at 12 months, time to progression, overall survival, and overall response rate.
WALTHAM, Mass., Nov 30, 2010 (BUSINESS WIRE) --
ImmunoGen, Inc. (Nasdaq: IMGN), a biotechnology company that develops antibody-based anticancer products using its Targeted Antibody Payload (TAP) technology, today announced the initiation of a randomized Phase I/II clinical trial to evaluate its proprietary product candidate, IMGN901 (lorvotuzumab mertansine), for first-line treatment of small-cell lung cancer (SCLC) in patients with extensive disease.
"We believe IMGN901 has the potential to be an important treatment for SCLC, particularly as part of a combination regimen," commented James O'Leary, MD, Vice President and Chief Medical Officer. "IMGN901 has been found to be well tolerated and to demonstrate evidence of activity when used as a single agent to treat this highly aggressive cancer. The tolerability profile of IMGN901 supports evaluating it in combination with other active agents, and - in preclinical testing - it has shown highly compelling activity used together with these same therapies."
This multi-national trial will evaluate IMGN901 used together with carboplatin plus etoposide (C/E) - standard care for first-line treatment of SCLC - versus C/E alone. In the dose-escalation Phase I portion of the trial, increasing doses of IMGN901 will be administered with C/E to establish the maximum tolerated dose of the study compound with C/E. In the Phase II portion, patients will be randomized to receive C/E plus IMGN901 (60 patients) or C/E alone (30 patients).
IMGN901 will be administered weekly for two weeks in a three-week cycle, and C/E will be dosed on the standard three-week schedule. Patients can receive up to six cycles of C/E, consistent with established usage, but those randomized to also receive IMGN901 will be allowed to remain on the study drug alone as long as they continue to benefit from it.
The primary endpoint of this trial is progression-free survival (PFS). Secondary endpoints include PFS at 6 months, overall survival at 12 months, time to progression, overall survival, and overall response rate.
http://www.bloomberg.com/news/2010-12-01/seattle-genetics-ma…
The two drugs “are the tip of an iceberg,” said Kantor, who is based in San Francisco, in a telephone interview. “Once one of these drugs proves itself clinically and is approved, we’re going to see many more over the next three to five years. And they will have a meaningful impact on cancer treatment.”
The two drugs “are the tip of an iceberg,” said Kantor, who is based in San Francisco, in a telephone interview. “Once one of these drugs proves itself clinically and is approved, we’re going to see many more over the next three to five years. And they will have a meaningful impact on cancer treatment.”
ImmunoGen, Inc. Announces Presentation of Positive Initial Clinical Data for IMGN901 Used in a Combination Regimen for Multiple Myeloma
- Updated Encouraging Data with Single Agent Use Also Provided -
WALTHAM, Mass., Dec 04, 2010 (BUSINESS WIRE) --
ImmunoGen, Inc. (Nasdaq: IMGN), a biotechnology company that develops antibody-based anticancer products, today announced the presentation of positive initial clinical data with the Company's IMGN901 anticancer compound when used as part of a standard combination regimen to treat relapsed multiple myeloma. Encouraging updated data also were reported for the compound when used as monotherapy in patients with extensively pre-treated multiple myeloma. These findings were reported at the 52nd ASH Annual Meeting and Exposition taking place in Orlando, Florida.
ImmunoGen's IMGN901 product candidate is designed to target and kill cancer cells that express the CD56 antigen. The compound is wholly owned by the Company and is in development for the treatment of CD56-expressing tumors, including multiple myeloma.
"The early findings with IMGN901 used together with lenalidomide and dexamethasone indicate this combination therapy can rapidly achieve objective responses," commented James O'Leary, MD, Vice President and Chief Medical Officer. "We anticipate that inclusion of IMGN901 in this standard combination regimen will not only increase the number of objective responses achieved, but also extend their durability. When used alone, IMGN901 provided prolonged benefit for a number of patients with heavily pre-treated disease."
IMGN901 Used in a Combination Regimen
Positive initial findings were reported from a dose-finding portion of a Phase I trial (Study 005) in which increasing doses of IMGN901 are administered in combination with lenalidomide (Revlimid(R)) and dexamethasone given at their standard doses. All patients had multiple myeloma that had recurred after treatment with other therapies.
At the time of data cut-off for analysis, two dose cohorts (75 and 90 mg/m2) had completed patient enrollment. Evidence of activity was reported in 6 of the 7 patients treated:
* Two of the three patients receiving 75 mg/m2 of IMGN901 had a very good partial response (VGPR). A VGPR is a new response category in multiple myeloma introduced as part of the International Myeloma Working Group Criteria. It was established to enable distinction of excellent objective responses that have outcomes similar to complete responses (CRs). These patients were in their sixth and seventh treatment cycles. The third patient received not only the study therapy, but also a lenalidomide-based regimen one month before starting combination treatment with IMGN901. This patient had progressive disease (PD).
* The four patients receiving 90 mg/m2 were enrolled more recently than those receiving 75 mg/m2, and thus the data for these patients were less mature. The first patient enrolled had a partial response (PR) and was in her third treatment cycle. Two other patients were in earlier stages of treatment, but had already achieved PRs by investigator assessment at the time of the data cut-off for presentation. The fourth patient has stable disease (SD). These patients all remain on study.
Enrollment was underway in a third dose cohort (112 mg/m2) at the time of data cut-off. The therapy has been well tolerated to date, and the maximum tolerated dose of IMGN901 in combination with lenalidomide and dexamethasone has not yet been defined.
IMGN901 Single Agent Therapy
Updated data also were reported from a trial (Study 003) assessing IMGN901 when used as a single agent in patients who had received multiple prior therapies for their disease. Among the 37 patients enrolled in either the dose-finding phase of the trial or its expansion phase, 6 had objective responses (2 partial responses and 4 minimal responses by EBMT criteria). Fifteen patients (41%) had durable clinical benefit (objective responses and/or stable disease for at least three months). Of note, nine patients were treated with IMGN901 for at least 20 weeks (5 months), including two patients who have been receiving the therapy for over one year. IMGN901 was found to be well tolerated, with no clinically significant myelosuppression.
Clinical Trial Information
In Study 005, new cohorts of patients receive increasing doses of IMGN901 to establish its maximum tolerated dose (MTD) when administered with lenalidomide (25 mg once daily for 21 days) and dexamethasone (40 mg weekly for four weeks). In this trial, IMGN901 is administered weekly for three weeks in a 4-week cycle. Once the MTD has been established, up to 40 patients are to be enrolled in the expansion phase of the trial.
In Study 003, IMGN901 is administered weekly for two weeks in a 3-week cycle. In the dose-escalation phase of this trial, the MTD of the compound was defined to be 112 mg/m2. Nineteen study patients have received IMGN901 at its MTD.
IMGN901 is also in clinical testing for the treatment of CD56+ solid tumors, which include small-cell lung cancer, Merkel cell carcinoma, and ovarian cancer.
About ImmunoGen, Inc.
ImmunoGen, Inc. develops targeted anticancer therapeutics using the Company's expertise in tumor biology, monoclonal antibodies and potent cancer-cell killing agents. The Company's Targeted Antibody Payload (TAP) technology uses monoclonal antibodies to deliver one of ImmunoGen's proprietary cancer-cell killing agents specifically to tumor cells. There are currently seven TAP compounds in the clinic, with a wealth of clinical data reported with the technology. ImmunoGen's collaborative partners include Amgen, Bayer Schering Pharma, Biogen Idec, Biotest, Genentech (a member of the Roche Group), Novartis, and sanofi-aventis. The most advanced compound using ImmunoGen's TAP technology, trastuzumab-DM1 (T-DM1), is in Phase III testing through the Company's collaboration with Genentech. More information about ImmunoGen can be found at www.immunogen.com.
Revlimid(R) is a registered trademark of Celgene Corporation.
Die Daten können sich sehen lassen!
Nun bin ich gespannt, was Biotest mit dem BT-062 zuwege gebracht hat. Ich vermute, dass Biotest dazu bis Montag Daten veröffentlichen wird, da das Unternehmen ebenfalls beim ASH-Meeting mit einer Präsentation vertreten ist. Zu vergleichen wären dann die BT-062-Daten mit den IMGN901-Monotherapie-Daten (Studie 003), wobei Unterschiede in den jeweiligen Dosisregimen etc. zu berücksichtigen sind.
- Updated Encouraging Data with Single Agent Use Also Provided -
WALTHAM, Mass., Dec 04, 2010 (BUSINESS WIRE) --
ImmunoGen, Inc. (Nasdaq: IMGN), a biotechnology company that develops antibody-based anticancer products, today announced the presentation of positive initial clinical data with the Company's IMGN901 anticancer compound when used as part of a standard combination regimen to treat relapsed multiple myeloma. Encouraging updated data also were reported for the compound when used as monotherapy in patients with extensively pre-treated multiple myeloma. These findings were reported at the 52nd ASH Annual Meeting and Exposition taking place in Orlando, Florida.
ImmunoGen's IMGN901 product candidate is designed to target and kill cancer cells that express the CD56 antigen. The compound is wholly owned by the Company and is in development for the treatment of CD56-expressing tumors, including multiple myeloma.
"The early findings with IMGN901 used together with lenalidomide and dexamethasone indicate this combination therapy can rapidly achieve objective responses," commented James O'Leary, MD, Vice President and Chief Medical Officer. "We anticipate that inclusion of IMGN901 in this standard combination regimen will not only increase the number of objective responses achieved, but also extend their durability. When used alone, IMGN901 provided prolonged benefit for a number of patients with heavily pre-treated disease."
IMGN901 Used in a Combination Regimen
Positive initial findings were reported from a dose-finding portion of a Phase I trial (Study 005) in which increasing doses of IMGN901 are administered in combination with lenalidomide (Revlimid(R)) and dexamethasone given at their standard doses. All patients had multiple myeloma that had recurred after treatment with other therapies.
At the time of data cut-off for analysis, two dose cohorts (75 and 90 mg/m2) had completed patient enrollment. Evidence of activity was reported in 6 of the 7 patients treated:
* Two of the three patients receiving 75 mg/m2 of IMGN901 had a very good partial response (VGPR). A VGPR is a new response category in multiple myeloma introduced as part of the International Myeloma Working Group Criteria. It was established to enable distinction of excellent objective responses that have outcomes similar to complete responses (CRs). These patients were in their sixth and seventh treatment cycles. The third patient received not only the study therapy, but also a lenalidomide-based regimen one month before starting combination treatment with IMGN901. This patient had progressive disease (PD).
* The four patients receiving 90 mg/m2 were enrolled more recently than those receiving 75 mg/m2, and thus the data for these patients were less mature. The first patient enrolled had a partial response (PR) and was in her third treatment cycle. Two other patients were in earlier stages of treatment, but had already achieved PRs by investigator assessment at the time of the data cut-off for presentation. The fourth patient has stable disease (SD). These patients all remain on study.
Enrollment was underway in a third dose cohort (112 mg/m2) at the time of data cut-off. The therapy has been well tolerated to date, and the maximum tolerated dose of IMGN901 in combination with lenalidomide and dexamethasone has not yet been defined.
IMGN901 Single Agent Therapy
Updated data also were reported from a trial (Study 003) assessing IMGN901 when used as a single agent in patients who had received multiple prior therapies for their disease. Among the 37 patients enrolled in either the dose-finding phase of the trial or its expansion phase, 6 had objective responses (2 partial responses and 4 minimal responses by EBMT criteria). Fifteen patients (41%) had durable clinical benefit (objective responses and/or stable disease for at least three months). Of note, nine patients were treated with IMGN901 for at least 20 weeks (5 months), including two patients who have been receiving the therapy for over one year. IMGN901 was found to be well tolerated, with no clinically significant myelosuppression.
Clinical Trial Information
In Study 005, new cohorts of patients receive increasing doses of IMGN901 to establish its maximum tolerated dose (MTD) when administered with lenalidomide (25 mg once daily for 21 days) and dexamethasone (40 mg weekly for four weeks). In this trial, IMGN901 is administered weekly for three weeks in a 4-week cycle. Once the MTD has been established, up to 40 patients are to be enrolled in the expansion phase of the trial.
In Study 003, IMGN901 is administered weekly for two weeks in a 3-week cycle. In the dose-escalation phase of this trial, the MTD of the compound was defined to be 112 mg/m2. Nineteen study patients have received IMGN901 at its MTD.
IMGN901 is also in clinical testing for the treatment of CD56+ solid tumors, which include small-cell lung cancer, Merkel cell carcinoma, and ovarian cancer.
About ImmunoGen, Inc.
ImmunoGen, Inc. develops targeted anticancer therapeutics using the Company's expertise in tumor biology, monoclonal antibodies and potent cancer-cell killing agents. The Company's Targeted Antibody Payload (TAP) technology uses monoclonal antibodies to deliver one of ImmunoGen's proprietary cancer-cell killing agents specifically to tumor cells. There are currently seven TAP compounds in the clinic, with a wealth of clinical data reported with the technology. ImmunoGen's collaborative partners include Amgen, Bayer Schering Pharma, Biogen Idec, Biotest, Genentech (a member of the Roche Group), Novartis, and sanofi-aventis. The most advanced compound using ImmunoGen's TAP technology, trastuzumab-DM1 (T-DM1), is in Phase III testing through the Company's collaboration with Genentech. More information about ImmunoGen can be found at www.immunogen.com.
Revlimid(R) is a registered trademark of Celgene Corporation.
Die Daten können sich sehen lassen!
Nun bin ich gespannt, was Biotest mit dem BT-062 zuwege gebracht hat. Ich vermute, dass Biotest dazu bis Montag Daten veröffentlichen wird, da das Unternehmen ebenfalls beim ASH-Meeting mit einer Präsentation vertreten ist. Zu vergleichen wären dann die BT-062-Daten mit den IMGN901-Monotherapie-Daten (Studie 003), wobei Unterschiede in den jeweiligen Dosisregimen etc. zu berücksichtigen sind.
Antwort auf Beitrag Nr.: 40.647.661 von Joschka Schröder am 05.12.10 00:11:48used as a single agent in patients who had received multiple prior therapies for their disease. Among the 37 patients enrolled in either the dose-finding phase of the trial or its expansion phase, 6 had objective responses
Eine response-Rate als "single agent" von ca. 16% ist meines Wissens nach zwar kein Überkracher, aber recht ordentlich und rechtfertigt m.E. allemal die Weiterentwicklung. IMGN 901 scheint mehr zu leisten, als zunächst erwartet.
Hier noch die ASH-Daten eines Konkurrenzprojekts von Array, die zunächst eher schlechter ausschauen:
ARRY-520 has shown promising preliminary clinical activity as a single agent in this heavily pretreated patient population. Of 30 evaluable patients, confirmed partial responses have been observed in two patients, one of which had eight prior lines of treatment and has been on study for more than 18 months. In addition, confirmed minimal responses have been reported in two patients. Twelve patients remain on study to date, including all responders, and eight patients have been treated for longer than six months. The Phase 2 portion of this study is underway.
Eine response-Rate als "single agent" von ca. 16% ist meines Wissens nach zwar kein Überkracher, aber recht ordentlich und rechtfertigt m.E. allemal die Weiterentwicklung. IMGN 901 scheint mehr zu leisten, als zunächst erwartet.
Hier noch die ASH-Daten eines Konkurrenzprojekts von Array, die zunächst eher schlechter ausschauen:
ARRY-520 has shown promising preliminary clinical activity as a single agent in this heavily pretreated patient population. Of 30 evaluable patients, confirmed partial responses have been observed in two patients, one of which had eight prior lines of treatment and has been on study for more than 18 months. In addition, confirmed minimal responses have been reported in two patients. Twelve patients remain on study to date, including all responders, and eight patients have been treated for longer than six months. The Phase 2 portion of this study is underway.
Antwort auf Beitrag Nr.: 40.647.885 von SLGramann am 05.12.10 09:36:40Man muss berücksichtigen, dass es sich in der Monostudie (wie auch beim BT-062) um Patienten handelt, die zuvor ohne Erfolg nahezu alle Therapien über sich haben ergehen lassen müssen, die es so gibt. Wenn man diese Form der Patientenselektion berücksichtigt, dann sind die Ergebnisse wirklich gut und übertreffen die Erwartungen.
Übermorgen beginnt das San Antonio Breast Cancer Symposium. Besonders interessant für IMGN-Investoren ist Poster Nr. 6-15-02:
A Phase Ib Study Evaluating Safety, Tolerability, Pharmacokinetics (PK), and Activity of the Phosphoinositide-3 Kinase (PI3K) Inhibitor GDC-0941 in Combination with Trastuzumab-MCC-DM1 (T-DM1) in Patients with Advanced HER2-Positive Breast Cancer
Krop IE, Wolff AC, Winer EP, Miller KD, Park BH, Ware J, Holden S, Levy GG, Derynck M, Storniolo AM. Dana-Farber Cancer Institute, Boston, MA; Johns Hopkins Kimmel Cancer Center, Baltimore, MD; Indiana University Simon Cancer Center, Indianapolis; Genentech Inc, South San Francisco, CA.
A Phase Ib Study Evaluating Safety, Tolerability, Pharmacokinetics (PK), and Activity of the Phosphoinositide-3 Kinase (PI3K) Inhibitor GDC-0941 in Combination with Trastuzumab-MCC-DM1 (T-DM1) in Patients with Advanced HER2-Positive Breast Cancer
Krop IE, Wolff AC, Winer EP, Miller KD, Park BH, Ware J, Holden S, Levy GG, Derynck M, Storniolo AM. Dana-Farber Cancer Institute, Boston, MA; Johns Hopkins Kimmel Cancer Center, Baltimore, MD; Indiana University Simon Cancer Center, Indianapolis; Genentech Inc, South San Francisco, CA.
Nicht zu vergessen natürlich Poster Nr. 3-14-06:
Pharmacokinetic (PK) Interaction Potential of Trastuzumab-DM1 (T-DM1) and Pertuzumab (P) in Pts with HER2-Positive, Locally Advanced or MBC: Results from a Phase 1b/2 Study
Burris III HA, Lu D, Dees EC, Cortes J, Yi J-H, Shih T, Girish S. Sarah Cannon Research Institute, Nashville, TN; Genentech, Inc., South San Francisco, CA; UNC Lineberger Comprehensive Cancer Center, Chapel Hill, NC; Vall d'Hebron University Hospital, Barcelona, Spain.
Pharmacokinetic (PK) Interaction Potential of Trastuzumab-DM1 (T-DM1) and Pertuzumab (P) in Pts with HER2-Positive, Locally Advanced or MBC: Results from a Phase 1b/2 Study
Burris III HA, Lu D, Dees EC, Cortes J, Yi J-H, Shih T, Girish S. Sarah Cannon Research Institute, Nashville, TN; Genentech, Inc., South San Francisco, CA; UNC Lineberger Comprehensive Cancer Center, Chapel Hill, NC; Vall d'Hebron University Hospital, Barcelona, Spain.
Jetzt habe ich tatsächlich noch Poster Nr. 3-14-10
A Dose-Escalation Study of Trastuzumab-DM1 (T-DM1), Paclitaxel (T), and Pertuzumab (P) in Patients with HER2-Positive, Locally Advanced or Metastatic Breast Cancer (MBC) Previously Treated with a Trastuzumab-Containing Regimen
Krop IE, Modi S, Elias A, LoRusso P, Choi YJ, Lu M. Dana-Farber Cancer Institute, Boston, MA; Memorial Sloan-Kettering Cancer Center, New York, NY; University of Colorado School of Medicine, Aurora; Wayne State University, Detroit, MI; Genentech Inc., South San Francisco, CA.
und Poster Nr. 3-14-22
Pharmacokinetics (PK) of Trastuzumab-DM1 (T-DM1) and Paclitaxel (T) in Patients with HER2-Positive Locally Advanced or Metastatic Breast Cancer (MBC) Previously Treated with a Trastuzumab-Containing Regimen
Lu D, Krop I, Modi S, Elias A, LoRusso P, Huang J, Lu M, Girish S. Genentech Inc, South San Francisco, CA; Dana-Farber Cancer Institute, Boston, MA; Memorial Sloan-Kettering Cancer Center, New York City, NY; University of Colorado School of Medicine, Aurora; Wayne State University, Detroit, MI.
vergessen.
Jetzt dürfte alles vollständig sein. Genug Material jedenfalls, um die Analystengemeinde einige Tage lang zu beschäftigen.
A Dose-Escalation Study of Trastuzumab-DM1 (T-DM1), Paclitaxel (T), and Pertuzumab (P) in Patients with HER2-Positive, Locally Advanced or Metastatic Breast Cancer (MBC) Previously Treated with a Trastuzumab-Containing Regimen
Krop IE, Modi S, Elias A, LoRusso P, Choi YJ, Lu M. Dana-Farber Cancer Institute, Boston, MA; Memorial Sloan-Kettering Cancer Center, New York, NY; University of Colorado School of Medicine, Aurora; Wayne State University, Detroit, MI; Genentech Inc., South San Francisco, CA.
und Poster Nr. 3-14-22
Pharmacokinetics (PK) of Trastuzumab-DM1 (T-DM1) and Paclitaxel (T) in Patients with HER2-Positive Locally Advanced or Metastatic Breast Cancer (MBC) Previously Treated with a Trastuzumab-Containing Regimen
Lu D, Krop I, Modi S, Elias A, LoRusso P, Huang J, Lu M, Girish S. Genentech Inc, South San Francisco, CA; Dana-Farber Cancer Institute, Boston, MA; Memorial Sloan-Kettering Cancer Center, New York City, NY; University of Colorado School of Medicine, Aurora; Wayne State University, Detroit, MI.
vergessen.
Jetzt dürfte alles vollständig sein. Genug Material jedenfalls, um die Analystengemeinde einige Tage lang zu beschäftigen.
Die Präsentationen zum SABC-Meeting sind von Roche noch nicht freigegeben.
Auf der heutigen Veranstaltung in London (Roche's Late Stage Pipeline Update) war man jedoch äußerst optimistisch, was die weitere Entwicklung des T-DM1 betrifft (Details zur geplanten Zulassung sowie laufenden Studien müssten auf der Roche-Homepage abrufbar sein).
Das lässt vermuten, dass die in den vorherigen Beiträgen aufgelisteten Präsentationen entsprechend erfreulich ausfallen werden. Morgen bzw. am Wochenende werden wir mehr wissen.
Auf der heutigen Veranstaltung in London (Roche's Late Stage Pipeline Update) war man jedoch äußerst optimistisch, was die weitere Entwicklung des T-DM1 betrifft (Details zur geplanten Zulassung sowie laufenden Studien müssten auf der Roche-Homepage abrufbar sein).
Das lässt vermuten, dass die in den vorherigen Beiträgen aufgelisteten Präsentationen entsprechend erfreulich ausfallen werden. Morgen bzw. am Wochenende werden wir mehr wissen.
Press Release Source: ImmunoGen, Inc. On Friday December 10, 2010, 6:30 pm EST
WALTHAM, Mass.--(BUSINESS WIRE)-- ImmunoGen, Inc. (Nasdaq:IMGN - News), a biopharmaceutical company that develops anticancer therapeutics using its Targeted Antibody Payload (TAP) technology, today announced the presentation of the first clinical data for trastuzumab-DM1 (T-DM1) used in combination with pertuzumab for first-line treatment of HER2+ metastatic breast cancer (mBC). These data were presented at the 33rd Annual San Antonio Breast Cancer Symposium (SABCS).
T-DM1 consists of the HER2-targeting antibody, trastuzumab, with ImmunoGen’s cancer cell-killing agent attached using the Company’s linker and method of attachment. T-DM1 is in global development by Roche under a licensing agreement between ImmunoGen and Genentech, a member of the Roche Group. Pertuzumab is a HER2 Dimerization Inhibitor in development by Roche.
T-DM1 Plus Pertuzumab for First-Line HER2+ mBC
The data reported today are from a Phase Ib/II clinical trial conducted by Roche to assess T-DM1 used in combination with pertuzumab to treat HER2+ mBC. The study enrolled 21 patients who had not received prior systemic anticancer therapy for metastatic disease. Among these patients, 57.1% had a confirmed objective response to treatment with T-DM1 plus pertuzumab.
All of these patients had received anticancer agents prior to their development of metastatic disease (e.g., as adjuvant therapy). Eighty-six percent (86%) of these patients had received Herceptin® (trastuzumab), 71% had received a taxane, and 62% had received an anthracycline before being diagnosed with metastatic disease.
T-DM1 Used Alone for First-Line HER2+ mBC
In October, preliminary data were reported for T-DM1 used alone as first-line treatment for HER2+ mBC.1 Those data were from a 137-patient, randomized Phase II trial. At the time of the cut-off date for the data included in that presentation, 47.8% of patients receiving T-DM1 as a single agent had a confirmed objective response, as compared to 41.4% of patients treated with Herceptin used in combination with a taxane. It was noted in the oral presentation that the study groups included patients with unconfirmed responses at the time of the data cut-off. Updated data from this trial are expected in 2Q2011.
“The data that have been reported with T-DM1 for the first-line treatment of HER2+ metastatic breast cancer are highly encouraging, both with T-DM1 as a single agent and used in combination with pertuzumab,” commented Daniel Junius, President and Chief Executive Officer. “Our TAP technology is designed to produce effective anticancer agents that also are well tolerated, supporting their evaluation in earlier stages of disease and/or as part of combination regimens.”
About the Development of T-DM1 for First-Line Use
In addition to the Phase II trial reported, a Phase III trial, MARIANNE, is underway that assesses T-DM1 for first-line treatment of HER2+ mBC. In MARIANNE, T-DM1 given as a single agent and T-DM1 given in combination with pertuzumab are both compared to Herceptin used in combination with a taxane.
About the Trial Reported at SABCS
The Ph 1b/II trial reported at SABCS was designed to assess T-DM1 used in combination with pertuzumab for HER2+ mBC, both as first-line therapy and to treat patients with disease that had recurred after treatment with other anticancer regimens. In addition to the findings reported at SABCS for the first-line setting, data were reported for the 46 patients with relapsed disease which were consistent with those previously reported for a subset of these patients.2
------------------
Soweit die Pressemeldung. Für den Laien klingts gut. 57% OR... Insbesondere im (indirekten) Vergleich zu den "41.4% of patients treated with Herceptin used in combination with a taxane" aus dem anderen erwähnten Trial.
Welche Werte der Markt und was Fachleute erwartet und erhofft haben, weiß ich indes nicht.
WALTHAM, Mass.--(BUSINESS WIRE)-- ImmunoGen, Inc. (Nasdaq:IMGN - News), a biopharmaceutical company that develops anticancer therapeutics using its Targeted Antibody Payload (TAP) technology, today announced the presentation of the first clinical data for trastuzumab-DM1 (T-DM1) used in combination with pertuzumab for first-line treatment of HER2+ metastatic breast cancer (mBC). These data were presented at the 33rd Annual San Antonio Breast Cancer Symposium (SABCS).
T-DM1 consists of the HER2-targeting antibody, trastuzumab, with ImmunoGen’s cancer cell-killing agent attached using the Company’s linker and method of attachment. T-DM1 is in global development by Roche under a licensing agreement between ImmunoGen and Genentech, a member of the Roche Group. Pertuzumab is a HER2 Dimerization Inhibitor in development by Roche.
T-DM1 Plus Pertuzumab for First-Line HER2+ mBC
The data reported today are from a Phase Ib/II clinical trial conducted by Roche to assess T-DM1 used in combination with pertuzumab to treat HER2+ mBC. The study enrolled 21 patients who had not received prior systemic anticancer therapy for metastatic disease. Among these patients, 57.1% had a confirmed objective response to treatment with T-DM1 plus pertuzumab.
All of these patients had received anticancer agents prior to their development of metastatic disease (e.g., as adjuvant therapy). Eighty-six percent (86%) of these patients had received Herceptin® (trastuzumab), 71% had received a taxane, and 62% had received an anthracycline before being diagnosed with metastatic disease.
T-DM1 Used Alone for First-Line HER2+ mBC
In October, preliminary data were reported for T-DM1 used alone as first-line treatment for HER2+ mBC.1 Those data were from a 137-patient, randomized Phase II trial. At the time of the cut-off date for the data included in that presentation, 47.8% of patients receiving T-DM1 as a single agent had a confirmed objective response, as compared to 41.4% of patients treated with Herceptin used in combination with a taxane. It was noted in the oral presentation that the study groups included patients with unconfirmed responses at the time of the data cut-off. Updated data from this trial are expected in 2Q2011.
“The data that have been reported with T-DM1 for the first-line treatment of HER2+ metastatic breast cancer are highly encouraging, both with T-DM1 as a single agent and used in combination with pertuzumab,” commented Daniel Junius, President and Chief Executive Officer. “Our TAP technology is designed to produce effective anticancer agents that also are well tolerated, supporting their evaluation in earlier stages of disease and/or as part of combination regimens.”
About the Development of T-DM1 for First-Line Use
In addition to the Phase II trial reported, a Phase III trial, MARIANNE, is underway that assesses T-DM1 for first-line treatment of HER2+ mBC. In MARIANNE, T-DM1 given as a single agent and T-DM1 given in combination with pertuzumab are both compared to Herceptin used in combination with a taxane.
About the Trial Reported at SABCS
The Ph 1b/II trial reported at SABCS was designed to assess T-DM1 used in combination with pertuzumab for HER2+ mBC, both as first-line therapy and to treat patients with disease that had recurred after treatment with other anticancer regimens. In addition to the findings reported at SABCS for the first-line setting, data were reported for the 46 patients with relapsed disease which were consistent with those previously reported for a subset of these patients.2
------------------
Soweit die Pressemeldung. Für den Laien klingts gut. 57% OR... Insbesondere im (indirekten) Vergleich zu den "41.4% of patients treated with Herceptin used in combination with a taxane" aus dem anderen erwähnten Trial.
Welche Werte der Markt und was Fachleute erwartet und erhofft haben, weiß ich indes nicht.
Antwort auf Beitrag Nr.: 40.693.352 von SLGramann am 11.12.10 09:23:20Nachbörsliche Taxe an der Nasdaq: 9,00 USD, das sind + 0,30 USD im Vergleich zum Schlusskurs im regulären Handel
Bild: die größten Innovationen in der Medizin 2010
Medizin-Sensationen 2010T-DM1 heißt die Hoffnung von Millionen Krebspatienten. Es ist der Name eines neuen Medikaments, das eine Chemotherapie verträglicher und wirksamer machen soll. Offenbar kann es Tumor-Zellen gezielt zerstören. Wissenschaftler der Pharma-Unternehmen Immunogen und Roche haben den Stoff entwickelt und bereits erfolgreich bei Brustkrebs-Patientinnen getestet. Die Experten gehen davon aus, dass es gegen zahlreiche Krebsarten einsetzbar sein wird.
...na bei so einem Fürsprecher wie der Bildzeitung sollte einer second und firstline Zulassung nichts mehr im Weg stehen
Gruesse, StefanR
Medizin-Sensationen 2010T-DM1 heißt die Hoffnung von Millionen Krebspatienten. Es ist der Name eines neuen Medikaments, das eine Chemotherapie verträglicher und wirksamer machen soll. Offenbar kann es Tumor-Zellen gezielt zerstören. Wissenschaftler der Pharma-Unternehmen Immunogen und Roche haben den Stoff entwickelt und bereits erfolgreich bei Brustkrebs-Patientinnen getestet. Die Experten gehen davon aus, dass es gegen zahlreiche Krebsarten einsetzbar sein wird.
...na bei so einem Fürsprecher wie der Bildzeitung sollte einer second und firstline Zulassung nichts mehr im Weg stehen

Gruesse, StefanR
Schöne Kursentwicklung von IMGN ... die Aktie läuft auf die 10 USD-Marke zu, der Kurs hat sich seit dem irrationalen Ausverkauf Ende August somit nahezu verdoppelt.
Gegenwärtig werden offensichtlich die Ergebnisse des SABRC-Symposiums im Kurs "verdaut" ... habe mir alle Präsentationen durchgelesen, viel Pharmakokinetik (z.B. keine nennenswerten Interferenzen zwischen T-DM1, Pertuzumab und Paclitxel, so dass eine Parallelmedikation gut durchführbar ist) und einige schöne Wirksamkeitsdaten ... per Saldo läuft bislang alles wie gewünscht/erwartet.
Gegenwärtig werden offensichtlich die Ergebnisse des SABRC-Symposiums im Kurs "verdaut" ... habe mir alle Präsentationen durchgelesen, viel Pharmakokinetik (z.B. keine nennenswerten Interferenzen zwischen T-DM1, Pertuzumab und Paclitxel, so dass eine Parallelmedikation gut durchführbar ist) und einige schöne Wirksamkeitsdaten ... per Saldo läuft bislang alles wie gewünscht/erwartet.
Nachdem sich der Kurs seit Ende August nahezu (auf aktuelle 9,89 USD) verdoppelt hat, dürfte die Luft nun etwas dünner werden.
Da komplexe mathematische Modelle bei der Unternehmensbewertung biotechnologischer Unternehmen meines Erachtens wenig taugen und man sich auch DCF-Berechnungen wegen zu vieler Unbekannter im Grunde genommen schenken kann (rechnet man noch mit Zulassungswahrscheinlichkeiten, so bildet man mit 100 %iger Gewissheit eine Situation ab, die so niemals eintreffen wird), bevorzuge ich simple Überschlagsrechnungen:
Im Fall positiver Studienergebnisse inkl. Zulassung dürfte Immunogen mit T-DM1 ab 2014 für fünf bis zehn Jahre ca. 100 Mio. USD p.a. an Meilensteinzahlungen kassieren. Auf Basis des gegenwärtigen Unternehmenswertes i.H. von 575 Mio. USD entspräche das einem T-DM1-basierten EV/EBT von 5,8. Man könnte also vereinfachend sagen, der gegenwärtige Unternehmenswert spiegele im positiven Fall den (anteiligen) Wert des T-DM1 wider.
Diese stark vereinfachende Überschlagsrechnung beinhaltet natürlich das Risiko, dass die Studienergebnisse letztendlich schlechter als erwartet ausfallen werden, was sich negativ auf die künftigen Produktumsätze auswirken würde. Zudem ist zu berücksichtigen, dass IMGN Monat für Monat Geld verbrennt (fließt in den Ausbau der eigenen Pipeline). Dem stehen andererseits die Werte der Restpipeline (derzeit allerdings kaum bewertbar) und der TAP-Technologie gegenüber.
Alles zusammen genommen erscheint die Aktie auf dem derzeitigen Kursniveau in etwa fair bewertet.
Der Schwächen dieser Herangehensweise bin ich mir durchaus bewusst. Ich halte solche Überschlagsrechnungen jedoch für sinnvoller als komplexe Berechnungen, die letztlich nur zu Pseudogenauigkeiten führen.
Da komplexe mathematische Modelle bei der Unternehmensbewertung biotechnologischer Unternehmen meines Erachtens wenig taugen und man sich auch DCF-Berechnungen wegen zu vieler Unbekannter im Grunde genommen schenken kann (rechnet man noch mit Zulassungswahrscheinlichkeiten, so bildet man mit 100 %iger Gewissheit eine Situation ab, die so niemals eintreffen wird), bevorzuge ich simple Überschlagsrechnungen:
Im Fall positiver Studienergebnisse inkl. Zulassung dürfte Immunogen mit T-DM1 ab 2014 für fünf bis zehn Jahre ca. 100 Mio. USD p.a. an Meilensteinzahlungen kassieren. Auf Basis des gegenwärtigen Unternehmenswertes i.H. von 575 Mio. USD entspräche das einem T-DM1-basierten EV/EBT von 5,8. Man könnte also vereinfachend sagen, der gegenwärtige Unternehmenswert spiegele im positiven Fall den (anteiligen) Wert des T-DM1 wider.
Diese stark vereinfachende Überschlagsrechnung beinhaltet natürlich das Risiko, dass die Studienergebnisse letztendlich schlechter als erwartet ausfallen werden, was sich negativ auf die künftigen Produktumsätze auswirken würde. Zudem ist zu berücksichtigen, dass IMGN Monat für Monat Geld verbrennt (fließt in den Ausbau der eigenen Pipeline). Dem stehen andererseits die Werte der Restpipeline (derzeit allerdings kaum bewertbar) und der TAP-Technologie gegenüber.
Alles zusammen genommen erscheint die Aktie auf dem derzeitigen Kursniveau in etwa fair bewertet.
Der Schwächen dieser Herangehensweise bin ich mir durchaus bewusst. Ich halte solche Überschlagsrechnungen jedoch für sinnvoller als komplexe Berechnungen, die letztlich nur zu Pseudogenauigkeiten führen.
Antwort auf Beitrag Nr.: 40.730.719 von Joschka Schröder am 17.12.10 19:41:01Na ja, ein weiterer Schwachpunkt meiner Überschlagsrechnung liegt natürlich darin, dass sich die T-DM1-Umsätze nur äußerst grob abschätzen lassen. In dem von mir beschriebenen Szenario habe ich den Zielumsatz recht konservativ angesetzt (T-DM1-Umsatz 2,5 Mrd. USD p.a., 4 % Umsatzbeteiligung für IMGN). Sollte Roche tatsächlich den angestrebten Umsatz i.H. von 4 bis 5 Mrd. USD realisieren können und IMGN möglicherweise (entsprechend den Analystenschätzungen) 5 % Tantiemen kassieren, käme das mehr als einer Verdoppelung des T-DM1-basierten EV Immunogen´s gleich (das Kursziel müsste entsprechend angehoben werden).
Wie man es also auch dreht, sämtliche Abschätzungen beeinhalten jede Menge Unschärfen. Grundsätzlich halte ich meinen einfachen Ansatz aber für sinnvoll, da man bei komplexeren Modellen den Wald vor lauter Bäumen nicht mehr sehen kann.
Wie man es also auch dreht, sämtliche Abschätzungen beeinhalten jede Menge Unschärfen. Grundsätzlich halte ich meinen einfachen Ansatz aber für sinnvoll, da man bei komplexeren Modellen den Wald vor lauter Bäumen nicht mehr sehen kann.
Xconomy wirft einen Blick auf zwei Kandidaten, bei denen in den nächsten 18 Monaten ein IND anstehen könnte:
(Persönlich finde ich es interessant, dass hier der folate receptor das Ziel ist. Das ist auch der Zielpunkt von Endocyte mit ihrem SMDC, die allerdings schon die P III vorbereiten.)
ImmunoGen CEO Highlights Two New Souped-Up Antibodies Against Cancer
Ryan McBride 2/25/11
ImmunoGen, in the eyes of Wall Street, is largely defined by one thing—its relationship with industry giant Genentech. That’s because Genentech uses ImmunoGen’s technology to help amp up the antibody trastuzumab (Herceptin) into a more potent breast cancer drug called T-DM1, which has shown significant promise in clinical trials.
Yet ImmunoGen chief executive Daniel Junius says there’s a lot more to the story. Today, his firm is hosting an analyst day in New York to emphasize some of the drugs that are wholly-owned by ImmunoGen—unlike T-DM1, in which Genentech will reap the lion’s share of the rewards. Junius gave me a preview yesterday of two so-called antibody-drug conjugates—which link targeted antibodies with toxins to make them more potent—that are 100-percent owned by ImmunoGen. Though these two molecules haven’t begun human testing, Junius made a good case for why they are important to his company and why they could prove valuable for the treatment of certain types of cancer.
Junius, who became CEO of ImmunoGen in 2009, wants his company to expand its own internal pipeline of compounds along with continuing its partnerships in which it shares rights to other products with drug giants such as Genentech (a unit of Swiss healthcare firm Roche) and Sanofi-Aventis. “We’re working very hard to be moving from a partner-based company—although that will still have a role—to being one that is much more focused on proprietary compounds,” he says.
This thinking makes sense given the impact of a recent regulatory setback for Genentech’s T-DM1 on ImmunoGen. The FDA handed Roche/Genentech a “refusal to file” letter in late August, essentially saying it wouldn’t accept the firm’s application for accelerated marketing approval of T-DM1 as a breast cancer treatment because of the agency’s opinion that the experimental treatment did not quality at this time for that faster-than-usual type of review. Some investors immediately fled from ImmunoGen’s stock, sending its shares down more than 35 percent on August 27, the day that Roche announced the “refuse to file” letter.
ImmunoGen’s stock has since recovered the value it lost on the day of the FDA letter, and Roche is still advancing T-DM1 through the third and final stage of clinical trials normally required for FDA approval. ImmunoGen also announced a partnership deal in October with Novartis that brought the firm $45 million in upfront cash and the opportunity for additional payments related to specific compounds within the collaboration. (ImmunoGen’s stock closed at $8.80 per share on Thursday, giving the company a market value of $598.7 million.)
The two compounds that the company plans to highlight today are called IMGN859 and IMGN529. Like T-DM1, these compounds combine the ability of antibodies to home in on tumor targets with the killer punch of an anti-cancer toxin. The firm uses linkers to keep the toxins bound to the antibody while it is in the bloodstream, limiting exposure to the anti-cancer agent on healthy tissues. ImmunoGen is reserving some of the details on its latest two compounds until a scientific meeting later this year.
Junius says that the compound called IMGN529 features an antibody with an affinity for an undisclosed target on non-Hodgkin’s lymphomas, a cancer of the white blood cells. In fact, the firm’s antibody alone—without any extra kick from an attached toxin—compared favorably in models of non-Hodgkin’s lymphoma with available antibody drugs such as Biogen Idec (NASDAQ:BIIB) and Genentech’s lucrative product, rituximab (Rituxan), according to Junius. Rituxan, first approved by the FDA in 1997, is a so-called “naked” antibody, which zeroes in on cancer cells, but which isn’t attached to a more potent toxin.
“We do think we have attributes with this [ImmunoGen] antibody that would potentially make it superior as a naked agent,” Junius says. And the company is boosting its compound’s cancer-killing ability further with its technology that links the toxin to the antibody.
ImmunoGen plans to file an Investigational New Drug (IND) application with FDA for permission to begin its first clinical trial of the compound by the middle of this year in patients with non-Hodgkin’s lymphoma, according to Junius. He declined to disclose the specific molecular target that the compound is supposed to home in on to treat lymphomas.
Yet Junius did say that the target for the other compound, IMGN853, is a protein known as folate receptor 1 that is found in breast, lung, and ovarian tumors. One thing he highlighted was that the compound’s linker component not only keeps the antibody and the toxin intact in the circulation but also might play a role in preventing cancer cells from developing resistance to the treatment over time. The plan is to begin initial human testing of the compound next year in patients with a variety of tumor types, as is common in Phase I trials for cancer drugs.
While Junius is emphasizing the firm’s internal programs, Roche/Genentech’s T-DM1 is much further along in clinical development than ImmunoGen’s wholly-owned compounds. And Roche is now planning to apply for marketing approval of T-DM1 in the U.S. and Europe in mid-2012 for patients who have breast cancer that expresses HER2 gene and who have failed to respond to a previous therapy, according to ImmunoGen. The compound would provide ImmunoGen, which has no products on the market, its first major revenue from drug sales.
Yet the company’s analysts are quite familiar with the T-DM1 story by now, and already have sketched out how much money ImmunoGen stands to collect from royalties of T-DM1 sales around the world. Today, ImmunoGen wants to tell them about its younger prospects, which could generate a lot of money for ImmunoGen if they can prove over time they offer as much benefit to patients as T-DM1.
Ryan McBride is Xconomy's correspondent. You can reach him at rmcbride@xconomy.com, or follow him on Twitter at http://twitter.com/Ryan_McBride.
(Persönlich finde ich es interessant, dass hier der folate receptor das Ziel ist. Das ist auch der Zielpunkt von Endocyte mit ihrem SMDC, die allerdings schon die P III vorbereiten.)
ImmunoGen CEO Highlights Two New Souped-Up Antibodies Against Cancer
Ryan McBride 2/25/11
ImmunoGen, in the eyes of Wall Street, is largely defined by one thing—its relationship with industry giant Genentech. That’s because Genentech uses ImmunoGen’s technology to help amp up the antibody trastuzumab (Herceptin) into a more potent breast cancer drug called T-DM1, which has shown significant promise in clinical trials.
Yet ImmunoGen chief executive Daniel Junius says there’s a lot more to the story. Today, his firm is hosting an analyst day in New York to emphasize some of the drugs that are wholly-owned by ImmunoGen—unlike T-DM1, in which Genentech will reap the lion’s share of the rewards. Junius gave me a preview yesterday of two so-called antibody-drug conjugates—which link targeted antibodies with toxins to make them more potent—that are 100-percent owned by ImmunoGen. Though these two molecules haven’t begun human testing, Junius made a good case for why they are important to his company and why they could prove valuable for the treatment of certain types of cancer.
Junius, who became CEO of ImmunoGen in 2009, wants his company to expand its own internal pipeline of compounds along with continuing its partnerships in which it shares rights to other products with drug giants such as Genentech (a unit of Swiss healthcare firm Roche) and Sanofi-Aventis. “We’re working very hard to be moving from a partner-based company—although that will still have a role—to being one that is much more focused on proprietary compounds,” he says.
This thinking makes sense given the impact of a recent regulatory setback for Genentech’s T-DM1 on ImmunoGen. The FDA handed Roche/Genentech a “refusal to file” letter in late August, essentially saying it wouldn’t accept the firm’s application for accelerated marketing approval of T-DM1 as a breast cancer treatment because of the agency’s opinion that the experimental treatment did not quality at this time for that faster-than-usual type of review. Some investors immediately fled from ImmunoGen’s stock, sending its shares down more than 35 percent on August 27, the day that Roche announced the “refuse to file” letter.
ImmunoGen’s stock has since recovered the value it lost on the day of the FDA letter, and Roche is still advancing T-DM1 through the third and final stage of clinical trials normally required for FDA approval. ImmunoGen also announced a partnership deal in October with Novartis that brought the firm $45 million in upfront cash and the opportunity for additional payments related to specific compounds within the collaboration. (ImmunoGen’s stock closed at $8.80 per share on Thursday, giving the company a market value of $598.7 million.)
The two compounds that the company plans to highlight today are called IMGN859 and IMGN529. Like T-DM1, these compounds combine the ability of antibodies to home in on tumor targets with the killer punch of an anti-cancer toxin. The firm uses linkers to keep the toxins bound to the antibody while it is in the bloodstream, limiting exposure to the anti-cancer agent on healthy tissues. ImmunoGen is reserving some of the details on its latest two compounds until a scientific meeting later this year.
Junius says that the compound called IMGN529 features an antibody with an affinity for an undisclosed target on non-Hodgkin’s lymphomas, a cancer of the white blood cells. In fact, the firm’s antibody alone—without any extra kick from an attached toxin—compared favorably in models of non-Hodgkin’s lymphoma with available antibody drugs such as Biogen Idec (NASDAQ:BIIB) and Genentech’s lucrative product, rituximab (Rituxan), according to Junius. Rituxan, first approved by the FDA in 1997, is a so-called “naked” antibody, which zeroes in on cancer cells, but which isn’t attached to a more potent toxin.
“We do think we have attributes with this [ImmunoGen] antibody that would potentially make it superior as a naked agent,” Junius says. And the company is boosting its compound’s cancer-killing ability further with its technology that links the toxin to the antibody.
ImmunoGen plans to file an Investigational New Drug (IND) application with FDA for permission to begin its first clinical trial of the compound by the middle of this year in patients with non-Hodgkin’s lymphoma, according to Junius. He declined to disclose the specific molecular target that the compound is supposed to home in on to treat lymphomas.
Yet Junius did say that the target for the other compound, IMGN853, is a protein known as folate receptor 1 that is found in breast, lung, and ovarian tumors. One thing he highlighted was that the compound’s linker component not only keeps the antibody and the toxin intact in the circulation but also might play a role in preventing cancer cells from developing resistance to the treatment over time. The plan is to begin initial human testing of the compound next year in patients with a variety of tumor types, as is common in Phase I trials for cancer drugs.
While Junius is emphasizing the firm’s internal programs, Roche/Genentech’s T-DM1 is much further along in clinical development than ImmunoGen’s wholly-owned compounds. And Roche is now planning to apply for marketing approval of T-DM1 in the U.S. and Europe in mid-2012 for patients who have breast cancer that expresses HER2 gene and who have failed to respond to a previous therapy, according to ImmunoGen. The compound would provide ImmunoGen, which has no products on the market, its first major revenue from drug sales.
Yet the company’s analysts are quite familiar with the T-DM1 story by now, and already have sketched out how much money ImmunoGen stands to collect from royalties of T-DM1 sales around the world. Today, ImmunoGen wants to tell them about its younger prospects, which could generate a lot of money for ImmunoGen if they can prove over time they offer as much benefit to patients as T-DM1.
Ryan McBride is Xconomy's correspondent. You can reach him at rmcbride@xconomy.com, or follow him on Twitter at http://twitter.com/Ryan_McBride.
Obwohl ich es im SGEN-Thread schon gepostet hatte, der Vollständigkeit halber auch hier der Verweis auf einen ausführlichen, vergleichenden Artikel über IMGN und SGEN von Ohad Hammer:
http://www.hammerstockblog.com/seattle-genetics-strengthens-…
http://www.hammerstockblog.com/seattle-genetics-strengthens-…
Mh, hier fehlen noch die Details...
Trotzdem eine gute Nachricht. Roche wird ja hoffentlich nicht umsonst von "signifikant" sprechen. Das Nebenwirkungsprofil ist eh besser. Ein weiterer kleiner Schritt auf dem Weg, Herceptin eines Tages abzulösen.
ImmunoGen, Inc . (Nasdaq: IMGN), a biotechnology company that develops targeted antibody-based anticancer products, today announced that Roche has disclosed positive top-line results from the first randomized trial assessing trastuzumab emtansine (T-DM1, previously known as trastuzumab-DM1) in HER2-positive metastatic breast cancer (MBC). T-DM1 consists of ImmunoGen’s DM1 cancer cell-killing agent attached using the Company’s linker to the HER2-targeting antibody, trastuzumab, developed by Genentech, a member of the Roche Group.
The top-line results disclosed by Roche in a press release today were that patients treated with T-DM1 had a significant improvement in progression-free survival compared with patients treated with Herceptin® (trastuzumab) plus chemotherapy (docetaxel) in the Phase II trial comparing these agents for first-line treatment for HER2-positive MBC.
The detailed findings from this randomized, 137-patient trial are being submitted for presentation at a future medical conference. Favorable preliminary data were reported previously from this trial at the 35 th Congress of the European Society of Medical Oncology (ESMO), but progression-free survival data were not available at that time. 1
“This top-line information about T-DM1’s performance in the first-line setting is very encouraging and adds to the favorable efficacy and safety data reported across a number of T-DM1 studies. We look forward to learning the detailed data when they are reported at a medical conference,” said Daniel Junius, President and CEO.
Trotzdem eine gute Nachricht. Roche wird ja hoffentlich nicht umsonst von "signifikant" sprechen. Das Nebenwirkungsprofil ist eh besser. Ein weiterer kleiner Schritt auf dem Weg, Herceptin eines Tages abzulösen.
ImmunoGen, Inc . (Nasdaq: IMGN), a biotechnology company that develops targeted antibody-based anticancer products, today announced that Roche has disclosed positive top-line results from the first randomized trial assessing trastuzumab emtansine (T-DM1, previously known as trastuzumab-DM1) in HER2-positive metastatic breast cancer (MBC). T-DM1 consists of ImmunoGen’s DM1 cancer cell-killing agent attached using the Company’s linker to the HER2-targeting antibody, trastuzumab, developed by Genentech, a member of the Roche Group.
The top-line results disclosed by Roche in a press release today were that patients treated with T-DM1 had a significant improvement in progression-free survival compared with patients treated with Herceptin® (trastuzumab) plus chemotherapy (docetaxel) in the Phase II trial comparing these agents for first-line treatment for HER2-positive MBC.
The detailed findings from this randomized, 137-patient trial are being submitted for presentation at a future medical conference. Favorable preliminary data were reported previously from this trial at the 35 th Congress of the European Society of Medical Oncology (ESMO), but progression-free survival data were not available at that time. 1
“This top-line information about T-DM1’s performance in the first-line setting is very encouraging and adds to the favorable efficacy and safety data reported across a number of T-DM1 studies. We look forward to learning the detailed data when they are reported at a medical conference,” said Daniel Junius, President and CEO.
Antwort auf Beitrag Nr.: 41.334.673 von SLGramann am 07.04.11 15:45:39Bei hohen Umsätzen die 10-Dollar-Marke durchbrochen. Das ist nach dieser Meldung m.E. keineswegs unangemessen.
Antwort auf Beitrag Nr.: 41.334.767 von SLGramann am 07.04.11 15:56:01Börsenschluss.
11.78 USD
+2.48 (26.67%)
bei ca. zehnfachem Umsatz.
Marktkap. jetzt 800 Mio. USD.
Nicht unangemessen, wie gesagt. Aber jetzt ist auch schon ne Menge im Kurs eingepreist, das muss man sehen. Vielleicht überrascht der Anti-CD19 von Sanofi ja positiv, dann könnte weiter Luft nach oben sein. Das dürfte sich in den nächsten Monaten klären.
11.78 USD
+2.48 (26.67%)
bei ca. zehnfachem Umsatz.
Marktkap. jetzt 800 Mio. USD.
Nicht unangemessen, wie gesagt. Aber jetzt ist auch schon ne Menge im Kurs eingepreist, das muss man sehen. Vielleicht überrascht der Anti-CD19 von Sanofi ja positiv, dann könnte weiter Luft nach oben sein. Das dürfte sich in den nächsten Monaten klären.
IMGN nutzt den Kurs für eine satte KE und wird sein Cash-Polster um ca. 90 Mio. Dollar aufhübschen. Natürlich gibts heute erst mal ein Minus...
ImmunoGen, Inc. (Nasdaq: IMGN) announced today that it has priced an underwritten public offering of 7,000,000 shares of its common stock at a price to the public of $12.00 per share. Gross proceeds are expected to be approximately $84.0 million, before deducting the underwriting discounts and commissions and offering expenses payable by ImmunoGen. The offering is expected to close on or about May 25, 2011, subject to satisfaction of customary closing conditions. ImmunoGen has granted the underwriters a thirty (30) day option to purchase up to 1,050,000 additional shares to cover over-allotments, if any.
ImmunoGen, Inc. (Nasdaq: IMGN) announced today that it has priced an underwritten public offering of 7,000,000 shares of its common stock at a price to the public of $12.00 per share. Gross proceeds are expected to be approximately $84.0 million, before deducting the underwriting discounts and commissions and offering expenses payable by ImmunoGen. The offering is expected to close on or about May 25, 2011, subject to satisfaction of customary closing conditions. ImmunoGen has granted the underwriters a thirty (30) day option to purchase up to 1,050,000 additional shares to cover over-allotments, if any.
Hammer mit einer Anmerkung zum SAR3419:
After over 3 years in clinical testing, Sanofi’s SAR3419 finally generates enough positive data to justify further clinical development in Non Hodgkin’s Lymphoma (NHL). SAR3419 is an ADC targeting CD19, a protein widely expressed in many blood cancers. It is based on Immunogen’s (IMGN) technology. According to the abstract, the drug was active, leading to a 32-36% response rate in the higher doses. Although this kind of response rate is low compared to the top 3 NHL drugs in development (Calistoga’s CAL-101 , Micromet’s (MITI) blinatumumab and Pharmacyclics’ (PCYC) PCI-32765), it is very hard to compare SAR3419 to other investigational agents. NHL is a very heterogeneous disease in terms of disease subtypes and treatment lines so SAR3419 could have an advantage in certain subtypes or in more heavily pretreated patients.
Wahrscheinlich stehen uns sehr langwierige P II-Studien bevor. Das Programm bleibt ein Hoffnungsträger ...irgendwie.
After over 3 years in clinical testing, Sanofi’s SAR3419 finally generates enough positive data to justify further clinical development in Non Hodgkin’s Lymphoma (NHL). SAR3419 is an ADC targeting CD19, a protein widely expressed in many blood cancers. It is based on Immunogen’s (IMGN) technology. According to the abstract, the drug was active, leading to a 32-36% response rate in the higher doses. Although this kind of response rate is low compared to the top 3 NHL drugs in development (Calistoga’s CAL-101 , Micromet’s (MITI) blinatumumab and Pharmacyclics’ (PCYC) PCI-32765), it is very hard to compare SAR3419 to other investigational agents. NHL is a very heterogeneous disease in terms of disease subtypes and treatment lines so SAR3419 could have an advantage in certain subtypes or in more heavily pretreated patients.
Wahrscheinlich stehen uns sehr langwierige P II-Studien bevor. Das Programm bleibt ein Hoffnungsträger ...irgendwie.
Weiß jemand wann sie Phase 3 Studie zu TDM-1 abgeschlossen werden soll? (mein Kenntnisstand ist Mitte 2012) Mich hat nur die Info auf
clinicaltrials.gov irritiert (Estimated Primary Completion Date: August 2013 (Final data collection date for primary outcome measure)
Danke.
Gruß
gunar_s
clinicaltrials.gov irritiert (Estimated Primary Completion Date: August 2013 (Final data collection date for primary outcome measure)
Danke.
Gruß
gunar_s
Antwort auf Beitrag Nr.: 41.629.503 von gunar_s am 09.06.11 21:42:06Du beziehst Dich sicher auf den EMILIA-Trial. Auch ich gehe für 2012 von zulassungsrelevanten Daten aus. 2013 könnte sich auf den primären Endpunkt Overall survival beziehen, dessen Validierung längere Zeit benötigt (der aber auch der Wichtigste ist). Dennoch ist auch Progression-free survival (PFS) ein primärer Endpunkt der Studie. Ich denke daher, dass wir 2012 die PFS-Daten und 2013 OS-Daten bekommen werden.
Nur meine Sichtweise. Wers besser weiß, bitte schreiben.
Nur meine Sichtweise. Wers besser weiß, bitte schreiben.
Antwort auf Beitrag Nr.: 41.634.994 von SLGramann am 10.06.11 21:01:03DANKE für Deine Einschätzung. Na dann hoffen wir auf gute Daten in 2012!
Gruß
gunar_s
Gruß
gunar_s
Immunogen rated 'Buy' on breast cancer drug T-DM1
Associated Press, 07.06.11, 07:34 AM EDT
NEW YORK -- A Jefferies and Co. analyst started covering shares of Immunogen Inc. with a "Buy" rating Wednesday, saying the company's drug candidate T-DM1 will become a standard treatment for breast cancer
Analyst Thomas Wei said the drug could become the standard treatment for advanced hormone-resistant breast cancer, replacing Roche ( RHHBY.PK - news - people )'s drug Herceptin. He said T-DM1 is safer than Herceptin, and said he thinks the drug will be approved as a secondary treatment for breast cancer in 2013, as a primary treatment in 2015, and as a supplemental treatment by 2018.
Immunogen is developing T-DM1 through a partnership with Roche. T-DM1 is a combination of Herceptin and a cell-killing agent discovered by Immunogen. Wei said T-DM1 will eventually take the majority of Herceptin's $5 billion in annual sales.
He set a price target of $19 on shares of the Waltham, Mass., company. Immunogen shares closed at $12.21 Tuesday, meaning Wei expects the stock to rise 55.6 percent over the next year.
Associated Press, 07.06.11, 07:34 AM EDT
NEW YORK -- A Jefferies and Co. analyst started covering shares of Immunogen Inc. with a "Buy" rating Wednesday, saying the company's drug candidate T-DM1 will become a standard treatment for breast cancer
Analyst Thomas Wei said the drug could become the standard treatment for advanced hormone-resistant breast cancer, replacing Roche ( RHHBY.PK - news - people )'s drug Herceptin. He said T-DM1 is safer than Herceptin, and said he thinks the drug will be approved as a secondary treatment for breast cancer in 2013, as a primary treatment in 2015, and as a supplemental treatment by 2018.
Immunogen is developing T-DM1 through a partnership with Roche. T-DM1 is a combination of Herceptin and a cell-killing agent discovered by Immunogen. Wei said T-DM1 will eventually take the majority of Herceptin's $5 billion in annual sales.
He set a price target of $19 on shares of the Waltham, Mass., company. Immunogen shares closed at $12.21 Tuesday, meaning Wei expects the stock to rise 55.6 percent over the next year.
Ohad Hammer nimmt IMGN jetzt der Bewertung wegen aus dem Depot. Nicht ganz abwegig, owohl das Unternehmen sicher eine tolle Zukunft hat.
Immunogen becomes a $1B company
Immunogen (IMGN) concluded the week with a market cap of ~$1B, up 200% in less than a year. This valuation is quite unusual for a company that ascribes the vast majority of its value from a 3-5% royalty stake in a single drug - Roche’s T-DM1. T-DM1, which utilizes Immunogen’s antibody-drug conjugate (ADC) technology, comprises of Herceptin conjugated to a drug payload. It is in two phase III trials and multiple phase II studies in breast cancer. If proven effective, many believe T-DM1 will eventually replace Herceptin, at least in certain treatment lines.
Although results from the trials are expected only next year and in 2013-2014, the market clearly assigns a high probability of success to both studies. This is reasonable in light of the impressive results T-DM1 has generated to date, including a phase II study that demonstrated unequivocal activity in patients with no real treatment options. This trial was supposed to get T-DM1 on the market but eventually the FDA was reluctant to review the application, stating the patient population had not exhausted every possible therapeutic option. In April, Roche announced that T-DM1 was superior to Herceptin in combination with chemotherapy in a randomized phase II trial (actual results expected later this year).
The best benchmark for T-DM1’s addressable market is Herceptin, which generated more than $5B in sales last year. Theoretically, T-DM1 could be even bigger than Herceptin because it might be useful in diseases where Herceptin is not effective like ovarian and prostate cancer. Moreover, T-DM1 will probably have better pricing and could be given for longer periods of times (where patients are treated to progression).
The majority of Herceptin’s sales come from early stage treatment while advanced stage breast cancer represents a $1-1.5B opportunity. Although Roche has an ongoing phase II evaluating T-DM1 as adjuvant therapy, its plans are still unclear and in any case, it will take years to get the drug approved in this setting. There are still no open trials in other tumor types, so it is too early to assess this opportunity as well.
This leaves T-DM1 with a market opportunity of ~2B assuming better pricing and longer treatment duration compared with Herceptin. Assuming the drug gets approved for 1st line breast cancer in 2013, it could reach sales of $1B in 2016, of which $30-50M will go straight to Immunogen’s bottom line. Even when assigning a very high probability of success, Immunogen’s current market cap seems to be more than fair.
Looking at Immunogen’s proprietary and partnered pipeline, there are not a lot of assets to which investors can ascribe meaningful value at present. The company’s two proprietary assets, IMGN901 and IMGN388 still do not have a clear route to registration. The prior has been in development for several years with mild activity as a single agent while the latter is still in phase I, with no clear signs of efficacy. IMGN901 will have randomized phase II results only in 2013.
With respect to the partnered pipeline, the only agent which has shown unequivocal activity is Sanofi’s SAR3419 in non-Hodgkin lymphoma (NHL). The two main issues with this agent is the abundance of approved treatments and promising agents in clinical development, at least in certain subtypes of NHL. The rest of Immunogen’s pipeline has either no clinical data or limited efficacy.
In summary, Immunogen has a validated technology but only a single asset with substantial value. New clinical from the company’s early stage pipeline (3 ongoing programs from Sanofi and Bayer) could support higher valuation but these are too early to be factored in at the moment. The company expects three additional programs to reach the clinic this year, so 2013 could be a very interesting year for Immunogen.
In terms of future catalysts, the most important catalysts are T-DM1 results from the 1st line trial in September as well as combination data with other investigational agents. In particular, it will be intriguing to see how activeT-DM1 is in combination with pertuzumab, which recently met the primary endpoint in a phase III trial. Sanofi is expected to present updated results and disclose its development plans for SAR3419 towards year end at ASH.
We are selling all of our holdings in Immunogen at a profit of 415%, solely based on the valuation issues discussed above. The company has exposure to one of the most promising drugs in development and its technology should generate multiple long term catalysts. Nevertheless, there is not much which could support the stock in the coming 6-9 months.
http://www.hammerstockblog.com/biotech-portfolio-updates-%E2…
Immunogen becomes a $1B company
Immunogen (IMGN) concluded the week with a market cap of ~$1B, up 200% in less than a year. This valuation is quite unusual for a company that ascribes the vast majority of its value from a 3-5% royalty stake in a single drug - Roche’s T-DM1. T-DM1, which utilizes Immunogen’s antibody-drug conjugate (ADC) technology, comprises of Herceptin conjugated to a drug payload. It is in two phase III trials and multiple phase II studies in breast cancer. If proven effective, many believe T-DM1 will eventually replace Herceptin, at least in certain treatment lines.
Although results from the trials are expected only next year and in 2013-2014, the market clearly assigns a high probability of success to both studies. This is reasonable in light of the impressive results T-DM1 has generated to date, including a phase II study that demonstrated unequivocal activity in patients with no real treatment options. This trial was supposed to get T-DM1 on the market but eventually the FDA was reluctant to review the application, stating the patient population had not exhausted every possible therapeutic option. In April, Roche announced that T-DM1 was superior to Herceptin in combination with chemotherapy in a randomized phase II trial (actual results expected later this year).
The best benchmark for T-DM1’s addressable market is Herceptin, which generated more than $5B in sales last year. Theoretically, T-DM1 could be even bigger than Herceptin because it might be useful in diseases where Herceptin is not effective like ovarian and prostate cancer. Moreover, T-DM1 will probably have better pricing and could be given for longer periods of times (where patients are treated to progression).
The majority of Herceptin’s sales come from early stage treatment while advanced stage breast cancer represents a $1-1.5B opportunity. Although Roche has an ongoing phase II evaluating T-DM1 as adjuvant therapy, its plans are still unclear and in any case, it will take years to get the drug approved in this setting. There are still no open trials in other tumor types, so it is too early to assess this opportunity as well.
This leaves T-DM1 with a market opportunity of ~2B assuming better pricing and longer treatment duration compared with Herceptin. Assuming the drug gets approved for 1st line breast cancer in 2013, it could reach sales of $1B in 2016, of which $30-50M will go straight to Immunogen’s bottom line. Even when assigning a very high probability of success, Immunogen’s current market cap seems to be more than fair.
Looking at Immunogen’s proprietary and partnered pipeline, there are not a lot of assets to which investors can ascribe meaningful value at present. The company’s two proprietary assets, IMGN901 and IMGN388 still do not have a clear route to registration. The prior has been in development for several years with mild activity as a single agent while the latter is still in phase I, with no clear signs of efficacy. IMGN901 will have randomized phase II results only in 2013.
With respect to the partnered pipeline, the only agent which has shown unequivocal activity is Sanofi’s SAR3419 in non-Hodgkin lymphoma (NHL). The two main issues with this agent is the abundance of approved treatments and promising agents in clinical development, at least in certain subtypes of NHL. The rest of Immunogen’s pipeline has either no clinical data or limited efficacy.
In summary, Immunogen has a validated technology but only a single asset with substantial value. New clinical from the company’s early stage pipeline (3 ongoing programs from Sanofi and Bayer) could support higher valuation but these are too early to be factored in at the moment. The company expects three additional programs to reach the clinic this year, so 2013 could be a very interesting year for Immunogen.
In terms of future catalysts, the most important catalysts are T-DM1 results from the 1st line trial in September as well as combination data with other investigational agents. In particular, it will be intriguing to see how activeT-DM1 is in combination with pertuzumab, which recently met the primary endpoint in a phase III trial. Sanofi is expected to present updated results and disclose its development plans for SAR3419 towards year end at ASH.
We are selling all of our holdings in Immunogen at a profit of 415%, solely based on the valuation issues discussed above. The company has exposure to one of the most promising drugs in development and its technology should generate multiple long term catalysts. Nevertheless, there is not much which could support the stock in the coming 6-9 months.
http://www.hammerstockblog.com/biotech-portfolio-updates-%E2…
Hallo, gibt es noch Mitinvestierte??? Der Kurs ist doch erfreulich! Wer meldet sich?
reaggy26
reaggy26
Ich bin investiert, aber hier im deutschen Forum tut sich nichts. (leider) ==> der Wert ist, wie so oft, den deutschen Aktionären, wohl relativ unbekannt!
Ich lese deshalb eigentlich nur das Ami-Forum bei yahoo. (dort wird jeden Tag kräftig gepostet, und man erhält deshalb mehr aktuelle Infos)
Denke erst Anfang 2012 wird sich hier im Forum wieder mehr tun, wenn dann langsam die Phase3-Ergenisse anstehen. (werde dann auch vorher massiv aufstocken)
Gruß an alle Mitinvestierten.
gunar_s
Ich lese deshalb eigentlich nur das Ami-Forum bei yahoo. (dort wird jeden Tag kräftig gepostet, und man erhält deshalb mehr aktuelle Infos)
Denke erst Anfang 2012 wird sich hier im Forum wieder mehr tun, wenn dann langsam die Phase3-Ergenisse anstehen. (werde dann auch vorher massiv aufstocken)
Gruß an alle Mitinvestierten.
gunar_s
Antwort auf Beitrag Nr.: 42.372.748 von gunar_s am 19.11.11 13:04:24muss mir das mal näher ansehen. aktie hielt sich 2011 gut! bei dem bescheidenen biotechumfeld!!

Hallo, keiner mehr investiert? Meldet euch doch mal! Gruss r.
Ich bin noch investiert. ;-) Hier im deutschen Forum ist es generell sehr ruhig. (lese hauptsächlich das Forum in der USA bei yahoo)
Alles wartet halt auf die Ergenisse der Phase3-Studie zu TDM1. (sollen ja wohl im ersten Halbjahr noch rauskommen)
Der Kurssprung der letzten Tage lag wohl an der Übernahme von Miti. (Micromet)
Gruß
gunar_s
Alles wartet halt auf die Ergenisse der Phase3-Studie zu TDM1. (sollen ja wohl im ersten Halbjahr noch rauskommen)
Der Kurssprung der letzten Tage lag wohl an der Übernahme von Miti. (Micromet)
Gruß
gunar_s
weiterhin investiert. Seit 1,5 Jahren. Freue mich über mehr als 100% Plus bisher im Depot...  Ein guter Exit könnte mit den Daten und dem BLA Filing möglich sein..
Ein guter Exit könnte mit den Daten und dem BLA Filing möglich sein..
 Ein guter Exit könnte mit den Daten und dem BLA Filing möglich sein..
Ein guter Exit könnte mit den Daten und dem BLA Filing möglich sein..
Endlich ein positives Ergebniss aus der Phase 3 Studie zur Zweitlinientherapie von Brustkrebs. Hab mir gestern morgen noch weitere Aktien in Deutschland zugekauft, nur das magere Kursplus von knapp 5 % in den USA ist schon der Hammer. Das Risiko ist nahezu raus aus der Aktie und der Kursanstieg ist fast lächerlich. :`-(
Klar, Immunogen erhält nur ca. 5-6% der Verkaufserlöse, aber das künftige Marktpotenzial liegt hier bei fast 6 Mrd. USD. Ich denke auch die noch laufende Studie zur Erstlinientherapie wird bestimmt von Erfolg gekrönt werden. (auch wenn die noch 1-2 Jahre läuft)
Bei der aktuellen Studie zur Zweitlinientherapie konnte von Roche zum zweiten Endpunkt der Studie (durchschnittliche Überlebenszeit) noch keine Aussage gemacht werden. (daraus interpretiere ich, es sind noch nicht genügend Patientinnen verstorben, was zwei positive Merkmale hat. (positiv für die Patientinnen und wohl auch positiv für die durchschnittliche Überlebenszeit)
Meiner Meinung nach drücken hier die Shortys aktuell auf den Kurs. (aber irgendwann müssen auch die sich mit Aktien eindecken um ihre Short-Position glatt zu stellen)Der Bericht von "Adam Feuerstein" ist aus meiner sicht pures "bashing", hab' schon öfters Aktiel von dem gelesen wo er über Biotech-Aktien herzieht. (meistens wohl um Geld mit short-Positionen zu machen)
Ich kann Leerverkäufer echt nicht .... !
Mich kann er mit seinem Artikel nicht schocken, ich behalte meine Aktien. (Roche will die Zulassung ja noch dieses Jahr für die USA und Europa beantragen und aus meiner Sicht auch wohl erhalten)
Und auch was die Umsätze als Zweitlinientherapie angeht bin ich optimistischer, da gibt es denke ich großes Potenzial für "off label use". (wenn ich Brustkrebs hätte, würde ich mich auch für die vorraussichtlich beste Therapie entscheiden, selbst wenn die noch nicht alle bürokratischen Hürden genommen hat.
Gruß
gunar_s
Klar, Immunogen erhält nur ca. 5-6% der Verkaufserlöse, aber das künftige Marktpotenzial liegt hier bei fast 6 Mrd. USD. Ich denke auch die noch laufende Studie zur Erstlinientherapie wird bestimmt von Erfolg gekrönt werden. (auch wenn die noch 1-2 Jahre läuft)
Bei der aktuellen Studie zur Zweitlinientherapie konnte von Roche zum zweiten Endpunkt der Studie (durchschnittliche Überlebenszeit) noch keine Aussage gemacht werden. (daraus interpretiere ich, es sind noch nicht genügend Patientinnen verstorben, was zwei positive Merkmale hat. (positiv für die Patientinnen und wohl auch positiv für die durchschnittliche Überlebenszeit)
Meiner Meinung nach drücken hier die Shortys aktuell auf den Kurs. (aber irgendwann müssen auch die sich mit Aktien eindecken um ihre Short-Position glatt zu stellen)Der Bericht von "Adam Feuerstein" ist aus meiner sicht pures "bashing", hab' schon öfters Aktiel von dem gelesen wo er über Biotech-Aktien herzieht. (meistens wohl um Geld mit short-Positionen zu machen)
Ich kann Leerverkäufer echt nicht .... !
Mich kann er mit seinem Artikel nicht schocken, ich behalte meine Aktien. (Roche will die Zulassung ja noch dieses Jahr für die USA und Europa beantragen und aus meiner Sicht auch wohl erhalten)
Und auch was die Umsätze als Zweitlinientherapie angeht bin ich optimistischer, da gibt es denke ich großes Potenzial für "off label use". (wenn ich Brustkrebs hätte, würde ich mich auch für die vorraussichtlich beste Therapie entscheiden, selbst wenn die noch nicht alle bürokratischen Hürden genommen hat.
Gruß
gunar_s
1) ohne auf Details einzugehen, 4 % Umsatzbeteiligung sind realistisch
2) mit dem positiven Studienausgang wurde allgemein gerechnet, insoweit hält sich der Kursanstieg im Rahmen
3) entscheidende Studiendetails werden erst Anfang Juni bei der ASCO vorgestellt werden. Erst danach wird man eine halbwegs valide Einschätzung über die spätere Umsatzentwicklung vornehmen können.
2) mit dem positiven Studienausgang wurde allgemein gerechnet, insoweit hält sich der Kursanstieg im Rahmen
3) entscheidende Studiendetails werden erst Anfang Juni bei der ASCO vorgestellt werden. Erst danach wird man eine halbwegs valide Einschätzung über die spätere Umsatzentwicklung vornehmen können.
Antwort auf Beitrag Nr.: 42.983.508 von gunar_s am 31.03.12 10:41:41Ich denke, Du meinst diesen Artikel von Feuerstein:
http://www.thestreet.com/story/11476972/1/immunogen-is-over-…
Kann darin kein irrationales "bashing" erkennen. Die Bewertungsfrage stellt sich hier nun mal. 4% oder 5% ist nun mal kein großer Brocken und bis zu einer möglichen(!) Ablösung von Herceptin in der Erstlinientherapie wird noch viel Zeit vergehen.
Trotzdem ist IMGN ein tolles Unternehmen und es gibt dort mehr als nur T-DM1.
Bspw. das: http://www.immunogen.com/pipeline/imgn853/
Sollte die Aktie noch mal unter 10 Dollar rutschen (was vielleicht nur im Falle eines kleinen Crashs des Marktes passieren wird), bin ich wahrscheinlich wieder dabei.
http://www.thestreet.com/story/11476972/1/immunogen-is-over-…
Kann darin kein irrationales "bashing" erkennen. Die Bewertungsfrage stellt sich hier nun mal. 4% oder 5% ist nun mal kein großer Brocken und bis zu einer möglichen(!) Ablösung von Herceptin in der Erstlinientherapie wird noch viel Zeit vergehen.
Trotzdem ist IMGN ein tolles Unternehmen und es gibt dort mehr als nur T-DM1.
Bspw. das: http://www.immunogen.com/pipeline/imgn853/
Sollte die Aktie noch mal unter 10 Dollar rutschen (was vielleicht nur im Falle eines kleinen Crashs des Marktes passieren wird), bin ich wahrscheinlich wieder dabei.
Antwort auf Beitrag Nr.: 42.983.959 von SLGramann am 31.03.12 13:39:59Volle Zustimmung!
Tolles Unternehmen, aber die Bewertung muß man immer im Auge behalten.
Die Umsatzbeteiligung wird eher 4 % betragen. Man darf nämlich nicht vergessen, zu welchen Zeiten und unter welchen Bedingungen die Verträge zwischen Genentech und IMGN abgeschlossen worden sind:
1) Immunogens Linker-Technik war damals noch nicht validiert.
2) Der Antikörper stammt nicht von IMGN, sondern von Genentech.
Entsprechend bescheiden ist der Vertrag im Vergleich zu dem, was heute in der Branche unterzeichnet wird (man muß sich nur die geringen Meilensteinzahlungen ansehen).
Und noch ein wichtiger Punkt: Roche/Genentech wird an IMGN (ab Esrtzulassung!) nur 10 bis 12 Jahre lang Royalties zahlen, für wesentliche Indikationen (z.B. Erstlinientherapie) also einen entsprechend kürzeren Zeitraum.
Per Saldo erscheint die Aktie daher gegenwärtig angemessen bewertet.
Tolles Unternehmen, aber die Bewertung muß man immer im Auge behalten.
Die Umsatzbeteiligung wird eher 4 % betragen. Man darf nämlich nicht vergessen, zu welchen Zeiten und unter welchen Bedingungen die Verträge zwischen Genentech und IMGN abgeschlossen worden sind:
1) Immunogens Linker-Technik war damals noch nicht validiert.
2) Der Antikörper stammt nicht von IMGN, sondern von Genentech.
Entsprechend bescheiden ist der Vertrag im Vergleich zu dem, was heute in der Branche unterzeichnet wird (man muß sich nur die geringen Meilensteinzahlungen ansehen).
Und noch ein wichtiger Punkt: Roche/Genentech wird an IMGN (ab Esrtzulassung!) nur 10 bis 12 Jahre lang Royalties zahlen, für wesentliche Indikationen (z.B. Erstlinientherapie) also einen entsprechend kürzeren Zeitraum.
Per Saldo erscheint die Aktie daher gegenwärtig angemessen bewertet.
Antwort auf Beitrag Nr.: 42.984.227 von Orcus am 31.03.12 15:49:48Und noch ein wichtiger Punkt: Roche/Genentech wird an IMGN (ab Esrtzulassung!) nur 10 bis 12 Jahre lang Royalties zahlen, für wesentliche Indikationen (z.B. Erstlinientherapie) also einen entsprechend kürzeren Zeitraum.
Das ist ja interessant! Das hatte ich noch gar nicht auf dem Schirm, wie lange überhaupt Royalties fließen. Wahrscheinlich geht "man" aus dem Bauch davon aus, dass sie fließen, solange Umsätze mit dem Produkt generiert werden. Aber das wäre wohl zu schön gewesen, um wahr zu sein.
PS: Freut mich immer sehr, Beiträge von Dir zu lesen.
Leider ist der Mor-Thread insbesondere "dank" zweier neuer, vollkommen substanzloser, dafür aber sehr eifriger Schreiberlinge inzwischen eine echte Zumutung geworden und mir ziemlich unerträglich.
Das ist ja interessant! Das hatte ich noch gar nicht auf dem Schirm, wie lange überhaupt Royalties fließen. Wahrscheinlich geht "man" aus dem Bauch davon aus, dass sie fließen, solange Umsätze mit dem Produkt generiert werden. Aber das wäre wohl zu schön gewesen, um wahr zu sein.
PS: Freut mich immer sehr, Beiträge von Dir zu lesen.
Leider ist der Mor-Thread insbesondere "dank" zweier neuer, vollkommen substanzloser, dafür aber sehr eifriger Schreiberlinge inzwischen eine echte Zumutung geworden und mir ziemlich unerträglich.
Zwei aktuelle Meldungen:
ImmunoGen, Inc. Initiates Phase I Trial in Non-Hodgkin's Lymphoma with Its Novel IMGN529 Anticancer Compound
— First of Two Unique ImmunoGen Product Candidates Expected to Enter Clinic in 2012 —
WALTHAM, Mass.--(BUSINESS WIRE)-- ImmunoGen, Inc. (Nasdaq: IMGN), a biotechnology company that develops anticancer therapeutics using its antibody expertise and Targeted Antibody Payload (TAP) technology, today announced the start of clinical testing with its IMGN529 product candidate. The Phase I trial initiated evaluates the safety, tolerability, pharmacokinetic profile and anticancer activity of escalating doses of IMGN529 in patients with non-Hodgkin's lymphoma (NHL) to establish the dose for future clinical trials.
Today NHL is frequently treated with the anticancer antibody, rituximab (Rituxan®), and/or with chemotherapy. The novel agent IMGN529, a TAP compound, contains a B-cell-targeting antibody that has demonstrated marked anticancer activity in preclinical testing.1 Attached to this antibody is a potent ImmunoGen cell-killing agent, DM1. The antibody serves: (1) to kill the cancer cells through multiple antibody-mediated mechanisms; and (2) to deliver the DM1 specifically to the cancer cells for additional, targeted anticancer potency.
"The Phase I trial now underway, together with our market research, is expected to provide the information needed to define a clear development path for IMGN529 in NHL," commented James O'Leary, MD, Vice President and Chief Medical Officer. "With its unique profile, we believe IMGN529 has the potential to be an important new therapy for the treatment of key B-cell malignancies."
About the Phase I Trial Initiated
This multi-center, first-in-human Phase I trial is expected to enroll approximately 55 patients with relapsed or relapsed/refractory, CD37-expressing NHL. Patients with follicular lymphoma, diffuse large B-cell lymphoma, mantle cell lymphoma, or marginal zone lymphoma — the more common types of NHL — are eligible for enrollment.
About IMGN529
ImmunoGen created IMGN529 for the treatment of B-cell malignancies that express its CD37 target. The prevalence of CD37 on malignant cells is similar to that of CD20, the target for rituximab: it is expressed widely on key NHL subtypes — including follicular lymphoma, diffuse large B-cell lymphoma, marginal zone lymphoma and mantle cell lymphoma — and also on chronic lymphocytic leukemia (CLL).1
IMGN529 contains a CD37-targeting ImmunoGen antibody that, in vitro, has been found to kill cancer cells through multiple mechanisms of action including pro-apoptotic activity, complement-dependent cytotoxicity (CDC) and antibody-dependent cellular cytotoxicity (ADCC).1,2 The attached DM1 kills cancer cells through a different mechanism — disruption of a key step that occurs during cell division.
About Non-Hodgkin's lymphoma
NHL comprises a diverse group of cancers that all derive from defects in cellular production of lymphocytes, a type of white blood cell. As the name suggests, NHL includes all lymphomas except Hodgkin's lymphoma. Approximately 85% of cases of NHL are B-cell lymphomas. It is estimated that, in the US, approximately 56,000 people are diagnosed with B-cell NHL each year and 16,000 die from the disease.3
About ImmunoGen, Inc.
ImmunoGen, Inc. develops targeted anticancer therapeutics using the Company's expertise in tumor biology, monoclonal antibodies, potent cancer-cell killing agents and engineered linkers. The Company's TAP technology uses monoclonal antibodies to deliver one of ImmunoGen's proprietary cancer-cell killing agents specifically to tumor cells. There are now numerous TAP compounds in clinical development with a wealth of clinical data reported. ImmunoGen's collaborative partners include Amgen, Bayer HealthCare, Biotest, Lilly, Novartis, Roche, and Sanofi. The most advanced compound using ImmunoGen's TAP technology, trastuzumab emtansine (T-DM1), is in Phase III testing through the Company's collaboration with Genentech, a member of the Roche Group. More information about ImmunoGen can be found at www.immunogen.com.
1Mayo M. et al., AACR 2011, abstract #4581.
2Deckert J. et al., AACR 2011, abstract #4565.
3American Cancer Society, What is non-Hodgkin's Lymphoma.
Rituxan® is a registered trademark of Biogen Idec Inc.
This press release includes forward-looking statements. For these statements, ImmunoGen claims the protection of the safe harbor for forward-looking statements provided by the Private Securities Litigation Reform Act of 1995. It should be noted that there are risks and uncertainties related to the development of novel anticancer products, including IMGN529, including risks related to preclinical and clinical studies, their timings and results. A review of these risks can be found in ImmunoGen's Annual Report on Form 10-K for the fiscal year ended June 30, 2011 and other reports filed with the Securities and Exchange Commission.
For Investors:
ImmunoGen, Inc.
Carol Hausner, 781-895-0600
Executive Director, Investor Relations and Corporate Communications
info@immunogen.com
or
For Media:
The Yates Network
Kathryn Morris, 845-635-9828
Source: ImmunoGen, Inc.
ImmunoGen, Inc. Announces the IND Is Now Active for Its Folate-Receptor Targeting Anticancer Compound, IMGN853
Potential new therapeutic for ovarian cancer, non-small cell lung cancer (NSCLC) and other solid tumors which over-express folate receptor 1 (FOLR1).
Achievement of active IND for IMGN853 closely follows start of patient dosing with IMGN529 and initiation of Phase II testing with IMGN901.
IMGN853 Phase I evaluation expected to begin in mid-2012.
WALTHAM, Mass.--(BUSINESS WIRE)-- ImmunoGen, Inc. (Nasdaq: IMGN), a biotechnology company that develops targeted anticancer therapeutics, today announced that the Investigational New Drug (IND) application for its IMGN853 product candidate is now active. IMGN853 is a potential new therapeutic for ovarian cancer, NSCLC, and other epithelial malignancies which over-express FOLR1. The Company expects Phase I evaluation of IMGN853 to begin in mid-2012.
Recently the Company announced the start of Phase II testing with its IMGN901 compound in small-cell lung cancer and — earlier today — it announced the start of Phase I testing with its IMGN529 compound in non-Hodgkin's lymphoma. All three product candidates utilize the Company's Targeted Antibody Payload (TAP) technology with ImmunoGen antibodies and are wholly owned by the Company.
"Our progress with IMGN901, IMGN529 and now IMGN853 speaks to our commitment to build and effectively advance a product pipeline of significant anticancer therapeutics," commented Daniel Junius, President and CEO. "Each of these product candidates employs our TAP technology with its specific design optimized for its target. IMGN853, for example, uses one of the novel linkers we engineered to counter the multi-drug resistance that cancer cells can develop. Given the expression patterns of its target, with IMGN853 we also have a diagnostic assay to help in the identification of the patients most likely to benefit from treatment."
About IMGN853
ImmunoGen created IMGN853 for the treatment of ovarian cancer, NSCLC, and other epithelial malignancies that over-express FOLR1. The compound comprises the Company's highly potent cancer-cell-killing agent, DM4, attached to its M9346A FOLR1-targeting antibody using one of the novel linkers ImmunoGen designed to counter multi-drug resistance. Many cancers develop multi-drug resistance with continued treatment, making the tumors increasingly difficult to kill.
About ImmunoGen, Inc.
ImmunoGen, Inc. develops targeted anticancer therapeutics using the Company's expertise in tumor biology, monoclonal antibodies, potent cancer-cell killing agents and engineered linkers. The Company's TAP technology uses monoclonal antibodies to deliver one of ImmunoGen's proprietary cancer-cell killing agents specifically to tumor cells. There are now numerous TAP compounds in clinical development with a wealth of clinical data reported. ImmunoGen's collaborative partners include Amgen, Bayer HealthCare, Biotest, Lilly, Novartis, Roche, and Sanofi. The most advanced compound using ImmunoGen's TAP technology, trastuzumab emtansine (T-DM1), is in Phase III testing through the Company's collaboration with Genentech, a member of the Roche Group. More information about ImmunoGen can be found at www.immunogen.com.
This press release includes forward-looking statements. For these statements, ImmunoGen claims the protection of the safe harbor for forward-looking statements provided by the Private Securities Litigation Reform Act of 1995. It should be noted that there are risks and uncertainties related to the development of novel anticancer products, including IMGN853, IMGN529 and IMGN901, including risks related to preclinical and clinical studies, their timings and results. A review of these risks can be found in ImmunoGen's Annual Report on Form 10-K for the fiscal year ended June 30, 2011 and other reports filed with the Securities and Exchange Commission.
For Investors:
ImmunoGen, Inc.
Carol Hausner, 781-895-0600
Executive Director, Investor Relations and Corporate Communications
info@immunogen.com
ImmunoGen, Inc. Initiates Phase I Trial in Non-Hodgkin's Lymphoma with Its Novel IMGN529 Anticancer Compound
— First of Two Unique ImmunoGen Product Candidates Expected to Enter Clinic in 2012 —
WALTHAM, Mass.--(BUSINESS WIRE)-- ImmunoGen, Inc. (Nasdaq: IMGN), a biotechnology company that develops anticancer therapeutics using its antibody expertise and Targeted Antibody Payload (TAP) technology, today announced the start of clinical testing with its IMGN529 product candidate. The Phase I trial initiated evaluates the safety, tolerability, pharmacokinetic profile and anticancer activity of escalating doses of IMGN529 in patients with non-Hodgkin's lymphoma (NHL) to establish the dose for future clinical trials.
Today NHL is frequently treated with the anticancer antibody, rituximab (Rituxan®), and/or with chemotherapy. The novel agent IMGN529, a TAP compound, contains a B-cell-targeting antibody that has demonstrated marked anticancer activity in preclinical testing.1 Attached to this antibody is a potent ImmunoGen cell-killing agent, DM1. The antibody serves: (1) to kill the cancer cells through multiple antibody-mediated mechanisms; and (2) to deliver the DM1 specifically to the cancer cells for additional, targeted anticancer potency.
"The Phase I trial now underway, together with our market research, is expected to provide the information needed to define a clear development path for IMGN529 in NHL," commented James O'Leary, MD, Vice President and Chief Medical Officer. "With its unique profile, we believe IMGN529 has the potential to be an important new therapy for the treatment of key B-cell malignancies."
About the Phase I Trial Initiated
This multi-center, first-in-human Phase I trial is expected to enroll approximately 55 patients with relapsed or relapsed/refractory, CD37-expressing NHL. Patients with follicular lymphoma, diffuse large B-cell lymphoma, mantle cell lymphoma, or marginal zone lymphoma — the more common types of NHL — are eligible for enrollment.
About IMGN529
ImmunoGen created IMGN529 for the treatment of B-cell malignancies that express its CD37 target. The prevalence of CD37 on malignant cells is similar to that of CD20, the target for rituximab: it is expressed widely on key NHL subtypes — including follicular lymphoma, diffuse large B-cell lymphoma, marginal zone lymphoma and mantle cell lymphoma — and also on chronic lymphocytic leukemia (CLL).1
IMGN529 contains a CD37-targeting ImmunoGen antibody that, in vitro, has been found to kill cancer cells through multiple mechanisms of action including pro-apoptotic activity, complement-dependent cytotoxicity (CDC) and antibody-dependent cellular cytotoxicity (ADCC).1,2 The attached DM1 kills cancer cells through a different mechanism — disruption of a key step that occurs during cell division.
About Non-Hodgkin's lymphoma
NHL comprises a diverse group of cancers that all derive from defects in cellular production of lymphocytes, a type of white blood cell. As the name suggests, NHL includes all lymphomas except Hodgkin's lymphoma. Approximately 85% of cases of NHL are B-cell lymphomas. It is estimated that, in the US, approximately 56,000 people are diagnosed with B-cell NHL each year and 16,000 die from the disease.3
About ImmunoGen, Inc.
ImmunoGen, Inc. develops targeted anticancer therapeutics using the Company's expertise in tumor biology, monoclonal antibodies, potent cancer-cell killing agents and engineered linkers. The Company's TAP technology uses monoclonal antibodies to deliver one of ImmunoGen's proprietary cancer-cell killing agents specifically to tumor cells. There are now numerous TAP compounds in clinical development with a wealth of clinical data reported. ImmunoGen's collaborative partners include Amgen, Bayer HealthCare, Biotest, Lilly, Novartis, Roche, and Sanofi. The most advanced compound using ImmunoGen's TAP technology, trastuzumab emtansine (T-DM1), is in Phase III testing through the Company's collaboration with Genentech, a member of the Roche Group. More information about ImmunoGen can be found at www.immunogen.com.
1Mayo M. et al., AACR 2011, abstract #4581.
2Deckert J. et al., AACR 2011, abstract #4565.
3American Cancer Society, What is non-Hodgkin's Lymphoma.
Rituxan® is a registered trademark of Biogen Idec Inc.
This press release includes forward-looking statements. For these statements, ImmunoGen claims the protection of the safe harbor for forward-looking statements provided by the Private Securities Litigation Reform Act of 1995. It should be noted that there are risks and uncertainties related to the development of novel anticancer products, including IMGN529, including risks related to preclinical and clinical studies, their timings and results. A review of these risks can be found in ImmunoGen's Annual Report on Form 10-K for the fiscal year ended June 30, 2011 and other reports filed with the Securities and Exchange Commission.
For Investors:
ImmunoGen, Inc.
Carol Hausner, 781-895-0600
Executive Director, Investor Relations and Corporate Communications
info@immunogen.com
or
For Media:
The Yates Network
Kathryn Morris, 845-635-9828
Source: ImmunoGen, Inc.
ImmunoGen, Inc. Announces the IND Is Now Active for Its Folate-Receptor Targeting Anticancer Compound, IMGN853
Potential new therapeutic for ovarian cancer, non-small cell lung cancer (NSCLC) and other solid tumors which over-express folate receptor 1 (FOLR1).
Achievement of active IND for IMGN853 closely follows start of patient dosing with IMGN529 and initiation of Phase II testing with IMGN901.
IMGN853 Phase I evaluation expected to begin in mid-2012.
WALTHAM, Mass.--(BUSINESS WIRE)-- ImmunoGen, Inc. (Nasdaq: IMGN), a biotechnology company that develops targeted anticancer therapeutics, today announced that the Investigational New Drug (IND) application for its IMGN853 product candidate is now active. IMGN853 is a potential new therapeutic for ovarian cancer, NSCLC, and other epithelial malignancies which over-express FOLR1. The Company expects Phase I evaluation of IMGN853 to begin in mid-2012.
Recently the Company announced the start of Phase II testing with its IMGN901 compound in small-cell lung cancer and — earlier today — it announced the start of Phase I testing with its IMGN529 compound in non-Hodgkin's lymphoma. All three product candidates utilize the Company's Targeted Antibody Payload (TAP) technology with ImmunoGen antibodies and are wholly owned by the Company.
"Our progress with IMGN901, IMGN529 and now IMGN853 speaks to our commitment to build and effectively advance a product pipeline of significant anticancer therapeutics," commented Daniel Junius, President and CEO. "Each of these product candidates employs our TAP technology with its specific design optimized for its target. IMGN853, for example, uses one of the novel linkers we engineered to counter the multi-drug resistance that cancer cells can develop. Given the expression patterns of its target, with IMGN853 we also have a diagnostic assay to help in the identification of the patients most likely to benefit from treatment."
About IMGN853
ImmunoGen created IMGN853 for the treatment of ovarian cancer, NSCLC, and other epithelial malignancies that over-express FOLR1. The compound comprises the Company's highly potent cancer-cell-killing agent, DM4, attached to its M9346A FOLR1-targeting antibody using one of the novel linkers ImmunoGen designed to counter multi-drug resistance. Many cancers develop multi-drug resistance with continued treatment, making the tumors increasingly difficult to kill.
About ImmunoGen, Inc.
ImmunoGen, Inc. develops targeted anticancer therapeutics using the Company's expertise in tumor biology, monoclonal antibodies, potent cancer-cell killing agents and engineered linkers. The Company's TAP technology uses monoclonal antibodies to deliver one of ImmunoGen's proprietary cancer-cell killing agents specifically to tumor cells. There are now numerous TAP compounds in clinical development with a wealth of clinical data reported. ImmunoGen's collaborative partners include Amgen, Bayer HealthCare, Biotest, Lilly, Novartis, Roche, and Sanofi. The most advanced compound using ImmunoGen's TAP technology, trastuzumab emtansine (T-DM1), is in Phase III testing through the Company's collaboration with Genentech, a member of the Roche Group. More information about ImmunoGen can be found at www.immunogen.com.
This press release includes forward-looking statements. For these statements, ImmunoGen claims the protection of the safe harbor for forward-looking statements provided by the Private Securities Litigation Reform Act of 1995. It should be noted that there are risks and uncertainties related to the development of novel anticancer products, including IMGN853, IMGN529 and IMGN901, including risks related to preclinical and clinical studies, their timings and results. A review of these risks can be found in ImmunoGen's Annual Report on Form 10-K for the fiscal year ended June 30, 2011 and other reports filed with the Securities and Exchange Commission.
For Investors:
ImmunoGen, Inc.
Carol Hausner, 781-895-0600
Executive Director, Investor Relations and Corporate Communications
info@immunogen.com
Antwort auf Beitrag Nr.: 43.049.786 von Orcus am 17.04.12 15:48:30Gerade eben hat Endocyte ihren gegen den Folate-Rezeptor gerichteten DC auf small molecule-Basis mit Merck in einem großen und lukrativen Deal verpartnert.
Ich hatte das Projekt nach schlechten OS-Daten (die leider auf sehr gute PFS-Daten folgten) für erledigt gehalten. Aber offensichtlich ist es das nicht.
Das Target macht einen sehr interessanten Eindruck und vielleicht ist ein ADC doch (noch) geeigneter, als ein SMDC?
IMGN 853 könnte vielleicht das spannendste Projekt in der IMGN-Eigenpipe sein.
Ich hatte das Projekt nach schlechten OS-Daten (die leider auf sehr gute PFS-Daten folgten) für erledigt gehalten. Aber offensichtlich ist es das nicht.
Das Target macht einen sehr interessanten Eindruck und vielleicht ist ein ADC doch (noch) geeigneter, als ein SMDC?
IMGN 853 könnte vielleicht das spannendste Projekt in der IMGN-Eigenpipe sein.
Antwort auf Beitrag Nr.: 43.050.590 von SLGramann am 17.04.12 17:48:21Das Target erscheint interessant.
Der Merck-Deal kommt in dieser Form etwas überraschend, weil die mit dem EC145 erzielten Studienergebnisse bei nüchterner Betrachtung recht dürftig waren.
OS 14,1 Monate vs. 16,9 Monate in der Kontrollgruppe!!! (mit wenig überzeugenden Begründungsversuchen)
PFS 4,0 Monate vs. 1,5 Monate in der Kontrollgruppe
2,5 Monate länger progressionsfrei bei gleichzeitig 2,8 Monate kürzerer Überlebenszeit ... es klingt vielleicht hart, aber bei solchen Daten muß man angesichts der limitierten Mittel im Gesundheitswesen wirklich darüber nachdenken, ob ein solches Medikament von den Versicherungen finanziert werden sollte.
Mutig von Merck, bei dieser Datenlage eine solche Kooperationsvereinbarung (120 Mio. USD Upfront und bis zu 880 Mio. USD Milestones) zu treffen.
Der Merck-Deal kommt in dieser Form etwas überraschend, weil die mit dem EC145 erzielten Studienergebnisse bei nüchterner Betrachtung recht dürftig waren.
OS 14,1 Monate vs. 16,9 Monate in der Kontrollgruppe!!! (mit wenig überzeugenden Begründungsversuchen)
PFS 4,0 Monate vs. 1,5 Monate in der Kontrollgruppe
2,5 Monate länger progressionsfrei bei gleichzeitig 2,8 Monate kürzerer Überlebenszeit ... es klingt vielleicht hart, aber bei solchen Daten muß man angesichts der limitierten Mittel im Gesundheitswesen wirklich darüber nachdenken, ob ein solches Medikament von den Versicherungen finanziert werden sollte.
Mutig von Merck, bei dieser Datenlage eine solche Kooperationsvereinbarung (120 Mio. USD Upfront und bis zu 880 Mio. USD Milestones) zu treffen.
Hallo, ist immer so ruhig hier. Mich als Börsenlaie würde mal interessieren, wie die fachkundigen Anleger diese Immugen-Aktie einschätzen und wie sie sie prognostisch beurteilen. Vielen Dank 

Roche, DNA und IMGN bringen heute positive News.
Trastuzumab Emtansine (T-DM1) EMILIA Phase III Trial soll primären Endpunkt erreicht haben.
Weitere News unter ASCO 2012 bloc live
Trastuzumab Emtansine (T-DM1) EMILIA Phase III Trial soll primären Endpunkt erreicht haben.
Weitere News unter ASCO 2012 bloc live
Hier kommen aktuelle Nachrichten...
ImmunoGen, Inc. Initiates Phase I Trial of IMGN853 in Ovarian Cancer and Other Solid Tumors Over-Expressing Its Folate Receptor Target
Wed July 11, 2012 6:30 AM | about: IMGN
NEWS PROVIDED BY:
Business Wire
Folate receptor 1 (FOLR1)-targeting compound is second novel ImmunoGen product candidate to enter clinic this year
WALTHAM, Mass.--(BUSINESS WIRE)-- ImmunoGen, Inc . (Nasdaq: IMGN), a biotechnology company that develops anticancer therapeutics using its antibody expertise and Targeted Antibody Payload (TAP) technology, today announced the start of clinical testing with its IMGN853 product candidate. The Phase I trial initiated evaluates the safety, tolerability, pharmacokinetics, pharmacodynamics and anticancer activity of this TAP compound in patients with ovarian cancer or other solid tumors that over-express FOLR1 (also known as folate receptor alpha), including non-small cell lung cancer (NSCLC). Once the maximum tolerated dose (MTD) of IMGN853 is established, the activity of the compound will be evaluated in disease-specific patient cohorts.
This trial is expected to provide key information needed to define the registration path for IMGN853, commented James OLeary, MD, Vice President and Chief Medical Officer. The study protocol allows for the use of single-patient cohorts for evaluation of the lower dose levels, which should accelerate the pace of advancement to higher doses and to the trials expansion phase. In the expansion phase, IMGN853 will be evaluated as a treatment for specific types of FOLR1-overexpressing tumors. These findings should enable us to make decisions needed to advance IMGN853 into later-stage clinical testing.
About the Phase I Trial Initiated
This multi-center, first-in-human US Phase I trial is designed to enroll approximately 64 patients with previously treated ovarian cancer, NSCLC or other epithelial malignancies that over-express FOLR1. Once the MTD is defined in the dose-escalation part of the trial, three expansion cohorts will be opened to evaluate the pharmacodynamics and antitumor activity of IMGN853 at this MTD in patients with specific types of cancers:
Epithelial ovarian cancer (EOC) that is refractory/resistant to platinum;
EOC that is relapsed/refractory to conventional treatments;
Adenocarcinoma NSCLC that is relapsed/refractory to conventional treatments.
More patients die from lung cancer in the US than from any other type of cancer: each year, approximately 226,000 patients in the US are diagnosed with lung cancer and approximately 160,000 die from the disease.1 About 40% of lung cancers are the adenocarcinoma subtype of NSCLC.2
Each year, there are approximately 22,000 new cases of ovarian cancer diagnosed in the US and approximately 15,500 women die from the disease.1 EOC accounts for approximately 85% to 90% of all cases of ovarian cancer.3
About IMGN853
The novel agent IMGN853, a TAP compound, contains an ImmunoGen FOLR1-targeting antibody attached to the Companys potent cell-killing agent, DM4. The antibody enables the compound to bind specifically to cancer cells expressing FOLR1, and the DM4 serves to kill these cells. The DM4 is attached to the antibody using one of ImmunoGens engineered linkers. The linker in IMGN853 serves not only to keep the DM4 stably attached to the antibody while the compound is in the bloodstream, but also once at the tumor site to counteract the multi-drug resistance that can make previously treated tumors more difficult to kill.
About ImmunoGen, Inc. (IMGN)
ImmunoGen, Inc. develops targeted anticancer therapeutics using the Company's expertise in tumor biology, monoclonal antibodies, potent cancer-cell killing agents and engineered linkers. The Company's TAP technology uses monoclonal antibodies to deliver one of ImmunoGen's proprietary cancer-cell killing agents specifically to tumor cells. There are now numerous TAP compounds in clinical development with a wealth of clinical data reported. ImmunoGens collaborative partners include Amgen, Bayer HealthCare Pharmaceuticals, Biotest, Lilly, Novartis, Roche, and Sanofi. The most advanced compound using ImmunoGen's TAP technology, trastuzumab emtansine (T-DM1), is in Phase III testing through the Company's collaboration with Genentech, a member of the Roche Group. More information about ImmunoGen can be found at www.immunogen.com.
1American Cancer Society (2012), Cancer Facts & Figures.
2American Cancer Society (2012), Lung Cancer (Non-Small Cell) Detailed Guide.
3American Cancer Society (2012), Ovarian Cancer Detailed Guide.
This press release includes forward-looking statements. For these statements, ImmunoGen claims the protection of the safe harbor for forward-looking statements provided by the Private Securities Litigation Reform Act of 1995. It should be noted that there are risks and uncertainties related to the development of novel anticancer products, including IMGN853, including risks related to preclinical and clinical studies, their timings and results. A review of these risks can be found in ImmunoGens Annual Report on Form 10-K for the fiscal year ended June 30, 2011 and other reports filed with the Securities and Exchange Commissio
ImmunoGen, Inc. Initiates Phase I Trial of IMGN853 in Ovarian Cancer and Other Solid Tumors Over-Expressing Its Folate Receptor Target
Wed July 11, 2012 6:30 AM | about: IMGN
NEWS PROVIDED BY:
Business Wire
Folate receptor 1 (FOLR1)-targeting compound is second novel ImmunoGen product candidate to enter clinic this year
WALTHAM, Mass.--(BUSINESS WIRE)-- ImmunoGen, Inc . (Nasdaq: IMGN), a biotechnology company that develops anticancer therapeutics using its antibody expertise and Targeted Antibody Payload (TAP) technology, today announced the start of clinical testing with its IMGN853 product candidate. The Phase I trial initiated evaluates the safety, tolerability, pharmacokinetics, pharmacodynamics and anticancer activity of this TAP compound in patients with ovarian cancer or other solid tumors that over-express FOLR1 (also known as folate receptor alpha), including non-small cell lung cancer (NSCLC). Once the maximum tolerated dose (MTD) of IMGN853 is established, the activity of the compound will be evaluated in disease-specific patient cohorts.
This trial is expected to provide key information needed to define the registration path for IMGN853, commented James OLeary, MD, Vice President and Chief Medical Officer. The study protocol allows for the use of single-patient cohorts for evaluation of the lower dose levels, which should accelerate the pace of advancement to higher doses and to the trials expansion phase. In the expansion phase, IMGN853 will be evaluated as a treatment for specific types of FOLR1-overexpressing tumors. These findings should enable us to make decisions needed to advance IMGN853 into later-stage clinical testing.
About the Phase I Trial Initiated
This multi-center, first-in-human US Phase I trial is designed to enroll approximately 64 patients with previously treated ovarian cancer, NSCLC or other epithelial malignancies that over-express FOLR1. Once the MTD is defined in the dose-escalation part of the trial, three expansion cohorts will be opened to evaluate the pharmacodynamics and antitumor activity of IMGN853 at this MTD in patients with specific types of cancers:
Epithelial ovarian cancer (EOC) that is refractory/resistant to platinum;
EOC that is relapsed/refractory to conventional treatments;
Adenocarcinoma NSCLC that is relapsed/refractory to conventional treatments.
More patients die from lung cancer in the US than from any other type of cancer: each year, approximately 226,000 patients in the US are diagnosed with lung cancer and approximately 160,000 die from the disease.1 About 40% of lung cancers are the adenocarcinoma subtype of NSCLC.2
Each year, there are approximately 22,000 new cases of ovarian cancer diagnosed in the US and approximately 15,500 women die from the disease.1 EOC accounts for approximately 85% to 90% of all cases of ovarian cancer.3
About IMGN853
The novel agent IMGN853, a TAP compound, contains an ImmunoGen FOLR1-targeting antibody attached to the Companys potent cell-killing agent, DM4. The antibody enables the compound to bind specifically to cancer cells expressing FOLR1, and the DM4 serves to kill these cells. The DM4 is attached to the antibody using one of ImmunoGens engineered linkers. The linker in IMGN853 serves not only to keep the DM4 stably attached to the antibody while the compound is in the bloodstream, but also once at the tumor site to counteract the multi-drug resistance that can make previously treated tumors more difficult to kill.
About ImmunoGen, Inc. (IMGN)
ImmunoGen, Inc. develops targeted anticancer therapeutics using the Company's expertise in tumor biology, monoclonal antibodies, potent cancer-cell killing agents and engineered linkers. The Company's TAP technology uses monoclonal antibodies to deliver one of ImmunoGen's proprietary cancer-cell killing agents specifically to tumor cells. There are now numerous TAP compounds in clinical development with a wealth of clinical data reported. ImmunoGens collaborative partners include Amgen, Bayer HealthCare Pharmaceuticals, Biotest, Lilly, Novartis, Roche, and Sanofi. The most advanced compound using ImmunoGen's TAP technology, trastuzumab emtansine (T-DM1), is in Phase III testing through the Company's collaboration with Genentech, a member of the Roche Group. More information about ImmunoGen can be found at www.immunogen.com.
1American Cancer Society (2012), Cancer Facts & Figures.
2American Cancer Society (2012), Lung Cancer (Non-Small Cell) Detailed Guide.
3American Cancer Society (2012), Ovarian Cancer Detailed Guide.
This press release includes forward-looking statements. For these statements, ImmunoGen claims the protection of the safe harbor for forward-looking statements provided by the Private Securities Litigation Reform Act of 1995. It should be noted that there are risks and uncertainties related to the development of novel anticancer products, including IMGN853, including risks related to preclinical and clinical studies, their timings and results. A review of these risks can be found in ImmunoGens Annual Report on Form 10-K for the fiscal year ended June 30, 2011 and other reports filed with the Securities and Exchange Commissio
schon wieder Neuigkeiten,nicht ganz so erfreulich finde ich ...
ImmunoGen, Inc. Prices Public Offering of Common Stock
Thu July 12, 2012 9:05 AM | about: IMGN
NEWS PROVIDED BY:
Business Wire
WALTHAM, Mass.--(BUSINESS WIRE)-- ImmunoGen, Inc. (IMGN) announced today that it has priced an underwritten public offering of 6.25 million shares of its common stock at a price to the public of $16 per share. Gross proceeds are expected to be approximately $100 million, before deducting the underwriting discounts and commissions and offering expenses payable by ImmunoGen. The offering is expected to close on or about July 17, 2012, subject to satisfaction of customary closing conditions. ImmunoGen has granted the underwriters a thirty (30) day option to purchase up to 937,500 additional shares.
Morgan Stanley & Co. LLC and Jefferies & Company, Inc. are acting as joint book-running managers for the offering and Oppenheimer & Co. Inc., RBC Capital Markets, LLC, William Blair & Company, LLC, Cowen and Company, LLC, and Summer Street Research Partners are acting as co-managers.
The securities described above are being offered by ImmunoGen pursuant to an automatically effective shelf registration statement that was previously filed with the Securities and Exchange Commission. This press release does not constitute an offer to sell or a solicitation of an offer to buy the securities in this offering, nor shall there be any sale of these securities in any state or other jurisdiction in which such offer, solicitation or sale would be unlawful prior to the registration or qualification under the securities laws of any such state or other jurisdiction. A preliminary prospectus supplement related to the offering was filed with the SEC and is available on the SECs website located at www.sec.gov. Copies of the final prospectus supplement and the accompanying prospectus relating to this offering may be obtained, when available, from Morgan Stanley & Co. LLC, Attn: Prospectus Department, 180 Varick Street, 2nd Floor, New York, NY 10014, by telephone at 866-718-1649, or by email at prospectus@morganstanley.com and from Jefferies & Company, Inc., Equity Syndicate Prospectus Department, 520 Madison Avenue, 12th Floor, New York, NY 10022, by telephone at 877-547-6340, or by email at Prospectus_Department@Jefferies.com.
About ImmunoGen, Inc.
ImmunoGen, Inc. develops targeted anticancer therapeutics using the Companys expertise in tumor biology, monoclonal antibodies, potent cancer-cell killing agents and engineered linkers. The Companys Targeted Antibody Payload (TAP) technology uses monoclonal antibodies to deliver one of ImmunoGens proprietary cancer cell-killing agents specifically to tumor cells. There are now ten TAP compounds in clinical development, of which three are wholly owned by ImmunoGen. ImmunoGens collaborative partners include Amgen, Bayer HealthCare, Biotest, Lilly, Novartis, Roche and Sanofi. The most advanced compound using ImmunoGens TAP technology, trastuzumab emtansine (T-DM1), is in Phase III testing through the Companys collaboration with Genentech, a member of the Roche Group.
This press release includes forward-looking statements, including statements related to the completion and timing of the public offering of securities by ImmunoGen and the expected gross proceeds from the offering. For these statements, ImmunoGen claims the protection of the safe harbor for forward-looking statements provided by the Private Securities Litigation Reform Act of 1995. It should be noted that there are risks and uncertainties related to the public offering. A review of these risks can be found in ImmunoGens Annual Report on Form 10-K for the fiscal year ended June 30, 2011 and other reports filed with the Securities and Exchange Commission. ImmunoGen undertakes no obligation to revise or update any forward-looking statement to reflect events or circumstances after the issuance of this press release.
http://cts.businesswire.com/ct/CT?id=bwnews&sty=201207120057…
ImmunoGen, Inc.
Carol Hausner, 781-895-0600
Executive Director, Investor Relations
and Corporate Communications
info@immunogen.com
Source: ImmunoGen, Inc.
Copyright Business Wire 2012
ImmunoGen, Inc. Prices Public Offering of Common Stock
Thu July 12, 2012 9:05 AM | about: IMGN
NEWS PROVIDED BY:
Business Wire
WALTHAM, Mass.--(BUSINESS WIRE)-- ImmunoGen, Inc. (IMGN) announced today that it has priced an underwritten public offering of 6.25 million shares of its common stock at a price to the public of $16 per share. Gross proceeds are expected to be approximately $100 million, before deducting the underwriting discounts and commissions and offering expenses payable by ImmunoGen. The offering is expected to close on or about July 17, 2012, subject to satisfaction of customary closing conditions. ImmunoGen has granted the underwriters a thirty (30) day option to purchase up to 937,500 additional shares.
Morgan Stanley & Co. LLC and Jefferies & Company, Inc. are acting as joint book-running managers for the offering and Oppenheimer & Co. Inc., RBC Capital Markets, LLC, William Blair & Company, LLC, Cowen and Company, LLC, and Summer Street Research Partners are acting as co-managers.
The securities described above are being offered by ImmunoGen pursuant to an automatically effective shelf registration statement that was previously filed with the Securities and Exchange Commission. This press release does not constitute an offer to sell or a solicitation of an offer to buy the securities in this offering, nor shall there be any sale of these securities in any state or other jurisdiction in which such offer, solicitation or sale would be unlawful prior to the registration or qualification under the securities laws of any such state or other jurisdiction. A preliminary prospectus supplement related to the offering was filed with the SEC and is available on the SECs website located at www.sec.gov. Copies of the final prospectus supplement and the accompanying prospectus relating to this offering may be obtained, when available, from Morgan Stanley & Co. LLC, Attn: Prospectus Department, 180 Varick Street, 2nd Floor, New York, NY 10014, by telephone at 866-718-1649, or by email at prospectus@morganstanley.com and from Jefferies & Company, Inc., Equity Syndicate Prospectus Department, 520 Madison Avenue, 12th Floor, New York, NY 10022, by telephone at 877-547-6340, or by email at Prospectus_Department@Jefferies.com.
About ImmunoGen, Inc.
ImmunoGen, Inc. develops targeted anticancer therapeutics using the Companys expertise in tumor biology, monoclonal antibodies, potent cancer-cell killing agents and engineered linkers. The Companys Targeted Antibody Payload (TAP) technology uses monoclonal antibodies to deliver one of ImmunoGens proprietary cancer cell-killing agents specifically to tumor cells. There are now ten TAP compounds in clinical development, of which three are wholly owned by ImmunoGen. ImmunoGens collaborative partners include Amgen, Bayer HealthCare, Biotest, Lilly, Novartis, Roche and Sanofi. The most advanced compound using ImmunoGens TAP technology, trastuzumab emtansine (T-DM1), is in Phase III testing through the Companys collaboration with Genentech, a member of the Roche Group.
This press release includes forward-looking statements, including statements related to the completion and timing of the public offering of securities by ImmunoGen and the expected gross proceeds from the offering. For these statements, ImmunoGen claims the protection of the safe harbor for forward-looking statements provided by the Private Securities Litigation Reform Act of 1995. It should be noted that there are risks and uncertainties related to the public offering. A review of these risks can be found in ImmunoGens Annual Report on Form 10-K for the fiscal year ended June 30, 2011 and other reports filed with the Securities and Exchange Commission. ImmunoGen undertakes no obligation to revise or update any forward-looking statement to reflect events or circumstances after the issuance of this press release.
http://cts.businesswire.com/ct/CT?id=bwnews&sty=201207120057…
ImmunoGen, Inc.
Carol Hausner, 781-895-0600
Executive Director, Investor Relations
and Corporate Communications
info@immunogen.com
Source: ImmunoGen, Inc.
Copyright Business Wire 2012
Antwort auf Beitrag Nr.: 43.378.793 von Laura6 am 12.07.12 15:35:15Ja, KEs sind nie wirklich schön. Aber bei IMGN noch eine Weile unabdingbar. Und sie haben jetzt und hier einen wirklich guten Preis bekommen. Insofern alles in allem ne gute Sache.
Entschuldigt bitte, aber was sind KEs - und geht der Stop bis über den 17.07. hinaus?
Antwort auf Beitrag Nr.: 43.385.084 von KlausAnlage am 13.07.12 21:44:29@Klaus,
KE = Kapitalerhöhung
http://de.wikipedia.org/wiki/Kapitalverw%C3%A4sserung
Teil 2 der Frage verstehe ich nicht.
Nichts für ungut, aber bist Du sicher, dass IMGN für Dich die richtige Aktie ist? Der Begriff KE sollte geläufig sein, wenn man sich für spekulatives Zeug interessiert imho.
KE = Kapitalerhöhung
http://de.wikipedia.org/wiki/Kapitalverw%C3%A4sserung
Teil 2 der Frage verstehe ich nicht.
Nichts für ungut, aber bist Du sicher, dass IMGN für Dich die richtige Aktie ist? Der Begriff KE sollte geläufig sein, wenn man sich für spekulatives Zeug interessiert imho.
@SL Gramann,
vielen Dank für die Erklärungen.
Du hast ja recht, man kann ja auch googeln. Zu Deiner Bemerkung im letzten Satz nur folgendes: Ich bin kein Börsen-Mathematiker. Ich habe mir oft hier im Forum die Diskussionen angehört, bin auf die IMGN-Sites auch im Ausland gegangen und habe mir meine persönlich-spekulative Meinung gebildet. Ich bin zu dem Schluss gekommen: Die Aktie ist gut! Und lerne ja auch daraus.
Schon seit etwa 2 Jahren bin ich investiert. Nicht besonders viel... aber sie wächst ja. Und das ist gut so! Ansonsten habe ich Papiere von Linde und Fresenius Medicare.
Nochmals vielen Dank und einen schönen Tag.
vielen Dank für die Erklärungen.
Du hast ja recht, man kann ja auch googeln. Zu Deiner Bemerkung im letzten Satz nur folgendes: Ich bin kein Börsen-Mathematiker. Ich habe mir oft hier im Forum die Diskussionen angehört, bin auf die IMGN-Sites auch im Ausland gegangen und habe mir meine persönlich-spekulative Meinung gebildet. Ich bin zu dem Schluss gekommen: Die Aktie ist gut! Und lerne ja auch daraus.
Schon seit etwa 2 Jahren bin ich investiert. Nicht besonders viel... aber sie wächst ja. Und das ist gut so! Ansonsten habe ich Papiere von Linde und Fresenius Medicare.
Nochmals vielen Dank und einen schönen Tag.
Antwort auf Beitrag Nr.: 43.389.510 von KlausAnlage am 16.07.12 11:14:56@Klaus, ist schon okay. Zum Fragen ist das Board ja da. Und wenn Dir der spekulative Charakter von IMGN mit allen möglichen Konsequenzen vollkommen klar ist, dann hast Du meiner Meinung nach eine relativ gute Wahl getroffen. Auch die beiden anderen Aktien haben durchaus ihre Stärken.
Heute Kurssturz bei IMGN, weil sich die Analystenschar erstmals mit der begrenzten Laufzeit der T-DM1-Lizenzzahlungen auseinandergesetzt hat. Der Conference Call war ein Trauerspiel ... er herrschte allgemeines Erstaunen über Dinge, die in den IMGN-Geschäftsberichten nachzulesen sind und die man sich mit gesundem Menschenverstand selbst herleiten kann. Unglaublich, was für Trottel "professionell" Aktien analysieren.
Aktuell notiert der Kurs unter 14 USD, eine schöne Kaufgelegenheit!
Aktuell notiert der Kurs unter 14 USD, eine schöne Kaufgelegenheit!
Hallo, wie beurteilen denn hier die Fachleute diese Aktie, die sich anscheinend wieder zur Zeit stetig erholt? Für ein kurzes Statement wäre ich sehr dankbar (Laie  )?
)?
 )?
)?
ImmunoGen: T-DM1 Significantly Improved Survival In EMILIA Phase III Trial
http://www.finanznachrichten.de/nachrichten-2012-08/24414062…
http://www.finanznachrichten.de/nachrichten-2012-08/24414062…
Hier die vollständige gute Nachricht...
ImmunoGen, Inc. Announces Trastuzumab Emtansine (T-DM1) Significantly Improved Survival in the EMILIA Phase III Trial
Mon August 27, 2012 1:00 AM | about: IMGN
NEWS PROVIDED BY:
Business Wire
Trastuzumab emtansine significantly improved overall survival (OS) as well as progression-free survival (PFS) in its lead Phase III trial, EMILIA.
Separately, the marketing application for trastuzumab emtansine has been submitted to the US FDA, and one is to be submitted shortly to the European Medicines Agency (EMA).
WALTHAM, Mass.--(BUSINESS WIRE)-- ImmunoGen, Inc. (Nasdaq: IMGN), a biotechnology company that develops anticancer products using its Targeted Antibody Payload (TAP) technology and antibody expertise, today announced that Roche has reported that updated results from its EMILIA Phase III trial show that patients treated with trastuzumab emtansine had a significant improvement in OS compared to those randomized to standard-of-care therapy. Trastuzumab emtansine utilizes ImmunoGens TAP technology with the trastuzumab antibody and is in global development by Roche under an agreement between ImmunoGen and Genentech, a member of the Roche Group.
Also reported today was that Genentech has submitted a Biologics License Application (BLA) for trastuzumab emtansine to the US FDA, and that Roche expects to soon submit a Marketing Authorization Application (MAA) to the EMA.
EMILIA was designed to evaluate trastuzumab emtansine for the treatment of patients with metastatic HER2-positive breast cancer who have previously received trastuzumab (Herceptin®) and a taxane. Patients enrolled were randomized to treatment with trastuzumab emtansine used alone or with lapatinib (Tykerb®) plus capecitabine (Xeloda®), standard-of-care in this setting.
The first EMILIA results were reported at the American Society of Clinical Oncology (ASCO) annual meeting in June 2012, and included that trastuzumab emtansine significantly improved PFS compared to standard-of-care therapy and that fewer of the trastuzumab emtansine-treated patients experienced Grade 3 or higher (severe) adverse events.1 A previous interim analysis of OS demonstrated a trend towards improved OS in the trastuzumab emtansine-treated patients. The updated results reported today will be presented at an upcoming medical meeting.
Its impressive that the overall survival endpoint has already been met this had been expected to occur well after the submission of the BLA and MAA to the regulatory authorities, commented Daniel Junius, President and CEO. We developed our TAP technology to achieve more effective, better tolerated anticancer therapies, and are delighted that people treated with trastuzumab emtansine survived significantly longer than those who received a standard therapy.
Roche has Phase III trials underway evaluating trastuzumab emtansine both for newly diagnosed and for previously treated metastatic HER2-positive breast cancer. Additionally, it plans to initiate registration trials beginning in 2013 to evaluate the compound for three settings in earlier-stage disease: adjuvant use; neoadjuvant use; and treatment of patients with residual invasive disease following standard neoadjuvant therapy.
About ImmunoGens TAP Technology
A TAP compound consists of a monoclonal, or manufactured, antibody that binds specifically to a target found on tumor cells with one of the Companys highly potent cancer-killing agents attached as a payload. The antibody serves to target the payload specifically to the cancer cells, and the payload serves to kill the cancer cells. In the case of some compounds that use ImmunoGens TAP technology (trastuzumab emtansine and ImmunoGens IMGN529 compound), the antibody component also has meaningful anticancer activity.
About ImmunoGen, Inc. (IMGN)
ImmunoGen, Inc. develops targeted anticancer therapeutics using the Company's expertise in tumor biology, monoclonal antibodies, potent cancer-cell killing agents and engineered linkers. The Company's TAP technology uses monoclonal antibodies to deliver one of ImmunoGen's proprietary cancer-killing agents specifically to tumor cells. There are now ten TAP compounds in clinical development, of which three are wholly owned by the Company. A marketing application for trastuzumab emtansine (T-DM1), the most advanced compound using ImmunoGen's TAP technology, has been submitted in the US. Roche is developing this compound globally under an agreement between ImmunoGen and Genentech, a member of the Roche Group. More information about ImmunoGen can be found at www.immunogen.com.
This press release includes forward-looking statements. For these statements, ImmunoGen claims the protection of the safe harbor for forward-looking statements provided by the Private Securities Litigation Reform Act of 1995. It should be noted that there are risks and uncertainties related to the development of novel anticancer products, including trastuzumab emtansine (T-DM1), including risks related to clinical studies and regulatory submissions, their timings and results. A review of these risks can be found in ImmunoGens Annual Report on Form 10-K for the fiscal year ended June 30, 2011 and other reports filed with the Securities and Exchange Commission.
1ASCO June 2012 (abstract #LBA1).
Tykerb® is a registered trademark of GlaxoSmithKline plc. Xeloda® is a registered trademark of Roche. Herceptin® is a registered trademark of Genentech, a member of the Roche Group.
http://cts.businesswire.com/ct/CT?id=bwnews&sty=201208260050…
For Investors:
ImmunoGen, Inc.
Carol Hausner, 781-895-0600
Executive Director, Investor Relations and Corporate Communications
info@immunogen.com
ImmunoGen, Inc. Announces Trastuzumab Emtansine (T-DM1) Significantly Improved Survival in the EMILIA Phase III Trial
Mon August 27, 2012 1:00 AM | about: IMGN
NEWS PROVIDED BY:
Business Wire
Trastuzumab emtansine significantly improved overall survival (OS) as well as progression-free survival (PFS) in its lead Phase III trial, EMILIA.
Separately, the marketing application for trastuzumab emtansine has been submitted to the US FDA, and one is to be submitted shortly to the European Medicines Agency (EMA).
WALTHAM, Mass.--(BUSINESS WIRE)-- ImmunoGen, Inc. (Nasdaq: IMGN), a biotechnology company that develops anticancer products using its Targeted Antibody Payload (TAP) technology and antibody expertise, today announced that Roche has reported that updated results from its EMILIA Phase III trial show that patients treated with trastuzumab emtansine had a significant improvement in OS compared to those randomized to standard-of-care therapy. Trastuzumab emtansine utilizes ImmunoGens TAP technology with the trastuzumab antibody and is in global development by Roche under an agreement between ImmunoGen and Genentech, a member of the Roche Group.
Also reported today was that Genentech has submitted a Biologics License Application (BLA) for trastuzumab emtansine to the US FDA, and that Roche expects to soon submit a Marketing Authorization Application (MAA) to the EMA.
EMILIA was designed to evaluate trastuzumab emtansine for the treatment of patients with metastatic HER2-positive breast cancer who have previously received trastuzumab (Herceptin®) and a taxane. Patients enrolled were randomized to treatment with trastuzumab emtansine used alone or with lapatinib (Tykerb®) plus capecitabine (Xeloda®), standard-of-care in this setting.
The first EMILIA results were reported at the American Society of Clinical Oncology (ASCO) annual meeting in June 2012, and included that trastuzumab emtansine significantly improved PFS compared to standard-of-care therapy and that fewer of the trastuzumab emtansine-treated patients experienced Grade 3 or higher (severe) adverse events.1 A previous interim analysis of OS demonstrated a trend towards improved OS in the trastuzumab emtansine-treated patients. The updated results reported today will be presented at an upcoming medical meeting.
Its impressive that the overall survival endpoint has already been met this had been expected to occur well after the submission of the BLA and MAA to the regulatory authorities, commented Daniel Junius, President and CEO. We developed our TAP technology to achieve more effective, better tolerated anticancer therapies, and are delighted that people treated with trastuzumab emtansine survived significantly longer than those who received a standard therapy.
Roche has Phase III trials underway evaluating trastuzumab emtansine both for newly diagnosed and for previously treated metastatic HER2-positive breast cancer. Additionally, it plans to initiate registration trials beginning in 2013 to evaluate the compound for three settings in earlier-stage disease: adjuvant use; neoadjuvant use; and treatment of patients with residual invasive disease following standard neoadjuvant therapy.
About ImmunoGens TAP Technology
A TAP compound consists of a monoclonal, or manufactured, antibody that binds specifically to a target found on tumor cells with one of the Companys highly potent cancer-killing agents attached as a payload. The antibody serves to target the payload specifically to the cancer cells, and the payload serves to kill the cancer cells. In the case of some compounds that use ImmunoGens TAP technology (trastuzumab emtansine and ImmunoGens IMGN529 compound), the antibody component also has meaningful anticancer activity.
About ImmunoGen, Inc. (IMGN)
ImmunoGen, Inc. develops targeted anticancer therapeutics using the Company's expertise in tumor biology, monoclonal antibodies, potent cancer-cell killing agents and engineered linkers. The Company's TAP technology uses monoclonal antibodies to deliver one of ImmunoGen's proprietary cancer-killing agents specifically to tumor cells. There are now ten TAP compounds in clinical development, of which three are wholly owned by the Company. A marketing application for trastuzumab emtansine (T-DM1), the most advanced compound using ImmunoGen's TAP technology, has been submitted in the US. Roche is developing this compound globally under an agreement between ImmunoGen and Genentech, a member of the Roche Group. More information about ImmunoGen can be found at www.immunogen.com.
This press release includes forward-looking statements. For these statements, ImmunoGen claims the protection of the safe harbor for forward-looking statements provided by the Private Securities Litigation Reform Act of 1995. It should be noted that there are risks and uncertainties related to the development of novel anticancer products, including trastuzumab emtansine (T-DM1), including risks related to clinical studies and regulatory submissions, their timings and results. A review of these risks can be found in ImmunoGens Annual Report on Form 10-K for the fiscal year ended June 30, 2011 and other reports filed with the Securities and Exchange Commission.
1ASCO June 2012 (abstract #LBA1).
Tykerb® is a registered trademark of GlaxoSmithKline plc. Xeloda® is a registered trademark of Roche. Herceptin® is a registered trademark of Genentech, a member of the Roche Group.
http://cts.businesswire.com/ct/CT?id=bwnews&sty=201208260050…
For Investors:
ImmunoGen, Inc.
Carol Hausner, 781-895-0600
Executive Director, Investor Relations and Corporate Communications
info@immunogen.com
Auch Ohad Hammer ist optimistich...
Upcoming Catalysts For Exelixis And Immunogen
August 27, 2012 | includes: EXEL, IMGN
Exelixis (EXEL) and Immunogen (IMGN) will have important phase III readouts in 2014. For Exelixis, the readout is from 2 phase III trials in prostate cancer, and for Immunogen, a phase III trial in 1st line breast cancer. This raises the question - why should investors hold the stocks throughout 2012-2013?
It is important to identify near-term catalysts for biotech companies, but biotech stocks tend to be volatile and their movement is not always catalyzed by fundamental events. A good example for that is the recent surge in Pharmacyclics (PCYC) despite limited news flow. Unfortunately, we sold Pharmacyclics 6 months ago for a 413% profit, under the assumption that the company had no meaningful catalysts until 2014. Since then, the stock is up more than 150%...
Exelixis
Exelixis raised $127.5M by issuing shares (at a price of $4.25 per share) and $250M via convertible notes (due 2019). Everybody knew Exelixis must continue to raise capital, yet the size of the deal and its timing are controversial. $375M (not including underwriters' 30-day option) is a bitter pill to swallow for a company with a $600-800M market cap. Looking on the bright side, for the first time the company has enough resources to take cabozantinib (cabo) to the finish line independently of a partner or the capital markets.
The recent fundraising, no matter how painful, does not change my perception of Exelixis. I still view cabo as a potential breakthrough in prostate cancer and believe it has utility in additional indications (especially renal and liver cancers). There are still open questions about the drug's bone effect and exact mechanism of action, making it a high risk investment. Still, even assuming a 33% probability of success in prostate cancer and using Medivation (MDVN) as a benchmark ($3.5B market cap after successful phase III and a licensing deal), Exelixis' valuation is still reasonable.
Exelixis' primary catalyst for 2012 is FDA approval in a niche indication that could provide the stock a "floor" valuation of $400M, excluding any potential upside.
FDA approval in MTC (November 2012) - Exelixis recently filed an NDA for cabo as a treatment for medullary thyroid cancer (MTC), a niche indication (U.S. peak sales <$100M). The deadline for FDA's decision is November 29th. Cabo has high chances of approval based on an impressive progression-free survival effect in phase III and the fact the trial was run under a special protocol assessment (SPA). Risks include cabo-related toxicity (which was fatal in some cases) and lack of survival difference (data still not mature).
Financial implications are limited, however, the approval can put a floor to Exelixis' valuation based on sales multiples. The only drug approved for advanced MTC is Asatrazenca's (AZN) Caprelsa, which recently got approved. It generated $12M in the first half of 2012, most of it in the U.S. As cabo appears more effective than Caprelsa, it can easily generate $40M in peak sales in the U.S. alone. Assuming a similar opportunity ex-U.S. and a sales multiple of 5, the MTC indication might be worth $400M for a pharma company with an oncology sales force.
Geographic deal (1H 2013) - Following approval in MTC, Exelixis could do a geographic deal that includes Asia or Asia+EU. This will probably be well received by investors as a source of non-dilutive funds and a way to cut down expenses. The company does not need a partner to get to 2014's catalysts, but in order to commercialize cabo globally, it will have to sell rights at least for Asia.
Phase II results in prostate cancer (1H 2013) - Exelixis will present updated results from a phase II trial in 150 chemo-pretreated patients. Although the trial does not have a control arm, it is a fairly large study with a homogeneous patient population that resembles the population in the ongoing phase III trials.
Initial data from this trial showed encouraging signs including bone scan responses in 67% of patients as well as effect on pain (usually caused by bone lesions) and bone metabolism markers. This degree of bone scan resolution is unprecedented, but it is still not clear whether it will lead to improved survival. In addition, cabo's effect on traditional endpoints that are primarily related to soft tissue lesions (as measured by objective response rate, progression free survival and PSA) was modest.
Therefore, the most important aspect of the trial would be looking at overall survival and whether it correlates to bone scan responses. The only proof that targeting bone metastases improves survival is Algeta's Alpharadin, which exclusively targets bone mets. Alpharadin prolonged survival of metastatic prostate cancer by 3.6 months. Interestingly, it does not lead to bone scan responses, so it is tempting to speculate that cabo's survival benefit could be greater.
Immunogen
Just as Exelixis' fate is tied to cabo, Immunogen's stock performance is dependent on T-DM1, a promising drug for breast cancer . Following the spectacular phase III data earlier this year and an almost certain approval, the next major milestone with T-DM1 will be data from the MARIANNE trial in 1st line metastatic breast cancer. Overall, Immunogen's market cap prices in high expectations from T-DM1 and new catalysts are needed to push the stock higher.
On top of T-DM1, Immunogen has 10 additional clinical stage programs in its pipeline, 3 proprietary and 7 partnered (with Sanofi, Amgen, Bayer and Biotest). It is safe to say that at least with one target, Immunogen's antibody-drug conjugate (ADC) technology works very well. With 10 programs in clinical trials (9 of which are ADCs), it looks like Immunogen has statistics on its side. Most of these programs are expected to generate results in the coming 12 months.
At its quarterly call earlier this month, Immunogen's CEO made an intriguing comment about 3 partnered programs (not including T-DM1) with a potential to enter pivotal studies in 2H13. These can be either classic phase III trials or pivotal phase II trials that lead to accelerated approval. This could be very significant for Immunogen, as the market ascribes very little to its pipeline. Of course, one has to assume that these remarks are based on feedback from Immunogen's partners based on clinical data.
One of the three is probably Sanofi's SAR3419 (anti-CD19), which already demonstrated clinical activity in lymphoma patients. Sanofi will probably advance it to phase III, but commercial success is not guaranteed as the CD19 field is packed with highly effective drugs in development.
Of the 6 remaining partnered programs, only 3 could actually have sufficient data to merit considering pivotal studies. In all 3 cases, available data is with monotherapy administration, which makes the data more reliable and development route easier.
BT-062 (Biotest) - This is an ADC targeting CD138 for multiple myeloma. Phase I with this agent given every 3 weeks showed some activity as a single agent but it is not potent enough to justify a pivotal trial. Biotest is evaluating BT-062 in 2 additional trials: A single agent trial where the drug is given every week (recruiting since September 2010) and a very recent combination trial with Revlimid (recruiting since July 2012). Theoretically, if the weekly study generates a response rate of 20+% in refractory myeloma patients, this agent could be approved based experience with Onyx's (ONXX) carfilzomib.
SAR650984 (Sanofi) - This is a CD38 naked antibody that entered phase I in mid-2010. Sanofi did not report results from this trial but Genmab (GEN.CO) reported excellent results for its CD38 antibody, daratumumab. Genmab's antibody looks extremely active as a single agent in multiple myeloma with a response rate of 42% and a good safety profile. Sanofi's SAR650984 looks similar to daratumumab in preclinical testing, so it is likely that Sanofi is also seeing promising results.
SAR566658 (Sanofi) - This is an ADC targeting a novel epitope on MUC1, which enterd phase I in September 2010. Sanofi did not report any data from the study but after almost 2 years it should have a good sense of the drug's clinical profile.
Each of the programs above (BT-062, SAR650984, SAR566658) represents a blockbuster opportunity. Licensing terms are modest (similar to T-DM1) as the deals were signed prior to the validation with T-DM1 (BT-062 is an exception since Immunogen has a co-development option). Nevertheless, even if one of the programs generates promising data in the coming year as monotherapy, the impact on Immunogen's stock should be dramatic. Results for SAR3419, BT-062 and SAR650984 might be presented at this year's ASH meeting in December.
The other 3 partnered programs are still too early in phase I: BAY94-9343 (Bayer, anti- mesothelin) started phase I in September 2011, AMG 172 (Amgen, anti- CA-IX) started phase I in December 2011 and AMG 595 (Amgen, anti-EGFRvIII) has still not been given to patients.
Meaningful data on Immunogen's proprietary pipeline is expected only in 2013. IMGN901 (anti-CD56) will have randomized data in small cell lung cancer in 2H 2013. IMGN529 (anti-CD37) and IMGN853 (anti-folate receptor 1) are expected to have phase I data in non-Hodgkin's lymphoma (NHL) and solid tumors respectively.
Grüße an alle Immunogenfans Laura6
Upcoming Catalysts For Exelixis And Immunogen
August 27, 2012 | includes: EXEL, IMGN
Exelixis (EXEL) and Immunogen (IMGN) will have important phase III readouts in 2014. For Exelixis, the readout is from 2 phase III trials in prostate cancer, and for Immunogen, a phase III trial in 1st line breast cancer. This raises the question - why should investors hold the stocks throughout 2012-2013?
It is important to identify near-term catalysts for biotech companies, but biotech stocks tend to be volatile and their movement is not always catalyzed by fundamental events. A good example for that is the recent surge in Pharmacyclics (PCYC) despite limited news flow. Unfortunately, we sold Pharmacyclics 6 months ago for a 413% profit, under the assumption that the company had no meaningful catalysts until 2014. Since then, the stock is up more than 150%...
Exelixis
Exelixis raised $127.5M by issuing shares (at a price of $4.25 per share) and $250M via convertible notes (due 2019). Everybody knew Exelixis must continue to raise capital, yet the size of the deal and its timing are controversial. $375M (not including underwriters' 30-day option) is a bitter pill to swallow for a company with a $600-800M market cap. Looking on the bright side, for the first time the company has enough resources to take cabozantinib (cabo) to the finish line independently of a partner or the capital markets.
The recent fundraising, no matter how painful, does not change my perception of Exelixis. I still view cabo as a potential breakthrough in prostate cancer and believe it has utility in additional indications (especially renal and liver cancers). There are still open questions about the drug's bone effect and exact mechanism of action, making it a high risk investment. Still, even assuming a 33% probability of success in prostate cancer and using Medivation (MDVN) as a benchmark ($3.5B market cap after successful phase III and a licensing deal), Exelixis' valuation is still reasonable.
Exelixis' primary catalyst for 2012 is FDA approval in a niche indication that could provide the stock a "floor" valuation of $400M, excluding any potential upside.
FDA approval in MTC (November 2012) - Exelixis recently filed an NDA for cabo as a treatment for medullary thyroid cancer (MTC), a niche indication (U.S. peak sales <$100M). The deadline for FDA's decision is November 29th. Cabo has high chances of approval based on an impressive progression-free survival effect in phase III and the fact the trial was run under a special protocol assessment (SPA). Risks include cabo-related toxicity (which was fatal in some cases) and lack of survival difference (data still not mature).
Financial implications are limited, however, the approval can put a floor to Exelixis' valuation based on sales multiples. The only drug approved for advanced MTC is Asatrazenca's (AZN) Caprelsa, which recently got approved. It generated $12M in the first half of 2012, most of it in the U.S. As cabo appears more effective than Caprelsa, it can easily generate $40M in peak sales in the U.S. alone. Assuming a similar opportunity ex-U.S. and a sales multiple of 5, the MTC indication might be worth $400M for a pharma company with an oncology sales force.
Geographic deal (1H 2013) - Following approval in MTC, Exelixis could do a geographic deal that includes Asia or Asia+EU. This will probably be well received by investors as a source of non-dilutive funds and a way to cut down expenses. The company does not need a partner to get to 2014's catalysts, but in order to commercialize cabo globally, it will have to sell rights at least for Asia.
Phase II results in prostate cancer (1H 2013) - Exelixis will present updated results from a phase II trial in 150 chemo-pretreated patients. Although the trial does not have a control arm, it is a fairly large study with a homogeneous patient population that resembles the population in the ongoing phase III trials.
Initial data from this trial showed encouraging signs including bone scan responses in 67% of patients as well as effect on pain (usually caused by bone lesions) and bone metabolism markers. This degree of bone scan resolution is unprecedented, but it is still not clear whether it will lead to improved survival. In addition, cabo's effect on traditional endpoints that are primarily related to soft tissue lesions (as measured by objective response rate, progression free survival and PSA) was modest.
Therefore, the most important aspect of the trial would be looking at overall survival and whether it correlates to bone scan responses. The only proof that targeting bone metastases improves survival is Algeta's Alpharadin, which exclusively targets bone mets. Alpharadin prolonged survival of metastatic prostate cancer by 3.6 months. Interestingly, it does not lead to bone scan responses, so it is tempting to speculate that cabo's survival benefit could be greater.
Immunogen
Just as Exelixis' fate is tied to cabo, Immunogen's stock performance is dependent on T-DM1, a promising drug for breast cancer . Following the spectacular phase III data earlier this year and an almost certain approval, the next major milestone with T-DM1 will be data from the MARIANNE trial in 1st line metastatic breast cancer. Overall, Immunogen's market cap prices in high expectations from T-DM1 and new catalysts are needed to push the stock higher.
On top of T-DM1, Immunogen has 10 additional clinical stage programs in its pipeline, 3 proprietary and 7 partnered (with Sanofi, Amgen, Bayer and Biotest). It is safe to say that at least with one target, Immunogen's antibody-drug conjugate (ADC) technology works very well. With 10 programs in clinical trials (9 of which are ADCs), it looks like Immunogen has statistics on its side. Most of these programs are expected to generate results in the coming 12 months.
At its quarterly call earlier this month, Immunogen's CEO made an intriguing comment about 3 partnered programs (not including T-DM1) with a potential to enter pivotal studies in 2H13. These can be either classic phase III trials or pivotal phase II trials that lead to accelerated approval. This could be very significant for Immunogen, as the market ascribes very little to its pipeline. Of course, one has to assume that these remarks are based on feedback from Immunogen's partners based on clinical data.
One of the three is probably Sanofi's SAR3419 (anti-CD19), which already demonstrated clinical activity in lymphoma patients. Sanofi will probably advance it to phase III, but commercial success is not guaranteed as the CD19 field is packed with highly effective drugs in development.
Of the 6 remaining partnered programs, only 3 could actually have sufficient data to merit considering pivotal studies. In all 3 cases, available data is with monotherapy administration, which makes the data more reliable and development route easier.
BT-062 (Biotest) - This is an ADC targeting CD138 for multiple myeloma. Phase I with this agent given every 3 weeks showed some activity as a single agent but it is not potent enough to justify a pivotal trial. Biotest is evaluating BT-062 in 2 additional trials: A single agent trial where the drug is given every week (recruiting since September 2010) and a very recent combination trial with Revlimid (recruiting since July 2012). Theoretically, if the weekly study generates a response rate of 20+% in refractory myeloma patients, this agent could be approved based experience with Onyx's (ONXX) carfilzomib.
SAR650984 (Sanofi) - This is a CD38 naked antibody that entered phase I in mid-2010. Sanofi did not report results from this trial but Genmab (GEN.CO) reported excellent results for its CD38 antibody, daratumumab. Genmab's antibody looks extremely active as a single agent in multiple myeloma with a response rate of 42% and a good safety profile. Sanofi's SAR650984 looks similar to daratumumab in preclinical testing, so it is likely that Sanofi is also seeing promising results.
SAR566658 (Sanofi) - This is an ADC targeting a novel epitope on MUC1, which enterd phase I in September 2010. Sanofi did not report any data from the study but after almost 2 years it should have a good sense of the drug's clinical profile.
Each of the programs above (BT-062, SAR650984, SAR566658) represents a blockbuster opportunity. Licensing terms are modest (similar to T-DM1) as the deals were signed prior to the validation with T-DM1 (BT-062 is an exception since Immunogen has a co-development option). Nevertheless, even if one of the programs generates promising data in the coming year as monotherapy, the impact on Immunogen's stock should be dramatic. Results for SAR3419, BT-062 and SAR650984 might be presented at this year's ASH meeting in December.
The other 3 partnered programs are still too early in phase I: BAY94-9343 (Bayer, anti- mesothelin) started phase I in September 2011, AMG 172 (Amgen, anti- CA-IX) started phase I in December 2011 and AMG 595 (Amgen, anti-EGFRvIII) has still not been given to patients.
Meaningful data on Immunogen's proprietary pipeline is expected only in 2013. IMGN901 (anti-CD56) will have randomized data in small cell lung cancer in 2H 2013. IMGN529 (anti-CD37) and IMGN853 (anti-folate receptor 1) are expected to have phase I data in non-Hodgkin's lymphoma (NHL) and solid tumors respectively.
Grüße an alle Immunogenfans Laura6
Morgen findet der R&D Day von Roche in London statt. Davon sollte auch der IMGN-Kurs profitieren können.
Im September gibt es auch noch einige Präsentationen für Investoren....
ImmunoGen, Inc. Announces Webcast of Presentations at Upcoming Investor Conferences
Tue September 4, 2012 6:30 AM | about: IMGN
NEWS PROVIDED BY:
Business Wire
WALTHAM, Mass.--(BUSINESS WIRE)-- ImmunoGen, Inc . (Nasdaq: IMGN), a biotechnology company that develops anticancer therapeutics using its antibody expertise and Targeted Antibody Payload (TAP) technology, today announced that the following presentations by Company management at upcoming investor conferences will be webcast:
Stifel Nicolaus 2012 Healthcare Conference
10:55 am ET on September 5, 2012 in Boston, MA
Presenter: Gregory Perry, Executive Vice President and CFO
Morgan Stanley Global Healthcare Conference
8:00 am ET on September 12, 2012 in New York, NY
Presenter: Daniel Junius, President and CEO
UBS Global Life Sciences Conference
3:00 pm ET on September 20, 2012 in New York, NY
Presenter: Daniel Junius, President and CEO
A webcast of each presentation can be accessed live through the Investor Information section of the Companys website, www.immunogen.com; a replay of each presentation will be available at the same location for one week.
The Company is also participating in the Credit Suisse 3rd Annual Small & Mid Cap Conference on September 21, 2012 in New York, NY.
mal sehen wie sich das im Kurs auswirkt.
Grüße Laura6
ImmunoGen, Inc. Announces Webcast of Presentations at Upcoming Investor Conferences
Tue September 4, 2012 6:30 AM | about: IMGN
NEWS PROVIDED BY:
Business Wire
WALTHAM, Mass.--(BUSINESS WIRE)-- ImmunoGen, Inc . (Nasdaq: IMGN), a biotechnology company that develops anticancer therapeutics using its antibody expertise and Targeted Antibody Payload (TAP) technology, today announced that the following presentations by Company management at upcoming investor conferences will be webcast:
Stifel Nicolaus 2012 Healthcare Conference
10:55 am ET on September 5, 2012 in Boston, MA
Presenter: Gregory Perry, Executive Vice President and CFO
Morgan Stanley Global Healthcare Conference
8:00 am ET on September 12, 2012 in New York, NY
Presenter: Daniel Junius, President and CEO
UBS Global Life Sciences Conference
3:00 pm ET on September 20, 2012 in New York, NY
Presenter: Daniel Junius, President and CEO
A webcast of each presentation can be accessed live through the Investor Information section of the Companys website, www.immunogen.com; a replay of each presentation will be available at the same location for one week.
The Company is also participating in the Credit Suisse 3rd Annual Small & Mid Cap Conference on September 21, 2012 in New York, NY.
mal sehen wie sich das im Kurs auswirkt.
Grüße Laura6
Schon wieder Aktuelle Neuigkeiten ,diesmal von IMGN 901....
ImmunoGen, Inc. Announces Presentation of New IMGN901 Clinical Data
Thu September 6, 2012 8:45 AM | about: IMGN
NEWS PROVIDED BY:
Business Wire
Phase I evaluation presented established IMGN901 dose being used in Phase II assessment the NORTH trial for first-line treatment of small-cell lung cancer (SCLC).
IMGN901 able to be administered at full single-agent dose in combination regimen assessed.
Encouraging activity reported in treatment of SCLC.
WALTHAM, Mass.--(BUSINESS WIRE)-- ImmunoGen, Inc. (IMGN), a biopharmaceutical company that develops anticancer therapeutics using its antibody expertise and Targeted Antibody Payload (TAP) technology, today announced the presentation of clinical data for the Companys IMGN901 targeted anticancer compound at the Chicago Multidisciplinary Symposium in Thoracic Oncology.
The data being reported today are from the dose-finding evaluation conducted to establish the recommended Phase II dose for our NORTH trial, commented James OLeary, MD, Vice President and Chief Medical Officer. IMGN901 was able to be administered in combination with a standard etoposide/carboplatin regimen at its full single-agent dose, which speaks to the favorable tolerability profile of this compound. Additionally, while enrollment wasnt limited to patients with SCLC, the findings seen in those patients are encouraging.
The Dose-Finding Evaluation Conducted
This Phase I assessment was designed to establish the dose of IMGN901 to be used in combination with etoposide (E) and carboplatin (C) in a Phase II assessment the NORTH trial of this combination regimen for the first-line treatment of SCLC. E/C is a standard treatment for newly diagnosed, extensive disease SCLC, and the NORTH trial is designed to assess whether adding IMGN901 to E/C provides a meaningful additional clinical benefit. In this assessment, IMGN901 is administered on Days 1 and 8 every 21 days.
Enrollment in the dose-finding evaluation was open to patients with any type of advanced solid tumors appropriately treated with E/C. All patients received E at its standard dose of 100 mg/m2,given on Days 1-3 every 21 days. Two different doses of C are widely used with E C AUC5 and C AUC6 and thus escalating doses of IMGN901 were evaluated with each. C is administered on Day 1 every 21 days. A total of 33 patients received one of the five dose combinations assessed (two alternative IMGN901 doses with C AUC6 and three with C AUC5). Thirteen of these patients had SCLC.
Phase II Dose Established
The Phase II dose established was IMGN901 at 112 mg/m2 with C AUC5 and E at 100 mg/m2. Higher IMGN901 doses were not evaluated as 112 mg/m2 was the maximum tolerated dose established in an assessment of IMGN901 given as a single agent in another trial with the D1, D8 every 21 days dosing schedule.
The overall safety profile of IMGN901 used with C/E was consistent with that of IMGN901 and of C/E used separately. Low grade (1 or 2) peripheral neuropathy was the most common adverse event considered by the investigators to be related to the treatment regimen, as reported previously for IMGN901, while myelosuppressive events were the most common related grade 3 or 4 events, as reported previously for C/E.
Activity Noted
Three of the 13 patients with SCLC enrolled had chemotherapy-naïve disease. Two of these three patients had an objective response (partial response or PR) by RECIST criteria to treatment with IMGN901 plus E/C.
All of the 10 patients with previously treated SCLC had received prior platinum-based therapy, and seven of these patients had platinum-resistant/refractory disease. Four of these ten patients had a PR, including two of the patients with platinum-resistant/refractory disease.
Among all of the 33 patients enrolled, ten had an objective response, and 24 (72.7%) had disease control (objective response or stable disease).
ImmunoGens NORTH Trial
The 120-patient NORTH trial is designed to evaluate the efficacy and safety of IMGN901 for first-line treatment of extensive disease SCLC. All patients enrolled are provided with up to six cycles of C/E. Two-thirds of the patients enrolled are randomized to also receive IMGN901. These patients can elect to remain on IMGN901, as monotherapy, after completion of the C/E cycles if benefiting from treatment. The trial is designed to compare the findings in the IMGN901-including treatment arm to historic controls, with the control arm serving to verify consistency with historical results.
The NORTH trial utilizes a Simon Two-Stage Design: once 59 patients have been enrolled across the two study arms, those two cohorts of patients will be followed for an interim analysis of progression-free survival (PFS) at 6 months. The interim analysis will focus on whether the IMGN901-including treatment arm met pre-defined clinical benefit hurdles. Success on this interim analysis will serve as a basis for certain development decisions by the Company.
The primary endpoint of the NORTH trial is PFS. Secondary endpoints include PFS at 6 months, overall survival at 12 months, time to progression, overall survival, and overall response rate.
About IMGN901
IMGN901 is designed to target and kill CD56+ cancer cells. This TAP compound is wholly owned by ImmunoGen and consists of the Companys CD56-targeting antibody with its DM1 cancer-cell killing agent attached using one of its engineered linkers. IMGN901 has been granted orphan drug designation for SCLC in the US and Europe.
In addition to SCLC, other CD56+ cancers include multiple myeloma and Merkel cell carcinoma. In early-stage clinical testing, IMGN901 has demonstrated encouraging activity in these cancers as well as in SCLC and also has orphan drug designation for them.
About SCLC
It is estimated that approximately 29,400 new cases of SCLC will be diagnosed in the United States this year.1 SCLC almost universally expresses CD56. Approximately two-thirds of patients have extensive disease at the time of diagnosis, as SCLC tends to spread broadly through the body quite early in its course.2 As a result, SCLC is usually treated with chemotherapy rather than with surgery.3 Median PFS for extensive disease SCLC is approximately 5.5 months, while median overall survival averages 9-11 months.3,4
About ImmunoGen, Inc.
ImmunoGen, Inc. develops targeted anticancer therapeutics using the Company's expertise in tumor biology, monoclonal antibodies, potent cancer-cell killing agents and engineered linkers. The Company's TAP technology uses monoclonal antibodies to deliver one of ImmunoGen's proprietary cancer-killing agents specifically to tumor cells. There are now ten TAP compounds in clinical development, of which three are wholly owned by the Company. ImmunoGens collaborative partners include Amgen, Bayer HealthCare, Biotest, Lilly, Novartis, Roche, and Sanofi. A marketing application for trastuzumab emtansine (T-DM1), the most advanced compound using ImmunoGen's TAP technology, has been submitted in the US. Roche is developing this compound under an agreement between ImmunoGen and Genentech, a member of the Roche Group. More information about ImmunoGen can be found at www.immunogen.com.
¹ American Cancer Society, Cancer Facts & Figures 2012.
2 American Cancer Society, Lung Cancer (Small Cell) 2012.
3Socinski, MA, Smith, EF, Lorigan, P, et al. (2009). J Clin Oncol, 27(28).
4Foster, NR, Qi, Y, Krook, JE, et al. (2009). J Clin Oncol, 27(15s).
Vielleicht kann mal einer der fachkundigen hier im Forum die Ergebnisse dieser Studie kommentieren.
Der Kurs steigt heute jedenfalls .!!!
viele Grüße Laura6
ImmunoGen, Inc. Announces Presentation of New IMGN901 Clinical Data
Thu September 6, 2012 8:45 AM | about: IMGN
NEWS PROVIDED BY:
Business Wire
Phase I evaluation presented established IMGN901 dose being used in Phase II assessment the NORTH trial for first-line treatment of small-cell lung cancer (SCLC).
IMGN901 able to be administered at full single-agent dose in combination regimen assessed.
Encouraging activity reported in treatment of SCLC.
WALTHAM, Mass.--(BUSINESS WIRE)-- ImmunoGen, Inc. (IMGN), a biopharmaceutical company that develops anticancer therapeutics using its antibody expertise and Targeted Antibody Payload (TAP) technology, today announced the presentation of clinical data for the Companys IMGN901 targeted anticancer compound at the Chicago Multidisciplinary Symposium in Thoracic Oncology.
The data being reported today are from the dose-finding evaluation conducted to establish the recommended Phase II dose for our NORTH trial, commented James OLeary, MD, Vice President and Chief Medical Officer. IMGN901 was able to be administered in combination with a standard etoposide/carboplatin regimen at its full single-agent dose, which speaks to the favorable tolerability profile of this compound. Additionally, while enrollment wasnt limited to patients with SCLC, the findings seen in those patients are encouraging.
The Dose-Finding Evaluation Conducted
This Phase I assessment was designed to establish the dose of IMGN901 to be used in combination with etoposide (E) and carboplatin (C) in a Phase II assessment the NORTH trial of this combination regimen for the first-line treatment of SCLC. E/C is a standard treatment for newly diagnosed, extensive disease SCLC, and the NORTH trial is designed to assess whether adding IMGN901 to E/C provides a meaningful additional clinical benefit. In this assessment, IMGN901 is administered on Days 1 and 8 every 21 days.
Enrollment in the dose-finding evaluation was open to patients with any type of advanced solid tumors appropriately treated with E/C. All patients received E at its standard dose of 100 mg/m2,given on Days 1-3 every 21 days. Two different doses of C are widely used with E C AUC5 and C AUC6 and thus escalating doses of IMGN901 were evaluated with each. C is administered on Day 1 every 21 days. A total of 33 patients received one of the five dose combinations assessed (two alternative IMGN901 doses with C AUC6 and three with C AUC5). Thirteen of these patients had SCLC.
Phase II Dose Established
The Phase II dose established was IMGN901 at 112 mg/m2 with C AUC5 and E at 100 mg/m2. Higher IMGN901 doses were not evaluated as 112 mg/m2 was the maximum tolerated dose established in an assessment of IMGN901 given as a single agent in another trial with the D1, D8 every 21 days dosing schedule.
The overall safety profile of IMGN901 used with C/E was consistent with that of IMGN901 and of C/E used separately. Low grade (1 or 2) peripheral neuropathy was the most common adverse event considered by the investigators to be related to the treatment regimen, as reported previously for IMGN901, while myelosuppressive events were the most common related grade 3 or 4 events, as reported previously for C/E.
Activity Noted
Three of the 13 patients with SCLC enrolled had chemotherapy-naïve disease. Two of these three patients had an objective response (partial response or PR) by RECIST criteria to treatment with IMGN901 plus E/C.
All of the 10 patients with previously treated SCLC had received prior platinum-based therapy, and seven of these patients had platinum-resistant/refractory disease. Four of these ten patients had a PR, including two of the patients with platinum-resistant/refractory disease.
Among all of the 33 patients enrolled, ten had an objective response, and 24 (72.7%) had disease control (objective response or stable disease).
ImmunoGens NORTH Trial
The 120-patient NORTH trial is designed to evaluate the efficacy and safety of IMGN901 for first-line treatment of extensive disease SCLC. All patients enrolled are provided with up to six cycles of C/E. Two-thirds of the patients enrolled are randomized to also receive IMGN901. These patients can elect to remain on IMGN901, as monotherapy, after completion of the C/E cycles if benefiting from treatment. The trial is designed to compare the findings in the IMGN901-including treatment arm to historic controls, with the control arm serving to verify consistency with historical results.
The NORTH trial utilizes a Simon Two-Stage Design: once 59 patients have been enrolled across the two study arms, those two cohorts of patients will be followed for an interim analysis of progression-free survival (PFS) at 6 months. The interim analysis will focus on whether the IMGN901-including treatment arm met pre-defined clinical benefit hurdles. Success on this interim analysis will serve as a basis for certain development decisions by the Company.
The primary endpoint of the NORTH trial is PFS. Secondary endpoints include PFS at 6 months, overall survival at 12 months, time to progression, overall survival, and overall response rate.
About IMGN901
IMGN901 is designed to target and kill CD56+ cancer cells. This TAP compound is wholly owned by ImmunoGen and consists of the Companys CD56-targeting antibody with its DM1 cancer-cell killing agent attached using one of its engineered linkers. IMGN901 has been granted orphan drug designation for SCLC in the US and Europe.
In addition to SCLC, other CD56+ cancers include multiple myeloma and Merkel cell carcinoma. In early-stage clinical testing, IMGN901 has demonstrated encouraging activity in these cancers as well as in SCLC and also has orphan drug designation for them.
About SCLC
It is estimated that approximately 29,400 new cases of SCLC will be diagnosed in the United States this year.1 SCLC almost universally expresses CD56. Approximately two-thirds of patients have extensive disease at the time of diagnosis, as SCLC tends to spread broadly through the body quite early in its course.2 As a result, SCLC is usually treated with chemotherapy rather than with surgery.3 Median PFS for extensive disease SCLC is approximately 5.5 months, while median overall survival averages 9-11 months.3,4
About ImmunoGen, Inc.
ImmunoGen, Inc. develops targeted anticancer therapeutics using the Company's expertise in tumor biology, monoclonal antibodies, potent cancer-cell killing agents and engineered linkers. The Company's TAP technology uses monoclonal antibodies to deliver one of ImmunoGen's proprietary cancer-killing agents specifically to tumor cells. There are now ten TAP compounds in clinical development, of which three are wholly owned by the Company. ImmunoGens collaborative partners include Amgen, Bayer HealthCare, Biotest, Lilly, Novartis, Roche, and Sanofi. A marketing application for trastuzumab emtansine (T-DM1), the most advanced compound using ImmunoGen's TAP technology, has been submitted in the US. Roche is developing this compound under an agreement between ImmunoGen and Genentech, a member of the Roche Group. More information about ImmunoGen can be found at www.immunogen.com.
¹ American Cancer Society, Cancer Facts & Figures 2012.
2 American Cancer Society, Lung Cancer (Small Cell) 2012.
3Socinski, MA, Smith, EF, Lorigan, P, et al. (2009). J Clin Oncol, 27(28).
4Foster, NR, Qi, Y, Krook, JE, et al. (2009). J Clin Oncol, 27(15s).
Vielleicht kann mal einer der fachkundigen hier im Forum die Ergebnisse dieser Studie kommentieren.
Der Kurs steigt heute jedenfalls .!!!
viele Grüße Laura6
Was ist den von der neune UBS-Analyse zu halten?
Heute wird IMGN abgeschlachtet. Auf der heutigen Telefonkonferenz wurde die Höhe der Tantiemen für T-DM1 beziffert ... viel bleibt da für IMGN nicht hängen. Umgekehrt müßte der Roche-Kurs steigen.
Antwort auf Beitrag Nr.: 43.756.190 von Joschka Schröder am 26.10.12 17:05:09Hallo JS,
sie haben dazu auch ein SEC-File draußen:
We are entitled to receive royalties based on worldwide sales of trastuzumab emtansine (T-DM1) by Genentech and its sublicensees.
The royalty term is determined on a country-by-country basis, and is initially 10 years from the date of first commercial sale of T-DM1 in the country. If, on such 10th anniversary, T-DM1 is covered by a valid claim under any patents controlled by us (excluding patents jointly owned by us and Genentech), then royalties remain payable on sales of T-DM1 in that country for an additional 2 years and no more.
The following two territories are used in our agreement with Genentech to determine the T-DM1 sales levels for the calculation of the applicable tiered royalty levels: (1) the United States of America and (2) the rest of the world. Royalties on sales of T-DM1 are determined based on annual calendar year net sales in each territory in accordance with a tiered structure calculated separately in each of the two territories as follows:
· 3% of net sales up to $250 million;
· 3.5% of net sales above $250 million and up to $400 million;
· 4% of net sales above $400 million and up to $700 million; and
· 5% of net sales above $700 million.
Royalties will be reduced to a flat 2% of net sales in any country at any time during the royalty term in which T-DM1 is not covered by a valid claim under any patents controlled by us (excluding patents jointly owned by us and Genentech or solely owned by Genentech) in such country.
The license agreement also provides for certain adjustments to the royalties payable to us if:
· Genentech makes certain third party license payments in order to exploit the TAP technology components of T-DM1, although such adjustments would in no event reduce the royalties payable for any country below the greater of 50% of the royalties otherwise payable with respect to sales of T-DM1 in such country, or 2% of net sales in such country; or
· a third party obtains regulatory approval in a country to market and sell a product containing a conjugate of an anti-HER2 antibody with a maytansinoid, in which case royalties will be reduced to a flat 1% of net sales of T-DM1 in such country
sie haben dazu auch ein SEC-File draußen:
We are entitled to receive royalties based on worldwide sales of trastuzumab emtansine (T-DM1) by Genentech and its sublicensees.
The royalty term is determined on a country-by-country basis, and is initially 10 years from the date of first commercial sale of T-DM1 in the country. If, on such 10th anniversary, T-DM1 is covered by a valid claim under any patents controlled by us (excluding patents jointly owned by us and Genentech), then royalties remain payable on sales of T-DM1 in that country for an additional 2 years and no more.
The following two territories are used in our agreement with Genentech to determine the T-DM1 sales levels for the calculation of the applicable tiered royalty levels: (1) the United States of America and (2) the rest of the world. Royalties on sales of T-DM1 are determined based on annual calendar year net sales in each territory in accordance with a tiered structure calculated separately in each of the two territories as follows:
· 3% of net sales up to $250 million;
· 3.5% of net sales above $250 million and up to $400 million;
· 4% of net sales above $400 million and up to $700 million; and
· 5% of net sales above $700 million.
Royalties will be reduced to a flat 2% of net sales in any country at any time during the royalty term in which T-DM1 is not covered by a valid claim under any patents controlled by us (excluding patents jointly owned by us and Genentech or solely owned by Genentech) in such country.
The license agreement also provides for certain adjustments to the royalties payable to us if:
· Genentech makes certain third party license payments in order to exploit the TAP technology components of T-DM1, although such adjustments would in no event reduce the royalties payable for any country below the greater of 50% of the royalties otherwise payable with respect to sales of T-DM1 in such country, or 2% of net sales in such country; or
· a third party obtains regulatory approval in a country to market and sell a product containing a conjugate of an anti-HER2 antibody with a maytansinoid, in which case royalties will be reduced to a flat 1% of net sales of T-DM1 in such country
Antwort auf Beitrag Nr.: 43.756.490 von SLGramann am 26.10.12 18:05:10Man beachte dabei insbesondere auch dieses feine Detail:
Royalties on sales of T-DM1 are determined based on annual calendar year net sales in each territory in accordance with a tiered structure calculated separately in each of the two territories as follows
Da es laut Vertrag zwei "Länder" gibt, sind die Schwellenwerte in Wahrheit ungefähr doppelt so hoch.
Royalties on sales of T-DM1 are determined based on annual calendar year net sales in each territory in accordance with a tiered structure calculated separately in each of the two territories as follows
Da es laut Vertrag zwei "Länder" gibt, sind die Schwellenwerte in Wahrheit ungefähr doppelt so hoch.
Antwort auf Beitrag Nr.: 43.756.499 von SLGramann am 26.10.12 18:09:22Du weist mit Recht auf den wesentlichen Punkt hin ... die separate Behandlung der beiden Regionen (USA/Rest der Welt). Das war für mich heute die größte Überraschung.
PS: Der SEC-File lag bereits zur Mittagszeit in meinem Postfach.
PS: Der SEC-File lag bereits zur Mittagszeit in meinem Postfach.
Hallo,
getreu meinem Prinzip, Biotec-Aktien nur bei Schwäche zu kaufen, habe ich bei IMGN erstmals mittelschwer zugelangt. Die T-DM1-Story gefällt mir eigentlich ganz gut,Q-Zahlen gehen wohl so, Aktie ist m.M. zwar nicht billig, aber der Kursverfall etwas übertrieben.
So long und Grüße
q.
getreu meinem Prinzip, Biotec-Aktien nur bei Schwäche zu kaufen, habe ich bei IMGN erstmals mittelschwer zugelangt. Die T-DM1-Story gefällt mir eigentlich ganz gut,Q-Zahlen gehen wohl so, Aktie ist m.M. zwar nicht billig, aber der Kursverfall etwas übertrieben.
So long und Grüße
q.
Antwort auf Beitrag Nr.: 43.756.915 von quepos am 26.10.12 20:07:07Hallo quepos,
sehe ich auch so. Bin nach längere Abstinenz gerade wieder in IMGN rein (zu 11,86 Dollar).
Langfristig sollte Herceptin der Maßstab für T-DM1 sein. Ich würde meinen, dass man den "Rest" von IMGN derzeit zu billig bekommt.
Vor allem auf IMGN 853 bin ich gespannt. Nächstes Jahr sollte es da erste Daten geben.
sehe ich auch so. Bin nach längere Abstinenz gerade wieder in IMGN rein (zu 11,86 Dollar).
Langfristig sollte Herceptin der Maßstab für T-DM1 sein. Ich würde meinen, dass man den "Rest" von IMGN derzeit zu billig bekommt.
Vor allem auf IMGN 853 bin ich gespannt. Nächstes Jahr sollte es da erste Daten geben.
Antwort auf Beitrag Nr.: 43.756.915 von quepos am 26.10.12 20:07:07Du solltest in jedem Fall alles sorgfältig durchrechnen, von einer Story alleine wird man nicht reich.
Ich habe den nachfolgenden Vergleich bereits im Morphosys-Thread gepostet:
Bis heute sahen die Analystenerwartungen für T-DM1 in etwa so aus:
Jefferies:
2014 - Umsatz USA 0,33 Mdr. USD - Restliche Welt 0 USD - Tantieme 4,0 %
2015 - Umsatz USA 0,67 Mdr. USD - Restliche Welt 0,55 Mrd. USD - Tantieme 4,8 %
2016 - Umsatz USA 0,98 Mdr. USD - Restliche Welt 1,40 Mrd. USD - Tantieme 5,3 %
2017 - Umsatz USA 1,39 Mdr. USD - Restliche Welt 1,63 Mrd. USD - Tantieme 5,8 %
Somit ergäbe sich gemäß Jefferies beispielsweise für 2016 eine Tantiemenzahlung i.H. von 126 Mio. USD.
Im Vergleich dazu kommt beispielsweise Cantor Fitzgerald auf 162 Mio. USD für 2016.
Die UBS, deren Berechnungen mir nicht vorliegen, war hingegen deutlich vorsichtiger (Kursziel für IMGN: 9 USD), was mich zur Vorsicht gemahnt hat, da die UBS-Analysten recht gute Kontakte nach Basel haben.
Wie könnte die Rechnung in der Realität ausschauen?
Offizieller Roche-Fahrplan für die T-DM1-Zulassungsgesuche:
2012: HER2-pos. pretreated mBC
2014: HER2-pos. mBC 1st line
2015: HER2-pos. gastric cancer
Daraus ergibt sich mittels Überschlagsrechnung (HER2-pos.mBC) für 2016:
Anzahl Patient(inn)en USA und restl. Welt je 10.000, jährl. Behandlungskosten 50.000 USD je Patient -> je 500 Mio. USD Umsatz in den USA und dem Rest der Welt -> Tantieme beträgt entsprechend jeweils 4 % (Royalties werden separat für beide Territorien berechnet) -> Gesamt-Royalties IMGN somit 40 Mio. USD (Tantiemen für die Indikation "HER2-positiver Magenkrebs" sind vernachlässigbar).
Da auch 2016/2017 nicht mit der Zulassung weiterer Indikationen zu rechnen ist, könnten 40 Mio. USD in etwa die jährlichen Mittelzuflüsse in diesem Zeitraum sein.
Auf dieser Basis könnte man jetzt überlegen, ob die Aktie günstig oder ungünstig bewertet ist (muß jeder für sich selbst entscheiden).
Ich habe den nachfolgenden Vergleich bereits im Morphosys-Thread gepostet:
Bis heute sahen die Analystenerwartungen für T-DM1 in etwa so aus:
Jefferies:
2014 - Umsatz USA 0,33 Mdr. USD - Restliche Welt 0 USD - Tantieme 4,0 %
2015 - Umsatz USA 0,67 Mdr. USD - Restliche Welt 0,55 Mrd. USD - Tantieme 4,8 %
2016 - Umsatz USA 0,98 Mdr. USD - Restliche Welt 1,40 Mrd. USD - Tantieme 5,3 %
2017 - Umsatz USA 1,39 Mdr. USD - Restliche Welt 1,63 Mrd. USD - Tantieme 5,8 %
Somit ergäbe sich gemäß Jefferies beispielsweise für 2016 eine Tantiemenzahlung i.H. von 126 Mio. USD.
Im Vergleich dazu kommt beispielsweise Cantor Fitzgerald auf 162 Mio. USD für 2016.
Die UBS, deren Berechnungen mir nicht vorliegen, war hingegen deutlich vorsichtiger (Kursziel für IMGN: 9 USD), was mich zur Vorsicht gemahnt hat, da die UBS-Analysten recht gute Kontakte nach Basel haben.
Wie könnte die Rechnung in der Realität ausschauen?
Offizieller Roche-Fahrplan für die T-DM1-Zulassungsgesuche:
2012: HER2-pos. pretreated mBC
2014: HER2-pos. mBC 1st line
2015: HER2-pos. gastric cancer
Daraus ergibt sich mittels Überschlagsrechnung (HER2-pos.mBC) für 2016:
Anzahl Patient(inn)en USA und restl. Welt je 10.000, jährl. Behandlungskosten 50.000 USD je Patient -> je 500 Mio. USD Umsatz in den USA und dem Rest der Welt -> Tantieme beträgt entsprechend jeweils 4 % (Royalties werden separat für beide Territorien berechnet) -> Gesamt-Royalties IMGN somit 40 Mio. USD (Tantiemen für die Indikation "HER2-positiver Magenkrebs" sind vernachlässigbar).
Da auch 2016/2017 nicht mit der Zulassung weiterer Indikationen zu rechnen ist, könnten 40 Mio. USD in etwa die jährlichen Mittelzuflüsse in diesem Zeitraum sein.
Auf dieser Basis könnte man jetzt überlegen, ob die Aktie günstig oder ungünstig bewertet ist (muß jeder für sich selbst entscheiden).
Antwort auf Beitrag Nr.: 43.757.041 von Joschka Schröder am 26.10.12 20:43:33Hallo JS,
ich würde sagen, dass T-DM1 allein nicht für eine überzeugende Investment-Story reicht, aber es legt schon mal eine gute Basis und hat langfristig noch sehr viel Potential.
2013 sollen die Untersuchungen für die neoadjuvante Anwendung beginnen. Das eröffnet langfristig sicher eine andere Dimension, oder?
Auf mittlere Sicht werden wir hier aber noch etwas anderes als T-DM1 brauchen, um erfolgreich zu sein.
SAR3419 ist da definitiv ein Hoffnungsträger. Für mich auch IMGN 853.
Die Technologieplattform ist natürlich ein Wert an sich.
Trotzdem keine einfache Entscheidung. Die Marktkap. liegt immer noch bei fast 1 Milliarde und weitere KEs sind für die nächsten Jahre absehbar.
Viele Grüße
SLG
ich würde sagen, dass T-DM1 allein nicht für eine überzeugende Investment-Story reicht, aber es legt schon mal eine gute Basis und hat langfristig noch sehr viel Potential.
2013 sollen die Untersuchungen für die neoadjuvante Anwendung beginnen. Das eröffnet langfristig sicher eine andere Dimension, oder?
Auf mittlere Sicht werden wir hier aber noch etwas anderes als T-DM1 brauchen, um erfolgreich zu sein.
SAR3419 ist da definitiv ein Hoffnungsträger. Für mich auch IMGN 853.
Die Technologieplattform ist natürlich ein Wert an sich.
Trotzdem keine einfache Entscheidung. Die Marktkap. liegt immer noch bei fast 1 Milliarde und weitere KEs sind für die nächsten Jahre absehbar.
Viele Grüße
SLG
Zitat von SLGramann: Trotzdem keine einfache Entscheidung. Die Marktkap. liegt immer noch bei fast 1 Milliarde und weitere KEs sind für die nächsten Jahre absehbar.
Ich bin selber noch am grübeln, welche Bewertung angemessen sein könnte. EV mittlerweile 564 Mio. € bzw. 728 Mio. USD. Im übrigen - wie gewohnt - volle Zustimmung zu Deinem Beitrag.
Antwort auf Beitrag Nr.: 43.757.103 von SLGramann am 26.10.12 21:11:50Wo liegt denn Deiner Meinung nach der "faire Wert"?
Antwort auf Beitrag Nr.: 43.757.222 von Joschka Schröder am 26.10.12 21:57:44Hallo JS,
der faire Wert, die Frage der Fragen...
Ich würde es so sagen:
1.) Der unmittelbare Wert von T-DM1 resultiert aus einem Einsatz im späteren Erkrankungsverlauf.
Daher ist es noch nicht angemessen, auf die heutigen Umsätze von Herceptin hochzurechnen.
2.) Langfristig (2020) könnte ich mir vorstellen, dass T-DM1 größer als Herceptin sein wird, aber das ist noch zu weit weg. Dennoch sollte man das nicht ganz aus den Augen lassen.
Was ist nun mit den Umsätzen auf kurze Sicht?
Da halte ich mich bis auf weiteres an folgende Ausführungen von Hammer:
The best benchmark for T-DM1’s addressable market is Herceptin, which generated more than $5B in sales last year. Theoretically, T-DM1 could be even bigger than Herceptin because it might be useful in diseases where Herceptin is not effective like ovarian and prostate cancer. Moreover, T-DM1 will probably have better pricing and could be given for longer periods of times (where patients are treated to progression).
The majority of Herceptin’s sales come from early stage treatment while advanced stage breast cancer represents a $1-1.5B opportunity. Although Roche has an ongoing phase II evaluating T-DM1 as adjuvant therapy, its plans are still unclear and in any case, it will take years to get the drug approved in this setting. There are still no open trials in other tumor types, so it is too early to assess this opportunity as well.
This leaves T-DM1 with a market opportunity of ~2B assuming better pricing and longer treatment duration compared with Herceptin. Assuming the drug gets approved for 1st line breast cancer in 2013, it could reach sales of $1B in 2016, of which $30-50M will go straight to Immunogen’s bottom line. Even when assigning a very high probability of success, Immunogen’s current market cap seems to be more than fair.
Hammer hat damals bei einer Marktkapitalisierung von ca. 1,2 Mrd. oder so aus dem oben geschriebenen Grund verkauft.
Nun gut, unterstellen wir für 2016 mal 40 Mio. nach Steuern aus T-DM1.
Da die Tantiemen in der ferneren Zukunft wahrscheinlich stark steigen werden, würde ich T-DM1 zwischen 500 und 600 Millionen Dollar an Wert für IMGN zubilligen.
3.) Jetzt stellt sich die Frage, was man für die anderen Programme und die Technologieplattform veranschlagt.
In Bezug auf die anderen Programme stehen interessante Monate bevor.
Laura hat das schon gepostet, aber ich wiederhole einige Auszüge:
At its quarterly call earlier this month, Immunogen’s CEO made an intriguing comment about 3 partnered programs (not including T-DM1) with a potential to enter pivotal studies in 2H13. These can be either classic phase III trials or pivotal phase II trials that lead to accelerated approval.
- One of the three is probably Sanofi’s SAR3419 (anti-CD19), which already demonstrated clinical activity in lymphoma patients. Sanofi will probably advance it to phase III but commercial success is not guaranteed as the CD19 field is packed with highly effective drugs in development.
- SAR650984 (Sanofi) – This is a CD38 naked antibody that entered phase I in mid-2010. Sanofi did not report results from this trial but Genmab (GEN.CO) reported excellent results for its CD38 antibody, daratumumab. Genmab’s antibody looks extremely active as a single agent in multiple myeloma with a response rate of 42% and a good safety profile. Sanofi’s SAR650984 looks similar to daratumumab in preclinical testing, so it is likely that Sanofi is also seeing promising results.
- BT-062 (Biotest) - This is an ADC targeting CD138 for multiple myeloma. Phase I with this agent given every 3 weeks showed some activity as a single agent but it is not potent enough to justify a pivotal trial. Biotest is evaluating BT-062 in 2 additional trials: A single agent trial where the drug is given every week (recruiting since September 2010) and a very recent combination trial with Revlimid (recruiting since July 2012). Theoretically, if the weekly study generates a response rate of 20+% in refractory myeloma patients, this agent could be approved based experience with Onyx’s (ONXX) carfilzomib.
Dazu kommt aus der Eigenpipe als spannendes Projekt IMGN853 (anti-folate receptor 1) und vielleicht ist sogar von IMGN901 (anti-CD56) noch etwas zu erwarten.
Ich bin einfach der Meinung, dass der Markt den Wert der (definitiv validierten!) Technologieplattform und die gesamte Pipeline jenseits von T-DM1 unterbewertet, wenn er dafür nur etwa 200 Mio. Dollar veranschlagt, wie er es derzeit offenbar tut.
Grüße
SLG
der faire Wert, die Frage der Fragen...

Ich würde es so sagen:
1.) Der unmittelbare Wert von T-DM1 resultiert aus einem Einsatz im späteren Erkrankungsverlauf.
Daher ist es noch nicht angemessen, auf die heutigen Umsätze von Herceptin hochzurechnen.
2.) Langfristig (2020) könnte ich mir vorstellen, dass T-DM1 größer als Herceptin sein wird, aber das ist noch zu weit weg. Dennoch sollte man das nicht ganz aus den Augen lassen.
Was ist nun mit den Umsätzen auf kurze Sicht?
Da halte ich mich bis auf weiteres an folgende Ausführungen von Hammer:
The best benchmark for T-DM1’s addressable market is Herceptin, which generated more than $5B in sales last year. Theoretically, T-DM1 could be even bigger than Herceptin because it might be useful in diseases where Herceptin is not effective like ovarian and prostate cancer. Moreover, T-DM1 will probably have better pricing and could be given for longer periods of times (where patients are treated to progression).
The majority of Herceptin’s sales come from early stage treatment while advanced stage breast cancer represents a $1-1.5B opportunity. Although Roche has an ongoing phase II evaluating T-DM1 as adjuvant therapy, its plans are still unclear and in any case, it will take years to get the drug approved in this setting. There are still no open trials in other tumor types, so it is too early to assess this opportunity as well.
This leaves T-DM1 with a market opportunity of ~2B assuming better pricing and longer treatment duration compared with Herceptin. Assuming the drug gets approved for 1st line breast cancer in 2013, it could reach sales of $1B in 2016, of which $30-50M will go straight to Immunogen’s bottom line. Even when assigning a very high probability of success, Immunogen’s current market cap seems to be more than fair.
Hammer hat damals bei einer Marktkapitalisierung von ca. 1,2 Mrd. oder so aus dem oben geschriebenen Grund verkauft.
Nun gut, unterstellen wir für 2016 mal 40 Mio. nach Steuern aus T-DM1.
Da die Tantiemen in der ferneren Zukunft wahrscheinlich stark steigen werden, würde ich T-DM1 zwischen 500 und 600 Millionen Dollar an Wert für IMGN zubilligen.
3.) Jetzt stellt sich die Frage, was man für die anderen Programme und die Technologieplattform veranschlagt.
In Bezug auf die anderen Programme stehen interessante Monate bevor.
Laura hat das schon gepostet, aber ich wiederhole einige Auszüge:
At its quarterly call earlier this month, Immunogen’s CEO made an intriguing comment about 3 partnered programs (not including T-DM1) with a potential to enter pivotal studies in 2H13. These can be either classic phase III trials or pivotal phase II trials that lead to accelerated approval.
- One of the three is probably Sanofi’s SAR3419 (anti-CD19), which already demonstrated clinical activity in lymphoma patients. Sanofi will probably advance it to phase III but commercial success is not guaranteed as the CD19 field is packed with highly effective drugs in development.
- SAR650984 (Sanofi) – This is a CD38 naked antibody that entered phase I in mid-2010. Sanofi did not report results from this trial but Genmab (GEN.CO) reported excellent results for its CD38 antibody, daratumumab. Genmab’s antibody looks extremely active as a single agent in multiple myeloma with a response rate of 42% and a good safety profile. Sanofi’s SAR650984 looks similar to daratumumab in preclinical testing, so it is likely that Sanofi is also seeing promising results.
- BT-062 (Biotest) - This is an ADC targeting CD138 for multiple myeloma. Phase I with this agent given every 3 weeks showed some activity as a single agent but it is not potent enough to justify a pivotal trial. Biotest is evaluating BT-062 in 2 additional trials: A single agent trial where the drug is given every week (recruiting since September 2010) and a very recent combination trial with Revlimid (recruiting since July 2012). Theoretically, if the weekly study generates a response rate of 20+% in refractory myeloma patients, this agent could be approved based experience with Onyx’s (ONXX) carfilzomib.
Dazu kommt aus der Eigenpipe als spannendes Projekt IMGN853 (anti-folate receptor 1) und vielleicht ist sogar von IMGN901 (anti-CD56) noch etwas zu erwarten.
Ich bin einfach der Meinung, dass der Markt den Wert der (definitiv validierten!) Technologieplattform und die gesamte Pipeline jenseits von T-DM1 unterbewertet, wenn er dafür nur etwa 200 Mio. Dollar veranschlagt, wie er es derzeit offenbar tut.
Grüße
SLG
Zitat von Joschka Schröder: Anzahl Patient(inn)en USA und restl. Welt je 10.000, jährl. Behandlungskosten 50.000 USD je Patient -> je 500 Mio. USD Umsatz in den USA und dem Rest der Welt -> Tantieme beträgt entsprechend jeweils 4 % (Royalties werden separat für beide Territorien berechnet) -> Gesamt-Royalties IMGN somit 40 Mio. USD (Tantiemen für die Indikation "HER2-positiver Magenkrebs" sind vernachlässigbar).
Da auch 2016/2017 nicht mit der Zulassung weiterer Indikationen zu rechnen ist, könnten 40 Mio. USD in etwa die jährlichen Mittelzuflüsse in diesem Zeitraum sein.
Aufgrund der gestaffelten Tantiemenhöhe dürfte die effektive Tantiemenquote geringer sein. Im obigen Beispiel: 250 Mio. USD zu 3 %, 150 Mio. USD zu 3,5 %, 100 Mio. USD zu 4 % ergibt/ergäbe eine Gesamttantieme in Höhe von 33,5 Mio. USD (effektive Quote mithin 3,4 %). Habe gestern leider nicht nachgefragt, ob diese Interpretation zutreffend ist.
Antwort auf Beitrag Nr.: 43.757.610 von SLGramann am 27.10.12 08:26:46Vielen Dank für Deine Einschätzung.
Ich habe mich noch einmal in Ruhe hingesetzt und anhand der mir aktuell zur Verfügung stehenden Daten und einiger Annahmen zur Marktdurchdringung eine Abschätzung von Umsatz- und Tantiemenentwicklung durchgeführt (werde versuchen, am Montag einige Details von Roche-Mitarbeitern validieren zu lassen).
Für die Indikation "HER2-pos. metastasierendes Mamma-Ca" komme ich für die USA und Europa auf jeweils ca. 770 Mio. USD T-DM1-Jahresumsatz, was einer Gesamt-Tantieme von 56 Mio. USD entspräche. Dieses Ziel könnte 2016 erreicht werden.
Für die Indikation "HER2-pos. nicht metastasierendes Mamma-Ca" käme später ggf. noch eine Gesamt-Tantieme in Höhe von 66 Mio. USD für die USA und Europa hinzu (Annahme: geringere Marktpenetration als in der obigen Indikation).
Zusammen wäre also für die USA und Europa im Idealfall in der Indikation "HER2-pos. Mamma-Ca" eine jährliche Gesamt-Tantieme i.H. von 122 Mio. USD realistisch.
Dazu kämen dann noch andere Länder (z.B. BRICs) und Indikationen (z.B: HER2 pos. Magen-Ca).
Hinsichtlich der Partner-Pipeline ist u.a. erwähnenswert, dass IMGN z.B. für Biotest´s BT-062-DM4 eine Option ziehen kann, die IMGN die 50 %igen Rechte (und Pflichten) für die künftigeUS-Vermarktung/Entwicklung überträgt. Der Optionspreis beträgt gerade mal 15 Mio. USD.
Auf dem aktuellen Kursniveau von nicht einmal 11,50 USD könnte ein erstes Investment in der Tat interessant sein.
Ich habe mich noch einmal in Ruhe hingesetzt und anhand der mir aktuell zur Verfügung stehenden Daten und einiger Annahmen zur Marktdurchdringung eine Abschätzung von Umsatz- und Tantiemenentwicklung durchgeführt (werde versuchen, am Montag einige Details von Roche-Mitarbeitern validieren zu lassen).
Für die Indikation "HER2-pos. metastasierendes Mamma-Ca" komme ich für die USA und Europa auf jeweils ca. 770 Mio. USD T-DM1-Jahresumsatz, was einer Gesamt-Tantieme von 56 Mio. USD entspräche. Dieses Ziel könnte 2016 erreicht werden.
Für die Indikation "HER2-pos. nicht metastasierendes Mamma-Ca" käme später ggf. noch eine Gesamt-Tantieme in Höhe von 66 Mio. USD für die USA und Europa hinzu (Annahme: geringere Marktpenetration als in der obigen Indikation).
Zusammen wäre also für die USA und Europa im Idealfall in der Indikation "HER2-pos. Mamma-Ca" eine jährliche Gesamt-Tantieme i.H. von 122 Mio. USD realistisch.
Dazu kämen dann noch andere Länder (z.B. BRICs) und Indikationen (z.B: HER2 pos. Magen-Ca).
Hinsichtlich der Partner-Pipeline ist u.a. erwähnenswert, dass IMGN z.B. für Biotest´s BT-062-DM4 eine Option ziehen kann, die IMGN die 50 %igen Rechte (und Pflichten) für die künftigeUS-Vermarktung/Entwicklung überträgt. Der Optionspreis beträgt gerade mal 15 Mio. USD.
Auf dem aktuellen Kursniveau von nicht einmal 11,50 USD könnte ein erstes Investment in der Tat interessant sein.
Antwort auf Beitrag Nr.: 43.757.977 von Joschka Schröder am 27.10.12 12:21:46Gesamt-Tantieme i.H. von 122 Mio. USD realistisch.
Hallo JS,
Du gehst also langfristig von T-DM1-Peak-Sales von ungefähr 3 Milliarden Dollar weltweit aus?
Das erscheint recht konservativ. Aber da wir dabei über weit entfernte Zeiträume reden und noch zahlreiche klinische Studien durchzuführen sind, ist ein vorsichtiges Herangehen ja auch geboten.
Zumindest ist bei Roche die Entscheidung gefallen, zu versuchen, T-DM1 eines fernen Tages sehr breit im Markt zu plazieren:
Registration trials in early stage HER2+ BC on track to start in 2013 — Roche plans to evaluate T-DM1 for neoadjuvant use, for adjuvant use and for treatment of residual invasive disease following surgery.
Grüße
PS: Hammer ist auch am Grübeln:
roy Says:
October 26th, 2012 at 12:40 pm
Hi Ohad
imgn is down sharply from recent high (took a plunge today), what you think would be a good entry point? thanks
Ohad Hammer Says:
October 26th, 2012 at 6:16 pm
Good question, i have been looking for an entry point as well.
At $10 IMGN is a great buy imo.
Ohad
Tja, für 10 Dollar würde ich nachkaufen. Ob die kommen, weiß kein Mensch.
Dass der Markt scheinbar überhaupt so viel bessere Konditionen unterstellt hat und jetzt dermaßen Amok läuft, ist schon etwas verwunderlich.
Dass die Tantiemen gestaffelt sind, war doch bekannt. Im Durchschnitt sollten sich mittel- und langfristig ungefähr 4% Tantiemen ergeben. Mit viel mehr hätte man nie rechnen dürfen.
Hallo JS,
Du gehst also langfristig von T-DM1-Peak-Sales von ungefähr 3 Milliarden Dollar weltweit aus?
Das erscheint recht konservativ. Aber da wir dabei über weit entfernte Zeiträume reden und noch zahlreiche klinische Studien durchzuführen sind, ist ein vorsichtiges Herangehen ja auch geboten.
Zumindest ist bei Roche die Entscheidung gefallen, zu versuchen, T-DM1 eines fernen Tages sehr breit im Markt zu plazieren:
Registration trials in early stage HER2+ BC on track to start in 2013 — Roche plans to evaluate T-DM1 for neoadjuvant use, for adjuvant use and for treatment of residual invasive disease following surgery.
Grüße
PS: Hammer ist auch am Grübeln:
roy Says:
October 26th, 2012 at 12:40 pm
Hi Ohad
imgn is down sharply from recent high (took a plunge today), what you think would be a good entry point? thanks
Ohad Hammer Says:
October 26th, 2012 at 6:16 pm
Good question, i have been looking for an entry point as well.
At $10 IMGN is a great buy imo.
Ohad
Tja, für 10 Dollar würde ich nachkaufen. Ob die kommen, weiß kein Mensch.
Dass der Markt scheinbar überhaupt so viel bessere Konditionen unterstellt hat und jetzt dermaßen Amok läuft, ist schon etwas verwunderlich.
Dass die Tantiemen gestaffelt sind, war doch bekannt. Im Durchschnitt sollten sich mittel- und langfristig ungefähr 4% Tantiemen ergeben. Mit viel mehr hätte man nie rechnen dürfen.
Die Analysten wurden wirklich auf dem falschen Fuß erwischt...
Some analysts estimated earlier that ImmunoGen would earn 5% royalties on sales of the cancer drug -- assuming that it gets approved. In a securities filing Friday, ImmunoGen disclosed that its royalty payments in the US and outside the country begin at 3% of sales and only reach the 5% level if revenue jumps above $700 million in a given year.
The disclosure has analysts like Joel Sendek of Stifel Nicolaus revising his revenue estimates for ImmunoGen. After initially predicting annual royalty revenue of $2.4 million to $176 million between 2013 and 2018, Sendek now estimates ImmunoGen will receive $300,000 beginning in 2013 up to $126 million in 2018.
Some analysts estimated earlier that ImmunoGen would earn 5% royalties on sales of the cancer drug -- assuming that it gets approved. In a securities filing Friday, ImmunoGen disclosed that its royalty payments in the US and outside the country begin at 3% of sales and only reach the 5% level if revenue jumps above $700 million in a given year.
The disclosure has analysts like Joel Sendek of Stifel Nicolaus revising his revenue estimates for ImmunoGen. After initially predicting annual royalty revenue of $2.4 million to $176 million between 2013 and 2018, Sendek now estimates ImmunoGen will receive $300,000 beginning in 2013 up to $126 million in 2018.
Zunächst muß ich die 122 Mio. USD auf 143 Mio. USD korrigieren. Ich Trottel hatte fälschlich beide Indikationen getrennt behandelt und die separat berechneten Tantiemen addiert, was natürlich zu Fehlern führt. Bei exakter Betrachtung der kumulierten Umsätze für die Indikation Mamma-Ca (das wären 3,25 Mrd. USD in meinem Beispiel) kommt man auf eine effektive Tantiemenquote von 4,4 % und die oben genannten 143 Mio. USD.
Das müssen jedoch keineswegs die Peak Sales sein, da ich
1) für die Indikation Erstlinientherapie bei nicht-metastasierendem Mamma-Ca nur eine Marktpenetration von 60 % angenommen habe;
2) für die Region "Rest der Welt" von Umsätzen ausgegangen bin, die denjenigen in den USA entsprechen. Dies ist zweifellos konservativ, weil Umsätze dieser Größenordnung bereits in Europa erreicht werden sollten;
3) weder BRIC-Staaten etc. noch andere Indikationen berücksichtigt habe;
4) meinen Überlegungen Behandlungskosten zugrunde gelegt habe, die in etwa den Kosten für eine Herceptin-Behandlung in Deutschland entsprechen. Tatsächlich könnte Roche für T-DM1 einen deutlich höheren Betrag verlangen.
Meine Rechnung ist also eher konservativ und liegt deutlich unter den von Roche in (länger zurückliegenden) persönlichen Gesprächen formulierten Erwartungen. Bei besonders günstiger Entwicklung könnten die Peak Sales auch doppelt so hoch sein.
Dass Jefferies u.a. überzogene Erwartungen an die Tantiemensätze hatten, war die ganze Zeit nicht recht nachvollziehbar (in meiner Excel-Tabelle steht seit mehreren Jahren "3 bis 5 %"). Aber die Analystengemeinde hatte ja auch bereits während der vorangegangenen Konferenz im Hinblick auf die begrenzten Laufzeiten überrascht reagiert, obwohl diese bereits zuvor in IMGN-Geschäftsberichten kommuniziert worden waren.
Neu war für mich die getrennte Berechnung nach Regionen (s. auch Dein gestriger Beitrag Nr. 168), die während der ersten Jahre nach Marktzulassung zu einer signifikanten Minderung der Tantieme führen wird.
Fazit: Auf dem derzeitigen Kursniveau (knapp 11,50 USD) dürften Käufe interessant und auf längere Sicht profitabel sein.
Das müssen jedoch keineswegs die Peak Sales sein, da ich
1) für die Indikation Erstlinientherapie bei nicht-metastasierendem Mamma-Ca nur eine Marktpenetration von 60 % angenommen habe;
2) für die Region "Rest der Welt" von Umsätzen ausgegangen bin, die denjenigen in den USA entsprechen. Dies ist zweifellos konservativ, weil Umsätze dieser Größenordnung bereits in Europa erreicht werden sollten;
3) weder BRIC-Staaten etc. noch andere Indikationen berücksichtigt habe;
4) meinen Überlegungen Behandlungskosten zugrunde gelegt habe, die in etwa den Kosten für eine Herceptin-Behandlung in Deutschland entsprechen. Tatsächlich könnte Roche für T-DM1 einen deutlich höheren Betrag verlangen.
Meine Rechnung ist also eher konservativ und liegt deutlich unter den von Roche in (länger zurückliegenden) persönlichen Gesprächen formulierten Erwartungen. Bei besonders günstiger Entwicklung könnten die Peak Sales auch doppelt so hoch sein.
Dass Jefferies u.a. überzogene Erwartungen an die Tantiemensätze hatten, war die ganze Zeit nicht recht nachvollziehbar (in meiner Excel-Tabelle steht seit mehreren Jahren "3 bis 5 %"). Aber die Analystengemeinde hatte ja auch bereits während der vorangegangenen Konferenz im Hinblick auf die begrenzten Laufzeiten überrascht reagiert, obwohl diese bereits zuvor in IMGN-Geschäftsberichten kommuniziert worden waren.
Neu war für mich die getrennte Berechnung nach Regionen (s. auch Dein gestriger Beitrag Nr. 168), die während der ersten Jahre nach Marktzulassung zu einer signifikanten Minderung der Tantieme führen wird.
Fazit: Auf dem derzeitigen Kursniveau (knapp 11,50 USD) dürften Käufe interessant und auf längere Sicht profitabel sein.
Zitat von SLGramann: PS: Hammer ist auch am Grübeln:
roy Says:
October 26th, 2012 at 12:40 pm
Hi Ohad
imgn is down sharply from recent high (took a plunge today), what you think would be a good entry point? thanks
Ohad Hammer Says:
October 26th, 2012 at 6:16 pm
Good question, i have been looking for an entry point as well.
At $10 IMGN is a great buy imo.
Ohad
Gibt es da einen Link? Vielen Dank!
Antwort auf Beitrag Nr.: 43.758.250 von Joschka Schröder am 27.10.12 14:50:14Das sind nur die neuesten Kommentare zu seinem letzten Beitrag in seinem Blog, der sich eigentlich mit Aveo beschäftigt.
In den Kommentaren wird aber zum Glück immer quer gefragt und diskutiert.
Hier ist der Link:
http://www.hammerstockblog.com/aveo-pharmaceuticals%E2%80%93…
In den Kommentaren wird aber zum Glück immer quer gefragt und diskutiert.
Hier ist der Link:
http://www.hammerstockblog.com/aveo-pharmaceuticals%E2%80%93…
Antwort auf Beitrag Nr.: 43.758.264 von SLGramann am 27.10.12 15:00:28Vielen Dank!
Ich habe noch einmal meine Aufzeichnungen vom Conference Call und einige pharmazeutische Statistiken durchgesehen. Meine erste Überschlagsrechnung zwar zu konservativ, u.a. weil die T-DM1-Therapie mehr kosten wird als in meinem Beispiel. Ich werde versuchen, morgen im Laufe des Tages ein Update zu posten.
Ich habe noch einmal meine Aufzeichnungen vom Conference Call und einige pharmazeutische Statistiken durchgesehen. Meine erste Überschlagsrechnung zwar zu konservativ, u.a. weil die T-DM1-Therapie mehr kosten wird als in meinem Beispiel. Ich werde versuchen, morgen im Laufe des Tages ein Update zu posten.
Ich habe gerade angefangen, die neueste UBS-Studie zu IMGN zu lesen. UBS hat das Kursziel von 10 USD auf 9 USD reduziert.
aktueller Kurs 10,90 USD ... aus meiner Sicht eine ausgezeichnete Kaufgelegenheit!
Details folgen.
Details folgen.
Ich habe mit drei völlig unterschiedlichen Methoden versucht, das T-DM1-Potiential abzuschätzen.
Zunächst habe ich auf Basis ausgesuchter Statistiken zur Inzidenz her2-überexprimierender Tumoren und möglichst realistischen Annahmen zu T-DM1-Preis, Behandlungsdauer und erwarteter Marktpenetration die Höhe der künftig von IMGN zu erwartenden Tantiemen geschätzt.
Jährliche Inzidenz in D ca. 18.000 Fälle, davon ca. 20 % metastasierend (mBC). D liegt bei der Inzidenz im europäischen Mittelfeld.
In den USA treten her2-positive Mamma-Ca USA ca. 20 % häufiger auf. Unter Berücksichtigung der Einwohnerzahl etc. kommt man für her2+ mBC in etwa auf folgende Fallzahlen:
USA 17.280
Europa 14.400
Hinsichtlich des T-DM1-Preises erscheinen jährlichen Behandlungskosten in Höhe von ca. 80.000 USD realistisch (zum Vergleich: Herceptin 45.000 USD, Perjeta bereits 70.800 USD ... und T-DM1 ist besonders innovativ und ersetzt zusätzlich die Chemotherapie).
Da die bisherigen Studien eine klare Überlegenheit des T-DM1 in der Indikation mBC gezeigt haben, rechne ich mit einer Marktdurchdringung von ca. 80 %, Behandlungsdauer 10 Monate (s. letzte Studiendaten).
Daraus ergibt sich für die Indikation mBC ein weltweiter Gesamtumsatz i.H. von 2,116 Mdr. USD, der in etwa zu gleichen Teilen den USA und Europa zuzuordnen ist (BRICs in meiner Rechnung irrelevant). Angesichts der mit Roche vereinbarten, gestaffelten Tantiemenregelung erhält man somit für die jährlichen Royalties in der Indikation mBC einen Betrag in Höhe von 85 Mio. USD. Royalties in dieser Größenordnung könnte IMGN in den Jahren ab 2016 erreichen (2013: Zulassung 2-4L mBC, 2014/15: 1L mBC).
Überschlagsrechnung für eBC (early breast cancer), erwartete Zulassung ca. 2017/18:
Fallzahl USA und Europa: jeweils ca. 38.000 Patient(inn)en, Marktdurchdringung 60%, Behandlungsdauer 1 Jahr.
Daraus folgt -> weltweiter Gesamtumsatz ca. 6,08 Mrd. USD, der in etwa zu gleichen Teilen auf Europa und die USA entfällt (BRICs etc. vernachlässigt). Unter Berücksichtigung der besonderen Tantiemenregelungen ergibt sich daraus für die Indikationen her2+ BC in Summe eine jährlicher Spitzenumsatz in Höhe von 8,2 Mrd. USD, was einer Tantieme in Höhe von 389 Mio. USD entspricht.
Nun folgt Kontrollrechnung A:
Roche kommuniziert für eBC und mBC folgende Ziele:
eBC: 70.000 Patient(inn)en
1L mBC: 18.000 Patient(inn)en
2-4L mBC: 26.000 Patient(in)en.
Behandlungszeit wie oben
Kosten T-DM1: 80.000 USD p.a. bzw. 6.667 USD p.m.
Daraus folgt für den Umsatz:
eBC: 5,950 Mrd.USD
1L mBC: 1,275 Mrd. USD
2-4L mBC: 1,842 Mrd. USD
und für die Tantiemenhöhe:
2-4L mBC: 72 Mio. USD
1-4 mBC: 153 Mio.USD
1L mBC: 433 Mio USD
Die Größenordnung der solchermaßen berechneten Tantiemenzahlungen stimmt mit den Werten meiner obigen Basisberechnung recht gut überein. Die Werte meiner Basisberechnung für mBC u.a. deshalb niedriger, weil ich dort keine Rezidivbehandlungen berücksichtigt habe.
Abschließend Kontrollrechnung B
Von Roche ist zu hören, dass man längerfristig Herceptin durch T-DM1 ersetzen möchte. Wenn man die in meiner Basisberechnung und der Kontrollrechnung A ermittelten T-DM1-Umsätze in entsprechende Herceptin-Umsätze umrechnet, sollten sich daher Werte ergeben, die in etwa den derzeitigen realen Herceptin-Umsätzen entsprechen. Bei der Umrechnung ist zu berücksichtigen, dass Herceptin bei mBC im Durchschnitt nur 8,1 Monate appliziert wird, während T-DM1 10 Monate lang gegeben wird. Die Therapiedauer bei eBC beträgt jeweils 1 Jahr.
Umrechnung der T-DM1-Umsätze aus der Basisberechnung führt zu einem Herceptin-Umsatz i.H. von 5,206 Mrd. USD. Damit wird der reale Wert (5,586 Mrd. USD im Jahr 2011) nur um 380 Mio. USD unterschritten. Dies ist wiederum plausibel, weil in meine Basisberechnung weder Umsätze aus der Indikation her2+ gastric cancer noch Umsätze aus der Bahndlung rezidivierenden mBC eingeflossen sind.
Umrechnung der T-DM1-Umsätze aus Kontrollrechnung B führt zu einem Herceptin-Umsatz i.H. von 5,384 Mrd. USD, was aus demselben Grund ausgezeichnet die Realität abbildet.
Auf dieser Basis läßt sich nun überlegen, wie die Aktie auf dem gegenwärtigen Niveau (aktuell ca. 11,00 USD) bewertet ist. Schon jetzt: Sie ist preiswert, auch wenn Analystenkommentare anderes behaupten. Dazu später mehr.
Da ich aus Zeitnot meine Beiträge schnell eintippe und dann gleich absende, bitte ich unrunde Formulierungen und etwaige Grammatikfehler zu entschuldigen.
Zunächst habe ich auf Basis ausgesuchter Statistiken zur Inzidenz her2-überexprimierender Tumoren und möglichst realistischen Annahmen zu T-DM1-Preis, Behandlungsdauer und erwarteter Marktpenetration die Höhe der künftig von IMGN zu erwartenden Tantiemen geschätzt.
Jährliche Inzidenz in D ca. 18.000 Fälle, davon ca. 20 % metastasierend (mBC). D liegt bei der Inzidenz im europäischen Mittelfeld.
In den USA treten her2-positive Mamma-Ca USA ca. 20 % häufiger auf. Unter Berücksichtigung der Einwohnerzahl etc. kommt man für her2+ mBC in etwa auf folgende Fallzahlen:
USA 17.280
Europa 14.400
Hinsichtlich des T-DM1-Preises erscheinen jährlichen Behandlungskosten in Höhe von ca. 80.000 USD realistisch (zum Vergleich: Herceptin 45.000 USD, Perjeta bereits 70.800 USD ... und T-DM1 ist besonders innovativ und ersetzt zusätzlich die Chemotherapie).
Da die bisherigen Studien eine klare Überlegenheit des T-DM1 in der Indikation mBC gezeigt haben, rechne ich mit einer Marktdurchdringung von ca. 80 %, Behandlungsdauer 10 Monate (s. letzte Studiendaten).
Daraus ergibt sich für die Indikation mBC ein weltweiter Gesamtumsatz i.H. von 2,116 Mdr. USD, der in etwa zu gleichen Teilen den USA und Europa zuzuordnen ist (BRICs in meiner Rechnung irrelevant). Angesichts der mit Roche vereinbarten, gestaffelten Tantiemenregelung erhält man somit für die jährlichen Royalties in der Indikation mBC einen Betrag in Höhe von 85 Mio. USD. Royalties in dieser Größenordnung könnte IMGN in den Jahren ab 2016 erreichen (2013: Zulassung 2-4L mBC, 2014/15: 1L mBC).
Überschlagsrechnung für eBC (early breast cancer), erwartete Zulassung ca. 2017/18:
Fallzahl USA und Europa: jeweils ca. 38.000 Patient(inn)en, Marktdurchdringung 60%, Behandlungsdauer 1 Jahr.
Daraus folgt -> weltweiter Gesamtumsatz ca. 6,08 Mrd. USD, der in etwa zu gleichen Teilen auf Europa und die USA entfällt (BRICs etc. vernachlässigt). Unter Berücksichtigung der besonderen Tantiemenregelungen ergibt sich daraus für die Indikationen her2+ BC in Summe eine jährlicher Spitzenumsatz in Höhe von 8,2 Mrd. USD, was einer Tantieme in Höhe von 389 Mio. USD entspricht.
Nun folgt Kontrollrechnung A:
Roche kommuniziert für eBC und mBC folgende Ziele:
eBC: 70.000 Patient(inn)en
1L mBC: 18.000 Patient(inn)en
2-4L mBC: 26.000 Patient(in)en.
Behandlungszeit wie oben
Kosten T-DM1: 80.000 USD p.a. bzw. 6.667 USD p.m.
Daraus folgt für den Umsatz:
eBC: 5,950 Mrd.USD
1L mBC: 1,275 Mrd. USD
2-4L mBC: 1,842 Mrd. USD
und für die Tantiemenhöhe:
2-4L mBC: 72 Mio. USD
1-4 mBC: 153 Mio.USD
1L mBC: 433 Mio USD
Die Größenordnung der solchermaßen berechneten Tantiemenzahlungen stimmt mit den Werten meiner obigen Basisberechnung recht gut überein. Die Werte meiner Basisberechnung für mBC u.a. deshalb niedriger, weil ich dort keine Rezidivbehandlungen berücksichtigt habe.
Abschließend Kontrollrechnung B
Von Roche ist zu hören, dass man längerfristig Herceptin durch T-DM1 ersetzen möchte. Wenn man die in meiner Basisberechnung und der Kontrollrechnung A ermittelten T-DM1-Umsätze in entsprechende Herceptin-Umsätze umrechnet, sollten sich daher Werte ergeben, die in etwa den derzeitigen realen Herceptin-Umsätzen entsprechen. Bei der Umrechnung ist zu berücksichtigen, dass Herceptin bei mBC im Durchschnitt nur 8,1 Monate appliziert wird, während T-DM1 10 Monate lang gegeben wird. Die Therapiedauer bei eBC beträgt jeweils 1 Jahr.
Umrechnung der T-DM1-Umsätze aus der Basisberechnung führt zu einem Herceptin-Umsatz i.H. von 5,206 Mrd. USD. Damit wird der reale Wert (5,586 Mrd. USD im Jahr 2011) nur um 380 Mio. USD unterschritten. Dies ist wiederum plausibel, weil in meine Basisberechnung weder Umsätze aus der Indikation her2+ gastric cancer noch Umsätze aus der Bahndlung rezidivierenden mBC eingeflossen sind.
Umrechnung der T-DM1-Umsätze aus Kontrollrechnung B führt zu einem Herceptin-Umsatz i.H. von 5,384 Mrd. USD, was aus demselben Grund ausgezeichnet die Realität abbildet.
Auf dieser Basis läßt sich nun überlegen, wie die Aktie auf dem gegenwärtigen Niveau (aktuell ca. 11,00 USD) bewertet ist. Schon jetzt: Sie ist preiswert, auch wenn Analystenkommentare anderes behaupten. Dazu später mehr.
Da ich aus Zeitnot meine Beiträge schnell eintippe und dann gleich absende, bitte ich unrunde Formulierungen und etwaige Grammatikfehler zu entschuldigen.
Antwort auf Beitrag Nr.: 43.772.409 von Joschka Schröder am 31.10.12 21:09:07Beim Übertrag meiner "Basisberechnung" ist mir ein kleiner Fehler unterlaufen:
Aufgrund der angenommenen 80 %igen Marktpenetration bei mBC belaufen sich die berechneten Umsätze auf 1,69 Mrd. USD (statt auf 2,12 Mrd. USD), dies entspricht Tantiemen in Höhe von 64 Mio. USD (statt 85 Mio. USD).
Wichtig: Es handelt sich hier ausschließlich um die Behandlung von Erstdiagnosen, während die auf Roche-Angaben basierende Kontrollrechnung A - realitätsnah - auch Rezidivbehandlungen umfaßt (stellen den überwiegenden Anteil der mBC-Behandlungen dar).
Bei den eBC-Berechnungen treten diese Differenzen erwartungsgemäß nicht auf (Umsatz in meinem Basismodell 6,08 Mrd. USD, in Kontrollrechnung A 5,95 Mrd. USD).
Ich werde versuchen, nachher noch etwas zu den Analystenschätzungen zu schreiben, die den Kursverfall ausgelöst haben.
Aufgrund der angenommenen 80 %igen Marktpenetration bei mBC belaufen sich die berechneten Umsätze auf 1,69 Mrd. USD (statt auf 2,12 Mrd. USD), dies entspricht Tantiemen in Höhe von 64 Mio. USD (statt 85 Mio. USD).
Wichtig: Es handelt sich hier ausschließlich um die Behandlung von Erstdiagnosen, während die auf Roche-Angaben basierende Kontrollrechnung A - realitätsnah - auch Rezidivbehandlungen umfaßt (stellen den überwiegenden Anteil der mBC-Behandlungen dar).
Bei den eBC-Berechnungen treten diese Differenzen erwartungsgemäß nicht auf (Umsatz in meinem Basismodell 6,08 Mrd. USD, in Kontrollrechnung A 5,95 Mrd. USD).
Ich werde versuchen, nachher noch etwas zu den Analystenschätzungen zu schreiben, die den Kursverfall ausgelöst haben.
Mit den größten Einfluß auf die Kursbewegungen der vergangenen zwei Börsentage hatte die IMGN-Studie der UBS (Kursziel: 9 USD).
Die Autoren dieser Studie entwickeln u.a. folgendes Szenario:
Umsatzpeak T-DM1 nach 2018: knapp über 2 Mrd. USD, ein Betrag, der deutlich zu niedrig angesetzt ist!
Zum Vergleich:
Umsatzpeak laut meiner Basisrechnung (dabei ein größeres her2+ mBC-Teilkollektiv nicht berückichtigt, ausserdem keine Umsätze in Drittländern und in der Indikation her2+ Magenkrebs): 7.8 Mrd. USD
Umsatzpeak, berechnet auf Basis verschiedener Roche-Daten (s. Kontrollrechnung A in #187): 9,1 Mrd. USD
Für das Jahr 2016 geht die UBS beispielsweise von Umsätzen i.H. von 1,05 Mrd. USD und Tantiemen i.H. von 36 Mio. USD aus ... doppelt so hohe Werte erscheinen realistisch!
Eine weitere Merkwürdigkeit der UBS-Berechnung liegt darin, dass sämtliche Tantiemenzahlungen einem Steuersatz von 35 % unterworfen werden. Nicht berücksichtigt wird dabei, dass IMGN steuerliche Verlustvorträge in Höhe von 266 Mio. USD (aus Bundesebene) und 156 Mio. USD (auf Länderebene) besitzt.
Jefferies (Kursziel: 16 USD) liegt mit den Schätzungen deutlich besser, z.B. T-DM1-Umsatz für 2016 2,1 Mrd. USD. Zu bemängeln ist, dass Jefferies u.a. nicht in der Lage ist, daraus die Tantiemenhöhe richtig zu berechnen (85 Mio. USD wären exakt statt 73 Mio. USD bei Jefferies). Dies ist um so überraschender, als seitens IMGN während der letzten Telefonkonferenz explizit betont worden ist, die effektive Royalty Rate betrage bei einem Umsatz in Höhe von 1 Mrd. USD 4,0 % (Jefferies kommt auf 3,6 %).
Welchen Einfluß hat nun die Tantiemenhöhe auf die IMGN-Bewertung?
Da man die Dinge nicht komplizierter machen muß als sie sind ... und Pseudogenauigkeiten nicht zielführend sind, hilft villeicht folgende Überlegung weiter:
Der IMGN-Unternehmenswert beträgt aktuell 690 Mio. USD. Via T-DM1 sind in den kommenden 12 Jahren Tantiemen zu erwarten, die sich zwischen 70 Mio. USD (2-4L her2+ mBC) und 400 Mio. USD (her2+ BC gesamt) pro Jahr bewegen dürften.
Dazu kommen Werte für die IMGN-Technik sowie einige aussichtsreiche Kooperationsprojekte mit anderen Unternehmen und diverse Eigenentwicklungen (interessant z.B. IMGN853 gegen folate receptor 1 und IMGN529 gegen CD37).
Da muß man nicht lange überlegen: Auf dem aktuellen Kursniveau von 11,08 USD ist die Aktie günstig bewertet.
Disclaimer oder ähnliches gibt es von mir nicht, weil dies hier eine öffentliche Diskussionsveranstaltung ist und ich niemandem Aktien verkaufen möchte. Dass ich gestern selber IMGN-Aktien gekauft habe, kann sich jeder denken.
Die Autoren dieser Studie entwickeln u.a. folgendes Szenario:
Umsatzpeak T-DM1 nach 2018: knapp über 2 Mrd. USD, ein Betrag, der deutlich zu niedrig angesetzt ist!
Zum Vergleich:
Umsatzpeak laut meiner Basisrechnung (dabei ein größeres her2+ mBC-Teilkollektiv nicht berückichtigt, ausserdem keine Umsätze in Drittländern und in der Indikation her2+ Magenkrebs): 7.8 Mrd. USD
Umsatzpeak, berechnet auf Basis verschiedener Roche-Daten (s. Kontrollrechnung A in #187): 9,1 Mrd. USD
Für das Jahr 2016 geht die UBS beispielsweise von Umsätzen i.H. von 1,05 Mrd. USD und Tantiemen i.H. von 36 Mio. USD aus ... doppelt so hohe Werte erscheinen realistisch!
Eine weitere Merkwürdigkeit der UBS-Berechnung liegt darin, dass sämtliche Tantiemenzahlungen einem Steuersatz von 35 % unterworfen werden. Nicht berücksichtigt wird dabei, dass IMGN steuerliche Verlustvorträge in Höhe von 266 Mio. USD (aus Bundesebene) und 156 Mio. USD (auf Länderebene) besitzt.
Jefferies (Kursziel: 16 USD) liegt mit den Schätzungen deutlich besser, z.B. T-DM1-Umsatz für 2016 2,1 Mrd. USD. Zu bemängeln ist, dass Jefferies u.a. nicht in der Lage ist, daraus die Tantiemenhöhe richtig zu berechnen (85 Mio. USD wären exakt statt 73 Mio. USD bei Jefferies). Dies ist um so überraschender, als seitens IMGN während der letzten Telefonkonferenz explizit betont worden ist, die effektive Royalty Rate betrage bei einem Umsatz in Höhe von 1 Mrd. USD 4,0 % (Jefferies kommt auf 3,6 %).
Welchen Einfluß hat nun die Tantiemenhöhe auf die IMGN-Bewertung?
Da man die Dinge nicht komplizierter machen muß als sie sind ... und Pseudogenauigkeiten nicht zielführend sind, hilft villeicht folgende Überlegung weiter:
Der IMGN-Unternehmenswert beträgt aktuell 690 Mio. USD. Via T-DM1 sind in den kommenden 12 Jahren Tantiemen zu erwarten, die sich zwischen 70 Mio. USD (2-4L her2+ mBC) und 400 Mio. USD (her2+ BC gesamt) pro Jahr bewegen dürften.
Dazu kommen Werte für die IMGN-Technik sowie einige aussichtsreiche Kooperationsprojekte mit anderen Unternehmen und diverse Eigenentwicklungen (interessant z.B. IMGN853 gegen folate receptor 1 und IMGN529 gegen CD37).
Da muß man nicht lange überlegen: Auf dem aktuellen Kursniveau von 11,08 USD ist die Aktie günstig bewertet.
Disclaimer oder ähnliches gibt es von mir nicht, weil dies hier eine öffentliche Diskussionsveranstaltung ist und ich niemandem Aktien verkaufen möchte. Dass ich gestern selber IMGN-Aktien gekauft habe, kann sich jeder denken.
Weiss jemand, bis wann die Patente laufen für a) Technologie DM1/DM4 plus Linker und b) für T-DM1?
Es gibt Unmengen an Patenten zu T-DM1. Wesentlich ist - und das hat der CEO am Freitag noch einmal bestätigt, dass in den Hauptmärkten USA, EU(5) und Japan bis 12 Jahre nach Erstzulassung Patentschutz besteht. Mithin wird 12 Jahre lang (jeweils ab Erstzulassung) die gestaffelte Tantiemenregelung (3 % bis 5 %, je nach Umsatz) gelten.
Letzte Nacht in meinem Postfach gelandet:
Immunogen Revenue Can Be Much Higher Than Analyst Predictions
November 1, 2012
In the past few days, when the ImmunoGen (IMGN) and Roche (RHHBF.PK) royalty agreement was announced, analysts dropped the ImmunoGen royalty earnings estimate from $2.4MM to $300K for the year 2013 and $176MM to $126MM for the year 2018. The revised royalty earning estimates caused ImmunoGen's stock price to plummet 16.7% in one day.
However, if you can look beyond the royalty agreement terms and focus on the revenue potential of TDM-1, you will come to realize that Roche's royalty payments to ImmunoGen can be much higher than analysts' conservative estimates.
In the year 2011, Roche achieved an annual Herceptin sale of $5.251BB in Swiss Francs. This comes to about $5.61BB in U.S. dollars. A $300,000 royalty payment reflects an annual TDM-1 sale of $10MM. To put this into perspective, a $300,000 royalty payment represents a 0.17% Herceptin market share penetration by TDM-1 for the year 2013.
Given that up to 23% of the Herceptin patients can experience serious side effects and that the EMILIA trial showed TDM-1's patients have a 35% improved survivability compared to the standard treatment, a 0.17% Herceptin market share penetration is absurdly low even if TDM-1's FDA submission is for a 2nd line treatment indication for metastatic breast cancer.
In the year 2013, data from the Marianne trial supporting TDM-1 for a 1st line therapy is expected to be available. A FDA submission or approval can occur around the year 2015. The revised analyst's ImmunoGen royalty payment for the year 2018 is $126MM. A figure of $126MM reflects a TDM-1 Herceptin's market penetration of less than 75%. This would be 3 years after the Herceptin patent has expired. Furthermore, by the year 2018, TDM-1 would have already been on the market for 5 years as a second line treatment, therefore, market uptake of TDM-1 to replace Herceptin should be much faster and more aggressive than analysts' conservative estimates.
ImmunoGen's potential revenue upswing can be dramatic. For every 1% TDM-1 penetrates into the Herceptin's market beyond analysts' predictions there can be an additional $1.6MM (3% royalty rate) to $2.8MM (5% royalty rate) in royalty payments. Any small upside deviation from analysts' conservative estimates will result in a considerable increase in ImmunoGen's revenue and value.
In addition to an increased revenue, an accelerated approval time line, the potential for future partnerships, and the rate of product development can also increase ImmunoGen's value. Currently ImmunoGen has several partnerships with Lilly (LLY),Novartis (NVS), Amgen (AMGN), Sanofi (SNY) Bayer (BAYRX.PK), Roche, and Biotest (BIESF.PK).
In summary, when one is assessing ImmunoGen's value, having an understanding of TDM-1's potential impact on generating revenue is far more important than focusing on the current royalty payment structure and reacting to analysts' limited conservative projections.
Quelle: http://seekingalpha.com/article/970521-immunogen-revenue-can…
Immunogen Revenue Can Be Much Higher Than Analyst Predictions
November 1, 2012
In the past few days, when the ImmunoGen (IMGN) and Roche (RHHBF.PK) royalty agreement was announced, analysts dropped the ImmunoGen royalty earnings estimate from $2.4MM to $300K for the year 2013 and $176MM to $126MM for the year 2018. The revised royalty earning estimates caused ImmunoGen's stock price to plummet 16.7% in one day.
However, if you can look beyond the royalty agreement terms and focus on the revenue potential of TDM-1, you will come to realize that Roche's royalty payments to ImmunoGen can be much higher than analysts' conservative estimates.
In the year 2011, Roche achieved an annual Herceptin sale of $5.251BB in Swiss Francs. This comes to about $5.61BB in U.S. dollars. A $300,000 royalty payment reflects an annual TDM-1 sale of $10MM. To put this into perspective, a $300,000 royalty payment represents a 0.17% Herceptin market share penetration by TDM-1 for the year 2013.
Given that up to 23% of the Herceptin patients can experience serious side effects and that the EMILIA trial showed TDM-1's patients have a 35% improved survivability compared to the standard treatment, a 0.17% Herceptin market share penetration is absurdly low even if TDM-1's FDA submission is for a 2nd line treatment indication for metastatic breast cancer.
In the year 2013, data from the Marianne trial supporting TDM-1 for a 1st line therapy is expected to be available. A FDA submission or approval can occur around the year 2015. The revised analyst's ImmunoGen royalty payment for the year 2018 is $126MM. A figure of $126MM reflects a TDM-1 Herceptin's market penetration of less than 75%. This would be 3 years after the Herceptin patent has expired. Furthermore, by the year 2018, TDM-1 would have already been on the market for 5 years as a second line treatment, therefore, market uptake of TDM-1 to replace Herceptin should be much faster and more aggressive than analysts' conservative estimates.
ImmunoGen's potential revenue upswing can be dramatic. For every 1% TDM-1 penetrates into the Herceptin's market beyond analysts' predictions there can be an additional $1.6MM (3% royalty rate) to $2.8MM (5% royalty rate) in royalty payments. Any small upside deviation from analysts' conservative estimates will result in a considerable increase in ImmunoGen's revenue and value.
In addition to an increased revenue, an accelerated approval time line, the potential for future partnerships, and the rate of product development can also increase ImmunoGen's value. Currently ImmunoGen has several partnerships with Lilly (LLY),Novartis (NVS), Amgen (AMGN), Sanofi (SNY) Bayer (BAYRX.PK), Roche, and Biotest (BIESF.PK).
In summary, when one is assessing ImmunoGen's value, having an understanding of TDM-1's potential impact on generating revenue is far more important than focusing on the current royalty payment structure and reacting to analysts' limited conservative projections.
Quelle: http://seekingalpha.com/article/970521-immunogen-revenue-can…
Zwar schon vom September 2012, aber in Bezug auf das "Restprogramm" ganz interesant:
http://www.hammerstockblog.com/upcoming-catalysts-for-exelix…
Immunogen
Just as Exelixis’ fate is tied to cabo, Immunogen’s stock performance is dependent on T-DM1, a promising drug for breast cancer . Following the spectacular phase III data earlier this year and an almost certain approval, the next major milestone with T-DM1 will be data from the MARIANNE trial in 1st line metastatic breast cancer. Overall, Immunogen’s market cap prices in high expectations from T-DM1 and new catalysts are needed to push the stock higher.
On top of T-DM1, Immunogen has 10 additional clinical stage programs in its pipeline, 3 proprietary and 7 partnered (with Sanofi, Amgen, Bayer and Biotest). It is safe to say that at least with one target, Immunogen’s antibody-drug conjugate (ADC) technology works very well. With 10 programs in clinical trials (9 of which are ADCs), it looks like Immunogen has statistics on its side. Most of these programs are expected to generate results in the coming 12 months.
At its quarterly call earlier this month, Immunogen’s CEO made an intriguing comment about 3 partnered programs (not including T-DM1) with a potential to enter pivotal studies in 2H13. These can be either classic phase III trials or pivotal phase II trials that lead to accelerated approval. This could be very significant for Immunogen, as the market ascribes very little to its pipeline. Of course, one has to assume that these remarks are based on feedback from Immunogen’s partners based on clinical data.
One of the three is probably Sanofi’s SAR3419 (anti-CD19), which already demonstrated clinical activity in lymphoma patients. Sanofi will probably advance it to phase III but commercial success is not guaranteed as the CD19 field is packed with highly effective drugs in development.
Of the 6 remaining partnered programs, only 3 could actually have sufficient data to merit considering pivotal studies. In all 3 cases, available data is with monotherapy administration, which makes the data more reliable and development route easier.
BT-062 (Biotest) - This is an ADC targeting CD138 for multiple myeloma. Phase I with this agent given every 3 weeks showed some activity as a single agent but it is not potent enough to justify a pivotal trial. Biotest is evaluating BT-062 in 2 additional trials: A single agent trial where the drug is given every week (recruiting since September 2010) and a very recent combination trial with Revlimid (recruiting since July 2012). Theoretically, if the weekly study generates a response rate of 20+% in refractory myeloma patients, this agent could be approved based experience with Onyx’s (ONXX) carfilzomib.
SAR650984 (Sanofi) – This is a CD38 naked antibody that entered phase I in mid-2010. Sanofi did not report results from this trial but Genmab (GEN.CO) reported excellent results for its CD38 antibody, daratumumab. Genmab’s antibody looks extremely active as a single agent in multiple myeloma with a response rate of 42% and a good safety profile. Sanofi’s SAR650984 looks similar to daratumumab in preclinical testing, so it is likely that Sanofi is also seeing promising results.
SAR566658 (Sanofi) - This is an ADC targeting a novel epitope on MUC1, which enterd phase I in September 2010. Sanofi did not report any data from the study but after almost 2 years it should have a good sense of the drug’s clinical profile.
Each of the programs above (BT-062, SAR650984, SAR566658) represents a blockbuster opportunity. Licensing terms are modest (similar to T-DM1) as the deals were signed prior to the validation with T-DM1 (BT-062 is an exception since Immunogen has a co-development option). Nevertheless, even if one of the programs generates promising data in the coming year as monotherapy, the impact on Immunogen’s stock should be dramatic. Results for SAR3419, BT-062 and SAR650984 might be presented at this year’s ASH meeting in December.
The other 3 partnered programs are still too early in phase I: BAY94-9343 (Bayer, anti- mesothelin) started phase I in September 2011, AMG 172 (Amgen, anti- CA-IX) started phase I in December 2011 and AMG 595 (Amgen, anti-EGFRvIII) has still not been given to patients.
Meaningful data on Immunogen’s proprietary pipeline is expected only in 2013. IMGN901 (anti-CD56) will have randomized data in small cell lung cancer in 2H 2013. IMGN529 (anti-CD37) and IMGN853 (anti-folate receptor 1) are expected to have phase I data in non-Hodgkin’s lymphoma (NHL) and solid tumors respectively.
"Frank Biotech Says:
September 8th, 2012 at 5:41 pm
Hi Ohad,
Do you plan to add any position of IMGN to you portfolio?
Any concernings on your position on PGNX since the recent fell of the PPS?
Thanks for your new post…great as always!!
Thanks again,
FB
Ohad Hammer Says:
September 9th, 2012 at 2:19 am
Yes I would be looking to come back to imgn in the coming months. There won’t be p2 data for sar3419 at ASH but maybe something from the cd38 program.
Ohad"
Grüsse, StefanR
http://www.hammerstockblog.com/upcoming-catalysts-for-exelix…
Immunogen
Just as Exelixis’ fate is tied to cabo, Immunogen’s stock performance is dependent on T-DM1, a promising drug for breast cancer . Following the spectacular phase III data earlier this year and an almost certain approval, the next major milestone with T-DM1 will be data from the MARIANNE trial in 1st line metastatic breast cancer. Overall, Immunogen’s market cap prices in high expectations from T-DM1 and new catalysts are needed to push the stock higher.
On top of T-DM1, Immunogen has 10 additional clinical stage programs in its pipeline, 3 proprietary and 7 partnered (with Sanofi, Amgen, Bayer and Biotest). It is safe to say that at least with one target, Immunogen’s antibody-drug conjugate (ADC) technology works very well. With 10 programs in clinical trials (9 of which are ADCs), it looks like Immunogen has statistics on its side. Most of these programs are expected to generate results in the coming 12 months.
At its quarterly call earlier this month, Immunogen’s CEO made an intriguing comment about 3 partnered programs (not including T-DM1) with a potential to enter pivotal studies in 2H13. These can be either classic phase III trials or pivotal phase II trials that lead to accelerated approval. This could be very significant for Immunogen, as the market ascribes very little to its pipeline. Of course, one has to assume that these remarks are based on feedback from Immunogen’s partners based on clinical data.
One of the three is probably Sanofi’s SAR3419 (anti-CD19), which already demonstrated clinical activity in lymphoma patients. Sanofi will probably advance it to phase III but commercial success is not guaranteed as the CD19 field is packed with highly effective drugs in development.
Of the 6 remaining partnered programs, only 3 could actually have sufficient data to merit considering pivotal studies. In all 3 cases, available data is with monotherapy administration, which makes the data more reliable and development route easier.
BT-062 (Biotest) - This is an ADC targeting CD138 for multiple myeloma. Phase I with this agent given every 3 weeks showed some activity as a single agent but it is not potent enough to justify a pivotal trial. Biotest is evaluating BT-062 in 2 additional trials: A single agent trial where the drug is given every week (recruiting since September 2010) and a very recent combination trial with Revlimid (recruiting since July 2012). Theoretically, if the weekly study generates a response rate of 20+% in refractory myeloma patients, this agent could be approved based experience with Onyx’s (ONXX) carfilzomib.
SAR650984 (Sanofi) – This is a CD38 naked antibody that entered phase I in mid-2010. Sanofi did not report results from this trial but Genmab (GEN.CO) reported excellent results for its CD38 antibody, daratumumab. Genmab’s antibody looks extremely active as a single agent in multiple myeloma with a response rate of 42% and a good safety profile. Sanofi’s SAR650984 looks similar to daratumumab in preclinical testing, so it is likely that Sanofi is also seeing promising results.
SAR566658 (Sanofi) - This is an ADC targeting a novel epitope on MUC1, which enterd phase I in September 2010. Sanofi did not report any data from the study but after almost 2 years it should have a good sense of the drug’s clinical profile.
Each of the programs above (BT-062, SAR650984, SAR566658) represents a blockbuster opportunity. Licensing terms are modest (similar to T-DM1) as the deals were signed prior to the validation with T-DM1 (BT-062 is an exception since Immunogen has a co-development option). Nevertheless, even if one of the programs generates promising data in the coming year as monotherapy, the impact on Immunogen’s stock should be dramatic. Results for SAR3419, BT-062 and SAR650984 might be presented at this year’s ASH meeting in December.
The other 3 partnered programs are still too early in phase I: BAY94-9343 (Bayer, anti- mesothelin) started phase I in September 2011, AMG 172 (Amgen, anti- CA-IX) started phase I in December 2011 and AMG 595 (Amgen, anti-EGFRvIII) has still not been given to patients.
Meaningful data on Immunogen’s proprietary pipeline is expected only in 2013. IMGN901 (anti-CD56) will have randomized data in small cell lung cancer in 2H 2013. IMGN529 (anti-CD37) and IMGN853 (anti-folate receptor 1) are expected to have phase I data in non-Hodgkin’s lymphoma (NHL) and solid tumors respectively.
"Frank Biotech Says:
September 8th, 2012 at 5:41 pm
Hi Ohad,
Do you plan to add any position of IMGN to you portfolio?
Any concernings on your position on PGNX since the recent fell of the PPS?
Thanks for your new post…great as always!!
Thanks again,
FB
Ohad Hammer Says:
September 9th, 2012 at 2:19 am
Yes I would be looking to come back to imgn in the coming months. There won’t be p2 data for sar3419 at ASH but maybe something from the cd38 program.
Ohad"
Grüsse, StefanR
Habe im Eifer des Gefechts bezüglich der Ohad Hammer-Aussage, sich einen Neueinstieg in den nächsten Monate zu überlegen, gleich noch den Textteil von SL Gramann, Beitrag 176, dazukopiert, damit doppelt vorhanden (Sorry).

Ich habe am Freitag zu 11,01 Dollar meine Position verdoppelt und bin gewillt, bei einem Kurs um die 10 Dollar nochmals nachzukaufen.
Man kann natürlich lange darüber philosophieren, ob nun 9 Dollar oder eher 12 Dollar derzeit eine angemessene Bewertung für IMGN sind.
Das hängt von Detailannahmen in den DCF-Modellen der Analysten ab, nicht zuletzt vom Abzinsungsfaktor und am Ende sind die meisten dieser Annahmen ziemlich wirklichkeitsfremd.
JoschkaSchröder hat mich kürzlich daran erinnert, dass für ein gutes Investment die grundsätzliche Richtigkeit der eigenen Investment-These viel wichtiger ist, als ein paar Prozente beim Kaufkurs hin oder her.
(Womit niemand sagen will, dass Bewertung keine Rolle spielt.)
Die grundsätzliche Investment-These ist bei IMGN ziemlich klar.
Wir haben einen Biotech mit einer validierten und zukunftsweisenden Technologie (neben SGEN ist IMGN meines Wissens nach bisher der einzige ADC-Designer, dessen Technologie in der Klinik voll validiert wurde).
Dann haben wir einen Royaltie-Anspruch von IMGN an einem der potentiell umsatzstärksten Krebs-Medikamente der Zukunft.
Die Zulassung von T-DM1 ist zumindest im Bereich mBC beinahe sicher.
Zwar hat die FDA vor 2,5 Jahren die Zulassung von T-DM1 in der 3line aus formalen Gründen abgelehnt, was uns hier damals sehr überrascht hat. Ich rechne aber wirklich nicht mit einer Wiederholung einer solchen Enttäuschung.
(Im Angesicht der neuesten EMILIA-Daten erscheint die damalige FDA-Entscheidung nicht nur als fragwürdig, sondern m.E. schon als skandalös. In der Realität hatten die betroffenen Patientinnen keine auch nur annährend gleichwertige Behandlungsalternative.)
Die Zulassung von T-DM1 wird in den USA nun wohl aber schnell erfolgen. Vermutlich binnen der nächsten 3 Monate. Dieses "Detail" aus dem CC war mir bisher entgangen.
Daniel M. Junius - President and Chief Executive Officer:
I will start again with T-DM1. So for the metastatic breast cancer indication, patients who have been previously treated with Herceptin and whose diseases has advanced while on Herceptin, we would expect U.S. approval either late this year or early 2013 with the sales to follow immediately thereafter.
European approval is expected sometime over the course of 2013 more likely than that in the back-half of the year.
Wir werden also Ende 2013 mal sehen was davon - stellvertretend für die Analysten-Gemeinde - zu halten war:
The disclosure has analysts like Joel Sendek of Stifel Nicolaus revising his revenue estimates for ImmunoGen. ... Sendek now estimates ImmunoGen will receive $300,000 beginning in 2013.
300.000,00 Dollar in 2013? Mal sehen, um welchen Faktor sich Mr. Sendek da vergaloppiert hat.
Natürlich werden die Royalties in 2013 noch nicht wirklich nennenswert sein, aber aller Voraussicht nach wird IMGN hier über einen ständig und bis ca. in das Jahr 2024 signifikant steigenden "nichtdilutativen" Einnahmestrom verfügen.
Wie viele Biotechs können von sich sagen, dass ihr Geschäft in dieser Weise "de-risked" ist?
Auf dieser Basis aus technologischer Innovation und materieller Absicherung kann IMGN in den nächsten Jahren sein Geschäft in eine ganz neue Dimension heben.
Natürlich bleibt ein Risiko, dass T-DM1 in künftigen Trials doch noch enttäuscht.
Ich denke aber, dass dieses Risiko sehr viel geringer ist, als die Chance, dass sich der "Rest" der Pipeline ebenfalls als nicht wertlos herausstellt.
Die kürzliche Reaktion des Marktes erscheint - wie nicht selten - als kurzsichtig und einseitig - in diesem Fall einseitig negativ.
Es ist psychologisch nicht die einfachste Übung sich gegen den Markt zu stellen und zu Kaufen, wenn es einen Kurs zerreißt.
Ich glaube aber, dass wir hier gute Gründe herausgearbeitet haben, warum das diesmal gerechtfertigt ist.
Mal sehen, wer in ein, zwei Jahren als Idiot dastehen wird - JS und SLG oder Mr. Market.
Hier noch ein Beitrag von Prohost (von denen ich sonst nicht sooo viel halte), aber hier haben sie recht:
http://www.prohostbiotech.com/_blog/News_and_Comments/post/I…
Man kann natürlich lange darüber philosophieren, ob nun 9 Dollar oder eher 12 Dollar derzeit eine angemessene Bewertung für IMGN sind.
Das hängt von Detailannahmen in den DCF-Modellen der Analysten ab, nicht zuletzt vom Abzinsungsfaktor und am Ende sind die meisten dieser Annahmen ziemlich wirklichkeitsfremd.
JoschkaSchröder hat mich kürzlich daran erinnert, dass für ein gutes Investment die grundsätzliche Richtigkeit der eigenen Investment-These viel wichtiger ist, als ein paar Prozente beim Kaufkurs hin oder her.
(Womit niemand sagen will, dass Bewertung keine Rolle spielt.)
Die grundsätzliche Investment-These ist bei IMGN ziemlich klar.
Wir haben einen Biotech mit einer validierten und zukunftsweisenden Technologie (neben SGEN ist IMGN meines Wissens nach bisher der einzige ADC-Designer, dessen Technologie in der Klinik voll validiert wurde).
Dann haben wir einen Royaltie-Anspruch von IMGN an einem der potentiell umsatzstärksten Krebs-Medikamente der Zukunft.
Die Zulassung von T-DM1 ist zumindest im Bereich mBC beinahe sicher.
Zwar hat die FDA vor 2,5 Jahren die Zulassung von T-DM1 in der 3line aus formalen Gründen abgelehnt, was uns hier damals sehr überrascht hat. Ich rechne aber wirklich nicht mit einer Wiederholung einer solchen Enttäuschung.
(Im Angesicht der neuesten EMILIA-Daten erscheint die damalige FDA-Entscheidung nicht nur als fragwürdig, sondern m.E. schon als skandalös. In der Realität hatten die betroffenen Patientinnen keine auch nur annährend gleichwertige Behandlungsalternative.)
Die Zulassung von T-DM1 wird in den USA nun wohl aber schnell erfolgen. Vermutlich binnen der nächsten 3 Monate. Dieses "Detail" aus dem CC war mir bisher entgangen.
Daniel M. Junius - President and Chief Executive Officer:
I will start again with T-DM1. So for the metastatic breast cancer indication, patients who have been previously treated with Herceptin and whose diseases has advanced while on Herceptin, we would expect U.S. approval either late this year or early 2013 with the sales to follow immediately thereafter.
European approval is expected sometime over the course of 2013 more likely than that in the back-half of the year.
Wir werden also Ende 2013 mal sehen was davon - stellvertretend für die Analysten-Gemeinde - zu halten war:
The disclosure has analysts like Joel Sendek of Stifel Nicolaus revising his revenue estimates for ImmunoGen. ... Sendek now estimates ImmunoGen will receive $300,000 beginning in 2013.
300.000,00 Dollar in 2013? Mal sehen, um welchen Faktor sich Mr. Sendek da vergaloppiert hat.
Natürlich werden die Royalties in 2013 noch nicht wirklich nennenswert sein, aber aller Voraussicht nach wird IMGN hier über einen ständig und bis ca. in das Jahr 2024 signifikant steigenden "nichtdilutativen" Einnahmestrom verfügen.
Wie viele Biotechs können von sich sagen, dass ihr Geschäft in dieser Weise "de-risked" ist?
Auf dieser Basis aus technologischer Innovation und materieller Absicherung kann IMGN in den nächsten Jahren sein Geschäft in eine ganz neue Dimension heben.
Natürlich bleibt ein Risiko, dass T-DM1 in künftigen Trials doch noch enttäuscht.
Ich denke aber, dass dieses Risiko sehr viel geringer ist, als die Chance, dass sich der "Rest" der Pipeline ebenfalls als nicht wertlos herausstellt.
Die kürzliche Reaktion des Marktes erscheint - wie nicht selten - als kurzsichtig und einseitig - in diesem Fall einseitig negativ.
Es ist psychologisch nicht die einfachste Übung sich gegen den Markt zu stellen und zu Kaufen, wenn es einen Kurs zerreißt.
Ich glaube aber, dass wir hier gute Gründe herausgearbeitet haben, warum das diesmal gerechtfertigt ist.
Mal sehen, wer in ein, zwei Jahren als Idiot dastehen wird - JS und SLG oder Mr. Market.

Hier noch ein Beitrag von Prohost (von denen ich sonst nicht sooo viel halte), aber hier haben sie recht:
http://www.prohostbiotech.com/_blog/News_and_Comments/post/I…
Antwort auf Beitrag Nr.: 43.784.213 von SLGramann am 04.11.12 15:52:02Das potentielle Zulassungsdatum wird nun konkret:
11/6/2012 5:49 PM ET
ImmunoGen Inc. (IMGN: Quote), said Tuesday that Genentech, a part of the Roche Group (RHHBY.PK), has revealed that the U.S. Food and Drug Administration has officially accepted the Biologics License Application for trastuzumab emtansine and granted it Priority Review.
The proposed indication is for the treatment of people with HER2-positive, unresectable locally advanced or metastatic breast cancer who have received prior treatment with Herceptin (trastuzumab) and a taxane chemotherapy.
Genentech also disclosed that Roche's Marketing Authorization Application for trastuzumab emtansine for people with HER2-positive metastatic breast cancer has been accepted for review by the European Medicines Agency.
The FDA grants Priority Review designation to drugs that may offer major advances in treatment or provide a treatment where no adequate therapy exists. The FDA has assigned this BLA a Prescription Drug User Fee Act (PDUFA) goal date of February 26, 2013.
Ich hoffe dabei, dass die FDA den Zeitraum nicht ausreizt und die Zulassung eher erfolgt. 2012 wird natürlich knapp.
Aufgrund des zeitlich befristeten Tantieme-Modells wäre die Zulassung bspw. im Januar 2013 langfristig sogar besser, als im Dezember 2012.
11/6/2012 5:49 PM ET
ImmunoGen Inc. (IMGN: Quote), said Tuesday that Genentech, a part of the Roche Group (RHHBY.PK), has revealed that the U.S. Food and Drug Administration has officially accepted the Biologics License Application for trastuzumab emtansine and granted it Priority Review.
The proposed indication is for the treatment of people with HER2-positive, unresectable locally advanced or metastatic breast cancer who have received prior treatment with Herceptin (trastuzumab) and a taxane chemotherapy.
Genentech also disclosed that Roche's Marketing Authorization Application for trastuzumab emtansine for people with HER2-positive metastatic breast cancer has been accepted for review by the European Medicines Agency.
The FDA grants Priority Review designation to drugs that may offer major advances in treatment or provide a treatment where no adequate therapy exists. The FDA has assigned this BLA a Prescription Drug User Fee Act (PDUFA) goal date of February 26, 2013.
Ich hoffe dabei, dass die FDA den Zeitraum nicht ausreizt und die Zulassung eher erfolgt. 2012 wird natürlich knapp.
Aufgrund des zeitlich befristeten Tantieme-Modells wäre die Zulassung bspw. im Januar 2013 langfristig sogar besser, als im Dezember 2012.

FDA grants Roche’s trastuzumab emtansine (T-DM1) Priority Review for HER2-positive metastatic breast cancer
Roche (SIX: RO, ROG; OTCQX: RHHBY) today announced that the U.S. Food and Drug Administration (FDA) has accepted the company’s Biologics License Application (BLA) for trastuzumab emtansine (T-DM1) and granted Priority Review. Trastuzumab emtansine’s proposed indication is for the treatment of people with HER2-positive, unresectable locally advanced or metastatic breast cancer (mBC) who have received prior treatment with Herceptin (trastuzumab) and a taxane chemotherapy. The FDA confirmed the action date is February 26, 2013.
“We are very pleased that the FDA has granted trastuzumab emtansine a Priority Review, as we know people with HER2-positive metastatic breast cancer still need new treatment options,” said Hal Barron, M.D., chief medical officer and head, Global Product Development.
Roche’s Marketing Authorisation Application for trastuzumab emtansine for people with HER2-positive mBC has also been accepted for review by the European Medicines Agency (EMA).
Genentech licenses technology for trastuzumab emtansine under an agreement with ImmunoGen, Inc.
Building on the results of trastuzumab emtansine studies to date, there are approximately 25 antibody-drug conjugates in Roche’s pipeline.
About Trastuzumab Emtansine (T-DM1)
Trastuzumab emtansine is an antibody-drug conjugate (ADC) being studied in HER2-positive cancers. It is comprised of the antibody trastuzumab and the chemotherapy DM1 attached together using a stable linker. Trastuzumab emtansine is designed to target and inhibit HER2 signalling and deliver the chemotherapy DM1 directly inside HER2-positive cancer cells. Trastuzumab emtansine binds to HER2-positive cancer cells and is thought to block out-of-control signals that make the cancer grow while also calling on the body’s immune system to attack the cancer cells. Once trastuzumab emtansine is taken up by those cancer cells, it is designed to destroy them by releasing the DM1.
Roche (SIX: RO, ROG; OTCQX: RHHBY) today announced that the U.S. Food and Drug Administration (FDA) has accepted the company’s Biologics License Application (BLA) for trastuzumab emtansine (T-DM1) and granted Priority Review. Trastuzumab emtansine’s proposed indication is for the treatment of people with HER2-positive, unresectable locally advanced or metastatic breast cancer (mBC) who have received prior treatment with Herceptin (trastuzumab) and a taxane chemotherapy. The FDA confirmed the action date is February 26, 2013.
“We are very pleased that the FDA has granted trastuzumab emtansine a Priority Review, as we know people with HER2-positive metastatic breast cancer still need new treatment options,” said Hal Barron, M.D., chief medical officer and head, Global Product Development.
Roche’s Marketing Authorisation Application for trastuzumab emtansine for people with HER2-positive mBC has also been accepted for review by the European Medicines Agency (EMA).
Genentech licenses technology for trastuzumab emtansine under an agreement with ImmunoGen, Inc.
Building on the results of trastuzumab emtansine studies to date, there are approximately 25 antibody-drug conjugates in Roche’s pipeline.
About Trastuzumab Emtansine (T-DM1)
Trastuzumab emtansine is an antibody-drug conjugate (ADC) being studied in HER2-positive cancers. It is comprised of the antibody trastuzumab and the chemotherapy DM1 attached together using a stable linker. Trastuzumab emtansine is designed to target and inhibit HER2 signalling and deliver the chemotherapy DM1 directly inside HER2-positive cancer cells. Trastuzumab emtansine binds to HER2-positive cancer cells and is thought to block out-of-control signals that make the cancer grow while also calling on the body’s immune system to attack the cancer cells. Once trastuzumab emtansine is taken up by those cancer cells, it is designed to destroy them by releasing the DM1.
Gute Nachrichten für IMGN vom Novartis-R&D-Day. Im Segment Onkologie wird sich Novartis in den kommenden Jahren insbesondere auf die Entwicklung von ADC´s konzentrieren. IMGN als ADC-Partner sollte davon profitieren.
Ich überfiege gerade eine Studie von Merryll Lynch über Roche. Peak Sales für T-DM1 im Jahr 2021 ... 894 Mio. USD. Zulassungswahrscheinlichkeit 50 % -> ins Modell fließen 447 Mio. USD. Tja, was soll man da noch sagen?
Kurzer Blick in die aktuelle IMGN-Studie von Cantor Fitzgerald:
Schätzung für T-DM1-Umsatz 2013: 3 Mio. USD
Wert T-DM1 per Share: 3 USD
Kann jeder für sich selbst kommentieren.
Schätzung für T-DM1-Umsatz 2013: 3 Mio. USD
Wert T-DM1 per Share: 3 USD
Kann jeder für sich selbst kommentieren.
Zitat von Joschka Schröder: Ich überfiege gerade eine Studie von Merryll Lynch über Roche. Peak Sales für T-DM1 im Jahr 2021 ... 894 Mio. USD. Zulassungswahrscheinlichkeit 50 % -> ins Modell fließen 447 Mio. USD. Tja, was soll man da noch sagen?
Ich halte 894Mio USD für viel zu wenig an Peak sales in 2021. Wenn Herceptin aktuell bei mehr als 4Mrd USD unterwegs ist! In dieser Dimension müssten m.E. die Peaksales für T-DM1 in 2021 mindestens auch sein, wenn nicht höher.
Antwort auf Beitrag Nr.: 43.804.294 von Joschka Schröder am 08.11.12 22:29:02Nur 3 Mio USD Umsatz in 2013 bei evtl. Zulassung bereits zu Jahresbeginn?
Will Roche etwa bis Weihnachten 2013 mit dem Vermarktungsstart warten?
Will Roche etwa bis Weihnachten 2013 mit dem Vermarktungsstart warten?

Zitat von Ville7: Nur 3 Mio USD Umsatz in 2013 bei evtl. Zulassung bereits zu Jahresbeginn?
Will Roche etwa bis Weihnachten 2013 mit dem Vermarktungsstart warten?
Die 3 Mio. € scheinen auch dann etwas zu niedrig, wenn man berücksichtigt, dass die Vermarktung wohl erst zum 1.3.13 beginnen wird und die Royalties jeweils mit einem Quartal Verzögerung fließen werden. Mehr als 100 Mio. USD sollte Roche mit T-DM1 schon in einem Zeitraum von sechs Monaten umsetzen können (entspricht einer Behandlung von etwa 2.500 Patient(inn)en, mithin weniger als 1/10 der von Roche für die 2L,3L,4L Therapie der her2+ mBC avisierten Patient(inn)en).
Zumindest habe ich bei 11 USD noch einmal nachgelegt. Die Zulassung im Februar sollte sicher sein und nach dem jüngsten Abtaucher (zugegeben, wegen den niedrigeren Royalties) sollte Speku-Luft bis mind. 15/16 USD nach oben sein.
Sind eigentlich neben den Royalties Meilensteinzahlungen vereinbart worden (z.B. Zulassung, Vermarktungsstart, Erreichen bestimmter Salestargets) und wenn ja wann und in welcher Höhe?
Sind eigentlich neben den Royalties Meilensteinzahlungen vereinbart worden (z.B. Zulassung, Vermarktungsstart, Erreichen bestimmter Salestargets) und wenn ja wann und in welcher Höhe?
Antwort auf Beitrag Nr.: 43.809.293 von Ville7 am 10.11.12 06:24:53Ja, geringfügige Meilensteine.
Aus dem letzten CC:
As we talk about or think about the financial terms, we’ve disclosed in the past milestones, which aggregate of $44 million, $13.5 million of that has already been earned and we have $15.5 million to potentially be earned with U.S. and European approval, and $0.5 million and $5 million respectively, the balance of $3 million would be divided across various additional regulatory events.
Aus dem letzten CC:
As we talk about or think about the financial terms, we’ve disclosed in the past milestones, which aggregate of $44 million, $13.5 million of that has already been earned and we have $15.5 million to potentially be earned with U.S. and European approval, and $0.5 million and $5 million respectively, the balance of $3 million would be divided across various additional regulatory events.
Antwort auf Beitrag Nr.: 43.809.293 von Ville7 am 10.11.12 06:24:53An Meilensteinen stehen noch 30,5 Mio. USD aus, davon für die Zulassung in den USA 10,5 Mio. USD und für diejenige in Europa 5 Mio. USD.
Antwort auf Beitrag Nr.: 43.809.411 von SLGramann am 10.11.12 09:21:01Ich sehe gerade, dass Du villes Frage bereits vor mir beantwortet hattest. Die Angaben vom CC erscheinen nicht ganz schlüssig, möglicherweise handelt es sich um einen Fehler in der Abschrift (seeking alpha - ich vermute, dass dies Deine Quelle ist - verwechselt schon einmal tier mit tear [s. Erläuterungen zum Tantiemen-Modell], weil bei der Übersetzung oft inhaltlich nicht mitgedacht wird):
44 Mio. USD Summe Meilensteine
abzgl. 13,5 Mio. USD bereits erhalten
abzgl. 10,5 Mio. USD für US-Zulassung
abzgl. 5 Mio. USD für EU-Zulassung
ergibt einen Restbetrag i.H. von 15 Mio. USD
"balance of $3 million" macht also wenig Sinn.
44 Mio. USD Summe Meilensteine
abzgl. 13,5 Mio. USD bereits erhalten
abzgl. 10,5 Mio. USD für US-Zulassung
abzgl. 5 Mio. USD für EU-Zulassung
ergibt einen Restbetrag i.H. von 15 Mio. USD
"balance of $3 million" macht also wenig Sinn.
Antwort auf Beitrag Nr.: 43.809.815 von Joschka Schröder am 10.11.12 13:23:41Ja, die Quelle war seeking alpha und die Zahlen dort sind wirklich nicht konsistent. Hatte ich bisher gar nicht drüber nachgedacht, weil ich bei 30 Mio. (und das stimmt ja zumindest) noch ausstehender Meilensteine gedanklich ausgestiegen war. Leider sind Meilensteine und Royalties wirklich nur Brosamen und IMGN wird darüber selbst am betrübtesten sein, dass man damals nicht in der Position war, einen angemesseneren Erfolgsanteil auszuhandeln.
Zum Glück ist T-DM1 ein ziemlich großes "Brot".
Zum Glück ist T-DM1 ein ziemlich großes "Brot".

Eine Analyse von Seeking Alpha mit ähnlicher Tendenz wie der Akteure hier:
http://seekingalpha.com/article/998751-why-immunogen-is-unde…
http://seekingalpha.com/article/998751-why-immunogen-is-unde…
Der IMGN-Kurs kommt einfach nicht vom Fleck. Aktuell 10,91 USD. In 68 min beginnt die IMGN-Unternehmenspräsentation bei Lazard ... vielleicht hilft dies dem Kurs ein wenig (morgen dann - wichtiger - Jefferies-Conference in London).
Ich schaue gerade in die aktuelle Studie der Credit Suisse. Was ich bislang gelesen habe, erinnert mich in Teilen stark an meine eigenen Berechnungen in diesem Thread, wobei CS bislang in vier Punkten abweicht:
1) Behandlungskosten für T-DM1 werden mit 8.000 USD pro Monat angesetzt (bei mir 80.000 USD pro Jahr)
2) Abzinsung mit 10 %, was ich angesichts der derzeitigen Zinssituation für deutlich überzogen halte
3) Steuerliche Verlustvorträge werden in der Sum-of-Parts-Berechnung mit einem Gegenwert von gerade mal 36,4 Mio. USD berücksichtigt.
4) Wert der Eigenpipeline = Null
Ich schaue gerade in die aktuelle Studie der Credit Suisse. Was ich bislang gelesen habe, erinnert mich in Teilen stark an meine eigenen Berechnungen in diesem Thread, wobei CS bislang in vier Punkten abweicht:
1) Behandlungskosten für T-DM1 werden mit 8.000 USD pro Monat angesetzt (bei mir 80.000 USD pro Jahr)
2) Abzinsung mit 10 %, was ich angesichts der derzeitigen Zinssituation für deutlich überzogen halte
3) Steuerliche Verlustvorträge werden in der Sum-of-Parts-Berechnung mit einem Gegenwert von gerade mal 36,4 Mio. USD berücksichtigt.
4) Wert der Eigenpipeline = Null
Goede avond,

habe meine Position kurz entschlossen verdoppelt. Erwarte auch Impulse jetzt kurzfristig, obwohl der Gesamtmarkt jetzt leider "credit cliff" spielt (als ob das nun neu wäre).
Wenn´s schon Insider-Käufe gibt...
(leider nur in spärlicher Menge, kann ich ja schon fast mithalten).
Gruß q.

habe meine Position kurz entschlossen verdoppelt. Erwarte auch Impulse jetzt kurzfristig, obwohl der Gesamtmarkt jetzt leider "credit cliff" spielt (als ob das nun neu wäre).
Wenn´s schon Insider-Käufe gibt...
(leider nur in spärlicher Menge, kann ich ja schon fast mithalten).
Gruß q.
http://seekingalpha.com/article/1008701-immunogen-s-manageme…
Der Immunogen CFO kann zwar keine harten Fakten bezüglich des Umsatzpotentials von T-DM1 liefern, aber das momentane Herceptin-Volumen über 6 mrd Dollar schein für immunogen eine realistische Richtgröße zu sein.
Zu der höheren Preisgestaltung und längerer Therapiedauer halte ich es für bemerkenswert, daß Herceptin momentan immer noch um 11% wächst, auch durch die zunehmenden Screening-Verfahren im ROW-Bereich bezügliche HER+ Antigenen.
Der medizinische Fortschritt wird in 2-3 Jahren, wenn T-DM1 aller Vorausicht nach sich etabliert hat, weltweit verfügbarer sein.
Freundliche Grüsse,
StefanR
Der Immunogen CFO kann zwar keine harten Fakten bezüglich des Umsatzpotentials von T-DM1 liefern, aber das momentane Herceptin-Volumen über 6 mrd Dollar schein für immunogen eine realistische Richtgröße zu sein.
Zu der höheren Preisgestaltung und längerer Therapiedauer halte ich es für bemerkenswert, daß Herceptin momentan immer noch um 11% wächst, auch durch die zunehmenden Screening-Verfahren im ROW-Bereich bezügliche HER+ Antigenen.
Der medizinische Fortschritt wird in 2-3 Jahren, wenn T-DM1 aller Vorausicht nach sich etabliert hat, weltweit verfügbarer sein.
Freundliche Grüsse,
StefanR
Antwort auf Beitrag Nr.: 43.826.917 von StefanR am 15.11.12 10:04:20Nachtrag: "Der med. Fortschritt wird weltweit verfügbar sein"
d.h. die Internationalisierung vorteilhafter Therapien wird zunehmend schneller von statten gehen, aufgrund der Diagnosemöglichkeiten hin zu personalisierten Krebstherapien, und der Finanzierbarkeit durch das Wachsen der Mittelschicht in China und Rohstoffländern (Brasilien..)
d.h. die Internationalisierung vorteilhafter Therapien wird zunehmend schneller von statten gehen, aufgrund der Diagnosemöglichkeiten hin zu personalisierten Krebstherapien, und der Finanzierbarkeit durch das Wachsen der Mittelschicht in China und Rohstoffländern (Brasilien..)
Zitat von Joschka Schröder: Nun folgt Kontrollrechnung A:
.
.
.
Daraus folgt für den Umsatz:
eBC: 5,950 Mrd.USD
1L mBC: 1,275 Mrd. USD
2-4L mBC: 1,842 Mrd. USD
und für die Tantiemenhöhe:
2-4L mBC: 72 Mio. USD
1-4 mBC: 153 Mio.USD
1L mBC: 433 Mio USD
Immer wieder interessant - und gelegentlich auch ärgerlich, wenn man alte Beiträge liest. Habe einen Übertragsfehler gefunden ... es muß heißen:
Tantiemenhöhe:
2-4L mBC: 72 Mio. USD
1-4L mBC: 153 Mio.USD
eBC plus mBC: 433 Mio USD
eBC = early breast cancer
mBC = metastatic breast cancer
alle her2+
Schöne Kursentwicklung bei IMGN im Vorfeld der ASH-Tagung ... aktuell 12,48 USD, +15 % seit der Tantiemendiskussion vor genau einem Monat.
Anleger des Pharmariesen Roche sollten sich den 26. Februar rot im Kalender markieren. Dann will nämlich die US-Arzneimittelbehörde FDA über die Zulassung des Krebsmittels T-DM1 entscheiden. Das Medikament soll gegen Brustkrebs eingesetzt werden und gilt bei Roche als großer Hoffnungsträger. Im Falle einer Zulassung winken dem Schweizer Unternehmen Milliardenumsätze – und Aktionären satte Kursgewinne.
T-DM1 soll – gemeinsam mit dem Medikament Perjeta – das Erbe von Herceptin antreten, dessen Patentschutz in Europa ab 2015 ablaufen wird. Herceptin ist der bisherige Erfolgsgarant bei Roche und generierte allein im Jahre 2011 einen Umsatz von 5,5 Mrd. Schweizer Franken (4,6 Mrd. Euro). Sollte die beiden Nachfolgeprodukte zugelassen werden, könnte Roche seine Erlöse nach Ansicht von Sarasin-Analyst David Kägi „erheblich“ steigern, „da der Preis für eine Behandlung mit Herceptin im Vergleich zu neueren Krebsmedikamenten aus historischen Gründen relativ tief angesetzt ist“. Dank der zuletzt „ausgezeichneten Studienresultate“ stünden die Chancen für T-DM1 und Perjeta gut. Falls die Arzneimittel eine Zulassung erhielten, könnte Roche seine weltweit führende Position in der Brustkrebsbehandlung sichern.
T-DM1 soll – gemeinsam mit dem Medikament Perjeta – das Erbe von Herceptin antreten, dessen Patentschutz in Europa ab 2015 ablaufen wird. Herceptin ist der bisherige Erfolgsgarant bei Roche und generierte allein im Jahre 2011 einen Umsatz von 5,5 Mrd. Schweizer Franken (4,6 Mrd. Euro). Sollte die beiden Nachfolgeprodukte zugelassen werden, könnte Roche seine Erlöse nach Ansicht von Sarasin-Analyst David Kägi „erheblich“ steigern, „da der Preis für eine Behandlung mit Herceptin im Vergleich zu neueren Krebsmedikamenten aus historischen Gründen relativ tief angesetzt ist“. Dank der zuletzt „ausgezeichneten Studienresultate“ stünden die Chancen für T-DM1 und Perjeta gut. Falls die Arzneimittel eine Zulassung erhielten, könnte Roche seine weltweit führende Position in der Brustkrebsbehandlung sichern.
Antwort auf Beitrag Nr.: 43.903.288 von StefanR am 07.12.12 16:02:04http://www.boerse-online.de/aktie/empfehlung/favorit/:Roche-…
Weiß jemand, wie der Analyst auf die Einschätzung "aus historischen Gründen rel. tief angesetzt" (Preisniveau) kommt?
Frdl Grüsse,
StefanR
Weiß jemand, wie der Analyst auf die Einschätzung "aus historischen Gründen rel. tief angesetzt" (Preisniveau) kommt?
Frdl Grüsse,
StefanR
Antwort auf Beitrag Nr.: 43.903.303 von StefanR am 07.12.12 16:06:17Gemeint ist vermutlich, dass Herceptin schon lange auf dem Markt ist und bei Markteinführung ein anderes Preisniveau herrschte als heutzutage. Und wenn ein Preis einmal festgelegt ist, läßt er sich schlecht in größerem Ausmaß erhöhen.
http://investor.immunogen.com/releases.cfm
neues vom ASH-Meeting auf der news-Seite von Immunogen bezüglich IMGN 901.
Nicht enttäuschend, aber auch nicht berauschend.
neues vom ASH-Meeting auf der news-Seite von Immunogen bezüglich IMGN 901.
Nicht enttäuschend, aber auch nicht berauschend.
Der IMGN-CEO hat immer wieder betont, dass die Indikation MM quasi nur nebenher läuft, weil es einfach zu viele (gute) Konkurrenzpräparate gibt. Hauptindikation für den IMGN901 sind diverse CD56-exprimierende Lungenkrebsarten.
IMGN notiert aktuell bei 13,08 USD (Tagesplus > 5 %) ... offensichtlich hatte die Investorengemeinde extrem geringe Erwartungen hinsichtlich IMGN901 und beginnt allmählich einen Wert ungleich Null für das anti CD56-Immunkojugat einzupreisen.
Antwort auf Beitrag Nr.: 43.916.483 von Joschka Schröder am 11.12.12 18:11:04PS: Analysten wie Kantor/Credit Suisse haben in ihren jüngsten Studien explizit darauf hingewiesen, dass sie dem IMGN901 bislang keinerlei Wert beigemessen hätten und sie in positiven IMGN901-Studiendaten den größten Kurs-Trigger sehen würden. Offensichtlich reichen die vergleichsweise unwesentlichen Daten aus der MM-Kombistudie schon aus, um bzgl. IMGN901-Bewertung ein Umdenken zu erzeugen. Da kann man wirklich gespannt sein, wie der Kurs auf positive Daten der (viel wichtigeren) NORTH-Studie reagieren wird.
Während ich diese Zeilen getippt habe, ist der Kurs bereits auf 13,16 USD gestiegen.
Während ich diese Zeilen getippt habe, ist der Kurs bereits auf 13,16 USD gestiegen.
Moin,

ja, sehr schöne Entwicklung heute. Die über T-DM1 hinausgehende Pipeline wird wohlwollend wahrgenommen. Sehe bei IMGN noch viel Spielraum nach oben.
Gruß q.

ja, sehr schöne Entwicklung heute. Die über T-DM1 hinausgehende Pipeline wird wohlwollend wahrgenommen. Sehe bei IMGN noch viel Spielraum nach oben.
Gruß q.
Rote-Hand-Brief
Herceptin wirksamer als Tyverb
APOTHEKE ADHOC, 11.12.2012 10:09 Uhr
Weniger wirksam: Tyverb soll nur angewendet werden, wenn Herceptin nicht mehr ausreichend wirkt.
Foto: APOTHEKE ADHOCBerlin - Herceptin (Trastuzumab, Roche) hat eine signifikant höhere Wirksamkeit als Tyverb (Lapatinib, GSK). Der Pharmakonzern weist daher in einem Rote-Hand-Brief darauf hin, dass Tyverb nur bei Patientinnen angewendet werden sollte, die auf Herceptin nicht mehr ausreichend ansprechen. Zudem muss Tyverb mit Xeloda (Capecitabin, Roche) kombiniert werden.
Das Krebsmittel ist zur Behandlung von metastasierendem Brustkrebs mit übermäßig aktiviertem Wachstumsfaktor HER 2 zugelassen. Zwei Vergleichsstudien zeigten keine signifikante Überlegenheit von Tyverb gegenüber Herceptin.
In einer Studie waren die Patientinnen mit Tyverb oder Herceptin in Kombination mit einem Taxan behandelt worden. Das progressionsfreie Überleben bei den mit Herceptin behandelten Patientinnen lag bei 11,4 Monaten. Patientinnen, die mit Tyverb behandelt wurden, überlebten 8,8 Monate progressionsfrei.
In einer weiteren Studie hatten Patientinnen statt dem Taxan zusätzlich Capecitabin erhalten. Auch hier war Herceptin überlegen. So traten weniger ZNS-Metastasen auf. Auch das progressionsfreie Überleben und das Gesamtüberleben waren länger.
...das vergrößert das Umsatzpotential von Herceptin und seinem potenten Nachfolger!
Herceptin wirksamer als Tyverb
APOTHEKE ADHOC, 11.12.2012 10:09 Uhr
Weniger wirksam: Tyverb soll nur angewendet werden, wenn Herceptin nicht mehr ausreichend wirkt.
Foto: APOTHEKE ADHOCBerlin - Herceptin (Trastuzumab, Roche) hat eine signifikant höhere Wirksamkeit als Tyverb (Lapatinib, GSK). Der Pharmakonzern weist daher in einem Rote-Hand-Brief darauf hin, dass Tyverb nur bei Patientinnen angewendet werden sollte, die auf Herceptin nicht mehr ausreichend ansprechen. Zudem muss Tyverb mit Xeloda (Capecitabin, Roche) kombiniert werden.
Das Krebsmittel ist zur Behandlung von metastasierendem Brustkrebs mit übermäßig aktiviertem Wachstumsfaktor HER 2 zugelassen. Zwei Vergleichsstudien zeigten keine signifikante Überlegenheit von Tyverb gegenüber Herceptin.
In einer Studie waren die Patientinnen mit Tyverb oder Herceptin in Kombination mit einem Taxan behandelt worden. Das progressionsfreie Überleben bei den mit Herceptin behandelten Patientinnen lag bei 11,4 Monaten. Patientinnen, die mit Tyverb behandelt wurden, überlebten 8,8 Monate progressionsfrei.
In einer weiteren Studie hatten Patientinnen statt dem Taxan zusätzlich Capecitabin erhalten. Auch hier war Herceptin überlegen. So traten weniger ZNS-Metastasen auf. Auch das progressionsfreie Überleben und das Gesamtüberleben waren länger.
...das vergrößert das Umsatzpotential von Herceptin und seinem potenten Nachfolger!
Auf der immunogen-Seite/investor relations /events-presentations ist der conference call von
Oppenheimer & Co. Inc. 23rd Annual Healthcare Conference
im Archiv zur Wiederholung zu hören.
Daniel Junius (CEO) unterstreicht immer wieder, daß 2013 für immunogen ein bezogen auf die gesamte Entwicklungspipeline wichtiges Jahr wird. Indirekt spricht er für den T-DM 1-Umsatz ein höheres Ziel als die momentanen 6 Milliarden Dollar für Herceptin aus.
Er erwähnt auch zu Beginn seiner Rede, daß Roche mit der Preisgestaltung von Herceptin aus Sicht von Roche zu defensiv gewesen sei.
Frdl Grüsse,
StefanR
Oppenheimer & Co. Inc. 23rd Annual Healthcare Conference
im Archiv zur Wiederholung zu hören.
Daniel Junius (CEO) unterstreicht immer wieder, daß 2013 für immunogen ein bezogen auf die gesamte Entwicklungspipeline wichtiges Jahr wird. Indirekt spricht er für den T-DM 1-Umsatz ein höheres Ziel als die momentanen 6 Milliarden Dollar für Herceptin aus.
Er erwähnt auch zu Beginn seiner Rede, daß Roche mit der Preisgestaltung von Herceptin aus Sicht von Roche zu defensiv gewesen sei.
Frdl Grüsse,
StefanR
Hallo, eben gefunden:
Amgen (AMGN) Licenses ImmunoGen's Maytansinoid TAP Technology
Article Related Press Releases (1) Stock Quotes (2) Comments (0)
December 19, 2012 6:33 AM EST
Get Alerts IMGN Hot Sheet
Price: $13.12 --0%
Overall Analyst Rating:
NEUTRAL (Down Down)
EPS Growth %: -15.4%
ImmunoGen, Inc. (Nasdaq: IMGN) announced that Amgen (Nasdaq: AMGN) has licensed the exclusive right to use the Company’s maytansinoid TAP technology to develop anticancer therapeutics to a third target, which is undisclosed. Amgen licensed rights for two other targets in 2009 and has two compounds in clinical testing under those licenses.
“We’re pleased with the interest major healthcare companies are showing in developing multiple product candidates with our TAP technology”
“We’re pleased with the interest major healthcare companies are showing in developing multiple product candidates with our TAP technology,” commented Daniel Junius, President and CEO. “In recent years, there has been a marked increase in the quantity of targets considered to be potentially appropriate for TAP compounds, which has expanded the opportunity for us and our partners.”
The licenses were taken under a 2000 agreement. For each license, ImmunoGen receives a $1 million upfront payment and is entitled to receive milestone payments potentially totaling $34 million plus royalties on the sales of any resulting products. Amgen is responsible for the development, manufacturing and marketing of any products resulting from the license.
Amgen (AMGN) Licenses ImmunoGen's Maytansinoid TAP Technology
Article Related Press Releases (1) Stock Quotes (2) Comments (0)
December 19, 2012 6:33 AM EST
Get Alerts IMGN Hot Sheet
Price: $13.12 --0%
Overall Analyst Rating:
NEUTRAL (Down Down)
EPS Growth %: -15.4%
ImmunoGen, Inc. (Nasdaq: IMGN) announced that Amgen (Nasdaq: AMGN) has licensed the exclusive right to use the Company’s maytansinoid TAP technology to develop anticancer therapeutics to a third target, which is undisclosed. Amgen licensed rights for two other targets in 2009 and has two compounds in clinical testing under those licenses.
“We’re pleased with the interest major healthcare companies are showing in developing multiple product candidates with our TAP technology”
“We’re pleased with the interest major healthcare companies are showing in developing multiple product candidates with our TAP technology,” commented Daniel Junius, President and CEO. “In recent years, there has been a marked increase in the quantity of targets considered to be potentially appropriate for TAP compounds, which has expanded the opportunity for us and our partners.”
The licenses were taken under a 2000 agreement. For each license, ImmunoGen receives a $1 million upfront payment and is entitled to receive milestone payments potentially totaling $34 million plus royalties on the sales of any resulting products. Amgen is responsible for the development, manufacturing and marketing of any products resulting from the license.
Antwort auf Beitrag Nr.: 43.944.006 von KlausAnlage am 19.12.12 13:14:00The licenses were taken under a 2000 agreement.
Die Bedingungen dieses Agreements sind aus heutiger Sicht wohl nur als grottenschlecht zu bezeichnen.
Fast muss man es bedauern, dass Amgen da noch immer Optionen ziehen kann (das Agreement an sich ist ausgelaufen).
Aus dem 10-K SEC-File:
In September 2000, we entered into a ten-year right-to-test agreement with Abgenix, Inc. which was later acquired by Amgen. The
agreement provides Amgen with the right to (a) test our maytansinoid TAP technology with Amgen's antibodies under a right-to-test, or
research, license, (b) take options, with certain restrictions, to individual targets selected by Amgen on either an exclusive or non-exclusive
basis for specified option periods and (c) upon exercise of those options, take exclusive or non-exclusive licenses to use our maytansinoid TAP
technology to develop and commercialize products directed to the specified targets on previously agreed-upon terms. Amgen no longer has the
right to take additional options under the right-to-test agreement, although multiple outstanding options remain in effect for the remainder of
their respective option periods.
For each exclusive development and commercialization license taken, we are entitled to receive an exercise fee of $1 million and up to a
total of $34 million in milestone payments, plus royalties on the commercial sales of any resulting products.
Die Bedingungen dieses Agreements sind aus heutiger Sicht wohl nur als grottenschlecht zu bezeichnen.
Fast muss man es bedauern, dass Amgen da noch immer Optionen ziehen kann (das Agreement an sich ist ausgelaufen).
Aus dem 10-K SEC-File:
In September 2000, we entered into a ten-year right-to-test agreement with Abgenix, Inc. which was later acquired by Amgen. The
agreement provides Amgen with the right to (a) test our maytansinoid TAP technology with Amgen's antibodies under a right-to-test, or
research, license, (b) take options, with certain restrictions, to individual targets selected by Amgen on either an exclusive or non-exclusive
basis for specified option periods and (c) upon exercise of those options, take exclusive or non-exclusive licenses to use our maytansinoid TAP
technology to develop and commercialize products directed to the specified targets on previously agreed-upon terms. Amgen no longer has the
right to take additional options under the right-to-test agreement, although multiple outstanding options remain in effect for the remainder of
their respective option periods.
For each exclusive development and commercialization license taken, we are entitled to receive an exercise fee of $1 million and up to a
total of $34 million in milestone payments, plus royalties on the commercial sales of any resulting products.
JPMorgan Healthcare Conference Highlights: ImmunoGen
By Sean Williams
January 8, 2013
The JPMorgan Healthcare Conference currently under way in San Francisco is arguably the most important event of the entire year for the health care sector. This is one of the rarest opportunities for biotechnology, pharmaceutical, and medical device companies to open up about where they've been and where they're headed, so it pays to take notice.
One company that presented yesterday that I had my keen eye on is ImmunoGen (NASDAQ: IMGN ) . ImmunoGen develops a proprietary technology known as targeted antibody payload, or TAP, that allows a chemotherapy toxin to be carried on an antibody until it comes into contact with a very specific protein produced by a targeted cancer cell; then it releases the toxin. There are very, very few biotechs focused on toxin payload delivery methods like this, with Seattle Genetics (NASDAQ: SGEN ) and its various antibody-drug conjugates being the other. Pfizer (NYSE: PFE ) in 2010 even tried its luck with a TAP-type drug known as Mylotarg, but couldn't get the toxin to stay attached to the antibody.
In short, the technology is amazing -- the successes few and far between!
As expected, during yesterday's presentation we heard that ImmunoGen fully expects U.S. and European approval for T-DM1 -- its HER2-positive breast cancer drug developed with Roche (NASDAQOTH: RHHBY ) -- early in 2013.
Considering that it reduced overall death risk relative to the placebo by 32% and extended overall median survival to 30.9 months, versus the 25.1 months delivered by GlaxoSmithKline's (NYSE: GSK ) Tykerb and Roche's Xeloda, I'd say CEO Dan Junius is correct in his optimism.
What was really noteworthy is that we got to hear a little bit about ImmunoGen's three other compounds in development expected to produce clinical results in 2013.
The first compound, IMGN901, is being developed to target cancers with the CD56 expression, including small-cell lung cancer, Merkel cell carcinoma, pediatric neuroblastoma, and multiple myeloma. What ImmunoGen has discovered in mid-stage trials is that not only has IMGN901 incited activity, but with regard to Merkel cell carcinoma, they've seen signs of activity even in platinum-resistant patients who no longer respond to first-line treatments. In multiple myeloma patients, ImmunoGen has seen increased activity in combination with Celgene's (NASDAQ: CELG ) Revlimid. Most data on IMGN901 is due out in the later half of 2013.
The second compound, IMGN853, uses the DM4 linker and is targeted at folate receptor positive cancers like ovarian and lung cancers, as well as small-cell carcinoma. This compound is currently in early stage trials, and data should be available by mid-year.
The final compound discussed by Dan Junius is IMGN529, a candidate for CD37 positive B-cell malignancies, like non-Hodgkin's lymphoma and chronic lymphocytic leukemia, with Tykerb plus Xeloda. This compound began phase 1 testing in April and is expected to provide some glimpse of efficacy and safety in late 2013.
ImmunoGen is also very well capitalized, ending its most recent quarter with $233.4 million in cash and projecting to finish its fiscal year (ending in June) with $172 million to $176 million in cash.
I think this is going to be a pivotal year for ImmunoGen, and I'd have to say that the positive, but limited, clinical data thus far provides evidence that the TAP technology the company possesses could become the drug combination therapy of the future.
It's still too early to declare either ImmunoGen or Seattle Genetics the better antibody-payload company and would suggest those looking to dip their feet into the sector simply consider buying both.
http://www.fool.com/investing/general/2013/01/08/jpmorgan-he…
By Sean Williams
January 8, 2013
The JPMorgan Healthcare Conference currently under way in San Francisco is arguably the most important event of the entire year for the health care sector. This is one of the rarest opportunities for biotechnology, pharmaceutical, and medical device companies to open up about where they've been and where they're headed, so it pays to take notice.
One company that presented yesterday that I had my keen eye on is ImmunoGen (NASDAQ: IMGN ) . ImmunoGen develops a proprietary technology known as targeted antibody payload, or TAP, that allows a chemotherapy toxin to be carried on an antibody until it comes into contact with a very specific protein produced by a targeted cancer cell; then it releases the toxin. There are very, very few biotechs focused on toxin payload delivery methods like this, with Seattle Genetics (NASDAQ: SGEN ) and its various antibody-drug conjugates being the other. Pfizer (NYSE: PFE ) in 2010 even tried its luck with a TAP-type drug known as Mylotarg, but couldn't get the toxin to stay attached to the antibody.
In short, the technology is amazing -- the successes few and far between!
As expected, during yesterday's presentation we heard that ImmunoGen fully expects U.S. and European approval for T-DM1 -- its HER2-positive breast cancer drug developed with Roche (NASDAQOTH: RHHBY ) -- early in 2013.
Considering that it reduced overall death risk relative to the placebo by 32% and extended overall median survival to 30.9 months, versus the 25.1 months delivered by GlaxoSmithKline's (NYSE: GSK ) Tykerb and Roche's Xeloda, I'd say CEO Dan Junius is correct in his optimism.
What was really noteworthy is that we got to hear a little bit about ImmunoGen's three other compounds in development expected to produce clinical results in 2013.
The first compound, IMGN901, is being developed to target cancers with the CD56 expression, including small-cell lung cancer, Merkel cell carcinoma, pediatric neuroblastoma, and multiple myeloma. What ImmunoGen has discovered in mid-stage trials is that not only has IMGN901 incited activity, but with regard to Merkel cell carcinoma, they've seen signs of activity even in platinum-resistant patients who no longer respond to first-line treatments. In multiple myeloma patients, ImmunoGen has seen increased activity in combination with Celgene's (NASDAQ: CELG ) Revlimid. Most data on IMGN901 is due out in the later half of 2013.
The second compound, IMGN853, uses the DM4 linker and is targeted at folate receptor positive cancers like ovarian and lung cancers, as well as small-cell carcinoma. This compound is currently in early stage trials, and data should be available by mid-year.
The final compound discussed by Dan Junius is IMGN529, a candidate for CD37 positive B-cell malignancies, like non-Hodgkin's lymphoma and chronic lymphocytic leukemia, with Tykerb plus Xeloda. This compound began phase 1 testing in April and is expected to provide some glimpse of efficacy and safety in late 2013.
ImmunoGen is also very well capitalized, ending its most recent quarter with $233.4 million in cash and projecting to finish its fiscal year (ending in June) with $172 million to $176 million in cash.
I think this is going to be a pivotal year for ImmunoGen, and I'd have to say that the positive, but limited, clinical data thus far provides evidence that the TAP technology the company possesses could become the drug combination therapy of the future.
It's still too early to declare either ImmunoGen or Seattle Genetics the better antibody-payload company and would suggest those looking to dip their feet into the sector simply consider buying both.
http://www.fool.com/investing/general/2013/01/08/jpmorgan-he…
JPMorgan Healthcare Conference Highlights: ImmunoGen
As expected, during yesterday's presentation we heard that ImmunoGen fully expects U.S. and European approval for T-DM1 -
its HER2-positive breast cancer drug developed with Roche (NASDAQOTH: RHHBY ) -- early in 2013.
..... der genaue FDA Termin ist am 26.02.2012....
As expected, during yesterday's presentation we heard that ImmunoGen fully expects U.S. and European approval for T-DM1 -
its HER2-positive breast cancer drug developed with Roche (NASDAQOTH: RHHBY ) -- early in 2013.
..... der genaue FDA Termin ist am 26.02.2012....
..... der genaue FDA Termin ist am 26.02.2013....
 ...
...
http://www.nzz.ch/aktuell/wirtschaft/wirtschaftsnachrichten/…
Wie dieser Tage bekanntwurde, stellt Lonza ein Brustkrebs-Produkt mit dem generischen Namen TDM-1 (Markenname: Kadcyla) für Roche her, das im Februar in den USA die Marktzulassung erhalten und sich nach Meinung von Analytikern zu einem Blockbuster entwickeln könnte. Lonza verfügt in Visp im Bereich ADC über eine Kompetenz, die nicht nur dem neusten Stand der Technologie entspricht, sondern auch ein beträchtliches kommerzielles Potenzial birgt.
Gruesse, StefanR
Wie dieser Tage bekanntwurde, stellt Lonza ein Brustkrebs-Produkt mit dem generischen Namen TDM-1 (Markenname: Kadcyla) für Roche her, das im Februar in den USA die Marktzulassung erhalten und sich nach Meinung von Analytikern zu einem Blockbuster entwickeln könnte. Lonza verfügt in Visp im Bereich ADC über eine Kompetenz, die nicht nur dem neusten Stand der Technologie entspricht, sondern auch ein beträchtliches kommerzielles Potenzial birgt.
Gruesse, StefanR

ImmunoGen, Inc. Announces Conference Call to Discuss its Second Quarter Fiscal Year 2013 Financial Results
WALTHAM, Mass.--(BUSINESS WIRE)--
ImmunoGen, Inc. (IMGN), a biotechnology company that develops anticancer products using its Targeted Antibody Payload (TAP) technology and antibody expertise, today announced that the Company will host a conference call at 8:00 a.m. ET on Friday, January 25, 2013, to discuss ImmunoGen's financial results for the three-month period ended December 31, 2012 – the second quarter of the Company’s 2013 fiscal year.
To access the live call by phone, dial 913-312-0721. Passcode: 8098402.
The call also may be accessed through the Investor Information section of the Company's website, www.immunogen.com. Following the live webcast, a replay of the call will be available at the same location through February 8, 2013.
http://finance.yahoo.com/news/immunogen-inc-announces-confer…
http://seekingalpha.com/article/1120801-4-promising-growth-s…
"According to Gregory Perry, Executive Vice President and CFO at ImmunoGen, "Roche, Sanofi and the rest of our partners are making tangible progress with compounds that can generate meaningful revenue to ImmunoGen. Our strong financial position enables us to aggressively fund advancement of our wholly owned compounds to further enhance shareholder value."
Presenting at the JPMorgan Healthcare Conference, Immunogen President and CEO Dan Junius explained that TAP technology uses the targeting ability of an antibody to bring a highly-toxic payload into a cell, release the cell, and through that start a mechanism that results in cell destruction. The technology used for the proprietary cell killing agent itself has a chemotherapeutic that's far, far more potent than standard chemotherapy - 100 to 1000 times more potent. Tubulin inhibitors inhibit cells from dividing and lead to cell death. The targeting nature of the technology permits the treatment to gain access to the cancer cells to kill them. By using an antibody-based approach, it avoids the systemic toxicity that you normally get with broad-based chemotherapeutics.
A TAP compound uses a tumor-targeting monoclonal antibody to deliver one of ImmunoGen's purpose-developed cancer-killing agents specifically to tumor cells. Ten TAP compounds are now in clinical testing, of which three are wholly owned by the company. Marketing applications for trastuzumab emtansine (T-DM1), the most advanced compound using ImmunoGen's TAP technology, are under review in the U.S. and Europe. Roche Holding (RHHBY) is developing this compound globally under an agreement between ImmunoGen and Genentech, a member of the Roche Group. This drug has been found to significantly extend survival rates in people who have aggressive forms of breast cancer. The results from clinical trials have been encouraging. T-DM1 couples Genentech's blockbuster cancer drug Herceptin (or trastuzumab) with a chemotherapy agent developed by ImmunoGen. Herceptin carries the chemotherapy agent to a precise landing spot on a cancer cell, delinking the toxic payload once inside the cancer cell. That offloading action minimizes damage to healthy surrounding cells as well as side effects like hair loss and nausea. The FDA's decision is due by February 26th, 2013. Decision Resources, a pharmaceutical research group, predicts the breast cancer market sales will reach $10.9 billion in 2018 due to new drugs.
Although T-DM1 filing is for second line treatment indication, it is likely that physicians will prescribe T-DM1 as a first line treatment rather than wait for patients to fail on Herceptin. Furthermore, since T-DM1 and Herceptin are both marketed by Roche, Roche is also more likely to aggressively promote T-DM1 than Herceptin since Herceptin's patent will expire in 2015. Most of Immunogen's revenues will come from royalties for product sales. The company has negotiated a potential $845 million in milestone payments with its partners for licensing its TAP technology.
If the FDA approves T-DM1, it will create a strong case for all the TAP technology based products for commercialization and for this drug to piggyback on the commercial success of Herceptin which currently generates over $5 billion in sales. The fact that Roche is going to market T-DM1 in addition to already marketing Herceptin will be another major plus factor because both drugs target the same prescribing physicians. Finally, FDA endorsement of TAP technology will boost the value of the 11 products based on this technology already in the development pipeline. Immunogen appears to be a compelling investment. This is another high potential growth play in therapeutics."
Grüsse, StefanR
"According to Gregory Perry, Executive Vice President and CFO at ImmunoGen, "Roche, Sanofi and the rest of our partners are making tangible progress with compounds that can generate meaningful revenue to ImmunoGen. Our strong financial position enables us to aggressively fund advancement of our wholly owned compounds to further enhance shareholder value."
Presenting at the JPMorgan Healthcare Conference, Immunogen President and CEO Dan Junius explained that TAP technology uses the targeting ability of an antibody to bring a highly-toxic payload into a cell, release the cell, and through that start a mechanism that results in cell destruction. The technology used for the proprietary cell killing agent itself has a chemotherapeutic that's far, far more potent than standard chemotherapy - 100 to 1000 times more potent. Tubulin inhibitors inhibit cells from dividing and lead to cell death. The targeting nature of the technology permits the treatment to gain access to the cancer cells to kill them. By using an antibody-based approach, it avoids the systemic toxicity that you normally get with broad-based chemotherapeutics.
A TAP compound uses a tumor-targeting monoclonal antibody to deliver one of ImmunoGen's purpose-developed cancer-killing agents specifically to tumor cells. Ten TAP compounds are now in clinical testing, of which three are wholly owned by the company. Marketing applications for trastuzumab emtansine (T-DM1), the most advanced compound using ImmunoGen's TAP technology, are under review in the U.S. and Europe. Roche Holding (RHHBY) is developing this compound globally under an agreement between ImmunoGen and Genentech, a member of the Roche Group. This drug has been found to significantly extend survival rates in people who have aggressive forms of breast cancer. The results from clinical trials have been encouraging. T-DM1 couples Genentech's blockbuster cancer drug Herceptin (or trastuzumab) with a chemotherapy agent developed by ImmunoGen. Herceptin carries the chemotherapy agent to a precise landing spot on a cancer cell, delinking the toxic payload once inside the cancer cell. That offloading action minimizes damage to healthy surrounding cells as well as side effects like hair loss and nausea. The FDA's decision is due by February 26th, 2013. Decision Resources, a pharmaceutical research group, predicts the breast cancer market sales will reach $10.9 billion in 2018 due to new drugs.
Although T-DM1 filing is for second line treatment indication, it is likely that physicians will prescribe T-DM1 as a first line treatment rather than wait for patients to fail on Herceptin. Furthermore, since T-DM1 and Herceptin are both marketed by Roche, Roche is also more likely to aggressively promote T-DM1 than Herceptin since Herceptin's patent will expire in 2015. Most of Immunogen's revenues will come from royalties for product sales. The company has negotiated a potential $845 million in milestone payments with its partners for licensing its TAP technology.
If the FDA approves T-DM1, it will create a strong case for all the TAP technology based products for commercialization and for this drug to piggyback on the commercial success of Herceptin which currently generates over $5 billion in sales. The fact that Roche is going to market T-DM1 in addition to already marketing Herceptin will be another major plus factor because both drugs target the same prescribing physicians. Finally, FDA endorsement of TAP technology will boost the value of the 11 products based on this technology already in the development pipeline. Immunogen appears to be a compelling investment. This is another high potential growth play in therapeutics."
Grüsse, StefanR
Zitat von Joschka Schröder: aktueller Kurs 10,90 USD ... aus meiner Sicht eine ausgezeichnete Kaufgelegenheit!
Details folgen.
Das war am 31.10.2012. Seitdem ist der Kurs in nicht einmal drei Monaten um knapp 50 % auf aktuell 15,85 USD gestiegen. Mithin hat sich das Chance-Risiko-Verhältnis aktuell deutlich verschlechtert. Es dürfte daher zweckmäßig sein, nunmehr an Gewinn(ab)sicherung zu denken, auch wenn der Kurs im Vorfeld der erwarteten T-DM1-Zulassung noch in eine Übertreibungszone laufen könnte.
ImmunoGen, Inc. Reports Second Quarter Fiscal Year 2013 Financial Results and Provides Quarterly Update
> Trastuzumab emtansine (T-DM1) marketing applications are under review in the US and Europe; US application has priority review status with a PDUFA date of February 26, 2013.
> In 2013, ImmunoGen expects to report clinical findings with its three lead wholly owned compounds and to advance its fourth compound, IMGN289, into clinical testing.
> Clinical findings also are expected to be reported for multiple partner compounds, with next compound on track to advance into pivotal testing in 2013.
WALTHAM, Mass.--(BUSINESS WIRE)--
ImmunoGen, Inc. (IMGN), a biotechnology company that develops anticancer products using its Targeted Antibody Payload (TAP) technology and antibody expertise, today reported financial results for the three-month period ended December 31, 2012 – the second quarter of the Company’s 2013 fiscal year – and provided an update on the Company.
“We expect 2013 to be a very important year for ImmunoGen,” commented Daniel Junius, President and CEO. “Roche is anticipating the approval of T-DM1 in the US early this year followed by approval in Europe later in 2013. We believe the launch of T-DM1 will be momentous for appropriate patients, their families, and their physicians. It will also mark the start of ImmunoGen earning what we believe will be a significant royalty stream.”
Mr. Junius continued, “We also believe that, in 2013, ImmunoGen’s progress on our proprietary pipeline will become more apparent. Over the course of the year, we expect to report clinical findings for our three lead TAP compounds and to advance our fourth, IMGN289, into clinical testing. We believe each of these compounds has the potential to be transformative to the treatment of its targeted cancer and we’ve designed development programs to advance each compound through proof of concept as promptly as possible.”
Product Pipeline Update
Lead compound with ImmunoGen’s TAP technology, T-DM1, is in global development by Roche:
The T-DM1 marketing applications for treatment of people with HER2+, unresectable locally advanced or metastatic breast cancer who have received prior treatment with Herceptin® (trastuzumab)and a taxane are under review in the US and Europe. Roche has noted that the US submission has been granted priority review status by the FDA with a PDUFA goal date of February 26, 2013. Roche also expects European approval of T-DM1 in 2013.
Roche expects to report data from its Ph III trial, MARIANNE, evaluating T-DM1 for first-line treatment of HER+ metastatic breast cancer in early 2014 and to apply for marketing approval for this use in 2014.
Roche intends to initiate registration trials in 2013 evaluating T-DM1 in three early stage HER2+ breast cancer settings – adjuvant, neoadjuvant, and residual invasive disease.
Roche is currently evaluating T-DM1 for the treatment of advanced HER2+ gastric cancer and expects to submit for approval for this use in 2015.
IMGN901, wholly owned ImmunoGen TAP compound for CD56+ cancers:
Small-cell lung cancer (SCLC) – The Company remains on track to have the data readout from the first stage of its Simon two-stage NORTH Phase II trial in the second half of 2013 – a readout designed to inform certain development decisions to be made by the Company. ImmunoGen expects to complete patient enrollment for the full trial in 2013, which would enable these findings to be reported in 2014. NORTH evaluates IMGN901 for the first-line treatment of SCLC used in combination with etoposide/carboplatin.
Multiple myeloma – IMGN901 showed activity in both Revlimid® (lenalidomide)-naïve and -refractory disease in a Phase I trial assessing it used in combination with Revlimid and dexamethasone presented at the ASH annual meeting in December.
IMGN853, ImmunoGen TAP compound for folate receptor α (FOL)-overexpressing tumors:
The Company expects the first clinical data with this TAP compound to be reported at a medical conference in mid-2013.
IMGN853 is a potential treatment for prevalent types of ovarian and non-small cell lung cancers, as well as for other FOL+ solid tumors.
IMGN529, ImmunoGen TAP compound for CD37+ hematological malignancies:
IMGN529 is in Phase I testing for the treatment of non-Hodgkin’s lymphoma, and the Company expects the first clinical data to be reported at a medical conference in late 2013.
IMGN529 employs ImmunoGen’s TAP technology with an antibody that also has anticancer properties.
IMGN289, ImmunoGen TAP compound for EGFR-overexpressing solid tumors:
IMGN289 is expected to be the next wholly owned ImmunoGen compound to advance into clinical testing. The Company expects to submit its IND in mid-2013 and to begin clinical testing in 2H 2013.
ImmunoGen expects to present data on the preclinical efficacy and tolerability of IMGN289 at a scientific meeting in 2Q 2013.
In addition to T-DM1, seven other compounds are in clinical testing through ImmunoGen’s partnerships:
Clinical data are expected to be reported with a number of these compounds in 2013.
A partner compound is projected to advance into pivotal testing in 2013.
Financial Results and Guidance
ImmunoGen reported a net loss of $24.4 million, or $0.29 per basic and diluted share, for the quarter ending December 31, 2012 (2Q FY2013), as compared to a net loss of $12.8 million, or $0.17 per basic and diluted share, for the same quarter of the last year (2Q FY2012).
Revenues for 2Q FY2013 were $2.6 million. This compares to $7.6 million for 2Q FY2012, which included $5.0 million in milestone payments not repeated in 2Q FY2013. Revenues in 2Q FY2013 comprise $2.0 million of research and development support fees, $0.4 million of license and milestone fees, and $0.1 million of clinical material reimbursement, compared to $0.9 million, $6.0 million, and $0.6 million, respectively, for the same quarter last year.
Operating expenses for 2Q FY2013 were $27.1 million, compared to $20.4 million in the same quarter last year. Operating expenses in 2Q FY2013 include research and development expenses of $21.7 million, compared to $15.6 million in 2Q FY2012. This increase is primarily due to greater investment by the Company to aggressively advance its wholly owned product candidates, and includes increased costs for third-party production of antibody for use in clinical materials, increased clinical trial costs, and increased personnel expenses. Operating expenses also include general and administrative expenses of $5.5 million in 2Q FY2013, compared to $4.8 million in 2Q FY2012. This increase is primarily due to increased patent expenses and recruitment costs.
ImmunoGen had approximately $211.0 million in cash and cash equivalents as of December 31, 2012 and no debt. Cash used in operations was $42.7 million in the first six months of FY2013, compared with $24.0 million in the same period in FY2012. Capital expenditures were $2.0 million and $0.8 million for the first six months of FY2013 and FY2012, respectively.
ImmunoGen’s financial guidance remains unchanged from that issued in October 2012. ImmunoGen expects its net loss for its fiscal year ending June 30, 2013 to be between $70 million to $74 million, its net cash used in operations to be between $78 million to $82 million, and its capital expenditures to be between $4 million to $5 million. Cash and cash equivalents at June 30, 2013 are anticipated to be between $172 million to $176 million.
“The expected approval and launch of T-DM1 will be an important milestone in ImmunoGen’s history,” commented Gregory Perry, Executive Vice President and CFO. “As sales develop, this compound should provide significant royalties that will help fund the advancement of our wholly owned product candidates.”
http://finance.yahoo.com/news/immunogen-inc-reports-second-q…" target="_blank" rel="nofollow ugc noopener">
http://finance.yahoo.com/news/immunogen-inc-reports-second-q…
> Trastuzumab emtansine (T-DM1) marketing applications are under review in the US and Europe; US application has priority review status with a PDUFA date of February 26, 2013.
> In 2013, ImmunoGen expects to report clinical findings with its three lead wholly owned compounds and to advance its fourth compound, IMGN289, into clinical testing.
> Clinical findings also are expected to be reported for multiple partner compounds, with next compound on track to advance into pivotal testing in 2013.
WALTHAM, Mass.--(BUSINESS WIRE)--
ImmunoGen, Inc. (IMGN), a biotechnology company that develops anticancer products using its Targeted Antibody Payload (TAP) technology and antibody expertise, today reported financial results for the three-month period ended December 31, 2012 – the second quarter of the Company’s 2013 fiscal year – and provided an update on the Company.
“We expect 2013 to be a very important year for ImmunoGen,” commented Daniel Junius, President and CEO. “Roche is anticipating the approval of T-DM1 in the US early this year followed by approval in Europe later in 2013. We believe the launch of T-DM1 will be momentous for appropriate patients, their families, and their physicians. It will also mark the start of ImmunoGen earning what we believe will be a significant royalty stream.”
Mr. Junius continued, “We also believe that, in 2013, ImmunoGen’s progress on our proprietary pipeline will become more apparent. Over the course of the year, we expect to report clinical findings for our three lead TAP compounds and to advance our fourth, IMGN289, into clinical testing. We believe each of these compounds has the potential to be transformative to the treatment of its targeted cancer and we’ve designed development programs to advance each compound through proof of concept as promptly as possible.”
Product Pipeline Update
Lead compound with ImmunoGen’s TAP technology, T-DM1, is in global development by Roche:
The T-DM1 marketing applications for treatment of people with HER2+, unresectable locally advanced or metastatic breast cancer who have received prior treatment with Herceptin® (trastuzumab)and a taxane are under review in the US and Europe. Roche has noted that the US submission has been granted priority review status by the FDA with a PDUFA goal date of February 26, 2013. Roche also expects European approval of T-DM1 in 2013.
Roche expects to report data from its Ph III trial, MARIANNE, evaluating T-DM1 for first-line treatment of HER+ metastatic breast cancer in early 2014 and to apply for marketing approval for this use in 2014.
Roche intends to initiate registration trials in 2013 evaluating T-DM1 in three early stage HER2+ breast cancer settings – adjuvant, neoadjuvant, and residual invasive disease.
Roche is currently evaluating T-DM1 for the treatment of advanced HER2+ gastric cancer and expects to submit for approval for this use in 2015.
IMGN901, wholly owned ImmunoGen TAP compound for CD56+ cancers:
Small-cell lung cancer (SCLC) – The Company remains on track to have the data readout from the first stage of its Simon two-stage NORTH Phase II trial in the second half of 2013 – a readout designed to inform certain development decisions to be made by the Company. ImmunoGen expects to complete patient enrollment for the full trial in 2013, which would enable these findings to be reported in 2014. NORTH evaluates IMGN901 for the first-line treatment of SCLC used in combination with etoposide/carboplatin.
Multiple myeloma – IMGN901 showed activity in both Revlimid® (lenalidomide)-naïve and -refractory disease in a Phase I trial assessing it used in combination with Revlimid and dexamethasone presented at the ASH annual meeting in December.
IMGN853, ImmunoGen TAP compound for folate receptor α (FOL)-overexpressing tumors:
The Company expects the first clinical data with this TAP compound to be reported at a medical conference in mid-2013.
IMGN853 is a potential treatment for prevalent types of ovarian and non-small cell lung cancers, as well as for other FOL+ solid tumors.
IMGN529, ImmunoGen TAP compound for CD37+ hematological malignancies:
IMGN529 is in Phase I testing for the treatment of non-Hodgkin’s lymphoma, and the Company expects the first clinical data to be reported at a medical conference in late 2013.
IMGN529 employs ImmunoGen’s TAP technology with an antibody that also has anticancer properties.
IMGN289, ImmunoGen TAP compound for EGFR-overexpressing solid tumors:
IMGN289 is expected to be the next wholly owned ImmunoGen compound to advance into clinical testing. The Company expects to submit its IND in mid-2013 and to begin clinical testing in 2H 2013.
ImmunoGen expects to present data on the preclinical efficacy and tolerability of IMGN289 at a scientific meeting in 2Q 2013.
In addition to T-DM1, seven other compounds are in clinical testing through ImmunoGen’s partnerships:
Clinical data are expected to be reported with a number of these compounds in 2013.
A partner compound is projected to advance into pivotal testing in 2013.
Financial Results and Guidance
ImmunoGen reported a net loss of $24.4 million, or $0.29 per basic and diluted share, for the quarter ending December 31, 2012 (2Q FY2013), as compared to a net loss of $12.8 million, or $0.17 per basic and diluted share, for the same quarter of the last year (2Q FY2012).
Revenues for 2Q FY2013 were $2.6 million. This compares to $7.6 million for 2Q FY2012, which included $5.0 million in milestone payments not repeated in 2Q FY2013. Revenues in 2Q FY2013 comprise $2.0 million of research and development support fees, $0.4 million of license and milestone fees, and $0.1 million of clinical material reimbursement, compared to $0.9 million, $6.0 million, and $0.6 million, respectively, for the same quarter last year.
Operating expenses for 2Q FY2013 were $27.1 million, compared to $20.4 million in the same quarter last year. Operating expenses in 2Q FY2013 include research and development expenses of $21.7 million, compared to $15.6 million in 2Q FY2012. This increase is primarily due to greater investment by the Company to aggressively advance its wholly owned product candidates, and includes increased costs for third-party production of antibody for use in clinical materials, increased clinical trial costs, and increased personnel expenses. Operating expenses also include general and administrative expenses of $5.5 million in 2Q FY2013, compared to $4.8 million in 2Q FY2012. This increase is primarily due to increased patent expenses and recruitment costs.
ImmunoGen had approximately $211.0 million in cash and cash equivalents as of December 31, 2012 and no debt. Cash used in operations was $42.7 million in the first six months of FY2013, compared with $24.0 million in the same period in FY2012. Capital expenditures were $2.0 million and $0.8 million for the first six months of FY2013 and FY2012, respectively.
ImmunoGen’s financial guidance remains unchanged from that issued in October 2012. ImmunoGen expects its net loss for its fiscal year ending June 30, 2013 to be between $70 million to $74 million, its net cash used in operations to be between $78 million to $82 million, and its capital expenditures to be between $4 million to $5 million. Cash and cash equivalents at June 30, 2013 are anticipated to be between $172 million to $176 million.
“The expected approval and launch of T-DM1 will be an important milestone in ImmunoGen’s history,” commented Gregory Perry, Executive Vice President and CFO. “As sales develop, this compound should provide significant royalties that will help fund the advancement of our wholly owned product candidates.”
http://finance.yahoo.com/news/immunogen-inc-reports-second-q…" target="_blank" rel="nofollow ugc noopener">
http://finance.yahoo.com/news/immunogen-inc-reports-second-q…
Zitat von Joschka Schröder:Zitat von Joschka Schröder: aktueller Kurs 10,90 USD ... aus meiner Sicht eine ausgezeichnete Kaufgelegenheit!
Details folgen.
Das war am 31.10.2012. Seitdem ist der Kurs in nicht einmal drei Monaten um knapp 50 % auf aktuell 15,85 USD gestiegen. Mithin hat sich das Chance-Risiko-Verhältnis aktuell deutlich verschlechtert. Es dürfte daher zweckmäßig sein, nunmehr an Gewinn(ab)sicherung zu denken, auch wenn der Kurs im Vorfeld der erwarteten T-DM1-Zulassung noch in eine Übertreibungszone laufen könnte.
Die Kurskorrektur könnte sich nun schnell dem Ende nähern, zumal jetzt auch in Japan über die Roche-Tochter Chugai ein Zulassungsantrag für T-DM1 gestellt wird.
Werde meine T-DM1-Rechnungen entsprechend überarbeiten.
Antwort auf Beitrag Nr.: 44.075.651 von Joschka Schröder am 29.01.13 10:01:57Kurze Überschlagsrechnung:
In Japan ca. 60.000 Brustkrebs-Neuerkrankungen p.a., davon 20 % her2+, insgesamt also 12.000 her2+ Neuerkrankungen verglichen mit 72.000 her2+-Neuerkrankungen in Europa und 86.400 in den USA (vgl. frühere Berechnungen).
Das T-DM1-Umsatzpotential erhöht sich durch eine JPN-Zulassung mithin um ca. 7.6 %.
Auf die Royalties-Einnahmen werden sich die Japan-Umsätze wegen der Tantiemenstaffelung deutlich überproportional auswirken (JPN wird zu EUR addiert).
Per Saldo sollte eine Zulassung in JPN den T-DM1-Wert für IMGN um gut 10 % erhöhen.
Sobald sich die Information des Chugai-Zulassungsantrags am Markt ausbreitet (die deutschen Nachrichtendienste haben darüber, wenn ich recht sehe, noch nicht berichtet), sollte die IMGN-Aktie mit steigenden Kursen reagieren.
In Japan ca. 60.000 Brustkrebs-Neuerkrankungen p.a., davon 20 % her2+, insgesamt also 12.000 her2+ Neuerkrankungen verglichen mit 72.000 her2+-Neuerkrankungen in Europa und 86.400 in den USA (vgl. frühere Berechnungen).
Das T-DM1-Umsatzpotential erhöht sich durch eine JPN-Zulassung mithin um ca. 7.6 %.
Auf die Royalties-Einnahmen werden sich die Japan-Umsätze wegen der Tantiemenstaffelung deutlich überproportional auswirken (JPN wird zu EUR addiert).
Per Saldo sollte eine Zulassung in JPN den T-DM1-Wert für IMGN um gut 10 % erhöhen.
Sobald sich die Information des Chugai-Zulassungsantrags am Markt ausbreitet (die deutschen Nachrichtendienste haben darüber, wenn ich recht sehe, noch nicht berichtet), sollte die IMGN-Aktie mit steigenden Kursen reagieren.
ImmunoGen, Inc. Announces Webcast of Presentations at Upcoming Investor Conferences
ImmunoGen, Inc. (IMGN), a biotechnology company that develops anticancer therapeutics using its Targeted Antibody Payload (TAP) technology and antibody expertise, today announced that the following presentations by Company management at upcoming investor conferences will be webcast:
15th Annual BIO CEO & Investor Conference
9:00 am ET, February 12, 2013 in New York, NY
Presenter: Daniel Junius, President and CEO
Citi 2013 Global Healthcare Conference
11:05 am ET, February 25, 2013 in New York, NY
Presenter: Daniel Junius, President and CEO
2013 RBC Capital Markets Global Healthcare Conference
10:30 am ET, February 26, 2013 in New York, NY
Presenter: Daniel Junius, President and CEO
Cowen and Company 33rd Annual Health Care Conference
10:00 am ET, March 5, 2013 in Boston, MA
Presenter: Gregory Perry, Executive Vice President and CFO
The Company is also participating in the Credit Suisse One-on-One Healthcare Conference March 5-6, 2013 in London, England.
The webcasts will be accessible live through the “Investor Information” section of the Company’s website, www.immunogen.com; a replay will be available at the same location for approximately a week.
http://finance.yahoo.com/news/immunogen-inc-announces-webcas…" target="_blank" rel="nofollow ugc noopener">
http://finance.yahoo.com/news/immunogen-inc-announces-webcas…
ImmunoGen, Inc. (IMGN), a biotechnology company that develops anticancer therapeutics using its Targeted Antibody Payload (TAP) technology and antibody expertise, today announced that the following presentations by Company management at upcoming investor conferences will be webcast:
15th Annual BIO CEO & Investor Conference
9:00 am ET, February 12, 2013 in New York, NY
Presenter: Daniel Junius, President and CEO
Citi 2013 Global Healthcare Conference
11:05 am ET, February 25, 2013 in New York, NY
Presenter: Daniel Junius, President and CEO
2013 RBC Capital Markets Global Healthcare Conference
10:30 am ET, February 26, 2013 in New York, NY
Presenter: Daniel Junius, President and CEO
Cowen and Company 33rd Annual Health Care Conference
10:00 am ET, March 5, 2013 in Boston, MA
Presenter: Gregory Perry, Executive Vice President and CFO
The Company is also participating in the Credit Suisse One-on-One Healthcare Conference March 5-6, 2013 in London, England.
The webcasts will be accessible live through the “Investor Information” section of the Company’s website, www.immunogen.com; a replay will be available at the same location for approximately a week.
http://finance.yahoo.com/news/immunogen-inc-announces-webcas…" target="_blank" rel="nofollow ugc noopener">
http://finance.yahoo.com/news/immunogen-inc-announces-webcas…
jetzt lasst das endlich zu ... hopp fda!
Antwort auf Beitrag Nr.: 44.112.043 von Ville7 am 06.02.13 22:51:15PDUFA date 26.02.13
LONDON, February 7, 2013
A new report by Visiongain shows that next-generation technologies will become a major driver for the antibody therapeutics market .
Worth just under $170m in 2012, the new wave of products will represent over 10% of all antibody therapeutics revenues by the end of 2023.
Antibody-drug conjugates (ADCs) are leading the way, but Fc-engineered, bispecific, and biosimilar antibodies, as well as next-generation fragments and antibody-like proteins will also show high revenue growth to 2023, the study predicts.
That revenue forecast and others appear in Next-Generation Antibody Therapeutics Market 2013-2023 published in February 2013.
http://www.visiongain.com/Report/978/Next-Generation-Antibod…
A new report by Visiongain shows that next-generation technologies will become a major driver for the antibody therapeutics market .
Worth just under $170m in 2012, the new wave of products will represent over 10% of all antibody therapeutics revenues by the end of 2023.
Antibody-drug conjugates (ADCs) are leading the way, but Fc-engineered, bispecific, and biosimilar antibodies, as well as next-generation fragments and antibody-like proteins will also show high revenue growth to 2023, the study predicts.
That revenue forecast and others appear in Next-Generation Antibody Therapeutics Market 2013-2023 published in February 2013.
http://www.visiongain.com/Report/978/Next-Generation-Antibod…
Auszüge aus:
New Technologies to Capture Over 10% of the Antibody Therapeutics Market by 2023´ Shows Visiongain Report
"With the EMA guidance in place, biosimilar antibodies will soon light a fire under the sector, increasing competition and forcing innovator companies to start differentiating their antibody products.
The next-generation platforms offer a kind of toolkit for doing differentiation and lifecycle management.
You can see Roche getting in on the ground floor there with what they´re doing with obinituzumab and T-DM1, using engineering and ADC technologies (Antibody-drug conjugates) to extend their rituximab and trastuzumab franchises.
T-DM1 is potentially a major watershed for the next-generation field, because it´s the first ADC against a solid tumour target.
http://www.wallstreet-online.de/nachricht/5093319-new-techno…" target="_blank" rel="nofollow ugc noopener">http://www.wallstreet-online.de/nachricht/5093319-new-techno…
New Technologies to Capture Over 10% of the Antibody Therapeutics Market by 2023´ Shows Visiongain Report
"With the EMA guidance in place, biosimilar antibodies will soon light a fire under the sector, increasing competition and forcing innovator companies to start differentiating their antibody products.
The next-generation platforms offer a kind of toolkit for doing differentiation and lifecycle management.
You can see Roche getting in on the ground floor there with what they´re doing with obinituzumab and T-DM1, using engineering and ADC technologies (Antibody-drug conjugates) to extend their rituximab and trastuzumab franchises.
T-DM1 is potentially a major watershed for the next-generation field, because it´s the first ADC against a solid tumour target.
http://www.wallstreet-online.de/nachricht/5093319-new-techno…" target="_blank" rel="nofollow ugc noopener">http://www.wallstreet-online.de/nachricht/5093319-new-techno…
Liebe Fachleute,
nach längerer Zeit des stillen Mitlesens habe ich mich heute nun auch im Board angemeldet, um die folgende Frage (die naiv sein mag) zu stellen. Ist es denkbar, daß in Falle eines positiven Approvals von T-DM1 durch die FDA Roche an einer vollständigen Übernahme vom IMGN interessiert sein könnte?
These: Mit der Zulassung von T-DM1 wäre wohl der ultimative proof of concept für diese neue Technologie gelungen, und Roche will sicherstellen, daß dieses Potential nicht für weitere Antikörperentwicklungen durch die Konkurrenz genutzt wird.
Antithese: IMGN kooperiert bereits heute mit verschiedenen anderen Pharma-Firmen, was einer Übernahme von IMGN durch Roche formal/(faktisch imm Wege stehen würde.
Ich würde mich über zusätzliche Thesen/Antithesen seitens der hier vertretenen Fachleute und insbesondere natürlich die daraus zu ziehenden Synthese freuen.
Besten Dank!
nach längerer Zeit des stillen Mitlesens habe ich mich heute nun auch im Board angemeldet, um die folgende Frage (die naiv sein mag) zu stellen. Ist es denkbar, daß in Falle eines positiven Approvals von T-DM1 durch die FDA Roche an einer vollständigen Übernahme vom IMGN interessiert sein könnte?
These: Mit der Zulassung von T-DM1 wäre wohl der ultimative proof of concept für diese neue Technologie gelungen, und Roche will sicherstellen, daß dieses Potential nicht für weitere Antikörperentwicklungen durch die Konkurrenz genutzt wird.
Antithese: IMGN kooperiert bereits heute mit verschiedenen anderen Pharma-Firmen, was einer Übernahme von IMGN durch Roche formal/(faktisch imm Wege stehen würde.
Ich würde mich über zusätzliche Thesen/Antithesen seitens der hier vertretenen Fachleute und insbesondere natürlich die daraus zu ziehenden Synthese freuen.
Besten Dank!
Antwort auf Beitrag Nr.: 44.137.953 von Emil_Punter am 13.02.13 19:53:05Was mich allerdings noch mehr irritiert ist, dass Roche auch mit Halozyme eine Herceptin-Entwicklung mit deren Technologie und z.T. denselben Indikationen am laufen hat.
Antwort auf Beitrag Nr.: 44.137.953 von Emil_Punter am 13.02.13 19:53:05Hallo Emil,
die Frage ist nicht naiv, aber leider ist sie auch nicht wirklich befriedigend zu beantworten.
Meine ganz subjektive Meinung:
Grundsätzlich sollte man sich von dem Gedanken verabschieden, dass ein Pharma einen kleinen Biotech-Partner nur deshalb aufkauft, um sich die Royalties zu sparen (im MorphoSys-Thread ist – mit Blick auf Novartis – immer wieder so argumentiert worden). Meiner Meinung nach funktioniert Wirtschaft nicht so simpel.
In der Praxis hat es natürlich immer wieder Übernahmen von kleinen Biotechs durch ihre Pharma-Partner gegeben – als Beispiele fallen mir gerade Glaxo mit HGSI oder Bristol mit Medarex ein.
Aber da kann es nicht nur um Royalties gehen, da muss schon ein strategisches Interesse vorhanden sein. Bspw. war bei Bristol Medarex an Yervoy mit einem erheblichen Anteil beteiligt geblieben (30%?) und hatte auch sonst viel zu bieten.
Ich sehe im Verhältnis Roche / IMGN kein so evidentes strategisches Interesse bei Roche, wie das Bristol bei Medarex hatte. Zum einen sind die Rechte von IMGN an T-DM1 mit im Schnitt etwas über 4% sehr bescheiden, zum anderen braucht Roche IMGN sonst eigentlich nicht wirklich. Für die Entwicklung von Antikörpern braucht Roche überhaupt niemanden auf der Welt und für ADCs haben sie eine intensive Partnerschaft mit SGEN – und wahrscheinlich laufen ein Dutzend Sachen, von denen wir alle noch nie was gehört haben.
Trotzdem ist eine Übernahme von IMGN durch Roche oder einen anderen Pharma natürlich grundsätzlich möglich. Im Moment halte ich das aber für eher unwahrscheinlich. Die Wahrscheinlichkeit für eine Übernahme steigt, falls sich in der Eigenpipe von IMGN beträchtlicher Wert zeigen sollte.
Ohne einen solchen Werttreiber in der Eigenpipe ist IMGN derzeit aber ganz gut bezahlt und wäre mit der üblichen Übernahmeprämie von 50% (+/- x) meines Erachtens sehr, sehr teuer bezahlt. Ich wüsste nicht, wer es so nötig haben könnte…
Grüße
die Frage ist nicht naiv, aber leider ist sie auch nicht wirklich befriedigend zu beantworten.
Meine ganz subjektive Meinung:
Grundsätzlich sollte man sich von dem Gedanken verabschieden, dass ein Pharma einen kleinen Biotech-Partner nur deshalb aufkauft, um sich die Royalties zu sparen (im MorphoSys-Thread ist – mit Blick auf Novartis – immer wieder so argumentiert worden). Meiner Meinung nach funktioniert Wirtschaft nicht so simpel.
In der Praxis hat es natürlich immer wieder Übernahmen von kleinen Biotechs durch ihre Pharma-Partner gegeben – als Beispiele fallen mir gerade Glaxo mit HGSI oder Bristol mit Medarex ein.
Aber da kann es nicht nur um Royalties gehen, da muss schon ein strategisches Interesse vorhanden sein. Bspw. war bei Bristol Medarex an Yervoy mit einem erheblichen Anteil beteiligt geblieben (30%?) und hatte auch sonst viel zu bieten.
Ich sehe im Verhältnis Roche / IMGN kein so evidentes strategisches Interesse bei Roche, wie das Bristol bei Medarex hatte. Zum einen sind die Rechte von IMGN an T-DM1 mit im Schnitt etwas über 4% sehr bescheiden, zum anderen braucht Roche IMGN sonst eigentlich nicht wirklich. Für die Entwicklung von Antikörpern braucht Roche überhaupt niemanden auf der Welt und für ADCs haben sie eine intensive Partnerschaft mit SGEN – und wahrscheinlich laufen ein Dutzend Sachen, von denen wir alle noch nie was gehört haben.
Trotzdem ist eine Übernahme von IMGN durch Roche oder einen anderen Pharma natürlich grundsätzlich möglich. Im Moment halte ich das aber für eher unwahrscheinlich. Die Wahrscheinlichkeit für eine Übernahme steigt, falls sich in der Eigenpipe von IMGN beträchtlicher Wert zeigen sollte.
Ohne einen solchen Werttreiber in der Eigenpipe ist IMGN derzeit aber ganz gut bezahlt und wäre mit der üblichen Übernahmeprämie von 50% (+/- x) meines Erachtens sehr, sehr teuer bezahlt. Ich wüsste nicht, wer es so nötig haben könnte…
Grüße
Antwort auf Beitrag Nr.: 44.137.953 von Emil_Punter am 13.02.13 19:53:05Hör auf SLGramann, das ist einer der vernüftigsten User im WO-Universum.
Übernahme durch Roche würde ich ausschließen, Novartis wäre ein geeigneterer Partner, nur müßte die Kooperation zwischen NOV und IMGN zunächst Früchte tragen, die Appetit auf mehr (d.h. Einverleiben der TAP-Technik) machen.
Derzeit erscheint IMGN in etwa fair bewertet.
Übernahme durch Roche würde ich ausschließen, Novartis wäre ein geeigneterer Partner, nur müßte die Kooperation zwischen NOV und IMGN zunächst Früchte tragen, die Appetit auf mehr (d.h. Einverleiben der TAP-Technik) machen.
Derzeit erscheint IMGN in etwa fair bewertet.
Herzlichen Dank Euch beiden für die schnelle und klare Antwort. Natürlich werde ich das beherzigen und auf Euch hören. Dann kann ich jetzt weiter beruhigt Calls auf meinen Bestand schreiben.
Zulassung T-DM1 dürfte nur noch Tage entfernt sein. Hat jemand das genaue PDUFA action date?
Antwort auf Beitrag Nr.: 44.174.788 von Algol am 22.02.13 15:46:55Nochmal:
http://boardvote.com/symbol/IMGN/communique/230456
http://boardvote.com/symbol/IMGN/communique/230456
... und startet in US mit -3 %
Antwort auf Beitrag Nr.: 44.175.074 von Algol am 22.02.13 16:41:40Kadcyla - wie spricht man das aus ?? 

Antwort auf Beitrag Nr.: 44.175.091 von me_2 am 22.02.13 16:44:37Mir erschließt sich oft noch nicht Mal, wie englische Alltagswörter ausgesprochen werden 

Antwort auf Beitrag Nr.: 44.175.103 von Algol am 22.02.13 16:46:53ist ja kein Engisch, sd. mehr so ein Kunstwort mit scientistischem Anklang. Aber häßlich. Die Apotheken dürfen halt nicht telefonisch bestellen ...
http://www.fiercebiotech.com/story/rochegenentechs-breakthro…
"The drug will cost $9,800 a month,or about $94,000 for a 9.5-month course of therapy"
http://www.spiegel.de/spiegel/print/d-79805411.html
"40.000 Euro" Jahreskosten sind ca. 53.000 Dollar Jahrestherapiekosten für Herceptin.
Frdl Grüsse,
StefanR
"
"The drug will cost $9,800 a month,or about $94,000 for a 9.5-month course of therapy"
http://www.spiegel.de/spiegel/print/d-79805411.html
"40.000 Euro" Jahreskosten sind ca. 53.000 Dollar Jahrestherapiekosten für Herceptin.
Frdl Grüsse,
StefanR
"
Antwort auf Beitrag Nr.: 44.175.074 von Algol am 22.02.13 16:41:40"The biggest news in today's press release, given that approval was expected, was that the label allows for use in front-line HER-2 positive metastatic breast cancer," says Cowen's Simos Simeonidis in a note this morning. "This was not a major surprise, since EMILIA included about 12% front-line mBC patients (about 60 1st-line mBC patients in the T-DM1 arm of the EMILIA trial), but it was definitely not a given."
Antwort auf Beitrag Nr.: 44.179.978 von SLGramann am 24.02.13 19:06:59Brauchen wir jetzt eigentlich den MARIANNE-Trial noch? Ich meine, es ist klar, dass der zu Ende geführt wird (Rekrutierung ist eh durch), aber aus regulatorischer Sicht - noch nötig oder "hat sich erledigt"?
http://www.fiercepharma.com/story/nod-roches-kadcyla-should-…
Below is a statement from Genentech spokesman Ed Lang:
“
The monthly cost of Kadcyla in the United States is $9,800. The estimated cost of a course of Kadcyla is approximately $94,000. This is based on people taking Kadcyla for 9.6 months.
When pricing Kadcyla, we considered a variety of factors including that cost of the combination of Tykerb and Xeloda (approximately $10,460 per month) which is the current standard treatment in this line of therapy and the comparator in the pivotal EMILIA study.
In the EMILIA study, people receiving Kadcyla survived a median of 5.8 months longer compared to those taking Tykerb and Xeloda. Fewer people who received Kadcyla experienced Grade 3 or higher (severe) AEs than those who received Tykerb and Xeloda (43.1% vs 59.2%). No new safety signals were observed and AEs were consistent with those seen in previous studies.
Güsse, StefanR
Below is a statement from Genentech spokesman Ed Lang:
“
The monthly cost of Kadcyla in the United States is $9,800. The estimated cost of a course of Kadcyla is approximately $94,000. This is based on people taking Kadcyla for 9.6 months.
When pricing Kadcyla, we considered a variety of factors including that cost of the combination of Tykerb and Xeloda (approximately $10,460 per month) which is the current standard treatment in this line of therapy and the comparator in the pivotal EMILIA study.
In the EMILIA study, people receiving Kadcyla survived a median of 5.8 months longer compared to those taking Tykerb and Xeloda. Fewer people who received Kadcyla experienced Grade 3 or higher (severe) AEs than those who received Tykerb and Xeloda (43.1% vs 59.2%). No new safety signals were observed and AEs were consistent with those seen in previous studies.
Güsse, StefanR
Schöner Kursverlauf bei IMGN. Die 16 USD (Kurs der letzten KP-Erhöhung und Ziel einiger Analysten, daher ein vermuteter starker Widerstand) sind leichter als erwartet genommen worden. Aktuell 16,20 USD.
Unter Berücksichtigung der angestrebten Japanzulassung notiert die Aktie derzeit in etwa mit dem doppelten jährlichen T-DM1-(Peak-)Vorsteuergewinn unter Berücksichtigung aller Mamma-CA-Indikationen. Berücksichtigt man nur die metastasierende Form, entspricht der Unternehmenswert (EV) etwa dem erwarteten elffachen T-DM1-(Peak-)Vorsteuergewinn.
Unter Berücksichtigung der angestrebten Japanzulassung notiert die Aktie derzeit in etwa mit dem doppelten jährlichen T-DM1-(Peak-)Vorsteuergewinn unter Berücksichtigung aller Mamma-CA-Indikationen. Berücksichtigt man nur die metastasierende Form, entspricht der Unternehmenswert (EV) etwa dem erwarteten elffachen T-DM1-(Peak-)Vorsteuergewinn.
Ungemach u.a. für Hersteller teurer Onkologika könnte aus den USA kommen (s. Beitrag Nr. 6485 im Biotest-Thread).
This Biotech Stock Looks Like a Good Investment
By Terry Chrisomalis - April 6, 2013
The biotech sector is heating up with new technology platforms that are showing big promise. One such big promising technology comes from a company known as ImmunoGen (NASDAQ: IMGN). ImmunoGen uses a system called the "TAP" technology, also known as Targeted Antibody Payload.
Currently, antibodies are able to bind to cancer cells but have no effect on killing the target cancer cells. This is where ImmunoGen's technology comes into play as it allows killing cells to bind to the antibodies.
This allows the cells to be known as payloads, or a way for the antibodies to specifically target the cancerous cells. Without the engineered payload, the antibodies can't fight cancer. This type of technology is unique and has shown great promise so far. The pipeline of ImmunoGen is extensive, and the company has partnered its technology platform with many other biotech companies.
Targeted cancer therapies
As mentioned before, the pipeline is deep, and thus far the company only has one approved drug from the FDA. This approved drug from the FDA is known as Kadcyla. This approved drug is used for the treatment for patients with HER-2 metastatic breast cancer. Patients would have had to previously use Herceptin and taxane chemotherapy, prior to treatment with Kadycla.
Kadcyla is an HER2-binding antibody, known as Trastuzumab. This antibody was created by Genetech, wich is a division of Roche. It uses ImmunoGens' DM1 cancer killing agent to target and kill the cancer cells with greater efficacy.
The market opportunity for ImmunoGen is huge with its breast cancer drug Kadcyla. ImmunoGen's partner, Genetech, was estimated to make $3.4 billion across markets in the United States, Europe, and other regions from a breast cancer drug. It was wise for ImmunoGen to partner with Roche's Genetech, as it is still expected to be the top selling HER-2 breast cancer drug maker until 2021.
Even with only one approved drug, ImmunoGen is great for long-term investors to take a look at. It didn't seem to have any trouble partnering with Genetech. It also trades at a relatively low valuation compared to other biotech cancer stocks, like Seattle Genetics (NASDAQ: SGEN).
Cancer therapies advancing
Another company with antibody targeting platform for cancer is Seattle Genetics. The difference, though, is that it derives its technology from monoclonal antibodies. Seattle Genetics also engineers the antibody to be able to target and kill cancer cells like ImmunoGen's technology does. But it engineers antibodies, and combines them with cell killing effects similar to that of chemotherapy.
Seattle Genetics has a big pipeline of cancer drugs, but the majority are all either pre-clinical or in the phase one stage of testing. Some of these candidates include: Prostate cancer, breast cancer, renal cell carcinoma, and several others. The good part is that it is currently generating revenue with one already FDA approved drug. That drug is Adcetris.
Adcetris treats a cancer known as Hodgkins Lymphoma. This disease is a cancer of lymph tissue that is often found in the: Spleen, Lymph nodes, Liver, bone marrow, and other sites. The company received about $132 million in sales in the first year of marketing, and expects the same guidance for 2013.
Buyout potential
As mentioned above Roche's Genetech has partnered with ImmunoGen on the drug Kadcyla. They also both incorporate the same type of technology.They both engineer the antibody that goes out and kills the cancerous cells. I feel that Roche may seek to buyout ImmunoGen as it progresses more through the clinical trials.
Another possible buyout could come from Merck (NYSE: MRK), because the company is starting to begin a lot of cancer drug programs. I think that it could add ImmunoGen to its portfolio to advance itself greatly in the cancer drug space. Merck has about $17 billion cash on hand, which would be enough if it wants to acquire ImmunoGen.
Final thought
ImmunoGen's technology seems to work, and the fact that it has already partnered with Genetech shows how much value it truly has. It is currently trading at around $16 per share and holds much value for the future -- whether it is the advancement of all of its drugs in the pipeline, or a possible buyout by Merck or any other big pharma. It can also unlock more value by partnering its technology with other antibody platforms.
Its breast cancer drug could be earning billions of dollars in the coming years, as we have seen Genetech produce $3.4 billion. There is no doubt that ImmunoGen has the right platform to bring out other drug candidates in the future. The fact that it has partnered with so many companies, such as Amgen, Bayer, and Sanofi, makes it valuable.
I believe that it is a long-term investment, and that it is the right time for ImmunoGen to shine.
http://beta.fool.com/rennrunn/2013/04/06/is-it-the-right-tim…
By Terry Chrisomalis - April 6, 2013
The biotech sector is heating up with new technology platforms that are showing big promise. One such big promising technology comes from a company known as ImmunoGen (NASDAQ: IMGN). ImmunoGen uses a system called the "TAP" technology, also known as Targeted Antibody Payload.
Currently, antibodies are able to bind to cancer cells but have no effect on killing the target cancer cells. This is where ImmunoGen's technology comes into play as it allows killing cells to bind to the antibodies.
This allows the cells to be known as payloads, or a way for the antibodies to specifically target the cancerous cells. Without the engineered payload, the antibodies can't fight cancer. This type of technology is unique and has shown great promise so far. The pipeline of ImmunoGen is extensive, and the company has partnered its technology platform with many other biotech companies.
Targeted cancer therapies
As mentioned before, the pipeline is deep, and thus far the company only has one approved drug from the FDA. This approved drug from the FDA is known as Kadcyla. This approved drug is used for the treatment for patients with HER-2 metastatic breast cancer. Patients would have had to previously use Herceptin and taxane chemotherapy, prior to treatment with Kadycla.
Kadcyla is an HER2-binding antibody, known as Trastuzumab. This antibody was created by Genetech, wich is a division of Roche. It uses ImmunoGens' DM1 cancer killing agent to target and kill the cancer cells with greater efficacy.
The market opportunity for ImmunoGen is huge with its breast cancer drug Kadcyla. ImmunoGen's partner, Genetech, was estimated to make $3.4 billion across markets in the United States, Europe, and other regions from a breast cancer drug. It was wise for ImmunoGen to partner with Roche's Genetech, as it is still expected to be the top selling HER-2 breast cancer drug maker until 2021.
Even with only one approved drug, ImmunoGen is great for long-term investors to take a look at. It didn't seem to have any trouble partnering with Genetech. It also trades at a relatively low valuation compared to other biotech cancer stocks, like Seattle Genetics (NASDAQ: SGEN).
Cancer therapies advancing
Another company with antibody targeting platform for cancer is Seattle Genetics. The difference, though, is that it derives its technology from monoclonal antibodies. Seattle Genetics also engineers the antibody to be able to target and kill cancer cells like ImmunoGen's technology does. But it engineers antibodies, and combines them with cell killing effects similar to that of chemotherapy.
Seattle Genetics has a big pipeline of cancer drugs, but the majority are all either pre-clinical or in the phase one stage of testing. Some of these candidates include: Prostate cancer, breast cancer, renal cell carcinoma, and several others. The good part is that it is currently generating revenue with one already FDA approved drug. That drug is Adcetris.
Adcetris treats a cancer known as Hodgkins Lymphoma. This disease is a cancer of lymph tissue that is often found in the: Spleen, Lymph nodes, Liver, bone marrow, and other sites. The company received about $132 million in sales in the first year of marketing, and expects the same guidance for 2013.
Buyout potential
As mentioned above Roche's Genetech has partnered with ImmunoGen on the drug Kadcyla. They also both incorporate the same type of technology.They both engineer the antibody that goes out and kills the cancerous cells. I feel that Roche may seek to buyout ImmunoGen as it progresses more through the clinical trials.
Another possible buyout could come from Merck (NYSE: MRK), because the company is starting to begin a lot of cancer drug programs. I think that it could add ImmunoGen to its portfolio to advance itself greatly in the cancer drug space. Merck has about $17 billion cash on hand, which would be enough if it wants to acquire ImmunoGen.
Final thought
ImmunoGen's technology seems to work, and the fact that it has already partnered with Genetech shows how much value it truly has. It is currently trading at around $16 per share and holds much value for the future -- whether it is the advancement of all of its drugs in the pipeline, or a possible buyout by Merck or any other big pharma. It can also unlock more value by partnering its technology with other antibody platforms.
Its breast cancer drug could be earning billions of dollars in the coming years, as we have seen Genetech produce $3.4 billion. There is no doubt that ImmunoGen has the right platform to bring out other drug candidates in the future. The fact that it has partnered with so many companies, such as Amgen, Bayer, and Sanofi, makes it valuable.
I believe that it is a long-term investment, and that it is the right time for ImmunoGen to shine.
http://beta.fool.com/rennrunn/2013/04/06/is-it-the-right-tim…

 ImmunoGen, Inc. Announces Preclinical Findings with its IMGN289 Product Candidate for the Treatment of EGFR-Overexpressing Cancers
ImmunoGen, Inc. Announces Preclinical Findings with its IMGN289 Product Candidate for the Treatment of EGFR-Overexpressing Cancers

>Novel antibody-drug conjugate (ADC) can kill Epidermal Growth Factor Receptor (EGFR)-overexpressing cancer cells via two mechanisms – EGFR-inhibition and direct cell-killing.
>In preclinical testing, IMGN289 was highly active against EGFR-overexpressing cancer cells, including those not dependent on EGFR signaling and those resistant to tyrosine kinase inhibitors (TKIs).
>ImmunoGen is on track to submit the IND for IMGN289 in mid-2013.
http://finance.yahoo.com/news/immunogen-inc-announces-precli…" target="_blank" rel="nofollow ugc noopener">
http://finance.yahoo.com/news/immunogen-inc-announces-precli…
Antwort auf Beitrag Nr.: 44.406.089 von bernie55 am 10.04.13 21:16:38IMGN heute nach der Analysten- und Investorenkonferenz mit Kurseinbruch um 10 %.
Habe einen Blick in die Präsentation geworfen. Etwas besonders auffälliges kann ich eigentlich nicht erkennen ... mit einer Ausnahme: Das Nebenwirkungsprofil von IMGN901 sieht nicht schön aus, z.B. bei knapp 50 % aller Patienten Neuropathien, dazu noch ne Menge anderer Nebenwirkungen. Habe aber keine Ahnung, ob dies der Grund für das Kursdesaster ist. Hat sich jemand die Diskussion angehört?
Habe einen Blick in die Präsentation geworfen. Etwas besonders auffälliges kann ich eigentlich nicht erkennen ... mit einer Ausnahme: Das Nebenwirkungsprofil von IMGN901 sieht nicht schön aus, z.B. bei knapp 50 % aller Patienten Neuropathien, dazu noch ne Menge anderer Nebenwirkungen. Habe aber keine Ahnung, ob dies der Grund für das Kursdesaster ist. Hat sich jemand die Diskussion angehört?
Moin Joschka Schröder,

hässlicher Kurseinbruch, ja.
Hat m.E. verschiedene Gründe:
-Gewinnmitnahmen: Der starke Anstieg der letzten Tage (am 8.4. war der Kurs auch bei 16$)
-Charttechnik: Das Hoch vom letzten Jahr (18,10$) wurde gestern angesteuert und wirkt als Widerstand)
das Ganze ausgelöst durch
-Programmverzögerung: IMGN901 (NORTH)verzögert sich mindestens 6 Monate wegen Anpassung der Startdosis.
(habe ich aus dem Yahoo-Messageboard von IMGN)
"From Presentation:
IMGN901 front-line SCLC Ph II trial (NORTH)
Adjusting starting dose – pushes back earliest possible
go/no go date by 6 months"
schreibt dort einer, der den cc verfolgt hat. Hängt ja wahrscheinlich sogar mit dem von dir erwähnten ungünstigen Nebenwirkungsprofil zusammen.
Ein derartiger Kuseinbruch ist eigentlich dadurch nicht gerechtferigt (sind ja ca. 140 Mio. Marktkapitalisierung), aber nach dem ebenso starken Anstieg vorher in wenigen Tagen bin ich mit Nachkäufen noch zurückhaltend. Kurs erholt sich ja auch nicht.
Gruß q.

hässlicher Kurseinbruch, ja.
Hat m.E. verschiedene Gründe:
-Gewinnmitnahmen: Der starke Anstieg der letzten Tage (am 8.4. war der Kurs auch bei 16$)
-Charttechnik: Das Hoch vom letzten Jahr (18,10$) wurde gestern angesteuert und wirkt als Widerstand)
das Ganze ausgelöst durch
-Programmverzögerung: IMGN901 (NORTH)verzögert sich mindestens 6 Monate wegen Anpassung der Startdosis.
(habe ich aus dem Yahoo-Messageboard von IMGN)
"From Presentation:
IMGN901 front-line SCLC Ph II trial (NORTH)
Adjusting starting dose – pushes back earliest possible
go/no go date by 6 months"
schreibt dort einer, der den cc verfolgt hat. Hängt ja wahrscheinlich sogar mit dem von dir erwähnten ungünstigen Nebenwirkungsprofil zusammen.
Ein derartiger Kuseinbruch ist eigentlich dadurch nicht gerechtferigt (sind ja ca. 140 Mio. Marktkapitalisierung), aber nach dem ebenso starken Anstieg vorher in wenigen Tagen bin ich mit Nachkäufen noch zurückhaltend. Kurs erholt sich ja auch nicht.
Gruß q.
Antwort auf Beitrag Nr.: 44.422.219 von quepos am 12.04.13 21:31:24Ich werde mir die Aufzeichnung des IMGN-CC am Wochenende anhören.
Im gestrigen Roche-Q1-CC gabe es interessante Aussagen zur Preispolitik: Perjeta wird in den USA etwa 15 % billiger angeboten als in Europa (laut O´Day sogar 20 %), die Kombi aus Perjeta und Herceptin sogar 30 % bis 35 % günstiger.
Dies läßt ahnen, dass auch der Kadcyla-Preis in Europa deutlich unter dem US-Preis liegen wird. Ich werde mein Modell entsprechend überarbeiten müssen.
Komisch, dass diese Thematik nirgendwo diskutiert worden ist. Im IMGN-Kurs hat sich dies gestern auch nicht niedergeschlagen. Muss mal am Montag schauen, ob das Thema zwischenzeitlich in US-Analystenkommentaren - oder evt. sogar während der heutigen IMGN-Konferenz - thematisiert worden ist.
Im gestrigen Roche-Q1-CC gabe es interessante Aussagen zur Preispolitik: Perjeta wird in den USA etwa 15 % billiger angeboten als in Europa (laut O´Day sogar 20 %), die Kombi aus Perjeta und Herceptin sogar 30 % bis 35 % günstiger.
Dies läßt ahnen, dass auch der Kadcyla-Preis in Europa deutlich unter dem US-Preis liegen wird. Ich werde mein Modell entsprechend überarbeiten müssen.
Komisch, dass diese Thematik nirgendwo diskutiert worden ist. Im IMGN-Kurs hat sich dies gestern auch nicht niedergeschlagen. Muss mal am Montag schauen, ob das Thema zwischenzeitlich in US-Analystenkommentaren - oder evt. sogar während der heutigen IMGN-Konferenz - thematisiert worden ist.
Möglicherweise war auch kursbelastend, dass weitere Kapitalmaßnahmen in Aussicht gestellt worden sind.
In der Tat NW-Problematik bei IMGN901. Nunmehr maximale Dosis 90 mg/m3, bei dieser Dosis sind bislang jedoch erst insgesamt sechs Patienten untersucht worden ... insoweit bleibt abzuwarten, ob die Dosis noch weiter angepaßt werden muss ... und wie die Wirkung bei niedriger Dosierung ausschaut.
Antwort auf Beitrag Nr.: 44.429.395 von Joschka Schröder am 14.04.13 22:07:54... muss natürlich heißen: 90 mg/m2
Habe am WE die gesamte Konferenz aufgearbeitet. Bzgl. IMGN901 ist Immunogen weit zurückgeworfen worden. Hinsichtlich der Nebenwirkungen (Neuropathie) besteht ein hohes Maß an Unsicherheit, die Möglichkeit, dass die Entwicklung letztlich abgebrochen werden muss, ist deutlich gestiegen.
Im übrigen muss man möglicherweise mit weiteren Kapitalerhöhungen rechnen. Auch ein Verkauf der Tantiemenrechte für Kadcyla (T-DM1) wird angedacht, steht aktuell jedoch nicht auf der Tagesordnung.
Es zeigt sich einmal mehr, dass die Entwicklung von Biotech-Unternehmen mit interessanter Technik sehr unübersichtlich und für Investoren undankbar wird, wenn die betreffenden Unternehmen nicht nur ihre Plattform vermarkten (und über Kooperationen Meilensteinzahlungen und Tantiemen kassieren), sondern selber groß in die Medikamentenentwicklung einsteigen.
Das ganze kennt man ja bereits aus Zeiten des Goldrausches: Unternehmen, die Goldgräber mit dem benötigten Werkzeug ausrüsten, boten immer eine lurative Investmentmöglichkeit. Sobald sich die Ausrüster jedoch selber auf Goldsuche begaben, verschlechterte sich das Chance-Risiko-Verhältnis deutlich.
Habe am WE die gesamte Konferenz aufgearbeitet. Bzgl. IMGN901 ist Immunogen weit zurückgeworfen worden. Hinsichtlich der Nebenwirkungen (Neuropathie) besteht ein hohes Maß an Unsicherheit, die Möglichkeit, dass die Entwicklung letztlich abgebrochen werden muss, ist deutlich gestiegen.
Im übrigen muss man möglicherweise mit weiteren Kapitalerhöhungen rechnen. Auch ein Verkauf der Tantiemenrechte für Kadcyla (T-DM1) wird angedacht, steht aktuell jedoch nicht auf der Tagesordnung.
Es zeigt sich einmal mehr, dass die Entwicklung von Biotech-Unternehmen mit interessanter Technik sehr unübersichtlich und für Investoren undankbar wird, wenn die betreffenden Unternehmen nicht nur ihre Plattform vermarkten (und über Kooperationen Meilensteinzahlungen und Tantiemen kassieren), sondern selber groß in die Medikamentenentwicklung einsteigen.
Das ganze kennt man ja bereits aus Zeiten des Goldrausches: Unternehmen, die Goldgräber mit dem benötigten Werkzeug ausrüsten, boten immer eine lurative Investmentmöglichkeit. Sobald sich die Ausrüster jedoch selber auf Goldsuche begaben, verschlechterte sich das Chance-Risiko-Verhältnis deutlich.
Noch zwei äußerst positive Aspekte:
1. Laut CC vom 26.4. werden bis zum POC aller vier unternehmenseigenen Präparate keine keine KP-Erhöhungen erforderlich sein.
2. Ich habe mir am WE noch einmal in Ruhe alle präklinischen Daten zum IMGN289 angesehen. Wirklich eindrucksvoll. Könnte so einschlagen wie T-DM1. Auf die klinischen Daten (erste Daten 2014) bin ich wirklich gespannt.
1. Laut CC vom 26.4. werden bis zum POC aller vier unternehmenseigenen Präparate keine keine KP-Erhöhungen erforderlich sein.
2. Ich habe mir am WE noch einmal in Ruhe alle präklinischen Daten zum IMGN289 angesehen. Wirklich eindrucksvoll. Könnte so einschlagen wie T-DM1. Auf die klinischen Daten (erste Daten 2014) bin ich wirklich gespannt.
Kadcyla ist jetzt auch in der Schweiz zugelassen (s. heutige "Finanz und Wirtschaft", S.23).
First Clinical Data Presented with IMGN853, ImmunoGen, Inc.'s Potential New Therapy for Ovarian and Other Cancers
First clinical findings presented with ImmunoGen's folate receptor α (FRα)-targeting antibody-drug conjugate (ADC), IMGN853.
Preliminary evidence of activity seen in dose-finding portion of trial.
WALTHAM, Mass.--(BUSINESS WIRE)-- ImmunoGen, Inc. (Nasdaq: IMGN), a biotechnology company that develops anticancer therapeutics using its Targeted Antibody Payload (TAP) ADC technology, today announced the presentation of the first clinical data with the Company's IMGN853 product candidate. The data are from the ongoing dose-finding portion of a Phase I clinical assessment of the compound, which is a potential treatment for many ovarian, endometrial, and non-small cell lung cancers, as well as other FRα-overexpressing cancers. The data are being presented (abstract #2573) at the American Society of Clinical Oncology (ASCO) annual meeting taking place in Chicago, IL.
First Data from Dose-Finding Assessment
The dose-finding portion of this Phase I clinical trial is designed to establish the maximum tolerated dose of IMGN853 and to define its dose-limiting toxicity (DLT). Patients with any type of cancer known to overexpress IMGN853's FRα target are eligible for enrollment in this phase of the trial. Once the maximum tolerated dose is established, IMGN853 will be evaluated in patients with specific types of FRα-overexpressing cancers, with prescreening to ensure tumor levels of FRα-overexpression meet defined criteria.
At the time of data cutoff for presentation, 18 patients had received IMGN853 at doses ranging from 0.15 to 7.0 mg/kg. DLT, seen at 7.0 mg/kg, was reversible blurred vision with epithelial corneal changes. The patients assigned to this dose were reduced to 5.0 mg/kg, the second highest dose evaluated. Additional new patients are being treated with 5.0 mg/kg to further assess that dose.
While this assessment is designed to evaluate the safety of IMGN853 and establish its maximum tolerated dose, evidence of clinical activity is also identified. Activity started to be seen when dose levels reached 3.3 mg/kg and included:
A patient with serous epithelial ovarian cancer assigned to treatment with IMGN853 at 3.3 mg/kg had a confirmed CA-125 response — a pronounced, sustained reduction in CA-125 levels — and stable disease lasting 18 weeks. This patient previously had received 12 other treatment regimens.
A patient with serous endometrial cancer achieved a partial response (PR), awaiting confirmation, after four cycles of treatment with IMGN853; she also had a marked decrease in CA-125 levels. This patient previously had received two platinum-based regimens that included paclitaxel. She was assigned to treatment with IMGN853 at the 5.0 mg/kg dose level and continues on therapy.
A patient with platinum-resistant, transitional cell ovarian cancer achieved a PR, awaiting confirmation, after two cycles of treatment with IMGN853. She also had a pronounced decrease in her CA-125 levels. She was assigned to receive IMGN853 at 7.0 mg/kg, experienced a DLT, and remains on study at 5.0 mg/kg.
All three of these patients had cancer that scored strongly positive1 for IMGN853's FRα target, as determined by well-established immunohistochemistry (IHC) assessment.
"We are highly encouraged by these initial clinical findings with IMGN853," commented Dr. Charles Morris, Executive Vice President and Chief Development Officer. "Preliminary evidence of activity has been seen in the dose-finding portion of this trial. We look forward to completing this part of the trial and beginning evaluation of IMGN853 in disease-specific patient populations."
ImmunoGen expects to begin the disease-specific, dose-expansion phase of this trial later this year. In that phase, IMGN853 will be evaluated in patients who have been prescreened for specific levels of FRα-overexpression and have either: (1) platinum-resistant ovarian cancer treated with three or fewer prior regimens; (2) relapsed/refractory ovarian cancer treated with less strictly defined prior therapies; or (3) adenocarcinoma non-small cell lung cancer. Addition of a cohort to assess IMGN853 for endometrial cancer is now also planned.
About IMGN853
IMGN853 is a FRα-targeting ADC wholly owned by ImmunoGen. It comprises three components developed by Company scientists: a humanized FRα-binding antibody, which serves to target the compound to FRα-expressing cancer cells; DM4, a potent cell-killing agent; and an engineered linker, which serves to keep the DM4 attached to the antibody en route to the cancer cells and also — once inside a cancer cell — helps counter the multi-drug resistance that can make previously treated cancers harder to kill.
IMGN853 is in Phase I testing for the treatment of FRα-overexpressing cancers, which include many ovarian, endometrial and adenocarcinoma non-small cell lung cancers.
About Ovarian, Endometrial, and Adenocarcinoma Non-Small Cell Lung Cancers
Each year, there are approximately 22,000 new cases of ovarian cancer diagnosed in the US and more than 14,000 women die from the disease.2 Epithelial ovarian cancer accounts for approximately 85% to 90% of all cases of ovarian cancer.3
An estimated 48,500 cases of endometrial cancers will be diagnosed in the US in 2013 and approximately 8,000 women will die from the disease.4
Each year, approximately 228,000 patients in the US are diagnosed with lung cancer and approximately 160,000 die from the disease.2 About 40% of lung cancers are the adenocarcinoma subtype of non-small cell lung cancer.5
First clinical findings presented with ImmunoGen's folate receptor α (FRα)-targeting antibody-drug conjugate (ADC), IMGN853.
Preliminary evidence of activity seen in dose-finding portion of trial.
WALTHAM, Mass.--(BUSINESS WIRE)-- ImmunoGen, Inc. (Nasdaq: IMGN), a biotechnology company that develops anticancer therapeutics using its Targeted Antibody Payload (TAP) ADC technology, today announced the presentation of the first clinical data with the Company's IMGN853 product candidate. The data are from the ongoing dose-finding portion of a Phase I clinical assessment of the compound, which is a potential treatment for many ovarian, endometrial, and non-small cell lung cancers, as well as other FRα-overexpressing cancers. The data are being presented (abstract #2573) at the American Society of Clinical Oncology (ASCO) annual meeting taking place in Chicago, IL.
First Data from Dose-Finding Assessment
The dose-finding portion of this Phase I clinical trial is designed to establish the maximum tolerated dose of IMGN853 and to define its dose-limiting toxicity (DLT). Patients with any type of cancer known to overexpress IMGN853's FRα target are eligible for enrollment in this phase of the trial. Once the maximum tolerated dose is established, IMGN853 will be evaluated in patients with specific types of FRα-overexpressing cancers, with prescreening to ensure tumor levels of FRα-overexpression meet defined criteria.
At the time of data cutoff for presentation, 18 patients had received IMGN853 at doses ranging from 0.15 to 7.0 mg/kg. DLT, seen at 7.0 mg/kg, was reversible blurred vision with epithelial corneal changes. The patients assigned to this dose were reduced to 5.0 mg/kg, the second highest dose evaluated. Additional new patients are being treated with 5.0 mg/kg to further assess that dose.
While this assessment is designed to evaluate the safety of IMGN853 and establish its maximum tolerated dose, evidence of clinical activity is also identified. Activity started to be seen when dose levels reached 3.3 mg/kg and included:
A patient with serous epithelial ovarian cancer assigned to treatment with IMGN853 at 3.3 mg/kg had a confirmed CA-125 response — a pronounced, sustained reduction in CA-125 levels — and stable disease lasting 18 weeks. This patient previously had received 12 other treatment regimens.
A patient with serous endometrial cancer achieved a partial response (PR), awaiting confirmation, after four cycles of treatment with IMGN853; she also had a marked decrease in CA-125 levels. This patient previously had received two platinum-based regimens that included paclitaxel. She was assigned to treatment with IMGN853 at the 5.0 mg/kg dose level and continues on therapy.
A patient with platinum-resistant, transitional cell ovarian cancer achieved a PR, awaiting confirmation, after two cycles of treatment with IMGN853. She also had a pronounced decrease in her CA-125 levels. She was assigned to receive IMGN853 at 7.0 mg/kg, experienced a DLT, and remains on study at 5.0 mg/kg.
All three of these patients had cancer that scored strongly positive1 for IMGN853's FRα target, as determined by well-established immunohistochemistry (IHC) assessment.
"We are highly encouraged by these initial clinical findings with IMGN853," commented Dr. Charles Morris, Executive Vice President and Chief Development Officer. "Preliminary evidence of activity has been seen in the dose-finding portion of this trial. We look forward to completing this part of the trial and beginning evaluation of IMGN853 in disease-specific patient populations."
ImmunoGen expects to begin the disease-specific, dose-expansion phase of this trial later this year. In that phase, IMGN853 will be evaluated in patients who have been prescreened for specific levels of FRα-overexpression and have either: (1) platinum-resistant ovarian cancer treated with three or fewer prior regimens; (2) relapsed/refractory ovarian cancer treated with less strictly defined prior therapies; or (3) adenocarcinoma non-small cell lung cancer. Addition of a cohort to assess IMGN853 for endometrial cancer is now also planned.
About IMGN853
IMGN853 is a FRα-targeting ADC wholly owned by ImmunoGen. It comprises three components developed by Company scientists: a humanized FRα-binding antibody, which serves to target the compound to FRα-expressing cancer cells; DM4, a potent cell-killing agent; and an engineered linker, which serves to keep the DM4 attached to the antibody en route to the cancer cells and also — once inside a cancer cell — helps counter the multi-drug resistance that can make previously treated cancers harder to kill.
IMGN853 is in Phase I testing for the treatment of FRα-overexpressing cancers, which include many ovarian, endometrial and adenocarcinoma non-small cell lung cancers.
About Ovarian, Endometrial, and Adenocarcinoma Non-Small Cell Lung Cancers
Each year, there are approximately 22,000 new cases of ovarian cancer diagnosed in the US and more than 14,000 women die from the disease.2 Epithelial ovarian cancer accounts for approximately 85% to 90% of all cases of ovarian cancer.3
An estimated 48,500 cases of endometrial cancers will be diagnosed in the US in 2013 and approximately 8,000 women will die from the disease.4
Each year, approximately 228,000 patients in the US are diagnosed with lung cancer and approximately 160,000 die from the disease.2 About 40% of lung cancers are the adenocarcinoma subtype of non-small cell lung cancer.5
Antwort auf Beitrag Nr.: 44.773.273 von Joschka Schröder am 03.06.13 13:01:09Gestern ist der IMGN-Kurs ordentlich unter die Räder gekommen, zwischenzeitlich -10 %!
Die Meldung zu IMGN853 war zwar nicht berauschend, jedoch war eigentlich auch nichts anderes zu erwarten! Wer sich das Studiendesign durchgelesen hat, weiß, dass in Phase 1 auch Patienten behandelt werden, die FRalpha überhaupt nicht exprimieren ... bei diesen Patienten kann IMGN853 natürlich nicht wirken.
Erst in der Dosis-Expansionsphase werden die Patienten entsprechend FRalpha-Expression selektiert. Verwertbare Aussagen über die Wirksamkeit des IMGN853 lassen sich erst nach der anschließenden Phase II (-> drei gut definierte Patientensubgruppen) machen.
Na ja, vermutlich hat niemand das Studienkonzept gründlich gelesen. Anders ist die Kursreaktion nicht zu verstehen.
Die Meldung zu IMGN853 war zwar nicht berauschend, jedoch war eigentlich auch nichts anderes zu erwarten! Wer sich das Studiendesign durchgelesen hat, weiß, dass in Phase 1 auch Patienten behandelt werden, die FRalpha überhaupt nicht exprimieren ... bei diesen Patienten kann IMGN853 natürlich nicht wirken.
Erst in der Dosis-Expansionsphase werden die Patienten entsprechend FRalpha-Expression selektiert. Verwertbare Aussagen über die Wirksamkeit des IMGN853 lassen sich erst nach der anschließenden Phase II (-> drei gut definierte Patientensubgruppen) machen.
Na ja, vermutlich hat niemand das Studienkonzept gründlich gelesen. Anders ist die Kursreaktion nicht zu verstehen.
Antwort auf Beitrag Nr.: 44.781.977 von Joschka Schröder am 04.06.13 14:10:12P1 mit dose finding und dann efficacy berichten ist ja schon ein bisschen schräg. Da erwartet man als Ergebnisse ja eher Toxizität/Safety und Pharmakokinetik pro Dosisgruppe.
Antwort auf Beitrag Nr.: 44.782.263 von me_2 am 04.06.13 14:41:59Na ja, bei onkologischen P1-Studien ist es eigentlich nicht ungewöhnlich, auch erste Effizienzdaten zu melden. Im vorliegenden Fall verhält es sich jedoch so, dass das P1-Kollektiv auch Tumorpatienten umfasst, die FRA überhaupt nicht exprimieren. In diesen Fällen geht es in der Tat ausschließlich um Toxizität und Pharmakokinetik ... und dieser Umstand ist von Analysten- und Investorenseite nicht ausreichend berücksichtigt worden.
Derzeit könnte für Nicht-Investierte ein aussichtsreicher Zeitpunkt sein, erste Positionen zu kaufen. Das aus meiner Sicht im gesamten Onkologie-Universum mit am aussichtsreichsten Entwicklungspräparat ist IMGN289 mit überragenden präklinischen Daten. IMGN289 ist für mich ein Grund, eine gewisse Aktienposition unabhängig von Schwankungen des Gesamtmarktes und der IMGN-Aktie überdauernd zu halten. Wenn IMGN289 das hält, was ich mir von diesem anti EGFR-Immunkonjugat verspreche, müßte sich der IMGN-Kurs in einigen Jahren vervielfachen.
Derzeit könnte für Nicht-Investierte ein aussichtsreicher Zeitpunkt sein, erste Positionen zu kaufen. Das aus meiner Sicht im gesamten Onkologie-Universum mit am aussichtsreichsten Entwicklungspräparat ist IMGN289 mit überragenden präklinischen Daten. IMGN289 ist für mich ein Grund, eine gewisse Aktienposition unabhängig von Schwankungen des Gesamtmarktes und der IMGN-Aktie überdauernd zu halten. Wenn IMGN289 das hält, was ich mir von diesem anti EGFR-Immunkonjugat verspreche, müßte sich der IMGN-Kurs in einigen Jahren vervielfachen.
Erfreuliches gibt es zu IMGN zu vermelden:
1. Umsätze mit Kadcyla (T-DM1) ziehen weiter an. Von 15,1 Mio. CHF pro Monat in Q1, auf durchschnittlich schon 21,7 Mio. CHF pro Monat in Q2 (übertrifft die Analystenerwartungen deutlich).
2. "The TH3RESA study, which compared Kadcyla to the physician’s choice of treatment in patients with HER2-positive breast cancer who have already been treated with a HER2-targeted therapy, also recently met its co-primary endpoint of progression-free survival. Detailed results will be presented at an upcoming medical conference. The other endpoint is overall survival, but these data are not yet mature."
3. Kadcyla (T-DM1) taucht in der Prognosetabelle erstmals unter der Indikation HER2+ early BC auf (Zulassung ab 2016).
4. Roche beendet die Entwicklung des EGFR-Antagonisten imgatuzumab. Wird nicht in die klinische Phase II gebracht. Vermutlich sieht man sich chancenlos gegenüber Immunogens IMGN289.
1. Umsätze mit Kadcyla (T-DM1) ziehen weiter an. Von 15,1 Mio. CHF pro Monat in Q1, auf durchschnittlich schon 21,7 Mio. CHF pro Monat in Q2 (übertrifft die Analystenerwartungen deutlich).
2. "The TH3RESA study, which compared Kadcyla to the physician’s choice of treatment in patients with HER2-positive breast cancer who have already been treated with a HER2-targeted therapy, also recently met its co-primary endpoint of progression-free survival. Detailed results will be presented at an upcoming medical conference. The other endpoint is overall survival, but these data are not yet mature."
3. Kadcyla (T-DM1) taucht in der Prognosetabelle erstmals unter der Indikation HER2+ early BC auf (Zulassung ab 2016).
4. Roche beendet die Entwicklung des EGFR-Antagonisten imgatuzumab. Wird nicht in die klinische Phase II gebracht. Vermutlich sieht man sich chancenlos gegenüber Immunogens IMGN289.
Zitat von Joschka Schröder: 4. Roche beendet die Entwicklung des EGFR-Antagonisten imgatuzumab. Wird nicht in die klinische Phase II gebracht. Vermutlich sieht man sich chancenlos gegenüber Immunogens IMGN289.
Das ist nicht ganz richtig ... imgatuzumab war bereits in Phase II (metastasierendes kolorektales Karzinom, Zweitlinienbehandlung), die Entwicklung ist jedoch eingestellt worden.
Nach den mittlerweile vorliegenden präklinischen Daten dürfte Immunnogens IMGN289 weit und breit das anti EGFR-Präparat sein. Ich selbst habe bzgl. IMGN289 größte Erwartungen.
Zitat von Joschka Schröder:Zitat von Joschka Schröder: 4. Roche beendet die Entwicklung des EGFR-Antagonisten imgatuzumab. Wird nicht in die klinische Phase II gebracht. Vermutlich sieht man sich chancenlos gegenüber Immunogens IMGN289.
Das ist nicht ganz richtig ... imgatuzumab war bereits in Phase II (metastasierendes kolorektales Karzinom, Zweitlinienbehandlung), die Entwicklung ist jedoch eingestellt worden.
Nach den mittlerweile vorliegenden präklinischen Daten dürfte Immunnogens IMGN289 weit und breit das anti EGFR-Präparat sein. Ich selbst habe bzgl. IMGN289 größte Erwartungen.
@ Joschka
Zunächst herzlichen Dank für Deine kompetenten regelmäßigen Updates zu Immunogen!
In welchem Umfang wird nach Deiner Einschätzung derzeit das Potential von IMGN289 von der Analysten- und Investorengemeinde bereits im Aktienkurs eskomptiert? Über welchen Zeitraum erwartete Du die notwendige Visibilität, damit es dazu ggf. kommen kann? Ist es richtig, daß es sich bei IMGN289 um eine rein eigene Entwicklung von Immunogen handelt?
Vorab schon einmal herzlichen Dank!
Antwort auf Beitrag Nr.: 45.126.855 von Joschka Schröder am 27.07.13 20:13:32Hallo Joschka Schröder,
was meint du konkret mit "das anti EGFR-Präparat"?
Grundsätzlich gibt es ja EGFR-AKs wie Erbitux und EGFR Small Molecules wie z.B. Tarceva. Warum wird Erbitux als AK bei Darmkrebs verwendet, aber nicht bei Lungenkrebs? Mit Tarceva als SM verhält es sich genau andersherum. So wie ich die Theorie verstehe, sind SMs nur bei mutiertem EGFR wirksam (Driver-Mutation), weniger oder nicht aber bei normalem Wild-Type EGFR. Als Nebenwirkung kommt es bei Behandlung mit EGFR-AKs oder SMs zu Hautausschlag: "One of the more serious side effects of cetuximab therapy is the incidence of acne-like rash. This rash rarely leads to dose reductions or termination of therapy. It is generally reversible." Dies liegt wohl daran, dass EGFR überall expressioniert ist, u.a. in der Haut.
EGFR ist bei NSCLC zwar oft überexpressioniert, aber nur in 10%-30% mutiert. Welchen Effekt hätte nun ein EGFR-ADC bei allen EGFR expressionierenden Zellen?
Zu Erbitux heißt es: "Approximately 75% of patients with metastatic colorectal cancer have an EGFR-expressing tumor and are therefore considered eligible for treatment with cetuximab or panitumumab, according to FDA guidelines. Unfortunately, there is evidence that immunohistochemical EGFR receptor testing does not predict response to either cetuximab or panitumumab, so that this has been called a "misleading biomarker" that has nevertheless caused insurers and even health systems to deny payment for EGFR antibody treatment for patients who lack a positive tumor EGFR histochemical test." http://en.wikipedia.org/wiki/Cetuximab Warum gibt keinen Zusammenhang zwischen EGFR und dem Ansprechen von Erbitux? "A study in June 2010 found that Erbitux failed to benefit patients with less advanced (non-metastasized) stages of colorectal cancer[6] with no improvement in survival rates. Adding Erbitux instead increased the side effects of chemotherapy."... wenn Erbitux nur auf EGFR wirkt, warum erhöht das die Nebenwirkung einer Chemo?
"When growth factors bind to their receptors on the surface of the cell, the receptors give a signal that causes cells to divide. Some cancers are caused by mutated receptors that give a signal to divide even without growth factor. That causes the cells to divide uncontrollably. Cetuximab binds to such receptors and turns off that signal."... das verstehe ich auch nicht? Wenn ich den EGFR-Receptor z.B. mittels AK blockiere, dann wird kein Wachstumssignal induziert und die Zellen teilen sich weniger. Aber was bringt es dann, den Rezeptor bei mutiertem EGFR zu blockieren, wenn in diesem Fall der Signalweg generell aktiv ist?
"Cetuximab binds to EGFR and turns off the uncontrolled growth in cancers with EGFR mutations (although in practice, studies have shown that the effect of cetuximab does not actually depend on the amount of EGFR receptor protein found on the cancer cells). However, if the KRAS protein in mutated, cetuximab has been found not to work, because the mutated KRAS gene downstream is causing the problem by continuously sending a growth signal (the KRAS protein) and this mutated gene now does not respond to the EGFR receptor."
Warum werden bei NSCL keine EGFR-AKs verwendet, wenn dort 90% EGFR expressionieren? http://www.mycancergenome.org/content/disease/lung-cancer/eg… Könnte es zu gravierenden Nebenwirkungen kommen, wenn man alle Zellen angreift, die EGFR expressionieren... alle Zellen im Körper expressionieren mehr oder weniger EGFR. "Activation of the receptor is important for the innate immune response in human skin." http://en.wikipedia.org/wiki/Epidermal_growth_factor_recepto… oder "Der EGF-Rezeptor ist ein Transmembranrezeptor mit intrinsischer Tyrosinkinase-Aktivität, der beim Menschen in allen Zellarten vorkommt."
Wenn ein EGFR-ADC etwas bringt, könnte er sehr wertvoll sein. EGFR-SMs verlieren bei EGFR-mutiertem NSCLC nach einiger Zeit in 50% aller Patienten durch eine weitere Mutation T790M ihre Wirkung. In diesem Fall gibt es bisher nichts, was noch hilft. CLVS hat nun einen EGFR-Hemmer in PI, der auch gegen T790M wirken soll. Erste Anzeichen der Wirksamkeit bei wenigen Patienten in der PI haben die MK zuletzt auf 2 Mrd USD gehoben. Entsprechend dürfte IMGN steigen, wenn sie etwas entsprechendes zeigen könnten.
Gruß
ipollit
was meint du konkret mit "das anti EGFR-Präparat"?
Grundsätzlich gibt es ja EGFR-AKs wie Erbitux und EGFR Small Molecules wie z.B. Tarceva. Warum wird Erbitux als AK bei Darmkrebs verwendet, aber nicht bei Lungenkrebs? Mit Tarceva als SM verhält es sich genau andersherum. So wie ich die Theorie verstehe, sind SMs nur bei mutiertem EGFR wirksam (Driver-Mutation), weniger oder nicht aber bei normalem Wild-Type EGFR. Als Nebenwirkung kommt es bei Behandlung mit EGFR-AKs oder SMs zu Hautausschlag: "One of the more serious side effects of cetuximab therapy is the incidence of acne-like rash. This rash rarely leads to dose reductions or termination of therapy. It is generally reversible." Dies liegt wohl daran, dass EGFR überall expressioniert ist, u.a. in der Haut.
EGFR ist bei NSCLC zwar oft überexpressioniert, aber nur in 10%-30% mutiert. Welchen Effekt hätte nun ein EGFR-ADC bei allen EGFR expressionierenden Zellen?
Zu Erbitux heißt es: "Approximately 75% of patients with metastatic colorectal cancer have an EGFR-expressing tumor and are therefore considered eligible for treatment with cetuximab or panitumumab, according to FDA guidelines. Unfortunately, there is evidence that immunohistochemical EGFR receptor testing does not predict response to either cetuximab or panitumumab, so that this has been called a "misleading biomarker" that has nevertheless caused insurers and even health systems to deny payment for EGFR antibody treatment for patients who lack a positive tumor EGFR histochemical test." http://en.wikipedia.org/wiki/Cetuximab Warum gibt keinen Zusammenhang zwischen EGFR und dem Ansprechen von Erbitux? "A study in June 2010 found that Erbitux failed to benefit patients with less advanced (non-metastasized) stages of colorectal cancer[6] with no improvement in survival rates. Adding Erbitux instead increased the side effects of chemotherapy."... wenn Erbitux nur auf EGFR wirkt, warum erhöht das die Nebenwirkung einer Chemo?
"When growth factors bind to their receptors on the surface of the cell, the receptors give a signal that causes cells to divide. Some cancers are caused by mutated receptors that give a signal to divide even without growth factor. That causes the cells to divide uncontrollably. Cetuximab binds to such receptors and turns off that signal."... das verstehe ich auch nicht? Wenn ich den EGFR-Receptor z.B. mittels AK blockiere, dann wird kein Wachstumssignal induziert und die Zellen teilen sich weniger. Aber was bringt es dann, den Rezeptor bei mutiertem EGFR zu blockieren, wenn in diesem Fall der Signalweg generell aktiv ist?
"Cetuximab binds to EGFR and turns off the uncontrolled growth in cancers with EGFR mutations (although in practice, studies have shown that the effect of cetuximab does not actually depend on the amount of EGFR receptor protein found on the cancer cells). However, if the KRAS protein in mutated, cetuximab has been found not to work, because the mutated KRAS gene downstream is causing the problem by continuously sending a growth signal (the KRAS protein) and this mutated gene now does not respond to the EGFR receptor."
Warum werden bei NSCL keine EGFR-AKs verwendet, wenn dort 90% EGFR expressionieren? http://www.mycancergenome.org/content/disease/lung-cancer/eg… Könnte es zu gravierenden Nebenwirkungen kommen, wenn man alle Zellen angreift, die EGFR expressionieren... alle Zellen im Körper expressionieren mehr oder weniger EGFR. "Activation of the receptor is important for the innate immune response in human skin." http://en.wikipedia.org/wiki/Epidermal_growth_factor_recepto… oder "Der EGF-Rezeptor ist ein Transmembranrezeptor mit intrinsischer Tyrosinkinase-Aktivität, der beim Menschen in allen Zellarten vorkommt."
Wenn ein EGFR-ADC etwas bringt, könnte er sehr wertvoll sein. EGFR-SMs verlieren bei EGFR-mutiertem NSCLC nach einiger Zeit in 50% aller Patienten durch eine weitere Mutation T790M ihre Wirkung. In diesem Fall gibt es bisher nichts, was noch hilft. CLVS hat nun einen EGFR-Hemmer in PI, der auch gegen T790M wirken soll. Erste Anzeichen der Wirksamkeit bei wenigen Patienten in der PI haben die MK zuletzt auf 2 Mrd USD gehoben. Entsprechend dürfte IMGN steigen, wenn sie etwas entsprechendes zeigen könnten.
Gruß
ipollit
Antwort auf Beitrag Nr.: 45.129.243 von Emil_Punter am 28.07.13 16:33:47Meiner Meinung wird IMGN289 bisher nicht im Kurs berücksichtigt. Ich verstehe noch nicht ganz, was man von IMGN289 erwarten kann. Wenn man aber ähnliches wie CLVS zeigen könnte, würde sich dies mit ersten Ergebnissen aus einer PI deutlich ändern. IMGN sollte 100% der Rechte besitzen. Neben IMGN289 gibt es ja noch andere interessante Kandidaten wie der Folate ADC IMGN853...
Gruß
ipollit
Gruß
ipollit
Antwort auf Beitrag Nr.: 45.129.267 von ipollit am 28.07.13 16:42:19Da habe ich mich mal wieder unter Zeitdruck schnell etwas getippt ... und die entscheidenden Worte vergessen. Es sollte eigentlich heißen „das mit Abstand aussichtsreichste anti EGFR-Präparat“.
Im Vergleich zu allen auf dem Markt und gegenwärtig in Entwicklung befindlichen Therapeutika besitzt IMGN289 u.a. den Vorteil, dass es über zwei unterschiedliche Wirkmechanismen verfügt:
1) Hemmung des EGFR-Signalwegs via direkte Antikörperwirkung
2) zusätzlich nach Aufnahme des ADC Abtöten der Zelle via Toxinwirkung.
IMGN289 ist somit grundsätzlich bei allen Formen EGFR-überexprimierenden Tumoren einsetzbar, auch solchen mit Mutationen des KRAS-Gens. Zum Zielspektrum gehören explizit auch nicht-kleinzellige Lungentumoren.
Auf einer Konferenz im vergangenen April wurde eindrücklich demonstriert, wie EGFR-hyperexprimierende Tumoren unterschiedlicher Klassen über die oben beschriebenen Mechanismen in vivo ausradiert werden konnten, wobei IMGN289 auch gegen TKI-resistente Tumorenzellen wirkt, bei denen beispielsweise Erlotinib versagt.
Insgesamt verfügt IMGN289 über dieselben Mechanismen wie Kadcyla (T-DM1), mit dem Unterschied, dass IMGN289 an HER1 bzw. ErbB1 bindet, während Kadcyla HER2 bzw. ErbB2 ansteuert. Sowohl IMGN289 als auch Kadcyla enthalten das DM1-Toxin, das über einen SMCC-Linker mit dem Antikörper verbunden ist.
IMGN289 weist im direkten Vergleich zu anderen anti EGFR-MABs wie Erbitux und Vetcibix weitere wichtige Vorteile auf:
Sowohl der nackte Antikörper als auch das vollständige Immunkonjugat sind weniger hauttoxisch (-> verminderte Induktion inflammatorischer Zytokine). Gleichzeitig ist die Anti-Tumoraktivität bereits des nackten Antikörpers größer als z.B. diejenige des Erbitux (s.o., Punkt 1, Ergebnis von in vivo-Versuchen im Xenograft-Mäusemodell).
PS: Zumindest in den mir vorliegenden Analystenstudien wird IMGN289 nicht berücksichtigt, obwohl es für mich ein wesentlicher Hoffnungsträger im Onkologiesektor ist. Erste klinische Studiendaten dürfte es zur ASH-Konferenz im Dezember geben.
Im Vergleich zu allen auf dem Markt und gegenwärtig in Entwicklung befindlichen Therapeutika besitzt IMGN289 u.a. den Vorteil, dass es über zwei unterschiedliche Wirkmechanismen verfügt:
1) Hemmung des EGFR-Signalwegs via direkte Antikörperwirkung
2) zusätzlich nach Aufnahme des ADC Abtöten der Zelle via Toxinwirkung.
IMGN289 ist somit grundsätzlich bei allen Formen EGFR-überexprimierenden Tumoren einsetzbar, auch solchen mit Mutationen des KRAS-Gens. Zum Zielspektrum gehören explizit auch nicht-kleinzellige Lungentumoren.
Auf einer Konferenz im vergangenen April wurde eindrücklich demonstriert, wie EGFR-hyperexprimierende Tumoren unterschiedlicher Klassen über die oben beschriebenen Mechanismen in vivo ausradiert werden konnten, wobei IMGN289 auch gegen TKI-resistente Tumorenzellen wirkt, bei denen beispielsweise Erlotinib versagt.
Insgesamt verfügt IMGN289 über dieselben Mechanismen wie Kadcyla (T-DM1), mit dem Unterschied, dass IMGN289 an HER1 bzw. ErbB1 bindet, während Kadcyla HER2 bzw. ErbB2 ansteuert. Sowohl IMGN289 als auch Kadcyla enthalten das DM1-Toxin, das über einen SMCC-Linker mit dem Antikörper verbunden ist.
IMGN289 weist im direkten Vergleich zu anderen anti EGFR-MABs wie Erbitux und Vetcibix weitere wichtige Vorteile auf:
Sowohl der nackte Antikörper als auch das vollständige Immunkonjugat sind weniger hauttoxisch (-> verminderte Induktion inflammatorischer Zytokine). Gleichzeitig ist die Anti-Tumoraktivität bereits des nackten Antikörpers größer als z.B. diejenige des Erbitux (s.o., Punkt 1, Ergebnis von in vivo-Versuchen im Xenograft-Mäusemodell).
PS: Zumindest in den mir vorliegenden Analystenstudien wird IMGN289 nicht berücksichtigt, obwohl es für mich ein wesentlicher Hoffnungsträger im Onkologiesektor ist. Erste klinische Studiendaten dürfte es zur ASH-Konferenz im Dezember geben.
Antwort auf Beitrag Nr.: 45.136.293 von Joschka Schröder am 29.07.13 19:17:41Ja, so habe ich es auch verstanden... ich sehe auch ein mögliches Potential eines EGFR-ADC, aber trotzdem bin ich mir noch nicht sicher, dass es damit nicht auch Probleme geben könnte.
Bei HER2 ist die Sache für mich klarer. Es geht mir nicht um den ADC als solchen, sondern um das Target. Warum ist IMGN289 weniger "hauttoxisch"? Soweit ich es verstehe, kommt der Hautausschlag dadurch zustande, dass der AK EGFR runterreguliert... also eine direkte Wirkung über wild type EGFR. Was für Nebenwirkungen sind zu erwarten, wenn beispielsweise diese Hautzellen durch IMGN289 gezielt zerstört werden? Oder über welchen Mechanismus wird das verhindert? Wenn IMGN289 nicht auf wild type EGFR wirken würde, wäre auch die Wirkung auf die Krebszellen dahin, die in der Mehrzahl nur wild type expressionieren. IMGN sagt zum J2898A-AK "Partial antagonist of EGFR-signaling – limited impact on growth of normal cells" Aber wie funktioniert das? Der AK bzw. ADC bindet nicht vollständig? Bindet er garnicht wild-type EGFR? Hautausschlag ist eine Nebenwirkung. Könnte es noch andere geben, die durch einen ADC erst gravierend werden? Immerhin hat IMGN diese bekannte Nebenwirkung versucht zu umgehen, vielleicht weil ein ADC ohne das, nicht tolerabel wäre?
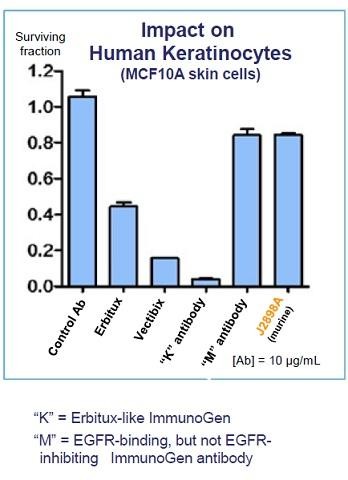
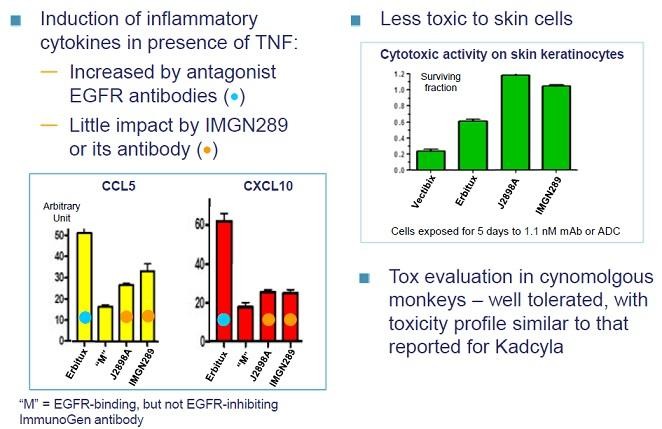
Kannst du mir sagen, wie es funktionieren kann, dass der ADC nicht auf die Haut wirkt, aber auf den Tumor (wenn beides wild type ist)?... das grüne Diagramm ist mir nicht klar? Wirkt ein ADC nicht, wenn er nur bindet, aber nicht hemmt?
Gruß
ipollit
Bei HER2 ist die Sache für mich klarer. Es geht mir nicht um den ADC als solchen, sondern um das Target. Warum ist IMGN289 weniger "hauttoxisch"? Soweit ich es verstehe, kommt der Hautausschlag dadurch zustande, dass der AK EGFR runterreguliert... also eine direkte Wirkung über wild type EGFR. Was für Nebenwirkungen sind zu erwarten, wenn beispielsweise diese Hautzellen durch IMGN289 gezielt zerstört werden? Oder über welchen Mechanismus wird das verhindert? Wenn IMGN289 nicht auf wild type EGFR wirken würde, wäre auch die Wirkung auf die Krebszellen dahin, die in der Mehrzahl nur wild type expressionieren. IMGN sagt zum J2898A-AK "Partial antagonist of EGFR-signaling – limited impact on growth of normal cells" Aber wie funktioniert das? Der AK bzw. ADC bindet nicht vollständig? Bindet er garnicht wild-type EGFR? Hautausschlag ist eine Nebenwirkung. Könnte es noch andere geben, die durch einen ADC erst gravierend werden? Immerhin hat IMGN diese bekannte Nebenwirkung versucht zu umgehen, vielleicht weil ein ADC ohne das, nicht tolerabel wäre?


Kannst du mir sagen, wie es funktionieren kann, dass der ADC nicht auf die Haut wirkt, aber auf den Tumor (wenn beides wild type ist)?... das grüne Diagramm ist mir nicht klar? Wirkt ein ADC nicht, wenn er nur bindet, aber nicht hemmt?
Gruß
ipollit
Antwort auf Beitrag Nr.: 45.137.913 von ipollit am 29.07.13 23:26:18Die Hauttoxizität kommt grundsätzlich auf zwei Wegen zustande:
1) direkte ADC-Wirkung
2) durch den Antikörper induzierte Ausschüttung verschiedener Zytokine, die über einen nachgeschalteten Entzündungsprozess zur Zerstörung bestimmter Hautzellen führt.
Punkt 1 ist bei IMGN289 natürlich gegeben, Punkt 2 dagegen nur in geringem Ausmaß (-> gute Antikörperselektion).
Bei Erbitux und Vectibix hingegen gibt es naturgemäß keine ADC-Wirkung, es kommt jedoch zu einer ausgeprägten Ausschüttung entzündlicher Zytokine (direkte Antikörperwirkung). Dieser Effekt allein ist stärker als die beiden IMGN289-Toxizitätsmechanismen zusammen.
Entscheidend für die geringere Schädlichkeit des IMGN289 ist also die geringere Freisetzung entzündlicher Zytokine.
1) direkte ADC-Wirkung
2) durch den Antikörper induzierte Ausschüttung verschiedener Zytokine, die über einen nachgeschalteten Entzündungsprozess zur Zerstörung bestimmter Hautzellen führt.
Punkt 1 ist bei IMGN289 natürlich gegeben, Punkt 2 dagegen nur in geringem Ausmaß (-> gute Antikörperselektion).
Bei Erbitux und Vectibix hingegen gibt es naturgemäß keine ADC-Wirkung, es kommt jedoch zu einer ausgeprägten Ausschüttung entzündlicher Zytokine (direkte Antikörperwirkung). Dieser Effekt allein ist stärker als die beiden IMGN289-Toxizitätsmechanismen zusammen.
Entscheidend für die geringere Schädlichkeit des IMGN289 ist also die geringere Freisetzung entzündlicher Zytokine.
Zitat von ipollit: IMGN sagt zum J2898A-AK "Partial antagonist of EGFR-signaling – limited impact on growth of normal cells" Aber wie funktioniert das? ...
Kannst du mir sagen, wie es funktionieren kann, dass der ADC nicht auf die Haut wirkt, aber auf den Tumor (wenn beides wild type ist)?
Vielleicht noch einmal kurz dazu: Die ADC-Wirkung auf gesundes Gewebe ist durch die Form des Mitosehemmenden Giftes DM1 limitiert. Sich langsam teilende Zellen werden von DM1 nur gering tangiert.
Die Hauttoxizität kommt hauptsächlich durch direkte Antikörper-Antigen-vermittelte Zytkinausschüttung (und deren Folgen) zustande ... und da hat IMGN289 gegenüber der Konkurrenz den wesentlichen Vorteil, weniger Zytokinfreisetzung zu induzieren.
Ist das vielleicht besser verständlich? Wenn nein, bitte melden.
Gibt es einen Link für die bisher veröffentlichten IMGN 289-Studiendaten?
Vielen Dank im voraus.
StefanR
Vielen Dank im voraus.
StefanR
Zitat von Joschka Schröder: Vielleicht noch einmal kurz dazu: Die ADC-Wirkung auf gesundes Gewebe ist durch die Form des Mitosehemmenden Giftes DM1 limitiert. Sich langsam teilende Zellen werden von DM1 nur gering tangiert.
Vielleicht etwas besser: Keratinozyten teilen sich im Vergleich zu anderen Gewebszellen vergleichweise schnell, jedoch deutlich langsamer als Tumorzellen.
@StafenR: Ich vermute, dass Du zum Thema etwas auf der IMGN-Homepage findest. Wenn ich mich recht erinnere, wurden Daten auf dem R&D-Day im April 2013 präsentiert.
ImmunoGen, Inc. Announces FDA Acceptance of IND for Company's Novel EGFR-Targeting ADC, IMGN289
Novel antibody-drug conjugate (ADC) IMGN289 on track to begin human clinical testing for treatment of EGFR-positive tumors in 4Q2013.
IMGN289 is a potential new treatment for lung, head and neck, and other EGFR-positive solid tumors, including ones not effectively treated with EGFR-directed therapies today.
Impressive IMGN289 efficacy in multiple EGFR-positive cancer models presented at 2013 American Association for Cancer Research (AACR).
WALTHAM, Mass.--(BUSINESS WIRE)-- ImmunoGen, Inc. (Nasdaq: IMGN), a biotechnology company that develops novel anticancer therapeutics using its Targeted Antibody Payload (TAP) ADC technology, today announced that the Company's IMGN289 Investigational New Drug (IND) application has been accepted by the US FDA and is now active. This enables ImmunoGen to advance IMGN289 into human clinical testing, expected to start in 4Q2013. This is the third IND for a novel, wholly owned anticancer compound to be submitted by ImmunoGen and accepted by the FDA in the past two years.
"We believe IMGN289 has the potential to be an important new therapy for many cancers, including squamous cell lung cancers and head and neck cancers, which have highly limited treatment options today," commented Dr. Charles Morris, EVP and Chief Development Officer. "Based on its profile, we expect IMGN289 to be more active than existing EGFR-directed therapies against tumors with high EGFR expression and also to be effective for some tumor types where existing therapies have not demonstrated meaningful efficacy."
About IMGN289
IMGN289, an ADC, is a potential new treatment for lung, head and neck, and other EGFR-positive solid tumors. It is designed to bind to and kill cancer cells that highly express EGFR.
IMGN289 contains an EGFR-targeting antibody developed by ImmunoGen that, in preclinical testing, demonstrated marked anticancer activity against EGFR-positive tumors responsive to EGFR inhibitors, with less skin toxicity than marketed antibodies to this target.1 The Company's potent DM1 cell-killing agent is attached to the antibody with ImmunoGen's thioether linker. This design is also used in the approved product, Kadcyla®. Both IMGN289 and Kadcyla target members of the ErbB family — EGFR (ErbB1) and HER2 (ErbB2), respectively — found on solid tumors that can act as driver oncoproteins.
Against EGFR-positive tumors responsive to EGFR inhibitors, IMGN289's antibody component alone demonstrated activity comparable to Erbitux® in preclinical models. The complete ADC — with the DM1 component — provided superior activity. 1-3
Its DM1 component enables IMGN289 to kill EGFR-positive cancer cells by a second mechanism that is not dependent on the EGFR pathway — disruption of the function of cellular microtubules. Thus, IMGN289 would be expected to be active against EGFR-positive cancers that are not responsive to EGFR inhibitors. Preclinical results support this expectation: IMGN289 has been found to demonstrate activity superior to Erbitux and Tarceva® against EGFR-independent and TKI-resistant cancer models, respectively.1-3
About the First-in-Human IMGN289 Clinical Trial
IMGN289 will be evaluated in a multi-center, US Phase I trial designed to assess the safety, tolerability, pharmacokinetics, pharmacodynamics and anticancer activity of the compound in patients with non-small cell lung cancer (NSCLC), squamous cell carcinoma of the head and neck cancer (SCCHN), or other EGFR-positive solid tumors. Once its maximum tolerated dose is defined, the activity of IMGN289 will be evaluated in disease-specific patient cohorts. The ones planned include SCCHN, squamous cell NSCLC, and NSCLC resistant to EGFR inhibitors.
About EGFR-Positive Cancers
EGFR is highly expressed on a number of types of solid tumors, including many cases of NSCLC and SCCHN.
Approximately 194,000 people will be diagnosed with NSCLC in the US in 2013 and 135,000 will die from the disease.4 Among NSCLC, the most prevalent subtypes are adenocarcinoma (AC), squamous cell carcinoma (SCC), and large cell carcinoma (LCC), accounting for approximately 40%, 25-30%, and 10-15% of NSCLC diagnoses, respectively.5 Research with tumor samples conducted at ImmunoGen found that approximately 20% of AC cases and about half of SCC and LCC cases strongly express EGFR.2
More than 51,000 people will be diagnosed with SCCHN in the US in 2013 and 9,800 will die from the disease.4 Research conducted at ImmunoGen found that over 90% of SCCHN cases strongly express EGFR.3
About ImmunoGen, Inc.
ImmunoGen, Inc. develops targeted anticancer therapeutics. The Company's TAP ADC technology uses a tumor-targeting engineered antibody to deliver one of ImmunoGen's highly potent cancer-cell killing agents specifically to tumor cells. The most advanced compound using ImmunoGen's TAP technology, Kadcyla, is marketed in the US by Genentech, a member of the Roche Group, and undergoing regulatory review in the European Union and Japan. ImmunoGen has four wholly owned clinical-stage compounds, with additional compounds in the clinic through partnerships. More information about ImmunoGen can be found at www.immunogen.com.
References
1Setiady et al., AACR 2013, abstract #5463
2Chittenden et al., AACR 2013, abstract #5467
3Ponte et al., AACR 2013, abstract #5483
4American Cancer Society (2013), Cancer Facts & Figures
5American Cancer Society (2013), Lung Cancer Detailed Guide
Kadcyla®, Erbitux®, and Tarceva® are trademarks of their respective owners.
Novel antibody-drug conjugate (ADC) IMGN289 on track to begin human clinical testing for treatment of EGFR-positive tumors in 4Q2013.
IMGN289 is a potential new treatment for lung, head and neck, and other EGFR-positive solid tumors, including ones not effectively treated with EGFR-directed therapies today.
Impressive IMGN289 efficacy in multiple EGFR-positive cancer models presented at 2013 American Association for Cancer Research (AACR).
WALTHAM, Mass.--(BUSINESS WIRE)-- ImmunoGen, Inc. (Nasdaq: IMGN), a biotechnology company that develops novel anticancer therapeutics using its Targeted Antibody Payload (TAP) ADC technology, today announced that the Company's IMGN289 Investigational New Drug (IND) application has been accepted by the US FDA and is now active. This enables ImmunoGen to advance IMGN289 into human clinical testing, expected to start in 4Q2013. This is the third IND for a novel, wholly owned anticancer compound to be submitted by ImmunoGen and accepted by the FDA in the past two years.
"We believe IMGN289 has the potential to be an important new therapy for many cancers, including squamous cell lung cancers and head and neck cancers, which have highly limited treatment options today," commented Dr. Charles Morris, EVP and Chief Development Officer. "Based on its profile, we expect IMGN289 to be more active than existing EGFR-directed therapies against tumors with high EGFR expression and also to be effective for some tumor types where existing therapies have not demonstrated meaningful efficacy."
About IMGN289
IMGN289, an ADC, is a potential new treatment for lung, head and neck, and other EGFR-positive solid tumors. It is designed to bind to and kill cancer cells that highly express EGFR.
IMGN289 contains an EGFR-targeting antibody developed by ImmunoGen that, in preclinical testing, demonstrated marked anticancer activity against EGFR-positive tumors responsive to EGFR inhibitors, with less skin toxicity than marketed antibodies to this target.1 The Company's potent DM1 cell-killing agent is attached to the antibody with ImmunoGen's thioether linker. This design is also used in the approved product, Kadcyla®. Both IMGN289 and Kadcyla target members of the ErbB family — EGFR (ErbB1) and HER2 (ErbB2), respectively — found on solid tumors that can act as driver oncoproteins.
Against EGFR-positive tumors responsive to EGFR inhibitors, IMGN289's antibody component alone demonstrated activity comparable to Erbitux® in preclinical models. The complete ADC — with the DM1 component — provided superior activity. 1-3
Its DM1 component enables IMGN289 to kill EGFR-positive cancer cells by a second mechanism that is not dependent on the EGFR pathway — disruption of the function of cellular microtubules. Thus, IMGN289 would be expected to be active against EGFR-positive cancers that are not responsive to EGFR inhibitors. Preclinical results support this expectation: IMGN289 has been found to demonstrate activity superior to Erbitux and Tarceva® against EGFR-independent and TKI-resistant cancer models, respectively.1-3
About the First-in-Human IMGN289 Clinical Trial
IMGN289 will be evaluated in a multi-center, US Phase I trial designed to assess the safety, tolerability, pharmacokinetics, pharmacodynamics and anticancer activity of the compound in patients with non-small cell lung cancer (NSCLC), squamous cell carcinoma of the head and neck cancer (SCCHN), or other EGFR-positive solid tumors. Once its maximum tolerated dose is defined, the activity of IMGN289 will be evaluated in disease-specific patient cohorts. The ones planned include SCCHN, squamous cell NSCLC, and NSCLC resistant to EGFR inhibitors.
About EGFR-Positive Cancers
EGFR is highly expressed on a number of types of solid tumors, including many cases of NSCLC and SCCHN.
Approximately 194,000 people will be diagnosed with NSCLC in the US in 2013 and 135,000 will die from the disease.4 Among NSCLC, the most prevalent subtypes are adenocarcinoma (AC), squamous cell carcinoma (SCC), and large cell carcinoma (LCC), accounting for approximately 40%, 25-30%, and 10-15% of NSCLC diagnoses, respectively.5 Research with tumor samples conducted at ImmunoGen found that approximately 20% of AC cases and about half of SCC and LCC cases strongly express EGFR.2
More than 51,000 people will be diagnosed with SCCHN in the US in 2013 and 9,800 will die from the disease.4 Research conducted at ImmunoGen found that over 90% of SCCHN cases strongly express EGFR.3
About ImmunoGen, Inc.
ImmunoGen, Inc. develops targeted anticancer therapeutics. The Company's TAP ADC technology uses a tumor-targeting engineered antibody to deliver one of ImmunoGen's highly potent cancer-cell killing agents specifically to tumor cells. The most advanced compound using ImmunoGen's TAP technology, Kadcyla, is marketed in the US by Genentech, a member of the Roche Group, and undergoing regulatory review in the European Union and Japan. ImmunoGen has four wholly owned clinical-stage compounds, with additional compounds in the clinic through partnerships. More information about ImmunoGen can be found at www.immunogen.com.
References
1Setiady et al., AACR 2013, abstract #5463
2Chittenden et al., AACR 2013, abstract #5467
3Ponte et al., AACR 2013, abstract #5483
4American Cancer Society (2013), Cancer Facts & Figures
5American Cancer Society (2013), Lung Cancer Detailed Guide
Kadcyla®, Erbitux®, and Tarceva® are trademarks of their respective owners.
Gibt es Details zur UBS sehr negativer Einschätzung? (die nicht neu zu sein scheint)... "UBS has extremely negative comments on $IMGN - We believe today’s pipeline updates should raise concern about EACH compound’s viability...UBS maintain Sell & reduce PT to $8.50. Toxicity reduces confidence in the pipeline; Delays in catalysts put focus on higher spending.... UBS: every compound in the clinic pot suffers from serious tox, which in our opinion, is related 2 leakage of the cytotoxic agent $IMGN"
oder weitere Kommentare auf Twitter...
- "$IMGN '529 in NHL is taking longer than expected due to DLT's at very low doses; no longer going to release interim 901 data via @ianestepan"
- "$imGN just said they r seeing DLT's at very low doses of their compounds (didnt hear which one) so dosing studies are taking longer"
- "$IMGN's linker is problematic. One of these days, people will realize Roche did A LOT of its own ADC work on Kadcyla."
- "But IMGN529 has the same SMCC-DM1 combination as Kadcyla."
- "Roche hasn't used their linker much since."
- "Saddest part of this? IMGN has made no progress on their linker in over a decade. Brutal indictment of their R&D."
Ist darüber etwas bekannt? Hat Roche für Kadcyla keinen IMGN-Linker verwendet? Falls ja, gibt es wirklich Problem mit dem Linker? Das könnte leider dann wirklich Folgen für die gesamte Pipeline haben! Es ist ein wenig merkwürdig, dass Genentech den ersten ADC mit IMGN entwickelt, dann aber die komplette eigene ADC-Pipeline auf SGEN umstellt oder sehe ich das falsch?
Sorry, falls ich zu kritisch nachhake... den EGFR-ADC finde ich schon sehr spannend. Für ein Investment möchte ich aber auch wissen, ob es mögliche negative Überraschungen geben kann. IMGN ist meiner Meinung nach bezügl. Kadcyla achon ausreichend bewertet (bei ca. 4% Royalties)... Potential müsste aus der weiteren eigenen Pipeline kommen. SGEN ist dagegen für mein Gefühl sehr hoch bewertet mit über 5 Mrd USD MK... das lässt sich für mich nicht durch Adcetris erklären, ein großer Teil der Bewertung scheint für die Technologie zu gelten. Demnach sieht es auch danach aus, dass SGEN hier die Nase vorne hat gegenüber der Technologie von IMGN.
Gruß
ipollit
oder weitere Kommentare auf Twitter...
- "$IMGN '529 in NHL is taking longer than expected due to DLT's at very low doses; no longer going to release interim 901 data via @ianestepan"
- "$imGN just said they r seeing DLT's at very low doses of their compounds (didnt hear which one) so dosing studies are taking longer"
- "$IMGN's linker is problematic. One of these days, people will realize Roche did A LOT of its own ADC work on Kadcyla."
- "But IMGN529 has the same SMCC-DM1 combination as Kadcyla."
- "Roche hasn't used their linker much since."
- "Saddest part of this? IMGN has made no progress on their linker in over a decade. Brutal indictment of their R&D."
Ist darüber etwas bekannt? Hat Roche für Kadcyla keinen IMGN-Linker verwendet? Falls ja, gibt es wirklich Problem mit dem Linker? Das könnte leider dann wirklich Folgen für die gesamte Pipeline haben! Es ist ein wenig merkwürdig, dass Genentech den ersten ADC mit IMGN entwickelt, dann aber die komplette eigene ADC-Pipeline auf SGEN umstellt oder sehe ich das falsch?
Sorry, falls ich zu kritisch nachhake... den EGFR-ADC finde ich schon sehr spannend. Für ein Investment möchte ich aber auch wissen, ob es mögliche negative Überraschungen geben kann. IMGN ist meiner Meinung nach bezügl. Kadcyla achon ausreichend bewertet (bei ca. 4% Royalties)... Potential müsste aus der weiteren eigenen Pipeline kommen. SGEN ist dagegen für mein Gefühl sehr hoch bewertet mit über 5 Mrd USD MK... das lässt sich für mich nicht durch Adcetris erklären, ein großer Teil der Bewertung scheint für die Technologie zu gelten. Demnach sieht es auch danach aus, dass SGEN hier die Nase vorne hat gegenüber der Technologie von IMGN.
Gruß
ipollit
Von wann stammen die Kommentare?
IMGN289 verwendet den gleichen Linker und das gleiche Toxin wie Kadcyla/T-DM1.
Und Roche äußert sich über Kadcyla schlichtweg euphorisch (gerade gestern wieder im persönlichen Gespräch). Auf der ESMO-Tagung im September werden neue Daten präsentiert.
Hinsichtlich des IMGN901 sind gewisse Toxizitätsprobleme bereits länger bekannt. Auch nicht neu sind die Verkaufsempfehlungen der UBS. In den UBS-Studien wurden jedoch nie die in den von Dir zitierten Kommentaren zum Ausdruck gebrachten Zweifel formuliert.
IMGN289 verwendet den gleichen Linker und das gleiche Toxin wie Kadcyla/T-DM1.
Und Roche äußert sich über Kadcyla schlichtweg euphorisch (gerade gestern wieder im persönlichen Gespräch). Auf der ESMO-Tagung im September werden neue Daten präsentiert.
Hinsichtlich des IMGN901 sind gewisse Toxizitätsprobleme bereits länger bekannt. Auch nicht neu sind die Verkaufsempfehlungen der UBS. In den UBS-Studien wurden jedoch nie die in den von Dir zitierten Kommentaren zum Ausdruck gebrachten Zweifel formuliert.
Zitat von ipollit: "UBS has extremely negative comments on $IMGN - We believe today’s pipeline updates should raise concern about EACH compound’s viability...UBS maintain Sell & reduce PT to $8.50. Toxicity reduces confidence in the pipeline; Delays in catalysts put focus on higher spending.... UBS: every compound in the clinic pot suffers from serious tox, which in our opinion, is related 2 leakage of the cytotoxic agent $IMGN"
Wer schreibt das?
Antwort auf Beitrag Nr.: 45.172.805 von Joschka Schröder am 02.08.13 21:20:27Hallo Joschka,
wurde heute auf twitter gepostet...
https://twitter.com/search?q=%24imgn&src=typd
https://twitter.com/ianestepan
Gruß
wurde heute auf twitter gepostet...
https://twitter.com/search?q=%24imgn&src=typd
https://twitter.com/ianestepan
Gruß
Antwort auf Beitrag Nr.: 45.172.843 von ipollit am 02.08.13 21:28:38zumindest scheint der Kadcyla Linker anders zu sein, als die anderen (alle?) IMGN-Linker:
http://www.orf-blog.com/seattle-genetics-strengthens-its-foo…
Genentech’s decision is a serious blow to Immunogen, but it does not mean that Genentech will not use its technology at all. Genentech still has licenses for 4 targets from Immunogen based on deals from 2005 and 2008. The fact that until now no clinical program has resulted from these deals is a bad indication but it does not completely rule out this option.
...
Although it seems that when given a choice, Genentech prefers Seattle Genetics’ technology, there are cases in which Immunogen’s technology is superior to that of Seattle Genetics. In particular, targets that do not get internalized efficiently seem more suitable for Immunogen’s (cleavable gestrichen) disulfide linkers like those used in all of its programs except T-DM1. Genentech appears to avoid these targets, as ADCs based on disulfide linkers are thought to have a less favorable therapeutic window (efficacy/safety ratio), even though Immunogen and its partners were able to reach clinically active doses in most clinical trials.
Indeed, to date, the only two ADCs which demonstrated sufficient potency as single agents are T-DM1 and SGN-35, both utilize (non-cleavable gestrichen) more stable linkers (either uncleavable or peptide based) for targets that are good internalizers. The rest of ADCs in Immunogen’s pipeline have not performed as nicely as T-DM1, although it is hard to attribute a given clinical profile to a single element. IMGN901, for example, had activity in multiple indications including lung cancer and multiple myeloma, but it was not potent enough as mono-therapy. This forced Immunogen to evaluate IMGN901 in combination with standard of care in three indications.
Developing a drug in combination is by definition more challenging. It requires comparative trials that are longer and more expensive, and it also has safety implications that may prevent optimal dosing. Most importantly, proof of concept is reached only after a large randomized phase II trial, a formidable challenge on its own (discussed here). This brings up the debate on whether targets that require (cleavable gestrichen) disulfide linkers should be pursued at all.
There may still be cases where ADCs based on (cleavable gestrichen) disulfide linkers show sufficient potency as single agents, especially in blood cancers that are considered less challenging than solid tumors. This year at ASCO, Sanofi is expected to present data for SAR3419, a CD19 ADC, given weekly as mono-therapy. Sanofi already announced this program will move into phase II as single agent, so one could expect data to be positive (although there are a lot of other promising agents in clinical development for NHL).
...
Interestingly, Sanofi’s SAR3419 utilizes Immunogen’s disulfide linker, even though CD19 is highly internalized. In one of Genentech’s seminal publications on ADCs for blood cancers, researchers also found that CD19 ADCs using Immunogen’s non-cleavable linkers were ineffective. Seattle Genetics published a paper in 2008, showing good efficacy with its non-cleavable linker.
...
Was das bedeutet und ob es hier überhaupt von Relevanz ist, weiß ich nicht.
Gruß
ipollit
http://www.orf-blog.com/seattle-genetics-strengthens-its-foo…
Genentech’s decision is a serious blow to Immunogen, but it does not mean that Genentech will not use its technology at all. Genentech still has licenses for 4 targets from Immunogen based on deals from 2005 and 2008. The fact that until now no clinical program has resulted from these deals is a bad indication but it does not completely rule out this option.
...
Although it seems that when given a choice, Genentech prefers Seattle Genetics’ technology, there are cases in which Immunogen’s technology is superior to that of Seattle Genetics. In particular, targets that do not get internalized efficiently seem more suitable for Immunogen’s (cleavable gestrichen) disulfide linkers like those used in all of its programs except T-DM1. Genentech appears to avoid these targets, as ADCs based on disulfide linkers are thought to have a less favorable therapeutic window (efficacy/safety ratio), even though Immunogen and its partners were able to reach clinically active doses in most clinical trials.
Indeed, to date, the only two ADCs which demonstrated sufficient potency as single agents are T-DM1 and SGN-35, both utilize (non-cleavable gestrichen) more stable linkers (either uncleavable or peptide based) for targets that are good internalizers. The rest of ADCs in Immunogen’s pipeline have not performed as nicely as T-DM1, although it is hard to attribute a given clinical profile to a single element. IMGN901, for example, had activity in multiple indications including lung cancer and multiple myeloma, but it was not potent enough as mono-therapy. This forced Immunogen to evaluate IMGN901 in combination with standard of care in three indications.
Developing a drug in combination is by definition more challenging. It requires comparative trials that are longer and more expensive, and it also has safety implications that may prevent optimal dosing. Most importantly, proof of concept is reached only after a large randomized phase II trial, a formidable challenge on its own (discussed here). This brings up the debate on whether targets that require (cleavable gestrichen) disulfide linkers should be pursued at all.
There may still be cases where ADCs based on (cleavable gestrichen) disulfide linkers show sufficient potency as single agents, especially in blood cancers that are considered less challenging than solid tumors. This year at ASCO, Sanofi is expected to present data for SAR3419, a CD19 ADC, given weekly as mono-therapy. Sanofi already announced this program will move into phase II as single agent, so one could expect data to be positive (although there are a lot of other promising agents in clinical development for NHL).
...
Interestingly, Sanofi’s SAR3419 utilizes Immunogen’s disulfide linker, even though CD19 is highly internalized. In one of Genentech’s seminal publications on ADCs for blood cancers, researchers also found that CD19 ADCs using Immunogen’s non-cleavable linkers were ineffective. Seattle Genetics published a paper in 2008, showing good efficacy with its non-cleavable linker.
...
Was das bedeutet und ob es hier überhaupt von Relevanz ist, weiß ich nicht.
Gruß
ipollit
Antwort auf Beitrag Nr.: 45.172.851 von Joschka Schröder am 02.08.13 21:29:31diesen Satz konkret hat Feuerstein geschrieben, den ich in der Tat für recht reißerisch und oberflächlich halte... die anderen Sätze kommen aber von Leuten, die meiner Meinung nach sich zumindest mit der Biotech-Materie ein wenig auskennen...
geschrieben, den ich in der Tat für recht reißerisch und oberflächlich halte... die anderen Sätze kommen aber von Leuten, die meiner Meinung nach sich zumindest mit der Biotech-Materie ein wenig auskennen...
Gruß
 geschrieben, den ich in der Tat für recht reißerisch und oberflächlich halte... die anderen Sätze kommen aber von Leuten, die meiner Meinung nach sich zumindest mit der Biotech-Materie ein wenig auskennen...
geschrieben, den ich in der Tat für recht reißerisch und oberflächlich halte... die anderen Sätze kommen aber von Leuten, die meiner Meinung nach sich zumindest mit der Biotech-Materie ein wenig auskennen...Gruß
Antwort auf Beitrag Nr.: 45.172.919 von ipollit am 02.08.13 21:50:27so ganz klar ist das auch nicht... so eindeutig scheint das mit dem Linker nicht zu sein. Der Beitrag von Ohad Hammer ist auch schon mehr als 2 Jahre alt und er hat nachträglich "cleavable" durchgestrichen.
Im Folgenden steht dagegen, dass IMGN eine Reihe von Linkern mit jeweils unterschiedlichen Eigenschaften verwendet. So kann es sein, dass einzelne Linker scheitern, aber auch gute dabei sein... man sieht es erst in der Klinik, ob etwas funktioniert.
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
... “How you connect the chemotherapy to the antibody turns out to be just absolutely critically important for being able to drive therapeutic index”—the amount of drug that can be given before safety is compromised, Genentech’s Mellman points out.
Because the linkers used in Adcetris and T-DM1 are stable, the entire ADC is internalized into the cell before the drug is released. In Adcetris, an enzyme found inside the cancer cell cleaves the cytotoxin; in T-DM1, the antibody is digested in the lysosome, releasing the toxin.
Both of those linkers do their job, but companies are working on linkers that will make ADCs more effective. ImmunoGen, for example, has developed a family of linkers. Some are cleavable, some are noncleavable, and some allow the toxin to migrate through the cell membrane to neighboring cells. The company recently got the green light from FDA to start human tests of IMGN853, an ovarian cancer treatment with a linker that counters the mechanism cells use to pump out drugs before they can do their work.
Once IMGN853 enters the clinic, ImmunoGen will have four different linkers in trials, Junius says. “But people shouldn’t perceive that each linker is an improvement on earlier linkers,” he cautions. Rather, the goal is to find the right properties for a particular ADC, such as how the linker affects the activity of the toxin and how it allows the toxin to be released in the cell.
“We’re learning constantly about what’s a good and what’s a bad linker,” says Hans-Peter Gerber, head of bioconjugate discovery and development in Pfizer’s oncology research unit. “The rule book is not written yet.”
...
Gruß
ipollit
Im Folgenden steht dagegen, dass IMGN eine Reihe von Linkern mit jeweils unterschiedlichen Eigenschaften verwendet. So kann es sein, dass einzelne Linker scheitern, aber auch gute dabei sein... man sieht es erst in der Klinik, ob etwas funktioniert.
http://investorshub.advfn.com/boards/read_msg.aspx?message_i…
... “How you connect the chemotherapy to the antibody turns out to be just absolutely critically important for being able to drive therapeutic index”—the amount of drug that can be given before safety is compromised, Genentech’s Mellman points out.
Because the linkers used in Adcetris and T-DM1 are stable, the entire ADC is internalized into the cell before the drug is released. In Adcetris, an enzyme found inside the cancer cell cleaves the cytotoxin; in T-DM1, the antibody is digested in the lysosome, releasing the toxin.
Both of those linkers do their job, but companies are working on linkers that will make ADCs more effective. ImmunoGen, for example, has developed a family of linkers. Some are cleavable, some are noncleavable, and some allow the toxin to migrate through the cell membrane to neighboring cells. The company recently got the green light from FDA to start human tests of IMGN853, an ovarian cancer treatment with a linker that counters the mechanism cells use to pump out drugs before they can do their work.
Once IMGN853 enters the clinic, ImmunoGen will have four different linkers in trials, Junius says. “But people shouldn’t perceive that each linker is an improvement on earlier linkers,” he cautions. Rather, the goal is to find the right properties for a particular ADC, such as how the linker affects the activity of the toxin and how it allows the toxin to be released in the cell.
“We’re learning constantly about what’s a good and what’s a bad linker,” says Hans-Peter Gerber, head of bioconjugate discovery and development in Pfizer’s oncology research unit. “The rule book is not written yet.”
...
Gruß
ipollit
Wer auch immer Feuerstein ist ... wenn er solch einen Mist schreibt, ist er ein Dummkopf, dessen Elaborate ich an Deiner Stelle nicht mehr lesen würde.
Da es schon spät ist, müssen wir die Diskussion vertagen. Ich werde am Wochenende versuchen, etwas zum Thema zu schreiben. Tatsache ist, dass die meisten, aber nicht alle IMGN-Eigenentwicklungen wie Kadcyla konzipiert sind. Von meinem persönlichen Favoriten IMGN289 abgesehen, habe ich im Hinblick auf die Eigenentwicklungen allerdings keine besonders hohen Erwartungen. Alles weitere am WE.
Da es schon spät ist, müssen wir die Diskussion vertagen. Ich werde am Wochenende versuchen, etwas zum Thema zu schreiben. Tatsache ist, dass die meisten, aber nicht alle IMGN-Eigenentwicklungen wie Kadcyla konzipiert sind. Von meinem persönlichen Favoriten IMGN289 abgesehen, habe ich im Hinblick auf die Eigenentwicklungen allerdings keine besonders hohen Erwartungen. Alles weitere am WE.
Antwort auf Beitrag Nr.: 45.173.227 von Joschka Schröder am 02.08.13 22:53:21A. Feuerstein... http://www.thestreet.com/author/1352996/adam-feuerstein/all.…
Antwort auf Beitrag Nr.: 45.173.303 von ipollit am 02.08.13 23:17:21Vielen Dank!
Before joining TheStreet in March 2001, Feuerstein covered business software for Upside.com. Prior to that he covered a variety of business beats, including technology and commercial real estate, at the San Francisco Business Times.
Feuerstein graduated from Emory University with a bachelor's degree in political science.
Mir ist rätselhat, woher man mit einer derartigen Ausbildung den Mut nimmt, Biotech-Kolumnen zu schreiben. Aber jetzt wundert mich nichts mehr.
Before joining TheStreet in March 2001, Feuerstein covered business software for Upside.com. Prior to that he covered a variety of business beats, including technology and commercial real estate, at the San Francisco Business Times.
Feuerstein graduated from Emory University with a bachelor's degree in political science.
Mir ist rätselhat, woher man mit einer derartigen Ausbildung den Mut nimmt, Biotech-Kolumnen zu schreiben. Aber jetzt wundert mich nichts mehr.
@ipollit
Tut mir leid, aber ich pack´s heute nicht mehr.
Obwohl ich mir fast das ganze WE mit Linkertechnologien und ADC´s um die Ohren geschlagen habe, bin ich mit dem Thema noch immer nicht durch. Review-Artikel, Patente, Kongressbeiträge ... ist leider alles etwas ausgewartet. Aber das Thema ist auch nicht ganz trivial und die Entwicklung schreitet ständig voran. Ich hoffe, dass ich in den nächsten Tagen, möglichst schon morgen oder übermorgen, so weit bin, das Thema mit einem halbwegs konstruktiven Beitrag (vorerst) abzuschließen.
Tut mir leid, aber ich pack´s heute nicht mehr.
Obwohl ich mir fast das ganze WE mit Linkertechnologien und ADC´s um die Ohren geschlagen habe, bin ich mit dem Thema noch immer nicht durch. Review-Artikel, Patente, Kongressbeiträge ... ist leider alles etwas ausgewartet. Aber das Thema ist auch nicht ganz trivial und die Entwicklung schreitet ständig voran. Ich hoffe, dass ich in den nächsten Tagen, möglichst schon morgen oder übermorgen, so weit bin, das Thema mit einem halbwegs konstruktiven Beitrag (vorerst) abzuschließen.
Hallo Joschka,
kein Problem... hat ja keine Eile, es geht auch mehr darum, die Dinge immer auch kritisch zu hinterfragen, um eventuelle Risiken zu entdecken. Kritische Betrachtungen sind meiner Meinung nach oft wertvoller als die einseitig positiven.
Gruß
ipollit
kein Problem... hat ja keine Eile, es geht auch mehr darum, die Dinge immer auch kritisch zu hinterfragen, um eventuelle Risiken zu entdecken. Kritische Betrachtungen sind meiner Meinung nach oft wertvoller als die einseitig positiven.
Gruß
ipollit
Antwort auf Beitrag Nr.: 45.179.101 von ipollit am 04.08.13 22:07:46Wie orientierungslos die Analystengemeinde ist, zeigt sich allein schon an den aktuellen Kurzielen, die am 2.8.2013 formuliert worden sind:
UBS: 8,50 USD (vorher 9,00 USD)
Credit Suisse: 16 USD (vorher 15 USD)
Jefferies: 21 USD (unverändert)
Ich habe die Studien gelesen ... und sie sind allesamt mit Fehlern behaftet. Der UBS-Analyst bewegt sich dabei jenseits von gut und böse, auch wenn hinsichtlich einiger Linkertechnologien durchaus Kritik und Skepsis angebracht ist.
Details wie angekündigt später.
UBS: 8,50 USD (vorher 9,00 USD)
Credit Suisse: 16 USD (vorher 15 USD)
Jefferies: 21 USD (unverändert)
Ich habe die Studien gelesen ... und sie sind allesamt mit Fehlern behaftet. Der UBS-Analyst bewegt sich dabei jenseits von gut und böse, auch wenn hinsichtlich einiger Linkertechnologien durchaus Kritik und Skepsis angebracht ist.
Details wie angekündigt später.
ImmunoGen, Inc. Reports Fourth Quarter and Fiscal Year 2013 Financial Results and Provides Fiscal Year 2014 Financial Guidance and Corporate Update
Kadcyla® sales off to strong start. Decision on approval in European Union, TH3RESA Phase III data presentation expected by Roche in 2H2013.
ImmunoGen progress with its proprietary pipeline includes advancement of third wholly owned product candidate for solid tumors, IMGN289, to active IND and presentation of first clinical data with IMGN853. Company remains on track to complete enrollment in IMGN901 NORTH Phase II trial in 2013 and to make key next-step decisions in mid-2014.
ImmunoGen advancement of its wholly owned compounds to clinical proof of concept well supported by the Company's solid financial position and many cash-generating partnerships.
WALTHAM, Mass.--(BUSINESS WIRE)-- ImmunoGen, Inc. (Nasdaq: IMGN), a biotechnology company that develops anticancer therapeutics using its Targeted Antibody Payload (TAP) antibody-drug conjugate (ADC) technology, today reported financial results for the three-month period and fiscal year ended June 30, 2013. ImmunoGen also provided guidance for its 2014 fiscal year and an update on the Company.
"We are starting to see the first commercial rewards from our many years of scientific innovation," commented Daniel Junius, President and CEO. "Kadcyla sales are off to a strong start in the US for its first indication, with many additional approvals expected. It is particularly gratifying to hear from patients about the difference Kadcyla is making for them and their caregivers."
Mr. Junius continued, "We're using our industry-leading technology and expertise to develop a pipeline of wholly owned compounds for cancers with significant unmet need today. We plan to meaningfully advance our clinical-stage pipeline over the course of this fiscal year, with achievements expected to include: initiation of clinical testing with our IMGN289 product candidate; presentation of additional clinical data for IMGN853; making a next-step decision for IMGN901; and having the dosing information needed to begin evaluation of our IMGN529 compound in specific non-Hodgkin's lymphoma subtypes. We also expect a number of partner-related events over the course of this fiscal year. For Kadcyla alone, we're expecting a decision about approval in the European Union and presentation of data from the TH3RESA trial within the next few months."
Product Pipeline Update
Kadcyla is an approved product that utilizes the Company's TAP technology. It is being developed and commercialized by Roche under an agreement with ImmunoGen. ImmunoGen receives and recognizes royalties on Kadcyla sales one quarter after the sales are reported by Roche.
Kadcyla gained FDA marketing approval in the US on February 22, 2013 for the treatment of people with HER2-positive metastatic breast cancer (BC) who had received prior treatment with Herceptin® (trastuzumab) and a taxane. Roche reported "strong uptake" of Kadcyla in the US, with year-to-date sales of 82 million CHF (approximately $87 million) through June 30, 2013.
Kadcyla was approved in Switzerland in May 2013, and Roche reported sales through June 30 of 1 MM CHF. Roche expects a decision about approval in the EU in 2H2013. A marketing application is also under review in Japan.
Roche is assessing Kadcyla in a number of additional indications, including for first-line treatment of HER2-positive metastatic BC (MARIANNE trial), for uses in early stage HER2-positive BC (including the KATHERINE trial), and for the treatment of advanced HER2-positive stomach cancer (GATSBY trial). The progression-free survival (PFS) endpoint of TH3RESA has been met, and Roche intends to submit these data for presentation at the ESMO annual meeting Sept. 27-Oct. 1, 2013. Roche expects results from MARIANNE in late 2014 and to apply for first-line treatment of HER2-positive metastatic BC and for treatment of advanced HER2-positive gastric cancer in 2015.
IMGN901 is ImmunoGen's lead wholly owned product candidate and is being evaluated for first-line treatment of small-cell lung cancer (SCLC). Its target, CD56, is found on a variety of cancers, including SCLC, other tumors of neuroendocrine origin, and multiple myeloma.
The Company's NORTH Phase II trial is designed to assess whether the addition of IMGN901 to standard of care etoposide/carboplatin (E/C) provides a meaningful benefit over E/C alone as first-line treatment for newly diagnosed, extensive disease SCLC. The primary endpoint is progression-free survival (PFS), with objective response rate and overall survival (OS) among the secondary endpoints. Current first-line therapy for this cancer has a median PFS of 5-5.5 months and OS of 9-11 months.
ImmunoGen expects to complete patient enrollment this quarter and to have the data needed to make next-step decisions for the compound by mid-2014. The Company expects NORTH clinical data will be reported at one or more medical conferences in 2014.
IMGN853 is a potential new therapy for ovarian, endometrial, and adenocarcinoma lung cancers, as well as other cancers that overexpress its folate receptor α (FRα) target. This TAP compound is also wholly owned by ImmunoGen.
The first IMGN853 clinical data were reported at the ASCO annual meeting in June 2013. They were from the dose-escalation part of the Phase I trial underway, which is designed to establish the IMGN853 dose for the expansion phase of the trial. Dose levels ranging from 0.15 to 7.0 mg/kg had been evaluated, and at the time of data cut-off for presentation, the 5.0 mg/kg dose was being further explored. Evidence of activity was reported in patients with strong FRα expression who had received IMGN853 at doses of 3.3 mg/kg or above.
ImmunoGen expects to start the expansion phase of this trial later this year, and to report updated findings from it in disease-specific populations in mid-2014.
IMGN289 is ImmunoGen's third wholly owned TAP compound for solid tumor indications, and is a potential new treatment for EGFR-positive cancers, including most squamous cell lung and head and neck cancers.
In preclinical testing, IMGN289 was found to be highly active against cancer cells resistant to EGFR inhibiting agents − including tyrosine kinase inhibitors (TKIs) — as well as those responsive to EGFR inhibition. This is attributed to the ability of IMGN289 to kill cancer cells directly with its potent cytotoxic component as well as through EGFR inhibition. The IMGN289 Investigational New Drug (IND) application is now active and ImmunoGen expects to begin its clinical testing by the end of 2013.
IMGN529 is ImmunoGen's lead wholly owned TAP compound for hematological malignancies. It is a potential treatment for CD37-positive non-Hodgkin's lymphoma (NHL) and chronic lymphocytic leukemia (CLL), and is currently in Phase I testing for NHL.
In addition to Kadcyla, six other TAP compounds and a CD38-targeting therapeutic antibody are in clinical testing through ImmunoGen's collaborative partnerships, with additional compounds progressing preclinically.
Fiscal Year 2013 Financial Results
For the Company's fiscal year ended June 30, 2013 (FY2013), ImmunoGen reported a net loss of $72.8 million, or $0.87 per basic and diluted share, compared to a net loss of $73.3 million, or $0.95 per basic and diluted share, for its fiscal year ended June 30, 2012 (FY2012). For the quarter ending June 30, 2013, ImmunoGen reported a net loss of $21.9 million, or $0.26 per basic and diluted share, compared to a net loss of $22.4 million, or $0.29 per basic and diluted share, for the same quarter in FY2012.
Revenues in FY2013 were $35.5 million, compared to $16.4 million in FY2012. Revenues in FY2013 include $24.2 million of license and milestone fees compared to $9.2 million in FY2012. The FY2013 fees include the $10.5 million milestone payment from Roche earned with the approval of Kadcyla in the US and $11.1 million of amortization of upfront license fees received from Novartis. The FY2012 fees include $5.0 million in milestone payments earned with partner advancement of three earlier-stage clinical TAP compounds. Revenues in FY2013 also include $7.9 million of research and development support fees, compared to $4.5 million for FY2012, and $2.8 million of clinical materials revenue, compared to $2.7 million for FY2012. The differences in support fees and clinical material revenue are primarily due to the variable nature in the amount of research and in the number of batches of clinical materials produced and released for partners on a year-to-year basis. Revenues in FY2013 also include $0.6 million of royalty payments received from Roche in June 2013 for sales of Kadcyla during the three-month period ended March 31, 2013. Kadcyla was approved for marketing in the US in late February 2013.
Operating expenses in FY2013 were $108.5 million, compared to $89.6 million in FY2012. Operating expenses in FY2013 include research and development expenses of $87.1 million, compared to $69.2 million in FY2012. This change is primarily due to increased spending by the Company to aggressively advance its wholly owned product candidates, and includes increased costs for third-party production of antibody for use in clinical materials and also increased personnel expenses. Operating expenses also include general and administrative expenses of $21.5 million in FY2013, compared to $20.4 million in FY2012. This increase is primarily due to increased personnel expenses, particularly stock compensation expense.
ImmunoGen had approximately $195.0 million in cash and cash equivalents as of June 30, 2013, compared with $160.9 million as of June 30, 2012 and had no debt outstanding in either period. Cash used in operations was $60.3 million in FY2013, compared with $34.3 million in FY2012; the FY2012 amount includes a $20 million upfront payment from a new collaboration established in that time period. Capital expenditures were $3.8 million and $2.9 million for FY2013 and FY2012, respectively.
Financial Guidance for FY 2014
For its fiscal year ending June 30, 2014, ImmunoGen expects its revenues to be between $66 million and $70 million, its expenses to be between $140 million and $144 million, its net loss to be between $72 million and $76 million, its cash used in operations to be between $74 million and $78 million, and its capital expenditures to be between $6 million and $8 million. Cash and marketable securities at June 30, 2014 are anticipated to be between $114 million and $118 million.
"Kadcyla sales in the US are off to a good start, and we believe it will become a very successful global product — one that makes an important difference for many patients," commented Gregory Perry, Executive Vice President and CFO. "We are aggressively advancing our wholly owned product candidates — while maintaining strong financial discipline — and we are working to generate proof of concept clinical data before the end of this fiscal year."
Kadcyla® sales off to strong start. Decision on approval in European Union, TH3RESA Phase III data presentation expected by Roche in 2H2013.
ImmunoGen progress with its proprietary pipeline includes advancement of third wholly owned product candidate for solid tumors, IMGN289, to active IND and presentation of first clinical data with IMGN853. Company remains on track to complete enrollment in IMGN901 NORTH Phase II trial in 2013 and to make key next-step decisions in mid-2014.
ImmunoGen advancement of its wholly owned compounds to clinical proof of concept well supported by the Company's solid financial position and many cash-generating partnerships.
WALTHAM, Mass.--(BUSINESS WIRE)-- ImmunoGen, Inc. (Nasdaq: IMGN), a biotechnology company that develops anticancer therapeutics using its Targeted Antibody Payload (TAP) antibody-drug conjugate (ADC) technology, today reported financial results for the three-month period and fiscal year ended June 30, 2013. ImmunoGen also provided guidance for its 2014 fiscal year and an update on the Company.
"We are starting to see the first commercial rewards from our many years of scientific innovation," commented Daniel Junius, President and CEO. "Kadcyla sales are off to a strong start in the US for its first indication, with many additional approvals expected. It is particularly gratifying to hear from patients about the difference Kadcyla is making for them and their caregivers."
Mr. Junius continued, "We're using our industry-leading technology and expertise to develop a pipeline of wholly owned compounds for cancers with significant unmet need today. We plan to meaningfully advance our clinical-stage pipeline over the course of this fiscal year, with achievements expected to include: initiation of clinical testing with our IMGN289 product candidate; presentation of additional clinical data for IMGN853; making a next-step decision for IMGN901; and having the dosing information needed to begin evaluation of our IMGN529 compound in specific non-Hodgkin's lymphoma subtypes. We also expect a number of partner-related events over the course of this fiscal year. For Kadcyla alone, we're expecting a decision about approval in the European Union and presentation of data from the TH3RESA trial within the next few months."
Product Pipeline Update
Kadcyla is an approved product that utilizes the Company's TAP technology. It is being developed and commercialized by Roche under an agreement with ImmunoGen. ImmunoGen receives and recognizes royalties on Kadcyla sales one quarter after the sales are reported by Roche.
Kadcyla gained FDA marketing approval in the US on February 22, 2013 for the treatment of people with HER2-positive metastatic breast cancer (BC) who had received prior treatment with Herceptin® (trastuzumab) and a taxane. Roche reported "strong uptake" of Kadcyla in the US, with year-to-date sales of 82 million CHF (approximately $87 million) through June 30, 2013.
Kadcyla was approved in Switzerland in May 2013, and Roche reported sales through June 30 of 1 MM CHF. Roche expects a decision about approval in the EU in 2H2013. A marketing application is also under review in Japan.
Roche is assessing Kadcyla in a number of additional indications, including for first-line treatment of HER2-positive metastatic BC (MARIANNE trial), for uses in early stage HER2-positive BC (including the KATHERINE trial), and for the treatment of advanced HER2-positive stomach cancer (GATSBY trial). The progression-free survival (PFS) endpoint of TH3RESA has been met, and Roche intends to submit these data for presentation at the ESMO annual meeting Sept. 27-Oct. 1, 2013. Roche expects results from MARIANNE in late 2014 and to apply for first-line treatment of HER2-positive metastatic BC and for treatment of advanced HER2-positive gastric cancer in 2015.
IMGN901 is ImmunoGen's lead wholly owned product candidate and is being evaluated for first-line treatment of small-cell lung cancer (SCLC). Its target, CD56, is found on a variety of cancers, including SCLC, other tumors of neuroendocrine origin, and multiple myeloma.
The Company's NORTH Phase II trial is designed to assess whether the addition of IMGN901 to standard of care etoposide/carboplatin (E/C) provides a meaningful benefit over E/C alone as first-line treatment for newly diagnosed, extensive disease SCLC. The primary endpoint is progression-free survival (PFS), with objective response rate and overall survival (OS) among the secondary endpoints. Current first-line therapy for this cancer has a median PFS of 5-5.5 months and OS of 9-11 months.
ImmunoGen expects to complete patient enrollment this quarter and to have the data needed to make next-step decisions for the compound by mid-2014. The Company expects NORTH clinical data will be reported at one or more medical conferences in 2014.
IMGN853 is a potential new therapy for ovarian, endometrial, and adenocarcinoma lung cancers, as well as other cancers that overexpress its folate receptor α (FRα) target. This TAP compound is also wholly owned by ImmunoGen.
The first IMGN853 clinical data were reported at the ASCO annual meeting in June 2013. They were from the dose-escalation part of the Phase I trial underway, which is designed to establish the IMGN853 dose for the expansion phase of the trial. Dose levels ranging from 0.15 to 7.0 mg/kg had been evaluated, and at the time of data cut-off for presentation, the 5.0 mg/kg dose was being further explored. Evidence of activity was reported in patients with strong FRα expression who had received IMGN853 at doses of 3.3 mg/kg or above.
ImmunoGen expects to start the expansion phase of this trial later this year, and to report updated findings from it in disease-specific populations in mid-2014.
IMGN289 is ImmunoGen's third wholly owned TAP compound for solid tumor indications, and is a potential new treatment for EGFR-positive cancers, including most squamous cell lung and head and neck cancers.
In preclinical testing, IMGN289 was found to be highly active against cancer cells resistant to EGFR inhibiting agents − including tyrosine kinase inhibitors (TKIs) — as well as those responsive to EGFR inhibition. This is attributed to the ability of IMGN289 to kill cancer cells directly with its potent cytotoxic component as well as through EGFR inhibition. The IMGN289 Investigational New Drug (IND) application is now active and ImmunoGen expects to begin its clinical testing by the end of 2013.
IMGN529 is ImmunoGen's lead wholly owned TAP compound for hematological malignancies. It is a potential treatment for CD37-positive non-Hodgkin's lymphoma (NHL) and chronic lymphocytic leukemia (CLL), and is currently in Phase I testing for NHL.
In addition to Kadcyla, six other TAP compounds and a CD38-targeting therapeutic antibody are in clinical testing through ImmunoGen's collaborative partnerships, with additional compounds progressing preclinically.
Fiscal Year 2013 Financial Results
For the Company's fiscal year ended June 30, 2013 (FY2013), ImmunoGen reported a net loss of $72.8 million, or $0.87 per basic and diluted share, compared to a net loss of $73.3 million, or $0.95 per basic and diluted share, for its fiscal year ended June 30, 2012 (FY2012). For the quarter ending June 30, 2013, ImmunoGen reported a net loss of $21.9 million, or $0.26 per basic and diluted share, compared to a net loss of $22.4 million, or $0.29 per basic and diluted share, for the same quarter in FY2012.
Revenues in FY2013 were $35.5 million, compared to $16.4 million in FY2012. Revenues in FY2013 include $24.2 million of license and milestone fees compared to $9.2 million in FY2012. The FY2013 fees include the $10.5 million milestone payment from Roche earned with the approval of Kadcyla in the US and $11.1 million of amortization of upfront license fees received from Novartis. The FY2012 fees include $5.0 million in milestone payments earned with partner advancement of three earlier-stage clinical TAP compounds. Revenues in FY2013 also include $7.9 million of research and development support fees, compared to $4.5 million for FY2012, and $2.8 million of clinical materials revenue, compared to $2.7 million for FY2012. The differences in support fees and clinical material revenue are primarily due to the variable nature in the amount of research and in the number of batches of clinical materials produced and released for partners on a year-to-year basis. Revenues in FY2013 also include $0.6 million of royalty payments received from Roche in June 2013 for sales of Kadcyla during the three-month period ended March 31, 2013. Kadcyla was approved for marketing in the US in late February 2013.
Operating expenses in FY2013 were $108.5 million, compared to $89.6 million in FY2012. Operating expenses in FY2013 include research and development expenses of $87.1 million, compared to $69.2 million in FY2012. This change is primarily due to increased spending by the Company to aggressively advance its wholly owned product candidates, and includes increased costs for third-party production of antibody for use in clinical materials and also increased personnel expenses. Operating expenses also include general and administrative expenses of $21.5 million in FY2013, compared to $20.4 million in FY2012. This increase is primarily due to increased personnel expenses, particularly stock compensation expense.
ImmunoGen had approximately $195.0 million in cash and cash equivalents as of June 30, 2013, compared with $160.9 million as of June 30, 2012 and had no debt outstanding in either period. Cash used in operations was $60.3 million in FY2013, compared with $34.3 million in FY2012; the FY2012 amount includes a $20 million upfront payment from a new collaboration established in that time period. Capital expenditures were $3.8 million and $2.9 million for FY2013 and FY2012, respectively.
Financial Guidance for FY 2014
For its fiscal year ending June 30, 2014, ImmunoGen expects its revenues to be between $66 million and $70 million, its expenses to be between $140 million and $144 million, its net loss to be between $72 million and $76 million, its cash used in operations to be between $74 million and $78 million, and its capital expenditures to be between $6 million and $8 million. Cash and marketable securities at June 30, 2014 are anticipated to be between $114 million and $118 million.
"Kadcyla sales in the US are off to a good start, and we believe it will become a very successful global product — one that makes an important difference for many patients," commented Gregory Perry, Executive Vice President and CFO. "We are aggressively advancing our wholly owned product candidates — while maintaining strong financial discipline — and we are working to generate proof of concept clinical data before the end of this fiscal year."
Der Kursrutsch die Tage war mal wieder typisch für Immunogen. (leider) Naja, wenn der "CEO Junius" Aktien verkauft reagiert der Markt meist immer so verschnupft. (aus meiner persönlichen Sicht ist der eh maßlos überbezahlt mit seinen Aktienoptionen wo er regelmäßig bekommt)
Mich machen aber eher die unterschiedlichen Kursziele der Analysten nachdenklich. Mir scheinen da ein paar Analysten von bestimmten Banken (schweizer Großbank) das Kursziel ,natürlich unbewusst, klein anzusetzen. Ein Schelm wer böses dabei denkt: schweizer Großbank , Roche = schweizer Pharmariese)
Mich machen aber eher die unterschiedlichen Kursziele der Analysten nachdenklich. Mir scheinen da ein paar Analysten von bestimmten Banken (schweizer Großbank) das Kursziel ,natürlich unbewusst, klein anzusetzen. Ein Schelm wer böses dabei denkt: schweizer Großbank , Roche = schweizer Pharmariese)
Mich machen die schon seit sehr langer Zeit vorhandenen großen Short-Positionen bei Immungen so nachdenklich. (meistens so zwischen 7-9 Mio. Aktien) Ich persönlich habe das Gefühl, da will jemand den Deckel auf dem Aktienkurs lassen. (ist aber meine ureigenste Interpretation dieser Sache)
Ich habe eine Bitte an die zumeist sehr kompetenten User dieses Threads. Könnte jemand mal ein paar Links reinstellen, die mir das Verstehen der Technologie, Materie und der Branche erleichtern. Ich möchte wirklich verstehen was da abläuft. Ich habe schon etwas bei Wikipedia reingelesen, aber Adc`s, EGFR und FRalpha-Expression bömische Dörfer geblieben. Vllt. gibt es da ja ein paar anschauliche Seiten auf deutsch, die mir das einlesen in die Thematik erleichtern. Ich möchte den Anschluss nicht verlieren und wenn möglich etwas positiv/kritisches zu diesem Thread beitragen. Danke im Voraus
Form 8-K for IMMUNOGEN INC
28-Aug-2013
Regulation FD Disclosure
ITEM 7.01 - REGULATION FD DISCLOSURE
On August 26, 2013, ImmunoGen, Inc. (referred to as "we," "us" or the "Company") entered into a license agreement with Eli Lilly and Company ("Lilly") granting Lilly rights to use our maytansinoid-based Targeted Antibody Payload (TAP) technology to develop and commercialize products directed to a specific antigen target on an exclusive basis. This license was granted pursuant to the terms of an existing Multi-Target Agreement entered into by the Company and Lilly in 2011.
In accordance with the terms of the Multi-Target Agreement, execution of the license agreement entitles us to receive development, regulatory and sales milestone payments potentially totaling $200.5 million, as well as royalties on the commercial sales of any resultant products.
28-Aug-2013
Regulation FD Disclosure
ITEM 7.01 - REGULATION FD DISCLOSURE
On August 26, 2013, ImmunoGen, Inc. (referred to as "we," "us" or the "Company") entered into a license agreement with Eli Lilly and Company ("Lilly") granting Lilly rights to use our maytansinoid-based Targeted Antibody Payload (TAP) technology to develop and commercialize products directed to a specific antigen target on an exclusive basis. This license was granted pursuant to the terms of an existing Multi-Target Agreement entered into by the Company and Lilly in 2011.
In accordance with the terms of the Multi-Target Agreement, execution of the license agreement entitles us to receive development, regulatory and sales milestone payments potentially totaling $200.5 million, as well as royalties on the commercial sales of any resultant products.
Antwort auf Beitrag Nr.: 45.335.907 von KlausAnlage am 27.08.13 18:01:52Ein kurzfristiger Rücktritt des CFO´s ist grundsätzlich negativ zu werten u. evtl. kritisch zu hinterfragen.
Bei Immunogen sehe ich das ganze weniger dramatisch, da die Bilanz für mich aufgeräumt und übersichtlich aussieht. Die Aktivseite besteht hauptsächlich aus Cash und die Verbindlichkeiten sind deutlich kleiner.
http://finance.yahoo.com/q/bs?s=IMGN
Evtl. zusammen mit den negativen Kommentaren zur Linkertechnologie ein guter Einstiegszeitpunkt, denn diese wäre aber wohl eher ein Thema des wissenschaftlichen Leiters des Unternehmens (CSO).
Des weiteren wurde heute eine Meldung zur Lizenzverlängerung mit Eli Lilly veröffentlicht. Eli Lilly darf weiterhin Immunogens TAP-Technologie zu den Konditionen der 2011er Vereinbarung verwenden.
http://biz.yahoo.com/e/130828/imgn8-k.html
Bei Immunogen sehe ich das ganze weniger dramatisch, da die Bilanz für mich aufgeräumt und übersichtlich aussieht. Die Aktivseite besteht hauptsächlich aus Cash und die Verbindlichkeiten sind deutlich kleiner.
http://finance.yahoo.com/q/bs?s=IMGN
Evtl. zusammen mit den negativen Kommentaren zur Linkertechnologie ein guter Einstiegszeitpunkt, denn diese wäre aber wohl eher ein Thema des wissenschaftlichen Leiters des Unternehmens (CSO).
Des weiteren wurde heute eine Meldung zur Lizenzverlängerung mit Eli Lilly veröffentlicht. Eli Lilly darf weiterhin Immunogens TAP-Technologie zu den Konditionen der 2011er Vereinbarung verwenden.
http://biz.yahoo.com/e/130828/imgn8-k.html
Zitat von Nase_weis_nix: Evtl. zusammen mit den negativen Kommentaren zur Linkertechnologie ein guter Einstiegszeitpunkt, denn diese wäre aber wohl eher ein Thema des wissenschaftlichen Leiters des Unternehmens (CSO).
Die Kommentierung der Linker-Technologie durch einige Analysten und ahnungslose Fondsmanager hat wenig Substanz.
Hisichtlich des in Kadcyla, IMGN289 und IMGN529 verwendeten stabilen Thioether-Linkers SMCC gibt es keinerlei Probleme.
Der spaltbare Disulfid-Linker SPP (in IMGN901) scheint im Plasma grenzwertig stabil zu ein (u.a. auffallend kurze Halbwertszeit) und führt offensichtlich zu einer unerwünschten Toxinabspaltung. Man muß abwarten, ob die Probleme bei IMGN901 durch eine Dosisreduktion ausreichend minimiert werden können, ohne dass die therapeutische Wirkung zu sehr leidet. In den Bewertungsmodellen der Analysten findet IMGN901 aber auch so bislang keine Berücksichtigung.
Der u.a. in SAR3419, BT-062, BAY 94-4393 und SAR566658 verwendete Disulfid-Linker SPDB ist stabiler als SPP. Okuläre Toxizitäten sind allerdings auch bei SAR3419 und BAY 94-4393 vereinzelt aufgetreten, zumindest bei SAR3419 hat man die Probleme jedoch laut Sanofi durch eine Veränderung des Dosisschemas gut in den Griff bekommen.
Von einer grundsäzlichen Untauglichkeit der TAP-Technologogie zu sprechen, ist alberner Unsinn und spricht für ein grundlegendes Unverständnis der Materie. Bei spaltbaren Disulfid-Linkern liegt es in der Natur der Sache, dass es durch Freisetzung des Toxins außerhalb der Zielzelle oder - therapeutisch sogar beabsichtigte - Diffusion in die Zellumgebung (-> Bystander-Effekt) mit anschließendem (unerwünschtem) Wiedereintritt in die Blutbahn zu reversiblen Nebenwirkungen an anderen Organen kommen kann (im vorliegenden Fall sind dies schnell teilende Hornhautzellen des Auges).
Nebenwirkungen (z.B. Neuropathien) treten auch bei spaltbaren Linkern der Konkurrenz (SGEN) auf ... und über die Nebenwirkungen konventioneller Chemotherapien müssen wir in diesem Zusammenhang erst gar nicht sprechen. Auch andere in der Onkologie eingesetzten Proteine wie FC-optimierte Antikörper o.ä. führen zu oft drastischen unerwünschten Nebeneffekten.
Lange Rede, kurzer Sinn: Die gegenwärtige Analystenschelte ist in dieser Form unberechtigt. Gleichwohl sind die spaltbaren Disufid-Linker kritisch zu beobachten. Die Überlegung, grundsätzlich stabile Thioether-Linker einzusetzen, ist jedoch nicht zielführend, weil sich diese Linker nur für bestimmte Tumorarten eignen.
Mein persönlicher Favorit ist IMGN289. Hier erwarte ich eine ähnliche Entwicklung wie bei T-DM1 (Kadcyla).
Antwort auf Beitrag Nr.: 45.347.675 von Joschka Schröder am 29.08.13 10:27:07JS, danke für die deutlichen Worte gegenüber einigen Analysten.
Leute, denen man fachliche Kompetenz unterstellen darf, sind jedenfalls nach wie vor bereit, Geld für diese Technologie auszugeben:
August 29, 2013
mmunoGen ($IMGN) says it's struck a $200 million deal to collaborate with Eli Lilly ($LLY) on developing new armed antibodies. In a filing with the SEC the biotech adds that Lilly will also pay out unspecified royalties on any approved drugs to come out of the pact, which deals with a specific antigen. The company's claim to fame so far rests with the pioneering anticancer technology behind Roche's ($RHHBY) Kadcyla.
http://www.fiercebiotech.com/story/eli-lilly-inks-200m-armed…
Leute, denen man fachliche Kompetenz unterstellen darf, sind jedenfalls nach wie vor bereit, Geld für diese Technologie auszugeben:
August 29, 2013
mmunoGen ($IMGN) says it's struck a $200 million deal to collaborate with Eli Lilly ($LLY) on developing new armed antibodies. In a filing with the SEC the biotech adds that Lilly will also pay out unspecified royalties on any approved drugs to come out of the pact, which deals with a specific antigen. The company's claim to fame so far rests with the pioneering anticancer technology behind Roche's ($RHHBY) Kadcyla.
http://www.fiercebiotech.com/story/eli-lilly-inks-200m-armed…
Hervorragende Ergebnisse der TH3ERESA-Studie (werden heute in Amsterdam präsentiert):
Roche’s Kadcyla helped people with advanced HER2-positive breast cancer live longer without their disease worsening in new phase III study
• Phase III TH3RESA study results will be presented today at the European Cancer Congress in Amsterdam
• Kadcyla nearly doubled the time that patients lived without their disease worsening compared with treatment of physician’s choice
• Kadcyla is the first antibody-drug conjugate to result from Roche’s 30 years of HER2 pathway research
Roche (SIX: RO, ROG; OTCQX: RHHBY) today announced that Kadcyla (trastuzumab emtansine) significantly extended the time people with advanced HER2-positive breast cancer (metastatic and unresectable locally advanced/recurrent) lived without their disease worsening (progression-free survival [PFS], a co-primary endpoint) compared to people who received a treatment of their physician’s choice in an open-label phase III study called TH3RESA. The data also showed the risk of disease worsening or death was reduced by 47 percent for people who received Kadcyla (HR=0.528, P<0.0001). Data for overall survival, the other co-primary endpoint, are not yet mature. No new safety signals were observed with Kadcyla.
The study enrolled people with advanced HER2-positive breast cancer who had progressed despite prior treatment with at least two prior HER2-targeted medicines. It randomised people to receive either treatment with Kadcyla or a treatment of their physician’s choice. Eighty percent of people treated with physician’s choice received a regimen containing Herceptin (trastuzumab).
“The TH3RESA study is the second large phase III study in which Kadcyla has improved the amount of time patients with an advanced form of HER2-positive breast cancer lived without their tumor growing,” said Hal Barron, M.D., chief medical officer and head, Global Product Development. “We are pleased that the data from multiple clinical trials reinforces Kadcyla’s benefit for people with this aggressive disease.”
The late-breaking TH3RESA data(1) will be presented today at the European Cancer Congress (ECC), by Dr Hans Wildiers, University Hospital Leuven, Gasthuisberg, Belgium (Abstract #LBA15, Saturday, September 28, 2013 at 1:03 p.m. CEST) and are also part of the official press programme.
Kadcyla recently received a positive opinion from the European Union’s Committee for Medicinal Products for Human Use (CHMP) as a single agent, for the treatment of adult patients with HER2-positive, unresectable locally advanced or metastatic breast cancer who previously received trastuzumab and a taxane, separately or in combination. A European Commission decision on EU marketing approval is expected by the end of the year. In February 2013, Kadcyla was approved by the U.S. Food and Drug Administration for the treatment of people with HER2-positive mBC who have received prior treatment with Herceptin and a taxane chemotherapy and have either already received treatment for metastatic cancer, or have had their early-stage cancer come back during or within six months of completing a course of treatment following surgery.
About the TH3RESA study
TH3RESA is a phase III randomised, open-label study comparing Kadcyla to the physician's choice of treatment in approximately 600 people with advanced HER2-positive breast cancer (metastatic or locally recurrent unresectable) who have received at least two prior treatments including Herceptin, lapatinib and a taxane. The co-primary endpoints are investigator-assessed PFS and OS. The secondary endpoints include objective response rate and safety profile.
Comparison ... Kadcyla ... Treatment of Physician’s Choice (Options included chemotherapy and Herceptin (68.5%), single agent chemotherapy (16.8%), lapatinib and Herceptin (10.3%), chemotherapy and lapatinib (2.7%), hormonal therapy and Herceptin (1.6%))
Median PFS (Investigator Assessment)
2.9 months difference HR=0.528 (95% CI 0.422, 0.661) P<0.0001 ... 6.2 months median PFS ... 3.3 months median PFS
Overall survival
The OS endpoint has not yet been reached HR=0.552 (95% CI, 0.369, 0.826) p=0.0034 ... Median overall survival not yet reached ... 14.9 months median overall survival
Objective Response Rate (ORR)
22.7% difference (95% CI, 16.2, 29.2) P<0.0001 ... 31.3% ... 8.6%
Safety profile: Rate of Grade 3 or higher AEs
32.3% ... 43.5%
.
.
.
Table summarising PFS results from Kadcyla arm and Herceptin-based regimens from the Treatment of Physician’s Choice arm
Kadcyla ... Subset: patients receiving Herceptin as part of a regimen in the Treatment of Physician’s Choice (80%)
PFS (Investigator Assessment)
3 months’ difference HR=0. 558 (95% CI, 0.437, 0.771) P<0.0001
Median PFS
6.2 months ... 3.2 months
About Roche’s medicines for HER2-positive disease
Roche has been leading research into the HER2 pathway for over 30 years and is committed to improving the health, quality of life and survival for patients with both early and metastatic stage HER2-positive disease.
Roche has developed a number of innovative medicines which have helped transform the treatment of HER2-positive breast cancer. HER2-positive breast cancer is a particularly aggressive form of the disease which affects approximately 20 percent of patients. Over the past 15 years the outlook for patients with HER2-positive disease has improved to the extent that patients with the disease experience better outcomes than those of patients with HER2-negative disease.
Eligibility for treatment with Roche HER2-medicines is determined by a diagnostic test, saving time from the outset by identifying those patients who will likely benefit from them.
Roche licenses technology for Kadcyla under an agreement with ImmunoGen, Inc.
Roche’s Kadcyla helped people with advanced HER2-positive breast cancer live longer without their disease worsening in new phase III study
• Phase III TH3RESA study results will be presented today at the European Cancer Congress in Amsterdam
• Kadcyla nearly doubled the time that patients lived without their disease worsening compared with treatment of physician’s choice
• Kadcyla is the first antibody-drug conjugate to result from Roche’s 30 years of HER2 pathway research
Roche (SIX: RO, ROG; OTCQX: RHHBY) today announced that Kadcyla (trastuzumab emtansine) significantly extended the time people with advanced HER2-positive breast cancer (metastatic and unresectable locally advanced/recurrent) lived without their disease worsening (progression-free survival [PFS], a co-primary endpoint) compared to people who received a treatment of their physician’s choice in an open-label phase III study called TH3RESA. The data also showed the risk of disease worsening or death was reduced by 47 percent for people who received Kadcyla (HR=0.528, P<0.0001). Data for overall survival, the other co-primary endpoint, are not yet mature. No new safety signals were observed with Kadcyla.
The study enrolled people with advanced HER2-positive breast cancer who had progressed despite prior treatment with at least two prior HER2-targeted medicines. It randomised people to receive either treatment with Kadcyla or a treatment of their physician’s choice. Eighty percent of people treated with physician’s choice received a regimen containing Herceptin (trastuzumab).
“The TH3RESA study is the second large phase III study in which Kadcyla has improved the amount of time patients with an advanced form of HER2-positive breast cancer lived without their tumor growing,” said Hal Barron, M.D., chief medical officer and head, Global Product Development. “We are pleased that the data from multiple clinical trials reinforces Kadcyla’s benefit for people with this aggressive disease.”
The late-breaking TH3RESA data(1) will be presented today at the European Cancer Congress (ECC), by Dr Hans Wildiers, University Hospital Leuven, Gasthuisberg, Belgium (Abstract #LBA15, Saturday, September 28, 2013 at 1:03 p.m. CEST) and are also part of the official press programme.
Kadcyla recently received a positive opinion from the European Union’s Committee for Medicinal Products for Human Use (CHMP) as a single agent, for the treatment of adult patients with HER2-positive, unresectable locally advanced or metastatic breast cancer who previously received trastuzumab and a taxane, separately or in combination. A European Commission decision on EU marketing approval is expected by the end of the year. In February 2013, Kadcyla was approved by the U.S. Food and Drug Administration for the treatment of people with HER2-positive mBC who have received prior treatment with Herceptin and a taxane chemotherapy and have either already received treatment for metastatic cancer, or have had their early-stage cancer come back during or within six months of completing a course of treatment following surgery.
About the TH3RESA study
TH3RESA is a phase III randomised, open-label study comparing Kadcyla to the physician's choice of treatment in approximately 600 people with advanced HER2-positive breast cancer (metastatic or locally recurrent unresectable) who have received at least two prior treatments including Herceptin, lapatinib and a taxane. The co-primary endpoints are investigator-assessed PFS and OS. The secondary endpoints include objective response rate and safety profile.
Comparison ... Kadcyla ... Treatment of Physician’s Choice (Options included chemotherapy and Herceptin (68.5%), single agent chemotherapy (16.8%), lapatinib and Herceptin (10.3%), chemotherapy and lapatinib (2.7%), hormonal therapy and Herceptin (1.6%))
Median PFS (Investigator Assessment)
2.9 months difference HR=0.528 (95% CI 0.422, 0.661) P<0.0001 ... 6.2 months median PFS ... 3.3 months median PFS
Overall survival
The OS endpoint has not yet been reached HR=0.552 (95% CI, 0.369, 0.826) p=0.0034 ... Median overall survival not yet reached ... 14.9 months median overall survival
Objective Response Rate (ORR)
22.7% difference (95% CI, 16.2, 29.2) P<0.0001 ... 31.3% ... 8.6%
Safety profile: Rate of Grade 3 or higher AEs
32.3% ... 43.5%
.
.
.
Table summarising PFS results from Kadcyla arm and Herceptin-based regimens from the Treatment of Physician’s Choice arm
Kadcyla ... Subset: patients receiving Herceptin as part of a regimen in the Treatment of Physician’s Choice (80%)
PFS (Investigator Assessment)
3 months’ difference HR=0. 558 (95% CI, 0.437, 0.771) P<0.0001
Median PFS
6.2 months ... 3.2 months
About Roche’s medicines for HER2-positive disease
Roche has been leading research into the HER2 pathway for over 30 years and is committed to improving the health, quality of life and survival for patients with both early and metastatic stage HER2-positive disease.
Roche has developed a number of innovative medicines which have helped transform the treatment of HER2-positive breast cancer. HER2-positive breast cancer is a particularly aggressive form of the disease which affects approximately 20 percent of patients. Over the past 15 years the outlook for patients with HER2-positive disease has improved to the extent that patients with the disease experience better outcomes than those of patients with HER2-negative disease.
Eligibility for treatment with Roche HER2-medicines is determined by a diagnostic test, saving time from the outset by identifying those patients who will likely benefit from them.
Roche licenses technology for Kadcyla under an agreement with ImmunoGen, Inc.
Neues vom Kongress der American Association for Cancer Research (gemeinsam veranstaltet mit dem NCI und der European Organisation for Research and Treatment of Cancer):
1. Auch bei Sanofi´s SAR566658 werden okuläre Toxizitäten beobachtet. SAR566658 beinhaltet den spaltbaren Disulfid-Linker SPDB, der u.a. auch in SAR3419, BT-062 und 94-9343 verwendet wird.
2. Interessante Entwicklung eines neues tri-glycyl peptide-Linkers durch Immunogen. Beladen mit 8 (!) DM1-Molekülen, größerer Stabilität, hoher Target-Toxizität, gleichzeitig aber ohne bystander killing activity. Eine aussichtsreiche Neuentwicklung!
3. Weitere interessante Neuentwicklung durch Immunogen: Eine neue Klasse DNA-alkierender Substanzen als hochwirksame, gleichzeitig aber gut verträgliche Toxinkomponenten für bestimmte ADCs.
FAZIT:
a) Das therapeutische Fenster für Immunkonjugate mit SPDB-Linker ist - wie bereits aus anderen Studien bekannt - relativ klein.
b) Imunogen hat neue Linker- und Toxinmoleküle entwickelt, die sehr aussichtsreich erscheinen. IMGN´s Forschungsaktivitäten sind in der Branche führend.
1. Auch bei Sanofi´s SAR566658 werden okuläre Toxizitäten beobachtet. SAR566658 beinhaltet den spaltbaren Disulfid-Linker SPDB, der u.a. auch in SAR3419, BT-062 und 94-9343 verwendet wird.
2. Interessante Entwicklung eines neues tri-glycyl peptide-Linkers durch Immunogen. Beladen mit 8 (!) DM1-Molekülen, größerer Stabilität, hoher Target-Toxizität, gleichzeitig aber ohne bystander killing activity. Eine aussichtsreiche Neuentwicklung!
3. Weitere interessante Neuentwicklung durch Immunogen: Eine neue Klasse DNA-alkierender Substanzen als hochwirksame, gleichzeitig aber gut verträgliche Toxinkomponenten für bestimmte ADCs.
FAZIT:
a) Das therapeutische Fenster für Immunkonjugate mit SPDB-Linker ist - wie bereits aus anderen Studien bekannt - relativ klein.
b) Imunogen hat neue Linker- und Toxinmoleküle entwickelt, die sehr aussichtsreich erscheinen. IMGN´s Forschungsaktivitäten sind in der Branche führend.
aktuelle Meldung:
ImmunoGen, Inc. Announces New License Agreement
WALTHAM, Mass.--(BUSINESS WIRE)-- ImmunoGen, Inc. (Nasdaq: IMGN), a biotechnology company that develops novel anticancer therapeutics using its antibody-drug conjugate (ADC) technology, today announced that Novartis has licensed the exclusive right to use the Company's ADC technology to develop anticancer therapeutics to an undisclosed target.
"We believe the therapies Novartis is developing with our ADC technology have the potential to make an important difference for patients," commented Daniel Junius, President and CEO.
This is the second license to be taken by Novartis under a 2010 agreement between the companies. For each license, ImmunoGen receives an upfront payment and is entitled to receive milestone payments potentially totaling approximately $200 million plus royalties on the sales of any resulting products. Novartis is responsible for the development, manufacturing and marketing of any products resulting from the license.
ImmunoGen, Inc. Announces New License Agreement
WALTHAM, Mass.--(BUSINESS WIRE)-- ImmunoGen, Inc. (Nasdaq: IMGN), a biotechnology company that develops novel anticancer therapeutics using its antibody-drug conjugate (ADC) technology, today announced that Novartis has licensed the exclusive right to use the Company's ADC technology to develop anticancer therapeutics to an undisclosed target.
"We believe the therapies Novartis is developing with our ADC technology have the potential to make an important difference for patients," commented Daniel Junius, President and CEO.
This is the second license to be taken by Novartis under a 2010 agreement between the companies. For each license, ImmunoGen receives an upfront payment and is entitled to receive milestone payments potentially totaling approximately $200 million plus royalties on the sales of any resulting products. Novartis is responsible for the development, manufacturing and marketing of any products resulting from the license.
Wichtig für die weitere Kursentwicklung: In der nächsten Woche gibt es die Kadcyla-Umsatzzahlen für Q3.
Von Analystenseite wurde immer wieder Immunogens TAP-Technologie in Frage gestellt (s. auch UBS-Kommentare, in diesem Thread zitiert). In diesem Zusammenhang hieß es wiederholt, Seattle Genetics Linker seien überlegen, Immunogens Linker führten verursachten hingegen toxische Nebenwirkungen.
Dass derart pauschale Kommentare unangemessen und wenig hilfreich sind, zeigen bereits die Kadcyla-Daten. Man muss jeden Linker und jedes Präparat getrennt betrachten!
Wenn man sich mal etwas gründlicher die Daten der Konkurrenz ansieht, wird zudem klar, dass das Nebenwirkungsprofil des SGEN-Lead-Kandidaten Adcetris keineswegs harmlos ist. Heute wurde ein Update neuer Adcetris-Studien veröffentlicht:
Seattle Genetics Highlights ADCETRIS® (Brentuximab Vedotin) Clinical Data in the Frontline Setting at the International Symposium on Hodgkin Lymphoma
- ADCETRIS Featured in More Than 10 Presentations -
- Data from ADCETRIS Phase 1 Frontline Hodgkin Lymphoma (HL) Clinical Trial Support Enrollment of Ongoing Global Phase 3 ECHELON-1 Clinical Trial for Patients with Advanced Frontline HL -
BOTHELL, Wash.--(BUSINESS WIRE)--Oct. 11, 2013-- Seattle Genetics, Inc. (Nasdaq: SGEN) today highlighted multiple ADCETRIS (brentuximab vedotin) data presentations at the 9th International Symposium on Hodgkin Lymphoma (ISHL) being held October 12-15, 2013 in Cologne, Germany. ADCETRIS is an antibody-drug conjugate (ADC) directed to CD30, which is expressed in classical Hodgkin lymphoma (HL) and systemic anaplastic large cell lymphoma (sALCL). ADCETRIS was granted accelerated approval by the U.S. Food and Drug Administration (FDA) in August 2011 for relapsed HL and sALCL and conditional marketing authorization by the European Commission in October 2012 for relapsed or refractory HL and sALCL.
“Since the last ISHL meeting in 2010, we have made significant progress in advancing ADCETRIS, including approvals in 35 countries to date for the treatment of relapsed HL and sALCL,” said Jonathan Drachman, M.D., Chief Medical Officer and Executive Vice President, Research and Development at Seattle Genetics. “In addition, we are evaluating ADCETRIS broadly in more than 20 ongoing clinical trials, including four global phase 3 trials in earlier lines of therapy for HL and mature T-cell lymphoma, as well as relapsed cutaneous T-cell lymphoma. Our goal is to establish ADCETRIS as the foundation of therapy for CD30-positive malignancies and improve the therapeutic outcome for patients.”
Three oral and nine poster presentations at ISHL illustrate the broad clinical development program for ADCETRIS in HL, including data from a phase 1 frontline advanced HL trial and a poster presentation describing the ongoing global phase 3 ECHELON-1 clinical trial in frontline HL. ADCETRIS is currently not approved for use in the treatment of newly diagnosed HL.
Frontline HL Data Presentations: Corporate-sponsored Trials
“Frontline Therapy with Brentuximab Vedotin Combined with ABVD or AVD in Patients with Newly Diagnosed Advanced Stage Hodgkin Lymphoma,” (P005) by Dr. Stephen Ansell, Professor of Medicine, Division of Hematology, Mayo Clinic
This phase 1 trial was conducted to evaluate ADCETRIS plus the chemotherapy regimen ABVD (Adriamycin, bleomycin, vinblastine and dacarbazine) or ADCETRIS plus AVD, which removes bleomycin, for the treatment of newly diagnosed advanced stage HL patients.
After completing a combination regimen of ADCETRIS plus AVD, 24 of 25 patients (96 percent) achieved a complete remission. Among the patients in the ADCETRIS plus ABVD cohorts, 21 of 22 patients (95 percent) who completed frontline therapy on study achieved a complete remission. The most common adverse events of any grade occurring in more than 30 percent of patients across both treatment regimens were hair loss, constipation, diarrhea, fatigue, insomnia, nausea, neutropenia, peripheral sensory neuropathy, fever and vomiting. As previously reported, pulmonary toxicity was seen in the ADCETRIS plus ABVD cohorts, resulting in a contraindication for the concomitant administration of ADCETRIS and bleomycin. No pulmonary toxicity was observed in the ADCETRIS plus AVD cohort.
These data support the enrollment of the ongoing global phase 3 ECHELON-1 trial. The design of the phase 3 trial will be described in a presentation at ISHL, titled “Phase 3 Study of Brentuximab Vedotin Plus Doxorubicin, Vinblastine and Dacarbazine (A+AVD) vs Doxorubicin, Bleomycin, Vinblastine and Dacarbazine (ABVD) as Front-line Treatment for Advanced Classical Hodgkin Lymphoma (HL): The ECHELON-1 Study,” (P017) by Dr. John Radford, Professor of Medical Oncology, University of Manchester. Visit www.clinicaltrials.org for more information about ECHELON-1.
Frontline HL Data Presentations: Investigator-sponsored Trials
“Brentuximab Vedotin plus AVD as Initial Therapy of Non-Bulky Limited Stage Classical Hodgkin Lymphoma: Interim Analysis of an Ongoing Phase II Trial,” (T035) by Dr. Jeremy Abramson, Director, Center for Lymphoma, Massachusetts General Hospital
A phase 2 investigator-sponsored trial evaluating ADCETRIS plus AVD as initial therapy for non-bulky limited stage classical HL is ongoing and expected to evaluate this regimen in 34 patients. Under the trial design, patients receive two cycles of single-agent ADCETRIS followed by ADCETRIS plus AVD. In the interim analysis, 19 patients were enrolled with a median age of 46. Of the 19 patients, 10 achieved a complete remission after four cycles of ADCETRIS plus AVD, seven remain on therapy and two discontinued therapy due to progressive disease or treatment-related death. The most common adverse events of any grade included nausea, peripheral neuropathy, fatigue, abdominal pain, diarrhea and constipation. Grade 3 or higher adverse events included neutropenic fever, peripheral sensory neuropathy and fatigue.
In the phase 1 corporate-sponsored study presented by Dr. Ansell at the 2013 ISHL meeting, 25 patients with advanced untreated HL were treated with ADCETRIS in combination with AVD. Neutropenic fever was manageable with growth factor support and peripheral neuropathy was manageable with dose reductions or delays in the next dose of therapy. No patients who received ADCETRIS plus AVD discontinued treatment due to adverse events.
“Sequential Brentuximab Vedotin (BV) with Adriamycin, Vinblastine, and Dacarbazine (AVD) for Older Patients with Untreated Hodgkin Lymphoma: Preliminary Toxicity Findings from a Phase II Window Study,” (T077) by Dr. Andrew Evens, Chief of Hematology/Oncology, Tufts Medical Center
In the interim efficacy and toxicity findings of this investigator-sponsored phase 2 trial, seven untreated, advanced stage HL patients were enrolled with a median age of 73 and either stage II or III disease (two patients each) or stage IV disease (three patients). Under the trial design, older HL patients receive two cycles of single-agent ADCETRIS followed by combination chemotherapy. In this interim analysis, after treatment with two cycles of ADCETRIS all patients experienced Grade 3 or higher adverse events, including neutropenia (three patients), diarrhea (three patients), infection (two patients) and pancreatitis (two patients). One patient death occurred due to acute pancreatitis. Enrollment of the study was temporarily suspended but has since re-opened with monitoring of pancreatic enzymes as well as an exclusion criterion for prior history of pancreatitis. Of the seven patients evaluated for efficacy after receiving two doses of ADCETRIS, one patient experienced a complete remission, four patients experienced a partial remission and two patients experienced stable disease. The phase 2 study is ongoing.
A corporate-sponsored retrospective analysis of patients age 60 or older with relapsed or refractory CD30-positive hematologic malignancies treated with ADCETRIS was presented at the American Society of Hematology (ASH) 2012 annual meeting. The analysis assessed the efficacy and safety of single-agent ADCETRIS among 22 sALCL patients, 16 HL patients and two patients with other CD30-positive malignancies. Data showed the incidence of adverse events was generally similar in older and younger patients, with peripheral sensory neuropathy, fatigue and anemia appearing to be more common among patients age 60 or older. Adverse events were manageable with dose modifications or delays.
Analysis of data collected from ADCETRIS clinical trials, as well as from the FDA Adverse Events Reporting System (FAERS) database, indicates that the reported incidence of pancreatitis in all patients treated with ADCETRIS is roughly one in 600. Pancreatitis is a known potential risk factor for several products approved by the FDA for use in the lymphoma disease setting.
Additional ADCETRIS Presentations:
“Progression-free Survival (PFS) Analyses of Two Pivotal Phase 2 Studies of Brentuximab Vedotin in Patients with Relapsed or Refractory (RR) Hodgkin Lymphoma (HL) or Systemic Anaplastic Large-cell Lymphoma (sALCL)” (P134, Corporate-sponsored Trial): Poster presentation
“PET Adapted Sequential Salvage Therapy with Brentuximab Vedotin and Augmented ICE for Transplant Eligible Patients with Relapsed and Refractory Hodgkin Lymphoma” (T128, Investigator-sponsored Trial): Oral presentation
“Phase 1/2 Study of Brentuximab Vedotin in Pediatric Patients with Relapsed or Refractory (RR) Hodgkin Lymphoma (HL) or Systemic Anaplastic Large-cell Lymphoma (sALCL): Interim Phase 1 Safety and Pharmacokinetic (PK) Data” (P132, Corporate-sponsored Trial): Poster presentation
“Post-Authorisation Safety Study (PASS) MA25101: An Observational Cohort Study of the Safety of Brentuximab Vedotin in the Treatment of Relapsed or Refractory (RR) CD30+ Hodgkin Lymphoma (HL) and RR Systemic Anaplastic Large Cell Lymphoma (sALCL). The ARROVEN Study” (P149, Corporate-sponsored Trial): Poster presentation
“Antitumor Activity of Brentuximab Vedotin in Patients with Relapsed or Refractory (RR) Hodgkin Lymphoma (HL) Following Autologous Stem Cell Transplant (ASCT): Meta-analysis Comparison” (P133, Corporate-sponsored Analysis): Poster presentation
“Brentuximab Vedotin in Relapsed/Refractory (RR) Hodgkin Lymphoma (HL) and RR Systemic Anaplastic Large-cell Lymphoma (sALCL): A Review of International Experience in the Named Patient Program (NPP)” (P139, Corporate-sponsored Analysis): Poster presentation
“Relapsed/Refractory (RR) Hodgkin Lymphoma (HL) Following Autologous Stem Cell Transplant (ASCT): Burden of Illness and Advancement in Treatment” (P144, Corporate-sponsored Analysis): Poster presentation
“UK Treatment Pathways and Resource Use Associated with Relapsed/Refractory Hodgkin Lymphoma After Autologous Stem Cell Transplant” (P102, Corporate-sponsored Analysis): Poster presentation
About Hodgkin Lymphoma
Lymphoma is a general term for a group of cancers that originate in the lymphatic system. There are two major categories of lymphoma: Hodgkin lymphoma and non-Hodgkin lymphoma. Hodgkin lymphoma is distinguished from other types of lymphoma by the presence of one characteristic type of cell, known as the Reed-Sternberg cell. The Reed-Sternberg cell generally expresses CD30.
About ADCETRIS
ADCETRIS (brentuximab vedotin) is an antibody-drug conjugate (ADC) comprising an anti-CD30 monoclonal antibody attached by a protease-cleavable linker to a microtubule disrupting agent, monomethyl auristatin E (MMAE), utilizing Seattle Genetics’ proprietary technology. The ADC employs a linker system that is designed to be stable in the bloodstream but to release MMAE upon internalization into CD30-expressing tumor cells.
ADCETRIS for intravenous injection was granted accelerated approval by the FDA in August 2011 and approval with conditions by Health Canada in February 2013 for two indications: (1) the treatment of patients with HL after failure of autologous stem cell transplant (ASCT) or after failure of at least two prior multi-agent chemotherapy regimens in patients who are not ASCT candidates, and (2) the treatment of patients with sALCL after failure of at least one prior multi-agent chemotherapy regimen. The indications for ADCETRIS are based on response rate. There are no data available demonstrating improvement in patient-reported outcomes or survival with ADCETRIS.
ADCETRIS was granted conditional marketing authorization by the European Commission in October 2012 for the treatment of adult patients with relapsed or refractory CD30+ Hodgkin lymphoma (HL): (1) following autologous stem cell transplant (ASCT), or (2) following at least two prior therapies when ASCT or multi-agent chemotherapy is not a treatment option. ADCETRIS is indicated for the treatment of adult patients with relapsed or refractory sALCL. See important safety information below.
ADCETRIS is being evaluated in more than 20 ongoing clinical trials across both corporate and investigator-sponsored studies. The trials are designed to broadly evaluate the potential of ADCETRIS in earlier lines of its approved indications as well as in many additional types of CD30-positive malignancies, including cutaneous T-cell lymphoma (CTCL), B-cell lymphomas and mature T-cell lymphomas (MTCL). For more information, visit www.clinicaltrials.gov. The clinical trials include:
ALCANZA, a phase 3 trial in relapsed CD30-positive CTCL
ECHELON-1, a phase 3 frontline trial in HL
ECHELON-2, a phase 3 frontline trial in MTCL
Seattle Genetics and Millennium: The Takeda Oncology Company, are jointly developing ADCETRIS. Under the terms of the collaboration agreement, Seattle Genetics has U.S. and Canadian commercialization rights and the Takeda Group has rights to commercialize ADCETRIS in the rest of the world. Seattle Genetics and Takeda are funding joint development costs for ADCETRIS on a 50:50 basis, except in Japan where the Takeda Group is solely responsible for development costs.
About Seattle Genetics
Seattle Genetics is a biotechnology company focused on the development and commercialization of monoclonal antibody-based therapies for the treatment of cancer. The company’s lead program, ADCETRIS® (brentuximab vedotin), received accelerated approval from the U.S. Food and Drug Administration in August 2011 and approval with conditions from Health Canada in February 2013 for two indications. In addition, under a collaboration with Millennium: The Takeda Oncology Company, ADCETRIS received conditional approval from the European Commission in October 2012. Seattle Genetics is also advancing a robust pipeline of clinical-stage ADC programs: SGN-75, ASG-22ME, SGN-CD19A, SGN-CD33A, ASG-15ME and SGN-LIV1A. Seattle Genetics has collaborations for its ADC technology with a number of leading biotechnology and pharmaceutical companies, including AbbVie, Agensys (an affiliate of Astellas), Bayer, Celldex, Daiichi Sankyo, Genentech, GlaxoSmithKline, Millennium, Pfizer and Progenics, as well as ADC co-development agreements with Agensys and Genmab. More information can be found at www.seattlegenetics.com.
U.S. Important Safety Information
BOXED WARNING Progressive multifocal leukoencephalopathy (PML): JC virus infection resulting in PML and death can occur in patients receiving ADCETRIS.
Contraindication:
Concomitant use of ADCETRIS and bleomycin is contraindicated due to pulmonary toxicity.
Warnings and Precautions:
Peripheral neuropathy: ADCETRIS treatment causes a peripheral neuropathy that is predominantly sensory. Cases of peripheral motor neuropathy have also been reported. ADCETRIS-induced peripheral neuropathy is cumulative. Treating physicians should monitor patients for symptoms of neuropathy, such as hypoesthesia, hyperesthesia, paresthesia, discomfort, a burning sensation, neuropathic pain or weakness and institute dose modifications accordingly.
Infusion reactions: Infusion-related reactions, including anaphylaxis, have occurred with ADCETRIS. Monitor patients during infusion. If an infusion reaction occurs, the infusion should be interrupted and appropriate medical management instituted. If anaphylaxis occurs, the infusion should be immediately and permanently discontinued and appropriate medical management instituted.
Neutropenia: Monitor complete blood counts prior to each dose of ADCETRIS and consider more frequent monitoring for patients with Grade 3 or 4 neutropenia. If Grade 3 or 4 neutropenia develops, manage by G-CSF support, dose delays, reductions or discontinuation. Prolonged (≥1 week) severe neutropenia can occur with ADCETRIS.
Tumor lysis syndrome: Patients with rapidly proliferating tumor and high tumor burden are at risk of tumor lysis syndrome and these patients should be monitored closely and appropriate measures taken.
Progressive multifocal leukoencephalopathy (PML): JC virus infection resulting in PML and death has been reported in ADCETRIS-treated patients. In addition to ADCETRIS therapy, other possible contributory factors include prior therapies and underlying disease that may cause immunosuppression. Consider the diagnosis of PML in any patient presenting with new-onset signs and symptoms of central nervous system abnormalities. Evaluation of PML includes, but is not limited to, consultation with a neurologist, brain MRI, and lumbar puncture or brain biopsy. Hold ADCETRIS if PML is suspected and discontinue ADCETRIS if PML is confirmed.
Stevens-Johnson syndrome: Stevens-Johnson syndrome has been reported with ADCETRIS. If Stevens-Johnson syndrome occurs, discontinue ADCETRIS and administer appropriate medical therapy.
Embryo-fetal toxicity: Fetal harm can occur. Pregnant women should be advised of the potential hazard to the fetus.
Adverse Reactions:
ADCETRIS was studied as monotherapy in 160 patients in two phase 2 trials. Across both trials, the most common adverse reactions (≥20%), regardless of causality, were neutropenia, peripheral sensory neuropathy, fatigue, nausea, anemia, upper respiratory tract infection, diarrhea, pyrexia, rash, thrombocytopenia, cough and vomiting.
Drug Interactions:
Patients who are receiving strong CYP3A4 inhibitors concomitantly with ADCETRIS should be closely monitored for adverse reactions.
For additional important safety information, including Boxed WARNING, please see the full U.S. prescribing information for ADCETRIS at www.seattlegenetics.com or www.ADCETRIS.com.
Certain of the statements made in this press release are forward-looking, such as those, among others, relating to therapeutic potential of ADCETRIS. Actual results or developments may differ materially from those projected or implied in these forward-looking statements. Factors that may cause such a difference include, but are not limited to, risks that data resulting from the ECHELON-1 trial with ADCETRIS will not support approvals in any of the studied indications. More information about the risks and uncertainties faced by Seattle Genetics is contained in the company’s 10-Q for the quarter ended June 30, 2013 filed with the Securities and Exchange Commission. Seattle Genetics disclaims any intention or obligation to update or revise any forward-looking statements, whether as a result of new information, future events or otherwise.
Source: Seattle Genetics, Inc.
Dass derart pauschale Kommentare unangemessen und wenig hilfreich sind, zeigen bereits die Kadcyla-Daten. Man muss jeden Linker und jedes Präparat getrennt betrachten!
Wenn man sich mal etwas gründlicher die Daten der Konkurrenz ansieht, wird zudem klar, dass das Nebenwirkungsprofil des SGEN-Lead-Kandidaten Adcetris keineswegs harmlos ist. Heute wurde ein Update neuer Adcetris-Studien veröffentlicht:
Seattle Genetics Highlights ADCETRIS® (Brentuximab Vedotin) Clinical Data in the Frontline Setting at the International Symposium on Hodgkin Lymphoma
- ADCETRIS Featured in More Than 10 Presentations -
- Data from ADCETRIS Phase 1 Frontline Hodgkin Lymphoma (HL) Clinical Trial Support Enrollment of Ongoing Global Phase 3 ECHELON-1 Clinical Trial for Patients with Advanced Frontline HL -
BOTHELL, Wash.--(BUSINESS WIRE)--Oct. 11, 2013-- Seattle Genetics, Inc. (Nasdaq: SGEN) today highlighted multiple ADCETRIS (brentuximab vedotin) data presentations at the 9th International Symposium on Hodgkin Lymphoma (ISHL) being held October 12-15, 2013 in Cologne, Germany. ADCETRIS is an antibody-drug conjugate (ADC) directed to CD30, which is expressed in classical Hodgkin lymphoma (HL) and systemic anaplastic large cell lymphoma (sALCL). ADCETRIS was granted accelerated approval by the U.S. Food and Drug Administration (FDA) in August 2011 for relapsed HL and sALCL and conditional marketing authorization by the European Commission in October 2012 for relapsed or refractory HL and sALCL.
“Since the last ISHL meeting in 2010, we have made significant progress in advancing ADCETRIS, including approvals in 35 countries to date for the treatment of relapsed HL and sALCL,” said Jonathan Drachman, M.D., Chief Medical Officer and Executive Vice President, Research and Development at Seattle Genetics. “In addition, we are evaluating ADCETRIS broadly in more than 20 ongoing clinical trials, including four global phase 3 trials in earlier lines of therapy for HL and mature T-cell lymphoma, as well as relapsed cutaneous T-cell lymphoma. Our goal is to establish ADCETRIS as the foundation of therapy for CD30-positive malignancies and improve the therapeutic outcome for patients.”
Three oral and nine poster presentations at ISHL illustrate the broad clinical development program for ADCETRIS in HL, including data from a phase 1 frontline advanced HL trial and a poster presentation describing the ongoing global phase 3 ECHELON-1 clinical trial in frontline HL. ADCETRIS is currently not approved for use in the treatment of newly diagnosed HL.
Frontline HL Data Presentations: Corporate-sponsored Trials
“Frontline Therapy with Brentuximab Vedotin Combined with ABVD or AVD in Patients with Newly Diagnosed Advanced Stage Hodgkin Lymphoma,” (P005) by Dr. Stephen Ansell, Professor of Medicine, Division of Hematology, Mayo Clinic
This phase 1 trial was conducted to evaluate ADCETRIS plus the chemotherapy regimen ABVD (Adriamycin, bleomycin, vinblastine and dacarbazine) or ADCETRIS plus AVD, which removes bleomycin, for the treatment of newly diagnosed advanced stage HL patients.
After completing a combination regimen of ADCETRIS plus AVD, 24 of 25 patients (96 percent) achieved a complete remission. Among the patients in the ADCETRIS plus ABVD cohorts, 21 of 22 patients (95 percent) who completed frontline therapy on study achieved a complete remission. The most common adverse events of any grade occurring in more than 30 percent of patients across both treatment regimens were hair loss, constipation, diarrhea, fatigue, insomnia, nausea, neutropenia, peripheral sensory neuropathy, fever and vomiting. As previously reported, pulmonary toxicity was seen in the ADCETRIS plus ABVD cohorts, resulting in a contraindication for the concomitant administration of ADCETRIS and bleomycin. No pulmonary toxicity was observed in the ADCETRIS plus AVD cohort.
These data support the enrollment of the ongoing global phase 3 ECHELON-1 trial. The design of the phase 3 trial will be described in a presentation at ISHL, titled “Phase 3 Study of Brentuximab Vedotin Plus Doxorubicin, Vinblastine and Dacarbazine (A+AVD) vs Doxorubicin, Bleomycin, Vinblastine and Dacarbazine (ABVD) as Front-line Treatment for Advanced Classical Hodgkin Lymphoma (HL): The ECHELON-1 Study,” (P017) by Dr. John Radford, Professor of Medical Oncology, University of Manchester. Visit www.clinicaltrials.org for more information about ECHELON-1.
Frontline HL Data Presentations: Investigator-sponsored Trials
“Brentuximab Vedotin plus AVD as Initial Therapy of Non-Bulky Limited Stage Classical Hodgkin Lymphoma: Interim Analysis of an Ongoing Phase II Trial,” (T035) by Dr. Jeremy Abramson, Director, Center for Lymphoma, Massachusetts General Hospital
A phase 2 investigator-sponsored trial evaluating ADCETRIS plus AVD as initial therapy for non-bulky limited stage classical HL is ongoing and expected to evaluate this regimen in 34 patients. Under the trial design, patients receive two cycles of single-agent ADCETRIS followed by ADCETRIS plus AVD. In the interim analysis, 19 patients were enrolled with a median age of 46. Of the 19 patients, 10 achieved a complete remission after four cycles of ADCETRIS plus AVD, seven remain on therapy and two discontinued therapy due to progressive disease or treatment-related death. The most common adverse events of any grade included nausea, peripheral neuropathy, fatigue, abdominal pain, diarrhea and constipation. Grade 3 or higher adverse events included neutropenic fever, peripheral sensory neuropathy and fatigue.
In the phase 1 corporate-sponsored study presented by Dr. Ansell at the 2013 ISHL meeting, 25 patients with advanced untreated HL were treated with ADCETRIS in combination with AVD. Neutropenic fever was manageable with growth factor support and peripheral neuropathy was manageable with dose reductions or delays in the next dose of therapy. No patients who received ADCETRIS plus AVD discontinued treatment due to adverse events.
“Sequential Brentuximab Vedotin (BV) with Adriamycin, Vinblastine, and Dacarbazine (AVD) for Older Patients with Untreated Hodgkin Lymphoma: Preliminary Toxicity Findings from a Phase II Window Study,” (T077) by Dr. Andrew Evens, Chief of Hematology/Oncology, Tufts Medical Center
In the interim efficacy and toxicity findings of this investigator-sponsored phase 2 trial, seven untreated, advanced stage HL patients were enrolled with a median age of 73 and either stage II or III disease (two patients each) or stage IV disease (three patients). Under the trial design, older HL patients receive two cycles of single-agent ADCETRIS followed by combination chemotherapy. In this interim analysis, after treatment with two cycles of ADCETRIS all patients experienced Grade 3 or higher adverse events, including neutropenia (three patients), diarrhea (three patients), infection (two patients) and pancreatitis (two patients). One patient death occurred due to acute pancreatitis. Enrollment of the study was temporarily suspended but has since re-opened with monitoring of pancreatic enzymes as well as an exclusion criterion for prior history of pancreatitis. Of the seven patients evaluated for efficacy after receiving two doses of ADCETRIS, one patient experienced a complete remission, four patients experienced a partial remission and two patients experienced stable disease. The phase 2 study is ongoing.
A corporate-sponsored retrospective analysis of patients age 60 or older with relapsed or refractory CD30-positive hematologic malignancies treated with ADCETRIS was presented at the American Society of Hematology (ASH) 2012 annual meeting. The analysis assessed the efficacy and safety of single-agent ADCETRIS among 22 sALCL patients, 16 HL patients and two patients with other CD30-positive malignancies. Data showed the incidence of adverse events was generally similar in older and younger patients, with peripheral sensory neuropathy, fatigue and anemia appearing to be more common among patients age 60 or older. Adverse events were manageable with dose modifications or delays.
Analysis of data collected from ADCETRIS clinical trials, as well as from the FDA Adverse Events Reporting System (FAERS) database, indicates that the reported incidence of pancreatitis in all patients treated with ADCETRIS is roughly one in 600. Pancreatitis is a known potential risk factor for several products approved by the FDA for use in the lymphoma disease setting.
Additional ADCETRIS Presentations:
“Progression-free Survival (PFS) Analyses of Two Pivotal Phase 2 Studies of Brentuximab Vedotin in Patients with Relapsed or Refractory (RR) Hodgkin Lymphoma (HL) or Systemic Anaplastic Large-cell Lymphoma (sALCL)” (P134, Corporate-sponsored Trial): Poster presentation
“PET Adapted Sequential Salvage Therapy with Brentuximab Vedotin and Augmented ICE for Transplant Eligible Patients with Relapsed and Refractory Hodgkin Lymphoma” (T128, Investigator-sponsored Trial): Oral presentation
“Phase 1/2 Study of Brentuximab Vedotin in Pediatric Patients with Relapsed or Refractory (RR) Hodgkin Lymphoma (HL) or Systemic Anaplastic Large-cell Lymphoma (sALCL): Interim Phase 1 Safety and Pharmacokinetic (PK) Data” (P132, Corporate-sponsored Trial): Poster presentation
“Post-Authorisation Safety Study (PASS) MA25101: An Observational Cohort Study of the Safety of Brentuximab Vedotin in the Treatment of Relapsed or Refractory (RR) CD30+ Hodgkin Lymphoma (HL) and RR Systemic Anaplastic Large Cell Lymphoma (sALCL). The ARROVEN Study” (P149, Corporate-sponsored Trial): Poster presentation
“Antitumor Activity of Brentuximab Vedotin in Patients with Relapsed or Refractory (RR) Hodgkin Lymphoma (HL) Following Autologous Stem Cell Transplant (ASCT): Meta-analysis Comparison” (P133, Corporate-sponsored Analysis): Poster presentation
“Brentuximab Vedotin in Relapsed/Refractory (RR) Hodgkin Lymphoma (HL) and RR Systemic Anaplastic Large-cell Lymphoma (sALCL): A Review of International Experience in the Named Patient Program (NPP)” (P139, Corporate-sponsored Analysis): Poster presentation
“Relapsed/Refractory (RR) Hodgkin Lymphoma (HL) Following Autologous Stem Cell Transplant (ASCT): Burden of Illness and Advancement in Treatment” (P144, Corporate-sponsored Analysis): Poster presentation
“UK Treatment Pathways and Resource Use Associated with Relapsed/Refractory Hodgkin Lymphoma After Autologous Stem Cell Transplant” (P102, Corporate-sponsored Analysis): Poster presentation
About Hodgkin Lymphoma
Lymphoma is a general term for a group of cancers that originate in the lymphatic system. There are two major categories of lymphoma: Hodgkin lymphoma and non-Hodgkin lymphoma. Hodgkin lymphoma is distinguished from other types of lymphoma by the presence of one characteristic type of cell, known as the Reed-Sternberg cell. The Reed-Sternberg cell generally expresses CD30.
About ADCETRIS
ADCETRIS (brentuximab vedotin) is an antibody-drug conjugate (ADC) comprising an anti-CD30 monoclonal antibody attached by a protease-cleavable linker to a microtubule disrupting agent, monomethyl auristatin E (MMAE), utilizing Seattle Genetics’ proprietary technology. The ADC employs a linker system that is designed to be stable in the bloodstream but to release MMAE upon internalization into CD30-expressing tumor cells.
ADCETRIS for intravenous injection was granted accelerated approval by the FDA in August 2011 and approval with conditions by Health Canada in February 2013 for two indications: (1) the treatment of patients with HL after failure of autologous stem cell transplant (ASCT) or after failure of at least two prior multi-agent chemotherapy regimens in patients who are not ASCT candidates, and (2) the treatment of patients with sALCL after failure of at least one prior multi-agent chemotherapy regimen. The indications for ADCETRIS are based on response rate. There are no data available demonstrating improvement in patient-reported outcomes or survival with ADCETRIS.
ADCETRIS was granted conditional marketing authorization by the European Commission in October 2012 for the treatment of adult patients with relapsed or refractory CD30+ Hodgkin lymphoma (HL): (1) following autologous stem cell transplant (ASCT), or (2) following at least two prior therapies when ASCT or multi-agent chemotherapy is not a treatment option. ADCETRIS is indicated for the treatment of adult patients with relapsed or refractory sALCL. See important safety information below.
ADCETRIS is being evaluated in more than 20 ongoing clinical trials across both corporate and investigator-sponsored studies. The trials are designed to broadly evaluate the potential of ADCETRIS in earlier lines of its approved indications as well as in many additional types of CD30-positive malignancies, including cutaneous T-cell lymphoma (CTCL), B-cell lymphomas and mature T-cell lymphomas (MTCL). For more information, visit www.clinicaltrials.gov. The clinical trials include:
ALCANZA, a phase 3 trial in relapsed CD30-positive CTCL
ECHELON-1, a phase 3 frontline trial in HL
ECHELON-2, a phase 3 frontline trial in MTCL
Seattle Genetics and Millennium: The Takeda Oncology Company, are jointly developing ADCETRIS. Under the terms of the collaboration agreement, Seattle Genetics has U.S. and Canadian commercialization rights and the Takeda Group has rights to commercialize ADCETRIS in the rest of the world. Seattle Genetics and Takeda are funding joint development costs for ADCETRIS on a 50:50 basis, except in Japan where the Takeda Group is solely responsible for development costs.
About Seattle Genetics
Seattle Genetics is a biotechnology company focused on the development and commercialization of monoclonal antibody-based therapies for the treatment of cancer. The company’s lead program, ADCETRIS® (brentuximab vedotin), received accelerated approval from the U.S. Food and Drug Administration in August 2011 and approval with conditions from Health Canada in February 2013 for two indications. In addition, under a collaboration with Millennium: The Takeda Oncology Company, ADCETRIS received conditional approval from the European Commission in October 2012. Seattle Genetics is also advancing a robust pipeline of clinical-stage ADC programs: SGN-75, ASG-22ME, SGN-CD19A, SGN-CD33A, ASG-15ME and SGN-LIV1A. Seattle Genetics has collaborations for its ADC technology with a number of leading biotechnology and pharmaceutical companies, including AbbVie, Agensys (an affiliate of Astellas), Bayer, Celldex, Daiichi Sankyo, Genentech, GlaxoSmithKline, Millennium, Pfizer and Progenics, as well as ADC co-development agreements with Agensys and Genmab. More information can be found at www.seattlegenetics.com.
U.S. Important Safety Information
BOXED WARNING Progressive multifocal leukoencephalopathy (PML): JC virus infection resulting in PML and death can occur in patients receiving ADCETRIS.
Contraindication:
Concomitant use of ADCETRIS and bleomycin is contraindicated due to pulmonary toxicity.
Warnings and Precautions:
Peripheral neuropathy: ADCETRIS treatment causes a peripheral neuropathy that is predominantly sensory. Cases of peripheral motor neuropathy have also been reported. ADCETRIS-induced peripheral neuropathy is cumulative. Treating physicians should monitor patients for symptoms of neuropathy, such as hypoesthesia, hyperesthesia, paresthesia, discomfort, a burning sensation, neuropathic pain or weakness and institute dose modifications accordingly.
Infusion reactions: Infusion-related reactions, including anaphylaxis, have occurred with ADCETRIS. Monitor patients during infusion. If an infusion reaction occurs, the infusion should be interrupted and appropriate medical management instituted. If anaphylaxis occurs, the infusion should be immediately and permanently discontinued and appropriate medical management instituted.
Neutropenia: Monitor complete blood counts prior to each dose of ADCETRIS and consider more frequent monitoring for patients with Grade 3 or 4 neutropenia. If Grade 3 or 4 neutropenia develops, manage by G-CSF support, dose delays, reductions or discontinuation. Prolonged (≥1 week) severe neutropenia can occur with ADCETRIS.
Tumor lysis syndrome: Patients with rapidly proliferating tumor and high tumor burden are at risk of tumor lysis syndrome and these patients should be monitored closely and appropriate measures taken.
Progressive multifocal leukoencephalopathy (PML): JC virus infection resulting in PML and death has been reported in ADCETRIS-treated patients. In addition to ADCETRIS therapy, other possible contributory factors include prior therapies and underlying disease that may cause immunosuppression. Consider the diagnosis of PML in any patient presenting with new-onset signs and symptoms of central nervous system abnormalities. Evaluation of PML includes, but is not limited to, consultation with a neurologist, brain MRI, and lumbar puncture or brain biopsy. Hold ADCETRIS if PML is suspected and discontinue ADCETRIS if PML is confirmed.
Stevens-Johnson syndrome: Stevens-Johnson syndrome has been reported with ADCETRIS. If Stevens-Johnson syndrome occurs, discontinue ADCETRIS and administer appropriate medical therapy.
Embryo-fetal toxicity: Fetal harm can occur. Pregnant women should be advised of the potential hazard to the fetus.
Adverse Reactions:
ADCETRIS was studied as monotherapy in 160 patients in two phase 2 trials. Across both trials, the most common adverse reactions (≥20%), regardless of causality, were neutropenia, peripheral sensory neuropathy, fatigue, nausea, anemia, upper respiratory tract infection, diarrhea, pyrexia, rash, thrombocytopenia, cough and vomiting.
Drug Interactions:
Patients who are receiving strong CYP3A4 inhibitors concomitantly with ADCETRIS should be closely monitored for adverse reactions.
For additional important safety information, including Boxed WARNING, please see the full U.S. prescribing information for ADCETRIS at www.seattlegenetics.com or www.ADCETRIS.com.
Certain of the statements made in this press release are forward-looking, such as those, among others, relating to therapeutic potential of ADCETRIS. Actual results or developments may differ materially from those projected or implied in these forward-looking statements. Factors that may cause such a difference include, but are not limited to, risks that data resulting from the ECHELON-1 trial with ADCETRIS will not support approvals in any of the studied indications. More information about the risks and uncertainties faced by Seattle Genetics is contained in the company’s 10-Q for the quarter ended June 30, 2013 filed with the Securities and Exchange Commission. Seattle Genetics disclaims any intention or obligation to update or revise any forward-looking statements, whether as a result of new information, future events or otherwise.
Source: Seattle Genetics, Inc.
Kadcyla nunmehr auch in Kanada zugelassen (Auskunft Roche).
Umsatz Kadcyla in Q3 ca. 73 Mio. CHF, das entspricht annualisiert ca. 315 Mio. USD (eigene Berechnungen). So kurz nach Zulassung sind das wirklich ausgezeichnete Zahlen.
Umsatz Kadcyla in Q3 ca. 73 Mio. CHF, das entspricht annualisiert ca. 315 Mio. USD (eigene Berechnungen). So kurz nach Zulassung sind das wirklich ausgezeichnete Zahlen.
Etwas irritierend ist allerdings der Vergleich mit dem Vorquartal, der auf vollständiger Basis nur für die USA möglich ist (in anderen Regionen wurden in Q2 wegen späterer Zulassungen nur Teilumsätze erzielt):
Umsatz Kadcyla USA in Q2: 64 Mio. CHF
Umsatz Kadcyla USA in Q3: 70 Mio. CHF
Auch unter Berücksichtigung von Währungskursschwankungen sind dies gerade einmal ca. 10 % Umsatzanstieg in USD auf Quartalsebene.
Da Kadcyla über lange Zeiträume verabreicht wird, mithin fast alle Patienten, die in Q2 das Präparat erhalten haben, auch in Q3 mit Kadcyla behandelt worden sind, erscheint ein Umsatzanstieg von 10 % eher enttäuschend. Eigentlich wären Steigerungen von deutlich über 50 %, wenn nicht sogar über 100 % (je nach Vorratshaltung der Apotheken) zu erwarten gewesen.
Umsatz Kadcyla USA in Q2: 64 Mio. CHF
Umsatz Kadcyla USA in Q3: 70 Mio. CHF
Auch unter Berücksichtigung von Währungskursschwankungen sind dies gerade einmal ca. 10 % Umsatzanstieg in USD auf Quartalsebene.
Da Kadcyla über lange Zeiträume verabreicht wird, mithin fast alle Patienten, die in Q2 das Präparat erhalten haben, auch in Q3 mit Kadcyla behandelt worden sind, erscheint ein Umsatzanstieg von 10 % eher enttäuschend. Eigentlich wären Steigerungen von deutlich über 50 %, wenn nicht sogar über 100 % (je nach Vorratshaltung der Apotheken) zu erwarten gewesen.
Zitat von Joschka Schröder: Neues vom Kongress der American Association for Cancer Research (gemeinsam veranstaltet mit dem NCI und der European Organisation for Research and Treatment of Cancer):
1. Auch bei Sanofi´s SAR566658 werden okuläre Toxizitäten beobachtet. SAR566658 beinhaltet den spaltbaren Disulfid-Linker SPDB, der u.a. auch in SAR3419, BT-062 und 94-9343 verwendet wird.
2. Interessante Entwicklung eines neues tri-glycyl peptide-Linkers durch Immunogen. Beladen mit 8 (!) DM1-Molekülen, größerer Stabilität, hoher Target-Toxizität, gleichzeitig aber ohne bystander killing activity. Eine aussichtsreiche Neuentwicklung!
3. Weitere interessante Neuentwicklung durch Immunogen: Eine neue Klasse DNA-alkierender Substanzen als hochwirksame, gleichzeitig aber gut verträgliche Toxinkomponenten für bestimmte ADCs.
FAZIT:
a) Das therapeutische Fenster für Immunkonjugate mit SPDB-Linker ist - wie bereits aus anderen Studien bekannt - relativ klein.
b) Imunogen hat neue Linker- und Toxinmoleküle entwickelt, die sehr aussichtsreich erscheinen. IMGN´s Forschungsaktivitäten sind in der Branche führend.
Heute kam die dazugehörige Unternehmensmeldung:
ImmunoGen, Inc. Announces SAR566658 Clinical Findings Reported at AACR-NCI-EORTC Conference
First clinical data reported for this novel antibody-drug conjugate (ADC) for ovarian, breast, and other epithelial cancers.
First of four partner compounds with clinical data presentations expected this quarter.
WALTHAM, Mass.--(BUSINESS WIRE)-- ImmunoGen, Inc. (Nasdaq: IMGN) today announced the presentation of interim data from the ongoing Phase I trial of Sanofi's SAR566658 at the AACR-NCI-EORTC International Conference on Molecular Targets and Cancer Therapeutics meeting (abstract #A73) being held in Boston. SAR566658 is an ADC targeted to CA6, which is found on many cases of ovarian, breast, and other epithelial cancers. The data reported support that SAR566658 is generally well tolerated and can induce objective responses and sustained stable disease in heavily pretreated patients with CA6-positive cancers.
SAR566658 was created by ImmunoGen and licensed preclinically to Sanofi as part of a broader collaboration between the companies. It comprises the Company's huDS6 CA6-targeting antibody with one of ImmunoGen's proprietary cell-killing agents (DM4) attached using one of its engineered linkers (SPDB). The interim findings reported today are from the dose-finding part of the first SAR566658 clinical trial.
A total of 34 patients received SAR566658 at doses ranging from 10-240 mg/m2 (6.5 mg/kg), administered every three weeks. Overall, SAR566658 was well tolerated, with limited adverse events typically associated with cytotoxic chemotherapy (hematologic toxicity, peripheral neuropathy). Reversible ocular corneal changes were seen at the higher doses. The recommended dose for further evaluation was determined to be 190 mg/m2, and SAR566658 is now being assessed at that dose in the extension phase of the trial.
Among the 20 patients who received SAR566658 at doses of 120 mg/m2 (3.2 mg/kg) or more, there were two partial responses (PR), two unconfirmed PRs, and nine with stable disease.
"These early clinical data indicate SAR566658 is generally well tolerated and can have anticancer activity against heavily pretreated CA6-positive tumors," commented John Lambert, PhD, EVP and Chief Scientific Officer. "They also provide further support that our maytansinoid ADC technology can achieve active, well-tolerated anticancer compounds."
qu 1 2014 earnings call Text von seeking alpha
http://seekingalpha.com/article/1776162-immunogen-incs-ceo-d…
Gruesse,
StefanR
http://seekingalpha.com/article/1776162-immunogen-incs-ceo-d…
Gruesse,
StefanR
Moin,

da haben wir den Salat:
PRESS RELEASE
November 5, 2013, 6:36 a.m. ET
.ImmunoGen, Inc. Announces Discontinuation of IMGN901 Study in Small-Cell Lung Cancer (SCLC) .
War wohl der Grund für den anhaltenden Kursverfall. Könnte wohl noch einen kleineren Kursrutsch geben, aber nun ist es wenigstens raus. Mal sehen, was die Amis draus machen.
Gruß q.

da haben wir den Salat:
PRESS RELEASE
November 5, 2013, 6:36 a.m. ET
.ImmunoGen, Inc. Announces Discontinuation of IMGN901 Study in Small-Cell Lung Cancer (SCLC) .
War wohl der Grund für den anhaltenden Kursverfall. Könnte wohl noch einen kleineren Kursrutsch geben, aber nun ist es wenigstens raus. Mal sehen, was die Amis draus machen.
Gruß q.
Das ist keine Überraschung:
1) der SPP-Linker taugt nicht viel (extrem leicht spaltbar -> ungünstige Toxikologie)
2) das Target ist ungeeignet. CD56 wird in zu vielen Organen in zu hohen Konzentrationen exprimiert.
Nach Kadcyla dürfte IMGN289 das einzige klinische Programm sein, das großen Erfolg verspricht. Hinsichtlich der SPDB-Linker (u.a. verwendet in Biotest´s BT-062) bin ich weniger optimistisch.
1) der SPP-Linker taugt nicht viel (extrem leicht spaltbar -> ungünstige Toxikologie)
2) das Target ist ungeeignet. CD56 wird in zu vielen Organen in zu hohen Konzentrationen exprimiert.
Nach Kadcyla dürfte IMGN289 das einzige klinische Programm sein, das großen Erfolg verspricht. Hinsichtlich der SPDB-Linker (u.a. verwendet in Biotest´s BT-062) bin ich weniger optimistisch.
Außerbörslich kann man IMGN an der NYSE Arca derzeit zu 13 USD kaufen. Dies bedeutet hinsichtlich der Börsenkapitalisierung/des EV umgerechnet einen Abschlag in Höhe von 304 Mio. USD gegenüber dem gestrigen Nasdaq-Schlusskurs.
304 Mio. USD Bewertungsbbschlag wegen einer fehlgeschlagenen P2-Studie für ein Präparat, das kein vernünftiger Analyst je ernsthaft in seinem Bewertungsmodell berücksichtigen konnte .. völlig übertrieben ... ein Witz.
Ärgerlich ist, dass IMGN das Projekt überhaupt so lange verfolgt hat, obwohl viele Probleme absehbar - und teilweise auch bereits bekannt - waren.
304 Mio. USD Bewertungsbbschlag wegen einer fehlgeschlagenen P2-Studie für ein Präparat, das kein vernünftiger Analyst je ernsthaft in seinem Bewertungsmodell berücksichtigen konnte .. völlig übertrieben ... ein Witz.
Ärgerlich ist, dass IMGN das Projekt überhaupt so lange verfolgt hat, obwohl viele Probleme absehbar - und teilweise auch bereits bekannt - waren.
Zitat von Joschka Schröder: Nach Kadcyla dürfte IMGN289 das einzige klinische Programm sein, das großen Erfolg verspricht. Hinsichtlich der SPDB-Linker (u.a. verwendet in Biotest´s BT-062) bin ich weniger optimistisch.
AMG595 und AMG172 sind ebenfalls wie Kadcyla konfiguriert. Die im Zusammenhang mit Immunogens spaltbaren Disulfid-Linkern bekannten Probleme dürften bei diesen Immunkonjugaten nicht auftreten.
Antwort auf Beitrag Nr.: 45.764.541 von Joschka Schröder am 05.11.13 14:35:37Hallo JS,
was hältst Du unter dem Aspekt der Linker-Technologie von IMGN853 (folate receptor). Ich finde das Target nämlich interessant (wegen der eigentlich guten Daten bei Endocyte, die aber mit ihrem small molecule andere Probleme haben).
Gruß
SLG
was hältst Du unter dem Aspekt der Linker-Technologie von IMGN853 (folate receptor). Ich finde das Target nämlich interessant (wegen der eigentlich guten Daten bei Endocyte, die aber mit ihrem small molecule andere Probleme haben).
Gruß
SLG
Antwort auf Beitrag Nr.: 45.764.939 von SLGramann am 05.11.13 15:10:57IMGN853 beinhaltet einen sulfo-SPDB-Linker: Im Vergleich zum SPDB-Linker in z.B. SAR3419, BT-062 und BY94-43-93 eine Verbesserung, aber weiterhin mit den bekannten Problemen der Disulfid-Linker (-> okuläre Toxizität infolge hohen freien Toxins, äußert sich u.a. in Verschwommensehen).
Aktuell notiert der Kurs an der Nyse Arca bei 14,20 USD, hat sich also wieder um 10 % erholt. Vorbörsliche Trades während allgemeiner (Kauf- oder Verkaufs-)Panik sind gewöhnlich die lukrativsten.
Antwort auf Beitrag Nr.: 45.765.017 von Joschka Schröder am 05.11.13 15:19:19Danke!
Ich denke, ich werde gleich eine Position eingehen. Ich habe 901 ohnehin kaum Wert beigemessen. Jetzt ist es komplett ausgepreist - und etwas mehr. Um so besser.
Ich denke, ich werde gleich eine Position eingehen. Ich habe 901 ohnehin kaum Wert beigemessen. Jetzt ist es komplett ausgepreist - und etwas mehr. Um so besser.
Antwort auf Beitrag Nr.: 45.765.077 von SLGramann am 05.11.13 15:26:05Frage ist wie immer, wo der Boden gefunden wird ....
Kann mal bitte jemand aufzeigen (oder einen Link bereitstellen) wie Roches zeitlichen Pläne sind Kadcyla nach first line BC zu bringen bzw. wie die weitere Entwicklungsstrategie aussieht? Hier ist letztlich das Geld vergraben, das Kadcyla zu einem Multimilliarden Blockbuster machen könnte.
Kann mal bitte jemand aufzeigen (oder einen Link bereitstellen) wie Roches zeitlichen Pläne sind Kadcyla nach first line BC zu bringen bzw. wie die weitere Entwicklungsstrategie aussieht? Hier ist letztlich das Geld vergraben, das Kadcyla zu einem Multimilliarden Blockbuster machen könnte.
Ein ahnungsloser Adam Feuerstein schreibt einmal mehr Unsinn -> http://www.thestreet.com/story/12096109/1/immunogens-smart-b…
"What most investors don't realize, however, is that Roche radically re-engineered the Immunogen linker and chemotherapy to make Kadcyla work. "
So ein Schmarrn! Linker und Toxin stammen von Immunogen und sind von Roche nicht modifiziert worden. Es handelt sich um dieselbe Thioether-Linker-Toxin-Verbindung, wie sie Immunogen in IMGN289 und Amgens-Kooperationspräparaten AMG595 und AMG172 eingesetzt hat.
Probleme bereiten die spaltbaren Linker. IMGN901 beeinhaltet zudem ein Target-Problem.
"What most investors don't realize, however, is that Roche radically re-engineered the Immunogen linker and chemotherapy to make Kadcyla work. "
So ein Schmarrn! Linker und Toxin stammen von Immunogen und sind von Roche nicht modifiziert worden. Es handelt sich um dieselbe Thioether-Linker-Toxin-Verbindung, wie sie Immunogen in IMGN289 und Amgens-Kooperationspräparaten AMG595 und AMG172 eingesetzt hat.
Probleme bereiten die spaltbaren Linker. IMGN901 beeinhaltet zudem ein Target-Problem.
kurszfristig war es bereits unter 13 USD....
Die Antworten auf meine Fragen standen in der letzte Q-Mitteilung:
Kadcyla (ado-trastuzumab emtansine)
Kadcyla utilizes ImmunoGen’s ADC technology with Roche’s Herceptin® (trastuzumab) antibody and is being developed and commercialized by Roche under an agreement with ImmunoGen. Recent developments include:
Sales development in the US, a positive CHMP opinion for the European Union, and approvals and/or launches in additional countries, including approval in Japan.
Roche reported Kadcyla sales year-to-date September 30, 2013 were 152 million CHF in the US and 4 million CHF ex-US (in total, approximately $168 million). ImmunoGen receives and recognizes royalties on Kadcyla sales the quarter after the quarter in which Roche records the sales.
Positive results from the TH3RESA trial were presented at the 2013 European Cancer Congress.
Roche reported its plans to conduct a pivotal trial assessing Kadcyla for neoadjuvant use in early stage HER2-positive breast cancer. It expects to start this trial in 2Q2014 and for the pCR (pathological complete response) data to be available in late 2015.
Roche continues to expect results from its first-line MARIANNE trial in 2014. It expects to apply in 2015 for marketing approval of Kadcyla for first-line treatment of HER2-positive metastatic breast cancer with MARIANNE data and for treatment of advanced HER2-positive gastric cancer with GATSBY data.
Die Antworten auf meine Fragen standen in der letzte Q-Mitteilung:
Kadcyla (ado-trastuzumab emtansine)
Kadcyla utilizes ImmunoGen’s ADC technology with Roche’s Herceptin® (trastuzumab) antibody and is being developed and commercialized by Roche under an agreement with ImmunoGen. Recent developments include:
Sales development in the US, a positive CHMP opinion for the European Union, and approvals and/or launches in additional countries, including approval in Japan.
Roche reported Kadcyla sales year-to-date September 30, 2013 were 152 million CHF in the US and 4 million CHF ex-US (in total, approximately $168 million). ImmunoGen receives and recognizes royalties on Kadcyla sales the quarter after the quarter in which Roche records the sales.
Positive results from the TH3RESA trial were presented at the 2013 European Cancer Congress.
Roche reported its plans to conduct a pivotal trial assessing Kadcyla for neoadjuvant use in early stage HER2-positive breast cancer. It expects to start this trial in 2Q2014 and for the pCR (pathological complete response) data to be available in late 2015.
Roche continues to expect results from its first-line MARIANNE trial in 2014. It expects to apply in 2015 for marketing approval of Kadcyla for first-line treatment of HER2-positive metastatic breast cancer with MARIANNE data and for treatment of advanced HER2-positive gastric cancer with GATSBY data.
Reuters schreibt auch Unsinn -> http://www.globalpost.com/dispatch/news/thomson-reuters/1311…
"The company said there had been one infection-related death, possibly related to the drug, among 198 patients receiving the therapy."
Diese Aussage ist richtig in Bezug auf frühere Mono-Studien, nicht jedoch i.B. auf die gerade abgebrochene Studie, in der es offensichtlich zu mehreren derartigen Todesfällen gekommen ist.
Eine derartige Ansammlung falscher Aussagen in öffentlichen Kommentierungen spricht für sich.
"The company said there had been one infection-related death, possibly related to the drug, among 198 patients receiving the therapy."
Diese Aussage ist richtig in Bezug auf frühere Mono-Studien, nicht jedoch i.B. auf die gerade abgebrochene Studie, in der es offensichtlich zu mehreren derartigen Todesfällen gekommen ist.
Eine derartige Ansammlung falscher Aussagen in öffentlichen Kommentierungen spricht für sich.
@Ville
Herceptin geht ca. 2014 off-patent... und ich bin mir recht sicher, dass Roche plant, mindestens den gesamten Umsatz in Kadcyla und Perjeta zu transferieren.
@Joschka
Habe gehört, dass Kadcyla als negative Kontrolle das Licht der Welt erblickt hat. Man wollte einen definitiven non-cleavable linker haben, so dass das toxin gar nicht freigesetzt werden konnte... und der ADC damit unwirksam wäre, wie man glaubte. In anbetracht der Chemie (alle S-S linker sehen irgendwie selbstgebastelt "mit viel IMGN-IP" aus, SMCC gibts seit Jahrzehnten von Pierce zu kaufen) bin ich geneigt, es zu glauben und nicht als Anekdote abzutun.
Überlege auch reinzugehen, warte eigentlich schon länger auf eine Gelegenheit, finde allerdings den Verlust des fortgeschrittensten unlizensierten Produkts keine Lapalie... vor drei Wochen noch von IMGN angepriesen...
Herceptin geht ca. 2014 off-patent... und ich bin mir recht sicher, dass Roche plant, mindestens den gesamten Umsatz in Kadcyla und Perjeta zu transferieren.
@Joschka
Habe gehört, dass Kadcyla als negative Kontrolle das Licht der Welt erblickt hat. Man wollte einen definitiven non-cleavable linker haben, so dass das toxin gar nicht freigesetzt werden konnte... und der ADC damit unwirksam wäre, wie man glaubte. In anbetracht der Chemie (alle S-S linker sehen irgendwie selbstgebastelt "mit viel IMGN-IP" aus, SMCC gibts seit Jahrzehnten von Pierce zu kaufen) bin ich geneigt, es zu glauben und nicht als Anekdote abzutun.
Überlege auch reinzugehen, warte eigentlich schon länger auf eine Gelegenheit, finde allerdings den Verlust des fortgeschrittensten unlizensierten Produkts keine Lapalie... vor drei Wochen noch von IMGN angepriesen...
Zitat von Joschka Schröder: Ein ahnungsloser Adam Feuerstein schreibt einmal mehr Unsinn -> http://www.thestreet.com/story/12096109/1/immunogens-smart-b…
"What most investors don't realize, however, is that Roche radically re-engineered the Immunogen linker and chemotherapy to make Kadcyla work. "
So ein Schmarrn! Linker und Toxin stammen von Immunogen und sind von Roche nicht modifiziert worden. Es handelt sich um dieselbe Thioether-Linker-Toxin-Verbindung, wie sie Immunogen in IMGN289 und Amgens-Kooperationspräparaten AMG595 und AMG172 eingesetzt hat.
Probleme bereiten die spaltbaren Linker. IMGN901 beeinhaltet zudem ein Target-Problem.
Hat Immunogen sich denn je dazu geäußert, wo welcher Linker eingesetzt ist? Woher weißt du, dass IMGN den Linker auch in den genannten anderen Antikörpern eingesetzt hat? Woher weißt du, dass Roche nicht tatsächlich noch modifiziert hat? Ich weiß es leider nicht, da ich mich nie darum bemüht hatte an diese detaillierten Infos zu kommen und auch gar nicht weiß, ob man an diese Infos überhaupt kommt, also ob sie überhaupt diclosed worden sind.
Antwort auf Beitrag Nr.: 45.766.617 von yok am 05.11.13 17:51:47Na ja, angepriesen ist der falsche Begriff. Hinsichtlich der absehbaren Probleme war man jedoch etwas zu blauäugig und hat sich von einigen guten Ergebnissen blenden lassen.
Zu Deiner Frage: Roche hat eine Vielzahl von Herceptin-Immunkonjugaten von IMGN und SGEN getestet und sich schließlich für T-DM1 entschieden. Ob man den SMCC-Linker dabei zunächst als weniger aussichtsreich eingeschätzt hat, entzieht sich meiner Kenntnis.
Hinsichtlich der spaltbaren Linker habe ich keine großen Erwartungen. Wenn es eine positive Überraschung gäbe ... um so schöner. Z.B. wird Sanofi bei der ASH-Tagung über SAR3419 berichten, Biotest gleichzeitig über BT-062.
Bei den derzeitigen Kursen um 13,0 USD kann man m.E. auf längere Sicht nicht zu allzu viel falsch machen. Den gegenwärtigen Unternehmenswert sollten spätere Kadcyla-Tantiemen innerhalb eines Zeitraums von zwei Jahren einspielen. Und ich wüßte nicht, wieso IMGN289 nicht ähnlich erfolgreich wie Kadcyla werden sollte.
Zu Deiner Frage: Roche hat eine Vielzahl von Herceptin-Immunkonjugaten von IMGN und SGEN getestet und sich schließlich für T-DM1 entschieden. Ob man den SMCC-Linker dabei zunächst als weniger aussichtsreich eingeschätzt hat, entzieht sich meiner Kenntnis.
Hinsichtlich der spaltbaren Linker habe ich keine großen Erwartungen. Wenn es eine positive Überraschung gäbe ... um so schöner. Z.B. wird Sanofi bei der ASH-Tagung über SAR3419 berichten, Biotest gleichzeitig über BT-062.
Bei den derzeitigen Kursen um 13,0 USD kann man m.E. auf längere Sicht nicht zu allzu viel falsch machen. Den gegenwärtigen Unternehmenswert sollten spätere Kadcyla-Tantiemen innerhalb eines Zeitraums von zwei Jahren einspielen. Und ich wüßte nicht, wieso IMGN289 nicht ähnlich erfolgreich wie Kadcyla werden sollte.
Antwort auf Beitrag Nr.: 45.766.673 von Ville7 am 05.11.13 17:58:51Ich habe alle Patente gelesen.
Antwort auf Beitrag Nr.: 45.766.617 von yok am 05.11.13 17:51:47yok: Na das wären ja immerhin 5% von vielleicht auch dann um die 6Mrd. USD Umsatz in vielleicht mal ein paar Jahren (2018f ?). Das sollte einen gewissen Bewertungsboden unter die Aktie ziehen.
Nur wo liegt dieser aktuelle Bewertungsboden, bei knapp unter 13 USD oder noch einiges tiefer?
Ich denke reingehen kann nur in Etappen Sinn machen. Ziel eines Trades könnte das Schließen des Gaps sein, also um die 16 USD.
Das könnte wohl frühestens mit der EU Zulassung in Angriff genommen werden....nach der positiven CHMP Opinion könnte das noch dieses Jahr sein. Sollte die Aktie aber weiter abstürzen und ein Blutbad anrichten wäre dieses Ziel vor allem auf auf diese Zeitfrist nicht wirklich realistisch....
Nur wo liegt dieser aktuelle Bewertungsboden, bei knapp unter 13 USD oder noch einiges tiefer?
Ich denke reingehen kann nur in Etappen Sinn machen. Ziel eines Trades könnte das Schließen des Gaps sein, also um die 16 USD.
Das könnte wohl frühestens mit der EU Zulassung in Angriff genommen werden....nach der positiven CHMP Opinion könnte das noch dieses Jahr sein. Sollte die Aktie aber weiter abstürzen und ein Blutbad anrichten wäre dieses Ziel vor allem auf auf diese Zeitfrist nicht wirklich realistisch....
Antwort auf Beitrag Nr.: 45.766.859 von Ville7 am 05.11.13 18:17:19Ich wüßte auch gerne, wie Feuerstein zu seiner Aussage kommt. Wenigstens die Tatsache, dass IMGN289 und Kadcyla bzgl. Linker und Toxin identisch konstruiert sind, hätte Feuerstein aus Unternehmenspräsentationen wissen müssen.
Das stimmt schon mit dem etappenweisen Einstieg. Was mich etwas zurückschreckt ist, dass es hier keinerlei Derivate gibt und ich also für einen ernsthaften Einstieg echtes Geld binden muss. Ich würde dann schon eher an was zumindest Mittelfrisitges denken... in anbetracht der Tatsache, dass IMGN901 der einzige Klinikkandidat mit diesem bescheuert labilen Linker war, werde ich mir vielleicht dieser Tage mal ein amuse-gueule gönnen. (Ironie des Schicksals, dass die Tox hier offenbar vom Target kam und nicht vom Linker, freies Toxin würde wohl eher keine Infektionen fördern.)
Wo habt ihr gekauft, in USA oder DE? Es werden ja erstaunlich kleine spreads an den deutschen Börsen gestellt.
Wo habt ihr gekauft, in USA oder DE? Es werden ja erstaunlich kleine spreads an den deutschen Börsen gestellt.
Antwort auf Beitrag Nr.: 45.766.549 von Joschka Schröder am 05.11.13 17:45:32diese Todesfälle sind schon übeles Zeichen.

Antwort auf Beitrag Nr.: 45.768.463 von yok am 05.11.13 21:18:07Was mich etwas zurückschreckt ist, dass es hier keinerlei Derivate gibt
@yok, bei bspw. IG Markets gibt es ein CFD auf IMGN. Persönlich würde ich mit so einer Konstruktion aber nur einen Hebel von 2 oder maximal 3 realisieren, sobald die Aktie einen Boden gefunden zu haben scheint. Du bekommst dort aber realistische Kurse gestellt.
Auf der ASH stellt Sanofi einen CD38-mab vor (Konkurrenz zu Daratumumab und MOR 202). IMGN hat das Royaltie-Ansprüche. Niemand weiß etwas über diesen Kandidaten. Gute Ergebnisse sind nicht auszuschließen und das könnte die Stimmungslage schon wieder etwas aufhellen.
Wann kommen die ASH-Abstracts? War das schon morgen?
@yok, bei bspw. IG Markets gibt es ein CFD auf IMGN. Persönlich würde ich mit so einer Konstruktion aber nur einen Hebel von 2 oder maximal 3 realisieren, sobald die Aktie einen Boden gefunden zu haben scheint. Du bekommst dort aber realistische Kurse gestellt.
Auf der ASH stellt Sanofi einen CD38-mab vor (Konkurrenz zu Daratumumab und MOR 202). IMGN hat das Royaltie-Ansprüche. Niemand weiß etwas über diesen Kandidaten. Gute Ergebnisse sind nicht auszuschließen und das könnte die Stimmungslage schon wieder etwas aufhellen.
Wann kommen die ASH-Abstracts? War das schon morgen?
Adam Feuerstein 11/05/2013
"What most investors don't realize, however, is that Roche radically re-engineered the Immunogen linker and chemotherapy to make Kadcyla work. This was proprietary work done by Roche that hasn't extended to Immunogen's other ADC drug candidates."
VERSUS
Dan Junius – President, Chief Executive Officer Immunogen
2013 Morgan Stanley Global Healthcare Conference
September 11, 2013 9:10 AM ET
The third compound for solid tumors is one that we are about to dose our first patient, and that will be before the end of this year. It’s a compound, IMGN289. This we and others find quite interesting because it follows an established pathway in that the target is EGFR. EGFR is attractive and certainly well validated as a target. It happens to be in ErbB-2 family, which similar to Herceptin targeting HER2 or ErbB-2—so it’s ErbB family, not ErbB-2 family, but ErbB family. So we have that as a similarity, and it’s a construct that’s very similar certainly in terms of linker and cytotoxin. It’s identical to what’s used in the approved product use in our technology, Kadcyla. The preclinical data looks very attractive. It’s an active antibody, so we have the opportunity for two mechanisms of action in cell-killing, both from the antibody itself as well as from the cytotoxin that we attach through our technology.
And then the last clinical program is one that’s hematologic – IMGN529. This targets CD37 – again, a construct similar to Kadcyla, same linker, same cytotoxin. Again, an active antibody – it’s an antibody that preclinically showed itself to be more active than Rituxan and then by adding the ADC technology we enhance the overall potency of the compound.
"What most investors don't realize, however, is that Roche radically re-engineered the Immunogen linker and chemotherapy to make Kadcyla work. This was proprietary work done by Roche that hasn't extended to Immunogen's other ADC drug candidates."
VERSUS
Dan Junius – President, Chief Executive Officer Immunogen
2013 Morgan Stanley Global Healthcare Conference
September 11, 2013 9:10 AM ET
The third compound for solid tumors is one that we are about to dose our first patient, and that will be before the end of this year. It’s a compound, IMGN289. This we and others find quite interesting because it follows an established pathway in that the target is EGFR. EGFR is attractive and certainly well validated as a target. It happens to be in ErbB-2 family, which similar to Herceptin targeting HER2 or ErbB-2—so it’s ErbB family, not ErbB-2 family, but ErbB family. So we have that as a similarity, and it’s a construct that’s very similar certainly in terms of linker and cytotoxin. It’s identical to what’s used in the approved product use in our technology, Kadcyla. The preclinical data looks very attractive. It’s an active antibody, so we have the opportunity for two mechanisms of action in cell-killing, both from the antibody itself as well as from the cytotoxin that we attach through our technology.
And then the last clinical program is one that’s hematologic – IMGN529. This targets CD37 – again, a construct similar to Kadcyla, same linker, same cytotoxin. Again, an active antibody – it’s an antibody that preclinically showed itself to be more active than Rituxan and then by adding the ADC technology we enhance the overall potency of the compound.
Antwort auf Beitrag Nr.: 45.769.584 von Ville7 am 06.11.13 07:53:42Woher soll denn bei Feuerstein auch die Biotechnologie-Expertise kommen?
"Before joining TheStreet in March 2001, Feuerstein covered business software for Upside.com. Prior to that he covered a variety of business beats, including technology and commercial real estate, at the San Francisco Business Times.
Feuerstein graduated from Emory University with a bachelor's degree in political science."
Quelle: http://www.thestreet.com/author/1352996/AdamFeuerstein/all.h…
"Before joining TheStreet in March 2001, Feuerstein covered business software for Upside.com. Prior to that he covered a variety of business beats, including technology and commercial real estate, at the San Francisco Business Times.
Feuerstein graduated from Emory University with a bachelor's degree in political science."
Quelle: http://www.thestreet.com/author/1352996/AdamFeuerstein/all.h…
Antwort auf Beitrag Nr.: 45.769.986 von Joschka Schröder am 06.11.13 08:40:01So einfach durch Diskreditierung seines Berufsbildungsweges kann man das nicht abtun.
Adam Feuerstein ist seit mehr als zehn Jahren als Biotechanalyst und Blogger von TheStreet unterwegs und hat sich dadurch ein sehr umfassendes Bild erworben - in allen Bereichen, auch der Technologien. Er ist regelmäßig auf Investorenkonferenzen und hat sehr oft hochrangige Biotech Execs zum Interview. Zudem hat er einen großen Connection und Insiderpool aus dem er schöpfen kann.
Wie "angesehen" er trotz seiner regelmäßigen Ausraster ist sieht man auch daran, dass ihm sogar die komplette Morphosys IR und viele hochrangige Analysten der Biotechszene auf Twitter "folgen". Also der Mann hat schon ein sehr großes Gewicht. Was man natürlich auch an der Kursbeeinflussung sehen kann.
Adam Feuerstein ist seit mehr als zehn Jahren als Biotechanalyst und Blogger von TheStreet unterwegs und hat sich dadurch ein sehr umfassendes Bild erworben - in allen Bereichen, auch der Technologien. Er ist regelmäßig auf Investorenkonferenzen und hat sehr oft hochrangige Biotech Execs zum Interview. Zudem hat er einen großen Connection und Insiderpool aus dem er schöpfen kann.
Wie "angesehen" er trotz seiner regelmäßigen Ausraster ist sieht man auch daran, dass ihm sogar die komplette Morphosys IR und viele hochrangige Analysten der Biotechszene auf Twitter "folgen". Also der Mann hat schon ein sehr großes Gewicht. Was man natürlich auch an der Kursbeeinflussung sehen kann.
Antwort auf Beitrag Nr.: 45.770.586 von Ville7 am 06.11.13 09:29:05Es ist o.k., dass Du Adam Feuerstein in Schutz nimmst. Ich denke aber schon, dass ein Biotech-Analyst ein gewisses fachliches Grundverständnis und Interesse an der Materie haben sollte. Und bei Feuerstein ist es in der Vergangenheit immer wieder vorgekommen, dass er aus Unkenntnis - anderes möchte ich ihm nicht unterstellen - unhaltbare Behauptungen aufgestellt hat. Dass so jemand am Kapitalmarkt eine wesentliche Rolle spielt, spricht für sich (und nicht unbedingt für rationale Märkte).
Antwort auf Beitrag Nr.: 45.771.262 von Joschka Schröder am 06.11.13 10:33:07Ich bin fern davon ihn für seine reißerischen Aussagen in Schutz zu nehmen. Nur aus der 10 jährigen Praxis als Vollzeit- Analyst und - Blogger im Biotechumfeld heraus sollte er eigentlich Einschätzungen treffen können. Da spielt seine vorige Ausbildung keine große Rolle mehr. Ihn deswegen zu diskreditieren ist nicht richtig.
Ich habe mich im Laufe meiner Investorenlaufbahn als Biotechinvestor des öfteren auch an seinen Aussagen gestoßen. Teilweise hat er den Nagel auf den Kopf getroffen, in vielen Fällen lag er auch sowas von offensichtlich grottenfalsch, dass man schon absichtliches Bashen unterstellen musste. Mein Freund wird das nicht mehr werden. Dennoch hat er eben diese mächtige Stellung im US-Biotech-Umfeld wie er sie hat.
Ich habe mich im Laufe meiner Investorenlaufbahn als Biotechinvestor des öfteren auch an seinen Aussagen gestoßen. Teilweise hat er den Nagel auf den Kopf getroffen, in vielen Fällen lag er auch sowas von offensichtlich grottenfalsch, dass man schon absichtliches Bashen unterstellen musste. Mein Freund wird das nicht mehr werden. Dennoch hat er eben diese mächtige Stellung im US-Biotech-Umfeld wie er sie hat.
Noch zur Diskussion um potentielle NW von Immunkonjugaten bzw. Immunogens Technologieplattform.
Tumortherapeutika - auch ADC´s - sind leider nicht frei von Nebenwirkungen. Hier eine aktuelle Warnung der EMA zu Adcetris, dem anti CD30-ADC von Seattle Genetics:
1.1. Brentuximab vedotin –Pulmonary toxicity
Substance (invented name)
Brentuximab vedotin (Adcetris, H/C/002455)
Authorisation procedure
Centralised
Signal
PTs Pneumonitis, interstitial lung disease, pulmonary alveolar haemorrhage, pulmonary toxicity
PRAC rapporteur(s)
Netherlands
Date of adoption
19 August 2013 (written procedure)
Recommendation
1. Based on the assessment of the cumulative review, the MAH is requested to include the risk of pulmonary toxicity as an important potential risk in the risk management plan (RMP), by 17 Oct 2013; and to propose adequate pharmacovigilance activities to investigate this risk. More data is needed to evaluate the risk of pulmonary toxicity in patients with poorer conditions such as hepatic and renal impaired patients. Evaluation of the risk of pulmonary toxicity in these subpopulations should be included in the investigation plan proposed for the risk of pulmonary toxicity.
2. The MAH should submit a variation to EMA by 6 Sep 2013 in order to include pulmonary toxicity as warning in the summary of products characteristics (SmPC) of brentuximab vedotin.
3. The possible effect of previous treatment with bleomycin in occurrence of pulmonary toxicity events should remain under close monitoring.
Tumortherapeutika - auch ADC´s - sind leider nicht frei von Nebenwirkungen. Hier eine aktuelle Warnung der EMA zu Adcetris, dem anti CD30-ADC von Seattle Genetics:
1.1. Brentuximab vedotin –Pulmonary toxicity
Substance (invented name)
Brentuximab vedotin (Adcetris, H/C/002455)
Authorisation procedure
Centralised
Signal
PTs Pneumonitis, interstitial lung disease, pulmonary alveolar haemorrhage, pulmonary toxicity
PRAC rapporteur(s)
Netherlands
Date of adoption
19 August 2013 (written procedure)
Recommendation
1. Based on the assessment of the cumulative review, the MAH is requested to include the risk of pulmonary toxicity as an important potential risk in the risk management plan (RMP), by 17 Oct 2013; and to propose adequate pharmacovigilance activities to investigate this risk. More data is needed to evaluate the risk of pulmonary toxicity in patients with poorer conditions such as hepatic and renal impaired patients. Evaluation of the risk of pulmonary toxicity in these subpopulations should be included in the investigation plan proposed for the risk of pulmonary toxicity.
2. The MAH should submit a variation to EMA by 6 Sep 2013 in order to include pulmonary toxicity as warning in the summary of products characteristics (SmPC) of brentuximab vedotin.
3. The possible effect of previous treatment with bleomycin in occurrence of pulmonary toxicity events should remain under close monitoring.
Joschka, Morphosys' Partner Oncomed (http://www.oncomed.com/) notiert nun deutlich unter IPO Preis. Siehts du in deren Ansatz (Stammzellen) und Technologie oder in deren 5 klinischen und 5 präklinischen Programmen etwas, was außergewöhnlich gut einschlagen könnte?
Antwort auf Beitrag Nr.: 45.772.512 von Ville7 am 06.11.13 12:39:29Zu Oncomed kann ich leider nichts Brauchbares beitragen. Habe ich mir noch nicht ansehen können.
Hier mal eine wohltuend optimistische Einschätzung von Seeking Alpha (von Blogger Prohost Biotech):
Stopping the Phase II trial of its ADC product IMGN901 on patients with non-small-cell lung cancer is most probably a temporary setback, which we believe would have no negative long-term impact on ImmunoGen’s (IMGN) success and growth. The failure of the drug has nothing to do with ImmunoGen’s TAP technology that has been validated through the approval of HER2 positive breast cancer ADC product Kadcyla® and through many years of experimentation.
Finding that the addition of IMGN901 to etoposide/carboplatin (E/C) was unlikely to demonstrate a sufficient improvement in progression-free survival compared to E/C alone to justify continuation of the trial, the firm was advised to halt the lung cancer clinical trials with the combination.
As ImmunoGen stated in its press release, infection-related toxicity is, indeed, a recognized risk in SCLC trials, including trials with etoposide/carboplatin. With regard to IMGN901 as a single agent, was given to 198 patients with only one incidence of infection-related death deemed possibly drug related.
At no time we heard Genentech or any other large pharmaceutical companies conducting clinical trials with ImunoGen’s CAD return back to ImmunoGen the rights to using its conjugated TAP technology because of side effects. None of the large pharmaceutical firms that licensed mmunoGen’s TAP technology to develop cancer drugs have complained, or stopped using the technology, or halted the development of any drug made through TAP. These firms include Roche (RHHBY), Sanofi (SNY), Bayer (BAYRY), Novartis (NVS), Amgen (AMGN), biotest (BIESF), and other firms. We never heard them complain of any leak from the linker, or any other defect in the CAD products. On the contrary, after experiencing the advantages of ImmunoGen’s TAP technology with its HER2 breast cancer drug Kadcyla, Genentech has licensed ImmunoGe’s TAP technology to develop several other drugs.
On September 11,2013, ImmunoGen CEO had already answered current critics' claims that the successful outcome of Roche’s/Immunogen drug was because Genentech has improved the technology, including the linker and the toxic drugs used. That was at the Morgan Stanley Global healthcare Conference. When Yigal Nochomovitz from Morgan Stanley asked Dan Junius, Immunogen CEO to “clarify the technology picture with Kadcyla in terms of which components are ImmunoGen technology – linker, payload – and whether you have rights to use the linker and payload in other assets.”
Answering him, ImmunoGen CEO said, “ Yes, I’d actually sort of turn it the other way. We own the linker and payload. We have the composition of matter patent on Kadcyla, so we contributed that technology. The piece of technology that came from Genentech was trastuzumab, the antibody that is marketed as a naked agent as Herceptin. But we own the composition of matter patent on the SMCC linker as well as on the cytotoxin itself, as well as methods of manufacture, et cetera. So the reason I turn it the other way in saying Genentech had to come to us for rights to use that, as opposed to them having any ownership of that technology.”
Logically speaking, one setback among more than 16 studies is not unusual, or a precedent. From what we experienced and heard until now, we do not expect long-term impact on ImmunoGen from this setback.
Kadcyla's sales for HER2 breast cancer will continue to climb and Kadcyla is expected to move up as first line treatment at the end of next year if not before – a move expected to increase Kadcyla’s sales, which are expected to exceed those of Roche’s HER2 breast cancer blockbuster Herceptin’s sales.
With regard to ImmunoGen’s wholly owned products, it is true that the firm might have lost one, but it has recently initiated trials with three wholly owned ADC compounds, including IMGN853 for ovarian, endometrial, and other cancers that highly express folate receptor α; IMGN529 for non-Hodgkin lymphoma; and IMGN289 for lung, head and neck, and other cancers that highly express EGFR.
We hope that the critics do not claim ADC drugs are toxic during dose escalation experiments when the firm pinpoints the toxic dose to avoid it, not to use it.
FORWARD-LOOKING: Material presented here is for informational purposes only. Nothing in this article should be taken as a solicitation to purchase or sell securities. Before buying or selling any stock you should do your own research and reach your own conclusion. Further, these are our 'opinions' and we may be wrong. We may have positions in securities mentioned in this article. You should take this into consideration before acting on any advice given in this article. If this makes you uncomfortable, then do not listen to our thoughts and opinions. The contents of this article do not take into consideration your individual investment objectives so consult with your own financial adviser before making an investment decision. Investing includes certain risks including loss of principal.
Disclosure: None
Stopping the Phase II trial of its ADC product IMGN901 on patients with non-small-cell lung cancer is most probably a temporary setback, which we believe would have no negative long-term impact on ImmunoGen’s (IMGN) success and growth. The failure of the drug has nothing to do with ImmunoGen’s TAP technology that has been validated through the approval of HER2 positive breast cancer ADC product Kadcyla® and through many years of experimentation.
Finding that the addition of IMGN901 to etoposide/carboplatin (E/C) was unlikely to demonstrate a sufficient improvement in progression-free survival compared to E/C alone to justify continuation of the trial, the firm was advised to halt the lung cancer clinical trials with the combination.
As ImmunoGen stated in its press release, infection-related toxicity is, indeed, a recognized risk in SCLC trials, including trials with etoposide/carboplatin. With regard to IMGN901 as a single agent, was given to 198 patients with only one incidence of infection-related death deemed possibly drug related.
At no time we heard Genentech or any other large pharmaceutical companies conducting clinical trials with ImunoGen’s CAD return back to ImmunoGen the rights to using its conjugated TAP technology because of side effects. None of the large pharmaceutical firms that licensed mmunoGen’s TAP technology to develop cancer drugs have complained, or stopped using the technology, or halted the development of any drug made through TAP. These firms include Roche (RHHBY), Sanofi (SNY), Bayer (BAYRY), Novartis (NVS), Amgen (AMGN), biotest (BIESF), and other firms. We never heard them complain of any leak from the linker, or any other defect in the CAD products. On the contrary, after experiencing the advantages of ImmunoGen’s TAP technology with its HER2 breast cancer drug Kadcyla, Genentech has licensed ImmunoGe’s TAP technology to develop several other drugs.
On September 11,2013, ImmunoGen CEO had already answered current critics' claims that the successful outcome of Roche’s/Immunogen drug was because Genentech has improved the technology, including the linker and the toxic drugs used. That was at the Morgan Stanley Global healthcare Conference. When Yigal Nochomovitz from Morgan Stanley asked Dan Junius, Immunogen CEO to “clarify the technology picture with Kadcyla in terms of which components are ImmunoGen technology – linker, payload – and whether you have rights to use the linker and payload in other assets.”
Answering him, ImmunoGen CEO said, “ Yes, I’d actually sort of turn it the other way. We own the linker and payload. We have the composition of matter patent on Kadcyla, so we contributed that technology. The piece of technology that came from Genentech was trastuzumab, the antibody that is marketed as a naked agent as Herceptin. But we own the composition of matter patent on the SMCC linker as well as on the cytotoxin itself, as well as methods of manufacture, et cetera. So the reason I turn it the other way in saying Genentech had to come to us for rights to use that, as opposed to them having any ownership of that technology.”
Logically speaking, one setback among more than 16 studies is not unusual, or a precedent. From what we experienced and heard until now, we do not expect long-term impact on ImmunoGen from this setback.
Kadcyla's sales for HER2 breast cancer will continue to climb and Kadcyla is expected to move up as first line treatment at the end of next year if not before – a move expected to increase Kadcyla’s sales, which are expected to exceed those of Roche’s HER2 breast cancer blockbuster Herceptin’s sales.
With regard to ImmunoGen’s wholly owned products, it is true that the firm might have lost one, but it has recently initiated trials with three wholly owned ADC compounds, including IMGN853 for ovarian, endometrial, and other cancers that highly express folate receptor α; IMGN529 for non-Hodgkin lymphoma; and IMGN289 for lung, head and neck, and other cancers that highly express EGFR.
We hope that the critics do not claim ADC drugs are toxic during dose escalation experiments when the firm pinpoints the toxic dose to avoid it, not to use it.
FORWARD-LOOKING: Material presented here is for informational purposes only. Nothing in this article should be taken as a solicitation to purchase or sell securities. Before buying or selling any stock you should do your own research and reach your own conclusion. Further, these are our 'opinions' and we may be wrong. We may have positions in securities mentioned in this article. You should take this into consideration before acting on any advice given in this article. If this makes you uncomfortable, then do not listen to our thoughts and opinions. The contents of this article do not take into consideration your individual investment objectives so consult with your own financial adviser before making an investment decision. Investing includes certain risks including loss of principal.
Disclosure: None
OMED ist der zweite Ami-Biotech, den ich mir gerade intensiv anschaue. Cancer stem cells sind sicherlich eines der kommenden wichtigen Themen in der Onkologie. Ob OMED die richtigen Targets richtig adressiert, kann ich auch nicht sagen. Die Nebenwirkungen der Pipelinekandidaten sind nicht von Pappe, aber scheinen nicht notwendigerweise unüberwindbar. Immerhin sind diese starken sehr spezifischen Nebenwirkungen wahrscheinlich auch ein Zeichen von hoher Wirksamkeit in ihren Pathways. Vom Chart her drängt sich der Einstieg noch nicht auf, kann aber auch ein Artefakt/Übertreibung bedingt durch die zu hohe Platzierung und vor allem die viel zu hohe Erstnotiz sein.
Weil mich ärgert, dass in Analystenkreisen immer noch die TAP-Technologie für den Abbruch der IMGN901-Studie verantwortlich gemacht wird, nachfolgend das CD56-Expressionsmuster:

Wie gut zu erkennen ist, wird CD56 von diversen Immunzellen exprimiert, in besonders hoher Konzentration von natürlichen Killerzellen. Die Infektionsproblematik ist auf dieses ungünstige Expressionsmuster zurückzuführen. Es handelt sich mithin um ein Targetproblem, dass während der Kombinationstherapie manifest geworden ist.
Der SPP-Linker ist besonders leicht spaltbar und im Hinblick auf mögliche andere NW nicht unproblematisch. Die aktuellen Ereignisse haben damit aber nichts zu tun.

Wie gut zu erkennen ist, wird CD56 von diversen Immunzellen exprimiert, in besonders hoher Konzentration von natürlichen Killerzellen. Die Infektionsproblematik ist auf dieses ungünstige Expressionsmuster zurückzuführen. Es handelt sich mithin um ein Targetproblem, dass während der Kombinationstherapie manifest geworden ist.
Der SPP-Linker ist besonders leicht spaltbar und im Hinblick auf mögliche andere NW nicht unproblematisch. Die aktuellen Ereignisse haben damit aber nichts zu tun.
@Joschka
Wenn Du sicher bist, dass die Immunogen- Technologie aufgrund von Falschinformationen in ein schlechtes Licht gerückt wird... brauchst Du Dich eigentlich nicht ärgern. Du könntest doch einfach die Gelegenheit beim Schopf ergreifen und ein paar MorphoSys- Aktien in Immunogen tauschen.
Hoffentlich kommt es bei MOR nicht zu solchen Vorgängen, die Technologie grundsätzlich in Frage zu stellen. Im anderen Thread habe ich gelesen, die MorphoSys IR folgt dem Dampfplauderer Feuerstein auf Twitter. Selten etwas Lächerlicheres gehört. Was soll das bringen, dieser Person zu folgen?
Wenn Du sicher bist, dass die Immunogen- Technologie aufgrund von Falschinformationen in ein schlechtes Licht gerückt wird... brauchst Du Dich eigentlich nicht ärgern. Du könntest doch einfach die Gelegenheit beim Schopf ergreifen und ein paar MorphoSys- Aktien in Immunogen tauschen.
Hoffentlich kommt es bei MOR nicht zu solchen Vorgängen, die Technologie grundsätzlich in Frage zu stellen. Im anderen Thread habe ich gelesen, die MorphoSys IR folgt dem Dampfplauderer Feuerstein auf Twitter. Selten etwas Lächerlicheres gehört. Was soll das bringen, dieser Person zu folgen?

Ich sehe gerade die ASH-Abstracts durch. Linker-bedingte Probleme sind weder bei SAR3419 noch bei BT-062 aufgetreten (beide mit spaltbarem SPDB-Linker)! Nach anderen IMGN-Kandidaten suche ich noch. Grüße an Herbert/Fred/Adam Feuerstein.
Der IMGN-Kurs dürfte heute unter Druck stehen, weil die SAR3419-Studienergebnisse insgesamt enttäuschend waren. Die Ergebnisse der BT-062-Kombistudie reißen mich auch nicht gerade vom Hocker.
Berichtetes Nebenwirkungsprofil o.k., Wirkung aber unbefriedigend. Per Saldo bleibt es dabei, dass sich der Unternehmenswert vermutlich aus Kadcyla und IMGN289 speist (dazu kommen ggf. noch die beiden AMG-Präparate). Für die anderen, derzeit in klinischen Studien befindlichen Präparate dürfte es schwer werden.
Berichtetes Nebenwirkungsprofil o.k., Wirkung aber unbefriedigend. Per Saldo bleibt es dabei, dass sich der Unternehmenswert vermutlich aus Kadcyla und IMGN289 speist (dazu kommen ggf. noch die beiden AMG-Präparate). Für die anderen, derzeit in klinischen Studien befindlichen Präparate dürfte es schwer werden.
@Joschka Schröder: Vielen DANK für die gute Recherche. Durch Ihre Informationen bin ich viel beruhigter in diesen turbulenten Zeiten für Immunogen. Sie hatten die jetzt aufgetretenen "Probleme" mit den spaltbaren Linkern ja schon im Vorfeld angedeutet. Ich fände es übrigens Klasse, wenn Sie gelegentlich auch einmal in einem US-Forum ihre fachkundige Meinung veröffentlichen würden. (z.B. Yahoo message-board von Immunogen) In dem großen Forum würde ihr Chart zum Targetproblem sicherlich gut ankommen, ebenso wie Ihre Unterscheidung zwischen den spaltbaren Linker von 901 und den neuen Thioether-Linkern. DANKE
Ein Satz aus dem abstract zu SAR650984:
The 10 mg/kg DL demonstrated 3 PR and 2 SD among 6 MM patients treated.
Die Patienten sind in ihrer Erkrankung sehr weit fortgeschritten (im Schnitt 7 vorherige Behandlungsregime).
Wenn ich es richtig verstehe, waren die schwersten Nebenwirkungen bisher solche des Grades 3.
https://ash.confex.com/ash/2013/webprogram/Paper60226.html
Ich finde das vielversprechend, bin und bleibe aber Laie und äußere das mit großem Vorbehalt.
The 10 mg/kg DL demonstrated 3 PR and 2 SD among 6 MM patients treated.
Die Patienten sind in ihrer Erkrankung sehr weit fortgeschritten (im Schnitt 7 vorherige Behandlungsregime).
Wenn ich es richtig verstehe, waren die schwersten Nebenwirkungen bisher solche des Grades 3.
https://ash.confex.com/ash/2013/webprogram/Paper60226.html
Ich finde das vielversprechend, bin und bleibe aber Laie und äußere das mit großem Vorbehalt.
Antwort auf Beitrag Nr.: 45.786.248 von SLGramann am 07.11.13 18:55:13Da kann ich mich nur anschließen. Die Präsentation dieses "nackten" Antikörpers hatte ich mir überhaupt noch nicht angesehen. Die SAR650984-Daten überzeugen.
Für SAR3419 und BT-062 würde ich dagegen auf Basis der derzeitigen Datenlage den Wert 0 ansetzen.
Für SAR3419 und BT-062 würde ich dagegen auf Basis der derzeitigen Datenlage den Wert 0 ansetzen.
Zitat von Joschka Schröder: Der IMGN-Kurs dürfte heute unter Druck stehen, weil die SAR3419-Studienergebnisse insgesamt enttäuschend waren.
Die mit dem Konkurrenzpräparat SGN-CD19A von Seattle Genetics erzielten Studienergebnisse sehen noch weniger schön aus -> https://ash.confex.com/ash/2013/webprogram/Paper59513.html
Interessant vielleicht auch, was Ohad Hammer zur Situation um IMGN sagt:
I was never a big fan of the program. Of course, every failure has an impact but with Kadcyla as a proof of concept, validation for IMGN’s technology is robust. The only issue is linker and payload selection for a given target and turns out that so far there is only 1 really good combination. I am still optimistic about IMGN853 despite the toxicity issues.
I plan on waiting for a better price, maybe around $11. At that level, the price reflects predominantly the T-DM1 royalty stake.
Zur Situation von ADCs im Allgemeinen:
No doubt ADCs are not as clean as people had hoped but they are still a promising approach and in some cases there will be ADCs with optimal combination of target/disease/linker/payload, of that I am certain.
Don’t see any meaningful readthrough for SGEN, if anything it is pssible because SGEN has been claiming IMGN’s linkers are less stable which can lead to toxicity. Important to note that SGEN have also encountered toxicity issues and their therapeutic window is not as wide as expected.
http://www.orf-blog.com/synta-implications-from-infinitys-hs…
I was never a big fan of the program. Of course, every failure has an impact but with Kadcyla as a proof of concept, validation for IMGN’s technology is robust. The only issue is linker and payload selection for a given target and turns out that so far there is only 1 really good combination. I am still optimistic about IMGN853 despite the toxicity issues.
I plan on waiting for a better price, maybe around $11. At that level, the price reflects predominantly the T-DM1 royalty stake.
Zur Situation von ADCs im Allgemeinen:
No doubt ADCs are not as clean as people had hoped but they are still a promising approach and in some cases there will be ADCs with optimal combination of target/disease/linker/payload, of that I am certain.
Don’t see any meaningful readthrough for SGEN, if anything it is pssible because SGEN has been claiming IMGN’s linkers are less stable which can lead to toxicity. Important to note that SGEN have also encountered toxicity issues and their therapeutic window is not as wide as expected.
http://www.orf-blog.com/synta-implications-from-infinitys-hs…
Sind die Amgen-Präp. eigentlich mit dem spaltbaren "alten" Linker oder mit dem neueren Thioether-Linker? (bei den spaltbaren scheint ja leider wenig brauchbares herauszukommen)
==> und IMGN289 ist ja erst in Phase I gestartet. Welche Bedingungen/Status müsste IMGN289 bekommen um in den Genuss einer vorzeitigen Zulassung nach Phase II durch die FDA zu erhalten. (da gibt es doch seit kurzem eine solche Möglichkeit wenn super Ergebnisse erzielt werden) Sorry, bin in der Materie zu sehr ein Laie. :-(
==> und IMGN289 ist ja erst in Phase I gestartet. Welche Bedingungen/Status müsste IMGN289 bekommen um in den Genuss einer vorzeitigen Zulassung nach Phase II durch die FDA zu erhalten. (da gibt es doch seit kurzem eine solche Möglichkeit wenn super Ergebnisse erzielt werden) Sorry, bin in der Materie zu sehr ein Laie. :-(
Zitat von Joschka Schröder: Für SAR3419 und BT-062 würde ich dagegen auf Basis der derzeitigen Datenlage den Wert 0 ansetzen.
Urteil BT-062 war vorschnell - nehme ich daher zurück, da die Patienten in der von mir zum Vergleich herangezogenen Carfilzomib-Kombistudien deutlich gesünder waren! Ich muss in den nächsten Tagen Vergleichsdaten für mehrfach vorbhandelte Patienten suchen.
@gunar_s: Die AMG-Präparate enthalten den Thioether-Linker. Die Begriffe "alt" und "neu" sind in diesem Zusammenhang allerdings unzutreffend. Thioether-Linker sind auch nicht für alle Tumorarten geeignet.
Novartis versus Feuerstein ... wer hat mehr Ahnung?
Aktuelle Meldung:
ImmunoGen, Inc. Announces Fifth New License Agreement in 2013
WALTHAM, Mass.--(BUSINESS WIRE)-- ImmunoGen, Inc. (Nasdaq: IMGN), a biotechnology company that develops targeted anticancer therapeutics, today announced that Novartis has licensed the exclusive right to use the Company's antibody-drug conjugate (ADC) technology to develop anticancer therapeutics to an undisclosed target. This is the third license to be taken by Novartis — and the fifth to be taken by a major healthcare company — this year.
Aktuelle Meldung:
ImmunoGen, Inc. Announces Fifth New License Agreement in 2013
WALTHAM, Mass.--(BUSINESS WIRE)-- ImmunoGen, Inc. (Nasdaq: IMGN), a biotechnology company that develops targeted anticancer therapeutics, today announced that Novartis has licensed the exclusive right to use the Company's antibody-drug conjugate (ADC) technology to develop anticancer therapeutics to an undisclosed target. This is the third license to be taken by Novartis — and the fifth to be taken by a major healthcare company — this year.
Ein Beitrag zur Diskussion über den Wert oder Unwert von IMGNs ADC-Technologie:
November 11, 2013
ImmunoGen, Inc. Announces Fifth New License Agreement in 2013
WALTHAM, Mass.--(BUSINESS WIRE)-- ImmunoGen, Inc. (Nasdaq: IMGN), a biotechnology company that develops targeted anticancer therapeutics, today announced that Novartis has licensed the exclusive right to use the Company's antibody-drug conjugate (ADC) technology to develop anticancer therapeutics to an undisclosed target. This is the third license to be taken by Novartis — and the fifth to be taken by a major healthcare company — this year.
"In the past year, Novartis, Eli Lilly and Amgen have each licensed exclusive rights to use our industry-leading ADC technology for one or more targets," commented Daniel Junius, President and CEO. "There are now numerous highly promising product candidates in the clinic through our own programs and through our partnerships, with many earlier-stage compounds advancing behind these."
The terms of this third Novartis license are consistent with the license announced last month.
November 11, 2013
ImmunoGen, Inc. Announces Fifth New License Agreement in 2013
WALTHAM, Mass.--(BUSINESS WIRE)-- ImmunoGen, Inc. (Nasdaq: IMGN), a biotechnology company that develops targeted anticancer therapeutics, today announced that Novartis has licensed the exclusive right to use the Company's antibody-drug conjugate (ADC) technology to develop anticancer therapeutics to an undisclosed target. This is the third license to be taken by Novartis — and the fifth to be taken by a major healthcare company — this year.
"In the past year, Novartis, Eli Lilly and Amgen have each licensed exclusive rights to use our industry-leading ADC technology for one or more targets," commented Daniel Junius, President and CEO. "There are now numerous highly promising product candidates in the clinic through our own programs and through our partnerships, with many earlier-stage compounds advancing behind these."
The terms of this third Novartis license are consistent with the license announced last month.
Antwort auf Beitrag Nr.: 45.806.690 von Joschka Schröder am 11.11.13 13:36:48Da haben wir uns überschnitten... 

Pre market jedoch im Minus das ist Sinnfrei...
Antwort auf Beitrag Nr.: 45.806.990 von Aurum2010 am 11.11.13 14:13:49das liegt daran ->
ImmunoGen Inc. (NASDAQ: IMGN) was downgraded to Underweight from Equal Weight at Morgan Stanley.
ImmunoGen Inc. (NASDAQ: IMGN) was downgraded to Underweight from Equal Weight at Morgan Stanley.
Downrating noch wegen des Stop der Phase II trial von IMGN901...
Denke IMGN kann das bei deren Pipeline und Partnerings locker verkraften.
Was habt Ihr hier für Preisfantasien? Zum den aktuellen Kursen ist IMGN mit mehr als 1 Milliarde bewertet.
Denke IMGN kann das bei deren Pipeline und Partnerings locker verkraften.
Was habt Ihr hier für Preisfantasien? Zum den aktuellen Kursen ist IMGN mit mehr als 1 Milliarde bewertet.
Zitat von Joschka Schröder:Zitat von Aurum2010: Zum den aktuellen Kursen ist IMGN mit mehr als 1 Milliarde bewertet.
Der aktuelle Unternehmenswert (Börsenkap. abzgl. NetCash) beträgt aktuell 689 Mio. USD (Kurs 13,10 USD). Im Vergleich dazu Morphosys 1.073 Mio. USD.
Muss natürlich heißen:
689 Mio. €
1.073 Mio. €
14,90 USD ... eine schöne Gelegenheit, die während der allgemeinen Panik aufgebaute Tradingposition zu schließen. Die defensive (-> konservativer Depotanteil) Langfristposition bleibt unberührt.
Der gegenwärtige Kursverlauf ist ein schönes Beispiel dafür, dass "der Markt" Schwierigkeiten hat, sich ein vernünftiges Urteil über Biotechnologieaktien im Allgemeinen und IMGN im Speziellen zu bilden.
Heute lag die Kursspanne bislang zwischen 13 USD und 15,44 USD. Morgan Stanley zu Börseneröffnung mit Kursziel 9,5 USD, vor einigen Tagen hingegen RBCCapital mit Kursziel 18 USD (davor 22 USD, bis zum 5.8.13 17 USD).
In die jüngste Studie von Cantor Fitzgerald (Kursziel 14 USD) habe ich vorhin einen Blick geworfen. Den Kadcyla-Royalties wird ein Wert von insgesamt 250 Mio. USD zugestanden (tatsächlich dürfte das in einigen Jahren dem jährlichen Tantiemenfluss entsprechen), die Eigenentwicklungen IMGN853, IMGN529 und IMGN829 werden undifferenziert mit je 100 Mio. USD bis 150 Mio. USD bewertet. Und in diesem Stil setzt sich das ganze fort.
Biotech ist eine schwer zu bewertende Branche - ich bin selber oft am verzweifeln ... dieser qualitativ minderwertige Analystenschrott ist aber kaum zu ertragen. Eine Krankenschwester oder ein Sozialhelfer müßten, wenn es mit rechten Dingen zuginge, das Vielfache eines durchschnittlichen Analysten verdienen.
Die Vorteile dieser im Blindflug erstellten Unternehmensanalysen liegen in erratischen Märkten. Wer sich selber mittels intensiver Recherche eine eigene Meinung bildet, kann gute Geschäfte machen.
Heute lag die Kursspanne bislang zwischen 13 USD und 15,44 USD. Morgan Stanley zu Börseneröffnung mit Kursziel 9,5 USD, vor einigen Tagen hingegen RBCCapital mit Kursziel 18 USD (davor 22 USD, bis zum 5.8.13 17 USD).
In die jüngste Studie von Cantor Fitzgerald (Kursziel 14 USD) habe ich vorhin einen Blick geworfen. Den Kadcyla-Royalties wird ein Wert von insgesamt 250 Mio. USD zugestanden (tatsächlich dürfte das in einigen Jahren dem jährlichen Tantiemenfluss entsprechen), die Eigenentwicklungen IMGN853, IMGN529 und IMGN829 werden undifferenziert mit je 100 Mio. USD bis 150 Mio. USD bewertet. Und in diesem Stil setzt sich das ganze fort.
Biotech ist eine schwer zu bewertende Branche - ich bin selber oft am verzweifeln ... dieser qualitativ minderwertige Analystenschrott ist aber kaum zu ertragen. Eine Krankenschwester oder ein Sozialhelfer müßten, wenn es mit rechten Dingen zuginge, das Vielfache eines durchschnittlichen Analysten verdienen.
Die Vorteile dieser im Blindflug erstellten Unternehmensanalysen liegen in erratischen Märkten. Wer sich selber mittels intensiver Recherche eine eigene Meinung bildet, kann gute Geschäfte machen.
Nachbörslich notiert die Aktie aktuell bei 14,29 USD.
Kurz der heutige Kursverlauf (Schlußkurs am Freitag 13,64 USD):
13,0 USD -> 15,5 USD -> 14,3 (nachbörslich)
... und während dieser Achterbahnfahrt keinerlei Unternehmensnews.
Das Spielkasino Börse ist außer Rand und Band.
Kurz der heutige Kursverlauf (Schlußkurs am Freitag 13,64 USD):
13,0 USD -> 15,5 USD -> 14,3 (nachbörslich)
... und während dieser Achterbahnfahrt keinerlei Unternehmensnews.
Das Spielkasino Börse ist außer Rand und Band.
Die Natur hat mich mit einem metastasierten Mammakarzinom Her2+ bedacht. Jetzt steht eine "second line" Behandlung an. Wenn ich die Kosten- / Nutzenbewertungen sehe und die Diskussion hier, dann werde ich wohl noch einige Tumore und Metastasen überleben müssen, bevor ich "third line" in den Genuß dieses wirksamen Medikaments komme.
Antwort auf Beitrag Nr.: 45.811.938 von Christina88 am 12.11.13 08:57:24@Christina88
Ich habe Ihnen eine Boardmail geschickt.
Ich habe Ihnen eine Boardmail geschickt.
Habe einen interessanten Artikel gefunden: (ein Link aus dem Ami-Forum)
http://oncology.healthace.com/111113/oncology_report_111113.…
http://oncology.healthace.com/111113/oncology_report_111113.…
ImmunoGen, Inc. Announces Approval of Roche's Kadcyla(R) in the European Union
European Commission has approved Kadcyla® for marketing in the EU, which triggers a $5 million milestone payment to ImmunoGen.
Kadcyla comprises Roche's trastuzumab antibody with ImmunoGen's linker and DM1 cell-killing agent.
WALTHAM, Mass.--(BUSINESS WIRE)-- ImmunoGen, Inc. (Nasdaq: IMGN), a biotechnology company that develops novel anticancer therapeutics using its antibody-drug conjugate (ADC) technology, today announced that the European Commission has granted marketing approval for Kadcyla (trastuzumab emtansine; ado-trastuzumab emtansine in the US) in the European Union (EU). This event triggers a $5 million milestone payment to ImmunoGen.
Kadcyla has been approved for the treatment of adult patients with HER2-positive, unresectable locally advanced or metastatic breast cancer who previously received Herceptin® (trastuzumab) and a taxane, separately or in combination. Patients should have either: (1) received prior therapy for locally advanced or metastatic disease or (2) developed disease recurrence during or within six months of completing adjuvant therapy.
As with the Kadcyla approvals that have been granted in the US, Japan, and other geographies, the approval in the EU is based on the findings in the EMILIA Phase III trial. In the EU and other international markets, the timing of the commercial availability of Kadcyla after approval can vary due to national differences in processes for establishing pricing/reimbursement, with some countries — including Germany — able to launch shortly after approval.
"The European Commission's decision is an important step toward Kadcyla becoming commercially available across the EU for patients with advanced HER2-positive breast cancer," commented Daniel Junius, ImmunoGen President and CEO.
About Kadcyla
Kadcyla consists of Roche's trastuzumab antibody with ImmunoGen's DM1 cytotoxic agent attached using one of the Company's engineered linkers. Roche has global development and commercialization rights for Kadcyla; ImmunoGen is entitled to receive royalties on product sales as well as specified milestone payments.
Roche is conducting studies assessing Kadcyla for a number of additional potential uses. These include for the first-line treatment of HER2-positive metastatic breast cancer, for early stage HER2-positive breast cancer and for advanced HER2-positive gastric cancer.
European Commission has approved Kadcyla® for marketing in the EU, which triggers a $5 million milestone payment to ImmunoGen.
Kadcyla comprises Roche's trastuzumab antibody with ImmunoGen's linker and DM1 cell-killing agent.
WALTHAM, Mass.--(BUSINESS WIRE)-- ImmunoGen, Inc. (Nasdaq: IMGN), a biotechnology company that develops novel anticancer therapeutics using its antibody-drug conjugate (ADC) technology, today announced that the European Commission has granted marketing approval for Kadcyla (trastuzumab emtansine; ado-trastuzumab emtansine in the US) in the European Union (EU). This event triggers a $5 million milestone payment to ImmunoGen.
Kadcyla has been approved for the treatment of adult patients with HER2-positive, unresectable locally advanced or metastatic breast cancer who previously received Herceptin® (trastuzumab) and a taxane, separately or in combination. Patients should have either: (1) received prior therapy for locally advanced or metastatic disease or (2) developed disease recurrence during or within six months of completing adjuvant therapy.
As with the Kadcyla approvals that have been granted in the US, Japan, and other geographies, the approval in the EU is based on the findings in the EMILIA Phase III trial. In the EU and other international markets, the timing of the commercial availability of Kadcyla after approval can vary due to national differences in processes for establishing pricing/reimbursement, with some countries — including Germany — able to launch shortly after approval.
"The European Commission's decision is an important step toward Kadcyla becoming commercially available across the EU for patients with advanced HER2-positive breast cancer," commented Daniel Junius, ImmunoGen President and CEO.
About Kadcyla
Kadcyla consists of Roche's trastuzumab antibody with ImmunoGen's DM1 cytotoxic agent attached using one of the Company's engineered linkers. Roche has global development and commercialization rights for Kadcyla; ImmunoGen is entitled to receive royalties on product sales as well as specified milestone payments.
Roche is conducting studies assessing Kadcyla for a number of additional potential uses. These include for the first-line treatment of HER2-positive metastatic breast cancer, for early stage HER2-positive breast cancer and for advanced HER2-positive gastric cancer.
Antwort auf Beitrag Nr.: 45.875.034 von Joschka Schröder am 20.11.13 09:15:26Dazu aus dem aktuellen Kommentar der Schweizerischen Finanz+Wirtschaft:
"Analysten trauen dem Medikament einen Spitzenumsatz von jährlich bis zu 8,5 Mrd. $ zu. Damit würde Roche die Einnahmen ihres bisher gegen HER2-positiven Brustkrebs verwendeten Produkts Herceptin deutlich übertreffen."
"Analysten trauen dem Medikament einen Spitzenumsatz von jährlich bis zu 8,5 Mrd. $ zu. Damit würde Roche die Einnahmen ihres bisher gegen HER2-positiven Brustkrebs verwendeten Produkts Herceptin deutlich übertreffen."
Der Vollständigkeit halber noch die aktuelle Roche-Meldung (ohne Tabellen etc.):
Roche’s Kadcyla approved in the EU for advanced HER2-positive breast cancer
• More than 70,000 people in Europe each year are diagnosed with advanced breast cancer, of whom approximately one in five will have HER2-positive disease
• There is currently no cure for advanced breast cancer, and whilst in recent years the outlook has improved, further treatments are needed to help ensure people continue to have options when their disease gets worse
• In a clinical study people with HER2-positive advanced breast cancer who were treated with Kadcyla survived almost six months longer than those receiving the standard treatment of lapatinib and Xeloda
• Patients also experienced fewer of the severe side effects commonly associated with chemotherapy, as Kadcyla’s targeted mode of action works to deliver the treatment directly to cancer cells, limiting damage to healthy tissues
Roche (SIX: RO, ROG; OTCQX: RHHBY) today announced that Kadcyla (trastuzumab emtansine or T-DM1), the latest targeted medicine from its HER2 franchise and its first antibody-drug conjugate, has been approved by the European Commission for people with previously treated HER2-positive advanced breast cancer.
Specifically, Kadcyla is indicated as a single agent for the treatment of adults with HER2-positive, unresectable locally advanced or metastatic breast cancer who previously received Herceptin (trastuzumab) and a taxane, separately or in combination. The indication also stipulates that those treated should either have received prior therapy for locally advanced or metastatic disease, or have had disease recurrence during or within six months of completing adjuvant therapy.
“Kadcyla's approval in the EU is important because this type of targeted medicine has been shown in clinical studies to offer clear benefits for people with advanced HER2-positive breast cancer,” said Hal Barron, M.D., Roche’s Chief Medical Officer and Head of Global Product Development. “Now that Kadcyla has been approved, we can begin discussions with the relevant EU reimbursement authorities to ensure that people who need this medicine can receive it as quickly as possible."
The decision is based on results from the pivotal Phase III EMILIA study in which people previously treated with Herceptin and a taxane for their HER2-positive advanced breast cancer were randomised to receive either Kadcyla or a standard treatment, lapatinib and Xeloda (capecitabine). People receiving Kadcyla survived significantly longer than those who received lapatanib and Xeloda (30.9 vs 25.1 months) and also lived for nearly 10 months (9.6 months) without their disease getting worse, a median of 3.2 months longer than those who received lapatinib and Xeloda. They also experienced fewer of the severe side effects commonly associated with chemotherapy, as Kadcyla’s targeted mode of action works to deliver the treatment directly to cancer cells, limiting damage to healthy tissues.
About Kadcyla
Kadcyla is the third targeted medicine Roche has developed for the treatment of HER2-positive breast cancer. It is a type of medicine called an antibody-drug conjugate and it connects two anti-cancer properties: the HER2 inhibition of trastuzumab (the active ingredient found in Herceptin) and the cytotoxic chemotherapy, DM1. The trastuzumab and the DM1 are joined together using a ‘stable’ linker to deliver DM1 directly to HER2-positive breast cancer cells.
Roche licenses technology for Kadcyla under an agreement with ImmunoGen, Inc.
Roche’s Kadcyla approved in the EU for advanced HER2-positive breast cancer
• More than 70,000 people in Europe each year are diagnosed with advanced breast cancer, of whom approximately one in five will have HER2-positive disease
• There is currently no cure for advanced breast cancer, and whilst in recent years the outlook has improved, further treatments are needed to help ensure people continue to have options when their disease gets worse
• In a clinical study people with HER2-positive advanced breast cancer who were treated with Kadcyla survived almost six months longer than those receiving the standard treatment of lapatinib and Xeloda
• Patients also experienced fewer of the severe side effects commonly associated with chemotherapy, as Kadcyla’s targeted mode of action works to deliver the treatment directly to cancer cells, limiting damage to healthy tissues
Roche (SIX: RO, ROG; OTCQX: RHHBY) today announced that Kadcyla (trastuzumab emtansine or T-DM1), the latest targeted medicine from its HER2 franchise and its first antibody-drug conjugate, has been approved by the European Commission for people with previously treated HER2-positive advanced breast cancer.
Specifically, Kadcyla is indicated as a single agent for the treatment of adults with HER2-positive, unresectable locally advanced or metastatic breast cancer who previously received Herceptin (trastuzumab) and a taxane, separately or in combination. The indication also stipulates that those treated should either have received prior therapy for locally advanced or metastatic disease, or have had disease recurrence during or within six months of completing adjuvant therapy.
“Kadcyla's approval in the EU is important because this type of targeted medicine has been shown in clinical studies to offer clear benefits for people with advanced HER2-positive breast cancer,” said Hal Barron, M.D., Roche’s Chief Medical Officer and Head of Global Product Development. “Now that Kadcyla has been approved, we can begin discussions with the relevant EU reimbursement authorities to ensure that people who need this medicine can receive it as quickly as possible."
The decision is based on results from the pivotal Phase III EMILIA study in which people previously treated with Herceptin and a taxane for their HER2-positive advanced breast cancer were randomised to receive either Kadcyla or a standard treatment, lapatinib and Xeloda (capecitabine). People receiving Kadcyla survived significantly longer than those who received lapatanib and Xeloda (30.9 vs 25.1 months) and also lived for nearly 10 months (9.6 months) without their disease getting worse, a median of 3.2 months longer than those who received lapatinib and Xeloda. They also experienced fewer of the severe side effects commonly associated with chemotherapy, as Kadcyla’s targeted mode of action works to deliver the treatment directly to cancer cells, limiting damage to healthy tissues.
About Kadcyla
Kadcyla is the third targeted medicine Roche has developed for the treatment of HER2-positive breast cancer. It is a type of medicine called an antibody-drug conjugate and it connects two anti-cancer properties: the HER2 inhibition of trastuzumab (the active ingredient found in Herceptin) and the cytotoxic chemotherapy, DM1. The trastuzumab and the DM1 are joined together using a ‘stable’ linker to deliver DM1 directly to HER2-positive breast cancer cells.
Roche licenses technology for Kadcyla under an agreement with ImmunoGen, Inc.
Co-Development BT-062 for US-Market:
http://www.biotest.de/ww/en/pub/investor_relations/news/news…
Ich hoffe Immunogen nutzt die Option für 15 Mio. $ , Geld haben Sie ja genug auf der hohen Kante. (wenn nicht, dann hat das Management jeglichen "Kredit" bei mir verloren)
Gruß und Dank an Joschka Schröder für den Verweis auf diesen Punkt der Lizenzvereinbarung. (im Thread "Biotest")
http://www.biotest.de/ww/en/pub/investor_relations/news/news…
Ich hoffe Immunogen nutzt die Option für 15 Mio. $ , Geld haben Sie ja genug auf der hohen Kante. (wenn nicht, dann hat das Management jeglichen "Kredit" bei mir verloren)
Gruß und Dank an Joschka Schröder für den Verweis auf diesen Punkt der Lizenzvereinbarung. (im Thread "Biotest")
Antwort auf Beitrag Nr.: 45.880.662 von gunar_s am 20.11.13 17:42:49Immunogen hat ausreichend Zeit, die weiteren Entwicklungen abzuwarten. Der IMGN-Vorstand hat dies kürzlich noch einmal betont. Falls sich der BT-062 als erfolgreich erweisen sollte, wäre es aus Immunogens Sicht zweckmäßig, so lange wie möglich mit dem Ziehen der Option zu warten. Bis dahin muss Biotest nämlich alleine für die gesamten Entwicklungskosten aufkommen. Je weiter die Entwicklung fortgeschritten ist, desto fundierter auch das Urteil, ob eine Projektbeteiligung Sinn macht.
Die Ergebnisse der SAR650984-Dosiseskalationsstudie (Monotherapie in der Indikation refakt./relaps. Multiples Myelom) sind hervorragend. Einen detaillierten Vergleich mit früheren Ergebnissen anderer Präparate muss ich gleich noch durchführen. Ich kann mich aber nicht daran erinnern, in einer derartigen Monotherapiestudie schon einmal ähnliches gesehen zu haben.
SAR650984-Präsentation heute Nacht bei der ASH-Tagung in New Orleans.
SAR650984 ist eine Erfindung von Immunogen, später auslizensiert an Sanofi. Es handelt sich um einen nackten Antikörper gegen CD38.
SAR650984-Präsentation heute Nacht bei der ASH-Tagung in New Orleans.
SAR650984 ist eine Erfindung von Immunogen, später auslizensiert an Sanofi. Es handelt sich um einen nackten Antikörper gegen CD38.
Kurz ein Vergleich der SAR650984-Daten (Sanofi/Immunogen) mit den BT-062-Daten (Biotest/Immunogen) aus einer vergleichbaren Dosiseskalationsstudie.
Die Patientenkollektivebeider Studien dürften sich nicht voneinander unterscheiden (quasi austherapierte, vielfach vorbehandelte Patienten). Jeweils Dosiseskalation in Monotherapie (BT-062 40 mg/m² bis 160 mg/m² an den Tagen 1,8 und 15 im Vierwochenzyklus; SAR650984 1 mg/kg bis 20 mg/kg je 14 Tage, teilweise gesplittet in 2 Gaben).
Die Ergebnisse:
BT-062
Complete Response (CR) 0%
Partial Response (PR) 4%
Minimal Response (MR) 4%
Overal Response Rate (ORR) 4%
Clinical Benefit Rate (CBR) 7%
SAR650984
Complete Response (CR) 8%
Partial Response (PR) 17%
Minimal Response (MR) 8%
Overal Response Rate (ORR) 25%
Clinical Benefit Rate (CBR) 33%
SAR650984 in Dosis größer gleich 10 mg/kg
Complete Response (CR) 18%
Partial Response (PR) 18%
Minimal Response (MR) 9%
Overal Response Rate (ORR) 36%
Clinical Benefit Rate (CBR) 45%
Fazit: Als Monotherapeutikum scheint SAR650984 deutlich überlegen. Gut für Immunogen, dass IMGN an beiden Entwicklungen beteiligt ist (SAR650984 an Sanofi auslizenziert, für BT-061 besitzt IMGN eine Co-Vermarktungsoption für die USA, ansonsten das übliche Tantiemenmodell).
Die Daten aus der BT-062/LEN/DEX-Kombistudie, die heute Nacht in den USA präsentiert werden, dürften deutlich besser ausgefallen sein. Diese Daten werde ich später mit Daten aus entsprechenden Kombistudien vergleichen.
Wie man es auch wendet ... der IMGN-Kurs müßte eine wesentlich stärkere Reaktion zeigen.
Die Patientenkollektivebeider Studien dürften sich nicht voneinander unterscheiden (quasi austherapierte, vielfach vorbehandelte Patienten). Jeweils Dosiseskalation in Monotherapie (BT-062 40 mg/m² bis 160 mg/m² an den Tagen 1,8 und 15 im Vierwochenzyklus; SAR650984 1 mg/kg bis 20 mg/kg je 14 Tage, teilweise gesplittet in 2 Gaben).
Die Ergebnisse:
BT-062
Complete Response (CR) 0%
Partial Response (PR) 4%
Minimal Response (MR) 4%
Overal Response Rate (ORR) 4%
Clinical Benefit Rate (CBR) 7%
SAR650984
Complete Response (CR) 8%
Partial Response (PR) 17%
Minimal Response (MR) 8%
Overal Response Rate (ORR) 25%
Clinical Benefit Rate (CBR) 33%
SAR650984 in Dosis größer gleich 10 mg/kg
Complete Response (CR) 18%
Partial Response (PR) 18%
Minimal Response (MR) 9%
Overal Response Rate (ORR) 36%
Clinical Benefit Rate (CBR) 45%
Fazit: Als Monotherapeutikum scheint SAR650984 deutlich überlegen. Gut für Immunogen, dass IMGN an beiden Entwicklungen beteiligt ist (SAR650984 an Sanofi auslizenziert, für BT-061 besitzt IMGN eine Co-Vermarktungsoption für die USA, ansonsten das übliche Tantiemenmodell).
Die Daten aus der BT-062/LEN/DEX-Kombistudie, die heute Nacht in den USA präsentiert werden, dürften deutlich besser ausgefallen sein. Diese Daten werde ich später mit Daten aus entsprechenden Kombistudien vergleichen.
Wie man es auch wendet ... der IMGN-Kurs müßte eine wesentlich stärkere Reaktion zeigen.
Antwort auf Beitrag Nr.: 46.013.392 von Joschka Schröder am 09.12.13 18:26:37Besonders erwähnenswert: Die MTD (Maximum tolerated dose) ist in der SAR650984-Studie noch nicht erreicht!
Habe schnell noch einmal in den alten SEC-Meldungen die Bedingungen der IMGN-Sanofi-Kooperation nachgelesen: Wenn ich mich nicht täusche, müßte Immunogen bzgl. SAR650984 eine Option auf Co-Promotion-Rechte für die USA besitzen ("ImmunoGen has an option to certain co-promotion rights in the United States on a product-by-product basis"). Das würde SAR650984´s Wert für Immunogen deutlich erhöhen.
http://www.myelomabeacon.com/resources/mtgs/ash2013/abs/284/
Tumor growth inhibition threshold was reached at Cmax for 1 patient at DL 5 mg/kg and 5 patients at DL 10 mg/kg.

Tumor growth inhibition threshold was reached at Cmax for 1 patient at DL 5 mg/kg and 5 patients at DL 10 mg/kg.
Antwort auf Beitrag Nr.: 46.015.834 von StefanR am 10.12.13 00:01:49Dein Link verweist nicht auf die aktuellen Daten. Es handelt sich vielmehr um ein vorläufiges Abstract, das viele Monate vor dem ASH-Meeting eingereicht worden ist. Die gestern vorgetragenen Studienergebnisse sind wesentlich besser.
On December 9, 2013 Biotest AG issued a press release on the presentation of BT-062 clinical findings at the 2013 American Society of Hematology (ASH) annual meeting. BT-062 is an antibody-drug conjugate (ADC) in development by Biotest. It comprises Biotest’s CD138-targeting antibody with ImmunoGen’s DM4 cancer-killing agent attached using one of ImmunoGen’s engineered linkers, and is being developed under a 2006 agreement between the companies.
The findings reported are from a Biotest Phase I/IIa clinical trial that evaluates BT-062 (administered days 1, 8 and 15 of a 4-week cycle) when used in combination with lenalidomide (Revlimid®) and dexamethasone. To be eligible for enrollment, patients must have relapsed or relapsed/refractory multiple myeloma; previous treatment with lenalidomide and/or dexamethasone was allowed.
In the Phase I portion of the trial, three different dose levels of BT-062 — 80, 100, 120 mg/m 2 — were evaluated in combination with lenalidomide/dexamethasone to establish the maximum tolerated dose (MTD) of BT-062 when used with these drugs. In its Phase II portion now underway, a total of 37 patients are to receive BT-062 at its MTD with lenalidomide/dexamethasone to further evaluate safety and efficacy.
BT-062 was found to be well tolerated in combination with lenalidomide/dexamethasone at dose levels up to 100 mg/m 2 , which was determined to be the MTD.
Across the three dose levels tested, 15 patients were evaluable for efficacy at the time of data cutoff for presentation at ASH. All (100%) of these heavily pretreated patients had clinical benefit from therapy, achieving stable disease or better, and 11 of these 15 patients achieved a partial response or better, resulting in an objective response rate (ORR) of 73%.
· The ORR was comparable, 75%, in the subgroup of patients who were refractory to lenalidomide/dexamethasone.
· Eight of the nine evaluable patients who received BT-062 at its MTD had a partial response or better, for an ORR of 89%.
In addition to reporting these clinical data, Biotest also noted in its press release that it plans to evaluate BT-062 for the treatment of relevant solid tumors in a Phase I/IIa study, with patient enrollment planned to start in early 2014. This study will recruit patients with metastatic triple negative breast cancer and ones with metastatic urinary bladder cancer.
ImmunoGen has an opt-in right for BT-062 co-development and co-commercialization jointly with Biotest in the US at a later stage of its development.
The findings reported are from a Biotest Phase I/IIa clinical trial that evaluates BT-062 (administered days 1, 8 and 15 of a 4-week cycle) when used in combination with lenalidomide (Revlimid®) and dexamethasone. To be eligible for enrollment, patients must have relapsed or relapsed/refractory multiple myeloma; previous treatment with lenalidomide and/or dexamethasone was allowed.
In the Phase I portion of the trial, three different dose levels of BT-062 — 80, 100, 120 mg/m 2 — were evaluated in combination with lenalidomide/dexamethasone to establish the maximum tolerated dose (MTD) of BT-062 when used with these drugs. In its Phase II portion now underway, a total of 37 patients are to receive BT-062 at its MTD with lenalidomide/dexamethasone to further evaluate safety and efficacy.
BT-062 was found to be well tolerated in combination with lenalidomide/dexamethasone at dose levels up to 100 mg/m 2 , which was determined to be the MTD.
Across the three dose levels tested, 15 patients were evaluable for efficacy at the time of data cutoff for presentation at ASH. All (100%) of these heavily pretreated patients had clinical benefit from therapy, achieving stable disease or better, and 11 of these 15 patients achieved a partial response or better, resulting in an objective response rate (ORR) of 73%.
· The ORR was comparable, 75%, in the subgroup of patients who were refractory to lenalidomide/dexamethasone.
· Eight of the nine evaluable patients who received BT-062 at its MTD had a partial response or better, for an ORR of 89%.
In addition to reporting these clinical data, Biotest also noted in its press release that it plans to evaluate BT-062 for the treatment of relevant solid tumors in a Phase I/IIa study, with patient enrollment planned to start in early 2014. This study will recruit patients with metastatic triple negative breast cancer and ones with metastatic urinary bladder cancer.
ImmunoGen has an opt-in right for BT-062 co-development and co-commercialization jointly with Biotest in the US at a later stage of its development.
Zitat von Joschka Schröder: Wie man es auch wendet ... der IMGN-Kurs müßte eine wesentlich stärkere Reaktion zeigen.
Die Reaktion verwundert mich nicht. Das ist üblich bei Aktien, die zuvor einen schweren Schlag hinnehmen mussten. Die brauchen meist lange bis sie sich wieder erholen und das Zutrauen wieder da ist.
Ich bin froh bei 13 und 13,5 in der jüngsten Panik nochmal kräftig nachgelegt zu haben. Eigentlich wollte ich diese Tradingposition nur bis 15,5 halten, denke aber inzwischen, dass 2014 auch problemlos 20 realisierbar sind.
http://seekingalpha.com/article/1893521-immunogens-ceo-prese…
11.11.2013 Oppenheim health conference
.....
"The other compound that was featured in an oral presentation is one from Sanofi, 650984. This is a compound that targets CD38. It is a naked antibody. So it doesn’t necessarily make a statement about our ADC technology, but given that within ADCs that we’re developing, we have several that have active antibodies in and of themselves, the fact that we have demonstrated with the data and I’ll review the data in a second, I think it does make a statement about our ability not just an ADC company, but the A portion of the ADC is important. We can develop antibodies that can be very effective as therapies. The data here again it was for multiple myeloma. This was as a single agent, what you had was of the evaluable [ph] patients 77% of them had stable disease or better. And again this is simply what the naked antibody and among the 11 patients receiving higher doses there were a number of CRs a number of PRs and a minimal response, so north of 30% it turns that the overall response rate for these patients had the higher dose levels. So quite interesting, CD38 is a target that’s attracted quite a bit of attention. It’s a -- there are other antibodies that’s been licensed in by big players J&J did a deal with Genmed, Celgene did a deal with MorphoSys, both around naked CD38 compound. So we think this looks to be quite interesting, we’ll see how Sanofi choose it to take it forward."
(Diesmal erst einen Tag alt, Joschka )
)
Grüsse, StefanR
11.11.2013 Oppenheim health conference
.....
"The other compound that was featured in an oral presentation is one from Sanofi, 650984. This is a compound that targets CD38. It is a naked antibody. So it doesn’t necessarily make a statement about our ADC technology, but given that within ADCs that we’re developing, we have several that have active antibodies in and of themselves, the fact that we have demonstrated with the data and I’ll review the data in a second, I think it does make a statement about our ability not just an ADC company, but the A portion of the ADC is important. We can develop antibodies that can be very effective as therapies. The data here again it was for multiple myeloma. This was as a single agent, what you had was of the evaluable [ph] patients 77% of them had stable disease or better. And again this is simply what the naked antibody and among the 11 patients receiving higher doses there were a number of CRs a number of PRs and a minimal response, so north of 30% it turns that the overall response rate for these patients had the higher dose levels. So quite interesting, CD38 is a target that’s attracted quite a bit of attention. It’s a -- there are other antibodies that’s been licensed in by big players J&J did a deal with Genmed, Celgene did a deal with MorphoSys, both around naked CD38 compound. So we think this looks to be quite interesting, we’ll see how Sanofi choose it to take it forward."
(Diesmal erst einen Tag alt, Joschka
 )
)Grüsse, StefanR
"Immunogen (NASDAQ:IMGN) CEO Daniel Junius sold 15,000 shares of the stock in a transaction dated Tuesday, December 10th. The shares were sold at an average price of $15.11, for a total transaction of $226,650.00. Following the completion of the sale, the chief executive officer now directly owns 73,336 shares of the company’s stock, valued at approximately $1,108,107. The sale was disclosed in a filing with the SEC, which can be accessed through this link. "
Die Insiderverkäufe sind einfach nervig!
Die Insiderverkäufe sind einfach nervig!

Die Aktien stammen aus dem Aktienoptionsprogramm. Taggleich gezogen (für, wenn ich mich recht erinnere, ca. 5 USD je Aktie) und anschließend über die Börse verkauft. Ist bei derartigen Firmen, bei denen ein Gehaltsanteil aus Aktienoptionen besteht, (leider) so üblich.
http://www.streetinsider.com/Corporate+News/ImmunoGen+(IMGN)…
Effective December 9, 2013, ImmunoGen, Inc. (Nasdaq: IMGN) and Eli Lilly and Company (NYSE: LLY) amended the Multi-Target Agreement that we entered into with Lilly on December 19, 2011 (the “Multi-Target Agreement”) and the first development and commercialization license that was taken thereunder on August 26, 2013 (the “License Agreement”). Under these amendments, Lilly now has the right to extend the three-year right-to-test period of the Multi-Target Agreement for up to two six-month periods by payment to us of additional consideration. In addition, Lilly will retroactively pay us an exercise fee of $2,000,000 for the License Agreement, with the right to elect which one of the additional development and commercialization licenses, if any, taken under the Multi-Target Agreement will have no exercise fee. Prior to these amendments, the Multi-Target Agreement provided for no extension of the right-to-test period, that no exercise fee was payable in connection with the first development and commercialization license taken thereunder, and that we would be entitled to receive an exercise fee of $2,000,000 for every subsequent development and commercialization license.
Effective December 9, 2013, ImmunoGen, Inc. (Nasdaq: IMGN) and Eli Lilly and Company (NYSE: LLY) amended the Multi-Target Agreement that we entered into with Lilly on December 19, 2011 (the “Multi-Target Agreement”) and the first development and commercialization license that was taken thereunder on August 26, 2013 (the “License Agreement”). Under these amendments, Lilly now has the right to extend the three-year right-to-test period of the Multi-Target Agreement for up to two six-month periods by payment to us of additional consideration. In addition, Lilly will retroactively pay us an exercise fee of $2,000,000 for the License Agreement, with the right to elect which one of the additional development and commercialization licenses, if any, taken under the Multi-Target Agreement will have no exercise fee. Prior to these amendments, the Multi-Target Agreement provided for no extension of the right-to-test period, that no exercise fee was payable in connection with the first development and commercialization license taken thereunder, and that we would be entitled to receive an exercise fee of $2,000,000 for every subsequent development and commercialization license.
Zitat von Joschka Schröder: Die Aktien stammen aus dem Aktienoptionsprogramm. Taggleich gezogen (für, wenn ich mich recht erinnere, ca. 5 USD je Aktie) und anschließend über die Börse verkauft. Ist bei derartigen Firmen, bei denen ein Gehaltsanteil aus Aktienoptionen besteht, (leider) so üblich.
Mir stellt sich schon lange die Frage, ob es sich bei solchen Optionsprogrammen nicht um eigentümerschädliche Vorgänge bzw. vorsätzlichen Betrug handelt. Fakt ist: Wertpapiere weisen erhebliche Kursschwankungen auf. Von dieser Tatsache profitieren die Insider, Bezieher der Optionen (was zahlen sie für die Optionen?) ganz gehörig. Unter dem Deckmantel des Leistungsanreizes werden somit Kursgewinne in Gehalt umgemünzt. Wobei sich die handelnden Personen quasi als Urheber der positiven Kursentwicklung sehen. Bei stark negativem Ausgang sich aber einfach aus der Verantwortung stehlen und jegliches eigene Verschulden abstreiten werden. Nicht vorhersehbare, äussere Umstände waren schuld. Irgendwas, Ausreden halt.
Das soll jetzt keine Kritik speziell an Immunogen sein, offenbar ist dies ja allgemein Usus. Joschka, Du hast angedeuted, dass Dir die Optionsprogramme ebenfalls missfallen. Mich würde es interessieren, wenn Du zu dieser Thematik (hier zwar Offtopic) mal etwas ausführlicher Stellung nimmst. Insbesondere, falls meine obige Darstellung auf einem Denkfehler basiert...
http://www.streetinsider.com/Corporate+News/Immunogen+(IMGN)…
"On December 16, 2013, Immunogen, Inc. (Nasdaq: IMGN) entered into a license agreement with sanofi-aventis U.S. LLC (NYSE: SNY) granting Sanofi rights to use our maytansinoid-based antibody-drug conjugate (ADC) technology to develop and commercialize products directed to a specific antigen target on an exclusive basis. Sanofi took this development and commercialization license pursuant to the terms of an existing right-to-test agreement entered into by the Company and Sanofi in 2006, and it is the first such license taken under that agreement.
In accordance with the terms of the right-to-test agreement, execution of the license agreement entitles us to receive an exercise fee of $2,000,000. We are also entitled to receive up to a total of $30,000,000 in development and regulatory milestone payments under the license agreement, as well as royalties on the commercial sales of any resulting products."
Grüße, StefanR
"On December 16, 2013, Immunogen, Inc. (Nasdaq: IMGN) entered into a license agreement with sanofi-aventis U.S. LLC (NYSE: SNY) granting Sanofi rights to use our maytansinoid-based antibody-drug conjugate (ADC) technology to develop and commercialize products directed to a specific antigen target on an exclusive basis. Sanofi took this development and commercialization license pursuant to the terms of an existing right-to-test agreement entered into by the Company and Sanofi in 2006, and it is the first such license taken under that agreement.
In accordance with the terms of the right-to-test agreement, execution of the license agreement entitles us to receive an exercise fee of $2,000,000. We are also entitled to receive up to a total of $30,000,000 in development and regulatory milestone payments under the license agreement, as well as royalties on the commercial sales of any resulting products."
Grüße, StefanR
Gute Kooperation mit innovativem Therapieansatz (aktuelle Meldung vom 9.1.14):
CytomX Therapeutics and ImmunoGen, Inc. Announce Strategic Collaboration to Develop Probody-Drug Conjugates Against Cancer Targets
— Collaboration enables creation of PDCs using CytomX's Probody Platform and ImmunoGen's ADC technology —
SOUTH SAN FRANCISCO & WALTHAM, Mass.--(BUSINESS WIRE)-- CytomX Therapeutics, the Probody™ therapeutics company, and ImmunoGen, Inc. (NASDAQ: IMGN), a biotechnology company that develops targeted anticancer therapies using its validated, industry-leading antibody-drug conjugate (ADC) technology, today announced a multi-year, strategic collaboration to develop Probody-drug conjugate (PDC) therapies for the treatment of cancer. Probodies are a potentially disruptive class of antibody therapeutics that may further broaden the opportunities for ADCs by localizing therapeutic activity to the tumor microenvironment.
Under the terms of the agreement, the companies will collaborate to develop PDCs against a defined number of targets. This collaboration brings together CytomX's proprietary antibody masking technology and tumor-selective protease substrates with ImmunoGen's highly potent ADC cell-killing agents and engineered linkers.
Each company retains full development control of PDC compounds resulting from its target selection and is responsible for preclinical and clinical testing, manufacturing, and commercialization. Each company is entitled to potentially receive clinical and post-approval milestone payments from the other company, as well as royalties on the sales of any marketed products resulting from this collaboration.
"This strategic collaboration with ImmunoGen is designed to allow each company to build pipeline value by capitalizing on the best of both technology platforms," said Sean McCarthy, D.Phil., chief executive officer of CytomX. "By combining our Probody technology with ImmunoGen's world class linker-payload capabilities we will accelerate towards our vision of bringing safer, more effective therapies to patients."
"ImmunoGen is committed to developing better therapies for the treatment of patients with cancer," commented John Lambert, PhD, EVP and Chief Scientific Officer. "We believe using our state-of-the-art ADC technology with CytomX's highly promising Probody Platform will enable us to develop therapies particularly well-suited for certain challenging cancers."
CytomX's Probodies are masked monoclonal antibodies that are designed to remain inert in healthy tissue but be activated specifically in the disease microenvironment. Through precise targeting of the disease microenvironment, Probodies have the potential to address diseases in ways that have not been possible to-date, enabling a new level of tissue targeting, selectivity and activation.
ImmunoGen's ADC technology is used in Roche's Kadcyla® and in multiple other ADC compounds now in clinical and preclinical testing. It includes highly potent cancer-cell killing agents developed specifically for targeted delivery to cancer cells using monoclonal antibodies, and linkers engineered to keep the agent attached to the antibody in the blood stream and control its release and activation inside a cancer cell.
About CytomX
CytomX Therapeutics, the Probody™ therapeutics company, is dedicated to transforming lives with safer, more effective therapies. CytomX's Probody Platform represents a disruptive approach to discovering and developing the next generation of antibody therapeutics and is enabling the development of a diversified pipeline in major unmet medical needs including cancer and inflammation. CytomX is led by a seasoned and proven management team and is financed by leading life science investors including Third Rock Ventures, Canaan Partners and the Roche Venture Fund. For more information, please visit www.cytomx.com.
About ImmunoGen, Inc.
ImmunoGen, Inc. develops targeted anticancer therapeutics. The Company's ADC technology uses a tumor-targeting engineered antibody to deliver one of ImmunoGen's highly potent cancer-cell killing agents specifically to tumor cells; the Company has also developed antibodies with anticancer activity of their own. The most advanced compound with ImmunoGen's ADC technology is Roche's Kadcyla®, which is marketed in the US by Genentech and is also gaining approvals internationally. Additional compounds are in clinical testing by ImmunoGen and through the Company's partnerships with Amgen, Bayer HealthCare, Biotest and Sanofi. More information about ImmunoGen can be found at www.immunogen.com.
CytomX Therapeutics and ImmunoGen, Inc. Announce Strategic Collaboration to Develop Probody-Drug Conjugates Against Cancer Targets
— Collaboration enables creation of PDCs using CytomX's Probody Platform and ImmunoGen's ADC technology —
SOUTH SAN FRANCISCO & WALTHAM, Mass.--(BUSINESS WIRE)-- CytomX Therapeutics, the Probody™ therapeutics company, and ImmunoGen, Inc. (NASDAQ: IMGN), a biotechnology company that develops targeted anticancer therapies using its validated, industry-leading antibody-drug conjugate (ADC) technology, today announced a multi-year, strategic collaboration to develop Probody-drug conjugate (PDC) therapies for the treatment of cancer. Probodies are a potentially disruptive class of antibody therapeutics that may further broaden the opportunities for ADCs by localizing therapeutic activity to the tumor microenvironment.
Under the terms of the agreement, the companies will collaborate to develop PDCs against a defined number of targets. This collaboration brings together CytomX's proprietary antibody masking technology and tumor-selective protease substrates with ImmunoGen's highly potent ADC cell-killing agents and engineered linkers.
Each company retains full development control of PDC compounds resulting from its target selection and is responsible for preclinical and clinical testing, manufacturing, and commercialization. Each company is entitled to potentially receive clinical and post-approval milestone payments from the other company, as well as royalties on the sales of any marketed products resulting from this collaboration.
"This strategic collaboration with ImmunoGen is designed to allow each company to build pipeline value by capitalizing on the best of both technology platforms," said Sean McCarthy, D.Phil., chief executive officer of CytomX. "By combining our Probody technology with ImmunoGen's world class linker-payload capabilities we will accelerate towards our vision of bringing safer, more effective therapies to patients."
"ImmunoGen is committed to developing better therapies for the treatment of patients with cancer," commented John Lambert, PhD, EVP and Chief Scientific Officer. "We believe using our state-of-the-art ADC technology with CytomX's highly promising Probody Platform will enable us to develop therapies particularly well-suited for certain challenging cancers."
CytomX's Probodies are masked monoclonal antibodies that are designed to remain inert in healthy tissue but be activated specifically in the disease microenvironment. Through precise targeting of the disease microenvironment, Probodies have the potential to address diseases in ways that have not been possible to-date, enabling a new level of tissue targeting, selectivity and activation.
ImmunoGen's ADC technology is used in Roche's Kadcyla® and in multiple other ADC compounds now in clinical and preclinical testing. It includes highly potent cancer-cell killing agents developed specifically for targeted delivery to cancer cells using monoclonal antibodies, and linkers engineered to keep the agent attached to the antibody in the blood stream and control its release and activation inside a cancer cell.
About CytomX
CytomX Therapeutics, the Probody™ therapeutics company, is dedicated to transforming lives with safer, more effective therapies. CytomX's Probody Platform represents a disruptive approach to discovering and developing the next generation of antibody therapeutics and is enabling the development of a diversified pipeline in major unmet medical needs including cancer and inflammation. CytomX is led by a seasoned and proven management team and is financed by leading life science investors including Third Rock Ventures, Canaan Partners and the Roche Venture Fund. For more information, please visit www.cytomx.com.
About ImmunoGen, Inc.
ImmunoGen, Inc. develops targeted anticancer therapeutics. The Company's ADC technology uses a tumor-targeting engineered antibody to deliver one of ImmunoGen's highly potent cancer-cell killing agents specifically to tumor cells; the Company has also developed antibodies with anticancer activity of their own. The most advanced compound with ImmunoGen's ADC technology is Roche's Kadcyla®, which is marketed in the US by Genentech and is also gaining approvals internationally. Additional compounds are in clinical testing by ImmunoGen and through the Company's partnerships with Amgen, Bayer HealthCare, Biotest and Sanofi. More information about ImmunoGen can be found at www.immunogen.com.
Zitat von Ville7: Die Reaktion verwundert mich nicht. Das ist üblich bei Aktien, die zuvor einen schweren Schlag hinnehmen mussten. Die brauchen meist lange bis sie sich wieder erholen und das Zutrauen wieder da ist.
Ich bin froh bei 13 und 13,5 in der jüngsten Panik nochmal kräftig nachgelegt zu haben. Eigentlich wollte ich diese Tradingposition nur bis 15,5 halten, denke aber inzwischen, dass 2014 auch problemlos 20 realisierbar sind.
Alles on track..die Erholung schreitet voran. Wer auch nochmal bei 13,x zugeschlagen hat hat bis jetzt 25% Buchgewinne in wenigen Monaten gemacht.
Wie ist euere Meinung zu diesem Bericht:
http://www.wkrb13.com/markets/253813/immunogen-downgraded-to…
Immunogen Downgraded to “Neutral” at Zacks (IMGN)
Posted by Jim Brewer on Jan 27th, 2014 // No Comments
Share on StockTwits
Immunogen Inc. logoImmunogen (NASDAQ:IMGN) was downgraded by Zacks from an “outperform” rating to a “neutral” rating in a research report issued on Monday, Analyst Ratings Network reports. They currently have a $18.20 price target on the stock. Zacks‘ price target would suggest a potential upside of 19.11% from the company’s current price.
IMGN has been the subject of a number of other recent research reports. Analysts at Morgan Stanley downgraded shares of Immunogen from an “equal weight” rating to an “underweight” rating in a research note to investors on Monday, November 11th. They now have a $9.50 price target on the stock. Separately, analysts at RBC Capital cut their price target on shares of Immunogen from $22.00 to $18.00 in a research note to investors on Friday, November 8th. They now have an “outperform” rating on the stock. Finally, analysts at Chardan Capital reiterated a “buy” rating on shares of Immunogen in a research note to investors on Tuesday, November 5th. They now have a $21.00 price target on the stock. Two investment analysts have rated the stock with a sell rating, five have issued a hold rating and six have issued a buy rating to the stock. Immunogen has an average rating of “Hold” and an average price target of $17.39.
In other Immunogen news, VP Charles Morris unloaded 7,138 shares of the company’s stock in a transaction dated Wednesday, January 22nd. The shares were sold at an average price of $17.00, for a total value of $121,346.00. Following the transaction, the vice president now directly owns 37,500 shares in the company, valued at approximately $637,500. The sale was disclosed in a filing with the SEC, which is available at this link.
Shares of Immunogen (NASDAQ:IMGN) traded down 1.05% during mid-day trading on Monday, hitting $15.12. The stock had a trading volume of 675,701 shares. Immunogen has a 1-year low of $12.55 and a 1-year high of $20.25. The stock has a 50-day moving average of $15.14 and a 200-day moving average of $16.32. The company’s market cap is $1.291 billion.
Immunogen (NASDAQ:IMGN) last issued its quarterly earnings data on Friday, January 31st. The company reported ($0.29) EPS for the quarter, missing the Thomson Reuters consensus estimate of ($0.18) by $0.11. Analysts expect that Immunogen will post $-0.75 EPS for the current fiscal year.
ImmunoGen, Inc (NASDAQ:IMGN) develops targeted, antibody-based therapeutics for the treatment of cancer.
To view Zacks’ full report, visit www.zacks.com
Danke
Klaus
http://www.wkrb13.com/markets/253813/immunogen-downgraded-to…
Immunogen Downgraded to “Neutral” at Zacks (IMGN)
Posted by Jim Brewer on Jan 27th, 2014 // No Comments
Share on StockTwits
Immunogen Inc. logoImmunogen (NASDAQ:IMGN) was downgraded by Zacks from an “outperform” rating to a “neutral” rating in a research report issued on Monday, Analyst Ratings Network reports. They currently have a $18.20 price target on the stock. Zacks‘ price target would suggest a potential upside of 19.11% from the company’s current price.
IMGN has been the subject of a number of other recent research reports. Analysts at Morgan Stanley downgraded shares of Immunogen from an “equal weight” rating to an “underweight” rating in a research note to investors on Monday, November 11th. They now have a $9.50 price target on the stock. Separately, analysts at RBC Capital cut their price target on shares of Immunogen from $22.00 to $18.00 in a research note to investors on Friday, November 8th. They now have an “outperform” rating on the stock. Finally, analysts at Chardan Capital reiterated a “buy” rating on shares of Immunogen in a research note to investors on Tuesday, November 5th. They now have a $21.00 price target on the stock. Two investment analysts have rated the stock with a sell rating, five have issued a hold rating and six have issued a buy rating to the stock. Immunogen has an average rating of “Hold” and an average price target of $17.39.
In other Immunogen news, VP Charles Morris unloaded 7,138 shares of the company’s stock in a transaction dated Wednesday, January 22nd. The shares were sold at an average price of $17.00, for a total value of $121,346.00. Following the transaction, the vice president now directly owns 37,500 shares in the company, valued at approximately $637,500. The sale was disclosed in a filing with the SEC, which is available at this link.
Shares of Immunogen (NASDAQ:IMGN) traded down 1.05% during mid-day trading on Monday, hitting $15.12. The stock had a trading volume of 675,701 shares. Immunogen has a 1-year low of $12.55 and a 1-year high of $20.25. The stock has a 50-day moving average of $15.14 and a 200-day moving average of $16.32. The company’s market cap is $1.291 billion.
Immunogen (NASDAQ:IMGN) last issued its quarterly earnings data on Friday, January 31st. The company reported ($0.29) EPS for the quarter, missing the Thomson Reuters consensus estimate of ($0.18) by $0.11. Analysts expect that Immunogen will post $-0.75 EPS for the current fiscal year.
ImmunoGen, Inc (NASDAQ:IMGN) develops targeted, antibody-based therapeutics for the treatment of cancer.
To view Zacks’ full report, visit www.zacks.com
Danke
Klaus
Antwort auf Beitrag Nr.: 46.323.313 von KlausAnlage am 28.01.14 12:47:37Ich finde diese Zacks Berichte total überflüssig. Manchmal habe ich sogar den Eindruck, dass sie von Computerprogrammen geschrieben werden oder zumindest mit Satzbausteinen. Dort werden lediglich quantitativ Zahlen aneinandergereiht, die mehr oder weniger bekannt waren. (kopieren/einfügen) Für eine Analyse wäre eine qualitative Aussage zum Wert/ den Aussichten der einzelnen Programme und der Technologie aber wesentlich sinnvoller.
Lesenswert, deswegen etwas umfangreicher...
"http://cen.acs.org/articles/92/i3/Building-Antibody-Drug-Con…
Building Antibody-Drug Conjugates
Participants in a complex supply chain are gearing up to meet demand for an expected flood of targeted therapies
By Ann M. Thayer
Building Antibody-Drug Conjugates
Altered Antibodies Offer Improved Conjugates
Site Specific: Developers Aim To Create Well-Defined Drug Conjugates
Surface rendering of a monoclonal antibody to show possible cytotoxin conjugation sites for creating an ADC. Blue patches are lysines, orange patches are cysteines, and green is a meditope-binding site. Click to rotate.
Credit: Courtesy of John Williams
They’re here. Antibody-drug conjugates, target-seeking molecular missiles with lethal payloads, have arrived.
Although just two ADCs, Seattle Genetics’ Adcetris and Roche’s Kadcyla, are on the market, they are proof that the products are technically feasible, therapeutically effective, and able to get regulatory approval. And with Kadcyla expected to hit blockbuster status, big and small pharma firms alike have plenty of incentive to invest in further development.

As a result, the number of ADCs in clinical trials has climbed to more than 30, according to London-based Roots Analysis. By 2018, sales of launched ADC products will exceed $5 billion, the market research firm predicts. Industry participants estimate that between 100 and 150 more ADCs are in the preclinical stage.
Like the two approved ADCs, most clinical candidates target cancer and rely on technology from Seattle Genetics or ImmunoGen to link potent cytotoxic drugs to disease-targeting antibodies. When they are successful as a therapy, the resulting conjugates remain stable in circulation and deliver their toxic payload only when they enter tumor cells, sparing healthy cells and reducing side effects.
Although the idea behind ADCs is straightforward, drug developers have had to overcome technical challenges to make them a reality. Now their manufacturing partners are being tested, as the growing number of development-stage ADCs taxes their production capacity. And beyond trying to meet demand, manufacturing firms are responding to a rapid evolution in cytotoxins, linking chemistries, and antibody design for the next generation of ADCs.
“The technology around all three components of the ADC is changing rapidly,” says Brian O’Neill, North American sales manager at Carbogen Amcis, a Swiss contract manufacturing organization, or CMO. The goals are typically improving specificity, lowering dosage, lowering costs, and targeting the right patient population.
ADCs are still a niche area of manufacturing, and few CMOs offer all of the drugs’ pieces, which makes for a complex supply chain. ADC assembly itself is challenging, requiring providers to simultaneously handle biologic materials in sterile conditions and manipulate highly potent small molecules under containment. Demand for experienced CMOs is strong.
Several of the established manufacturers have recently announced expansions. New entrants are trying to break in, but given the quality, regulatory, and safety requirements, “it will take time for additional CMOs to become established in ADC manufacturing,” says Scott Miller, head of special projects at Carbogen Amcis.
“There clearly is a need for manufacturing capacity for ADCs, particularly at the clinical and commercial scale,” Miller adds. Carbogen Amcis is increasing its clinical-scale conjugation capacity in Bubendorf, Switzerland, where it also makes potent drugs, and upgrading product-finishing capabilities in Riom, France.
Because of their potency and frequent use in niche disease areas, production runs for ADCs are small. Hundreds of grams are enough for early clinical studies, and kilogram amounts suffice for commercial supply. Nevertheless, the small-scale capacity additions now under way “may be a little bit shortsighted,” suggests Charlie Johnson, chief executive officer of ADC Biotechnology, a process technology firm based in Wales.
Kadcyla has been a wake-up call for suppliers. The ADC is widely expected to succeed the established forerunner antibody drug Herceptin as a treatment for advanced breast cancer, which means that demand will quickly call for hundreds of kilograms per year. Although the demand for most products will remain small, other big opportunities still could emerge for lung, breast, and colorectal cancer treatments, Johnson says.
In fact, Roche decided late last year to spend $200 million to build its own production facility in Basel, Switzerland, to support Kadcyla and another eight ADCs in its clinical pipeline. Custom chemicals firm Lonza, which also manufactures Kadcyla, is investing $15 million to add a second commercial-scale ADC facility in Visp, Switzerland, later this year.
Among CMOs, Lonza claims one of the most complete offerings, covering antibody production, linker and toxin synthesis, and conjugation of the components. Expansion into the fill and finish of the final product is a “strategic interest,” says Syed T. Husain, head of business development for chemical manufacturing.
Working with a single supplier that can handle all the stages of ADC manufacturing avoids having to transfer technology and hand off highly toxic compounds. “In splitting up the supply chain between the toxin, conjugation, and fill-finish, customers become concerned because these are such high-value materials, and shipping them around the world adds risk,” Husain argues.
Like Lonza, France’s Novasep can supply antibodies, potent compounds, and conjugations, but not every customer wants all these services from a single source, acknowledges Jean-François Marcoux, the firm’s technical business development manager. “The demands for the biological and small-molecule aspects are very different and are sometimes treated separately by our customers,” he says.
“It is good, though, for a CMO to have experience in all areas because you will not develop your payload the same way if you know what it will entail in the conjugation and vice versa,” Marcoux adds. To meet growing customer demand, the company invested $4 million in 2012 to expand capacity for synthesizing ADC payloads.
Executives with companies that don’t offer antibody production note that many customers come to them with antibodies in hand. “Antibody manufacturing, for the most part, has not been a bottleneck,” says Cynthia Wooge, a market manager at SAFC, the custom manufacturing arm of Sigma-Aldrich. “Many people have developed the antibody first because they want a specific targeting effect, and then they look at how to make it into a more effective therapeutic by arming it.”
For example, by turning the antibody used in Kadcyla into an ADC, Roche has helped extend its life, because patents on Herceptin, Roche’s third-largest product, will expire in Europe this year and in the U.S. within five years. In other instances, constructing an ADC can salvage an antibody that was ineffective alone as a therapeutic.
SAFC supports bioprocessing and cell-line development but doesn’t make antibodies. Its strength is in supplying toxins and linkers. The business recently began expanding its conjugation capabilities in St. Louis and its highly potent drug facility in Verona, Wis. “Now is the right time to invest in commercial-scale conjugation capability,” Wooge says.
India’s Piramal Healthcare is another chemistry-based CMO that is trying to make the supply chain more seamless. “A number of customers, particularly the small entrants, find it difficult to manage complex supply chains that are fragmented between various suppliers,” says Aidan Walker, Piramal’s president for formulation services. At the same time, “customers want to ensure that they are working with the best provider of each part of the value chain.”
Piramal sees partnerships as a way to achieve both goals. “There may be opportunities to both shorten the development time and improve the service if we are able to talk to and work alongside the antibody supplier.” Through an alliance with Fujifilm Diosynth Biotechnologies, Piramal can offer customers biologics manufacturing along with its own conjugation services.
In July, Piramal began a $2.5 million project to add a second commercial-scale ADC conjugation suite at its Grangemouth, Scotland, site. “The market seems reasonably comfortable with the supply of toxin and linker,” Walker says. “The constraint, and where we frequently get asked questions, is around the fill-finish capacity, and we are more actively pursuing that as a potential area of growth.”
New Jersey-based Catalent Pharma Solutions is also taking a partnership approach to filling out its offering. Already an antibody manufacturer and provider of analytical services for ADCs, it expanded further into ADC technology in April 2013 by taking an equity interest in Redwood Bioscience. It has exclusive rights to market Redwood’s SMARTag technology for engineering antibodies for conjugation. The partners hope to develop the technology and attract additional partners.
Redwood’s approach involves introducing amino acids into the antibody as linkage points. From there, using existing linkers or new ones developed in-house, it can chemoenzymatically attach commonly used cytotoxins and other payloads at defined locations. The company says it has successfully tested more than 50 such combinations against multiple targets.
The aim of this so-called site-specific conjugation is to create homogeneous ADC structures in terms of their drug loading and position. Greater homogeneity is expected to improve ADC stability and performance while greatly simplifying the demanding analytics needed to characterize their complex structures.
Some CMOs have reported that they spend more than 50% of their time on an ADC project developing analytical methods, validating production, and testing. Always critical in drug manufacturing, analytics are doubly important with ADCs because both chemical analysis and biological testing are involved, SAFC’s Wooge explains. For example, beyond the usual impurity and stability testing, manufacturers must assess whether the conjugation has gone as planned and if both the antibody and drug remain active.
And regulators have indicated that they’ll expect the same degree of characterization and impurity control for the separate biologic and toxin as for the final combination. “More and more, the payload or toxin is considered as an active ingredient by the regulatory agencies, even if it later will be conjugated to an antibody,” Novasep’s Marcoux says.
At the same time, more potent classes of toxins, having different mechanisms of action, are emerging as alternatives to the auristatins from Seattle Genetics and the maytansines from ImmunoGen, all of which act by inhibiting tubulins, which are proteins involved in cell growth.
In October, ImmunoGen presented preclinical data on new indolinobenzodiazepine DNA-alkylating agents, or IGNs. The firm created the IGNs to expand the development of ADCs against cancers that express few binding sites or are resistant or not sensitive to other drugs.
DNA-binding pyrrolobenzodiazepines (PBDs) from Spirogen have garnered enough attention that AstraZeneca paid $440 million last year to buy the London-based firm. AstraZeneca also has a stake in Switzerland’s ADC Therapeutics, which develops ADCs using PBD dimers attached via biodegradable linkers.
Similarly, the Dutch firm Synthon has developed synthetic duocarmycins, another class of DNA-binding drugs, and complementary linker chemistry. Other new cytotoxins of note, according to Roots Analysis, include Heidelberg Pharma’s α-amanitin, which comes from the green death cap mushroom, and the plant-derived deBouganin from Canada’s Viventia Bio.
Orders of magnitude more potent than the marketed cytotoxic agents, these new compounds are harder to deal with in the manufacturing plant, ADC Bio’s Johnson explains. “If we are going to continue to go down this route, then we are going to have to get smarter about how we conjugate them.” Over the next five to 10 years, he contends, “the manufacturability of ADCs is really going to become key.”
For example, Johnson says his firm is seeing a lot of hard-to-conjugate drugs, hydrophobic ones in particular. With those, if the ratio of drug molecule to antibody gets too high, the ADC molecules can aggregate and can’t be purified.
To avoid these problems, ADC Bio has developed a “lock and release” technology through which it immobilizes the antibody on a solid support, conjugates it, and then releases the ADC in a soluble form. The process can use any drug-linker chemistry and be run on columns in flow mode, the firm claims.
In May, Johnson says, ADC Bio opened a tech service lab. Like others in the field, it is starting to work on next-generation linker and toxin technology. For example, in addition to improving the solubility of the drug-linker and the conjugate, many ADC developers are looking for ways to prereact the linker and toxin and attach them to the antibody in a one-step process.
Linker and toxin pairings significantly influence an ADC’s stability, pharmacokinetics, and efficacy. All the parts must function correctly if the ADC is to bind selectively to the target before the toxin is internalized and released in a tumor cell. If they don’t, premature release of the drug can poison the patient while naked antibodies compete with the ADC at target-binding sites.
The ADC field has been dominated by Seattle Genetics’ technology, which links cytotoxins to cysteines in the antibody structure, and ImmunoGen’s, which attaches drugs to surface-accessible lysines. Although these approaches have been validated by approved products and multiple licenses from big pharma firms, more can be learned about improving potency, linker stability, and targeting (C&EN, June 18, 2012, page 12).
“People are trying to push the envelope around new linkers and toxins,” Piramal’s Walker says. And the company is starting to see customer requests for development and manufacturing of these new materials for toxicology and early clinical testing. “We’ve also been approached by many small companies that have a linker, a toxin, or an antibody but never all three, and little way of proving whether it could be conjugated.”
In response, Piramal has added a proof-of-concept service. Taking whatever the customer brings, the company adds the other needed components and then quickly creates and tests an ADC to see if the customer’s idea is worth pursuing. The service, Walker believes, “will give some new players a chance to expand the potential of the ADC business.”
Site-specific conjugation technologies designed to make more homogeneous ADCs are making their way into manufacturers’ plants. Piramal, for example, will soon start its first development and production run for a customer that is using a new site-specific approach, Walker says. “It’s the first one that we have seen but is certainly an area of discussion that is becoming more prevalent.”
Almost all the ADCs in clinical development use established conjugation chemistries and cytotoxins. Manufacturers have become adept at working with them, but they may soon be challenged by new technologies.
New cytotoxin classes, linker chemistries, and antibody designs will only multiply the possible combinations that CMOs will face. Looking ahead, suppliers also point to growing interest in ADCs outside oncology in areas such as inflammatory and autoimmune diseases. And requests are coming in for combining an array of payloads with antibodies, nanoparticles, and other carriers. Challenges like these should keep ADC manufacturers busy for some time to come."
Gruesse, StefanR
"http://cen.acs.org/articles/92/i3/Building-Antibody-Drug-Con…
Building Antibody-Drug Conjugates
Participants in a complex supply chain are gearing up to meet demand for an expected flood of targeted therapies
By Ann M. Thayer
Building Antibody-Drug Conjugates
Altered Antibodies Offer Improved Conjugates
Site Specific: Developers Aim To Create Well-Defined Drug Conjugates
Surface rendering of a monoclonal antibody to show possible cytotoxin conjugation sites for creating an ADC. Blue patches are lysines, orange patches are cysteines, and green is a meditope-binding site. Click to rotate.
Credit: Courtesy of John Williams
They’re here. Antibody-drug conjugates, target-seeking molecular missiles with lethal payloads, have arrived.
Although just two ADCs, Seattle Genetics’ Adcetris and Roche’s Kadcyla, are on the market, they are proof that the products are technically feasible, therapeutically effective, and able to get regulatory approval. And with Kadcyla expected to hit blockbuster status, big and small pharma firms alike have plenty of incentive to invest in further development.

As a result, the number of ADCs in clinical trials has climbed to more than 30, according to London-based Roots Analysis. By 2018, sales of launched ADC products will exceed $5 billion, the market research firm predicts. Industry participants estimate that between 100 and 150 more ADCs are in the preclinical stage.
Like the two approved ADCs, most clinical candidates target cancer and rely on technology from Seattle Genetics or ImmunoGen to link potent cytotoxic drugs to disease-targeting antibodies. When they are successful as a therapy, the resulting conjugates remain stable in circulation and deliver their toxic payload only when they enter tumor cells, sparing healthy cells and reducing side effects.
Although the idea behind ADCs is straightforward, drug developers have had to overcome technical challenges to make them a reality. Now their manufacturing partners are being tested, as the growing number of development-stage ADCs taxes their production capacity. And beyond trying to meet demand, manufacturing firms are responding to a rapid evolution in cytotoxins, linking chemistries, and antibody design for the next generation of ADCs.
“The technology around all three components of the ADC is changing rapidly,” says Brian O’Neill, North American sales manager at Carbogen Amcis, a Swiss contract manufacturing organization, or CMO. The goals are typically improving specificity, lowering dosage, lowering costs, and targeting the right patient population.
ADCs are still a niche area of manufacturing, and few CMOs offer all of the drugs’ pieces, which makes for a complex supply chain. ADC assembly itself is challenging, requiring providers to simultaneously handle biologic materials in sterile conditions and manipulate highly potent small molecules under containment. Demand for experienced CMOs is strong.
Several of the established manufacturers have recently announced expansions. New entrants are trying to break in, but given the quality, regulatory, and safety requirements, “it will take time for additional CMOs to become established in ADC manufacturing,” says Scott Miller, head of special projects at Carbogen Amcis.
“There clearly is a need for manufacturing capacity for ADCs, particularly at the clinical and commercial scale,” Miller adds. Carbogen Amcis is increasing its clinical-scale conjugation capacity in Bubendorf, Switzerland, where it also makes potent drugs, and upgrading product-finishing capabilities in Riom, France.
Because of their potency and frequent use in niche disease areas, production runs for ADCs are small. Hundreds of grams are enough for early clinical studies, and kilogram amounts suffice for commercial supply. Nevertheless, the small-scale capacity additions now under way “may be a little bit shortsighted,” suggests Charlie Johnson, chief executive officer of ADC Biotechnology, a process technology firm based in Wales.
Kadcyla has been a wake-up call for suppliers. The ADC is widely expected to succeed the established forerunner antibody drug Herceptin as a treatment for advanced breast cancer, which means that demand will quickly call for hundreds of kilograms per year. Although the demand for most products will remain small, other big opportunities still could emerge for lung, breast, and colorectal cancer treatments, Johnson says.
In fact, Roche decided late last year to spend $200 million to build its own production facility in Basel, Switzerland, to support Kadcyla and another eight ADCs in its clinical pipeline. Custom chemicals firm Lonza, which also manufactures Kadcyla, is investing $15 million to add a second commercial-scale ADC facility in Visp, Switzerland, later this year.
Among CMOs, Lonza claims one of the most complete offerings, covering antibody production, linker and toxin synthesis, and conjugation of the components. Expansion into the fill and finish of the final product is a “strategic interest,” says Syed T. Husain, head of business development for chemical manufacturing.
Working with a single supplier that can handle all the stages of ADC manufacturing avoids having to transfer technology and hand off highly toxic compounds. “In splitting up the supply chain between the toxin, conjugation, and fill-finish, customers become concerned because these are such high-value materials, and shipping them around the world adds risk,” Husain argues.
Like Lonza, France’s Novasep can supply antibodies, potent compounds, and conjugations, but not every customer wants all these services from a single source, acknowledges Jean-François Marcoux, the firm’s technical business development manager. “The demands for the biological and small-molecule aspects are very different and are sometimes treated separately by our customers,” he says.
“It is good, though, for a CMO to have experience in all areas because you will not develop your payload the same way if you know what it will entail in the conjugation and vice versa,” Marcoux adds. To meet growing customer demand, the company invested $4 million in 2012 to expand capacity for synthesizing ADC payloads.
Executives with companies that don’t offer antibody production note that many customers come to them with antibodies in hand. “Antibody manufacturing, for the most part, has not been a bottleneck,” says Cynthia Wooge, a market manager at SAFC, the custom manufacturing arm of Sigma-Aldrich. “Many people have developed the antibody first because they want a specific targeting effect, and then they look at how to make it into a more effective therapeutic by arming it.”
For example, by turning the antibody used in Kadcyla into an ADC, Roche has helped extend its life, because patents on Herceptin, Roche’s third-largest product, will expire in Europe this year and in the U.S. within five years. In other instances, constructing an ADC can salvage an antibody that was ineffective alone as a therapeutic.
SAFC supports bioprocessing and cell-line development but doesn’t make antibodies. Its strength is in supplying toxins and linkers. The business recently began expanding its conjugation capabilities in St. Louis and its highly potent drug facility in Verona, Wis. “Now is the right time to invest in commercial-scale conjugation capability,” Wooge says.
India’s Piramal Healthcare is another chemistry-based CMO that is trying to make the supply chain more seamless. “A number of customers, particularly the small entrants, find it difficult to manage complex supply chains that are fragmented between various suppliers,” says Aidan Walker, Piramal’s president for formulation services. At the same time, “customers want to ensure that they are working with the best provider of each part of the value chain.”
Piramal sees partnerships as a way to achieve both goals. “There may be opportunities to both shorten the development time and improve the service if we are able to talk to and work alongside the antibody supplier.” Through an alliance with Fujifilm Diosynth Biotechnologies, Piramal can offer customers biologics manufacturing along with its own conjugation services.
In July, Piramal began a $2.5 million project to add a second commercial-scale ADC conjugation suite at its Grangemouth, Scotland, site. “The market seems reasonably comfortable with the supply of toxin and linker,” Walker says. “The constraint, and where we frequently get asked questions, is around the fill-finish capacity, and we are more actively pursuing that as a potential area of growth.”
New Jersey-based Catalent Pharma Solutions is also taking a partnership approach to filling out its offering. Already an antibody manufacturer and provider of analytical services for ADCs, it expanded further into ADC technology in April 2013 by taking an equity interest in Redwood Bioscience. It has exclusive rights to market Redwood’s SMARTag technology for engineering antibodies for conjugation. The partners hope to develop the technology and attract additional partners.
Redwood’s approach involves introducing amino acids into the antibody as linkage points. From there, using existing linkers or new ones developed in-house, it can chemoenzymatically attach commonly used cytotoxins and other payloads at defined locations. The company says it has successfully tested more than 50 such combinations against multiple targets.
The aim of this so-called site-specific conjugation is to create homogeneous ADC structures in terms of their drug loading and position. Greater homogeneity is expected to improve ADC stability and performance while greatly simplifying the demanding analytics needed to characterize their complex structures.
Some CMOs have reported that they spend more than 50% of their time on an ADC project developing analytical methods, validating production, and testing. Always critical in drug manufacturing, analytics are doubly important with ADCs because both chemical analysis and biological testing are involved, SAFC’s Wooge explains. For example, beyond the usual impurity and stability testing, manufacturers must assess whether the conjugation has gone as planned and if both the antibody and drug remain active.
And regulators have indicated that they’ll expect the same degree of characterization and impurity control for the separate biologic and toxin as for the final combination. “More and more, the payload or toxin is considered as an active ingredient by the regulatory agencies, even if it later will be conjugated to an antibody,” Novasep’s Marcoux says.
At the same time, more potent classes of toxins, having different mechanisms of action, are emerging as alternatives to the auristatins from Seattle Genetics and the maytansines from ImmunoGen, all of which act by inhibiting tubulins, which are proteins involved in cell growth.
In October, ImmunoGen presented preclinical data on new indolinobenzodiazepine DNA-alkylating agents, or IGNs. The firm created the IGNs to expand the development of ADCs against cancers that express few binding sites or are resistant or not sensitive to other drugs.
DNA-binding pyrrolobenzodiazepines (PBDs) from Spirogen have garnered enough attention that AstraZeneca paid $440 million last year to buy the London-based firm. AstraZeneca also has a stake in Switzerland’s ADC Therapeutics, which develops ADCs using PBD dimers attached via biodegradable linkers.
Similarly, the Dutch firm Synthon has developed synthetic duocarmycins, another class of DNA-binding drugs, and complementary linker chemistry. Other new cytotoxins of note, according to Roots Analysis, include Heidelberg Pharma’s α-amanitin, which comes from the green death cap mushroom, and the plant-derived deBouganin from Canada’s Viventia Bio.
Orders of magnitude more potent than the marketed cytotoxic agents, these new compounds are harder to deal with in the manufacturing plant, ADC Bio’s Johnson explains. “If we are going to continue to go down this route, then we are going to have to get smarter about how we conjugate them.” Over the next five to 10 years, he contends, “the manufacturability of ADCs is really going to become key.”
For example, Johnson says his firm is seeing a lot of hard-to-conjugate drugs, hydrophobic ones in particular. With those, if the ratio of drug molecule to antibody gets too high, the ADC molecules can aggregate and can’t be purified.
To avoid these problems, ADC Bio has developed a “lock and release” technology through which it immobilizes the antibody on a solid support, conjugates it, and then releases the ADC in a soluble form. The process can use any drug-linker chemistry and be run on columns in flow mode, the firm claims.
In May, Johnson says, ADC Bio opened a tech service lab. Like others in the field, it is starting to work on next-generation linker and toxin technology. For example, in addition to improving the solubility of the drug-linker and the conjugate, many ADC developers are looking for ways to prereact the linker and toxin and attach them to the antibody in a one-step process.
Linker and toxin pairings significantly influence an ADC’s stability, pharmacokinetics, and efficacy. All the parts must function correctly if the ADC is to bind selectively to the target before the toxin is internalized and released in a tumor cell. If they don’t, premature release of the drug can poison the patient while naked antibodies compete with the ADC at target-binding sites.
The ADC field has been dominated by Seattle Genetics’ technology, which links cytotoxins to cysteines in the antibody structure, and ImmunoGen’s, which attaches drugs to surface-accessible lysines. Although these approaches have been validated by approved products and multiple licenses from big pharma firms, more can be learned about improving potency, linker stability, and targeting (C&EN, June 18, 2012, page 12).
“People are trying to push the envelope around new linkers and toxins,” Piramal’s Walker says. And the company is starting to see customer requests for development and manufacturing of these new materials for toxicology and early clinical testing. “We’ve also been approached by many small companies that have a linker, a toxin, or an antibody but never all three, and little way of proving whether it could be conjugated.”
In response, Piramal has added a proof-of-concept service. Taking whatever the customer brings, the company adds the other needed components and then quickly creates and tests an ADC to see if the customer’s idea is worth pursuing. The service, Walker believes, “will give some new players a chance to expand the potential of the ADC business.”
Site-specific conjugation technologies designed to make more homogeneous ADCs are making their way into manufacturers’ plants. Piramal, for example, will soon start its first development and production run for a customer that is using a new site-specific approach, Walker says. “It’s the first one that we have seen but is certainly an area of discussion that is becoming more prevalent.”
Almost all the ADCs in clinical development use established conjugation chemistries and cytotoxins. Manufacturers have become adept at working with them, but they may soon be challenged by new technologies.
New cytotoxin classes, linker chemistries, and antibody designs will only multiply the possible combinations that CMOs will face. Looking ahead, suppliers also point to growing interest in ADCs outside oncology in areas such as inflammatory and autoimmune diseases. And requests are coming in for combining an array of payloads with antibodies, nanoparticles, and other carriers. Challenges like these should keep ADC manufacturers busy for some time to come."
Gruesse, StefanR
Quartalsergebnisse, sieht vorbörslich gut aus:
(RTTNews.com) - ImmunoGen, Inc. ( IMGN ), a developer of targeted anticancer therapeutics, reported Friday that its second-quarter net income was $3.81 million or $0.04 per share, compared to a net loss of $24.39 million or $0.29 per share last year.
On average, 15 analysts polled by Thomson Reuters expected loss of $0.18 per share for the quarter. Analysts' estimates typically exclude special items.
Revenues were $30.1 million for the quarter, significantly higher than last year's $2.6 million. Analysts expected revenues of $18.16 million.
The company noted that its latest quarter revenues included $25.7 million of license and milestone fees, compared to $0.4 million a year ago.
Looking ahead for the full year, the company continues to project net loss between $67 million and $71 million, and revenues between $71 million and $75 million. Analysts estimate loss per share of $0.74 and revenues of $71.65 million.
Daniel Junius, President and CEO, said, "We expect 2014 to be a very active year. … We are making solid progress with our IMGN529 compound and expect to report the first clinical data mid-year."
Separately, ImmunoGen announced the appointment of Eric Guempel as Vice President of Product Strategy and Program Management. He reports to Charles Morris, Executive Vice President and Chief Development Officer of ImmunoGen.
Read more: http://www.nasdaq.com/article/immunogen-posts-profit-in-q2-b…
Grüße
Oberländler
(RTTNews.com) - ImmunoGen, Inc. ( IMGN ), a developer of targeted anticancer therapeutics, reported Friday that its second-quarter net income was $3.81 million or $0.04 per share, compared to a net loss of $24.39 million or $0.29 per share last year.
On average, 15 analysts polled by Thomson Reuters expected loss of $0.18 per share for the quarter. Analysts' estimates typically exclude special items.
Revenues were $30.1 million for the quarter, significantly higher than last year's $2.6 million. Analysts expected revenues of $18.16 million.
The company noted that its latest quarter revenues included $25.7 million of license and milestone fees, compared to $0.4 million a year ago.
Looking ahead for the full year, the company continues to project net loss between $67 million and $71 million, and revenues between $71 million and $75 million. Analysts estimate loss per share of $0.74 and revenues of $71.65 million.
Daniel Junius, President and CEO, said, "We expect 2014 to be a very active year. … We are making solid progress with our IMGN529 compound and expect to report the first clinical data mid-year."
Separately, ImmunoGen announced the appointment of Eric Guempel as Vice President of Product Strategy and Program Management. He reports to Charles Morris, Executive Vice President and Chief Development Officer of ImmunoGen.
Read more: http://www.nasdaq.com/article/immunogen-posts-profit-in-q2-b…
Grüße
Oberländler
Kadcyla nunmehr auch in GB zugelassen -> http://www.bioportfolio.com/news/article/1819326/Trastuzumab…
Hier noch je ein kleiner Artikel zu SAR650984 und BT-062 (Seite 7+8)
==> sorry, habe es leider nicht so drauf mit aktiven Links :-(
http://myeloma.org/pdfs/MT909_d1web.pdf
==> sorry, habe es leider nicht so drauf mit aktiven Links :-(
http://myeloma.org/pdfs/MT909_d1web.pdf
Positive Meldung (vom 20.2.2014) für Immunogen ... andere Unternehmen führen nunmehr Kombistudien eigener Präparate mit Kadcyla durch:
WASHINGTON (dpa-AFX) - Oncothyreon Inc. (ONTY) and Array BioPharma Inc. (ARRY) announced the initiation of a Phase 1b trial of ONT-380 or ARRY-380 in combination with Kadcyla (ado-trastuzumab emtansine or TDM-1) in patients with metastatic HER2+ breast cancer. ONT-380 is an orally active, reversible and selective small-molecule HER2 inhibitor invented by Array and being developed by Oncothyreon in collaboration with Array. The trial is a dose-escalation study in up to 48 patients who have been previously treated with Herceptin (trastuzumab) and a taxane for metastatic breast cancer. The primary objective is to determine the maximum-tolerated and/or recommended Phase 2 dose (MTD/RP2D) of ONT-380 in combination with the approved dose of Kadcyla. Secondary objectives include an evaluation of the safety and preliminary anti-tumor activity of the combination. Following determination of the MTD/RP2D, the study includes an expansion arm at the MTD/RP2D as well as an optional second expansion arm in patients with central nervous system metastases. 'ONT-380 and Kadcyla are both directed at HER2, but with differing mechanisms of action.... 'The strategy of combining two agents targeting HER2 has previously proven useful in HER2+ breast cancer, and we believe the combination of ONT-380 and Kadcyla is particularly relevant to evaluate as the treatment of metastatic HER2+ breast cancer continues to evolve,' said Diana Hausman, M.D., Chief Medical Officer of Oncothyreon.
WASHINGTON (dpa-AFX) - Oncothyreon Inc. (ONTY) and Array BioPharma Inc. (ARRY) announced the initiation of a Phase 1b trial of ONT-380 or ARRY-380 in combination with Kadcyla (ado-trastuzumab emtansine or TDM-1) in patients with metastatic HER2+ breast cancer. ONT-380 is an orally active, reversible and selective small-molecule HER2 inhibitor invented by Array and being developed by Oncothyreon in collaboration with Array. The trial is a dose-escalation study in up to 48 patients who have been previously treated with Herceptin (trastuzumab) and a taxane for metastatic breast cancer. The primary objective is to determine the maximum-tolerated and/or recommended Phase 2 dose (MTD/RP2D) of ONT-380 in combination with the approved dose of Kadcyla. Secondary objectives include an evaluation of the safety and preliminary anti-tumor activity of the combination. Following determination of the MTD/RP2D, the study includes an expansion arm at the MTD/RP2D as well as an optional second expansion arm in patients with central nervous system metastases. 'ONT-380 and Kadcyla are both directed at HER2, but with differing mechanisms of action.... 'The strategy of combining two agents targeting HER2 has previously proven useful in HER2+ breast cancer, and we believe the combination of ONT-380 and Kadcyla is particularly relevant to evaluate as the treatment of metastatic HER2+ breast cancer continues to evolve,' said Diana Hausman, M.D., Chief Medical Officer of Oncothyreon.
Insider Selling: Immunogen VP Sells 6,936 Shares of Stock (IMGN)
Posted by Shane Hupp on Feb 28th, 2014 // No Comments
Immunogen logoImmunogen (NASDAQ:IMGN) VP Charles Morris unloaded 6,936 shares of the stock in a transaction dated Wednesday, February 26th. The shares were sold at an average price of $17.35, for a total transaction of $120,339.60. Following the completion of the transaction, the vice president now directly owns 37,500 shares in the company, valued at approximately $650,625. The transaction was disclosed in a legal filing with the Securities & Exchange Commission, which can be accessed through this link.
IMGN has been the subject of a number of recent research reports. Analysts at Guggenheim raised their price target on shares of Immunogen from $14.00 to $15.00 in a research note on Friday, January 31st. Separately, analysts at Zacks downgraded shares of Immunogen from an “outperform” rating to a “neutral” rating in a research note on Monday, January 27th. They now have a $18.20 price target on the stock. Finally, analysts at Zacks upgraded shares of Immunogen from a “neutral” rating to an “outperform” rating in a research note on Friday, December 27th. They now have a $16.60 price target on the stock. Two equities research analysts have rated the stock with a sell rating, three have given a hold rating and six have assigned a buy rating to the stock. The stock presently has an average rating of “Hold” and a consensus target price of $17.79.
Shares of Immunogen (NASDAQ:IMGN) opened at 17.67 on Friday. Immunogen has a one year low of $12.55 and a one year high of $20.25. The stock’s 50-day moving average is $15.77 and its 200-day moving average is $15.81. The company’s market cap is $1.514 billion.
Immunogen (NASDAQ:IMGN) last issued its quarterly earnings data on Friday, January 31st. The company reported ($0.29) EPS for the quarter, missing the Thomson Reuters consensus estimate of ($0.18) by $0.11. The company had revenue of $30.10 million for the quarter, compared to the consensus estimate of $18.16 million. During the same quarter in the prior year, the company posted ($0.29) earnings per share. The company’s quarterly revenue was up 1057.7% on a year-over-year basis. Analysts expect that Immunogen will post $-0.67 EPS for the current fiscal year.
ImmunoGen, Inc (NASDAQ:IMGN) develops targeted, antibody-based therapeutics for the treatment of cancer.
Posted by Shane Hupp on Feb 28th, 2014 // No Comments
Immunogen logoImmunogen (NASDAQ:IMGN) VP Charles Morris unloaded 6,936 shares of the stock in a transaction dated Wednesday, February 26th. The shares were sold at an average price of $17.35, for a total transaction of $120,339.60. Following the completion of the transaction, the vice president now directly owns 37,500 shares in the company, valued at approximately $650,625. The transaction was disclosed in a legal filing with the Securities & Exchange Commission, which can be accessed through this link.
IMGN has been the subject of a number of recent research reports. Analysts at Guggenheim raised their price target on shares of Immunogen from $14.00 to $15.00 in a research note on Friday, January 31st. Separately, analysts at Zacks downgraded shares of Immunogen from an “outperform” rating to a “neutral” rating in a research note on Monday, January 27th. They now have a $18.20 price target on the stock. Finally, analysts at Zacks upgraded shares of Immunogen from a “neutral” rating to an “outperform” rating in a research note on Friday, December 27th. They now have a $16.60 price target on the stock. Two equities research analysts have rated the stock with a sell rating, three have given a hold rating and six have assigned a buy rating to the stock. The stock presently has an average rating of “Hold” and a consensus target price of $17.79.
Shares of Immunogen (NASDAQ:IMGN) opened at 17.67 on Friday. Immunogen has a one year low of $12.55 and a one year high of $20.25. The stock’s 50-day moving average is $15.77 and its 200-day moving average is $15.81. The company’s market cap is $1.514 billion.
Immunogen (NASDAQ:IMGN) last issued its quarterly earnings data on Friday, January 31st. The company reported ($0.29) EPS for the quarter, missing the Thomson Reuters consensus estimate of ($0.18) by $0.11. The company had revenue of $30.10 million for the quarter, compared to the consensus estimate of $18.16 million. During the same quarter in the prior year, the company posted ($0.29) earnings per share. The company’s quarterly revenue was up 1057.7% on a year-over-year basis. Analysts expect that Immunogen will post $-0.67 EPS for the current fiscal year.
ImmunoGen, Inc (NASDAQ:IMGN) develops targeted, antibody-based therapeutics for the treatment of cancer.
Im zweiten Halbjahr werden ja die Ergebnisse des Marianne-Trials für die first-line-Therapie mit Kadcyla erwartet.
Wie sind denn eure Einschätzungen? Welchem Versuchsarm traut ihr die besten Ergebnisse zu? (die Standard-Therapie wird wohl aus meiner Sicht überboten werden)
- Kadcyla alleine oder Kadcyla und Perjeta?
Hoffe Kadcyla alleine wird die besten Ergebnisse liefern, aber auch die Kombi mit Perjeta wäre o.k.! (da habe ich nur bedenken, dass in einigen Ländern dann Bedenken aufkommen, weil die Gesamtkosten für die zwei Medikamente zusammen doch sehr hoch sind ==> Roche langt da preistechnisch doch ganz ordentlich zu)
Wird auf alle Fälle ein interessantes zweites Halbjahr 2014 werden.
Wie sind denn eure Einschätzungen? Welchem Versuchsarm traut ihr die besten Ergebnisse zu? (die Standard-Therapie wird wohl aus meiner Sicht überboten werden)
- Kadcyla alleine oder Kadcyla und Perjeta?
Hoffe Kadcyla alleine wird die besten Ergebnisse liefern, aber auch die Kombi mit Perjeta wäre o.k.! (da habe ich nur bedenken, dass in einigen Ländern dann Bedenken aufkommen, weil die Gesamtkosten für die zwei Medikamente zusammen doch sehr hoch sind ==> Roche langt da preistechnisch doch ganz ordentlich zu)
Wird auf alle Fälle ein interessantes zweites Halbjahr 2014 werden.
Sagen einem Experten die "neuen" Ansätze etwas, welche in den zwei der vier geplanten Postern von Immunogen beim AACR-Meeting präsentiert werden? (anilino-maytansionid ADC bzw. DNA alkylating agent)
Abstract #1618 "New peptide-linked anilino-maytansinoid antibody-drug conjugates (ADCs) for the treatment of cancer" (8:00am-12:00pm PT, Poster Section 27, Poster Board Number 1)
Abstract #2644 "Antibody-drug conjugates (ADCs) with a novel DNA-alkylating agent, DGN462, are highly potent in vitro and in vivo against human cancer models" (1:00-5:00pm PT, Poster Section 31, Poster Board Number 5)
Danke.
Abstract #1618 "New peptide-linked anilino-maytansinoid antibody-drug conjugates (ADCs) for the treatment of cancer" (8:00am-12:00pm PT, Poster Section 27, Poster Board Number 1)
Abstract #2644 "Antibody-drug conjugates (ADCs) with a novel DNA-alkylating agent, DGN462, are highly potent in vitro and in vivo against human cancer models" (1:00-5:00pm PT, Poster Section 31, Poster Board Number 5)
Danke.
Was haltet Ihr Fachleute denn von dieser Aktie mittel- bis langfristig? Es ist hier so still geworden....
VG Klaus
VG Klaus
Erfreuliches von Immunogen ... das veränderte Dosisregime bei IMGN853 scheint erfolgreich. Aktuell keine okulären Toxizitäten mehr bei höherer Dosierung.
ImmunoGen, Inc. Announces First Clinical Findings with Refined Dosing Strategy for IMGN853
Initial Findings Show New Dosing Approach for IMGN853 Achieves Objective
Data Presented at American Association for Cancer Research Annual Meeting
WALTHAM, Mass. & SAN DIEGO--(BUSINESS WIRE)-- ImmunoGen, Inc. (NASDAQ: IMGN), a biotechnology company that develops novel anticancer therapeutics using its antibody-drug conjugate (ADC) technology, today announced the first findings from Company research aimed at optimizing the dosing of its IMGN853 product candidate. The data were presented at the American Association for Cancer Research (AACR) Annual Meeting in San Diego, CA.
Based on findings in the first patients to receive IMGN853, ImmunoGen identified that clinical activity is seen with the compound starting at doses of 3.3 mg/kg and its dose-limiting toxicity is the reversible ocular side effects (blurred vision and keratitis) reported with ADCs in development by several companies. These side effects occurred at IMGN853 doses of 5 mg/kg and above, with dose based on patient total body weight (TBW).
As presented today, modeling research conducted by ImmunoGen predicted that dosing IMGN853 using adjusted ideal body weight (ADJ) rather than TBW should reduce the variability among patients in the concentration of IMGN853 in their blood, as ADJ would better match the dose administered to patient blood volume. Reducing this variability should enable IMGN853 to be well tolerated in more patients at dose levels greater than 3.3 mg/kg. Based on these insights, dosing in the ongoing IMGN853 Phase 1 trial was changed to ADJ several months ago, and the first findings were reported today.
The clinical findings to date validate the prediction: none (0 of 6) of the patients treated with IMGN853 at 5 mg/kg ADJ have had ocular side effects of any grade. This compares with 4 of 10 patients treated at 5 mg/kg TBW. IMGN853 dose escalation above 5 mg/kg ADJ is ongoing.
"ImmunoGen is committed to successfully developing novel drugs that make a difference for people with cancer," said Dr. Charles Morris, ImmunoGen Executive Vice President and Chief Development Officer. "Key to drug development is establishing the dosing strategy that provides the greatest efficacy with the least toxicity for each compound, and we believe the findings reported today reflect a strong path forward for IMGN853. We look forward to sharing additional IMGN853 clinical data in the months ahead."
ImmunoGen also identified that dosing IMGN853 with a modified weekly schedule - weekly for three weeks every four weeks - should maximize tumor exposure to the compound while keeping IMGN853 blood levels in well-tolerated ranges. This dosing schedule, also using ADJ, has been added to the IMGN853 Phase 1 trial, but patient enrollment started too recently for findings to be available by AACR.
IMGN853 is in Phase I clinical testing for the treatment of folate receptor α (FRα)-positive cancers. The Company is currently establishing the maximum tolerated dose (MTD) of IMGN853 when administered once every three weeks using ADJ. Once this MTD is established, IMGN853 will be evaluated at that dose specifically in patients with platinum-resistant ovarian cancer and in patients with relapsed endometrial cancer. The Company is now also establishing its MTD with the modified weekly schedule.
About IMGN853
IMGN853, an ADC, is a potential new treatment for ovarian, endometrial, lung and other cancers that highly express FRα. It comprises an ImmunoGen FRα-targeting antibody attached to the Company's potent cancer cell-killing agent, DM4. The antibody serves to target the compound specifically to cancer cells expressing FRα, and the DM4 serves to kill these cells.
ImmunoGen, Inc. Announces First Clinical Findings with Refined Dosing Strategy for IMGN853
Initial Findings Show New Dosing Approach for IMGN853 Achieves Objective
Data Presented at American Association for Cancer Research Annual Meeting
WALTHAM, Mass. & SAN DIEGO--(BUSINESS WIRE)-- ImmunoGen, Inc. (NASDAQ: IMGN), a biotechnology company that develops novel anticancer therapeutics using its antibody-drug conjugate (ADC) technology, today announced the first findings from Company research aimed at optimizing the dosing of its IMGN853 product candidate. The data were presented at the American Association for Cancer Research (AACR) Annual Meeting in San Diego, CA.
Based on findings in the first patients to receive IMGN853, ImmunoGen identified that clinical activity is seen with the compound starting at doses of 3.3 mg/kg and its dose-limiting toxicity is the reversible ocular side effects (blurred vision and keratitis) reported with ADCs in development by several companies. These side effects occurred at IMGN853 doses of 5 mg/kg and above, with dose based on patient total body weight (TBW).
As presented today, modeling research conducted by ImmunoGen predicted that dosing IMGN853 using adjusted ideal body weight (ADJ) rather than TBW should reduce the variability among patients in the concentration of IMGN853 in their blood, as ADJ would better match the dose administered to patient blood volume. Reducing this variability should enable IMGN853 to be well tolerated in more patients at dose levels greater than 3.3 mg/kg. Based on these insights, dosing in the ongoing IMGN853 Phase 1 trial was changed to ADJ several months ago, and the first findings were reported today.
The clinical findings to date validate the prediction: none (0 of 6) of the patients treated with IMGN853 at 5 mg/kg ADJ have had ocular side effects of any grade. This compares with 4 of 10 patients treated at 5 mg/kg TBW. IMGN853 dose escalation above 5 mg/kg ADJ is ongoing.
"ImmunoGen is committed to successfully developing novel drugs that make a difference for people with cancer," said Dr. Charles Morris, ImmunoGen Executive Vice President and Chief Development Officer. "Key to drug development is establishing the dosing strategy that provides the greatest efficacy with the least toxicity for each compound, and we believe the findings reported today reflect a strong path forward for IMGN853. We look forward to sharing additional IMGN853 clinical data in the months ahead."
ImmunoGen also identified that dosing IMGN853 with a modified weekly schedule - weekly for three weeks every four weeks - should maximize tumor exposure to the compound while keeping IMGN853 blood levels in well-tolerated ranges. This dosing schedule, also using ADJ, has been added to the IMGN853 Phase 1 trial, but patient enrollment started too recently for findings to be available by AACR.
IMGN853 is in Phase I clinical testing for the treatment of folate receptor α (FRα)-positive cancers. The Company is currently establishing the maximum tolerated dose (MTD) of IMGN853 when administered once every three weeks using ADJ. Once this MTD is established, IMGN853 will be evaluated at that dose specifically in patients with platinum-resistant ovarian cancer and in patients with relapsed endometrial cancer. The Company is now also establishing its MTD with the modified weekly schedule.
About IMGN853
IMGN853, an ADC, is a potential new treatment for ovarian, endometrial, lung and other cancers that highly express FRα. It comprises an ImmunoGen FRα-targeting antibody attached to the Company's potent cancer cell-killing agent, DM4. The antibody serves to target the compound specifically to cancer cells expressing FRα, and the DM4 serves to kill these cells.
Hallo Herr Schröder,
wie ist Ihre professionelle Meinung zu diesem Poster? ==> sollte das von immunogen sein ! (habe aber keine Ahnung wer da der Partner ist, Oasis?)
.......................
Abstract Number: 2644
Presentation Title: Antibody-drug conjugates (ADCs) with a novel DNA-alkylating agent, DGN462, are highly potent in vitro and in vivo against human cancer models
Presentation Time: Monday, Apr 07, 2014, 1:00 PM - 5:00 PM
Location: Hall A-E, Poster Section 31
Poster Board Number: 5
Author Block: Kathleen Whiteman, Charlene Audette, Andre Dandeneau, Megan Ellis, Nathan Fishkin, Lauren Harvey, Holly Johnson, Yelena Kovtun, Erin Maloney, Michael Miller, Alan Wilhelm, Ravi Chari. ImmunoGen, Inc., Waltham, MA
Abstract Body: Most ADCs in the clinic utilize a tubulin-binding small molecule as the cytotoxic payload. Although many cancers are sensitive to tubulin agents, some are more responsive to DNA-interacting agents. We have developed a new class of highly potent cytotoxic agents, IGNs, for use in ADCs that consists of indolino-benzodiazepine dimers with a novel DNA-alkylating mechanism of action. We found that IGNs containing a di-imine moiety act via DNA-crosslinking and -alkylating, whereas IGNs with a mono-imine induce DNA alkylation only. Although ADCs with either form of IGN were highly active, ADCs containing di-imine IGNs caused delayed toxicity in mice, leading to mortality. The mono-imine IGN, DGN462, was selected as our lead IGN as, when conjugated to an antibody via a cleavable linkage, the resultant ADC had favorable tolerability in mice (maximally tolerated dose of 40 mg/kg; 700 µg/kg DGN462 dose) without delayed toxicity.
The ability of DGN462 to alkylate DNA was demonstrated by measurement of DNA adduct formation with double-stranded DNA and in cells. DGN462 formed covalent DNA adducts through alkylation of the C2- amino group of guanine. Consistent with the activity of other DNA alkylating agents, DGN462-treated cells progressed slowly through S-phase and were arrested in G2/M phase of the cell cycle in a dose dependent manner.
ADCs consisting of ~3 molecules of DGN462 per antibody, attached via a cleavable linker, had desirable biochemical characteristics, including high monomer content (> 97%), low free drug (< 0.1%) and symmetrical mass distribution profiles. These DGN462 ADCs were highly potent and antigen-specific in vitro against various cell types, including PgP-expressing cells, with IC50 values ranging from 2 pM to 3 nM depending on the target, cell type and antigen density. DGN462 ADCs display bystander activity in vitro, indicating that intracellular processing of conjugate by target cancer cells releases metabolites that can kill antigen-negative cells in direct proximity, which may provide an advantage in solid tumors expressing antigen heterogeneously.
A CD33-targeting DGN462 ADC was highly active against AML xenografts, with a minimal efficacious dose (MED) of 0.6 mg/kg (conjugate dose), while a non-targeting control was inactive. A DGN462 ADC targeting epidermal growth factor receptor was highly active and antigen-specific against a head and neck squamous cell carcinoma model, with a 1.6 mg/kg MED. The intact conjugate half-life was approximately 90 hours in mice, and bioactivity of conjugate was maintained at 72 hours post dosing, indicating that intact conjugate remains active in vivo.
DGN462 ADCs have an acceptable safety profile and potent antigen-specific DNA-alkylating mechanism of action with the potential for activity in tumors with low sensitivity to tubulin agents, heterogeneous antigen expression and/or PgP-mediated drug resistance.
wie ist Ihre professionelle Meinung zu diesem Poster? ==> sollte das von immunogen sein ! (habe aber keine Ahnung wer da der Partner ist, Oasis?)
.......................
Abstract Number: 2644
Presentation Title: Antibody-drug conjugates (ADCs) with a novel DNA-alkylating agent, DGN462, are highly potent in vitro and in vivo against human cancer models
Presentation Time: Monday, Apr 07, 2014, 1:00 PM - 5:00 PM
Location: Hall A-E, Poster Section 31
Poster Board Number: 5
Author Block: Kathleen Whiteman, Charlene Audette, Andre Dandeneau, Megan Ellis, Nathan Fishkin, Lauren Harvey, Holly Johnson, Yelena Kovtun, Erin Maloney, Michael Miller, Alan Wilhelm, Ravi Chari. ImmunoGen, Inc., Waltham, MA
Abstract Body: Most ADCs in the clinic utilize a tubulin-binding small molecule as the cytotoxic payload. Although many cancers are sensitive to tubulin agents, some are more responsive to DNA-interacting agents. We have developed a new class of highly potent cytotoxic agents, IGNs, for use in ADCs that consists of indolino-benzodiazepine dimers with a novel DNA-alkylating mechanism of action. We found that IGNs containing a di-imine moiety act via DNA-crosslinking and -alkylating, whereas IGNs with a mono-imine induce DNA alkylation only. Although ADCs with either form of IGN were highly active, ADCs containing di-imine IGNs caused delayed toxicity in mice, leading to mortality. The mono-imine IGN, DGN462, was selected as our lead IGN as, when conjugated to an antibody via a cleavable linkage, the resultant ADC had favorable tolerability in mice (maximally tolerated dose of 40 mg/kg; 700 µg/kg DGN462 dose) without delayed toxicity.
The ability of DGN462 to alkylate DNA was demonstrated by measurement of DNA adduct formation with double-stranded DNA and in cells. DGN462 formed covalent DNA adducts through alkylation of the C2- amino group of guanine. Consistent with the activity of other DNA alkylating agents, DGN462-treated cells progressed slowly through S-phase and were arrested in G2/M phase of the cell cycle in a dose dependent manner.
ADCs consisting of ~3 molecules of DGN462 per antibody, attached via a cleavable linker, had desirable biochemical characteristics, including high monomer content (> 97%), low free drug (< 0.1%) and symmetrical mass distribution profiles. These DGN462 ADCs were highly potent and antigen-specific in vitro against various cell types, including PgP-expressing cells, with IC50 values ranging from 2 pM to 3 nM depending on the target, cell type and antigen density. DGN462 ADCs display bystander activity in vitro, indicating that intracellular processing of conjugate by target cancer cells releases metabolites that can kill antigen-negative cells in direct proximity, which may provide an advantage in solid tumors expressing antigen heterogeneously.
A CD33-targeting DGN462 ADC was highly active against AML xenografts, with a minimal efficacious dose (MED) of 0.6 mg/kg (conjugate dose), while a non-targeting control was inactive. A DGN462 ADC targeting epidermal growth factor receptor was highly active and antigen-specific against a head and neck squamous cell carcinoma model, with a 1.6 mg/kg MED. The intact conjugate half-life was approximately 90 hours in mice, and bioactivity of conjugate was maintained at 72 hours post dosing, indicating that intact conjugate remains active in vivo.
DGN462 ADCs have an acceptable safety profile and potent antigen-specific DNA-alkylating mechanism of action with the potential for activity in tumors with low sensitivity to tubulin agents, heterogeneous antigen expression and/or PgP-mediated drug resistance.
Die Verkaufszahlen für Kadcyla in Q1 sehen sehr gut. In den USA Umsatzsteigerung (in USD) um 15 % im Vergleich zu Q4 2013. Verkaufsstart in Japan steht unmittelbar bevor.
Die Kadcyla-Umsatzentwicklung liegt genau in (meinem) Plan.
Auf Basis meiner Berechungen liegt der Quotient aus aktuellem Unternehmenswert und Kadcyla-Spitzen-Jahrestantiemen derzeit bei 2. Mit anderen Worten: Sobald die Kadcyla die erwarteten Peak Sales erwirtschaftet, werden die IMGN daraus zufließenden Tantiemen innerhalb von zwei Jahren den derzeitigen Unternehmenswert abbilden.
Unter Berücksichtigung einer 30 %igen Steuerquote notiert die Aktie derzeit mit dem etwa 3 bis 4fachen Kadcyla-Nachsteuer-Tantiemengewinn.
Die Aktie notiert deutlich unter Wert.
Die Kadcyla-Umsatzentwicklung liegt genau in (meinem) Plan.
Auf Basis meiner Berechungen liegt der Quotient aus aktuellem Unternehmenswert und Kadcyla-Spitzen-Jahrestantiemen derzeit bei 2. Mit anderen Worten: Sobald die Kadcyla die erwarteten Peak Sales erwirtschaftet, werden die IMGN daraus zufließenden Tantiemen innerhalb von zwei Jahren den derzeitigen Unternehmenswert abbilden.
Unter Berücksichtigung einer 30 %igen Steuerquote notiert die Aktie derzeit mit dem etwa 3 bis 4fachen Kadcyla-Nachsteuer-Tantiemengewinn.
Die Aktie notiert deutlich unter Wert.
Endlich ist es so weit ... Verkaufsstart Kadcyla in den USA am morgigen Freitag!
April 17, 2014 (Tokyo) – Chugai Pharmaceutical Co., Ltd. [Main Office: Chuo-ku, Tokyo.
Chairman & CEO: Osamu Nagayama (hereafter, “Chugai”)] announced today that it will launch
the anti-HER2 antibody-tubulin polymerization inhibitor conjugate “Kadcyla® Intravenous Infusion
100 mg and 160 mg” [generic name: trastuzumab emtansine (genetic recombinant)] (hereafter,
Kadcyla®) for the indication of “HER2-positive inoperable or recurrent breast cancer” on April 18,
2014. Kadcyla® received a manufacturing and marketing approval on September 20, 2013 and
was listed on the National Health Insurance (NHI) reimbursement price list on April 17, 2014.
April 17, 2014 (Tokyo) – Chugai Pharmaceutical Co., Ltd. [Main Office: Chuo-ku, Tokyo.
Chairman & CEO: Osamu Nagayama (hereafter, “Chugai”)] announced today that it will launch
the anti-HER2 antibody-tubulin polymerization inhibitor conjugate “Kadcyla® Intravenous Infusion
100 mg and 160 mg” [generic name: trastuzumab emtansine (genetic recombinant)] (hereafter,
Kadcyla®) for the indication of “HER2-positive inoperable or recurrent breast cancer” on April 18,
2014. Kadcyla® received a manufacturing and marketing approval on September 20, 2013 and
was listed on the National Health Insurance (NHI) reimbursement price list on April 17, 2014.
Antwort auf Beitrag Nr.: 46.843.774 von Joschka Schröder am 17.04.14 18:18:30...Verkaufsstart in Japan.
Noch eine Frage: anhand der obrigen Rechnung käme ich auf Peaksales von über 10 Milliarden, da IMGN ja 5% Royalties bekommt. Ist das die Annahme oder übersehe ich da etwas?
Noch eine Frage: anhand der obrigen Rechnung käme ich auf Peaksales von über 10 Milliarden, da IMGN ja 5% Royalties bekommt. Ist das die Annahme oder übersehe ich da etwas?
Antwort auf Beitrag Nr.: 46.843.868 von kmastra am 17.04.14 18:34:01Auf Basis verschiedener Datensätze kommt man für Kadcyla jeweils auf Peak Sales in Höhe von ca. 9 bis 10 Mrd. USD.
Der aktuelle Unternehmenswert berechnet sich wiederum als Differenz aus Börsenkapitalisierung und Nettofinanzvermögen.
Der aktuelle Unternehmenswert berechnet sich wiederum als Differenz aus Börsenkapitalisierung und Nettofinanzvermögen.
Antwort auf Beitrag Nr.: 46.844.088 von Joschka Schröder am 17.04.14 19:16:01Alles klar. Danke!
Der Vermarktungsstart in Japan sollte die Gesamtumsätze des Jahres auf 500Mio USD bringen.
Meines Wissens sind die Royalties aktuell noch bei nur 3% und klettern ab 700 USD/Jahr (oder höher?) auf bis zu 5%.
Gibt es weitere Zahlungen von Roche? Sales-based Milestones? Ist da was bekannt?
Meines Wissens sind die Royalties aktuell noch bei nur 3% und klettern ab 700 USD/Jahr (oder höher?) auf bis zu 5%.
Gibt es weitere Zahlungen von Roche? Sales-based Milestones? Ist da was bekannt?
Antwort auf Beitrag Nr.: 46.768.941 von KlausAnlage am 04.04.14 18:02:33Was haltet Ihr Fachleute denn von dieser Aktie mittel- bis langfristig? Es ist hier so still geworden....
VG Klaus
Hallo,
nicht vom Markt nervös machen lassen. Die Biotechs waren insgesamt im Blasenmodus, das wurde oder wird jetzt etwas korrigiert. Gut so! Das belastet dann natürlich auch IMGN.
Die Aussichten sind gerade bei IMGN mittel und langfristig ausgezeichnet.
Kadcyla sichert die Bewertung nach unten ab und nach oben gibts durch viele Projekte jede Menge Potential.
In diesem Zusammenhang kann ich bspw. auf den Beitrag #415 von Joschka verweisen. Das kann noch sehr wichtig und sehr positiv werden.
VG Klaus
Hallo,
nicht vom Markt nervös machen lassen. Die Biotechs waren insgesamt im Blasenmodus, das wurde oder wird jetzt etwas korrigiert. Gut so! Das belastet dann natürlich auch IMGN.
Die Aussichten sind gerade bei IMGN mittel und langfristig ausgezeichnet.
Kadcyla sichert die Bewertung nach unten ab und nach oben gibts durch viele Projekte jede Menge Potential.
In diesem Zusammenhang kann ich bspw. auf den Beitrag #415 von Joschka verweisen. Das kann noch sehr wichtig und sehr positiv werden.
Antwort auf Beitrag Nr.: 46.845.326 von Ville7 am 18.04.14 04:51:32Hallo Ville,
zur Stafflung der Royalties kannst Du in Beitrag #167 schauen (5% > 700 Mio. im jeweiligen Territorium sind richtig).
Zu den Milestones: Das kann man komplett vernachlässigen. Sales-Milestones meines Wissens nach 0,0.
Ansonsten development und regulytory-milestones von insgesamt 44 Mio. Dollar für das gesamte Projekt.
(was für ein scheiß-deal, mit heutigen Standards verglichen. aber so war das wohl im Jahre 2000...)
Gruß
SLG
zur Stafflung der Royalties kannst Du in Beitrag #167 schauen (5% > 700 Mio. im jeweiligen Territorium sind richtig).
Zu den Milestones: Das kann man komplett vernachlässigen. Sales-Milestones meines Wissens nach 0,0.
Ansonsten development und regulytory-milestones von insgesamt 44 Mio. Dollar für das gesamte Projekt.
(was für ein scheiß-deal, mit heutigen Standards verglichen. aber so war das wohl im Jahre 2000...)
Gruß
SLG
Jemand hat die Preise für Kadcyla in Japan ausgegraben:
100 mg/vial 235,108 yen
160 mg/vial 373,945 yen
am Beispiel des 160mg vials sieht man, dass die Japaner erfolgreich im Aushandeln eines Discounts waren:
160mg vial T-DM1
in USA = USD 5325.25
in Japan = USD 3650.825
Any comments?
100 mg/vial 235,108 yen
160 mg/vial 373,945 yen
am Beispiel des 160mg vials sieht man, dass die Japaner erfolgreich im Aushandeln eines Discounts waren:
160mg vial T-DM1
in USA = USD 5325.25
in Japan = USD 3650.825
Any comments?
Antwort auf Beitrag Nr.: 46.848.340 von Ville7 am 19.04.14 11:14:39Ergänzung:
In deutschen Apotheken kostet 160mg Kadcyla 4049,81 €, d.h. knapp USD 5.600.
In Europa scheinen sich somit noch bessere Preise als in USA erzielen zu lassen.
In deutschen Apotheken kostet 160mg Kadcyla 4049,81 €, d.h. knapp USD 5.600.
In Europa scheinen sich somit noch bessere Preise als in USA erzielen zu lassen.
IMGN ASCO 2014 Abstracts - zumindest die Überschriften wurden im Meeting Planner bereits veröffentlicht:
Abstract #8506
Starlyte phase II study of coltuximab ravtansine (CoR, SAR3419) single agent: Clinical activity and safety in patients (pts) with relapsed/refractory (R/R) diffuse large B-cell lymphoma (DLBCL; NCT01472887).
Marek Trneny, MD Disclosure
Charles University Hospital, Department of Hematology
Abstract #8532
A phase I trial of SAR650984, a CD38 monoclonal antibody, in relapsed or refractory multiple myeloma.
Thomas G. Martin, MD, III
Poster Board: #12
Abstract #8512
A phase Ib dose escalation trial of SAR650984 (Anti-CD-38 mAb) in combination with lenalidomide and dexamethasone in relapsed/refractory multiple myeloma.
Thomas G. Martin, MD, III Disclosure
University of San Francisco
Abstract #8526
Preliminary findings from a phase I, multicenter, open-label study of the anti-CD37 antibody-drug conjugate (ADC), IMGN529, in adult patients with relapsed or refractory non-Hodgkin lymphoma (NHL).
Anastasios Stathis, MD
Poster Board: #6
Abstract #5571
Relationship of pharmacokinetics (PK), toxicity, and initial evidence of clinical activity with IMGN853, a folate receptor alpha (FRa) targeting antibody drug conjugate in patients (Pts) with epithelial ovarian cancer (EOC) and other FRa-positive solid tumors.
Kathleen N. Moore, MD
Poster Board: #353
Abstract #605
Relationship between tumor biomarkers (BM) and efficacy in TH3RESA, a phase 3 study of trastuzumab emtansine (T-DM1) versus treatment of physician’s choice (TPC) in HER2-positive advanced breast cancer (BC) previously treated with trastuzumab and lapatinib.
Sung-Bae Kim, M.D., Ph.D.
Poster Board: #69
Abstract #606
Trastuzumab emtansine (T-DM1) plus capecitabine (X) in patients with HER2-positive MBC: MO28230 TRAX-HER2 phase 1 results.
Karen A. Gelmon, MD, FRCPC
Poster Board: #70
Abstract #609
Retrospective analysis of toxicity in patients (pts) with liver metastases (mets) from phase 3 studies of trastuzumab emtansine (T-DM1) in pts with metastatic breast cancer (MBC).
David Miles, MD
Poster Board: #73
Abstract #650
T-DM1 in HER2-positive breast cancer brain metastases (BM).
Rupert Bartsch, MD
Poster Board: #114
Abstract #TPS662
A phase 1b study of ONT-380, an oral HER2-specific inhibitor, combined with ado‑trastuzumab emtansine (T-DM1), in HER2+ metastatic breast cancer (MBC).
Virginia F. Borges, MD
Poster Board: #121A
Abstract #TPS672
Phase I study of BYL719 and trastuzumab-MCC-DM1 (T-DM1) in HER2-positive metastatic breast cancer (MBC) patients with progression on trastuzumab and taxane-based therapy.
Sarika Jain, MD
Poster Board: #126A
Abstract #11001
PET/CT with 89Zr-trastuzumab and 18F-FDG to individualize treatment with trastuzumab emtansine (T-DM1) in metastatic HER2-positive breast cancer (mBC).
Geraldine Gebhart, MD
Institut Jules Bordet – Université Libre de Bruxelles
Abstract #8506
Starlyte phase II study of coltuximab ravtansine (CoR, SAR3419) single agent: Clinical activity and safety in patients (pts) with relapsed/refractory (R/R) diffuse large B-cell lymphoma (DLBCL; NCT01472887).
Marek Trneny, MD Disclosure
Charles University Hospital, Department of Hematology
Abstract #8532
A phase I trial of SAR650984, a CD38 monoclonal antibody, in relapsed or refractory multiple myeloma.
Thomas G. Martin, MD, III
Poster Board: #12
Abstract #8512
A phase Ib dose escalation trial of SAR650984 (Anti-CD-38 mAb) in combination with lenalidomide and dexamethasone in relapsed/refractory multiple myeloma.
Thomas G. Martin, MD, III Disclosure
University of San Francisco
Abstract #8526
Preliminary findings from a phase I, multicenter, open-label study of the anti-CD37 antibody-drug conjugate (ADC), IMGN529, in adult patients with relapsed or refractory non-Hodgkin lymphoma (NHL).
Anastasios Stathis, MD
Poster Board: #6
Abstract #5571
Relationship of pharmacokinetics (PK), toxicity, and initial evidence of clinical activity with IMGN853, a folate receptor alpha (FRa) targeting antibody drug conjugate in patients (Pts) with epithelial ovarian cancer (EOC) and other FRa-positive solid tumors.
Kathleen N. Moore, MD
Poster Board: #353
Abstract #605
Relationship between tumor biomarkers (BM) and efficacy in TH3RESA, a phase 3 study of trastuzumab emtansine (T-DM1) versus treatment of physician’s choice (TPC) in HER2-positive advanced breast cancer (BC) previously treated with trastuzumab and lapatinib.
Sung-Bae Kim, M.D., Ph.D.
Poster Board: #69
Abstract #606
Trastuzumab emtansine (T-DM1) plus capecitabine (X) in patients with HER2-positive MBC: MO28230 TRAX-HER2 phase 1 results.
Karen A. Gelmon, MD, FRCPC
Poster Board: #70
Abstract #609
Retrospective analysis of toxicity in patients (pts) with liver metastases (mets) from phase 3 studies of trastuzumab emtansine (T-DM1) in pts with metastatic breast cancer (MBC).
David Miles, MD
Poster Board: #73
Abstract #650
T-DM1 in HER2-positive breast cancer brain metastases (BM).
Rupert Bartsch, MD
Poster Board: #114
Abstract #TPS662
A phase 1b study of ONT-380, an oral HER2-specific inhibitor, combined with ado‑trastuzumab emtansine (T-DM1), in HER2+ metastatic breast cancer (MBC).
Virginia F. Borges, MD
Poster Board: #121A
Abstract #TPS672
Phase I study of BYL719 and trastuzumab-MCC-DM1 (T-DM1) in HER2-positive metastatic breast cancer (MBC) patients with progression on trastuzumab and taxane-based therapy.
Sarika Jain, MD
Poster Board: #126A
Abstract #11001
PET/CT with 89Zr-trastuzumab and 18F-FDG to individualize treatment with trastuzumab emtansine (T-DM1) in metastatic HER2-positive breast cancer (mBC).
Geraldine Gebhart, MD
Institut Jules Bordet – Université Libre de Bruxelles
Antwort auf Beitrag Nr.: 46.848.340 von Ville7 am 19.04.14 11:14:39Hallo Ville, schön von Dir zu hören.
Weißt Du, aus welcher Quelle die jeweiligen Preisdaten stammen?
Direkt von Roche weiß ich nur, dass Kadcyla in Europa ca. 15 % billiger ist als in den USA. In Japan gab es ja monatelang Probleme bei der Preisfestsetzung, so dass gut vorstellbar ist, dass Kadcyla dort noch günstiger als in Europa verkauft wird. Bzgl. weiteren Details werde ich in den nächsten Tagen noch einmal in Basel nachfragen.
PS: ASCO wird spannend. Die Abstracts gibt Mitte Mai.
Weißt Du, aus welcher Quelle die jeweiligen Preisdaten stammen?
Direkt von Roche weiß ich nur, dass Kadcyla in Europa ca. 15 % billiger ist als in den USA. In Japan gab es ja monatelang Probleme bei der Preisfestsetzung, so dass gut vorstellbar ist, dass Kadcyla dort noch günstiger als in Europa verkauft wird. Bzgl. weiteren Details werde ich in den nächsten Tagen noch einmal in Basel nachfragen.
PS: ASCO wird spannend. Die Abstracts gibt Mitte Mai.
Die Bedingungen im Gesundheitssystem werden härter ... nun geht es um die Kadcyla-Preise in England -> http://www.fiercepharma.com/story/nice-rejects-roches-hot-ne…
Kann mir jemand bitte einen Link zu einer Firmenpräsentation von ImmunoGen posten? Ich habe im IR Bereich nichts dergleichen gefunden.
Morgen kommen Zahlen. Erachte ImmunoGen als sehr spannende Firma / Investment.
Morgen kommen Zahlen. Erachte ImmunoGen als sehr spannende Firma / Investment.
http://www.sec.gov/Archives/edgar/data/855654/00011046591403…
...
A number of leading companies in oncology are developing anticancer compounds through partnerships with ImmunoGen. Recent updates include:
· The first clinical data with Amgen’s AMG 595 in glioblastoma were reported at AACR, with evidence of activity seen at doses that were well tolerated.
· With the presentation of the AMG 595 data at AACR, encouraging initial clinical findings have now been reported for six partner compounds in addition to Kadcyla: Amgen’s AMG 595, Bayer HealthCare’s BAY 94-9343 (anetumab ravtansine), Biotest’s BT-062 (indatuximab ravtansine), Sanofi’s SAR3419 (coltuximab ravtansine), SAR566658, and SAR650984.
· Patient dosing has begun in a clinical trial assessing CD138-targeting BT-062 for the treatment of triple negative metastatic breast cancer and metastatic urinary bladder cancer. BT-062 also is in clinical testing for the treatment of multiple myeloma. ImmunoGen has a BT-062 opt-in right for co-development and co-commercialization jointly with Biotest in the US.
· ImmunoGen expects one or more partner IND submissions in 2014, plus additional clinical data presentations.
Financial Results
For the Company’s quarter ended March 31, 2014 (3Q FY2014), ImmunoGen reported a net loss of $37.5 million, or $0.44 per basic and diluted share, compared to a net loss of $1.4 million, or $0.02 per basic and diluted share, for the same quarter last year (3Q FY2013). Included in the current period is a $12.8 million ($0.15/share) non-cash expense related to the collaboration recently established with CytomX.
Revenues for 3Q FY2014 were $6.9 million, compared to $25.0 million for 3Q FY2013. Revenues in the current period include $0.3 million of license and milestone fees, compared to $22.0 million in 3Q FY2013. The prior year fees include $11.1 million of amortization of an upfront license fee received from Novartis in FY2011 that was recognized in 3Q FY2013 with Novartis taking a development and commercialization license in that quarter as well as a $10.5 million milestone payment from Roche earned in 3Q FY2013 with the approval of Kadcyla in the US.
Revenues in 3Q FY2014 also include $2.6 million of royalty payments received from Roche in March 2014 for sales of Kadcyla during the three-month period ended December 31, 2013; the Company had no royalty revenue in 3Q FY2013. Additionally, revenues in 3Q FY2014 include $1.9 million of research and development support fees, compared to $2.3 million in such fees for 3Q FY2013, and $2.1 million of clinical materials revenue, compared to $0.7 million for 3Q FY2013. The amount of research and the number of batches of clinical materials produced and released to partners varies on a quarter-to-quarter basis.
3
Operating expenses in 3Q FY2014 were $44.3 million, compared to $26.3 million in 3Q FY2013. Operating expenses in 3Q FY2014 include research and development expenses of $38.3 million, compared to $21.3 million in 3Q FY2013. In 3Q 2014, the Company recorded a $12.8 million non-cash charge to research and development expense for technology rights obtained under the collaboration agreement executed with CytomX in January 2014. Also driving the change from the prior period are increased personnel expenses and increased costs associated with manufacturing clinical materials on behalf of our partners. Operating expenses also include general and administrative expenses of $6.0 million in 3Q FY2014, compared to $5.0 million in 3Q FY2013. This increase is primarily due to increased personnel expenses and patent expenses.
ImmunoGen had approximately $164.1 million in cash and cash equivalents as of March 31, 2014, compared with $195.0 million as of June 30, 2013, and had no debt outstanding in either period. Cash used in operations was $34.7 million in the first nine months of FY2014, compared with $48.7 million in the same period in FY2013. Capital expenditures were $4.7 million and $2.4 million for the first nine months of FY2014 and FY2013, respectively.
Updated Financial Guidance for Fiscal Year 2014
ImmunoGen is updating its financial guidance for FY2014 from that issued in January 2014. ImmunoGen now expects:
· Revenues to be between $60 million and $64 million, compared with previous guidance of between $71 million and $75 million;
· Operating expenses to be between $133 million and $137 million, compared with previous guidance of between $140 million and $144 million;
· Net loss to be between $71 million and $75 million, compared with previous guidance of between $67 million and $71 million;
· Net cash used in operations to be between $56 million and $60 million, compared with previous guidance of between $64 million and $68 million;
· Capital expenditures to between $8 million and $10 million, unchanged from previous guidance; and
· To end its fiscal year on June 30, 2014 with cash and cash equivalents of between $134 million and $138 million, compared with previous guidance of between $124 million and $128 million.
...
...
A number of leading companies in oncology are developing anticancer compounds through partnerships with ImmunoGen. Recent updates include:
· The first clinical data with Amgen’s AMG 595 in glioblastoma were reported at AACR, with evidence of activity seen at doses that were well tolerated.
· With the presentation of the AMG 595 data at AACR, encouraging initial clinical findings have now been reported for six partner compounds in addition to Kadcyla: Amgen’s AMG 595, Bayer HealthCare’s BAY 94-9343 (anetumab ravtansine), Biotest’s BT-062 (indatuximab ravtansine), Sanofi’s SAR3419 (coltuximab ravtansine), SAR566658, and SAR650984.
· Patient dosing has begun in a clinical trial assessing CD138-targeting BT-062 for the treatment of triple negative metastatic breast cancer and metastatic urinary bladder cancer. BT-062 also is in clinical testing for the treatment of multiple myeloma. ImmunoGen has a BT-062 opt-in right for co-development and co-commercialization jointly with Biotest in the US.
· ImmunoGen expects one or more partner IND submissions in 2014, plus additional clinical data presentations.
Financial Results
For the Company’s quarter ended March 31, 2014 (3Q FY2014), ImmunoGen reported a net loss of $37.5 million, or $0.44 per basic and diluted share, compared to a net loss of $1.4 million, or $0.02 per basic and diluted share, for the same quarter last year (3Q FY2013). Included in the current period is a $12.8 million ($0.15/share) non-cash expense related to the collaboration recently established with CytomX.
Revenues for 3Q FY2014 were $6.9 million, compared to $25.0 million for 3Q FY2013. Revenues in the current period include $0.3 million of license and milestone fees, compared to $22.0 million in 3Q FY2013. The prior year fees include $11.1 million of amortization of an upfront license fee received from Novartis in FY2011 that was recognized in 3Q FY2013 with Novartis taking a development and commercialization license in that quarter as well as a $10.5 million milestone payment from Roche earned in 3Q FY2013 with the approval of Kadcyla in the US.
Revenues in 3Q FY2014 also include $2.6 million of royalty payments received from Roche in March 2014 for sales of Kadcyla during the three-month period ended December 31, 2013; the Company had no royalty revenue in 3Q FY2013. Additionally, revenues in 3Q FY2014 include $1.9 million of research and development support fees, compared to $2.3 million in such fees for 3Q FY2013, and $2.1 million of clinical materials revenue, compared to $0.7 million for 3Q FY2013. The amount of research and the number of batches of clinical materials produced and released to partners varies on a quarter-to-quarter basis.
3
Operating expenses in 3Q FY2014 were $44.3 million, compared to $26.3 million in 3Q FY2013. Operating expenses in 3Q FY2014 include research and development expenses of $38.3 million, compared to $21.3 million in 3Q FY2013. In 3Q 2014, the Company recorded a $12.8 million non-cash charge to research and development expense for technology rights obtained under the collaboration agreement executed with CytomX in January 2014. Also driving the change from the prior period are increased personnel expenses and increased costs associated with manufacturing clinical materials on behalf of our partners. Operating expenses also include general and administrative expenses of $6.0 million in 3Q FY2014, compared to $5.0 million in 3Q FY2013. This increase is primarily due to increased personnel expenses and patent expenses.
ImmunoGen had approximately $164.1 million in cash and cash equivalents as of March 31, 2014, compared with $195.0 million as of June 30, 2013, and had no debt outstanding in either period. Cash used in operations was $34.7 million in the first nine months of FY2014, compared with $48.7 million in the same period in FY2013. Capital expenditures were $4.7 million and $2.4 million for the first nine months of FY2014 and FY2013, respectively.
Updated Financial Guidance for Fiscal Year 2014
ImmunoGen is updating its financial guidance for FY2014 from that issued in January 2014. ImmunoGen now expects:
· Revenues to be between $60 million and $64 million, compared with previous guidance of between $71 million and $75 million;
· Operating expenses to be between $133 million and $137 million, compared with previous guidance of between $140 million and $144 million;
· Net loss to be between $71 million and $75 million, compared with previous guidance of between $67 million and $71 million;
· Net cash used in operations to be between $56 million and $60 million, compared with previous guidance of between $64 million and $68 million;
· Capital expenditures to between $8 million and $10 million, unchanged from previous guidance; and
· To end its fiscal year on June 30, 2014 with cash and cash equivalents of between $134 million and $138 million, compared with previous guidance of between $124 million and $128 million.
...
Ein Artikel in der gestrigen Ausgabe des Guardian, über die Preise für Kadcyla:
http://www.theguardian.com/commentisfree/2014/apr/25/kadcyla…
http://www.theguardian.com/commentisfree/2014/apr/25/kadcyla…
Rising R&D Expenses Drive ImmunoGen's Q3 Loss Significantly Higher
http://www.fool.com/investing/general/2014/04/25/rising-rd-e…
http://www.fool.com/investing/general/2014/04/25/rising-rd-e…
"ImmunoGen's CEO Discusses Q3 2014 Results - Earnings Call Transcript"
http://seekingalpha.com/article/2166573-immunogens-ceo-discu…
http://seekingalpha.com/article/2166573-immunogens-ceo-discu…
Die Kursreaktion am vergangenen Freitag konnte ich nicht recht nachvollziehen. Aus meiner Sicht war es eine gute Kaufgelegenheit.
Nicht Neues, aber dennoch lesenswert -> http://www.journalonko.de/newsview.php?id=7325
Nicht Neues, aber dennoch lesenswert -> http://www.journalonko.de/newsview.php?id=7325
Ich glaube die unter 3 Mio. USD Kadcyla Royalties in Kombination mit der Info, dass man ca. 43% (oder so ähnlich?) Marktsättigung US in der zugelassenen Indikation erreicht hat, hat bei einigen die Dollarzeichen schmelzen lassen. Persönlich bin ich aber überzeugt, dass Roche die aktuellen Herceptinumsätze in Zukunft mit Perjeta und Kadcyla nicht nur ausgleichen sondern übertreffen will. Warum sollte es nicht auch in 1st line gut sein? Her2 ist aufgrund seiner hohen Rezeptordichte auf Tumorzellen und der guten Internalisierung eines der "einfachsten" ADC-targets.
Ich werde versuchen, dieser Tage endlich mal einen Einstieg in die Aktie zu schaffen, nachdem ich sie bereits lange genug beobachte. Beim dip unter die 12 neulich abends hab ich ein paar cents zu knapp limitiert (meine Frau meinte nur süffisant: musst du gerade einen Panikkauf machen?) und dann weinend zugeschaut, wie sie sofort wieder über 14 ging...
Was ich im übrigen nicht gut finde bei IMGN ist diese Überbetonung des neuen Dosierungsschemas für den Folate receptor ADC, da geht es doch nur um ein paar Prozent Dosis hin oder her - wenn das therapeutic window wirklich so schmal ist, dann glaube ich da nicht an eine Zulassung.
Und dann ist da natürlich noch der NBI, der wahrscheinlich noch lange nicht auskonsolidiert hat...
Ich werde versuchen, dieser Tage endlich mal einen Einstieg in die Aktie zu schaffen, nachdem ich sie bereits lange genug beobachte. Beim dip unter die 12 neulich abends hab ich ein paar cents zu knapp limitiert (meine Frau meinte nur süffisant: musst du gerade einen Panikkauf machen?) und dann weinend zugeschaut, wie sie sofort wieder über 14 ging...
Was ich im übrigen nicht gut finde bei IMGN ist diese Überbetonung des neuen Dosierungsschemas für den Folate receptor ADC, da geht es doch nur um ein paar Prozent Dosis hin oder her - wenn das therapeutic window wirklich so schmal ist, dann glaube ich da nicht an eine Zulassung.
Und dann ist da natürlich noch der NBI, der wahrscheinlich noch lange nicht auskonsolidiert hat...
Antwort auf Beitrag Nr.: 46.881.662 von yok am 27.04.14 13:58:52Die Royalties-Höhe war eigentlich bereits seit einigen Monaten (mit der Veröffentlichung der Roche-Q4-Zahlen) bekannt. Die Zahlen passen auch recht gut zu den Angaben zur Marktdurchdringung (bisher sehr begrenzte Indikation).
Was IMGN853 betrifft, so bleibe auch ich zunächst einmal zurückhaltend. Sobald die ASCO-Daten vorliegen, wird man sich vermutlich ein besseres Bild von der Situation (PK, therapeutisches Fenster usw.) machen könnnen.
Was IMGN853 betrifft, so bleibe auch ich zunächst einmal zurückhaltend. Sobald die ASCO-Daten vorliegen, wird man sich vermutlich ein besseres Bild von der Situation (PK, therapeutisches Fenster usw.) machen könnnen.
... noch etwas Altes ...
Beim Stöbern bin ich auf einen m.e. interessanten Biotech-Blog gestossen, der sich im verlinkten Artikel mit den bei IMGN901 aufgetretenen Nebenwirkungen (Infektionen) befasst und näher auf die im Raum gestellten generellen Probleme (okulare Toxizität) von Immunogens ADC-Technologie eingeht:
http://sugarconebiotech.blogspot.de/#!/2013/11/immunogens-ad…
Zusammenfassung:
Aufgrund der höheren Infektionsrate wurde die IMGN901 Studie abgebrochen. Möglicherweise wurde mit CD56 ein unpassendes Ziel gewählt, welches ursächlich für die aufgetretenen Infektionen war.
Weiter kann bei Immunkonjugaten unterschiedlicher Hersteller okulare Toxiziät beobachtet werden. Immunogen arbeitet an Modifikationen, welche diese reduzieren soll. Siehe referenzierte Patente, Dosis u. Verabreichungsschemas.
Für Interessierte der Link zur Homepage des Blogs: http://www.sugarconebiotech.com/
Beim Stöbern bin ich auf einen m.e. interessanten Biotech-Blog gestossen, der sich im verlinkten Artikel mit den bei IMGN901 aufgetretenen Nebenwirkungen (Infektionen) befasst und näher auf die im Raum gestellten generellen Probleme (okulare Toxizität) von Immunogens ADC-Technologie eingeht:
http://sugarconebiotech.blogspot.de/#!/2013/11/immunogens-ad…
Zusammenfassung:
Aufgrund der höheren Infektionsrate wurde die IMGN901 Studie abgebrochen. Möglicherweise wurde mit CD56 ein unpassendes Ziel gewählt, welches ursächlich für die aufgetretenen Infektionen war.
Weiter kann bei Immunkonjugaten unterschiedlicher Hersteller okulare Toxiziät beobachtet werden. Immunogen arbeitet an Modifikationen, welche diese reduzieren soll. Siehe referenzierte Patente, Dosis u. Verabreichungsschemas.
Für Interessierte der Link zur Homepage des Blogs: http://www.sugarconebiotech.com/
Ohad Hammer fasst den Stand aus seiner Sicht heute in seinem Blog zusammen:
Immunogen – Multiple catalysts ahead
Long time followers of this blog will remember Immunogen (IMGN) was one of my top picks for years before selling the stock at $15 3 years ago. Back then, the main issue I had with Immunogen was the lack of catalysts beyond T-DM1 (Kadcyla). The company’s lead proprietary ADC (IMGN901) was only mildly active and had safety issues, whereas the company’s partnered pipeline lacked exciting programs like Kadcyla.
Today, Immunogen is in a completely different place. Kadcyla is generating significant sales for Roche ($115M in Q1 2014) and is likely to grow based on geographic expansion and 1st line results in breast cancer (expected later this year). Immunogen’s wholly owned pipeline is early with 3 phase I programs but 1 ADC (IMGN853, anti- folate receptor) already generated signs of efficacy. Another ADC (IMGN289, anti-EGFR) will probably have meaningful results only in 2015 but its target and design make it very attractive. As for its partnered pipeline, Immunogen finally has a program with strong efficacy as monotherapy and a clear route to market (SAR650984, anti-CD38).
Kadcyla and the 3 programs mentioned above are expected to generate significant news flow in the coming 12 months. For Kadcyla, the biggest event is data from a phase III in 1st line breast cancer (2H14). The trial evaluates Kadcyla alone or with Perjeta vs. standard of care. A positive outcome should push Kadcyla to annual sales of $1.5B. Assuming an average royalty rate of 4%, Kadcyla should earn Immunogen $60M annually for 10+ years. Expansion to adjuvant/ neo-adjuvant breast cancer or gastric cancer represents additional upside.
IMGN853 will have updated phase I results at ASCO that might alleviate investors’ skepticism following safety issues and the recently announced failure of Endocyte’s (ECYT) vintafolide. On the safety front, Immunogen already implemented dosing modifications that appear to improve the safety profile (especially ocular toxicity) but this needs further validation with longer follow up.
The phase III failure of vintafolide, which targets folate receptor with a competing technology (small molecule drug conjugate), increases the risk around folate receptor as a target but IMGN853 could succeed where vintafolide failed. IMGN853 is better positioned for unlocking the therapeutic potential of Folate receptor as a target given its higher potency and favorable exposure in humans (days vs. hours). This explains why, in contrast to vintafolide, IMGN853 has activity as monotherapy already in phase I.
IMGN289 is Immunogen’s most intriguing program (at least from a scientific standpoint). Although EGFR is a validated target for naked antibodies (Erbitux, Vectibix), it is considered unsuitable for ADCs due to safety concerns (especially skin toxicity). Immunogen circumvented the toxicity issue by identifying an antibody that does not lead to significant skin toxicity in cell culture and animals. The company then armed the antibody using the same linker and payload as in Kadcyla (EGFR is HER2 are similar structurally and functionally). The new ADC (IMGN289) demonstrated potent activity in animals but without EGFR-associated toxicities. Initial results are expected in 2H14, but they will probably not be mature enough to demonstrate clinical proof of concept.
SAR650984 (anti-CD38 naked antibody) belongs to the most exciting class of myeloma drugs in development. The antibody (licensed to Sanofi [SNY]) generated a promising efficacy signal that appears comparable to that of daratumumab, Genmab’s (GEN) anti-CD38 currently in pivotal studies. Both antibodies will have updated results at ASCO.
Immunogen’s market cap (~$1B) is predominantly derived from the Kadcyla royalty stake ($600-700M assuming $1.5B peak sales). Immunogen’s pipeline (10 programs in clinical development), partnership deals [Sanofi, Novartis (NVS), Lilly (LLY) and Amgen (AMGN)] and the technology platform are assigned a reasonable valuation of ~$350M. At ASCO, clear efficacy for SAR650984 in multiple myeloma or IMGN853 in ovarian cancer should lead to further price appreciation.
http://www.orf-blog.com/6-stocks-on-my-watch-list/
Immunogen – Multiple catalysts ahead
Long time followers of this blog will remember Immunogen (IMGN) was one of my top picks for years before selling the stock at $15 3 years ago. Back then, the main issue I had with Immunogen was the lack of catalysts beyond T-DM1 (Kadcyla). The company’s lead proprietary ADC (IMGN901) was only mildly active and had safety issues, whereas the company’s partnered pipeline lacked exciting programs like Kadcyla.
Today, Immunogen is in a completely different place. Kadcyla is generating significant sales for Roche ($115M in Q1 2014) and is likely to grow based on geographic expansion and 1st line results in breast cancer (expected later this year). Immunogen’s wholly owned pipeline is early with 3 phase I programs but 1 ADC (IMGN853, anti- folate receptor) already generated signs of efficacy. Another ADC (IMGN289, anti-EGFR) will probably have meaningful results only in 2015 but its target and design make it very attractive. As for its partnered pipeline, Immunogen finally has a program with strong efficacy as monotherapy and a clear route to market (SAR650984, anti-CD38).
Kadcyla and the 3 programs mentioned above are expected to generate significant news flow in the coming 12 months. For Kadcyla, the biggest event is data from a phase III in 1st line breast cancer (2H14). The trial evaluates Kadcyla alone or with Perjeta vs. standard of care. A positive outcome should push Kadcyla to annual sales of $1.5B. Assuming an average royalty rate of 4%, Kadcyla should earn Immunogen $60M annually for 10+ years. Expansion to adjuvant/ neo-adjuvant breast cancer or gastric cancer represents additional upside.
IMGN853 will have updated phase I results at ASCO that might alleviate investors’ skepticism following safety issues and the recently announced failure of Endocyte’s (ECYT) vintafolide. On the safety front, Immunogen already implemented dosing modifications that appear to improve the safety profile (especially ocular toxicity) but this needs further validation with longer follow up.
The phase III failure of vintafolide, which targets folate receptor with a competing technology (small molecule drug conjugate), increases the risk around folate receptor as a target but IMGN853 could succeed where vintafolide failed. IMGN853 is better positioned for unlocking the therapeutic potential of Folate receptor as a target given its higher potency and favorable exposure in humans (days vs. hours). This explains why, in contrast to vintafolide, IMGN853 has activity as monotherapy already in phase I.
IMGN289 is Immunogen’s most intriguing program (at least from a scientific standpoint). Although EGFR is a validated target for naked antibodies (Erbitux, Vectibix), it is considered unsuitable for ADCs due to safety concerns (especially skin toxicity). Immunogen circumvented the toxicity issue by identifying an antibody that does not lead to significant skin toxicity in cell culture and animals. The company then armed the antibody using the same linker and payload as in Kadcyla (EGFR is HER2 are similar structurally and functionally). The new ADC (IMGN289) demonstrated potent activity in animals but without EGFR-associated toxicities. Initial results are expected in 2H14, but they will probably not be mature enough to demonstrate clinical proof of concept.
SAR650984 (anti-CD38 naked antibody) belongs to the most exciting class of myeloma drugs in development. The antibody (licensed to Sanofi [SNY]) generated a promising efficacy signal that appears comparable to that of daratumumab, Genmab’s (GEN) anti-CD38 currently in pivotal studies. Both antibodies will have updated results at ASCO.
Immunogen’s market cap (~$1B) is predominantly derived from the Kadcyla royalty stake ($600-700M assuming $1.5B peak sales). Immunogen’s pipeline (10 programs in clinical development), partnership deals [Sanofi, Novartis (NVS), Lilly (LLY) and Amgen (AMGN)] and the technology platform are assigned a reasonable valuation of ~$350M. At ASCO, clear efficacy for SAR650984 in multiple myeloma or IMGN853 in ovarian cancer should lead to further price appreciation.
http://www.orf-blog.com/6-stocks-on-my-watch-list/
Ich finde Ohad Hammers Einschätzung von nur 1.5Mrd USD p.a. zu den sales von Kadcyla etwas zu niedrig.
Herceptin verkauft sich aktuell für 6-7 Mrd USD pro Jahr. Nach Auslauf des Patentschutzes könnte das 2018 immer noch 2.8 Mrd USD weltweit bringen. So zumindest nach Morgan Stanley.
Die Frage ist: Inweiweit wird die Verfügbarkeit von sehr viel billigerem generischem Herceptin die Verkäufe von Kadcyla behindern?
Herceptin verkauft sich aktuell für 6-7 Mrd USD pro Jahr. Nach Auslauf des Patentschutzes könnte das 2018 immer noch 2.8 Mrd USD weltweit bringen. So zumindest nach Morgan Stanley.
Die Frage ist: Inweiweit wird die Verfügbarkeit von sehr viel billigerem generischem Herceptin die Verkäufe von Kadcyla behindern?
Antwort auf Beitrag Nr.: 46.920.652 von Ville7 am 05.05.14 06:37:20Die 1,5 Mrd. USD beziehen sich ausschließlich auf die Indikation mBC (mtastasierender Brustkrebs). Damit liegt OH meines Erachtens nicht so schlecht. Ich komme hier auf 2,2 Mrd. USD.
Zusammen mit den anderen Indikationen lande ich bei ca. 9 Mrd. USD.
Zusammen mit den anderen Indikationen lande ich bei ca. 9 Mrd. USD.
Zitat von Joschka Schröder: Die 1,5 Mrd. USD beziehen sich ausschließlich auf die Indikation mBC (mtastasierender Brustkrebs). Damit liegt OH meines Erachtens nicht so schlecht. Ich komme hier auf 2,2 Mrd. USD.
Zusammen mit den anderen Indikationen lande ich bei ca. 9 Mrd. USD.
Hi Joschka, eben gerade nicht. Und das ist was mich in seiner Einschätzung irritiert:
"...Kadcyla and the 3 programs mentioned above are expected to generate significant news flow in the coming 12 months. For Kadcyla, the biggest event is data from a phase III in 1st line breast cancer (2H14). The trial evaluates Kadcyla alone or with Perjeta vs. standard of care. A positive outcome should push Kadcyla to annual sales of $1.5B. Assuming an average royalty rate of 4%, Kadcyla should earn Immunogen $60M annually for 10+ years. Expansion to adjuvant/ neo-adjuvant breast cancer or gastric cancer represents additional upside.
...
Immunogen’s market cap (~$1B) is predominantly derived from the Kadcyla royalty stake ($600-700M assuming $1.5B peak sales). ..."
Die USD 1.5B sind gerechnet mindestens inklusive von positivem Ergebnissen des MARIANNE trials. Also plus 1st line bc!
Antwort auf Beitrag Nr.: 46.921.540 von Ville7 am 05.05.14 10:17:22Hallo Ville, ich glaube, da liegt ein Mißverständnis vor.
CEO Junius im letzten CC:
In terms of Roche's sponsored study, they will lead to registration filings the next Phase III finding that we would expect would be from MARIANNE in the second half of this year. I am sure you all aware this is for first line HER2-positive metastatic breast cancer patients, data later this year would lead to filing in 2015 according to Roche.
Hammer schreibt zwar von "1st line breast cancer", meint aber mit Sicherheit "1st line metastatic breast cancer".
CEO Junius im letzten CC:
In terms of Roche's sponsored study, they will lead to registration filings the next Phase III finding that we would expect would be from MARIANNE in the second half of this year. I am sure you all aware this is for first line HER2-positive metastatic breast cancer patients, data later this year would lead to filing in 2015 according to Roche.
Hammer schreibt zwar von "1st line breast cancer", meint aber mit Sicherheit "1st line metastatic breast cancer".
Zitat von kmastra: The phase III failure of vintafolide, which targets folate receptor with a competing technology (small molecule drug conjugate), increases the risk around folate receptor as a target but IMGN853 could succeed where vintafolide failed. IMGN853 is better positioned for unlocking the therapeutic potential of Folate receptor as a target given its higher potency and favorable exposure in humans (days vs. hours). This explains why, in contrast to vintafolide, IMGN853 has activity as monotherapy already in phase I.
Das Target sehe ich durch die vintafolide-Entwicklungen in keiner Weise beschädigt. Vielmehr ist dies ein schwerer Rückschlag für die von Endocyte verwendete Technik.
Antwort auf Beitrag Nr.: 46.922.118 von Joschka Schröder am 05.05.14 11:37:37Danke für die Aufklärung. Mit war erst nicht bewusst, dass MARIANNE 1st line metastatic ist.
Du siehst USD 9Mrd Peak und 2,2 mit den Indikationen der bisherigen Zulassung in 2nd line und 1st line metastatic bc.
In welchen Indikationen siehst du die anderen 6,8 Mrd? Bzw. welche Indikationen müssen errungen werden für die fettesten der low hanging fruits?
Du siehst USD 9Mrd Peak und 2,2 mit den Indikationen der bisherigen Zulassung in 2nd line und 1st line metastatic bc.
In welchen Indikationen siehst du die anderen 6,8 Mrd? Bzw. welche Indikationen müssen errungen werden für die fettesten der low hanging fruits?
Antwort auf Beitrag Nr.: 46.925.262 von Ville7 am 05.05.14 20:30:58wenn alles wie erhofft läuft, geschätzt
ca. 6,6 Mrd. USD in der Indikation "early breast CA"
dazu noch bis zu max. 500 Mio. USD in der Indikation "1st line metastatic gastric CA"
ca. 6,6 Mrd. USD in der Indikation "early breast CA"
dazu noch bis zu max. 500 Mio. USD in der Indikation "1st line metastatic gastric CA"
Antwort auf Beitrag Nr.: 46.926.064 von Joschka Schröder am 05.05.14 23:39:49Wann schätzt du eine mögliche Zulassung und in welchen Kombinationen?
Aktuell finde ich in clinical trials nur zwei relevante Studien, beide erst in Phase II:
* A Study of Trastuzumab Emtansine (T-DM1) Sequentially With Anthracycline-Based Chemotherapy, As Adjuvant or Neoadjuvant Therapy for Patients With Early Stage HER2-Positive Breast Cancer
* T-DM1 vs Paclitaxel/Trastuzumab for Breast (ATEMPT Trial)
Sollte man letztere auf Phase III ausweiten, so erwarte ich eine Zulassungsmöglichkeit nur auf Basis der geringeren Nebenwirkungen, nicht auf Basis von Wirksamkeit.
Macht es für Roche nicht eigentlich Sinn, die Kombi Perjeta + Kadcyla auch in "early bc" zu testen? Ich finde hierzu keine Studie.
Was ist dir an Bestrebungen im Bereich "early bc" bekannt?
Aktuell finde ich in clinical trials nur zwei relevante Studien, beide erst in Phase II:
* A Study of Trastuzumab Emtansine (T-DM1) Sequentially With Anthracycline-Based Chemotherapy, As Adjuvant or Neoadjuvant Therapy for Patients With Early Stage HER2-Positive Breast Cancer
* T-DM1 vs Paclitaxel/Trastuzumab for Breast (ATEMPT Trial)
Sollte man letztere auf Phase III ausweiten, so erwarte ich eine Zulassungsmöglichkeit nur auf Basis der geringeren Nebenwirkungen, nicht auf Basis von Wirksamkeit.
Macht es für Roche nicht eigentlich Sinn, die Kombi Perjeta + Kadcyla auch in "early bc" zu testen? Ich finde hierzu keine Studie.
Was ist dir an Bestrebungen im Bereich "early bc" bekannt?
Antwort auf Beitrag Nr.: 46.927.468 von Ville7 am 06.05.14 10:16:37Ich habe leider aktuell nicht die Zeit, um selber in den clinicaltrails nachzusehen.
Auf S.62 in Roche´s Q2-Präsentation 2013 ist aber von einer laufenden P3-Studie mit Kadcyla in der Indikation "early breast cancer" die Rede.
Ich denke, dass es auch hier auf Wirksamkeit und Verträglichkeit ankommen wird. Insgesamt erwarte ich klare Vorteile für Kadcyla gegenüber der derzeitigen Standardtherapie.
Auf S.62 in Roche´s Q2-Präsentation 2013 ist aber von einer laufenden P3-Studie mit Kadcyla in der Indikation "early breast cancer" die Rede.
Ich denke, dass es auch hier auf Wirksamkeit und Verträglichkeit ankommen wird. Insgesamt erwarte ich klare Vorteile für Kadcyla gegenüber der derzeitigen Standardtherapie.
Antwort auf Beitrag Nr.: 46.927.468 von Ville7 am 06.05.14 10:16:37Hallo Ville,
IMGN schreibt im letzten Q-Bericht:
Early stage HER2-positive breast cancer - Roche has three Phase III trials with Kadcyla: KAITLIN, for adjuvant use, which is underway; KATHERINE, for residual invasive disease, which is underway; and KRISTINE, for neo-adjuvant use, which is expected to start this quarter.
IMGN schreibt im letzten Q-Bericht:
Early stage HER2-positive breast cancer - Roche has three Phase III trials with Kadcyla: KAITLIN, for adjuvant use, which is underway; KATHERINE, for residual invasive disease, which is underway; and KRISTINE, for neo-adjuvant use, which is expected to start this quarter.
Zitat von SLGramann: Hallo Ville,
IMGN schreibt im letzten Q-Bericht:
Early stage HER2-positive breast cancer - Roche has three Phase III trials with Kadcyla: KAITLIN, for adjuvant use, which is underway; KATHERINE, for residual invasive disease, which is underway; and KRISTINE, for neo-adjuvant use, which is expected to start this quarter.
Danke, habs gefunden. So wie es aussieht ist es noch ewig hin, bis diese Trials fertig sind. Die Auswahl des Endpunktes ist aus finanzieller Sicht enttäuschend. 2023 bzw. 2024 als completion dates. Zulassung dann in 2025 oder so. Weiß jemand wie lange IMGN Royalties bezahlt bekommt?
KATHERINE:
A Study of Trastuzumab Emtansine Versus Trastuzumab as Adjuvant Therapy in Patients With HER2-Positive Breast Cancer Who Have Residual Tumor in the Breast or Axillary Lymph Nodes Following Preoperative Therapy (KATHERINE)
Roche Id: BO27938
Endpunkt: Invasive disease-free survival (IDFS) 10 Jahre!!!
Completion: 2023 !!!!
KAITLIN
A Study of Kadcyla (Trastuzumab Emtansine) Plus Perjeta (Pertuzumab) Following Anthracyclines in Comparison With Herceptin (Trastuzumab) Plus Perjeta and a Taxane Following Anthracyclines as Adjuvant Therapy in Patients With Operable HER2-positive Primary Breast Cancer
Roche Id: BO28407
Endpunkt: Invasive disease-free survival (IDFS) 10 Jahre!!!
Completion: 2024 !!!
KRISTINE: noch keine Infos.
Ist das KRISTINE?
A Study Comparing Kadcyla Plus Perjeta Treatment to Chemotherapy Combined With Herceptin Plus Perjeta in Patients With HER2-Positive Breast Cancer
NCT02131064
gemeldet 2.5.2014
Endpunkt: Local evaluation of pathological complete response / 21 Monate
Completion: 2018
A Study Comparing Kadcyla Plus Perjeta Treatment to Chemotherapy Combined With Herceptin Plus Perjeta in Patients With HER2-Positive Breast Cancer
NCT02131064
gemeldet 2.5.2014
Endpunkt: Local evaluation of pathological complete response / 21 Monate
Completion: 2018
@Ville
Ich bin gerade dabei, die jüngsten Roche-Präsentationen und die gegenwärtigen Studien durchzusehen.
1) Tantiemenlaufzeit 12 Jahre, USA und Europa also bis 2025/26, Japan bis 2026
2) In der letzten Präsentation wird als Datum für die geplante Zulassung in der Indikation eBC "2017 and beyond" genannt.
3) Eine P3-Studie in der Indikation eBC soll im Februar 2018 abgeschlossen sein -> http://clinicaltrials.gov/ct2/show?term=T-DM1&rank=25.
4) Eine weitere P3-Studie im September 2018 -> http://clinicaltrials.gov/ct2/show?term=T-DM1&rank=29
Insgesamt kann man wohl also davon ausgehen, dass im positiven Fall eine Zulassung in der Indikation eBC Anfang 2019 erfolgen wird.
Ich bin gerade dabei, die jüngsten Roche-Präsentationen und die gegenwärtigen Studien durchzusehen.
1) Tantiemenlaufzeit 12 Jahre, USA und Europa also bis 2025/26, Japan bis 2026
2) In der letzten Präsentation wird als Datum für die geplante Zulassung in der Indikation eBC "2017 and beyond" genannt.
3) Eine P3-Studie in der Indikation eBC soll im Februar 2018 abgeschlossen sein -> http://clinicaltrials.gov/ct2/show?term=T-DM1&rank=25.
4) Eine weitere P3-Studie im September 2018 -> http://clinicaltrials.gov/ct2/show?term=T-DM1&rank=29
Insgesamt kann man wohl also davon ausgehen, dass im positiven Fall eine Zulassung in der Indikation eBC Anfang 2019 erfolgen wird.
Zu Kristine findet man in den Präsentationen keine Details. Die von Dir genannte Studie (identisch mit der Studie unter Punkt 4 in Beitrag 452) könnte es tatsächlich sein. Ich werde in den nächsten Tagen in Basel nachfragen.
Denkbar ist zudem eine fast-track-Zulassung nach erfolgreicher Phase II. Da gibt es z.B. eine derartige Studie, die vom Dana-Farber-Institut durchgeführt wird und bis 2015 läuft -> http://clinicaltrials.gov/ct2/show/NCT01853748?term=%22T-DM1…
@Ville und SLGraman
Danke für die anregende Diskussion. Es ist immer gut, zum nachdenken gezwungen zu werden.
@Ville und SLGraman
Danke für die anregende Diskussion. Es ist immer gut, zum nachdenken gezwungen zu werden.
Antwort auf Beitrag Nr.: 46.932.688 von Joschka Schröder am 06.05.14 23:37:49Hallo Joschka,
die Nummer 3) ist KAITLIN, eine der Studien mit dem Endpunkt IDFS bis zu 10 Jahre (IDFS up to 10 years). Interessant wäre von Roche zu erfahren, wann die erste Entblindung tatsächlich erfolgt...nach 5 Jahren? Falls deine Quelle das hergibt wäre das interessant zu wissen.
Mit 2019 in der Zulassung könnte ich noch leben, aber kurz vor Ablauf der Tantiemelaufzeit erst eine Zulassung in early bc wäre ziemlich enttäuschend.
die Nummer 3) ist KAITLIN, eine der Studien mit dem Endpunkt IDFS bis zu 10 Jahre (IDFS up to 10 years). Interessant wäre von Roche zu erfahren, wann die erste Entblindung tatsächlich erfolgt...nach 5 Jahren? Falls deine Quelle das hergibt wäre das interessant zu wissen.
Mit 2019 in der Zulassung könnte ich noch leben, aber kurz vor Ablauf der Tantiemelaufzeit erst eine Zulassung in early bc wäre ziemlich enttäuschend.
Antwort auf Beitrag Nr.: 46.933.024 von Ville7 am 07.05.14 07:07:20Hallo Ville,
ich habe direkt an der Quelle nachgefragt.
Zulassung eBC (neoadjuvant) im positiven Fall bereits 2015 in den USA geplant, 2017/18 in Europa.
Ggf. auch fast-track-Zulassungen in bBC möglich, wobei Studien Dritter wie ATEMPT und ADAPT ohne Weiteres mit einbezogen werden könnten.
Von den späten Completion-Terminen einiger Studien darf man sich nicht irritieren lassen. Das sind theoretische Termine, zu denen der letzte Patient aus der Studie (Nachbeobachtung) ausgeschieden sein sollte.
Ich hoffe, das hilft weiter.
Aus meiner Sicht sehen wir derzeit klare Kaufkurse. EV aktuell 588 Mio. €, mithin die Hälfte des - auch nicht unrealistischen - MOR-Unternehmenswertes. Ich baue meine Position weiter aus.
ich habe direkt an der Quelle nachgefragt.
Zulassung eBC (neoadjuvant) im positiven Fall bereits 2015 in den USA geplant, 2017/18 in Europa.
Ggf. auch fast-track-Zulassungen in bBC möglich, wobei Studien Dritter wie ATEMPT und ADAPT ohne Weiteres mit einbezogen werden könnten.
Von den späten Completion-Terminen einiger Studien darf man sich nicht irritieren lassen. Das sind theoretische Termine, zu denen der letzte Patient aus der Studie (Nachbeobachtung) ausgeschieden sein sollte.
Ich hoffe, das hilft weiter.
Aus meiner Sicht sehen wir derzeit klare Kaufkurse. EV aktuell 588 Mio. €, mithin die Hälfte des - auch nicht unrealistischen - MOR-Unternehmenswertes. Ich baue meine Position weiter aus.
Antwort auf Beitrag Nr.: 46.938.392 von Joschka Schröder am 07.05.14 17:20:57Hallo Joschka,
danke für deine Nachforschungen bei Roche und deine Einschätzung.
2015 halte ich für Zulassung in eBC für unmöglich. Der ATEMPT trial käme hier noch am Nähesten hin. Allerdings frage ich mich wie das gehen soll, dass diese Studie, die im Mai 2013 gestartet wurde und aktuell noch rekrutiert im Juni 2015 abgeschlossen werden soll, wenn der Endpunkt "Disease Free Survival in Patients Treated with T-DM1 [ Time Frame: 2 years ]" ist.
danke für deine Nachforschungen bei Roche und deine Einschätzung.
2015 halte ich für Zulassung in eBC für unmöglich. Der ATEMPT trial käme hier noch am Nähesten hin. Allerdings frage ich mich wie das gehen soll, dass diese Studie, die im Mai 2013 gestartet wurde und aktuell noch rekrutiert im Juni 2015 abgeschlossen werden soll, wenn der Endpunkt "Disease Free Survival in Patients Treated with T-DM1 [ Time Frame: 2 years ]" ist.
Ohad Hammer hat geantwortet auf meine Frage:
------------------
Ville on May 5, 2014 at 12:33 am said:
Hi Ohad, isn’t a forecast of $1.5B peak sales in Kadcyla a little bit low? Okay there will be competition by the then much cheaper generic Herceptin, but it is and will be a much more effective drug. And Herceptin, with a lower price tag than Kadcyla, is selling at $6-7B right now (with no generic competition).
---------------------
Ohad Hammer on May 5, 2014 at 9:35 am said:
JQ – Send me an email.
Ville – Agree Kadcyla can be as big as Herceptin down the road but a lot depends on the adjuvant setting which takes time for approval and where the burden of proof is on Kadcyla. Kadcyla can also be effective in additional tumors that overexpress HER2.
Ohad
------------------
Ville on May 5, 2014 at 12:33 am said:
Hi Ohad, isn’t a forecast of $1.5B peak sales in Kadcyla a little bit low? Okay there will be competition by the then much cheaper generic Herceptin, but it is and will be a much more effective drug. And Herceptin, with a lower price tag than Kadcyla, is selling at $6-7B right now (with no generic competition).
---------------------
Ohad Hammer on May 5, 2014 at 9:35 am said:
JQ – Send me an email.
Ville – Agree Kadcyla can be as big as Herceptin down the road but a lot depends on the adjuvant setting which takes time for approval and where the burden of proof is on Kadcyla. Kadcyla can also be effective in additional tumors that overexpress HER2.
Ohad
Zitat von Ville7: Ergänzung:
In deutschen Apotheken kostet 160mg Kadcyla 4049,81 €, d.h. knapp USD 5.600.
In Europa scheinen sich somit noch bessere Preise als in USA erzielen zu lassen.
Entscheidend für Roche/IMGN sind die Kosten (Einnahmen) ab Werk. Hier liegt das US-Peisniveau am höchsten, Japan mit über 20 % Abschlag, in Europa ist der Preisnachlass noch etwas größer.
Zitat von Ville7: 2015 halte ich für Zulassung in eBC für unmöglich.
Die interne Planung hat mich auch sehr überrascht, zumal in der letzten Präsentation von 2017 ff. die Rede war und nicht ganz klar ist, auf welcher Basis der Antrag gestellt werden könnte. Wenn sich eine günstige Gelegenheit ergibt, werde ich gelegentlich noch einmal nachhaken.
Für mich wäre ein eBC-Zulassung im Zeitraum 2018/19 völlig o.k.. IMGN hätte dann die Möglichkeit, noch ca. acht Jahre lang kräftig Tantiemen abzuschöpfen.
Neue Kooperation zwischen IMGN und Oxford BioTherapeutics. Es geht um ein voll humanes ADC in der Indikation dreifach neg. Brustkrebs -> http://www.obn.org.uk/obn_/news_item.php?r=QMKUE5928621
Antwort auf Beitrag Nr.: 46.943.056 von Joschka Schröder am 08.05.14 11:19:57Übernimmt Oxford hier nicht einen AK von Amgen, der mit einem ADC von IMGN ergänzt wurde? Das bedeutet für mich, dass Amgen den einfach weiterlizensiert hat und es keine direkte und neue Geschäftsbeziehung zwischen Oxford und IMGN gibt. Oder verstehe ich das falsch?
Antwort auf Beitrag Nr.: 46.944.936 von Ville7 am 08.05.14 15:08:36Ob Oxford die TAP-Lizenz direkt von IMGN gezogen hat oder es sich um eine der vier exclusiven single-target-Lizenzen handelt, die sich Amgen von IMGN gesichert hat (davon sind mir nur zwei Targets definitiv bekannt), geht aus der Meldung leider nicht hervor. Könnte man gelegentlich bei IMGN oder Amgen nachfragen.
Antwort auf Beitrag Nr.: 46.945.832 von Joschka Schröder am 08.05.14 16:36:12Ich hoffe die high-beta Biotechs haben jetzt ihren Tiefpunkt gefunden. Der Biotech Index ist zwar immer noch sehr hoch, aber ich sehe bei vielen hochspekulativen und sehr ungeliebten Biotechs nicht mehr sehr viel mehr Spielraum nach unten. Vielleicht noch max. -25% - bei einer Chance auf Erholung über +25% bis +50% von aktuellem Niveau. ASCO abstracts kommen nächste Woche, das sollte auch erst mal stabilisieren. Ob nach ASCO ein weiterer Abverkauf erfolgt werden wir sehen. Ich habe auf jeden Fall gestern eine weitere Position IMGN aufgenommen und sollte es noch deutlich billiger werden bin ich nochmal dabei.
MARIANNE wird uns 2014 noch beglücken, das sollte uns wieder in gerechtfertigte Höhen bringen.
Wann rechnest du mit ersten IMGN-289 Daten, Joschka? Da müsste doch 2015 schon ein Zwischenstand der Phase I auch bezüglich Wirksamkeit kommuniziert werden können. Primary completion date ist 2017, aber IMGN kann und wird hoffentlich schon vorher weitere Phase (I/)II Studien starten.
Wann rechnest du mit ersten IMGN-289 Daten, Joschka? Da müsste doch 2015 schon ein Zwischenstand der Phase I auch bezüglich Wirksamkeit kommuniziert werden können. Primary completion date ist 2017, aber IMGN kann und wird hoffentlich schon vorher weitere Phase (I/)II Studien starten.
Antwort auf Beitrag Nr.: 46.946.176 von Ville7 am 08.05.14 17:16:10Werte wie IMGN und SGEN mit jeweils über 40 % Kursrückgang erscheinen geradezu ausgebomt. Die ADC-Werte sind zudem ungerechtfertigter Weise wegen des Endocyte-Desasters unter die Räder gekommen, obwohl die von Endocyte verwendete Technik (Toxin via Linker an small molecule) wenig mit konventionellen ADC´s zu tun hat. Ich hoffe, dass sich die antizyklischen Käufe auszahlen werden.
Antwort auf Beitrag Nr.: 46.946.268 von Ville7 am 08.05.14 17:26:53IMGN289: Im letzten CC wurde die Veröffentlichung erster Daten für das 2. Halbjahr 2014 angekündigt. Aus der unternehmenseigenen Pipeline ist IMGN289 mein klarer Favorit.
Antwort auf Beitrag Nr.: 46.946.336 von Joschka Schröder am 08.05.14 17:35:54Was sind deine Peakumsatzerwartungen, falls mal zugelassen? Ein Blockbuster wird das dann m.E. eher nicht werden - gemessen an den nicht konjugierten Antikörpern selben Targets, die derzeit zugelassen sind.
Antwort auf Beitrag Nr.: 46.965.706 von Ville7 am 12.05.14 17:17:41Erbitux hat 2012 außerhalb der USA Umsätze in Höhe von 1,2 Mrd. USD generiert. Dazu kommen noch entsprechende US-Umsätze sowie Umsätze von Konkurrenzpräparaten.
Nach all den bislang vorliegenden präklinischen Daten rechne ich damit, dass IMGN289 deutlich wirksamer sein wird als sämtliche Konkurrenzpräparate, bei gleichzeitig signifikant geringeren Nebenwirkungen.
IMGN289-Umsätze im mittleren einstelligen Milliardenbereich entsprächen meinen Erwartungen.
Nach all den bislang vorliegenden präklinischen Daten rechne ich damit, dass IMGN289 deutlich wirksamer sein wird als sämtliche Konkurrenzpräparate, bei gleichzeitig signifikant geringeren Nebenwirkungen.
IMGN289-Umsätze im mittleren einstelligen Milliardenbereich entsprächen meinen Erwartungen.
Zitat von Joschka Schröder: Nach all den bislang vorliegenden präklinischen Daten rechne ich damit, dass IMGN289 deutlich wirksamer sein wird als sämtliche Konkurrenzpräparate, bei gleichzeitig signifikant geringeren Nebenwirkungen.
Der Sammelbegriff "Konkurrenzpräparate" umfaßt in diesem Fall auch Erbitux.
Phase IIa Trial of Trastuzumab Emtansine With Pertuzumab for Patients With Human Epidermal Growth Factor Receptor 2-Positive, Locally Advanced, or Metastatic Breast Cancer. [10. Mai 2014]
http://www.ncbi.nlm.nih.gov/pubmed/24733796
http://www.ncbi.nlm.nih.gov/pubmed/24733796
Antwort auf Beitrag Nr.: 46.966.654 von Joschka Schröder am 12.05.14 20:03:07Danke, ich hatte wohl die Sales-Zahlen dieser Produkte zu schlampig ergoogelt.
Erhöhte Wirksamkeit sollte ja bei einem ADC erwartet werden. Was ist aber der Hintergrund deiner Erwartungshaltung, dass IMGN-289 signifikant weniger Nebenwirkungen produzieren sollte?
Erhöhte Wirksamkeit sollte ja bei einem ADC erwartet werden. Was ist aber der Hintergrund deiner Erwartungshaltung, dass IMGN-289 signifikant weniger Nebenwirkungen produzieren sollte?
Antwort auf Beitrag Nr.: 46.968.072 von Nase_weis_nix am 13.05.14 02:23:17Wie sind diese Daten zu bewerten?
* ORR 33% in advanced metastatic breast cancer
* ORR 57% in first line metastatic breast cancer
---------
J Clin Oncol. 2014 May 10;32(14):1437-44. doi: 10.1200/JCO.2013.52.6590. Epub 2014 Apr 14.
Phase IIa Trial of Trastuzumab Emtansine With Pertuzumab for Patients With Human Epidermal Growth Factor Receptor 2-Positive, Locally Advanced, or Metastatic Breast Cancer.
Miller KD1, Diéras V, Harbeck N, Andre F, Mahtani RL, Gianni L, Albain KS, Crivellari D, Fang L, Michelson G, de Haas SL, Burris HA.
Author information
Abstract
PURPOSE:
Our phase IIa study characterized the safety and efficacy of two human epidermal growth factor receptor 2 (HER2) -targeted agents, trastuzumab emtansine (T-DM1) and pertuzumab, in patients with HER2-positive metastatic breast cancer (MBC).
PATIENTS AND METHODS:
Patients with HER2-positive locally advanced breast cancer or MBC were treated with 3.6 mg/kg T-DM1 plus pertuzumab (840-mg loading dose, then 420 mg subsequently) once every 3 weeks. The primary efficacy end point was investigator-assessed objective response rate (ORR).
RESULTS:
Sixty-four patients (43 patients in the second-line or greater setting [advanced MBC]; 21 patients in the first-line setting [first-line MBC]) were enrolled. Patients with advanced MBC had received trastuzumab and a median of six prior nonhormonal treatments for MBC; 86% of first-line MBC patients had received trastuzumab in the (neo)adjuvant setting. The ORR was 41% overall, 33% in patients with advanced MBC, and 57% in first-line patients. Median progression-free survival was 6.6, 5.5, and 7.7 months, respectively. The most common adverse events were fatigue (61%), nausea (50%), and diarrhea (39%). The most frequent grade ≥ 3 adverse events were thrombocytopenia (13%), fatigue (11%), and liver enzyme elevations (increased ALT: 9%; increased AST: 9%). One patient had left ventricular ejection fraction of less than 40% after study drug discontinuation. Exploratory biomarker analyses demonstrated that patients with above-median tumor HER2 mRNA levels had a numerically higher ORR than patients with below-median levels (44% v 33%, respectively).
CONCLUSION:
T-DM1 and pertuzumab can be combined at full doses with no unexpected toxicities. The preliminary efficacy in patients in the first-line and advanced MBC settings warrants further investigation.
* ORR 33% in advanced metastatic breast cancer
* ORR 57% in first line metastatic breast cancer
---------
J Clin Oncol. 2014 May 10;32(14):1437-44. doi: 10.1200/JCO.2013.52.6590. Epub 2014 Apr 14.
Phase IIa Trial of Trastuzumab Emtansine With Pertuzumab for Patients With Human Epidermal Growth Factor Receptor 2-Positive, Locally Advanced, or Metastatic Breast Cancer.
Miller KD1, Diéras V, Harbeck N, Andre F, Mahtani RL, Gianni L, Albain KS, Crivellari D, Fang L, Michelson G, de Haas SL, Burris HA.
Author information
Abstract
PURPOSE:
Our phase IIa study characterized the safety and efficacy of two human epidermal growth factor receptor 2 (HER2) -targeted agents, trastuzumab emtansine (T-DM1) and pertuzumab, in patients with HER2-positive metastatic breast cancer (MBC).
PATIENTS AND METHODS:
Patients with HER2-positive locally advanced breast cancer or MBC were treated with 3.6 mg/kg T-DM1 plus pertuzumab (840-mg loading dose, then 420 mg subsequently) once every 3 weeks. The primary efficacy end point was investigator-assessed objective response rate (ORR).
RESULTS:
Sixty-four patients (43 patients in the second-line or greater setting [advanced MBC]; 21 patients in the first-line setting [first-line MBC]) were enrolled. Patients with advanced MBC had received trastuzumab and a median of six prior nonhormonal treatments for MBC; 86% of first-line MBC patients had received trastuzumab in the (neo)adjuvant setting. The ORR was 41% overall, 33% in patients with advanced MBC, and 57% in first-line patients. Median progression-free survival was 6.6, 5.5, and 7.7 months, respectively. The most common adverse events were fatigue (61%), nausea (50%), and diarrhea (39%). The most frequent grade ≥ 3 adverse events were thrombocytopenia (13%), fatigue (11%), and liver enzyme elevations (increased ALT: 9%; increased AST: 9%). One patient had left ventricular ejection fraction of less than 40% after study drug discontinuation. Exploratory biomarker analyses demonstrated that patients with above-median tumor HER2 mRNA levels had a numerically higher ORR than patients with below-median levels (44% v 33%, respectively).
CONCLUSION:
T-DM1 and pertuzumab can be combined at full doses with no unexpected toxicities. The preliminary efficacy in patients in the first-line and advanced MBC settings warrants further investigation.
Antwort auf Beitrag Nr.: 46.968.114 von Ville7 am 13.05.14 03:57:50Habe mir die Arbeit noch nicht im Original ansehen können. Meine ersten Eindrücke nach einem Vergleich mit Kadcya-Monotherapie-Ergebnissen:
1) Kadcyla wirkt bei advanced MBC genauso gut wie die Kombi aus Kadcyla + Perjeta. Perjeta scheint keinen Zusatznutzen zu bringen.
2) Unter Aspekten potentieller Nebenwirkungen scheint eine Kombi hingegen machbar, auch wenn die - nicht unerwartete - Herzproblematik in einem Fall äußerst unschön ist.
Sollten sich die Ergebnisse in weiteren Studien bestätigen, so dürfte sich die Kadcyla-Behandlung bei fortgeschrittenem MBC als Monotherapie etablieren. Für die Preisgestaltung wäre dies positiv.
1) Kadcyla wirkt bei advanced MBC genauso gut wie die Kombi aus Kadcyla + Perjeta. Perjeta scheint keinen Zusatznutzen zu bringen.
2) Unter Aspekten potentieller Nebenwirkungen scheint eine Kombi hingegen machbar, auch wenn die - nicht unerwartete - Herzproblematik in einem Fall äußerst unschön ist.
Sollten sich die Ergebnisse in weiteren Studien bestätigen, so dürfte sich die Kadcyla-Behandlung bei fortgeschrittenem MBC als Monotherapie etablieren. Für die Preisgestaltung wäre dies positiv.
Die Hauttoxizität ist insbesondere aufgrund der besonderen Antikörperselektion viel geringer. Die zugrunde liegenden Mechanismen wurden im vergangenen Jahr während eines CC ausführlich erläutert. Scheint sich alles auch in der derzeit laufenden klinischen Stude zu bestätigen.
Zu skin Toxicity IMGN 289
IMGN soll nur ein partieller Antagonist sein, also keine komplette Blockade des EGFR-Rezeptors bewirken.
http://seekingalpha.com/article/2166573-immunogens-ceo-discu…
.....
Charly Morris:
"..as I described before we believe that this relates to a partial -- to only partial on antagonist activity which appears to allow enough signaling for skin cells to be able to resist to be a fact that antibody but enough antagonist activity for that to contribute to efficacy as well as to deliver of the payload."
IMGN soll nur ein partieller Antagonist sein, also keine komplette Blockade des EGFR-Rezeptors bewirken.
http://seekingalpha.com/article/2166573-immunogens-ceo-discu…
.....
Charly Morris:
"..as I described before we believe that this relates to a partial -- to only partial on antagonist activity which appears to allow enough signaling for skin cells to be able to resist to be a fact that antibody but enough antagonist activity for that to contribute to efficacy as well as to deliver of the payload."
Sehr erfreuliche Sanofi-Präsentation zu SAR3419 (anti CD-19-ADC aus Kooperation mit Immunogen) beim ASCO-Meeting:
Starlyte phase II study of coltuximab ravtansine (CoR, SAR3419) single agent: Clinical activity and safety in patients (pts) with relapsed/refractory (R/R) diffuse large B-cell lymphoma (DLBCL; NCT01472887).
Author(s): Marek Trneny, Gregor Verhoef, Martin JS Dyer, Dina Ben Yehuda, Caterina Patti, Miguel Canales, Andrés López, Farrukh Awan, Paul Montgomery, Andrea Janikova, Anna Maria Barbui, Kazimierz Sulek, Maria José Terol, John A. Radford, Laure Siraudin, Laurence Hatteville, Sandrine Schwab, Corina Oprea, Alessandro M. Gianni; Charles University Hospital, Department of Hematology, Prague, Czech Republic; UZ Leuven, Leuven, Belgium; Leicester University, Leicester, United Kingdom; Hadassah Medical Center, Jerusalem, Israel; Azienda Ospedali Riuniti Villa Sofia, Palermo, Italy; Hospital Universitario La Paz, Madrid, Spain; Hospital Universitari Vall d'Hebron, Barcelona, Spain; The Ohio State University, Columbus, OH; St. Lukes/Mountain States Tumor Institute, Boise, ID; University Hospital Brno, Brno, Czech Republic; Azienda Ospedaliera Papa Giovanni XXIII, Bergamo, Italy; Military Medical Institute, Warszawa, Poland; Hospital Clínico Universitario de Valencia, Valencia, Spain; University of Manchester/Christie Hospital NHS Foundation Trust, Manchester, United Kingdom; Lincoln, Boulogne-Billancourt, France; Sanofi R&D, Vitry-sur-Seine, France; Sanofi R&D, Chilly-Mazarin, France; Fondazione IRCCS Istituto Nazionale Tumori and Università degli Studi di Milano, Milan, Italy
Abstract Disclosures
Abstract:
Background: CoR is an anti-CD19 antibody maytansinoid conjugate. CD19 is expressed in the majority of B cell lymphomas. Phase I program showed clinical activity in pts with both indolent and aggressive lymphomas. Methods: Pts withCD19+ R/R DLBCL after at least one standard treatment including rituximab and not candidate for transplantation were eligible. Primary refractory pts were excluded. Biopsy was required at baseline. CoR 55 mg/m² was administered weekly for 4 weeks then bi-weekly until disease progression or other study discontinuation criteria. The primary objective was to demonstrate an overall response rate (ORR) of at least 20% following Cheson 2007 criteria. Tumor assessments were done every 12 weeks. Secondary objectives were: safety, pharmacokinetics (PK), duration of response (DOR), progression free and overall survival (PFS, OS). Assessment of correlation between biomarkers (BM) status and disease outcome was an exploratory objective. Results: 41 pts were evaluable. Median age was 71 (39:85), 53.7% were male; 92.7% had ECOG performance status 0-1. 31.7% had received ≥ 3 prior regimens for DLBCL. The ORR was 43.9% (90% CI: 30.6% to 57.9%, p-value<0.0001) including 5 complete responses (12.2%). DOR, OS and PFS data are not mature (11 pts ongoing). The most common (>10%) all grades (gr) non-hematologic treatment-emergent adverse events (TEAEs) were nausea (23.0%), diarrhea (19.7%), fatigue and cough (18.0%), vomiting and decrease appetite (13.1%), asthenia, abdominal and back pain (11.5%). TEAEs led to treatment discontinuation in 4 pts. Only gr 1-2 eye disorders were reported, including 1 pt with unrelated gr 2 keratitis. Peripheral neuropathies were observed in 5 pts, all were gr 1-2. Hematological toxicity was moderate, with gr 3-4 neutropenia, thrombocytopenia and anemia in 26.4%, 9.9% and 6.6% pts respectively. PK assessment and investigations on BM expression are ongoing. Conclusions: CoR as single agent demonstrated significant activity in R/R DLBCL pts and reached its primary endpoint for ORR, with acceptable safety profile. Trial funded by Sanofi. Clinical trial information: NCT01472887.
Starlyte phase II study of coltuximab ravtansine (CoR, SAR3419) single agent: Clinical activity and safety in patients (pts) with relapsed/refractory (R/R) diffuse large B-cell lymphoma (DLBCL; NCT01472887).
Author(s): Marek Trneny, Gregor Verhoef, Martin JS Dyer, Dina Ben Yehuda, Caterina Patti, Miguel Canales, Andrés López, Farrukh Awan, Paul Montgomery, Andrea Janikova, Anna Maria Barbui, Kazimierz Sulek, Maria José Terol, John A. Radford, Laure Siraudin, Laurence Hatteville, Sandrine Schwab, Corina Oprea, Alessandro M. Gianni; Charles University Hospital, Department of Hematology, Prague, Czech Republic; UZ Leuven, Leuven, Belgium; Leicester University, Leicester, United Kingdom; Hadassah Medical Center, Jerusalem, Israel; Azienda Ospedali Riuniti Villa Sofia, Palermo, Italy; Hospital Universitario La Paz, Madrid, Spain; Hospital Universitari Vall d'Hebron, Barcelona, Spain; The Ohio State University, Columbus, OH; St. Lukes/Mountain States Tumor Institute, Boise, ID; University Hospital Brno, Brno, Czech Republic; Azienda Ospedaliera Papa Giovanni XXIII, Bergamo, Italy; Military Medical Institute, Warszawa, Poland; Hospital Clínico Universitario de Valencia, Valencia, Spain; University of Manchester/Christie Hospital NHS Foundation Trust, Manchester, United Kingdom; Lincoln, Boulogne-Billancourt, France; Sanofi R&D, Vitry-sur-Seine, France; Sanofi R&D, Chilly-Mazarin, France; Fondazione IRCCS Istituto Nazionale Tumori and Università degli Studi di Milano, Milan, Italy
Abstract Disclosures
Abstract:
Background: CoR is an anti-CD19 antibody maytansinoid conjugate. CD19 is expressed in the majority of B cell lymphomas. Phase I program showed clinical activity in pts with both indolent and aggressive lymphomas. Methods: Pts withCD19+ R/R DLBCL after at least one standard treatment including rituximab and not candidate for transplantation were eligible. Primary refractory pts were excluded. Biopsy was required at baseline. CoR 55 mg/m² was administered weekly for 4 weeks then bi-weekly until disease progression or other study discontinuation criteria. The primary objective was to demonstrate an overall response rate (ORR) of at least 20% following Cheson 2007 criteria. Tumor assessments were done every 12 weeks. Secondary objectives were: safety, pharmacokinetics (PK), duration of response (DOR), progression free and overall survival (PFS, OS). Assessment of correlation between biomarkers (BM) status and disease outcome was an exploratory objective. Results: 41 pts were evaluable. Median age was 71 (39:85), 53.7% were male; 92.7% had ECOG performance status 0-1. 31.7% had received ≥ 3 prior regimens for DLBCL. The ORR was 43.9% (90% CI: 30.6% to 57.9%, p-value<0.0001) including 5 complete responses (12.2%). DOR, OS and PFS data are not mature (11 pts ongoing). The most common (>10%) all grades (gr) non-hematologic treatment-emergent adverse events (TEAEs) were nausea (23.0%), diarrhea (19.7%), fatigue and cough (18.0%), vomiting and decrease appetite (13.1%), asthenia, abdominal and back pain (11.5%). TEAEs led to treatment discontinuation in 4 pts. Only gr 1-2 eye disorders were reported, including 1 pt with unrelated gr 2 keratitis. Peripheral neuropathies were observed in 5 pts, all were gr 1-2. Hematological toxicity was moderate, with gr 3-4 neutropenia, thrombocytopenia and anemia in 26.4%, 9.9% and 6.6% pts respectively. PK assessment and investigations on BM expression are ongoing. Conclusions: CoR as single agent demonstrated significant activity in R/R DLBCL pts and reached its primary endpoint for ORR, with acceptable safety profile. Trial funded by Sanofi. Clinical trial information: NCT01472887.
(Posting von g3233 kopiert von Investorvillage zu Ergebnissen von CD-38 AKs auf ASCO 2014):
daratumumab vs. SAR650984
Dose-dependent efficacy of daratumumab (DARA) as monotherapy in patients with relapsed or refractory multiple myeloma (RR MM)
http://abstracts.asco.org/144/AbstView_144_127438.html
Methods: Pts =18 yrs, RR to at least 2 prior lines of therapy, incl. IMiDs and proteasome inhibitors, and ineligible for ASCT were enrolled at 2 dose levels: A: 8mg/kg +/- pre-dose (10mg) wkly for the first 8 infusions.B: 16mg/kg without pre-dose with a 3-wk washout period between the first 2 doses followed by 7 wkly doses. Then all pts were dosed every 2nd wk for 16 wks followed by dosing every 4th wk until disease progression, toxicity or for max 24 mths.
Results: Data from 30 pts in the 8mg/kg cohort and 15 pts in the 16mg/kg cohort recruited into the GEN501 expansion part are presented. Median age was 58.2 (35.1-76.9) and 64.1 (50.5-75.0) years, prior treatment lines were 5 (3-11), and 4 (2-8) and time since diagnosis was 5.5 (2.1-15.2) and 7.1 (0.4-13.3) years, respectively.
ORR at 8 mg/kg (n=30): 7%
ORR at 16 mg/kg (n=13): 46%
Conclusions: DARA monotherapy in RR MM pts resulted in high single agent activity when administered at 16 mg/kg (46% ORR). The safety profile was manageable. Full response data will be presented at the meeting incl. bone marrow assessments.
http://clinicaltrials.gov/ct2/show/NCT00574288
http://clinicaltrials.gov/ct2/show/NCT02136134
http://clinicaltrials.gov/ct2/show/NCT02076009
Daratumumab has received Fast Track Designation and Breakthrough Therapy Designation from the US FDA for the treatment of patients with multiple myeloma who have received at least three prior lines of therapy including a proteasome inhibitor (PI) and an immunomodulatory agent (IMiD) or who are double refractory to a PI and IMiD. Breakthrough Therapy Designation is a program intended to expedite the development and review of drugs to treat serious or life-threatening diseases in cases where preliminary clinical evidence shows that the drug may provide substantial improvements over available therapy. Daratumumab has also received Orphan Drug Designation from the US FDA and the EMA for the treatment of multiple myeloma.
=============
A phase I trial of SAR650984, a CD38 monoclonal antibody, in relapsed or refractory multiple myeloma
http://abstracts.asco.org/144/AbstView_144_129808.html
Methods: SAR was given IV weekly (QW) or every 2 weeks (Q2W). Dose levels (DL) 0.3, 1, 3, 5, 10 and 20 mg/kg Q2W and 10 mg/kg QW using the classic 3+3 design were evaluated.
Results: 35 pts with RRMM were treated; median age 64 yrs (40-76); median lines of therapy were 6 (2-14), 34/35 received an IMiD and a proteasome inhibitor (57% had carfilzomib (C) and/or pomalidomide (P). MTD was not reached at any DL.
ORR at ALL DL (n=34): 24%
ORR at >= 10 mg/kg (n=18): 33%
Conclusions: The MTD of SAR was not reached. SAR demonstrates encouraging and durable single agent efficacy in heavily pretreated RRMM pts, including those with prior (C) and (P) and warrants further evaluation.
daratumumab vs. SAR650984
Dose-dependent efficacy of daratumumab (DARA) as monotherapy in patients with relapsed or refractory multiple myeloma (RR MM)
http://abstracts.asco.org/144/AbstView_144_127438.html
Methods: Pts =18 yrs, RR to at least 2 prior lines of therapy, incl. IMiDs and proteasome inhibitors, and ineligible for ASCT were enrolled at 2 dose levels: A: 8mg/kg +/- pre-dose (10mg) wkly for the first 8 infusions.B: 16mg/kg without pre-dose with a 3-wk washout period between the first 2 doses followed by 7 wkly doses. Then all pts were dosed every 2nd wk for 16 wks followed by dosing every 4th wk until disease progression, toxicity or for max 24 mths.
Results: Data from 30 pts in the 8mg/kg cohort and 15 pts in the 16mg/kg cohort recruited into the GEN501 expansion part are presented. Median age was 58.2 (35.1-76.9) and 64.1 (50.5-75.0) years, prior treatment lines were 5 (3-11), and 4 (2-8) and time since diagnosis was 5.5 (2.1-15.2) and 7.1 (0.4-13.3) years, respectively.
ORR at 8 mg/kg (n=30): 7%
ORR at 16 mg/kg (n=13): 46%
Conclusions: DARA monotherapy in RR MM pts resulted in high single agent activity when administered at 16 mg/kg (46% ORR). The safety profile was manageable. Full response data will be presented at the meeting incl. bone marrow assessments.
http://clinicaltrials.gov/ct2/show/NCT00574288
http://clinicaltrials.gov/ct2/show/NCT02136134
http://clinicaltrials.gov/ct2/show/NCT02076009
Daratumumab has received Fast Track Designation and Breakthrough Therapy Designation from the US FDA for the treatment of patients with multiple myeloma who have received at least three prior lines of therapy including a proteasome inhibitor (PI) and an immunomodulatory agent (IMiD) or who are double refractory to a PI and IMiD. Breakthrough Therapy Designation is a program intended to expedite the development and review of drugs to treat serious or life-threatening diseases in cases where preliminary clinical evidence shows that the drug may provide substantial improvements over available therapy. Daratumumab has also received Orphan Drug Designation from the US FDA and the EMA for the treatment of multiple myeloma.
=============
A phase I trial of SAR650984, a CD38 monoclonal antibody, in relapsed or refractory multiple myeloma
http://abstracts.asco.org/144/AbstView_144_129808.html
Methods: SAR was given IV weekly (QW) or every 2 weeks (Q2W). Dose levels (DL) 0.3, 1, 3, 5, 10 and 20 mg/kg Q2W and 10 mg/kg QW using the classic 3+3 design were evaluated.
Results: 35 pts with RRMM were treated; median age 64 yrs (40-76); median lines of therapy were 6 (2-14), 34/35 received an IMiD and a proteasome inhibitor (57% had carfilzomib (C) and/or pomalidomide (P). MTD was not reached at any DL.
ORR at ALL DL (n=34): 24%
ORR at >= 10 mg/kg (n=18): 33%
Conclusions: The MTD of SAR was not reached. SAR demonstrates encouraging and durable single agent efficacy in heavily pretreated RRMM pts, including those with prior (C) and (P) and warrants further evaluation.
Antwort auf Beitrag Nr.: 46.985.622 von Ville7 am 15.05.14 10:22:50Die Ergebnisse sind richtig gut, zumal sich SAR650984 noch in der Dosiseskalation befindet (MTD noch nicht erreicht; bei Daratumumab werden bereits Expansion-Kohorten untersucht).
Antwort auf Beitrag Nr.: 46.985.756 von Joschka Schröder am 15.05.14 10:36:31Die SAR650984-Monotherapie-Ergebnisse entsprechen in etwa den Daten, die beim letzten ASH-Kongress vorgestellt worden sind (sind einen Hauch schwächer).
Interessant auch die Kombistudie mit Lenalidomide + Dexamethasone, hier finden sich im Abstract nur erste positive Daten, die sich allerdings noch nicht richtig einordnen lassen. Die wichtigen Kohortendaten werden erst vor Ort veröffentlicht, so dass dann auch ein Vergleich mit Biotest´s BT-062 möglich wird. An beiden Präparaten ist IMGN beteiligt.
-> http://abstracts.asco.org/144/AbstView_144_133856.html
Interessant auch die Kombistudie mit Lenalidomide + Dexamethasone, hier finden sich im Abstract nur erste positive Daten, die sich allerdings noch nicht richtig einordnen lassen. Die wichtigen Kohortendaten werden erst vor Ort veröffentlicht, so dass dann auch ein Vergleich mit Biotest´s BT-062 möglich wird. An beiden Präparaten ist IMGN beteiligt.
-> http://abstracts.asco.org/144/AbstView_144_133856.html
Antwort auf Beitrag Nr.: 46.986.440 von Joschka Schröder am 15.05.14 11:56:54Noch zur Kombistudie: Die SAR650984-Patienten waren stärker vorbehandelt als die BT-062-Patienten in der ASH-Präsentation. Muss man im Hinterkopf behalten.
Die IMGN529-Daten gefallen mir nicht besonders. Diesem Präparat habe ich auch in der Vergangenheit keinen positiven Wert zugeordnet. Meiner Meinung nach sollte man die Entwicklung stoppen. -> http://abstracts.asco.org/144/AbstView_144_132154.html
Die IMGN529-Daten gefallen mir nicht besonders. Diesem Präparat habe ich auch in der Vergangenheit keinen positiven Wert zugeordnet. Meiner Meinung nach sollte man die Entwicklung stoppen. -> http://abstracts.asco.org/144/AbstView_144_132154.html
Das neue Dosisschema für IMGN853 scheint zu funktionieren. Um die therapeutische Wirksamkeit im Konkurrenzvergleich zu beurteilen, ist die Datenlage noch zu dünn. -> http://abstracts.asco.org/144/AbstView_144_132285.html
Mein ASCO-Abstract-Fazit zu IMGN:
1) Die Eigenentwicklungen bereiten weiterhin Probleme. Die Entwicklung des IMGN529 würde ich einstellen. Bei IMGN853 muss man noch ein wenig abwarten. Mein absoluter Favorit ist weiterhin IMGN289.
2) Occuläre Toxizitäten sind auch bei einigen SGEN-Präparaten zu beobachten.
3) Positiv die Ergebnisse des anti CD19-ADC´s SAR3419, vermutlich in etwa gleichwertig dürfte allerdings SGEN-19A sein. Auf diesem Sektor gibt es harte Konkurrenz durch andere Präparate und Therapieformen (u.a. CART19).
4) Die bisherigen Monotherapie-Ergebnisse des anti CD38-Präparats SAR650984 (ASH 2013) sind nahezu bestätigt worden. In der Kombibehandlung mit LEN und DEX schneiden die anti CD38-MAK´s bislang jedoch schlechter ab als der BT-062 (anti CD138-ADC von Biotest/IMGN). Wir befinden uns jedoch noch in der Dosiseskalation.
Vom ASCO-Meeting erwarte ich per Saldo keine positiven Impulse auf den IMGN-Kurs.
Wichtig werden die nächsten Kadcyla-Daten und die ersten klinischen IMGN289-Daten sein.
1) Die Eigenentwicklungen bereiten weiterhin Probleme. Die Entwicklung des IMGN529 würde ich einstellen. Bei IMGN853 muss man noch ein wenig abwarten. Mein absoluter Favorit ist weiterhin IMGN289.
2) Occuläre Toxizitäten sind auch bei einigen SGEN-Präparaten zu beobachten.
3) Positiv die Ergebnisse des anti CD19-ADC´s SAR3419, vermutlich in etwa gleichwertig dürfte allerdings SGEN-19A sein. Auf diesem Sektor gibt es harte Konkurrenz durch andere Präparate und Therapieformen (u.a. CART19).
4) Die bisherigen Monotherapie-Ergebnisse des anti CD38-Präparats SAR650984 (ASH 2013) sind nahezu bestätigt worden. In der Kombibehandlung mit LEN und DEX schneiden die anti CD38-MAK´s bislang jedoch schlechter ab als der BT-062 (anti CD138-ADC von Biotest/IMGN). Wir befinden uns jedoch noch in der Dosiseskalation.
Vom ASCO-Meeting erwarte ich per Saldo keine positiven Impulse auf den IMGN-Kurs.
Wichtig werden die nächsten Kadcyla-Daten und die ersten klinischen IMGN289-Daten sein.
Beim bevorstehenden Kongress der Amerikanischen Urologischen Gesellschaft wird eine mögliche spätere Indikationserweiterung auf stark HER2-exprimierenden Blasenkrebs diskutiert.
Sunday, May 18, 2014 10:30 AM-12:30 PM
OCCC: W 304 A
Bladder Cancer: Basic Research II
Funding: none
MP28-14: Targeting HER2 with Trastuzumab-DM1 (T-DM1) in HER2-overexpressing bladder cancer
Tetsutaro Hayashi*, Wolfgang Jaeger, Igor Moskalev, Shannon Awrey, Na Li, Ladan Fazli, Vancouver, Canada, Wataru Yasui, Akio Matsubara, Hiroshima, Japan, Peter Black, Vancouver, Canada
Abstract: MP28-14
Introduction and Objectives
Human epidermal growth factor receptor-2 (HER2) is involved in proliferation, cell survival and metastasis, and remains an attractive therapeutic target in bladder cancer. Although trastuzumab has failed to show any significant benefit in early phase clinical trials, some of this may be due to poor drug potency. T-DM1 (Genentech Inc., South San Francisco, CA) is a new drug consisting of trastuzumab conjugated with a cytotoxic agent, DM1 (derivative of maytansine 1). It has been proven effective even in breast cancer patients refractory to trastuzumab. The objective of this study was to establish the pre-clinical proof of principle for targeting HER2 with T-DM1 in bladder cancer.
Methods
HER2 expression was analyzed in bladder tumors by immunohistochemistry (IHC) using the same scoring criteria as breast cancer. Bladder cancer cell lines including several with acquired resistance to cisplatin (CDDP-R) were screened for expression of HER2 by Western blot and quantitative RT-PCR. The growth-inhibitory effect was compared between trastuzumab and T-DM1 by proliferation assay and fluorescence activated cell sorting (FACS). In vivo effects were evaluated in an orthotopic bladder cancer xenograft model with bioluminescence imaging.
Results
HER2 overexpression (2+ and 3+ staining) was observed in 59 of 159 (37%) bladder cancer patients treated by radical cystectomy and was correlated with higher histological grade and advanced stage. In 12 bladder cancer cell lines, RT4V6 showed highest HER2 expression and showed 24% higher growth inhibition with 1μg/ml T-DM1 compared to trastuzumab. FACS analysis revealed T-DM1, but not trastuzumab, induced apoptosis of RT4V6 cells after G2/M cell cycle arrest (1μg/ml). We confirmed HER2 expression to be three to ten times higher in of CDDP-R cell lines compared to the parental cell lines. RT112 CDDP-R and T24 CDDP-R cell lines showed higher sensitivity for T-DM1 at the concentration of 0.1μg/ml and 1μg/ml than parental cell lines (p<0.05, p<0.01). In vivo growth of RT112 CDDP-R xenografts was inhibited by T-DM1 compared to treatment with either a control IgG or trastuzumab. IHC of the xenografts revealed that T-DM1 induced apoptosis and diminished Ki67 positive cells compared to the same controls.
Conclusions
Our results demonstrate that T-DM1 has promising anti-tumor effects in pre-clinical models of HER2-overexpressing bladder cancer. Targeting HER2 with T-DM1 warrants further clinical investigations, especially in patients with HER2 alterations or cisplatin resistance.
Sunday, May 18, 2014 10:30 AM-12:30 PM
OCCC: W 304 A
Bladder Cancer: Basic Research II
Funding: none
MP28-14: Targeting HER2 with Trastuzumab-DM1 (T-DM1) in HER2-overexpressing bladder cancer
Tetsutaro Hayashi*, Wolfgang Jaeger, Igor Moskalev, Shannon Awrey, Na Li, Ladan Fazli, Vancouver, Canada, Wataru Yasui, Akio Matsubara, Hiroshima, Japan, Peter Black, Vancouver, Canada
Abstract: MP28-14
Introduction and Objectives
Human epidermal growth factor receptor-2 (HER2) is involved in proliferation, cell survival and metastasis, and remains an attractive therapeutic target in bladder cancer. Although trastuzumab has failed to show any significant benefit in early phase clinical trials, some of this may be due to poor drug potency. T-DM1 (Genentech Inc., South San Francisco, CA) is a new drug consisting of trastuzumab conjugated with a cytotoxic agent, DM1 (derivative of maytansine 1). It has been proven effective even in breast cancer patients refractory to trastuzumab. The objective of this study was to establish the pre-clinical proof of principle for targeting HER2 with T-DM1 in bladder cancer.
Methods
HER2 expression was analyzed in bladder tumors by immunohistochemistry (IHC) using the same scoring criteria as breast cancer. Bladder cancer cell lines including several with acquired resistance to cisplatin (CDDP-R) were screened for expression of HER2 by Western blot and quantitative RT-PCR. The growth-inhibitory effect was compared between trastuzumab and T-DM1 by proliferation assay and fluorescence activated cell sorting (FACS). In vivo effects were evaluated in an orthotopic bladder cancer xenograft model with bioluminescence imaging.
Results
HER2 overexpression (2+ and 3+ staining) was observed in 59 of 159 (37%) bladder cancer patients treated by radical cystectomy and was correlated with higher histological grade and advanced stage. In 12 bladder cancer cell lines, RT4V6 showed highest HER2 expression and showed 24% higher growth inhibition with 1μg/ml T-DM1 compared to trastuzumab. FACS analysis revealed T-DM1, but not trastuzumab, induced apoptosis of RT4V6 cells after G2/M cell cycle arrest (1μg/ml). We confirmed HER2 expression to be three to ten times higher in of CDDP-R cell lines compared to the parental cell lines. RT112 CDDP-R and T24 CDDP-R cell lines showed higher sensitivity for T-DM1 at the concentration of 0.1μg/ml and 1μg/ml than parental cell lines (p<0.05, p<0.01). In vivo growth of RT112 CDDP-R xenografts was inhibited by T-DM1 compared to treatment with either a control IgG or trastuzumab. IHC of the xenografts revealed that T-DM1 induced apoptosis and diminished Ki67 positive cells compared to the same controls.
Conclusions
Our results demonstrate that T-DM1 has promising anti-tumor effects in pre-clinical models of HER2-overexpressing bladder cancer. Targeting HER2 with T-DM1 warrants further clinical investigations, especially in patients with HER2 alterations or cisplatin resistance.
IMGN wird weiterhin für die schwachen ASCO-Abstracts abgestraft.
Wenig erfreuliches gibt es von SAR3419 (anti CD19-ADC von Sanofi/IMGN) zu berichten: Die P2-Studie in der Indikation ALL ist wegen Erfolglosigkeit eingestellt worden -> http://www.clinicaltrials.gov/ct2/show?term=sar3419&rank=3
Antwort auf Beitrag Nr.: 47.077.344 von Joschka Schröder am 30.05.14 20:28:01Um so erfreulicher die Daten in der Indikation NHL:
ImmunoGen, Inc. Announces Favorable STARLYTE Phase II Clinical Data with Sanofi's SAR3419 in Diffuse Large B-Cell Lymphoma
SAR3419 achieved objective responses well above the study threshold and was found to have a favorable safety profile.
Objective responses reported in patients whose disease had not responded to prior therapy.
Selected for Best of ASCO.
WALTHAM, Mass.--(BUSINESS WIRE)-- ImmunoGen, Inc. (NASDAQ: IMGN), a biotechnology company that develops novel anticancer therapeutics using its antibody-drug conjugate (ADC) technology, today announced the presentation of favorable clinical findings with SAR3419 (coltuximab ravtansine) from the STARLYTE Phase II trial in diffuse large B-cell lymphoma (DLBCL). SAR3419 is a CD19-targeting ADC developed by ImmunoGen and licensed to Sanofi as part of a broader collaboration between the companies. The study results were reported in an oral abstract session at the American Society of Clinical Oncology (ASCO) 50th Annual Meeting being held in Chicago, IL; they were also selected for Best of ASCO (abstract #8506).
In the data presented today, study investigators reported achievement of proof of concept, with 43.9% objective response rate (ORR) for the per protocol population (patients with relapsed or relapsed/refractory disease). The primary objective of the study was to assess whether single agent SAR3419 could achieve an ORR of at least 20% in this patient population using Cheson 2007 criteria. Additionally, objective responses were reported among the patients enrolled with primary refractory disease - cancer that had not responded to first-line treatment - with a 21.4% ORR.
"SAR3419 demonstrated promising activity against previously treated DLBCL, including disease that had not responded to first-line treatment," commented Daniel Junius, president and CEO of ImmunoGen. "We believe the unique profile of SAR3419 can make an important difference for patients with DLBCL, and potentially for other types of B-cell malignancies. These data also add to the growing body of favorable findings with ADCs using our technology."
The STARLYTE trial is evaluating the efficacy and safety of SAR3419 used as a single agent to treat relapsed or relapsed/refractory CD19-positive DLBCL. Patients received SAR3419 at 55 mg/m2 weekly for four weeks and then every other week until disease progression or discontinuation. Of the patients enrolled in the trial, 55 were evaluable for efficacy and 61 were evaluable for safety.
The 41 per protocol patients included 26 patients with relapsed but not refractory disease and 15 patients with disease refractory to their last treatment. Among these patients:
The ORR was 53.8% among the patients with relapsed disease, with 69.2% having stable disease or better. The 14 patients with objective responses included 5 patients with complete responses (CRs) and 9 patients with partial responses (PRs).
Among the 15 patients with disease refractory to the last treatment, the ORR was 26.7%, with 46.7% having stable disease or better. These included 1 CR and 3 PRs.
The 55 efficacy evaluable patients also included 14 individuals with primary refractory disease. Among these patients, the ORR was 21.4%, with 35.7% having stable disease or better. The objective responses reported included 1 CR as well as 2 PRs.
The investigators reported that SAR3419 was found to have a favorable safety profile, with few treatment-related grade 3/4 adverse events (AEs) or serious AEs reported. No grade 3 or 4 peripheral neuropathy or ocular events were observed; any ocular events were low grade (1 or 2), manageable and reversible. Moderate hematological toxicities were reported including anemia, thrombocytopenia and neutropenia.
ImmunoGen, Inc. Announces Favorable STARLYTE Phase II Clinical Data with Sanofi's SAR3419 in Diffuse Large B-Cell Lymphoma
SAR3419 achieved objective responses well above the study threshold and was found to have a favorable safety profile.
Objective responses reported in patients whose disease had not responded to prior therapy.
Selected for Best of ASCO.
WALTHAM, Mass.--(BUSINESS WIRE)-- ImmunoGen, Inc. (NASDAQ: IMGN), a biotechnology company that develops novel anticancer therapeutics using its antibody-drug conjugate (ADC) technology, today announced the presentation of favorable clinical findings with SAR3419 (coltuximab ravtansine) from the STARLYTE Phase II trial in diffuse large B-cell lymphoma (DLBCL). SAR3419 is a CD19-targeting ADC developed by ImmunoGen and licensed to Sanofi as part of a broader collaboration between the companies. The study results were reported in an oral abstract session at the American Society of Clinical Oncology (ASCO) 50th Annual Meeting being held in Chicago, IL; they were also selected for Best of ASCO (abstract #8506).
In the data presented today, study investigators reported achievement of proof of concept, with 43.9% objective response rate (ORR) for the per protocol population (patients with relapsed or relapsed/refractory disease). The primary objective of the study was to assess whether single agent SAR3419 could achieve an ORR of at least 20% in this patient population using Cheson 2007 criteria. Additionally, objective responses were reported among the patients enrolled with primary refractory disease - cancer that had not responded to first-line treatment - with a 21.4% ORR.
"SAR3419 demonstrated promising activity against previously treated DLBCL, including disease that had not responded to first-line treatment," commented Daniel Junius, president and CEO of ImmunoGen. "We believe the unique profile of SAR3419 can make an important difference for patients with DLBCL, and potentially for other types of B-cell malignancies. These data also add to the growing body of favorable findings with ADCs using our technology."
The STARLYTE trial is evaluating the efficacy and safety of SAR3419 used as a single agent to treat relapsed or relapsed/refractory CD19-positive DLBCL. Patients received SAR3419 at 55 mg/m2 weekly for four weeks and then every other week until disease progression or discontinuation. Of the patients enrolled in the trial, 55 were evaluable for efficacy and 61 were evaluable for safety.
The 41 per protocol patients included 26 patients with relapsed but not refractory disease and 15 patients with disease refractory to their last treatment. Among these patients:
The ORR was 53.8% among the patients with relapsed disease, with 69.2% having stable disease or better. The 14 patients with objective responses included 5 patients with complete responses (CRs) and 9 patients with partial responses (PRs).
Among the 15 patients with disease refractory to the last treatment, the ORR was 26.7%, with 46.7% having stable disease or better. These included 1 CR and 3 PRs.
The 55 efficacy evaluable patients also included 14 individuals with primary refractory disease. Among these patients, the ORR was 21.4%, with 35.7% having stable disease or better. The objective responses reported included 1 CR as well as 2 PRs.
The investigators reported that SAR3419 was found to have a favorable safety profile, with few treatment-related grade 3/4 adverse events (AEs) or serious AEs reported. No grade 3 or 4 peripheral neuropathy or ocular events were observed; any ocular events were low grade (1 or 2), manageable and reversible. Moderate hematological toxicities were reported including anemia, thrombocytopenia and neutropenia.
Antwort auf Beitrag Nr.: 47.082.350 von Joschka Schröder am 01.06.14 17:37:58Wenn man die Ergebnisse normalisiert, d.h. die Zusammensetzung der Patientenkollektive berücksichtigt (relapsed versus refractory), so scheint das Konkurrenzpräparat SGN-CD19A von Seattle Genetics jedoch besser abzuschneiden als SAR3419. Und beim SGN-CD19 wird noch nicht mit der optimalen Dosis gearbeiten (Dosisfindung läuft noch).
Aus dem US-Forum bei Yahoo:
.................................
Excerpts from an article link found on Investor Village- Conclusions: Our results indicate that targeting HER-2 with T-DM1 may offer a new therapeutic approach in HER-2 over-expressing lung cancers including those resistant to EGFR TKIs. Article state between 2 and 20% of NSCLC pts. over-express HER2. That's a large potential new market. TDM1 is going to be huge, the only question is when and how much of that huge $ amount will IMGN receive under their contract.
.................................
Excerpts from an article link found on Investor Village- Conclusions: Our results indicate that targeting HER-2 with T-DM1 may offer a new therapeutic approach in HER-2 over-expressing lung cancers including those resistant to EGFR TKIs. Article state between 2 and 20% of NSCLC pts. over-express HER2. That's a large potential new market. TDM1 is going to be huge, the only question is when and how much of that huge $ amount will IMGN receive under their contract.
Hallo ich kann keine Neuigkeiten finden für die knapp 9% Aufschlag heute?
Zitat von schnappi: Hallo ich kann keine Neuigkeiten finden für die knapp 9% Aufschlag heute?
Die UBS hat heute die Aktie von SELL auf HOLD hochgestuft mit Kursziel 13 USD. Begründet wird dies mit der fundamentalen Absicherung der Aktie durch die Kadcyla Royalties.
Wenn auch das Kursziel von 13 USD nicht überschwänglich ist, ist die veränderte Researcheinschätzung der UBS bemerkenswert, war die UBS doch sehr lange negativ für die Aktie gestimmt.
@ Joschka, kommst Du an die UBS-Studie heran?
Antwort auf Beitrag Nr.: 47.145.242 von Emil_Punter am 12.06.14 19:35:17Vor 10 Tagen hatte die UBS noch ein KZ von 8,50 USD. Die Studie vom 2.6. habe ich gelesen.
In die aktuelle Studie werde ich vermutlich nicht mehr schauen, weil ich mich an der Börse aus dem Biotech-Sektor zurückziehe. Während der vergangenen Jahre konnte man dort viel Geld verdienen. Mittlerweile hat sich die Situation jedoch verändert: Rechercheaufwand und Entwicklungsrisiken (u.a. infolge Konkurrenzdrucks) stehen bei den meisten Werten in keinem vertretbaren Verhältnis mehr zu potentiellen Kursavancen. Da gibt es derzeit aussichtsreichere Branchen mit besserem Chance-Risiko-Profil.
In die aktuelle Studie werde ich vermutlich nicht mehr schauen, weil ich mich an der Börse aus dem Biotech-Sektor zurückziehe. Während der vergangenen Jahre konnte man dort viel Geld verdienen. Mittlerweile hat sich die Situation jedoch verändert: Rechercheaufwand und Entwicklungsrisiken (u.a. infolge Konkurrenzdrucks) stehen bei den meisten Werten in keinem vertretbaren Verhältnis mehr zu potentiellen Kursavancen. Da gibt es derzeit aussichtsreichere Branchen mit besserem Chance-Risiko-Profil.
Zitat von Joschka Schröder: In die aktuelle Studie werde ich vermutlich nicht mehr schauen, weil ich mich an der Börse aus dem Biotech-Sektor zurückziehe. Während der vergangenen Jahre konnte man dort viel Geld verdienen. Mittlerweile hat sich die Situation jedoch verändert: Rechercheaufwand und Entwicklungsrisiken (u.a. infolge Konkurrenzdrucks) stehen bei den meisten Werten in keinem vertretbaren Verhältnis mehr zu potentiellen Kursavancen. Da gibt es derzeit aussichtsreichere Branchen mit besserem Chance-Risiko-Profil.
Zumindest für mich käme dieser Rückzug überraschend, bist Du doch geradezu in diesem Board ein Protagonist dieser Branche (wenn ich etwa an den Biotest Thread denke). Ich - und viele andere sicherlich auch - würde es sehr bedauern, wenn Du Dich aus diesem und anderen Biotech Threads zukünftig als kompetenter Kommentator zurückziehen würdest.
An welche anderen Branchen denkst Du denn konkret - sofern Du uns das jetzt schon verraten willst?
Je tiefer man Einblick in die Branche hat, desto schwieriger wird es, dort rational zu investieren. Zum einen lassen sich kaum noch alle wesentlichen Parallelentwicklungen überblicken ... und es gibt immer wieder aussichtsreiche neue Ansätze, so dass Unternehmensbewertungen im Biotech-Bereich immer schwieriger werden. Zum anderen gibt es kaum einen institutionellen Anleger (in der aktuellen UBS-Kehrtwende bei IMGN spiegelt sich dies gut wider), der in der Lage wäre, eine fundierte Investitionsentscheidung zu treffen. Es geht zu wie im Spielkasino. Auf die Dauer kostet das einfach zu viel Energie.
Die Branche ist reif geworden und die Zeiten des einfachen Geld Verdienens sind im Biotech-Sektor vorbei.
Die Branche ist reif geworden und die Zeiten des einfachen Geld Verdienens sind im Biotech-Sektor vorbei.
Danke für die Info,
noch am Rande für die Zukunft interessant finde ich Robotertechnologie für die alltägliche Hilfe zB. Haushalt usw.
noch am Rande für die Zukunft interessant finde ich Robotertechnologie für die alltägliche Hilfe zB. Haushalt usw.
Antwort auf Beitrag Nr.: 47.145.772 von Joschka Schröder am 12.06.14 21:06:12Welche Branchen sind für dich denn noch günstig? Ich finde alles inzwischen sehr teuer. Biotech ist den anderen Branchen da natürlich ein kleines Stück vorausgelaufen....
Antwort auf Beitrag Nr.: 47.148.422 von Ville7 am 13.06.14 11:38:59Du hast recht, teuer ist mittlerweile fast alles.
Speziell in der Biotech-Branche kommt jedoch hinzu, dass sich Unternehmen kaum noch halbwegs valide bewerten lassen, weil es so viele nahezu gleichwertige Parallelentwicklungen mit jeweils leicht modifizierten Ansätzen gibt. Mit einem vertretbaren Aufwand (mehr als 24 Stunden hat der Tag leider nicht) lassen sich der Biotech-Sektor bzw. Teile dieses Sektors kaum mehr analysieren.
In vielen anderen Branchen ist es möglich, sich mit deutlich weniger Aufwand ein klareres Bild zu verschaffen.
Speziell in der Biotech-Branche kommt jedoch hinzu, dass sich Unternehmen kaum noch halbwegs valide bewerten lassen, weil es so viele nahezu gleichwertige Parallelentwicklungen mit jeweils leicht modifizierten Ansätzen gibt. Mit einem vertretbaren Aufwand (mehr als 24 Stunden hat der Tag leider nicht) lassen sich der Biotech-Sektor bzw. Teile dieses Sektors kaum mehr analysieren.
In vielen anderen Branchen ist es möglich, sich mit deutlich weniger Aufwand ein klareres Bild zu verschaffen.
[urlhttp://www.businesswire.com/news/home/20140616005236/en/ImmunoGen-Announces-Preclinical-Findings-IMGN779-Potential-Treatment#.U57OltaKDg8][/url]
"About IMGN779
IMGN779 is a novel, DNA-alkylating ADC. Its payload, linker and antibody were developed by ImmunoGen and are wholly owned by the Company. IMGN779 comprises the highly potent, DNA-alkylating payload DGN462 conjugated via cleavable disulfide linker to the CD33-targeting antibody, Z4681A. "
"About IMGN779
IMGN779 is a novel, DNA-alkylating ADC. Its payload, linker and antibody were developed by ImmunoGen and are wholly owned by the Company. IMGN779 comprises the highly potent, DNA-alkylating payload DGN462 conjugated via cleavable disulfide linker to the CD33-targeting antibody, Z4681A. "
Beitrag zu dieser Diskussion schreiben
Zu dieser Diskussion können keine Beiträge mehr verfasst werden, da der letzte Beitrag vor mehr als zwei Jahren verfasst wurde und die Diskussion daraufhin archiviert wurde.
Bitte wenden Sie sich an feedback@wallstreet-online.de und erfragen Sie die Reaktivierung der Diskussion oder starten Sie eine neue Diskussion.
Investoren beobachten auch:
| Wertpapier | Perf. % |
|---|---|
| +0,73 | |
| -0,05 | |
| -0,05 | |
| -0,05 | |
| 0,00 | |
| +0,23 | |
| -0,07 | |
| -0,06 | |
| 0,00 | |
| +3,54 |
Meistdiskutiert
| Wertpapier | Beiträge | |
|---|---|---|
| 63 | ||
| 55 | ||
| 46 | ||
| 38 | ||
| 20 | ||
| 14 | ||
| 12 | ||
| 11 | ||
| 10 | ||
| 10 |
30.11.23 · dpa-AFX · Ford Motor |
30.11.23 · wallstreetONLINE NewsUpdate · Immunogen |
30.11.23 · dpa-AFX · Ford Motor |
30.11.23 · dpa-AFX · Ford Motor |
| Zeit | Titel |
|---|---|
| 30.11.23 |



















