Merck & Co. (Seite 5)
eröffnet am 24.12.20 12:31:49 von
neuester Beitrag 08.01.24 18:25:50 von
neuester Beitrag 08.01.24 18:25:50 von
Beiträge: 73
ID: 1.336.969
ID: 1.336.969
Aufrufe heute: 1
Gesamt: 11.178
Gesamt: 11.178
Aktive User: 0
ISIN: US58933Y1055 · WKN: A0YD8Q · Symbol: 6MK
120,80
EUR
+0,17 %
+0,20 EUR
Letzter Kurs 20:02:02 Tradegate
Neuigkeiten
| Merck & Co Aktien ab 5,80 Euro handeln - Ohne versteckte Kosten!Anzeige |
12:45 Uhr · Business Wire (engl.) |
08.05.24 · wO Newsflash |
08.05.24 · Accesswire |
08.05.24 · Business Wire (engl.) |
Werte aus der Branche Pharmaindustrie
| Wertpapier | Kurs | Perf. % |
|---|---|---|
| 1,8550 | +147,33 | |
| 0,5700 | +55,23 | |
| 5,4500 | +41,56 | |
| 150,47 | +38,68 | |
| 1,0000 | +33,33 |
| Wertpapier | Kurs | Perf. % |
|---|---|---|
| 97,10 | -18,68 | |
| 5,2500 | -19,23 | |
| 20,000 | -20,00 | |
| 18,280 | -21,55 | |
| 2,1900 | -22,34 |
Beitrag zu dieser Diskussion schreiben
Gemäß dieser Meldung sind für Ende 2021/Anfang 2022 bereits 2,5 Mrd USD an Umsatz so gut wie sicher.
Einnahmen von 5-10 Mrd USD bis Ende 2022 scheinen im Rahmen des Möglichen.
Hätte persönlich nicht an so ein großes Volumen geglaubt.
https://www.wallstreet-online.de/nachricht/14650172-merck-an…
Einnahmen von 5-10 Mrd USD bis Ende 2022 scheinen im Rahmen des Möglichen.
Hätte persönlich nicht an so ein großes Volumen geglaubt.
https://www.wallstreet-online.de/nachricht/14650172-merck-an…
Die Kombi machts - Merck & Pfizer als Viruskiller
Es wird wohl darauf hinauslaufen, um Resistenzen zu vermeiden, beide Pillen zu gleichzeitig zu verordnen:... Eine andere Frage ist, ob es nicht Sinn machen könnte, das Medikament mit Molnupiravir® von MSD zu kombinieren. Neben einer Steigerung der Wirkung könnte eine solche kombinierte Applikation zweier Virustatika mit unterschiedlichem Wirkmechanismus in einer Art Cocktail möglicherweise das Auftreten von Resistenzen reduzieren, wie der Pharma-Experte Derek Lowe in einem Beitrag seiner Pharma-Blog-Serie für das Magazin Science schreibt: „Es gibt Hinweise darauf, dass es schwierig ist, eine Resistenz gegen Molnupiravir zu entwickeln (aufgrund seines Mechanismus, der sich von dem anderer häufig verwendeter Transkriptasehemmer unterscheidet). Aber Molnupiravir ist noch nicht an Millionen von Patienten verabreicht worden. Ich habe noch keine vergleichbaren In-vitro-Resistenzversuche mit dem Proteasehemmer von Pfizer gesehen, aber man muss davon ausgehen, dass sich eine Resistenz leichter entwickeln kann.“
Quelle: https://www.doccheck.com/de/detail/articles/36041-pfizer-pil…
Bin hier am Freitag auch eingestiegen.
Gutes Unternehmen mit Blockbuster Keytruda, Tiermedizinsparte und interessanten Partnerschaften.
Zudem mit günstiger Bewertung und ordentlicher Dividende nach unten recht gut abgesichert.
Das COVID Medikament ist eigentlich überhaupt nicht relevant für diesen Konzern eher ein kleines positives Imagepillchen.
Gutes Unternehmen mit Blockbuster Keytruda, Tiermedizinsparte und interessanten Partnerschaften.
Zudem mit günstiger Bewertung und ordentlicher Dividende nach unten recht gut abgesichert.
Das COVID Medikament ist eigentlich überhaupt nicht relevant für diesen Konzern eher ein kleines positives Imagepillchen.
zu Pfizers Medikament Paxlovid:
Paxlovid enthält Ritonavir. Der Wirkstoff gehört zu den Proteaseinhibitoren und wird in Kombination mit weiteren Mitteln bei der HIV-Therapie eingesetzt.
Die Nebenwirkungen von Ritonavir sind:
Sehr häufige Nebenwirkungen (≥ 1/10):
Dysgeusie, orale und periphere Parästhesien, Kopfschmerzen, Schwindel, periphere Neuropathie
Pharyngitis, Schmerzen im Mund-Rachen-Bereich, Husten
Bauchschmerzen (Ober- und Unterbauch), Übelkeit, Durchfall (einschließlich schweren Durchfalls mit Störungen des Elektrolythaushalts), Erbrechen, Dyspepsie
Juckreiz, Exanthem (einschließlich erythematösen und makulopapulösen Exanthems)
Arthralgie und Rückenschmerzen
Erschöpfungssyndrom, einschließlich Asthenie, Erröten (Flush), Hitzegefühl
Häufig auftretende Nebenwirkungen (≥1/100 – <1/10):
Leukozyten erniedrigt, Hämoglobin erniedrigt, Neutrophile erniedrigt, Eosinophile erhöht, Thrombozyten erniedrigt
Überempfindlichkeit, einschließlich Urtikaria und Gesichtsödem
Hypercholesterinämie, Hypertriglyzeridämie, Gicht, Ödeme, periphere Ödeme, Dehydratation (meist im Zusammenhang mit gastrointestinalen Symptomen)
Schlaflosigkeit, Angstzustände, Verwirrung, Aufmerksamkeitsstörung, Synkope, Krampfanfall
Verschwommenes Sehen
Hypertonie, Hypotonie, einschließlich orthostatische Hypotonie, Kälte der Körperperipherie
Appetitlosigkeit, Blähungen, Geschwürbildung im Mund, gastrointestinale Blutung, gastrointestinale Refluxerkrankung, Pankreatitis
Hepatitis (einschließlich erhöhte GOT, GPT und GGT), Bilirubin im Blut erhöht (einschließlich Ikterus)
Akne
Myositis, Rhabdomyolyse, Myalgie, Myopathie, erhöhte CPK
Vermehrte Miktion, Nierenfunktionsstörung (z.B. Oligurie, Kreatinin erhöht)
Menorrhagie
Fieber, Gewichtsverlust
Amylase erhöht, freies und Gesamt-Thyroxin erniedrigt
Quelle: https://www.gelbe-liste.de/wirkstoffe/Ritonavir_26245
Nebenwirkung Molnupiravir:
Die Rate von behandlungsbedingten oder schwerwiegenden Nebenwirkungen war nicht höher als in der Placebo-Gruppe.
Quelle: https://www.aerzteblatt.de/nachrichten/127820/COVID-19-Orale…
Paxlovid enthält Ritonavir. Der Wirkstoff gehört zu den Proteaseinhibitoren und wird in Kombination mit weiteren Mitteln bei der HIV-Therapie eingesetzt.
Die Nebenwirkungen von Ritonavir sind:
Sehr häufige Nebenwirkungen (≥ 1/10):
Dysgeusie, orale und periphere Parästhesien, Kopfschmerzen, Schwindel, periphere Neuropathie
Pharyngitis, Schmerzen im Mund-Rachen-Bereich, Husten
Bauchschmerzen (Ober- und Unterbauch), Übelkeit, Durchfall (einschließlich schweren Durchfalls mit Störungen des Elektrolythaushalts), Erbrechen, Dyspepsie
Juckreiz, Exanthem (einschließlich erythematösen und makulopapulösen Exanthems)
Arthralgie und Rückenschmerzen
Erschöpfungssyndrom, einschließlich Asthenie, Erröten (Flush), Hitzegefühl
Häufig auftretende Nebenwirkungen (≥1/100 – <1/10):
Leukozyten erniedrigt, Hämoglobin erniedrigt, Neutrophile erniedrigt, Eosinophile erhöht, Thrombozyten erniedrigt
Überempfindlichkeit, einschließlich Urtikaria und Gesichtsödem
Hypercholesterinämie, Hypertriglyzeridämie, Gicht, Ödeme, periphere Ödeme, Dehydratation (meist im Zusammenhang mit gastrointestinalen Symptomen)
Schlaflosigkeit, Angstzustände, Verwirrung, Aufmerksamkeitsstörung, Synkope, Krampfanfall
Verschwommenes Sehen
Hypertonie, Hypotonie, einschließlich orthostatische Hypotonie, Kälte der Körperperipherie
Appetitlosigkeit, Blähungen, Geschwürbildung im Mund, gastrointestinale Blutung, gastrointestinale Refluxerkrankung, Pankreatitis
Hepatitis (einschließlich erhöhte GOT, GPT und GGT), Bilirubin im Blut erhöht (einschließlich Ikterus)
Akne
Myositis, Rhabdomyolyse, Myalgie, Myopathie, erhöhte CPK
Vermehrte Miktion, Nierenfunktionsstörung (z.B. Oligurie, Kreatinin erhöht)
Menorrhagie
Fieber, Gewichtsverlust
Amylase erhöht, freies und Gesamt-Thyroxin erniedrigt
Quelle: https://www.gelbe-liste.de/wirkstoffe/Ritonavir_26245
Nebenwirkung Molnupiravir:
Die Rate von behandlungsbedingten oder schwerwiegenden Nebenwirkungen war nicht höher als in der Placebo-Gruppe.
Quelle: https://www.aerzteblatt.de/nachrichten/127820/COVID-19-Orale…
Dazu noch ergänzend: Wer hat denn entschieden, wer in das Krankenhaus kommt? Vielleicht waren ja die Tester bei Merck nur vorsichtiger? Was welches Mittel kann und nicht kann, wird sich erst dann zeigen, wenn viel mehr Vergleiche da sind.
Pro Merck:
1. Bereits zugelassen in UK
2. Lieferverträge / Vorbestellungen liegen vor
3. Sehr gute Verträglichkeit
Pro Merck:
1. Bereits zugelassen in UK
2. Lieferverträge / Vorbestellungen liegen vor
3. Sehr gute Verträglichkeit
Cool bleiben
Die Studie bei Merck:The submission is based on positive results from a planned interim analysis from the Phase 3 MOVe-OUT clinical trial, which evaluated molnupiravir in non-hospitalized adult patients with mild-to-moderate COVID-19 who were at increased risk for progressing to severe COVID-19 and/or hospitalization. At the interim analysis, molnupiravir 800 mg twice-daily reduced the risk of hospitalization or death by approximately 50%; 7.3% of patients who received molnupiravir were hospitalized through Day 29 following randomization (28/385), compared with 14.1% of placebo-treated patients (53/377) that were either hospitalized or died; p=0.0012. Through Day 29, no deaths were reported in patients who received molnupiravir, as compared to 8 deaths in patients who received placebo. The incidence of any adverse event was comparable in the molnupiravir and placebo groups (35% and 40%, respectively). The incidence of drug-related adverse events was also comparable (12% and 11%, respectively), and fewer patients in the molnupiravir group discontinued therapy due to an adverse event compared to the placebo group (1.3% and 3.4%, respectively).
Übersetzt:
Der Antrag stützt sich auf die positiven Ergebnisse einer geplanten Zwischenanalyse der klinischen Phase-3-Studie MOVe-OUT, in der Molnupiravir bei nicht hospitalisierten erwachsenen Patienten mit leichter bis mittelschwerer COVID-19 untersucht wurde, bei denen ein erhöhtes Risiko für ein Fortschreiten zu schwerer COVID-19 und/oder eine Hospitalisierung bestand. Bei der Zwischenanalyse verringerte Molnupiravir 800 mg zweimal täglich das Risiko einer Krankenhauseinweisung oder eines Todesfalls um etwa 50 %; 7,3 % der Patienten, die Molnupiravir erhielten, wurden bis zum Tag 29 nach der Randomisierung ins Krankenhaus eingeliefert (28/385), verglichen mit 14,1 % der mit Placebo behandelten Patienten (53/377), die entweder ins Krankenhaus eingeliefert wurden oder starben; p=0,0012. Bis zum 29. Tag wurden bei den Patienten, die Molnupiravir erhielten, keine Todesfälle gemeldet, im Vergleich zu 8 Todesfällen bei den Patienten, die Placebo erhielten. Die Häufigkeit jeglicher unerwünschter Ereignisse war in den Molnupiravir- und Placebogruppen vergleichbar (35 % bzw. 40 %). Die Häufigkeit arzneimittelbedingter unerwünschter Ereignisse war ebenfalls vergleichbar (12 % bzw. 11 %), und in der Molnupiravir-Gruppe brachen weniger Patienten die Therapie aufgrund eines unerwünschten Ereignisses ab als in der Placebo-Gruppe (1,3 % bzw. 3,4 %).
Studie bei Pizer:
The scheduled interim analysis showed an 89% reduction in risk of COVID-19-related hospitalization or death from any cause compared to placebo in patients treated within three days of symptom onset (primary endpoint); 0.8% of patients who received PAXLOVID™ were hospitalized through Day 28 following randomization (3/389 hospitalized with no deaths), compared to 7.0% of patients who received placebo and were hospitalized or died (27/385 hospitalized with 7 subsequent deaths). The statistical significance of these results was high (p<0.0001). Similar reductions in COVID-19-related hospitalization or death were observed in patients treated within five days of symptom onset; 1.0% of patients who received PAXLOVID™ were hospitalized through Day 28 following randomization (6/607 hospitalized, with no deaths), compared to 6.7% of patients who received a placebo (41/612 hospitalized with 10 subsequent deaths), with high statistical significance (p<0.0001). In the overall study population through Day 28, no deaths were reported in patients who received PAXLOVID™ as compared to 10 (1.6%) deaths in patients who received placebo.
Übersetzt:
Die geplante Zwischenanalyse zeigte eine 89%ige Verringerung des Risikos einer COVID-19-bedingten Krankenhauseinweisung oder eines Todes aus jeglicher Ursache im Vergleich zu Placebo bei Patienten, die innerhalb von drei Tagen nach Symptombeginn behandelt wurden (primärer Endpunkt). 0,8% der Patienten, die PAXLOVID™ erhielten, wurden bis zum Tag 28 nach der Randomisierung ins Krankenhaus eingewiesen (3/389 Krankenhauseinweisungen ohne Todesfälle), verglichen mit 7,0% der Patienten, die Placebo erhielten und ins Krankenhaus eingewiesen wurden oder starben (27/385 Krankenhauseinweisungen mit 7 Todesfällen). Die statistische Signifikanz dieser Ergebnisse war hoch (p<0,0001). Ein ähnlicher Rückgang der COVID-19-bedingten Krankenhauseinweisungen oder Todesfälle wurde bei Patienten beobachtet, die innerhalb von fünf Tagen nach Auftreten der Symptome behandelt wurden; 1,0 % der Patienten, die PAXLOVID™ erhielten, wurden bis zum Tag 28 nach der Randomisierung ins Krankenhaus eingewiesen (6/607 Krankenhauseinweisungen, keine Todesfälle), verglichen mit 6,7 % der Patienten, die ein Placebo erhielten (41/612 Krankenhauseinweisungen mit 10 Todesfällen), mit hoher statistischer Signifikanz (p<0,0001). In der gesamten Studienpopulation wurden bis zum 28. Tag keine Todesfälle bei Patienten gemeldet, die PAXLOVID™ erhielten, verglichen mit 10 (1,6 %) Todesfällen bei Patienten, die Placebo erhielten.
Mein Fazit:
Auf jeden Fall hat das Merck Präparat kaum bis keine Nebenwirkungen (ähnlich wie Placebo) und ist somit sehr gut verträglich.
Ist natürlich erst einmal ein Schock, der Kurs wird sich bestimmt erholen.
Antwort auf Beitrag Nr.: 69.817.977 von rokz am 05.11.21 12:02:54
Pfizer hat ebenso ein Mittel
https://www.finanzen.net/nachricht/aktien/breaking-pfizer-me…
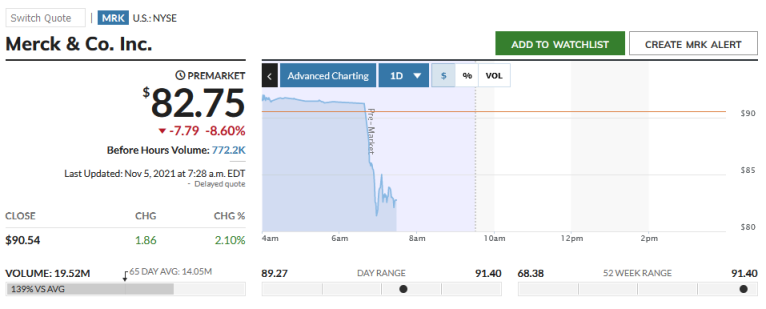
Was ist los?
Die Zulassung ist da für UK
https://www.merck.com/news/merck-and-ridgebacks-molnupiravir…Britische Arzneimittelzulassungsbehörde genehmigt Molnupiravir für die Behandlung von leichtem bis mittelschwerem COVID-19 bei Erwachsenen mit positivem SARS-CoV-2-Diagnosetest und mindestens einem Risikofaktor für die Entwicklung einer schweren Erkrankung
Anträge werden weiterhin von anderen Zulassungsbehörden, einschließlich der U.S. Food and Drug Administration und der Europäischen Arzneimittelagentur, geprüft
KENILWORTH, N.J. & MIAMI--(BUSINESS WIRE)-- Merck (NYSE: MRK), außerhalb der Vereinigten Staaten und Kanadas als MSD bekannt, und Ridgeback Biotherapeutics gaben heute bekannt, dass die britische Arzneimittelbehörde MHRA (Medicines and Healthcare products Regulatory Agency) die Zulassung für Molnupira im Vereinigten Königreich (U. Es handelt sich dabei um das erste orale antivirale Medikament, das für die Behandlung von leichten bis mittelschweren COVID-19-Erkrankungen bei Erwachsenen mit einem positiven SARS-CoV-2-Diagnosetest und mindestens einem Risikofaktor für die Entwicklung einer schweren Erkrankung zugelassen ist. In Großbritannien ist LAGEVRIO® (lah-GEV-ree-oh) der geplante Markenname für Molnupiravir; der Markenname für Molnupiravir in anderen Ländern wurde noch nicht genehmigt. Merck gab bekannt, dass sein Antrag auf eine Notfallzulassung (Emergency Use Authorization, EUA) für Molnupiravir bei der US-amerikanischen Food and Drug Administration (FDA) geprüft wird, und teilte vor kurzem mit, dass die Europäische Arzneimittelagentur eine fortlaufende Prüfung des Zulassungsantrags des Unternehmens eingeleitet hat. Merck arbeitet aktiv an der Einreichung von Anträgen bei anderen Zulassungsbehörden auf der ganzen Welt.
"Die erste weltweite Zulassung von Molnupiravir ist ein großer Erfolg in der einzigartigen Tradition von Merck, bahnbrechende Medikamente und Impfstoffe für die größten gesundheitlichen Herausforderungen der Welt auf den Markt zu bringen. In Verfolgung von Mercks unerschütterlicher Mission, Leben zu retten und zu verbessern, werden wir weiterhin mit Strenge und Dringlichkeit vorgehen, um Molnupiravir so schnell wie möglich für Patienten auf der ganzen Welt verfügbar zu machen", sagte Robert M. Davis, Chief Executive Officer und President von Merck.
"Als orales Therapeutikum stellt Molnupiravir eine wichtige Ergänzung zu den Impfstoffen und Medikamenten dar, die bisher zur Bekämpfung der COVID-19-Pandemie eingesetzt wurden", so Dr. Dean Y. Li, Executive Vice President und Präsident, Merck Research Laboratories. "Wir sind den Prüfärzten, Patienten und ihren Familien sehr dankbar für ihre entscheidenden Beiträge zur MOVe-OUT-Studie, die diese Zulassung ermöglicht haben."
Die Zulassung basiert auf den positiven Ergebnissen einer geplanten Zwischenanalyse der klinischen Phase-3-Studie MOVe-OUT, in der Molnupiravir 800 mg zweimal täglich bei nicht hospitalisierten, ungeimpften erwachsenen Patienten mit im Labor bestätigter leichter bis mittelschwerer COVID-19, Symptombeginn innerhalb von fünf Tagen nach Randomisierung der Studie und mindestens einem Risikofaktor, der mit einem schlechten Krankheitsverlauf assoziiert ist (z. B. Herzerkrankungen, Diabetes), untersucht wurde.
"Als wir uns auf den Weg machten, Molnupiravir von einer Hoffnung zur Realität zu machen, sahen wir uns in der Verantwortung, so schnell und sicher wie möglich zu handeln. Wir waren davon überzeugt, dass jeder gerettete Tag Leben retten und schwere Krankheiten sowie das weltweite Leid dieser Pandemie begrenzen kann", sagte Wendy Holman, Chief Executive Officer von Ridgeback Biotherapeutics. "Es ist erfreulich, diesen Meilenstein zu erreichen und zu zeigen, dass die außerordentlichen Anstrengungen unserer Mitarbeiter, Patienten, Ärzte und unseres Teams sowie die persönlichen Opfer, die sie gebracht haben, dieses wichtige Ziel nun erreicht haben. Es ist auch erfreulich, dass die erste globale Zulassung in Großbritannien erfolgt ist, dem Ort, an dem wir Molnupiravir dem ersten mutigen Probanden verabreicht haben."
Über die weltweiten Bemühungen von Merck, den Zugang zu Molnupiravir nach einer behördlichen Zulassung oder Freigabe zu beschleunigen
Merck setzt sich dafür ein, Molnupiravir weltweit rechtzeitig DeepL zur Verfügung zu stellen. Dazu gehören Risikoinvestitionen für die Produktion von Millionen von Therapieschritten, eine Preisstaffelung auf der Grundlage der Fähigkeit von Regierungen, die Gesundheitsversorgung zu finanzieren, der Abschluss von Liefervereinbarungen mit Regierungen sowie die Gewährung freiwilliger Lizenzen an Generikahersteller und an den Medicines Patent Pool, um Molnupiravir-Generika in Ländern mit niedrigem und mittlerem Einkommen nach lokalen Zulassungen oder Genehmigungen verfügbar zu machen.
Versorgung: In Erwartung der Ergebnisse von MOVe-OUT und der potenziellen behördlichen Genehmigung oder Zulassung hat Merck Molnupiravir auf Risiko produziert und geht davon aus, dass bis Ende 2021 10 Millionen Behandlungseinheiten und 2022 mindestens 20 Millionen Einheiten produziert werden.
Liefervereinbarungen: Anfang dieses Jahres schloss Merck eine Beschaffungsvereinbarung mit der US-Regierung ab, wonach das Unternehmen nach Erteilung der EUA oder der Zulassung durch die US-FDA etwa 1,7 Millionen Kurse Molnupiravir an die US-Regierung liefern wird. Darüber hinaus hat Merck mit Regierungen weltweit Liefer- und Vorkaufsvereinbarungen für Molnupiravir abgeschlossen, darunter auch mit der britischen Regierung für 480.000 Therapieschritte, vorbehaltlich der behördlichen Genehmigung, und befindet sich derzeit in Gesprächen mit weiteren Regierungen.
12:45 Uhr · Business Wire (engl.) · Merck & Co |
08.05.24 · wO Newsflash · BMW |
04.05.24 · wO Chartvergleich · American Express |
01.05.24 · dpa-AFX · Bayer |
29.04.24 · dpa-AFX · Bayer |
27.04.24 · wO Chartvergleich · AT & S Austria Technologie & Systemtechnik |