Exelixis....ein schlafender Riese? USD 3.40 am 14.5.2014 - 500 Beiträge pro Seite
eröffnet am 15.05.14 05:58:48 von
neuester Beitrag 29.06.21 21:28:56 von
neuester Beitrag 29.06.21 21:28:56 von
Beiträge: 832
ID: 1.194.406
ID: 1.194.406
Aufrufe heute: 0
Gesamt: 97.303
Gesamt: 97.303
Aktive User: 0
ISIN: US30161Q1040 · WKN: 936718 · Symbol: EXEL
23,730
USD
+0,13 %
+0,030 USD
Letzter Kurs 02:00:00 Nasdaq
Neuigkeiten
16.04.24 · Business Wire (engl.) |
01.04.24 · wO Chartvergleich |
29.03.24 · wO Chartvergleich |
28.03.24 · wO Chartvergleich |
27.02.24 · Business Wire (engl.) |
Werte aus der Branche Biotechnologie
| Wertpapier | Kurs | Perf. % |
|---|---|---|
| 25,28 | +72,56 | |
| 4,7450 | +35,57 | |
| 5,0200 | +26,13 | |
| 8,9900 | +22,31 | |
| 0,6650 | +19,82 |
| Wertpapier | Kurs | Perf. % |
|---|---|---|
| 0,6050 | -18,24 | |
| 6,5500 | -19,14 | |
| 3,9900 | -21,30 | |
| 2,3100 | -25,00 | |
| 7,2800 | -59,58 |
zu Cabozantinib wurden folgende Beiträge auf ASCO (American Society for Clinical Oncology) angekündigt:
Oral Presentation
Abstract 4501: “Effect of cabozantinib on immunosuppressive subsets in metastatic urothelial carcinoma.”
[Note: This is an NCI-CTEP study.]
Dr. Andrea Apolo, Center for Cancer Research, National Cancer Institute, Bethesda, MD
Oral Abstract Session: Genitourinary Cancer
Monday, June 2, 9:45 a.m. - 12:45 p.m., E Hall D1 (talk from 9:57-10:09 a.m.)
Poster Discussion Presentation
Abstract 5027/Poster 42: “Phase 1 dose finding study of cabozantinib (cabo) + abiraterone (abi) combination therapy in castration resistant prostate cancer (CRPC): An investigator-sponsored study.”
[Note: This is an Investigator-Sponsored Trial.]
Dr. Christopher Sweeney, The Dana Farber Cancer Institute, Boston, MA
Poster Highlights Session: Genitourinary (Prostate) Cancer
Saturday, May 31, 1:15-4:15 p.m. (poster display, E354b); 4:45-6:00 p.m. (discussion, E354b)
Abstract 8014/Poster 28: “Phase II trial of XL184 (cabozantinib) plus erlotinib in patients (pts) with advanced EGFR-mutant non-small cell lung cancer (NSCLC) with progressive disease (PD) on epidermal growth factor receptor (EGFR) tyrosine kinase inhibitor (TKI) therapy: a California Cancer Consortium phase II trial (NCI 9303).”
[Note: This is an NCI-CTEP study.]
Dr. Karen Reckamp, City of Hope Cancer Center, Duarte, California
Poster Highlights Session: Lung Cancer
Tuesday, June 3, 8:00–11:00 a.m. (poster display, room E354b); 11:30 a.m.–12:45 p.m. (discussion, E354b)
General Poster Presentations
Abstract TPS4150/Poster 234A: “Phase 3 randomized, double-blind, controlled study of cabozantinib (XL184) versus placebo in subjects with hepatocellular carcinoma who have received prior sorafenib (CELESTIAL; NCT01908426).”
Dr. Ghassan K. Abou-Alfa, Memorial Sloan-Kettering Cancer Center, New York
General Poster Session: Gastrointestinal (Noncolorectal) Cancer
Saturday, May 31, 8:00-11:45 a.m., South Hall A2
[Note: This is a Trials in Progress abstract.]
Abstract TPS4157/Poster 237B: “A phase II trial of cabozantinib in patients with carcinoid and pancreatic neuroendocrine tumors.”
[Note: This is an Investigator-Sponsored Trial, and a Trials in Progress abstract.]
Dr. Jason Faris, Massachusetts General Hospital, Boston, MA
General Poster Session: Gastrointestinal (Noncolorectal) Cancer
Saturday, May 31, 8:00-11:45 a.m., South Hall A2
Abstract TPS5629/Poster 402A: “Phase II study of XL184 (Cabozantinib) in recurrent or metastatic endometrial cancer: A trial of the PMH, Chicago and California Phase II Consortia.”
[Note: This is an NCI-CTEP study, and a Trials in Progress abstract.]
Dr. Michelle Wilson, Princess Margaret Cancer Centre, Toronto, Ontario, Canada
General Poster Session: Gynecologic Cancer
Saturday, May 31, 8:00-11:45 a.m., South Hall A2
Abstract 10078/Poster 379: “A phase I study of Cabozantinib (XL184) in children and adolescents with recurrent or refractory solid tumors, including CNS tumors: A Children’s Oncology Group phase I consortium trial.”
[Note: This is an NCI-CTEP study.]
Dr. Meredith K. Chuk, The Johns Hopkins Hospital, Baltimore, MD
General Poster Session: Pediatric Oncology
Monday, June 2, 8:00-11:45 a.m., South Hall A2
Abstract TPS4601/Poster 163A: “Phase 3 randomized study of cabozantinib (XL184) versus everolimus in subjects with clear cell renal cell carcinoma (METEOR).”
[Note: This is a Trials in Progress abstract.]
Dr. Toni K. Choueiri, Dana Farber Cancer Institute, Boston, MA
General Poster Session: Genitourinary Cancer
Monday, June 2, 1:15-5:00 p.m., South Hall A2
Abstract 5072/Poster 201: “A safety study of cabozantinib (C) plus docetaxel (D) and prednisone (P) in metastatic castrate-resistant prostate cancer (mCRPC).”
[Note: This is an NCI-CTEP study.]
Dr. Fatima Karzai, Center for Cancer Research, National Cancer Institute, Bethesda, MD
General Poster Session: Genitourinary Cancer
Monday, June 2, 1:15–5:00 p.m., South Hall A2
Oral Presentation
Abstract 4501: “Effect of cabozantinib on immunosuppressive subsets in metastatic urothelial carcinoma.”
[Note: This is an NCI-CTEP study.]
Dr. Andrea Apolo, Center for Cancer Research, National Cancer Institute, Bethesda, MD
Oral Abstract Session: Genitourinary Cancer
Monday, June 2, 9:45 a.m. - 12:45 p.m., E Hall D1 (talk from 9:57-10:09 a.m.)
Poster Discussion Presentation
Abstract 5027/Poster 42: “Phase 1 dose finding study of cabozantinib (cabo) + abiraterone (abi) combination therapy in castration resistant prostate cancer (CRPC): An investigator-sponsored study.”
[Note: This is an Investigator-Sponsored Trial.]
Dr. Christopher Sweeney, The Dana Farber Cancer Institute, Boston, MA
Poster Highlights Session: Genitourinary (Prostate) Cancer
Saturday, May 31, 1:15-4:15 p.m. (poster display, E354b); 4:45-6:00 p.m. (discussion, E354b)
Abstract 8014/Poster 28: “Phase II trial of XL184 (cabozantinib) plus erlotinib in patients (pts) with advanced EGFR-mutant non-small cell lung cancer (NSCLC) with progressive disease (PD) on epidermal growth factor receptor (EGFR) tyrosine kinase inhibitor (TKI) therapy: a California Cancer Consortium phase II trial (NCI 9303).”
[Note: This is an NCI-CTEP study.]
Dr. Karen Reckamp, City of Hope Cancer Center, Duarte, California
Poster Highlights Session: Lung Cancer
Tuesday, June 3, 8:00–11:00 a.m. (poster display, room E354b); 11:30 a.m.–12:45 p.m. (discussion, E354b)
General Poster Presentations
Abstract TPS4150/Poster 234A: “Phase 3 randomized, double-blind, controlled study of cabozantinib (XL184) versus placebo in subjects with hepatocellular carcinoma who have received prior sorafenib (CELESTIAL; NCT01908426).”
Dr. Ghassan K. Abou-Alfa, Memorial Sloan-Kettering Cancer Center, New York
General Poster Session: Gastrointestinal (Noncolorectal) Cancer
Saturday, May 31, 8:00-11:45 a.m., South Hall A2
[Note: This is a Trials in Progress abstract.]
Abstract TPS4157/Poster 237B: “A phase II trial of cabozantinib in patients with carcinoid and pancreatic neuroendocrine tumors.”
[Note: This is an Investigator-Sponsored Trial, and a Trials in Progress abstract.]
Dr. Jason Faris, Massachusetts General Hospital, Boston, MA
General Poster Session: Gastrointestinal (Noncolorectal) Cancer
Saturday, May 31, 8:00-11:45 a.m., South Hall A2
Abstract TPS5629/Poster 402A: “Phase II study of XL184 (Cabozantinib) in recurrent or metastatic endometrial cancer: A trial of the PMH, Chicago and California Phase II Consortia.”
[Note: This is an NCI-CTEP study, and a Trials in Progress abstract.]
Dr. Michelle Wilson, Princess Margaret Cancer Centre, Toronto, Ontario, Canada
General Poster Session: Gynecologic Cancer
Saturday, May 31, 8:00-11:45 a.m., South Hall A2
Abstract 10078/Poster 379: “A phase I study of Cabozantinib (XL184) in children and adolescents with recurrent or refractory solid tumors, including CNS tumors: A Children’s Oncology Group phase I consortium trial.”
[Note: This is an NCI-CTEP study.]
Dr. Meredith K. Chuk, The Johns Hopkins Hospital, Baltimore, MD
General Poster Session: Pediatric Oncology
Monday, June 2, 8:00-11:45 a.m., South Hall A2
Abstract TPS4601/Poster 163A: “Phase 3 randomized study of cabozantinib (XL184) versus everolimus in subjects with clear cell renal cell carcinoma (METEOR).”
[Note: This is a Trials in Progress abstract.]
Dr. Toni K. Choueiri, Dana Farber Cancer Institute, Boston, MA
General Poster Session: Genitourinary Cancer
Monday, June 2, 1:15-5:00 p.m., South Hall A2
Abstract 5072/Poster 201: “A safety study of cabozantinib (C) plus docetaxel (D) and prednisone (P) in metastatic castrate-resistant prostate cancer (mCRPC).”
[Note: This is an NCI-CTEP study.]
Dr. Fatima Karzai, Center for Cancer Research, National Cancer Institute, Bethesda, MD
General Poster Session: Genitourinary Cancer
Monday, June 2, 1:15–5:00 p.m., South Hall A2
auch Cobimetinib wird auf ASCO zum Thema:
he cobimetinib oral presentation expected at the meeting (time Central Daylight Time):
Abstract 9006: “Metabolic tumor burden for prediction of overall survival following combined BRAF/MEK inhibition in patients with advanced BRAF mutant melanoma.”
Prof. Grant A. MacArthur, Peter MacCallum Cancer Centre, Victoria, Australia
Oral Abstract Session: Melanoma/Skin Cancers
Monday, June 2, 3:00-6:00 p.m, E Arie Crown Theater (talk from 4:36–4:48 p.m.)
Und möglicherweise erfährt man etwas über coBRIM, das ist die ph3-Pivotalstudie zu Cobimetinib/Vemurafenib zur Behandlung von schwarzem Hautkrebs, und zwar an folgendem Forum:
We are pleased to invite you to an analyst briefing to discuss data presented on the Roche Group's oncology products and pipeline at the American Society of Clinical Oncology Annual Meeting (ASCO) in Chicago (30 May - 3 June 2014).
Venue
Marriott Downtown Chicago
Chicago A-D (Level 5)
540 North Michigan Avenue
60611 Chicago
map
Date/Time
Sunday, 1 June 2014
6:30pm to 8:00pm Central Daylight Time CDT (Chicago)
followed by a buffet reception.
Download to my calendar
Agenda
Cancer Immunotherapy: Translating science into medical benefit
Ira Mellman, Vice President, Cancer Immunology, Genentech
Hy Levitsky, Head Cancer Immunotherapy Experimental Medicine, Roche Pharma Research and Early Development
Oncology pipeline update
Sandra Horning, Chief Medical Officer and Head Global Product Development
Oncology business and strategy update
Daniel O'Day, Chief Operating Officer Roche Pharmaceutical
Meeting information
Date: 1 June 2014
Time (CDT):
6:00pm Registration desk opens
6:30pm Start of meeting
8:00pm End of meeting followed by a buffet reception
he cobimetinib oral presentation expected at the meeting (time Central Daylight Time):
Abstract 9006: “Metabolic tumor burden for prediction of overall survival following combined BRAF/MEK inhibition in patients with advanced BRAF mutant melanoma.”
Prof. Grant A. MacArthur, Peter MacCallum Cancer Centre, Victoria, Australia
Oral Abstract Session: Melanoma/Skin Cancers
Monday, June 2, 3:00-6:00 p.m, E Arie Crown Theater (talk from 4:36–4:48 p.m.)
Und möglicherweise erfährt man etwas über coBRIM, das ist die ph3-Pivotalstudie zu Cobimetinib/Vemurafenib zur Behandlung von schwarzem Hautkrebs, und zwar an folgendem Forum:
We are pleased to invite you to an analyst briefing to discuss data presented on the Roche Group's oncology products and pipeline at the American Society of Clinical Oncology Annual Meeting (ASCO) in Chicago (30 May - 3 June 2014).
Venue
Marriott Downtown Chicago
Chicago A-D (Level 5)
540 North Michigan Avenue
60611 Chicago
map
Date/Time
Sunday, 1 June 2014
6:30pm to 8:00pm Central Daylight Time CDT (Chicago)
followed by a buffet reception.
Download to my calendar
Agenda
Cancer Immunotherapy: Translating science into medical benefit
Ira Mellman, Vice President, Cancer Immunology, Genentech
Hy Levitsky, Head Cancer Immunotherapy Experimental Medicine, Roche Pharma Research and Early Development
Oncology pipeline update
Sandra Horning, Chief Medical Officer and Head Global Product Development
Oncology business and strategy update
Daniel O'Day, Chief Operating Officer Roche Pharmaceutical
Meeting information
Date: 1 June 2014
Time (CDT):
6:00pm Registration desk opens
6:30pm Start of meeting
8:00pm End of meeting followed by a buffet reception
Immer wieder tolle Beiträge.Alle Infos in Englisch.Wenn das inne Hose geht kann man ja auf Übersetzungsfehler hinweisen.
Exelixis sichert das geistige Eigentum über eine Vielzahl von Patenten und Applikationen - weiss jemand den Unterschied?
Results of Search in US Patent Collection db for:
AN/Exelixis: 118 patents.
Hits 1 through 50 out of 118
http://patft.uspto.gov/netacgi/nph-Parser?Sect1=PTO2&Sect2=H…
Results of Search in PGPUB Full-Text Database for:
AN/Exelixis: 158 applications.
Hits 1 through 50 out of 158
http://appft.uspto.gov/netacgi/nph-Parser?Sect1=PTO2&Sect2=H…
Results of Search in US Patent Collection db for:
AN/Exelixis: 118 patents.
Hits 1 through 50 out of 118
http://patft.uspto.gov/netacgi/nph-Parser?Sect1=PTO2&Sect2=H…
Results of Search in PGPUB Full-Text Database for:
AN/Exelixis: 158 applications.
Hits 1 through 50 out of 158
http://appft.uspto.gov/netacgi/nph-Parser?Sect1=PTO2&Sect2=H…
Antwort auf Beitrag Nr.: 46.990.916 von VanGillen am 15.05.14 19:37:48In Biotech zu investieren ohne englische Sprachkenntnisse halte ich für sehr gewagt, weil die allermeisten wichtigen Informationen fast ausschliesslich in Englisch zur Verfügung stehen.
Deswegen werden die zitierten Beiträge auch nur seltenst in Deutsch zu haben sein.
Good luck!
Deswegen werden die zitierten Beiträge auch nur seltenst in Deutsch zu haben sein.
Good luck!
Antwort auf Beitrag Nr.: 47.001.432 von Cyberhexe am 17.05.14 15:16:39
58 studies found for: cabozantinib
http://www.clinicaltrials.gov/ct2/results?term=cabozantinib
Es ist unglaublich, wie intensiv Cabozantinib in der Klinik getestet wird, wobei einige der Studien vom National Cancer Institute (NCI) finanziert werden.
15 studies found for: cobimetinib
http://www.clinicaltrials.gov/ct2/results?term=cobimetinib
Aber auch Cobimetinib wird vielfältig untersucht und zwar zusammen mit vemurafenib, Onartuzumab, MPDL3280A, GDC-0941, itraconazole, MEHD7945A und GDC-0068 in den unterschiedlichsten Indikationen.
58 studies found for: cabozantinib
http://www.clinicaltrials.gov/ct2/results?term=cabozantinib
Es ist unglaublich, wie intensiv Cabozantinib in der Klinik getestet wird, wobei einige der Studien vom National Cancer Institute (NCI) finanziert werden.
15 studies found for: cobimetinib
http://www.clinicaltrials.gov/ct2/results?term=cobimetinib
Aber auch Cobimetinib wird vielfältig untersucht und zwar zusammen mit vemurafenib, Onartuzumab, MPDL3280A, GDC-0941, itraconazole, MEHD7945A und GDC-0068 in den unterschiedlichsten Indikationen.
Rückgang von Knochenmetastasen, Behandlung mit Cabozantinib
Von jacekw 8. Oktober 2013 Behandlung, Medikamente, prostatakrebs news
inShare
Rückgang von Knochenmetastasen bei Prostatakrebs unter Behandlung mit Cabozantinib
Cabozantinib als Kapseln wird vermarkted in USA unter der Cabozantinib Cometriq XL184 ProstatakrebsName Cometriq, bekannt auch als XL184. Der Kinase-Inhibitor Cometriq wird von Exelixis produziert, einer Pharmafirma aus San Francisco.
Cabozantinib Konzentrat und Lösungsmittel zur Herstellung einer Infusionslösung, wird vermarkted bei uns unter der Name Jevtana. Wird von Sanofi-Aventis Deutschland GmbH produziert.
Wirkstoff Cabozantinib gehört zu der Gruppe der Kinasehemmer.
Cabozantinib Cometriq XL184 zeigte in einer Untersuchung bei Patienten mit knochenmetastasiertem Prostatakarzinom innerhalb kurzer Zeit einen deutlichen Rückgang der Knochenmetastasen. Einige Patienten wurden nach der Behandlung im gesamten Skelett Metastasen frei.
In der Studie wurden 20 Patienten untersucht und nur bei einem hat sich keine positive Wirkung gegen die Metastasen gezeigt.
Ob sich die Behandlung mit XL184 auf das Überleben der Patienten auswirkt ist aktuell noch nicht bekannt.
Bisher wird zur Behandlung des fortschreitenden, metastasierenden, medullären Schilddrüsenkarzinoms eingesetzt.
Cabozantinib hat antitumorale Eigenschaften: hemmt verschiedene Tyrosinkinasen (RET, MET, VEGFR-1, -2, -3, KIT, TRKB, FLT-3, AXL, TIE-2), die an der Entstehung und am Wachstum von Tumoren und an der Gefässneubildung beteiligt sind.
Cometriq, Wirkstoff Cabozantinib wurde in den USA Ende November 2012 in Form von Kapseln zur Behandlung von bereits metastasiertem medullären Schilddrüsenkarzinom zugelassen
Die Cometriq Kapseln sollen nüchtern eingenommen werden (zwei Stunden vor oder eine Stunde nach dem Essen) und nicht zusammen mit Grapefruitsaft und anderen Fruchtsäften angenommen werden.
Jevtana® 60 mg Konzentrat und Lösungsmittel zur Herstellung einer Infusionslösung, Wirkstoff Cabozantinib ist seit April 2011 verfügbar.
Jevtana wird alle drei Wochen als einstündige Infusion in einer Dosis von 25 mg pro Quadratmeter Körperoberfläche gegeben. Zusätzlich müssen die Patienten täglich 10 mg Prednison oder Prednisolon oral einnehmen.
Nebenwirkungen
Cabozantinib ist ein Substrat von CYP3A4 und hat entsprechende Nebenwirkungen.
Zu den häufigsten Nebenwirkungen gehören Durchfall, Hand-Fuss-Syndrom, Appetitmangel, Gewichtsverlust, Übelkeit, Müdigkeit, Entzündungen und Geschwüre im Mund, Ergrauen der Haare und Haarausfall, Geschmacksstörungen, Bluthochdruck, Bauchschmerzen und Verstopfung, Schmerzen und Schwellungen der Finger.
Auch andere Nebenwirkungen wie Verschlechterung der Leberenzymwerte und der Zahl der Leukozyten und Thrombozyten sind möglich.
In den zulassungsrelevanten Studien bei Schilddrüsenkarzinom überlebten Patienten, durchschnittlich 11,2 Monate progressionsfrei. Bei Patienten, die Placebo erhalten hatten, lag die Spanne bei vier Monaten. Die Tumorgröße hat sich bei den mit Cometriq behandelten Patienten reduziert.
Cabozantinib wird gegenwärtig auch bei Krebserkrankungen von Eierstöcken, Gehirn, Brust, nicht-kleinzelligem Bronchialkarzinom, Melanom und hepatozellulärem Karzinom getestet
Kosten, Preis für Jevtana, Cabozantinib
JEVTANA 60 mg Infusionslösungskonzentrat von Sanofi-Aventis Deutschland GmbH Packung: 1 ST | N1 kostet (Stand Jan. 2014) 5444,27 €
Kosten, Preis für Cometriq, Cabozantinib
Eine Packung mit 28 Kapseln mit 140mg Cometrig kostet in USA aktuell (Stand Okt.2013) um die 2.630 $
- See more at: http://prostatakrebs-tipps.de/cabozantinib-cometriq/#sthash.…
Von jacekw 8. Oktober 2013 Behandlung, Medikamente, prostatakrebs news
inShare
Rückgang von Knochenmetastasen bei Prostatakrebs unter Behandlung mit Cabozantinib
Cabozantinib als Kapseln wird vermarkted in USA unter der Cabozantinib Cometriq XL184 ProstatakrebsName Cometriq, bekannt auch als XL184. Der Kinase-Inhibitor Cometriq wird von Exelixis produziert, einer Pharmafirma aus San Francisco.
Cabozantinib Konzentrat und Lösungsmittel zur Herstellung einer Infusionslösung, wird vermarkted bei uns unter der Name Jevtana. Wird von Sanofi-Aventis Deutschland GmbH produziert.
Wirkstoff Cabozantinib gehört zu der Gruppe der Kinasehemmer.
Cabozantinib Cometriq XL184 zeigte in einer Untersuchung bei Patienten mit knochenmetastasiertem Prostatakarzinom innerhalb kurzer Zeit einen deutlichen Rückgang der Knochenmetastasen. Einige Patienten wurden nach der Behandlung im gesamten Skelett Metastasen frei.
In der Studie wurden 20 Patienten untersucht und nur bei einem hat sich keine positive Wirkung gegen die Metastasen gezeigt.
Ob sich die Behandlung mit XL184 auf das Überleben der Patienten auswirkt ist aktuell noch nicht bekannt.
Bisher wird zur Behandlung des fortschreitenden, metastasierenden, medullären Schilddrüsenkarzinoms eingesetzt.
Cabozantinib hat antitumorale Eigenschaften: hemmt verschiedene Tyrosinkinasen (RET, MET, VEGFR-1, -2, -3, KIT, TRKB, FLT-3, AXL, TIE-2), die an der Entstehung und am Wachstum von Tumoren und an der Gefässneubildung beteiligt sind.
Cometriq, Wirkstoff Cabozantinib wurde in den USA Ende November 2012 in Form von Kapseln zur Behandlung von bereits metastasiertem medullären Schilddrüsenkarzinom zugelassen
Die Cometriq Kapseln sollen nüchtern eingenommen werden (zwei Stunden vor oder eine Stunde nach dem Essen) und nicht zusammen mit Grapefruitsaft und anderen Fruchtsäften angenommen werden.
Jevtana® 60 mg Konzentrat und Lösungsmittel zur Herstellung einer Infusionslösung, Wirkstoff Cabozantinib ist seit April 2011 verfügbar.
Jevtana wird alle drei Wochen als einstündige Infusion in einer Dosis von 25 mg pro Quadratmeter Körperoberfläche gegeben. Zusätzlich müssen die Patienten täglich 10 mg Prednison oder Prednisolon oral einnehmen.
Nebenwirkungen
Cabozantinib ist ein Substrat von CYP3A4 und hat entsprechende Nebenwirkungen.
Zu den häufigsten Nebenwirkungen gehören Durchfall, Hand-Fuss-Syndrom, Appetitmangel, Gewichtsverlust, Übelkeit, Müdigkeit, Entzündungen und Geschwüre im Mund, Ergrauen der Haare und Haarausfall, Geschmacksstörungen, Bluthochdruck, Bauchschmerzen und Verstopfung, Schmerzen und Schwellungen der Finger.
Auch andere Nebenwirkungen wie Verschlechterung der Leberenzymwerte und der Zahl der Leukozyten und Thrombozyten sind möglich.
In den zulassungsrelevanten Studien bei Schilddrüsenkarzinom überlebten Patienten, durchschnittlich 11,2 Monate progressionsfrei. Bei Patienten, die Placebo erhalten hatten, lag die Spanne bei vier Monaten. Die Tumorgröße hat sich bei den mit Cometriq behandelten Patienten reduziert.
Cabozantinib wird gegenwärtig auch bei Krebserkrankungen von Eierstöcken, Gehirn, Brust, nicht-kleinzelligem Bronchialkarzinom, Melanom und hepatozellulärem Karzinom getestet
Kosten, Preis für Jevtana, Cabozantinib
JEVTANA 60 mg Infusionslösungskonzentrat von Sanofi-Aventis Deutschland GmbH Packung: 1 ST | N1 kostet (Stand Jan. 2014) 5444,27 €
Kosten, Preis für Cometriq, Cabozantinib
Eine Packung mit 28 Kapseln mit 140mg Cometrig kostet in USA aktuell (Stand Okt.2013) um die 2.630 $
- See more at: http://prostatakrebs-tipps.de/cabozantinib-cometriq/#sthash.…
ASCO steht vor der Tür...und Roche hat für den 1. Juni ein Treffen mit Analysten angekündugt, um über die Fortschritte in der Onkologie-Pipeline zu berichten:
http://www.roche.com/investors/ir_agenda/asco-2014.htm
Vielleicht erfährt man etwas über coBRIM, der ph3-Studie mit Vemurafenib+Cobimetinib zur Behandlaung von schwarzem Hautkrebs. Diese Studie befindet sich derzeit im "read-out Modus".
http://www.roche.com/de/media/media_releases/med-cor-2014-05…
Abstract 9006
Zelboraf (Vemurafenib) + Cobimetinib (Prüftherapie) Metabolische Tumorlast zur Vorhersage des Gesamtüberlebens nach kombinierter BRAF/MEK-Hemmung bei Patienten mit fortgeschrittenem BRAF-mutiertem Melanom.
http://www.finanzen.ch/nachrichten/aktien/Roche-erzielt-erst…
Aufgrund der vorliegenden Datenanalyse sollte von Anfang an die Behandlung des Melanoms mit der Kombinationstherapie gestartet werden, um nicht erst die sonst sich relativ schnell entwickelnden Resistenzen gegen den BRAF-Inhibitor allein aufkommen zu lassen und damit wertvolle Zeit in der Behandlung der Patienten zu verlieren, kommentiert der zuständige Analyst der Zürcher Kantonalbank (ZKB). "Wir könnten uns daher vorstellen, dass Roche die Phase-III Daten nicht abwartet, sondern ein rollierendes Zulassungsverfahren bzw. vorerst eine provisorische Zulassung sogleich beantragen wird", so die ZKB.
über Cabozantinib wird auf dem Treffen der American Society of Clinical Oncology (ASCO) natürlich auch intensiv berichtet werden:
http://meetinglibrary.asco.org/search/site/cabozantinib?the_…
http://www.roche.com/investors/ir_agenda/asco-2014.htm
Vielleicht erfährt man etwas über coBRIM, der ph3-Studie mit Vemurafenib+Cobimetinib zur Behandlaung von schwarzem Hautkrebs. Diese Studie befindet sich derzeit im "read-out Modus".
http://www.roche.com/de/media/media_releases/med-cor-2014-05…
Abstract 9006
Zelboraf (Vemurafenib) + Cobimetinib (Prüftherapie) Metabolische Tumorlast zur Vorhersage des Gesamtüberlebens nach kombinierter BRAF/MEK-Hemmung bei Patienten mit fortgeschrittenem BRAF-mutiertem Melanom.
http://www.finanzen.ch/nachrichten/aktien/Roche-erzielt-erst…
Aufgrund der vorliegenden Datenanalyse sollte von Anfang an die Behandlung des Melanoms mit der Kombinationstherapie gestartet werden, um nicht erst die sonst sich relativ schnell entwickelnden Resistenzen gegen den BRAF-Inhibitor allein aufkommen zu lassen und damit wertvolle Zeit in der Behandlung der Patienten zu verlieren, kommentiert der zuständige Analyst der Zürcher Kantonalbank (ZKB). "Wir könnten uns daher vorstellen, dass Roche die Phase-III Daten nicht abwartet, sondern ein rollierendes Zulassungsverfahren bzw. vorerst eine provisorische Zulassung sogleich beantragen wird", so die ZKB.
über Cabozantinib wird auf dem Treffen der American Society of Clinical Oncology (ASCO) natürlich auch intensiv berichtet werden:
http://meetinglibrary.asco.org/search/site/cabozantinib?the_…
ASCO 2014: New drug may overcome lung cancer’s chemotherapy resistance
For lung cancer patients whose tumors are resistant to a class of chemotherapy called tyrosine kinase inhibitors (TKI), a drug called cabozantinib may be able to undo that resistance, according to a new City of Hope study.
A new City of Hope study shows that the drug cabozantinib undo lung cancer's resistance to chemotherapy.
A new City of Hope study shows that the drug cabozantinib could help undo lung cancer's resistance to chemotherapy.
The results will be presented at the American Society of Clinical Oncology's annual meeting on June 3.
"Previous studies have shown that in patients with nonsmall cell lung cancer linked to a EGFR gene mutation, the proteins MET and VEGF promote tumor growth and make it resistant to TKI chemotherapy," said Karen Reckamp, M.D., M.S., co-director of the Lung Cancer and Thoracic Oncology Program and first author of the abstract. "Because cabozantinib can block both of these proteins, we want to see if can can reverse that drug resistance as well."
For this phase II trial, Reckamp and her colleagues studied 35 patients with advanced, EGFR-mutant nonsmall cell lung cancer whose disease had progressed despite TKI therapy. The patients were given 40 milligrams of cabozantinib in addition to 150 milligrams of TKI drug erlotinib daily for 28 days, and were then examined to determine whether their tumors had responded to the combination therapy.
In the abstract, Reckamp reported that the cabozanitinib-erlotinib combination therapy significantly slowed tumor growth, as measured by a slower doubling time (the amount of time it takes a tumor to double in size) compared to before the treatment. Additionally, four patients showed partial remission of their cancer while on cabozantinib-erlotinib therapy. Based on these findings, the researchers noted that the cabozantinib-erlotinib regimen has potential benefits for patients with EGFR-mutant nonsmall cell lung cancer that should be further investigated.
Cabozantinib is currently approved for medullary thyroid cancer and is also being tested in clinical trials for melanoma, brain tumors, and liver, breast, ovarian and prostate cancers.
For lung cancer patients whose tumors are resistant to a class of chemotherapy called tyrosine kinase inhibitors (TKI), a drug called cabozantinib may be able to undo that resistance, according to a new City of Hope study.
A new City of Hope study shows that the drug cabozantinib undo lung cancer's resistance to chemotherapy.
A new City of Hope study shows that the drug cabozantinib could help undo lung cancer's resistance to chemotherapy.
The results will be presented at the American Society of Clinical Oncology's annual meeting on June 3.
"Previous studies have shown that in patients with nonsmall cell lung cancer linked to a EGFR gene mutation, the proteins MET and VEGF promote tumor growth and make it resistant to TKI chemotherapy," said Karen Reckamp, M.D., M.S., co-director of the Lung Cancer and Thoracic Oncology Program and first author of the abstract. "Because cabozantinib can block both of these proteins, we want to see if can can reverse that drug resistance as well."
For this phase II trial, Reckamp and her colleagues studied 35 patients with advanced, EGFR-mutant nonsmall cell lung cancer whose disease had progressed despite TKI therapy. The patients were given 40 milligrams of cabozantinib in addition to 150 milligrams of TKI drug erlotinib daily for 28 days, and were then examined to determine whether their tumors had responded to the combination therapy.
In the abstract, Reckamp reported that the cabozanitinib-erlotinib combination therapy significantly slowed tumor growth, as measured by a slower doubling time (the amount of time it takes a tumor to double in size) compared to before the treatment. Additionally, four patients showed partial remission of their cancer while on cabozantinib-erlotinib therapy. Based on these findings, the researchers noted that the cabozantinib-erlotinib regimen has potential benefits for patients with EGFR-mutant nonsmall cell lung cancer that should be further investigated.
Cabozantinib is currently approved for medullary thyroid cancer and is also being tested in clinical trials for melanoma, brain tumors, and liver, breast, ovarian and prostate cancers.
Cobi-Konkurrent Mekinist scheint nicht so zu überzeugen...
Gruß
ipollit

Gruß
ipollit
...und wieder hat Exelxis ein neues Patent bzw. "patent application" gesichert, wobei das Unternehmen den Peer-Vergleich mit anderen Unternehmen ähnlicher Grösse nicht zu scheuen braucht:
http://appft.uspto.gov/netacgi/nph-Parser?Sect1=PTO2&Sect2=H…
http://patft.uspto.gov/netacgi/nph-Parser?Sect1=PTO2&Sect2=H…
United States Patent Application 20140155378
Kind Code A9
Bannen; Lynne Canne ; et al. June 5, 2014
c-Met Modulators and Method of Use
Abstract
The present invention provides compounds for modulating protein kinase enzymatic activity for modulating cellular activities such as proliferation, differentiation, programmed cell death, migration and chemoinvasion. More specifically, the invention provides quinazolines and quinolines which inhibit, regulate, and/or modulate kinase receptor, particularly c-Met, KDF, c-Kit, flt-3 and flt-4, signal transduction pathways related to the changes in cellular activities as mentioned above, compositions which contain these compounds, and methods of using them to treat kinase-dependent diseases and conditions. The present invention also provides methods for making compounds as mentioned above, and compositions which contain these compounds.
Inventors: Bannen; Lynne Canne; (Lucerne, CA) ; Chan; Diva Sze-ming; (Oakland, CA) ; Chen; Jeff; (San Francisco, CA) ; Forsyth; Timothy Patrick; (Hayward, CA) ; Huynh; Tai Phat; (Oakland, CA) ; Jammalamadaka; Vasu; (Pleasanton, CA) ; Khoury; Richard George; (San Mateo, CA) ; Leahy; James William; (San Leandro, CA) ; Mac; Morrison B.; (San Francisco, CA) ; Mann; Larry W.; (Richland, MI) ; Nuss; John M.; (Danville, CA) ; Parks; Jason Jevious; (Sacramento, CA) ; Takeuchi; Craig Stacy; (Burlingame, CA) ; Wang; Yong; (Foster City, CA) ; Xu; Wei; (Danville, CA)
Applicant:
Name City State Country Type
Exelixis, Inc.
South San Francisco
CA
US
Assignee: Exelixis, Inc.
South San Francisco
CA
http://appft.uspto.gov/netacgi/nph-Parser?Sect1=PTO2&Sect2=H…
http://patft.uspto.gov/netacgi/nph-Parser?Sect1=PTO2&Sect2=H…
United States Patent Application 20140155378
Kind Code A9
Bannen; Lynne Canne ; et al. June 5, 2014
c-Met Modulators and Method of Use
Abstract
The present invention provides compounds for modulating protein kinase enzymatic activity for modulating cellular activities such as proliferation, differentiation, programmed cell death, migration and chemoinvasion. More specifically, the invention provides quinazolines and quinolines which inhibit, regulate, and/or modulate kinase receptor, particularly c-Met, KDF, c-Kit, flt-3 and flt-4, signal transduction pathways related to the changes in cellular activities as mentioned above, compositions which contain these compounds, and methods of using them to treat kinase-dependent diseases and conditions. The present invention also provides methods for making compounds as mentioned above, and compositions which contain these compounds.
Inventors: Bannen; Lynne Canne; (Lucerne, CA) ; Chan; Diva Sze-ming; (Oakland, CA) ; Chen; Jeff; (San Francisco, CA) ; Forsyth; Timothy Patrick; (Hayward, CA) ; Huynh; Tai Phat; (Oakland, CA) ; Jammalamadaka; Vasu; (Pleasanton, CA) ; Khoury; Richard George; (San Mateo, CA) ; Leahy; James William; (San Leandro, CA) ; Mac; Morrison B.; (San Francisco, CA) ; Mann; Larry W.; (Richland, MI) ; Nuss; John M.; (Danville, CA) ; Parks; Jason Jevious; (Sacramento, CA) ; Takeuchi; Craig Stacy; (Burlingame, CA) ; Wang; Yong; (Foster City, CA) ; Xu; Wei; (Danville, CA)
Applicant:
Name City State Country Type
Exelixis, Inc.
South San Francisco
CA
US
Assignee: Exelixis, Inc.
South San Francisco
CA
United States Patent 8,748,440
Martin , et al. June 10, 2014
Quinazolinone modulators of nuclear receptors
Abstract
Compounds, pharmaceutical compositions and methods for modulating the activity of nuclear receptors are provided. In particular, quinazolinones are provided for modulating the activity of farnesoid X receptor (FXR) and/or orphan nuclear receptors.
--------------------------------------------------------------------------------
Inventors: Martin; Richard (San Diego, CA), Kahl; Jeffrey D (San Diego, CA), Flatt; Brenton T (Poway, CA), Griffith; Ronald (Escondido, CA)
Applicant: Name City State Country Type
Martin; Richard
Kahl; Jeffrey D
Flatt; Brenton T
Griffith; Ronald
San Diego
San Diego
Poway
Escondido
Assignee: Exelixis, Inc. (South San Francisco, CA)
Appl. No.: 13/247,328
Martin , et al. June 10, 2014
Quinazolinone modulators of nuclear receptors
Abstract
Compounds, pharmaceutical compositions and methods for modulating the activity of nuclear receptors are provided. In particular, quinazolinones are provided for modulating the activity of farnesoid X receptor (FXR) and/or orphan nuclear receptors.
--------------------------------------------------------------------------------
Inventors: Martin; Richard (San Diego, CA), Kahl; Jeffrey D (San Diego, CA), Flatt; Brenton T (Poway, CA), Griffith; Ronald (Escondido, CA)
Applicant: Name City State Country Type
Martin; Richard
Kahl; Jeffrey D
Flatt; Brenton T
Griffith; Ronald
San Diego
San Diego
Poway
Escondido
Assignee: Exelixis, Inc. (South San Francisco, CA)
Appl. No.: 13/247,328
neue Patentapplikation für Exelixis:
United States Patent Application 20140186407
Kind Code A9
Wilson; Jo Ann July 3, 2014
--------------------------------------------------------------------------------
C-Met Modulator Pharmaceutical Compositions
Abstract
Pharmaceutical compositions and unit dosage forms comprising Compound I are disclosed. ##STR00001##
Assignee: Exelixis Inc.
South San Francisco CA
United States Patent Application 20140186407
Kind Code A9
Wilson; Jo Ann July 3, 2014
--------------------------------------------------------------------------------
C-Met Modulator Pharmaceutical Compositions
Abstract
Pharmaceutical compositions and unit dosage forms comprising Compound I are disclosed. ##STR00001##
Assignee: Exelixis Inc.
South San Francisco CA
http://wallstcheatsheet.com/business/big-pharma-needs-growth…
Big Pharma Needs Growth: Two Severely Undervalued Companies Ripe for a Takeover
There is another company that I also believe is incredibly undervalued and the Street is completely discounting. I have identified Exelixis as a great takeover target for Pfizer or any other of its competitors. I think after a selloff in shares, Exelixis may on its own be one of the best opportunities for a trader to double their money this year. Why should Pfizer or any other company care about Exelixis? Well, Exelixis has been riding high all year. This multibillion dollar market capitalization company was recently just cut in half after the company’s update to its phase 3 results for Cometriq (also known as cabozantinib) as a treatment for late-stage prostate cancer.
...
But there is more. The company has a decent pipeline. Aside from thyroid cancer and prostate cancer, Cometriq is also being studied in two other phase 3 trials. These are the METEOR and CELESTIAL trials to study its effects relative to standard therapies. These trials will assess Comtriqs efficacy in hindering metastatic renal cell carcinoma and hepatocellular carcinoma patients who’ve received treatment with Nexavar. The only trouble is that competition is stiff with other companies. Thus, Exelixis data will have to be strong to gain market share. This may be why investors over reacted to the news that the COMET-1 study was continuing. In the mean time, the company has a bevy of other cooperative agreements with large players like Merck and GlaxoSmithKline that will provide the necessary cash that Exelixis requires to conduct its trials and further its research and development processes.
Exelixis also recently presented data for Cobimetinib in combincation with Vemurafenib to treat metastatic melanoma with a specific mutation (BRAF-600.) This is a little data heavy, but I will do my best to walk through the epidemiology. The phase 1b dose escalation study was designed to evaluate the safety and tolerability of cobimetinib in combination with vemurafenib. The dose escalation stage of the trial comprised 10 dosing cohorts of 3-6 patients and evaluated three different dosing schedules of cobimetinib in combination with twice daily administration of vemurafenib.
After the maximum tolerated dose, that is, the dose which patients can most reasonably withstand without severe side effects was defined, two dose cohorts were expanded and additional patients with BRAF-mutated melanoma who were either BRAFi-naïve or vemurafenib-progressing patients were accrued. As of October 1st, 2013, 129 patients had been treated, comprising 66 patients who had previously progressed while receiving vemurafenib and 63 patients who were BRAFi-naïve. Of the 63 BRAFi-naïve patients, 43 (68 percent) were previously untreated and 20 (32 percent) had been treated with agents other than a BRAFi. The majority of the patients had Stage IV, M1c melanoma at the time of enrollment (vemurafenib-progressors 82 percent, BRAFi-naïve 70 percent.) The median duration of follow-up in vemurafenib-progressor and BRAFi-naïve patients was 6.3 and 12.7 months, respectively.
The final results of the exploratory secondary endpoints of BRIM7 showed anti-tumor activity for the combination of cobimetinib and vemurafenib. In BRAFi-naïve patients (n=63), an 87% confirmed overall response rate (ORR) was achieved, including 10 percent complete responses and 78 percent partial responses. An additional 10 percent of patients achieved stable disease. The majority of tumor responses were observed within the first six weeks following initiation of treatment. The median progression free survival (PFS) for BRAFi-naïve patients was 13.7 months. Results for vemurafenib-progressor patients (n=66) showed a 15 percent confirmed ORR, 42 percent stable disease rate, and median PFS of 2.8 months. The median overall survival (OS) for BRAFi-naïve patients had not been reached, with a 1 year survival estimate of 83 percent. For the vemurafenib-progressor patients the median OS was 8.3 months with an estimated 1 year survival of 32 percent. Thus, the data were extremely favorable.
In summation, the data for both Synta and Exelixis are strong. Both deserve a multi-billion dollar market cap but are trading at a significant and short-term discount. Pfizer, Gilead, and its competitors will require growth. There is now question about that. The Street is completely discounting these companies and I think before it releases news that send stocks flying, a larger competitor that needs growth should consider stepping in.
Big Pharma Needs Growth: Two Severely Undervalued Companies Ripe for a Takeover
There is another company that I also believe is incredibly undervalued and the Street is completely discounting. I have identified Exelixis as a great takeover target for Pfizer or any other of its competitors. I think after a selloff in shares, Exelixis may on its own be one of the best opportunities for a trader to double their money this year. Why should Pfizer or any other company care about Exelixis? Well, Exelixis has been riding high all year. This multibillion dollar market capitalization company was recently just cut in half after the company’s update to its phase 3 results for Cometriq (also known as cabozantinib) as a treatment for late-stage prostate cancer.
...
But there is more. The company has a decent pipeline. Aside from thyroid cancer and prostate cancer, Cometriq is also being studied in two other phase 3 trials. These are the METEOR and CELESTIAL trials to study its effects relative to standard therapies. These trials will assess Comtriqs efficacy in hindering metastatic renal cell carcinoma and hepatocellular carcinoma patients who’ve received treatment with Nexavar. The only trouble is that competition is stiff with other companies. Thus, Exelixis data will have to be strong to gain market share. This may be why investors over reacted to the news that the COMET-1 study was continuing. In the mean time, the company has a bevy of other cooperative agreements with large players like Merck and GlaxoSmithKline that will provide the necessary cash that Exelixis requires to conduct its trials and further its research and development processes.
Exelixis also recently presented data for Cobimetinib in combincation with Vemurafenib to treat metastatic melanoma with a specific mutation (BRAF-600.) This is a little data heavy, but I will do my best to walk through the epidemiology. The phase 1b dose escalation study was designed to evaluate the safety and tolerability of cobimetinib in combination with vemurafenib. The dose escalation stage of the trial comprised 10 dosing cohorts of 3-6 patients and evaluated three different dosing schedules of cobimetinib in combination with twice daily administration of vemurafenib.
After the maximum tolerated dose, that is, the dose which patients can most reasonably withstand without severe side effects was defined, two dose cohorts were expanded and additional patients with BRAF-mutated melanoma who were either BRAFi-naïve or vemurafenib-progressing patients were accrued. As of October 1st, 2013, 129 patients had been treated, comprising 66 patients who had previously progressed while receiving vemurafenib and 63 patients who were BRAFi-naïve. Of the 63 BRAFi-naïve patients, 43 (68 percent) were previously untreated and 20 (32 percent) had been treated with agents other than a BRAFi. The majority of the patients had Stage IV, M1c melanoma at the time of enrollment (vemurafenib-progressors 82 percent, BRAFi-naïve 70 percent.) The median duration of follow-up in vemurafenib-progressor and BRAFi-naïve patients was 6.3 and 12.7 months, respectively.
The final results of the exploratory secondary endpoints of BRIM7 showed anti-tumor activity for the combination of cobimetinib and vemurafenib. In BRAFi-naïve patients (n=63), an 87% confirmed overall response rate (ORR) was achieved, including 10 percent complete responses and 78 percent partial responses. An additional 10 percent of patients achieved stable disease. The majority of tumor responses were observed within the first six weeks following initiation of treatment. The median progression free survival (PFS) for BRAFi-naïve patients was 13.7 months. Results for vemurafenib-progressor patients (n=66) showed a 15 percent confirmed ORR, 42 percent stable disease rate, and median PFS of 2.8 months. The median overall survival (OS) for BRAFi-naïve patients had not been reached, with a 1 year survival estimate of 83 percent. For the vemurafenib-progressor patients the median OS was 8.3 months with an estimated 1 year survival of 32 percent. Thus, the data were extremely favorable.
In summation, the data for both Synta and Exelixis are strong. Both deserve a multi-billion dollar market cap but are trading at a significant and short-term discount. Pfizer, Gilead, and its competitors will require growth. There is now question about that. The Street is completely discounting these companies and I think before it releases news that send stocks flying, a larger competitor that needs growth should consider stepping in.
GENENTECH’S INVESTIGATIONAL MEDICINE COBIMETINIB, USED IN COMBINATION WITH ZELBORAF® (VEMURAFENIB), HELPED PEOPLE WITH ADVANCED MELANOMA LIVE SIGNIFICANTLY LONGER WITHOUT THEIR DISEASE WORSENING
• Data from the coBRIM study will be presented at an upcoming medical meeting
• Genentech plans to submit these data to the U.S. Food and Drug Administration (FDA)
South San Francisco, Calif. -- July 13, 2014 --
Genentech, a member of the Roche Group (SIX: RO, ROG; OTCQX: RHHBY), today announced that the Phase III coBRIM study met its primary endpoint. The study demonstrated that the investigational MEK inhibitor cobimetinib, used in combination with Genentech's BRAF inhibitor Zelboraf, helped patients with previously untreated BRAF V600 mutation-positive advanced melanoma live significantly longer without their disease worsening (progression-free survival; PFS) compared to Zelboraf alone. Adverse events were consistent with those observed in a previous study of the combination.
"Despite great progress in our understanding and therapy in recent years, advanced melanoma remains a difficult and deadly disease that requires more treatment options," said Sandra Horning, M.D., chief medical officer and head of Global Product Development. "These encouraging data support the potential combined use of cobimetinib with Zelboraf to block tumor growth longer than Zelboraf alone. We hope this combination therapy will lead to a new option for patients."
Data from this pivotal study will be presented at an upcoming medical meeting. Additionally, Genentech plans to submit these data to the FDA for potential approval.
Cobimetinib is designed to selectively block the activity of MEK, one of a series of proteins inside cells that make up a signaling pathway that helps regulate cell division and survival. Cobimetinib binds to MEK while Zelboraf binds to mutant BRAF, another protein on the pathway, to interrupt abnormal signaling that can cause tumors to grow.
• Data from the coBRIM study will be presented at an upcoming medical meeting
• Genentech plans to submit these data to the U.S. Food and Drug Administration (FDA)
South San Francisco, Calif. -- July 13, 2014 --
Genentech, a member of the Roche Group (SIX: RO, ROG; OTCQX: RHHBY), today announced that the Phase III coBRIM study met its primary endpoint. The study demonstrated that the investigational MEK inhibitor cobimetinib, used in combination with Genentech's BRAF inhibitor Zelboraf, helped patients with previously untreated BRAF V600 mutation-positive advanced melanoma live significantly longer without their disease worsening (progression-free survival; PFS) compared to Zelboraf alone. Adverse events were consistent with those observed in a previous study of the combination.
"Despite great progress in our understanding and therapy in recent years, advanced melanoma remains a difficult and deadly disease that requires more treatment options," said Sandra Horning, M.D., chief medical officer and head of Global Product Development. "These encouraging data support the potential combined use of cobimetinib with Zelboraf to block tumor growth longer than Zelboraf alone. We hope this combination therapy will lead to a new option for patients."
Data from this pivotal study will be presented at an upcoming medical meeting. Additionally, Genentech plans to submit these data to the FDA for potential approval.
Cobimetinib is designed to selectively block the activity of MEK, one of a series of proteins inside cells that make up a signaling pathway that helps regulate cell division and survival. Cobimetinib binds to MEK while Zelboraf binds to mutant BRAF, another protein on the pathway, to interrupt abnormal signaling that can cause tumors to grow.
gestern wurden über 38 Mio Aktien gehandelt, nachdem angekündigt wurde, dass coBRIM (Kombitherapie Vemurafenib+Cobimetinib gegenüber Vemurafenib in Phase 3) beim progressionsfreien Überleben einen statistisch signifikanten Vorteil zeigt! Detaillierte Ergebnisse sollen demnächst auf einem wissenschaftlichen Kongress (wahrscheinlich ESMO in Madrid; 26.9. bis 30.9.2014 http://www.esmo.org/Conferences/ESMO-2014-Congress) veröffentlicht werden.
A.Feuerstein zitiert zudem David Miller, einen Hedge Fonds Manager im Gesundheitssektor, wonach Roche anscheinend Interesse zeigt, den Kooperationspartner von Cobimetinib (Exelixis) zu übernehmen und nennt einen möglichen Kaufpreis von etwas über 1 Milliarde USD.
http://www.thestreet.com/story/12772905/1/investor-believes-…
Ich halte diese Summe für sehr konservativ, nachdem institutionelle Investoren Anfang Jahr noch bereit waren, in einer Kapitalerhöhung 10 Mio Aktien zu einem Preis von 8 USD abzunehmen. Also "double digits" erscheint mir ein Minimum zu sein.
A.Feuerstein zitiert zudem David Miller, einen Hedge Fonds Manager im Gesundheitssektor, wonach Roche anscheinend Interesse zeigt, den Kooperationspartner von Cobimetinib (Exelixis) zu übernehmen und nennt einen möglichen Kaufpreis von etwas über 1 Milliarde USD.
http://www.thestreet.com/story/12772905/1/investor-believes-…
Ich halte diese Summe für sehr konservativ, nachdem institutionelle Investoren Anfang Jahr noch bereit waren, in einer Kapitalerhöhung 10 Mio Aktien zu einem Preis von 8 USD abzunehmen. Also "double digits" erscheint mir ein Minimum zu sein.
...und wieder wurde ein interessantes US Patent zum Signalweg p53 zugestanden:
United States Patent 8,771,942
Belvin , et al. July 8, 2014
--------------------------------------------------------------------------------
SCDs as modifiers of the p53 pathway and methods of use
Abstract
Human SCD genes are identified as modulators of the p53 pathway, and thus are therapeutic targets for disorders associated with defective p53 function. Methods for identifying modulators of p53, comprising screening for agents that modulate the activity of SCD are provided.
--------------------------------------------------------------------------------
Inventors: Belvin; Marcia (Albany, CA), Francis-Lang; Helen (San Francisco, CA), Friedman; Lori (San Carlos, CA), Plowman; Gregory D. (San Carlos, CA), Heuer; Timothy S. (Pacifica, CA)
Applicant: Name City State Country Type
Belvin; Marcia
Francis-Lang; Helen
Friedman; Lori
Plowman; Gregory D.
Heuer; Timothy S.
Assignee: Exelixis, Inc. (South San Francisco, CA)
Family ID: 27789086
Appl. No.: 12/714,257
Filed: February 26, 2010
United States Patent 8,771,942
Belvin , et al. July 8, 2014
--------------------------------------------------------------------------------
SCDs as modifiers of the p53 pathway and methods of use
Abstract
Human SCD genes are identified as modulators of the p53 pathway, and thus are therapeutic targets for disorders associated with defective p53 function. Methods for identifying modulators of p53, comprising screening for agents that modulate the activity of SCD are provided.
--------------------------------------------------------------------------------
Inventors: Belvin; Marcia (Albany, CA), Francis-Lang; Helen (San Francisco, CA), Friedman; Lori (San Carlos, CA), Plowman; Gregory D. (San Carlos, CA), Heuer; Timothy S. (Pacifica, CA)
Applicant: Name City State Country Type
Belvin; Marcia
Francis-Lang; Helen
Friedman; Lori
Plowman; Gregory D.
Heuer; Timothy S.
Assignee: Exelixis, Inc. (South San Francisco, CA)
Family ID: 27789086
Appl. No.: 12/714,257
Filed: February 26, 2010
William Blair Reiterates Outperform On Exelixis Following Positive Phase 3 Results
July 15, 2014 12:17 PM EDT by Ben Weinberg in Exclusive Area, Healthcare // 0 Comments
In a research report released yesterday, William Blair analyst John Sonnier reiterated an Outperform rating on Exelixis Inc (EXEL). The report follows yesterday’s news of positive top-line results from coBRIM, the phase 3 pivotal trial evaluating cobimetinib, a specific MEK inhibitor discovered by Exelixis, in combination with vemurafenib in previously untreated patients with unresectable locally advanced or metastatic melanoma harboring the BRAFV600 mutation. No price target was assigned.
Sonnier wrote, “We expect data from three additional Phase III programs over the coming 12-18 months, including the COMET trial results with cabozantinib in metastatic castration resistant prostate cancer (mCRPC) by the end of the year. We reiterate our enthusiasm for cabozantinib in mCRPC, as we believe targeting bone pain along with overall survival has the potential to differentiate cabozantinib as an asset with a unique clinical profile. In addition, Phase III data with cabozantinib in renal cell carcinoma (RCC) is expected in 2015, which illustrates cabozantinib’s potential broad applicability across multiple indications”.
http://www.wallstreet-online.de/diskussion/1194406-11-20/exe…
July 15, 2014 12:17 PM EDT by Ben Weinberg in Exclusive Area, Healthcare // 0 Comments
In a research report released yesterday, William Blair analyst John Sonnier reiterated an Outperform rating on Exelixis Inc (EXEL). The report follows yesterday’s news of positive top-line results from coBRIM, the phase 3 pivotal trial evaluating cobimetinib, a specific MEK inhibitor discovered by Exelixis, in combination with vemurafenib in previously untreated patients with unresectable locally advanced or metastatic melanoma harboring the BRAFV600 mutation. No price target was assigned.
Sonnier wrote, “We expect data from three additional Phase III programs over the coming 12-18 months, including the COMET trial results with cabozantinib in metastatic castration resistant prostate cancer (mCRPC) by the end of the year. We reiterate our enthusiasm for cabozantinib in mCRPC, as we believe targeting bone pain along with overall survival has the potential to differentiate cabozantinib as an asset with a unique clinical profile. In addition, Phase III data with cabozantinib in renal cell carcinoma (RCC) is expected in 2015, which illustrates cabozantinib’s potential broad applicability across multiple indications”.
http://www.wallstreet-online.de/diskussion/1194406-11-20/exe…
Hatte gat nicht auf dem Radar, dass mit Cobi noch weitere Combi's laufen.
Antwort auf Beitrag Nr.: 47.378.492 von rollingovermilestones am 26.07.14 14:22:21sowohl Cobimetinib als auch Cabozantinib werden in verschiedenen Anwendungen sowie Kombinationen in der Klinik getestet, teilweise finanziert von halbstaatlichen Trägern wie das NCI (National Cancer Institute) oder der "University of Michigan Cancer Center" oder des "Massachusetts General Hospital". Die Liste der klinischen Versuche ist eindrucksvoll zu
a.) Cabozantinib: 58 Studien
http://www.clinicaltrials.gov/ct2/results?term=cabozantinib
b.) Cobimetinib: 15 Studien
http://www.clinicaltrials.gov/ct2/results?term=Cobimetinib
darunter jene in Kombi mit
Onartuzumab (momentan "on hold", weil Monotherapie mit Onartuzumab enttäuschende Ergebnisse geliefert hat --> http://www.gene.com/media/press-releases/14562/2014-03-02/ge…)
MPDL3280A (an Engineered Anti-PDL1 Antibody)
A Phase 1b Study in Combination With Cobimetinib in Patients With Locally Advanced or Metastatic Solid Tumors
MEHD7945A
A Study of with Cobimetinib (GDC-0973) in Patients With Locally Advanced or Metastatic Cancers With Mutant KRAS
Vemurafenib als Kombi mit Cobimetinib: ph3-Ergebnisse coBRIM haben den primären Endpunkt erreicht; detaillierte Ergebnisse werden Ende September auf ESMO in Madrid bekanntgegeben.
Dazu erscheint eine Kombitherapie mit einem Taxan möglich und zwar beim dreifach HER-negativen Brustkrebs.
Bin sehr gespannt, welche Möglichkeiten noch in Erwägung gezogen werden.
a.) Cabozantinib: 58 Studien
http://www.clinicaltrials.gov/ct2/results?term=cabozantinib
b.) Cobimetinib: 15 Studien
http://www.clinicaltrials.gov/ct2/results?term=Cobimetinib
darunter jene in Kombi mit
Onartuzumab (momentan "on hold", weil Monotherapie mit Onartuzumab enttäuschende Ergebnisse geliefert hat --> http://www.gene.com/media/press-releases/14562/2014-03-02/ge…)
MPDL3280A (an Engineered Anti-PDL1 Antibody)
A Phase 1b Study in Combination With Cobimetinib in Patients With Locally Advanced or Metastatic Solid Tumors
MEHD7945A
A Study of with Cobimetinib (GDC-0973) in Patients With Locally Advanced or Metastatic Cancers With Mutant KRAS
Vemurafenib als Kombi mit Cobimetinib: ph3-Ergebnisse coBRIM haben den primären Endpunkt erreicht; detaillierte Ergebnisse werden Ende September auf ESMO in Madrid bekanntgegeben.
Dazu erscheint eine Kombitherapie mit einem Taxan möglich und zwar beim dreifach HER-negativen Brustkrebs.
Bin sehr gespannt, welche Möglichkeiten noch in Erwägung gezogen werden.
gute Zusammenfassung in q2 Präsentation:
Thread: Kein Titel für Thread 1407312146810245408719712621
folgende 3 kursbewegenden Ereignisse stehen unmittelbar bevor:
coBRIM wird derzeit konsolidiert => ph3 Kombitherapie cobimetinib/vemurafenib vs vemurafenib zur Behandlung von Patienten mit einer BRAF V600 Mutation und einem nicht operierbaren fortgeschrittenen metastatischen Melanom
Kooperationspartner Roche/Genentech hat bereits bekanntgegeben, dass eine statistisch signifikante Lebensverlängerung erreicht wurde; detaillierte Ergebnisse werden auf ESMO (26.-30.9. in Madrid) veröffentlicht. Sehr wahrscheinlich erfolgt ein baldiger Zulassungsantrag in den USA und Europa (sehr wahrscheinlich noch in 2014)
COMET1 und COMET2 dürften sich mittlerweile auch im Readout-Modus befinden. Hierbei handelt es sich um 2 Studien bei kastrationsrefraktären Prostatakarzinoms --> CRPC (Castration Resistant Prostata Carzinom)
COMET1, mit dem primären Endpunkt Lebensverlängerung, ist eine Plazebo-kontrollierte ph3-Studie, in welcher 960 Männer mit CRPC - bereits mehrfach vorbehandelt - randomisiert entweder mit Cabozantinib oder Prednison behandelt werden.
COMET2, ebenfalls eine ph3-Studie, fokussiert sich beim primären Endpunkt auf die Schmerzreduzierung bei CRPC.
A Phase 3, Randomized, Double-blind, Controlled Trial of Cabozantinib (XL184) Versus Mitoxantrone Plus Prednisone in Men With Previously Treated Symptomatic Castration-resistant Prostate Cancer
Estimated Enrollment: 246
Study Start Date: March 2012
Während ein statistisch signifikanter Überlebensvorteil unter der Kombitherapie in coBRIM bereits mitgeteilt wurde, sind die beiden CRPC-ph3-Studien im Ergebnis noch völlig offen, wobei COMET-2 jedoch wahrscheinlich günstigere Erfolgsaussichten bescheinigt werden. Den überlebensvorteil in COMET1 nachzuweisen halten Experten in Anbetracht der vielfach vorbehandelten und schwer kranken Studienteilnehmer für die weitaus grössere Herausforderung.
Thread: Kein Titel für Thread 1407312146810245408719712621
folgende 3 kursbewegenden Ereignisse stehen unmittelbar bevor:
coBRIM wird derzeit konsolidiert => ph3 Kombitherapie cobimetinib/vemurafenib vs vemurafenib zur Behandlung von Patienten mit einer BRAF V600 Mutation und einem nicht operierbaren fortgeschrittenen metastatischen Melanom
Kooperationspartner Roche/Genentech hat bereits bekanntgegeben, dass eine statistisch signifikante Lebensverlängerung erreicht wurde; detaillierte Ergebnisse werden auf ESMO (26.-30.9. in Madrid) veröffentlicht. Sehr wahrscheinlich erfolgt ein baldiger Zulassungsantrag in den USA und Europa (sehr wahrscheinlich noch in 2014)
COMET1 und COMET2 dürften sich mittlerweile auch im Readout-Modus befinden. Hierbei handelt es sich um 2 Studien bei kastrationsrefraktären Prostatakarzinoms --> CRPC (Castration Resistant Prostata Carzinom)
COMET1, mit dem primären Endpunkt Lebensverlängerung, ist eine Plazebo-kontrollierte ph3-Studie, in welcher 960 Männer mit CRPC - bereits mehrfach vorbehandelt - randomisiert entweder mit Cabozantinib oder Prednison behandelt werden.
COMET2, ebenfalls eine ph3-Studie, fokussiert sich beim primären Endpunkt auf die Schmerzreduzierung bei CRPC.
A Phase 3, Randomized, Double-blind, Controlled Trial of Cabozantinib (XL184) Versus Mitoxantrone Plus Prednisone in Men With Previously Treated Symptomatic Castration-resistant Prostate Cancer
Estimated Enrollment: 246
Study Start Date: March 2012
Während ein statistisch signifikanter Überlebensvorteil unter der Kombitherapie in coBRIM bereits mitgeteilt wurde, sind die beiden CRPC-ph3-Studien im Ergebnis noch völlig offen, wobei COMET-2 jedoch wahrscheinlich günstigere Erfolgsaussichten bescheinigt werden. Den überlebensvorteil in COMET1 nachzuweisen halten Experten in Anbetracht der vielfach vorbehandelten und schwer kranken Studienteilnehmer für die weitaus grössere Herausforderung.
Antwort auf Beitrag Nr.: 47.594.053 von Cyberhexe am 24.08.14 07:23:56anbei die im letzten Beitrag zitierte Präsentation:
http://de.slideshare.net/Companyspotlight/140731-q2-14-earni…
http://de.slideshare.net/Companyspotlight/140731-q2-14-earni…
Antwort auf Beitrag Nr.: 47.594.053 von Cyberhexe am 24.08.14 07:23:56Kooperationspartner Roche/Genentech hat bereits bekanntgegeben, dass eine statistisch signifikante Lebensverlängerung erreicht wurde; detaillierte Ergebnisse werden auf ESMO (26.-30.9. in Madrid) veröffentlicht.
Hab ich da was übersehen? Soweit ich weiß gab es noch keine Aussage zum OS sondern nur zum PFS. So wie ich es versteh läuft da die Auswertung noch und selbst zur ESMO wird wohl noch nichts dazu gesagt werden können.
Hab ich da was übersehen? Soweit ich weiß gab es noch keine Aussage zum OS sondern nur zum PFS. So wie ich es versteh läuft da die Auswertung noch und selbst zur ESMO wird wohl noch nichts dazu gesagt werden können.
...du hast recht, primärer Endpunkt in coBRIM ist das progressionsfreie Überleben, und dieser Endpunkt wurde mit statistischer Signifikanz erreicht. Auf die Überlebenszeit als sekundärem Endpunkt ist man bisher noch nicht eingegangen.
Die Veröffentlichung der coBRIM-Ergebnisse wurden jedoch auf der Halbjahreskonferenz angelkündigt und zwar via
http://www.roche.com/investors/ir_agenda/halfyear-2014.htm
--> Downloads
Presentation slides with/without appendix
slide 11
"Planned data presentations in H2 2014"
ESMO
Madrid, 26-30 Sep
Zelboraf + Cobimetinib1
• Phase 3 (coBRIM)
(planned)
Sollte BRIM7 reproduziert werden, dann ist auch bei der Überlebenszeit ein Vorteil ersichtlich und die Roche-Kombi dürfte sich als medizinischer Standard etablieren.
Die Veröffentlichung der coBRIM-Ergebnisse wurden jedoch auf der Halbjahreskonferenz angelkündigt und zwar via
http://www.roche.com/investors/ir_agenda/halfyear-2014.htm
--> Downloads
Presentation slides with/without appendix
slide 11
"Planned data presentations in H2 2014"
ESMO
Madrid, 26-30 Sep
Zelboraf + Cobimetinib1
• Phase 3 (coBRIM)
(planned)
Sollte BRIM7 reproduziert werden, dann ist auch bei der Überlebenszeit ein Vorteil ersichtlich und die Roche-Kombi dürfte sich als medizinischer Standard etablieren.
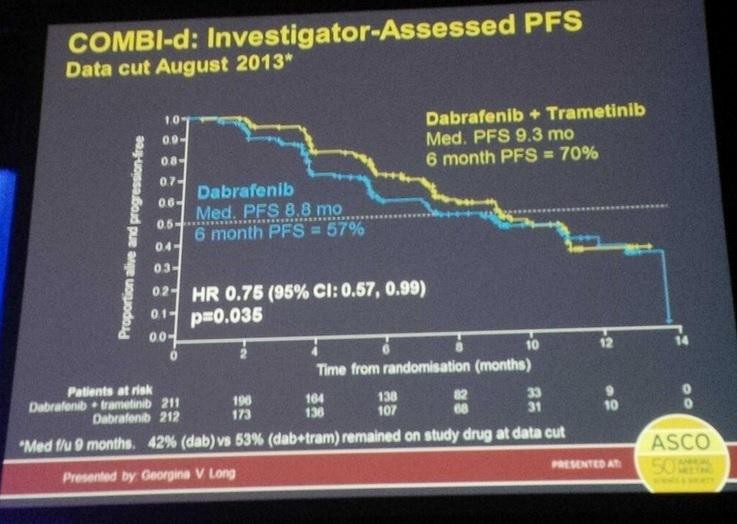
Antwort auf Beitrag Nr.: 47.596.557 von Cyberhexe am 24.08.14 19:56:49Vergleicht man die bisherigen Ergebnisse der Kombitherapie (BRAF/MEKinhibitor) von gsk --> dabrafenib + trametinib mit derjenigen von Roche/Genentech cobimetinib+vemurafenib ph1b => BRIM7, so ist die Überlegenheit der Roche-Therapieein absehbar:
Dabrafenib + Trametinib vs. Dabrafenib + Placebo
Phase 3 as first line therapy in patients with unresectable or metastatic BRAFE/K mutation positive cutaneous melanoma
CR 10% 9% (Complete Response)
PR 56% 43% (Partial Response)
SD 26% 33% (Stable Disease)
PD 6% 9%
Not evaluable 1% 7%
ORR (=CR+PR) = 67% 51%
Kaplan-Meier Estimates for PFS, Median à 9.3 months 8.8 months
Duration of response, Median à 9.2 months 10.2 month
--> barely met PFS primary, HR = 0.75 (medians: 8.8 vs. 9.3).
GSK combo ph1/2 150/2; n=54 patients
150mg Dabrafenib + 2 mg Trametinib
CR 9%
PR 67%
SD 24%
PD 0%
Not evaluable 0%
ORR (=CR+PR) = 76%
Kaplan-Meier Estimates for PFS, Median à 9.4 months
Duration of response, Median à 10.5 months
BRIM7 combi vemurafenib+cobimetinib ph1b; n=63 patients
CR 9.5%
PR 77.8%
SD 9.5%
PD 3.2%
Not evaluable 0%
ORR (=CR+PR) = 87%
Kaplan-Meier Estimates for PFS, Median à 13.7 months
Duration of response, Median à 12.5 months
-----> wenn BRIM7 bei coBRIM annähernd reproduziert werden, dann wird die Roche-Kombitherapie Marfktführer.
Dabrafenib + Trametinib vs. Dabrafenib + Placebo
Phase 3 as first line therapy in patients with unresectable or metastatic BRAFE/K mutation positive cutaneous melanoma
CR 10% 9% (Complete Response)
PR 56% 43% (Partial Response)
SD 26% 33% (Stable Disease)
PD 6% 9%
Not evaluable 1% 7%
ORR (=CR+PR) = 67% 51%
Kaplan-Meier Estimates for PFS, Median à 9.3 months 8.8 months
Duration of response, Median à 9.2 months 10.2 month
--> barely met PFS primary, HR = 0.75 (medians: 8.8 vs. 9.3).
GSK combo ph1/2 150/2; n=54 patients
150mg Dabrafenib + 2 mg Trametinib
CR 9%
PR 67%
SD 24%
PD 0%
Not evaluable 0%
ORR (=CR+PR) = 76%
Kaplan-Meier Estimates for PFS, Median à 9.4 months
Duration of response, Median à 10.5 months
BRIM7 combi vemurafenib+cobimetinib ph1b; n=63 patients
CR 9.5%
PR 77.8%
SD 9.5%
PD 3.2%
Not evaluable 0%
ORR (=CR+PR) = 87%
Kaplan-Meier Estimates for PFS, Median à 13.7 months
Duration of response, Median à 12.5 months
-----> wenn BRIM7 bei coBRIM annähernd reproduziert werden, dann wird die Roche-Kombitherapie Marfktführer.
auf ESMO in Madrid (26.-30.9.) werden die coBRIM-Ergebnisse im Detail veröffentlicht; möglicherweise folgt kurz darauf die Einreichung der Zulassungsunterlagen --> normalerweise zuerst in den USA über die FDA - aber das muss nicht sein.
09-26-2014
14:00 - 14:15 1085O - Survival, response duration, and activity by BRAF mutation (MT) status in a phase 1 trial
of nivolumab (anti-PD-1, BMS-936558, ONO-4538) and ipilimumab (IPI) concurrent therapy in
advanced melanoma (MEL)
Harriet Kluger, New Haven, CT/US
14:15 - 14:30 1086O - Phase Ib/II study of LEE011 (CDK4/6 inhibitor) and LGX818 (BRAF inhibitor) in
BRAF-mutant melanoma
Matthew Taylor, Portland, OR/US
12:45 - 12:45 1131TiP - Phase 1 Study Evaluating Safety and Tolerability of MEDI4736, an Anti-programmed Cell
Death Ligand-1 (PD-L1) Antibody, in Combination with Dabrafenib and Trametinib or Trametinib
Alone in Patients with Unresectable or Metastatic Melanoma
Michael Gordon, Scottsdale, AZ/US
09-29-2014
13:00 - 13:00 1088PD - Long-term survival of ipilimumab-naïve patients (pts) with advanced melanoma (MEL)
treated with nivolumab (anti-PD-1; BMS-936558, ONO-4538) in a phase 1 trial
David McDermott, Boston, MA/US
13:20 - 13:20 1091PD - COMBI-d: Quality of Life (QOL) impact of the combination of dabrafenib and trametinib
(D+T) versus dabrafenib monotherapy (D) in patients with BRAF V600E/K unresectable or
metastatic melanoma in a Phase III trial
Dirk Schadendorf, Essen/DE
13:20 - 13:20 1093PD - Vemurafenib and Cobimetinib Potently Inhibit pS6 Signaling in BRAFV600
Mutation–Positive Locally Advanced or Metastatic Melanoma From BRIM7 Study
Yibing Yan, South San Francisco, CA/US
16:30 - 16:45 LBA5_PR - Phase 3, Double-Blind, Placebo-Controlled Study of Vemurafenib Versus Vemurafenib
+ Cobimetinib in Previously Untreated BRAFV600 Mutation–Positive Patients With Unresectable
Locally Advanced or Metastatic Melanoma (NCT01689519)
Grant McArthur, East Melbourne, VIC/AU
Presidential Symposium 2
Chairs
R. Stahel (Zürich, Switzerland)
Session Type
Presidential Symposium
Details
ESMO 2014, 29.09.2014, 16:00 - 17:20, Madrid
Calendar Export Share
LBA3_PR - A phase 3 randomized, open-label study of nivolumab (anti-PD-1; BMS-936558; ONO-4538) versus investigator’s choice chemotherapy (ICC) in patients with advanced melanoma after prior anti-CTLA-4 therapy
J. Weber (Tampa, United States of America)
D. Minor (San Francisco, United States of America)
S. D'Angelo (New York, United States of America)
F. Hodi (Boston, United States of America)
R. Gutzmer (Hannover, Germany)
B. Neyns (Brussels, Belgium)
C. Hoeller (Vienna, Austria)
N. Khushalani (Buffalo, United States of America)
W. Miller (Montreal, Canada)
J. Grob (, France)
C. Lao (Ann Arbor, United States of America)
G. Linette (St. Louis, United States of America)
K. Grossmann (Salt Lake City, United States of America)
J. Hassel (Heidelberg, Germany)
P. Lorigan (Manchester, United Kingdom)
M. Maio (Siena, Italy)
M. Sznol (New Haven, United States of America)
A. Lambert (Braine-l’Alleud, Belgium)
A. Yang (, United States of America)
J. Larkin (London, United Kingdom)
Invited discussant abstract LBA3_PR
I. Melero (Pamplona, Spain)
LBA5_PR - Phase 3, Double-Blind, Placebo-Controlled Study of Vemurafenib Versus Vemurafenib + Cobimetinib in Previously Untreated BRAFV600 Mutation–Positive Patients With Unresectable Locally Advanced or Metastatic Melanoma (NCT01689519)
G. McArthur (Melbourne, Australia)
P. Ascierto (Napoli, Italy)
J. Larkin (London, United Kingdom)
A. Ribas (Los Angeles, United States of America)
G. Liszkay (, Hungary)
M. Maio (Siena, Italy)
M. Mandalà (Bergamo, Italy)
L. Demidov (Moscow, Russian Federation)
D. Stroyakovsky (Istra, Russian Federation)
L. Thomas (Rhone, France)
L. De La Cruz Merino (Sevilla, Spain)
V. Atkinson (Woolloongabba, Australia)
C. Dutriaux (Bordeaux, France)
C. Garbe (Tubingen, Germany)
I. Chang (South San Francisco, United States of America)
S. Hack (South San Francisco)
B. Dréno (Nantes, France)
Invited discussant abstrcts LBA5_PR and one TBC
C. Blank (Amsterdam, Netherlands)
https://www.webges.com/cslide/library/esmo/browse/search/4Eq…
09-26-2014
14:00 - 14:15 1085O - Survival, response duration, and activity by BRAF mutation (MT) status in a phase 1 trial
of nivolumab (anti-PD-1, BMS-936558, ONO-4538) and ipilimumab (IPI) concurrent therapy in
advanced melanoma (MEL)
Harriet Kluger, New Haven, CT/US
14:15 - 14:30 1086O - Phase Ib/II study of LEE011 (CDK4/6 inhibitor) and LGX818 (BRAF inhibitor) in
BRAF-mutant melanoma
Matthew Taylor, Portland, OR/US
12:45 - 12:45 1131TiP - Phase 1 Study Evaluating Safety and Tolerability of MEDI4736, an Anti-programmed Cell
Death Ligand-1 (PD-L1) Antibody, in Combination with Dabrafenib and Trametinib or Trametinib
Alone in Patients with Unresectable or Metastatic Melanoma
Michael Gordon, Scottsdale, AZ/US
09-29-2014
13:00 - 13:00 1088PD - Long-term survival of ipilimumab-naïve patients (pts) with advanced melanoma (MEL)
treated with nivolumab (anti-PD-1; BMS-936558, ONO-4538) in a phase 1 trial
David McDermott, Boston, MA/US
13:20 - 13:20 1091PD - COMBI-d: Quality of Life (QOL) impact of the combination of dabrafenib and trametinib
(D+T) versus dabrafenib monotherapy (D) in patients with BRAF V600E/K unresectable or
metastatic melanoma in a Phase III trial
Dirk Schadendorf, Essen/DE
13:20 - 13:20 1093PD - Vemurafenib and Cobimetinib Potently Inhibit pS6 Signaling in BRAFV600
Mutation–Positive Locally Advanced or Metastatic Melanoma From BRIM7 Study
Yibing Yan, South San Francisco, CA/US
16:30 - 16:45 LBA5_PR - Phase 3, Double-Blind, Placebo-Controlled Study of Vemurafenib Versus Vemurafenib
+ Cobimetinib in Previously Untreated BRAFV600 Mutation–Positive Patients With Unresectable
Locally Advanced or Metastatic Melanoma (NCT01689519)
Grant McArthur, East Melbourne, VIC/AU
Presidential Symposium 2
Chairs
R. Stahel (Zürich, Switzerland)
Session Type
Presidential Symposium
Details
ESMO 2014, 29.09.2014, 16:00 - 17:20, Madrid
Calendar Export Share
LBA3_PR - A phase 3 randomized, open-label study of nivolumab (anti-PD-1; BMS-936558; ONO-4538) versus investigator’s choice chemotherapy (ICC) in patients with advanced melanoma after prior anti-CTLA-4 therapy
J. Weber (Tampa, United States of America)
D. Minor (San Francisco, United States of America)
S. D'Angelo (New York, United States of America)
F. Hodi (Boston, United States of America)
R. Gutzmer (Hannover, Germany)
B. Neyns (Brussels, Belgium)
C. Hoeller (Vienna, Austria)
N. Khushalani (Buffalo, United States of America)
W. Miller (Montreal, Canada)
J. Grob (, France)
C. Lao (Ann Arbor, United States of America)
G. Linette (St. Louis, United States of America)
K. Grossmann (Salt Lake City, United States of America)
J. Hassel (Heidelberg, Germany)
P. Lorigan (Manchester, United Kingdom)
M. Maio (Siena, Italy)
M. Sznol (New Haven, United States of America)
A. Lambert (Braine-l’Alleud, Belgium)
A. Yang (, United States of America)
J. Larkin (London, United Kingdom)
Invited discussant abstract LBA3_PR
I. Melero (Pamplona, Spain)
LBA5_PR - Phase 3, Double-Blind, Placebo-Controlled Study of Vemurafenib Versus Vemurafenib + Cobimetinib in Previously Untreated BRAFV600 Mutation–Positive Patients With Unresectable Locally Advanced or Metastatic Melanoma (NCT01689519)
G. McArthur (Melbourne, Australia)
P. Ascierto (Napoli, Italy)
J. Larkin (London, United Kingdom)
A. Ribas (Los Angeles, United States of America)
G. Liszkay (, Hungary)
M. Maio (Siena, Italy)
M. Mandalà (Bergamo, Italy)
L. Demidov (Moscow, Russian Federation)
D. Stroyakovsky (Istra, Russian Federation)
L. Thomas (Rhone, France)
L. De La Cruz Merino (Sevilla, Spain)
V. Atkinson (Woolloongabba, Australia)
C. Dutriaux (Bordeaux, France)
C. Garbe (Tubingen, Germany)
I. Chang (South San Francisco, United States of America)
S. Hack (South San Francisco)
B. Dréno (Nantes, France)
Invited discussant abstrcts LBA5_PR and one TBC
C. Blank (Amsterdam, Netherlands)
https://www.webges.com/cslide/library/esmo/browse/search/4Eq…
Antwort auf Beitrag Nr.: 47.656.773 von Cyberhexe am 31.08.14 16:50:41...anbei noch die Medienmitteilung von Roche: bei diesem Analystentreffen auf ESMO in Madrid dürften detaillierte Ergebnisse zu coBRIM bekannt werden!
Investor Update
Basel, 26 August 2014
Invitation to Roche’s investor science conference call from ESMO 2014Conference call on 29 September 2014
We kindly invite investors and analysts to participate in a conference call to discuss new clinical data on the Roche oncology products and pipeline presented during the 2014 annual meeting of the European Society for Medical Oncology 2014 in Madrid on:
Monday, 29 September 2014 from 10:00 am – 11:00 am CEST09:00 am to 10:00 am BST
04:00 am to 05:00 am EDT
01:00 am to 02:00 am PDT
http://www.roche.com/de/investors/ir_update/inv-update-2014-…
Investor Update
Basel, 26 August 2014
Invitation to Roche’s investor science conference call from ESMO 2014Conference call on 29 September 2014
We kindly invite investors and analysts to participate in a conference call to discuss new clinical data on the Roche oncology products and pipeline presented during the 2014 annual meeting of the European Society for Medical Oncology 2014 in Madrid on:
Monday, 29 September 2014 from 10:00 am – 11:00 am CEST09:00 am to 10:00 am BST
04:00 am to 05:00 am EDT
01:00 am to 02:00 am PDT
http://www.roche.com/de/investors/ir_update/inv-update-2014-…
Servus Cyberhexe,
was hast Du für ein Kurzziel für Exelixis?
Übernahmechance durch Roche?
Gruß
Fredy
was hast Du für ein Kurzziel für Exelixis?
Übernahmechance durch Roche?
Gruß
Fredy
Antwort auf Beitrag Nr.: 47.661.297 von Cyberhexe am 01.09.14 11:47:51Am Montag (29.9.) wird Roche im Rahmen von ESMO in Madrid die Ergebnisse von coBRIM bekannt geben. Hierbei handelt es sich um eine ph3-Studie, in welcher die Kombitherapie vemurafenib (brand: Zelboraf)/cobimetinib gegenüber vemurafenib verglichen wird. Primärer Endpunkt ist eine Verbesserung des progressionsfreien Ueberleben (PFS=Progression Free Survival), welcher gemäss Pressemitteilung vom 13.7. (Genentech) http://www.gene.com/media/press-releases/14568/2014-07-13/ge… bzw. 14.7. (Roche u. Exelixis) mit statistischer Signifikanz erreicht wurde.
In der folgenden Übersicht werden die bisher verfügbaren Daten der Kombitherapie von gsk (bzw.nach Übernahme deren "Krebsportfolio" Novartis) --> Dabrafenib + Trametinib
mit jenen von Roche --> vemurafenib (brand: Zelboraf)/cobimetinib
verglichen:
Dabrafenib + Trametinib vs. Dabrafenib + Placebo
Phase 3 als Erstlinienbehandlung von Patienten mit nicht entfernbarem oder metastasenbildenden (BRAFE/K-Mutation positiv) Hautkrebs
CR 10% 9% (complete response = vollständiges Ansprechen auf Therapie)
PR 56% 43% (partial response = teilweise)
SD 26% 33% (stable disease = kein Fortschreiten der Tumorerkrankung)
PD 6% 9% (progression disease = Fortschreiten der TE)
Not evaluable 1% 7%
ORR (=CR+PR) = 67% 51%
Kaplan-Meier PFS, Median 9.3 Monate gegenüber 8.8 Monaten
Dauer der Wirkung, Median 9.2 Monate gegenüber 10.2 Monaten !!!
--> der primäre Endpunkt wurde gerade so erreicht, HR = 0.75 (median: 8.8 vs. 9.3). Die Dauer der "response" ist jedoch bei der Monotherapie günstiger, weshalb die Zulassung in Europa vorerst nicht erteilt wurde.
Der besseren Vergleichbarkeit wegen auch noch die Daten aus Phase 1/2 der gsk-Kombi Dabrafenib + Trametinib :
GSK combo ph1/2 150/2; n=54 patients
150mg Dabrafenib + 2 mg Trametinib
CR 9%
PR 67%
SD 24%
PD 0%
Not evaluable 0%
ORR (=CR+PR) = 76%
Kaplan-Meier Estimates for PFS, Median 9.4 months
Duration of response, Median 10.5 months
Im Vergleich hierzu die Daten der Phase 1b-Studie der Roche/Genentech-Kombi
BRIM7 vemurafenib+cobimetinib ph1b; n=63 patients
CR 9.5%
PR 77.8%
SD 9.5%
PD 3.2%
Not evaluable 0%
ORR (=CR+PR) = 87%
Kaplan-Meier Estimates for PFS, Median 13.7 months
Duration of response, Median 12.5 months
Sollte coBRIM dieses Ergebnis annähernd bestätigen, wird die Roche-Kombi zur Standardtherapie werden. Achtung! Normalerweise werden in den mächtigeren ph3-Studien die Ergebnisse der kleineren ph1/2 jedoch nicht erreicht, weshalb alles über 11 Monate PFS in coBRIM exzellent wäre!
Es ist und bleibt spannend. Am Montag lässt Roche die Katze aus dem Sack.
Das derzeitige Kursniveau ist für mich nicht nachvollziehbar, da cobimetinib ein Eckpfeiler im Roche/Genentech-Onkologie-Portfolio darstellt, und zwar werden folgende Ansätze in der Klinik getestet:
1.) zusammen mit vemurafenib den gleichen Signalweg hemmend (MAP)
2.) zusammen mit anderen Wirkstoffen unterschiedliche Signalwege hemmend: z.B. PI3K, mTOR, ALK, DAF
http://www.clinicaltrials.gov/ct2/show/NCT01974258?term=cobi…
http://www.clinicaltrials.gov/ct2/show/NCT01986166?term=cobi…
http://www.clinicaltrials.gov/ct2/show/NCT00996892?term=cobi…
http://www.clinicaltrials.gov/ct2/show/NCT01562275?term=cobi…
3.) den Zelltod auslösend gemeinsam mit Zytostatika (noch nicht in der Klinik) bzw. eine Immunreaktion auslösend mit PDL1
http://www.clinicaltrials.gov/ct2/show/NCT01988896?term=cobi…
In November 2013, Exelixis exercised its option to co-promote cobimetinib in the United States. Exelixis is entitled to an initial equal share of U.S. profits and losses, which will decrease as sales increase, and will share equally in the U.S. marketing and commercialization costs. Exelixis is eligible to receive royalties on any sales of the product outside the United States.
In der folgenden Übersicht werden die bisher verfügbaren Daten der Kombitherapie von gsk (bzw.nach Übernahme deren "Krebsportfolio" Novartis) --> Dabrafenib + Trametinib
mit jenen von Roche --> vemurafenib (brand: Zelboraf)/cobimetinib
verglichen:
Dabrafenib + Trametinib vs. Dabrafenib + Placebo
Phase 3 als Erstlinienbehandlung von Patienten mit nicht entfernbarem oder metastasenbildenden (BRAFE/K-Mutation positiv) Hautkrebs
CR 10% 9% (complete response = vollständiges Ansprechen auf Therapie)
PR 56% 43% (partial response = teilweise)
SD 26% 33% (stable disease = kein Fortschreiten der Tumorerkrankung)
PD 6% 9% (progression disease = Fortschreiten der TE)
Not evaluable 1% 7%
ORR (=CR+PR) = 67% 51%
Kaplan-Meier PFS, Median 9.3 Monate gegenüber 8.8 Monaten
Dauer der Wirkung, Median 9.2 Monate gegenüber 10.2 Monaten !!!
--> der primäre Endpunkt wurde gerade so erreicht, HR = 0.75 (median: 8.8 vs. 9.3). Die Dauer der "response" ist jedoch bei der Monotherapie günstiger, weshalb die Zulassung in Europa vorerst nicht erteilt wurde.
Der besseren Vergleichbarkeit wegen auch noch die Daten aus Phase 1/2 der gsk-Kombi Dabrafenib + Trametinib :
GSK combo ph1/2 150/2; n=54 patients
150mg Dabrafenib + 2 mg Trametinib
CR 9%
PR 67%
SD 24%
PD 0%
Not evaluable 0%
ORR (=CR+PR) = 76%
Kaplan-Meier Estimates for PFS, Median 9.4 months
Duration of response, Median 10.5 months
Im Vergleich hierzu die Daten der Phase 1b-Studie der Roche/Genentech-Kombi
BRIM7 vemurafenib+cobimetinib ph1b; n=63 patients
CR 9.5%
PR 77.8%
SD 9.5%
PD 3.2%
Not evaluable 0%
ORR (=CR+PR) = 87%
Kaplan-Meier Estimates for PFS, Median 13.7 months
Duration of response, Median 12.5 months
Sollte coBRIM dieses Ergebnis annähernd bestätigen, wird die Roche-Kombi zur Standardtherapie werden. Achtung! Normalerweise werden in den mächtigeren ph3-Studien die Ergebnisse der kleineren ph1/2 jedoch nicht erreicht, weshalb alles über 11 Monate PFS in coBRIM exzellent wäre!
Es ist und bleibt spannend. Am Montag lässt Roche die Katze aus dem Sack.
Das derzeitige Kursniveau ist für mich nicht nachvollziehbar, da cobimetinib ein Eckpfeiler im Roche/Genentech-Onkologie-Portfolio darstellt, und zwar werden folgende Ansätze in der Klinik getestet:
1.) zusammen mit vemurafenib den gleichen Signalweg hemmend (MAP)
2.) zusammen mit anderen Wirkstoffen unterschiedliche Signalwege hemmend: z.B. PI3K, mTOR, ALK, DAF
http://www.clinicaltrials.gov/ct2/show/NCT01974258?term=cobi…
http://www.clinicaltrials.gov/ct2/show/NCT01986166?term=cobi…
http://www.clinicaltrials.gov/ct2/show/NCT00996892?term=cobi…
http://www.clinicaltrials.gov/ct2/show/NCT01562275?term=cobi…
3.) den Zelltod auslösend gemeinsam mit Zytostatika (noch nicht in der Klinik) bzw. eine Immunreaktion auslösend mit PDL1
http://www.clinicaltrials.gov/ct2/show/NCT01988896?term=cobi…
In November 2013, Exelixis exercised its option to co-promote cobimetinib in the United States. Exelixis is entitled to an initial equal share of U.S. profits and losses, which will decrease as sales increase, and will share equally in the U.S. marketing and commercialization costs. Exelixis is eligible to receive royalties on any sales of the product outside the United States.
Antwort auf Beitrag Nr.: 47.661.447 von Magnetfeldfredy am 01.09.14 12:05:49Hallo Freddy
mein Kursziel war bei "double digits", also mindestens USD 10, und zwar weil
1.) cobimetinib ein Eckpfeiler im Roche/Genentech Onkologie-Portfolio darstellt und Exelixis an den US-Rechten nahezu 50% inne hat sowie an den ex-US-Verkäufen mit Lizenzzahlungen (royalties) beteiligt ist
2.) cabozantinib in 60 teilweise fremdfinanzierten (z.B. National Cancer Institute) klinischen Studien zu den unterschiedlichsten Krebsarten erprobt wird und zudem in einer wenn auch zugegebenermassen "kleinen" Indikation (soll heissen, dass wenig Patienten damit behandelt werden --> brand "COMETRIQ" ist indiziert für die Behandlung des medullären Schilddrüsenkarzinoms bei erwachsenen Patienten mit progredienter, nicht resektabler, lokal fortgeschrittener oder metastasierter Erkrankung) bereits in den USA und in Europa zugelassen ist
3.) die bisherig erteilten Patente bereits den Wert der aktuellen Marktkapitalisierung rechtfertigen
Nachdem von vielen erwarteten Scheitern von comet-1 (cabozantinib zur Behandlung von refraktärem Prostatakrebs) wurde die Aktie regelrecht runtergeprügelt, so dass mE der Wert der anderen Möglichkeiten vernachlässigt wird.
Von den Voraussetzungen her hat sich für mich mit dem Scheitern von comet-1 nicht sehr viel verändert, so dass ich eigentlich immer noch der Meinung bin, dass Exelixis Wert nicht unter 2 Mrd USD sein sollte. Natürlich verunsichert das momentane Kursszenario den Kleinanleger, ich bin jedoch dennoch zuversichtlich, dass mit Veröffentlichung von coBRIM und der darauffolgenden Einreichung der Zulassungsunterlagen bei EMA und FDA eine Kurserholung stattfinden sollte.
Ganz wichtig erscheint mir die für 2015 zu erwartende Veröffentlichung der Daten von METEOR (A Study of Cabozantinib (XL184) vs Everolimus in Subjects With Metastatic Renal Cell Carcinoma) zur Behandlung von Nierenkrebs. Falls der primäre Endpunkt erreichtwürde, dann wirds richtig lustig.
http://www.clinicaltrials.gov/ct2/show/NCT01865747?term=mete…
mein Kursziel war bei "double digits", also mindestens USD 10, und zwar weil
1.) cobimetinib ein Eckpfeiler im Roche/Genentech Onkologie-Portfolio darstellt und Exelixis an den US-Rechten nahezu 50% inne hat sowie an den ex-US-Verkäufen mit Lizenzzahlungen (royalties) beteiligt ist
2.) cabozantinib in 60 teilweise fremdfinanzierten (z.B. National Cancer Institute) klinischen Studien zu den unterschiedlichsten Krebsarten erprobt wird und zudem in einer wenn auch zugegebenermassen "kleinen" Indikation (soll heissen, dass wenig Patienten damit behandelt werden --> brand "COMETRIQ" ist indiziert für die Behandlung des medullären Schilddrüsenkarzinoms bei erwachsenen Patienten mit progredienter, nicht resektabler, lokal fortgeschrittener oder metastasierter Erkrankung) bereits in den USA und in Europa zugelassen ist
3.) die bisherig erteilten Patente bereits den Wert der aktuellen Marktkapitalisierung rechtfertigen
Nachdem von vielen erwarteten Scheitern von comet-1 (cabozantinib zur Behandlung von refraktärem Prostatakrebs) wurde die Aktie regelrecht runtergeprügelt, so dass mE der Wert der anderen Möglichkeiten vernachlässigt wird.
Von den Voraussetzungen her hat sich für mich mit dem Scheitern von comet-1 nicht sehr viel verändert, so dass ich eigentlich immer noch der Meinung bin, dass Exelixis Wert nicht unter 2 Mrd USD sein sollte. Natürlich verunsichert das momentane Kursszenario den Kleinanleger, ich bin jedoch dennoch zuversichtlich, dass mit Veröffentlichung von coBRIM und der darauffolgenden Einreichung der Zulassungsunterlagen bei EMA und FDA eine Kurserholung stattfinden sollte.
Ganz wichtig erscheint mir die für 2015 zu erwartende Veröffentlichung der Daten von METEOR (A Study of Cabozantinib (XL184) vs Everolimus in Subjects With Metastatic Renal Cell Carcinoma) zur Behandlung von Nierenkrebs. Falls der primäre Endpunkt erreichtwürde, dann wirds richtig lustig.
http://www.clinicaltrials.gov/ct2/show/NCT01865747?term=mete…
Antwort auf Beitrag Nr.: 47.890.013 von Cyberhexe am 27.09.14 10:43:55Nachtrag:
1.) Zulassunsunterlagen zu Cometriq (generic name: Cabozantinib) der europäischen Arzneimittelbehörde EMA:
http://www.ema.europa.eu/docs/de_DE/document_library/EPAR_-_…
2.) Liste der 60 klinischen Studien mit Cabozantinib:
http://www.clinicaltrials.gov/ct2/results?term=cabozantinib&…
Sponsoren z.B.:
University of Alabama at Birmingham
Massachusetts General Hospital
Dana-Farber Cancer Institute
University of Michigan Cancer Center
National Cancer Institute (NCI)
usw
3.) Auflistung der US-Patente
http://patft.uspto.gov/netacgi/nph-Parser?Sect1=PTO2&Sect2=H…
Auflistung der Patentapplikationen
http://appft.uspto.gov/netacgi/nph-Parser?Sect1=PTO2&Sect2=H…
Auflistung der weltweit auffindbaren Patente:
1624!!
http://worldwide.espacenet.com/searchResults?compact=false&S…
1.) Zulassunsunterlagen zu Cometriq (generic name: Cabozantinib) der europäischen Arzneimittelbehörde EMA:
http://www.ema.europa.eu/docs/de_DE/document_library/EPAR_-_…
2.) Liste der 60 klinischen Studien mit Cabozantinib:
http://www.clinicaltrials.gov/ct2/results?term=cabozantinib&…
Sponsoren z.B.:
University of Alabama at Birmingham
Massachusetts General Hospital
Dana-Farber Cancer Institute
University of Michigan Cancer Center
National Cancer Institute (NCI)
usw
3.) Auflistung der US-Patente
http://patft.uspto.gov/netacgi/nph-Parser?Sect1=PTO2&Sect2=H…
Auflistung der Patentapplikationen
http://appft.uspto.gov/netacgi/nph-Parser?Sect1=PTO2&Sect2=H…
Auflistung der weltweit auffindbaren Patente:
1624!!
http://worldwide.espacenet.com/searchResults?compact=false&S…
Antwort auf Beitrag Nr.: 47.594.053 von Cyberhexe am 24.08.14 07:23:56bereits vor Bekanntgabe der COMET1-Ergebnisse (01.09.2014) wurden dieser Studie nur geringe Erfolgsaussichten bescheinigt (siehe Mail vom 24.8.2014), so dass der Kurseinbruch um fast 70% für viele nicht nachvollziehbar ist:
cyberhexe schrieb am 24.08.14 07:23:56
Beitrag Nr. 21 (47.594.053)
folgende 3 kursbewegenden Ereignisse stehen unmittelbar bevor:
coBRIM wird derzeit konsolidiert => ph3 Kombitherapie cobimetinib/vemurafenib vs vemurafenib zur Behandlung von Patienten mit einer BRAF V600 Mutation und einem nicht operierbaren fortgeschrittenen metastatischen Melanom
Kooperationspartner Roche/Genentech hat bereits bekanntgegeben, dass eine statistisch signifikante Lebensverlängerung erreicht wurde; detaillierte Ergebnisse werden auf ESMO (26.-30.9. in Madrid) veröffentlicht. Sehr wahrscheinlich erfolgt ein baldiger Zulassungsantrag in den USA und Europa (sehr wahrscheinlich noch in 2014)
COMET1 und COMET2 dürften sich mittlerweile auch im Readout-Modus befinden. Hierbei handelt es sich um 2 Studien bei kastrationsrefraktären Prostatakarzinoms --> CRPC (Castration Resistant Prostata Carzinom)
COMET1, mit dem primären Endpunkt Lebensverlängerung, ist eine Plazebo-kontrollierte ph3-Studie, in welcher 960 Männer mit CRPC - bereits mehrfach vorbehandelt - randomisiert entweder mit Cabozantinib oder Prednison behandelt werden.
COMET2, ebenfalls eine ph3-Studie, fokussiert sich beim primären Endpunkt auf die Schmerzreduzierung bei CRPC.
A Phase 3, Randomized, Double-blind, Controlled Trial of Cabozantinib (XL184) Versus Mitoxantrone Plus Prednisone in Men With Previously Treated Symptomatic Castration-resistant Prostate Cancer
Estimated Enrollment: 246
Study Start Date: March 2012
Während ein statistisch signifikanter Überlebensvorteil unter der Kombitherapie in coBRIM bereits mitgeteilt wurde, sind die beiden CRPC-ph3-Studien im Ergebnis noch völlig offen, wobei COMET-2 jedoch wahrscheinlich günstigere Erfolgsaussichten bescheinigt werden. Den überlebensvorteil in COMET1 nachzuweisen halten Experten in Anbetracht der vielfach vorbehandelten und schwer kranken Studienteilnehmer für die weitaus grössere Herausforderung.
Für mich ist dieser Kurs (USD 1.56 am 26.9.14) ein "strong buy" - habe gestern mein letztes trockenes Pulver in Exelixis investiert bei einem mittlerweile unvernünftigen Investitionsgrad ...aber die Verlockung ist nun mal zu gross!
...aber die Verlockung ist nun mal zu gross!
gltal
cyberhexe schrieb am 24.08.14 07:23:56
Beitrag Nr. 21 (47.594.053)
folgende 3 kursbewegenden Ereignisse stehen unmittelbar bevor:
coBRIM wird derzeit konsolidiert => ph3 Kombitherapie cobimetinib/vemurafenib vs vemurafenib zur Behandlung von Patienten mit einer BRAF V600 Mutation und einem nicht operierbaren fortgeschrittenen metastatischen Melanom
Kooperationspartner Roche/Genentech hat bereits bekanntgegeben, dass eine statistisch signifikante Lebensverlängerung erreicht wurde; detaillierte Ergebnisse werden auf ESMO (26.-30.9. in Madrid) veröffentlicht. Sehr wahrscheinlich erfolgt ein baldiger Zulassungsantrag in den USA und Europa (sehr wahrscheinlich noch in 2014)
COMET1 und COMET2 dürften sich mittlerweile auch im Readout-Modus befinden. Hierbei handelt es sich um 2 Studien bei kastrationsrefraktären Prostatakarzinoms --> CRPC (Castration Resistant Prostata Carzinom)
COMET1, mit dem primären Endpunkt Lebensverlängerung, ist eine Plazebo-kontrollierte ph3-Studie, in welcher 960 Männer mit CRPC - bereits mehrfach vorbehandelt - randomisiert entweder mit Cabozantinib oder Prednison behandelt werden.
COMET2, ebenfalls eine ph3-Studie, fokussiert sich beim primären Endpunkt auf die Schmerzreduzierung bei CRPC.
A Phase 3, Randomized, Double-blind, Controlled Trial of Cabozantinib (XL184) Versus Mitoxantrone Plus Prednisone in Men With Previously Treated Symptomatic Castration-resistant Prostate Cancer
Estimated Enrollment: 246
Study Start Date: March 2012
Während ein statistisch signifikanter Überlebensvorteil unter der Kombitherapie in coBRIM bereits mitgeteilt wurde, sind die beiden CRPC-ph3-Studien im Ergebnis noch völlig offen, wobei COMET-2 jedoch wahrscheinlich günstigere Erfolgsaussichten bescheinigt werden. Den überlebensvorteil in COMET1 nachzuweisen halten Experten in Anbetracht der vielfach vorbehandelten und schwer kranken Studienteilnehmer für die weitaus grössere Herausforderung.
Für mich ist dieser Kurs (USD 1.56 am 26.9.14) ein "strong buy" - habe gestern mein letztes trockenes Pulver in Exelixis investiert bei einem mittlerweile unvernünftigen Investitionsgrad
 ...aber die Verlockung ist nun mal zu gross!
...aber die Verlockung ist nun mal zu gross!gltal
Antwort auf Beitrag Nr.: 47.890.082 von Cyberhexe am 27.09.14 10:56:53diese Vortragsreihe auf ESMO sollte man als Exelixis-Investor nicht verpassen:
https://www.webges.com/cslide/library/esmo/browse/itinerary/…
Presidential Symposium
ESMO 29.09.2014 16.00 - 17.20 Madrid
...
LBA5_PR Phase 3,double-blind placebo-controlled study of vemurafenib vs. vemurafenib + cobimetinib in previously untreated BRAFV600 mutation-positive patients with unresectable locally advanced or metastatic melanoma.
Diese Bekanntgabe der coBRIM-Ergebnisse sollte eine Phase der Kurserholung einleiten, zumal im Oktober bereits die Zulassung beantragt werden könnte. Bin gespannt, ob diese nicht doch zuerst in Europa (EMA) geschieht, da gsk´s Kombitherapie (dabrafenib+trametinib) in Europa noch nicht zugelassen wurde bzw. die Zulassung beim ersten Antrag verweigert wurde.
https://www.webges.com/cslide/library/esmo/browse/itinerary/…
Presidential Symposium
ESMO 29.09.2014 16.00 - 17.20 Madrid
...
LBA5_PR Phase 3,double-blind placebo-controlled study of vemurafenib vs. vemurafenib + cobimetinib in previously untreated BRAFV600 mutation-positive patients with unresectable locally advanced or metastatic melanoma.
Diese Bekanntgabe der coBRIM-Ergebnisse sollte eine Phase der Kurserholung einleiten, zumal im Oktober bereits die Zulassung beantragt werden könnte. Bin gespannt, ob diese nicht doch zuerst in Europa (EMA) geschieht, da gsk´s Kombitherapie (dabrafenib+trametinib) in Europa noch nicht zugelassen wurde bzw. die Zulassung beim ersten Antrag verweigert wurde.
Danke für Deine Einschätzung, Dreckswallstreet vernichtet, Exelixis, Dendreon........
hm, die mögliche Zulassung hat keinen hinter dem Ofen hervorgeholt. Schwafeln doch eher alle von Chapter 11. Komisch.
das ist der Hammer:
cabozantinib wird zusammen mit Herceptin (generic name: Trastuzumab) in einer klinischen Studie getestet und zwar bei Brustkrebs mit Metastasen im Gehirn.Cabozantinib +/- Trastuzumab In Breast Cancer Patients w/ Brain Metastases
This study is not yet open for participant recruitment. (see Contacts and Locations)
Verified October 2014 by Dana-Farber Cancer Institute
Sponsor:
Dana-Farber Cancer Institute
Collaborators:
Exelixis
Genentech
Information provided by (Responsible Party):
Sara Tolaney, Dana-Farber Cancer Institute
https://clinicaltrials.gov/ct2/show/NCT02260531?term=cabozan…
Antwort auf Beitrag Nr.: 48.012.475 von Cyberhexe am 12.10.14 14:46:12
darf ich fragen,wieso das jetzt der Hammer ist? Meinst Du wegen Trastuzumab (Genentech). Leitest Du daraus ein Buyout ab?
Zitat von Cyberhexe: cabozantinib wird zusammen mit Herceptin (generic name: Trastuzumab) in einer klinischen Studie getestet und zwar bei Brustkrebs mit Metastasen im Gehirn.
Cabozantinib +/- Trastuzumab In Breast Cancer Patients w/ Brain Metastases
This study is not yet open for participant recruitment. (see Contacts and Locations)
Verified October 2014 by Dana-Farber Cancer Institute
Sponsor:
Dana-Farber Cancer Institute
Collaborators:
Exelixis
Genentech
Information provided by (Responsible Party):
Sara Tolaney, Dana-Farber Cancer Institute
https://clinicaltrials.gov/ct2/show/NCT02260531?term=cabozan…
darf ich fragen,wieso das jetzt der Hammer ist? Meinst Du wegen Trastuzumab (Genentech). Leitest Du daraus ein Buyout ab?
Antwort auf Beitrag Nr.: 48.014.188 von riverstar_de am 12.10.14 20:04:53ich hatte nicht damit gerechnet, dass Roche/Genentech an Cabozantinib interessiert ist, vielmehr habe ich weitere klinische Studien in Verbindung mit Cobimetinib erwartet; die dürften jedoch nicht lange ausbleiben, da die strategische Bedeutung von cobi für den Konzern ausser Frage steht und zwar in verschiedenen Ansätzen
1.) in Kombitherapie den gleichen und verschiedene Signalwege angreifend
2,) zusammen mit MPDL3280A eine Immunantwort auslösend (Anti-PDL1-Antikörper) https://clinicaltrials.gov/ct2/show/NCT01986166?term=cobimet…
3.) gemeinsam mit Zytostatikas den Zelltod verursachend
4.) in Monotherapie (bin gespannt, ob die von Roche lanciert wird)
aber wenn jetzt auch noch Interesse an cabo besteht, dann dürfte eine Übernahme von Exelixis realistischer sein - nur zu welchem Preis? In Anbetracht von 2 zugelassenen Molekülen (dh proof-of-concept wurde sowohl für cobi als auch cabo erbracht), die für viele weitere Krebserkrankungen bereits in der Klinik erprobt werden, sowie von über 1600 Patenten weltweit, ist eine Bewertung gar nicht so einfach. Die USD 8 Milliarden, die Roche neulich für Intermune bezahlt hat, stehen natürlich (noch) nicht zur Diskussion, sollte jedoch METEOR positive Ergebnisse liefern, wird eine Übernahme mindestens halb so teuer. Eine Uebernahme zum jetzigen Zeitpunkt wäre da wesentlich günstiger. Mal sehen, ob in diesem Jahr noch etwas darüber zu hören ist.
1.) in Kombitherapie den gleichen und verschiedene Signalwege angreifend
2,) zusammen mit MPDL3280A eine Immunantwort auslösend (Anti-PDL1-Antikörper) https://clinicaltrials.gov/ct2/show/NCT01986166?term=cobimet…
3.) gemeinsam mit Zytostatikas den Zelltod verursachend
4.) in Monotherapie (bin gespannt, ob die von Roche lanciert wird)
aber wenn jetzt auch noch Interesse an cabo besteht, dann dürfte eine Übernahme von Exelixis realistischer sein - nur zu welchem Preis? In Anbetracht von 2 zugelassenen Molekülen (dh proof-of-concept wurde sowohl für cobi als auch cabo erbracht), die für viele weitere Krebserkrankungen bereits in der Klinik erprobt werden, sowie von über 1600 Patenten weltweit, ist eine Bewertung gar nicht so einfach. Die USD 8 Milliarden, die Roche neulich für Intermune bezahlt hat, stehen natürlich (noch) nicht zur Diskussion, sollte jedoch METEOR positive Ergebnisse liefern, wird eine Übernahme mindestens halb so teuer. Eine Uebernahme zum jetzigen Zeitpunkt wäre da wesentlich günstiger. Mal sehen, ob in diesem Jahr noch etwas darüber zu hören ist.
Antwort auf Beitrag Nr.: 48.018.568 von Cyberhexe am 13.10.14 12:30:37
danke für die Erklärung. Wie erklärst Du Dir den weiteren Kursverfall wo doch die Nachrichtenlage aktuell gar nicht mehr soo schlecht ist?
Zitat von Cyberhexe: ich hatte nicht damit gerechnet, dass Roche/Genentech an Cabozantinib interessiert ist, vielmehr habe ich weitere klinische Studien in Verbindung mit Cobimetinib erwartet; die dürften jedoch nicht lange ausbleiben, da die strategische Bedeutung von cobi für den Konzern ausser Frage steht und zwar in verschiedenen Ansätzen
1.) in Kombitherapie den gleichen und verschiedene Signalwege angreifend
2,) zusammen mit MPDL3280A eine Immunantwort auslösend (Anti-PDL1-Antikörper) https://clinicaltrials.gov/ct2/show/NCT01986166?term=cobimet…
3.) gemeinsam mit Zytostatikas den Zelltod verursachend
4.) in Monotherapie (bin gespannt, ob die von Roche lanciert wird)
aber wenn jetzt auch noch Interesse an cabo besteht, dann dürfte eine Übernahme von Exelixis realistischer sein - nur zu welchem Preis? In Anbetracht von 2 zugelassenen Molekülen (dh proof-of-concept wurde sowohl für cobi als auch cabo erbracht), die für viele weitere Krebserkrankungen bereits in der Klinik erprobt werden, sowie von über 1600 Patenten weltweit, ist eine Bewertung gar nicht so einfach. Die USD 8 Milliarden, die Roche neulich für Intermune bezahlt hat, stehen natürlich (noch) nicht zur Diskussion, sollte jedoch METEOR positive Ergebnisse liefern, wird eine Übernahme mindestens halb so teuer. Eine Uebernahme zum jetzigen Zeitpunkt wäre da wesentlich günstiger. Mal sehen, ob in diesem Jahr noch etwas darüber zu hören ist.
danke für die Erklärung. Wie erklärst Du Dir den weiteren Kursverfall wo doch die Nachrichtenlage aktuell gar nicht mehr soo schlecht ist?
wow....das ist eine Supernachricht, dh die Kombinationstherapie vemurafenib (brand Zelboraf) und cobimetinib könnte im Sommer 2015 bereits auf den Markt kommen - also wenn jetzt nicht die Post abgeht, verstehe ich die Börsenwelt überhaupt nicht mehr!
Basel, 16. Oktober 2014
Roche mit solidem Verkaufswachstum in den ersten neun Monaten 2014
...
Zelboraf (-8%), metastasierendes Melanom mit BRAF-V600-Mutation: In den Vereinigten Staaten (-42%) steht Zelboraf derzeit in erheblichem Wettbewerb, während in Europa die Verkäufe um 2% zulegten. Im September wurden Ergebnisse der zulassungsrelevanten Phase-III-Studie coBRIM, in der
die Kombinationsbehandlung mit dem Prüfmedikament Cobimetinib (dem MEK-Hemmer von Roche) plus Zelboraf einer Behandlung mit Zelboraf allein gegenüberstellt wurde, auf der ESMO vorgestellt und
im New England Journal of Medicine veröffentlicht. Diese Ergebnisse zeigten, dass die Kombinationsbehandlung das Risiko einer Verschlechterung der Krankheit um die Hälfte senkte. Roche hat die Daten bei der Europäischen Arzneimittelagentur eingereicht. Die FDA hat für die
Kombinationstherapie eine schnellere Prüfung (Fast Track Designation) zugesagt, und das Zulassungsgesuch in den Vereinigten Staaten soll noch in diesem Jahr eingereicht werden.
Basel, 16. Oktober 2014
Roche mit solidem Verkaufswachstum in den ersten neun Monaten 2014
...
Zelboraf (-8%), metastasierendes Melanom mit BRAF-V600-Mutation: In den Vereinigten Staaten (-42%) steht Zelboraf derzeit in erheblichem Wettbewerb, während in Europa die Verkäufe um 2% zulegten. Im September wurden Ergebnisse der zulassungsrelevanten Phase-III-Studie coBRIM, in der
die Kombinationsbehandlung mit dem Prüfmedikament Cobimetinib (dem MEK-Hemmer von Roche) plus Zelboraf einer Behandlung mit Zelboraf allein gegenüberstellt wurde, auf der ESMO vorgestellt und
im New England Journal of Medicine veröffentlicht. Diese Ergebnisse zeigten, dass die Kombinationsbehandlung das Risiko einer Verschlechterung der Krankheit um die Hälfte senkte. Roche hat die Daten bei der Europäischen Arzneimittelagentur eingereicht. Die FDA hat für die
Kombinationstherapie eine schnellere Prüfung (Fast Track Designation) zugesagt, und das Zulassungsgesuch in den Vereinigten Staaten soll noch in diesem Jahr eingereicht werden.
Hallo Cyberhexe,
danke für deine Ausführungen. Ich finde den Kursverfall ebenfalls übertrieben, aber der Boden scheint vorerst gefunden. Wann ist denn mit Ergebnissen aus der METEOR Studie zu rechnen? Mit Sanofi und Daiichi-Sankyo hat man ja noch je eine Phase2 Studie in der Pipeline. Erwartest du dir hier, auch positive Nachrichten?
danke für deine Ausführungen. Ich finde den Kursverfall ebenfalls übertrieben, aber der Boden scheint vorerst gefunden. Wann ist denn mit Ergebnissen aus der METEOR Studie zu rechnen? Mit Sanofi und Daiichi-Sankyo hat man ja noch je eine Phase2 Studie in der Pipeline. Erwartest du dir hier, auch positive Nachrichten?
Antwort auf Beitrag Nr.: 48.055.210 von Cyberhexe am 16.10.14 14:07:15
hast Du eine Ahnung, warum man vom 14.07.14 bis jetzt gewartet hat? Hätte man doch gleich Zulassungsantrag stellen können, oder?
Zitat von Cyberhexe: wow....das ist eine Supernachricht, dh die Kombinationstherapie vemurafenib (brand Zelboraf) und cobimetinib könnte im Sommer 2015 bereits auf den Markt kommen - also wenn jetzt nicht die Post abgeht, verstehe ich die Börsenwelt überhaupt nicht mehr!
Basel, 16. Oktober 2014
Roche mit solidem Verkaufswachstum in den ersten neun Monaten 2014
...
Zelboraf (-8%), metastasierendes Melanom mit BRAF-V600-Mutation: In den Vereinigten Staaten (-42%) steht Zelboraf derzeit in erheblichem Wettbewerb, während in Europa die Verkäufe um 2% zulegten. Im September wurden Ergebnisse der zulassungsrelevanten Phase-III-Studie coBRIM, in der
die Kombinationsbehandlung mit dem Prüfmedikament Cobimetinib (dem MEK-Hemmer von Roche) plus Zelboraf einer Behandlung mit Zelboraf allein gegenüberstellt wurde, auf der ESMO vorgestellt und
im New England Journal of Medicine veröffentlicht. Diese Ergebnisse zeigten, dass die Kombinationsbehandlung das Risiko einer Verschlechterung der Krankheit um die Hälfte senkte. Roche hat die Daten bei der Europäischen Arzneimittelagentur eingereicht. Die FDA hat für die
Kombinationstherapie eine schnellere Prüfung (Fast Track Designation) zugesagt, und das Zulassungsgesuch in den Vereinigten Staaten soll noch in diesem Jahr eingereicht werden.
hast Du eine Ahnung, warum man vom 14.07.14 bis jetzt gewartet hat? Hätte man doch gleich Zulassungsantrag stellen können, oder?
Antwort auf Beitrag Nr.: 48.060.508 von riverstar_de am 16.10.14 21:29:13für einen Zulassungsantrag bei der FDA müssen tonnenweise Dokumente eingereicht werden, bei denen jeder i-Punkt und jeder t-Strich vorhanden sein muss, andernfalls hat man keine Chance eine Zulassung zu erhalten; an der Fertigstellung dieser Dokumente arbeiten zwar x-Leute mit Hochdruck, es benötigt dennoch eine gewisse Zeit, bis die Dossiers gespickt mit den Studienergebnissen bzw. Auswertungen vorliegen. Roche hat das Potenzial so schnell zusein: Ende September wurden die Ergebnisse von coBRIM bekanntgegeben und nun wurde der zulassungsantrag bereits eingereicht. In Europa war man früher (Anfang September), weil die coBRIM-Ergebnisse nachgereicht werden konnten.
Antwort auf Beitrag Nr.: 48.063.316 von Cyberhexe am 17.10.14 09:52:16Ende September wurden die Ergebnisse von coBRIM bekanntgegeben und nun wurde der zulassungsantrag bereits eingereicht.
sorry stimmt ja gar nicht, der Zulassungsantrag wurde bei der FDA noch nicht eingereicht sonder noch für dieses Jahr angekündigt; wie gesagt, dafür benötigt man Zeit.
Die FDA hat für die Kombinationstherapie eine schnellere Prüfung (Fast Track Designation) zugesagt, und das Zulassungsgesuch in den Vereinigten Staaten soll noch in diesem Jahr eingereicht werden.
sorry stimmt ja gar nicht, der Zulassungsantrag wurde bei der FDA noch nicht eingereicht sonder noch für dieses Jahr angekündigt; wie gesagt, dafür benötigt man Zeit.
Die FDA hat für die Kombinationstherapie eine schnellere Prüfung (Fast Track Designation) zugesagt, und das Zulassungsgesuch in den Vereinigten Staaten soll noch in diesem Jahr eingereicht werden.
Antwort auf Beitrag Nr.: 48.063.316 von Cyberhexe am 17.10.14 09:52:16
dann war der 14.07.14 nur der 1. Endpunkt der phase 3.
http://www.roche.com/media/media_releases/med-cor-2014-07-14…
Zitat von Cyberhexe: für einen Zulassungsantrag bei der FDA müssen tonnenweise Dokumente eingereicht werden, bei denen jeder i-Punkt und jeder t-Strich vorhanden sein muss, andernfalls hat man keine Chance eine Zulassung zu erhalten; an der Fertigstellung dieser Dokumente arbeiten zwar x-Leute mit Hochdruck, es benötigt dennoch eine gewisse Zeit, bis die Dossiers gespickt mit den Studienergebnissen bzw. Auswertungen vorliegen. Roche hat das Potenzial so schnell zusein: Ende September wurden die Ergebnisse von coBRIM bekanntgegeben und nun wurde der zulassungsantrag bereits eingereicht. In Europa war man früher (Anfang September), weil die coBRIM-Ergebnisse nachgereicht werden konnten.
dann war der 14.07.14 nur der 1. Endpunkt der phase 3.
http://www.roche.com/media/media_releases/med-cor-2014-07-14…
Enrichment of c-Met(+) tumorigenic stromal cells of giant cell tumor of bone and targeting by cabozantinib.
Liu L1, Aleksandrowicz E1, Fan P1, Schönsiegel F1, Zhang Y1, Sähr H2, Gladkich J1, Mattern J1, Depeweg D2, Lehner B2, Fellenberg J2, Herr I1.
Author information
Abstract
Giant cell tumor of bone (GCTB) is a very rare tumor entity, which is little examined owing to the lack of established cell lines and mouse models and the restriction of available primary cell lines. The stromal cells of GCTB have been made responsible for the aggressive growth and metastasis, emphasizing the presence of a cancer stem cell population. To identify and target such tumor-initiating cells, stromal cells were isolated from eight freshly resected GCTB tissues. Tumorigenic properties were examined by colony and spheroid formation, differentiation, migration, MTT (3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide) assay, immunohistochemistry, antibody protein array, Alu in situ hybridization, FACS analysis and xenotransplantation into fertilized chicken eggs and mice. A sub-population of the neoplastic stromal cells formed spheroids and colonies, differentiated to osteoblasts, migrated to wounded regions and expressed the metastasis marker CXC-chemokine receptor type 4, indicating self-renewal, invasion and differentiation potential. Compared with adherent-growing cells, markers for pluripotency, stemness and cancer progression, including the CSC surface marker c-Met, were enhanced in spheroidal cells. This c-Met-enriched sub-population formed xenograft tumors in fertilized chicken eggs and mice. Cabozantinib, an inhibitor of c-Met in phase II trials, eliminated CSC features with a higher therapeutic effect than standard chemotherapy. This study identifies a c-Met(+) tumorigenic sub-population within stromal GCTB cells and suggests the c-Met inhibitor cabozantinib as a new therapeutic option for targeted elimination of unresectable or recurrent GCTB.
Liu L1, Aleksandrowicz E1, Fan P1, Schönsiegel F1, Zhang Y1, Sähr H2, Gladkich J1, Mattern J1, Depeweg D2, Lehner B2, Fellenberg J2, Herr I1.
Author information
Abstract
Giant cell tumor of bone (GCTB) is a very rare tumor entity, which is little examined owing to the lack of established cell lines and mouse models and the restriction of available primary cell lines. The stromal cells of GCTB have been made responsible for the aggressive growth and metastasis, emphasizing the presence of a cancer stem cell population. To identify and target such tumor-initiating cells, stromal cells were isolated from eight freshly resected GCTB tissues. Tumorigenic properties were examined by colony and spheroid formation, differentiation, migration, MTT (3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide) assay, immunohistochemistry, antibody protein array, Alu in situ hybridization, FACS analysis and xenotransplantation into fertilized chicken eggs and mice. A sub-population of the neoplastic stromal cells formed spheroids and colonies, differentiated to osteoblasts, migrated to wounded regions and expressed the metastasis marker CXC-chemokine receptor type 4, indicating self-renewal, invasion and differentiation potential. Compared with adherent-growing cells, markers for pluripotency, stemness and cancer progression, including the CSC surface marker c-Met, were enhanced in spheroidal cells. This c-Met-enriched sub-population formed xenograft tumors in fertilized chicken eggs and mice. Cabozantinib, an inhibitor of c-Met in phase II trials, eliminated CSC features with a higher therapeutic effect than standard chemotherapy. This study identifies a c-Met(+) tumorigenic sub-population within stromal GCTB cells and suggests the c-Met inhibitor cabozantinib as a new therapeutic option for targeted elimination of unresectable or recurrent GCTB.
Antwort auf Beitrag Nr.: 48.063.994 von riverstar_de am 17.10.14 10:42:55The combined therapy reduced the risk of disease worsening or death by half (hazard ratio [HR]=0.51, 95 percent confidence interval [CI] 0.39-0.68; p<0.0001), with a median PFS of 9.9 months for cobimetinib plus Zelboraf compared to 6.2 months with Zelboraf alone. The safety profile was consistent with a previous study of the combination. The most common adverse events seen in the combination arm included diarrhea, nausea, rash, photosensitivity, and lab abnormalities.1
The coBRIM results were statistically significant across multiple secondary endpoints. The median PFS by independent review committee (IRC) was 11.3 months for the combination arm compared to 6.0 months for the control arm (HR=0.60, 95 percent CI 0.45-0.79; p=0.0003). The objective response rate (ORR) was higher in the combination compared to the control arm (68 vs. 45 percent; p<0.0001). Overall survival (OS) data are not yet mature.1
Im Juli wurde lediglich bekannt gegeben, dass der primäre Endpunkt erreicht wurde, die detaillierte Auswertung und die Konsolidierung der Studienprotokolle ist jedoch eine diagnostische Herausforderung, welche allein schon an den unterschiedlichen Ergebnisse der Studienleitung (median 9.9 Monate) und eines unabhängigen Kontrollgremiums (11.3 Monate) sichtbar wird. Es gilt hierzu zu bedenken, dass ein Fortschreiten der Tumorerkrankung keine binäre Angelegenheit ist und die Sichtung von unzähligen Aufnahmen (MRIs) erforderlich macht.
Zudem ist die Studie noch nicht abgeschlossen, da der Überlebensvorteil noch nicht mit statistischer Signifikanz berechnet werden konnte --> "Overall survival (OS) data are not yet mature." Die Auswertung dieses Endpunktes ist jedoch wesentlich einfacher, da es sich hierbei um eine binäre Angelegenheit handelt (tot oder lebendig).
Erst wenn die Unterlagen zu CoBRIM vollständig erstellt wurden (das waren früher tonnenweise Papierdokumente, heute jedoch elektronisch), kann bei der FDA der Zulassungsantrag gestellt werden - dies soll, wie von Roche angekündigt, noch dieses Jahr geschehen. Mit der europäischen Arzneimittelbehörde hat man sich datrauf verständigt die CoBRIM-Ergebnisse nachzuliefern (rollende Zulassung), so dass der Zulassungsprozess schon im September gestrtet werden konnte.
The coBRIM results were statistically significant across multiple secondary endpoints. The median PFS by independent review committee (IRC) was 11.3 months for the combination arm compared to 6.0 months for the control arm (HR=0.60, 95 percent CI 0.45-0.79; p=0.0003). The objective response rate (ORR) was higher in the combination compared to the control arm (68 vs. 45 percent; p<0.0001). Overall survival (OS) data are not yet mature.1
Im Juli wurde lediglich bekannt gegeben, dass der primäre Endpunkt erreicht wurde, die detaillierte Auswertung und die Konsolidierung der Studienprotokolle ist jedoch eine diagnostische Herausforderung, welche allein schon an den unterschiedlichen Ergebnisse der Studienleitung (median 9.9 Monate) und eines unabhängigen Kontrollgremiums (11.3 Monate) sichtbar wird. Es gilt hierzu zu bedenken, dass ein Fortschreiten der Tumorerkrankung keine binäre Angelegenheit ist und die Sichtung von unzähligen Aufnahmen (MRIs) erforderlich macht.
Zudem ist die Studie noch nicht abgeschlossen, da der Überlebensvorteil noch nicht mit statistischer Signifikanz berechnet werden konnte --> "Overall survival (OS) data are not yet mature." Die Auswertung dieses Endpunktes ist jedoch wesentlich einfacher, da es sich hierbei um eine binäre Angelegenheit handelt (tot oder lebendig).
Erst wenn die Unterlagen zu CoBRIM vollständig erstellt wurden (das waren früher tonnenweise Papierdokumente, heute jedoch elektronisch), kann bei der FDA der Zulassungsantrag gestellt werden - dies soll, wie von Roche angekündigt, noch dieses Jahr geschehen. Mit der europäischen Arzneimittelbehörde hat man sich datrauf verständigt die CoBRIM-Ergebnisse nachzuliefern (rollende Zulassung), so dass der Zulassungsprozess schon im September gestrtet werden konnte.
Hallo Cyberhexe,
danke für deine Ausführungen. Ich finde den Kursverfall ebenfalls übertrieben, aber der Boden scheint vorerst gefunden. Wann ist denn mit Ergebnissen aus der METEOR Studie zu rechnen? Mit Sanofi und Daiichi-Sankyo hat man ja noch je eine Phase2 Studie in der Pipeline. Erwartest du dir hier, auch positive Nachrichten?
die Entblindung von METEOR ist auf 2015 angekündigt; wann dies jedoch genau sein soll, ist mir nicht bekannt.
Die neben Cobimetinib und Cabozantinib am weitesten entwickelten Projekte...
SAR245408 (XL147) PI3K Sanofi Phase 2
CS-3150 (XL550)MR Daiichi-Sankyo Phase 2
SAR245409 (XL765)PI3K, mTOR Sanofi Phase 1b/2
...bewerte ich für mich persönlich konservativ, nämlich ohne Wert, und betrachte jede positive Nachricht als unerwartetes Zubrot.
Jedoch sind Cabozantinib und bald auch Cobimetinib am Markt zugelassene Wirkstoffe mit unglaublich vielen Möglichkeiten. Beispielsweise wird Cobi mit 5 anderen Wirkstoffen bereits in der Klinik kombiniert (einschliesslich der Studie mit Onartuzumab, - allerdings wurde die Entwicklung des metMAb Onartuzumab in "single use" gestoppt, da keine ausreichende klinische Wirksamkeit gezeigt werden konnte. Ich könnte mir vorstellen, dass diese Studie nun "on hold" (keine zusätzliche Rekrutierung) ist - und dürfte noch mit weiteren Wirkstoffen (Antikörper, Taxane etc.) in der Klinik untersucht werden. Cobimetinib hemmt den MEK-Signalweg und kann, nach Meinung von Experten, die Wirksamkeit von anderen Krebsmedikamenten verlängern, so dass sich daraus ein vielfältiges Anwendungspotenzial ergibt.
Zu Cabozantinib sind derzeit 61 klinische Studien auffindbar, welche zu einem guten Teil auch von anderen Sponsoren (z.B National, Cancer Instiitute, University of Alabama at Birmingham, Cedars-Sinai Medical Center, Massachusetts General Hospitalund einige mehr) finanziert werden - das breite Interesse spricht eindeutig für eine prognostizierte Wirksamkeit! Dies alles in Verbindung mit den weltweit erteilten Patenten (über 1600) ist eindeutig von Wert, meiner Meinung nach ein Vielfaches der derzeitigen Marktkapitalisierung!! Deswegen für mich ein klares "Strong buy"!
danke für deine Ausführungen. Ich finde den Kursverfall ebenfalls übertrieben, aber der Boden scheint vorerst gefunden. Wann ist denn mit Ergebnissen aus der METEOR Studie zu rechnen? Mit Sanofi und Daiichi-Sankyo hat man ja noch je eine Phase2 Studie in der Pipeline. Erwartest du dir hier, auch positive Nachrichten?
die Entblindung von METEOR ist auf 2015 angekündigt; wann dies jedoch genau sein soll, ist mir nicht bekannt.
Die neben Cobimetinib und Cabozantinib am weitesten entwickelten Projekte...
SAR245408 (XL147) PI3K Sanofi Phase 2
CS-3150 (XL550)MR Daiichi-Sankyo Phase 2
SAR245409 (XL765)PI3K, mTOR Sanofi Phase 1b/2
...bewerte ich für mich persönlich konservativ, nämlich ohne Wert, und betrachte jede positive Nachricht als unerwartetes Zubrot.
Jedoch sind Cabozantinib und bald auch Cobimetinib am Markt zugelassene Wirkstoffe mit unglaublich vielen Möglichkeiten. Beispielsweise wird Cobi mit 5 anderen Wirkstoffen bereits in der Klinik kombiniert (einschliesslich der Studie mit Onartuzumab, - allerdings wurde die Entwicklung des metMAb Onartuzumab in "single use" gestoppt, da keine ausreichende klinische Wirksamkeit gezeigt werden konnte. Ich könnte mir vorstellen, dass diese Studie nun "on hold" (keine zusätzliche Rekrutierung) ist - und dürfte noch mit weiteren Wirkstoffen (Antikörper, Taxane etc.) in der Klinik untersucht werden. Cobimetinib hemmt den MEK-Signalweg und kann, nach Meinung von Experten, die Wirksamkeit von anderen Krebsmedikamenten verlängern, so dass sich daraus ein vielfältiges Anwendungspotenzial ergibt.
Zu Cabozantinib sind derzeit 61 klinische Studien auffindbar, welche zu einem guten Teil auch von anderen Sponsoren (z.B National, Cancer Instiitute, University of Alabama at Birmingham, Cedars-Sinai Medical Center, Massachusetts General Hospitalund einige mehr) finanziert werden - das breite Interesse spricht eindeutig für eine prognostizierte Wirksamkeit! Dies alles in Verbindung mit den weltweit erteilten Patenten (über 1600) ist eindeutig von Wert, meiner Meinung nach ein Vielfaches der derzeitigen Marktkapitalisierung!! Deswegen für mich ein klares "Strong buy"!
Antwort auf Beitrag Nr.: 48.059.305 von McNay am 16.10.14 19:31:03die Entblindung von METEOR ist auf 2015 angekündigt; wann dies jedoch genau sein soll, ist mir nicht bekannt.
Die neben Cobimetinib und Cabozantinib am weitesten entwickelten Projekte...
SAR245408 (XL147) PI3K Sanofi Phase 2
CS-3150 (XL550)MR Daiichi-Sankyo Phase 2
SAR245409 (XL765)PI3K, mTOR Sanofi Phase 1b/2
...bewerte ich für mich persönlich konservativ, nämlich ohne Wert, und betrachte jede positive Nachricht als unerwartetes Zubrot.
Jedoch sind Cabozantinib und bald auch Cobimetinib am Markt zugelassene Wirkstoffe mit unglaublich vielen Möglichkeiten. Beispielsweise wird Cobi mit 5 anderen Wirkstoffen bereits in der Klinik kombiniert (einschliesslich der Studie mit Onartuzumab, - allerdings wurde die Entwicklung des metMAb Onartuzumab in "single use" gestoppt, da keine ausreichende klinische Wirksamkeit gezeigt werden konnte. Ich könnte mir vorstellen, dass diese Studie nun "on hold" - keine zusätzliche Rekrutierung ist) und dürfte noch mit weiteren Wirkstoffen (Antikörper, Taxane etc.) in der Klinik untersucht werden. Cobimetinib hemmt den MEK-Signalweg und kann, nach Meinung von Experten, die Wirksamkeit von anderen Krebsmedikamenten verlängern, so dass sich daraus ein vielfältiges Anwendungspotenzial ergibt.
Zu Cabozantinib sind derzeit 61 klinische Studien auffindbar, welche zu einem guten Teil auch von anderen Sponsoren (z.B National, Cancer Instiitute, University of Alabama at Birmingham, Cedars-Sinai Medical Center, Massachusetts General Hospitalund einige mehr) finanziert werden - das breite Interesse spricht eindeutig für eine prognostizierte Wirksamkeit! Dies alles in Verbindung mit den weltweit erteilten Patenten (über 1600) ist eindeutig von Wert, meiner Meinung nach ein Vielfaches der derzeitigen Marktkapitalisierung!! Deswegen für mich ein klares "Strong buy"!
Die neben Cobimetinib und Cabozantinib am weitesten entwickelten Projekte...
SAR245408 (XL147) PI3K Sanofi Phase 2
CS-3150 (XL550)MR Daiichi-Sankyo Phase 2
SAR245409 (XL765)PI3K, mTOR Sanofi Phase 1b/2
...bewerte ich für mich persönlich konservativ, nämlich ohne Wert, und betrachte jede positive Nachricht als unerwartetes Zubrot.
Jedoch sind Cabozantinib und bald auch Cobimetinib am Markt zugelassene Wirkstoffe mit unglaublich vielen Möglichkeiten. Beispielsweise wird Cobi mit 5 anderen Wirkstoffen bereits in der Klinik kombiniert (einschliesslich der Studie mit Onartuzumab, - allerdings wurde die Entwicklung des metMAb Onartuzumab in "single use" gestoppt, da keine ausreichende klinische Wirksamkeit gezeigt werden konnte. Ich könnte mir vorstellen, dass diese Studie nun "on hold" - keine zusätzliche Rekrutierung ist) und dürfte noch mit weiteren Wirkstoffen (Antikörper, Taxane etc.) in der Klinik untersucht werden. Cobimetinib hemmt den MEK-Signalweg und kann, nach Meinung von Experten, die Wirksamkeit von anderen Krebsmedikamenten verlängern, so dass sich daraus ein vielfältiges Anwendungspotenzial ergibt.
Zu Cabozantinib sind derzeit 61 klinische Studien auffindbar, welche zu einem guten Teil auch von anderen Sponsoren (z.B National, Cancer Instiitute, University of Alabama at Birmingham, Cedars-Sinai Medical Center, Massachusetts General Hospitalund einige mehr) finanziert werden - das breite Interesse spricht eindeutig für eine prognostizierte Wirksamkeit! Dies alles in Verbindung mit den weltweit erteilten Patenten (über 1600) ist eindeutig von Wert, meiner Meinung nach ein Vielfaches der derzeitigen Marktkapitalisierung!! Deswegen für mich ein klares "Strong buy"!
Hallo Cyberhexe,
wie bewertest du eigentlich die Ergebnisse von Cobrim. Nach dem was du vorher geschrieben hast, waren die Ergebnisse doch eher enttäuschend?
Ohad Hammer mit einer Einschätzung:
Exelixis – Robust efficacy for cobi but differentiation remains unclear
At ESMO, Roche and Exelixis (EXEL) presented positive results for cobimetinib in combination with Zelboraf in melanoma. Results were robust with a 3.6-month PFS benefit (9.9 vs. 6.2 months, HR=0.51) and a positive OS trend (HR=0.65) that will likely become statistically significant with additional follow up.
The data were clearly positive and should lead to approval of cobimetinib, but the drug does not appear differentiated from GSK’s (GSK) MEK inhibitor, which led to a similar PFS benefit (11.4 vs. 7.3 months, HR=0.56) when combined with GSK’s BRAF inhibitor (Tafinlar). GSK’s combination also led to a statistically significant improvement in OS (HR=0.69). The only clear difference was in the side effect profiles, as Roche’s combination led to more photosensitivity whereas GSK’s combination led to a higher rate of fever.
Without a clear winner, it remains to be seen which combination will be more commercially successful. On the one hand, Roche is the global leader in oncology and BRAF+ melanoma in particular. On the other, GSK’s combination is already approved in the US. Assuming a 50-50 split and a global opportunity of $600M for MEK inhibitors in BRAF+ melanoma, Exelixis should generate ~$100M in annual revenue. (30-50% profit split in the US plus 10-15% royalties ex-US).
Exelixis shares continued to slide despite the positive results and the imminent revenue stream expected to begin next year. This can be explained in part by the lack of clear differentiation from GSK’s Mekinist, but the most serious overhang for Exelixis is its significant debt ($380M). Until this is resolved, it will be challenging for investors to attribute real value to its pipeline.
http://www.orf-blog.com/biotech-portfolio-update-three-reado…
Interessante Überlegungen auch hier:
http://epvantage.com/Universal/View.aspx?type=Story&id=53213…
Interessant finde ich, dass in dem GSK-NOV Deal (Novartis "kauft" die Onkologiesparte von GSK) explizit ein CVR eingearbeitet wurde, der GsK eine Zahlung von 1,5 Milliarden US$ verspricht, wenn die OS Daten zu Mekinist + Tafinlar positiv sind. Das spricht zumindest dafür, dass das Potenzial der Kombi vorhanden ist. Wer sich dann wo durchsetzt wird man abwarten müssen... SG kmastra
wie bewertest du eigentlich die Ergebnisse von Cobrim. Nach dem was du vorher geschrieben hast, waren die Ergebnisse doch eher enttäuschend?
Ohad Hammer mit einer Einschätzung:
Exelixis – Robust efficacy for cobi but differentiation remains unclear
At ESMO, Roche and Exelixis (EXEL) presented positive results for cobimetinib in combination with Zelboraf in melanoma. Results were robust with a 3.6-month PFS benefit (9.9 vs. 6.2 months, HR=0.51) and a positive OS trend (HR=0.65) that will likely become statistically significant with additional follow up.
The data were clearly positive and should lead to approval of cobimetinib, but the drug does not appear differentiated from GSK’s (GSK) MEK inhibitor, which led to a similar PFS benefit (11.4 vs. 7.3 months, HR=0.56) when combined with GSK’s BRAF inhibitor (Tafinlar). GSK’s combination also led to a statistically significant improvement in OS (HR=0.69). The only clear difference was in the side effect profiles, as Roche’s combination led to more photosensitivity whereas GSK’s combination led to a higher rate of fever.
Without a clear winner, it remains to be seen which combination will be more commercially successful. On the one hand, Roche is the global leader in oncology and BRAF+ melanoma in particular. On the other, GSK’s combination is already approved in the US. Assuming a 50-50 split and a global opportunity of $600M for MEK inhibitors in BRAF+ melanoma, Exelixis should generate ~$100M in annual revenue. (30-50% profit split in the US plus 10-15% royalties ex-US).
Exelixis shares continued to slide despite the positive results and the imminent revenue stream expected to begin next year. This can be explained in part by the lack of clear differentiation from GSK’s Mekinist, but the most serious overhang for Exelixis is its significant debt ($380M). Until this is resolved, it will be challenging for investors to attribute real value to its pipeline.
http://www.orf-blog.com/biotech-portfolio-update-three-reado…
Interessante Überlegungen auch hier:
http://epvantage.com/Universal/View.aspx?type=Story&id=53213…
Interessant finde ich, dass in dem GSK-NOV Deal (Novartis "kauft" die Onkologiesparte von GSK) explizit ein CVR eingearbeitet wurde, der GsK eine Zahlung von 1,5 Milliarden US$ verspricht, wenn die OS Daten zu Mekinist + Tafinlar positiv sind. Das spricht zumindest dafür, dass das Potenzial der Kombi vorhanden ist. Wer sich dann wo durchsetzt wird man abwarten müssen... SG kmastra
Obschon natürlich bekannt ist, dass es nicht so einfach ist, die Ergebnisse aus frühen ph1b oder ph2 in mächtigen ph3-Studien zu bestätigen, hatte ich in coBRIM zumindest einen Median beim progressionsfreien Überleben grösser 10 Monate erwartet, da in 1b (BRIM7) ein Median von knapp unter 13 Mon realisiert wurde. Da war die Enttäuschung zu Beginn schon greifbar. Nachdem sich jedoch der Rauch etwas gelichtet hat, und man die Ergebnisse näher betrachtet, dann sind diese nicht so schlecht. Die Wirksamkeit ist sicherlich mit der Kombitherapie von gsk (bzw. zukünftig Novartis) vergleichbar, beim Nebenwirkungsprofil scheint mir jedoch die Roche/Genentech-Kombinationstherapie günstiger zu sein - bei gsk sehr häufig hohes Fieber (grade 3 und 4 über 70%) sowie ebenfalls sehr häufig (knapp 60%) Erkältungen. Dies ist bei derart in der Gesundheit angeschlagenen Patienten ungünstig, weshalb zu erwarten ist, dass Roche/Genentech beim Umsatz die Nase vorne haben wird.
Antwort auf Beitrag Nr.: 48.129.143 von Cyberhexe am 25.10.14 07:23:25
BRIM7 combi vemurafenib+cobimetinib ph1b; n=63 patients
CR 9.5%
PR 77.8%
SD 9.5%
PD 3.2%
Not evaluable 0%
ORR (=CR+PR) = 87%
Kaplan-Meier Estimates for PFS, Median à 13.7 months
Duration of response, Median à 12.5 months
Median bei PFS bei BRIM7 => 13.7 Monate --> deswegen waren die 9.9 Monate in pH3 CoBRIM schon etwas enttäuschend!
BRIM7 combi vemurafenib+cobimetinib ph1b; n=63 patients
CR 9.5%
PR 77.8%
SD 9.5%
PD 3.2%
Not evaluable 0%
ORR (=CR+PR) = 87%
Kaplan-Meier Estimates for PFS, Median à 13.7 months
Duration of response, Median à 12.5 months
Median bei PFS bei BRIM7 => 13.7 Monate --> deswegen waren die 9.9 Monate in pH3 CoBRIM schon etwas enttäuschend!
wow...Phase 2 Trial of Cabozantinib and Erlotinib in Patients With EGFR Wild-Type Non-Small Cell Lung Cancer
...dieses Ergebnis ist der HAMMER...progressionsfreies Überleben unter Cabozantinib verdoppelt im Vergleich zu Roches Erlotinib (brand TARCEVA) beim nicht-kleinzelligen Bronchialkarzinom - eine Schnittstelle mehr von Roche zu Exelixis. Da bei Tarceva der patentschutz abgelaufen ist und diese Umsätze zukünftig wohl sehr rasch schrumpfen werden, wäre die Schnittstelle (bzw. Uebernahme) von Exelixis eine Möglichkeit, diesen Umsatzverlust zu kompensieren. Für mich bedeutet dies.... "when not if"!!News Release
Exelixis Announces Positive Top-Line Results From a Phase 2 Trial of Cabozantinib and Erlotinib in Patients With EGFR Wild-Type Non-Small Cell Lung Cancer
- Study E1512 Met Primary Endpoint, Significantly Improving Progression-Free Survival in the Cabozantinib Monotherapy and Cabozantinib/Erlotinib Arms Compared to the Erlotinib Arm –
SOUTH SAN FRANCISCO, Calif.--(BUSINESS WIRE)--Nov. 4, 2014-- Exelixis, Inc. (NASDAQ:EXEL) today announced positive top-line results from a randomized phase 2 trial of cabozantinib and erlotinib alone or in combination as second- or third-line therapy in patients with stage IV EGFR wild-type non-small cell lung cancer (NSCLC). This trial (Study E1512) is sponsored by the U.S. National Cancer Institute (NCI) through a Cooperative Research and Development Agreement between the Cancer Therapy Evaluation Program (CTEP), Division of Cancer Treatment and Diagnosis, NCI and Exelixis. Study E1512 was designed and is being conducted by the ECOG-ACRIN Cancer Research Group as part of Exelixis’ collaboration with the NCI. Joel Neal, M.D., Ph.D., from ECOG-ACRIN member institution Stanford University/Stanford Cancer Institute, chairs the study.
In the E1512 trial, 125 patients were randomized to one of the three arms: erlotinib, cabozantinib, or the combination. During a pre-planned interim ECOG-ACRIN Data Safety Monitoring Committee analysis for futility, it was found that the trial met its primary endpoint of improving progression-free survival (PFS) with cabozantinib alone and also with the combination of cabozantinib plus erlotinib, as compared to erlotinib alone, and the results were highly statistically significant. Safety data were consistent with those observed in other trials of cabozantinib. At time of analysis, the median follow-up was 5.9 months and overall survival data were immature.
The results of the trial are the subject of ongoing analyses and will be submitted by the investigators for presentation at a future medical conference.
Exelixis President and CEO, Michael M. Morrissey, Ph.D., commented on the results: “This is one of the first substantial data sets from our collaboration with NCI-CTEP, which has enabled us to broaden the cabozantinib development program while focusing our internal resources on our pivotal trials. We are excited by these positive results and are looking forward to working with the trial investigators to support future development of cabozantinib in NSCLC and beyond, while we await top-line results from our pivotal phase 3 trial METEOR in metastatic renal cell carcinoma, now anticipated in the second quarter of 2015.”
Cowen Upgrades Exelixis (EXEL) to Outperform
http://www.streetinsider.com/Upgrades/Cowen+Upgrades+Exelixi…
Antwort auf Beitrag Nr.: 48.223.555 von Cyberhexe am 05.11.14 03:10:29Korrektur:
ein generisches Präparat zu Erlotinib (generic name TARCEVA) wurde bereits zugelassen, jedoch kann dieses aufgrund des noch andauernden Patentschutzes noch nicht vermarktet werden:
Has a generic version of Tarceva been approved?
A generic version of Tarceva has been approved by the FDA. However, this does not mean that the product will necessarily be commercially available - possibly because of drug patents and/or drug exclusivity. The following products are equivalent to Tarceva and have been approved by the FDA:
erlotinib hydrochloride tablet;oral
• Manufacturer: MYLAN PHARMS INC
Approval date: June 11, 2014
Strength(s): EQ 25MG BASE [AB], EQ 100MG BASE [AB], EQ 150MG BASE [AB]
so wie es aussieht, besteht bis Mai 2016:
Related Exclusivities
Exclusivity is exclusive marketing rights granted by the FDA upon approval of a drug and can run concurrently with a patent or not. Exclusivity is a statutory provision and is granted to an NDA applicant if statutory requirements are met.
•
Exclusivity expiration dates:
◦May 14, 2016 - FIRSTLINE TREATMENT OF PATIENTS WITH METASTATIC NON- SMALL CELL LUNG CANCER (NSCLC) WHOSE TUMORS HAVE EPIDERMAL GROWTH FACTOR RECEPTOR (EGFR) EXON 19 DELETIONS OR EXON 21(L858R) SUBSTITUTION MUTATIONS AS DETECTED BY AN FDA- APPROVED TEST
Da jedoch Cabozantinib das progressionsfreie Überleben verdoppelt, bin ich mal gespannt, wie es bei NSCLC weitergeht. Cabo ist ja bereits zugelassen bei Schilddrüsenkrebs, weshalb ein beschleunigtes Zulassungsverfahren aufgrund statistisch signifikanter ph2-Daten nicht ausgeschlossen. ES BLEIBT SPANNEND!
ein generisches Präparat zu Erlotinib (generic name TARCEVA) wurde bereits zugelassen, jedoch kann dieses aufgrund des noch andauernden Patentschutzes noch nicht vermarktet werden:
Has a generic version of Tarceva been approved?
A generic version of Tarceva has been approved by the FDA. However, this does not mean that the product will necessarily be commercially available - possibly because of drug patents and/or drug exclusivity. The following products are equivalent to Tarceva and have been approved by the FDA:
erlotinib hydrochloride tablet;oral
• Manufacturer: MYLAN PHARMS INC
Approval date: June 11, 2014
Strength(s): EQ 25MG BASE [AB], EQ 100MG BASE [AB], EQ 150MG BASE [AB]
so wie es aussieht, besteht bis Mai 2016:
Related Exclusivities
Exclusivity is exclusive marketing rights granted by the FDA upon approval of a drug and can run concurrently with a patent or not. Exclusivity is a statutory provision and is granted to an NDA applicant if statutory requirements are met.
•
Exclusivity expiration dates:
◦May 14, 2016 - FIRSTLINE TREATMENT OF PATIENTS WITH METASTATIC NON- SMALL CELL LUNG CANCER (NSCLC) WHOSE TUMORS HAVE EPIDERMAL GROWTH FACTOR RECEPTOR (EGFR) EXON 19 DELETIONS OR EXON 21(L858R) SUBSTITUTION MUTATIONS AS DETECTED BY AN FDA- APPROVED TEST
Da jedoch Cabozantinib das progressionsfreie Überleben verdoppelt, bin ich mal gespannt, wie es bei NSCLC weitergeht. Cabo ist ja bereits zugelassen bei Schilddrüsenkrebs, weshalb ein beschleunigtes Zulassungsverfahren aufgrund statistisch signifikanter ph2-Daten nicht ausgeschlossen. ES BLEIBT SPANNEND!
3 % Plus nach den Zahlen, Ergebnissen und Ausblicken sind recht wenig, finde ich. Irgendwas läuft hier doch im Hintergrund ab. Nicht da die jemand einfach nur billig übernehmen will.
sehr eindrucksvoll: MAPK Signalweg via Roche-Internet
http://www.roche.com/research_and_development/what_we_are_wo…...und Cobimetinib ist Roches wichtigste Aktivsubstanz, die den MAPK-Signalweg hemmt!
Negativ ist bei EXEL leider die Verschuldung zu sehen. M.E. wären ohne diesen Fakt weitaus höhere Kurse gerechtfertigt. Man darf das Problem aber nicht unterschätzen, denn wenn die nächsten P IIIs bei Cabo auch floppen sieht es ziemlich düster aus. Zwar ist jetzt noch viel Cash vorhanden aber die Studien und auch die Vermarktung von Cabo kostet auch viel Geld. Von den Royalties etc. durch Cobi wird man die Schulden nicht zurück zahlen können...
http://www.evaluategroup.com/Universal/View.aspx?type=Story&…
http://www.orf-blog.com/exelixis-post-the-prostate-cancer-fa…
http://www.evaluategroup.com/Universal/View.aspx?type=Story&…
http://www.orf-blog.com/exelixis-post-the-prostate-cancer-fa…
Antwort auf Beitrag Nr.: 48.301.819 von kmastra am 12.11.14 19:47:00Betrachtet man den Roche-Umsatz von Zelboraf (vemurafenib) in den ersten 9 Monaten von 2014
in Mio CHF
Zelboraf 230 -8% 53 -42% 145 2% 32 69%
ist folgendes festzustellen: die US-Umsätze (CHF 230 Mio) gehen dramatisch (-42%) zurück. Dies aufgrund der wesentlich wirksameren Kombitherapie von gsk (Trametinib/Dabrafenib). In Europa hingegen leichter (+2%) Zuwachs sowie in rest of world ein starkes (+69%) Umsatzwachstum, da dort die Kombi von gsk noch nicht zugelassen wurde. Roche ist deswegen bestrebt, die eigene Kombitherapie (Vemurafenib/Cobimetinib) schnellstmöglichst am Markt zu platzieren: in Europe Zulassung beantragt im September 2014; in den US noch vor Ende des Jahres - fast track wurde bereits zugestanden.
Sobald die Kombitherapie zugelassen ist, dürften die Zelboraf-Umsätze fast vollständig "kannibalisiert" werden - erwarteter Umsatz der Kombi pro Jahr so um die 500 Mio CHF. Hiervon müssten mindestens 100 Mio an Exelixis abgetreten werden.
Darüber hinaus ist Cobimetinib in weiteren klinischen Studien mit anderen Wirkstoffen in Erprobung und weitere Studien könnten/werden folgen.
Also auch wenn Cabo vollständig floppen sollte, dann ist mit Cobi immerhin ein Wert geschaffen, der über Jahre zumindest ein Minimum der Geschäftsfähigkeit erhalten sollte. Die Kursphantasie ergibt sich zugegebenermassen aus dem Erfolg von Cabozantinib in Renal Cell Carcinoma (Nierenkrebs) bzw Hepatocellular carcinoma (Leberkrebs)
The ongoing phase III study of cabozantinib in kidney cancer is expected to report results in 2015. The liver cancer study will complete in 2017, Exelixis said.
Aber auch das erst kürzlich bekanntgegebene Erreichen eines primären Endpunktes (Verdoppelung Progression Free Survival) gegenüber Erlotinib (brand TARCEVA von Roche) bei NSCLC (Studie NCT01708954 bei nicht kleinzelligem Lungenkrebs = NSCLC) lässt auf zusätzliches Potenzial hoffen (Erlotinib-Umsatz in den ersten 9 Monaten 2014 = CHF 971 millions !!!).
Allein schon die Tatsache, dass sehr viele unabhängige bzw. nicht-gewinnorientierte Institutionen klinische Studien mit Cabozantinib finanziere, stimmt mich hinsichtlich dessen Potenzial sehr optimistisch. Diese Non-Profit-Org sind u.a.
University of Alabama at Birmingham --> NCT02101736
John Strickler, M.D., Duke University Medical Center --> NCT02008383
Edwin Posadas, MD, Cedars-Sinai Medical Center --> NCT01834651
Massachusetts General Hospital --> NCT01954745, NCT01588821, NCT01582295
University of Michigan Cancer Center --> NCT01428219, NCT01663272
National Cancer Institute (NCI) --> NCT01709435, NCT01822522, NCT01811212, NCT01708954 (NSCLC)
M.D. Anderson Cancer Center --> NCT01630590
Dana-Farber Cancer Institute --> NCT02036476
etc.
in Mio CHF
Zelboraf 230 -8% 53 -42% 145 2% 32 69%
ist folgendes festzustellen: die US-Umsätze (CHF 230 Mio) gehen dramatisch (-42%) zurück. Dies aufgrund der wesentlich wirksameren Kombitherapie von gsk (Trametinib/Dabrafenib). In Europa hingegen leichter (+2%) Zuwachs sowie in rest of world ein starkes (+69%) Umsatzwachstum, da dort die Kombi von gsk noch nicht zugelassen wurde. Roche ist deswegen bestrebt, die eigene Kombitherapie (Vemurafenib/Cobimetinib) schnellstmöglichst am Markt zu platzieren: in Europe Zulassung beantragt im September 2014; in den US noch vor Ende des Jahres - fast track wurde bereits zugestanden.
Sobald die Kombitherapie zugelassen ist, dürften die Zelboraf-Umsätze fast vollständig "kannibalisiert" werden - erwarteter Umsatz der Kombi pro Jahr so um die 500 Mio CHF. Hiervon müssten mindestens 100 Mio an Exelixis abgetreten werden.
Darüber hinaus ist Cobimetinib in weiteren klinischen Studien mit anderen Wirkstoffen in Erprobung und weitere Studien könnten/werden folgen.
Also auch wenn Cabo vollständig floppen sollte, dann ist mit Cobi immerhin ein Wert geschaffen, der über Jahre zumindest ein Minimum der Geschäftsfähigkeit erhalten sollte. Die Kursphantasie ergibt sich zugegebenermassen aus dem Erfolg von Cabozantinib in Renal Cell Carcinoma (Nierenkrebs) bzw Hepatocellular carcinoma (Leberkrebs)
The ongoing phase III study of cabozantinib in kidney cancer is expected to report results in 2015. The liver cancer study will complete in 2017, Exelixis said.
Aber auch das erst kürzlich bekanntgegebene Erreichen eines primären Endpunktes (Verdoppelung Progression Free Survival) gegenüber Erlotinib (brand TARCEVA von Roche) bei NSCLC (Studie NCT01708954 bei nicht kleinzelligem Lungenkrebs = NSCLC) lässt auf zusätzliches Potenzial hoffen (Erlotinib-Umsatz in den ersten 9 Monaten 2014 = CHF 971 millions !!!).
Allein schon die Tatsache, dass sehr viele unabhängige bzw. nicht-gewinnorientierte Institutionen klinische Studien mit Cabozantinib finanziere, stimmt mich hinsichtlich dessen Potenzial sehr optimistisch. Diese Non-Profit-Org sind u.a.
University of Alabama at Birmingham --> NCT02101736
John Strickler, M.D., Duke University Medical Center --> NCT02008383
Edwin Posadas, MD, Cedars-Sinai Medical Center --> NCT01834651
Massachusetts General Hospital --> NCT01954745, NCT01588821, NCT01582295
University of Michigan Cancer Center --> NCT01428219, NCT01663272
National Cancer Institute (NCI) --> NCT01709435, NCT01822522, NCT01811212, NCT01708954 (NSCLC)
M.D. Anderson Cancer Center --> NCT01630590
Dana-Farber Cancer Institute --> NCT02036476
etc.
Antwort auf Beitrag Nr.: 48.304.042 von Cyberhexe am 13.11.14 02:35:06Korrektur zum letzten Beitrag:
ist folgendes festzustellen: die US-Umsätze (CHF 53 Mio) gehen dramatisch (-42%) zurück.
ist folgendes festzustellen: die US-Umsätze (CHF 53 Mio) gehen dramatisch (-42%) zurück.
hi cyberhexe,
wirklich interessant beitäge....
hab was von cobi / immuntherapy gelesen, von welchem immuno produkt wird hier gesprochen?
http://www.translational-medicine.com/content/12/1/294/abstr…
wie siehts mit den schulden aus, wieviel, wann fällig ? ist deerfield mit im spiel?
du merkst schon worauf ich anspiele....
wirklich interessant beitäge....
hab was von cobi / immuntherapy gelesen, von welchem immuno produkt wird hier gesprochen?
http://www.translational-medicine.com/content/12/1/294/abstr…
wie siehts mit den schulden aus, wieviel, wann fällig ? ist deerfield mit im spiel?
du merkst schon worauf ich anspiele....

Exelixis Announces Positive Preliminary Data From an Investigator-Sp 1 Trial of XL888 and Vemurafenib
gerade in Zürich veröffentlicht und zwar am Kongress der SMR (Society for Melanoma Research):8:25am - 10:25am
CONCURRENT BREAKOUT SESSION - Late Breaking Clinical Data
Preliminary data on the phase I study of vemurafenib and heatshock protein 90 (HSP90) inhibitor XL888 in
metastatic BRAF V600 mutant melanoma
Keiran Smalley, H. Lee Moffitt Cancer Cente
http://www.exelixis.com/investors-media/press-releases?cpurl…
Study Results
The trial had enrolled fifteen subjects (cohorts 1-3, n=3; cohort 4, n=6), and the median age was 60 years. Seventy-three percent of the subjects were male, and the majority of subjects (14/15) were assessed as having the stage IV metastatic form of their disease.
The most common adverse events were consistent with previous studies of vemurafenib and included anorexia, fatigue, arthralgia, and rash. Diarrhea and vision changes were seen at all dose levels, with the highest rates being seen in cohort 4. These events resolved upon dose interruption. Dose-limiting toxicities only occurred in cohort 4 (grade 3 diarrhea and pancreatitis), and an MTD has not yet been established. The trial also reported fewer secondary cutaneous neoplasms in higher XL888 dose cohorts.
At the time of data cut-off, objective tumor regression was observed in 11 of 12 response-evaluable patients (two complete responses and nine partial responses), for an objective response rate of 92%. Additionally, one stage IIIC patient with a partial response underwent resection of residual disease and pathology showed no viable tumor cells. Three patients who did not have post baseline tumor assessments were excluded from the response analysis; two patients elected alternative treatment prior to the first post baseline scan, and the third patient was still in the first cycle of study treatment. The estimated PFS at 6- and 12-months was 63% (95% CI: 28 - 84%) and 39% (95% CI: 11 - 68%), respectively.
Antwort auf Beitrag Nr.: 48.331.357 von GuHu1 am 15.11.14 21:54:22
A Phase 1b Study of MPDL3280A (an Engineered Anti-PDL1 Antibody) in Combination With Cobimetinib in Patients With Locally Advanced or Metastatic Solid Tumors
https://clinicaltrials.gov/ct2/show/NCT01988896?term=cobimet…
MPDL3280A (an engineered anti-PDL1 antibody)
is designed to harness the body's own immune system to fight tumor cells.
Cobi + MPDL3280A, ein die Immunantwort stimulierender Antikörper!
A Phase 1b Study of MPDL3280A (an Engineered Anti-PDL1 Antibody) in Combination With Cobimetinib in Patients With Locally Advanced or Metastatic Solid Tumors
https://clinicaltrials.gov/ct2/show/NCT01988896?term=cobimet…
MPDL3280A (an engineered anti-PDL1 antibody)
is designed to harness the body's own immune system to fight tumor cells.
ein neues US-Patent für Exelixis...
..., welches uU sehr wertvoll sein könnte, da dieses Enzym eine bedeutende Rolle im Signalweg der Apoptosis (programmierten Zelltod) inne hat:United States Patent 8,889,664
Bajjalieh , et al. November 18, 2014
Phosphatidylinositol 3-kinase inhibitors and methods of their use
Abstract
The present invention comprises small molecule inhibitors of phosphatidylinositol 3-kinase (PI3K), which is associated with a number of malignancies such as ovarian cancer, cervical cancer, breast cancer, colon cancer, rectal cancer, and glioblastomas, among others. Accordingly, the compounds of the present invention are useful for treating, preventing, and/or inhibiting these diseases.
Assignee: Exelixis, Inc. (South San Francisco, CA)
http://patft.uspto.gov/netacgi/nph-Parser?Sect1=PTO2&Sect2=H…
Antwort auf Beitrag Nr.: 48.345.115 von Cyberhexe am 18.11.14 07:15:59
PI3K in the title or abstract AND Exelixis as the applicant
http://worldwide.espacenet.com/searchResults?submitted=true&…
PI3K
ist ein kritisches Enzym beim programmierten Zelltod (Apoptosis); welweit sind 78 Patente recherchierbar mit den Suchkriterien:PI3K in the title or abstract AND Exelixis as the applicant
http://worldwide.espacenet.com/searchResults?submitted=true&…
Sehr, sehr schöner Artikel über das Chance/Risiko-Profil von EXEL (mehr Risiko als Chance  )
)
Exelixis: Why This Company Could Become The Next Dendreon
Last week, Dendreon, the maker of prostate cancer treatment Provenge, filed for chapter 11 bankruptcy due to significant debt, and I believe Exelixis could reach this same fate.
While EXEL has one revenue stream and will likely have another by the end of 2015, these revenues are not significant enough to fund operations and debt.
The company has a $58.5 million shareholder deficit (propped up by almost $64 million in goodwill), coupled with significant debt obligations, leading to my sell recommendation.
At the beginning of last week, Dendreon (NASDAQ NDN), the maker of prostate cancer treatment Provenge, filed for chapter 11 bankruptcy, with shares declining over 88% last week. While Provenge had a lot of promise, leading the company to see a share price north of $50 in 2010, the company continued to miss sales estimates and was finished by debt consisting of $620 million in 2016 convertible notes making restructuring the best option. Another company that has the potential to find itself in a similar situation is Exelixis (NASDAQ:EXEL). While its two top drugs certainly have promise, the company is saddled with a significant load of debt and burns through piles of cash, leading to my sell recommendation.
NDN), the maker of prostate cancer treatment Provenge, filed for chapter 11 bankruptcy, with shares declining over 88% last week. While Provenge had a lot of promise, leading the company to see a share price north of $50 in 2010, the company continued to miss sales estimates and was finished by debt consisting of $620 million in 2016 convertible notes making restructuring the best option. Another company that has the potential to find itself in a similar situation is Exelixis (NASDAQ:EXEL). While its two top drugs certainly have promise, the company is saddled with a significant load of debt and burns through piles of cash, leading to my sell recommendation.
Recent Pipeline News
Many have been very bullish on the pipeline's prospects, with links to the bull thesis here and here. Some of the recent pieces of news in regards to the pipeline include:
November 6, 2014 Exelixis Completes Enrollment of the METEOR Phase 3 Pivotal Trial of Cabozantinib in Metastatic Renal Cell Carcinoma = METEOR is a 650 patient phase 3 trial evaluating coabozantinib as a treatment of metastatic renal cell carcinoma. Top line efficacy and safety data is expected in Q2 2015.
September 29, 2014 Exelixis Announces Positive Results from Phase 3 Pivotal Trial of Cobimetinib in Combination with Vemurafenib in Patients with BRAF V600 Mutation-Positive Advanced Melanoma = This is certainly good news, and EXEL's partner Roche (OTCQX:RHHBY) will submit the NDA filing to FDA this year.
September 2, 2014 Exelixis Announces Results from the COMET-1 Phase 3 Pivotal Trial of Cabozantinib in Men with Metastatic Castration-Resistant Prostate Cancer ((mCRPC)) = This was a pivotal phase 3 study that was extremely important as prostate cancer was a huge market that the company was targeting. This failure triggered the company to halt its other phase 3 study (COMET-2) as well as a phase 2 study combining the drug with abiraterone in relationship to treating mCRPC.
Seeking Alpha writer Christopher Davis put together a compulation of Cabozantinib trials, and I recommend that as a good place to start as part of the Exelixis due diligence process. My thesis centers around the company's precarious financial position, and I will spend most of the article highlighting this as other pieces have covered the potential of the company's pipeline.
Revenues
The major problem I notice is that EXEL has not been able to get a product to the end of the approval process with an indication that has the potential to provide substantial revenues to fund future research and development as well as pay down debt.
Ever since a revenue spike in late 2011 due to the acceleration of deferred license revenue from the early termination of a collaboration with Bristol Myers (NYSE:BMY), quarterly revenue has consistently languished below $15 million.
While the company is slowly beginning to generate revenues for a few indications, none of these revenue streams will be huge by any means. The company launched Cometriq in the US in late January 2013 after receiving approval on November 29, 2012 for patients with progressive, metastatic medullary thyroid cancer (MTC). While quarterly revenues have been trending in the right direction, sales are expected to peak at only $20-$40 million annually in US plus a smaller amount from Europe, potentially in the neighborhood of $50 million total for peak sales annually for this indication. On September 29th though, the company announced positive results from CoBRIM, a phase 3 pivotal study of cobimentinib in combination with vemurafenib in patients with BRAF V600 mutation-positive advanced melanoma. Per the company's copromotion agreement with its partner Roche, EXEL will be entitled to 50% of profits from the first $200 million of US sales, which will decrease to 30% of sales in excess of $400 million. Given competition in the space from GlaxoSmithKline's (NYSE:GSK) MEK-BRAF inhibitor combination of trapetinib and dabrafenib, Leerink Partners analysts expect only $150 million in peak sales.
Balance Sheet and Debt Structure
While I firmly believe you can identify value in small-cap speculative biotechs, I think a solid balance sheet is extremely important as it provides the company with a nice cushion should something go wrong. Exelixis' balance sheet is downright scary. Someone just taking a quick look at the recently-released third quarter press release might think that the company is a bargain as it currently has $294 million in cash/equivalents/investments yet only has a market cap of $338 million. This quick look paints a horribly inaccurate view of the company's financial picture. Even with all that cash, the company actually has a shareholder's deficit of $58.5 million, suggesting that the market is still placing an enterprise value of about $400 million. Almost $64 million of the assets on the balance sheet are goodwill. This goodwill for the most part has been on the balance sheet for at least ten years, and would likely provide little or no value, should the company have any type of a liquidity crunch.
Why am I bringing up a liquidity crunch? The company currently has almost $275 million in convertible notes on the balance sheet as well as a $80 million loan. In June 2010, EXEL had sold Deerfield Management $124 million in principal of convertible notes for aggregate proceeds of $80 million. As these were five-year notes due July 1, 2015, this suggests an interest rate a bit north of 9%. On January 22, 2014, the company entered into an agreement with Deerfield to include an option to extend the maturity date of the loans to July 1, 2018. The company said in the recent quarterly call that it expects to extend the maturity of the notes as allowed per the updated agreement. The interest rate of the notes will spike to a combined 15% on July 2, 2015 as per the terms of this agreement. The companies further updated the agreement on July 10th, requiring EXEL to make annual prepayments on the Deerfield Notes of 15% of development/commercialization revenue received the prior year in 2016, 2017, and 2018 should Deerfield choose to receive the payments (maximum of $27.5 million). The company is able to make prepayments on the notes with common stock. This agreement with Deerfield contained covenants including restrictions on the incurrence of additional indebtedness.
In August 2012, the company sold $287.5 million of 4.25% convertible senior subordinated notes due 2019. Per the 10-Q, "the initial conversion rate of 188.2353 shares of common stock per $1,000 principal amount of the 2019 Notes is equivalent to a conversion price of approximately $5.31 per share of common stock and is subject to adjustment in connection with certain events." Should a "fundamental change" occur to the company as defined by the indenture, the note holders have the right to require the company to purchase the notes for cash and pay accrued and unpaid interest. Furthermore, if certain bankruptcy or insolvency-related events occur, the notes will become immediately due and payable.
The company's loan and security agreement with Silicon Valley Bank more or less just provides the company with a line of credit for operations. The outstanding principal under the lines of credit and term loan were $80.8 million as of Q3 end, and the company is required to maintain an amount equal to at least 100% of the principal and line of credit in investment accounts with Silicon Valley Bank or an affiliate. Given the nature of this source of liquidity, it is structured to assist with day-to-day operations and would not be helpful with any major liquidity issues.
Burn Rate
Exelixis burns through a substantial amount of cash every quarter and the current gap between revenue and expenses is one of the highest the company has seen in the past ten years. While the restructuring the company put in place after the failure of the COMET-1 trial is no doubt a step in the right direction, it will take time to reap the benefits of this. Burn will nonetheless still be high as the company continues running its clinical trials, especially its expensive phase 3 METEOR and phase 3 CELESTIAL trials.
With analyst estimates for about $37 million in revenue next year, the company will be lucky if 2015 revenues will even cover one quarter's worth of expenses. The company has guided that it expects current cash/equivalents/investments to fund operations through 2015.
An Opposite Point of View
Some believe the future for EXEL is very bright due to the potential sales from cobimetinib as a treatment for melanoma. While most analysts estimate $150 million or so in peak sales for this indication, some believe that this collaboration with Roche has the potential to become the standard of care and provide up to a billion in peak sales, making EXEL a potential takeout target for Roche due to the favorable revenue split that EXEL will be getting considering the terms of the deal. I personally believe that almost a billion in sales is extremely unlikely given the competition in the space. As far as the buyout potential, I think it is reasonable to assume that nothing is coming any time soon as it would have likely come soon after the data release back in the summer. Big pharma is smart, and I believe Roche understands that it can get EXEL and its pipeline at a much cheaper price in the future given the company's scary balance sheet and significant cash burn.
Conclusion
My thesis centers around the belief that the company's methodology for raising cash has put it in a precarious position and will negatively effect the company as operations continue, with raising additional capital being substantially more difficult.
Shares outstanding have increased over 75% since 2011. In the company's large 2012 offering, EXEL had to include convertible notes in the offering along with common stock to sweeten the deal to entice institutional investors, which allows institutional investors to manipulate the stock to an extent for abnormal profits as is discussed here. The company's 10-Q even states, "the price of our common stock could be affected by possible sales of common stock by investors who view the 2019 Notes as a more attractive means of equity participation in our company and by hedging or arbitrage trading activity that we expect to occur involving our common stock." On top of the potentially debilitating effects of the company's debt and the chance that a significant amount of common stock will have to be issued to satisfy this debt, the company will also need to raise additional funds, likely in the second half of next year. Due to the various covenants and constraints associate with its current debt agreements, raising further funds will be increasingly difficult, and due to the depressed stock price, selling common stock to raise funds will be extremely dilutive given how much the company will need to raise in order to fund its substantial burn rate. Debt cost will become more burdensome to the company as time goes on due to the need to make possible prepayments and as interest compounds. Barring extremely promising results from an upcoming late-stage trial such as the METEOR trial results due out in Q2 2015, the company will continue to burn through cash due to its high burn rate, setting it up for further dilution at a minimum and even for a potential bankruptcy should the company's financial situation continue to deteriorate, leading to my sell recommendation.
http://seekingalpha.com/article/2688545-exelixis-why-this-co…
 )
)Exelixis: Why This Company Could Become The Next Dendreon
Last week, Dendreon, the maker of prostate cancer treatment Provenge, filed for chapter 11 bankruptcy due to significant debt, and I believe Exelixis could reach this same fate.
While EXEL has one revenue stream and will likely have another by the end of 2015, these revenues are not significant enough to fund operations and debt.
The company has a $58.5 million shareholder deficit (propped up by almost $64 million in goodwill), coupled with significant debt obligations, leading to my sell recommendation.
At the beginning of last week, Dendreon (NASDAQ
 NDN), the maker of prostate cancer treatment Provenge, filed for chapter 11 bankruptcy, with shares declining over 88% last week. While Provenge had a lot of promise, leading the company to see a share price north of $50 in 2010, the company continued to miss sales estimates and was finished by debt consisting of $620 million in 2016 convertible notes making restructuring the best option. Another company that has the potential to find itself in a similar situation is Exelixis (NASDAQ:EXEL). While its two top drugs certainly have promise, the company is saddled with a significant load of debt and burns through piles of cash, leading to my sell recommendation.
NDN), the maker of prostate cancer treatment Provenge, filed for chapter 11 bankruptcy, with shares declining over 88% last week. While Provenge had a lot of promise, leading the company to see a share price north of $50 in 2010, the company continued to miss sales estimates and was finished by debt consisting of $620 million in 2016 convertible notes making restructuring the best option. Another company that has the potential to find itself in a similar situation is Exelixis (NASDAQ:EXEL). While its two top drugs certainly have promise, the company is saddled with a significant load of debt and burns through piles of cash, leading to my sell recommendation.Recent Pipeline News
Many have been very bullish on the pipeline's prospects, with links to the bull thesis here and here. Some of the recent pieces of news in regards to the pipeline include:
November 6, 2014 Exelixis Completes Enrollment of the METEOR Phase 3 Pivotal Trial of Cabozantinib in Metastatic Renal Cell Carcinoma = METEOR is a 650 patient phase 3 trial evaluating coabozantinib as a treatment of metastatic renal cell carcinoma. Top line efficacy and safety data is expected in Q2 2015.
September 29, 2014 Exelixis Announces Positive Results from Phase 3 Pivotal Trial of Cobimetinib in Combination with Vemurafenib in Patients with BRAF V600 Mutation-Positive Advanced Melanoma = This is certainly good news, and EXEL's partner Roche (OTCQX:RHHBY) will submit the NDA filing to FDA this year.
September 2, 2014 Exelixis Announces Results from the COMET-1 Phase 3 Pivotal Trial of Cabozantinib in Men with Metastatic Castration-Resistant Prostate Cancer ((mCRPC)) = This was a pivotal phase 3 study that was extremely important as prostate cancer was a huge market that the company was targeting. This failure triggered the company to halt its other phase 3 study (COMET-2) as well as a phase 2 study combining the drug with abiraterone in relationship to treating mCRPC.
Seeking Alpha writer Christopher Davis put together a compulation of Cabozantinib trials, and I recommend that as a good place to start as part of the Exelixis due diligence process. My thesis centers around the company's precarious financial position, and I will spend most of the article highlighting this as other pieces have covered the potential of the company's pipeline.
Revenues
The major problem I notice is that EXEL has not been able to get a product to the end of the approval process with an indication that has the potential to provide substantial revenues to fund future research and development as well as pay down debt.
Ever since a revenue spike in late 2011 due to the acceleration of deferred license revenue from the early termination of a collaboration with Bristol Myers (NYSE:BMY), quarterly revenue has consistently languished below $15 million.
While the company is slowly beginning to generate revenues for a few indications, none of these revenue streams will be huge by any means. The company launched Cometriq in the US in late January 2013 after receiving approval on November 29, 2012 for patients with progressive, metastatic medullary thyroid cancer (MTC). While quarterly revenues have been trending in the right direction, sales are expected to peak at only $20-$40 million annually in US plus a smaller amount from Europe, potentially in the neighborhood of $50 million total for peak sales annually for this indication. On September 29th though, the company announced positive results from CoBRIM, a phase 3 pivotal study of cobimentinib in combination with vemurafenib in patients with BRAF V600 mutation-positive advanced melanoma. Per the company's copromotion agreement with its partner Roche, EXEL will be entitled to 50% of profits from the first $200 million of US sales, which will decrease to 30% of sales in excess of $400 million. Given competition in the space from GlaxoSmithKline's (NYSE:GSK) MEK-BRAF inhibitor combination of trapetinib and dabrafenib, Leerink Partners analysts expect only $150 million in peak sales.
Balance Sheet and Debt Structure
While I firmly believe you can identify value in small-cap speculative biotechs, I think a solid balance sheet is extremely important as it provides the company with a nice cushion should something go wrong. Exelixis' balance sheet is downright scary. Someone just taking a quick look at the recently-released third quarter press release might think that the company is a bargain as it currently has $294 million in cash/equivalents/investments yet only has a market cap of $338 million. This quick look paints a horribly inaccurate view of the company's financial picture. Even with all that cash, the company actually has a shareholder's deficit of $58.5 million, suggesting that the market is still placing an enterprise value of about $400 million. Almost $64 million of the assets on the balance sheet are goodwill. This goodwill for the most part has been on the balance sheet for at least ten years, and would likely provide little or no value, should the company have any type of a liquidity crunch.
Why am I bringing up a liquidity crunch? The company currently has almost $275 million in convertible notes on the balance sheet as well as a $80 million loan. In June 2010, EXEL had sold Deerfield Management $124 million in principal of convertible notes for aggregate proceeds of $80 million. As these were five-year notes due July 1, 2015, this suggests an interest rate a bit north of 9%. On January 22, 2014, the company entered into an agreement with Deerfield to include an option to extend the maturity date of the loans to July 1, 2018. The company said in the recent quarterly call that it expects to extend the maturity of the notes as allowed per the updated agreement. The interest rate of the notes will spike to a combined 15% on July 2, 2015 as per the terms of this agreement. The companies further updated the agreement on July 10th, requiring EXEL to make annual prepayments on the Deerfield Notes of 15% of development/commercialization revenue received the prior year in 2016, 2017, and 2018 should Deerfield choose to receive the payments (maximum of $27.5 million). The company is able to make prepayments on the notes with common stock. This agreement with Deerfield contained covenants including restrictions on the incurrence of additional indebtedness.
In August 2012, the company sold $287.5 million of 4.25% convertible senior subordinated notes due 2019. Per the 10-Q, "the initial conversion rate of 188.2353 shares of common stock per $1,000 principal amount of the 2019 Notes is equivalent to a conversion price of approximately $5.31 per share of common stock and is subject to adjustment in connection with certain events." Should a "fundamental change" occur to the company as defined by the indenture, the note holders have the right to require the company to purchase the notes for cash and pay accrued and unpaid interest. Furthermore, if certain bankruptcy or insolvency-related events occur, the notes will become immediately due and payable.
The company's loan and security agreement with Silicon Valley Bank more or less just provides the company with a line of credit for operations. The outstanding principal under the lines of credit and term loan were $80.8 million as of Q3 end, and the company is required to maintain an amount equal to at least 100% of the principal and line of credit in investment accounts with Silicon Valley Bank or an affiliate. Given the nature of this source of liquidity, it is structured to assist with day-to-day operations and would not be helpful with any major liquidity issues.
Burn Rate
Exelixis burns through a substantial amount of cash every quarter and the current gap between revenue and expenses is one of the highest the company has seen in the past ten years. While the restructuring the company put in place after the failure of the COMET-1 trial is no doubt a step in the right direction, it will take time to reap the benefits of this. Burn will nonetheless still be high as the company continues running its clinical trials, especially its expensive phase 3 METEOR and phase 3 CELESTIAL trials.
With analyst estimates for about $37 million in revenue next year, the company will be lucky if 2015 revenues will even cover one quarter's worth of expenses. The company has guided that it expects current cash/equivalents/investments to fund operations through 2015.
An Opposite Point of View
Some believe the future for EXEL is very bright due to the potential sales from cobimetinib as a treatment for melanoma. While most analysts estimate $150 million or so in peak sales for this indication, some believe that this collaboration with Roche has the potential to become the standard of care and provide up to a billion in peak sales, making EXEL a potential takeout target for Roche due to the favorable revenue split that EXEL will be getting considering the terms of the deal. I personally believe that almost a billion in sales is extremely unlikely given the competition in the space. As far as the buyout potential, I think it is reasonable to assume that nothing is coming any time soon as it would have likely come soon after the data release back in the summer. Big pharma is smart, and I believe Roche understands that it can get EXEL and its pipeline at a much cheaper price in the future given the company's scary balance sheet and significant cash burn.
Conclusion
My thesis centers around the belief that the company's methodology for raising cash has put it in a precarious position and will negatively effect the company as operations continue, with raising additional capital being substantially more difficult.
Shares outstanding have increased over 75% since 2011. In the company's large 2012 offering, EXEL had to include convertible notes in the offering along with common stock to sweeten the deal to entice institutional investors, which allows institutional investors to manipulate the stock to an extent for abnormal profits as is discussed here. The company's 10-Q even states, "the price of our common stock could be affected by possible sales of common stock by investors who view the 2019 Notes as a more attractive means of equity participation in our company and by hedging or arbitrage trading activity that we expect to occur involving our common stock." On top of the potentially debilitating effects of the company's debt and the chance that a significant amount of common stock will have to be issued to satisfy this debt, the company will also need to raise additional funds, likely in the second half of next year. Due to the various covenants and constraints associate with its current debt agreements, raising further funds will be increasingly difficult, and due to the depressed stock price, selling common stock to raise funds will be extremely dilutive given how much the company will need to raise in order to fund its substantial burn rate. Debt cost will become more burdensome to the company as time goes on due to the need to make possible prepayments and as interest compounds. Barring extremely promising results from an upcoming late-stage trial such as the METEOR trial results due out in Q2 2015, the company will continue to burn through cash due to its high burn rate, setting it up for further dilution at a minimum and even for a potential bankruptcy should the company's financial situation continue to deteriorate, leading to my sell recommendation.
http://seekingalpha.com/article/2688545-exelixis-why-this-co…
Antwort auf Beitrag Nr.: 48.354.724 von rollingovermilestones am 18.11.14 22:16:37Bedenkenswert.
Alles in allem ist EXEL ein außerordentlich schlecht gemanagtes Unternehmen. Fast alle wirklich wichtigen Entscheidungen wurden falsch getroffen.
Dass die Pipeline ihren Wert hat, steht auf einem anderen Blatt.
Ich bin und bleibe mit einer kleinen Position dabei.
Eine finanzielle Restrukturierung innerhalb der nächsten 6 Monate ist zwingend. Man fragt sich indes, wie und zu welchen Konditionen das erfolgen kann.
Alles in allem ist EXEL ein außerordentlich schlecht gemanagtes Unternehmen. Fast alle wirklich wichtigen Entscheidungen wurden falsch getroffen.
Dass die Pipeline ihren Wert hat, steht auf einem anderen Blatt.
Ich bin und bleibe mit einer kleinen Position dabei.
Eine finanzielle Restrukturierung innerhalb der nächsten 6 Monate ist zwingend. Man fragt sich indes, wie und zu welchen Konditionen das erfolgen kann.
Antwort auf Beitrag Nr.: 48.356.002 von SLGramann am 19.11.14 08:17:30Das mit dem schlechten Management sehe ich gleich.
Eine breite Pipeline der Profitgier zu opfern, war und ist nicht sehr nachhaltig.
Auch wenn es mit Cabo besser ausgegangen wäre, bliebe das in meinen Augen eine Fehlentscheidung!
Bei den Ressourcen wäre ein Partner nützlich gewesen.
Hab mir heute mal wieder einen webcast angesehen:
http://www.veracast.com/webcasts/stifel/healthcare2014/39103…
Man merkt deutlich, dass der Wind inzwischen ziemlich kalt bläst. Der Vortrag von MM war zum Teil sehr fahrig.
Der CEO wirkt trotzdessen arrogant und ebenso größenwahnsinnig, da kann ich mir nicht helfen.
Zu Cabo ist noch zu erwähnen, dass GSK inzwischen XL880 eingestellt hat. Dieser Inhibitor adressierte die gleichen Targets. Insofern (wenn auch der Vergleich nicht trefflich ist) scheint die Aussicht nicht wirklich rosig zu sein.
Mit etwas Glück gibt es eine Zula und dann bleibt, auf eine Übernahme zu hoffen.
Mit großem Glück kommt irgendwann ein Ritter....
Eine breite Pipeline der Profitgier zu opfern, war und ist nicht sehr nachhaltig.
Auch wenn es mit Cabo besser ausgegangen wäre, bliebe das in meinen Augen eine Fehlentscheidung!
Bei den Ressourcen wäre ein Partner nützlich gewesen.
Hab mir heute mal wieder einen webcast angesehen:
http://www.veracast.com/webcasts/stifel/healthcare2014/39103…
Man merkt deutlich, dass der Wind inzwischen ziemlich kalt bläst. Der Vortrag von MM war zum Teil sehr fahrig.
Der CEO wirkt trotzdessen arrogant und ebenso größenwahnsinnig, da kann ich mir nicht helfen.
Zu Cabo ist noch zu erwähnen, dass GSK inzwischen XL880 eingestellt hat. Dieser Inhibitor adressierte die gleichen Targets. Insofern (wenn auch der Vergleich nicht trefflich ist) scheint die Aussicht nicht wirklich rosig zu sein.
Mit etwas Glück gibt es eine Zula und dann bleibt, auf eine Übernahme zu hoffen.
Mit großem Glück kommt irgendwann ein Ritter....
Zitat von SLGramann: Bedenkenswert.
Alles in allem ist EXEL ein außerordentlich schlecht gemanagtes Unternehmen. Fast alle wirklich wichtigen Entscheidungen wurden falsch getroffen.
Dass die Pipeline ihren Wert hat, steht auf einem anderen Blatt.
Ich bin und bleibe mit einer kleinen Position dabei.
Eine finanzielle Restrukturierung innerhalb der nächsten 6 Monate ist zwingend. Man fragt sich indes, wie und zu welchen Konditionen das erfolgen kann.
Antwort auf Beitrag Nr.: 48.361.546 von rollingovermilestones am 19.11.14 16:34:43"Das mit dem schlechten Management sehe ich gleich.
Eine breite Pipeline der Profitgier zu opfern, war und ist nicht sehr nachhaltig."
die Pipeline wird geopfert? Verstehe ich nicht!
"Auch wenn es mit Cabo besser ausgegangen wäre, bliebe das in meinen Augen eine Fehlentscheidung!"
Cabozantinib ist bereits am Markt, nämlich zur Behandlung von Schilddrüsenkrebs. Bisher wurde lediglich bei COMET-1, einer ph3-Studie bei CRPC (castrate resistant prostata carcinom), der primäre Endpunkt OS (Overall Survival --> also Lebenszeitverlängerung) nicht erreicht. Diese Studie war sicherlich ein heisser Ritt und kann nachträglich natürlich als schlechtes Studiendesign interpretiert werden (hinterher ist man immer schlauer!). Aber klinische Studien, insbesondere in Phase 3, bleiben immer eine riskante Angelegenheit mit unbekanntem Ausgang.
"Bei den Ressourcen wäre ein Partner nützlich gewesen."
Falls bspw. METEOR (ph3-Studie zur Behandlung von Nierenkarzinom) ein Erfolg wird, dann ist die Ausgangsbasis für Verhandlungen über eine Partnerschaft weitaus günstiger.
Hab mir heute mal wieder einen webcast angesehen:
http://www.veracast.com/webcasts/stifel/healthcare2014/39103…
Man merkt deutlich, dass der Wind inzwischen ziemlich kalt bläst. Der Vortrag von MM war zum Teil sehr fahrig.
Der CEO wirkt trotzdessen arrogant und ebenso größenwahnsinnig, da kann ich mir nicht helfen.
?
Zu Cabo ist noch zu erwähnen, dass GSK inzwischen XL880 eingestellt hat. Dieser Inhibitor adressierte die gleichen Targets. Insofern (wenn auch der Vergleich nicht trefflich ist) scheint die Aussicht nicht wirklich rosig zu sein.
Es werden immer wieder Moleküle in der Klinik scheitern!
Mit etwas Glück gibt es eine Zula und dann bleibt, auf eine Übernahme zu hoffen.
Wieso mit etwas Glück? Es gibt bereits eine Zulassung für Cabo und diejenige für Cobi (in Kombi mit Zelboraf = vemurafenib) wurde bereits bei der EMA in Europa im September beantragt. Bei der FDA wird der Antrag noch in 2014 eingereicht, wobei Fast Track von der FDA bereits zugesichert wurde --> im Sommer 2015 (vielleicht schon im Juni) wird Cobi den US-Markt erreichen.
Mit großem Glück kommt irgendwann ein Ritter....
...auch das hat mit Glück reichlich wenig zu tun!!
Eine breite Pipeline der Profitgier zu opfern, war und ist nicht sehr nachhaltig."
die Pipeline wird geopfert? Verstehe ich nicht!
"Auch wenn es mit Cabo besser ausgegangen wäre, bliebe das in meinen Augen eine Fehlentscheidung!"
Cabozantinib ist bereits am Markt, nämlich zur Behandlung von Schilddrüsenkrebs. Bisher wurde lediglich bei COMET-1, einer ph3-Studie bei CRPC (castrate resistant prostata carcinom), der primäre Endpunkt OS (Overall Survival --> also Lebenszeitverlängerung) nicht erreicht. Diese Studie war sicherlich ein heisser Ritt und kann nachträglich natürlich als schlechtes Studiendesign interpretiert werden (hinterher ist man immer schlauer!). Aber klinische Studien, insbesondere in Phase 3, bleiben immer eine riskante Angelegenheit mit unbekanntem Ausgang.
"Bei den Ressourcen wäre ein Partner nützlich gewesen."
Falls bspw. METEOR (ph3-Studie zur Behandlung von Nierenkarzinom) ein Erfolg wird, dann ist die Ausgangsbasis für Verhandlungen über eine Partnerschaft weitaus günstiger.
Hab mir heute mal wieder einen webcast angesehen:
http://www.veracast.com/webcasts/stifel/healthcare2014/39103…
Man merkt deutlich, dass der Wind inzwischen ziemlich kalt bläst. Der Vortrag von MM war zum Teil sehr fahrig.
Der CEO wirkt trotzdessen arrogant und ebenso größenwahnsinnig, da kann ich mir nicht helfen.
?
Zu Cabo ist noch zu erwähnen, dass GSK inzwischen XL880 eingestellt hat. Dieser Inhibitor adressierte die gleichen Targets. Insofern (wenn auch der Vergleich nicht trefflich ist) scheint die Aussicht nicht wirklich rosig zu sein.
Es werden immer wieder Moleküle in der Klinik scheitern!
Mit etwas Glück gibt es eine Zula und dann bleibt, auf eine Übernahme zu hoffen.
Wieso mit etwas Glück? Es gibt bereits eine Zulassung für Cabo und diejenige für Cobi (in Kombi mit Zelboraf = vemurafenib) wurde bereits bei der EMA in Europa im September beantragt. Bei der FDA wird der Antrag noch in 2014 eingereicht, wobei Fast Track von der FDA bereits zugesichert wurde --> im Sommer 2015 (vielleicht schon im Juni) wird Cobi den US-Markt erreichen.
Mit großem Glück kommt irgendwann ein Ritter....
...auch das hat mit Glück reichlich wenig zu tun!!
Antwort auf Beitrag Nr.: 48.354.724 von rollingovermilestones am 18.11.14 22:16:37dieser Bericht ist sehr einseitig und unterschlägt viele wichtige Informationen, bspw. diese:
"Exelixis Announces Positive Top-Line Results From a Phase 2 Trial of Cabozantinib and Erlotinib in Patients With EGFR Wild-Type Non-Small Cell Lung Cancer
- Study E1512 Met Primary Endpoint, Significantly Improving Progression-Free Survival in the Cabozantinib Monotherapy and Cabozantinib/Erlotinib Arms Compared to the Erlotinib Arm –
SOUTH SAN FRANCISCO, Calif.--(BUSINESS WIRE)--Nov. 4, 2014-- Exelixis, Inc. (NASDAQ:EXEL) today announced positive top-line results from a randomized phase 2 trial of cabozantinib and erlotinib alone or in combination as second- or third-line therapy in patients with stage IV EGFR wild-type non-small cell lung cancer (NSCLC). This trial (Study E1512) is sponsored by the U.S. National Cancer Institute (NCI) through a Cooperative Research and Development Agreement between the Cancer Therapy Evaluation Program (CTEP), Division of Cancer Treatment and Diagnosis, NCI and Exelixis. Study E1512 was designed and is being conducted by the ECOG-ACRIN Cancer Research Group as part of Exelixis’ collaboration with the NCI. Joel Neal, M.D., Ph.D., from ECOG-ACRIN member institution Stanford University/Stanford Cancer Institute, chairs the study.
In the E1512 trial, 125 patients were randomized to one of the three arms: erlotinib, cabozantinib, or the combination. During a pre-planned interim ECOG-ACRIN Data Safety Monitoring Committee analysis for futility, it was found that the trial met its primary endpoint of improving progression-free survival (PFS) with cabozantinib alone and also with the combination of cabozantinib plus erlotinib, as compared to erlotinib alone, and the results were highly statistically significant. Safety data were consistent with those observed in other trials of cabozantinib. At time of analysis, the median follow-up was 5.9 months and overall survival data were immature.
The results of the trial are the subject of ongoing analyses and will be submitted by the investigators for presentation at a future medical conference."
Darüber wird im seekingalpha-Bericht keine Silbe erwähnt, obschon dieses Studienergebnis bereits veröffentlicht war (siehe Datum). Man bedenke, dass Roche in den ersten 9 Monaten mit erlotinib einen Umsatz von nahezu 1 Milliarde CHF erzielt hat und dies fast ausschliesslich zur Behandlung von NSCLC (nicht kleinzelligem Lungenkrebs). Natürlich ist die Liquidität ein sehr wichtiges Kriterium, wenn jedoch Informationen derart unterschlagen werden, dann kann man nicht von einer seriösen Berichterstattung ausgehen.
"Exelixis Announces Positive Top-Line Results From a Phase 2 Trial of Cabozantinib and Erlotinib in Patients With EGFR Wild-Type Non-Small Cell Lung Cancer
- Study E1512 Met Primary Endpoint, Significantly Improving Progression-Free Survival in the Cabozantinib Monotherapy and Cabozantinib/Erlotinib Arms Compared to the Erlotinib Arm –
SOUTH SAN FRANCISCO, Calif.--(BUSINESS WIRE)--Nov. 4, 2014-- Exelixis, Inc. (NASDAQ:EXEL) today announced positive top-line results from a randomized phase 2 trial of cabozantinib and erlotinib alone or in combination as second- or third-line therapy in patients with stage IV EGFR wild-type non-small cell lung cancer (NSCLC). This trial (Study E1512) is sponsored by the U.S. National Cancer Institute (NCI) through a Cooperative Research and Development Agreement between the Cancer Therapy Evaluation Program (CTEP), Division of Cancer Treatment and Diagnosis, NCI and Exelixis. Study E1512 was designed and is being conducted by the ECOG-ACRIN Cancer Research Group as part of Exelixis’ collaboration with the NCI. Joel Neal, M.D., Ph.D., from ECOG-ACRIN member institution Stanford University/Stanford Cancer Institute, chairs the study.
In the E1512 trial, 125 patients were randomized to one of the three arms: erlotinib, cabozantinib, or the combination. During a pre-planned interim ECOG-ACRIN Data Safety Monitoring Committee analysis for futility, it was found that the trial met its primary endpoint of improving progression-free survival (PFS) with cabozantinib alone and also with the combination of cabozantinib plus erlotinib, as compared to erlotinib alone, and the results were highly statistically significant. Safety data were consistent with those observed in other trials of cabozantinib. At time of analysis, the median follow-up was 5.9 months and overall survival data were immature.
The results of the trial are the subject of ongoing analyses and will be submitted by the investigators for presentation at a future medical conference."
Darüber wird im seekingalpha-Bericht keine Silbe erwähnt, obschon dieses Studienergebnis bereits veröffentlicht war (siehe Datum). Man bedenke, dass Roche in den ersten 9 Monaten mit erlotinib einen Umsatz von nahezu 1 Milliarde CHF erzielt hat und dies fast ausschliesslich zur Behandlung von NSCLC (nicht kleinzelligem Lungenkrebs). Natürlich ist die Liquidität ein sehr wichtiges Kriterium, wenn jedoch Informationen derart unterschlagen werden, dann kann man nicht von einer seriösen Berichterstattung ausgehen.
Antwort auf Beitrag Nr.: 48.354.724 von rollingovermilestones am 18.11.14 22:16:37
Given competition in the space from GlaxoSmithKline's (NYSE:GSK) MEK-BRAF inhibitor combination of trapetinib and dabrafenib, Leerink Partners analysts expect only $150 million in peak sales.
Roche will mit der Kombitherapie (Cobi+Vemurafenib) die ursprüngliche Position des Marktführers (mit Zelboraf=Vemurafenib) zurück erobern --> peak sales in Höhe von 150 mUSD halte ich für reichlich untertrieben....
man bedenke, dass Roche trotz der gsk-Konkurrenz mit Zelboraf immer noch einen Umsatz in Höhe von 230 mCHF für die ersten 9 Monate ausgewiesen hat (ausschliesslich melanoma). Und die Kombi mit Cobimetinib ist wesentlich effektiver als zelboraf (=vemurafenib) in Mono:
The trial met its primary endpoint of demonstrating a statistically significant increase in investigator-determined progression-free survival (PFS). The median PFS was 9.9 months for the combination of cobimetinib and vemurafenib versus 6.2 months for vemurafenib alone (hazard ratio [HR]=0.51, 95 percent CI 0.39-0.68; p<0.0001), demonstrating the combination reduced the risk of the disease worsening by half (49 percent). The median PFS by independent review committee (IRC), a secondary endpoint, was 11.3 months for the combination arm compared to 6.0 months for the control arm (HR=0.60, 95 percent CI 0.45-0.79; p=0.0003). Objective response rate (ORR), another secondary endpoint, was 68% for the combination versus 45% for vemurafenib alone (p<0.0001). Overall survival data are not yet mature (HR=0.65, 95 percent CI 0.42-1.00; p=0.046), and at the interim analysis the p-value did not cross the prespecified boundary for significance. The safety profile of the combination was consistent with that observed in a previous study.
Given competition in the space from GlaxoSmithKline's (NYSE:GSK) MEK-BRAF inhibitor combination of trapetinib and dabrafenib, Leerink Partners analysts expect only $150 million in peak sales.
Roche will mit der Kombitherapie (Cobi+Vemurafenib) die ursprüngliche Position des Marktführers (mit Zelboraf=Vemurafenib) zurück erobern --> peak sales in Höhe von 150 mUSD halte ich für reichlich untertrieben....
man bedenke, dass Roche trotz der gsk-Konkurrenz mit Zelboraf immer noch einen Umsatz in Höhe von 230 mCHF für die ersten 9 Monate ausgewiesen hat (ausschliesslich melanoma). Und die Kombi mit Cobimetinib ist wesentlich effektiver als zelboraf (=vemurafenib) in Mono:
The trial met its primary endpoint of demonstrating a statistically significant increase in investigator-determined progression-free survival (PFS). The median PFS was 9.9 months for the combination of cobimetinib and vemurafenib versus 6.2 months for vemurafenib alone (hazard ratio [HR]=0.51, 95 percent CI 0.39-0.68; p<0.0001), demonstrating the combination reduced the risk of the disease worsening by half (49 percent). The median PFS by independent review committee (IRC), a secondary endpoint, was 11.3 months for the combination arm compared to 6.0 months for the control arm (HR=0.60, 95 percent CI 0.45-0.79; p=0.0003). Objective response rate (ORR), another secondary endpoint, was 68% for the combination versus 45% for vemurafenib alone (p<0.0001). Overall survival data are not yet mature (HR=0.65, 95 percent CI 0.42-1.00; p=0.046), and at the interim analysis the p-value did not cross the prespecified boundary for significance. The safety profile of the combination was consistent with that observed in a previous study.
Stifel 2014 Healthcare Conference
November 18, 2014
Michael M. Morrissey, Ph.D.
President and CEO
slide 5/25
Cabozantinib: Broadly Active, with Activity Against
Multiple Disease Compartments
Multi targeted kinase inhibitor
• MET, VEGFR, RET, others
• Key targets involved in tumor growth, survival, metastasis, resistance
• Activity profile distinct from selective VEGFR or MET inhibitors
Broadly active, documented antitumor activity in 15 tumor types
Optimized dosing in phase 2
More than 4,000 patients treated in clinical trials
45+ clinical trials listed at www.clinicaltrials.gov
slide 10/25
10
Opportunity in Renal Cell Carcinoma (RCC)
A rapidly changing marketplace
•Four drugs approved in past five years
•> 20,000 drug eligible patients in U.S.*
•Total U.S. sales for agents to treat metastatic RCC were $870M in 2012*
Opportunities for differentiated agents
•Recent development dominated by VEGFR and
mTOR inhibition
•Clear-cell RCC disease biology suggests strong rationale for targeting
MET and VEGFR
Potential in first line RCC
•25% of first line RCC patients have primary refractory disease to
VEGFR targeting TKIs
November 18, 2014
Michael M. Morrissey, Ph.D.
President and CEO
slide 5/25
Cabozantinib: Broadly Active, with Activity Against
Multiple Disease Compartments
Multi targeted kinase inhibitor
• MET, VEGFR, RET, others
• Key targets involved in tumor growth, survival, metastasis, resistance
• Activity profile distinct from selective VEGFR or MET inhibitors
Broadly active, documented antitumor activity in 15 tumor types
Optimized dosing in phase 2
More than 4,000 patients treated in clinical trials
45+ clinical trials listed at www.clinicaltrials.gov
slide 10/25
10
Opportunity in Renal Cell Carcinoma (RCC)
A rapidly changing marketplace
•Four drugs approved in past five years
•> 20,000 drug eligible patients in U.S.*
•Total U.S. sales for agents to treat metastatic RCC were $870M in 2012*
Opportunities for differentiated agents
•Recent development dominated by VEGFR and
mTOR inhibition
•Clear-cell RCC disease biology suggests strong rationale for targeting
MET and VEGFR
Potential in first line RCC
•25% of first line RCC patients have primary refractory disease to
VEGFR targeting TKIs
Antwort auf Beitrag Nr.: 48.388.418 von Cyberhexe am 22.11.14 15:00:0917/25
zu Cobimetinib
Potent, highly selective inhibitor of MEK, component of the
RAS/RAF/MEK/ERK pathway activated in wide variety of tumors
•In development with Genentech, a member of the Roche Group
•Initial 50/50 share of U.S. profits/losses; Exelixis to copromote in U.S.
•Entitled to a low double digit royalty on ex U.S. revenue
Positive results from coBRIM, ongoing phase 3 pivotal trial
•Evaluating vemurafenib with/without cobimetinib
in previously untreated BRAF V600 mutation positive patients with
unresectable locally advanced or metastatic melanoma
•Presented positive data at ESMO 2014, Madrid, September 29
•MAA filed by Roche in EU; U.S. NDA by Genentech expected before yearend
2014 (Fast Track Designation)
Five additional phase 1 combination trials ongoing, including a PDL1
inhibitor, and in several tumor types (NSCLC and colorectal cancer)
zu Cobimetinib
Potent, highly selective inhibitor of MEK, component of the
RAS/RAF/MEK/ERK pathway activated in wide variety of tumors
•In development with Genentech, a member of the Roche Group
•Initial 50/50 share of U.S. profits/losses; Exelixis to copromote in U.S.
•Entitled to a low double digit royalty on ex U.S. revenue
Positive results from coBRIM, ongoing phase 3 pivotal trial
•Evaluating vemurafenib with/without cobimetinib
in previously untreated BRAF V600 mutation positive patients with
unresectable locally advanced or metastatic melanoma
•Presented positive data at ESMO 2014, Madrid, September 29
•MAA filed by Roche in EU; U.S. NDA by Genentech expected before yearend
2014 (Fast Track Designation)
Five additional phase 1 combination trials ongoing, including a PDL1
inhibitor, and in several tumor types (NSCLC and colorectal cancer)
Antwort auf Beitrag Nr.: 48.388.466 von Cyberhexe am 22.11.14 15:11:25zu XL888 22/25
Exelixis discovery
–
Conducted single agent phase 1 study
–
Paused development to focus on cabozantinib
In 2012, Moffitt Cancer Center initiated an IST phase 1 study to evaluate
the combination of vemurafenib and XL888 in malignant melanoma
–
Based on preclinical studies of XL888 in vemurafenib
resistant malignant melanoma models conducted at Moffitt
–
Late breaking oral presentation
(2014 Society for Melanoma Research,
November 13-16, Zurich,Switzerland)
Results support further investigation of the combination with other third agents, including planned phase 1b study with cobimetinib
Exelixis discovery
–
Conducted single agent phase 1 study
–
Paused development to focus on cabozantinib
In 2012, Moffitt Cancer Center initiated an IST phase 1 study to evaluate
the combination of vemurafenib and XL888 in malignant melanoma
–
Based on preclinical studies of XL888 in vemurafenib
resistant malignant melanoma models conducted at Moffitt
–
Late breaking oral presentation
(2014 Society for Melanoma Research,
November 13-16, Zurich,Switzerland)
Results support further investigation of the combination with other third agents, including planned phase 1b study with cobimetinib
Antwort auf Beitrag Nr.: 48.388.481 von Cyberhexe am 22.11.14 15:15:34
The trial had enrolled fifteen subjects (cohorts 1-3, n=3; cohort 4, n=6), and the median age was 60 years. Seventy-three percent of the subjects were male, and the majority of subjects (14/15) were assessed as having the stage IV metastatic form of their disease.
The most common adverse events were consistent with previous studies of vemurafenib and included anorexia, fatigue, arthralgia, and rash. Diarrhea and vision changes were seen at all dose levels, with the highest rates being seen in cohort 4. These events resolved upon dose interruption. Dose-limiting toxicities only occurred in cohort 4 (grade 3 diarrhea and pancreatitis), and an MTD has not yet been established. The trial also reported fewer secondary cutaneous neoplasms in higher XL888 dose cohorts.
At the time of data cut-off, objective tumor regression was observed in 11 of 12 response-evaluable patients (two complete responses and nine partial responses), for an objective response rate of 92%. Additionally, one stage IIIC patient with a partial response underwent resection of residual disease and pathology showed no viable tumor cells. Three patients who did not have post baseline tumor assessments were excluded from the response analysis; two patients elected alternative treatment prior to the first post baseline scan, and the third patient was still in the first cycle of study treatment. The estimated PFS at 6- and 12-months was 63% (95% CI: 28 - 84%) and 39% (95% CI: 11 - 68%), respectively.
About XL888
sehr viel versprechend:
Study ResultsThe trial had enrolled fifteen subjects (cohorts 1-3, n=3; cohort 4, n=6), and the median age was 60 years. Seventy-three percent of the subjects were male, and the majority of subjects (14/15) were assessed as having the stage IV metastatic form of their disease.
The most common adverse events were consistent with previous studies of vemurafenib and included anorexia, fatigue, arthralgia, and rash. Diarrhea and vision changes were seen at all dose levels, with the highest rates being seen in cohort 4. These events resolved upon dose interruption. Dose-limiting toxicities only occurred in cohort 4 (grade 3 diarrhea and pancreatitis), and an MTD has not yet been established. The trial also reported fewer secondary cutaneous neoplasms in higher XL888 dose cohorts.
At the time of data cut-off, objective tumor regression was observed in 11 of 12 response-evaluable patients (two complete responses and nine partial responses), for an objective response rate of 92%. Additionally, one stage IIIC patient with a partial response underwent resection of residual disease and pathology showed no viable tumor cells. Three patients who did not have post baseline tumor assessments were excluded from the response analysis; two patients elected alternative treatment prior to the first post baseline scan, and the third patient was still in the first cycle of study treatment. The estimated PFS at 6- and 12-months was 63% (95% CI: 28 - 84%) and 39% (95% CI: 11 - 68%), respectively.
About XL888
cabozantinib with immunotherapy
J Transl Med. 2014 Nov 13;12(1):294. [Epub ahead of print]Dual effects of a targeted small-molecule inhibitor (cabozantinib) on immune-mediated killing of tumor cells and immune tumor microenvironment permissiveness when combined with a cancer vaccine.
Kwilas AR, Ardiani A, Donahue RN, Aftab DT, Hodge JW.
Abstract
BackgroundGrowing awareness of the complexity of carcinogenesis has made multimodal therapies for cancer increasingly compelling and relevant. In recent years, immunotherapy has gained acceptance as an active therapeutic approach to cancer treatment, even though cancer is widely considered an immunosuppressive disease. Combining immunotherapy with targeted agents that have immunomodulatory capabilities could significantly improve its efficacy.MethodsWe evaluated the ability of cabozantinib, a receptor tyrosine kinase inhibitor, to modulate the immune system in vivo as well as alter the phenotype of tumor cells in vitro in order to determine if this inhibitor could act synergistically with a cancer vaccine.ResultsOur studies indicated that cabozantinib altered the phenotype of MC38-CEA murine tumor cells, rendering them more sensitive to immune-mediated killing. Cabozantinib also altered the frequency of immune sub-populations in the periphery as well as in the tumor microenvironment, which generated a more permissive immune environment. When cabozantinib was combined with a poxviral-based cancer vaccine targeting a self-antigen, the combination significantly reduced the function of regulatory T cells and increased cytokine production from effector T cells in response to the antigen. These alterations to the immune landscape, along with direct modification of tumor cells, led to markedly improved antitumor efficacy.
Conclusions:These studies support the clinical combination of cabozantinib with immunotherapy for the treatment of cancer.
http://www.ncbi.nlm.nih.gov/pubmed/25388653
cobi to treat Triple Negative Breast Cancer
About the cobimetinib and Zelboraf combination Cobimetinib is designed to selectively block the activity of MEK, one of a series of proteins inside cells that make up a signaling pathway that helps regulate cell division and survival. Cobimetinib binds to MEK while Zelboraf binds to mutant BRAF, another protein on the pathway, to interrupt abnormal signaling that can cause tumors to grow.
About cobimetinib
Cobimetinib (GDC-0973, XL518) was discovered by Exelixis Inc. and is being developed in collaboration with Exelixis. Cobimetinib is also being investigated in combination with several investigational medicines, including an immunotherapy, in several tumor types such as non-small cell lung cancer, and colorectal cancer, triple- negative breast cancer and melanoma.
beeindruckende Performance!
Antwort auf Beitrag Nr.: 48.684.668 von riverstar_de am 03.01.15 02:19:11... heute vor allem ...
Antwort auf Beitrag Nr.: 48.728.162 von soalex am 08.01.15 17:30:19
und heute schon wieder....
EXEL kann davon profitieren, dass Roche heute neue Studien mit COBI bekannt gegeben hat:
Zitat von soalex: ... heute vor allem ...
und heute schon wieder....
EXEL kann davon profitieren, dass Roche heute neue Studien mit COBI bekannt gegeben hat:

Antwort auf Beitrag Nr.: 48.728.162 von soalex am 08.01.15 17:30:19Bin jetzt auch hier drin.
Die Performance ist wirklich Bombe hier.
Bin durch Zufall auf die Aktie gekommen, habe mir die 2 Tage durchgearbeitet und muß sagen sehr sehr hohes Potenzial.
Leider bei 1,70 rein.
2 Tage eher wäre besser

Glaube wir sehen bald aber schnell die 2,00
Kursziel ist bei mir 2,80 - 3,50
Die Performance ist wirklich Bombe hier.
Bin durch Zufall auf die Aktie gekommen, habe mir die 2 Tage durchgearbeitet und muß sagen sehr sehr hohes Potenzial.
Leider bei 1,70 rein.
2 Tage eher wäre besser


Glaube wir sehen bald aber schnell die 2,00
Kursziel ist bei mir 2,80 - 3,50
Antwort auf Beitrag Nr.: 48.991.982 von Quick1 am 05.02.15 18:34:49Bombe na jah
kommt auf den Einstiegszeitpunkt an


hier meiner:
18.07.2014
Kauf
EXELIXIS INC. DL-,01
2,5820 EUR
Dein Optimissmus in allen Ehren, ich bin froh wenn ich meinen Einstandskurs erreiche!
Dachte damals nach dem 1.Crash kanns nicht weiter runtergehen, aber Pustekuchen.
Aber du hast recht zur Zeit scheint sich was zu tun, gen Norden!
Guter EInstiegzeitpunkt, denk ich - viel Glück
bin auch dick in AEZS drin.
Gruss S.

kommt auf den Einstiegszeitpunkt an



hier meiner:
18.07.2014
Kauf
EXELIXIS INC. DL-,01
2,5820 EUR
Dein Optimissmus in allen Ehren, ich bin froh wenn ich meinen Einstandskurs erreiche!
Dachte damals nach dem 1.Crash kanns nicht weiter runtergehen, aber Pustekuchen.
Aber du hast recht zur Zeit scheint sich was zu tun, gen Norden!
Guter EInstiegzeitpunkt, denk ich - viel Glück
bin auch dick in AEZS drin.
Gruss S.
Antwort auf Beitrag Nr.: 48.992.417 von Schaeffi am 05.02.15 19:20:37Die kommt schon, ich würde wahrscheinlich nachkaufen an deiner Stelle. Das du ein Einstieg bei 2,10 hast oder so, Aber jeder muß es selber wissen,
Wie sagt man so schön wenn ich das immer alles wüsste.
Habe noch Nuvo Research gekauft, letzte Woche von 7 Euro auf 2,90 runter.
Bin bei 3,00 rein gegangen, sehe auch dort eine Korrektur auf 5,00 Euro in den nächsten Wochen.
AEZS wird schon kommen.
Habe damals EDAP gekauft bei 1,11 und haben mich ausgelacht. Guck mal wo die jetzt stehen. !!!! Schmeckt
Wie sagt man so schön wenn ich das immer alles wüsste.
Habe noch Nuvo Research gekauft, letzte Woche von 7 Euro auf 2,90 runter.
Bin bei 3,00 rein gegangen, sehe auch dort eine Korrektur auf 5,00 Euro in den nächsten Wochen.
AEZS wird schon kommen.
Habe damals EDAP gekauft bei 1,11 und haben mich ausgelacht. Guck mal wo die jetzt stehen. !!!! Schmeckt

Antwort auf Beitrag Nr.: 48.992.591 von Quick1 am 05.02.15 19:35:25überlege echt zu verbilligen
mal sehen
hab auch nur Kleingeld im Vergleich zu TST und AEZS hier drin.
zu nuvo:
könnt schon was werden!
möcht aber nicht noch mehr Kanadier im Depot haben
is irgendwie überlastet damit, mein Depot!
kannst mir ja über BM schreiben an was de grad noch so drann bist,
ich schreib zurück.
Gruss S.
mal sehen
hab auch nur Kleingeld im Vergleich zu TST und AEZS hier drin.
zu nuvo:
könnt schon was werden!
möcht aber nicht noch mehr Kanadier im Depot haben
is irgendwie überlastet damit, mein Depot!
kannst mir ja über BM schreiben an was de grad noch so drann bist,
ich schreib zurück.
Gruss S.
Cabo als Alternative beim Leberkarzinom
...in der Klinik in Phase 3 --> Study of Cabozantinib (XL184) vs Placebo in Subjects With Hepatocellular Carcinoma Who Have Received Prior Sorafenib (CELESTIAL)Cancer Biol Ther. 2015 Feb 10:0. [Epub ahead of print]
Clinical Observation of Liver Cancer Patients Treated with Axitinib and Cabozantinib after Failed Sorafenib Treatment: A Case Report and Literature Review.
Zhang B1, Zhang X, Zhou T, Liu J.
Author information
Abstract
Abstract Hepatocellular carcinoma (HCC) is a major pathological type of primary liver cancer. Sorafenib has demonstrated definite efficacy in targeted therapy for HCC. However, when treatment with sorafenib fails, suitable drugs must be found for further treatment. This article reports a case of an HCC patient who was treated with angiogenesis inhibitor axitinib and c-Met inhibitor cabozantinib following treatment with sorafenib. The report focuses on clinical treatment and toxicity. Rational application of targeted therapy is also explored.
Antwort auf Beitrag Nr.: 49.042.838 von Cyberhexe am 11.02.15 18:46:55Und das heißt? Ganz schönes Gezocke heute...Aber langfristig sollte es wieder hoch gehen! UP
Antwort auf Beitrag Nr.: 48.992.417 von Schaeffi am 05.02.15 19:20:37
ist die stark, komm gar nicht dazu nachzukaufen und meinen Einstiegskurs zu drücken! Bis ich schau is der wieder erreicht
leg mich bei ca. 2USD auf die Lauer.
Zitat von Schaeffi: Bombe na jah
kommt auf den Einstiegszeitpunkt an
hier meiner:
18.07.2014
Kauf
EXELIXIS INC. DL-,01
2,5820 EUR
Dein Optimissmus in allen Ehren, ich bin froh wenn ich meinen Einstandskurs erreiche!
...
ist die stark, komm gar nicht dazu nachzukaufen und meinen Einstiegskurs zu drücken! Bis ich schau is der wieder erreicht

leg mich bei ca. 2USD auf die Lauer.
Exelixis: Expected METEOR Trial Success Changes Everything
http://seekingalpha.com/article/2922566-exelixis-expected-me…"Totgesagte leben länger"

Antwort auf Beitrag Nr.: 49.097.447 von Schaeffi am 17.02.15 18:59:14Auzug aus der 2. Seite, da die ja oft gesperrt sind:
Seeking Alpha
Portfolio
News
Articles
StockTalk
Alerts
PRO
Sign in / Join Now
Thomas Chin
Growth, value, long-term horizon
Profile| Send Message|
Follow (2 followers)
Exelixis: Expected METEOR Trial Success Changes Everything
Feb. 17, 2015 10:54 AM ET | About: Exelixis, Inc. (EXEL)
Disclosure: The author is long EXEL. (More...)
Long term debt matures in the 2018-2019 timeframe. It cost $7.5M in non-cash interest in Q3 (the interest compounds until maturity). In 2019, 77% of the long term debt matures in the form of 4.25% convertible notes. The Deerfield notes will be renewed in July 2015 for another 3 years.
Exelixis Q3 2014 financial report has made it clear that the current cash of $293.5 M is good thru 2015 with the announced restructuring, while still maintaining $81 M cash for operational liquidity. This safe financial runway extends past 2015 with any new revenues.
Within the secure 2015 timeframe, a comprehensive financial solution does exist with the success of the METEOR trial in RCC with a potential billion dollar revenue stream. Cometriq's superior benefit will make it the new standard of care for 2nd line RCC. This would erase all current financial concerns. See the section titled "METEOR Success Changes Everything" for a full description of the RCC trial. There I provide evidence for early METEOR trial success. METEOR success is real, the only remaining concern is that it will run into 2016 for FDA approval and require some more time before sales ramp up to break even.
Here's a scenario for how events may play out to secure the RCC revenue stream:
If the METEOR trial results are as impressive as expected, Fast-Track filing of the NDA is likely, meaning a shorter 6 month review.
If the NDA filing could be completed 2 month after the METEOR read out of results, this could lead to FDA approval by Feb 2016.
Cobimetinib revenue in the 2nd half of 2015, and the start of MTC revenue from the EU, could fund 2016 operations until the FDA approval of Cometriq in RCC.
After FDA approval, there shouldn't be any problems negotiating any financial terms to fund operations until the company reaches breakeven.
This may require just 1,000 RCC patients and take only 6 months to add $175M in annual RCC revenue.
Early filing with the EMA (European Medicines Agency) might also lead to a 2016 approval of Cometriq in RCC.
page 2 / 8
| Next »
Share this article with a colleague
About this article
Emailed to: 4,870 people who get EXEL real-time alerts and 532,644 people who get Investing Ideas daily.
Author payment: $35 + $0.01/page view. Authors of PRO articles receive a minimum guaranteed payment of $150-500.
Become a contributor »
Tagged: Investing Ideas, Long Ideas, Healthcare, Biotechnology
Problem with this article? Please tell us. Disagree with this article? Submit your own.
Latest on EXEL
Exelixis reports February 24 Mon, Feb 2
Midday Gainers / Losers Wed, Jan 28
Bullish breakout for Exelixis Thu, Jan 8
Update: My Take On Exelixis' New Agreement With Sobi To Provide COMETRIQ In Europe Wed, Jan 7
Exelixis restructures contract with Swedish Orphan Wed, Jan 7
Turnaround potential? 2014's worst performers in the Russell 2000 Sun, Jan 4
Midday Gainers / Losers Fri, Jan 2
Exelixis' Partners File New Drug Application For Cobemetinib - Welcome News But Little Impact Tue, Dec 16
Roche submits NDA for skin cancer med Mon, Dec 15
EXEL vs. ETF alternatives
ETF Alternatives
sponsored by
Top Authors | RSS Feeds | Sitemap | About Us | Contact Us
Terms of Use | Privacy | Xignite quote data | © 2015 Seeking Alpha
Seeking Alpha
Portfolio
News
Articles
StockTalk
Alerts
PRO
Sign in / Join Now
Thomas Chin
Growth, value, long-term horizon
Profile| Send Message|
Follow (2 followers)
Exelixis: Expected METEOR Trial Success Changes Everything
Feb. 17, 2015 10:54 AM ET | About: Exelixis, Inc. (EXEL)
Disclosure: The author is long EXEL. (More...)
Long term debt matures in the 2018-2019 timeframe. It cost $7.5M in non-cash interest in Q3 (the interest compounds until maturity). In 2019, 77% of the long term debt matures in the form of 4.25% convertible notes. The Deerfield notes will be renewed in July 2015 for another 3 years.
Exelixis Q3 2014 financial report has made it clear that the current cash of $293.5 M is good thru 2015 with the announced restructuring, while still maintaining $81 M cash for operational liquidity. This safe financial runway extends past 2015 with any new revenues.
Within the secure 2015 timeframe, a comprehensive financial solution does exist with the success of the METEOR trial in RCC with a potential billion dollar revenue stream. Cometriq's superior benefit will make it the new standard of care for 2nd line RCC. This would erase all current financial concerns. See the section titled "METEOR Success Changes Everything" for a full description of the RCC trial. There I provide evidence for early METEOR trial success. METEOR success is real, the only remaining concern is that it will run into 2016 for FDA approval and require some more time before sales ramp up to break even.
Here's a scenario for how events may play out to secure the RCC revenue stream:
If the METEOR trial results are as impressive as expected, Fast-Track filing of the NDA is likely, meaning a shorter 6 month review.
If the NDA filing could be completed 2 month after the METEOR read out of results, this could lead to FDA approval by Feb 2016.
Cobimetinib revenue in the 2nd half of 2015, and the start of MTC revenue from the EU, could fund 2016 operations until the FDA approval of Cometriq in RCC.
After FDA approval, there shouldn't be any problems negotiating any financial terms to fund operations until the company reaches breakeven.
This may require just 1,000 RCC patients and take only 6 months to add $175M in annual RCC revenue.
Early filing with the EMA (European Medicines Agency) might also lead to a 2016 approval of Cometriq in RCC.
page 2 / 8
| Next »
Share this article with a colleague
About this article
Emailed to: 4,870 people who get EXEL real-time alerts and 532,644 people who get Investing Ideas daily.
Author payment: $35 + $0.01/page view. Authors of PRO articles receive a minimum guaranteed payment of $150-500.
Become a contributor »
Tagged: Investing Ideas, Long Ideas, Healthcare, Biotechnology
Problem with this article? Please tell us. Disagree with this article? Submit your own.
Latest on EXEL
Exelixis reports February 24 Mon, Feb 2
Midday Gainers / Losers Wed, Jan 28
Bullish breakout for Exelixis Thu, Jan 8
Update: My Take On Exelixis' New Agreement With Sobi To Provide COMETRIQ In Europe Wed, Jan 7
Exelixis restructures contract with Swedish Orphan Wed, Jan 7
Turnaround potential? 2014's worst performers in the Russell 2000 Sun, Jan 4
Midday Gainers / Losers Fri, Jan 2
Exelixis' Partners File New Drug Application For Cobemetinib - Welcome News But Little Impact Tue, Dec 16
Roche submits NDA for skin cancer med Mon, Dec 15
EXEL vs. ETF alternatives
ETF Alternatives
sponsored by
Top Authors | RSS Feeds | Sitemap | About Us | Contact Us
Terms of Use | Privacy | Xignite quote data | © 2015 Seeking Alpha
Das könnte eine zweite Dendreon im positiven Sinne werden, Tenbagger und dann schnell verkaufen, obwohl mit Roche hat Exelixis einen Weltklasse Partner was Dendreon nie schaffte!
Auch Roche teilte mit...
Roche Gets FDA Priority Review for Cancer Treatment
By Dow Jones Business News, February 19, 2015, 02:02:00 AM
ZURICH-- Roche Holding AG said Thursday one of its skin cancer treatments had been granted a priority review by the U.S. Food and Drug Administration, cutting the time the drug might take to become available to patients.
Basel-based Roche said the FDA would make an accelerated decision on its cobimetinib drug when used with another medication, Zelboraf, to treat a serious form of skin cancer known as BRAF V600 mutation-positive melanoma. The drug is being developed by Genentech, part of the Roche Group, and Exelixis, Inc. which is a biopharmaceutical company.
In a late stage trial of the drug, cobimetinib raised the median length of time patients experienced no worsening of their disease to 9.9 months when used with Zelboraf, up from 6.2 months for Zelboraf alone, Roche said.
The priority review cuts the FDA decision time to six months from the standard 10 months.
The FDA will make a decision on Aug. 11, Roche said.
http://www.nasdaq.com/article/roche-gets-fda-priority-review…
Roche Gets FDA Priority Review for Cancer Treatment
By Dow Jones Business News, February 19, 2015, 02:02:00 AM
ZURICH-- Roche Holding AG said Thursday one of its skin cancer treatments had been granted a priority review by the U.S. Food and Drug Administration, cutting the time the drug might take to become available to patients.
Basel-based Roche said the FDA would make an accelerated decision on its cobimetinib drug when used with another medication, Zelboraf, to treat a serious form of skin cancer known as BRAF V600 mutation-positive melanoma. The drug is being developed by Genentech, part of the Roche Group, and Exelixis, Inc. which is a biopharmaceutical company.
In a late stage trial of the drug, cobimetinib raised the median length of time patients experienced no worsening of their disease to 9.9 months when used with Zelboraf, up from 6.2 months for Zelboraf alone, Roche said.
The priority review cuts the FDA decision time to six months from the standard 10 months.
The FDA will make a decision on Aug. 11, Roche said.
http://www.nasdaq.com/article/roche-gets-fda-priority-review…
Ich bin auch dabei, denn scheint mir sehr interessant ...
hmmm die 2 USD sehen wir glaub ich nicht mehr
hoffe auf ein Pullback 2,5 USD zur 200tagelinie
dann kaufe ich nach!
ca 3USD is Widerstand
ca 4USD wäre Gap Close
50day dreht nach oben
200 day ist kurz davor
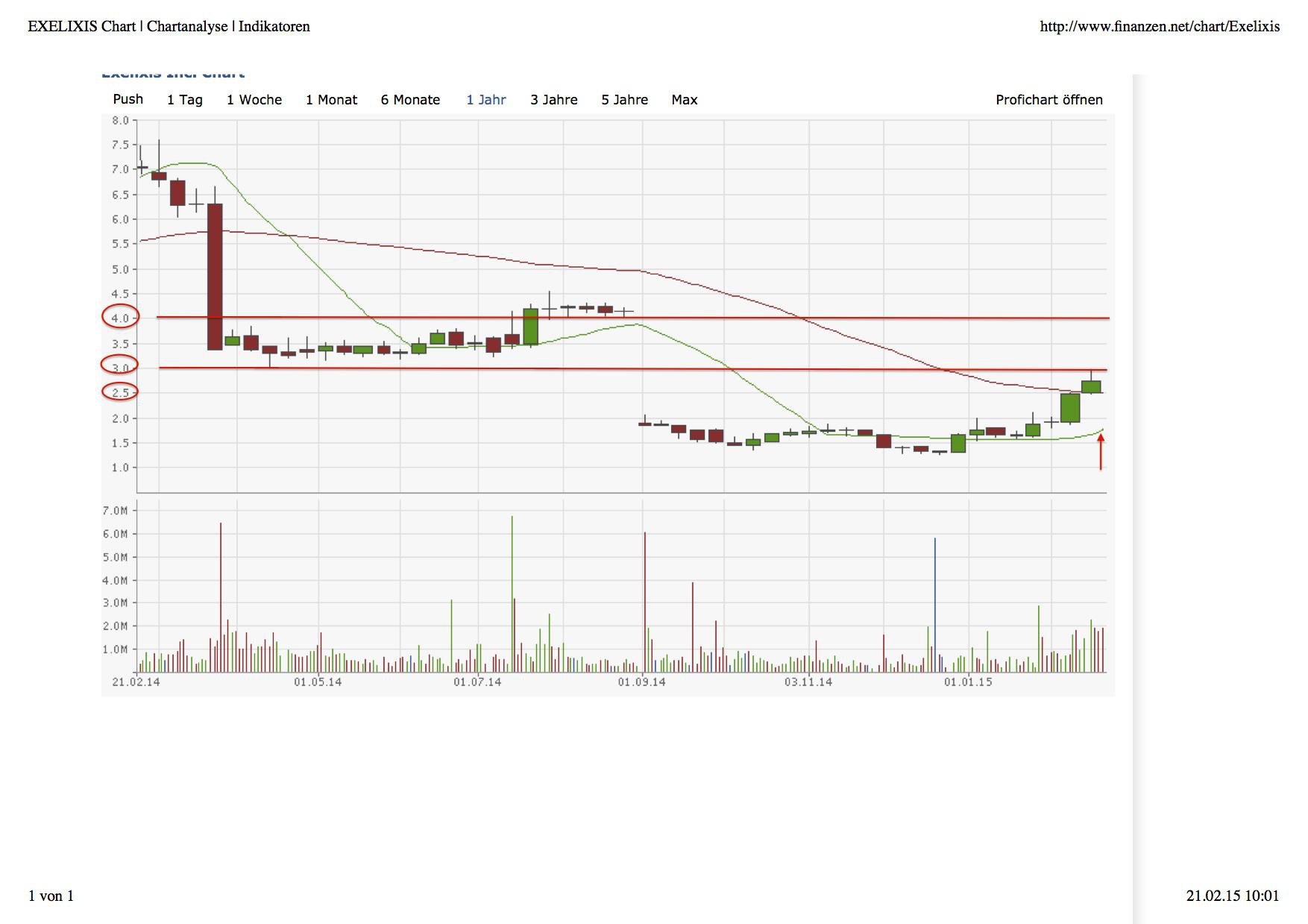
hoffe auf ein Pullback 2,5 USD zur 200tagelinie
dann kaufe ich nach!
ca 3USD is Widerstand
ca 4USD wäre Gap Close
50day dreht nach oben
200 day ist kurz davor

Eine Woche weg und schon explodiert der Kurs  Was ist passiert? Gab es News?
Was ist passiert? Gab es News? Oder ist das die Vorfreude auf die hoffentlich guten News (abgesehen von den Zahlen) am Dienstag?
Oder ist das die Vorfreude auf die hoffentlich guten News (abgesehen von den Zahlen) am Dienstag?
Euch einen schönen Sonntag!!! UP
 Was ist passiert? Gab es News?
Was ist passiert? Gab es News? Oder ist das die Vorfreude auf die hoffentlich guten News (abgesehen von den Zahlen) am Dienstag?
Oder ist das die Vorfreude auf die hoffentlich guten News (abgesehen von den Zahlen) am Dienstag?Euch einen schönen Sonntag!!! UP
Antwort auf Beitrag Nr.: 49.141.289 von Up-runner am 22.02.15 14:38:10
oder
aus Stockwatch:
Exelixis expects lower losses in final results 2014
Pursuant to the CSE and SEC Regulations and in order to fully inform the shareholders and the investing public in general, Exelixis Investment Public Limited announces that the consolidated results for the year ended December 31, 2014 are expected to show lower losses compared to the corresponding results of the financial year 2013.
This drop in losses on a consolidated level is mostly attributable to the lower loss from the impairment of financial assets available for sale.
usw.
Why Shares of Exelixis, Inc. Briefly Spiked Higher
http://www.fool.com/investing/general/2015/02/19/why-shares-…" target="_blank" rel="nofollow ugc noopener">http://www.fool.com/investing/general/2015/02/19/why-shares-… oder
aus Stockwatch:
Exelixis expects lower losses in final results 2014
Pursuant to the CSE and SEC Regulations and in order to fully inform the shareholders and the investing public in general, Exelixis Investment Public Limited announces that the consolidated results for the year ended December 31, 2014 are expected to show lower losses compared to the corresponding results of the financial year 2013.
This drop in losses on a consolidated level is mostly attributable to the lower loss from the impairment of financial assets available for sale.
usw.
Ich Frage mich, warum die Aktie so wenig Aufmerksamkeit bekommt...Finde den stetigen Anstieg sehr gut. Meint Ihr, dass bald News kommen? Grüße UP 

Hallo Exel-Freunde,
bin seit 2.9. hier investiert. Hat sich schon gelohnt bisher
Wenn man die Tagesumsätze bei der Nasdaq ansieht, finde ich nicht, dass Exelixis wenig Aufmerksamkeit findet. Man kann sich natürlich immer noch mehr wünschen.
Eben kam der 2014-Jahres- und Q1-15-Bericht raus. Noch nicht alles gelesen, aber sehr interessante Passagen und Ausblicke...
http://www.exelixis.com/investors-media/sec-filings
Allen longs - und auch SwingTradern - viel Erfolg!
Viel Glück vor allem den schon länger Investierten, die auf eine Rückkehr in den Bereich ihres EK hoffen!
Gruß
TwoPack
bin seit 2.9. hier investiert. Hat sich schon gelohnt bisher

Wenn man die Tagesumsätze bei der Nasdaq ansieht, finde ich nicht, dass Exelixis wenig Aufmerksamkeit findet. Man kann sich natürlich immer noch mehr wünschen.
Eben kam der 2014-Jahres- und Q1-15-Bericht raus. Noch nicht alles gelesen, aber sehr interessante Passagen und Ausblicke...
http://www.exelixis.com/investors-media/sec-filings
Allen longs - und auch SwingTradern - viel Erfolg!
Viel Glück vor allem den schon länger Investierten, die auf eine Rückkehr in den Bereich ihres EK hoffen!
Gruß
TwoPack
Antwort auf Beitrag Nr.: 49.222.094 von TwoPack am 03.03.15 00:45:14
Danke für die Glückwünsche
meinen EK von Mitten letzten Jahres hab ich die Woche wieder erreicht!
Hab leider verpasst nachzukaufen, gab zu wenig Rücksetzer beim Anstieg
Aber es gibt Schlimmeres denk ich
Gruss S.
Zitat von TwoPack: Hallo Exel-Freunde,
bin seit 2.9. hier investiert. Hat sich schon gelohnt bisher
...
..
..
Allen longs - und auch SwingTradern - viel Erfolg!
Viel Glück vor allem den schon länger Investierten, die auf eine Rückkehr in den Bereich ihres EK hoffen!
Gruß
TwoPack
Danke für die Glückwünsche

meinen EK von Mitten letzten Jahres hab ich die Woche wieder erreicht!
Hab leider verpasst nachzukaufen, gab zu wenig Rücksetzer beim Anstieg

Aber es gibt Schlimmeres denk ich

Gruss S.
Mit "Beachtung" meinte ich hier in Deutschland. Drüben ist ja Volumen da. Habe heute nochmal leicht nachgelegt. Mein Kursziel sind die 3,50€. Bin von Exel überzeugt.
Uns allen viel Erfolg UP
UP
Uns allen viel Erfolg
 UP
UP
@ UP
ja, da hast Du recht, die Beachtung in Deutschland ist börslich minimal.
Aber der Thread ist ganz gut besucht hier. Dank an alle, die so umfangreich Infos reingestellt haben
(OREX ist z.B. auch eine wenig beachtete Aktie in D, obwohl die Zulassung für die EU so gut wie durch ist, und im Forum sind wir nur zu dritt).
@ Schaeffi
wenn der Aufwärtstrend sich etabliert, beneiden dich bald viele für deinen günstigen EK...
Gruß
TwoPack
ja, da hast Du recht, die Beachtung in Deutschland ist börslich minimal.
Aber der Thread ist ganz gut besucht hier. Dank an alle, die so umfangreich Infos reingestellt haben

(OREX ist z.B. auch eine wenig beachtete Aktie in D, obwohl die Zulassung für die EU so gut wie durch ist, und im Forum sind wir nur zu dritt).
@ Schaeffi
wenn der Aufwärtstrend sich etabliert, beneiden dich bald viele für deinen günstigen EK...
Gruß
TwoPack
Antwort auf Beitrag Nr.: 49.225.178 von TwoPack am 03.03.15 12:15:23Finde den Bericht auch sehr positiv. Top ist, dass Roche mir im Boot ist. Es wird noch ein paar kleine Rücksetzer geben, aber die Richtung stimmt. Werden spannende Wochen und Monate
Der Aufwärtstrend ist intakt. Die 3 Dollar SK haben auch gestern gehaltene...es kann so weiter gehen 

Antwort auf Beitrag Nr.: 49.097.882 von Magnetfeldfredy am 17.02.15 19:27:14
Man hat mit Cobi einen kommenden Blockbuster, die Wichtigkeit dieses Medis sieht die FDA und weitere Experten schon länger, siehe Priority Reviw im August 2015.
Die Aktie sollte bis dahin und natürlich darüber hinaus auf alte Höhen klettern, da Sie bei dem momentanen Share Price noch stark unterbewertet ist.
Mein erstes Kursziel sind 10$, wo ich vielleicht mal über einen Teilverkauf nachdenke, langfristig möchte ich noch keine Ziele angeben, aber das Ziel wird weit weit höher liegen bei dem Marktpotenital.
Exelixis (NASDAQ: EXEL) announced that the U.S. Food and Drug Administration (FDA) has accepted for review Genentech’s New Drug Application (NDA) for cobimetinib in combination with vemurafenib for patients with unresectable or metastatic melanoma harboring a BRAF V600 mutation. Cobimetinib is a specific MEK inhibitor that was discovered by Exelixis and is now the subject of a worldwide co-development agreement between Exelixis and Genentech, a member of the Roche Group.
FDA has granted Priority Review to the NDA and assigned a Prescription Drug User Fee Act (PDUFA) action date of August 11, 2015. A Priority Review designation is granted to medicines that the FDA determines have the potential to provide significant improvements in the treatment, prevention or diagnosis of a
Zitat von Magnetfeldfredy: Das könnte eine zweite Dendreon im positiven Sinne werden, Tenbagger und dann schnell verkaufen, obwohl mit Roche hat Exelixis einen Weltklasse Partner was Dendreon nie schaffte!
Man hat mit Cobi einen kommenden Blockbuster, die Wichtigkeit dieses Medis sieht die FDA und weitere Experten schon länger, siehe Priority Reviw im August 2015.
Die Aktie sollte bis dahin und natürlich darüber hinaus auf alte Höhen klettern, da Sie bei dem momentanen Share Price noch stark unterbewertet ist.
Mein erstes Kursziel sind 10$, wo ich vielleicht mal über einen Teilverkauf nachdenke, langfristig möchte ich noch keine Ziele angeben, aber das Ziel wird weit weit höher liegen bei dem Marktpotenital.
Exelixis (NASDAQ: EXEL) announced that the U.S. Food and Drug Administration (FDA) has accepted for review Genentech’s New Drug Application (NDA) for cobimetinib in combination with vemurafenib for patients with unresectable or metastatic melanoma harboring a BRAF V600 mutation. Cobimetinib is a specific MEK inhibitor that was discovered by Exelixis and is now the subject of a worldwide co-development agreement between Exelixis and Genentech, a member of the Roche Group.
FDA has granted Priority Review to the NDA and assigned a Prescription Drug User Fee Act (PDUFA) action date of August 11, 2015. A Priority Review designation is granted to medicines that the FDA determines have the potential to provide significant improvements in the treatment, prevention or diagnosis of a
Antwort auf Beitrag Nr.: 49.245.641 von Pali1 am 05.03.15 10:22:38
Was ist denn das Marktpotenzial? Und wie kommst du auf den Kurs?
Zitat von Pali1: Mein erstes Kursziel sind 10$, wo ich vielleicht mal über einen Teilverkauf nachdenke, langfristig möchte ich noch keine Ziele angeben, aber das Ziel wird weit weit höher liegen bei dem Marktpotenital.
Was ist denn das Marktpotenzial? Und wie kommst du auf den Kurs?
Cobimetinib
Exelixis hält nahezu 50% an Cobimetinib, seines Zeichen viel versprechender Wirkstoff im Onkologie-Portfolio von Roche/Genentech; die beiden Zulassungen der Kombitherapie mit Zelboraf in den USA und der EU sind wohl nur Formsache. Darüber hinaus wird Cobi die Eigenschaft vorhergesagt, die Wirksamkeit von Wirkstoffen zu verlängern bzw. den Zeitpunkt der Unwirksamkeit von Onkologie-Wirkstoffen hinauszuzögern. Von speziellem Interesse ist auch die ph2-Studie mit Paclitaxel zur Behandlung von TNBC (dreifach negativem Brustkrebs HER---) sowie die ph1-Studien mit den immunologisch wirksamen Antikörpern von Roche.lets have a view on the Lifecycle potential of cobimetinib for Roche:
- cobi belongs to a class of agents called MEK inhibitors that target the MAPK signaling pathway
- cobi is a novel and selective MEK inhibitor; in combination with other medicines, cobi may enhance anti-tumor activity and inhibit mechanisms of resistance
- dysregulation of the MAPK pathway occurs in a wide range of tumor types and e.g. resistance to BRAF inhibition can occur through activation of MAPK hence inhibiting both pathways is much better -- combo of MEK (cobi) and a BRAF inhibitor (vemurafenib) has been proven to be more successful in patients with metastatic melanoma
- much more possibilities with cobi -- blocking the MAPK pathway via MEK1/2 inhibition is an very promising strategy in delaying or preventing the development of drug resistance
cobi is currently investigated in combi with other agents in a number of phI clinical trials, e.g. in a ph I non-randomized study of cobimetinib in combination with MPDL3280A (a novel anti-PDL1 antibody/immunotherapy) in patients with locally advanced or metastatic solid tumors (actively recruiting) or in combi with MEHD7945A (a first-in-class HER3/EGFR dual-action antibody) in patients with locally advanced or metastatic KRAS-mutant solid tumors (actively recruiting
Exelix hält sich gut- ich habe mir gestern ein paar zu 2,84 € gekauft. läuft z.Zt. im Trend nach oben
-charttechnisch - könnte bis zum schließen der Kurslücke hochlaufen bei 4 $ - meistens dreht
dann der Kurs - bei den meisten Werten - weil die in den USA -GAP-Fetischisten sind.
vorbörslich steht der Kurs 2,84 zu 2,90 -
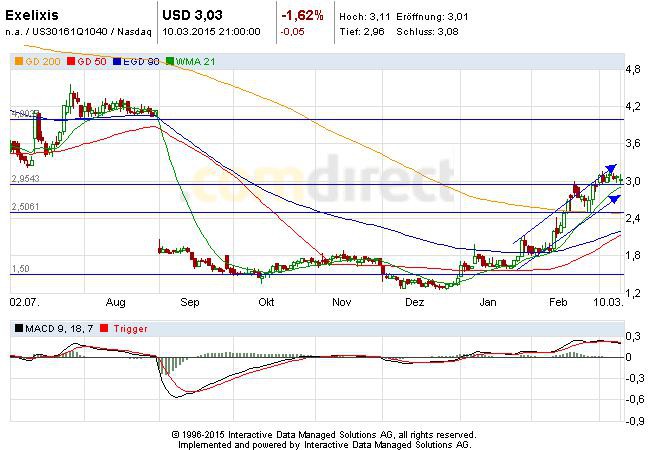
-charttechnisch - könnte bis zum schließen der Kurslücke hochlaufen bei 4 $ - meistens dreht
dann der Kurs - bei den meisten Werten - weil die in den USA -GAP-Fetischisten sind.
vorbörslich steht der Kurs 2,84 zu 2,90 -

Antwort auf Beitrag Nr.: 49.297.100 von urpferdchen am 11.03.15 11:16:59
METEOR is an open-label trial of cabozantinib in patients with mRCC that is being conducted at up to 200 sites in up to 26 countries. The trial is expected to enroll 650 patients with clear cell RCC who have received and progressed on at least one VEGFR-TKI. Patient enrollment will be weighted toward Western Europe, North America, and Australia, and patients will be stratified based on the number of prior VEGFR-TKI therapies received and commonly applied RCC risk criteria developed by Motzer et al. Patients will be randomized 1:1 to receive 60 mg of cabozantinib daily or 10 mg of everolimus daily. No cross-over is allowed between the study arms.
The primary endpoint is progression-free survival (PFS) and the secondary endpoint is overall survival (OS). Exploratory endpoints include patient-reported outcomes, biomarkers, safety, and pharmacokinetics. PFS is an established acceptable endpoint for RCC clinical trials and has been used to support approval of sorafenib, sunitinib, everolimus, axitinib, and pazopanib in this indication.
Based on available clinical trial data, the primary endpoint assumes a median PFS of 5 months for the everolimus arm and 7.5 months for cabozantinib arm. This provides for a hazard ratio (HR) of 0.67 and 90% power and requires 259 PFS events among the first 375 patients randomized. The secondary endpoint assumes a median OS of 15 months for the everolimus arm and 20 months for the cabozantinib arm. This provides for a HR of 0.75 and 80% power and requires 413 events.
Chart nicht ausschlaggebend
...vielmehr wird es kurzfristig darauf ankommen, ob der primäre Endpunkt (progressionsfreies Überleben) bei METEOR erreicht wird oder nicht. Falls ja, dann wird der Kurs nach Bekanntgabe dieser ph3-Studie in Richtung USD10 abheben, falls nicht, dann gehts wieder abwärts. Studienergebnis soll im April/Mai bekannt gegeben werden.METEOR is an open-label trial of cabozantinib in patients with mRCC that is being conducted at up to 200 sites in up to 26 countries. The trial is expected to enroll 650 patients with clear cell RCC who have received and progressed on at least one VEGFR-TKI. Patient enrollment will be weighted toward Western Europe, North America, and Australia, and patients will be stratified based on the number of prior VEGFR-TKI therapies received and commonly applied RCC risk criteria developed by Motzer et al. Patients will be randomized 1:1 to receive 60 mg of cabozantinib daily or 10 mg of everolimus daily. No cross-over is allowed between the study arms.
The primary endpoint is progression-free survival (PFS) and the secondary endpoint is overall survival (OS). Exploratory endpoints include patient-reported outcomes, biomarkers, safety, and pharmacokinetics. PFS is an established acceptable endpoint for RCC clinical trials and has been used to support approval of sorafenib, sunitinib, everolimus, axitinib, and pazopanib in this indication.
Based on available clinical trial data, the primary endpoint assumes a median PFS of 5 months for the everolimus arm and 7.5 months for cabozantinib arm. This provides for a hazard ratio (HR) of 0.67 and 90% power and requires 259 PFS events among the first 375 patients randomized. The secondary endpoint assumes a median OS of 15 months for the everolimus arm and 20 months for the cabozantinib arm. This provides for a HR of 0.75 and 80% power and requires 413 events.
Heute 10 - 11 % billiger bei 2,48 € - gibt es dafür einen Grund ?
Antwort auf Beitrag Nr.: 49.312.847 von urpferdchen am 12.03.15 16:52:30
Gewinnmitnahmen
gerissene SL, ganz normale Konsolidierung nach dem steilen Anstieg
Unterstützung ist gefunden im Bereich 2,45-2,5, der Trend kann weiter nach oben laufen
Zitat von urpferdchen: Heute 10 - 11 % billiger bei 2,48 € - gibt es dafür einen Grund ?
Gewinnmitnahmen
gerissene SL, ganz normale Konsolidierung nach dem steilen Anstieg
Unterstützung ist gefunden im Bereich 2,45-2,5, der Trend kann weiter nach oben laufen
Antwort auf Beitrag Nr.: 49.316.954 von Pali1 am 13.03.15 08:11:16Scheint in der Tat weiter den Kanal hoch zu gehen. Viele arbeiten doch mit SL. Denke, die 3 Dollar sind wieder das Ziel. Hier muss man einfach Geduld haben und abwarten.  Grüße UP
Grüße UP
 Grüße UP
Grüße UP
The under-the-radar growth story:
"Keep in mind that Exelixis is by no means out of the woods just yet, ... However,..."

http://www.investopedia.com/articles/markets/030615/exelixis…
"Keep in mind that Exelixis is by no means out of the woods just yet, ... However,..."

http://www.investopedia.com/articles/markets/030615/exelixis…
Die kommenden Wochen/Monate werden spannend für Exelixis und deren Aktionäre, da einige Kurs beeinflussende Ergebnisse anstehen:
1.) die Entblindung der ph3-Studie METEOR = Pivotal-Studie --> Cabozantinib zur Behandlung non metastasierendem Nierenzellkarzinom
METEOR is an open-label, event-driven trial with the primary endpoint of progression-free survival (PFS).
Based on available clinical trial data, the primary endpoint of METEOR assumes a median PFS of 5 months for the everolimus arm and 7.5 months for the cabozantinib arm. The trial protocol specifies that the primary analysis will be conducted on the first 375 patients enrolled, and will be triggered after at least 259 events occur, providing 90% power to detect a hazard ratio (HR) of 0.67. Enrollment of the first 375 patients was completed in June 2014.
Secondary endpoints for METEOR include overall survival and objective response rate. The secondary endpoint assumes a median OS of 15 months for the everolimus arm and 20 months for the cabozantinib arm. The study was designed to observe 408 deaths in the entire intention-to-treat population, providing 80% power to detect a HR of 0.75.
2.) Zulassungsentscheidung der FDA zur Behandlaung von metastasierendem Hautkrebs mit der Kombination aus Vemurafenib (brand name: Zelboraf) und Cobimetinib (Cotellic): Zulassungswahrscheinlichkeit > 90%; Zulassungsentscheidung sehr wahrscheinlich im Juni 2015 (Antrag eingereicht im Dezember 2014 -> fast track, dh beschleunigte Bearbeitung durch die FDA wurde gewährt)
3.) Zulassungsentscheidung der EMA zur Behandlaung von metastasierendem Hautkrebs mit der Kombination aus Vemurafenib (brand name: Zelboraf) und Cobimetinib (Cotellic); Zulassungswahrscheinlichkeit > 90%; Zulassungsentscheidung im Herbst 2015 (Antrag eingereicht im September 2014)
Da die Zulassungsantraege von Genentech bzw. Roche eingereicht wurden, ist bei 2 und 3 wohl nicht mit Überraschungen zu rechnen, d.h. die Kombitherapie wird wohl von beiden Arzneimittelbehörden zugelassen, so dass diese noch in 2015 am Markt eingeführt werden sollte.
Ein grosses Fragezeicvhen steht hinter METEOR. Sollten die Endpunkte erreicht werden, dann dürften einstellige Kurse der Vergangenheit angehören.
1.) die Entblindung der ph3-Studie METEOR = Pivotal-Studie --> Cabozantinib zur Behandlung non metastasierendem Nierenzellkarzinom
METEOR is an open-label, event-driven trial with the primary endpoint of progression-free survival (PFS).
Based on available clinical trial data, the primary endpoint of METEOR assumes a median PFS of 5 months for the everolimus arm and 7.5 months for the cabozantinib arm. The trial protocol specifies that the primary analysis will be conducted on the first 375 patients enrolled, and will be triggered after at least 259 events occur, providing 90% power to detect a hazard ratio (HR) of 0.67. Enrollment of the first 375 patients was completed in June 2014.
Secondary endpoints for METEOR include overall survival and objective response rate. The secondary endpoint assumes a median OS of 15 months for the everolimus arm and 20 months for the cabozantinib arm. The study was designed to observe 408 deaths in the entire intention-to-treat population, providing 80% power to detect a HR of 0.75.
2.) Zulassungsentscheidung der FDA zur Behandlaung von metastasierendem Hautkrebs mit der Kombination aus Vemurafenib (brand name: Zelboraf) und Cobimetinib (Cotellic): Zulassungswahrscheinlichkeit > 90%; Zulassungsentscheidung sehr wahrscheinlich im Juni 2015 (Antrag eingereicht im Dezember 2014 -> fast track, dh beschleunigte Bearbeitung durch die FDA wurde gewährt)
3.) Zulassungsentscheidung der EMA zur Behandlaung von metastasierendem Hautkrebs mit der Kombination aus Vemurafenib (brand name: Zelboraf) und Cobimetinib (Cotellic); Zulassungswahrscheinlichkeit > 90%; Zulassungsentscheidung im Herbst 2015 (Antrag eingereicht im September 2014)
Da die Zulassungsantraege von Genentech bzw. Roche eingereicht wurden, ist bei 2 und 3 wohl nicht mit Überraschungen zu rechnen, d.h. die Kombitherapie wird wohl von beiden Arzneimittelbehörden zugelassen, so dass diese noch in 2015 am Markt eingeführt werden sollte.
Ein grosses Fragezeicvhen steht hinter METEOR. Sollten die Endpunkte erreicht werden, dann dürften einstellige Kurse der Vergangenheit angehören.
Servus Hexe,
wie hoch schätzt Du die Erfolgswahrscheinlichkeit bei der Meteor Studie ein?
Lg
Fredy
wie hoch schätzt Du die Erfolgswahrscheinlichkeit bei der Meteor Studie ein?
Lg
Fredy
Antwort auf Beitrag Nr.: 49.401.008 von Cyberhexe am 23.03.15 19:12:09"Ein grosses Fragezeicvhen steht hinter METEOR. Sollten die Endpunkte erreicht werden, dann dürften einstellige Kurse der Vergangenheit angehören."
Das ist richtig.
Man sollte aber im Hinterkopf haben, dass ein Scheitern von METEOR absolut katastrophal wäre. M.E. wäre das für EXEL existenzgefährdend.
Cobi ist hingegen eine Marginalie. Die entsprechenden Zulassungen allein würden Exilixis wohl kaum retten.
Viel mehr als - immerhin - 50:50 ist das meiner Meinung nach auf keinen Fall.
Das ist richtig.
Man sollte aber im Hinterkopf haben, dass ein Scheitern von METEOR absolut katastrophal wäre. M.E. wäre das für EXEL existenzgefährdend.
Cobi ist hingegen eine Marginalie. Die entsprechenden Zulassungen allein würden Exilixis wohl kaum retten.
Viel mehr als - immerhin - 50:50 ist das meiner Meinung nach auf keinen Fall.
Antwort auf Beitrag Nr.: 49.401.767 von SLGramann am 23.03.15 20:45:43"Cobi ist hingegen eine Marginalie. Die entsprechenden Zulassungen allein würden Exilixis wohl kaum retten.
Viel mehr als - immerhin - 50:50 ist das meiner Meinung nach auf keinen Fall."
Was meinst du mit Marginalie? Und wofür soll das 50:50 gemeint sein? Doch wohl nicht für die Zulassungswahrscheinlichkeit von Cobimetinib. Diese ist so gut wie sicher, weil die Ergebnisse der ph3-Studie (coBRIM) praktisch keine andere Entscheidung rechtfertigen würden. Die Unsicherheit liegt bei solchen Zulassungsantraegen eigentlich immer bei der Unvollstaendigkeit der Zulassungsunterlagen - hätte Exelixis selbst diese Unterlagen eingereicht, dann wäre mehr Pessimismus gerechtfertigt; jedoch bei Roche/Genentech bin ich mir sicher, dass an den Zulassunsunterlagen formell alles iO ist. Also Zulassungswahrscheinlichkeit nahezu 100%- Und diese Zulassung wird Exelixis das Überleben garantieren!! ...zumal Cobimetinib einEckpfeiler im Onkologie-Portfolio von Roche darstellt.
Die grosse Unbekannte ist jedoch Cabozantinib...falls METEOR die Erwartungen erfüllt und primäre und sekundäre Endpunkte mit statistischer Signifikanz erreicht werden, dannsehen wir "double digits"...
Viel mehr als - immerhin - 50:50 ist das meiner Meinung nach auf keinen Fall."
Was meinst du mit Marginalie? Und wofür soll das 50:50 gemeint sein? Doch wohl nicht für die Zulassungswahrscheinlichkeit von Cobimetinib. Diese ist so gut wie sicher, weil die Ergebnisse der ph3-Studie (coBRIM) praktisch keine andere Entscheidung rechtfertigen würden. Die Unsicherheit liegt bei solchen Zulassungsantraegen eigentlich immer bei der Unvollstaendigkeit der Zulassungsunterlagen - hätte Exelixis selbst diese Unterlagen eingereicht, dann wäre mehr Pessimismus gerechtfertigt; jedoch bei Roche/Genentech bin ich mir sicher, dass an den Zulassunsunterlagen formell alles iO ist. Also Zulassungswahrscheinlichkeit nahezu 100%- Und diese Zulassung wird Exelixis das Überleben garantieren!! ...zumal Cobimetinib einEckpfeiler im Onkologie-Portfolio von Roche darstellt.
Die grosse Unbekannte ist jedoch Cabozantinib...falls METEOR die Erwartungen erfüllt und primäre und sekundäre Endpunkte mit statistischer Signifikanz erreicht werden, dannsehen wir "double digits"...
Unser Glück wird sein, dass Roche mit im Boot sitzt. Die werden bestimmt drauf achten, dass nichts vergessen wird. Da haben sie mM viel Erfahrung. In ein paar Wochen wissen wir mehr  UP
UP
 UP
UP
Antwort auf Beitrag Nr.: 49.403.036 von Cyberhexe am 24.03.15 00:50:23"Was meinst du mit Marginalie? Und wofür soll das 50:50 gemeint sein?"
Mit 50:50 meine ich einen Erfolg von METEOR.
Die Zulassungswahrscheinlichkeit von Cobi würde ich bei 90% sehen. Allerdings ist Cobi im Vergleich zu Cabo kommerziell eine Marginalie und Cobi allein wird meiner Meinung nach ahrscheinlich nicht reichen, um EXEL zu retten.
Mit 50:50 meine ich einen Erfolg von METEOR.
Die Zulassungswahrscheinlichkeit von Cobi würde ich bei 90% sehen. Allerdings ist Cobi im Vergleich zu Cabo kommerziell eine Marginalie und Cobi allein wird meiner Meinung nach ahrscheinlich nicht reichen, um EXEL zu retten.
Antwort auf Beitrag Nr.: 49.403.480 von SLGramann am 24.03.15 08:05:47Mit 50:50 meine ich einen Erfolg von METEOR.
Die Zulassungswahrscheinlichkeit von Cobi würde ich bei 90% sehen. Allerdings ist Cobi im Vergleich zu Cabo kommerziell eine Marginalie und Cobi allein wird meiner Meinung nach ahrscheinlich nicht reichen, um EXEL zu retten.
Cobimetinib ist im Onkologie-Portfolio von Roche/Genentech ein Eckpfeiler, da diesem Wirkstoff auch eine Verzögerung des Therapieversagen bei anderen Wirkstoffen nachgesagt wird und deswegen mit vielen anderen Wirkstoffen getestet werden kann/soll: zB mit Paclitaxel bei TNBC (dreifach negativem Brustkrebs) oder mit dem immunologisch wirksamen Antikörper von Roche/Genentech MPDL3280A (anti-PDL1) --> "A Phase 1b Study of MPDL3280A (an Engineered Anti-PDL1 Antibody) in Combination With Cobimetinib in Patients With Locally Advanced or Metastatic Solid Tumors " etc.
Cobimetinib könnte im besten Fall ein Megablockbuster abgeben, den Roche/Genentech sicherlich nicht zur Hälfte mit Exelixis teilen würde. Allerdings ist das Zukunftsmusik. Real ist jedoch die Kombitherapie von Zelboraf (vemurafenib) und Cotellic (cobimetinib) zur Behandlung von metastasierendem Hautkrebs. Für diese Indikation dürfte jedoch auch relativ schnell ein Umsatz von 500 m USD/a erreicht werden, so dass für Cobi immervhin ca. 100 mUSD/a zur Verfügung stehen sollten. Mit dieser Summe kann man die Geschäftstätigkeit finanzieren.
Positiv stimmt mich zudem, dass EXEL die Urheberrechte über Patente sichert. Und diese Liste ist beeindruckend:
http://worldwide.espacenet.com/searchResults?ST=singleline&l…
Die Zulassungswahrscheinlichkeit von Cobi würde ich bei 90% sehen. Allerdings ist Cobi im Vergleich zu Cabo kommerziell eine Marginalie und Cobi allein wird meiner Meinung nach ahrscheinlich nicht reichen, um EXEL zu retten.
Cobimetinib ist im Onkologie-Portfolio von Roche/Genentech ein Eckpfeiler, da diesem Wirkstoff auch eine Verzögerung des Therapieversagen bei anderen Wirkstoffen nachgesagt wird und deswegen mit vielen anderen Wirkstoffen getestet werden kann/soll: zB mit Paclitaxel bei TNBC (dreifach negativem Brustkrebs) oder mit dem immunologisch wirksamen Antikörper von Roche/Genentech MPDL3280A (anti-PDL1) --> "A Phase 1b Study of MPDL3280A (an Engineered Anti-PDL1 Antibody) in Combination With Cobimetinib in Patients With Locally Advanced or Metastatic Solid Tumors " etc.
Cobimetinib könnte im besten Fall ein Megablockbuster abgeben, den Roche/Genentech sicherlich nicht zur Hälfte mit Exelixis teilen würde. Allerdings ist das Zukunftsmusik. Real ist jedoch die Kombitherapie von Zelboraf (vemurafenib) und Cotellic (cobimetinib) zur Behandlung von metastasierendem Hautkrebs. Für diese Indikation dürfte jedoch auch relativ schnell ein Umsatz von 500 m USD/a erreicht werden, so dass für Cobi immervhin ca. 100 mUSD/a zur Verfügung stehen sollten. Mit dieser Summe kann man die Geschäftstätigkeit finanzieren.
Positiv stimmt mich zudem, dass EXEL die Urheberrechte über Patente sichert. Und diese Liste ist beeindruckend:
http://worldwide.espacenet.com/searchResults?ST=singleline&l…
Antwort auf Beitrag Nr.: 49.403.753 von Cyberhexe am 24.03.15 08:40:25"..so dass für Cobi immervhin ca. 100 mUSD/a zur Verfügung stehen sollten. Mit dieser Summe kann man die Geschäftstätigkeit finanzieren."
soll natürlich heissen:
...so dass für Exelixis immervhin ca. 100 mUSD/a zur Verfügung stehen sollten. Mit dieser Summe kann man die Geschäftstätigkeit finanzieren.
Die Verträge zw. Roche/Genentech und Exelixis über Cobimetinib sind zweigeteilt:
in den USA hat EXEL ein nahezu gleichberechtigtes Co-Vermarktungsrecht, und ausserhalb der USA werden zweistellige (d.h. > 10%) Lizenzzahlungen fällig auf den Umsatz.
Exelixis is entitled to an initial equal share of U.S. profits and losses, which will decrease as sales increase, and will share equally in the U.S. marketing and commercialization costs. Exelixis is eligible to receive royalties on any sales of the product outside the United States. In November 2013, Exelixis exercised its option under the co-development agreement to provide up to 25% of the total sales force in the United States, should cobimetinib be approved.
soll natürlich heissen:
...so dass für Exelixis immervhin ca. 100 mUSD/a zur Verfügung stehen sollten. Mit dieser Summe kann man die Geschäftstätigkeit finanzieren.
Die Verträge zw. Roche/Genentech und Exelixis über Cobimetinib sind zweigeteilt:
in den USA hat EXEL ein nahezu gleichberechtigtes Co-Vermarktungsrecht, und ausserhalb der USA werden zweistellige (d.h. > 10%) Lizenzzahlungen fällig auf den Umsatz.
Exelixis is entitled to an initial equal share of U.S. profits and losses, which will decrease as sales increase, and will share equally in the U.S. marketing and commercialization costs. Exelixis is eligible to receive royalties on any sales of the product outside the United States. In November 2013, Exelixis exercised its option under the co-development agreement to provide up to 25% of the total sales force in the United States, should cobimetinib be approved.
Antwort auf Beitrag Nr.: 49.401.008 von Cyberhexe am 23.03.15 19:12:09
Hallo Hexe
DIE FRAGE, die sich mir hier stellt!!
in welchem Zeitraum diese Katalysatoren für den Kurs relevant sein könnten!
was meinst Du, wann könnten die nächsten Ergebnisse zu Primary and Secondary Endpoint
METEOR aufschlagen?
falls das zeitlich vor den vermeintlich schon sicheren gute News zu Punkt 2.) und 3.) ist, dann wären diese wirklich nur noch marginal für den Kurs.
d.h. METEOR pos. -->Kurs double digits, wie du schreibst
METEOR neg. -->Kursdesaster (1 -1,5 USD) und gute News interessieren erst mal keine S. mehr
mehr
falls aber Ergebnisse zu Primary and Secondary Endpoint
METEOR erst danach kämen, also nach den guten News im Juni, kann man auf einen stetigen Anstieg bis dahin spekulieren.
LG S.
Zitat von Cyberhexe: Die kommenden Wochen/Monate werden spannend für Exelixis und deren Aktionäre, da einige Kurs beeinflussende Ergebnisse anstehen:
1.) die Entblindung der ph3-Studie METEOR = Pivotal-Studie --> Cabozantinib zur Behandlung non metastasierendem Nierenzellkarzinom
METEOR is an open-label, event-driven trial with the primary endpoint of progression-free survival (PFS).
Based on available clinical trial data, the primary endpoint of METEOR assumes a median PFS of 5 months for the everolimus arm and 7.5 months for the cabozantinib arm. The trial protocol specifies that the primary analysis will be conducted on the first 375 patients enrolled, and will be triggered after at least 259 events occur, providing 90% power to detect a hazard ratio (HR) of 0.67. Enrollment of the first 375 patients was completed in June 2014.
Secondary endpoints for METEOR include overall survival and objective response rate. The secondary endpoint assumes a median OS of 15 months for the everolimus arm and 20 months for the cabozantinib arm. The study was designed to observe 408 deaths in the entire intention-to-treat population, providing 80% power to detect a HR of 0.75.
2.) Zulassungsentscheidung der FDA zur Behandlaung von metastasierendem Hautkrebs mit der Kombination aus Vemurafenib (brand name: Zelboraf) und Cobimetinib (Cotellic): Zulassungswahrscheinlichkeit > 90%; Zulassungsentscheidung sehr wahrscheinlich im Juni 2015 (Antrag eingereicht im Dezember 2014 -> fast track, dh beschleunigte Bearbeitung durch die FDA wurde gewährt)
3.) Zulassungsentscheidung der EMA zur Behandlaung von metastasierendem Hautkrebs mit der Kombination aus Vemurafenib (brand name: Zelboraf) und Cobimetinib (Cotellic); Zulassungswahrscheinlichkeit > 90%; Zulassungsentscheidung im Herbst 2015 (Antrag eingereicht im September 2014)
Da die Zulassungsantraege von Genentech bzw. Roche eingereicht wurden, ist bei 2 und 3 wohl nicht mit Überraschungen zu rechnen, d.h. die Kombitherapie wird wohl von beiden Arzneimittelbehörden zugelassen, so dass diese noch in 2015 am Markt eingeführt werden sollte.
Ein grosses Fragezeicvhen steht hinter METEOR. Sollten die Endpunkte erreicht werden, dann dürften einstellige Kurse der Vergangenheit angehören.
Hallo Hexe
DIE FRAGE, die sich mir hier stellt!!
in welchem Zeitraum diese Katalysatoren für den Kurs relevant sein könnten!
was meinst Du, wann könnten die nächsten Ergebnisse zu Primary and Secondary Endpoint
METEOR aufschlagen?
falls das zeitlich vor den vermeintlich schon sicheren gute News zu Punkt 2.) und 3.) ist, dann wären diese wirklich nur noch marginal für den Kurs.
d.h. METEOR pos. -->Kurs double digits, wie du schreibst
METEOR neg. -->Kursdesaster (1 -1,5 USD) und gute News interessieren erst mal keine S.
 mehr
mehr falls aber Ergebnisse zu Primary and Secondary Endpoint
METEOR erst danach kämen, also nach den guten News im Juni, kann man auf einen stetigen Anstieg bis dahin spekulieren.
LG S.
Antwort auf Beitrag Nr.: 49.404.152 von Schaeffi am 24.03.15 09:13:27METEOR-Ergebnisse werden in q2/2015 erwartet
Die Zulassung der Kombitherapie in den US of A ist im allerbesten Fall im Mai 2015 möglich (noch früher kann ich mir bei der FDA nicht vorstellen) - ich rechne allerdings mit Juni/Juli 2015; die EMA benötigt erfahrungsgemäss mehr Zeit, weil nach 180 Tagen die Behörde noch eine Liste (LoOI = List of outstanding issues) mit Fragen verschickt, deren Beantwortung mehr manchmal weniger Zeit in Anspruch nimmt. Ich erwarte die Zulassung in Europa im Herbst 2015 - vielleicht September, könnte aber auch länger dauern.
Wenn METEOR negativ ist, dann stürzt der Kurs von EXELIXIS auf unter 1 USD. Daran wird sich wohl eine erneute Restrukturierung anschliessen, bei der die Geschäftstätigkeit gegen Null gefahren wird. Die beiden Zulassungen würden den Kurs wieder steigen lassen, bevor Roche dann wohl endgültig das Unternehmen schlucken würde.
Die Zulassung der Kombitherapie in den US of A ist im allerbesten Fall im Mai 2015 möglich (noch früher kann ich mir bei der FDA nicht vorstellen) - ich rechne allerdings mit Juni/Juli 2015; die EMA benötigt erfahrungsgemäss mehr Zeit, weil nach 180 Tagen die Behörde noch eine Liste (LoOI = List of outstanding issues) mit Fragen verschickt, deren Beantwortung mehr manchmal weniger Zeit in Anspruch nimmt. Ich erwarte die Zulassung in Europa im Herbst 2015 - vielleicht September, könnte aber auch länger dauern.
Wenn METEOR negativ ist, dann stürzt der Kurs von EXELIXIS auf unter 1 USD. Daran wird sich wohl eine erneute Restrukturierung anschliessen, bei der die Geschäftstätigkeit gegen Null gefahren wird. Die beiden Zulassungen würden den Kurs wieder steigen lassen, bevor Roche dann wohl endgültig das Unternehmen schlucken würde.
Antwort auf Beitrag Nr.: 49.404.380 von Cyberhexe am 24.03.15 09:27:20Dem stimme ich weitgehend zu.
Die METEOR-Ergebnisse erwarte ich konkret im Mai. Dafür gibt es natürlich keine Garantie, aber Mai ist schon ziemlich wahrscheinlich.
Cobi-Zulassung wahrscheinlich danach - Juni/Juli ist sicher realistisch.
Bei METEOR-Fail sehe ich ebenfalls Kurse von 1 Dollar und weniger. Bei wirklich überzeugenden METEOR-Daten könnte es relativ zügig Richtung 10 Dollar gehen.
Bei Cobis bitte beachten, dass man gegen etablierte Konkurrenz mit gleichem Wirkprinzip anzutreten hat.
Die Kombi-Geschichten wie PD1 sind wirklich Zukunftsmusik. Mega-Blockbuster erscheint mir aber in jedem Fall als sehr unwahrscheinlich.
Ich will nur, dass sich hier jeder auch über die sehr hohen Risiken im Klaren ist. Viel mehr als ne Sportwette ist EXEL derzeit nicht wirklich.
Die METEOR-Ergebnisse erwarte ich konkret im Mai. Dafür gibt es natürlich keine Garantie, aber Mai ist schon ziemlich wahrscheinlich.
Cobi-Zulassung wahrscheinlich danach - Juni/Juli ist sicher realistisch.
Bei METEOR-Fail sehe ich ebenfalls Kurse von 1 Dollar und weniger. Bei wirklich überzeugenden METEOR-Daten könnte es relativ zügig Richtung 10 Dollar gehen.
Bei Cobis bitte beachten, dass man gegen etablierte Konkurrenz mit gleichem Wirkprinzip anzutreten hat.
Die Kombi-Geschichten wie PD1 sind wirklich Zukunftsmusik. Mega-Blockbuster erscheint mir aber in jedem Fall als sehr unwahrscheinlich.
Ich will nur, dass sich hier jeder auch über die sehr hohen Risiken im Klaren ist. Viel mehr als ne Sportwette ist EXEL derzeit nicht wirklich.
Antwort auf Beitrag Nr.: 49.405.145 von SLGramann am 24.03.15 10:34:46auf das Risiko wurde bereits mehrfach hingewiesen, dass der Kurs auf < 1 USD abstürzen würde, falls die Endpunkte in METEOR nicht erreicht werden.
Hinsichtlich Cobimetinib wäre anzumerken, dass die Kombitherapie von gsk (trametinib --> Mekinist™ and dabrafenib --> Tafinlar™) zur Behandlung von "metastaic melanoma" bei ähnlichem ein etwas ungünstigeres Nebenwirkungsprofil ergeben hat, so dass Roche/Genentech diesen kleinen Vorteil sicherlich optimal in Szene setzen werden. Die Konkurrenz der immuniologisch wirksamen neu zugelassenen Wirkstoffe ist sicherlich zu beachten, aber cobimetinib/vemurafenib wird sicherlich 1/3 bis 1/4 des Potenzials für sich in Anspruch nehmen. Die prognostizoerten Umsatzerlöse in Höhe von 500m bis 600m USD/a dürften realistisch sein. PDL1 ist sicherlich Zukunftsmusik, hat aber bereits von der FDA des Status einer "Breakthrough Therapy" erworben und wird bei Roche/Genentech zur Behandlung von "Locally Advanced or Metastatic Solid Tumors" bereits in der Klinik getestet. Falls sich die Theorie der Verzögerung des Therapieversagens bei Cobi erhärtet, dann ist der Megablockbuster gar nicht so unwahrscheinlich. Oder hast du andere Informationen?
Hinsichtlich Cobimetinib wäre anzumerken, dass die Kombitherapie von gsk (trametinib --> Mekinist™ and dabrafenib --> Tafinlar™) zur Behandlung von "metastaic melanoma" bei ähnlichem ein etwas ungünstigeres Nebenwirkungsprofil ergeben hat, so dass Roche/Genentech diesen kleinen Vorteil sicherlich optimal in Szene setzen werden. Die Konkurrenz der immuniologisch wirksamen neu zugelassenen Wirkstoffe ist sicherlich zu beachten, aber cobimetinib/vemurafenib wird sicherlich 1/3 bis 1/4 des Potenzials für sich in Anspruch nehmen. Die prognostizoerten Umsatzerlöse in Höhe von 500m bis 600m USD/a dürften realistisch sein. PDL1 ist sicherlich Zukunftsmusik, hat aber bereits von der FDA des Status einer "Breakthrough Therapy" erworben und wird bei Roche/Genentech zur Behandlung von "Locally Advanced or Metastatic Solid Tumors" bereits in der Klinik getestet. Falls sich die Theorie der Verzögerung des Therapieversagens bei Cobi erhärtet, dann ist der Megablockbuster gar nicht so unwahrscheinlich. Oder hast du andere Informationen?
hi leute
ich möchte hier investieren..... kurse zu einem euro???
ist die wahrscheinlichkeit so groß das die daten negativ sind??
ich reskiere es trotzdem, wie ist euer bauchgefühl??
schönen abend
ich möchte hier investieren..... kurse zu einem euro???
ist die wahrscheinlichkeit so groß das die daten negativ sind??
ich reskiere es trotzdem, wie ist euer bauchgefühl??
schönen abend
Lese Dir die letzten Beiträge durch...dann siehst Du die Chancen und Risiken. Bei 1€ würde ich dann aber nicht mehr einsteigen. Dann gab es negative News. Aber es kann auch UP gehen  Auf jeden Fall brauchst Du hier starke Nerven
Auf jeden Fall brauchst Du hier starke Nerven  Viel Erfolg! UP
Viel Erfolg! UP
 Auf jeden Fall brauchst Du hier starke Nerven
Auf jeden Fall brauchst Du hier starke Nerven  Viel Erfolg! UP
Viel Erfolg! UP
Antwort auf Beitrag Nr.: 49.433.405 von nicotoll9 am 26.03.15 18:52:44Anbei das Ergebnis der Phase 2-Studie von Cabozantinib bei Nierenkrebs:
Phase 2:
Cabozantinib as a novel therapy for renal cell carcinoma.
Vaishampayan U1.
Author information
Abstract
Cabozantinib/XL184 (Exelexis, Inc.) has demonstrated remarkable responses in kidney cancer. Preclinical results revealed VEGF, KIT and MET inhibition in a variety of solid tumors such as thyroid, ovarian, renal, lung, liver and prostate cancers. A phase II trial demonstrated efficacy in renal cancer with a 28 % objective response rate, stable disease rate of 62 % and median progression free survival of 14.7 months. Predominant toxicities of fatigue and diarrhea were noted. Dramatic responses in bone metastases (three of four patients) make the agent especially valuable for palliation in a disease, where presence of bone metastases is a predictor of worse survival. Cabozantinib is an emerging novel agent with promising activity in advanced kidney cancer. Randomized trials are planned in comparison with standard VEGF inhibitor therapy. Defining the role of MET overexpression would help patient selection and enrich and enhance the future evaluation of this targeted novel agent.
...und nachfolgend das Design von METEOR (ph3-Studie zur Behandlung von RCC (Renal Cell Cancer) mit cabo:
Exelixis Initiates Phase 3 Pivotal Trial of Cabozantinib in Patients With Metastatic Renal Cell Carcinoma
SOUTH SAN FRANCISCO, Calif.--(BUSINESS WIRE)--May. 31, 2013-- Exelixis, Inc. (NASDAQ:EXEL) today announced it has initiated METEOR, a phase 3 pivotal trial comparing cabozantinib to everolimus in patients with metastatic renal cell carcinoma (mRCC) who have experienced disease progression following treatment with at least one prior VEGFR tyrosine kinase inhibitor (TKI). The primary endpoint for the trial is progression-free survival.
The primary endpoint is progression-free survival (PFS) and the secondary endpoint is overall survival (OS). Exploratory endpoints include patient-reported outcomes, biomarkers, safety, and pharmacokinetics. PFS is an established acceptable endpoint for RCC clinical trials and has been used to support approval of sorafenib, sunitinib, everolimus, axitinib, and pazopanib in this indication.
Based on available clinical trial data, the primary endpoint assumes a median PFS of 5 months for the everolimus arm and 7.5 months for cabozantinib arm. This provides for a hazard ratio (HR) of 0.67 and 90% power and requires 259 PFS events among the first 375 patients randomized. The secondary endpoint assumes a median OS of 15 months for the everolimus arm and 20 months for the cabozantinib arm. This provides for a HR of 0.75 and 80% power and requires 413 events.
Phase 2:
Cabozantinib as a novel therapy for renal cell carcinoma.
Vaishampayan U1.
Author information
Abstract
Cabozantinib/XL184 (Exelexis, Inc.) has demonstrated remarkable responses in kidney cancer. Preclinical results revealed VEGF, KIT and MET inhibition in a variety of solid tumors such as thyroid, ovarian, renal, lung, liver and prostate cancers. A phase II trial demonstrated efficacy in renal cancer with a 28 % objective response rate, stable disease rate of 62 % and median progression free survival of 14.7 months. Predominant toxicities of fatigue and diarrhea were noted. Dramatic responses in bone metastases (three of four patients) make the agent especially valuable for palliation in a disease, where presence of bone metastases is a predictor of worse survival. Cabozantinib is an emerging novel agent with promising activity in advanced kidney cancer. Randomized trials are planned in comparison with standard VEGF inhibitor therapy. Defining the role of MET overexpression would help patient selection and enrich and enhance the future evaluation of this targeted novel agent.
...und nachfolgend das Design von METEOR (ph3-Studie zur Behandlung von RCC (Renal Cell Cancer) mit cabo:
Exelixis Initiates Phase 3 Pivotal Trial of Cabozantinib in Patients With Metastatic Renal Cell Carcinoma
SOUTH SAN FRANCISCO, Calif.--(BUSINESS WIRE)--May. 31, 2013-- Exelixis, Inc. (NASDAQ:EXEL) today announced it has initiated METEOR, a phase 3 pivotal trial comparing cabozantinib to everolimus in patients with metastatic renal cell carcinoma (mRCC) who have experienced disease progression following treatment with at least one prior VEGFR tyrosine kinase inhibitor (TKI). The primary endpoint for the trial is progression-free survival.
The primary endpoint is progression-free survival (PFS) and the secondary endpoint is overall survival (OS). Exploratory endpoints include patient-reported outcomes, biomarkers, safety, and pharmacokinetics. PFS is an established acceptable endpoint for RCC clinical trials and has been used to support approval of sorafenib, sunitinib, everolimus, axitinib, and pazopanib in this indication.
Based on available clinical trial data, the primary endpoint assumes a median PFS of 5 months for the everolimus arm and 7.5 months for cabozantinib arm. This provides for a hazard ratio (HR) of 0.67 and 90% power and requires 259 PFS events among the first 375 patients randomized. The secondary endpoint assumes a median OS of 15 months for the everolimus arm and 20 months for the cabozantinib arm. This provides for a HR of 0.75 and 80% power and requires 413 events.
Auf den ersten Blick erscheint es zwingend, dass der primäre Endpunkt bei METEOR erreicht wird, zumal die Studie einen Vorteil beim progressionsfreien Überleben von "nur" 2.5 Monaten als primären Endpunkt nachzuweisen hat - 7.5 Monate anstatt 5 Monate unter everolimus. Die Dauer von 5 Monaten bei everolimus bezieht sich auf eine ph3-Studie gegenüber Placebo:
Phase 3 trial of everolimus for metastatic renal cell carcinoma : final results and analysis of prognostic factors.
RESULTS:
The median PFS was 4.9 months (everolimus) versus 1.9 months (placebo) (hazard ratio [HR], 0.33; P < .001) by independent central review and 5.5 months (everolimus) versus 1.9 months (placebo) (HR, 0.32; P < .001) by investigators.The median OS was 14.8 months (everolimus) versus 14.4 months (placebo) (HR, 0.87; P = .162), with 80% of patients in the placebo arm crossed over to everolimus.
Studiendesign von METEOR:
http://ir.exelixis.com/phoenix.zhtml?c=120923&p=irol-newsArt…
Based on available clinical trial data, the primary endpoint of METEOR assumes a median PFS of 5 months for the everolimus arm and 7.5 months for the cabozantinib arm. The trial protocol specifies that the primary analysis will be conducted on the first 375 patients enrolled, and will be triggered after at least 259 events occur, providing 90% power to detect a hazard ratio (HR) of 0.67. Enrollment of the first 375 patients was completed in June 2014.
In Phase 2 war der Vorteil beim progressionsfreien Überleben 14.7 Monate, so dass man meinen müsste METEOR sei ein Selbstläufer und die anvisierten 7.5 Monate mit Leichtigkeit zu erreichen sein:
Cabozantinib Demonstrates Encouraging Activity in Patients with Heavily Pretreated Metastatic Renal Cell Carcinoma
Median Overall Survival Not Yet Reached After Median Follow-up of 14.7 Months
SOUTH SAN FRANCISCO, Calif.--(BUSINESS WIRE)--Jun. 2, 2012
Progression-Free Survival, Overall Survival, and Treatment Duration. Kaplan Meier estimate of median progression-free survival (PFS) is 14.7 months (95% CI, lower limit 7.3 months – upper limit not reached). Median overall survival (OS) has not yet been reached after median follow-up of 14.7 months. The estimated 1-year survival rate is 60%. Seven patients remain on study and progression free with treatment durations ranging up to 21.8+ months.
Aber ACHTUNG! Bei Arzneimittelstudien ist es üblicherweise ein stabiler Trend, dass ph2-Ergebnisse in den mächtigeren ph3-Studien weniger positiv ausfallen und die Ergebnisse in ph2 lediglich annähernd bestätigt werden. Positiv ist sicherlich, dass das progressionsfreie Überleben und nicht das Gesamtüberleben als primärer Endpunkt gewählt wurde, da selbst bei den weniger erfolgreichen COMET-Studien bei CRPC (Castration resistant Prostata Carcinom) beim PFS ein Vorteil gezeigt wurde. Also ich bin vorsichtig optimistisch.
Phase 3 trial of everolimus for metastatic renal cell carcinoma : final results and analysis of prognostic factors.
RESULTS:
The median PFS was 4.9 months (everolimus) versus 1.9 months (placebo) (hazard ratio [HR], 0.33; P < .001) by independent central review and 5.5 months (everolimus) versus 1.9 months (placebo) (HR, 0.32; P < .001) by investigators.The median OS was 14.8 months (everolimus) versus 14.4 months (placebo) (HR, 0.87; P = .162), with 80% of patients in the placebo arm crossed over to everolimus.
Studiendesign von METEOR:
http://ir.exelixis.com/phoenix.zhtml?c=120923&p=irol-newsArt…
Based on available clinical trial data, the primary endpoint of METEOR assumes a median PFS of 5 months for the everolimus arm and 7.5 months for the cabozantinib arm. The trial protocol specifies that the primary analysis will be conducted on the first 375 patients enrolled, and will be triggered after at least 259 events occur, providing 90% power to detect a hazard ratio (HR) of 0.67. Enrollment of the first 375 patients was completed in June 2014.
In Phase 2 war der Vorteil beim progressionsfreien Überleben 14.7 Monate, so dass man meinen müsste METEOR sei ein Selbstläufer und die anvisierten 7.5 Monate mit Leichtigkeit zu erreichen sein:
Cabozantinib Demonstrates Encouraging Activity in Patients with Heavily Pretreated Metastatic Renal Cell Carcinoma
Median Overall Survival Not Yet Reached After Median Follow-up of 14.7 Months
SOUTH SAN FRANCISCO, Calif.--(BUSINESS WIRE)--Jun. 2, 2012
Progression-Free Survival, Overall Survival, and Treatment Duration. Kaplan Meier estimate of median progression-free survival (PFS) is 14.7 months (95% CI, lower limit 7.3 months – upper limit not reached). Median overall survival (OS) has not yet been reached after median follow-up of 14.7 months. The estimated 1-year survival rate is 60%. Seven patients remain on study and progression free with treatment durations ranging up to 21.8+ months.
Aber ACHTUNG! Bei Arzneimittelstudien ist es üblicherweise ein stabiler Trend, dass ph2-Ergebnisse in den mächtigeren ph3-Studien weniger positiv ausfallen und die Ergebnisse in ph2 lediglich annähernd bestätigt werden. Positiv ist sicherlich, dass das progressionsfreie Überleben und nicht das Gesamtüberleben als primärer Endpunkt gewählt wurde, da selbst bei den weniger erfolgreichen COMET-Studien bei CRPC (Castration resistant Prostata Carcinom) beim PFS ein Vorteil gezeigt wurde. Also ich bin vorsichtig optimistisch.
3 (Rough) Dates Exelixis Shareholders Need to Know
Artikel von Sean Williams auf Investopedia:
http://www.investopedia.com/stock-analysis/033015/3-rough-da…
Artikel von Sean Williams auf Investopedia:
http://www.investopedia.com/stock-analysis/033015/3-rough-da…
Cobimetinib ist ein Eckpfeiler im Onkologie-Portfolio von Roche/Genentech und wird in vielen klinischen Studien eingesetzt. Falls cobi auf das Therapieversagen von Wirkstoffen tatsächlich einen verzögernden Einfluss hat, dann ist Megablockbuster-Potenzial nicht ausgeschlossen.
Anbei die aktuellen Studien mit cobimetinib:, wobei deren Anzahl stetig zunimmt:
A Study of MEHD7945A and Cobimetinib (GDC-0973) in Patients With Locally Advanced or Metastatic Cancers With Mutant KRAS (NCT01986166);
A Phase 1b Study of MPDL3280A (an Engineered Anti-PDL1 Antibody) in Combination With Cobimetinib in Patients With Locally Advanced or Metastatic Solid Tumors (NCT01988896);
Trial of Vemurafenib/Cobimetinib With or Without Bevacizumab in Patients With Stage IV BRAF V600 Mutant Melanoma (NCT01495988)
A Phase 1b Study of MPDL3280A (an Engineered Anti-PDL1 Antibody) in Combination With Vemurafenib (Zelboraf®) or Vemurafenib Plus Cobimetinib in Patients With Previously Untreated BRAF V600-Mutation Positive Metastatic Melanoma (NCT01656642)
A Study of Cobimetinib in Combination With Paclitaxel as First-line Treatment for Patients With Metastatic Triple-negative Breast Cancer (NCT02322814)
A Study of Neo-adjuvant Use of Vemurafenib Plus Cobimetinib for BRAF Mutant Melanoma With Palpable Lymph Node Metastases (NCT02036086)
A Phase II Study of Cobimetinib in Combination with Vemurafenib in Active Melanoma Brain Metastases (CoBRIM-B) (NCT02230306)
Neoadjuvant Vemurafenib + Cobimetinib in Melanoma: NEO-VC (NCT02303951)
Under the terms of our co-development agreement with Genentech for cobimetinib, we are entitled to an initial equal share of U.S. profits and losses for cobimetinib, with our share decreasing as sales increase, and we will share equally in the U.S. marketing and commercialization costs. The profit share has multiple tiers: we are entitled to 50% of profits from the first $200 million of U.S. actual sales, decreasing to 30% of profits from U.S. actual sales in excess of $400 million. We are entitled to low double-digit royalties on ex-U.S. net sales. In November 2013, we exercised an option under the co-development agreement to co-promote in the United States. As a result of exercising our option to co-promote, we may provide up to 25% of the total sales force for cobimetinib in the United States if commercialized, and will call on customers and otherwise engage in promotional activities using that sales force, consistent with the terms of the co-development agreement and a co-promotion agreement to be entered into by the parties.
Anbei die aktuellen Studien mit cobimetinib:, wobei deren Anzahl stetig zunimmt:
A Study of MEHD7945A and Cobimetinib (GDC-0973) in Patients With Locally Advanced or Metastatic Cancers With Mutant KRAS (NCT01986166);
A Phase 1b Study of MPDL3280A (an Engineered Anti-PDL1 Antibody) in Combination With Cobimetinib in Patients With Locally Advanced or Metastatic Solid Tumors (NCT01988896);
Trial of Vemurafenib/Cobimetinib With or Without Bevacizumab in Patients With Stage IV BRAF V600 Mutant Melanoma (NCT01495988)
A Phase 1b Study of MPDL3280A (an Engineered Anti-PDL1 Antibody) in Combination With Vemurafenib (Zelboraf®) or Vemurafenib Plus Cobimetinib in Patients With Previously Untreated BRAF V600-Mutation Positive Metastatic Melanoma (NCT01656642)
A Study of Cobimetinib in Combination With Paclitaxel as First-line Treatment for Patients With Metastatic Triple-negative Breast Cancer (NCT02322814)
A Study of Neo-adjuvant Use of Vemurafenib Plus Cobimetinib for BRAF Mutant Melanoma With Palpable Lymph Node Metastases (NCT02036086)
A Phase II Study of Cobimetinib in Combination with Vemurafenib in Active Melanoma Brain Metastases (CoBRIM-B) (NCT02230306)
Neoadjuvant Vemurafenib + Cobimetinib in Melanoma: NEO-VC (NCT02303951)
Under the terms of our co-development agreement with Genentech for cobimetinib, we are entitled to an initial equal share of U.S. profits and losses for cobimetinib, with our share decreasing as sales increase, and we will share equally in the U.S. marketing and commercialization costs. The profit share has multiple tiers: we are entitled to 50% of profits from the first $200 million of U.S. actual sales, decreasing to 30% of profits from U.S. actual sales in excess of $400 million. We are entitled to low double-digit royalties on ex-U.S. net sales. In November 2013, we exercised an option under the co-development agreement to co-promote in the United States. As a result of exercising our option to co-promote, we may provide up to 25% of the total sales force for cobimetinib in the United States if commercialized, and will call on customers and otherwise engage in promotional activities using that sales force, consistent with the terms of the co-development agreement and a co-promotion agreement to be entered into by the parties.
Cobimetinib
Der Zulassungsantrag für Cobimetinib/Vemurafenib zur Behandlung von "metastatic melanoma" (metastasierender Hautkrebs) wurde im Dezember 2014 bei der FDA eingereicht und von dieser akzeptiert und für vollständig empfunden. Ausserdem wurde eine beschleunigte Bearbeitung zugesagt (FDA Grants Priority Review) und eine Entscheidung auf spätestens 11.8.2015 angekündigt (Assigns Action Date of August 11, 2015). Ich erwarte jedoch, dass die Arzneimittelbehörde bereits früher ihre Entscheidung bekanntgibt, da der Nutzen gegenüber der bereits zugelassenen Monotherapie mit vemurafenib unbestritten ist: "The median PFS was 9.9 months for the combination of cobimetinib and vemurafenib versus 6.2 months for vemurafenib alone (hazard ratio [HR] = 0.51, 95 percent CI 0.39-0.68; p < 0.0001)."Ich tippe mal auf Juli, wobei ich insgeheim natürlich auf eine noch frühere Bekanntgabe der Zulassungsentscheidung hoffe. Die Entscheidung selbst kann eigentlich nur positiv sein, da Roche/Genentech erfahren genug sind, so dass weder formale noch inhaltliche Mängel eine Rückweisung verursachen sollten.
COTELLIC
es scheint so, dass der "brand name" von cobimetinib bereits feststeht: COTELLIChttps://nyemetoder.no/metoder/cobimetinib-cotellic
interessanter Beitrag im Journal "Cancer Research"
Cabozantinib wirksam bei der Behandlung von gastrointestinalem Stromatumor - allerdings nur in-vitro Nachweis; dennoch nährt auch dies die Hoffnung, dass bei METEOR ein positiver Effekt (bei PFS = Progression Free Survival, also progressionsfreies Überleben gegenüber SOC [standard of care] = everolimus) bei der Behandlung von metastasiertem Nierenzellkarzinom mit statistischer Signifikanz nachgewiesen wird.Everolimus wurde für die Second-line-Therapie beim metastasierten Nierenzellkarzinom zugelassen, hat daneben inzwischen aber auch die Zulassung, für die Behandlung des mit der Tuberösen Sklerose assoziierten subependymalen Riesenzellastrozytoms und für die Behandlung von fortgeschrittenen oder metastasierten neuroendokrinen Pankreastumoren] erhalten.
Cancer Res. 2015 Apr 2. pii: canres.2564.2014. [Epub ahead of print]
Pharmacological inhibition of KIT activates MET signaling in gastrointestinal stromal tumors.
Cohen NA1, Zeng S2, Seifert AM2, Kim TS1, Sorenson EC2, Greer JB3, Beckman MJ3, Santamaria-Barria JA1, Crawley MH1, Green BL1, Rossi F4, Besmer P4, Antonescu CR5, DeMatteo RP6.
Author information
Abstract
Gastrointestinal stromal tumors (GIST) are the most common adult sarcomas and the oncogenic driver is usually a KIT or PDGFRA mutation. While GIST are often initially sensitive to imatinib or other tyrosine kinase inhibitors, resistance generally develops necessitating backup strategies for therapy. In this study, we determined that a subset of human GIST specimens that acquired imatinib resistance acquired expression of activated forms of the MET oncogene. MET activation also developed after imatinib therapy in a mouse model of GIST (KitV558del/+ mice), where it was associated with increased tumor hypoxia. MET activation also occurred in imatinib-sensitive human GIST cell lines after imatinib treatment in vitro. MET inhibition by crizotinib or RNA interference was cytotoxic to an imatinib-resistant human GIST cell population. Moreover, combining crizotinib and imatinib was more effective than imatinib alone in imatinib-sensitive GIST models. Lastly, cabozantinib,a dual MET and KIT small molecule inhibitor, was markedly more effective than imatinib in multiple preclinical models of imatinib-sensitive and imatinib-resistant GIST. Collectively, our findings showed that activation of compensatory MET signaling by KIT inhibition may contribute to tumor resistance. Furthermore, our work offered a preclinical proof of concept for MET inhibition by cabozantinib as an effective strategy for GIST treatment.
Mal schauen, ob es heute weiter in Richtung 3$ geht...Es bleibt spannend  UP
UP
 UP
UP
Exelixis’ Cabozantinib Granted Fast Track Designation by FDA For Advanced Renal Cell Carcinoma
http://www.exelixis.com/investors-media/press-releases
3.30 im PRE ! ! !
http://www.exelixis.com/investors-media/press-releases
3.30 im PRE ! ! !
Da ist ja die 3 vorm Komma  Weiter geht's! UP
Weiter geht's! UP
 Weiter geht's! UP
Weiter geht's! UP
Antwort auf Beitrag Nr.: 49.526.435 von TwoPack am 09.04.15 14:57:58Anbei die Voraussetzungen, dass "Fast Track" gewährt wird sowie die daraus abgeleiteten Erleichterungen beim Zulassungsprozess. Sehr wahrscheinlich wird wohl Punkt 1.)...
"Showing superior effectiveness, effect on serious outcomes or improved effect on serious outcomes"
...den Ausschlag dafür gegeben hat, dass die Behörde (FDA) der Vergabe von "Fast Track" zugestimmt hat. Insofern rechnet auch die FDA damit, dass bei der Zweitlinienbehandlung von RCC (Renal Cell Carcinoma) mit cabozantinib eine besseres Behandlungsergebnis als unter Standardbehandlung (everolimus) zu erzielen ist. Mit allergrösster Wahrscheinlichkeit sind jedoch die METEOR-Daten nicht bekannt und werden diese Entscheidung auch nicht beeinflusst haben. Fast Track ist wohl ausschliesslich auf die viel versprechenden ph2-Ergebnisse zurückzuführen (median PFS = 14.7 months).
Fast Track
Fast track is a process designed to facilitate the development, and expedite the review of drugs to treat serious conditions and fill an unmet medical need. The purpose is to get important new drugs to the patient earlier. Fast Track addresses a broad range of serious conditions.
Determining whether a condition is serious is a matter of judgment, but generally is based on whether the drug will have an impact on such factors as survival, day-to-day functioning, or the likelihood that the condition, if left untreated, will progress from a less severe condition to a more serious one. AIDS, Alzheimer’s, heart failure and cancer are obvious examples of serious conditions. However, diseases such as epilepsy, depression and diabetes are also considered to be serious conditions.
Filling an unmet medical need is defined as providing a therapy where none exists or providing a therapy which may be potentially better than available therapy.
Any drug being developed to treat or prevent a condition with no current therapy obviously is directed at an unmet need. If there are available therapies, a fast track drug must show some advantage over available therapy, such as:
1.) Showing superior effectiveness, effect on serious outcomes or improved effect on serious outcomes
2.) Avoiding serious side effects of an available therapy
3.) Improving the diagnosis of a serious condition where early diagnosis results in an improved outcome
4.) Decreasing a clinical significant toxicity of an available therapy that is common and causes discontinuation of treatment
5.) Ability to address emerging or anticipated public health need
A drug that receives Fast Track designation is eligible for some or all of the following:
More frequent meetings with FDA to discuss the drug's development plan and ensure collection of appropriate data needed to support drug approval
More frequent written communication from FDA about such things as the design of the proposed clinical trials and use of biomarkers
Eligibility for Accelerated Approval and Priority Review, if relevant criteria are met
Rolling Review, which means that a drug company can submit completed sections of its Biologic License Application (BLA) or New Drug Application (NDA) for review by FDA, rather than waiting until every section of the NDA is completed before the entire application can be reviewed. BLA or NDA review usually does not begin until the drug company has submitted the entire application to the FDA
Fast Track designation must be requested by the drug company. The request can be initiated at any time during the drug development process. FDA will review the request and make a decision within sixty days based on whether the drug fills an unmet medical need in a serious condition.
Once a drug receives Fast Track designation, early and frequent communication between the FDA and a drug company is encouraged throughout the entire drug development and review process. The frequency of communication assures that questions and issues are resolved quickly, often leading to earlier drug approval and access by patients.
http://www.fda.gov/ForPatients/Approvals/Fast/ucm405399.htm
"Showing superior effectiveness, effect on serious outcomes or improved effect on serious outcomes"
...den Ausschlag dafür gegeben hat, dass die Behörde (FDA) der Vergabe von "Fast Track" zugestimmt hat. Insofern rechnet auch die FDA damit, dass bei der Zweitlinienbehandlung von RCC (Renal Cell Carcinoma) mit cabozantinib eine besseres Behandlungsergebnis als unter Standardbehandlung (everolimus) zu erzielen ist. Mit allergrösster Wahrscheinlichkeit sind jedoch die METEOR-Daten nicht bekannt und werden diese Entscheidung auch nicht beeinflusst haben. Fast Track ist wohl ausschliesslich auf die viel versprechenden ph2-Ergebnisse zurückzuführen (median PFS = 14.7 months).
Fast Track
Fast track is a process designed to facilitate the development, and expedite the review of drugs to treat serious conditions and fill an unmet medical need. The purpose is to get important new drugs to the patient earlier. Fast Track addresses a broad range of serious conditions.
Determining whether a condition is serious is a matter of judgment, but generally is based on whether the drug will have an impact on such factors as survival, day-to-day functioning, or the likelihood that the condition, if left untreated, will progress from a less severe condition to a more serious one. AIDS, Alzheimer’s, heart failure and cancer are obvious examples of serious conditions. However, diseases such as epilepsy, depression and diabetes are also considered to be serious conditions.
Filling an unmet medical need is defined as providing a therapy where none exists or providing a therapy which may be potentially better than available therapy.
Any drug being developed to treat or prevent a condition with no current therapy obviously is directed at an unmet need. If there are available therapies, a fast track drug must show some advantage over available therapy, such as:
1.) Showing superior effectiveness, effect on serious outcomes or improved effect on serious outcomes
2.) Avoiding serious side effects of an available therapy
3.) Improving the diagnosis of a serious condition where early diagnosis results in an improved outcome
4.) Decreasing a clinical significant toxicity of an available therapy that is common and causes discontinuation of treatment
5.) Ability to address emerging or anticipated public health need
A drug that receives Fast Track designation is eligible for some or all of the following:
More frequent meetings with FDA to discuss the drug's development plan and ensure collection of appropriate data needed to support drug approval
More frequent written communication from FDA about such things as the design of the proposed clinical trials and use of biomarkers
Eligibility for Accelerated Approval and Priority Review, if relevant criteria are met
Rolling Review, which means that a drug company can submit completed sections of its Biologic License Application (BLA) or New Drug Application (NDA) for review by FDA, rather than waiting until every section of the NDA is completed before the entire application can be reviewed. BLA or NDA review usually does not begin until the drug company has submitted the entire application to the FDA
Fast Track designation must be requested by the drug company. The request can be initiated at any time during the drug development process. FDA will review the request and make a decision within sixty days based on whether the drug fills an unmet medical need in a serious condition.
Once a drug receives Fast Track designation, early and frequent communication between the FDA and a drug company is encouraged throughout the entire drug development and review process. The frequency of communication assures that questions and issues are resolved quickly, often leading to earlier drug approval and access by patients.
http://www.fda.gov/ForPatients/Approvals/Fast/ucm405399.htm
Antwort auf Beitrag Nr.: 49.531.886 von Cyberhexe am 10.04.15 07:44:42Median PFS war in der finalen Analyse dann doch "nur noch" 12.8 Monate. Die 14,7 Monate schwirren wie man sieht aber immer noch rum.
Die Daten von METEOR werden zum singulären Event für die Firma. Make or break, da man schon negative im net cash ist und auch das geliehene Geld rapide zu neige geht. Da hilft auch cobimetinib, dessen Zulassung für mich so gut wie sicher ist, nicht.
Ich bin sehr gespannt.
Es bestehen wie immer gewisse Risiken, da oftmals das Vergleichsprodukt (hier Everolimus) besser abschneidet oder die open label Phase II Ergebnisse nicht bestätigt werden können.
Die Daten von METEOR werden zum singulären Event für die Firma. Make or break, da man schon negative im net cash ist und auch das geliehene Geld rapide zu neige geht. Da hilft auch cobimetinib, dessen Zulassung für mich so gut wie sicher ist, nicht.
Ich bin sehr gespannt.
Es bestehen wie immer gewisse Risiken, da oftmals das Vergleichsprodukt (hier Everolimus) besser abschneidet oder die open label Phase II Ergebnisse nicht bestätigt werden können.
Antwort auf Beitrag Nr.: 49.638.839 von Ville7 am 24.04.15 17:24:48Weitere Unsicherheit ist, dass die Phase II Ergebnisse mit der 140mg Dosis erreicht wurden und die METEOR Studie mit nur 60mg arbeitet.
Laut Unternehmen war in der Phase II aber nach Dosisreduzierungen die durchschnittliche Dosis bei 75mg, somit weit näher an den 60mg. Aber das kann entscheidend für die Wirksamkeit sein.
Laut Unternehmen war in der Phase II aber nach Dosisreduzierungen die durchschnittliche Dosis bei 75mg, somit weit näher an den 60mg. Aber das kann entscheidend für die Wirksamkeit sein.
Antwort auf Beitrag Nr.: 49.638.890 von Ville7 am 24.04.15 17:29:52
hast Du 'nen Link zum Nachlesen?
Zitat von Ville7: Weitere Unsicherheit ist, dass die Phase II Ergebnisse mit der 140mg Dosis erreicht wurden und die METEOR Studie mit nur 60mg arbeitet.
Laut Unternehmen war in der Phase II aber nach Dosisreduzierungen die durchschnittliche Dosis bei 75mg, somit weit näher an den 60mg. Aber das kann entscheidend für die Wirksamkeit sein.
hast Du 'nen Link zum Nachlesen?
Senior Clinical Scientist Cobimetinib
http://www.roche.com/careers/jobs/jobsearch/job.htm?id=G-004…Roche suchteinen Senior Clinical Scientist für Cobimetinib. Die US-Zulassung dürfte wohl in wenigen Wochen nicht Monate erteilt werden. Wahrscheinlich dauerts in Europa wieder mal etwas länger.
Senior Clinical Scientist Cobimetinib
http://www.roche.com/careers/jobs/jobsearch/job.htm?id=G-004…Roche sucht einen Senior Clinical Scientist für Cobimetinib. Die US-Zulassung dürfte wohl in wenigen Wochen nicht Monate erteilt werden. Wahrscheinlich dauerts in Europa wieder mal etwas länger.
Antwort auf Beitrag Nr.: 49.639.454 von riverstar_de am 24.04.15 18:47:24Ein Link reicht da nicht. Da ist umfassende Recherche nötig. Sorry. Als einstiegspunkt kannst ja die Earning-Call Transkripte der letzten Quartale nehmen. Und darauf die eigene Due Diligence aufbauen.
Vorsicht: Exelixis ist extremes high risk!
Vorsicht: Exelixis ist extremes high risk!
Antwort auf Beitrag Nr.: 49.654.928 von Ville7 am 27.04.15 19:53:07Exelixis ist Biotech pur, die Zulassung unter Federführung von Roche fast sicher, kommen jetzt noch positive Phase III Ergebnisse für die Nierenkrebsindikation dann sind zweistellige Kurse sehr realistisch, nach unten sehe ich durch die wahrscheinliche Zulassung mit Roche ca. 50 % Kursverlustgefahr!
Das Upside-Potential ist höher als das Downsidepotential, Daumen drücken!
Das Upside-Potential ist höher als das Downsidepotential, Daumen drücken!
Antwort auf Beitrag Nr.: 49.662.444 von Magnetfeldfredy am 28.04.15 15:18:45"Exelixis ist Biotech pur"
sowohl cobimetinib als auch cabozantinib sind "kleine Moleküle" (small molecules) und auch bei den Kandidaten in früher Phase gibt es keinen Antikörper bzw. biotechnologisch generiertes Molekül.
Also nicht "Biotech pur" sondern "von Biotech keine Spur" würde eher passen!
sowohl cobimetinib als auch cabozantinib sind "kleine Moleküle" (small molecules) und auch bei den Kandidaten in früher Phase gibt es keinen Antikörper bzw. biotechnologisch generiertes Molekül.
Also nicht "Biotech pur" sondern "von Biotech keine Spur" würde eher passen!
Danke für die Aufklärung!
Antwort auf Beitrag Nr.: 49.662.444 von Magnetfeldfredy am 28.04.15 15:18:45
ville hatte ja sehr schön ausgeführt, warum es ggf. sehr wohl floppen könnte. SLGramann hatte das auch eher als Sportwette bezeichnet. Klar zocken kann man immer, aber Chance ist wohl doch eher gering.
Zitat von Magnetfeldfredy: Exelixis ist Biotech pur, die Zulassung unter Federführung von Roche fast sicher, kommen jetzt noch positive Phase III Ergebnisse für die Nierenkrebsindikation dann sind zweistellige Kurse sehr realistisch, nach unten sehe ich durch die wahrscheinliche Zulassung mit Roche ca. 50 % Kursverlustgefahr!
Das Upside-Potential ist höher als das Downsidepotential, Daumen drücken!
ville hatte ja sehr schön ausgeführt, warum es ggf. sehr wohl floppen könnte. SLGramann hatte das auch eher als Sportwette bezeichnet. Klar zocken kann man immer, aber Chance ist wohl doch eher gering.
Antwort auf Beitrag Nr.: 49.672.248 von riverstar_de am 29.04.15 15:23:40Die Chance ist doch eher wohl gering, weil Du das sagst, so ein Schmarrn, schau Dir mal die Phase II Ergebnisse an!
Die Chancen stehen genau bei 50%, nicht mehr und nicht weniger!
Es gibt 2 gewichtige Gründe in Exelixis zu investieren, die da heiseen Cobimetinib & Cabozantinib. Hierzu ein paar Informationen:
Cabozantinib (brand name Cometriq)
1.) bereits zugelassen in US und EU zur Behandlung des medullären
Schilddrüsenkarzinoms bei erwachsenen Patienten mit progredienter,
nicht resektabler, lokal fortgeschrittener oder metastasierter
Erkrankung; Umsatzpotenzial (peak sales) ca. 100 mUSD/y
2.) die Entblindung der ph3-Studie METEOR = Pivotal-Studie --> Cabozantinib zur Behandlung non metastasierendem Nierenzellkarzinom steht unmittelbar bevor; Ergebnisbekanntgabe angekündigt auf 2q2015
METEOR is an open-label, event-driven trial with the primary endpoint of progression-free survival (PFS).
Based on available clinical trial data, the primary endpoint of METEOR assumes a median PFS of 5 months for the everolimus arm and 7.5 months for the cabozantinib arm. The trial protocol specifies that the primary analysis will be conducted on the first 375 patients enrolled, and will be triggered after at least 259 events occur, providing 90% power to detect a hazard ratio (HR) of 0.67. Enrollment of the first 375 patients was completed in June 2014.
3.) die Entblindung der ph3-Studie CELESTIAL = Pivotal-Studie --> Study of Cabozantinib (XL184) vs Placebo in Subjects With Hepatocellular Carcinoma Who Have Received Prior Sorafenib, angekündigt auf 2017
4.) insgesamt 64 klinische Studien von Cabozantinib, überwiegend finanziert von NonProfitOrganisations wie zB:
- Sponsor: University of Alabama at Birmingham
- Sponsor: John Strickler, M.D.
- Sponsor: M.D. Anderson Cancer Center
- Sponsor: Massachusetts General Hospital
- Sponsor: National Cancer Institute (NCI)
und viele mehr
https://clinicaltrials.gov/ct2/results?term=cabozantinib&Sea…
Diese Sponsoren scheinen an den Erfolg von Cabozantinib zu glauben, da andernfalls nicht derat viele Studien fremdfinanziert würden.
Cobimetinib
Der Zulassungsantrag für Cobimetinib/Vemurafenib zur Behandlung von "metastatic melanoma" (metastasierender Hautkrebs) wurde im Dezember 2014 bei der FDA eingereicht und von dieser akzeptiert und für vollständig empfunden. Ausserdem wurde eine beschleunigte Bearbeitung zugesagt (FDA Grants Priority Review) und eine Entscheidung auf spätestens 11.8.2015 angekündigt (Assigns Action Date of August 11, 2015). Ich erwarte jedoch, dass die Arzneimittelbehörde bereits früher ihre Entscheidung bekanntgibt, da der Nutzen gegenüber der bereits zugelassenen Monotherapie mit vemurafenib unbestritten ist: "The median PFS was 9.9 months for the combination of cobimetinib and vemurafenib versus 6.2 months for vemurafenib alone (hazard ratio [HR] = 0.51, 95 percent CI 0.39-0.68; p < 0.0001)."
Ich tippe mal auf Juli, wobei ich insgeheim natürlich auf eine noch frühere Bekanntgabe der Zulassungsentscheidung hoffe. Die Entscheidung selbst kann eigentlich nur positiv sein, da Roche/Genentech erfahren genug sind, so dass weder formale noch inhaltliche Mängel eine Rückweisung verursachen sollten.
Cobimetionib ist ein Eckpfeiler im Onkolgie-Portfolio von Roche/Genentech und zwar in folgender Hinsicht:
Cobi wird "verdächtigt" auf das Therapieversagen von anderen Wirkstoffen einen verzögernden Einfluss zu haben. Falls sich diese These bestätigt, scheint Megablockbuster-Potenzial nicht ausgeschlossen.
Cobi wird zusammen mit paclitaxel in einer ph2-Studie zur Behandlung von TNBC (triple negative breast cancer) getestet
cobi wird zusammen mit dem immunologisch wirkenden MPDL3280A (an Engineered Anti-PDL1 Antibody) gegen verschieden Krebsformen getestet
cobi MEHD7945A, a biotherapeutic targeting EGFR and HER3
Cabozantinib (brand name Cometriq)
1.) bereits zugelassen in US und EU zur Behandlung des medullären
Schilddrüsenkarzinoms bei erwachsenen Patienten mit progredienter,
nicht resektabler, lokal fortgeschrittener oder metastasierter
Erkrankung; Umsatzpotenzial (peak sales) ca. 100 mUSD/y
2.) die Entblindung der ph3-Studie METEOR = Pivotal-Studie --> Cabozantinib zur Behandlung non metastasierendem Nierenzellkarzinom steht unmittelbar bevor; Ergebnisbekanntgabe angekündigt auf 2q2015
METEOR is an open-label, event-driven trial with the primary endpoint of progression-free survival (PFS).
Based on available clinical trial data, the primary endpoint of METEOR assumes a median PFS of 5 months for the everolimus arm and 7.5 months for the cabozantinib arm. The trial protocol specifies that the primary analysis will be conducted on the first 375 patients enrolled, and will be triggered after at least 259 events occur, providing 90% power to detect a hazard ratio (HR) of 0.67. Enrollment of the first 375 patients was completed in June 2014.
3.) die Entblindung der ph3-Studie CELESTIAL = Pivotal-Studie --> Study of Cabozantinib (XL184) vs Placebo in Subjects With Hepatocellular Carcinoma Who Have Received Prior Sorafenib, angekündigt auf 2017
4.) insgesamt 64 klinische Studien von Cabozantinib, überwiegend finanziert von NonProfitOrganisations wie zB:
- Sponsor: University of Alabama at Birmingham
- Sponsor: John Strickler, M.D.
- Sponsor: M.D. Anderson Cancer Center
- Sponsor: Massachusetts General Hospital
- Sponsor: National Cancer Institute (NCI)
und viele mehr
https://clinicaltrials.gov/ct2/results?term=cabozantinib&Sea…
Diese Sponsoren scheinen an den Erfolg von Cabozantinib zu glauben, da andernfalls nicht derat viele Studien fremdfinanziert würden.
Cobimetinib
Der Zulassungsantrag für Cobimetinib/Vemurafenib zur Behandlung von "metastatic melanoma" (metastasierender Hautkrebs) wurde im Dezember 2014 bei der FDA eingereicht und von dieser akzeptiert und für vollständig empfunden. Ausserdem wurde eine beschleunigte Bearbeitung zugesagt (FDA Grants Priority Review) und eine Entscheidung auf spätestens 11.8.2015 angekündigt (Assigns Action Date of August 11, 2015). Ich erwarte jedoch, dass die Arzneimittelbehörde bereits früher ihre Entscheidung bekanntgibt, da der Nutzen gegenüber der bereits zugelassenen Monotherapie mit vemurafenib unbestritten ist: "The median PFS was 9.9 months for the combination of cobimetinib and vemurafenib versus 6.2 months for vemurafenib alone (hazard ratio [HR] = 0.51, 95 percent CI 0.39-0.68; p < 0.0001)."
Ich tippe mal auf Juli, wobei ich insgeheim natürlich auf eine noch frühere Bekanntgabe der Zulassungsentscheidung hoffe. Die Entscheidung selbst kann eigentlich nur positiv sein, da Roche/Genentech erfahren genug sind, so dass weder formale noch inhaltliche Mängel eine Rückweisung verursachen sollten.
Cobimetionib ist ein Eckpfeiler im Onkolgie-Portfolio von Roche/Genentech und zwar in folgender Hinsicht:
Cobi wird "verdächtigt" auf das Therapieversagen von anderen Wirkstoffen einen verzögernden Einfluss zu haben. Falls sich diese These bestätigt, scheint Megablockbuster-Potenzial nicht ausgeschlossen.
Cobi wird zusammen mit paclitaxel in einer ph2-Studie zur Behandlung von TNBC (triple negative breast cancer) getestet
cobi wird zusammen mit dem immunologisch wirkenden MPDL3280A (an Engineered Anti-PDL1 Antibody) gegen verschieden Krebsformen getestet
cobi MEHD7945A, a biotherapeutic targeting EGFR and HER3
Antwort auf Beitrag Nr.: 49.674.852 von Magnetfeldfredy am 29.04.15 18:50:09
Die Chancen stehen genau bei 50%, nicht mehr und nicht weniger!
Hi Freddy
wir kommst du auf diese Prognose?
Die Chancen stehen genau bei 50%, nicht mehr und nicht weniger!
Hi Freddy
wir kommst du auf diese Prognose?
KRAS-Associated Thymoma And Thymic Carcinoma Clinical Trials
NCT01988896 Phase I A Phase 1b Study of MPDL3280A (an Engineered Anti-PDL1 Antibody) in Combination With Cobimetinib in Patients With Locally Advanced or Metastatic Solid Tumors
NCT01986166 Phase I A Study of MEHD7945A and Cobimetinib (GDC-0973) in Patients With Locally Advanced or Metastatic Cancers With Mutant KRAS
NCT01988896 Phase I A Phase 1b Study of MPDL3280A (an Engineered Anti-PDL1 Antibody) in Combination With Cobimetinib in Patients With Locally Advanced or Metastatic Solid Tumors
NCT01986166 Phase I A Study of MEHD7945A and Cobimetinib (GDC-0973) in Patients With Locally Advanced or Metastatic Cancers With Mutant KRAS
Antwort auf Beitrag Nr.: 49.676.859 von Cyberhexe am 29.04.15 22:11:59Fortsetzung "Es gibt 2 gewichtige Gründe in Exelixis zu investieren, die da heiseen Cobimetinib & Cabozantinib"
darüber hinaus hat Exelixis viele Patente und damit verbundene Urheberrechte gesichert:
US --> http://patft.uspto.gov/netacgi/nph-Parser?Sect1=PTO2&Sect2=H…
Results of Search in US Patent Collection db for:
AN/Exelixis: 132 patents.
Results of Search in PGPUB Production Database March 15th - September 30th 2001 for:
AN/Exelixis: 171 applications.
Hits 1 through 50 out of 171
http://appft.uspto.gov/netacgi/nph-Parser?Sect1=PTO2&Sect2=H…
weltweit --> http://worldwide.espacenet.com/searchResults?ST=singleline&l…
Approximately 1,672 results found in the Worldwide database for:
ia = Exelixis using Smart search
Only the first 500 results are displayed.
darüber hinaus hat Exelixis viele Patente und damit verbundene Urheberrechte gesichert:
US --> http://patft.uspto.gov/netacgi/nph-Parser?Sect1=PTO2&Sect2=H…
Results of Search in US Patent Collection db for:
AN/Exelixis: 132 patents.
Results of Search in PGPUB Production Database March 15th - September 30th 2001 for:
AN/Exelixis: 171 applications.
Hits 1 through 50 out of 171
http://appft.uspto.gov/netacgi/nph-Parser?Sect1=PTO2&Sect2=H…
weltweit --> http://worldwide.espacenet.com/searchResults?ST=singleline&l…
Approximately 1,672 results found in the Worldwide database for:
ia = Exelixis using Smart search
Only the first 500 results are displayed.
Antwort auf Beitrag Nr.: 49.676.904 von Cyberhexe am 29.04.15 22:14:41Servus Hexe,
Du bist fachlich super drauf, Hut ab!
Ich sehe einfach die Chance von 50 %, meets primary endpoint or not!
Außerdem bei den vielen Trials, der bestehenden Zulassung für Schilddrüsenkrebs, der zu erwartenden Zulassung von Roche sehe ich keinen Totalausfall!
LG
Fredy
Du bist fachlich super drauf, Hut ab!
Ich sehe einfach die Chance von 50 %, meets primary endpoint or not!
Außerdem bei den vielen Trials, der bestehenden Zulassung für Schilddrüsenkrebs, der zu erwartenden Zulassung von Roche sehe ich keinen Totalausfall!
LG
Fredy
analysis based on past data
The median patient of the 375 patients was enrolled in april 2014, the last patient in june 2014. Means 12 months and 10 months from now.Data from the everolimus p3 indicates a 4,9 month overall survival. This phase 3 further showed that after 10months 25% had not progressed and after 12months 10% had not progressed.
Cabozantinib phase 2 showed a 12.8 months pfs. Let's assume this 12.8 months doesn't hold up because a phase 2 often overestimates PFS and let's calculate with 11 months.
Lets calculate based on the past data and this assumption how many patients progressed assuming something around little over 11 months.
How many progressed so far: everolimus 155+cabozantinib 94 = 249. Very close to the target.
But caution,everolimus could have done much better and cabozantinib much worse. We just have to wait.
-----
ich übersetze meinen eigenen text fürs yahoo board bezüglich METEOR jetzt nicht - was man aus der Berechnung sieht ist, dass der verlauf bisher eigentlich sehr in line mit den Erwartungen aus den Daten der beiden vergangenen trials ist.
Gestern im Q1 CC wurde bestätigt, dass der 259. Patient noch nicht progressed ist, man aber ganz kurz davor steht.
Aber Vorsicht, man weiß wie es mit den COMETs gelaufen ist, wo der Plazebo sehr viel besser war. Andererseits gibt es einen entscheidenden Unterschied zu den COMETs. Bei COMET flossen auch nachfolgende Behandlungen (und da gibts in MRPC echt gute!) mit in die Berechnung des dortigen OS Endpunkts. Beim Endpunkt PFS spielen diese eigentlich keine Rolle, da nur bis zur Progression gemessen wird und danacherst das nächste Medikament kommt.
Von daher rechne ich mit einer Chance 60:40 für Cabozantinib. Wir werden es dann in den nächsten 1-3 Monaten sehen.
Für positive OS Daten bin ich hingegen nicht so optimistisch.
Antwort auf Beitrag Nr.: 49.689.096 von Ville7 am 01.05.15 12:23:44
ist 259 das zu erreichende Ziel?
Zitat von Ville7: The median patient of the 375 patients was enrolled in april 2014, the last patient in june 2014. Means 12 months and 10 months from now.
Data from the everolimus p3 indicates a 4,9 month overall survival. This phase 3 further showed that after 10months 25% had not progressed and after 12months 10% had not progressed.
Cabozantinib phase 2 showed a 12.8 months pfs. Let's assume this 12.8 months doesn't hold up because a phase 2 often overestimates PFS and let's calculate with 11 months.
Lets calculate based on the past data and this assumption how many patients progressed assuming something around little over 11 months.
How many progressed so far: everolimus 155+cabozantinib 94 = 249. Very close to the target.
But caution,everolimus could have done much better and cabozantinib much worse. We just have to wait.
-----
ich übersetze meinen eigenen text fürs yahoo board bezüglich METEOR jetzt nicht - was man aus der Berechnung sieht ist, dass der verlauf bisher eigentlich sehr in line mit den Erwartungen aus den Daten der beiden vergangenen trials ist.
Gestern im Q1 CC wurde bestätigt, dass der 259. Patient noch nicht progressed ist, man aber ganz kurz davor steht.
Aber Vorsicht, man weiß wie es mit den COMETs gelaufen ist, wo der Plazebo sehr viel besser war. Andererseits gibt es einen entscheidenden Unterschied zu den COMETs. Bei COMET flossen auch nachfolgende Behandlungen (und da gibts in MRPC echt gute!) mit in die Berechnung des dortigen OS Endpunkts. Beim Endpunkt PFS spielen diese eigentlich keine Rolle, da nur bis zur Progression gemessen wird und danacherst das nächste Medikament kommt.
Von daher rechne ich mit einer Chance 60:40 für Cabozantinib. Wir werden es dann in den nächsten 1-3 Monaten sehen.
Für positive OS Daten bin ich hingegen nicht so optimistisch.
ist 259 das zu erreichende Ziel?
Antwort auf Beitrag Nr.: 49.689.096 von Ville7 am 01.05.15 12:23:44Servus Ville,
gute Analyse von Dir, aber keiner weiß wirklich was!
Das Management handelt taktisch clever, evtl. bekommen wir schon die Zulassung in der Partnerschaft mit Roche/Genentech bevor wir erfahren ob die primary endpoints erreicht wurden, d.h. höher Kurse nach Zulassung bzw. weniger Crash nach Nichterreichen bzw. viel höhere Kurse nach Zulassung und "meets Primary endpoints"?
gute Analyse von Dir, aber keiner weiß wirklich was!
Das Management handelt taktisch clever, evtl. bekommen wir schon die Zulassung in der Partnerschaft mit Roche/Genentech bevor wir erfahren ob die primary endpoints erreicht wurden, d.h. höher Kurse nach Zulassung bzw. weniger Crash nach Nichterreichen bzw. viel höhere Kurse nach Zulassung und "meets Primary endpoints"?
Antwort auf Beitrag Nr.: 49.689.318 von riverstar_de am 01.05.15 13:08:32259 Patienten, deren Krankheit fortschreitet, triggern die PFS Analyse.
Antwort auf Beitrag Nr.: 49.689.372 von Magnetfeldfredy am 01.05.15 13:16:50Ja, jetzt gibt es Chancen, dass die Cobi Zulassung vor den Meteor Daten kommen.
Allerdings wage ich nicht zu beurteilen wie der Kurs sich im einen oder anderen Fall verhält.
Auch mit Cobi-Zulassung ist Exelixis ohne Cashinfusion über Q1 2016 hinaus nicht überlebensfähig und eine KE wäre fatal für die bisherigen Aktionäre.
Mit guten Meteor Daten sieht das natürlich ganz anders aus - hier braucht man dann auf jeden Fall genausoviel Geld, aber es wird dann eine Menge Geldgeber geben.
Allerdings wage ich nicht zu beurteilen wie der Kurs sich im einen oder anderen Fall verhält.
Auch mit Cobi-Zulassung ist Exelixis ohne Cashinfusion über Q1 2016 hinaus nicht überlebensfähig und eine KE wäre fatal für die bisherigen Aktionäre.
Mit guten Meteor Daten sieht das natürlich ganz anders aus - hier braucht man dann auf jeden Fall genausoviel Geld, aber es wird dann eine Menge Geldgeber geben.
Antwort auf Beitrag Nr.: 49.693.275 von Magnetfeldfredy am 02.05.15 09:37:46Stifel sieht in der Verschiebung der Daten weder ein positives noch ein negatives Zeichen. Auch aus meiner Erfahrung ist es ein gedanklicher Kurzschluss zu meinen, dass eine Verschiebung eines Trial-Ergebnisses auf gute Daten in verum-Gruppe schließen lässt. Kann sein, muss aber keineswegs sein.
Auch ansonsten ist Stifel skeptisch, vor allem aufgrund der finanziellen Verpflichtungen, die EXEL drücken:

Auch ansonsten ist Stifel skeptisch, vor allem aufgrund der finanziellen Verpflichtungen, die EXEL drücken:

Antwort auf Beitrag Nr.: 49.693.275 von Magnetfeldfredy am 02.05.15 09:37:46Stiefel ist einfach nur negativ auf Exelixis eingestellt, PFS wurde bei Schilddrüsenkrebs und Prostatakrebs erreicht, warum nicht diese als positive Beispiele anführen......
Antwort auf Beitrag Nr.: 49.695.639 von SLGramann am 02.05.15 21:45:28SLGraman, ich stimme dir zu, dass man aus einer Verzögerung nicht auf den Erfolg schließen sollte.
Aus verschiedenen möglichen Gründen:
1. Managament verzögert oft die Herausgabe von Daten (liegt hier aber, wenn Exelixis Managmenet nicht explizit gelogen hat, hier nicht vor, denn das Triggerevent des 259. progressierenden Patienten ist laut Q1 CC noch nicht erfolgt) oder
2. Everolimus wirkt weit besser und Cabozantinib weit schlechter als in früheren trials.
Während ich 1. ausschließe, aber 2. niemals ausschließen kann, kann ich sagen, dass auf Basis auch nur annähernder historischer Daten für Everolimus und der Stifel-Annahme, dass Nebenwirkungen von Cabozantinib die PFS Ergebnisse verhageln das Trigger-Event schon vor mehreren Monaten hätte erreicht sein müssen. Nehmen wir an, dass Everolimus 2 Monate besser wirkt (also 7 Monate PFS, das wären schon 40% besser als bei der damals nicht so kleinen Zulassungsstudie) und Cabozantinib auch nur 7 Monate medianes PFS liefert (das wären 50% schlechte als in Phase 2), dann müsste das Triggerevent im (Juni2017 + 7 Monate =) Januar 2015 spätestens erfolgt sein. Ist es aber nicht und wir befinden uns nochmal 4 Monate später. Wir wären nach aktueller Triggerinfo (noch nicht getriggert!) aktuell bei beiderseitigem medianem >10 Monats-PFS.
Die Stifel-These ist für mich daher unlogischer als meine eigene These, die ich zuvor dargelegt und auf deren mögliche Invalidität ich hingewiesen habe. Daher komme ich persönlich mit aller eigener Vorsicht auf eine 60:40 Chance und nicht auf nur 50:50. Aber das muss jeder mit sich selbst auskaspern. Mir ist Exelxis eine Spekulation wert, obwohl es auch im Gutfall mit großer Wahrscheinlichkeit eine Kapitalerhöhung und Verwässerung geben wird - neben der bereits drohenden massiven Verwässerung durch die aktuellen Warrants. Andererseits hat Exelixis auch vor, nur in USA selbst zu vermarkten und ein Deal+Upfront könnte Exelixis auf einen Schlag massiv entlasten.
Für mich ist das Glas etwas halbvoller als für andere... wir werden sehen!
Aus verschiedenen möglichen Gründen:
1. Managament verzögert oft die Herausgabe von Daten (liegt hier aber, wenn Exelixis Managmenet nicht explizit gelogen hat, hier nicht vor, denn das Triggerevent des 259. progressierenden Patienten ist laut Q1 CC noch nicht erfolgt) oder
2. Everolimus wirkt weit besser und Cabozantinib weit schlechter als in früheren trials.
Während ich 1. ausschließe, aber 2. niemals ausschließen kann, kann ich sagen, dass auf Basis auch nur annähernder historischer Daten für Everolimus und der Stifel-Annahme, dass Nebenwirkungen von Cabozantinib die PFS Ergebnisse verhageln das Trigger-Event schon vor mehreren Monaten hätte erreicht sein müssen. Nehmen wir an, dass Everolimus 2 Monate besser wirkt (also 7 Monate PFS, das wären schon 40% besser als bei der damals nicht so kleinen Zulassungsstudie) und Cabozantinib auch nur 7 Monate medianes PFS liefert (das wären 50% schlechte als in Phase 2), dann müsste das Triggerevent im (Juni2017 + 7 Monate =) Januar 2015 spätestens erfolgt sein. Ist es aber nicht und wir befinden uns nochmal 4 Monate später. Wir wären nach aktueller Triggerinfo (noch nicht getriggert!) aktuell bei beiderseitigem medianem >10 Monats-PFS.
Die Stifel-These ist für mich daher unlogischer als meine eigene These, die ich zuvor dargelegt und auf deren mögliche Invalidität ich hingewiesen habe. Daher komme ich persönlich mit aller eigener Vorsicht auf eine 60:40 Chance und nicht auf nur 50:50. Aber das muss jeder mit sich selbst auskaspern. Mir ist Exelxis eine Spekulation wert, obwohl es auch im Gutfall mit großer Wahrscheinlichkeit eine Kapitalerhöhung und Verwässerung geben wird - neben der bereits drohenden massiven Verwässerung durch die aktuellen Warrants. Andererseits hat Exelixis auch vor, nur in USA selbst zu vermarkten und ein Deal+Upfront könnte Exelixis auf einen Schlag massiv entlasten.
Für mich ist das Glas etwas halbvoller als für andere... wir werden sehen!
Antwort auf Beitrag Nr.: 49.702.806 von Ville7 am 04.05.15 13:42:27Da haben sich in das schnelle Posting wieder Fehler eingeschlichen, sollte z.B. Juni 2014 und nicht Juni 2017 heissen... wer noch mehr Schreibfehler findet darf sie behalten. 

Drug-Drug Interaction Potential of Cobimetinib
Use of Transgenic Mouse Models to Understand the Oral Disposition and Drug-Drug Interaction Potential of Cobimetinib, a MEK InhibitorAbstract
Data from the clinical absolute bioavailability (F) study with cobimetinib suggested that F was lower than predicted based on its low hepatic extraction and good absorption. The CYP3A4 transgenic (Tg) mouse model with differential expression of CYP3A4 in the liver (Cyp3a(-/-)Tg-3A4Hep) or intestine (Cyp3a(-/-)Tg-3A4Int) and both liver and intestine (Cyp3a(-/-)Tg-3A4Hep/Int) were used to study the contribution of intestinal metabolism to the F of cobimetinib. In addition, the effect of CYP3A4 inhibition and induction on cobimetinib exposures was tested in the Cyp3a(-/-)Tg-3A4Hep/Int and PXR-CAR-CYP3A4/CYP3A7 mouse models, respectively. After i.v. administration of 1 mg/kg cobimetinib to wild-type [(WT) FVB], Cyp3a(-/-)Tg-3A4Hep, Cyp3a(-/-)Tg-3A4Int, or Cyp3a(-/-)Tg-3A4Hep/Int mice, clearance (CL) (26-35 ml/min/kg) was similar in the CYP3A4 transgenic and WT mice. After oral administration of 5 mg/kg cobimetinib, the area under the curve (AUC) values of cobimetinib in WT, Cyp3a(-/-)Tg-3A4Hep, Cyp3a(-/-)Tg-3A4Int, or Cyp3a(-/-)Tg-3A4Hep/Int mice were 1.35, 3.39, 1.04, and 0.701 μM⋅h, respectively. The approximately 80% lower AUC of cobimetinib in transgenic mice when intestinal CYP3A4 was present suggested that the intestinal first pass contributed to the oral CL of cobimetinib. Oxidative metabolites observed in human circulation were also observed in the transgenic mice. In drug-drug interaction (DDI) studies using Cyp3a(-/-)Tg-3A4Hep/Int mice, 8- and 4-fold increases in oral and i.v. cobimetinib exposure, respectively, were observed with itraconazole co-administration. In PXR-CAR-CYP3A4/CYP3A7 mice, rifampin induction decreased cobimetinib oral exposure by approximately 80%. Collectively, these data support the conclusion that CYP3A4 intestinal metabolism contributes to the oral disposition of cobimetinib and suggest that under certain circumstances the transgenic model may be useful in predicting clinical DDIs.
http://www.ncbi.nlm.nih.gov/pubmed/25813936
Cabo at ASCO 2015
Saturday, May 30 | 8:00 AM - 11:30 AMBreast Cancer—Triple-Negative/Cytotoxics/Local Therapy
Session Type: Poster Session
Track(s): Breast Cancer
Presentation(s):
Abstract #1080
A Phase II study of cabozantinib for metastatic triple-negative breast cancer (TNBC).
Sara M. Tolaney, MD, MPH
Dana Farber Cancer Institute
Saturday, May 30 | 1:15 PM - 4:45 PM
Gynecologic Cancer
Session Type: Poster Session
Track(s): Gynecologic Cancer
Head and Neck Cancer
Session Type: Poster Session
Track(s): Head and Neck Cancer
Presentation(s):
Abstract #6012
Final overall survival analysis of EXAM, an international, double-blind, randomized, placebo-controlled phase III trial of cabozantinib (Cabo) in medullary thyroid carcinoma (MTC) patients with documented RECIST progression at baseline.
Martin Schlumberger, MD
Institut Gustave Roussy
Genitourinary (Prostate) Cancer
Session Type: Poster Session
Track(s): Genitourinary Cancer
Presentation(s):
Abstract #5037
Phase 1 study with expansion cohorts of cabozantinib (C) + abiraterone (A) in metastatic castration resistant prostate cancer (mCRPC): Investigator-sponsored study.
Christopher Sweeney, MBBS
Dana-Farber Cancer Institute
Sunday, May 31 | 8:00 AM - 11:00 AM
Lung Cancer—Non-Small Cell Metastatic
Session Type: Oral Abstract Session
Track(s): Lung Cancer
Presentation(s):
Abstract #8003
8:36 AM - 8:48 AM
Cabozantinib (C), erlotinib (E) or the combination (E+C) as second- or third-line therapy in patients with EGFR wild-type (wt) non-small cell lung cancer (NSCLC): A randomized phase 2 trial of the ECOG-ACRIN Cancer Research Group (E1512).
Joel W. Neal, MD/PhD
Stanford Cancer Institute/Stanford University School of Medicine
Abstract #8007
10:12 AM - 10:24 AM
Phase II study of cabozantinib for patients with advanced RET-rearranged lung cancers.
Alexander E. Drilon, MD
Memorial Sloan Kettering Cancer Center
Monday, Jun 1 | 8:00 AM - 11:30 AM
Lung Cancer—Non-Small Cell Metastatic
Session Type: Poster Session
Track(s): Lung Cancer
Monday, Jun 1 | 1:15 PM - 4:45 PM
Melanoma/Skin Cancers
Session Type: Poster Session
Track(s): Melanoma/Skin Cancers
Presentation(s):
Abstract #TPS9087
Randomized phase II study comparing the MET inhibitor cabozantinib to temozolomide (TMZ) or dacarbazine (DTIC) in ocular melanoma: A091201.
Jason John Luke, MD, FACP
University of Chicago
Cobi at ASCO 2015
Saturday, May 30 | 8:00 AM - 11:30 AMDevelopmental Therapeutics—Clinical Pharmacology and Experimental Therapeutics
Session Type: Poster Session
Track(s): Developmental Therapeutics and Translational Research
Presentation(s):
Abstract #2573
Population pharmacokinetics and dosing implications for cobimetinib in patients with solid tumors.
Kelong Han, PhD
Genentech, Inc.
Saturday, May 30 | 1:15 PM - 4:15 PM
Melanoma/Skin Cancers
Session Type: Oral Abstract Session
Track(s): Melanoma/Skin Cancers
Presentation(s):
Abstract #9006
3:15 PM - 3:27 PM
Update of progression-free survival (PFS) and correlative biomarker analysis from coBRIM: Phase III study of cobimetinib (cobi) plus vemurafenib (vem) in advanced BRAF-mutated melanoma.
James M. G. Larkin, MD, PhD
The Royal Marsden NHS Foundation Trust
Monday, Jun 1 | 1:15 PM - 4:45 PM
Melanoma/Skin Cancers
Session Type: Poster Session
Track(s): Melanoma/Skin Cancers
Presentation(s):
Abstract #9020
Extended follow-up results of phase Ib study (BRIM7) of vemurafenib (VEM) with cobimetinib (COBI) in BRAF-mutant melanoma.
Anna C. Pavlick, DO
New York University Cancer Center
Abstract #9021
Quality-of-life (QOL) assessment in patients (pts) with metastatic melanoma receiving vemurafenib (V) and cobimetinib (C).
Brigitte Dréno, MD, PhD
Nantes University
Abstract #9033
Clinical features of cobimetinib (COBI)–associated serous retinopathy (SR) in BRAF-mutated melanoma patients (pts) treated in the coBRIM study.
Luis De La Cruz-Merino, MD, PhD
Hospital Universitario Virgen Macarena
Abstract #TPS9088
Phase 2 study of cobimetinib in combination with vemurafenib in active melanoma brain metastases (coBRIM-B).
Melissa K. Yee, MD
University of Pittsburgh Cancer Institute
Exelixis bricht mit hohem Umsatz nach oben aus, news imminent?
Antwort auf Beitrag Nr.: 49.695.639 von SLGramann am 02.05.15 21:45:28
was ist das für eine Quelle, die Du da reingestellt hast?
Zitat von SLGramann: Stifel sieht in der Verschiebung der Daten weder ein positives noch ein negatives Zeichen. Auch aus meiner Erfahrung ist es ein gedanklicher Kurzschluss zu meinen, dass eine Verschiebung eines Trial-Ergebnisses auf gute Daten in verum-Gruppe schließen lässt. Kann sein, muss aber keineswegs sein.
Auch ansonsten ist Stifel skeptisch, vor allem aufgrund der finanziellen Verpflichtungen, die EXEL drücken:
was ist das für eine Quelle, die Du da reingestellt hast?
4 neue Stellen bei Roche/gene bzgl. Cobimetinib
Senior Medical Director - and 3 other new job opportunities reg Cobihttp://www.gene.com/careers/find-a-job?searchterms=cobimetin…
4 jobs match your search criteria:
Date Job Title Job Level Location
May 5, 2015 Senior Medical Director - Cobimetinib (Late Development Oncology)
Genentech is seeking a talented Medical Director who isenthusiastic about translating preclinical discoveries into developing the nextgeneration of cancer therapies. This individual will act as clinical leadfor trials that explore the potential of new therapeutics targeting keypathways that regulate growth and survival of cancer cells, particularlyinvolving the MAPK pathway. Given cobimetinib’s broad development plan (rangingfrom Phase 1b to phase 3 studies), this position provides a unique opportunityto gain exposure to all stages of clinical development in Oncology. Overtime, there will be opportunities to work on multiple agents with diverse mechanisms,and may involve collaborations with corporate development partners and otherDevelopment teams at Genentech. The Medical Director will act as theclinical representative to a number of cross-functional teams responsible forthe design, implementation, monitoring, analysis, and reporting of cobimetinib studies.They will also participate in developing the long-range strategic plans for cobimetiniband/or other molecules. Additional responsibilities may involve participationin clinical aspects of the Diagnostics program, interaction with Research, andassessment of in-licensing opportunities. Directline management experience is a plus.
Experienced South San Francisco , California Down arrow
May 5, 2015 Medical Director - Cobimetinib (Late Development Oncology)
Genentech is seeking a talented Medical Directorwho is enthusiastic about translating preclinical discoveries into developingthe next generation of cancer therapies. This individual will act asclinical lead for trials that explore the potential of new therapeutics targetingkey pathways that regulate growth and survival of cancer cells, particularlyinvolving the MAPK pathway. Given cobimetinib’s broad development plan (rangingfrom Phase 1b to phase 3 studies), this position provides a unique opportunityto gain exposure to all stages of clinical development in Oncology. Overtime, there will be opportunities to work on multiple agents with diverse mechanisms,and may involve collaborations with corporate development partners and otherDevelopment teams at Genentech. The Medical Director will act as theclinical representative to a number of cross-functional teams responsible forthe design, implementation, monitoring, analysis, and reporting of cobimetinib studies.They will also participate in developing the long-range strategic plans for cobimetiniband/or other molecules. Additional responsibilities may involve participationin clinical aspects of the Diagnostics program, interaction with Research, andassessment of in-licensing opportunities.
Experienced South San Francisco , California Down arrow
May 5, 2015 Senior Medical Director - Cobimetinib (Late Development Oncology)
Genentech is seeking a talented Medical Director who isenthusiastic about translating preclinical discoveries into developing the nextgeneration of cancer therapies. This individual will act as clinical leadfor trials that explore the potential of new therapeutics targeting keypathways that regulate growth and survival of cancer cells, particularlyinvolving the MAPK pathway. Given cobimetinib’s broad development plan (rangingfrom Phase 1b to phase 3 studies), this position provides a unique opportunityto gain exposure to all stages of clinical development in Oncology. Overtime, there will be opportunities to work on multiple agents with diverse mechanisms,and may involve collaborations with corporate development partners and otherDevelopment teams at Genentech. The Medical Director will act as theclinical representative to a number of cross-functional teams responsible forthe design, implementation, monitoring, analysis, and reporting of cobimetinib studies.They will also participate in developing the long-range strategic plans for cobimetiniband/or other molecules. Additional responsibilities may involve participationin clinical aspects of the Diagnostics program, interaction with Research, andassessment of in-licensing opportunities. Directline management experience is a plus.
Experienced South San Francisco , California Down arrow
Apr 24, 2015 Senior Clinical Scientist Cobimetinib (Late Development Oncology)
We are looking for a talented Clinical Scientist who is enthusiastic about translating preclinical discoveries into developing the next generation of cancer therapies. This individual will be focused on supporting clinical studies which explore the potential of new therapeutics which target key pathways that regulate growth and survival of cancer cells, particularly involving MAPK pathway. Given our program's broad development plan (which includes studies ranging from early Phase Ib and Phase II proof of concept studies through large Phase III registration studies) this position provides a unique opportunity to gain exposure to all stages of clinical development in Oncology.. Over time, there will be opportunities to work on multiple agents, with diverse mechanisms. Genentech is seeking Clinical Scientist, preferably with Oncology drug development and clinical trials experience, to participate in the exploratory clinical development of new agents for the treatment of cancer. The position will involve clinical trial development with novel anti-cancer agents within the Genentech portfolio. This program includes early proof of concept through registration studies in a variety of targets and may involve collaborations with corporate development partners and other Development teams at Genentech. The Clinical Scientist will support one or more cross-functional teams responsible for the design, implementation, monitoring, analysis, and reporting of studies conducted within the Cobimetinib program. Depending on the experience and ability of the individual, there may be the opportunities to participate in developing the long-range strategic plans for the molecule or molecules, participation in clinical aspects of the Diagnostics program, and interaction with Research scientists....
erlotinib/Roche
Erlotinib has still blockbuster status bec it has generated 295 mCHF in the 1st q/2015 with 2 approved indications:Indication and Use according to FDA PRESCRIBING INFORMATION for TARCEVA (generic name: erlotinib)
TARCEVA is a kinase inhibitor indicated for the treatment of:
• Locally advanced or metastatic non-small cell lung cancer (NSCLC)
after failure of at least one prior chemotherapy regimen. (1.1)
• First-line treatment of patients with locally advanced, unresectable or
metastatic pancreatic cancer, in combination with gemcitabine. (1.2)
In December 2014 very promising preliminary results regarding cabo resp. cabo/erlo vs. erlo had been published:
SOUTH SAN FRANCISCO, Calif.--(BUSINESS WIRE)--Nov. 4, 2014-- Exelixis, Inc. (NASDAQ:EXEL) today announced positive top-line results from a randomized phase 2 trial of cabozantinib and erlotinib alone or in combination as second- or third-line therapy in patients with stage IV EGFR wild-type non-small cell lung cancer (NSCLC). This trial (Study E1512) is sponsored by the U.S. National Cancer Institute (NCI) through a Cooperative Research and Development Agreement between the Cancer Therapy Evaluation Program (CTEP), Division of Cancer Treatment and Diagnosis, NCI and Exelixis. Study E1512 was designed and is being conducted by the ECOG-ACRIN Cancer Research Group as part of Exelixis’ collaboration with the NCI. Joel Neal, M.D., Ph.D., from ECOG-ACRIN member institution Stanford University/Stanford Cancer Institute, chairs the study.
In the E1512 trial, 125 patients were randomized to one of the three arms: erlotinib, cabozantinib, or the combination. During a pre-planned interim ECOG-ACRIN Data Safety Monitoring Committee analysis for futility, it was found that the trial met its primary endpoint of improving progression-free survival (PFS) with cabozantinib alone and also with the combination of cabozantinib plus erlotinib, as compared to erlotinib alone, and the results were highly statistically significant. Safety data were consistent with those observed in other trials of cabozantinib. At time of analysis, the median follow-up was 5.9 months and overall survival data were immature.
The results of the trial are the subject of ongoing analyses and will be submitted by the investigators for presentation at a future medical conference.
Now at ASCO 2015 the final results from this ph2 study will be given. If the test results are overwhelming it would be one reason more for the Basel headquarter of Roche to absorb the South City based company in the neighborhood of Genentech.
Abstract #8003
8:36 AM - 8:48 AM
Cabozantinib (C), erlotinib (E) or the combination (E+C) as second- or third-line therapy in patients with EGFR wild-type (wt) non-small cell lung cancer (NSCLC): A randomized phase 2 trial of the ECOG-ACRIN Cancer Research Group (E1512).
Joel W. Neal, MD/PhD
Stanford Cancer Institute/Stanford University School of Medicine
Abstract #8007
10:12 AM - 10:24 AM
Phase II study of cabozantinib for patients with advanced RET-rearranged lung cancers.
Alexander E. Drilon, MD
Memorial Sloan Kettering Cancer Center
Antwort auf Beitrag Nr.: 49.751.610 von Cyberhexe am 11.05.15 06:28:42Hallo Cyberhexe,
hab den post von franca_ole auch gelesen.
https://finance.yahoo.com/mbview/threadview/?&bn=a3fc981a-f4…
Die Spannung steigt bis zur ASCO.
Auch Franca sieht ja den eventuellen Buyout durch Roche. Es wird ja schon länger darüber gemunkelt...
Gruß
TwoPack
hab den post von franca_ole auch gelesen.
https://finance.yahoo.com/mbview/threadview/?&bn=a3fc981a-f4…
Die Spannung steigt bis zur ASCO.
Auch Franca sieht ja den eventuellen Buyout durch Roche. Es wird ja schon länger darüber gemunkelt...
Gruß
TwoPack
Antwort auf Beitrag Nr.: 49.755.159 von TwoPack am 11.05.15 14:38:43
http://finance.yahoo.com/mb/forumview/?&v=m&bn=a3fc981a-f450…
Post von Franca_ole für TwoPack ;-)
http://finance.yahoo.com/mb/forumview/?&v=m&bn=a3fc981a-f450…
KRAS
...Roche hat bereits die Diagnostik für "KRAS", und die entsprechenden klinischen Versuche bereits initialisiert. Cobi ist bei KRAS "induzierten" Krebsformen einer der Therapie-Favoriten im Onkologie-Portfolio der Basler. Exelixis hätte für Cobi keinen besseren Partner finden können!Roche Obtains FDA Approval For Cobas KRAS Mutation Test
By RTT News, May 11, 2015, 01:15:00 AM EDT
Roche (RHHBY.PK) announced Monday that the U.S. Food and Drug Administration has approved the cobas KRAS Mutation Test for diagnostic use. The real-time PCR test is designed to identify KRAS mutations in tumor samples from metastatic colorectal cancer or mCRC patients and aid clinicians in determining a therapeutic path for them.
According to the Centers for Disease Control and Prevention, colorectal cancer is the second leading cause of cancer-related deaths in the United States and the third most common cancer in men and women. The cobas KRAS Mutation Test is intended to be used as an aid in the identification of mCRC patients for whom treatment with Erbitux (cetuximab) or Vectibix (panitumumab) may be effective if no KRAS mutation is present.
In a separate press release, Genentech, a member of the Roche Group, said that it will present data from 10 of its approved cancer medicines and 10 investigational medicines during the American Society of Clinical Oncology (ASCO) Annual Meeting from May 29 - June 2 in Chicago.
These data demonstrate the strength of Genentech's oncology pipeline, particularly in cancer immunotherapy and personalized medicine. Updated results from studies of cobimetinib in combination with Zelboraf (vemurafenib) will also be presented at ASCO.
Cobimetinib is currently under review with both the U.S. Food and Drug Administration (FDA) and the European Medicines Agency. Data presented at ASCO for alectinib and Gazyvawill support regulatory submissions, and the Gazyva data will be highlighted as part of ASCO's official press program.
Genentech noted that it is also discussing interim data for MPDL3280A from the POPLAR study with the FDA as part of its Breakthrough Therapy Designation in lung cancer.
http://www.nasdaq.com/article/roche-obtains-fda-approval-for…
A Study of MEHD7945A and Cobimetinib (GDC-0973) in Patients With Locally Advanced or Metastatic Cancers With Mutant KRAS
https://clinicaltrials.gov/ct2/show/NCT01986166
ASCO2015 - cabozantinib in patients with EGFR wild-type (wt) non-small cell lung cancer (NSCLC)
Abstract:Background: Cabozantinib (C) is a small molecule inhibitor of multiple receptor tyrosine kinases, including MET, VEGFR2 & RET. MET is involved in tumor differentiation & VEGFR2 is a mediator of angiogenesis. Erlotinib (E) is FDA approved for the treatment of NSCLC. Methods: The primary objective of this randomized phase II study was to compare progression-free survival (PFS) of patients (pts) treated with E vs. C, & E vs E+C; each comparison had 91% power to detect a PFS hazard ratio (HR) of 0.5 with a 1-sided 0.10-level test stratified on prior number of therapies & ECOG PS. Secondary objectives included overall survival (OS), RECIST 1.1 response & CTCAE v4 toxicity. Pts were selected with previously treated (1-2 regimens) metastatic non-squamous EGFR wt NSCLC. Submission of archival tissue for central MET IHC testing was required. Oral daily dosing was: E-150 mg; C-60 mg; E+C-150 mg E, 40 mg C. Imaging was performed every 8 weeks. Pts optionally crossed over to E+C following progression on E or C. Results: One hundred and twenty-five pts were enrolled, of which 115 were eligible and treated (E, n = 39; C, n = 39; E+C, n = 37). Pt characteristics were balanced between arms except for lower rate of brain mets history on E (p = 0.02). Median follow up is 8.5 m. Compared with E (median 1.9 m), PFS was significantly improved on C (3.9 m, HR 0.33, p = 0.0002, 80% CI 0.22-0.49) and E+C (4.1 m, HR 0.31, p = 0.0002, 80% CI 0.21-0.46). Similarly, compared with E (median 4.0 m), OS was significantly improved on C (HR 0.52, p = 0.02) and E+C arm HR 0.50, p = 0.02). Grade 3-4 treatment-related hypertension & mucositis were higher on C and grade 3-4 diarrhea was higher on E+C. Overall worst grade toxicities were also significantly higher on C and E+C. MET IHC results were available on 88 patients from the primary analysis & 85% were positive (1-3+ membrane or cytoplasm staining with MET4 antibody). There was no correlation between MET status and PFS.
Conclusions: C & C+E significantly improved PFS over E alone in pts with EGFR wt NSCLC. Cabozantinib-based regimens are promising for further investigation in this patient population. Funded by ECOG-ACRIN and NCI Contract No. HHSN261200800001E. Clinical trial information: NCT01708954
Wie beurteilst Du die Ergebnisse
Wie beurteilst Du die Ergebnisse?
Antwort auf Beitrag Nr.: 49.777.470 von Magnetfeldfredy am 14.05.15 10:35:19
Compared with E (median 1.9 m), PFS was significantly improved on C (3.9 m, HR 0.33, p = 0.0002, 80% CI 0.22-0.49) and E+C (4.1 m, HR 0.31, p = 0.0002, 80% CI 0.21-0.46). Similarly, compared with E (median 4.0 m), OS was significantly improved on C (HR 0.52, p = 0.02) and E+C arm HR 0.50, p = 0.02)
Das Risiko zu sterben, ist in der Erlotinib-Gruppe ca. 50 % grösser --> HR Overall Survival 0.52 bzw. 0.50 (mit statistischer Signifikanz p< 0.05).
Obschon Roche mit Tarceva immer noch ca. 1200 mCHF/a (1.2 Milliarden/Jahr) Umsatz macht (insgesamt bei 3 zugelassenen Indikationen), ist davon auszugehen, dass andere viel versprechende Wirkstoffe wie zB MPDL3280A den Markt erreichen, so dass die Indikation NSCLC für Exelixis nicht von sehr grosser Bedeutung sein wird - allerhöchstens 3line.
Roche-Immuntherapeutikum MPDL3280A verdoppelte die Überlebenswahrscheinlichkeit verglichen mit Chemotherapie bei Patienten mit einer bestimmten Art von Lungenkrebs
Roche (SIX: RO, ROG; OTCQX: RHHBY) gab heute die Zwischenresultate einer globalen, randomisierten Phase-II-Studie (POPLAR) bei Patienten mit vorbehandeltem NSCLC bekannt. Wie die Studie zeigte, verdoppelte das in der klinischen Prüfung befindliche Immuntherapeutikum MPDL3280A (Anti-PDL1) die Überlebenswahrscheinlichkeit (Gesamtüberleben [OS], HR=0,47) bei Patienten, deren Krebs die höchsten Konzentrationen von PD-L1 (programmierter Zelltod-Ligand-1) exprimierte, verglichen mit Docetaxel-Chemotherapie. Eine Verlängerung des Überlebens wurde auch bei Patienten mit mittlerem und hohem (HR=0,56) oder jeglichem Grad der PD-L1-Expression (HR=0,63), die mit einem von Roche entwickelten Test charakterisiert wurde, beobachtet. MPDL3280A war allgemein gut verträglich. Die Nebenwirkungen entsprachen denen in früheren Studien mit MPDL3280A bei NSCLC. Die aktualisierten Resultate werden in einem Vortrag auf dem 51. Jahreskongress der American Society of Clinical Oncology (ASCO) vorgestellt.
Die 2 herausragenden Ereignisse demnächst sind die Folgenden:
1.) spätestens am 11.8.2015 Bekanntgabe der FDA über die Zulassungsentscheidung der Kombitherapie (Cobimetinib/Vemurafenib) zur Behandlung von schwarzem Hautkrebs --> Zulassungswahrscheinlichkeit sehr hoch (nahezu 100%) - mit einer frühzeitigen Entscheidung ist zu rechnen (im Juli), weil die Ergebnisse so viel besser sind als die Behandlung mit Vemurafenib: PFS (Cobi/vem)= 12.3 Monate gegenüber 7.2 Monate (Vemurafenib+Plazebo) bei einer HR (Hazard Ratio) von 0.58 - die war allerdings bei einer früheren Auswertung schon besser 0.51!
2.) Bekanntgabe der Daten zu METEOR = ph3-Studie zur Behandlung von Nierenkrebs (RCC) mit Cabozantinib; Bekanntgabe früh im 3. Quartal
--> ich rechne mit einer stat signifikanten Verbesserung der PFS (progression free survival) mit einer HR von höchstens 0.5
Das erste Ereignis wird mit grosser Wahrscheinlichkeit positiv verlaufen, so dass das 2. ereignis fast schon binären Charakter aufweist: wenn positiv, mit einer PFS von grösser 8 Monaten (bei einer HR von ca. 0.5), dann dürften zweistellige Kurse (>10 USD) nicht unrealistisch sein.
Cabo
die Ergebnisse gegenüber Erlotinib (brand name: Tarceva) sind ausserordentlich:Compared with E (median 1.9 m), PFS was significantly improved on C (3.9 m, HR 0.33, p = 0.0002, 80% CI 0.22-0.49) and E+C (4.1 m, HR 0.31, p = 0.0002, 80% CI 0.21-0.46). Similarly, compared with E (median 4.0 m), OS was significantly improved on C (HR 0.52, p = 0.02) and E+C arm HR 0.50, p = 0.02)
Das Risiko zu sterben, ist in der Erlotinib-Gruppe ca. 50 % grösser --> HR Overall Survival 0.52 bzw. 0.50 (mit statistischer Signifikanz p< 0.05).
Obschon Roche mit Tarceva immer noch ca. 1200 mCHF/a (1.2 Milliarden/Jahr) Umsatz macht (insgesamt bei 3 zugelassenen Indikationen), ist davon auszugehen, dass andere viel versprechende Wirkstoffe wie zB MPDL3280A den Markt erreichen, so dass die Indikation NSCLC für Exelixis nicht von sehr grosser Bedeutung sein wird - allerhöchstens 3line.
Roche-Immuntherapeutikum MPDL3280A verdoppelte die Überlebenswahrscheinlichkeit verglichen mit Chemotherapie bei Patienten mit einer bestimmten Art von Lungenkrebs
Roche (SIX: RO, ROG; OTCQX: RHHBY) gab heute die Zwischenresultate einer globalen, randomisierten Phase-II-Studie (POPLAR) bei Patienten mit vorbehandeltem NSCLC bekannt. Wie die Studie zeigte, verdoppelte das in der klinischen Prüfung befindliche Immuntherapeutikum MPDL3280A (Anti-PDL1) die Überlebenswahrscheinlichkeit (Gesamtüberleben [OS], HR=0,47) bei Patienten, deren Krebs die höchsten Konzentrationen von PD-L1 (programmierter Zelltod-Ligand-1) exprimierte, verglichen mit Docetaxel-Chemotherapie. Eine Verlängerung des Überlebens wurde auch bei Patienten mit mittlerem und hohem (HR=0,56) oder jeglichem Grad der PD-L1-Expression (HR=0,63), die mit einem von Roche entwickelten Test charakterisiert wurde, beobachtet. MPDL3280A war allgemein gut verträglich. Die Nebenwirkungen entsprachen denen in früheren Studien mit MPDL3280A bei NSCLC. Die aktualisierten Resultate werden in einem Vortrag auf dem 51. Jahreskongress der American Society of Clinical Oncology (ASCO) vorgestellt.
Die 2 herausragenden Ereignisse demnächst sind die Folgenden:
1.) spätestens am 11.8.2015 Bekanntgabe der FDA über die Zulassungsentscheidung der Kombitherapie (Cobimetinib/Vemurafenib) zur Behandlung von schwarzem Hautkrebs --> Zulassungswahrscheinlichkeit sehr hoch (nahezu 100%) - mit einer frühzeitigen Entscheidung ist zu rechnen (im Juli), weil die Ergebnisse so viel besser sind als die Behandlung mit Vemurafenib: PFS (Cobi/vem)= 12.3 Monate gegenüber 7.2 Monate (Vemurafenib+Plazebo) bei einer HR (Hazard Ratio) von 0.58 - die war allerdings bei einer früheren Auswertung schon besser 0.51!
2.) Bekanntgabe der Daten zu METEOR = ph3-Studie zur Behandlung von Nierenkrebs (RCC) mit Cabozantinib; Bekanntgabe früh im 3. Quartal
--> ich rechne mit einer stat signifikanten Verbesserung der PFS (progression free survival) mit einer HR von höchstens 0.5
Das erste Ereignis wird mit grosser Wahrscheinlichkeit positiv verlaufen, so dass das 2. ereignis fast schon binären Charakter aufweist: wenn positiv, mit einer PFS von grösser 8 Monaten (bei einer HR von ca. 0.5), dann dürften zweistellige Kurse (>10 USD) nicht unrealistisch sein.
Servus,
vielen Dank für Deine fachkundigen Erläuterugen!
Die Analyst Nicolas Stiefel sieht in den toxischen Nebenwirkungen und dadurch bedingten niedrigeren Dosierungen Probleme, wie siehst Du das?
http://us.lrd.yahoo.com/_ylt=Ahva1mTAx1ThoZRvrY_H6e6HH8V_;_y…
vielen Dank für Deine fachkundigen Erläuterugen!
Die Analyst Nicolas Stiefel sieht in den toxischen Nebenwirkungen und dadurch bedingten niedrigeren Dosierungen Probleme, wie siehst Du das?
http://us.lrd.yahoo.com/_ylt=Ahva1mTAx1ThoZRvrY_H6e6HH8V_;_y…
Antwort auf Beitrag Nr.: 49.789.032 von Magnetfeldfredy am 16.05.15 08:50:15nun, klassische Krebstherapie hat immer etwas mit einer maximal tolerierbaren Dosis zu tun (MTD), welche jedoch normalerweise in der klinischen Phase 1 bestimmt wird. Cabozantinib (brand name: COMETRIQ) ist in den US sowie auch in Europa bereits zugelassen und zwar zur Behandlung von Schilddrüsenkrebs, wobei in dieser Therapie 140 mg Cabozantinib pro Tag appliziert werden --> aus Verschreibungsinformationen der FDA:
NDICATIONS AND USAGE
_______________
COMETRIQ is a kinase inhibitor
indicated for the treatment of
patients with progressive, metast
atic medullary thyroid cancer
(MTC). (1)
____________
DOSAGE AND ADMINISTRATION
____________
Recommended Dose: 140 mg orally, once daily. (2.1)
Instruct patients not to eat for at
least 2 hours before and at least 1
hour after taking COMETRIQ. (2.1)
Sicherlich hat Cabozantinib unschöne Nebenwirkungen, jedoch ist dies wohl der Preis für die Effizienz dieses Wirkstoffes. Wenn Stifel allerdings nun schreibt, dass 60 mg nicht tolerierbar seien, dann hat dieser Analyst entweder die Zulassungsunterlagen von COMETRIQ zur Behandlung von Schilddrüsenkrebs nicht gelesen, da sowohl FDA als auch EMA in der Nutzen/Risiko-Abwägung entschieden haben, dass 140 mg tolerierbar seien, oder aber dieser Analyst hat eine Agenda, die da heisst, Negativschlagzeilen zu Exelixis zu produzieren:
We believe data in this indication and others to be presented at ASCO, will support our contention that 60 mg is too intolerable for patients, which could bode poorly for the ongoing Phase 3 METEOR trial which employs this dose in relatively
Read more: http://www.benzinga.com/analyst-ratings/analyst-color/15/05/…
NDICATIONS AND USAGE
_______________
COMETRIQ is a kinase inhibitor
indicated for the treatment of
patients with progressive, metast
atic medullary thyroid cancer
(MTC). (1)
____________
DOSAGE AND ADMINISTRATION
____________
Recommended Dose: 140 mg orally, once daily. (2.1)
Instruct patients not to eat for at
least 2 hours before and at least 1
hour after taking COMETRIQ. (2.1)
Sicherlich hat Cabozantinib unschöne Nebenwirkungen, jedoch ist dies wohl der Preis für die Effizienz dieses Wirkstoffes. Wenn Stifel allerdings nun schreibt, dass 60 mg nicht tolerierbar seien, dann hat dieser Analyst entweder die Zulassungsunterlagen von COMETRIQ zur Behandlung von Schilddrüsenkrebs nicht gelesen, da sowohl FDA als auch EMA in der Nutzen/Risiko-Abwägung entschieden haben, dass 140 mg tolerierbar seien, oder aber dieser Analyst hat eine Agenda, die da heisst, Negativschlagzeilen zu Exelixis zu produzieren:
We believe data in this indication and others to be presented at ASCO, will support our contention that 60 mg is too intolerable for patients, which could bode poorly for the ongoing Phase 3 METEOR trial which employs this dose in relatively
Read more: http://www.benzinga.com/analyst-ratings/analyst-color/15/05/…
Super erklärt, danke, ich denke er ist ein Instrument der Shorts.........
Ich habe recherchiert, Stiefel hat ein hold Ranking mit Kursziel 12 US Dollar, ein Wiederspruch in sich, vielleicht will er noch für seine Klienten billige Shares einsammeln?
http://us.lrd.yahoo.com/_ylt=Aj03IEXOc.VDQETTMswKB6yHH8V_;_y…" target="_blank" rel="nofollow ugc noopener">[http://us.lrd.yahoo.com/_ylt=Aj03IEXOc.VDQETTMswKB6yHH8V_;_y…
http://us.lrd.yahoo.com/_ylt=Aj03IEXOc.VDQETTMswKB6yHH8V_;_y…" target="_blank" rel="nofollow ugc noopener">[http://us.lrd.yahoo.com/_ylt=Aj03IEXOc.VDQETTMswKB6yHH8V_;_y…
Sorry:
Updated Positive Results from Two Trials of Cobimetinib in Combination with Vemurafenib for the Treatment of Patients with Advanced Melanoma Presented at 2015 ASCO Annual Meeting
- Updated results from coBRIM phase 3 pivotal trial show median progression-free survival of one year for patients with BRAF V600 mutation-positive advanced melanoma –
- Additional data from phase 1b BRIM7 study showed 61 percent of patients who had not been previously treated with a BRAF inhibitor were alive after two years -
- Cobimetinib for use in combination with vemurafenib is the subject of pending U.S. and European regulatory applications, with U.S. PDUFA date of August 11, 2015 -
.
Business Wire
Exelixis Inc.
21 minutes ago
. ˠ
➕
✕
.
..
.
.
SOUTH SAN FRANCISCO, Calif.--(BUSINESS WIRE)--
Exelixis Inc. (EXEL) today announced updated positive results for cobimetinib, an Exelixis-discovered investigational compound, in combination with vemurafenib for the treatment of patients with previously untreated BRAF V600 mutation-positive advanced melanoma. Updated data from coBRIM (Abstract #9006), the phase 3 pivotal trial conducted by Exelixis’ collaborator Genentech, a member of the Roche Group, showed the combination helped patients with previously untreated BRAF V600 mutation-positive advanced melanoma live a median of one year (12.3 months) without disease progression or death, compared to 7.2 months with vemurafenib alone (hazard ratio [HR] = 0.58, 95% confidence interval [CI] 0.46-0.72). Data from a second trial, the phase 1b BRIM7 study (Abstract #9020), showed that treatment with the combination resulted in a median overall survival of more than two years (28.5 months) for patients without prior BRAF inhibitor treatment. Both data sets will be presented at the 2015 Annual Meeting of the American Society of Clinical Oncology (ASCO), which is being held this week in Chicago, Illinois.
“The updated results for the combination of cobimetinib and vemurafenib, including a median progression-free survival of one year in patients with previously untreated BRAF V600 mutation-positive advanced melanoma, are encouraging,” said Michael M. Morrissey, Ph.D., president and chief executive officer of Exelixis. “The data underscore the potential for the combination to become a meaningful new treatment option for patients with this type of melanoma. We congratulate Genentech and Roche on two well-run trials, and we look forward to working with them to bring the combination to physicians and patients in the event of potential regulatory approval later this year.”
The updated results from coBRIM also showed higher response rates with cobimetinib and vemurafenib compared to vemurafenib alone. Objective response rate, a secondary endpoint of the trial, was 70% (16% compete response [CR], 54% partial response [PR]) with the combination compared to 50% (11% CR, 40% PR) with vemurafenib alone. The CR rate with the combination has increased from 10% to 16% with further follow-up as some patients who had an initial PR achieved a CR after more than one year of treatment. The safety profile of the combination was consistent with data previously reported. The most common adverse events in the combination arm include diarrhea, rash, nausea, fever, sun sensitivity, liver lab abnormalities, elevated creatine phosphokinase (CPK, an enzyme released by muscles) and vomiting.
Follow-up data from BRIM7, the phase 1b study that provided the rationale for the coBRIM pivotal trial, demonstrated that the combination of cobimetinib and vemurafenib resulted in a median overall survival of 28.5 months, with 61% of BRAF inhibitor-naive patients remaining alive after two years. The safety profile from the BRIM7 trial was consistent with previous analyses, and the incidence of serous retinopathy, cardiomyopathy and cutaneous squamous cell carcinoma were similar to those previously reported.
The coBRIM data will be presented in an oral session today by Dr. James Larkin, FRCP, of The Royal Marsden Hospital, London, UK (Abstract #9006, May 30, 3:15-3:27 pm CDT), while the BRIM7 data will be presented in a poster session by Dr. Anna Pavlick, New York University Medical Center (Abstract #9020, June 1, 1:15-4:45 pm CDT).
The cobimetinib New Drug Application for BRAF V600 mutation-positive advanced melanoma was granted priority review by the U.S. Food and Drug Administration (FDA) and a decision is expected by August 11, 2015. The European Medicines Agency is expected to make a decision on Roche’s marketing authorization application for cobimetinib before the end of this year.
About the coBRIM Study
The coBRIM trial is an international, randomized, double-blind, placebo-controlled Phase III study evaluating the safety and efficacy of 60 mg once daily of cobimetinib in combination with 960 mg twice daily of vemurafenib, compared to 960 mg twice daily of vemurafenib alone. In the study, 495 patients with BRAF V600 mutation-positive unresectable locally advanced or metastatic melanoma (detected by the cobas® 4800 BRAF Mutation Test) and previously untreated for advanced disease, were randomized to receive vemurafenib every day on a 28-day cycle plus either cobimetinib or placebo for days 1-21. Treatment was continued until disease progression, unacceptable toxicity or withdrawal of consent. Investigator-assessed PFS is the primary endpoint. Secondary endpoints include PFS by independent review committee, overall response rate, overall survival, duration of response and other safety, pharmacokinetic and quality of life measures.
The most common adverse events reported in patients taking cobimetinib in combination with vemurafenib (≥ 20%) were diarrhea, rash, nausea, fever, sun sensitivity, liver lab abnormalities, elevated creatine phosphokinase (CPK, an enzyme released by muscles) and vomiting. Serous retinopathy (collection of fluid under the retina) was observed at a higher frequency in the combination arm (26% vs. 3%) with most of these events either Grade 1 or 2, asymptomatic, and temporary in nature. Some adverse events, including cutaneous squamous cell carcinomas and keratoacanthomas, were reported less frequently in the combination arm.
.
.
Related Quotes
.
EXEL
3.15
+0.64%
Exelixis, Inc. Watchlist
3.15+0.02(0.64%)
NASDAQFri, May 29, 2015 4:00 PM EDT
EXELIXIS, INC. Files SEC form 8-K, Submission of Matters to a Vote of Security Holders
EDGAR Online 1 day 15 hrs ago
5 Things Exelixis Management Wants You to Know
Investopedia q 7 days ago
More
.
About the BRIM7 Study
BRIM7 is a Phase 1b study of 129 patients evaluating the safety and tolerability of cobimetinib in combination with vemurafenib in people with BRAF V600 mutation-positive unresectable or metastatic melanoma who had either not been previously treated with a BRAF inhibitor or had shown disease progression following treatment with a BRAF inhibitor. The primary endpoint of the BRIM7 study focused on safety, tolerability, and the identification of an optimal dose. The secondary outcome measures focused on efficacy. Patients in the dose-escalation stage of the study received cobimetinib 60, 80 or 100 mg once daily given on a schedule of 14 days on/14 days off; 21 days on/7 days off; or continuously for 28 days, and vemurafenib 720 or 960 mg twice daily continuously. Following the dose-escalation stage, two dose levels were selected for further investigation: cobimetinib 60 mg once daily for 21 days on/7 days off and vemurafenib (720 mg or 960 mg twice daily).
The most common adverse events were mild to moderate in severity, and the overall frequency of adverse events with an extended median follow-up of up to 21 months have remained consistent without new safety signals.
About the Cobimetinib Development Collaboration
Exelixis discovered cobimetinib internally and advanced the compound to investigational new drug (IND) status. In late 2006, Exelixis entered into a collaboration agreement with Genentech, under which Exelixis received initial upfront and milestone payments in connection with signing the agreement and submitting the IND. Exelixis was responsible for development of cobimetinib through the determination of the maximum tolerated dose in phase 1, at which point Genentech exercised its option to further develop the compound.
In November 2013, Exelixis exercised its option to co-promote cobimetinib, if approved, in the United States. Exelixis is entitled to an initial equal share of U.S. profits and losses, which will decrease as sales increase, and will share equally in the U.S. marketing and commercialization costs. Exelixis is eligible to receive royalties on any sales of the product outside the United States.
About the Cobimetinib and Vemurafenib Combination
Cobimetinib is a selective inhibitor that blocks the activity of MEK, a protein kinase that is part of a key pathway (the RAS-RAF-MEK-ERK pathway) that promotes cell division and survival. This pathway is frequently activated in human cancers including melanoma, where mutation of one of its components (BRAF) causes abnormal activation in about 50% of tumors. Tumors with BRAF mutations may develop resistance and subsequently progress after treatment with a BRAF inhibitor. In preclinical melanoma models, co-treatment with a BRAF inhibitor and a MEK inhibitor may delay the emergence of resistant tumors. In addition to the combination with vemurafenib in melanoma, cobimetinib is also being investigated in combination with several investigational medicines, including an immunotherapy, in several tumor types, including non-small cell lung cancer, colorectal cancer, triple-negative breast cancer and melanoma.
About Melanoma and its BRAF V600 Mutation-Positive Form
Melanoma is the less common, but more serious category of skin cancer that starts in the skin’s pigment producing cells known as melanocytes. According to the American Cancer Society, approximately five percent of skin cancer diagnoses are melanoma, but melanoma accounts for a large majority of skin cancer deaths. In recent years, there have been significant advances in treatment for metastatic melanoma and people with the disease have more options. However, it continues to be a serious health issue with a high unmet need and a steadily increasing incidence over the past 30 years. It is projected that approximately half of all melanomas, and eight percent of solid tumors, contain a mutation of the BRAF protein. BRAF is a key component of the RAS-RAF-MEK-ERK pathway involved in normal cell growth and survival. However, mutations that keep the BRAF protein in an active state may cause excessive signaling in the pathway, leading to uncontrolled cell growth and survival. The BRAF V600 mutation-positive form of melanoma is associated with high-risk characteristics of the disease, including early onset, the absence of chronic skin damage, and decreased survival.
About Exelixis
Exelixis, Inc. is a biopharmaceutical company committed to developing small molecule therapies for the treatment of cancer. Exelixis is focusing its development and commercialization efforts primarily on COMETRIQ® (cabozantinib), its wholly-owned inhibitor of multiple receptor tyrosine kinases. Another Exelixis-discovered compound, cobimetinib, a highly selective inhibitor of MEK, is being evaluated by Roche and Genentech (a member of the Roche Group) in a broad development program under a collaboration with Exelixis. For more information, please visit the company's web site at www.exelixis.com.
Updated Positive Results from Two Trials of Cobimetinib in Combination with Vemurafenib for the Treatment of Patients with Advanced Melanoma Presented at 2015 ASCO Annual Meeting
- Updated results from coBRIM phase 3 pivotal trial show median progression-free survival of one year for patients with BRAF V600 mutation-positive advanced melanoma –
- Additional data from phase 1b BRIM7 study showed 61 percent of patients who had not been previously treated with a BRAF inhibitor were alive after two years -
- Cobimetinib for use in combination with vemurafenib is the subject of pending U.S. and European regulatory applications, with U.S. PDUFA date of August 11, 2015 -
.
Business Wire
Exelixis Inc.
21 minutes ago
. ˠ
➕
✕
.
..
.
.
SOUTH SAN FRANCISCO, Calif.--(BUSINESS WIRE)--
Exelixis Inc. (EXEL) today announced updated positive results for cobimetinib, an Exelixis-discovered investigational compound, in combination with vemurafenib for the treatment of patients with previously untreated BRAF V600 mutation-positive advanced melanoma. Updated data from coBRIM (Abstract #9006), the phase 3 pivotal trial conducted by Exelixis’ collaborator Genentech, a member of the Roche Group, showed the combination helped patients with previously untreated BRAF V600 mutation-positive advanced melanoma live a median of one year (12.3 months) without disease progression or death, compared to 7.2 months with vemurafenib alone (hazard ratio [HR] = 0.58, 95% confidence interval [CI] 0.46-0.72). Data from a second trial, the phase 1b BRIM7 study (Abstract #9020), showed that treatment with the combination resulted in a median overall survival of more than two years (28.5 months) for patients without prior BRAF inhibitor treatment. Both data sets will be presented at the 2015 Annual Meeting of the American Society of Clinical Oncology (ASCO), which is being held this week in Chicago, Illinois.
“The updated results for the combination of cobimetinib and vemurafenib, including a median progression-free survival of one year in patients with previously untreated BRAF V600 mutation-positive advanced melanoma, are encouraging,” said Michael M. Morrissey, Ph.D., president and chief executive officer of Exelixis. “The data underscore the potential for the combination to become a meaningful new treatment option for patients with this type of melanoma. We congratulate Genentech and Roche on two well-run trials, and we look forward to working with them to bring the combination to physicians and patients in the event of potential regulatory approval later this year.”
The updated results from coBRIM also showed higher response rates with cobimetinib and vemurafenib compared to vemurafenib alone. Objective response rate, a secondary endpoint of the trial, was 70% (16% compete response [CR], 54% partial response [PR]) with the combination compared to 50% (11% CR, 40% PR) with vemurafenib alone. The CR rate with the combination has increased from 10% to 16% with further follow-up as some patients who had an initial PR achieved a CR after more than one year of treatment. The safety profile of the combination was consistent with data previously reported. The most common adverse events in the combination arm include diarrhea, rash, nausea, fever, sun sensitivity, liver lab abnormalities, elevated creatine phosphokinase (CPK, an enzyme released by muscles) and vomiting.
Follow-up data from BRIM7, the phase 1b study that provided the rationale for the coBRIM pivotal trial, demonstrated that the combination of cobimetinib and vemurafenib resulted in a median overall survival of 28.5 months, with 61% of BRAF inhibitor-naive patients remaining alive after two years. The safety profile from the BRIM7 trial was consistent with previous analyses, and the incidence of serous retinopathy, cardiomyopathy and cutaneous squamous cell carcinoma were similar to those previously reported.
The coBRIM data will be presented in an oral session today by Dr. James Larkin, FRCP, of The Royal Marsden Hospital, London, UK (Abstract #9006, May 30, 3:15-3:27 pm CDT), while the BRIM7 data will be presented in a poster session by Dr. Anna Pavlick, New York University Medical Center (Abstract #9020, June 1, 1:15-4:45 pm CDT).
The cobimetinib New Drug Application for BRAF V600 mutation-positive advanced melanoma was granted priority review by the U.S. Food and Drug Administration (FDA) and a decision is expected by August 11, 2015. The European Medicines Agency is expected to make a decision on Roche’s marketing authorization application for cobimetinib before the end of this year.
About the coBRIM Study
The coBRIM trial is an international, randomized, double-blind, placebo-controlled Phase III study evaluating the safety and efficacy of 60 mg once daily of cobimetinib in combination with 960 mg twice daily of vemurafenib, compared to 960 mg twice daily of vemurafenib alone. In the study, 495 patients with BRAF V600 mutation-positive unresectable locally advanced or metastatic melanoma (detected by the cobas® 4800 BRAF Mutation Test) and previously untreated for advanced disease, were randomized to receive vemurafenib every day on a 28-day cycle plus either cobimetinib or placebo for days 1-21. Treatment was continued until disease progression, unacceptable toxicity or withdrawal of consent. Investigator-assessed PFS is the primary endpoint. Secondary endpoints include PFS by independent review committee, overall response rate, overall survival, duration of response and other safety, pharmacokinetic and quality of life measures.
The most common adverse events reported in patients taking cobimetinib in combination with vemurafenib (≥ 20%) were diarrhea, rash, nausea, fever, sun sensitivity, liver lab abnormalities, elevated creatine phosphokinase (CPK, an enzyme released by muscles) and vomiting. Serous retinopathy (collection of fluid under the retina) was observed at a higher frequency in the combination arm (26% vs. 3%) with most of these events either Grade 1 or 2, asymptomatic, and temporary in nature. Some adverse events, including cutaneous squamous cell carcinomas and keratoacanthomas, were reported less frequently in the combination arm.
.
.
Related Quotes
.
EXEL
3.15
+0.64%
Exelixis, Inc. Watchlist
3.15+0.02(0.64%)
NASDAQFri, May 29, 2015 4:00 PM EDT
EXELIXIS, INC. Files SEC form 8-K, Submission of Matters to a Vote of Security Holders
EDGAR Online 1 day 15 hrs ago
5 Things Exelixis Management Wants You to Know
Investopedia q 7 days ago
More
.
About the BRIM7 Study
BRIM7 is a Phase 1b study of 129 patients evaluating the safety and tolerability of cobimetinib in combination with vemurafenib in people with BRAF V600 mutation-positive unresectable or metastatic melanoma who had either not been previously treated with a BRAF inhibitor or had shown disease progression following treatment with a BRAF inhibitor. The primary endpoint of the BRIM7 study focused on safety, tolerability, and the identification of an optimal dose. The secondary outcome measures focused on efficacy. Patients in the dose-escalation stage of the study received cobimetinib 60, 80 or 100 mg once daily given on a schedule of 14 days on/14 days off; 21 days on/7 days off; or continuously for 28 days, and vemurafenib 720 or 960 mg twice daily continuously. Following the dose-escalation stage, two dose levels were selected for further investigation: cobimetinib 60 mg once daily for 21 days on/7 days off and vemurafenib (720 mg or 960 mg twice daily).
The most common adverse events were mild to moderate in severity, and the overall frequency of adverse events with an extended median follow-up of up to 21 months have remained consistent without new safety signals.
About the Cobimetinib Development Collaboration
Exelixis discovered cobimetinib internally and advanced the compound to investigational new drug (IND) status. In late 2006, Exelixis entered into a collaboration agreement with Genentech, under which Exelixis received initial upfront and milestone payments in connection with signing the agreement and submitting the IND. Exelixis was responsible for development of cobimetinib through the determination of the maximum tolerated dose in phase 1, at which point Genentech exercised its option to further develop the compound.
In November 2013, Exelixis exercised its option to co-promote cobimetinib, if approved, in the United States. Exelixis is entitled to an initial equal share of U.S. profits and losses, which will decrease as sales increase, and will share equally in the U.S. marketing and commercialization costs. Exelixis is eligible to receive royalties on any sales of the product outside the United States.
About the Cobimetinib and Vemurafenib Combination
Cobimetinib is a selective inhibitor that blocks the activity of MEK, a protein kinase that is part of a key pathway (the RAS-RAF-MEK-ERK pathway) that promotes cell division and survival. This pathway is frequently activated in human cancers including melanoma, where mutation of one of its components (BRAF) causes abnormal activation in about 50% of tumors. Tumors with BRAF mutations may develop resistance and subsequently progress after treatment with a BRAF inhibitor. In preclinical melanoma models, co-treatment with a BRAF inhibitor and a MEK inhibitor may delay the emergence of resistant tumors. In addition to the combination with vemurafenib in melanoma, cobimetinib is also being investigated in combination with several investigational medicines, including an immunotherapy, in several tumor types, including non-small cell lung cancer, colorectal cancer, triple-negative breast cancer and melanoma.
About Melanoma and its BRAF V600 Mutation-Positive Form
Melanoma is the less common, but more serious category of skin cancer that starts in the skin’s pigment producing cells known as melanocytes. According to the American Cancer Society, approximately five percent of skin cancer diagnoses are melanoma, but melanoma accounts for a large majority of skin cancer deaths. In recent years, there have been significant advances in treatment for metastatic melanoma and people with the disease have more options. However, it continues to be a serious health issue with a high unmet need and a steadily increasing incidence over the past 30 years. It is projected that approximately half of all melanomas, and eight percent of solid tumors, contain a mutation of the BRAF protein. BRAF is a key component of the RAS-RAF-MEK-ERK pathway involved in normal cell growth and survival. However, mutations that keep the BRAF protein in an active state may cause excessive signaling in the pathway, leading to uncontrolled cell growth and survival. The BRAF V600 mutation-positive form of melanoma is associated with high-risk characteristics of the disease, including early onset, the absence of chronic skin damage, and decreased survival.
About Exelixis
Exelixis, Inc. is a biopharmaceutical company committed to developing small molecule therapies for the treatment of cancer. Exelixis is focusing its development and commercialization efforts primarily on COMETRIQ® (cabozantinib), its wholly-owned inhibitor of multiple receptor tyrosine kinases. Another Exelixis-discovered compound, cobimetinib, a highly selective inhibitor of MEK, is being evaluated by Roche and Genentech (a member of the Roche Group) in a broad development program under a collaboration with Exelixis. For more information, please visit the company's web site at www.exelixis.com.
ASCO2015: progressionsfreies Überleben von 12,3 Monaten mit Cobimetinib kombiniert mit Zelboraf
Der primäre Endpunkt in coBRIM hat sich signifikant verbessert, und zwar der Median des progressionsfreien Überleben von 9.9 Monate auf 12.3 Monate und ist damit eindeutig besser als bei der Novartis-Kombitherapie bestehend aus Dabrafenib und Trametinib. Dies dürfte für Zelboraf/Cotellic gegenüber der Novartis-Kombitherapie einen gewichtigen Wettbewerbsvorteil darstellen.Basel, 30. Mai 2015
Aktualisierte Daten für Roche-Prüfkombination mit Cobimetinib und Zelboraf (Vemurafenib) bei Patienten mit fortgeschrittenem Melanom zeigen einjähriges Überleben ohne ein Fortschreiten der Erkrankung
Phase-III-Studie coBRIM zeigt medianes progressionsfreies Überleben von 12,3 Monaten mit Cobimetinib kombiniert mit Zelboraf
Zusätzliche Daten der Phase-Ib-Studie BRIM7 zeigen, dass 61 Prozent der Patienten, die zuvor noch mit keinem BRAF-Hemmer behandelt worden waren, nach zwei Jahren noch am Leben waren
Eine Entscheidung der amerikanischen Zulassungsbehörde FDA über das Zulassungsgesuch von Roche für Cobimetinib in Kombination mit Zelboraf wird für August 2015 erwartet, und auch die europäische Arzneimittel-Agentur EMA prüft zurzeit ein Zulassungsgesuch
Roche (SIX: RO, ROG; OTCQX: RHHBY) gab heute Follow-Up-Daten von zwei Studien des MEK-Hemmers Cobimetinib in Kombination mit Zelboraf® (Vemurafenib) bekannt. Aktualisierte Daten der zulassungsentscheidenden Phase-III-Studie coBRIM zeigen, dass die Kombinationstherapie Patienten mit nicht vorbehandeltem BRAF-V600-Mutations-positivem fortgeschrittenem Melanom half, im Median ein Jahr (12,3 Monate) ohne Fortschreiten ihrer Erkrankung oder Tod zu überleben (progressionsfreies Überleben, PFS), verglichen mit 7,2 Monaten unter Zelboraf allein (Hazard Ratio [HR]=0,58, 95%-Konfidenzintervall [KI] 0,46-0,72, p<0,0001).1
„Die Kombination von Cobimetinib und Zelboraf verlängerte die Zeit, die Patienten lebten, ohne dass ihre Erkrankung weiter fortschritt, auf ein Jahr“, so Sandra Horning, Chief Medical Officer und Leiterin der globalen Produktentwicklung. „Diese Resultate sind hochinteressant, da sie die Bedeutung der Kombination von Medikamenten, die gezielt gegen Signale wirken, die das Wachstum rund der Hälfte aller Melanome regulieren.“
Die aktualisierten Resultate der coBRIM-Studie zeigten ausserdem höhere Ansprechraten mit Cobimetinib und Zelboraf im Vergleich zu Zelboraf allein. Die objektive Ansprechrate (ORR) der Kombination betrug 70 Prozent (16 Prozent komplette Remission [CR], 54 Prozent partielle Remission [PR]), verglichen mit 50 Prozent (11 Prozent CR, 40 Prozent PR) in der Zelboraf–Gruppe (p<0,0001).1 Zudem stieg im weiteren Verlauf der Nachbeobachtung die komplette Remissionsrate der Kombinationstherapie von 10 Prozent auf 15 Prozent, da einige Patienten mit partieller Remission nach über einjähriger Behandlung eine komplette Remission erreichten. Das Sicherheitsprofil von Cobimetinib und Zelboraf entsprach den bereits bekannten Sicherheitsdaten. Die häufigsten Nebenwirkungen in der Kombinationsgruppe waren Durchfall, Hautausschlag, Übelkeit, Fieber, Sonnenlichtempfindlichkeit, veränderte Leberfunktionswerte, erhöhte Kreatinphosphokinase (CPK, in den Muskeln produziertes Enzym) und Erbrechen.
Nachbeobachtungsdaten der Phase-Ib-Studie BRIM7 zeigten, dass Patienten, die zuvor noch mit keinem BRAF-Hemmer behandelt worden waren, unter Cobimetinib und Zelboraf im Median über zwei Jahre (28,5 Monate) überlebten. Ausserdem waren in der verlängerten Nachbeobachtung 61 Prozent der Patienten, die zuvor noch mit keinem BRAF-Hemmer behandelt worden waren, nach zwei Jahren noch am Leben.2 Das Sicherheitsprofil entsprach den früheren Analysen. Die Häufigkeit von seröser Retinopathie, Kardiomyopathie und Plattenepithelkarzinomen der Haut war vergleichbar mit den früher beobachteten Raten.
Die Daten der coBRIM- und der BRIM7-Studie werden auf dem 51. Jahreskongress der American Society of Clinical Oncology (ASCO) in Chicago vom 39. Mai–2. Juni vorgestellt. Die CoBRIM-Daten werden heute in einem Vortrag von James Larkin, FRCP, Ph.D., The Royal Marsden Hospital, London, UK, präsentiert (Abstract Nr. 9006, 30. Mai, 15:15–15:27 Ortszeit).. Die BRIM7-Daten werden in einem Postervortrag von Anna Pavlick, D.O., New York University Medical Center, vorgestellt (Abstract Nr. 9020, 1. Juni, 13:15–16:45 Ortszeit).
Das Zulassungsgesuch für Cobimetinib zur Therapie des fortgeschrittenen Melanoms mit BRAF-Mutationen wird im beschleunigten Zulassungsverfahren der amerikanischen Zulassungsbehörde FDA (Food and Drug Administration) geprüft. Eine Entscheidung wird für August 2015 erwartet. Die europäische Arzneimittel-Agentur (EMA) wird voraussichtlich noch vor Ende 2015 eine Entscheidung über das Zulassungsgesuch von Roche für Cobimetinib treffen.
http://www.roche.com/de/media/store/releases/med-cor-2015-05…
Antwort auf Beitrag Nr.: 49.881.097 von Cyberhexe am 30.05.15 16:28:38man dürfte nun erwarten, dass die FDA vor dem eigentlichen PDUFA-Datum, dem 11.8.2015, Cobimetinib die Marktzulassung erteilt. Deswegen rechne ich mit einer positiven Entscheidung im Juli, und hoffe darauf, dass bereits im Juni die Zulassung erteilt wird.
Antwort auf Beitrag Nr.: 49.881.106 von Cyberhexe am 30.05.15 16:32:04Danke Dir, Franca, für die Texte und deine Einschätzungen!
Exelixis macht wirklich viel Spaß dieser Tage...
Gruß
TwoPack
Exelixis macht wirklich viel Spaß dieser Tage...
Gruß
TwoPack
Cobimetinib: es gibt eine neue ph1-Studie
https://clinicaltrials.gov/ct2/show/NCT02457793?term=cobimet…A Study of the Safety, Tolerability, and Effects of Cobimetinib and GDC-0994 in Patients With Locally Advanced or Metastatic Solid Tumors
This study is not yet open for participant recruitment. (see Contacts and Locations)
Verified May 2015 by Genentech, Inc.
Sponsor:
Genentech, Inc.
Information provided by (Responsible Party):
Genentech, Inc.
ClinicalTrials.gov Identifier:
NCT02457793
First received: May 27, 2015
Last updated: May 28, 2015
Last verified: May 2015
Purpose
This is a two-stage dose-escalation study to assess the safety, tolerability and effects of oral dosing of cobimetinib and GDC-0994 administered in combination in patients with histologically confirmed, locally advanced, or metastatic solid tumors for which standard therapies either do not exist or have proven ineffective or intolerable.
Condition:
Non-Small Cell Lung Cancer
Metastatic Colorectal Cancer
Metastatic Non Small Cell Lung Cancer
Melanoma
Drug: Cobimetinib
Drug: GD0-994
Phase 1
Official Title:
A Phase Ib, Open-Label, Dose-Escalation Study Of The Safety, Tolerability, and Pharmacokinetics of Cobimetinib and GDC-0994 In Patients With Locally Advanced or Metastatic Solid Tumors
Primary Outcome Measures:
Percentage of patients with dose limiting toxicity (DLTs) [ Time Frame: Up to 3 years ] [ Designated as safety issue: No ]
Percentage of patients experiencing at least one adverse event [ Time Frame: Up to 3 years ] [ Designated as safety issue: No ]
Mean change from baseline in vital signs [ Time Frame: Up to 3 years ] [ Designated as safety issue: No ]
Percentage of patients with at least one adverse event of special interest [ Time Frame: Up to 3 years ] [ Designated as safety issue: No ]
Percentage of patients experiencing at least one serious adverse event [ Time Frame: Up to 3 years ] [ Designated as safety issue: No ]
Percentage of patients experiencing laboratory abnormalities [ Time Frame: Up to 3 years ] [ Designated as safety issue: No ]
Estimated Enrollment: 142
Study Start Date: May 2015
Antwort auf Beitrag Nr.: 49.882.276 von Cyberhexe am 31.05.15 07:12:47nach den korrigierten Ergebnissen aus coBRIM wird cobi/vemurafenib bei der Behandlung des schwarzen Hautkrebses einen beträchtlichen Anteil für sich benspruchen!
http://www.ncbi.nlm.nih.gov/pubmed/26001180
Expert Opin Pharmacother. 2015 Jun;16(9):1285-97. doi: 10.1517/14656566.2015.1044971.
BRAF and MEK inhibition for the treatment of advanced BRAF mutant melanoma.
Richman J1, Martin-Liberal J, Diem S, Larkin J.
Author information
Abstract
INTRODUCTION:
BRAF inhibition alone has achieved unprecedented efficacy results in patients affected by BRAF-mutated advanced melanoma. Since these findings, it was postulated that dual inhibition of BRAF and other components of the RAS/RAF/MEK/ERK MAPK pathway (such as MEK) would be superior to BRAF inhibition as monotherapy. A series of recent clinical trials have confirmed this hypothesis.
AREAS COVERED:
In this article, the biological rationale for both single and concomitant inhibitions of the MAPK pathway in BRAF mutant melanoma is provided. Moreover, available clinical data on the efficacy and toxicity of BRAF and MEK inhibition as single agents and in combination are extensively reviewed.
EXPERT OPINION:
Dual BRAF and MEK inhibition in advanced BRAF-mutated melanoma is superior to single inhibition in terms of efficacy without significant increase in toxicity. Therefore, BRAF plus MEK inhibition is expected to supersede single-agent BRAF inhibition in these patients in the near future.
http://www.ncbi.nlm.nih.gov/pubmed/26001180
Expert Opin Pharmacother. 2015 Jun;16(9):1285-97. doi: 10.1517/14656566.2015.1044971.
BRAF and MEK inhibition for the treatment of advanced BRAF mutant melanoma.
Richman J1, Martin-Liberal J, Diem S, Larkin J.
Author information
Abstract
INTRODUCTION:
BRAF inhibition alone has achieved unprecedented efficacy results in patients affected by BRAF-mutated advanced melanoma. Since these findings, it was postulated that dual inhibition of BRAF and other components of the RAS/RAF/MEK/ERK MAPK pathway (such as MEK) would be superior to BRAF inhibition as monotherapy. A series of recent clinical trials have confirmed this hypothesis.
AREAS COVERED:
In this article, the biological rationale for both single and concomitant inhibitions of the MAPK pathway in BRAF mutant melanoma is provided. Moreover, available clinical data on the efficacy and toxicity of BRAF and MEK inhibition as single agents and in combination are extensively reviewed.
EXPERT OPINION:
Dual BRAF and MEK inhibition in advanced BRAF-mutated melanoma is superior to single inhibition in terms of efficacy without significant increase in toxicity. Therefore, BRAF plus MEK inhibition is expected to supersede single-agent BRAF inhibition in these patients in the near future.
[urlhttp://finance.yahoo.com/news/exelixis-announces-positive-results-phase-130000860.html][/url]
Nochmal good News!
Nochmal good News!
!
Dieser Beitrag wurde von CommunitySupport moderiert. Grund: auf eigenen Wunsch des UsersOptionen: ungewöhnliche Aktivität...
...bei den Calls mit einem Ausübungspreis von USD 3.50 und zwar jenen, die am 19. Juni 2015 auslaufen sowie USD 4.00 mit einem Ablaufdatum Mitte August 2015.Möglicherweise steht die Zulassung von Cobi kurz bevor - würde mich nicht wundern, wenn die FDA noch im Juni eine positive Zulassungsentscheidung bekannt geben würde...möglicherweise noch kommende Woche, also noch vor Ablauf der Juni Calls. Oder sollte dies vielleicht ein Zufall sein?! ...wohl eher nicht!
Mit welchen Kursen rechnest Du bei einer Zulassung?
Antwort auf Beitrag Nr.: 49.971.783 von Cyberhexe am 14.06.15 16:36:51
war dann wohl doch eher Zufall.
Zitat von Cyberhexe: ...bei den Calls mit einem Ausübungspreis von USD 3.50 und zwar jenen, die am 19. Juni 2015 auslaufen sowie USD 4.00 mit einem Ablaufdatum Mitte August 2015.
Möglicherweise steht die Zulassung von Cobi kurz bevor - würde mich nicht wundern, wenn die FDA noch im Juni eine positive Zulassungsentscheidung bekannt geben würde...möglicherweise noch kommende Woche, also noch vor Ablauf der Juni Calls. Oder sollte dies vielleicht ein Zufall sein?! ...wohl eher nicht!
war dann wohl doch eher Zufall.
Die Zulassung kann jeden Tag kommen, die Meteor Ergebnisse auch, die Player positionieren sich!
SOUTH SAN FRANCISCO, Calif.--(BUSINESS WIRE)-- Yesterday, Exelixis' (NASDAQ:EXEL) partner Genentech, a member of the Roche Group, informed Exelixis that, in order to accommodate its review of a supplemental data submission, the U.S. Food and Drug Administration (FDA) has extended the Prescription Drug User Fee Act (PDUFA) action date for its review of Genentech's New Drug Application (NDA) for cobimetinib by the standard extension period of three months, from August 11, 2015 to November 11, 2015.
FDA extended its review after Genentech submitted, at FDA request, additional data from coBRIM, the phase 3 registrational trial of cobimetinib and vemurafenib in patients with BRAF V600 mutation-positive advanced melanoma.
http://www.nasdaq.com/press-release/exelixis-provides-update…
FDA extended its review after Genentech submitted, at FDA request, additional data from coBRIM, the phase 3 registrational trial of cobimetinib and vemurafenib in patients with BRAF V600 mutation-positive advanced melanoma.
http://www.nasdaq.com/press-release/exelixis-provides-update…
Besser als Ablehnung!
Antwort auf Beitrag Nr.: 49.971.783 von Cyberhexe am 14.06.15 16:36:51
na ja, die Zulassung war ja quas nur noch eine Formsache. Bei Meteor wird es dann nach dem Gesetz der Serie auch eher nichts werden.
Klar die Zulassung kann noch kommen, aber es wird eben noch dauern.
Zitat von Cyberhexe: ...bei den Calls mit einem Ausübungspreis von USD 3.50 und zwar jenen, die am 19. Juni 2015 auslaufen sowie USD 4.00 mit einem Ablaufdatum Mitte August 2015.
Möglicherweise steht die Zulassung von Cobi kurz bevor - würde mich nicht wundern, wenn die FDA noch im Juni eine positive Zulassungsentscheidung bekannt geben würde...möglicherweise noch kommende Woche, also noch vor Ablauf der Juni Calls. Oder sollte dies vielleicht ein Zufall sein?! ...wohl eher nicht!
na ja, die Zulassung war ja quas nur noch eine Formsache. Bei Meteor wird es dann nach dem Gesetz der Serie auch eher nichts werden.
Klar die Zulassung kann noch kommen, aber es wird eben noch dauern.
Das sind ja sehr qualifizierte Aussagen, lächerlich!
Antwort auf Beitrag Nr.: 50.094.330 von Magnetfeldfredy am 01.07.15 22:16:03
und Du machst gar keine :-)
Für Cyberhexe war alle nur noch eine Formsache mit der Zulassung - auch die interpretationen zu den Optionen war nicht richtig. Egal, klar, aber es muss eben nicht jede Bewertung der "Experten" richtig sein.
Ob Meteor nun floppt oder nicht - who knows, leider eben keiner.
Zitat von Magnetfeldfredy: Das sind ja sehr qualifizierte Aussagen, lächerlich!
und Du machst gar keine :-)
Für Cyberhexe war alle nur noch eine Formsache mit der Zulassung - auch die interpretationen zu den Optionen war nicht richtig. Egal, klar, aber es muss eben nicht jede Bewertung der "Experten" richtig sein.
Ob Meteor nun floppt oder nicht - who knows, leider eben keiner.
Antwort auf Beitrag Nr.: 50.095.938 von riverstar_de am 02.07.15 09:13:45mit der Verlängerung von PDUFA um 3 Monate habe ich tatsächlich nicht gerechnet, da die aktualisierten Ergebnisse von CoBRIM bis auf die Hazard Ratio (0.58 anstatt 0.52) durchweg positiv ausgefallen sind --> vor allem der primäre Endpunkt des progressionsfreien Überlebens kontte im Median auf 12.3 Monate zulegen, so dass die gsk-Kombitherapie dabrafenib&trametinib bei der Effizienz auf alle Fälle nicht besser abschneidet.
After a median follow-up of 14 months, the median progression-free survival (PFS) was 12.3 months for patients treated with vemurafenib and cobimetinib compared with 7.2 months in those treated with vemurafenib monotherapy (hazard ratio [HR] = 0.58; 95% CI, 0.45–0.72). - See more at: http://www.cancernetwork.com/asco-2015-melanoma/updated-data-targeted-therapy-combination-confirm-benefit-melanoma#sthash.eC1QqB2I.dpuf
Obschon Priority Review gewährt wurde, benötigt die FDA nun mehr Zeit, um die aktualisierten Ergebnisse von coBRIM auszuwerten. Die Zulassungswahrscheinlichkeit von Cobimetinib ist jedoch nun, nach Bekanntgabe der aktualisiertenn Ergebnisse von CoBRIM, nicht kleiner geworden sondern close to 100% - da bin ich mir sicher.
Zum binären Ereigbis der Bekanntgabe der METEOR-Ergebnisse bin ich, wie bereits mehrfach berichtet, vorsichtig optimistisch. Eine Gewähr, dass dies tatsächlich positiv ausgehen wird, kann jedoch niemand geben.... nicht einmal die wahren Experten ;-)
After a median follow-up of 14 months, the median progression-free survival (PFS) was 12.3 months for patients treated with vemurafenib and cobimetinib compared with 7.2 months in those treated with vemurafenib monotherapy (hazard ratio [HR] = 0.58; 95% CI, 0.45–0.72). - See more at: http://www.cancernetwork.com/asco-2015-melanoma/updated-data-targeted-therapy-combination-confirm-benefit-melanoma#sthash.eC1QqB2I.dpuf
Obschon Priority Review gewährt wurde, benötigt die FDA nun mehr Zeit, um die aktualisierten Ergebnisse von coBRIM auszuwerten. Die Zulassungswahrscheinlichkeit von Cobimetinib ist jedoch nun, nach Bekanntgabe der aktualisiertenn Ergebnisse von CoBRIM, nicht kleiner geworden sondern close to 100% - da bin ich mir sicher.
Zum binären Ereigbis der Bekanntgabe der METEOR-Ergebnisse bin ich, wie bereits mehrfach berichtet, vorsichtig optimistisch. Eine Gewähr, dass dies tatsächlich positiv ausgehen wird, kann jedoch niemand geben.... nicht einmal die wahren Experten ;-)
hier nochmals zum Vergleich die gsk-Kombi-Ergebnisse - da sind die 12.3 Monate medianPFS von Vemurafenib+Cobimetinib in CoBRIM doch sehr ambitiös:
1.) Dabrafenib (D) & Trametinib (T) vs. Vemurafenib
In this open-label, phase 3 trial, we randomly assigned 704 patients with metastatic melanoma with a BRAF V600 mutation to receive either a combination of dabrafenib (150 mg twice daily) and trametinib (2 mg once daily) or vemurafenib (960 mg twice daily) orally as first-line therapy. The primary end point was overall survival.
Results
At the preplanned interim overall survival analysis, which was performed after 77% of the total number of expected events occurred, the overall survival rate at 12 months was 72% (95% confidence interval [CI], 67 to 77) in the combination-therapy group and 65% (95% CI, 59 to 70) in the vemurafenib group (hazard ratio for death in the combination-therapy group, 0.69; 95% CI, 0.53 to 0.89; P=0.005). The prespecified interim stopping boundary was crossed, and the study was stopped for efficacy in July 2014. Median progression-free survival was 11.4 months in the combination-therapy group and 7.3 months in the vemurafenib group (hazard ratio, 0.56; 95% CI, 0.46 to 0.69; P<0.001). The objective response rate was 64% in the combination-therapy group and 51% in the vemurafenib group (P<0.001). Rates of severe adverse events and study-drug discontinuations were similar in the two groups. Cutaneous squamous-cell carcinoma and keratoacanthoma occurred in 1% of patients in the combination-therapy group and 18% of those in the vemurafenib group.
2.) D&T vs. D
9011^
Background: As monotherapies, the BRAF inhibitor dabrafenib (D) and the MEK inhibitor trametinib (T) demonstrated superior progression-free survival (PFS) v chemotherapy in pts with BRAFV600 mutant, metastatic melanoma (MM). Resistance develops in most pts, and oncogenic toxicities (e.g., cutaneous squamous carcinoma (cuSCC)) are associated with BRAF inhibition. Simultaneous inhibition of BRAF and MEK mitigated these effects in the Phase I/II study of D+T v D (NCT01072175), with an improvement in overall response rate (ORR), PFS and reduced frequency of cuSCC. This Phase III study (NCT01584648) was conducted to confirm the superiority of D+T over D in pts with BRAFV600E/K mutant MM. Methods: Pts were randomized 1:1 to receive D (150 mg twice daily) + T (2 mg once daily) or D+ placebo (P) as first-line therapy. Eligible pts were ≥18 years and ECOG performance status ≤1, with histologically confirmed unresectable stage IIIC or IV, BRAFV600E/K mutant cutaneous melanoma. The primary endpoint was investigator-assessed PFS; secondary endpoints were overall survival (OS), ORR, duration of response, and safety. Cross over was prohibited. The study has 95% power and a one-sided α=0.025 to detect a PFS hazard ratio (HR) of 0.59. Results: From May 2012 to Jan 2013, 423 pts were randomized (211 to D+T, 212 to D+P). Median follow up was 9 mo (0-16 mo). HR for investigator-assessed PFS was 0.75 (95% CI: 0.57, 0.99; p=0.035), in favor of D+T with a median PFS of 9.3 v 8.8 mo with D+P. The confirmed ORR was 67% (complete response [CR] 10%) for D+T and 51% (CR 9%) for D+P (p=0.0015). HR for interim OS was 0.63 (95% CI 0.42, 0.94; p=0.023), in favor of D+T (40 v 55 deaths). Rates of AEs were similar for both arms. More pts had AEs leading to dose modifications with D+T v D+P. Increased incidence (51% v 28%) and severity (grade 3, 6% v 2%) of pyrexia occurred with D+T v D+P. Fewer cutaneous hyperproliferative events occurred with D+T v D+P (CuSCC 2% v 9%; hyperkeratosis 3% v 32%).
1.) Dabrafenib (D) & Trametinib (T) vs. Vemurafenib
In this open-label, phase 3 trial, we randomly assigned 704 patients with metastatic melanoma with a BRAF V600 mutation to receive either a combination of dabrafenib (150 mg twice daily) and trametinib (2 mg once daily) or vemurafenib (960 mg twice daily) orally as first-line therapy. The primary end point was overall survival.
Results
At the preplanned interim overall survival analysis, which was performed after 77% of the total number of expected events occurred, the overall survival rate at 12 months was 72% (95% confidence interval [CI], 67 to 77) in the combination-therapy group and 65% (95% CI, 59 to 70) in the vemurafenib group (hazard ratio for death in the combination-therapy group, 0.69; 95% CI, 0.53 to 0.89; P=0.005). The prespecified interim stopping boundary was crossed, and the study was stopped for efficacy in July 2014. Median progression-free survival was 11.4 months in the combination-therapy group and 7.3 months in the vemurafenib group (hazard ratio, 0.56; 95% CI, 0.46 to 0.69; P<0.001). The objective response rate was 64% in the combination-therapy group and 51% in the vemurafenib group (P<0.001). Rates of severe adverse events and study-drug discontinuations were similar in the two groups. Cutaneous squamous-cell carcinoma and keratoacanthoma occurred in 1% of patients in the combination-therapy group and 18% of those in the vemurafenib group.
2.) D&T vs. D
9011^
Background: As monotherapies, the BRAF inhibitor dabrafenib (D) and the MEK inhibitor trametinib (T) demonstrated superior progression-free survival (PFS) v chemotherapy in pts with BRAFV600 mutant, metastatic melanoma (MM). Resistance develops in most pts, and oncogenic toxicities (e.g., cutaneous squamous carcinoma (cuSCC)) are associated with BRAF inhibition. Simultaneous inhibition of BRAF and MEK mitigated these effects in the Phase I/II study of D+T v D (NCT01072175), with an improvement in overall response rate (ORR), PFS and reduced frequency of cuSCC. This Phase III study (NCT01584648) was conducted to confirm the superiority of D+T over D in pts with BRAFV600E/K mutant MM. Methods: Pts were randomized 1:1 to receive D (150 mg twice daily) + T (2 mg once daily) or D+ placebo (P) as first-line therapy. Eligible pts were ≥18 years and ECOG performance status ≤1, with histologically confirmed unresectable stage IIIC or IV, BRAFV600E/K mutant cutaneous melanoma. The primary endpoint was investigator-assessed PFS; secondary endpoints were overall survival (OS), ORR, duration of response, and safety. Cross over was prohibited. The study has 95% power and a one-sided α=0.025 to detect a PFS hazard ratio (HR) of 0.59. Results: From May 2012 to Jan 2013, 423 pts were randomized (211 to D+T, 212 to D+P). Median follow up was 9 mo (0-16 mo). HR for investigator-assessed PFS was 0.75 (95% CI: 0.57, 0.99; p=0.035), in favor of D+T with a median PFS of 9.3 v 8.8 mo with D+P. The confirmed ORR was 67% (complete response [CR] 10%) for D+T and 51% (CR 9%) for D+P (p=0.0015). HR for interim OS was 0.63 (95% CI 0.42, 0.94; p=0.023), in favor of D+T (40 v 55 deaths). Rates of AEs were similar for both arms. More pts had AEs leading to dose modifications with D+T v D+P. Increased incidence (51% v 28%) and severity (grade 3, 6% v 2%) of pyrexia occurred with D+T v D+P. Fewer cutaneous hyperproliferative events occurred with D+T v D+P (CuSCC 2% v 9%; hyperkeratosis 3% v 32%).
Antwort auf Beitrag Nr.: 50.101.956 von Cyberhexe am 02.07.15 22:39:14by the way....Cobimetinib wird die Zulassung erhalten und zwar in Europa und in den USA - da bin ich mir sicher. Falls nicht, dann werde ich auf weitere Beiträge auf dieser Plattform bei wo vollständig verzichten!
Hinsichtlich Timeline erwarte ich nun die Zulassung in Europa durch die EMA auf Ende 2015 und in den USA durch die FDA vor Ablauf der neuen PDUFA am 11.11.2015.
Hinsichtlich Timeline erwarte ich nun die Zulassung in Europa durch die EMA auf Ende 2015 und in den USA durch die FDA vor Ablauf der neuen PDUFA am 11.11.2015.
Antwort auf Beitrag Nr.: 50.101.956 von Cyberhexe am 02.07.15 22:39:14Servus Hexe,
Du denkst also, daß die FDA mehr Zeit benötigt um die neuen Daten auszuwerten, wäre logisch oder gibt es Sicherheitbedenken, was meinst Du?
Die Meteor Daten können jetzt tagtäglich kommen, sie werden auf alle Fälle einschlagen wie ein Meteor, ob positiv oder negativ, yes I hope!
Du denkst also, daß die FDA mehr Zeit benötigt um die neuen Daten auszuwerten, wäre logisch oder gibt es Sicherheitbedenken, was meinst Du?
Die Meteor Daten können jetzt tagtäglich kommen, sie werden auf alle Fälle einschlagen wie ein Meteor, ob positiv oder negativ, yes I hope!

Antwort auf Beitrag Nr.: 50.110.506 von Magnetfeldfredy am 04.07.15 13:39:48ganz genau, die neuen coBRIM-Daten werden statistisch von der FDA ausgewertet bzw. überprüft, wonach mit grössster Wahrscheinlichkeit die Zulassung erteilt wird. Die neu berechneten Werte haben sich, wie bereits erwähnt, bis auf die Hazard Ratio noch einmal verbessert und da auch die Nebenwirkungen frühere Auswertungen bestätigen, sehe ich keinen Grund warum Cobi in der Kombitherapie mit Vemurafenib nicht zugelassen werden sollte. Gegenüber der Einzeltherapie ist das ein Quantensprung für die Patienten. Ich kann mir in Anbetracht der grossartigen Ergebnisse auch nur schwer vorstellen, dass die FDA die volle Zeit bis zum 11.11. benötigen wird , um eine Zulassungsentscheidung bekanntzugeben.
Danke für ein Fachwissen!
Antwort auf Beitrag Nr.: 50.102.055 von Cyberhexe am 02.07.15 22:58:35
Bei Biotechs ist nichts sicher. Soviel ist aber sicher.
Zitat von Cyberhexe: by the way....Cobimetinib wird die Zulassung erhalten und zwar in Europa und in den USA - da bin ich mir sicher. Falls nicht, dann werde ich auf weitere Beiträge auf dieser Plattform bei wo vollständig verzichten!
Hinsichtlich Timeline erwarte ich nun die Zulassung in Europa durch die EMA auf Ende 2015 und in den USA durch die FDA vor Ablauf der neuen PDUFA am 11.11.2015.
Bei Biotechs ist nichts sicher. Soviel ist aber sicher.

Ich bin nun ziemlich gespannt auf die METEOR Daten. Die sollten nun so langsam kommen.
Meiner Einschätzung nach ne 60:40 Spekulation... entweder < 1 USD (40%) oder > 6,5 (60%), zumindest beim PFS. Beim OS bin ich weniger optimistisch. Wir werden es sehen...
Meiner Einschätzung nach ne 60:40 Spekulation... entweder < 1 USD (40%) oder > 6,5 (60%), zumindest beim PFS. Beim OS bin ich weniger optimistisch. Wir werden es sehen...
Servus Ville,
bist Du auch mit an Bord?
bist Du auch mit an Bord?
Antwort auf Beitrag Nr.: 50.162.721 von Ville7 am 10.07.15 21:23:05betrachtet man die coBRIM-Ergebnisse im Detail und setzt voraus, dass Roche und Genentech richtig ausgewertet haben, dann ist die Wahrscheinlichkeit einer Zulassung nahezu 100%. Bleibt also nur die Ungewissheit über die internen Berechnungen der beteiligten Firmen. Und da bin ich mir ziemlich sicher (nahezu 100%), dass keine Fehler gemacht wurden. Biotech hin und Unsicherheit her, Roche ist der Biotech-Branchenprimus, der bisher weder durch formale noch durch Rechenfehler beim Zulassungsprozedere aufgefallen ist. Deswegen, sollte jemand an einer positiven Zulassungsentscheidung von Cobi/Vemurafenib zur Behandlung des schwarzen Melanoms zweifeln, ich wette jederzeit dagegen.
Von allergrösster Bedeutung bleibt dennoch die METEOR-Auswertung, wobei ich hier vorsichtig optimistisch bin. Gerade beim progressionsfreien Überleben hat Cabozantinib bisher in allen Indikationen gute bis sehr gute Ergebnisse geliefert. Sollte sich dieser Trend fortsetzen und der primäre Endpunkt erreicht werden - die Auswertung von Overall survival, als sekundärem Endpunkt, wird abschliessend wohl erst zu einem späteren Zeitpunkt erfolgen-, dann dürften zweistellige Kurse nicht ausser Reichweite sein.
Von allergrösster Bedeutung bleibt dennoch die METEOR-Auswertung, wobei ich hier vorsichtig optimistisch bin. Gerade beim progressionsfreien Überleben hat Cabozantinib bisher in allen Indikationen gute bis sehr gute Ergebnisse geliefert. Sollte sich dieser Trend fortsetzen und der primäre Endpunkt erreicht werden - die Auswertung von Overall survival, als sekundärem Endpunkt, wird abschliessend wohl erst zu einem späteren Zeitpunkt erfolgen-, dann dürften zweistellige Kurse nicht ausser Reichweite sein.
Ja Fredy ich bin auch dabei....
Cyberexe, wegen der Cobi-Verzögerung heißt es jetzt "All eyes on METEOR". Ohne gute Cabozantinib Daten sehe ich keinen finanziellen Erfolg für mein EXEL-Investment, nicht mal langfristig, trotz meinen niedrigen EK Kursen. Zu viel Kapitalbedarf - massive Verwässerung und das dann bei sehr niedrigen Kursen.
Cyberexe, wegen der Cobi-Verzögerung heißt es jetzt "All eyes on METEOR". Ohne gute Cabozantinib Daten sehe ich keinen finanziellen Erfolg für mein EXEL-Investment, nicht mal langfristig, trotz meinen niedrigen EK Kursen. Zu viel Kapitalbedarf - massive Verwässerung und das dann bei sehr niedrigen Kursen.
Bei den Stellenanzeigen ist nun seit längerer Zeit zumindest wieder einmal eine temporäre Stelle ausgeschrieben, nämlich:
Temporary Clinical Supplies Manager II
Job ID #: 1356 Location: South San Francisco, CA
Functional Area: Biotechnology Department: Chemistry, Manufacturing & Control
Position Type: Full-Time Temporary Education Required: Bachelors Degree
Experience Required: 5 - 7 Years Relocation Provided:
...und ausserdem:
Exelixis hat mit dem 48-jährigen Chris Senner einen neuen CFO (Jahresgehalt: 500 TSD$, sowie Optionen zu $3,66). Dieser war zuvor bei Gilead Vizedirektor in der Finanzabteilung und wechselt nun in ein Unternehmen, dessen Zukunft ungewiss sein soll!?!
Exelixis Appoints Chris Senner as Executive Vice President and Chief Financial Officer
-- Veteran pharmaceutical finance professional most recently served at Gilead Sciences --
SOUTH SAN FRANCISCO, Calif.--(BUSINESS WIRE)--Jul. 15, 2015-- Exelixis, Inc. (NASDAQ:EXEL) today announced the appointment of Christopher J. Senner as Executive Vice President and Chief Financial Officer. Mr. Senner has nearly 25 years of experience in biopharmaceutical finance, including deep expertise in global financial operations and controls, strategic planning and analysis, supply chain finance and business development. He joins Exelixis after five years at Gilead Sciences, where he served as Vice President, Corporate Finance. He previously spent eighteen years at Wyeth in a variety of financial roles with increasing responsibility for many of the company’s divisions and regions. He joins Exelixis in advance of several potentially transformational milestones anticipated this year, including top-line results from the METEOR phase 3 pivotal trial and the potential U.S. and EU regulatory approvals of cobimetinib, a compound discovered by Exelixis and then licensed to Genentech for further development and commercialization.
In this role, Mr. Senner will oversee the company’s global finance function, leveraging extensive experience gained earlier in his career. While at Gilead, he was accountable for controllership and operational financial planning and analysis, including research and development, manufacturing, commercial operations, and tax and treasury planning. At Wyeth, he served in a variety of capacities, most notably as CFO of the company’s $10 billion U.S. pharmaceuticals business and the BioPharma Business Unit, a $5 billion global inflammation, oncology and hematology business.
“With more than 25 years of service between two of the biopharmaceutical industry’s most highly-regarded companies, Chris Senner is exceptionally well prepared to lead Exelixis’ finance function as our next CFO,” said Michael M. Morrissey, Ph.D., President and Chief Executive Officer of Exelixis. “Chris’ global commercial finance expertise will serve Exelixis well as we prepare for top-line results from METEOR and the potential regulatory approval of cobimetinib, two milestones that we hope will advance and accelerate the company’s transformation into a global commercial organization.”
Mr. Senner will succeed Deborah Burke, who has served as Senior Vice President and Chief Financial Officer since September 2014. Ms. Burke joined Exelixis in 2005 and was the company’s Vice President, Finance and Controller before being appointed interim CFO in June 2014. She will remain with Exelixis in the role of Senior Vice President, Finance and Controller.
“I’d like to thank Debbie for her many contributions as Chief Financial Officer over this past year. Her support has been invaluable as we have navigated through a challenging time for the company,” continued Dr. Morrissey. “We are fortunate that we will continue to have the benefit of her input and experience as we move forward.”
“It is a very exciting time to join Exelixis,” said Mr. Senner. “Should its near-term catalysts prove positive, the company is poised to make additional, important contributions to the treatment of cancer and dramatically advance its commercial presence. I’m looking forward to working with Mike, Debbie and the rest of the Exelixis team to make the most of the potential opportunities that lie ahead.”
Temporary Clinical Supplies Manager II
Job ID #: 1356 Location: South San Francisco, CA
Functional Area: Biotechnology Department: Chemistry, Manufacturing & Control
Position Type: Full-Time Temporary Education Required: Bachelors Degree
Experience Required: 5 - 7 Years Relocation Provided:
...und ausserdem:
Exelixis hat mit dem 48-jährigen Chris Senner einen neuen CFO (Jahresgehalt: 500 TSD$, sowie Optionen zu $3,66). Dieser war zuvor bei Gilead Vizedirektor in der Finanzabteilung und wechselt nun in ein Unternehmen, dessen Zukunft ungewiss sein soll!?!
Exelixis Appoints Chris Senner as Executive Vice President and Chief Financial Officer
-- Veteran pharmaceutical finance professional most recently served at Gilead Sciences --
SOUTH SAN FRANCISCO, Calif.--(BUSINESS WIRE)--Jul. 15, 2015-- Exelixis, Inc. (NASDAQ:EXEL) today announced the appointment of Christopher J. Senner as Executive Vice President and Chief Financial Officer. Mr. Senner has nearly 25 years of experience in biopharmaceutical finance, including deep expertise in global financial operations and controls, strategic planning and analysis, supply chain finance and business development. He joins Exelixis after five years at Gilead Sciences, where he served as Vice President, Corporate Finance. He previously spent eighteen years at Wyeth in a variety of financial roles with increasing responsibility for many of the company’s divisions and regions. He joins Exelixis in advance of several potentially transformational milestones anticipated this year, including top-line results from the METEOR phase 3 pivotal trial and the potential U.S. and EU regulatory approvals of cobimetinib, a compound discovered by Exelixis and then licensed to Genentech for further development and commercialization.
In this role, Mr. Senner will oversee the company’s global finance function, leveraging extensive experience gained earlier in his career. While at Gilead, he was accountable for controllership and operational financial planning and analysis, including research and development, manufacturing, commercial operations, and tax and treasury planning. At Wyeth, he served in a variety of capacities, most notably as CFO of the company’s $10 billion U.S. pharmaceuticals business and the BioPharma Business Unit, a $5 billion global inflammation, oncology and hematology business.
“With more than 25 years of service between two of the biopharmaceutical industry’s most highly-regarded companies, Chris Senner is exceptionally well prepared to lead Exelixis’ finance function as our next CFO,” said Michael M. Morrissey, Ph.D., President and Chief Executive Officer of Exelixis. “Chris’ global commercial finance expertise will serve Exelixis well as we prepare for top-line results from METEOR and the potential regulatory approval of cobimetinib, two milestones that we hope will advance and accelerate the company’s transformation into a global commercial organization.”
Mr. Senner will succeed Deborah Burke, who has served as Senior Vice President and Chief Financial Officer since September 2014. Ms. Burke joined Exelixis in 2005 and was the company’s Vice President, Finance and Controller before being appointed interim CFO in June 2014. She will remain with Exelixis in the role of Senior Vice President, Finance and Controller.
“I’d like to thank Debbie for her many contributions as Chief Financial Officer over this past year. Her support has been invaluable as we have navigated through a challenging time for the company,” continued Dr. Morrissey. “We are fortunate that we will continue to have the benefit of her input and experience as we move forward.”
“It is a very exciting time to join Exelixis,” said Mr. Senner. “Should its near-term catalysts prove positive, the company is poised to make additional, important contributions to the treatment of cancer and dramatically advance its commercial presence. I’m looking forward to working with Mike, Debbie and the rest of the Exelixis team to make the most of the potential opportunities that lie ahead.”
Cabozantinib
Alternative Names: BMS-907351; Cabozantinib s-malate; Cometriq; XL-184
Latest Information Update: 15 Jul 2015
At a glance
Originator: Exelixis
Developer:
Dana-Farber Cancer Institute; Duke University Medical Center; Exelixis; Massachusetts General Hospital; Memorial Sloan-Kettering Cancer Center; National Cancer Institute (USA); Swedish Orphan Biovitrum
Class:
Anilides; Antineoplastics; Cyclopropanes; Quinolines; Small molecules
Mechanism of Action
Proto oncogene protein c met inhibitors; Proto oncogene protein c ret inhibitors; Vascular endothelial growth factor receptor-2 antagonists
Orphan Drug Status: Yes - Thyroid cancer
On Fast track: Renal cancer
New Molecular Entity: Yes
Highest Development Phases
Marketed:
Thyroid cancer
Phase III:
Hepatocellular carcinoma; Renal cancer
Phase II:
Astrocytoma; Breast cancer; Cholangiocarcinoma; Glioblastoma; Merkel cell carcinoma; Non-small cell lung cancer; Ovarian cancer; Solid tumours; Urogenital cancer
Phase I:
Acute myeloid leukaemia; Cancer; Colorectal cancer; Multiple myeloma
Suspended
Prostate cancer
Alternative Names: BMS-907351; Cabozantinib s-malate; Cometriq; XL-184
Latest Information Update: 15 Jul 2015
At a glance
Originator: Exelixis
Developer:
Dana-Farber Cancer Institute; Duke University Medical Center; Exelixis; Massachusetts General Hospital; Memorial Sloan-Kettering Cancer Center; National Cancer Institute (USA); Swedish Orphan Biovitrum
Class:
Anilides; Antineoplastics; Cyclopropanes; Quinolines; Small molecules
Mechanism of Action
Proto oncogene protein c met inhibitors; Proto oncogene protein c ret inhibitors; Vascular endothelial growth factor receptor-2 antagonists
Orphan Drug Status: Yes - Thyroid cancer
On Fast track: Renal cancer
New Molecular Entity: Yes
Highest Development Phases
Marketed:
Thyroid cancer
Phase III:
Hepatocellular carcinoma; Renal cancer
Phase II:
Astrocytoma; Breast cancer; Cholangiocarcinoma; Glioblastoma; Merkel cell carcinoma; Non-small cell lung cancer; Ovarian cancer; Solid tumours; Urogenital cancer
Phase I:
Acute myeloid leukaemia; Cancer; Colorectal cancer; Multiple myeloma
Suspended
Prostate cancer
HUUUUUU...
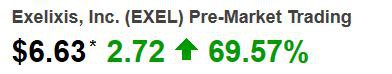
Deswegen sind wir dabei!
Gruß an alle
TwoPack

Deswegen sind wir dabei!
Gruß an alle
TwoPack
Das ist nahe am homerun. Glückwunsch!
Yeah, another winner!!!! Die Daten sehen auf den ersten Blick sogar sensationell gut aus.
Glückwunsch an die anderen Mutigen!
Glückwunsch an die anderen Mutigen!
Ou yes! Da freuen wir uns!
Vorbörslich aktuell bei nur noch knapp über 5 USD. Sicherlich kommt die nächste KE bald, aber bei den Daten und dem daraus resultierenden Potential m.E. im Moment zu billig.
Was für ein Timing! Der Rückgang hängt mit "noch besseren" Ergebnissen von BMY zusammen. Die fast zeitgleiche Bekanntgabe kann ja fast kein Zufall sein, oder?
http://www.fiercebiotech.com/story/bristol-myers-flags-early…
http://www.fiercebiotech.com/story/bristol-myers-flags-early…
Antwort auf Beitrag Nr.: 50.224.032 von kmastra am 20.07.15 14:45:39Ja, bitter für EXEL, aber gut für Patienten.
Noch gibt es bei Nivolumab keine konkreten Daten, aber die werden wahrscheinlich sehr überzeugend sein.
PRINCETON, N.J.--(BUSINESS WIRE)--Bristol-Myers Squibb Company (NYSE:BMY) today announced that an open-label, randomized Phase III study evaluating Opdivo (nivolumab) versus everolimus in previously-treated patients with advanced or metastatic renal cell carcinoma (RCC) was stopped early because an assessment conducted by the independent Data Monitoring Committee (DMC) concluded that the study met its endpoint, demonstrating superior overall survival in patients receiving Opdivo compared to the control arm. The company looks forward to sharing these data with health authorities soon.
“The results of CheckMate -025 mark the first time an Immuno-Oncology agent has demonstrated a survival advantage in advanced renal cell carcinoma, a patient group that currently has limited treatment options,” said Michael Giordano, senior vice president, Head of Development, Oncology, Bristol-Myers Squibb. “Through our Opdivo clinical development program, we aim to redefine treatment expectations for patients with advanced RCC by providing improved survival.”
CheckMate -025 investigators are being informed of the decision to stop the comparative portion of the trial. Bristol-Myers Squibb is working to ensure that eligible patients will be informed of the opportunity to continue or start treatment with Opdivo in an open-label extension as part of the company’s commitment to providing patient access to Opdivo, and characterizing long-term survival. The company will complete a full evaluation of the final CheckMate -025 data and work with investigators on the future presentation and publication of the results.
So ist Biotech...
Noch gibt es bei Nivolumab keine konkreten Daten, aber die werden wahrscheinlich sehr überzeugend sein.
PRINCETON, N.J.--(BUSINESS WIRE)--Bristol-Myers Squibb Company (NYSE:BMY) today announced that an open-label, randomized Phase III study evaluating Opdivo (nivolumab) versus everolimus in previously-treated patients with advanced or metastatic renal cell carcinoma (RCC) was stopped early because an assessment conducted by the independent Data Monitoring Committee (DMC) concluded that the study met its endpoint, demonstrating superior overall survival in patients receiving Opdivo compared to the control arm. The company looks forward to sharing these data with health authorities soon.
“The results of CheckMate -025 mark the first time an Immuno-Oncology agent has demonstrated a survival advantage in advanced renal cell carcinoma, a patient group that currently has limited treatment options,” said Michael Giordano, senior vice president, Head of Development, Oncology, Bristol-Myers Squibb. “Through our Opdivo clinical development program, we aim to redefine treatment expectations for patients with advanced RCC by providing improved survival.”
CheckMate -025 investigators are being informed of the decision to stop the comparative portion of the trial. Bristol-Myers Squibb is working to ensure that eligible patients will be informed of the opportunity to continue or start treatment with Opdivo in an open-label extension as part of the company’s commitment to providing patient access to Opdivo, and characterizing long-term survival. The company will complete a full evaluation of the final CheckMate -025 data and work with investigators on the future presentation and publication of the results.
So ist Biotech...
Ja, bitter für EXEL, aber gut für Patienten.
Absolut! Zumal Cabo ja auch noch als Alternative zur Verfügung steht für diejendigen, die auf Nivo nicht ansprechen - und das wird ja ein Großteil sein. Finde den Anstieg von EXEL fast schon zu moderat - ist ja jetzt nicht überflüssig geworden!
Absolut! Zumal Cabo ja auch noch als Alternative zur Verfügung steht für diejendigen, die auf Nivo nicht ansprechen - und das wird ja ein Großteil sein. Finde den Anstieg von EXEL fast schon zu moderat - ist ja jetzt nicht überflüssig geworden!
Antwort auf Beitrag Nr.: 50.224.104 von SLGramann am 20.07.15 14:52:22Um so bitterer - du weißt das SLGramann - wenn einem das Produkt, das einem heute die Party etwas verdirbt, vor 6 Jahren von BMS quasi gestohlen wurde (über den skandalösen MEDX Verkauf)...
Antwort auf Beitrag Nr.: 50.224.293 von Ville7 am 20.07.15 15:11:02die Medarex wäre heute über 100 USD wert...und nicht die popligen 16 USD Zwangsenteignung...
Vielen Dank an Cyberhexe für die einmaligen fachkundigen Beiträge zu Exilixis!
Was meint ihr wie sich der Kurs in den nächsten Tagen noch entwickeln wird? Ab wieviel werdet ihr verkaufen?
Liebe Grüsse und eine frohen Tag bei diesen super News!
Und danke für eure Hilfe, besonders an Cyberhexe!
Liebe Grüsse und eine frohen Tag bei diesen super News!
Und danke für eure Hilfe, besonders an Cyberhexe!
Antwort auf Beitrag Nr.: 50.224.104 von SLGramann am 20.07.15 14:52:22"Ja, bitter für EXEL, aber gut für Patienten."
Sehr schön... METEOR hatte wohl die höchste Erfolgswahrscheinlichkeit, gut das es geklappt hat!
Warum soll Nivo Carbo in RCC stoppen? Es handelt sich nicht zwangsläufig um Konkurrenten. In RCC ist VEGF etabliert... IO wird daran nichts ändern bzw. gilt VEGF als ein möglicher synergetisches Target mit VEGF. Carbo's MET-Hemmung könnte eventuellen VEGF-Resistenzen entgegenwirken, wodurch Carbo auch 1st-line interessant sein könnte.
Ein wenig überrascht bin ich, dass Carbo in METEOR auch von den Nebenwirkungen nicht so gravierend ist, denn dies war zuletzt ein großer Kritikpunkt insbesondere bei NSCLC (wo die Ergebnisse bezügl. der Wirksamkeit nicht so schlecht aussahen, auch unabhängig von RET).
Vor Kurzen wurde z.B. in Blasenkrebs eine Carbo + Nivo Kombi gestartet:
http://finance.yahoo.com/news/exelixis-announces-start-phase…
"“There is a strong rationale for combining cabozantinib with immunoncology agents, including clinical evidence of the compound’s ability to create a more immune-permissive environment, as well as preclinical data that suggest cabozantinib increases T-cell infiltration into tumors,” said Michael M. Morrissey, Ph.D., president and chief executive officer of Exelixis. “In addition to bladder cancer, we believe that data on the tolerability and activity of the therapy combinations studied in this trial could have relevance in other disease settings, including non-small cell lung cancer and kidney cancer.”
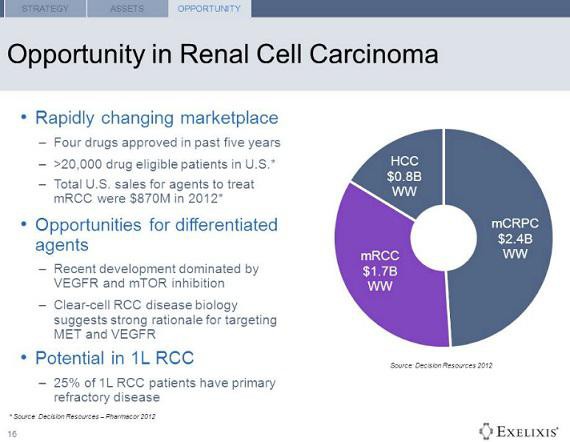
Gruß
ipollit
Sehr schön... METEOR hatte wohl die höchste Erfolgswahrscheinlichkeit, gut das es geklappt hat!

Warum soll Nivo Carbo in RCC stoppen? Es handelt sich nicht zwangsläufig um Konkurrenten. In RCC ist VEGF etabliert... IO wird daran nichts ändern bzw. gilt VEGF als ein möglicher synergetisches Target mit VEGF. Carbo's MET-Hemmung könnte eventuellen VEGF-Resistenzen entgegenwirken, wodurch Carbo auch 1st-line interessant sein könnte.
Ein wenig überrascht bin ich, dass Carbo in METEOR auch von den Nebenwirkungen nicht so gravierend ist, denn dies war zuletzt ein großer Kritikpunkt insbesondere bei NSCLC (wo die Ergebnisse bezügl. der Wirksamkeit nicht so schlecht aussahen, auch unabhängig von RET).
Vor Kurzen wurde z.B. in Blasenkrebs eine Carbo + Nivo Kombi gestartet:
http://finance.yahoo.com/news/exelixis-announces-start-phase…
"“There is a strong rationale for combining cabozantinib with immunoncology agents, including clinical evidence of the compound’s ability to create a more immune-permissive environment, as well as preclinical data that suggest cabozantinib increases T-cell infiltration into tumors,” said Michael M. Morrissey, Ph.D., president and chief executive officer of Exelixis. “In addition to bladder cancer, we believe that data on the tolerability and activity of the therapy combinations studied in this trial could have relevance in other disease settings, including non-small cell lung cancer and kidney cancer.”

Gruß
ipollit
Antwort auf Beitrag Nr.: 50.224.293 von Ville7 am 20.07.15 15:11:02Um so bitterer - du weißt das SLGramann - wenn einem das Produkt, das einem heute die Party etwas verdirbt, vor 6 Jahren von BMS quasi gestohlen wurde (über den skandalösen MEDX Verkauf)...
Nicht zu vergessen ist aber auch, dass Cabo bzw. XL184 ursprünglich von BMS einlizensiert wurde für über 200 Mio USD, die an EXEL gingen... später wurde es wieder an EXEL zurückgegeben:
http://ir.exelixis.com/phoenix.zhtml?c=120923&p=irol-newsArt…
Gruß
ipollit[/url]
Nicht zu vergessen ist aber auch, dass Cabo bzw. XL184 ursprünglich von BMS einlizensiert wurde für über 200 Mio USD, die an EXEL gingen... später wurde es wieder an EXEL zurückgegeben:
http://ir.exelixis.com/phoenix.zhtml?c=120923&p=irol-newsArt…
Gruß
ipollit[/url]
Ohad Hammer scheint auch wieder eine Position aufgenommen zu haben.
Wer ist Ohad Hammer?
Antwort auf Beitrag Nr.: 50.236.029 von Magnetfeldfredy am 21.07.15 21:24:57http://www.orf-blog.com/tag/exel/
Ohad Hammer - ein Blogger zu BioTechs.
Ohad Hammer - ein Blogger zu BioTechs.
Exelixis hat gestern nachbörslich eine Kapitalerhöung engekündigt. Sie hätten die Aktie ruhig noch etwas laufen lassen können bevor sie das tun... aber der neue CFO will wohl auf sicher spielen.
Antwort auf Beitrag Nr.: 50.237.322 von TwoPack am 22.07.15 01:30:05Danke!

Antwort auf Beitrag Nr.: 50.237.520 von Ville7 am 22.07.15 06:55:02"Exelixis hat gestern nachbörslich eine Kapitalerhöung engekündigt. Sie hätten die Aktie ruhig noch etwas laufen lassen können bevor sie das tun... aber der neue CFO will wohl auf sicher spielen."
Ja, so wird der dringendste Cash-Bedarf schnell gestillt und man verbessert auch ein wenig die Verhandlungsposition hinsichtlich einer Auslizensierung der Nicht-US-Rechte an Cabo, die vermutlich in nicht all zu ferner Zukunft erfolgen wird. Das dürfte dann ebenfalls einiges an Cash einspielen.
Ja, so wird der dringendste Cash-Bedarf schnell gestillt und man verbessert auch ein wenig die Verhandlungsposition hinsichtlich einer Auslizensierung der Nicht-US-Rechte an Cabo, die vermutlich in nicht all zu ferner Zukunft erfolgen wird. Das dürfte dann ebenfalls einiges an Cash einspielen.
Auf investorvillage postet ein User:
ARRY/AZN: MEK inhibitor didnt meet primary endpoint!
it seems that Cobimetinib has a lead over Selumetinib!
BOULDER, Colo., July 22, 2015 /PRNewswire/ -- AstraZeneca today announced that the Phase 3 SUMIT study of selumetinib in combination with dacarbazine for the treatment of patients with metastatic uveal melanoma did not meet its primary endpoint of progression free survival.
http://finance.yahoo.com/news/astrazeneca-provides-selumetin…
ARRY/AZN: MEK inhibitor didnt meet primary endpoint!
it seems that Cobimetinib has a lead over Selumetinib!
BOULDER, Colo., July 22, 2015 /PRNewswire/ -- AstraZeneca today announced that the Phase 3 SUMIT study of selumetinib in combination with dacarbazine for the treatment of patients with metastatic uveal melanoma did not meet its primary endpoint of progression free survival.
http://finance.yahoo.com/news/astrazeneca-provides-selumetin…
Antwort auf Beitrag Nr.: 50.243.361 von TwoPack am 22.07.15 18:12:02"it seems that Cobimetinib has a lead over Selumetinib!"
Das geht mir derzeit zu weit. Da werden Äpfel mit Birnen verglichen. Man vergisst scheinbar auch schnell, dass auch Cabo schon mal krachend gescheitert ist (CRPC).
Das geht mir derzeit zu weit. Da werden Äpfel mit Birnen verglichen. Man vergisst scheinbar auch schnell, dass auch Cabo schon mal krachend gescheitert ist (CRPC).
So ein Schmarrn, das geht mir zuweit, Cabo hat sensationelle Ergebnisse geliefert und Exelixis steht kurz vor der Zulassung für schwarzen Hautkrebs, hat 40 vielversprechende Trials laufen, Übernahmeziel mit mindestens double Digits!
Antwort auf Beitrag Nr.: 50.243.481 von SLGramann am 22.07.15 18:31:03Die Aussage ist, dass der MEK-Hemmer Cobimetinib beim schwarzen Hautkrebs (locally advanced or metastatic melanoma) kurz vor der Zulassung steht (in US and EU), jedoch der MEK-Hemmer Selumetinib in ph3 bei der Therapie des Aderhautmelanoms (Uveal melanoma) ducrhgefallen ist. Auch wenn die Indikation nicht ganz identisch ist, so hat dennoch Cobi gegenüber Selumetinib bei der Behandlung des Melanoms auf alle Fälle die Nase vorn.
Ich rechne mit einer US-Zulassung von Cobi vor Ablauf der verlängerten PDUFA (11.11.15)...im August wohl nicht, möglicherweise (Ende) September, wahrscheinlich im Oktober. In Europa dauerts wieder mal länger, obschon der Antrag 3 Monate eher eingereicht wurde. Da derzeit die Uhr der Zulassungsprozedur steht (day 180 zur Klärung von Outstanding Issues --> gemeint sind die coBRIM updates), dürfte eine Zulassunsempfehlung des CHMP nicht vor September ausgesprochen werden (day 210). Die Zulassungsentscheidung der Kommission verzögert sich dann noch einmal um 67 Tage, so dass die Zulassung selbst nicht vor November ausgesprochen werden wird. Auf alle Fälle dürfte Roche/Genentech auf die Markteinführung bereits bestens vorbereitet sein, so dass von einer zügigen Vermarktung der Kombitherapie (Vemurafenib/Cobi) auszugehen ist. Spätestens dann sollten einstellige Kurse bei EXEL der Vergangenheit angehören.
...by the way greetings from Franca
Ich rechne mit einer US-Zulassung von Cobi vor Ablauf der verlängerten PDUFA (11.11.15)...im August wohl nicht, möglicherweise (Ende) September, wahrscheinlich im Oktober. In Europa dauerts wieder mal länger, obschon der Antrag 3 Monate eher eingereicht wurde. Da derzeit die Uhr der Zulassungsprozedur steht (day 180 zur Klärung von Outstanding Issues --> gemeint sind die coBRIM updates), dürfte eine Zulassunsempfehlung des CHMP nicht vor September ausgesprochen werden (day 210). Die Zulassungsentscheidung der Kommission verzögert sich dann noch einmal um 67 Tage, so dass die Zulassung selbst nicht vor November ausgesprochen werden wird. Auf alle Fälle dürfte Roche/Genentech auf die Markteinführung bereits bestens vorbereitet sein, so dass von einer zügigen Vermarktung der Kombitherapie (Vemurafenib/Cobi) auszugehen ist. Spätestens dann sollten einstellige Kurse bei EXEL der Vergangenheit angehören.
...by the way greetings from Franca

Antwort auf Beitrag Nr.: 50.243.676 von Magnetfeldfredy am 22.07.15 18:54:20
du verwechselst Cabo mit Cobi. Aber egal, Birnen sind auch nur Äpfel!
Zitat von Magnetfeldfredy: So ein Schmarrn, das geht mir zuweit, Cabo hat sensationelle Ergebnisse geliefert und Exelixis steht kurz vor der Zulassung für schwarzen Hautkrebs, hat 40 vielversprechende Trials laufen, Übernahmeziel mit mindestens double Digits!
du verwechselst Cabo mit Cobi. Aber egal, Birnen sind auch nur Äpfel!

Antwort auf Beitrag Nr.: 50.245.857 von Cyberhexe am 23.07.15 07:04:29Okay, machen wir mal eine Newsflow-Erwartungsliste:
2015-07: Kapitalerhöhung
2015/08-12: Partner für Cabozantinib in ex-US
2015/10: Zulassung Cobi in USA
2015/12: Zulassung Cobi in Europa
2016/01-03: Zulassungsantrag Cabozantinib RCC
2016/03-05: priority review für Cabozantinib RCC
2016: HCC Daten Cabozantinib (OS Endpoint)
2016: RCC finale Daten Cabozantinib
2016/8-12: um RCC erweiterte Zulassung Cabozantinib in USA
2017: um RCC erweiterte Zulassung Cabozantinib in Europa
Noch was?
(muss meinen optimalen Ausstiegszeitpunkt anvisieren )
)
2015-07: Kapitalerhöhung
2015/08-12: Partner für Cabozantinib in ex-US
2015/10: Zulassung Cobi in USA
2015/12: Zulassung Cobi in Europa
2016/01-03: Zulassungsantrag Cabozantinib RCC
2016/03-05: priority review für Cabozantinib RCC
2016: HCC Daten Cabozantinib (OS Endpoint)
2016: RCC finale Daten Cabozantinib
2016/8-12: um RCC erweiterte Zulassung Cabozantinib in USA
2017: um RCC erweiterte Zulassung Cabozantinib in Europa
Noch was?
(muss meinen optimalen Ausstiegszeitpunkt anvisieren
 )
)
Antwort auf Beitrag Nr.: 50.247.327 von Ville7 am 23.07.15 10:14:32die sehr gute Auflistung könnte man noch ergänzen, und zwar ...
... dem Ergebnis der Studie... "A Phase 1b Study of MPDL3280A (an Engineered Anti-PDL1 Antibody) in Combination With Cobimetinib in Patients With Locally Advanced or Metastatic Solid Tumors (NCT01988896)" ..., welche derzeit ausgewertet wird. Sollte Cobi zusammen mit Atezolizumab (generic name des immunologisch wirksamen mAK MPDL3280A von Roche/Genentech) viel versprechende Ergebnisse liefern, dann dürfte dies wohl endgültig das Fass zum Überlaufen bringen bzw (etwas verständlicher) dann dürfte die Zeit für eine Übernahme von Exelixis durch Roche fällig sein.
...ausserdem gilt es zu beachten, dass die Ergebnisse der ph2 Studie von Cobi mit Paclitaxel von Roche/Genentech zur Behandlung von TNBC (Triple Negative Breast Cancer) irgendwann in 2016 bekannt gegeben werden. Daran anschliessend wird eine "LIP go decision" (LIP für Lifecycle Investment Point) erforderlich sein, ob diese Verbindung in ph3 geprüft werden soll. Eine Zulassung wird jedoch nicht vor 2019 möglich sein (wohl eher erst in 2020).
Abschliessend ist zu befürchten, dass Exelixis (ähnlich wie Medarex) übernommen wird, bevor das ganze Potenzial von Cobimetinib ersichtlich wird. Denn Cobi hat auf alle Fälle Blockbuster-Potenzial (Jahresunsatz > 1 Mrd USD)!!
Falls dies so eintreffen sollte, dann rechtfertigt davon knapp die Hälfte eine Marktkapitalisierung von mindestens 5 Milliarden USD (d.h. mindestens > 20 USD/Aktie)...but time will tell!
... dem Ergebnis der Studie... "A Phase 1b Study of MPDL3280A (an Engineered Anti-PDL1 Antibody) in Combination With Cobimetinib in Patients With Locally Advanced or Metastatic Solid Tumors (NCT01988896)" ..., welche derzeit ausgewertet wird. Sollte Cobi zusammen mit Atezolizumab (generic name des immunologisch wirksamen mAK MPDL3280A von Roche/Genentech) viel versprechende Ergebnisse liefern, dann dürfte dies wohl endgültig das Fass zum Überlaufen bringen bzw (etwas verständlicher) dann dürfte die Zeit für eine Übernahme von Exelixis durch Roche fällig sein.
...ausserdem gilt es zu beachten, dass die Ergebnisse der ph2 Studie von Cobi mit Paclitaxel von Roche/Genentech zur Behandlung von TNBC (Triple Negative Breast Cancer) irgendwann in 2016 bekannt gegeben werden. Daran anschliessend wird eine "LIP go decision" (LIP für Lifecycle Investment Point) erforderlich sein, ob diese Verbindung in ph3 geprüft werden soll. Eine Zulassung wird jedoch nicht vor 2019 möglich sein (wohl eher erst in 2020).
Abschliessend ist zu befürchten, dass Exelixis (ähnlich wie Medarex) übernommen wird, bevor das ganze Potenzial von Cobimetinib ersichtlich wird. Denn Cobi hat auf alle Fälle Blockbuster-Potenzial (Jahresunsatz > 1 Mrd USD)!!
Falls dies so eintreffen sollte, dann rechtfertigt davon knapp die Hälfte eine Marktkapitalisierung von mindestens 5 Milliarden USD (d.h. mindestens > 20 USD/Aktie)...but time will tell!
Ohad Hammer hat in seinem Blog was zu EXEL geschrieben. Wie imer sehr lesenswert:
http://www.orf-blog.com/exelixis-renal-cancer-data-are-too-g…
http://www.orf-blog.com/exelixis-renal-cancer-data-are-too-g…
Antwort auf Beitrag Nr.: 50.318.733 von kmastra am 03.08.15 11:34:44Hammer schreibt:
"Exelixis also has co-promotion rights for Roche’s MEK inhibitor that is expected to reach the market next year for BRAF+ melanoma. As cobimetinib (cobi) will be the second MEK inhibitor approved for this indication, expectations are low but the drug could still generate $100M for Exelixis via direct sales and royalties."
...ich schätze mal, dass Cobi im September oder Oktober 2015 von der FDA zugelassen wird, bei der EMA in Europa dürfte es wohl November werden. Obschon ich ursprünglich mit früheren Zulassungsdaten vor allem in den US gerechnet habe, bin ich mir jedoch ziemlich sicher, dass Roche/Genentech bereits in den Startlöchern ist und am Tag nach der Zulassung die Vermarktung aufnehmen wird.
Cobi ist nach Trametinib (Handelsname Mekinist) tatsächlich der 2. MEK-Hemmer mit anti-cancerogener Aktivität, der die Vermarktung erreichen wird. Allerdings ist die grösste Effizienz der MEK-Hemmer dann gegeben, wenn diese mit einem weiteren Wirkstoff in Kombitherapie appliziert werden, und zwar mit einem Arzneistoff aus der Gruppe der Proteinkinaseinhibitoren, der die Funktion des Proteins B-Raf hemmt: Cobi zusammen mit Vemurafenib (Roche/Genentech) und Trametinib gemeinsam mit Dabrafenib (gsk/Novartis).
Die bisher verfügbaren Ergebnisse (PFS, OS) scheinen die Roche-Verbindung zu favorisieren, so dass der Cobi-Umsatz (peak sales) für die Indikation mMelanoma sicherlich 100m USD übersteigen sollte. Weil darüber hinaus etliche weitere Therapien in der Klinik mit Cobi getestet werden (die Theorie besagt, dass Cobi das Therapieversagen anderer Wirkstoffe verzögern soll), besteht durchaus die berechtigte Hoffnung, dass Cobi Blockbuster-Potenzial errreichen kann/wird - natürlich nicht vor 2020.
"Exelixis also has co-promotion rights for Roche’s MEK inhibitor that is expected to reach the market next year for BRAF+ melanoma. As cobimetinib (cobi) will be the second MEK inhibitor approved for this indication, expectations are low but the drug could still generate $100M for Exelixis via direct sales and royalties."
...ich schätze mal, dass Cobi im September oder Oktober 2015 von der FDA zugelassen wird, bei der EMA in Europa dürfte es wohl November werden. Obschon ich ursprünglich mit früheren Zulassungsdaten vor allem in den US gerechnet habe, bin ich mir jedoch ziemlich sicher, dass Roche/Genentech bereits in den Startlöchern ist und am Tag nach der Zulassung die Vermarktung aufnehmen wird.
Cobi ist nach Trametinib (Handelsname Mekinist) tatsächlich der 2. MEK-Hemmer mit anti-cancerogener Aktivität, der die Vermarktung erreichen wird. Allerdings ist die grösste Effizienz der MEK-Hemmer dann gegeben, wenn diese mit einem weiteren Wirkstoff in Kombitherapie appliziert werden, und zwar mit einem Arzneistoff aus der Gruppe der Proteinkinaseinhibitoren, der die Funktion des Proteins B-Raf hemmt: Cobi zusammen mit Vemurafenib (Roche/Genentech) und Trametinib gemeinsam mit Dabrafenib (gsk/Novartis).
Die bisher verfügbaren Ergebnisse (PFS, OS) scheinen die Roche-Verbindung zu favorisieren, so dass der Cobi-Umsatz (peak sales) für die Indikation mMelanoma sicherlich 100m USD übersteigen sollte. Weil darüber hinaus etliche weitere Therapien in der Klinik mit Cobi getestet werden (die Theorie besagt, dass Cobi das Therapieversagen anderer Wirkstoffe verzögern soll), besteht durchaus die berechtigte Hoffnung, dass Cobi Blockbuster-Potenzial errreichen kann/wird - natürlich nicht vor 2020.
Antwort auf Beitrag Nr.: 50.324.058 von Cyberhexe am 03.08.15 22:56:40Cobimetinib wird zusammen mit Duligotuzmab in der Klinik geprüft und zwar zur Behandlung von lokalem oder metastasierenden Krebs mit KRAS-Mutationen. Roche hat ebenfalls einen diagnostischen Test entwickelt, mit welchem eben dieser KRAS-Mutationsstatus in Krebszellen zu bestimmen ist. Dieser Test wurde bereits im Mai 2015 von der FDA zugelassen.
Roche Obtains FDA Approval For Cobas KRAS Mutation Test - Quick Facts
By RTT News, May 11, 2015, 01:15:00 AM EDT
(RTTNews.com) - Roche (RHHBY.PK) announced Monday that the U.S. Food and Drug Administration has approved the cobas KRAS Mutation Test for diagnostic use. The real-time PCR test is designed to identify KRAS mutations in tumor samples from metastatic colorectal cancer or mCRC patients and aid clinicians in determining a therapeutic path for them.
A Study of MEHD7945A and Cobimetinib (GDC-0973) in Patients With Locally Advanced or Metastatic Cancers With Mutant KRAS
https://clinicaltrials.gov/ct2/show/NCT01986166
Duligotuzmab (Anti-HER3/EGFR, MEHD7945A, RG7597), a dual action antibody, is a phage-derived, human IgG1 monoclonal antibody that is designed to target human epidermal growth factor receptor 3 (HER3) and epidermal growth factor receptor (EGFR).
Mechanism of Action / Target
Receptor tyrosine kinase signaling, anti-human epidermal growth factor receptor 3 (HER3) and epidermal growth factor receptor (EGFR) dual action antibody
Roche Obtains FDA Approval For Cobas KRAS Mutation Test - Quick Facts
By RTT News, May 11, 2015, 01:15:00 AM EDT
(RTTNews.com) - Roche (RHHBY.PK) announced Monday that the U.S. Food and Drug Administration has approved the cobas KRAS Mutation Test for diagnostic use. The real-time PCR test is designed to identify KRAS mutations in tumor samples from metastatic colorectal cancer or mCRC patients and aid clinicians in determining a therapeutic path for them.
A Study of MEHD7945A and Cobimetinib (GDC-0973) in Patients With Locally Advanced or Metastatic Cancers With Mutant KRAS
https://clinicaltrials.gov/ct2/show/NCT01986166
Duligotuzmab (Anti-HER3/EGFR, MEHD7945A, RG7597), a dual action antibody, is a phage-derived, human IgG1 monoclonal antibody that is designed to target human epidermal growth factor receptor 3 (HER3) and epidermal growth factor receptor (EGFR).
Mechanism of Action / Target
Receptor tyrosine kinase signaling, anti-human epidermal growth factor receptor 3 (HER3) and epidermal growth factor receptor (EGFR) dual action antibody
Wiedermal Danke Hexe für Deine Beiträge!!
Wirklich beeindruckend, die Pipeline von Genentech.
http://www.gene.com/medical-professionals/pipeline
Und die Zusammenarbeit sicher ein Segen für Exelixis.
Faszinierend dieses Duligotuzmab und die ganze Phagen-Thematik!
Das Phagen-Display:
https://de.wikipedia.org/wiki/Phagen-Display
Wirklich beeindruckend, die Pipeline von Genentech.
http://www.gene.com/medical-professionals/pipeline
Und die Zusammenarbeit sicher ein Segen für Exelixis.
Faszinierend dieses Duligotuzmab und die ganze Phagen-Thematik!
Das Phagen-Display:
https://de.wikipedia.org/wiki/Phagen-Display
Antwort auf Beitrag Nr.: 50.345.163 von TwoPack am 06.08.15 13:59:40Was macht für dich Phage Display in Verbindung mit dem konkreten Genentech-Antikörper so faszinierend?
Phage Display ist eine Möglichkeit Antikörper zu generieren. Eine andere ist sie aus transgenen Mäusen zu erlangen. Morphosys beispielsweise hat seine knapp 100 Antikörper alle aus der eigenen Bibiliothek - mit phage display generiert.
Phage Display ist eine Möglichkeit Antikörper zu generieren. Eine andere ist sie aus transgenen Mäusen zu erlangen. Morphosys beispielsweise hat seine knapp 100 Antikörper alle aus der eigenen Bibiliothek - mit phage display generiert.
Antwort auf Beitrag Nr.: 50.352.513 von Ville7 am 07.08.15 12:02:32Für dich vielleicht normaler Standard, übt es auf mich, der ich in der Biotechnologie nicht zu Hause bin, noch die Faszination des Neuen aus 
Also entschuldige, wenn ich Deine Frage umgehen muss

Also entschuldige, wenn ich Deine Frage umgehen muss

Das nächste Trffen der CHMP-Expertenrunde wird vom 21. bis 24.9.15 stattfinden. Dort ist mit einer Zulassungsempfehlung für Cobimetinib in Kombi mit Vemurafenib zu rechnen, wonach die Europäische Kommission 67 Tage später die Marktzulassung erteilen wird. Die CHMP-Entscheidung wird wohl am 25.9. bekanntgegeben.
http://www.ema.europa.eu/ema/index.jsp?curl=pages%2Fabout_us…
Die Entscheidung der FDA könnte auch zu diesem Zeitpunkt bekanntgegeben werden, so dass Anfang Oktober ein zweistelliger Kurs nicht ausgeschlossen ist.
http://www.ema.europa.eu/ema/index.jsp?curl=pages%2Fabout_us…
Die Entscheidung der FDA könnte auch zu diesem Zeitpunkt bekanntgegeben werden, so dass Anfang Oktober ein zweistelliger Kurs nicht ausgeschlossen ist.
Servus Franca,
tolle Recherche, aber bei den crash-Märkten glaube ich vorerst nicht an zweistellige Kurse, aber hoffen darauf können wir ja!
tolle Recherche, aber bei den crash-Märkten glaube ich vorerst nicht an zweistellige Kurse, aber hoffen darauf können wir ja!
Antwort auf Beitrag Nr.: 50.461.785 von Cyberhexe am 22.08.15 12:59:26"Die Entscheidung der FDA könnte auch zu diesem Zeitpunkt bekanntgegeben werden, so dass Anfang Oktober ein zweistelliger Kurs nicht ausgeschlossen ist."
Würde ich auch nicht ausschließen, aber nicht unbedingt aus diesem Grund. Ich denke immer noch, dass Du das Potential von Cobi ziemlich überschätzt (zumindest kurzfristig).
Davon unabhängig ist EXEL sicher ein Kauf.
Hier eine ganz aktuelle Einschätzung von Ohad Hammer, der eine Übernahme für nicht unwahrscheinlich hält (das hätte dann sicher ca. eine Kursverdopplung zur Folge):
Exelixis – partnering discussions may turn into an acquisition
With what appears to be an impressive survival benefit (see my take here) in a pivotal trial in renal cancer (the METEOR trial), Exelixis’ cabozantinib has potential sales of $600M using conservative assumptions (limited penetration in RCC, no expansion to other indications). The company plans to present detailed results from the trial at ESMO/ECC 2015 (September 25-29). Based on last month’s press release the data should be outstanding with a significant PFS benefit over the market leader (Novartis’ [NVS] Afinitor) and an impressive survival trend that will have to be corroborated at a second analysis next year.
Cabozantinib’s safety profile is the drug’s main disadvantage so it will be important to see whether the safety profile will be deemed acceptable by physicians in light of the clinical benefit. Investors are also concerned about competition with BMS’ (BMY) Opdivo, which also demonstrated superiority over Afinitor in the same patient population.
Exelixis’ CEO indicated the company is in partnering discussions for ex-US rights for cabo. As Exelixis plans to submit U.S. and EU regulatory filings in early 2016 (the study was conducted in US and EU sites), the drug may receive approval in Q3 2016. By then, Exelixis must have a partner in place to launch cabo which will initially compete with Opdivo (expected to be launched on the same time frame).
The strength of the METEOR data (better PFS than the market leader, a strong survival trend) and the scarcity of novel oncology drugs should enable Exelixis to strike a lucrative licensing deal while retaining commercial rights in the US. The company’s modest market cap of ~$1.3B also makes it an attractive acquisition target, so partnering discussions may end up as an acquisition bid from a partner with an established oncology salesforce. Assuming peak sales of $600M in RCC for cabo, $50M in MTC (medullary thyroid cancer) for cabo and $100M for Exelixis’ stake in cobimetinib (MEK inhibitor partnered with Roche), Exelixis should generate $750M in annual revenues excluding any upside from other indications. Using a modest sales multiple of 4 results in a $3B acquisition price. Adding additional opportunities for both drugs may push the price tag to $3.5B.
Potential acquirers may be companies with a presence in GU cancers that do not compete directly with cabozantinib or companies with an interest to expand their oncology franchise. The prior group includes Bayer and J&J (JNJ), the latter group includes Gilead (GILD) and Celgene (CELG).
http://www.orf-blog.com/biotech-portfolio-updates-thoughts-o…
Würde ich auch nicht ausschließen, aber nicht unbedingt aus diesem Grund. Ich denke immer noch, dass Du das Potential von Cobi ziemlich überschätzt (zumindest kurzfristig).
Davon unabhängig ist EXEL sicher ein Kauf.
Hier eine ganz aktuelle Einschätzung von Ohad Hammer, der eine Übernahme für nicht unwahrscheinlich hält (das hätte dann sicher ca. eine Kursverdopplung zur Folge):
Exelixis – partnering discussions may turn into an acquisition
With what appears to be an impressive survival benefit (see my take here) in a pivotal trial in renal cancer (the METEOR trial), Exelixis’ cabozantinib has potential sales of $600M using conservative assumptions (limited penetration in RCC, no expansion to other indications). The company plans to present detailed results from the trial at ESMO/ECC 2015 (September 25-29). Based on last month’s press release the data should be outstanding with a significant PFS benefit over the market leader (Novartis’ [NVS] Afinitor) and an impressive survival trend that will have to be corroborated at a second analysis next year.
Cabozantinib’s safety profile is the drug’s main disadvantage so it will be important to see whether the safety profile will be deemed acceptable by physicians in light of the clinical benefit. Investors are also concerned about competition with BMS’ (BMY) Opdivo, which also demonstrated superiority over Afinitor in the same patient population.
Exelixis’ CEO indicated the company is in partnering discussions for ex-US rights for cabo. As Exelixis plans to submit U.S. and EU regulatory filings in early 2016 (the study was conducted in US and EU sites), the drug may receive approval in Q3 2016. By then, Exelixis must have a partner in place to launch cabo which will initially compete with Opdivo (expected to be launched on the same time frame).
The strength of the METEOR data (better PFS than the market leader, a strong survival trend) and the scarcity of novel oncology drugs should enable Exelixis to strike a lucrative licensing deal while retaining commercial rights in the US. The company’s modest market cap of ~$1.3B also makes it an attractive acquisition target, so partnering discussions may end up as an acquisition bid from a partner with an established oncology salesforce. Assuming peak sales of $600M in RCC for cabo, $50M in MTC (medullary thyroid cancer) for cabo and $100M for Exelixis’ stake in cobimetinib (MEK inhibitor partnered with Roche), Exelixis should generate $750M in annual revenues excluding any upside from other indications. Using a modest sales multiple of 4 results in a $3B acquisition price. Adding additional opportunities for both drugs may push the price tag to $3.5B.
Potential acquirers may be companies with a presence in GU cancers that do not compete directly with cabozantinib or companies with an interest to expand their oncology franchise. The prior group includes Bayer and J&J (JNJ), the latter group includes Gilead (GILD) and Celgene (CELG).
http://www.orf-blog.com/biotech-portfolio-updates-thoughts-o…
Antwort auf Beitrag Nr.: 50.463.642 von SLGramann am 23.08.15 07:31:19Ich denke immer noch, dass Du das Potential von Cobi ziemlich überschätzt (zumindest kurzfristig).
Cobimetinib (brand: Cotellic) ist ein Eckpfeiler im Onkologieportfolio von Genentech/Roche, und zwar besagt die Theorie, dass Cobi das Therapieversagen anderer Wirkstoffe verzögert. Sollte sich diese Theorie bestätigen, dann wird Cobi ein Blockbuster, allerdings nicht vor 2020! Kurzfristig sind ausschliesslich die Umsätze der Kombinationstherapie mit Vemurafenib (brand: Zelboraf) bei Patienten mit nicht vorbehandeltem BRAF-V600-Mutations-positivem fortgeschrittenem Melanom von Bedeutung. Der Median beim progressionfreien Überleben beträgt bei Roche/Genentechs Kombitherapie 12,3 Monate, verglichen mit 7,2 Monaten unter Zelboraf in Monotherapie. Der Median beim progressionsfreien Überleben PFS der Kombitherapie von Novartis (Dabrafenib/Trametinib) ist geringer. Trotz der das Immunsystem aktivierenden Konkurrenz (Ipilimumab, Nivolumab und Pembrolizumab), wird Roche mit der Kombitherapie Cotellic/Zelboraf einen beträchtlichen Anteil der Kosten für die Behandlung von schwarzem Hautkrebs für sich beanspruchen. Natürlich sind einige Unwägbarkeiten zu berücksichtigen, jedoch sollte der Umsatz der Kombitherapie (Cotellic/Zelboraf) relativ rasch den Umsatz der Zelboraf-Monotherapie (2013 ca. 360 mUSD) übertreffen --> der Median beim progressionfreien Überleben beträgt bei Roche/Genentechs Kombitherapie 12,3 Monate, verglichen mit 7,2 Monaten unter Zelboraf in Monotherapie.
Ich rechne für 2017 mit einem Umsatz der Kombitherapie von 400 mUSD mit steigender Tendenz für die Jahre danach. Sollte ich das kurzfristige Potenzial tatsächlich überschätzen...mea culpa - aber mit welchen Umsätzen rechnest denn du??
How common is skin cancer?
The incidence of both non-melanoma and melanoma skin cancers has been increasing over the past decades. Currently, between 2 and 3 million non-melanoma skin cancers and 132,000 melanoma skin cancers occur globally each year. One in every three cancers diagnosed is a skin cancer and, according to Skin Cancer Foundation Statistics, one in every five Americans will develop skin cancer in their lifetime.
As ozone levels are depleted, the atmosphere loses more and more of its protective filter function and more solar UV radiation reaches the Earth's surface. It is estimated that a 10 per cent decrease in ozone levels will result in an additional 300,000 non-melanoma and 4,500 melanoma skin cancer cases. The global incidence of melanoma continues to increase – however, the main factors that predispose to the development of melanoma seem to be connected with recreational exposure to the sun and a history of sunburn. These factors lie within each individual's own responsibility.
Cobimetinib (brand: Cotellic) ist ein Eckpfeiler im Onkologieportfolio von Genentech/Roche, und zwar besagt die Theorie, dass Cobi das Therapieversagen anderer Wirkstoffe verzögert. Sollte sich diese Theorie bestätigen, dann wird Cobi ein Blockbuster, allerdings nicht vor 2020! Kurzfristig sind ausschliesslich die Umsätze der Kombinationstherapie mit Vemurafenib (brand: Zelboraf) bei Patienten mit nicht vorbehandeltem BRAF-V600-Mutations-positivem fortgeschrittenem Melanom von Bedeutung. Der Median beim progressionfreien Überleben beträgt bei Roche/Genentechs Kombitherapie 12,3 Monate, verglichen mit 7,2 Monaten unter Zelboraf in Monotherapie. Der Median beim progressionsfreien Überleben PFS der Kombitherapie von Novartis (Dabrafenib/Trametinib) ist geringer. Trotz der das Immunsystem aktivierenden Konkurrenz (Ipilimumab, Nivolumab und Pembrolizumab), wird Roche mit der Kombitherapie Cotellic/Zelboraf einen beträchtlichen Anteil der Kosten für die Behandlung von schwarzem Hautkrebs für sich beanspruchen. Natürlich sind einige Unwägbarkeiten zu berücksichtigen, jedoch sollte der Umsatz der Kombitherapie (Cotellic/Zelboraf) relativ rasch den Umsatz der Zelboraf-Monotherapie (2013 ca. 360 mUSD) übertreffen --> der Median beim progressionfreien Überleben beträgt bei Roche/Genentechs Kombitherapie 12,3 Monate, verglichen mit 7,2 Monaten unter Zelboraf in Monotherapie.
Ich rechne für 2017 mit einem Umsatz der Kombitherapie von 400 mUSD mit steigender Tendenz für die Jahre danach. Sollte ich das kurzfristige Potenzial tatsächlich überschätzen...mea culpa - aber mit welchen Umsätzen rechnest denn du??
How common is skin cancer?
The incidence of both non-melanoma and melanoma skin cancers has been increasing over the past decades. Currently, between 2 and 3 million non-melanoma skin cancers and 132,000 melanoma skin cancers occur globally each year. One in every three cancers diagnosed is a skin cancer and, according to Skin Cancer Foundation Statistics, one in every five Americans will develop skin cancer in their lifetime.
As ozone levels are depleted, the atmosphere loses more and more of its protective filter function and more solar UV radiation reaches the Earth's surface. It is estimated that a 10 per cent decrease in ozone levels will result in an additional 300,000 non-melanoma and 4,500 melanoma skin cancer cases. The global incidence of melanoma continues to increase – however, the main factors that predispose to the development of melanoma seem to be connected with recreational exposure to the sun and a history of sunburn. These factors lie within each individual's own responsibility.
Antwort auf Beitrag Nr.: 50.464.833 von Cyberhexe am 23.08.15 13:54:23"Ich rechne für 2017 mit einem Umsatz der Kombitherapie von 400 mUSD mit steigender Tendenz für die Jahre danach. Sollte ich das kurzfristige Potenzial tatsächlich überschätzen...mea culpa - aber mit welchen Umsätzen rechnest denn du??"
Doch, doch, das sehe ich im Prinzip genauso (mit dem Hinweis darauf, dass EXEL nur den kleineren Anteil verbuchen kann).
Nehmen wir doch ruhig die 100 Mio. für EXEL, die auch Hammer schätzt als relativ kurzfristig realisierbares Umsatzpotential für EXEL aus Cobi.
Ich gehe davon aus, dass positive Entscheidungen der FDA und EMA überwiegend erwartet werden und weitgehend eingepreist sind.
Wichtiger sind und bleiben die Cabo-Daten. Detaillierte Daten kommen Ende September. Davon erwarte ich mehr Bewegung - hoffentlich nach oben. Danach wird dann eine Verpartnerung von Cabo oder eine Übernahme von EXEL kursbestimmend sein.
Cobi bleibt für mich der unwichtigere Teil im Puzzle.
Doch, doch, das sehe ich im Prinzip genauso (mit dem Hinweis darauf, dass EXEL nur den kleineren Anteil verbuchen kann).
Nehmen wir doch ruhig die 100 Mio. für EXEL, die auch Hammer schätzt als relativ kurzfristig realisierbares Umsatzpotential für EXEL aus Cobi.
Ich gehe davon aus, dass positive Entscheidungen der FDA und EMA überwiegend erwartet werden und weitgehend eingepreist sind.
Wichtiger sind und bleiben die Cabo-Daten. Detaillierte Daten kommen Ende September. Davon erwarte ich mehr Bewegung - hoffentlich nach oben. Danach wird dann eine Verpartnerung von Cabo oder eine Übernahme von EXEL kursbestimmend sein.
Cobi bleibt für mich der unwichtigere Teil im Puzzle.
Antwort auf Beitrag Nr.: 50.464.917 von SLGramann am 23.08.15 14:21:16mit grossem Interesse werden die Daten einer relativ mächtigen ph1-Studie (93 Studienteilnehmer) mit Cobi und Atezolizumab erwartet - aktuell befindet sich diese Studie im read-out Modus:
A Phase 1b Study of MPDL3280A (an Engineered Anti-PDL1 Antibody) in Combination With Cobimetinib in Patients With Locally Advanced or Metastatic Solid Tumors
Bei viel versprechenden Resultaten wird Cobi weit aus mehr in den Vordergrund rücken. Und ausserdem sind die Zulassungen von Cobi in US und Europa noch nicht vollständig eingepreist. Time will tell!
A Phase 1b Study of MPDL3280A (an Engineered Anti-PDL1 Antibody) in Combination With Cobimetinib in Patients With Locally Advanced or Metastatic Solid Tumors
Bei viel versprechenden Resultaten wird Cobi weit aus mehr in den Vordergrund rücken. Und ausserdem sind die Zulassungen von Cobi in US und Europa noch nicht vollständig eingepreist. Time will tell!
Super news, schade daß der Gesamtmarkt abkackt:
http://finance.yahoo.com/news/fda-grants-breakthrough-therap…
http://finance.yahoo.com/news/fda-grants-breakthrough-therap…
Antwort auf Beitrag Nr.: 50.471.910 von Magnetfeldfredy am 24.08.15 15:02:13FDA Grants Breakthrough Therapy Designation (BTD) to Exelixis’ Cabozantinib for the Treatment of Renal Cell Carcinoma in Patients Who Received One Prior Therapy
-- Provides Opportunity to Expedite Regulatory Timelines
-- Exelixis Plans to Complete Submission of Cabozantinib U.S. NDA for Advanced RCC in 2015
anbei eine gute Zusammenfassung über die Bedeutung von "Breakthrough Therapy":
http://www.fda.gov/downloads/AboutFDA/CentersOffices/Officeo…
Action is planned for at least one month prior
to PDUFA goal date.
...eine bevorzugte Bearbeitung des Zulassungsantrag wird gewährt, um den Patienten diesen Wirkstoff möglichst rasch verfügbar zu machen.
Da der Zulassungsantrag noch in 2015 bei der Arzneimittelbehörde (FDA) eingereicht werden soll und die Behörde bei BTD einen Monat vor PDUFA (also 9 anstatt 10 Monate) über den Antrag entscheiden will, ist ein Marktzugang von Cabo zur Behandlung von RCC im August 2016 vorstellbar - einige "off label"-Anwendungen werden bereits früher stattfinden, da Cabo bereits zur Behandlung des fortschreitenden, metastasierenden, medullären Schilddrüsenkarzinoms zugelassen ist. Die Aussichten werden immer besser.
-- Provides Opportunity to Expedite Regulatory Timelines
-- Exelixis Plans to Complete Submission of Cabozantinib U.S. NDA for Advanced RCC in 2015
anbei eine gute Zusammenfassung über die Bedeutung von "Breakthrough Therapy":
http://www.fda.gov/downloads/AboutFDA/CentersOffices/Officeo…
Action is planned for at least one month prior
to PDUFA goal date.
...eine bevorzugte Bearbeitung des Zulassungsantrag wird gewährt, um den Patienten diesen Wirkstoff möglichst rasch verfügbar zu machen.
Da der Zulassungsantrag noch in 2015 bei der Arzneimittelbehörde (FDA) eingereicht werden soll und die Behörde bei BTD einen Monat vor PDUFA (also 9 anstatt 10 Monate) über den Antrag entscheiden will, ist ein Marktzugang von Cabo zur Behandlung von RCC im August 2016 vorstellbar - einige "off label"-Anwendungen werden bereits früher stattfinden, da Cabo bereits zur Behandlung des fortschreitenden, metastasierenden, medullären Schilddrüsenkarzinoms zugelassen ist. Die Aussichten werden immer besser.
Antwort auf Beitrag Nr.: 50.478.582 von Cyberhexe am 25.08.15 05:58:35Eigentlich wäre nun zu erwarten, dass Exelixis zusätzliches Personal rekrutiert, damit die sehr umfangreiche Arbeit eines Zulassungsgesuches möglichst rasch (Zeit ist sehr viel Geld!) und professionell erledigt wird. Bisher ist diesbezüglich noch nichts festzustellen:
http://www.exelixis.com/careers/job-opportunities
Es darf angezweifelt werden, ob diese Mammutaufgabe mit den verbliebenen Ressourcen kurzfristig zu leisten ist. Möglicherweise wird diese Expertise auch extern eingekauft.
http://www.exelixis.com/careers/job-opportunities
Es darf angezweifelt werden, ob diese Mammutaufgabe mit den verbliebenen Ressourcen kurzfristig zu leisten ist. Möglicherweise wird diese Expertise auch extern eingekauft.
Vielleicht wird Exelixis ja bald übernommen und der Übernehmer, big pharma, macht den Zulassungsantrag?
!
Dieser Beitrag wurde von CloudMOD moderiert. Grund: auf eigenen Wunsch des Users
Cobimetinib in der Schweiz zugelassen:
http://www.exelixis.com/investors-media/press-releases
Exelixis Announces First Regulatory Approval of Cobimetinib in Switzerland
-- The Second Product Discovered by Exelixis to Receive Regulatory Approval --
-- Additional Regulatory Applications in the U.S. and EU Currently under Review --
...
The Swissmedic approval was based on an updated analysis of the coBRIM study data that showed that patients with previously untreated BRAF V600 mutation-positive advanced melanoma live a median of more than a year (12.3 months) without progression of their disease (progression-free survival, PFS) on combination therapy with cobimetinib and vemurafenib, and 7.2 months on vemurafenib monotherapy.
...
http://www.exelixis.com/investors-media/press-releases
Exelixis Announces First Regulatory Approval of Cobimetinib in Switzerland
-- The Second Product Discovered by Exelixis to Receive Regulatory Approval --
-- Additional Regulatory Applications in the U.S. and EU Currently under Review --
...
The Swissmedic approval was based on an updated analysis of the coBRIM study data that showed that patients with previously untreated BRAF V600 mutation-positive advanced melanoma live a median of more than a year (12.3 months) without progression of their disease (progression-free survival, PFS) on combination therapy with cobimetinib and vemurafenib, and 7.2 months on vemurafenib monotherapy.
...
Super news, damit ist für mich die Zulassung in Europa und USA auch gesichert!
Antwort auf Beitrag Nr.: 50.500.923 von Magnetfeldfredy am 27.08.15 13:59:00Denk ich auch. Schön das.
Kann mir nicht vorstellen, dass Cobi in der EU und den USA nicht zugelassen wird.
Kann mir nicht vorstellen, dass Cobi in der EU und den USA nicht zugelassen wird.
Der Motley Fool über Exelixis als Übernahmekandidat:
As Sean [Sean Williams] aptly pointed out, biotech mergers and acquisitions tend to come out of left field, making them nearly impossible to predict. That being said, I suspect that the tiny oncology company Exelixis is starting to garner some interest from bigger pharmas right now, and may end up getting bought out before year's end.
My belief centers around the potential for Exelixis' flagship cancer drug Cometriq to successfully expand its label soon to include an advanced kidney cancer indication. As a refresher, the company reported that Cometriq easily topped Novartis' Afinitor in terms of progression-free survival last July, perhaps putting the former drug's roughly $400 million in annual sales into play going forward.
If a Cometriq label expansion weren't enough of an incentive, Exelixis and its partner, Roche , are also barreling toward their Nov. 11 target review date with the FDA for their combo therapy of cobimetinib and Zelboraf, indicated for BRAF V600 mutation-positive metastatic melanoma. Most industry insiders believe this combo therapy will indeed get the green light come November, which would give Exelixis two approved products, with perhaps three approved indications within the next year.
All told, I think Exelixis is turning into a compelling buyout target based on the recent progress of its clinical pipeline that's targeting one of the fastest-growing areas of biopharmaceuticals, namely oncology.
http://www.nasdaq.com/article/we-believe-healthcares-next-bi…
As Sean [Sean Williams] aptly pointed out, biotech mergers and acquisitions tend to come out of left field, making them nearly impossible to predict. That being said, I suspect that the tiny oncology company Exelixis is starting to garner some interest from bigger pharmas right now, and may end up getting bought out before year's end.
My belief centers around the potential for Exelixis' flagship cancer drug Cometriq to successfully expand its label soon to include an advanced kidney cancer indication. As a refresher, the company reported that Cometriq easily topped Novartis' Afinitor in terms of progression-free survival last July, perhaps putting the former drug's roughly $400 million in annual sales into play going forward.
If a Cometriq label expansion weren't enough of an incentive, Exelixis and its partner, Roche , are also barreling toward their Nov. 11 target review date with the FDA for their combo therapy of cobimetinib and Zelboraf, indicated for BRAF V600 mutation-positive metastatic melanoma. Most industry insiders believe this combo therapy will indeed get the green light come November, which would give Exelixis two approved products, with perhaps three approved indications within the next year.
All told, I think Exelixis is turning into a compelling buyout target based on the recent progress of its clinical pipeline that's targeting one of the fastest-growing areas of biopharmaceuticals, namely oncology.
http://www.nasdaq.com/article/we-believe-healthcares-next-bi…
Der Pharmakovigilanzausschuss PRAC kommt dieser Tage in London zusammen, 7. bis 10.Sept.
Auch Cobimetinib steht auf dem Programm:
5.1.8. Cobimetinib - EMEA/H/C/003960
Scope: Treatment of metastatic melanoma
Action: For adoption of PRAC RMP AR, PRAC RMP assessment overview and advice to CHMP
http://www.ema.europa.eu/ema/index.jsp?curl=pages/news_and_e…
Auch Cobimetinib steht auf dem Programm:
5.1.8. Cobimetinib - EMEA/H/C/003960
Scope: Treatment of metastatic melanoma
Action: For adoption of PRAC RMP AR, PRAC RMP assessment overview and advice to CHMP
http://www.ema.europa.eu/ema/index.jsp?curl=pages/news_and_e…
Wie sieht's eigentlich mit den Kursziel von Exelixis aus?
Finde irgendwie keine verlässlichen Angaben.
Danke für eure Hilfe.
Liebe Grüsse
Finde irgendwie keine verlässlichen Angaben.
Danke für eure Hilfe.
Liebe Grüsse
Verlässliche Angaben für ein Kursziel eines hochspekulativen Biotechinvestments wirst du nirgends finden. 

Antwort auf Beitrag Nr.: 50.597.588 von Ville7 am 10.09.15 16:29:36 Verlässliche Angaben für ein Kursziel eines hochspekulativen Biotechinvestments wirst du nirgends finden.
Allerdings wird Exelixis mehr und mehr berechenbar, da die beiden Wirkstoffe Cabo und Cobi mittlerweile zugelassen sind: Cabo --> Schilddrüsenkrebs in US und EU sowie sehr wahrscheinlich zur Behandlung des Nierenkarzinom
Cobi in Kombi with Vemurafenib zur Behandlung des schwarzen Hautkrebs in CH und mit allergrösster Wahrscheinlichkeit auch in US und EU. Der Jahresumsatz dürfte in 2018 bei mindestens USD 500m liegen, so dass daraus schon konkrete Kursziele abzuleiten sind. Ohne mich an diesen dennoch spekulativen Berechnungen zu beteiligen, halte ich ein zweistelliges Kursziel aufgrund dieser relativ sicheren Annahmen als sehr realistisch.
Die Phantasie ist natürlich weitaus höher, zunal mit Cobi sehr viel versprechende therapeutische Ansätze verfolgt werden:
Die Verabreichung von Cobimetinib mit anderen Wirkstoffen könnte verschiedene Vorteile haben:
1.) das Therapieversagen von anderen Arzneimitteln kann verzögert werden
2.) geringere Nebenwirkungen bei Kombinationstherapie, weil uU geringere Dosen verabreicht werden
3.) synergistische Wirkung auf den Therapieerfolg in Kombination mit anderen Wirkstoffen mit unterschiedlichem Wirkmechanismus
Allerdings wird Exelixis mehr und mehr berechenbar, da die beiden Wirkstoffe Cabo und Cobi mittlerweile zugelassen sind: Cabo --> Schilddrüsenkrebs in US und EU sowie sehr wahrscheinlich zur Behandlung des Nierenkarzinom
Cobi in Kombi with Vemurafenib zur Behandlung des schwarzen Hautkrebs in CH und mit allergrösster Wahrscheinlichkeit auch in US und EU. Der Jahresumsatz dürfte in 2018 bei mindestens USD 500m liegen, so dass daraus schon konkrete Kursziele abzuleiten sind. Ohne mich an diesen dennoch spekulativen Berechnungen zu beteiligen, halte ich ein zweistelliges Kursziel aufgrund dieser relativ sicheren Annahmen als sehr realistisch.
Die Phantasie ist natürlich weitaus höher, zunal mit Cobi sehr viel versprechende therapeutische Ansätze verfolgt werden:
Die Verabreichung von Cobimetinib mit anderen Wirkstoffen könnte verschiedene Vorteile haben:
1.) das Therapieversagen von anderen Arzneimitteln kann verzögert werden
2.) geringere Nebenwirkungen bei Kombinationstherapie, weil uU geringere Dosen verabreicht werden
3.) synergistische Wirkung auf den Therapieerfolg in Kombination mit anderen Wirkstoffen mit unterschiedlichem Wirkmechanismus
Antwort auf Beitrag Nr.: 50.611.805 von Cyberhexe am 12.09.15 16:39:48"halte ich ein zweistelliges Kursziel aufgrund dieser relativ sicheren Annahmen als sehr realistisch."
Das sehe ich ebenso. Wir waren hier im Thread glaube ich seit Monaten einig, dass im Falle eines Erfolges des METEOR-Trials Kurse von um die 10 Dollar relativ bald möglich werden.
Wir haben die Erfolgswahrscheinlichkeiten nur anders eingeschätzt. Ville und Cyberhexe eher über 50% und ich eher zwischen 30 und 50%.
Durch den Erfolg von Coba bei RCC steht EXEL auf einer ganz anderen Basis. Mal sehen, welche Detailergebnisse Ende September veröffentlicht werden. Ich rechne da aber eigentlich nicht mit negativen Überraschungen.
Die große Frage der nächsten Monate wird sicher sein, ob man die Ex-US-Rechte von Coba auslizensiert oder ob EXEL gleich ganz übernommen wird.
Auch im Falle einer Übernahme würde ich zum jetzigen Zeitpunkt einen Preis von um die 10 Dollar/Aktie erwarten.
Ein Übernahmeszenario würde ich derzeit aber aus meiner Interessenlage nicht favorisieren.
In einem Jahr wird Cabo die abschließenden Daten in der Indikation HCC liefern. Zwar sind die Chancen auf einen Erfolg hier sicher (deutlich) niedriger, als sie es bei RCC waren, aber wenn es doch zu einem Erfolg käme, wäre das dann auch ziemlich disruptiv. Der medizinische Bedarf an einem neuen Wirkstoff ist in dieser Indikation außerordentlich dringend.
Da der entsprechende CELESTRIAL-Trial schon weit fortgeschritten ist, wäre es doch vielleicht sinnvoll, das man die Ergebnisse abwartet, bevor man daran denkt, das ganze Unternehmen zu verkaufen.
Das sehe ich ebenso. Wir waren hier im Thread glaube ich seit Monaten einig, dass im Falle eines Erfolges des METEOR-Trials Kurse von um die 10 Dollar relativ bald möglich werden.
Wir haben die Erfolgswahrscheinlichkeiten nur anders eingeschätzt. Ville und Cyberhexe eher über 50% und ich eher zwischen 30 und 50%.
Durch den Erfolg von Coba bei RCC steht EXEL auf einer ganz anderen Basis. Mal sehen, welche Detailergebnisse Ende September veröffentlicht werden. Ich rechne da aber eigentlich nicht mit negativen Überraschungen.
Die große Frage der nächsten Monate wird sicher sein, ob man die Ex-US-Rechte von Coba auslizensiert oder ob EXEL gleich ganz übernommen wird.
Auch im Falle einer Übernahme würde ich zum jetzigen Zeitpunkt einen Preis von um die 10 Dollar/Aktie erwarten.
Ein Übernahmeszenario würde ich derzeit aber aus meiner Interessenlage nicht favorisieren.
In einem Jahr wird Cabo die abschließenden Daten in der Indikation HCC liefern. Zwar sind die Chancen auf einen Erfolg hier sicher (deutlich) niedriger, als sie es bei RCC waren, aber wenn es doch zu einem Erfolg käme, wäre das dann auch ziemlich disruptiv. Der medizinische Bedarf an einem neuen Wirkstoff ist in dieser Indikation außerordentlich dringend.
Da der entsprechende CELESTRIAL-Trial schon weit fortgeschritten ist, wäre es doch vielleicht sinnvoll, das man die Ergebnisse abwartet, bevor man daran denkt, das ganze Unternehmen zu verkaufen.
http://www.exelixis.com/careers/job-opportunities
seit längerer Zeit hat Exelixis nun wieder Stellenangebote ausgeschrieben und zwar 3 FTE (Full Time Employees), allerdings im administrativen Bereich. Wird hier der Verkauf der Gesellschaft vorbereitet? In Anbetracht der bevorstehenden Aufgabe, die Zulassungsunterlagen von Cabo zur Behandlung von RCC vorzubereiten, würde man bei der Rekrutierung andere Prioriotäten erwarten. Time will tell!
...übrigens hat sich Cramer auch wieder erstaunlich "bullish" zu EXEL geäussert: "I've liked that...EXEL came out to be one of my favorite biotechs, even up here at $6."
Das war auch schon anders - aber lieber spät als nie!
Nächste Woche wird sich das CHMP bei der EMA wohl zu Cobi äussern: ich rechne mit nichts anderem als einer Zulassungsempfehlung - Bekanntgabe wohl am Freitag, 25.9.15.
seit längerer Zeit hat Exelixis nun wieder Stellenangebote ausgeschrieben und zwar 3 FTE (Full Time Employees), allerdings im administrativen Bereich. Wird hier der Verkauf der Gesellschaft vorbereitet? In Anbetracht der bevorstehenden Aufgabe, die Zulassungsunterlagen von Cabo zur Behandlung von RCC vorzubereiten, würde man bei der Rekrutierung andere Prioriotäten erwarten. Time will tell!
...übrigens hat sich Cramer auch wieder erstaunlich "bullish" zu EXEL geäussert: "I've liked that...EXEL came out to be one of my favorite biotechs, even up here at $6."
Das war auch schon anders - aber lieber spät als nie!
Nächste Woche wird sich das CHMP bei der EMA wohl zu Cobi äussern: ich rechne mit nichts anderem als einer Zulassungsempfehlung - Bekanntgabe wohl am Freitag, 25.9.15.
Antwort auf Beitrag Nr.: 50.632.788 von Cyberhexe am 16.09.15 05:06:06
Was EXEL angeht so sollte es positiv weitergehen - zweistellige Kurse wären nett.
Cramer
...ist nichts anderes als ein Börsen-Clown, der hat null Ahnung. Was EXEL angeht so sollte es positiv weitergehen - zweistellige Kurse wären nett.
Antwort auf Beitrag Nr.: 50.633.034 von Ville7 am 16.09.15 07:38:35Cramer
...ist nichts anderes als ein Börsen-Clown, der hat null Ahnung.
...nun, das sehe ich schon ein wenig differenzierter. Cramer ist sicherlich ein Clown, aber das mit Null-Ahnung würde ich so nicht unterschreiben. Dessen Biotech-Experte, Adam Feuerstein, nämlich, versteht sogar ziemlich viel von klinischen Studien und der Vermarktung von pharmazeutischen Produkten - auch wenn ich ihn schon mehrfach hätte auf den Mond schiessen können. Bei Provenge bspw, dem ersten onkologisch wirksamen Vakzin, welches zur Marktreife gebracht wurde, vertrat AF die Meinung, dass dieser Wirkstoff niemals zugelassen werden würde, und falls doch, dass Dendreon dennoch Pleite gehen würde. Ich vertrat hierzu eine diametral andere Meinung. Provenge würde zugelassen werden und würde einen wirtschaftlichen Aufschwung bei Dendreon herbeiführen. Nun Provenge wurde tatsächlich zugelassen (Umsatz derzeit ca. USD 300m/y) aber Dendreon ging trotz einer zwischenzeitlichen Marktpapitalisierung von über 4 Milliarden USD Pleite. Die Skepsis von AF hat mich dazu veranlasst, recht frühzeitig den Grossteil meiner Aktien mit grossem Gewinn (5 bagger) zu verkaufen. Doch nicht nur bei Dendreon auch bei vielen anderen Prognosen lag AF richtig - und vor allen Dingen wurden diese Prognosen auch oft wissenschaftlich begründet. Null-Ahnung - ganz sicher nicht!
...ist nichts anderes als ein Börsen-Clown, der hat null Ahnung.
...nun, das sehe ich schon ein wenig differenzierter. Cramer ist sicherlich ein Clown, aber das mit Null-Ahnung würde ich so nicht unterschreiben. Dessen Biotech-Experte, Adam Feuerstein, nämlich, versteht sogar ziemlich viel von klinischen Studien und der Vermarktung von pharmazeutischen Produkten - auch wenn ich ihn schon mehrfach hätte auf den Mond schiessen können. Bei Provenge bspw, dem ersten onkologisch wirksamen Vakzin, welches zur Marktreife gebracht wurde, vertrat AF die Meinung, dass dieser Wirkstoff niemals zugelassen werden würde, und falls doch, dass Dendreon dennoch Pleite gehen würde. Ich vertrat hierzu eine diametral andere Meinung. Provenge würde zugelassen werden und würde einen wirtschaftlichen Aufschwung bei Dendreon herbeiführen. Nun Provenge wurde tatsächlich zugelassen (Umsatz derzeit ca. USD 300m/y) aber Dendreon ging trotz einer zwischenzeitlichen Marktpapitalisierung von über 4 Milliarden USD Pleite. Die Skepsis von AF hat mich dazu veranlasst, recht frühzeitig den Grossteil meiner Aktien mit grossem Gewinn (5 bagger) zu verkaufen. Doch nicht nur bei Dendreon auch bei vielen anderen Prognosen lag AF richtig - und vor allen Dingen wurden diese Prognosen auch oft wissenschaftlich begründet. Null-Ahnung - ganz sicher nicht!
Method of Treating Lung Adenocarcinoma
Exelixis sichert fleissig intellektuelles Eigentum:http://appft.uspto.gov/netacgi/nph-Parser?Sect1=PTO2&Sect2=H…
United States Patent Application 20150238477
Kind Code A1
Aftab; Dana T. August 27, 2015
Method of Treating Lung Adenocarcinoma
Abstract
This invention is directed to the treatment of cancer in a patient, particularly a patient with lung adenocarcinoma, and more particularly a patient with KIF5B-RET fusion-positive non-small cell lung cancer, with an inhibitor of MET, VEGF, and RET which is a compound of Formula I: ##STR00001## or a pharmaceutically acceptable salt thereof.
Applicant:
EXELIXIS, INC.
South San Francisco CA US
neue Studie mit Cobi: CONVERCE
Vemurafenib and Cobimetinib Combination in BRAF Mutated Melanoma With Brain Metastasis (CONVERCE)Estimated Enrollment: 137
Study Start Date: September 2015
Estimated Study Completion Date: June 2018
Estimated Primary Completion Date: February 2018 (Final data collection date for primary outcome measure)
https://www.clinicaltrials.gov/ct2/show/NCT02537600?term=cob…
Mit grosser Spannung erwarte ich auf einem der anstehenden Kongresse (ESMO wohl nicht, da kein Abstract gefunden) erste Daten folgender Cobi/Atezulizumab-Studie:
A Phase 1b Study of MPDL3280A (an Engineered Anti-PDL1 Antibody) in Combination With Cobimetinib in Patients With Locally Advanced or Metastatic Solid Tumors
Sollten diese Daten viel versprechend sein, dann würde Roche bzw. Genentech wohl kaum länger zögern, EXEL zu übernehmen.
Opdivo (nivolumab) erhält von der FDA den Status: Breakthrough Therapy Designation
man darf auf die Gesamtüberlebenszeit-Daten zu Nivolumab und Cabo bei RCC gespannt sein, die auf dem kommenden ESMO-Kongress (EUROPEAN SOCIETY FOR MEDICAL ONCOLOGY) in Wien ECC-ESMO am 26.9. veröffentlicht werden; auch wenn diejenige von Cabo weniger gut ausfallen sollte, wird sich Cabo dennoch einen gewissen Marktanteil (ja ich weiss, bei Pharmawirkstoffen zur Anwendung am Menschen ein fürchterliches Wort) sichern. http://news.bms.com/press-release/bristol-myers-squibbs-opdi…
Bristol-Myers Squibb’s Opdivo (nivolumab) Receives Breakthrough Therapy Designation from U.S. Food and Drug Administration for Advanced Renal Cell Carcinoma
Designation based on positive results of the Phase 3 study, CheckMate -025, reinforcing significant unmet medical need in this patient population
CheckMate -025 marks the first time any agent has demonstrated, as a primary endpoint, an overall survival benefit vs. standard of care in second-line metastatic renal cell carcinoma
Wednesday, September 16, 2015 8:00 am EDT
PRINCETON, N.J.--(BUSINESS WIRE)--Bristol-Myers Squibb Company (NYSE:BMY) today announced that the U.S. Food and Drug Administration (FDA) has granted Breakthrough Therapy Designation to Opdivo for the potential indication of advanced or metastatic renal cell carcinoma (RCC). The Breakthrough Therapy designation is an FDA program intended to expedite the development and review of medicines with early signals of potential clinical benefit in serious diseases to help ensure patients have access to new therapies as soon as possible.
This designation is based on results of CheckMate -025, a Phase 3 study that evaluated the survival of patients with previously treated advanced or metastatic clear-cell RCC versus everolimus, a current standard of care for patients with previously treated kidney cancer. The trial was stopped early in July 2015 because an assessment conducted by the independent Data Monitoring Committee (DMC) concluded that the study met its primary endpoint of overall survival, demonstrating superior overall survival in patients receiving Opdivo compared to the control arm. Bristol-Myers Squibb will be presenting further data from this study at the upcoming 2015 European Cancer Congress (ECC), and looks forward to submitting these data to regulatory authorities this year.
Sehr interessante Beiträge! Ein spezieller Dank gilt auch Cyberhexe.
Schade dass es sowas nicht bei anderen guten Stocks gibt: ARRY, XENE, ESPR, IMGN... oder hab ich da was verpasst...?
Ich denke, dass es nur noch eine Frage der Zeit sein wird bis EXEL durchstartet. Denn die Pipeline ist einfach zu gut.
Viele Grüße
Schade dass es sowas nicht bei anderen guten Stocks gibt: ARRY, XENE, ESPR, IMGN... oder hab ich da was verpasst...?
Ich denke, dass es nur noch eine Frage der Zeit sein wird bis EXEL durchstartet. Denn die Pipeline ist einfach zu gut.
Viele Grüße
Nächste Woche werden wir sehen wie gut die Cabo RCC Daten wirklich sind...v.a. auch in Bezug auf die nivolumab Konkurrenz. Dann wird eine Neubewertung* stattfinden...
* (nach oben oder unten)
..............
Phase 3 METEOR Cabo Trial in RCC in Late Breaker Presidential Session at ECC2015 on 26Sep2015 in Vienna
Abstract title:
LATE BREAKING ABSTRACT: Cabozantinib versus everolimus in patients with advanced renal cell carcinoma: Results of the randomized phase 3 METEOR trial
* (nach oben oder unten)
..............
Phase 3 METEOR Cabo Trial in RCC in Late Breaker Presidential Session at ECC2015 on 26Sep2015 in Vienna
Abstract title:
LATE BREAKING ABSTRACT: Cabozantinib versus everolimus in patients with advanced renal cell carcinoma: Results of the randomized phase 3 METEOR trial
Der Analyst William Blair, siehe meinen Link oben, hat sich mit dem Management getroffen und sicher mehr Einsicht in die Daten bekommen, outperform Rating!
Nach unten werden die Daten sicher nicht bewegen sonst hätte er nich zum Kauf empfohlen!
Nach unten werden die Daten sicher nicht bewegen sonst hätte er nich zum Kauf empfohlen!
Antwort auf Beitrag Nr.: 50.663.223 von Ville7 am 20.09.15 07:57:43wenn man als "late breaking" eingeladen wird, werden es wohl sehr gute Daten sein.
Sie werden nicht versuchen, schlechte Daten noch auffällig zu veröffentlichen, oder?
Sie werden nicht versuchen, schlechte Daten noch auffällig zu veröffentlichen, oder?
Die Daten sind ein Gamechanger für Exelixis, 42 % besser als Everolismus, das Standartprodukt bei Nierenkrebs, second line, mit starken Trend zum weitern Endupunkt, OS!
Cabo soll auch besonders bei jüngeren Menschen die damit behandelt wurden noch weit aus bessere Daten geliefert haben....., ich freue mich auf die Daten.
Cobi erhielt die Zulassung als Combipräperat in der Schweiz, US Zulassung und EU Zulassung am/vor 11.11.2015, wenn das keine Trigger sind?
Franca, unsere Supercyberhexe, hat alles richtig vorausgesagt und glaubt, daß zweistellige Kurse möglich sind, ich auch!
Cabo soll auch besonders bei jüngeren Menschen die damit behandelt wurden noch weit aus bessere Daten geliefert haben....., ich freue mich auf die Daten.
Cobi erhielt die Zulassung als Combipräperat in der Schweiz, US Zulassung und EU Zulassung am/vor 11.11.2015, wenn das keine Trigger sind?
Franca, unsere Supercyberhexe, hat alles richtig vorausgesagt und glaubt, daß zweistellige Kurse möglich sind, ich auch!
Antwort auf Beitrag Nr.: 50.663.730 von question-mark am 20.09.15 10:51:34
Brystol M. ist mit nivolumab zur selben konferenz auch als late breaker mit deren RCC Daten eingeladen. Von daher ist es fuer Investoren wichtig zu sehen wie die Daten im Vergleich sind.
Zitat von question-mark: wenn man als "late breaking" eingeladen wird, werden es wohl sehr gute Daten sein.
Sie werden nicht versuchen, schlechte Daten noch auffällig zu veröffentlichen, oder?
Brystol M. ist mit nivolumab zur selben konferenz auch als late breaker mit deren RCC Daten eingeladen. Von daher ist es fuer Investoren wichtig zu sehen wie die Daten im Vergleich sind.
Der Markt ist groß genung für Cabo + Nivo..., die verschiedene Wirkweise ist meiner Meinung nach entscheidend und das hat Cabo ja schon beim Schilddrüsenkrebs eindrucksvoll bewiesen und wird auch bei zahlreichen anderen Studien für Furore sorgen, so z.B. beim schwierig zu behandelnden Leberkrebs, wenn da die Primary endpoints erreicht werden haben wir evtl. einen Tenbagger, als ich will noch keine billige Übernahme für 10 US Dollar...
Cobi bei Neuroblastoma
Cobi hat ein erstaunliches Potenzial - bevor diese Erkenntnis zu allen Stakeholdern durchgedrungen ist, könnten Roche/Genentech den Sack zu machen.Ich rechne übrigens damit, dass der Ausschuss für Humanarzneimittel der EMA (CHMP) in seiner Morgen beginnenden September-Sitzung (21.9 - 24.9.) - die erste nach den Sommerferien - die Empfehlung ausspricht, Cobi in Verbindung mit Vemurafenib (Zelboraf) zur Behandlung des schwarzen Hautkrebs zuzulassen (Antrag wurde in 09/14 bei der EMA eingereicht). Bekanntgabe erfolgt wohl am Freitag. Ich hoffe dann auf Kurse jenseits USD 7.
J Exp Clin Cancer Res. 2015 Sep 18;34(1):104.
Targeted inhibition of MEK1 by cobimetinib leads to differentiation and apoptosis in neuroblastoma cells.
Singh A1,2, Ruan Y3,4, Tippett T5, Narendran A6,7.
Author information
Abstract
BACKGROUND:
Neuroblastoma (NB) is one of the most common childhood malignancies. Currently, high risk NB carries a poor outcome and significant treatment related toxicities and, thus has been a focus for new therapeutics research in pediatric oncology. In this study, we evaluated the effects of the MEK inhibitor cobimetinib, as a single agent and in combinations, on the growth, survival and differentiation properties against a molecularly representative panel of NB cell lines.
METHODS:
In vitro anti-proliferative activity of cobimetinib alone or in combination was investigated by cell viability assays and its target modulatory activity was evaluated using phospho-kinases antibody arrays and western blot analysis. To determine the effect of combination with cis-RA on differentiation and resulting enhanced cellular cytotoxicity, the expression of glial fibrillary acidic protein (GFAP) and microtubule-associated protein 2 (MAP2) expression levels were examined by immuno-fluorescence.
RESULTS:
Our findings show that cobimetinib alone induced a concentration-dependent loss of cell viability in all NB cell lines. In addition, cobimetinib showed feedback activation of MEK1/2, and the dephosphorylation of extracellular signal-regulated kinases (ERK1/2) and c-RAF, providing information on the biological correlates of MEK inhibition in NB. Combined treatment with cis-RA, led to differentiation and enhanced sensitization of NB cells lines to cobimetinib.
CONCLUSION:
Collectively, our results provide evidence that cobimetinib, in combination with cis-RA, represents a feasible option to develop novel treatment strategies for refractory NB.
Hier eine Einschätzung von Ohad Hammer in Bezug auf das ECC-Meeting und die Frage "Nivo gegen Cabo" bzw. eben die vernünftigere Frage, inwiefern die verschiedenen Produkte koexistieren können:
http://www.orf-blog.com/ecc-2015-renal-cancer-showdown-betwe…
http://www.orf-blog.com/ecc-2015-renal-cancer-showdown-betwe…
Antwort auf Beitrag Nr.: 50.666.343 von SLGramann am 20.09.15 20:59:59
Das war auch nie die Frage für mich, eine Coexistenz wird es für diese zwei Medikamente natürlich geben.
Die Frage ist nur, wie gut Cabo im Vergleich zu Nivo ist. Von Nivo sind ja bisher keine OS Daten bekannt. Wenn Cabo auch nur annähernd in der Nähe ist (und noch die Signifikanz schafft, wobei ich da keine Zweifel habe) wäre das bestimmt mehr als der Markt erwartet.
Es geht halt darum wieviel Kuchen sich Cabo abschneiden kann und je nach Daten kann es da zwischen einem Marktpotential von 300 bis 900 Mio USD in RCC schwanken. Bei 900 ist EXEL m.E. 5x so viel wert wie bei 300 - also schon wichtig das Potential abschätzen zu können.
Zitat von SLGramann: Hier eine Einschätzung von Ohad Hammer in Bezug auf das ECC-Meeting und die Frage "Nivo gegen Cabo" bzw. eben die vernünftigere Frage, inwiefern die verschiedenen Produkte koexistieren können:
http://www.orf-blog.com/ecc-2015-renal-cancer-showdown-betwe…
Das war auch nie die Frage für mich, eine Coexistenz wird es für diese zwei Medikamente natürlich geben.
Die Frage ist nur, wie gut Cabo im Vergleich zu Nivo ist. Von Nivo sind ja bisher keine OS Daten bekannt. Wenn Cabo auch nur annähernd in der Nähe ist (und noch die Signifikanz schafft, wobei ich da keine Zweifel habe) wäre das bestimmt mehr als der Markt erwartet.
Es geht halt darum wieviel Kuchen sich Cabo abschneiden kann und je nach Daten kann es da zwischen einem Marktpotential von 300 bis 900 Mio USD in RCC schwanken. Bei 900 ist EXEL m.E. 5x so viel wert wie bei 300 - also schon wichtig das Potential abschätzen zu können.
Agenda
des Arzneimittelausschusses der EMA (CHMP) für die Sitzung vom 21.9. bis 24.9.:http://www.ema.europa.eu/docs/en_GB/document_library/Agenda/…
siehe Seite 12/45
3.1.4.
cobimetinib
EMEA/H/C/003960
treatment of metastatic melanoma
Scope: Opinion
Action: For adoption
List of Outstanding Issues adopted on 25.06.2015. List of Questions adopted on
22.01.2015.
Antwort auf Beitrag Nr.: 50.675.763 von Cyberhexe am 22.09.15 00:41:10
the decision by CHMP will be published on Friday, Sept 25th, at the latest. And everything else as a recommendation for approval would be a surprise. After a positive recommendation of CHMP it will last a total of 67 days until the final decision of the European Commission will be published: 27 days for the Translation check of Product Information bec the Product Information has to be published in all 24 official EU languages and 40 days for the EC Decision Making Process hence Cobi should reach the EU market at the beginning of December 2015, only days behind the US.
http://www.investorvillage.com/smbd.asp?mb=1086&mn=1047&pt=m…
Cobi, CHMP and European Commission
gut erklärt by Franca 
the decision by CHMP will be published on Friday, Sept 25th, at the latest. And everything else as a recommendation for approval would be a surprise. After a positive recommendation of CHMP it will last a total of 67 days until the final decision of the European Commission will be published: 27 days for the Translation check of Product Information bec the Product Information has to be published in all 24 official EU languages and 40 days for the EC Decision Making Process hence Cobi should reach the EU market at the beginning of December 2015, only days behind the US.
http://www.investorvillage.com/smbd.asp?mb=1086&mn=1047&pt=m…
Antwort auf Beitrag Nr.: 50.676.015 von Cyberhexe am 22.09.15 07:12:25am 25.9. werden glaube ich auch die Cabo und Nivo late breaking abstracts der Conference in Wien veröffentlicht. Wird also spannend für EXEL.
Exelixis to Host Investor/Analyst Webcast During European Cancer Congress 2015
Eine Präsentation am Samstag, 26.9.:
- Briefing to Discuss Results from METEOR Phase 3 Pivotal Trial of Cabozantinib in Advanced Renal Cell Carcinoma Presented at the Meeting -
Zwei Präsentationen von Genentech zu Cobimetinib am Sonntag, 27.9.:
- Cabozantinib and Exelixis-Discovered Cobimetinib to be Subject of Three Presentations -
http://www.exelixis.com/investors-media/press-releases
Investor/Analyst Webcast über die erste Präsentation, 26.9.:
The investor/analyst webcast will be held following the presentation on Saturday, September 26, 2015, from 12:30-2:00 p.m. EDT / 9:30-11:00 a.m. PDT (18:30-20:00 local time in Vienna)
Eine Präsentation am Samstag, 26.9.:
- Briefing to Discuss Results from METEOR Phase 3 Pivotal Trial of Cabozantinib in Advanced Renal Cell Carcinoma Presented at the Meeting -
Zwei Präsentationen von Genentech zu Cobimetinib am Sonntag, 27.9.:
- Cabozantinib and Exelixis-Discovered Cobimetinib to be Subject of Three Presentations -
http://www.exelixis.com/investors-media/press-releases
Investor/Analyst Webcast über die erste Präsentation, 26.9.:
The investor/analyst webcast will be held following the presentation on Saturday, September 26, 2015, from 12:30-2:00 p.m. EDT / 9:30-11:00 a.m. PDT (18:30-20:00 local time in Vienna)
Sorry, die Zeilen sind mir teilweise etwas durcheinandergeraten 

Abstract 4LBA: Late-Breaking Abstract: Cabozantinib versus Everolimus in Patients with Advanced Renal Cell Carcinoma: Results of the Randomized Phase 3 METEOR Trial
und
Abstract 25LBA: Late-Breaking Abstract: Impact of Baseline Genetic Heterogeneities on Progression-Free Survival (PFS) in Patients (pts) with Advanced BRAFV600-mutated Melanoma Treated with Cobimetinib (COBI) + Vemurafenib (VEM) in the phase 3 coBRIM Study
werden, da late-breaking, erst am Tage der Präsentation auf der ECC-Seite zu sehen sein: http://www.europeancancercongress.org
(Abstracts where authors did not consent to early release will be published online on the first day of the Congress, 25 September 2015. Abstracts selected for oral presentations, late-breaking abstracts and abstracts selected for media will only be released for general viewing on the ECCO website and app on the day of their respective presentations.)
Abstract 3340: Treatment beyond Progression in Advanced BRAF-mutated Melanoma with Vemurafenib and Cobimetinib: Results from the BRIM7 Trial
bereits zu lesen:
http://www.europeancancercongress.org/Scientific-Programme/A…
Session title: Melanoma and Skin Cancer
Session type: Poster Session
Track: Melanoma and Skin Cancer
Abstract number: 3340
Abstract title:
Treatment beyond progression in advanced BRAF-mutated melanoma with vemurafenib and cobimetinib: Results from the BRIM7 trial
K. Lewis(1), A. Ribas(2), R. Gonzalez(3), O. Hamid(4), A. Daud(5), I. Puzanov(6), J. Hsu(7), N. Choong(8), D. Koralek(8), G. McArthur(9)
(1)University of Colorado Comprehensive Cancer Center, Department of Medicine, Aurora, USA
(2)The Jonsson Comprehensive Cancer Center at University of California, Department of Medicine, Los Angeles, USA
(3)University of Colorado Comprehensive Cancer Center, Medical Oncology, Aurora, USA
(4)The Angeles Clinic and Research Institute, Translational Research - Medical Oncology, Los Angeles, USA
(5)University of California, San Francisco, Hematology/Oncology Division, San Francisco, USA
(6)Vanderbilt-Ingram Cancer Center, Department of Medicine, Division of Hematology-Oncology, Nashville, USA
(7)Genentech Inc., Biostatistics, South San Francisco, USA
(8)Genentech, Inc., Product Development Oncology, South San Francisco, USA
(9)Peter MacCallum Cancer Centre, Medical Oncology, East Melbourne, Australia
Background: Disease progression in advanced BRAF-mutated melanoma patients treated with a BRAF inhibitor (BRAFi) with or without a MEK inhibitor (MEKi) can occur in a solitary lesion or in a limited number of lesions. There might be a role for treatment by ablative therapy to isolated lesions while maintaining BRAFi treatment for the remaining sensitive lesions (Azer MW, 2014; Kim K, 2011), and this might improve patient outcomes (Chan MK, 2014). BRIM7 is a phase 1b trial of cobimetinib (cobi) + vemurafenib (vem) evaluating safety and efficacy in patients with advanced BRAF-mutated melanoma. Treatment beyond progression (TBP) was allowed in this study and afforded the evaluation of the utility of TBP with BRAFi+MEKi. This retrospective analysis aims to describe the differences in overall survival (OS) between BRAFi-naive patients with TBP and those without TBP.
Material and Methods: The study methods were previously described (Ribas A, 2014). Eligible patients had advanced BRAFV600-mutated melanoma and Eastern Cooperative Oncology Group performance status (ECOG PS) 0–1. Patients in the dose escalation phase received vem 720 or 960mg twice daily (bid) continually and cobi 60, 80, or 100mg daily (qd) 14 d on/14 d off (14/14); 21/7 or continually (28/0). Two dose levels were expanded: vem (720mg and 960mg bid) + cobi 60mg qd 21/7. Patients were allowed to continue TBP with medical monitor approval when continued treatment was considered clinically beneficial. Time to event was estimated using the Kaplan–Meier method.
Results: 63 BRAFi-naive patients were accrued and given combination cobi+vem. As of data cutoff September 5, 2014, 39 patients had progressed: 26 (67%) received TBP. Baseline characteristics (sex, age, ECOG PS, stage of disease) of TBP patients were generally similar to those of non-TBP patients. Elevated lactate dehydrogenase level was slightly more common in TBP patients. At the time of disease progression, 69% of patients who received TBP exhibited only new lesions (78% brain lesions), compared with 46% (83% brain lesions) of non-TBP patients. Best overall response and ECOG PS, at time of progression, were similar in the 2 groups. For TBP patients, median treatment post-progression was 130 d (range 21–420). Of 39 patients who progressed on cobi+vem treatment, 15/26 (65%) TBP and 8/13 (62%) non-TBP died. Median OS for TBP patients was 22.0 months (95%CI 13.44-NE) and 19.4 months for non-TBP patients (95%CI 10.35–28.48).
Conclusions: Patients with disease progression due to only new lesions were more likely to receive TBP, though this may be confounded by other unmeasured factors. OS appeared to be comparable between patients who did and did not receive TBP, with overlapping CI. Due to the retrospective exploratory nature of this analysis, results should be interpreted with caution.
Conflict of interest: Ownership: Ribas: Stockholder Kite Pharma. Daud: Stockholder OncoSec. Hsu: Stockholder Roche. Choong: Stockholder Roche. Koralek: Stockholder Roche. Advisory Board: Lewis: Received honoraria from Roche/Genentech. Ribas: Received honoraria from Genentech/Roche (paid to institution). Gonzalez: Roche/Genentech, GSK, Novartis, BMS, Merck, Amgen. Corporate-sponsored Research: Gonzales: Investigator for Roche/Genentech, GSK, Novartis, BMS, Merck, Amgen. Hamid: Consultant for Genentech. Speakers Bureau for Genentech. Gonzales: Research funding with Genentech. Daud: Grant/Research Support from Merck, Pfizer, GSK, OncoSec, Novartis, Genentech, Roche, BMS. McArthur: Research support from Pfizer, Celgene, Ventana. Other Substantive Relationships: Ribas: Consultant for Amgen, GSK, Genentech, Merck. Gonzales: Consultant for Genentech/Roche, Amgen. Hamid: Consultant for Genentech and Speakers Bureau for Genentech. Hsu: Employee Roche. Choong: Employee Genentech (member of the Roche Group). Koralek: Employee Genentech. Daud: Consultant for Genentech, BMS, Amgen, Celgene, Median Technologies. McArthur: Consultant for Provectus (Uncompensated consultancy for Pfizer, Millenium, GSK, Roche-Genentech, Novartis, BMS & Amgen).
Keywords:
vemurafenib
cobimetinib
metastatic melanoma
Enttäuschende Ergebnisse?
und
Abstract 25LBA: Late-Breaking Abstract: Impact of Baseline Genetic Heterogeneities on Progression-Free Survival (PFS) in Patients (pts) with Advanced BRAFV600-mutated Melanoma Treated with Cobimetinib (COBI) + Vemurafenib (VEM) in the phase 3 coBRIM Study
werden, da late-breaking, erst am Tage der Präsentation auf der ECC-Seite zu sehen sein: http://www.europeancancercongress.org
(Abstracts where authors did not consent to early release will be published online on the first day of the Congress, 25 September 2015. Abstracts selected for oral presentations, late-breaking abstracts and abstracts selected for media will only be released for general viewing on the ECCO website and app on the day of their respective presentations.)
Abstract 3340: Treatment beyond Progression in Advanced BRAF-mutated Melanoma with Vemurafenib and Cobimetinib: Results from the BRIM7 Trial
bereits zu lesen:
http://www.europeancancercongress.org/Scientific-Programme/A…
Session title: Melanoma and Skin Cancer
Session type: Poster Session
Track: Melanoma and Skin Cancer
Abstract number: 3340
Abstract title:
Treatment beyond progression in advanced BRAF-mutated melanoma with vemurafenib and cobimetinib: Results from the BRIM7 trial
K. Lewis(1), A. Ribas(2), R. Gonzalez(3), O. Hamid(4), A. Daud(5), I. Puzanov(6), J. Hsu(7), N. Choong(8), D. Koralek(8), G. McArthur(9)
(1)University of Colorado Comprehensive Cancer Center, Department of Medicine, Aurora, USA
(2)The Jonsson Comprehensive Cancer Center at University of California, Department of Medicine, Los Angeles, USA
(3)University of Colorado Comprehensive Cancer Center, Medical Oncology, Aurora, USA
(4)The Angeles Clinic and Research Institute, Translational Research - Medical Oncology, Los Angeles, USA
(5)University of California, San Francisco, Hematology/Oncology Division, San Francisco, USA
(6)Vanderbilt-Ingram Cancer Center, Department of Medicine, Division of Hematology-Oncology, Nashville, USA
(7)Genentech Inc., Biostatistics, South San Francisco, USA
(8)Genentech, Inc., Product Development Oncology, South San Francisco, USA
(9)Peter MacCallum Cancer Centre, Medical Oncology, East Melbourne, Australia
Background: Disease progression in advanced BRAF-mutated melanoma patients treated with a BRAF inhibitor (BRAFi) with or without a MEK inhibitor (MEKi) can occur in a solitary lesion or in a limited number of lesions. There might be a role for treatment by ablative therapy to isolated lesions while maintaining BRAFi treatment for the remaining sensitive lesions (Azer MW, 2014; Kim K, 2011), and this might improve patient outcomes (Chan MK, 2014). BRIM7 is a phase 1b trial of cobimetinib (cobi) + vemurafenib (vem) evaluating safety and efficacy in patients with advanced BRAF-mutated melanoma. Treatment beyond progression (TBP) was allowed in this study and afforded the evaluation of the utility of TBP with BRAFi+MEKi. This retrospective analysis aims to describe the differences in overall survival (OS) between BRAFi-naive patients with TBP and those without TBP.
Material and Methods: The study methods were previously described (Ribas A, 2014). Eligible patients had advanced BRAFV600-mutated melanoma and Eastern Cooperative Oncology Group performance status (ECOG PS) 0–1. Patients in the dose escalation phase received vem 720 or 960mg twice daily (bid) continually and cobi 60, 80, or 100mg daily (qd) 14 d on/14 d off (14/14); 21/7 or continually (28/0). Two dose levels were expanded: vem (720mg and 960mg bid) + cobi 60mg qd 21/7. Patients were allowed to continue TBP with medical monitor approval when continued treatment was considered clinically beneficial. Time to event was estimated using the Kaplan–Meier method.
Results: 63 BRAFi-naive patients were accrued and given combination cobi+vem. As of data cutoff September 5, 2014, 39 patients had progressed: 26 (67%) received TBP. Baseline characteristics (sex, age, ECOG PS, stage of disease) of TBP patients were generally similar to those of non-TBP patients. Elevated lactate dehydrogenase level was slightly more common in TBP patients. At the time of disease progression, 69% of patients who received TBP exhibited only new lesions (78% brain lesions), compared with 46% (83% brain lesions) of non-TBP patients. Best overall response and ECOG PS, at time of progression, were similar in the 2 groups. For TBP patients, median treatment post-progression was 130 d (range 21–420). Of 39 patients who progressed on cobi+vem treatment, 15/26 (65%) TBP and 8/13 (62%) non-TBP died. Median OS for TBP patients was 22.0 months (95%CI 13.44-NE) and 19.4 months for non-TBP patients (95%CI 10.35–28.48).
Conclusions: Patients with disease progression due to only new lesions were more likely to receive TBP, though this may be confounded by other unmeasured factors. OS appeared to be comparable between patients who did and did not receive TBP, with overlapping CI. Due to the retrospective exploratory nature of this analysis, results should be interpreted with caution.
Conflict of interest: Ownership: Ribas: Stockholder Kite Pharma. Daud: Stockholder OncoSec. Hsu: Stockholder Roche. Choong: Stockholder Roche. Koralek: Stockholder Roche. Advisory Board: Lewis: Received honoraria from Roche/Genentech. Ribas: Received honoraria from Genentech/Roche (paid to institution). Gonzalez: Roche/Genentech, GSK, Novartis, BMS, Merck, Amgen. Corporate-sponsored Research: Gonzales: Investigator for Roche/Genentech, GSK, Novartis, BMS, Merck, Amgen. Hamid: Consultant for Genentech. Speakers Bureau for Genentech. Gonzales: Research funding with Genentech. Daud: Grant/Research Support from Merck, Pfizer, GSK, OncoSec, Novartis, Genentech, Roche, BMS. McArthur: Research support from Pfizer, Celgene, Ventana. Other Substantive Relationships: Ribas: Consultant for Amgen, GSK, Genentech, Merck. Gonzales: Consultant for Genentech/Roche, Amgen. Hamid: Consultant for Genentech and Speakers Bureau for Genentech. Hsu: Employee Roche. Choong: Employee Genentech (member of the Roche Group). Koralek: Employee Genentech. Daud: Consultant for Genentech, BMS, Amgen, Celgene, Median Technologies. McArthur: Consultant for Provectus (Uncompensated consultancy for Pfizer, Millenium, GSK, Roche-Genentech, Novartis, BMS & Amgen).
Keywords:
vemurafenib
cobimetinib
metastatic melanoma
Enttäuschende Ergebnisse?
RORGamma Modulators
Exelixis schützt sorgfältig geistiges Eigentum, in diesem Fall gemeinsam mit BMS. Weiss jemand Näheres zu "RORy modulators"? Heute geht die September-Sitzung des Arzneimittelausschusses der EMA (CHMP) zu Ende, auf deren Agenda auch die abschliessende Beurteilung von Cobi in Verbindung von Vemurafenib steht.
Ich rechne fest mit einer positiven Zulassungsempfehlung, so dass die Commission innerhalb der nächsten 67 Tage die Kombitherapie zulassen wird. Infolgedessen wird Cobi durch das zentralisierte Zulassungsverfahren innerhalb der gesamten EU mit ihren über 500 Mio Einwohnern zur Verfügung stehen.
Bin gespannt, ob Heute diebezüglich schon etwas bekannt wird oder erst Morgen mit dem offiziellen Protokoll der Sitzung.
United States Patent Application 20150266856
Kind Code A1
Xu; Wei ; et al. September 24, 2015
RORGamma Modulators
Abstract
Described are RORy modulators of the formula (I), and N-oxides thereof, and pharmaceutically acceptable salts thereof, and solvates and hydrates thereof, wherein R.sup.1, R.sup.2, R.sup.3, R.sup.4, R.sup.5, R.sup.6, R.sup.a, x, y, L, G, Z, the bond denoted by "q", the ring system denoted by "A" and the ring system denoted by "B" are defined herein. Also provided are pharmaceutical compositions comprising the same. Such compounds and compositions are useful in methods for modulating RORy activity in a cell and methods for treating a subject suffering from a disease or disorder in which the subject would therapeutically benefit from modulation of RORy activity, for example, autoimmune and/or inflammatory disorders. ##STR00001##
Inventors: Xu; Wei; (Danville, CA) ; Wang; Yong; (Foster City, CA) ; Ma; Sunghoon; (Foster City, CA) ; Koltun; Elena S.; (Foster City, CA) ; Kim; Byung Gyu; (Daejeon, SK) ; Jeong; Joon Won; (Belmont, CA) ; Dhar; T.G. Muralii; (Princeton, NJ) ; Bannen; Lynn Canne; (Pacifica, CA)
Applicant:
Name City State Country Type
BRISTOL-MYERS SQUIBB COMPANY
EXELIXIS, INC.
http://appft.uspto.gov/netacgi/nph-Parser?Sect1=PTO2&Sect2=H…
ECC-ESMO
Es steht uns ein äusserst spannendes Wochenende bevor mit der Bekanntgabe der detaillierten Ergebnisse zu RCC und mMelanoma. Folgende Termine/Zeiten sind gegeben:
26.9.2015 16:20
4LBA
LATE BREAKING ABSTRACT: Cabozantinib versus everolimus in patients with advanced renal cell carcinoma: Results of the randomized phase 3 METEOR trial
Speaker: T. Choueiri (USA)
27.9.2015 12:10
25LBA
LATE BREAKING ABSTRACT: Impact of baseline genetic heterogeneities on progression-free survival (PFS) in patients (pts) with advanced BRAFV600-mutated melanoma treated with cobimetinib (COBI) + vemurafenib (VEM) in the phase 3 coBRIM study
Speaker: G. McArthur (Australia)
Display abstract
...aber die Konkurrenz schläft nicht:
26.9.2015 16:10
3LBA
LATE BREAKING ABSTRACT: CheckMate 025: a randomized, open-label, phase III study of nivolumab (NIVO) versus everolimus (EVE) in advanced renal cell carcinoma (RCC)
Speaker: P. Sharma (USA)
27.9.2014 11:40
23LBA
LATE BREAKING ABSTRACT: An open-label, randomized, phase 2 study of nivolumab (NIVO) given sequentially with ipilimumab (IPI) in patients with advanced melanoma (CheckMate 064)
Speaker: F.S. Hodi (USA)
Es steht uns ein äusserst spannendes Wochenende bevor mit der Bekanntgabe der detaillierten Ergebnisse zu RCC und mMelanoma. Folgende Termine/Zeiten sind gegeben:
26.9.2015 16:20
4LBA
LATE BREAKING ABSTRACT: Cabozantinib versus everolimus in patients with advanced renal cell carcinoma: Results of the randomized phase 3 METEOR trial
Speaker: T. Choueiri (USA)
27.9.2015 12:10
25LBA
LATE BREAKING ABSTRACT: Impact of baseline genetic heterogeneities on progression-free survival (PFS) in patients (pts) with advanced BRAFV600-mutated melanoma treated with cobimetinib (COBI) + vemurafenib (VEM) in the phase 3 coBRIM study
Speaker: G. McArthur (Australia)
Display abstract
...aber die Konkurrenz schläft nicht:
26.9.2015 16:10
3LBA
LATE BREAKING ABSTRACT: CheckMate 025: a randomized, open-label, phase III study of nivolumab (NIVO) versus everolimus (EVE) in advanced renal cell carcinoma (RCC)
Speaker: P. Sharma (USA)
27.9.2014 11:40
23LBA
LATE BREAKING ABSTRACT: An open-label, randomized, phase 2 study of nivolumab (NIVO) given sequentially with ipilimumab (IPI) in patients with advanced melanoma (CheckMate 064)
Speaker: F.S. Hodi (USA)
 Schön! Es hat geklappt. CHMP gibt positive Empfehlung für Cobimetinib (Cotellic) an EC
Schön! Es hat geklappt. CHMP gibt positive Empfehlung für Cobimetinib (Cotellic) an EC 
Cotellic (cobimetinib) was recommended by the Committee for the treatment of metastatic melanoma.
http://www.ema.europa.eu/ema/index.jsp?curl=pages/news_and_e…
war das weitgehend so erwartet worden?
Exelixis Announces Key Senior Leadership Hires in Medical Affairs, Sales, and Marketing to Support Commercialization of Cabozantinib and Cobimetinib
SOUTH SAN FRANCISCO, Calif.--(BUSINESS WIRE)--Sep. 24, 2015-- Exelixis, Inc. (NASDAQ:EXEL) today announced three high-level appointments as the company prepares for the potential commercialization of its lead compound, cabozantinib, for the treatment of advanced renal cell carcinoma (RCC) following positive results from the METEOR pivotal phase 3 trial. William Berg, M.D. has joined the company as Senior Vice President of Medical Affairs, Jonathan Berndt as Vice President of Sales, and Gregg Bernier as Vice President of Marketing.
...
http://www.exelixis.com/investors-media/press-releases
Will, Jon, and Gregg an die Arbeit!
SOUTH SAN FRANCISCO, Calif.--(BUSINESS WIRE)--Sep. 24, 2015-- Exelixis, Inc. (NASDAQ:EXEL) today announced three high-level appointments as the company prepares for the potential commercialization of its lead compound, cabozantinib, for the treatment of advanced renal cell carcinoma (RCC) following positive results from the METEOR pivotal phase 3 trial. William Berg, M.D. has joined the company as Senior Vice President of Medical Affairs, Jonathan Berndt as Vice President of Sales, and Gregg Bernier as Vice President of Marketing.
...
http://www.exelixis.com/investors-media/press-releases
Will, Jon, and Gregg an die Arbeit!

Antwort auf Beitrag Nr.: 50.708.889 von question-mark am 25.09.15 14:19:12ich denke ja! Hattest Du Zweifel?
hier die Exelixis-Veröffentlichung zur CHMP-Empfehlung:
European CHMP Adopts Positive Opinion for Cobimetinib in Combination with Vemurafenib for the Treatment of Advanced Melanoma
...
http://www.exelixis.com/investors-media/press-releases
hier die Exelixis-Veröffentlichung zur CHMP-Empfehlung:
European CHMP Adopts Positive Opinion for Cobimetinib in Combination with Vemurafenib for the Treatment of Advanced Melanoma
...
http://www.exelixis.com/investors-media/press-releases
Antwort auf Beitrag Nr.: 50.708.889 von question-mark am 25.09.15 14:19:12
Wirst du an der Marktreaktion sehen. Hier im Board hat das wohl jeder so erwartet.
Zitat von question-mark: war das weitgehend so erwartet worden?
Wirst du an der Marktreaktion sehen. Hier im Board hat das wohl jeder so erwartet.
Trotzdem positiv diese Nachricht!
war wohl schon eingepreist, hab jetzt mal eine kleine Startposi, mal sehen was die nächsten Monate kommt
Hier Links zu den neuesten Veröffentlichungen / Meldungen:
Meteor PIII RCC results presented at European Cancer Congress 2015:
http://www.wallstreet-online.de/nachricht/7983333-exelixis-a…
Adam Feuerstein stellt die Daten von Opdivo (PD-L1 von BMS) u. COMETRIQ / cabozantinib (TKI von EXEL) gegenüber:
http://www.thestreet.com/story/13302067/1/bristol-exelixis-d…
Meteor PIII RCC results presented at European Cancer Congress 2015:
http://www.wallstreet-online.de/nachricht/7983333-exelixis-a…
Adam Feuerstein stellt die Daten von Opdivo (PD-L1 von BMS) u. COMETRIQ / cabozantinib (TKI von EXEL) gegenüber:
http://www.thestreet.com/story/13302067/1/bristol-exelixis-d…
Antwort auf Beitrag Nr.: 50.713.467 von Nase_weis_nix am 26.09.15 01:42:03Nach einem ersten Blick eine ganz vorsichtige Einschätzung:
Das scheint für EXEL doch recht gut auszusehen. Nivolumab vielleicht ein klein wenig schwächer, als erwartet. Interim-HR für OS bei Cabo schaut mit 0,67 zunächst mal konkurrenzfähig aus.
Stand jetzt gehe ich davon aus, dass wirklich genug Raum für beide Wirkstoffe sein wird. Cabo wahrscheinlich erst mal als Option nach Nivolumab, aber das ist trotzdem sofort ein ein relevanter Markt. Eine Kombination beider Wirkstoffe könnte langfristig interessant sein.
Die Wahrscheinlichkeit, dass EXEL demnächst übernommen wird, dürfte sich nochmals erhöht haben.
Das scheint für EXEL doch recht gut auszusehen. Nivolumab vielleicht ein klein wenig schwächer, als erwartet. Interim-HR für OS bei Cabo schaut mit 0,67 zunächst mal konkurrenzfähig aus.
Stand jetzt gehe ich davon aus, dass wirklich genug Raum für beide Wirkstoffe sein wird. Cabo wahrscheinlich erst mal als Option nach Nivolumab, aber das ist trotzdem sofort ein ein relevanter Markt. Eine Kombination beider Wirkstoffe könnte langfristig interessant sein.
Die Wahrscheinlichkeit, dass EXEL demnächst übernommen wird, dürfte sich nochmals erhöht haben.
Entscheidend wird auch sein was die jeweilige Behandlung kostet, zudem wird Cabo oroal eingenommen, ein großer Vorteil meiner Meinung nach!
Der heutig CC von Exelixis war sehr gut, Cabo wird aufgrund seines PFS und evtl. OS seine Marktanteile sichern, es wird nicht die Frage sein: NIVO oder CABO, sondern wer wann!
NIVO kosted 150.000 USD pro Jahr, CABO weiß ich nicht, aber wer soll das bezahlen?
NIVO kosted 150.000 USD pro Jahr, CABO weiß ich nicht, aber wer soll das bezahlen?
Antwort auf Beitrag Nr.: 50.716.593 von Magnetfeldfredy am 26.09.15 20:53:14
Bei Selleckchem wäre die Monatsdosis (wie im RCC-phase3-trial 60mg pro Tag) - allerdings nur für Forschungszwecke - für knapp 9.000 $ erhältlich. Per annum 108.000,- $.

Bei Selleckchem wäre die Monatsdosis (wie im RCC-phase3-trial 60mg pro Tag) - allerdings nur für Forschungszwecke - für knapp 9.000 $ erhältlich. Per annum 108.000,- $.
http://us.lrd.yahoo.com/_ylt=AqSu4xjJ7D24qHV3NvdwyOuHH8V_;_y…Super Zusammenfassung der klasse Ergebnisse von Cabo:
Antwort auf Beitrag Nr.: 50.716.593 von Magnetfeldfredy am 26.09.15 20:53:14Habe diese Bewertung des Instituts für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) gefunden. Wurde 10-2014 für die gesetzlichen Krankenkassen erstellt.
https://www.g-ba.de/downloads/92-975-573/Bewertung%20der%20T…
Sehr interessant.
Darin auch die Kosten:
diese belaufen sich pro Patient für die Behandlung des medullären Schilddrüsenkarzinoms in Deutschland auf: 12 x 7656,66 = ~91.880,- € (Seite 7 Dossier, S. 13 im pdf).
Wenn dein Preis für Nivo stimmt, ist Cometriq also gut 25% 'günstiger'.
Bei Einsatz von Cometriq kostet das die GKV zwischen 6 Mio. und 47 Mio., abhängig von der Zahl der Erkrankungen/ Behandlungen (64 bis 503 Patienten)
https://www.g-ba.de/downloads/92-975-573/Bewertung%20der%20T…
Sehr interessant.
Darin auch die Kosten:
diese belaufen sich pro Patient für die Behandlung des medullären Schilddrüsenkarzinoms in Deutschland auf: 12 x 7656,66 = ~91.880,- € (Seite 7 Dossier, S. 13 im pdf).
Wenn dein Preis für Nivo stimmt, ist Cometriq also gut 25% 'günstiger'.
Bei Einsatz von Cometriq kostet das die GKV zwischen 6 Mio. und 47 Mio., abhängig von der Zahl der Erkrankungen/ Behandlungen (64 bis 503 Patienten)
Ohad Hammer mit einer Einordnung der Cabo/Nivo-Ergebnisse:

http://www.orf-blog.com/reviewing-data-for-cabo-and-opdivo-i…
Wie schon mehrfach geschrieben, ist eine Übernahme von EXEL sehr wahrscheinlich. Der Markt sollte jetzt mal langsam einen faireren Wert einpreisen - auch wenn gerade Biotech-Crash ist.

http://www.orf-blog.com/reviewing-data-for-cabo-and-opdivo-i…
Wie schon mehrfach geschrieben, ist eine Übernahme von EXEL sehr wahrscheinlich. Der Markt sollte jetzt mal langsam einen faireren Wert einpreisen - auch wenn gerade Biotech-Crash ist.
Ja, Hillary Clinton hat mit Ihrer Aussage die amerikanischen Gesundheitskosten drastisch senken zu wollen für diese bittere Lage geführt, jedoch kostet Nivo ca. 150.000 US Dollar pro Jahr und Exelixis ca. 100.000 USD pro Jahr, ein Drittel weniger!
Zweistellige Kurse bei Übernahme sind realistisch wie unsere Super Cyberhexe schon prognostizierte.
Zweistellige Kurse bei Übernahme sind realistisch wie unsere Super Cyberhexe schon prognostizierte.
EXEL
Fairerer Preis...
Das avg. daily share volume ist seit Monaten einfach zu niedrig - mal abgesehen von Ende Juli - bzw. das short interest unverhältnismäßig hoch.
Verglichen mit Gilead (MK von 150 Mrd. und O/S von 1,5 Mrd.), die bis Ende Mai ebenfalls +/- 50 Mio. shorts hatten und seit 7 Wochen sogar nur noch durchschnittlich 25 Mio., ist das short interest bei Exelixis schon beängstigend.
EXEL Short-Ratio von 11,5 days to cover. GILD 3.
Bin mal gespannt, wie sich News von der ECCO bemerkbar machen.
Könnte auch untergehen beim derzeitigen allgemeinen Bio-Tech-Abverkauf.
Und gibt es einen Zusammenhang zwischen einer eventuellen baldigen Übernahme und dem hohen short interest... Nur laut gedacht.
http://www.nasdaq.com/symbol/exel/short-interest
Fairerer Preis...
Das avg. daily share volume ist seit Monaten einfach zu niedrig - mal abgesehen von Ende Juli - bzw. das short interest unverhältnismäßig hoch.
Verglichen mit Gilead (MK von 150 Mrd. und O/S von 1,5 Mrd.), die bis Ende Mai ebenfalls +/- 50 Mio. shorts hatten und seit 7 Wochen sogar nur noch durchschnittlich 25 Mio., ist das short interest bei Exelixis schon beängstigend.
EXEL Short-Ratio von 11,5 days to cover. GILD 3.
Bin mal gespannt, wie sich News von der ECCO bemerkbar machen.
Könnte auch untergehen beim derzeitigen allgemeinen Bio-Tech-Abverkauf.
Und gibt es einen Zusammenhang zwischen einer eventuellen baldigen Übernahme und dem hohen short interest... Nur laut gedacht.
http://www.nasdaq.com/symbol/exel/short-interest
Antwort auf Beitrag Nr.: 50.721.138 von TwoPack am 28.09.15 00:57:35Nach dem Wochenende inkl. News heute erstmal satt 4% Minus zum Auftakt. Stark
Antwort auf Beitrag Nr.: 50.725.329 von biopadawan am 28.09.15 15:34:59bin auch hellauf begeistert , mein Einstieg letzte Woche war perfektes timing.
, mein Einstieg letzte Woche war perfektes timing.
Naja, wird eben nachgelegt, wenn sich die Sache beruhigt.
 , mein Einstieg letzte Woche war perfektes timing.
, mein Einstieg letzte Woche war perfektes timing.Naja, wird eben nachgelegt, wenn sich die Sache beruhigt.
METEOR
die wohl wichtigste Erkenntnis zu METEOR ist die Folgende:"A planned interim analysis showed that overall survival was longer with cabozantinib than with everolimus (hazard ratio for death, 0.67; 95% CI, 0.51 to 0.89; P=0.005) but did not cross the significance boundary for the interim analysis."
http://www.ncbi.nlm.nih.gov/pubmed/26406150
Um als Wirkstoff bei RCC auch wirtschaftlich erfolgreich zu sein, ist ein Überlebensvorteil unter Therapie unabdingbar. In Anbetracht des hervorragenden Zwischenergebnis (HR=0.67, p=0.005) ist ein abschliessnd statistisch signifikanter Überlebensvorteil wohl reine Formsache, zumal die maximal zulässige Irrtumswahrscheinlichkeit bei der finalen Analyse lediglich kleiner 5% sein muss --> p=0.05. Um so unverständlicher ist die aktuelle Kursentwicklung. Jedoch werden weitere gute Nachrichten (Zulassung von Cobi in EU zum 1.12.2015 sowie spätestens am 11.11.2015 in den US - ich hoffe auf eine vorzeitige Zulassung im Oktober) den Kurs über USD7 anheben.
http://us.rd.yahoo.com/finance/external/mfool/SIG=139nrmt59/…Die unverständliche Kursentwicklung ist ausschließlich dem Biotechausverkauf zuzuschreiben, Gott sei Dank hat Cabo meiner Meinung nach hervorragende Ergebnisse geliefert, ansonsten wäre Exelixis geschlachtet worden:
Cobimetinib
ich halte es für sehr wahrscheinlich, dass sich den meisten Martteilnehmern das Potenzial von Cobi bisher noch nicht vollständig erschlossen hat. Möglicherweise ist das Interesse, daran etwas zu ändern, bei Genentech auch nicht sehr ausgeprägt. Da Exelixis bei den US-Rechten über nahezu 50% verfügt sowie an den RoW-Rechten im zweistelligen Prozentbereich mit Lizenzgebühren partizipiert, wird die Begehrlichkeit des Grosskonzerns nach der vollständigen Übernahme der Cobi-Rechte mit steigenden Erfolgsaussichten grösser. Während kurzfristig lediglich die Umsätze in Verbindung mit Vemurafenib zur Behandlung des metastatsierenden Hautkrebses zur Diskussion stehen (ab 2018 ca. 500 - 800 mUSD/a und dies sehr wahrscheinlich bis zum Patentablauf in ca. 15 Jahren), ist mittel-bis langfristig ein weitaus grösseres Potenzial in anderen Indikationen bzw. in Kombitherapie mit anderen Wirkstoffen zu beachten. Sollte sich die Vermutung bestätigen, dass unter Cobi das Therapieversagen anderer Wirkstoffe herausgezögert werden kann, dann wird Cobi zum Megablockbuster und für Exelixis wäre eine "cash cow" geboren. So weit wird es mM nach nicht kommen, da dies durch eine Übernahme verhindert werden wird. Bleibt nur zu hoffen, dass dann die Kleinaktionäre nicht wie bei vielen anderen Beispielen mit Peanuts abgespeist werden. Mein grösstes Fiasko diesbezüglich war mein voluminöses Investment in Medarex. Einige der heutigen Top-Wirkstoffe mit riesigem Potenzial (Ipilimumab, Nivolumab) wurden von Medarex entwickelt . Allerdings wurde Medarex vor deren Marktreife in 2009 von Bristol Myers Squibb übernommen, noch bevor das vollständige Marktpotenzial dieser Entwicklungen sichtbar wurde. Die Kleianleger wurden unter berücksichtigung des heutigen Potenzials mit Kleingeld abgefunden.
Ähnliches ist bei Exelixis zu befürchten. Cobi ist nämlich ein Eckpfeiler in Genentechs Onkologieportfolio und wird derzeit mit vielen verschiedenen anderen Wirkstoffen in frühen klinischen Phasen getestet. Und dies bei sehr "prominenten" Indikationen wie zB solid tumors, CRC, NSCLC oder TNBC. Da die Ergebnisse teilweise als Interimsergebnisse bereits vorliegen sollten, ohne dass diese der Öffentlichkeit mitgeteilt werden müssten (Zwischenergebnisse in frühen klinischen Phasen werden normalerweise nicht publiziert), hat man als Kleinanleger immer einen Informationsnachteil.
Go Exelixis go.........
Sevus Hexe, wo würdest Du den Übernahmepreis ansiedeln?
Antwort auf Beitrag Nr.: 50.770.551 von Magnetfeldfredy am 04.10.15 13:11:51Hi Freddy
im erwähnten Beispiel (Medarex) betrug der Übernahmepreis ca. USD 2.4 Mrd. Wird die Barreserve in Höhe von ca. 300 mUSD berücksichtigt, reduziert sich der Preis auf 2.1 Mrd USD. Das jährliche Umsatzpotenzial der von Medarex entwickelten Wirkstoffe dürfte jedoch diesen Kaufpreis weit übersteigen, so dass BMS rückblickend hier ein Superschnäppchen gemacht hat - und zwar auch auf Kosten der Kleinanleger.
Eine Übernahme von EXEL ist ebenfalls ein Versprechen in die Zukunft, wobei Insidern natürlich ganz andere Berechnungsgrundlagen zur Verfügung stehen. Fakt ist, dass Kleinanleger hierbei meistens den Kürzeren ziehen - so wohl auch bei EXEL. Sollte beispielsweise Cobi synergistisch zu Genentechs PDL1-Antikörper Atezolizumab wirken, dann dürfte ein Übernahmeangebot vor der Publikation dieser Wirkungsweise stattfinden. Diese ph1-Studien sollen relativ zeitnah den read-out Modus erreichen, so dass zumindest Trends schon in 2016 zur Verfügung stehen - Insidern wohlgemerkt! Kurzum, für mich sind zweistellige Kurse das Mindeste, um einem Deal zuzustimmen, weil sowohl die hard facts (cobi, cabo bei mMelanoma, MTC und RCC) als auch die Perspektiven (HCC, Cobi als multeinsetzbarer Kombiwirkstoff) viel versprechend sind.
im erwähnten Beispiel (Medarex) betrug der Übernahmepreis ca. USD 2.4 Mrd. Wird die Barreserve in Höhe von ca. 300 mUSD berücksichtigt, reduziert sich der Preis auf 2.1 Mrd USD. Das jährliche Umsatzpotenzial der von Medarex entwickelten Wirkstoffe dürfte jedoch diesen Kaufpreis weit übersteigen, so dass BMS rückblickend hier ein Superschnäppchen gemacht hat - und zwar auch auf Kosten der Kleinanleger.
Eine Übernahme von EXEL ist ebenfalls ein Versprechen in die Zukunft, wobei Insidern natürlich ganz andere Berechnungsgrundlagen zur Verfügung stehen. Fakt ist, dass Kleinanleger hierbei meistens den Kürzeren ziehen - so wohl auch bei EXEL. Sollte beispielsweise Cobi synergistisch zu Genentechs PDL1-Antikörper Atezolizumab wirken, dann dürfte ein Übernahmeangebot vor der Publikation dieser Wirkungsweise stattfinden. Diese ph1-Studien sollen relativ zeitnah den read-out Modus erreichen, so dass zumindest Trends schon in 2016 zur Verfügung stehen - Insidern wohlgemerkt! Kurzum, für mich sind zweistellige Kurse das Mindeste, um einem Deal zuzustimmen, weil sowohl die hard facts (cobi, cabo bei mMelanoma, MTC und RCC) als auch die Perspektiven (HCC, Cobi als multeinsetzbarer Kombiwirkstoff) viel versprechend sind.
Ist zwar nicht unerwartet, aber trotzdem nun offiziell... Cobi hat in der coBRIM PIII auch eine signifikante Lebensverlängerung gezeigt:
"Exelixis Announces Positive Overall Survival Results from Phase 3 Pivotal Trial of Cobimetinib in Combination with Vemurafenib in Patients with BRAF V600 Mutation-Positive Advanced Melanoma"
http://finance.yahoo.com/news/exelixis-announces-positive-ov…
US-Zulassung dürfte im November erfolgen. Positiv für EXEL ist, dass man in den USA auch eine eigene Vertriebsmannschaft haben wird, die später direkt auch zur Vermarktung von Cabo genutzt werden kann, denke ich.
Gruß
ipollit
"Exelixis Announces Positive Overall Survival Results from Phase 3 Pivotal Trial of Cobimetinib in Combination with Vemurafenib in Patients with BRAF V600 Mutation-Positive Advanced Melanoma"
http://finance.yahoo.com/news/exelixis-announces-positive-ov…
US-Zulassung dürfte im November erfolgen. Positiv für EXEL ist, dass man in den USA auch eine eigene Vertriebsmannschaft haben wird, die später direkt auch zur Vermarktung von Cabo genutzt werden kann, denke ich.
Gruß
ipollit
Erstaunlich. EXEL erwischt immer solche Tage fuer gute news wo der biotech index oder der gesamtmarkt in den keller geht...
Roche (RHHBY) Reports Positive Data on Skin Cancer Drugs
http://www.nasdaq.com/article/roche-rhhby-reports-positive-d…
http://www.nasdaq.com/article/roche-rhhby-reports-positive-d…
Cobimetinib die Wunderwaffe?
Cobimetinib hemmt selektiv das MEK-Signal innerhalb des MAPK-Signalweges (mitogen activated protein kinase) bzw. der signalgebenden Enzymkaskade RAS-RAF-MEK-ERK, an deren Ende der Impuls zur Zellteilung gegeben wird.DER MAPK-Signalweg hat in vielen Krebsformen eine zentrale Bedeutung:
Onkogene RAS-Mutationen sind am Entstehen von verschiedenartigen Krebsformen beteiligt, so bspw. bei ca. 50% der CRC-Erkrankungen (Dickdarmkrebs). Onkogene RAF-Mutationen, konkret BRAF, wurden ursächlich identifiziert bei ca. 50% Hautkrebserkrankungen, 40% Schilddrüsenkrebs, 30% Unterleibskrebs (eierstock) sowie ca. 10% CRC.
Durch die vielfache Beteiligung von MEK in diesen die Zellteilung auslösenden Signalwegen, ist es möglich, Cobi mit vielerlei anderen Wirkstoffen zu kombinieren, um somit eine anti-neoplastsche Wirkung zu optimieren
--> https://clinicaltrials.gov/ct2/results?term=cobimetinib&Sear…
Da die Akltivierung des MAPK-Signalwegs häufig ursächlich mit dem Therapieversagen von antitumoralen Wirkstoffen in Verbiundung gebracht wird, ist die Blockade dieses Signalweges ausserdem eine viel versprechende Strategie, um derartige Resistenzen zu vermeiden oder zumindest zu verzögern.
Die Kombination mit anderen Wirkstoffen erfolgt nach den folgenden Prinzipien:
- Hemmung innerhalb des gleichen Signalweges, also MAPK-Signalweg zB mit Vemurafenib zur Hemmung von RAF
- Hemmung von verschiedenen Signalwegen zB des Signalweges, der die Angiogenese, also die Neubildung von Blutgefässen, fördert --> Vascular Endothelial Growth Factor (VEGF) oder --> Epidermal growth factor receptor (EGFR)
- durch Anregung des programmierten Zelltods zB in Kombination mit Taxanen
- und "last but not least" das körpereigene Immunsystem auf die Krebszellen aufmerksam zu machen und es zu einer Immunantwort zu aktivieren. Es wird vermutet, dass Cobi eine durch andere Stoffe (wie zB monoklonale Antikörper) induzierte Immunantwort verstärkt --> https://clinicaltrials.gov/ct2/show/NCT01656642?term=cobimet…
- Thewrapieversagen wird durch Hemmung des MAPK-Signalweges verzögert
http://www.roche.com/research_and_development/what_we_are_wo…
Cobi könnte eine grosse Geschichte werden - Good Hunting!
ch
Genial wenn Cobi vielen Krebskranken helfen könnte und uns Aktionäre bereichern würde, bald müßte die Zulassung kommen!
Antwort auf Beitrag Nr.: 50.871.063 von Cyberhexe am 17.10.15 15:48:21http://www.cellsignal.com/common/content/content.jsp?id=scie…
Antwort auf Beitrag Nr.: 50.871.063 von Cyberhexe am 17.10.15 15:48:21"Cobimetinib hemmt selektiv das MEK-Signal"
Ich ergänze das fehlende PS:
MEK-Inhibitoren gibt es inzwischen fast wie Sand am Meer - bereits am Markt zugelassen oder in PIII-Studien. Bisher erfolgt auch kein breiter Einsatz in allen möglichen Indikationen. Es sieht zwar danach aus, dass sich das Einsatzgebiet der MEKs künftig erweitern wird, aber Cobi ist nur einer unter vielen und nicht DER MEK-Inhibitor.
Ich halte bis jetzt auch den Begriff "Wunderwaffe" für stark übertrieben.
Die Entwicklung ist ganz sicher positiv zu bewerten, aber man muss es auch nicht übertreiben.
Ich ergänze das fehlende PS:
MEK-Inhibitoren gibt es inzwischen fast wie Sand am Meer - bereits am Markt zugelassen oder in PIII-Studien. Bisher erfolgt auch kein breiter Einsatz in allen möglichen Indikationen. Es sieht zwar danach aus, dass sich das Einsatzgebiet der MEKs künftig erweitern wird, aber Cobi ist nur einer unter vielen und nicht DER MEK-Inhibitor.
Ich halte bis jetzt auch den Begriff "Wunderwaffe" für stark übertrieben.
Die Entwicklung ist ganz sicher positiv zu bewerten, aber man muss es auch nicht übertreiben.
Antwort auf Beitrag Nr.: 50.873.913 von SLGramann am 18.10.15 13:05:18wenn man andere Beiträge kritisiert, dann sollte man diese zumindest nicht nur oberflächlich gelesen haben: "Cobimetinib die Wunderwaffe?"
Das Fragezeichen soll die These durchaus in Frage stellen!
Ja natürlich, es gibt einige MEK-Hemmer, die bereits in der Klinik erprobt werden bzw. bereits am Markt zugelassen sind. Allerdings wird wohl kein anderer in derart unterschiedlichen Studien nach den geschilderten 4 Prinzipien erprobt, die da wären:
- Hemmung innerhalb des gleichen Signalweges, also MAPK-Signalweg zB mit Vemurafenib zur Hemmung von RAF
- Hemmung von verschiedenen Signalwegen zB des Signalweges, der die Angiogenese, also die Neubildung von Blutgefässen, fördert --> Vascular Endothelial Growth Factor (VEGF) oder --> Epidermal growth factor receptor (EGFR)
- durch Anregung des programmierten Zelltods zB in Kombination mit Taxanen (Paclitaxel zur Behandlung von TNBC)
- und "last but not least" das körpereigene Immunsystem auf die Krebszellen aufmerksam zu machen und es zu einer Immunantwort zu aktivieren. Es wird vermutet, dass Cobi eine durch andere Stoffe induzierte Immunantwort verstärkt - synergistische Wirkung zu Atezolizumab?
Was mir an dieser Kritik wie auch an vielen anderen Beiträgen bei wo fehlt, ist der konstruktive Part. Man hätte sich beispielsweise die Mühe machen können, die anderen bereits am Markt etablierten MEK-Hemmer wie zB Trametinib wenigstens vorzustellen.
Das Fragezeichen soll die These durchaus in Frage stellen!
Ja natürlich, es gibt einige MEK-Hemmer, die bereits in der Klinik erprobt werden bzw. bereits am Markt zugelassen sind. Allerdings wird wohl kein anderer in derart unterschiedlichen Studien nach den geschilderten 4 Prinzipien erprobt, die da wären:
- Hemmung innerhalb des gleichen Signalweges, also MAPK-Signalweg zB mit Vemurafenib zur Hemmung von RAF
- Hemmung von verschiedenen Signalwegen zB des Signalweges, der die Angiogenese, also die Neubildung von Blutgefässen, fördert --> Vascular Endothelial Growth Factor (VEGF) oder --> Epidermal growth factor receptor (EGFR)
- durch Anregung des programmierten Zelltods zB in Kombination mit Taxanen (Paclitaxel zur Behandlung von TNBC)
- und "last but not least" das körpereigene Immunsystem auf die Krebszellen aufmerksam zu machen und es zu einer Immunantwort zu aktivieren. Es wird vermutet, dass Cobi eine durch andere Stoffe induzierte Immunantwort verstärkt - synergistische Wirkung zu Atezolizumab?
Was mir an dieser Kritik wie auch an vielen anderen Beiträgen bei wo fehlt, ist der konstruktive Part. Man hätte sich beispielsweise die Mühe machen können, die anderen bereits am Markt etablierten MEK-Hemmer wie zB Trametinib wenigstens vorzustellen.
Antwort auf Beitrag Nr.: 50.877.135 von Cyberhexe am 19.10.15 07:13:32"Man hätte sich beispielsweise die Mühe machen können, die anderen bereits am Markt etablierten MEK-Hemmer wie zB Trametinib wenigstens vorzustellen."
Das ist sicher richtig. Mir ging es aber in erster Linie um die ergänzende Information, dass Cobi kein solitärer Durchbruch ist, sondern ein MEK-Inhibitor unter vielen. Was für Cobi spricht, ist natürlich der Entwickler Roche/Genentech, der in jeder Hinsicht first class ist.
Hier eine grobe Übersicht über MEKs:
https://am.asco.org/exploring-pathway-inhibiting-mek-cancer-…
(Erwähnenswert ist, dass der MEK-Inhibitor Trametinib (Mekinist) inzwischen von GSK zu Novartis "gewandert" ist, was seine kommerzielle Schlagkraft erhöhen dürfte.
Dafür hängt der ursprüngliche MEK-Inhibitor von Novartis MEK162 derzeit in der Luft und wartet bei seinem Entwickler Array auf eine Neuverpartnerung, die an sich bis zum Ende des Jahres erfolgen soll...
Hier besteht die Möglichkeit, dass ein weiterer großer Pharma einen PIII-MEK in die Hand bekommen wird.
Das ist sicher richtig. Mir ging es aber in erster Linie um die ergänzende Information, dass Cobi kein solitärer Durchbruch ist, sondern ein MEK-Inhibitor unter vielen. Was für Cobi spricht, ist natürlich der Entwickler Roche/Genentech, der in jeder Hinsicht first class ist.
Hier eine grobe Übersicht über MEKs:
https://am.asco.org/exploring-pathway-inhibiting-mek-cancer-…
(Erwähnenswert ist, dass der MEK-Inhibitor Trametinib (Mekinist) inzwischen von GSK zu Novartis "gewandert" ist, was seine kommerzielle Schlagkraft erhöhen dürfte.
Dafür hängt der ursprüngliche MEK-Inhibitor von Novartis MEK162 derzeit in der Luft und wartet bei seinem Entwickler Array auf eine Neuverpartnerung, die an sich bis zum Ende des Jahres erfolgen soll...
Hier besteht die Möglichkeit, dass ein weiterer großer Pharma einen PIII-MEK in die Hand bekommen wird.
Antwort auf Beitrag Nr.: 50.877.135 von Cyberhexe am 19.10.15 07:13:32"Was mir an dieser Kritik wie auch an vielen anderen Beiträgen bei wo fehlt, ist der konstruktive Part."
Noch eine Ergänzung am Rande:
Was mir an W ebenfalls oft nicht gefällt, ist, dass sich hier Leute in Aktien verlieben und dann eine Fanbrille aufsetzen.
ebenfalls oft nicht gefällt, ist, dass sich hier Leute in Aktien verlieben und dann eine Fanbrille aufsetzen.
Das bezieht sich jetzt nicht auf Dich, aber bspw. auf Deinen Fan Magnetfeld. Statt differenzierte Informationen zu suchen, um rational entscheiden zu können, wird alles kritiklos begrüßt, was das eigene Weltbild zu bestätigen scheint und alles negiert, was den Horizont erweitern würde.
Noch eine Ergänzung am Rande:
Was mir an W
 ebenfalls oft nicht gefällt, ist, dass sich hier Leute in Aktien verlieben und dann eine Fanbrille aufsetzen.
ebenfalls oft nicht gefällt, ist, dass sich hier Leute in Aktien verlieben und dann eine Fanbrille aufsetzen.Das bezieht sich jetzt nicht auf Dich, aber bspw. auf Deinen Fan Magnetfeld. Statt differenzierte Informationen zu suchen, um rational entscheiden zu können, wird alles kritiklos begrüßt, was das eigene Weltbild zu bestätigen scheint und alles negiert, was den Horizont erweitern würde.
Cyberhexe hat super Ahnung von Exelixis und der Materie, im Gegensatz zu Dir und ja ich bewundere diese Ahnung!
Antwort auf Beitrag Nr.: 50.878.185 von Magnetfeldfredy am 19.10.15 10:25:22… oh Freddy, wenn du nur ein Bisschen über den Tellerrand rausschauen bzw. in anderen Bio-Threads hier lesen würdest - und da besonders die Beiträge von SL - dann könntest nicht so ein Zeug schreiben!
Meiner Ansicht nach hat SL wirklich einen guten Durchblick, von dem ich jedenfalls schon mehrmals profitiert habe (nebenbei: ein Danke an SL!). Und er hat in dem Kommentar oben wirklich den Nagel auf den Kopf getroffen, nicht nur mit Blick auf deine Beiträge hier. Es gibt so viele, die ihr Aktien-Engagement scheinbar genauso betreiben, wie das Engagement bei ihrem Fußballverein.
Das kann man ja machen – jedem das seine. Aber bitte nicht solche User wie SL vergraulen.
Martin
Meiner Ansicht nach hat SL wirklich einen guten Durchblick, von dem ich jedenfalls schon mehrmals profitiert habe (nebenbei: ein Danke an SL!). Und er hat in dem Kommentar oben wirklich den Nagel auf den Kopf getroffen, nicht nur mit Blick auf deine Beiträge hier. Es gibt so viele, die ihr Aktien-Engagement scheinbar genauso betreiben, wie das Engagement bei ihrem Fußballverein.
Das kann man ja machen – jedem das seine. Aber bitte nicht solche User wie SL vergraulen.
Martin
Ich hab nicht angefangen und Cyberhexe ist in Exelixis eine absolute Fachfrau!
Antwort auf Beitrag Nr.: 50.880.210 von Magnetfeldfredy am 19.10.15 14:17:30aber SLG auch, und der "Biotech" thread in dem er schreibt ist fachlich eine Freude, viele Werte besprochen und es wird alles auch kritisch beleuchtet.
Antwort auf Beitrag Nr.: 50.880.051 von v-man07 am 19.10.15 13:57:49"Aber bitte nicht solche User wie SL vergraulen."
Danke. Aber keine Sorge. Ich teile manchmal aus und dann kann ich auch einstecken. Alles gut.
Zum Thema:
In der Sache ist es mir wichtig, dass Dinge nicht zu einseitig dargestellt werden. Meiner ganz persönlichen Meinung nach neigt Cyberhexe nämlich etwas dazu. An seiner/ihrer fachlichen Kompetenz zweifle ich überhaupt nicht. Ich vermisse in manchen Texten nur ein Aber.
Dieses fehlende Aber erschwert dem einen oder anderen möglicherweise die Kontrolle des Risikos.
Wir sind uns hier glaube ich alle einig, dass EXEL eine spannende und vielversprechende Geschichte (geworden) ist. Der Hinweis, dass Cobi nur ein MEK-Inhibitor unter vielen ist, kann gerade dann nicht schaden.
Danke. Aber keine Sorge. Ich teile manchmal aus und dann kann ich auch einstecken. Alles gut.
Zum Thema:
In der Sache ist es mir wichtig, dass Dinge nicht zu einseitig dargestellt werden. Meiner ganz persönlichen Meinung nach neigt Cyberhexe nämlich etwas dazu. An seiner/ihrer fachlichen Kompetenz zweifle ich überhaupt nicht. Ich vermisse in manchen Texten nur ein Aber.
Dieses fehlende Aber erschwert dem einen oder anderen möglicherweise die Kontrolle des Risikos.
Wir sind uns hier glaube ich alle einig, dass EXEL eine spannende und vielversprechende Geschichte (geworden) ist. Der Hinweis, dass Cobi nur ein MEK-Inhibitor unter vielen ist, kann gerade dann nicht schaden.
Antwort auf Beitrag Nr.: 50.880.504 von SLGramann am 19.10.15 14:54:40nicht die uneingeschränkte Zustimmung sondern der Diskurs ist Sinn und Zweck eines solchen Forums - nur deswegen bin ich hier. Es ist sicherlich so, und das hat die Vergangenheit bewiesen, dass mein Blick hin und wieder durch die rosa Brille getrübt wird, weshalb die Widerrede mehr als wünschenswert ist.
ABER... ... ich habe auch schon erlebt, dass Chancen wie bspw. bei Medarex nicht erkannt bzw. bewusst verschleiert werden, um Kleinanleger mit Peanuts abzuspeisen. Es ist auf alle Fälle Fakt, dass Cobi derzeit im Onkologie-Entwicklungsportfolio von Roche/Genentech neben Atezolizumab eine exponierte Stellung einnimmt - und sollte sich die Vermutung bestätigen, dass zwischen beiden Wirkstoffen synergistische Interaktionen bestehen, sollten sich die Kleinanleger vorsehen, nicht ähnlich übervorteilt zu werden wie bei Medarex.
... ich habe auch schon erlebt, dass Chancen wie bspw. bei Medarex nicht erkannt bzw. bewusst verschleiert werden, um Kleinanleger mit Peanuts abzuspeisen. Es ist auf alle Fälle Fakt, dass Cobi derzeit im Onkologie-Entwicklungsportfolio von Roche/Genentech neben Atezolizumab eine exponierte Stellung einnimmt - und sollte sich die Vermutung bestätigen, dass zwischen beiden Wirkstoffen synergistische Interaktionen bestehen, sollten sich die Kleinanleger vorsehen, nicht ähnlich übervorteilt zu werden wie bei Medarex.
ABER...
 ... ich habe auch schon erlebt, dass Chancen wie bspw. bei Medarex nicht erkannt bzw. bewusst verschleiert werden, um Kleinanleger mit Peanuts abzuspeisen. Es ist auf alle Fälle Fakt, dass Cobi derzeit im Onkologie-Entwicklungsportfolio von Roche/Genentech neben Atezolizumab eine exponierte Stellung einnimmt - und sollte sich die Vermutung bestätigen, dass zwischen beiden Wirkstoffen synergistische Interaktionen bestehen, sollten sich die Kleinanleger vorsehen, nicht ähnlich übervorteilt zu werden wie bei Medarex.
... ich habe auch schon erlebt, dass Chancen wie bspw. bei Medarex nicht erkannt bzw. bewusst verschleiert werden, um Kleinanleger mit Peanuts abzuspeisen. Es ist auf alle Fälle Fakt, dass Cobi derzeit im Onkologie-Entwicklungsportfolio von Roche/Genentech neben Atezolizumab eine exponierte Stellung einnimmt - und sollte sich die Vermutung bestätigen, dass zwischen beiden Wirkstoffen synergistische Interaktionen bestehen, sollten sich die Kleinanleger vorsehen, nicht ähnlich übervorteilt zu werden wie bei Medarex. CHMP
Der europäische Arzneimittelausschuss CHMP hat in seiner Oktobersitzung (21. bis 24.10.2015) über den Antrag von Exelixis hinsichtlich eines beschleunigten Zulassungsverfahrens für Cabo zur Behandlung von RCC zu entscheiden.Das Ergebnis sollte am Freitag bekannt gegeben werden.
8.1.3.
-
cabozantinib
-
H000416
treatment of renal cell carcinoma
Scope: Request for an Accelerated Assessment
Action: For adoption
Letter from the company dated
27 August 2015
requesting an accelerated assessment
Rapporteurs’ accelerated assessment briefing note
http://www.ema.europa.eu/docs/en_GB/document_library/Agenda/…
FDA: Rolling Submission für Cabo bei RCC
"Rolling Submission" erlaubt dem Antragsteller, einzelne Teile des Zulassungsantrages (in diesem Fall ein NDA) separat einzureichen. Die wichtigsten Teile eines solchen Zulassungsantrages sind:QUALITY --> Chemistry Manufacturing and Controls (CMC)
NONCLINICAL STUDY REPORTS
CLINICAL STUDY REPORTS
Das waren früher xTonnen von Papier, die da eingereicht werden mussten. Mittlerweile erfolgt die Antragstellung elektronisch - die damit verbundene Arbeit jedoch bleibt gleich und scheint für eine Firma der Grösse Exelixis ein nur schwer lösbares Unterfangen zu sein. Also ohne fremde Expertise / Unterstützung wird das kaum zu bewältigen sein. Vielleicht gibt es demnächst ja auch Neuigkeiten diesbezüglich, dass man bespw. einen potenten Vertriebspartner mit an Bord nimmt, der dann auch gleich bei der Antragstellung behilflich sein könnte.
Thu, Oct 22, 2015,
Exelixis Initiates Rolling Submission of U.S. New Drug Application for Cabozantinib for the Treatment of Advanced Kidney Cancer
Business Wire Exelixis, Inc.
3 hours ago
SOUTH SAN FRANCISCO, Calif.--(BUSINESS WIRE)--
Exelixis, Inc. (EXEL) today announced the company has initiated submission of its rolling New Drug Application (NDA) to the U.S. Food & Drug Administration (FDA) for cabozantinib for the treatment of advanced renal cell carcinoma (RCC) patients who have received one prior therapy. Cabozantinib was granted Breakthrough Therapy Designation by the FDA in August 2015. Exelixis agreed with FDA that the submission would be a rolling NDA and the company has filed the first component of the application for potential approval of cabozantinib in the United States. The rolling NDA allows completed portions of an NDA to be submitted and reviewed by the FDA on an ongoing basis. Exelixis plans to complete the NDA submission before the end of 2015.
The rolling NDA submission is based on results of METEOR, a phase 3 pivotal trial comparing cabozantinib to everolimus in patients with advanced RCC who experienced disease progression following treatment with a VEGF receptor tyrosine kinase inhibitor. In July 2015, Exelixis announced top-line results from METEOR demonstrating that the trial had met its primary endpoint of improving progression-free survival (PFS); compared with everolimus, cabozantinib was associated with a 42% reduction in the risk of disease progression or death. These data were later presented at the European Cancer Congress in September 2015 and concurrently published in The New England Journal of Medicine.
Zur Zeit wird jede positive news geshorted, freue mich schon wenn die shorts gegrillt werden, spätestens am 11.11.2015 bei der zu erwartenden Zulassung!
EADO Kongress in Marseille
European Association of Dermata Oncology Kongress vom 28. - 31.Oktober 2015
Heute, Donnerstag 29.10.2015, wird Roche ab 17h30 ein Symposium abhalten, welches die Kombitherapie (Zelboraf+Cotellic) zur Behandlung des schwarzen Hautkrebses zum Thema haben wird.
Auch wenn keine Neuigkeiten zu erwarten sind (wenn, dann vielleicht ein Update zu Overall Survival...ich rechne zwar nicht damit!), so gilt es doch die bevorstehende Marktzulassung (in Europa sehr wahrscheinlich am 1.12.2015) vorzubereiten und sich ins Gedächtnis der verschreibenden Ärzten einzuprägen - die Konkurrenz ist allerdings auch vertreten:
http://www.eado-melanomacenters-marseille2015.com/programme/…
Antwort auf Beitrag Nr.: 50.878.185 von Magnetfeldfredy am 19.10.15 10:25:22
SLGraman steht da keineswegs hinten an. Es ist leider so, dass Cyberhexe, trotz aller guter Infos, etwas die rosarote Brille auf hat und zu wenig nach links oder rechts schaut. Ich bin ja auch in EXEL, aber in Cobi habe ich nie eine Wunderwaffe oder einen Blockbuster gesehen. Gutes Zubrot bis zu Cabo Zulassung in RCC, mehr nicht.
Und Magnetfeldfredy, du als gebranntes DNDN Kind solltest sehr vorsichtig sein. Vieles ist nicht das was es scheint. Und wird nach einem Pump gnadenlos gedumpt.
Zitat von Magnetfeldfredy: Cyberhexe hat super Ahnung von Exelixis und der Materie, im Gegensatz zu Dir und ja ich bewundere diese Ahnung!
SLGraman steht da keineswegs hinten an. Es ist leider so, dass Cyberhexe, trotz aller guter Infos, etwas die rosarote Brille auf hat und zu wenig nach links oder rechts schaut. Ich bin ja auch in EXEL, aber in Cobi habe ich nie eine Wunderwaffe oder einen Blockbuster gesehen. Gutes Zubrot bis zu Cabo Zulassung in RCC, mehr nicht.
Und Magnetfeldfredy, du als gebranntes DNDN Kind solltest sehr vorsichtig sein. Vieles ist nicht das was es scheint. Und wird nach einem Pump gnadenlos gedumpt.
Antwort auf Beitrag Nr.: 50.899.872 von Cyberhexe am 21.10.15 17:20:08Und? Was ist daraus geworden? Da du diesbezüglich nichts gepostet hast gehe ich davon aus, dass es nicht zu einer beschlenigten Zulassung kommen wird.
Zitat von Cyberhexe: Der europäische Arzneimittelausschuss CHMP hat in seiner Oktobersitzung (21. bis 24.10.2015) über den Antrag von Exelixis hinsichtlich eines beschleunigten Zulassungsverfahrens für Cabo zur Behandlung von RCC zu entscheiden.
Das Ergebnis sollte am Freitag bekannt gegeben werden.
8.1.3.
-
cabozantinib
-
H000416
treatment of renal cell carcinoma
Scope: Request for an Accelerated Assessment
Action: For adoption
Letter from the company dated
27 August 2015
requesting an accelerated assessment
Rapporteurs’ accelerated assessment briefing note
http://www.ema.europa.eu/docs/en_GB/document_library/Agenda/…
Antwort auf Beitrag Nr.: 50.961.498 von Ville7 am 29.10.15 14:09:07hierzu sind leider noch keine Nachrichten recherchierbar - auch nicht auf der EMA-Seite.
Übrigens...die FDA hat gestern Ipilimumab (brand name Yervoy) zur Behandlung von schwarzem Hautkrebs zugelassen.
"Today the U.S. Food and Drug Administration expanded the approved use of Yervoy (ipilimumab) to include a new use as adjuvant therapy for patients with stage III melanoma, to lower the risk that the melanoma will return following surgery."
http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/uc…
Übrigens...die FDA hat gestern Ipilimumab (brand name Yervoy) zur Behandlung von schwarzem Hautkrebs zugelassen.
"Today the U.S. Food and Drug Administration expanded the approved use of Yervoy (ipilimumab) to include a new use as adjuvant therapy for patients with stage III melanoma, to lower the risk that the melanoma will return following surgery."
http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/uc…
Antwort auf Beitrag Nr.: 50.961.477 von Ville7 am 29.10.15 14:05:11Ja, ich habe mit Dendreon viel Geld bei der Zulassung verdient und wieder etwas verloren, das soll mich aber nicht hindern mit Exelixis wieder Erfolg zu haben, Phase III erreicht für Nierenkrebs, Cabo + Cobi werden EXEL schon rocken!

Antwort auf Beitrag Nr.: 50.961.477 von Ville7 am 29.10.15 14:05:11Ich bin ja auch in EXEL, aber in Cobi habe ich nie eine Wunderwaffe oder einen Blockbuster gesehen.
Nun ja, jetzt gehen diese unsauberen Geschichten wieder los, auf die ich zukünftig nicht mehr reagieren möchte.
Ich habe Cobi nie als Wunderwaffe vorgestellt - ein Fragezeichen wird, wie jeder weiss, zur Kennzeichnung von Fragesätzen verwendet. Ausser Frage steht jedoch, dass Cobi im Entwicklungsportfolio von Roche/Genentech eine exponierte Stellung einnimmt. Ob dies dann mittel- bis langfristig (nicht vor 2019) zu weiteren Indikationen führt (TNBC, NSCLC, CRC, AML, Neoplasms, Solid tumors etc.), kann NIEMAND vorhersagen. Das Potenzial ist jedoch riesig, zumal sich die Vermutung, dass Cobi die induzierte Immunantwort von Atezolizumab (derzeit in Mono in einigen ph3-Studien) synergistisch verstärkt, durch verschiedene Publikationen verdichtet.
Dies war ein Blick nach vorne. Was gibst denn links und rechts?
Nun ja, jetzt gehen diese unsauberen Geschichten wieder los, auf die ich zukünftig nicht mehr reagieren möchte.
Ich habe Cobi nie als Wunderwaffe vorgestellt - ein Fragezeichen wird, wie jeder weiss, zur Kennzeichnung von Fragesätzen verwendet. Ausser Frage steht jedoch, dass Cobi im Entwicklungsportfolio von Roche/Genentech eine exponierte Stellung einnimmt. Ob dies dann mittel- bis langfristig (nicht vor 2019) zu weiteren Indikationen führt (TNBC, NSCLC, CRC, AML, Neoplasms, Solid tumors etc.), kann NIEMAND vorhersagen. Das Potenzial ist jedoch riesig, zumal sich die Vermutung, dass Cobi die induzierte Immunantwort von Atezolizumab (derzeit in Mono in einigen ph3-Studien) synergistisch verstärkt, durch verschiedene Publikationen verdichtet.
Dies war ein Blick nach vorne. Was gibst denn links und rechts?

Antwort auf Beitrag Nr.: 50.964.480 von Cyberhexe am 29.10.15 19:56:19
http://www.roche.com/irp150601.pdf
https://clinicaltrials.gov/ct2/results?term=cobimetinib&pg=2
http://www.roche.com/irp150601.pdf
https://clinicaltrials.gov/ct2/results?term=cobimetinib&pg=2
Antwort auf Beitrag Nr.: 50.964.549 von Cyberhexe am 29.10.15 20:06:41wertvolle Info, Cyberhexe, vielen Dank.
Ist Atezolizumab identisch mit der Substanz: MPDL3280A?
A Phase 1b Study of MPDL3280A (an Engineered Anti-PDL1 Antibody) in Combination With Cobimetinib in Patients With Locally Advanced or Metastatic Solid Tumors
Criteria
Inclusion Criteria:
Age >/= 18 years.
Solid tumor that is metastatic, locally advanced or recurrent.
ECOG performance status of 0 or 1.
Life expectancy >/= 12 weeks.
Measurable disease, as defined by RECIST v1.1.
Adequate blood and organ function.
Use of highly effective contraception.
Histological tumor tissue specimen.
Patients enrolling in the expansion cohorts in Stage 2 must consent to tumor biopsies and must have one of the following types of cancer:
KRAS-mutant metatastic colorectal cancer (mCRC)
Non-small cell lung cancer (NSCLC)
Melanoma
https://www.clinicaltrials.gov/ct2/show/NCT01988896?term=cob…
A Study of Cobimetinib in Combination With Paclitaxel as First-line Treatment for Patients With Metastatic Triple-negative Breast Cancer
A Study of the Safety, Tolerability, and Effects of Cobimetinib and GDC-0994 in Patients With Locally Advanced or Metastatic Solid Tumors
und viele mehr!
Ist Atezolizumab identisch mit der Substanz: MPDL3280A?
A Phase 1b Study of MPDL3280A (an Engineered Anti-PDL1 Antibody) in Combination With Cobimetinib in Patients With Locally Advanced or Metastatic Solid Tumors
Criteria
Inclusion Criteria:
Age >/= 18 years.
Solid tumor that is metastatic, locally advanced or recurrent.
ECOG performance status of 0 or 1.
Life expectancy >/= 12 weeks.
Measurable disease, as defined by RECIST v1.1.
Adequate blood and organ function.
Use of highly effective contraception.
Histological tumor tissue specimen.
Patients enrolling in the expansion cohorts in Stage 2 must consent to tumor biopsies and must have one of the following types of cancer:
KRAS-mutant metatastic colorectal cancer (mCRC)
Non-small cell lung cancer (NSCLC)
Melanoma
https://www.clinicaltrials.gov/ct2/show/NCT01988896?term=cob…
A Study of Cobimetinib in Combination With Paclitaxel as First-line Treatment for Patients With Metastatic Triple-negative Breast Cancer
A Study of the Safety, Tolerability, and Effects of Cobimetinib and GDC-0994 in Patients With Locally Advanced or Metastatic Solid Tumors
und viele mehr!
Antwort auf Beitrag Nr.: 50.964.480 von Cyberhexe am 29.10.15 19:56:19"Ausser Frage steht jedoch, dass Cobi im Entwicklungsportfolio von Roche/Genentech eine exponierte Stellung einnimmt."
Wie kommst du zu dieser Aussage?... das kann ich so nicht erkennen, Cobi ist bei Roche ein Mittel unter vielen. Hätte Cobi eine größere Bedeutung für Roche, warum haben sie dann nicht bei EXEL zugeschlagen, als der Kurs vor den METEOR-Daten releativ im Keller war? Schließlich erhält EXEL für Cobi ungewöhnlich hohe Royalties von bis zu 35%.
MEK-Hemmer gibt es zahlreich in der Entwicklung. Hier nimmt Cobi auch keine besondere Stellung ein. Ursprünglich wollte Roche mit dem BRAF-Hemmer Zelboraf in Melanoma groß durchstarten... Zelboraf sah recht aussichtsreich aus und Roche war auf diesem Gebiet führend. Nur stellte es sich schnell heraus, dass Zelboraf nach kurzer Zeit zu Resistenzen führt und man mit einem MEK-Hemmer diesen Resistenzen entgegenwirken kann. So war die Einlizensierung von Cobi für Roche ein Schutz von Zelboraf... mehr erstmal nicht. Andere haben dagegen MEK-Hemmer schon von Anfang an sehr viel breiter entwickelt.
In der letzten Präsentation http://www.roche.com/irp3q15e.pdf von Roche nimmt Cobi keine besondere Stellung ein, es wird nicht separat erwähnt und spielt erstmal nur in der Kombi mit Zelboraf in Melanoma eine Rolle. Zelboraf wird im Bereich der Onkologie herausgehoben, aber wie man sieht, ist es relativ unbedeutend gegenüber z.B. Herceptin, Avastin, Rituxan usw... die Umsätze sind mit -25% deutlich rückläufig. Aber auch die Cobi-Kombi wird die Konkurrenz von NVS und ARRY zu spüren bekommen.
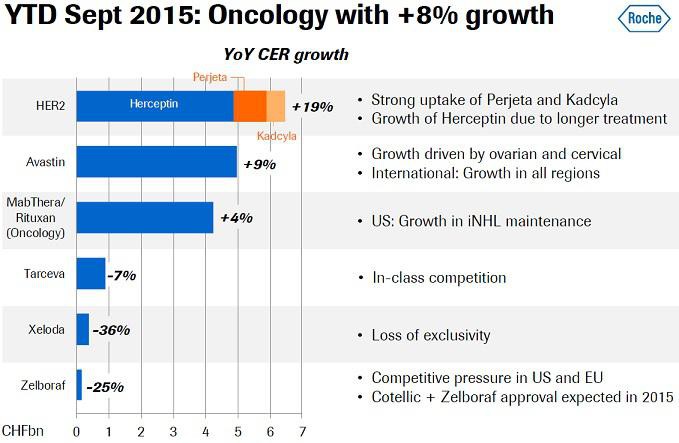
ARRY wurde früher als "kleine EXEL" bezeichnet... ich würde bei MEK-Hemmern ARRY bevorzugen, da sie gleich zwei MEK-Hemmer in mehreren PIIIs haben. Binimetinib wurde bisher von NVS entwickelt. Nach der Übernahme von GSK's Krebspipeline hat NVS Binimetinib an ARRY zurückgegeben und als Geschenk noch den BRAF-Hemmer Encorafenib oben drauf. Zudem wird der zweite MEK-Hemmer Selumetinib von AZN entwickelt.
Der fortgeschrittenste MEK-Hemmer ist wohl Mekinist, den NVS zusammen mit dem BRAF-Hemmer Tafinlar von GSK übernommen hat.
Die Anzahl der laufenden Studien mit diesen Mitteln spricht eine klare Sprache:
- NVS's Mekinist (Trametinib), zugelassen: 102 Studien, 63 rekrutierende
- AZN/ARRY's Selumetinib, PIII: 88 Studien, 26 rekrutierende
- ARRY's Binimetinib (MEK162), PIII: 35 Studien, 20 rekrutierende
- Roche/EXEL's Cobimetinib (GDC-0973), NDA: 26 Studien, 12 rekrutierende
Es gibt Unterschiede in den Entwicklungsansätzen. Selumetinib wird hauptsächlich in KRAS-Lungenkrebs in Kombi mit Chemo entwickelt. Selumetinib scheint eher ein schwächerer MEK-Hemmer zu sein, aber mit dem Vorteil, dass er mit Chemos kombiniert werden kann. Eine Wirkung bei KRAS-Mutationen wäre ein großer Erfolg, da KRAS sehr therapieresistent ist... hier wirkt bisher nur die Chemo. Der KRAS-Anteil bildet bei Lungenkrebs die größte Mutationsgruppe noch vor EGFR-Mutationen (KRAS-Mutationen betreffen den MAPK/ERK-Signalweg, zu dem u.a. RAS, RAF, MEK und ERK gehören... genauso wie z.B. BRAF- oder NRAS-Mutationen).
Die Standard-Anwendung von MEK-Hemmer ist die BRAF+MEK-Kombi in Melanoma (schwarzer Hautkrebs), da diese Kombination eine hohe Wirkung hat... Tafinlar+Mekinist, Zelboraf+Cobimetinib und Encorafenib+Binimetinib werden sich bald den Markt teilen (Wie groß ist der Markt? 1 bis 1,5 Mrd USD?). Selumetinib wird hier nicht entwickelt. Vielleicht wird es längerfristig noch Kombis wie BRAF+MEK+ERK gegeben, um Resistenzen gegen BRAF+MEK zu reduzieren. Roche hat z.B. mit ARRYs GDC-0994 auch eine ERK-Hemmer in der Pipeline. Melanoma wird zukünftig auch von PD1 dominiert werden.
https://am.asco.org/exploring-pathway-rasrafmekerk-pathway-f…
http://mct.aacrjournals.org/content/11/5/1143
BRAF-Mutationen sind bei Melanoma sehr häufig. Relevant sind auch NRAS-Mutationen. Hier scheint ARRY führend zu sein, da bald PIII-Daten vorliegen sollten. Cobi wird anscheinend nicht gegen NRAS entwickelt. Interessant finde ich auch MEK-Kombis gegen Darmkrebs z.B. mit EGFR-AKs wie Erbitux... auch eine Entwicklung von ARRY, nicht aber von Cobi.
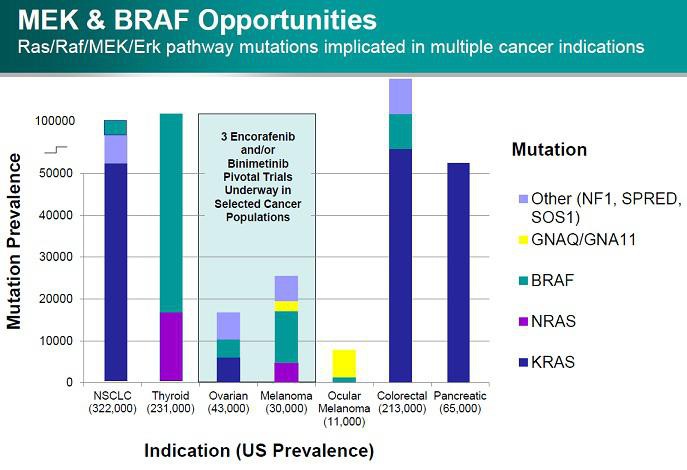
Der IO-Einsatz von Cobi in Kombi mit Atezolizumab ist zwar interessant, doch meiner Meinung nur High-Risk. Eine direkte Wirkung von MEK-Hemmern auf das Immunsystem ist nicht eindeutig erwiesen. Roche selber ordnet MEK-Hemmer nur unter "Antigen release" ein, d.h. Krebsmittel, die Krebszellen abtöten und somit deren Bestandteile dem Immunsystem zugänglich machen. Dazu gehören auch Zelboraf oder EGFR, ALK-Hemmer sowie CD20-AKs und Chemos.
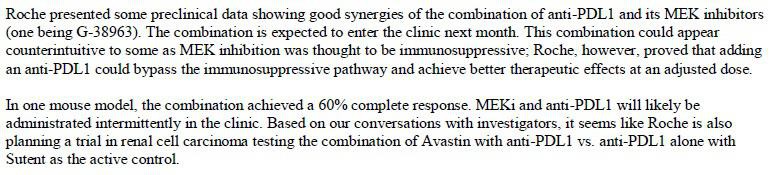
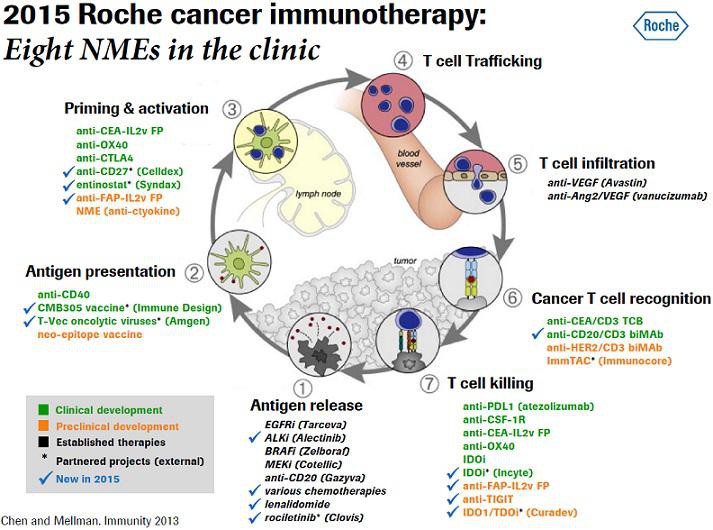
Gibt es eine Monotherapie mit MEK-Hemmern? Ich kenne momentan keine. MEK-Hemmer scheinen nur in der Kombination mit anderen Mitteln wirksam zu sein. Gleichzeitig können solche Kombis aber auch sehr toxisch sein. Insgesamt ist die Entwicklung von MEK-Hemmern schwierig.
Gruß
ipollit
Wie kommst du zu dieser Aussage?... das kann ich so nicht erkennen, Cobi ist bei Roche ein Mittel unter vielen. Hätte Cobi eine größere Bedeutung für Roche, warum haben sie dann nicht bei EXEL zugeschlagen, als der Kurs vor den METEOR-Daten releativ im Keller war? Schließlich erhält EXEL für Cobi ungewöhnlich hohe Royalties von bis zu 35%.
MEK-Hemmer gibt es zahlreich in der Entwicklung. Hier nimmt Cobi auch keine besondere Stellung ein. Ursprünglich wollte Roche mit dem BRAF-Hemmer Zelboraf in Melanoma groß durchstarten... Zelboraf sah recht aussichtsreich aus und Roche war auf diesem Gebiet führend. Nur stellte es sich schnell heraus, dass Zelboraf nach kurzer Zeit zu Resistenzen führt und man mit einem MEK-Hemmer diesen Resistenzen entgegenwirken kann. So war die Einlizensierung von Cobi für Roche ein Schutz von Zelboraf... mehr erstmal nicht. Andere haben dagegen MEK-Hemmer schon von Anfang an sehr viel breiter entwickelt.
In der letzten Präsentation http://www.roche.com/irp3q15e.pdf von Roche nimmt Cobi keine besondere Stellung ein, es wird nicht separat erwähnt und spielt erstmal nur in der Kombi mit Zelboraf in Melanoma eine Rolle. Zelboraf wird im Bereich der Onkologie herausgehoben, aber wie man sieht, ist es relativ unbedeutend gegenüber z.B. Herceptin, Avastin, Rituxan usw... die Umsätze sind mit -25% deutlich rückläufig. Aber auch die Cobi-Kombi wird die Konkurrenz von NVS und ARRY zu spüren bekommen.

ARRY wurde früher als "kleine EXEL" bezeichnet... ich würde bei MEK-Hemmern ARRY bevorzugen, da sie gleich zwei MEK-Hemmer in mehreren PIIIs haben. Binimetinib wurde bisher von NVS entwickelt. Nach der Übernahme von GSK's Krebspipeline hat NVS Binimetinib an ARRY zurückgegeben und als Geschenk noch den BRAF-Hemmer Encorafenib oben drauf. Zudem wird der zweite MEK-Hemmer Selumetinib von AZN entwickelt.
Der fortgeschrittenste MEK-Hemmer ist wohl Mekinist, den NVS zusammen mit dem BRAF-Hemmer Tafinlar von GSK übernommen hat.
Die Anzahl der laufenden Studien mit diesen Mitteln spricht eine klare Sprache:
- NVS's Mekinist (Trametinib), zugelassen: 102 Studien, 63 rekrutierende
- AZN/ARRY's Selumetinib, PIII: 88 Studien, 26 rekrutierende
- ARRY's Binimetinib (MEK162), PIII: 35 Studien, 20 rekrutierende
- Roche/EXEL's Cobimetinib (GDC-0973), NDA: 26 Studien, 12 rekrutierende
Es gibt Unterschiede in den Entwicklungsansätzen. Selumetinib wird hauptsächlich in KRAS-Lungenkrebs in Kombi mit Chemo entwickelt. Selumetinib scheint eher ein schwächerer MEK-Hemmer zu sein, aber mit dem Vorteil, dass er mit Chemos kombiniert werden kann. Eine Wirkung bei KRAS-Mutationen wäre ein großer Erfolg, da KRAS sehr therapieresistent ist... hier wirkt bisher nur die Chemo. Der KRAS-Anteil bildet bei Lungenkrebs die größte Mutationsgruppe noch vor EGFR-Mutationen (KRAS-Mutationen betreffen den MAPK/ERK-Signalweg, zu dem u.a. RAS, RAF, MEK und ERK gehören... genauso wie z.B. BRAF- oder NRAS-Mutationen).
Die Standard-Anwendung von MEK-Hemmer ist die BRAF+MEK-Kombi in Melanoma (schwarzer Hautkrebs), da diese Kombination eine hohe Wirkung hat... Tafinlar+Mekinist, Zelboraf+Cobimetinib und Encorafenib+Binimetinib werden sich bald den Markt teilen (Wie groß ist der Markt? 1 bis 1,5 Mrd USD?). Selumetinib wird hier nicht entwickelt. Vielleicht wird es längerfristig noch Kombis wie BRAF+MEK+ERK gegeben, um Resistenzen gegen BRAF+MEK zu reduzieren. Roche hat z.B. mit ARRYs GDC-0994 auch eine ERK-Hemmer in der Pipeline. Melanoma wird zukünftig auch von PD1 dominiert werden.
https://am.asco.org/exploring-pathway-rasrafmekerk-pathway-f…
http://mct.aacrjournals.org/content/11/5/1143
BRAF-Mutationen sind bei Melanoma sehr häufig. Relevant sind auch NRAS-Mutationen. Hier scheint ARRY führend zu sein, da bald PIII-Daten vorliegen sollten. Cobi wird anscheinend nicht gegen NRAS entwickelt. Interessant finde ich auch MEK-Kombis gegen Darmkrebs z.B. mit EGFR-AKs wie Erbitux... auch eine Entwicklung von ARRY, nicht aber von Cobi.

Der IO-Einsatz von Cobi in Kombi mit Atezolizumab ist zwar interessant, doch meiner Meinung nur High-Risk. Eine direkte Wirkung von MEK-Hemmern auf das Immunsystem ist nicht eindeutig erwiesen. Roche selber ordnet MEK-Hemmer nur unter "Antigen release" ein, d.h. Krebsmittel, die Krebszellen abtöten und somit deren Bestandteile dem Immunsystem zugänglich machen. Dazu gehören auch Zelboraf oder EGFR, ALK-Hemmer sowie CD20-AKs und Chemos.

Gibt es eine Monotherapie mit MEK-Hemmern? Ich kenne momentan keine. MEK-Hemmer scheinen nur in der Kombination mit anderen Mitteln wirksam zu sein. Gleichzeitig können solche Kombis aber auch sehr toxisch sein. Insgesamt ist die Entwicklung von MEK-Hemmern schwierig.
Gruß
ipollit
Antwort auf Beitrag Nr.: 50.979.795 von ipollit am 01.11.15 16:10:52das ist ja ein Mammutbeitrag - immer dann, wenn nicht copy/paste leider mit vielen Fehlern!
Exelixis erhält keine Lizenzgebühren in Höhe von 35%. Innerhalb der US besitzt die Firma ein gleichberechtigtes Mitvermarktungsrecht, welches jedoch beginnend ab einem Umsatz von 200 mUSD bis auf 30% absinkt. Ausserhalb der US ist Exelixis mit Lizenzgebühren (double digit royalties) am Unsatz beteiligt.
Cobi wird mittlerweile in 27 klinischen Studien eingesetzt - mit stark steigender tendenz (bspw. bei Triple Negative Breast Cancer und "solid tumors"). Kein anderer Wirkstoff in der riesigen Grafik über das Onkologie-Portfolio von Roche hat bisher eine ähnliche Bedeutung.
Herceptin, Avastin und Rituxan sind kurz vor Ablauf des Patentschutzes, also schon relativ weit im Lebenszyklus vorangeschritten und werden demnächst sich mit generischen Produkten (Biosimilars) auseinander setzen müssen. Diese Produkte mit Cobimetinib (Patentschutz bis 2030 und erst am Beginn des Lebenszykluses) zu vergleichen ist, Verzeihung, ein absoluter QUATSCH.
Aber das ist nun mal das Gefährliche bei solchen Halbwahrheiten, die ausser copy/paste sehr viele Fehler produzieren...
Exelixis erhält keine Lizenzgebühren in Höhe von 35%. Innerhalb der US besitzt die Firma ein gleichberechtigtes Mitvermarktungsrecht, welches jedoch beginnend ab einem Umsatz von 200 mUSD bis auf 30% absinkt. Ausserhalb der US ist Exelixis mit Lizenzgebühren (double digit royalties) am Unsatz beteiligt.
Cobi wird mittlerweile in 27 klinischen Studien eingesetzt - mit stark steigender tendenz (bspw. bei Triple Negative Breast Cancer und "solid tumors"). Kein anderer Wirkstoff in der riesigen Grafik über das Onkologie-Portfolio von Roche hat bisher eine ähnliche Bedeutung.
Herceptin, Avastin und Rituxan sind kurz vor Ablauf des Patentschutzes, also schon relativ weit im Lebenszyklus vorangeschritten und werden demnächst sich mit generischen Produkten (Biosimilars) auseinander setzen müssen. Diese Produkte mit Cobimetinib (Patentschutz bis 2030 und erst am Beginn des Lebenszykluses) zu vergleichen ist, Verzeihung, ein absoluter QUATSCH.
Aber das ist nun mal das Gefährliche bei solchen Halbwahrheiten, die ausser copy/paste sehr viele Fehler produzieren...
Bravo, ich habe bei Exelixis keine rosarote Brille aber das Potential ist gewaltig!

Antwort auf Beitrag Nr.: 50.979.795 von ipollit am 01.11.15 16:10:52"Gibt es eine Monotherapie mit MEK-Hemmern? Ich kenne momentan keine. MEK-Hemmer scheinen nur in der Kombination mit anderen Mitteln wirksam zu sein. Gleichzeitig können solche Kombis aber auch sehr toxisch sein. Insgesamt ist die Entwicklung von MEK-Hemmern schwierig."
...die allermeisten Krebstherapien sind Kombitherapien.
Wie Cyberhexe in ihrem hervorragenden Beitrag Nr. 342 geschrieben hat, gibt es verschiedene Möglichkeiten Cobimetinib zu kombinieren:
"Hemmung innerhalb des gleichen Signalweges, also MAPK-Signalweg zB mit Vemurafenib zur Hemmung von RAF
- Hemmung von verschiedenen Signalwegen zB des Signalweges, der die Angiogenese, also die Neubildung von Blutgefässen, fördert --> Vascular Endothelial Growth Factor (VEGF) oder --> Epidermal growth factor receptor (EGFR)
- durch Anregung des programmierten Zelltods zB in Kombination mit Taxanen (Paclitaxel zur Behandlung von TNBC)
- und "last but not least" das körpereigene Immunsystem auf die Krebszellen aufmerksam zu machen und es zu einer Immunantwort zu aktivieren. Es wird vermutet, dass Cobi eine durch andere Stoffe induzierte Immunantwort verstärkt - synergistische Wirkung zu Atezolizumab?"
Ein wesentliches Ziel bei Kombitherapien ist es, den synergistischen Effekt zB durch die Hemmung des gleichen Signalweges zu nutzen und dadurch sogar eine Dosisverringerung mit entsprechend weniger Nebenwirkungen zu erzielen (oder höhere Wirkung). Mit einer Aussage wie der zitierten, hat ipolit einmal mehr den Nagel nicht getroffen. Bin mal gespannt wie Cyberhexe darauf reagiert.
...die allermeisten Krebstherapien sind Kombitherapien.
Wie Cyberhexe in ihrem hervorragenden Beitrag Nr. 342 geschrieben hat, gibt es verschiedene Möglichkeiten Cobimetinib zu kombinieren:
"Hemmung innerhalb des gleichen Signalweges, also MAPK-Signalweg zB mit Vemurafenib zur Hemmung von RAF
- Hemmung von verschiedenen Signalwegen zB des Signalweges, der die Angiogenese, also die Neubildung von Blutgefässen, fördert --> Vascular Endothelial Growth Factor (VEGF) oder --> Epidermal growth factor receptor (EGFR)
- durch Anregung des programmierten Zelltods zB in Kombination mit Taxanen (Paclitaxel zur Behandlung von TNBC)
- und "last but not least" das körpereigene Immunsystem auf die Krebszellen aufmerksam zu machen und es zu einer Immunantwort zu aktivieren. Es wird vermutet, dass Cobi eine durch andere Stoffe induzierte Immunantwort verstärkt - synergistische Wirkung zu Atezolizumab?"
Ein wesentliches Ziel bei Kombitherapien ist es, den synergistischen Effekt zB durch die Hemmung des gleichen Signalweges zu nutzen und dadurch sogar eine Dosisverringerung mit entsprechend weniger Nebenwirkungen zu erzielen (oder höhere Wirkung). Mit einer Aussage wie der zitierten, hat ipolit einmal mehr den Nagel nicht getroffen. Bin mal gespannt wie Cyberhexe darauf reagiert.
Antwort auf Beitrag Nr.: 50.979.795 von ipollit am 01.11.15 16:10:52"Der IO-Einsatz von Cobi in Kombi mit Atezolizumab ist zwar interessant, doch meiner Meinung nur High-Risk. Eine direkte Wirkung von MEK-Hemmern auf das Immunsystem ist nicht eindeutig erwiesen. Roche selber ordnet MEK-Hemmer nur unter "Antigen release" ein, d.h. Krebsmittel, die Krebszellen abtöten und somit deren Bestandteile dem Immunsystem zugänglich machen. Dazu gehören auch Zelboraf oder EGFR, ALK-Hemmer sowie CD20-AKs und Chemos."
Noch so ein ipolit-Schmarrn:
Pharma-Forschung, zumal bei NME, ist immer mit einem hohen Risiko verbunden!
Cobimetinib wird in der Klinik zusammen mit Atezolizumab geprüft, weshalb wohl die Vermutung nahe liegt, dass Roche/Genentech einen synergistischen Effekt erwarten. Weshalb sonst sollte man diese beiden unterschiedlichen Wirkstoffe mit einem unterschiedlichen Mechanismus gemeinsam prüfen? Bevor diese Studienergebnisse vorliegen, ist natürlich nichts bewiesen. Aber das ist bei den allermeisten Studien so. Also. bei deinem Beitrag kann man wirklich fast jede eigene Aussage auf nonsens herunterbrechen. Das sollte man nicht unkommentiert stehen lassen!!
Noch so ein ipolit-Schmarrn:
Pharma-Forschung, zumal bei NME, ist immer mit einem hohen Risiko verbunden!
Cobimetinib wird in der Klinik zusammen mit Atezolizumab geprüft, weshalb wohl die Vermutung nahe liegt, dass Roche/Genentech einen synergistischen Effekt erwarten. Weshalb sonst sollte man diese beiden unterschiedlichen Wirkstoffe mit einem unterschiedlichen Mechanismus gemeinsam prüfen? Bevor diese Studienergebnisse vorliegen, ist natürlich nichts bewiesen. Aber das ist bei den allermeisten Studien so. Also. bei deinem Beitrag kann man wirklich fast jede eigene Aussage auf nonsens herunterbrechen. Das sollte man nicht unkommentiert stehen lassen!!
Antwort auf Beitrag Nr.: 50.979.795 von ipollit am 01.11.15 16:10:52 "Interessant finde ich auch MEK-Kombis gegen Darmkrebs z.B. mit EGFR-AKs wie Erbitux... auch eine Entwicklung von ARRY, nicht aber von Cobi."
noch so ein ipolit-Irrtum, denn mit dem von Array einlizenzierten Wirkstoff GDC-0994 wird Cobi von Genentech in der Klinik zur Behandlung ua auch von Darmkrebs geprüft:
Non-Small Cell Lung Cancer, Metastatic Colorectal Cancer, Metastatic Non Small Cell Lung Cancer, Metastatic Cancers, Melanoma
https://clinicaltrials.gov/ct2/show/NCT02457793?term=cobimet…
für Heute reichts - letzte Empfehlung an alle...ipolits Beiträge sehr sorgfältig prüfen, da VIELE Fehler!!
noch so ein ipolit-Irrtum, denn mit dem von Array einlizenzierten Wirkstoff GDC-0994 wird Cobi von Genentech in der Klinik zur Behandlung ua auch von Darmkrebs geprüft:
Non-Small Cell Lung Cancer, Metastatic Colorectal Cancer, Metastatic Non Small Cell Lung Cancer, Metastatic Cancers, Melanoma
https://clinicaltrials.gov/ct2/show/NCT02457793?term=cobimet…
für Heute reichts - letzte Empfehlung an alle...ipolits Beiträge sehr sorgfältig prüfen, da VIELE Fehler!!
Zwar taucht Cobi (Cotellic) auf den Folien von Roche's Investor Day auf... doch ist das Potential laut Roche relativ zu den anderen Pipeline-Kandidaten begrenzt... zumindest in Indikationen, die in der fortgeschrittenen klinischen Entwicklung sind. Sieht so eine "exponierte Stellung" aus?
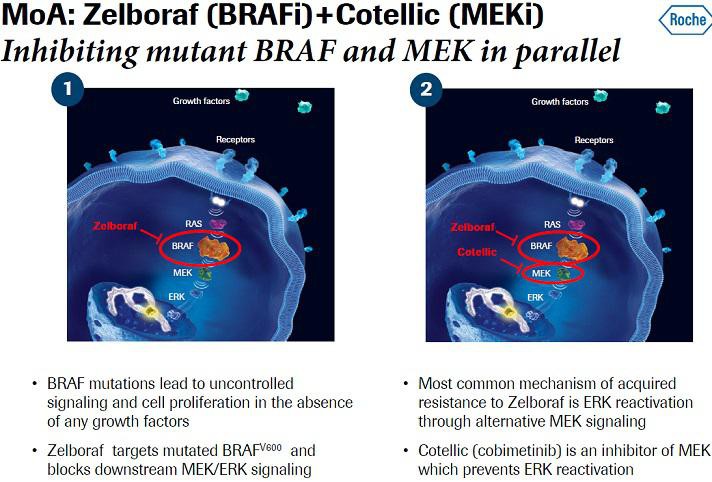

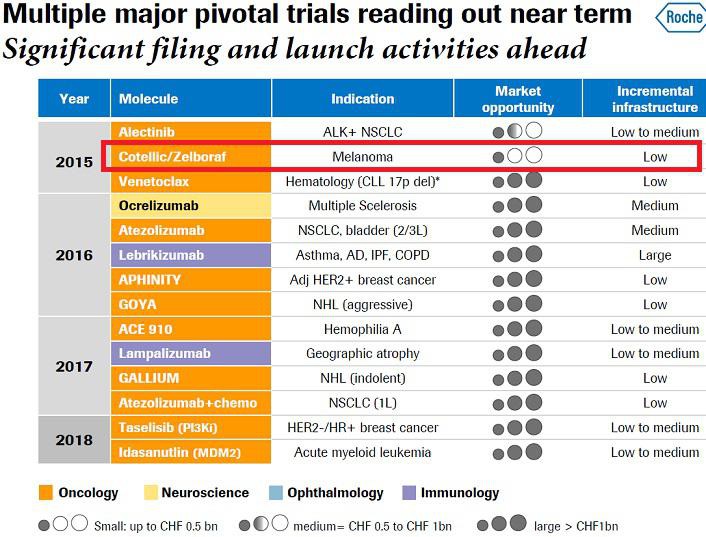
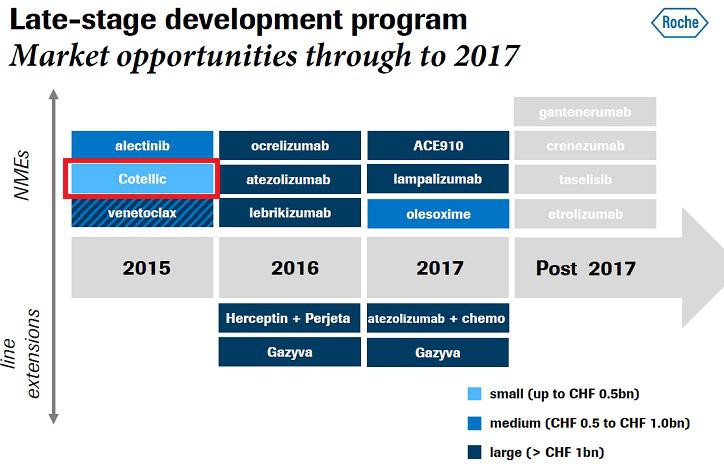
Gruß
ipollit




Gruß
ipollit
Antwort auf Beitrag Nr.: 50.983.428 von witzfigur am 02.11.15 10:44:02witzfigur,
- ich meine konkret eine Kombi von MEK-Hemmern und EGFR-AKs in Darmkrebs (Erbitux ist in Darmkrebs ein Standard)... da ist Roche nicht dabei
- "Cobimetinib wird in der Klinik zusammen mit Atezolizumab geprüft, weshalb wohl die Vermutung nahe liegt, dass Roche/Genentech einen synergistischen Effekt erwarten."... was verstehst du unter synergetischem Effekt? Atezolizumab + Chemo ist auch synergistisch. Ich meinte konkret, dass ein IO-Effekt von MEK-Hemmern nicht erwiesen ist (ich verweise nochmal auf die Roche-Folie zur Immuntherpie). Siehst du einen IO-Effekt von Cobi?
- "die allermeisten Krebstherapien sind Kombitherapien"... die meisten, wenn nicht sogar alle Breakthrough-Therapien haben einen ausreichenden Mono-Therapie Effekt. Zwei Target-Therapien in Kombi als erste Zulassung sind eher ungewöhnlich. "dadurch sogar eine Dosisverringerung mit entsprechend weniger Nebenwirkungen zu erzielen"... das sehe ich anders! Bei der Kombi sollte man auch jeweils gleich hoch wie bei einer Mono-Therapie dosieren, um das Target jeweils ausreichend zu hemmen. Z.B. möchte man BRAF und MEK komplett hemmen und nicht beides nur ein wenig. So hat Selumetinib z.B. den Vorteil, dass es bei voller Dosierung mit der Chemo kombiniert werden kann. Ist das bei Cobi auch der Fall? Normalerweise sind die Nebenwirkungen aber additiv... d.h. überlappende Nebenwirkungen sind schlecht, unterschiedliche Nebenwirkungen gut. Bei BRAF + MEK gibt es die seltene Eigenschaft, dass diese Kombi die Nebenwirkungen von BRAF-Mono senkt... das ist aber nicht die Regel.
- "mit stark steigender tendenz"... naja, das ist dein subjektiver Eindruck. "Kein anderer Wirkstoff in der riesigen Grafik über das Onkologie-Portfolio von Roche hat bisher eine ähnliche Bedeutung."... ist das etwa keine rosa Brille? Hast du eine Ahnung wieviel tausende Studien Roche durchführt? Fakt ist, dass von den von mir genannten MEK-Hemmern mit Cobi momentan die wenigsten Studien durchgeführt werden.
Ich wollte ja nur sagen, dass Cobi ein aussichtsreiches und gutes Produkt ist, es ist aber kein besonderes Produkt für Roche. So eine Aussage finde ich übertrieben!
Gruß
ipollit
- ich meine konkret eine Kombi von MEK-Hemmern und EGFR-AKs in Darmkrebs (Erbitux ist in Darmkrebs ein Standard)... da ist Roche nicht dabei
- "Cobimetinib wird in der Klinik zusammen mit Atezolizumab geprüft, weshalb wohl die Vermutung nahe liegt, dass Roche/Genentech einen synergistischen Effekt erwarten."... was verstehst du unter synergetischem Effekt? Atezolizumab + Chemo ist auch synergistisch. Ich meinte konkret, dass ein IO-Effekt von MEK-Hemmern nicht erwiesen ist (ich verweise nochmal auf die Roche-Folie zur Immuntherpie). Siehst du einen IO-Effekt von Cobi?
- "die allermeisten Krebstherapien sind Kombitherapien"... die meisten, wenn nicht sogar alle Breakthrough-Therapien haben einen ausreichenden Mono-Therapie Effekt. Zwei Target-Therapien in Kombi als erste Zulassung sind eher ungewöhnlich. "dadurch sogar eine Dosisverringerung mit entsprechend weniger Nebenwirkungen zu erzielen"... das sehe ich anders! Bei der Kombi sollte man auch jeweils gleich hoch wie bei einer Mono-Therapie dosieren, um das Target jeweils ausreichend zu hemmen. Z.B. möchte man BRAF und MEK komplett hemmen und nicht beides nur ein wenig. So hat Selumetinib z.B. den Vorteil, dass es bei voller Dosierung mit der Chemo kombiniert werden kann. Ist das bei Cobi auch der Fall? Normalerweise sind die Nebenwirkungen aber additiv... d.h. überlappende Nebenwirkungen sind schlecht, unterschiedliche Nebenwirkungen gut. Bei BRAF + MEK gibt es die seltene Eigenschaft, dass diese Kombi die Nebenwirkungen von BRAF-Mono senkt... das ist aber nicht die Regel.
- "mit stark steigender tendenz"... naja, das ist dein subjektiver Eindruck. "Kein anderer Wirkstoff in der riesigen Grafik über das Onkologie-Portfolio von Roche hat bisher eine ähnliche Bedeutung."... ist das etwa keine rosa Brille? Hast du eine Ahnung wieviel tausende Studien Roche durchführt? Fakt ist, dass von den von mir genannten MEK-Hemmern mit Cobi momentan die wenigsten Studien durchgeführt werden.
Ich wollte ja nur sagen, dass Cobi ein aussichtsreiches und gutes Produkt ist, es ist aber kein besonderes Produkt für Roche. So eine Aussage finde ich übertrieben!
Gruß
ipollit
Antwort auf Beitrag Nr.: 51.018.474 von ipollit am 05.11.15 21:50:40Zwar taucht Cobi (Cotellic) auf den Folien von Roche's Investor Day auf...
Genau - Cotellic "taucht" sogar sehr oft auf:
Cotellic + Zelboraf (mM 1L)
Cotellic + Atezolizumab (CRC, NSCLC, KRAS, mM
Cotellic + Atezolizumab + Zelboraf (mM 1L)
Cotellic + Paclitaxel (Triple Negative Breast Cancer)
Cotellic + Duligzutumab (KRAS + solid tumors)
Cotellic + ERK inhibitpr (solid tumors)
Cotellic + Idasanutlin (solid tumors)
"doch ist das Potential laut Roche relativ zu den anderen Pipeline-Kandidaten begrenzt... zumindest in Indikationen, die in der fortgeschrittenen klinischen Entwicklung sind. Sieht so eine "exponierte Stellung" aus?"
wo steht, dass das Potenzial laut Roche begrenzt ist? ROCHE gibt lediglich eine Umsatzprognose in der Indikation mMelanoma. Man sehe sich jedoch die Vielzahl der Indikationen an, in welchen Cobi geprüft wird. EXPONIERTER geht fast nicht mehr. Lediglich Atezolizumab läuft Cobi da den Spitzenrang ab. Bei den Publikationen auf Pubmed ist übrigens die steigende Tendenz bezgl. Cobi durchaus nachvollziehbar. Bin gespannt, wie lange es noch dauert, bis die ersten Pivotalstudien gestartet werden.
Übrigens...Cyberhexe heisst nun Franca_ole, und zwar wird dadurch mein nickname global vereinheitlicht.
Genau - Cotellic "taucht" sogar sehr oft auf:
Cotellic + Zelboraf (mM 1L)
Cotellic + Atezolizumab (CRC, NSCLC, KRAS, mM
Cotellic + Atezolizumab + Zelboraf (mM 1L)
Cotellic + Paclitaxel (Triple Negative Breast Cancer)
Cotellic + Duligzutumab (KRAS + solid tumors)
Cotellic + ERK inhibitpr (solid tumors)
Cotellic + Idasanutlin (solid tumors)
"doch ist das Potential laut Roche relativ zu den anderen Pipeline-Kandidaten begrenzt... zumindest in Indikationen, die in der fortgeschrittenen klinischen Entwicklung sind. Sieht so eine "exponierte Stellung" aus?"
wo steht, dass das Potenzial laut Roche begrenzt ist? ROCHE gibt lediglich eine Umsatzprognose in der Indikation mMelanoma. Man sehe sich jedoch die Vielzahl der Indikationen an, in welchen Cobi geprüft wird. EXPONIERTER geht fast nicht mehr. Lediglich Atezolizumab läuft Cobi da den Spitzenrang ab. Bei den Publikationen auf Pubmed ist übrigens die steigende Tendenz bezgl. Cobi durchaus nachvollziehbar. Bin gespannt, wie lange es noch dauert, bis die ersten Pivotalstudien gestartet werden.
Übrigens...Cyberhexe heisst nun Franca_ole, und zwar wird dadurch mein nickname global vereinheitlicht.
Antwort auf Beitrag Nr.: 51.033.945 von Franca_ole am 08.11.15 11:21:42 Cotellic + Duligzutumab (KRAS + solid tumors) 
Duligotuzumab ... sollte das heissen.
Duligotuzumab ist ein anti-EGFR/anti-HER3 mAB, der bereits seit 2 Jahren zusammen mit Cobi in der Klinik geprüft wird:
A Study of MEHD7945A and Cobimetinib (GDC-0973) in Patients With Locally Advanced or Metastatic Cancers With Mutant KRAS
https://clinicaltrials.gov/ct2/show/NCT01986166?term=cobimet…
Bisher wurden 5 Studien mit diesem Antikörper initialisiert:
https://clinicaltrials.gov/ct2/results?term=MEHD7945A&Search…

Duligotuzumab ... sollte das heissen.
Duligotuzumab ist ein anti-EGFR/anti-HER3 mAB, der bereits seit 2 Jahren zusammen mit Cobi in der Klinik geprüft wird:
A Study of MEHD7945A and Cobimetinib (GDC-0973) in Patients With Locally Advanced or Metastatic Cancers With Mutant KRAS
https://clinicaltrials.gov/ct2/show/NCT01986166?term=cobimet…
Bisher wurden 5 Studien mit diesem Antikörper initialisiert:
https://clinicaltrials.gov/ct2/results?term=MEHD7945A&Search…
Antwort auf Beitrag Nr.: 51.034.002 von Franca_ole am 08.11.15 11:31:42Gut, ich halte EXEL ja auch für aussichtsreich... momentan ist es meine drittgrößte Position. Allerdings setze ich den Schwerpunkt auf Cometriq und weniger auf Cobi, wobei letzteres natürlich aufgrund der hohen Royalties ein schöner Bonus ist.
RCC ist für Cobi ein großer Erfolg und alleine ausreichend für eine gute Bewertung. HCC wird etwas schwieriger werden, aber ich sehe es trotzem als eine 50:50 Chance, da z.B. Kommentare von ARQL bezügl MET in HCC darauf hinweisen, dass MET eine relvante VEGF-Hemmer-Resistenz ist.
Spannend fände ich eine Anwendung von Cabo in NSCLC... das wäre ein riesiger Markt. Die bisherigen Ergebnisse sehen meine ich nicht so schlecht aus, wobei vielleicht das Nebenwirkungsprofil von Cabo nicht ganz optimal ist.
HRs zwischen 0,3 und 0,6 sind ordentlich... allerdings bisher nur PII-Ergebnisse. Bei wt-EGFR müsste Erlotinib nahe am Placebo sein. wt-EGFR müsste meiner Meinung nach eigentlich nur EGFR-mut ausschließen (oder verstehe ich das falsch?... ich meine nicht RET-NSCLC, das separat zu betrachten wäre), ein eher kleiner Anteil an NSCLC.
http://www.businesswire.com/news/home/20150531005055/en/Exel…
"The median PFS for the combination of cabozantinib and erlotinib was 4.7 months versus 1.9 months for erlotinib alone, a more than two-fold increase that corresponds to a 65% reduction in the risk of disease worsening (hazard ratio [HR]=0.35, 80% CI 0.23-0.52, p=0.0005). The median PFS for cabozantinib monotherapy was 4.2 months versus 1.9 months for erlotinib alone, a more than doubling that corresponds to a 62% reduction in the risk of disease worsening (HR=0.38, 80% CI 0.27-0.55, p=0.0004).
...
Median OS was 13.3 months for the combination of cabozantinib and erlotinib, and 9.2 months for cabozantinib alone, as compared to 4.1 months for erlotinib alone. These results correspond to a 56% reduction in the risk of death (HR=0.44, p=0.004) for the combination of cabozantinib plus erlotinib, and a 41% reduction in the risk of death (HR=0.59, p=0.03) for the cabozantinib monotherapy arm, respectively, when individually compared to the erlotinib arm.
Wie ist hier das Potential?

Gruß
ipollit
RCC ist für Cobi ein großer Erfolg und alleine ausreichend für eine gute Bewertung. HCC wird etwas schwieriger werden, aber ich sehe es trotzem als eine 50:50 Chance, da z.B. Kommentare von ARQL bezügl MET in HCC darauf hinweisen, dass MET eine relvante VEGF-Hemmer-Resistenz ist.
Spannend fände ich eine Anwendung von Cabo in NSCLC... das wäre ein riesiger Markt. Die bisherigen Ergebnisse sehen meine ich nicht so schlecht aus, wobei vielleicht das Nebenwirkungsprofil von Cabo nicht ganz optimal ist.
HRs zwischen 0,3 und 0,6 sind ordentlich... allerdings bisher nur PII-Ergebnisse. Bei wt-EGFR müsste Erlotinib nahe am Placebo sein. wt-EGFR müsste meiner Meinung nach eigentlich nur EGFR-mut ausschließen (oder verstehe ich das falsch?... ich meine nicht RET-NSCLC, das separat zu betrachten wäre), ein eher kleiner Anteil an NSCLC.
http://www.businesswire.com/news/home/20150531005055/en/Exel…
"The median PFS for the combination of cabozantinib and erlotinib was 4.7 months versus 1.9 months for erlotinib alone, a more than two-fold increase that corresponds to a 65% reduction in the risk of disease worsening (hazard ratio [HR]=0.35, 80% CI 0.23-0.52, p=0.0005). The median PFS for cabozantinib monotherapy was 4.2 months versus 1.9 months for erlotinib alone, a more than doubling that corresponds to a 62% reduction in the risk of disease worsening (HR=0.38, 80% CI 0.27-0.55, p=0.0004).
...
Median OS was 13.3 months for the combination of cabozantinib and erlotinib, and 9.2 months for cabozantinib alone, as compared to 4.1 months for erlotinib alone. These results correspond to a 56% reduction in the risk of death (HR=0.44, p=0.004) for the combination of cabozantinib plus erlotinib, and a 41% reduction in the risk of death (HR=0.59, p=0.03) for the cabozantinib monotherapy arm, respectively, when individually compared to the erlotinib arm.
Wie ist hier das Potential?

Gruß
ipollit
New Therapy for Triple-negative Breast Cancer Shows Promise in Laboratory Studies
http://www.oncologynurseadvisor.com/web-exclusives/new-thera…
http://www.oncologynurseadvisor.com/web-exclusives/new-thera…
JA, es gibt ein paar Indikationen (z.B. NSCLC, BC, ...), da wäre es echt nett, wenn da noch die ein oder andere P3 für Cabo starten würde. Die Daten geben es definitiv her. Prostatakrebs war so eine bescheuerte Entscheidung, v.a. dann auch noch gleich zwei riesen Studien - und nicht sauber mit der FDA abgestimmt!!!
Aber erst mal muss ein Partner her .. oder ein Übernahmeangebot, aber dann interessiert die weitere Entwicklung kaum noch...
Aber erst mal muss ein Partner her .. oder ein Übernahmeangebot, aber dann interessiert die weitere Entwicklung kaum noch...
FDA approves Cotellic as part of combination treatment for advanced melanoma
http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/uc…
Wie zu erwarten war; aber ein Restrisiko bleibt ja immer. Daher eine gute Nachricht - die sich hoffentlich auch positiv in Bezug auf den Kurs auswirkt, sofern noch nicht restlos eingepreist
http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/uc…
Wie zu erwarten war; aber ein Restrisiko bleibt ja immer. Daher eine gute Nachricht - die sich hoffentlich auch positiv in Bezug auf den Kurs auswirkt, sofern noch nicht restlos eingepreist


 Wurde der Kurs angehalten
Wurde der Kurs angehalten

realtime Nasdaq bei 6.08, Stand 11:07 ET - jetzt 12:02 ET und immer noch 6.08
Geil, vielleicht kommt gleich noch ein Übernahmeangebot von Roche......
Danke Franka, Du bist die Beste!
Danke Franka, Du bist die Beste!
Tatsächlich: Trading halt
Halt - News Pending
Trading is halted pending the release of material news.
http://www.nasdaqtrader.com/trader.aspx?id=tradehalts#
Na, dann mal her mit der news !
!
Halt - News Pending
Trading is halted pending the release of material news.
http://www.nasdaqtrader.com/trader.aspx?id=tradehalts#
Na, dann mal her mit der news
 !
!
Trading Halt
11/10/2015 11:07:49 EXEL Exelixis, Inc. NASDAQ
T1
11/10/2015 11:07:49 EXEL Exelixis, Inc. NASDAQ
T1
Antwort auf Beitrag Nr.: 51.055.284 von TwoPack am 10.11.15 18:17:36Cobi approval ist ja schon "material", aber vielleicht kommt noch was mehr "material". 

Vielleicht brauchen die auch nur so lang um ihre eigene Meldung zur Zulassung von Cobi zu schreiben 
Auf jeden Fall ist die News bei Roche längst raus und es ist komisch, dass EXEL nicht mal eine Zeit nennt, wann das Trading wieder losgeht.

Auf jeden Fall ist die News bei Roche längst raus und es ist komisch, dass EXEL nicht mal eine Zeit nennt, wann das Trading wieder losgeht.
die machen doch nicht nur wegen der Zulassung einen trading halt, oder?
Antwort auf Beitrag Nr.: 51.055.683 von question-mark am 10.11.15 18:55:08
Fakt ist (so viel habe ich rausgefunden):
die FDA hat die News schon 10min veröffentlicht gehabt, erst dann hat EXEL den Handel stoppen lassen.
Das ist alles sehr strange ... entweder hat man bei EXEL vollkommen geschlafen oder ne andere News kommt noch.
Zitat von question-mark: die machen doch nicht nur wegen der Zulassung einen trading halt, oder?
Fakt ist (so viel habe ich rausgefunden):
die FDA hat die News schon 10min veröffentlicht gehabt, erst dann hat EXEL den Handel stoppen lassen.
Das ist alles sehr strange ... entweder hat man bei EXEL vollkommen geschlafen oder ne andere News kommt noch.
Jetzt auch T2 als Grund für den Halt
T2
Halt - News Released
The news has begun the dissemination process through a Regulation FD compliant method(s).
Heißt wohl Warten auf die Pressekonferenz 5 pm ET...
T2
Halt - News Released
The news has begun the dissemination process through a Regulation FD compliant method(s).
Heißt wohl Warten auf die Pressekonferenz 5 pm ET...
Antwort auf Beitrag Nr.: 51.056.097 von TwoPack am 10.11.15 19:43:17und T3
T3 News and Resumption Times
The news has been fully disseminated through a Regulation FD compliant method(s); or NASDAQ has determined either that system misuse or malfunction that caused extraordinary market activity will no longer have a material effect on the market for the security or that system misuse or malfunction is not the cause of the extraordinary market activity; or NASDAQ has determined the conditions which led to a halt in an Exchange-Traded Fund are no longer present. Two times will be displayed: (1) the time when market participants can enter quotations, followed by (2) the time the security will be released for trading. All trade halt and resumption times will be posted in HH:MM:SS format.
T3 News and Resumption Times
The news has been fully disseminated through a Regulation FD compliant method(s); or NASDAQ has determined either that system misuse or malfunction that caused extraordinary market activity will no longer have a material effect on the market for the security or that system misuse or malfunction is not the cause of the extraordinary market activity; or NASDAQ has determined the conditions which led to a halt in an Exchange-Traded Fund are no longer present. Two times will be displayed: (1) the time when market participants can enter quotations, followed by (2) the time the security will be released for trading. All trade halt and resumption times will be posted in HH:MM:SS format.
[urlhttp://finance.yahoo.com/news/fda-approves-cotellic-cobimetinib-combination-183700488.html][/url]
Offizielle Pressemeldung!
Offizielle Pressemeldung!
http://finance.yahoo.com/news/fda-approves-cotellic-cobimeti…" target="_blank" rel="nofollow ugc noopener">[http://finance.yahoo.com/news/fda-approves-cotellic-cobimeti…
11/10/2015 11:07:49 EXEL Exelixis, Inc. NASDAQ 11/10/2015 13:55:00 14:00:00
T1
T2
T3
http://www.nasdaqtrader.com/trader.aspx?id=tradehalts#
Na dann los!
T1
T2
T3
http://www.nasdaqtrader.com/trader.aspx?id=tradehalts#
Na dann los!
Was für ein Witz. Die News war schon raus und dann halten sie das Trading für 3h an um die eigene Meldung rauszubringen. Was für Schwachmaten! Sorry.
Wahrscheinlich schließen wir sogar im negativen Bereich.
ich hatte mich schon geärgert, dass ich nur so wenige shares habe, naja, war wohl unbegründet
Da sieht man zwischenzeitlich schon die Phoenix-Asteroiden schimmern und ist kurz davor sich ne Flasche Schampus zu holen... unfassbar 







Antwort auf Beitrag Nr.: 51.055.359 von Ville7 am 10.11.15 18:25:30"Auf jeden Fall ist die News bei Roche längst raus und es ist komisch, dass EXEL nicht mal eine Zeit nennt, wann das Trading wieder losgeht."
wann hat Roche eine Meldung herausgegeben?
http://www.roche.com/media/store/releases.htm
Also auf deren Homepage ist um 20h55 noch nichts zu finden. Genentech hat fast zeitgleich mit Exelixis eine Pressemitteilung veröffentlicht - die sind ja auch fast Nachbarn in der Bayarea. Roche wird sehr wahrscheinlich erst Morgen über die Zulassung berichten.
wann hat Roche eine Meldung herausgegeben?
http://www.roche.com/media/store/releases.htm
Also auf deren Homepage ist um 20h55 noch nichts zu finden. Genentech hat fast zeitgleich mit Exelixis eine Pressemitteilung veröffentlicht - die sind ja auch fast Nachbarn in der Bayarea. Roche wird sehr wahrscheinlich erst Morgen über die Zulassung berichten.
Ein User, SandManB, spekuliert auf stocktwits während des Trading Halts:
"Speculation... Nearly 30% of float is short. If a buyout, the scramble to cover could have skyrocketed stock price past BO price."
Erscheint logisch für den Fall, da ist ein B/O auf dem Tapet; aber wirklich eine hirnrissige Aktion von Exelixis, wenn nicht, und stattdessen nur die - zum Großteil bereits eingetütete - Zulassung und die anstehende Verkündung der Quartalszahlen, die kaum jdn. hinter dem Ofen hervorlocken dürften.
"Speculation... Nearly 30% of float is short. If a buyout, the scramble to cover could have skyrocketed stock price past BO price."
Erscheint logisch für den Fall, da ist ein B/O auf dem Tapet; aber wirklich eine hirnrissige Aktion von Exelixis, wenn nicht, und stattdessen nur die - zum Großteil bereits eingetütete - Zulassung und die anstehende Verkündung der Quartalszahlen, die kaum jdn. hinter dem Ofen hervorlocken dürften.
Antwort auf Beitrag Nr.: 51.056.667 von TwoPack am 10.11.15 21:05:40Irgendetwas läuft da "backstage", denn in Anbetracht der positiven Nachrichten... (--> ph3 CRC Cabozantinib, Zulassung von Cobi in der Schweiz und nun in US sowie am 1.12.2015 in der EU, gelungene Kapitalerhöhung an die Börse) ... könnte man meinen, dass die arg geschrumpfte Belegschaft von Exelixis wieder schnell anwachsen sollte, um die Einreichung der Zulassungsunterlagen --> Cabo/RCR möglichst rasch abzuschliessen. Aber lediglich 4 ausgeschriebene Stellen deuten nicht darauf hin, dass Exelixis diese Zulassung aus eigener Kraft stemmen wird.
Wer weiss, vielleicht erfährt man diesbezüglich Neuigkeiten auf der CC nach Börsenschluss?
Wer weiss, vielleicht erfährt man diesbezüglich Neuigkeiten auf der CC nach Börsenschluss?
Antwort auf Beitrag Nr.: 51.056.811 von Franca_ole am 10.11.15 21:25:13Wenn Du Übernahmeverhandlungen vermutest, die sind keineswegs abwegig, aber etwas konkretes erwarte ich heute nicht.
Wie es scheint, war die Aktion mit dem 3-stündigen Handels-Stopp einzig der Zeitdifferenz zw. FDA-Info und der Verspätung der eigenen Zulassungsverkündung geschuldet. Andere, gewichtige Gründe wären auch um 14:00 nicht vom Tisch gewesen.
Vielleicht läuft es auf eine Auslagerung von Vermarktungen hinaus (daher keine Neueinstellungen?) und vorerst noch nicht auf eine Übernahme. Dann aber zu 12 $ mindestens ist zu hoffen...
Wir werden sehen was sie zu sagen haben: 5 p.m ET
Wie es scheint, war die Aktion mit dem 3-stündigen Handels-Stopp einzig der Zeitdifferenz zw. FDA-Info und der Verspätung der eigenen Zulassungsverkündung geschuldet. Andere, gewichtige Gründe wären auch um 14:00 nicht vom Tisch gewesen.
Vielleicht läuft es auf eine Auslagerung von Vermarktungen hinaus (daher keine Neueinstellungen?) und vorerst noch nicht auf eine Übernahme. Dann aber zu 12 $ mindestens ist zu hoffen...
Wir werden sehen was sie zu sagen haben: 5 p.m ET

Das war ein unnötiger Aufreger und vorwiegend der Unfähigikeit der Firma geschuldet, die den Halt erst 10 min nach FDA Meldung veranlasst hat und dann 2-3h für die eigene Pressemeldung gebraucht hat.
Die Q3 Zahlen und CC war weitgehend informationsfrei (bezüglich neuer Infos)... Pricing von Cotellic ist vielleicht noch interessant. Roche verschleudert Cotellic in der Combi für etwas über dem halben Preis von vemurafenib. Das ist nicht so gute News - war aber nicht anders zu erwarten, denn wieso sollte Roche Exelixis in der Co-Vermarktung einen großen Kuchen abgeben? Zudem sind die aktuellen Cabo Sales nur noch flat (at best). Deweiteren kosten die Mitarbeiter-Incentives irrsinnig Geld, sodass sie ihre Prognose des Verlusts ans obere Ende der Prognosespanne bringen mussten. Nachbörslich ist der Kurs auf 6.17 zurückgegangen (von 6.33), von daher stellt sich die Frage, ob es nun erneut an der 6.25 scheitert, was sehr wahrscheinlich wäre.
Es scheint schon ziemlich viel eingepreist zu sein und es gibt keine Anschlusskäufer. Daher könnte es auch irgendwann gefährlich werden - sollte sich der Frust mal nach unten entladen.
Die nächsten Events sind:
1. Präsentation der detaillierten Cobi OS Daten Ende November
2. Zulassungsantrag Cabo RCC stellen in USA bis Ende Dezember
3. Zulassungsantrag Cabo RCC stellen in Europa bis Q1 2016
4. Überlebensdaten von METEOR in 2016
5. Zulassung USA Juni bis August 2016
6. Partner Europa oder Übernahme in 2016
7. Zulassung Europa in 2016 oder Anfang 2017
8. Phase II Daten zu CaboSun in RCC
9. CELSTIAL Daten in 2017
Die wichtigen Dinge habe ich fett markiert. Ergänzungen willkommen.
Die Q3 Zahlen und CC war weitgehend informationsfrei (bezüglich neuer Infos)... Pricing von Cotellic ist vielleicht noch interessant. Roche verschleudert Cotellic in der Combi für etwas über dem halben Preis von vemurafenib. Das ist nicht so gute News - war aber nicht anders zu erwarten, denn wieso sollte Roche Exelixis in der Co-Vermarktung einen großen Kuchen abgeben? Zudem sind die aktuellen Cabo Sales nur noch flat (at best). Deweiteren kosten die Mitarbeiter-Incentives irrsinnig Geld, sodass sie ihre Prognose des Verlusts ans obere Ende der Prognosespanne bringen mussten. Nachbörslich ist der Kurs auf 6.17 zurückgegangen (von 6.33), von daher stellt sich die Frage, ob es nun erneut an der 6.25 scheitert, was sehr wahrscheinlich wäre.
Es scheint schon ziemlich viel eingepreist zu sein und es gibt keine Anschlusskäufer. Daher könnte es auch irgendwann gefährlich werden - sollte sich der Frust mal nach unten entladen.
Die nächsten Events sind:
1. Präsentation der detaillierten Cobi OS Daten Ende November
2. Zulassungsantrag Cabo RCC stellen in USA bis Ende Dezember
3. Zulassungsantrag Cabo RCC stellen in Europa bis Q1 2016
4. Überlebensdaten von METEOR in 2016
5. Zulassung USA Juni bis August 2016
6. Partner Europa oder Übernahme in 2016
7. Zulassung Europa in 2016 oder Anfang 2017
8. Phase II Daten zu CaboSun in RCC
9. CELSTIAL Daten in 2017
Die wichtigen Dinge habe ich fett markiert. Ergänzungen willkommen.
Antwort auf Beitrag Nr.: 51.057.987 von Ville7 am 11.11.15 06:49:12"Das war ein unnötiger Aufreger und vorwiegend der Unfähigikeit der Firma geschuldet, die den Halt erst 10 min nach FDA Meldung veranlasst hat und dann 2-3h für die eigene Pressemeldung gebraucht hat."
...na und - Roche hat beispw. erst Heute über die Zulassung berichtet -->
http://www.roche.com/media/store/releases/med-cor-2015-11-11…
Wenn du der Meinung bist, dass 10 Minuten beim "Trading Halt" oder 3h bei der Veröffentlichung einer Pressemitteilung von fundamentaler Bedeutung sind, dann hast du wohl einiges nicht verstanden.
Ich bin immer noch der Meinung, dass vor allem Cobi, nicht Cabo, die grosse Phantasie auslöst. In der Roche-Entwicklungspipeline wird Cobi mit einigen anderen Wirkstoffen geprüft (werden), und zwar in sehr mächtigen Indikationen wie NSCLC, solid tumors, CRC, TNBC etc. Sollte sich die Vermutung bestätigen, dass Cobi das Therapieversagen verzögert bzw. eine synergistische Wirkung mit den immunstimulierenden APIs nachgewiesen wird, spätestens dann wird Roche Exelixis schlucken. Jedoch niemals wegen Cabo.
Franca_ole ist Cyberhexe...F_ole same nickname as on Twitter, Financeyahoo and Investor Village!
...na und - Roche hat beispw. erst Heute über die Zulassung berichtet -->
http://www.roche.com/media/store/releases/med-cor-2015-11-11…
Wenn du der Meinung bist, dass 10 Minuten beim "Trading Halt" oder 3h bei der Veröffentlichung einer Pressemitteilung von fundamentaler Bedeutung sind, dann hast du wohl einiges nicht verstanden.
Ich bin immer noch der Meinung, dass vor allem Cobi, nicht Cabo, die grosse Phantasie auslöst. In der Roche-Entwicklungspipeline wird Cobi mit einigen anderen Wirkstoffen geprüft (werden), und zwar in sehr mächtigen Indikationen wie NSCLC, solid tumors, CRC, TNBC etc. Sollte sich die Vermutung bestätigen, dass Cobi das Therapieversagen verzögert bzw. eine synergistische Wirkung mit den immunstimulierenden APIs nachgewiesen wird, spätestens dann wird Roche Exelixis schlucken. Jedoch niemals wegen Cabo.
Franca_ole ist Cyberhexe...F_ole same nickname as on Twitter, Financeyahoo and Investor Village!
Antwort auf Beitrag Nr.: 51.058.935 von Franca_ole am 11.11.15 09:00:03
Jo Cyberhexe, Franca, Biotechgott oder -göttin oder was auch immer... ich kenne dich schon von früher und wir waren öfters verschiedener (z.B. DNDN), und auch öfters gleicher Meinung (z.B. MEDX), größtenteils ohne miteinander zu diskutieren.
Ich habe jahrzehntelange Erfahrung in Börse und Biotechinvestments. Also stell mich nicht als unwissenden Idioten hin, der nur auf Länge von Trading Halts schaut und ein Investment danach beurteilt. Und dich als die/den übergroße(n) Helden/Heldin, der/dem keiner das Wasser reichen kann. Das ist einfach nur lächerlich.
Cobi ist für Exelixis weit unbedeutender als Cabo. Cobi ist ein Anhängsel für ne Combi. Cobi wird immer das Produkt sein, dessen Preis Roche in einer Combi nach unten nimmt, wenn die Combi zu teuer wird. Das ist schon dahingehend logisch, weil Roche eigene wirtschaftliche Interessen verfolgt. Also selbst wenn es in der einen oder anderen Kombi mit größeren Marktpotential irgendwann erscheinen wird, dann wird es dennoch für Exelixis eine untergeordnete Bedeutung spielen, weil Roche die Pricingpower hat. Exelixis hat darüber keine Kontrolle. Und auch vom Potential her bist du viel zu bullish re Cobi. Es gibt einige Konkurrenzprodukte zu Cobi mit gleichem Wirkungsmechanismus. SLGraman und ipollit haben dich darüber bereits aufgeklärt, aber bei dir prallt so was ja ab wie Teflon. Da gibt es kein Alleinstellungsmerkmal bei Cobi. Da ist Cabozantinib leicht anders, da es in einigen Studien eine klare Überlegenheit gegenüber seinen Brüdern der Konkurrenz gezeigt hat. Aber der Überburner ist auch das Produkt nicht.
Exelixis steht und fällt mit Cabozantinib. Wenn du nur wegen Cobi drin bist, wirst du mit deinem Investment wahrscheinlich sogar Erfolg haben, aber nicht weil Cobi der Erfolg für Exelixis wird, sondern Cabozantinib.
Im Übrigen stehe ich der Firma weiterhin sehr kritisch gegenüber, da sie schon oft gezeigt hat, dass sie mit ihren Finanzierungsrunden und -arten und eigenen Optionszuteilungen über die Leichen der Aktionäre geht ohne eine Wimper zu zucken.
Never fall in Love mit einem Produkt (Cobi) oder einer Firma (EXEL). Schaut so aus als hättest du noch das ein oder andere zu lernen.
Disclosure: immer noch long.
Zitat von Franca_ole: "Das war ein unnötiger Aufreger und vorwiegend der Unfähigikeit der Firma geschuldet, die den Halt erst 10 min nach FDA Meldung veranlasst hat und dann 2-3h für die eigene Pressemeldung gebraucht hat."
...na und - Roche hat beispw. erst Heute über die Zulassung berichtet -->
http://www.roche.com/media/store/releases/med-cor-2015-11-11…
Wenn du der Meinung bist, dass 10 Minuten beim "Trading Halt" oder 3h bei der Veröffentlichung einer Pressemitteilung von fundamentaler Bedeutung sind, dann hast du wohl einiges nicht verstanden.
Ich bin immer noch der Meinung, dass vor allem Cobi, nicht Cabo, die grosse Phantasie auslöst. In der Roche-Entwicklungspipeline wird Cobi mit einigen anderen Wirkstoffen geprüft (werden), und zwar in sehr mächtigen Indikationen wie NSCLC, solid tumors, CRC, TNBC etc. Sollte sich die Vermutung bestätigen, dass Cobi das Therapieversagen verzögert bzw. eine synergistische Wirkung mit den immunstimulierenden APIs nachgewiesen wird, spätestens dann wird Roche Exelixis schlucken. Jedoch niemals wegen Cabo.
Franca_ole ist Cyberhexe...F_ole same nickname as on Twitter, Financeyahoo and Investor Village!
Jo Cyberhexe, Franca, Biotechgott oder -göttin oder was auch immer... ich kenne dich schon von früher und wir waren öfters verschiedener (z.B. DNDN), und auch öfters gleicher Meinung (z.B. MEDX), größtenteils ohne miteinander zu diskutieren.
Ich habe jahrzehntelange Erfahrung in Börse und Biotechinvestments. Also stell mich nicht als unwissenden Idioten hin, der nur auf Länge von Trading Halts schaut und ein Investment danach beurteilt. Und dich als die/den übergroße(n) Helden/Heldin, der/dem keiner das Wasser reichen kann. Das ist einfach nur lächerlich.
Cobi ist für Exelixis weit unbedeutender als Cabo. Cobi ist ein Anhängsel für ne Combi. Cobi wird immer das Produkt sein, dessen Preis Roche in einer Combi nach unten nimmt, wenn die Combi zu teuer wird. Das ist schon dahingehend logisch, weil Roche eigene wirtschaftliche Interessen verfolgt. Also selbst wenn es in der einen oder anderen Kombi mit größeren Marktpotential irgendwann erscheinen wird, dann wird es dennoch für Exelixis eine untergeordnete Bedeutung spielen, weil Roche die Pricingpower hat. Exelixis hat darüber keine Kontrolle. Und auch vom Potential her bist du viel zu bullish re Cobi. Es gibt einige Konkurrenzprodukte zu Cobi mit gleichem Wirkungsmechanismus. SLGraman und ipollit haben dich darüber bereits aufgeklärt, aber bei dir prallt so was ja ab wie Teflon. Da gibt es kein Alleinstellungsmerkmal bei Cobi. Da ist Cabozantinib leicht anders, da es in einigen Studien eine klare Überlegenheit gegenüber seinen Brüdern der Konkurrenz gezeigt hat. Aber der Überburner ist auch das Produkt nicht.
Exelixis steht und fällt mit Cabozantinib. Wenn du nur wegen Cobi drin bist, wirst du mit deinem Investment wahrscheinlich sogar Erfolg haben, aber nicht weil Cobi der Erfolg für Exelixis wird, sondern Cabozantinib.
Im Übrigen stehe ich der Firma weiterhin sehr kritisch gegenüber, da sie schon oft gezeigt hat, dass sie mit ihren Finanzierungsrunden und -arten und eigenen Optionszuteilungen über die Leichen der Aktionäre geht ohne eine Wimper zu zucken.
Never fall in Love mit einem Produkt (Cobi) oder einer Firma (EXEL). Schaut so aus als hättest du noch das ein oder andere zu lernen.
Disclosure: immer noch long.
erniewerner (yahoo Message Board)
Sell the news
This situation very similar to what happened when Cabo was approved for MTC. A lot of new faces showed up in anticipation of the approval on the PDUFA date. The stock rallied approaching the deadline, spiked and collapsed in the aftermath. I think overestimating the size of the indication has a lot to do with both situations. This has always been a news driven stock and it seems to move up in large bites and then give most of it back again and I think that circumstance will continue.
I plan to start trading again when the range becomes more apparent. I think $5.40 is still a very important support level.
Upcoming events;
Cabo RCC NDA completed (December)
JV (any time now)
CaboSun results (1st half 2016)
Other CRADA results (ongoing)
Celestial full enrolment (??)
Meteor OS analysis (March timeframe)
FDA accepts NDA and sets PDUFA for Cabo in RCC (Jan/Feb)
Celestial interim analyses (2016?)
RCC approval (July/Aug)
Sell the news
This situation very similar to what happened when Cabo was approved for MTC. A lot of new faces showed up in anticipation of the approval on the PDUFA date. The stock rallied approaching the deadline, spiked and collapsed in the aftermath. I think overestimating the size of the indication has a lot to do with both situations. This has always been a news driven stock and it seems to move up in large bites and then give most of it back again and I think that circumstance will continue.
I plan to start trading again when the range becomes more apparent. I think $5.40 is still a very important support level.
Upcoming events;
Cabo RCC NDA completed (December)
JV (any time now)
CaboSun results (1st half 2016)
Other CRADA results (ongoing)
Celestial full enrolment (??)
Meteor OS analysis (March timeframe)
FDA accepts NDA and sets PDUFA for Cabo in RCC (Jan/Feb)
Celestial interim analyses (2016?)
RCC approval (July/Aug)
Antwort auf Beitrag Nr.: 51.055.359 von Ville7 am 10.11.15 18:25:30Ville7
schrieb am 10.11.15 18:25:30
Beitrag Nr. 381
"Vielleicht brauchen die auch nur so lang um ihre eigene Meldung zur Zulassung von Cobi zu schreiben
Auf jeden Fall ist die News bei Roche längst raus und es ist komisch, dass EXEL nicht mal eine Zeit nennt, wann das Trading wieder losgeht."
Richtig ist: Roche hat am 11.11.2015 hierzu eine Pressemitteilung herausgegeben.
Ich unterstelle jetzt mal, dass dieses Gerücht auf yahoo aufgeschnappt wurde - ich habe es dort auch gelesen-, um dieses dann ohne es zu verifizieren hier auf wallstreet zu verbreiten.
"Ville7
schrieb am 10.11.15 20:09:37
Beitrag Nr. 389 (51.056.292)
Was für ein Witz. Die News war schon raus und dann halten sie das Trading für 3h an um die eigene Meldung rauszubringen. Was für Schwachmaten! Sorry. "
...als ob man ein Management an diesen Nichtigkeieten messen könnte!
"Ville7
schrieb am 11.11.15 06:49:12
Beitrag Nr. 397 (51.057.987)
Das war ein unnötiger Aufreger und vorwiegend der Unfähigikeit der Firma geschuldet, die den Halt erst 10 min nach FDA Meldung veranlasst hat und dann 2-3h für die eigene Pressemeldung gebraucht hat.
Die Q3 Zahlen und CC war weitgehend informationsfrei (bezüglich neuer Infos)... Pricing von Cotellic ist vielleicht noch interessant. Roche verschleudert Cotellic in der Combi für etwas über dem halben Preis von vemurafenib. Das ist nicht so gute News - war aber nicht anders zu erwarten, denn wieso sollte Roche Exelixis in der Co-Vermarktung einen großen Kuchen abgeben? Zudem sind die aktuellen Cabo Sales nur noch flat (at best). Deweiteren kosten die Mitarbeiter-Incentives irrsinnig Geld, sodass sie ihre Prognose des Verlusts ans obere Ende der Prognosespanne bringen mussten. Nachbörslich ist der Kurs auf 6.17 zurückgegangen (von 6.33), von daher stellt sich die Frage, ob es nun erneut an der 6.25 scheitert, was sehr wahrscheinlich wäre."
ohne Kommentar!
ville 7
schrieb am 11.11.15 09:45:53
Beitrag Nr. 399
Ich habe jahrzehntelange Erfahrung in Börse und Biotechinvestments.
Kommentar:
Man wird an seinen Beiträgen gemessen und nicht an der Zeit.
"Cobi ist für Exelixis weit unbedeutender als Cabo."
Kommentar: das ist schwarz-weiss; weder du noch ich, noch andere "Experten" können wirklich beurteilen, welches der beiden Produkte bedeutender ist. Fakt ist, dass Cobi Patentschutz geniesst bis 2030, während derjenige von Cabo bereits 2024 ausläuft (für die Indikation Schilddrüsenkrebs gibt es eine Verlängerung bis 2030). Die Exklusivität geht bereits 2018/2019 verloren.
"Cobi ist ein Anhängsel für ne Combi."
Kommentar:
na und! Was willst du damit aussagen. Die allermeisten Krebstherapien sind ausschliesslich Kombinationstherapien.
"Cobi wird immer das Produkt sein, dessen Preis Roche in einer Combi nach unten nimmt, wenn die Combi zu teuer wird. Das ist schon dahingehend logisch, weil Roche eigene wirtschaftliche Interessen verfolgt. Also selbst wenn es in der einen oder anderen Kombi mit größeren Marktpotential irgendwann erscheinen wird, dann wird es dennoch für Exelixis eine untergeordnete Bedeutung spielen, weil Roche die Pricingpower hat."
Kommentar:
Vemurafenib (brand: Zelboraf) wird im Gegensatz zu Cobi nicht in weiteren Indikationen getestet. Bei der Preisbildung von Cobi wird der komplette Lebenszyklus sowie die potenziellen Indikationen berücksichtigt, weil es an ein und demselben Markt nur einen Preis für ein Medikament geben kann. Da konnte nicht nur mMelanoma berücksichtigt werden. Natürlich ist das Argument des Teilens auf niedrigerem Niveau nicht ganz von der Hand zu weisen.
Und auch vom Potential her bist du viel zu bullish re Cobi. Es gibt einige Konkurrenzprodukte zu Cobi mit gleichem Wirkungsmechanismus. SLGraman und ipollit haben dich darüber bereits aufgeklärt, aber bei dir prallt so was ja ab wie Teflon.
Kommentar:
Es gibt praktisch zu jedem onkologisch wirksamen Wirkstoff Konkurrenzprodukte. Falls sich jedoch ein Hinauszögern des Therapieversagens sowie der synergistische Effekt zu Atezolizumab bestätigen sollten, dann bin ich nicht zu bullish. Bestätigen sich diese Thesen nicht, dann ist Cobi lediglich ein Kombiwirkstoff ähnlich wie Vemurafenib zur Behandlung von mMelanoma.
SLGraman und ipolt spielen nicht in deiner Liga - das solltest du so akzeptieren!
"Da gibt es kein Alleinstellungsmerkmal bei Cobi. Da ist Cabozantinib leicht anders, da es in einigen Studien eine klare Überlegenheit gegenüber seinen Brüdern der Konkurrenz gezeigt hat. Aber der Überburner ist auch das Produkt nicht."
Kommentar:
Alleinstellungsmerkmale sind wirklich sehr, sehr selten. Cobi scheint den Vorteil zu haben, dass die Kombi mit Zelboraf bei mMelanoma den anderen Therapien aus den gleichen Wirkstoffgruppen überlegen ist. Ein ganz grosser Pluspunkt ist zudem die Verbindung mit Roche/Genentech. Der onkologische Weltmarktführer hat sowohl das Kapital, die Marktmacht, andere für die Kombitherapie viel versprechende APIs als auch die Expertise eine Arzneimittelentwicklung erfolgreich abzuschliessen. Das schliesst natürlich nicht aus, dass auch andere erfolgreich sein werden. Sollte der synergistische Effekt bspw. zu Atezolizumab nachgewiesen werden, dann könnten kühnste Erwartungen übertroffen werden (man beachte den Konjunktiv!).
"Exelixis steht und fällt mit Cabozantinib."
Kommentar:
das ist wieder schwarz-weiss; ein Unternehmen wird von vielen Faktoren beeinflusst, Exelixis im Wesentlichen von Cabo, Cobi sowie Cash Flow. Das grosse Problem von Exel ist, dass bei der Entwicklung von Cabo kein potenter Mitstreiter zur Verfügung steht, um alle viel versprechenden Indikationen zu testen. Aber vielleicht wird sich das noch ändern. Der Patentschutz dauert jedoch nicht ewig (siehe oben)
"Wenn du nur wegen Cobi drin bist, wirst du mit deinem Investment wahrscheinlich sogar Erfolg haben, aber nicht weil Cobi der Erfolg für Exelixis wird, sondern Cabozantinib."
Kommentar:
Ich bin nicht nur wegen Cobi und auch nicht nur wegen Cabo in Exelixis investiert. Das Gesamtkonzept ist entscheidend. Hier sind wir dann mal wieder bei Adam&Eva.
"Im Übrigen stehe ich der Firma weiterhin sehr kritisch gegenüber, da sie schon oft gezeigt hat, dass sie mit ihren Finanzierungsrunden und -arten und eigenen Optionszuteilungen über die Leichen der Aktionäre geht ohne eine Wimper zu zucken".
welche Leichen?
"Never fall in Love mit einem Produkt (Cobi) oder einer Firma (EXEL). Schaut so aus als hättest du noch das ein oder andere zu lernen."
Du solltest Fragesätze von anderen Sätzen unterscheiden.
alles in allem, solltest du an deiner Kritikfähigkeit arbeiten, denn dieses Forum lebt hauptsächlich vom Diskurs. Darüber hinaus lebt die Diskussionsrunde von der Vielfalt der Teilnehmer, und hierbei hat jeder so seinen Part. Du den Deinen!
schrieb am 10.11.15 18:25:30
Beitrag Nr. 381
"Vielleicht brauchen die auch nur so lang um ihre eigene Meldung zur Zulassung von Cobi zu schreiben

Auf jeden Fall ist die News bei Roche längst raus und es ist komisch, dass EXEL nicht mal eine Zeit nennt, wann das Trading wieder losgeht."
Richtig ist: Roche hat am 11.11.2015 hierzu eine Pressemitteilung herausgegeben.
Ich unterstelle jetzt mal, dass dieses Gerücht auf yahoo aufgeschnappt wurde - ich habe es dort auch gelesen-, um dieses dann ohne es zu verifizieren hier auf wallstreet zu verbreiten.
"Ville7
schrieb am 10.11.15 20:09:37
Beitrag Nr. 389 (51.056.292)
Was für ein Witz. Die News war schon raus und dann halten sie das Trading für 3h an um die eigene Meldung rauszubringen. Was für Schwachmaten! Sorry. "
...als ob man ein Management an diesen Nichtigkeieten messen könnte!
"Ville7
schrieb am 11.11.15 06:49:12
Beitrag Nr. 397 (51.057.987)
Das war ein unnötiger Aufreger und vorwiegend der Unfähigikeit der Firma geschuldet, die den Halt erst 10 min nach FDA Meldung veranlasst hat und dann 2-3h für die eigene Pressemeldung gebraucht hat.
Die Q3 Zahlen und CC war weitgehend informationsfrei (bezüglich neuer Infos)... Pricing von Cotellic ist vielleicht noch interessant. Roche verschleudert Cotellic in der Combi für etwas über dem halben Preis von vemurafenib. Das ist nicht so gute News - war aber nicht anders zu erwarten, denn wieso sollte Roche Exelixis in der Co-Vermarktung einen großen Kuchen abgeben? Zudem sind die aktuellen Cabo Sales nur noch flat (at best). Deweiteren kosten die Mitarbeiter-Incentives irrsinnig Geld, sodass sie ihre Prognose des Verlusts ans obere Ende der Prognosespanne bringen mussten. Nachbörslich ist der Kurs auf 6.17 zurückgegangen (von 6.33), von daher stellt sich die Frage, ob es nun erneut an der 6.25 scheitert, was sehr wahrscheinlich wäre."
ohne Kommentar!
ville 7
schrieb am 11.11.15 09:45:53
Beitrag Nr. 399
Ich habe jahrzehntelange Erfahrung in Börse und Biotechinvestments.
Kommentar:
Man wird an seinen Beiträgen gemessen und nicht an der Zeit.
"Cobi ist für Exelixis weit unbedeutender als Cabo."
Kommentar: das ist schwarz-weiss; weder du noch ich, noch andere "Experten" können wirklich beurteilen, welches der beiden Produkte bedeutender ist. Fakt ist, dass Cobi Patentschutz geniesst bis 2030, während derjenige von Cabo bereits 2024 ausläuft (für die Indikation Schilddrüsenkrebs gibt es eine Verlängerung bis 2030). Die Exklusivität geht bereits 2018/2019 verloren.
"Cobi ist ein Anhängsel für ne Combi."
Kommentar:
na und! Was willst du damit aussagen. Die allermeisten Krebstherapien sind ausschliesslich Kombinationstherapien.
"Cobi wird immer das Produkt sein, dessen Preis Roche in einer Combi nach unten nimmt, wenn die Combi zu teuer wird. Das ist schon dahingehend logisch, weil Roche eigene wirtschaftliche Interessen verfolgt. Also selbst wenn es in der einen oder anderen Kombi mit größeren Marktpotential irgendwann erscheinen wird, dann wird es dennoch für Exelixis eine untergeordnete Bedeutung spielen, weil Roche die Pricingpower hat."
Kommentar:
Vemurafenib (brand: Zelboraf) wird im Gegensatz zu Cobi nicht in weiteren Indikationen getestet. Bei der Preisbildung von Cobi wird der komplette Lebenszyklus sowie die potenziellen Indikationen berücksichtigt, weil es an ein und demselben Markt nur einen Preis für ein Medikament geben kann. Da konnte nicht nur mMelanoma berücksichtigt werden. Natürlich ist das Argument des Teilens auf niedrigerem Niveau nicht ganz von der Hand zu weisen.
Und auch vom Potential her bist du viel zu bullish re Cobi. Es gibt einige Konkurrenzprodukte zu Cobi mit gleichem Wirkungsmechanismus. SLGraman und ipollit haben dich darüber bereits aufgeklärt, aber bei dir prallt so was ja ab wie Teflon.
Kommentar:
Es gibt praktisch zu jedem onkologisch wirksamen Wirkstoff Konkurrenzprodukte. Falls sich jedoch ein Hinauszögern des Therapieversagens sowie der synergistische Effekt zu Atezolizumab bestätigen sollten, dann bin ich nicht zu bullish. Bestätigen sich diese Thesen nicht, dann ist Cobi lediglich ein Kombiwirkstoff ähnlich wie Vemurafenib zur Behandlung von mMelanoma.
SLGraman und ipolt spielen nicht in deiner Liga - das solltest du so akzeptieren!
"Da gibt es kein Alleinstellungsmerkmal bei Cobi. Da ist Cabozantinib leicht anders, da es in einigen Studien eine klare Überlegenheit gegenüber seinen Brüdern der Konkurrenz gezeigt hat. Aber der Überburner ist auch das Produkt nicht."
Kommentar:
Alleinstellungsmerkmale sind wirklich sehr, sehr selten. Cobi scheint den Vorteil zu haben, dass die Kombi mit Zelboraf bei mMelanoma den anderen Therapien aus den gleichen Wirkstoffgruppen überlegen ist. Ein ganz grosser Pluspunkt ist zudem die Verbindung mit Roche/Genentech. Der onkologische Weltmarktführer hat sowohl das Kapital, die Marktmacht, andere für die Kombitherapie viel versprechende APIs als auch die Expertise eine Arzneimittelentwicklung erfolgreich abzuschliessen. Das schliesst natürlich nicht aus, dass auch andere erfolgreich sein werden. Sollte der synergistische Effekt bspw. zu Atezolizumab nachgewiesen werden, dann könnten kühnste Erwartungen übertroffen werden (man beachte den Konjunktiv!).
"Exelixis steht und fällt mit Cabozantinib."
Kommentar:
das ist wieder schwarz-weiss; ein Unternehmen wird von vielen Faktoren beeinflusst, Exelixis im Wesentlichen von Cabo, Cobi sowie Cash Flow. Das grosse Problem von Exel ist, dass bei der Entwicklung von Cabo kein potenter Mitstreiter zur Verfügung steht, um alle viel versprechenden Indikationen zu testen. Aber vielleicht wird sich das noch ändern. Der Patentschutz dauert jedoch nicht ewig (siehe oben)
"Wenn du nur wegen Cobi drin bist, wirst du mit deinem Investment wahrscheinlich sogar Erfolg haben, aber nicht weil Cobi der Erfolg für Exelixis wird, sondern Cabozantinib."
Kommentar:
Ich bin nicht nur wegen Cobi und auch nicht nur wegen Cabo in Exelixis investiert. Das Gesamtkonzept ist entscheidend. Hier sind wir dann mal wieder bei Adam&Eva.
"Im Übrigen stehe ich der Firma weiterhin sehr kritisch gegenüber, da sie schon oft gezeigt hat, dass sie mit ihren Finanzierungsrunden und -arten und eigenen Optionszuteilungen über die Leichen der Aktionäre geht ohne eine Wimper zu zucken".
welche Leichen?
"Never fall in Love mit einem Produkt (Cobi) oder einer Firma (EXEL). Schaut so aus als hättest du noch das ein oder andere zu lernen."
Du solltest Fragesätze von anderen Sätzen unterscheiden.
alles in allem, solltest du an deiner Kritikfähigkeit arbeiten, denn dieses Forum lebt hauptsächlich vom Diskurs. Darüber hinaus lebt die Diskussionsrunde von der Vielfalt der Teilnehmer, und hierbei hat jeder so seinen Part. Du den Deinen!
Antwort auf Beitrag Nr.: 51.064.530 von Franca_ole am 11.11.15 17:26:15Bei allem Respekt, aber dir ist einfach nicht mehr zu helfen. Deine Antworten und die Art und Weise der Antworten lassen auf ein tiefergründiges Problem schließen. Daher werde ich mir meine Antworten darauf sparen, dieses und auch noch auf der Ebene "weiterzudiskutieren" ist sogar noch weit unter meinem Niveau, deswegen lasse ich es.
Ein Satz ist mal wieder bezeichnend für mein bei dir vermutetes psych. Problem:
SLGraman und ipolt spielen nicht in deiner Liga - das solltest du so akzeptieren!
Fassen wir zusammen: Wir haben eine Weltliga, darin spielt die Franca_Ole, alias Cyberhexe. Keiner kann ihr das Wasser reichen, sie ist gottgleich in der Analyse von Biotechunternehmen. Dann gibts die Bundesliga, darin spielen ipollit und SLGraman. Und in der Kreisklasse spielt der Ville.
Erstaunlich, dass man mit einem Kreisklasse-Depot über unzählige Jahre konstant fette Erfolge einfahren kann und durch eigene Recherche serienweise Top Picks auswählt (aber das können die Affen mit dem Dartpfeil ja auch).
Ich darf daher gar nicht daran denken, was man in der Weltliga an Performance macht!!!... ich verneige mich schon mal erfürchtig und entschuldige mich für die Majestätsbeleidigung.
Ein Satz ist mal wieder bezeichnend für mein bei dir vermutetes psych. Problem:
SLGraman und ipolt spielen nicht in deiner Liga - das solltest du so akzeptieren!
Fassen wir zusammen: Wir haben eine Weltliga, darin spielt die Franca_Ole, alias Cyberhexe. Keiner kann ihr das Wasser reichen, sie ist gottgleich in der Analyse von Biotechunternehmen. Dann gibts die Bundesliga, darin spielen ipollit und SLGraman. Und in der Kreisklasse spielt der Ville.
Erstaunlich, dass man mit einem Kreisklasse-Depot über unzählige Jahre konstant fette Erfolge einfahren kann und durch eigene Recherche serienweise Top Picks auswählt (aber das können die Affen mit dem Dartpfeil ja auch).
Ich darf daher gar nicht daran denken, was man in der Weltliga an Performance macht!!!... ich verneige mich schon mal erfürchtig und entschuldige mich für die Majestätsbeleidigung.
Ich weiß nicht Ville was Du für ein Problem hast, Du weißt viel und Franca weiß viel, die Synergie bringt`s!
Warum greifst Du Franca an????
Warum greifst Du Franca an????
Antwort auf Beitrag Nr.: 51.064.917 von Ville7 am 11.11.15 17:58:28... nicht ein Argument/Gegenargument, dazu Polemik ohne Ende und Schwarz-Weiss-Geschwätz wie bei blutigen Anfängern. Das soll sich antun wer will - ohne mich!
Melde mich ab!

Melde mich ab!

Antwort auf Beitrag Nr.: 51.067.554 von Franca_ole am 11.11.15 23:47:41
Sehr, sehr schade! Schätze all deine Beiträge sehr!
War zwar schon bei EXEL eingestiegen bevor ich deinen Thread hier entdeckt habe, und hatte bereits meine eigene DD gemacht, aber erst hier, und hauptsächlich durch deine Beiträge, konnte ich tiefer in die Cabo/Cobi-Materie vordringen. Herzlichen Dank an Dich!
Dies soll aber kein Nachruf sein Eher eine Bitte, hier doch weiterzumachen!
Eher eine Bitte, hier doch weiterzumachen!
@ville
angriffslustig =ungleich= lustig
Zitat von Franca_ole: Melde mich ab!
Sehr, sehr schade! Schätze all deine Beiträge sehr!
War zwar schon bei EXEL eingestiegen bevor ich deinen Thread hier entdeckt habe, und hatte bereits meine eigene DD gemacht, aber erst hier, und hauptsächlich durch deine Beiträge, konnte ich tiefer in die Cabo/Cobi-Materie vordringen. Herzlichen Dank an Dich!
Dies soll aber kein Nachruf sein
 Eher eine Bitte, hier doch weiterzumachen!
Eher eine Bitte, hier doch weiterzumachen!@ville
angriffslustig =ungleich= lustig
Franca come back!
Ich habe aber auch nichts gegen Ville, nur du kannst Ihn ja auf Ignore setzen und wir wollen auf Deine geschätzten Beiträge nicht verzichten!
Ich habe aber auch nichts gegen Ville, nur du kannst Ihn ja auf Ignore setzen und wir wollen auf Deine geschätzten Beiträge nicht verzichten!
Genau, die blutigen Anfänger / Kreisligisten einfach ignorieren! Der Thread ist nur für Weltligisten und deren Fans. Ab und zu vielleicht auch für die Bundesliga - aber bitte nur von Königins Gnade und wenn die Meinung genehm ist!
Ich sag auch Ciao hier - meine Erkenntnisse/Einschätzungen interessieren eh nur mich selbst - für meine eigenen Entscheidungen (blutige Anfängerentscheidungen, selbstverständlich!).
Ich sag auch Ciao hier - meine Erkenntnisse/Einschätzungen interessieren eh nur mich selbst - für meine eigenen Entscheidungen (blutige Anfängerentscheidungen, selbstverständlich!).

Antwort auf Beitrag Nr.: 51.073.122 von Ville7 am 12.11.15 15:25:34Hhm, genauso schade wäre es, wenn Du dich hier auch nicht mehr blicken ließest!
Auch Deine zahlreichen Beiträge waren doch hier für alle stets höchst willkommen - ich z.B. habe dich abonniert und nicht etwa auf ignore gesetzt.
Jetzt, nach diesem kurzen Showdown zw. Dir und C_H_franca_ole, gut, da kann man sagen, ihr beide habt etwas überreagiert. War es vielleicht auch dem Kursverfall nach der Zulassung und den Q-Zahlen geschuldet?
Auch wenn Du und C_H_franca_ole z.T. unterschiedliche Einschätzungen zu EXEL, zu Cabo oder Cobi habt, und euch deswegen vielleicht auch mal fetzt, wäre es nach einer Auseinandersetzung souveräner, wieder in die Diskussionsspur zu finden.
Das EXEL-Board würde durch euren Abgang sehr an Qualität verlieren.
Viele Grüße
TwoPack
Auch Deine zahlreichen Beiträge waren doch hier für alle stets höchst willkommen - ich z.B. habe dich abonniert und nicht etwa auf ignore gesetzt.
Jetzt, nach diesem kurzen Showdown zw. Dir und C_H_franca_ole, gut, da kann man sagen, ihr beide habt etwas überreagiert. War es vielleicht auch dem Kursverfall nach der Zulassung und den Q-Zahlen geschuldet?
Auch wenn Du und C_H_franca_ole z.T. unterschiedliche Einschätzungen zu EXEL, zu Cabo oder Cobi habt, und euch deswegen vielleicht auch mal fetzt, wäre es nach einer Auseinandersetzung souveräner, wieder in die Diskussionsspur zu finden.
Das EXEL-Board würde durch euren Abgang sehr an Qualität verlieren.
Viele Grüße
TwoPack
Kristine Harjes und Todd Campbell vom Fool über Exelixis:
http://www.nasdaq.com/article/did-you-miss-these-top-stories…
http://www.nasdaq.com/article/did-you-miss-these-top-stories…
Exelixis Announces European Commission Approval of COTELLIC™ (Cobimetinib) for Use in Combination with Vemurafenib in Advanced BRAF V600 Mutation-Positive Melanoma
http://www.exelixis.com/investors-media/press-releases
Dem Kurs scheint es leider wieder mal wurscht zu sein, und war natürlich alles schon eingetütet.
Der Markt hat sicherlich aber auch die wenig euphorisch machenden Werte registriert, die am Wochenende bekannt gegeben wurden, wonach das mittlere OS für Cotellic+Verumafenib bei 22,3 Monaten, das für Dabrafenib+Trametinib von Novartis aber bei 25,6 Monaten liegt.
http://www.exelixis.com/investors-media/press-releases
Dem Kurs scheint es leider wieder mal wurscht zu sein, und war natürlich alles schon eingetütet.
Der Markt hat sicherlich aber auch die wenig euphorisch machenden Werte registriert, die am Wochenende bekannt gegeben wurden, wonach das mittlere OS für Cotellic+Verumafenib bei 22,3 Monaten, das für Dabrafenib+Trametinib von Novartis aber bei 25,6 Monaten liegt.
Antwort auf Beitrag Nr.: 51.177.147 von TwoPack am 25.11.15 20:40:24Zur momentanen Situation des Share price hier ein paar passender Ausspruch eines Users vom Yahoo-Board:
"In the interim, I'm heading to Walmart to flyer windshields with pro-EXEL propaganda."

"In the interim, I'm heading to Walmart to flyer windshields with pro-EXEL propaganda."

BMYs PD1-AK Opdivo bekommt vorerst keine Zulassung in BRAFV600+ Melanoma:
"Bristol-Myers Squibb Company today announced that the U.S. Food and Drug Administration (FDA) has issued a Complete Response Letter for its supplemental Biologics License Application (sBLA) for Opdivo (nivolumab) as a single agent for the treatment of previously untreated patients, specifically those with BRAF V600 mutation positive unresectable or metastatic melanoma."
Die Standard-Therapie in BRAFV600+ bleibt ein BRAF + MEK Hemmer.
Gruß
ipollit
"Bristol-Myers Squibb Company today announced that the U.S. Food and Drug Administration (FDA) has issued a Complete Response Letter for its supplemental Biologics License Application (sBLA) for Opdivo (nivolumab) as a single agent for the treatment of previously untreated patients, specifically those with BRAF V600 mutation positive unresectable or metastatic melanoma."
Die Standard-Therapie in BRAFV600+ bleibt ein BRAF + MEK Hemmer.
Gruß
ipollit
http://sleekmoney.com/exelixis-inc-exel-director-lance-wills…
Na dann, kann ja nix mehr schief gehen...
Na dann, kann ja nix mehr schief gehen...
Antwort auf Beitrag Nr.: 51.294.852 von Milestones am 13.12.15 10:03:23
http://sleekmoney.com/exelixis-inc-exel-director-lance-wills…
Hmm, das war wohl nix...
daher nochmal als URL:http://sleekmoney.com/exelixis-inc-exel-director-lance-wills…
Positive Subgruppen-Daten:
http://finance.yahoo.com/news/exelixis-announces-positive-re…
Hexe komm doch zurück, Ville mault doch immer rum hat aber auch viel Ahnung!
http://finance.yahoo.com/news/exelixis-announces-positive-re…
Hexe komm doch zurück, Ville mault doch immer rum hat aber auch viel Ahnung!
Deems New Drug Application Sufficiently Complete and Grants Priority Review for Cabozantinib as a Treatment for Advanced Renal Cell Carcinoma
By Business Wire, January 28, 2016, 08:00:00 AM EDT
SOUTH SAN FRANCISCO, Calif.--(BUSINESS WIRE)-- Exelixis, Inc. (NASDAQ:EXEL) today announced that the U.S. Food & Drug Administration (FDA) has determined the company's New Drug Application (NDA) for cabozantinib as a treatment for patients with advanced renal cell carcinoma (RCC) who have received one prior therapy to be sufficiently complete to permit a substantive review. The NDA will be considered officially filed 60 days from the date of the completion of the submission, or February 20, 2016. The FDA granted Priority Review to the filing and assigned a Prescription Drug User Fee Act action date of June 22, 2016.
"With FDA granting Priority Review to our application, Exelixis is one step closer to offering physicians cabozantinib as an important new therapeutic option for their patients with advanced renal cell carcinoma," said Michael M. Morrissey, Ph.D., president and CEO of Exelixis. "While we work closely with the FDA during the review process, Exelixis will continue to execute on our commercial plans, including our commitment to be ready for a potential launch by April 1st of this year."
A Priority Review designation is granted by the FDA for drugs that, if approved, would be significant improvements in the treatment, prevention or diagnosis of a disease. Previously, the FDA granted cabozantinib Breakthrough Therapy designation (August 2015) and Fast Track designation (April 2015) for the compound's proposed RCC indication.
The NDA is based on the results of METEOR, a phase 3 pivotal trial comparing cabozantinib to everolimus in patients with advanced RCC who experienced disease progression following treatment with a VEGF receptor tyrosine kinase inhibitor. In July 2015, Exelixis announced top-line results demonstrating that the trial had met its primary endpoint of improving progression-free survival; compared with everolimus, cabozantinib was associated with a 42% reduction in the rate of disease progression or death. These data were later presented at the European Cancer Congress in September 2015 and concurrently published in The New England Journal of Medicine.
On January 11, 2016, Exelixis announced the submission of a Marketing Authorization Application (MAA) for cabozantinib as a treatment for patients with advanced RCC who have received one prior therapy to the European Medicines Agency (EMA). The EMA's Committee for Medicinal Products for Human Use (CHMP) previously granted accelerated assessment to cabozantinib for advanced RCC. As a result, the company's MAA will be eligible for a 150-day review, versus the standard 210 days (excluding clock stops when information is requested by CHMP).
Cabozantinib is currently marketed in capsule form under the brand name COMETRIQ® in the United States for the treatment of progressive, metastatic medullary thyroid cancer (MTC), and in the European Union for the treatment of adult patients with progressive, unresectable locally advanced or metastatic MTC. COMETRIQ is not indicated for patients with RCC. In the METEOR trial, and all other cancer trials currently underway, Exelixis is investigating a tablet formulation of cabozantinib distinct from the COMETRIQ capsule form. The tablet formulation of cabozantinib is the subject of the NDA for advanced RCC.
By Business Wire, January 28, 2016, 08:00:00 AM EDT
SOUTH SAN FRANCISCO, Calif.--(BUSINESS WIRE)-- Exelixis, Inc. (NASDAQ:EXEL) today announced that the U.S. Food & Drug Administration (FDA) has determined the company's New Drug Application (NDA) for cabozantinib as a treatment for patients with advanced renal cell carcinoma (RCC) who have received one prior therapy to be sufficiently complete to permit a substantive review. The NDA will be considered officially filed 60 days from the date of the completion of the submission, or February 20, 2016. The FDA granted Priority Review to the filing and assigned a Prescription Drug User Fee Act action date of June 22, 2016.
"With FDA granting Priority Review to our application, Exelixis is one step closer to offering physicians cabozantinib as an important new therapeutic option for their patients with advanced renal cell carcinoma," said Michael M. Morrissey, Ph.D., president and CEO of Exelixis. "While we work closely with the FDA during the review process, Exelixis will continue to execute on our commercial plans, including our commitment to be ready for a potential launch by April 1st of this year."
A Priority Review designation is granted by the FDA for drugs that, if approved, would be significant improvements in the treatment, prevention or diagnosis of a disease. Previously, the FDA granted cabozantinib Breakthrough Therapy designation (August 2015) and Fast Track designation (April 2015) for the compound's proposed RCC indication.
The NDA is based on the results of METEOR, a phase 3 pivotal trial comparing cabozantinib to everolimus in patients with advanced RCC who experienced disease progression following treatment with a VEGF receptor tyrosine kinase inhibitor. In July 2015, Exelixis announced top-line results demonstrating that the trial had met its primary endpoint of improving progression-free survival; compared with everolimus, cabozantinib was associated with a 42% reduction in the rate of disease progression or death. These data were later presented at the European Cancer Congress in September 2015 and concurrently published in The New England Journal of Medicine.
On January 11, 2016, Exelixis announced the submission of a Marketing Authorization Application (MAA) for cabozantinib as a treatment for patients with advanced RCC who have received one prior therapy to the European Medicines Agency (EMA). The EMA's Committee for Medicinal Products for Human Use (CHMP) previously granted accelerated assessment to cabozantinib for advanced RCC. As a result, the company's MAA will be eligible for a 150-day review, versus the standard 210 days (excluding clock stops when information is requested by CHMP).
Cabozantinib is currently marketed in capsule form under the brand name COMETRIQ® in the United States for the treatment of progressive, metastatic medullary thyroid cancer (MTC), and in the European Union for the treatment of adult patients with progressive, unresectable locally advanced or metastatic MTC. COMETRIQ is not indicated for patients with RCC. In the METEOR trial, and all other cancer trials currently underway, Exelixis is investigating a tablet formulation of cabozantinib distinct from the COMETRIQ capsule form. The tablet formulation of cabozantinib is the subject of the NDA for advanced RCC.
Medicines Agency Acceptance of Marketing Authorization Application for Cabozantinib as a Treatment for Advanced Renal Cell Carcinoma
By Business Wire, January 28, 2016, 04:05:00 PM EDT
SOUTH SAN FRANCISCO, Calif.--(BUSINESS WIRE)-- Exelixis, Inc. (NASDAQ:EXEL) today announced the European Medicines Agency (EMA) has accepted for review the Marketing Authorization Application (MAA) for cabozantinib as a treatment for patients with advanced renal cell carcinoma (RCC) who have received one prior therapy. The completion of the MAA validation process confirms that the submission is sufficient to permit a substantive review for marketing authorization in the European Union.
The EMA's Committee for Medicinal Products for Human Use (CHMP) previously granted accelerated assessment to cabozantinib for advanced RCC. As a result, the MAA will be eligible for a 150-day review, versus the standard 210 days (excluding clock stops when information is requested by CHMP).
The MAA is based on the results of METEOR, a phase 3 pivotal trial comparing cabozantinib to everolimus in patients with advanced RCC who experienced disease progression following treatment with a VEGF receptor tyrosine kinase inhibitor. In July 2015, Exelixis announced top-line results from METEOR demonstrating that the trial had met its primary endpoint of improving progression-free survival; compared with everolimus, a standard of care for second line RCC therapy, cabozantinib was associated with a 42% reduction in the rate of disease progression or death. These data were later presented at the European Cancer Congress in September 2015 and concurrently published in The New England Journal of Medicine.
Read more: http://www.nasdaq.com/press-release/exelixis-announces-europ…
By Business Wire, January 28, 2016, 04:05:00 PM EDT
SOUTH SAN FRANCISCO, Calif.--(BUSINESS WIRE)-- Exelixis, Inc. (NASDAQ:EXEL) today announced the European Medicines Agency (EMA) has accepted for review the Marketing Authorization Application (MAA) for cabozantinib as a treatment for patients with advanced renal cell carcinoma (RCC) who have received one prior therapy. The completion of the MAA validation process confirms that the submission is sufficient to permit a substantive review for marketing authorization in the European Union.
The EMA's Committee for Medicinal Products for Human Use (CHMP) previously granted accelerated assessment to cabozantinib for advanced RCC. As a result, the MAA will be eligible for a 150-day review, versus the standard 210 days (excluding clock stops when information is requested by CHMP).
The MAA is based on the results of METEOR, a phase 3 pivotal trial comparing cabozantinib to everolimus in patients with advanced RCC who experienced disease progression following treatment with a VEGF receptor tyrosine kinase inhibitor. In July 2015, Exelixis announced top-line results from METEOR demonstrating that the trial had met its primary endpoint of improving progression-free survival; compared with everolimus, a standard of care for second line RCC therapy, cabozantinib was associated with a 42% reduction in the rate of disease progression or death. These data were later presented at the European Cancer Congress in September 2015 and concurrently published in The New England Journal of Medicine.
Read more: http://www.nasdaq.com/press-release/exelixis-announces-europ…
Wenn der scheiß Biotech-Bearmarkt nicht wäre würde Exelixis ganz woanders stehen!
Exelixis Announces Positive Overall Survival Results from METEOR, the Phase 3 Pivotal Trial of Cabozantinib in Advanced Renal Cell Carcinoma
By Business Wire, February 01, 2016, 08:00:00 AM EDT
- Cabozantinib significantly improved overall survival as compared with everolimus -
- First therapy to demonstrate improvement in overall survival, progression-free survival, and objective response rate in a large, pivotal phase 3 study in previously treated renal cell carcinoma patients -
- Exelixis intends to share the data with U.S. and EU regulators, and to present the data at a medical meeting later in 2016 -
SOUTH SAN FRANCISCO, Calif.--(BUSINESS WIRE)-- Exelixis, Inc. (NASDAQ:EXEL) today announced positive overall survival (OS) results from METEOR, the phase 3 pivotal trial comparing cabozantinib to everolimus in 658 patients with advanced renal cell carcinoma (RCC) who have experienced disease progression following treatment with a VEGF receptor tyrosine kinase inhibitor (TKI). In a second interim analysis for OS, a secondary endpoint of the trial, the results showed a highly statistically significant and clinically meaningful increase in OS for patients randomized to cabozantinib as compared to everolimus. Ongoing study monitoring did not identify any new safety signals. Exelixis intends to present these data at a medical meeting later this year.
"With these results, cabozantinib is now the first and only therapy evaluated in a large, pivotal study in previously treated patients with advanced renal cell carcinoma to demonstrate a benefit in all three key efficacy parameters - overall survival, progression-free survival and objective response rate," said Michael M. Morrissey, Ph.D., president and chief executive officer of Exelixis. "This is an important moment for the kidney cancer community, including the patients, clinical investigators, and Exelixis team members who made the METEOR trial possible. Exelixis will share these new results with regulators as part of ongoing review processes in the United States and European Union. Our highest priority is to bring this new option for advanced RCC to patients as quickly as possible."
In late December 2015, Exelixis announced that it completed the submission of its rolling New Drug Application (NDA) for cabozantinib as a treatment for patients with advanced RCC who have received one prior therapy; the U.S. Food and Drug Administration (FDA) recently granted Priority Review to the application and set a Prescription Drug User Fee Act action date of June 22, 2016. The FDA previously granted Breakthrough Therapy and Fast Track designations to cabozantinib for its potential advanced RCC indication.
On January 28, 2016, the European Medicines Agency (EMA) validated Exelixis' Marketing Authorization Application (MAA) for cabozantinib as a treatment for patients with advanced renal cell carcinoma who have received one prior therapy. The MAA has been granted accelerated assessment, making it eligible for a 150-day review, versus the standard 210 days (excluding clock stops when information is requested by the EMA's Committee for Medicinal Products for Human Use).
Both regulatory applications are based on the results of METEOR. In July 2015, Exelixis announced top-line results from METEOR demonstrating that the trial had met its primary endpoint of improving progression-free survival; compared with everolimus, a standard of care therapy for second line RCC, cabozantinib was associated with a 42% reduction in the rate of disease progression or death. Median PFS for cabozantinib was 7.4 months as compared to 3.8 months with everolimus (HR=0.58, 95% CI 0.45-0.75, p < 0.001). Cabozantinib also significantly improved the objective response rate as compared to everolimus. These data were later presented at the European Cancer Congress in September 2015 and concurrently published in The New England Journal of Medicine.
Cabozantinib is currently marketed in capsule form under the brand name COMETRIQ® in the United States for the treatment of progressive, metastatic medullary thyroid cancer (MTC), and in the European Union for the treatment of adult patients with progressive, unresectable locally advanced or metastatic MTC. COMETRIQ is not indicated for patients with RCC. In the METEOR trial, and all other cancer trials currently underway, Exelixis is investigating a tablet formulation of cabozantinib distinct from the COMETRIQ capsule form. The tablet formulation of cabozantinib is the subject of the NDA and MAA for advanced RCC.
Read more: http://www.nasdaq.com/press-release/exelixis-announces-posit…
By Business Wire, February 01, 2016, 08:00:00 AM EDT
- Cabozantinib significantly improved overall survival as compared with everolimus -
- First therapy to demonstrate improvement in overall survival, progression-free survival, and objective response rate in a large, pivotal phase 3 study in previously treated renal cell carcinoma patients -
- Exelixis intends to share the data with U.S. and EU regulators, and to present the data at a medical meeting later in 2016 -
SOUTH SAN FRANCISCO, Calif.--(BUSINESS WIRE)-- Exelixis, Inc. (NASDAQ:EXEL) today announced positive overall survival (OS) results from METEOR, the phase 3 pivotal trial comparing cabozantinib to everolimus in 658 patients with advanced renal cell carcinoma (RCC) who have experienced disease progression following treatment with a VEGF receptor tyrosine kinase inhibitor (TKI). In a second interim analysis for OS, a secondary endpoint of the trial, the results showed a highly statistically significant and clinically meaningful increase in OS for patients randomized to cabozantinib as compared to everolimus. Ongoing study monitoring did not identify any new safety signals. Exelixis intends to present these data at a medical meeting later this year.
"With these results, cabozantinib is now the first and only therapy evaluated in a large, pivotal study in previously treated patients with advanced renal cell carcinoma to demonstrate a benefit in all three key efficacy parameters - overall survival, progression-free survival and objective response rate," said Michael M. Morrissey, Ph.D., president and chief executive officer of Exelixis. "This is an important moment for the kidney cancer community, including the patients, clinical investigators, and Exelixis team members who made the METEOR trial possible. Exelixis will share these new results with regulators as part of ongoing review processes in the United States and European Union. Our highest priority is to bring this new option for advanced RCC to patients as quickly as possible."
In late December 2015, Exelixis announced that it completed the submission of its rolling New Drug Application (NDA) for cabozantinib as a treatment for patients with advanced RCC who have received one prior therapy; the U.S. Food and Drug Administration (FDA) recently granted Priority Review to the application and set a Prescription Drug User Fee Act action date of June 22, 2016. The FDA previously granted Breakthrough Therapy and Fast Track designations to cabozantinib for its potential advanced RCC indication.
On January 28, 2016, the European Medicines Agency (EMA) validated Exelixis' Marketing Authorization Application (MAA) for cabozantinib as a treatment for patients with advanced renal cell carcinoma who have received one prior therapy. The MAA has been granted accelerated assessment, making it eligible for a 150-day review, versus the standard 210 days (excluding clock stops when information is requested by the EMA's Committee for Medicinal Products for Human Use).
Both regulatory applications are based on the results of METEOR. In July 2015, Exelixis announced top-line results from METEOR demonstrating that the trial had met its primary endpoint of improving progression-free survival; compared with everolimus, a standard of care therapy for second line RCC, cabozantinib was associated with a 42% reduction in the rate of disease progression or death. Median PFS for cabozantinib was 7.4 months as compared to 3.8 months with everolimus (HR=0.58, 95% CI 0.45-0.75, p < 0.001). Cabozantinib also significantly improved the objective response rate as compared to everolimus. These data were later presented at the European Cancer Congress in September 2015 and concurrently published in The New England Journal of Medicine.
Cabozantinib is currently marketed in capsule form under the brand name COMETRIQ® in the United States for the treatment of progressive, metastatic medullary thyroid cancer (MTC), and in the European Union for the treatment of adult patients with progressive, unresectable locally advanced or metastatic MTC. COMETRIQ is not indicated for patients with RCC. In the METEOR trial, and all other cancer trials currently underway, Exelixis is investigating a tablet formulation of cabozantinib distinct from the COMETRIQ capsule form. The tablet formulation of cabozantinib is the subject of the NDA and MAA for advanced RCC.
Read more: http://www.nasdaq.com/press-release/exelixis-announces-posit…
"Exelixis is looking at a de-risked revenue stream of $850M per year"
Buying more Exelixis following positive renal cancer data
Ohad Hammer über Exelixis:
http://www.orf-blog.com/buying-more-exelixis-following-posit…
Buying more Exelixis following positive renal cancer data
Ohad Hammer über Exelixis:
http://www.orf-blog.com/buying-more-exelixis-following-posit…
Ja, wenn der scheiß Biotech-Bearmarket nicht wäre...........
Aber irgendwann kommen auch wieder normale Zeiten und dann ist Exelixis eine Perle!
Aber irgendwann kommen auch wieder normale Zeiten und dann ist Exelixis eine Perle!
Heute nach Börsenschluss die Q4- und 2015er Zahlen:
SOUTH SAN FRANCISCO, Calif.--(BUSINESS WIRE)--Feb. 15, 2016-- Exelixis, Inc. (NASDAQ:EXEL) announced today that its fourth quarter and full year 2015 financial results will be released on Monday, February 29, 2016 after the markets close. At 5:00 p.m. EST / 2:00 p.m. PST, Exelixis management will host a conference call to discuss the results and provide a general business update. The conference call will be accessible via the Internet from the company’s website.
http://exelixis.com/investors-media/press-releases
SOUTH SAN FRANCISCO, Calif.--(BUSINESS WIRE)--Feb. 15, 2016-- Exelixis, Inc. (NASDAQ:EXEL) announced today that its fourth quarter and full year 2015 financial results will be released on Monday, February 29, 2016 after the markets close. At 5:00 p.m. EST / 2:00 p.m. PST, Exelixis management will host a conference call to discuss the results and provide a general business update. The conference call will be accessible via the Internet from the company’s website.
http://exelixis.com/investors-media/press-releases
Exelixis and Ipsen Enter into Exclusive Licensing Agreement to Commercialize and Develop Novel Cancer Therapy Cabozantinib in Regions Outside the United States, Canada and Japan
- Cabozantinib commercialized for medullary thyroid cancer (MTC) and filed for advanced renal cell carcinoma (RCC) -
- $200 million upfront payment and subsequent regulatory and commercial milestones -
http://exelixis.com/investors-media
- Cabozantinib commercialized for medullary thyroid cancer (MTC) and filed for advanced renal cell carcinoma (RCC) -
- $200 million upfront payment and subsequent regulatory and commercial milestones -
http://exelixis.com/investors-media
Cotellic Sales Q1 2016 lt. Roche:
US: 2 Millionen CHF
EU: 9 Millionen CHF
1 CHF = ca. 1.02 USD
US: 2 Millionen CHF
EU: 9 Millionen CHF
1 CHF = ca. 1.02 USD
ASCO 2016
Exelixis-Discovered Compounds to Be Featured in 18 Presentations at 2016 ASCO Annual MeetingSOUTH SAN FRANCISCO, Calif.--(BUSINESS WIRE)--Apr. 20, 2016-- Exelixis, Inc. (NASDAQ: EXEL) today announced that new data for cabozantinib, cobimetinib and XL888 will be presented at the upcoming 2016 Annual Meeting of the American Society of Clinical Oncology (ASCO) in Chicago, June 3 – 7, 2016.
An oral presentation will include pivotal overall survival data from the METEOR study, the randomized phase 3 trial of cabozantinib versus everolimus in patients with previously treated advanced renal cell carcinoma (RCC). These data were submitted to the U.S. Food and Drug Administration (FDA) in the New Drug Application (NDA) for cabozantinib for patients with advanced RCC who have received one prior therapy. On January 28, 2016 Exelixis announced that the FDA accepted the NDA for cabozantinib. The FDA granted Priority Review to the filing and assigned a Prescription Drug User Fee Act action date of June 22, 2016. Additional presentations at ASCO will highlight results from early and mid-stage trials of cabozantinib in other disease settings, including metastatic colorectal cancer, endometrial cancer and metastatic urothelial carcinomas.
“The overall survival data for cabozantinib from the METEOR trial represent an important milestone in the treatment of advanced renal cell carcinoma,” said Michael M. Morrissey, Ph.D., president and chief executive officer of Exelixis. “When taken alongside data from the trial’s other endpoints, this result makes cabozantinib the first therapy to demonstrate improvements in the three key measures of efficacy in a large randomized phase 3 trial of patients with this advanced form of cancer. Exelixis is committed to ongoing clinical research for patients who need new treatment options, and the slate of data for Exelixis-discovered compounds at this year’s ASCO Annual Meeting speaks to the urgency with which we and our collaborators are working to improve care and outcomes for patients with cancer.”
Cabozantinib will be the subject of nine presentations. The full schedule of cabozantinib presentations expected at the meeting is as follows (all times are in Central Daylight Time):
Oral Presentations:
[4506] “Overall survival (OS) in METEOR, a randomized phase 3 trial of cabozantinib (Cabo) versus everolimus (Eve) in patients (pts) with advanced renal cell carcinoma (RCC).”
Dr. Toni K. Choueiri, Dana Farber Cancer Institute, Boston, Massachusetts
Oral Abstract Session: Genitourinary (Nonprostate) Cancer: 8 – 11 a.m.
Sunday, June 5, 10:12 – 10:24 a.m.
Poster Presentations
[9068] “MDM2 amplification (Amp) to mediate cabozantinib resistance in patients (Pts) with advanced RET-rearranged lung cancers.”
Romel Somwar, Memorial Sloan Kettering Cancer Center, New York, New York
Poster Session: Lung Cancer—Non-Small Cell Metastatic
Poster presented Saturday, June 4, 8 – 11:30 a.m., Hall A (Poster #391)
Note: This is an Investigator-Sponsored Trial.
[3548] “Phase Ib study of cabozantinib plus panitumumab in KRAS wild-type (WT) metastatic colorectal cancer (mCRC).”
Dr. John Strickler, Duke University Medical Center, Durham, North Carolina
Poster Session: Gastrointestinal (Colorectal) Cancer
Poster presented Saturday, June 4, 8 – 11:30 a.m., Hall A (Poster #245)
Note: This is an Investigator-Sponsored Trial.
[2565] “Population pharmacokinetic (PopPK) and exposure-response (ER) modeling of cabozantinib (C) in patients (pts) with renal cell carcinoma (RCC) in the phase 3 METEOR study.”
Dr. Steve Lacy, Exelixis, Inc., South San Francisco, California
Poster Session: Developmental Therapeutics—Clinical Pharmacology and Experimental Therapeutics
Poster presented Sunday, June 5, 8 – 11:30 a.m., Hall A (Poster #265)
[1093] “Effect of cabozantinib treatment on circulating immune cell populations in patients with metastatic triple-negative breast cancer (TNBC).”
Dr. Dan G. Duda, Massachusetts General Hospital, Boston. Massachusetts
Poster Session: Breast Cancer—Triple-Negative/Cytotoxics/Local Therapy
Poster presented Sunday, June 5, 8 – 11:30 a.m., Hall A (Poster #198)
Note: This is an Investigator-Sponsored Trial.
[4534] “A phase II study of cabozantinib in patients (pts) with relapsed or refractory metastatic urothelial carcinoma (mUC).”
Dr. Andrea Borghese Apolo, Genitourinary Malignancies Branch, Center for Cancer Research, National Cancer Institute, National Institutes of Health, Washington, D.C.
Poster Discussion Session: Genitourinary (Nonprostate) Cancer
Poster presented Monday, June 6, 1 – 4:30 p.m., Hall A; discussed at 4:45 – 6 p.m. in Arie Crown Theater
Note: This is a National Cancer Institute Cancer Therapy Evaluation Program (NCI-CTEP) study.
[4558] “Efficacy of cabozantinib (C) vs everolimus (E) in patients (pts) with advanced renal cell carcinoma (RCC) and bone metastases (mets) from the phase III METEOR study.”
Dr. Bernard Escudier, Institut Gustave Roussy, Villejuif, France
Poster Session: Genitourinary (Nonprostate) Cancer
Poster presented, Monday, June 6, 1 – 4:30 p.m., Hall A (Poster #180)
[4557] “Outcomes based on prior VEGFR TKI and PD-1 checkpoint inhibitor therapy in METEOR, a randomized phase 3 trial of cabozantinib (C) vs everolimus (E) in advanced renal cell carcinoma (RCC).”
Dr. Thomas Powles, Barts Cancer Institute, Queen Mary University, London, England
Poster Session: Genitourinary (Nonprostate) Cancer
Poster Presented Monday, June 6, 1 – 4:30 p.m., Hall A (Poster #179)
[5586] “Phase II study of cabozantinib in recurrent/metastatic endometrial cancer (EC): a study of the Princess Margaret, Chicago and California Phase II Consortia.”
Dr. Neesha Dhani, Princess Margaret Cancer Centre, University Health Network, Chicago, Illinois
Poster Session: Gynecologic Cancer
Poster Presented Monday, June 6, 1 – 4:30 p.m., Hall A (Poster #409)
Note: This is an NCI-CTEP study.
Investor/Analyst Briefing to Review Cabozantinib Data
Exelixis will host a live investor/analyst briefing on Sunday, June 5, 2016, from 7:30-9:30 p.m. EDT / 6:30-8:30 p.m. CDT / 4:30-6:30 p.m. PDT. During the briefing, Exelixis management and invited guest speakers will review and provide context for cabozantinib data presented at the ASCO Annual Meeting. The briefing will be webcasted. To access the webcast, log onto www.exelixis.com and proceed to the Event Calendar page under Investors & Media. Please connect to the company’s website at least 15 minutes prior to the webcast to ensure adequate time for any software download that may be required to listen to the webcast. An archived replay of the webcast will be available on the Event Calendar page under Investors & Media at www.exelixis.com for one year. A telephone replay of the webcast will be available until 11:59 p.m. EDT on June 7, 2016; please visit the Event Calendar page for details on phone replay access when available.
XL888 Data to be Presented in a Poster
In addition, investigational compound XL888 will be the subject of the following poster presentation (in Central Daylight Time):
[9544] “Phase I study of vemurafenib and heat shock protein 90 (HSP90) inhibitor XL888 in metastatic BRAF V600 mutant melanoma.”
Dr. Zeynep Eroglu, H. Lee Moffitt Cancer Center & Research Institute, Tampa, Florida
Poster Session: Melanoma/Skin Cancers
Poster presented Saturday, June 4, 1 – 4:30 p.m., Hall A (Poster #149)
Note: This is an Investigator-Sponsored Trial.
Cobimetinib to be Featured in Eight Presentations
Also at the meeting, Exelixis’ collaborator Genentech, a member of the Roche Group, will present data on cobimetinib, an Exelixis-discovered compound, in disease settings including colorectal cancer, triple-negative breast cancer, and BRAF-mutant melanoma. The full schedule of cobimetinib presentations expected at the meeting is as follows (all times are in Central Daylight Time):
Oral Presentation:
[3502] “Clinical activity and safety of cobimetinib (cobi) and atezolizumab in colorectal cancer (CRC).”
Dr. Johanna Bendell, Sarah Cannon Research Institute, Nashville, Tennessee
Oral Abstract Session: Gastrointestinal (Colorectal) Cancer
Oral presentation on Sunday, June 5, 8 – 11 a.m., Hall B1 (abstract scheduled for 8:24 – 8:36 a.m.)
Poster Discussion:
[9510] Extended follow-up results of a phase 1B study (BRIM7) of cobimetinib and vemurafenib in BRAF-mutant melanoma
Dr. Adil Daud, University of California, San Francisco, San Francisco, California
Poster Session: Melanoma/Skin Cancers
Poster presentation from Saturday, June 4, 1 – 4:30 p.m. (Poster #115) in Hall A; discussion on Saturday, June 4, 4:45 – 6 p.m. in room E354b
Poster Presentations:
[9528] “Clinical predictors of response for coBRIM, a phase 3 study of cobimetinib (C) in combination with vemurafenib (V) in advanced BRAF-mutated melanoma (MM).”
Dr. James Larkin, The Royal Marsden Hospital, London, UK
Poster Session: Melanoma/Skin Cancers
Saturday, June 4, 1 – 4:30 p.m., Hall A (Poster #133)
[9530] “Efficacy of cobimetinib (C) and vemurafenib (V) in advanced BRAF-mutated melanoma patients (pts) with poor and favorable prognosis in the coBRIM phase 3 study.”
Dr. Grant A McArthur, Peter MacCallum Cancer Centre, East Melbourne, Australia and University of Melbourne, Parkville, Australia
Poster Session: Melanoma/Skin Cancers
Saturday, June 4, 1 – 4:30 p.m., Hall A (Poster #135)
[9533] “Adverse event (AE) incidence rates with cobimetinib (C) plus vemurafenib (V) treatment: extended follow-up (f/u) of the phase 3 coBRIM study.”
Dr. Brigitte Dréno, Nantes University, Nantes, France
Poster Session: Melanoma/Skin Cancers
Saturday, June 4, 1 – 4:30 p.m., Hall A (Poster #138)
[9536] “Identifying prognostic subgroups for outcomes in BRAFV600-mutated metastatic melanoma patients (pts) treated with vemurafenib (V) ± cobimetinib (C): A pooled analysis of BRIM-2, BRIM-3, BRIM-7 and coBRIM.”
Dr. James Larkin, The Royal Marsden Hospital, London, UK
Poster Session: Melanoma/Skin Cancers
Saturday, June 4, 1 – 4:30 p.m., Hall A (Poster #141)
[1074] “Cobimetinib (C) + paclitaxel (P) as first-line treatment in patients (pts) with advanced triple-negative breast cancer (TNBC): updated results and biomarker data from the phase 2 COLET study.”
Dr. Adam Brufsky, NRG Oncology/NSABP and Magee Women's Hospital, Pittsburgh, PA
Poster Session: Breast Cancer—Triple-Negative/Cytotoxics/Local Therapy
Sunday, June 5, 8 – 11:30 a.m., Hall A (Poster #179)
[TPS1100] “COLET (NCT02322814): A multistage, phase 2 study evaluating the safety and efficacy of cobimetinib (C) in combination with paclitaxel (P) as first- line treatment for patients (pts) with metastatic triple-negative breast cancer (TNBC).”
Dr. David Miles, Mount Vernon Cancer Centre, London, UK
Poster Session: Breast Cancer —Triple-Negative/Cytotoxics/Local Therapy
Sunday, June 5, 8 – 11:30 a.m., Hall A (Poster #203a)
Ziemlich verspätete Reaktion am Markt. Der scheint jetzt erst zu registrieren, wie gut die Overall Survival Daten wirklich sind. HR von 0,66 gegenüber Everolimus (Nivolumab hat nur 0,73). Zudem 4,9 Monate Überlebens-Vorteil. In absoluter Relation zwar schlechter, in prozentualer Relation aber auch besser als bei Nivolumab. Denn Nivolumab hat in seinem Trial gegen Everolimus gegen viel gesündere Patienten getestet (z.B. nur max. 2 TKI und keine brain metastasis). Zudem hat Cabo einen auffälligen Vorteil in PFS, den Nivolumab wegen seiner Wirkart als Immuntherapie nicht aufweisen kann. Ärzte achten angeblich am meisten auf PFS und OS. Von daher kann Cabometyx eigentlich nur einen erfolgreichen Start hinlegen.
Pricing ist bei 13.750 USD für eine Packung von 30 Tabletten a 20, 40 oder 60mg. 17000 Patienten ist die Targetpopulation in 2nd/3rd line RCC. Optimistische Rechnung: Bei Annahme für den Peak von 20% und 8 Monatiger durchschnittlicher Behandlungsdauer (wie in METEOR trial) wären dies 3400 Patienten a 8*13750 USD = 374 Mio USD Peaksales-Potential.
Pricing ist bei 13.750 USD für eine Packung von 30 Tabletten a 20, 40 oder 60mg. 17000 Patienten ist die Targetpopulation in 2nd/3rd line RCC. Optimistische Rechnung: Bei Annahme für den Peak von 20% und 8 Monatiger durchschnittlicher Behandlungsdauer (wie in METEOR trial) wären dies 3400 Patienten a 8*13750 USD = 374 Mio USD Peaksales-Potential.
Hi Ville,
sehe ich genauso, die Kursreaktion ist trotzdem sehr entäuschend, da wirken "Kräfte von außen" um Exelixis unten zu halten!
Ich halte aber weiter aufgrund Deiner obigen Ausführungen und irgendwann müssen die Shorts covern!
sehe ich genauso, die Kursreaktion ist trotzdem sehr entäuschend, da wirken "Kräfte von außen" um Exelixis unten zu halten!
Ich halte aber weiter aufgrund Deiner obigen Ausführungen und irgendwann müssen die Shorts covern!
Antwort auf Beitrag Nr.: 52.280.638 von Magnetfeldfredy am 26.04.16 17:13:42Die shorts werden nicht covern, da die meisten shorts die holder der warrants sind und sich absichern. Von daher liegt jeder, der hofft, dass ein squeeze möglich ist, falsch.
Na ja, ein buy-out hast Du nicht berücksichtigt!
Antwort auf Beitrag Nr.: 52.281.190 von Magnetfeldfredy am 26.04.16 18:21:03Wirds auch nicht geben, dazu hat die Unternehmung die Weichen klar anders gestellt....
Ich versuche hier mal halbwegs formatiert die RCC Studienergebnisse zwischen MTEOR (Cabozantinib vs Everolismus) u. Checkmate 025 (Nivolumab vs Everolismus) gegenüberzustellen.
Cabo hat sich gegenüber Nivo sehr gut geschlagen. Ich konnte mir nur die im Studienverlauf gesunkene ORR (all) bei METEOR nicht erklären. Natürlich gibt es auch viele SD (Stable Disease) Fälle (ca 62%), welche hier nicht berücksichtigt sind. Kann hier jemand aufklären?
Nivo beansprucht aufgrund des milden Nebenwirkungsprofils eine hohe QOL (quality of living). Bei Cabo konnte man mittels Dosisreduzierungen (Cabo in 60/40/20 mg erhältlich) die Nebenwirkungen in den Griff bekommen u. die Abbruchrate auf ähnlichem Niveau niedrig halten. Nivo wird als Infusion u. Cabo in Tablettenform verabreicht, was bei der Verabreichung wieder für Cabo spricht.
Bei Cabo gibt es Subgruppen, welche besonder gut ansprechen (nachträgliche Analyse). Bei Nivo ist es bislang nicht gelungen, solche Subgruppen zu lokalisieren.
Ich sehe Cabo u. Nivo als nahezu gleichwertig an, mit jeweiligen Stärken u. Schwächen, obwohl Nivo vorab als das zukünftig dominierende Mittel der Wahl in 2nd line RCC dargestellt wurde.
Study METEOR Check Mate 025
Item Cabo Ever Nivo Ever Unit
PFS (median) 7.4 3.8 4.6 4.4 month
PFS (HR) 0.58 - 0.88 - rate
OS (median) 21.4 16.5 25 19.6 month
OS (HR) 0.66 - 0.73 - rate
ORR (all) 17 (21) 3 (5) 25.1 5.4 %
ORR (complete responses) ? ? 0.9 0.5 %
Adverse Events (grade 3/4) 68 58 19 37 %
Dose reductions due to AE 60 (60) 24 (25) N/A ? %
Disconiuation due to AE 10 (9) 10 (10) 8 13 %
() = data from older study results (PFS evaluation)
Other numbers = latest available data from study results
Cabo hat sich gegenüber Nivo sehr gut geschlagen. Ich konnte mir nur die im Studienverlauf gesunkene ORR (all) bei METEOR nicht erklären. Natürlich gibt es auch viele SD (Stable Disease) Fälle (ca 62%), welche hier nicht berücksichtigt sind. Kann hier jemand aufklären?
Nivo beansprucht aufgrund des milden Nebenwirkungsprofils eine hohe QOL (quality of living). Bei Cabo konnte man mittels Dosisreduzierungen (Cabo in 60/40/20 mg erhältlich) die Nebenwirkungen in den Griff bekommen u. die Abbruchrate auf ähnlichem Niveau niedrig halten. Nivo wird als Infusion u. Cabo in Tablettenform verabreicht, was bei der Verabreichung wieder für Cabo spricht.
Bei Cabo gibt es Subgruppen, welche besonder gut ansprechen (nachträgliche Analyse). Bei Nivo ist es bislang nicht gelungen, solche Subgruppen zu lokalisieren.
Ich sehe Cabo u. Nivo als nahezu gleichwertig an, mit jeweiligen Stärken u. Schwächen, obwohl Nivo vorab als das zukünftig dominierende Mittel der Wahl in 2nd line RCC dargestellt wurde.
Antwort auf Beitrag Nr.: 52.283.959 von Nase_weis_nix am 27.04.16 05:53:24ORR wird vom unabhängigen Komitee überprüft. Deswegen gibt es Unterschiede zwischen dem ORR, da einige ORR der Nachprüfung nicht standhalten, wurde also nach Überprüfung runterkorrigiert. CR gab es bei Cabo und Ever übrigens keine, nur PR.
Noch einige Punkte:
* Immuntherapien wie Nivo wirken zumeist zeitversetzt, daher werden die bei PFS immer schlechte Ergebnisse aufzeigen. Eine Immuntherapie braucht Zeit, bis der Körper sich zur Wehr setzt
* diese verzögerte Wirkung sieht man auch daran, dass die Patienten in METEOR, die Cabo nach Nivo erhalten haben im OS ein HR von 0,22 (!!!) vorweisen können. Das bedeutet, selbst wenn sich Nivo in 2nd line durchsetzt und Cabo in 3rd line geht, dass Cabos Potential dadurch nicht wirklich beschnitten wird.
* auch Nivo hat sehr unangenehme Nebenwirkungen
* Nivo wirkte nur bei einer Gruppe von Patienten richtig richtig gut, von Cabo haben viel mehr Patienten profitiert
* die Ärzte kennen TKIs und wissen damit umzugehen, vielleicht ein Pluspunkt gegenüber Nivo
* Nivo hat einen Vorsprung im Markt von 6 Monaten, klares Plus für Nivo
* Nivo wird durch BMS vermarktet, da ist mehr Bums dahinter als bei der Promotion durch die kleine Exelixis, auch ein klares Plus für Nivo
Wir werden sehen, inwieweit die Cabo Daten zu einer guten Akzeptanz führen. Auf jeden Fall betont die Firma richigerweise, dass Cabo von den vielen in diesem Bereich bisher als absoluter Standard eingesetzten TKIs als einzige einen signifikanten und recht großen Überlebensvorteil aufzeigen konnte.
Noch einige Punkte:
* Immuntherapien wie Nivo wirken zumeist zeitversetzt, daher werden die bei PFS immer schlechte Ergebnisse aufzeigen. Eine Immuntherapie braucht Zeit, bis der Körper sich zur Wehr setzt
* diese verzögerte Wirkung sieht man auch daran, dass die Patienten in METEOR, die Cabo nach Nivo erhalten haben im OS ein HR von 0,22 (!!!) vorweisen können. Das bedeutet, selbst wenn sich Nivo in 2nd line durchsetzt und Cabo in 3rd line geht, dass Cabos Potential dadurch nicht wirklich beschnitten wird.
* auch Nivo hat sehr unangenehme Nebenwirkungen
* Nivo wirkte nur bei einer Gruppe von Patienten richtig richtig gut, von Cabo haben viel mehr Patienten profitiert
* die Ärzte kennen TKIs und wissen damit umzugehen, vielleicht ein Pluspunkt gegenüber Nivo
* Nivo hat einen Vorsprung im Markt von 6 Monaten, klares Plus für Nivo
* Nivo wird durch BMS vermarktet, da ist mehr Bums dahinter als bei der Promotion durch die kleine Exelixis, auch ein klares Plus für Nivo
Wir werden sehen, inwieweit die Cabo Daten zu einer guten Akzeptanz führen. Auf jeden Fall betont die Firma richigerweise, dass Cabo von den vielen in diesem Bereich bisher als absoluter Standard eingesetzten TKIs als einzige einen signifikanten und recht großen Überlebensvorteil aufzeigen konnte.
Ich gebe Cabo große Chancen sich im Markt durchzusetzen, die Immuntherapie muss wie bei Dendreon`s Provenge per Infusion verabreicht werden, Cabo in Tablettenform.
Viele Patienten wollen lieber Tabletten schlucken und die Ärzte verschreiben es auch lieber/öfters.
Time will tell......, ich bleibe dabei die Ergebnisse sind super und Exelixis hat noch viele heiße Eisen im Feuer, Leberkrebsergebnisse nächstes Jahr.......
Viele Patienten wollen lieber Tabletten schlucken und die Ärzte verschreiben es auch lieber/öfters.
Time will tell......, ich bleibe dabei die Ergebnisse sind super und Exelixis hat noch viele heiße Eisen im Feuer, Leberkrebsergebnisse nächstes Jahr.......
Antwort auf Beitrag Nr.: 52.284.067 von Magnetfeldfredy am 27.04.16 06:57:47DNDN und Provenge ist mit Nivo nicht vergleichbar.
Provenge hatte nicht einen, sondern zwei Nachteile:
1. nicht oral
2. nicht off-the-shelf
Der gestrige Tag hat gezeigt, dass man Spikes immer besser verkaufen sollte. Und dann später wieder eindecken.
Für EXEL wird es nicht einfach mit dem Kurs. Wir werden m.E. erst wieder 52Week Highs sehen, wenn absehbar ist, dass Cabo sich gut verkauft oder absehbar ist, dass eine weitere Indikation ein Durchmarsch werden könnte (z.B. hervorragende Daten von Phase 2 zu ASCO) oder Indikationsausweitungen denkbar sind (z.B. Cabo in RCC mit Nivo/Ipi oder Cabo gegen Sunitinib/CaboSun trial).
Es liegen einfach die Warrants mit der massiven Verwässerung auf dem Kurs. Es ist im Moment nicht davon auszugehen, dass EXEL im August einen Teil davon zurückzahlt um von der Verwässerungsgefahr wegzukommen oder die Zinslast bis zum Ende der Warrantlaufzeit herunterzukommen. Es schaut eher so aus, als werden sie weiter voll investieren und das Cash brauchen.
D.h. EXEL wird weiter ins Risiko gehen und es wird neue Indikationen und Indikationsausweitungen bedürfen, die viele Jahre entfernt sind um den Kurs über 10 USD zu hieven.
Eine Übernahme sehe ich wie gesagt nicht, da die Unternehmung die Weichen klar anders gestellt hat und eine Übernahme sich viel mehr gelohnt hätte, als EXEL noch keinen ROW-Partner hatte und noch kein eigenes Sales-Team aufgebaut hatte. Daher wird das nicht passieren.
Fazit: wer hier auf das schnelle Geld aus ist wird enttäuscht werden. Leider sind viele so positioniert, das wird möglicherweise noch Monate auf dem Kurs lasten.
Provenge hatte nicht einen, sondern zwei Nachteile:
1. nicht oral
2. nicht off-the-shelf
Der gestrige Tag hat gezeigt, dass man Spikes immer besser verkaufen sollte. Und dann später wieder eindecken.
Für EXEL wird es nicht einfach mit dem Kurs. Wir werden m.E. erst wieder 52Week Highs sehen, wenn absehbar ist, dass Cabo sich gut verkauft oder absehbar ist, dass eine weitere Indikation ein Durchmarsch werden könnte (z.B. hervorragende Daten von Phase 2 zu ASCO) oder Indikationsausweitungen denkbar sind (z.B. Cabo in RCC mit Nivo/Ipi oder Cabo gegen Sunitinib/CaboSun trial).
Es liegen einfach die Warrants mit der massiven Verwässerung auf dem Kurs. Es ist im Moment nicht davon auszugehen, dass EXEL im August einen Teil davon zurückzahlt um von der Verwässerungsgefahr wegzukommen oder die Zinslast bis zum Ende der Warrantlaufzeit herunterzukommen. Es schaut eher so aus, als werden sie weiter voll investieren und das Cash brauchen.
D.h. EXEL wird weiter ins Risiko gehen und es wird neue Indikationen und Indikationsausweitungen bedürfen, die viele Jahre entfernt sind um den Kurs über 10 USD zu hieven.
Eine Übernahme sehe ich wie gesagt nicht, da die Unternehmung die Weichen klar anders gestellt hat und eine Übernahme sich viel mehr gelohnt hätte, als EXEL noch keinen ROW-Partner hatte und noch kein eigenes Sales-Team aufgebaut hatte. Daher wird das nicht passieren.
Fazit: wer hier auf das schnelle Geld aus ist wird enttäuscht werden. Leider sind viele so positioniert, das wird möglicherweise noch Monate auf dem Kurs lasten.
Nächste Woche Donnerstag zu den Q1 Zahlen wird Exelixis u.a. zu folgenden Themen Stellung nehmen:
1. wann ungefähr die Ergebnisse von CaboSun (1st line RCC Phase II) zu erwarten sind
2. wann ungefähr mit ersten Daten zu CaboNivo/CaboNivoIpi (Phase 1) in RCC zu rechnen ist
3. ob Exelixis plant im August die Schulden vorzeitig zurückzuzahlen oder alles Cash für die Entwicklung braucht
4. wo Cabo Potential jenseits RCC und HCC hat
Wurde von der IR so bestätigt.
1. wann ungefähr die Ergebnisse von CaboSun (1st line RCC Phase II) zu erwarten sind
2. wann ungefähr mit ersten Daten zu CaboNivo/CaboNivoIpi (Phase 1) in RCC zu rechnen ist
3. ob Exelixis plant im August die Schulden vorzeitig zurückzuzahlen oder alles Cash für die Entwicklung braucht
4. wo Cabo Potential jenseits RCC und HCC hat
Wurde von der IR so bestätigt.
Cyberhexe a la franca_ole hat sich aus dem Staub gemacht (abgemeldet) und pflegt diesen Thread nicht mehr.
Daher beende ich das hier mal.
Bitte hier zu Exelixis weiterschreiben:
http://www.wallstreet-online.de/diskussion/1230913-1-10/exel…
Daher beende ich das hier mal.

Bitte hier zu Exelixis weiterschreiben:
http://www.wallstreet-online.de/diskussion/1230913-1-10/exel…
Well done!
franca_ole • Apr 28, 2016 1:35 AM as a matter of course Roches pricing of the melanoma combo resp. of its parts is very annoying for EXEL stockholders but I think Roche as a beefy partner will claim similar market share than NVS with its melanoma franchise; it will be around USD 500m/a (not in 2016 but in 2019 at the latest). But its much more interesting if the synergy between Cobii and Roches upcoming blockbuster Atezolizumab is given. ASCO will tell it firstly:
Oral Presentation:
[3502] “Clinical activity and safety of cobimetinib (cobi) and atezolizumab in colorectal cancer (CRC).”
Dr. Johanna Bendell, Sarah Cannon Research Institute, Nashville, Tennessee
Oral Abstract Session: Gastrointestinal (Colorectal) Cancer
Oral presentation on Sunday, June 5, 8 – 11 a.m., Hall B1 (abstract scheduled for 8:24 – 8:36
Herzlich willkommen zurück Hexe, bleib dabei, Ville weiß viel, Du weißt viel und wir "Normalos" sind froh über Euer Fachwissen!
Cabo/RCC in Europe: PRAC meeting
The Pharmacovigilance Risk Assessment Committee (PRAC) is the committee at the European Medicines Agency that is responsible for assessing and monitoring safety issues for human medicines. The PRAC's recommendations are considered by the Committee for Medicinal Products for Human Use (CHMP) when it adopts opinions for centrally authorised medicines:EMA/PRAC/325452/2016
Procedure Management and Committees Support Division
Pharmacovigilance Risk Assessment Committee (PRAC)
Draft agenda for the meeting on 10-13 May 2016
5.1.3. Cabozantinib - EMEA/H/C/004163
Scope (accelerated assessment): Treatment of advanced renal cell carcinoma (RCC)
Action: For adoption of PRAC RMP AR, PRAC RMP assessment overview and advice to CHMP
Falls keine "Outstanding Issues" anstehen, könnte der Arzneimittelausschuss der EMA --> CHMP eine Zulassungsempfehlung schon auf ihrem Mai-Treffen aussprechen - ich erwarte jedoch eine Entscheidung im Juni (20.-23.6.) - Veröffentlichung möglicherweise am 24.6.2016
Potenzial von COTELLIC (R) (generischer Name: Cobimetinib)
Folgende 4 Ansätze sind möglich:1.) Hemmung innerhalb des gleichen Signalweges
a.) with vemurafenib to treat mMelanoma
b.) with an ERK inhibitor to treat sold tumors
"A Study of the Safety, Tolerability, and Effects of Cobimetinib and GDC-0994 in Patients With Locally Advanced or Metastatic Solid Tumors" (phase 1b)
2.) Hemmung eines parallelen Signalweges --> Hemmung der Angiogenese
Vascular Endothelial Growth Factor (VEGF-Hemmer) or Epidermal growth factor receptor (EGFR-Hemmer) z.b. gemeinsam mit Bevacizumab (Handelsname Avastin)
3.) Verbesserung der Immunantwort - Hemmer des MEK-Signalweges können die antitumorale Reaktion der immunologiosch wirksamen Antikörper synergistisch beeinflussen; Roche/Genentech’s Atezolizumab wird derzeit in zig-Monostudien getestet, aber auch in Kombination mit Roche/Genentechs MEK-Hemmer Cobimetinib:
a.) "Study of Atezolizumab in Combination With Cobimetinib in Participants With Locally Advanced or Metastatic Solid Tumors" NCT01988896
b.) "A Phase 1b Study of Atezolizumab in Combination With Vemurafenib or Vemurafenib Plus Cobimetinib in Participants With BRAFV600-Mutation Positive Metastatic Melanoma" NCT01656642
ASCO will show first results. If the theory will be proofed, Cobi, as preferred MEK inhibitor of Roche/Genentech, will get much more attention.
Auf ASCO sind die ersten Ergebnisse dieser Kombination angekündigt. Sollte der "proof of concept" erbracht werden, dann dürften viele weitere Indikationen mit dieser Kombitherapie in der Klinik folgen.
4.) den plötzlichen Zelltod fördernd
a.) gemeinsam mit dem Taxan Paclitaxel zur Behandlung des "dreifach negativen Brustkrebs" (TNBC = Triple Negative Breast Cancer)
"A Study of Cobimetinib in Combination With Paclitaxel as First-line Treatment for Patients With Metastatic Triple-negative Breast Cancer" (phase 2)
b.) möglicherweise gemeinsam mit dem "B-cell lymphoma 2"-Hemmer, der ebenfalls den plötzlichen Zelltod fördert --> die FDA hat unlängst Genentech’s Venetoclax zur Behandlung von Patienten mit chronic lymphocytic leukemia (CLL) zugelassen. Venetoclax ist das erste FDA-zugelassene Medikament zur Behandlung des B-cell lymphoma 2 (BCL-2)-Protein, welches das Wachstum der Krebszellen fördert und bei vielen Patienten mit CLL "overexpressed" ist . Eine Kombination mit Cobi könnte Sinn machen --> obschon bisher keine klinischen Studien abrufbar sind.
Antwort auf Beitrag Nr.: 52.390.119 von cyberhexe123 am 12.05.16 09:59:07In deinem Beitrag zum "Potenzial von COTELLIC" sollte man hinsichtlich der Suggerierung, Cotellic sei für Roche DIE erleuchtete Ergänzung zu deren Produkten, hinzufügen, dass die genannten Produkte, u.a. Atezo, von Roche auch in Kombination mit einer Vielzahl anderer Entwicklungsprodukte getestet wird. Im Sinne eines "Was könnte funktionieren?".
Antwort auf Beitrag Nr.: 52.392.504 von Ville7 am 12.05.16 13:21:59ville schrieb:
"sollte man hinsichtlich der Suggerierung, Cotellic sei für Roche DIE erleuchtete Ergänzung zu deren Produkten"
in meinem Beitrag wird überhaupt nichts suggeriert, es werden lediglich die verschiedenen Möglichkeiten aufgezeigt, die eine Anwendung eines MEK-Hemmers zulassen, die da wären:
1.) Hemmung innerhalb des gleichen Signalwege (gemeinsam mit Vemurafenib zur Behandlung von mMelanoma --> bereits zugelassen)
2.) Hemmung eines parallelen Signalweges --> Hemmung der Angiogenese
3.) Verbesserung der Immunantwort - Hemmer des MEK-Signalweges können die antitumorale Reaktion der immunologiosch wirksamen Antikörper ("Checkpint-Hemmer") synergistisch beeinflussen
4.) den plötzlichen Zelltod fördernd
Cobi ist, wenn ich mich recht erinnere, der einzige MEK-Hemmer in der Klinik von Roche/Genentech. Ich habe jedoch nie von einer "erleuchteten Ergänzung" gesprochen, lediglich die verschiedenen Möglichkeiten aufgezeigt, die beispw. schon Anfangs Juni bei ASCO einer wissenschaftlichen Beurteilung ausgesetzt sein werden -->
Oral Presentation:
[3502] “Clinical activity and safety of cobimetinib (cobi) and atezolizumab in colorectal cancer (CRC).”
Dr. Johanna Bendell, Sarah Cannon Research Institute, Nashville, Tennessee
Oral Abstract Session: Gastrointestinal (Colorectal) Cancer
Oral presentation on Sunday, June 5, 8 – 11 a.m., Hall B1 (abstract scheduled for 8:24 – 8:36 a.m.)
Aber das ist halt dein Stil: Halbwahrheiten verbreiten (die besseren deiner Beiträge sind meistens aus YMB -meistens fehlerhaft- abgeschrieben; deine Reputation dort ist übrigens sehr bescheiden!), waghalsige Schlussfolgerungen präsentieren und zu guter letzt immer wiederkehrend Unterstellungen (siehe oben) vorzunehmen.
Da es nun 2 Foren zu Exelixis gibt, würde ich vorschlagen, dass wir uns zukünfitg aus dem Weg gehen. Auf diese Form der Auseinandersetzung habe ich nämlich keine Lust.
"sollte man hinsichtlich der Suggerierung, Cotellic sei für Roche DIE erleuchtete Ergänzung zu deren Produkten"
in meinem Beitrag wird überhaupt nichts suggeriert, es werden lediglich die verschiedenen Möglichkeiten aufgezeigt, die eine Anwendung eines MEK-Hemmers zulassen, die da wären:
1.) Hemmung innerhalb des gleichen Signalwege (gemeinsam mit Vemurafenib zur Behandlung von mMelanoma --> bereits zugelassen)
2.) Hemmung eines parallelen Signalweges --> Hemmung der Angiogenese
3.) Verbesserung der Immunantwort - Hemmer des MEK-Signalweges können die antitumorale Reaktion der immunologiosch wirksamen Antikörper ("Checkpint-Hemmer") synergistisch beeinflussen
4.) den plötzlichen Zelltod fördernd
Cobi ist, wenn ich mich recht erinnere, der einzige MEK-Hemmer in der Klinik von Roche/Genentech. Ich habe jedoch nie von einer "erleuchteten Ergänzung" gesprochen, lediglich die verschiedenen Möglichkeiten aufgezeigt, die beispw. schon Anfangs Juni bei ASCO einer wissenschaftlichen Beurteilung ausgesetzt sein werden -->
Oral Presentation:
[3502] “Clinical activity and safety of cobimetinib (cobi) and atezolizumab in colorectal cancer (CRC).”
Dr. Johanna Bendell, Sarah Cannon Research Institute, Nashville, Tennessee
Oral Abstract Session: Gastrointestinal (Colorectal) Cancer
Oral presentation on Sunday, June 5, 8 – 11 a.m., Hall B1 (abstract scheduled for 8:24 – 8:36 a.m.)
Aber das ist halt dein Stil: Halbwahrheiten verbreiten (die besseren deiner Beiträge sind meistens aus YMB -meistens fehlerhaft- abgeschrieben; deine Reputation dort ist übrigens sehr bescheiden!), waghalsige Schlussfolgerungen präsentieren und zu guter letzt immer wiederkehrend Unterstellungen (siehe oben) vorzunehmen.
Da es nun 2 Foren zu Exelixis gibt, würde ich vorschlagen, dass wir uns zukünfitg aus dem Weg gehen. Auf diese Form der Auseinandersetzung habe ich nämlich keine Lust.
Cobi in der Klinik
es gibt eine neue klinische Studie (Phase 2) mit Cobi - mit weiteren Studien ist zu rechnen: A Study to Detect V-Raf Murine Sarcoma Viral Oncogene Homolog B1 (BRAF) V600 Mutation on Cell-Free Deoxyribonucleic Acid (cfDNA) From Plasma in Participants With Advanced Melanoma
Sponsor:
Hoffmann-La Roche
Condition
Metastatic Melanoma, BRAF V600 Mutation Positive
Drug: Cobimetinib
Drug: Vemurafenib
Phase 2
ClinicalTrials.gov Identifier:
NCT02768207
First received: May 9, 2016
Last updated: May 9, 2016
Last verified: May 2016
Estimated Enrollment: 208
Study Start Date: April 2016
Estimated Study Completion Date: February 2019
Antwort auf Beitrag Nr.: 52.399.803 von cyberhexe123 am 13.05.16 10:08:09Der "shameless pumper" namens Cyberhexe ist zurück. 
Das Ego hat sie nach der recht feigen Flucht zurückgetrieben, weil sie es nicht sehen konnte, wie ihre überall im Internet krankhaft angestrebte Meinungsführerschaft flöten geht. Und dazu wird auch noch ein Thread von jemand eröffnet, der nicht wie sie den Himmel ausschließlich voller rosa Geigen hängen sieht und in entscheidenden Punkten eine andere Meinung hat.
Das muss schon geschmerzt haben...
Aber jetzt ist sie ja zurück und die Fangemeinde wird sie huldigen. Alle freuen sich.
Achja noch zwei Dinge:
1. deine Miskreditierung meiner Person juckt mich nicht die Bohne. Ich bin seit mehr als einem Jahrzehnt dafür bekannt auch stets das Unagenehme schonungslos auszusprechen. Reputation ist mir dabei schnurzegal, was zählt ist auf dem Konto/Depot. "Recht haben" oder exzessiv Buchgewinne "feiern" dürfen andere. Du gerne auch, falls du welche hast.
2. ich werde einen Teufel tun und meine Postings auf irgendwelche Threads oder die eigenen zu beschränken. Das hier ist ein offenes Forum. Wem's nicht passt, der soll eben einen Blog ohne Kommentarfunktion schreiben. Viel Spaß dabei!

Das Ego hat sie nach der recht feigen Flucht zurückgetrieben, weil sie es nicht sehen konnte, wie ihre überall im Internet krankhaft angestrebte Meinungsführerschaft flöten geht. Und dazu wird auch noch ein Thread von jemand eröffnet, der nicht wie sie den Himmel ausschließlich voller rosa Geigen hängen sieht und in entscheidenden Punkten eine andere Meinung hat.
Das muss schon geschmerzt haben...
Aber jetzt ist sie ja zurück und die Fangemeinde wird sie huldigen. Alle freuen sich.

Achja noch zwei Dinge:
1. deine Miskreditierung meiner Person juckt mich nicht die Bohne. Ich bin seit mehr als einem Jahrzehnt dafür bekannt auch stets das Unagenehme schonungslos auszusprechen. Reputation ist mir dabei schnurzegal, was zählt ist auf dem Konto/Depot. "Recht haben" oder exzessiv Buchgewinne "feiern" dürfen andere. Du gerne auch, falls du welche hast.
2. ich werde einen Teufel tun und meine Postings auf irgendwelche Threads oder die eigenen zu beschränken. Das hier ist ein offenes Forum. Wem's nicht passt, der soll eben einen Blog ohne Kommentarfunktion schreiben. Viel Spaß dabei!
Bei der bevorstehenden Zulassungsentscheidung bzw. eine erweiterte Zulassung der FDA von Lenvatinib zur Behandlung von mRCC (PDUFA 16.05.2016) ist zu beachten, dass sich eine Expertenrunde des National Comprehensive Cancer Network (NCCN) gegen die gemeinsame Applikation von lenvatinib und everolimus bei wiederkehrendem inoperabler Erkrankung in Stadium IV ausgesprochen hat.
NCCN Guidelines for Kidney Cancer V.2.2016 – Web Conference – 11/09/15 External request: Submission from Eisai Inc. for the inclusion of lenvatinib as a treatment option for subsequent therapy in combination with everolimus for relapse or for surgically unresectable Stage IV disease with predominant clear cell histology.
Based on discussion and the noted reference, the panel consensus was to not include lenvatinib in combination with everolimus as a treatment option for subsequent therapy for relapse or for surgically unresectable Stage IV disease with predominant clear cell histology due to limited data.
yes 1 no 12 abstain 0
Motzer RJ, Hutson TE, Glen H, et al. Randomized phase 2 three-arm trial of lenvatinib, everolimus, and the combination in patients with metastatic renal cell carcinoma. Lancet Oncology 2015;16:1473-1482.
Bliebe die Zulassung zur Behandlung in einem früheren Stadium oder aber als Monotherapie, wobei diese Ergebnisse nicht besser sind als die bei Cabozantinib.
Die Behauptung, dass Phase 2 eine Nichtzulassung begründen würde, ist wieder mal weit daneben, da es sich um eine erweiterte Zulassung handelt und die Mächtigkeit der Studie bei dem Resultat mit statistischer Signifikanz durchaus akzeptabel ist - als neues Molekül wäre das zu wenig, als erweiterter Zulassungsantrag (supplemental New Drug Application) mit ähnlichem Nebenwirkungsprofil jedoch nicht.
NCCN Guidelines for Kidney Cancer V.2.2016 – Web Conference – 11/09/15 External request: Submission from Eisai Inc. for the inclusion of lenvatinib as a treatment option for subsequent therapy in combination with everolimus for relapse or for surgically unresectable Stage IV disease with predominant clear cell histology.
Based on discussion and the noted reference, the panel consensus was to not include lenvatinib in combination with everolimus as a treatment option for subsequent therapy for relapse or for surgically unresectable Stage IV disease with predominant clear cell histology due to limited data.
yes 1 no 12 abstain 0
Motzer RJ, Hutson TE, Glen H, et al. Randomized phase 2 three-arm trial of lenvatinib, everolimus, and the combination in patients with metastatic renal cell carcinoma. Lancet Oncology 2015;16:1473-1482.
Bliebe die Zulassung zur Behandlung in einem früheren Stadium oder aber als Monotherapie, wobei diese Ergebnisse nicht besser sind als die bei Cabozantinib.
Die Behauptung, dass Phase 2 eine Nichtzulassung begründen würde, ist wieder mal weit daneben, da es sich um eine erweiterte Zulassung handelt und die Mächtigkeit der Studie bei dem Resultat mit statistischer Signifikanz durchaus akzeptabel ist - als neues Molekül wäre das zu wenig, als erweiterter Zulassungsantrag (supplemental New Drug Application) mit ähnlichem Nebenwirkungsprofil jedoch nicht.
Zulassung
FDA Approves Eisai's LENVIMA® (lenvatinib) for the Treatment of Patients with Advanced Renal Cell Carcinoma in Combination with Everolimus Following Prior Anti-Angiogenic Therapy- Near-tripling in progression-free survival demonstrated by LENVIMA and everolimus when compared with a standard of care advances treatment paradigm in this category
- Activity of first and only FDA-approved TKI-mTOR inhibitor regimen appears to be synergistic, suggesting complementary mechanisms of action
- Approval follows Breakthrough Therapy designation and Priority Review by the FDA and marks second time LENVIMA has been shown to improve progression-free survival in patients with difficult-to-treat cancer
Antwort auf Beitrag Nr.: 52.406.472 von cyberhexe123 am 14.05.16 00:06:39
Übersetzt heisst das ungefähr so viel, dass das Risiko der Patienten, im betrachteten Zeitraum zu sterben, bei Cabo um 34% geringer als in der Vergleichsgruppe mit everolimus, bzw. 33% geringer ist bei lenvatinib in Kombination mit everolimus als in der Vergleichsgruppe mit everolimus (Mono).
Hazard Ratio
Von Bedeutung ist die Hazard ratio, die bei Cabo (0.66) gegenüber everolimus minimal besser ist als bei der nun zugelassenen Kombitherapie (0.67) gegen everolimus.Übersetzt heisst das ungefähr so viel, dass das Risiko der Patienten, im betrachteten Zeitraum zu sterben, bei Cabo um 34% geringer als in der Vergleichsgruppe mit everolimus, bzw. 33% geringer ist bei lenvatinib in Kombination mit everolimus als in der Vergleichsgruppe mit everolimus (Mono).
Erstaunlich ist, dass sich die Konfidenzintervalle bei der Überlebenszeitanalyse doch relativ deutlich überschneiden und auch keine Irrtumswahrscheinlichkeit angegeben ist:
The patients who received LEN+EVE experienced a 10.1-month increase in median OS compared with those who received everolimus monotherapy (25.5 months [95% CI: 16.4–32.1] versus 15.4 months [95% CI: 11.8–20.6]; HR 0.67; 95% CI: 0.42–1.08). This OS analysis was conducted when 63% of deaths had occurred in the combination arm and 74% of deaths had occurred in the everolimus arm.
The patients who received LEN+EVE experienced a 10.1-month increase in median OS compared with those who received everolimus monotherapy (25.5 months [95% CI: 16.4–32.1] versus 15.4 months [95% CI: 11.8–20.6]; HR 0.67; 95% CI: 0.42–1.08). This OS analysis was conducted when 63% of deaths had occurred in the combination arm and 74% of deaths had occurred in the everolimus arm.
Antwort auf Beitrag Nr.: 52.406.247 von cyberhexe123 am 13.05.16 22:55:12
Macht es Spaß meine Aussagen zu verdrehen? Du tust wirklich alles um dich als den wahren Profi zu inzenieren. Du brauchst das, oder?
Psst: Bist du ja auch! Keiner kann dir das Wasser reichen! Alle doof, du superklug!
Psst2: Für mich bist du hinter deiner Fassade nur ein großes Ego ohne Fähigkeit auf die Downsides zu schauen und ein mieser kleiner Pumper, der anderen nur die Upsides suggeriert.
Unterlasse diese falschen Behauptungen! Ich habe nicht gesagt, dass eine Phase 2 generell die Zulassung nicht rechtfertigt. Nur diese Phase 2 war trotz erreichter Signifikanz mit einem sehr kleinen Kollektiv und sie war open label. Open label entspricht nicht dem Standard. Man sieht es immer wieder, wie Drugs in Phase 3 trotz hervoragenden Ergebnissen in Phase II open label Studien scheitern - egal ob mit oder ohne Kontrollarm (der hier ja gegeben war). Zudem gab es einige Nebenwirkungsevents, die die FDA eigentlich berücksichtigt hätte haben sollen (prozentual mehr drug related Todesfälle).
Ich lehne mich daher mal aus dem Fenster und prognostiziere, dass die EMA diese Kombination nicht ohne eine größere Phase III Studie, die Wirksamkeit und Sicherheit bestätigt zulassen wird.
PS: Du Profi wirst natürlich alles besser wissen und meine Aussagen sind bestenfalls anfängerhaft. Aber das wissen ja inzwischen alle lesenden Forenteilnehmer zu Genüge.
Zitat von cyberhexe123: Die Behauptung, dass Phase 2 eine Nichtzulassung begründen würde, ist wieder mal weit daneben, da es sich um eine erweiterte Zulassung handelt und die Mächtigkeit der Studie bei dem Resultat mit statistischer Signifikanz durchaus akzeptabel ist - als neues Molekül wäre das zu wenig, als erweiterter Zulassungsantrag (supplemental New Drug Application) mit ähnlichem Nebenwirkungsprofil jedoch nicht.
Macht es Spaß meine Aussagen zu verdrehen? Du tust wirklich alles um dich als den wahren Profi zu inzenieren. Du brauchst das, oder?
Psst: Bist du ja auch! Keiner kann dir das Wasser reichen! Alle doof, du superklug!
Psst2: Für mich bist du hinter deiner Fassade nur ein großes Ego ohne Fähigkeit auf die Downsides zu schauen und ein mieser kleiner Pumper, der anderen nur die Upsides suggeriert.
Unterlasse diese falschen Behauptungen! Ich habe nicht gesagt, dass eine Phase 2 generell die Zulassung nicht rechtfertigt. Nur diese Phase 2 war trotz erreichter Signifikanz mit einem sehr kleinen Kollektiv und sie war open label. Open label entspricht nicht dem Standard. Man sieht es immer wieder, wie Drugs in Phase 3 trotz hervoragenden Ergebnissen in Phase II open label Studien scheitern - egal ob mit oder ohne Kontrollarm (der hier ja gegeben war). Zudem gab es einige Nebenwirkungsevents, die die FDA eigentlich berücksichtigt hätte haben sollen (prozentual mehr drug related Todesfälle).
Ich lehne mich daher mal aus dem Fenster und prognostiziere, dass die EMA diese Kombination nicht ohne eine größere Phase III Studie, die Wirksamkeit und Sicherheit bestätigt zulassen wird.
PS: Du Profi wirst natürlich alles besser wissen und meine Aussagen sind bestenfalls anfängerhaft. Aber das wissen ja inzwischen alle lesenden Forenteilnehmer zu Genüge.
Antwort auf Beitrag Nr.: 52.406.547 von cyberhexe123 am 14.05.16 00:49:32
So viel zur tollen Phase 2. Open label, wenig Patienten. Große Chance, dass Zufallsfaktoren wirken, auch bei den Sicherheitsdaten. Für mich unverständlich, dass die FDA das zulässt. Und dann nicht mal als "conditional approval", d.h. dass eine confirmatory Phase 3 benötigt wird.
Zitat von cyberhexe123: Erstaunlich ist, dass sich die Konfidenzintervalle bei der Überlebenszeitanalyse doch relativ deutlich überschneiden und auch keine Irrtumswahrscheinlichkeit angegeben ist:
The patients who received LEN+EVE experienced a 10.1-month increase in median OS compared with those who received everolimus monotherapy (25.5 months [95% CI: 16.4–32.1] versus 15.4 months [95% CI: 11.8–20.6]; HR 0.67; 95% CI: 0.42–1.08). This OS analysis was conducted when 63% of deaths had occurred in the combination arm and 74% of deaths had occurred in the everolimus arm.
So viel zur tollen Phase 2. Open label, wenig Patienten. Große Chance, dass Zufallsfaktoren wirken, auch bei den Sicherheitsdaten. Für mich unverständlich, dass die FDA das zulässt. Und dann nicht mal als "conditional approval", d.h. dass eine confirmatory Phase 3 benötigt wird.
Antwort auf Beitrag Nr.: 52.406.547 von cyberhexe123 am 14.05.16 00:49:32Der Median der Überlebenszeitanalyse scheint auf den ersten Blick eindeutig für Eisais Kombitherapie zu sprechen, betrachtet man jedoch die Hazard Ratio sowie die 95%-Konfidenzintervalle, ändern sich die Vorzeichen. Die obere Grenze des CI von L+E ist nämlich grösser 1 und somit gleichbedeutend mit einem ungünstigeren Behandlungsverlauf gegenüber der Vergleichsmethode. Bei Cabo ist die obere 95%-Konfidenz-Intervallgrenze deutlich unter 1 (--> 0.83). Ich will vorsichtig sein, dies aus der Ferne zu interpretieren, jedoch könnte dies in häufiger und fataler auftretenden Nebenwirkungen begründet sein.
Lenvatinib+Everolimus
The patients who received LEN+EVE experienced a 10.1-month increase in median OS compared with those who received everolimus monotherapy (25.5 months [95% CI: 16.4–32.1] versus 15.4 months [95% CI: 11.8–20.6]; HR 0.67; 95% CI: 0.42–1.08). This OS analysis was conducted when 63% of deaths had occurred in the combination arm and 74% of deaths had occurred in the everolimus arm.
Cabozantinib
As announced in February 2016, CABOMETYX also demonstrated a statistically significant and clinically meaningful increase in overall survival in the METEOR trial. Compared with everolimus, CABOMETYX was associated with a 34 percent reduction in the rate of death. Median overall survival was 21.4 months for patients receiving CABOMETYX versus 16.5 months for those receiving everolimus (HR=0.66, 95% CI 0.53-0.83, P=0.0003).
Lenvatinib+Everolimus
The patients who received LEN+EVE experienced a 10.1-month increase in median OS compared with those who received everolimus monotherapy (25.5 months [95% CI: 16.4–32.1] versus 15.4 months [95% CI: 11.8–20.6]; HR 0.67; 95% CI: 0.42–1.08). This OS analysis was conducted when 63% of deaths had occurred in the combination arm and 74% of deaths had occurred in the everolimus arm.
Cabozantinib
As announced in February 2016, CABOMETYX also demonstrated a statistically significant and clinically meaningful increase in overall survival in the METEOR trial. Compared with everolimus, CABOMETYX was associated with a 34 percent reduction in the rate of death. Median overall survival was 21.4 months for patients receiving CABOMETYX versus 16.5 months for those receiving everolimus (HR=0.66, 95% CI 0.53-0.83, P=0.0003).
Antwort auf Beitrag Nr.: 52.407.573 von cyberhexe123 am 14.05.16 10:46:10
Ich will vorsichtig sein, dies aus der Ferne zu interpretieren, jedoch könnte dies in häufiger und fataler auftretenden Nebenwirkungen begründet sein.
...gemeint ist natürlich fatalere Nebenwirkungen bei L+E.
Komisch ist, dass keine Irrtumswahrscheinlichhkeit in der Überlebenszeitanalyse von L+E angegeben ist!
Bei diesen Konfidenzintervallen würde ich meinen, dass statistsische Signifikanz wohl nur sehr knapp realisiert wurde.
Ich will vorsichtig sein, dies aus der Ferne zu interpretieren, jedoch könnte dies in häufiger und fataler auftretenden Nebenwirkungen begründet sein.
...gemeint ist natürlich fatalere Nebenwirkungen bei L+E.
Komisch ist, dass keine Irrtumswahrscheinlichhkeit in der Überlebenszeitanalyse von L+E angegeben ist!
Bei diesen Konfidenzintervallen würde ich meinen, dass statistsische Signifikanz wohl nur sehr knapp realisiert wurde.
Antwort auf Beitrag Nr.: 52.407.615 von cyberhexe123 am 14.05.16 10:56:39was mich wundert, dass die FDA entgegen den Experten der NCCN Lenvatinib mit Everolimus auch für wiederkehrenden inoperable Nierenkrebs in Stadium 4 zugelassen hat:
Based on discussion and the noted reference, the panel consensus was to not include lenvatinib in combination with everolimus as a treatment option for subsequent therapy for relapse or for surgically unresectable Stage IV disease with predominant clear cell histology due to limited data.
Ich dachte, dass es zumindest hierbei zu einer Labelbeschränkung kommen würde.
Die Mächtigkeit der Studie war jedoch nie ein Problem, da es sich beim Zulassungsantrag um eine erweiterte Indikation handelt. Wäre dieser Wirkstoff nicht bereits in einer anderen Indikation zugelassen, dann hätte die FDA sicherlich nicht so entschieden.
Die EMA ist im Vergleich zur FDA tatsächlich konservativer und weniger offen für Zulassungsanträge basierend auf relativ kleinen Studien. Um jedoch die Chancen einer Zulassung in Europa genauer abzuschätzen, müsste man die Irrtumswahrscheinlichkeit (p-Wert) dieser Studie wissen.
Based on discussion and the noted reference, the panel consensus was to not include lenvatinib in combination with everolimus as a treatment option for subsequent therapy for relapse or for surgically unresectable Stage IV disease with predominant clear cell histology due to limited data.
Ich dachte, dass es zumindest hierbei zu einer Labelbeschränkung kommen würde.
Die Mächtigkeit der Studie war jedoch nie ein Problem, da es sich beim Zulassungsantrag um eine erweiterte Indikation handelt. Wäre dieser Wirkstoff nicht bereits in einer anderen Indikation zugelassen, dann hätte die FDA sicherlich nicht so entschieden.
Die EMA ist im Vergleich zur FDA tatsächlich konservativer und weniger offen für Zulassungsanträge basierend auf relativ kleinen Studien. Um jedoch die Chancen einer Zulassung in Europa genauer abzuschätzen, müsste man die Irrtumswahrscheinlichkeit (p-Wert) dieser Studie wissen.
Antwort auf Beitrag Nr.: 52.407.666 von cyberhexe123 am 14.05.16 11:09:18Hallo! Bin auch in Exelixis investiert und verfolge schon einige Zeit die Foren (hauptsächlich in USA). Bin immer dankbar für Infos - von daher danke an "Euch" zwei! Ist zwar schade dass Ihr Euch nicht riechen könnt aber ist nun mal so. Und: mit Sicherheit seid Ihr mir mit Eurem Wissen meilenweit voraus!
Nun kurz zu meinem eigentlichen Beitrag:
Die gestrige Zulassung von der Kombi sehe ich mit einem lachenden und einem weinenden Auge. Einerseits bedeutet es mehr Konkurrenz für uns, andererseits ist die Kuh nun vom Tisch und wir wissen was Sache ist. Ich persönlich glaube nicht, dass uns die Kombi viel vom Kuchen wegnehmen wird (Kosten, keine deutliche Verbesserung der Monobehandlung durch Cabo, Nebenwirkungen, "nur" ein Phase 2 Trail mit etwa 150 Teilnehmern).
Mein Blick richtet sich auf die kommenden ASCO-Abstrakte. Ich könnte mir durchaus Vorstellen, dass es hier einige positive Überraschungen geben wird. Ich schau gezielt auf die Ergebnisse des Meteor-Trail - und hier auf die Gruppe, die zuvor eine Immun-Therapie bekommen haben. Ich schätze jetzt einfach mal, dass die progressiv-freie Überlebenszeit hier bei >16 Monaten liegt. Und wenn ich einfach mal weiter spinne könnte das bedeuten, dass es bald einen neuen Standard gibt: eine Immun-Behandlung gefolgt von Cabo. Natürlich freue ich mich auch auf die Berichte von Cobi - auch hier denke ich wird es positive Überraschungen geben.
Ich bin jedenfalls sehr optimistisch und hoffe, dass uns die gestrige Zulassung am Montag kursmäßig nicht zu sehr nach hinten werfen wird.
Hoffe nicht zu viel falsch geschrieben zu haben und freue mich auf weitere Beiträge von Euch :-)
Nun kurz zu meinem eigentlichen Beitrag:
Die gestrige Zulassung von der Kombi sehe ich mit einem lachenden und einem weinenden Auge. Einerseits bedeutet es mehr Konkurrenz für uns, andererseits ist die Kuh nun vom Tisch und wir wissen was Sache ist. Ich persönlich glaube nicht, dass uns die Kombi viel vom Kuchen wegnehmen wird (Kosten, keine deutliche Verbesserung der Monobehandlung durch Cabo, Nebenwirkungen, "nur" ein Phase 2 Trail mit etwa 150 Teilnehmern).
Mein Blick richtet sich auf die kommenden ASCO-Abstrakte. Ich könnte mir durchaus Vorstellen, dass es hier einige positive Überraschungen geben wird. Ich schau gezielt auf die Ergebnisse des Meteor-Trail - und hier auf die Gruppe, die zuvor eine Immun-Therapie bekommen haben. Ich schätze jetzt einfach mal, dass die progressiv-freie Überlebenszeit hier bei >16 Monaten liegt. Und wenn ich einfach mal weiter spinne könnte das bedeuten, dass es bald einen neuen Standard gibt: eine Immun-Behandlung gefolgt von Cabo. Natürlich freue ich mich auch auf die Berichte von Cobi - auch hier denke ich wird es positive Überraschungen geben.
Ich bin jedenfalls sehr optimistisch und hoffe, dass uns die gestrige Zulassung am Montag kursmäßig nicht zu sehr nach hinten werfen wird.
Hoffe nicht zu viel falsch geschrieben zu haben und freue mich auf weitere Beiträge von Euch :-)
Antwort auf Beitrag Nr.: 52.407.948 von exel2016 am 14.05.16 12:17:35exel schrieb:
"Die gestrige Zulassung von der Kombi sehe ich mit einem lachenden und einem weinenden Auge. Einerseits bedeutet es mehr Konkurrenz für uns, andererseits ist die Kuh nun vom Tisch und wir wissen was Sache ist. Ich persönlich glaube nicht, dass uns die Kombi viel vom Kuchen wegnehmen wird (Kosten, keine deutliche Verbesserung der Monobehandlung durch Cabo, Nebenwirkungen, "nur" ein Phase 2 Trail mit etwa 150 Teilnehmern)."
Bin fast vollständig deiner Meinung, lediglich die Mächtigkeit der Studie wird kaum Einfluss haben auf die Vermarktung. Da werden wohl lediglich die Ergebnisse (Wirkung und Nebenwirkung) und die Kosten verglichen. Ebenfalls von grösster Bedeutung ist die Vermarktungsstrategie einschliesslich Vertriebs-know how. Eisai als Vermarkter der neu zugelassenen Kombi hat durchaus Expertise in der klinischen Onkologie, haben sie doch neben LENVIMA mit HALAVEN ein nicht Taxan-basiertes Zytostatikum, das in Monotherapie für die Behandlung von Patienten mit lokal fortgeschrittenem oder metastasiertem Brustkrebs eingesetzt wird und zwar weltweit. Die Vertriebskanäle sind also vorhanden, das know how ebenfalls.
"Mein Blick richtet sich auf die kommenden ASCO-Abstrakte"
meiner auch!
"Natürlich freue ich mich auch auf die Berichte von Cobi - auch hier denke ich wird es positive Überraschungen geben."
...die sind für mich fast noch interessanter als die von Cabo und zwar vor allem die "Oral Abstract Session" am 5.6.2016 " Clinical Activity and Safety of Cobi + Atezolizumab in colorectal cancer (CRC)
Johanna C. Bendell, MD --> Presenter
Sarah Cannon Research Inst.
Sollte sich die synergistische Wirkung von Cobi zu Atezolizumab (TECENTRIQ) bewahrheiten (man beachte den Konjunktiv bzw. im Englischen IF and WHEN!!), dann dürften viele weitere Studien dieser Kombitherapie (MEK-Hemmer + Checkpoint-Hemmer) in Kürze folgen. Genentech wird dann mit zunehmender Wahrscheinlichkeit seinen unmittelbaren Nachbarn (ok...eine Strasse weiter) in South San Francisco (SSF) übernehmen, da Cobi Genentechs einziger MEK-Hemmer in der Klinik ist.
"Die gestrige Zulassung von der Kombi sehe ich mit einem lachenden und einem weinenden Auge. Einerseits bedeutet es mehr Konkurrenz für uns, andererseits ist die Kuh nun vom Tisch und wir wissen was Sache ist. Ich persönlich glaube nicht, dass uns die Kombi viel vom Kuchen wegnehmen wird (Kosten, keine deutliche Verbesserung der Monobehandlung durch Cabo, Nebenwirkungen, "nur" ein Phase 2 Trail mit etwa 150 Teilnehmern)."
Bin fast vollständig deiner Meinung, lediglich die Mächtigkeit der Studie wird kaum Einfluss haben auf die Vermarktung. Da werden wohl lediglich die Ergebnisse (Wirkung und Nebenwirkung) und die Kosten verglichen. Ebenfalls von grösster Bedeutung ist die Vermarktungsstrategie einschliesslich Vertriebs-know how. Eisai als Vermarkter der neu zugelassenen Kombi hat durchaus Expertise in der klinischen Onkologie, haben sie doch neben LENVIMA mit HALAVEN ein nicht Taxan-basiertes Zytostatikum, das in Monotherapie für die Behandlung von Patienten mit lokal fortgeschrittenem oder metastasiertem Brustkrebs eingesetzt wird und zwar weltweit. Die Vertriebskanäle sind also vorhanden, das know how ebenfalls.
"Mein Blick richtet sich auf die kommenden ASCO-Abstrakte"
meiner auch!
"Natürlich freue ich mich auch auf die Berichte von Cobi - auch hier denke ich wird es positive Überraschungen geben."
...die sind für mich fast noch interessanter als die von Cabo und zwar vor allem die "Oral Abstract Session" am 5.6.2016 " Clinical Activity and Safety of Cobi + Atezolizumab in colorectal cancer (CRC)
Johanna C. Bendell, MD --> Presenter
Sarah Cannon Research Inst.
Sollte sich die synergistische Wirkung von Cobi zu Atezolizumab (TECENTRIQ) bewahrheiten (man beachte den Konjunktiv bzw. im Englischen IF and WHEN!!), dann dürften viele weitere Studien dieser Kombitherapie (MEK-Hemmer + Checkpoint-Hemmer) in Kürze folgen. Genentech wird dann mit zunehmender Wahrscheinlichkeit seinen unmittelbaren Nachbarn (ok...eine Strasse weiter) in South San Francisco (SSF) übernehmen, da Cobi Genentechs einziger MEK-Hemmer in der Klinik ist.
Ipsen Deutschland
...hat derzeit über 20 offene Stellen ausgeschrieben, und zwar Pharmareferenten mit folgendem Tätigkeitfeld und Profil:Im Rahmen des Aufbaus unseres neuen onkologischen Geschäftsbereichs suchen wir gemeinsam mit Ashfield Healthcare einen
Key Account Manager (m/w) im Bereich Onkologie
für das Gebiet Karlsruhe, Kaiserslautern, Mannheim, Freiburg, Lörrach
Ihre Aufgaben
Mit Cabozantinib hat IPSEN einen innovativen Wirkstoff im Bereich Onkologie/solide Tumore erworben und bereitet nun die Markteinführung in der Indikation „Nierenzellkarzinom" vor. Als Key Account Manager unterstützen Sie den Produktlaunch von Anfang an. Sie bauen gemeinsam mit unserem Medical Team und in Zusammenarbeit mit Market Access und Marketing ein tragfähiges, langfristiges KOL-Netzwerk auf und besprechen Cabozantinib mit Onkologen in Praxis und Klinik.
Im Rahmen dieser Tätigkeiten werden Sie:
Fachärzte und Kliniken im Bereich Onkologie (insbesondere Hämato-/Onkologie und Uro-/Onkologie) beraten und betreuen
Bestehende Netzwerke zu Meinungsbildnern und Fachkreisen pflegen und erweitern
Budgetverantwortung übernehmen, um Projekte und Veranstaltungen organisieren und durchführen zu können
Eigenverantwortlich Aktionspläne erstellen und umsetzen
Zielgruppenanalysen durchführen und Strategien zur Kundengewinnung und Marktdurchdringung entwickeln
Ihr Profil
Pharmareferenten und Naturwissenschaftler mit einschlägiger Erfahrung im Indikationsgebiet Onkologie, idealweise mit bestehenden Kontakten zu Onkologen im niedergelassenen Bereich sowie der Klinik
Gerne auch Hochschulabsolventen mit Kenntnissen im Bereich der soliden Tumore, vorzugsweise in der Indikation Nierenzellkarzinom
Fähigkeiten im Beziehungsmanagement sowie ein großes Kundenverständnis, um Produkte entsprechend der Bedürfnisse Ihrer Ansprechpartner zu präsentieren
Überzeugendes Auftreten und die Fähigkeit, Netzwerke geschickt aufzubauen und zu pflegen, sowie Kenntnisse im gesundheitspolitischem Umfeld
Ausgeprägtes Verhandlungsgeschick und gute kommunikative Fähigkeiten
Hohe Eigenmotivation und Lernbereitschaft
Gute Kenntnisse im Umgang mit MS Office sowie gute Englischkenntnisse in Word und Schrift
http://ipsen-pharma.de/startseite/karriere/stellenangebote/s…
Antwort auf Beitrag Nr.: 52.406.520 von cyberhexe123 am 14.05.16 00:34:06
Abstract:
Background: Atezolizumab (atezo; MPDL3280A) is an engineered antibody that inhibits binding of PD-L1 to its receptors, PD-1 and B7.1. Atezo has demonstrated monotherapy activity in a multitude of human tumor types. However, response rates in microsatellite stable (MSS) CRCs have been lower than in other indications. In preclinical models, targeted inhibition of MEK leads to upregulation of MHC I on tumor cells, induces intratumoral T-cell infiltration and enhances anti-PDL1 activity. We therefore conducted a Phase Ib study combining cobi (MEK inhibitor) and atezo in patients (pts) with advanced solid tumors. Methods: Cobi was escalated from 20 to 60 mg daily (21 days on/7 days off) and combined with atezo 800 mg IV q2w. Tumor-specific expansion cohorts, including KRAS-mutant CRC, and serial biopsy cohorts in solid tumors were opened upon determination of the MTD. Safety, tolerability and confirmed ORR by RECIST v1.1 were evaluated. Results: As of October 12, 2015, 23 CRC (22 KRAS mutant, 1 WT) pts were enrolled during escalation and expansion. No dose-limiting toxicities were observed, and expansion occurred at atezo 800 mg q2w and cobi 60 mg. Median follow-up for safety in CRC pts was 3.78 mo (range, 1.1-11.7). The most common treatment-related AEs included diarrhea (69.6%), fatigue (52.2%), dermatitis acneiform (43.5%), rash (34.8%), maculopapular rash (26.1%), pruritus (26.1%) and nausea (26.1%). Incidence of treatment-related G3-4 AEs was 34.8%. The only treatment-related G3-4 AE in ≥ 2 pts was diarrhea (8.7%). No G5 AEs were reported. The ORR was 17% (4 PR, 5 SD). Three responses were ongoing (range, 4.0 to 7.7 mo at time of data cutoff). Three responders were mismatch repair-proficient, and 1 was unknown. Response was not associated with baseline PD-L1 expression. Results from the serial biopsy cohort showed enhanced PD-L1 upregulation, CD8 T-cell infiltration and MHC I expression on treatment, providing mechanistic rationale for the combination. Conclusions: The combination of cobi and atezo in CRC is well tolerated at the maximum administered doses. These results show that pts with MSS CRC can respond to the combination of cobi and atezo, and provide support for continued evaluation of the combination. Clinical trial information: NCT01988896
ASCO Abstract 3502 Atezolizumab + Cobi zur Behandlung von Darmkrebs
sieht gut aus auf den ersten Blick...ein zweiter Blick wird nötig sein. Aber zuerst gibt es noch weitere Abstracts zu sichten!Abstract:
Background: Atezolizumab (atezo; MPDL3280A) is an engineered antibody that inhibits binding of PD-L1 to its receptors, PD-1 and B7.1. Atezo has demonstrated monotherapy activity in a multitude of human tumor types. However, response rates in microsatellite stable (MSS) CRCs have been lower than in other indications. In preclinical models, targeted inhibition of MEK leads to upregulation of MHC I on tumor cells, induces intratumoral T-cell infiltration and enhances anti-PDL1 activity. We therefore conducted a Phase Ib study combining cobi (MEK inhibitor) and atezo in patients (pts) with advanced solid tumors. Methods: Cobi was escalated from 20 to 60 mg daily (21 days on/7 days off) and combined with atezo 800 mg IV q2w. Tumor-specific expansion cohorts, including KRAS-mutant CRC, and serial biopsy cohorts in solid tumors were opened upon determination of the MTD. Safety, tolerability and confirmed ORR by RECIST v1.1 were evaluated. Results: As of October 12, 2015, 23 CRC (22 KRAS mutant, 1 WT) pts were enrolled during escalation and expansion. No dose-limiting toxicities were observed, and expansion occurred at atezo 800 mg q2w and cobi 60 mg. Median follow-up for safety in CRC pts was 3.78 mo (range, 1.1-11.7). The most common treatment-related AEs included diarrhea (69.6%), fatigue (52.2%), dermatitis acneiform (43.5%), rash (34.8%), maculopapular rash (26.1%), pruritus (26.1%) and nausea (26.1%). Incidence of treatment-related G3-4 AEs was 34.8%. The only treatment-related G3-4 AE in ≥ 2 pts was diarrhea (8.7%). No G5 AEs were reported. The ORR was 17% (4 PR, 5 SD). Three responses were ongoing (range, 4.0 to 7.7 mo at time of data cutoff). Three responders were mismatch repair-proficient, and 1 was unknown. Response was not associated with baseline PD-L1 expression. Results from the serial biopsy cohort showed enhanced PD-L1 upregulation, CD8 T-cell infiltration and MHC I expression on treatment, providing mechanistic rationale for the combination. Conclusions: The combination of cobi and atezo in CRC is well tolerated at the maximum administered doses. These results show that pts with MSS CRC can respond to the combination of cobi and atezo, and provide support for continued evaluation of the combination. Clinical trial information: NCT01988896
Antwort auf Beitrag Nr.: 52.435.077 von cyberhexe123 am 18.05.16 23:37:17COLET (NCT02322814): A multistage, phase 2 study evaluating the safety and efficacy of cobimetinib (C) in combination with paclitaxel (P) as first-line treatment for patients (pts) with metastatic triple-negative breast cancer (TNBC).
Sub-category:
Triple-Negative Breast Cancer
Category:
Breast Cancer—Triple-Negative/Cytotoxics/Local Therapy
Meeting:
2016 ASCO Annual Meeting
Abstract No:
TPS1100
Poster Board Number:
Poster Session (Board #203a)
Citation:
J Clin Oncol 34, 2016 (suppl; abstr TPS1100)
Author(s): David Miles, Sung-Bae Kim, V. A. McNally, Brian P. Simmons, Matthew Wongchenko, Jessie J. Hsu, Adam M. Brufsky; Mount Vernon Cancer Centre, London, United Kingdom; Asan Medical Center, University of Ulsan College of Medicine, Seoul, South Korea; Roche Products, Ltd., Welwyn Garden City, United Kingdom; Genentech, Inc., South San Francisco, CA; University of Pittsburgh, Pittsburgh, PA
Abstract Disclosures
Abstract:
Background: Preclinical data suggest that up-regulation of the MAPK pathway is a potential resistance mechanism against taxane chemotherapy. Often, resistance to taxane chemotherapy occurs in TNBC pts, and genetic alterations (including mutations and gene amplifications) in the MAPK pathway are present in many TNBC tumors; therefore, the combination of taxane chemotherapy and MEK inhibition could be an effective treatment option. Methods: COLET is evaluating the safety and efficacy of C+P in pts with metastatic or locally advanced TNBC who have not previously received systemic therapy for metastatic disease. There are 2 stages: an initial safety run-in stage (n≈12), followed by a 1:1 randomized stage (n≈100) of C+P or placebo (PBO) + P. Pts are stratified by prior neoadjuvant/adjuvant taxane therapy and disease-free interval from last chemotherapy dose. Pts will receive P 80 mg/m2 on Days 1, 8, and 15 of each 28-day cycle and C/PBO 60 mg/day on Days 3-23 of each 28-day cycle until disease progression or toxicity occurs. Key eligibility criteria include metastatic or locally advanced TNBC, no prior systemic therapy (neoadjuvant or adjuvant therapy is allowed if completed >6 mo prior), measureable disease per RECIST v1.1, and left ventricular ejection fraction > institutional lower limit of normal or > 50%. A key exclusion criterion is progressive/unstable brain metastases. The specific aims of the safety run-in stage were to determine the safety and tolerability of C+P. The specific aims of the randomized stage include investigator-assessed PFS (primary end point), safety, pharmacokinetics, the effect of subtypes and genetic alterations on PFS, mechanisms of resistance, and health-related quality of life. In the randomized stage, pts will be followed up until 60 PFS events occur across the 2 arms. This provides 77% power to detect a hazard ratio of 0.5 at a two-sided significance level of 0.05. Recruitment into safety run-in is complete; randomization stage accrual has begun. Pts from sites across Europe, North America, and the Asia-Pacific region will be enrolled.
Sub-category:
Triple-Negative Breast Cancer
Category:
Breast Cancer—Triple-Negative/Cytotoxics/Local Therapy
Meeting:
2016 ASCO Annual Meeting
Abstract No:
TPS1100
Poster Board Number:
Poster Session (Board #203a)
Citation:
J Clin Oncol 34, 2016 (suppl; abstr TPS1100)
Author(s): David Miles, Sung-Bae Kim, V. A. McNally, Brian P. Simmons, Matthew Wongchenko, Jessie J. Hsu, Adam M. Brufsky; Mount Vernon Cancer Centre, London, United Kingdom; Asan Medical Center, University of Ulsan College of Medicine, Seoul, South Korea; Roche Products, Ltd., Welwyn Garden City, United Kingdom; Genentech, Inc., South San Francisco, CA; University of Pittsburgh, Pittsburgh, PA
Abstract Disclosures
Abstract:
Background: Preclinical data suggest that up-regulation of the MAPK pathway is a potential resistance mechanism against taxane chemotherapy. Often, resistance to taxane chemotherapy occurs in TNBC pts, and genetic alterations (including mutations and gene amplifications) in the MAPK pathway are present in many TNBC tumors; therefore, the combination of taxane chemotherapy and MEK inhibition could be an effective treatment option. Methods: COLET is evaluating the safety and efficacy of C+P in pts with metastatic or locally advanced TNBC who have not previously received systemic therapy for metastatic disease. There are 2 stages: an initial safety run-in stage (n≈12), followed by a 1:1 randomized stage (n≈100) of C+P or placebo (PBO) + P. Pts are stratified by prior neoadjuvant/adjuvant taxane therapy and disease-free interval from last chemotherapy dose. Pts will receive P 80 mg/m2 on Days 1, 8, and 15 of each 28-day cycle and C/PBO 60 mg/day on Days 3-23 of each 28-day cycle until disease progression or toxicity occurs. Key eligibility criteria include metastatic or locally advanced TNBC, no prior systemic therapy (neoadjuvant or adjuvant therapy is allowed if completed >6 mo prior), measureable disease per RECIST v1.1, and left ventricular ejection fraction > institutional lower limit of normal or > 50%. A key exclusion criterion is progressive/unstable brain metastases. The specific aims of the safety run-in stage were to determine the safety and tolerability of C+P. The specific aims of the randomized stage include investigator-assessed PFS (primary end point), safety, pharmacokinetics, the effect of subtypes and genetic alterations on PFS, mechanisms of resistance, and health-related quality of life. In the randomized stage, pts will be followed up until 60 PFS events occur across the 2 arms. This provides 77% power to detect a hazard ratio of 0.5 at a two-sided significance level of 0.05. Recruitment into safety run-in is complete; randomization stage accrual has begun. Pts from sites across Europe, North America, and the Asia-Pacific region will be enrolled.
Antwort auf Beitrag Nr.: 52.435.089 von cyberhexe123 am 18.05.16 23:41:20Phase II study of cabozantinib in recurrent/metastatic endometrial cancer (EC): a study of the Princess Margaret, Chicago and California Phase II Consortia.
Sub-category:
Uterine Cancer
Category:
Gynecologic Cancer
Meeting:
2016 ASCO Annual Meeting
Abstract No:
5586
Poster Board Number:
Poster Session (Board #409)
Citation:
J Clin Oncol 34, 2016 (suppl; abstr 5586)
Author(s): Neesha C. Dhani, Hal W. Hirte, Marcus O. Butler, Stephanie Lheureux, Julie Burnier, Michelle K. Wilson, Angela Jain, Mihaela C. Cristea, Stephen Welch, Waldo Jimenez, Daniela Matei, Katia Sonia Tonkin, Erica Stringer, Carolyn Johnston, Judy Quintos, Christine Tran, Katherine Karakasis, Lisa Wang, John Joseph Wright, Amit M. Oza; Princess Margaret Cancer Centre, University Health Network, Division of Medical Oncology and Hematology, Toronto, ON, Canada; Juravinski Cancer Centre, Hamilton, ON, Canada; Princess Margaret Cancer Centre, Toronto, ON, Canada; Fox Chase Cancer Ctr, Havertown, PA; Department of Medical Oncology and Therapeutics Research, City of Hope, Duarte, CA; London Regional Cancer Program, London, ON, Canada; McMaster University, Hamilton, ON, Canada; Indiana Univ Simon Cancer Ctr, Indianapolis, IN; Cross Cancer Inst, Edmonton, AB, Canada; University of Chicago Medical Center, Chicago, IL; University of Michigan Hospital, Ann Arbor, MI; PRINCESS MARGARET CANCER CENTRE, Toronto, ON, Canada; University Health Netword, Toronto, ON, Canada; University Health Network, Toronto, ON, Canada; Department of Biostatistics, Princess Margaret Cancer Centre, Toronto, ON, Canada; National Cancer Institute at the National Institutes of Health, Bethesda, MD
Abstract Disclosures
Abstract:
Background: Cabozantinib is a multi-targeted kinase inhibitor against MET, VEGFR, TIE2, RET, AXL and KIT, influencing mitogenic/angiogenic epithelial-stromal cross-talk. It is a rational strategy in endometrial cancer (EC) where the transient benefit of VEGF-targeting is related to signaling through MET/HGF, TIE2 & AXL. The correlation of MET/HGF with EC pathogenesis also supports evaluating cabozantinib in recurrent/metastatic EC, a poor prognosis disease with no standard 2nd line therapy. Methods: PHL86/NCI#9322/NCT01935934 is a multi-centre, phase II trial of cabozantinib (60mg oral daily on a 28-day cycle) in patients (pts) with EC recurring within a year of adjuvant chemotherapy, or with progression after 1 line of chemotherapy for metastatic disease. Enrollment to experimental (E) cohort is stratified by histology (serous (SER) vs endometroid (END)) in a Simon two-stage design for a co-primary endpoint of response rate ( > 30%) or 12- week progression-free-survival (PFS) ( > 55%). Observation of > 8 partial responses (PRs) or > 16 instances of 12 wk-PFS (in 36 pts) would be considered a signal of activity. Pts are also enrolled to an exploratory (ex) cohort of rare histology EC. Results: From May 2013 to Dec 2015, 79 pts (E: 61 (25 SER, 36 END); ex: 18) have been treated; toxicity/outcome data on 71 pts is reported. Prior treatment included chemotherapy (52pts: 1 line; 18 pts: 2 lines) & radiation (28 pts). Most common Grade 3 (G3) toxicity was hypertension (16/71 pts), other relevant G3 events were bowel perforation/fistula (2 pts), GI bleed (1 pt). Common toxicities also included GI disturbance, biochemical abnormalities, cytopenias and palmer-plantar erythrodysesthesia. In endometroid histology pts (n = 36), 4 PRs and 17 instances of > 12-wk PFS have been observed. Mutational profiling (miSeq) demonstrated more mutations (PTEN, CTNNB1) in END vs SER histology EC, with more p53 mutations in SER EC. Conclusions: Cabozantinib is well-tolerated and met its predefined activity endpoint in previously treated END-EC. Correlations between mutational status and response are being investigated. The current data justify further evaluation of this agent in EC. Clinical trial information: NCT01935934
Sub-category:
Uterine Cancer
Category:
Gynecologic Cancer
Meeting:
2016 ASCO Annual Meeting
Abstract No:
5586
Poster Board Number:
Poster Session (Board #409)
Citation:
J Clin Oncol 34, 2016 (suppl; abstr 5586)
Author(s): Neesha C. Dhani, Hal W. Hirte, Marcus O. Butler, Stephanie Lheureux, Julie Burnier, Michelle K. Wilson, Angela Jain, Mihaela C. Cristea, Stephen Welch, Waldo Jimenez, Daniela Matei, Katia Sonia Tonkin, Erica Stringer, Carolyn Johnston, Judy Quintos, Christine Tran, Katherine Karakasis, Lisa Wang, John Joseph Wright, Amit M. Oza; Princess Margaret Cancer Centre, University Health Network, Division of Medical Oncology and Hematology, Toronto, ON, Canada; Juravinski Cancer Centre, Hamilton, ON, Canada; Princess Margaret Cancer Centre, Toronto, ON, Canada; Fox Chase Cancer Ctr, Havertown, PA; Department of Medical Oncology and Therapeutics Research, City of Hope, Duarte, CA; London Regional Cancer Program, London, ON, Canada; McMaster University, Hamilton, ON, Canada; Indiana Univ Simon Cancer Ctr, Indianapolis, IN; Cross Cancer Inst, Edmonton, AB, Canada; University of Chicago Medical Center, Chicago, IL; University of Michigan Hospital, Ann Arbor, MI; PRINCESS MARGARET CANCER CENTRE, Toronto, ON, Canada; University Health Netword, Toronto, ON, Canada; University Health Network, Toronto, ON, Canada; Department of Biostatistics, Princess Margaret Cancer Centre, Toronto, ON, Canada; National Cancer Institute at the National Institutes of Health, Bethesda, MD
Abstract Disclosures
Abstract:
Background: Cabozantinib is a multi-targeted kinase inhibitor against MET, VEGFR, TIE2, RET, AXL and KIT, influencing mitogenic/angiogenic epithelial-stromal cross-talk. It is a rational strategy in endometrial cancer (EC) where the transient benefit of VEGF-targeting is related to signaling through MET/HGF, TIE2 & AXL. The correlation of MET/HGF with EC pathogenesis also supports evaluating cabozantinib in recurrent/metastatic EC, a poor prognosis disease with no standard 2nd line therapy. Methods: PHL86/NCI#9322/NCT01935934 is a multi-centre, phase II trial of cabozantinib (60mg oral daily on a 28-day cycle) in patients (pts) with EC recurring within a year of adjuvant chemotherapy, or with progression after 1 line of chemotherapy for metastatic disease. Enrollment to experimental (E) cohort is stratified by histology (serous (SER) vs endometroid (END)) in a Simon two-stage design for a co-primary endpoint of response rate ( > 30%) or 12- week progression-free-survival (PFS) ( > 55%). Observation of > 8 partial responses (PRs) or > 16 instances of 12 wk-PFS (in 36 pts) would be considered a signal of activity. Pts are also enrolled to an exploratory (ex) cohort of rare histology EC. Results: From May 2013 to Dec 2015, 79 pts (E: 61 (25 SER, 36 END); ex: 18) have been treated; toxicity/outcome data on 71 pts is reported. Prior treatment included chemotherapy (52pts: 1 line; 18 pts: 2 lines) & radiation (28 pts). Most common Grade 3 (G3) toxicity was hypertension (16/71 pts), other relevant G3 events were bowel perforation/fistula (2 pts), GI bleed (1 pt). Common toxicities also included GI disturbance, biochemical abnormalities, cytopenias and palmer-plantar erythrodysesthesia. In endometroid histology pts (n = 36), 4 PRs and 17 instances of > 12-wk PFS have been observed. Mutational profiling (miSeq) demonstrated more mutations (PTEN, CTNNB1) in END vs SER histology EC, with more p53 mutations in SER EC. Conclusions: Cabozantinib is well-tolerated and met its predefined activity endpoint in previously treated END-EC. Correlations between mutational status and response are being investigated. The current data justify further evaluation of this agent in EC. Clinical trial information: NCT01935934
Antwort auf Beitrag Nr.: 52.435.077 von cyberhexe123 am 18.05.16 23:37:17Bisher nichtssagend. Ja, es gab einen Wirkeffekt von Atezo mit Cobi. Nur was für einen Wirkeffekt hätte Atezo alleine gebracht? Das weiß man nicht. Einzige gesicherte Aussage ist, dass Atezo+Cobi für eine Kombination in maximaler Cobi Dosierung sicher genug ist. Mir ist das bei weitem nicht genug um meine Einstellung zum Cobi-Potential grundlegend zu überdenken.
Antwort auf Beitrag Nr.: 52.435.089 von cyberhexe123 am 18.05.16 23:41:20In diesem Abstract wird eine beginnende Studie vorgestellt und keine Ergebnisse. Die Infos über die Studie kann man sich selbst auch bei clinicaltrials.gov ersehen oder erlesen. Das sind die Abstracts, die für Investoren keine Neuerungen bieten.
Antwort auf Beitrag Nr.: 52.435.101 von cyberhexe123 am 18.05.16 23:44:36Die geringe Response Rate und die Events mit einem PFS von 3 Monaten oder mehr in weniger als der Hälfte der Patienten haut mich nicht um. Das Setting ist latest line und der Effekt für Patienten gering. Unklar, ob man hier aus wirtschaflichen Gründen überhaupt in eine P3 gehen wird. Man hat dann mit durchschnittlichen Behandlungsdauern von unter 3 Monaten zu rechnen.
Abstract# 3014
interessante Studie --> ph1 von pembro+ NVS-Kombitherapie (dabrafenib+trametinib) in BRAF mutiertem Hautkrebs. Mit dieser Dreifach-Therapie geht es weiter in Phase 2.Pembrolizumab (pembro) in combination with dabrafenib (D) and trametinib (T) for BRAF-mutant advanced melanoma: Phase 1 KEYNOTE-022 study.
Abstract:
Background: The anti–PD-1 antibody pembro has demonstrated durable responses in ~30%-40% of patients (pts) with advanced melanoma. The combination of BRAF inhibitor D and MEK inhibitor T, the standard treatment for BRAF-mutant melanoma, leads to rapid responses and improved survival, but 50% of pts eventually experience disease progression around 12 mo. KEYNOTE-022 (NCT02130466) is a phase 1/2 study designed to assess safety and efficacy of the recommended doses of pembro in combination with D and T. Here, we report on the safety and efficacy of this triplet combination in BRAF-mutant melanoma in phase 1 testing. Methods: Key eligibility criteria included BRAFV600E/K-mutant stage III/IV advanced melanoma, ≥ 1 measurable lesion per RECIST v1.1, ECOG PS 0-1, and no prior treatment with BRAF/MEK inhibitors. A 3 + 3 design was used for dose escalation, with dose confirmation in an expansion cohort guided by the toxicity probability interval method. Pts received pembro 2 mg/kg Q3W + D 150 mg twice daily (BID) + T 2 mg daily (QD). AEs (NCI CTCAE v4.0) were collected throughout the study + 30 days; DLT observation window was the first 6 wk after dosing. Primary efficacy end point was ORR (RECIST v1.1, investigator). Results: As of the Jan 2016 data cutoff, 15 pts were enrolled across the dose determination and dose confirmation arms. The predefined criteria for progression to phase 2 were met, with DLTs reported in 3 pts: pt 1 had gr 4 neutropenia (treatment interrupted); pt 2 had gr 4 ALT increased (discontinued); pt 3 had gr 3 ALT, AST, and gamma-glutamyltransferase increased (discontinued). All events resolved. Overall, 10 (67%) pts experienced gr 3-4 treatment-related AEs, with 5 (33%) discontinuations; there were no treatment-related deaths. ORR (unconfirmed) in 15 pts was 60% (n = 9 PR, n = 2 SD, n = 3 PD). Based on these results, the recommended phase 2 regimen is pembro 2 mg/kg Q3W + D 150 mg BID + T 2 mg QD. Conclusions: The approved doses of pembro in combination with D + T administered concurrently provided a manageable toxicity profile in pts with BRAF-mutant melanoma. A phase 2 study will further evaluate safety and efficacy of this triplet combination as first-line therapy for BRAF-mutant melanoma. Clinical trial information: NCT02130466
Antwort auf Beitrag Nr.: 52.437.069 von cyberhexe123 am 19.05.16 10:04:20
Pembrolizumab versus ipilimumab for advanced melanoma: Final overall survival analysis of KEYNOTE-006.
Conclusions: With an additional 9 mo of follow-up, median OS was not reached for pembro, and the superiority of pembro over ipi for advanced melanoma was confirmed. Coupled with the durability of response and manageable safety profile, these data support pembro as a standard of care for advanced melanoma. Clinical trial information: NCT01866319
Abstract#9504
nicht unerwartet: Bestätigung der Überlegenheit von pembro zu ipi bei fortgeschrittenem Hautkrebs:Pembrolizumab versus ipilimumab for advanced melanoma: Final overall survival analysis of KEYNOTE-006.
Conclusions: With an additional 9 mo of follow-up, median OS was not reached for pembro, and the superiority of pembro over ipi for advanced melanoma was confirmed. Coupled with the durability of response and manageable safety profile, these data support pembro as a standard of care for advanced melanoma. Clinical trial information: NCT01866319
Antwort auf Beitrag Nr.: 52.435.089 von cyberhexe123 am 18.05.16 23:41:20
Cobimetinib (C) + paclitaxel (P) as first-line treatment in patients (pts) with advanced triple-negative breast cancer (TNBC): Updated results and biomarker data from the phase 2 COLET study.
Conclusions: This is the first study to evaluate C+P in TNBC. The safety profile of C+P is consistent with known safety profiles. Initial results are promising, and enrollment in the randomized stage is ongoing (primary efficacy outcome of progression-free survival). Pts in the safety stage continue to be followed up for long-term safety and disease progression. Clinical trial information: NCT02322814
Abstract#1074
Cobimetinib (C) + paclitaxel (P) as first-line treatment in patients (pts) with advanced triple-negative breast cancer (TNBC): Updated results and biomarker data from the phase 2 COLET study.
Conclusions: This is the first study to evaluate C+P in TNBC. The safety profile of C+P is consistent with known safety profiles. Initial results are promising, and enrollment in the randomized stage is ongoing (primary efficacy outcome of progression-free survival). Pts in the safety stage continue to be followed up for long-term safety and disease progression. Clinical trial information: NCT02322814
Antwort auf Beitrag Nr.: 52.437.189 von cyberhexe123 am 19.05.16 10:14:25
sorry...wollte noch was ergänzen --> viel versprechendes Ergebnis bei dreifach negativem Brustkrebs in Erstlinienbehandlung. Genentech scheint mit der Kombi aus Paclitaxel und Cobi dem "proof of concept" d.h. synergistische Wirkung von Cobi bei der Apoptosis (programmierter Zelltod) nahe zu sein.
A Study of Cobimetinib in Combination With Paclitaxel as First-line Treatment for Patients With Metastatic Triple-negative Breast Cancer
Zitat von cyberhexe123: Cobimetinib (C) + paclitaxel (P) as first-line treatment in patients (pts) with advanced triple-negative breast cancer (TNBC): Updated results and biomarker data from the phase 2 COLET study.
Conclusions: This is the first study to evaluate C+P in TNBC. The safety profile of C+P is consistent with known safety profiles. Initial results are promising, and enrollment in the randomized stage is ongoing (primary efficacy outcome of progression-free survival). Pts in the safety stage continue to be followed up for long-term safety and disease progression. Clinical trial information: NCT02322814
sorry...wollte noch was ergänzen --> viel versprechendes Ergebnis bei dreifach negativem Brustkrebs in Erstlinienbehandlung. Genentech scheint mit der Kombi aus Paclitaxel und Cobi dem "proof of concept" d.h. synergistische Wirkung von Cobi bei der Apoptosis (programmierter Zelltod) nahe zu sein.
A Study of Cobimetinib in Combination With Paclitaxel as First-line Treatment for Patients With Metastatic Triple-negative Breast Cancer
ville schrieb:
"Wenn man das nicht nur liest, sondern dann auch versteht, dann merkt man bereits an diesem Beispiel, dass die Kriterien bei Checkmate strenger waren als bei METEOR. Wenn man dann noch die Ergebnisse der Kontrollgruppen vergleicht ist das die Bestätigung (PFS Ever in Meteor = nur 3.8 Monate, PFS Ever in Checkmate = 4,4 Monate)"
...die Herleitung wird deutlicher, wenn man anstatt des Median des progressionsfreien Überlebens (mPFS = median Progression Free Survival) denjenigen der Überlebenszeitanlyse (mOS = median Overall Survival) der Vergleichsgruppen heranzieht:
Meteor/Everolimus mOS = 16.5m
CheckMate025/Everolimus mOS = 19.6m
"Wenn man das nicht nur liest, sondern dann auch versteht, dann merkt man bereits an diesem Beispiel, dass die Kriterien bei Checkmate strenger waren als bei METEOR. Wenn man dann noch die Ergebnisse der Kontrollgruppen vergleicht ist das die Bestätigung (PFS Ever in Meteor = nur 3.8 Monate, PFS Ever in Checkmate = 4,4 Monate)"
...die Herleitung wird deutlicher, wenn man anstatt des Median des progressionsfreien Überlebens (mPFS = median Progression Free Survival) denjenigen der Überlebenszeitanlyse (mOS = median Overall Survival) der Vergleichsgruppen heranzieht:
Meteor/Everolimus mOS = 16.5m
CheckMate025/Everolimus mOS = 19.6m
wesentlich entscheidend für den wirtschaftlichen Erfolg ist das Label einer Behandlungsmethode!
Hierzu lohnt sich ein vergleich in die beiden von der FDA publizierten Label:
1.) Indikation und Anwendung
CABOMETYX is a kinase inhibitor indicated for the treatment of patients with advanced renal cell carcinoma (RCC) who have received prior anti angiogenic therapy.
OPDIVO (nivolumab) is indicated for the treatment of patients with advanced renal cell
carcinoma (RCC) who have received prior anti-angiogenic therapy
identisch
2.) Dosierung und Anwendung
Recommended Dose: 60 mg orally, once daily.
The recommended dose of OPDIVO is 3 mg/kg administered as an intravenous infusion over 60 minutes every 2 weeks until disease progression or unacceptable toxicity.
Vorteil Cabo, da infusionsabhängige Überempfindlichkeit bei opdivo (6% O vs. 1% E)
5.) Warnungen und Vorsichtsmassnahmen
intensive Blutungen (2.1% Cabo vs 1.6% Everolimus), teilweise fatal
Perforation und Fisteln im Magen-darm-Bereich (1.2% vs 0%)
trombotische Ereignisse (7.3& vs. 3.9%)
Bluthochdruck (37% vs. 7.1%) --> Blutdruck regelmässig kontrollieren!
Durchfall (74% vs. 28%)
Palmar-plantar erythrodysesthesia syndrome (42% vs. 6%) ...was immer das auch ist
CABOMETYX can cause fetal harm when administered to a pregnant woman!
Lungenentzündung (5% Opdivo vs. 18% Everolimus) bei Opdivo teilweise fatal
Durchfall/Dickdarmentzündung (25% O vs. 32% E)
Leberwerte (+AST: 33% vs. 39% - +alk.Phosphatase: 32% vs. 2% / +tot.Bilirubin: 9% vs. 3.5%)
immun vermittelte Hepatitis ca. 1.5%
Nierenentzündung (7% vs. 3%)
Ausschlag (28% vs. 36%)
etc.
infusionsabhängige Überempfindlichkeit (6% O vs. 1% E)
OPDIVO can cause fetal harm when administered to a pregnant woman!
Studienabbrecher wegen Nebenwirkungen:
CABOMETYX 10% vs. 10% Everolimus.
The dose was reduced in 60% of patients receiving CABOMETYX and in 24% of patients
receiving everolimus.
Opdivo 16% vs. Everolimus 19%
Todesrate in Behandlung bzw. bis 30 Tage nach d letzten Dosis:
Opdivo 4.7% vs. 8.6% Everolimus
KLINISCHE STUDIEN
....
Fortsetzung folgt
Hierzu lohnt sich ein vergleich in die beiden von der FDA publizierten Label:
1.) Indikation und Anwendung
CABOMETYX is a kinase inhibitor indicated for the treatment of patients with advanced renal cell carcinoma (RCC) who have received prior anti angiogenic therapy.
OPDIVO (nivolumab) is indicated for the treatment of patients with advanced renal cell
carcinoma (RCC) who have received prior anti-angiogenic therapy
identisch
2.) Dosierung und Anwendung
Recommended Dose: 60 mg orally, once daily.
The recommended dose of OPDIVO is 3 mg/kg administered as an intravenous infusion over 60 minutes every 2 weeks until disease progression or unacceptable toxicity.
Vorteil Cabo, da infusionsabhängige Überempfindlichkeit bei opdivo (6% O vs. 1% E)
5.) Warnungen und Vorsichtsmassnahmen
intensive Blutungen (2.1% Cabo vs 1.6% Everolimus), teilweise fatal
Perforation und Fisteln im Magen-darm-Bereich (1.2% vs 0%)
trombotische Ereignisse (7.3& vs. 3.9%)
Bluthochdruck (37% vs. 7.1%) --> Blutdruck regelmässig kontrollieren!
Durchfall (74% vs. 28%)
Palmar-plantar erythrodysesthesia syndrome (42% vs. 6%) ...was immer das auch ist

CABOMETYX can cause fetal harm when administered to a pregnant woman!
Lungenentzündung (5% Opdivo vs. 18% Everolimus) bei Opdivo teilweise fatal
Durchfall/Dickdarmentzündung (25% O vs. 32% E)
Leberwerte (+AST: 33% vs. 39% - +alk.Phosphatase: 32% vs. 2% / +tot.Bilirubin: 9% vs. 3.5%)
immun vermittelte Hepatitis ca. 1.5%
Nierenentzündung (7% vs. 3%)
Ausschlag (28% vs. 36%)
etc.
infusionsabhängige Überempfindlichkeit (6% O vs. 1% E)
OPDIVO can cause fetal harm when administered to a pregnant woman!
Studienabbrecher wegen Nebenwirkungen:
CABOMETYX 10% vs. 10% Everolimus.
The dose was reduced in 60% of patients receiving CABOMETYX and in 24% of patients
receiving everolimus.
Opdivo 16% vs. Everolimus 19%
Todesrate in Behandlung bzw. bis 30 Tage nach d letzten Dosis:
Opdivo 4.7% vs. 8.6% Everolimus
KLINISCHE STUDIEN
....
Fortsetzung folgt
Antwort auf Beitrag Nr.: 52.443.573 von cyberhexe123 am 20.05.16 01:14:2812.1
Mechanism of Action
In vitro biochemical and/or cellular assays have shown that cabozantinib inhibits the tyrosine kinase activity of MET, VEGFR-1, -2 and -3, AXL, RET, ROS1, TYRO3, MER, KIT, TRKB, FLT-3, and TIE-2. These receptor tyrosine kinases are involved in both normal cellular function and pathologic processes such as oncogenesis, metastasis, tumor angiogenesis, drug resistance, and maintenance of the tumor microenvironment
12.1
Mechanism of Action
Binding of the PD-1 ligands, PD-L1 and PD-L2, to the PD-1 receptor found on T cells, inhibits T-cell proliferation and cytokine production. Upregulation of PD-1 ligands occurs in some tumors and signaling through this pathway can contribute to inhibition of active T-cell immune
surveillance of tumors.
14 Clinical Studies
Table 5.
Overall Survival and Objective Response Rate in Study 1 (ITT)
Endpoint : Median Overall Survival
CABOMETYX N = 330 Everolimus N = 328
Median OS (95% CI), months
CABOMETYX 21.4 (18.7, NE)
Everolimos 16.5 (14.7, 18.8)
HR (95% CI), 0.66 (0.53, 0.83), p=0.0003 -> stratified log-rank test with prior VEGFR-targeting
Confirmed ORR (partial responses only) (95% CI)
CABOMETYX 17% (13%, 22%)
Everolimus 3% (2%, 6%)
p<0.0001
14 Clinical Studies
Endpoint : Median Overall Survival
OPDIVO N = 410 Everolimus N = 411
Median OS (95% CI), months
OPDIVO 25.0 (21.7, NE)
Everolimos 19.6 (17.6, 23.1)
HR (95% CI), 0.73 (0.60, 0.89), p=0.0018 Hazard ratio is obtained from a Cox proportional-hazards model; p-value is obtained from a two-sided log-rank test
Confirmed ORR (partial responses only) (95% CI)
OPDIVO 21.5% (17.6, 25.8)
Everolimus 3.9% (2.2, 6.2)
p<0.0001
Mechanism of Action
In vitro biochemical and/or cellular assays have shown that cabozantinib inhibits the tyrosine kinase activity of MET, VEGFR-1, -2 and -3, AXL, RET, ROS1, TYRO3, MER, KIT, TRKB, FLT-3, and TIE-2. These receptor tyrosine kinases are involved in both normal cellular function and pathologic processes such as oncogenesis, metastasis, tumor angiogenesis, drug resistance, and maintenance of the tumor microenvironment
12.1
Mechanism of Action
Binding of the PD-1 ligands, PD-L1 and PD-L2, to the PD-1 receptor found on T cells, inhibits T-cell proliferation and cytokine production. Upregulation of PD-1 ligands occurs in some tumors and signaling through this pathway can contribute to inhibition of active T-cell immune
surveillance of tumors.
14 Clinical Studies
Table 5.
Overall Survival and Objective Response Rate in Study 1 (ITT)
Endpoint : Median Overall Survival
CABOMETYX N = 330 Everolimus N = 328
Median OS (95% CI), months
CABOMETYX 21.4 (18.7, NE)
Everolimos 16.5 (14.7, 18.8)
HR (95% CI), 0.66 (0.53, 0.83), p=0.0003 -> stratified log-rank test with prior VEGFR-targeting
Confirmed ORR (partial responses only) (95% CI)
CABOMETYX 17% (13%, 22%)
Everolimus 3% (2%, 6%)
p<0.0001
14 Clinical Studies
Endpoint : Median Overall Survival
OPDIVO N = 410 Everolimus N = 411
Median OS (95% CI), months
OPDIVO 25.0 (21.7, NE)
Everolimos 19.6 (17.6, 23.1)
HR (95% CI), 0.73 (0.60, 0.89), p=0.0018 Hazard ratio is obtained from a Cox proportional-hazards model; p-value is obtained from a two-sided log-rank test
Confirmed ORR (partial responses only) (95% CI)
OPDIVO 21.5% (17.6, 25.8)
Everolimus 3.9% (2.2, 6.2)
p<0.0001
Antwort auf Beitrag Nr.: 52.455.918 von cyberhexe123 am 22.05.16 17:06:26
Indikation und Anwendung
Zweitlinienbehandlung im Anschluss an eine Erstlinienbehandlung mit einem Angiogenesehemmer (Verhindert bzw. vermindert die Bildung neuer Blutgefässe, die den Tumor versorgen)
Urteil: total identisch
Dosierung und Anwendung
klarer Vorteil bei Cabo, da einerseits infusionsabhängige Überempfindlichkeit bei opdivo möglich...andererseits wird die orale Applikation gegenüber einer intravenösen Anwendung von fast allen Patienten favorisiert --> es ist iA einfacher eine Tablette zu schlucken.
Vorteil Cabozantinib
Warnungen / Nebenwirkungen
da wird es für den Laien mitunter schwierig, eine präzise Einschätzung zu geben;
eindeutig scheint mir, dass bei immungeschwächten Patienten ein Immun-Modulator wohl eher nachrangig verabreicht werden dürfte; bei Cabo ist eine Blutdrucküberwachung angezeigt, während bei Nivolumab ein Monitoring der Lungenfunktion im Vordergrund stehen dürfte.
Alles in allem, für den Laien scheint das Nebenwirkungsprofil keinen wesentlichen Unterschied herzugeben.
Unentschieden
12.) Wirmechanismus
Da es sich bei den Immun-Checkpoint-Modulatoren um einen in der Onkologie neuen Wirkmechanismus handelt, dürften die verschreibenden Onkologen in diesem Punkt eher die Innovation bevorzugen.
Vorteil Nivolumab (OPDIVO)
14.) Klinik / Wirkung
Obschon Nivolumab/OPDIVO bei der Überlebenszeitanalyse (Median Überleben) einen Vorteil zu haben scheint (25.0 Monate vs. 21.4 Monate), relativiert sich dies bei genauer Betrachtung. Da die Studienteilnehmer im Durchschnitt bei METEOR kränker waren (AUSSCHLUSSkriterien bei CheckMate!), ist eine Bewertung der Wirkung über die Hazard Ratio aussagekräftiger. Und diese ist bei METEOR (HR=0.66) günstiger als bei CheckMate025 (HR=0.73); allerdings wurde bei CheckMate das multivariable Statistik-Modell der Cox-Regression angewendet, welches oft ungünstigere (im Sinne von schlechteren Ergebnissen gegenüber der log-rank-Methode) Ergebnisse liefert.
Unentschieden
Aufgrund der von der FDA veröffentlichten Label beider Anwendungen ist kein Favorit der Zweitlinienbehandlung bei Nierenkrebs (RCC) auszumachen.
Kommentare bzw. Korrekturen erwünscht!
Gegenüberstellung der beiden Label zur Zweitlinienbehandlung von RCC
Ich möchte nicht den Fehler begehen, mit meinem begrenzten Wissen falsche Schlussfolgerungen zu ziehen, und dennoch sollten folgende Bemerkungen im Ansatz richtig sein:Indikation und Anwendung
Zweitlinienbehandlung im Anschluss an eine Erstlinienbehandlung mit einem Angiogenesehemmer (Verhindert bzw. vermindert die Bildung neuer Blutgefässe, die den Tumor versorgen)
Urteil: total identisch
Dosierung und Anwendung
klarer Vorteil bei Cabo, da einerseits infusionsabhängige Überempfindlichkeit bei opdivo möglich...andererseits wird die orale Applikation gegenüber einer intravenösen Anwendung von fast allen Patienten favorisiert --> es ist iA einfacher eine Tablette zu schlucken.
Vorteil Cabozantinib
Warnungen / Nebenwirkungen
da wird es für den Laien mitunter schwierig, eine präzise Einschätzung zu geben;
eindeutig scheint mir, dass bei immungeschwächten Patienten ein Immun-Modulator wohl eher nachrangig verabreicht werden dürfte; bei Cabo ist eine Blutdrucküberwachung angezeigt, während bei Nivolumab ein Monitoring der Lungenfunktion im Vordergrund stehen dürfte.
Alles in allem, für den Laien scheint das Nebenwirkungsprofil keinen wesentlichen Unterschied herzugeben.
Unentschieden
12.) Wirmechanismus
Da es sich bei den Immun-Checkpoint-Modulatoren um einen in der Onkologie neuen Wirkmechanismus handelt, dürften die verschreibenden Onkologen in diesem Punkt eher die Innovation bevorzugen.
Vorteil Nivolumab (OPDIVO)
14.) Klinik / Wirkung
Obschon Nivolumab/OPDIVO bei der Überlebenszeitanalyse (Median Überleben) einen Vorteil zu haben scheint (25.0 Monate vs. 21.4 Monate), relativiert sich dies bei genauer Betrachtung. Da die Studienteilnehmer im Durchschnitt bei METEOR kränker waren (AUSSCHLUSSkriterien bei CheckMate!), ist eine Bewertung der Wirkung über die Hazard Ratio aussagekräftiger. Und diese ist bei METEOR (HR=0.66) günstiger als bei CheckMate025 (HR=0.73); allerdings wurde bei CheckMate das multivariable Statistik-Modell der Cox-Regression angewendet, welches oft ungünstigere (im Sinne von schlechteren Ergebnissen gegenüber der log-rank-Methode) Ergebnisse liefert.
Unentschieden
Aufgrund der von der FDA veröffentlichten Label beider Anwendungen ist kein Favorit der Zweitlinienbehandlung bei Nierenkrebs (RCC) auszumachen.
Kommentare bzw. Korrekturen erwünscht!
http://finance.yahoo.com/news/exelixis-announces-results-ran…Wie`s ausschaut wird Cabo bald first line Behandlung, dann Blockbusterpotential, geil:
Antwort auf Beitrag Nr.: 52.461.762 von Magnetfeldfredy am 23.05.16 16:52:02das wird Pfizer nicht gefallen, weil Sunitinib (marketed as Sutent by Pfizer) bisher als Standardtherapie in Erstlinienbehandlung beim Nierenzellkarzinom angewendet wird:
SAN FRANCISCO--(BUSINESS WIRE)--May 23, 2016-- Exelixis, Inc. (NASDAQ:EXEL) today announced positive top-line results from the CABOSUN randomized phase 2 trial of cabozantinib in patients with previously untreated advanced renal cell carcinoma (RCC). The trial met its primary endpoint, demonstrating a statistically significant and clinically meaningful improvement in progression-free survival (PFS) for cabozantinib compared with sunitinib in patients with advanced intermediate- or poor-risk RCC. The safety data in the cabozantinib-treated arm of the study were consistent with those observed in previous studies in patients with advanced RCC. CABOSUN is being conducted by The Alliance for Clinical Trials in Oncology as part of Exelixis’ collaboration with the National Cancer Institute’s Cancer Therapy Evaluation Program (NCI-CTEP). The final results from CABOSUN will be submitted for presentation at a future medical conference.
Bin mal gespannt wie sich die Arzneimittelbehörde dazu äussert. Erst unlängst wurde eine Zweitlinientherapie zur Behandlung von RCC aufgrund einer ph2-Studie zugelassen:
Lenvatinib Receives Approval for Advanced RCC
News | May 16, 2016 | Renal Cell Carcinoma, Genitourinary Cancers
By Dave Levitan
The US Food and Drug Administration (FDA) approved lenvatinib (Lenvima) in combination with everolimus for the treatment of advanced renal cell carcinoma (RCC). The approval is for patients who were previously treated with an anti-angiogenic therapy.
"Lenvatinib plus everolimus is the first and only FDA-approved regimen that successfully combines treatments that employ tyrosine kinase and mTOR inhibition, the primary targets of advanced RCC treatment for the past decade," said Robert Motzer, MD, of Memorial Sloan Kettering Cancer in New York, in a press release. Motzer led a phase II study of the lenvatinib/everolimus combination in advanced RCC, the results of which led to the FDA approval. Lenvatinib received both breakthrough therapy designation and a priority review from the FDA.
- See more at: http://www.cancernetwork.com/renal-cell-carcinoma/lenvatinib…
SAN FRANCISCO--(BUSINESS WIRE)--May 23, 2016-- Exelixis, Inc. (NASDAQ:EXEL) today announced positive top-line results from the CABOSUN randomized phase 2 trial of cabozantinib in patients with previously untreated advanced renal cell carcinoma (RCC). The trial met its primary endpoint, demonstrating a statistically significant and clinically meaningful improvement in progression-free survival (PFS) for cabozantinib compared with sunitinib in patients with advanced intermediate- or poor-risk RCC. The safety data in the cabozantinib-treated arm of the study were consistent with those observed in previous studies in patients with advanced RCC. CABOSUN is being conducted by The Alliance for Clinical Trials in Oncology as part of Exelixis’ collaboration with the National Cancer Institute’s Cancer Therapy Evaluation Program (NCI-CTEP). The final results from CABOSUN will be submitted for presentation at a future medical conference.
Bin mal gespannt wie sich die Arzneimittelbehörde dazu äussert. Erst unlängst wurde eine Zweitlinientherapie zur Behandlung von RCC aufgrund einer ph2-Studie zugelassen:
Lenvatinib Receives Approval for Advanced RCC
News | May 16, 2016 | Renal Cell Carcinoma, Genitourinary Cancers
By Dave Levitan
The US Food and Drug Administration (FDA) approved lenvatinib (Lenvima) in combination with everolimus for the treatment of advanced renal cell carcinoma (RCC). The approval is for patients who were previously treated with an anti-angiogenic therapy.
"Lenvatinib plus everolimus is the first and only FDA-approved regimen that successfully combines treatments that employ tyrosine kinase and mTOR inhibition, the primary targets of advanced RCC treatment for the past decade," said Robert Motzer, MD, of Memorial Sloan Kettering Cancer in New York, in a press release. Motzer led a phase II study of the lenvatinib/everolimus combination in advanced RCC, the results of which led to the FDA approval. Lenvatinib received both breakthrough therapy designation and a priority review from the FDA.
- See more at: http://www.cancernetwork.com/renal-cell-carcinoma/lenvatinib…
Antwort auf Beitrag Nr.: 52.464.389 von cyberhexe123 am 24.05.16 08:11:27weil Cabozantinib bereits in 2 Indikationen zugelassen ist und in CABOSUN keine neuen Signale bzgl. Sicherheit aufgefallen sind...
The safety data in the cabozantinib-treated arm of the study were consistent with those observed in previous studies in patients with advanced RCC. CABOSUN is being conducted by The Alliance for Clinical Trials in Oncology as part of Exelixis’ collaboration with the National Cancer Institute’s Cancer Therapy Evaluation Program (NCI-CTEP).
...ist eine Labelerweiterung bei RCC aufgrund dieser ph2-Studie nicht ausgeschlossen:
1 INDICATIONS AND USAGE
CABOMETYX is indicated for the treatment of patients with advanced renal cell carcinoma (RCC)
who have received prior anti-angiogenic therapy.
Von Bedeutung ist natürlich das genaue Resultat, welches auf einem medizinischen Kongress präsentiert wird.
The final results from CABOSUN will be submitted for presentation at a future medical conference.
The safety data in the cabozantinib-treated arm of the study were consistent with those observed in previous studies in patients with advanced RCC. CABOSUN is being conducted by The Alliance for Clinical Trials in Oncology as part of Exelixis’ collaboration with the National Cancer Institute’s Cancer Therapy Evaluation Program (NCI-CTEP).
...ist eine Labelerweiterung bei RCC aufgrund dieser ph2-Studie nicht ausgeschlossen:
1 INDICATIONS AND USAGE
CABOMETYX is indicated for the treatment of patients with advanced renal cell carcinoma (RCC)
who have received prior anti-angiogenic therapy.
Von Bedeutung ist natürlich das genaue Resultat, welches auf einem medizinischen Kongress präsentiert wird.
The final results from CABOSUN will be submitted for presentation at a future medical conference.
Auch der Partner Ipsen äußert sich und bringt Cabo als first line Treatment ins Gespräch.
http://us.lrd.yahoo.com/_ylt=AkOKaSRuiC1GjlJ5wQqE3S.HH8V_;_y…
http://us.lrd.yahoo.com/_ylt=AkOKaSRuiC1GjlJ5wQqE3S.HH8V_;_y…
Antwort auf Beitrag Nr.: 52.435.077 von cyberhexe123 am 18.05.16 23:37:17Auch wenn das verschiedene Forumsteilnehmer nicht wahrhaben wollen....
ville: "2. Auch der Abstract von cobi mit atezo, der in einer oralen Präsentation stattfinden wird, gibt null Hinweise auf das mögliche Kombi-Potential (oder Nicht-Potential) von Cobi mit Roche's anti-PD1 Antikörper. Wie schon geschrieben braucht es dazu eben einen Kontrollarm."
(oder Nicht-Potential) von Cobi mit Roche's anti-PD1 Antikörper. Wie schon geschrieben braucht es dazu eben einen Kontrollarm."
...ASCO Abstract 3502 Atezolizumab + Cobi zur Behandlung von Darmkrebs ist viel versprechend. Bin auf die Details der angekündigten Präsentation gespannt, und würde mich wundern, wenn da nicht bald auch eine Pivotalstudie initialisiert wird.
ville: "2. Auch der Abstract von cobi mit atezo, der in einer oralen Präsentation stattfinden wird, gibt null Hinweise auf das mögliche Kombi-Potential
 (oder Nicht-Potential) von Cobi mit Roche's anti-PD1 Antikörper. Wie schon geschrieben braucht es dazu eben einen Kontrollarm."
(oder Nicht-Potential) von Cobi mit Roche's anti-PD1 Antikörper. Wie schon geschrieben braucht es dazu eben einen Kontrollarm."...ASCO Abstract 3502 Atezolizumab + Cobi zur Behandlung von Darmkrebs ist viel versprechend. Bin auf die Details der angekündigten Präsentation gespannt, und würde mich wundern, wenn da nicht bald auch eine Pivotalstudie initialisiert wird.
Antwort auf Beitrag Nr.: 52.468.787 von cyberhexe123 am 24.05.16 20:01:58ville: "2. Auch der Abstract von cobi mit atezo, der in einer oralen Präsentation stattfinden wird, gibt null Hinweise auf das mögliche Kombi-Potential  (oder Nicht-Potential) von Cobi mit Roche's anti-PD1 Antikörper. Wie schon geschrieben braucht es dazu eben einen Kontrollarm."
(oder Nicht-Potential) von Cobi mit Roche's anti-PD1 Antikörper. Wie schon geschrieben braucht es dazu eben einen Kontrollarm."
Phase 1 Studien sind niemals Pivotalstudien sondern dienen der Prüfung der initialen Sicherheit bzw. Verträglichkeit und der Messung pharmakokinetischer Werte. Bei Studien mit onkologischen Wirkstoffen werden auch diese frühen Studien oft an Patienten (und nicht an gesunden Freiwilligen) durchgeführt, da die Verabreichung eines zytotoxischen Wirkstoffes an gesunde Freiwillige ethisch nicht vertretbar ist. Aber einen Kontrollarm in Phase 1? Sorry wenn ich dies in aller Deutlichkeit so schreibe, aber von klinischen Studien scheinst du nicht viel zu verstehen!
 (oder Nicht-Potential) von Cobi mit Roche's anti-PD1 Antikörper. Wie schon geschrieben braucht es dazu eben einen Kontrollarm."
(oder Nicht-Potential) von Cobi mit Roche's anti-PD1 Antikörper. Wie schon geschrieben braucht es dazu eben einen Kontrollarm."Phase 1 Studien sind niemals Pivotalstudien sondern dienen der Prüfung der initialen Sicherheit bzw. Verträglichkeit und der Messung pharmakokinetischer Werte. Bei Studien mit onkologischen Wirkstoffen werden auch diese frühen Studien oft an Patienten (und nicht an gesunden Freiwilligen) durchgeführt, da die Verabreichung eines zytotoxischen Wirkstoffes an gesunde Freiwillige ethisch nicht vertretbar ist. Aber einen Kontrollarm in Phase 1? Sorry wenn ich dies in aller Deutlichkeit so schreibe, aber von klinischen Studien scheinst du nicht viel zu verstehen!
Im Laufe des heutigen Tages wird das Protokoll des Monatstreffen des europ. Arzneimittelausschusses (CHMP) veröffentlicht (23.5.-26.5.2016). Bin gespannt, ob Neuigkeiten zum beschleunigten Zulassungsantrag von Cabo zur Behandlung des Nierenzellkarzinoms veröffentlicht werden. Auf der Agenda ist die "List of Questions":
3.3.1.
- cabozantinib EMEA/H/C/004163
Accelerated assessment
treatment of advanced renal cell carcinoma (RCC)
Scope: Day 120 list of questions
Action: For adoption
http://www.ema.europa.eu/docs/en_GB/document_library/Agenda/…
3.3.1.
- cabozantinib EMEA/H/C/004163
Accelerated assessment
treatment of advanced renal cell carcinoma (RCC)
Scope: Day 120 list of questions
Action: For adoption
http://www.ema.europa.eu/docs/en_GB/document_library/Agenda/…
Antwort auf Beitrag Nr.: 52.435.077 von cyberhexe123 am 18.05.16 23:37:17
Axel Grothey, renommierter Onkologe an der Mayo-Klinik in Rochester, Minnesota, hat auf den zitierten Abstract 3502 mit besonderer Bedeutung hingewiesen:
https://www.practiceupdate.com/content/asco-2016-dr-axel-gro…
Zitat von cyberhexe123: sieht gut aus auf den ersten Blick...ein zweiter Blick wird nötig sein. Aber zuerst gibt es noch weitere Abstracts zu sichten!
Abstract:
Background: Atezolizumab (atezo; MPDL3280A) is an engineered antibody that inhibits binding of PD-L1 to its receptors, PD-1 and B7.1. Atezo has demonstrated monotherapy activity in a multitude of human tumor types. However, response rates in microsatellite stable (MSS) CRCs have been lower than in other indications. In preclinical models, targeted inhibition of MEK leads to upregulation of MHC I on tumor cells, induces intratumoral T-cell infiltration and enhances anti-PDL1 activity. We therefore conducted a Phase Ib study combining cobi (MEK inhibitor) and atezo in patients (pts) with advanced solid tumors. Methods: Cobi was escalated from 20 to 60 mg daily (21 days on/7 days off) and combined with atezo 800 mg IV q2w. Tumor-specific expansion cohorts, including KRAS-mutant CRC, and serial biopsy cohorts in solid tumors were opened upon determination of the MTD. Safety, tolerability and confirmed ORR by RECIST v1.1 were evaluated. Results: As of October 12, 2015, 23 CRC (22 KRAS mutant, 1 WT) pts were enrolled during escalation and expansion. No dose-limiting toxicities were observed, and expansion occurred at atezo 800 mg q2w and cobi 60 mg. Median follow-up for safety in CRC pts was 3.78 mo (range, 1.1-11.7). The most common treatment-related AEs included diarrhea (69.6%), fatigue (52.2%), dermatitis acneiform (43.5%), rash (34.8%), maculopapular rash (26.1%), pruritus (26.1%) and nausea (26.1%). Incidence of treatment-related G3-4 AEs was 34.8%. The only treatment-related G3-4 AE in ≥ 2 pts was diarrhea (8.7%). No G5 AEs were reported. The ORR was 17% (4 PR, 5 SD). Three responses were ongoing (range, 4.0 to 7.7 mo at time of data cutoff). Three responders were mismatch repair-proficient, and 1 was unknown. Response was not associated with baseline PD-L1 expression. Results from the serial biopsy cohort showed enhanced PD-L1 upregulation, CD8 T-cell infiltration and MHC I expression on treatment, providing mechanistic rationale for the combination. Conclusions: The combination of cobi and atezo in CRC is well tolerated at the maximum administered doses. These results show that pts with MSS CRC can respond to the combination of cobi and atezo, and provide support for continued evaluation of the combination. Clinical trial information: NCT01988896
Axel Grothey, renommierter Onkologe an der Mayo-Klinik in Rochester, Minnesota, hat auf den zitierten Abstract 3502 mit besonderer Bedeutung hingewiesen:
https://www.practiceupdate.com/content/asco-2016-dr-axel-gro…
Antwort auf Beitrag Nr.: 52.499.344 von cyberhexe123 am 30.05.16 06:19:16Es würde mich wundern, wenn nicht bald eine Pivotalstudie von Atezolizumab+Cobimetinib zur Behandlung von CRC initialisert werden würde:
The purpose of this column is not to answer that question conclusively – since I am writing it prior to the June 5 data presentation. The only information released so far is the written abstract – but the data released certainly appears to be promising, at the very least at the scientific and abstract level!
Which abstract was everyone talking about?
Abstract 3502 “Clinical activity and safety of cobimetinib (cobi) and atezolizumab in colorectal cancer (CRC)”
https://adventuresinlivingterminallyoptimistic.com/2016/05/2…
The purpose of this column is not to answer that question conclusively – since I am writing it prior to the June 5 data presentation. The only information released so far is the written abstract – but the data released certainly appears to be promising, at the very least at the scientific and abstract level!
Which abstract was everyone talking about?
Abstract 3502 “Clinical activity and safety of cobimetinib (cobi) and atezolizumab in colorectal cancer (CRC)”
https://adventuresinlivingterminallyoptimistic.com/2016/05/2…
zu PI3K-delta-Hemmern...
...gibt es ein neues Patent für Exelixis:http://patft.uspto.gov/netacgi/nph-Parser?Sect1=PTO2&Sect2=H…
Antwort auf Beitrag Nr.: 52.470.178 von cyberhexe123 am 25.05.16 06:47:09
Auf diesen erneuten kleinen miesen Angriff auf meine Person werde ich nicht reagieren. Zeigt er doch nur welch geistig Kind du bist.
Zitat von cyberhexe123: ville: "2. Auch der Abstract von cobi mit atezo, der in einer oralen Präsentation stattfinden wird, gibt null Hinweise auf das mögliche Kombi-Potential(oder Nicht-Potential) von Cobi mit Roche's anti-PD1 Antikörper. Wie schon geschrieben braucht es dazu eben einen Kontrollarm."
Phase 1 Studien sind niemals Pivotalstudien sondern dienen der Prüfung der initialen Sicherheit bzw. Verträglichkeit und der Messung pharmakokinetischer Werte. Bei Studien mit onkologischen Wirkstoffen werden auch diese frühen Studien oft an Patienten (und nicht an gesunden Freiwilligen) durchgeführt, da die Verabreichung eines zytotoxischen Wirkstoffes an gesunde Freiwillige ethisch nicht vertretbar ist. Aber einen Kontrollarm in Phase 1? Sorry wenn ich dies in aller Deutlichkeit so schreibe, aber von klinischen Studien scheinst du nicht viel zu verstehen!
Auf diesen erneuten kleinen miesen Angriff auf meine Person werde ich nicht reagieren. Zeigt er doch nur welch geistig Kind du bist.
Antwort auf Beitrag Nr.: 52.499.344 von cyberhexe123 am 30.05.16 06:19:16Um eine moegliche Blendung unbedarfter User zu unterbinden: besagter Onkologe hat 19 abstracts und dabei nur abstracts in seinem Spezialisierungs-Feld Darmkrebs gewaehlt... also so herausragend wie es suggeriert wird ist diese Tatsache nicht. Cyberhexe mag teils gute Info liefern aber ich bleibe bei meiner Kritik: das Bild, das stets gezeichnet wird ist zu rosarot ... Ihren blind followern wird das ggfs weh tun. Ville Ende.
Antwort auf Beitrag Nr.: 52.509.875 von Ville7 am 31.05.16 15:33:11
...einfach bei den Fakten bleiben, dann werden auch deine Beiträge erträglicher. Deiner Meinung nach bringt Abstract 3502 Cobi+Atezolizumab "null Hinweise" ...
ville: "2. Auch der Abstract von cobi mit atezo, der in einer oralen Präsentation stattfinden wird, gibt null Hinweise auf das mögliche Kombi-Potential (oder Nicht-Potential) von Cobi mit Roche's anti-PD1 Antikörper. Wie schon geschrieben braucht es dazu eben einen Kontrollarm."
(oder Nicht-Potential) von Cobi mit Roche's anti-PD1 Antikörper. Wie schon geschrieben braucht es dazu eben einen Kontrollarm."
... hingegen ist dieser für prominente Onkologen "viel versprechend". Meine Einschätzung dieses Abstract mag man für blauäugig halten, aber ich würde mich wundern, wenn nicht bald eine Pivotalstudie bei Darmkrebs mit Cobi und Atezolizumab initialisiert wird.
Deine Analyse hingegen ("NULL HINWEISE") ist wie so oft (um nicht zu sagen immer) mehr als lächerlich - würdest du dich darauf beschränken, die Information unkommentiert zu melden, wäre das für alle von Vorteil! Du bist sicherlich einer der Gründe, weshalb die deutschen Investoren in den amerikanischen Foren als "the silly German investors" belächelt werden!
Zitat von Ville7: Um eine moegliche Blendung unbedarfter User zu unterbinden: besagter Onkologe hat 19 abstracts und dabei nur abstracts in seinem Spezialisierungs-Feld Darmkrebs gewaehlt... also so herausragend wie es suggeriert wird ist diese Tatsache nicht. Cyberhexe mag teils gute Info liefern aber ich bleibe bei meiner Kritik: das Bild, das stets gezeichnet wird ist zu rosarot ... Ihren blind followern wird das ggfs weh tun. Ville Ende.
...einfach bei den Fakten bleiben, dann werden auch deine Beiträge erträglicher. Deiner Meinung nach bringt Abstract 3502 Cobi+Atezolizumab "null Hinweise" ...
ville: "2. Auch der Abstract von cobi mit atezo, der in einer oralen Präsentation stattfinden wird, gibt null Hinweise auf das mögliche Kombi-Potential
 (oder Nicht-Potential) von Cobi mit Roche's anti-PD1 Antikörper. Wie schon geschrieben braucht es dazu eben einen Kontrollarm."
(oder Nicht-Potential) von Cobi mit Roche's anti-PD1 Antikörper. Wie schon geschrieben braucht es dazu eben einen Kontrollarm."... hingegen ist dieser für prominente Onkologen "viel versprechend". Meine Einschätzung dieses Abstract mag man für blauäugig halten, aber ich würde mich wundern, wenn nicht bald eine Pivotalstudie bei Darmkrebs mit Cobi und Atezolizumab initialisiert wird.
Deine Analyse hingegen ("NULL HINWEISE") ist wie so oft (um nicht zu sagen immer) mehr als lächerlich - würdest du dich darauf beschränken, die Information unkommentiert zu melden, wäre das für alle von Vorteil! Du bist sicherlich einer der Gründe, weshalb die deutschen Investoren in den amerikanischen Foren als "the silly German investors" belächelt werden!
Antwort auf Beitrag Nr.: 52.511.423 von cyberhexe123 am 31.05.16 18:34:57Deine Kommentare erzeugen jedes Mal einen Würgereiz in mir, da du der Meister der falschen Unterstellungen und an Arroganz von keinem im Netz zu überbieten bist.
Nochmal für dich Super-Hirn zum mitschreiben: der Abstract zu Cobi/Atezo gibt außer Phantasie nichts her, da eine Phase 1 Studie bezüglich Wirksamkeit einfach nichts hergibt. Man kann nicht sagen ob gut oder schlecht, weil es eine P1 ist (und dadurch eben keinen Kontrollarm hat). Du hast genau das mir Anfänger doch am 25.5. erklärt. (Finde ich übrigens gut, dass du mir genau das erklärt hast, was ich zuvor in diesem Sinne geschrieben habe , das zeigt mir, dass du es verstanden hast :laugh
, das zeigt mir, dass du es verstanden hast :laugh .
.
Und erneut verweigere ich für mich hier die rosa Brille: Bevor Roche sich nicht in eine gewisse Richtung äußert werde ich für mich nichts einpreisen.
PS: Es wäre schön, wenn du anderen Investoren ihre Meinung lässt und ihnen auch zugestehst, wie sie mit ihrem eigenen Spekulations- und Risikomanagement umgehen. Und sie nicht als dumm, unwissend, Anfänger und was auch immer beschimpfst.
Nochmal für dich Super-Hirn zum mitschreiben: der Abstract zu Cobi/Atezo gibt außer Phantasie nichts her, da eine Phase 1 Studie bezüglich Wirksamkeit einfach nichts hergibt. Man kann nicht sagen ob gut oder schlecht, weil es eine P1 ist (und dadurch eben keinen Kontrollarm hat). Du hast genau das mir Anfänger doch am 25.5. erklärt. (Finde ich übrigens gut, dass du mir genau das erklärt hast, was ich zuvor in diesem Sinne geschrieben habe
 , das zeigt mir, dass du es verstanden hast :laugh
, das zeigt mir, dass du es verstanden hast :laugh .
.Und erneut verweigere ich für mich hier die rosa Brille: Bevor Roche sich nicht in eine gewisse Richtung äußert werde ich für mich nichts einpreisen.
PS: Es wäre schön, wenn du anderen Investoren ihre Meinung lässt und ihnen auch zugestehst, wie sie mit ihrem eigenen Spekulations- und Risikomanagement umgehen. Und sie nicht als dumm, unwissend, Anfänger und was auch immer beschimpfst.
Antwort auf Beitrag Nr.: 52.512.098 von Ville7 am 31.05.16 20:04:33einfach bei den Fakten bleiben...für dich hat diese Phase 1-Studie NULL HINWEISE - weil du diese nicht lesen kannst - und dennoch beginnt jede Entwicklung in der Klinik mit einer solchen. Oft genug ist danach Schluss, weil das Ergebnis nicht viel versprechend ist. Dieses Ergebnis jedoch ist viel versprechend - nicht mehr und nicht weniger - und meine Prognose ist deshalb die bereits Geäusserte, dass demnächst eine Pivotalstudie in dieser Indikation mit genau dieser Wirkstoffkombination initialisiert wird. Selbstverständlich kann ich hierbei falsch liegen, jedoch sind die Ergebnisse zu viel versprechend, so dass ich davon überzeugt bin.
Aber dir fehlt in Phase 1 ein Kontrollarm ... das ist leider schon nicht mehr zum Lachen
Aus Gründen der Boardhygiene würde ich mir wünschen, dass du deine pubertären Beiträge im anderen Thread veröffentlichst. Aber das Leben ist wie so oft kein Wunschkonzert
Aber dir fehlt in Phase 1 ein Kontrollarm ... das ist leider schon nicht mehr zum Lachen

Aus Gründen der Boardhygiene würde ich mir wünschen, dass du deine pubertären Beiträge im anderen Thread veröffentlichst. Aber das Leben ist wie so oft kein Wunschkonzert

PS: Dass ich konkret deine Spekulation einer Ankündigung einer Weiterentwicklung oder P3 Studie (pivotal oder nicht) als "blauäugig" bezeichnet haben soll ist ebenso eine falsche Unterstellung.
PPS: dass bestimmte Onkologen etwas als "vielversprechend" bezeichnen, davon kann ich mir nichts kaufen. Das ist ebenso nur eine Spekulation dieser Onkologen auf 1. eine Weiterentwicklung seitens Roche (was ich auch für wahrscheinlich halte; wobei die Frage ist ob sie gleich -ohne POC- in eine pivotal P3 gehen) + Erfolg (das wird sich noch zeigen müssen).
PPS: dass bestimmte Onkologen etwas als "vielversprechend" bezeichnen, davon kann ich mir nichts kaufen. Das ist ebenso nur eine Spekulation dieser Onkologen auf 1. eine Weiterentwicklung seitens Roche (was ich auch für wahrscheinlich halte; wobei die Frage ist ob sie gleich -ohne POC- in eine pivotal P3 gehen) + Erfolg (das wird sich noch zeigen müssen).
Antwort auf Beitrag Nr.: 52.512.314 von cyberhexe123 am 31.05.16 20:23:36Jetzt kann ich zudem "nicht lesen" und bin "pubertär". Sehr schön, was dir an weiteren Attributen für mich "kompletten Anfänger" einfällt. Fühle mich geehrt. Hauptsache du Profi behälst jederzeit den Durchblick. Als DER Checker im Biotechbereich. Second to none!
Du langweilst mich mit deinen versuchten Verdrehungen. Ja eine P1 hat keinen Kontrollarm, das ist meistens so. P1 sind zumeist Sicherheitsstudien. Daher kann man eben die Wirksamkeit nicht beurteilen (und erhält nur erste Hinweise) und genau das sage ich, dass mir eine Phase 1 Studie nicht dafür ausreicht um euphorisch zu werden!
Aber halt: du kannst ja die Wirksamkeit auf Basis dieser Phase 1 Studie (ja ohne Kontrollarm) und den vorliegenden Abstract-Infos einschätzen. Auch dass es dafür ausreicht, dass Roche direkt in eine pivotal P3 springt... Glückwunsch, dass du das kannst!!
Ich will es nicht einschätzen, da ich es aus den Daten nicht ablesen kann. Daher bekommst du von mir NULL INFO (ich übersetze: null Lobgesang, null rosa Brille!). Daher warte ich offizielle Verlautbarungen von Roche ab. So jetzt habe ich es dir oft genug erklärt.
Frage an die anderen: Bin ich denn wirklich so schlecht zu verstehen?
PPS: Der Hygiene in diesem Thread täte es gut, wenn du mal bei dir selbst anfangen würdest.
Du langweilst mich mit deinen versuchten Verdrehungen. Ja eine P1 hat keinen Kontrollarm, das ist meistens so. P1 sind zumeist Sicherheitsstudien. Daher kann man eben die Wirksamkeit nicht beurteilen (und erhält nur erste Hinweise) und genau das sage ich, dass mir eine Phase 1 Studie nicht dafür ausreicht um euphorisch zu werden!
Aber halt: du kannst ja die Wirksamkeit auf Basis dieser Phase 1 Studie (ja ohne Kontrollarm) und den vorliegenden Abstract-Infos einschätzen. Auch dass es dafür ausreicht, dass Roche direkt in eine pivotal P3 springt... Glückwunsch, dass du das kannst!!
Ich will es nicht einschätzen, da ich es aus den Daten nicht ablesen kann. Daher bekommst du von mir NULL INFO (ich übersetze: null Lobgesang, null rosa Brille!). Daher warte ich offizielle Verlautbarungen von Roche ab. So jetzt habe ich es dir oft genug erklärt.
Frage an die anderen: Bin ich denn wirklich so schlecht zu verstehen?
PPS: Der Hygiene in diesem Thread täte es gut, wenn du mal bei dir selbst anfangen würdest.
Antwort auf Beitrag Nr.: 52.512.473 von Ville7 am 31.05.16 20:43:07ville schrieb: Jetzt kann ich zudem "nicht lesen" und bin "pubertär".
du kannst die Ergebnisse von klinischen Studien nicht lesen im Sinne von nicht verstehen - das hast du nun zu oft unter Beweis gestellt! Wer Kontrollarme in Phase 1-Studien vermisst, sollte sich nicht über ein Anfänger-Image wundern!
Wie würdest du folgende Zitate von dir einordnen? erwachsen? "Auf diesen erneuten kleinen miesen Angriff"... "Deine Kommentare erzeugen jedes Mal einen Würgereiz in mir"..."Für mich bist du hinter deiner Fassade nur ein großes Ego ohne Fähigkeit auf die Downsides zu schauen und ein mieser kleiner Pumper, der anderen nur die Upsides suggeriert."..."Der "shameless pumper" namens Cyberhexe ist zurück."..."wie ihre überall im Internet krankhaft angestrebte Meinungsführerschaft flöten geht."
"Auf diesen erneuten kleinen miesen Angriff"... "Deine Kommentare erzeugen jedes Mal einen Würgereiz in mir"..."Für mich bist du hinter deiner Fassade nur ein großes Ego ohne Fähigkeit auf die Downsides zu schauen und ein mieser kleiner Pumper, der anderen nur die Upsides suggeriert."..."Der "shameless pumper" namens Cyberhexe ist zurück."..."wie ihre überall im Internet krankhaft angestrebte Meinungsführerschaft flöten geht."
Es wäre mir wirklich sehr angenehm, wenn du dich mit derartigen pubertären Redewendungen auf den anderen Thread beschränken könntest.
du kannst die Ergebnisse von klinischen Studien nicht lesen im Sinne von nicht verstehen - das hast du nun zu oft unter Beweis gestellt! Wer Kontrollarme in Phase 1-Studien vermisst, sollte sich nicht über ein Anfänger-Image wundern!
Wie würdest du folgende Zitate von dir einordnen? erwachsen?
 "Auf diesen erneuten kleinen miesen Angriff"... "Deine Kommentare erzeugen jedes Mal einen Würgereiz in mir"..."Für mich bist du hinter deiner Fassade nur ein großes Ego ohne Fähigkeit auf die Downsides zu schauen und ein mieser kleiner Pumper, der anderen nur die Upsides suggeriert."..."Der "shameless pumper" namens Cyberhexe ist zurück."..."wie ihre überall im Internet krankhaft angestrebte Meinungsführerschaft flöten geht."
"Auf diesen erneuten kleinen miesen Angriff"... "Deine Kommentare erzeugen jedes Mal einen Würgereiz in mir"..."Für mich bist du hinter deiner Fassade nur ein großes Ego ohne Fähigkeit auf die Downsides zu schauen und ein mieser kleiner Pumper, der anderen nur die Upsides suggeriert."..."Der "shameless pumper" namens Cyberhexe ist zurück."..."wie ihre überall im Internet krankhaft angestrebte Meinungsführerschaft flöten geht."Es wäre mir wirklich sehr angenehm, wenn du dich mit derartigen pubertären Redewendungen auf den anderen Thread beschränken könntest.
Antwort auf Beitrag Nr.: 52.513.655 von cyberhexe123 am 31.05.16 23:35:001. zu der neuerlichen Wiederholung der Verdrehung deinerseits: 'ohne Worte'
2. zu diesen aus dem Zusammenhang genommenen Zitaten stehe ich voll und ganz; sie hatten und haben im jeweiligen Kontext und teilweise im Gesamten ihre volle Berechtigung.
2. zu diesen aus dem Zusammenhang genommenen Zitaten stehe ich voll und ganz; sie hatten und haben im jeweiligen Kontext und teilweise im Gesamten ihre volle Berechtigung.
so schnell hätte ich ehrlicherweise die Pivotalstudie zu Cobi+Atezolizumab bei CRC nicht erwartet:
http://finance.yahoo.com/mbview/threadview/?&bn=a3fc981a-f45…
https://clinicaltrials.gov/ct2/show/NCT02788279?term=cobimet…
...bin mal gespannt, ob demnächst noch weitere Pivotalstudien initialisiert werden.
http://finance.yahoo.com/mbview/threadview/?&bn=a3fc981a-f45…
https://clinicaltrials.gov/ct2/show/NCT02788279?term=cobimet…
...bin mal gespannt, ob demnächst noch weitere Pivotalstudien initialisiert werden.
Antwort auf Beitrag Nr.: 52.509.875 von Ville7 am 31.05.16 15:33:11
...nun, die Pivotalstudie ist relativ schnell gekommen und der einzig Unbedarfte ist wohl der Verfasser des zitierten Beitrages #52.509.875
Wenn du etwas Anstand hättest, dann würde dir wenigstens ein kleines "mea culpa" möglich sein. Aber das würde mich schon sehr überraschen!
Zitat von Ville7: Um eine moegliche Blendung unbedarfter User zu unterbinden: besagter Onkologe hat 19 abstracts und dabei nur abstracts in seinem Spezialisierungs-Feld Darmkrebs gewaehlt... also so herausragend wie es suggeriert wird ist diese Tatsache nicht. Cyberhexe mag teils gute Info liefern aber ich bleibe bei meiner Kritik: das Bild, das stets gezeichnet wird ist zu rosarot ... Ihren blind followern wird das ggfs weh tun. Ville Ende.
...nun, die Pivotalstudie ist relativ schnell gekommen und der einzig Unbedarfte ist wohl der Verfasser des zitierten Beitrages #52.509.875
Wenn du etwas Anstand hättest, dann würde dir wenigstens ein kleines "mea culpa" möglich sein. Aber das würde mich schon sehr überraschen!
Antwort auf Beitrag Nr.: 52.528.772 von cyberhexe123 am 02.06.16 18:17:54
Wieso sollte ich mich bei dir entschuldigen? Nur weil deine viel zu reißerisch vorgetragene Vorabspekulation diesmal aufging? Hast du dich bei allen auch artig entschuldigt, dass seit deiner Threaderöffnung vieles in die Hose ging und du fleissig gepumpt hattest? Ich hoffe doch...
Du solltest dich bei mir entschuldigen, weil du es nicht akzeptierst, dass ich etwas für mich erst einpreise, wenn ich die "Action" von Roche sehe und meine Aussagen ständig verdrehst.
Ich hab keine Lust für dich noch mehr rauszusuchen um deine Verdrehungen zu widerlegen. Kann jeder selbst nachlesen, dass ich nie gesagt habe, dass Cobi scheitern wird. Für mich ist das weiterhin (inzwischen noch weit besseres) Upside. Bevor EXEL damit signifikant über den Break Even geht ( Cobi macht für EXEL in 2016 in der Co-Vermarktung Millionenverluste) braucht es wohl noch mind. bis 2020.
Ich bleibe dabei: Cabo hat für EXEL größeres Potential als für Cobi. Und wenn Cobi erste P3 Ergebnisse liefert werde ich sehr wahrscheinlich kein Investor von EXEL mehr und längst weitergezogen sein.
Ich habe jetzt aber echt keine Lust mehr mit dir unmöglichen Person meine Zeit zu verschwenden. Jetzt darfst du nochmal ganz fies über mich herziehen, ohne dass ich darauf eingehe. Bitte schön, das Feld ist frei für dich.
Zitat von cyberhexe123: ...nun, die Pivotalstudie ist relativ schnell gekommen und der einzig Unbedarfte ist wohl der Verfasser des zitierten Beitrages #52.509.875
Wenn du etwas Anstand hättest, dann würde dir wenigstens ein kleines "mea culpa" möglich sein. Aber das würde mich schon sehr überraschen!
Wieso sollte ich mich bei dir entschuldigen? Nur weil deine viel zu reißerisch vorgetragene Vorabspekulation diesmal aufging? Hast du dich bei allen auch artig entschuldigt, dass seit deiner Threaderöffnung vieles in die Hose ging und du fleissig gepumpt hattest? Ich hoffe doch...
Du solltest dich bei mir entschuldigen, weil du es nicht akzeptierst, dass ich etwas für mich erst einpreise, wenn ich die "Action" von Roche sehe und meine Aussagen ständig verdrehst.
Zitat von Ville7: Ich will es nicht einschätzen, da ich es aus den Daten nicht ablesen kann. Daher bekommst du von mir NULL INFO (ich übersetze: null Lobgesang, null rosa Brille!). Daher warte ich offizielle Verlautbarungen von Roche ab. So jetzt habe ich es dir oft genug erklärt.
Ich hab keine Lust für dich noch mehr rauszusuchen um deine Verdrehungen zu widerlegen. Kann jeder selbst nachlesen, dass ich nie gesagt habe, dass Cobi scheitern wird. Für mich ist das weiterhin (inzwischen noch weit besseres) Upside. Bevor EXEL damit signifikant über den Break Even geht ( Cobi macht für EXEL in 2016 in der Co-Vermarktung Millionenverluste) braucht es wohl noch mind. bis 2020.
Ich bleibe dabei: Cabo hat für EXEL größeres Potential als für Cobi. Und wenn Cobi erste P3 Ergebnisse liefert werde ich sehr wahrscheinlich kein Investor von EXEL mehr und längst weitergezogen sein.
Ich habe jetzt aber echt keine Lust mehr mit dir unmöglichen Person meine Zeit zu verschwenden. Jetzt darfst du nochmal ganz fies über mich herziehen, ohne dass ich darauf eingehe. Bitte schön, das Feld ist frei für dich.
Antwort auf Beitrag Nr.: 52.399.803 von cyberhexe123 am 13.05.16 10:08:0913.05.16 10:08:09
Antwort 52.399.803 von ville:
2. ich werde einen Teufel tun und meine Postings auf irgendwelche Threads oder die eigenen zu beschränken. Das hier ist ein offenes Forum. Wem's nicht passt, der soll eben einen Blog ohne Kommentarfunktion schreiben. Viel Spaß dabei!
...nun , wenn du jetzt einverstanden bist, dann würde ich meine Beiträge auf meinen Thread beschränken! Du hingegen hälst dich fern - WARUM NICHT GLEICH SO?
Zitat von cyberhexe123: in meinem Beitrag wird überhaupt nichts suggeriert, es werden lediglich die verschiedenen Möglichkeiten aufgezeigt, die eine Anwendung eines MEK-Hemmers zulassen, die da wären:
1.) Hemmung innerhalb des gleichen Signalwege (gemeinsam mit Vemurafenib zur Behandlung von mMelanoma --> bereits zugelassen)
2.) Hemmung eines parallelen Signalweges --> Hemmung der Angiogenese
3.) Verbesserung der Immunantwort - Hemmer des MEK-Signalweges können die antitumorale Reaktion der immunologiosch wirksamen Antikörper ("Checkpint-Hemmer") synergistisch beeinflussen
4.) den plötzlichen Zelltod fördernd
Cobi ist, wenn ich mich recht erinnere, der einzige MEK-Hemmer in der Klinik von Roche/Genentech. Ich habe jedoch nie von einer "erleuchteten Ergänzung" gesprochen, lediglich die verschiedenen Möglichkeiten aufgezeigt, die beispw. schon Anfangs Juni bei ASCO einer wissenschaftlichen Beurteilung ausgesetzt sein werden -->
Oral Presentation:
[3502] “Clinical activity and safety of cobimetinib (cobi) and atezolizumab in colorectal cancer (CRC).”
Dr. Johanna Bendell, Sarah Cannon Research Institute, Nashville, Tennessee
Oral Abstract Session: Gastrointestinal (Colorectal) Cancer
Oral presentation on Sunday, June 5, 8 – 11 a.m., Hall B1 (abstract scheduled for 8:24 – 8:36 a.m.)
Aber das ist halt dein Stil: Halbwahrheiten verbreiten (die besseren deiner Beiträge sind meistens aus YMB -meistens fehlerhaft- abgeschrieben; deine Reputation dort ist übrigens sehr bescheiden!), waghalsige Schlussfolgerungen präsentieren und zu guter letzt immer wiederkehrend Unterstellungen (siehe oben) vorzunehmen.
Da es nun 2 Foren zu Exelixis gibt, würde ich vorschlagen, dass wir uns zukünfitg aus dem Weg gehen. Auf diese Form der Auseinandersetzung habe ich nämlich keine Lust.
Antwort 52.399.803 von ville:
2. ich werde einen Teufel tun und meine Postings auf irgendwelche Threads oder die eigenen zu beschränken. Das hier ist ein offenes Forum. Wem's nicht passt, der soll eben einen Blog ohne Kommentarfunktion schreiben. Viel Spaß dabei!
...nun , wenn du jetzt einverstanden bist, dann würde ich meine Beiträge auf meinen Thread beschränken! Du hingegen hälst dich fern - WARUM NICHT GLEICH SO?
Antwort auf Beitrag Nr.: 52.529.165 von cyberhexe123 am 02.06.16 19:23:20
Nein, ich bin nicht einverstanden. Ich kann zwar gerne auf deine Kommentare in dem von mir eröffneten Thread verzichten, denn es zwingt dich keiner die Messages eines unseriösen Anfängers zu lesen.
Ich lasse mir von dir keinen Maulkorb verpassen. Du wirst auch in deinem Thread keine Narrenfreiheit haben. Wenn du das Konzept von W : O nicht akzeptierst, dann eröffne einen Blog und deaktiviere die Kommentarfunktion.
Zitat von cyberhexe123: 13.05.16 10:08:09
Zitat von cyberhexe123: in meinem Beitrag wird überhaupt nichts suggeriert, es werden lediglich die verschiedenen Möglichkeiten aufgezeigt, die eine Anwendung eines MEK-Hemmers zulassen, die da wären:
1.) Hemmung innerhalb des gleichen Signalwege (gemeinsam mit Vemurafenib zur Behandlung von mMelanoma --> bereits zugelassen)
2.) Hemmung eines parallelen Signalweges --> Hemmung der Angiogenese
3.) Verbesserung der Immunantwort - Hemmer des MEK-Signalweges können die antitumorale Reaktion der immunologiosch wirksamen Antikörper ("Checkpint-Hemmer") synergistisch beeinflussen
4.) den plötzlichen Zelltod fördernd
Cobi ist, wenn ich mich recht erinnere, der einzige MEK-Hemmer in der Klinik von Roche/Genentech. Ich habe jedoch nie von einer "erleuchteten Ergänzung" gesprochen, lediglich die verschiedenen Möglichkeiten aufgezeigt, die beispw. schon Anfangs Juni bei ASCO einer wissenschaftlichen Beurteilung ausgesetzt sein werden -->
Oral Presentation:
[3502] “Clinical activity and safety of cobimetinib (cobi) and atezolizumab in colorectal cancer (CRC).”
Dr. Johanna Bendell, Sarah Cannon Research Institute, Nashville, Tennessee
Oral Abstract Session: Gastrointestinal (Colorectal) Cancer
Oral presentation on Sunday, June 5, 8 – 11 a.m., Hall B1 (abstract scheduled for 8:24 – 8:36 a.m.)
Aber das ist halt dein Stil: Halbwahrheiten verbreiten (die besseren deiner Beiträge sind meistens aus YMB -meistens fehlerhaft- abgeschrieben; deine Reputation dort ist übrigens sehr bescheiden!), waghalsige Schlussfolgerungen präsentieren und zu guter letzt immer wiederkehrend Unterstellungen (siehe oben) vorzunehmen.
Da es nun 2 Foren zu Exelixis gibt, würde ich vorschlagen, dass wir uns zukünfitg aus dem Weg gehen. Auf diese Form der Auseinandersetzung habe ich nämlich keine Lust.
Antwort 52.399.803 von ville:
2. ich werde einen Teufel tun und meine Postings auf irgendwelche Threads oder die eigenen zu beschränken. Das hier ist ein offenes Forum. Wem's nicht passt, der soll eben einen Blog ohne Kommentarfunktion schreiben. Viel Spaß dabei!
...nun , wenn du jetzt einverstanden bist, dann würde ich meine Beiträge auf meinen Thread beschränken! Du hingegen hälst dich fern - WARUM NICHT GLEICH SO?
Nein, ich bin nicht einverstanden. Ich kann zwar gerne auf deine Kommentare in dem von mir eröffneten Thread verzichten, denn es zwingt dich keiner die Messages eines unseriösen Anfängers zu lesen.
Ich lasse mir von dir keinen Maulkorb verpassen. Du wirst auch in deinem Thread keine Narrenfreiheit haben. Wenn du das Konzept von W : O nicht akzeptierst, dann eröffne einen Blog und deaktiviere die Kommentarfunktion.
Beitrag zu dieser Diskussion schreiben
Zu dieser Diskussion können keine Beiträge mehr verfasst werden, da der letzte Beitrag vor mehr als zwei Jahren verfasst wurde und die Diskussion daraufhin archiviert wurde.
Bitte wenden Sie sich an feedback@wallstreet-online.de und erfragen Sie die Reaktivierung der Diskussion oder starten Sie eine neue Diskussion.
Investoren beobachten auch:
| Wertpapier | Perf. % |
|---|---|
| +2,80 | |
| -5,17 | |
| +0,79 | |
| +9,23 | |
| +3,16 | |
| -2,66 | |
| +8,91 | |
| +2,13 | |
| +0,94 | |
| -0,32 |
Meistdiskutiert
| Wertpapier | Beiträge | |
|---|---|---|
| 207 | ||
| 119 | ||
| 59 | ||
| 50 | ||
| 46 | ||
| 39 | ||
| 38 | ||
| 30 | ||
| 30 | ||
| 28 |
01.04.24 · wO Chartvergleich · Consolidated Water |
29.03.24 · wO Chartvergleich · Consolidated Water |
28.03.24 · wO Chartvergleich · Energiekontor |





















