+++ Trevena +++ Revolution in der Schmerztherapie? (Seite 139)
eröffnet am 04.01.18 20:37:22 von
neuester Beitrag 03.02.24 08:02:54 von
neuester Beitrag 03.02.24 08:02:54 von
Beiträge: 2.375
ID: 1.270.862
ID: 1.270.862
Aufrufe heute: 0
Gesamt: 280.117
Gesamt: 280.117
Aktive User: 0
ISIN: US89532E2081 · WKN: A3DWN1 · Symbol: TRVN
0,4095
USD
+2,38 %
+0,0095 USD
Letzter Kurs 02.05.24 Nasdaq
Werte aus der Branche Biotechnologie
| Wertpapier | Kurs | Perf. % |
|---|---|---|
| 3,3000 | +70,98 | |
| 1,7850 | +42,80 | |
| 1,7200 | +35,43 | |
| 1,0700 | +31,13 | |
| 5,8700 | +26,24 |
| Wertpapier | Kurs | Perf. % |
|---|---|---|
| 0,7500 | -16,67 | |
| 23,300 | -16,67 | |
| 0,5305 | -17,51 | |
| 3,5000 | -26,24 | |
| 11,500 | -29,23 |
Beitrag zu dieser Diskussion schreiben
nächste Widerstände 1,06 $ 1,22 $

druck unterm Deckel
Antwort auf Beitrag Nr.: 62.412.374 von flyingbeef am 17.01.20 22:44:21beim letzten AC wurden Wirkung/Nutzen/Missbrauch schon intensiv diskutiert; diesbezüglich wurden keine weiteren Aktivitäten innerhalb des CRL eingefordert wurden, sondern lediglich diverse Abklärungen bei Nebenwirkungen und Metaboliten. Weil die innerhalb des CRL zitierten offenen Fragen nun eindeutig geklärt sind bzw. die Bedenken hinsichtlich Kardiotox ausgeräumt wurden, macht es aus meiner Sicht wenig Sinn eine Expertenrunde noch einmal einzuberufen, um über diese neuen Erkenntnisse zu diskutieren. Und ob eine Wiederholung der Diskussion hinsichtlich Missbrauch und Suchpotenzial einen zusätzlichen Erkenntnisgewinn zu leisten vermag, möchte ich doch sehr bezweifeln. Deswegen bin ich mir ziemlich sicher, dass kein weiteres AC zu Oli einberufen wird.
Wegen dem Thema Adcom tauscht man sich auf Stockwits auch recht "aktiv" aus.
Viele denken es wird keine geben.
Es gibt aber auch Stimmen die darauf wetten dass es wieder ein Adcom geben wird/muss.
Jedoch auch dijenigen die das sagen sind davon überzeugt das Trevena diesmal auch bei einem Adcom sehr gute Chancen hat die Überwiegende und wichtige Mehrheit zu überzeugen und ordnen daher solch ein Verfahren nicht als Gefahr ein.
Begründung warum es nochmals trotz CRL Erfüllung ein Adcom geben muss ist die politische Brisanz die das Thema Opioide inne hat. Daher schätzen einige dass es sozusagen diesen zusätzlichen "Baustein" benötigt, um dem Medikament später auch genügend Rückendwind zu geben so dass Kritiker so wenig Angriffsfläche wie möglich haben und man öffentlich behaupten kann man hatte alle Register bei der Zulassung gezogen und wirklich seehr verantwortungsvoll geprüft. So meine Interpretation aus dem ganzen.
Fazit:
Adcom wäre aus Sicht derer die damit rechnen kein Hals und Beinbruch und wenn es angekündigt werden sollte könnte man das auch als zusätzliche Starthilfe einordnen. Das Risiko dass sowas mit sich bringt ist dann wohl auch gewollt da es dieser "Absegnung" Bedarf um in aktueller Situation so einen Wirkstoff mit ausreichend Marktakzeptanz auszustatten. Es nützt ja nichts das zuzulassen und später traut sich keiner es richtig einzusetzen weil zu viele das ganze leicht angreifen und anzweifeln können.
Daher auch wenn es dazu kommt würde ich nicht in Panik verfallen und das sogar als notwendigen Baustein betrachten.
Viele denken es wird keine geben.
Es gibt aber auch Stimmen die darauf wetten dass es wieder ein Adcom geben wird/muss.
Jedoch auch dijenigen die das sagen sind davon überzeugt das Trevena diesmal auch bei einem Adcom sehr gute Chancen hat die Überwiegende und wichtige Mehrheit zu überzeugen und ordnen daher solch ein Verfahren nicht als Gefahr ein.
Begründung warum es nochmals trotz CRL Erfüllung ein Adcom geben muss ist die politische Brisanz die das Thema Opioide inne hat. Daher schätzen einige dass es sozusagen diesen zusätzlichen "Baustein" benötigt, um dem Medikament später auch genügend Rückendwind zu geben so dass Kritiker so wenig Angriffsfläche wie möglich haben und man öffentlich behaupten kann man hatte alle Register bei der Zulassung gezogen und wirklich seehr verantwortungsvoll geprüft. So meine Interpretation aus dem ganzen.
Fazit:
Adcom wäre aus Sicht derer die damit rechnen kein Hals und Beinbruch und wenn es angekündigt werden sollte könnte man das auch als zusätzliche Starthilfe einordnen. Das Risiko dass sowas mit sich bringt ist dann wohl auch gewollt da es dieser "Absegnung" Bedarf um in aktueller Situation so einen Wirkstoff mit ausreichend Marktakzeptanz auszustatten. Es nützt ja nichts das zuzulassen und später traut sich keiner es richtig einzusetzen weil zu viele das ganze leicht angreifen und anzweifeln können.
Daher auch wenn es dazu kommt würde ich nicht in Panik verfallen und das sogar als notwendigen Baustein betrachten.
Nach Erhalt des CRL im November 2018 gab es Ende Januar 2019 ein Treffen mit der FDA, bei welchem die weiteren Schritte zur Evaluierung von zusätzlich benötigten Daten festgelegt wurden.
CHESTERBROOK, Pa., Jan. 28, 2019 (GLOBE NEWSWIRE) -- Trevena, Inc. (TRVN) today announced the receipt of the official Type A meeting minutes from the U.S. Food and Drug Administration (FDA) regarding the Complete Response Letter (CRL) received for the oliceridine New Drug Application (NDA).
FDA has agreed that the Company’s current safety database will support labeling at a maximum daily dose of 27 mg.
FDA also has agreed that the Company can conduct a study in healthy volunteers to collect the requested QT interval data and that the study should include placebo- and positive-control arms. The Company intends to submit a detailed protocol and analysis plan to FDA shortly and, following receipt of FDA feedback, anticipates initiating this study in the first half of this year. The Company is not required to provide any additional efficacy data to resubmit the oliceridine NDA.
“We are encouraged by the productive discussion with FDA, which we believe has provided a path to resubmit the oliceridine NDA,” said Carrie L. Bourdow, President and Chief Executive Officer. “We remain committed to our mission of ensuring access to safe and effective treatment options for hospital patients who require an IV opioid to manage their moderate to severe acute pain.”
To address other items in the CRL, FDA has indicated that the Company should include supporting nonclinical data related to the characterization of the 9662 metabolite and the remaining product validation reports when the oliceridine NDA is resubmitted.
Die wichtigste Konsequenz war die Initialisierung der QTc-Studie bei gesunden Freiwilligen gegenüber Plazebo. Das Ergebnis dieser Studie wurde mit Pressemitteilung vom 4.11.2019 der Öffentlichkeit mitgeteilt:
Recent Corporate Highlights:
Completed multi-dose QT study for oliceridine. No accumulation of effect was observed on the QT interval. A small, transient effect, consistent with that observed in the single-dose QT study, began dissipating after 12 hours and was absent at the end of the 24-hour study period despite repeated dosing of oliceridine.
Oliceridine was well tolerated, with 59 subjects receiving the 27 mg maximum daily dose. There were no serious adverse events.
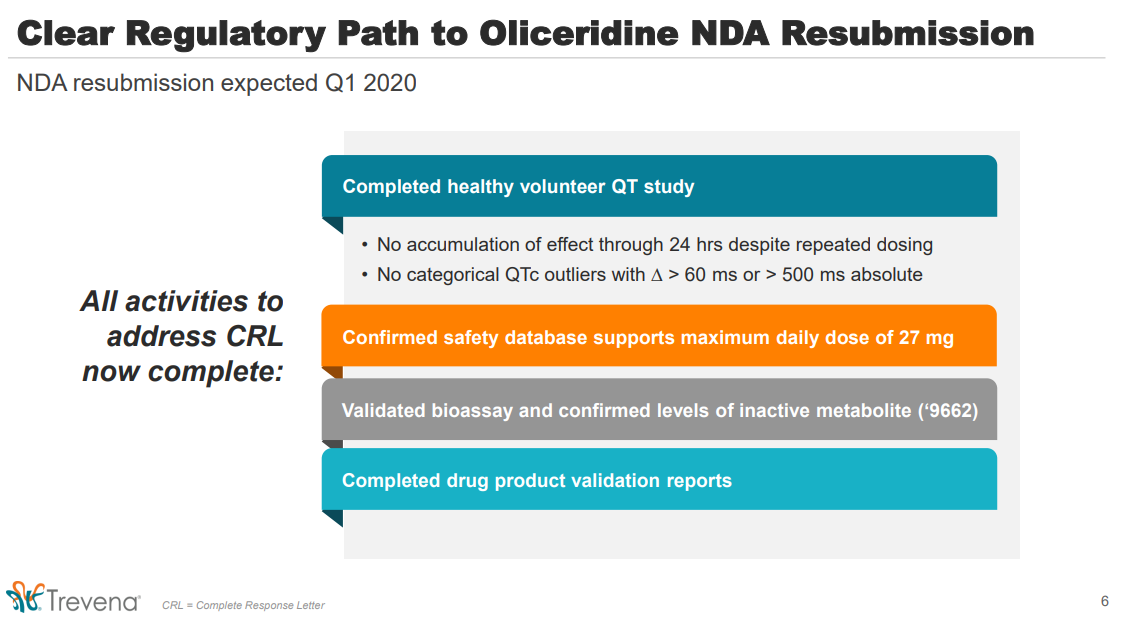
Und weil alle im CRL (Complete Response Letter) aufgeführten Mängel erfüllt wurden und sich daraus (QTc-Studie) keine Risiken ableiten, müssten nun alle Voraussetzungen des SPA (Special Protocol Assessment) erfüllt sein, so dass die FDA keine andere Wahl hat, als Oliceridine die Zulassung zu erteilen. Deswegen wäre auch die Einberufung eines weiteren AC (Advisory Committee) eine Riesenüberraschung. Je mehr ich in die Unterlagen "reingehe" umso überzeugter bin ich, dass Oli zugelassen wird.
TIME WILL TELL!
ch
CHESTERBROOK, Pa., Jan. 28, 2019 (GLOBE NEWSWIRE) -- Trevena, Inc. (TRVN) today announced the receipt of the official Type A meeting minutes from the U.S. Food and Drug Administration (FDA) regarding the Complete Response Letter (CRL) received for the oliceridine New Drug Application (NDA).
FDA has agreed that the Company’s current safety database will support labeling at a maximum daily dose of 27 mg.
FDA also has agreed that the Company can conduct a study in healthy volunteers to collect the requested QT interval data and that the study should include placebo- and positive-control arms. The Company intends to submit a detailed protocol and analysis plan to FDA shortly and, following receipt of FDA feedback, anticipates initiating this study in the first half of this year. The Company is not required to provide any additional efficacy data to resubmit the oliceridine NDA.
“We are encouraged by the productive discussion with FDA, which we believe has provided a path to resubmit the oliceridine NDA,” said Carrie L. Bourdow, President and Chief Executive Officer. “We remain committed to our mission of ensuring access to safe and effective treatment options for hospital patients who require an IV opioid to manage their moderate to severe acute pain.”
To address other items in the CRL, FDA has indicated that the Company should include supporting nonclinical data related to the characterization of the 9662 metabolite and the remaining product validation reports when the oliceridine NDA is resubmitted.
Die wichtigste Konsequenz war die Initialisierung der QTc-Studie bei gesunden Freiwilligen gegenüber Plazebo. Das Ergebnis dieser Studie wurde mit Pressemitteilung vom 4.11.2019 der Öffentlichkeit mitgeteilt:
Recent Corporate Highlights:
Completed multi-dose QT study for oliceridine. No accumulation of effect was observed on the QT interval. A small, transient effect, consistent with that observed in the single-dose QT study, began dissipating after 12 hours and was absent at the end of the 24-hour study period despite repeated dosing of oliceridine.
Oliceridine was well tolerated, with 59 subjects receiving the 27 mg maximum daily dose. There were no serious adverse events.

Und weil alle im CRL (Complete Response Letter) aufgeführten Mängel erfüllt wurden und sich daraus (QTc-Studie) keine Risiken ableiten, müssten nun alle Voraussetzungen des SPA (Special Protocol Assessment) erfüllt sein, so dass die FDA keine andere Wahl hat, als Oliceridine die Zulassung zu erteilen. Deswegen wäre auch die Einberufung eines weiteren AC (Advisory Committee) eine Riesenüberraschung. Je mehr ich in die Unterlagen "reingehe" umso überzeugter bin ich, dass Oli zugelassen wird.
TIME WILL TELL!
ch
Antwort auf Beitrag Nr.: 62.406.029 von flyingbeef am 17.01.20 13:16:35Dann sind wir uns doch alle einig :-)
Ich wollte Oliceridin auch nicht schlecht reden (bin ja selbst investiert), aber du hattest ja gezielt nach den Punkten gefragt, die evtl. zu der niedrigen Bewertung am Markt beitragen.
Ich hoffe und gehe eigentlich davon aus, dass wir kein weiteres Adcom benötigen. Wenn doch, stellt das sicher nochmal ein Risiko dar. Schon 2018 wurden einerseits die geringeren Nebenwirkungen hinterfragt (Stichwort: waren die Dosen von Morphin und Oliceridin wirkungsgleich?) und andererseits kritisiert, dass geringere Nebenwirkungen die Wahrscheinlichkeit von Missbrauch erhöhen. Fast wie ein Hexenprozess. Wenn sie nun partout keine Opiate mehr zulassen wollen, können sie also immer einen Strick drehen. Möglicherweise befürchten sie inzwischen sogar, die Ärzte könnten sich das Zeug selbst spritzen.
Dieses Risiko sollte einem Anleger bewusst sein, aber ich schätze es als eher gering ein, weil ich grundsätzlich (wie Cyberhexe auch) der FDA vertraue, dass sie korrekt und gründlich arbeitet.
Ich wollte Oliceridin auch nicht schlecht reden (bin ja selbst investiert), aber du hattest ja gezielt nach den Punkten gefragt, die evtl. zu der niedrigen Bewertung am Markt beitragen.
Ich hoffe und gehe eigentlich davon aus, dass wir kein weiteres Adcom benötigen. Wenn doch, stellt das sicher nochmal ein Risiko dar. Schon 2018 wurden einerseits die geringeren Nebenwirkungen hinterfragt (Stichwort: waren die Dosen von Morphin und Oliceridin wirkungsgleich?) und andererseits kritisiert, dass geringere Nebenwirkungen die Wahrscheinlichkeit von Missbrauch erhöhen. Fast wie ein Hexenprozess. Wenn sie nun partout keine Opiate mehr zulassen wollen, können sie also immer einen Strick drehen. Möglicherweise befürchten sie inzwischen sogar, die Ärzte könnten sich das Zeug selbst spritzen.
Dieses Risiko sollte einem Anleger bewusst sein, aber ich schätze es als eher gering ein, weil ich grundsätzlich (wie Cyberhexe auch) der FDA vertraue, dass sie korrekt und gründlich arbeitet.
@ opportoni @cyberhexe
Danke für eure Sichtweisen ist sehr hilfreich das aktuell aus unterschiedlichen Gesichtspunkte zu betrachten.
Was ich so aus den "alten" Pressemitteilungen herausfiltern konnte ist in Summe eigentlich relativ einhellig egal aus welcher Perspektive dazu etwas geschrieben wurde dass dieses neue Medikament sehr wohl "erwünscht" ist und auch seine Chance bekommen soll, sollte die Firma Ihre Ergebnisse noch weiter verfeinern und untermauern. Dies haben Sie aus meiner Sicht sehr wohl die letzten Monate getan und sind dazu nun in der Lage. Denke auch das hier bewusst etwas auf Zeit gespielt werden sollte so das sich die Opiat"-aufregung" etwas bis zum neuen Verfahren legt.
Abseits dessen wie "durchschlagend" nun sag ich mal der Vorteil bei Nebenwirkungen und Suchtpotential ist, konnten Sie aber auch nachweisen das bei geringerer Dosierung wesentlich schneller z.B. Schmerzreduktion usw. erreicht werden kann was ich durchaus auch als sehr gutes Argument erachten würde, Personen die schonmal seehr intensive Schmerzen erleiden mussten können sicher sagen, alles was schneller hilft ist in solchen Situationen sehr willkommen und das sehen Ärzte sicher auch so.
Ich sehe auch durch eben diese eingeschränktere Zulassung eigentlich erst mal eher Vorteile und somit Medikamentenmissbrauchsprobleme usw. damit nahezu ausgeklammert was in aktueller Situation und Sichtweise auf Opiate allgemein nur von Vorteil sein kann und die richtige Strategie ist.
Das dadurch erst mal nicht ein sehr grosser Markt adressiert wird aber dennoch eine gute Einkommensquelle mit verlässlicher Basis geschafft werden kann sehe ich ebenfalls als Pluspunkt an, Hintergrund ist man bleibt auf dem Boden, man hat andere Wirkstoffe in der Pipeline die Firma setzt ja bewusst auf Weiterentwicklung(en) und kann diese dann stabil finanzieren uuund last but not least der Markt ist auch für eine kleinere Firma "realistisch" eher bedienbar mit Partnern als dass es hier unbedingt einen Big Pharma Deal benötigten würde damit das Business Model überhaupt funktioniert.
Fazit:
- Realistische Planung
- Wirklich realistische Zulassungschance
- Realistische Umsetzungsmöglichkeit
- Sehr gute Zukunftsaussichten für die Firma sich zu stabilisieren und später dann bei anderen Zulassungen Ihr Umsatzpotential wesentlich darüber hinaus auszubauen
= Erster Wertzuwachs der Aktie fast garantiert denke die 3 bis 3,5 Dollar Ziele sind da auch gerechtfertigt
= Stabiles Wachstum über lange Sicht möglich
= für langfristige Investments sollte das alles im Umkehrschluss sehr gut geparktes Geld sein d.h. dass werden die institutionellen Anleger auch dann gutieren und nach Zulassung und spätestens ersten Marktverfolgen im großen Umfang dazukommen... (daher macht mir aktuell die geringe Quote auch keine grosse Sorgen)
Für mich absolut gutes Investment mit sehr guten stabilen Aussichten ist jetzt nicht die extreme Kursrakete erst mal (obwohl man das nie sagen kann ob ein Hype passieren würde) aber Risiko sehe ich als gut begrenzt an und Gewinn fast sicher man muss nur etwas warten können.
Danke für eure Sichtweisen ist sehr hilfreich das aktuell aus unterschiedlichen Gesichtspunkte zu betrachten.
Was ich so aus den "alten" Pressemitteilungen herausfiltern konnte ist in Summe eigentlich relativ einhellig egal aus welcher Perspektive dazu etwas geschrieben wurde dass dieses neue Medikament sehr wohl "erwünscht" ist und auch seine Chance bekommen soll, sollte die Firma Ihre Ergebnisse noch weiter verfeinern und untermauern. Dies haben Sie aus meiner Sicht sehr wohl die letzten Monate getan und sind dazu nun in der Lage. Denke auch das hier bewusst etwas auf Zeit gespielt werden sollte so das sich die Opiat"-aufregung" etwas bis zum neuen Verfahren legt.
Abseits dessen wie "durchschlagend" nun sag ich mal der Vorteil bei Nebenwirkungen und Suchtpotential ist, konnten Sie aber auch nachweisen das bei geringerer Dosierung wesentlich schneller z.B. Schmerzreduktion usw. erreicht werden kann was ich durchaus auch als sehr gutes Argument erachten würde, Personen die schonmal seehr intensive Schmerzen erleiden mussten können sicher sagen, alles was schneller hilft ist in solchen Situationen sehr willkommen und das sehen Ärzte sicher auch so.
Ich sehe auch durch eben diese eingeschränktere Zulassung eigentlich erst mal eher Vorteile und somit Medikamentenmissbrauchsprobleme usw. damit nahezu ausgeklammert was in aktueller Situation und Sichtweise auf Opiate allgemein nur von Vorteil sein kann und die richtige Strategie ist.
Das dadurch erst mal nicht ein sehr grosser Markt adressiert wird aber dennoch eine gute Einkommensquelle mit verlässlicher Basis geschafft werden kann sehe ich ebenfalls als Pluspunkt an, Hintergrund ist man bleibt auf dem Boden, man hat andere Wirkstoffe in der Pipeline die Firma setzt ja bewusst auf Weiterentwicklung(en) und kann diese dann stabil finanzieren uuund last but not least der Markt ist auch für eine kleinere Firma "realistisch" eher bedienbar mit Partnern als dass es hier unbedingt einen Big Pharma Deal benötigten würde damit das Business Model überhaupt funktioniert.
Fazit:
- Realistische Planung
- Wirklich realistische Zulassungschance
- Realistische Umsetzungsmöglichkeit
- Sehr gute Zukunftsaussichten für die Firma sich zu stabilisieren und später dann bei anderen Zulassungen Ihr Umsatzpotential wesentlich darüber hinaus auszubauen
= Erster Wertzuwachs der Aktie fast garantiert denke die 3 bis 3,5 Dollar Ziele sind da auch gerechtfertigt
= Stabiles Wachstum über lange Sicht möglich
= für langfristige Investments sollte das alles im Umkehrschluss sehr gut geparktes Geld sein d.h. dass werden die institutionellen Anleger auch dann gutieren und nach Zulassung und spätestens ersten Marktverfolgen im großen Umfang dazukommen... (daher macht mir aktuell die geringe Quote auch keine grosse Sorgen)
Für mich absolut gutes Investment mit sehr guten stabilen Aussichten ist jetzt nicht die extreme Kursrakete erst mal (obwohl man das nie sagen kann ob ein Hype passieren würde) aber Risiko sehe ich als gut begrenzt an und Gewinn fast sicher man muss nur etwas warten können.
Antwort auf Beitrag Nr.: 62.392.826 von opportoni am 16.01.20 13:00:05...nun, aus meiner Sicht bleiben da einige Eigenschaften unberücksichtigt, die für den Markterfolg eines Medikamentes von zentraler Bedeutung sind.
Grundsätzlich bleibt Oli ein Opiat, das bei intravenöser Anwendung nur im Krankenhausbetrieb angewendet wird und somit vom Missbrauch her wenig Oberfläche bietet. Allerdings sind einige Begleiterscheinungen (Atemdepression, Verdauungsproblem --> Verstopfung etc.) unter Oliceridine günstiger als bei den bisher bekannten Opiaten. Deswegen werden sehr wahrscheinlich Patienten, die einer Risikogruppe angehören, mit Oli behandelt, obwohl dieses verglichen mit konventionellen Opiaten teurer sein wird --> durch das geringere Risiko für "kostspielige" Nebenwirkungen jedoch dennoch günstiger! Der gesunde Betrachter würde vielleicht meinen, dass eine Verdauungsstörung wie zB eine Verstopfung doch nichts ungewöhnliches ist. In postoperativem Zustand kann eine solche Störung jedoch ein ernste und kostspielige Angelegenheit werden, in seltenen Fällen sogar mit fatalem Ende.
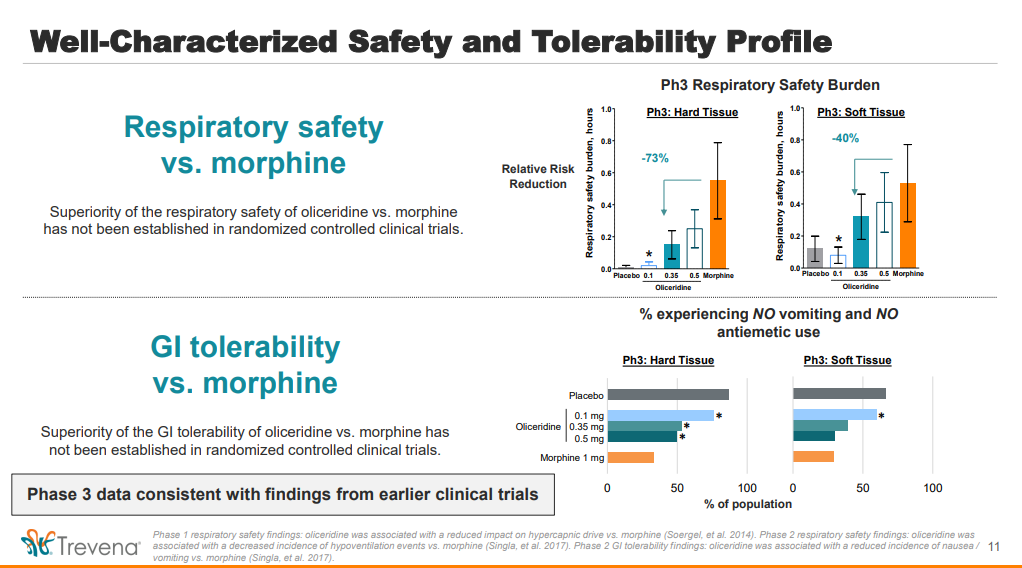
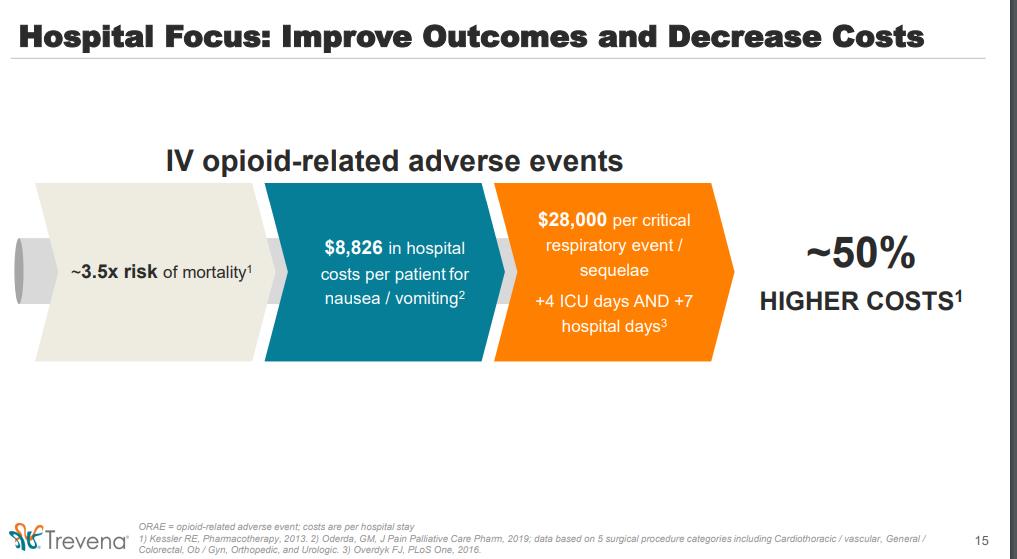
Grundsätzlich bleibt Oli ein Opiat, das bei intravenöser Anwendung nur im Krankenhausbetrieb angewendet wird und somit vom Missbrauch her wenig Oberfläche bietet. Allerdings sind einige Begleiterscheinungen (Atemdepression, Verdauungsproblem --> Verstopfung etc.) unter Oliceridine günstiger als bei den bisher bekannten Opiaten. Deswegen werden sehr wahrscheinlich Patienten, die einer Risikogruppe angehören, mit Oli behandelt, obwohl dieses verglichen mit konventionellen Opiaten teurer sein wird --> durch das geringere Risiko für "kostspielige" Nebenwirkungen jedoch dennoch günstiger! Der gesunde Betrachter würde vielleicht meinen, dass eine Verdauungsstörung wie zB eine Verstopfung doch nichts ungewöhnliches ist. In postoperativem Zustand kann eine solche Störung jedoch ein ernste und kostspielige Angelegenheit werden, in seltenen Fällen sogar mit fatalem Ende.


Antwort auf Beitrag Nr.: 62.391.842 von flyingbeef am 16.01.20 11:32:39Ich denke, da kommt einiges zusammen. Die Opioid-Krise ist das eine.
Manch einem geht es mit der Wiedereinreichung des NDA nicht schnell genug und zuletzt klang es nach einer leichten Verzögerung, weil das "as early as possible" weggefallen ist. Diese trifft wiederum auf eine schwache Finanzierung und damit die Gefahr der Verwässerung.
Rein technisch droht durch den niedrigen Aktienkurs die Gefahr, das Nasdaq Listing zu verlieren und die Beteiligung institutioneller Investoren ist mit 20% sehr niedrig.
Dann ist es zwar ein Schmerzmittel mit neuem Wirkmechanismus, aber die deshalb erhofften Vorteile in Bezug auf Nebenwirkungen und Suchtpotenzial sind dann doch nicht so groß ausgefallen wie anfangs angenommen. Das führt bei einigen zu der Sorge, dass Ärzte weiterhin das nutzen, was sie kennen und was mutmaßlich auch zu einem niedrigeren Preis verfügbar ist.
Dagegen spricht, dass gerade die Ärzte im Adcom sich eher für die Zulassung ausgesprochen haben, um überhaupt eine Alternative zu haben und auch, weil sie es als einen ersten Schritt auf dem Weg zu wirklich deutlich besseren Schmerzmitteln ansehen.
Last but not least, ist die IV Darreichung in kontrollierter Umgebung zwar vorteilhaft für die Zulassung, begrenzt aber hinterher das Marktpotenzial.
PDUFA date wird voraussichtlich in Q3 sein und bis dahin erwarte ich steigende Kurse.
Manch einem geht es mit der Wiedereinreichung des NDA nicht schnell genug und zuletzt klang es nach einer leichten Verzögerung, weil das "as early as possible" weggefallen ist. Diese trifft wiederum auf eine schwache Finanzierung und damit die Gefahr der Verwässerung.
Rein technisch droht durch den niedrigen Aktienkurs die Gefahr, das Nasdaq Listing zu verlieren und die Beteiligung institutioneller Investoren ist mit 20% sehr niedrig.
Dann ist es zwar ein Schmerzmittel mit neuem Wirkmechanismus, aber die deshalb erhofften Vorteile in Bezug auf Nebenwirkungen und Suchtpotenzial sind dann doch nicht so groß ausgefallen wie anfangs angenommen. Das führt bei einigen zu der Sorge, dass Ärzte weiterhin das nutzen, was sie kennen und was mutmaßlich auch zu einem niedrigeren Preis verfügbar ist.
Dagegen spricht, dass gerade die Ärzte im Adcom sich eher für die Zulassung ausgesprochen haben, um überhaupt eine Alternative zu haben und auch, weil sie es als einen ersten Schritt auf dem Weg zu wirklich deutlich besseren Schmerzmitteln ansehen.
Last but not least, ist die IV Darreichung in kontrollierter Umgebung zwar vorteilhaft für die Zulassung, begrenzt aber hinterher das Marktpotenzial.
PDUFA date wird voraussichtlich in Q3 sein und bis dahin erwarte ich steigende Kurse.
Hallo bin vor einigen Wochen nun ebenfalls hier mit 15k Aktien eingestiegen und wollte mich nun auch mal kurz zu Wort melden.
Klingt ja derzeit alles wie "läuft" nach Plan usw. das Potential ist langfristig groß die Wirkung im Vergleich mit anderen Produkten überzeugt auch und würde die Situation für Patienten definitiv verbessern usw.
Also alles gute Nachrichten. Wie begründet sich dann das doch seeehr überschaubare Volumen bei der Aktie ?
Wird wegen der generellen Opioidkrise eine Zulassung derzeit von den meisten Anlegern noch als eher unwahrscheinlich angesehen auch wenn das Unternehmen in vielen relevanten offenen Fragen nun ausreichend validierte Antworten liefern kann ?
Was ist eure Vermutung ?
Ich denke auch dass eine Anwendung nach Zulassung erst mal sehr fokussiert sein wird und zunächst noch nicht den in deren Präsentation großen Markt adressieren wird. Aber auch das würde ja eine Vervielfachung des Kurses hier rechtfertigen also warum diese Zurückhaltung... was meint Ihr ?
Klingt ja derzeit alles wie "läuft" nach Plan usw. das Potential ist langfristig groß die Wirkung im Vergleich mit anderen Produkten überzeugt auch und würde die Situation für Patienten definitiv verbessern usw.
Also alles gute Nachrichten. Wie begründet sich dann das doch seeehr überschaubare Volumen bei der Aktie ?
Wird wegen der generellen Opioidkrise eine Zulassung derzeit von den meisten Anlegern noch als eher unwahrscheinlich angesehen auch wenn das Unternehmen in vielen relevanten offenen Fragen nun ausreichend validierte Antworten liefern kann ?
Was ist eure Vermutung ?
Ich denke auch dass eine Anwendung nach Zulassung erst mal sehr fokussiert sein wird und zunächst noch nicht den in deren Präsentation großen Markt adressieren wird. Aber auch das würde ja eine Vervielfachung des Kurses hier rechtfertigen also warum diese Zurückhaltung... was meint Ihr ?



















