+++ Trevena +++ Revolution in der Schmerztherapie? (Seite 169)
eröffnet am 04.01.18 20:37:22 von
neuester Beitrag 03.02.24 08:02:54 von
neuester Beitrag 03.02.24 08:02:54 von
Beiträge: 2.375
ID: 1.270.862
ID: 1.270.862
Aufrufe heute: 0
Gesamt: 280.116
Gesamt: 280.116
Aktive User: 0
ISIN: US89532E2081 · WKN: A3DWN1 · Symbol: TRVN
0,3900
USD
-2,50 %
-0,0100 USD
Letzter Kurs 16:55:31 Nasdaq
Werte aus der Branche Biotechnologie
| Wertpapier | Kurs | Perf. % |
|---|---|---|
| 4,1150 | +113,21 | |
| 1,2099 | +34,52 | |
| 0,9500 | +33,67 | |
| 2,6802 | +27,02 | |
| 7,0300 | +16,78 |
| Wertpapier | Kurs | Perf. % |
|---|---|---|
| 0,7601 | -14,64 | |
| 1,6100 | -15,26 | |
| 5,8000 | -17,61 | |
| 3,5000 | -26,24 | |
| 11,100 | -31,69 |
Beitrag zu dieser Diskussion schreiben
Antwort auf Beitrag Nr.: 59.051.665 von kmastra am 25.10.18 10:58:13
Vermutlich. Im AdComm Meeting selbst waren sie excellent und haben sich keine Blöße gegeben. Es scheint aber, dass man im Vorfeld besser mit der FDA hätte kooperieren können um nicht mit einem so negativen Grund-Tenor in den Vorabunterlagen zu starten.
Zitat von kmastra: Wenn es nicht klappt muss man die Schuld aber sicher bei TRVN suchen...
Vermutlich. Im AdComm Meeting selbst waren sie excellent und haben sich keine Blöße gegeben. Es scheint aber, dass man im Vorfeld besser mit der FDA hätte kooperieren können um nicht mit einem so negativen Grund-Tenor in den Vorabunterlagen zu starten.
Der größte Unterschied zu Morphin scheint mir in der schnelleren Wirkung zu liegen. Damit lässt sich im Grunde auch der Vorteil bei Übelkeit und Erbrechen erklären. Im KKH wird das ja mit einer Apparatur zur Selbstverabreichung gelöst. Der Patient kann sich per Knopfdruck selber eine kleine Dosis verabreichen. Danach ist das für eine Zeit (6 Minuten? genaue Zeit weiß ich aus dem Kopf nicht) gesperrt. Wenn es aber länger dauert bis der Patient die Wirkung spürt drückt er halt beim nächstmöglichen Zeitpunkt nochmal drauf. So kommt es bei Morphin wohl eher zu einer Überdosierung. TRVN hatte das in der Vergangenheit in den Präsentationen in einer graphischen Darstellung aufgezeigt.
Ich fänd es von daher schade, wenn Oliceridin nicht zugelassen würde. Der Unterschied zu Morphin ist sicher nicht groß aber doch vorhanden. Wenn es nicht klappt muss man die Schuld aber sicher bei TRVN suchen...
Ich fänd es von daher schade, wenn Oliceridin nicht zugelassen würde. Der Unterschied zu Morphin ist sicher nicht groß aber doch vorhanden. Wenn es nicht klappt muss man die Schuld aber sicher bei TRVN suchen...
Antwort auf Beitrag Nr.: 59.049.316 von Cyberhexe am 25.10.18 07:13:47Genau. Und meine Hoffnung ist halt, dass die FDA das einsieht und eine P4 verlangt. Wenn sich die Sichtweise des Sponsors darin bestätigt, hätte man einen Schritt nach vorn gemacht, was die Arzneimittelsicherheit angeht. Wenn nicht, hätte man nichts verloren und vor allem die Entwicklung dieser neuen Produktklasse nicht abgewürgt. Dass Oli schlechter ist, ist auf Basis der vorliegenden Daten nicht zu erwarten.
Antwort auf Beitrag Nr.: 59.049.142 von deRendite am 25.10.18 04:30:57
...ich kann deinen Beobachtungen voll und ganz zustimmen, dass die AC-Mitglieder äquivalenten Dosen ähnliche Nebenwirkungen beigemessen haben, obschon Trevena versucht hat, auf ein breiteres therapeutische Fenster hinzuweisen:
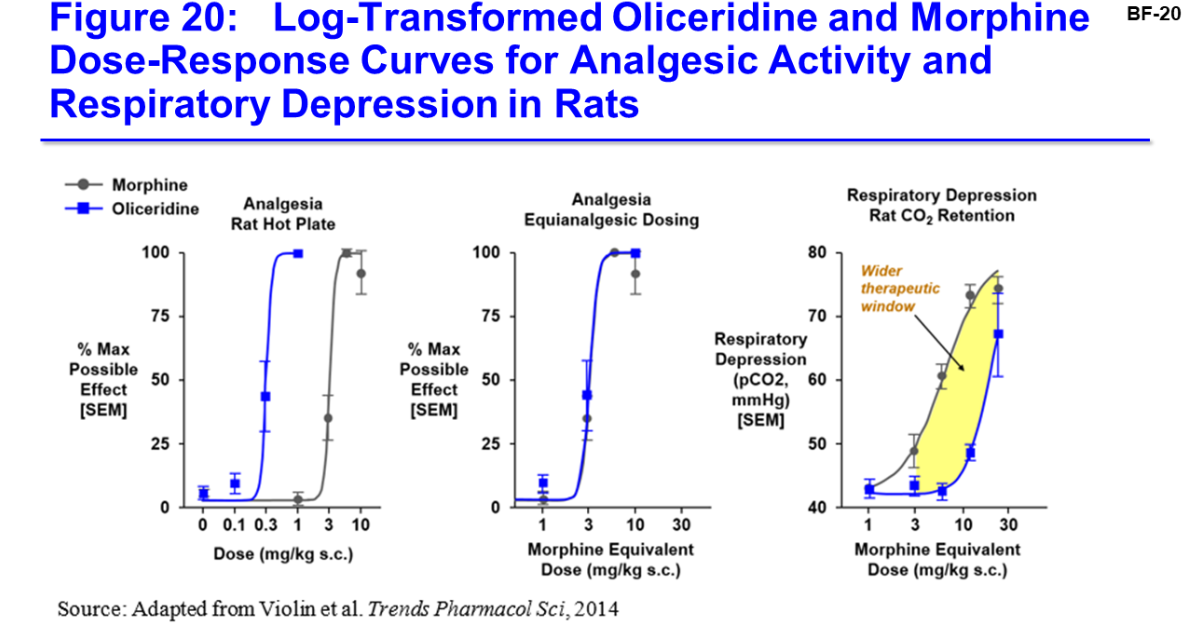
Zitat von deRendite: DIe Zahlen von Trevena zu den Risiken und Nebenwirkungen sehen gut aus, aber im AC wurde immer wieder bezweifelt, ob da nicht Äpfel mit Birnen verglichen wurden. Soll heißen, ob die Dosis die gleiche Wirksamkeit wie die zum Vergleich herangezogene Morphin-Dosis hatte. Darauf zielt ja auch der erste Punkt in der oben zitierten FDA Folie zu den 3001 und 3002 Studien ab. Die Vermutung einiger Panel-Mitglieder war, dass Oliceridin bei einer gleich wirkenden Dosis nicht mehr besser ist als Morphin. Es wurde aber fst einhellig (bis auf ein weibliches Panel-Mitglied) festgeatellt, dass Oliceridin in dem Punkt höchstwahrscheinlich nicht schlechter ist als Morphin. Deshalb hoffe ich dennoch auf Zulassung.
...ich kann deinen Beobachtungen voll und ganz zustimmen, dass die AC-Mitglieder äquivalenten Dosen ähnliche Nebenwirkungen beigemessen haben, obschon Trevena versucht hat, auf ein breiteres therapeutische Fenster hinzuweisen:

Antwort auf Beitrag Nr.: 59.047.780 von Cyberhexe am 24.10.18 22:05:19DIe Zahlen von Trevena zu den Risiken und Nebenwirkungen sehen gut aus, aber im AC wurde immer wieder bezweifelt, ob da nicht Äpfel mit Birnen verglichen wurden. Soll heißen, ob die Dosis die gleiche Wirksamkeit wie die zum Vergleich herangezogene Morphin-Dosis hatte. Darauf zielt ja auch der erste Punkt in der oben zitierten FDA Folie zu den 3001 und 3002 Studien ab. Die Vermutung einiger Panel-Mitglieder war, dass Oliceridin bei einer gleich wirkenden Dosis nicht mehr besser ist als Morphin. Es wurde aber fst einhellig (bis auf ein weibliches Panel-Mitglied) festgeatellt, dass Oliceridin in dem Punkt höchstwahrscheinlich nicht schlechter ist als Morphin. Deshalb hoffe ich dennoch auf Zulassung.
Antwort auf Beitrag Nr.: 59.046.148 von PESCADOS am 24.10.18 19:44:35
...das wäre total kontraproduktiv, vor einer derat wichtigen Entscheidung mit irgendwelchen Kommentaren an die Öffentlichkeit zu gehen. Auf dem AC wurde alles gesagt , was zu sagen ist. Nun ist der Ball bei der Arzneimittelbehörde.
...und unabhängig davon, welche Entscheidung am 2.11.veröffentlicht wird, ist festzustellen, das Trevena bzw. deren Referenten am AC einen hervorragenden job gemacht haben.

Zitat von PESCADOS: Leider gab es dazu noch immer kein Statement vom Management!
...das wäre total kontraproduktiv, vor einer derat wichtigen Entscheidung mit irgendwelchen Kommentaren an die Öffentlichkeit zu gehen. Auf dem AC wurde alles gesagt , was zu sagen ist. Nun ist der Ball bei der Arzneimittelbehörde.
...und unabhängig davon, welche Entscheidung am 2.11.veröffentlicht wird, ist festzustellen, das Trevena bzw. deren Referenten am AC einen hervorragenden job gemacht haben.

Antwort auf Beitrag Nr.: 59.046.046 von Cyberhexe am 24.10.18 19:37:00Leider gab es dazu noch immer kein Statement vom Management!
Antwort auf Beitrag Nr.: 59.045.995 von Cyberhexe am 24.10.18 19:31:00in Trevenas Präsentation sieht das schon wesentlich gefälliger aus:
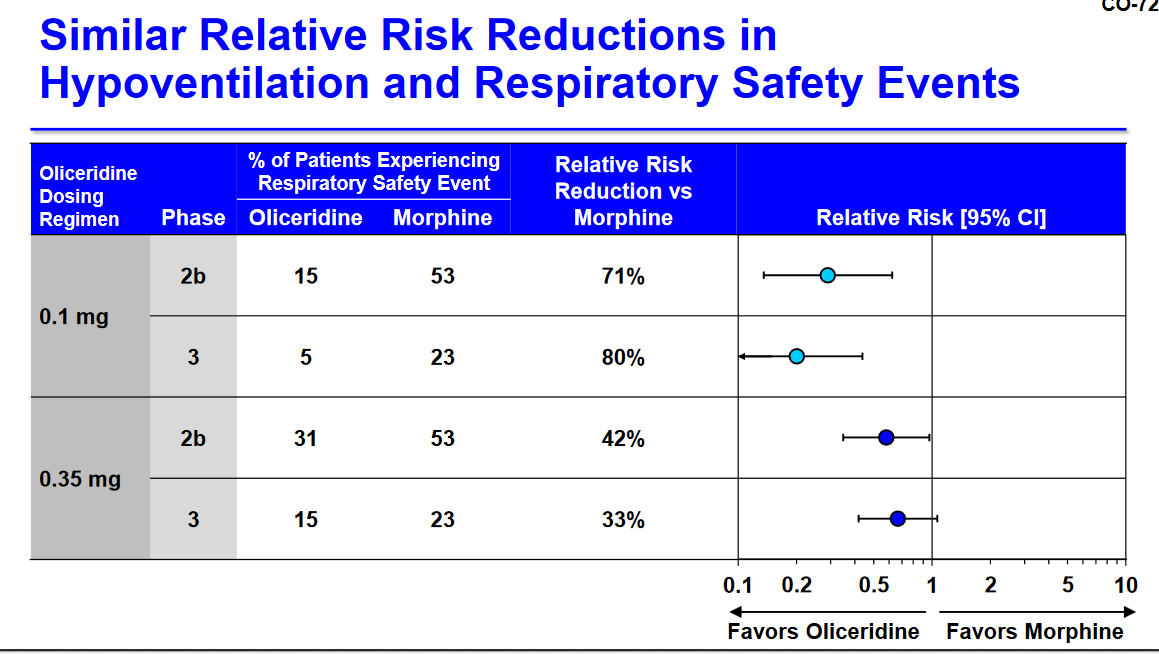

Antwort auf Beitrag Nr.: 59.045.584 von Cyberhexe am 24.10.18 18:55:51der Knackpunkt:
der Nachweis, dass Oli hinsichtlich Atmungsdepression vorteilhaft ist, wurde nicht mit statistischer Signifikanz erbracht:

der Nachweis, dass Oli hinsichtlich Atmungsdepression vorteilhaft ist, wurde nicht mit statistischer Signifikanz erbracht:

Antwort auf Beitrag Nr.: 58.977.723 von Cyberhexe am 17.10.18 07:32:59
...meine Verkaufsorder konnte bisher nicht realisiert werden, so dass ich sehr wahrscheinlich am 2.11. 15.000 Aktien halten werde.
Weil das Potenzial für Missbrauch eines in Krankenhäusern verabreichten iv-Schmerzmittels doch eher überschaubar ist, halte ich die Zulassungschancen von Oli nicht wesentlich geringer als für das oral verabreichte Dsuvia (PDUFA 3.11.2018). Abstimmungsverhalten bei Dsuvia an dessen AC 10 zu 3 für Zulassung.
Zitat von Cyberhexe: Wie sind die Aussichten hinsichtlich der anstehenden Zulassungsentscheidung? Folgende Szenarien sind möglich:
1.) mit einer bedigungslosen Zulassung ist überhaupt nicht zu rechnen. Deren Wahrscheinlichkeit dürfte gegen 0 gehen.
2.) eine bedingte Zulassung in Verbindung mit einer ph4-Studie (postmarket drug safety surveillance) ist wohl das bestmögliche Szenario; obschon ich mir diese Variante nebst der nächsten Variante für meine 15.000 Aktien wünsche, halte ich die Wahrscheinlichkeit für eher gering (wenn ich schätzen müsste, vierlleicht 10%)
3.) Da die Beurteilung bereits eingereichter Daten zur QT-Verlängerung (verzögerte Repolarisation beim Herzschlag) noch aussteht, könnte die FDA den Zeitpunkt für die Entscheidung (PDUFA) um 3 Monate verschieben, also auf 2.2.2019 (20%)
4.) in Anbetracht der Datenlage und des Abstimmungsvervhalten der AC-Mitglieder ist die Wahrscheinlichkeit eines CRL (Complete Response Letter) gross (70%). In diesem Fall wird darauf zu achten sein, welche zusätzlichen Daten von der Behörde verlangt werden. Der schlechteste Fall wäre, wenn eine komplette zusätzliche ph3-Studie verlangt wird, welche einerseits lange dauert und andererseits mit den vorhandenen Ressourcen kaum zu finanzieren ist. Weniger dramatisch wäre das Einfordern einer nicht-klinischen Studie. Die Wahrscheinlichkeit der beiden Fälle würde ich auf 50/50 schätzen, so dass das "Worst case scenario" mit einer persönlichen Wahrscheinlichkeit von ca. 35% erwartet wird.
In Anbetracht der Wahrscheinlichkeit und des Potenzials bei Nichteintreten des schlechtesten Falles (65%) werde ich sehr wahrscheinlich mit 2/3 der 15.000 Aktien die Zulassungsentscheidung am 2.11.2018 abwarten.
5.000 Aktien sind bereits mit einer Verkaufsorder vermerkt ($1.19)
...meine Verkaufsorder konnte bisher nicht realisiert werden, so dass ich sehr wahrscheinlich am 2.11. 15.000 Aktien halten werde.
Weil das Potenzial für Missbrauch eines in Krankenhäusern verabreichten iv-Schmerzmittels doch eher überschaubar ist, halte ich die Zulassungschancen von Oli nicht wesentlich geringer als für das oral verabreichte Dsuvia (PDUFA 3.11.2018). Abstimmungsverhalten bei Dsuvia an dessen AC 10 zu 3 für Zulassung.





















