IGXT (Mkap $34 M) 2 US-Zulassungsanträge im 4Q + weiteres Produkt wartet auf FDA Zulassung (Seite 69)
eröffnet am 27.07.16 17:27:05 von
neuester Beitrag 21.03.24 14:04:18 von
neuester Beitrag 21.03.24 14:04:18 von
Beiträge: 1.197
ID: 1.235.830
ID: 1.235.830
Aufrufe heute: 1
Gesamt: 195.662
Gesamt: 195.662
Aktive User: 0
ISIN: US45822R1014 · WKN: A0RP0X · Symbol: IGX
0,2400
CAD
0,00 %
0,0000 CAD
Letzter Kurs 03.05.24 Toronto
Neuigkeiten
08.04.24 · globenewswire |
05.04.24 · globenewswire |
21.03.24 · globenewswire |
14.03.24 · globenewswire |
Werte aus der Branche Pharmaindustrie
| Wertpapier | Kurs | Perf. % |
|---|---|---|
| 1,2000 | +471,16 | |
| 13,110 | +38,44 | |
| 6,5000 | +27,45 | |
| 1,2100 | +21,00 | |
| 48,25 | +19,94 |
| Wertpapier | Kurs | Perf. % |
|---|---|---|
| 24,050 | -12,55 | |
| 4,0300 | -12,96 | |
| 6,2600 | -14,25 | |
| 3,8500 | -14,45 | |
| 36,70 | -22,87 |
Beitrag zu dieser Diskussion schreiben
Antwort auf Beitrag Nr.: 54.374.497 von allin123 am 21.02.17 17:48:25Ich hacke den heutigen Absturz als techn. Reaktion ab, nachdem keine good News kommen und der Widerstand 0,90 zu stark ist.
Da muß schon was Essentielles her.
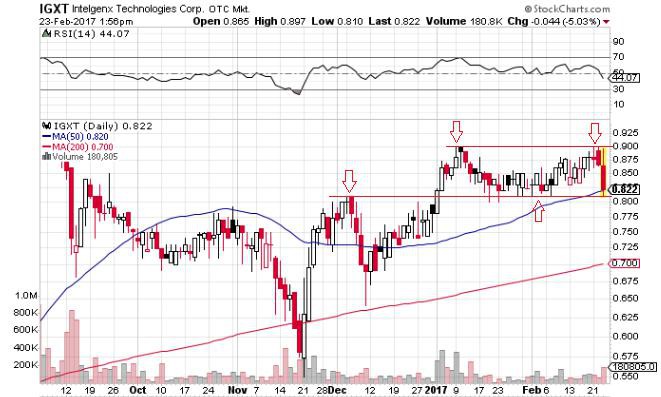
Da muß schon was Essentielles her.

Antwort auf Beitrag Nr.: 54.323.900 von illmatix am 15.02.17 10:29:06wenn die 90 auch mal endlich durch ist, könnten wir uns auch mal wieder dem Dollar widmen 

moin,
der chart sieht irgendwie nach ausbruch aus
der chart sieht irgendwie nach ausbruch aus

Antwort auf Beitrag Nr.: 54.285.797 von Biohero am 09.02.17 22:02:08Danke!
Dann gehen wir mal davon aus, das die Termine in Zukunft eingehalten werden.
Ist schon sehr wichtig, dass auch endlich produziert werden kann.
Dann gehen wir mal davon aus, das die Termine in Zukunft eingehalten werden.
Ist schon sehr wichtig, dass auch endlich produziert werden kann.
Antwort auf Beitrag Nr.: 54.285.518 von charlie01 am 09.02.17 21:30:51Redhill kann nichts dafür es liegt an Igxt weil das mit ihrer neuen Produktionsstätte länger dauert als sie geplant hatten aber so wie es bisher aussieht könnte es mit den Zulassungsanträgen im 2Q diesmal klappen .


Antwort auf Beitrag Nr.: 54.285.155 von Biohero am 09.02.17 20:37:34bzgl. Zeitplan ist denn IGXT dafür verantwortlich oder durch die Verpartnerung die entsprechende Firma, wie bei Rizatriptan eben Redhill?
Antwort auf Beitrag Nr.: 54.283.667 von allin123 am 09.02.17 18:01:09Die Upfront Zahlungen die man seit den letzten Quartalszahlen in November erhalten hat dürfte nur eine kleine Summe ausmachen bestenfalls kommen da ein paar hunderttausend dollar zusammen .Viel wichtiger ist jetzt auf die burn-rate zu achten nachdem Forfivo verkauft worden ist .
Die beste Nachricht im letzten halbjahr ist der Tadalafil Patent Deal mit Eli lilly damit ist der weg frei für eine Partnerschaft womit man jetzt jederzeit rechnen kann .
Im bereich Drug Delivery wozu z.b. auch IPCI und AQS.V gehören würde ich was Potential und Risiko angeht IGXT auf Platz 1 stellen weil das risiko niedriger als bei den beiden anderen kandidaten und das Potential höher ist gefolgt von IPCI und dann AQS . Das einzige was ich an IGXT zu bemängeln hab ist wie im threadtitel zu erahnen ist das sie sich nicht an ihren eignen Zeitplan einhalten deshalb bin ich auch hier erstmal noch an der seitenlinie . Vielleicht werde ich nach den Quartalszahlen wieder ein paar stücke zulegen .
Marktkap $56 Million
Cash: $5.7 Million (stand 30.Sep 2016)
Montelukast For Mild Cognitive Impairment
•Phase II-a study (proof of concept) to commence Q1/2017
•First efficacy data in humans available Q4/2017
•Several Pharma companies have expressed strong interest
Rizaport For Migraines
•Planned USA submission to FDA H1/2017
•Expected USA approval H2/2017
Tadalafil For Erectile Dysfunction
IntelGenx secured license from Lilly for Tadalfil ED dosing patent ‘166
Accelerates our partnering of this product for commercializing Tadalafil in the U.S
•505(b)(2) USA NDA submission in H1/2017
•Expected USA approval H1/2018
Buprenorphine/Naloxone Sublingual Film Product for the Treatment of Opiate Addiction
News bzgl Patentstreitigkeit mit Indivior PLC and Monosol Rx, LLC
Die beste Nachricht im letzten halbjahr ist der Tadalafil Patent Deal mit Eli lilly damit ist der weg frei für eine Partnerschaft womit man jetzt jederzeit rechnen kann .
Im bereich Drug Delivery wozu z.b. auch IPCI und AQS.V gehören würde ich was Potential und Risiko angeht IGXT auf Platz 1 stellen weil das risiko niedriger als bei den beiden anderen kandidaten und das Potential höher ist gefolgt von IPCI und dann AQS . Das einzige was ich an IGXT zu bemängeln hab ist wie im threadtitel zu erahnen ist das sie sich nicht an ihren eignen Zeitplan einhalten deshalb bin ich auch hier erstmal noch an der seitenlinie . Vielleicht werde ich nach den Quartalszahlen wieder ein paar stücke zulegen .
Marktkap $56 Million
Cash: $5.7 Million (stand 30.Sep 2016)
Montelukast For Mild Cognitive Impairment
•Phase II-a study (proof of concept) to commence Q1/2017
•First efficacy data in humans available Q4/2017
•Several Pharma companies have expressed strong interest
Rizaport For Migraines
•Planned USA submission to FDA H1/2017
•Expected USA approval H2/2017
Tadalafil For Erectile Dysfunction
IntelGenx secured license from Lilly for Tadalfil ED dosing patent ‘166
Accelerates our partnering of this product for commercializing Tadalafil in the U.S
•505(b)(2) USA NDA submission in H1/2017
•Expected USA approval H1/2018
Buprenorphine/Naloxone Sublingual Film Product for the Treatment of Opiate Addiction
News bzgl Patentstreitigkeit mit Indivior PLC and Monosol Rx, LLC
Antwort auf Beitrag Nr.: 54.266.657 von illmatix am 08.02.17 09:26:19bei den ganzen Deals, müsste eigentlich ordentlich Cash in der Kasse liegen  Allerdings sorgen gute Finanzdaten bei einem Bio-Wert imho noch für keine heftigen Kurssprünge, wir brauchen endlich mal Studienergebnisse bzw. FDA-relevante News
Allerdings sorgen gute Finanzdaten bei einem Bio-Wert imho noch für keine heftigen Kurssprünge, wir brauchen endlich mal Studienergebnisse bzw. FDA-relevante News
So wie es heute ausschaut, schliessen wir trotz erneutem Deal wieder nur mit 1-2c im Plus. Viel zu wenig für meinen Geschmack. Aber ich irre mich (zum positiven) gern
 Allerdings sorgen gute Finanzdaten bei einem Bio-Wert imho noch für keine heftigen Kurssprünge, wir brauchen endlich mal Studienergebnisse bzw. FDA-relevante News
Allerdings sorgen gute Finanzdaten bei einem Bio-Wert imho noch für keine heftigen Kurssprünge, wir brauchen endlich mal Studienergebnisse bzw. FDA-relevante NewsSo wie es heute ausschaut, schliessen wir trotz erneutem Deal wieder nur mit 1-2c im Plus. Viel zu wenig für meinen Geschmack. Aber ich irre mich (zum positiven) gern

IntelGenx and Tetra Bio-Pharma Announce the Signing of a Term Sheet for the Development and Commercialization of a Dronabinol XL Tablet
Marketwired MarketwiredFebruary 9, 2017
SAINT-LAURENT, QUEBEC--(Marketwired - Feb 9, 2017) - IntelGenx Corp. ("IntelGenx"), (TSX VENTURE:IGX)(IGXT) and Tetra Bio-Pharma Inc. ("Tetra") (CSE:TBP)(OTC PINK:GRPOF), today announced the signing of a binding term sheet for the development and commercialization of a drug product containing dronabinol. Under the binding term sheet, Tetra will have exclusive rights to sell the product in North America with a right of first negotiation for outside the U.S. and Canada. The U.S. cancer pain market is expected to reach $5 billion in 2018.
Per the Binding Term Sheet, Tetra will make a non-refundable exclusive negotiation payment to IntelGenx, an upfront payment along with set milestone payments based on the completion of an efficacy study, approvals from FDA and Health Canada and launching of the product.
IntelGenx will be responsible for the research and development of the product, including clinical studies and will develop the product as an oral mucoadhesive tablet based on its proprietary AdVersa® controlled-release technology. Tetra will be responsible for funding the product development, and will own and control all regulatory approvals, including the application and any other marketing authorizations. Tetra will also be responsible for all aspects of commercializing the drug product.
"We are pleased to partner with Tetra Bio-Pharma to enter the lucrative cannabis market," said Dr. Horst G. Zerbe, President and CEO of IntelGenx. "We will work with Tetra to bring this much needed THC product to North American patients suffering from anorexia and cancer chemotherapy-related pain. This announcement is a further testament to the strength of IntelGenx' scientists who continue to execute the development of innovative products using our advanced oral delivery platforms."
PhytoPain Pharma Inc., a subsidiary of Tetra will be submitting a request for a Type B pre-IND meeting with the Division of Anesthesia, Analgesia, and Addiction Products (DAAAP), Center for Drug Evaluation and Research (CDER), USA Food and Drug Administration (FDA) to discuss the marketing requirements for Dronabinol AdVersa® Mucoadhesive tablet product. Tetra intends on developing Dronabinol AdVersa® Mucoadhesive tablet as an analgesic for the management of Breakthrough Cancer Pain. Once the safety and efficacy is demonstrated in patients, this drug product will be eligible for approval under the 505(b)(2) New Drug Application (NDA) path commented Dr. Guy Chamberland, Chief Scientific Officer and Regulatory Affairs. The 505(b)(2) pathway represents a significant reduction in time and cost to market commented Dr. Chamberland. He added that the company will also be meeting with the Therapeutic Product Directorate, Health Canada to discuss the clinical development and marketing requirements.
Dr. Chamberland further commented that there are many clinical problems associated with the use of currently available form of Dronabinol in patients with anorexia and cancer chemotherapy. It has been demonstrated that psychoactive drugs exert their euphoria, and other psychoactive effects, when the blood levels of the drug rapidly increase. The pharmacokinetic profile of THC and its metabolite significantly affect the abuse potential of Dronabinol. The significant advantage of the Mucoadhesive technology is the controlled-release of THC resulting in a longer time release of the drug avoiding a rapid increase in the blood. There is also an improved bioavailability and potentially reduced gastro-intestinal side effects making the sustained-release THC product a promising alternative in the battle for the reduction of opioids in patients with chronic pain.
About Tetra Bio Pharma:
Tetra Bio-Pharma is a multi subsidiary publicly traded company (CSE:TBP)(OTC PINK:GRPOF) engaged in the development of Bio Pharmaceuticals and Natural Health Products containing Cannabis and other medicinal plant based elements.
Tetra Bio Pharma is focused on combining the traditional methods of medicinal cannabis use with the supporting scientific validation and safety data required for inclusion into the existing bio pharma industry by regulators physicians and insurance companies. More information is available about the company at: www.tetrabiopharma.com.
About IntelGenx:
Marketwired MarketwiredFebruary 9, 2017
SAINT-LAURENT, QUEBEC--(Marketwired - Feb 9, 2017) - IntelGenx Corp. ("IntelGenx"), (TSX VENTURE:IGX)(IGXT) and Tetra Bio-Pharma Inc. ("Tetra") (CSE:TBP)(OTC PINK:GRPOF), today announced the signing of a binding term sheet for the development and commercialization of a drug product containing dronabinol. Under the binding term sheet, Tetra will have exclusive rights to sell the product in North America with a right of first negotiation for outside the U.S. and Canada. The U.S. cancer pain market is expected to reach $5 billion in 2018.
Per the Binding Term Sheet, Tetra will make a non-refundable exclusive negotiation payment to IntelGenx, an upfront payment along with set milestone payments based on the completion of an efficacy study, approvals from FDA and Health Canada and launching of the product.
IntelGenx will be responsible for the research and development of the product, including clinical studies and will develop the product as an oral mucoadhesive tablet based on its proprietary AdVersa® controlled-release technology. Tetra will be responsible for funding the product development, and will own and control all regulatory approvals, including the application and any other marketing authorizations. Tetra will also be responsible for all aspects of commercializing the drug product.
"We are pleased to partner with Tetra Bio-Pharma to enter the lucrative cannabis market," said Dr. Horst G. Zerbe, President and CEO of IntelGenx. "We will work with Tetra to bring this much needed THC product to North American patients suffering from anorexia and cancer chemotherapy-related pain. This announcement is a further testament to the strength of IntelGenx' scientists who continue to execute the development of innovative products using our advanced oral delivery platforms."
PhytoPain Pharma Inc., a subsidiary of Tetra will be submitting a request for a Type B pre-IND meeting with the Division of Anesthesia, Analgesia, and Addiction Products (DAAAP), Center for Drug Evaluation and Research (CDER), USA Food and Drug Administration (FDA) to discuss the marketing requirements for Dronabinol AdVersa® Mucoadhesive tablet product. Tetra intends on developing Dronabinol AdVersa® Mucoadhesive tablet as an analgesic for the management of Breakthrough Cancer Pain. Once the safety and efficacy is demonstrated in patients, this drug product will be eligible for approval under the 505(b)(2) New Drug Application (NDA) path commented Dr. Guy Chamberland, Chief Scientific Officer and Regulatory Affairs. The 505(b)(2) pathway represents a significant reduction in time and cost to market commented Dr. Chamberland. He added that the company will also be meeting with the Therapeutic Product Directorate, Health Canada to discuss the clinical development and marketing requirements.
Dr. Chamberland further commented that there are many clinical problems associated with the use of currently available form of Dronabinol in patients with anorexia and cancer chemotherapy. It has been demonstrated that psychoactive drugs exert their euphoria, and other psychoactive effects, when the blood levels of the drug rapidly increase. The pharmacokinetic profile of THC and its metabolite significantly affect the abuse potential of Dronabinol. The significant advantage of the Mucoadhesive technology is the controlled-release of THC resulting in a longer time release of the drug avoiding a rapid increase in the blood. There is also an improved bioavailability and potentially reduced gastro-intestinal side effects making the sustained-release THC product a promising alternative in the battle for the reduction of opioids in patients with chronic pain.
About Tetra Bio Pharma:
Tetra Bio-Pharma is a multi subsidiary publicly traded company (CSE:TBP)(OTC PINK:GRPOF) engaged in the development of Bio Pharmaceuticals and Natural Health Products containing Cannabis and other medicinal plant based elements.
Tetra Bio Pharma is focused on combining the traditional methods of medicinal cannabis use with the supporting scientific validation and safety data required for inclusion into the existing bio pharma industry by regulators physicians and insurance companies. More information is available about the company at: www.tetrabiopharma.com.
About IntelGenx:
Antwort auf Beitrag Nr.: 54.251.681 von allin123 am 06.02.17 18:01:54moin,
ich meine damit die zahlen diese werden hier für eine überraschung sirgen ...
diese werden hier für eine überraschung sirgen ...
denke ich mal
ich meine damit die zahlen
 diese werden hier für eine überraschung sirgen ...
diese werden hier für eine überraschung sirgen ...denke ich mal






















