INTERCEPT (ICPT) mit Potenzial USD 64.46 (27.9.19) - 500 Beiträge pro Seite
eröffnet am 28.09.19 23:46:35 von
neuester Beitrag 21.01.23 17:18:40 von
neuester Beitrag 21.01.23 17:18:40 von
Beiträge: 46
ID: 1.312.902
ID: 1.312.902
Aufrufe heute: 0
Gesamt: 5.005
Gesamt: 5.005
Aktive User: 0
ISIN: US45845P1084 · WKN: A1J5U0 · Symbol: ICPT
19,000
USD
0,00 %
0,000 USD
Letzter Kurs 08.11.23 Nasdaq
Neuigkeiten
09.05.24 · globenewswire |
29.02.24 · globenewswire |
13.11.23 · globenewswire |
10.11.23 · globenewswire |
08.11.23 · globenewswire |
Werte aus der Branche Pharmaindustrie
| Wertpapier | Kurs | Perf. % |
|---|---|---|
| 0,5700 | +55,23 | |
| 5,4500 | +41,56 | |
| 1,1500 | +34,98 | |
| 1,0000 | +33,33 | |
| 6,5900 | +31,80 |
| Wertpapier | Kurs | Perf. % |
|---|---|---|
| 5,2500 | -19,23 | |
| 0,7300 | -19,34 | |
| 1,2700 | -19,62 | |
| 2,0150 | -21,29 | |
| 2.849,50 | -83,34 |
Intercept hat den Zulassungsantrag (NDA) von Ocaliva zur Behandlung von durch NASH verursachte Fibrose, wie angekündigt im 3q19, bei der FDA eingereicht und kündigt bereits an, im 4q19 den Zulassungsantrag auch bei der EMA einzureichen. Gleichzeitig wurde bei der FDA eine beschleunigte Bearbeitung des Zulassungsantrages (Priority Review) beantragt. Falls dies genehmigt wird, und davon ist auszugehen, könnte eine Zulassungsentscheidung Ende März 2020 realistisch sein.
Bin mit 500 Stück am Freitag eingestiegen.
Sep 27, 2019
Intercept Submits New Drug Application to the U.S. FDA for Obeticholic Acid in Patients with Fibrosis Due to NASH
PDF Version
NDA supported by positive interim analysis results from REGENERATE Phase 3 study demonstrating OCA’s improvement of liver fibrosis without worsening of NASH
NEW YORK, Sept. 27, 2019 (GLOBE NEWSWIRE) -- Intercept Pharmaceuticals, Inc. (Nasdaq:ICPT), a biopharmaceutical company focused on the development and commercialization of novel therapeutics to treat progressive non-viral liver diseases, today announced that it has submitted a New Drug Application (NDA) to the U.S. Food and Drug Adminstration (FDA) for obeticholic acid (OCA) for the treatment of patients with fibrosis due to nonalcoholic steatohepatitis (NASH).
OCA is the only investigational therapy to meet the primary endpoint of a Phase 3 study in patients with NASH and is the only such therapy that the FDA has designated a Breakthrough Therapy for NASH with fibrosis. As such, Intercept has requested a Priority Review for the NDA, which, if granted, would result in an anticipated six-month review period.
The submission is based on positive interim analysis results from the pivotal Phase 3 REGENERATE study in patients with liver fibrosis due to NASH. In the study, OCA 25 mg achieved its primary endpoint by demonstrating robust improvement in liver fibrosis (by ≥1 stage) without worsening of NASH at 18 months (p=0.0002 vs placebo).
“Our submission of the first NDA for the treatment of fibrosis due to NASH is a very important milestone for the field and the culmination of more than a decade of hard work,” said Mark Pruzanski, M.D., President and Chief Executive Officer of Intercept. “I am grateful to the thousands of NASH patients participating in our clinical studies, the investigators and study personnel at our study sites around the globe, and the entire Intercept team for bringing us to this point. We look forward to continuing to work with the FDA through the NDA review period and believe that, if approved, OCA has the potential to become an essential treatment for people living with advanced fibrosis due to NASH.”
Intercept also intends to file a marketing authorization application (MAA) with the European Medicines Agency in the fourth quarter of this year.
ir.interceptpharma.com/news-releases/news-release-details/in…
Bin mit 500 Stück am Freitag eingestiegen.
Sep 27, 2019
Intercept Submits New Drug Application to the U.S. FDA for Obeticholic Acid in Patients with Fibrosis Due to NASH
PDF Version
NDA supported by positive interim analysis results from REGENERATE Phase 3 study demonstrating OCA’s improvement of liver fibrosis without worsening of NASH
NEW YORK, Sept. 27, 2019 (GLOBE NEWSWIRE) -- Intercept Pharmaceuticals, Inc. (Nasdaq:ICPT), a biopharmaceutical company focused on the development and commercialization of novel therapeutics to treat progressive non-viral liver diseases, today announced that it has submitted a New Drug Application (NDA) to the U.S. Food and Drug Adminstration (FDA) for obeticholic acid (OCA) for the treatment of patients with fibrosis due to nonalcoholic steatohepatitis (NASH).
OCA is the only investigational therapy to meet the primary endpoint of a Phase 3 study in patients with NASH and is the only such therapy that the FDA has designated a Breakthrough Therapy for NASH with fibrosis. As such, Intercept has requested a Priority Review for the NDA, which, if granted, would result in an anticipated six-month review period.
The submission is based on positive interim analysis results from the pivotal Phase 3 REGENERATE study in patients with liver fibrosis due to NASH. In the study, OCA 25 mg achieved its primary endpoint by demonstrating robust improvement in liver fibrosis (by ≥1 stage) without worsening of NASH at 18 months (p=0.0002 vs placebo).
“Our submission of the first NDA for the treatment of fibrosis due to NASH is a very important milestone for the field and the culmination of more than a decade of hard work,” said Mark Pruzanski, M.D., President and Chief Executive Officer of Intercept. “I am grateful to the thousands of NASH patients participating in our clinical studies, the investigators and study personnel at our study sites around the globe, and the entire Intercept team for bringing us to this point. We look forward to continuing to work with the FDA through the NDA review period and believe that, if approved, OCA has the potential to become an essential treatment for people living with advanced fibrosis due to NASH.”
Intercept also intends to file a marketing authorization application (MAA) with the European Medicines Agency in the fourth quarter of this year.
ir.interceptpharma.com/news-releases/news-release-details/in…
Antwort auf Beitrag Nr.: 61.591.119 von Cyberhexe am 28.09.19 23:46:35aus dem letzten Quartalsbericht (2q19 auf Ende Juni) über die Vereinbarung mit Sumitomo zur Vermarktung von Ocaliva in Asien:
- Sumitomo Dainippon hat die Rechte zur Vermarktung in Japan und Korea zurückgegeben
- falls bestimmte Meilensteine in der Klinik in China bis zum 31.12.2020 nicht erreicht werden, kann auch dieser Vertrag gekündigt werden
- ursprünglich vereinbart wurden gestaffelte Lizenzzahlungen bis zu "mid-twenties" % vom Nettoumsatz
4. Significant Agreements
Sumitomo Dainippon Pharma Co., Ltd
in percentage terms based on net sales of OCA products in China (excluding Taiwan). Sumitomo Dainippon is responsible for the costs of developing and commercializing OCA in its territory.
The Company has concluded that Sumitomo Dainippon does not represent a customer of the Company, and therefore the Sumitomo Agreement is outside of the scope of ASC 606. The Company has accounted, and continues to account, for the Sumitomo Agreement under the legacy accounting guidance. The Company’s substantive performance obligations under this agreement include an exclusive license to its technology, technical and scientific support to the development plan and
participation on a joint steering committee. The Company determined that these performance obligations represent a single unit of accounting, since, initially, the license does not have stand-alone value to Sumitomo Dainippon without the Company’s technical expertise and steering committee participation during the development of OCA. The development period is currently estimated as continuing through June 2020 and, as such, the $15.0 million upfront payment is being
recognized ratably over this period. The Company recognized licensing revenue of $0.4 million and $0.4 million for the three months ended June 30, 2019 and 2018, respectively, and $0.8 million and $1.2 million for the six months ended June 30, 2019 and 2018, respectively, under the Sumitomo Agreement. Included in licensing revenue for the six months ended June 30, 2018 is $0.4 million related to the accelerated recognition, as a result of the Sumitomo Amendment, of the
remaining portion of deferred revenue associated with the $1.0 million upfront payment that the Company received under the Original Sumitomo Agreement in connection with Sumitomo Dainippon’s exercise of the Country Option with respect to Korea.
The Company recognizes milestone payments when the associated milestones are achieved. As of June 30, 2019, and December 31, 2018, the Company had recorded deferred revenues of $1.6 million and $2.4 million, respectively, under this agreement.
...
The Company may be eligible to receive additional milestone payments under
the Sumitomo Agreement in an aggregate amount of up to approximately $23.0 million based on the occurrence of certain clinical trial and regulatory-related events and tiered royalty payments up to the mid-twenties in percentage terms based on net sales of OCA products in China (excluding Taiwan). Sumitomo Dainippon is responsible for the costs of developing and commercializing OCA in its territory.
http://ir.interceptpharma.com/static-files/ff11140a-262c-4bf…
- Sumitomo Dainippon hat die Rechte zur Vermarktung in Japan und Korea zurückgegeben
- falls bestimmte Meilensteine in der Klinik in China bis zum 31.12.2020 nicht erreicht werden, kann auch dieser Vertrag gekündigt werden
- ursprünglich vereinbart wurden gestaffelte Lizenzzahlungen bis zu "mid-twenties" % vom Nettoumsatz
4. Significant Agreements
Sumitomo Dainippon Pharma Co., Ltd
in percentage terms based on net sales of OCA products in China (excluding Taiwan). Sumitomo Dainippon is responsible for the costs of developing and commercializing OCA in its territory.
The Company has concluded that Sumitomo Dainippon does not represent a customer of the Company, and therefore the Sumitomo Agreement is outside of the scope of ASC 606. The Company has accounted, and continues to account, for the Sumitomo Agreement under the legacy accounting guidance. The Company’s substantive performance obligations under this agreement include an exclusive license to its technology, technical and scientific support to the development plan and
participation on a joint steering committee. The Company determined that these performance obligations represent a single unit of accounting, since, initially, the license does not have stand-alone value to Sumitomo Dainippon without the Company’s technical expertise and steering committee participation during the development of OCA. The development period is currently estimated as continuing through June 2020 and, as such, the $15.0 million upfront payment is being
recognized ratably over this period. The Company recognized licensing revenue of $0.4 million and $0.4 million for the three months ended June 30, 2019 and 2018, respectively, and $0.8 million and $1.2 million for the six months ended June 30, 2019 and 2018, respectively, under the Sumitomo Agreement. Included in licensing revenue for the six months ended June 30, 2018 is $0.4 million related to the accelerated recognition, as a result of the Sumitomo Amendment, of the
remaining portion of deferred revenue associated with the $1.0 million upfront payment that the Company received under the Original Sumitomo Agreement in connection with Sumitomo Dainippon’s exercise of the Country Option with respect to Korea.
The Company recognizes milestone payments when the associated milestones are achieved. As of June 30, 2019, and December 31, 2018, the Company had recorded deferred revenues of $1.6 million and $2.4 million, respectively, under this agreement.
...
The Company may be eligible to receive additional milestone payments under
the Sumitomo Agreement in an aggregate amount of up to approximately $23.0 million based on the occurrence of certain clinical trial and regulatory-related events and tiered royalty payments up to the mid-twenties in percentage terms based on net sales of OCA products in China (excluding Taiwan). Sumitomo Dainippon is responsible for the costs of developing and commercializing OCA in its territory.
http://ir.interceptpharma.com/static-files/ff11140a-262c-4bf…
Antwort auf Beitrag Nr.: 61.603.048 von Cyberhexe am 01.10.19 09:00:15innerhalb der nächsten 5 Wochen hat die FDA darüber zu entscheiden, ob der von Intercept eingereichte Zulassungsantrag von Ocaliva zur Behandlung einer durch NASH verursachten Fibrose formal angenommen wird - formal heisst, dass der Zulassungsantrag auf Vollständigkeit geprüft wird. Sollte der Antrag angenommen werden, dürfte der Kurs auf über $70 anziehen.
Antwort auf Beitrag Nr.: 61.732.429 von Cyberhexe am 21.10.19 08:53:05
Falls kein AC einberufen und Priority Review zugestanden wird, dürfte der Kurs relativ scghnell $80 überschreiten.
Time will tell!
Zitat von Cyberhexe: innerhalb der nächsten 5 Wochen hat die FDA darüber zu entscheiden, ob der von Intercept eingereichte Zulassungsantrag von Ocaliva zur Behandlung einer durch NASH verursachten Fibrose formal angenommen wird - formal heisst, dass der Zulassungsantrag auf Vollständigkeit geprüft wird. Sollte der Antrag angenommen werden, dürfte der Kurs auf über $70 anziehen.
Falls kein AC einberufen und Priority Review zugestanden wird, dürfte der Kurs relativ scghnell $80 überschreiten.
Time will tell!
Antwort auf Beitrag Nr.: 61.734.982 von Cyberhexe am 21.10.19 14:26:09interessante Aussagen in nachfolgendem Artikel veröffentlicht am 8.9.19 im Journal "Hepatology Research"
- das NASH-Marktvolumen in den 7 wichtigsten Märkten wird in 2026 auf über 25 Milliarden USD geschätzt
- ein NASH-Medi wird frühestens 2021 am Markt sein
--> ich glaube allerdings, dass Ocaliva noch in 2020 von der FDA die Marktzulassung erhalten wird. Bis zum 26.11. hat die FDA formal über die Antragsannahme zu entscheiden und wird dann sehr wahrscheinlich bekanntgeben, ob Priority Review gewährt wird....womit eigentlich zu rechnen ist. PDUFA könnte dann Ende 1q2020 sein. Das ist der frühestmögliche Zeitpunkt für die Zulassungsentscheidung. Falls positiv - ich rechne damit-, dürfte der Kurs dreistellig sein!
Phase 3 drug pipelines in the treatment of NASH
Yoshio Sumida Takeshi Okanoue Atsushi Nakajima Japan Study Group of NAFLD (JSG‐NAFLD)
First published: 08 September 2019
Abstract
Nonalcoholic steatohepatitis (NASH) which is a more severe form of nonalcoholic fatty liver disease (NAFLD) can at least partly lead to cirrhosis, hepatocellular carcinoma (HCC), and hepatic failure. Liver transplantation is the only option for NASH cirrhosis at this time. By 2020, NASH is projected to overtake hepatitis C as the leading cause of liver transplants in the U.S. There are still no approved drugs for treating NASH. Although there are about 196 agents of investigational NASH therapies in various stages of development, we here mainly review phase 3 drug candidates in the pipeline for NASH. The NASH space across the seven major markets of the U.S., France, Germany, Italy, Spain, the UK, and Japan, is set to rise from $618 million in 2016 to around $25.3 billion by 2026. However, the fact that the race to develop an effective drug against NASH has reached the home stretch, with five drug candidates (obeticholic acid, elafibranor, selonsertib, cenicriviroc, and resmetirom) in phase 3 stage of the trial, is welcome news for patients. The very earliest a NASH drug could hit the market is 2021, assuming all goes well as planned.
https://onlinelibrary.wiley.com/doi/abs/10.1111/hepr.13425" target="_blank" rel="nofollow ugc noopener">https://onlinelibrary.wiley.com/doi/abs/10.1111/hepr.13425
- das NASH-Marktvolumen in den 7 wichtigsten Märkten wird in 2026 auf über 25 Milliarden USD geschätzt
- ein NASH-Medi wird frühestens 2021 am Markt sein
--> ich glaube allerdings, dass Ocaliva noch in 2020 von der FDA die Marktzulassung erhalten wird. Bis zum 26.11. hat die FDA formal über die Antragsannahme zu entscheiden und wird dann sehr wahrscheinlich bekanntgeben, ob Priority Review gewährt wird....womit eigentlich zu rechnen ist. PDUFA könnte dann Ende 1q2020 sein. Das ist der frühestmögliche Zeitpunkt für die Zulassungsentscheidung. Falls positiv - ich rechne damit-, dürfte der Kurs dreistellig sein!
Phase 3 drug pipelines in the treatment of NASH
Yoshio Sumida Takeshi Okanoue Atsushi Nakajima Japan Study Group of NAFLD (JSG‐NAFLD)
First published: 08 September 2019
Abstract
Nonalcoholic steatohepatitis (NASH) which is a more severe form of nonalcoholic fatty liver disease (NAFLD) can at least partly lead to cirrhosis, hepatocellular carcinoma (HCC), and hepatic failure. Liver transplantation is the only option for NASH cirrhosis at this time. By 2020, NASH is projected to overtake hepatitis C as the leading cause of liver transplants in the U.S. There are still no approved drugs for treating NASH. Although there are about 196 agents of investigational NASH therapies in various stages of development, we here mainly review phase 3 drug candidates in the pipeline for NASH. The NASH space across the seven major markets of the U.S., France, Germany, Italy, Spain, the UK, and Japan, is set to rise from $618 million in 2016 to around $25.3 billion by 2026. However, the fact that the race to develop an effective drug against NASH has reached the home stretch, with five drug candidates (obeticholic acid, elafibranor, selonsertib, cenicriviroc, and resmetirom) in phase 3 stage of the trial, is welcome news for patients. The very earliest a NASH drug could hit the market is 2021, assuming all goes well as planned.
https://onlinelibrary.wiley.com/doi/abs/10.1111/hepr.13425" target="_blank" rel="nofollow ugc noopener">https://onlinelibrary.wiley.com/doi/abs/10.1111/hepr.13425
Antwort auf Beitrag Nr.: 61.732.429 von Cyberhexe am 21.10.19 08:53:05
...der "Zug" scheint langsam Fahrt aufzunehmen. Gestern +$5.10 auf $73.49.
Zitat von Cyberhexe: innerhalb der nächsten 5 Wochen hat die FDA darüber zu entscheiden, ob der von Intercept eingereichte Zulassungsantrag von Ocaliva zur Behandlung einer durch NASH verursachten Fibrose formal angenommen wird - formal heisst, dass der Zulassungsantrag auf Vollständigkeit geprüft wird. Sollte der Antrag angenommen werden, dürfte der Kurs auf über $70 anziehen.
...der "Zug" scheint langsam Fahrt aufzunehmen. Gestern +$5.10 auf $73.49.
Antwort auf Beitrag Nr.: 61.770.947 von Cyberhexe am 26.10.19 09:24:27Intercept Pharmaceuticals Reports Third Quarter 2019 Financial Results and Provides Business Update
Worldwide Ocaliva net sales of $61.5 million in the third quarter of 2019 representing 32% growth versus the prior year quarter; increasing full year 2019 worldwide Ocaliva net sales guidance range to between $245 million and $250 million
U.S. NDA for NASH submitted; EU MAA submission for NASH planned for fourth quarter of 2019
New NASH and PBC clinical data to be presented at The Liver Meeting® 2019
Conference call scheduled for 8:30 a.m. ET today
http://ir.interceptpharma.com/news-releases/news-release-det…
Worldwide Ocaliva net sales of $61.5 million in the third quarter of 2019 representing 32% growth versus the prior year quarter; increasing full year 2019 worldwide Ocaliva net sales guidance range to between $245 million and $250 million
U.S. NDA for NASH submitted; EU MAA submission for NASH planned for fourth quarter of 2019
New NASH and PBC clinical data to be presented at The Liver Meeting® 2019
Conference call scheduled for 8:30 a.m. ET today
http://ir.interceptpharma.com/news-releases/news-release-det…
Antwort auf Beitrag Nr.: 61.840.350 von Cyberhexe am 05.11.19 13:19:49nicht gerade beeindruckendes Quartal, Ocaliva net sales im Vergleich zu Q2 rückläufig (65.9 -> 61.5), Geld ist noch genug vorhanden, alles hängt von der Zulassung für NASH nächstes Jahr ab
Antwort auf Beitrag Nr.: 61.840.920 von paul81 am 05.11.19 14:31:36Intercept Pharmaceuticals (NASDAQ:ICPT)‘s stock had its “buy” rating reiterated by analysts at Needham & Company LLC in a research report issued to clients and investors on Tuesday, AnalystRatings.com reports. They presently have a $150.00 price target on the biopharmaceutical company’s stock.
...Needham hat das Kursziel von $150 bestätigt - nit too bad!
...Needham hat das Kursziel von $150 bestätigt - nit too bad!
Antwort auf Beitrag Nr.: 61.845.066 von Cyberhexe am 05.11.19 20:29:31...von der Quartalspressekonferenz von heute:
- interessanter Hinweis auf das Treffen der "American Association for the study of Liver Diseases" --> AASLD, welches vom 8. bis 12. November in Boston, Massachusetts, stattfinden wird. Mehr als 20 "Abstracts" und "late breaking abstracts" werden angekündigt. Vora allem der Hinweis, dass "...demonstrating OCA's durable therapeutic benefit with no new long-term safety findings in PBC patients on treatment for up to six years"
kein neues Signal bei der Langzeittherapie (5 Jahre !) festgestellt wurde, erhöht die Zulassungswahrscheinlichkeit auch in der Indikation "NASH mit Fibrose".
In addition to the execution of our regulatory filings, we've continued to be laser focused on ensuring commercial readiness for the first-ever NASH launch. With more than 15 years of experience focused on the development of novel therapies to treat progressive non-viral liver diseases, Intercept remains the only company to have demonstrated a therapeutic anti-fibrotic benefit in large placebo-controlled Phase II and III trials with our first-in-class FXR agonist OCA that we believe to be crucial for the effective treatment of patients with advanced fibrosis due to NASH.
As the leader in this space, we've proven time and again, there simply are no shortcuts. Developing effective new treatments for these indications is a marathon, not a sprint, and we remain well positioned for continued success with the anticipated first-approved NASH therapy on the horizon. We are in the fortunate position to be building on our established strong standing within the liver community globally. Based on the foundation we've built and ongoing commercial success of our PBC business worldwide, we have great confidence in our ability to execute a successful first-to-market launch of OCA in NASH, which provided FDA grants us priority review and approval, could be as early as the spring of 2020.
I mentioned PBC and I'm pleased to point out the continued strong momentum in our business globally. We've continued to see steady demand growth versus the prior year quarter, based on solid execution of our commercial organization worldwide. Given our performance to date, we've now increased our 2019 full year net sales guidance for Ocaliva to between $245 million and $250 million.
We believe our established medical and commercial infrastructure supporting the PBC business uniquely positions us for success in NASH. We've developed strong relationships with hepatologists and gastroenterologists, the specialists treating patients with advanced fibrosis due to NASH, many of whom have already gained valuable experience prescribing Ocaliva to PBC patients. As we've previously stated, we are flexing up our existing infrastructure and capabilities, while building on our relationships within the community in preparation for our NASH launch.
Following its anticipated approval, OCA is positioned to become the foundational therapy in patients with advanced fibrosis due to NASH. We continue to have productive interactions with physicians, payers and patient groups, which Jerry will discuss in more detail shortly. These stakeholders all recognize the critical importance of a therapy with a robust anti-fibrotic benefit, underscoring what we believe to be OCA's key advantage.
I now want to pivot and spend some time discussing the upcoming Annual Meeting of the American Association for the study of liver diseases, the AASLD Liver meeting, where we will have a significant presence and more than 20 abstracts being presented in the general and late-breaker sessions. Our team is dedicated to our customers in the hepatology community and we're excited about the posters and presentations that will be showcased at the liver meeting.
Some highlights, on the PBC side, we're presenting the final results from our Phase III poised 5-year open-label phase, demonstrating OCA's durable therapeutic benefit with no new long-term safety findings in PBC patients on treatment for up to six years. On the NASH side, we'll have an oral presentation of the REGENERATE interim analysis results in the expanded intent-to-treat population, which reinforces the consistent benefit that OCA provides across the broader patient population. There are also two important patient-reported outcome or PRO abstracts from REGENERATE, including one demonstrating that patient-reported quality of life scores are substantially below population norms, indicating that NASH with established fibrosis is not an asymptomatic disease. And that effective anti-fibrotic treatment can improve PRO scores.
- interessanter Hinweis auf das Treffen der "American Association for the study of Liver Diseases" --> AASLD, welches vom 8. bis 12. November in Boston, Massachusetts, stattfinden wird. Mehr als 20 "Abstracts" und "late breaking abstracts" werden angekündigt. Vora allem der Hinweis, dass "...demonstrating OCA's durable therapeutic benefit with no new long-term safety findings in PBC patients on treatment for up to six years"
kein neues Signal bei der Langzeittherapie (5 Jahre !) festgestellt wurde, erhöht die Zulassungswahrscheinlichkeit auch in der Indikation "NASH mit Fibrose".
In addition to the execution of our regulatory filings, we've continued to be laser focused on ensuring commercial readiness for the first-ever NASH launch. With more than 15 years of experience focused on the development of novel therapies to treat progressive non-viral liver diseases, Intercept remains the only company to have demonstrated a therapeutic anti-fibrotic benefit in large placebo-controlled Phase II and III trials with our first-in-class FXR agonist OCA that we believe to be crucial for the effective treatment of patients with advanced fibrosis due to NASH.
As the leader in this space, we've proven time and again, there simply are no shortcuts. Developing effective new treatments for these indications is a marathon, not a sprint, and we remain well positioned for continued success with the anticipated first-approved NASH therapy on the horizon. We are in the fortunate position to be building on our established strong standing within the liver community globally. Based on the foundation we've built and ongoing commercial success of our PBC business worldwide, we have great confidence in our ability to execute a successful first-to-market launch of OCA in NASH, which provided FDA grants us priority review and approval, could be as early as the spring of 2020.
I mentioned PBC and I'm pleased to point out the continued strong momentum in our business globally. We've continued to see steady demand growth versus the prior year quarter, based on solid execution of our commercial organization worldwide. Given our performance to date, we've now increased our 2019 full year net sales guidance for Ocaliva to between $245 million and $250 million.
We believe our established medical and commercial infrastructure supporting the PBC business uniquely positions us for success in NASH. We've developed strong relationships with hepatologists and gastroenterologists, the specialists treating patients with advanced fibrosis due to NASH, many of whom have already gained valuable experience prescribing Ocaliva to PBC patients. As we've previously stated, we are flexing up our existing infrastructure and capabilities, while building on our relationships within the community in preparation for our NASH launch.
Following its anticipated approval, OCA is positioned to become the foundational therapy in patients with advanced fibrosis due to NASH. We continue to have productive interactions with physicians, payers and patient groups, which Jerry will discuss in more detail shortly. These stakeholders all recognize the critical importance of a therapy with a robust anti-fibrotic benefit, underscoring what we believe to be OCA's key advantage.
I now want to pivot and spend some time discussing the upcoming Annual Meeting of the American Association for the study of liver diseases, the AASLD Liver meeting, where we will have a significant presence and more than 20 abstracts being presented in the general and late-breaker sessions. Our team is dedicated to our customers in the hepatology community and we're excited about the posters and presentations that will be showcased at the liver meeting.
Some highlights, on the PBC side, we're presenting the final results from our Phase III poised 5-year open-label phase, demonstrating OCA's durable therapeutic benefit with no new long-term safety findings in PBC patients on treatment for up to six years. On the NASH side, we'll have an oral presentation of the REGENERATE interim analysis results in the expanded intent-to-treat population, which reinforces the consistent benefit that OCA provides across the broader patient population. There are also two important patient-reported outcome or PRO abstracts from REGENERATE, including one demonstrating that patient-reported quality of life scores are substantially below population norms, indicating that NASH with established fibrosis is not an asymptomatic disease. And that effective anti-fibrotic treatment can improve PRO scores.
Antwort auf Beitrag Nr.: 61.591.119 von Cyberhexe am 28.09.19 23:46:35
spätestens am 25. November hat die FDA die formale Annahme des Zulassungsantrages sowie die Entscheidung über "Priority Review" bekanntzugeben.
Dreistelliger Kurs dürfte bald in Sichtweite sein:
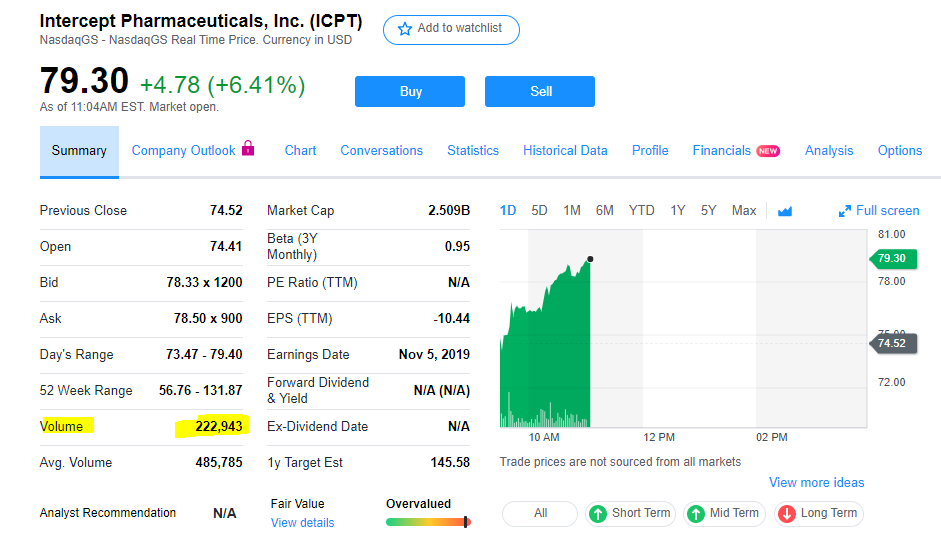
Zitat von Cyberhexe: Intercept hat den Zulassungsantrag (NDA) von Ocaliva zur Behandlung von durch NASH verursachte Fibrose, wie angekündigt im 3q19, bei der FDA eingereicht und kündigt bereits an, im 4q19 den Zulassungsantrag auch bei der EMA einzureichen. Gleichzeitig wurde bei der FDA eine beschleunigte Bearbeitung des Zulassungsantrages (Priority Review) beantragt. Falls dies genehmigt wird, und davon ist auszugehen, könnte eine Zulassungsentscheidung Ende März 2020 realistisch sein.
Bin mit 500 Stück am Freitag eingestiegen.
Sep 27, 2019
Intercept Submits New Drug Application to the U.S. FDA for Obeticholic Acid in Patients with Fibrosis Due to NASH
PDF Version
NDA supported by positive interim analysis results from REGENERATE Phase 3 study demonstrating OCA’s improvement of liver fibrosis without worsening of NASH
ir.interceptpharma.com/news-releases/news-release-details/in…
spätestens am 25. November hat die FDA die formale Annahme des Zulassungsantrages sowie die Entscheidung über "Priority Review" bekanntzugeben.
Dreistelliger Kurs dürfte bald in Sichtweite sein:

Bravo, endlich mal jemand, der eine nachhaltige Pharma-Aktie mit einem wahren Boom-Effekt ins Forum stellt! Bezüglich NASH sind einige am Start, der Amrkt gibt viel her, aber einer muss eben der Erste sein und das wird INTERCEPT! Ich habe ein langes Gesprach mit einem Biotech-Fondmanager geführt, der durchblicken ließ, dass man diesem Wert eine Verdoppelung bis März zutraut, da ist die finale Zulassung noch nicht einmal inbegriffen! Kaufen Kaufen Kaufen....
Gute news und 0 Umsatz an deutschen Handelsplätzen.... ....http://ir.interceptpharma.com/news-releases/news-release-det….
....http://ir.interceptpharma.com/news-releases/news-release-det…. 
 ....http://ir.interceptpharma.com/news-releases/news-release-det….
....http://ir.interceptpharma.com/news-releases/news-release-det…. 
das hat sich jetzt geändert.....aber viele sind nicht unbedingt dabei....
Der Kurs Richtung Süden heute, habe aber nix Negatives gefunden,,,,,https://ca.advfn.com/stock-market/NASDAQ/ICPT/stock-news/812… 

Antwort auf Beitrag Nr.: 62.101.796 von grayWOLF am 07.12.19 00:52:30stimmt, das war auch das einzige, was ich gefunden habe. Andererseits war es klar, dass ein Kurs, der so steil ansteigt, auch mal einen deutlichen Rücksetzer erleben kann, aber 10 % fand ich schon heftig.
Antwort auf Beitrag Nr.: 62.101.796 von grayWOLF am 07.12.19 00:52:30In dem Artikel selber waren einige kritische Kommentare zu Ocaliva:


Danke....hatte ich nicht gesehen.
Antwort auf Beitrag Nr.: 62.105.249 von xylophon am 07.12.19 21:55:47Intercept’s CEO Mark Pruzanski auf die Frage, wieviel Patienten mit Ocaliva behandelt werden könnten?
Es gibt schätzungsweise 6 Millionen Menschen in den USA mit NASH. Aber die Patienten, die den höchsten ungedeckten Bedarf haben, die am meisten gefährdet sind, sind Patienten mit fortgeschrittener Fibrose. Das sind die Patienten, die bis zur Zirrhose erkranken können und es auch tun. Und wir denken, dass es bei diesen Patienten am sinnvollsten ist, einzugreifen.
Aufgrund unserer Arbeit gehen wir davon aus, dass es heute etwa 500.000 in diesen Spezialpraxen gibt. Wir gehen davon aus, dass noch etwa 2,5 Millionen weitere Patienten in der Primärversorgung identifiziert werden müssen, aber offen gesagt, 500.000 ist eine gute Zahl von Menschen mit dieser Krankheit, mit fortgeschrittener Fibrose.
Hinsichtlich des festgestellten Juckreizes und wie sich dies auf die Anwendung von Ocaliva auswirken wird, hat er in etwa so geantwortet:
Wir sind diesbezüglich sehr offen. Juckreiz, oder juckende Haut, ist eine gut charakterisierte und bekannte Nebenwirkung dieses Medikaments und der gesamten Medikamentenklasse. Bei den meisten Patienten ist diese Nebenwirkung gut beherrschbar. Sind PBC-Patienten deswegen abgesetzt worden? Ja. Ist das der Hauptgrund? Nein. Bei NASH glauben wir, dass Juckreiz bei diesen Patienten beherrschbar ist.
Angesprochen auf den Preis von Ocaliva (bei der Indikation PBC fallen für Ocaliva Kosten in Höhe von $84'000/Jahr an. hat der CEO geantwortet:
$84.000 für eine seltene Krankheit halten wir für angemessen. Wir haben jedoch die Möglichkeit, den Preis für NASH anders zu gestalten, aber es noch keine Entscheidung diesbezüglich gefallen. Bei der Preisgestaltung für NASH werden Patienten mit fortgeschrittener Fibrose eine Spezialindikation sein, daher erwarten wir spezielle Produktpreise.
aus einem Interview mit STAT-Writer Adam Feuerstein - veröffentklicht am 14.1.2020
...wenn man die geäusserten Zahlen berücksichtigt, erhält man Schwindel erregende Beträge: 500'000 * 84'000$/a --> 42 Milliarden $/a Umsatzpotenzial. Obschon diese Zahl utopisch ist, verdeutlicht diese das Umsatzpotenzial eines NASH-Kandidaten wie Ocaliva. Das wird spannend!
Es gibt schätzungsweise 6 Millionen Menschen in den USA mit NASH. Aber die Patienten, die den höchsten ungedeckten Bedarf haben, die am meisten gefährdet sind, sind Patienten mit fortgeschrittener Fibrose. Das sind die Patienten, die bis zur Zirrhose erkranken können und es auch tun. Und wir denken, dass es bei diesen Patienten am sinnvollsten ist, einzugreifen.
Aufgrund unserer Arbeit gehen wir davon aus, dass es heute etwa 500.000 in diesen Spezialpraxen gibt. Wir gehen davon aus, dass noch etwa 2,5 Millionen weitere Patienten in der Primärversorgung identifiziert werden müssen, aber offen gesagt, 500.000 ist eine gute Zahl von Menschen mit dieser Krankheit, mit fortgeschrittener Fibrose.
Hinsichtlich des festgestellten Juckreizes und wie sich dies auf die Anwendung von Ocaliva auswirken wird, hat er in etwa so geantwortet:
Wir sind diesbezüglich sehr offen. Juckreiz, oder juckende Haut, ist eine gut charakterisierte und bekannte Nebenwirkung dieses Medikaments und der gesamten Medikamentenklasse. Bei den meisten Patienten ist diese Nebenwirkung gut beherrschbar. Sind PBC-Patienten deswegen abgesetzt worden? Ja. Ist das der Hauptgrund? Nein. Bei NASH glauben wir, dass Juckreiz bei diesen Patienten beherrschbar ist.
Angesprochen auf den Preis von Ocaliva (bei der Indikation PBC fallen für Ocaliva Kosten in Höhe von $84'000/Jahr an. hat der CEO geantwortet:
$84.000 für eine seltene Krankheit halten wir für angemessen. Wir haben jedoch die Möglichkeit, den Preis für NASH anders zu gestalten, aber es noch keine Entscheidung diesbezüglich gefallen. Bei der Preisgestaltung für NASH werden Patienten mit fortgeschrittener Fibrose eine Spezialindikation sein, daher erwarten wir spezielle Produktpreise.
aus einem Interview mit STAT-Writer Adam Feuerstein - veröffentklicht am 14.1.2020
...wenn man die geäusserten Zahlen berücksichtigt, erhält man Schwindel erregende Beträge: 500'000 * 84'000$/a --> 42 Milliarden $/a Umsatzpotenzial. Obschon diese Zahl utopisch ist, verdeutlicht diese das Umsatzpotenzial eines NASH-Kandidaten wie Ocaliva. Das wird spannend!
Antwort auf Beitrag Nr.: 62.378.030 von Cyberhexe am 15.01.20 08:11:11Citigroup sieht die Aktie fair bewertet, hebt aber das Kursziel von 85$ auf 140$ an.
The analyst believes the NASH launch is appropriately priced in.
Wir hören lieber auf den Vorstand, die institutionellen Investoren und die Cyberhexe und kaufen bei Schwäche nach.
https://finance.yahoo.com/news/citi-downgrades-intercept-say…
Das AdCom Meeting wurde für den 22. April angesetzt.... Die Zulassung verzögert sich etwas....
The FDA has tentatively scheduled the AdCom for April 22, 2020. Intercept anticipates that the FDA accordingly will extend the recently announced March 26, 2020 Prescription Drug User Fee Act (PDUFA) target action date for Intercept’s NDA. Intercept previously announced the FDA’s acceptance of the NDA and granting of priority review.
https://finance.yahoo.com/news/intercept-provides-regulatory…
The analyst believes the NASH launch is appropriately priced in.
Wir hören lieber auf den Vorstand, die institutionellen Investoren und die Cyberhexe und kaufen bei Schwäche nach.
https://finance.yahoo.com/news/citi-downgrades-intercept-say…
Das AdCom Meeting wurde für den 22. April angesetzt.... Die Zulassung verzögert sich etwas....
The FDA has tentatively scheduled the AdCom for April 22, 2020. Intercept anticipates that the FDA accordingly will extend the recently announced March 26, 2020 Prescription Drug User Fee Act (PDUFA) target action date for Intercept’s NDA. Intercept previously announced the FDA’s acceptance of the NDA and granting of priority review.
https://finance.yahoo.com/news/intercept-provides-regulatory…
Antwort auf Beitrag Nr.: 61.591.119 von Cyberhexe am 28.09.19 23:46:35
Hallo Cyberhexe,
bist du bei Intercept nicht mehr dabei?
Viele Grüße
Zitat von Cyberhexe: Intercept hat den Zulassungsantrag (NDA) von Ocaliva zur Behandlung von durch NASH verursachte Fibrose, wie angekündigt im 3q19, bei der FDA eingereicht und kündigt bereits an, im 4q19 den Zulassungsantrag auch bei der EMA einzureichen. Gleichzeitig wurde bei der FDA eine beschleunigte Bearbeitung des Zulassungsantrages (Priority Review) beantragt. Falls dies genehmigt wird, und davon ist auszugehen, könnte eine Zulassungsentscheidung Ende März 2020 realistisch sein.
Bin mit 500 Stück am Freitag eingestiegen.
Sep 27, 2019
Intercept Submits New Drug Application to the U.S. FDA for Obeticholic Acid in Patients with Fibrosis Due to NASH
PDF Version
NDA supported by positive interim analysis results from REGENERATE Phase 3 study demonstrating OCA’s improvement of liver fibrosis without worsening of NASH
NEW YORK, Sept. 27, 2019 (GLOBE NEWSWIRE) -- Intercept Pharmaceuticals, Inc. (Nasdaq:ICPT), a biopharmaceutical company focused on the development and commercialization of novel therapeutics to treat progressive non-viral liver diseases, today announced that it has submitted a New Drug Application (NDA) to the U.S. Food and Drug Adminstration (FDA) for obeticholic acid (OCA) for the treatment of patients with fibrosis due to nonalcoholic steatohepatitis (NASH).
OCA is the only investigational therapy to meet the primary endpoint of a Phase 3 study in patients with NASH and is the only such therapy that the FDA has designated a Breakthrough Therapy for NASH with fibrosis. As such, Intercept has requested a Priority Review for the NDA, which, if granted, would result in an anticipated six-month review period.
The submission is based on positive interim analysis results from the pivotal Phase 3 REGENERATE study in patients with liver fibrosis due to NASH. In the study, OCA 25 mg achieved its primary endpoint by demonstrating robust improvement in liver fibrosis (by ≥1 stage) without worsening of NASH at 18 months (p=0.0002 vs placebo).
“Our submission of the first NDA for the treatment of fibrosis due to NASH is a very important milestone for the field and the culmination of more than a decade of hard work,” said Mark Pruzanski, M.D., President and Chief Executive Officer of Intercept. “I am grateful to the thousands of NASH patients participating in our clinical studies, the investigators and study personnel at our study sites around the globe, and the entire Intercept team for bringing us to this point. We look forward to continuing to work with the FDA through the NDA review period and believe that, if approved, OCA has the potential to become an essential treatment for people living with advanced fibrosis due to NASH.”
Intercept also intends to file a marketing authorization application (MAA) with the European Medicines Agency in the fourth quarter of this year.
ir.interceptpharma.com/news-releases/news-release-details/in…
Hallo Cyberhexe,
bist du bei Intercept nicht mehr dabei?
Viele Grüße
Antwort auf Beitrag Nr.: 62.916.837 von pako21 am 07.03.20 15:18:32
...hab mein Depot auf überschaubare Werte reduziert und deswegen Intercept mit knapp +50% verkauft. Aktuell halte ich lediglich 4 Werte und bin auch mal short gegangen - das ist eine ganz neue Erfahrung!
long: TRVN, CHMA, XENE, SRPT
short: CYDY
Zitat von pako21:Zitat von Cyberhexe: Intercept hat den Zulassungsantrag (NDA) von Ocaliva zur Behandlung von durch NASH verursachte Fibrose, wie angekündigt im 3q19, bei der FDA eingereicht und kündigt bereits an, im 4q19 den Zulassungsantrag auch bei der EMA einzureichen. Gleichzeitig wurde bei der FDA eine beschleunigte Bearbeitung des Zulassungsantrages (Priority Review) beantragt. Falls dies genehmigt wird, und davon ist auszugehen, könnte eine Zulassungsentscheidung Ende März 2020 realistisch sein.
Bin mit 500 Stück am Freitag eingestiegen.
Sep 27, 2019
Intercept Submits New Drug Application to the U.S. FDA for Obeticholic Acid in Patients with Fibrosis Due to NASH
PDF Version
NDA supported by positive interim analysis results from REGENERATE Phase 3 study demonstrating OCA’s improvement of liver fibrosis without worsening of NASH
NEW YORK, Sept. 27, 2019 (GLOBE NEWSWIRE) -- Intercept Pharmaceuticals, Inc. (Nasdaq:ICPT), a biopharmaceutical company focused on the development and commercialization of novel therapeutics to treat progressive non-viral liver diseases, today announced that it has submitted a New Drug Application (NDA) to the U.S. Food and Drug Adminstration (FDA) for obeticholic acid (OCA) for the treatment of patients with fibrosis due to nonalcoholic steatohepatitis (NASH).
OCA is the only investigational therapy to meet the primary endpoint of a Phase 3 study in patients with NASH and is the only such therapy that the FDA has designated a Breakthrough Therapy for NASH with fibrosis. As such, Intercept has requested a Priority Review for the NDA, which, if granted, would result in an anticipated six-month review period.
The submission is based on positive interim analysis results from the pivotal Phase 3 REGENERATE study in patients with liver fibrosis due to NASH. In the study, OCA 25 mg achieved its primary endpoint by demonstrating robust improvement in liver fibrosis (by ≥1 stage) without worsening of NASH at 18 months (p=0.0002 vs placebo).
“Our submission of the first NDA for the treatment of fibrosis due to NASH is a very important milestone for the field and the culmination of more than a decade of hard work,” said Mark Pruzanski, M.D., President and Chief Executive Officer of Intercept. “I am grateful to the thousands of NASH patients participating in our clinical studies, the investigators and study personnel at our study sites around the globe, and the entire Intercept team for bringing us to this point. We look forward to continuing to work with the FDA through the NDA review period and believe that, if approved, OCA has the potential to become an essential treatment for people living with advanced fibrosis due to NASH.”
Intercept also intends to file a marketing authorization application (MAA) with the European Medicines Agency in the fourth quarter of this year.
ir.interceptpharma.com/news-releases/news-release-details/in…
Hallo Cyberhexe,
bist du bei Intercept nicht mehr dabei?
Viele Grüße
...hab mein Depot auf überschaubare Werte reduziert und deswegen Intercept mit knapp +50% verkauft. Aktuell halte ich lediglich 4 Werte und bin auch mal short gegangen - das ist eine ganz neue Erfahrung!
long: TRVN, CHMA, XENE, SRPT
short: CYDY
Antwort auf Beitrag Nr.: 62.918.925 von Cyberhexe am 07.03.20 21:50:06Danke!
Ich habe bisher nur mit Indizes auf fallende und steigende Kurse spekuliert.
Viel Erfolg
Ich habe bisher nur mit Indizes auf fallende und steigende Kurse spekuliert.
Viel Erfolg
Nicht ganz unproblematisch....
https://infoviewer.infodesk.com/infodisplay/item/2ae5ff4e-08…
Antwort auf Beitrag Nr.: 63.792.878 von mogge67 am 25.05.20 13:31:34Sogar problematisch 😁
https://newsfilter.io/a/600ba01c0f7d4032a94af879129fa606
Läuft wohl immer mehr auf
NGM
MDGL
VKTX
raus.
Bin noch nicht wieder im Nash Bereich
Investiert. Werde zur gegebenen Zeit nachdem meine Covid Werte was abgeworfen haben hier wieder rein gehen.
S.
https://newsfilter.io/a/600ba01c0f7d4032a94af879129fa606
Läuft wohl immer mehr auf
NGM
MDGL
VKTX
raus.
Bin noch nicht wieder im Nash Bereich
Investiert. Werde zur gegebenen Zeit nachdem meine Covid Werte was abgeworfen haben hier wieder rein gehen.
S.
Antwort auf Beitrag Nr.: 64.220.578 von Schaeffi am 29.06.20 14:11:37das ist bitter, mit dieser Aktie habe ich einfach kein Glück. Für meine Frau habe ich sie mal mit Erfolg getradet, bei mir selbst erwische ich immer die falschen Zeitpunkte. Beim Kauf im März war ich sicher, mit Gewinn raus zu gehen, aber jetzt bin ich erst mal raus. Meist dauert so ein Absturz nicht nur 1 Tag....
@Schaeffi
Ja, sogar problematisch!
Ich bin, wie ich schon öfter bekundet habe, eher überzeugt vom Ansatz FGF oder GLP-1.
Es handelt sich um körpereigene Hormone, die man therapeutisch nutzt.
Gerade bei NAFLD sind die Prozesse hochkomplex und nicht bis ins letzte Detail verstanden.
Aus diesem Grund bin ich beim Eingriff in diese Prozesse, mit "exogenen Substanzen", eher pessimistisch gestimmt.
Selbstverständlich bin ich mir im Klaren darüber, dass auch FGF und GLP-1 scheitern könnten.
Völlig subjektiv habe ich hier aber eine positivere Einschätzung.
Ich war letzte Woche auf einer Fortbildung.
Einer der Referenten präsentierte einen exzellenten Vortrag über Lebererkrankungen, welcher mich in meiner Einschätzung noch bestärkt hat.
Natürlich bin ich mir bewusst, dass ich mit meiner persönlichen Einschätzung trotzdem völlig falsch liegen kann.
Die aktuelle Entwicklung zeigt aber auch, dass die Behandlung von NAFLD sehr komplex ist, was durch die Schwierigkeiten, eine Zulassung zu bekommen, bestätigt wird.
Insofern bleibe ich NGM, Akero und NovoNordisk erst einmal treu und warte die Entwicklung ab.
Akero wird ja noch heute Daten präsentieren. Bin gespannt!
Ja, sogar problematisch!
Ich bin, wie ich schon öfter bekundet habe, eher überzeugt vom Ansatz FGF oder GLP-1.
Es handelt sich um körpereigene Hormone, die man therapeutisch nutzt.
Gerade bei NAFLD sind die Prozesse hochkomplex und nicht bis ins letzte Detail verstanden.
Aus diesem Grund bin ich beim Eingriff in diese Prozesse, mit "exogenen Substanzen", eher pessimistisch gestimmt.
Selbstverständlich bin ich mir im Klaren darüber, dass auch FGF und GLP-1 scheitern könnten.
Völlig subjektiv habe ich hier aber eine positivere Einschätzung.
Ich war letzte Woche auf einer Fortbildung.
Einer der Referenten präsentierte einen exzellenten Vortrag über Lebererkrankungen, welcher mich in meiner Einschätzung noch bestärkt hat.
Natürlich bin ich mir bewusst, dass ich mit meiner persönlichen Einschätzung trotzdem völlig falsch liegen kann.
Die aktuelle Entwicklung zeigt aber auch, dass die Behandlung von NAFLD sehr komplex ist, was durch die Schwierigkeiten, eine Zulassung zu bekommen, bestätigt wird.
Insofern bleibe ich NGM, Akero und NovoNordisk erst einmal treu und warte die Entwicklung ab.
Akero wird ja noch heute Daten präsentieren. Bin gespannt!
welche Unternehmen / Aktien haben denn Konkurenz-Produkte zu NAFLD/NASH von ICTP die ggfs. größeres Potential haben?
Antwort auf Beitrag Nr.: 65.251.090 von somersault am 01.10.20 13:42:46Da ich auch ein Nash Beobachter bin.
Für mich sind das neben.
NGM
AKRO
noch
MDGL
VKTX
die ich für aussichtsreich halte.
GNFT und ICPT haben geloost.
S.
Für mich sind das neben.
NGM
AKRO
noch
MDGL
VKTX
die ich für aussichtsreich halte.
GNFT und ICPT haben geloost.
S.
Antwort auf Beitrag Nr.: 65.251.411 von Schaeffi am 01.10.20 14:11:40ich halte derzeit die THR-beta-Agonisten von Madrigal (RESMETIROM) und Viking (VK2809) am aussichtsreichsten, wobei von diesen RESMETIROM eindeutig am weitesten entwickelt ist:
https://clinicaltrials.gov/ct2/show/NCT04197479?term=RESMETI…
https://clinicaltrials.gov/ct2/show/NCT03900429?term=RESMETI…
https://clinicaltrials.gov/ct2/show/NCT04197479?term=RESMETI…
https://clinicaltrials.gov/ct2/show/NCT03900429?term=RESMETI…
Intercept Pharmaceuticals: Wachstumspotenzial von 467 %
Die Crème de la Crème der Chancen, zumindest auf dieser Liste, ist der auf Lebererkrankungen fokussierte Biotech-Small-Cap Intercept Pharmaceuticals. Yasmeen Rahimi von Piper Sandler stuft Intercept mit einem Kursziel von 82 US-Dollar ein. Wenn dies zutrifft, würde die Aktie gegenüber dem Schlusskurs der vergangenen Woche um 467 % zulegen.
Obeticholsäure (OCA) als Mittel zur Behandlung der nichtalkoholischen Steatohepatitis (NASH) ist für Intercept ein entscheidender Faktor. NASH betrifft 2 bis 5 % der erwachsenen US-Bevölkerung, ist eine Indikation mit einem geschätzten Umsatzvolumen von 35 Mrd. US-Dollar und hat keine von der FDA zugelassene Behandlung auf dem Markt.
Das Hauptmedikament von Intercept hat in der Phase-3-Studie Regenerate einen der beiden co-primären Endpunkte erreicht, nämlich eine statistisch signifikante Verbesserung der Leberfibrose ohne Verschlechterung der NASH. Die wirksamere höhere Dosis führte jedoch auch zu einem bemerkenswerten Anstieg der Abbrüche von Studienteilnehmern und einer höheren Prävalenz von Pruritus (Juckreiz) im Vergleich zur Placebogruppe. Intercept hat bei seinem ersten Versuch, die Zulassung von OCA zu erhalten, einen Complete Response Letter erhalten und beabsichtigt, weitere Studiendaten einzureichen in der Hoffnung, dass es in die Apothekenregale kommt. Selbst wenn das Medikament zugelassen und nur für eine kleine Gruppe von NASH-Patienten eingesetzt würde, könnte es ein jährliches Umsatzpotenzial in Milliardenhöhe bieten.
Darüber hinaus ist OCA von der FDA zur Behandlung der primär biliären Cholangitis (PBC) zugelassen. Mit dieser PBC-Indikation könnte Intercept einen Jahresumsatz von über 350 Mio. US-Dollar erzielen. Obwohl das Risiko-Ertrags-Profil von Intercept hier günstig ist, erscheint das Kursziel von 82 US-Dollar zu hoch.
https://www.onvista.de/news/laut-wall-street-5-aktien-mit-19…
💡
Ich bin gespannt, ob der Schluss vom Freitag was zu sagen hat oder ob es erstmal wieder runter geht, aber schöner Break des downtrends. Hätte nichts gegen einen gap up für einen QuickWin, aber nehme ich den positiven Aufwärtstrend. 😉
und wieder runter gegen 10 EUR...wieder zu früh eingegkauft...
Intercept Announces Positive Data in Fibrosis due to NASH from a New Analysis of its Phase 3 REGENERATE Study of Obeticholic Acid (OCA)
OCA 25 mg met the agreed primary endpoint of improvement in liver fibrosis without worsening of NASH at 18 months (p<0.0001), consistent with the original REGENERATE analysis
OCA 25 mg demonstrated double the response rate in reduction of liver fibrosis without worsening of NASH vs. placebo
Includes larger and more robust safety database of 2,477 patients with nearly 1,000 on study drug for 4 years
Intercept to resubmit new drug application (NDA) in liver fibrosis due to NASH; pre-submission meeting with FDA scheduled later this month
https://finance.yahoo.com/news/intercept-announces-positive-…
OCA 25 mg met the agreed primary endpoint of improvement in liver fibrosis without worsening of NASH at 18 months (p<0.0001), consistent with the original REGENERATE analysis
OCA 25 mg demonstrated double the response rate in reduction of liver fibrosis without worsening of NASH vs. placebo
Includes larger and more robust safety database of 2,477 patients with nearly 1,000 on study drug for 4 years
Intercept to resubmit new drug application (NDA) in liver fibrosis due to NASH; pre-submission meeting with FDA scheduled later this month
https://finance.yahoo.com/news/intercept-announces-positive-…
Positive Daten aber der Kurs in USA fällt x eben knapp 10 Prozent
Muss man das jetzt verstehen….also doch nicht positiv oder was?
Muss man das jetzt verstehen….also doch nicht positiv oder was?
Intercept aims for another NASH try with new Ocaliva analysis. Will the FDA bite?
An Intercept Pharmaceuticals trial has hit one of its primary endpoints showing Ocaliva can improve on liver fibrosis, but it failed to show a significant benefit on nonalcoholic steatohepatitis resolution.
https://www.fiercepharma.com/pharma/intercept-aims-2nd-nash-…
An Intercept Pharmaceuticals trial has hit one of its primary endpoints showing Ocaliva can improve on liver fibrosis, but it failed to show a significant benefit on nonalcoholic steatohepatitis resolution.
https://www.fiercepharma.com/pharma/intercept-aims-2nd-nash-…
Antwort auf Beitrag Nr.: 71.943.153 von pako21 am 08.07.22 13:59:58
https://ir.interceptpharma.com/press-releases
_________________________________________________________________
Presseinformation
Intercept gibt bekannt, dass auf dem AASLD The Liver Meeting® 2022 neue Daten zu PBC, Leberfibrose aufgrund von NASH und Pipeline vorgestellt werden
31. Oktober 2022 um 4:05 PM EDT
PDF herunterladen
Daten aus der Phase-3-Studie REGENERATE, die ein positives Nutzen-Risiko-Profil von Obeticholsäure (OCA) bei Leberfibrose aufgrund von NASH belegen, werden in einem Podiumsvortrag zu später Stunde vorgestellt
Präsentation einer Analyse, die eine Verbesserung der Ergebnisse, einschließlich des transplantationsfreien Überlebens, bei PBC-Patienten, die mit OCA behandelt wurden, im Vergleich zu Placebo und externen Kontrollen belegt
Neue Daten zu INT-787, dem FXR-Agonisten der nächsten Generation von Intercept, werden in zwei Postern vorgestellt
MORRISTOWN, N.J., 31. Oktober 2022 (GLOBE NEWSWIRE) -- Intercept Pharmaceuticals, Inc. (Nasdaq: ICPT), ein biopharmazeutisches Unternehmen, das sich auf die Entwicklung und Vermarktung neuartiger Therapeutika zur Behandlung fortschreitender nicht-viraler Lebererkrankungen konzentriert, gab heute bekannt, dass mehrere Abstracts zu Obeticholsäure (OCA) und INT-787, einem FXR-Agonisten der nächsten Generation, auf dem The Liver Meeting® 2022, der Jahrestagung der American Association for the Study of Liver Diseases (AASLD), vorgestellt werden. Das Liver Meeting® findet vom 4. bis 8. November 2022 in Washington, D.C. statt.
"Wir freuen uns, dieses Jahr persönlich am Liver Meeting® teilzunehmen, wo wir eine Vielzahl von Daten vorstellen werden, die den klinischen Nutzen von OCA sowohl bei PBC als auch bei Leberfibrose aufgrund von NASH belegen, sowie ausgewählte präklinische und frühe klinische Daten zu unserem FXR-Agonisten der nächsten Generation, INT-787", sagte Dr. M. Michelle Berrey, MPH, President of R&D und Chief Medical Officer von Intercept. "Wir freuen uns besonders, zusätzliche Analysen unserer zulassungsrelevanten REGENERATE-Studie vorzustellen, die unserer Meinung nach das positive Nutzen-Risiko-Profil von OCA bei Leberfibrose aufgrund von NASH weiter untermauern. Die umfassenden Sicherheitsanalysen und die neuen histologischen Ergebnisse der REGENERATE-Studie werden in den neuen Zulassungsantrag einfließen, den wir bis Ende des Jahres erneut einreichen wollen."
Die Verwendung von OCA bei Fibrose aufgrund von NASH ist ein Prüfverfahren und wurde weder von der US Food and Drug Administration noch von einer anderen Gesundheitsbehörde zugelassen.
Zu den Präsentationen auf dem Liver Meeting gehören:
Bahnbrechende mündliche Präsentation über Fibrose aufgrund von NASH
"Topline-Ergebnisse aus einer neuen Analyse der REGENERATE-Studie mit Obeticholsäure zur Behandlung der nichtalkoholischen Steatohepatitis" (Abstract #5008)
Arun J. Sanyal, Rohit Loomba, Quentin M. Anstee, Vlad Ratziu, Kris V. Kowdley, Mary E. Rinella, Muhammad Y. Sheikh, James F. Trotter, Whitfield L. Knapple, Eric J. Lawitz, Manal F. Abdalmalek, Philip N. Newsome, Jerome Boursier, Philippe Mathurin, Jean-Francois Dufour, M. Michelle Berrey, Steven J. Shiff, Sangeeta Sawhney, Thomas Capozza, Rina Leyva, Stephen A. Harrison und Zobair M. Younossi
Nur zu Info:
Quelle:https://ir.interceptpharma.com/press-releases
_________________________________________________________________
Presseinformation
Intercept gibt bekannt, dass auf dem AASLD The Liver Meeting® 2022 neue Daten zu PBC, Leberfibrose aufgrund von NASH und Pipeline vorgestellt werden
31. Oktober 2022 um 4:05 PM EDT
PDF herunterladen
Daten aus der Phase-3-Studie REGENERATE, die ein positives Nutzen-Risiko-Profil von Obeticholsäure (OCA) bei Leberfibrose aufgrund von NASH belegen, werden in einem Podiumsvortrag zu später Stunde vorgestellt
Präsentation einer Analyse, die eine Verbesserung der Ergebnisse, einschließlich des transplantationsfreien Überlebens, bei PBC-Patienten, die mit OCA behandelt wurden, im Vergleich zu Placebo und externen Kontrollen belegt
Neue Daten zu INT-787, dem FXR-Agonisten der nächsten Generation von Intercept, werden in zwei Postern vorgestellt
MORRISTOWN, N.J., 31. Oktober 2022 (GLOBE NEWSWIRE) -- Intercept Pharmaceuticals, Inc. (Nasdaq: ICPT), ein biopharmazeutisches Unternehmen, das sich auf die Entwicklung und Vermarktung neuartiger Therapeutika zur Behandlung fortschreitender nicht-viraler Lebererkrankungen konzentriert, gab heute bekannt, dass mehrere Abstracts zu Obeticholsäure (OCA) und INT-787, einem FXR-Agonisten der nächsten Generation, auf dem The Liver Meeting® 2022, der Jahrestagung der American Association for the Study of Liver Diseases (AASLD), vorgestellt werden. Das Liver Meeting® findet vom 4. bis 8. November 2022 in Washington, D.C. statt.
"Wir freuen uns, dieses Jahr persönlich am Liver Meeting® teilzunehmen, wo wir eine Vielzahl von Daten vorstellen werden, die den klinischen Nutzen von OCA sowohl bei PBC als auch bei Leberfibrose aufgrund von NASH belegen, sowie ausgewählte präklinische und frühe klinische Daten zu unserem FXR-Agonisten der nächsten Generation, INT-787", sagte Dr. M. Michelle Berrey, MPH, President of R&D und Chief Medical Officer von Intercept. "Wir freuen uns besonders, zusätzliche Analysen unserer zulassungsrelevanten REGENERATE-Studie vorzustellen, die unserer Meinung nach das positive Nutzen-Risiko-Profil von OCA bei Leberfibrose aufgrund von NASH weiter untermauern. Die umfassenden Sicherheitsanalysen und die neuen histologischen Ergebnisse der REGENERATE-Studie werden in den neuen Zulassungsantrag einfließen, den wir bis Ende des Jahres erneut einreichen wollen."
Die Verwendung von OCA bei Fibrose aufgrund von NASH ist ein Prüfverfahren und wurde weder von der US Food and Drug Administration noch von einer anderen Gesundheitsbehörde zugelassen.
Zu den Präsentationen auf dem Liver Meeting gehören:
Bahnbrechende mündliche Präsentation über Fibrose aufgrund von NASH
"Topline-Ergebnisse aus einer neuen Analyse der REGENERATE-Studie mit Obeticholsäure zur Behandlung der nichtalkoholischen Steatohepatitis" (Abstract #5008)
Arun J. Sanyal, Rohit Loomba, Quentin M. Anstee, Vlad Ratziu, Kris V. Kowdley, Mary E. Rinella, Muhammad Y. Sheikh, James F. Trotter, Whitfield L. Knapple, Eric J. Lawitz, Manal F. Abdalmalek, Philip N. Newsome, Jerome Boursier, Philippe Mathurin, Jean-Francois Dufour, M. Michelle Berrey, Steven J. Shiff, Sangeeta Sawhney, Thomas Capozza, Rina Leyva, Stephen A. Harrison und Zobair M. Younossi
Antwort auf Beitrag Nr.: 72.673.138 von fuszi am 01.11.22 17:42:35
https://ir.interceptpharma.com/news-releases/news-release-de…
____________________________________________________________________________________________________________________
Presseinformation
Intercept Pharmaceuticals veröffentlicht Finanzergebnisse für das dritte Quartal 2022 und gibt aktuelle Geschäftszahlen bekannt
1. November 2022 um 7:00 AM EDT
PDF herunterladen
Ocaliva®-Nettoumsatz in den USA von 77,6 Millionen US-Dollar; 16,4 % Wachstum gegenüber dem Vorjahresquartal
Das Unternehmen erhöht die Prognose für den bereinigten Nettoumsatz von Ocaliva im Jahr 2022 (Non-GAAP) auf 340 bis 350 Mio. US-Dollar und senkt die Prognose für die bereinigten Betriebskosten (Non-GAAP) auf 350 bis 365 Mio. US-Dollar
Zum 30. September 2022 verfügt das Unternehmen über liquide Mittel, liquide Mitteläquivalente, liquide Mittel mit Verfügungsbeschränkung und zur Veräußerung verfügbare Schuldtitel in Höhe von 497,8 Millionen US-Dollar
Das Unternehmen bleibt auf Kurs, um bis Ende 2022 einen neuen Zulassungsantrag (NDA) für Obeticholsäure (OCA) bei Leberfibrose aufgrund von NASH auf der Grundlage der positiven Phase-3-Studie REGENERATE einzureichen
MORRISTOWN, N.J., Nov. 01, 2022 (GLOBE NEWSWIRE) -- Intercept Pharmaceuticals, Inc. (Nasdaq: ICPT), ein biopharmazeutisches Unternehmen, das sich auf die Entwicklung und Vermarktung neuartiger Therapeutika zur Behandlung fortschreitender, nicht-viraler Lebererkrankungen konzentriert, gab heute seine Finanzergebnisse für das am 30. September 2022 zu Ende gegangene Quartal bekannt.
"Wir haben in diesem Quartal ein beschleunigtes, zweistelliges Wachstum bei Ocaliva erzielt, was zu einer Erhöhung unserer Umsatzprognose für dieses Jahr geführt hat", sagte Jerry Durso, Präsident und Chief Executive Officer von Intercept. "Das Ergebnis dieses Quartals unterstreicht die Stärke und den Wert unseres PBC-Geschäfts, und angesichts der Anzahl der Patienten, die für eine Zweitlinientherapie in Frage kommen, bieten sich erhebliche Wachstumschancen. Wichtig ist, dass die Langzeitdaten, die wir generieren, die Rolle, die Ocaliva in der Zukunft der PBC-Behandlung spielen kann, unterstreichen."
"Kurzfristig sind wir weiterhin auf dem Weg, unseren Zulassungsantrag für die Behandlung von Leberfibrose aufgrund von NASH bis Ende dieses Jahres erneut einzureichen, basierend auf der zweiten positiven Zwischenanalyse unserer Phase-3-Studie REGENERATE", so Durso weiter. "Darüber hinaus werden weitere Daten aus der REGENERATE-Studie im Laufe dieses Monats in einer späten mündlichen Präsentation auf dem The Liver Meeting® vorgestellt. Wichtig ist, dass wir angesichts der jüngsten strategischen Transaktionen, die unsere Kapitalstruktur gestärkt haben, finanziell gut aufgestellt sind, um diese kritische Zeit zu überstehen und gleichzeitig für die Zukunft zu bauen."
Höhepunkte des Programms
Primär biliäre Cholangitis (PBC)
Gastroenterology veröffentlichte Daten, die zeigen, dass Patienten, die im Rahmen einer klinischen Studie mit OCA behandelt wurden, ein längeres transplantationsfreies Überleben hatten als Patienten mit PBC aus realen Patientenregistern, die keine OCA erhielten.
Wir stellen weiterhin Daten aus unserer Post-Marketing-Studie COBALT sowie ergänzende reale Daten aus großen Datensätzen in den USA, Großbritannien und Europa zusammen, die in einen Zulassungsantrag bei der FDA einfließen sollen, um unsere Anforderungen für die Nachzulassung von Ocaliva bei PBC zu erfüllen. Um eine umfassende Prüfung unseres Antrags zu ermöglichen, werden wir, wie von der FDA gefordert, eine größere Anzahl von Real-World-Analysen und Bewertungen von Ereignissen aus unserer Phase-4-Studie COBALT einbeziehen, wodurch sich unser voraussichtlicher Zeitplan für die Einreichung auf 2023 verschieben wird.
Unser Entwicklungsprogramm für die Kombination von OCA und Bezafibrat in fester Dosierung läuft weiter, und wir untersuchen weiterhin Patienten und nehmen weitere klinische Zentren in unsere beiden Phase-2-Studien auf, in denen verschiedene Dosierungen von OCA und Bezafibrat für die geplante Kombination in fester Dosierung untersucht werden.
Nichtalkoholische Steatohepatitis (NASH)
Wir sind weiterhin auf dem besten Weg, unseren Zulassungsantrag für OCA bei Leberfibrose aufgrund von NASH bis Ende 2022 erneut einzureichen, basierend auf der positiven neuen Zwischenanalyse unserer Phase-3-Studie REGENERATE, die Anfang des Jahres abgeschlossen wurde.
Weitere Daten aus der REGENERATE-Studie werden in einer späten mündlichen Präsentation auf dem The Liver Meeting® vorgestellt.
Wie bereits bekannt gegeben, hat unsere REVERSE-Studie der Phase 3 bei Patienten mit kompensierter Zirrhose aufgrund von NASH den vorgeschriebenen primären Endpunkt nicht erreicht. Wichtig ist, dass in dieser Patientenpopulation mit kompensierter Zirrhose keine neuen Sicherheitssignale für OCA beobachtet wurden.
Pipeline
Unsere umfassende Phase-1-Studie für unseren FXR-Agonisten der nächsten Generation, INT-787, hat die letzte Kohorte erreicht. Wir freuen uns darauf, nächste Woche auf dem The Liver Meeting® Daten aus unseren Phase-1-Studien sowie unsere Leitindikation und Updates zu unserer Proof-of-Concept-Studie FRESH vorzustellen
Neue Infos:
Quelle:https://ir.interceptpharma.com/news-releases/news-release-de…
____________________________________________________________________________________________________________________
Presseinformation
Intercept Pharmaceuticals veröffentlicht Finanzergebnisse für das dritte Quartal 2022 und gibt aktuelle Geschäftszahlen bekannt
1. November 2022 um 7:00 AM EDT
PDF herunterladen
Ocaliva®-Nettoumsatz in den USA von 77,6 Millionen US-Dollar; 16,4 % Wachstum gegenüber dem Vorjahresquartal
Das Unternehmen erhöht die Prognose für den bereinigten Nettoumsatz von Ocaliva im Jahr 2022 (Non-GAAP) auf 340 bis 350 Mio. US-Dollar und senkt die Prognose für die bereinigten Betriebskosten (Non-GAAP) auf 350 bis 365 Mio. US-Dollar
Zum 30. September 2022 verfügt das Unternehmen über liquide Mittel, liquide Mitteläquivalente, liquide Mittel mit Verfügungsbeschränkung und zur Veräußerung verfügbare Schuldtitel in Höhe von 497,8 Millionen US-Dollar
Das Unternehmen bleibt auf Kurs, um bis Ende 2022 einen neuen Zulassungsantrag (NDA) für Obeticholsäure (OCA) bei Leberfibrose aufgrund von NASH auf der Grundlage der positiven Phase-3-Studie REGENERATE einzureichen
MORRISTOWN, N.J., Nov. 01, 2022 (GLOBE NEWSWIRE) -- Intercept Pharmaceuticals, Inc. (Nasdaq: ICPT), ein biopharmazeutisches Unternehmen, das sich auf die Entwicklung und Vermarktung neuartiger Therapeutika zur Behandlung fortschreitender, nicht-viraler Lebererkrankungen konzentriert, gab heute seine Finanzergebnisse für das am 30. September 2022 zu Ende gegangene Quartal bekannt.
"Wir haben in diesem Quartal ein beschleunigtes, zweistelliges Wachstum bei Ocaliva erzielt, was zu einer Erhöhung unserer Umsatzprognose für dieses Jahr geführt hat", sagte Jerry Durso, Präsident und Chief Executive Officer von Intercept. "Das Ergebnis dieses Quartals unterstreicht die Stärke und den Wert unseres PBC-Geschäfts, und angesichts der Anzahl der Patienten, die für eine Zweitlinientherapie in Frage kommen, bieten sich erhebliche Wachstumschancen. Wichtig ist, dass die Langzeitdaten, die wir generieren, die Rolle, die Ocaliva in der Zukunft der PBC-Behandlung spielen kann, unterstreichen."
"Kurzfristig sind wir weiterhin auf dem Weg, unseren Zulassungsantrag für die Behandlung von Leberfibrose aufgrund von NASH bis Ende dieses Jahres erneut einzureichen, basierend auf der zweiten positiven Zwischenanalyse unserer Phase-3-Studie REGENERATE", so Durso weiter. "Darüber hinaus werden weitere Daten aus der REGENERATE-Studie im Laufe dieses Monats in einer späten mündlichen Präsentation auf dem The Liver Meeting® vorgestellt. Wichtig ist, dass wir angesichts der jüngsten strategischen Transaktionen, die unsere Kapitalstruktur gestärkt haben, finanziell gut aufgestellt sind, um diese kritische Zeit zu überstehen und gleichzeitig für die Zukunft zu bauen."
Höhepunkte des Programms
Primär biliäre Cholangitis (PBC)
Gastroenterology veröffentlichte Daten, die zeigen, dass Patienten, die im Rahmen einer klinischen Studie mit OCA behandelt wurden, ein längeres transplantationsfreies Überleben hatten als Patienten mit PBC aus realen Patientenregistern, die keine OCA erhielten.
Wir stellen weiterhin Daten aus unserer Post-Marketing-Studie COBALT sowie ergänzende reale Daten aus großen Datensätzen in den USA, Großbritannien und Europa zusammen, die in einen Zulassungsantrag bei der FDA einfließen sollen, um unsere Anforderungen für die Nachzulassung von Ocaliva bei PBC zu erfüllen. Um eine umfassende Prüfung unseres Antrags zu ermöglichen, werden wir, wie von der FDA gefordert, eine größere Anzahl von Real-World-Analysen und Bewertungen von Ereignissen aus unserer Phase-4-Studie COBALT einbeziehen, wodurch sich unser voraussichtlicher Zeitplan für die Einreichung auf 2023 verschieben wird.
Unser Entwicklungsprogramm für die Kombination von OCA und Bezafibrat in fester Dosierung läuft weiter, und wir untersuchen weiterhin Patienten und nehmen weitere klinische Zentren in unsere beiden Phase-2-Studien auf, in denen verschiedene Dosierungen von OCA und Bezafibrat für die geplante Kombination in fester Dosierung untersucht werden.
Nichtalkoholische Steatohepatitis (NASH)
Wir sind weiterhin auf dem besten Weg, unseren Zulassungsantrag für OCA bei Leberfibrose aufgrund von NASH bis Ende 2022 erneut einzureichen, basierend auf der positiven neuen Zwischenanalyse unserer Phase-3-Studie REGENERATE, die Anfang des Jahres abgeschlossen wurde.
Weitere Daten aus der REGENERATE-Studie werden in einer späten mündlichen Präsentation auf dem The Liver Meeting® vorgestellt.
Wie bereits bekannt gegeben, hat unsere REVERSE-Studie der Phase 3 bei Patienten mit kompensierter Zirrhose aufgrund von NASH den vorgeschriebenen primären Endpunkt nicht erreicht. Wichtig ist, dass in dieser Patientenpopulation mit kompensierter Zirrhose keine neuen Sicherheitssignale für OCA beobachtet wurden.
Pipeline
Unsere umfassende Phase-1-Studie für unseren FXR-Agonisten der nächsten Generation, INT-787, hat die letzte Kohorte erreicht. Wir freuen uns darauf, nächste Woche auf dem The Liver Meeting® Daten aus unseren Phase-1-Studien sowie unsere Leitindikation und Updates zu unserer Proof-of-Concept-Studie FRESH vorzustellen
Was geht da ab ?
https://www.marketwatch.com/investing/stock/icpt?mod=mw_quot… Warum die Aktie von Intercept Pharmaceuticals heute stark ansteigt:
Quelle:https://www.fool.com/investing/2022/11/01/why-intercept-phar…
_________________________________________________________________________________________
Die Anleger bejubeln das Q3-Update des Arzneimittelherstellers.
Was geschah
Die Aktien von Intercept Pharmaceuticals (ICPT 15.15%) stiegen um 12:02 p.m. ET am Dienstag um 15.7%. Der große Gewinn kam, nachdem der Arzneimittelhersteller seine Ergebnisse für das dritte Quartal vor der Markteröffnung bekannt gab.
Intercept meldete für das 3. Quartal einen Umsatz von 77,6 Mio. $, 16,5 % mehr als im Vorjahr. Die Konsensschätzung der Wall Street lag bei einem Umsatz von 74,1 Millionen Dollar. Das Unternehmen verzeichnete im 3. Quartal einen Gewinn von 267,5 Mio. US-Dollar bzw. 7,80 US-Dollar pro Aktie. Dies stellt eine deutliche Verbesserung gegenüber dem Nettoverlust von 3,6 Millionen Dollar oder 0,11 Dollar pro Aktie im Vorjahreszeitraum dar. Damit wurde auch die durchschnittliche Gewinnschätzung der Analysten von 4,61 Dollar pro Aktie deutlich übertroffen.
Darüber hinaus erhöhte Intercept seine Prognose für den bereinigten Nettoumsatz von Ocaliva für das Gesamtjahr 2022. Das Unternehmen geht nun davon aus, dass das Medikament gegen primäre biliäre Cholangitis (PBC) zwischen 340 und 350 Millionen US-Dollar einbringen wird, gegenüber der vorherigen Prognose von 325 bis 345 Millionen US-Dollar.
Intercept Announces Additional Positive Data in Fibrosis due to NASH from New Analysis of Phase 3 REGENERATE Study at AASLD The Liver Meeting® 2022
- OCA 25 mg demonstrated double the response rate of placebo in reduction of liver fibrosis without worsening of NASH; consistent antifibrotic effect shown across multiple analyses
- OCA 25 mg showed increased antifibrotic efficacy in patients with advanced fibrosis without cirrhosis
- Robust safety assessment of 2,477 patients, including 1,000 on study drug for four years, supports chronic administration of OCA
- REGENERATE data to be presented in late-breaking oral session on Monday, November 7
- Company remains on track to resubmit new drug application for OCA in liver fibrosis due to NASH by end of 2022
https://finance.yahoo.com/news/intercept-announces-additiona…
- OCA 25 mg demonstrated double the response rate of placebo in reduction of liver fibrosis without worsening of NASH; consistent antifibrotic effect shown across multiple analyses
- OCA 25 mg showed increased antifibrotic efficacy in patients with advanced fibrosis without cirrhosis
- Robust safety assessment of 2,477 patients, including 1,000 on study drug for four years, supports chronic administration of OCA
- REGENERATE data to be presented in late-breaking oral session on Monday, November 7
- Company remains on track to resubmit new drug application for OCA in liver fibrosis due to NASH by end of 2022
https://finance.yahoo.com/news/intercept-announces-additiona…
Intercept Resubmits New Drug Application to U.S. FDA for Obeticholic Acid in Patients with Liver Fibrosis due to NASH
The company anticipates that the FDA will classify this application as a Class 2 resubmission with a PDUFA target review time of 6 months.
https://finance.yahoo.com/news/intercept-resubmits-drug-appl…
The company anticipates that the FDA will classify this application as a Class 2 resubmission with a PDUFA target review time of 6 months.
https://finance.yahoo.com/news/intercept-resubmits-drug-appl…
Antwort auf Beitrag Nr.: 72.969.833 von pako21 am 23.12.22 14:55:32Ist denn nun der Antrag schon eingereicht? Bei clinical.gov kann ich dazu nichts finden.
Falls der Antrag eingereicht ist, hätten wir noch einen kleinen Vorsprung vor Madrigal. Auch wenn deren Produkt noch besser auf die Fettleber Problematik passen soll.
Falls der Antrag eingereicht ist, hätten wir noch einen kleinen Vorsprung vor Madrigal. Auch wenn deren Produkt noch besser auf die Fettleber Problematik passen soll.
FDA Accepts Intercept’s New Drug Application for OCA for the Treatment of Pre-Cirrhotic Liver Fibrosis Due to NASH
FDA indicated that it considers this a complete, Class 2 resubmission and has assigned a Prescription Drug User Fee Act (PDUFA) target action date of June 22, 2023, for the NDA. The timeline for the review of the NDA by FDA remains subject to change.
https://finance.yahoo.com/news/fda-accepts-intercept-drug-ap…
FDA indicated that it considers this a complete, Class 2 resubmission and has assigned a Prescription Drug User Fee Act (PDUFA) target action date of June 22, 2023, for the NDA. The timeline for the review of the NDA by FDA remains subject to change.
https://finance.yahoo.com/news/fda-accepts-intercept-drug-ap…
wünsche den ebenfalls Investierten ein spannendes Jahr mit diesem Investment. Nach dem das Jahr 2022 für die Biopharmas kein gutes Jahr war,sollte es in 2023 wohl besser werden.
Vielleicht ergibt sich ja im Forum ein fundierter Austausch über die Ereignisse bezüglich Intercept und soweit möglich die Einschätzung der Marktentwicklung.
Vielleicht ergibt sich ja im Forum ein fundierter Austausch über die Ereignisse bezüglich Intercept und soweit möglich die Einschätzung der Marktentwicklung.
Beitrag zu dieser Diskussion schreiben
Investoren beobachten auch:
| Wertpapier | Perf. % |
|---|---|
| +1,32 | |
| -1,03 | |
| +0,59 | |
| -0,05 | |
| +0,85 | |
| -0,34 | |
| +0,34 | |
| +1,00 | |
| -3,11 | |
| +3,01 |
Meistdiskutiert
| Wertpapier | Beiträge | |
|---|---|---|
| 45 | ||
| 45 | ||
| 44 | ||
| 17 | ||
| 16 | ||
| 15 | ||
| 13 | ||
| 10 | ||
| 9 | ||
| 9 |

















