Medarex, oder wie kommt ein Esel von tiefen Süden in den hohen Norden - 500 Beiträge pro Seite (Seite 7)
eröffnet am 03.07.03 18:54:04 von
neuester Beitrag 13.09.09 21:31:37 von
neuester Beitrag 13.09.09 21:31:37 von
Beiträge: 3.951
ID: 749.702
ID: 749.702
Aufrufe heute: 0
Gesamt: 312.668
Gesamt: 312.668
Aktive User: 0
Top-Diskussionen
| Titel | letzter Beitrag | Aufrufe |
|---|---|---|
| 26.04.24, 14:53 | 660 | |
| gestern 23:32 | 224 | |
| vor 48 Minuten | 199 | |
| heute 00:14 | 176 | |
| gestern 22:06 | 167 | |
| gestern 18:36 | 161 | |
| heute 00:33 | 156 | |
| gestern 16:03 | 100 |
Meistdiskutierte Wertpapiere
| Platz | vorher | Wertpapier | Kurs | Perf. % | Anzahl | ||
|---|---|---|---|---|---|---|---|
| 1. | 1. | 18.159,50 | -0,16 | 207 | |||
| 2. | 2. | 194,05 | +15,31 | 119 | |||
| 3. | 3. | 2.331,28 | -0,15 | 60 | |||
| 4. | 4. | 65,95 | -2,66 | 50 | |||
| 5. | 5. | 7,9000 | +7,48 | 46 | |||
| 6. | 6. | 0,8300 | -29,66 | 39 | |||
| 7. | 7. | 15,116 | -5,73 | 38 | |||
| 8. | 9. | 2,4050 | +25,82 | 30 |
Antwort auf Beitrag Nr.: 30.355.931 von Ville7 am 27.06.07 20:30:41Wenn ich wieder eingestiegen bin, dann impliziert das doch das ich zwischendurch ausgestiege n bin, oder?... Dachte schon jetzt rennt se mir davon...
n bin, oder?... Dachte schon jetzt rennt se mir davon...
 n bin, oder?... Dachte schon jetzt rennt se mir davon...
n bin, oder?... Dachte schon jetzt rennt se mir davon...
Moin,

auch ich bin immer noch hier und dabei, lese aber in der Regel nur mit. Den 3000-ten Beitrag schreibe ich aber trotzdem gern.
Für mich ist und bleibt die Sache ganz klar: Kommt Ipilimumab, geht der Kurs nicht nur auf 20, sondern in der Folge weiter auf 40$ und mehr, da Alternativanwendungen zugelassen werden würden, also Blockbusterpotenzial ganz klar.
Die Wahrscheinlichkeit dafür sehe ich als hoch an, 80-90%. Positiv auch die finanzielle Grundlage an Cash und Assets, z.B. (trotz des Verkaufs neulich) von Genmab (gerade auch mit News).
Die breite Pipeline ist auch noch ein Hoffnungsträger für die Zukunft.
Also ganz klar dabeibleiben und Geduld haben. Die Stunde der Bios kommt noch, damals in 2000/2001 waren sie allerdings leider als letzte dran, die "entdeckt" wurden. Im Moment sind wir erst wieder bei Bluechips und MDAX, dann kommen Low-Techs und High-Techs, auch diesmal wieder zuletzt die Bios ?
?
Schlecht ist, daß die fehlenden Quartalsberichte wegen des Options-Skandals (nenn ich mal so) immer noch auf sich warten lassen. Gibt bestimmt einige Investoren, die darauf warten.

Auffällig und ich meine gut ist das stark angestiegenen Handelsvolumen im letzten Halbjahr oder Jahr. Oft wurden Blocktrades gesehen von 100.000 und mehr Aktien, anscheinend Käufe von Fonds etc.

So, erstmal viele Grüße
q.

auch ich bin immer noch hier und dabei, lese aber in der Regel nur mit. Den 3000-ten Beitrag schreibe ich aber trotzdem gern.
Für mich ist und bleibt die Sache ganz klar: Kommt Ipilimumab, geht der Kurs nicht nur auf 20, sondern in der Folge weiter auf 40$ und mehr, da Alternativanwendungen zugelassen werden würden, also Blockbusterpotenzial ganz klar.
Die Wahrscheinlichkeit dafür sehe ich als hoch an, 80-90%. Positiv auch die finanzielle Grundlage an Cash und Assets, z.B. (trotz des Verkaufs neulich) von Genmab (gerade auch mit News).
Die breite Pipeline ist auch noch ein Hoffnungsträger für die Zukunft.
Also ganz klar dabeibleiben und Geduld haben. Die Stunde der Bios kommt noch, damals in 2000/2001 waren sie allerdings leider als letzte dran, die "entdeckt" wurden. Im Moment sind wir erst wieder bei Bluechips und MDAX, dann kommen Low-Techs und High-Techs, auch diesmal wieder zuletzt die Bios
 ?
?Schlecht ist, daß die fehlenden Quartalsberichte wegen des Options-Skandals (nenn ich mal so) immer noch auf sich warten lassen. Gibt bestimmt einige Investoren, die darauf warten.

Auffällig und ich meine gut ist das stark angestiegenen Handelsvolumen im letzten Halbjahr oder Jahr. Oft wurden Blocktrades gesehen von 100.000 und mehr Aktien, anscheinend Käufe von Fonds etc.

So, erstmal viele Grüße
q.
http://www.fool.com/investing/high-growth/2007/07/10/turnaro…
Turnaround Time for Biotech?
By Todd Wenning July 10, 2007
3 Recommendations
Is it turnaround time for biotech stocks?
That's the question I posed in March, in a previous version of this article. Since then, biotech stocks have experienced a bit of volatility. According to SmartMoney's Sector Tracker, biotechs were up a collective 10% for the year ended May. But they've given back some of those gains in the past six weeks, and they're now up just 3.6% for past year. The past year's winners include InterMune (Nasdaq: ITMN), Myriad Genetics (Nasdaq: MYGN), and Medarex (Nasdaq: MEDX), each up more than 50% since last July.
But despite these winners, biotech stocks as a group still trail the S&P 500 by more than 18 percentage points over the past year. Biotech investors must be wondering when their shares will spring back to life.
The current biotech funk follows a very good 2005. The Biotech HOLDRs ETF (BBH) surged 31%, and the sector was anchored by big winners like Adventrx Pharmaceuticals (AMEX: ANX), LifeCell (Nasdaq: LIFC), and Genentech (NYSE: DNA) which returned 193%, 86%, and 70%, respectively.
Get 'em while they're cold
According to Fool biotech guru Charly Travers, "2006 was a Dr. Jekyll and Mr. Hyde year for biotech. The first half of the year was terrible, but the sector came on strong at the end. Frankly, every year is like that with these companies. If you look back over the last five years at the performance of the Nasdaq Biotech Index, you will see every single year had a major pullback at some time or another."
During last year's pullback, some of the major biotech companies took advantage and snapped up some smaller players. For instance, Eli Lilly nabbed Icos, and Gilead Sciences added Myogen after each stock traded downward.
Does this consolidation mean that 2007 will produce a bumper crop of pharmaceuticals? Standard & Poor's biotech analyst Paul Starsia isn't so sure. In a January 2007 interview with BusinessWeek, Starsia predicted that 2007 will be a "building year," and didn't see any transformational products or technologies in the pipeline.
He's been right so far -- the biotech sector has dropped 0.7% year to date.
No news is good news
Since the biotech sector has largely underperformed the market in recent years, now is a good time to start researching investment ideas in the industry. After all, health-care spending is rising at record rates. Moreover, many small biotech companies have enormous potential in their research programs. They should be considered for at least a slice of a larger portfolio, simply because of their total return prospects. The best 50 stocks of the past 10 years include Gilead and Celgene.
That said, this is an inherently volatile sector, and it should be treated as such. A few failed FDA screenings could send a small biotech stock straight to the compost heap.
So how do you separate the winners from the losers when it comes to small biotech companies? Charly recommends looking for firms that:
* Use proven technologies (like molecule or monoclonal antibody drugs).
* Have qualified management with a track record of solid decision-making.
* Are solidifying partnerships with more established industry players.
If you'd like to learn more about a few promising biotechs, our Motley Fool Rule Breakers growth investing service can help. Led by Motley Fool co-founder David Gardner, Rule Breakers has selected a handful of biotech stocks they think are poised for growth. In fact, one of Charly's best picks, Vertex Pharmaceuticals, is up 173% since its recommendation in February 2005.
You can take a look at all of our past recommendations and research for 30 days, free of charge. Simply click here to take advantage of a free trial -- there's no obligation to subscribe.
This article was originally published on March 26, 2007. It has been updated.
Todd Wenning's random '90s movie of the day is Dazed and Confused, starring Matthew McConaughey. He does not own shares of any company mentioned. Eli Lilly is an Income Investor choice. InterMune and Myriad Genetics are also Rule Breakers picks. The Fool's disclosure policy knows there's always a party at the Moon Tower.
Turnaround Time for Biotech?
By Todd Wenning July 10, 2007
3 Recommendations
Is it turnaround time for biotech stocks?
That's the question I posed in March, in a previous version of this article. Since then, biotech stocks have experienced a bit of volatility. According to SmartMoney's Sector Tracker, biotechs were up a collective 10% for the year ended May. But they've given back some of those gains in the past six weeks, and they're now up just 3.6% for past year. The past year's winners include InterMune (Nasdaq: ITMN), Myriad Genetics (Nasdaq: MYGN), and Medarex (Nasdaq: MEDX), each up more than 50% since last July.
But despite these winners, biotech stocks as a group still trail the S&P 500 by more than 18 percentage points over the past year. Biotech investors must be wondering when their shares will spring back to life.
The current biotech funk follows a very good 2005. The Biotech HOLDRs ETF (BBH) surged 31%, and the sector was anchored by big winners like Adventrx Pharmaceuticals (AMEX: ANX), LifeCell (Nasdaq: LIFC), and Genentech (NYSE: DNA) which returned 193%, 86%, and 70%, respectively.
Get 'em while they're cold
According to Fool biotech guru Charly Travers, "2006 was a Dr. Jekyll and Mr. Hyde year for biotech. The first half of the year was terrible, but the sector came on strong at the end. Frankly, every year is like that with these companies. If you look back over the last five years at the performance of the Nasdaq Biotech Index, you will see every single year had a major pullback at some time or another."
During last year's pullback, some of the major biotech companies took advantage and snapped up some smaller players. For instance, Eli Lilly nabbed Icos, and Gilead Sciences added Myogen after each stock traded downward.
Does this consolidation mean that 2007 will produce a bumper crop of pharmaceuticals? Standard & Poor's biotech analyst Paul Starsia isn't so sure. In a January 2007 interview with BusinessWeek, Starsia predicted that 2007 will be a "building year," and didn't see any transformational products or technologies in the pipeline.
He's been right so far -- the biotech sector has dropped 0.7% year to date.
No news is good news
Since the biotech sector has largely underperformed the market in recent years, now is a good time to start researching investment ideas in the industry. After all, health-care spending is rising at record rates. Moreover, many small biotech companies have enormous potential in their research programs. They should be considered for at least a slice of a larger portfolio, simply because of their total return prospects. The best 50 stocks of the past 10 years include Gilead and Celgene.
That said, this is an inherently volatile sector, and it should be treated as such. A few failed FDA screenings could send a small biotech stock straight to the compost heap.
So how do you separate the winners from the losers when it comes to small biotech companies? Charly recommends looking for firms that:
* Use proven technologies (like molecule or monoclonal antibody drugs).
* Have qualified management with a track record of solid decision-making.
* Are solidifying partnerships with more established industry players.
If you'd like to learn more about a few promising biotechs, our Motley Fool Rule Breakers growth investing service can help. Led by Motley Fool co-founder David Gardner, Rule Breakers has selected a handful of biotech stocks they think are poised for growth. In fact, one of Charly's best picks, Vertex Pharmaceuticals, is up 173% since its recommendation in February 2005.
You can take a look at all of our past recommendations and research for 30 days, free of charge. Simply click here to take advantage of a free trial -- there's no obligation to subscribe.
This article was originally published on March 26, 2007. It has been updated.
Todd Wenning's random '90s movie of the day is Dazed and Confused, starring Matthew McConaughey. He does not own shares of any company mentioned. Eli Lilly is an Income Investor choice. InterMune and Myriad Genetics are also Rule Breakers picks. The Fool's disclosure policy knows there's always a party at the Moon Tower.
Antwort auf Beitrag Nr.: 30.625.498 von Ville7 am 11.07.07 08:54:23Bescheidener Kursverlauf heute...

medarex mit news--klappt nur mit dem kopieren irgendwie nicht 

Meilensteinzahlungen erhalten 

Antwort auf Beitrag Nr.: 30.742.628 von sattler14 am 18.07.07 12:30:22http://biz.yahoo.com/prnews/070718/new034.html?.v=14
Antwort auf Beitrag Nr.: 30.743.065 von Ville7 am 18.07.07 13:03:28Sind ja tolle News lt. Kursverlauf!

Lasst euch nicht aus den Antikörperfirmen wie Medarex oder Morphosys rausschütteln. Diese Firmen, sofern alleinstehend, werden in Sentiment-Sippenhaft genommen, das Sentiment für Biotech im generellen ist am Boden. Weltweit. Erst wenn der $$$ fliesst gehen die Leute rein. Das eröffnet natürlich super late stage Übernahme Chancen für big Pharma.
Ich gehe davon aus, dass Antikörper nach und nach in den Fokus der Öffentlichkeit geraten und in ein bis drei (vielleicht auch erst fünf) Jahren ein richtiger Hype um diese Firmen entsteht.
Hier schon mal ein Vorgeschmack, ein kürzlich auf CNBC gesendeter Bericht über MDX-010 (Ipilimumab) von Medarex:
http://wcbstv.com/video/?id=101812
Und speziell für meinen Freund Tragerlof: Ich kann mich mit meiner Einschätzung täuschen, es ist lediglich meine persönliche Meinung.
Ich gehe davon aus, dass Antikörper nach und nach in den Fokus der Öffentlichkeit geraten und in ein bis drei (vielleicht auch erst fünf) Jahren ein richtiger Hype um diese Firmen entsteht.
Hier schon mal ein Vorgeschmack, ein kürzlich auf CNBC gesendeter Bericht über MDX-010 (Ipilimumab) von Medarex:
http://wcbstv.com/video/?id=101812
Und speziell für meinen Freund Tragerlof: Ich kann mich mit meiner Einschätzung täuschen, es ist lediglich meine persönliche Meinung.
Hi und Guten Morgen,
danke für den Clip, ist immer gut zu sehen, dass Medarex langsam in der Öffentlichkeit bekannter wird.
Hoffen wir auf eine positive Entscheidung der FDA !
stay looooooong
danke für den Clip, ist immer gut zu sehen, dass Medarex langsam in der Öffentlichkeit bekannter wird.
Hoffen wir auf eine positive Entscheidung der FDA !
stay looooooong

Antwort auf Beitrag Nr.: 30.854.611 von rafelguraf am 26.07.07 09:50:40hi rafelguraf,
Hoffen wir auf eine positive Entscheidung der FDA !
Vor der Entscheidung der FDA kommen noch die Phase II Monotherapie Ergebnisse und die Phase III Ergebnisse. Hoffen wir, dass die gut sind.
Hoffen wir auf eine positive Entscheidung der FDA !
Vor der Entscheidung der FDA kommen noch die Phase II Monotherapie Ergebnisse und die Phase III Ergebnisse. Hoffen wir, dass die gut sind.

worin liegt der 8,5% Anstieg begruendet ? ich hab medarex seit 4 jahren im Depot , bin noch in den roten zahlen mit dem teil... aber die Hoffnung stirbt zuletzt....
Antwort auf Beitrag Nr.: 31.073.326 von Braini am 08.08.07 07:56:06CNTO BLAs kommen wohl in Q4/07 und Q1/08
Ipilimumab (MDX-010) Ergebnisse kommen wohl in Q3/Q4 07 und BLA soll in Q1 08 stattfinden.
Sollte MDX-010 zugelassen werden könnte das der Startschuss für die neue Ära in der Behandlung von Krebs sein. Die Vaccine könnten nach und nach Chemos ablösen und MDX-010 als Antreiber des Immunsystems würde prächtig zu allen Vaccinen dazupassen. Könnte, hätte, wäre...wir werden sehen.
Antikörper werden an der Börse m.E. noch nicht entsprechend als Medikamentenklasse gewürdigt. Kommt aber bestimmt noch...
Ursache für den Anstieg wohl: Short Covering und Positionierung auf die kommenden Ereignisse.
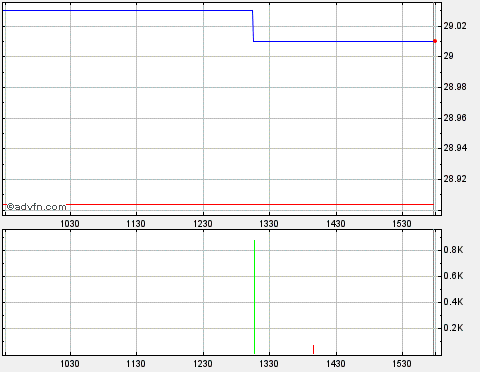
Springt heute bisher fast auf 52Wochen Hoch. Sehr stark!
Ipilimumab (MDX-010) Ergebnisse kommen wohl in Q3/Q4 07 und BLA soll in Q1 08 stattfinden.
Sollte MDX-010 zugelassen werden könnte das der Startschuss für die neue Ära in der Behandlung von Krebs sein. Die Vaccine könnten nach und nach Chemos ablösen und MDX-010 als Antreiber des Immunsystems würde prächtig zu allen Vaccinen dazupassen. Könnte, hätte, wäre...wir werden sehen.
Antikörper werden an der Börse m.E. noch nicht entsprechend als Medikamentenklasse gewürdigt. Kommt aber bestimmt noch...
Ursache für den Anstieg wohl: Short Covering und Positionierung auf die kommenden Ereignisse.
Springt heute bisher fast auf 52Wochen Hoch. Sehr stark!
Antwort auf Beitrag Nr.: 31.080.708 von Ville7 am 08.08.07 15:47:1552 Wochenhoch übrigens auf 16.59 USD. Ein Ausbruch darüber würde charttechnische Kräfte freisetzen.
Vielleicht ist auch ein Übernahmeangebot in der Mache... wer weiß.
Vielleicht ist auch ein Übernahmeangebot in der Mache... wer weiß.
Antwort auf Beitrag Nr.: 31.081.260 von Ville7 am 08.08.07 16:12:33Oh tut das gut. Nach MOR hatte ich sowas bitter noetig. Bin eigentlich heute in der Frueh eingestiegen, hauptsaechlich wegen der fortgeschrittenen Pipeline. Manchmal kann man wohl doch Glueck haben. Danke fuer den Tipp.
Antwort auf Beitrag Nr.: 31.080.708 von Ville7 am 08.08.07 15:47:15Antikörper werden an der Börse m.E. noch nicht entsprechend als Medikamentenklasse gewürdigt. Kommt aber bestimmt noch...
...und wieder eine falsche Aussage:
Rituximab, Bevacizumab, Trastzumab, Tocilizumab und Daclizumab sind der Grundstein für die Bewertung von Roche und Genentech.
...und wieder eine falsche Aussage:
Rituximab, Bevacizumab, Trastzumab, Tocilizumab und Daclizumab sind der Grundstein für die Bewertung von Roche und Genentech.
Antwort auf Beitrag Nr.: 31.082.204 von Cyberhexe am 08.08.07 16:54:01Du hast echt was an der Waffel du komische Hexe.
Antikörper Firmen werden derzeit erst bezahlt, wenn sie mit den Produkten Cash generieren.
Aussichtsreiche Produkte in Phase III (wie bei MEDX) oder Technologieanbieter (wie MOR und MEDX) werden bewertungstechnisch bisher recht stiefmütterlich behandelt. Keine wirkliche Fantasie für diese Medikamentenklasse. Zurechtgestutzt auf KGV Bewertung (MOR) oder ein bisschen mehr als Equitybewertung (MEDX bisher).
Die Entdeckung steht bevor, wahrscheinlich geht sie gerade erst los. Alles i.m.H.O.
Antikörper Firmen werden derzeit erst bezahlt, wenn sie mit den Produkten Cash generieren.
Aussichtsreiche Produkte in Phase III (wie bei MEDX) oder Technologieanbieter (wie MOR und MEDX) werden bewertungstechnisch bisher recht stiefmütterlich behandelt. Keine wirkliche Fantasie für diese Medikamentenklasse. Zurechtgestutzt auf KGV Bewertung (MOR) oder ein bisschen mehr als Equitybewertung (MEDX bisher).
Die Entdeckung steht bevor, wahrscheinlich geht sie gerade erst los. Alles i.m.H.O.
Antwort auf Beitrag Nr.: 31.081.605 von CenkG am 08.08.07 16:27:03Gratulation zu deiner schnellen Entscheidung, CenkG. 

Antwort auf Beitrag Nr.: 31.082.471 von Ville7 am 08.08.07 17:06:46hallooooooooooooo...wir leben im Jahr 2007 - und es gibt seit Jahren zugelassene Antikörper. Ohne die aufgezählten Antikörper (Rituximab, Bevacizumab, Trastuzumab) wäre Genentech beispielsweise eine unbedeutende Gesellschaft...unbekannt dazu. Und du schreibst dummes Zeug daher und meinst jeder müsste dies glauben - Widerspruch bzw. eine Richtigstellung sind angeblich nicht erlaubt! Bei GPC Biotech sind schon genügend Teilnehmer auf deine Lügengeschichten reingefallen! Es reicht!
Antwort auf Beitrag Nr.: 31.082.973 von Cyberhexe am 08.08.07 17:31:31Das hat uns Ville doch nicht anders gemeint



Antwort auf Beitrag Nr.: 31.083.055 von Friseuse am 08.08.07 17:36:08...allerdings sind MABs schon seit einigen Jahren am Markt und begründen den wirtschaftlichen Erfolg von Amgen, Genentech und Roche. Selbstverständlich werden diese als eigene Medikamentenklasse wahrgenommen.
Vor zehn Jahren, anno 1997, wurden
die ersten klinischen Studien
mit Avastin durchgeführt,
und zwar gegen fortgeschrittenen, das
heisst metastasierten Dickdarmkrebs.
Im Mai 2003 dann der Paukenschlag:
Die Roche-Tochter Genentech – Erfinderin
und Herstellerin des innovativen
Präparats – konnte positive Resultate
einer zentralen Studie der Phase III bekannt
geben. In dieser Studie hatten
die teilnehmenden Patienten entweder
Bevacizumab (der Name des Wirkstoffes
von Avastin) in Kombination mit
einer Standard-Chemotherapie (5-
Fluorouracil) erhalten oder dann die
Chemotherapie allein. Das erstaunliche
Ergebnis: Die Patienten, die Avastin
zusammen mit der Chemotherapie
erhalten hatten, überlebten im Schnitt
fünfMonate länger als jene, die nur die
Chemo bekommen hatten. Eine solch
deutliche Verlängerung der Überlebenszeit
war in einer Phase-III-Studie
bei Patienten mit Dickdarmkrebs vorher
noch nie dokumentiert worden.
Bereits im Februar 2004 wurde Avastin
– nach der in Rekordzeit erfolgten Zulassung
durch die amerikanische Gesundheitsbehörde
FDA – in den Vereinigten
Staaten eingeführt. Wenige
Monate später dann auch in der
Schweiz und der EU. Seither haben bereits
über 200000 Patienten das Medikament
erhalten. Mit Verkäufen von
rund drei Milliarden Franken im Jahre
2006 befindet sich das Produkt bereits
in der Spitzengruppe der drei umsatzstärksten
Arzneimittel von Roche.
Vor zehn Jahren, anno 1997, wurden
die ersten klinischen Studien
mit Avastin durchgeführt,
und zwar gegen fortgeschrittenen, das
heisst metastasierten Dickdarmkrebs.
Im Mai 2003 dann der Paukenschlag:
Die Roche-Tochter Genentech – Erfinderin
und Herstellerin des innovativen
Präparats – konnte positive Resultate
einer zentralen Studie der Phase III bekannt
geben. In dieser Studie hatten
die teilnehmenden Patienten entweder
Bevacizumab (der Name des Wirkstoffes
von Avastin) in Kombination mit
einer Standard-Chemotherapie (5-
Fluorouracil) erhalten oder dann die
Chemotherapie allein. Das erstaunliche
Ergebnis: Die Patienten, die Avastin
zusammen mit der Chemotherapie
erhalten hatten, überlebten im Schnitt
fünfMonate länger als jene, die nur die
Chemo bekommen hatten. Eine solch
deutliche Verlängerung der Überlebenszeit
war in einer Phase-III-Studie
bei Patienten mit Dickdarmkrebs vorher
noch nie dokumentiert worden.
Bereits im Februar 2004 wurde Avastin
– nach der in Rekordzeit erfolgten Zulassung
durch die amerikanische Gesundheitsbehörde
FDA – in den Vereinigten
Staaten eingeführt. Wenige
Monate später dann auch in der
Schweiz und der EU. Seither haben bereits
über 200000 Patienten das Medikament
erhalten. Mit Verkäufen von
rund drei Milliarden Franken im Jahre
2006 befindet sich das Produkt bereits
in der Spitzengruppe der drei umsatzstärksten
Arzneimittel von Roche.
Antwort auf Beitrag Nr.: 31.083.231 von Cyberhexe am 08.08.07 17:45:24Das Gegenteil war ja nicht die Aussage von Ville. Es geht um die Produktbewertung vor Markteinführung, die gibt es einfach nicht. Bei einer Morphosys fällt die gesamte Pipeline in der Bewertung unter den Tisch, bei einer Medarex zickt der Markt mit Bewertung trotz baldiger Zulassungsentscheidungen.
Das ist heftig und ändert sich wohl mit dem heutigen Ausbruch.
Das in der Medikamentenklasse zugelassene Produkte Bewertung ziehen ist unbestritten, ist auch richtig so. Nur werden Biotechs wie Kleinpharmas behandelt, was sie nicht sind. Es geht um Venturebewertung von Biotechs, die gab es als sie keine Pipeline hatten und jetzt mit Pipeline gibt es sie nicht. Was sich da Analos in den Bart setzen ist voll kirre, lies mal Analüsterchen zu Morphosys. Das sind grausamste Verbrechen an jeder Vernunft.

Das ist heftig und ändert sich wohl mit dem heutigen Ausbruch.
Das in der Medikamentenklasse zugelassene Produkte Bewertung ziehen ist unbestritten, ist auch richtig so. Nur werden Biotechs wie Kleinpharmas behandelt, was sie nicht sind. Es geht um Venturebewertung von Biotechs, die gab es als sie keine Pipeline hatten und jetzt mit Pipeline gibt es sie nicht. Was sich da Analos in den Bart setzen ist voll kirre, lies mal Analüsterchen zu Morphosys. Das sind grausamste Verbrechen an jeder Vernunft.

Antwort auf Beitrag Nr.: 31.083.446 von Friseuse am 08.08.07 17:56:30...nun ja, alle in der Pharmabranche forschenden Biotech-Unternehmen haben mittlerweile mit den vielen Enttäuschungen und Nichtzulassungen zu kämpfen, so dass der Markt alle "potentiellen Kandidaten" halt wirklich nur mit einem grossen Abschlag bewertet. Dies ändert sich erst dann, wenn tatsächliche Erfolgsmeldungen bekanntgegeben werden.
Die Marktkapitalisierung von Medarfex war beispielsweise vor einigen Jahren bereits 5x so hoch als aktuell, obwohl Medarex damals wirklich noch sehr weit davon entfernt war, einen Wirkstoff am Markt zu platzieren.
http://finance.yahoo.com/q/bc?s=MEDX&t=my
Natürlich ist diese Gesellschaft mit ihren Schlüsseltechnologien m.E. unterbewertet, die Gründe hierfür sind jedoch sicherlich nicht darin zu finden, dass MABs nicht als eigenständige Mediklamentenklasse wahrgenommen werden. Das ist dummes Zeug!
Die Marktkapitalisierung von Medarfex war beispielsweise vor einigen Jahren bereits 5x so hoch als aktuell, obwohl Medarex damals wirklich noch sehr weit davon entfernt war, einen Wirkstoff am Markt zu platzieren.
http://finance.yahoo.com/q/bc?s=MEDX&t=my
Natürlich ist diese Gesellschaft mit ihren Schlüsseltechnologien m.E. unterbewertet, die Gründe hierfür sind jedoch sicherlich nicht darin zu finden, dass MABs nicht als eigenständige Mediklamentenklasse wahrgenommen werden. Das ist dummes Zeug!
Antwort auf Beitrag Nr.: 31.083.231 von Cyberhexe am 08.08.07 17:45:24Schon mal was von vollhumanen Mabs gehört?

Die von dir angesprochenen bereits vermakteten AK besieren auf alter Technologie und sind nicht besonders verträglich, da das Nebenwirkungsprofil kritischer ist. MEDX und MOR haben vollhumane AK - das ist ein Schritt weiter.
Aber ich habe es Leid dir immer das 1x1 von Bio-Firmen beibringen zu müssen. Du bist und bleibst einfach nicht aufnahmefähig.
Friseuse kann sich das mit die antun, ich hab keinen Bock dazu.

Die von dir angesprochenen bereits vermakteten AK besieren auf alter Technologie und sind nicht besonders verträglich, da das Nebenwirkungsprofil kritischer ist. MEDX und MOR haben vollhumane AK - das ist ein Schritt weiter.
Aber ich habe es Leid dir immer das 1x1 von Bio-Firmen beibringen zu müssen. Du bist und bleibst einfach nicht aufnahmefähig.
Friseuse kann sich das mit die antun, ich hab keinen Bock dazu.
Antwort auf Beitrag Nr.: 31.083.738 von Cyberhexe am 08.08.07 18:11:18Jetzt müssen wir Biotech allgemein von mABs trennen. Die Trennung hat sich im Pharmasektor ja auch vollzogen, braucht man nicht zu erfinden. Antikörpertechnologie liefert Medikamente, Pharmas machen damit absolut und relativ stetig steigende Umsätze.
Logische Schlußfolgerung wäre Bewertung von R&D entsprechend der Entwicklungsphase, nach Zielmarktgröße, Zeitabstand. Das machen heute die gleichen Analos nicht die in 2000 mit reinen Fiktionen um die Häuser gezogen sind.
die in 2000 mit reinen Fiktionen um die Häuser gezogen sind.
Das hier ist ja keine unerprobte Technologie, man hat selbst Zulassungswahrscheinlichkeiten als Daten. Auch wenn es nahe geht, hier ist nicht die Baustelle der Dendreons und GPCs.
Nichts für ungut

Logische Schlußfolgerung wäre Bewertung von R&D entsprechend der Entwicklungsphase, nach Zielmarktgröße, Zeitabstand. Das machen heute die gleichen Analos nicht
 die in 2000 mit reinen Fiktionen um die Häuser gezogen sind.
die in 2000 mit reinen Fiktionen um die Häuser gezogen sind. Das hier ist ja keine unerprobte Technologie, man hat selbst Zulassungswahrscheinlichkeiten als Daten. Auch wenn es nahe geht, hier ist nicht die Baustelle der Dendreons und GPCs.
Nichts für ungut

Antwort auf Beitrag Nr.: 31.084.306 von Ville7 am 08.08.07 18:40:40...ganau das nervt mich an diesem Teilnehmer: eine Lüge folgt der nächsten - eigentlich sollte man derartige unpräzis bis lügenhaft schreibende Teilnehmer nicht nur korrigieren, denn es hat nicht jeder die Möglichkeiot dessen Lügen zu entlarven - siehe GPC Biotech! Beispielsweise ist Avastin ein humanisierter Antikörper, der bis auf ein geringes Sensibilisierungspotential sehr gut verträglich ist. Im Gegensatz zu Zytostatikas wie z.B. Satarplatin sind die Nebenwirkungen geradezu lächerlich und dies bei wesentlich grösserer Wirksamkeit. Aber auch diese Tatsache hast du schon immer abgestritten! Copy/Paste reicht eben nicht aus - man sollte ein Minimum davon auch verstanden haben!
Nach der erfolgreichen ‘Humanisierung’
des Maus-Antikörpers konnte
Genentech schliesslich Avastin
entwickeln, einen mit Hilfe von gentechnisch
modifizierten Säugerzellen
herstellbaren, humanisierten monoklonalen
Antikörper gegen VEGF, der
auf-grund des zungenbrecherischen
englischen Fachausdrucks ‘recombinant
humanized Monoclonal Antibody
to Vascular Endothelial Growth
Factor’ mit dem Kürzel rhuMAb-
VEGF bezeichnet wurde. Somit war
die Bahn endlich frei, um diesen
Wirkstoff erstmals an Menschen zu
testen. Wie diese klinischen Studien
ausgegangen sind, wurde bereits eingangs
angedeutet, nämlich äusserst
positiv.
Nach der erfolgreichen ‘Humanisierung’
des Maus-Antikörpers konnte
Genentech schliesslich Avastin
entwickeln, einen mit Hilfe von gentechnisch
modifizierten Säugerzellen
herstellbaren, humanisierten monoklonalen
Antikörper gegen VEGF, der
auf-grund des zungenbrecherischen
englischen Fachausdrucks ‘recombinant
humanized Monoclonal Antibody
to Vascular Endothelial Growth
Factor’ mit dem Kürzel rhuMAb-
VEGF bezeichnet wurde. Somit war
die Bahn endlich frei, um diesen
Wirkstoff erstmals an Menschen zu
testen. Wie diese klinischen Studien
ausgegangen sind, wurde bereits eingangs
angedeutet, nämlich äusserst
positiv.
Antwort auf Beitrag Nr.: 31.084.526 von Friseuse am 08.08.07 18:53:46...natürlich ist Medarex wesentlich breiter aufgestellt als dndn, deswegen bin ich z.Z. auch in medx investiert und bei dndn nur an der Seitenlinie. Aber auch bei medx steht die Marktreife erst noch auf dem Prüfstein!
...und schon wieder sind wir beim andropogen-unabhängigen Prostatakrebs (AIPC)!
http://clincancerres.aacrjournals.org/cgi/content/abstract/1…
http://clincancerres.aacrjournals.org/cgi/content/abstract/1…
Antwort auf Beitrag Nr.: 31.084.955 von Cyberhexe am 08.08.07 19:16:35Wow, da lernt jemand Medarex und dessen Pipeline kennen...


Einfach herrlich naiv, dieser User.



Einfach herrlich naiv, dieser User.
Antwort auf Beitrag Nr.: 31.084.983 von Ville7 am 08.08.07 19:18:02...bin mal gespannt, ob du immer noch der Meinung bist, ein Platinderivat aus der Onkologie-Steinzeit sei bei AIPC wirkungsvoller als Wirkstoffe aus der Klasse der MABs oder Vakzine!
Ich werde auch hier, falls erforderlich, nicht zurückschrecken, dich als unpräzisen und mit Halbwahrheiten argumentierenden Teilnehmer zu entlarven, der, falls seine Interessen dadurch bedient werden, immer wieder mit Falschaussagen aufgefallen ist.
Börse ist Chance und Risiko - Halbwahrheiten und Lügen sind kontraproduktiv!
Ich werde auch hier, falls erforderlich, nicht zurückschrecken, dich als unpräzisen und mit Halbwahrheiten argumentierenden Teilnehmer zu entlarven, der, falls seine Interessen dadurch bedient werden, immer wieder mit Falschaussagen aufgefallen ist.
Börse ist Chance und Risiko - Halbwahrheiten und Lügen sind kontraproduktiv!
Antwort auf Beitrag Nr.: 31.085.234 von Cyberhexe am 08.08.07 19:33:02Geh mal zum Psychater, du hast es echt nötig.
Und was sollen die Lügen? Ich habe mabs nie mit Platinderivaten verglichen. Ich bin kein Verfechter von Chemos, im Gegenteil..das schrieb ich dir aber schon mehrfach. Darum geht es aber nicht. Jedem selbst ist überlassen, auf welche Produkte oder Unternehmen er spekuliert - hier ist Börse!
Bei GPC lag ich daneben (u.a. aufgrund von Irreführungen des Managements, ich nenne hier nur den unabgestimmten SPA, die Probleme im Vorfeld mit der FDA und die bekannten recht schlechten OS Zwischendaten, die erst mit den ODAC Unterlagen öffentlich wurden). Bei Provenge lagst du falsch.
Zurück zu dem von dir angeschnittenen Thema: Kein Antikörper und kein Vaccine hat je eine doppelverblindete Phase III Studie in AIPC oder HRPC (wie auch immer du hormonrestistenten Prostatakrebs abkürzen willst) statistisch signifikant und wirksam beendet. Auch nicht deine Fehlspeku Provenge von DNDN, bei der in einer Ex-Post Analyse Daten verdreht wurden, daher wurde das Medikament auch nicht von der FDA vor den vollständigen OS Daten der großen Studie zugelassen. Von Vaccinen und Mabs gegen HRPC gibt es bisher nur sehr sehr vielversprechende Phase II Daten, diese sind aber nicht unbedingt aussagekräftig, da Arzt und Patient wissen, dass das Medikament vergeben wurde und hier der Plazeboeffekt sehr reinspielen kann.
Es bleibt abzuwarten, ob diese Spekulation mit der Immunisierung mittels CTLA-4 Blockade durch Ipilimumab aufgeht. Das ist der größte Valuedriver bei MEDX.
Und jetzt habe ich fertig mit dir, denn du kannst nur rumstänkern und Lügen verbreiten. Mehr kannst du leider nicht.
Und was sollen die Lügen? Ich habe mabs nie mit Platinderivaten verglichen. Ich bin kein Verfechter von Chemos, im Gegenteil..das schrieb ich dir aber schon mehrfach. Darum geht es aber nicht. Jedem selbst ist überlassen, auf welche Produkte oder Unternehmen er spekuliert - hier ist Börse!
Bei GPC lag ich daneben (u.a. aufgrund von Irreführungen des Managements, ich nenne hier nur den unabgestimmten SPA, die Probleme im Vorfeld mit der FDA und die bekannten recht schlechten OS Zwischendaten, die erst mit den ODAC Unterlagen öffentlich wurden). Bei Provenge lagst du falsch.
Zurück zu dem von dir angeschnittenen Thema: Kein Antikörper und kein Vaccine hat je eine doppelverblindete Phase III Studie in AIPC oder HRPC (wie auch immer du hormonrestistenten Prostatakrebs abkürzen willst) statistisch signifikant und wirksam beendet. Auch nicht deine Fehlspeku Provenge von DNDN, bei der in einer Ex-Post Analyse Daten verdreht wurden, daher wurde das Medikament auch nicht von der FDA vor den vollständigen OS Daten der großen Studie zugelassen. Von Vaccinen und Mabs gegen HRPC gibt es bisher nur sehr sehr vielversprechende Phase II Daten, diese sind aber nicht unbedingt aussagekräftig, da Arzt und Patient wissen, dass das Medikament vergeben wurde und hier der Plazeboeffekt sehr reinspielen kann.
Es bleibt abzuwarten, ob diese Spekulation mit der Immunisierung mittels CTLA-4 Blockade durch Ipilimumab aufgeht. Das ist der größte Valuedriver bei MEDX.
Und jetzt habe ich fertig mit dir, denn du kannst nur rumstänkern und Lügen verbreiten. Mehr kannst du leider nicht.
Antwort auf Beitrag Nr.: 31.085.535 von Ville7 am 08.08.07 19:50:59ville schrieb:
Von Vaccinen und Mabs gegen HRPC gibt es bisher nur sehr sehr vielversprechende Phase II Daten, diese sind aber nicht unbedingt aussagekräftig, da Arzt und Patient wissen, dass das Medikament vergeben wurde und hier der Plazeboeffekt sehr reinspielen kann.
...und schon wieder eine Lügengeschichte - eigentlich reicht es - immer und überall ist dein Auftauchen mit Lügen verbunden!
http://investor.dendreon.com/ReleaseDetail.cfm?ReleaseID=178…
Von Vaccinen und Mabs gegen HRPC gibt es bisher nur sehr sehr vielversprechende Phase II Daten, diese sind aber nicht unbedingt aussagekräftig, da Arzt und Patient wissen, dass das Medikament vergeben wurde und hier der Plazeboeffekt sehr reinspielen kann.
...und schon wieder eine Lügengeschichte - eigentlich reicht es - immer und überall ist dein Auftauchen mit Lügen verbunden!
http://investor.dendreon.com/ReleaseDetail.cfm?ReleaseID=178…
Geil, endlich wieder ein richtiger Thread in dem es hoch hergeht, nachdem GPC und Dendreon nach den letzten Zuckungen leider in der Versenkung verschwinden werden.
Alle Prominenz hier versammelt, Hexen, Friseusen, GPC-Ville. Eck64 und SLB fehlen hier noch. Also ich werde mir was einfallen lassen um eurem gesammelten Halbwissen noch eins draufzusetzen.
Ernsthaft:
Weiß einer wieso Medarex heute steigt? Habe keine Meldung gefunden. Die bäumen sich ja richtig auf in meinem Biotech-Schrottdepot!

Alle Prominenz hier versammelt, Hexen, Friseusen, GPC-Ville. Eck64 und SLB fehlen hier noch. Also ich werde mir was einfallen lassen um eurem gesammelten Halbwissen noch eins draufzusetzen.

Ernsthaft:
Weiß einer wieso Medarex heute steigt? Habe keine Meldung gefunden. Die bäumen sich ja richtig auf in meinem Biotech-Schrottdepot!

Antwort auf Beitrag Nr.: 31.085.621 von Cyberhexe am 08.08.07 19:55:35Wir haben das Genüge diskutiert und die FDA hat dazu entschieden, dass die Daten von DNDN nicht überzeugend sind. Durch die Art der Auswertung, das Weglassens von schlechten Events und des Auswertungsverfahrens hat DNDN hier schlichtweg beschissen. Wären die Daten glaubwürdig gewesen, wäre Provenge zugelassen worden.
Also höre endlich mit den Lügen auf, meine Aussagen sind korrekt.
Also höre endlich mit den Lügen auf, meine Aussagen sind korrekt.
Antwort auf Beitrag Nr.: 31.085.535 von Ville7 am 08.08.07 19:50:59 das Medikament vergeben wurde und hier der Plazeboeffekt sehr reinspielen kann.
...dilettantischer kann man nicht argumentieren. Klinische Studien sind dann aussagekräftig, wenn diese randomisiert sind und doppelt verblindet - also weder Arzt noch Patient sind darüber orientiert, ob ein Scheinpräparat oder das Verum appliziert werden. Und dies war selbstverständlich auch bei den Phase3-Studien zu Provenge der Fall!
...dilettantischer kann man nicht argumentieren. Klinische Studien sind dann aussagekräftig, wenn diese randomisiert sind und doppelt verblindet - also weder Arzt noch Patient sind darüber orientiert, ob ein Scheinpräparat oder das Verum appliziert werden. Und dies war selbstverständlich auch bei den Phase3-Studien zu Provenge der Fall!
Antwort auf Beitrag Nr.: 31.085.704 von Cashverbrenner am 08.08.07 20:00:16Übernimm du mal. Ich geh jetzt.
Antwort auf Beitrag Nr.: 31.085.736 von Cyberhexe am 08.08.07 20:01:35Wer redet denn von Phase II und DNDN? Klar waren diese Provenge Studien doppelverblindete Phase III Studien.
Nur der Auswertung mangelte es gewaltig an Glaubwürdigkeit. U.a. wurde der eigentliche Endpoint verfehlt, das Studienziel wurde nachträglich von DNDN verändert. DNDN hat Ex-Post Analyse von Daten betrieben. Sowas führt immer zu statistischen Fehlern und wird von Statitikern nicht geduldet. Daher durfte es die FDA nicht zulassen. Das kapierste heute noch nicht.
Schluss jetzt, Feierabend. Was auch immer du noch an Lügen daherbringst juckt mich jetzt nicht mehr.
Nur der Auswertung mangelte es gewaltig an Glaubwürdigkeit. U.a. wurde der eigentliche Endpoint verfehlt, das Studienziel wurde nachträglich von DNDN verändert. DNDN hat Ex-Post Analyse von Daten betrieben. Sowas führt immer zu statistischen Fehlern und wird von Statitikern nicht geduldet. Daher durfte es die FDA nicht zulassen. Das kapierste heute noch nicht.
Schluss jetzt, Feierabend. Was auch immer du noch an Lügen daherbringst juckt mich jetzt nicht mehr.
Antwort auf Beitrag Nr.: 31.085.727 von Ville7 am 08.08.07 20:01:16Hätte Dendreon bei den eingereichten Daten beschissen, dann wäre es nie uns nimmer zu einem Advisory Committee gekommen. In derartigen Fällen werden die Anträge auf Zulassung nicht einmal angenommen.
Ein weiterer Beweis deines Kalibers!
Ein weiterer Beweis deines Kalibers!
Antwort auf Beitrag Nr.: 31.085.875 von Ville7 am 08.08.07 20:08:31das Studienziel wurde nachträglich von DNDN verändert.
...so ein Schmarn! Der Studienentwurf kann nicht verändert werden, es sei denn die FDA gibt ausdrücklich deren Zustimmung, so geschehen beispielsweise bei D9902B!
DNDN hat Ex-Post Analyse von Daten betrieben
...was soll denn das sein? Du meinst wahrscheinlich "post hoc" - dies wurde deshalb gemacht, da Overall Survival nicht im Studienentwurf vorgesehen war. Die FDA hat jedoch OS nachträglich als Goldstandard definiert und somit diese Analysen ausdrücklich zugelassen. Wäre dies nicht so gewesen, wären diese Daten nie und nimmer Gegenstand eines AC gewesen.
Sowas führt immer zu statistischen Fehlern und wird von Statitikern nicht geduldet.
Einzig die geringe Mächtigkeit der Studien wurden durchgehend bemängelt. Gravierende Fehler bei der Auswertung haben eine Zurückweisung eines Zulassungsantrages zur Folge.
Diese eigene Wahrheit und faktenverdrehende Sichtweise ist gefährlich!
...so ein Schmarn! Der Studienentwurf kann nicht verändert werden, es sei denn die FDA gibt ausdrücklich deren Zustimmung, so geschehen beispielsweise bei D9902B!
DNDN hat Ex-Post Analyse von Daten betrieben
...was soll denn das sein? Du meinst wahrscheinlich "post hoc" - dies wurde deshalb gemacht, da Overall Survival nicht im Studienentwurf vorgesehen war. Die FDA hat jedoch OS nachträglich als Goldstandard definiert und somit diese Analysen ausdrücklich zugelassen. Wäre dies nicht so gewesen, wären diese Daten nie und nimmer Gegenstand eines AC gewesen.
Sowas führt immer zu statistischen Fehlern und wird von Statitikern nicht geduldet.
Einzig die geringe Mächtigkeit der Studien wurden durchgehend bemängelt. Gravierende Fehler bei der Auswertung haben eine Zurückweisung eines Zulassungsantrages zur Folge.
Diese eigene Wahrheit und faktenverdrehende Sichtweise ist gefährlich!
Gerüchte Gerüchte Gerüchte.....................
Mysterious Move in Medarex
A strange move in shares of Medarex (MEDX - Cramer's Take - Stockpickr - Rating) (MEDX) had traders talking Wednesday. Medarex is developing a skin cancer treatment. Pete Najarian could only point to a video in which a doctor talked about the miraculous effect of their drug MDX010. Bristol Myers> (BBI - Cramer's Take - Stockpickr - Rating), which is partnered with Medarex, also went up -- with lots of options activity. Bolling said if the video was true and the drug really cures melanoma, the stock would be up 9,000%.
Mysterious Move in Medarex
A strange move in shares of Medarex (MEDX - Cramer's Take - Stockpickr - Rating) (MEDX) had traders talking Wednesday. Medarex is developing a skin cancer treatment. Pete Najarian could only point to a video in which a doctor talked about the miraculous effect of their drug MDX010. Bristol Myers> (BBI - Cramer's Take - Stockpickr - Rating), which is partnered with Medarex, also went up -- with lots of options activity. Bolling said if the video was true and the drug really cures melanoma, the stock would be up 9,000%.
Antwort auf Beitrag Nr.: 31.098.591 von OskarderCrasher am 09.08.07 17:13:12Das Video hatte ich in #3007 am 26.7. gepostet.
http://wcbstv.com/video/?id=101812
http://wcbstv.com/video/?id=101812
Antwort auf Beitrag Nr.: 31.098.591 von OskarderCrasher am 09.08.07 17:13:12nicht schlecht, diese Nachrichten über den Kandidaten von Medarex.
Scheint authentisches Video zu sein, da äußern sich immerhin Leute vom Memorial Sloan Kettering Institute, einer ersten Adresse in der Tumorforschung.

Scheint authentisches Video zu sein, da äußern sich immerhin Leute vom Memorial Sloan Kettering Institute, einer ersten Adresse in der Tumorforschung.

interessanter Vortrag zum Thema "schwarzes Melanom"
http://www.dermatology.uni-kiel.de/media/PDF/Lehre/SS2007/vs…
Ipilimumab in deutschen Kliniken:
http://www.klinikum.uni-heidelberg.de/1047.pdf
http://www.tumorzentrum-tuebingen.de/Studien_ZDO.pdf
http://www.med.tum.de/de/gesundheitsversorgung/kliniken/med3…
http://www.dermatology.uni-kiel.de/media/PDF/Lehre/SS2007/vs…
Ipilimumab in deutschen Kliniken:
http://www.klinikum.uni-heidelberg.de/1047.pdf
http://www.tumorzentrum-tuebingen.de/Studien_ZDO.pdf
http://www.med.tum.de/de/gesundheitsversorgung/kliniken/med3…
Gute Zusammenfassung der Präklinik und Klinik mit Ipilimumab:
http://journals.prous.com/journals/servlet/xmlxsl/dof/200631…
http://journals.prous.com/journals/servlet/xmlxsl/dof/200631…
in der Klinik ist wirklich was los:
http://www.hemonctoday.com/200705/0705drugchart.pdf
...wobei vor allem bei der Indikation Hautkrebs eine rege Betriebsamkeit festzustellen ist.
http://www.hemonctoday.com/200705/0705drugchart.pdf
...wobei vor allem bei der Indikation Hautkrebs eine rege Betriebsamkeit festzustellen ist.
interessanter Vortrag eines VP von BMS über unvorteilhaftes Studiendesign bzw. Strategien bei der Entwicklung von Therapieansätzen bzw. Aktivsubstanzen in der Krebstherapie:
von besonderem Interesse hierbei 10/42 --> das Ansprechverhalten von Ipilimumab bei Haut- und Nierenkrebs mit hoher Signifikanz:
http://www.acceleratingworkshop.org/docs/Presentations/Canet…
von besonderem Interesse hierbei 10/42 --> das Ansprechverhalten von Ipilimumab bei Haut- und Nierenkrebs mit hoher Signifikanz:
http://www.acceleratingworkshop.org/docs/Presentations/Canet…
Antwort auf Beitrag Nr.: 31.119.753 von Cyberhexe am 10.08.07 19:02:11Kleine Korrektur vom Freitag kann man vergessen.
Gehe jetzt voll bei Medarex rein. Stong Buy, Kursziel Dausend EURO.
Gehe jetzt voll bei Medarex rein. Stong Buy, Kursziel Dausend EURO.

Wen es interessiert, hier einen Teil meiner Schnippsel zur Wirksamkeit von Ipilimumab und Ticilimumab in Phase I, II und Aussagen von Medarex:
MDX-010 (Ipilimumab)
Meldung von Juni 2007
356 Patienten
Ergebnisse aus verschiedenen Trials mit Patienten mit Stage III oder Stage IV metastatischem Melanom
46 12,92% CR oder PR
28 7,87% in Woche 12 oder später
16 4,49% SD bevor Resonse (CR oder PR)
10 2,81% PR bevor CR
Phase II Dosis-Eskalierungsstudie bei Patienten mit metastatischem Melanom - gesamte Gruppe
88 Patienten
17 19,32% CR, PR, SD
15 17,05% CR, PR, SD und Dauer > 6 Monate
Phase II Dosis-Eskalierungsstudie bei Patienten mit metastatischem Melanom - Gruppe, die 10mg/kg Dosierung erhalten hat
23 Patienten
9 39,13% CR, PR, SD
8 34,78% CR, PR, SD und Dauer > 6 Monate
Meldung von Juni 2004
MDX-010 and Dacarbazine Combination in Metastatic Melanoma Phase II Study (3mg/kg Dosierung)
35 Patienten
10 28,57% CR, PR, SD
6 17,14% CR, PR
1 2,86% CR
Median Duration der Response: 167 Tage
Vergleich Dacarbazine alleine: ORR 6,8%, Median Duration der Response: 128 Tage
Meldung von April 2005
MDX-010/MDX-1379 Combination in Patients with Metastatic Melanoma (Stage IV Patienten; 3mg/kg)
56 Patienten
29 MDX-010 und MDX-1379 3mg/kg alle drei Wochen
2 6,90% CR
4 13,79% CR, PR
27 MDX-010 und MDX-1379 3mg/kg, follow up alle 3 Wochen 1mg/kg
3 11,11% PR
CP-675,206 (Ticilimumab)
Phase II Studie mit Patienten mit fortgeschrittenen Melanomen
10mg/kg alle 3 Monate 10,3 Monate Median OS
15mg/kg alle 3 Monate 11,2 Monate Median OS
Expectations der FDA bzgl. Ipilimumab
monotherapy ORR >=8% bisherige Erfahrungswerte mit FDA
keine vorab definierte Hürde
Duration der Responses
Totalität der Daten
bisherige Beobachtungen bei Ipilimumab
8 bis 25% ORR
356 mit 3/4: 13% (mit 3% CRR), aber sehr dauerhaft
0,75 der Responses waren durable
Vergleich zu Chemotherapie:
durchschnittlich 6 Monate Median OS
nur 3,6% der Responses waren durable
im Vergleich zu 56% durable Responders bei Ipilimumab
1500 Patienten behandelt mit Ipilimumab
Steriodgabe hat keinen Einfluss auf die Wirksamkeit
-----------------------------------
Alles in allem bisher sehr positive Daten, die - sofern in den doppelverblindeten Phase III Studien bestätigt und auf andere Indikationen ausweitbar - zu potentiellen Blockbusterbehandlungsmöglichkeiten werden könnten.
MDX-010 (Ipilimumab)
Meldung von Juni 2007
356 Patienten
Ergebnisse aus verschiedenen Trials mit Patienten mit Stage III oder Stage IV metastatischem Melanom
46 12,92% CR oder PR
28 7,87% in Woche 12 oder später
16 4,49% SD bevor Resonse (CR oder PR)
10 2,81% PR bevor CR
Phase II Dosis-Eskalierungsstudie bei Patienten mit metastatischem Melanom - gesamte Gruppe
88 Patienten
17 19,32% CR, PR, SD
15 17,05% CR, PR, SD und Dauer > 6 Monate
Phase II Dosis-Eskalierungsstudie bei Patienten mit metastatischem Melanom - Gruppe, die 10mg/kg Dosierung erhalten hat
23 Patienten
9 39,13% CR, PR, SD
8 34,78% CR, PR, SD und Dauer > 6 Monate
Meldung von Juni 2004
MDX-010 and Dacarbazine Combination in Metastatic Melanoma Phase II Study (3mg/kg Dosierung)
35 Patienten
10 28,57% CR, PR, SD
6 17,14% CR, PR
1 2,86% CR
Median Duration der Response: 167 Tage
Vergleich Dacarbazine alleine: ORR 6,8%, Median Duration der Response: 128 Tage
Meldung von April 2005
MDX-010/MDX-1379 Combination in Patients with Metastatic Melanoma (Stage IV Patienten; 3mg/kg)
56 Patienten
29 MDX-010 und MDX-1379 3mg/kg alle drei Wochen
2 6,90% CR
4 13,79% CR, PR
27 MDX-010 und MDX-1379 3mg/kg, follow up alle 3 Wochen 1mg/kg
3 11,11% PR
CP-675,206 (Ticilimumab)
Phase II Studie mit Patienten mit fortgeschrittenen Melanomen
10mg/kg alle 3 Monate 10,3 Monate Median OS
15mg/kg alle 3 Monate 11,2 Monate Median OS
Expectations der FDA bzgl. Ipilimumab
monotherapy ORR >=8% bisherige Erfahrungswerte mit FDA
keine vorab definierte Hürde
Duration der Responses
Totalität der Daten
bisherige Beobachtungen bei Ipilimumab
8 bis 25% ORR
356 mit 3/4: 13% (mit 3% CRR), aber sehr dauerhaft
0,75 der Responses waren durable
Vergleich zu Chemotherapie:
durchschnittlich 6 Monate Median OS
nur 3,6% der Responses waren durable
im Vergleich zu 56% durable Responders bei Ipilimumab
1500 Patienten behandelt mit Ipilimumab
Steriodgabe hat keinen Einfluss auf die Wirksamkeit
-----------------------------------
Alles in allem bisher sehr positive Daten, die - sofern in den doppelverblindeten Phase III Studien bestätigt und auf andere Indikationen ausweitbar - zu potentiellen Blockbusterbehandlungsmöglichkeiten werden könnten.
http://www.prnewswire.com/cgi-bin/stories.pl?ACCT=104&STORY=…
Launch of Drugs from Medarex/Bristol-Myers Squibb and Pfizer Will Significantly Impact the Market for Treatment of Malignant Melanoma
Increased Freedom in Treatment Design Is the Advantage, According to a New
Report from Decision Resources
WALTHAM, Mass., Aug. 15 /PRNewswire/ -- Decision Resources, one of the
world's leading research and advisory firms focusing on pharmaceutical and
healthcare issues, finds that the launch of Medarex/Bristol-Myers Squibb's
ipilimumab and Pfizer's ticilimumab will significantly impact the market
for treatment of malignant melanoma. According to the new report entitled
New Therapies Entering the Market May Raise Hurdles: A Malignant Melanoma
Study, both ipilimumab and ticilimumab offer clinicians more freedom in
treatment design based on the individual patient's performance status.
The approval of ipilimumab and ticilimumab will have a significant
impact on the stage IV malignant melanoma market.
"Although ipilimumab will initially target relapsing patients and
ticilimumab will be used as a first-line monotherapy, ipilimumab will move
into the first-line setting in combination with the commonly used
chemotherapy agent dacarbazine," said Mohamed Muhsin, analyst at Decision
Resources. "The availability of both agents, approved for different
regimens (ticilimumab as a monotherapy; ipilimumab in combination), will
give clinicians more freedom in deciding whether to incorporate a
chemotherapy agent based on the individual patient's performance status,
and it will help them avoid the reimbursement issues associated with
prescribing off-label."
About New Therapies Entering the Market May Raise Hurdles: A Malignant
Melanoma Study
New Therapies Entering the Market May Raise Hurdles: A Malignant
Melanoma Study covers the current and future state of the malignant
melanoma drug market. The report includes the following:
-- More than 3,000 physician responses that define drug attributes that
drive prescription now and in the future.
- Clinical end point tradeoffs that are most influential to physicians.
- Areas of unmet need with highest potential.
- Benchmark trial results for specific drug opportunities.
- Patient share potential for emerging therapies and target product
profiles.
-- Decision Resources proprietary analysis of commercial factors that
accelerate or constrain a drug's market potential.
- Promotion: DTC spend, detailing intensity.
- Reimbursement: formulary tier, prior approval restriction, quantity
limits.
- Labeling: black box warnings, approved patient segments,
contraindications.
- Competition: order of entry, pricing, generic entry, pipeline sales
forecast.
- Medical practice: decision trees, treating physician type, line of
therapy.
- Comparisons of the key clinical attributes of current and emerging
therapies in the areas of efficacy, safety, and delivery.
- Analysis and supporting data that identify the clinical "Gold
Standard" now and over the next ten years.
- Key insights as to which clinical end points have the greatest
influence on physician decision-making.
The report can be purchased by contacting Decision Resources. Members
of the media may request an interview with an analyst.
About Decision Resources
Decision Resources, Inc. (http://www.decisionresources.com) is a world
leader in market research publications, advisory services, and consulting
designed to help clients shape strategy, allocate resources, and master
their chosen markets.
All company, brand, or product names contained in this document may be
trademarks or registered trademarks of their respective holders.
For more information, contact:
Elizabeth Marshall
Decision Resources, Inc.
781-296-2563
emarshall@dresources.com
Launch of Drugs from Medarex/Bristol-Myers Squibb and Pfizer Will Significantly Impact the Market for Treatment of Malignant Melanoma
Increased Freedom in Treatment Design Is the Advantage, According to a New
Report from Decision Resources
WALTHAM, Mass., Aug. 15 /PRNewswire/ -- Decision Resources, one of the
world's leading research and advisory firms focusing on pharmaceutical and
healthcare issues, finds that the launch of Medarex/Bristol-Myers Squibb's
ipilimumab and Pfizer's ticilimumab will significantly impact the market
for treatment of malignant melanoma. According to the new report entitled
New Therapies Entering the Market May Raise Hurdles: A Malignant Melanoma
Study, both ipilimumab and ticilimumab offer clinicians more freedom in
treatment design based on the individual patient's performance status.
The approval of ipilimumab and ticilimumab will have a significant
impact on the stage IV malignant melanoma market.
"Although ipilimumab will initially target relapsing patients and
ticilimumab will be used as a first-line monotherapy, ipilimumab will move
into the first-line setting in combination with the commonly used
chemotherapy agent dacarbazine," said Mohamed Muhsin, analyst at Decision
Resources. "The availability of both agents, approved for different
regimens (ticilimumab as a monotherapy; ipilimumab in combination), will
give clinicians more freedom in deciding whether to incorporate a
chemotherapy agent based on the individual patient's performance status,
and it will help them avoid the reimbursement issues associated with
prescribing off-label."
About New Therapies Entering the Market May Raise Hurdles: A Malignant
Melanoma Study
New Therapies Entering the Market May Raise Hurdles: A Malignant
Melanoma Study covers the current and future state of the malignant
melanoma drug market. The report includes the following:
-- More than 3,000 physician responses that define drug attributes that
drive prescription now and in the future.
- Clinical end point tradeoffs that are most influential to physicians.
- Areas of unmet need with highest potential.
- Benchmark trial results for specific drug opportunities.
- Patient share potential for emerging therapies and target product
profiles.
-- Decision Resources proprietary analysis of commercial factors that
accelerate or constrain a drug's market potential.
- Promotion: DTC spend, detailing intensity.
- Reimbursement: formulary tier, prior approval restriction, quantity
limits.
- Labeling: black box warnings, approved patient segments,
contraindications.
- Competition: order of entry, pricing, generic entry, pipeline sales
forecast.
- Medical practice: decision trees, treating physician type, line of
therapy.
- Comparisons of the key clinical attributes of current and emerging
therapies in the areas of efficacy, safety, and delivery.
- Analysis and supporting data that identify the clinical "Gold
Standard" now and over the next ten years.
- Key insights as to which clinical end points have the greatest
influence on physician decision-making.
The report can be purchased by contacting Decision Resources. Members
of the media may request an interview with an analyst.
About Decision Resources
Decision Resources, Inc. (http://www.decisionresources.com) is a world
leader in market research publications, advisory services, and consulting
designed to help clients shape strategy, allocate resources, and master
their chosen markets.
All company, brand, or product names contained in this document may be
trademarks or registered trademarks of their respective holders.
For more information, contact:
Elizabeth Marshall
Decision Resources, Inc.
781-296-2563
emarshall@dresources.com
Antwort auf Beitrag Nr.: 31.170.794 von Ville7 am 15.08.07 16:00:40Etwa 5-Jahreshoch bei Medarex erreicht.
Nach meinem Eindruck zeigt der Chart ein Kaufsignal, wie man so schön sagt. Ganz anders als bei anderen Biotechs, geschweige denn deutschen Biotechs. Bei Medarex ist was im Busche.
Also kauft jetzt mal schön. The Trend is your friend.

Nach meinem Eindruck zeigt der Chart ein Kaufsignal, wie man so schön sagt. Ganz anders als bei anderen Biotechs, geschweige denn deutschen Biotechs. Bei Medarex ist was im Busche.
Also kauft jetzt mal schön. The Trend is your friend.

Antwort auf Beitrag Nr.: 31.212.341 von Cashverbrenner am 17.08.07 22:28:17Die Institutionellen halten inzwischen über 100% (den shorts sei dank -> letzte Shortquote über 20%):
http://www.nasdaq.com/asp/holdings.asp?mode=&kind=&symbol=WA…
http://www.nasdaq.com/asp/holdings.asp?mode=&kind=&symbol=WA…
Antwort auf Beitrag Nr.: 31.213.999 von Ville7 am 18.08.07 10:08:54Verstehe ich das richtig, daß von den Instis mehr Aktien short verkauft wurden als vorhanden sind? Das würde den Anstieg erklären und noch weiteren Anstieg erzwingen. Bin kein Fachmann bei Shortselling, aber das würde bedeuten daß der Kurs noch weiter steigen sollte.
Antwort auf Beitrag Nr.: 31.214.099 von Cashverbrenner am 18.08.07 10:34:24Nicht ganz. Die Instiquote gibt nur den Anteil der institutionellen Holdings an. Sie ist bei derzeit angegebenen 101%. Wer nun short ist geht daraus nicht hervor.
Verteilung könnte also so aussehen auf der Longseite:
Institutionelle: 101%
Pfizer und Management: 10%
Private: 11%
-------------------
Long Holding gesamt: 122%
abzüglich Short Quote von 22% (Stand Juli):
100% = 126,9 Mio Aktien
Verständlich?
Verteilung könnte also so aussehen auf der Longseite:
Institutionelle: 101%
Pfizer und Management: 10%
Private: 11%
-------------------
Long Holding gesamt: 122%
abzüglich Short Quote von 22% (Stand Juli):
100% = 126,9 Mio Aktien
Verständlich?
http://www.ft.com/cms/s/2/e4e6a040-4f8f-11dc-b485-0000779fd2…
"Dr Mark Scholz, with Prostate Oncology Specialists in California, said cancer vaccines like GVAX and Provenge have made progress in that they sensitize the immune system to cancer cells. But, he said, the immunotherapy products “haven’t hit it out of the park yet.”
Scholz, who also serves as executive director of the Prostate Cancer Research Institute in California, was far more excited about the possibility of combining immunotherapy with Medarex and Bristol-Myers Squibb’s CTLA-4 inhibitor. “It will take medicines like GVAX and Provenge and make them work infinitely better,” he said, citing a study of Leukine and CTLA-4. “I think it’s absolutely a humongous breakthrough…I have little doubt that CTLA-4 will be a breakthrough product.”
"Dr Mark Scholz, with Prostate Oncology Specialists in California, said cancer vaccines like GVAX and Provenge have made progress in that they sensitize the immune system to cancer cells. But, he said, the immunotherapy products “haven’t hit it out of the park yet.”
Scholz, who also serves as executive director of the Prostate Cancer Research Institute in California, was far more excited about the possibility of combining immunotherapy with Medarex and Bristol-Myers Squibb’s CTLA-4 inhibitor. “It will take medicines like GVAX and Provenge and make them work infinitely better,” he said, citing a study of Leukine and CTLA-4. “I think it’s absolutely a humongous breakthrough…I have little doubt that CTLA-4 will be a breakthrough product.”
http://theoncologist.alphamedpress.org/cgi/content/full/12/7…
Besonders interessant: Response Rates in Kombo mit Interleukin (22%) und die Case Histories.
Besonders interessant: Response Rates in Kombo mit Interleukin (22%) und die Case Histories.
Antwort auf Beitrag Nr.: 31.237.705 von Ville7 am 21.08.07 11:31:04bis wann werden denn phase III Ergebnisse erwartet ?
Bin am ueberlegen Optionsscheine mit Basis 18 Dollar zu kaufen, bin mir aber mit der Laufzeit nicht sicher, ob ich Dez. 2008 er kaufen soll, oder ob Januar, oder Juni 2008 auch ausreichen.
Bin am ueberlegen Optionsscheine mit Basis 18 Dollar zu kaufen, bin mir aber mit der Laufzeit nicht sicher, ob ich Dez. 2008 er kaufen soll, oder ob Januar, oder Juni 2008 auch ausreichen.
Antwort auf Beitrag Nr.: 31.243.046 von uk0804 am 21.08.07 17:25:33Pipeline:
7 in Phase III
4 in Phase II
2 in Phase I/II
20 in Phase I
1 Preclinical
Zeitplan ?
7 in Phase III
4 in Phase II
2 in Phase I/II
20 in Phase I
1 Preclinical
Zeitplan ?
Antwort auf Beitrag Nr.: 31.243.046 von uk0804 am 21.08.07 17:25:33Thank you for your e-mail. Regarding ipilimumab (also known as MDX-010), a registrational trial for monotherapy treatment in metastatic melanoma has completed enrollment, with a Biologics License Application (or BLA) filing expected late 2007/early 2008. Top-line data is expected in 2007.
According to Johnson & Johnson's public presentations, expectations for a BLA filing for CNTO 1275 is expected in 2007, and a BLA filing for CNTO 148 is expected in early 2008.
Thank you for your interest in Medarex.
Best regards,
Information@Medarex
------------------------------------
Hello Medarex,
when about this or next year can i expect phase III data publication of
* MEDX-010 monotherapy
* CNTO 148
* CNTO 1275
Thanks in advance.
Regards
According to Johnson & Johnson's public presentations, expectations for a BLA filing for CNTO 1275 is expected in 2007, and a BLA filing for CNTO 148 is expected in early 2008.
Thank you for your interest in Medarex.
Best regards,
Information@Medarex
------------------------------------
Hello Medarex,
when about this or next year can i expect phase III data publication of
* MEDX-010 monotherapy
* CNTO 148
* CNTO 1275
Thanks in advance.
Regards
Antwort auf Beitrag Nr.: 31.250.789 von uk0804 am 22.08.07 10:11:32Plus 1 Phase III (Ticilimumab), welche nicht in der MEDX Auflistung erscheint. Ein Anit-CTLA-4 Antikörper für den MEDX bei Vermarktung zweistellige Royalites erhält. Also eigentlich 8 Phase III Produkte!
Plus 60% der Pipeline von Celldex, denn Celldex gehört zu 60% MEDX:
http://www.celldextherapeutics.com/wt/page/pipeline
Plus 11% Anteil an Genmab und somit an deren Pipeline
Plus Anteil an IDM-Pharma...
Plus 60% der Pipeline von Celldex, denn Celldex gehört zu 60% MEDX:
http://www.celldextherapeutics.com/wt/page/pipeline
Plus 11% Anteil an Genmab und somit an deren Pipeline
Plus Anteil an IDM-Pharma...
Antwort auf Beitrag Nr.: 31.254.236 von Ville7 am 22.08.07 13:51:25Also uk0804, ich übersetze die eine Woche alte Aussage des MEDX-IR in meine eigenen Erwartungen der
Datenveröffentlichung:
MDX-010 monotherapy: Oktober bis Dezember 2007.
CNTO 1275: September bis Oktober2007.
CNTO 148: Oktober bis November 2007.
Antragseinreichung an die FDA (BLA) dann (bei guten Daten):
MDX-010 monotherapy: Dezember bis Februar 2008.
CNTO 1275: November 2007 bis Dezember 2007.
CNTO 148: Januar 2008 bis Februar 2008.
Dass hier einiges an Daten erwartet wird sieht man am Aktienkurs. Der hat die letzten Tage schon etwas Erwartungshaltung eingepreist. Sollten gute Daten kommen war das m.E. aber erst der Anfang.
Datenveröffentlichung:
MDX-010 monotherapy: Oktober bis Dezember 2007.
CNTO 1275: September bis Oktober2007.
CNTO 148: Oktober bis November 2007.
Antragseinreichung an die FDA (BLA) dann (bei guten Daten):
MDX-010 monotherapy: Dezember bis Februar 2008.
CNTO 1275: November 2007 bis Dezember 2007.
CNTO 148: Januar 2008 bis Februar 2008.
Dass hier einiges an Daten erwartet wird sieht man am Aktienkurs. Der hat die letzten Tage schon etwas Erwartungshaltung eingepreist. Sollten gute Daten kommen war das m.E. aber erst der Anfang.
Antwort auf Beitrag Nr.: 31.243.046 von uk0804 am 21.08.07 17:25:33Ich würde - wenn du unbedingt zocken willst - die Juni oder Dezember nehmen. Ich selbst habe mir bei Kurs 14 Dollar 20er OS mit LZ Dezember 08 ins Depot gelegt. Ansonsten würde ich dir eher die Aktie selbst empfehlen. Biotech selbst ist riskant und chancenreich genug. Bei einem Flop von MDX-010 hättest du so wenigestens die sehr gute Möglichkeit dennoch auf mittel bis langfristige Sicht zu gewinnen.
Möglicherweise treten wir ab hier in einen Wartemodus ein. Möglicherweise kommt erst nach Pipeline-News Bewegung nach oben oder unten rein:
[URL ]http://www.tradesignalonline.com/content.asp?p=wpa/tsb/default.asp&fcid=2292818[/URL]
]http://www.tradesignalonline.com/content.asp?p=wpa/tsb/default.asp&fcid=2292818[/URL]
[URLChart öffnen]http://www.tradesignalonline.com/content.asp?p=wpa/tsb/default.asp&fcid=2292818[/URL]
[URL
[URLChart öffnen]http://www.tradesignalonline.com/content.asp?p=wpa/tsb/default.asp&fcid=2292818[/URL]
Antwort auf Beitrag Nr.: 31.256.818 von Ville7 am 22.08.07 16:30:21@ville7: vielen Dank für die Informationen 

Einzelfallbeschreibung einer Patientin eines MDX-010 Trials mit Stage IV Melanoma. Womöglich hat sie MDX-010 erhalten (siehe beschriebene Nebenwirkungen).
http://www.mpip.org/cgi/mpip/patient_db?mode=getbyid&id=1092…
http://www.mpip.org/cgi/mpip/patient_db?mode=getbyid&id=1092…
Antwort auf Beitrag Nr.: 31.312.345 von Ville7 am 28.08.07 10:22:53habe mich mit 1000 Stück Optionsscheine Laufzeit Dez. 2008 Basis 18 Dollar positioniert. Ich denke damit ist genügend Sicherheitspuffer für etwaige Verzögerung bei den News eingebaut.
Danke noch mal für die Info mit dem Zeitplan
Danke noch mal für die Info mit dem Zeitplan

!
Dieser Beitrag wurde moderiert. Grund: Spammposting
10:01 am S&P DOWNGRADES OPINION ON SHARES OF MEDAREX TO HOLD FROM BUY S&P Marketscope
SNPMarketScopeResearchNotes2007-08-30 10:01:36.000 MEDX MEDAREX INC J.Loo-CFA
S&P DOWNGRADES OPINION ON SHARES OF MEDAREX TO HOLD FROM BUY
Our downgrade is based on valuation as the shares have reached our 12-month target price of $17. We believe MEDX is now fairly valued, reflecting what we see as the company's robust pipeline of 37 compounds in development and its potential BLA filing in early 2008 for MDX-010 with partner Bristol Myers. We expect data from Phase III trials for MDX-010 in the second half. However, we note response rates from past trials have been moderate at 13%-19%, which may raise concerns about potential FDA approval. However, durability has been positive with some responses over five years.|US;MEDX|49879|199000
SNPMarketScopeResearchNotes2007-08-30 10:01:36.000 MEDX MEDAREX INC J.Loo-CFA
S&P DOWNGRADES OPINION ON SHARES OF MEDAREX TO HOLD FROM BUY
Our downgrade is based on valuation as the shares have reached our 12-month target price of $17. We believe MEDX is now fairly valued, reflecting what we see as the company's robust pipeline of 37 compounds in development and its potential BLA filing in early 2008 for MDX-010 with partner Bristol Myers. We expect data from Phase III trials for MDX-010 in the second half. However, we note response rates from past trials have been moderate at 13%-19%, which may raise concerns about potential FDA approval. However, durability has been positive with some responses over five years.|US;MEDX|49879|199000
Antwort auf Beitrag Nr.: 31.344.242 von Ville7 am 30.08.07 16:31:00Selbst mit fortgeschrittener Pipeline hat mans schwer.
Laufender cashflow zählt, alles andere wird zur Zeit zwar zur Kenntnis genommen, aber nicht euphorische eingepreist.
Laufender cashflow zählt, alles andere wird zur Zeit zwar zur Kenntnis genommen, aber nicht euphorische eingepreist.
Antwort auf Beitrag Nr.: 31.254.236 von Ville7 am 22.08.07 13:51:25when about this or next year can i expect phase III data publication of
* MEDX-010 monotherapy
...kleine Korrektur:
es handelt sich hierbei nicht um eine Phase-III-Studie, sondern um eine unverblindete, "einarmige" und nicht randomisierte Phase-II-Studie mit 150 Teilnehmern, welche jedoch in Absprache mit der FDA als Zulassungsstudie entworfen wurde.
Anbei das Studienprotokoll:
http://clinicaltrials.gov/ct/show/NCT00289627?order=11
* MEDX-010 monotherapy
...kleine Korrektur:
es handelt sich hierbei nicht um eine Phase-III-Studie, sondern um eine unverblindete, "einarmige" und nicht randomisierte Phase-II-Studie mit 150 Teilnehmern, welche jedoch in Absprache mit der FDA als Zulassungsstudie entworfen wurde.
Anbei das Studienprotokoll:
http://clinicaltrials.gov/ct/show/NCT00289627?order=11
Antwort auf Beitrag Nr.: 31.327.958 von uk0804 am 29.08.07 13:27:45...bin ebenfalls mit Dez08 Calls (Basis 20 $) eingedeckt. Da der Zulassungsantrag für Ipilimumab in Mono/2nd line beim schwarzen Melanom auf Anfang 2008 erwartet wird und bei "fast track" innerhalb 6 Monaten abzuarbeiten ist, erscheint dieser Zielhorizont auf Ende 2008 für die Optionen nicht unklug. Bleibt zu hoffen, dass die Ergebnisse mit den hohen Dosen (10 mg/kg, Ergebnisse gibt es bisher lediglich zu geringer dosierten -3 mg/kg- Phase II-Studien...so viel ich weiss!) den Erwartungen entsprechen! Die objektive Ansprechrate bei den geringer dosierten Studien in Monotherapie war m.E. bei 5%.
Antwort auf Beitrag Nr.: 31.350.373 von Cyberhexe am 30.08.07 23:57:17Bezüglich der ORR in MDX-010 monotherapy sind die ORR-Daten der bisherigen Studien nicht so gut. Allerdings ist die Duration der Responses sehr ermutigend. Auch bei dacarbazine (DITC), dem einzig zugelassenen Medikament (Chemo) gibt es nur Ansprechraten von "nur" 5-7% (mit durchschnittlicher Überlebenszeit von nur 6-7 Monaten). Mit sehr kurzen Responsedauern. Lt. Medarex waren 3,6% bei dacarbazine (DITC) durable responses, bei Ipilimumab aber bis zu 75%.
Hier die Daten vorausgehender vergleichbarer Phase II Studien mit Ipilimumab:
Phase II Dosis-Eskalierungsstudie bei Patienten mit metastatischem Melanom - gesamte Gruppe
88 Patienten
4 4,55% CR, PR (=ORR)
17 19,32% CR, PR, SD
15 17,05% CR, PR, SD und Dauer > 6 Monate
Mit unterschiedlichen Dosierungen (bei der auch 10mg/kg dabei war) gab es nur 4,55% Ansprechrate.
Schaut man sich die 10mg/kg Untergruppe an, dann sind die Daten schon besser:
Phase II Dosis-Eskalierungsstudie bei Patienten mit metastatischem Melanom - Gruppe, die 10mg/kg Dosierung erhalten hat
23 Patienten
1 4,35% CR
1 4,35% PR
2 8,70% CR, PR (=ORR)
7 30,43% SD
9 39,13% CR, PR, SD
8 34,78% CR, PR, SD und Dauer > 6 Monate
Ermutigend ist hier, dass die Anzahl von Stable Diseases viel höher ist als in den anderen Dosierungssschemen. Das ist positiv!
Allerdings ist die Samplesize dieser Studie viel zu gering.
Insgesamt bin ich nicht voll überzeugt bullish für die MDX-010 monotherapy Studie, da der Markt Ansprechraten über 10-12% erwartet (siehe S&P Abstufung gestern). Aber in 2nd line metastatic melanoma sind die Zulassungshürden geringer und ich rechne insgesamt auf jeden Fall mit einer Zulassung von MDX-010. Als Kombi mit Vaccinen oder mit Chemo wird Ipilimumab m.E. sehr gute Ergebnisse produzieren.
Ich hoffe, dass die CNTO Ergebnisse (die ich auf jeden Fall positive werwarte) vor den MDX-010 Ergebnissen kommen und dass ich meine Optionsscheine dann zum Teil abwerfen kann (Einsatz rausnehmen und dafür hoffentlich nur 1/3 der Scheine weggeben), damit ich bezüglich meines Einsatzes in die OS kein Risiko mehr fahre. (Bei der Aktie sitze ich das gerne aus- bei der Pipe!)
Hier die Daten vorausgehender vergleichbarer Phase II Studien mit Ipilimumab:
Phase II Dosis-Eskalierungsstudie bei Patienten mit metastatischem Melanom - gesamte Gruppe
88 Patienten
4 4,55% CR, PR (=ORR)
17 19,32% CR, PR, SD
15 17,05% CR, PR, SD und Dauer > 6 Monate
Mit unterschiedlichen Dosierungen (bei der auch 10mg/kg dabei war) gab es nur 4,55% Ansprechrate.
Schaut man sich die 10mg/kg Untergruppe an, dann sind die Daten schon besser:
Phase II Dosis-Eskalierungsstudie bei Patienten mit metastatischem Melanom - Gruppe, die 10mg/kg Dosierung erhalten hat
23 Patienten
1 4,35% CR
1 4,35% PR
2 8,70% CR, PR (=ORR)
7 30,43% SD
9 39,13% CR, PR, SD
8 34,78% CR, PR, SD und Dauer > 6 Monate
Ermutigend ist hier, dass die Anzahl von Stable Diseases viel höher ist als in den anderen Dosierungssschemen. Das ist positiv!
Allerdings ist die Samplesize dieser Studie viel zu gering.
Insgesamt bin ich nicht voll überzeugt bullish für die MDX-010 monotherapy Studie, da der Markt Ansprechraten über 10-12% erwartet (siehe S&P Abstufung gestern). Aber in 2nd line metastatic melanoma sind die Zulassungshürden geringer und ich rechne insgesamt auf jeden Fall mit einer Zulassung von MDX-010. Als Kombi mit Vaccinen oder mit Chemo wird Ipilimumab m.E. sehr gute Ergebnisse produzieren.
Ich hoffe, dass die CNTO Ergebnisse (die ich auf jeden Fall positive werwarte) vor den MDX-010 Ergebnissen kommen und dass ich meine Optionsscheine dann zum Teil abwerfen kann (Einsatz rausnehmen und dafür hoffentlich nur 1/3 der Scheine weggeben), damit ich bezüglich meines Einsatzes in die OS kein Risiko mehr fahre. (Bei der Aktie sitze ich das gerne aus- bei der Pipe!)
Antwort auf Beitrag Nr.: 31.352.684 von Ville7 am 31.08.07 10:29:16vD...hab die Ergebnisee mittlerweile auch in mehrfacher Ausführung gefunden:
http://www.expertopin.com/doi/pdf/10.1517/14712598.7.8.1245?…
http://www.asco.org/portal/site/ASCO/menuitem.34d60f5624ba07…
http://www.medarex.com/cgi-local/item.pl/20070605-1011294
http://www.expertopin.com/doi/pdf/10.1517/14712598.7.8.1245?…
http://www.asco.org/portal/site/ASCO/menuitem.34d60f5624ba07…
http://www.medarex.com/cgi-local/item.pl/20070605-1011294
CNTO 1275
Novel, dual mechanism
of action
Subcutaneous delivery
Every 12 week dosing!
Development program
– Proof of concept trial
in psoriatic arthritis
– 2 placebo controlled trials
– Etanercept comparator trial
Initial indication in Psoriasis
– U.S./E.U. filings 4Q 2007
Other indications planned
including Crohn’s Disease
p28/79
http://www.jnj.com/investor/documents/presentations/pcreview…
p18/79
CNTO148
U.S./E.U. filings:
– Early 2008: subcutaneous, signs
and symptoms
• Rheumatoid Arthritis
• Ankylosing Spondylitis
• Psoriatic Arthritis
– 2009: intravenous; structural damag
Novel, dual mechanism
of action
Subcutaneous delivery
Every 12 week dosing!
Development program
– Proof of concept trial
in psoriatic arthritis
– 2 placebo controlled trials
– Etanercept comparator trial
Initial indication in Psoriasis
– U.S./E.U. filings 4Q 2007
Other indications planned
including Crohn’s Disease
p28/79
http://www.jnj.com/investor/documents/presentations/pcreview…
p18/79
CNTO148
U.S./E.U. filings:
– Early 2008: subcutaneous, signs
and symptoms
• Rheumatoid Arthritis
• Ankylosing Spondylitis
• Psoriatic Arthritis
– 2009: intravenous; structural damag
[URL ]http://www.tradesignalonline.com/content.asp?p=wpa/tsb/default.asp&fcid=2309494[/URL]
]http://www.tradesignalonline.com/content.asp?p=wpa/tsb/default.asp&fcid=2309494[/URL]
[URLChart öffnen]http://www.tradesignalonline.com/content.asp?p=wpa/tsb/default.asp&fcid=2309494[/URL]
!,5 Jahre Kampf um die 16USD-Marke. Jetzt endlich gewonnen?
[URLChart öffnen]http://www.tradesignalonline.com/content.asp?p=wpa/tsb/default.asp&fcid=2309494[/URL]
!,5 Jahre Kampf um die 16USD-Marke. Jetzt endlich gewonnen?
Potentielle Konkurrenz zu MDX-010 in metastatic melanoma: STA-4783 von SNTA:
"Synta Pharmaceuticals Corp., (NASDAQ: SNTA - News) a biopharmaceutical company focused on discovering, developing, and commercializing small molecule drugs to treat severe medical conditions, today announced encouraging results from the analysis of overall survival (OS) time for patients in the Company's double-blind, randomized, controlled, multi-center Phase 2b clinical trial in metastatic melanoma for its lead compound, STA-4783.
The analysis of overall survival showed that patients randomized to receive STA-4783 plus paclitaxel (N=53) experienced a median survival of 12 months, compared to 7.8 months for all patients who initially received paclitaxel alone (N=28). The Phase 2b trial included a crossover design that allowed patients who initially received paclitaxel alone to receive STA-4783 plus paclitaxel following evidence of a worsening of their disease. Of the 28 patients who initially received paclitaxel alone, 19 elected to subsequently receive STA-4783. The median overall survival for this group was 14.3 months. By contrast, the group of patients initially treated with paclitaxel alone who did not subsequently receive STA-4783 experienced a median survival of 5.6 months. Other randomized trial results in metastatic melanoma have consistently shown a median survival time of between six and nine months regardless of treatment (1).
..."
http://biz.yahoo.com/bw/070605/20070605005818.html?.v=1
"Synta Pharmaceuticals Corp., (NASDAQ: SNTA - News) a biopharmaceutical company focused on discovering, developing, and commercializing small molecule drugs to treat severe medical conditions, today announced encouraging results from the analysis of overall survival (OS) time for patients in the Company's double-blind, randomized, controlled, multi-center Phase 2b clinical trial in metastatic melanoma for its lead compound, STA-4783.
The analysis of overall survival showed that patients randomized to receive STA-4783 plus paclitaxel (N=53) experienced a median survival of 12 months, compared to 7.8 months for all patients who initially received paclitaxel alone (N=28). The Phase 2b trial included a crossover design that allowed patients who initially received paclitaxel alone to receive STA-4783 plus paclitaxel following evidence of a worsening of their disease. Of the 28 patients who initially received paclitaxel alone, 19 elected to subsequently receive STA-4783. The median overall survival for this group was 14.3 months. By contrast, the group of patients initially treated with paclitaxel alone who did not subsequently receive STA-4783 experienced a median survival of 5.6 months. Other randomized trial results in metastatic melanoma have consistently shown a median survival time of between six and nine months regardless of treatment (1).
..."
http://biz.yahoo.com/bw/070605/20070605005818.html?.v=1
 Weiß eigentlich einer warum Medarex so in die Knie gestern gegangen ist bzw. die letzte Woche?
Weiß eigentlich einer warum Medarex so in die Knie gestern gegangen ist bzw. die letzte Woche?
nervosität der Märkte, glaube das hat nix mit Meda direkt zutun, die Krise ist noch längst nicht ausgestanden, im Gegenteil wir befinden uns erst am anfang.....
Gegen die Headfonds ist die immokrise ein Witz, aber das gehört nich in diesen Treat
Gegen die Headfonds ist die immokrise ein Witz, aber das gehört nich in diesen Treat
bin ja bloss froh, das ich bei 13,- EUR mit kl. Plus gleich wieder verkauft habe.
Aber vielleicht bin ich ja einfach auch zu mimosenhaft.
die 16 $ haben also doch nicht gehalten eck. Schade.
Aber vielleicht bin ich ja einfach auch zu mimosenhaft.
die 16 $ haben also doch nicht gehalten eck. Schade.
Antwort auf Beitrag Nr.: 31.506.973 von thüringer am 10.09.07 18:43:14Echt deftiger Rückschlag:
[URL ]http://www.tradesignalonline.com/content.asp?p=wpa/tsb/default.asp&fcid=2321482[/URL]
]http://www.tradesignalonline.com/content.asp?p=wpa/tsb/default.asp&fcid=2321482[/URL]
[URLChart öffnen]http://www.tradesignalonline.com/content.asp?p=wpa/tsb/default.asp&fcid=2321482[/URL]
Der Dreiecksausbruch als Bullenfalle. Langfristig ist natürlich nichts kaputt, aber wenn du bei 13€ raus bist, dann hast du ja auch nichts falsch gemacht. Kannst ja wieder rein, wenn sich die Märkte ausgeko.... haben.
[URL
[URLChart öffnen]http://www.tradesignalonline.com/content.asp?p=wpa/tsb/default.asp&fcid=2321482[/URL]
Der Dreiecksausbruch als Bullenfalle. Langfristig ist natürlich nichts kaputt, aber wenn du bei 13€ raus bist, dann hast du ja auch nichts falsch gemacht. Kannst ja wieder rein, wenn sich die Märkte ausgeko.... haben.

Vielleicht ist ja die nicht so hohe MDX-010 in Phase II ein Grund? Also kurzfristig eher die Skeptiker mit Oberwasser?
http://www.thestreet.com/_yahoo/newsanalysis/biotech/1037860…
http://www.thestreet.com/_yahoo/newsanalysis/biotech/1037860…
wo ist eig. Ville? Wie ist deine Einschätzung zu medarex aktuell?
Antwort auf Beitrag Nr.: 31.610.690 von thüringer am 16.09.07 15:55:07wo ist eig. Ville? Wie ist deine Einschätzung zu medarex aktuell?
Gut zwei Wochen im Urlaub gewesen.
Einschätzung zur Company MEDX mittel-/langfristig absolut unverändert.
Einschätzung zu MEDX-010 ebenso (siehe #3070 - ich war/bin nicht voll überzeugt vor den Phase III Daten für Monotherapie alleine)
Die Karte der schlechten Daten für Monotherapie wird gerade gespielt - siehe den Feuerstein Artikel, dessen Negativität bezüglich MDX-010 ich aber so keinesfalls teile:
http://www.thestreet.com/_yahoo/newsanalysis/biotech/1037860…
Ein Herauskommen der ORR von unter 10% und damit Feuersteins negatives Szenario ist recht wahrscheinlich wenn man die Phase II Daten analysiert. Siehe hierzu auch meine losgetretene Diskussion im Yahoo Board von vor drei Wochen (User Ville9). Aber angesichts der vielen SD Events, der Responsedauern und der 2nd line Anwendung ist eine Zulassung in Monotherapy dennoch möglich. Schlecht vom Markt aufgenommene Daten könnten nochmal eine Kaufmöglichkeit ergeben.
Nächstes Event wird m.E. aber erstmal gute CNTO Daten sein.
Ich bin/bleibe Optimist - unabhängig vom kurzfristig nach oben oder unten manipulierten Kursgeschehen.
Gut zwei Wochen im Urlaub gewesen.
Einschätzung zur Company MEDX mittel-/langfristig absolut unverändert.
Einschätzung zu MEDX-010 ebenso (siehe #3070 - ich war/bin nicht voll überzeugt vor den Phase III Daten für Monotherapie alleine)
Die Karte der schlechten Daten für Monotherapie wird gerade gespielt - siehe den Feuerstein Artikel, dessen Negativität bezüglich MDX-010 ich aber so keinesfalls teile:
http://www.thestreet.com/_yahoo/newsanalysis/biotech/1037860…
Ein Herauskommen der ORR von unter 10% und damit Feuersteins negatives Szenario ist recht wahrscheinlich wenn man die Phase II Daten analysiert. Siehe hierzu auch meine losgetretene Diskussion im Yahoo Board von vor drei Wochen (User Ville9). Aber angesichts der vielen SD Events, der Responsedauern und der 2nd line Anwendung ist eine Zulassung in Monotherapy dennoch möglich. Schlecht vom Markt aufgenommene Daten könnten nochmal eine Kaufmöglichkeit ergeben.
Nächstes Event wird m.E. aber erstmal gute CNTO Daten sein.
Ich bin/bleibe Optimist - unabhängig vom kurzfristig nach oben oder unten manipulierten Kursgeschehen.
Antwort auf Beitrag Nr.: 31.635.084 von Ville7 am 17.09.07 18:38:44http://siliconinvestor.advfn.com/readmsg.aspx?msgid=23876996
Da steht möglicherweise auch interessantes?
Genmab scheint sich rechte von Medx gekrallt zu haben und dabei den besseren Schnitt gemacht? So ganz habe ichs aber nicht kapiert. Noch ein überbleibsel der zuschusterei von Rechten an drakemans Frau bei genmab......
Da steht möglicherweise auch interessantes?
Genmab scheint sich rechte von Medx gekrallt zu haben und dabei den besseren Schnitt gemacht? So ganz habe ichs aber nicht kapiert. Noch ein überbleibsel der zuschusterei von Rechten an drakemans Frau bei genmab......
Antwort auf Beitrag Nr.: 31.635.224 von eck64 am 17.09.07 18:50:14Medarex hält aktuell noch 10.8% der Genmab-Anteile - bei einer aktuellen Marktkapitalisierung von ca. 2.7 Mrd USD entspricht dies derzeit immerhin 300 Mio USD.
Die letzte Vereinbarung, in welcher die Rechte eines MAK, wahrscheinlich für MDX-018, vollständig an Genmab abgegeben wurden, kann m.E. nur schwer beurteilt werden, da die Gegenleistung nicht beziffert wird - ich habe lediglich von einem \"asset exchange\" gelesen. Weiss da jemand mehr?
Pressemitteilung vom 13.9.07
COPENHAGEN, Sept 13 (Reuters) - Danish biotech firm Genmab (GEN.CO: Quote, Profile, Research) said it had secured full rights to its drug candidate HuMax-Inflam through an asset exchange with partner Medarex (MEDX.O: Quote, Profile, Research).
Under the terms of the deal, Genmab will get full rights to the antibody, which targets inflammatory conditions and cancer, and Medarex will receive full rights to multiple disease programmes in oncology.
http://www.reuters.com/article/marketsNews/idUKL138059582007…
In welcher Form Medarex hier profitiert wird nicht im Detail erläutert. Es handelt sich hierbei wohl um den Antikörper MDX-018, welcher im Jahresbericht 2006 noch als gemeinsames Entwicklungsprojekt mit folgender Aufteilung der Vermarktungsrechte geführt ist:
MDX-018. . . . . . . . . . . . Inflammatory Disease
Under our collaboration with Genmab on MDX-018, we have the right to 100% of all revenues and profits in Asia. Outside of Asia, we and Genmab share in the revenues and profits on a 50/50 basis,
subject to certain payments that Genmab owes us with respect to milestones and royalties on MDX-018.
Bei den beiden zur Zulassung anstehendem Antikörper von Centocor (CNTO148 u. CNTO 1275) erhält MEDX im Zulassungsfall Einmalzahlungen und Lizenzgebühren vom generierten Umsatz - aber in welcher Höhe? (normalerweise \"double digits\", also im zweistelligen Prozentbereich; möglicherweise zwischen 10 und 15%)
CNTO 148
Indikation: Rheumatoid Arthritis, Psoriatic Arthritis,
Ankylosing Spondylitis
CNTO 1275
Indikation: Schuppenflechte
We expect to receive milestone payments as this product candidate moves through clinical trials, and royalties on product sales, should commercialization occur.
Bei MDX-010 wird mit Spannung das Ergebnis von Studie CA184-008 erwartet:
http://clinicaltrials.gov/ct/show/NCT00289627?order=14
Da die grösseren Phase3-Studien die in Phase2 erzielten Ergebnisse oft nicht ganz bestätigen können, ist die Skepsis von AF nicht ganz unbegründet. Und denoch wäre eine DCR über 35% wohl ein ausreichender Grund für eine Zulassung, zumal bisher keine weiteren Therapiemöglichkeiten zur Verfügung stehen. Die Spannung steigt.
Die letzte Vereinbarung, in welcher die Rechte eines MAK, wahrscheinlich für MDX-018, vollständig an Genmab abgegeben wurden, kann m.E. nur schwer beurteilt werden, da die Gegenleistung nicht beziffert wird - ich habe lediglich von einem \"asset exchange\" gelesen. Weiss da jemand mehr?
Pressemitteilung vom 13.9.07
COPENHAGEN, Sept 13 (Reuters) - Danish biotech firm Genmab (GEN.CO: Quote, Profile, Research) said it had secured full rights to its drug candidate HuMax-Inflam through an asset exchange with partner Medarex (MEDX.O: Quote, Profile, Research).
Under the terms of the deal, Genmab will get full rights to the antibody, which targets inflammatory conditions and cancer, and Medarex will receive full rights to multiple disease programmes in oncology.
http://www.reuters.com/article/marketsNews/idUKL138059582007…
In welcher Form Medarex hier profitiert wird nicht im Detail erläutert. Es handelt sich hierbei wohl um den Antikörper MDX-018, welcher im Jahresbericht 2006 noch als gemeinsames Entwicklungsprojekt mit folgender Aufteilung der Vermarktungsrechte geführt ist:
MDX-018. . . . . . . . . . . . Inflammatory Disease
Under our collaboration with Genmab on MDX-018, we have the right to 100% of all revenues and profits in Asia. Outside of Asia, we and Genmab share in the revenues and profits on a 50/50 basis,
subject to certain payments that Genmab owes us with respect to milestones and royalties on MDX-018.
Bei den beiden zur Zulassung anstehendem Antikörper von Centocor (CNTO148 u. CNTO 1275) erhält MEDX im Zulassungsfall Einmalzahlungen und Lizenzgebühren vom generierten Umsatz - aber in welcher Höhe? (normalerweise \"double digits\", also im zweistelligen Prozentbereich; möglicherweise zwischen 10 und 15%)
CNTO 148
Indikation: Rheumatoid Arthritis, Psoriatic Arthritis,
Ankylosing Spondylitis
CNTO 1275
Indikation: Schuppenflechte
We expect to receive milestone payments as this product candidate moves through clinical trials, and royalties on product sales, should commercialization occur.
Bei MDX-010 wird mit Spannung das Ergebnis von Studie CA184-008 erwartet:
http://clinicaltrials.gov/ct/show/NCT00289627?order=14
Da die grösseren Phase3-Studien die in Phase2 erzielten Ergebnisse oft nicht ganz bestätigen können, ist die Skepsis von AF nicht ganz unbegründet. Und denoch wäre eine DCR über 35% wohl ein ausreichender Grund für eine Zulassung, zumal bisher keine weiteren Therapiemöglichkeiten zur Verfügung stehen. Die Spannung steigt.
Antwort auf Beitrag Nr.: 31.638.732 von Cyberhexe am 18.09.07 00:05:31konkret zu MDX-018:
erhält Medarex neben dem Recht alle weiteren onkologischen Indikationen zu MDX-018 "abzuschöpfen" noch weitere Gegenleistungen?
erhält Medarex neben dem Recht alle weiteren onkologischen Indikationen zu MDX-018 "abzuschöpfen" noch weitere Gegenleistungen?
Antwort auf Beitrag Nr.: 31.638.742 von Cyberhexe am 18.09.07 00:09:23sorry, ich bin wohl etwas neben der Spur: nach nochmaligem Durchlesen scheint die Vereinbarung so zu sein, dass die Rechte von MDX-018 voll auf Genmab übergehen und Medarex im Austausch dafür die Rechte von verschiedenen anderen MAKs erhält.
Antwort auf Beitrag Nr.: 31.638.732 von Cyberhexe am 18.09.07 00:05:31Da muss ich dich enttäuschen, die CNTO AK werden ca. zwischen 3 und 5% Royalties abwerfen, MEDX sogenanntes Cash&Carry Geschäft. Siehe meine Zusammenfassung aus einer MEDX Präsentation von Anfang des Jahres (#2830):
-------------
...
von Phase III Produkten:
1 Koentwicklung:
Ipilimumab (MEDX-010); 35% Kosten bei Medarex: Einreichung Zulassungsantrag in 2007
2 niedere Royalties/Milestones:
Golimumab (CNTO 148): Einreichung Zulassungsantrag 2007/2008
CNTO 1275: Einreichung Zulassungsantrag 2007
2 zweistellige Royalties:
Ticilimumab (CP-675,206)
Zanolimumab(Humax-CD4: Phase III Daten in HJ1/2007 erwartet
2 Equity Interest => Genmab:
Ofatumamab(Humax-CD20: Phase III Daten in HJ2/2007 erwartet
Zalutumumab (Humax-EGFR): Phase III Daten 2008 erwartet
...
-------------
...
von Phase III Produkten:
1 Koentwicklung:
Ipilimumab (MEDX-010); 35% Kosten bei Medarex: Einreichung Zulassungsantrag in 2007
2 niedere Royalties/Milestones:
Golimumab (CNTO 148): Einreichung Zulassungsantrag 2007/2008
CNTO 1275: Einreichung Zulassungsantrag 2007
2 zweistellige Royalties:
Ticilimumab (CP-675,206)
Zanolimumab(Humax-CD4: Phase III Daten in HJ1/2007 erwartet
2 Equity Interest => Genmab:
Ofatumamab(Humax-CD20: Phase III Daten in HJ2/2007 erwartet
Zalutumumab (Humax-EGFR): Phase III Daten 2008 erwartet
...
...hab mir noch enmal intensiv die Phase2-Studie zu Ipilimumab (MDX-010-15) zur Gemüte geführt (ville hat diese Ergebnisse zumindest teilweise auch schon mitgeteilt, aber aufgrund deren Bedeutung möchte ich noch einmal darauf zurückkommen!)
In dieser unverblindeten Studie wurden 3 unterschiedliche Gruppen betrachtet:
A (n=34) 2.8, 3, 5 mg/kg an Tag 1, 57, 85
B (n=30) Einmaldosis von 7.5, 10, 15 oder 20 mg/kg
C (n=24) 10 mg/kg alle 3w an Tag 1, 22, 43, 64
Der Einfluss auf die Tumoraktivität wurde nach RECIST (Response Evaluation Criteria in Solid Tumors) ausgewertet.
Als Ergebnis wurde die Disease Control Rate (DCR) berechnet, welche den OR (Overall Response = vollständiges (CR) oder partielles Ansprechen (PR)) sowie den SD, die nicht fortschreitenden Krankheitsbilder (stable disease), umfasst.
Ergebnis
A (n=24)
OR: 1PR (246 days)
SD: 4 (29+, 61+, 168, 172)
--> DCR = 15%
B (n=30)
OR: 1PR (211+)
SD: 3 (67+, 109, 395+)
--> DCR = 13%
C (n=23!) eine Lungenkrebspatient wurde aus der Wertung genommen!?
OR: 1CR, 1PR (263+, 275+)
SD: 7 (99, 190, 194, 194+, 246, 351+, 179+)
--> DCR = 39%
Der Overall Response (also CR und PR) beträgt jedoch lediglich 2/23 also ca. 9% !
in Absprache mit der FDA wurde Cohort C als Ausgangsbasis für die Zulassungsstudie CA184-008 gewählt:
http://clinicaltrials.gov/ct/show/NCT00289627?order=14
Die Auswertung erfolgt jedoch nicht nach RECIST sondern nach WHO, dem Standard der Weltgesundheitsorganisation zur Messung der Tumoraktivität, der normalerweise als Resultat ein höheres Ansprechverhalten als unter RECIST ergibt. Dies ist m.E. jedoch nur ein marginaler Vorteil, da bei einer zu treffenden FDA-Entscheidung dieser Vorteil nicht unberücksichtigt bleiben wird.
Was ist nun aus der mächtigeren Zulassungsstudie (150 Teilnehmer)zu erwarten? Erfahrungsgemäss bleiben die Ergebnisse aus grösseren Studien fast immer hinter den Ergebnissen von kleinen Studien zurück. AF ist der Meinung, dass bei einem OR kleiner/gleich 10% - und davon sollte man als Realist ausgehen (trotz WHO) - die Chancen auf eine Zulassung gegen Null gehen. Aus Mangel an Therapiealternativen bin ich jedoch sehr zuversichtlich, dass die Praktiker in einem potentiellen AC eine DCR > 35% - und darauf darf man hoffen - als ausreichenden Grund für eine Zulassungsempfehlung akzeptieren würden.
Time will tell!
In dieser unverblindeten Studie wurden 3 unterschiedliche Gruppen betrachtet:
A (n=34) 2.8, 3, 5 mg/kg an Tag 1, 57, 85
B (n=30) Einmaldosis von 7.5, 10, 15 oder 20 mg/kg
C (n=24) 10 mg/kg alle 3w an Tag 1, 22, 43, 64
Der Einfluss auf die Tumoraktivität wurde nach RECIST (Response Evaluation Criteria in Solid Tumors) ausgewertet.
Als Ergebnis wurde die Disease Control Rate (DCR) berechnet, welche den OR (Overall Response = vollständiges (CR) oder partielles Ansprechen (PR)) sowie den SD, die nicht fortschreitenden Krankheitsbilder (stable disease), umfasst.
Ergebnis
A (n=24)
OR: 1PR (246 days)
SD: 4 (29+, 61+, 168, 172)
--> DCR = 15%
B (n=30)
OR: 1PR (211+)
SD: 3 (67+, 109, 395+)
--> DCR = 13%
C (n=23!) eine Lungenkrebspatient wurde aus der Wertung genommen!?
OR: 1CR, 1PR (263+, 275+)
SD: 7 (99, 190, 194, 194+, 246, 351+, 179+)
--> DCR = 39%
Der Overall Response (also CR und PR) beträgt jedoch lediglich 2/23 also ca. 9% !
in Absprache mit der FDA wurde Cohort C als Ausgangsbasis für die Zulassungsstudie CA184-008 gewählt:
http://clinicaltrials.gov/ct/show/NCT00289627?order=14
Die Auswertung erfolgt jedoch nicht nach RECIST sondern nach WHO, dem Standard der Weltgesundheitsorganisation zur Messung der Tumoraktivität, der normalerweise als Resultat ein höheres Ansprechverhalten als unter RECIST ergibt. Dies ist m.E. jedoch nur ein marginaler Vorteil, da bei einer zu treffenden FDA-Entscheidung dieser Vorteil nicht unberücksichtigt bleiben wird.
Was ist nun aus der mächtigeren Zulassungsstudie (150 Teilnehmer)zu erwarten? Erfahrungsgemäss bleiben die Ergebnisse aus grösseren Studien fast immer hinter den Ergebnissen von kleinen Studien zurück. AF ist der Meinung, dass bei einem OR kleiner/gleich 10% - und davon sollte man als Realist ausgehen (trotz WHO) - die Chancen auf eine Zulassung gegen Null gehen. Aus Mangel an Therapiealternativen bin ich jedoch sehr zuversichtlich, dass die Praktiker in einem potentiellen AC eine DCR > 35% - und darauf darf man hoffen - als ausreichenden Grund für eine Zulassungsempfehlung akzeptieren würden.
Time will tell!
Antwort auf Beitrag Nr.: 31.652.274 von Cyberhexe am 18.09.07 22:53:45Korrektur:
Ergebnis
A (n=24)
richtig: n=34
Ergebnis
A (n=24)
richtig: n=34
@Cyberhexe: Danke für deine verständliche Aufklärung zu den PII Daten und der AF Kritik.
Versteh ich das richtig, dass die FDA wahrscheinlich ablehnen wird, wenn zu wenige Patienten (< 10 %) vollständig oder teilweise ansprechen. Es sollte zumindest bei 35 % kein Fortschreiten der Krankheit bestehen?
Ganz naiv gesprochen: Wenn für ca. 35 % der Patienten zumindest die Lebenserwartung deutlich erhöht werden kann (und es ja keine Alternativen Thearpiemöglichkeiten gibt), dann würde doch jeder einzelne Betroffene alles dafür geben, dass diese Therapie auf den Markt kommt.
Wir werden sehen.
Versteh ich das richtig, dass die FDA wahrscheinlich ablehnen wird, wenn zu wenige Patienten (< 10 %) vollständig oder teilweise ansprechen. Es sollte zumindest bei 35 % kein Fortschreiten der Krankheit bestehen?
Ganz naiv gesprochen: Wenn für ca. 35 % der Patienten zumindest die Lebenserwartung deutlich erhöht werden kann (und es ja keine Alternativen Thearpiemöglichkeiten gibt), dann würde doch jeder einzelne Betroffene alles dafür geben, dass diese Therapie auf den Markt kommt.
Wir werden sehen.
Antwort auf Beitrag Nr.: 31.653.983 von Lycos2 am 19.09.07 08:05:1214,40-es reicht du blöde scheiß-aktie



Antwort auf Beitrag Nr.: 31.693.355 von mountainbiker am 21.09.07 21:07:15

Antwort auf Beitrag Nr.: 31.693.577 von mountainbiker am 21.09.07 21:26:16Wie weit will se denn noch runter - ich kann nicht mehr mit dem ganzen Biotech Schrott! Alles rundrum steigt... Ich kotz gleich

Antwort auf Beitrag Nr.: 31.693.671 von mountainbiker am 21.09.07 21:34:2614,34...
Antwort auf Beitrag Nr.: 31.693.694 von mountainbiker am 21.09.07 21:36:54
Nachdem es eine Weile für Medarex deutlich besser lief als für Morphosys, hat sich das ja im letzten Monat massiv umgekehrt:


Kann Morphosys jetzt noch mehr aufholen? Oder ist Medarex unverdient abgestraft? Ist Feuerstein der ganze Grund, oder welches Misstrauen haut jetzt so übel rein in die performance?
AUf lange Sicht ist der Vergleich eh nur marginal Unterschiedlich.

Kann Morphosys jetzt noch mehr aufholen? Oder ist Medarex unverdient abgestraft? Ist Feuerstein der ganze Grund, oder welches Misstrauen haut jetzt so übel rein in die performance?
AUf lange Sicht ist der Vergleich eh nur marginal Unterschiedlich.
Antwort auf Beitrag Nr.: 31.714.491 von eck64 am 23.09.07 21:01:24Und wieder über 2% Miese...

Antwort auf Beitrag Nr.: 31.729.547 von mountainbiker am 24.09.07 21:13:10Tschuldigung: 3%

habe im yahoo message board folgendes gelesen:
Phase III Ergebnisse von CNTO 1275 auf Psoriasis werden am 3. Oktober erwartet am World Congress of Dermatology in Buenos Aires
anscheinend ein 3 Milliarden Markt Psoriasis , Medx würde 3 - 5 Prozent Royalities bekommen.
Keine Gewähr ob diese Angaben stimmen.
Phase III Ergebnisse von CNTO 1275 auf Psoriasis werden am 3. Oktober erwartet am World Congress of Dermatology in Buenos Aires
anscheinend ein 3 Milliarden Markt Psoriasis , Medx würde 3 - 5 Prozent Royalities bekommen.
Keine Gewähr ob diese Angaben stimmen.
Antwort auf Beitrag Nr.: 31.737.190 von uk0804 am 25.09.07 15:13:57Deckt sich mit meinen Infos. In 10 Tagen wissen wir mehr. Ich erwarte super Ergebnisse.
Antwort auf Beitrag Nr.: 31.739.091 von Ville7 am 25.09.07 17:13:06hab heute noch mal nachgekauft und meinen Einstandskurs verbilligt. ich hoffe wir haben das Tief gesehen.
Auf gute Ergebnisse nächsten Mittwoch !!!
Auf gute Ergebnisse nächsten Mittwoch !!!
Antwort auf Beitrag Nr.: 31.737.190 von uk0804 am 25.09.07 15:13:57...anbei die Bestätigung:
http://www.investor.jnj.com/releaseDetail.cfm?ReleaseID=2657…
Pivotal Ustekinumab (CNTO 1275) Phase 3 Data to Debut at World Congress of Dermatology Meeting
HORSHAM, Pa., Sept. 25 /PRNewswire/ -- Findings from an international, multicenter, randomized, double-blind, placebo-controlled Phase 3 trial evaluating ustekinumab (CNTO 1275) in the treatment of moderate to severe plaque psoriasis will be presented for the first time at the 21st meeting of the World Congress of Dermatology, which takes place from Sept. 30 to Oct. 5, 2007 in Buenos Aires, Argentina.
The presentation, entitled CNTO 1275 (anti-IL-12/23p40) Treatment of Psoriasis: Phase 3 Trial Results will take place on Wednesday, Oct. 3, 2007 from 11 a.m. to 1 p.m. local time (GMT +3:00; 10:00 a.m. to 12:00 p.m. EDT), Room A, La Rural Convention Center, Buenos Aires, Argentina.
These first reported findings will be the subject of a live press briefing and webcast, which will be broadcast from the World Congress of Dermatology on Wednesday, Oct. 3 at 2 p.m. EDT. Media and analysts are invited to register at http://www.CNTO1275WCD.com and listen live on Oct. 3 as investigators from the trial will review and discuss the data.
About Ustekinumab
Ustekinumab is a new, fully-human monoclonal antibody in Phase 3 development by Centocor, Inc. for the treatment of moderate to severe plaque psoriasis and is being investigated as an infrequently-administered subcutaneous injection. Ustekinumab is a novel biologic therapy that targets interleukin 12 (IL-12) and interleukin 23 (IL-23), naturally occurring proteins that are important in normalizing the immune system and that are also believed to play a role in immune-mediated inflammatory diseases.
Centocor discovered ustekinumab and has exclusive marketing rights to the product in the United States. Janssen-Cilag companies will market ustekinumab in all countries outside of the United States.
About Psoriasis
Psoriasis is a chronic, immune-mediated disease that results from inflammation in the skin and overproduction of skin cells that accumulate on the surface causing red, scaly plaques that may itch and bleed. This chronic inflammation is driven in part by IL-12 and IL-23, cytokines involved in the regulation of the body's immune response. It is estimated that 125 million people worldwide have psoriasis, including two percent of both the U.S. and European populations, or some 7.5 million Americans and 10 million Europeans. Nearly one-quarter of people with psoriasis have cases that are considered moderate to severe.
http://www.investor.jnj.com/releaseDetail.cfm?ReleaseID=2657…
Pivotal Ustekinumab (CNTO 1275) Phase 3 Data to Debut at World Congress of Dermatology Meeting
HORSHAM, Pa., Sept. 25 /PRNewswire/ -- Findings from an international, multicenter, randomized, double-blind, placebo-controlled Phase 3 trial evaluating ustekinumab (CNTO 1275) in the treatment of moderate to severe plaque psoriasis will be presented for the first time at the 21st meeting of the World Congress of Dermatology, which takes place from Sept. 30 to Oct. 5, 2007 in Buenos Aires, Argentina.
The presentation, entitled CNTO 1275 (anti-IL-12/23p40) Treatment of Psoriasis: Phase 3 Trial Results will take place on Wednesday, Oct. 3, 2007 from 11 a.m. to 1 p.m. local time (GMT +3:00; 10:00 a.m. to 12:00 p.m. EDT), Room A, La Rural Convention Center, Buenos Aires, Argentina.
These first reported findings will be the subject of a live press briefing and webcast, which will be broadcast from the World Congress of Dermatology on Wednesday, Oct. 3 at 2 p.m. EDT. Media and analysts are invited to register at http://www.CNTO1275WCD.com and listen live on Oct. 3 as investigators from the trial will review and discuss the data.
About Ustekinumab
Ustekinumab is a new, fully-human monoclonal antibody in Phase 3 development by Centocor, Inc. for the treatment of moderate to severe plaque psoriasis and is being investigated as an infrequently-administered subcutaneous injection. Ustekinumab is a novel biologic therapy that targets interleukin 12 (IL-12) and interleukin 23 (IL-23), naturally occurring proteins that are important in normalizing the immune system and that are also believed to play a role in immune-mediated inflammatory diseases.
Centocor discovered ustekinumab and has exclusive marketing rights to the product in the United States. Janssen-Cilag companies will market ustekinumab in all countries outside of the United States.
About Psoriasis
Psoriasis is a chronic, immune-mediated disease that results from inflammation in the skin and overproduction of skin cells that accumulate on the surface causing red, scaly plaques that may itch and bleed. This chronic inflammation is driven in part by IL-12 and IL-23, cytokines involved in the regulation of the body's immune response. It is estimated that 125 million people worldwide have psoriasis, including two percent of both the U.S. and European populations, or some 7.5 million Americans and 10 million Europeans. Nearly one-quarter of people with psoriasis have cases that are considered moderate to severe.
Antwort auf Beitrag Nr.: 31.742.253 von Cyberhexe am 25.09.07 21:15:04...und der wissenschaftliche Vortrag von G.Krüger dürfte die Ergebnisse auch thematisieren:
October 3, 2007
- PSORIASIS: KRUEGER James G. (United States) – 12:16 to 12:31
http://www.dermato2007.org/ENGLISH/scientific_act.html
http://content.nejm.org/cgi/content/short/356/6/580
October 3, 2007
- PSORIASIS: KRUEGER James G. (United States) – 12:16 to 12:31
http://www.dermato2007.org/ENGLISH/scientific_act.html
http://content.nejm.org/cgi/content/short/356/6/580
..über MDX-010 (aus ymb):
Licensing
Bristol-Myers Squibb Co In November 2004, BMS and Medarex entered into a worldwide collaboration to develop and commercialize ipilimumab andMDX-1379. BMS and Medarex agreed to jointly continue to investigate the development of ipilimumab in additional tumor types. The companies would share in the costs of developing ipilimumab and MDX-1379 in the US and EU based on a pre-agreed percentage allocation. BMS would be responsible for all development outside of these territories. Medarex would receive an initial cash payment of US $50 million, of which US $25 million would be a purchase of its common stock. Medarex could receive up to US $205 million if all regulatory milestones are met, and up to US $275 million in sales-related milestones. Medarex would have an option to co-promote and share profits with BMS in the US based on a pre-agreed percentage split. BMS would receive an exclusive license ex-US and pay royalties to Medarex [569419]. In December 2004, The FTC requested an extension of the review period for the collaboration for ipilimumab. The companies complied with the request and voluntarily provided additional information related to the filing of their notification and report forms under the Hart-Scott-Rodino antitrust improvements act. BMS withdrew and refiled its Hart-Scott-Rodino filing to provide the FTC with additional time to complete its review. At that time, the FTC review period was expected to expire in January 2005 [575510]; the collaboration became effective in January 2005 [587419].
http://72.14.253.104/search?q=cache:IQqeqz8UbSYJ:www.biomedc…
Licensing
Bristol-Myers Squibb Co In November 2004, BMS and Medarex entered into a worldwide collaboration to develop and commercialize ipilimumab andMDX-1379. BMS and Medarex agreed to jointly continue to investigate the development of ipilimumab in additional tumor types. The companies would share in the costs of developing ipilimumab and MDX-1379 in the US and EU based on a pre-agreed percentage allocation. BMS would be responsible for all development outside of these territories. Medarex would receive an initial cash payment of US $50 million, of which US $25 million would be a purchase of its common stock. Medarex could receive up to US $205 million if all regulatory milestones are met, and up to US $275 million in sales-related milestones. Medarex would have an option to co-promote and share profits with BMS in the US based on a pre-agreed percentage split. BMS would receive an exclusive license ex-US and pay royalties to Medarex [569419]. In December 2004, The FTC requested an extension of the review period for the collaboration for ipilimumab. The companies complied with the request and voluntarily provided additional information related to the filing of their notification and report forms under the Hart-Scott-Rodino antitrust improvements act. BMS withdrew and refiled its Hart-Scott-Rodino filing to provide the FTC with additional time to complete its review. At that time, the FTC review period was expected to expire in January 2005 [575510]; the collaboration became effective in January 2005 [587419].
http://72.14.253.104/search?q=cache:IQqeqz8UbSYJ:www.biomedc…
Neue Short Interest Daten gabs gestern auch. Short interest um 13,9% gestiegen auf 26,9% des Floats. Institutional Ownership immer noch bei 100,6%. Macht euch gefasst auf einen heissen Herbst. Entweder die Shorts oder ihr brennt. 

ab heute nur noch eine richtung  norden ...
norden ...
zumindest bis 12,50 euronen
 norden ...
norden ...zumindest bis 12,50 euronen
Update zu den Terminen aus der UBS Präsentation gestern:
MEDX erwartet nächste Woche Daten von JnJ zu CNTO 1275
MEDX erwartet Daten zu CNTO 148 von JnJ auf dem ACR*
* ich interpretiere 'ACR' als "American College of Rheumatology", Annual Meeting am 6.-11. November
MEDX erwartet MDX-010 Topline Data noch im Laufe des Jahres ("later this year"). CFO Schade spricht von Ergebnissen von drei Studien.
--------------------
Meine Erwartung also für Phase III Daten:
CNTO 1275: 3.Oktober 2007
CNTO 148: 6. bis 11. November 2007
MDX-010: November/Dezember 2007
MEDX erwartet nächste Woche Daten von JnJ zu CNTO 1275
MEDX erwartet Daten zu CNTO 148 von JnJ auf dem ACR*
* ich interpretiere 'ACR' als "American College of Rheumatology", Annual Meeting am 6.-11. November
MEDX erwartet MDX-010 Topline Data noch im Laufe des Jahres ("later this year"). CFO Schade spricht von Ergebnissen von drei Studien.
--------------------
Meine Erwartung also für Phase III Daten:
CNTO 1275: 3.Oktober 2007
CNTO 148: 6. bis 11. November 2007
MDX-010: November/Dezember 2007
der Markt für Ustekinumab ist gigantisch:
1.1. Psoriasis vulgaris
1.1.1. Epidemiologie
Die Psoriasis vulgaris ist eine genetisch determinierte, chronisch-entzündliche Hauterkrankung, deren Häufigkeit weltweit mit 0,1-2,8% angegeben wird (Farber & Nall, 1974). Sie variiert erheblich je nach geographischer Lage. In nichtselektionierten Bevölkerungsgruppen wurden Prävalenzen von 0,5% (USA), 1,6% (England), 2% (Ungarn), bis maximal 11,8% (Kasachstan-Mittelasiens) ermittelt (Farber & Nall, 1998).
1.1. Psoriasis vulgaris
1.1.1. Epidemiologie
Die Psoriasis vulgaris ist eine genetisch determinierte, chronisch-entzündliche Hauterkrankung, deren Häufigkeit weltweit mit 0,1-2,8% angegeben wird (Farber & Nall, 1974). Sie variiert erheblich je nach geographischer Lage. In nichtselektionierten Bevölkerungsgruppen wurden Prävalenzen von 0,5% (USA), 1,6% (England), 2% (Ungarn), bis maximal 11,8% (Kasachstan-Mittelasiens) ermittelt (Farber & Nall, 1998).
Antwort auf Beitrag Nr.: 31.759.819 von Cyberhexe am 27.09.07 11:03:48...wobei die Zahlen zur Prävalenz bei Psoriasis sehr unterschiedlich sind. Sehr häufig ist nämlich zu lesen, dass in den Staaten mehr als 5 Mio Menschen an der Schuppenflechte erkrankt sind:
http://www.psoriasis.org/about/stats/
Worldwide
Psoriasis affects an estimated 2-3 percent of the world's population.
125 million people worldwide have psoriasis, according to the World Psoriasis Day consortium.
National health concern
According to the National Institutes of Health (NIH), between 5.8 and 7.5 million Americans have psoriasis.
Studies have shown that between 10 percent and 30 percent of people with psoriasis also develop psoriatic arthritis.
http://www.wrongdiagnosis.com/p/psoriasis/prevalence.htm
Prevalance of Psoriasis: 5.5 million people in the USA
In Anbetracht der Verbreitung der Schuppenflechte und den beschränkten Therapiemöglichkeiten könnte CNTO-1275 bei einer Bestätigung der Phase-2-Ergebnisse ein riesiges Geschäft werden - vielleicht sollte man sich JNJ auch einmal näher betrachten!
http://www.psoriasis.org/about/stats/
Worldwide
Psoriasis affects an estimated 2-3 percent of the world's population.
125 million people worldwide have psoriasis, according to the World Psoriasis Day consortium.
National health concern
According to the National Institutes of Health (NIH), between 5.8 and 7.5 million Americans have psoriasis.
Studies have shown that between 10 percent and 30 percent of people with psoriasis also develop psoriatic arthritis.
http://www.wrongdiagnosis.com/p/psoriasis/prevalence.htm
Prevalance of Psoriasis: 5.5 million people in the USA
In Anbetracht der Verbreitung der Schuppenflechte und den beschränkten Therapiemöglichkeiten könnte CNTO-1275 bei einer Bestätigung der Phase-2-Ergebnisse ein riesiges Geschäft werden - vielleicht sollte man sich JNJ auch einmal näher betrachten!
Antwort auf Beitrag Nr.: 31.761.055 von Cyberhexe am 27.09.07 12:33:39Johnson und Johnson ist ein richtiges dow jones Dickschiff mit an die 200 Milliarden Marktkapitalisierung und weit diversifiziertem Geschäft.
Da ist es schön, wenn so was dazu kommt, aber es ist im Gesamtgeschäft trotzdem nur ein kleiner Anteil.
Da ist es schön, wenn so was dazu kommt, aber es ist im Gesamtgeschäft trotzdem nur ein kleiner Anteil.
Antwort auf Beitrag Nr.: 31.761.184 von eck64 am 27.09.07 12:44:14...Ende 2007/Anfang 2008 wird JNJ noch bis zu 7 Zulassungsanträge bei der FDA einreichen, deren Produkte ein gewaltiges Umsatzpotential zugestanden wird und dies bei Bruttomargen um die 85%. Dies dürfte sich positiv auf den Unternehmensgewinn auswirken, weshalb die JNJ-Optionen durchaus interessant erscheinen und derzeit ein günstiges Chance/Risiko-Verhältnis bieten. Bei kleineren Gesellschaften ist, und da gebe ich dir Recht, jedoch weitaus mehr Phantasie möglich:
http://www.wallstreet-online.de/dyn/community/thread.html?th…
http://www.wallstreet-online.de/dyn/community/thread.html?th…
bei der nächste Woche in Kalifornien stattfindenden Konferenz über Hautkrebs sind selbstverständlich auch BMY und Medarex vertreten - ob da allerdings Neuigkeiten präsentiert werden, bleibt abzuwarten:
OCTOBER 3-4, 2007
Perspectives in Melanoma XI
Huntington Beach, California
Thursday, October 4, 2007
12:00 pm
The evolving role of CTLA-4 in melanoma
A luncheon satellite symposium
Supported by:
Bristol-Myers Squibb/Medarex
http://www.imedex.com/announcements/283.asp
OCTOBER 3-4, 2007
Perspectives in Melanoma XI
Huntington Beach, California
Thursday, October 4, 2007
12:00 pm
The evolving role of CTLA-4 in melanoma
A luncheon satellite symposium
Supported by:
Bristol-Myers Squibb/Medarex
http://www.imedex.com/announcements/283.asp
Antwort auf Beitrag Nr.: 31.766.670 von Cyberhexe am 27.09.07 18:24:33Und wieder in die Grütze heute...
Antwort auf Beitrag Nr.: 31.767.823 von mountainbiker am 27.09.07 19:40:43Verdammte Scheiße, ist doch alles Geldvernichtung... 

Antwort auf Beitrag Nr.: 31.783.802 von mountainbiker am 28.09.07 23:55:37wart mal bis Ende nächster Woche. Vielleicht wird s was !!!
Antwort auf Beitrag Nr.: 31.786.509 von uk0804 am 29.09.07 18:12:48Alles fett im Plus - nur unsere Looser Aktie mal wieder nicht...

Naja, könnt auch daran liegen 
Rating-Update: Toronto (aktiencheck.de AG) - Die Analysten von BMO Capital Markets stufen die Aktie von Medarex (ISIN US5839161016/ WKN 883040) in einer Ersteinschätzung mit "underperform" ein. Das Kursziel werde bei 11 USD gesehen. (01.10.2007/ac/a/u)
Am Mittwoch wirds dann spannend.

Rating-Update: Toronto (aktiencheck.de AG) - Die Analysten von BMO Capital Markets stufen die Aktie von Medarex (ISIN US5839161016/ WKN 883040) in einer Ersteinschätzung mit "underperform" ein. Das Kursziel werde bei 11 USD gesehen. (01.10.2007/ac/a/u)
Am Mittwoch wirds dann spannend.

Antwort auf Beitrag Nr.: 31.812.397 von Lycos2 am 02.10.07 08:09:29die nächsten drei Monate werden spannend. Bin gespannt wo wir heute abend in Amerika landen. Ob die Aufmerksamkeit mit Veröffentlichung der Phase III Daten auf dem Dermatologen Kongress steigt.
Bin zuversichtlich
Bin zuversichtlich
Keine 10 Minuten alt: CNTO 1275 (anti-IL12/IL23) results are better than expected!
http://www.reuters.com/article/marketsNews/idUKN023957152007…
http://www.reuters.com/article/marketsNews/idUKN023957152007…
Antwort auf Beitrag Nr.: 31.833.366 von sirjethro am 03.10.07 18:23:50Geht wahrscheinlich gleich wieder ins Minus - bei den News...
Nö. Nimmt Anlauf ... ;-)
Antwort auf Beitrag Nr.: 31.833.366 von sirjethro am 03.10.07 18:23:50Warum haben die eigentlich nur gegen Placebo getestet?
Gegen psoriasis gibts doch auch schon zugelassene Medikamente, z.B. raptiva?
Gegen psoriasis gibts doch auch schon zugelassene Medikamente, z.B. raptiva?
Jubel trubel Heiterkeit ....
 sieht anders aus.
sieht anders aus.
Antwort auf Beitrag Nr.: 31.835.014 von eck64 am 03.10.07 20:30:15Und schon ins Minus - es ist einfach unglaublich

Antwort auf Beitrag Nr.: 31.835.248 von mountainbiker am 03.10.07 20:52:23Studienergebnisse braucht man also zukünftig nicht mehr abwarten - bringt eh nichts...
Antwort auf Beitrag Nr.: 31.834.526 von eck64 am 03.10.07 19:52:16Mit den gestrigen Ergebnissen braucht sich Ustekinumab nicht zu verstecken. Nebenwirkungsprofil zeigte keine Auffälligkeiten gegenüber Plazebo. Target ist neu und gegenüber Remicade hat es den Vorteil ein voll humaner AK zu sein. Zudem mus man es nur zweimal in 12 Wochen geben und danach alle 12 Wochen. Remicade dagegen muss man alle 2 Wochen verabreichen. Daher sollte es als zusätzliche Behandlung zugelassen werden und es dadurch eines der besten Produkte sein.
Raptiva (target: CD11a):
PASI 75 nach 12 Wochen: 41%
PASI 50 nach 12 Wochen: 82%
Enbrel (target: anti-TNF-alpha)::
PASI 75 nach 12 Wochen: 30%
Remicade (target: anti-TNF-alpha):
PASI 75 nach 10 Wochen: 88%
5 mal verabreicht
Ustekinumab (target: IL-12 und IL-23):
PASI 90 nach 12 Wochen: 51%
PASI 75 nach 12 Wochen: 76%
2 mal verabreicht
voll human
PASI: Prozent der Beseitigung der Schuppenflechte.
Raptiva (target: CD11a):
PASI 75 nach 12 Wochen: 41%
PASI 50 nach 12 Wochen: 82%
Enbrel (target: anti-TNF-alpha)::
PASI 75 nach 12 Wochen: 30%
Remicade (target: anti-TNF-alpha):
PASI 75 nach 10 Wochen: 88%
5 mal verabreicht
Ustekinumab (target: IL-12 und IL-23):
PASI 90 nach 12 Wochen: 51%
PASI 75 nach 12 Wochen: 76%
2 mal verabreicht
voll human
PASI: Prozent der Beseitigung der Schuppenflechte.
Antwort auf Beitrag Nr.: 31.837.129 von Ville7 am 04.10.07 07:46:37Ich hatte auch nicht gemeint, dass die sich verstecken müssen mit den Ergebnissen, nur warum nicht direkt verglichen wurde.
Aber: Wenn das Verabreichungsprofil so unterschiedlich ist, dann kann man natürlich nicht das oder das gegeben, weil es vom Profil her nicht passt.
Aber: Wenn das Verabreichungsprofil so unterschiedlich ist, dann kann man natürlich nicht das oder das gegeben, weil es vom Profil her nicht passt.
Antwort auf Beitrag Nr.: 31.837.145 von eck64 am 04.10.07 07:52:15Mit welchem Präparat hätten sie es denn vergleichen sollen? Es gibt inzwischen zahlreiche Behandlungsoptionen. Eck, mal ehrlich, so ein Vergleich ist doch vollkommen unüblich oder zeig mir ein Beispiel, wo in autoimmun-/entzündlichen Erkrankungen in Phase III gegen bestehende Medikamente getestet wird. Wichtig ist, dass mit Plazebo verglichen wird. Und die PASI Werte sind nun auch standardisiert.
Antwort auf Beitrag Nr.: 31.837.266 von Ville7 am 04.10.07 08:18:00anscheinend ist weder in der veröffentlichung von j+j noch bei centeor der name medarex gefallen. und medarex hält es nicht für nötig pr zu betreiben. Deshalb wo keine news, da keine Interessenten, da kein ansteigender Kurs
Antwort auf Beitrag Nr.: 31.838.312 von uk0804 am 04.10.07 09:59:24Das ist richtig. Daher bestimmt die Angst vor den MDX-010-Daten weiter das Bild.
Für alle Unformierten, diese Übersicht inklusive Wirkungsweise MDX-010, kann man gar nicht oft genug posten, dieses ASCO Poster spricht mehr als 1000 Worte:
http://themelanomablog.com/storage/ASCO_2007_Ipilimumab_Kine…
Ein paar Ausschnitte hieraus als Appetizer (Einzelfälle):
SD prior to PR:

Apparent PD prior to a durable CR:

SD ist definiert als Tumorrückgang bis auf 51%. Fast 40% hatten in einer Phase II Studie Complete Response (CR), Partial Response (PR) oder Stable Disease. Knapp 9% hatten CR und OR (= Overall Response Rate/ORR). Die FDA wird nicht herumkommen die Totalität der Daten zu berücksichtigen. Eine 10% Hürde für ORR auszugeben und darauf zu bestehen, wenn der Benefit in fast 40% der Patienten ersichtlich ist ist für mich nicht verständlich.
-------------------------------------------
Recht stark meiner Ansicht, dass die FDA um Ipilimumab (MDX-010) längerfristig nicht herumkommt, ist dieser Poster hier. Ich stelle sein Posting aus Yahoo einfach mal hier rein.
-----------------------------
FWIW
I can't imagine that there's any serious long that wasn't looking forward to today's data - there weren't very many meaningful large investors on the margin that missed or didn’t anticipate the story. 110% of the float is in the hands of institutions and most of them do their due diligence. I don’t think a MEDX press release would have made a difference after a few hours.
In a few weeks when the CNTO 1275 BLA is filed MEDX will receive a milestone payment. That will be on the news ticker.
Today we got exactly what the longs were expecting, in fact more than I had hoped for. The response rates were a few percent better than I would have assumed, and the unequivocal statements on the safety of 1275 (clear superiority over TNF-alpha blockers) exceeded what I would have been willing to assume coming into this year. (Maybe the shorts can spin that as a negative - will 1275 slow the expansion of the Remicade/Cnto 148 franchise by slowing the uptake on TNF-alpha blockers in the psoriasis indication?) I’m just glad I saw no mention of HAHA in the results.
But don't you think the shorts looking to position themselves ahead of the melanoma data were planning to short into this event too?
Remember, every drug that tried to win approval to treat melanoma in the last 30 years has failed. (Recent failures include Nexavar and Genasense). For most of the long/short hedgies, shorting MEDX - perhaps with a hedge of long calls (open interest in the calls is now about 90 million shares, more than 2 times the outstanding short position) - is a no-brainer.
My personal best guess is that the data will frustrate the maximum number of people by coming in with a response rate of around 8%. For a few hours, maybe a few days or weeks, the shorts might be able to argue that an ODAC panel will vote against approval and keep the stock from jumping to new highs. (Antibody therapies fall under the purview of ODAC).
But even is the reported response rate is closer to 6%, I'm confident of approval. BMY/MEDX will be required to provide 3 month follow-up data, and not even the staunchest bear can deny that it will look stronger as SD trickles into PR.
What will carry the day will be arguments that CTLA-4 blockers are a key component of cancer immunotherapy. BMY/MEDX will ensure that the panel members are fully aware of the clear signals of efficacy of CTLA-4 blockers when combined with vaccines. Hell, that’s 5 year old news.
A close listening to the DNDN panel meeting shows that they understand that immunotherapy as a modality of treatment is valid.
Combination therapy is the way of the future. You can't get there without approving the individual components.
I have reviewed the ASCO posters closely, trying to ascertain how many of the 209 monotherapy patients (19 responses) received multiple doses of therapeutic levels of antibody comparable to the 4 doses at 10 mg/kg that the patients in the pivotal studies got. The vast majority of the ASCO-reported patients got less than optimal dosing, and the dose-response relationship of this antibody is now pretty well established.
As for when the responses came, the most negative reading of the posters would be that 60% of the responses came after week 12. But 80% or more came by week 24, the relevant endpoint.
So I handicap it this way:
15% chance of a response rate of 7% or less. I still think that MEDX/BMY would file with that data, and that the 3 month update and the observed SD and survival would carry the day at the panel vote, but perhaps the stock could trade in the 12 area for a while, but no lower. Remember, today’s CNTO news validated the platform and pipeline, and there will be more CNTO news coming in first week of November, perhaps within days of the top line melanoma data. And even most shorts think that the DTIC/Ipi trial will yield data strong enough for approval by 2009. Their time horizon is just very short. (I’ve been following CTLA-4 since at least ’98)
50% chance of something between 7.5% and 9% ORR. I’d expect the stock to be flat to slightly higher, and trend higher as shorts wise up before any ODAC panel vote.
35% chance of an ORR that is within a rounding error of 10% or higher. I’d expect $20 quickly. 11% would be a clear home run with first trade easily well over $20.
In the long run, which is pretty much all I care about, I firmly believe that most of the 2011 value of this company will be derived from PD-1, IP-10, 1401, Genmab, the c.diff antibodies, the platform and the royalties it throws off, etc., not Ipilimumab. At least not Ipilimumab solely in the melanoma indication. If/when GVAX-anything or Provenge/Nuevenge whateverPhage becomes available,that's all upside.
If we can remain independent, this company can create real wealth.
However the story unfolds, from here it gets a lot more volatile and exciting.
Fasten your seat belts.
Für alle Unformierten, diese Übersicht inklusive Wirkungsweise MDX-010, kann man gar nicht oft genug posten, dieses ASCO Poster spricht mehr als 1000 Worte:
http://themelanomablog.com/storage/ASCO_2007_Ipilimumab_Kine…
Ein paar Ausschnitte hieraus als Appetizer (Einzelfälle):
SD prior to PR:

Apparent PD prior to a durable CR:

SD ist definiert als Tumorrückgang bis auf 51%. Fast 40% hatten in einer Phase II Studie Complete Response (CR), Partial Response (PR) oder Stable Disease. Knapp 9% hatten CR und OR (= Overall Response Rate/ORR). Die FDA wird nicht herumkommen die Totalität der Daten zu berücksichtigen. Eine 10% Hürde für ORR auszugeben und darauf zu bestehen, wenn der Benefit in fast 40% der Patienten ersichtlich ist ist für mich nicht verständlich.
-------------------------------------------
Recht stark meiner Ansicht, dass die FDA um Ipilimumab (MDX-010) längerfristig nicht herumkommt, ist dieser Poster hier. Ich stelle sein Posting aus Yahoo einfach mal hier rein.
-----------------------------
FWIW
I can't imagine that there's any serious long that wasn't looking forward to today's data - there weren't very many meaningful large investors on the margin that missed or didn’t anticipate the story. 110% of the float is in the hands of institutions and most of them do their due diligence. I don’t think a MEDX press release would have made a difference after a few hours.
In a few weeks when the CNTO 1275 BLA is filed MEDX will receive a milestone payment. That will be on the news ticker.
Today we got exactly what the longs were expecting, in fact more than I had hoped for. The response rates were a few percent better than I would have assumed, and the unequivocal statements on the safety of 1275 (clear superiority over TNF-alpha blockers) exceeded what I would have been willing to assume coming into this year. (Maybe the shorts can spin that as a negative - will 1275 slow the expansion of the Remicade/Cnto 148 franchise by slowing the uptake on TNF-alpha blockers in the psoriasis indication?) I’m just glad I saw no mention of HAHA in the results.
But don't you think the shorts looking to position themselves ahead of the melanoma data were planning to short into this event too?
Remember, every drug that tried to win approval to treat melanoma in the last 30 years has failed. (Recent failures include Nexavar and Genasense). For most of the long/short hedgies, shorting MEDX - perhaps with a hedge of long calls (open interest in the calls is now about 90 million shares, more than 2 times the outstanding short position) - is a no-brainer.
My personal best guess is that the data will frustrate the maximum number of people by coming in with a response rate of around 8%. For a few hours, maybe a few days or weeks, the shorts might be able to argue that an ODAC panel will vote against approval and keep the stock from jumping to new highs. (Antibody therapies fall under the purview of ODAC).
But even is the reported response rate is closer to 6%, I'm confident of approval. BMY/MEDX will be required to provide 3 month follow-up data, and not even the staunchest bear can deny that it will look stronger as SD trickles into PR.
What will carry the day will be arguments that CTLA-4 blockers are a key component of cancer immunotherapy. BMY/MEDX will ensure that the panel members are fully aware of the clear signals of efficacy of CTLA-4 blockers when combined with vaccines. Hell, that’s 5 year old news.
A close listening to the DNDN panel meeting shows that they understand that immunotherapy as a modality of treatment is valid.
Combination therapy is the way of the future. You can't get there without approving the individual components.
I have reviewed the ASCO posters closely, trying to ascertain how many of the 209 monotherapy patients (19 responses) received multiple doses of therapeutic levels of antibody comparable to the 4 doses at 10 mg/kg that the patients in the pivotal studies got. The vast majority of the ASCO-reported patients got less than optimal dosing, and the dose-response relationship of this antibody is now pretty well established.
As for when the responses came, the most negative reading of the posters would be that 60% of the responses came after week 12. But 80% or more came by week 24, the relevant endpoint.
So I handicap it this way:
15% chance of a response rate of 7% or less. I still think that MEDX/BMY would file with that data, and that the 3 month update and the observed SD and survival would carry the day at the panel vote, but perhaps the stock could trade in the 12 area for a while, but no lower. Remember, today’s CNTO news validated the platform and pipeline, and there will be more CNTO news coming in first week of November, perhaps within days of the top line melanoma data. And even most shorts think that the DTIC/Ipi trial will yield data strong enough for approval by 2009. Their time horizon is just very short. (I’ve been following CTLA-4 since at least ’98)
50% chance of something between 7.5% and 9% ORR. I’d expect the stock to be flat to slightly higher, and trend higher as shorts wise up before any ODAC panel vote.
35% chance of an ORR that is within a rounding error of 10% or higher. I’d expect $20 quickly. 11% would be a clear home run with first trade easily well over $20.
In the long run, which is pretty much all I care about, I firmly believe that most of the 2011 value of this company will be derived from PD-1, IP-10, 1401, Genmab, the c.diff antibodies, the platform and the royalties it throws off, etc., not Ipilimumab. At least not Ipilimumab solely in the melanoma indication. If/when GVAX-anything or Provenge/Nuevenge whateverPhage becomes available,that's all upside.
If we can remain independent, this company can create real wealth.
However the story unfolds, from here it gets a lot more volatile and exciting.
Fasten your seat belts.
Antwort auf Beitrag Nr.: 31.837.129 von Ville7 am 04.10.07 07:46:37wenn ich richtig orientiert bin, wird Remicade hauptsächlich zur Behandlung der Psoriatischen Arthritis verwendet... --> Remicade ist indiziert zur Reduktion der Anzeichen und Symptome der Arthritis bei Patienten mit aktiver psoriatischer Arthritis, deren Ansprechen auf andere krankheitsmodifizierende Arzneimittel unzureichend war
...und kann somit mit CNTO-1275 nur bedingt verglichen werden, zumal die möglichen Nebenwirkungen von Remicade fatal sein können:
Infektionen, Infliximab und andere Wirkstoffe, die TNFα hemmen, können selten Autoimmun-Erkrankungen (u.a. Lupus-ähnliche Syndrome) auslösen, Neurologische Störungen, Störungen der Leber und der Gallengänge, in den kontrollierten klinischen Studien zu allen TNF-Blockern wurden bei Patienten, die einen TNF-Blocker erhielten, mehr Lymphom-Fälle beobachtet, als bei Patienten, die die Kontrollsubstanzen erhielten, Herzinsuffizienz etc. und zwar in einer Häufigkeit weit über Plazebo - im Gegensatz zu CNTO-1275!
Beim Vergleich hingegen mit Enbrel (Quartalsumsatz > 500 Mio USD) schneidet CNTO-1275 sehr gut ab:
Leonardi said CNTO 1275 would be far more convenient for patients than Enbrel, the most widely used current treatment for psoriasis, which is given by injection once or twice a week.
Moreover, he said Enbrel's typical effectiveness at once-weekly dosing is far less impressive than that seen with CNTO 1275 in its separate trial. "There's a compelling difference" in favor of CNTO 1275, he said.
Dennoch hätte ich für meine Optionen einen anderen Einfluss auf den MEDX-Kurs gewünscht. Hab sie deswegen Heute gegen PDLI-Optionen eingetauscht. Der Ausgang der 1. MDX-010-Ph3-Studie ist mir nun doch zu offen!
...und kann somit mit CNTO-1275 nur bedingt verglichen werden, zumal die möglichen Nebenwirkungen von Remicade fatal sein können:
Infektionen, Infliximab und andere Wirkstoffe, die TNFα hemmen, können selten Autoimmun-Erkrankungen (u.a. Lupus-ähnliche Syndrome) auslösen, Neurologische Störungen, Störungen der Leber und der Gallengänge, in den kontrollierten klinischen Studien zu allen TNF-Blockern wurden bei Patienten, die einen TNF-Blocker erhielten, mehr Lymphom-Fälle beobachtet, als bei Patienten, die die Kontrollsubstanzen erhielten, Herzinsuffizienz etc. und zwar in einer Häufigkeit weit über Plazebo - im Gegensatz zu CNTO-1275!
Beim Vergleich hingegen mit Enbrel (Quartalsumsatz > 500 Mio USD) schneidet CNTO-1275 sehr gut ab:
Leonardi said CNTO 1275 would be far more convenient for patients than Enbrel, the most widely used current treatment for psoriasis, which is given by injection once or twice a week.
Moreover, he said Enbrel's typical effectiveness at once-weekly dosing is far less impressive than that seen with CNTO 1275 in its separate trial. "There's a compelling difference" in favor of CNTO 1275, he said.
Dennoch hätte ich für meine Optionen einen anderen Einfluss auf den MEDX-Kurs gewünscht. Hab sie deswegen Heute gegen PDLI-Optionen eingetauscht. Der Ausgang der 1. MDX-010-Ph3-Studie ist mir nun doch zu offen!
Antwort auf Beitrag Nr.: 31.846.984 von Cyberhexe am 04.10.07 20:02:0875% meiner Optionsscheine sind auch ausgestoppt worden. Den Einsatz in die OS habe ich somit rausgenommen, die restlichen 25% sind for free und die halte ich weiter-komme was wolle. Die Aktien halte ich auch weiter, langfristig kann mit den beiden CNTO-Produkten nichts schief gehen.
Der Kursverkauf ist sehr sehr seltsam. Entweder gibt es ein Leak und die MDX-010 Ergebnisse sind schlecht oder unsere Hedgefunds-Freunde spielen mal wieder ein bitterböses Spiel und versuchen vor einem Lift-Off der Aktie noch den letzten Long rauszupressen. Vielleicht gibts ja auch plötzlich ein Bid, das könnte die Kursdrückerei auch erklären.
Wir werden sehen. Scheinbar sollen die MDX-010 Ergebnisse erst zu Jahresende/Jahresanfang veröffentlicht werden. Die CNTO-148 Ergebnisse kommen als wohl noch zuvor (Anfang November). Gute Nerven wünsche ich allen Longs.
Der Kursverkauf ist sehr sehr seltsam. Entweder gibt es ein Leak und die MDX-010 Ergebnisse sind schlecht oder unsere Hedgefunds-Freunde spielen mal wieder ein bitterböses Spiel und versuchen vor einem Lift-Off der Aktie noch den letzten Long rauszupressen. Vielleicht gibts ja auch plötzlich ein Bid, das könnte die Kursdrückerei auch erklären.
Wir werden sehen. Scheinbar sollen die MDX-010 Ergebnisse erst zu Jahresende/Jahresanfang veröffentlicht werden. Die CNTO-148 Ergebnisse kommen als wohl noch zuvor (Anfang November). Gute Nerven wünsche ich allen Longs.
Antwort auf Beitrag Nr.: 31.851.053 von Ville7 am 05.10.07 09:32:15Wenn die 14 USD nicht halten drohen deftige Abgaben.
Rein nach (veröffentlichter!) Faktenlage muss man sich wirklich sehr wundern, was da so im Kurs passiert.
Das normale bei der Börse eben: Entweder da wussten doch wieder einige mehr, oder vor lauter kollektivem in die Hose machen baut sich ein sehr gutes Chance-Risiko-Verhältnis auf.
Eine Erklärung habe ich noch: Die fda hat in letzter Zeit einige seltsame Zu- und Nichtzulassungen beschlossen, die so vom Markt nicht erwartet worden waren. Vielleicht werden aktuell auch fortgeschrittene P3en kaum mehr eingepreist, solange das "go to market" der fda nicht schriftlich vorliegt?
Rein nach (veröffentlichter!) Faktenlage muss man sich wirklich sehr wundern, was da so im Kurs passiert.
Das normale bei der Börse eben: Entweder da wussten doch wieder einige mehr, oder vor lauter kollektivem in die Hose machen baut sich ein sehr gutes Chance-Risiko-Verhältnis auf.
Eine Erklärung habe ich noch: Die fda hat in letzter Zeit einige seltsame Zu- und Nichtzulassungen beschlossen, die so vom Markt nicht erwartet worden waren. Vielleicht werden aktuell auch fortgeschrittene P3en kaum mehr eingepreist, solange das "go to market" der fda nicht schriftlich vorliegt?
Antwort auf Beitrag Nr.: 31.851.314 von eck64 am 05.10.07 09:53:57Sollte es so kommen drohen erst mal Abgaben bis in den Bereich von 12,50/13, bei dem die alte Kanalbgerenzung liegt. Dann haben wir das Gap bei 11,71 bis 12,26. Und das untere Ende des langjährigen Aufwärtskanals liegt bei 11 bis 11,50.
[URL ]http://www.tradesignalonline.com/content.asp?p=wpa/tsb/default.asp&fcid=2360813[/URL]
]http://www.tradesignalonline.com/content.asp?p=wpa/tsb/default.asp&fcid=2360813[/URL]
[URLChart öffnen]http://www.tradesignalonline.com/content.asp?p=wpa/tsb/default.asp&fcid=2360813[/URL]
Sollte MDX-010 (sehr) schlechte Daten produzieren gibt es m.E. sogar einen Schub unter die 10 Dollar. Das wäre die Zone in der ich definitiv nachfassen würde - MEDX lebt auch ohne Ipilimumab. Allein die CNTO Antikörper werden die sehr aussichtsreiche Pipeline in den nächsten Jahren finanzieren.
[URL
[URLChart öffnen]http://www.tradesignalonline.com/content.asp?p=wpa/tsb/default.asp&fcid=2360813[/URL]
Sollte MDX-010 (sehr) schlechte Daten produzieren gibt es m.E. sogar einen Schub unter die 10 Dollar. Das wäre die Zone in der ich definitiv nachfassen würde - MEDX lebt auch ohne Ipilimumab. Allein die CNTO Antikörper werden die sehr aussichtsreiche Pipeline in den nächsten Jahren finanzieren.
http://messages.finance.yahoo.com/Stocks_%28A_to_Z%29/Stocks…
MORGAN STANLEY RESEARCH
"Quick Comment : Melanoma conference Supports Anti-Ctla-4 Potential Conclusion: our positive thesis on the potential of ipilimumab is reinforced after attending the Perspective in Melanoma conference , where we had the chance to discuss the drugs with several thought leaders(key takeaways summarized below). We remain Overweight-v. Low responce rates (PR) are approvable . There was near consensus that 8% to 10% responce rate should be adequate for the drugs approval. if the durability of responces and manageable toxcity is upheld. in the registrational trials. Most physicians believe that the RR in the pivotal trails would mirror the earlier Phase I/II trials. Some believed that the responce rate could be better in the ongoing trials, as the toxcities are more manageable now and the dose can be pushed higher. Interestingly, several physicians placed the bar for the lower limit of the responce rate around 5% (but they would need to see durability for two years). Additionally , most physicians agreed that the stable disease will likely matter as patients transition to being responders, even after 6+ months. This increases are confidence in both the outcome of the trial and the approvability of the data. BMY/MEDX likely has a stronger application than PFE as it supported by a larger data set, which extends 5+ years. This could be instrumental in gaining approval as it provides a more compelling data set on durability of responces (MEDX has 25 patients whose responces have extended 5+ years.)
MORGAN STANLEY RESEARCH
"Quick Comment : Melanoma conference Supports Anti-Ctla-4 Potential Conclusion: our positive thesis on the potential of ipilimumab is reinforced after attending the Perspective in Melanoma conference , where we had the chance to discuss the drugs with several thought leaders(key takeaways summarized below). We remain Overweight-v. Low responce rates (PR) are approvable . There was near consensus that 8% to 10% responce rate should be adequate for the drugs approval. if the durability of responces and manageable toxcity is upheld. in the registrational trials. Most physicians believe that the RR in the pivotal trails would mirror the earlier Phase I/II trials. Some believed that the responce rate could be better in the ongoing trials, as the toxcities are more manageable now and the dose can be pushed higher. Interestingly, several physicians placed the bar for the lower limit of the responce rate around 5% (but they would need to see durability for two years). Additionally , most physicians agreed that the stable disease will likely matter as patients transition to being responders, even after 6+ months. This increases are confidence in both the outcome of the trial and the approvability of the data. BMY/MEDX likely has a stronger application than PFE as it supported by a larger data set, which extends 5+ years. This could be instrumental in gaining approval as it provides a more compelling data set on durability of responces (MEDX has 25 patients whose responces have extended 5+ years.)
09:42 MEDX Medarex trading up 3.5% this morning, strength attributed to AMGN-for-MEDX rumor (14.56 +0.49) -Update-
Source: Briefing.com
Source: Briefing.com
Antwort auf Beitrag Nr.: 31.858.770 von Ville7 am 05.10.07 17:32:53Gerüchte um ein mögliches Takeover durch Amgen machen der Aktie ziemlich Beine!

MEDX ist Top 4 geshorteter Biotech-Stock im NBI (hinter DNDN, Salix und CV Therapeutics mit 26,43% des Floats Short):
http://www.minyanville.com/articles/Fed-FOMC-Genentech-Dendr…
http://www.minyanville.com/articles/Fed-FOMC-Genentech-Dendr…
Einmal ein richtiger Short Squezze, da steht dann MEDX in den 20ern. 

wann kommen den jetzt eigentlich wieder einmal kursbewegende news???

Antwort auf Beitrag Nr.: 31.859.772 von Ville7 am 05.10.07 18:39:31Mannomann, die tut sich aber auch schwer.
Einpreisung erst mit der ersten Zulassung? Oder erst nach Gewinnquartal(en)?
Die Fantasie wird immer weiter ausgegrenzt bei den Bios.
Einpreisung erst mit der ersten Zulassung? Oder erst nach Gewinnquartal(en)?
Die Fantasie wird immer weiter ausgegrenzt bei den Bios.
Die Fantasie wird immer weiter ausgegrenzt bei den Bios
das ist die ganze problematik im biotechsektor,das vertrauen der anleger ist weg.aber auch etwas zurecht,denn es haben viele firmen gefloppt und die anleger eine menge geld verloren.(ich inclusive)
asics
das ist die ganze problematik im biotechsektor,das vertrauen der anleger ist weg.aber auch etwas zurecht,denn es haben viele firmen gefloppt und die anleger eine menge geld verloren.(ich inclusive)
asics
Antwort auf Beitrag Nr.: 31.917.240 von asics01 am 09.10.07 20:46:22Wär ich mal bloß bei den Solars geblieben...

Antwort auf Beitrag Nr.: 31.914.149 von eck64 am 09.10.07 17:43:19
Short interest bei MEDX erneut gestiegen. Sollte MDX-010 doch auf Anhieb gute Ergebnisse liefern (viele erwarten schlechte Daten) könnten wir einen DNDN ähnlichen Move erleben.
Short interest bei MEDX erneut gestiegen. Sollte MDX-010 doch auf Anhieb gute Ergebnisse liefern (viele erwarten schlechte Daten) könnten wir einen DNDN ähnlichen Move erleben.
Antwort auf Beitrag Nr.: 31.918.971 von Ville7 am 09.10.07 22:37:14Sanofi-Aventis will stark in Krebsantikörper einsteigen und ein kompetentes Unternehmen kaufen.
Medarex könnte zum Kreis der Kandidaten gehören.
"Monoklonale Antikörper sind ein Schwachpunkt, da sind wir spät dran", sagte Spek. Er hoffe, dass Sanofi-Aventis es nicht endgültig verpasst habe. Ein Zukauf könne hier Abhilfe schaffen.
Zudem liebäugele Spek mit einem zweiten Aktienrückkaufprogramm, berichtet die "FTD". Das aktuelle 3-Mrd-EUR-Programm ende im Mai 2008. "Eine Verlängerung oder Erweiterung des Programms müsste dem Aufsichtsrat vor Mai 2008 vorgeschlagen werden", sagte Spek.
Medarex könnte zum Kreis der Kandidaten gehören.
"Monoklonale Antikörper sind ein Schwachpunkt, da sind wir spät dran", sagte Spek. Er hoffe, dass Sanofi-Aventis es nicht endgültig verpasst habe. Ein Zukauf könne hier Abhilfe schaffen.
Zudem liebäugele Spek mit einem zweiten Aktienrückkaufprogramm, berichtet die "FTD". Das aktuelle 3-Mrd-EUR-Programm ende im Mai 2008. "Eine Verlängerung oder Erweiterung des Programms müsste dem Aufsichtsrat vor Mai 2008 vorgeschlagen werden", sagte Spek.
Antwort auf Beitrag Nr.: 31.920.307 von Cashverbrenner am 10.10.07 08:49:46Nun da möchte zumindest ein Journalist die Brücke zu Medarex schlagen indem er indirekt auf einen interessanten Ansatz anspricht (siehe unten fett markiert), den MEDX mit MDX-010 fährt. Gut möglich, dass sie ein Auge auf Medarex werfen. Für einen Pharma, der bisher noch nicht gut in Antikörpern aufgestellt ist wäre Medarex die Topadresse um mit einem Schlag alle Defizite wegzubügeln. Medarex hat eine Vielzahl von fortgeschrittenen Partnerprogrammen, aber - und das ist für einen Big Pharma umso wichtiger auch eine Vielzahl von eigenen und semi-eigenen Programmen, d.h. es verbleibt viel Umsatzpotential im eigenen Hause. Sanofi wäre auf einen Schlag top aufgestellt.
--------------------------------
AFX News Limited
Sanofi Aventis considers acquisitions to catch up in monoclonal antibodies
10.10.07, 3:46 AM ET
FRANKFURT (Thomson Financial) - Sanofi-Aventis is considering making acquisitions in order to catch up in the field of monoclonal antibodies, pharmaceutical head Hanspeter Spek told Financial Times Deutschland.
'Monoclonal antibodies are our weak point, we are running very late there,' Spek said.
He added that he hopes it is not too late to catch up and that an acquisition could put things right.
Monoclonal antibodies identical antibodies produced by one type of immune cell and are all clones of a single parent cell. They can then serve to detect or purify one specific substance, which has become an important tool in biochemistry, molecular biology and medicine.
One possible treatment for cancer involves monoclonal antibodies that bind only to cancer cell-specific antigens and induce an immunological response against the target cancer cell.
judith.csaba@thomson.com
jcs/jrr
COPYRIGHT
Copyright Thomson Financial News Limited 2007. All rights reserved.
The copying, republication or redistribution
--------------------------------
AFX News Limited
Sanofi Aventis considers acquisitions to catch up in monoclonal antibodies
10.10.07, 3:46 AM ET
FRANKFURT (Thomson Financial) - Sanofi-Aventis is considering making acquisitions in order to catch up in the field of monoclonal antibodies, pharmaceutical head Hanspeter Spek told Financial Times Deutschland.
'Monoclonal antibodies are our weak point, we are running very late there,' Spek said.
He added that he hopes it is not too late to catch up and that an acquisition could put things right.
Monoclonal antibodies identical antibodies produced by one type of immune cell and are all clones of a single parent cell. They can then serve to detect or purify one specific substance, which has become an important tool in biochemistry, molecular biology and medicine.
One possible treatment for cancer involves monoclonal antibodies that bind only to cancer cell-specific antigens and induce an immunological response against the target cancer cell.
judith.csaba@thomson.com
jcs/jrr
COPYRIGHT
Copyright Thomson Financial News Limited 2007. All rights reserved.
The copying, republication or redistribution
Antwort auf Beitrag Nr.: 31.925.162 von Ville7 am 10.10.07 14:41:26für einen Big Pharma umso wichtiger auch eine Vielzahl von eigenen und semi-eigenen Programmen, d.h. es verbleibt viel Umsatzpotential im eigenen Hause.
Genau hier sehe ich auch eine viel größere Übernahmewahrscheinlichkeit als z.B. dass sich Sanofi-Aventis Morphosys krallt.
Medarex hat nicht nur Technik für kündtige Produkte, sondern eben auch eigenvermarktbare marktnahme Produkte, die sofort das Loch in der Pipeline stopfen würden.
Allerdings müsste man deutlich jenseits 3 mrd USD auf den Tisch legen.....
Genau hier sehe ich auch eine viel größere Übernahmewahrscheinlichkeit als z.B. dass sich Sanofi-Aventis Morphosys krallt.
Medarex hat nicht nur Technik für kündtige Produkte, sondern eben auch eigenvermarktbare marktnahme Produkte, die sofort das Loch in der Pipeline stopfen würden.
Allerdings müsste man deutlich jenseits 3 mrd USD auf den Tisch legen.....
Antwort auf Beitrag Nr.: 31.925.391 von eck64 am 10.10.07 14:59:22Allerdings müsste man deutlich jenseits 3 mrd USD auf den Tisch legen
Das wäre kein Problem für SA. Es gibt noch andere Hinweise daß da was laufen könnte. Ich werde bei Kursen um 10€ jetzt sehr kräftig aufstocken.
Das wäre kein Problem für SA. Es gibt noch andere Hinweise daß da was laufen könnte. Ich werde bei Kursen um 10€ jetzt sehr kräftig aufstocken.

Das wäre kein Problem für SA. Es gibt noch andere Hinweise daß da was laufen könnte. Ich werde bei Kursen um 10€ jetzt sehr kräftig aufstocken. Zwinkern
Stimmt, wär\' doch die ideale Lösung für Sanofi. Aber, wenn MEDX-010 im ersten Moment nicht die gewünschten Daten liefert, hat Sanofi wohl Gelegenheit viel billiger zu kaufen. Und da würd ich auch nochmal zuschlagen. Ich werde vorerst abwarten....
lg - Lycos
Stimmt, wär\' doch die ideale Lösung für Sanofi. Aber, wenn MEDX-010 im ersten Moment nicht die gewünschten Daten liefert, hat Sanofi wohl Gelegenheit viel billiger zu kaufen. Und da würd ich auch nochmal zuschlagen. Ich werde vorerst abwarten....

lg - Lycos
Reuters
Antibodies forecast to stay fastest-growing drugs
Thursday October 11, 7:08 pm ET
LONDON (Reuters) - Monoclonal antibodies -- injectable medicines that mimic the body's own immune system -- will remain the fast-growing segment of the pharmaceuticals market in the next five years, according to a report on Friday.
ADVERTISEMENT
Independent market analyst Datamonitor said antibody-based treatments, which currently generate global revenues of around $20 billion, would see sales grow 14 percent a year between 2006 and 2012.
That compares with expected annual growth of just 0.6 percent for traditional small molecule drugs, where a raft of blockbuster products face generic competition between 2010 and 2012.
Monoclonal antibodies are already big sellers for the treatment of cancer and rheumatoid arthritis.
The market is dominated by a handful of success stories with Roche (VTX:ROG.VX - News) and Genentech's (NYSE: DNA - News) Avastin, Herceptin and Rituxan, Abbott's (NYSE:ABT - News) Humira and Johnson & Johnson's (NYSE:JNJ - News) Remicade accounting for 80 percent of sales in 2006.
The commercial dominance of these products is expected to continue, with the same five drugs forecast to account for 70 percent of 2012 antibody revenues.
But a second tier of newer antibody players is also emerging. Datamonitor expects Biogen IDEC (NasdaqGS:BIIB - News), Amgen (NasdaqGS:AMGN - News), Novartis (VTX:NOVN.VX - News) and UCB (Brussels:UCB.BR - News) to all expand their market presence by 2012.
Antibodies forecast to stay fastest-growing drugs
Thursday October 11, 7:08 pm ET
LONDON (Reuters) - Monoclonal antibodies -- injectable medicines that mimic the body's own immune system -- will remain the fast-growing segment of the pharmaceuticals market in the next five years, according to a report on Friday.
ADVERTISEMENT
Independent market analyst Datamonitor said antibody-based treatments, which currently generate global revenues of around $20 billion, would see sales grow 14 percent a year between 2006 and 2012.
That compares with expected annual growth of just 0.6 percent for traditional small molecule drugs, where a raft of blockbuster products face generic competition between 2010 and 2012.
Monoclonal antibodies are already big sellers for the treatment of cancer and rheumatoid arthritis.
The market is dominated by a handful of success stories with Roche (VTX:ROG.VX - News) and Genentech's (NYSE: DNA - News) Avastin, Herceptin and Rituxan, Abbott's (NYSE:ABT - News) Humira and Johnson & Johnson's (NYSE:JNJ - News) Remicade accounting for 80 percent of sales in 2006.
The commercial dominance of these products is expected to continue, with the same five drugs forecast to account for 70 percent of 2012 antibody revenues.
But a second tier of newer antibody players is also emerging. Datamonitor expects Biogen IDEC (NasdaqGS:BIIB - News), Amgen (NasdaqGS:AMGN - News), Novartis (VTX:NOVN.VX - News) and UCB (Brussels:UCB.BR - News) to all expand their market presence by 2012.
Antwort auf Beitrag Nr.: 31.956.446 von Ville7 am 12.10.07 15:15:39and UCB (Brussels:UCB.BR - News) ....
Ist dir UCB schon mal als kommender mAB-Highflyer untergekommen? Was haben die denn, oder was gehört denen?
Ist dir UCB schon mal als kommender mAB-Highflyer untergekommen? Was haben die denn, oder was gehört denen?
lt. godmode kam es am 10.10.07- 21:06 (kurs 14,42 $) zu einem blocktrade in höhe vom 3 mill. aktien
??????
??????
Antwort auf Beitrag Nr.: 31.962.495 von d2402 am 12.10.07 21:00:28

Antwort auf Beitrag Nr.: 31.958.065 von eck64 am 12.10.07 16:29:10Ist dir UCB schon mal als kommender mAB-Highflyer untergekommen? Was haben die denn, oder was gehört denen?
UCB entwickelt den MAB Certolizumab (Cimzia) zur Behandlung der Darmerkrankung Morbus Crohn oder rheumatoider Arthritis.
UCB entwickelt den MAB Certolizumab (Cimzia) zur Behandlung der Darmerkrankung Morbus Crohn oder rheumatoider Arthritis.
Antwort auf Beitrag Nr.: 31.958.065 von eck64 am 12.10.07 16:29:10Wie schon im MOR thread ausgeführt ist der Report voll banane und ohne prognostische Fähigkeiten. MEDX nicht zu erwähnen bei der Pipe ist anfängerhaft.
UCB ist wohl ein Unternehmen, das Humanisierungstechnologien anbietet und auch die Herstellung von mabs.
Pipeline:
http://www.ucb-group.com/investor_relations/ucb_in_brief/243…
Haut mich jetzt nicht vom Hocker. Alte Technologie und zudem eine Pipeline mit nur 1/4 des Potentials von MEDX.
Aktienkurs entwickelt sich dieses Jahr erstaunlich konform zu dem von Morphosys.
Soviel meine 10min Analyse von UCB.
UCB ist wohl ein Unternehmen, das Humanisierungstechnologien anbietet und auch die Herstellung von mabs.
Pipeline:
http://www.ucb-group.com/investor_relations/ucb_in_brief/243…
Haut mich jetzt nicht vom Hocker. Alte Technologie und zudem eine Pipeline mit nur 1/4 des Potentials von MEDX.
Aktienkurs entwickelt sich dieses Jahr erstaunlich konform zu dem von Morphosys.
Soviel meine 10min Analyse von UCB.
Antwort auf Beitrag Nr.: 31.962.917 von Cashverbrenner am 12.10.07 21:42:02Cimzia ist ein humanisiertes FAB Fragment. Kurzes Rumgoogeln hat gezeigt, dass sie ein bisschen Probleme mit den Zulassungsbehörden haben die Zulassung zu bekommen. Also mich haut UCB wahrlich nicht vom Hocker. Das wirft ein sehr schwaches Bild auf Datamonitor, wollen die doch fast 8000 Euro für ihren Mab Report.
Hier die Wirksamkeitsdaten einer Phase III Studie bei Morbus Crohn. Jetzt müsste man nur noch mit anderen bereits vermarkteten anti-TNF-alpha's vergleichen (Sicherheit und Wirksamkeit):
http://www.presseportal.de/print.htx?nr=1021985
http://www.presseportal.de/print.htx?nr=1021985
Antwort auf Beitrag Nr.: 31.965.462 von Ville7 am 13.10.07 08:07:13Danke.
Nur sollte das doch keinesfalls reichen um die auf ein Niveau mit Amgen, Biogen und Novartis zu heben?
Und Medarex nicht zu erwähnen ist wirklich sträflich. Da ist soviel in der Röhre, das kann ja nicht mehr alles nichts werden....
Nur sollte das doch keinesfalls reichen um die auf ein Niveau mit Amgen, Biogen und Novartis zu heben?

Und Medarex nicht zu erwähnen ist wirklich sträflich. Da ist soviel in der Röhre, das kann ja nicht mehr alles nichts werden....

Antwort auf Beitrag Nr.: 31.971.179 von eck64 am 13.10.07 18:34:03Das ist doch alles nur noch zum Heulen

Antwort auf Beitrag Nr.: 32.010.637 von mountainbiker am 15.10.07 21:54:12Kauf doch Elan!
Antwort auf Beitrag Nr.: 32.023.234 von werner_w. am 16.10.07 14:02:39

Antwort auf Beitrag Nr.: 32.023.234 von werner_w. am 16.10.07 14:02:39

Antwort auf Beitrag Nr.: 32.036.369 von Poppholz am 16.10.07 22:52:52Und wieder ein schöner Tag...

ville,
kannst du mir sagen, warum zur Zeit alle so über MEDX herziehen?
Finanzen.net
Medarex Ersteinschätzung
Mittwoch 17. Oktober 2007, 17:23 Uhr
Rating-Update:
New York (aktiencheck.de AG) - Die Analysten der Banc of America stufen die Aktie von Medarex (ISIN US5839161016/ WKN 883040) in einer Ersteinschätzung mit "sell" ein. Das Kursziel werde bei 10 USD gesehen. (17.10.2007/ac/a/u)
Analyse-Datum: 17.10.2007
http://de.biz.yahoo.com/17102007/338/medarex-ersteinschaetzu…
kannst du mir sagen, warum zur Zeit alle so über MEDX herziehen?

Finanzen.net
Medarex Ersteinschätzung
Mittwoch 17. Oktober 2007, 17:23 Uhr
Rating-Update:
New York (aktiencheck.de AG) - Die Analysten der Banc of America stufen die Aktie von Medarex (ISIN US5839161016/ WKN 883040) in einer Ersteinschätzung mit "sell" ein. Das Kursziel werde bei 10 USD gesehen. (17.10.2007/ac/a/u)
Analyse-Datum: 17.10.2007
http://de.biz.yahoo.com/17102007/338/medarex-ersteinschaetzu…
Antwort auf Beitrag Nr.: 32.053.314 von eck64 am 17.10.07 18:55:13Diese blöden Biotech Aktien , überall kann man reich werden, nur hier nicht... außer man ist short...
, überall kann man reich werden, nur hier nicht... außer man ist short...
 , überall kann man reich werden, nur hier nicht... außer man ist short...
, überall kann man reich werden, nur hier nicht... außer man ist short...  das würde mich auch interessieren. Besitze MEDX mittlerweile 3 oder 4 Jahre, aber im Moment spiele ich mit den Gedanken zu verkaufen. Positive Daten, aber down, ich möchte nicht wissen, wenn die Daten von MDX 010 rauskommen un die diesmal nicht positiv sind, wie schon von allen vermutet. Bei der market cap ist ziemlich viel Platz nach unten, dann kann man, wenn einer eine Übernahme planen sollte, bedeutent günstiger an die Aktien kommen.
das würde mich auch interessieren. Besitze MEDX mittlerweile 3 oder 4 Jahre, aber im Moment spiele ich mit den Gedanken zu verkaufen. Positive Daten, aber down, ich möchte nicht wissen, wenn die Daten von MDX 010 rauskommen un die diesmal nicht positiv sind, wie schon von allen vermutet. Bei der market cap ist ziemlich viel Platz nach unten, dann kann man, wenn einer eine Übernahme planen sollte, bedeutent günstiger an die Aktien kommen.Verstehe einer diese Aktie........aber vielleicht kann mir dieses einer erklären
Antwort auf Beitrag Nr.: 32.053.314 von eck64 am 17.10.07 18:55:13Hab ich die Analyse verfasst oder wieso sollte ich sie kommentieren?
ehrlich gesagt hätte ich diese Kursschwäche nicht erwartet. Erst Outperformer mit Mehrjahreshoch und dann das. Da wartet man wohl besser die Ergebnisse ab.
Antwort auf Beitrag Nr.: 32.063.047 von Ville7 am 18.10.07 12:05:49Ich habe gefragt, ob du was weißt? Immerhin stöberst du in Amis-Boards usw.
Wenn du dich selbst nur wunderst, warum die alle trotz der ganzen P3-Kandidaten auf Medx einhacken und sie runterschreiben und runtershorten, dann brauchst du auch nix kommentieren.

Naja, unter der 200er kaufen hat sich mittelfristig immer ausgezahlt.....
Wenn du dich selbst nur wunderst, warum die alle trotz der ganzen P3-Kandidaten auf Medx einhacken und sie runterschreiben und runtershorten, dann brauchst du auch nix kommentieren.

Naja, unter der 200er kaufen hat sich mittelfristig immer ausgezahlt.....
Antwort auf Beitrag Nr.: 32.086.445 von eck64 am 19.10.07 17:05:03Klar weiß ich mehr, hier der gesamte Report:
http://mysite.verizon.net/rzfric/bofamedxreport.pdf
Vergleiche den mal mit deinem Pipelinebewertungsansatz (Figure 5, Seite 7).
Die zwei CNTO Antikörper (abgeschlossene P III, davon einer mit best in class Ergebnissen und der andere als vollhumaner Ersatz des 3 Mrd USD Blockbusters Remicade) plus der Novartis AK in Phase III werden zusammen mit gerade mal 157 Mio USD, d.h. knapp über 100 Mio Euro Wert für Medarex bewertet (alle zusammen mit Peak Sales Potential von 2Mrd USD). Und das mit 4% Royalties gerechnet. Was hälst du davon?
MDX-010 wird ein Peak Sales Potential von nur 300Mio USD zugerechnet und zwar mit Zulassung gerechnet, wenn auch verzögert. Nur 300 Mio USD obwohl Brystol Myers Squibb und Medarex late stage Studien in allen Krebsarten anstossen.
Ein großer Teil der Pipeline (die 20 P1 en) und der generelle Equity Interest in Genmab und Celldex und die Technologieplattform an sich wird gar nicht bewertet.
Klar, dass die BoA so auf 10 USD Kursziel kommt.
Lies dir die Analyse bitte mal durch.
http://mysite.verizon.net/rzfric/bofamedxreport.pdf
Vergleiche den mal mit deinem Pipelinebewertungsansatz (Figure 5, Seite 7).
Die zwei CNTO Antikörper (abgeschlossene P III, davon einer mit best in class Ergebnissen und der andere als vollhumaner Ersatz des 3 Mrd USD Blockbusters Remicade) plus der Novartis AK in Phase III werden zusammen mit gerade mal 157 Mio USD, d.h. knapp über 100 Mio Euro Wert für Medarex bewertet (alle zusammen mit Peak Sales Potential von 2Mrd USD). Und das mit 4% Royalties gerechnet. Was hälst du davon?
MDX-010 wird ein Peak Sales Potential von nur 300Mio USD zugerechnet und zwar mit Zulassung gerechnet, wenn auch verzögert. Nur 300 Mio USD obwohl Brystol Myers Squibb und Medarex late stage Studien in allen Krebsarten anstossen.
Ein großer Teil der Pipeline (die 20 P1 en) und der generelle Equity Interest in Genmab und Celldex und die Technologieplattform an sich wird gar nicht bewertet.
Klar, dass die BoA so auf 10 USD Kursziel kommt.
Lies dir die Analyse bitte mal durch.
Antwort auf Beitrag Nr.: 32.095.723 von Ville7 am 21.10.07 07:15:26Hallo ville,
habe da reingestöbert in die Analyse.
Offensichtlich gestehen die Analos den Projekten nur sehr verhaltene Umsatzentwicklung zu. Und wenn sie damit recht haben, dann ist Medx jetzt auch nicht mehr als 10 USD wert.
Hast du die Verlustreihe gesehen, mit der die rechnen?
1,21/1,10/1,20/0,90,0,75 als EPS von 2006 bis 2010E.
2010 immer noch mit satt Verlust je Aktie. Im Prinzip also verständlich, wenn sie dann bei Medx in der Bewertung keine Milliarden draufpacken.
Ausweg: Medx müsste selbst einen langfristigen Rahmenfinanzplan rausgeben, wenn sie intern wirklich damit rechnen, wesentlich besser sein zu können. Sprich schnelleres Umsatzwachstum und zügigeren Break even. Mit 168,5 mio USD Umsatz 2010 ist halt keine Kursexplosion zu machen.
ich könnte mir gut vorstellen, dass da wesentlich schneller was gehen könnte, was entsprechend deftig das Kursziel korrigieren würde. Aber dafür muss das Management glaubhaft bessere Perspektiven vortragen.
xxxxxxxxxxxxxx
Und wenn du das mit Morphosys vergleichst:
Die haben immerhin einen gewaltigen Vorteil: Anziehende Meilensteinzahlungen und tantiemen bringen Morphosys nicht den Break even näher, sondern sind laufend purer Vorsteuergewinn.
habe da reingestöbert in die Analyse.
Offensichtlich gestehen die Analos den Projekten nur sehr verhaltene Umsatzentwicklung zu. Und wenn sie damit recht haben, dann ist Medx jetzt auch nicht mehr als 10 USD wert.
Hast du die Verlustreihe gesehen, mit der die rechnen?
1,21/1,10/1,20/0,90,0,75 als EPS von 2006 bis 2010E.
2010 immer noch mit satt Verlust je Aktie. Im Prinzip also verständlich, wenn sie dann bei Medx in der Bewertung keine Milliarden draufpacken.
Ausweg: Medx müsste selbst einen langfristigen Rahmenfinanzplan rausgeben, wenn sie intern wirklich damit rechnen, wesentlich besser sein zu können. Sprich schnelleres Umsatzwachstum und zügigeren Break even. Mit 168,5 mio USD Umsatz 2010 ist halt keine Kursexplosion zu machen.
ich könnte mir gut vorstellen, dass da wesentlich schneller was gehen könnte, was entsprechend deftig das Kursziel korrigieren würde. Aber dafür muss das Management glaubhaft bessere Perspektiven vortragen.
xxxxxxxxxxxxxx
Und wenn du das mit Morphosys vergleichst:
Die haben immerhin einen gewaltigen Vorteil: Anziehende Meilensteinzahlungen und tantiemen bringen Morphosys nicht den Break even näher, sondern sind laufend purer Vorsteuergewinn.
Antwort auf Beitrag Nr.: 32.097.241 von eck64 am 21.10.07 13:51:11heute noch mal minus 4 Prozent.
Warten auf Amerika...
Ich halte durch bis zu den Ergebnissen, vorher lass ich mich nicht rausschütteln.
Hoffentlich ist Anfang November unser Tag
Warten auf Amerika...
Ich halte durch bis zu den Ergebnissen, vorher lass ich mich nicht rausschütteln.
Hoffentlich ist Anfang November unser Tag
Antwort auf Beitrag Nr.: 32.103.678 von uk0804 am 22.10.07 09:32:30Was meinst du für Ergebnisse?
Quartalszahlen oder Studienergebnisse?


Quartalszahlen oder Studienergebnisse?

Antwort auf Beitrag Nr.: 32.104.130 von eck64 am 22.10.07 10:13:37Ergebnisse
Antwort auf Beitrag Nr.: 32.106.605 von uk0804 am 22.10.07 13:39:23entschuldigung: ich meinte natürlich studienergebnisse
Meine Sum-of-the-Parts Valuation ergibt ein anderes Ergebnis als das der BoA, da alle Parts berücksichtigt werden, nicht nur einige. Zudem wurden Peak Sales für MDX-010 und CNTO 1275,148 höher angesetzt, da der BoA Ansatz hier vollkommen unplausibel ist.


Antwort auf Beitrag Nr.: 32.121.228 von Ville7 am 23.10.07 15:42:41Erklärungen für den heutigen Kursverlauf in einem positiven Marktumfeld ? 

Antwort auf Beitrag Nr.: 32.123.729 von uk0804 am 23.10.07 18:15:34Lang dauerts nicht mehr und ich spring von der Brücke...
Antwort auf Beitrag Nr.: 32.125.761 von mountainbiker am 23.10.07 20:46:2312,31 - ok ich spring dann mal

Antwort auf Beitrag Nr.: 32.135.207 von mountainbiker am 24.10.07 16:02:18wart halt noch bis Mitte November wenn vielleicht Studienergebnisse vorliegen. Springen kannst dann ja immer noch. Vielleicht aber statt von der Brücke hoch in die Luft 





Antwort auf Beitrag Nr.: 32.136.721 von uk0804 am 24.10.07 17:34:29bin voll deiner Meinung. Irgendwann erwacht auch unser "Dornröschen"

Antwort auf Beitrag Nr.: 32.139.517 von hannas am 24.10.07 20:46:09Naja, bald haben wir ja die 10
Medarex Ersteinschätzung
Rating-Update:
New York (aktiencheck.de AG) - Die Analysten der Banc of America stufen die Aktie von Medarex (ISIN US5839161016/ WKN 883040) in einer Ersteinschätzung mit "sell" ein. Das Kursziel werde bei 10 USD gesehen. (17.10.2007/ac/a/u)
Analyse-Datum: 17.10.2007
Rating-Update:
New York (aktiencheck.de AG) - Die Analysten der Banc of America stufen die Aktie von Medarex (ISIN US5839161016/ WKN 883040) in einer Ersteinschätzung mit "sell" ein. Das Kursziel werde bei 10 USD gesehen. (17.10.2007/ac/a/u)
Analyse-Datum: 17.10.2007
Antwort auf Beitrag Nr.: 32.152.660 von asics01 am 25.10.07 19:13:54ich liege schon eine weile mit dem finger auf der kauftaste auf der lauer,aber irgendetwas hält mich ab.was soll ich tun?????????
Antwort auf Beitrag Nr.: 32.153.048 von asics01 am 25.10.07 19:37:26Ich würde die MDX-010 Ergebnisse abwarten, dann biste auf der sicheren Seite. Alles andere ist gerade Zock oder fallendes Messer abgreifen.
Scheinbar gibt es eine Ursache für den Verfall. Pfizer hat sich wohl im September umentschieden und will nicht mehr aufgrund der Response Rate ein BLA einreichen sondern aufgrund von Overall Survival nächstes Jahr oder übernächstes Jahr. Man vermutet nun die Response Rates beim Pfizer Anti-CTLA-4 waren zu gering und Pfizer geht nun auf Nummer sicher um sich eine Blamage zu ersparen. Aus dieser Erkenntnis/Spekulation wird daraus die Spekulation abgeleitet, dass auch Ipilimumab, welches den gleichen Wirkmechanismus hat, nicht funktioniert. Daher haben die Shorts seit dem wahrscheinlichen Pfizer Leak leichtes Spiel.
Scheinbar gibt es eine Ursache für den Verfall. Pfizer hat sich wohl im September umentschieden und will nicht mehr aufgrund der Response Rate ein BLA einreichen sondern aufgrund von Overall Survival nächstes Jahr oder übernächstes Jahr. Man vermutet nun die Response Rates beim Pfizer Anti-CTLA-4 waren zu gering und Pfizer geht nun auf Nummer sicher um sich eine Blamage zu ersparen. Aus dieser Erkenntnis/Spekulation wird daraus die Spekulation abgeleitet, dass auch Ipilimumab, welches den gleichen Wirkmechanismus hat, nicht funktioniert. Daher haben die Shorts seit dem wahrscheinlichen Pfizer Leak leichtes Spiel.
Antwort auf Beitrag Nr.: 32.162.687 von Ville7 am 26.10.07 14:43:14danke,na dann mach ich das mal so,auch auf die gefahr hin dass die ergebnisse gut sind,und ich dem kurs hinterher schauen muss.aber wie du geschrieben hast ohne grund hat es medarex nicht so zerbrösselt.
asics
asics
Antwort auf Beitrag Nr.: 32.163.866 von asics01 am 26.10.07 15:44:51
Antwort auf Beitrag Nr.: 32.166.265 von uk0804 am 26.10.07 17:58:18kauf Dir halt lieber anstelle von 1.000 Aktien für 9.000 Euro lieber 1000 optionsscheine mit Basis 18 Euro und Laufzeit bis Dez. 2008. Die kosten Dich dann 1.500 €, kannst aber ev. bei einem Buyout oder einen positiven Studienergebnisse extrem profitieren. Ich denke recht viel tiefer als 8 Dollar wird Medarex auch bei negativem Ergebniss nicht fallen. Der Optionsschein wird dann immer noch 500 Euro wert sein. Das heißt du verlierst maximal 1000 Euro, bist aber voll dabei wenn es wirklich positiv sein sollte. So bin zumindest ich positioniert. Nur in lnagfristigen Optionsscheinen.
Antwort auf Beitrag Nr.: 32.166.335 von uk0804 am 26.10.07 18:02:03wo und über welchen Broker kaufst Du die Optionsscheine?
Bin bisher nur in Aktien investiert, könnte mir aber eine "Erweiterung" durchaus vorstellen.
(Medarex befindet sich nach wie vor auf meiner Watchlist)
Bin bisher nur in Aktien investiert, könnte mir aber eine "Erweiterung" durchaus vorstellen.
(Medarex befindet sich nach wie vor auf meiner Watchlist)
Antwort auf Beitrag Nr.: 32.170.282 von Poppholz am 26.10.07 22:46:18ich kaufe die optionsscheine direkt online über mein online depot bei einer raiffeisenbank. du brauchst nur die nötige risikoaufklärung bei der bank, dann kannst du für den handel freigeschaltet werden. ist keine große sache. es besteht ja keine nachschußpflicht. schlimmstenfalls ist der einsatz weg, mehr aber nicht. anders als wenn man short geht oder cfd s handelt.
Kein Witz! Ipilimumab (MDX-010) wurde an Hunden getestet und soll wirksam sein.
Video ansehen!
http://video.msn.com/video.aspx?mkt=en-us&vid=d7f603e0-86bb-…

Video ansehen!
http://video.msn.com/video.aspx?mkt=en-us&vid=d7f603e0-86bb-…

Daten des nach CNTO-1275 nächsten MEDX-Blockbuster-Kandidaten (mit Medarex Anteilen von 3-5%) wird höchstwahrscheinlich hier bekannt gegeben:
CNTO 148: 6. bis 11. November 2007 "American College of Rheumatology", Annual Meeting
CNTO 148: 6. bis 11. November 2007 "American College of Rheumatology", Annual Meeting
Antwort auf Beitrag Nr.: 32.183.789 von Ville7 am 29.10.07 09:15:38Das darf doch alles nicht mehr wahr sein! Q-Cells, Solon usw hab ich verkauft und schön in MOR und MEDX getauscht. Könnt ausflippen momentan...

Habe mich jetzt auch mal zu einem überschaubaren Investment in einen MEDX-Call hinreissen lassen. Irgendwie sieht das doch so aus, als könnten wir die Unterkante dieses etwas ungehobelten Aufwärtstrends erreicht haben. Und Angst des Marktes vor schlechten Studienergebnissen ist ja auch nichts Schlechtes, zumindest falls die Ergebnisse nachher doch taugen sollten...
29.10.2007 21:03
Ono and Medarex Announce Allowance of Investigational New Drug Application for Fully Human Anti-PD1 Antibody
PRINCETON, N.J., Oct. 29 /PRNewswire-FirstCall/ -- Ono Pharmaceutical Co., Ltd. and Medarex, (Nachrichten/Aktienkurs) Inc. announced today the allowance of an investigational new drug application (IND) filed with the U.S. Food&Drug Administration (FDA) for MDX-1106 (ONO-4538: development code of Ono Pharmaceutical Co., Ltd.), a fully human anti-PD-1 antibody being investigated for the treatment of chronic viral infections, with the first trial to target hepatitis C. MDX-1106 was developed under the May 2005 collaborative research agreement between Ono and Medarex, and currently is in a separate ongoing Phase I clinical study in patients with recurrent or treatment- refractory cancer.
The new Phase I single-dose, dose-escalation trial with MDX-1106/ONO-4538 is expected to enroll up to 34 patients with active hepatitis C genotype 1 infection (HCV). The study is intended to evaluate the safety, pharmacokinetics, and preliminary efficacy of single doses of MDX-1106/ONO- 4538.
"Recently, involvement of PD-1 in hepatitis C has been reported in the scientific literature," said Shozo Matsuoka, Ph.D., Senior Managing Director of Ono Pharmaceutical, Co., Ltd. "ONO-4538/MDX-1106 aims to improve the immune capacity of the body and treat hepatitis C with a novel mechanism of action which inhibits the involvement of PD-1. We are seeking to develop ONO- 4538/MDX-1106 to be a new treatment for hepatitis C."
"We value our partnership with Ono and are pleased with the progress to study the potential of MDX-1106 in both oncology and infectious diseases," said Howard Pien, President and CEO of Medarex. "We believe that our ongoing program in patients with cancer is currently progressing well and that this exploratory Phase I study in HCV may be a step toward potentially adding new infectious disease indications for therapeutic blockade of this important T cell regulatory molecule."
Ono and Medarex Announce Allowance of Investigational New Drug Application for Fully Human Anti-PD1 Antibody
PRINCETON, N.J., Oct. 29 /PRNewswire-FirstCall/ -- Ono Pharmaceutical Co., Ltd. and Medarex, (Nachrichten/Aktienkurs) Inc. announced today the allowance of an investigational new drug application (IND) filed with the U.S. Food&Drug Administration (FDA) for MDX-1106 (ONO-4538: development code of Ono Pharmaceutical Co., Ltd.), a fully human anti-PD-1 antibody being investigated for the treatment of chronic viral infections, with the first trial to target hepatitis C. MDX-1106 was developed under the May 2005 collaborative research agreement between Ono and Medarex, and currently is in a separate ongoing Phase I clinical study in patients with recurrent or treatment- refractory cancer.
The new Phase I single-dose, dose-escalation trial with MDX-1106/ONO-4538 is expected to enroll up to 34 patients with active hepatitis C genotype 1 infection (HCV). The study is intended to evaluate the safety, pharmacokinetics, and preliminary efficacy of single doses of MDX-1106/ONO- 4538.
"Recently, involvement of PD-1 in hepatitis C has been reported in the scientific literature," said Shozo Matsuoka, Ph.D., Senior Managing Director of Ono Pharmaceutical, Co., Ltd. "ONO-4538/MDX-1106 aims to improve the immune capacity of the body and treat hepatitis C with a novel mechanism of action which inhibits the involvement of PD-1. We are seeking to develop ONO- 4538/MDX-1106 to be a new treatment for hepatitis C."
"We value our partnership with Ono and are pleased with the progress to study the potential of MDX-1106 in both oncology and infectious diseases," said Howard Pien, President and CEO of Medarex. "We believe that our ongoing program in patients with cancer is currently progressing well and that this exploratory Phase I study in HCV may be a step toward potentially adding new infectious disease indications for therapeutic blockade of this important T cell regulatory molecule."
Antwort auf Beitrag Nr.: 32.195.829 von Cashverbrenner am 29.10.07 21:14:02Die Aktie wird morgen trotzdem weiter fallen...

Antwort auf Beitrag Nr.: 32.196.232 von mountainbiker am 29.10.07 21:43:42Charttechnisch ist alles noch im grünen Bereich und die Aktie wird ab ca. 8 EURO wieder steigen. Aber wer glaubt schon an Charttechnik.

Antwort auf Beitrag Nr.: 32.197.974 von Cashverbrenner am 30.10.07 07:53:15puh... was für ein Biotech jahr: Dendreon bekommt keine Zulassung, GPC bekommt keine Zulassung und bringt jetzt auch noch schlechte Studienergebnisse, Paion bringt schlechte Phase III Daten.
persönlich 3 mal daneben gelangt heuer!!!
Was wird unsere Medarex machen ?
persönlich 3 mal daneben gelangt heuer!!!
Was wird unsere Medarex machen ?

Antwort auf Beitrag Nr.: 32.219.737 von uk0804 am 31.10.07 15:55:28GPC bekommt keine Zulassung
Biotech ist leider Mega-Out. Denke aber im nächsten Frühjahr wird es ein Comeback geben. Dann kommen auch die defensiven Pharmawerte wieder hoch, wenn die Zycliker mit abflachender Konjuktur absaufen werden.
Über GPC wird niemand mehr sprechen. Habe das auch nie als Biotechfirma gesehen, mit einem einlizensierten Altprodukt von Bristol-Myers, das sonst niemand haben wollte.
Biotech ist leider Mega-Out. Denke aber im nächsten Frühjahr wird es ein Comeback geben. Dann kommen auch die defensiven Pharmawerte wieder hoch, wenn die Zycliker mit abflachender Konjuktur absaufen werden.
Über GPC wird niemand mehr sprechen. Habe das auch nie als Biotechfirma gesehen, mit einem einlizensierten Altprodukt von Bristol-Myers, das sonst niemand haben wollte.
Antwort auf Beitrag Nr.: 32.225.420 von Cashverbrenner am 31.10.07 22:05:12was hat denn der xetra Kurs heute zu bedeuten ? + 12 % . Hat da nur einer unlimitiert gekauft oder ist da was im Busch ?
!
Dieser Beitrag wurde moderiert. Grund: Spammposting
Antwort auf Beitrag Nr.: 32.231.510 von uk0804 am 01.11.07 13:22:05Bitte nicht nach Xetra orientieren, sondern nach der deutschen Börse mit den größten Umsätzen: Frankfurt.
 Gegenreaktion oder doch gute Eregbnisse? Wir werden es nächste Woche sehen?
Gegenreaktion oder doch gute Eregbnisse? Wir werden es nächste Woche sehen?
Antwort auf Beitrag Nr.: 32.263.525 von Ville7 am 03.11.07 07:00:07Am besten gleich Nasi schauen. Manchmal ahnt Frankfurt die Richtung richtig, häufig auch nicht und der Kurs wandert ab 14:00 ganz anders.....
Auch Unterstützungen, Trends und Widerstände sind in Dollar relevant und durch die Wechselkursänderungen verzogen.
Auch Unterstützungen, Trends und Widerstände sind in Dollar relevant und durch die Wechselkursänderungen verzogen.
Antwort auf Beitrag Nr.: 32.265.155 von Taube75 am 03.11.07 13:13:52Bis 14 ists Gegenreaktion:

Oberhalb trendwende.
Oberhalb trendwende.
Antwort auf Beitrag Nr.: 32.265.618 von eck64 am 03.11.07 14:10:27 Moin,

mal wieder ein Lebenszeichen von mir, halte ja immer noch ziemlich viele Esel hier, wenngleich ich immerhin die Hälfte der Herde bei >12€ losgeschlagen hatte (zum Glück). Wollte eigentlich gestern wieder mit dem Rückkauf beginnen, da das Gap aus dem Frühjahr geschlossen wurde. Hab ich nun nicht - da sieht man, was dabei rauskommt! Naja, es gibt sicher noch andere Gelegenheiten.
Wesentlich ist natürlich Ipilimumab - hier mal ein Artikel von Forbes, der auch das Sell-Rating der BOA erwähnt. Wenn man das so liest, glaubt man ja fast an Wunderheilung, also eigentlich sollte es doch eine Zulassung geben - trotz vielleicht (noch)nicht ganz so hoher response-rate. Aber bei einigen konnte offenbar ein vollständiger Rückgang der Tumore erreicht werden. Wie sich die Sache langfristig verhält, weiß man natürlich noch nicht.
Gruß q.
------------
Health
Targeting Melanoma
Robert Langreth 11.12.07
Edward Watson
China's Richest
The Jonney Machine
The Next Billion
Indian Gold
Complete Contents
A new arsenal of therapies is aimed at a widespread and lethal skin cancer.
When Edward Watson found a black spot on his left forearm in May 2004, the physician, then 39 years old, realized that it was the return of the melanoma that he had previously been treated for. This time it was beyond a skin cancer. Tumors had spread to his back, spine, adrenal gland, lung, ribs, pelvis and both hips. He took a positron emission scan, and, he says, "I lit up like a Christmas tree." His surgeon told him he had eight months to live.
Watson quit his job for Pfizer (nyse: PFE - news - people ) in Australia, moved back to his native New Zealand and prepared to die. Then former Pfizer colleagues told him about a new drug, tremelimumab, in early trials. It was an antibody that primes the immune system to attack and kill tumors.
A few weeks later Watson was on a plane to the U.S. to start treatment at UCLA. The antibody produced a rash on his chest and made him lethargic. By fall he noticed that the tumor on his back was shrinking; doctors removed it and found dead cancer cells. He continued flying back quarterly to see UCLA oncologist Antoni Ribas for infusions. By June 2006 the tumors were gone. Watson remains in remission and continues to take the drug every six months. He recently started a business. "This drug has saved my life; there are no two ways about it," he says.
Watson is one of the first to benefit from a new generation of melanoma drugs working their way through human trials. The drugs, in testing at Pfizer, Bristol-Myers Squibb (nyse: BMY - news - people ) and elsewhere, may improve upon medicine's dismal track record of treating the most deadly form of skin cancer. One blocks the mutant proteins inside melanoma that cause their rampant growth. Another prods the immune system into attacking and destroying the cancer. Neither approach is likely to be a cure on its own; a combination of therapies may be needed.
Melanoma, a cancer of the skin's melanocytes, or pigment cells, hits 60,000 Americans each year and kills 8,000 of them. It can strike in the prime of life and is one of the few cancers whose incidence is exploding, for unclear reasons. Risk factors include sunburn, fair skin and having lots of moles. Most cases are localized and can be cured with surgery. But when melanoma metastasizes, watch out. It "tends to spread to many, many parts of the body at an alarming rate," says Memorial Sloan-Kettering Cancer Center melanoma expert Jedd D. Wolchok. Chemotherapy helps only 10% of metastatic melanoma patients, usually for just a few months.
Until recently researchers had little clue what molecular changes drive melanoma's rapid growth. But that has changed in a flurry of basic biology findings. "In terms of understanding what makes melanoma tick, in the past five years there has been an utter revolution," says Keith Flaherty, a physician at the University of Pennsylvania.
In 2002 gene researchers in the U.K. discovered that two-thirds of melanomas have a mutation in a growth-promoting gene inside skin cells called BRAF. The mutation causes the BRAF protein to become stuck in the "on" position, so it constantly sends a signal to the nucleus that it is time to proliferate. BRAF blockers are now in early-stage human trials at Novartis (nyse: NVS - news - people ) and separately at Roche, which works with partner Plexxikon. AstraZeneca (nyse: AZN - news - people ) is in midstage trials with 180 melanoma patients for a drug that hits a related target called mitogen-activated protein kinase kinase. "Every company I know of is interested in this," says Plexxikon Chief Executive Peter Hirth.
Therapies that trick the immune system into attacking melanoma are further along. Such immune system boosters have the potential to treat many types of cancer, but melanoma is one of the prime initial targets because it is one of the few cancers known to go into spontaneous remission on its own, indicating a possible immune response at work. The immune system activator interleukin-2 helps 15% of advanced melanoma cases and cures a few, but it produces such devastating side effects that patients must be hospitalized.
Pfizer's drug tremelimumab and Bristol-Myers Squibb's ipilimumab are antibodies to a protein called CTLA-4 (cytotoxic T-lymphocyte antigen-4) that acts as an emergency brake to prevent killer T cells from attacking healthy tissue. The antibodies bind to the CTLA-4, found on a cell's surface, and shut off the brake. Killer T cells then attack the cancer cells. Both drugs are in final-stage trials on hundreds of melanoma patients.
Much credit for the concept goes to immunologist James Allison, now at Sloan-Kettering in New York. In the mid-1990s he theorized that CTLA-4 might prevent the immune system from mounting an effective response against tumors. Others were skeptical. But Allison showed in 1996 that he could shrink tumors in mice by injecting them with antibodies to CTLA-4.
Both Pfizer and Medarex (nasdaq: MEDX - news - people ), a biotech firm in Princeton, New Jersey, subsequently produced human antibodies to CTLA-4 and began testing them in patients a few years later. In 2005 Bristol-Myers Squibb paid Medarex $50 million in cash plus up to $480 in payments contingent on the success of Medarex's antibody.
At a meeting of cancer specialists last June Bristol-Myers and Medarex reported their drug shrank tumors in 46, or 13%, of 356 melanoma patients. The Pfizer antibody shrank melanomas in 7 of 84 patients in a midstage trial. The success rates were modest, but cancer doctors say that some patients may have had delayed responses. In some people tumors started to regress months after they had been declared treatment failures, says Bristol-Myers Vice President Renzo Canetta.
UCLA's Ribas calls the response rates "very low" and cautions that the anti-CTLA-4 drugs are just a first step. But even if the drugs improve survival only minimally, they are likely to be approved, he says. Bristol-Myers and Medarex are expected to finish key trials this fall. RBC Capital Markets analyst Jason Kantor pegged the odds of disappointing results "relatively high" in a recent report and rated Medarex an underperform; if the response rate is under 10%, it would make near-term approval "iffy," he says. Side effects of the drugs can include inflammation of the colon, thyroid or pancreas, or other autoimmune problems.
One reason for the limited response rate may be that some patients' T cells do a poor job of recognizing melanoma. To improve this situation, researchers are combining new antimelanoma vaccines with anti-CTLA-4 drugs. The idea is that the vaccines will train T cells to spot cancer, while the antibody will make sure the T cells remain activated long enough to do their dirty work.
Sharon Belvin was one of the first to try such a combination therapy. In May 2004, just a week before her wedding, she had developed a melanoma metastasis in her left lung. Belvin was only 22. The tumor grew through her chest cavity underneath her collarbone. Various chemo drugs and interleukin-2 produced nerve damage and other nasty side effects and didn't solve the problem. By June 2005 she had tumors in both lungs and could barely breathe or walk. Then Wolchok put her in a trial testing ipilimumab with an experimental Medarex vaccine. After only four treatments the tumors started to melt away. They were gone by mid-2006. The Jamesville, North Carolina resident has been off therapy for a year and is pregnant with her first child, a girl due Feb. 10.

mal wieder ein Lebenszeichen von mir, halte ja immer noch ziemlich viele Esel hier, wenngleich ich immerhin die Hälfte der Herde bei >12€ losgeschlagen hatte (zum Glück). Wollte eigentlich gestern wieder mit dem Rückkauf beginnen, da das Gap aus dem Frühjahr geschlossen wurde. Hab ich nun nicht - da sieht man, was dabei rauskommt! Naja, es gibt sicher noch andere Gelegenheiten.
Wesentlich ist natürlich Ipilimumab - hier mal ein Artikel von Forbes, der auch das Sell-Rating der BOA erwähnt. Wenn man das so liest, glaubt man ja fast an Wunderheilung, also eigentlich sollte es doch eine Zulassung geben - trotz vielleicht (noch)nicht ganz so hoher response-rate. Aber bei einigen konnte offenbar ein vollständiger Rückgang der Tumore erreicht werden. Wie sich die Sache langfristig verhält, weiß man natürlich noch nicht.
Gruß q.
------------
Health
Targeting Melanoma
Robert Langreth 11.12.07
Edward Watson
China's Richest
The Jonney Machine
The Next Billion
Indian Gold
Complete Contents
A new arsenal of therapies is aimed at a widespread and lethal skin cancer.
When Edward Watson found a black spot on his left forearm in May 2004, the physician, then 39 years old, realized that it was the return of the melanoma that he had previously been treated for. This time it was beyond a skin cancer. Tumors had spread to his back, spine, adrenal gland, lung, ribs, pelvis and both hips. He took a positron emission scan, and, he says, "I lit up like a Christmas tree." His surgeon told him he had eight months to live.
Watson quit his job for Pfizer (nyse: PFE - news - people ) in Australia, moved back to his native New Zealand and prepared to die. Then former Pfizer colleagues told him about a new drug, tremelimumab, in early trials. It was an antibody that primes the immune system to attack and kill tumors.
A few weeks later Watson was on a plane to the U.S. to start treatment at UCLA. The antibody produced a rash on his chest and made him lethargic. By fall he noticed that the tumor on his back was shrinking; doctors removed it and found dead cancer cells. He continued flying back quarterly to see UCLA oncologist Antoni Ribas for infusions. By June 2006 the tumors were gone. Watson remains in remission and continues to take the drug every six months. He recently started a business. "This drug has saved my life; there are no two ways about it," he says.
Watson is one of the first to benefit from a new generation of melanoma drugs working their way through human trials. The drugs, in testing at Pfizer, Bristol-Myers Squibb (nyse: BMY - news - people ) and elsewhere, may improve upon medicine's dismal track record of treating the most deadly form of skin cancer. One blocks the mutant proteins inside melanoma that cause their rampant growth. Another prods the immune system into attacking and destroying the cancer. Neither approach is likely to be a cure on its own; a combination of therapies may be needed.
Melanoma, a cancer of the skin's melanocytes, or pigment cells, hits 60,000 Americans each year and kills 8,000 of them. It can strike in the prime of life and is one of the few cancers whose incidence is exploding, for unclear reasons. Risk factors include sunburn, fair skin and having lots of moles. Most cases are localized and can be cured with surgery. But when melanoma metastasizes, watch out. It "tends to spread to many, many parts of the body at an alarming rate," says Memorial Sloan-Kettering Cancer Center melanoma expert Jedd D. Wolchok. Chemotherapy helps only 10% of metastatic melanoma patients, usually for just a few months.
Until recently researchers had little clue what molecular changes drive melanoma's rapid growth. But that has changed in a flurry of basic biology findings. "In terms of understanding what makes melanoma tick, in the past five years there has been an utter revolution," says Keith Flaherty, a physician at the University of Pennsylvania.
In 2002 gene researchers in the U.K. discovered that two-thirds of melanomas have a mutation in a growth-promoting gene inside skin cells called BRAF. The mutation causes the BRAF protein to become stuck in the "on" position, so it constantly sends a signal to the nucleus that it is time to proliferate. BRAF blockers are now in early-stage human trials at Novartis (nyse: NVS - news - people ) and separately at Roche, which works with partner Plexxikon. AstraZeneca (nyse: AZN - news - people ) is in midstage trials with 180 melanoma patients for a drug that hits a related target called mitogen-activated protein kinase kinase. "Every company I know of is interested in this," says Plexxikon Chief Executive Peter Hirth.
Therapies that trick the immune system into attacking melanoma are further along. Such immune system boosters have the potential to treat many types of cancer, but melanoma is one of the prime initial targets because it is one of the few cancers known to go into spontaneous remission on its own, indicating a possible immune response at work. The immune system activator interleukin-2 helps 15% of advanced melanoma cases and cures a few, but it produces such devastating side effects that patients must be hospitalized.
Pfizer's drug tremelimumab and Bristol-Myers Squibb's ipilimumab are antibodies to a protein called CTLA-4 (cytotoxic T-lymphocyte antigen-4) that acts as an emergency brake to prevent killer T cells from attacking healthy tissue. The antibodies bind to the CTLA-4, found on a cell's surface, and shut off the brake. Killer T cells then attack the cancer cells. Both drugs are in final-stage trials on hundreds of melanoma patients.
Much credit for the concept goes to immunologist James Allison, now at Sloan-Kettering in New York. In the mid-1990s he theorized that CTLA-4 might prevent the immune system from mounting an effective response against tumors. Others were skeptical. But Allison showed in 1996 that he could shrink tumors in mice by injecting them with antibodies to CTLA-4.
Both Pfizer and Medarex (nasdaq: MEDX - news - people ), a biotech firm in Princeton, New Jersey, subsequently produced human antibodies to CTLA-4 and began testing them in patients a few years later. In 2005 Bristol-Myers Squibb paid Medarex $50 million in cash plus up to $480 in payments contingent on the success of Medarex's antibody.
At a meeting of cancer specialists last June Bristol-Myers and Medarex reported their drug shrank tumors in 46, or 13%, of 356 melanoma patients. The Pfizer antibody shrank melanomas in 7 of 84 patients in a midstage trial. The success rates were modest, but cancer doctors say that some patients may have had delayed responses. In some people tumors started to regress months after they had been declared treatment failures, says Bristol-Myers Vice President Renzo Canetta.
UCLA's Ribas calls the response rates "very low" and cautions that the anti-CTLA-4 drugs are just a first step. But even if the drugs improve survival only minimally, they are likely to be approved, he says. Bristol-Myers and Medarex are expected to finish key trials this fall. RBC Capital Markets analyst Jason Kantor pegged the odds of disappointing results "relatively high" in a recent report and rated Medarex an underperform; if the response rate is under 10%, it would make near-term approval "iffy," he says. Side effects of the drugs can include inflammation of the colon, thyroid or pancreas, or other autoimmune problems.
One reason for the limited response rate may be that some patients' T cells do a poor job of recognizing melanoma. To improve this situation, researchers are combining new antimelanoma vaccines with anti-CTLA-4 drugs. The idea is that the vaccines will train T cells to spot cancer, while the antibody will make sure the T cells remain activated long enough to do their dirty work.
Sharon Belvin was one of the first to try such a combination therapy. In May 2004, just a week before her wedding, she had developed a melanoma metastasis in her left lung. Belvin was only 22. The tumor grew through her chest cavity underneath her collarbone. Various chemo drugs and interleukin-2 produced nerve damage and other nasty side effects and didn't solve the problem. By June 2005 she had tumors in both lungs and could barely breathe or walk. Then Wolchok put her in a trial testing ipilimumab with an experimental Medarex vaccine. After only four treatments the tumors started to melt away. They were gone by mid-2006. The Jamesville, North Carolina resident has been off therapy for a year and is pregnant with her first child, a girl due Feb. 10.
Update von der gestrigen JP Morgan Conference:
1. Daten der drei Front Line Studies zu MDX-010 in 2nd line Melanoma kommen in den nächsten Wochen
2. Manufactoring Facility und Sales force für MDX-010 in Planung. MEDX möchte selbst seine Sales Force aufbauen (gemäss 45%) um auch für spätere Produkte eine Verkaufmannschaft zu haben.
4. BMS und PFE sind in Diskussion für die Patent Nutzung des CTLA-4 Moleküls. BMS besitzt dies Intellaectuall Property. MEDX hält Patente bezüglich der speziellen Nutzung des Antikörpers zur Behandlung von Krankheiten wie Krebs.
5. MDX-010 1st line Combo mit DTIC Patientenaufnahme soll in HJ1 2008 abgeschlossen sein. Ein halbes Jahr vor dem Plan. Ergebnisse dieser Studie dann Ende 2008. (Zur Erinnerung: MDX-010+DTIC brachte in Phase II 14,8 Monate OS im Vergleich zu nur 7,8 Monate zu DTIC historisch)
1. Daten der drei Front Line Studies zu MDX-010 in 2nd line Melanoma kommen in den nächsten Wochen
2. Manufactoring Facility und Sales force für MDX-010 in Planung. MEDX möchte selbst seine Sales Force aufbauen (gemäss 45%) um auch für spätere Produkte eine Verkaufmannschaft zu haben.
4. BMS und PFE sind in Diskussion für die Patent Nutzung des CTLA-4 Moleküls. BMS besitzt dies Intellaectuall Property. MEDX hält Patente bezüglich der speziellen Nutzung des Antikörpers zur Behandlung von Krankheiten wie Krebs.
5. MDX-010 1st line Combo mit DTIC Patientenaufnahme soll in HJ1 2008 abgeschlossen sein. Ein halbes Jahr vor dem Plan. Ergebnisse dieser Studie dann Ende 2008. (Zur Erinnerung: MDX-010+DTIC brachte in Phase II 14,8 Monate OS im Vergleich zu nur 7,8 Monate zu DTIC historisch)
Achja, das nächste Event ist der CNTO 148. Die Phase III Daten wird JnJ am 8.11. auf dem ACR präsentieren. Also übermorgen. CNTO 148 ist der vollhumane Ersatz von JnJ und Schering-Plough für den Blockbuster Remicade.
Danke für die Info. Hoffentlich wirkt sich die Präsentation endlich stimulierend auf den Kurs aus.
Jetzt habe ich heute mal den starken Euro und den Spread zu MOR ausgenutzt:
Für 8,26€ bzw. ca. 12,02USD gekauft.
Was zuviel ist, ist zuviel.
Für 8,26€ bzw. ca. 12,02USD gekauft.
Was zuviel ist, ist zuviel.
[URL ]http://www.tradesignalonline.com/content.asp?p=wpa/tsb/default.asp&fcid=2417383[/URL]
]http://www.tradesignalonline.com/content.asp?p=wpa/tsb/default.asp&fcid=2417383[/URL]
[URLChart öffnen]http://www.tradesignalonline.com/content.asp?p=wpa/tsb/default.asp&fcid=2417383[/URL]
Mal sehen ob der zeitpunkt ok war.
[URLChart öffnen]http://www.tradesignalonline.com/content.asp?p=wpa/tsb/default.asp&fcid=2417383[/URL]
Mal sehen ob der zeitpunkt ok war.

Nochmal eine weitere Info von mir zusammengefasst aus der letzten Präsentation:
1*P III / 2* P II und 1* PI Data wird auf dem ACR 2007 präsentiert (Nov 6 to 11):
MEDI 545 - Lupus - Phase I Data
CNTO 1275 - Psoriatic Arthritis - Phase II Data
CNTO 148 - Psoriatic Arthritis/Ankylosing Spondylitis - Phase III Data
Humax CD 20 - Rheumatoid Arthritis - Phase II Data
Eigentlich ein Traum, aber scheinbar zählt derzeit nur MDX-010.
1*P III / 2* P II und 1* PI Data wird auf dem ACR 2007 präsentiert (Nov 6 to 11):
MEDI 545 - Lupus - Phase I Data
CNTO 1275 - Psoriatic Arthritis - Phase II Data
CNTO 148 - Psoriatic Arthritis/Ankylosing Spondylitis - Phase III Data
Humax CD 20 - Rheumatoid Arthritis - Phase II Data
Eigentlich ein Traum, aber scheinbar zählt derzeit nur MDX-010.
Antwort auf Beitrag Nr.: 32.313.509 von Ville7 am 06.11.07 19:13:37Noch den potentiellen Anteil von MEDX an den Programmen:
MEDI 545 - Co-Promote Option
CNTO 1275 - 3-5% Milestones/Royalties
CNTO 148 - 3-5% Milestones/Royalties
Humax CD 20 - Equity Interest (10,9% Anteil von MEDX an Genmab)
MEDI 545 - Co-Promote Option
CNTO 1275 - 3-5% Milestones/Royalties
CNTO 148 - 3-5% Milestones/Royalties
Humax CD 20 - Equity Interest (10,9% Anteil von MEDX an Genmab)
Antwort auf Beitrag Nr.: 32.313.509 von Ville7 am 06.11.07 19:13:37Ebenso auf dem ACR 2007:
MDX-1411 - anti CD70 - Preclinical Data
(IND noch in Q4 2007)
MDX-1411 - anti CD70 - Preclinical Data
(IND noch in Q4 2007)
Perfekt am unteren Kanalende gestoppt und dabei das Gap geschlossen:
[URL ]http://www.tradesignalonline.com/content.asp?p=wpa/tsb/default.asp&fcid=2417877[/URL]
]http://www.tradesignalonline.com/content.asp?p=wpa/tsb/default.asp&fcid=2417877[/URL]
[URLChart öffnen]http://www.tradesignalonline.com/content.asp?p=wpa/tsb/default.asp&fcid=2417877[/URL]
Wie gehts weiter?
[URL
[URLChart öffnen]http://www.tradesignalonline.com/content.asp?p=wpa/tsb/default.asp&fcid=2417877[/URL]
Wie gehts weiter?
Johnson & Johnson To Host Analyst Meeting/Webcast to Discuss Three Late-Stage Pipeline Compounds Presented at American College Of Rheumatology (ACR) Conference
November 8, 2007 at 5:00 PM Eastern Time
http://www.investor.jnj.com/medialist.cfm?page=concall
8.11. 23:00 Uhr MEZ Webcast von JnJ zu CNTO 148 und CNTO 1275
November 8, 2007 at 5:00 PM Eastern Time
http://www.investor.jnj.com/medialist.cfm?page=concall
8.11. 23:00 Uhr MEZ Webcast von JnJ zu CNTO 148 und CNTO 1275
Must reads! Zwei neue Dokumente der medizinischen Gemeinde über Ipilimumab:
1.
http://clincancerres.aacrjournals.org dann auf neue Artikel des 2.11. klicken und den dritten Artikel als PDF herunterladen!
Artikel zeigt eine Supgruppe in der Peptidstudie, welche als Monotherapie behandelt wurde und 19% Response Rate aufwies! (Tabelle 3 B). P Value allerdings aufgrund der sample size nicht annähernd signifikant!
2.
http://www.isbtc.org/news/nci_manuscript.pdf
NCI Workshop, Ärzte diskutieren unterschiedlichste Ansätze, u.a. Anti-CTLA-4. Sehr positive Meinung! Sie gehen von wahrscheinlichem Approval von Anti-CTLA-4 aus.
1.
http://clincancerres.aacrjournals.org dann auf neue Artikel des 2.11. klicken und den dritten Artikel als PDF herunterladen!
Artikel zeigt eine Supgruppe in der Peptidstudie, welche als Monotherapie behandelt wurde und 19% Response Rate aufwies! (Tabelle 3 B). P Value allerdings aufgrund der sample size nicht annähernd signifikant!
2.
http://www.isbtc.org/news/nci_manuscript.pdf
NCI Workshop, Ärzte diskutieren unterschiedlichste Ansätze, u.a. Anti-CTLA-4. Sehr positive Meinung! Sie gehen von wahrscheinlichem Approval von Anti-CTLA-4 aus.
@Ville: Zuerst mal: Danke für deine ausgezeichnete Arbeit. (gilt natürlich auch für den Rest in diesem Forum 
Davon ausgehend, dass du auch öfters im Yahoo MSG-Board postest und dein Username dort, ähnlich wie der in diesm Forum ist
 - hätte ich eine Frage.
- hätte ich eine Frage.
Hälst du diese Ergebnisse (siehe Abstract weiter unten) für noch zu wenig aussagekräftig oder deuten sie doch auf eine Überraschung bei der Präsentation von MEDX-010 hin?
Wie interpretierst du diesen Abstract?
lg
Lycos
1: Clin Cancer Res. 2007 Nov 2; [Epub ahead of print]Prognostic Factors Related to Clinical Response in Patients with Metastatic Melanoma Treated by CTL-Associated Antigen-4 Blockade.Downey SG, Klapper JA, Smith FO, Yang JC, Sherry RM, Royal RE, Kammula US, Hughes MS, Allen TE, Levy CL, Yellin M, Nichol G, White DE, Steinberg SM, Rosenberg SA.
Surgery Branch and the Biostatistics and Data Management Section, Center for Cancer Research, National Cancer Institute, NIH, Bethesda, Maryland and Medarex, Inc., Princeton, New Jersey.
PURPOSE: CTL-associated antigen 4 (CTLA-4) can inhibit T-cell activation and helps maintain peripheral self-tolerance. Previously, we showed immune-related adverse events (IRAE) and objective, durable clinical responses in patients with metastatic melanoma treated with CTLA-4 blockade. We have now treated 139 patients in two trials and have sufficient follow-up to examine factors associated with clinical response.EXPERIMENTAL DESIGN: A total of 139 patients with metastatic melanoma were treated: 54 patients received ipilimumab in conjunction with peptide vaccinations and 85 patients were treated with intra-patient dose escalation of ipilimumab and randomized to receive peptides in accordance with HL-A*0201 status.RESULTS: Three patients achieved complete responses (CR; ongoing at 29+, 52+, and 53+ months); an additional 20 patients achieved partial responses (PR) for an overall objective response rate of 17%. The majority of patients (62%, 86 of 139) developed some form of IRAE, which was associated with a greater probability of objective antitumor response (P = 0.0004); all patients with CR had more severe IRAEs. Prior therapy with IFNalpha-2b was a negative prognostic factor, whereas prior high-dose interleukin-2 did not significantly affect the probability of response. There were no significant differences in the rate of clinical response or development of IRAEs between the two trials. The duration of tumor response was not affected by the use of high-dose steroids for abrogation of treatment-related toxicities (P = 0.23). There were no treatment-related deaths.CONCLUSION: In patients with metastatic melanoma, ipilimumab can induce durable objective clinical responses, which are related to the induction of IRAEs.

Davon ausgehend, dass du auch öfters im Yahoo MSG-Board postest und dein Username dort, ähnlich wie der in diesm Forum ist

 - hätte ich eine Frage.
- hätte ich eine Frage.Hälst du diese Ergebnisse (siehe Abstract weiter unten) für noch zu wenig aussagekräftig oder deuten sie doch auf eine Überraschung bei der Präsentation von MEDX-010 hin?
Wie interpretierst du diesen Abstract?
lg
Lycos
1: Clin Cancer Res. 2007 Nov 2; [Epub ahead of print]Prognostic Factors Related to Clinical Response in Patients with Metastatic Melanoma Treated by CTL-Associated Antigen-4 Blockade.Downey SG, Klapper JA, Smith FO, Yang JC, Sherry RM, Royal RE, Kammula US, Hughes MS, Allen TE, Levy CL, Yellin M, Nichol G, White DE, Steinberg SM, Rosenberg SA.
Surgery Branch and the Biostatistics and Data Management Section, Center for Cancer Research, National Cancer Institute, NIH, Bethesda, Maryland and Medarex, Inc., Princeton, New Jersey.
PURPOSE: CTL-associated antigen 4 (CTLA-4) can inhibit T-cell activation and helps maintain peripheral self-tolerance. Previously, we showed immune-related adverse events (IRAE) and objective, durable clinical responses in patients with metastatic melanoma treated with CTLA-4 blockade. We have now treated 139 patients in two trials and have sufficient follow-up to examine factors associated with clinical response.EXPERIMENTAL DESIGN: A total of 139 patients with metastatic melanoma were treated: 54 patients received ipilimumab in conjunction with peptide vaccinations and 85 patients were treated with intra-patient dose escalation of ipilimumab and randomized to receive peptides in accordance with HL-A*0201 status.RESULTS: Three patients achieved complete responses (CR; ongoing at 29+, 52+, and 53+ months); an additional 20 patients achieved partial responses (PR) for an overall objective response rate of 17%. The majority of patients (62%, 86 of 139) developed some form of IRAE, which was associated with a greater probability of objective antitumor response (P = 0.0004); all patients with CR had more severe IRAEs. Prior therapy with IFNalpha-2b was a negative prognostic factor, whereas prior high-dose interleukin-2 did not significantly affect the probability of response. There were no significant differences in the rate of clinical response or development of IRAEs between the two trials. The duration of tumor response was not affected by the use of high-dose steroids for abrogation of treatment-related toxicities (P = 0.23). There were no treatment-related deaths.CONCLUSION: In patients with metastatic melanoma, ipilimumab can induce durable objective clinical responses, which are related to the induction of IRAEs.
Antwort auf Beitrag Nr.: 32.319.248 von Lycos2 am 07.11.07 08:22:17Das war eine Peptidkombinationsstudie. Der Abstract bezieht sich auf Dokument 1 meines Postings in #3221. Dort findest du auch Supgruppenergebnisse (Tabelle3, speziell B). U.a. auch eine Subgruppe, welche kein Peptid dazubekommen hat und somit als Monotherapie behandelt wurde. Mit 5mg bis 9mg/kg Dosierung alle drei Wochen. Dies entspricht fast der Dosierung der front line Studien, die zur Zulassung herangezogen werden sollen und auf deren Ergebnisse wir warten. In dieser Supgruppe war 19% Response Rate zu beobachten. Der P Value war allerdings aufgrund der geringen sample size nicht annähernd statistisch signifikant! Zudem war die Studie wie alle Studien zuvor unkontrolliert und offen.
Fazit: Dieser Abstract gehört generell zu einer Peptidkombistudie und gibt somit insgesamt wenig Hinweise auf die Wirksamkeit als Monotherapie. Allerdings gab es auch eine kleine Monotherapiesupgruppe, die mit 19% Response Rate eine weit höhere Rate aufwies als die bisher reporteten Phase I und II Daten, wo die Response Rates bei 4,55% (mit 3mg/kg) respektive 8,x% (bei 10mg/kg) lagen und die aber ebenfalls eine geringe sample size aufwiesen. Es ist und bleibt also ein Lotteriespiel, ob die Frontlinestudies über 8-10% herauskommen oder darunter.
Fazit: Dieser Abstract gehört generell zu einer Peptidkombistudie und gibt somit insgesamt wenig Hinweise auf die Wirksamkeit als Monotherapie. Allerdings gab es auch eine kleine Monotherapiesupgruppe, die mit 19% Response Rate eine weit höhere Rate aufwies als die bisher reporteten Phase I und II Daten, wo die Response Rates bei 4,55% (mit 3mg/kg) respektive 8,x% (bei 10mg/kg) lagen und die aber ebenfalls eine geringe sample size aufwiesen. Es ist und bleibt also ein Lotteriespiel, ob die Frontlinestudies über 8-10% herauskommen oder darunter.
Da wird wieder ganze (Short-)Arbeit geleistet!

medarex wird jeden tag billiger,ich liege noch auf der lauer
Antwort auf Beitrag Nr.: 32.328.765 von Ville7 am 07.11.07 17:53:25Ich weiß ja, dass ich "unklug" bin, aber ich habe mich gerade mit ein paar € gegen den Markt gestemmt. 
Vielleicht kommen sie ja heute oder morgen wieder in den Uptrend.
Gruß
Zock

Vielleicht kommen sie ja heute oder morgen wieder in den Uptrend.
Gruß
Zock
Antwort auf Beitrag Nr.: 32.329.200 von Zock1000 am 07.11.07 18:18:19Was heisst unklug? Vielleicht wäre jetzt der klügste Kaufzeitpunkt. Vielleicht bei 10 oder bei 8 USD sollte MDX-010 keine guten Daten liefern.
Es ist auf jeden Fall sehr seltsam, dass Medarex in Front von 1 Phase III, 2 Phase II, einem Phase I Ergebnis und präklinischen Daten eines AK so in Grund und Boden geshortet werden kann und wird.
Manipulation oder undichte Quelle? Wir werden es sicherich noch erfahren ob der klüger war, der nun gekauft oder verkauft hat. Das Jahr wird noch schmerzhaft werden oder freudig. Je nachdem.
Es ist auf jeden Fall sehr seltsam, dass Medarex in Front von 1 Phase III, 2 Phase II, einem Phase I Ergebnis und präklinischen Daten eines AK so in Grund und Boden geshortet werden kann und wird.
Manipulation oder undichte Quelle? Wir werden es sicherich noch erfahren ob der klüger war, der nun gekauft oder verkauft hat. Das Jahr wird noch schmerzhaft werden oder freudig. Je nachdem.

Antwort auf Beitrag Nr.: 32.329.635 von Ville7 am 07.11.07 18:44:31Manipulation oder undichte Quelle? Wir werden es sicherich noch erfahren ob der klüger war, der nun gekauft oder verkauft hat. Das Jahr wird noch schmerzhaft werden oder freudig. Je nachdem.
Das kenn ich doch irgendwo her .
.
Das kenn ich doch irgendwo her
 .
.
Antwort auf Beitrag Nr.: 32.329.066 von asics01 am 07.11.07 18:11:26bin ebenfalls täglich am schauen.


Antwort auf Beitrag Nr.: 32.333.373 von Poppholz am 07.11.07 22:23:39na poppi,
möglicherweise findest du einen besseren einstiegspunkt als ich.
die ein/zwei wochen geb ich dem wert u.U noch.
Ist schon blöde wenn du gleich mit rotem vorzeichen startest.
möglicherweise findest du einen besseren einstiegspunkt als ich.

die ein/zwei wochen geb ich dem wert u.U noch.
Ist schon blöde wenn du gleich mit rotem vorzeichen startest.
07.11.2007 22:04
Medarex Announces Election of Marc Rubin as New Board Member
PRINCETON, N.J., Nov. 7 /PRNewswire-FirstCall/ --
Medarex, (Nachrichten/Aktienkurs) Inc. today announced that Marc Rubin, M.D. has been elected by the company's Board of Directors to serve as a director on Medarex's Board, effective November 1, 2007.
Dr. Rubin is President and CEO of Titan Pharmaceutical, Inc., a biopharmaceutical company publicly traded on the American Stock Exchange. Prior to joining Titan in October 2007, he was Head of Global Research and Development for Bayer Schering Pharma and a member of the Executive Committee of Bayer Healthcare and the Board of Management of Bayer Schering Pharma. Prior to his position at Bayer Schering Pharma, Dr. Rubin was a Member of the Executive Board and President of Development for Schering AG, as well as Chairman of Schering Berlin Inc. and President of Berlex Pharmaceuticals, a division of Schering AG. His position included responsibility for three Global Business Units. Before joining Schering AG, Dr. Rubin held several positions of increasing responsibility at GlaxoSmithKline, including oversight of the development, approval and commercial strategy for numerous programs. Dr. Rubin completed his clinical training in internal medicine at The Johns Hopkins Hospital and subspecialty training in both oncology and infectious disease at the National Institutes of Health. He received his M.D. from Cornell University Medical College and did his undergraduate work at Cornell University.
"We are very pleased Marc is joining our Board of Directors," said Howard H. Pien, President and CEO of Medarex. "He brings strong industry experience to our Board which will complement the Board's leadership in continuing to guide the company's future growth strategy and value creation."
About Medarex
Medarex is a biopharmaceutical company focused on the discovery, development and potential commercialization of fully human antibody-based therapeutics to treat life-threatening and debilitating diseases, including cancer, inflammation, autoimmune disorders and infectious diseases. Medarex applies its UltiMAb(R) technology and product development and clinical manufacturing experience to generate, support and potentially commercialize a broad range of fully human antibody product candidates for itself and its partners. More than 30 of these therapeutic product candidates derived from Medarex technology are in human clinical testing or have had INDs submitted for such trials, with seven of the most advanced product candidates currently in Phase III clinical trials. Medarex is committed to building value by developing a diverse pipeline of antibody products to address the world's unmet healthcare needs. For more information about Medarex, visit its website at http://www.medarex.com/.
Medarex(R), the Medarex logo and UltiMAb(R) are registered trademarks of Medarex, Inc. All rights are reserved.
http://www.finanznachrichten.de/nachrichten-2007-11/artikel-…
Medarex Announces Election of Marc Rubin as New Board Member
PRINCETON, N.J., Nov. 7 /PRNewswire-FirstCall/ --
Medarex, (Nachrichten/Aktienkurs) Inc. today announced that Marc Rubin, M.D. has been elected by the company's Board of Directors to serve as a director on Medarex's Board, effective November 1, 2007.
Dr. Rubin is President and CEO of Titan Pharmaceutical, Inc., a biopharmaceutical company publicly traded on the American Stock Exchange. Prior to joining Titan in October 2007, he was Head of Global Research and Development for Bayer Schering Pharma and a member of the Executive Committee of Bayer Healthcare and the Board of Management of Bayer Schering Pharma. Prior to his position at Bayer Schering Pharma, Dr. Rubin was a Member of the Executive Board and President of Development for Schering AG, as well as Chairman of Schering Berlin Inc. and President of Berlex Pharmaceuticals, a division of Schering AG. His position included responsibility for three Global Business Units. Before joining Schering AG, Dr. Rubin held several positions of increasing responsibility at GlaxoSmithKline, including oversight of the development, approval and commercial strategy for numerous programs. Dr. Rubin completed his clinical training in internal medicine at The Johns Hopkins Hospital and subspecialty training in both oncology and infectious disease at the National Institutes of Health. He received his M.D. from Cornell University Medical College and did his undergraduate work at Cornell University.
"We are very pleased Marc is joining our Board of Directors," said Howard H. Pien, President and CEO of Medarex. "He brings strong industry experience to our Board which will complement the Board's leadership in continuing to guide the company's future growth strategy and value creation."
About Medarex
Medarex is a biopharmaceutical company focused on the discovery, development and potential commercialization of fully human antibody-based therapeutics to treat life-threatening and debilitating diseases, including cancer, inflammation, autoimmune disorders and infectious diseases. Medarex applies its UltiMAb(R) technology and product development and clinical manufacturing experience to generate, support and potentially commercialize a broad range of fully human antibody product candidates for itself and its partners. More than 30 of these therapeutic product candidates derived from Medarex technology are in human clinical testing or have had INDs submitted for such trials, with seven of the most advanced product candidates currently in Phase III clinical trials. Medarex is committed to building value by developing a diverse pipeline of antibody products to address the world's unmet healthcare needs. For more information about Medarex, visit its website at http://www.medarex.com/.
Medarex(R), the Medarex logo and UltiMAb(R) are registered trademarks of Medarex, Inc. All rights are reserved.
http://www.finanznachrichten.de/nachrichten-2007-11/artikel-…
Antwort auf Beitrag Nr.: 32.333.984 von GuHu1 am 07.11.07 23:21:29ich muss halt schauen, wo ich noch freies Kapital aufgetrieben bekomme, da meine Invests meist langfristig ausgelegt sind.
Mal schauen.

Mal schauen.

Antwort auf Beitrag Nr.: 32.334.196 von Poppholz am 07.11.07 23:52:09ich bin i.d.r auch immer long.
aber heute kannste froh sein das du nicht flüssig warst
aber heute kannste froh sein das du nicht flüssig warst

Antwort auf Beitrag Nr.: 32.334.274 von GuHu1 am 08.11.07 00:03:18und das bei den meisten Aktien auf meiner Watchlist.
Bald wird der BioTec Bereich aber auch wieder anziehen und dann werde ich hoffentlich rechtzeitig dabei sein.

Bald wird der BioTec Bereich aber auch wieder anziehen und dann werde ich hoffentlich rechtzeitig dabei sein.

Antwort auf Beitrag Nr.: 32.333.003 von GuHu1 am 07.11.07 21:58:51Medarex ist kein Einproduktunternehmen wie Dendreon oder GPC Biotech. Daher kennst du das sicherlich, hier wird es aber ein schönes Leben auch nach dem "Tod" geben. 

Hier ist die Nachricht. Natürlich wieder mal OHNE Erwähnung von Medarex, dies ist wahrscheinlich so mit JnJ vertraglich vereinbart. 3-5% auch dieses Produkts werden an Medarex fliessen. Zur Erinnerung: anti-TNF-alpha Antikörper hatten in 2006 zusammen einen Umsatz von über 10 Millionen USD!
CNTO148 hat ein überlegenes Dosierungsschema gegenüber den Blockbustern Humira, Enbrel und auch Remicade, welches nicht vom Patienten selbst gespritzt werden kann. Es soll den Blockbuster Remicade bei JnJ ersetzen, da dieser kein vollhumaner AK ist. Im Prinzip also sehr gute Nachrichten, aber dadurch, dass es der Markt nicht erfährt tut sich im Preis positives.
---------------------
J&J, Schering-Plough arthritis drug meets goals
Wed Nov 7, 2007 6:40pm EST
By Toni Clarke
BOSTON, Nov. 7 (Reuters) - Johnson & Johnson (JNJ.N: Quote, Profile, Research) and Schering-Plough Corp (SGP.N: Quote, Profile, Research) said on Wednesday that their experimental drug golimumab was effective in clinical trials in reducing symptoms of psoriatic arthritis and ankylosing spondylitis -- conditions related to rheumatoid arthritis.
In two late-stage studies, golimumab met the main goals and significantly improved symptoms of both disorders compared to patients taking a placebo, according to data presented at the annual scientific meeting of the American College of Rheumatology in Boston.
Psoriatic arthritis combines the characteristics of arthritis and the skin disorder psoriasis, while ankylosing spondylitis is a progressive form of spinal arthritis that can cause fusing of the vertebrae.
Golimumab works by blocking an inflammatory protein known as tumor necrosis factor, or TNF.
In a 405-person trial of patients with psoriatic arthritis, 51 percent of patients receiving 50 milligrams of the drug and 45 percent of patients taking 100 mg saw their arthritis symptoms improve by at least 20 percent, compared with 9 percent of patients taking a placebo after 14 weeks.
At 24 weeks, 61 percent of patients who took the higher dose of golimumab achieved a 20 percent reduction in their symptoms, compared to 12 percent of patients who took a placebo. Of patients who took the lower dose, 52 percent achieved a 20 percent improvement, researchers said.
In a trial of 356 patients with active ankylosing spondylitis, 59 percent of patients receiving 50 mg of the drug and 60 percent of patients receiving 100 mg achieved at least a 20 percent improvement in their symptoms, compared with 22 percent of patients taking a placebo at 14 weeks.
At 24 weeks, 66 percent of patients receiving the higher dose of golimumab and 56 percent who took the lower dose achieved a 20 percent improvement in symptoms compared with 23 percent of patients receiving a placebo.
The drug is also in late stage trials as a treatment for rheumatoid arthritis with results expected next year.
J&J said it expects to file for marketing approval for all three indications in 2008.
Anti-TNF drugs are one of the most successful groups of all biologic medicines. They include Abbott Laboratories' (ABT.N: Quote, Profile, Research) Humira, Amgen Inc's (AMGN.O: Quote, Profile, Research) Enbrel and J&J's (JNJ.N: Quote, Profile, Research) Remicade, which together generated sales of nearly $10 billion in 2006.
Side effects of golimumab were similar to those seen with other TNF-inhibitors, said Dr. Arthur Kavanaugh, professor of medicine at the University of California, San Diego, and lead investigator of the psoriatic arthritis trial.
Golimumab's makers believe it will have a competitive edge over other drugs in the class as it is injected by the patient once a month. Rival Humira must be injected once every two weeks and Enbrel is injected once a week. Remicade is given once every two months intravenously at the hospital or doctor's office.
The companies hope golimumab will also win approval to be given as an intravenous treatment once every three months.
CNTO148 hat ein überlegenes Dosierungsschema gegenüber den Blockbustern Humira, Enbrel und auch Remicade, welches nicht vom Patienten selbst gespritzt werden kann. Es soll den Blockbuster Remicade bei JnJ ersetzen, da dieser kein vollhumaner AK ist. Im Prinzip also sehr gute Nachrichten, aber dadurch, dass es der Markt nicht erfährt tut sich im Preis positives.
---------------------
J&J, Schering-Plough arthritis drug meets goals
Wed Nov 7, 2007 6:40pm EST
By Toni Clarke
BOSTON, Nov. 7 (Reuters) - Johnson & Johnson (JNJ.N: Quote, Profile, Research) and Schering-Plough Corp (SGP.N: Quote, Profile, Research) said on Wednesday that their experimental drug golimumab was effective in clinical trials in reducing symptoms of psoriatic arthritis and ankylosing spondylitis -- conditions related to rheumatoid arthritis.
In two late-stage studies, golimumab met the main goals and significantly improved symptoms of both disorders compared to patients taking a placebo, according to data presented at the annual scientific meeting of the American College of Rheumatology in Boston.
Psoriatic arthritis combines the characteristics of arthritis and the skin disorder psoriasis, while ankylosing spondylitis is a progressive form of spinal arthritis that can cause fusing of the vertebrae.
Golimumab works by blocking an inflammatory protein known as tumor necrosis factor, or TNF.
In a 405-person trial of patients with psoriatic arthritis, 51 percent of patients receiving 50 milligrams of the drug and 45 percent of patients taking 100 mg saw their arthritis symptoms improve by at least 20 percent, compared with 9 percent of patients taking a placebo after 14 weeks.
At 24 weeks, 61 percent of patients who took the higher dose of golimumab achieved a 20 percent reduction in their symptoms, compared to 12 percent of patients who took a placebo. Of patients who took the lower dose, 52 percent achieved a 20 percent improvement, researchers said.
In a trial of 356 patients with active ankylosing spondylitis, 59 percent of patients receiving 50 mg of the drug and 60 percent of patients receiving 100 mg achieved at least a 20 percent improvement in their symptoms, compared with 22 percent of patients taking a placebo at 14 weeks.
At 24 weeks, 66 percent of patients receiving the higher dose of golimumab and 56 percent who took the lower dose achieved a 20 percent improvement in symptoms compared with 23 percent of patients receiving a placebo.
The drug is also in late stage trials as a treatment for rheumatoid arthritis with results expected next year.
J&J said it expects to file for marketing approval for all three indications in 2008.
Anti-TNF drugs are one of the most successful groups of all biologic medicines. They include Abbott Laboratories' (ABT.N: Quote, Profile, Research) Humira, Amgen Inc's (AMGN.O: Quote, Profile, Research) Enbrel and J&J's (JNJ.N: Quote, Profile, Research) Remicade, which together generated sales of nearly $10 billion in 2006.
Side effects of golimumab were similar to those seen with other TNF-inhibitors, said Dr. Arthur Kavanaugh, professor of medicine at the University of California, San Diego, and lead investigator of the psoriatic arthritis trial.
Golimumab's makers believe it will have a competitive edge over other drugs in the class as it is injected by the patient once a month. Rival Humira must be injected once every two weeks and Enbrel is injected once a week. Remicade is given once every two months intravenously at the hospital or doctor's office.
The companies hope golimumab will also win approval to be given as an intravenous treatment once every three months.
Wie gut, daß es 10 Milliarden und nicht 10 Millionen sind. Remicade hatte einen Umsatz von 1,2 Milliarden in 2006. Wenn Golimumab dieses nun ersetzt, dann sollte MEDX Royalties on Höhe von 36-60 Millionen pro Jahr bekommen. Nicht die Welt, aber immerhin.
Aber wenn ich nur daran denke, daß Genmab mittlerweile doppelt so viel kostet wie MEDX, dann wird mir schlecht. Aber so ist das eben, wenn man mit die besten Produkte seiner Frau gibt, damit sie eine eigene Firma hat. Die Familie hat den Nutzen, der Aktionär das Nachsehen.
Aber wenn ich nur daran denke, daß Genmab mittlerweile doppelt so viel kostet wie MEDX, dann wird mir schlecht. Aber so ist das eben, wenn man mit die besten Produkte seiner Frau gibt, damit sie eine eigene Firma hat. Die Familie hat den Nutzen, der Aktionär das Nachsehen.
Antwort auf Beitrag Nr.: 32.338.242 von Ennox am 08.11.07 11:37:10Darf ich dich korrigieren? Remicade hatte einen Umsatz von über 2,5 Millionen USD in 2006. Siehe Platz 18 der Tabelle unten. Konkurrent Enbrel übrigens mit über 3 Mrd USd auf Platz 8. Humira kommt auf Platz 52, dürfte sich 2007 aber stark verbessert haben.


Naja ich hoffe es waren nicht wirklich nur
Remicade hatte einen Umsatz von über 2,5 Millionen USD in 2006.
da würde ich das Nichtbeachten des Marktes schon verstehen.
Ich geh mal davon aus, dass es sich auch hier um Milliarden handelt. Schafft es Golimumab in dieser Größenordnung wären das satte 125 Mill. USD an Royalities.
Interessant ist zur Zeit wohl wirklich nur MEDX-010.
Remicade hatte einen Umsatz von über 2,5 Millionen USD in 2006.
da würde ich das Nichtbeachten des Marktes schon verstehen.

Ich geh mal davon aus, dass es sich auch hier um Milliarden handelt. Schafft es Golimumab in dieser Größenordnung wären das satte 125 Mill. USD an Royalities.

Interessant ist zur Zeit wohl wirklich nur MEDX-010.

Antwort auf Beitrag Nr.: 32.339.101 von Lycos2 am 08.11.07 12:27:51Natürlich Milliarden. 

Endlich mal etwas PR von Medarex ... wird auch Zeit nach all der Abschlachterei trotz guter News in Serie!!
-----------
Press Release Source: Medarex, Inc.
Medarex Announces Presentations on UltiMAb(R) Antibodies at 71st Annual Meeting of the American College of Rheumatology
Thursday November 8, 7:00 am ET
PRINCETON, N.J., Nov. 8 /PRNewswire-FirstCall/ -- Medarex, Inc. (Nasdaq: MEDX - News) announced today that at least five antibodies generated from Medarex's UltiMAb® technology in which Medarex wholly owns or has an economic interest through co-promote/profit sharing rights, royalties and/or equity ownership, are expected to be the subject of oral or poster presentations at the 71st Annual Meeting of the American College of Rheumatology (ACR), being held November 6-11, 2007 in Boston.
Golimumab (CNTO 148) and ustekinumab (CNTO 1275) Phase III or Phase II clinical data for inflammatory diseases in development by Medarex's licensing partner, Centocor, Inc.
-- "Golimumab, a new, human TNF-alpha antibody administered as a monthly
subcutaneous injection in ankylosing spondylitis (AS): 24-week efficacy
and safety results of the randomized, placebo-controlled GO-RAISE
study" (Presentation #L10, Spondylarthropathies and Psoriatic Arthritis
Session) - Poster presentation scheduled for Thursday, November 8, 2007
at 8:00 A.M.
-- "Characterization of golimumab (CNTO 148), a novel monoclonal antibody
specific for human TNFa" (Presentation #274, RA Treatment: Small
Molecules Sessions) - Poster presentation scheduled for Thursday,
November 8, 2007 at 8:00 A.M.
-- "Phase II, randomized, placebo-controlled study of CNTO 1275, a human
interleukin-12/23 monoclonal antibody, in psoriatic arthritis"
(Presentation #L16, Spondylarthropathies and Psoriatic Arthritis
Session) - Oral presentation scheduled for Saturday, November 10, 2007
at 3:15 P.M.
-- "Golimumab, a new human TNF-alpha antibody administered as a monthly
subcutaneous injection in psoriatic arthritis: 24-week efficacy and
safety results of the randomized, placebo-controlled GO-REVEAL study"
(Presentation #L14, Spondylarthropathies and Psoriatic Arthritis
Session) - Oral presentation scheduled for Saturday, November 10, 2007
at 2:45 P.M.
On November 1, 2007, Johnson & Johnson announced that it will sponsor an analyst meeting and webcast on Thursday, November 8, 2007, from 5:00-6:00 P.M. Eastern Time to discuss late-stage compounds, including golimumab and ustekinumab.
Ofatumumab (HuMax-CD20) Phase II clinical data for rheumatoid arthritis in development by Medarex's licensing partner, Genmab A/S
-- "Ofatumumab, a human CD20 monoclonal antibody, in the treatment of
rheumatoid arthritis: early results from an ongoing, double-blind,
randomized, placebo controlled clinical trial" (Presentation #2086, RA
Treatment: Small Molecules Session) - Poster presentation scheduled for
Saturday, November 10, 2007 at 3:00 P.M.
MEDI-545 Phase I clinical data for systemic lupus erythematosus in development by Medarex's partner, MedImmune, Inc.
-- "Safety of MEDI-545, an anti-interferon-. monoclonal antibody, in
MI-CP126, a phase I study in systemic lupus erythematosus (SLE)"
(Presentation #428, SLE Session) - Poster presentation scheduled for
Thursday, November 8, 2007 at 8:00 A.M.
-- "Neutralization of type I IFN inducible genes in phase I trial of
anti-IFNa mAb for the treatment of SLE: utility as pharmacodynamic
markers" (Presentation #429, SLE Session) - Poster presentation
scheduled for Thursday, November 8, 2007 at 8:00 A.M.
-- "Anti-IFN-a antibody neutralization of early and late transcriptional
responses in PBMC stimulated with serum from SLE patients"
(Presentation #840, Genetics, Genomics and Proteomics Session) - Poster
presentation scheduled for Friday, November 9, 2007 at 8:00 A.M.
-- "MEDI-545, an anti-interferon alpha monoclonal antibody, shows evidence
of clinical activity in systemic lupus erythematosus" (Presentation
#1315, SLE Session) - Oral presentation scheduled for Friday, November
9, 2007 at 2:30 P.M.
Preclinical data for an anti-CD70 antibody in development by Medarex
-- "Functional blocking and targeted depletion of activated lymphocytes by
fucosylated and non-fucosylated fully human anti-CD70 IgG1"
(Presentation #1984, T-cell Biology and Targets in Autoimmune Disease
Session) - Poster presentation scheduled for Saturday, November 10,
2007 at 8:00 A.M.
-----------
Press Release Source: Medarex, Inc.
Medarex Announces Presentations on UltiMAb(R) Antibodies at 71st Annual Meeting of the American College of Rheumatology
Thursday November 8, 7:00 am ET
PRINCETON, N.J., Nov. 8 /PRNewswire-FirstCall/ -- Medarex, Inc. (Nasdaq: MEDX - News) announced today that at least five antibodies generated from Medarex's UltiMAb® technology in which Medarex wholly owns or has an economic interest through co-promote/profit sharing rights, royalties and/or equity ownership, are expected to be the subject of oral or poster presentations at the 71st Annual Meeting of the American College of Rheumatology (ACR), being held November 6-11, 2007 in Boston.
Golimumab (CNTO 148) and ustekinumab (CNTO 1275) Phase III or Phase II clinical data for inflammatory diseases in development by Medarex's licensing partner, Centocor, Inc.
-- "Golimumab, a new, human TNF-alpha antibody administered as a monthly
subcutaneous injection in ankylosing spondylitis (AS): 24-week efficacy
and safety results of the randomized, placebo-controlled GO-RAISE
study" (Presentation #L10, Spondylarthropathies and Psoriatic Arthritis
Session) - Poster presentation scheduled for Thursday, November 8, 2007
at 8:00 A.M.
-- "Characterization of golimumab (CNTO 148), a novel monoclonal antibody
specific for human TNFa" (Presentation #274, RA Treatment: Small
Molecules Sessions) - Poster presentation scheduled for Thursday,
November 8, 2007 at 8:00 A.M.
-- "Phase II, randomized, placebo-controlled study of CNTO 1275, a human
interleukin-12/23 monoclonal antibody, in psoriatic arthritis"
(Presentation #L16, Spondylarthropathies and Psoriatic Arthritis
Session) - Oral presentation scheduled for Saturday, November 10, 2007
at 3:15 P.M.
-- "Golimumab, a new human TNF-alpha antibody administered as a monthly
subcutaneous injection in psoriatic arthritis: 24-week efficacy and
safety results of the randomized, placebo-controlled GO-REVEAL study"
(Presentation #L14, Spondylarthropathies and Psoriatic Arthritis
Session) - Oral presentation scheduled for Saturday, November 10, 2007
at 2:45 P.M.
On November 1, 2007, Johnson & Johnson announced that it will sponsor an analyst meeting and webcast on Thursday, November 8, 2007, from 5:00-6:00 P.M. Eastern Time to discuss late-stage compounds, including golimumab and ustekinumab.
Ofatumumab (HuMax-CD20) Phase II clinical data for rheumatoid arthritis in development by Medarex's licensing partner, Genmab A/S
-- "Ofatumumab, a human CD20 monoclonal antibody, in the treatment of
rheumatoid arthritis: early results from an ongoing, double-blind,
randomized, placebo controlled clinical trial" (Presentation #2086, RA
Treatment: Small Molecules Session) - Poster presentation scheduled for
Saturday, November 10, 2007 at 3:00 P.M.
MEDI-545 Phase I clinical data for systemic lupus erythematosus in development by Medarex's partner, MedImmune, Inc.
-- "Safety of MEDI-545, an anti-interferon-. monoclonal antibody, in
MI-CP126, a phase I study in systemic lupus erythematosus (SLE)"
(Presentation #428, SLE Session) - Poster presentation scheduled for
Thursday, November 8, 2007 at 8:00 A.M.
-- "Neutralization of type I IFN inducible genes in phase I trial of
anti-IFNa mAb for the treatment of SLE: utility as pharmacodynamic
markers" (Presentation #429, SLE Session) - Poster presentation
scheduled for Thursday, November 8, 2007 at 8:00 A.M.
-- "Anti-IFN-a antibody neutralization of early and late transcriptional
responses in PBMC stimulated with serum from SLE patients"
(Presentation #840, Genetics, Genomics and Proteomics Session) - Poster
presentation scheduled for Friday, November 9, 2007 at 8:00 A.M.
-- "MEDI-545, an anti-interferon alpha monoclonal antibody, shows evidence
of clinical activity in systemic lupus erythematosus" (Presentation
#1315, SLE Session) - Oral presentation scheduled for Friday, November
9, 2007 at 2:30 P.M.
Preclinical data for an anti-CD70 antibody in development by Medarex
-- "Functional blocking and targeted depletion of activated lymphocytes by
fucosylated and non-fucosylated fully human anti-CD70 IgG1"
(Presentation #1984, T-cell Biology and Targets in Autoimmune Disease
Session) - Poster presentation scheduled for Saturday, November 10,
2007 at 8:00 A.M.
Antwort auf Beitrag Nr.: 32.339.101 von Lycos2 am 08.11.07 12:27:51Die Analysten schaffen es wohl, selbst in P3 Beteiligung am Erfolg über Tantiememodelle auszublenden.
Focus liegt auf Eigenentwicklung, wobei man da aber immerhin noch das volle Vermarktungsrisiko trägt.
3 oder 5% Tantieme von 0 Umsatz an sind ja letztlich einfacher zu handeln und wesentlich weniger riskant als ein Vertriebsaufbau, Produktion, Marketing usw. um dann am Ende 15 bis 25% marge zu erzielen, wenn alles klappt.
Focus liegt auf Eigenentwicklung, wobei man da aber immerhin noch das volle Vermarktungsrisiko trägt.
3 oder 5% Tantieme von 0 Umsatz an sind ja letztlich einfacher zu handeln und wesentlich weniger riskant als ein Vertriebsaufbau, Produktion, Marketing usw. um dann am Ende 15 bis 25% marge zu erzielen, wenn alles klappt.
RT bereits wieder auf 11,90.
War das jetzt noch die deftige Bärenfalle zum Abschluss?
[URL ]http://www.tradesignalonline.com/content.asp?p=wpa/tsb/default.asp&fcid=2422576[/URL]
]http://www.tradesignalonline.com/content.asp?p=wpa/tsb/default.asp&fcid=2422576[/URL]
[URLChart öffnen]http://www.tradesignalonline.com/content.asp?p=wpa/tsb/default.asp&fcid=2422576[/URL]
War das jetzt noch die deftige Bärenfalle zum Abschluss?
[URL
[URLChart öffnen]http://www.tradesignalonline.com/content.asp?p=wpa/tsb/default.asp&fcid=2422576[/URL]
ville,
da brennen heut ein paar shorties. Wer hat denn jetzt die Lunte gezündet, bzw. welcher Vortrag wars?
da brennen heut ein paar shorties. Wer hat denn jetzt die Lunte gezündet, bzw. welcher Vortrag wars?
Antwort auf Beitrag Nr.: 32.335.471 von Ville7 am 08.11.07 08:50:59yep 

JnJ Präsentation:
http://www.investor.jnj.com/downloads/28221jnj.pdf
Ein paar Fakten:
Golimumab (CNTO 148):
Golimumab hat das beste Dosierungsschema aller anti-TNF-alphas.
Positive Daten in Psoriatic Arthritis und Ankylosing Spondylitis bei guter Sicherheit.
Ausstehende Phase III Daten: Diverse Trials zu Rhuematodider Arthritis, Präsentation im Sommer 2008 (EULAR). Zudem IV Dosing noch kein Publikations-Termin festgelegt.
BLA Filing EU/USA in HJ1 2008.
Ustekinumab (CNTO 1275):
Proriasis Phase III: best in class Ergebnisse, nur alle 12 Wochen zu verabreichen! Gute Sicherheit.
Psoriatic Arthritis: Gute Phase II Ergebnisse. Gute Sicherheit.
BLA Filing EU/USA in Q4 2007.
http://www.investor.jnj.com/downloads/28221jnj.pdf
Ein paar Fakten:
Golimumab (CNTO 148):
Golimumab hat das beste Dosierungsschema aller anti-TNF-alphas.
Positive Daten in Psoriatic Arthritis und Ankylosing Spondylitis bei guter Sicherheit.
Ausstehende Phase III Daten: Diverse Trials zu Rhuematodider Arthritis, Präsentation im Sommer 2008 (EULAR). Zudem IV Dosing noch kein Publikations-Termin festgelegt.
BLA Filing EU/USA in HJ1 2008.
Ustekinumab (CNTO 1275):
Proriasis Phase III: best in class Ergebnisse, nur alle 12 Wochen zu verabreichen! Gute Sicherheit.
Psoriatic Arthritis: Gute Phase II Ergebnisse. Gute Sicherheit.
BLA Filing EU/USA in Q4 2007.
Vielleicht reichts jetzt mal für einen Trendbruch?

Im Stundenchart gerade:
Rising Three Methods
In einem Aufwärtstrend ereignet sich ein langer, weißer Körper, gefolgt von drei Tagen mit einem dezenten Abwärtstrend.
Am fünften Tag nehmen die "Bullen" das Ruder und der Kurs klettert in neue Höhen.
Dieser schwache Abwärtstrend zwischen zwei Tagen mit einem langen, weißen Body bedeutet, daß die Investoren eine kurzfristige Verschnaufpause eingelegt hatten, der Aufwärtstrend aber weiter bestehen bleibt.
Aussagekraft: gut
Im Stundenchart gerade:

Rising Three Methods
In einem Aufwärtstrend ereignet sich ein langer, weißer Körper, gefolgt von drei Tagen mit einem dezenten Abwärtstrend.
Am fünften Tag nehmen die "Bullen" das Ruder und der Kurs klettert in neue Höhen.
Dieser schwache Abwärtstrend zwischen zwei Tagen mit einem langen, weißen Body bedeutet, daß die Investoren eine kurzfristige Verschnaufpause eingelegt hatten, der Aufwärtstrend aber weiter bestehen bleibt.
Aussagekraft: gut
aus Yahoo:
News Very Soon
2 minutes ago
erniewerner
52/Male
The 150 patient monotherapy trial shows completed as of 11/08/07. The 110 patient prophylactic budesonide trial shows complete as of 11/01/07. The dose escalation trial is still showing an "active, not recruiting" status.
If MEDX/BMY doesn't have topline results from the 2 completed trials yet, they should get them very soon. A news release should follow shortly. One of the best ways to minimize leaks is to not keep secrets.
http://www.clinicaltrials.gov/archive/NCT00289627/2007_11_08…
News Very Soon
2 minutes ago
erniewerner
52/Male
The 150 patient monotherapy trial shows completed as of 11/08/07. The 110 patient prophylactic budesonide trial shows complete as of 11/01/07. The dose escalation trial is still showing an "active, not recruiting" status.
If MEDX/BMY doesn't have topline results from the 2 completed trials yet, they should get them very soon. A news release should follow shortly. One of the best ways to minimize leaks is to not keep secrets.
http://www.clinicaltrials.gov/archive/NCT00289627/2007_11_08…
Antwort auf Beitrag Nr.: 32.396.035 von Ville7 am 12.11.07 17:29:09Naja, Eselsgalopp.

[URL ]http://www.tradesignalonline.com/content.asp?p=wpa/tsb/default.asp&fcid=2428992[/URL]
]http://www.tradesignalonline.com/content.asp?p=wpa/tsb/default.asp&fcid=2428992[/URL]
[URLChart öffnen]http://www.tradesignalonline.com/content.asp?p=wpa/tsb/default.asp&fcid=2428992[/URL]
Erst bis 14 und dann 25. Wird auch Zeit.

[URL
[URLChart öffnen]http://www.tradesignalonline.com/content.asp?p=wpa/tsb/default.asp&fcid=2428992[/URL]
Erst bis 14 und dann 25. Wird auch Zeit.

[URL ]http://www.tradesignalonline.com/content.asp?p=wpa/tsb/default.asp&fcid=2431803[/URL]
]http://www.tradesignalonline.com/content.asp?p=wpa/tsb/default.asp&fcid=2431803[/URL]
[URLChart öffnen]http://www.tradesignalonline.com/content.asp?p=wpa/tsb/default.asp&fcid=2431803[/URL]
Wenigstens mal bis 14 zurück?
[URLChart öffnen]http://www.tradesignalonline.com/content.asp?p=wpa/tsb/default.asp&fcid=2431803[/URL]
Wenigstens mal bis 14 zurück?
Institutional Ownership laut Nasdaq auf 103,9% angestiegen. (Anmerkung: eine Insitutional Holdership von über 100% ist durch die hohe Shortquote möglich)
Short interest zudem wieder angestiegen:
Settlement Date | Short Interest | Avg Daily Share Volume | Days to Cover
Oct. 31, 2007 33,032,782 2,477,841 13.33
25.40% des Floats sind somit Short!
----------------------------------------
Im Falle guter MDX-010 Daten werden wir DNDN ähnliche Verhältnisse sehen (Short Squeeze). Den negativen Fall darf man natürlich nicht ausklammern. Nicht umsonst spekulieren so viele auf schlechte MDX-010 Monotherapie Ergebnisse.
Short interest zudem wieder angestiegen:
Settlement Date | Short Interest | Avg Daily Share Volume | Days to Cover
Oct. 31, 2007 33,032,782 2,477,841 13.33
25.40% des Floats sind somit Short!
----------------------------------------
Im Falle guter MDX-010 Daten werden wir DNDN ähnliche Verhältnisse sehen (Short Squeeze). Den negativen Fall darf man natürlich nicht ausklammern. Nicht umsonst spekulieren so viele auf schlechte MDX-010 Monotherapie Ergebnisse.
Was noch interessanter ist: die Bank of Amerika hat ihre Holding um mehr als eine Million Aktien erhöht. Und das zu Kursen weit über ihrem Kursziel ihres Initial Covering (Analyse) von 10 USD.
Owner Name | Date | Shares Held | Change (Shares) | % Change (Shares) | Value ($1000)
BANK OF AMERICA CORP... 9/30/2007 1,081,316 1,049,705 >1,000.00% $12,954
Jeder möge sich nun seinen Teil über die wahren Interessen der BoA denken.
Owner Name | Date | Shares Held | Change (Shares) | % Change (Shares) | Value ($1000)
BANK OF AMERICA CORP... 9/30/2007 1,081,316 1,049,705 >1,000.00% $12,954
Jeder möge sich nun seinen Teil über die wahren Interessen der BoA denken.
Institutional Holdings nun 110% !!! Hier schauen:
http://www.nasdaq.com/asp/holdings.asp?mode=&kind=&symbol=me…
Die dritte Studie ist nun auch auf completed gesetzt!
http://www.clinicaltrials.gov/ct2/show/NCT00289640?term=mdx+…
Damit sind nun alle drei Studien auf completed. Zur Erinnerung: topline data besteht aus drei Phase II Studien.
D.h. ab jetzt ist jeden Tag mit der Veröffentlichung der topline MDX-010 Ergebnissen zu rechnen!
Viel Glück an alle Longs!
http://www.nasdaq.com/asp/holdings.asp?mode=&kind=&symbol=me…
Die dritte Studie ist nun auch auf completed gesetzt!
http://www.clinicaltrials.gov/ct2/show/NCT00289640?term=mdx+…
Damit sind nun alle drei Studien auf completed. Zur Erinnerung: topline data besteht aus drei Phase II Studien.
D.h. ab jetzt ist jeden Tag mit der Veröffentlichung der topline MDX-010 Ergebnissen zu rechnen!
Viel Glück an alle Longs!
Antwort auf Beitrag Nr.: 32.432.277 von Ville7 am 15.11.07 04:42:57nun 110%
Wenn ich solche Zahlen lese, kann ich es immer fast nicht glauben.
Der Markt ist so vollgepumpt mit liqui, dass man das Geld nicht mehr unterkriegt. Und da wird mit irren Volumen eben auch short gegangen.
Was Medx fehlt sind die Nachrichten die cash bringen, bzw. wenigstens zügig Aussicht darauf. Der Quartalsverlust/die burnrate ist immer noch gewaltig. Und dafür wird ein enormes Potential mit einer Reihe von Kandidaten entwickelt. Es wird Zeit, das hier der Kostendeckungstrend dreht, dann explodiert der Kurs. Bei der short rate sowieso.
Wenn ich solche Zahlen lese, kann ich es immer fast nicht glauben.
Der Markt ist so vollgepumpt mit liqui, dass man das Geld nicht mehr unterkriegt. Und da wird mit irren Volumen eben auch short gegangen.
Was Medx fehlt sind die Nachrichten die cash bringen, bzw. wenigstens zügig Aussicht darauf. Der Quartalsverlust/die burnrate ist immer noch gewaltig. Und dafür wird ein enormes Potential mit einer Reihe von Kandidaten entwickelt. Es wird Zeit, das hier der Kostendeckungstrend dreht, dann explodiert der Kurs. Bei der short rate sowieso.
Antwort auf Beitrag Nr.: 32.438.821 von eck64 am 15.11.07 15:28:23aus yahoo message board:
ich weiß nicht ob s neu ist:
ORR 17% (Not rated) 19 minutes ago
http://clincancerres.aacrjournals.org/cg...
Prognostic Factors Related to Clinical Response in Patients with Metastatic Melanoma Treated by CTL-Associated Antigen-4 Blockade
Stephanie G. Downey1, Jacob A. Klapper1, Franz O. Smith1, James C. Yang1, Richard M. Sherry1, Richard E. Royal1, Udai S. Kammula1, Marybeth S. Hughes1, Tamika E. Allen1, Catherine L. Levy1, Michael Yellin3, Geoffrey Nichol3, Donald E. White1, Seth M. Steinberg2 and Steven A. Rosenberg1
Authors' Affiliations: 1 Surgery Branch and the 2 Biostatistics and Data Management Section, Center for Cancer Research, National Cancer Institute, NIH, Bethesda, Maryland and 3 Medarex, Inc., Princeton, New Jersey
Requests for reprints: Steven A. Rosenberg, Surgery Branch, National Cancer Institute, NIH, Room 3-3940, 10 Center Drive, Bethesda, MD 20892-1201. Phone: 301-496-4164; E-mail: sar@nih.gov.
Purpose: CTL-associated antigen 4 (CTLA-4) can inhibit T-cell activation and helps maintain peripheral self-tolerance. Previously, we showed immune-related adverse events (IRAE) and objective, durable clinical responses in patients with metastatic melanoma treated with CTLA-4 blockade. We have now treated 139 patients in two trials and have sufficient follow-up to examine factors associated with clinical response.
Experimental Design: A total of 139 patients with metastatic melanoma were treated: 54 patients received ipilimumab in conjunction with peptide vaccinations and 85 patients were treated with intra-patient dose escalation of ipilimumab and randomized to receive peptides in accordance with HLA-A*0201 status.
Results: Three patients achieved complete responses (CR; ongoing at 29+, 52+, and 53+ months); an additional 20 patients achieved partial responses (PR) for an overall objective response rate of 17%. The majority of patients (62%, 86 of 139) developed some form of IRAE, which was associated with a greater probability of objective antitumor response (P = 0.0004); all patients with CR had more severe IRAEs. Prior therapy with IFN{alpha}-2b was a negative prognostic factor, whereas prior high-dose interleukin-2 did not significantly affect the probability of response. There were no significant differences in the rate of clinical response or development of IRAEs between the two trials. The duration of tumor response was not affected by the use of high-dose steroids for abrogation of treatment-related toxicities (P = 0.23). There were no treatment-related deaths.
Conclusion: In patients with metastatic melanoma, ipilimumab can induce durable objective clinical responses, which are related to the induction of IRAEs.
ich weiß nicht ob s neu ist:
ORR 17% (Not rated) 19 minutes ago
http://clincancerres.aacrjournals.org/cg...
Prognostic Factors Related to Clinical Response in Patients with Metastatic Melanoma Treated by CTL-Associated Antigen-4 Blockade
Stephanie G. Downey1, Jacob A. Klapper1, Franz O. Smith1, James C. Yang1, Richard M. Sherry1, Richard E. Royal1, Udai S. Kammula1, Marybeth S. Hughes1, Tamika E. Allen1, Catherine L. Levy1, Michael Yellin3, Geoffrey Nichol3, Donald E. White1, Seth M. Steinberg2 and Steven A. Rosenberg1
Authors' Affiliations: 1 Surgery Branch and the 2 Biostatistics and Data Management Section, Center for Cancer Research, National Cancer Institute, NIH, Bethesda, Maryland and 3 Medarex, Inc., Princeton, New Jersey
Requests for reprints: Steven A. Rosenberg, Surgery Branch, National Cancer Institute, NIH, Room 3-3940, 10 Center Drive, Bethesda, MD 20892-1201. Phone: 301-496-4164; E-mail: sar@nih.gov.
Purpose: CTL-associated antigen 4 (CTLA-4) can inhibit T-cell activation and helps maintain peripheral self-tolerance. Previously, we showed immune-related adverse events (IRAE) and objective, durable clinical responses in patients with metastatic melanoma treated with CTLA-4 blockade. We have now treated 139 patients in two trials and have sufficient follow-up to examine factors associated with clinical response.
Experimental Design: A total of 139 patients with metastatic melanoma were treated: 54 patients received ipilimumab in conjunction with peptide vaccinations and 85 patients were treated with intra-patient dose escalation of ipilimumab and randomized to receive peptides in accordance with HLA-A*0201 status.
Results: Three patients achieved complete responses (CR; ongoing at 29+, 52+, and 53+ months); an additional 20 patients achieved partial responses (PR) for an overall objective response rate of 17%. The majority of patients (62%, 86 of 139) developed some form of IRAE, which was associated with a greater probability of objective antitumor response (P = 0.0004); all patients with CR had more severe IRAEs. Prior therapy with IFN{alpha}-2b was a negative prognostic factor, whereas prior high-dose interleukin-2 did not significantly affect the probability of response. There were no significant differences in the rate of clinical response or development of IRAEs between the two trials. The duration of tumor response was not affected by the use of high-dose steroids for abrogation of treatment-related toxicities (P = 0.23). There were no treatment-related deaths.
Conclusion: In patients with metastatic melanoma, ipilimumab can induce durable objective clinical responses, which are related to the induction of IRAEs.
Antwort auf Beitrag Nr.: 32.449.587 von uk0804 am 16.11.07 11:45:50Nicht neu.
Antwort auf Beitrag Nr.: 32.450.484 von Ville7 am 16.11.07 12:42:39Siehe Posting #3221, da findet man ein mehrseitiges PDF zu dieser Studie.
GENMAB TO PRESENT HUMAX-IL8 PRE-CLINICAL DATA
Copenhagen, Denmark; November 16, 2007 – Genmab A/S (OMX: GEN) announced today encouraging pre-clinical data on its HuMax-IL8™ antibody (formerly known as HuMax-Inflam). Pre-clinical studies characterized the exact HuMax-IL8 binding site on IL8, which overlaps with the docking site for the IL8 receptor, CXCR1. HuMax-IL8 was found to effectively block formation of new blood vessels induced by IL8 in an animal model. The antibody was also shown to affect tumor vascularization in different primary human tumors grown in immunocompromised mice. The antibody, furthermore, effectively suppressed tumor growth of primary sarcoma, melanoma and gastric tumors in immunocompromised mouse models.
“These pre-clinical data illustrate that HuMax-IL8 effectively blocks IL8-induced formation of new blood vessels and affects tumor vascularization, both of which may well play a role in the potent anti-tumor effects induced by this antibody,” said Prof. Jan G. J. van de Winkel, Ph.D, Genmab’s Chief Scientific Officer.
Prof. van de Winkel will present these data today at the European Society for Medical Oncology International Symposium on Immunology in Athens, Greece.
About HuMax-IL8
HuMax-IL8 is a high affinity fully human IgG1,κ antibody directed towards IL-8. IL-8 is a major mediator of inflammation, a potent chemoattractant for white blood cells called neutrophils, as well as an important factor in angiogenesis. HuMax-IL8 effectively blocks binding of IL-8 to neutrophils and inhibits neutrophils from migrating towards sites of inflammation via a process known as chemotaxis. HuMax-IL8 also potently inhibits IL-8 induced neutrophil activation. In pre-clinical studies, HuMax-IL8 has been shown to inhibit tumor growth in tumor models using primary human tumors in immunodeficient mice.
Copenhagen, Denmark; November 16, 2007 – Genmab A/S (OMX: GEN) announced today encouraging pre-clinical data on its HuMax-IL8™ antibody (formerly known as HuMax-Inflam). Pre-clinical studies characterized the exact HuMax-IL8 binding site on IL8, which overlaps with the docking site for the IL8 receptor, CXCR1. HuMax-IL8 was found to effectively block formation of new blood vessels induced by IL8 in an animal model. The antibody was also shown to affect tumor vascularization in different primary human tumors grown in immunocompromised mice. The antibody, furthermore, effectively suppressed tumor growth of primary sarcoma, melanoma and gastric tumors in immunocompromised mouse models.
“These pre-clinical data illustrate that HuMax-IL8 effectively blocks IL8-induced formation of new blood vessels and affects tumor vascularization, both of which may well play a role in the potent anti-tumor effects induced by this antibody,” said Prof. Jan G. J. van de Winkel, Ph.D, Genmab’s Chief Scientific Officer.
Prof. van de Winkel will present these data today at the European Society for Medical Oncology International Symposium on Immunology in Athens, Greece.
About HuMax-IL8
HuMax-IL8 is a high affinity fully human IgG1,κ antibody directed towards IL-8. IL-8 is a major mediator of inflammation, a potent chemoattractant for white blood cells called neutrophils, as well as an important factor in angiogenesis. HuMax-IL8 effectively blocks binding of IL-8 to neutrophils and inhibits neutrophils from migrating towards sites of inflammation via a process known as chemotaxis. HuMax-IL8 also potently inhibits IL-8 induced neutrophil activation. In pre-clinical studies, HuMax-IL8 has been shown to inhibit tumor growth in tumor models using primary human tumors in immunodeficient mice.
Institutional Ownership nun bei 112.8%
Quelle: Nasdaq
Stand bzw. Meldedatum: 30.9.2006
http://www.nasdaq.com/asp/holdings.asp?mode=&kind=&symbol=me…
Allerdings haben knapp 11 Millionen Aktien oder 9% der Ownership noch ein Meldedatum von 30.6.07 oder früher. In jedem Falle -sofern Nasdaqs Daten korrekt sind- lag die Institutional Ownership am 30.9. über 100%.
Quelle: Nasdaq
Stand bzw. Meldedatum: 30.9.2006
http://www.nasdaq.com/asp/holdings.asp?mode=&kind=&symbol=me…
Allerdings haben knapp 11 Millionen Aktien oder 9% der Ownership noch ein Meldedatum von 30.6.07 oder früher. In jedem Falle -sofern Nasdaqs Daten korrekt sind- lag die Institutional Ownership am 30.9. über 100%.
Anscheinend ist es in den USA ja zur Zeit in einfach so die shortquote unternehmensunspezifisch die shortquote hochzufahren, weil man allgemein mit schwachen Kursen durch die Subprimekrise und dorhende Rezession rechnet.
Einzelne Firmen sollten dann mit guten spezifischen news erhebliches Potential gegen den trend haben.
Im Sinne des Aufwärtstrends ist Medx aktuell weit unten. Also Medx gogogo.

Antwort auf Beitrag Nr.: 32.462.188 von Ville7 am 17.11.07 09:06:20ville hat mich gebeten folgende Nachricht ins Board zu stellen.
Er wird sich bei WO abmelden, da er gesperrt ist und wohl auch nicht mehr entsperrt wird.
Er wird sich bei WO abmelden, da er gesperrt ist und wohl auch nicht mehr entsperrt wird.
Antwort auf Beitrag Nr.: 32.602.573 von GundV am 28.11.07 18:20:51schade, was hat er den böses getan ? seine infos waren doch immer sachlich und kompetent
Antwort auf Beitrag Nr.: 32.602.573 von GundV am 28.11.07 18:20:51Und sonst keine Info?
Komisch - aber nicht lustig.
Gruß
Zock
Komisch - aber nicht lustig.

Gruß
Zock
Antwort auf Beitrag Nr.: 32.602.573 von GundV am 28.11.07 18:20:51wen es interessiert:
http://www.carookee.com/forum/RMBS/3/19143442#19143442
http://www.wallstreet-online.de/dyn/community/thread.html?th…
bitte als wertfreie info betrachten, nicht mehr und nicht weniger.
http://www.carookee.com/forum/RMBS/3/19143442#19143442
http://www.wallstreet-online.de/dyn/community/thread.html?th…
bitte als wertfreie info betrachten, nicht mehr und nicht weniger.

Bin kein Chartfan, aber der 5-Jahres - Medarex-Chart, besonders in US-Dollar sieht aus wie eine Kaufeinladung.
Antwort auf Beitrag Nr.: 32.662.141 von lordknut am 04.12.07 17:40:43bei bios gibt es keine charttechnik,da gibt es nur fakten
Antwort auf Beitrag Nr.: 32.662.396 von asics01 am 04.12.07 18:00:54Moin,

"...zählen nur Fakten"

Dann gab´s ja heute wohl schon wieder schlechte Nachrichten:
Medarex says FDA approves 2 IND applications for MDX-1342
By Sarah Turner
Last update: 6:09 a.m. EST Dec. 4, 2007Print RSS Disable Live Quotes
LONDON (MarketWatch) -- Medarex Inc. (MEDX:MEDX
News, chart, profile, more
Last:
Delayed quote dataAdd to portfolio
Analyst
Create alertInsider
Discuss
Financials
Sponsored by:
MEDX, , ) said that the Food & Drug Administration has approved two separate investigational new drug applications filed for MDX-1342, one for the treatment of chronic lymphocytic leukemia and the other for rheumatoid arthritis. "We are pleased with the advancement of a new product candidate from Medarex's proprietary pipeline into clinical trials," said Howard Pien, president and CEO.
Tja, Kurs im Minus, nahe 52-Wochen-Tief...
Selbst wenn immer noch kein Antrag für IpilimuMab käme, ist der Kurs ein Witz. Aber was soll´s (siehe Morphosys: Trotz erneuter Hammer-Meldung Kurs auf Ausgabepreisniveau vom letzten Jahrtausend...).
Hat mit Fakten rein garnichts zu tun. Was hier zählt, ist das Sentiment. Ich hab´s zwar satt, aber ich warte auch weiter. Kommt schon noch. Immer noch eine der aussichtsreichsten Zukunfttechnologien überhaupt (Antikörper gegen alles und jedes, vor allem natürlich gegen Krankheiten).
Gruß q.

"...zählen nur Fakten"

Dann gab´s ja heute wohl schon wieder schlechte Nachrichten:
Medarex says FDA approves 2 IND applications for MDX-1342
By Sarah Turner
Last update: 6:09 a.m. EST Dec. 4, 2007Print RSS Disable Live Quotes
LONDON (MarketWatch) -- Medarex Inc. (MEDX:MEDX
News, chart, profile, more
Last:
Delayed quote dataAdd to portfolio
Analyst
Create alertInsider
Discuss
Financials
Sponsored by:
MEDX, , ) said that the Food & Drug Administration has approved two separate investigational new drug applications filed for MDX-1342, one for the treatment of chronic lymphocytic leukemia and the other for rheumatoid arthritis. "We are pleased with the advancement of a new product candidate from Medarex's proprietary pipeline into clinical trials," said Howard Pien, president and CEO.
Tja, Kurs im Minus, nahe 52-Wochen-Tief...
Selbst wenn immer noch kein Antrag für IpilimuMab käme, ist der Kurs ein Witz. Aber was soll´s (siehe Morphosys: Trotz erneuter Hammer-Meldung Kurs auf Ausgabepreisniveau vom letzten Jahrtausend...).
Hat mit Fakten rein garnichts zu tun. Was hier zählt, ist das Sentiment. Ich hab´s zwar satt, aber ich warte auch weiter. Kommt schon noch. Immer noch eine der aussichtsreichsten Zukunfttechnologien überhaupt (Antikörper gegen alles und jedes, vor allem natürlich gegen Krankheiten).
Gruß q.
kommen heute die Resultate ? BMY hat heute seine Konferenz.
Ev. kommen IPI Phase III Daten
Ev. kommen IPI Phase III Daten

schade, ville hätte sicher mehr dazu zu sagen und die info wäre hier schneller im thread. 
http://www.investorvillage.com/smbd.asp?mb=248&mn=557&pt=msg…
CENTOCOR AND JANSSEN-CILAG SUBMIT APPLICATIONS REQUESTING APPROVAL OF USTEKINUMAB IN THE U.S. AND EUROPE FOR TREATMENT OF MODERATE TO SEVERE PLAQUE PSORIASIS
Two International Phase 3 Trials Evaluated Infrequent Dosing of Ustekinumab in Nearly 2,000 Patients
HORSHAM, PA, and BEERSE, BELGIUM, December 4, 2007 – Centocor, Inc. and Janssen-Cilag International NV announced today that regulatory applications have been submitted requesting the approval of ustekinumab (CNTO 1275) in the United States and Europe for the treatment of adult patients with chronic moderate to severe plaque psoriasis. Centocor has submitted a Biologics License Application (BLA) with the U.S. Food and Drug Administration (FDA) and Janssen-Cilag International NV has submitted a Marketing Authorization Application (MAA) to the European Medicines Agency (EMEA). Ustekinumab is a new, human monoclonal antibody with a novel mechanism of action that targets the cytokines interleukin-12 (IL-12) and interleukin-23 (IL-23), naturally occurring proteins that are important in regulating immune responses and that are thought to be associated with some immune-mediated inflammatory disorders, including psoriasis.
It is estimated that 125 million people worldwide have psoriasis, including two percent of both the U.S. and European populations, or some 7.5 million Americans and 10 million Europeans. Nearly one-quarter of people with psoriasis have cases that are considered moderate to severe.1
The submissions are based on a comprehensive development program including data from two large Phase 3 multicenter, randomized, double-blind, placebo-controlled trials involving nearly 2,000 patients that evaluated the safety and efficacy of ustekinumab in the treatment of moderate to severe plaque-type psoriasis. The primary endpoint of each pivotal study was the proportion of patients who achieved at least a 75 percent reduction in psoriasis as measured by the Psoriasis Area and Severity Index (PASI 75).
"We are very encouraged by the promising results that we have seen through the ustekinumab clinical development program evaluating the efficacy and safety of this novel biologic in the treatment of moderate to severe plaque psoriasis," said Jerome A. Boscia, M.D., senior vice president, Clinical R&D, Centocor, Inc. "We remain committed to developing safe and effective new therapies for patients with inflammatory diseases like psoriasis through continued research and development in disease areas where unmet needs in treatment remain."
About Psoriasis
Psoriasis is a chronic, immune-mediated disease, which results from the overproduction of skin cells resulting in their accumulation on the surface of the skin, which causes red, scaly plaques that may itch and bleed. It is estimated that approximately 7.5 million people in the United States and 10 million Europeans are living with psoriasis and nearly one-quarter of those people have cases that are considered moderate to severe.1
About Ustekinumab
Ustekinumab is a new, human monoclonal antibody in Phase 3 development by Centocor, Inc. for the treatment of moderate to severe plaque psoriasis, and is being investigated as an infrequently administered subcutaneous injection. Ustekinumab is a novel biologic therapy that targets interleukin 12 (IL-12) and interleukin 23 (IL-23), naturally occurring proteins that are important in regulating the immune system and that are also believed to play a role in immune-mediated inflammatory disorders.
Centocor discovered ustekinumab and has exclusive marketing rights to the product in the United States. Janssen-Cilag companies have exclusive marketing rights in all countries outside of the United States. Centocor, Inc. and the Janssen-Cilag companies are members of the Johnson & Johnson family of companies.
About Centocor, Inc.
Centocor is harnessing the power of world-leading research and biomanufacturing to deliver innovative biomedicines that transform patients' lives. Centocor has already brought innovation to the treatment of Crohn's disease, rheumatoid arthritis, ankylosing spondylitis, psoriatic arthritis, ulcerative colitis, pediatric Crohn's disease and psoriasis.
The world leader in monoclonal antibody production and technology, Centocor has brought critical biologic therapies to patients suffering from debilitating immune disorders.
About Janssen-Cilag International NV and Janssen-Cilag
Janssen-Cilag International NV and Janssen-Cilag companies have a long track record in developing and marketing treatments for central nervous system disorders, pain management, infectious diseases, gastrointestinal disorders and oncology.
1. National Psoriasis Foundation. About Psoriasis: Statistics. Available at: http://www.psoriasis.org/about/stats
Medarex will get between 3% and 5% of the revenues from this important product.
###

http://www.investorvillage.com/smbd.asp?mb=248&mn=557&pt=msg…
CENTOCOR AND JANSSEN-CILAG SUBMIT APPLICATIONS REQUESTING APPROVAL OF USTEKINUMAB IN THE U.S. AND EUROPE FOR TREATMENT OF MODERATE TO SEVERE PLAQUE PSORIASIS
Two International Phase 3 Trials Evaluated Infrequent Dosing of Ustekinumab in Nearly 2,000 Patients
HORSHAM, PA, and BEERSE, BELGIUM, December 4, 2007 – Centocor, Inc. and Janssen-Cilag International NV announced today that regulatory applications have been submitted requesting the approval of ustekinumab (CNTO 1275) in the United States and Europe for the treatment of adult patients with chronic moderate to severe plaque psoriasis. Centocor has submitted a Biologics License Application (BLA) with the U.S. Food and Drug Administration (FDA) and Janssen-Cilag International NV has submitted a Marketing Authorization Application (MAA) to the European Medicines Agency (EMEA). Ustekinumab is a new, human monoclonal antibody with a novel mechanism of action that targets the cytokines interleukin-12 (IL-12) and interleukin-23 (IL-23), naturally occurring proteins that are important in regulating immune responses and that are thought to be associated with some immune-mediated inflammatory disorders, including psoriasis.
It is estimated that 125 million people worldwide have psoriasis, including two percent of both the U.S. and European populations, or some 7.5 million Americans and 10 million Europeans. Nearly one-quarter of people with psoriasis have cases that are considered moderate to severe.1
The submissions are based on a comprehensive development program including data from two large Phase 3 multicenter, randomized, double-blind, placebo-controlled trials involving nearly 2,000 patients that evaluated the safety and efficacy of ustekinumab in the treatment of moderate to severe plaque-type psoriasis. The primary endpoint of each pivotal study was the proportion of patients who achieved at least a 75 percent reduction in psoriasis as measured by the Psoriasis Area and Severity Index (PASI 75).
"We are very encouraged by the promising results that we have seen through the ustekinumab clinical development program evaluating the efficacy and safety of this novel biologic in the treatment of moderate to severe plaque psoriasis," said Jerome A. Boscia, M.D., senior vice president, Clinical R&D, Centocor, Inc. "We remain committed to developing safe and effective new therapies for patients with inflammatory diseases like psoriasis through continued research and development in disease areas where unmet needs in treatment remain."
About Psoriasis
Psoriasis is a chronic, immune-mediated disease, which results from the overproduction of skin cells resulting in their accumulation on the surface of the skin, which causes red, scaly plaques that may itch and bleed. It is estimated that approximately 7.5 million people in the United States and 10 million Europeans are living with psoriasis and nearly one-quarter of those people have cases that are considered moderate to severe.1
About Ustekinumab
Ustekinumab is a new, human monoclonal antibody in Phase 3 development by Centocor, Inc. for the treatment of moderate to severe plaque psoriasis, and is being investigated as an infrequently administered subcutaneous injection. Ustekinumab is a novel biologic therapy that targets interleukin 12 (IL-12) and interleukin 23 (IL-23), naturally occurring proteins that are important in regulating the immune system and that are also believed to play a role in immune-mediated inflammatory disorders.
Centocor discovered ustekinumab and has exclusive marketing rights to the product in the United States. Janssen-Cilag companies have exclusive marketing rights in all countries outside of the United States. Centocor, Inc. and the Janssen-Cilag companies are members of the Johnson & Johnson family of companies.
About Centocor, Inc.
Centocor is harnessing the power of world-leading research and biomanufacturing to deliver innovative biomedicines that transform patients' lives. Centocor has already brought innovation to the treatment of Crohn's disease, rheumatoid arthritis, ankylosing spondylitis, psoriatic arthritis, ulcerative colitis, pediatric Crohn's disease and psoriasis.
The world leader in monoclonal antibody production and technology, Centocor has brought critical biologic therapies to patients suffering from debilitating immune disorders.
About Janssen-Cilag International NV and Janssen-Cilag
Janssen-Cilag International NV and Janssen-Cilag companies have a long track record in developing and marketing treatments for central nervous system disorders, pain management, infectious diseases, gastrointestinal disorders and oncology.
1. National Psoriasis Foundation. About Psoriasis: Statistics. Available at: http://www.psoriasis.org/about/stats
Medarex will get between 3% and 5% of the revenues from this important product.
###
wieder keine Ergebnisse für MDX-010 verlautbart bei der BMY-Konferenz. Statt dessen scheint nun eine 4. Studie auf. Schön langsam verlier ich die Geduld.
Antwort auf Beitrag Nr.: 32.680.269 von hannas am 06.12.07 09:56:33anscheinend sollen die ergebnisse innerhalb der nächsten 30 Tage kommen. !!!
Antwort auf Beitrag Nr.: 32.680.491 von uk0804 am 06.12.07 10:17:51die Daten der ersten 3 Studien müßten schon längstens bekannt sein, sie sind im Juni 2007 beendet worden. Trotzdem sind sie der Öffentlichkeit noch nicht präsentiert worden. Nun heißt es auf der BMY-Konferenz, daß die Daten innerhalb des nächsten Monats mit der FDA besprochen werden sollen und die Ergebnisse erst bei der ASCO im Mai/Juni 2008 präsentiert werden.
Ich frage mich nun, wann erfahren wir Investoren die Studienergebnisse? Von der IR-Abteilung bei MEDX erhält man ja überhaupt keine Nachrichten (siehe BLA von Cnto 1275 durch Centocor).
Ich frage mich nun, wann erfahren wir Investoren die Studienergebnisse? Von der IR-Abteilung bei MEDX erhält man ja überhaupt keine Nachrichten (siehe BLA von Cnto 1275 durch Centocor).

ups... , dann muss ich raus aus meinen dez 07 und jan 08 calls...
danke, dachte , dass ergebnisse der öffentlichkeit innerhalb der nächsten 30 tage präsentiert werden

danke, dachte , dass ergebnisse der öffentlichkeit innerhalb der nächsten 30 tage präsentiert werden
BMY : Dr Daniel's comments 6-Dec-07 01:13 am
We believe that our next molecule, Ipilimumab, will establish a new immunotherapy treatment paradigm for patients with cancer. As you know we entered into an alliance with MEDX to codevelop and cocommercialize ipilimumab initially for MM where significant unmet medical need remains and few treatment options are available. There is a long history of scientific experiments that have sought to understand the role of a patient's own immune system in the development of cancer and the battle against tumors. One explanation for the inability of a patient's body to recognize a cancer spore is that the cellular immune system has been inactivated. One of the major signals for the inactivation of cellular immunity is the engagement of the CTLA4 receptor on T cells. On the right side we see how ipilimumab, a mab directed against the CTLA4 receptor blocks the inhibition of T cells. In this way the patient's T cells can proliferate and hopefully respond to the tumor. The idea is powerful. To reengage the patient's own immune system to control the growth of their cancer. Now because the drug works with the patient's own immune system the tempo and the nature of the response of ipilimumab will likely be different than traditional cytotoxics. The onset of activity as judged by greater graphic measures of tumor may be somewhat later, as the immune system needs time to reactivate, yet the responses should be profound and meaningful. We selected MM as the initial cancer in which to demonstrate the unique therapeutic profile of ipilimumab. MM kills about 37,000 people each year worldwide. Many in the prime of their lives. Median survival time from initial diagnosis to death in MM is less than a year. Our initial registrational path in previously treated MM contains 3 studies of 24 week duration. The primary endpoint is BORR. Patients who have responses or who have stable disease on ipilimumab are eligible for a long term maint study, study 025. The patient numbers for 025 are listed here as to be determined as patients continue to complete the 6 months of initial ipilimumab therapy and roll over into that study. A second registrational path is in untreated MM. We have almost fully enrolled a registrational study which randomized patients to a combination of ipilimumab+DTIC or DTIC alone. In this study we will look at both PFS and OS. And lastly in the first half of 2008 we will begin a cooperative study in the adjuvant setting of melanoma focusing on patients who are high risk for developing metastatic disease.
We are in the process of unblinding the data from the studies of previously treated melanoma. Within the next month we should begin we should be able to begin discussions of these data with the FDA. Results will be presented next year at ASCO.
Pending FDA discussions we and our partner MEDX plan to submit our BLA in the first half of 2008. Beyond this initial strategy though, I've outlined additional registrational paths. Ipilimumab is a first in class compound. And immunotherapy represents a novel paradigm in cancer. We realize that this degree of innovation in drug development is associated with risks. Yet we remain confident with this approach and view this initial indication as proof of concept of the value of this therapeutic protein. Even as we continue to learn about ipilimumab, how it works and how it can play an important role in the treating of MM we also have ongoing phase 2 projects in multiple tumor types including lung, prostate, bladder, breast and pancreas. We've also started investigational work in lymphoma and leukemia. We believe that ipilimumab will open a number of therapeutic options all worthy of further exploration.
Klingt sehr positiv, aber es ist doch kein schneller news fluss zu erwarten.
We believe that our next molecule, Ipilimumab, will establish a new immunotherapy treatment paradigm for patients with cancer. As you know we entered into an alliance with MEDX to codevelop and cocommercialize ipilimumab initially for MM where significant unmet medical need remains and few treatment options are available. There is a long history of scientific experiments that have sought to understand the role of a patient's own immune system in the development of cancer and the battle against tumors. One explanation for the inability of a patient's body to recognize a cancer spore is that the cellular immune system has been inactivated. One of the major signals for the inactivation of cellular immunity is the engagement of the CTLA4 receptor on T cells. On the right side we see how ipilimumab, a mab directed against the CTLA4 receptor blocks the inhibition of T cells. In this way the patient's T cells can proliferate and hopefully respond to the tumor. The idea is powerful. To reengage the patient's own immune system to control the growth of their cancer. Now because the drug works with the patient's own immune system the tempo and the nature of the response of ipilimumab will likely be different than traditional cytotoxics. The onset of activity as judged by greater graphic measures of tumor may be somewhat later, as the immune system needs time to reactivate, yet the responses should be profound and meaningful. We selected MM as the initial cancer in which to demonstrate the unique therapeutic profile of ipilimumab. MM kills about 37,000 people each year worldwide. Many in the prime of their lives. Median survival time from initial diagnosis to death in MM is less than a year. Our initial registrational path in previously treated MM contains 3 studies of 24 week duration. The primary endpoint is BORR. Patients who have responses or who have stable disease on ipilimumab are eligible for a long term maint study, study 025. The patient numbers for 025 are listed here as to be determined as patients continue to complete the 6 months of initial ipilimumab therapy and roll over into that study. A second registrational path is in untreated MM. We have almost fully enrolled a registrational study which randomized patients to a combination of ipilimumab+DTIC or DTIC alone. In this study we will look at both PFS and OS. And lastly in the first half of 2008 we will begin a cooperative study in the adjuvant setting of melanoma focusing on patients who are high risk for developing metastatic disease.
We are in the process of unblinding the data from the studies of previously treated melanoma. Within the next month we should begin we should be able to begin discussions of these data with the FDA. Results will be presented next year at ASCO.
Pending FDA discussions we and our partner MEDX plan to submit our BLA in the first half of 2008. Beyond this initial strategy though, I've outlined additional registrational paths. Ipilimumab is a first in class compound. And immunotherapy represents a novel paradigm in cancer. We realize that this degree of innovation in drug development is associated with risks. Yet we remain confident with this approach and view this initial indication as proof of concept of the value of this therapeutic protein. Even as we continue to learn about ipilimumab, how it works and how it can play an important role in the treating of MM we also have ongoing phase 2 projects in multiple tumor types including lung, prostate, bladder, breast and pancreas. We've also started investigational work in lymphoma and leukemia. We believe that ipilimumab will open a number of therapeutic options all worthy of further exploration.
Klingt sehr positiv, aber es ist doch kein schneller news fluss zu erwarten.
Medarex to Receive Milestone Payment for Submission of Regulatory Applications Requesting Approval of Ustekinumab (CNTO 1275) for Treatment of Psoriasis
PRINCETON, N.J., Dec. 7 /PRNewswire-FirstCall/ -- Medarex, Inc. (Nasdaq: MEDX)
today announced that it will receive an undisclosed milestone payment from its
licensing partner, Centocor, Inc., for the submission of regulatory applications
requesting approval of ustekinumab (CNTO 1275) in the United States and in Europe
for the treatment of chronic moderate to severe plaque psoriasis by Centocor.
Ustekinumab is a human monoclonal antibody that binds to the cytokines IL-12 and
IL-23 and was generated using Medarex's UltiMAb(R) technology. Medarex may receive
future milestone payments and royalties should this product candidate progress to
commercialization and achieve commercial sales.
"News of a first regulatory filing for approval for an antibody developed from
Medarex technology is an important milestone for Medarex and marks a major
achievement in translating the technology developed by our head of research, Dr.
Nils Lonberg, into innovative and potentially significant treatments for many unmet
medical needs," said Howard H. Pien, President and CEO of Medarex. "We believe that
the ongoing development progress of ustekinumab and other antibody programs
generated from Medarex's UltiMAb platform will continue to highlight the therapeutic
importance and value creation opportunities of antibodies and our technology."
Medarex is a biopharmaceutical company focused on the discovery, development and
potential commercialization of fully human antibody-based therapeutics to treat
life-threatening and debilitating diseases, including cancer, inflammation,
autoimmune disorders and infectious diseases. Medarex applies its UltiMAb(R)
technology and product development and clinical manufacturing experience to
generate, support and potentially commercialize a broad range of fully human
antibody product candidates for itself and its partners. More than 30 of these
therapeutic product candidates derived from Medarex technology are in human clinical
testing or have had INDs submitted for such trials, with seven of the most advanced
product candidates currently in Phase III clinical trials. Medarex is committed to
building value by developing a diverse pipeline of antibody products to address the
world's unmet healthcare needs. For more information about Medarex, visit its
website at www.medarex.com.
Medarex Statement on Cautionary Factors
Except for the historical information presented herein, matters discussed herein
may constitute forward-looking statements that are subject to certain risks and
uncertainties that could cause actual results to differ materially from any future
results, performance or achievements expressed or implied by such statements.
Statements that are not historical facts, including statements preceded by, followed
by, or that include the words "potential"; "believe"; "anticipate"; "intend";
"plan"; "expect"; "estimate"; "could"; "may"; or similar statements are
forward-looking statements. Medarex disclaims, however, any intent or obligation to
update these forward-looking statements. Risks and uncertainties include risks
associated with product development, unforeseen safety issues resulting from the
administration of antibody products in humans, uncertainties concerning Centocor's
activities under its agreement with Medarex, as well as risks detailed from time to
time in Medarex's public disclosure filings with the U.S. Securities and Exchange
Commission (SEC), including its Annual Report on Form 10-K for the fiscal year ended
December 31, 2006 and its quarterly reports on Form 10-Q. There can be no assurance
that future milestone payments will be paid, whether the product development efforts
will succeed, or whether other developed products will receive required regulatory
clearance or that, even if such regulatory clearance were received, such products
would ultimately achieve commercial success. Copies of Medarex's public disclosure
filings are available from its investor relations department.
Medarex(R), the Medarex logo and UltiMAb(R) are registered trademarks of
Medarex, Inc. All rights are reserved.
SOURCE Medarex, Inc.
-0- 12/07/2007
Die Medarex Story könnte noch mal richtig gut ausgehen .
Hoffen wir auf einen baldigen positiven news flow !!!
PRINCETON, N.J., Dec. 7 /PRNewswire-FirstCall/ -- Medarex, Inc. (Nasdaq: MEDX)
today announced that it will receive an undisclosed milestone payment from its
licensing partner, Centocor, Inc., for the submission of regulatory applications
requesting approval of ustekinumab (CNTO 1275) in the United States and in Europe
for the treatment of chronic moderate to severe plaque psoriasis by Centocor.
Ustekinumab is a human monoclonal antibody that binds to the cytokines IL-12 and
IL-23 and was generated using Medarex's UltiMAb(R) technology. Medarex may receive
future milestone payments and royalties should this product candidate progress to
commercialization and achieve commercial sales.
"News of a first regulatory filing for approval for an antibody developed from
Medarex technology is an important milestone for Medarex and marks a major
achievement in translating the technology developed by our head of research, Dr.
Nils Lonberg, into innovative and potentially significant treatments for many unmet
medical needs," said Howard H. Pien, President and CEO of Medarex. "We believe that
the ongoing development progress of ustekinumab and other antibody programs
generated from Medarex's UltiMAb platform will continue to highlight the therapeutic
importance and value creation opportunities of antibodies and our technology."
Medarex is a biopharmaceutical company focused on the discovery, development and
potential commercialization of fully human antibody-based therapeutics to treat
life-threatening and debilitating diseases, including cancer, inflammation,
autoimmune disorders and infectious diseases. Medarex applies its UltiMAb(R)
technology and product development and clinical manufacturing experience to
generate, support and potentially commercialize a broad range of fully human
antibody product candidates for itself and its partners. More than 30 of these
therapeutic product candidates derived from Medarex technology are in human clinical
testing or have had INDs submitted for such trials, with seven of the most advanced
product candidates currently in Phase III clinical trials. Medarex is committed to
building value by developing a diverse pipeline of antibody products to address the
world's unmet healthcare needs. For more information about Medarex, visit its
website at www.medarex.com.
Medarex Statement on Cautionary Factors
Except for the historical information presented herein, matters discussed herein
may constitute forward-looking statements that are subject to certain risks and
uncertainties that could cause actual results to differ materially from any future
results, performance or achievements expressed or implied by such statements.
Statements that are not historical facts, including statements preceded by, followed
by, or that include the words "potential"; "believe"; "anticipate"; "intend";
"plan"; "expect"; "estimate"; "could"; "may"; or similar statements are
forward-looking statements. Medarex disclaims, however, any intent or obligation to
update these forward-looking statements. Risks and uncertainties include risks
associated with product development, unforeseen safety issues resulting from the
administration of antibody products in humans, uncertainties concerning Centocor's
activities under its agreement with Medarex, as well as risks detailed from time to
time in Medarex's public disclosure filings with the U.S. Securities and Exchange
Commission (SEC), including its Annual Report on Form 10-K for the fiscal year ended
December 31, 2006 and its quarterly reports on Form 10-Q. There can be no assurance
that future milestone payments will be paid, whether the product development efforts
will succeed, or whether other developed products will receive required regulatory
clearance or that, even if such regulatory clearance were received, such products
would ultimately achieve commercial success. Copies of Medarex's public disclosure
filings are available from its investor relations department.
Medarex(R), the Medarex logo and UltiMAb(R) are registered trademarks of
Medarex, Inc. All rights are reserved.
SOURCE Medarex, Inc.
-0- 12/07/2007
Die Medarex Story könnte noch mal richtig gut ausgehen .
Hoffen wir auf einen baldigen positiven news flow !!!

Nu aber :

Bald wieder über 14, dann wäre der Einbruch endgültig ausgestanden.
Bald wieder über 14, dann wäre der Einbruch endgültig ausgestanden.

Antwort auf Beitrag Nr.: 32.715.729 von eck64 am 10.12.07 16:11:51Alles überholt, morgen geht es -30% in die Grütze, außerbörsich bereits Absturz:



Conference call scheduled for tomorrow, Tuesday, December 11, 2007 at 8:45 am
ET
PRINCETON, N.J., Dec. 10 /PRNewswire-FirstCall/ -- Medarex, Inc. (Nasdaq: MEDX)
and Bristol-Myers Squibb Company (NYSE: BMY) today announced top-line data from the
three registrational trials (008, 022, 007) that constitute the monotherapy program
for ipilimumab -- an investigational immunotherapy -- in patients with metastatic
melanoma. The results from study 008, conducted under Special Protocol Assessment
(SPA), did not meet the primary endpoint, which was to rule out a best objective
response rate of less than 10 percent. However, the totality of data from the
registrational program included a clear dose response effect observed in study 022
and best objective response rates across the three studies ranging from mid-single
digits to mid-teens as determined by independent radiology review.
The objective responses were consistent with previous observations and included
complete and partial responses. The majority of the responses were ongoing at the
end of the observation period. In contrast to standard cytotoxic therapy, responses
at the highest doses were noted to evolve over time; these patterns of response
appear potentially unique to this form of therapy.
Given the importance of these findings and the limited treatment options for
this patient population, Medarex and Bristol-Myers Squibb are planning to meet with
regulatory agencies in the near future. Pending these discussions, the companies
aim to submit a regulatory filing to the U.S. Food and Drug Administration (FDA) in
the first half of 2008.
Overall, the safety results from the three studies were generally consistent
with data from previously reported clinical trials of ipilimumab and, as expected,
the most common immune related adverse events (greater than five percent) consisted
of rash, diarrhea, and hepatitis. Safety data from the 10 mg/kg cohorts were
consistent with results from similar or lower doses of previously reported clinical
data.



Conference call scheduled for tomorrow, Tuesday, December 11, 2007 at 8:45 am
ET
PRINCETON, N.J., Dec. 10 /PRNewswire-FirstCall/ -- Medarex, Inc. (Nasdaq: MEDX)
and Bristol-Myers Squibb Company (NYSE: BMY) today announced top-line data from the
three registrational trials (008, 022, 007) that constitute the monotherapy program
for ipilimumab -- an investigational immunotherapy -- in patients with metastatic
melanoma. The results from study 008, conducted under Special Protocol Assessment
(SPA), did not meet the primary endpoint, which was to rule out a best objective
response rate of less than 10 percent. However, the totality of data from the
registrational program included a clear dose response effect observed in study 022
and best objective response rates across the three studies ranging from mid-single
digits to mid-teens as determined by independent radiology review.
The objective responses were consistent with previous observations and included
complete and partial responses. The majority of the responses were ongoing at the
end of the observation period. In contrast to standard cytotoxic therapy, responses
at the highest doses were noted to evolve over time; these patterns of response
appear potentially unique to this form of therapy.
Given the importance of these findings and the limited treatment options for
this patient population, Medarex and Bristol-Myers Squibb are planning to meet with
regulatory agencies in the near future. Pending these discussions, the companies
aim to submit a regulatory filing to the U.S. Food and Drug Administration (FDA) in
the first half of 2008.
Overall, the safety results from the three studies were generally consistent
with data from previously reported clinical trials of ipilimumab and, as expected,
the most common immune related adverse events (greater than five percent) consisted
of rash, diarrhea, and hepatitis. Safety data from the 10 mg/kg cohorts were
consistent with results from similar or lower doses of previously reported clinical
data.
Antwort auf Beitrag Nr.: 32.721.256 von Cashverbrenner am 10.12.07 23:14:59jau, da wirds wohl ein fettes minus geben.
wer noch nicht MEDXen hat, kann ja dann morgen zugreifen...
dazu dann ein paar schlaftabletten auf 5 jahre, und alles ist wieder gut
wer noch nicht MEDXen hat, kann ja dann morgen zugreifen...
dazu dann ein paar schlaftabletten auf 5 jahre, und alles ist wieder gut

- 17,5 % ist schon knallhart. Richtig interessant wird sein was MEDX heute beim CC bekannt gibt. Hoffe zumindest auf einen positiven Ausblick. 
@Path: Bist du bei Medx dabei?
sl - Lycos

@Path: Bist du bei Medx dabei?
sl - Lycos
Habe Medarex seit langem auf meiner Watchlist.
Ist jetzt der Zeitpunkt für einen Einstieg gekommen oder geht es noch weitere 10% runter, wenn die USA die Pforten öffnet?

Ist jetzt der Zeitpunkt für einen Einstieg gekommen oder geht es noch weitere 10% runter, wenn die USA die Pforten öffnet?

Antwort auf Beitrag Nr.: 32.723.086 von Poppholz am 11.12.07 09:48:51bisher sind noch keine 10.000 Stück gehandelt worden in Deutschland (über alle Börsen).
Wenn hier noch einige aussteigen wollen, dann kommt der Kurs noch in Bewegung.
Wenn hier noch einige aussteigen wollen, dann kommt der Kurs noch in Bewegung.
Drakeman sagte vor einiger Zeit einmal in bezug auf MDX-010 und MDX-060, daß wir auf einer Goldmine sitzen. Fraglich ist nur, wen er damit meinte, sich und seine Frau oder die Aktionäre.
Das einzig positive an der Sache ist, daß die Aktie "nur" um 20% gefallen ist. Es hätten auch 50% oder mehr sein können.
Wie es weitergeht efahren wir um 14.45 Uhr.
Das einzig positive an der Sache ist, daß die Aktie "nur" um 20% gefallen ist. Es hätten auch 50% oder mehr sein können.
Wie es weitergeht efahren wir um 14.45 Uhr.
Antwort auf Beitrag Nr.: 32.723.984 von Ennox am 11.12.07 11:08:17meine Optionsscheine mit Laufzeit bis Dezembr 08 will auch keiner haben.
Würdet Ihr warten bis heute nachmittag ?
Würdet Ihr warten bis heute nachmittag ?
Also ich hab für 7,19 nachgekauft.
Durchschnittspreis von 12,40 auf 10,40 gesunken, aber immer noch tiefrot
Durchschnittspreis von 12,40 auf 10,40 gesunken, aber immer noch tiefrot

AP
Out of the Gate: Medarex Skids
Tuesday December 11, 10:24 am ET
Medarex Shares Slide As Melanoma Drug Trial Fails; Analyst Says Other Data 'Irrelevant'
NEW YORK (AP) -- Shares of Medarex Inc. dropped to a new 52-week low Tuesday after the company said its cancer drug candidate ipilimumab did not meet its main goal in a late-stage trial of advanced melanoma patients.
ADVERTISEMENT
Medarex and its partner, Bristol-Myers Squibb Co., reported the results of three trials on Monday afternoon. In one study, ipilimumab did not meet its goal of shrinking tumors in at least 10 percent of the trial's 155 patients.
Medarex shares fell $2.35, or 17.6 percent, to $11 in morning trading, and set a low of $10.70 on double average volume. Previously the stock ranged between $10.70 and $11.43 over the past year.
Bristol-Myers stock dipped 22 cents, to $29.09.
BMO Capital Markets analyst Jason Zhang said that while another trial appeared to show that high doses of the drug were effective, he said the 10.0 mg/kg dose was the same as that studied in the first trial, which failed to achieve a 10 percent overall response rate.
"In all, this data supports our view that ipilimumab is not approvable based on the merits of these trials," he wrote in a note to clients. "In addition, we believe investors should not carry false hope of approval based on the company's guidance that it would discuss these findings with the FDA and possibly file for approval based on the merits of these results."
Zhang maintained an "Underperform," or "Sell," rating on the stock.
Bear Stearns analyst Akhtar Samad downgraded the stock to "Peer Perform," or "Neutral," from "Outperform" on the news.
He said the missed enpoint of the Phase 3 trial compromises odds of FDA approval and raises the risk for remaining late-stage trials with ipilimumab for which data isn't due until late 2008. Samad said he sees no major near-term catalysts for the stock and believes the stock would be fairly valued at $9.
http://biz.yahoo.com/ap/071211/medarex_out_of_the_gate.html?…" target="_blank" rel="nofollow ugc noopener">
http://biz.yahoo.com/ap/071211/medarex_out_of_the_gate.html?…
Out of the Gate: Medarex Skids
Tuesday December 11, 10:24 am ET
Medarex Shares Slide As Melanoma Drug Trial Fails; Analyst Says Other Data 'Irrelevant'
NEW YORK (AP) -- Shares of Medarex Inc. dropped to a new 52-week low Tuesday after the company said its cancer drug candidate ipilimumab did not meet its main goal in a late-stage trial of advanced melanoma patients.
ADVERTISEMENT
Medarex and its partner, Bristol-Myers Squibb Co., reported the results of three trials on Monday afternoon. In one study, ipilimumab did not meet its goal of shrinking tumors in at least 10 percent of the trial's 155 patients.
Medarex shares fell $2.35, or 17.6 percent, to $11 in morning trading, and set a low of $10.70 on double average volume. Previously the stock ranged between $10.70 and $11.43 over the past year.
Bristol-Myers stock dipped 22 cents, to $29.09.
BMO Capital Markets analyst Jason Zhang said that while another trial appeared to show that high doses of the drug were effective, he said the 10.0 mg/kg dose was the same as that studied in the first trial, which failed to achieve a 10 percent overall response rate.
"In all, this data supports our view that ipilimumab is not approvable based on the merits of these trials," he wrote in a note to clients. "In addition, we believe investors should not carry false hope of approval based on the company's guidance that it would discuss these findings with the FDA and possibly file for approval based on the merits of these results."
Zhang maintained an "Underperform," or "Sell," rating on the stock.
Bear Stearns analyst Akhtar Samad downgraded the stock to "Peer Perform," or "Neutral," from "Outperform" on the news.
He said the missed enpoint of the Phase 3 trial compromises odds of FDA approval and raises the risk for remaining late-stage trials with ipilimumab for which data isn't due until late 2008. Samad said he sees no major near-term catalysts for the stock and believes the stock would be fairly valued at $9.
http://biz.yahoo.com/ap/071211/medarex_out_of_the_gate.html?…" target="_blank" rel="nofollow ugc noopener">
http://biz.yahoo.com/ap/071211/medarex_out_of_the_gate.html?…
Puh da bin ich wohl noch glimpflich weggekommen, aber immerhin 12% Miese. 

Moinsen,
was meint ihr? wie gehts weiter? einsteigen???
gruß
mc namera
was meint ihr? wie gehts weiter? einsteigen???
gruß
mc namera
Antwort auf Beitrag Nr.: 32.735.605 von McNamera am 12.12.07 09:59:55wenn du Geduld hast: ja
wenn du das Risiko suchst: ja
wenn du das Risiko suchst: ja
Antwort auf Beitrag Nr.: 32.736.934 von uk0804 am 12.12.07 11:44:55
dem chart nach sollte man sich nicht wundern, wenn es noch Einstiegschancen zu 9 USD geben sollte.
Das war gestern ein richtiger Porzellanzerschlagetag und die shorties haben erstmal Oberwasser.
Ville, hast du deine langlaufenden OS noch?
dem chart nach sollte man sich nicht wundern, wenn es noch Einstiegschancen zu 9 USD geben sollte.
Das war gestern ein richtiger Porzellanzerschlagetag und die shorties haben erstmal Oberwasser.

Ville, hast du deine langlaufenden OS noch?
Antwort auf Beitrag Nr.: 32.730.149 von Handbuch am 11.12.07 18:57:56hallo Handbuch, leider ist mein englich nicht mehr so gut. Könnten Sie mir in ein paar Sätzen dsa Wichtigste aus Ihrem Beitrag übersetzen. Danke
Was heißt Geduld haben? Manche warten seit Jahren darauf, daß etwas passiert. Vor 5 Jahren hieß es Schlaftablette nehmen und dann wieder aufwachen -> MEDX ganz weit oben.
Bislang sehe ich davon nicht viel und ich weiß auch nicht, ob das noch etwas wird.
Bislang sehe ich davon nicht viel und ich weiß auch nicht, ob das noch etwas wird.
Antwort auf Beitrag Nr.: 32.737.126 von eck64 am 12.12.07 12:02:24Eck, Ausbruch aus dem Keil nach unten, das sieht nicht gut aus.
Antwort auf Beitrag Nr.: 32.738.363 von flow_solver am 12.12.07 13:55:47Schreib ich doch. Der chart sieht nicht gut aus.
Da brauchts richtige positive news um hier ne Bärenfalle draus zu machen.
Der chart sieht nicht gut aus. das tief vom März ist deutlich nach unten gebrochen mit bad news. Die nächste Stütze ist erst bei ca. 8,50 bis 9 USD.
Da brauchts richtige positive news um hier ne Bärenfalle draus zu machen.
Der chart sieht nicht gut aus. das tief vom März ist deutlich nach unten gebrochen mit bad news. Die nächste Stütze ist erst bei ca. 8,50 bis 9 USD.
What's Next For Medarex?
posted on: December 12, 2007
On Monday evening, Medarex (MEDX) announced the results of one of the three completed clinical trials being carried out on one of their promising Phase III candidate. Ipilimumab, an oncology monoclonal antibody molecule, currently being developed in partnership with Bristol-Meyers-Squibb (BMY) "failed to achieve complete or partial shrinkage of tumors in at least 10 percent of the trial's 155 patients with melanoma".
As expected, the market punished Medarex with the stock price falling almost 20% in after-hours trading. Come Tuesday morning, the company held a conference call to discuss the top-line results from the completed clinical trials. Unfortunately the pre-market conference call did little to stem the fall-out from the disappointing clinical read-out.
The statement released by Medarex on Monday evening contains little information regarding the unexpected radiological results and it is expected that the data from the 3 clinical trials will be presented at the 2008 American Society of Clinical Oncology conference. A quick look at the US government clinical trials portal reveals very little about the pivotal clinical trials in patients with advanced metastatic melanoma. Other than Mederex own admission that they did not achieve the primary end-point it's difficult to determine if their planned Ipilimumab regulatory submission will be successful. However, it is important to note that similar clinical trials of monoclonal antibody therapies have also failed to achieve tumor shrinkage as was the case with Ipilimumab. On the other hand, some of these studies are known to have increased the survival benefit of patients enrolled in such studies. In light of these findings, there is the possibility that the FDA may give a favorable response to Ipilimumab application for advanced metastatic melanoma.
While I am yet to listen to this morning's conference call, I am comforted by the fact that as of today, the majority of Medarex's 34 candidates in clinical development are in partnership with other pharmaceutical companies. Out of which, 7 of the candidates are in Phase III development for oncology and inflammatory indications including Ipilimumab which is being fast tracked for patients with metastaticmelanoma. With such a rich late-stage pipeline and the expected low attrition rate of their biological candidates, it is only a matter of time before Medarex turns profitable or is bought out.
With the stock trading at a 52-week low, I am tempted to load up though there is the added risk of the disappointing clinical trial results failing to overcome the regulatory hurdle next year. For that reason, I'll wait until after I have listened to the pre-recorded conference call or read the transcript before making my next move.
Christopher Ssembonge
http://seekingalpha.com/article/57045-what-s-next-for-medare…
posted on: December 12, 2007
On Monday evening, Medarex (MEDX) announced the results of one of the three completed clinical trials being carried out on one of their promising Phase III candidate. Ipilimumab, an oncology monoclonal antibody molecule, currently being developed in partnership with Bristol-Meyers-Squibb (BMY) "failed to achieve complete or partial shrinkage of tumors in at least 10 percent of the trial's 155 patients with melanoma".
As expected, the market punished Medarex with the stock price falling almost 20% in after-hours trading. Come Tuesday morning, the company held a conference call to discuss the top-line results from the completed clinical trials. Unfortunately the pre-market conference call did little to stem the fall-out from the disappointing clinical read-out.
The statement released by Medarex on Monday evening contains little information regarding the unexpected radiological results and it is expected that the data from the 3 clinical trials will be presented at the 2008 American Society of Clinical Oncology conference. A quick look at the US government clinical trials portal reveals very little about the pivotal clinical trials in patients with advanced metastatic melanoma. Other than Mederex own admission that they did not achieve the primary end-point it's difficult to determine if their planned Ipilimumab regulatory submission will be successful. However, it is important to note that similar clinical trials of monoclonal antibody therapies have also failed to achieve tumor shrinkage as was the case with Ipilimumab. On the other hand, some of these studies are known to have increased the survival benefit of patients enrolled in such studies. In light of these findings, there is the possibility that the FDA may give a favorable response to Ipilimumab application for advanced metastatic melanoma.
While I am yet to listen to this morning's conference call, I am comforted by the fact that as of today, the majority of Medarex's 34 candidates in clinical development are in partnership with other pharmaceutical companies. Out of which, 7 of the candidates are in Phase III development for oncology and inflammatory indications including Ipilimumab which is being fast tracked for patients with metastaticmelanoma. With such a rich late-stage pipeline and the expected low attrition rate of their biological candidates, it is only a matter of time before Medarex turns profitable or is bought out.
With the stock trading at a 52-week low, I am tempted to load up though there is the added risk of the disappointing clinical trial results failing to overcome the regulatory hurdle next year. For that reason, I'll wait until after I have listened to the pre-recorded conference call or read the transcript before making my next move.
Christopher Ssembonge
http://seekingalpha.com/article/57045-what-s-next-for-medare…
December 12, 2007 - 9:59 AM EST
Gilead, Bristol-Myers to Market HIV Drug and Medarex, Bristol-Myers Report Drug Data
--(www.USEquityNews.com)-- 12/12/2007 - Pharmaceutical industry alert provided by U.S. Equity News. Bristol-Myers Squibb Co. and biopharmaceutical company Gilead Sciences Inc. (NASDAQ: GILD) said recently they have agreed to collaborate to commercialize the drug Atripla in Europe for the treatment of adults infected with HIV. If approved by the European Commission, Atripla would represent the first and only once-daily single-tablet regimen for HIV infection in the European Union. The companies expect the European Commission to issue its decision by the end of the year.
Celgene International S¿rl (NASDAQ: CELG) announced that clinical data from two ongoing REVLIMID studies in Relapsed/Refractory Aggressive Non-Hodgkins Lymphoma (NHL) were reported during the 49th Annual Meeting of the American Society of Hematology (ASH). These studies demonstrate REVLIMID's activity in NHL and the need to further evaluate treatment in this critical area of blood disease. NHL is the most common form of blood cancer in the United States affecting nearly 500,000 people.
Biopharmaceutical company Medarex Inc. (NASDAQ: MEDX) and partner Bristol-Myers Squibb Co. said recently one of three studies evaluating cancer drug ipilimumab in patients with advanced melanoma failed to meet its main goal. Medarex's shares plummeted in after-hours trading. The companies did not report full data on the other two studies.
Aida Pharmaceuticals (OTCBB: AIDA) recently announced that the company's upcoming Rh-Apo2L cancer drug has been named as a "New and High-Tech Transforming Products of 2007" by the Shanghai New High Technology Service Centre ("SNHTSC"), a special government commercialization division led by the Shanghai Municipal Government. This designation will allow Rh-Apo2L to have preferential policies during the commercialization process after Aida completes China's State Food and Drug Administration ("SFDA") clinical testing of the product. The stated role of the SNHTSC, according to its website http://www.hitec.net.cn, is to be a clearinghouse that allows the Chinese government to evaluate and narrow down technology candidates that have the greatest potential for national and global commercialization.
About U.S. Equity News
U.S. Equity News provides information, resources and news services for investors of small-cap, micro-cap and emerging companies. U.S. Equity News distributes RSS news feeds and a free subscription-based newsletter available through its website at www.usequitynews.com.
U.S. Equity News is a financial news distribution service by Equity Solutions, Inc. (www.equityirsolutions.com) that provides a platform for public companies to disseminate important news to key Wall Street interest such as shareholders and new investors. Equity Solutions, Inc. can assist by providing an effective increase in the awareness of a public company's news, development and corporate story through its proprietary network and its financial portal. U.S. Equity News and its affiliates charge each client cash for news distribution and may take an equity position in the companies mentioned herein, please visit the disclaimer at www.USEquityNews.com.
Source: U.S. Equity News (December 12, 2007 - 9:59 AM EST)

und schon gehts up in USA,
nur Deutschland schläft noch
Gilead, Bristol-Myers to Market HIV Drug and Medarex, Bristol-Myers Report Drug Data
--(www.USEquityNews.com)-- 12/12/2007 - Pharmaceutical industry alert provided by U.S. Equity News. Bristol-Myers Squibb Co. and biopharmaceutical company Gilead Sciences Inc. (NASDAQ: GILD) said recently they have agreed to collaborate to commercialize the drug Atripla in Europe for the treatment of adults infected with HIV. If approved by the European Commission, Atripla would represent the first and only once-daily single-tablet regimen for HIV infection in the European Union. The companies expect the European Commission to issue its decision by the end of the year.
Celgene International S¿rl (NASDAQ: CELG) announced that clinical data from two ongoing REVLIMID studies in Relapsed/Refractory Aggressive Non-Hodgkins Lymphoma (NHL) were reported during the 49th Annual Meeting of the American Society of Hematology (ASH). These studies demonstrate REVLIMID's activity in NHL and the need to further evaluate treatment in this critical area of blood disease. NHL is the most common form of blood cancer in the United States affecting nearly 500,000 people.
Biopharmaceutical company Medarex Inc. (NASDAQ: MEDX) and partner Bristol-Myers Squibb Co. said recently one of three studies evaluating cancer drug ipilimumab in patients with advanced melanoma failed to meet its main goal. Medarex's shares plummeted in after-hours trading. The companies did not report full data on the other two studies.
Aida Pharmaceuticals (OTCBB: AIDA) recently announced that the company's upcoming Rh-Apo2L cancer drug has been named as a "New and High-Tech Transforming Products of 2007" by the Shanghai New High Technology Service Centre ("SNHTSC"), a special government commercialization division led by the Shanghai Municipal Government. This designation will allow Rh-Apo2L to have preferential policies during the commercialization process after Aida completes China's State Food and Drug Administration ("SFDA") clinical testing of the product. The stated role of the SNHTSC, according to its website http://www.hitec.net.cn, is to be a clearinghouse that allows the Chinese government to evaluate and narrow down technology candidates that have the greatest potential for national and global commercialization.
About U.S. Equity News
U.S. Equity News provides information, resources and news services for investors of small-cap, micro-cap and emerging companies. U.S. Equity News distributes RSS news feeds and a free subscription-based newsletter available through its website at www.usequitynews.com.
U.S. Equity News is a financial news distribution service by Equity Solutions, Inc. (www.equityirsolutions.com) that provides a platform for public companies to disseminate important news to key Wall Street interest such as shareholders and new investors. Equity Solutions, Inc. can assist by providing an effective increase in the awareness of a public company's news, development and corporate story through its proprietary network and its financial portal. U.S. Equity News and its affiliates charge each client cash for news distribution and may take an equity position in the companies mentioned herein, please visit the disclaimer at www.USEquityNews.com.
Source: U.S. Equity News (December 12, 2007 - 9:59 AM EST)

und schon gehts up in USA,
nur Deutschland schläft noch

Antwort auf Beitrag Nr.: 32.739.182 von eck64 am 12.12.07 15:02:12Es harrt wohl mehr der Veröffentlichung negativer News. Erst werden Fristen nicht eingehalten und später bricht die Produktfanta von Blockbustern zusammen.
December 18, 2007 - 6:00 AM EST
Medarex to Receive Milestone Payment from Amgen
PRINCETON, N.J., Dec. 18 /PRNewswire-FirstCall/ -- Medarex, Inc. (Nasdaq: MEDX) today announced that it will receive a milestone payment for an undisclosed amount from its licensing partner, Amgen, for advancing an antibody into human clinical trials. The antibody was developed using Medarex's UltiMAb(R) technology and is the fifth UltiMAb-derived antibody in clinical development by Amgen, including two UltiMAb antibodies in Phase II clinical studies. Medarex may receive future milestone payments and royalties should this product candidate progress through clinical development and to the market.
'As a leading biotechnology company, Amgen continues to use its product development expertise to move UltiMAb-derived antibodies into clinical development and potentially toward commercialization,' said Howard H. Pien, President and CEO of Medarex. 'We are pleased by the advancements made by Amgen with UltiMAb antibodies and look forward to their continued progress.'
Medarex is a biopharmaceutical company focused on the discovery, development and potential commercialization of fully human antibody-based therapeutics to treat life-threatening and debilitating diseases, including cancer, inflammation, autoimmune disorders and infectious diseases. Medarex applies its UltiMAb(R) technology and product development and clinical manufacturing experience to generate, support and potentially commercialize a broad range of fully human antibody product candidates for itself and its partners. More than 30 of these therapeutic product candidates derived from Medarex technology are in human clinical testing or have had INDs submitted for such trials, with seven of the most advanced product candidates currently in Phase III clinical trials or the subject of regulatory applications for marketing authorization. Medarex is committed to building value by developing a diverse pipeline of antibody products to address the world's unmet healthcare needs. For more information about Medarex, visit its Web site at www.medarex.com.
Medarex Statement on Cautionary Factors
Except for the historical information presented herein, matters discussed herein may constitute forward-looking statements that are subject to certain risks and uncertainties that could cause actual results to differ materially from any future results, performance or achievements expressed or implied by such statements. Statements that are not historical facts, including statements preceded by, followed by, or that include the words 'potential'; 'believe'; 'anticipate'; 'may'; or similar statements are forward-looking statements. Medarex disclaims, however, any intent or obligation to update these forward-looking statements. Risks and uncertainties include risks associated with product development, unforeseen safety issues resulting from the administration of antibody products in humans, as well as risks detailed from time to time in Medarex's public disclosure filings with the U.S. Securities and Exchange Commission (SEC), including its Annual Report on Form 10-K for the fiscal year ended December 31, 2006 and its quarterly reports on Form 10-Q. There can be no assurance that future milestone payments will be paid, whether the product development efforts will succeed, or whether other developed products will receive required regulatory clearance or that, even if such regulatory clearance were received, such products would ultimately achieve commercial success. Copies of Medarex's public disclosure filings are available from its investor relations department.
Medarex(R), the Medarex logo and UltiMAb(R) are registered trademarks of Medarex, Inc. All rights are reserved.
SOURCE Medarex, Inc.
Source: PR Newswire (December 18, 2007 - 6:00 AM EST)
Medarex to Receive Milestone Payment from Amgen
PRINCETON, N.J., Dec. 18 /PRNewswire-FirstCall/ -- Medarex, Inc. (Nasdaq: MEDX) today announced that it will receive a milestone payment for an undisclosed amount from its licensing partner, Amgen, for advancing an antibody into human clinical trials. The antibody was developed using Medarex's UltiMAb(R) technology and is the fifth UltiMAb-derived antibody in clinical development by Amgen, including two UltiMAb antibodies in Phase II clinical studies. Medarex may receive future milestone payments and royalties should this product candidate progress through clinical development and to the market.
'As a leading biotechnology company, Amgen continues to use its product development expertise to move UltiMAb-derived antibodies into clinical development and potentially toward commercialization,' said Howard H. Pien, President and CEO of Medarex. 'We are pleased by the advancements made by Amgen with UltiMAb antibodies and look forward to their continued progress.'
Medarex is a biopharmaceutical company focused on the discovery, development and potential commercialization of fully human antibody-based therapeutics to treat life-threatening and debilitating diseases, including cancer, inflammation, autoimmune disorders and infectious diseases. Medarex applies its UltiMAb(R) technology and product development and clinical manufacturing experience to generate, support and potentially commercialize a broad range of fully human antibody product candidates for itself and its partners. More than 30 of these therapeutic product candidates derived from Medarex technology are in human clinical testing or have had INDs submitted for such trials, with seven of the most advanced product candidates currently in Phase III clinical trials or the subject of regulatory applications for marketing authorization. Medarex is committed to building value by developing a diverse pipeline of antibody products to address the world's unmet healthcare needs. For more information about Medarex, visit its Web site at www.medarex.com.
Medarex Statement on Cautionary Factors
Except for the historical information presented herein, matters discussed herein may constitute forward-looking statements that are subject to certain risks and uncertainties that could cause actual results to differ materially from any future results, performance or achievements expressed or implied by such statements. Statements that are not historical facts, including statements preceded by, followed by, or that include the words 'potential'; 'believe'; 'anticipate'; 'may'; or similar statements are forward-looking statements. Medarex disclaims, however, any intent or obligation to update these forward-looking statements. Risks and uncertainties include risks associated with product development, unforeseen safety issues resulting from the administration of antibody products in humans, as well as risks detailed from time to time in Medarex's public disclosure filings with the U.S. Securities and Exchange Commission (SEC), including its Annual Report on Form 10-K for the fiscal year ended December 31, 2006 and its quarterly reports on Form 10-Q. There can be no assurance that future milestone payments will be paid, whether the product development efforts will succeed, or whether other developed products will receive required regulatory clearance or that, even if such regulatory clearance were received, such products would ultimately achieve commercial success. Copies of Medarex's public disclosure filings are available from its investor relations department.
Medarex(R), the Medarex logo and UltiMAb(R) are registered trademarks of Medarex, Inc. All rights are reserved.
SOURCE Medarex, Inc.
Source: PR Newswire (December 18, 2007 - 6:00 AM EST)
Antwort auf Beitrag Nr.: 32.803.285 von Feuerzangenbowle am 18.12.07 15:13:08schon vorbörslich Handel 
t 10.64 200 NGS 09:15:25
10.70 500 NGS 09:01:18
t 10.66 100 PAC 08:59:48

t 10.64 200 NGS 09:15:25
10.70 500 NGS 09:01:18
t 10.66 100 PAC 08:59:48
January 3, 2008 - 7:01 AM EST
Medarex to Present at the 26th Annual JPMorgan Healthcare Conference
PRINCETON, N.J., Jan. 3 /PRNewswire-FirstCall/ -- Medarex, Inc. (Nasdaq: MEDX) announced today that it is scheduled to present at the 26th Annual JPMorgan Healthcare Conference at 10:30 a.m. ET on Tuesday, January 8, 2008. The event will be webcast live and will be available in the Investor Relations section of the Medarex Web site at www.medarex.com. An archived edition of the presentation will be available following the event.
About Medarex
Medarex is a biopharmaceutical company focused on the discovery, development and potential commercialization of fully human antibody-based therapeutics to treat life-threatening and debilitating diseases, including cancer, inflammation, autoimmune disorders and infectious diseases. Medarex applies its UltiMAb(R) technology and product development and clinical manufacturing experience to generate, support and potentially commercialize a broad range of fully human antibody product candidates for itself and its partners. More than 30 of these therapeutic product candidates derived from Medarex technology are in human clinical testing or have had INDs submitted for such trials, with seven of the most advanced product candidates currently in Phase 3 clinical trials or the subject of regulatory applications for marketing authorization. Medarex is committed to building value by developing a diverse pipeline of antibody products to address the world's unmet healthcare needs. For more information about Medarex, visit its Web site at www.medarex.com.
Medarex(R), the Medarex logo and UltiMAb(R) are registered trademarks of Medarex, Inc. All rights are reserved.
SOURCE Medarex, Inc.
Medarex to Present at the 26th Annual JPMorgan Healthcare Conference
PRINCETON, N.J., Jan. 3 /PRNewswire-FirstCall/ -- Medarex, Inc. (Nasdaq: MEDX) announced today that it is scheduled to present at the 26th Annual JPMorgan Healthcare Conference at 10:30 a.m. ET on Tuesday, January 8, 2008. The event will be webcast live and will be available in the Investor Relations section of the Medarex Web site at www.medarex.com. An archived edition of the presentation will be available following the event.
About Medarex
Medarex is a biopharmaceutical company focused on the discovery, development and potential commercialization of fully human antibody-based therapeutics to treat life-threatening and debilitating diseases, including cancer, inflammation, autoimmune disorders and infectious diseases. Medarex applies its UltiMAb(R) technology and product development and clinical manufacturing experience to generate, support and potentially commercialize a broad range of fully human antibody product candidates for itself and its partners. More than 30 of these therapeutic product candidates derived from Medarex technology are in human clinical testing or have had INDs submitted for such trials, with seven of the most advanced product candidates currently in Phase 3 clinical trials or the subject of regulatory applications for marketing authorization. Medarex is committed to building value by developing a diverse pipeline of antibody products to address the world's unmet healthcare needs. For more information about Medarex, visit its Web site at www.medarex.com.
Medarex(R), the Medarex logo and UltiMAb(R) are registered trademarks of Medarex, Inc. All rights are reserved.
SOURCE Medarex, Inc.
January 8, 2008 - 6:00 AM EST
PharmAthene and Medarex Announce FY 2008 U.S. Congressional Appropriation of up to $1.6 Million for Continued Development of Anthrax Therapeutic Valortim(TM)
ANNAPOLIS, Md. and PRINCETON, N.J., Jan. 8 /PRNewswire-FirstCall/ -- PharmAthene, Inc., (Amex: PIP) a biodefense company developing medical countermeasures against biological and chemical threats, and Medarex, Inc. (Nasdaq: MEDX), a leading monoclonal antibody company, today announced that the FY 2008 U.S. Congressional appropriation for the Department of Defense (DoD) includes up to $1.6 million payable to PharmAthene on a cost reimbursement basis to support ongoing development of Valortim(TM), a fully human monoclonal antibody generated by Medarex's UltiMAb(R) technology that is being co-developed by the two companies for the prevention and treatment of anthrax infection.
David P. Wright, President and Chief Executive Officer of PharmAthene commented, 'We're very pleased by the U.S. Government's ongoing support of Valortim and commitment to advancing this important product for consideration as part of our Nation's arsenal to protect against the devastating consequences of an anthrax attack. Total government funding pledged in support of Valortim over the last four fiscal years is up to $23 million, excluding this FY 08 appropriation.'
Mr. Wright continued, 'Valortim has demonstrated potent activity in neutralizing the anthrax toxin in preclinical studies as well as favorable safety data collected from our Phase I clinical study. We believe that Valortim may have important competitive advantages which, if demonstrated, would make it a strong choice for procurement consideration in the Strategic National Stockpile.'
'This funding will contribute to the continued development of this potentially important biodefense product. Together with PharmAthene we continue to advance the development of Valortim and believe that data collected to date -- from preclinical and clinical research -- show that Valortim could become an important part of the government's biodefense program to prevent and treat anthrax infection,' said Israel Lowy, M.D., Ph.D., Senior Director of Infectious Disease for Medarex.
About Valortim
Valortim (MDX-1303) is a fully human antibody designed to protect against anthrax infection, including inhalation anthrax, the most lethal form of illness in humans caused by the Bacillus anthracis bacterium. The investigational antibody is designed to target a protein component known as the anthrax protective antigen (PA) of the lethal toxin complex produced by the bacterium. The anthrax protective antigen is believed to initiate the onset of the illness by attaching to cells in the infected person, and then is believed to facilitate the entry of additional destructive toxins into the cells. Valortim is designed to target anthrax protective antigen and protect the cells from damage by the anthrax toxins.
Valortim has been administered intravenously and intramuscularly to healthy human volunteers in a completed phase I study, was well tolerated at doses as high as 20 mg/kg (IV), and was not immunogenic. These study results were presented at the 2006 Annual Meeting of the Infectious Diseases Society of America. Pharmacokinetic analysis suggested that doses as low as 1 mg/kg resulted in circulating levels of antibody after a month, with a similar potency for neutralizing anthrax toxin in vitro as was seen with serum obtained from subjects who had been vaccinated with anthrax vaccine.
Preclinical studies suggest that Valortim has the potential to provide significant protection against anthrax infection when administered prophylactically (prior to the emergence of symptoms of anthrax infection) and also may increase survival when administered therapeutically (once symptoms become evident).
About Anthrax
According to the Centers for Disease Control and Prevention, anthrax is an acute infectious disease caused by the spore-forming bacterium Bacillus anthracis. Anthrax most commonly occurs in hoofed mammals and can also infect humans. Symptoms of disease vary depending on how the disease is contracted, but usually occur within seven days after exposure. The serious forms of human anthrax are inhalation anthrax, cutaneous anthrax, and intestinal anthrax. Initial symptoms of inhalation anthrax infection may resemble a common cold. After several days, the symptoms may progress to severe breathing problems and shock. Inhalation anthrax is often fatal, even if treated by antibiotics. Currently, antibiotics are the only drugs available for therapeutic or prophylactic use, and post-exposure prophylaxis is the only FDA-approved indication for such products. However, antibiotic therapy, while useful, is believed to be associated with a number of limitations, including: (1) lack of activity against the toxins produced by the B. anthracis bacteria (2) need for long-term dosing to achieve full protection, complicated by side effects and non-compliance (3) lack of efficacy when administered late in the anthrax disease cycle, and (4) lack of effectiveness against multi-drug resistant or genetically engineered strains of anthrax.
About PharmAthene, Inc.
PharmAthene (Amex: PIP) was formed to meet the critical needs of the United States and its allies by developing and commercializing medical countermeasures against biological and chemical weapons. PharmAthene's lead programs include Valortim(TM) for the prevention and treatment of anthrax infection and Protexia(R) for the prevention and treatment of morbidity and mortality associated with exposure to chemical nerve agents. For more information on PharmAthene, please visit www.PharmAthene.com.
About Medarex, Inc.
Medarex is a biopharmaceutical company focused on the discovery, development and potential commercialization of fully human antibody-based therapeutics to treat life-threatening and debilitating diseases, including cancer, inflammation, autoimmune disorders and infectious diseases. Medarex applies its UltiMAb(R) technology and product development and clinical manufacturing experience to generate, support and potentially commercialize a broad range of fully human antibody product candidates for itself and its partners. More than 30 of these therapeutic product candidates derived from Medarex technology are in human clinical testing or have had INDs submitted for such trials, with seven of the most advanced product candidates currently in Phase III clinical trials. Medarex is committed to building value by developing a diverse pipeline of antibody products to address the world's unmet healthcare needs. For more information about Medarex, visit its website at www.medarex.com.
Statement on Cautionary Factors
For PharmAthene: Except for the historical information presented herein, matters discussed may constitute forward-looking statements within the meaning of the Private Securities Litigation Reform Act of 1995 that are subject to certain risks and uncertainties that could cause actual results to differ materially from any future results, performance or achievements expressed or implied by such statements. Statements that are not historical facts, including statements preceded by, followed by, or that include the words 'potential'; 'believe'; 'anticipate'; 'intend'; 'plan'; 'expect'; 'estimate'; 'could'; 'may'; 'should'; 'could'; or similar statements are forward-looking statements. PharmAthene disclaims, however, any intent or obligation to update these forward-looking statements. Risks and uncertainties include risks associated with the reliability of the results of the studies relating to human safety and possible adverse effects resulting from the administration of Valortim in humans, timely and successful development of an efficient and scalable manufacturing process, unexpected funding delays by NIAID/BARDA, unforeseen safety issues resulting from the handling of Bacillus anthracis, as well as risks detailed from time to time in PharmAthene's public disclosure filings with the U.S. Securities and Exchange Commission (the 'SEC'). There can be no assurance that such development efforts will succeed or that other developed products will receive required regulatory clearance or that, even if such regulatory clearance were received, such products would ultimately achieve commercial success. Copies of PharmAthene's public disclosure filings are available from its investor relations department.
For Medarex: Except for the historical information presented herein, matters discussed herein may constitute forward-looking statements within the meaning of the Private Securities Litigation Reform Act of 1995 that are subject to certain risks and uncertainties that could cause actual results to differ materially from any future results, performance or achievements expressed or implied by such statements. Statements that are not historical facts, including statements preceded by, followed by, or that include the words 'potential'; 'believe'; 'suggest'; 'may'; 'appear'; or similar statements are forward-looking statements. Medarex disclaims, however, any intent or obligation to update these forward-looking statements, except as required by law. Risks and uncertainties include risks associated with the reliability of the results of the initial work conducted on Valortim relating to animal efficacy, human safety and likelihood of successful development of an efficient and scalable manufacturing process, unexpected funding delays by NIAID/BARDA, unforeseen safety issues resulting from the handling of Bacillus anthracis, unforeseen safety issues resulting from the administration of Valortim(TM) (MDX-1303) in human subjects, uncertainties related to product manufacturing as well as risks detailed from time to time in Medarex's public disclosure filings with the U.S. Securities and Exchange Commission (SEC), including its Annual Report on Form 10-K for the fiscal year ended December 31, 2006 and its quarterly reports on Form 10-Q. There can be no assurance that such development efforts will succeed or that other developed products will receive required regulatory clearance or that, even if such regulatory clearance were received, such products would ultimately achieve commercial success. Copies of Medarex's public disclosure filings are available from its investor relations department.
Medarex(R), the Medarex logo and UltiMAb(R) are registered trademarks of Medarex, Inc. All rights are reserved. Valortim(TM) is a trademark of PharmAthene, Inc. All rights are reserved.
SOURCE Medarex, Inc. and PharmAthene, Inc.
Source: PR Newswire (January 8, 2008 - 6:00 AM EST)
PharmAthene and Medarex Announce FY 2008 U.S. Congressional Appropriation of up to $1.6 Million for Continued Development of Anthrax Therapeutic Valortim(TM)
ANNAPOLIS, Md. and PRINCETON, N.J., Jan. 8 /PRNewswire-FirstCall/ -- PharmAthene, Inc., (Amex: PIP) a biodefense company developing medical countermeasures against biological and chemical threats, and Medarex, Inc. (Nasdaq: MEDX), a leading monoclonal antibody company, today announced that the FY 2008 U.S. Congressional appropriation for the Department of Defense (DoD) includes up to $1.6 million payable to PharmAthene on a cost reimbursement basis to support ongoing development of Valortim(TM), a fully human monoclonal antibody generated by Medarex's UltiMAb(R) technology that is being co-developed by the two companies for the prevention and treatment of anthrax infection.
David P. Wright, President and Chief Executive Officer of PharmAthene commented, 'We're very pleased by the U.S. Government's ongoing support of Valortim and commitment to advancing this important product for consideration as part of our Nation's arsenal to protect against the devastating consequences of an anthrax attack. Total government funding pledged in support of Valortim over the last four fiscal years is up to $23 million, excluding this FY 08 appropriation.'
Mr. Wright continued, 'Valortim has demonstrated potent activity in neutralizing the anthrax toxin in preclinical studies as well as favorable safety data collected from our Phase I clinical study. We believe that Valortim may have important competitive advantages which, if demonstrated, would make it a strong choice for procurement consideration in the Strategic National Stockpile.'
'This funding will contribute to the continued development of this potentially important biodefense product. Together with PharmAthene we continue to advance the development of Valortim and believe that data collected to date -- from preclinical and clinical research -- show that Valortim could become an important part of the government's biodefense program to prevent and treat anthrax infection,' said Israel Lowy, M.D., Ph.D., Senior Director of Infectious Disease for Medarex.
About Valortim
Valortim (MDX-1303) is a fully human antibody designed to protect against anthrax infection, including inhalation anthrax, the most lethal form of illness in humans caused by the Bacillus anthracis bacterium. The investigational antibody is designed to target a protein component known as the anthrax protective antigen (PA) of the lethal toxin complex produced by the bacterium. The anthrax protective antigen is believed to initiate the onset of the illness by attaching to cells in the infected person, and then is believed to facilitate the entry of additional destructive toxins into the cells. Valortim is designed to target anthrax protective antigen and protect the cells from damage by the anthrax toxins.
Valortim has been administered intravenously and intramuscularly to healthy human volunteers in a completed phase I study, was well tolerated at doses as high as 20 mg/kg (IV), and was not immunogenic. These study results were presented at the 2006 Annual Meeting of the Infectious Diseases Society of America. Pharmacokinetic analysis suggested that doses as low as 1 mg/kg resulted in circulating levels of antibody after a month, with a similar potency for neutralizing anthrax toxin in vitro as was seen with serum obtained from subjects who had been vaccinated with anthrax vaccine.
Preclinical studies suggest that Valortim has the potential to provide significant protection against anthrax infection when administered prophylactically (prior to the emergence of symptoms of anthrax infection) and also may increase survival when administered therapeutically (once symptoms become evident).
About Anthrax
According to the Centers for Disease Control and Prevention, anthrax is an acute infectious disease caused by the spore-forming bacterium Bacillus anthracis. Anthrax most commonly occurs in hoofed mammals and can also infect humans. Symptoms of disease vary depending on how the disease is contracted, but usually occur within seven days after exposure. The serious forms of human anthrax are inhalation anthrax, cutaneous anthrax, and intestinal anthrax. Initial symptoms of inhalation anthrax infection may resemble a common cold. After several days, the symptoms may progress to severe breathing problems and shock. Inhalation anthrax is often fatal, even if treated by antibiotics. Currently, antibiotics are the only drugs available for therapeutic or prophylactic use, and post-exposure prophylaxis is the only FDA-approved indication for such products. However, antibiotic therapy, while useful, is believed to be associated with a number of limitations, including: (1) lack of activity against the toxins produced by the B. anthracis bacteria (2) need for long-term dosing to achieve full protection, complicated by side effects and non-compliance (3) lack of efficacy when administered late in the anthrax disease cycle, and (4) lack of effectiveness against multi-drug resistant or genetically engineered strains of anthrax.
About PharmAthene, Inc.
PharmAthene (Amex: PIP) was formed to meet the critical needs of the United States and its allies by developing and commercializing medical countermeasures against biological and chemical weapons. PharmAthene's lead programs include Valortim(TM) for the prevention and treatment of anthrax infection and Protexia(R) for the prevention and treatment of morbidity and mortality associated with exposure to chemical nerve agents. For more information on PharmAthene, please visit www.PharmAthene.com.
About Medarex, Inc.
Medarex is a biopharmaceutical company focused on the discovery, development and potential commercialization of fully human antibody-based therapeutics to treat life-threatening and debilitating diseases, including cancer, inflammation, autoimmune disorders and infectious diseases. Medarex applies its UltiMAb(R) technology and product development and clinical manufacturing experience to generate, support and potentially commercialize a broad range of fully human antibody product candidates for itself and its partners. More than 30 of these therapeutic product candidates derived from Medarex technology are in human clinical testing or have had INDs submitted for such trials, with seven of the most advanced product candidates currently in Phase III clinical trials. Medarex is committed to building value by developing a diverse pipeline of antibody products to address the world's unmet healthcare needs. For more information about Medarex, visit its website at www.medarex.com.
Statement on Cautionary Factors
For PharmAthene: Except for the historical information presented herein, matters discussed may constitute forward-looking statements within the meaning of the Private Securities Litigation Reform Act of 1995 that are subject to certain risks and uncertainties that could cause actual results to differ materially from any future results, performance or achievements expressed or implied by such statements. Statements that are not historical facts, including statements preceded by, followed by, or that include the words 'potential'; 'believe'; 'anticipate'; 'intend'; 'plan'; 'expect'; 'estimate'; 'could'; 'may'; 'should'; 'could'; or similar statements are forward-looking statements. PharmAthene disclaims, however, any intent or obligation to update these forward-looking statements. Risks and uncertainties include risks associated with the reliability of the results of the studies relating to human safety and possible adverse effects resulting from the administration of Valortim in humans, timely and successful development of an efficient and scalable manufacturing process, unexpected funding delays by NIAID/BARDA, unforeseen safety issues resulting from the handling of Bacillus anthracis, as well as risks detailed from time to time in PharmAthene's public disclosure filings with the U.S. Securities and Exchange Commission (the 'SEC'). There can be no assurance that such development efforts will succeed or that other developed products will receive required regulatory clearance or that, even if such regulatory clearance were received, such products would ultimately achieve commercial success. Copies of PharmAthene's public disclosure filings are available from its investor relations department.
For Medarex: Except for the historical information presented herein, matters discussed herein may constitute forward-looking statements within the meaning of the Private Securities Litigation Reform Act of 1995 that are subject to certain risks and uncertainties that could cause actual results to differ materially from any future results, performance or achievements expressed or implied by such statements. Statements that are not historical facts, including statements preceded by, followed by, or that include the words 'potential'; 'believe'; 'suggest'; 'may'; 'appear'; or similar statements are forward-looking statements. Medarex disclaims, however, any intent or obligation to update these forward-looking statements, except as required by law. Risks and uncertainties include risks associated with the reliability of the results of the initial work conducted on Valortim relating to animal efficacy, human safety and likelihood of successful development of an efficient and scalable manufacturing process, unexpected funding delays by NIAID/BARDA, unforeseen safety issues resulting from the handling of Bacillus anthracis, unforeseen safety issues resulting from the administration of Valortim(TM) (MDX-1303) in human subjects, uncertainties related to product manufacturing as well as risks detailed from time to time in Medarex's public disclosure filings with the U.S. Securities and Exchange Commission (SEC), including its Annual Report on Form 10-K for the fiscal year ended December 31, 2006 and its quarterly reports on Form 10-Q. There can be no assurance that such development efforts will succeed or that other developed products will receive required regulatory clearance or that, even if such regulatory clearance were received, such products would ultimately achieve commercial success. Copies of Medarex's public disclosure filings are available from its investor relations department.
Medarex(R), the Medarex logo and UltiMAb(R) are registered trademarks of Medarex, Inc. All rights are reserved. Valortim(TM) is a trademark of PharmAthene, Inc. All rights are reserved.
SOURCE Medarex, Inc. and PharmAthene, Inc.
Source: PR Newswire (January 8, 2008 - 6:00 AM EST)
January 8, 2008 - 7:00 AM EST
Medarex Announces Allowance of Investigational New Drug Application for Wholly Owned Fully Human Anti-CD70 Antibody, MDX-1411
PRINCETON, N.J., Jan. 8 /PRNewswire-FirstCall/ -- Medarex, Inc. (Nasdaq: MEDX) announced today the allowance of an investigational new drug application (IND) filed with the U.S. Food & Drug Administration (FDA) for MDX-1411 for the treatment of CD70-expressing malignancies, with the initial clinical study to focus on the treatment of clear cell renal cell carcinoma (ccRCC). MDX-1411 was generated by Medarex's UltiMAb Human Antibody Development System(R).
The open-label, multi-center, dose-escalation, multi-dose Phase I clinical trial is expected to enroll up to 40 patients with advanced ccRCC. The trial is designed to determine the safety, tolerability and maximum tolerated dose of MDX-1411 as well as characterize preliminary efficacy and pharmacokinetics.
'The advancement of this antibody into the clinical trial process adds to our internal pipeline and expands our portfolio of potentially new oncology therapeutics,' said Howard H. Pien, President and CEO of Medarex. 'We expect the growth of our pipeline to continue through the addition of proprietary products along with new antibodies that are developed through collaborations.'
About MDX-1411
MDX-1411 is a fully human monoclonal antibody that targets the CD70 receptor, which is a member of the tumor necrosis factor (TNF) family. CD70 is expressed in a number of cancers, including ccRCC primary tumors and metastatic lesions. Preclinical in vitro studies showed that MDX-1411 binds to CD70 positive cells and induces antibody-dependent cellular cytotoxicity (ADCC), an important mechanism of action of therapeutic antibodies that induces the destruction of targeted cells by the immune system. Preclinical in vivo studies conducted in ccRCC xenograft models demonstrated anti-tumor activity.
About Renal Cell Carcinoma (RCC)
According to the American Cancer Society there were almost 39,000 new cases of RCC and 13,000 deaths caused by RCC in 2006. About 80% of RCC cases are clear cell renal cell carcinoma making it the most common among five types of RCC. Renal cell carcinoma generally starts as one or more tumors in one or both kidneys and in advanced stages can spread to other organs. Current treatment options for RCC include surgery, radiation, chemotherapy, immunotherapy and targeted therapeutics.
About Medarex
Medarex is a biopharmaceutical company focused on the discovery, development and potential commercialization of fully human antibody-based therapeutics to treat life-threatening and debilitating diseases, including cancer, inflammation, autoimmune disorders and infectious diseases. Medarex applies its UltiMAb(R) technology and product development and clinical manufacturing experience to generate, support and potentially commercialize a broad range of fully human antibody product candidates for itself and its partners. More than 30 of these therapeutic product candidates derived from Medarex technology are in human clinical testing or have had INDs submitted for such trials, with seven of the most advanced product candidates currently in Phase III clinical trials or the subject of regulatory applications for marketing authorization. Medarex is committed to building value by developing a diverse pipeline of antibody products to address the world's unmet healthcare needs. For more information about Medarex, visit its Web site at www.medarex.com.
Statement on Cautionary Factors
Except for the historical information presented herein, matters discussed herein may constitute forward-looking statements that are subject to certain risks and uncertainties that could cause actual results to differ materially from any future results, performance or achievements expressed or implied by such statements. Statements that are not historical facts, including statements preceded by, followed by, or that include the words 'potential'; 'expect'; 'could'; 'may'; or similar statements are forward-looking statements. Medarex disclaims, however, any intent or obligation to update these forward-looking statements. Risks and uncertainties include risks associated with product discovery and development, uncertainties related to the outcome of clinical trials, slower than expected rates of patient recruitment, unforeseen safety issues resulting from the administration of MDX-1411 in patients, uncertainties related to product manufacturing as well as risks detailed from time to time in Medarex's public disclosure filings with the U.S. Securities and Exchange Commission (SEC), including its Annual Report on Form 10-K for the fiscal year ended December 31, 2006 and its quarterly reports on Form 10-Q. There can be no assurance that such development efforts will succeed or that other developed products will receive required regulatory clearance or that, even if such regulatory clearance were received, such products would ultimately achieve commercial success. Copies of Medarex's public disclosure filings are available from its investor relations department.
Medarex(R), the Medarex logo and UltiMAb(R) are registered trademarks of Medarex, Inc. All rights are reserved.
SOURCE Medarex, Inc.
Medarex Announces Allowance of Investigational New Drug Application for Wholly Owned Fully Human Anti-CD70 Antibody, MDX-1411
PRINCETON, N.J., Jan. 8 /PRNewswire-FirstCall/ -- Medarex, Inc. (Nasdaq: MEDX) announced today the allowance of an investigational new drug application (IND) filed with the U.S. Food & Drug Administration (FDA) for MDX-1411 for the treatment of CD70-expressing malignancies, with the initial clinical study to focus on the treatment of clear cell renal cell carcinoma (ccRCC). MDX-1411 was generated by Medarex's UltiMAb Human Antibody Development System(R).
The open-label, multi-center, dose-escalation, multi-dose Phase I clinical trial is expected to enroll up to 40 patients with advanced ccRCC. The trial is designed to determine the safety, tolerability and maximum tolerated dose of MDX-1411 as well as characterize preliminary efficacy and pharmacokinetics.
'The advancement of this antibody into the clinical trial process adds to our internal pipeline and expands our portfolio of potentially new oncology therapeutics,' said Howard H. Pien, President and CEO of Medarex. 'We expect the growth of our pipeline to continue through the addition of proprietary products along with new antibodies that are developed through collaborations.'
About MDX-1411
MDX-1411 is a fully human monoclonal antibody that targets the CD70 receptor, which is a member of the tumor necrosis factor (TNF) family. CD70 is expressed in a number of cancers, including ccRCC primary tumors and metastatic lesions. Preclinical in vitro studies showed that MDX-1411 binds to CD70 positive cells and induces antibody-dependent cellular cytotoxicity (ADCC), an important mechanism of action of therapeutic antibodies that induces the destruction of targeted cells by the immune system. Preclinical in vivo studies conducted in ccRCC xenograft models demonstrated anti-tumor activity.
About Renal Cell Carcinoma (RCC)
According to the American Cancer Society there were almost 39,000 new cases of RCC and 13,000 deaths caused by RCC in 2006. About 80% of RCC cases are clear cell renal cell carcinoma making it the most common among five types of RCC. Renal cell carcinoma generally starts as one or more tumors in one or both kidneys and in advanced stages can spread to other organs. Current treatment options for RCC include surgery, radiation, chemotherapy, immunotherapy and targeted therapeutics.
About Medarex
Medarex is a biopharmaceutical company focused on the discovery, development and potential commercialization of fully human antibody-based therapeutics to treat life-threatening and debilitating diseases, including cancer, inflammation, autoimmune disorders and infectious diseases. Medarex applies its UltiMAb(R) technology and product development and clinical manufacturing experience to generate, support and potentially commercialize a broad range of fully human antibody product candidates for itself and its partners. More than 30 of these therapeutic product candidates derived from Medarex technology are in human clinical testing or have had INDs submitted for such trials, with seven of the most advanced product candidates currently in Phase III clinical trials or the subject of regulatory applications for marketing authorization. Medarex is committed to building value by developing a diverse pipeline of antibody products to address the world's unmet healthcare needs. For more information about Medarex, visit its Web site at www.medarex.com.
Statement on Cautionary Factors
Except for the historical information presented herein, matters discussed herein may constitute forward-looking statements that are subject to certain risks and uncertainties that could cause actual results to differ materially from any future results, performance or achievements expressed or implied by such statements. Statements that are not historical facts, including statements preceded by, followed by, or that include the words 'potential'; 'expect'; 'could'; 'may'; or similar statements are forward-looking statements. Medarex disclaims, however, any intent or obligation to update these forward-looking statements. Risks and uncertainties include risks associated with product discovery and development, uncertainties related to the outcome of clinical trials, slower than expected rates of patient recruitment, unforeseen safety issues resulting from the administration of MDX-1411 in patients, uncertainties related to product manufacturing as well as risks detailed from time to time in Medarex's public disclosure filings with the U.S. Securities and Exchange Commission (SEC), including its Annual Report on Form 10-K for the fiscal year ended December 31, 2006 and its quarterly reports on Form 10-Q. There can be no assurance that such development efforts will succeed or that other developed products will receive required regulatory clearance or that, even if such regulatory clearance were received, such products would ultimately achieve commercial success. Copies of Medarex's public disclosure filings are available from its investor relations department.
Medarex(R), the Medarex logo and UltiMAb(R) are registered trademarks of Medarex, Inc. All rights are reserved.
SOURCE Medarex, Inc.
Jefferies upgrades Medarex (MEDX 9.22) to Buy from Hold and maintains their $14 tgt, as they believe MEDX is well poised for upside from any incremental positive data at ASCO given current low expectations for CTLA-4 inhibitors and a discounted share price.
Source: Briefing.com
Source: Briefing.com
http://ftalphaville.ft.com/blog/2008/01/28/10509/markets-liv…
NH:
PM: Ok neil — how abotu some RAW
PM: Waddya got for us today??
NH: yes, but we will have to go to Denmark for it
PM: o…kay
NH: company called Genmab
NH: biotech company, specialising in cancer drugs and RA treatments
NH: GlaxoSmithKline a 10% shareholder
NH: the two companies are developing a drug called HuMax-CD20
NH: and GSK has the rights to manufacture and commericalise the drug
PM: so they are thinking of bidding??
NH: er no
NH: that’s not the story
PM: so what is?
PM: or who is?
NH: Biogen
PM: I have heard of them
PM: US biotech company
PM: put itself up to sale before Xmas
NH: well, it was forced to put itself up for sale by US activist investor Carl Ichan
NH: Sale talks failed because Ichan wanted too much
NH: anyway Ichan is out now and Biogen is on the prowl for acquisitions
PM: How do we know that??
NH: check out this interview
NH: went up on PharmaWire a week or so back
NH: Biogen Idec could make a large-scale acquisition this year following its recent failed attempt to sell itself, said the company’s CEO Jim Mullen.
NH: In an exclusive interview with this news service, Mullen said the company is always looking at value-add opportunities. Although he said it would be hard to give guidance, he added that prospective targets did not necessarily need to own late stage drugs.
NH: When asked to provide a target range for a buy, the executive responded: “We could spend USD 10bn”. Regarding a merger, Mullen said that would have to be determined. Biogen has a current market capitalization of around USD 18bn.
NH: While Merrill Lynch and Goldman Sachs acted as financial advisors to Biogen in its sale process, the executive said both firms have been on retainer on an “ongoing basis” from previous acquisitions, as they have intimate knowledge about Biogen’s change of control provisions.
NH: Yet, it appears further share buybacks will not be part of Biogen’s imminent business strategy. Last May Biogen authorized a share repurchase of USD 3bn through a modified “Dutch Auction” tender offer. Despite some heightened tension among the activist shareholder community over reasons leading to the busted sale, Mullen said the company did not anticipate the need to buyback more shares. He did point out, however, that Biogen has some short term debt and a number of other credit facilities it might choose to pay down, including a USD 1.5bn bridge loan currently sitting on the balance sheet.
NH: Mullen also emphasized that two drugs will be launched this year from the existing pipeline of specialty products. With its blockbuster multiple sclerosis (MS) drug Avonex coming off patent in 2013, and Biogen’s patents for Rituxan, for the treatment of rheumatoid arthritis and non-Hodgkins Lymphoma expiring between 2013 and 2018, Mullen said he still sees further growth from the strong pipeline.
NH: Biogen has 15 product candidates in Phase II clinical trials or beyond, as well as the 10 or more data readouts expected between September 2007 and year-end 2008.
He said the company wants to be first in biologics as it focuses on rheumatoid arthritis, in identifying and treating TNF antagonist failures. Biogen will also focus on its lupus products with Genentech and Roche and provide more data on its leukemia products.
NH: During a recent investor meeting, Mullen outlined how the company’s sale process unraveled following the initial announcement in October. Confidentiality agreements had been signed as information regarding Biogen’s collaboration agreements and product details were provided. Management held one-on-one company presentations, which led to non-binding offers being submitted by prospective parties.
Mullen said “every corner of the company” was evaluated, from actual site visits to agreements regarding antitrust issues and any material adverse effect clauses. He said in the end Biogen asked potential buyers to submit binding offers, which would have allowed the acquirer direct negotiations with co-promotion partners Genentech and Elan, for Rituxan and Tysabri respectively.
PM: Er….. thanks for all that.
PM: so they have $10bn to spend
PM: How much is Genmab worth???
NH: well, its shares are up 6% at 400 krona this morning
NH: so that makes it worth around $3bn
PM: So this deal is very do-able
NH: yes, but you know the sort of premiums that can be paid in pharma M&A
NH: so this could be a stretch for Biogen
PM: You seem to know a fair bit about this company
NH: been chasing the story for a weeks now
NH: not getting anywhere
NH: apparently senior executives from Genmab have been in the Boston area, where Biogen is based in the past couple of weeks
NH: been talking to strategic partners, allegdly
PM: whatever that means
NH: well I think I know what it might mean
PM: Go on
NH: I am told there is Genmab shareholder that may need to sell
PM: not Glaxo
NH: no, don’t think they need to sell
NH: it’s a US biotech company called Medarex
NH: Valued a $1.2bn
NH: has had a tough time
NH: and would apparently look favourably on an offer for its 10% holding in Genmab
PM: So Biogen would buy it and then launch a bid for Genmab?
NH: not sure
NH: but what is interesting is that GSK cannot buy Genmab shares on the open market
NH: when they signed the deal for Hu-MaxCD20 they agreed not to buy anymore stock unless a third party made an offer for Genmab
NH: perhaps Biogen will buy this stake and then wait and see how the situation develops
NH: and there is another possible seller of stock
NH: a fund called the Biotech Turnaround Fund
NH: they own around 5% of the company
PM: You seem to know FAR too much about this
PM: But why are Biogen so hugely interested in acquiring Genmab??
NH: a couple of reasons
NH: One – they do not have many late-stage products in their pipeline
NH: and Genmab is unusual among European biotechs in that it is had a number of products in Phase III clinical trials
NH: they have five Phase III clinical trials across three drugs
NH: these drugs are for nasty stuff like non-hodgkin’s lymphoma, lymphoytic leukamia
NH: apart from the late stage drugs there is another reason I am told that Biogen would like to buy
PM: Go on
NH: Biogen gets royalties from a Roche drug called Rituxan, which treats rheumatoid arthritis and non-Hodgkins Lymphoma
NH: Now, HuMax CD20 is aiming to take on that drug
NH: And if it is half as good as some reports claim it could provide very stiff competition
PM: right, thanks for all of that
NH: no problems
NH: but I would stress this is all really RAW
NH: the company will not comment nor will some of the executives I have tried to talk to
NH: and of course, one has to ask why anyone would try and acquire a company where GSK holds a 10% and the rights to its most important drug
NH: on top of that a lot of punters have been in and out of Genmab stock
NH: so there is a distinct possibility that so people are long and wrong
NH: that said, there is a clearly a buzz around in this stock and we will be watching it closely
PM: Ok
NH:
PM: Ok neil — how abotu some RAW
PM: Waddya got for us today??
NH: yes, but we will have to go to Denmark for it
PM: o…kay
NH: company called Genmab
NH: biotech company, specialising in cancer drugs and RA treatments
NH: GlaxoSmithKline a 10% shareholder
NH: the two companies are developing a drug called HuMax-CD20
NH: and GSK has the rights to manufacture and commericalise the drug
PM: so they are thinking of bidding??
NH: er no
NH: that’s not the story
PM: so what is?
PM: or who is?
NH: Biogen
PM: I have heard of them
PM: US biotech company
PM: put itself up to sale before Xmas
NH: well, it was forced to put itself up for sale by US activist investor Carl Ichan
NH: Sale talks failed because Ichan wanted too much
NH: anyway Ichan is out now and Biogen is on the prowl for acquisitions
PM: How do we know that??
NH: check out this interview
NH: went up on PharmaWire a week or so back
NH: Biogen Idec could make a large-scale acquisition this year following its recent failed attempt to sell itself, said the company’s CEO Jim Mullen.
NH: In an exclusive interview with this news service, Mullen said the company is always looking at value-add opportunities. Although he said it would be hard to give guidance, he added that prospective targets did not necessarily need to own late stage drugs.
NH: When asked to provide a target range for a buy, the executive responded: “We could spend USD 10bn”. Regarding a merger, Mullen said that would have to be determined. Biogen has a current market capitalization of around USD 18bn.
NH: While Merrill Lynch and Goldman Sachs acted as financial advisors to Biogen in its sale process, the executive said both firms have been on retainer on an “ongoing basis” from previous acquisitions, as they have intimate knowledge about Biogen’s change of control provisions.
NH: Yet, it appears further share buybacks will not be part of Biogen’s imminent business strategy. Last May Biogen authorized a share repurchase of USD 3bn through a modified “Dutch Auction” tender offer. Despite some heightened tension among the activist shareholder community over reasons leading to the busted sale, Mullen said the company did not anticipate the need to buyback more shares. He did point out, however, that Biogen has some short term debt and a number of other credit facilities it might choose to pay down, including a USD 1.5bn bridge loan currently sitting on the balance sheet.
NH: Mullen also emphasized that two drugs will be launched this year from the existing pipeline of specialty products. With its blockbuster multiple sclerosis (MS) drug Avonex coming off patent in 2013, and Biogen’s patents for Rituxan, for the treatment of rheumatoid arthritis and non-Hodgkins Lymphoma expiring between 2013 and 2018, Mullen said he still sees further growth from the strong pipeline.
NH: Biogen has 15 product candidates in Phase II clinical trials or beyond, as well as the 10 or more data readouts expected between September 2007 and year-end 2008.
He said the company wants to be first in biologics as it focuses on rheumatoid arthritis, in identifying and treating TNF antagonist failures. Biogen will also focus on its lupus products with Genentech and Roche and provide more data on its leukemia products.
NH: During a recent investor meeting, Mullen outlined how the company’s sale process unraveled following the initial announcement in October. Confidentiality agreements had been signed as information regarding Biogen’s collaboration agreements and product details were provided. Management held one-on-one company presentations, which led to non-binding offers being submitted by prospective parties.
Mullen said “every corner of the company” was evaluated, from actual site visits to agreements regarding antitrust issues and any material adverse effect clauses. He said in the end Biogen asked potential buyers to submit binding offers, which would have allowed the acquirer direct negotiations with co-promotion partners Genentech and Elan, for Rituxan and Tysabri respectively.
PM: Er….. thanks for all that.
PM: so they have $10bn to spend
PM: How much is Genmab worth???
NH: well, its shares are up 6% at 400 krona this morning
NH: so that makes it worth around $3bn
PM: So this deal is very do-able
NH: yes, but you know the sort of premiums that can be paid in pharma M&A
NH: so this could be a stretch for Biogen
PM: You seem to know a fair bit about this company
NH: been chasing the story for a weeks now
NH: not getting anywhere
NH: apparently senior executives from Genmab have been in the Boston area, where Biogen is based in the past couple of weeks
NH: been talking to strategic partners, allegdly
PM: whatever that means
NH: well I think I know what it might mean
PM: Go on
NH: I am told there is Genmab shareholder that may need to sell
PM: not Glaxo
NH: no, don’t think they need to sell
NH: it’s a US biotech company called Medarex
NH: Valued a $1.2bn
NH: has had a tough time
NH: and would apparently look favourably on an offer for its 10% holding in Genmab
PM: So Biogen would buy it and then launch a bid for Genmab?
NH: not sure
NH: but what is interesting is that GSK cannot buy Genmab shares on the open market
NH: when they signed the deal for Hu-MaxCD20 they agreed not to buy anymore stock unless a third party made an offer for Genmab
NH: perhaps Biogen will buy this stake and then wait and see how the situation develops
NH: and there is another possible seller of stock
NH: a fund called the Biotech Turnaround Fund
NH: they own around 5% of the company
PM: You seem to know FAR too much about this
PM: But why are Biogen so hugely interested in acquiring Genmab??
NH: a couple of reasons
NH: One – they do not have many late-stage products in their pipeline
NH: and Genmab is unusual among European biotechs in that it is had a number of products in Phase III clinical trials
NH: they have five Phase III clinical trials across three drugs
NH: these drugs are for nasty stuff like non-hodgkin’s lymphoma, lymphoytic leukamia
NH: apart from the late stage drugs there is another reason I am told that Biogen would like to buy
PM: Go on
NH: Biogen gets royalties from a Roche drug called Rituxan, which treats rheumatoid arthritis and non-Hodgkins Lymphoma
NH: Now, HuMax CD20 is aiming to take on that drug
NH: And if it is half as good as some reports claim it could provide very stiff competition
PM: right, thanks for all of that
NH: no problems
NH: but I would stress this is all really RAW
NH: the company will not comment nor will some of the executives I have tried to talk to
NH: and of course, one has to ask why anyone would try and acquire a company where GSK holds a 10% and the rights to its most important drug
NH: on top of that a lot of punters have been in and out of Genmab stock
NH: so there is a distinct possibility that so people are long and wrong
NH: that said, there is a clearly a buzz around in this stock and we will be watching it closely
PM: Ok
Antwort auf Beitrag Nr.: 33.190.511 von Ville7 am 28.01.08 14:45:57Da isser ja wieder. 
Hasse 'n Dieterich?
Übrigens:
New York (aktiencheck.de AG) - Die Analysten von Jefferies & Co stufen die Aktie von Medarex (ISIN US5839161016/ WKN 883040) von "hold" auf "buy" hoch. Das Kursziel werde bei 14 USD gesehen. (28.01.2008/ac/a/u) Analyse-Datum: 28.01.2008
Gruß
Zock

Hasse 'n Dieterich?
Übrigens:
New York (aktiencheck.de AG) - Die Analysten von Jefferies & Co stufen die Aktie von Medarex (ISIN US5839161016/ WKN 883040) von "hold" auf "buy" hoch. Das Kursziel werde bei 14 USD gesehen. (28.01.2008/ac/a/u) Analyse-Datum: 28.01.2008
Gruß
Zock
MEDX reduziert den Anteil an Genmab auf 5%.
http://www.reuters.com/article/marketsNews/idUKL297411022008…
-----------------------------
Genmab next biotech M&A target? Analysts doubt it
Tue Jan 29, 2008 6:28am EST
By Ben Hirschler
LONDON, Jan 29 (Reuters) - Denmark's Genmab (GEN.CO: Quote, Profile, Research) is a rare success story in European biotech but speculation that it is about to be taken over may be wide of the mark, according to industry analysts.
Shares in the antibody specialist rose 5 percent on Monday after Britain's Times newspaper said Biogen Idec (BIIB.O: Quote, Profile, Research) was considering a bid in a move that could flush out a counter-offer from Genmab's key partner GlaxoSmithKline Plc (GSK.L: Quote, Profile, Research).
On Tuesday, however, the stock was back down 8 percent as Goldman Sachs placed 2.5 million shares with institutional investors on behalf of Medarex Inc (MEDX.O: Quote, Profile, Research).
The decision by Genmab's sister company to sell down its holding leaves Canaccord Adams analyst Karl Keegan more convinced than ever that a sale of the firm -- which has a market value of around $2.75 billion -- is not imminent.
"Genmab doesn't make sense as a take-out candidate, given what we know about the pipeline today and the fact that its antibody engine is licensed from Medarex," he said.
Analysts at ING agreed. They also pointed to the fact Genmab's biggest new drug hope, the experimental cancer and arthritis treatment HuMax-CD20, was a direct competitor to Biogen's Rituxan.
"We find it immensely unlikely that the anti-trust authorities would allow Biogen Idec to have ownership of the only two drugs in this class. Thus we view Biogen Idec as a very unlikely bidder," they said in a note.
ING estimates HuMax-CD20 accounts for 50 percent of Genmab's net present value. But rights to the drug are locked up, since it has been licensed to Glaxo, which clinched a $2 billion deal with the Danish firm for the product in December 2006.
Glaxo could always decide to buy the whole company but it has little need to do so after cherry-picking Genmab's prime asset, analysts believe.
Glaxo probably also has limited interest in other research at Genmab, having bought a firm with rival antibody technology, called Domantis, around the same time it struck the Genmab deal.
Officials at the companies involved declined to comment. (Editing by Paul Bolding)
http://www.reuters.com/article/marketsNews/idUKL297411022008…
-----------------------------
Genmab next biotech M&A target? Analysts doubt it
Tue Jan 29, 2008 6:28am EST
By Ben Hirschler
LONDON, Jan 29 (Reuters) - Denmark's Genmab (GEN.CO: Quote, Profile, Research) is a rare success story in European biotech but speculation that it is about to be taken over may be wide of the mark, according to industry analysts.
Shares in the antibody specialist rose 5 percent on Monday after Britain's Times newspaper said Biogen Idec (BIIB.O: Quote, Profile, Research) was considering a bid in a move that could flush out a counter-offer from Genmab's key partner GlaxoSmithKline Plc (GSK.L: Quote, Profile, Research).
On Tuesday, however, the stock was back down 8 percent as Goldman Sachs placed 2.5 million shares with institutional investors on behalf of Medarex Inc (MEDX.O: Quote, Profile, Research).
The decision by Genmab's sister company to sell down its holding leaves Canaccord Adams analyst Karl Keegan more convinced than ever that a sale of the firm -- which has a market value of around $2.75 billion -- is not imminent.
"Genmab doesn't make sense as a take-out candidate, given what we know about the pipeline today and the fact that its antibody engine is licensed from Medarex," he said.
Analysts at ING agreed. They also pointed to the fact Genmab's biggest new drug hope, the experimental cancer and arthritis treatment HuMax-CD20, was a direct competitor to Biogen's Rituxan.
"We find it immensely unlikely that the anti-trust authorities would allow Biogen Idec to have ownership of the only two drugs in this class. Thus we view Biogen Idec as a very unlikely bidder," they said in a note.
ING estimates HuMax-CD20 accounts for 50 percent of Genmab's net present value. But rights to the drug are locked up, since it has been licensed to Glaxo, which clinched a $2 billion deal with the Danish firm for the product in December 2006.
Glaxo could always decide to buy the whole company but it has little need to do so after cherry-picking Genmab's prime asset, analysts believe.
Glaxo probably also has limited interest in other research at Genmab, having bought a firm with rival antibody technology, called Domantis, around the same time it struck the Genmab deal.
Officials at the companies involved declined to comment. (Editing by Paul Bolding)
COVERAGE INITIATED: Medarex (MEDX) initiated by UBS. Initial rating Buy.
Briefing.com
06:36 a.m. 01/29/2008
Briefing.com
06:36 a.m. 01/29/2008
Antwort auf Beitrag Nr.: 33.201.497 von Ville7 am 29.01.08 14:37:41
und ich dachte schon ich bin nur noch alleine hier
und muß das Licht ausmachen


und ich dachte schon ich bin nur noch alleine hier

und muß das Licht ausmachen


February 1, 2008 - 6:00 AM EST
Medarex Announces Completion of Sale of Shares in Genmab A/S
PRINCETON, N.J., Feb. 1 /PRNewswire-FirstCall/ -- Medarex, Inc. (Nasdaq: MEDX) announced today that it has completed the sale of approximately 2.5 million shares of Genmab A/S which stock is traded on the Copenhagen Stock Exchange. The trade is expected to settle on February 1, 2008. Medarex expects to receive approximately $151.8 million (USD) in net proceeds from the sale. The sale of Genmab shares reduces Medarex's ownership in Genmab to approximately 5.1 percent.
About Medarex
Medarex is a biopharmaceutical company focused on the discovery, development and potential commercialization of fully human antibody-based therapeutics to treat life-threatening and debilitating diseases, including cancer, inflammation, autoimmune disorders and infectious diseases. Medarex applies its UltiMAb(R) technology and product development and clinical manufacturing experience to generate, support and potentially commercialize a broad range of fully human antibody product candidates for itself and its partners. More than 30 of these therapeutic product candidates derived from Medarex technology are in human clinical testing or have had INDs submitted for such trials, with seven of the most advanced product candidates currently in Phase III clinical trials or the subject of regulatory applications for marketing authorization. Medarex is committed to building value by developing a diverse pipeline of antibody products to address the world's unmet healthcare needs. For more information about Medarex, visit its Web site at www.medarex.com.
Medarex(R), the Medarex logo and UltiMAb(R) are registered trademarks of Medarex, Inc. All rights are reserved.
SOURCE Medarex, Inc.
Source: PR Newswire (February 1, 2008 - 6:00 AM EST)
Medarex Announces Completion of Sale of Shares in Genmab A/S
PRINCETON, N.J., Feb. 1 /PRNewswire-FirstCall/ -- Medarex, Inc. (Nasdaq: MEDX) announced today that it has completed the sale of approximately 2.5 million shares of Genmab A/S which stock is traded on the Copenhagen Stock Exchange. The trade is expected to settle on February 1, 2008. Medarex expects to receive approximately $151.8 million (USD) in net proceeds from the sale. The sale of Genmab shares reduces Medarex's ownership in Genmab to approximately 5.1 percent.
About Medarex
Medarex is a biopharmaceutical company focused on the discovery, development and potential commercialization of fully human antibody-based therapeutics to treat life-threatening and debilitating diseases, including cancer, inflammation, autoimmune disorders and infectious diseases. Medarex applies its UltiMAb(R) technology and product development and clinical manufacturing experience to generate, support and potentially commercialize a broad range of fully human antibody product candidates for itself and its partners. More than 30 of these therapeutic product candidates derived from Medarex technology are in human clinical testing or have had INDs submitted for such trials, with seven of the most advanced product candidates currently in Phase III clinical trials or the subject of regulatory applications for marketing authorization. Medarex is committed to building value by developing a diverse pipeline of antibody products to address the world's unmet healthcare needs. For more information about Medarex, visit its Web site at www.medarex.com.
Medarex(R), the Medarex logo and UltiMAb(R) are registered trademarks of Medarex, Inc. All rights are reserved.
SOURCE Medarex, Inc.
Source: PR Newswire (February 1, 2008 - 6:00 AM EST)
Servus zusammen,
was meint ihr, ist der Boden gefunden???
Bin kurz vorm Einstieg...
good night
was meint ihr, ist der Boden gefunden???
Bin kurz vorm Einstieg...
good night
Antwort auf Beitrag Nr.: 33.266.333 von McNamera am 04.02.08 21:31:22 Bin damals im jahre 2003 bei ca.4US$ eingestiegen hatte doch mal ab und zu verkaufen sollen aber wie du siehst ein wenig plus aber ist ok .ich denke mit wenig einsatz eine kleine position eingehen und wenn sie noch weiter runterkommt einfach nachkaufen.
Bin damals im jahre 2003 bei ca.4US$ eingestiegen hatte doch mal ab und zu verkaufen sollen aber wie du siehst ein wenig plus aber ist ok .ich denke mit wenig einsatz eine kleine position eingehen und wenn sie noch weiter runterkommt einfach nachkaufen.
ich kaufe erst wieder unter 6 euro falls medx fallen sollte.
gruß Medarex75
 Bin damals im jahre 2003 bei ca.4US$ eingestiegen hatte doch mal ab und zu verkaufen sollen aber wie du siehst ein wenig plus aber ist ok .ich denke mit wenig einsatz eine kleine position eingehen und wenn sie noch weiter runterkommt einfach nachkaufen.
Bin damals im jahre 2003 bei ca.4US$ eingestiegen hatte doch mal ab und zu verkaufen sollen aber wie du siehst ein wenig plus aber ist ok .ich denke mit wenig einsatz eine kleine position eingehen und wenn sie noch weiter runterkommt einfach nachkaufen.ich kaufe erst wieder unter 6 euro falls medx fallen sollte.
gruß Medarex75
Antwort auf Beitrag Nr.: 33.266.333 von McNamera am 04.02.08 21:31:22 ist doch ein klasse übernahmekandidat die medarex auf lange sicht wird die geschluckt
ist doch ein klasse übernahmekandidat die medarex auf lange sicht wird die geschluckt
gruß medarex
 ist doch ein klasse übernahmekandidat die medarex auf lange sicht wird die geschluckt
ist doch ein klasse übernahmekandidat die medarex auf lange sicht wird die geschluckt gruß medarex
Antwort auf Beitrag Nr.: 33.266.333 von McNamera am 04.02.08 21:31:22Moin McNamera,

ich denke auch über eine Aufstockung nach und werde das wohl auch nächste Woche tun. Habe seit Jahren eine recht große Position in Medarex, ist nicht immer einfach. Zum Glück habe ich meinen "Trading-Anteil" zu etwas über 12€ verkauft, allerdings leider die andere Hälfte behalten. Bin aber zu überzeugt von MEDX gewesen, um alles zu verkaufen. Eine überraschende Übernahme ist auch jederzeit möglich (siehe ABGX). Sehe die Chance im Moment auch wieder als sehr gut an.

Gruß q.

ich denke auch über eine Aufstockung nach und werde das wohl auch nächste Woche tun. Habe seit Jahren eine recht große Position in Medarex, ist nicht immer einfach. Zum Glück habe ich meinen "Trading-Anteil" zu etwas über 12€ verkauft, allerdings leider die andere Hälfte behalten. Bin aber zu überzeugt von MEDX gewesen, um alles zu verkaufen. Eine überraschende Übernahme ist auch jederzeit möglich (siehe ABGX). Sehe die Chance im Moment auch wieder als sehr gut an.

Gruß q.
Hallo zusammen,
erstmal vielen Dank für Eure Meinungen! Ich bin zwar noch nicht rein, aber habe es immer noch vor. Denke, wenn der Markt nochmal zurück kommt, sehen wir Kurse unter 6 €. Dann ist hoffentlich ein guter Zeitpunkt. Demnach halte ich es wie Du Medarex75.
Lasst euch hier mal wieder lesen :-).
Bis die Tage
erstmal vielen Dank für Eure Meinungen! Ich bin zwar noch nicht rein, aber habe es immer noch vor. Denke, wenn der Markt nochmal zurück kommt, sehen wir Kurse unter 6 €. Dann ist hoffentlich ein guter Zeitpunkt. Demnach halte ich es wie Du Medarex75.
Lasst euch hier mal wieder lesen :-).
Bis die Tage
Antwort auf Beitrag Nr.: 33.332.087 von McNamera am 11.02.08 17:05:44Immer nur runter - macht echt kein Spass mehr...

Ja, wo ist der Boden?????????????
Antwort auf Beitrag Nr.: 33.396.578 von McNamera am 17.02.08 20:17:31 die 100 tagelinie befindet sich knapp unter den 12 us$ und die 200 tagelinie befindet sich knapp oberhalb der 12 us$.
die 100 tagelinie befindet sich knapp unter den 12 us$ und die 200 tagelinie befindet sich knapp oberhalb der 12 us$.
aktuell befinden wir uns das ist meine meinung noch immer im abwärtstrend erst wenn wir die 10 us$ knacken lohnt sich einer erster einstieg.
wie gesagt das ist meine meinung



gruß medarex
 die 100 tagelinie befindet sich knapp unter den 12 us$ und die 200 tagelinie befindet sich knapp oberhalb der 12 us$.
die 100 tagelinie befindet sich knapp unter den 12 us$ und die 200 tagelinie befindet sich knapp oberhalb der 12 us$.aktuell befinden wir uns das ist meine meinung noch immer im abwärtstrend erst wenn wir die 10 us$ knacken lohnt sich einer erster einstieg.
wie gesagt das ist meine meinung




gruß medarex




Wird noch was aus dem 010er oder beschränken die sich auf Aktienverkäufe
oder beschränken die sich auf Aktienverkäufe
 oder beschränken die sich auf Aktienverkäufe
oder beschränken die sich auf Aktienverkäufe
Antwort auf Beitrag Nr.: 33.433.364 von Friseuse am 21.02.08 11:22:00Wieder über 5% in den Miesen - das ist doch Vollschrott

Antwort auf Beitrag Nr.: 33.440.410 von mountainbiker am 21.02.08 20:04:489,02 : Ich hasse dich MEDX

Antwort auf Beitrag Nr.: 33.441.366 von mountainbiker am 21.02.08 21:29:2420.02.2008 22:13
Medarex to Announce 2007 Fourth Quarter and Year-End Financial Results on Tuesday, February 26, 2008
PRINCETON, N.J., Feb. 20 /PRNewswire-FirstCall/ -- Medarex, (News/Aktienkurs) Inc. is scheduled to announce its 2007 fourth quarter and year-end results on Tuesday, February 26, 2008 by press release after the financial markets close.
Following the release, Medarex's management will host a conference call and live webcast at 4:30 p.m. Eastern Time. To access the call live, please dial 1-866-510-0710 (U.S./Canada) or 1-617-597-5378 (international) and enter passcode number 15176024. The webcast can be accessed through the Investor Relations section of Medarex's website at http://www.medarex.com/ and will be archived for 14 days following the webcast.
A telephonic replay of the conference call will be available until midnight Eastern Time, March 4, 2008. Access numbers for this replay are 1-888-286-8010 (U.S./Canada) or 1-617-801-6888 (international); passcode number 75836084.
Erwartet wird offensichtlich fast nix mehr. Echt krass:

Medarex to Announce 2007 Fourth Quarter and Year-End Financial Results on Tuesday, February 26, 2008
PRINCETON, N.J., Feb. 20 /PRNewswire-FirstCall/ -- Medarex, (News/Aktienkurs) Inc. is scheduled to announce its 2007 fourth quarter and year-end results on Tuesday, February 26, 2008 by press release after the financial markets close.
Following the release, Medarex's management will host a conference call and live webcast at 4:30 p.m. Eastern Time. To access the call live, please dial 1-866-510-0710 (U.S./Canada) or 1-617-597-5378 (international) and enter passcode number 15176024. The webcast can be accessed through the Investor Relations section of Medarex's website at http://www.medarex.com/ and will be archived for 14 days following the webcast.
A telephonic replay of the conference call will be available until midnight Eastern Time, March 4, 2008. Access numbers for this replay are 1-888-286-8010 (U.S./Canada) or 1-617-801-6888 (international); passcode number 75836084.
Erwartet wird offensichtlich fast nix mehr. Echt krass:
Antwort auf Beitrag Nr.: 33.440.410 von mountainbiker am 21.02.08 20:04:48Ich habe andere Sorgenkinder, mit Medarex kam ich prima klar und nur etwas zu früh raus.
Der Beteiligungsverlust an Genmab signalisiert für mich Pipelineprobleme, die glauben nicht mehr an einen baldigen Markterfolg und fressen den Kitt aus den Fenstern. Aus allen Ritzen wird Cash gezogen.
Meine Meinung, wegen mir kann das Gegenteil richtig sein.
Der Beteiligungsverlust an Genmab signalisiert für mich Pipelineprobleme, die glauben nicht mehr an einen baldigen Markterfolg und fressen den Kitt aus den Fenstern. Aus allen Ritzen wird Cash gezogen.
Meine Meinung, wegen mir kann das Gegenteil richtig sein.
@ville,
ich nehme an, dass du mitliest.
Weil du dich bei Medarex weit besser auskennst als ich:
Könntest du mal einen kurzen Abriss geben, warum du denkst, das Medarex zur Zeit dermassen schlecht gelaufen ist?
Eckpunkte Shortrate (warum so hoch?)
Genmab verkauf
Finanzbedarf
Pipeline: Wann sind P3- und Zulassungs-Termine?
Wäre echt super von dir. Natürlich auch gerne von anderen berufenen.
ich nehme an, dass du mitliest.
Weil du dich bei Medarex weit besser auskennst als ich:
Könntest du mal einen kurzen Abriss geben, warum du denkst, das Medarex zur Zeit dermassen schlecht gelaufen ist?
Eckpunkte Shortrate (warum so hoch?)
Genmab verkauf
Finanzbedarf
Pipeline: Wann sind P3- und Zulassungs-Termine?
Wäre echt super von dir. Natürlich auch gerne von anderen berufenen.

Antwort auf Beitrag Nr.: 33.450.547 von eck64 am 22.02.08 18:10:05Wieder 3% im Minus - nächstens verbrenn ich mein Geld im Kamin, da spar ich mir wenigstens die Ölkosten...

Antwort auf Beitrag Nr.: 33.452.065 von mountainbiker am 22.02.08 20:21:488,70 USD - nicht EURO!!!




Antwort auf Beitrag Nr.: 33.452.441 von Feuerzangenbowle am 22.02.08 21:08:12Auf gehts, heut kna cken wir noch die 8,50 - sonst wär ich schon etwas enttäuscht...
cken wir noch die 8,50 - sonst wär ich schon etwas enttäuscht...
 cken wir noch die 8,50 - sonst wär ich schon etwas enttäuscht...
cken wir noch die 8,50 - sonst wär ich schon etwas enttäuscht...
Antwort auf Beitrag Nr.: 33.452.441 von Feuerzangenbowle am 22.02.08 21:08:12Medarex wird für die bald kommende Übernahme gedrückt, ist ja immer noch über eine Milliarde Dollar wert!
Pfizer geht voraus und sammelt die verbilligten Biotechs reihenweise ein, so wie gerade Coley und Encysive, da gab es denselben Kursverlauf.
Die anderen Big Pharma mit ihrer ausgetrockneten Pipeline werden garantiert folgen.
Daß das Teil von niedrigem Niveau dann mal um 100% steigt ist natürlich kaum ein Trost für die schon Investierten. Bin leider auch seit 16 EURO drin. Die einzige Möglichkeit ist da viel tiefer noch mal nachzufassen. So bei 2 EURO werde ich nochmal nachlegen. Bis dahin ...
Pfizer geht voraus und sammelt die verbilligten Biotechs reihenweise ein, so wie gerade Coley und Encysive, da gab es denselben Kursverlauf.
Die anderen Big Pharma mit ihrer ausgetrockneten Pipeline werden garantiert folgen.
Daß das Teil von niedrigem Niveau dann mal um 100% steigt ist natürlich kaum ein Trost für die schon Investierten. Bin leider auch seit 16 EURO drin. Die einzige Möglichkeit ist da viel tiefer noch mal nachzufassen. So bei 2 EURO werde ich nochmal nachlegen. Bis dahin ...
Antwort auf Beitrag Nr.: 33.454.642 von MrBean07 am 23.02.08 09:52:11 Bei 2 Euronen wäre ich auch mit von der Partie aber das glaube ich weniger.
Bei 2 Euronen wäre ich auch mit von der Partie aber das glaube ich weniger.
Kurse unter 6 Euronen sind für mich klare Kaufkurse.Werde für die nächste Woche eine kleine Posi eingehen.
 Bei 2 Euronen wäre ich auch mit von der Partie aber das glaube ich weniger.
Bei 2 Euronen wäre ich auch mit von der Partie aber das glaube ich weniger.Kurse unter 6 Euronen sind für mich klare Kaufkurse.Werde für die nächste Woche eine kleine Posi eingehen.

Antwort auf Beitrag Nr.: 33.450.547 von eck64 am 22.02.08 18:10:05Sämtliche Biotechtitel (Vertex,Myriad,Sepracor usw)sind alle so schlecht gelaufen wie Medarex.Das liegt nicht nur an Medarex.
Die Biotechtitel sind zur zeit out.
Wenn ich die letzte Woche den Gesamtmarkt sehe bei den Biotechs dann ist das nicht auf einzelne Werte zurückzuführen sondern auf die gesamte Branche.
Die Biotechtitel sind zur zeit out.
Wenn ich die letzte Woche den Gesamtmarkt sehe bei den Biotechs dann ist das nicht auf einzelne Werte zurückzuführen sondern auf die gesamte Branche.

Antwort auf Beitrag Nr.: 33.455.079 von medarex75 am 23.02.08 11:44:17Das medarex unter dem schlechten BioTec Gesamtmarkt mitleidet ist schon klar. Nur gehen ja nicht alle Aktien exakt mit dem Index mit, sondern haben neben dem Indexleben ein Eigenleben.
Also: Nächste Woche gibts Zahlen. Cash sollte nach Genmab fast-komplettausstieg ausreichend vorhanden sein, aber wann tut sich in Richtung Zulassung was? Ab wann kann Medarex auf Eigenfinanzierbarkeit durch Verkäufe rechnen?
Usw. usf.
Also: Nächste Woche gibts Zahlen. Cash sollte nach Genmab fast-komplettausstieg ausreichend vorhanden sein, aber wann tut sich in Richtung Zulassung was? Ab wann kann Medarex auf Eigenfinanzierbarkeit durch Verkäufe rechnen?
Usw. usf.
Antwort auf Beitrag Nr.: 33.454.642 von MrBean07 am 23.02.08 09:52:11
2€ das kannst du mir nicht antun



2€ das kannst du mir nicht antun


Moin,

habe heute erstmals wieder eine ordentliche Tradingposition zu meiner leider immer noch bestehenden Longposition zugekauft (zu 6,10 €). Denke mal, dass der Kursverfall so langsam zu Ende sein sollte.
Zahlen kommen ja auch, mal sehen, was die bringen (nach GenMab-Verkauf etc.).

Falls es noch tiefer geht, kaufe ich noch ein weiteres Mal zu.

Wäre aber auch nett, mal wieder etwas mehr Grün zu sehen bei den Eselchen!
Gruß q.

habe heute erstmals wieder eine ordentliche Tradingposition zu meiner leider immer noch bestehenden Longposition zugekauft (zu 6,10 €). Denke mal, dass der Kursverfall so langsam zu Ende sein sollte.
Zahlen kommen ja auch, mal sehen, was die bringen (nach GenMab-Verkauf etc.).

Falls es noch tiefer geht, kaufe ich noch ein weiteres Mal zu.

Wäre aber auch nett, mal wieder etwas mehr Grün zu sehen bei den Eselchen!
Gruß q.
Antwort auf Beitrag Nr.: 33.483.591 von quepos am 26.02.08 21:00:48 Im 3 Jahreschart schön zu sehen ,wir befinden uns immer noch im Abwärtstrend
Im 3 Jahreschart schön zu sehen ,wir befinden uns immer noch im Abwärtstrend



 Im 3 Jahreschart schön zu sehen ,wir befinden uns immer noch im Abwärtstrend
Im 3 Jahreschart schön zu sehen ,wir befinden uns immer noch im Abwärtstrend



Understanding the Evolving Role of Immunotherapy in the Treatment of Malignant Melanoma (Slides With Audio):
http://www.medscape.com/viewarticle/570643
http://www.medscape.com/viewarticle/570643
Was möchtest Du uns hiermit mitteilen? Oder sollen wir ein Abonnement eingehen?

Entschuldigung. Bitte den Einstieg über die erste Yahoo Message vornehmen (Link klicken!), müsste dann gehen (obwohl's der selbe Link ist):
http://messages.finance.yahoo.com/Stocks_%28A_to_Z%29/Stocks…
Gehts jetzt?
http://messages.finance.yahoo.com/Stocks_%28A_to_Z%29/Stocks…
Gehts jetzt?
 Danke Ville7 für die prompte Anwort. Funktioniert und hört sich nicht verkehrt an.
Danke Ville7 für die prompte Anwort. Funktioniert und hört sich nicht verkehrt an.
Antwort auf Beitrag Nr.: 33.507.367 von Friseuse am 28.02.08 19:12:01 Na von friseuse was sagste jetzt .
Na von friseuse was sagste jetzt .
glasklarer abwärtstrend .dein chartbild sagt doch gar nichts aus









 Na von friseuse was sagste jetzt .
Na von friseuse was sagste jetzt .glasklarer abwärtstrend .dein chartbild sagt doch gar nichts aus










Hier noch nicht bekannt:
Ustekinumab (CNTO-1275) BLA von der FDA zur Prüfung angenommen (4.Feb 08):
http://www.centocor.com/centocor/i/press_releases/ustekniuma…
BLA-Stellung für CNTO-148 dürfte nur noch eine Frage der Zeit sein.
Ustekinumab (CNTO-1275) BLA von der FDA zur Prüfung angenommen (4.Feb 08):
http://www.centocor.com/centocor/i/press_releases/ustekniuma…
BLA-Stellung für CNTO-148 dürfte nur noch eine Frage der Zeit sein.
Antwort auf Beitrag Nr.: 33.569.102 von Ville7 am 06.03.08 16:03:08So, die 8,50 sind nun auch nach unten durch... Viel Spaß auch noch...
Antwort auf Beitrag Nr.: 33.583.505 von mountainbiker am 07.03.08 20:56:06Einfach unglaublich...

Im Moment an den 2003er-Hochs....
Antwort auf Beitrag Nr.: 33.593.799 von eck64 am 09.03.08 23:40:04MEDX: 7,90 nicht Euro, DOLLAR!!!

Antwort auf Beitrag Nr.: 33.600.066 von mountainbiker am 10.03.08 17:59:07Dieses verdammte Drecksding! Biotech - dass ich nicht lache...

Antwort auf Beitrag Nr.: 33.600.066 von mountainbiker am 10.03.08 17:59:077,81

Antwort auf Beitrag Nr.: 33.600.066 von mountainbiker am 10.03.08 17:59:07Bis ich mit denen mal wieder im Plus bin, wär ich mit Festgeld schon lane Millionär...

Eine Genentech mit Erfolgen steigt

Eine Medarex mit Erfolgsverzug und Substanzverlusten sinkt

Ein Deal wäre die Aktie im Fall von Dochnocherfolgen
Eine Medarex mit Erfolgsverzug und Substanzverlusten sinkt
Ein Deal wäre die Aktie im Fall von Dochnocherfolgen

Zur Zeit wird MEDX vom brutalen Markt heruntergedrückt.
Demnächst soll lt. MEDX Management anstehen für das wichtigste Programm ipilimumab:
Q1/Q2 2008: Diskussion mit der FDA(schon angelaufen) und bei Fehlen von Desinteresse der FDA das Filing einer second Line Melanoma BLA für MDX-010
Q2 2008: ASCO Daten aus den Frontline Studies für MDX-010 second line
Q4 2008/2009: front line study Daten MDX-010
Demnächst soll lt. MEDX Management anstehen für das wichtigste Programm ipilimumab:
Q1/Q2 2008: Diskussion mit der FDA(schon angelaufen) und bei Fehlen von Desinteresse der FDA das Filing einer second Line Melanoma BLA für MDX-010
Q2 2008: ASCO Daten aus den Frontline Studies für MDX-010 second line
Q4 2008/2009: front line study Daten MDX-010
Antwort auf Beitrag Nr.: 33.603.908 von Ville7 am 11.03.08 07:06:09Das wird im aktuellen Umfeld auch viel ausmachen:
Exchange: NASDAQ GM
Shares Outstanding: 127,459,000
Market Cap: 999.3 Million
Short Interest: 24,677,328 (19.36%)
xxxxxxxxxxxx
Wenn sowieso wenige Kaufinteresse im Biomarkt ist, dann fängt shortmassen niemand auf....
Exchange: NASDAQ GM
Shares Outstanding: 127,459,000
Market Cap: 999.3 Million
Short Interest: 24,677,328 (19.36%)
xxxxxxxxxxxx
Wenn sowieso wenige Kaufinteresse im Biomarkt ist, dann fängt shortmassen niemand auf....
Company / Shares Short, Feb. 15 /Shares Short, Jan. 31 /% Change / Float* / 1-Month Return / CAPS Rating (out of 5)
Medarex / 24.7 / 28.4 / (12.96%) / 126.7 / (7.06%) / **
http://www.fool.com/investing/general/2008/03/07/beating-bac…
Medarex / 24.7 / 28.4 / (12.96%) / 126.7 / (7.06%) / **
http://www.fool.com/investing/general/2008/03/07/beating-bac…
Moin,

frohe Ostern erstmal,
habe jetzt ein gutes Gefühl, dass wir wieder steigende Kurse sehen werden. Alles Negative ist irgendwie eingepreist, die Börsenstimmung mies und für Bios sowieso und die Shorties haben mit dem großen Knüppel auch noch mal auf alles eingedroschen.
Habe gestern nochmals ordentlich MEDX nachgelegt als Trading-Position.
Nun muß es nur noch klappen!
Sehe gute Chancen auch nach der Action von gestern (wirklich fettes Volumen etc.), dass es wieder rauf geht. Ein paar Finanzwerte habe ich auch schon (z.B. DB), obwohl man nicht genau weiß, was noch so kommt. Aber man muss ja in Zeiten der Unsicherheit kaufen, sonst lohnt´s nicht!
Gruß q.

frohe Ostern erstmal,
habe jetzt ein gutes Gefühl, dass wir wieder steigende Kurse sehen werden. Alles Negative ist irgendwie eingepreist, die Börsenstimmung mies und für Bios sowieso und die Shorties haben mit dem großen Knüppel auch noch mal auf alles eingedroschen.
Habe gestern nochmals ordentlich MEDX nachgelegt als Trading-Position.
Nun muß es nur noch klappen!
Sehe gute Chancen auch nach der Action von gestern (wirklich fettes Volumen etc.), dass es wieder rauf geht. Ein paar Finanzwerte habe ich auch schon (z.B. DB), obwohl man nicht genau weiß, was noch so kommt. Aber man muss ja in Zeiten der Unsicherheit kaufen, sonst lohnt´s nicht!
Gruß q.
Mensch,
interessiert sich den niemand mehr für den Laden?
Was meint ihr? Einsteigen?
Gruß
Mc
interessiert sich den niemand mehr für den Laden?
Was meint ihr? Einsteigen?
Gruß
Mc
Antwort auf Beitrag Nr.: 33.767.990 von McNamera am 31.03.08 16:51:06Kauf bis Ville wieder mehr schreibt

Antwort auf Beitrag Nr.: 33.776.411 von Friseuse am 01.04.08 12:46:20Kein schlechter Tipp. 

Antwort auf Beitrag Nr.: 33.780.253 von Ville7 am 01.04.08 17:52:49 sieht gut aus alles geht nuff nuff nuff
sieht gut aus alles geht nuff nuff nuff
 sieht gut aus alles geht nuff nuff nuff
sieht gut aus alles geht nuff nuff nuff
MEDX nachbörslich minus 9,x%. Pfizer mit ernsthaften Problemen bei Tremelimumab (Pfizers Version des Anti-CTLA-4):
http://biz.yahoo.com/bw/080401/20080401006838.html?.v=1
Pfizer Announces Discontinuation of Phase III Clinical Trial for Patients with Advanced Melanoma
Tuesday April 1, 5:48 pm ET
NEW YORK--(BUSINESS WIRE)--Pfizer Inc announced today the discontinuation of a Phase III clinical trial (A3671009), of single-agent tremelimumab (CP-675,206) in patients with advanced melanoma, after the review of interim data showed that the trial would not demonstrate superiority to standard chemotherapy.
Pfizer has communicated with worldwide regulatory authorities and investigators regarding the discontinuation of the trial. Investigators will work with their patients to determine if they are benefiting from treatment and therefore should continue treatment with tremelimumab. All patients are encouraged to contact their physician with questions about their treatment.
“Although this outcome is disappointing, Pfizer remains committed to investigating new treatment options for patients with melanoma, a high risk area of research with significant unmet medical need. We continue to focus on additional studies involving tremelimumab alone and in combination with other therapies which are currently ongoing in patients with several types of cancer,” said Charles Baum, M.D., Ph.D., Vice President and Oncology Therapeutic Area Head at Pfizer Global Research and Development. “We will continue to assess the study data to understand the clinical benefit seen in some patients who received tremelimumab.”
The full data set from study A3671009 is being analyzed, and more details are expected to be available at the upcoming American Society for Clinical Oncology Annual Meeting in June 2008.
“We have a robust pipeline within Pfizer Oncology and we remain committed to the discovery and development of novel cancer treatments which hold promise for patients with cancer,” said Dr. Baum. “We are extremely grateful for the strong support we have received for this clinical trial from the physicians, study staff, and most importantly from the patients.”
Pfizer is developing several classes of agents in its Immuno-Oncology pipeline including CD40 agonists, toll-like receptor (TLR) agonists and vaccines.
http://biz.yahoo.com/bw/080401/20080401006838.html?.v=1
Pfizer Announces Discontinuation of Phase III Clinical Trial for Patients with Advanced Melanoma
Tuesday April 1, 5:48 pm ET
NEW YORK--(BUSINESS WIRE)--Pfizer Inc announced today the discontinuation of a Phase III clinical trial (A3671009), of single-agent tremelimumab (CP-675,206) in patients with advanced melanoma, after the review of interim data showed that the trial would not demonstrate superiority to standard chemotherapy.
Pfizer has communicated with worldwide regulatory authorities and investigators regarding the discontinuation of the trial. Investigators will work with their patients to determine if they are benefiting from treatment and therefore should continue treatment with tremelimumab. All patients are encouraged to contact their physician with questions about their treatment.
“Although this outcome is disappointing, Pfizer remains committed to investigating new treatment options for patients with melanoma, a high risk area of research with significant unmet medical need. We continue to focus on additional studies involving tremelimumab alone and in combination with other therapies which are currently ongoing in patients with several types of cancer,” said Charles Baum, M.D., Ph.D., Vice President and Oncology Therapeutic Area Head at Pfizer Global Research and Development. “We will continue to assess the study data to understand the clinical benefit seen in some patients who received tremelimumab.”
The full data set from study A3671009 is being analyzed, and more details are expected to be available at the upcoming American Society for Clinical Oncology Annual Meeting in June 2008.
“We have a robust pipeline within Pfizer Oncology and we remain committed to the discovery and development of novel cancer treatments which hold promise for patients with cancer,” said Dr. Baum. “We are extremely grateful for the strong support we have received for this clinical trial from the physicians, study staff, and most importantly from the patients.”
Pfizer is developing several classes of agents in its Immuno-Oncology pipeline including CD40 agonists, toll-like receptor (TLR) agonists and vaccines.
kann mir jemand sagen was los ist?
Antwort auf Beitrag Nr.: 33.788.524 von McNamera am 02.04.08 14:20:5002.04.2008, 09:38:24
Nachricht
Pfizer stellt Studie zur Behandlung von Melanomen ein
NEW YORK (Dow Jones)--Die Pfizer Inc hat eine Phase-III-Studie zum Antikörper Tremelimumab bei Patienten mit fortgeschrittenen Melanomen eingestellt. Eine Überprüfung der inzwischen gewonnenen Daten habe gezeigt, dass das Medikament nicht besser als eine Standard-Chemotherapie wirke, teilte Pfizer mit Sitz in New York am Dienstag mit. Die Aktie des Unternehmens reagierte mit einem nachbörslich mit einem Kursverlust von 1,8% auf die Nachricht.
"Obwohl dieses Ergebnis enttäuschend ist, wird Pfizer weiterhin neue Behandlungsmöglichkeiten für Patienten mit Melanomen prüfen", sagte Charles Baum von Pfizer Global Research und Development. Der Pharmakonzern werde sich auf zusätzliche Studien mit Tremelimumab allein oder in Kombination mit anderen Therapien konzentrieren, die man derzeit an Patienten mit verschiedenen Krebsarten teste.
Webseite: http://www.pfizer.com -Von Kathy Shwiff, Dow Jones Newswires, ++49 (0) 69 297 25 108, unternehmen.de@dowjones.com DJG/DJN/pia/cbr
(END) Dow Jones Newswires
April 02, 2008 03:38 ET (07:38 GMT)
© 2008 Dow Jones & Company, Inc.
------------------------------------------
Medarex hätte 2 stellige % Royalties auf die Vermarktung bekommen. Zudem ist MEDX Hoffnungsträger ipilimumab auf das selbe Target gerichtet (CTLA-4). Kein Wunder, dass Medarex kräftigst abgestraft wird. Die Pfizer Nachricht ist schlecht. Allerdings macht es zu diesen Kursen m.E. kein Sinn zu verkaufen. Eher zu kaufen, aber das hängt davon ab wie man die Firma bewertet.
Nachricht
Pfizer stellt Studie zur Behandlung von Melanomen ein
NEW YORK (Dow Jones)--Die Pfizer Inc hat eine Phase-III-Studie zum Antikörper Tremelimumab bei Patienten mit fortgeschrittenen Melanomen eingestellt. Eine Überprüfung der inzwischen gewonnenen Daten habe gezeigt, dass das Medikament nicht besser als eine Standard-Chemotherapie wirke, teilte Pfizer mit Sitz in New York am Dienstag mit. Die Aktie des Unternehmens reagierte mit einem nachbörslich mit einem Kursverlust von 1,8% auf die Nachricht.
"Obwohl dieses Ergebnis enttäuschend ist, wird Pfizer weiterhin neue Behandlungsmöglichkeiten für Patienten mit Melanomen prüfen", sagte Charles Baum von Pfizer Global Research und Development. Der Pharmakonzern werde sich auf zusätzliche Studien mit Tremelimumab allein oder in Kombination mit anderen Therapien konzentrieren, die man derzeit an Patienten mit verschiedenen Krebsarten teste.
Webseite: http://www.pfizer.com -Von Kathy Shwiff, Dow Jones Newswires, ++49 (0) 69 297 25 108, unternehmen.de@dowjones.com DJG/DJN/pia/cbr
(END) Dow Jones Newswires
April 02, 2008 03:38 ET (07:38 GMT)
© 2008 Dow Jones & Company, Inc.
------------------------------------------
Medarex hätte 2 stellige % Royalties auf die Vermarktung bekommen. Zudem ist MEDX Hoffnungsträger ipilimumab auf das selbe Target gerichtet (CTLA-4). Kein Wunder, dass Medarex kräftigst abgestraft wird. Die Pfizer Nachricht ist schlecht. Allerdings macht es zu diesen Kursen m.E. kein Sinn zu verkaufen. Eher zu kaufen, aber das hängt davon ab wie man die Firma bewertet.
 Verdammt
Verdammt
Selten so in die Sch.... gegriffen, wie bei Medarex.


 stellt sich die Frage, wann Sie es einmal schaffen, dass ein Product Phase 3 übersteht. Mit ipilimumab steht es auch nicht zum Besten. Wann kommen andere vielversprechendere Ergebnisse. Nach dem Markt zu urteilen in nächster Zeit nicht mehr. Irgendwann müssen die mal regelmäßige Einanhmen erhalten, sonst geht mit der Liquidität auch einmal zu Ende. Man hat nicht mehr so viel Beteiligungen, die man verkaufen kann, um so cash zu generieren. Weiß einer mehr?
stellt sich die Frage, wann Sie es einmal schaffen, dass ein Product Phase 3 übersteht. Mit ipilimumab steht es auch nicht zum Besten. Wann kommen andere vielversprechendere Ergebnisse. Nach dem Markt zu urteilen in nächster Zeit nicht mehr. Irgendwann müssen die mal regelmäßige Einanhmen erhalten, sonst geht mit der Liquidität auch einmal zu Ende. Man hat nicht mehr so viel Beteiligungen, die man verkaufen kann, um so cash zu generieren. Weiß einer mehr?
Antwort auf Beitrag Nr.: 33.791.052 von Taube75 am 02.04.08 17:33:21BMS sucht schon für möglichen ipi Launch - eher kein Aprilscherz:
http://deploycws.bms.com/cws58/seeker.html?&dvt_xpath=./Node…
ipi hat die Chance in 2nd line und in der 1st line DTIC Combo. Treme 1st line ohne Combo gegen Chemo ist tot. Status quo. Per se heisst es noch nicht, dass ipi tot ist oder chancenlos ist. Ich bleibe auf jeden Fall dabei. Im akuellen Kurs ist treme und ipi schon fast komplett ausgepreist.
Überaschungen auf der positiven Seite daher m.E. nicht ausgeschlossen (AACR, ASCO), Übernahme...aber vor weiterem oder Neueinstieg auf jeden Fall Bodenbildung abwarten.
http://deploycws.bms.com/cws58/seeker.html?&dvt_xpath=./Node…
ipi hat die Chance in 2nd line und in der 1st line DTIC Combo. Treme 1st line ohne Combo gegen Chemo ist tot. Status quo. Per se heisst es noch nicht, dass ipi tot ist oder chancenlos ist. Ich bleibe auf jeden Fall dabei. Im akuellen Kurs ist treme und ipi schon fast komplett ausgepreist.
Überaschungen auf der positiven Seite daher m.E. nicht ausgeschlossen (AACR, ASCO), Übernahme...aber vor weiterem oder Neueinstieg auf jeden Fall Bodenbildung abwarten.
Antwort auf Beitrag Nr.: 33.791.052 von Taube75 am 02.04.08 17:33:21Liqui hat man 500 Mio USD Cash, reicht locker für drei Jahre (sogar mit erhöhtem ipi cash burn, der allein 40Mio USD/Jahr ausmacht). Zudem hat man Beteiligungen, die nochmal ein Jahr Cash generieren können. Also Cash kein Problem. Zudem sollten die überragenden zwei CNTO AK (CNTO148, CNTO1275) zugelassen werden und bald zum Cashflow beitragen (ich schätze 50-150Mio USD/Jahr nach Anlaufphase).
MEDX wird sicherlich kein Problem haben, an Geld zu kommen. Man wird einfach weitere Aktien ausgeben. Ein guter Zeitpunkt für diese Aktionen waren bislang immer die Wochen nach der Hauptversammlung. Insgeheim glaube ich ja, daß der Verkauf des Genmab-Anteils daher rührt, daß man nicht mehr wirklich an eine schnelle Vermarktung von Ipi glaubt und sich noch einmal schnell Cash beschaffen wollte.
Die gerade erfolgte Pressemitteilung hat nur kurzfristig gewirkt und kam viel zu spät. Gestern vor Eröffnung wäre es notwendig gewesen. Jetzt ist schon alles passiert. Wie sehr man dieser PM überhaubt glaubt wird sich zeigen, ich glaube eher, daß es weiter bergab geht.
Die gerade erfolgte Pressemitteilung hat nur kurzfristig gewirkt und kam viel zu spät. Gestern vor Eröffnung wäre es notwendig gewesen. Jetzt ist schon alles passiert. Wie sehr man dieser PM überhaubt glaubt wird sich zeigen, ich glaube eher, daß es weiter bergab geht.
Antwort auf Beitrag Nr.: 33.799.188 von Ennox am 03.04.08 14:40:40Hier ist sie nochmal die Presseerklärung:
Press Release Source: Medarex, Inc.
Medarex Announces Ipilimumab Program Continues to Move Forward
Thursday April 3, 8:00 am ET
Previously-Stated Guidance Remains Unchanged
PRINCETON, N.J., April 3, 2008 /PRNewswire-FirstCall/ -- Medarex, Inc. (Nasdaq: MEDX - News) today issued the following statement in response to the announcement by Pfizer Inc that it was discontinuing its Phase 3 clinical trial of front-line treatment with Pfizer's single-agent anti-CTLA-4 antibody (tremelimumab) compared to chemotherapy in patients with advanced melanoma. Dr. Geoffrey M. Nichol, M.B.Ch.B., Senior Vice President, Product Development of Medarex, stated:
ADVERTISEMENT
"While Pfizer's tremelimumab and Medarex's ipilimumab have a similar mechanism of action and have been considered by some as similar molecules, it is natural to attempt to draw parallels between the two molecules. However, we feel we need to make certain clarifications. First, the two antibodies are different molecules, and results from one antibody program may not be indicative of results from another program. The molecules are of different IgG antibody subclasses, administered at different doses and dosing schedules, and with different pharmacokinetic parameters.
Second, while, as previously reported, the results from the Phase 2 study under special protocol assessment did not meet the primary endpoint, the three studies in our Phase 2 program were suggestive of ipilimumab's potential for clinical anti-tumor activity based on the totality of the data and are under discussion with regulatory agencies.
Third, Medarex's ongoing ipilimumab Phase 3 program (study 024) for front- line treatment of advanced melanoma is different in design from the Pfizer trial, and at this time, it is too early to draw any clinical conclusions from the Pfizer announcement. In addition, a recent review of our ongoing 024 Phase 3 trial by the Data Monitoring Committee (DMC) indicated that our trial should continue.
Finally, we and our partner, Bristol-Myers Squibb Company, continue to move firmly forward. Our previously-stated guidance remains unchanged and regulatory discussions are pending."
About the Chemotherapy Combination Registrational Trial
Study 024 is a randomized, blinded registrational Phase 3 study designed to evaluate the effect of dacarbazine in combination with 10mg/kg ipilimumab or placebo on progression-free survival and overall survival in 500 patients with previously untreated metastatic melanoma (front-line). Ipilimumab is administered at 10 mg/kg once every three weeks for up to four doses. Subsequently, eligible patients who have not experienced disease progression at week 24 will continue in a maintenance phase where a single dose of ipilimumab or placebo will be administered once every 12 weeks until disease progression. All efficacy analyses, except for overall survival and survival rate at one year, will be conducted when at least 416 events for progression- free survival have been observed in the study and all patients have been followed for at least 12 weeks.
In June 2006, the 024 registrational Phase 3 trial was reviewed by the U.S. Food and Drug Administration (FDA) under a Special Protocol Assessment (SPA) concerning the suitability of the trial design to support regulatory approval. In December 2006, the FDA granted Fast Track status to this program which provides for expedited regulatory review for new drugs that demonstrate the potential to address unmet medical needs for the treatment of serious or life-threatening conditions. Trial enrollment was completed in the first- quarter of 2008.
About Ipilimumab
Ipilimumab is a fully human antibody that binds to CTLA-4 (cytotoxic T lymphocyte-associated antigen 4), a molecule on T-cells that plays a critical role in regulating natural immune responses. The absence or presence of CTLA- 4 can augment or suppress the immune system's T-cell response in fighting disease. Ipilimumab is designed to block the activity of CTLA-4, thereby sustaining an active immune response in its attack on cancer cells.
Comprehensive Clinical Trial Program for Ipilimumab
Ipilimumab is being developed through a joint partnership between Bristol- Myers Squibb and Medarex. Based on nonclinical and clinical studies showing that antibody blockade of CTLA-4 plays an important role in sustaining an active immune response to fight cancer, Bristol-Myers Squibb and Medarex are pursuing a broad clinical development program with ipilimumab evaluating its potential use in advanced metastatic melanoma, as well as prostate, lung, pancreatic, bladder, breast, lymphoma and leukemia cancers. More than 2,000 patients have been treated with ipilimumab as a monotherapy or in combination with other agents in clinical trials.
For further information about ipilimumab clinical trials, please visit www.clinicaltrials.gov.
About Advanced Melanoma
Melanoma is a form of skin cancer characterized by the uncontrolled growth of pigment-producing cells (melanocytes) located in the skin. As with many cancers, it is more difficult to treat once the disease has spread beyond the skin to other parts of the body by way of the bloodstream or the lymphatic system (metastatic disease). Melanoma accounts for about three percent of skin cancer cases, but it causes most skin cancer deaths. The American Cancer Society estimates that in 2007 there will be 59,940 new cases of melanoma in the U.S., and about 8,110 people will die of this disease.
About Medarex
Medarex is a biopharmaceutical company focused on the discovery, development and potential commercialization of fully human antibody-based therapeutics to treat life-threatening and debilitating diseases, including cancer, inflammation, autoimmune disorders and infectious diseases. Medarex applies its UltiMAb® technology and product development and clinical manufacturing experience to generate, support and potentially commercialize a broad range of fully human antibody product candidates for itself and its partners. More than 30 of these therapeutic product candidates derived from Medarex technology are in human clinical testing or have had INDs submitted for such trials, with seven of the most advanced product candidates currently in Phase 3 clinical trials or the subject of regulatory applications for marketing authorization. Medarex is committed to building value by developing a diverse pipeline of antibody products to address the world's unmet healthcare needs. For more information about Medarex, visit its Web site at www.medarex.com.
Medarex Statement on Cautionary Factors
Except for the historical information presented herein, matters discussed herein may constitute forward-looking statements that are subject to certain risks and uncertainties that could cause actual results to differ materially from any future results, performance or achievements expressed or implied by such statements. Statements that are not historical facts, including statements preceded by, followed by, or that include the words "potential"; "believe"; "plan"; "should"; "may"; or similar statements are forward-looking statements. Medarex disclaims, however, any intent or obligation to update these forward-looking statements. No forward-looking statement can be guaranteed. Risks and uncertainties include risks associated with whether the development of the product described in this press release will be successful or whether the data from the registrational program described in this press release will support the filing of a Biological License Application (BLA) with the U.S. Food and Drug Administration (FDA, or if a BLA is filed with the FDA, that it will be filed in the timeframe described in this press release or will receive regulatory approval, or whether future clinical trials will result in the same outcomes as these clinical trials and whether the regulatory authorities will interpret the data from these clinical trials in the same manner, as well as risks detailed from time to time in Medarex's public disclosure filings with the U.S. Securities and Exchange Commission (SEC), including its Annual Report on Form 10-K for the fiscal year ended December 31, 2007 and its quarterly reports on Form 10-Q. There can be no assurance that such development efforts will succeed or that other developed products will receive required regulatory clearance or that, even if such regulatory clearance were received, such products would ultimately achieve commercial success. Copies of Medarex's public disclosure filings are available from its investor relations department.
Medarex®, the Medarex logo and UltiMAb® are registered trademarks of Medarex, Inc. All rights are reserved.
--------------------------------------------------------------------------------
Source: Medarex, Inc.
Press Release Source: Medarex, Inc.
Medarex Announces Ipilimumab Program Continues to Move Forward
Thursday April 3, 8:00 am ET
Previously-Stated Guidance Remains Unchanged
PRINCETON, N.J., April 3, 2008 /PRNewswire-FirstCall/ -- Medarex, Inc. (Nasdaq: MEDX - News) today issued the following statement in response to the announcement by Pfizer Inc that it was discontinuing its Phase 3 clinical trial of front-line treatment with Pfizer's single-agent anti-CTLA-4 antibody (tremelimumab) compared to chemotherapy in patients with advanced melanoma. Dr. Geoffrey M. Nichol, M.B.Ch.B., Senior Vice President, Product Development of Medarex, stated:
ADVERTISEMENT
"While Pfizer's tremelimumab and Medarex's ipilimumab have a similar mechanism of action and have been considered by some as similar molecules, it is natural to attempt to draw parallels between the two molecules. However, we feel we need to make certain clarifications. First, the two antibodies are different molecules, and results from one antibody program may not be indicative of results from another program. The molecules are of different IgG antibody subclasses, administered at different doses and dosing schedules, and with different pharmacokinetic parameters.
Second, while, as previously reported, the results from the Phase 2 study under special protocol assessment did not meet the primary endpoint, the three studies in our Phase 2 program were suggestive of ipilimumab's potential for clinical anti-tumor activity based on the totality of the data and are under discussion with regulatory agencies.
Third, Medarex's ongoing ipilimumab Phase 3 program (study 024) for front- line treatment of advanced melanoma is different in design from the Pfizer trial, and at this time, it is too early to draw any clinical conclusions from the Pfizer announcement. In addition, a recent review of our ongoing 024 Phase 3 trial by the Data Monitoring Committee (DMC) indicated that our trial should continue.
Finally, we and our partner, Bristol-Myers Squibb Company, continue to move firmly forward. Our previously-stated guidance remains unchanged and regulatory discussions are pending."
About the Chemotherapy Combination Registrational Trial
Study 024 is a randomized, blinded registrational Phase 3 study designed to evaluate the effect of dacarbazine in combination with 10mg/kg ipilimumab or placebo on progression-free survival and overall survival in 500 patients with previously untreated metastatic melanoma (front-line). Ipilimumab is administered at 10 mg/kg once every three weeks for up to four doses. Subsequently, eligible patients who have not experienced disease progression at week 24 will continue in a maintenance phase where a single dose of ipilimumab or placebo will be administered once every 12 weeks until disease progression. All efficacy analyses, except for overall survival and survival rate at one year, will be conducted when at least 416 events for progression- free survival have been observed in the study and all patients have been followed for at least 12 weeks.
In June 2006, the 024 registrational Phase 3 trial was reviewed by the U.S. Food and Drug Administration (FDA) under a Special Protocol Assessment (SPA) concerning the suitability of the trial design to support regulatory approval. In December 2006, the FDA granted Fast Track status to this program which provides for expedited regulatory review for new drugs that demonstrate the potential to address unmet medical needs for the treatment of serious or life-threatening conditions. Trial enrollment was completed in the first- quarter of 2008.
About Ipilimumab
Ipilimumab is a fully human antibody that binds to CTLA-4 (cytotoxic T lymphocyte-associated antigen 4), a molecule on T-cells that plays a critical role in regulating natural immune responses. The absence or presence of CTLA- 4 can augment or suppress the immune system's T-cell response in fighting disease. Ipilimumab is designed to block the activity of CTLA-4, thereby sustaining an active immune response in its attack on cancer cells.
Comprehensive Clinical Trial Program for Ipilimumab
Ipilimumab is being developed through a joint partnership between Bristol- Myers Squibb and Medarex. Based on nonclinical and clinical studies showing that antibody blockade of CTLA-4 plays an important role in sustaining an active immune response to fight cancer, Bristol-Myers Squibb and Medarex are pursuing a broad clinical development program with ipilimumab evaluating its potential use in advanced metastatic melanoma, as well as prostate, lung, pancreatic, bladder, breast, lymphoma and leukemia cancers. More than 2,000 patients have been treated with ipilimumab as a monotherapy or in combination with other agents in clinical trials.
For further information about ipilimumab clinical trials, please visit www.clinicaltrials.gov.
About Advanced Melanoma
Melanoma is a form of skin cancer characterized by the uncontrolled growth of pigment-producing cells (melanocytes) located in the skin. As with many cancers, it is more difficult to treat once the disease has spread beyond the skin to other parts of the body by way of the bloodstream or the lymphatic system (metastatic disease). Melanoma accounts for about three percent of skin cancer cases, but it causes most skin cancer deaths. The American Cancer Society estimates that in 2007 there will be 59,940 new cases of melanoma in the U.S., and about 8,110 people will die of this disease.
About Medarex
Medarex is a biopharmaceutical company focused on the discovery, development and potential commercialization of fully human antibody-based therapeutics to treat life-threatening and debilitating diseases, including cancer, inflammation, autoimmune disorders and infectious diseases. Medarex applies its UltiMAb® technology and product development and clinical manufacturing experience to generate, support and potentially commercialize a broad range of fully human antibody product candidates for itself and its partners. More than 30 of these therapeutic product candidates derived from Medarex technology are in human clinical testing or have had INDs submitted for such trials, with seven of the most advanced product candidates currently in Phase 3 clinical trials or the subject of regulatory applications for marketing authorization. Medarex is committed to building value by developing a diverse pipeline of antibody products to address the world's unmet healthcare needs. For more information about Medarex, visit its Web site at www.medarex.com.
Medarex Statement on Cautionary Factors
Except for the historical information presented herein, matters discussed herein may constitute forward-looking statements that are subject to certain risks and uncertainties that could cause actual results to differ materially from any future results, performance or achievements expressed or implied by such statements. Statements that are not historical facts, including statements preceded by, followed by, or that include the words "potential"; "believe"; "plan"; "should"; "may"; or similar statements are forward-looking statements. Medarex disclaims, however, any intent or obligation to update these forward-looking statements. No forward-looking statement can be guaranteed. Risks and uncertainties include risks associated with whether the development of the product described in this press release will be successful or whether the data from the registrational program described in this press release will support the filing of a Biological License Application (BLA) with the U.S. Food and Drug Administration (FDA, or if a BLA is filed with the FDA, that it will be filed in the timeframe described in this press release or will receive regulatory approval, or whether future clinical trials will result in the same outcomes as these clinical trials and whether the regulatory authorities will interpret the data from these clinical trials in the same manner, as well as risks detailed from time to time in Medarex's public disclosure filings with the U.S. Securities and Exchange Commission (SEC), including its Annual Report on Form 10-K for the fiscal year ended December 31, 2007 and its quarterly reports on Form 10-Q. There can be no assurance that such development efforts will succeed or that other developed products will receive required regulatory clearance or that, even if such regulatory clearance were received, such products would ultimately achieve commercial success. Copies of Medarex's public disclosure filings are available from its investor relations department.
Medarex®, the Medarex logo and UltiMAb® are registered trademarks of Medarex, Inc. All rights are reserved.
--------------------------------------------------------------------------------
Source: Medarex, Inc.
moin@all,
bin mittwoch zu 4,85 rein. klar, kann es noch etwas weiter runter gehen, allerdings kommt eine medarex von 12,XX €. sobald die branche wieder gute nachrichten prodiziert, glaube ich, dass medarex schnell (4-8 Monate) mal 20-30% macht.
Nur meine Meinung
Gruß
Mc
bin mittwoch zu 4,85 rein. klar, kann es noch etwas weiter runter gehen, allerdings kommt eine medarex von 12,XX €. sobald die branche wieder gute nachrichten prodiziert, glaube ich, dass medarex schnell (4-8 Monate) mal 20-30% macht.
Nur meine Meinung
Gruß
Mc
glaube ich, dass medarex schnell (4-8 Monate) mal 20-30% macht.
kommt wohl ganz drauf an, was bei MEDX 010 rauskommt. Bewegung wirds wohl sicher geben, nur in welche Richtung
ich greif zur Zeit konstant daneben. Also vielleicht kein gutes Omen
was solls, ist ja nur Geld
kommt wohl ganz drauf an, was bei MEDX 010 rauskommt. Bewegung wirds wohl sicher geben, nur in welche Richtung

ich greif zur Zeit konstant daneben. Also vielleicht kein gutes Omen

was solls, ist ja nur Geld

Antwort auf Beitrag Nr.: 33.789.190 von Ville7 am 02.04.08 15:15:53Ja

Manchmal kommt ganz überraschend ein Übernahmeangebot daher...manchmal auch nicht. Auf jeden Fall wirds bis ASCO (Ende Mai) spannend. BLA or not to BLA. Gute oder schlechte Ergebnisse von MDX-010? Was hat es mit dem embargoed AACR Abstract (Mitte April) auf sich?
Ich habe vorhin ein paar Medarex gekauft.
Im 5- MinutenChart sieht es meiner Meinung nach jetzt ganz gut aus für eine (kurzfristige) Erholung.....
BOT 100 MEDX false Stock MEDX (NMS) 7.44 USD ARCA 20080411 15:49:28 00012d42.47ff31ae.01.01 1,00
BOT 100 MEDX false Stock MEDX (NMS) 7.44 USD ARCA 20080411 15:49:28 00012d42.47ff31af.01.01 0.00
BOT 200 MEDX false Stock MEDX (NMS) 7.44 USD ARCA 20080411 15:49:28 00012d42.47ff31b0.01.01 1,00
BOT 100 MEDX false Stock MEDX (NMS) 7.44 USD ARCA 20080411 15:49:28 00012d42.47ff31b1.01.01 0,50
BOT 100 MEDX false Stock MEDX (NMS) 7.44 USD ARCA 20080411 15:49:28 00012d42.47ff31b2.01.01 0,50
BOT 100 MEDX false Stock MEDX (NMS) 7.44 USD ARCA 20080411 15:49:28 00012d42.47ff31b3.01.01 0,50
BOT 200 MEDX false Stock MEDX (NMS) 7.44 USD ARCA 20080411 15:49:28 00012d42.47ff31b4.01.01 1,00
BOT 1000 MEDX false Stock MEDX (NMS) 7.44 USD ARCA 20080411 15:49:28 00012d42.47ff31b5.01.01 5,00
BOT 500 MEDX false Stock MEDX (NMS) 7.44 USD ISLAND 20080411 15:49:28 0000e69b.47ff47dc.01.01 2,50
BOT 100 MEDX false Stock MEDX (NMS) 7.44 USD ISLAND 20080411 15:49:28 0000e69b.47ff47dd.01.01 0,50
BOT 100 MEDX false Stock MEDX (NMS) 7.44 USD ISLAND 20080411 15:49:28 0000e69b.47ff47de.01.01 0,50
BOT 100 MEDX false Stock MEDX (NMS) 7.44 USD ISLAND 20080411 15:49:28 0000e69b.47ff47df.01.01 0,50
Im 5- MinutenChart sieht es meiner Meinung nach jetzt ganz gut aus für eine (kurzfristige) Erholung.....
BOT 100 MEDX false Stock MEDX (NMS) 7.44 USD ARCA 20080411 15:49:28 00012d42.47ff31ae.01.01 1,00
BOT 100 MEDX false Stock MEDX (NMS) 7.44 USD ARCA 20080411 15:49:28 00012d42.47ff31af.01.01 0.00
BOT 200 MEDX false Stock MEDX (NMS) 7.44 USD ARCA 20080411 15:49:28 00012d42.47ff31b0.01.01 1,00
BOT 100 MEDX false Stock MEDX (NMS) 7.44 USD ARCA 20080411 15:49:28 00012d42.47ff31b1.01.01 0,50
BOT 100 MEDX false Stock MEDX (NMS) 7.44 USD ARCA 20080411 15:49:28 00012d42.47ff31b2.01.01 0,50
BOT 100 MEDX false Stock MEDX (NMS) 7.44 USD ARCA 20080411 15:49:28 00012d42.47ff31b3.01.01 0,50
BOT 200 MEDX false Stock MEDX (NMS) 7.44 USD ARCA 20080411 15:49:28 00012d42.47ff31b4.01.01 1,00
BOT 1000 MEDX false Stock MEDX (NMS) 7.44 USD ARCA 20080411 15:49:28 00012d42.47ff31b5.01.01 5,00
BOT 500 MEDX false Stock MEDX (NMS) 7.44 USD ISLAND 20080411 15:49:28 0000e69b.47ff47dc.01.01 2,50
BOT 100 MEDX false Stock MEDX (NMS) 7.44 USD ISLAND 20080411 15:49:28 0000e69b.47ff47dd.01.01 0,50
BOT 100 MEDX false Stock MEDX (NMS) 7.44 USD ISLAND 20080411 15:49:28 0000e69b.47ff47de.01.01 0,50
BOT 100 MEDX false Stock MEDX (NMS) 7.44 USD ISLAND 20080411 15:49:28 0000e69b.47ff47df.01.01 0,50
Antwort auf Beitrag Nr.: 33.867.546 von Gruenfeld am 11.04.08 16:01:07Ich habe vorgestern ein paar gekauft.
bei 7,18 bzw. zu 4,55€.
Auf ariva hatte ich dazu diesen chart gepostet:

bei 7,18 bzw. zu 4,55€.
Auf ariva hatte ich dazu diesen chart gepostet:
17% shortquote, da täten richtige good news ordentlich was bewegen.
Heute abend 22Uhr wird es spannend für MEDX und CEGE Aktionäre. Was gibt es neues zu GVAX+ipilimumab(MDX-010) beim AACR? Der Abstract wurde zurückgehalten um die Meldung in das AACR Presseprogramm mitaufzunehmen. Daher ist mit nicht unbedeutender News zu rechnen und in aller Regel nicht mit negativer!
------------------------------------------
Abstract Number: 2538
Session Title: Clinical Immunotherapy
Presentation Title: Dendritic and T cell functions in patients with metastatic hormone-refractory prostate cancer treated with GVAX immunotherapy for prostate cancer and ipilimumab
Presentation Start/End Time: Monday, Apr 14, 2008, 1:25 PM - 1:40 PM
Location: Room 30A-C, San Diego Convention Center
Author Block: Saskia J.A.M. Santegoets, Alfons J.M. Van den Eertwegh, Sinead M. Lougheed, Anita G.M. Stam, Helen Gall, Petra E.T. Scholten, Mary B.E. Von Blomberg, Erik Hooijberg, Karin Jooss, Nathalie Sacks, Minh Nguyen, Thomas Harding, Thomas Harding, Kristen Hege, Israel Lowy, Winald R. Gerritsen, Rik J. Scheper, Tanja D. De Gruijl. VU University Medical Center, Amsterdam, The Netherlands, Cell Genesys Inc, San Francisco, CA, Medarex, Bloomsbury, NY
Abstract 2538 has been selected for inclusion in the AACR’s Annual Meeting press program and is therefore embargoed until date and time of press briefing or scientific presentation, whichever comes first. The abstract is scheduled for scientific presentation and will be posted to this site at or after the following date and time: 4/14/2008 1:00 PM.
------------------------------------------
Abstract Number: 2538
Session Title: Clinical Immunotherapy
Presentation Title: Dendritic and T cell functions in patients with metastatic hormone-refractory prostate cancer treated with GVAX immunotherapy for prostate cancer and ipilimumab
Presentation Start/End Time: Monday, Apr 14, 2008, 1:25 PM - 1:40 PM
Location: Room 30A-C, San Diego Convention Center
Author Block: Saskia J.A.M. Santegoets, Alfons J.M. Van den Eertwegh, Sinead M. Lougheed, Anita G.M. Stam, Helen Gall, Petra E.T. Scholten, Mary B.E. Von Blomberg, Erik Hooijberg, Karin Jooss, Nathalie Sacks, Minh Nguyen, Thomas Harding, Thomas Harding, Kristen Hege, Israel Lowy, Winald R. Gerritsen, Rik J. Scheper, Tanja D. De Gruijl. VU University Medical Center, Amsterdam, The Netherlands, Cell Genesys Inc, San Francisco, CA, Medarex, Bloomsbury, NY
Abstract 2538 has been selected for inclusion in the AACR’s Annual Meeting press program and is therefore embargoed until date and time of press briefing or scientific presentation, whichever comes first. The abstract is scheduled for scientific presentation and will be posted to this site at or after the following date and time: 4/14/2008 1:00 PM.
Hier der embargoed AACR Abstract, der nun gestern freigegeben wurde:
Abstract Number: 2538
Session Title: Clinical Immunotherapy
Presentation Title: Dendritic and T cell functions in patients with metastatic hormone-refractory prostate cancer treated with GVAX immunotherapy for prostate cancer and ipilimumab
Presentation Start/End Time:
Monday, Apr 14, 2008, 1:25 PM - 1:40 PM
Location:
Room 30A-C, San Diego Convention Center
Author Block:
Saskia J.A.M. Santegoets, Alfons J.M. Van den Eertwegh, Sinead M. Lougheed, Anita G.M. Stam, Helen Gall, Petra E.T. Scholten, Mary B.E. Von Blomberg, Erik Hooijberg, Karin Jooss, Nathalie Sacks, Minh Nguyen, Thomas Harding, Thomas Harding, Kristen Hege, Israel Lowy, Winald R. Gerritsen, Rik J. Scheper, Tanja D. De Gruijl. VU University Medical Center, Amsterdam, The Netherlands, Cell Genesys Inc, San Francisco, CA, Medarex, Bloomsbury, NY
The effects of a combination of two allogeneic, GM-CSF-secreting prostate cancer cell lines (GVAX Immunotherapy for Prostate Cancer, Cell Genesys, Inc.) and escalating doses of the anti-CTLA4 antibody ipilimumab (MDX-010, Medarex, Inc.) are currently being evaluated in a Phase I trial of patients with metastatic, hormone-refractory prostate cancer (HRPC). The anticipated synergy of these two novel therapies may potentially lead to augmented T cell-mediated anti-tumor immunity via improved dendritic cell (DC) functions and blockade of inhibitory feedback loops in activated tumor-specific T cells. All patients received a 500 million cell prime dose of the cellular immunotherapy on day 1 followed by bi-weekly intradermal administrations of 300 million cells for a 24-week period. Ipilimumab was administered every 4 wks from day 1 during the same period. Patients were enrolled in cohorts of 3; each cohort was assigned an escalating dose of ipilimumab at 0.3, 1, 3 or 5 mg/kg. Results showed PSA declines of >50% in 5/6 patients at the two highest dose levels of anti-CTLA-4, as well as resolution of multiple lesions on bone scan in two patients, and resolution of abdominal lymph node disease by CT scan and improvement in bone pain in one patient each. T cell activation was monitored to identify changes that correlate with clinical efficacy. Preliminary DC and T cell data are encouraging. Pre-treatment frequencies of circulating myeloid DC (MDC) subsets were significantly reduced in the enrolled HRPC patients, as compared to age- and sex-matched healthy controls. A transient increase in MDC frequencies was observed at the lowest ipilimumab dose level (0.3 mg/kg), but not at the two highest dose levels. The latter may be explained by an observed massive recruitment of MDC to the immunotherapy injection sites. Evidence of transient activation of circulating MDC, concomitant increases of the activation marker HLA-DR on circulating T cells and increased frequencies of circulating memory/effector T cells was found during treatment at the higher ipilimumab dose levels. The transient activation of circulating MDC and T cells showed a reverse kinetics with serum PSA levels. Furthermore, intense skin reactions were observed in response to administration of the cellular immunotherapy, which is consistent with the observed increases in T cell infiltration and Granzyme B expression in injection site biopsies taken during the treatment course and is suggestive of early immune activation. To increase the chances of detecting tumor-specific T cells, both blood and injection sites are monitored for T cell reactivity. Functional regulatory T cell activity is tested in parallel. These on-going analyses are expected to yield valuable data concerning immune effects achieved by the GVAX/ipilimumab combination.
-------------
Die Meldung war leider nichts neues, die Daten von ASCO 2007 sind nur nochmal aufgewärmt worden. Erst auf ASCO 2008 (Ende Mai/Anfang Juni) werden wir jetzt die vollen Daten der Phase I sehen (mit 20-25 Patienten).
Die Bewertung von MEDX ist derzeit ein Witz und ein Boden im Kurs ist derzeit nicht abzusehen. Selbst bei Einstellung von MDX-010 und Tremelimumab zusammen würden keine derartige Bewertung rechtfertigen.
Ich glaube bei Medarex geht gerade eine Riesensauerei ab. Irgendein Big Pharma gab den Auftrag den Kurs in Grund un Boden zu shorten um nachher ein Übernahmeangebot billig lancieren zu können. Nur meine Spekulation.
Börsenwert: 939 Mio USD
Cash: 500 Mio USD
Beteiligungen: 150 Mio USD
------------------------------
Bewertung ex Cash: 289 Mio USD = 182 Mio EUR
Eigene Pipeline:
1 mal Phase III
2 mal Phase II
7 mal Phase I
Echte Partner-Pipeline (ohne Genmab AK):
4 mal Phase III (davon zwei BLAs gestellt)
4 mal Phase II
mind. 11 mal Phase I
Präklinik:
>70 AK
Zusätzliche Werte:
Eigene AK Production facility
Abstract Number: 2538
Session Title: Clinical Immunotherapy
Presentation Title: Dendritic and T cell functions in patients with metastatic hormone-refractory prostate cancer treated with GVAX immunotherapy for prostate cancer and ipilimumab
Presentation Start/End Time:
Monday, Apr 14, 2008, 1:25 PM - 1:40 PM
Location:
Room 30A-C, San Diego Convention Center
Author Block:
Saskia J.A.M. Santegoets, Alfons J.M. Van den Eertwegh, Sinead M. Lougheed, Anita G.M. Stam, Helen Gall, Petra E.T. Scholten, Mary B.E. Von Blomberg, Erik Hooijberg, Karin Jooss, Nathalie Sacks, Minh Nguyen, Thomas Harding, Thomas Harding, Kristen Hege, Israel Lowy, Winald R. Gerritsen, Rik J. Scheper, Tanja D. De Gruijl. VU University Medical Center, Amsterdam, The Netherlands, Cell Genesys Inc, San Francisco, CA, Medarex, Bloomsbury, NY
The effects of a combination of two allogeneic, GM-CSF-secreting prostate cancer cell lines (GVAX Immunotherapy for Prostate Cancer, Cell Genesys, Inc.) and escalating doses of the anti-CTLA4 antibody ipilimumab (MDX-010, Medarex, Inc.) are currently being evaluated in a Phase I trial of patients with metastatic, hormone-refractory prostate cancer (HRPC). The anticipated synergy of these two novel therapies may potentially lead to augmented T cell-mediated anti-tumor immunity via improved dendritic cell (DC) functions and blockade of inhibitory feedback loops in activated tumor-specific T cells. All patients received a 500 million cell prime dose of the cellular immunotherapy on day 1 followed by bi-weekly intradermal administrations of 300 million cells for a 24-week period. Ipilimumab was administered every 4 wks from day 1 during the same period. Patients were enrolled in cohorts of 3; each cohort was assigned an escalating dose of ipilimumab at 0.3, 1, 3 or 5 mg/kg. Results showed PSA declines of >50% in 5/6 patients at the two highest dose levels of anti-CTLA-4, as well as resolution of multiple lesions on bone scan in two patients, and resolution of abdominal lymph node disease by CT scan and improvement in bone pain in one patient each. T cell activation was monitored to identify changes that correlate with clinical efficacy. Preliminary DC and T cell data are encouraging. Pre-treatment frequencies of circulating myeloid DC (MDC) subsets were significantly reduced in the enrolled HRPC patients, as compared to age- and sex-matched healthy controls. A transient increase in MDC frequencies was observed at the lowest ipilimumab dose level (0.3 mg/kg), but not at the two highest dose levels. The latter may be explained by an observed massive recruitment of MDC to the immunotherapy injection sites. Evidence of transient activation of circulating MDC, concomitant increases of the activation marker HLA-DR on circulating T cells and increased frequencies of circulating memory/effector T cells was found during treatment at the higher ipilimumab dose levels. The transient activation of circulating MDC and T cells showed a reverse kinetics with serum PSA levels. Furthermore, intense skin reactions were observed in response to administration of the cellular immunotherapy, which is consistent with the observed increases in T cell infiltration and Granzyme B expression in injection site biopsies taken during the treatment course and is suggestive of early immune activation. To increase the chances of detecting tumor-specific T cells, both blood and injection sites are monitored for T cell reactivity. Functional regulatory T cell activity is tested in parallel. These on-going analyses are expected to yield valuable data concerning immune effects achieved by the GVAX/ipilimumab combination.
-------------
Die Meldung war leider nichts neues, die Daten von ASCO 2007 sind nur nochmal aufgewärmt worden. Erst auf ASCO 2008 (Ende Mai/Anfang Juni) werden wir jetzt die vollen Daten der Phase I sehen (mit 20-25 Patienten).
Die Bewertung von MEDX ist derzeit ein Witz und ein Boden im Kurs ist derzeit nicht abzusehen. Selbst bei Einstellung von MDX-010 und Tremelimumab zusammen würden keine derartige Bewertung rechtfertigen.
Ich glaube bei Medarex geht gerade eine Riesensauerei ab. Irgendein Big Pharma gab den Auftrag den Kurs in Grund un Boden zu shorten um nachher ein Übernahmeangebot billig lancieren zu können. Nur meine Spekulation.
Börsenwert: 939 Mio USD
Cash: 500 Mio USD
Beteiligungen: 150 Mio USD
------------------------------
Bewertung ex Cash: 289 Mio USD = 182 Mio EUR
Eigene Pipeline:
1 mal Phase III
2 mal Phase II
7 mal Phase I
Echte Partner-Pipeline (ohne Genmab AK):
4 mal Phase III (davon zwei BLAs gestellt)
4 mal Phase II
mind. 11 mal Phase I
Präklinik:
>70 AK
Zusätzliche Werte:
Eigene AK Production facility
Antwort auf Beitrag Nr.: 33.885.411 von Ville7 am 15.04.08 09:11:12Immer diese Verschwörungstheorien.... 
Aber was soll man auch sonst denken, so wie die Kurse laufen?
Eine Erklärung habe ich auch keine, ausser das eben niemand den shorties Paroli bietet.

Aber was soll man auch sonst denken, so wie die Kurse laufen?
Eine Erklärung habe ich auch keine, ausser das eben niemand den shorties Paroli bietet.
Antwort auf Beitrag Nr.: 33.867.546 von Gruenfeld am 11.04.08 16:01:07MEDX 5- MinutenChart
Zeitraum: 10 Wochentage

Montag und Dienstag wurde der Kurs gleich nach Handelsbeginn stark abverkauft. Die Ursache ist ungeklärt..... vielleicht automatische Verkaufsprogramme? Rational jedenfalls nicht nachvollziehbar.
Egal. Der Bar mit der Eigenschaft At['17.04.2008 19:35:00'] ist ein Kaufsignal laut Rotating Gruen. Den EntryBar (Beitrag #3376) hat die Funktion auch gut berechnet. Unglaublich!
Zeitraum: 10 Wochentage
Montag und Dienstag wurde der Kurs gleich nach Handelsbeginn stark abverkauft. Die Ursache ist ungeklärt..... vielleicht automatische Verkaufsprogramme? Rational jedenfalls nicht nachvollziehbar.
Egal. Der Bar mit der Eigenschaft At['17.04.2008 19:35:00'] ist ein Kaufsignal laut Rotating Gruen. Den EntryBar (Beitrag #3376) hat die Funktion auch gut berechnet. Unglaublich!

Im aktuellen Kursbereich zieht jedenfalls das Volumen wieder an:

Um die 7,x wird also wieder stärker gekämpft und damit besteht die Chance auf Bodenbildung.
Muss ja auch nicht immer weiter Richtung cash fallen....
Um die 7,x wird also wieder stärker gekämpft und damit besteht die Chance auf Bodenbildung.
Muss ja auch nicht immer weiter Richtung cash fallen....
Antwort auf Beitrag Nr.: 33.927.118 von eck64 am 20.04.08 03:54:13Wird auch Zeit, Eck.
Mein "gegen den Markt stemmen" von Anfang November bei knapp unter 8€ war doch nicht gut (die habe ich heute noch). Jetzt habe ich vor einigen Tagen bei 4,80€ nachgelegt - und ZACK waren sie anschließend bei 4,50€.
Nervöser werde ich aber erst am Kreuzwiderstand.
Gruß
Zock
Mein "gegen den Markt stemmen" von Anfang November bei knapp unter 8€ war doch nicht gut (die habe ich heute noch). Jetzt habe ich vor einigen Tagen bei 4,80€ nachgelegt - und ZACK waren sie anschließend bei 4,50€.
Nervöser werde ich aber erst am Kreuzwiderstand.
Gruß
Zock
MEDX nachbörslich $7.11
[urlMedarex and Bristol-Myers Squibb Joint Statement on Submission Status of Ipilimumab]http://biz.yahoo.com/prnews/080425/nef051.html?.v=41[/url]
PR Newswire(Fri 4:10pm)
[urlMedarex and Bristol-Myers Squibb Joint Statement on Submission Status of Ipilimumab]http://biz.yahoo.com/prnews/080425/nef051.html?.v=41[/url]
PR Newswire(Fri 4:10pm)
Antwort auf Beitrag Nr.: 33.976.461 von Gruenfeld am 25.04.08 22:45:32

Antwort auf Beitrag Nr.: 33.976.461 von Gruenfeld am 25.04.08 22:45:32Hi Gruenfeld!  Wie komme ich an dennachbörslichen Kurs von Medarex? Danke
Wie komme ich an dennachbörslichen Kurs von Medarex? Danke
 Wie komme ich an dennachbörslichen Kurs von Medarex? Danke
Wie komme ich an dennachbörslichen Kurs von Medarex? Danke
Antwort auf Beitrag Nr.: 33.978.272 von Sinne am 26.04.08 16:18:07http://bigcharts.marketwatch.com/advchart/frames/main.asp?ti…
Da steht sogar 7,05 und 198 743 Stücke nachbörslich.....
Da steht sogar 7,05 und 198 743 Stücke nachbörslich.....
Antwort auf Beitrag Nr.: 33.978.470 von eck64 am 26.04.08 17:43:29 irgendwie erstehe ich es nicht? Es gab doch nichts überraschendes? Oder etwa, dass die FDA in 2008 hierüber nicht mehr entscheidet? Kann mir einer begünden,warum medx schon wieder abschmiert.danke
irgendwie erstehe ich es nicht? Es gab doch nichts überraschendes? Oder etwa, dass die FDA in 2008 hierüber nicht mehr entscheidet? Kann mir einer begünden,warum medx schon wieder abschmiert.danke
 irgendwie erstehe ich es nicht? Es gab doch nichts überraschendes? Oder etwa, dass die FDA in 2008 hierüber nicht mehr entscheidet? Kann mir einer begünden,warum medx schon wieder abschmiert.danke
irgendwie erstehe ich es nicht? Es gab doch nichts überraschendes? Oder etwa, dass die FDA in 2008 hierüber nicht mehr entscheidet? Kann mir einer begünden,warum medx schon wieder abschmiert.danke
Antwort auf Beitrag Nr.: 33.981.038 von Taube75 am 27.04.08 20:19:10 soory, hatte es nochmals durchgelesen. also verschiebung des Antrages nach 2008. Aber war dieses nicht klar? Die FDA will mehr Fakten, aber die haben ja noch kein p davorgesetzt.
soory, hatte es nochmals durchgelesen. also verschiebung des Antrages nach 2008. Aber war dieses nicht klar? Die FDA will mehr Fakten, aber die haben ja noch kein p davorgesetzt.
 soory, hatte es nochmals durchgelesen. also verschiebung des Antrages nach 2008. Aber war dieses nicht klar? Die FDA will mehr Fakten, aber die haben ja noch kein p davorgesetzt.
soory, hatte es nochmals durchgelesen. also verschiebung des Antrages nach 2008. Aber war dieses nicht klar? Die FDA will mehr Fakten, aber die haben ja noch kein p davorgesetzt.
Hallo Fundi-Spezis:
Stehen bald auch mal gute news zu erwarten?
Was macht die burnrate, bis wann sind die genmab verkäufe "verzehrt"?
Wie wichtig ist die Verschiebung insgesamt? Droht da Indikations-Totalverlust?
Stehen bald auch mal gute news zu erwarten?
Was macht die burnrate, bis wann sind die genmab verkäufe "verzehrt"?
Wie wichtig ist die Verschiebung insgesamt? Droht da Indikations-Totalverlust?
schrottpapier hochgelobt und nix dahinter.schaut euch mal meine cez an seit 1994 dabei.der volle neid!bei 1,5e steig ich hier ein



MEDX 5- MinutenChart
Zeitraum: 10 Wochentage

Zeitraum: 10 Wochentage
Antwort auf Beitrag Nr.: 33.912.122 von Gruenfeld am 17.04.08 20:17:29Nach den Gap- Downs vom 02.04.08 und 28.04.08 ist kein signifikanter Kursrückgang mehr zu verzeichnen. Die Chancen stehen gut, dass eines der beiden Gaps mfr. einen Umkehrpunkt im Kursverlauf darstellt.
Meine MEDX- Position (ausgeführte Order siehe Beitrag #3376) ist trotz negativer Ipilimumab- Nachricht kaum im Minus. Klasse von Rotating Gruen! Jetzt kommt sie wieder-- gibt als Rückgabewert den 5- MinutenBar mit der Eigenschaft At['07.05.2008 16:35:00']. Unglaublich wie zurückhaltend und geduldig die Funktion ist, bevor sie ein Kaufsignal setzt!
Meine MEDX- Position (ausgeführte Order siehe Beitrag #3376) ist trotz negativer Ipilimumab- Nachricht kaum im Minus. Klasse von Rotating Gruen! Jetzt kommt sie wieder-- gibt als Rückgabewert den 5- MinutenBar mit der Eigenschaft At['07.05.2008 16:35:00']. Unglaublich wie zurückhaltend und geduldig die Funktion ist, bevor sie ein Kaufsignal setzt!

Antwort auf Beitrag Nr.: 34.048.179 von Gruenfeld am 07.05.08 16:56:32

Gestern wieder neues 3-Jahrestief. Und in Euro sieht es natürlich noch übler aus.

Gestern wieder neues 3-Jahrestief. Und in Euro sieht es natürlich noch übler aus.

Antwort auf Beitrag Nr.: 34.053.308 von eck64 am 08.05.08 10:31:16Ich finde bemerkenswert, wie langanhaltend und stetig der Kursrückgang der Medarex- Aktie ist. Seit dem zyklischen Hoch vom 08.08.2007 gibt es keine nennenswerte Erholung* im Kursverlauf. Wir werden sehen, wie die Teilnehmer auf diese Situation reagieren.
*Ansätze zur Erholung gab es natürlich schon, aber diese wurden jedesmal durch immer neue Gaps zerstört.
*Ansätze zur Erholung gab es natürlich schon, aber diese wurden jedesmal durch immer neue Gaps zerstört.
Antwort auf Beitrag Nr.: 34.048.179 von Gruenfeld am 07.05.08 16:56:32At[09.05.2008 16:45:00]
Wieder ein Bar aus dem Traumland. Wie sauber und präzise 'Rotating Gruen' den Medarex- Chart zerlegt.....
Auch wenn #3394 nicht funktioniert hat, die Signale sind charttechnisch phantastisch plaziert!
Wieder ein Bar aus dem Traumland. Wie sauber und präzise 'Rotating Gruen' den Medarex- Chart zerlegt.....
Auch wenn #3394 nicht funktioniert hat, die Signale sind charttechnisch phantastisch plaziert!

Antwort auf Beitrag Nr.: 34.066.707 von Gruenfeld am 09.05.08 17:14:58Hallo Gruenfeld!
Du schreibst bereits einigemale von "Rotating Gruen" . Kannst Du bitte mit kurzen Worten erklären, was sich dahinter verbirgt? Wäre dir dankbar
. Kannst Du bitte mit kurzen Worten erklären, was sich dahinter verbirgt? Wäre dir dankbar  !
!
Du schreibst bereits einigemale von "Rotating Gruen"
 . Kannst Du bitte mit kurzen Worten erklären, was sich dahinter verbirgt? Wäre dir dankbar
. Kannst Du bitte mit kurzen Worten erklären, was sich dahinter verbirgt? Wäre dir dankbar  !
!
Antwort auf Beitrag Nr.: 34.067.906 von Sinne am 09.05.08 19:52:31Rotating Gruen ist eine Funktion, die Handelssignale zurück gibt. Momentan existiert sie nur als abgespeckte Version in der Skriptsprache mmTalk. Sie wird mein altes System (GF4- Systematik) ersetzen, das mit dem krassen Kursabsturz Mitte Januar 2008 nicht zurecht kam.
Rotating deshalb, weil der Kursverlauf bei Kaufsignalen immer eine positive Krümmung* hat. Und Gruen eben, weil die Funktion von mir programmiert ist. Natürlich ist alle Theorie grau und Rotating Gruen muss sich erst bewähren..... aber ich habe viel Zutrauen in die Mathematik, die in der Funktion verbaut ist.
*Beim Medarex 5- MinutenChart kann man zum Beispiel vom zyklischen Hoch (24.04.2008 17:50:00) aus eine Parabel berechnen, deren 2te Ableitung positiv ist.
Rotating deshalb, weil der Kursverlauf bei Kaufsignalen immer eine positive Krümmung* hat. Und Gruen eben, weil die Funktion von mir programmiert ist. Natürlich ist alle Theorie grau und Rotating Gruen muss sich erst bewähren..... aber ich habe viel Zutrauen in die Mathematik, die in der Funktion verbaut ist.
*Beim Medarex 5- MinutenChart kann man zum Beispiel vom zyklischen Hoch (24.04.2008 17:50:00) aus eine Parabel berechnen, deren 2te Ableitung positiv ist.
Was taugt MDX-010 wirklich? Hinweise ab Mitte Mai, denn Abstracts sind ab 15.5. online. Short interest (zahlen von gesten) übrigens weiter über 21 Millionen.
-------------------------
Medarex Announces Presentations at Annual Meeting of the American Society of Clinical Oncology
PRINCETON, N.J., April 29 /PRNewswire-FirstCall/ -- Medarex, Inc. (Nasdaq: MEDX)
announced today that the following clinical and preclinical abstracts for ipilimumab
in melanoma, prostate cancer and other cancers, as well as for anti-PD-1 and
anti-CD70 antibody candidates for cancer treatment, are expected to be the subject
of presentations at the Annual Meeting of the American Society of Clinical Oncology,
being held May 30-June 3, 2008 in Chicago:
Survival, Response, Safety and Biomarker Data of Ipilimumab in Melanoma
-- "Antitumor response and new lesions in advanced melanoma patients on
ipilimumab treatment" (Abstract #3020, Developmental Therapeutics:
Immunotherapy Session) -- Poster presentation and discussion from 2:00
p.m. to 6:00 p.m. local time on Friday, May 30, 2008.
-- "Long-term survival of patients with advanced melanoma who received
ipilimumab administered at 10mg/kg every 3 weeks for 4 doses (induction
dosing)" (Abstract #3018, Developmental Therapeutics: Immunotherapy
Session) - Poster presentation and discussion from 2:00 p.m. to 6:00
p.m. local time on Friday, May 30, 2008.
-- "Potential immune biomarkers of gastrointestinal toxicities and
efficacy in patients with advanced melanoma treated with ipilimumab
with or without prophylactic budesonide" (Abstract #3022, Developmental
Therapeutics: Immunotherapy Session) -- Poster presentation and
discussion from 2:00 p.m. to 6:00 p.m. local time on Friday, May 30,
2008.
-- "Novel efficacy criteria for antitumor activity to immunotherapy using
the example of ipilimumab, an anti-CTLA-4 monoclonal antibody"
(Abstract #3008, Developmental Therapeutics: Immunotherapy
Session) -- Oral presentation beginning at 4:30 p.m. local time one
Saturday, May 31, 2008.
-- "Effect of prior treatment status on the efficacy and safety of
ipilimumab monotherapy in treatment-naive and previously treated
patients with advanced melanoma" (Abstract #9055, Melanoma
Session) -- Poster presentation from 2:00 p.m. to 6:00 p.m. local time
on Saturday, May 31, 2008.
-- "An analysis of the effectiveness of specific guidelines for the
management of ipilimumab-mediated diarrhea/colitis: prevention of
gastrointestinal perforation and/or colectomy" (Abstract #9063,
Melanoma Session) - Poster presentation from 2:00 p.m. to 6:00 p.m.
local time on Saturday, May 31, 2008.
-- "Model-based evaluation of ipilimumab dosage regimen in patients with
advanced melanoma" (Abstract #9073, Melanoma Session) -- Poster
presentation from 2:00 p.m. to 6:00 p.m. local time on Saturday, May
31, 2008.
-- "Safety and efficacy of ipilimumab with or without prophylactic
budesonide in treatment-naive and previously treated patients with
advanced melanoma" (Abstract #9010, Melanoma Session) -- Oral
presentation beginning at 10:15 a.m. local time on Sunday, June 1,
2008.
-- "Efficacy and safety of ipilimumab induction and maintenance dosing in
patients with advanced melanoma who progressed on one or more prior
therapies" (Abstract #9021, Melanoma Session) -- Poster presentation
and discussion from 2:00 p.m. to 6:00 p.m. local time on Sunday, June
1, 2008.
-- "Disease control and long-term survival in chemotherapy-naive patients
with advanced melanoma treated with ipilimumab (MDX-010) with or
without dacarbazine" (Abstract #9022, Melanoma Session) -- Poster
presentation and discussion from 2:00 p.m. to 6:00 p.m. local time on
Sunday, June 1, 2008.
-- "Dose effect of ipilimumab in patients with advanced melanoma: results
from a phase 2, randomized, dose-ranging study" (Abstract #9025,
Melanoma Session) -- Poster presentation and discussion from 2:00 p.m.
to 6:00 p.m. local time on Sunday, June 1, 2008.
-- "Prolonged survival in objective responders to ipilimumab therapy"
(Abstract #20004) -- Publication only.
Response and Safety Data of Ipilimumab in Prostate
-- "Phase 1 trial of ipilimumab (IPI) alone and in combination with
radiotherapy (XRT) in patients with metastatic castration resistant
prostate cancer (mCRPC)" (Abstract #5004, New Targeted Strategies for
Patients with Prostate Cancer Session) -- Oral presentation beginning
at 11:30 a.m. local time on Monday, June 2, 2008.
-- "Expanded phase 1 combination trial of GVAX immunotherapy for prostate
cancer and ipilimumab in patients with metastatic hormone-refractory
prostate cancer (mHRPC)" (Abstract #5146, Genitourinary Cancer Session)
-- Poster presentation from 8:00 a.m. to 12:00 p.m. local time on
Saturday, May 31, 2008.
Clinical and Preclinical Data of Additional Immunotherapy and Antibody-Drug
Conjugate Programs
-- "Safety and activity of MDX-1106 (ONO-4538), an anti-PD-1 monoclonal
antibody, in patients with selected refractory or relapse malignancies"
(Abstract #3006, Developmental Therapeutics: Immunotherapy
Session) -- Oral presentation beginning at 4:00 p.m. local time on
Saturday, May 31, 2008.
-- "Antitumor activity of anti-CTLA-4 monoclonal antibody (mAb) in
combination with ixabepilone in preclinical tumor models" (Abstract
#3048, Developmental Therapeutics: Immunotherapy Session) -- Poster
presentation from 2:00 p.m. to 6:00 p.m. local time on Sunday, June 1,
2008.
-- "Effect of a fully human anti-CD70 antibody on apoptosis and
dephosphorylation of MAPK proteins in chronic lymphocytic leukemia"
(Abstract #3073, Developmental Therapeutics: Immunotherapy
Session) -- Poster presentation from 2:00 p.m. to 6:00 p.m. local time
on Sunday, June 1, 2008.
More information about the ASCO Annual Meeting may be found at www.asco.org.
-------------------------
Medarex Announces Presentations at Annual Meeting of the American Society of Clinical Oncology
PRINCETON, N.J., April 29 /PRNewswire-FirstCall/ -- Medarex, Inc. (Nasdaq: MEDX)
announced today that the following clinical and preclinical abstracts for ipilimumab
in melanoma, prostate cancer and other cancers, as well as for anti-PD-1 and
anti-CD70 antibody candidates for cancer treatment, are expected to be the subject
of presentations at the Annual Meeting of the American Society of Clinical Oncology,
being held May 30-June 3, 2008 in Chicago:
Survival, Response, Safety and Biomarker Data of Ipilimumab in Melanoma
-- "Antitumor response and new lesions in advanced melanoma patients on
ipilimumab treatment" (Abstract #3020, Developmental Therapeutics:
Immunotherapy Session) -- Poster presentation and discussion from 2:00
p.m. to 6:00 p.m. local time on Friday, May 30, 2008.
-- "Long-term survival of patients with advanced melanoma who received
ipilimumab administered at 10mg/kg every 3 weeks for 4 doses (induction
dosing)" (Abstract #3018, Developmental Therapeutics: Immunotherapy
Session) - Poster presentation and discussion from 2:00 p.m. to 6:00
p.m. local time on Friday, May 30, 2008.
-- "Potential immune biomarkers of gastrointestinal toxicities and
efficacy in patients with advanced melanoma treated with ipilimumab
with or without prophylactic budesonide" (Abstract #3022, Developmental
Therapeutics: Immunotherapy Session) -- Poster presentation and
discussion from 2:00 p.m. to 6:00 p.m. local time on Friday, May 30,
2008.
-- "Novel efficacy criteria for antitumor activity to immunotherapy using
the example of ipilimumab, an anti-CTLA-4 monoclonal antibody"
(Abstract #3008, Developmental Therapeutics: Immunotherapy
Session) -- Oral presentation beginning at 4:30 p.m. local time one
Saturday, May 31, 2008.
-- "Effect of prior treatment status on the efficacy and safety of
ipilimumab monotherapy in treatment-naive and previously treated
patients with advanced melanoma" (Abstract #9055, Melanoma
Session) -- Poster presentation from 2:00 p.m. to 6:00 p.m. local time
on Saturday, May 31, 2008.
-- "An analysis of the effectiveness of specific guidelines for the
management of ipilimumab-mediated diarrhea/colitis: prevention of
gastrointestinal perforation and/or colectomy" (Abstract #9063,
Melanoma Session) - Poster presentation from 2:00 p.m. to 6:00 p.m.
local time on Saturday, May 31, 2008.
-- "Model-based evaluation of ipilimumab dosage regimen in patients with
advanced melanoma" (Abstract #9073, Melanoma Session) -- Poster
presentation from 2:00 p.m. to 6:00 p.m. local time on Saturday, May
31, 2008.
-- "Safety and efficacy of ipilimumab with or without prophylactic
budesonide in treatment-naive and previously treated patients with
advanced melanoma" (Abstract #9010, Melanoma Session) -- Oral
presentation beginning at 10:15 a.m. local time on Sunday, June 1,
2008.
-- "Efficacy and safety of ipilimumab induction and maintenance dosing in
patients with advanced melanoma who progressed on one or more prior
therapies" (Abstract #9021, Melanoma Session) -- Poster presentation
and discussion from 2:00 p.m. to 6:00 p.m. local time on Sunday, June
1, 2008.
-- "Disease control and long-term survival in chemotherapy-naive patients
with advanced melanoma treated with ipilimumab (MDX-010) with or
without dacarbazine" (Abstract #9022, Melanoma Session) -- Poster
presentation and discussion from 2:00 p.m. to 6:00 p.m. local time on
Sunday, June 1, 2008.
-- "Dose effect of ipilimumab in patients with advanced melanoma: results
from a phase 2, randomized, dose-ranging study" (Abstract #9025,
Melanoma Session) -- Poster presentation and discussion from 2:00 p.m.
to 6:00 p.m. local time on Sunday, June 1, 2008.
-- "Prolonged survival in objective responders to ipilimumab therapy"
(Abstract #20004) -- Publication only.
Response and Safety Data of Ipilimumab in Prostate
-- "Phase 1 trial of ipilimumab (IPI) alone and in combination with
radiotherapy (XRT) in patients with metastatic castration resistant
prostate cancer (mCRPC)" (Abstract #5004, New Targeted Strategies for
Patients with Prostate Cancer Session) -- Oral presentation beginning
at 11:30 a.m. local time on Monday, June 2, 2008.
-- "Expanded phase 1 combination trial of GVAX immunotherapy for prostate
cancer and ipilimumab in patients with metastatic hormone-refractory
prostate cancer (mHRPC)" (Abstract #5146, Genitourinary Cancer Session)
-- Poster presentation from 8:00 a.m. to 12:00 p.m. local time on
Saturday, May 31, 2008.
Clinical and Preclinical Data of Additional Immunotherapy and Antibody-Drug
Conjugate Programs
-- "Safety and activity of MDX-1106 (ONO-4538), an anti-PD-1 monoclonal
antibody, in patients with selected refractory or relapse malignancies"
(Abstract #3006, Developmental Therapeutics: Immunotherapy
Session) -- Oral presentation beginning at 4:00 p.m. local time on
Saturday, May 31, 2008.
-- "Antitumor activity of anti-CTLA-4 monoclonal antibody (mAb) in
combination with ixabepilone in preclinical tumor models" (Abstract
#3048, Developmental Therapeutics: Immunotherapy Session) -- Poster
presentation from 2:00 p.m. to 6:00 p.m. local time on Sunday, June 1,
2008.
-- "Effect of a fully human anti-CD70 antibody on apoptosis and
dephosphorylation of MAPK proteins in chronic lymphocytic leukemia"
(Abstract #3073, Developmental Therapeutics: Immunotherapy
Session) -- Poster presentation from 2:00 p.m. to 6:00 p.m. local time
on Sunday, June 1, 2008.
More information about the ASCO Annual Meeting may be found at www.asco.org.
Hier kann man die shorts einsehen:

Erstaunlich dabei: Von September bis November waren durchgehend 32 bis 34 Millionen(!!!) Aktien short in Medarex.
Seither ist der Kurs nochmal ordentlich durchgesackt und die shorties haben es geschafft auf diesen Billig niveau ihre shorts auf 21 mio Stücke zu reduzieren.
Shorties haben also bereits gut 10 mio Stücke eingedeckt und damit den Kursverfall gebremst. Ich kanns gar nicht glauben. Ich hatte eher an Rekordshorts gedacht bzw. gehofft.
Ich hatte eher an Rekordshorts gedacht bzw. gehofft.
Erstaunlich dabei: Von September bis November waren durchgehend 32 bis 34 Millionen(!!!) Aktien short in Medarex.
Seither ist der Kurs nochmal ordentlich durchgesackt und die shorties haben es geschafft auf diesen Billig niveau ihre shorts auf 21 mio Stücke zu reduzieren.
Shorties haben also bereits gut 10 mio Stücke eingedeckt und damit den Kursverfall gebremst. Ich kanns gar nicht glauben.
 Ich hatte eher an Rekordshorts gedacht bzw. gehofft.
Ich hatte eher an Rekordshorts gedacht bzw. gehofft.
Antwort auf Beitrag Nr.: 34.069.913 von eck64 am 10.05.08 09:58:24Ein Großteil der Shortposition war Hedging gegen massive Longspekulationen, die inzwischen aufgelöst wurden. Daher kannste das nicht in der Form interpretieren wie du es eben getan hast.
Bin jedenfalls letzte Woche zu 4,59€ rein, in der Hoffnung dass wir die Tiefs gesehen haben.

Antwort auf Beitrag Nr.: 34.070.007 von Ville7 am 10.05.08 10:37:27Ich verstehe den Unterschied jetzt nicht?
Die Marktstimmung und speziell Medarex hat es ermöglicht die shortpositionen um über 10 mio Stücke abzubauen, ohne damit den Kurs hochzublasen. Ich finde das beeindruckend.
Die Marktstimmung und speziell Medarex hat es ermöglicht die shortpositionen um über 10 mio Stücke abzubauen, ohne damit den Kurs hochzublasen. Ich finde das beeindruckend.
UPGRADE: Medarex (MEDX) upgraded by Needham from Hold to Buy.
----------------------------------------------------- ---------------------------
Briefing.com
08:26 a.m. 05/13/2008
Target 11,00$
----------------------------------------------------- ---------------------------
Briefing.com
08:26 a.m. 05/13/2008
Target 11,00$
 Oh wie ist das schön so was hat man lange nicht gesehen.
Oh wie ist das schön so was hat man lange nicht gesehen.Es geht wieder los !!!!!!!!!!!!!!!
gruß medarex75
Advisory meeting June 17 for Ustekinumab.
ODAC meeting für CNTO-1275 am 17.6.! D.h. das erste MEDX-Partnerprodukt könnte Q3 2008 zugelassen werden.
CNTO-1275 hatte best-in-class Ergebnisse in Psoriasis. Die bisherigen Klassenbesten sind Milliardenblockbustermedikamente. MEDX Anteil würde bei 3-5% liegen. Zudem ist von Meilensteinzahlungen auszugehen.
Am 15.5. dann die ASCO Abstracts.
Und am Wochenende dann die Phase I Ergebnisse zu MDX-1100 gegen UC und RA.
Eine newsreiche Woche.
ODAC meeting für CNTO-1275 am 17.6.! D.h. das erste MEDX-Partnerprodukt könnte Q3 2008 zugelassen werden.
CNTO-1275 hatte best-in-class Ergebnisse in Psoriasis. Die bisherigen Klassenbesten sind Milliardenblockbustermedikamente. MEDX Anteil würde bei 3-5% liegen. Zudem ist von Meilensteinzahlungen auszugehen.
Am 15.5. dann die ASCO Abstracts.
Und am Wochenende dann die Phase I Ergebnisse zu MDX-1100 gegen UC und RA.
Eine newsreiche Woche.
J&J exec says psoriasis drug could dominate field
Wed May 14, 2008 3:02pm EDT
NEW YORK, May 14 (Reuters) - A top Johnson & Johnson (JNJ.N: Quote, Profile, Research) research official said on Wednesday the company's experimental drug ustekinumab could become the "gold standard" for treating psoriasis, in part because it would require only four injections a year.
"If you look at its benefits, including efficacy, convenience and safety profile, it certainly has potential to be the leader in treatment of psoriasis," Michael Elliott, senior vice president of immunology research for J&J's Centocor division, said in an interview.
J&J is hoping the medicine, formerly known as CNTO-1275, will be approved by the U.S. Food and Drug Administration by September and win European approval early next year. An FDA advisory panel plans to review the medicine on June 17.
Elliott said it would compete directly with Enbrel, a blockbuster medicine sold jointly by Wyeth (WYE.N: Quote, Profile, Research) and Amgen (AMGN.O: Quote, Profile, Research) that now commands an estimated 75 percent share of the U.S. psoriasis market, as well as with Abbott Laboratories Inc's (ABT.N: Quote, Profile, Research) injectable Humira. It would also compete with J&J's own Remicade, which is given by intravenous infusion.
"Over a 12-week period, you need to have 24 shots of Enbrel, but only one shot of ustekinumab," Elliott said, predicting that the far greater convenience of his product will resonate with patients and doctors.
Wed May 14, 2008 3:02pm EDT
NEW YORK, May 14 (Reuters) - A top Johnson & Johnson (JNJ.N: Quote, Profile, Research) research official said on Wednesday the company's experimental drug ustekinumab could become the "gold standard" for treating psoriasis, in part because it would require only four injections a year.
"If you look at its benefits, including efficacy, convenience and safety profile, it certainly has potential to be the leader in treatment of psoriasis," Michael Elliott, senior vice president of immunology research for J&J's Centocor division, said in an interview.
J&J is hoping the medicine, formerly known as CNTO-1275, will be approved by the U.S. Food and Drug Administration by September and win European approval early next year. An FDA advisory panel plans to review the medicine on June 17.
Elliott said it would compete directly with Enbrel, a blockbuster medicine sold jointly by Wyeth (WYE.N: Quote, Profile, Research) and Amgen (AMGN.O: Quote, Profile, Research) that now commands an estimated 75 percent share of the U.S. psoriasis market, as well as with Abbott Laboratories Inc's (ABT.N: Quote, Profile, Research) injectable Humira. It would also compete with J&J's own Remicade, which is given by intravenous infusion.
"Over a 12-week period, you need to have 24 shots of Enbrel, but only one shot of ustekinumab," Elliott said, predicting that the far greater convenience of his product will resonate with patients and doctors.
Heute auch Shareholdermeeting (annual meeting).
Das Meeting findet zum ersten Male an der Westküste in California statt. Scheinbar hat das Management beabsichtigt vor den zumeist Ostküsteshareholdern zu fliehen. Dies nach Info eines Shareholders aus dem erweiterten Management - siehe Yahoo Board.
Traurig.
Mit den beiden CNTO Produkten voraus sollte MEDX demnächst den Boden gefunden haben.
Das Meeting findet zum ersten Male an der Westküste in California statt. Scheinbar hat das Management beabsichtigt vor den zumeist Ostküsteshareholdern zu fliehen. Dies nach Info eines Shareholders aus dem erweiterten Management - siehe Yahoo Board.
Traurig.
Mit den beiden CNTO Produkten voraus sollte MEDX demnächst den Boden gefunden haben.
Antwort auf Beitrag Nr.: 34.098.452 von Ville7 am 15.05.08 10:50:34Das Westküstenmeeting hat anscheinden begeistert!
Der Kurs ist nachbörslich von 7,94 auf 9 USD gehüpft!

Was da wohl alles erzählt wurde? Veröffentlichte news habe ich noch keine gesehen.
Jetzt habe ich noch ein Forum geschaut:
http://siliconinvestor.advfn.com/readmsg.aspx?msgid=24593751
Novel efficacy criteria for antitumor activity to immunotherapy using the example of ipilimumab, an anti-CTLA-4 monoclonal antibody.
[I think this a pretty interesting abstract (from an ipi-centric point of view). But how long time will it take to turn the ocean liner named FDA around to accept different response criteria? If such an endeavour is even possible].
2008 ASCO Annual Meeting
Abstract No: 3008
Citation: J Clin Oncol 26: 2008 (May 20 suppl; abstr 3008)
Author(s): F. S. Hodi, The Global Ipilimumab Melanoma Study Group
Abstract:
Background:
Ipilimumab represents a new class of immunotherapeutic agent. Antitumor activity (CR, PR, or SD) to ipilimumab in melanoma can take weeks to months and 3 main clinical patterns were observed: (1) immediate, (2) late (after progression; PD), and (3) in the presence of new lesions. Modified World Health Organization (mWHO) response criteria do not recognize the latter 2 patterns. PD by mWHO prompts cessation of treatment and follow-up. To capture the patterns of activity, novel or broader assessment criteria are needed.
Methods:
Patients (pts) with advanced melanoma in 3 phase II trials received 10 mg/kg ipilimumab induction dosing every 3 weeks (Q3W) X 4. Eligible pts continued maintenance therapy Q12W. Activity was assessed using conventional mWHO and novel immune-related response criteria (irRC) developed using the thresholds for response previously defined by conventional mWHO criteria. Contrary to mWHO, irRC
(1) only considered measurable lesions (>1cm),
(2) defined total tumor burden (TB) as the sum of index lesions identified at baseline and new lesions detected after baseline,
(3) aimed for follow-up post PD to detect late activity.
Pts with stable disease (SD) and slow decline in tumor volume >25% from baseline were included as clinically meaningful as they had objective activity without reaching the 50% threshold of PR. The totality of pts with an objective reduction of TB from baseline (CR, PR, SD with >25% decline) is reported.
Results:
284 pts were evaluated. Conventional antitumor response rates (mWHO) in pts treated with 10 mg/kg ipilimumab monotherapy were 5.8%, 11.1%, and 15.8%, respectively. The totality of pts with an objective reduction of TB from baseline per irRC were 25.8%, 15.3%, and 30.9%, respectively.
Conclusions:
irRC may more accurately describe response to immunotherapy. Following pts for late response may avoid premature treatment cessation in pts with PD prior to response. Possible mechanisms underlying the clinical activity patterns are late effects of the immune system, sufficient availability of antigen for immune recognition, and increase of tumor volume through lymphocytic infiltration/edema before response. irRC need prospective validation and confirmation by survival data.
xxxxxxxxxxxxxxxxxxxxxxx
Ob die fda mitspielt? Der Markt hat das abstract wohl sehr gut aufgenommen, oder es ist doch was auf der HV gewesen.....
Der Kurs ist nachbörslich von 7,94 auf 9 USD gehüpft!


Was da wohl alles erzählt wurde? Veröffentlichte news habe ich noch keine gesehen.
Jetzt habe ich noch ein Forum geschaut:
http://siliconinvestor.advfn.com/readmsg.aspx?msgid=24593751
Novel efficacy criteria for antitumor activity to immunotherapy using the example of ipilimumab, an anti-CTLA-4 monoclonal antibody.
[I think this a pretty interesting abstract (from an ipi-centric point of view). But how long time will it take to turn the ocean liner named FDA around to accept different response criteria? If such an endeavour is even possible].
2008 ASCO Annual Meeting
Abstract No: 3008
Citation: J Clin Oncol 26: 2008 (May 20 suppl; abstr 3008)
Author(s): F. S. Hodi, The Global Ipilimumab Melanoma Study Group
Abstract:
Background:
Ipilimumab represents a new class of immunotherapeutic agent. Antitumor activity (CR, PR, or SD) to ipilimumab in melanoma can take weeks to months and 3 main clinical patterns were observed: (1) immediate, (2) late (after progression; PD), and (3) in the presence of new lesions. Modified World Health Organization (mWHO) response criteria do not recognize the latter 2 patterns. PD by mWHO prompts cessation of treatment and follow-up. To capture the patterns of activity, novel or broader assessment criteria are needed.
Methods:
Patients (pts) with advanced melanoma in 3 phase II trials received 10 mg/kg ipilimumab induction dosing every 3 weeks (Q3W) X 4. Eligible pts continued maintenance therapy Q12W. Activity was assessed using conventional mWHO and novel immune-related response criteria (irRC) developed using the thresholds for response previously defined by conventional mWHO criteria. Contrary to mWHO, irRC
(1) only considered measurable lesions (>1cm),
(2) defined total tumor burden (TB) as the sum of index lesions identified at baseline and new lesions detected after baseline,
(3) aimed for follow-up post PD to detect late activity.
Pts with stable disease (SD) and slow decline in tumor volume >25% from baseline were included as clinically meaningful as they had objective activity without reaching the 50% threshold of PR. The totality of pts with an objective reduction of TB from baseline (CR, PR, SD with >25% decline) is reported.
Results:
284 pts were evaluated. Conventional antitumor response rates (mWHO) in pts treated with 10 mg/kg ipilimumab monotherapy were 5.8%, 11.1%, and 15.8%, respectively. The totality of pts with an objective reduction of TB from baseline per irRC were 25.8%, 15.3%, and 30.9%, respectively.
Conclusions:
irRC may more accurately describe response to immunotherapy. Following pts for late response may avoid premature treatment cessation in pts with PD prior to response. Possible mechanisms underlying the clinical activity patterns are late effects of the immune system, sufficient availability of antigen for immune recognition, and increase of tumor volume through lymphocytic infiltration/edema before response. irRC need prospective validation and confirmation by survival data.
xxxxxxxxxxxxxxxxxxxxxxx
Ob die fda mitspielt? Der Markt hat das abstract wohl sehr gut aufgenommen, oder es ist doch was auf der HV gewesen.....
Antwort auf Beitrag Nr.: 34.106.966 von eck64 am 16.05.08 08:52:46Hmm,
Abseits von den üblicherweise durch die fda vorgegebenen Fortschrittskriterien erreicht ipilimumab nachträglich und langfirstig sehr viel bessere Werte, offensichtlich weil sich das Immunsystem erst an den Antikörper gewöhnen muss und die Tumore teilweise auch im Abwehrkampf zunächst etwas schneller fortschreiten, bevor ipilimumab seine vollen Antitumor-Aktivitäten entfalten kann.
Aber die fda ist zur Zeit nicht gerade als Freund von innovativen Betrachtungen bekannt.....
Abseits von den üblicherweise durch die fda vorgegebenen Fortschrittskriterien erreicht ipilimumab nachträglich und langfirstig sehr viel bessere Werte, offensichtlich weil sich das Immunsystem erst an den Antikörper gewöhnen muss und die Tumore teilweise auch im Abwehrkampf zunächst etwas schneller fortschreiten, bevor ipilimumab seine vollen Antitumor-Aktivitäten entfalten kann.
Aber die fda ist zur Zeit nicht gerade als Freund von innovativen Betrachtungen bekannt.....
Die Abstracts sind raus. Alles in allem was der Markt erwartet hatte.
Das ipilimumab Programm wird nun gemäß FDA Wunsch nach Goldstandard Overall Survival beurteilt. Kernstudie wird die DTIC/ipi Kombination sein, die auch doppelt verblindet ist. Um die nötige Power in der Studie zu haben muss die Patientenaufnahme der für ursprünglich PFS designten Studie wahrscheinlich nochmal aufgenommen werden.
D.h. eine Verzögerung von ipilimumab BLA Filing auf Ende 2009 bzw. Anfang 2010. Zulassung dann eventuell Mitte bis Ende 2010, gute Ergebnisse vorausgesetzt.
In der Zwischenzeit dürfte man sich bei der extremst geprügelten Medarex wieder auf andere Cash- and Carry-Programme konzentrieren wie
a) CNTO-1275 (Zulassung möglicherweise in USA Q3 2008, Europa Q1/2009)
b) CNTO-148 (Zulassung möglicherweise in Europa Q1 2009, USA Q2/2009)
Beide mit best-in class Ergebnissen oder best-in-class Dosierungen und somit mehr als konkurrenzfähig zu den bisherigen Multimilliardenblockbusterkonkurrenten.
Beide Produkte mit jeweils 3-5% Royalties könnten bis in 2010/2011 oder 2012 den Break Even herbeiführen.
Das ipilimumab Programm wird nun gemäß FDA Wunsch nach Goldstandard Overall Survival beurteilt. Kernstudie wird die DTIC/ipi Kombination sein, die auch doppelt verblindet ist. Um die nötige Power in der Studie zu haben muss die Patientenaufnahme der für ursprünglich PFS designten Studie wahrscheinlich nochmal aufgenommen werden.
D.h. eine Verzögerung von ipilimumab BLA Filing auf Ende 2009 bzw. Anfang 2010. Zulassung dann eventuell Mitte bis Ende 2010, gute Ergebnisse vorausgesetzt.
In der Zwischenzeit dürfte man sich bei der extremst geprügelten Medarex wieder auf andere Cash- and Carry-Programme konzentrieren wie
a) CNTO-1275 (Zulassung möglicherweise in USA Q3 2008, Europa Q1/2009)
b) CNTO-148 (Zulassung möglicherweise in Europa Q1 2009, USA Q2/2009)
Beide mit best-in class Ergebnissen oder best-in-class Dosierungen und somit mehr als konkurrenzfähig zu den bisherigen Multimilliardenblockbusterkonkurrenten.
Beide Produkte mit jeweils 3-5% Royalties könnten bis in 2010/2011 oder 2012 den Break Even herbeiführen.
Antwort auf Beitrag Nr.: 34.108.293 von Ville7 am 16.05.08 10:53:27Die Abstracts sind raus. Alles in allem was der Markt erwartet hatte.
Wie erklärst du dir dann weit über 10% nachbörsenplus, wenn alles so erwartet wurde?
Wie erklärst du dir dann weit über 10% nachbörsenplus, wenn alles so erwartet wurde?

Antwort auf Beitrag Nr.: 34.108.422 von eck64 am 16.05.08 11:03:431,06 USD Kurssprung nachbörslich sind immerhin 135mio USD in der Marktkapitalisierung nach oben.
Irgendwas nichterwartetes sollte schon dabei sein.
sollte schon dabei sein. 
Irgendwas nichterwartetes
 sollte schon dabei sein.
sollte schon dabei sein. 
Antwort auf Beitrag Nr.: 34.108.422 von eck64 am 16.05.08 11:03:431,06 USD Kurssprung nachbörslich sind immerhin 135mio USD in der Marktkapitalisierung nach oben.
Irgendwas nichterwartetes sollte schon dabei sein.
sollte schon dabei sein. 
Irgendwas nichterwartetes
 sollte schon dabei sein.
sollte schon dabei sein. 
Der nachbörsliche Kurssprung anhand von einem Volumen von nur insgesamt 15.000 Stück ist nicht gerade verlässlich.
Möglicherweise werden die 9 USD heute zu Hauptbörsenzeit nicht erreicht werden können, wenngleich zum Verfallstag alles möglich ist.
Möglicherweise werden die 9 USD heute zu Hauptbörsenzeit nicht erreicht werden können, wenngleich zum Verfallstag alles möglich ist.
Abstract zu MDX-1106 gegen PD-1; mögliche Combivariante zu CTLA-4, wenngleich auch nach 8 Wochen noch keine Responses, doch aber schon einzelne Hinweise auf Wirksamkeit, beobachtet werden konnten:
Background: Programmed death-1 (PD-1), an inhibitory receptor expressed on activated T cells, may suppress antitumor immunity. Objectives of this first in human phase I trial of MDX-1106 (ONO-4538), a fully human IgG4 anti-PD-1 blocking antibody, are to evaluate safety and maximum tolerated dose (MTD). Other objectives include evaluation of pharmacokinetics (PK) and immunological effects.
Methods: Patients (pts) had treatment refractory metastatic non-small cell lung cancer (NSCLC), renal cell carcinoma (RCC), colon cancer (CC), melanoma (MEL), or prostate cancer (HRPC), and no history of autoimmune disease. Sequential cohorts of 6 pts received a single IV dose of MDX-1106 at 0.3, 1, 3, or 10 mg/kg. Disease status was evaluated at wk 8 by RECIST criteria. Pts with SD or lesional responses could receive additional MDX-1106 at wks 12 and 16, at the original dose.
Results: 24 pts, 6 at each dose level (9 CC, 5 NSCLC, 6 MEL, 4 HRPC), were enrolled through 11/07. 23 pts have been assessed for tumor response at 8 wks. All doses were well tolerated and no MDX-1106 related SAEs occurred. Two pts (treated at 3 and 10 mg/kg) developed arthritic symptoms requiring treatment, and 2 pts had an asymptomatic TSH elevation. Objective tumor responses (CR or PR) were not observed within 8 wks. Three pts had significant lesional regressions (1 NSCLC pt at 1 mg/kg, 2 MEL pts at 10 mg/kg). Five pts with SD or lesional regressions received retreatment. Biopsy of a regressing MEL lymph node metastasis showed a moderately increased CD8+ T cell infiltrate post treatment. PK and immunological evaluations are underway.
Conclusions: The targeted maximum dose of 10 mg/kg of MDX-1106 was achieved without observing dose-limiting toxicities, and lesional tumor regressions were observed in 3 of 23 pts evaluated. An expansion cohort at 10 mg/kg is enrolling 15 additional pts. Therapy with MDX-1106 to enhance endogenous antitumor immunity, either alone or in combination with other therapeutic modalities, warrants further study.
Background: Programmed death-1 (PD-1), an inhibitory receptor expressed on activated T cells, may suppress antitumor immunity. Objectives of this first in human phase I trial of MDX-1106 (ONO-4538), a fully human IgG4 anti-PD-1 blocking antibody, are to evaluate safety and maximum tolerated dose (MTD). Other objectives include evaluation of pharmacokinetics (PK) and immunological effects.
Methods: Patients (pts) had treatment refractory metastatic non-small cell lung cancer (NSCLC), renal cell carcinoma (RCC), colon cancer (CC), melanoma (MEL), or prostate cancer (HRPC), and no history of autoimmune disease. Sequential cohorts of 6 pts received a single IV dose of MDX-1106 at 0.3, 1, 3, or 10 mg/kg. Disease status was evaluated at wk 8 by RECIST criteria. Pts with SD or lesional responses could receive additional MDX-1106 at wks 12 and 16, at the original dose.
Results: 24 pts, 6 at each dose level (9 CC, 5 NSCLC, 6 MEL, 4 HRPC), were enrolled through 11/07. 23 pts have been assessed for tumor response at 8 wks. All doses were well tolerated and no MDX-1106 related SAEs occurred. Two pts (treated at 3 and 10 mg/kg) developed arthritic symptoms requiring treatment, and 2 pts had an asymptomatic TSH elevation. Objective tumor responses (CR or PR) were not observed within 8 wks. Three pts had significant lesional regressions (1 NSCLC pt at 1 mg/kg, 2 MEL pts at 10 mg/kg). Five pts with SD or lesional regressions received retreatment. Biopsy of a regressing MEL lymph node metastasis showed a moderately increased CD8+ T cell infiltrate post treatment. PK and immunological evaluations are underway.
Conclusions: The targeted maximum dose of 10 mg/kg of MDX-1106 was achieved without observing dose-limiting toxicities, and lesional tumor regressions were observed in 3 of 23 pts evaluated. An expansion cohort at 10 mg/kg is enrolling 15 additional pts. Therapy with MDX-1106 to enhance endogenous antitumor immunity, either alone or in combination with other therapeutic modalities, warrants further study.
Antwort auf Beitrag Nr.: 34.108.660 von Ville7 am 16.05.08 11:22:19Ja klar, nachbörse hat eigene Gesetze.
Aber immerhin zieht Frankfurt (natürlich vergleichsweise mickervolumen) das US-Nachbörsenniveau fast komplett nach.
Haben die in Frankfurt für Medarex bzw. Nasi allgemein professionelle Marketmakers, die irgendwelche Umrechnungs-Kurse und spreads garantieren?
Oder handelt in Frankfurt nur jeder auf eigene Kappe?
Aber immerhin zieht Frankfurt (natürlich vergleichsweise mickervolumen) das US-Nachbörsenniveau fast komplett nach.
Haben die in Frankfurt für Medarex bzw. Nasi allgemein professionelle Marketmakers, die irgendwelche Umrechnungs-Kurse und spreads garantieren?
Oder handelt in Frankfurt nur jeder auf eigene Kappe?
Medarex Reports Phase 1 Clinical Data of MDX-1100 at Digestive Disease Week
21 May 2008
Data Supportive of Phase 2 Clinical Development Program Currently Underway
PRINCETON, NJ, USA | May 21, 2008 | Medarex, Inc. (Nasdaq: MEDX) announced today positive safety data from two Phase 1 trials that support the Phase 2 clinical development program of MDX-1100, a fully human monoclonal antibody that
targets CXCL10 (also known as IP-10), for the treatment of inflammatory diseases.
MDX-1100 could potentially treat diseases such as ulcerative colitis (UC) and rheumatoid arthritis (RA) by suppressing the inflammatory process characteristic of these diseases. Results from the Phase 1 trials were presented at the Digestive Disease Week (DDW), being held May 17-22, 2008 in San Diego. (Abstracts #704, #T1145 and #W1170)
A Phase 1 open-label pilot study was conducted to evaluate the safety (primary endpoint) and preliminary efficacy of escalating single doses of MDX-1100 in 11 patients with moderate to severe UC. This study demonstrated that single doses (ranging from 0.3 to 10.0 mg/kg) of MDX-1100 in patients with active UC were safe and well-tolerated. Four patients in the study had protocol-defined clinical responses, determined by the Ulcerative Colitis Disease Activity Index (UCDAI) which scores the frequency and the amount of bloody stool per day that is recorded in a patient diary, physician global assessment and the assessment of colon mucosal inflammation ascertained by endoscopy. None of the three serious adverse events reported in the study were considered drug related. (Abstract #704)
A separate Phase 1 double-blind, placebo-controlled study was conducted to determine safety and pharmacokinetics of escalating single doses (ranging from 0.01 to 10 mg/kg) of MDX-1100 in 50 healthy volunteers. MDX-1100 demonstrated dose-proportional pharmacokinetics, and a potential pharmacodynamic effect that signaled a decrease in the production of CXCL10 was observed at 10 mg/kg. There were no infusion reactions, and the drug was non-immunogenic. No serious adverse effects were observed in this study. The most common drug related adverse events were drowsiness, cough and shortness of breath. (Abstract #T1145)
"The safety and preliminary efficacy data from these Phase 1 studies provide the foundation for our recently initiated Phase 2 program with MDX-1100," said Geoffrey M. Nichol, Senior Vice President, Product Development of Medarex. "We are excited
with the Phase 2 program and look forward to the outcome of the proof-of-concept studies in ulcerative colitis and rheumatoid arthritis."
Additional studies presented at DDW demonstrated that CXCL10 induced expression of several pro-inflammatory molecules and that these CXCL10 inducible genes were upregulated in patients with ulcerative colitis. (Abstract #W1170)
About MDX-1100
MDX-1100 is a fully human antibody that targets CXCL10 (also known as IP-10), a chemokine expressed in association with multiple inflammatory disease indications such as rheumatoid arthritis, inflammatory bowel disease and multiple sclerosis.
Published data suggests that CXCL10 plays key roles in murine models of inflammatory bowel disease (IBD) and RA. Moreover, CXCL10 levels are increased in patients with these diseases. Phase 2 proof-of-concept clinical trials of MDX-1100 in ulcerative
colitis and rheumatoid arthritis have been initiated.
About Ulcerative Colitis
Ulcerative colitis (UC) is a chronic inflammatory bowel disease of the colon and is characterized by inflammation and ulceration of the lining of the colon. Symptoms typically include bloody diarrhea and abdominal pain and in severe cases may require
colectomy. According to the Crohn's & Colitis Foundation of America, it is estimated that there are up to approximately 500,000 Americans with ulcerative colitis.
About Rheumatoid Arthritis
According to the American College of Rheumatology, more than two million Americans suffer from rheumatoid arthritis (RA), a chronic autoimmune disease that develops when certain cells of the immune system inappropriately attack healthy
joint tissue, thereby causing swelling, inflammation and damage of joints, as well as systemic inflammation and damage of other tissues.
About Medarex
Medarex is a biopharmaceutical company focused on the discovery, development and potential commercialization of fully human antibody-based therapeutics to treat life-threatening and debilitating diseases, including cancer, inflammation, autoimmune disorders and infectious diseases. Medarex applies its UltiMAb(R) technology and product development and clinical manufacturing experience to generate, support and potentially commercialize a broad range of fully human antibody product candidates for itself and its partners. Over forty of these therapeutic product candidates derived from Medarex technology are in human clinical testing or have had INDs submitted for such trials, with seven of the most advanced product candidates currently in Phase 3 clinical trials or the subject of regulatory applications for marketing authorization. Medarex is committed to building value by developing a diverse pipeline of antibody products to address the world's unmet healthcare needs. For more information about Medarex, visit its website at www.medarex.com.
http://www.pipelinereview.com/content/view/19749/102/
21 May 2008
Data Supportive of Phase 2 Clinical Development Program Currently Underway
PRINCETON, NJ, USA | May 21, 2008 | Medarex, Inc. (Nasdaq: MEDX) announced today positive safety data from two Phase 1 trials that support the Phase 2 clinical development program of MDX-1100, a fully human monoclonal antibody that
targets CXCL10 (also known as IP-10), for the treatment of inflammatory diseases.
MDX-1100 could potentially treat diseases such as ulcerative colitis (UC) and rheumatoid arthritis (RA) by suppressing the inflammatory process characteristic of these diseases. Results from the Phase 1 trials were presented at the Digestive Disease Week (DDW), being held May 17-22, 2008 in San Diego. (Abstracts #704, #T1145 and #W1170)
A Phase 1 open-label pilot study was conducted to evaluate the safety (primary endpoint) and preliminary efficacy of escalating single doses of MDX-1100 in 11 patients with moderate to severe UC. This study demonstrated that single doses (ranging from 0.3 to 10.0 mg/kg) of MDX-1100 in patients with active UC were safe and well-tolerated. Four patients in the study had protocol-defined clinical responses, determined by the Ulcerative Colitis Disease Activity Index (UCDAI) which scores the frequency and the amount of bloody stool per day that is recorded in a patient diary, physician global assessment and the assessment of colon mucosal inflammation ascertained by endoscopy. None of the three serious adverse events reported in the study were considered drug related. (Abstract #704)
A separate Phase 1 double-blind, placebo-controlled study was conducted to determine safety and pharmacokinetics of escalating single doses (ranging from 0.01 to 10 mg/kg) of MDX-1100 in 50 healthy volunteers. MDX-1100 demonstrated dose-proportional pharmacokinetics, and a potential pharmacodynamic effect that signaled a decrease in the production of CXCL10 was observed at 10 mg/kg. There were no infusion reactions, and the drug was non-immunogenic. No serious adverse effects were observed in this study. The most common drug related adverse events were drowsiness, cough and shortness of breath. (Abstract #T1145)
"The safety and preliminary efficacy data from these Phase 1 studies provide the foundation for our recently initiated Phase 2 program with MDX-1100," said Geoffrey M. Nichol, Senior Vice President, Product Development of Medarex. "We are excited
with the Phase 2 program and look forward to the outcome of the proof-of-concept studies in ulcerative colitis and rheumatoid arthritis."
Additional studies presented at DDW demonstrated that CXCL10 induced expression of several pro-inflammatory molecules and that these CXCL10 inducible genes were upregulated in patients with ulcerative colitis. (Abstract #W1170)
About MDX-1100
MDX-1100 is a fully human antibody that targets CXCL10 (also known as IP-10), a chemokine expressed in association with multiple inflammatory disease indications such as rheumatoid arthritis, inflammatory bowel disease and multiple sclerosis.
Published data suggests that CXCL10 plays key roles in murine models of inflammatory bowel disease (IBD) and RA. Moreover, CXCL10 levels are increased in patients with these diseases. Phase 2 proof-of-concept clinical trials of MDX-1100 in ulcerative
colitis and rheumatoid arthritis have been initiated.
About Ulcerative Colitis
Ulcerative colitis (UC) is a chronic inflammatory bowel disease of the colon and is characterized by inflammation and ulceration of the lining of the colon. Symptoms typically include bloody diarrhea and abdominal pain and in severe cases may require
colectomy. According to the Crohn's & Colitis Foundation of America, it is estimated that there are up to approximately 500,000 Americans with ulcerative colitis.
About Rheumatoid Arthritis
According to the American College of Rheumatology, more than two million Americans suffer from rheumatoid arthritis (RA), a chronic autoimmune disease that develops when certain cells of the immune system inappropriately attack healthy
joint tissue, thereby causing swelling, inflammation and damage of joints, as well as systemic inflammation and damage of other tissues.
About Medarex
Medarex is a biopharmaceutical company focused on the discovery, development and potential commercialization of fully human antibody-based therapeutics to treat life-threatening and debilitating diseases, including cancer, inflammation, autoimmune disorders and infectious diseases. Medarex applies its UltiMAb(R) technology and product development and clinical manufacturing experience to generate, support and potentially commercialize a broad range of fully human antibody product candidates for itself and its partners. Over forty of these therapeutic product candidates derived from Medarex technology are in human clinical testing or have had INDs submitted for such trials, with seven of the most advanced product candidates currently in Phase 3 clinical trials or the subject of regulatory applications for marketing authorization. Medarex is committed to building value by developing a diverse pipeline of antibody products to address the world's unmet healthcare needs. For more information about Medarex, visit its website at www.medarex.com.
http://www.pipelinereview.com/content/view/19749/102/
MEDX 5- MinutenChart
Zeitraum: 10 Wochentage

Zeitraum: 10 Wochentage
Antwort auf Beitrag Nr.: 34.066.707 von Gruenfeld am 09.05.08 17:14:58Mit dem 5 Minuten- Bar zum Handelsbeginn (property At['28.05.2008 15:30:00']) steht 'Rotating Gruen' wieder auf Kauf.
Vor einer Woche generierte die Funktion ein Verkaufssignal (property At['21.05.2008 20:05:00']), es kam aber nicht wirklich zu Anschlussverkäufen.....
Der Grund für das Gap ist ein Upgrade von RBC Capital Markets
Vor einer Woche generierte die Funktion ein Verkaufssignal (property At['21.05.2008 20:05:00']), es kam aber nicht wirklich zu Anschlussverkäufen.....
Der Grund für das Gap ist ein Upgrade von RBC Capital Markets
Medx kann sich wohl endlich von den üblen Tiefs erholen.
ASCO vorwehen?
Antwort auf Beitrag Nr.: 34.188.243 von Gruenfeld am 28.05.08 16:05:54Chart siehe Beitrag #3420..... 
Eigenschaft At['04.06.2008 17:20:00']
Nochmal ein Kaufsignal von Rotating Gruen (im 5- MinutenChart). Am Montag wurde Medarex nach Börseneröffnung extrem abverkauft, offensichtlich eine Reaktion auf die News vom Wochenende.
Zu $11.- oder so will ich meine Position verkaufen-- das wäre ein gutes Ergebnis.

Eigenschaft At['04.06.2008 17:20:00']
Nochmal ein Kaufsignal von Rotating Gruen (im 5- MinutenChart). Am Montag wurde Medarex nach Börseneröffnung extrem abverkauft, offensichtlich eine Reaktion auf die News vom Wochenende.
Zu $11.- oder so will ich meine Position verkaufen-- das wäre ein gutes Ergebnis.
Konzentriert euch auf die kurz- bis mittelfristigen Werttreiber:
CNTO-1275 und CNTO-148. ODAC Meeting für 1275 am 17.6., also in einer Woche. Zulassung höchstwahrscheinlich in Q3.
Amgen mit Enbrel (ca. 2,4 Mio USD Jahresumsatz) fürchtet die Konkurrenz so sehr, dass sie die Risiken beider Produkte aufführen:
http://sec.edgar-online.com/2008/05/12/0001193125-08-110189/…" target="_blank" rel="nofollow ugc noopener">http://sec.edgar-online.com/2008/05/12/0001193125-08-110189/…
In addition to the factors mentioned in the "Product sales" section above, future worldwide ENBREL sales growth will be dependent, in part, on such factors as:
• the effects of competing products or therapies, which may include new indications for existing products and new competitive products coming to market, such as J&J's CNTO 1275 (ustekinumab) and CNTO 148 (golimumab) and, in part, our ability to differentiate ENBREL based on its safety profile and efficacy;
CNTO-1275 und CNTO-148. ODAC Meeting für 1275 am 17.6., also in einer Woche. Zulassung höchstwahrscheinlich in Q3.
Amgen mit Enbrel (ca. 2,4 Mio USD Jahresumsatz) fürchtet die Konkurrenz so sehr, dass sie die Risiken beider Produkte aufführen:
http://sec.edgar-online.com/2008/05/12/0001193125-08-110189/…" target="_blank" rel="nofollow ugc noopener">http://sec.edgar-online.com/2008/05/12/0001193125-08-110189/…
In addition to the factors mentioned in the "Product sales" section above, future worldwide ENBREL sales growth will be dependent, in part, on such factors as:
• the effects of competing products or therapies, which may include new indications for existing products and new competitive products coming to market, such as J&J's CNTO 1275 (ustekinumab) and CNTO 148 (golimumab) and, in part, our ability to differentiate ENBREL based on its safety profile and efficacy;
"Enbrel (ca. 2,4 Mio USD Jahresumsatz)"
Korrektur: es werden ca. 6 sein und nicht Millionen sondern Milliarden. Q1 2008 Umsätze von Enbrel waren über 1500 Mio USD.
Korrektur: es werden ca. 6 sein und nicht Millionen sondern Milliarden. Q1 2008 Umsätze von Enbrel waren über 1500 Mio USD.
Umsätze der bedeutensten anti-TNF-alphas legen weltweit auf USD Basis kräftig zu, hier die Umsätze in Mio USD der Quartale Q1 2008 verglichen mit Q1 2007:
Produkt(Vermarktung) Q1 2007 Q1 2008 Wachstum YoY
Enbrel (Amgen/Wyeth) 1175 1557 +32,51%
Remicade (JnJ) .... 731 998 +36,53%
Humira (Abott) .... 571 878 +53,77%
Als best-in-class Produkte sollten sich CNTO-1275 und CNTO-148 zusammen längerfristig mindestens 25% Marktanteile sichern. Das wären bei 13 Mrd USD Umsatz des Gesamtkuchens ca. 3,25 Milliarden USD/Jahr oder bei 4% Royalties ca. 130 Mio USD für MEDX jährlich. Diese Summe wurde ungefähr helfen den derzeitigen Cashburn zu stoppen. Alles on-top wäre pure profit.
Produkt(Vermarktung) Q1 2007 Q1 2008 Wachstum YoY
Enbrel (Amgen/Wyeth) 1175 1557 +32,51%
Remicade (JnJ) .... 731 998 +36,53%
Humira (Abott) .... 571 878 +53,77%
Als best-in-class Produkte sollten sich CNTO-1275 und CNTO-148 zusammen längerfristig mindestens 25% Marktanteile sichern. Das wären bei 13 Mrd USD Umsatz des Gesamtkuchens ca. 3,25 Milliarden USD/Jahr oder bei 4% Royalties ca. 130 Mio USD für MEDX jährlich. Diese Summe wurde ungefähr helfen den derzeitigen Cashburn zu stoppen. Alles on-top wäre pure profit.
Da ist schon viel Geld unterwegs.
Wird Zeit, das Medaarex an den Honigtöpfen Platz nimmt.
Und die eigene Breite Pipeline aus Eigenmitteln finanzieren zu können wäre schon ein wichtiger Schritt nach vorne.
Wird Zeit, das Medaarex an den Honigtöpfen Platz nimmt.
Und die eigene Breite Pipeline aus Eigenmitteln finanzieren zu können wäre schon ein wichtiger Schritt nach vorne.
Super News heute, CNTO-148 funktioniert u.a. auch in Patienten, die mit anderen anti-TNF-alphas vorbehandelt wurden.
Lasst den Markt ignorieren, dass CNTO-148 wahrscheinlich der best in class anti-TNF ist.
Antrag auf Zulassung in Europa ist bereits gestellt. Antrag auf Zulassung in USA folgt in Kürze. Zulassungen dann in 2009.
-----------------
PHASE 3 DATA SHOW EFFICACY OF GOLIMUMAB IN PATIENTS WITH ACTIVE RHEUMATOID ARTHRITIS PREVIOUSLY TREATED WITH ANTI-TNF AGENTS
Study Demonstrated a Significant Reduction in the Signs and Symptoms of RA and Improved Physical Function
PARIS, France - 11 June 2008 - Findings presented for the first time from a novel, randomized, double-blind, placebo-controlled Phase 3 study showed that patients with moderately-to-severely active rheumatoid arthritis (RA) who were previously treated with anti-tumor necrosis factor (TNF)-alpha agents, experienced significant improvements in signs and symptoms and physical function after receiving every four week subcutaneous injections of golimumab (CNTO 148) 50 mg or 100 mg. Investigators also reported that the patients who received golimumab showed sustained improvements in disease activity and physical function through six months. The study was presented at the European League Against Rheumatism (EULAR) Annual Congress of Rheumatology.
"Our findings show that golimumab holds great promise in various RA patient populations, including those patients who have previously discontinued other TNF inhibitors," said Josef S. Smolen, M.D., professor and Chairman, Department of Rheumatology, Medical University of Vienna and lead study investigator. "Golimumab may provide an appropriate treatment option to the many people facing the consequences of this debilitating disease."
In the study, GOlimumab After Former anti-TNF Therapy Evaluated in RA (GO-AFTER), 35 percent and 38 percent of patients receiving golimumab 50 mg and 100 mg, respectively, achieved the primary endpoint of at least 20 percent improvement in arthritis symptoms (ACR 20) at week 14, compared with 18 percent of patients receiving placebo (p<0.001). These results were maintained through six months. Importantly, among the 58 percent of patients whose prior anti-TNF alpha therapy had been discontinued due to lack of efficacy, 36 percent receiving golimumab 50 mg and 43 percent receiving golimumab 100 mg achieved ACR 20 as compared to 18 percent of patients treated with placebo (p=0.006 for 50 mg group, p<0.001 for 100 mg group, respectively). Patients in each study group continued to receive stable doses of methotrexate (MTX), sulfasalazine (SSZ) and/or hydrochloroquine (HCQ) if they were receiving them at baseline.
"When treating patients with progressive rheumatoid arthritis, our goal is to reduce pain and improve physical function," said Jonathan Kay, M.D., Director, Clinical Trials, Rheumatology Unit, Massachusetts General Hospital; Associate Clinical Professor of Medicine, Harvard Medical School and lead study investigator. "We are encouraged by the results of these trials which suggest that golimumab may offer a significant benefit to a growing population of RA patients with prior TNF inhibitor experience."
Patients in both treatment groups receiving golimumab also experienced significant improvement in physical function and disease activity through six months as measured by the Health Assessment Questionnaire (HAQ) and the Disease Activity Score (DAS28), respectively. At 24 weeks, 52 percent of patients in the combined golimumab dosing group experienced a clinically relevant improvement in physical function (improvement in HAQ score of at least 0.25 from baseline), compared with 34 percent of patients receiving placebo (p<0.001). HAQ assesses the degree of difficulty a patient has in accomplishing tasks in eight functional areas (dressing, arising, eating, walking, hygiene, reaching, gripping and other activities of daily living). Additionally, at six months, more than half of patients in the combined golimumab group were classified as DAS28 responders (using either C-reactive protein [CRP] or erythrocyte sedimentation [ESR] rate), compared with 23 percent and 25 percent of placebo-treated patients, respectively, indicating improvements in levels of disease activity.
Additionally, two separate Phase 3 studies, which were also presented at EULAR, evaluated golimumab in RA patients who had active RA despite MTX therapy (GO-FORWARD), and golimumab in RA patients who had not previously been treated with MTX (GO-BEFORE).
"Golimumab has the potential to benefit a broad range of patients by offering monthly subcutaneous treatment for RA," said Robert J. Spiegel, M.D., chief medical officer, Schering-Plough Research Institute. "These findings mark an important milestone for golimumab as we look forward to expanding the immunology franchise at Schering-Plough and remaining leaders in the rheumatology community."
In March 2008, Centocor Inc. and Schering-Plough Corporation (NYSE: SGP) announced that a Marketing Authorization Application (MAA) had been submitted to the European Medicines Agency requesting the approval of golimumab as a monthly subcutaneous treatment for adults with RA, psoriatic arthritis and ankylosing spondylitis. The initial submission and Phase 3 development programs are unprecedented among anti-TNF-alpha therapies, as they mark the first time that an MAA has been proposed for review inclusive of three unique disease states. Golimumab, Centocor's and Schering-Plough's next-generation human anti-TNF-alpha monoclonal antibody, is being studied as an every four-week subcutaneous injection and an intravenous (IV) infusion therapy.
DATA FROM TWO PHASE 3 STUDIES SHOW ANTI-TNF GOLIMUMAB SIGNIFICANTLY IMPROVED SIGNS AND SYMPTOMS OF RHEUMATOID ARTHRITIS
Patients Receiving Every Four-Week Subcutaneous Golimumab Also Experienced Improvements in Physical Function and Disease Activity
PARIS, France - 11 June 2008 - Findings from two new Phase 3 studies showed that patients receiving every four-week subcutaneous injections of golimumab (CNTO 148) 50 mg and 100 mg and weekly methotrexate (MTX) experienced significant improvements in the signs and symptoms of rheumatoid arthritis (RA) as well as in physical function and disease activity, with some patients achieving remission as measured by Disease Activity Score (DAS28). Findings from two multicenter, randomized, double-blind, placebo-controlled Phase 3 studies showed the efficacy of golimumab in two important populations - MTX-naive patients and patients with active RA despite ongoing treatment with MTX. These data were presented at the European League Against Rheumatism (EULAR) Annual Congress of Rheumatology. Golimumab is currently in the most comprehensive initial Phase 3 development program to date for an anti-tumor necrosis factor (TNF)-alpha biologic therapy with ongoing studies for the treatment of RA, psoriatic arthritis and ankylosing spondylitis.
In the study, GOlimumab FOR subjects With Active RA Despite MTX (GO-FORWARD), both the 50 mg and 100 mg doses of golimumab were studied in patients whose disease was active despite ongoing treatment with MTX. At week 14, 55 percent of patients receiving golimumab 50 mg plus MTX and 56 percent receiving golimumab 100 mg plus MTX achieved at least 20 percent improvement in signs and symptoms of RA (ACR 20), compared to 33 percent of patients receiving placebo and MTX (p<0.01 and p<0.001, respectively). Improvements were seen as early as first clinical assessment, which was four weeks after the first golimumab injection, and generally continued to improve over time.
"The data in this study demonstrate that golimumab is beneficial in improving numerous disease parameters, including inducing remission, in patients whose disease was active despite ongoing treatment with methotrexate," said Edward Keystone, M.D., FRCPC, director of the Rebecca MacDonald Centre for Arthritis & Autoimmune Disease at Mount Sinai Hospital in Toronto, and lead study investigator. "Since some patients do not respond adequately to methotrexate alone, this combination therapy could prove to be a highly valuable treatment option based on these results."
Patients receiving golimumab also experienced improvement in physical function as assessed by the Health Assessment Questionnaire (HAQ). At 24 weeks, 68 percent of patients in the golimumab 50 mg dosing group and 72 percent of patients receiving golimumab 100 mg experienced clinically relevant improvement in physical function (improvement in HAQ score of at least 0.25 from baseline), compared with 39 percent of patients receiving placebo plus MTX (p<0.0001). HAQ assess the degree of difficulty a patient has in accomplishing tasks in eight functional areas (dressing, arising, eating, walking, hygiene, reaching, gripping, and other activities of daily living).
At week 14, 74 percent and 76 percent of patients in the golimumab 50 mg and 100 mg plus MTX groups, respectively, were classified as DAS28 (using C-reactive protein [CRP]) responders, compared with 52 percent of patients receiving MTX alone (p<0.001). Importantly, 35 percent and 32 percent of patients in the respective golimumab groups achieved remission based on DAS28 (CRP), compared with 13 percent of patients receiving placebo plus MTX (p<0.001). These improvements were sustained through six months.
In another Phase 3 study, GOlimumab Before Employing methotrexate as the First-line Option in the treatment of Rheumatoid arthritis of Early onset (GO-BEFORE), MTX-naïve patients treated with golimumab 50 mg or 100 mg in combination with MTX experienced improvement in signs and symptoms of arthritis as well as in disease activity. The study's primary endpoint was based on an intent-to-treat (ITT) analysis, which included all patients randomized in the study. However, three patients did not receive study drug but were included in the analysis as nonresponders. In the primary analysis of the combined group of patients receiving either golimumab 50 mg or 100 mg in combination with MTX, 38 percent (40 percent receiving 50 mg and 37 percent receiving 100 mg) achieved at least 50 percent improvement in signs and symptoms of RA (ACR 50) through week 24, compared with 29 percent of patients receiving placebo plus MTX (p=0.053 for the combined group, p=0.042 for 50 mg and p=0.177 for 100 mg). When the three patients who did not receive golimumab were excluded in a modified intent-to-treat (mITT) analysis, the results showed that 39 percent of patients in the combined golimumab plus MTX group (41 percent receiving 50 mg and 37 percent receiving 100 mg) achieved ACR 50, compared with 29 percent of patients receiving placebo plus MTX (p=0.049 for the combined group, p=0.038 for 50 mg and p=0.177 for 100 mg). Additionally, 62 percent of patients in the combined golimumab plus MTX group (62 percent for each dose group) achieved ACR 20, compared with 49 percent receiving placebo plus MTX (p=0.011 for the combined group and p=0.028 for each dose group).
"These data show that treatment with golimumab induces an important depth of response, improving multiple aspects of rheumatoid arthritis and leading to significant decreases in disease activity," said Roy Fleischmann, M.D., Clinical Professor, Department of Internal Medicine at the University of Texas Southwestern Medical Center; Chief, Division of Rheumatology at St. Paul University Hospital in Dallas, Texas and lead study investigator. "Golimumab, which is an anti-TNF therapy, is a promising treatment option for multiple patient populations with this chronic and potentially debilitating inflammatory disease."
Also at week 24, patients receiving golimumab plus MTX experienced improvements in disease activity as measured by DAS28. Seventy-six percent of patients in the combined golimumab group were classified as DAS28 responders (using C Reactive Protein [CRP]), and 38 percent achieved DAS 28 remission, compared with 61 percent and 28 percent of patients receiving placebo and MTX, respectively (p<0.001 for responders and p=0.031 for remission).
"We are encouraged by the findings of both of these Phase 3 studies," said Robert J. Spiegel, M.D., chief medical officer, Schering-Plough Research Institute. "Golimumab holds great promise as an anti-TNF therapy for patients who may benefit from monthly subcutaneous injections for RA and related rheumatic diseases."
In March 2008, Centocor Inc. and Schering-Plough Corporation (NYSE: SGP) announced that a Marketing Authorization Application (MAA) had been submitted to the European Medicines Agency requesting the approval of golimumab as a monthly subcutaneous treatment for adults with RA, psoriatic arthritis and ankylosing spondylitis. The initial submission and Phase 3 development programs are unprecedented among anti-TNF-alpha therapies, as they mark the first time that an MAA has been proposed for review inclusive of three unique disease states. Golimumab, Centocor's and Schering-Plough's next-generation human anti-TNF-alpha monoclonal antibody, is being studied as an every four-week subcutaneous injection and an intravenous (IV) infusion therapy.
Lasst den Markt ignorieren, dass CNTO-148 wahrscheinlich der best in class anti-TNF ist.
Antrag auf Zulassung in Europa ist bereits gestellt. Antrag auf Zulassung in USA folgt in Kürze. Zulassungen dann in 2009.
-----------------
PHASE 3 DATA SHOW EFFICACY OF GOLIMUMAB IN PATIENTS WITH ACTIVE RHEUMATOID ARTHRITIS PREVIOUSLY TREATED WITH ANTI-TNF AGENTS
Study Demonstrated a Significant Reduction in the Signs and Symptoms of RA and Improved Physical Function
PARIS, France - 11 June 2008 - Findings presented for the first time from a novel, randomized, double-blind, placebo-controlled Phase 3 study showed that patients with moderately-to-severely active rheumatoid arthritis (RA) who were previously treated with anti-tumor necrosis factor (TNF)-alpha agents, experienced significant improvements in signs and symptoms and physical function after receiving every four week subcutaneous injections of golimumab (CNTO 148) 50 mg or 100 mg. Investigators also reported that the patients who received golimumab showed sustained improvements in disease activity and physical function through six months. The study was presented at the European League Against Rheumatism (EULAR) Annual Congress of Rheumatology.
"Our findings show that golimumab holds great promise in various RA patient populations, including those patients who have previously discontinued other TNF inhibitors," said Josef S. Smolen, M.D., professor and Chairman, Department of Rheumatology, Medical University of Vienna and lead study investigator. "Golimumab may provide an appropriate treatment option to the many people facing the consequences of this debilitating disease."
In the study, GOlimumab After Former anti-TNF Therapy Evaluated in RA (GO-AFTER), 35 percent and 38 percent of patients receiving golimumab 50 mg and 100 mg, respectively, achieved the primary endpoint of at least 20 percent improvement in arthritis symptoms (ACR 20) at week 14, compared with 18 percent of patients receiving placebo (p<0.001). These results were maintained through six months. Importantly, among the 58 percent of patients whose prior anti-TNF alpha therapy had been discontinued due to lack of efficacy, 36 percent receiving golimumab 50 mg and 43 percent receiving golimumab 100 mg achieved ACR 20 as compared to 18 percent of patients treated with placebo (p=0.006 for 50 mg group, p<0.001 for 100 mg group, respectively). Patients in each study group continued to receive stable doses of methotrexate (MTX), sulfasalazine (SSZ) and/or hydrochloroquine (HCQ) if they were receiving them at baseline.
"When treating patients with progressive rheumatoid arthritis, our goal is to reduce pain and improve physical function," said Jonathan Kay, M.D., Director, Clinical Trials, Rheumatology Unit, Massachusetts General Hospital; Associate Clinical Professor of Medicine, Harvard Medical School and lead study investigator. "We are encouraged by the results of these trials which suggest that golimumab may offer a significant benefit to a growing population of RA patients with prior TNF inhibitor experience."
Patients in both treatment groups receiving golimumab also experienced significant improvement in physical function and disease activity through six months as measured by the Health Assessment Questionnaire (HAQ) and the Disease Activity Score (DAS28), respectively. At 24 weeks, 52 percent of patients in the combined golimumab dosing group experienced a clinically relevant improvement in physical function (improvement in HAQ score of at least 0.25 from baseline), compared with 34 percent of patients receiving placebo (p<0.001). HAQ assesses the degree of difficulty a patient has in accomplishing tasks in eight functional areas (dressing, arising, eating, walking, hygiene, reaching, gripping and other activities of daily living). Additionally, at six months, more than half of patients in the combined golimumab group were classified as DAS28 responders (using either C-reactive protein [CRP] or erythrocyte sedimentation [ESR] rate), compared with 23 percent and 25 percent of placebo-treated patients, respectively, indicating improvements in levels of disease activity.
Additionally, two separate Phase 3 studies, which were also presented at EULAR, evaluated golimumab in RA patients who had active RA despite MTX therapy (GO-FORWARD), and golimumab in RA patients who had not previously been treated with MTX (GO-BEFORE).
"Golimumab has the potential to benefit a broad range of patients by offering monthly subcutaneous treatment for RA," said Robert J. Spiegel, M.D., chief medical officer, Schering-Plough Research Institute. "These findings mark an important milestone for golimumab as we look forward to expanding the immunology franchise at Schering-Plough and remaining leaders in the rheumatology community."
In March 2008, Centocor Inc. and Schering-Plough Corporation (NYSE: SGP) announced that a Marketing Authorization Application (MAA) had been submitted to the European Medicines Agency requesting the approval of golimumab as a monthly subcutaneous treatment for adults with RA, psoriatic arthritis and ankylosing spondylitis. The initial submission and Phase 3 development programs are unprecedented among anti-TNF-alpha therapies, as they mark the first time that an MAA has been proposed for review inclusive of three unique disease states. Golimumab, Centocor's and Schering-Plough's next-generation human anti-TNF-alpha monoclonal antibody, is being studied as an every four-week subcutaneous injection and an intravenous (IV) infusion therapy.
DATA FROM TWO PHASE 3 STUDIES SHOW ANTI-TNF GOLIMUMAB SIGNIFICANTLY IMPROVED SIGNS AND SYMPTOMS OF RHEUMATOID ARTHRITIS
Patients Receiving Every Four-Week Subcutaneous Golimumab Also Experienced Improvements in Physical Function and Disease Activity
PARIS, France - 11 June 2008 - Findings from two new Phase 3 studies showed that patients receiving every four-week subcutaneous injections of golimumab (CNTO 148) 50 mg and 100 mg and weekly methotrexate (MTX) experienced significant improvements in the signs and symptoms of rheumatoid arthritis (RA) as well as in physical function and disease activity, with some patients achieving remission as measured by Disease Activity Score (DAS28). Findings from two multicenter, randomized, double-blind, placebo-controlled Phase 3 studies showed the efficacy of golimumab in two important populations - MTX-naive patients and patients with active RA despite ongoing treatment with MTX. These data were presented at the European League Against Rheumatism (EULAR) Annual Congress of Rheumatology. Golimumab is currently in the most comprehensive initial Phase 3 development program to date for an anti-tumor necrosis factor (TNF)-alpha biologic therapy with ongoing studies for the treatment of RA, psoriatic arthritis and ankylosing spondylitis.
In the study, GOlimumab FOR subjects With Active RA Despite MTX (GO-FORWARD), both the 50 mg and 100 mg doses of golimumab were studied in patients whose disease was active despite ongoing treatment with MTX. At week 14, 55 percent of patients receiving golimumab 50 mg plus MTX and 56 percent receiving golimumab 100 mg plus MTX achieved at least 20 percent improvement in signs and symptoms of RA (ACR 20), compared to 33 percent of patients receiving placebo and MTX (p<0.01 and p<0.001, respectively). Improvements were seen as early as first clinical assessment, which was four weeks after the first golimumab injection, and generally continued to improve over time.
"The data in this study demonstrate that golimumab is beneficial in improving numerous disease parameters, including inducing remission, in patients whose disease was active despite ongoing treatment with methotrexate," said Edward Keystone, M.D., FRCPC, director of the Rebecca MacDonald Centre for Arthritis & Autoimmune Disease at Mount Sinai Hospital in Toronto, and lead study investigator. "Since some patients do not respond adequately to methotrexate alone, this combination therapy could prove to be a highly valuable treatment option based on these results."
Patients receiving golimumab also experienced improvement in physical function as assessed by the Health Assessment Questionnaire (HAQ). At 24 weeks, 68 percent of patients in the golimumab 50 mg dosing group and 72 percent of patients receiving golimumab 100 mg experienced clinically relevant improvement in physical function (improvement in HAQ score of at least 0.25 from baseline), compared with 39 percent of patients receiving placebo plus MTX (p<0.0001). HAQ assess the degree of difficulty a patient has in accomplishing tasks in eight functional areas (dressing, arising, eating, walking, hygiene, reaching, gripping, and other activities of daily living).
At week 14, 74 percent and 76 percent of patients in the golimumab 50 mg and 100 mg plus MTX groups, respectively, were classified as DAS28 (using C-reactive protein [CRP]) responders, compared with 52 percent of patients receiving MTX alone (p<0.001). Importantly, 35 percent and 32 percent of patients in the respective golimumab groups achieved remission based on DAS28 (CRP), compared with 13 percent of patients receiving placebo plus MTX (p<0.001). These improvements were sustained through six months.
In another Phase 3 study, GOlimumab Before Employing methotrexate as the First-line Option in the treatment of Rheumatoid arthritis of Early onset (GO-BEFORE), MTX-naïve patients treated with golimumab 50 mg or 100 mg in combination with MTX experienced improvement in signs and symptoms of arthritis as well as in disease activity. The study's primary endpoint was based on an intent-to-treat (ITT) analysis, which included all patients randomized in the study. However, three patients did not receive study drug but were included in the analysis as nonresponders. In the primary analysis of the combined group of patients receiving either golimumab 50 mg or 100 mg in combination with MTX, 38 percent (40 percent receiving 50 mg and 37 percent receiving 100 mg) achieved at least 50 percent improvement in signs and symptoms of RA (ACR 50) through week 24, compared with 29 percent of patients receiving placebo plus MTX (p=0.053 for the combined group, p=0.042 for 50 mg and p=0.177 for 100 mg). When the three patients who did not receive golimumab were excluded in a modified intent-to-treat (mITT) analysis, the results showed that 39 percent of patients in the combined golimumab plus MTX group (41 percent receiving 50 mg and 37 percent receiving 100 mg) achieved ACR 50, compared with 29 percent of patients receiving placebo plus MTX (p=0.049 for the combined group, p=0.038 for 50 mg and p=0.177 for 100 mg). Additionally, 62 percent of patients in the combined golimumab plus MTX group (62 percent for each dose group) achieved ACR 20, compared with 49 percent receiving placebo plus MTX (p=0.011 for the combined group and p=0.028 for each dose group).
"These data show that treatment with golimumab induces an important depth of response, improving multiple aspects of rheumatoid arthritis and leading to significant decreases in disease activity," said Roy Fleischmann, M.D., Clinical Professor, Department of Internal Medicine at the University of Texas Southwestern Medical Center; Chief, Division of Rheumatology at St. Paul University Hospital in Dallas, Texas and lead study investigator. "Golimumab, which is an anti-TNF therapy, is a promising treatment option for multiple patient populations with this chronic and potentially debilitating inflammatory disease."
Also at week 24, patients receiving golimumab plus MTX experienced improvements in disease activity as measured by DAS28. Seventy-six percent of patients in the combined golimumab group were classified as DAS28 responders (using C Reactive Protein [CRP]), and 38 percent achieved DAS 28 remission, compared with 61 percent and 28 percent of patients receiving placebo and MTX, respectively (p<0.001 for responders and p=0.031 for remission).
"We are encouraged by the findings of both of these Phase 3 studies," said Robert J. Spiegel, M.D., chief medical officer, Schering-Plough Research Institute. "Golimumab holds great promise as an anti-TNF therapy for patients who may benefit from monthly subcutaneous injections for RA and related rheumatic diseases."
In March 2008, Centocor Inc. and Schering-Plough Corporation (NYSE: SGP) announced that a Marketing Authorization Application (MAA) had been submitted to the European Medicines Agency requesting the approval of golimumab as a monthly subcutaneous treatment for adults with RA, psoriatic arthritis and ankylosing spondylitis. The initial submission and Phase 3 development programs are unprecedented among anti-TNF-alpha therapies, as they mark the first time that an MAA has been proposed for review inclusive of three unique disease states. Golimumab, Centocor's and Schering-Plough's next-generation human anti-TNF-alpha monoclonal antibody, is being studied as an every four-week subcutaneous injection and an intravenous (IV) infusion therapy.
Antwort auf Beitrag Nr.: 34.282.347 von Ville7 am 11.06.08 15:59:55Ignoriert ist eher freundlich ausgedrückt:
CNTO-1275 dann am Dienstag vor ODAC. Ich erwarte eine Empfehlung. Die FDA stresst zwar ein mögliches Krebsrisiko, dieses gibt es aber auch bei den anti-TNF-alphas und nicht nur bei einem Produkt gegen IL-12 und IL-23.
http://www.reuters.com/article/marketsNews/idINN133234612008…
http://www.reuters.com/article/marketsNews/idINN133234612008…
Unglaublich, dass Medarex neuerlich in derartige Tiefen abgeschmiert ist. Wenn man bedenkt-- wie schwach der Dollar ggü. dem Euro notiert- ist die Bewertung der (fortgeschrittenen) Medarex- Pipeline wirklich auf einem lächerlichen Niveau. Trotzdem finden sich anscheinend immer wieder neue Verkäufer.

Rotating Gruen steht seit dem Bar mit der Eigenschaft At['16.06.2008 21:10:00'] wieder auf Kauf.
Heute ODAC Sitzung zu CNTO-1275.
Bright Prospects for J&J Psoriasis Drug
http://blogs.wsj.com/health/2008/06/16/bright-prospects-for-…
Bright Prospects for J&J Psoriasis Drug
http://blogs.wsj.com/health/2008/06/16/bright-prospects-for-…
hi,
ich interessiere mich seit fast 8 Jahren für MEDX und wollte daher mal in den Kreis der Profis und Investoren fragen wie es den sein kann dass dieser saubere 5-Jahrestrend so dermassen brechen konnte???
MIND



ich interessiere mich seit fast 8 Jahren für MEDX und wollte daher mal in den Kreis der Profis und Investoren fragen wie es den sein kann dass dieser saubere 5-Jahrestrend so dermassen brechen konnte???
MIND



Das Advisory Panel hat einstimmig für eine Empfehlung der Zulassung von CNTO-1275 gestimmt. Die FDA folgt i.d.R. dieser Empfehlung. Zulassung möglicherweise schon im September.
Antwort auf Beitrag Nr.: 34.316.894 von mindgames1001 am 17.06.08 15:23:14Nicht ausreichende Top-Line Daten für ipi, dazu das schlechte Börsenumfeld für high beta stockes. Das wurde von Hedgefonds massiv zum Shorten genutzt und hat wahrscheinlich ziemlich viele Bullen verbrannt.
Antwort auf Beitrag Nr.: 34.320.631 von Ville7 am 17.06.08 23:27:07Nachbörse bis 7,75 hoch.
3% hoch nach diesem miesen Tag ist nicht so wahnsinnig viel.
Der eigentliche schub kommt erst, wenn die fda die Empfehlung abnickt?
3% hoch nach diesem miesen Tag ist nicht so wahnsinnig viel.
Der eigentliche schub kommt erst, wenn die fda die Empfehlung abnickt?
Antwort auf Beitrag Nr.: 34.320.631 von Ville7 am 17.06.08 23:27:07Die Marktkap bleibt unter 1 mrd USD.....
Dem Markt ists anscheinend wurssct, das demnächst mit CNTO 1275 der erste Medx-AK zur Zulassung kömmt.
Einstimmige Zulassungsempfehlung ist doch ein Wort.
Dem Markt ists anscheinend wurssct, das demnächst mit CNTO 1275 der erste Medx-AK zur Zulassung kömmt.
Einstimmige Zulassungsempfehlung ist doch ein Wort.

Rotiert das grün mal wieder?
Ein chart zum wahrsinnig werden:

Ein chart zum wahrsinnig werden:
tiefer gehts immer oder so habe den Einstieg in den letzten Wochen gewagt hab heut die letzte Posi gekauft nach meinem Total Ausstieg bei Mor vor einiger Zeit und kleineren Wiedereinstieg hab ich noch in andere Bios investiert war zu Mor-lastig Micromet und Jerini waren meine Topkaufe mit gut 100% plus bei beiden aber das nur am Rande.
Ich habe heute neben meiner kleinen Aktienposi einen OS für einen trade gekauft.

Den CB216J gabs zu 44/46.
Da sollten in der Gegenreaktion ein paar %e drin sein.
Den CB216J gabs zu 44/46.
Da sollten in der Gegenreaktion ein paar %e drin sein.
Antwort auf Beitrag Nr.: 34.327.671 von eck64 am 18.06.08 19:57:17Rotiert das grün mal wieder?
Ja, PMedarex^.Close.At['19.06.2008 21:30:00'] hat heute wieder ein Kaufsignal (Rotating Gruen) erzeugt.
Das Letzte aus Beitrag #3431 war leider ein Fehlsignal.
Chart siehe Beitrag #3431
Ja, PMedarex^.Close.At['19.06.2008 21:30:00'] hat heute wieder ein Kaufsignal (Rotating Gruen) erzeugt.
Das Letzte aus Beitrag #3431 war leider ein Fehlsignal.
Chart siehe Beitrag #3431
Antwort auf Beitrag Nr.: 34.331.985 von eck64 am 19.06.08 12:24:15Auch der CB216J jetzt schon fast 20% in den Miesen. Aktuell 0,38/0,39.
Medarex kennt irgendwie nur noch eine Richtung.

Medarex kennt irgendwie nur noch eine Richtung.

Antwort auf Beitrag Nr.: 34.354.541 von Handbuch am 23.06.08 16:02:02So wie es aussieht, wird das tief nochmal getestet.
Und Basis 8 ist innerhalb von wenigen Stunden auch wieder da, wenn der Markt dreht. Noch mach ich mir keine Sorgen, das der Schein noch ins plus gehen köntne.....
Und Basis 8 ist innerhalb von wenigen Stunden auch wieder da, wenn der Markt dreht. Noch mach ich mir keine Sorgen, das der Schein noch ins plus gehen köntne.....
PMedarex^.Close.At['24.06.2008 15:45:00']
Daumen drücken, dass es jetzt funktioniert. Das Signal vom Freitag hat nur die Fallgeschwindigkeit etwas gebremst.
Fehlsignale in Serie. Der Abwärtstrend im Juni lässt sich in einen bullischen Keil eingrenzen. Unten ein neuer Versuch von Rotating Gruen, aber der wurde auch umgehend gleich abverkauft. Eine verrückte Situation.....
PMedarex^.Close.At['26.06.2008 19:50:00']
PMedarex^.Close.At['26.06.2008 19:50:00']
Rotating red im Downtrend.

Immerhin geht die Downdynamik zurück. Bei den chartfixierten US-Spielern ist Trend alles. Gebrochen ist der Uptrend seit Baissetief

In der Luft mag eine sekundäre Erholungsbewegung bis 11-12 Dollar liegen. Vertrauen in Medarex ist schlecht, Kontrolle bei den Märchenerzählern und Verlustgurken war immer besser. Übern Daumen hat Medarex ein charttechnisches Downziel erreicht, im Umfeld krüpelt eine erfolgreiche Genentech zum Ausguckniveau zurück.

Berechenbar ist hier im Grunde nur das US- Zockerverhalten, entsprechend wichtig eine neue Uptrendbildung. Vorher bleibt die Aktie heikel. Eine Produktzulassung mit einstelligen Tantiemen in einer Nicht-Blockbusterindikation verdampft in chronisch maroden Zahlen, kann allerdings ganz gut zu einer Erholungsbewegung passen. Ohne Durchmarsch mehrerer Projekte in der Pipelinespitze bleibt die Aktie Spielzeug ohne investives Format.
Immerhin geht die Downdynamik zurück. Bei den chartfixierten US-Spielern ist Trend alles. Gebrochen ist der Uptrend seit Baissetief
In der Luft mag eine sekundäre Erholungsbewegung bis 11-12 Dollar liegen. Vertrauen in Medarex ist schlecht, Kontrolle bei den Märchenerzählern und Verlustgurken war immer besser. Übern Daumen hat Medarex ein charttechnisches Downziel erreicht, im Umfeld krüpelt eine erfolgreiche Genentech zum Ausguckniveau zurück.
Berechenbar ist hier im Grunde nur das US- Zockerverhalten, entsprechend wichtig eine neue Uptrendbildung. Vorher bleibt die Aktie heikel. Eine Produktzulassung mit einstelligen Tantiemen in einer Nicht-Blockbusterindikation verdampft in chronisch maroden Zahlen, kann allerdings ganz gut zu einer Erholungsbewegung passen. Ohne Durchmarsch mehrerer Projekte in der Pipelinespitze bleibt die Aktie Spielzeug ohne investives Format.
Tag. Mal wieder erfreuliche Nachrichten von MEDX bzw. eigentlich von Centocor. Wann gibts dazu eine offizielle Meldung von MEDX? Erst bei Meilensteinzahlung?
lG Lycos
***********************************************************
Centocor Submits Application to FDA Requesting Approval of Golimumab for Treatment of Rheumatoid Arthritis, Psoriatic Arthritis and Ankylosing Spondylitis
June 27, 2008
Centocor, Inc. announced today that a Biologics License Application (BLA) has been submitted to the U.S. Food and Drug Administration (FDA) requesting the approval of golimumab (CNTO 148) as a monthly subcutaneous treatment for adults with active forms of rheumatoid arthritis, psoriatic arthritis and ankylosing spondylitis. Golimumab, Centocor's next-generation human anti-TNF-alpha monoclonal antibody, is being studied as an every four week subcutaneous injection and is also being studied as an intravenous (IV) infusion therapy. In February 2008, Centocor submitted a Marketing Authorization Application (MAA) to the European Medicines Agency (EMEA) requesting the approval of golimumab as a monthly subcutaneous treatment for the same indications.
"This submission marks a major milestone in the clinical development program of golimumab, and we look forward to working with the FDA to bring golimumab to market," said Jerome A. Boscia, M.D., senior vice president, Clinical R&D, Centocor, Inc. "We remain focused on our commitment to innovation in the field of biomedicines, to addressing the ongoing needs of patients living with these debilitating diseases and to physicians in need of additional therapeutic options to effectively treat their patients."
Five pivotal Phase 3 trials support the BLA, which include the GOlimumab Before Employing methotrexate as the First-line Option in the treatment of Rheumatoid arthritis of Early onset (GO-BEFORE) study; the GOlimumab FOR subjects With Active RA Despite MTX (GO-FORWARD) study; and A Multicenter, Randomized, Double-blind, Placebo-controlled Trial of Golimumab, a Human Anti-TNF-alpha Monoclonal Antibody, Administered Subcutaneously in Subjects with Active Rheumatoid Arthritis and Previously Treated with Biologic Anti-TNF-alpha Agent(s) (GO-AFTER) study were recently presented at the European League Against Rheumatism Annual Congress. In November 2007, primary endpoint study findings from the Golimumab - A Randomized Evaluation of Safety and Efficacy in Subjects with Psoriatic Arthritis Using a Human Anti-TNF Monoclonal Antibody (GO-REVEAL) trial and the Golimumab - A Randomized Study in Ankylosing Spondylitis Subjects of a Novel Anti-TNF mAB Injection (SC) Given Every Four Weeks (GO-RAISE) trial were reported at the American College of Rheumatology Annual Scientific Meeting.
lG Lycos
***********************************************************
Centocor Submits Application to FDA Requesting Approval of Golimumab for Treatment of Rheumatoid Arthritis, Psoriatic Arthritis and Ankylosing Spondylitis
June 27, 2008
Centocor, Inc. announced today that a Biologics License Application (BLA) has been submitted to the U.S. Food and Drug Administration (FDA) requesting the approval of golimumab (CNTO 148) as a monthly subcutaneous treatment for adults with active forms of rheumatoid arthritis, psoriatic arthritis and ankylosing spondylitis. Golimumab, Centocor's next-generation human anti-TNF-alpha monoclonal antibody, is being studied as an every four week subcutaneous injection and is also being studied as an intravenous (IV) infusion therapy. In February 2008, Centocor submitted a Marketing Authorization Application (MAA) to the European Medicines Agency (EMEA) requesting the approval of golimumab as a monthly subcutaneous treatment for the same indications.
"This submission marks a major milestone in the clinical development program of golimumab, and we look forward to working with the FDA to bring golimumab to market," said Jerome A. Boscia, M.D., senior vice president, Clinical R&D, Centocor, Inc. "We remain focused on our commitment to innovation in the field of biomedicines, to addressing the ongoing needs of patients living with these debilitating diseases and to physicians in need of additional therapeutic options to effectively treat their patients."
Five pivotal Phase 3 trials support the BLA, which include the GOlimumab Before Employing methotrexate as the First-line Option in the treatment of Rheumatoid arthritis of Early onset (GO-BEFORE) study; the GOlimumab FOR subjects With Active RA Despite MTX (GO-FORWARD) study; and A Multicenter, Randomized, Double-blind, Placebo-controlled Trial of Golimumab, a Human Anti-TNF-alpha Monoclonal Antibody, Administered Subcutaneously in Subjects with Active Rheumatoid Arthritis and Previously Treated with Biologic Anti-TNF-alpha Agent(s) (GO-AFTER) study were recently presented at the European League Against Rheumatism Annual Congress. In November 2007, primary endpoint study findings from the Golimumab - A Randomized Evaluation of Safety and Efficacy in Subjects with Psoriatic Arthritis Using a Human Anti-TNF Monoclonal Antibody (GO-REVEAL) trial and the Golimumab - A Randomized Study in Ankylosing Spondylitis Subjects of a Novel Anti-TNF mAB Injection (SC) Given Every Four Weeks (GO-RAISE) trial were reported at the American College of Rheumatology Annual Scientific Meeting.
Antwort auf Beitrag Nr.: 34.385.670 von Friseuse am 26.06.08 23:18:26Friseuse,
die Tantiemen der Centocor- Antikörper (Ustekinumab & Golimumab) könnten die Marktkapitalisierung von Medarex mittlerweile alleine stellen. Ein paar Prozent auf den Umsatz hört sich vielleicht nicht nach viel an, aber es ist Reingewinn ohne irgenwelchen Aufwand. Offensichtlich hat die Börse jedoch ein Problem mit den hohen Verlusten, die die umfangreiche Medarex- Pipeline verursacht.
PMedarex^.Close.At['30.06.2008 21:10:00']
Ein Signal vom Freitag, das wieder zu nichts führte. Eine so hohe Frequenz von Signalen (alle 200 Bars) tritt bei Rotating Gruen normalerweise gar nicht erst auf. Irgendwie hängt dieses nicht erwünschte Verhalten damit zusammen, dass der Downtrend seit dem 05.06.2008 in sehr engen Bahnen und ohne klare Strukturen* daherkommt.
* mit Ausnahme der technischen Erholung vom 16.06.2008
die Tantiemen der Centocor- Antikörper (Ustekinumab & Golimumab) könnten die Marktkapitalisierung von Medarex mittlerweile alleine stellen. Ein paar Prozent auf den Umsatz hört sich vielleicht nicht nach viel an, aber es ist Reingewinn ohne irgenwelchen Aufwand. Offensichtlich hat die Börse jedoch ein Problem mit den hohen Verlusten, die die umfangreiche Medarex- Pipeline verursacht.
PMedarex^.Close.At['30.06.2008 21:10:00']
Ein Signal vom Freitag, das wieder zu nichts führte. Eine so hohe Frequenz von Signalen (alle 200 Bars) tritt bei Rotating Gruen normalerweise gar nicht erst auf. Irgendwie hängt dieses nicht erwünschte Verhalten damit zusammen, dass der Downtrend seit dem 05.06.2008 in sehr engen Bahnen und ohne klare Strukturen* daherkommt.
* mit Ausnahme der technischen Erholung vom 16.06.2008
PMedarex^.Close.At['01.07.2008 15:30:00']
Der Bar zur Eröffnung heute ist ein Verkaufssignal laut Rotating Gruen. Aber zum Glück entpuppt sich dieses ebenfalls als schlechtes Signal, ansonsten würde man hier noch in Teufels Küche kommen! :O
PMedarex^.Close.At['01.07.2008 16:00:00']
Schon steht die Aktie wieder auf Kauf. Wirklich ein unglaublich bemerkenswerter Kursverlauf. Wenn ich einmal Zeit und Lust habe, werde ich die Daten in Charybdis importieren und von dort aus umfassend analysieren.
Der Bar zur Eröffnung heute ist ein Verkaufssignal laut Rotating Gruen. Aber zum Glück entpuppt sich dieses ebenfalls als schlechtes Signal, ansonsten würde man hier noch in Teufels Küche kommen! :O
PMedarex^.Close.At['01.07.2008 16:00:00']
Schon steht die Aktie wieder auf Kauf. Wirklich ein unglaublich bemerkenswerter Kursverlauf. Wenn ich einmal Zeit und Lust habe, werde ich die Daten in Charybdis importieren und von dort aus umfassend analysieren.
Antwort auf Beitrag Nr.: 34.413.753 von Gruenfeld am 01.07.08 16:44:59Wie und wo kauft man am besten?
Medarex ist sehr stark gefallen,hmmmm.
Bitte um Antwort.
Medarex ist sehr stark gefallen,hmmmm.

Bitte um Antwort.
Antwort auf Beitrag Nr.: 34.414.920 von Bioperle am 01.07.08 19:02:46Am besten kauft man gar nicht, dann hat man seine Ruh. 
Nein. Wie, wo oder was man kauft, muss jeder für sich selbst entscheiden. Ich stelle hier Signale meines neuen Systems 'Rotating Gruen' vor. Aber wie man sieht, ist es mit dem stetig negativen Kursverlauf des 5- Minuten Charts (der letzten Zeit) überfordert.
Aus fundamentaler Sicht sind die jetzigen Kurse meiner Meinung nach ein Geschenk. Aber ein letzter Ausverkauf, Kapitulation mit grossem Volumen kann trotzdem noch kommen.

Nein. Wie, wo oder was man kauft, muss jeder für sich selbst entscheiden. Ich stelle hier Signale meines neuen Systems 'Rotating Gruen' vor. Aber wie man sieht, ist es mit dem stetig negativen Kursverlauf des 5- Minuten Charts (der letzten Zeit) überfordert.
Aus fundamentaler Sicht sind die jetzigen Kurse meiner Meinung nach ein Geschenk. Aber ein letzter Ausverkauf, Kapitulation mit grossem Volumen kann trotzdem noch kommen.
Antwort auf Beitrag Nr.: 34.415.177 von Gruenfeld am 01.07.08 19:29:33Liebe(r) Gruenfeld,
danke für Deine Signale deines neuen Systems 'Rotating Gruen'
Sind diese Antikörper von Medarex,verheissungsvoll genug?
Der Chart sieht alles andere als,für eine bessere rosige Zukunft aus.
PS.Überlege mit knapp 500 in Stuttgart einzusteigen.
danke für Deine Signale deines neuen Systems 'Rotating Gruen'
Sind diese Antikörper von Medarex,verheissungsvoll genug?
Der Chart sieht alles andere als,für eine bessere rosige Zukunft aus.

PS.Überlege mit knapp 500 in Stuttgart einzusteigen.

Sind diese Antikörper von Medarex,verheissungsvoll genug?
Ehrlich gesagt fehlt mir jegliche Kompetenz, die Medikamentenentwicklung von Medarex zu beurteilen. Auf jeden Fall ist deren [urlPipeline]http://www.medarex.com/Development/Pipeline.htm[/url] aus meiner Sicht extrem umfangreich.
Was ich an der Aktie gut finde: Ustekinumab und Golimumab werden-- unter Vorbehalt der Zulassung- in den nächsten Jahren nachhaltig für eine Verbesserung von Umsatz und Ergebnis sorgen. Natürlich werden sie den MEDX- Fehlbetrag nur zu einem Teil ausgleichen können..... aber ohne den Umstand der beträchtlichen operativen Verluste würde die Medarex- Aktie auch nicht auf so niedrigem Niveau notieren.
Ehrlich gesagt fehlt mir jegliche Kompetenz, die Medikamentenentwicklung von Medarex zu beurteilen. Auf jeden Fall ist deren [urlPipeline]http://www.medarex.com/Development/Pipeline.htm[/url] aus meiner Sicht extrem umfangreich.
Was ich an der Aktie gut finde: Ustekinumab und Golimumab werden-- unter Vorbehalt der Zulassung- in den nächsten Jahren nachhaltig für eine Verbesserung von Umsatz und Ergebnis sorgen. Natürlich werden sie den MEDX- Fehlbetrag nur zu einem Teil ausgleichen können..... aber ohne den Umstand der beträchtlichen operativen Verluste würde die Medarex- Aktie auch nicht auf so niedrigem Niveau notieren.
Antwort auf Beitrag Nr.: 34.331.985 von eck64 am 19.06.08 12:24:15Wer erwischt schon das tief. 

Boden erreicht nun wieder aufwärts?
Was macht denn dein Call Eck?
Was macht denn dein Call Eck?
Antwort auf Beitrag Nr.: 34.464.218 von schnappi am 08.07.08 19:49:47Der call? Schnappt nach Luft. 
Morgen noch so nen Tag und er ist im plus.

Über 7 wäre die Bodenbildung im kleinen Zeitfenster gelungen.
Kurse bis 8 sollten dann zügig drin sein.

Und alles andere wird sich dann weisen. Ist doch nur ein paar Tage hin....

Morgen noch so nen Tag und er ist im plus.
Über 7 wäre die Bodenbildung im kleinen Zeitfenster gelungen.
Kurse bis 8 sollten dann zügig drin sein.
Und alles andere wird sich dann weisen. Ist doch nur ein paar Tage hin....
Antwort auf Beitrag Nr.: 34.464.218 von schnappi am 08.07.08 19:49:47Siehst du Schnappi, den Einstand hätte ich wieder. 
Mit richtigem timing allerdings doppelt so viele Stücke.



Mit richtigem timing allerdings doppelt so viele Stücke.

Antwort auf Beitrag Nr.: 34.489.876 von eck64 am 11.07.08 15:59:34hauptsache im grünen heut steigts Anfangas mal wieder neues hab ich nicht gefunden kann auch nicht immer nur runter laufen
10%

War dies der Auslöser
Medarex Highlights Strength in Antibody Development and Underlying Pipeline Strategy at R&D Day Event in New York City
PRINCETON, N.J., July 10 /PRNewswire-FirstCall/ -- Medarex, Inc. (Nasdaq: MEDX)
today provided a detailed overview of the company's strategy, strength in research
discovery and antibody development, and the multiple opportunities Medarex is
engaged in for creating long-term value. In addition, comprehensive updates on
current and future antibody programs as well as updated 2008 financial guidance were
presented by Medarex's President and CEO, Howard H. Pien, and other members of
senior management.
"Medarex's science and technology provides a solid foundation for creating and
renewing a broad portfolio of innovative and commercially attractive product
candidates," said Mr. Pien. "We remain excited and confident of the path forward for
the broad oncology program of ipilimumab, our lead product candidate in development
with Bristol-Myers Squibb Company. We are also developing a strong pipeline that
includes six other exciting product candidates that represent multiple commercial
opportunities for Medarex. We believe that there is tremendous value in our
pipeline, and we are well- positioned in our research capabilities and development
strategy for sustaining a pipeline of commercially attractive candidates to achieve
significant growth in the years ahead."
Product Portfolio
Medarex has developed a portfolio of product candidates that address important
disease pathways in oncology and inflammatory diseases, including immune modulation
by co-stimulatory and checkpoint molecules, inhibition of pro-inflammatory
cytokines, and B-cell targeted approaches. In addition to providing an update on the
broad program for ipilimumab, an investigational immunotherapy for multiple oncology
indications, Medarex also highlighted the company's scientific and commercial
vision, clinical development plans to proof-of-concept, and development milestones
of select programs in clinical development. Some of the programs discussed included
the following:
-- MDX-1106 (ONO-4538) is a fully human anti-PD-1 antibody in development with
Ono Pharmaceuticals, Inc. for solid tumors. Preliminary data of anti- tumor activity
in multiple tumor types from an ongoing Phase 1 trial were previously reported at a
recent medical conference. A multi-dose Phase 2 study in solid tumors is expected to
begin in 2008. A separate Phase 1 trial for hepatitis C viral infection is ongoing,
with data expected in 2009.
-- MDX-1100 is a fully human antibody that targets IP-10, a chemokine that
promotes the recruitment of pro-inflammatory cells that can cause tissue damage in
rheumatoid arthritis and inflammatory bowel diseases. MDX-1100 represents a
breakthrough mechanism of action for inflammatory disease and is being investigated
in separate Phase 2 proof-of-concept trials for ulcerative colitis and rheumatoid
arthritis. Interim data from these trials are expected in 2009.
-- MDX-1401 is a fully human antibody that targets CD30, a member of the TNF
family expressed on CD30-positive lymphomas, including Hodgkin's lymphoma. MDX-1401
is a second-generation antibody enhanced for improved antibody effector function
over the parental anti-CD30 antibody, MDX-060. Preliminary data from an ongoing
Phase 1 trial of MDX-1401 is expected in 2008 at a medical conference, with final
data expected in 2009.
-- MDX-1342 is a fully human antibody with enhanced antibody effector function
that selectively binds to CD19, a molecule expressed on a broad range of B-cell
malignancies. MDX-1342 also induces the depletion and elimination of B-cells for
inflammatory disease indications. Phase 1 trials in chronic lymphocytic leukemia and
rheumatoid arthritis are ongoing with data expected in 2009.
-- MDX-1411 is a fully human antibody with enhanced antibody effector function
that targets CD70, a member of the TNF family that is highly expressed on multiple
cancers, including renal cell carcinoma, lymphoma and glioblastoma. CD70 expression
on activated lymphocytes may also be implicated in autoimmune diseases. Data from
the ongoing Phase 1 trial in clear cell renal carcinoma is expected in 2009.
Additional opportunities include the expected initiation of a Phase 1 trial of
MDX-1411 in lymphomas in 2008, as well as an anti-CD70 antibody-drug conjugate
program.
-- MDX-1203 targets the CD70 molecule expressed on multiple cancers and is
expected to be the first Medarex antibody-drug conjugate candidate to enter clinical
development in 2008/early 2009.
"We are making great strides in developing potentially important therapeutics to
address a wide range of cancer and inflammatory diseases," Geoffrey M. Nichol,
M.B.Ch.B., Senior Vice President of Product Development at Medarex. "We continue to
progress towards proof-of-concept for multiple programs and look forward to
advancing our most promising candidates towards market approval."
Research and Development
Medarex has enhanced its core UltiMAb(R) antibody platform with a suite of
technologies that optimize or enhance the therapeutic activity of antibodies. One
important technology expansion is the company's proprietary antibody-drug conjugate
(ADC) platform. Medarex believes that its ADC technology overcomes many of the key
development challenges of drug conjugates, including issues of linker stability,
potency and multi-drug resistance while maintaining a wide therapeutic window with
minimal toxicity. Coupled with cutting-edge antibody technologies, Medarex's
sophisticated drug development infrastructure and decision-making processes engage
expertise in the areas of science, clinical development and market research to
maximize efficiency, increase productivity, augment the quality of our antibody drug
development efforts and increase the probability of success for product candidates.
"We have a world-class antibody drug development platform which allows us to
enrich our pipeline with best-in-class antibody candidates," said Nils Lonberg,
Senior Vice President and Scientific Director at Medarex. "We are uniquely
structured to identify, optimize and channel our most promising lead candidates into
clinical development on a continual basis to ensure the future growth and value of
our pipeline."
Throughout this year and next, Medarex anticipates a strong flow of research and
development milestones, including the goal of moving two or more antibodies into
clinical development.
Financial Guidance Update
Medarex also updated its previously issued guidance for 2008. For the full year
of 2008, Medarex currently expects a cash burn rate per month of approximately $12.4
million, a decrease from previous guidance for monthly cash burn rate of
approximately $14.5 million. This guidance includes Medarex's continual investment
in its pipeline and the net contributions to the ipilimumab program.
Also for the full year of 2008, Medarex expects projected revenues to be in the
range of $48 to $52 million; R&D expense in the range of $175 to $185 million;
G&A expense in the range of $31 to $35 million; net interest income to be
approximately $12 million; and capital expenditures to be approximately $10 million.
Estimates for the full year depreciation and amortization of approximately $13
million, and FAS 123(R) non-cash stock-based compensation expense in the range of
$19 to $23 million remain unchanged.
"We have consistently managed our resources to invest into the growth of our
pipeline," said Christian S. Schade, Senior Vice President and CFO of Medarex. "Our
commitment to steadily support our research and development efforts to proof of
concept and enhance value under increased efficiencies remains unchanged."
Factors that may cause variations in Medarex's projected earnings and financial
performance and other risks and uncertainties are discussed in the section below
entitled "Statement on Cautionary Factors" and in our filings with the U.S.
Securities and Exchange Commission.
Medarex Highlights Strength in Antibody Development and Underlying Pipeline Strategy at R&D Day Event in New York City
PRINCETON, N.J., July 10 /PRNewswire-FirstCall/ -- Medarex, Inc. (Nasdaq: MEDX)
today provided a detailed overview of the company's strategy, strength in research
discovery and antibody development, and the multiple opportunities Medarex is
engaged in for creating long-term value. In addition, comprehensive updates on
current and future antibody programs as well as updated 2008 financial guidance were
presented by Medarex's President and CEO, Howard H. Pien, and other members of
senior management.
"Medarex's science and technology provides a solid foundation for creating and
renewing a broad portfolio of innovative and commercially attractive product
candidates," said Mr. Pien. "We remain excited and confident of the path forward for
the broad oncology program of ipilimumab, our lead product candidate in development
with Bristol-Myers Squibb Company. We are also developing a strong pipeline that
includes six other exciting product candidates that represent multiple commercial
opportunities for Medarex. We believe that there is tremendous value in our
pipeline, and we are well- positioned in our research capabilities and development
strategy for sustaining a pipeline of commercially attractive candidates to achieve
significant growth in the years ahead."
Product Portfolio
Medarex has developed a portfolio of product candidates that address important
disease pathways in oncology and inflammatory diseases, including immune modulation
by co-stimulatory and checkpoint molecules, inhibition of pro-inflammatory
cytokines, and B-cell targeted approaches. In addition to providing an update on the
broad program for ipilimumab, an investigational immunotherapy for multiple oncology
indications, Medarex also highlighted the company's scientific and commercial
vision, clinical development plans to proof-of-concept, and development milestones
of select programs in clinical development. Some of the programs discussed included
the following:
-- MDX-1106 (ONO-4538) is a fully human anti-PD-1 antibody in development with
Ono Pharmaceuticals, Inc. for solid tumors. Preliminary data of anti- tumor activity
in multiple tumor types from an ongoing Phase 1 trial were previously reported at a
recent medical conference. A multi-dose Phase 2 study in solid tumors is expected to
begin in 2008. A separate Phase 1 trial for hepatitis C viral infection is ongoing,
with data expected in 2009.
-- MDX-1100 is a fully human antibody that targets IP-10, a chemokine that
promotes the recruitment of pro-inflammatory cells that can cause tissue damage in
rheumatoid arthritis and inflammatory bowel diseases. MDX-1100 represents a
breakthrough mechanism of action for inflammatory disease and is being investigated
in separate Phase 2 proof-of-concept trials for ulcerative colitis and rheumatoid
arthritis. Interim data from these trials are expected in 2009.
-- MDX-1401 is a fully human antibody that targets CD30, a member of the TNF
family expressed on CD30-positive lymphomas, including Hodgkin's lymphoma. MDX-1401
is a second-generation antibody enhanced for improved antibody effector function
over the parental anti-CD30 antibody, MDX-060. Preliminary data from an ongoing
Phase 1 trial of MDX-1401 is expected in 2008 at a medical conference, with final
data expected in 2009.
-- MDX-1342 is a fully human antibody with enhanced antibody effector function
that selectively binds to CD19, a molecule expressed on a broad range of B-cell
malignancies. MDX-1342 also induces the depletion and elimination of B-cells for
inflammatory disease indications. Phase 1 trials in chronic lymphocytic leukemia and
rheumatoid arthritis are ongoing with data expected in 2009.
-- MDX-1411 is a fully human antibody with enhanced antibody effector function
that targets CD70, a member of the TNF family that is highly expressed on multiple
cancers, including renal cell carcinoma, lymphoma and glioblastoma. CD70 expression
on activated lymphocytes may also be implicated in autoimmune diseases. Data from
the ongoing Phase 1 trial in clear cell renal carcinoma is expected in 2009.
Additional opportunities include the expected initiation of a Phase 1 trial of
MDX-1411 in lymphomas in 2008, as well as an anti-CD70 antibody-drug conjugate
program.
-- MDX-1203 targets the CD70 molecule expressed on multiple cancers and is
expected to be the first Medarex antibody-drug conjugate candidate to enter clinical
development in 2008/early 2009.
"We are making great strides in developing potentially important therapeutics to
address a wide range of cancer and inflammatory diseases," Geoffrey M. Nichol,
M.B.Ch.B., Senior Vice President of Product Development at Medarex. "We continue to
progress towards proof-of-concept for multiple programs and look forward to
advancing our most promising candidates towards market approval."
Research and Development
Medarex has enhanced its core UltiMAb(R) antibody platform with a suite of
technologies that optimize or enhance the therapeutic activity of antibodies. One
important technology expansion is the company's proprietary antibody-drug conjugate
(ADC) platform. Medarex believes that its ADC technology overcomes many of the key
development challenges of drug conjugates, including issues of linker stability,
potency and multi-drug resistance while maintaining a wide therapeutic window with
minimal toxicity. Coupled with cutting-edge antibody technologies, Medarex's
sophisticated drug development infrastructure and decision-making processes engage
expertise in the areas of science, clinical development and market research to
maximize efficiency, increase productivity, augment the quality of our antibody drug
development efforts and increase the probability of success for product candidates.
"We have a world-class antibody drug development platform which allows us to
enrich our pipeline with best-in-class antibody candidates," said Nils Lonberg,
Senior Vice President and Scientific Director at Medarex. "We are uniquely
structured to identify, optimize and channel our most promising lead candidates into
clinical development on a continual basis to ensure the future growth and value of
our pipeline."
Throughout this year and next, Medarex anticipates a strong flow of research and
development milestones, including the goal of moving two or more antibodies into
clinical development.
Financial Guidance Update
Medarex also updated its previously issued guidance for 2008. For the full year
of 2008, Medarex currently expects a cash burn rate per month of approximately $12.4
million, a decrease from previous guidance for monthly cash burn rate of
approximately $14.5 million. This guidance includes Medarex's continual investment
in its pipeline and the net contributions to the ipilimumab program.
Also for the full year of 2008, Medarex expects projected revenues to be in the
range of $48 to $52 million; R&D expense in the range of $175 to $185 million;
G&A expense in the range of $31 to $35 million; net interest income to be
approximately $12 million; and capital expenditures to be approximately $10 million.
Estimates for the full year depreciation and amortization of approximately $13
million, and FAS 123(R) non-cash stock-based compensation expense in the range of
$19 to $23 million remain unchanged.
"We have consistently managed our resources to invest into the growth of our
pipeline," said Christian S. Schade, Senior Vice President and CFO of Medarex. "Our
commitment to steadily support our research and development efforts to proof of
concept and enhance value under increased efficiencies remains unchanged."
Factors that may cause variations in Medarex's projected earnings and financial
performance and other risks and uncertainties are discussed in the section below
entitled "Statement on Cautionary Factors" and in our filings with the U.S.
Securities and Exchange Commission.
Antwort auf Beitrag Nr.: 34.494.663 von schnappi am 12.07.08 13:13:26Das ist das mit Medarex. Eine tolle Pipeline.
Und die fordert ihren Tribut.
Cashburn 12,4 mio USD jeden Monat. Bei Jahresumsatz um 50 mio USD.
Medarex bracuht mindestens 2 Zulassungen um in 2 bis 3 Jahren das erste mal die schwarze 0 zu schreiben.
Snickers, wenns mal wieder etwas länger braucht. Und leider mag der finanzmarkt absehbare Entwicklungen auf 2 bis 4 Jahre nicht einpreisen sondern liebt die Katapultstarts. Da wird in Kursen auf absehbare Ereignisse hingehungert und dann gibts den Schub im Kurs.
Mal sehen, ob sich Medarex jetzt mal wieder vernünftig einpendeln kann. Vor einem Jahr stand sie noch bei unglaublichen 18 USD.....
Und die fordert ihren Tribut.
Cashburn 12,4 mio USD jeden Monat. Bei Jahresumsatz um 50 mio USD.
Medarex bracuht mindestens 2 Zulassungen um in 2 bis 3 Jahren das erste mal die schwarze 0 zu schreiben.
Snickers, wenns mal wieder etwas länger braucht. Und leider mag der finanzmarkt absehbare Entwicklungen auf 2 bis 4 Jahre nicht einpreisen sondern liebt die Katapultstarts. Da wird in Kursen auf absehbare Ereignisse hingehungert und dann gibts den Schub im Kurs.
Mal sehen, ob sich Medarex jetzt mal wieder vernünftig einpendeln kann. Vor einem Jahr stand sie noch bei unglaublichen 18 USD.....

Antwort auf Beitrag Nr.: 34.494.734 von eck64 am 12.07.08 13:34:35
Mit Downtrendbruch?
Nach den verheerenden letzten Monaten eine tolle Wochenkerze. Aber mittelfristig ist noch nichts gewonnen.
Mit Downtrendbruch?
Nach den verheerenden letzten Monaten eine tolle Wochenkerze. Aber mittelfristig ist noch nichts gewonnen.
Antwort auf Beitrag Nr.: 34.494.734 von eck64 am 12.07.08 13:34:35Welche Entwicklung ist bei einer Medarex absehbar und ist die Pipeline wirklich toll
Ersichtlich ist eine laufend verfehlte Börsenansprache. Medarex gibt den klassischen Amerikaner, amazing im Text bis zu neuen Paradigmen in der Krebsbehandlung und angepeilte Ziele scheitern oder ziehen sich.
Warum sollte die Börse mit einer positiven Visibilität in Kursen auf dieses Schauspiel antworten Medarex selbst glaubte bei diversen Substanzauszehrungen der Aktie den eigenen Erfolgsverkündungen nicht. Folglich ist die Kursbewegung nicht antizipativ, sie ist heftig spät reaktiv auf stetige Zielverfehlungen und dies mit einem Langjahresuptrendbruch stark in der Aussage.
Medarex selbst glaubte bei diversen Substanzauszehrungen der Aktie den eigenen Erfolgsverkündungen nicht. Folglich ist die Kursbewegung nicht antizipativ, sie ist heftig spät reaktiv auf stetige Zielverfehlungen und dies mit einem Langjahresuptrendbruch stark in der Aussage.
Da bleibt nur die Hoffnung auf Wunderheilung dieser Aktie

Ersichtlich ist eine laufend verfehlte Börsenansprache. Medarex gibt den klassischen Amerikaner, amazing im Text bis zu neuen Paradigmen in der Krebsbehandlung und angepeilte Ziele scheitern oder ziehen sich.
Warum sollte die Börse mit einer positiven Visibilität in Kursen auf dieses Schauspiel antworten
 Medarex selbst glaubte bei diversen Substanzauszehrungen der Aktie den eigenen Erfolgsverkündungen nicht. Folglich ist die Kursbewegung nicht antizipativ, sie ist heftig spät reaktiv auf stetige Zielverfehlungen und dies mit einem Langjahresuptrendbruch stark in der Aussage.
Medarex selbst glaubte bei diversen Substanzauszehrungen der Aktie den eigenen Erfolgsverkündungen nicht. Folglich ist die Kursbewegung nicht antizipativ, sie ist heftig spät reaktiv auf stetige Zielverfehlungen und dies mit einem Langjahresuptrendbruch stark in der Aussage.Da bleibt nur die Hoffnung auf Wunderheilung dieser Aktie
Antwort auf Beitrag Nr.: 34.495.185 von eck64 am 12.07.08 16:31:04sie steht aber kurz vor der 100 tagelinie
Antwort auf Beitrag Nr.: 34.495.550 von schnappi am 12.07.08 18:59:45Mal sehen ob der Trend sich weiter fortsetzt.
Ganz so schlecht wie der Chart sich deutet,ist das Unternehmen wohl doch nicht aufgestellt.
Ganz so schlecht wie der Chart sich deutet,ist das Unternehmen wohl doch nicht aufgestellt.

Antwort auf Beitrag Nr.: 34.489.876 von eck64 am 11.07.08 15:59:34Die Marktverfassung ist so übel. Ich habe für 55 cent verkauft.
Vielleicht kriegt man ihn wieder für 35 bis 40?
Vielleicht kriegt man ihn wieder für 35 bis 40?
Heut mal wieder stark der ganze Biosektor hoffendlich nicht nur ne kurze Luftnummer

Antwort auf Beitrag Nr.: 34.516.126 von schnappi am 15.07.08 23:08:18Zur Info
BioWa and Medarex Announce License of BioWa's COMPLEGENT(TM) Technology
http://translate.google.de/translate?hl=de&sl=en&u=http://ww…
Schönen Tag noch.
BioWa and Medarex Announce License of BioWa's COMPLEGENT(TM) Technology
http://translate.google.de/translate?hl=de&sl=en&u=http://ww…
Schönen Tag noch.

Antwort auf Beitrag Nr.: 34.508.232 von eck64 am 15.07.08 10:04:20Zur Info in Deutsch
MEDAREX Highlights Stärke der Antikörper Entwicklung und zugrunde liegenden Pipeline-Strategie im R & D Day in New York City
http://translate.google.de/translate?hl=de&sl=en&u=http://mo…
@eck64
Sieht doch gar nicht so schlecht aus,was sagt deine Chartkugel.
MEDAREX Highlights Stärke der Antikörper Entwicklung und zugrunde liegenden Pipeline-Strategie im R & D Day in New York City
http://translate.google.de/translate?hl=de&sl=en&u=http://mo…
@eck64
Sieht doch gar nicht so schlecht aus,was sagt deine Chartkugel.

Antwort auf Beitrag Nr.: 34.413.753 von Gruenfeld am 01.07.08 16:44:59MEDX 5-MinutenChart
Zeitraum: 10 Wochentage

PMedarex^.Close.At['22.07.2008 15:30:00']
Heute zum Handelsstart hat Rotating Gruen ein Verkaufssignal im 5-MinutenChart generiert. Seit Beitrag #3450 vom 01.07.2008 stand die Funktion auf Kauf. Jetzt ist sie der Meinung, die Krümmung des Kursverlaufs ist nicht mehr so positiv, wie es die letzten Wochen der Fall war. Klasse gemacht, denn eine Konsolidierungsbewegung (der Gewinne seit dem zyklischen Tief) scheint in der nächsten Zeit durchaus plausibel.
Wie steht es mit dem Interesse, soll ich 5- MinutenChart weiter kommentieren oder nicht? Die bisherigen Beiträge reichen eigentlich als Einblick in die Funktionsweise von Rotating Gruen.
Zeitraum: 10 Wochentage
PMedarex^.Close.At['22.07.2008 15:30:00']
Heute zum Handelsstart hat Rotating Gruen ein Verkaufssignal im 5-MinutenChart generiert. Seit Beitrag #3450 vom 01.07.2008 stand die Funktion auf Kauf. Jetzt ist sie der Meinung, die Krümmung des Kursverlaufs ist nicht mehr so positiv, wie es die letzten Wochen der Fall war. Klasse gemacht, denn eine Konsolidierungsbewegung (der Gewinne seit dem zyklischen Tief) scheint in der nächsten Zeit durchaus plausibel.
Wie steht es mit dem Interesse, soll ich 5- MinutenChart weiter kommentieren oder nicht? Die bisherigen Beiträge reichen eigentlich als Einblick in die Funktionsweise von Rotating Gruen.
Antwort auf Beitrag Nr.: 34.561.661 von Gruenfeld am 22.07.08 16:42:58 "Wie steht es mit dem Interesse, soll ich 5- MinutenChart weiter kommentieren oder nicht?"
Doch, bitte.
"Die bisherigen Beiträge reichen eigentlich als Einblick in die Funktionsweise von Rotating Gruen."
Ich bin - bei meinem sporadischen Einklicken - immer noch nicht dahinter gekommen, welche Linie oder Formation die Funktion "Rotating Grün" auf dem Schaubild darstellt.
Hast Du das mal hier irgendwo erklärt? Unter welcher #?
Kannst nur Du aus irgendeiner "Berechnungs"-Tabelle entnehmen, wie gerade das "At" ist, oder müsste das Jeder hier (mich natürlich ausgenommen) auf dem Chart erkennen können?
auf dem Chart erkennen können?
Gruß
Zock
PS: Ich verkaufe meine Stücke trotzdem z.Z. nicht -
....aber ich habe ja auch keine Calls wie der "gierige" Eck (da wäre ich wohl auch schwach geworden. Glückwunsch.)
(da wäre ich wohl auch schwach geworden. Glückwunsch.)
Doch, bitte.
"Die bisherigen Beiträge reichen eigentlich als Einblick in die Funktionsweise von Rotating Gruen."
Ich bin - bei meinem sporadischen Einklicken - immer noch nicht dahinter gekommen, welche Linie oder Formation die Funktion "Rotating Grün" auf dem Schaubild darstellt.
Hast Du das mal hier irgendwo erklärt? Unter welcher #?
Kannst nur Du aus irgendeiner "Berechnungs"-Tabelle entnehmen, wie gerade das "At" ist, oder müsste das Jeder hier (mich natürlich ausgenommen)
 auf dem Chart erkennen können?
auf dem Chart erkennen können?Gruß
Zock
PS: Ich verkaufe meine Stücke trotzdem z.Z. nicht -
....aber ich habe ja auch keine Calls wie der "gierige" Eck
 (da wäre ich wohl auch schwach geworden. Glückwunsch.)
(da wäre ich wohl auch schwach geworden. Glückwunsch.)
ei Eck der call läuft wohl

Antwort auf Beitrag Nr.: 34.562.606 von Zock1000 am 22.07.08 18:10:41Meine Aktien habe ich ja noch.
Und mein call-verkauf, ja klar war das zu früh.
Ich hatte gedacht die krieg ich tiefer wieder rein....
Aber an einem trade im plus ist noch keiner verarmt.
Und mein call-verkauf, ja klar war das zu früh.
Ich hatte gedacht die krieg ich tiefer wieder rein....
Aber an einem trade im plus ist noch keiner verarmt.

Antwort auf Beitrag Nr.: 34.562.633 von eck64 am 22.07.08 18:13:50Laß nur eck. Habe den call gestern auch viel zu früh für 0,79 € verkauft (KK 0,46 €). Heute hätte er schon 0,90 € gebracht. Könnte mich in der A... beißen, aber was solls. 



Antwort auf Beitrag Nr.: 34.562.816 von Handbuch am 22.07.08 18:31:33Heute hätte er schon 0,90 € gebracht.
0,96 €
Aber wie Eck schon sagte:
"Aber an einem trade im plus ist noch keiner verarmt."
Gruß
Zock
0,96 €
Aber wie Eck schon sagte:
"Aber an einem trade im plus ist noch keiner verarmt."
Gruß
Zock
 hey leute super chart,abwärtstrend verlassen siegt gut aus ,hoffentlich sehen wir kurse über 10 $
hey leute super chart,abwärtstrend verlassen siegt gut aus ,hoffentlich sehen wir kurse über 10 $gruß medarex75
Antwort auf Beitrag Nr.: 34.563.897 von medarex75 am 22.07.08 20:31:37Big Pharma saugt jetzt die restlichen guten BioTechs auf, siehe Pfizer, Roche.
Gerade Antikörperfirmen werden übernommen, da die Großen da wenig Kompetenz haben.
Denke Medarex wird noch in diesem jahr geschluckt und werde deshalb massiv auf diesem Niveau aufstocken.
Gerade Antikörperfirmen werden übernommen, da die Großen da wenig Kompetenz haben.
Denke Medarex wird noch in diesem jahr geschluckt und werde deshalb massiv auf diesem Niveau aufstocken.

 Medarex Receives Milestone Payment for Acceptance of Investigational New Drug Application
Medarex Receives Milestone Payment for Acceptance of Investigational New Drug Application 
Wednesday July 23, 8:00 am ET
PRINCETON, N.J., July 23 /PRNewswire-FirstCall/ -- Medarex, Inc. (Nasdaq: MEDX - News) today announced that it has received a milestone payment of an undisclosed amount from its licensing partner, Centocor R&D Inc., for the acceptance of an Investigational New Drug Application (IND) to the U.S. Food and Drug Administration (FDA) for an undisclosed antibody. The antibody was generated by Medarex's UltiMAb Human Antibody Development System®. Medarex may receive future milestone payments and royalties should this product candidate progress to commercialization and achieve commercial sales.
"We are excited about the development of new antibodies generated by Medarex's UltiMAb® technology platform," said Howard H. Pien, President and CEO of Medarex. "The advancement of this antibody into the clinical trial process further enhances our financial assets that consist of the antibodies being developed through our collaborations."
http://biz.yahoo.com/prnews/080723/new016.html?.v=60
Antwort auf Beitrag Nr.: 34.562.606 von Zock1000 am 22.07.08 18:10:41PMedarex^.Close.At['24.07.2008 16:45:00']
Das Signal aus Beitrag #3471 war ein Fehlsignal. Ich bin mir noch nicht im klaren, ob man am besser einen engen Stop setzt..... oder Rotating Gruen einfach mehr Bars als Parameter übergibt. Je mehr Bars man der Funktion gibt, umso weniger Handelssignale werden erzeugt. In diesem Fall würde aber auch das heutige Signal nicht genommen.
@Zock1000
welche Linie oder Formation die Funktion "Rotating Grün" auf dem Schaubild darstellt.
Die Charts dienen nur der Veranschaulichung. Rotating Gruen darzustellen ist nicht so einfach, weil es sich um sehr viele Daten handelt..... ich kann mir aber zur Visualisierung einzelne Linien herauspicken.
Hast Du das mal hier irgendwo erklärt? Unter welcher #?
Ja habe ich, später such ich das Posting mal raus.
Kannst nur Du aus irgendeiner "Berechnungs"-Tabelle entnehmen, wie gerade das "At" ist, oder müsste das Jeder hier (mich natürlich ausgenommen) auf dem Chart erkennen können?
Die At- Eigenschaft regelt den Zugriff auf Kursdaten. Dabei wird die Funktion GetPriceAt(const ADate: string) aufgerufen. Bei den BigCharts- Abbildungen kannst Du es nur ungefähr abschätzen, welcher Bar nun genau das Signal ausgelöst hat. Um es genau zu erkennen braucht man eine richtige Software.
Das Signal aus Beitrag #3471 war ein Fehlsignal. Ich bin mir noch nicht im klaren, ob man am besser einen engen Stop setzt..... oder Rotating Gruen einfach mehr Bars als Parameter übergibt. Je mehr Bars man der Funktion gibt, umso weniger Handelssignale werden erzeugt. In diesem Fall würde aber auch das heutige Signal nicht genommen.
@Zock1000
welche Linie oder Formation die Funktion "Rotating Grün" auf dem Schaubild darstellt.
Die Charts dienen nur der Veranschaulichung. Rotating Gruen darzustellen ist nicht so einfach, weil es sich um sehr viele Daten handelt..... ich kann mir aber zur Visualisierung einzelne Linien herauspicken.
Hast Du das mal hier irgendwo erklärt? Unter welcher #?
Ja habe ich, später such ich das Posting mal raus.
Kannst nur Du aus irgendeiner "Berechnungs"-Tabelle entnehmen, wie gerade das "At" ist, oder müsste das Jeder hier (mich natürlich ausgenommen) auf dem Chart erkennen können?
Die At- Eigenschaft regelt den Zugriff auf Kursdaten. Dabei wird die Funktion GetPriceAt(const ADate: string) aufgerufen. Bei den BigCharts- Abbildungen kannst Du es nur ungefähr abschätzen, welcher Bar nun genau das Signal ausgelöst hat. Um es genau zu erkennen braucht man eine richtige Software.
Antwort auf Beitrag Nr.: 34.580.219 von Gruenfeld am 24.07.08 17:43:00Ein paar kurze Anmerkungen zur Rotating Gruen- Funktion stehen in Beitrag #3399.
Antwort auf Beitrag Nr.: 34.580.731 von Zock1000 am 24.07.08 18:37:34Der Vollständigkeit halber. Damit dieser Thread wieder zum Leben erweckt wird.
lg - Lycos
***************************************************************
Medarex Announces Allowance of Investigational New Drug Application for Wholly-Owned Fully Human Anti-PD-L1 Antibody, MDX-1105
Clinical study planned for advanced or recurrent solid tumors
PRINCETON, N.J., Aug. 5 /PRNewswire-FirstCall/ -- Medarex, Inc. (Nasdaq: MEDX)
announced today the allowance of an investigational new drug application (IND) filed
with the U.S. Food & Drug Administration (FDA) for MDX-1105, for the treatment
of patients with selected advanced or recurrent solid tumors, specifically renal
cell carcinoma, melanoma, non-small cell lung cancer or epithelial ovarian cancer.
MDX-1105 is a fully human antibody that targets the PD-L1 pathway to promote
enhanced T-cell immune responses against cancer and reverse T-cell inactivation in
chronic infectious disease.
The open-label, multi-dose, dose-escalation Phase 1 clinical trial is expected
to enroll up to 46 patients with selected advanced or recurrent solid tumors. This
trial is designed to establish and evaluate the safety, tolerability and maximum
tolerated dose, as well as preliminary pharmacodynamics and efficacy, of MDX-1105.
"We are pleased that another product candidate from our proprietary pipeline has
progressed into clinical trials," said Howard H. Pien, President and CEO of Medarex.
"We believe that our fully human anti-PD-1 and anti-PD-L1 antibodies represent the
next stage in immunotherapy beyond the anti-CTLA-4 antibodies. We look forward to
exploring the potential of MDX-1105 as a possible new treatment option for patients
with cancer and infectious disease."
lg - Lycos
***************************************************************
Medarex Announces Allowance of Investigational New Drug Application for Wholly-Owned Fully Human Anti-PD-L1 Antibody, MDX-1105
Clinical study planned for advanced or recurrent solid tumors
PRINCETON, N.J., Aug. 5 /PRNewswire-FirstCall/ -- Medarex, Inc. (Nasdaq: MEDX)
announced today the allowance of an investigational new drug application (IND) filed
with the U.S. Food & Drug Administration (FDA) for MDX-1105, for the treatment
of patients with selected advanced or recurrent solid tumors, specifically renal
cell carcinoma, melanoma, non-small cell lung cancer or epithelial ovarian cancer.
MDX-1105 is a fully human antibody that targets the PD-L1 pathway to promote
enhanced T-cell immune responses against cancer and reverse T-cell inactivation in
chronic infectious disease.
The open-label, multi-dose, dose-escalation Phase 1 clinical trial is expected
to enroll up to 46 patients with selected advanced or recurrent solid tumors. This
trial is designed to establish and evaluate the safety, tolerability and maximum
tolerated dose, as well as preliminary pharmacodynamics and efficacy, of MDX-1105.
"We are pleased that another product candidate from our proprietary pipeline has
progressed into clinical trials," said Howard H. Pien, President and CEO of Medarex.
"We believe that our fully human anti-PD-1 and anti-PD-L1 antibodies represent the
next stage in immunotherapy beyond the anti-CTLA-4 antibodies. We look forward to
exploring the potential of MDX-1105 as a possible new treatment option for patients
with cancer and infectious disease."
Und heute überwiegt wieder die Angst wegen den durch Studien steigenden Kosten? ,)
Antwort auf Beitrag Nr.: 34.580.219 von Gruenfeld am 24.07.08 17:43:00
PMedarex^.Close.At['05.08.2008 16:15:00']
Das Verkaufssignal vom 24. Juli (siehe Beitrag #3480) bremste den Kursanstieg der Meradrex- Aktie 5 Tage lang, am 31. Juli wurde dann aber zu Bösrenbeginn wieder kräftig gekauft. Die Dynamik der Rallye seit dem zyklischen Tief (Anfang Juli) ist unglaublich stark. Im TagesChart war MEDX (laut GF4-64bit) bis zu 40% überkauft!
Das neue Signal von heute gefällt mir wieder ausgesprochen gut. Im Gegensatz zu den 2 vorhergehenden Signalen ist der Kursverlauf diesmal über einen längeren Zeitraum* negativ gekrümmt. Bisher scheinen die Teilnehmer aber nicht beeindruckt davon!? Angesichts der immensen Kursgewinne haben sie ihre Ängstlichkeit offenbar abgelegt.
*im 5- MinutenChart mehr als 1600 Bars schätzungsweise
PMedarex^.Close.At['05.08.2008 16:15:00']
Das Verkaufssignal vom 24. Juli (siehe Beitrag #3480) bremste den Kursanstieg der Meradrex- Aktie 5 Tage lang, am 31. Juli wurde dann aber zu Bösrenbeginn wieder kräftig gekauft. Die Dynamik der Rallye seit dem zyklischen Tief (Anfang Juli) ist unglaublich stark. Im TagesChart war MEDX (laut GF4-64bit) bis zu 40% überkauft!
Das neue Signal von heute gefällt mir wieder ausgesprochen gut. Im Gegensatz zu den 2 vorhergehenden Signalen ist der Kursverlauf diesmal über einen längeren Zeitraum* negativ gekrümmt. Bisher scheinen die Teilnehmer aber nicht beeindruckt davon!? Angesichts der immensen Kursgewinne haben sie ihre Ängstlichkeit offenbar abgelegt.
*im 5- MinutenChart mehr als 1600 Bars schätzungsweise
Ich wurde per BM zu Infos zu MEDX gefragt:
* Einschätzung und Ausblick v.a. in Bezug auf MDX-010
* Zulassungsnahe Piplineevents in nächster Zeit
* Zufriedenheit mit der MEDX Entwicklung
-----------------------------------------------------------------
Vorweg: der Medarex Aktienkurs befriedigt mich keinesfalls. Die Chance für einen Buyout noch in 2008 halte ich daher für sehr gut. Denn die Technologie und die Pipeline in diesem Zukunftswachstumsmarkt sind hervorragend und diverse Pharmas kranken nachwievor an mangelnder Aufstellung im Antikörper Bereich.
Bei MDX-010 gab und gibt es einige Verzögerungen: kein BLA aufgrund der Phase II Studien, weil die Response Rate nach 12/24 Wochen nicht gefiel und die Phase III Kombistudie wurde im Endpunkt von progression free survival (PFS) auf Overall survival (OS) geändert. Das ist per se nicht schlecht, denn die Chancen bei OS sind aufgrund der Art und Weise wie das Medikament wohl wirkt (zeitverzögert). Dadurch ergibt sich aber auch eine Verzögerung in der Trialauswertung von 12-18 Monaten, mit MDX-010 Daten ist also erst HJ2 2009 zu rechnen. Die betroffene Studie ist eventuell mit nur 500 Patienten evetuell für OS underpowered, also Gefahr der Nicht-Signifikanz, da ist für mich das größte Risiko. Ansonsten gibt es noch die Phase III Adjuvant Studie, aber hier ist vor 2010/2011 nicht mit Daten zu rechnen.
Die Entwicklung auf der Forschungsseite gefällt mir, im R&D Day haben sie eine fette Eigen-Präklinik präsentiert und sie haben einige Technologien entwickelt und genutzt, die Morphosys z.b. nicht hat.
Konjugattechnologie: An Antikörper werden Gifte gehängt. MEDX hat stabile Brücken dafür gebaut. Diese töten i.V. mit dem AK die Krebs-Zellen. Geht mit verschiedenen Targets, man konzentriert sich auf diese, bei denen man guten Patentschutz hat. Sehr gute präklinische Daten. Phase I Starts noch dieses Jahr. Morphosys hat eine solche Technologie nicht im Angebot.
Enhanced Effector Funktion: Medarex optimiert die lange Kette des Antikörpers (die FC Region). Dadurch erreichen sie eine weit bessere Wirkung als ohne diese Optimierung. Der Antikörper gegen CD30 (MDX-1401) ist z.b. 2-3 mal besser in der Lyse als der MDX-060 aufgrund dieser Technologie. Morphosys kann nur die kleinen Ketten kombinatorisch verändern, sie müssten die FC Optimierungs-Technologie einkaufen oder einlizensieren. D.h. ihre AKs sind diesbezüglich bisher vollständig unoptimiert.
Zu den Pipelineevents - alles aus dem Gedächtnis. Wer genaue Infos möchte schaut sich v.a. den WebCast zum R&D Day an (knapp 4 h) - auf der Medarex-Homepage.
Zulassungsnahe Genmab-Antikörper (MEDX hält ja noch 5% an Genmab):
Vor Kurzem wurde übrigens Humax-CD20 Daten von Genmab präsentiert. Humax-CD20 ist der vollhumane Ersatz für den Multimillarden-Blockbuster Rituxan. Und Humax-CD20 war in dieser Studie besser als Rituxan. Genmab schoß daraufhin auch kräftig nach oben.
Phase III Ergebnisse Humax-CD4 müssten noch in 2008 kommen.
Zulassungsnahe Partner-Pipelineevents in nächster Zeit:
Zulassung CNTO1275 ab September. Peakmarkt-Potential 1800 Mio USD. Antiel für MEDX dann mind. 50Mio USD. (Aussage MEDX)
Zulassung CNTO148 ab 2009. Peakmark-Potential 2800 Mio USD. Anteil für MEDX dann mind. 90 Mio USD. (Aussage MEDX)
Phase III Ergebnisse ACZ885 noch in 2008
Eigen-Pipeline-Events nach MDX-010 - nur Phase II:
Phase II MDX-060 Ergebnisse Ende 2008: Kombi mit Chemotherapie. Programm wird höchstwahrscheinlich zugunsten MDX-1401 eingestellt, da diese AK weit besser optimiert ist. Bei dennoch guten Daten wird aber eine Phase III gestartet.
Phase II Ergebnisse MDX-1100 Anfang 2009: Das beste der am weitesten fortgeschrittenen eigenen Pferde im Stall. Zielt auf den Multimillarden-Markt Autoimmunerkrankungen und würde im Erfolgsfalle in der Liga von Remicade, Humira, etc. mitspielen.
Phase II Ergebnisse MDX-066 (CDA-1) + MDX-1388 (CDA-2) HJ1 2009: Gegen die Gifte von Krankenhausbakterienerregern gerichtet. Hier könnte sich bei guten Daten ein sehr großer Markt auftun. Wird aber von MEDX nicht sehr hochgespielt. Daher habe ich hier das Gefühl, dass sie selbst nicht viel erwarten.
* Einschätzung und Ausblick v.a. in Bezug auf MDX-010
* Zulassungsnahe Piplineevents in nächster Zeit
* Zufriedenheit mit der MEDX Entwicklung
-----------------------------------------------------------------
Vorweg: der Medarex Aktienkurs befriedigt mich keinesfalls. Die Chance für einen Buyout noch in 2008 halte ich daher für sehr gut. Denn die Technologie und die Pipeline in diesem Zukunftswachstumsmarkt sind hervorragend und diverse Pharmas kranken nachwievor an mangelnder Aufstellung im Antikörper Bereich.
Bei MDX-010 gab und gibt es einige Verzögerungen: kein BLA aufgrund der Phase II Studien, weil die Response Rate nach 12/24 Wochen nicht gefiel und die Phase III Kombistudie wurde im Endpunkt von progression free survival (PFS) auf Overall survival (OS) geändert. Das ist per se nicht schlecht, denn die Chancen bei OS sind aufgrund der Art und Weise wie das Medikament wohl wirkt (zeitverzögert). Dadurch ergibt sich aber auch eine Verzögerung in der Trialauswertung von 12-18 Monaten, mit MDX-010 Daten ist also erst HJ2 2009 zu rechnen. Die betroffene Studie ist eventuell mit nur 500 Patienten evetuell für OS underpowered, also Gefahr der Nicht-Signifikanz, da ist für mich das größte Risiko. Ansonsten gibt es noch die Phase III Adjuvant Studie, aber hier ist vor 2010/2011 nicht mit Daten zu rechnen.
Die Entwicklung auf der Forschungsseite gefällt mir, im R&D Day haben sie eine fette Eigen-Präklinik präsentiert und sie haben einige Technologien entwickelt und genutzt, die Morphosys z.b. nicht hat.
Konjugattechnologie: An Antikörper werden Gifte gehängt. MEDX hat stabile Brücken dafür gebaut. Diese töten i.V. mit dem AK die Krebs-Zellen. Geht mit verschiedenen Targets, man konzentriert sich auf diese, bei denen man guten Patentschutz hat. Sehr gute präklinische Daten. Phase I Starts noch dieses Jahr. Morphosys hat eine solche Technologie nicht im Angebot.
Enhanced Effector Funktion: Medarex optimiert die lange Kette des Antikörpers (die FC Region). Dadurch erreichen sie eine weit bessere Wirkung als ohne diese Optimierung. Der Antikörper gegen CD30 (MDX-1401) ist z.b. 2-3 mal besser in der Lyse als der MDX-060 aufgrund dieser Technologie. Morphosys kann nur die kleinen Ketten kombinatorisch verändern, sie müssten die FC Optimierungs-Technologie einkaufen oder einlizensieren. D.h. ihre AKs sind diesbezüglich bisher vollständig unoptimiert.
Zu den Pipelineevents - alles aus dem Gedächtnis. Wer genaue Infos möchte schaut sich v.a. den WebCast zum R&D Day an (knapp 4 h) - auf der Medarex-Homepage.
Zulassungsnahe Genmab-Antikörper (MEDX hält ja noch 5% an Genmab):
Vor Kurzem wurde übrigens Humax-CD20 Daten von Genmab präsentiert. Humax-CD20 ist der vollhumane Ersatz für den Multimillarden-Blockbuster Rituxan. Und Humax-CD20 war in dieser Studie besser als Rituxan. Genmab schoß daraufhin auch kräftig nach oben.
Phase III Ergebnisse Humax-CD4 müssten noch in 2008 kommen.
Zulassungsnahe Partner-Pipelineevents in nächster Zeit:
Zulassung CNTO1275 ab September. Peakmarkt-Potential 1800 Mio USD. Antiel für MEDX dann mind. 50Mio USD. (Aussage MEDX)
Zulassung CNTO148 ab 2009. Peakmark-Potential 2800 Mio USD. Anteil für MEDX dann mind. 90 Mio USD. (Aussage MEDX)
Phase III Ergebnisse ACZ885 noch in 2008
Eigen-Pipeline-Events nach MDX-010 - nur Phase II:
Phase II MDX-060 Ergebnisse Ende 2008: Kombi mit Chemotherapie. Programm wird höchstwahrscheinlich zugunsten MDX-1401 eingestellt, da diese AK weit besser optimiert ist. Bei dennoch guten Daten wird aber eine Phase III gestartet.
Phase II Ergebnisse MDX-1100 Anfang 2009: Das beste der am weitesten fortgeschrittenen eigenen Pferde im Stall. Zielt auf den Multimillarden-Markt Autoimmunerkrankungen und würde im Erfolgsfalle in der Liga von Remicade, Humira, etc. mitspielen.
Phase II Ergebnisse MDX-066 (CDA-1) + MDX-1388 (CDA-2) HJ1 2009: Gegen die Gifte von Krankenhausbakterienerregern gerichtet. Hier könnte sich bei guten Daten ein sehr großer Markt auftun. Wird aber von MEDX nicht sehr hochgespielt. Daher habe ich hier das Gefühl, dass sie selbst nicht viel erwarten.
Statt Seitenhiebe auf Morphosys zu verteilen, hättest du ruhig auch erwähnen können, das Zahlen rausgekommen sind:
Wie üblich sehr wenig Umsatz (10 mio USD) und massive Verlustevon 51 mio USD im Quartal!
http://www.rttnews.com/ArticleView.aspx?Id=675512
Medarex Q2 loss widens; revenue down 18.4% - Update
8/5/2008 6:42 PM ET
(RTTNews) - Tuesday, Medarex Inc. (MEDX: News, Chart, Quote ), a biopharmaceutical company, reported wider loss for the second quarter, as revenues decreased 18.4% from the year-ago quarter.
Net loss for the quarter widened to $53.1 million or $0.42 per share, from $41.0 million or $0.32 per share in the same quarter last year. Adjusted loss, which excludes stock based compensation and other items, was $43.6 million, or $0.34 per share, wider than $32.6 million or $0.26 per share last year. Analysts polled by First Call/Thomson Financial expected loss of $0.35 per share for the quarter.
Total revenues for the quarter fell 18.4% to $10.0 million from $11.8 million a year ago, and missed the analysts' estimate of $12.5 million.
Research and development expenses for the quarter increased to $52.6 million from $45.3 million prior year. Operating loss widened to $55.1 million from $44.1 million a year ago.
For the six-month period, net income was $50.2 million or $0.38 per share, lower than $69.3 million or $0.52 per share a year ago. Revenues grew to $22 million from $23.3 million prior year.
Medarex closed Tuesday's regular trading at $9.94, up $0.12 or 1.22%.
by RTT Staff Writer
For comments and feedback: contact editorial@rttnews.com
xxxxxxxxxxxxxxxxxxxxxxx
Letztlich muss man die 51 mio USD Quartalsverlust auch in Beziehung setzen zum CNTO1275: 50Mio USD im Jahr bei Peaksales (ab 2012?)
CNTO148: 90 mio USD im Jahr (nicht Quartal) bei peaksales (ab 2012?)
Neben der tollen pipeline von Medarex ist die Zeit das Problem. Es ist noch so sehr lange hin, bis der Rubel ausreichend zurückrollt.
Und vorher steht das Risiko der Verzögerungen, Rückschläge und Kapitalerhöhungen.
Ich sehe eine hohe Chance auf Übernahme!
Für ein Big Pharma sind 2 oder gar 3 Milliarden USD für eine Übernahme kein Problem. Und Quartalsverluste von 50 mio gehen bei Big Pharma unter. Aber man kriegt eine Technologie und eine Reihe interessanter Pipelineprojekte.
J&J bzw. Centocor wären da natürlich prädestiniert, denn die können sogar absehbare Tantiemen gegenrechnen.
Wie üblich sehr wenig Umsatz (10 mio USD) und massive Verlustevon 51 mio USD im Quartal!
http://www.rttnews.com/ArticleView.aspx?Id=675512
Medarex Q2 loss widens; revenue down 18.4% - Update
8/5/2008 6:42 PM ET
(RTTNews) - Tuesday, Medarex Inc. (MEDX: News, Chart, Quote ), a biopharmaceutical company, reported wider loss for the second quarter, as revenues decreased 18.4% from the year-ago quarter.
Net loss for the quarter widened to $53.1 million or $0.42 per share, from $41.0 million or $0.32 per share in the same quarter last year. Adjusted loss, which excludes stock based compensation and other items, was $43.6 million, or $0.34 per share, wider than $32.6 million or $0.26 per share last year. Analysts polled by First Call/Thomson Financial expected loss of $0.35 per share for the quarter.
Total revenues for the quarter fell 18.4% to $10.0 million from $11.8 million a year ago, and missed the analysts' estimate of $12.5 million.
Research and development expenses for the quarter increased to $52.6 million from $45.3 million prior year. Operating loss widened to $55.1 million from $44.1 million a year ago.
For the six-month period, net income was $50.2 million or $0.38 per share, lower than $69.3 million or $0.52 per share a year ago. Revenues grew to $22 million from $23.3 million prior year.
Medarex closed Tuesday's regular trading at $9.94, up $0.12 or 1.22%.
by RTT Staff Writer
For comments and feedback: contact editorial@rttnews.com
xxxxxxxxxxxxxxxxxxxxxxx
Letztlich muss man die 51 mio USD Quartalsverlust auch in Beziehung setzen zum CNTO1275: 50Mio USD im Jahr bei Peaksales (ab 2012?)
CNTO148: 90 mio USD im Jahr (nicht Quartal) bei peaksales (ab 2012?)
Neben der tollen pipeline von Medarex ist die Zeit das Problem. Es ist noch so sehr lange hin, bis der Rubel ausreichend zurückrollt.
Und vorher steht das Risiko der Verzögerungen, Rückschläge und Kapitalerhöhungen.
Ich sehe eine hohe Chance auf Übernahme!
Für ein Big Pharma sind 2 oder gar 3 Milliarden USD für eine Übernahme kein Problem. Und Quartalsverluste von 50 mio gehen bei Big Pharma unter. Aber man kriegt eine Technologie und eine Reihe interessanter Pipelineprojekte.
J&J bzw. Centocor wären da natürlich prädestiniert, denn die können sogar absehbare Tantiemen gegenrechnen.

Antwort auf Beitrag Nr.: 34.657.792 von eck64 am 06.08.08 10:13:28Wo habe ich einen Seitenhieb auf Morphosys verteilt? Fühlt sich da der Hüter des heiligen Morphosys Grals wieder angegriffen? Echt ätzend, Herr Eck.
Ich habe nach den zwei Technologien bei Morphosys gefragt, diese gibt es bei ihnen nicht im Angebot. Respektiere bitte diese Fakten.
Bezüglich Cash: das reicht bei MEDX locker aus für die nächsten 5 Jahre. 425 Mio USD auf der Kante, dazu 5% Anteil an der aufstrebenden Genmab, was derzeit über 100 Mio USD wert ist, dazu 80Mio USD Anteil an der aufstrebenden AVANT. Dazu den Revenuestream durch die Centocor-mabs. Hier muss keiner Zweifel haben, dass sie unbedingt Partner für ihre Pipe bräuchten oder nun verwässern müssten mittels KE. Wenn der erste MEDX mab am Markt ist, dann ist der BE da. Also keine Sorge. Aber bis dahin wird sich eben wohl ein Pharma MEDX geschnappt haben - leider.
Ich habe nach den zwei Technologien bei Morphosys gefragt, diese gibt es bei ihnen nicht im Angebot. Respektiere bitte diese Fakten.
Bezüglich Cash: das reicht bei MEDX locker aus für die nächsten 5 Jahre. 425 Mio USD auf der Kante, dazu 5% Anteil an der aufstrebenden Genmab, was derzeit über 100 Mio USD wert ist, dazu 80Mio USD Anteil an der aufstrebenden AVANT. Dazu den Revenuestream durch die Centocor-mabs. Hier muss keiner Zweifel haben, dass sie unbedingt Partner für ihre Pipe bräuchten oder nun verwässern müssten mittels KE. Wenn der erste MEDX mab am Markt ist, dann ist der BE da. Also keine Sorge. Aber bis dahin wird sich eben wohl ein Pharma MEDX geschnappt haben - leider.
Antwort auf Beitrag Nr.: 34.657.930 von Ville7 am 06.08.08 10:28:21Die Vergangenheit zu Kapitalverwässerungen von Medarex lehrt etwas anderes.
Auch die von dir hochgehalten 5% an genmab als Finanzierungsreserve waren mal 100% Medarex.
Das hier große Teile der aussichtreichen eigenen Pipeline zur Finanzierung weggegeben wurden und jetzt nur noch zu 5% im Firmenbesitz sind, zähle ich zur Verwässerung dazu.
Aktueller cashburn ist 50 mio USD.
Die 1. Zulassung eines Medarex mABs wird den cashburn dämpfen, aber noch nicht den BE bringen.
xxxxxxxxxxxxx
Ich habe nach den zwei Technologien bei Morphosys gefragt, diese gibt es bei ihnen nicht im Angebot.
Ich habe übrigens hier keine Frage zu MOR-Technologien gelesen?
Ausserdem, wäre doch zu Fragen bezüglich Morphosys-Technologien ein Morphosysthread geeigneter?
Zu Konjugattechnologien was allgemeines:
Es gibt eine ganze Reihe von zugelassenen mABs mit großem therapeutischem und wirtschaftlichem Erfolg.
Aufgepimpte AKs sind bis jetzt nicht darunter. Das wird sich erst beweisen müssen. Die Natur hat einen toxikologischen Zieltransporter nicht erfunden. Da wird sich erst noch zeigen müssen, wie erfolgreich dieses Konzept sein wird.
Es gibt wohl auch eine Reihe von MOR-AKs von Partnern, die auf diese und andere Weisen "aufgerüstet" wurden. Ob es zum verbesserten Erfolg führen wird, bleibt abzuwarten.
Schering hat MOR-AKs mit fluoreszierenden Substanzen gekoppelt, Centocor ist sogar mit einem toxikologisch aufgemotzten MOR-AK in der Klinik. Bayer hat auch was präklinisches in der Mache. Ich vermute in der weithin undokumentierten Pipeline von MOR noch mehr in dieser Richtung.
Allerdings wie bereits von mir gesagt: Ich bin da noch etwas reserviert.
Genug zu Mor hier im Thread? Zu or doch besser andernorts?
xxxxxxxxxxxxxxxxxxx
Könntest du bitte noch erläutern, wie eine erste mAB-zulassung 50 mio USD Quartalscashburn ausgleichen soll?
Für wann erwartest du denn konkret den BE?
Auch die von dir hochgehalten 5% an genmab als Finanzierungsreserve waren mal 100% Medarex.
Das hier große Teile der aussichtreichen eigenen Pipeline zur Finanzierung weggegeben wurden und jetzt nur noch zu 5% im Firmenbesitz sind, zähle ich zur Verwässerung dazu.
Aktueller cashburn ist 50 mio USD.
Die 1. Zulassung eines Medarex mABs wird den cashburn dämpfen, aber noch nicht den BE bringen.
xxxxxxxxxxxxx
Ich habe nach den zwei Technologien bei Morphosys gefragt, diese gibt es bei ihnen nicht im Angebot.
Ich habe übrigens hier keine Frage zu MOR-Technologien gelesen?

Ausserdem, wäre doch zu Fragen bezüglich Morphosys-Technologien ein Morphosysthread geeigneter?
Zu Konjugattechnologien was allgemeines:
Es gibt eine ganze Reihe von zugelassenen mABs mit großem therapeutischem und wirtschaftlichem Erfolg.
Aufgepimpte AKs sind bis jetzt nicht darunter. Das wird sich erst beweisen müssen. Die Natur hat einen toxikologischen Zieltransporter nicht erfunden. Da wird sich erst noch zeigen müssen, wie erfolgreich dieses Konzept sein wird.
Es gibt wohl auch eine Reihe von MOR-AKs von Partnern, die auf diese und andere Weisen "aufgerüstet" wurden. Ob es zum verbesserten Erfolg führen wird, bleibt abzuwarten.
Schering hat MOR-AKs mit fluoreszierenden Substanzen gekoppelt, Centocor ist sogar mit einem toxikologisch aufgemotzten MOR-AK in der Klinik. Bayer hat auch was präklinisches in der Mache. Ich vermute in der weithin undokumentierten Pipeline von MOR noch mehr in dieser Richtung.
Allerdings wie bereits von mir gesagt: Ich bin da noch etwas reserviert.
Genug zu Mor hier im Thread? Zu or doch besser andernorts?
xxxxxxxxxxxxxxxxxxx
Könntest du bitte noch erläutern, wie eine erste mAB-zulassung 50 mio USD Quartalscashburn ausgleichen soll?
Für wann erwartest du denn konkret den BE?
Antwort auf Beitrag Nr.: 34.658.667 von eck64 am 06.08.08 11:49:17Den üblichen 'rant' von dir ignoriere ich mal - jeder hat mal nen ultraschlechten Tag. Sieh dir den Medarex R&D Day Webcast an und wir reden vielleicht nochmal.
Könntest du bitte noch erläutern, wie eine erste mAB-zulassung 50 mio USD Quartalscashburn ausgleichen soll?
Durch Einnahmen aus Produktverkäufen. War dir das neu?
War dir das neu? 
Zuvor wird sich der Verlust und Cashburn durch die Einnahmen aus den beiden Centocorprodukten laufend reduzieren - trotz Ausweitung der F+E Ausgaben. Wie ich es klar beschrieben habe. S.u.
Für wann erwartest du denn konkret den BE?
2011/2012 [bei ipi (MDX-010) Zulassung in 2010.]
2012/2013 [bei MEDX-1100 Zulassung in 2011 und zuvor ipi-Nicht-Zulassung.]
Wobei bei ipi schon zuvor massiv Meilensteinzahlungen von BMY fliessen würden. Für ipi sind insgesamt 250 Mio USD an Entwicklungs- Zulassungs- und Vermarktungsmeilensteinen vereinbart.
Desweiteren schreien viele MEDX Produkte nach Verpartnerung, welches Cash bringen und/oder schonen würde. Z.b. ist anti-PD1-L hochinteressant, da es synergistisch zu anti-CTLA-4 ist.
Könntest du bitte noch erläutern, wie eine erste mAB-zulassung 50 mio USD Quartalscashburn ausgleichen soll?
Durch Einnahmen aus Produktverkäufen.
 War dir das neu?
War dir das neu? 
Zuvor wird sich der Verlust und Cashburn durch die Einnahmen aus den beiden Centocorprodukten laufend reduzieren - trotz Ausweitung der F+E Ausgaben. Wie ich es klar beschrieben habe. S.u.
Für wann erwartest du denn konkret den BE?
2011/2012 [bei ipi (MDX-010) Zulassung in 2010.]
2012/2013 [bei MEDX-1100 Zulassung in 2011 und zuvor ipi-Nicht-Zulassung.]
Wobei bei ipi schon zuvor massiv Meilensteinzahlungen von BMY fliessen würden. Für ipi sind insgesamt 250 Mio USD an Entwicklungs- Zulassungs- und Vermarktungsmeilensteinen vereinbart.
Desweiteren schreien viele MEDX Produkte nach Verpartnerung, welches Cash bringen und/oder schonen würde. Z.b. ist anti-PD1-L hochinteressant, da es synergistisch zu anti-CTLA-4 ist.
Medarex hat sogar noch mehr Produkte im Stall als sie auf ihrer Homepage in der Pipeline überhaupt angegeben haben. Es ist kein Antikörper, sondern eine Weiterentwicklung eines bisher erfolgreichen Chemotherapeutikums. Dies geht nun in Phase II.
Phase II Clinical Trials for DTS-201
http://siliconinvestor.advfn.com/readmsg.aspx?msgid=24822521
http://siliconinvestor.advfn.com/readmsg.aspx?msgid=24822525" target="_blank" rel="nofollow ugc noopener">
http://siliconinvestor.advfn.com/readmsg.aspx?msgid=24822525
http://www.diatos.com/main.php?page=4&idnews=48
"DTS-201 consists of doxorubicin, a marketed cytotoxic agent effective against a wide variety of solid tumors, conjugated to a proprietary first generation peptide similar to the company’s second generation Tumor-Selective Prodrug (TSP) technology."
"In return, Medarex has an option, exercisable before Super-Leu-Dox reaches Phase III development, to co-develop and co-commercialize the product with Diatos in Europe. If Medarex exercises its option, the parties will share equally all development and commercialization costs and future potential revenues from sales and sublicensing of Super-Leu-Dox in Europe. If Medarex elects not to co-develop and co-commercialize the product in Europe, Diatos will have the right to develop and commercialize Super-Leu-Dox in Europe and will be responsible for all development activities and costs. In that event, Medarex will receive royalties on any commercial sales of the product."
Phase II Clinical Trials for DTS-201
http://siliconinvestor.advfn.com/readmsg.aspx?msgid=24822521
http://siliconinvestor.advfn.com/readmsg.aspx?msgid=24822525" target="_blank" rel="nofollow ugc noopener">
http://siliconinvestor.advfn.com/readmsg.aspx?msgid=24822525
http://www.diatos.com/main.php?page=4&idnews=48
"DTS-201 consists of doxorubicin, a marketed cytotoxic agent effective against a wide variety of solid tumors, conjugated to a proprietary first generation peptide similar to the company’s second generation Tumor-Selective Prodrug (TSP) technology."
"In return, Medarex has an option, exercisable before Super-Leu-Dox reaches Phase III development, to co-develop and co-commercialize the product with Diatos in Europe. If Medarex exercises its option, the parties will share equally all development and commercialization costs and future potential revenues from sales and sublicensing of Super-Leu-Dox in Europe. If Medarex elects not to co-develop and co-commercialize the product in Europe, Diatos will have the right to develop and commercialize Super-Leu-Dox in Europe and will be responsible for all development activities and costs. In that event, Medarex will receive royalties on any commercial sales of the product."
Antwort auf Beitrag Nr.: 34.659.537 von Ville7 am 06.08.08 13:18:56Anscheinend hast du einen shclechten Tag?
Ich bin jedenfalls sehr zufrieden.
Danke für die Klarstellung. Dein vorheriges posting las sich noch so, als ob nach Zulassung der CNTOs bereits der BE erreichbar sei.
Wenn du jetzt den BE wieder auf 2011 bis 2013 schiebst, dann stellt sich doch die Frage der Finanzierung bis dahin.
3,5 bis 5,5 Jahre cashburn von 50 mio (abnehmend)je Quartal. Da bleibe ich dabei, das es wohl kaum ohne weitere KEs oder Assetverkauf abgehen kann.
Und wie gesagt: Genmab war mal 100% Medarex. Das vollends abzustoßen ist auch Verwässerung.
Nichtsdestotrotz. Eine Menge starker und interessanter Projekte in der Pipe. Und mit Stimmungsdreh an der Börse auch bei massiven Quartalsverlusten eine Menge Wert.
Ich bin jedenfalls sehr zufrieden.

Danke für die Klarstellung. Dein vorheriges posting las sich noch so, als ob nach Zulassung der CNTOs bereits der BE erreichbar sei.
Wenn du jetzt den BE wieder auf 2011 bis 2013 schiebst, dann stellt sich doch die Frage der Finanzierung bis dahin.
3,5 bis 5,5 Jahre cashburn von 50 mio (abnehmend)je Quartal. Da bleibe ich dabei, das es wohl kaum ohne weitere KEs oder Assetverkauf abgehen kann.
Und wie gesagt: Genmab war mal 100% Medarex. Das vollends abzustoßen ist auch Verwässerung.
Nichtsdestotrotz. Eine Menge starker und interessanter Projekte in der Pipe. Und mit Stimmungsdreh an der Börse auch bei massiven Quartalsverlusten eine Menge Wert.
Antwort auf Beitrag Nr.: 34.660.147 von eck64 am 06.08.08 14:29:54Informier' dich erst mal richtig über den Cashburn. Die 50 Mio haste dir aus den Fingern gesogen, die Firma sagt was anderes! Aber das ist deine Art der Informationsgewinnung. Einfach was Falsches behaupten und warten, das es von denen, die informiert sind richtig gestellt wird. Typisch eck.
Antwort auf Beitrag Nr.: 34.660.235 von Ville7 am 06.08.08 14:40:02Ist halt der Quartalsbericht von gestern, lies es halt selbst nach:
Net loss for the quarter widened to $53.1 million or $0.42 per share,
Aber es stimmt. Der ausgeweitete Netto-Verlust beträgt sogar 53 mio USD und natürlich nicht identisch mit dem cashburn.
Der cashburn wird ja noch über Beteiligungsverkäufe "geschönt".
Der cash hat von 464,5mio USD auf 426,7mio USD um "nur" 37,8 mio USD abgenommen.
Je schneller Assets verkauft werden, desto eher gibts auch mal ein Quartal mit cashburn = 0.
Vorhin gings aber um Break even und den cashbedarf bis dahin. Und das ist nicht gleichzusetzen mit der cashreduktion in einem Quartal sondern mit den im Quartal anfallenden und zu finanzierenden Verlusten.
Leb weiter in deinem Wolkenkuckucksheim. Ich habe meine Medarex lieber einigermassen im korrekten bewusstsein, wo die Finanzierung steht. Und die ist eben noch nicht sicher zum BE.
Net loss for the quarter widened to $53.1 million or $0.42 per share,
Aber es stimmt. Der ausgeweitete Netto-Verlust beträgt sogar 53 mio USD und natürlich nicht identisch mit dem cashburn.
Der cashburn wird ja noch über Beteiligungsverkäufe "geschönt".
Der cash hat von 464,5mio USD auf 426,7mio USD um "nur" 37,8 mio USD abgenommen.
Je schneller Assets verkauft werden, desto eher gibts auch mal ein Quartal mit cashburn = 0.
Vorhin gings aber um Break even und den cashbedarf bis dahin. Und das ist nicht gleichzusetzen mit der cashreduktion in einem Quartal sondern mit den im Quartal anfallenden und zu finanzierenden Verlusten.
Leb weiter in deinem Wolkenkuckucksheim. Ich habe meine Medarex lieber einigermassen im korrekten bewusstsein, wo die Finanzierung steht. Und die ist eben noch nicht sicher zum BE.
Antwort auf Beitrag Nr.: 34.660.368 von eck64 am 06.08.08 14:54:41Schön, dass du wenigstens gemerkt hast, dass du Nettoverlust und Cashburn verwechselt hast. Schliesslich hat MEDX ja auch jährliche Einnahmen von 50 Mio USD und erhält Zinsen auf den Cash.
Ansonsten kann ich dir nur dringend empfehlen dich zu informieren und nicht rumzuraten.
Damit es dir leichter fällt hier die aufbereitete ungelogene Form von Medarex:


Der einzige, der hier lügt bist du. Aber deine Motive sind klar- du willst von anderen Infos abschnorren die du selbst nicht hast und dabei einen auf Überall-Vollchecker machen. Wer's nötig hat!
Und noch was: Lern mal lesen. Ich habe nirgendwo geschrieben, dass MEDX sicher beim BE ist. Gehst du eigentlich mit deinen Geschäftspartnern auch so um?
So, Ende Ville. Es macht einfach keinen Spass mit dir zu diskutieren.
Ansonsten kann ich dir nur dringend empfehlen dich zu informieren und nicht rumzuraten.
Damit es dir leichter fällt hier die aufbereitete ungelogene Form von Medarex:


Der einzige, der hier lügt bist du. Aber deine Motive sind klar- du willst von anderen Infos abschnorren die du selbst nicht hast und dabei einen auf Überall-Vollchecker machen. Wer's nötig hat!
Und noch was: Lern mal lesen. Ich habe nirgendwo geschrieben, dass MEDX sicher beim BE ist. Gehst du eigentlich mit deinen Geschäftspartnern auch so um?
So, Ende Ville. Es macht einfach keinen Spass mit dir zu diskutieren.
Antwort auf Beitrag Nr.: 34.660.483 von Ville7 am 06.08.08 15:06:32Du bist echt ein übler Pöbler.
Das hast du drauf und dafür bist du bekannt.
Was du hier bringst ist der cashburn 12,4 mio USD pro Monat, bei laufenden Verkäufen von assets. Nur gibts halt nicht ewig was zu verkaufen.
Ganz schön dreist von dir den 53 mio USD Nettoquartalsverlust von Medarex als Lüge zu bezeichnen.
Das es dir keinen Spaß macht, den Fakten ins Auge zu sehen ist allerdings dein Bier.
Medarex wird seine Finanzierung hinkreigen. Bei so einer guten Pipeline. Da wird sich schon ein Pharma finden.
Das hast du drauf und dafür bist du bekannt.
Was du hier bringst ist der cashburn 12,4 mio USD pro Monat, bei laufenden Verkäufen von assets. Nur gibts halt nicht ewig was zu verkaufen.
Ganz schön dreist von dir den 53 mio USD Nettoquartalsverlust von Medarex als Lüge zu bezeichnen.
Das es dir keinen Spaß macht, den Fakten ins Auge zu sehen ist allerdings dein Bier.
Medarex wird seine Finanzierung hinkreigen. Bei so einer guten Pipeline. Da wird sich schon ein Pharma finden.

Beitrag zu dieser Diskussion schreiben
Zu dieser Diskussion können keine Beiträge mehr verfasst werden, da der letzte Beitrag vor mehr als zwei Jahren verfasst wurde und die Diskussion daraufhin archiviert wurde.
Bitte wenden Sie sich an feedback@wallstreet-online.de und erfragen Sie die Reaktivierung der Diskussion oder starten Sie eine neue Diskussion.
Meistdiskutiert
| Wertpapier | Beiträge | |
|---|---|---|
| 207 | ||
| 119 | ||
| 60 | ||
| 50 | ||
| 46 | ||
| 39 | ||
| 38 | ||
| 30 | ||
| 30 | ||
| 28 |
| Wertpapier | Beiträge | |
|---|---|---|
| 28 | ||
| 19 | ||
| 19 | ||
| 18 | ||
| 17 | ||
| 16 | ||
| 15 | ||
| 15 | ||
| 14 | ||
| 14 |






















